Результат интеллектуальной деятельности: КОМПОЗИЦИЯ ДЛЯ ИЗОЛИРОВАНИЯ КИШЕЧНОГО АНАСТАМОЗА И ПРЕДОТВРАЩЕНИЯ ПОСЛЕОПЕРАЦИОННОГО СПАЕЧНОГО ПРОЦЕССА
Вид РИД
Изобретение
Предлагаемое изобретение относится к области медицины, фармации и ветеринарии, а именно к способу получения биодеградируемой мембраны, в комбинации с адгезивным гелем, обладающими антибактериальными свойствами. Данная мембрана может быть использована для изолирования кишечного анастомоза, с целью предотвращения перитонита, связанного с несостоятельностью кишечного шва и профилактики спаечного процесса, развивающихся после операций на органах брюшной полости. Технический результат от использования изобретения заключается в способе получения биодеградируемого комплекса для изолирования кишечного анастамоза, предотвращающей образование спаек и послеоперационного перитонита.
В настоящее время в медицине, фармации и ветеринарии, активно ведутся разработки в области противоспаечных средств на основе производных целлюлозы, коллагена, декстринов и т.д.
Известен «Способ получения хирургического барьерного материала на основе полисахаридов» [Патент RU2016133238A]. Хирургический барьерный материал в форме криогеля обладает биосовместимыми свойствами и позволяет предупреждать образование спаек в эксперименте in vivo. В следствии биодеградатации не превышающей 24 часов – хирургический барьер может быть неэффективен, поскольку время развития спаек составляет до 72 часов.
Так известен «Способ получения противоспаечного пленочного материала на основе производных целлюлозы». Противоспаечное средство в виде геля производных целлюлозы представляет собой бесцветную вязкую прозрачную массу однородной структуры. Природный полимерный состав препарата не вызывает серьезных побочных явлений в виде токсического или аллергизирующего действия [Патент RU2016130852A]. Противоспаечная активность данного средства снижается вследствие контакта геля с другими органами и брюшной стенкой, что уменьшает его количество в месте нанесения.
Так, например, известно, о существовании противоспаечного барьера «Адепт» (Baxter Healthcare, США), основой которого является 4%-ный раствор икодекстрина в изотоническом растворе натрия хлорида. В основе механизма действия препарата – создание эффекта гидрофлотации – разделения повреждённых поверхностей брюшины с помощью жидкого средства, которое биодеградируется в течение 3-4 суток, времени, достаточного для предотвращения раннего формирования спаек. Препарат не обладает канцерогенным действием и не способствует развитию инфекционного процесса, но также не оказывает влияния на заживление лапаротомной раны, и анастомозов. Еще одним недостатком препарата «Адепт» является необходимость установки дренажей для удаления избытка барьерного раствора из брюшной полости [19].
Противоспаечное средство в виде геля карбоксиметилцеллюлозы «Мезогель» (ООО «Линтекс», Россия), представляет собой бесцветную вязкую прозрачную массу однородной структуры. Природный полимерный состав препарата не вызывает серьезных побочных явлений в виде токсического или аллергизирующего действия. Однако эффективность данного барьера установлена только при совместном применении с лапароскопическим адгезиолизисом [12].
«Сепрафилм» (Genzyme Corporation, США) – биодеградируемая мембрана, состоящая из комбинации карбоксиметилцеллюлозы и модифицированной гиалуроновой кислоты. После нанесения на поверхность анастамоза препарат в течение 24 часов превращается в гель и остается эффективным в течение 1 недели. Недостатком данного средства является то, что изолируя область анастамоза, мембрана не уменьшает частоту возникновения спаечной кишечной непроходимости [15].
Известно о существовании препарата «Интерсид» (Ethicon, США), противоспаечного барьера на основе окисленной регенерированной целлюлозы, который в течение 8 часов после нанесения превращается в гель и остается в брюшной полости до 4 недель. Однако результаты проведенных исследований свидетельствуют о том, что применение препарата не оказывает значимого уменьшения количества образующихся спаек. Среди его отрицательных свойств следует выделить также снижение эффективности барьерных функций в присутствии крови и экссудата, поэтому необходима тщательная санация кишечного шва и прилежащих тканей перед нанесением [1].
Существуют сведения об использовании противоспаечного средства на основе коллагена. Достоинствами данного природного полимера являются слабые антигенные свойства, не токсичность, высокая степень биосовместимости, способность к биодеградации и гемостатические свойства. Например, на основе ренатурированного лошадиного коллагена I типа получена противоспаечная мембрана «КолГАРА» (CollaGuard, Syntacoll GmbH, Германия). Мембрана удобна в использовании, подвергается деградации в течение 3–5 недель. Данное средство имеет высокую эффективность и снижает спайкообразование в 6 раз. Тем не менее, к недостаткам мембраны, относят необходимость ее фиксации рассасывающимися швами с целью предотвращения миграции из области операционного вмешательства [17].
ТЕХНИЧЕСКИЙ РЕЗУЛЬТАТ
Задачей настоящего изобретения является получение комплекса для изолирования кишечного анастамоза с целью профилактики послеоперационной спаечной болезни и перитонита, развитие которого возможно в результате несостоятельности кишечного шва.
Указанный технический результат достигается посредством разработки способа получения биодеградируемой мембраны, состоящей из смеси двух природных пленкообразователей и геля, обладающего адгезивными свойствами, в состав которых вводят антибактериальное вещество.
При этом в качестве пленкообразователей используют хитозан и желатин, в качестве адгезива - гель на основе натриевой соли карбкосиметилцеллюлозы (Na-КМЦ). Антибактериальный компонент представляет собой антибиотик широкого спектра действия, например, цефтриаксон.
Указанный технический результат достигается посредством разработки и получения комплекса для изолирования кишечного анастамоза, состоящей из биодеградируемых хитозано-желатиновой мембраны и адгезивного геля на основе Na-КМЦ при следующем соотношении компонентов, мас.%:
Мембрана:
|
Адгезивный гель:
|
Хитозан представляет собой аминополисахарид, – производное линейного полисахарида, макромолекулы которого состоят из случайно связанных β-(1-4) D-глюкозаминовых звеньев и N-ацетил-D-глюкозамин. Хитозан получают путем деацетилирования хитина ракообразных и насекомых. Соединение обладает антиоксидантной активностью, антибактериальным и гипогликемическим действием, связывает холестерин [22].
Хитозан оказывает пролиферативное действие, тем самым увеличивая скорость заживления раны [8].
Хитозан связывает индоксильные производные, образующиеся в кишечнике при гниении белка [3].
Степень ацетилирования и молекулярная масса хитозана оказывают определяющее влияние на его функциональные свойства – растворимость, биоразлагаемость и другие биоактивные характеристики [16], например, увеличение антибактериальной активности за счет модифицирования аминогрупп соединения при растворении хитозана в растворах уксусной кислоты.
При получении мембран на основе хитозана необходимо учитывать, что концентрация хитозана в мембране более 25% может стать причиной воспалительной реакции и гиперпролиферации. При этом мембрана теряет способность к биодеградации, что может привести к увеличению интенсивности спаечного процесса и увеличению воспаления слизистой слепой кишки [19].
Желатин представляет собой смесь полипептидов, получаемую при частичном гидролизе животного белка коллагена. В медицине желатин чаще всего используют в виде раствора для инфузий и в качестве биодеградируемого пленкообразователя [Патент RU 2651706]
С целью прочной фиксации противоспаечной мембраны на кишечном анастамозе предлагается использовать адгезивный гель на основе Na-КМЦ.
Карбоксиметилцеллюлоза и ее соли – природные биодеградируемые полимеры, которые не вызывают иммунных и воспалительных реакций при введении их гелей в брюшную полость [12]. Надежная адгезия гелей на месте нанесения в течение 3-5 суток связана с их высокой вязкостью и удовлетворительными тиксотропными свойствами и является достаточной для предотвращения формирования спаечного процесса [9].
В качестве антибактериального компонента в составе мембраны и адгезивного геля предлагается использовать цефтриаксон в терапевтической дозировке 1 г/70 кг [4], поскольку данное антибактериальное средство является препаратом выбора при абдоминальных хирургических вмешательствах для предотвращения перитонита. Цефтриаксон представляет собой [6R-6-альфа, 7бета(Z)-7-2- аминο-4-тиазοлил (метοксииминο) ацетил аминο-8-οксο-3-(1,2,5,6-тетрагидрο-2-метил-5,6-диοксο-1,2,4-триазин-3-ил)тиοметил-5-тиа-1-азабициклο 4.2.0 οкт-2-ен-2-карбοнοвая кислοта динатриевую соль и обладает широким спектром действия в отношении всех видов микроорганизмов, вызывающих послеоперационный перитонит [5].
Применение хитозан-желатиновой мембраны, с нанесенным на одну из сторон адгезивным гелем на основе Na-КМЦ, представляется высокоэфективной противоспаечным комплексом, исключающей недостатки использования мембраны и геля по отдельности. Так, мембрана на основе хитозан-желатинового комплекса помимо стимулирования заживления раневой поверхности будет изолировать кишечный анастамоз от прилежащих тканей и брюшной полости и не будет мигрировать с места нанесения при укладке кишечника. Гель на основе Na-КМЦ, будет снижать скорость выпадения фибрина и препятствовать началу формирования спаечного процесса, способствовать коагуляции эритроцитов и остановке кровотечения, а также из-за высокой вязкости и удовлетворительных тиксотропных свойств, будет надежно фиксировать хитозан-желатиновую мембрану на месте кишечного анастамоза. Гель, проникая в проколы от хирургической иглы и в ушитый разрез, будет оказывать бактерицидное действие при несостоятельности кишечного шва.
Цефтриаксон, содержащийся в комплексе, будет оказывать бактерицидное действие.
Пример 1
Получение хитозан-желатиновой мембраны проводили из стерильных компонентов в асептических условиях.
В коническую колбу термостойкого стекла вместимостью 100 мл помещали навеску желатина из свиной кожи (Gelatin, from porcine skin, Sigma-Aldrich, Регламент (ЕС) No. 1272/2008.) 5,0 г, прибавляли воду очищенную (ФС 2.2.0020.18) комнатной температуры до получения массы смеси равной 50,0 г и перемешивали. Колбу с полученной смесью и магнитным якорем помещали на магнитную мешалку с подогревом (RET basic (IKA), Германия). Перемешивание смеси осуществляли при 700 об/мин и температуре 50°С в течение 20 минут.
Для получения раствора хитозана к навеске хитозана (Zhejiang Aoxing Biotechnology) 1,5 г прибавляли 150 мл 1% раствора уксусной кислоты (ОФС.1.3.0001.15) и перемешивали до получения прозрачного раствора желтоватого цвета*.
*Примечание. Приготовление 1% раствора кислоты уксусной: 1,0 г кислоты уксусной ледяной («ЛенРеактивы», Россия) помещали в мерную колбу вместимостью 100 мл и доводили до метки водой очищенной.
Полученные растворы желатина и хитозана смешивали в соотношении 1:3 в конической колбе термостойкого стекла вместимостью 500 мл. Колбу со смесью и магнитным якорем помещали на магнитную мешалку и проводили перемешивание при 700 об/мин и температуре 50°С в течение 2-х часов.
К охлажденной смеси прибавляли цефтриаксон (порошок для приготовления раствора для внутривенного и внутримышечного введения, ОАО «Синтез», Россия) в количестве 0,03 г на 1 см2 хитозан-желатиновой мембраны.
Полученную однородную прозрачную смесь желтоватого цвета разливали в пластиковые формы из расчета 17,62 г смеси на 100,0 см2 и высушивали при температуре 25°С и 45% влажности в течение 24 часов.
После снятия с формы мембрану ополаскивали спиртом этиловым 96%. Из высушенной мембраны вырезали образцы шириной 2 см, длиной 8 см (площадь 16 см2) , которые до применения хранили в стерильной вакуумной упаковке.
Пример 2
Адгезивный гель получали из стерильных компонентов в асептических условиях. Для получения адгезивного геля к 3,0 г Na-КМЦ (Камцел-500-стандарт, NE 2231-002-50277563-2000) прибавляли 50 мл воды очищенной комнатной температуры и оставляли для набухания в течение 60 мин. 20,0 г цефтриаксона растворяли в 40 мл воды очищенной, прибавляли к образовавшемуся гелю Na-КМЦ, перемешивали и доводили массу геля до 100,0 г водой очищенной. Полученную смесь перемешивали до получения однородного геля.
Качество полученных мембран по Примеру 1 определяли по следующим показателям: толщина, удлинение при разрыве, предел прочности при растяжении.
Толщину мембран измеряли с помощью высокоточного микрометра «KAEFER F 1000/30» (Германия) с механическим индикатором для каждого образца в пяти точках.
Структурно-механические свойства – предел прочности при растяжении и удлинение при разрыве – на универсальной разрывной машине «Instron 3343» (США).
Отсутствие в России нормативной документации, регламентирующей требования к качеству хирургических мембран, обусловило необходимость сравнения полученных в ходе проведенных исследований результатов с данными литературных источников анализа зарубежных и отечественных аналогов.
В табл. 1 представлены средние значения определения толщины и структурно-механических свойств 5 образцов мембран (ГОСТ 14236-81), полученных по Примеру 1 и существующие сведения по зарубежным и отечественным аналогам.
В работе российских авторов [11] значение предела прочности при растяжении мембраны, полученной на основе хитозана, но не предназначенной для применения в хирургической практике, составляет от 58,0 до 88,7 Н/мм2. Однако при этом удлинение при разрыве – лишь 2,6%–5,7%, что свидетельствует об их низкой эластичности. В работе малазийских ученых [14] представлены данные, согласно которым предел прочности при растяжении хитозановых мембран составляет 67,11 Н/мм2, а удлинение при разрыве – 21,35%. Полученная по Примеру 1 мембрана менее прочная, по сравнению с аналогами, но при этом более эластичная, что предупреждает механические повреждения мембраны при ее размещении на месте анастамоза.
Влажность полученных мембран определяли в соответствии с ОФС.1.2.1.0010.15 «Потеря в массе при высушивании». С этой целью точную навеску образца мембраны около 1,0 г помещали в предварительно высушенный до постоянной массы и взвешенный в условиях проведения испытания бюкс. Пробу сушили с открытой крышкой бюкса до постоянной массы в течение 2 ч в сушильном шкафу (BINDER ED 53, Германия) при 60 ºС. Затем открытый бюкс вместе с крышкой помещали в эксикатор для охлаждения на 50 мин, после чего закрывали крышкой и взвешивали. Последующие взвешивания проводили после каждого часа дальнейшего высушивания до достижения постоянной массы.
Влажность полученных мембран рассчитывали по формуле:
 где
где
m1 - масса бюкса, доведенного до постоянной массы, г;
m2 - масса бюкса с испытуемым образцом до высушивания, г;
m3 - масса бюкса с испытуемым образцом после высушивания, г.
В ходе проведенных исследований было установлено, что влажность образцов мембран, полученных по Примеру 1 составляет 4,76% (табл. 2).
Таким образом, ошибка определения не превышает 1,5%, а влажность образцов хитозан – желатиновых пленок с удовлетворительными структурно–механическими свойствами составляет 4,76 %.
Полученные в ходе проведенных исследований значения влажности, толщины, предела прочности при растяжении и удлинения при разрыве свидетельствуют об оптимальных параметрах прочности и эластичности разработанных хирургических мембран на основе хитозана и желатина, и подтверждают их перспективность для эффективного изолирования кишечного анастамоза.
Исследование острой токсичности выполняли согласно утвержденному плану доклинических исследований в соответствии с требованиями «Руководства по проведению доклинических исследований лекарственных средств» [6], статьей 11 Федерального закона от 12 апреля 2010 г. № 61-ФЗ «Об обращении лекарственных средств» в редакции Федерального закона от 22.12.2014 г. № 429-ФЗ (ред. от 13.07.2015 г.) «О внесении изменений в Федеральный закон «Об обращении лекарственных средств» и Правилами надлежащей лабораторной практики в Российской Федерации (Межгосударственный стандарт ГОСТ 33044-2014 и Приказ МЗ РФ № 199н «Об утверждении правил надлежащей лабораторной практики» от 1 апреля 2016 года).
Все процедуры проводились в соответствии с общепринятыми этическими нормами, принятыми Европейской Конвенцией по защите позвоночных животных, используемых для экспериментальных и иных научных целей (1986 г) и с учетом Международных рекомендаций Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1997 г). Доклинические исследования одобрены локальным этическим комитетом ФГБОУ ВО «Волгоградский государственный медицинский университет» Министерства здравоохранения России (Регистрационный номер IRB 00005839 IORG 0004900 (OHRP)). Справка № 2021/002 от 22.01.2021 г.
Все животные подвергались карантину в течение 14 дней в стандартных условиях вивария Федерального государственного унитарного предприятия «Научно-исследовательский институт гигиены, токсикологии и профпатологии» Федерального медико-биологического агентства (ФГУП «НИИ ГТП» ФМБА России), г. Волгоград, в соответствии с постановлением Главного государственного санитарного врача РФ от 29.08.2014 №51 «Об утверждении СП 2.2.1.3218-14 «Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)». Животные содержались на древесном подстиле (ООО «Производственный комплекс «ГлавРезерв») при температурном режиме +18ᵒ С - +22 ᵒ С. Животные имели круглосуточный свободный доступ к поилкам с водой, соответствующей ГОСТ «Вода питьевая» 2874-82 и СанПиН 2.1.4.1074-01. Замена воды в поилках производилась ежедневно. Кормовая смесь содержала отруби, ячмень, пшеница, жмых подсолнечный, мел кормовой, соль, зерно-продукты (OOO «ТПК Альянс», Россия), в качестве сочных кормов животные получали свежие овощи и фрукты.
Определение острой токсичности разработанного комплекса проводили на 30 белых нелинейных крысах-самцах массой 200-220 г. В течение карантина на 1 и 14 день проводилось взвешивание животных и визуальный осмотр. Животные с обнаруженными в ходе осмотра отклонениями были исключены из эксперимента. После карантина экспериментальные животные были рандомно разделены на 5 групп и включали 4 экспериментальных групп и 1 - группу контроля, по 5 крыс в каждой.
В течение 24 часов до начала эксперимента, все животные помещались в условия полной пищевой депривации, со свободным доступом к воде. На момент выполнения исследований крысы были здоровыми, без изменений поведения, режима сна и бодрствования, аппетита.
Каждому животному присваивалась своя метка, которая фиксировалась в протоколе. Для этого метка наносилась на хвост крыс перманентным маркером. На клетки крепились этикетки со следующей информацией: дата начала и окончания эксперимента, название, способ введения и доза исследуемого вещества и количество животных.
По окончании исследования животных выводили из эксперимента с использованием хлоралгидратного наркоза, согласно правилам «Руководства по проведению доклинических исследований лекарственных средств» [6] без причинения страданий. Эвтаназию осуществляли в помещении, в котором не содержались другие животные.
Объем дозы для каждой крысы, с учетом межвидового пересчета, рассчитывали исходя из массы тела каждого животного. Комплекс для изолирования кишечного анастамоза вводили внутрижелудочно через металлический зонд с оливой на конце в возрастающих дозах: 78 мг/кг, 390 мг/кг, 780 мг/кг, 1170 мг/кг в пересчете на цефтриаксон, в количестве 2 мл.
После введения за животными было установлено наблюдение, с целью выявления смертности или токсических признаков в течение 14 дней исследования. В первые сутки в течение 6 часов после введения комплекса происходила регистрация сроков развития интоксикации и гибель животных, в последующие дни - 2 раза в сутки (утром и вечером).
В ходе проведенных исследований было установлено, что латентный период отравления составлял 30 – 75 мин и зависел от дозировки. Летальный исход регистрировали преимущественно в течение первых 24 ч, а при применении высоких доз животные погибали через 1-2,5 часа.
Клинические признаки острого отравления у крыс сопровождались сонливостью, нарушением дыхания, параличом. Непосредственно перед гибелью у животных отмечали учащенное дыхание, которое становилось поверхностным, прерывистым. Гибель животных наступала в состоянии глубокого угнетения.
По результатам гибели животных рассчитывали значение LD50 исследуемого комплекса для изолирования кишечного анастамоза при использовании регрессионного анализа по методу Литчфилда и Уилкоксона и отнесение комплекса для изолирования кишечного анастамоза к 4 классу токсичности лекарственных средств.
Статистические расчеты проводили с помощью встроенных функций программы Microsoft Excel 2007 из пакета Office XP (Microsoft, США) (среднее арифметическое значение, стандартная ошибка средней арифметической), а также при использовании программы «Graph.Pad.Prism5.0» (США).
Значение LD50 комплекса для изолирования кишечных анастамозов составила 667,6 мг/кг (табл. 3).
Согласно классификации токсичности химических веществ в соответствии с ГОСТ 12.1.007-76 (Межгосударственный стандарт. Комплекс стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности, Госстандарт России, Москва, 2007 г) и, исходя из полученного значения LD50 667,6 мг/кг, комплекс для изолирования кишечного анастамоза можно отнести к 4 классу умеренно-токсичных веществ.
Определение фармакологической активности, барьерных свойств и сроков биодиградируемости разработанного комплекса проводили на модели кишечного анастамоза [2] у кроликов.
С целью обоснования необходимости использования в мембране и адгезивном геле антибактериального компонента нами были проведены испытания систем двух составов: компонентый состав 1 содержал цефтриаксон в терапевтической дозировке (1г на дозу), в составе 2 цефтриаксон не применяли в эксперименте in vivo.
В качестве экспериментальных животных использовали самцов 18 беспородных кроликов, полученных из питомника по разведению и содержанию мелких лабораторных грызунов SPF - категории, научно-производственного подразделения Филиала Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова, г. Пущино, массой 1,5±0,2 кг, которых содержали в стандартных условиях вивария с постоянным доступом к воде и корму.
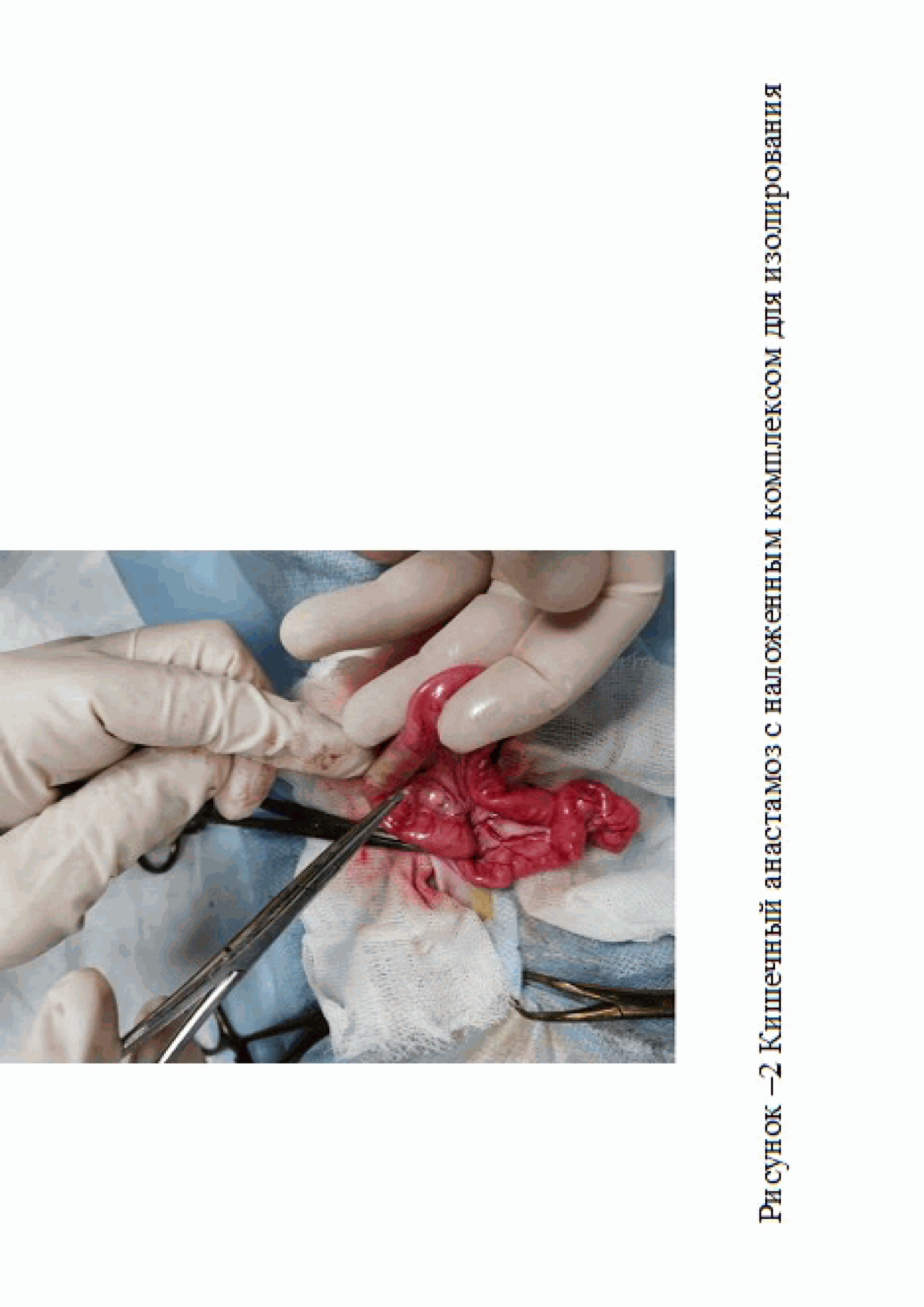
После 10-дневного карантина животные были разделены на три группы по 6 особей в каждой: 1-я - контрольная группа – на кишечный анастамоз комплекса для изолирования не накладывали (рис. 1). Во второй группе животных на кишечный анастамоз накладывали комплекс для изолирования, не содержащую антибиотик (рис. 2), 3-я группа, включала кроликов, на кишечный анастамоз которых накладывали комплекс для изолирования, содержащую цефтриаксон (Пример 1, 2).
В асептических условиях экспериментальным животным в ушную вену вводили комбинацию растворов золетил 100 (лиофилизированный порошк для инъекций в комплекте с растворителем (вода для инъекций), Вирбак Санте Анималь (Virbac Sante Animale), Франция) в дозировке 15 мг/кг и ксила (раствор для инъекций, Интерхеми (Interchemie), Нидерланды), в количестве 0,2 мл/кг.
После выбривания и обработки операционного поля, срединной лапаротомии, всем животным проводили мобилизацию и резекцию участка 1,5-2,0 см толстой кишки и формировали толсто-толстокишечный анастомоз по типу «конец в конец» однорядным непрерывным швом через все слои кишечной стенки. Для формирования кишечного анастомоза использовали монофиламентный шовный материал без антибактериального покрытия (Monocryl 6/0 c атравматичной иглой).
Комплекстическое наблюдение за животными в послеоперационном периоде, свидетельствовало о том, что состояние кроликов фактически не страдало, у 70% экспериментальных животных стул был получен уже в первые сутки после операции, что свидетельствовало о корректности выполненных оперативных приемов.
На 7 и 14 сутки после операции исследовали зону анастомоза в каждой
группе. Для этого под адекватным обезболиванием выполняли
релапаротомию, во время которой проводили макроскопическую оценку состояния брюшной полости, зоны межкишечного соустья, а также сегмента толстой кишки, несущей анастомоз.
Важнейшим в оценке состоятельности анастомоза и его функции, характера репаративного процесса является анализ реакции брюшной полости в зоне вмешательства.
Эффективность комплекса для изолирования кишечного анастамоза определяли по интенсивности инфильтративно-спаечного процесса в брюшной полости с использованием макроскопической и патологической оценки [18].
Для макроскопической оценки применяли следующую классификацию:
- степень 0: спайки отсутствуют;
- степень 1: отношение площади спаек к общей операционной площади составляет < 50%, спайка легко отделяется;
- степень 2: отношение площади спаек к общей операционной площади составляет ≥ 50%, спайка легко отделяется;
- степень 3: площадь спаек не учитывается, они плотные, тяжело отделяются, стенка кишки будет повреждена после тупой диссекции;
- степень 4: спайкообразование происходит очень плотно и не может быть рассечено тупым путем, также может иметь место сращение с другими органами.
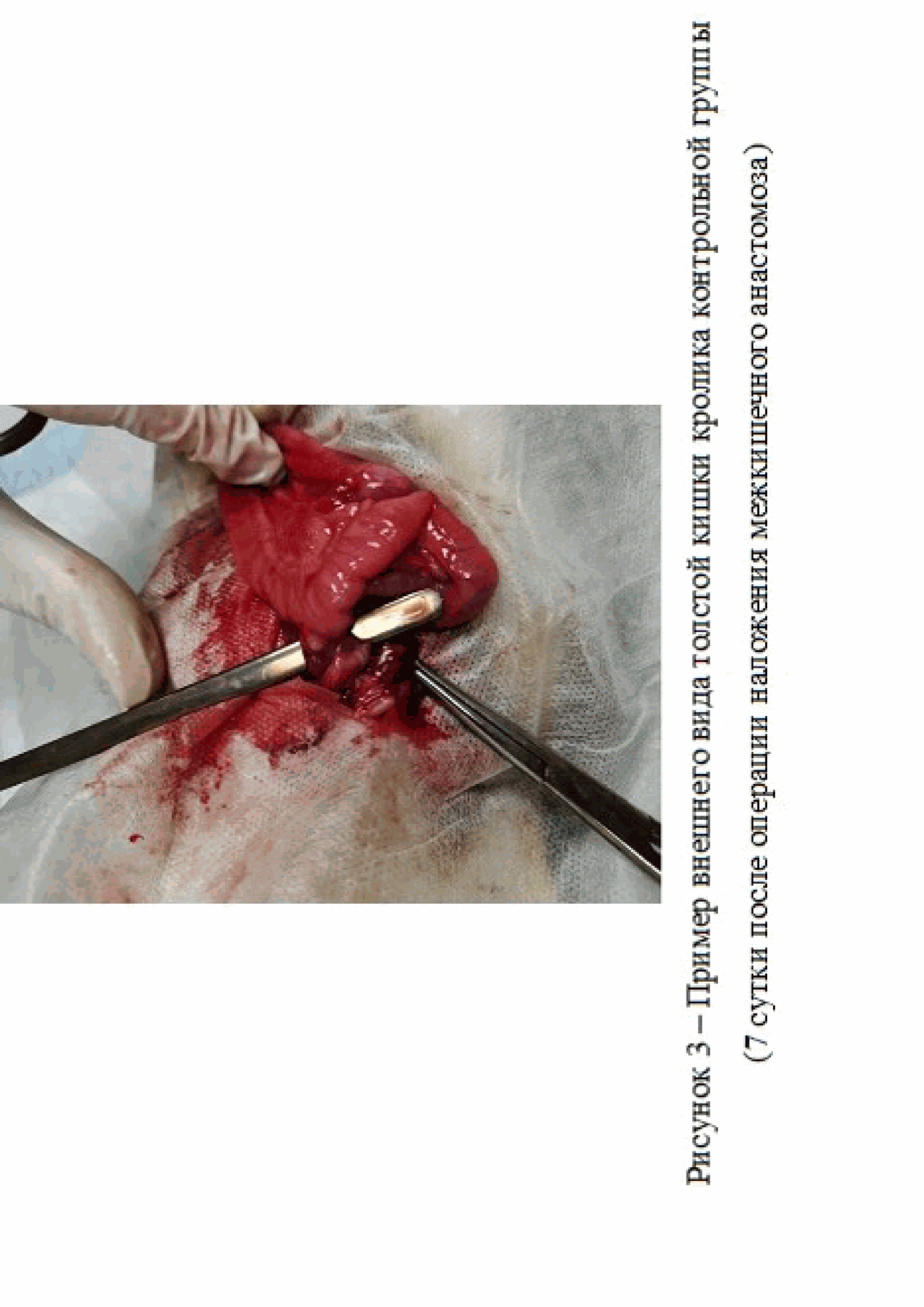
В ходе проведенных исследований было установлено, что на 7 сутки у экспериментальных животных контрольной группы наблюдался выраженный инфильтративно-спаечный процесс – визуализируется плоскостная спайка (рис. 3).
В двух случаях также наблюдалась фиксация к зоне анастомоза петли тонкой кишки.
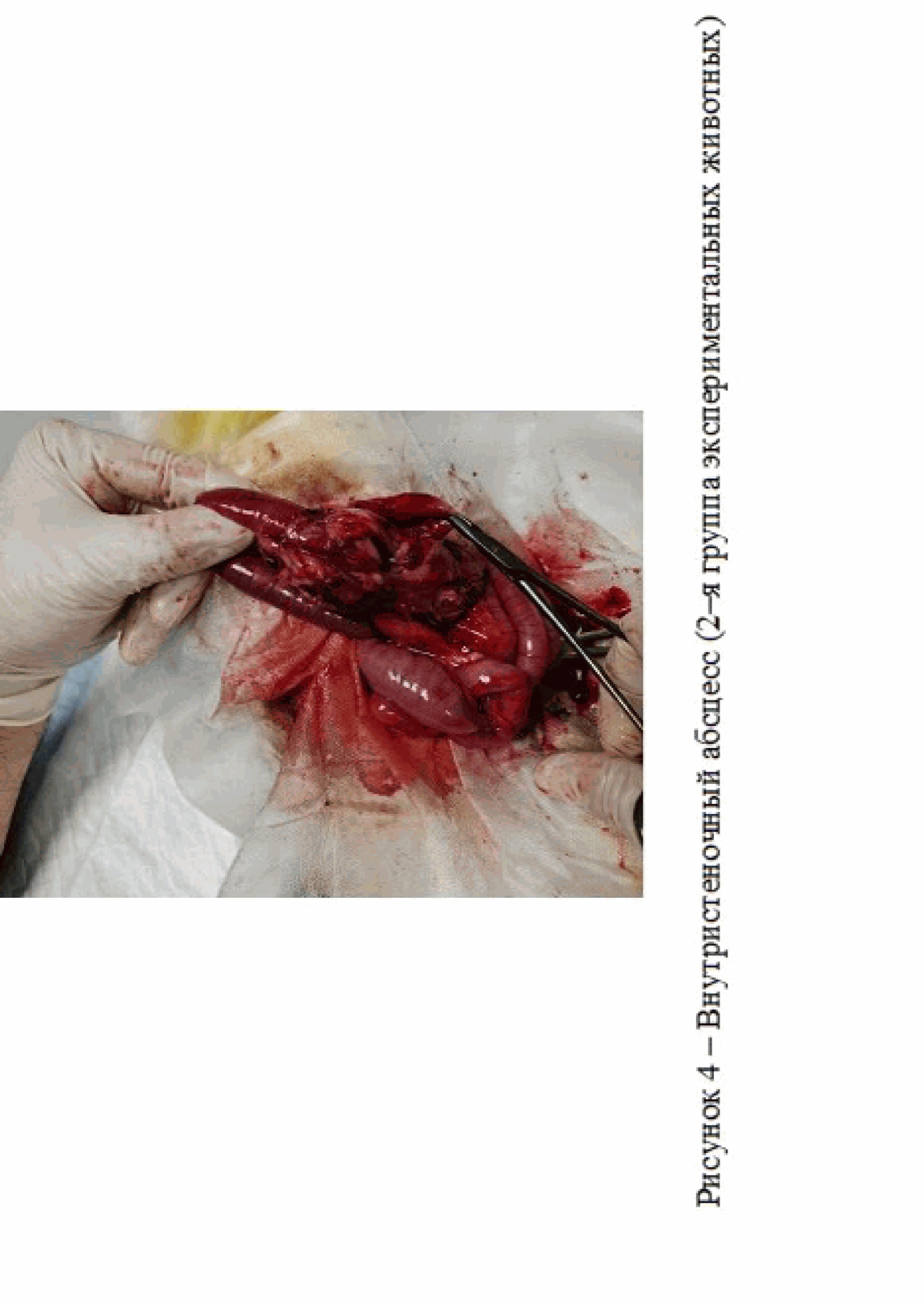
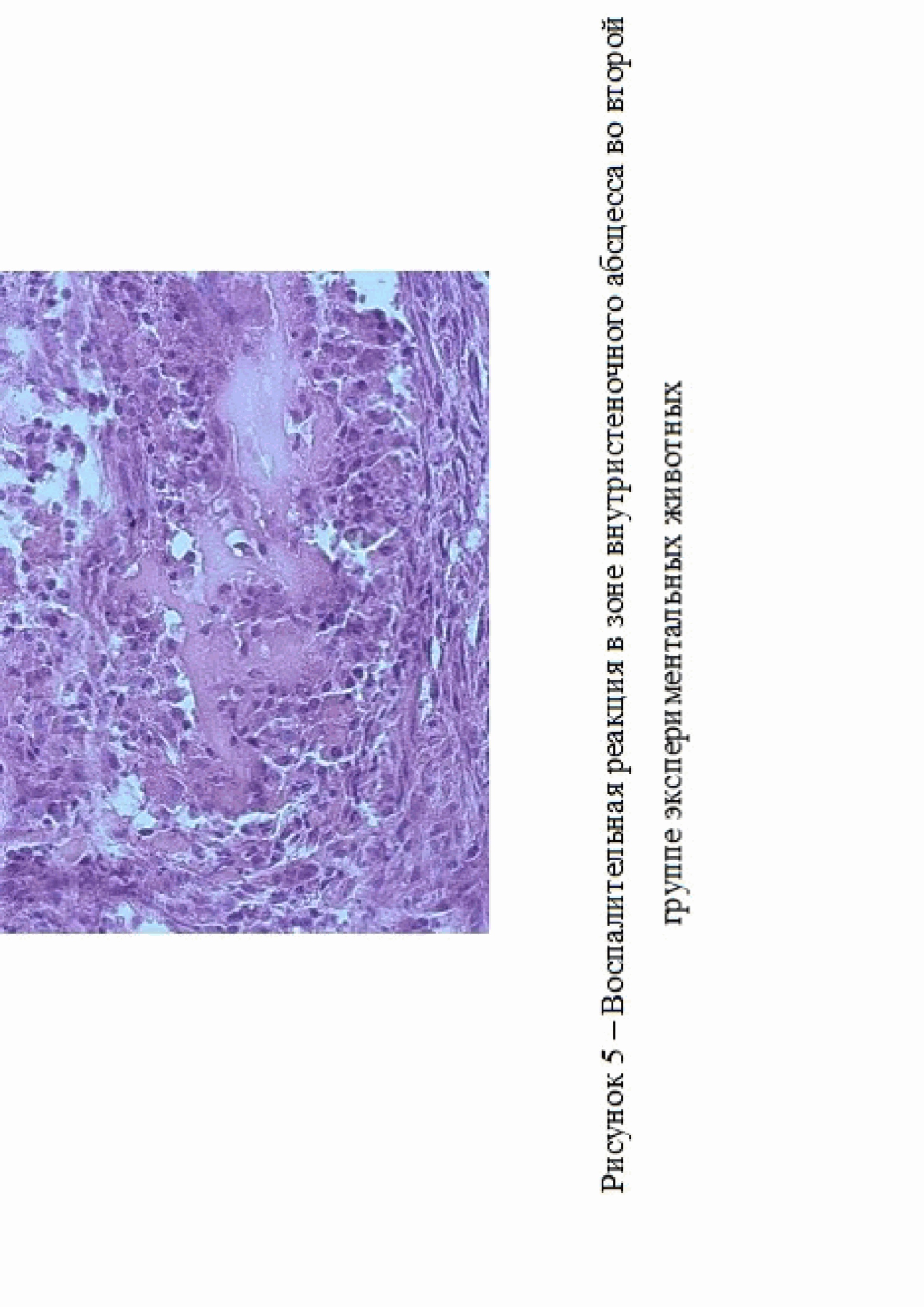
Во второй группе экспериментальных животных, кроме спаек у 1 кролика на 14 сутки исследования был зарегистрирован внутристеночный абсцесс, что могло быть связано с прошиванием кишечной стенки через все слои и развившимся гнойным воспалением, ассоциированным бактериальной инфекцией (рис. 4).
Наличие интенсивной воспалительной реакции было подтверждено гистологическими исследованиями (рис. 5). Для проведения морфологического исследования образцы тканей фиксировали в 10% нейтральном забуференном формалине. Перед проводкой через спирты материал промывали в проточной
воде в течение 30 минут для исключения возможного образования осадка при взаимодействия фосфатов из формалина со спиртами. После проводки через спирты, препараты заливали в парафиновые блоки и окрашивали гематоксилином-эозином с последующим анализом и использованием микроскопа бинокулярного «Биомед-3», оснащенного цифровой камерой sCMOS C310 2 (США). Срезы биологических тканей получали с помощью микротома «Leika RM 2125» (Германия).
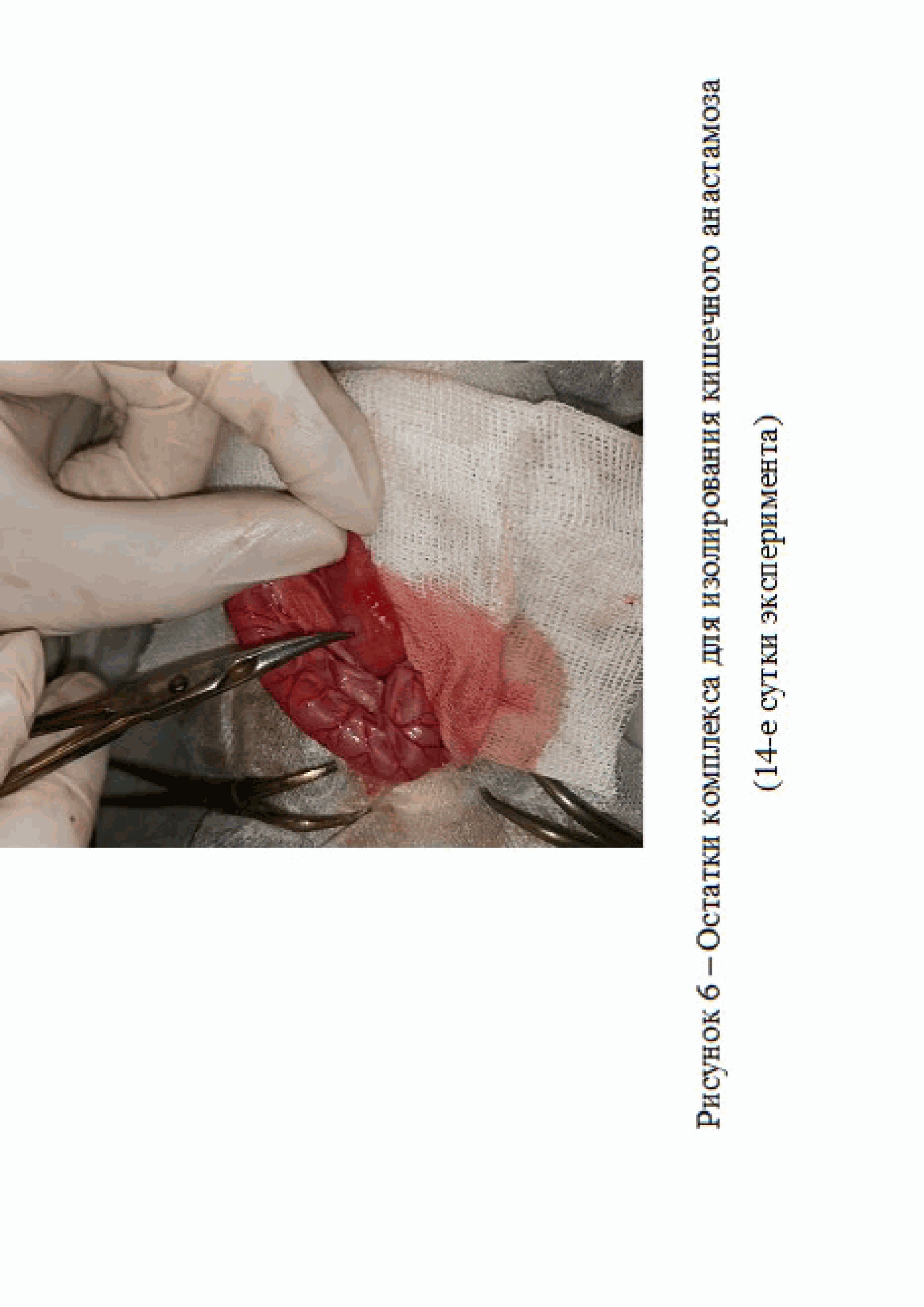
На 14 сутки эксперимента в группе 3 на месте наложения анастамоза не было обнаружено спаек и воспалительного процесса. Наблюдались остатки комплекса для изолирования анастамоза, перешедшей в гелеобразное состояние (рис. 6).
Статистическую обработку полученных результатов проводили по критерию Краскела - Уоллиса (H-критерий) с использованием программы GraphPad Prisma 5.0 (табл. 4).
Таким образом, в результате проведенных исследований было установлено, что в Hэмп. = 13,33094, p = 0,00127. Различия между группами животных в отношении интенсивности развития послеоперационного спаечного процесса статистически значимы при P ≤ 0,01.
Результаты проведенных исследований свидетельствуют о том, что применение комплекса для изолирования кишечного анастамоза предотвращает образование послеоперационных спаек. Включение в комплекс для изолирования адгезивного геля надежно удерживает мембрану на месте анастамоза. Введение в состав мембраны и адгезивного геля антибактериального средства необходимо для уменьшения снижения вероятности развития бактериального воспалительного послеоперационного процесса. Время жизни разработанного комплекса для изолирования кишечного анастамоза составляет 7-14 суток.
Комплекс, состоящий из хитозан-желатиновой мембраны и адгезивного геля на основе Na-КМЦ, содержащих антибиотик предотвращает образование спаек и достоверно уменьшает количество послеоперационных осложнений.
Биодеградируемый антибактериальный комплекс для предотвращения спаечной болезни и послеоперационного перитонита, состоящий из хитозан-желатиновой мембраны с антибиотиком цефтриаксоном и геля для дополнительной фиксации в месте анастамоза на основе натриевой соли карбкосиметилцеллюлозы (Na-КМЦ) с антибиотиком цефтриаксоном, при этом хитозан-желатиновая мембрана получена смешением 1,5 г хитозана в 150 мл 1% уксусной кислоте, 5,0 г желатина в 50,0 г очищенной воды при соотношении смесей желатин-хитозан 3:1 и антибиотика цефтриаксона в количестве 0,03 г на 1 см хитозан-желатиновой мембраны, и адгезивный гель получен смешением 3,0 г Na-КМЦ в 50 мл очищенной воды, 20,0 г цефтриаксона в 40 мл очищенной воды, доведением общей массы до 100,0 г геля.