Результат интеллектуальной деятельности: Отделение антител с тремя легкими цепями при помощи катионообменной хроматографии
Вид РИД
Изобретение
[1] Данная заявка испрашивает приоритет в отношении предварительной заявки на патент США № 62/562188, поданной 22 сентября 2017 г., которая включена в данный документ посредством ссылки.
ССЫЛКА НА ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ, ПРЕДСТАВЛЕННЫЙ В ЭЛЕКТРОННОМ ВИДЕ
[2] Содержание представленного в электронном виде перечня последовательностей (название: 2921_097PC01_ST25; размер: 15736 байт; и дата создания: 21 сентября 2018 г.) полностью включено в данный документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[3] Область изобретения, в целом, относится к способам выделения антител с тремя легкими цепями (H2L3) (например, анти-CD123 антител H2L3) или их антигенсвязывающих фрагментов из композиции антител, содержащей антитела H2L3 или их антигенсвязывающие фрагменты и антитела с двумя легкими цепями (H2L2) (например, анти-CD123 H2L2) или их антигенсвязывающие фрагменты.
УРОВЕНЬ ТЕХНИКИ
[4] Рекомбинантные антитела, сконструированные с реактивными остатками цистеина, то есть «сконструированные введением цистеина антитела», могут быть ковалентно конъюгированы с представляющими интерес лекарственными средствами для создания нацеленных терапевтических средств. Исследования показали, что клетки млекопитающих, стабильно трансфицированные для экспрессии таких сконструированных введением цистеина антител, также секретируют высокомолекулярный вид, известный как антитело с тремя легкими цепями (H2L3) (Gomez et al., Biotechnol Bioeng. 105(4): 748-60 (2010)). Модифицированные цистеином антитела H2L3 представляют собой продукт образования дисульфидной связи между дополнительной легкой цепью и одним из сконструированных остатков цистеина в модифицированном цистеином антителе H2L2. Уровень модифицированных цистеином антител H2L3 в культуре клеток связан с линией клеток и условиями культивирования. Хотя условия культивирования клеток можно изменить, чтобы минимизировать образование H2L3 (например, путем использования температурных сдвигов во время культивирования клеток), результат в значительной степени зависит от клеточной линии (Gomez et al., Biotechnol Prof. 26(5): 1438-45 (2010)).
[5] Из-за сходства с мономерным видом отделение антител H2L3 является проблемой во время последующей очистки моноклональных модифицированных цистеином антител H2L2. В одном конкретном исследовании было обнаружено, что хроматография гидрофобного взаимодействия (HIC) снижает уровень H2L3 от приблизительно 3 % до 0,5 % при очистке сконструированного без введения цистеина моноклонального антитела (Wollacott et al., mAbs 5(6): 925-935 (2013)). В том же исследовании катионообменная хроматография была использована для удаления антител H2L3. Однако даже в модифицированных условиях этого процесса было недостаточно, чтобы снизить процентное содержание H2L3 до менее 1 % во всех протестированных клеточных линиях. Авторы пришли к выводу, что электростатические эффекты в катионообменной хроматографии недостаточно сильны, чтобы удалить антитела H2L3. Таким образом, чтобы получить наиболее стабильный продукт антител (например, для терапевтических антител и иммуноконъюгатов, содержащих такие антитела), существует необходимость в более эффективном отделении видов H2L3 во время очистки антител.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[6] Данное изобретение относится к разработке стратегии эффективной очистки для отделения антител с тремя легкими цепями (H2L3) от антител с двумя легкими цепями (H2L2). В этих способах используется тот факт, что катионообменные смолы разделяют белки, главным образом, на основе заряда. Как указано в данном документе, где рН смолы ниже, чем у представляющего интерес антитела (например, от 3,8 до 6,5), все виды антител, включая H2L3 и H2L2, связываются с катионообменной смолой. Когда антитела элюируются из катионообменных смол с использованием композиции для элюирования с высоким pH и/или низкой концентрацией соли, виды H2L3 элюируются не только в поздних фракциях после элюирования основного пика видов H2L2, но также и в более ранних фракциях, содержащих желаемые виды H2L2. Однако, как показано в данном документе, оптимизация катионообменных смол за счет использования более низкого рН и более высоких концентраций соли может привести к тому, что большинство или все виды H2L3 элюируются в поздних фракциях после элюирования основного пика видов H2L2. При использовании оптимизированной сильной смолы для катионообменной хроматографии POROS™ XS количество антитела H2L3 в композиции антител может быть уменьшено с 11 % до менее чем 1 %, и этот уровень восстановления воспроизводим в различных клеточных линиях.
[7] В некоторых вариантах осуществления способ отделения антител H2L3 или их антигенсвязывающих фрагментов от композиции антител, содержащей антитела H2L3 или их антигенсвязывающие фрагменты и антитела H2L2 или их антигенсвязывающие фрагменты, включает (i) нанесение композиции антител на катионообменную смолу, так что антитела H2L3 или их антигенсвязывающие фрагменты и антитела H2L2 или их антигенсвязывающие фрагменты связываются со смолой; (ii) нанесение композиции для элюирования с рН от приблизительно 3,8 до приблизительно 5,0 на катионообменную смолу; и (iii) сбор композиции H2L2, элюированной из смолы.
[8] В некоторых вариантах осуществления способ отделения антител H2L3 или их антигенсвязывающих фрагментов от композиции антител, содержащей антитела H2L3 или их антигенсвязывающие фрагменты и антитела H2L2 или их антигенсвязывающие фрагменты, включает (i) нанесение композиции антител на катионообменную смолу, так что антитела H2L3 или их антигенсвязывающие фрагменты и антитела H2L2 или их антигенсвязывающие фрагменты связываются со смолой; (ii) нанесение композиции для элюирования с концентрацией соли от приблизительно 300 мМ до приблизительно 600 мМ на катионообменную смолу; и (iii) сбор композиции H2L2, элюированной из смолы.
[9] В некоторых вариантах осуществления способ отделения анти-CD123 антител H2L3 или их антигенсвязывающих фрагментов от композиции анти-CD123 антител, содержащей анти-CD123 антитела H2L3 или их антигенсвязывающие фрагменты и анти-CD123 антитела H2L2 или их антигенсвязывающие фрагменты включает (i) нанесение композиции анти-CD123 антител на катионообменную смолу так, чтобы анти-CD123 антитела H2L3 или их антигенсвязывающие фрагменты и анти-CD123 антитела H2L2 или их антигенсвязывающие фрагменты связывались со смолой; (ii) нанесение композиции для элюирования с рН от приблизительно 3,8 до приблизительно 5,5 на катионообменную смолу; и (iii) сбор композиции анти-CD123 H2L2, элюированной из смолы, причем анти-CD123 антитела H2L3 или их антигенсвязывающие фрагменты и анти-CD123 антитела H2L2 или их антигенсвязывающие фрагменты содержат последовательности CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи SEQ ID NO: 5-7, соответственно, и последовательности CDR1, CDR2 и CDR3 вариабельной области легкой цепи SEQ ID NO: 8-10, соответственно.
[10] В некоторых вариантах осуществления способ отделения анти-CD123 антител H2L3 или их антигенсвязывающих фрагментов от композиции анти-CD123 антител, содержащей анти-CD123 антитела H2L3 или их антигенсвязывающие фрагменты и анти-CD123 антитела H2L2 или их антигенсвязывающие фрагменты включает (i) нанесение композиции анти-CD123 антител на катионообменную смолу так, чтобы анти-CD123 антитела H2L3 или их антигенсвязывающие фрагменты и анти-CD123 антитела H2L2 или их антигенсвязывающие фрагменты связывались со смолой; (ii) нанесение композиции для элюирования с концентрацией соли от приблизительно 300 мМ до приблизительно 600 мМ на катионообменную смолу; и (iii) сбор композиции анти-CD123 H2L2, элюированной из смолы, причем анти-CD123 антитела H2L3 или их антигенсвязывающие фрагменты и анти-CD123 антитела H2L2 или их антигенсвязывающие фрагменты содержат последовательности CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи SEQ ID NO: 5-7, соответственно, и последовательности CDR1, CDR2 и CDR3 вариабельной области легкой цепи SEQ ID NO: 8-10, соответственно.
[11] В некоторых вариантах осуществления не более 2 % антител или их антигенсвязывающих фрагментов в композиции H2L2 представляют собой антитела H2L3 или их антигенсвязывающие фрагменты. В некоторых вариантах осуществления не более 1% антител или их антигенсвязывающих фрагментов в композиции H2L2 представляют собой антитела H2L3 или их антигенсвязывающие фрагменты. В некоторых вариантах осуществления не более 0,5% антител или их антигенсвязывающих фрагментов в композиции H2L2 представляют собой антитела H2L3 или их антигенсвязывающие фрагменты.
[12] В некоторых вариантах осуществления по меньшей мере 98 %, по меньшей мере 99 % или по меньшей мере 99,5 % антител или их антигенсвязывающих фрагментов в композиции H2L2 представляют собой антитела H2L2 или их антигенсвязывающие фрагменты. В некоторых вариантах осуществления композиция H2L2 содержит не более 25 %, не более 20 %, не более 15 %, не более 10 % или не более 5 % антител H2L3 или их антигенсвязывающих фрагментов в композиции антител, наносимой на катионообменную смолу.
[13] В некоторых вариантах осуществления композиция H2L2 содержит один или более элюированных объемов колонки, выбранных из объемов колонки 1-9. В некоторых вариантах осуществления композиция H2L2 содержит элюированные объемы колонки 1-4. В некоторых вариантах осуществления катионообменная смола содержит полистирол, сшитый дивинилбензолом. В некоторых вариантах осуществления катионообменная смола содержит поверхностные функциональные группы сульфопропила (-CH2CH2CH2SO3-). В некоторых вариантах осуществления размер частиц катионообменной смолы составляет приблизительно 50 мкм. В некоторых вариантах осуществления катионообменная смола имеет бимодальное распределение пор по размерам. В некоторых вариантах осуществления бимодальное распределение пор по размерам включает поры диаметром приблизительно 500 нМ и поры диаметром приблизительно 22 нМ. В некоторых вариантах осуществления катионообменная смола представляет собой сильную катионообменную смолу POROS™ XS.
[14] В некоторых вариантах осуществления композиция для элюирования содержит соль. В некоторых вариантах осуществления соль в композиции для элюирования представляет собой хлоридную соль. В некоторых вариантах осуществления хлоридная соль представляет собой хлорид натрия, хлорид калия, хлорид кальция или хлорид магния. В некоторых вариантах осуществления концентрация соли в композиции для элюирования составляет от приблизительно 100 мМ до приблизительно 600 мМ, от приблизительно 300 мМ до приблизительно 500 мМ или от приблизительно 350 мМ до приблизительно 450 мМ. В некоторых вариантах осуществления концентрация соли в композиции для элюирования составляет от приблизительно 300 мМ до приблизительно 500 мМ или от приблизительно 350 мМ до приблизительно 450 мМ. В некоторых вариантах осуществления концентрация соли в композиции для элюирования составляет приблизительно 400 мМ. В некоторых вариантах осуществления композиция для элюирования имеет рН от приблизительно 3,8 до приблизительно 6,5. В некоторых вариантах осуществления композиция для элюирования имеет рН от приблизительно 3,8 до приблизительно 5,0. В некоторых вариантах осуществления композиция для элюирования имеет рН приблизительно 4,2.
[15] В некоторых вариантах осуществления способ включает нанесение композиции для уравновешивания на катионообменную смолу перед нанесением композиции антител на катионообменную смолу. В некоторых вариантах осуществления композиция для уравновешивания содержит ацетат натрия. В некоторых вариантах осуществления концентрация ацетата натрия в композиции для уравновешивания составляет от приблизительно 10 мМ до 150 мМ. В некоторых вариантах осуществления концентрация ацетата натрия в композиции для уравновешивания составляет приблизительно 50 мМ. В некоторых вариантах осуществления композиция для уравновешивания имеет рН от приблизительно 3,8 до приблизительно 6,5. В некоторых вариантах осуществления композиция для уравновешивания имеет рН приблизительно 4,2.
[16] В некоторых вариантах осуществления композиция антител содержит от приблизительно 10 до приблизительно 100 г/л белка. В некоторых вариантах осуществления композиция антител содержит от приблизительно 30 г/л до приблизительно 50 г/л или от приблизительно 35 г/л до приблизительно 45 г/л белка. В некоторых вариантах осуществления композиция антител содержит приблизительно 40 г/л белка. В некоторых вариантах осуществления композиция антител имеет рН от приблизительно 3,8 до приблизительно 6,5. В некоторых вариантах осуществления композиция антител имеет рН приблизительно 4,2.
[17] В некоторых вариантах осуществления от приблизительно 1 % до приблизительно 20 % антител или их антигенсвязывающих фрагментов в композиции антител представляют собой антитела H2L3 или их антигенсвязывающие фрагменты. В некоторых вариантах осуществления от приблизительно 1 % до приблизительно 15 %, или от приблизительно 5 % до приблизительно 15 %, или от приблизительно 3 % до приблизительно 12 %, или от приблизительно 10 % до приблизительно 15 % антител или их антигенсвязывающих фрагментов в композиции антител представляют собой антитела H2L3 или их антигенсвязывающие фрагменты. В некоторых вариантах осуществления композиция H2L2 содержит по меньшей мере 40 %, по меньшей мере 45 %, по меньшей мере 50 % или по меньшей мере 55% антител H2L2 или их антигенсвязывающих фрагментов в композиции антител, наносимой на катионообменную смолу.
[18] В некоторых вариантах осуществления композиция антител содержит сконструированные введением цистеина антитела или их антигенсвязывающие фрагменты. В некоторых вариантах осуществления сконструированные введением цистеина антитела или их антигенсвязывающие фрагменты содержат сконструированный остаток цистеина в положении 442 согласно нумерации EU/OU. В некоторых вариантах осуществления композиция антител содержит антитела. В некоторых вариантах осуществления композиция антител содержит антигенсвязывающие фрагменты антител. В некоторых вариантах осуществления композиция антител содержит Fab, Fab', F(ab')2, Fd, одноцепочечный Fv или scFv, дисульфид-связанный Fv, домен V-NAR, IgNar, интратело, IgGΔCH2, минитело, F(ab')3, тетратело, триатело, диатело, однодоменное антитело, DVD-Ig, Fcab, mAb2, (scFv)2 или scFv-Fc. В некоторых вариантах осуществления композиция антител содержит антитела или их антигенсвязывающие фрагменты, полученные из клеточной линии CHO.
[19] В некоторых вариантах осуществления способ дополнительно включает конъюгирование антител H2L2 или их антигенсвязывающих фрагментов в композиции H2L2 с цитотоксином с образованием композиции иммуноконъюгатов. В некоторых вариантах осуществления композицию иммуноконъюгатов получают в соответствии со способами, описанными в данном документе. В некоторых вариантах осуществления композиция иммуноконъюгатов содержит не более 2 % антител H2L3 или их антигенсвязывающих фрагментов. В некоторых вариантах осуществления композиция иммуноконъюгатов содержит не более 1% антител H2L3 или их антигенсвязывающих фрагментов. В некоторых вариантах осуществления композиция иммуноконъюгатов содержит не более 0,5% антител H2L3 или их антигенсвязывающих фрагментов.
[20] В некоторых вариантах осуществления композицию H2L2 получают в соответствии со способами, описанными в данном документе. Композиция H2L2 по п. 46, содержащая не более 2 % антител H2L3 или их антигенсвязывающих фрагментов. В некоторых вариантах осуществления композиция H2L2 содержит не более 1 % антител H2L3 или их антигенсвязывающих фрагментов. В некоторых вариантах осуществления композиция H2L2 содержит не более 0,5% антител H2L3 или их антигенсвязывающих фрагментов.
[21] В некоторых вариантах осуществления (i) катионообменная смола содержит полистирол, сшитый дивинилбензолом, поверхностные функциональные группы сульфопропила (-CH2CH2CH2SO3-), и имеет размер частиц приблизительно 50 мкм и бимодальное распределение пор по размерам, имеющее поры диаметром приблизительно 500 нМ, и поры диаметром приблизительно 22 нМ; (ii) композиция для элюирования содержит от приблизительно 300 до 600 мМ хлоридной соли и рН от приблизительно 3,8 до приблизительно 5,0; (iii) композиция антител содержит от приблизительно 10 до приблизительно 100 г/л белка, и от приблизительно 10 % до приблизительно 15 % антител или их антигенсвязывающих фрагментов в композиции антител представляют собой антитела H2L3 или их антигенсвязывающие фрагменты; (iv) композиция H2L2 содержит один или более элюированных объемов колонки, выбранных из объемов колонки 1-9; и (v) не более 2 % антител или их антигенсвязывающих фрагментов в композиции H2L2 представляют собой антитела H2L3 или их антигенсвязывающие фрагменты.
[22] В некоторых вариантах осуществления (i) катионообменная смола содержит полистирол, сшитый дивинилбензолом, поверхностные функциональные группы сульфопропила (-CH2CH2CH2SO3-), и имеет размер частиц приблизительно 50 мкм и бимодальное распределение пор по размерам, имеющее поры диаметром приблизительно 500 нМ, и поры диаметром приблизительно 22 нМ; (ii) композиция для элюирования содержит от приблизительно 400 мМ NaCl и имеет рН приблизительно 4,2; (iii) композиция антител содержит от приблизительно 30 до приблизительно 50 г/л белка, и от приблизительно 10 % до приблизительно 15 % антител или их антигенсвязывающих фрагментов в композиции антител представляют собой антитела H2L3 или их антигенсвязывающие фрагменты; (iv) композиция H2L2 содержит элюированные объемы колонки 1-4; и (v) не более 1% антител или их антигенсвязывающих фрагментов в композиции H2L2 представляют собой антитела H2L3 или их антигенсвязывающие фрагменты.
[23] В некоторых вариантах осуществления композиция содержит анти-CD123 антитела или их антигенсвязывающие фрагменты, причем менее 1 % анти-CD123 антител или их антигенсвязывающих фрагментов представляют собой антитела H2L3 или их антигенсвязывающие фрагменты, и при этом анти-CD123 антитела или их антигенсвязывающие фрагменты содержат последовательности CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи SEQ ID NO: 5-7, соответственно, и последовательности CDR1, CDR2 и CDR3 вариабельной области легкой цепи SEQ ID NO: 8-10, соответственно. В некоторых вариантах осуществления анти-CD123 антитело содержит последовательность вариабельной области тяжелой цепи SEQ ID NO: 1. В некоторых вариантах осуществления анти-CD123 антитело или его антигенсвязывающий фрагмент содержат последовательность вариабельной области легкой цепи SEQ ID NO: 2. В некоторых вариантах осуществления анти-CD123 антитело или его антигенсвязывающий фрагмент сконструированы введением цистеина. В некоторых вариантах осуществления анти-CD123 антитело содержит последовательность тяжелой цепи SEQ ID NO: 3. В некоторых вариантах осуществления анти-CD123 антитело содержит последовательность легкой цепи SEQ ID NO: 4. В некоторых вариантах осуществления менее 0,5 % анти-CD123 антител или их антигенсвязывающих фрагментов представляют собой антитела H2L3 или их антигенсвязывающие фрагменты.
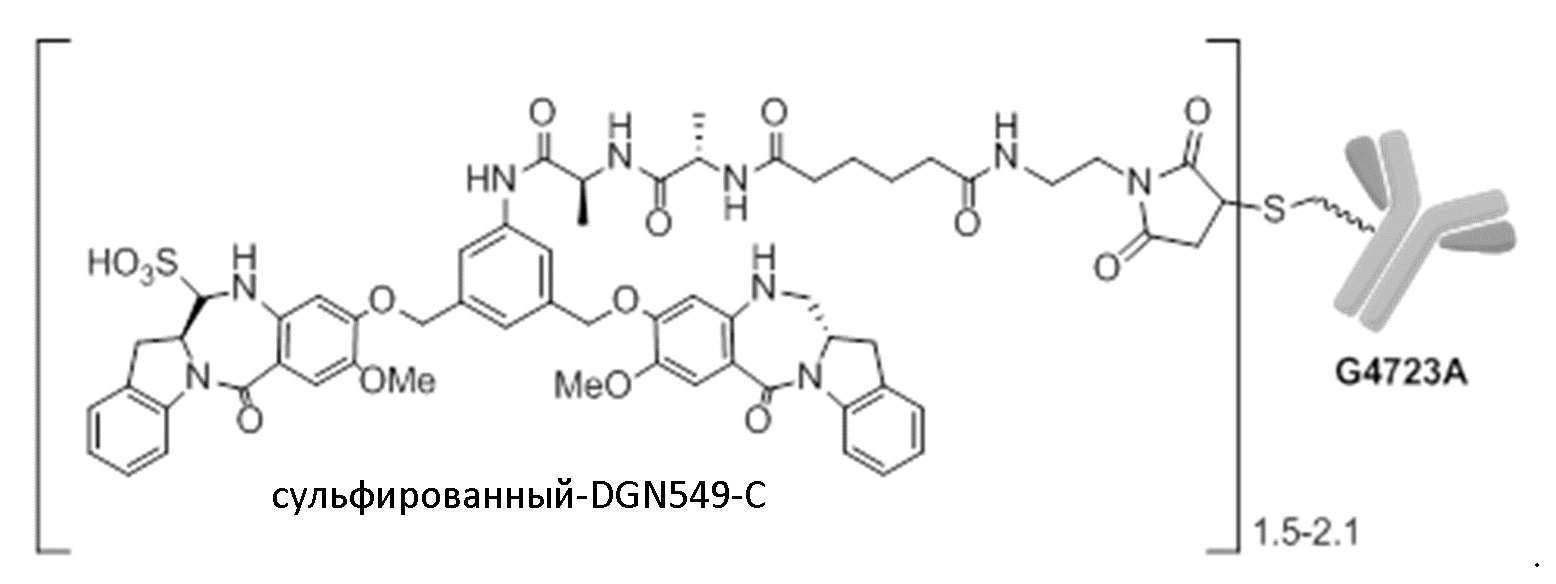
[24] В некоторых вариантах осуществления композиция содержит анти-CD123 иммуноконъюгаты, причем иммуноконъюгаты содержат анти-CD123 антитела или их антигенсвязывающие фрагменты, связанные с DGN549-C, при этом менее 1 % анти-CD123 антител или их антигенсвязывающих фрагментов представляют собой антитела H2L3 или их антигенсвязывающие фрагменты, и при этом анти-CD123 антитела или их антигенсвязывающие фрагменты содержат последовательности CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи SEQ ID NO: 5-7, соответственно, и последовательности CDR1, CDR2 и CDR3 вариабельной области легкой цепи SEQ ID NO: 8-10, соответственно. В некоторых вариантах осуществления анти-CD123 антитело содержит последовательность вариабельной области тяжелой цепи SEQ ID NO: 1. В некоторых вариантах осуществления анти-CD123 антитело или его антигенсвязывающий фрагмент содержат последовательность вариабельной области легкой цепи SEQ ID NO: 2. В некоторых вариантах осуществления анти-CD123 антитело или его антигенсвязывающий фрагмент сконструированы введением цистеина. В некоторых вариантах осуществления анти-CD123 антитело содержит последовательность тяжелой цепи SEQ ID NO: 3. В некоторых вариантах осуществления анти-CD123 антитело содержит последовательность легкой цепи SEQ ID NO: 4. В некоторых вариантах осуществления иммуноконъюгат имеет структуру:
сульфированный-DGN549-C
[25] В некоторых вариантах осуществления менее 0,5 % анти-CD123 антител или их антигенсвязывающих фрагментов представляют собой антитела H2L3 или их антигенсвязывающие фрагменты.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ/ФИГУР
[26] На Фиг. 1 показана хроматограмма эксклюзионной ультраэффективной жидкостной хроматографии (SEC-UPLC) для композиции сконструированного введением цистеина моноклонального антитела (CysmAb) после очистки белком А. Обозначенные пики представляют собой мономер CysmAb, агрегаты, антитело с тремя легкими цепями (H2L3) и низкомолекулярные (LMW) виды. Ось Y хроматограммы представляет собой меру интенсивности поглощения (в ЕОП или единицах оптической плотности). На оси X указаны единицы времени (минуты) и они используются для определения времени удерживания для каждого пика.
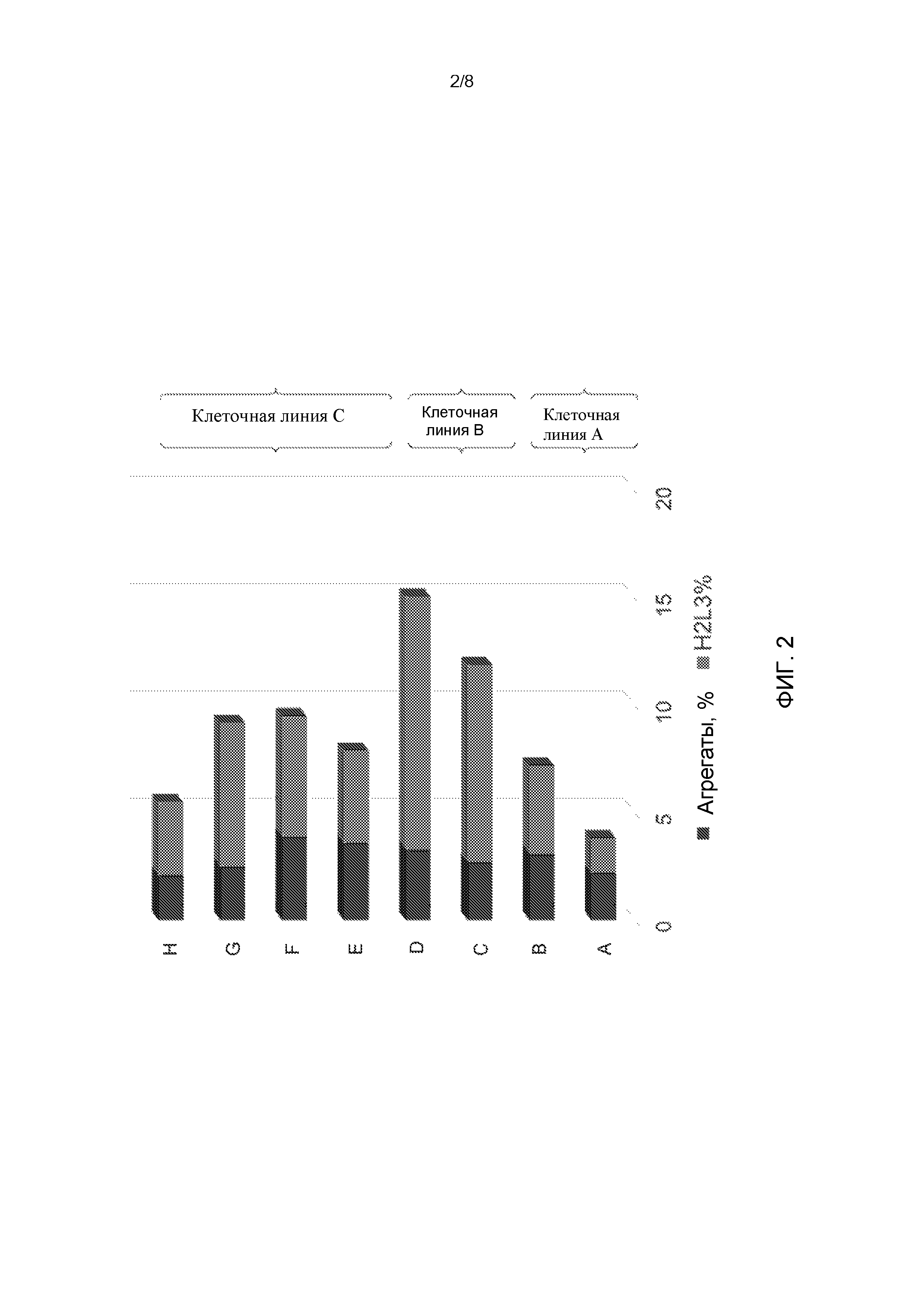
[27] На Фиг. 2 показано процентное содержание агрегатов (темно-серые столбцы) и антител H2L3 (светло-серые столбцы) в различных производственных партиях биореактора (A, B, C, D, E, F, G и H). Агрегаты и антитела к H2L3 в партиях A и B были получены в клеточной линии A. Агрегаты и антитела к H2L3 в партиях C и D были получены в клеточной линии B. Агрегаты и антитела к H2L3 в партиях E, F, G и H были получены в клеточной линии С.
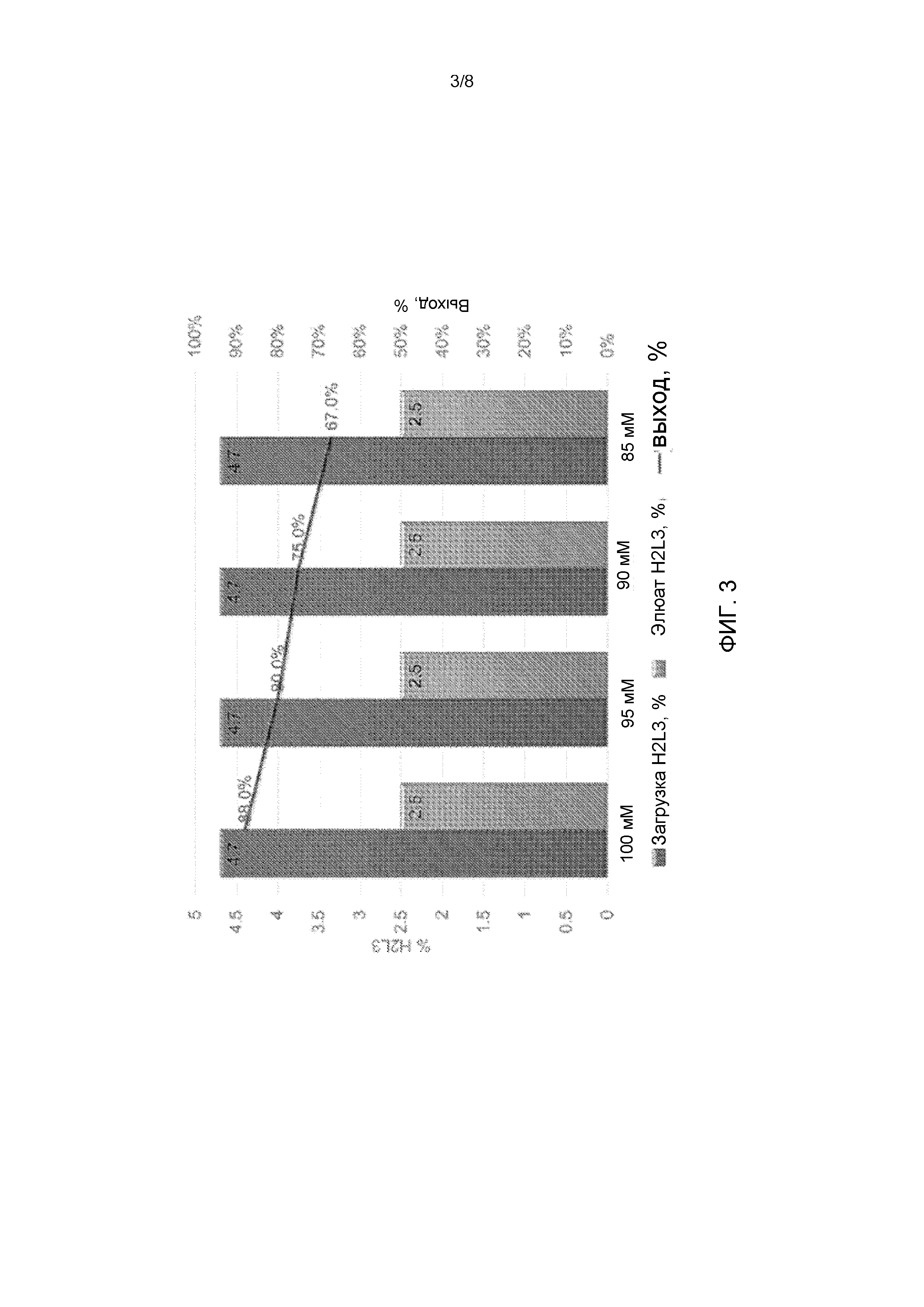
[28] На Фиг. 3 показано процентное содержание антител H2L3 в элюате после очистки керамическим гидроксиапатитом (CHT) при различных концентрациях соли (100 мМ, 95 мМ, 90 мМ или 85 мМ калий-фосфатного буфера). Загрузка H2L3% (темно-серые столбцы), элюат H2L3% (светло-серые столбцы).
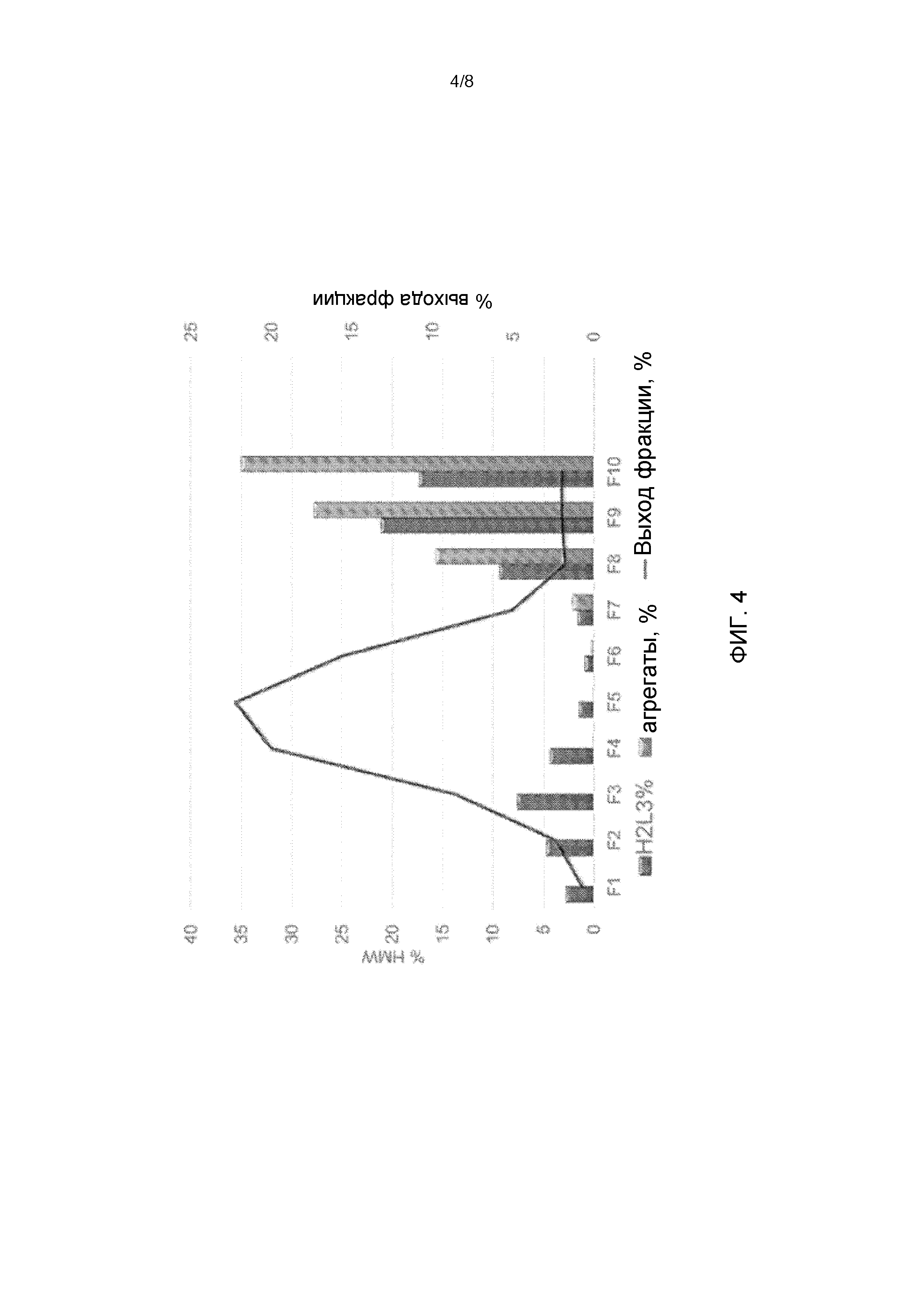
[28] На Фиг. 4 показан профиль элюирования сконструированных введением цистеина видов мкАт, наложенных на профиль элюирования агрегатов и видов H2L3. Выход фракции % (черная линия), агрегаты % (светло-серые столбцы) и H2L3 % (темно-серые столбцы) измеряли для каждой фракции 1-10 (F1-F10) (ось х).
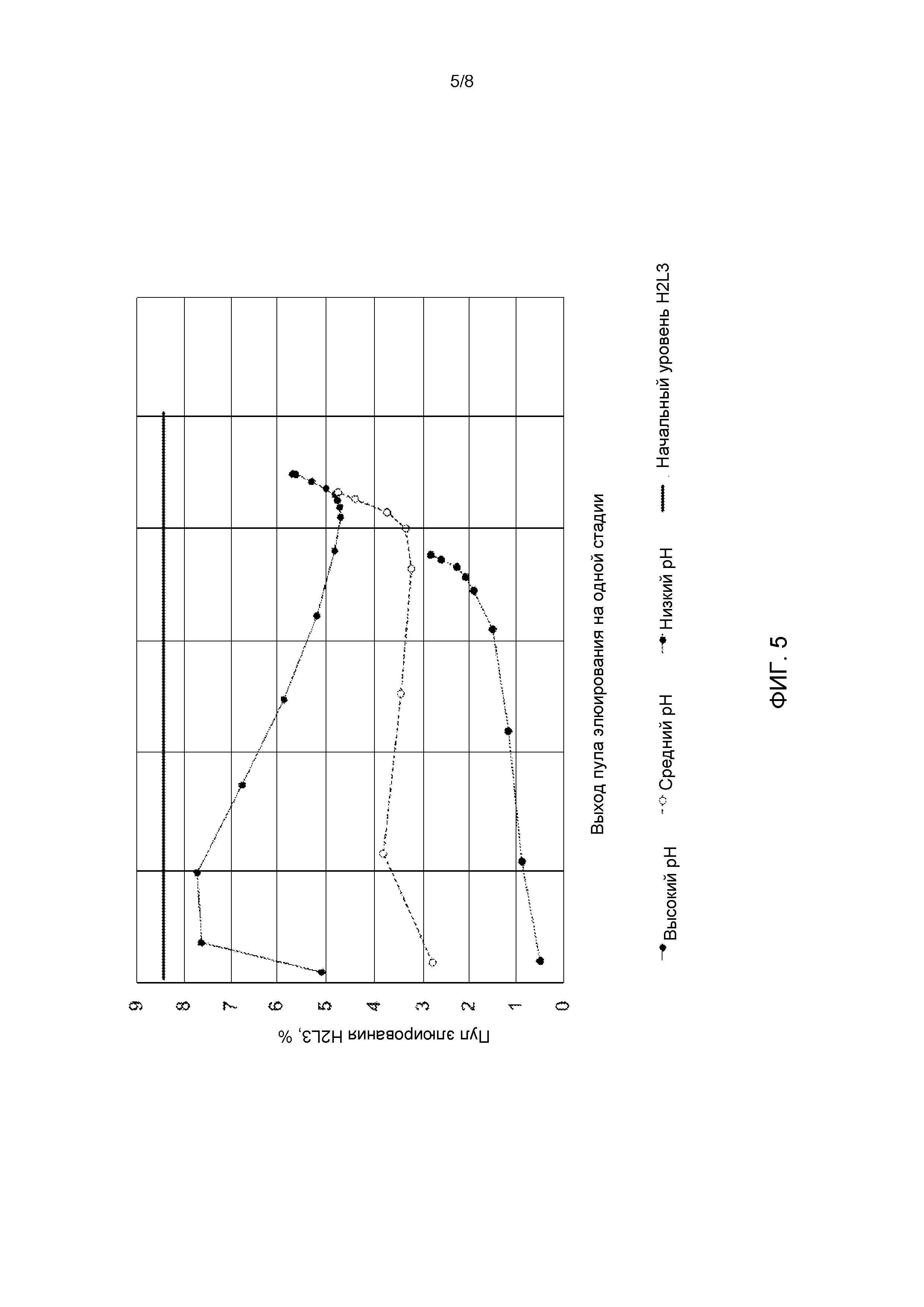
[30] На Фиг. 5 показано процентное содержание H2L3 в пуле элюирования при разных значениях pH. Высокий pH (сплошная линия, черный круг), средний pH (пунктирная линия, незакрашенный круг), низкий pH (пунктирная линия, черный круг), начальный уровень H2L3 (прямая черная линия).
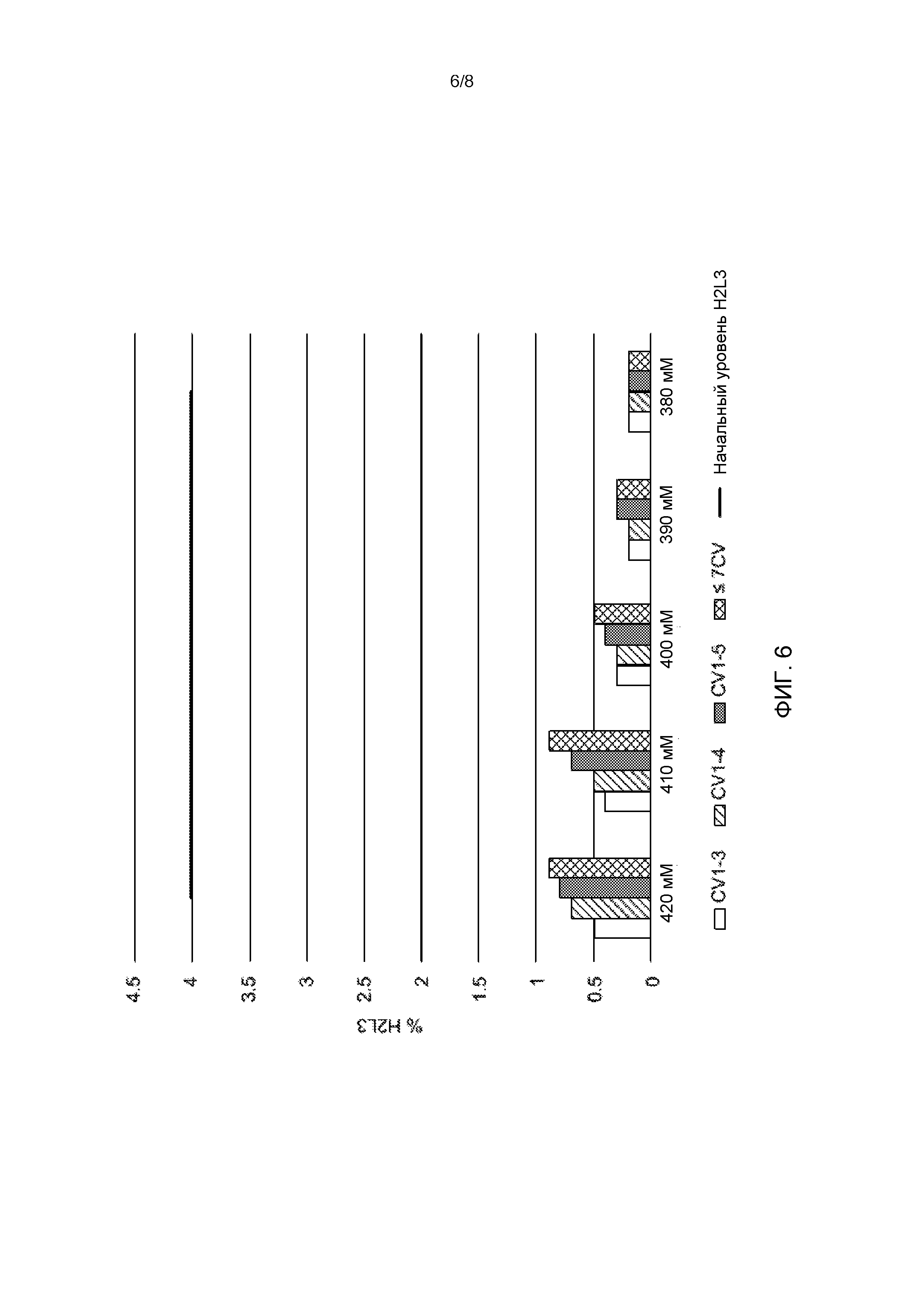
[31] На Фиг. 6 показано процентное содержание H2L3 в элюате при различных концентрациях NaCl (420 мМ, 410 мМ, 400 мМ, 390 мМ и 380 мМ) и собираемых объемах (CV1-3, CV1-4, CV1-5 и менее/равных 7CV). Начальный уровень H2L3 (прямая черная линия).
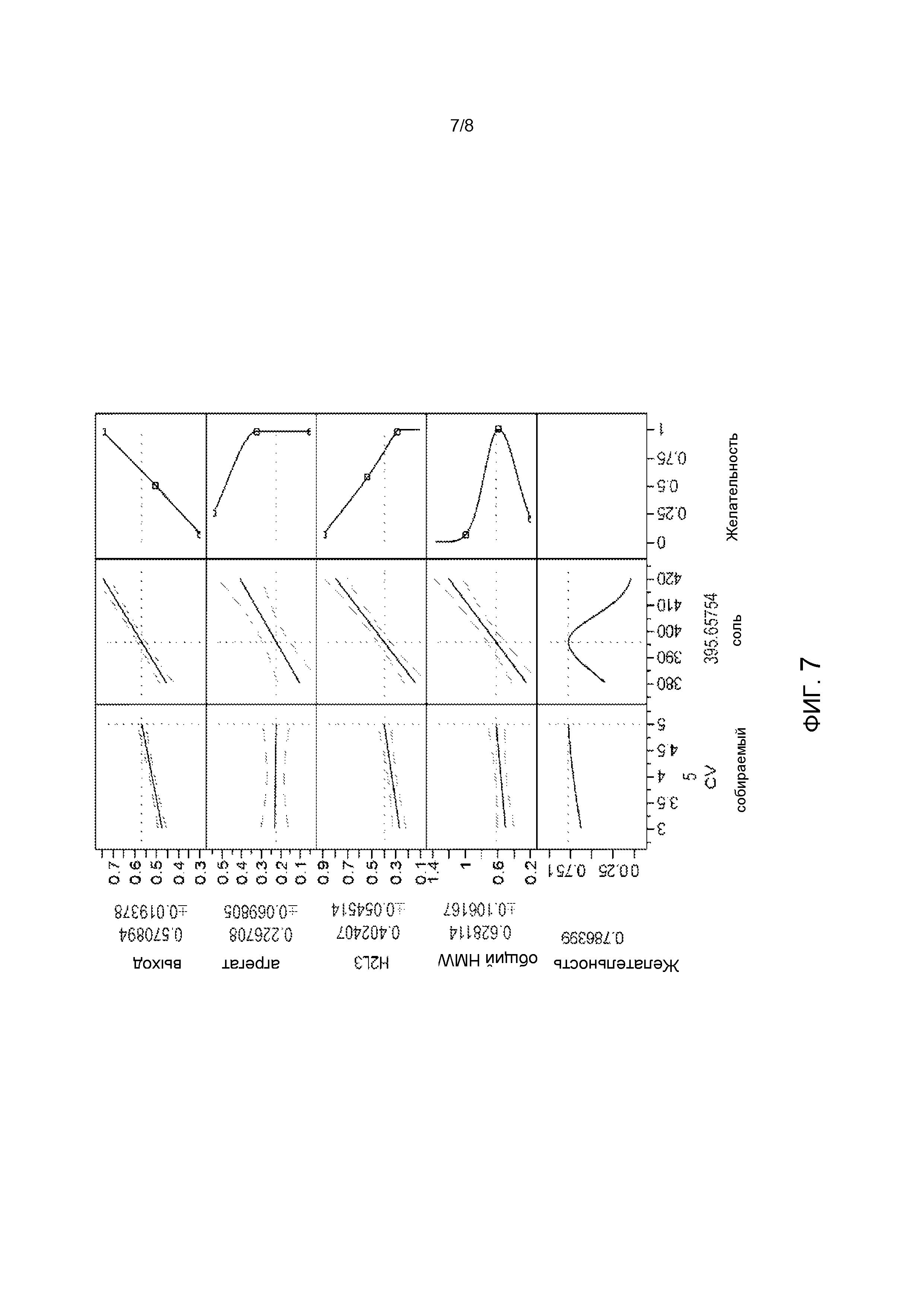
[32] На Фиг. 7 показаны окончательные условия элюирования для катионообменной хроматографии POROS™ XS, основанные на статистическом анализе желательности очистки CysmAb.
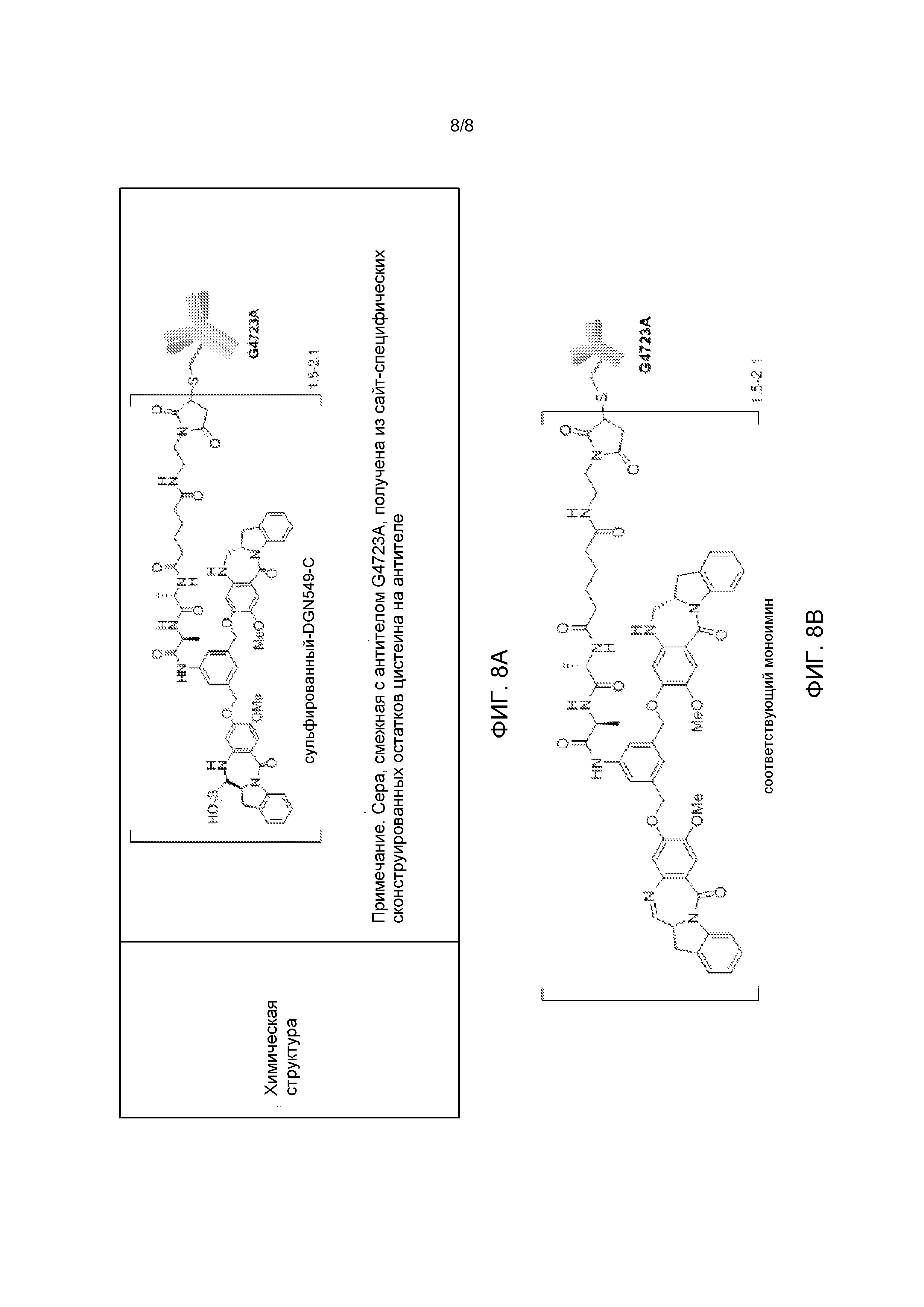
[33] На Фиг. 8А показана химическая структура IMGN632. IMGN632 представляет собой композицию, содержащую иммуноконъюгаты, содержащие анти-CD123 антитело G4723, связанное с цитотоксической полезной нагрузкой DGN549-C, в бисульфите натрия. Большая часть иммуноконъюгата в композиции находится в сульфированном варианте, приведенном на Фиг. 8А.
[34] На Фиг. 8В показана несульфированная форма иммуноконъюгата, содержащая анти-CD123 антитело G4723, связанное с цитотоксической полезной нагрузкой DGN549-C (моноиминовая структура), которая также может присутствовать в композиции IMGN632.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[35] В данном изобретении предложены способы отделения антител H2L3 (например, анти-CD123 антител H2L3) или их антигенсвязывающих фрагментов от композиции антител, содержащей антитела H2L3 или их антигенсвязывающие фрагменты и антитела H2L2 (например, анти-CD123 антитела) или их антигенсвязывающие фрагменты.
I. Определения
[36] Для облегчения понимания данного изобретения ниже приведен ряд терминов и фраз.
[37] «Катионообменная смола» относится к твердой фазе, которая заряжена отрицательно и которая имеет свободные катионы для обмена с катионами в водном растворе, прошедшем через твердую фазу. Можно использовать любой отрицательно заряженный лиганд, присоединенный к твердой фазе, подходящей для образования катионообменной смолы, например, карбоксилат, сульфонат и другие. Коммерчески доступные катионообменные смолы включают, но не ограничиваются ими, например, те, которые имеют группу на основе сульфоната; группу на основе сульфоэтила; группу на основе сульфопропила; группу на основе сульфоизобутила; группу на основе сульфоксиэтила, группу на основе карбоксиметила; группы на основе сульфоновой и карбоновой кислот; группу на основе карбоновой кислоты; группу на основе сульфоновой кислоты; и группу на основе ортофосфата. Как указано в данном документе белки (например, антитела или их антигенсвязывающие фрагменты) могут быть разделены на основе взаимодействия между отрицательно заряженными группами в катионообменной смоле и положительно заряженными группами на белках (например, антителами или их антигенсвязывающими фрагментами).
[38] Термин «элюировать» и его грамматические варианты относятся к удалению молекулы, например, представляющего интерес полипептида, из смолы (например, хроматографического материала) с использованием соответствующих условий, например, изменения ионной силы или рН буфера, окружающего смолу (например, хроматографический материал), путем изменения гидрофобности молекулы или путем изменения химического свойства лиганда (например, заряда), так что представляющий интерес белок не может связывать смолу и, следовательно, элюируется из смолы (например, колонки для хроматографии). Термин «элюат» относится к элюируемому компоненту из смолы (например, из колонки), содержащей представляющий интерес полипептид, когда раствор наносится на колонку. После элюирования представляющего интерес полипептида смолу (например, колонку) можно регенерировать, дезинфицировать и хранить в случае необходимости.
[39] Термин «антитело» означает молекулу иммуноглобулина, которая распознает и специфически связывается с мишенью, такой как белок, полипептид, пептид, углевод, полинуклеотид, липид, или комбинацией вышеперечисленного, через по меньшей мере один сайт распознавания антигена в вариабельной области молекулы иммуноглобулина. В контексте данного документа термин «антитело» включает интактные поликлональные антитела, интактные моноклональные антитела, химерные антитела, гуманизированные антитела, человеческие антитела, гибридные белки, содержащие антитело, и любую другую модифицированную молекулу иммуноглобулина при условии, что антитела проявляют желаемую биологическую активность. Антитело может быть любым из пяти основных классов иммуноглобулинов: IgA, IgD, IgE, IgG, и IgM, или их подклассов (изотипов) (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2), на основе идентичности их константных доменов тяжелой цепи, называемых альфа, дельта, эпсилон, гамма и мю, соответственно. Различные классы иммуноглобулинов имеют различные и хорошо известные структуры субъединиц и трехмерные конфигурации. Антитела могут быть неконъюгированными или конъюгированными с другими молекулами, такими как токсины, радиоизотопы и т. д.
[40] Термин «фрагмент антитела» относится к части интактного антитела с достаточным положительным зарядом для связывания с катионообменной смолой. «Антигенсвязывающий фрагмент» относится к части интактного антитела, которая связывается с антигеном и имеет достаточный положительный заряд для связывания с катионообменной смолой. Антигенсвязывающий фрагмент может содержать определяющие антигенность вариабельные области интактного антитела. Примеры фрагментов антител включают, но не ограничиваются ими, фрагменты Fab, Fab', F(ab')2, и Fv, линейные антитела, и одноцепочечные антитела.
[41] Термин «антитело с тремя легкими цепями» или «H2L3» или его антигенсвязывающий фрагмент относится к антителу или его антигенсвязывающему фрагменту, который содержит две тяжелые цепи или их фрагменты и три легкие цепи или их фрагменты.
[42] Термин «антитело с двумя легкими цепями» или «H2L2» или его антигенсвязывающий фрагмент относится к антителу или его антигенсвязывающему фрагменту, который содержит две тяжелые цепи или их фрагменты и две легкие цепи или их фрагменты.
[43] Термин «композиция антител» относится к композиции, содержащей антитела или их антигенсвязывающие фрагменты. Композиция антител может содержать антитела и другие компоненты, которые были получены в клеточной культуре (например, из клеток СНО), очищены с использованием колонки с белком А и, необязательно, дополнительно очищены с использованием анионообменной колонки. В дополнение к антителам или их антигенсвязывающим фрагментам композиция антител может содержать, например, трис-уксусную кислоту. Композиция антител также может содержать агрегаты.
[44] Композиция «H2L2» относится к композиции, элюированной из катионообменной смолы, которая содержит большую долю видов H2L2, чем композиция антител, нанесенная на катионообменную смолу.
[45] Композиция «H2L3» относится к композиции, элюированной из катионообменной смолы, которая содержит большую долю видов H2L3, чем композиция антител, нанесенная на катионообменную смолу.
[46] Термин «сконструированное введением цистеина» антитело или его антигенсвязывающий фрагмент включает антитело или его антигенсвязывающий фрагмент по меньшей мере с одним цистеином («Cys»), который обычно не присутствует в данном остатке легкой цепи или тяжелой цепи антитела или его антигенсвязывающего фрагмента. Такой Cys, который также может называться «сконструированным Cys», может быть сконструирован с использованием любой стандартного метода молекулярной биологии или рекомбинантной технологии (например, путем замены кодирующей последовательности для остатка, не являющегося Cys, в остатке-мишени на кодирующую последовательность для Cys). Например, если исходный остаток представляет собой Ser с кодирующей последовательностью 5’-UCU-3’, кодирующая последовательность может быть мутирована (например, посредством сайт-направленного мутагенеза) до 5’-UGU-3’, которая кодирует Cys. В определенных вариантах осуществления сконструированное введением Cys антитело или его антигенсвязывающий фрагмент имеет сконструированный Cys в тяжелой цепи. В определенных вариантах осуществления сконструированный Cys находится в домене СН3 тяжелой цепи или вблизи него. В некоторых вариантах осуществления сконструированный Cys находится в остатке 442 тяжелой цепи (нумерация EU/OU; индекс EU, Kabat et al, Sequences of Proteins of Immunological Interest, 5th Ed., NIH publication No. 91-3242, 1991, все содержание которой включено в данный документ посредством ссылки). В некоторых вариантах осуществления область Fc содержит цистеин в одном или более положениях 239, 282, 289, 297, 312, 324, 330, 335, 337, 339, 356, 359, 361, 383, 384, 398, 400, 440, 422 и 442, пронумерованных индексом EU. В некоторых вариантах осуществления цистеином можно заменить один или более из следующих остатков: V205 (нумерация по Кабату) в легкой цепи, A118 (нумерация EU) в тяжелой цепи и S400 (нумерация EU) в области Fc тяжелой цепи. В некоторых вариантах осуществления вариабельный домен легкой цепи, например, scFv, имеет цистеин в положении 100 согласно Кабату. В определенных вариантах осуществления вариабельный домен тяжелой цепи, например, scFv, имеет цистеин в положении 44 согласно Кабату. Сконструированные введением цистеина антитела могут быть получены, как описано, например, в патенте США № 7521541, в патенте США № 7855275, опубликованной заявке на патент США № 20110033378 и WO 2011/005481.
[47] «Моноклональное» антитело или его антигенсвязывающий фрагмент относится к гомогенной популяции антител или их антигенсвязывающих фрагментов, вовлеченных в высокоспецифическое распознавание и связывание одной антигенной детерминанты, или эпитопа. Этим они отличаются от поликлональных антител, которые обычно включают различные антитела, направленные против различных антигенных детерминант. Термин «моноклональное» антитело или его антигенсвязывающий фрагмент охватывает как интактные, так и полноразмерные моноклональные антитела, а также фрагменты антител (например, Fab, Fab', F(ab')2, Fv), одноцепочечные (ScFv) мутанты, гибридные белки, содержащие часть антитела, и любую другую модифицированную молекулу иммуноглобулина, содержащую сайт распознавания антигена. Кроме того, «моноклональное» антитело или его антигенсвязывающий фрагмент относится к таким антителам и их антигенсвязывающим фрагментам, сделанным любым количеством способов, в том числе, но не ограничиваясь ими, гибридомой, селекцией фагов, рекомбинантной экспрессией, и трансгенными животными.
[48] Термин «гуманизированное» антитело или его антигенсвязывающий фрагмент относится к формам нечеловеческих (например, мышиных) антител или их антигенсвязывающих фрагментов, которые являются специфическими иммуноглобулиновыми цепями, химерными иммуноглобулинами или их фрагментами, которые содержат минимальное нечеловеческие (например, мышиные) последовательности. Как правило, гуманизированные антитела или антигенсвязывающие фрагменты представляют собой иммуноглобулины человека, в которых остатки из определяющей комплементарность области (CDR) заменены остатками из CDR отличных от человека видов (например, мыши, крысы, кролика, хомяка), которые имеют желаемую специфичность, аффинность и характеристики («с привитой CDR») (Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-327 (1988); Verhoeyen et al., Science 239:1534-1536 (1988)). В некоторых случаях остатки каркасной области (FR) Fv иммуноглобулина человека заменены соответствующими остатками антитела или фрагмента из отличных от человека видов, которое обладает желаемой специфичностью, аффинностью и характеристиками. Гуманизированное антитело или его антигенсвязывающий фрагмент могут быть дополнительно модифицированы путем замены дополнительных остатков или в каркасной области Fv и/или в пределах замененных нечеловеческих остатков для улучшения и оптимизации специфичности, аффинности, и/или характеристик антитела или его антигенсвязывающего фрагмента. В общем, гуманизированное антитело или его антигенсвязывающий фрагмент будут содержать по существу все из по меньшей мере одного, и, как правило, двух или трех вариабельных доменов, содержащих все или по существу все области CDR, которые соответствуют нечеловеческому иммуноглобулину, а все или по существу все области FR представляют собой области консенсусной последовательности человеческого иммуноглобулина. Гуманизированное антитело или его антигенсвязывающий фрагмент могут также содержать по меньшей мере часть константной области или домена (Fc) иммуноглобулина, как правило, иммуноглобулина человека. Примеры способов, используемых для создания гуманизированных антител описаны в патенте США 5225539; Roguska et al., Proc. Natl. Acad. Sci., USA, 91(3):969-973 (1994), и Roguska et al., Protein Eng. 9(10):895-904 (1996). В некоторых вариантах осуществления «гуманизированное антитело» представляет собой антитело с измененной поверхностью.
[49] «Вариабельная область» антитела относится к вариабельной области легкой цепи антитела или вариабельной области тяжелой цепи антитела, или отдельно, или в комбинации. Каждая из вариабельных областей тяжелой и легкой цепи состоит из четырех каркасных областей (FR), соединенных тремя определяющими комплементарность областями (CDR), также известными как гипервариабельные области. CDR, в каждой цепи удерживаются вместе в непосредственной близости посредством FR, и, с CDR из другой цепи способствуют образованию антигенсвязывающего участка антител. Существует по меньшей мере два способа определения CDR: (1) подход, основанный на межвидовой вариабельности последовательностей (т. е. Kabat et al., Sequences of Proteins of Immunological Interest, (5th ed., 1991, National Institutes of Health, Bethesda Md.), "Kabat"); и (2) подход, основанный на кристаллографических исследованиях комплексов антиген-антитело (Al-lazikani et al, J. Molec. Biol. 273:927-948 (1997)). Кроме того, иногда в данной области техники для определения CDR используются комбинации этих двух подходов.
[50] Система нумерации по Кабату в общем случае используется для обозначения остатка в вариабельном домене (приблизительно остатки 1-107 легкой цепи и остатки 1-113 тяжелой цепи) (например, Kabat et al., Sequences of Immunological Interest. (5th Ed., 1991, National Institutes of Health, Bethesda, Md.) ("Kabat").
[51] Нумерация положений аминокислот как в Кабат относится к системе нумерации, используемой для вариабельных доменов тяжелой цепи или вариабельных доменов легкой цепи, составляющих антитела в Kabat и др. (Sequences of Immunological Interest. (5th Ed., 1991, National Institutes of Health, Bethesda, Md.), "Kabat"). При использовании этой системы нумерации фактическая линейная аминокислотная последовательность может содержать меньшее количество или дополнительное количество аминокислот, что соответствует укорочению FR или CDR вариабельного домена или вставке в них. Например, вариабельный домен тяжелой цепи может включать единичную аминокислотную вставку (остаток 52a в соответствии с Кабат) после остатка 52 в H2 и вставленные аминокислотные остатки (например, остатки 82а, 82b и 82c и т. д. в соответствии с Кабат) после FR аминокислотного остатка 82 тяжелой цепи. Нумерация остатков по Кабату может быть определена для данного антитела путем выравнивания областей гомологии в последовательности антитела со «стандартной» пронумерованной по Кабату последовательностью. Чотиа, вместо этого, относится к расположению структурных петель (Chothia and Lesk, J. Mol. Biol. 196:901-917 (1987)). Конец петли CDR-H1 по Чотиа при нумерации согласно системе нумерации по Кабату варьируется между H32 и H34 в зависимости от длины петли (это связано с тем, что в схеме нумерации по Кабату в H35A и H35B размещаются вставки; если ни 35A ни 35B не присутствуют, петля заканчивается в 32; если присутствует только 35A, петля заканчивается в 33; если присутствуют оба 35A и 35B, петля заканчивается в 34). Гипервариабельные области по AbM представляют собой компромиссный вариант между CDR по Кабату, и структурными петлями по Чотиа, и используются в программном обеспечении для моделирования антител Oxford Molecular's AbM.
|
[52] Термин «человеческое» антитело или его антигенсвязывающий фрагмент означает антитело или его антигенсвязывающий фрагмент, продуцируемое человеком, или антитело или его антигенсвязывающий фрагмент, имеющий аминокислотную последовательность, соответствующую антителу или его антигенсвязывающему фрагменту, продуцируемому человеком, сделанному с использованием любого метода, известного в данной области техники. Данное определение человеческого антитела или его антигенсвязывающего фрагмент включает интактные или полноразмерные антитела и их фрагменты.
[53] Термин «химерные» антитела или их антигенсвязывающие фрагменты относится к антителам или их антигенсвязывающим фрагментам, причем аминокислотная последовательность получена из двух или более видов. Как правило, вариабельная область как легких, так и тяжелых цепей соответствует вариабельной области антител или их антигенсвязывающих фрагментов, полученных из одного вида млекопитающих (например, мыши, крысы, кролика и т. п.) с желаемой специфичностью, аффинностью и характеристиками в то время как константные области гомологичны последовательностям антител или их антигенсвязывающих фрагментов, полученным из другого источника (как правило, из человека), чтобы избежать индукции иммунного ответа у этого вида.
[54] Термин «эпитоп» или «антигенная детерминанта» используются в данном документе взаимозаменяемо и относятся к той части антигена, которая может распознаваться и специфически связывается с конкретным антителом. Когда антиген является полипептидом, «эпитопы» могут образовываться как смежными аминокислотами, так и несмежными аминокислотами, сформированными укладкой третичной структуры белка. Эпитопы, образованные из смежных аминокислот, как правило, сохраняются при денатурации белка, тогда как эпитопы, образованные третичной структурой, как правило, утрачиваются при денатурации белка. Эпитоп обычно содержит по меньшей мере 3 и более, обычно, по меньшей мере 5 или 8-10 аминокислот в уникальной пространственной конформации.
[55] «Аффинность связывания» в целом относится к силе суммарного количества нековалентных взаимодействий между одним сайтом связывания молекулы (например, антителом) и ее партнером по связыванию (например, антигеном). Если не указано иное, в контексте данного документа «аффинность связывания» относится к действительной аффинности связывания, которая отражает взаимодействие в соотношении 1:1 между членами связывающей пары (например, антителом и антигеном). Аффинность молекулы X к ее партнеру Y в целом можно выразить константой диссоциации (Kd). Аффинность может быть измерена обычными способами, известными в данной области техники, включая описанные в данном документе. Низкоаффинные антитела обычно связывают антиген медленно и склонны легко диссоциировать, тогда как высокоаффинные антитела обычно связывают антиген быстрее и имеют тенденцию оставаться связанными дольше. В данной области техники известен ряд способов измерения аффинности связывания, любой из которых можно использовать в целях данного изобретения. Конкретные иллюстративные варианты осуществления описаны ниже.
[56] Фраза «или более», когда используется в данном документе для обозначения аффинности связывания, относится к более сильному связыванию между молекулой и ее партнером по связыванию. Фраза «или более», когда используется в данном документе, относится к более сильному связыванию, представленному меньшим числовым значением Kd. Например, антитело, которое имеет аффинность к антигену «0,6 нМ или более», аффинность антитела к антигену составляет <0,6 нМ, т. е. 0,59 нМ, 0,58 нМ, 0,57 нМ и т. д., или любое значение меньше чем 0,6 нМ.
[57] Под термином «специфически связывается» обычно подразумевают, что антитело связывается с эпитопом через его антигенсвязывающий домен, и что связывание приводит к некоторой комплементарности между антигенсвязывающим доменом и эпитопом. Согласно этому определению считается, что антитело «специфически связывается» с эпитопом, когда оно связывается с этим эпитопом через его антигенсвязывающий домен более легко, чем связывается со случайным, неродственным эпитопом. Термин «специфичность» используется в данном документе, чтобы определить относительную аффинность с помощью которой определенное антитело связывается с определенным эпитопом. Например, можно считать, что антитело «А» имеет более высокую специфичность для данного эпитопа, чем антитело «B», или можно сказать, что антитело «А» связывается с эпитопом «C» с более высокой специфичностью, чем для соответствующего эпитопа «D».
[58] Под термином «преимущественно связывается» подразумевают, что антитело специфически связывается с эпитопом более легко, чем оно связывается с родственным, подобным, гомологичным или аналогичным эпитопом. Таким образом, антитело, которое «преимущественно связывается» с данным эпитопом, более вероятно связывается с этим эпитопом, чем с соответствующим эпитопом, даже если такое антитело может перекрестно реагировать с родственным эпитопом.
[59] Термины «полипептид», «пептид» и «белок» используются в данном документе взаимозаменяемо для обозначения полимеров аминокислот любой длины. Полимер может быть линейным или разветвленным, он может содержать модифицированные аминокислоты, и он может быть разделен не аминокислотами. Кроме того, указанные термины включают аминокислотный полимер, который был модифицирован природным путем или путем вмешательства; например, образованием дисульфидных связей, гликозилированием, липидацией, ацетилированием, фосфорилированием или любыми другими манипуляциями или модификациями, такие как конъюгация с меченым компонентом. Также термин включает, например, полипептиды, содержащие один или более аналогов аминокислоты (включающие, например, неприродные аминокислоты и т. д.), а также другие модификации известные в данной области техники. Понятно, что, поскольку полипептиды согласно данному изобретению основаны на антителах, в некоторых вариантах осуществления полипептиды могут встречаться в виде отдельных цепей или связанных цепей.
[60] Термин «иммуноконъюгат» или «конъюгат» в контексте данного документа относится к соединению или его производному, которое связано с клеточносвязывающим агентом (то есть, анти-CD123 антителом или его фрагментом) и определяется общей формулой: C-A, где C = цитотоксин (например, майтанзиноид, бензодиазепиновое соединение, включая пирролобензодиазепины (PBD) и тетрациклические бензодиазепины, такие как индолинобензодиазепины) и A = антитело или его антигенсвязывающий фрагмент, например анти-CD123 антитело или фрагмент антитела. Иммуноконъюгат может необязательно содержать линкер и определяться общей формулой C-L-A, где C = цитотоксин, L = линкер и A = антитело или его антигенсвязывающий фрагмент, например, анти-CD123 антитело или фрагмент антитела. Иммуноконъюгаты также могут быть определены с помощью общей формулы в обратном порядке: C-A или A-L-C. Иммуноконъюгаты также могут содержать несколько цитотоксинов (C) на антитело или его антигенсвязывающий фрагмент (A) или несколько цитотоксинов (C) и линкеров (L) на антитело или его антигенсвязывающий фрагмент (A).
[61] «Линкер» представляет собой любой химический фрагмент, который способен связывать соединение, обычно лекарственное средство (такое как майтанзиноид, бензодиазепиновое соединение, включая пирролобензодиазепины (PBD) и тетрациклические бензодиазепины, такие как индолинобензодиазепины), с агентом, связывающим клетки (таким как анти-CD123 антителом или его фрагментом) стабильным ковалентным способом. Линкеры могут быть восприимчивы к или по существу устойчивы к, например, расщеплению дисульфидной связи, в условиях, при которых соединение или антитело остается активным. Подходящие линкеры хорошо известны в данной области техники и включают, например, дисульфидные группы и тиоэфирные группы.
[62] Фраза «фармацевтически приемлемый» указывает на то, что вещество или композиция должны быть химически и/или токсикологически совместимыми с другими ингредиентами, составляющими препарат, и/или млекопитающим, которое ими лечат.
[63] Термин «фармацевтический состав» относится к препарату, который находится в такой форме, чтобы обеспечить биологическую активность активного ингредиента, чтобы быть эффективным, и который не содержит каких-либо дополнительных компонентов, которые являются неприемлемо токсичными для субъекта, которому будет вводиться состав. Состав может быть стерильным.
[64] Термины «(человеческий) ИЛ-3Rα», «альфа-рецептор интерлейкина-3» или «CD123», используемые в данном документе взаимозаменяемо, относятся к любому нативному (человеческому) ИЛ-3Rα или CD123, если не указано иное. Белок CD123 представляет собой интерлейкин-3-специфическую субъединицу гетеродимерного рецептора цитокинов (рецептор ИЛ-3 или ИЛ-3R). Термины охватывают «полноразмерные» непроцессированные полипептиды CD123, а также любую форму полипептида CD123, возникающую в результате процессинга внутри клетки. Термин также включает встречающиеся в природе варианты CD123, например, те, которые кодируются сплайс-вариантами и аллельными вариантами. Описанные в данном документе полипептиды CD123 могут быть выделены из различных источников, например, из разных типов тканей человека, или из другого источника, или получены рекомбинантными или синтетическими способами. Когда указано конкретно «CD123» может быть использован для обозначения нуклеиновой кислоты, которая кодирует полипептид CD123. Последовательности человеческого CD123 известны и включают, например, последовательности, связанные с идентификационными номерами NCBI NP_002174 и NM_002183 (последовательности белка и нуклеиновой кислоты для варианта 1 человеческого CD123), и NP_001254642 и NM_001267713 (последовательности белка и нуклеиновой кислоты для варианта 2 человеческого CD123). В контексте данного документа термин «человеческий CD123» относится к CD123, содержащему последовательность SEQ ID NO: 11 или SEQ ID NO:12.
1 MVLLWLTLLL IALPCLLQTK EDPNPPITNL RMKAKAQQLT WDLNRNVTDI ECVKDADYSM
61 PAVNNSYCQF GAISLCEVTN YTVRVANPPF STWILFPENS GKPWAGAENL TCWIHDVDFL
121 SCSWAVGPGA PADVQYDLYL NVANRRQQYE CLHYKTDAQG TRIGCRFDDI SRLSSGSQSS
181 HILVRGRSAA FGIPCTDKFV VFSQIEILTP PNMTAKCNKT HSFMHWKMRS HFNRKFRYEL
241 QIQKRMQPVI TEQVRDRTSF QLLNPGTYTV QIRARERVYE FLSAWSTPQR FECDQEEGAN
301 TRAWRTSLLI ALGTLLALVC VFVICRRYLV MQRLFPRIPH MKDPIGDSFQ NDKLVVWEAG
361 KAGLEECLVT EVQVVQKT (SEQ ID NO:11)
1 MVLLWLTLLL IALPCLLQTK EGGKPWAGAE NLTCWIHDVD FLSCSWAVGP GAPADVQYDL
61 YLNVANRRQQ YECLHYKTDA QGTRIGCRFD DISRLSSGSQ SSHILVRGRS AAFGIPCTDK
121 FVVFSQIEIL TPPNMTAKCN KTHSFMHWKM RSHFNRKFRY ELQIQKRMQP VITEQVRDRT
181 SFQLLNPGTY TVQIRARERV YEFLSAWSTP QRFECDQEEG ANTRAWRTSL LIALGTLLAL
241 VCVFVICRRY LVMQRLFPRI PHMKDPIGDS FQNDKLVVWE AGKAGLEECL VTEVQVVQKT
(SEQ ID NO:12)
[65] Термин «анти-CD123 антитело» или «антитело, которое связывается с CD123» означает антитело, которое способно связываться CD123 с достаточной аффинностью таким образом, что антитело становится пригодным в качестве диагностического и/или терапевтического агента для нацеливания на CD123 (например, антитело huMov19 (M9346A)). Степень связывания анти-CD123 антитела с неродственным белком, не являющимся CD123, составляет менее чем приблизительно 10 % от связывания антитела с CD123, измеренного, например, с помощью радиоиммунологического анализа (РИА).
[66] Термин «IMGN632» относится к композиции иммуноконъюгатов, приведенной на Фиг. 8. Композиция иммуноконъюгатов содержит иммуноконъюгаты, содержащие в среднем от 1,5 до 2,1 цитотоксических агентов DGN549-C на антитело huCD123-6Gv4.7 («G4723A») в сульфированной версии (Фиг. 8A). Композиция иммуноконъюгатов также может содержать несульфированный иммуноконъюгат (моноиминовую структуру, приведенную на Фиг. 8B).
[67] Используемые в данном описании и формуле изобретения формы единственного числа включают формы множественного числа, если из контекста явно не следует иное.
[68] Следует понимать, что в тех случаях, когда варианты осуществления описаны в данном документе с формулировкой «содержащий», в противном случае аналогичные варианты осуществления, описанные в терминах «состоящий из» и/или «состоящий в основном из», также обеспечены.
[69] Термин «и/или», используемый в фразе, такой как «A и/или B» в данном документе, предназначен для включения «A и B», «A или B», «A» и «B». Аналогично, термин «и/или», используемый во фразе, такой как «A, B и/или C», предназначен для охвата каждого из следующих вариантов осуществления: A, B, и C; A, B, или C; A или C; A или B; B или C; A и C; A и B; B и C; A (отдельно); B (отдельно); и C (отдельно).
II. Катионообменные смолы
[70] В соответствии со способами, предложенными в данном документе, катионообменные смолы могут быть использованы для отделения антител с тремя легкими цепями (H2L3) и их антигенсвязывающих фрагментов от композиции, содержащей антитела H2L3 и антитела с двумя легкими цепями (H2L2) и их антигенсвязывающие фрагменты.
[71] Одна иллюстративная катионообменная смола, используемая в способах, представленных в данном документе, представляют собой оптимизированную сильную катионообменную смолу POROS™ XS (Thermos Fisher, ранее Life Technologies Corporation, Карлсбад, Калифорния; 10 000 мл = кат. № 440334; 5000 мл = кат. № 4404335; 1000 мл = кат. № 4404336; 250 мл = кат. № 4404337; 10 мл = кат. № 82071, и 50 мл = кат. № 82072).
[72] Катионообменная смола может содержать, например, полистирол, сшитый дивинилбензолом. Катионообменная смола может иметь поверхностные функциональные группы сульфопропила (-CH2CH2CH2SO3-). Катионообменная смола может содержать полистирол, сшитый дивинилбензолом, и иметь поверхностные функциональные группы сульфопропила (-CH2CH2CH2SO3-).
[73] В некоторых вариантах осуществления катионообменная смола не является колонкой Fractogel SE HiCap (EMD Millipore). В некоторых вариантах осуществления катионообменная смола не основана на метакрилате.
[74] Катионообменная смола может иметь размер частиц приблизительно 50 мкм. Катионообменная смола может иметь бимодальное распределение пор по размерам, например, с диаметром пор приблизительно 500 нМ и диаметром пор приблизительно 22 нМ. Катионообменная смола может иметь размер частиц приблизительно 50 мкм и бимодальное распределение пор по размерам, например, с диаметром пор приблизительно 500 нМ и диаметром пор приблизительно 22 нМ.
[75] Катионообменная смола может содержать полистирол, сшитый дивинилбензолом, поверхностные функциональные группы сульфопропила (-CH2CH2CH2SO3-), иметь размер частиц приблизительно 50 мкм и иметь бимодальное распределение пор по размерам, имеющее поры диаметром 500 нМ и поры диаметром приблизительно 22 Нм.
[76] Объем катионообменной смолы может быть определенного размера. Например, объем катионообменной смолы может составлять от приблизительно 10 до приблизительно 15000 мл. Объем катионообменной смолы может составлять от приблизительно 20 до приблизительно 25 мл. Объем катионообменной смолы может составлять от приблизительно 100 до приблизительно 150 мл. Объем катионообменной смолы может составлять от приблизительно 10 000 до приблизительно 15 000 мл. Объем катионообменной смолы может составлять приблизительно 13 800 мл. Объем катионообменной смолы может составлять 32 л или более.
[77] Катионообменная смола может быть в форме колонки.
III. Антитела и их антигенсвязывающие фрагменты
[78] Антитела и их антигенсвязывающие фрагменты (например, терапевтически применимые антитела и их антигенсвязывающие фрагменты) обычно содержат две тяжелые цепи или их фрагменты и две легкие цепи или их фрагменты. Однако также были обнаружены виды с тремя легкими цепями (H2L3), содержащие две тяжелые цепи или их фрагменты и три легкие цепи или их фрагменты. Такой вид H2L3 может встречаться с более высокой вероятностью в антителах, сконструированных введением цистеина, и их антигенсвязывающих фрагментах, например, когда вид H2L3 возникает в результате дисульфидной связи, образованной между дополнительной легкой цепью и одним из сконструированных цистеинов на антителе или их антигенсвязывающих фрагментах. Соответственно, используемая в данном документе композиция антител может содержать сконструированные введением цистеина антитела или их антигенсвязывающие фрагменты. Подобным образом, антитело H2L2 или H2L3 или его антигенсвязывающий фрагмент могут быть сконструированным введением цистеина антителом H2L2 или H2L3 или его антигенсвязывающим фрагментом. Сконструированное введением цистеина антитело или его антигенсвязывающий фрагмент может, например, содержать сконструированный остаток цистеина в положении 442 согласно нумерации EU/OU.
[79] В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты представляют собой гуманизированные антитела или их антигенсвязывающие фрагменты. В некоторых вариантах осуществления гуманизированное антитело или его фрагмент представляет собой антитело с измененной поверхностью или его антигенсвязывающий фрагмент. В других вариантах осуществления антитела или их антигенсвязывающие фрагменты представляют собой полностью человеческое антитело или его антигенсвязывающий фрагмент.
[80] Например, в данных способах можно использовать анти-CD123 антитело или его антигенсвязывающий фрагмент. Анти-CD123 антитело или его антигенсвязывающий фрагмент могут содержать последовательности антитела huCD123-6Gv4.7, приведенные ниже в Таблицах 1-3. Например, анти-CD123 антитело или его антигенсвязывающий фрагмент для применения в способах, предложенных в данном документе, могут содержать последовательности CDR-1, CDR-2 и CDR-3 вариабельной области тяжелой цепи SEQ ID NO: 5, 6 и 7, соответственно, последовательности CDR-1, CDR-2 и CDR-3 вариабельной области легкой цепи SEQ ID NO: 8, 9 и 10, соответственно. Анти-CD123 антитело или его антигенсвязывающий фрагмент для применения в способах, предложенных в данном документе, могут содержать вариабельный домен тяжелой цепи, содержащий последовательность, представленную в SEQ ID NO: 1. Анти-CD123 антитело или его антигенсвязывающий фрагмент для применения в способах, предложенных в данном документе, могут содержать вариабельный домен легкой цепи, содержащий последовательность, представленную в SEQ ID NO: 2. Анти-CD123 антитело или его антигенсвязывающий фрагмент для применения в способах, предложенных в данном документе, могут содержать вариабельный домен тяжелой цепи, содержащий последовательность, представленную в SEQ ID NO: 1, и вариабельный домен легкой цепи, содержащий последовательность, представленную в SEQ ID NO: 2. Анти-CD123 антитело или его антигенсвязывающий фрагмент для применения в способах, предложенных в данном документе, могут содержать вариабельный домен тяжелой цепи, содержащий последовательность, представленную в SEQ ID NO: 3. Анти-CD123 антитело или его антигенсвязывающий фрагмент для применения в способах, представленных в данном документе, могут содержать легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 4. Анти-CD123 антитело или его антигенсвязывающий фрагмент для применения в способах, предложенных в данном документе, могут содержать вариабельный домен тяжелой цепи, содержащий последовательность, представленную в SEQ ID NO: 3, и легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 4.
[81] В одном примере анти-CD123 антитело или его антигенсвязывающий фрагмент для применения в способах, предложенных в данном документе, могут содержать вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, содержащие последовательности, представленные в таблице 1. В другом примере анти-CD123 антитело или его антигенсвязывающий фрагмент для применения в способах, предложенных в данном документе, могут содержать тяжелую цепь и легкую цепь, содержащие последовательности, представленные в таблице 2. В еще одном примере анти-CD123 антитело или его антигенсвязывающий фрагмент для использования в способах, предложенных в данном документе, могут содержать определяющие комплементарность области вариабельных областей тяжелой и легкой цепей, содержащие последовательности, представленные в таблице 3.



[82] Анти-CD123 антитело или его антигенсвязывающий фрагмент могут связываться с эпитопом в аминокислотах с 205 по 346 человеческого CD123.
[83] Антитело или его антигенсвязывающий фрагмент (например, сконструированное введением цистеина антитело или его антигенсвязывающий фрагмент, анти-CD123 антитело или его антигенсвязывающий фрагмент, или сконструированное введением цистеина антитело или его антигенсвязывающий фрагмент) для применения в данных способах могут быть получены рекомбинантным способом. Например, антитело или его антигенсвязывающий фрагмент (например, сконструированное введением цистеина антитело или его антигенсвязывающий фрагмент, анти-CD123 антитело или его антигенсвязывающий фрагмент, или сконструированное введением цистеина антитело или его антигенсвязывающий фрагмент) для применения в данных способах могут быть получены в линии клеток млекопитающих, например, в клетке СНО.
IV. Композиции антител
[84] В соответствии со способами, предложенными в данном документе, композиции антител, содержащие как антитела с тремя легкими цепями (H2L3) и их антигенсвязывающие фрагменты, так и антитела с двумя легкими цепями (H2L2) и их антигенсвязывающие фрагменты, могут быть нанесены на катионообменную колонку для разделения видов H2L3 и H2L2.
[85] Композиции антител для применения в способах, предложенных в данном документе, могут представлять собой композиции, в которых от приблизительно 1 % до приблизительно 20 % антител или их антигенсвязывающих фрагментов представляют собой антитела H2L3 или их антигенсвязывающие фрагменты. Композиции антител для применения в способах, предложенных в данном документе, могут представлять собой композиции, в которых от приблизительно 1 % до приблизительно 15 %, или от приблизительно 5 % до приблизительно 15 %, или от приблизительно 3 % до приблизительно 12 %, или от приблизительно 10 % до приблизительно 15 % антител или их антигенсвязывающих фрагментов в композиции антител представляют собой антитела H2L3 или их антигенсвязывающие фрагменты.
[86] Композиция антител для применения в способах, предложенных в данном документе, может содержать конкретную концентрацию белка, так что применяют конкретную плотность загрузки к катионообменной смоле. Концентрация белка (плотность загрузки) может составлять, например, от приблизительно 10 г/л до приблизительно 100 г/л. Концентрация белка (плотность загрузки) может составлять от приблизительно 30 г/л до приблизительно 50 г/л. Концентрация белка (плотность загрузки) может составлять от приблизительно 30 г/л до приблизительно 45 г/л. Концентрация белка (плотность загрузки) может составлять от приблизительно 30 г/л до приблизительно 40 г/л. Концентрация белка (плотность загрузки) может составлять приблизительно 40 г/л.
[87] В дополнение к видам H2L2 и H2L3, композиция антител может содержать агрегаты. Например, композиция антител может содержать от приблизительно 1 до приблизительно 10 % агрегатов. Композиция антител может содержать от приблизительно 1 до приблизительно 5 % агрегатов. Композиция антител может содержать от приблизительно 2 до приблизительно 5 % агрегатов.
[88] Композиция антител может иметь определенный рН, например, от приблизительно 3,8 до приблизительно 6,5. Композиция антител может иметь рН от приблизительно 3,8 до приблизительно 5,5. Композиция антител может иметь рН от приблизительно 3,8 до приблизительно 5,0. Композиция антител может иметь рН от приблизительно 3,8 до приблизительно 4,7. Композиция антител может иметь рН от приблизительно 3,8 до приблизительно 4,4. Композиция антител может иметь рН от приблизительно 3,8 до приблизительно 4,2. Композиция антител может иметь рН от приблизительно 4,0 до приблизительно 5,0. Композиция антител может иметь рН от приблизительно 4,0 до приблизительно 4,7. Композиция антител может иметь рН от приблизительно 4,0 до приблизительно 4,4. Композиция антител может иметь рН от приблизительно 4,0 до приблизительно 4,2. Композиция антител может иметь рН приблизительно 4,2.
[89] pH композиции антител может быть, например, таким же, как рН композиции для уравновешивания (композиции для связывания), которую, как более подробно описано ниже, можно нанести на катионообменную смолу перед нанесением композиции антител на катионообменную смолу. pH композиции антител может быть, например, таким же, как pH композиции для элюирования, которую, как более подробно описано ниже, можно наносить на катионообменную смолу после композиции антител для элюирования композиции H2L2. pH композиции антител может быть таким же, как pH композиции для уравновешивания (композиции для связывания) и композиции для элюирования.
[90] В некоторых вариантах осуществления композиция антител не имеет рН 6,0. В некоторых вариантах осуществления композиция антител имеет рН менее 6,0.
[91] Композиция антител может содержать очищенные белком А антитела или их антигенсвязывающие фрагменты. Композиция антител может содержать антитела или их антигенсвязывающие фрагменты, которые были очищены белком А и очищены в анионообменной колонке. Таким образом, композиция антител может содержать такие компоненты, как буферы (например, трис-уксусная кислота) и/или агрегаты антител, в дополнение к растворимым антителам H2L2 и H2L3 или их антигенсвязывающим фрагментам.
V. Элюирующие растворы и способы элюирования для получения композиций H2L2 и H2L3
[92] В соответствии со способами, предложенными в данном документе, антитела с тремя легкими цепями, (H2L3) и их антигенсвязывающие фрагменты и антитела с двумя легкими цепями (H2L2) и их антигенсвязывающие фрагменты могут быть отдельно элюированы из катионообменной колонки.
[93] В частности, композиция для элюирования может быть нанесена на катионообменную смолу (например, колонку) для предпочтительного элюирования вида H2L2, и затем из смолы может быть собрана композиция H2L2. В данном документе для применения в таких способах предложены композиции для элюирования.
[94] Композиция для элюирования для применения в способах, предложенных в данном документе, может содержать соль. Соль может представлять собой хлоридную соль, например, хлорид натрия, хлорид калия, хлорид кальция или хлорид магния. В одном случае соль представляет собой хлорид натрия. Концентрация соли (например, хлорида натрия) в композиции для элюирования может составлять, например, от приблизительно 100 мМ до приблизительно 600 мМ. Концентрация соли (например, хлорида натрия) в композиции для элюирования может составлять от приблизительно 200 мМ до приблизительно 600 мМ. Концентрация соли (например, хлорида натрия) в композиции для элюирования может составлять от приблизительно 300 мМ до приблизительно 600 мМ. Концентрация соли (например, хлорида натрия) в композиции для элюирования может составлять от приблизительно 400 мМ до приблизительно 600 мМ. Концентрация соли (например, хлорида натрия) в композиции для элюирования может составлять от приблизительно 200 мМ до приблизительно 500 мМ. Концентрация соли (например, хлорида натрия) в композиции для элюирования может составлять от приблизительно 300 мМ до приблизительно 500 мМ. Концентрация соли (например, хлорида натрия) в композиции для элюирования может составлять от приблизительно 400 мМ до приблизительно 500 мМ. Концентрация соли (например, хлорида натрия) в композиции для элюирования может составлять от приблизительно 380 мМ до приблизительно 420 мМ. Концентрация соли (например, хлорида натрия) в композиции для элюирования может составлять приблизительно 400 мМ.
[95] В некоторых вариантах осуществления композиция для элюирования не имеет концентрации соли в 100 мМ. В некоторых вариантах осуществления композиция для элюирования имеет концентрацию соли более 100 мМ.
[96] Композиция для элюирования для применения в способах, предложенных в данном документе, может иметь определенный рН. pH может составлять, например, от приблизительно 3,8 до приблизительно 6,5. Композиция для элюирования может иметь рН от приблизительно 3,8 до приблизительно 5,5. Композиция для элюирования может иметь рН от приблизительно 3,8 до приблизительно 5,0. Композиция для элюирования может иметь рН от приблизительно 3,8 до приблизительно 4,7. Композиция для элюирования может иметь рН от приблизительно 3,8 до приблизительно 4,4. Композиция для элюирования может иметь рН от приблизительно 3,8 до приблизительно 4,2. Композиция для элюирования может иметь рН от приблизительно 4,0 до приблизительно 5,0. Композиция для элюирования может иметь рН от приблизительно 4,0 до приблизительно 4,7. Композиция для элюирования может иметь рН от приблизительно 4,0 до приблизительно 4,4. Композиция для элюирования может иметь рН от приблизительно 4,0 до приблизительно 4,2. Композиция для элюирования может иметь рН приблизительно 4,2.
[97] В некоторых вариантах осуществления композиция для элюирования не имеет рН 6,0. В некоторых вариантах осуществления композиция имеет для элюирования рН менее 6,0.
[98] Композиция для элюирования для применения в способах, предложенных в данном документе, может иметь конкретную комбинацию концентрации соли и рН. Например, концентрация соли (например, хлорида натрия) может составлять от приблизительно 300 мМ до приблизительно 600 мМ, а рН может составлять от приблизительно 3,8 до приблизительно 5,5. Концентрация соли (например, хлорида натрия) может составлять от приблизительно 300 мМ до приблизительно 500 мМ, а рН может составлять от приблизительно 3,8 до приблизительно 5,0. Концентрация соли (например, хлорида натрия) может составлять от приблизительно 380 мМ до приблизительно 420 мМ, а рН может составлять от приблизительно 4,0 до приблизительно 4,4. Концентрация соли (например, хлорида натрия) может составлять приблизительно 400 мМ, а рН может составлять приблизительно 4,2.
[99] В некоторых вариантах осуществления композиция для элюирования не имеет 100 мМ хлорида натрия при рН 6,0.
[100] Как продемонстрировано в данном документе, нанесение композиции для элюирования, предложенной в данном документе (например, с низким рН и высокой концентрацией соли), на катионообменную смолу, предложенную в данном документе, содержащую композицию антител, предложенную в данном документе, с антителами H2L2 и H2L3 или их антигенсвязывающими фрагментами, может привести к элюированию композиции H2L2 с незначительной или полным отсутствием контаминации H2L3. Это связано с тем, что способы, предложенные в данном документе, могут вызывать постоянное элюирование вида H2L3 (после пика элюирования H2L2) вместо элюирования как на ранней стадии (вместе с пиком элюирования H2L2), так и на поздней (после пика элюирования H2L2).
[101] Таким образом, композиция H2L2, предложенная в данном документе, может содержать один или более элюированных объемов колонки. Например, композиция H2L2 может содержать один элюированной объем колонки, выбранный из объемов колонки 1-9. Композиция H2L2 может содержать два элюированных объема колонки, выбранные из объемов колонки 1-9 (например, объемы колонок 1 и 2 или объемы колонок 3 и 4). Композиция H2L2 может содержать три, четыре, пять, шесть, семь, восемь или девять объемов элюированной колонки, выбранных из объемов колонки 1-9. Композиция H2L2 также может содержать элюированные объемы колонки 1-9 (то есть пул первых девяти объемов колонки). Композиция H2L2, предложенная в данном документе, может содержать элюированные объемы колонки 1-8 (то есть пул первых четырех объемов колонки). Композиция H2L2, предложенная в данном документе, может содержать элюированные объемы колонки 1-7 (то есть пул первых четырех объемов колонки). Композиция H2L2, предложенная в данном документе, может содержать элюированные объемы колонки 1-6 (то есть пул первых четырех объемов колонки). Композиция H2L2, предложенная в данном документе, может содержать элюированные объемы колонки 1-5 (то есть пул первых четырех объемов колонки). Композиция H2L2, предложенная в данном документе, может содержать элюированные объемы колонки 1-4 (то есть пул первых четырех объемов колонки). Композиция H2L2, предложенная в данном документе, может содержать элюированные объемы колонки 1-3 (то есть пул первых четырех объемов колонки).
[102] Используя способы, предложенные в данном документе, вид H2L3 может быть эффективно отделен от вида H2L2 в композиции антител. Например, используемые в данном документе способы могут привести к получению композиции H2L2, содержащей не более 25 %, не более 20 %, не более 15 %, не более 10 % или не более 5 % вида H2L3, который присутствовал в композиции антител, нанесенных на катионообменную смолу. С другой стороны, используемые в данном документе способы могут привести к получению композиции H2L3, содержащей по меньшей мере 75 %, по меньшей мере 80 %, по меньшей мере 85 %, по меньшей мере 90 % или по меньшей мере 95 % видов H2L3, которые присутствовали в композиции антител, наносимой на катионообменную смолу.
[103] С помощью приведенных в данном документе способов можно получить композицию H2L2, в которой не более 2 %, не более 1 % или не более 0,5 % антител или антигенсвязывающих фрагментов представляют собой виды H2L3. С помощью приведенных в данном документе способов можно получить композицию H2L2, в которой по меньшей мере 98 %, по меньшей мере 99 % или по меньшей мере 99,5 % антител или их антигенсвязывающих фрагментов в композиции H2L2 представляют собой антитела H2L2 или их антигенсвязывающие фрагменты.
[104] С помощью приведенных в данном документе способов можно также получить композицию H2L2, содержащую меньше агрегатов, чем композиция антител, нанесенная на катионообменную смолу. Например, с помощью приведенных в данном документе способов можно получить композицию H2L2, содержащую не более 1 % агрегатов или не более 0,5 % агрегатов. Используя способы, предложенные в данном документе, можно получить композицию H2L2, содержащую приблизительно 0,3 % агрегатов, приблизительно 0,2 % агрегатов или приблизительно 0,1 % агрегатов.
[105] Преимущественно способы, предложенные в данном документе, также обеспечивают высокий выход. Например, используя способы, предложенные в данном документе, может быть получена композиция H2L2, которая содержит по меньшей мере 40 %, по меньшей мере 45 %, по меньшей мере 50 % или по меньшей мере 55 % антител H2L2 или их антигенсвязывающих фрагментов в композиции антител, наносимой на катионообменную смолу.
[106] Чтобы уравновесить катионообменную смолу и способствовать связыванию антител H2L2 и H2L3 со смолой, композиция для уравновешивания (или композиция для связывания) может быть нанесена на смолу до того, как композиция антител будет нанесена на смолу. Композицию для уравновешивания (композицию для связывания) можно использовать для поддержания рН и/или проводимости смолы. Подходящие буферы, которые можно использовать для этой цели, хорошо известны в данной области техники и включают любой буфер при рН, который совместим с выбранной смолой, используемой на стадии хроматографии для разделения видов H2L3 и H2L2. Композиция для уравновешивания (композиция для связывания) может содержать, например, ацетат натрия, в концентрации, которая является достаточно высокой для поддержания рН, но не слишком высокой для предотвращения связывания антител и их антигенсвязывающих фрагментов в композиции антител с катионообменной смолой.
[107] Композиция для уравновешивания (композиция для связывания) может содержать, например, от 10 мМ до 150 мМ ацетата натрия. Композиция для уравновешивания (композиция для связывания) может содержать, например, от 25 мМ до 150 мМ ацетата натрия. Композиция для уравновешивания (композиция для связывания) может содержать 50 мМ ацетата натрия.
[108] В некоторых вариантах композиция для уравновешивания (композиция для связывания) не содержит 20 мМ ацетата натрия. В некоторых вариантах композиция для уравновешивания (композиция для связывания) содержит более 20 мМ ацетата натрия.
[109] Композиция для уравновешивания (композиция для связывания) также может иметь определенный рН, например, от приблизительно 3,8 до приблизительно 6,5. Композиция для уравновешивания (композиция для связывания) может иметь рН от приблизительно 3,8 до приблизительно 5,5. Композиция для уравновешивания (композиция для связывания) может иметь рН от приблизительно 3,8 до приблизительно 5,0. Композиция для уравновешивания (композиция для связывания) может иметь рН от приблизительно 3,8 до приблизительно 4,7. Композиция для уравновешивания (композиция для связывания) может иметь рН от приблизительно 3,8 до приблизительно 4,4. Композиция для уравновешивания (композиция для связывания) может иметь рН от приблизительно 3,8 до приблизительно 4,2. Композиция для уравновешивания (композиция для связывания) может иметь рН от приблизительно 4,0 до приблизительно 5,0. Композиция для уравновешивания (композиция для связывания) может иметь рН от приблизительно 4,0 до приблизительно 4,7. Композиция для уравновешивания (композиция для связывания) может иметь рН от приблизительно 4,0 до приблизительно 4,4. Композиция для уравновешивания (композиция для связывания) может иметь рН от приблизительно 4,0 до приблизительно 4,2. Композиция для уравновешивания (композиция для связывания) может иметь рН приблизительно 4,2.
[110] В некоторых вариантах осуществления композиция для уравновешивания (композиция для связывания) не имеет pH 6,0. В некоторых вариантах осуществления композиция для уравновешивания (композиция для связывания) имеет pH менее 6,0.
[111] Как продемонстрировано в данном документе способ отделения антител H2L3 или их антигенсвязывающих фрагментов от композиции антител, содержащей антитела H2L3 или их антигенсвязывающие фрагменты и антитела H2L2 или их антигенсвязывающие фрагменты, может включать (i) нанесение композиции антител на катионообменную смолу, так что антитела H2L3 или их антигенсвязывающие фрагменты и антитела H2L2 или их антигенсвязывающие фрагменты связываются со смолой; (ii) нанесение композиции для элюирования на катионообменную смолу; и (iii) сбор композиции H2L2, элюированной из смолы. Способ может необязательно включать нанесение композиции для уравновешивания (композиции для связывания) на катионообменную смолу до того, как композицию антител наносят на катионообменную смолу. Как продемонстрировано в данном документе, выбор катионообменной смолы, а также pH и концентрации соли в композиции для элюирования может преимущественно приводить к элюированию всех видов H2L3 после выхода пика H2L2 и позволяет собирать композиции H2L2 с небольшим количеством (например, менее чем на 1 %) или отсутствием видов H2L3.
VI. Применение композиций H2L2
[112] В соответствии со способами, предложенными в данном документе, антитела с тремя легкими цепями (H2L3) и их антигенсвязывающие фрагменты могут быть отделены от антител с двумя легкими цепями (H2L2) и их антигенсвязывающих фрагментов для получения композиций H2L2. Такие композиции H2L2 применимы, например, для терапевтических целей. Например, композиции H2L2 можно использовать для приготовления фармацевтических композиций, содержащих высокочистые антитела H2L2 или их антигенсвязывающие фрагменты, например, композиции, содержащие не более, например, 1 % или 0,5 % видов H2L3.
[113] Композиции H2L2, полученные в соответствии с описанными в данном документе способами, также могут быть использованы для получения иммуноконъюгатов. Преимущественно, иммуноконъюгаты, полученные из композиций H2L2, предложенных в данном документе, будут содержать небольшое количество видов или не будут содержать виды H2L3. Такие иммуноконъюгаты могут быть получены с использованием линкерной группы для связывания лекарственного средства или пролекарства с антителом или его антигенсвязывающим фрагментом. Подходящие линкерные группы хорошо известны в данной области техники и включают, например, дисульфидные группы, тиоэфирные группы, кислотные группы, фотолабильные группы, пептидазо-лабильные группы и эстеразо-лабильные группы. Отдельный иммуноконъюгат может содержать, например, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 лекарственных средств или пролекарств на антитело или его антигенсвязывающий фрагмент. Композиция, содержащая такие иммуноконъюгаты, может иметь в среднем от приблизительно 1 до приблизительно 10, от приблизительно 1 до приблизительно 5, от приблизительно 1 до приблизительно 3 или от приблизительно 1,5 до приблизительно 2,1 лекарственных средств или пролекарств на антитело или его антигенсвязывающий фрагмент.
[114] Композиция иммуноконъюгатов, полученная в соответствии с предложенными в данном документе способами, может содержать не более 2 %, не более 1 % или не более 0,5 % видов H2L3. Композиция иммуноконъюгатов, полученная в соответствии с предложенными в данном документе способами, может содержать по меньшей мере 98 %, по меньшей мере 99 % или по меньшей мере 99,5 % видов H2L2.
[115] Например, композиция H2L2, содержащая анти-CD123 антитела H2L2 или их антигенсвязывающие фрагменты (например, huCD123-6Gv4.7; G4723A), может быть конъюгирована с цитотоксическим агентом с образованием иммуноконъюгата. Цитотоксическим агентом может быть, например, индолинбензодиазепиновый агент, убивающий раковые клетки такой как DGN549-C. Способы получения таких иммуноконъюгатов представлены, например, в WO 2017/004025 и WO 2017/004026; содержание которых полностью включено в данный документ посредством ссылки.
[116] В некоторых вариантах осуществления композиция H2L2, содержащая анти-CD123 антитела H2L2 или их антигенсвязывающие фрагменты (например, huCD123-6Gv4.7; G4723A), может быть конъюгирована с DGN549-C. Полученная композиция иммуноконъюгатов может содержать в среднем от 1,5 до 2,1 цитотоксинов (DGN549-C) на антитело (huCD123-6Gv4.7; G4723A). Композиция иммуноконъюгатов может быть составлена в бисульфате натрия с образованием IMGN632, как показано на Фиг. 8А (и 8В).
ПРИМЕРЫ
[117] Понятно, что примеры и варианты осуществления, описанные в данном документе, предназначены только для иллюстративных целей и что различные модификации или изменения в их свете будут предложены специалистам в данной области техники и должны быть включены в сущность и сферу применения этой заявки.
Пример 1. Оценка уровней H2L3
[118] Ранее было показано, что клетки млекопитающих, стабильно трансфицированные для экспрессии таких сконструированных введением цистеина антител, также секретируют высокомолекулярный вид, известный как антитело с тремя легкими цепями (H2L3) (Gomez et al., Biotechnol Bioeng. 2010 Mar 1;105(4):748-60). Эти антитела содержат дополнительную (третью) легкую цепь, связанную с сконструированным цистеином на антителе. Разделение этого нового вида с высокой молекулярной массой (HMW) создает проблему во время последующей очистки сконструированных введением цистеина моноклональных антител (CysmAb) из-за сходства с мономерным видом. Чтобы разработать надежную и эффективную стратегию очистки для удаления видов H2L3, было оценено содержание H2L3 в иллюстративном антителе, и были оценены различные способы удаления H2L3.
[119] 0Иллюстративное исследованное моноклональное антитело было антитело huCD123-6Gv4.7 (G4723A), сконструированное цистеином (см. WO 2017/004025 и WO 2017/004026, содержание которых полностью включено в данный документ посредством ссылки; см. также таблицы 1-3 выше). Антитело экспрессировали в клетках СНО, а затем его очищали от очищенных супернатантов клеточных культур с использованием хроматографии на основе белка А. После хроматографии на белке А чистоту (включая процентное содержание мономера, агрегатов, H2L3 и низкомолекулярных видов) антитела оценивали с использованием эксклюзионной ультраэффективной жидкостной хроматографии (SEC-UPLC). Анализ SEC-UPLC продемонстрировал вид H2L3 (Фиг. 1). Хроматограмма SEC-UPLC демонстрируют время удерживания для каждого пика вида композиции CysmAb: мономер (17,686 минут), агрегаты (15,336 минут), H2L3 (16,638 минут) и низкомолекулярные виды (19,008 и 22,445 минут) (Фиг. 1).
[120] Были проанализированы эксперименты с использованием восьми различных производственных партий биореактора одного и того же антитела (A, B, C, D, E, F, G и H). Количество H2L3 зависело как от клеточной линии, так и от условия культивирования и колебалось от 2 до 11 % (Фиг. 2).
Пример 2. Хроматография на керамическом гидроксиапатите неэффективна для отделения H2L3
[121] Удаление вида H2L3 не было эффективно достигнуто с помощью хроматографии на керамическом гидроксиапатите (CHT). (Фиг. 3). В этих экспериментах колонку CHT уравновешивали буфером, содержащим 20 мМ фосфата калия, при pH 6,7. CysmAb с 4,7 % вида H2L3 наносили на смолу CHT ™ (BioRad Laboratories, Геркулес, Калифорния) и элюировали путем поэтапного элюирования с использованием 100 мМ, 95 мМ, 90 мМ или 85 мМ калий-фосфатного буфера при рН 6,7. Пик элюирования собирали при mAU выше 50 во фракциях 1CV. Выход на одной стадии антитела и H2L3 % каждой фракции анализировали и использовали для расчета и сравнения с выходом на одной стадии антитела и H2L3 % виртуального пула с 6 объемами колонки (CV). Предполагалось, что высокомолекулярные виды (то есть агрегаты и H2L3) будут сильнее связываться со смолой CHT из-за их большего размера и будут элюироваться в последующих фракциях. Кроме того, считалось, что элюирование с более низкой концентрацией фосфата приведет к более широким пикам элюирования и более низкому выходу на одной стадии виртуального пула при улучшении разделения. Тем не менее, на Фиг. 3 показано, что удаление видов H2L3 не улучшилось в пределах испытанного диапазона фосфатов и осталось на уровне 2,5 %. Дополнительные эксперименты по изменению концентрации соли также не позволили эффективно отделить виды H2L3, и было мало возможностей для изменения pH в колонке CHT. Таким образом, хроматография на CHT не способна эффективно отделить H2L3.
Пример 3. Оптимизированная катионообменная хроматография эффективно отделяет H2L3
[122] Удаление видов H2L3 было проверено с помощью сильной катионообменной хроматографии POROS™ XS. Сильную катионообменную смолу POROS™ XS (Life Technologies Corporation, Карлсбад, Калифорния) уравновешивали буфером, содержащим 50 мМ ацетата натрия, при рН 5,5. Композицию CysmAb с 3 % агрегатов и 4 % вида H2L3 загружали в колонку POROS™ XS и элюировали при помощи градиентного элюирования с использованием 0-200 мМ NaCl в течение 20 CV. Пик элюирования собирали при mAU выше 50 во фракциях 0,5 CV. Выход антитела на одной стадии, агрегат% и H2L3% каждой фракции анализировали и наносили на график в зависимости от количества фракций. На Фиг. 4 показано, что агрегированные виды элюировали в поздних фракциях (F8-F10) и эффективно отделяли от основного пика элюированного антитела. Виды H2L3 также элюировали в различных фракциях, отличных от основного пика элюированного антитела. Значительную часть видов H2L3 элюировали в поздних фракциях и эффективно отделяли от основного пика антитела H2L2 (Фиг. 4). Однако часть видов H2L3 совместно элюировалась с более ранними фракциями пика антитела (Фиг. 4). Полагают, что элюирующийся рано вид H2L3 образуется в результате того, что свободный цистеин в антителах H2L3 кэпирован глутатионом. Кэпированный глутатионом вид является более кислым (с более низкой PI) и, следовательно, элюируется в более ранней фракции. Считается, что элюирующийся поздно вид H2L3 образуется в результате того, что свободный цистеин в антителах H2L3 кэпирован цистеином. Кэпированный цистеином вид является менее кислым (с более высокой PI) и, следовательно, элюируется в более поздней фракции.
[123] С учетом этих результатов дальнейшая оптимизация условий связывания и элюирования из колонки POROS™ XS была проведена таким образом, чтобы вызвать элюирование элюирующегося рано вида H2L3 в более поздней фракции для более эффективного отделения от основного пика H2L2. Было обнаружено, что снижение рН связывания и элюирования в хроматографии Poros XS значительно улучшило удаление частиц H2L3 (Фиг. 5).
[124] Градиентное элюирование NaCl проводили при помощи хроматографии POROS™ XS при рН 5,0, 4,7 и 4,4 (при рН 5,0, 150-300 мМ NaCl в течение 20CV; при рН 4,7 и 4,4, 0-500 мМ NaCl в течение 25 CV). Материал для нанесения на смолу POROS™ XS (композиция антител) содержал приблизительно 8,4 % вида H2L3. Пик элюирования собирали при mAU выше 100 во фракциях 0,5 CV. Анализировали выход антител на одной стадии и H2L3% каждой фракции. H2L3 % виртуального пула с разным собираемым объемом наносили на график против выхода каждого виртуального пула. Количество совместно элюированных видов H2L3 в более ранних фракциях пика антитела снижалось с уменьшением рН. На Фиг. 5 показано, что уменьшение рН связывания и элюирования из колонки POROS™ XS значительно улучшило удаление видов H2L3 так, что элюирование с более низким рН давало продукт с более низким содержанием видов H2L3. При pH 4,4 H2L3 эффективно отделялся от антитела и элюировался только в более поздних фракциях. При элюировании с более низким pH образуется продукт (композиция H2L2) с более низким содержанием видов H2L3.
[125] Как было показано концентрация соли и собираемый объем пика элюирования также влияют на удаление H2L3 (Фиг. 6). В этих экспериментах исходный материал (композиция антител) с примерно 4,1 % видами H2L3 загружали в колонку POROS™ XS, уравновешенную 50 мМ ацетатом натрия при pH 4,2. Связанное антитело элюировали с использованием 380-420 мМ NaCl в 50 мМ натрий-ацетатном буфере при рН 4,2. Пик элюирования собирали при mAU выше 100 во фракциях 1 CV. H2L3% виртуальных пулов элюировали при различных концентрациях NaCl и с разными собираемыми объемами. На Фиг. 6 показано, что чем ниже концентрация NaCl и чем меньше собираемый объем, тем ниже H2L3% был достигнут в пуле элюирования. Во всем диапазоне протестированных концентраций NaCl H2L3% виртуальных пулов был уменьшен с 4,1 % до <1 %.
[126] Результаты эксперимента на Фиг. 6 были проанализированы с использованием инструмента для прогнозирования профилей JMP®. Была построена математическая модель для прогнозирования выхода H2L3% и общего высокомолекулярного вида (HMW)% при различных концентрациях соли и собираемых объемах. На Фиг. 7 показано, что концентрация соли значительно влияла на все отклики, в то время как собираемый объем значительно влиял только на выход на одной стадии. Желательность каждого отклика определяли исходя из требований к качеству продуктов и практических соображений. Для условия конечного процесса рассматривали комбинации концентрации соли и собираемого объема с наибольшей общей желательностью.
[127] Путем оптимизации условий связывания и элюирования, включая рН, концентрацию соли, плотность загрузки и собираемый объем, уровень H2L3 последовательно снижался до < 1 % в конечном продукте (Таблица 4; эксперименты проводили в тех же условиях POROS, как описано выше, при pH 4,2, с 400 мМ NaCl, собирая 4CV (т. е. объем колонки 1-4)).

[128] На основании экспериментов, описанных выше, было определено, что идеальный диапазон для pH, соли, плотности загрузки и собираемого объема является следующим: pH от приблизительно 3,8 до 6,5, концентрация соли от приблизительно 100 мМ до 600 мМ, плотность загрузки приблизительно 10-100 г/л, и собираемый объем от приблизительно 1 до 9 CV.
[129] Следует принять во внимание, что раздел «Подробное описание», а не разделы «Краткого описания» и «Реферат», предназначен для интерпретации формулы изобретения. В разделах «Краткое описание» и «Реферат» указаны один или более, но не все иллюстративные варианты осуществления данного изобретения, как это предусмотрено изобретателем(ями), и, таким образом, не предназначены для ограничения данного изобретения и прилагаемой формулы изобретения любым способом.
[130] Данное изобретение было описано выше с помощью функциональных структурных блоков, иллюстрирующих осуществление указанных функций и их взаимосвязей. Границы этих функциональных структурных элементов были произвольно определены в данном документе для удобства описания. Альтернативные границы могут быть определены до тех пор, пока указанные функции и их отношения будут надлежащим образом выполняться.
[131] Вышеизложенное описание конкретных вариантов осуществления полностью отражает общий характер изобретения, который другие могут, применяя знания в пределах уровня техники, легко модифицировать и/или адаптировать для различных применений подобных конкретных вариантов осуществления, без излишнего экспериментирования, не отступая от общей концепции данного изобретения. Следовательно, такие адаптации и модификации предназначены для того, чтобы быть в пределах значения и диапазона эквивалентов раскрытых вариантов осуществления на основе представленных в данном документе инструкций и указаний. Следует понимать, что формулировки или терминология в данном документе предназначены для описания, а не ограничения, так что терминология или формулировки данного описания должны интерпретироваться квалифицированным специалистом в свете инструкций и указаний.
[132] Объем притязаний и объем данного изобретения не должны ограничиваться каким-либо из вышеописанных иллюстративных вариантов осуществления, но должны определяться только в соответствии со следующей формулой изобретения и их эквивалентами.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ImmunoGen, Inc.
LIU, Fang
LI, Xinfang
<120> Разделение антител с тремя легкими цепями при помощи катионообменной
хроматографии
<130> 2921.097PC01/EKS/CLD/BMB
<150> 62/562 188
<151> 22.09.2017
<160> 12
<170> PatentIn версия 3.5
<210> 1
<211> 121
<212> Белок
<213> Искусственная последовательность
<220>
<223> Вариабельная область тяжелой цепи huCD123-6Gv7
<400> 1
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Ser Ser
20 25 30
Ile Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Lys Pro Tyr Asn Asp Gly Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Ser Asp Arg Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Gly Asn Asp Tyr Tyr Asp Thr Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 2
<211> 108
<212> Белок
<213> искусственная последовательность
<220>
<223> Вариабельная область легкой цепи huCD123-6Gv4
<400> 2
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Asn Ser Tyr
20 25 30
Leu Ser Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Thr Leu Ile
35 40 45
Tyr Arg Val Asn Arg Leu Val Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Asn Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp Ala Phe Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 3
<211> 450
<212> Белок
<213> искусственная последовательность
<220>
<223> Полноразмерная тяжелая цепь huCD123-6Gv7-C442
<400> 3
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Ser Ser
20 25 30
Ile Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Lys Pro Tyr Asn Asp Gly Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Ser Asp Arg Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Gly Asn Asp Tyr Tyr Asp Thr Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Cys Leu Ser
435 440 445
Pro Gly
450
<210> 4
<211> 214
<212> Белок
<213> искусственная последовательность
<220>
<223> Полноразмерная легкая цепь huCD123-6Gv4
<400> 4
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Asn Ser Tyr
20 25 30
Leu Ser Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Thr Leu Ile
35 40 45
Tyr Arg Val Asn Arg Leu Val Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Asn Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp Ala Phe Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 5
<211> 5
<212> Белок
<213> искусственная последовательность
<220>
<223> CDR1 вариабельной области тяжелой цепи huCD123-6Gv7-C442
<400> 5
Ser Ser Ile Met His
1 5
<210> 6
<211> 17
<212> Белок
<213> искусственная последовательность
<220>
<223> CDR2 вариабельной области тяжелой цепи huCD123-6Gv7-C442
<400> 6
Tyr Ile Lys Pro Tyr Asn Asp Gly Thr Lys Tyr Asn Glu Lys Phe Lys
1 5 10 15
Gly
<210> 7
<211> 12
<212> Белок
<213> искусственная последовательность
<220>
<223> CDR3 вариабельной области тяжелой цепи huCD123-6Gv7-C442
<400> 7
Glu Gly Gly Asn Asp Tyr Tyr Asp Thr Met Asp Tyr
1 5 10
<210> 8
<211> 11
<212> Белок
<213> искусственная последовательность
<220>
<223> CDR1 вариабельной области легкой цепи huCD123-6Gv4
<400> 8
Arg Ala Ser Gln Asp Ile Asn Ser Tyr Leu Ser
1 5 10
<210> 9
<211> 7
<212> Белок
<213> искусственная последовательность
<220>
<223> CDR2 вариабельной области легкой цепи huCD123-6Gv4
<400> 9
Arg Val Asn Arg Leu Val Asp
1 5
<210> 10
<211> 9
<212> Белок
<213> искусственная последовательность
<220>
<223> CDR3 вариабельной области легкой цепи huCD123-6Gv4
<400> 10
Leu Gln Tyr Asp Ala Phe Pro Tyr Thr
1 5
<210> 11
<211> 378
<212> Белок
<213> Homo Sapiens
<400> 11
Met Val Leu Leu Trp Leu Thr Leu Leu Leu Ile Ala Leu Pro Cys Leu
1 5 10 15
Leu Gln Thr Lys Glu Asp Pro Asn Pro Pro Ile Thr Asn Leu Arg Met
20 25 30
Lys Ala Lys Ala Gln Gln Leu Thr Trp Asp Leu Asn Arg Asn Val Thr
35 40 45
Asp Ile Glu Cys Val Lys Asp Ala Asp Tyr Ser Met Pro Ala Val Asn
50 55 60
Asn Ser Tyr Cys Gln Phe Gly Ala Ile Ser Leu Cys Glu Val Thr Asn
65 70 75 80
Tyr Thr Val Arg Val Ala Asn Pro Pro Phe Ser Thr Trp Ile Leu Phe
85 90 95
Pro Glu Asn Ser Gly Lys Pro Trp Ala Gly Ala Glu Asn Leu Thr Cys
100 105 110
Trp Ile His Asp Val Asp Phe Leu Ser Cys Ser Trp Ala Val Gly Pro
115 120 125
Gly Ala Pro Ala Asp Val Gln Tyr Asp Leu Tyr Leu Asn Val Ala Asn
130 135 140
Arg Arg Gln Gln Tyr Glu Cys Leu His Tyr Lys Thr Asp Ala Gln Gly
145 150 155 160
Thr Arg Ile Gly Cys Arg Phe Asp Asp Ile Ser Arg Leu Ser Ser Gly
165 170 175
Ser Gln Ser Ser His Ile Leu Val Arg Gly Arg Ser Ala Ala Phe Gly
180 185 190
Ile Pro Cys Thr Asp Lys Phe Val Val Phe Ser Gln Ile Glu Ile Leu
195 200 205
Thr Pro Pro Asn Met Thr Ala Lys Cys Asn Lys Thr His Ser Phe Met
210 215 220
His Trp Lys Met Arg Ser His Phe Asn Arg Lys Phe Arg Tyr Glu Leu
225 230 235 240
Gln Ile Gln Lys Arg Met Gln Pro Val Ile Thr Glu Gln Val Arg Asp
245 250 255
Arg Thr Ser Phe Gln Leu Leu Asn Pro Gly Thr Tyr Thr Val Gln Ile
260 265 270
Arg Ala Arg Glu Arg Val Tyr Glu Phe Leu Ser Ala Trp Ser Thr Pro
275 280 285
Gln Arg Phe Glu Cys Asp Gln Glu Glu Gly Ala Asn Thr Arg Ala Trp
290 295 300
Arg Thr Ser Leu Leu Ile Ala Leu Gly Thr Leu Leu Ala Leu Val Cys
305 310 315 320
Val Phe Val Ile Cys Arg Arg Tyr Leu Val Met Gln Arg Leu Phe Pro
325 330 335
Arg Ile Pro His Met Lys Asp Pro Ile Gly Asp Ser Phe Gln Asn Asp
340 345 350
Lys Leu Val Val Trp Glu Ala Gly Lys Ala Gly Leu Glu Glu Cys Leu
355 360 365
Val Thr Glu Val Gln Val Val Gln Lys Thr
370 375
<210> 12
<211> 300
<212> Белок
<213> Homo Sapiens
<400> 12
Met Val Leu Leu Trp Leu Thr Leu Leu Leu Ile Ala Leu Pro Cys Leu
1 5 10 15
Leu Gln Thr Lys Glu Gly Gly Lys Pro Trp Ala Gly Ala Glu Asn Leu
20 25 30
Thr Cys Trp Ile His Asp Val Asp Phe Leu Ser Cys Ser Trp Ala Val
35 40 45
Gly Pro Gly Ala Pro Ala Asp Val Gln Tyr Asp Leu Tyr Leu Asn Val
50 55 60
Ala Asn Arg Arg Gln Gln Tyr Glu Cys Leu His Tyr Lys Thr Asp Ala
65 70 75 80
Gln Gly Thr Arg Ile Gly Cys Arg Phe Asp Asp Ile Ser Arg Leu Ser
85 90 95
Ser Gly Ser Gln Ser Ser His Ile Leu Val Arg Gly Arg Ser Ala Ala
100 105 110
Phe Gly Ile Pro Cys Thr Asp Lys Phe Val Val Phe Ser Gln Ile Glu
115 120 125
Ile Leu Thr Pro Pro Asn Met Thr Ala Lys Cys Asn Lys Thr His Ser
130 135 140
Phe Met His Trp Lys Met Arg Ser His Phe Asn Arg Lys Phe Arg Tyr
145 150 155 160
Glu Leu Gln Ile Gln Lys Arg Met Gln Pro Val Ile Thr Glu Gln Val
165 170 175
Arg Asp Arg Thr Ser Phe Gln Leu Leu Asn Pro Gly Thr Tyr Thr Val
180 185 190
Gln Ile Arg Ala Arg Glu Arg Val Tyr Glu Phe Leu Ser Ala Trp Ser
195 200 205
Thr Pro Gln Arg Phe Glu Cys Asp Gln Glu Glu Gly Ala Asn Thr Arg
210 215 220
Ala Trp Arg Thr Ser Leu Leu Ile Ala Leu Gly Thr Leu Leu Ala Leu
225 230 235 240
Val Cys Val Phe Val Ile Cys Arg Arg Tyr Leu Val Met Gln Arg Leu
245 250 255
Phe Pro Arg Ile Pro His Met Lys Asp Pro Ile Gly Asp Ser Phe Gln
260 265 270
Asn Asp Lys Leu Val Val Trp Glu Ala Gly Lys Ala Gly Leu Glu Glu
275 280 285
Cys Leu Val Thr Glu Val Gln Val Val Gln Lys Thr
290 295 300
<---