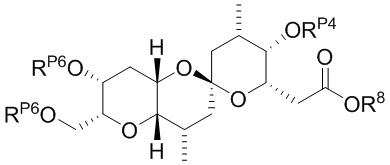
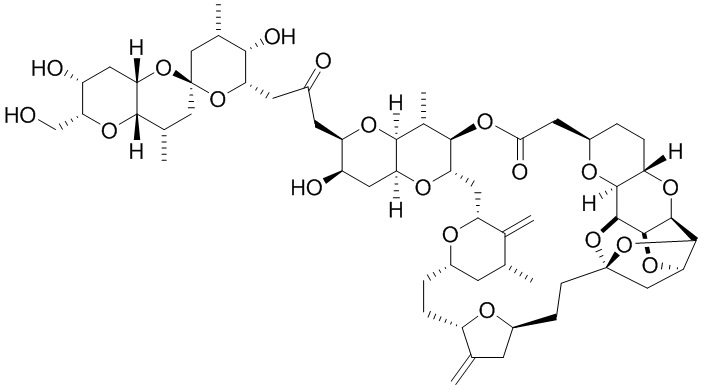
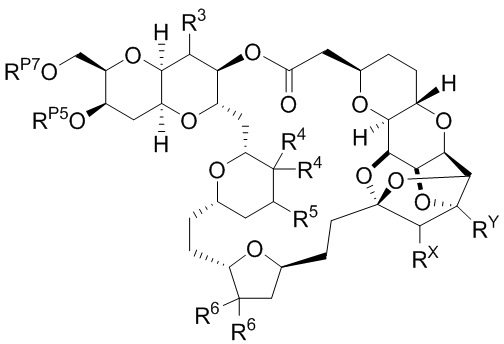
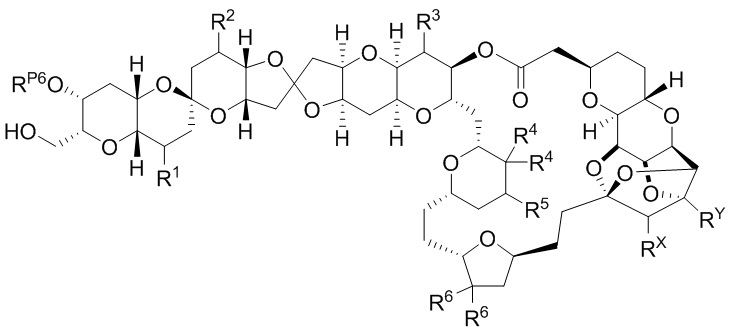
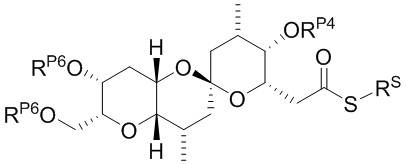
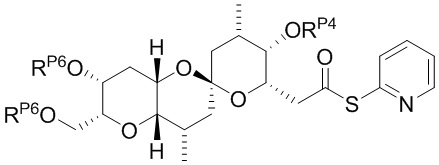
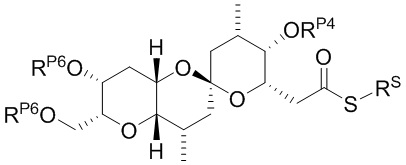
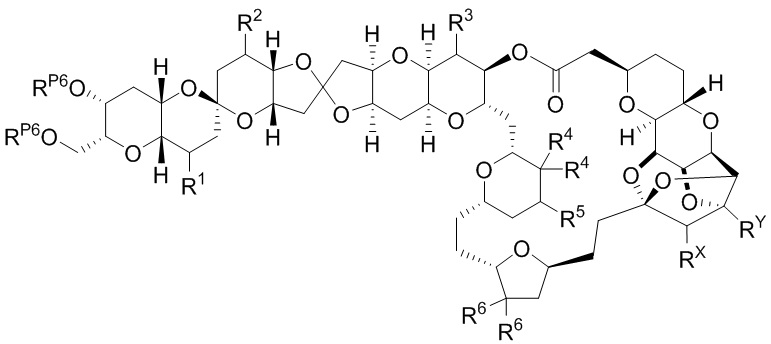
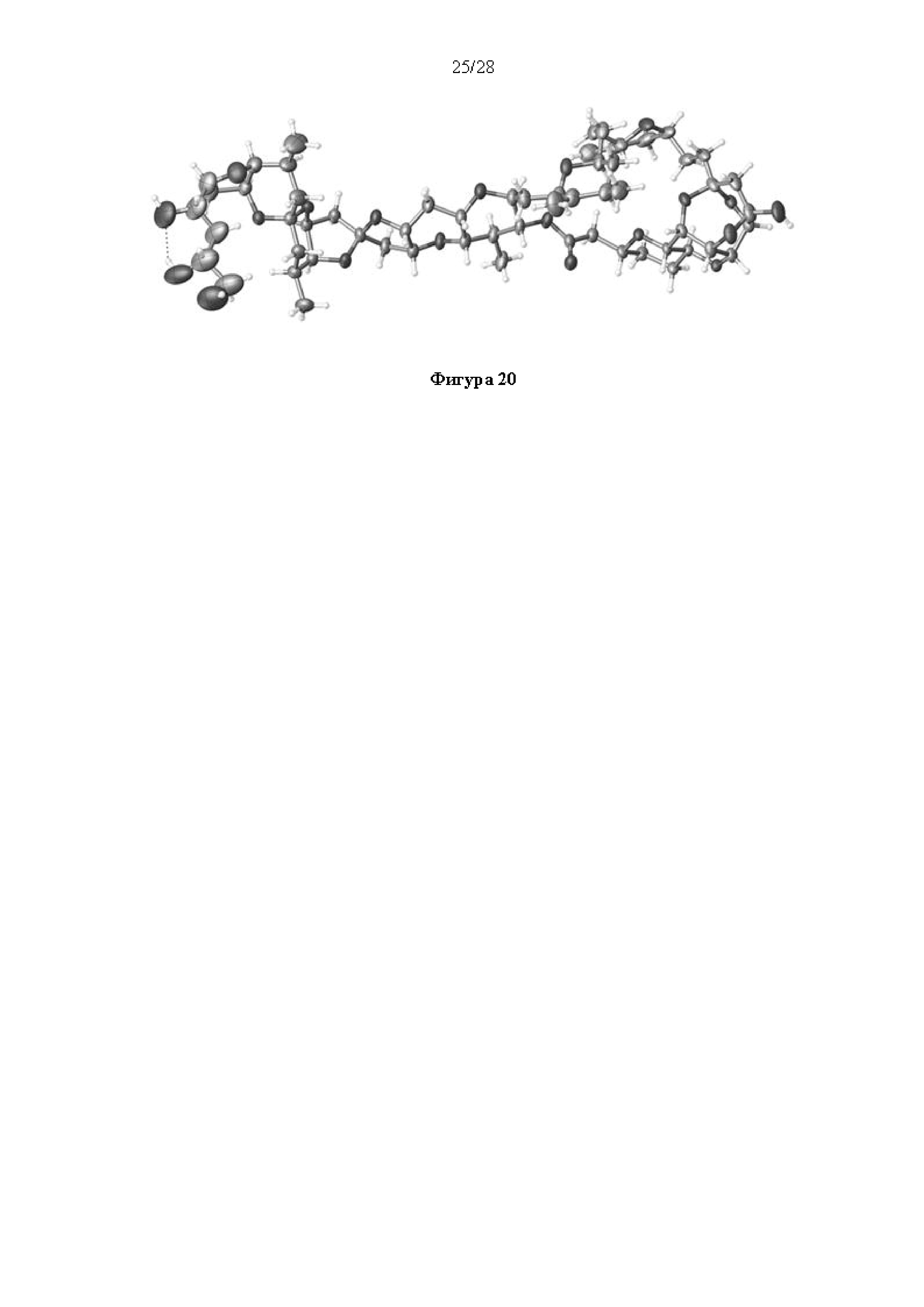
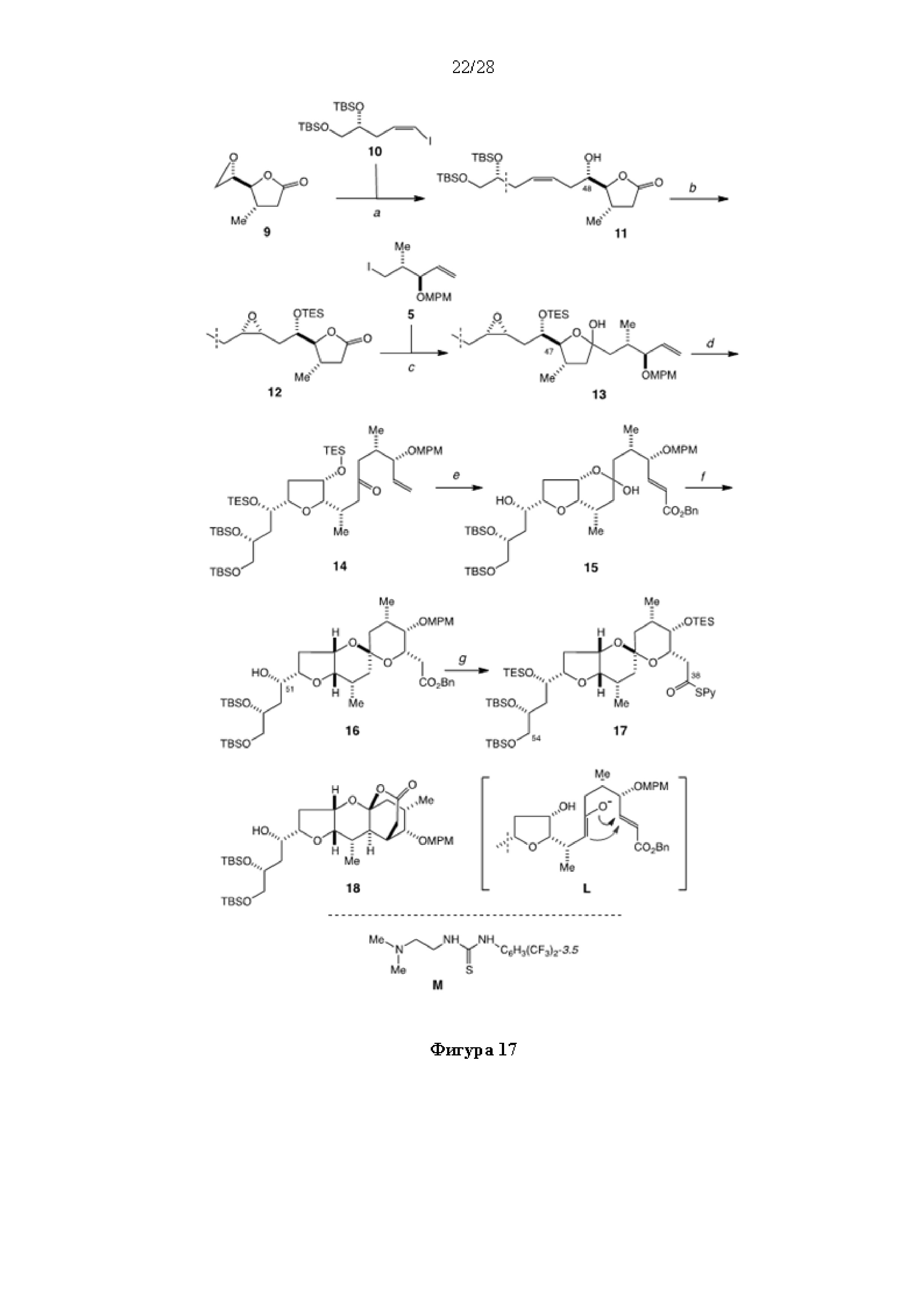
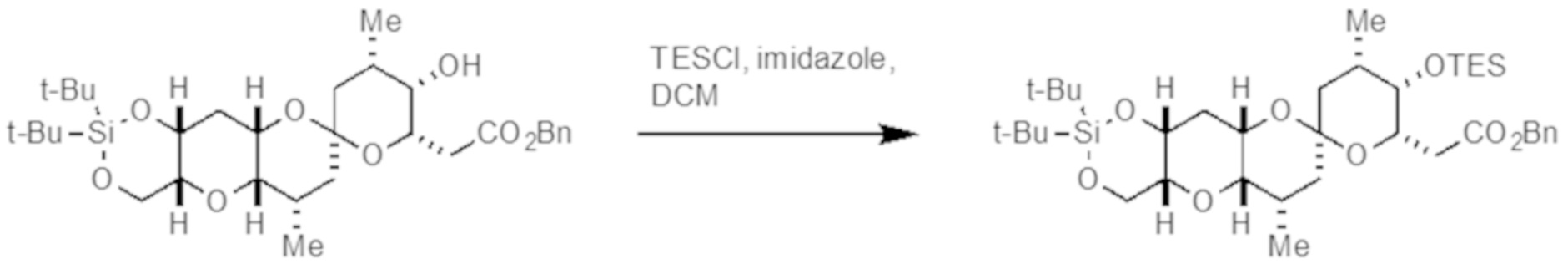
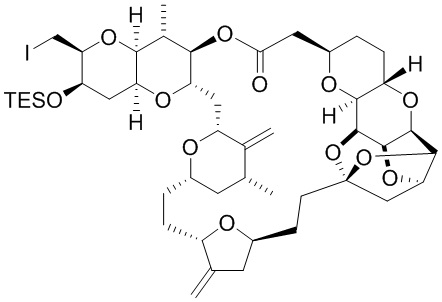
Результат интеллектуальной деятельности: СИНТЕЗ ГАЛИХОНДРИНОВ
Вид РИД
Изобретение
Родственные связи
[0001] По настоящей заявке испрашивается приоритет согласно 35 U.S.С. §119(e) в соответствии с предварительными заявками на выдачу патента США №62/529,333, поданной 6 июля 2017 года, и №62/529,310, поданной 6 июля 2017 года, полное содержание которых включено в настоящий документ посредством ссылки.
Предшествующий уровень техники настоящего изобретения
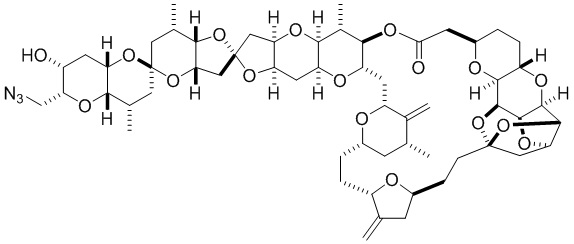
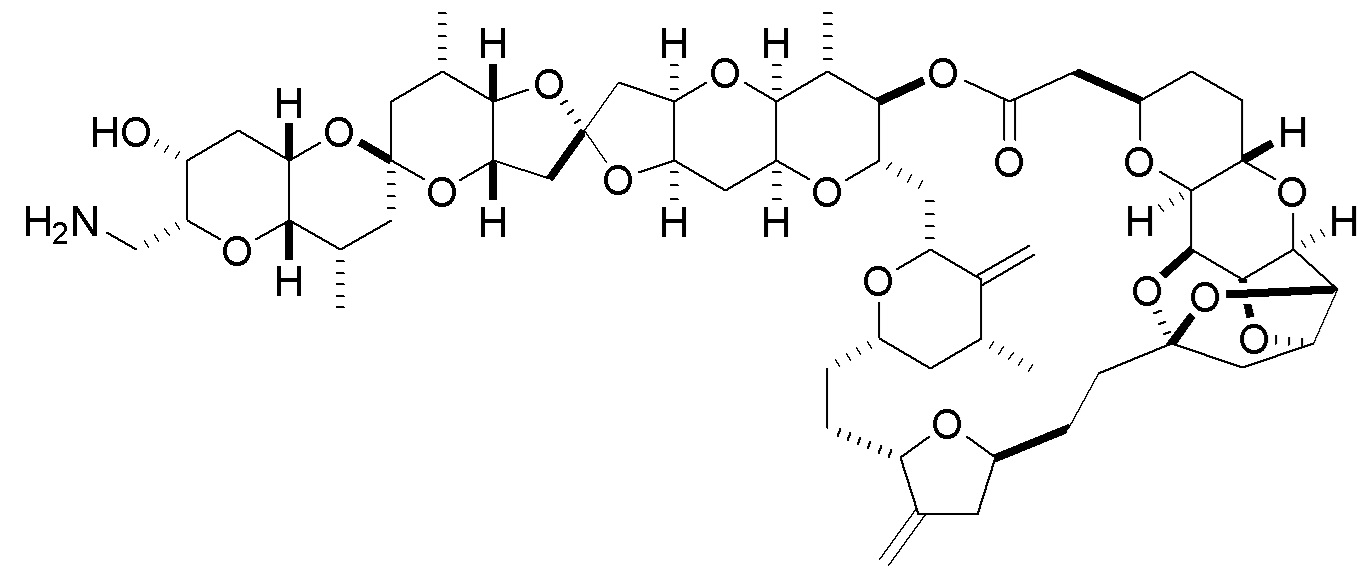
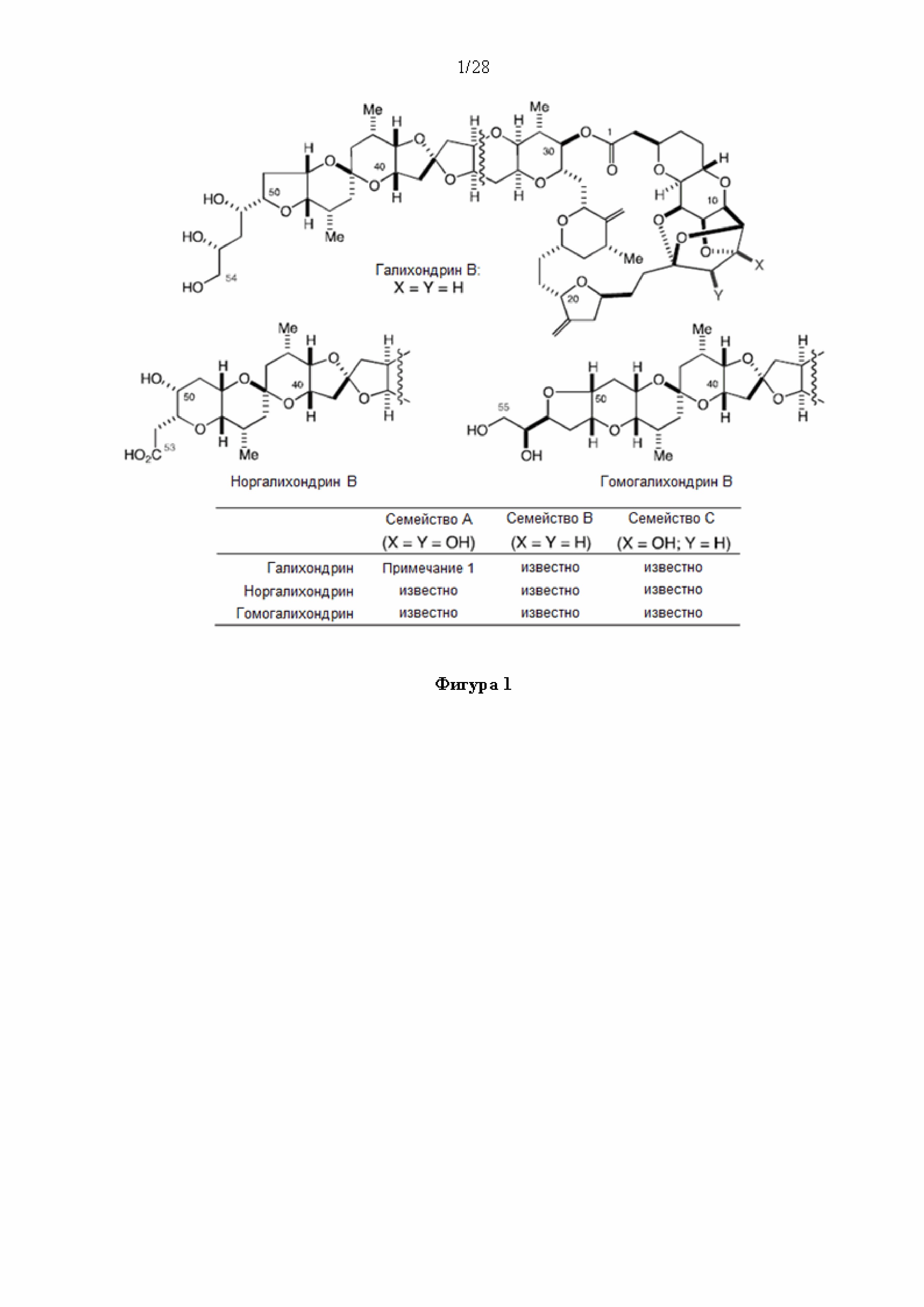
[0002] Галихондрины представляют собой полиэфирные продукты природного происхождения, первоначально выделенные Uemura, Hirata и сотр. из морской губки Halichondria okadai (см., например, Uemura, D.; Takahashi, K.; Yamamoto, Т.; Katayama, С.; Tanaka, J.; Okumura, Y.; Uemura, Y.J. Am. Chem. Soc. 1985, 107, 4796; Hirata, Y.; Uemura, D. Pure Appl. Chem. 1986, 58, 701). Несколько дополнительных представителей, включая галистатин, были выделены из различных морских губок. Этот класс продуктов природного происхождения проявляет вызывающее интерес структурное разнообразие, как то степень окисления атомов углерода С8-С14-полицикла и длина углеродного остова. Поэтому, этот класс продуктов природного происхождения подразделяется на норгалихондриновый ряд (например, норгалихондрин А, В и С), галихондриновый ряд (например, галихондрин А, В, С) и гомогалихондриновый ряд (например, гомогалихондрин А, В, С) (см. Фигура 1). За исключением галихондрина А, все представители были выделены из природных источников. По причине их примечательного структурного построения и уникальной противоопухолевой активности, галихондринам было уделено много внимания со стороны научного сообщества.
Краткое раскрытие настоящего изобретения
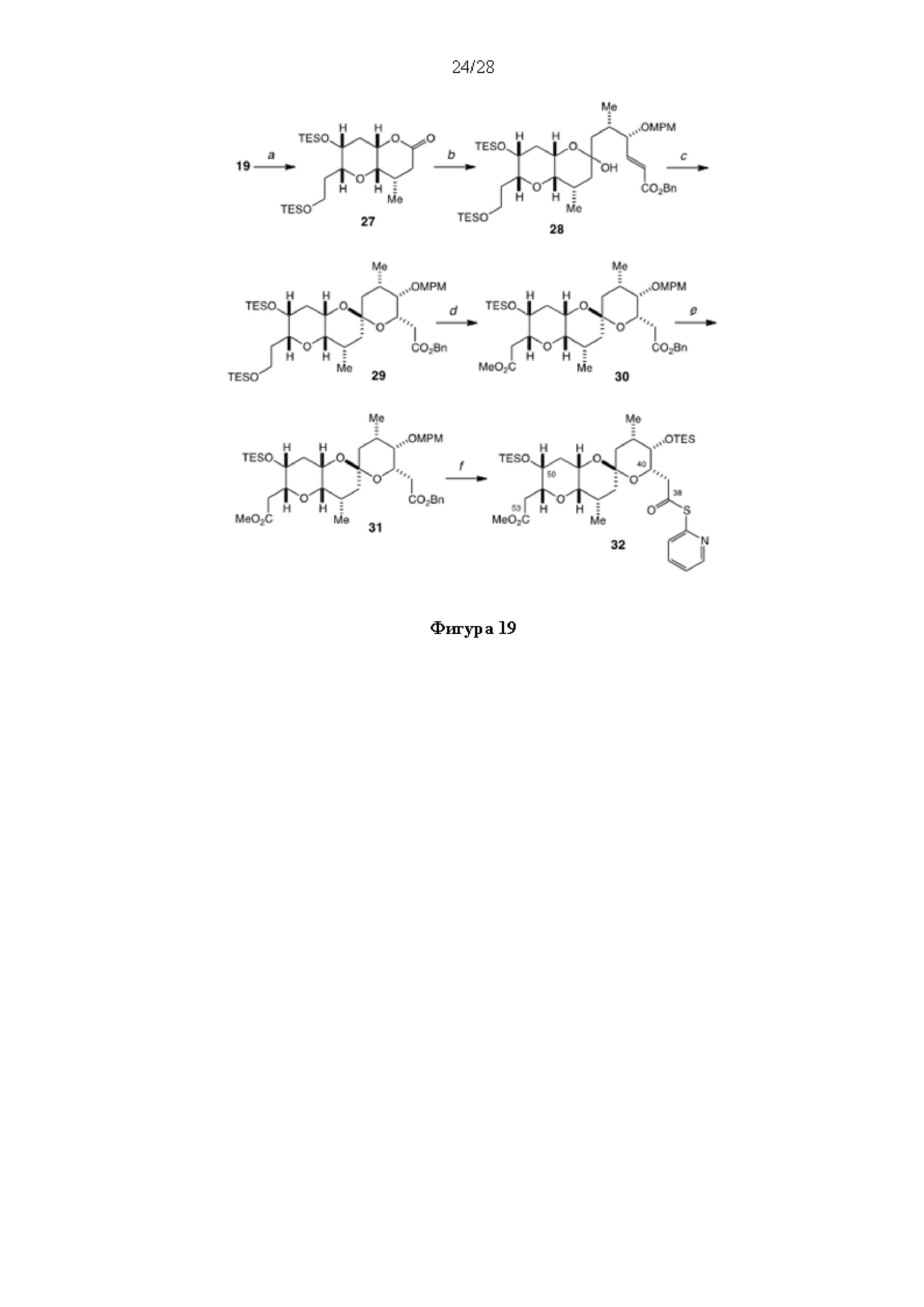
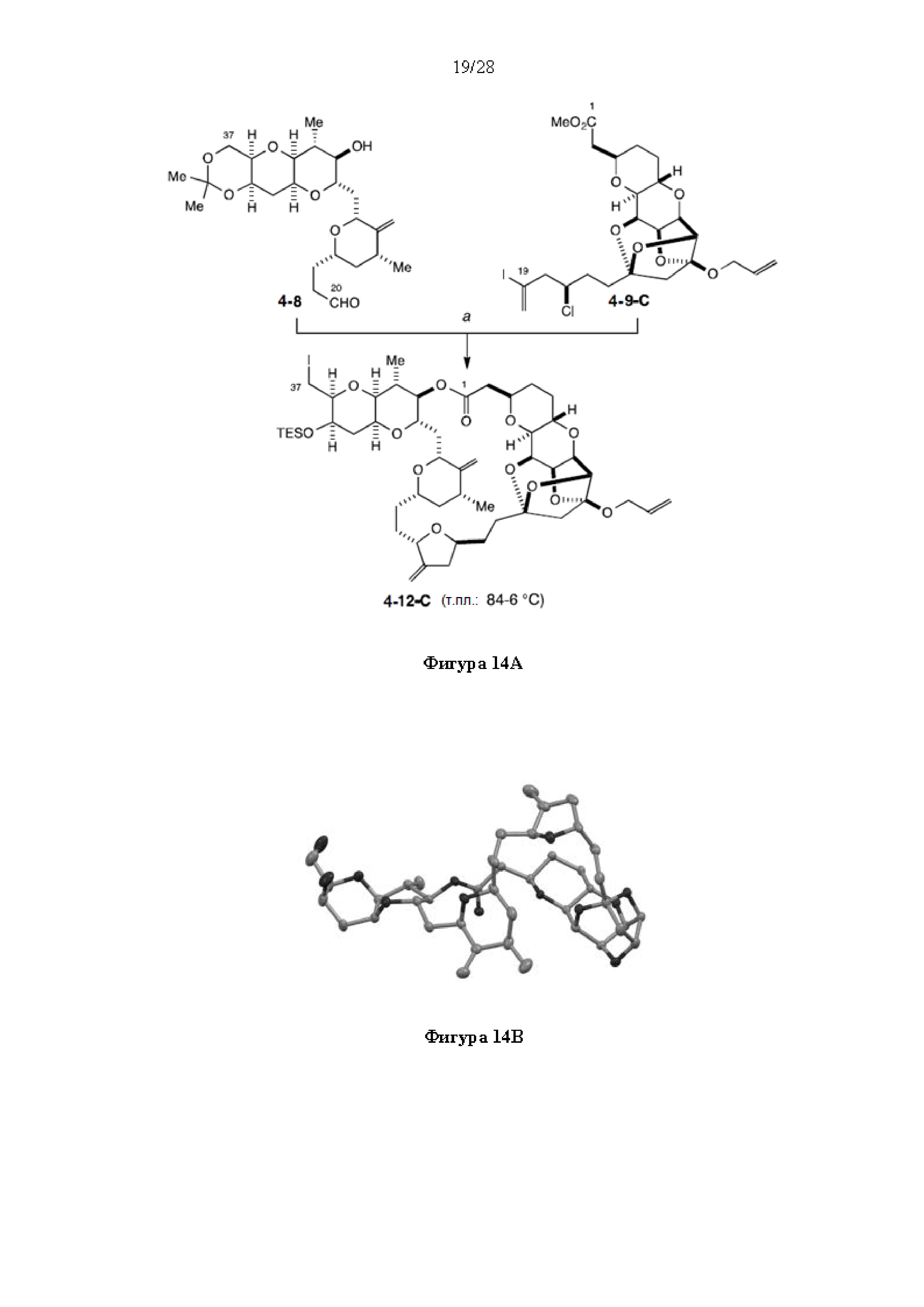
[0003] Настоящее изобретение относится к новым способам синтеза, применимым при синтезе галихондриновых продуктов природного происхождения и родственных молекул. Как описано в настоящем документе, в качестве ключевой реакции синтеза была разработана новая никель/цирконий-опосредованная реакция сочетания. В дополнение к способам синтеза, настоящее изобретение также относится к соединениям, которые представляют собой синтетические промежуточные соединения, применимые для синтеза галихондриновых продуктов природного происхождения и их аналогов.
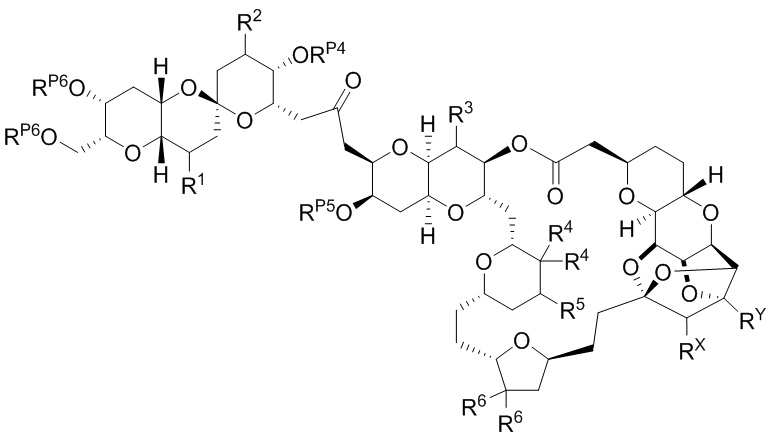
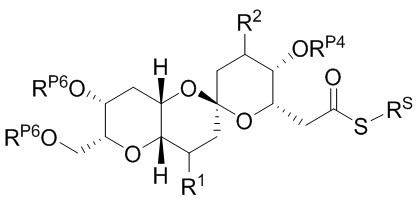
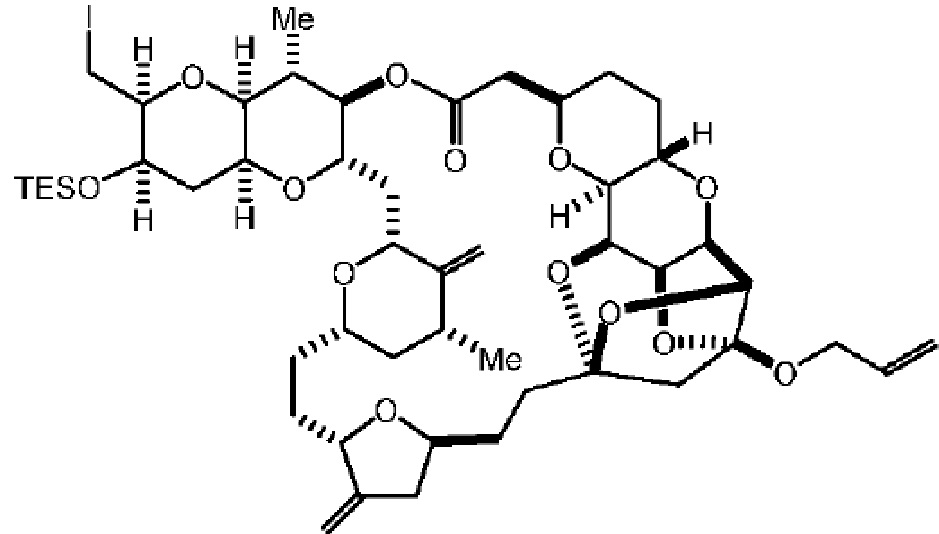
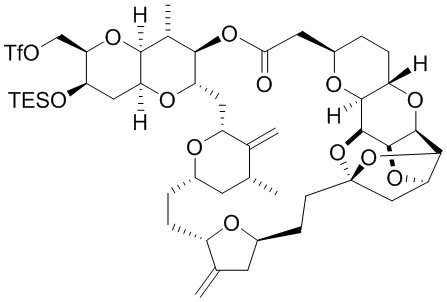
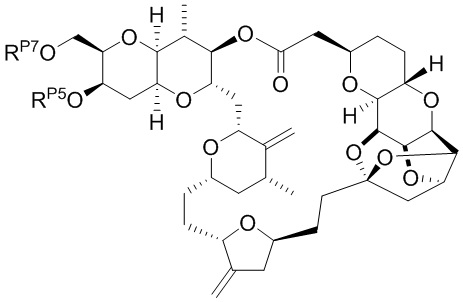
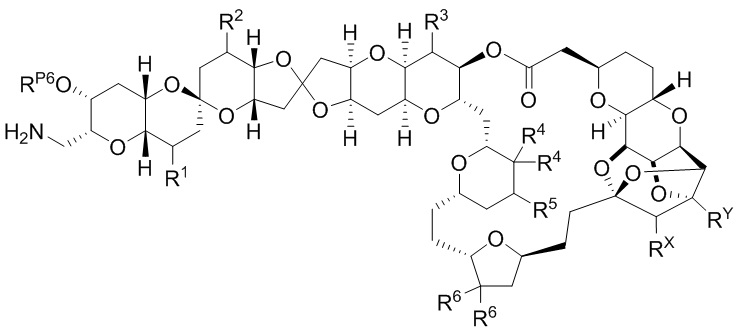
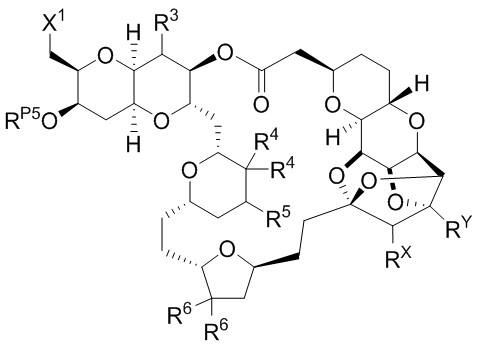
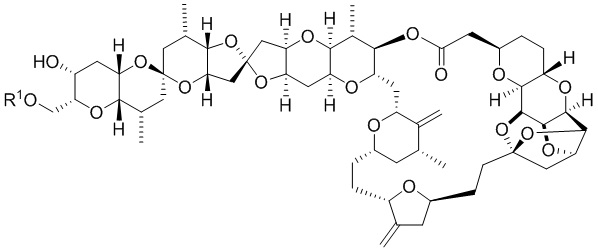
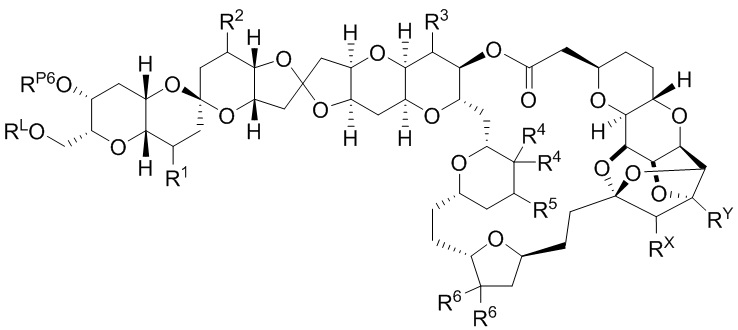
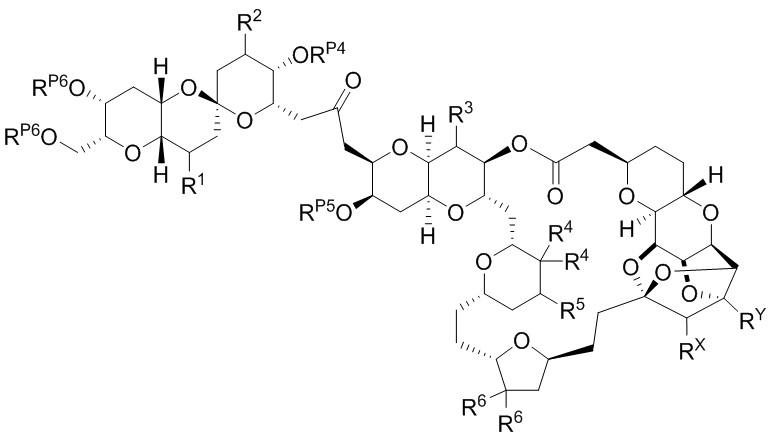
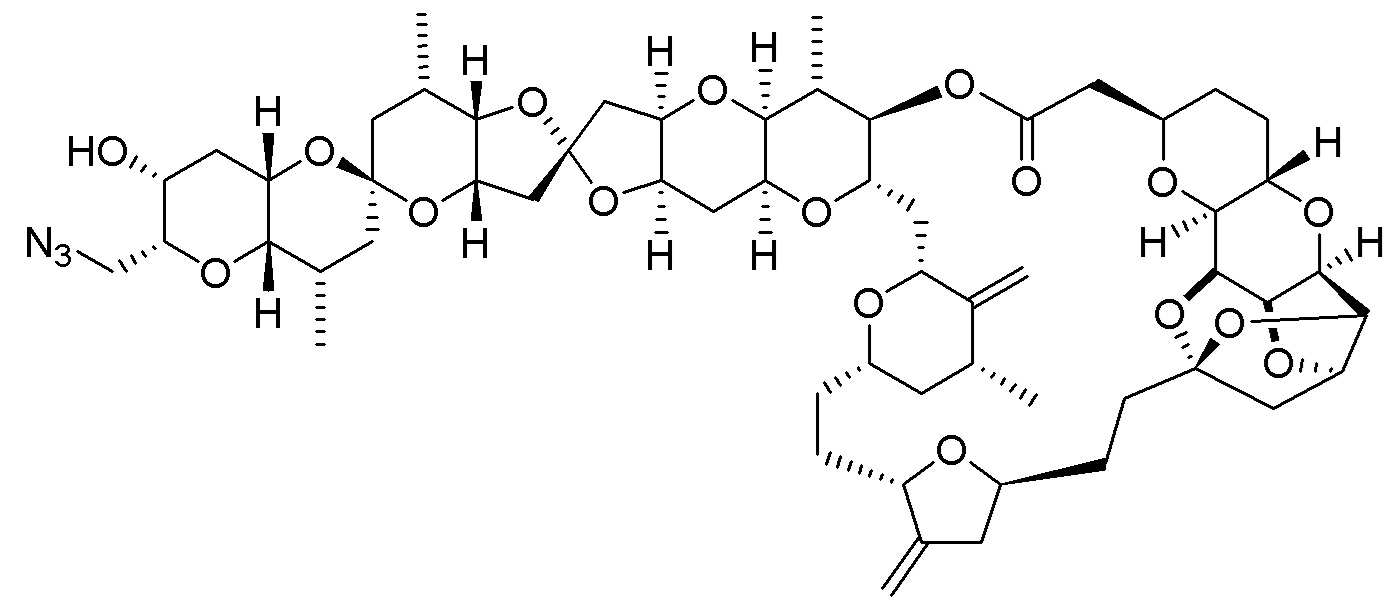
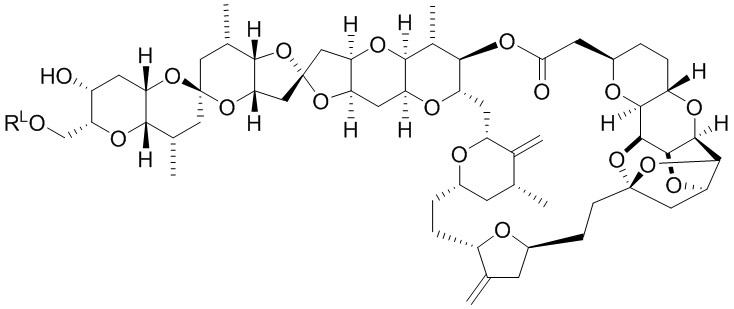
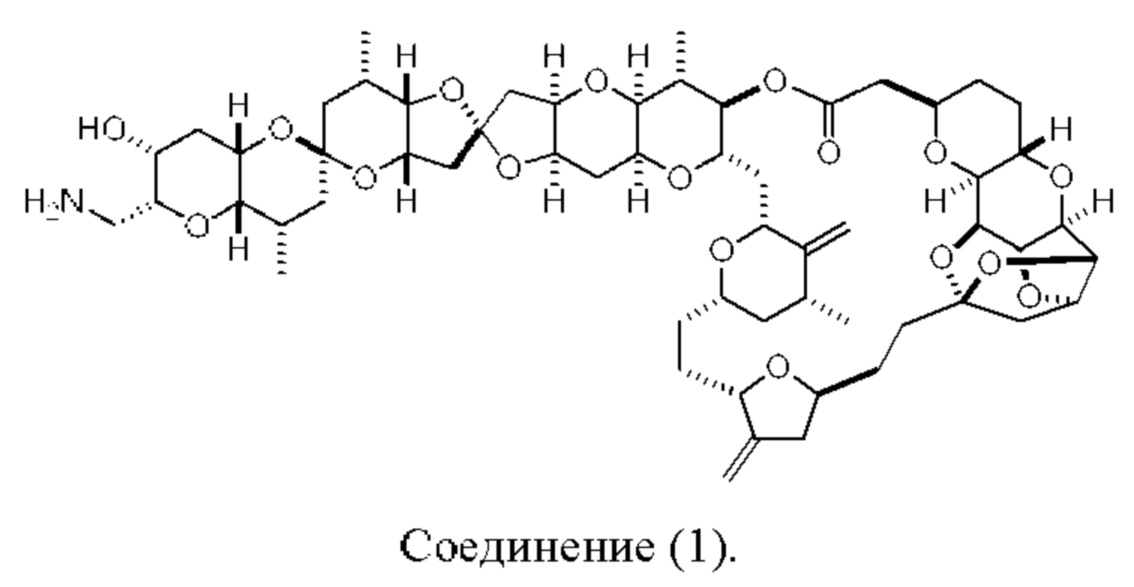
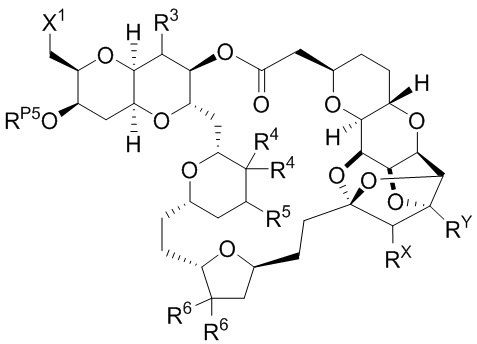
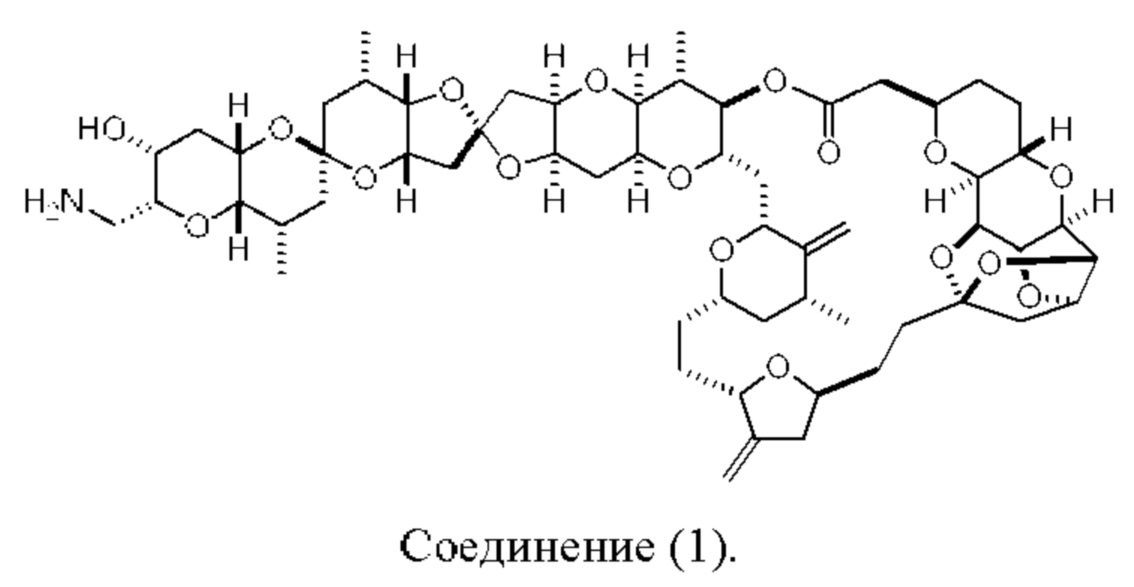
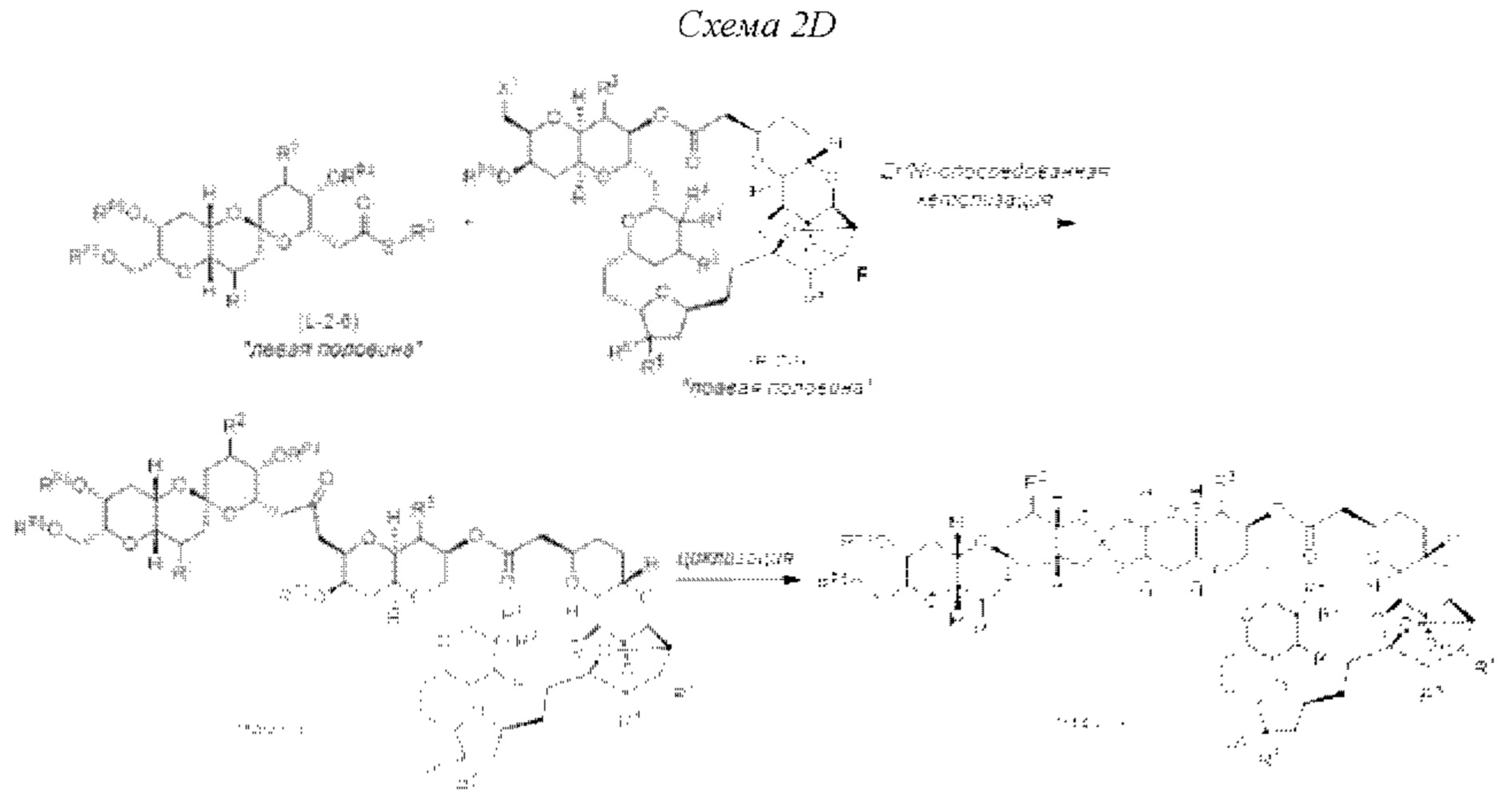
[0004] Например, согласно определенным вариантам осуществления в настоящем документе раскрыты соединения и способы, применимые для синтеза соединения (1):
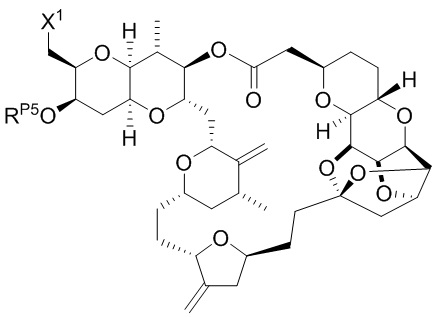
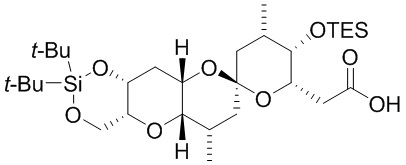
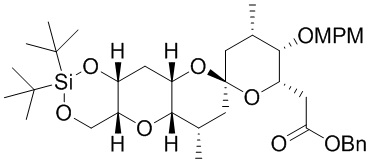
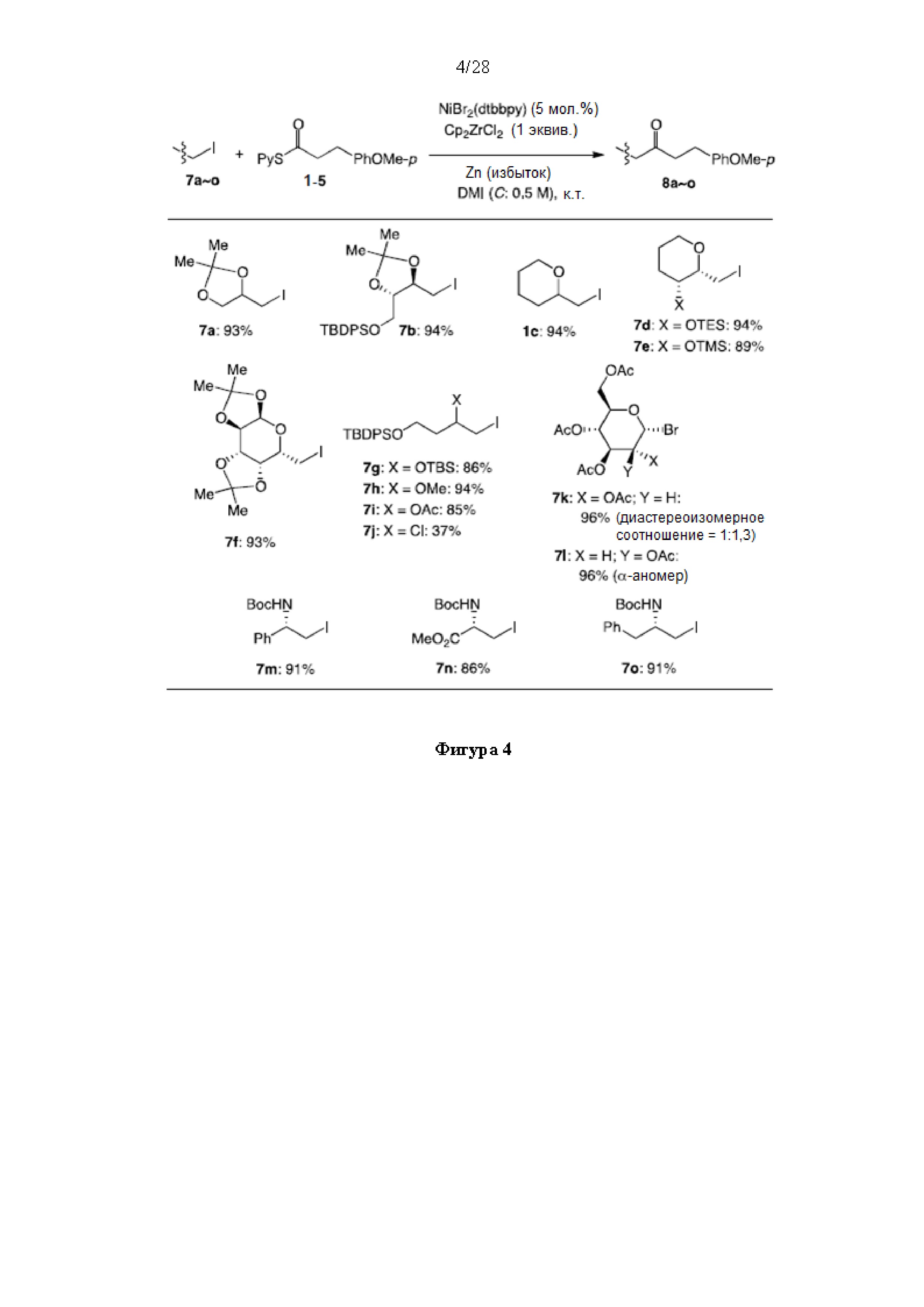
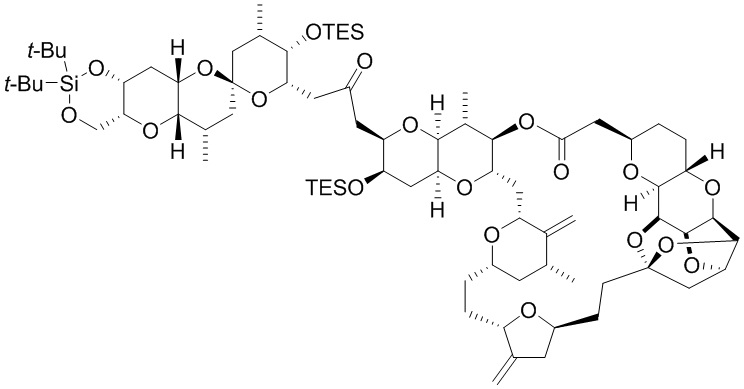
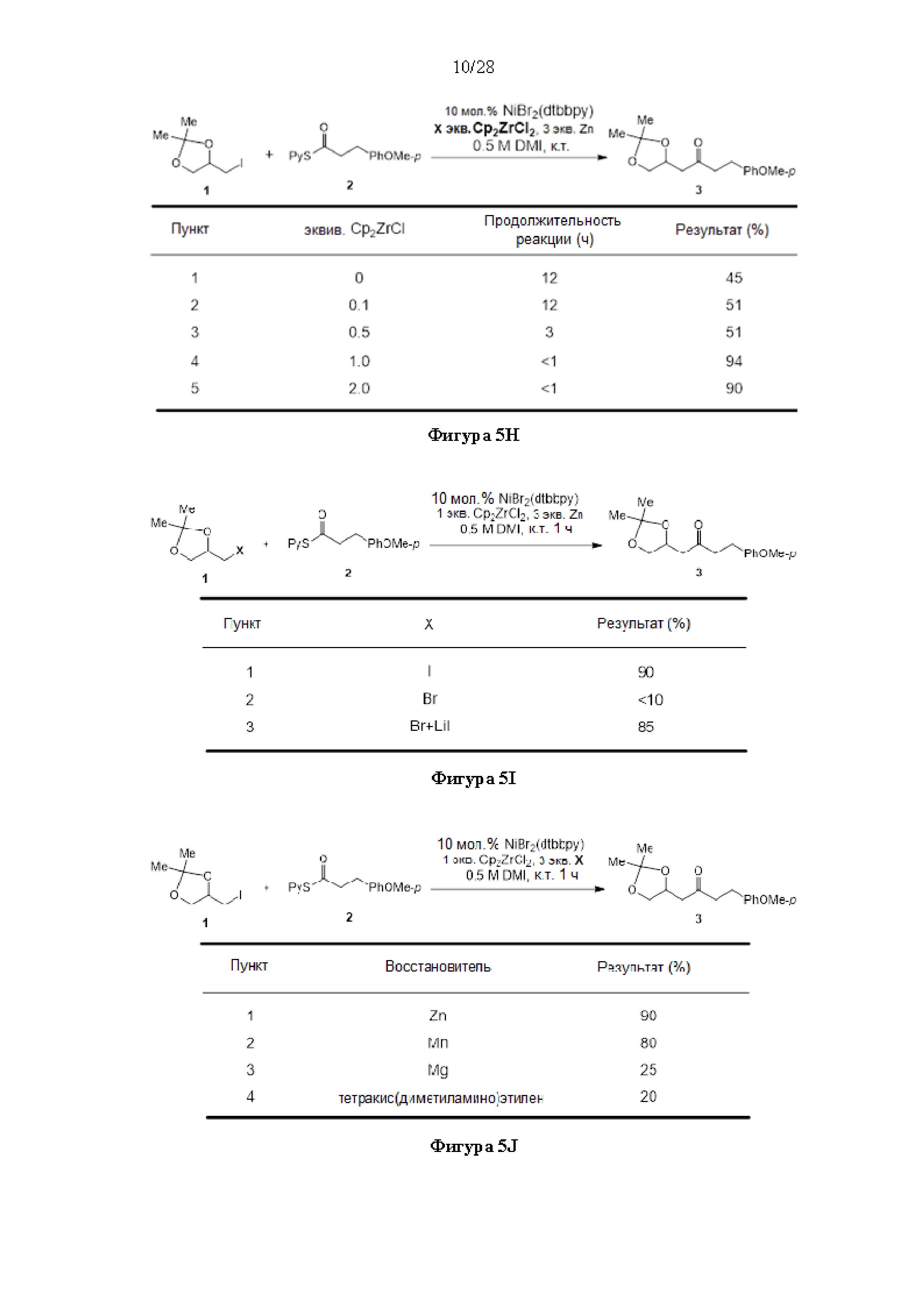
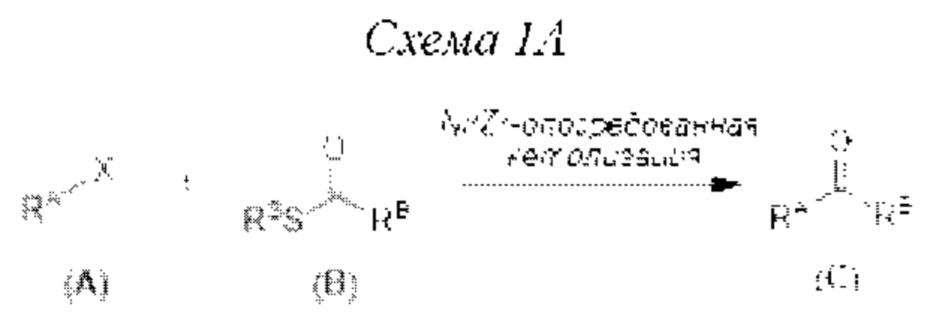
[0005] Согласно одному аспекту настоящее изобретение относится к способам получения кетонов с использованием Ni/Zr-опосредованной реакции сочетания, отображенной на Схеме 1А. Указанные реакции сочетания могут быть применимы для синтеза галихондринов (например, галихондрина А, В, С; гомогалихондрина А, В, С; норгалихондрина А, В, С) и их аналогов.
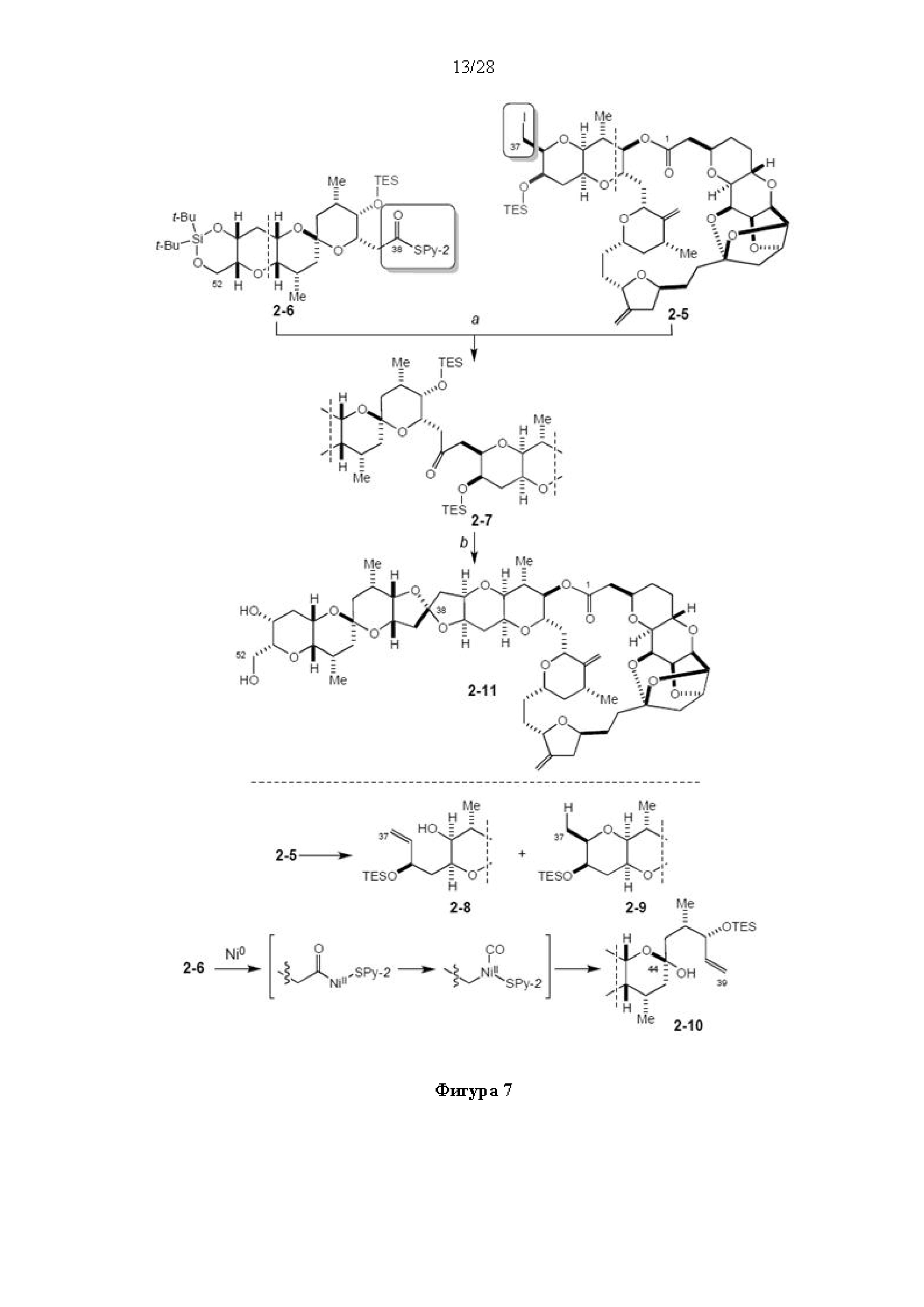
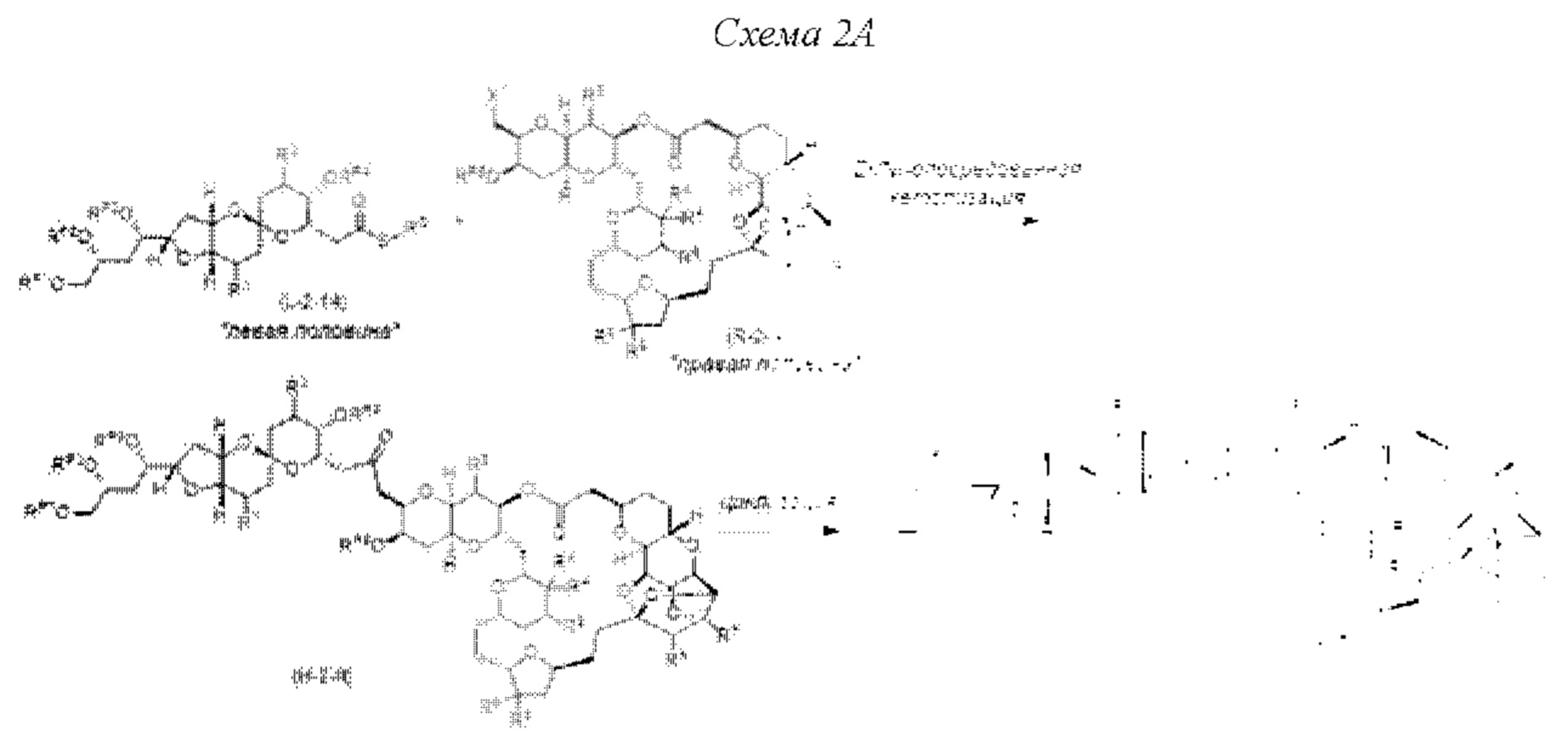
[0006] Применение Ni/Zr-опосредованных реакций сочетания, раскрытых в настоящем документе, для получения соединений галихондринов ого ряда (например, галихондрина А, В, С и их аналога) отображено, например, на Схеме 2А. Эта стратегия включает в себя сочетание структурного элемента «левой половины» со структурным элементом «правой половины» посредством Ni/Zr-опосредованной реакции кетолизации, описанной в настоящем документе.
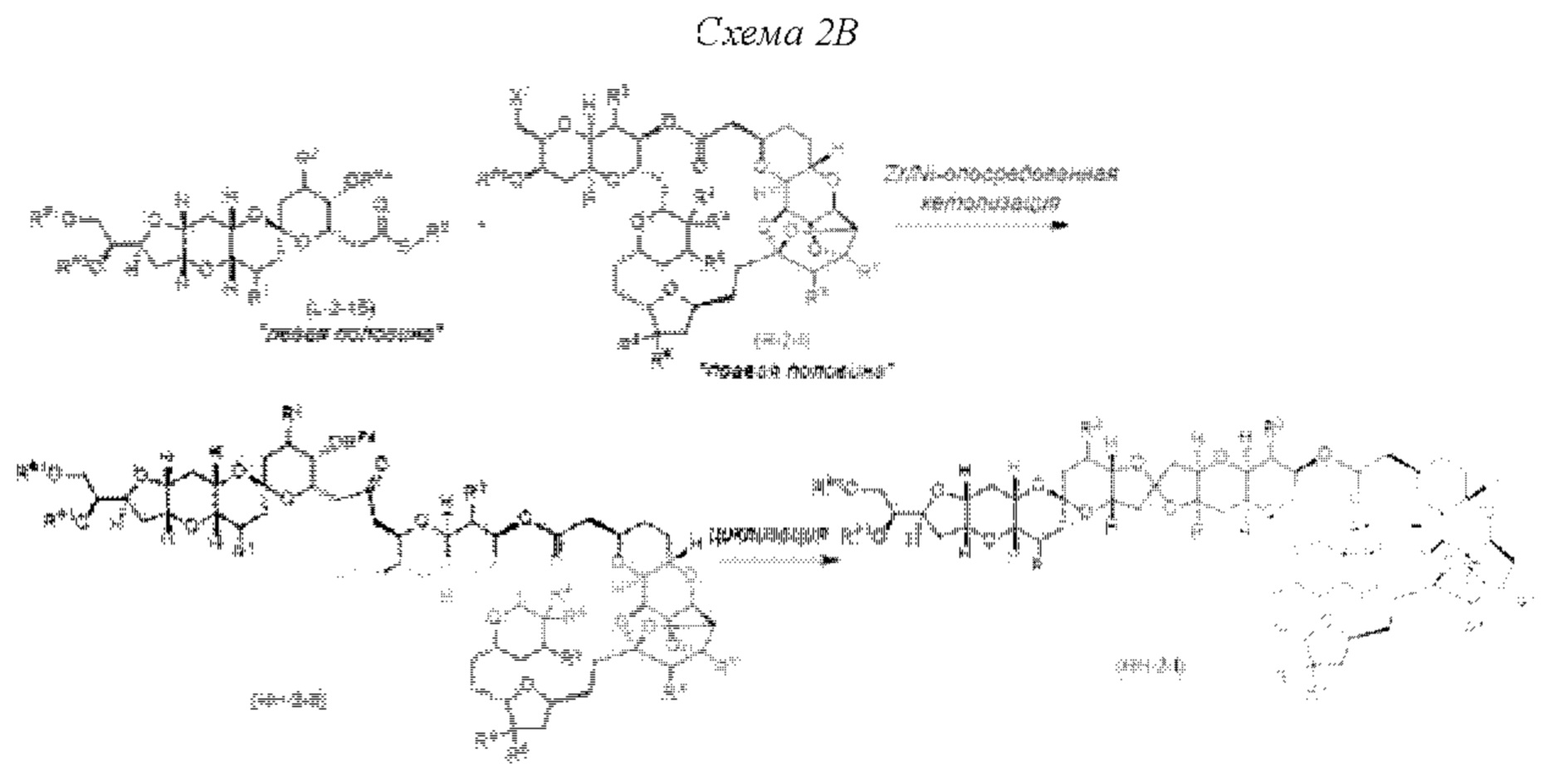
[0007] Применение Ni/Zr-опосредованных реакций сочетания, раскрытых в настоящем документе, для получения соединений гомогалихондринового ряда (например, гомогалихондрина А, В, С и их аналога) отображено, например, на Схеме 2В. Эта стратегия включает в себя сочетание структурного элемента «левой половины» со структурным элементом «правой половины» посредством Ni/Zr-опосредованной реакции кетолизации, описанной в настоящем документе.
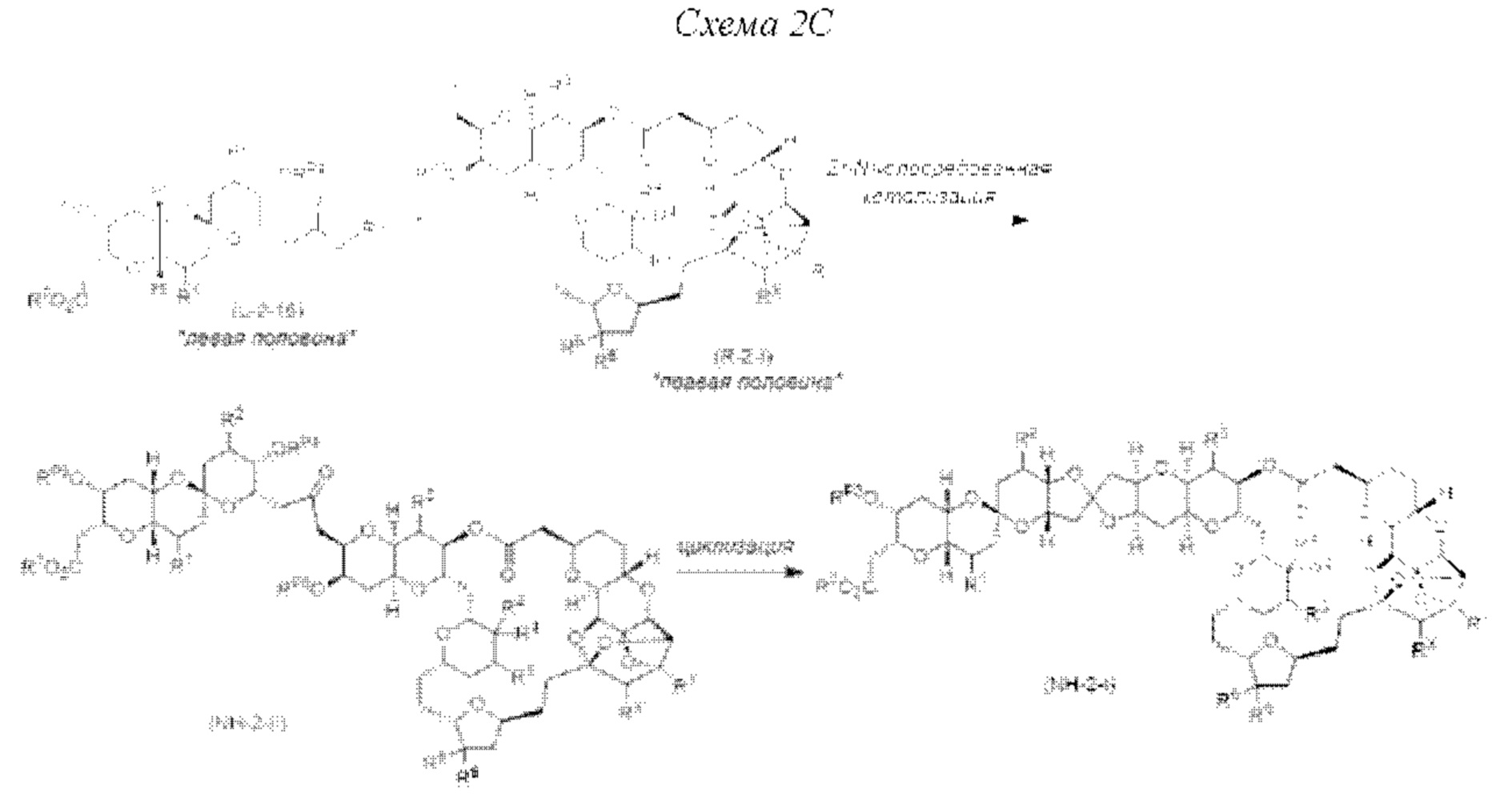
[0008] Применение Ni/Zr-опосредованных реакций сочетания, раскрытых в настоящем документе, для получения соединений норгалихондринового ряда (например, норгалихондрина А, В, С и их аналога) отображено, например, на Схеме 2С. Эта стратегия включает в себя сочетание структурного элемента «левой половины» со структурным элементом «правой половины» посредством Ni/Zr-опосредованной реакции кетолизации, описанной в настоящем документе.
[0009] Применение Ni/Zr-опосредованных реакций сочетания, раскрытых в настоящем документе, для получения дополнительных аналогов галихондринового ряда отображено, например, на Схеме 2D. Эта стратегия включает в себя сочетание структурного элемента «левой половины» со структурным элементом «правой половины» посредством Ni/Zr-опосредованной реакции кетолизации, описанной в настоящем документе.
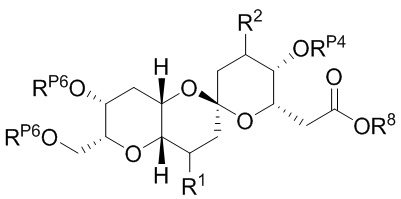
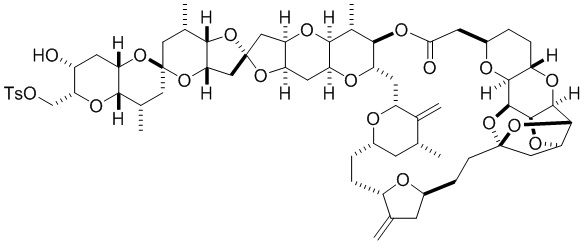
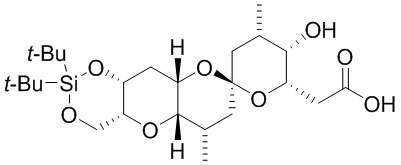
[0010] В общем, раскрытые способы получения галихондринов (например, галихондрина А, В, С; гомогалихондрина А, В, С; норгалихондрина А, В, С) и их аналогов включают в себя сочетание фрагмента «левой половины» с фрагментом «правой половины». Согласно другому аспекту настоящее изобретение относится к способам, применимым для получения структурных элементов упомянутых «правой половины» и «левой половины».
[0011] Согласно другому аспекту настоящее изобретение относится к соединениям, которые являются полезными промежуточными соединениями на пути получения галихондринов (например, галихондринов А, В, С; гомогалихондринов А, В, С; норгалихондринов А, В, С) и их аналогов. Например, согласно одному аспекту в настоящем изобретении раскрыты структурные элементы «левой половины» и «правой половины» галихондринов (например, галихондринов А, В, С; гомогалихондринов А, В, С; норгалихондринов А, В, С) и их аналогов, и промежуточные соединения, применимые для получения упомянутых структурных элементов.
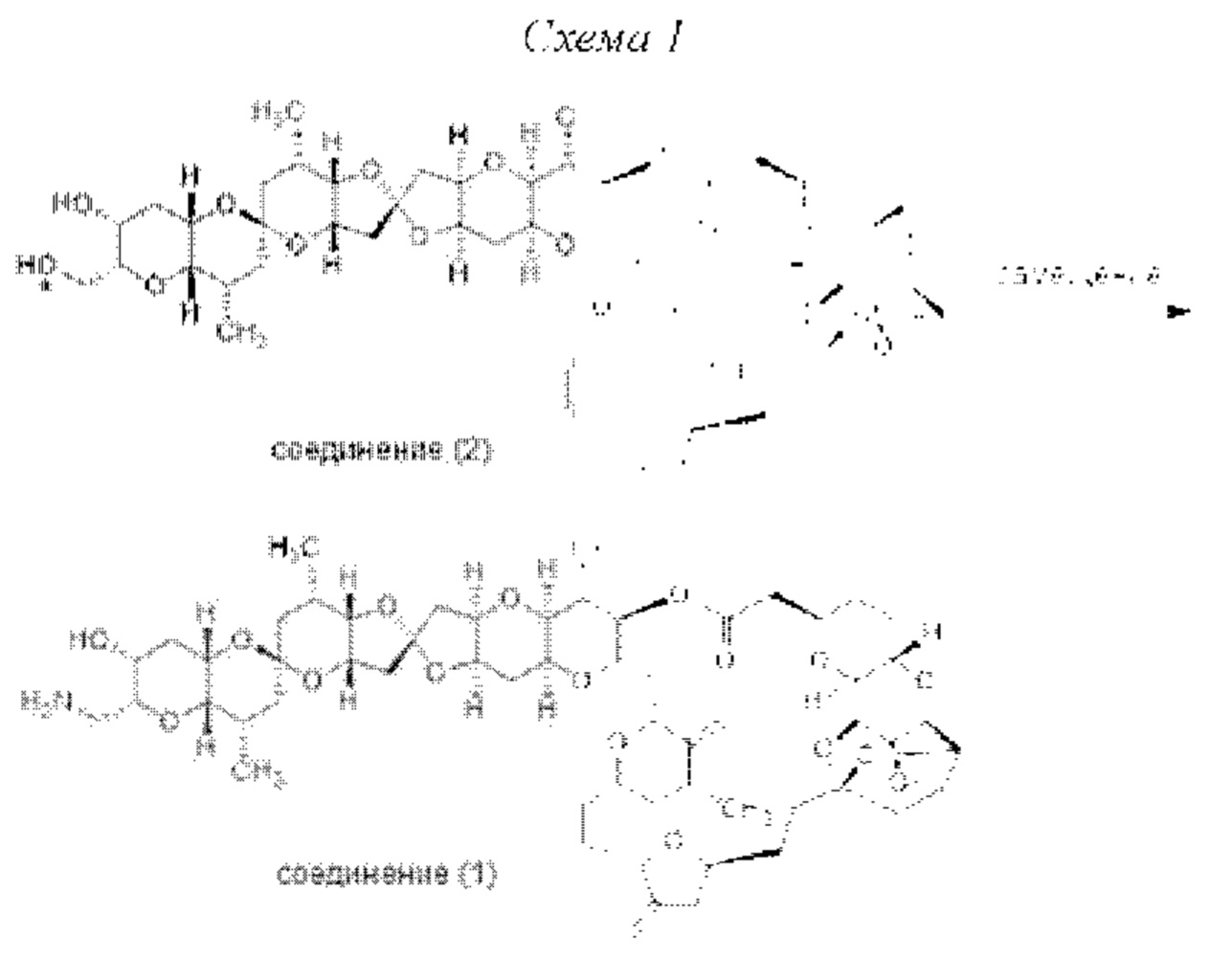
[0012] Согласно еще одному аспекту настоящее изобретение относится к способам, применимым для получения аналогов галихондринов; в частности, при получении соединения (1). Настоящее изобретение также относится к соединениям (т.е., синтетическим промежуточным соединениям), применимым для синтеза соединения (1).
[0013] Согласно одному аспекту настоящее изобретение относится к способам получения соединения (1), которые включают в себя замещение первичной гидроксильной группы соединения (2) (-ОН; помечена * на Схеме 1) аминогруппой (-NH2). Замещение может проводиться в одну или несколько стадий. Например, замещение может проводиться путем преобразования первичной гидроксильной группы соединения (2) до уходящей группы (например, -OR1), с последующим замещением уходящей группы амином или предшественником амина (например, азидом).
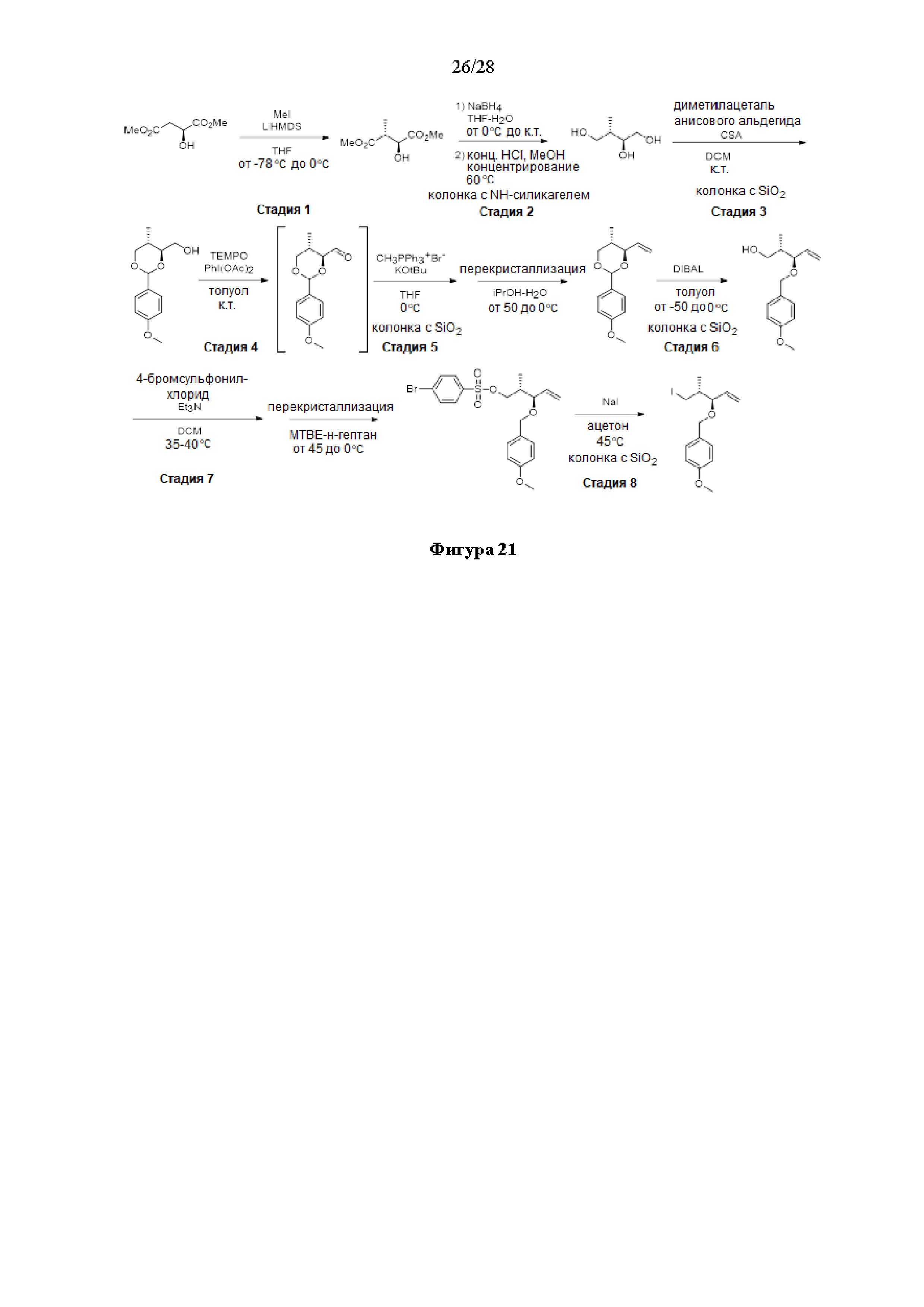
[0014] Современные способы синтеза галихондринов могут быть найдены, например, в международных публикациях согласно РСТ WO 2016/176560, опубликованной 3 ноября 2016 года, и WO 2016/003975, опубликованной 7 января 2016 года, полное содержание которых включено в настоящий документ посредством ссылки.
[0015] Другие современные способы синтеза галихондринов могут быть найдены, например, в патенте США №9,938,288, выданном 10 апреля 2018 года, в предварительной заявке на выдачу патента США №62/586,416, поданной 15 ноября 2017 года, в международной заявке № PCT/US 2018/031765, поданной 9 мая 2018 года, в публикации заявки на выдачу патента США № US 2018/0155361, опубликованной 7 июня 2018 года, полное содержание которых включено в настоящий документ посредством ссылки.
[0016] Подробности определенных вариантов осуществления настоящего изобретения представлены далее в разделе «Подробное раскрытие определенных вариантов осуществления», описанном ниже. Другие характерные черты, цели и преимущества настоящего изобретения станут очевидны из разделов «Определения», «Примеры», «Фигуры» и формулы изобретения.
Определения
[0017] Ниже более подробно описаны определения конкретных функциональных групп и химических терминов. Химические элементы определены в соответствии с Периодической таблицей элементов, версия CAS, Handbook of Chemistry и Physics, 75th Ed., внутренняя сторона обложки, и конкретные функциональные группы, как правило, определены как описано в настоящем документе. В дополнение, общие начала органической химии, а также конкретные функциональные фрагменты и реакционная способность, описаны в Organic Chemistry, Thomas Sorrell, University Science Books, Sausalito, 1999; Smith и March, March's Advanced Organic Chemistry, 5th Edition, John Wiley & Sons, Inc., New York, 2001; Larock, Comprehensive Organic Transformations, VCH Publishers, Inc., New York, 1989; и Carruthers, Some Modern Methods of Organic Synthesis, 3rd Edition, Cambridge University Press, Cambridge, 1987.
[0018] Соединения, описанные в настоящем документе, могут содержать один или несколько асимметрических центров, а потому может существовать в различных стереоизомерных формах, например, в виде энантиомеров и/или диастереоизомеров. Например, соединения, описанные в настоящем документе, могут находиться в форме отдельного энантиомера, диастереоизомера или геометрического изомера, или могут находиться в форме смеси стереоизомеров, включая рацемические смеси и смеси, обогащенные одним или несколькими стереоизомерами. Изомеры могут быть выделены из смесей способами, известными специалистам в данной области техники, включая хиральную жидкостную хроматографию высокого давления (HPLC) и формирование и кристаллизацию хиральных солей; или предпочтительные изомеры могут быть получены посредством асимметрических способов синтеза (см., например, Jacques et al., Enantiomers, Racemates и Resolutions (Wiley Interscience, New York, 1981); Wilen et at, Tetrahedron 33:2725 (1977); Eliel, E.L. Stereochemistry of Carbon Compounds (McGraw-Hill, NY, 1962); и Wilen, S.H., Tables of Resolving Agents и Optical Resolutions p. 268 (E.L. Eliel, Ed., Univ. of Notre Dame Press, Notre Dame, IN 1972)). Настоящее изобретение дополнительно охватывает соединения в виде отдельных изомеров, по существу свободных от других изомеров, и, в качестве альтернативы, в виде смесей различных изомеров.
[0019] Если не указано иное, то подразумевается, что описанные в настоящем документе структуры включают в себя соединения, которые отличаются лишь присутствием одного или нескольких обогащенных изотопами атомов. Например, соединения, характеризующиеся строением согласно настоящему изобретению за исключением замены водорода дейтерием или тритием, замены 19F на 18F или замены 12С на 13С или 14С, подпадают под объем настоящего раскрытия. Такие соединения применимы, например, в качестве аналитических инструментов или зондов в биологических методах анализа.
[0020] Если приводится диапазон значений, то, что он охватывает каждое значение и поддиапазон в границах диапазона. Например подразумевается, что «С1-6алкил» охватывает C1, С2, С3, C4, С5, С6, C1-6, С1-5, С1-4, C1-3, С1-2, С2-6, С2-5, С2-4, С2-3, С3-6, С3-5, С3-4, С4-6, С4-5 и С5-6алкил.
[0021] Термин «алифатическая группа» относится к алкильной, алкенильной, алкинильной и карбоциклической группам. По аналогии, термин «гетероалифатическая группа» относится к гетероалкильной, гетероалкенильной, гетероалкинильной и гетероциклической группам.
[0022] Термин «алкил» относится к радикалу неразветвленной или разветвленной насыщенной углеводородной группы, содержащей от 1 до 10 атомов углерода («С1-10алкил»). Согласно некоторым вариантам осуществления алкильная группа содержит от 1 до 9 атомов углерода («С1-9алкил»). Согласно некоторым вариантам осуществления алкильная группа содержит от 1 до 8 атомов углерода («С1-8алкил»). Согласно некоторым вариантам осуществления алкильная группа содержит от 1 до 7 атомов углерода («С1-7алкил»). Согласно некоторым вариантам осуществления алкильная группа содержит от 1 до 6 атомов углерода («С1-6алкил»). Согласно некоторым вариантам осуществления алкильная группа содержит от 1 до 5 атомов углерода («C1-5алкил»). Согласно некоторым вариантам осуществления алкильная группа содержит от 1 до 4 атомов углерода («С1-4алкил»). Согласно некоторым вариантам осуществления алкильная группа содержит от 1 до 3 атомов углерода («C1-3алкил»). Согласно некоторым вариантам осуществления алкильная группа содержит от 1 до 2 атомов углерода («C1-2алкил»). Согласно некоторым вариантам осуществления алкильная группа содержит 1 атом углерода («С1алкил»). Согласно некоторым вариантам осуществления алкильная группа содержит от 2 до 6 атомов углерода («С2-6алкил»). Примеры С1-6алкильных групп включают в себя метил (C1), этил (С2), пропил (С3) (например, н-пропил, изопропил), бутил (С4) (например, н-бутил, трет-бутил, втор-бушл, изобутил), пентил (С5) (например, н-пентил, 3-пентанил, амил, неопентил, 3-метил-2-бутанил, третичный амил), и гексил (С6) (например, н-гексил). Дополнительные примеры алкильных групп включают в себя н-гептил (С7), н-октил (C8), и т.п. Если не указано иное, то в каждом случае алкильная группа независимо является незамещенной («незамещенный алкил») или замещенной («замещенный алкил») одним или несколькими заместителями (например, галогеном, таким как F). Согласно определенным вариантам осуществления алкильная группа представляет собой незамещенный С1-10алкил (такой как незамещенный С1-6алкил, например, -СН3 (Me), незамещенный этил (Et), незамещенный пропил (Pr, например, незамещенный н-пропил (n-Pr), незамещенный изопропил (i-Pr)), незамещенный бутил (Bu, например, незамещенный н-бутил (n-Bu), незамещенный трет-бутил (трет-Bu или трет-Bu), незамещенный втор-бутил (втор-Bu), незамещенный изобутил (i-Bu)). Согласно определенным вариантам осуществления алкильная группа представляет собой замещенный С1-10алкил (такой как замещенный С1-6алкил, например, -CF3, Bn).
[0023] Термин «галогеналкил» представляет собой замещенную алкильную группу, в которой один или несколько атомов водорода независимо заменены галогеном, например, фтором, бромом, хлором или йодом. Согласно некоторым вариантам осуществления галогеналкильный фрагмент содержит от 1 до 8 атомов углерода («С1-8галогеналкил»). Согласно некоторым вариантам осуществления галогеналкильный фрагмент содержит от 1 до 6 атомов углерода («С1-6галогеналкил»). Согласно некоторым вариантам осуществления галогеналкильный фрагмент содержит от 1 до 4 атомов углерода («С1-4галогеналкил»). Согласно некоторым вариантам осуществления галогеналкильный фрагмент содержит от 1 до 3 атомов углерода («C1-3галогеналкил»). Согласно некоторым вариантам осуществления галогеналкильный фрагмент содержит от 1 до 2 атомов углерода («С1-2галогеналкил»). Примеры галогеналкильных групп включают в себя -CHF2, -CH2F, -CF3, -CH2CF3, -CF2CF3, -CF2CF2CF3, -CCl3, -CFCl2, -CF2Cl, и т.п.
[0024] Термин «гетероалкил» относится к алкильной группе, которая дополнительно содержит по меньшей мере один гетероатом (например, 1, 2, 3 или 4 гетероатомов), выбранный из атомов кислорода, азота или серы, внутри основной цепи (т.е., вставленный между двумя смежными атомами углерода) и/или помещенный в одно или несколько концевых положений основной цепи. Согласно определенным вариантам осуществления гетероалкильная группа относится к насыщенной группе, содержащей от 1 до 10 атомов углерода и 1 или несколько гетероатомов внутри основной цепи («гетероС1-10алкил»). Согласно некоторым вариантам осуществления гетероалкильная группа представляет собой насыщенную группу, содержащую от 1 до 9 атомов углерода и 1 или несколько гетероатомов внутри основной цепи («гетероС1-9алкил»). Согласно некоторым вариантам осуществления гетероалкильная группа представляет собой насыщенную группу, содержащую от 1 до 8 атомов углерода и 1 или несколько гетероатомов внутри основной цепи («гетероС1-8алкил»). Согласно некоторым вариантам осуществления гетероалкильная группа представляет собой насыщенную группу, содержащую от 1 до 7 атомов углерода и 1 или несколько гетероатомов внутри основной цепи («гетероС1-7алкил»). Согласно некоторым вариантам осуществления гетероалкильная группа представляет собой насыщенную группу, содержащую от 1 до 6 атомов углерода и 1 или несколько гетероатомов внутри основной цепи («гетероС1-6алкил»). Согласно некоторым вариантам осуществления гетероалкильная группа представляет собой насыщенную группу, содержащую от 1 до 5 атомов углерода и 1 или 2 гетероатома внутри основной цепи («гетероС1-5алкил»). Согласно некоторым вариантам осуществления гетероалкильная группа представляет собой насыщенную группу, содержащую от 1 до 4 атомов углерода и 1 или 2 гетероатома внутри основной цепи («гетероС1-4алкил»). Согласно некоторым вариантам осуществления гетероалкильная группа представляет собой насыщенную группу, содержащую от 1 до 3 атомов углерода и 1 гетероатом внутри основной цепи («гетероС1-3алкил»). Согласно некоторым вариантам осуществления гетероалкильная группа представляет собой насыщенную группу, содержащую от 1 до 2 атомов углерода и 1 гетероатом внутри основной цепи («гетероС1-2алкил»). Согласно некоторым вариантам осуществления гетероалкильная группа представляет собой насыщенную группу, содержащую 1 атом углерода и 1 гетероатом («гетероС1алкил»). Согласно некоторым вариантам осуществления гетероалкильная группа представляет собой насыщенную группу, содержащую от 2 до 6 атомов углерода и 1 или 2 гетероатома внутри основной цепи («гетероС2-6алкил»). Если не указано иное, то в каждом случае гетероалкильная группа независимо является незамещенной («незамещенный гетероалкил») или замещенной («замещенный гетероалкил») одним или несколькими заместителями. Согласно определенным вариантам осуществления гетероалкильная группа представляет собой незамещенный гетероС1-10алкил. Согласно определенным вариантам осуществления гетероалкильная группа представляет собой замещенный гетероС1-10алкил.
[0025] Термин «алкенил» относится к радикалу неразветвленной или разветвленной углеводородной группы, содержащей от 2 до 10 атомов углерода и одну или несколько углерод-углеродных двойных связей (например, 1, 2, 3 или 4 двойные связи). Согласно некоторым вариантам осуществления алкенильная группа содержит от 2 до 9 атомов углерода («С2-9алкенил»). Согласно некоторым вариантам осуществления алкенильная группа содержит от 2 до 8 атомов углерода («С2-8алкенил»). Согласно некоторым вариантам осуществления алкенильная группа содержит от 2 до 7 атомов углерода («С2-7алкенил»). Согласно некоторым вариантам осуществления алкенильная группа содержит от 2 до 6 атомов углерода («С2-6алкенил»). Согласно некоторым вариантам осуществления алкенильная группа содержит от 2 до 5 атомов углерода («С2-5алкенил»). Согласно некоторым вариантам осуществления алкенильная группа содержит от 2 до 4 атомов углерода («С2-4алкенил»). Согласно некоторым вариантам осуществления алкенильная группа содержит от 2 до 3 атомов углерода («С2-3алкенил»). Согласно некоторым вариантам осуществления алкенильная группа содержит 2 атома углерода («С2алкенил»). Одна или несколько углерод-углеродных двойных связей могут быть внутренними (такими, как в 2-бутениле) или концевыми (такими, как в 1-бутениле). Примеры С2-4алкенильных групп включают в себя этенил (С2), 1-пропенил (С3), 2-пропенил (С3), 1-бутенил (С4), 2-бутенил (С4), бутадиенил (С4), и т.п. Примеры С2-6алкенильных групп включают в себя упомянутые выше С2-4алкенильные группы, а также пентенил (С5), пентадиенил (С5), гексенил (С6), и т.п. Дополнительные примеры алкенила включают в себя гептенил (С7), октенил (C8), октатриенил (C8), и т.п. Если не указано иное, то в каждом случае алкенильная группа независимо является незамещенной («незамещенный алкенил») или замещенной («замещенный алкенил») одним или несколькими заместителями. Согласно определенным вариантам осуществления алкенильная группа представляет собой незамещенный С2-10алкенил. Согласно определенным вариантам осуществления алкенильная группа представляет собой замещенный С2-10алкенил. В алкенильной группе, двойная связь С=С, для которой стереохимия не указана (например, -СН=СНСН3 или 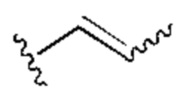 ), может представлять собой (Е)- или (2)-двойную связь.
), может представлять собой (Е)- или (2)-двойную связь.
[0026] Термин «гетероалкенил» относится к алкенильной группе, которая дополнительно содержит по меньшей мере один гетероатом (например, 1, 2, 3 или 4 гетероатома), выбранный из атомов кислорода, азота или серы, внутри основной цепи (т.е., вставленный между двумя смежными атомами углерода) и/или помещенный в одно или несколько концевых положений основной цепи. Согласно определенным вариантам осуществления гетероалкенильная группа относится к группе, содержащей от 2 до 10 атомов углерода, по меньшей мере одну двойную связь и 1 или несколько гетероатомов внутри основной цепи («гетероС2-10алкенил»). Согласно некоторым вариантам осуществления гетероалкенильная группа содержит от 2 до 9 атомов углерода, по меньшей мере одну двойную связь и 1 или несколько гетероатомов внутри основной цепи («гетероС2-9алкенил»). Согласно некоторым вариантам осуществления гетероалкенильная группа содержит от 2 до 8 атомов углерода, по меньшей мере одну двойную связь и 1 или несколько гетероатомов внутри основной цепи («гетероС2-8алкенил»). Согласно некоторым вариантам осуществления гетероалкенильная группа содержит от 2 до 7 атомов углерода, по меньшей мере одну двойную связь и 1 или несколько гетероатомов внутри основной цепи («гетероС2-7алкенил»). Согласно некоторым вариантам осуществления гетероалкенильная группа содержит от 2 до 6 атомов углерода, по меньшей мере одну двойную связь и 1 или несколько гетероатомов внутри основной цепи («гетероС2-6алкенил»). Согласно некоторым вариантам осуществления гетероалкенильная группа содержит от 2 до 5 атомов углерода, по меньшей мере одну двойную связь и 1 или 2 гетероатома внутри основной цепи («гетероС2-5алкенил»). Согласно некоторым вариантам осуществления гетероалкенильная группа содержит от 2 до 4 атомов углерода, по меньшей мере одну двойную связь и 1 или 2 гетероатома внутри основной цепи («гетероС2-4алкенил»). Согласно некоторым вариантам осуществления гетероалкенильная группа содержит от 2 до 3 атомов углерода, по меньшей мере одну двойную связь и 1 гетероатом внутри основной цепи («гетероС2-3алкенил»). Согласно некоторым вариантам осуществления гетероалкенильная группа содержит от 2 до 6 атомов углерода, по меньшей мере одну двойную связь и 1 или 2 гетероатома внутри основной цепи («гетероС2-6алкенил»). Если не указано иное, то в каждом случае гетероалкенильная группа независимо является незамещенной («незамещенный гетероалкенил») или замещенной («замещенный гетероалкенил») одним или несколькими заместителями. Согласно определенным вариантам осуществления гетероалкенильная группа представляет собой незамещенный гетероС2-10алкенил. Согласно определенным вариантам осуществления гетероалкенильная группа представляет собой замещенный гетероС2-10алкенил.
[0027] Термин «алкинил» относится к радикалу неразветвленной или разветвленной углеводородной группы, содержащей от 2 до 10 атомов углерода и одну или несколько углерод-углеродных тройных связей (например, 1, 2, 3 или 4 тройных связи) («С2-10алкинил»). Согласно некоторым вариантам осуществления алкинильная группа содержит от 2 до 9 атомов углерода («С2-9алкинил»). Согласно некоторым вариантам осуществления алкинильная группа содержит от 2 до 8 атомов углерода («С2-8алкинил»). Согласно некоторым вариантам осуществления алкинильная группа содержит от 2 до 7 атомов углерода («С2-7алкинил»). Согласно некоторым вариантам осуществления алкинильная группа содержит от 2 до 6 атомов углерода («С2-6алкинил»). Согласно некоторым вариантам осуществления алкинильная группа содержит от 2 до 5 атомов углерода («С2-5алкинил»). Согласно некоторым вариантам осуществления алкинильная группа содержит от 2 до 4 атомов углерода («С2-4алкинил»). Согласно некоторым вариантам осуществления алкинильная группа содержит от 2 до 3 атомов углерода («С2-3алкинил»). Согласно некоторым вариантам осуществления алкинильная группа содержит 2 атома углерода («С2алкинил»). Одна или несколько углерод-углеродных тройных связей могут быть внутренними (такими, как в 2-бутиниле) или концевыми (такими, как в 1-бутиниле). Примеры С2-4алкинильных групп включают в себя без ограничения этинил (С2), 1-пропинил (С3), 2-пропинил (С3), 1-бутинил (С4), 2-бутинил (С4), и т.п. Примеры С2-4алкинильных групп включают в себя упомянутые выше С2-4алкинильные группы, а также пентинил (С5), гексинил (С6), и т.п. Дополнительные примеры алкинила включают в себя гептинил (С7), октинил (C8), и т.п. Если не указано иное, то в каждом случае алкинильная группа независимо является незамещенной («незамещенный алкинил») или замещенной («замещенный алкинил») одним или несколькими заместителями. Согласно определенным вариантам осуществления алкинильная группа представляет собой незамещенный С2-10алкинил. Согласно определенным вариантам осуществления алкинильная группа представляет собой замещенный С2-10алкинил.
[0028] Термин «гетероалкинил» относится к алкинильной группе, которая дополнительно содержит по меньшей мере один гетероатом (например, 1, 2, 3 или 4 гетероатома), выбранных из атомов кислорода, азота или серы, внутри основной цепи (т.е., вставленный между двумя смежными атомами углерода) и/или помещенный в одно или несколько концевых положений основной цепи. Согласно определенным вариантам осуществления гетероалкинильная группа относится к группе, содержащей от 2 до 10 атомов углерода, по меньшей мере одну тройную связь и 1 или несколько гетероатомов внутри основной цепи («гетероС2-10алкинил»). Согласно некоторым вариантам осуществления гетероалкинильная группа содержит от 2 до 9 атомов углерода, по меньшей мере одну тройную связь и 1 или несколько гетероатомов внутри основной цепи («гетероС2-9алкинил»). Согласно некоторым вариантам осуществления гетероалкинильная группа содержит от 2 до 8 атомов углерода, по меньшей мере одну тройную связь и 1 или несколько гетероатомов внутри основной цепи («гетероС2-8алкинил»). Согласно некоторым вариантам осуществления гетероалкинильная группа содержит от 2 до 7 атомов углерода, по меньшей мере одну тройную связь и 1 или несколько гетероатомов внутри основной цепи («гетероС2-7алкинил»). Согласно некоторым вариантам осуществления гетероалкинильная группа содержит от 2 до 6 атомов углерода, по меньшей мере одну тройную связь и 1 или несколько гетероатомов внутри основной цепи («гетероС2-6алкинил»). Согласно некоторым вариантам осуществления гетероалкинильная группа содержит от 2 до 5 атомов углерода, по меньшей мере одну тройную связь и 1 или 2 гетероатома внутри основной цепи («гетероС2-5алкинил»). Согласно некоторым вариантам осуществления гетероалкинильная группа содержит от 2 до 4 атомов углерода, по меньшей мере одну тройную связь и 1 или 2 гетероатома внутри основной цепи («гетероС2-4алкинил»). Согласно некоторым вариантам осуществления гетероалкинильная группа содержит от 2 до 3 атомов углерода, по меньшей мере одну тройную связь и 1 гетероатом внутри основной цепи («гетероС2-3алкинил»). Согласно некоторым вариантам осуществления гетероалкинильная группа содержит от 2 до 6 атомов углерода, по меньшей мере одну тройную связь и 1 или 2 гетероатома внутри основной цепи («гетероС2-6алкинил»). Если не указано иное, то в каждом случае гетероалкинильная группа независимо является незамещенной («незамещенный гетероалкинил») или замещенной («замещенный гетероалкинил») одним или несколькими заместителями. Согласно определенным вариантам осуществления гетероалкинильная группа представляет собой незамещенный гетероС2-10алкинил. Согласно определенным вариантам осуществления гетероалкинильная группа представляет собой замещенный гетероС2-10алкинил.
[0029] Термин «карбоциклил» или «карбоциклическая группа» относится к радикалу неароматической циклической углеводородной группы, содержащей от 3 до 14 кольцевых атомов углерода («С3-14карбоциклил») и не содержащему гетероатомов в не ароматической кольцевой системе. Согласно некоторым вариантам осуществления карбоциклильная группа содержит от 3 до 10 кольцевых атомов углерода («С3-10карбоциклил»). Согласно некоторым вариантам осуществления карбоциклильная группа содержит от 3 до 8 кольцевых атомов углерода («С3-8карбоциклил»). Согласно некоторым вариантам осуществления карбоциклильная группа содержит от 3 до 7 кольцевых атомов углерода («С3-7карбоциклил»). Согласно некоторым вариантам осуществления карбоциклильная группа содержит от 3 до 6 кольцевых атомов углерода («С3-6карбоциклил»). Согласно некоторым вариантам осуществления карбоциклильная группа содержит от 4 до 6 кольцевых атомов углерода («С4-6карбоциклил»). Согласно некоторым вариантам осуществления карбоциклильная группа содержит от 5 до 6 кольцевых атомов углерода («С5-6карбоциклил»). Согласно некоторым вариантам осуществления карбоциклильная группа содержит от 5 до 10 кольцевых атомов углерода («C5-10карбоциклил»). Иллюстративные С3-6карбоциклильные группы включают в себя без ограничения циклопропил (С3), циклопропенил (С3), циклобутил (С4), циклобутенил (С4), циклопентил (С5), циклопентенил (С5), циклогексил (С6), циклогексенил (С6), циклогексадиенил (С6), и т.п. Иллюстративные С3-8карбоциклильные группы включают в себя без ограничения упомянутые выше С3-6карбоциклильные группы, а также циклогептил (С7), циклогептенил (С7), циклогептадиенил (С7), циклогептатриенил (С7), циклооктил (C8), циклооктенил (C8), бицикло[2.2.1]гептанил (С7), бицикло[2.2.2]октанил (C8), и т.п. Иллюстративные С3-10карбоциклильные группы включают в себя без ограничения упомянутые выше С3-8карбоциклильные группы, а также циклононил (С9), циклононенил (С9), циклодецил (С10), циклодеценил (С10), октагидро-1H-индецил (С9), декагидронафталинил (С10), спиро[4.5]деканил (С10), и т.п. Как иллюстрируют приведенные выше примеры, согласно определенным вариантам осуществления карбоциклильная группа является либо моноциклической («моноциклический карбоциклил»), либо полициклической (например, содержащей конденсированную, связанную мостиковой связью или спиро кольцевую систему, такую как бициклическая система («бициклический карбоциклил») или трициклическую систему («трициклический карбоциклил»)), и может быть насыщенной или может содержать одну или несколько углерод-углеродных двойных или тройных связей. «Карбоциклил» также включает в себя кольцевые системы, в которых карбоциклильное кольцо, определенное выше, конденсировано с одним или несколькими арильными или гетероарильными группами, где точка присоединения находится на карбоциклильном кольце, и в таких случаях число атомов углерода остается в силе для обозначения числа атомов углерода в карбоциклической кольцевой системе. Если не указано иное, то в каждом случае карбоциклильная группа независимо является незамещенной («незамещенный карбоциклил») или замещенной («замещенный карбоциклил») одним или несколькими заместителями. Согласно определенным вариантам осуществления карбоциклильная группа представляет собой незамещенный С3-14карбоциклил. Согласно определенным вариантам осуществления карбоциклильная группа представляет собой a substituted С3-14карбоциклил.
[0030] Согласно некоторым вариантам осуществления «карбоциклил» представляет собой моноциклическую насыщенную карбоциклильную группу, содержащую от 3 до 14 кольцевых атомов углерода («С3-14циклоалкил»). Согласно некоторым вариантам осуществления циклоалкильная группа содержит от 3 до 10 кольцевых атомов углерода («С3-10циклоалкил»). Согласно некоторым вариантам осуществления циклоалкильная группа содержит от 3 до 8 кольцевых атомов углерода («С3-8циклоалкил»). Согласно некоторым вариантам осуществления циклоалкильная группа содержит от 3 до 6 кольцевых атомов углерода («С3-6циклоалкил»). Согласно некоторым вариантам осуществления циклоалкильная группа содержит от 4 до 6 кольцевых атомов углерода («С4-6циклоалкил»). Согласно некоторым вариантам осуществления циклоалкильная группа содержит от 5 до 6 кольцевых атомов углерода («С5-6циклоалкил»). Согласно некоторым вариантам осуществления циклоалкильная группа содержит от 5 до 10 кольцевых атомов углерода («С5-10циклоалкил»). Примеры С5-6циклоалкильных групп включают в себя циклопентил (С5) и циклогексил (С5). Примеры С3-6циклоалкильных групп включают в себя упомянутые выше С5-6циклоалкильные группы, а также циклопропил (С3) и циклобутил (С4). Примеры С3-8циклоалкильных групп включают в себя упомянутые выше С3-6циклоалкильные группы, а также циклогептил (С7) и циклооктил (C8). Если не указано иное, то в каждом случае циклоалкильная группа независимо является незамещенной («незамещенный циклоалкил») или замещенной («замещенный циклоалкил») одним или несколькими заместителями. Согласно определенным вариантам осуществления циклоалкильная группа представляет собой незамещенный С3-14циклоалкил. Согласно определенным вариантам осуществления циклоалкильная группа представляет собой замещенный С3-14циклоалкил.
[0031] Термин «гетероциклил» или «гетероциклическая группа» относится к радикалу 3-14-членной неароматической кольцевой системы, содержащей кольцевые атомы углерода и от 1 до 4 кольцевых гетероатомов, где каждый гетероатом независимо выбран из азота, кислорода и серы («3-14-членный гетероциклил»). В гетероциклильных группах, которые содержат один или несколько атомов азота, точкой присоединения может являться атом углерода или азота, если это позволяет валентность. Гетероциклильная группа может быть либо моноциклической («моноциклический гетероциклил»), либо полициклической (например, конденсированной, связанной мостиковой связью или спирокольцевой системой, такой как бициклическая система («бициклический гетероциклил») или трициклическая система («трициклический гетероциклил»)), и может быть насыщенной или может содержать одну или несколько углерод-углеродных двойных или тройных связей. Гетероциклильные полициклические кольцевые системы могут включать в себя один или несколько гетероатомов в одном или в обоих кольцах. «Гетероциклил» также включает в себя кольцевые системы, в которых гетероциклильное кольцо, определенное выше, конденсировано с одной или несколькими карбоциклильными группами, где точка присоединения расположена либо на карбоциклильном, либо на гетероциклильном кольце, или кольцевые системы, в которых гетероциклильное кольцо, определенное выше, конденсировано с одной или несколькими арильными или гетероарильными группами, где точка присоединения расположена на гетероциклильном кольце, и в таких случаях число кольцевых атомов остается в силе для обозначения числа кольцевых атомов в гетероциклильной кольцевой системе. Если не указано иное, то в каждом случае гетероциклил независимо является незамещенным («незамещенный гетероциклил») или замещенным («замещенный гетероциклил») одним или несколькими заместителями. Согласно определенным вариантам осуществления гетероциклильная группа представляет собой незамещенный 3-14-членный гетероциклил. Согласно определенным вариантам осуществления гетероциклильная группа представляет собой замещенный 3-14-членный гетероциклил.
[0032] Согласно некоторым вариантам осуществления гетероциклильная группа представляет собой 5-10-членную неароматическую кольцевую систему, содержащую кольцевые атомы углерода и 1-4 кольцевых гетероатомов, где каждый гетероатом независимо выбран из азота, кислорода и серы («5-10-членный гетероциклил»). Согласно некоторым вариантам осуществления гетероциклильная группа представляет собой 5-8-членную неароматическую кольцевую систему, содержащую кольцевые атомы углерода и 1-4 кольцевых гетероатомов, где каждый гетероатом независимо выбран из азота, кислорода и серы («5-8-членный гетероциклил»). Согласно некоторым вариантам осуществления гетероциклильная группа представляет собой 5-6-членную не ароматическую кольцевую систему, содержащую кольцевые атомы углерода и 1-4 кольцевых гетероатомов, где каждый гетероатом независимо выбран из азота, кислорода и серы («5-6-членный гетероциклил»). Согласно некоторым вариантам осуществления 5-6-членный гетероциклил содержит 1-3 кольцевых гетероатомов, выбранных из азота, кислорода и серы. Согласно некоторым вариантам осуществления 5-6-членный гетероциклил содержит 1-2 кольцевых гетероатомов, выбранных из азота, кислорода и серы. Согласно некоторым вариантам осуществления 5-6-членный гетероциклил содержит 1 кольцевой гетероатом, выбранный из азота, кислорода и серы.
[0033] Иллюстративные 3-членные гетероциклильные группы, содержащие 1 гетероатом, включают в себя без ограничения азиридинил, оксиранил и тииранил. Иллюстративные 4-членные гетероциклильные группы, содержащие 1 гетероатом, включают в себя без ограничения азетидинил, оксетанил и тиетанил. Иллюстративные 5-членные гетероциклильные группы, содержащие 1 гетероатом, включают в себя без ограничения тетрагидрофуранил, дигидрофуранил, тетрагидротиофенил, дигидротиофенил, пирролидинил, дигидропирролил и пирролил-2,5-дион. Иллюстративные 5-членные гетероциклильные группы, содержащие 2 гетероатома, включают в себя без ограничения диоксаланил, оксатиоланил и дитиоланил. Иллюстративные 5-членные гетероциклильные группы, содержащие 3 гетероатома, включают в себя без ограничения тиазолинил, оксадиазолинил и тиадиазолинил. Иллюстративные 6-членные гетероциклильные группы, содержащие 1 гетероатом, включают в себя без ограничения пиперидинил, тетрагидропиранил, дигидропиридинил и тианил. Иллюстративные 6-членные гетероциклильные группы, содержащие 2 гетероатома, включают в себя без ограничения пиперазинил, морфолинил, дитианил и диоксанил. Иллюстративные 6-членные гетероциклильные группы, содержащие 3 гетероатома, включают в себя без ограничения триазинил. Иллюстративные 7-членные гетероциклильные группы, содержащие 1 гетероатом, включают в себя без ограничения азепанил, оксепанил и тиепанил. Иллюстративные 8-членные гетероциклильные группы, содержащие 1 гетероатом, включают в себя без ограничения азоканил, оксеканил и тиоканил. Иллюстративные бициклические гетероциклильные группы включают в себя без ограничения индолинил, изоиндолинил, дигидробензофуранил, дигидробензотиенил, тетрагидробензотиенил, тетрагидробензофуранил, тетрагидроиндолил, тетрагидрохинолинил, тетрагидроизохинолинил, декагидрохинолинил, декагидроизохинолинил, октагидрохроменил, октагидроизохроменил, декагидронафтиридинил, декагидро-1,8-нафтиридинил, октагидропирроло[3,2-b]пиррол, индолинил, фталимидил, нафталимидил, хроманил, хроменил, 1Н-бензо[е][1,4]диазепинил, 1,4,5,7-тетрагидропирано[3,4-b]пирролил, 5,6-дигидро-4Н-фуро[3,2-b]пирролил, 6,7-дигидро-5Н-фуро[3,2-b]пиранил, 5,7-дигидро-4Н-тиено[2,3-с]пиранил, 2,3-дигидро-1H-пирроло[2,3-b]пиридинил, 2,3-дигидрофуро[2,3-b]пиридинил, 4,5,6,7-тетрагидро-1H-пирроло[2,3-b]пиридинил, 4,5,6,7-тетрагидрофуро[3,2-с]пиридинил, 4,5,6,7-тетрагидротиено[3,2-b]пиридинил, 1,2,3,4-тетрагидро-1,6-нафтиридинил, и т.п.
[0034] Термин «арил» относится к радикалу моноциклической или полициклической (например, бициклической или трициклической) 4n+2 ароматической кольцевой системы (например, содержащей 6, 10 или 14 π электронов, совместно используемых в циклической структуре), содержащей 6-14 кольцевых атомов углерода и не содержащему гетероатомов в ароматической кольцевой системе («С6-14арил»). Согласно некоторым вариантам осуществления арильная группа содержит 6 кольцевых атомов углерода («С6арил»; например, фенил). Согласно некоторым вариантам осуществления арильная группа содержит 10 кольцевых атомов углерода («С10арил»; например, нафтил, такой как 1-нафтил и 2-нафтил). Согласно некоторым вариантам осуществления арильная группа содержит 14 кольцевых атомов углерода («С14арил»; например, антрацил). «Арил» также включает в себя кольцевые системы, в которых арильное кольцо, определенное выше, конденсировано с одной или несколькими карбоциклильными или гетероциклильными группами, где радикал или точка присоединения находится на арильном кольце, и в таких случаях число атомов углерода остается в силе для обозначения числа атомов углерода в арильной кольцевой системе. Если не указано иное, то в каждом случае арильная группа независимо является незамещенной («незамещенный арил») или замещенной («замещенный арил») одним или несколькими заместителями. Согласно определенным вариантам осуществления арильная группа представляет собой незамещенный С6-14арил. Согласно определенным вариантам осуществления арильная группа представляет собой замещенный С6-14арил.
[0035] Термин «гетероарил» относится к радикалу 5-14-членной моноциклической или полициклической (например, бициклической, трициклической) 4n+2 ароматической кольцевой системы (например, содержащей 6, 10 или 14 к электронов, совместно используемых в циклической структуре), содержащей кольцевые атомы углерода и 1-4 кольцевых гетероатомов в ароматической кольцевой системе, где каждый гетероатом независимо выбран из азота, кислорода и серы («5-14-членный гетероарил»). В гетероарильных группах, которые содержат один или несколько атомов азота, точкой присоединения может являться атом углерода или азота, если это позволяет валентность. Гетероарильные полициклические кольцевые системы могут включать в себя один или несколько гетероатомов в одном или обоих кольцах. «Гетероарил» включает в себя кольцевые системы, в которых гетероарильное кольцо, определенное выше, конденсировано с одной или несколькими карбоциклильными или гетероциклильными группами, где точка присоединения находится на гетероарильном кольце, и в таких случаях число кольцевых атомов остается в силе для обозначения числа кольцевых атомов в гетер оар иль ной кольцевой системе. «Гетероарил» также включает в себя кольцевые системы, в которых гетероарильное кольцо, определенное выше, конденсировано с одной или несколькими арильными группами, где точка присоединения расположена либо на арильном, либо на гетероарильном кольце, и в таких случаях число кольцевых атомов остается в силе для обозначения числа кольцевых атомов в конденсированной полициклической (арильной/гетероарильной) кольцевой системе. Полициклические гетероарильные группы, в которых одно кольцо не содержит гетероатом (например, индолил, хинолинил, карбазолил, и т.п.), точка присоединения может находиться на любом кольце, т.е. либо на кольце, содержащем гетероатом (например, 2-индолил), либо на кольце, не содержащем гетероатом (например, 5-индолил).
[0036] Согласно некоторым вариантам осуществления гетероарильная группа представляет собой 5-10-членную ароматическую кольцевую систему, содержащую кольцевые атомы углерода и 1-4 кольцевых гетероатомов в ароматической кольцевой системе, где каждый гетероатом независимо выбран из азота, кислорода и серы («5-10-членный гетероарил»). Согласно некоторым вариантам осуществления гетероарильная группа представляет собой 5-8-членную ароматическую кольцевую систему, содержащую кольцевые атомы углерода и 1-4 кольцевых гетероатомов в ароматической кольцевой системе, где каждый гетероатом независимо выбран из азота, кислорода и серы («5-8-членный гетероарил»). Согласно некоторым вариантам осуществления гетероарильная группа представляет собой 5-6-членную ароматическую кольцевую систему, содержащую кольцевые атомы углерода и 1-4 кольцевых гетероатомов в ароматической кольцевой системе, где каждый гетероатом независимо выбран из азота, кислорода и серы («5-6-членный гетероарил»). Согласно некоторым вариантам осуществления 5-6-членный гетероарил содержит 1-3 кольцевых гетероатомов, выбранных из азота, кислорода и серы. Согласно некоторым вариантам осуществления 5-6-членный гетероарил содержит 1-2 кольцевых гетероатомов, выбранных из азота, кислорода и серы. Согласно некоторым вариантам осуществления 5-6-членный гетероарил содержит 1 кольцевой гетероатом, выбранный из азота, кислорода и серы. Если не указано иное, то в каждом случае гетероарильная группа независимо является незамещенной («незамещенный гетероарил») или замещенной («замещенный гетероарил») одним или несколькими заместителями. Согласно определенным вариантам осуществления гетероарильная группа представляет собой незамещенный 5-14-членный гетероарил. Согласно определенным вариантам осуществления гетероарильная группа представляет собой замещенный 5-14-членный гетероарил.
[0037] Иллюстративные 5-членные гетероарильные группы, содержащие 1 гетероатом, включают в себя без ограничения пирролил, фуранил и тиофенил. Иллюстративные 5-членные гетероарильные группы, содержащие 2 гетероатома, включают в себя без ограничения имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил и изотиазолил. Иллюстративные 5-членные гетероарильные группы, содержащие 3 гетероатома, включают в себя без ограничения триазолил, оксадиазолил и тиадиазолил. Иллюстративные 5-членные гетероарильные группы, содержащие 4 гетероатома, включают в себя без ограничения тетразолил. Иллюстративные 6-членные гетероарильные группы, содержащие 1 гетероатом, включают в себя без ограничения пиридинил. Иллюстративные 6-членные гетероарильные группы, содержащие 2 гетероатома, включают в себя без ограничения пиридазинил, пиримидинил и пиразинил. Иллюстративные 6-членные гетероарильные группы, содержащие 3 или 4 гетероатома, включают в себя без ограничения триазинил и тетразинил, соответственно. Иллюстративные 7-членные гетероарильные группы, содержащие 1 гетероатом, включают в себя без ограничения азепинил, оксепинил и тиепинил. Иллюстративные 5,6-бициклические гетероарильные группы включают в себя без ограничения индолил, изоиндолил, индазолил, бензотриазолил, бензотиофенил, изобензотиофенил, бензофуранил, бензоизофуранил, бензимидазолил, бензоксазолил, бензизоксазолил, бенз оксадиазолил, бензтиазолил, бензизотиазолил, бензтиадиазолил, индолизинил и пуринил. Иллюстративные 6,6-бициклические гетероарильные группы включают в себя без ограничения нафтиридинил, птеридинил, хинолинил, изохинолинил, циннолинил, хиноксалинил, фталазинил и хиназолинил. Иллюстративные трициклические гетероарильные группы включают в себя без ограничения фенантридинил, дибензофуранил, карбазолил, акридинил, фенотиазинил, феноксазинил и феназинил.
[0038] Термин «ненасыщенная связь» относится к двойной или тройной связи.
[0039] Термин «ненасыщенный» или «частично ненасыщенный» относится к фрагменту, который содержит по меньшей мере одну двойную или тройную связь.
[0040] Термин «насыщенный» относится к фрагменту, который не содержит двойную или тройную связь, т.е. фрагмент содержит только одинарные связи.
[0041] Добавление суффикса «-ен» к группе указывает на то, что группа представляет собой двухвалентный фрагмент, например, алкилен представляет собой двухвалентный фрагмент алкила, алкенилен представляет собой двухвалентный фрагмент алкенила, алкинилен представляет собой двухвалентный фрагмент алкинила, гетероалкилен представляет собой двухвалентный фрагмент гетероалкила, гетероалкенилен представляет собой двухвалентный фрагмент гетеро алкенила, гетероалкинилен представляет собой двухвалентный фрагмент гетероалкинила, карбоциклилен представляет собой двухвалентный фрагмент карбоциклила, гетероциклилен представляет собой двухвалентный фрагмент гетероциклила, арилен представляет собой двухвалентный фрагмент арила, и гетероарилен представляет собой двухвалентный фрагмент гетероарила.
[0042] Если в настоящем документе в явном виде не указано иное, то какая-либо группа является необязательно замещенной. Термин «необязательно замещенный» относится к замещенному или незамещенному. Согласно определенным вариантам осуществления алкильная, алкенильная, алкинильная, гетероалкильная, гетероалкенильная, гетероалкинильная, карбоциклильная, гетероциклильная, арильная и гетероарильная группы являются необязательно замещенными. «Необязательно замещенный» относится к группе, которая может быть замещенной или незамещенной (например, «замещенная» или «незамещенная» алкильная, «замещенная» или «незамещенная» алкенильная, «замещенная» или «незамещенная» алкинильная, «замещенная» или «незамещенная» гетероалкильная, «замещенная» или «незамещенная» гетероалкенильная, «замещенная» или «незамещенная» гетероалкинильная, «замещенная» или «незамещенная» карбоциклильная, «замещенная» или «незамещенная» гетероциклильная, «замещенная» или «незамещенная» арильная или «замещенная» или «незамещенная» гетероарильная группа). В общем, термин «замещенный» означает, что по меньшей мере один водород, присутствующий на группе, заменен допустимым заместителем, например, заместителем, который после замещения приводит к получению стабильного соединения, например, соединения, которое не претерпевает спонтанной трансформации, такой как перегруппировка, циклизация, отщепление или другая реакция. Если не указано иное, то «замещенная» группа содержит заместитель в одном или нескольких пригодных для замещения положениях группы, и если в какой-либо данной структуре замещено более одного положения, то в каждом положении заместитель является одним и тем же или другим. Предполагается, что термин «замещенный» включает в себя замещение всеми возможными заместителями органических соединений и включает в себя любой из заместителей, описанных в настоящем документе, который приводит к получению стабильного соединения. Настоящим изобретением предусмотрены абсолютно все такие комбинации с целью получения стабильного соединения. Применительно к настоящему изобретению, гетероатомы, такие как азот, могут содержать водородные заместители и/или любой подходящий заместитель, описанный в настоящем документе, который отвечает валентности гетероатомов и приводит к образованию стабильного фрагмента. Подразумевается, что настоящее изобретение не ограничивается каким-либо путем иллюстративными заместителями, описанными в настоящем документе.
[0043] Иллюстративные заместители атома углерода включают в себя без ограничения галоген, -CN, -NO2, -N3, -SO2H, -SO3H, -ОН, -ORaa, -ON(Rbb)2, -N(Rbb)2, -N(Rbb)3+X-, -N(ORcc)Rbb, -SH, -SRaa, -SSRcc, -C(=O)Raa, -CO2H, -CHO, -C(ORcc)3, -CO2Raa, -OC(=O)Raa, -OCO2Raa, -C(=O)N(Rbb)2, -OC(=O)N(Rbb)2, -NRbbC(=O)Raa, -NRbbCO2Raa, -NRbbC(=O)N(Rbb)2, -C(=NRbb)Raa, -C(=NRbb)ORaa, -OC(=NRbb)Raa, -OC(=NRbb)ORaa, -C(=NRbb)N(Rbb)2, -OC(=NRbb)N(Rbb)2, -NRbbC(=NRbb)N(Rbb)2, -C(=O)NRbbSO2Raa, -NRbbSO2Raa, -SO2N(Rbb)2, -SO2Raa, -SO2ORaa, -OSO2Raa, -S(=O)Raa, -OS(=O)Raa, -Si(Raa)3, -OSi(Raa)3 -C(=S)N(Rbb)2, -C(=O)SRaa, -C(=S)SRaa, -SC(=S)SRaa, -SC(=O)SRaa, -OC(=O)SRaa, -SC(=O)ORaa, -SC(=O)Raa, -P(=O)(Raa)2, -P(=O)(ORcc)2, -OP(=O)(Raa)2, -OP(=O)(ORcc)2, -P(=O)(N(Rbb)2)2, -OP(=O)(N(Rbb)2)2, -NRbbP(=O)(Raa)2, -NRbbP(=O)(ORcc)2, NRbbP(=O)(N(Rbb)2)2, -P(Rcc)2, -P(ORcc)2, -P(Rcc)3+X-, -P(ORcc)3+X-, -P(Rcc)4, -P(ORcc)4, -OP(Rcc)2, -OP(Rcc)3+X-, -OP(ORcc)2, -OP(ORcc)3+X-, -OP(Rcc)4, -OP(ORcc)4, -B(Raa)2, -B(ORcc)2, -BRaa(ORcc), С1-10алкил, С1-10пергалогеналкил, С2-10алкенил, С2-10алкинил, гетероС1-10алкил, гетероС2-10алкенил, гетероС2-10алкинил, С3-10карбоциклил, 3-14-членный гетероциклил, С6-14арил и 5-14-членный гетероарил, где каждый алкил, алкенил, алкинил, гетероалкил, гетероалкенил, гетероалкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 группами Rdd; где X- представляет собой противоион;
иди два геминальных водорода на атоме углерода заменены группой =O, =S, =NN(Rbb)2, =NNRbbC(=O)Raa, =NNRbbC(=O)ORaa, =NNRbbS(=O)2Raa, =NRbb или =NORcc;
в каждом случае Raa независимо выбран из С1-10алкила, С1-10пергалогеналкила, С2-10алкенила, С2-10алкинила, гетероС1-10алкила, гетероС2-10алкенила, гетероС2-10алкинила, С3-10карбоциклила, 3-14-членного гетероциклила, С6-14арилаи 5-14-членного гетероарила, или две группы Raa объединены с образованием 3-14-членного гетероциклила или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, гетероалкил, гетероалкенил, гетероалкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 группами Rdd;
в каждом случае Rbb независимо выбран из водорода, -ОН, -ORaa, -N(Rcc)2, -CN, -C(=O)Raa, -C(=O)N(Rcc)2, -CO2Raa, -SO2Raa, -C(=NRcc)ORaa, -C(=NRcc)N(Rcc)2, -SO2N(Rcc)2, -SO2Rcc, -SO2ORcc, -SORaa, -C(=S)N(Rcc)2, -C(=O)SRcc, -C(=S)SRcc, -P(=O)(Raa)2, -P(=O)(ORcc)2, -P(=O)(N(Rcc)2)2, С1-10алкила, С1-10пергалогеналкила, C2-10алкенила, C2-10алкинила, гетероС1-10алкила, гетероС2-10алкенила, гетероС2-10алкинила, С3-10карбоциклила, 3-14-членного гетероциклила, С6-14арилаи 5-14-членного гетероарила, или две группы Rbb объединены с образованием 3-14-членного гетероциклила или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, гетероалкил, гетероалкенил, гетероалкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 группами Rdd; где X- представляет собой противоион;
в каждом случае Rcc независимо выбран из водорода, С1-10алкила, C1-10пергалогеналкила, С2-10алкенила, С2-10алкинила, гетероС1-10алкила, гетероС2-10алкенила, гетероС2-10алкинила, С3-10карбоциклила, 3-14-членного гетероциклила, С6-14арила и 5-14-членного гетероарила, или две группы Rcc объединены с образованием 3-14-членного гетероциклила или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, гетероалкил, гетероалкенил, гетер оалкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 группами Rdd;
в каждом случае Rdd независимо выбран из галогена, -CN, -NO2, -N3, -SO2H, -SO3H, -ОН, -ORee, -ON(Rff)2, -N(Rff)2, -N(Rff)3+X-, -N(ORee)Rff, -SH, -SRee, -SSRee, -C(=O)Ree, -CO2H, -CO2Ree, -OC(=O)Ree, -OCO2Ree, -C(=O)N(Rff)2, -OC(=O)N(Rff)2, -NRffC(=O)Ree, -NRffCO2Ree, -NRffC(=O)N(Rff)2, -C(=NRff)ORee, -OC(=NRff)Ree, -OC(=NRff)ORee, -C(=NRff)N(Rff)2, -OC(=NRff)N(Rff)2, -NRffC(=NRff)N(Rff)2, -NRffSO2Ree, -SO2N(Rff)2, -SO2Ree, -SO2ORee, -OSO2Ree, -S(=O)Ree, -Si(Ree)3, -OSi(Ree)3, -C(=S)N(Rff)2, -C(=O)SRee, -C(=S)SRee, -SC(=S)SRee, -P(=O)(ORee)2, -P(=O)(Ree)2, -OP(=O)(Ree)2, -OP(=O)(ORee)2, C1-6алкила, C1-6пергалогеналкила, С2-6алкенила, С2-6алкинила, гетероС1-6алкила, гетероС2-6алкенила, гетероС2-6алкинила, С3-10карбоциклила, 3-10-членного гетероциклила, С6-10арила, 5-10-членного гетероарила, где каждый алкил, алкенил, алкинил, гетероалкил, гетероалкенил, гетер оалкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1,2, 3, 4 или 5 группами Rgg, или два геминальных заместителя Rdd могут быть объединены с образованием =O или =S; где X- представляет собой противоион;
в каждом случае Ree независимо выбран из С1-6алкила, C1-6пергалогеналкила, С2-6алкенила, С2-6алкинила, гетероС1-6алкила, гетероС2-6алкенила, гетероС2-6алкинила, С3-10карбоциклила, С6-10арила, 3-10-членного гетероциклила и 3-10-членного гетероарила, где каждый алкил, алкенил, алкинил, гетероалкил, гетероалкенил, гетероалкинил, карбоциклил, гетероциклил, арил, и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 группами Rgg;
в каждом случае Rff независимо выбран из водорода, С1-6алкила, С1-6пергалогеналкила, С2-6алкенила, С2-6алкинила, гетероС1-6алкила, гетероС2-6алкенила, гетероС2-6алкинила, С3-10карбоциклила, 3-10-членного гетероциклила, С6-10арила и 5-10-членного гетероарила, или две группы Rff объединены с образованием 3-10-членного гетероциклила или 5-10-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, гетероалкил, гетероалкенил, гетероалкинил, карбоциклил, гетероциклил, арил, и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 группами Rgg; и
в каждом случае Rgg независимо представляет собой галоген, -CN, -NO2, -N3, -SO2H, -SO3H, -ОН, -ОС1-6алкил, -ON(С1-6алкил)2, -N(С1-6алкил)2, -N(С1-6алкил)3+Х-, -NH(C1-6алкил)2+Х-, -NH2(С1-6алкил)+Х-, -NH3+X-, -N(ОС1-6алкил)(С1-6алкил), -N(OH)(C1-6алкил), -NH(OH), -SH, -SC1-6алкил, -SS(С1-6алкил), -С(=O)(С1-6алкил), -CO2H, -CO2(С1-6алкил), -ОС(=O)(С1-6алкил), -OCO2(С1-6алкил), -C(=O)NH2, -С(=O)N(С1-6алкил)2, -OC(=O)NH(C1-6алкил), -NHC(=O)(С1-6алкил), -N(С1-6алкил)С(=O)(С1-6алкил), -NHCO2(С1-6алкил), -NHC(=O)N(С1-6алкил)2, -NHC(=O)NH(C1-6алкил), -NHC(=O)NH2, -C(=NH)O(C1-6алкил), -OC(=NH)(C1-6алкил), -ОС(=NH)ОС1-6алкил, -C(=NH)N(C1-6алкил)2, -C(=NH)NH(C1-6алкил), -C(=NH)NH2, -OC(=NH)N(C1-6алкил)2, -OC(=NH)NH(C1-6алкил), -OC(=NH)NH2, -NHC(=NH)N(C1-6алкил)2, -NHC(=NH)NH2, -NHSO2(С1-6алкил), -SO2N(C1-6алкил)2, -SO2NH(C1-6алкил), -SO2NH2, -SO2(С1-6алкил), -SO2O(С1-6алкил), -OSO2(С1-6алкил), -SO(C1-6алкил), -Si(С1-6алкил)3, -OSi(С1-6алкил)3 -С(=S)N(С1-6алкил)2, С(=S)NH(С1-6алкил), C(=S)NH2, -С(=O)S(С1-6алкил), -C(=S)SC1-6алкил, -SC(=S)SC1-6алкил, -Р(=O)(ОС1-6алкил)2, -Р(=O)(С1-6алкил)2, -ОР(=O)(С1-6алкил)2, -OP(=O)(OC1-6алкил)2, С1-6алкил, С1-6пергалогеналкил, С2-6алкенил, С2-6алкинил, гетероС1-6алкил, гетероС2-6алкенил, гетероС2-6алкинил, С3-10карбоциклил, С6-10арил, 3-10-членный гетероциклил, 5-10-членный гетероарил; или два геминальных заместителя Rgg могут быть объединены с образованием =O или =S; где X- представляет собой противоион.
[0044] Согласно определенным вариантам осуществления заместители атома углерода включают в себя: галоген, -CN, -NO2, -N3, -SO2H, -SO3H, -ОН, -OC1-6алкил, -ON(С1-6алкил)2, -N(С1-6алкил)2, -N(C1-6алкил)3+Х-, -NH(С1-6алкил)2+Х-, -NH2(С1-6алкил)+Х-, -NH3+X-, -N(OC1-6алкил)(С1-6алкил), -N(ОН)(С1-6алкил), -NH(OH), -SH, -SC1-6алкил, -SS(C1-6алкил), -С(=O)(С1-6алкил), -СО2Н, -CO2(С1-6алкил), -ОС(=O)(С1-6алкил), -OCO2(С1-6алкил), -C(=O)NH2, -C(=O)N(C1-6алкил)2, -OC(=O)NH(C1-6алкил), -NHC(=O)(C1-6алкил), -N(C1-6алкил)С(=O)(С1-6алкил), -NHCO2(С1-6алкил), -NHC(=O)N(C1-6алкил)2, -NHC(=O)NH(C1-6алкил), -NHC(=O)NH2, -C(=NH)O(C1-6алкил), -OC(=NH)(C1-6алкил), -OC(=NH)OC1-6алкил, -C(=NH)N(C1-6алкил)2, -C(=NH)NH(C1-6алкил), -C(=NH)NH2, -OC(=NH)N(C1-6алкил)2, -OC(=NH)NH(C1-6алкил), -OC(=NH)NH2, -NHC(=NH)N(C1-6алкил)2, -NHC(=NH)NH2, -NHSO2(C1-6алкил), -SO2N(С1-6алкил)2, -SO2NH(C1-6алкил), -SO2NH2, -SO2(С1-6алкил), -SO2O(С1-6алкил), -OSO2(С1-6алкил), -SO(С1-6алкил), -Si(С1-6алкил)3, -OSi(С1-6алкил)3 -С(=S)N(С1-6алкил)2, С(=S)NH(С1-6алкил), C(=S)NH2, -C(=O)S(C1-6алкил), -С(=S)SC1-6алкил, -SC(=S)SC1-6алкил, -Р(=O)(OC1-6алкил)2, -Р(=O)(С1-6алкил)2, -ОР(=O)(С1-6алкил)2, -ОР(=O)(ОС1-6алкил)2, C1-6алкил, С1-6пергалогеналкил, С2-6алкенил, С2-6алкинил, гетероС1-6алкил, гетероС2-6алкенил, гетероС2-6алкинил, С3-10карбоциклил, С6-10арил, 3-10-членный гетероциклил, 5-10-членный гетероарил; или два геминальных заместителя Rgg могут быть объединены с образованием =O или =S; где X- представляет собой противоион.
[0045] Термин «галоид» или «галоген» относится к фтору (фтор, -F), хлору (-хлор, -Cl), брому (-бром, -Br) или йоду (-йод, -I).
[0046] Термин «гидроксил» или «гидрокси» относится к группе -ОН. Термин «замещенный гидроксил», или «замещенный гидроксил» в качестве расширения, относится к гидроксильной группе, в которой атом кислорода, присоединенный непосредственно к первичной молекуле, замещен отличной от водорода группой, и включает в себя группы, выбранные из -ORaa, -ON(Rbb)2, -OC(=O)SRaa, -OC(=O)Raa, -OCO2Raa, -OC(=O)N(Rbb)2, -OC(=NRbb)Raa, -OC(=NRbb)ORaa, -OC(=NRbb)N(Rbb)2, -OS(=O)Raa, -OSO2Raa, -OSi(Raa)3, -OP(Rcc)2, -OP(Rcc)3+X-, -OP(ORcc)2, -OP(ORcc)3+X-, -OP(=O)(Raa)2, -OP(=O)(ORcc)2 и -OP(=O)(N(Rbb)2)2, где значения X-, Raa, Rbb и Rcc определены в настоящем документе.
[0047] Термин «амино» относится к группе -NH2. Термин «замещенный амино» в качестве расширения относится к монозамещенному амино, дизамещенному амино или тризамещенному амино. Согласно определенным вариантам осуществления «замещенный амино» представляет собой монозамещенный амино или дизамещенный амино.
[0048] Термин «монозамещенный амино» относится к аминогруппе, в которой атом азота, присоединенный непосредственно к первичной молекуле, замещен одним водородом и одной отличной от водорода группой, и включает в себя группы, выбранные из -NH(Rbb), -NHC(=O)Raa, -NHCO2Raa, -NHC(=O)N(Rbb)2, -NHC(=NRbb)N(Rbb)2, -NHSO2Raa, -NHP(=O)(ORcc)2 и -NHP(=O)(N(Rbb)2)2, где значения Raa, Rbb и Rcc определены в настоящем документе, и где Rbb группы -NH(Rbb) не представляет собой водород.
[0049] Термин «дизамещенный амино» относится к аминогруппе, в которой атом азота, присоединенный непосредственно к первичной молекуле, замещен двумя отличными от водорода группами, и включает в себя группы, выбранные из -N(Rbb)2, -NRbbC(=O)Raa, -NRbbCO2Raa, -NRbbC(=O)N(Rbb)2, -NRbbC(=NRbb)N(Rbb)2, -NRbbSO2Raa, -NRbbP(=O)(ORcc)2 и -NRbbP(=O)(N(Rbb)2)2, где значения Raa, Rbb и Rcc определены в настоящем документе, при условии, что атом азота, присоединенный непосредственно к первичной молекуле, не замещен водородом.
[0050] Термин «тризамещенный амино» относится к аминогруппе, в которой атом азота, присоединенный непосредственно к первичной молекуле, замещен тремя группами, и включает в себя группы, выбранные из -N(Rbb)3 и -N(Rbb)3+X-, где значения Rbb и X- определены в настоящем документе.
[0051] Термин «сульфонил» относится к группе, выбранной из -SO2N(Rbb)2, -SO2Raa и -SO2ORaa, где значения Raa и Rbb определены в настоящем документе.
[0052] Термин «сульфинил» относится к группе -S(=O)Raa, где значение Raa определено в настоящем документе.
[0053] Термин «ацил» относится к группе, характеризующейся общей формулой -C(=O)RX1, -C(=O)ORX1, -C(=O)-O-C(=O)RX1, -C(=O)SRX1, -C(=O)N(RX1)2, -C(=S)RX1, -C(=S)N(RX1)2, -C(=S)O(RX1), -C(=S)S(RX1), -C(=NRX1)RX1, -C(=NRX1)ORX1, -C(=NRX1)SRX1 и -C(=NRX1)N(RX1)2, где RX1 представляет собой водород; галоген; замещенный или незамещенный гидроксил; замещенный или незамещенный тиол; замещенный или незамещенный амино; замещенный или незамещенный ацил; циклическая или ациклическая, замещенная или незамещенная, разветвленная или неразветвленная алифатическая группа; циклическая или ациклическая, замещенная или незамещенная, разветвленная или неразветв ленная гетероалифатическая группа; циклический или ациклический, замещенный или незамещенный, разветвленный или неразветвленный алкил; циклический или ациклический, замещенный или незамещенный, разветвленный или неразветвленный алкенил; замещенный или незамещенный алкинил; замещенный или незамещенный арил, замещенный или незамещенный гетероарил, (алифатическая группа)окси, (гетероалифатическая группа)окси, алкилокси, гетероалкилокси, арилокси, гетероарилокси, (алифатическая группа)тиокси, (гетероалифатическая группа)тиокси, алкилтиокси, гетероалкилтиокси, арилтиокси, гетероарилтиокси, моно- или ди(алифатическая группа)амино, моно- или ди(гетероалифатическая группа)амино, моно- или диалкиламино, моно- или дигетероалкиламино, моно- или диариламино, или моно- или дигетероариламино; или две группы RX1 образуют вместе 5-6-членное гетероциклическое кольцо. Иллюстративные ацильные группы включают в себя альдегиды (-СНО), карбоновые кислоты (-СО2Н), кетоны, ацилгалогениды, сложные эфиры, амиды, имины, карбонаты, карбаматы и мочевины. Заместители ацила включают в себя без ограничения любой из заместителей, описанных в настоящем документе, который приводит к образованию стабильного фрагмента (например, алифатическая группа, алкил, алкенил, алкинил, гетероалифатическая группа, гетероциклическая группа, арил, гетероарил, ацил, оксо, имино, тиоксо, циано, изоциано, амино, азидо, нитро, гидроксил, тиол, галоген, (алифатическая группа)амино, (гетероалифатическая группа)амино, алкиламино, гетероалкиламино, ариламино, гетероариламино, алкиларил, арилалкил, (алифатическая группа)окси, (гетероалифатическая группа)окси, алкилокси, гетероалкилокси, арилокси, гетероарилокси, (алифатическая группа)тиокси, (гетероалифатическая группа)тиокси, алкилтиокси, гетероалкилтиокси, арилтиокси, гетероарилтиокси, ацилокси, и т.п., каждый из которых может быть дополнительно замещен или не замещен).
[0054] Термин «карбонил» относится к группе, в которой атом углерода, присоединенный непосредственно к первичной молекуле, sp2-гибридизован, и замещен атомом кислорода, азота или серы, например, к группе, выбранной из кетонов (например, -C(=O)Raa), карбоновых кислот (например, -СО2Н), альдегидов (-СНО), сложных эфиров (например, -CO2Raa, -C(=O)SRaa, -C(=S)SRaa), амидов (например, -C(=O)N(Rbb)2, -C(=O)NRbbSO2Raa, -C(=S)N(Rbb)2) и иминов (например, -C(=NRbb)Raa, -C(=NRbb)ORaa), -C(=NRbb)N(Rbb)2), где значения Raa и Rbb определены в настоящем документе.
[0055] Термин «силил» относится к группе -Si(Raa)3, где значение Raa определено в настоящем документе.
[0056] Термин «оксо» относится к группе =O, и термин «тиооксо» относится к группе =S.
[0057] Атомы азота могут быть замещенными или незамещенными, если это позволяет валентность, и включают в себя первичные, вторичные, третичные и четвертичные атомы азота. Иллюстративные заместители атома азота включают в себя без ограничения водород, -ОН, -ORaa, -N(Rcc)2, -CN, -C(=O)Raa, -C(=O)N(Rcc)2, -CO2Raa, -SO2Raa, -C(=NRbb)Raa, -C(=NRcc)ORaa, -C(=NRcc)N(Rcc)2, -SO2N(Rcc)2, -SO2Rcc, -SO2ORcc, -SORaa, -C(=S)N(Rcc)2, -C(=O)SRcc, -C(=S)SRcc, -P(=O)(ORcc)2, -P(=O)(Raa)2, -P(=O)(N(Rcc)2)2, C1-10алкил, С1-10пергалогеналкил, С2-10алкенил, С2-10алкинил, гетероС1-10алкил, гетероС2-10алкенил, гетероС2-10алкинил, С3-10карбоциклил, 3-14-членный гетероциклил, С6-14арил и 5-14-членный гетероарил, или две группы Rcc, присоединенных к атому N, объединены с образованием 3-14-членного гетероциклила или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, гетероалкил, гетероалкенил, гетероалкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 группами Rdd, и где значения Raa, Rbb, Rcc и Rdd определены выше.
[0058] Согласно определенным вариантам осуществления заместитель, присутствующий на атоме азота, представляет собой азот-защитную группу (также называемую в настоящем документе «амино-защитной группой»). Азот-защитные группы включают в себя без ограничения -ОН, -ORaa, -N(Rcc)2, -C(=O)Raa, -C(=O)N(Rcc)2, -CO2Raa, -SO2Raa, -C(=NRcc)Raa, -C(=NRcc)ORaa, -C(=NRcc)N(Rcc)2, -SO2N(Rcc)2, -SO2Rcc, -SO2ORcc, -SORaa, -C(=S)N(Rcc)2, -C(=O)SRcc, -C(=S)SRcc, С1-10алкильную (например, аралкильную, гетероаралкильную), С2-10алкенильную, С2-10алкинильную, гетероС1-10алкильную, гетероС2-10алкенильную, гетероС2-10алкинильную, С3-10карбоциклильную, 3-14-членную гетероциклильную, С6-14арильную и 5-14-членную гетероарильную группы, где каждый алкил, алкенил, алкинил, гетероалкил, гетероалкенил, гетероалкинил, карбоциклил, гетероциклил, аралкил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 группами Rdd, и где значения Raa, Rbb, Rcc и Rdd определены в настоящем документе. Азот-защитные группы хорошо известны из уровня техники и включают в себя группы, подробно описанные в документе Protecting Groups in Organic Synthesis, T.W. Greene и P.G.M. Wuts, 3rd edition, John Wiley & Sons, 1999, включенном в настоящий документе посредством ссылки.
[0059] Например, азот-защитные группы, такие как амидные группы (например, -C(=O)Raa) включают в себя без ограничения формамид, ацетамид, хлорацетамид, трихлорацетамид, трифторацетамид, фенилацетамид, 3-фенилпропанамид, пиколинамид, 3-пиридилкарбоксамид, производное N-бензоилфенилаланила, бензамид, пара-фенилбензамид, орто-нитрофенилацетамид, орто-нитрофеноксиацетамид, ацетоацетамид, (N'-дитиобензилоксиациламино)ацетамид, 3-(пара-гидроксифенил)-пропанамид, 3-(орто-нитрофенил)пропанамид, 2-метил-2-(орто-нитрофенокси)-пропанамид, 2-метил-2-(орто-фенилазофенокси)пропанамид, 4-хлорбутанамид, 3-метил-3-нитробутанамид, орто-нитроциннамид, производное N-ацетил метионина, орто-нитробензамид и орто-(бензоилоксиметил)бензамид.
[0060] Азот-защитные группы, такие как карбаматные группы (например, -C(=O)ORaa) включают в себя без ограничения метилкарбамат, этилкарбамат, 9-флуоренил метил карбамат (Fmoc), 9-(2-сульфо)флуоренилметилкарбамат, 9-(2,7-дибром)флуоренилметилкарбамат, 2,7-ди-трет-бутил-[9-(10,10-диоксо-10,10,10,10-тетрагидротиоксантил)]метилкарбамат (DBD-Tmoc), 4-метоксифенацилкарбамат (Phenoc), 2,2,2-трихлорэтилкарбамат (Troc), 2-триметилсилилэтилкарбамат (Теос), 2-фенилэтилкарбамат (hZ), 1-(1-адамантил)-1-метилэтилкарбамат (Adpoc), 1,1-диметил-2-галогенэтилкарбамат, 1,1-диметил-2,2-дибромэтилкарбамат (DB-трет-BOC), 1,1-диметил-2,2,2-трихлорэтилкарбамат (ТСВОС), 1-метил-1-(4-бифенилил)этилкарбамат (Врос), 1-(3,5-ди-трет-бутилфенил)-1-метилэтилкарбамат (t-Bumeoc), 2-(2'- и 4'-пиридил)этилкарбамат (Руос), 2-(N,N-дициклогексилкарбоксамидо)этилкарбамат, трет-бутилкарбамат (ВОС или Boc), 1-адамантилкарбамат (Adoc), винилкарбамат (Voc), аллилкарбамат (Alloc), 1-изопропилаллилкарбамат (Ipaoc), циннамилкарбамат (Сое), 4-нитроциннамилкарбамат (Noc), 8-хинолилкарбамат, N-гидроксипиперидинилкарбамат, алкилдитиокарбамат, бензилкарбамат (Cbz), пара-метоксибензилкарбамат (Moz), пара-нитробензилкарбамат, пара-бромбензилкарбамат, пара-хлорбензилкарбамат, 2,4-дихлорбензилкарбамат, 4-метилсульфинилбензилкарбамат (Msz), 9-антрилметилкарбамат, дифенил метил карбамат, 2-метилтиоэтилкарбамат, 2-метилсульфонилэтилкарбамат, 2-(пара-толуолсульфонил)этилкарбамат, [2-(1,3-дитианил)]метилкарбамат (Dmoc), 4-метилтиофенилкарбамат (Mtpc), 2,4-диметилтиофенилкарбамат (Bmpc), 2-фосфониоэтилкарбамат (Реос), 2-трифенилфосфониоизопропилкарбамат (Ррос), 1,1-диметил-2-цианоэтилкарбамат, мета-хлор-пара-ацилоксибензилкарбамат, пара-(дигидроксиборил)бензилкарбамат, 5-бензизоксазолилметилкарбамат, 2-(трифторметил)-6-хромонилметилкарбамат (Tcroc), мета-нитрофенилкарбамат, 3,5-диметоксибензил-карбамат, орто-нитробензилкарбамат, 3,4-диметокси-6-нитробензилкарбамат, фенил(орто-нитрофенил)метилкарбамат, трет-амилкарбамат, S-бензилтиокарбамат, пара-цианобензилкарбамат, циклобутилкарбамат, циклогексилкарбамат, циклопентилкарбамат, циклопропилметилкарбамат, пара-децилоксибензилкарбамат, 2,2-диметоксиацилвинилкарбамат, орто-(N,N-диметилкарбоксамидо)бензилкарбамат, 1,1-диметил-3-(N,N-диметилкарбоксамидо)пропилкарбамат, 1,1-диметилпропинилкарбамат, ди(2-пиридил)метилкарбамат, 2-фуранилметилкарбамат, 2-йодэтилкарбамат, изоборанил карбамат, изобутилкарбамат, изоникотинилкарбамат, пара-(р'-метоксифенилазо)-бензилкарбамат, 1-метилциклобутилкарбамат, 1-метилциклогексилкарбамат, 1-метил-1-циклопропилметилкарбамат, 1-метил-1-(3,5-диметоксифенил)этилкарбамат, 1-метил-1-(пара-фенилазофенил)этилкарбамат, 1-метил-1-фенилэтилкарбамат, 1-метил-1-(4-пиридил)этилкарбамат, фенилкарбамат, пара-(фенилазо)бензилкарбамат, 2,4,6-три-трет-бутилфенилкарбамат, 4-(триметиламмоний)бензилкарбамат и 2,4,6-триметилбензилкарбамат.
[0061] Азот-защитные группы, такие как сульфонамидные группы (например, -S(=O)2Raa) включают в себя без ограничения пара-толуолсульфонамид (Ts), бензолсульфонамид, 2,3,6-триметил-4-метоксибензолсульфонамид (Mtr), 2,4,6-триметоксибензолсульфонамид (Mtb), 2,6-диметил-4-метоксибензолсульфонамид (Pme), 2,3,5,6-тетраметил-4-метоксибензолсульфонамид (Mte), 4-метоксибензолсульфонамид (Mbs), 2,4,6-триметилбензолсульфонамид (Mts), 2,6-диметокси-4-метилбензолсульфонамид (iMds), 2,2,5,7,8-пентаметилхроман-6-сульфонамид (Рте), метансульфонамид (Ms), β-триметилсилилэтансульфонамид (SES), 9-антраценсульфонамид, 4-(4',8'-диметоксинафтилметил)бензолсульфонамид (DNMBS), бензилсульфонамид, трифторметилсульфонамид и фенацилсульфонамид.
[0062] Другие азот-защитные группы включают в себя без ограничения фенотиазинил-(10)-ацильное производное, N'-пара-толуолсульфониламиноацильное производное, N'-фениламинотиоацильное производное, производное N-бензоилфенилаланила, производное N-ацетилметионина, 4,5-дифенил-3-оксазолин-2-он, N-фталимид, N-дитиасукцинимид (Dts), N-2,3-дифенилмалеимид, N-2,5-диметилпиррол, N-1,1,4,4-тетраметилдисилилазациклопентановый аддукт (STABASE), 5-замещенный 1,3-диметил-1,3,5-триазациклогексан-2-он, 5-замещенный 1,3-дибензил-1,3,5-триазациклогексан-2-он, 1-замещенный 3,5-динитро-4-пиридон, N-метиламин, N-аллиламин, N-[2-(триметилсилил)этокси]метиламин (SEM), N-3-ацетоксипропиламин, N-(1-изопропил-4-нитро-2-оксо-3-пирролин-3-ил)амин, четвертичные аммониевые соли, N-бензиламин, N-ди(4-метоксифенил)метиламин, N-5-дибензосубериламин, N-трифенилметиламин (Tr), N-[(4-метоксифенил)дифенилметил]амин (MMTr), N-9-фенилфлуорениламин (PhF), N-2,7-дихлор-9-флуоренилметиленамин, N-ферроценилметиламино (Fcm), N-2-пиколиламино-N'-оксид, N-1,1-диметилтиометиле намин, N-бензилиденамин, N-пара-метоксибензилиденамин, N-дифенилметиленамин, N-[(2-пиридил)мезитил]метиленамин, N-(N',N'-диметиламинометилен)амин, N,N'-изопропилидендиамин, N-пара-нитробензилиденамин, N-салицилиденамин, N-5-хлорсалицилиденамин, N-(5-хлор-2-гидроксифенил)-фенилметиленамин, N-циклогексилиденамин, N-(5,5-диметил-3-оксо-1-циклогексенил)амин, N-борановое производное, производное N-дифенилбориновой кислоты, N-[фенил(пентаацилхром- или вольфрам)ацил]амин, хелат N-меди, хелат N-цинка, N-нитроамин, N-нитрозоамин, амин-N-оксид, дифенилфосфинамид (Dpp), диметилтиофосфинамид (Mpt), дифенилтиофосфинамид (Ppt), диалкилфосфорамидаты, дибензилфосфорамидат, дифенилфосфорамидат, бензолсульфенамид, орто-нитробензолсульфенамид (Nps), 2,4-динитробензолсульфенамид, пентахлорбензолсульфенамид, 2-нитро-4-метоксибензолсульфенамид, трифенилметилсульфенамид и 3-нитропиридинсульфенамид (Npys). Согласно определенным вариантам осуществления азот-защитная группа представляет собой бензил (Bn), трет-бутилоксикарбонил (ВОС), карбобензилокси (Cbz), 9-флуоренилметилоксикарбонил (Fmoc), трифторацетил, трифенилметил, ацетил (Ас), бензоил (Bz), пара-метоксибензил (РМВ), 3,4-диметоксибензил (DMPM), пара-метоксифенил (РМР), 2,2,2-трихлорэтилоксикарбонил (Troc), трифенилметил (Tr), тозил (Ts), брозил (Bs), нозил (Ns), мезил (Ms), трифлил (Tf) или дансил (Ds).
[0063] Согласно определенным вариантам осуществления заместитель, присутствующий на атоме кислорода, представляет собой кислород-защитную группу (также называемую в настоящем документе «гидроксил-защитной группой»). Кислород-защитные группы включают в себя без ограничения -Raa, -N(Rbb)2, -C(=O)SRaa, -C(=O)Raa, -CO2Raa, -C(=O)N(Rbb)2, -C(=NRbb)Raa, -C(=NRbb)ORaa, -C(=NRbb)N(Rbb)2, -S(=O)Raa, -SO2Raa, -Si(Raa)3, -P(Rcc)2, -P(Rcc)3+X-, -P(ORcc)2, -P(ORcc)3+X-, -P(=O)(Raa)2, -P(=O)(ORcc)2 и -P(=O)(N(Rbb)2)2, где значения X-, Raa, Rbb и Rcc определены в настоящем документе. Кислород-защитные группы хорошо известны из уровня техники и включают в себя группы, подробно описанные в документе Protecting Groups in Organic Synthesis, T.W. Greene и P.G.M. Wuts, 3rd edition, John Wiley & Sons, 1999, включенном в настоящий документ посредством ссылки.
[0064] Иллюстративные кислород-защитные группы включают в себя без ограничения метил, метоксилметил (MOM), метилтиометил (МТМ), трет-бутилтиометил, (фенилдиметилсилил)метоксиметил (SMOM), бензилоксиметил (ВОМ), пара-метоксибензилоксиметил (РМВМ), (4-метоксифенокси)метил (пара-АОМ), гваяколметил (GUM), трет-бутоксиметил, 4-пентенилоксиметил (РОМ), силоксиметил, 2-метоксиэтоксиметил (MEM), 2,2,2-трихлорэтоксиметил, бис(2-хлорэтокси)метил, 2-(триметилсилил)этоксиметил (SEMOR), тетрагидропиранил (ТНР), 3-бромтетрагидропиранил, тетрагидротиопиранил, 1-метоксициклогексил, 4-метокситетрагидропиранил (МТНР), 4-метокситетрагидротиопиранил, 4-метокситетрагидротиопиранил-S,S-диоксидо, 1-[(2-хлор-4-метил)фенил]-4-метоксипиперидин-4-ил (СТМР), 1,4-диоксан-2-ил, тетрагидрофуранил, тетрагидротиофуранил, 2,3,3а,4,5,6,7,7а-октагидро-7,8,8-триметил-4,7-метанобензофуран-2-ил, 1-этоксиэтил, 1-(2-хлорэтокси)этил, 1-метил-1-метоксиэтил, 1-метил-1-бензилоксиэтил, 1-метил-1-бензилокси-2-фторэтил, 2,2,2-трихлорэтил, 2-триметилсилилэтил, 2-(фенилселенил)этил, трет-бутил, аллил, пара-хлорфенил, пара-метоксифенил, 2,4-динитрофенил, бензил (Bn), пара-метоксибензил, 3,4-диметоксибензил, орто-нитробензил, пара-нитробензил, пара-галогенбензил, 2,6-дихлорбензил, пара-цианобензил, пара-фенилбензил, 2-пиколил, 4-пиколил, 3-метил-2-пиколил-К-оксид, дифенилметил, р,р'-динитробензгидрил, 5-дибензосуберил, трифенилметил, α-нафтилдифенилметил, пара-метоксифенилдифенилметил, ди(пара-метоксифенил)-фенилметил, три(пара-метоксифенил)метил, 4-(4'-бромфенацилоксифенил)дифенилметил, 4,4',4''-трис(4,5-дихлорфталимидофенил)метил, 4,4',4''-трис(левулиноилоксифенил)метил, 4,4',4''-трис(бензоилоксифенил)метил, 3-(имидазол-1-ил)бис(4',4''-диметоксифенил)метил, 1,1-бис(4-метоксифенил)-1'-пиренилметил, 9-антрил, 9-(9-фенил)ксантенил, 9-(9-фенил-10-оксо)антрил, 1,3-бензодитиолан-2-ил, бензизотиазолил S,S-диоксидо, триметилсилил (TMS), триэтилсилил (TES), триизопропилсилил (TIPS), диметилизопропилсилил (IPDMS), диэтилизопропилсилил (DEIPS), диметилгексилсилил, трет-бутил-диметилсилил (TBDMS), трет-бутилдифенилсилил (TBDPS), трибензилсилил, три-пара-ксилилсилил, трифенилсилил, дифенилметилсилил (DPMS), трет-бутилметоксифенилсилил (TBMPS), формиат, бензоилформиат, ацетат, хлорацетат, дихлорацетат, трихлор ацетат, трифторацетат, метоксиацетат, трифенилметоксиацетат, феноксиацетат, пара-хлорфеноксиацетат, 3-фенилпропионат, 4-оксопентаноат (левулинат), 4,4-(этилендитио)пентаноат (левулиноилдитиоацеталь), пивалоат, адамантоат, кротонат, 4-метоксикротонат, бензоат, пара-фенилбензоат, 2,4,6-триметилбензоат (мезитоат), метилкарбонат, 9-флуоренилметилкарбонат (Fmoc), этилкарбонат, 2,2,2-трихлорэтилкарбонат (Troc), 2-(триметилсилил)этилкарбонат (TMSEC), 2-(фенилсульфонил)этилкарбонат (Psec), 2-(трифенилфосфонио)этилкарбонат (Реос), изобутилкарбонат, винилкарбонат, аллилкарбонат, трет-бутилкарбонат (ВОС или Boc), иара-нитрофенилкарбонат, бензил карбонат, иара-метоксибензилкарбонат, 3,4-диметоксибензилкарбонат, орто-нитробензилкарбонат, иора-нитробензилкарбонат, S-бензилтиокарбонат, 4-этокси-1-нафтилкарбонат, метилдитиокарбонат, 2-йодбензоат, 4-азидобутират, 4-нитро-4-метилпентаноат, орто-(дибромметил)бензоат, 2-формилбензолсульфонат, 2-(метилтиометокси)этил, 4-(метилтиометокси)бутират, 2-(метилтиометоксиметил)бензоат, 2,6-дихлор-4-метилфеноксиацетат, 2,6-дихлор-4-(1,1,3,3-тетраметилбутил)феноксиацетат, 2,4-бис(1,1-диметилпропил)феноксиацетат, хлордифенилацетат, изобутират, моносукциноат, (Е)-2-метил-2-бутеноат, орто-(метоксиацил)бензоат, α-нафтоат, нитрат, алкил-N,N,N',N'-тетраметилфосфородиамидат, алкил-N-фенил карбамат, борат, диметилфосфинотиоил, алкил-2,4-динитрофенилсульфенат, сульфат, метансульфонат (мезилат), бензилсульфонат и тозилат (Ts). Согласно определенным вариантам осуществления кислород-защитная группа представляет собой силил. Согласно определенным вариантам осуществления кислород-защитная группа представляет собой трет-бутилдифенилсилил (TBDPS), трет-бутилдиметилсилил (TBDMS), триизопропилсилил (TIPS), трифенилсилил (TPS), триэтилсилил (TES), триметилсилил (TMS), триизопропилсилоксиметил (ТОМ), ацетил (Ас), бензоил (Bz), аллилкарбонат, 2,2,2-трихлорэтилкарбонат (Troc), 2-триметилсилилэтилкарбонат, метоксиметил (MOM), 1-этоксиэтил (ЕЕ), 2-метокси-2-пропил (МОР), 2,2,2-трихлорэтоксиэтил, 2-метоксиэтоксиметил (MEM), 2-триметилсилилэтоксиметил (SEM), метилтиометил (МТМ), тетрагидропиранил (ТНР), тетрагидрофуранил (THF), пара-метоксифенил (РМР), трифенилметил (Tr), метокситритил (ММТ), диметокситритил (DMT), аллил, пара-метоксибензил (РМВ, МРМ), трет-бутил, бензил (Bn), аллил или пивалоил (Piv).
[0065] Согласно определенным вариантам осуществления заместитель, присутствующий на атоме серы, представляет собой сера-защитную группу (также называемую «тиол-защитной группой»). Сера-защитные группы включают в себя без ограничения -Raa, -N(Rbb)2, -C(=O)SRaa, -C(=O)Raa, -CO2Raa, -C(=O)N(Rbb)2, -C(=NRbb)Raa, -C(=NRbb)ORaa, -C(=NRbb)N(Rbb)2, -S(=O)Raa, -SO2Raa, -Si(Raa)3, -P(Rcc)2, -P(Rcc)3+X-, -P(ORcc)2, -P(ORcc)3+X-, -P(=O)(Raa)2, -P(=O)(ORcc)2 и -P(=O)(N(Rbb)2)2, где значения Raa, Rbb и Rcc определены в настоящем документе. Сера-защитные группы хорошо известны из уровня техники и включают в себя группы, подробно описанные в документе Protecting Groups in Organic Synthesis, T.W. Greene и P.G.M. Wuts, 3rd edition, John Wiley & Sons, 1999, включенном в настоящий документе. Согласно определенным вариантам осуществления сера-защитная группа представляет собой ацетамидометил, трет-бутал, 3-нитро-2-пиридинсульфенил, 2-пиридинсульфенил или трифенилметил.
[0066] «Противоион» или «анионный противоион» представляет собой отрицательно заряженную группу, связанную с положительно заряженной группой для обеспечения электронейтральности. Анионный противоион может быть одновалентным (т.е., содержащим один формальный отрицательный заряд). Анионный противоион также может быть многовалентным (т.е., содержащим более одного формального отрицательного заряда), таким как двухвалентный или трехвалентный. Иллюстративные противоионы включают в себя галоид-анионы (например, F-, Cl-, Br-, I-), NO3-, ClO4-, ОН-, H2PO4-, НСО3-, HSO4-, сульфонат-ионы (например, метансульфонат, трифторметансульфонат, пара-толуолсульфонат, бензолсульфонат, 10-камфорсульфонат, нафталин-2-сульфонат, нафталин 1 сульфоновой кислоты 5 сульфонат, этан 1 сульфоновой кислоты 2 сульфонат, и т.п.), карбоксилат-ионы (например, ацетат, пропаноат, бензоат, глицерат, лактат, тартрат, гликолят, глюконат, и т.п.), BF4-, PF4-, PF6-, AsF6-, SbF6-, В[3,5-(CF3)2С6Н3]4]-, B(C6F5)4-, BPh4-, Al(ОС(CF3)3)4-, и карборановые анионы (например, СВ11Н12- или (HCB11Me5Br6)-). Иллюстративные противоионы, которые могут быть многовалентными, включают в себя СО32-, НРО42-, РО43-, В4О72-, SO42-, S2O32-, карбоксилат-анионы (например, тартрат, цитрат, фумарат, малеат, малат, малонат, глюконат, сукцинат, глутарат, адипат, пимелат, суберат, азелат, себацинат, салицилат, фталаты, аспартат, глутамат, и т.п.) и карбораны.
[0067] Термин «уходящая группа» приводится в своем обычном значении в области синтетической органической химии и относится к атому или группе, способной к вытеснению нуклеофилом (см., например, Smith, March Advanced Organic Chemistry 6th ed. (501-502)). Примеры подходящих уходящих групп включают в себя без ограничения галоген (такой как F, Cl, Br или I (йод)), алкоксикарбонилокси, арилоксикарбонилокси, алкансульфонилокси, аренсульфонилокси, алкилкарбонилокси (например, ацетокси), арилкарбонилокси, арилокси, метокси, N,O-диметилгидроксиламино, пиксил и галоидформиаты. В некоторых случаях уходящая группа представляет собой сложный эфир сульфоновой кислоты, такой как толуолсульфонат (тозилат, -OTs), метансульфонат (мезилат, -OMs), пара-бромбензолсульфонилокси (брозилат, -OBs), -OS(=O)2(CF2)3CF3 (нонафлат, -ONf) или трифторметансульфонат (трифлат, -OTf). В некоторых случаях уходящая группа представляет собой брозилат, такой как пара-бромбензол-сульфонилокси. В некоторых случаях уходящая группа представляет собой нозилат, такой как 2-нитробензолсульфонилокси. Уходящая группа также может представлять собой фосфиноксид (например, образующийся в процессе реакции по Митцунобу) или внутреннюю уходящую группу, такую как эпоксид или циклический сульфат. Другими неограничивающими примерами уходящих групп являются вода, аммиак, спирты, эфирные группировки, тиоэфирные группировки, галогениды цинка, магний-содержащие фрагменты, соли диазония и медь-содержащие фрагменты. Дополнительные иллюстративные уходящие группы включают в себя без ограничения галоген (например, хлор, бром, йод) и активированные замещенные гидроксильные группы (например, -OC(=O)SRaa, -OC(=O)Raa, -OCO2Raa, -OC(=O)N(Rbb)2, -OC(=NRbb)Raa, -OC(=NRbb)ORaa, -OC(=NRbb)N(Rbb)2, -OS(=O)Raa, -OSO2Raa, -OP(Rcc)2, -OP(Rcc)3, -OP(=O)2Raa, -OP(=O)(Raa)2, -OP(=O)(ORcc)2, -OP(=O)2N(Rbb)2 и -OP(=O)(NRbb)2, где значения Raa, Rbb и Rcc определены в настоящем документе).
[0068] Использование в настоящем документе выражения «по меньшей мере один случай» относится к 1, 2, 3, 4 или более случаям, но также охватывает и диапазоны, например, например, от 1 до 4, от 1 до 3, от 1 до 2, от 2 до 4, от 2 до 3 или от 3 до 4 случаев, включительно.
[0069] «Отличная от водорода группа» относится к любой группе, которая определена как определенная переменная, которая не является водородом.
[0070] Последующие определения представляют собой более общие термины используемые на всем протяжении настоящей заявки.
[0071] Используемый в настоящем документе термин «соль» относится к абсолютно всем солям и охватывает фармацевтически приемлемые соли. Термин «фармацевтически приемлемая соль» относится к таким солям, которые подходят в рамках здравого медицинского суждения для применения в контакте с тканями людей и низших животных без проявления нежелательной токсичности, раздражения, аллергической реакции, и т.п., и соразмерны с разумным соотношением пользы и риска. Фармацевтически приемлемые соли хорошо известны из уровня техники. Например, фармацевтически приемлемые соли подробно описаны Berge et at. в документе J. Pharmaceutical Sciences, 1977, 66, 1-19, включенном в настоящий документ посредством ссылки. Фармацевтически приемлемые соли соединений по настоящем изобретению включают в себя соли, являющиеся производными подходящих неорганических и органических кислот и оснований. Примерами фармацевтически приемлемых нетоксичных кислотно-аддитивных солей являются соли аминогруппы, образованные с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота и перхлорная кислота, или с органическими кислотами, такими как уксусная кислота, щавелевая кислота, малеиновая кислота, винная кислота, лимонная кислота, янтарная кислота или малоновая кислота, или с использованием других способов, известных из уровня техники, таких как ионообмен. Другие фармацевтически приемлемые соли включают в себя адипаты, альгинаты, аскорбаты, аспартаты, бензолсульфонаты, бензоаты, бисульфаты, бораты, бутираты, камфораты, камфорсульфонаты, цитраты, циклопентанпропионаты, диглюконаты, додецилсульфаты, этансульфонаты, формиаты, фумараты, глюкогептонаты, глицерофосфаты, глюконаты, гемисульфаты, гептаноаты, гексаноаты, гидройодиды, 2-гидроксиэтансульфонаты, лактобионаты, лактаты, лаураты, лаурилсульфаты, малаты, малеаты, малонаты, метансульфонаты, 2-нафталинсульфонаты, никотинаты, нитраты, олеаты, оксалаты, пальмитаты, памоаты, пектинаты, персульфаты, 3-фенилпропионаты, фосфаты, пикраты, пивалаты, пропионаты, стеараты, сукцинаты, сульфаты, тартраты, тиоцианаты, пара-толуолсульфонаты, ундеканоаты, валераты, и т.п. Соли, являющиеся производными соответствующих оснований, включают в себя соли щелочных металлов, щелочно-земельных, аммония и N+(С1-4алкил)4. Иллюстративные соли щелочных или щелочно-земельных металлов включают в себя соли натрия, лития, калия, кальция, магния, и т.п. Дополнительные фармацевтически приемлемые соли включают в себя, в соответствующих случаях, нетоксичные катионы аммония, четвертичного аммония и амина, образованных с использованием противоионов, таких как галогенид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, низший алкилсульфонат и арилсульфонат.
[0072] Также следует понимать, что соединения, которые характеризуются той же молекулярной формулой, но отличаются по природе или последовательности своих атомов или расположению своих атомов в пространстве, называют «изомерами». Изомеры, которые отличаются по расположению своих атомов в пространстве, называют «стереоизомерами».
[0073] Стереоизомеры, которые не являются зеркальными отражениями друг друга, называют «диастереоизомерами», а стереоизомеры, которые представляют собой несовпадающие при наложении зеркальные отражения друг друга, называют «энантиомеры». Если соединение содержит центр асимметрии, например, он связан с четырьмя разными группами, то возможна пара энантиомеров. Энантиомер может быть охарактеризован по абсолютной конфигурации его центра асимметрии и описывается согласно правилам R- и S-номенклатуры Кана-Прелога, или способом, при котором молекула вращает плоскость поляризованного света и обозначается как правовращающая или левовращающая (т.е., как (+) или (-)-изомеры, соответственно). Хиральное соединение может существовать либо в виде отдельного энантиомера, либо в виде их смеси. Смесь, содержащая равные пропорции энантиомеров, называется «рацемической смесью».
[0074] Термин «малая молекула» относится к молекулам, природного происхождения или искусственно созданным (например, посредством химического синтеза), которые характеризуются сравнительно низкой молекулярной массой. Обычно, малая молекула представляет собой органическое соединение (т.е., она содержит углерод). Малая молекула может содержать множество углерод-углеродных связей, стереоцентров и других функциональных групп (например, амино, гидроксильных, карбонильных и гетероциклических колец, и т.п.). Согласно определенным вариантам осуществления молекулярная масса малой молекулы не превышает приблизительно 1000 г/моль, не превышает приблизительно 900 г/моль, не превышает приблизительно 800 г/моль, не превышает приблизительно 700 г/моль, не превышает приблизительно 600 г/моль, не превышает приблизительно 500 г/моль, не превышает приблизительно 400 г/моль, не превышает приблизительно 300 г/моль, не превышает приблизительно 200 г/моль или не превышает приблизительно 100 г/моль. Согласно определенным вариантам осуществления молекулярная масса малой молекулы составляет по меньшей мере приблизительно 100 г/моль, по меньшей мере приблизительно 200 г/моль, по меньшей мере приблизительно 300 г/моль, по меньшей мере приблизительно 400 г/моль, по меньшей мере приблизительно 500 г/моль, по меньшей мере приблизительно 600 г/моль, по меньшей мере приблизительно 700 г/моль, по меньшей мере приблизительно 800 г/моль, или по меньшей мере приблизительно 900 г/моль или по меньшей мере приблизительно 1000 г/моль. Комбинации указанных выше диапазонов значений (например, составляет по меньшей мере приблизительно 200 г/моль и не превышает приблизительно 500 г/моль) также возможно. Согласно определенным вариантам осуществления малая молекула представляет собой терапевтически эффективное средство, такое как лекарство (например, молекулу, одобренную Управлением США по контролю качества продуктов питания и медикаментов в порядке, установленном Сводом федеральных законов (C.F.R.)).
[0075] Термин «катализ», «катализировать» или «каталитический» относится к увеличению скорости химической реакции вследствие участия вещества, называемого «катализатором». Согласно определенным вариантам осуществления, в процессе реакции количество и природа катализатора остаются по существу неизменными. Согласно определенным вариантам осуществления, после реакции катализатор регенерируется, или природа катализатора по существу восстанавливается. Катализатор может принимать участие во множестве химических преобразований. Эффект катализатора может варьировать в зависимости от присутствия других веществ, известных как ингибиторы или яды (которые снижают каталитическую активность) или промоторы (которые увеличивают активность). Катализируемые реакции характеризуются более низкой энергией активации (ограничивающей скорость свободной энергией активации), чем соответствующая не катализируемая реакции, что приводит к более высокой скорости реакции при той же температуре. Катализаторы могут оказывать положительное воздействие на реакционную среду, связываться с реагентами с поляризацией связей, образовывать специфические промежуточные продукты, которые обычно не образуются в не катализируемой реакции, или вызывать диссоциацию реагентов до реакционно-способных форм.
[0076] Термин «растворитель» относится к веществу, которое растворяет один или несколько растворенных компонентов, что приводит к получению раствора. Растворитель может служить в качестве среды для проведения любой реакции или трансформации, описанной в настоящем документе. Растворитель может растворять один или несколько взаимодействующих веществ или реагентов в реакционной смеси. Растворитель может облегчать смешивание одного или несколько реагентов или взаимодействующих веществ в реакционной смеси. Растворитель также может служить для повышения или снижения скорости реакции относительно реакции в другом растворителе. Растворители могут быть полярными или неполярными, протонными или апротонными. Общеизвестные органические растворители, применимые в способах, описанных в настоящем документе, включают в себя без ограничения ацетон, ацетонитрил, бензол, бензонитрил, 1-бутанол, 2-бутанон, бутилацетат, трет-бутилметиловый эфир, сероуглерод, тетрахлорид углерода, хлорбензол, 1-хлорбутан, хлороформ, циклогексан, циклопентан, 1,2-дихлорбензол, 1,2-дихлорэтан, дихлорметан (DCM), N,N-диметилацетамид, N,N-диметилформамид (DMF), 1,3-диметил-3,4,5,6-тетрагидро-2-пиримидинон (DMPU), 1,4-диоксан, 1,3-диоксан, диэтиловый эфир, 2-этоксиэтиловый эфир, этилацетат, этиловый спирт, этиленгликоль, диметиловый эфир, гептан, н-гексан, гексаны, гексаметилфосфорамид (НМРА), 2-метоксиэтанол, 2-метоксиэтилацетат, метиловый спирт, 2-метилбутан, 4-метил-2-пентанон, 2-метил-1-пропанол, 2-метил-2-пропанол, 1-метил-2-пирролидинон, диметилсульфоксид (DMSO), нитрометан, 1-октанол, пентан, 3-пентанон, 1-пропанол, 2-пропанол, пиридин, тетрахлорэтилен, тетрагидрофуран (THF), 2-метилтетрагидрофуран, толуол, трихлорбензол, 1,1,2-трихлортрифторэтан, 2,2,4-триметилпентан, триметиламин, триэтиламин, N,N-диизопропилэтиламин, диизопропиламин, воду, орто-ксилол и пара-ксилол.
Краткое описание фигур
[0077] Прилагаемые фигуры, которые составляют часть настоящего описания, иллюстрируют несколько вариантов осуществления настоящего изобретения и в совокупности с описанием предназначены для пояснения основных положений настоящего изобретения.
[0078] На Фигуре 1 представлены структуры галихондрина А, В, и С; гомогалихондрина А, В, и С; и норгалихондрина А, В, и С.
[0079] На Фигуре 2А представлен пример Ni/Zr-опосредованной кетолизации. На Фигуре 2В представлен пример Ni-катализированного сочетания кетонов. На Фигуре 2С представлены исследования возможности реализации Ni-опосредованного однореакторного сочетания кетонов в трех разных вариантах.
[0080] На Фигуре 3А представлены предлагаемые каталитические циклы Ni/Zr-опосредованной кетолизации, раскрытой в настоящем изобретении. На Фигуре ЗВ представлено иллюстративное сочетание с общеизвестными радикальными зондами.
[0081] На Фигуре 4 представлено однореакторное сочетание кетонов с нуклеофилами, содержащими α-OR и другие функциональные группы. Реакционные условия: 1-5 (1,0 эквив.), 1-7 (1,2 эквив.), NiBr2⋅(dtbbpy) (5 мол. %).
[0082] На Фигуре 5А представлены примеры реакции Ni/Zr-кетолизации, и на Фигуре 5В представлен дополнительный пример.
[0083] На Фигуре 5С представлены результаты экспериментов по скринингу лигандов никеля. На Фигуре 5D представлены эксперименты сравнения NiBr2, NiCl2 и NiI2. На Фигуре 5Е представлены результаты экспериментов по скринингу растворителей. На Фигуре 5F представлены результаты экспериментов по скринингу сорастворителей. На Фигуре 5G представлены эксперименты по скринингу добавок. На Фигуре 5Н представлен скрининг количества эквивалентов циркония. На Фигуре 5I представлены исследования с различными электрофилами. На Фигуре 5J представлены эксперименты по скринингу восстановителя. На Фигуре 5K представлены концентрационные исследования. На Фигуре 5L представлены эксперименты по определению соотношения субстратов.
[0084] На Фигуре 6 представлены потенциальные пути получения галихондринов и их аналогов.
[0085] На Фигуре 7 представлена раскрытая в настоящем документе Ni/Zr-кетолизация, примененная для синтеза аналога галихондрина. Реагенты и условия: (а) соединение 2-5 (1,0 эквив.), 2-6 (1,3 эквив.), NiBr2⋅(dtbbpy) (30 мол. %), Cp2ZrCl2 (3 эквив.), (t-Bu)2(Me)Py (4 эквив.), Zn (6 эквив.) в 5:1 DMI-EtOAc (С 0,1 М), к.т. (b) HF-Py (20 эквив.), THF, а затем TBAF (4 эквив.), пивалевая кислота (2 эквив.), DMF, к.т. (с) PPTS (5 эквив.), CH2Cl2, ~20°С, 2 ч. Сокращения: TES=Et3Si-; SPy-2: 2-тиопиридин; DMI: 1,3-диметил-2-имидазолидинон; TBAF: фторид тетрабутиламмония; PPTS: иара-толуолсульфонат пиридиния.
[0086] На Фигуре 8А представлены иллюстративные правые и левые половины галихондринов, гомогалихондринов и норгалихондринов. На Фигуре 8В представлен иллюстративный синтез галихондринов. Реагенты и условия: Для всех случаев, стадия 1 представляла собой сочетание кетона в условиях, указанных на Схеме 3; стадия 2 представляла собой TBAF (10 эквив.), пивалевая кислота (5 эквив.), DMF, к.т., 3-8 ч; стадия 3 представляла собой PPTS, CH2Cl2, ~20°С, 2-4 часа. Эпимеризацию С38-эпи-галихондринов проводили с TMSOTf, CH2Cl2, -78°С. Для галихондринов семейств А или С, за этими стадиями следовало: PPTS, 2,2-диметилпропан-1,3-диол, i-PrOH, к.т., в течение ночи; или Pd(PPh3)4, димедон, CH2Cl2, к.т., 4-8 часов, соответственно. Для норгалихондринового ряда, в конце трансформации сложный метиловый эфир в положении С53 гидролизовали путем обработки водн. LiOH, THF, к.т. Число после i и ii указывает выход для сочетаний кетона и общий выход после сочетания кетона, соответственно.
[0087] На Фигуре 9А представлен иллюстративный синтез структурного элемента С27-С37. Реагенты и условия: а. 1. LiBH4, Et2O, 0°С (~100%). 2. TES-Cl, имидазол, CH2Cl2, к.т. (~100%). 3. Окисление по Сверну (см., например, Rodriguez, A.; Nomen, М.; Spur, В.W.; Godfroid, J. J. Tetrahedron Lett. 1999, 40, 5161); b. 1. Cr-катализатор, полученный из соединения (S)-4-E (10 мол.%), (Me)2Phen-(OMe)2⋅NiCl2 (2 мол.%), LiCl (2 эквив.), Mn (избыток), Cp2ZrCh (1,1 эквив.), 2,6-лутидин (1 эквив.), MeCN (С 0,4 М), к.т., 1 часа (93% после 2 стадий; диастереоизомерное соотношение=19:1). 2. MPMO(=NH)CCl2, La(OTf)3, толуол, к.т., 6 часов. 3. р-Т&ОН (кат.), МеОН-CH2Cl2, к.т., 4 часа (88% после 2 стадий), с. 1. K3PO4 (1 эквив.), 18-краун-6 (3 эквив.), толуол (79%). 2. DIBAL, CH2Cl2, -78°С, 1,5 часа (94%). Сокращение: 18-краун-6=1,4,7,10,13,16-гексаоксакциклооктадекан; DIBAL=гидрид диизобутилалюминия; р-TsOH=пара-толуолсульфоновая кислота. На Фигуре 9В представлены иллюстративные сульфонамидные лиганды и комплексы никеля, применимые в реакциях Ni/Cr-сочетания, раскрытых в настоящем документе.
[0088] На Фигуре 10А представлен иллюстративный синтез структурного элемента С20-С37. Реагенты и условия: а. 1. Cr-катализатор, полученный из соединения (R)-4-F (10 мол. %), (Et)2Phen⋅NiCl2 (2 мол. %), LiCl (2 эквив.), Mn (избыток), Cp2ZrCl2 (1 эквив.), MeCN (С 0,3 М), к.т., 3 часа. 2. TBAF (2 эквив.), АсОН (0,6 эквив.), THF, 0°С→к.т. (79% после 2 стадий). 3. TES-H (10 эквив.), TEOTf (5 эквив.), CH2Cl2, 0°С, 3 часа (87%). 4. 2,2-диметоксипропан (3 эквив.), ацетон, 0°С→к.т. b. DIBAL, CH2Cl2, -78°С, 1,5 часа (89% после 2 стадий). Сокращение: МРМ=p-MeOC6H4CH2-; TES=Et3Si-. На Фигуре 10В представлен стереохимический анализ протекания реакции восстановительной циклизации: целевые и нецелевые семейства.
[0089] На Фигуре 11 представлен иллюстративный синтез структурного элемента С1-С37 галихондринов семейства В. Реагенты и условия: а. 1. Cr-катализатор, полученный из соединения (S)-4-G (10 мол. %), (Et)2Phen•NiCl2 (2 мол. %), LiCl (2 эквив.), Mn (избыток), ZrCp2Cl2 (2,5 эквив.), 2,6-ди-трет-бутил-4-метилпиридин (2,5 эквив.), MeCN (С 0.x М), к.т., 2 часа. 2. K2СО3 (10 эквив.), 60°С, 16 ч, затем добавление H2O (1/10 объема МеОН), 60°С, 3 часа. b. 2-метил-6-нитробензойный ангидрид (6 эквив.), 4-диметиламинопиридин (12 эквив.), i-Pr2NEt (6 эквив.), толуол, 70°С (шприцевой насос; 73% после 3 стадий), с. 1. р-TsOH, МеОН, к.т., 1 час. 2. Tf2O (1,2 эквив.), 2,6-лутидин (5 эквив.), CH2Cl2, -78°С, 15 мин, а затем добавление TESOTf (1,5 эквив.), -78°С→0°С, затем добавление NaI (5 эквив.) в DMF, к.т., 2,5 часа (94% после стадий). Сокращение: TES = Et3Si-; p-TsOH = пара-толуолсульфоновая кислота.
[0090] На Фигуре 12 представлена рентгеновская структура С35/С37-диола 4-10-В.
[0091] На Фигуре 13 представлен иллюстративный синтез структурного элемента С1-С37 галихондринов семейства А. Реагенты и условия: а. 1. Ac2O, Ру, к.т. 2. CSA, CH2Cl2-МеОН, к.т. 3. TBSOTf, 2,6-лутидин, CH2Cl2, -78°С, 1 час (92% после 3 стадий). 4. DIBAL, CH2Cl2, -78°С, 1 час (88%). Затем, следовали последовательности синтеза в условиях, указанных на Фигуре 11, за исключением того, что для Ni/Cr-опосредованного сочетания использовали (Ме)6PhenNiCl2 (2 мол. %). Общий выход соединения 4-12-А из бис-TBS-4-8 составил 40,8%, что считается хорошим выходом по сравнению с общим выходом галихондринов семейства В. Сокращение: TBS = tBuMe2Si-; CSA = камфорсульфоновая кислота.
[0092] На Фигуре 14А представлен иллюстративный синтез структурного элемента С1-С37 галихондринов семейства С. Реагенты и условия: а. Следовали последовательности синтеза в условиях, указанных на Фигуре 11. Общий выход соединения 4-12-А из соединения 4-8 составил 54,2%, что считается хорошим выходом по сравнению с общим выходом галихондринов семейства В. На Фигуре 14В представлена рентгеновская структура продукта.
[0093] На Фигуре 15 представлен иллюстративный стереоконтролируемый синтез [6,6]-спирокеталя. Сокращение: МРМ = pMeOC6H4CH2-.
[0094] На Фигуре 16 представлен иллюстративный синтез левой половины аналогов галихондрина. Реагенты и условия: а. 1. TBSOTf (2,5 эквив.), Et3N (5 эквив.), CH2Cl2, 0°С~к.т., 3 часа. 2. водн. NH4Cl, EtOAc, THF, 50°С, 3 часа (100% после 2 стадий). b. 1. DIBAL (1,3 эквив.), CH2Cl2, -78°С, 40 минут. 2. MePPh3Br (4 эквив.), f-BuOK (3 эквив.), THF, 0°С~к.т., 1,5 часа (96% после 2 стадий). 3. 9-BBN (2,5 экв.), THF, к.т., 1,5 часа, затем водн. NaBO3⋅H2O. 4. TEMPO (10 мол. %), PhI(ОАс)2 (3 эквив.), NaHCO3 (10 эквив.), 4°С, 15 часов (97% после 2 стадий), с. 5 (1,4 эквив.), t-BuLi (2,6 эквив.), THF, -78°С, 15 мин (90%). d. 1. OsO4 (10 мол. %), NMMO (2 эквив.), H2O, ацетон, к.т., 21 час. 2. Pb(OAc)4 (1,2 эквив.), K2CO3 (3 эквив.), CH2Cl2, к.т., 1 час (83% после 2 стадий). 3. (МеО)2Р(=O)CH2CO2Bn (4 эквив.), K3PO4 (3 эквив.), к.т., 23 часа. е. LiBr (10 эквив.), DBU (5 эквив.), BnOAc (10 эквив.), MeCN, к.т., 12 ч, 2. DDQ (2 эквив.), CH2Cl2, буфер рН 7, к.т., 40 мин (75% после 3 стадий). 3. TESCl (2 эквив.), имидазол (4 эквив.), CH2Cl2, к.т., 16 часов. 4. Н2 (1 атм), Pd/C, EtOAc, к.т., 45 мин, 5. (PyS)2 (1,4 эквив.), PPh3 (1,2 эквив.), CH2Cl2, к.т., 17 ч (96% после 3 стадий). Сокращение: DIBAL = гидрид диизобутилалюминия; 9-BBN = 9-борабициклононан; TEMPO = 2,2,6,6-тетраметил-1-пиперидинилокси; NMMO или NMO = 4-метилморфолин-N-оксид; DBU = 1,8-диазабицикло[5.4.0]-ундец-7-ен; DDQ = 2,3-дихлор-5,6-дициано-пара-бензохинон.
[0095] На Фигуре 17 представлен иллюстративный синтез структурного элемента левой половины галихондринов. Реагенты и условия: а. соединение 10 (1,8 эквив.), n-BuLi (1,75 эквив.), Li(тиенилCuCN) (2,0 эквив.), BF3⋅Et2O (1,6 эквив.), Et2O, -78°С, 1 час (81%). b. 1. VO(TMHD)2 (5 мол. %), tBuOOH (5,5 М в декане, 2 эквив.), толуол, к.т., 5 часов. 2. TESCl (2,0 эквив.), имидазол (4,0 эквив.), CH2Cl2, 0°С, 2 ч (85% после 2 стадий), с. t-BuLi (2,6 эквив.), THF, -78°С, 0,5 часа (85%). d. 1. (PhO)2P(=O)OH (5 мол. %), толуол (0,05 М), 0°С→к.т., 12 часов. 2. TESCl (3,0 эквив.), имидазол (6,0 эквив.), CH2Cl2, к.т., 2 часа (85% после 2 стадий), е. 1. OsO4 (5% моль), NMMO (2,0 эквив.), ацетон/H2O, к.т., 12 часов. 2. Pb(OAc)4 (1,5 эквив.), K2CO3 (10 эквив.), CH2Cl2, к.т., 10 минут.3. (МеО)2Р(=O)COOBn (4 эквив.), K3PO4 (8 эквив.), толуол, к.т., 15 часов (82% после 3 стадий). 4. (PhO)2P(=O)OH (5 мол. %), THF-H2O (4:1, 0,02 М), к.т., 24 часа. 5. TBSCl (1,5 эквив.), имидазол (3,0 эквив.), CH2Cl2, к.т., 2 часа (80% после 2 стадий). ƒ. BnOAc (1 эквив.) и LiCl (10 эквив.), DBU (20 эквив.), MeCN (0,05 М), 24 ч (86% вместе с 8% соединения 18); или BnOAc (1 эквив.) и LiCl (10 эквив.), DBU (20 эквив.), М (50 мол. %), MeCN (0,05 М), 2 часа; затем BnOAc (1 эквив.) и LiCl (10 эквив.), DBU (20 эквив.), MeCN (0,05 М), 24 часа (93%). g. 1. DDQ (1,6 эквив.), CH2Cl2, фосфатный буфер, 0°С, 0,5 часа. 2. TESCl (3 эквив.), имидазол (6 эквив.), CH2Cl2, к.т., 2 часа (90% после 2 стадий). 3. Pd/C, баллон с Н2, EtOAc, к.т., 1 час. 4. (PyS)2 (1,4 эквив.), PPh3 (1,3 эквив.), толуол, к.т., 3 ч (91% после 2 стадий). Сокращение: TMHD = трис(2,2,6,6-тетраметил-3,5-гептандионат).
[0096] На Фигуре 18 представлен иллюстративный синтез структурного элемента левой половины гомогалихондринового ряда. Реагенты и условия: а. 1. DIBAL (1,3 эквив.), CH2Cl2, -78°С, 15 мин. 2. MePPh3Br (4 эквив.), t-BuOK (3 эквив.), THF, 0°С-к.т., 20 минут. 3. TBSOTf (1,3 эквив.), 2,6-лутидин (2 эквив.), CH2Cl2, 0°С-к.т., 1 час.4. HF⋅Py (~8 эквив.), пиридин, MeCN, -10°С-к.т., 1,5 часа (96% после 4 стадий). b. 1. Tf2O (1,2 эквив.), 2,6-лутидин (4 эквив.), CH2Cl2, -78°С, 10 минут. 2. NaCN (10 эквив.), DMSO, к.т., 1 час.3. TBSCl (3 эквив.), пиридин (8 эквив.), AgNO3 (3 эквив.), DMF, 0°С-к.т., 18 часов (87% после 3 стадий), с. 1. DIBAL (1,1 эквив.), CH2Cl2, гексаны, -78°С, 30 минут.2. (CF3CH2O)2P(O)CH2CO2Me (1,5 эквив.), 18-краун-6 (8 эквив.), KHMDS (1,5 эквив.), THF, -78°С, 30 минут (84% после 2 стадий). 3. DIBAL (4 эквив.), THF, -78°С~0°С, 30 минут (99%). d. 1. (+)-DET (20 мол. %), Ti(OPr-i)4 (15 мол. %), ТВНР (1,5 эквив.), MS  , CH2Cl2, -10°С, 15 часов (86% для целевого изомера, 11% для нецелевого изомера). 2. TBAF (6 эквив.), MS
, CH2Cl2, -10°С, 15 часов (86% для целевого изомера, 11% для нецелевого изомера). 2. TBAF (6 эквив.), MS 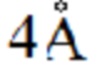 , THF (96%). е. 1. TBSCl (1,5 эквив.), Et3N (4 эквив.), CH2Cl2, к.т., 5 часов (99%). 2. TESCl (1,2 эквив.), имидазол (3 эквив.), CH2Cl2, 0°С-к.т., 15 минут. 3. 9-BBN (3 эквив.), THF, 0°С-к.т., 1 час, затем водн. NaBO3⋅H2O (94% после 2 стадий). 4. TEMPO (20 мол. %), PhI(ОАс)2 (3 эквив.), CH2Cl2, к.т., 36 часов (95%). f. 1. 5 (1,3 эквив.), t-BuLi (2,5 эквив.), THF, -78°С, 30 минут. 2. OsO4 (10 мол. %), NMMO (2 эквив.), H2O, ацетон, к.т., 4 часа. 3. Pb(OAc)4 (1,5 эквив.), K2CO3 (10 эквив.), CH2Cl2, к.т., 15 минут (68% после 3 стадий). 4. (МеО)2Р(=O)CH2CO2Bn (5 эквив.), NaH (4 эквив.), THF, 0°С, 3 часа (88%). g. 1. LiBr (10 эквив.), DBU (20 эквив.), MeCN, к.т., 11 часов (70%). h. DDQ (3 эквив.), CH2Cl2, t-BuOH, буфер рН 7, к.т., 15 минут (86%). 2. TESCl (1,5 эквив.), имидазол (3 эквив.), CH2Cl2, к.т., 4 ч (97%). 3. Н2 (1 атм), Pd/C, AcOEt, к.т., 2 часа (89%). 4. (PyS)2 (1,2 эквив.), PPh3 (3 эквив.), толуол, к.т., 12 часов (97%). Сокращение: 18-краун-6 = 1,4,7,10,13,16-гексаоксакциклооктадекан; KHMDS = бис(триметилсилил)амид калия; 9-BBN = 9-борабициклононан; DET = диэтилтартрат; ТВНР = трет-бутиловый гидропероксид; MS = молекулярные сита; TBAF = фторид тетрабутиламмония.
, THF (96%). е. 1. TBSCl (1,5 эквив.), Et3N (4 эквив.), CH2Cl2, к.т., 5 часов (99%). 2. TESCl (1,2 эквив.), имидазол (3 эквив.), CH2Cl2, 0°С-к.т., 15 минут. 3. 9-BBN (3 эквив.), THF, 0°С-к.т., 1 час, затем водн. NaBO3⋅H2O (94% после 2 стадий). 4. TEMPO (20 мол. %), PhI(ОАс)2 (3 эквив.), CH2Cl2, к.т., 36 часов (95%). f. 1. 5 (1,3 эквив.), t-BuLi (2,5 эквив.), THF, -78°С, 30 минут. 2. OsO4 (10 мол. %), NMMO (2 эквив.), H2O, ацетон, к.т., 4 часа. 3. Pb(OAc)4 (1,5 эквив.), K2CO3 (10 эквив.), CH2Cl2, к.т., 15 минут (68% после 3 стадий). 4. (МеО)2Р(=O)CH2CO2Bn (5 эквив.), NaH (4 эквив.), THF, 0°С, 3 часа (88%). g. 1. LiBr (10 эквив.), DBU (20 эквив.), MeCN, к.т., 11 часов (70%). h. DDQ (3 эквив.), CH2Cl2, t-BuOH, буфер рН 7, к.т., 15 минут (86%). 2. TESCl (1,5 эквив.), имидазол (3 эквив.), CH2Cl2, к.т., 4 ч (97%). 3. Н2 (1 атм), Pd/C, AcOEt, к.т., 2 часа (89%). 4. (PyS)2 (1,2 эквив.), PPh3 (3 эквив.), толуол, к.т., 12 часов (97%). Сокращение: 18-краун-6 = 1,4,7,10,13,16-гексаоксакциклооктадекан; KHMDS = бис(триметилсилил)амид калия; 9-BBN = 9-борабициклононан; DET = диэтилтартрат; ТВНР = трет-бутиловый гидропероксид; MS = молекулярные сита; TBAF = фторид тетрабутиламмония.
[0097] На Фигуре 19 представлен иллюстративный синтез структурного элемента С38-С53 левой половины норгалихондринового ряда. Реагенты и условия: а. 1. Tf2O (1,2 эквив.), 2,6-лутидин (4 эквив.), CH2Cl2, -78°С, 10 минут. 2. NaCN (10 эквив.), DMSO, к.т., 1 часа (87% после 2 стадий). 3. DIBAL (4,5 эквив.), CH2Cl2, -78°С, 30 минут. 4. NaBH4 (5 эквив.), МеОН, к.т., 30 минут. 5. TBSOTf (3 эквив.), 2,6-лутидин (3,5 эквив.), CH2Cl2, к.т., 30 минут (90% после 3 стадий). 6. 9-BBN (2 эквив.), THF, к.т., 2 часа, затем NaOH, H2O2, H2O, к.т., 3 ч (91%). 7. TEMPO (0,5 эквив.), PhI(ОАс)2 (5,0 эквив.), CH3CN, H2O, THF, к.т., 12 часов (90%). 8. p-TsOH•H2O (1,0 эквив.), H2O (10 эквив.), CH2Cl2, к.т., 24 часа. 9. TESOTf (10 эквив.), 2,6-лутидин (12 эквив.), CH2Cl2, к.т., 1 час (76% после 2 стадий). b. 1. соединение 5, t-BuLi (2,2 эквив.), толуол, Et2O, -78°С, 10 минут (82%). 2. OsO4 (5 мол. %), NMMO (2 эквив.), H2O, ацетон, к.т., 12 часов. 3. Pb(OAc)4 (2 эквив.), K2CO3 (10 эквив.), к.т., 30 минут (86% после 2 стадий). 4. (МеО)2Р(=O)CH2CO2Bn (4 эквив.), K3PO4 (3 эквив.), к.т., 36 часов (93%). с. LiBr (10 эквив.), DBU (5 эквив.), BnOAc (2 эквив.), CH3CN, к.т., 12 часов (82%). d. 1. TBAF (1,5 эквив.), HOAc (1,0 эквив.), THF, 0°C, 5 часов (81%). 2. Перйодинан Десс-Мартина (2,0 эквив.), NaHCO3 (10 эквив.), CH2Cl2, к.т., 30 мин. 3. NaClO2 (3 эквив.), NaH2PO4 (4 эквив.), 2-метил-2-бутен, t-BuOH, H2O, к.т., 30 минут. 4. TMSCH2N2 (3,0 эквив.), бензол, МеОН, к.т., 5 минут (87% после 3 стадий), е. 1. DDQ (2,0 эквив.), CH2Cl2, водный буфер рН 7, к.т., 1 час. 2. TESOTf (2,0 эквив.), 2,6-лутидин (2,5 эквив.), CH2Cl2, к.т., 30 минут (83% после 2 стадий). f. 1. Pd/C (10 масс. %), Н2, EtOAc, к.т., 3 часа. 2. (SPy)2 (1,4 эквив.), PPh3 (1,2 эквив.), толуол, к.т., 12 часов (88% после 2 стадий). Сокращение: p-TsOH = пара-толуолсульфоновая кислота.
[0098] На Фигуре 20 представлена рентгеновская структура галихондрина С, полученного с использованием способов, раскрытых в настоящем документе. Бесцветный монокристалл галихондрина С получали путем перекристаллизации из MeOH:CH2Cl2=1:1.
[0099] На Фигуре 21 представлена иллюстративная схема синтеза для получения иллюстративного фрагмента С33-С43 галихондринов и их аналогов.
[00100] На Фигуре 22 представлена иллюстративная схема синтеза для получения иллюстративного фрагмента С27-С37 галихондринов и их аналогов.
[00101] На Фигуре 23 представлена иллюстративная схема синтеза для получения иллюстративного фрагмента С39-С43 галихондринов и их аналогов.
Подробное раскрытие определенных вариантов осуществления
[00102] В настоящем документе раскрыты Ni/Zr-опосредованные реакции сочетания, применимые для получения кетон-содержащих соединений. Раскрытые в настоящем документе Ni/Zr-опосредованные реакции кетолизации особенно применимы для синтеза галихондринов и их аналогов. Поэтому, в настоящем документе также раскрыты способы получения галихондринов (например, галихондрина А, В, С; гомогалихондрина А, В, С; норгалихондрина А, В, С) и их аналогов.
[00103] Согласно определенным вариантам осуществления в настоящем документе раскрыты способы, применимые для получения соединений формулы (Н3-А), включая соединение (1):
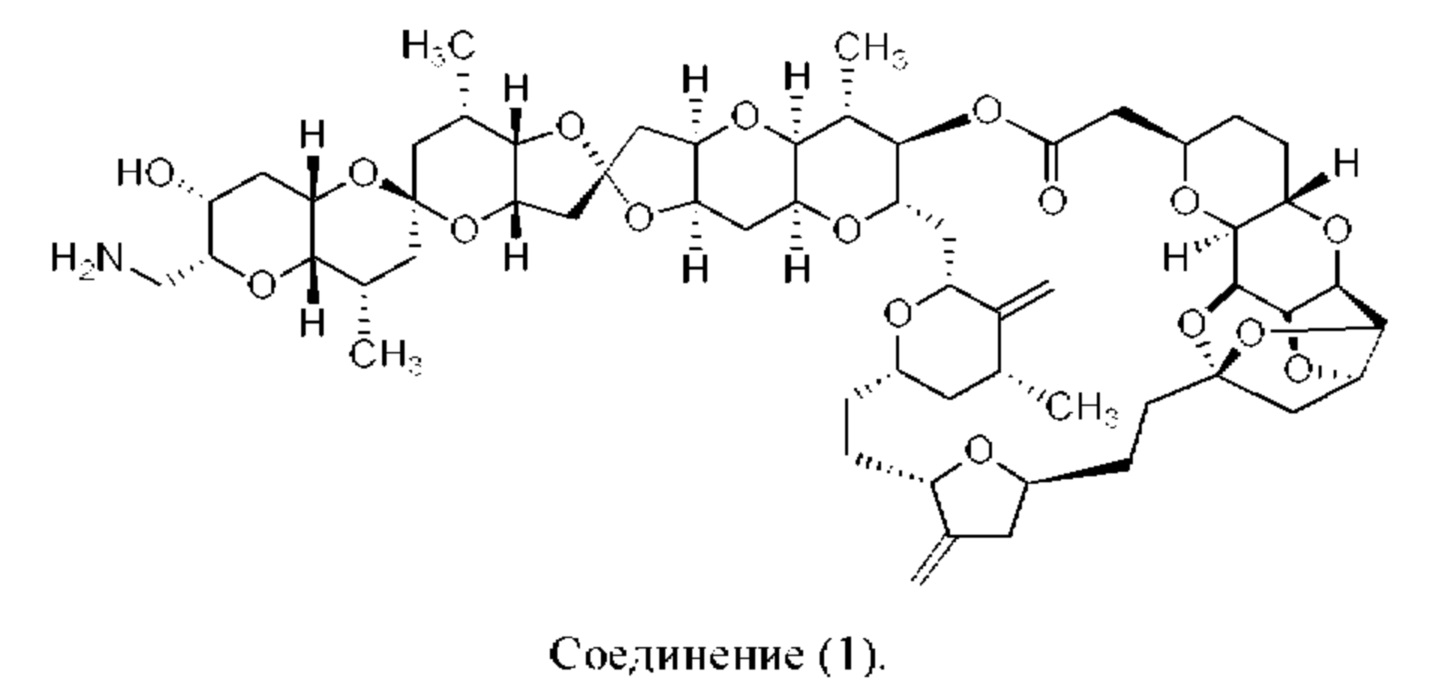
[00104] Настоящее изобретение также относится к соединениям (т.е., промежуточным соединениям), применимым в способах, раскрытых в настоящем документе. Согласно определенным вариантам осуществления соединения, раскрытые в настоящем документе, применимы в качестве синтетических промежуточных соединений на пути получения галихондринов и их аналогов. Кроме того, настоящее изобретение относится к реагентам и катализаторам, применимым в способах, раскрытых в настоящем документе.
Ni/Zr-опосредованные реакции кетолизации
[00105] Согласно одному аспекту в настоящем изобретении раскрыты никель/цирконий-опосредованные реакции кетолизации («Ni/Zr-опосредованные реакции кетолизации»), включающие в себя сочетание тиоэфира и алкилгалогенида (например, алкилйодида, алкилбромида, алкилхлорида, и т.п.) или алкильной уходящей группы (например, алкилсульфоната) (Схема 1А). Реакции кетолизации могут быть межмолекулярными или внутримолекулярными (т.е., на Схеме 1А, RA и RB необязательно объединенные линкером). Согласно определенным вариантам осуществления соединение формулы (А) представляет собой первичный или вторичный алкилгалогенид (X1=галоген), и соединение формулы (В) представляет собой алкилтиоэфир (RB=необязательно замещенный алкил), как представлено на Схеме 1 В.
Схема 1А
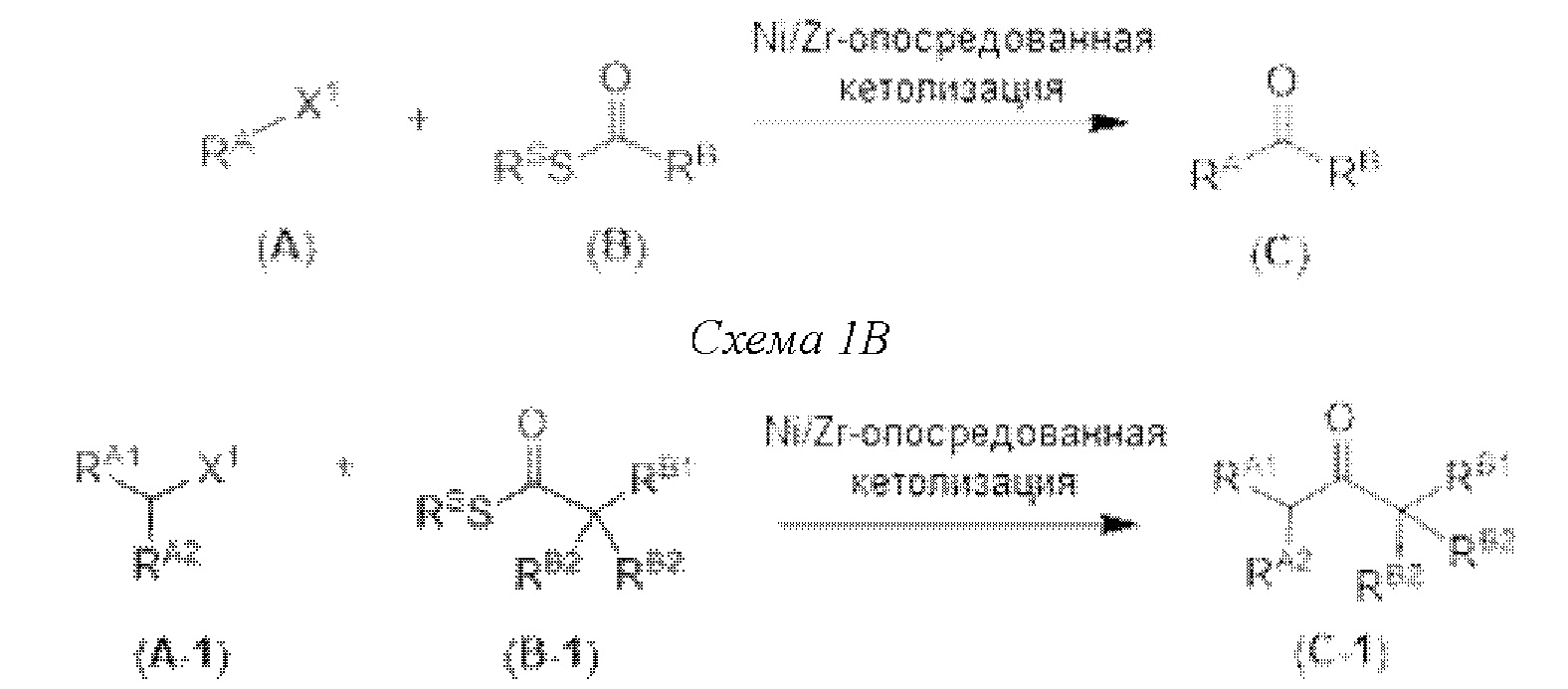
[00106] Как представлено на Схеме 1А, в настоящем документе раскрыты способы получения соединения формулы (С):
или его соли, причем способы включают в себя осуществление взаимодействия соединения формулы (А):
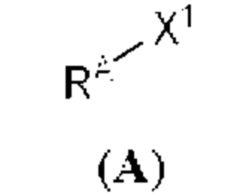
или его соли с соединением формулы (В):
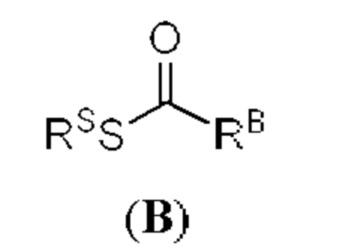
или его солью, в присутствии никеля и циркония; где:
RA представляет собой необязательно замещенный алкил;
RB представляет собой необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный арил, необязательно замещенный карбоциклил, необязательно замещенный гетероарил или необязательно замещенный гетероциклил;
где RA и RB необязательно объединены вместе посредством линкера, где линкер выбран из группы, состоящей из необязательно замещенного алкилена, необязательно замещенного гетер оал киле на, необязательно замещенного алкенилена, необязательно замещенного гетероалкенилена, необязательно замещенного алкинилена, необязательно замещенного гетероалкинилена, необязательно замещенного арилена, необязательно замещенного гетероарилена, необязательно замещенного карбоциклилена, необязательно замещенного гетероциклилена, необязательно замещенного ацилена и их комбинаций;
X1 представляет собой галоген или уходящую группу; и
RS представляет собой необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил или необязательно замещенный гетероарил.
[00107] Согласно определенным вариантам осуществления RA представляет собой малую молекулу. Согласно определенным вариантам осуществления RB представляет собой малую молекулу. Малые молекулы охватывают малые молекулы сложного строения, такие как продукты природного происхождения, фармацевтические средства и их фрагменты, и промежуточные к ним соединения.
[00108] В соответствии с общим определением в настоящем документе «линкер» представляет собой группу, содержащую необязательно замещенный алкилен, необязательно замещенный гетероалкилен, необязательно замещенный алкенилен, необязательно замещенный гетероалкенилен, необязательно замещенный алкинилен, необязательно замещенный гетероалкинилен, необязательно замещенный арилен, необязательно замещенный гетероарилен, необязательно замещенный карбоциклилен, необязательно замещенный гетероциклилен, необязательно замещенный ацилен, или любую их комбинацию.
[00109] Согласно определенным вариантам осуществления соединение формулы (А) представляет собой соединение формулы (А-1):
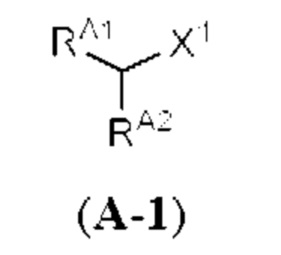
или его соль; соединение формулы (В) представляет собой соединение формулы (В-1):
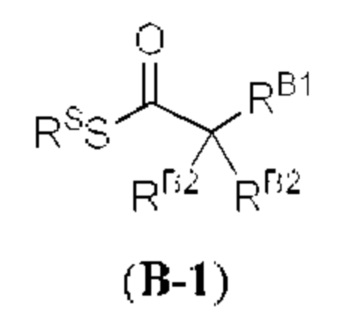
или его соль; и соединение формулы (С) представляет собой соединение формулы (С-1):
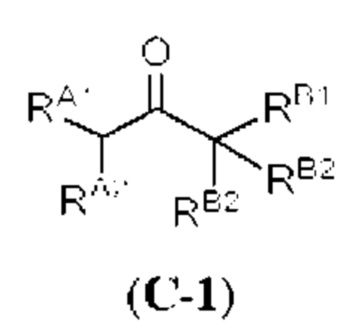
или его соль, где:
X1 представляет собой галоген или уходящую группу;
RS представляет собой необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил или необязательно замещенный гетероарил;
в каждом случае RA1, RA2, RB1 и RB2 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный арил, необязательно замещенный карбоциклил, необязательно замещенный гетероарил или необязательно замещенный гетероциклил; где RA1 и RB1 необязательно объединены вместе посредством линкера.
[00110] Согласно определенным вариантам осуществления RA1 представляет собой малую молекулу. Согласно определенным вариантам осуществления RB1 и RB2 независимо представляют собой малые молекулы. Малые молекулы охватывают малые молекулы сложного строения, такие как продукты природного происхождения, фармацевтические средства и их фрагменты, и промежуточные к ним соединения.
[00111] Ni/Zr-опосредованные реакции кетолизации, раскрытые в настоящем документе, могут проводиться во внутримолекулярной форме с получением циклических кетонов, как представлено на Схеме 1С.
Схема 1С

[00112] Как представлено на Схеме 1С, в настоящем документе раскрыты способы получения соединения формулы (С-2):
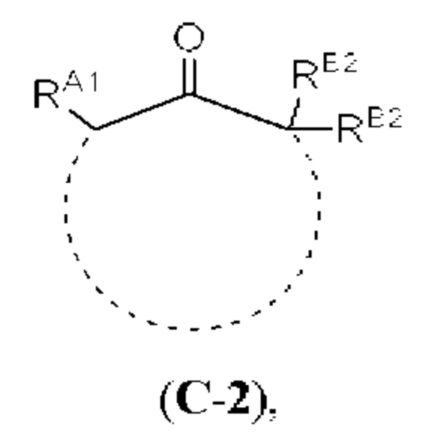
или его соли, включающие в себя осуществление взаимодействия соединения формулы (А-В):
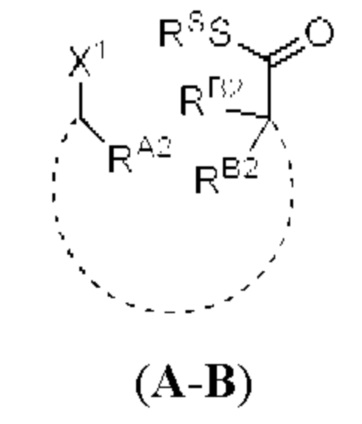
или его соли, в присутствии никеля и циркония; где:
RA2 и RB2 представляют собой необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный арил, необязательно замещенный карбоциклил, необязательно замещенный гетероарил или необязательно замещенный гетероциклил;
X1 представляет собой галоген или уходящую группу;
RS представляет собой необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил или необязательно замещенный гетероарил; и
 представляет собой линкер.
представляет собой линкер.
[00113] Ni/Zr-опосредованные реакции кетолизации, раскрытые в настоящем документе, проводят в присутствии никеля. Согласно определенным вариантам осуществления реакцию кетолизации проводят в присутствии комплекса никеля. В реакции может быть использован любой комплекс никеля (например, соль никеля, комплекс никеля, никелевый катализатор или никелевый предкатализатор), известный или доступный из уровня техники. Согласно определенным вариантам осуществления реакцию кетолизации проводят в присутствии никеля (II). Согласно определенному варианту осуществления реакцию кетолизации проводят в присутствии никеля (0). Согласно определенным вариантам осуществления комплекс никеля характеризуется формулой: NiX2•(лиганд), где X представляет собой галоген (например, Cl, Br, I или F). Согласно определенным вариантам осуществления «лиганд» представляет собой бидентатный лиганд. Согласно определенным вариантам осуществления лиганд представляет собой необязательно замещенный биспиридильный лиганд. Согласно определенным вариантам осуществления комплекс никеля представляет собой NiX2•(tbbpy), где X представляет собой галоген (например, Cl, Br, I или F), и «tbbpy» представляет собой 4,4'-бис(трет-бутил)-2,2'-бипиридин, характеризующийся структурой:  Согласно определенным вариантам осуществления комплекс никеля представляет собой NiCl2•(tbbpy). Согласно определенным вариантам осуществления комплекс никеля представляет собой NiBr2•(tbbpy).
Согласно определенным вариантам осуществления комплекс никеля представляет собой NiCl2•(tbbpy). Согласно определенным вариантам осуществления комплекс никеля представляет собой NiBr2•(tbbpy).
[00114] Согласно определенным вариантам осуществления комплекс никеля используют после формирования комплекса источником никеля и «лигандом» в растворе. Согласно определенным вариантам осуществления комплекс никеля характеризуется формулой: NiX2•(лиганд); где X представляет собой галоген, и «лиганд» представляет собой бидентатный лиганд. Согласно определенным вариантам осуществления источник никеля представляет собой NiCl2; «лиганд» представляет собой 4,4'-ди-трет-бутил-2,2'-дипиридил (tbbpy); и полученный комплекс никеля представляет собой соединение формулы NiCl2•(tbbpy). Согласно определенным вариантам осуществления источник никеля представляет собой NiBr2; «лиганд» представляет собой 4,4'-ди-трет-бутил-2,2'-дипиридил (tbbpy); и полученный комплекс представляет собой соединение формулы NiBr2•(tbbpy).
[00115] Согласно определенным вариантам осуществления никель содержится в каталитическом количестве. Согласно определенным вариантам осуществления в реакционной смеси никель содержится в количестве приблизительно 1-5 мол. %, 5-10 мол. %, 1-10 мол. %, 5-20 мол. %, 10-20 мол. %, 20-30 мол. %, 20-40 мол. %, 30-40 мол. %, 40-50 мол. %, 50-60 мол. %, 60-70 мол. %, 70-80 мол. % или 80-90 мол. % относительно соединения формулы (А) или (В). Согласно определенным вариантам осуществления никель содержится в количестве 1-50 мол. %. Согласно определенным вариантам осуществления никель содержится в количестве 1-10 мол. %. Согласно определенным вариантам осуществления никель содержится в количестве приблизительно 5 мол. %. Согласно определенным вариантам осуществления никель содержится в количестве приблизительно 30 мол. %. Согласно определенным вариантам осуществления в реакционной смеси никель содержится в стехиометрическом или избыточном количестве относительно соединения формулы (А) или (В). Согласно определенным вариантам осуществления никель содержится в количестве приблизительно 1 эквивалента (т.е., стехиометрическом). Согласно другим вариантам осуществления никель содержится в количестве более 1 эквивалента (т.е., избыточном).
[00116] Как описано выше, Ni/Zr-опосредованные реакции кетолизации проводят в присутствии циркония. Согласно определенным вариантам осуществления реакцию проводят в присутствии комплекса циркония. В реакции может быть использован любой источник циркония (например, соль циркония, комплекс циркония, циркониевый катализатор или циркониевый предкатализатор), известный или доступный из уровня техники. Согласно определенным вариантам осуществления источник циркония представляет собой соединение формулы (лиганд)nZrX2; где n равен числу лигандов (например, 0, 1, 2, 3, 4), и X представляет собой галоген (например, Cl, Br, I или F). Согласно определенным вариантам осуществления п равен 2, и лиганд представляет собой циклопентадиенил. Согласно определенным вариантам осуществления источник циркония представляет собой Cp2ZrX2. Согласно определенным вариантам осуществления источник циркония представляет собой Cp2ZrCl2.
[00117] Согласно определенным вариантам осуществления цирконий содержится в каталитическом количестве. Согласно определенным вариантам осуществления, в реакционной смеси цирконий содержится в количестве 1-5 мол. %, 5-10 мол. %, 1-10 мол. %, 5-20 мол. %, 10-20 мол. %, 20-30 мол. %, 30-40 мол. %, 40-50 мол. %, 50-60 мол. %, 60-70 мол. %, 70-80 мол. %, или 80-90 мол. % относительно соединения формулы (А) или (В). Согласно определенным вариантам осуществления, в реакционной смеси цирконий содержится в стехиометрическом или избыточном количестве относительно соединения формулы (А) или (В). Согласно определенным вариантам осуществления цирконий содержится в количестве приблизительно 1 эквивалента (т.е., стехиометрическом). Согласно другим вариантам осуществления цирконий содержится в количестве более 1 эквивалента (т.е., избыточном). Согласно определенным вариантам осуществления цирконий содержится в количестве приблизительно 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 2,5, 3, 3,5, 4, 4,5, 5, 6, 7, 8, 9 или 10 эквивалентов. Согласно определенным вариантам осуществления цирконий содержится в количестве приблизительно 3 эквивалентов.
[00118] Согласно определенным вариантам осуществления Ni/Zr-опосредованную реакцию кетолизации, раскрытую в настоящем документе, проводят в присутствии одного или нескольких дополнительных реагентов или катализаторов, таких как металл-восстановитель. Согласно определенным вариантам осуществления металл-восстановитель представляет собой цинк. Согласно определенным вариантам осуществления металл-восстановитель представляет собой магний. Согласно определенным вариантам осуществления используют металлический цинк (т.е., цинк (0)). Согласно определенным вариантам осуществления используют металлический магний (т.е., магний (0)). Согласно определенным вариантам осуществления реакцию проводят в присутствии цинкового порошка, цинковой фольги, цинковых гранул или любой другой формы металлического цинка. Согласно определенным вариантам осуществления используют соль цинка, такую как ацетат цинка, сульфат цинка, хлорид цинка, бромид цинка, йодид цинка, фторид цинка, сульфид цинка или фосфат цинка. Цинк может содержаться в каталитическом, стехиометрическом или избыточном количестве. Согласно определенным вариантам осуществления цинк содержится в избытке (т.е., более 1 эквивалента) относительно соединения формулы (А) или формулы (В). Согласно определенным вариантам осуществления используют от 1 до 10 эквивалентов цинка. Согласно определенным вариантам осуществления цинк содержится в количестве приблизительно 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 5,5, 6, 7, 8, 9 или 10 эквивалентов. Согласно определенным вариантам осуществления используют приблизительно 6 эквивалентов цинка.
[00119] Согласно определенным вариантам осуществления реакцию кетолизации проводят в присутствии одного или нескольких реагентов, которые помогают активировать металлический цинк в реакции (например, путем очистки поверхности оксида цинка). Согласно определенным вариантам осуществления реакцию проводят в присутствии триалкилсилилгалогенида (например, триэтилсилилхлорида (TESCl)). Этот реагент может содержаться в каталитическом, стехиометрическом или избыточном количестве. Согласно определенным вариантам осуществления этот реагент содержится в количестве приблизительно 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 5,5, 6, 7, 8, 9 или 10 эквивалентов. Согласно определенным вариантам осуществления этот реагент содержится в количестве приблизительно 1,5 эквивалента.
[00120] Согласно определенным вариантам осуществления Ni/Zr-опосредованную кетолизацию проводят в присутствии одного или нескольких дополнительных реагентов (т.е., в дополнение к никелю, цирконию или цинку).
[00121] Согласно определенным вариантам осуществления Ni/Zr-опосредованную реакцию кетолизации проводят в присутствии основания или акцептора протонов. Согласно определенным вариантам осуществления основание представляет собой пиридиновое основание. Согласно определенным вариантам осуществления основание представляет собой 2,6-ди-трет-бутилпиридин. Согласно определенным вариантам осуществления основание представляет собой 2,6-лутидин. Согласно определенным вариантам осуществления основание представляет собой 2,6-ди-трет-бутил-4-метилпиридин. Согласно определенным вариантам осуществления основание используют в стехиометрическом или избыточном количестве. Согласно определенным вариантам осуществления основание или акцептор протонов содержится в количестве приблизительно 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 5,5, 6, 7, 8, 9 или 10 эквивалентов. Согласно определенным вариантам осуществления используют приблизительно 4 эквивалента основания или акцептора протонов.
[00122] Согласно определенным вариантам осуществления Ni/Zr-опосредованную кетолизацию, описанную в настоящем документе, проводят в растворителе. Может быть использован любой растворитель, и объем способа по настоящему изобретению не ограничен каким либо конкретным растворителем или смесью растворителей. Растворитель может быть полярным или неполярным, протонным или апротонным, или представлять собой комбинацию растворителей (например, сорастворителей). В настоящем документе раскрыты примеры применимых органических растворителей. Согласно определенным вариантам осуществления реакцию кетолизации проводят в 1,3-диметил-2-имидазолидиноне (DMI). Согласно определенным вариантам осуществления реакцию кетолизации проводят в смеси 1,3-диметил-2-имидазолидинон (DMI)/тетрагидрофуран (THF). Согласно определенным вариантам осуществления реакцию кетолизации проводят в смеси 1,3-диметил-2-имидазолидинон (DMI)/этилацетат (EtOAc).
[00123] Ni/Zr-опосредованные реакции кетолизации, описанные в настоящем документе, могут проводиться при любой концентрации в растворителе. Концентрация относится к молярной концентрации (моль/л) партнеров сочетания (например, соединений формулы (А) или (В)) в растворителе. Согласно определенным вариантам осуществления концентрация составляет приблизительно 0,1 М. Согласно определенным вариантам осуществления концентрация составляет приблизительно 0,5 М. Согласно определенным вариантам осуществления концентрация составляет приблизительно 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8 или 0,9 М. Согласно определенным вариантам осуществления концентрация выше 1 М. Согласно определенным вариантам осуществления концентрация ниже 0,1 М.
[00124] Ni/Zr-опосредованные реакции кетолизации, описанные в настоящем документе, могут проводиться при любой температуре. Согласно определенным вариантам осуществления реакцию проводят при температуре около комнатной температуры (т.е., от 18 до 24°С). Согласно определенным вариантам осуществления реакцию проводят при температуре ниже комнатной температуры (например, от 0°С до комнатной температуры). Согласно определенным вариантам осуществления реакцию проводят при температуре выше комнатной температуры (например, от комнатной температуры до 100°С). Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от комнатной температуры приблизительно до 100°С. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от комнатной температуры приблизительно до 50°С.
[00125] Согласно определенным вариантам осуществления Ni/Zr-опосредованную реакцию кетолизации проводят в присутствии комплекса никеля, комплекса циркония и металла-восстановителя. Согласно определенным вариантам осуществления комплекс никеля представляет собой NiBr2(dtbbpy). Согласно определенным вариантам осуществления комплекс циркония представляет собой Cp2ZrCl2. Согласно определенным вариантам осуществления металл-восстановитель представляет собой цинк. Согласно определенным вариантам осуществления реакцию проводят в присутствии NiBr2(dtbbpy), Cp2ZrCl2 и металлического цинка. Согласно определенным вариантам осуществления реакцию проводят в полярном растворителе, таком как DMI (1,3-диметил-2-имидазолидинон). Согласно определенным вариантам осуществления реакцию проводят при температуре около комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от комнатной температуры приблизительно до 100°С. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от комнатной температуры приблизительно до 50°С. Например, согласно определенным вариантам осуществления сочетание проводят в следующих условиях: 5 мол. % NiBr2(dtbbpy), 1,0 эквивалент Cp2ZrCl2, избыток металлического цинка в DMI при комнатной температуре.
[00126] Согласно определенным вариантам осуществления реакцию проводят в присутствии NiBr2(dtbbpy), Cp2ZrCl2, металлического цинка и основания или акцептора протонов. Согласно определенным вариантам осуществления реакцию проводят в присутствии NiBr2(dtbbpy), Cp2ZrCl2, металлического цинка и (t-Bu)2(Ме)Ру. Согласно определенным вариантам осуществления реакцию проводят в смеси DMI и EtOAc (этилацетата). Согласно определенным вариантам осуществления реакцию проводят при температуре около комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от комнатной температуры приблизительно до 100°С. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от комнатной температуры приблизительно до 50°С. Например, согласно определенным вариантам осуществления сочетание проводят в следующих условиях: 30 мол. % NiBr2(dtbbpy), 3,0 эквивалента Cp2ZrCl2, 6,0 эквивалентов металлического цинка и 4,0 эквивалента (t-Bu)2(Ме)Ру в DMI-EtOAc при комнатной температуре.
Синтез галихондринов и аналогов
[00127] Ni/Zr-опосредованные реакции кетолизации, раскрытые в настоящем документе, могут применяться для синтеза галихондринов (например, галихондрина А, В, С; гомогалихондрина А, В, С, норгалихондрина А, В, С) и их аналогов. Согласно определенным вариантам осуществления способы применимы для синтеза соединений формулы (Н3-А), таких как соединение (1). Согласно определенным вариантам осуществления указанные способы включают в себя стадии: (1) сочетания структурного элемента «левой половины» со структурным элементом «правой половины» посредством Ni/Zr-опосредованной реакции кетолизации, раскрытой в настоящем документе; последующей (2) циклизации полученного продукта сочетания (например, опосредованной кислотой циклизации); а затем необязательно любых синтетических трансформаций, необходимых для получения целевого продукта.
Синтез галихондринов
[00128] Ni/Zr-опосредованные реакции кетолизации, раскрытые в настоящем документе, могут применяться для получения галихондринов (например, галихондрина А, В, С) и их аналогов. Например, как представлено на Схеме 2А, путем сочетания «левой половины» формулы (L-2-14) с «правой половиной» формулы (R-2-I) посредством Ni/Zr-опосредованной кетолизации получают кетон формулы (H-2-II), путем циклизации которого получают соединение формулы (H-2-I), которое представляет собой галихондрин или его аналог, или промежуточное к нему соединение.
Схема 2А
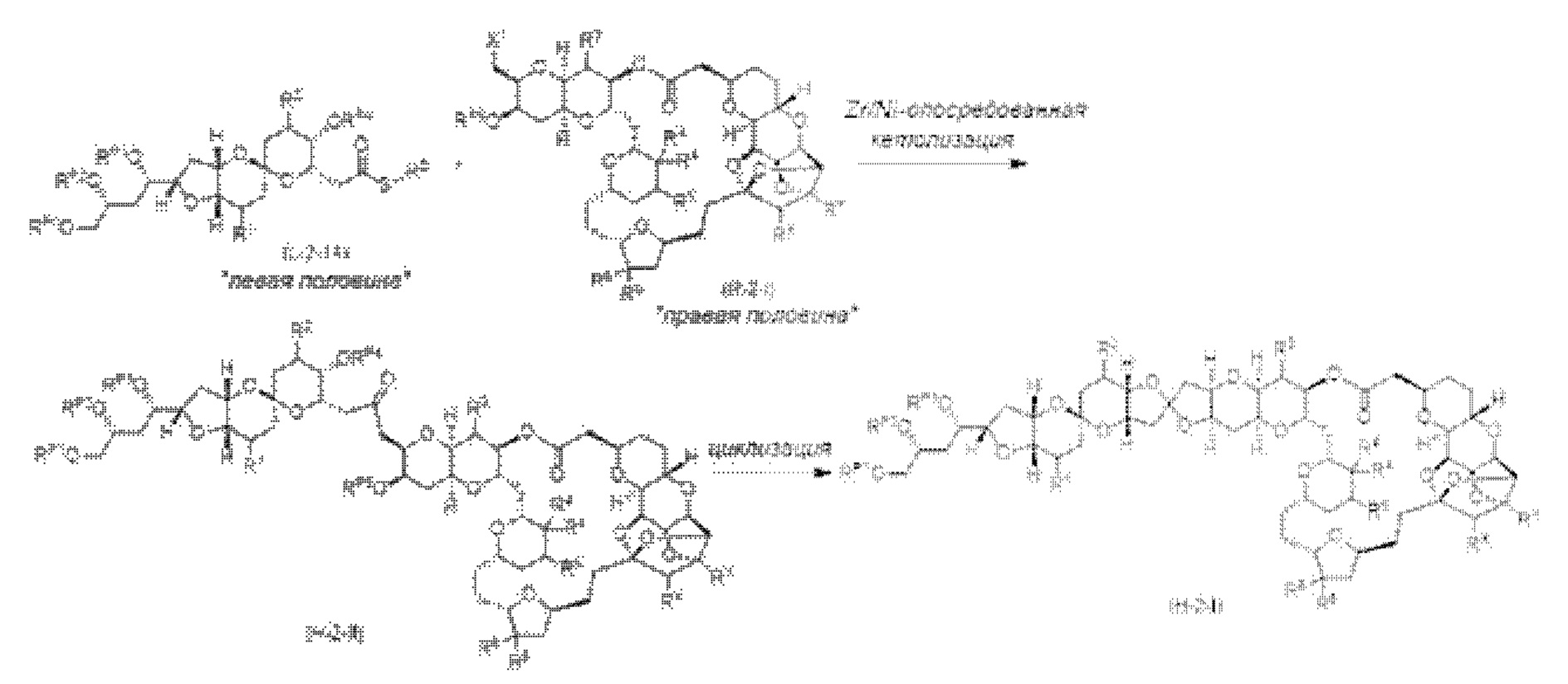
[00129] В настоящем документе раскрыт способ получения соединения формулы (H-2-I):
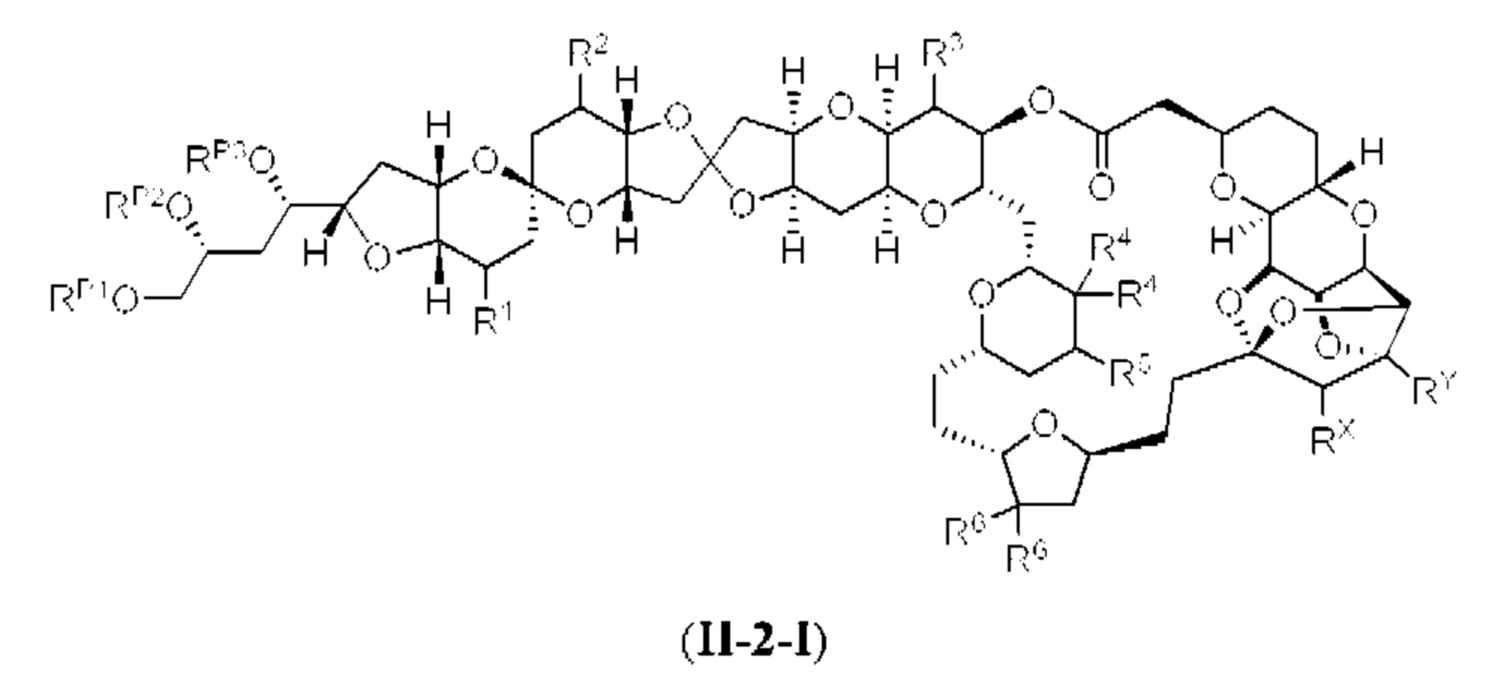
или его соли, причем способ включает в себя циклизацию соединения формулы (Н-2-II):
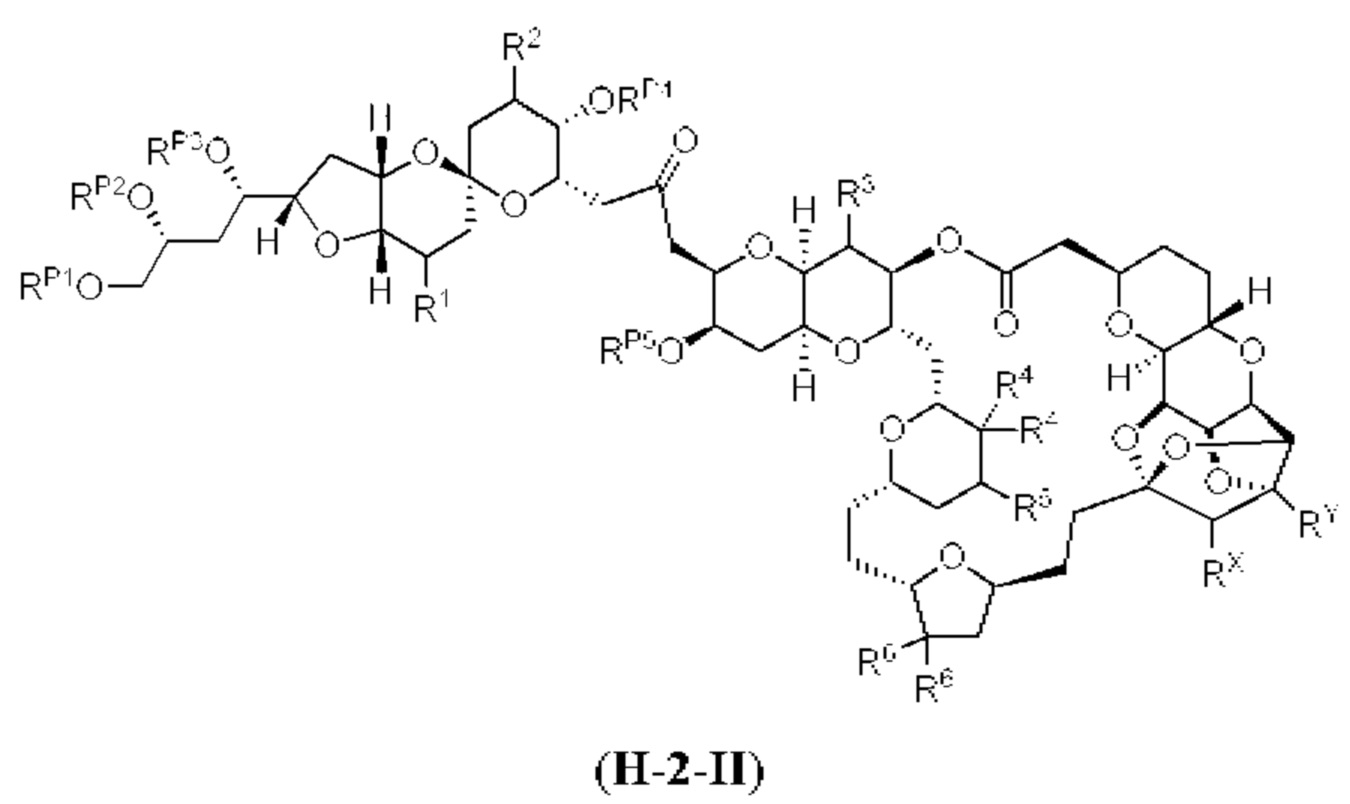
или его соли, где:
каждый из R1, R2, R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R4 образуют вместе: 
в каждом случае R6 независимо представляет собой водород, галоген, необязательно замещенный алкил, или две группы R6 образуют вместе: 
каждый из RP1, RP2, RP3, RP4 и RP5 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
RX представляет собой водород или -ORXa, где RXa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RY представляет собой водород или -ORYa, где RYa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
где RXa и RYa необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00130] Согласно определенным вариантам осуществления стадию циклизации соединения формулы (H-2-II) или его соли проводят в присутствии кислоты. Кислота может представлять собой кислоту Льюиса или кислоту Брэнстеда. Согласно определенным вариантам осуществления кислота представляет собой кислоту Брэнстеда. Согласно определенным вариантам осуществления кислота представляет собой сульфоновую кислоту. Согласно определенным вариантам осуществления кислота представляет собой соль сульфоновой кислоты. Согласно определенным вариантам осуществления кислота представляет собой соль пиридиния. Согласно определенным вариантам осуществления кислота представляет собой пара-толуолсульфонат пиридиния (PPTS). Согласно определенным вариантам осуществления кислота содержится в каталитическом количестве. Согласно определенным вариантам осуществления кислота содержится в стехиометрическом (например, приблизительно 1 эквивалент) или избыточном количестве (например, более 1 эквивалента). Согласно определенным вариантам осуществления кислота содержится в избыточном количестве (например, приблизительно 5 эквивалентов).
[00131] Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии PPTS. Согласно определенным вариантам осуществления указанную стадию проводят в растворителе, таком как CH2Cl2. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при температуре около комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят приблизительно при 20°С. Например, согласно определенным вариантам осуществления стадию циклизации проводят в следующих условиях: 5 эквивалентов PPTS в CH2Cl2 приблизительно при 20°С (например, в течение 2 часов).
[00132] Согласно определенным вариантам осуществления, RP1, RP2 и RP3 представляют собой силильные защитные группы, и RP4 и RP5 представляют собой водород. Согласно определенным вариантам осуществления, RP1 и RP2 представляют собой TBS, RP3 представляет собой TES, и RP4 и RP5 представляют собой водород.
[00133] Согласно определенным вариантам осуществления соединение формулы (H-2-II) представляет собой соединение формулы (H-2-IIA):
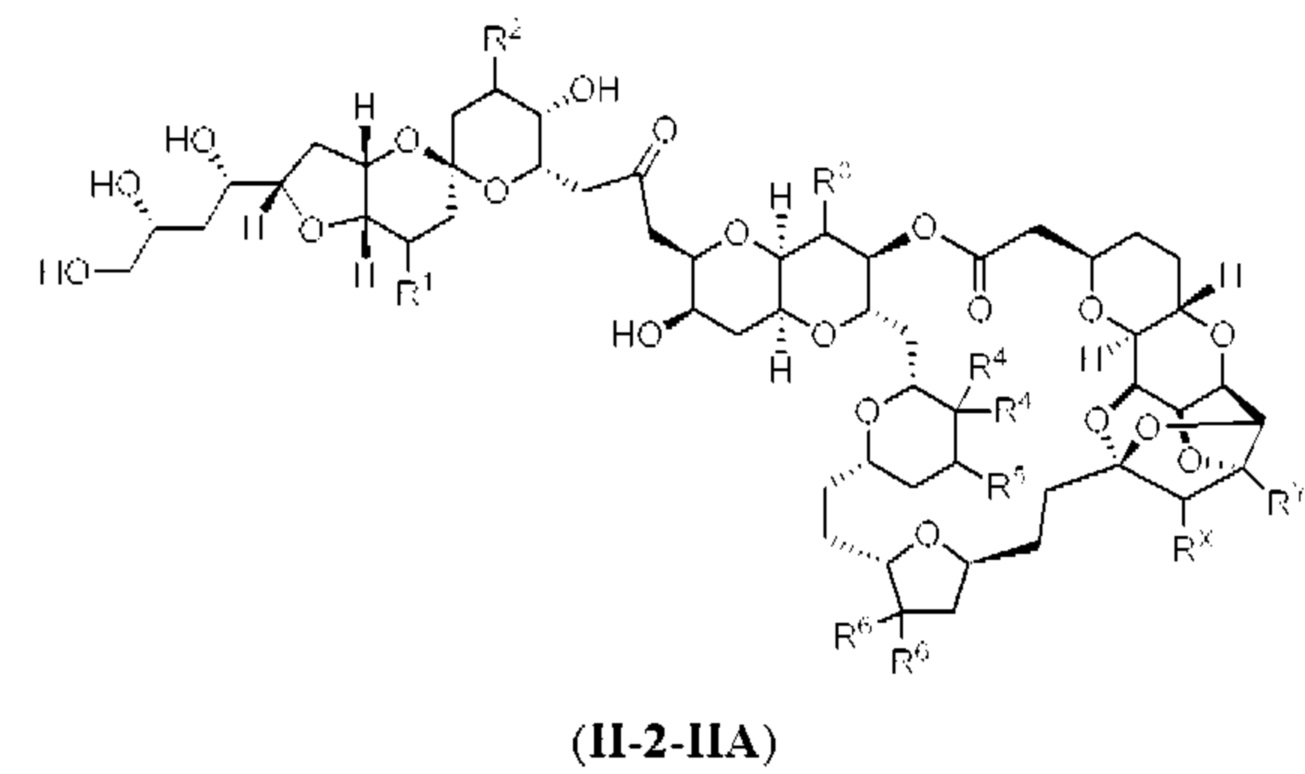
или его соль.
[00134] В настоящем документе раскрыт способ получения соединения формулы (H-2-II):
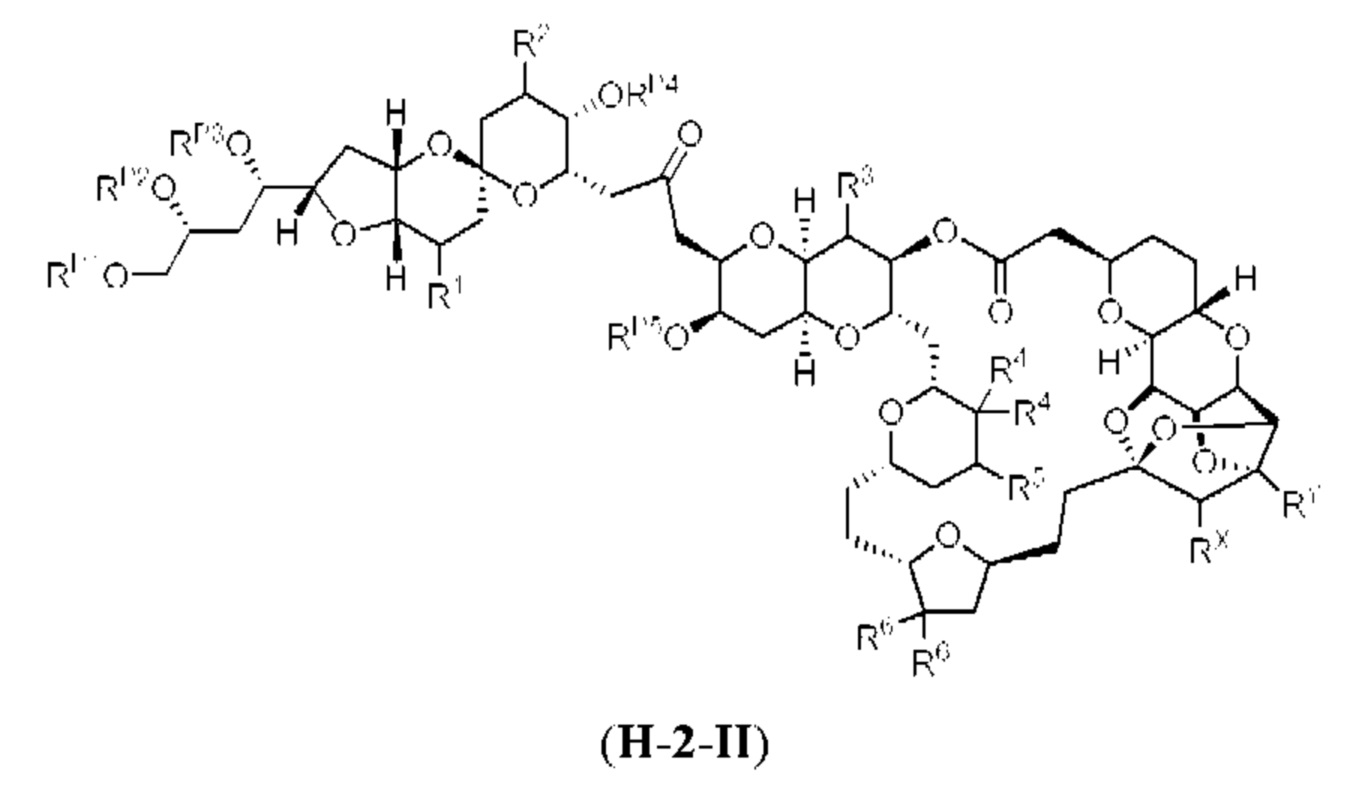
или его соли, причем способ включает в себя сочетание соединения формулы (L-2-14):
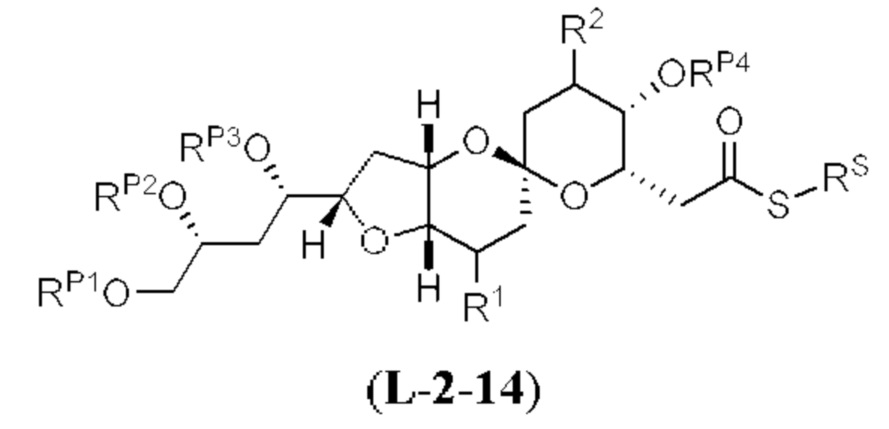
или его соли с соединением формулы (R-2-I):
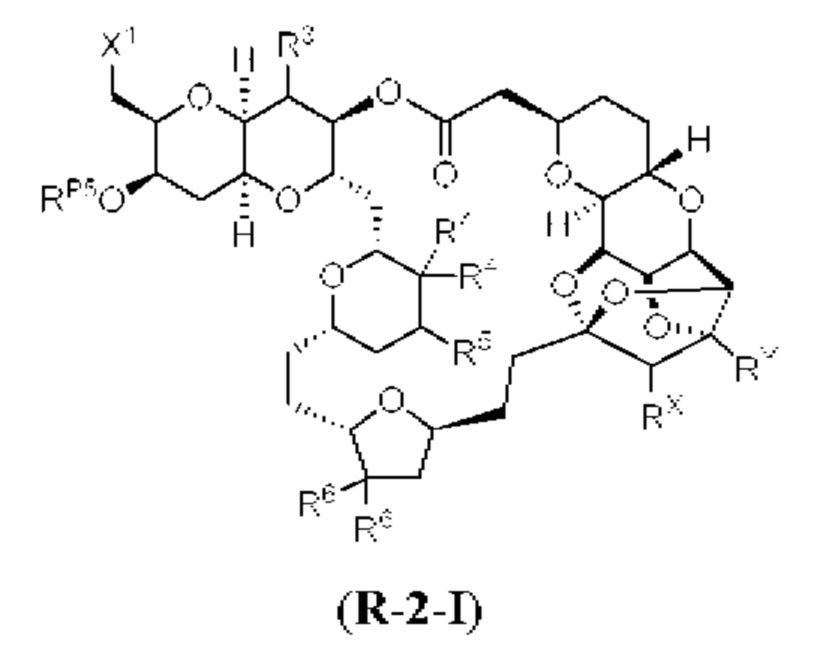
или его солью, где:
RS представляет собой необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил или необязательно замещенный гетероарил;
X1 представляет собой галоген или уходящую группу;
каждый из R1, R2, R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R4 образуют вместе: 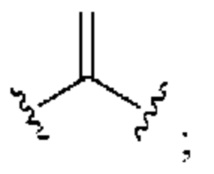
в каждом случае R6 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R6 образуют вместе: 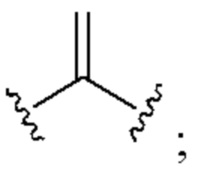
каждый из RP1, RP2, RP3, RP4 и RP5 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
RX представляет собой водород или -ORXa, где RXa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RY представляет собой водород или -ORYa, где RYa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
где RXa и RYa необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00135] Согласно определенным вариантам осуществления, стадия сочетания с получением соединения формулы (H-2-II) представляет собой Ni/Zr-опосредованную кетолизацию, раскрытую в настоящем документе. Для сочетания могут быть использованы любые реагенты и условия, раскрытые в настоящем документе для Ni/Zr-опосредованной кетолизации. Согласно определенным вариантам осуществления Ni/Zr-опосредованную реакцию кетолизации проводят в присутствии комплекса никеля, комплекса циркония и металла-восстановителя. Реакцию также можно проводить в присутствии одного или нескольких дополнительных реагентов, таких как основание или акцептор протонов. Согласно определенным вариантам осуществления комплекс никеля представляет собой NiBr2(dtbbpy). Согласно определенным вариантам осуществления комплекс циркония представляет собой Cp2ZrCl2. Согласно определенным вариантам осуществления металл-восстановитель представляет собой цинк. Согласно определенным вариантам осуществления дополнительное основание или акцептор протонов представляет собой (t-Bu)2(Ме)Ру. Согласно определенным вариантам осуществления реакцию проводят в присутствии NiBr2(dtbbpy), Cp2ZrCl2 и металлического цинка. Согласно определенным вариантам осуществления реакцию проводят в присутствии NiBr2(dtbbpy), Cp2ZrCl2 и металлического цинка. Согласно определенным вариантам осуществления реакцию проводят в присутствии NiBr2(dtbbpy), Cp2ZrCl2, металлического цинка и (t-Bu)2(Ме)Ру. Согласно определенным вариантам осуществления реакцию проводят в полярном растворителе, таком как DMI (1,3-диметил-2-имидазолидинон). Согласно определенным вариантам осуществления реакцию проводят в смеси DMI и EtOAc (этилацетата). Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от комнатной температуры приблизительно до 100°С. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от комнатной температуры приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при температуре около комнатной температуры.
[00136] Например, согласно определенным вариантам осуществления сочетание проводят в следующих условиях: 30 мол. % NiBr2(dtbbpy), 3,0 эквивалента Cp2ZrCl2, 6,0 эквивалентов металлического цинка и 4,0 эквивалента (t-Bu)2(Ме)Ру в DMI-EtOAc при комнатной температуре.
[00137] Согласно определенным вариантам осуществления RP1, RP2, RP3, RP4 и RP5 представляют собой силильные защитные группы. Согласно определенным вариантам осуществления RP1 и RP2 представляют собой TBS; и RP3, RP4 и RP5 представляют собой TES.
[00138] Согласно определенным вариантам осуществления способ получения соединения формулы (H-2-II) дополнительно содержит одну или несколько стадий снятия защитных групп с одного или нескольких атомов кислорода соединения формулы (H-2-II) (например, с получением соединения формулы (H-2-IIA) или его соли). Согласно определенным вариантам осуществления полученное соединение или его соль могут быть затем использованы на стадии циклизации с получением соединения формулы (H-2-I) или его соли. Согласно определенным вариантам осуществления стадию снятия защитных групп проводят в присутствии источника фторида (например, если один или несколько атомов кислорода защищены силильными группами).
[00139] Примеры источников фторида, применимых в настоящем изобретении, включают в себя без ограничения фториды металлов (например, фторид натрия, фторид калия, фторид цезия, фторид серебра) и фториды тетраал кил аммония (например, фторид тетраметиламмония, фторид тетраэтиламмония, фторид тетрабутиламмония). Согласно определенным вариантам осуществления источник фтора представляет собой фторид тетраалкиламмония. Согласно определенным вариантам осуществления источник фтора представляет собой фторид тетрабутиламмония (TBAF). Согласно определенным вариантам осуществления используют фтороводород (HF). Согласно определенным вариантам осуществления в качестве источника HF используют НЕ•пиридин. Другие примеры защитных групп, применимых в настоящем изобретении, и реагенты, применимые в реакциях введения/снятия защитных групп могут быть установлены из уровня техники, например, из документа Protecting Groups in Organic Synthesis, T.W. Greene и P.G.M. Wilts, 3rd edition, John Wiley & Sons, 1999, включенного в настоящий документ посредством ссылки.
[00140] После получения соединения формулы (H-2-I) или его соли, способ может содержать одну или несколько дополнительных стадий (например, снятия защитных групп, введения защитных групп, замещения, присоединения, отщепления) с получением целевого соединения (например, галихондрина А, В, С, или его аналога).
Синтез гомогалихондринов
[00141] Ni/Zr-опосредованные реакции кетолизации, раскрытые в настоящем документе, могут применяться для получения гомогалихондринов (например, гомогалихондрина А, В, С) и их аналогов. Например, как представлено на Схеме 2В, путем сочетания «левой половины» формулы (L-2-16) с «правой половиной» формулы (R-2-I) посредством Ni/Zr-опосредованной кетолизации получают кетон формулы (HH-2-II), путем циклизации которого получают соединение формулы (HH-2-I), которое представляет собой гомогалихондриновый продукт природного происхождения или его аналог, или промежуточное к нему соединение.
Схема 2В
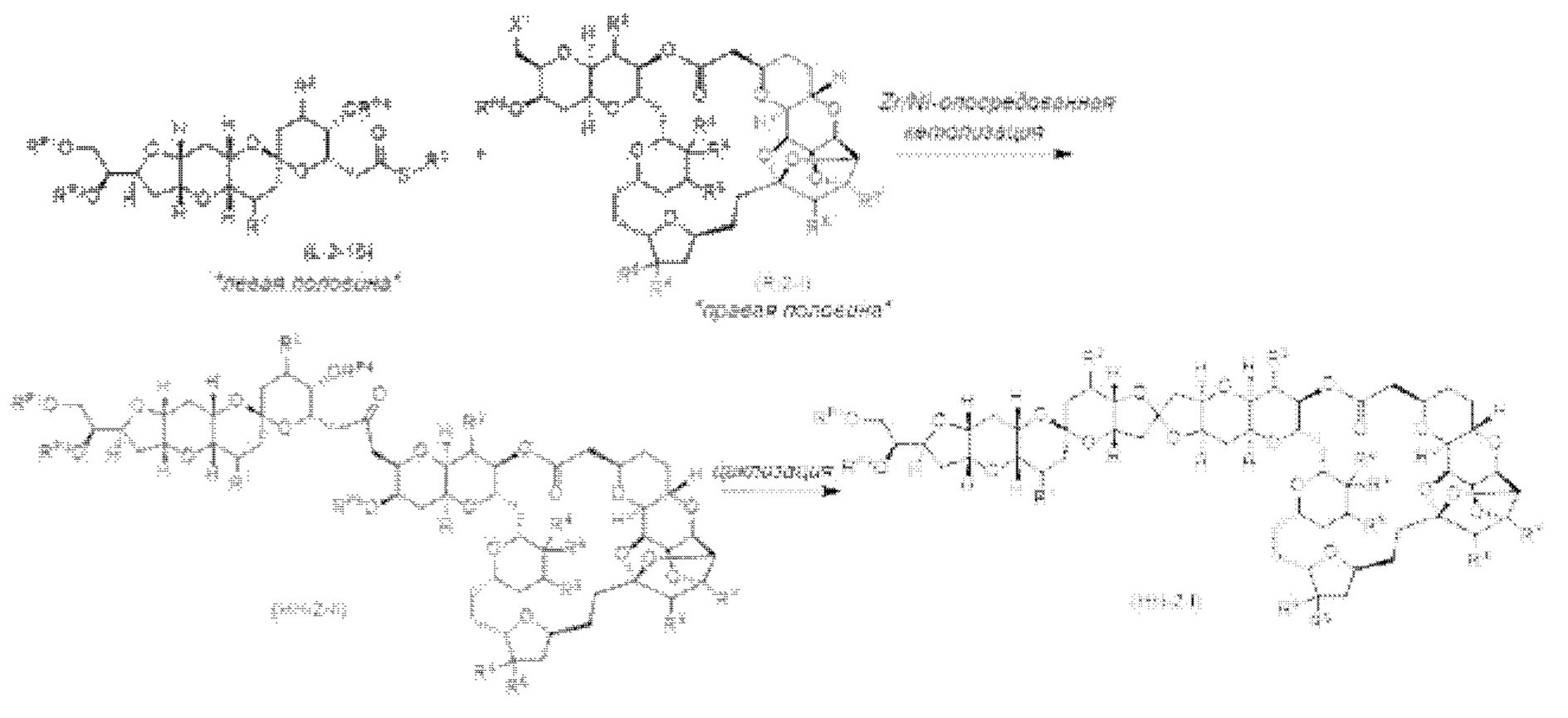
[00142] В настоящем документе раскрыт способ получения соединения формулы (HH-2-I):
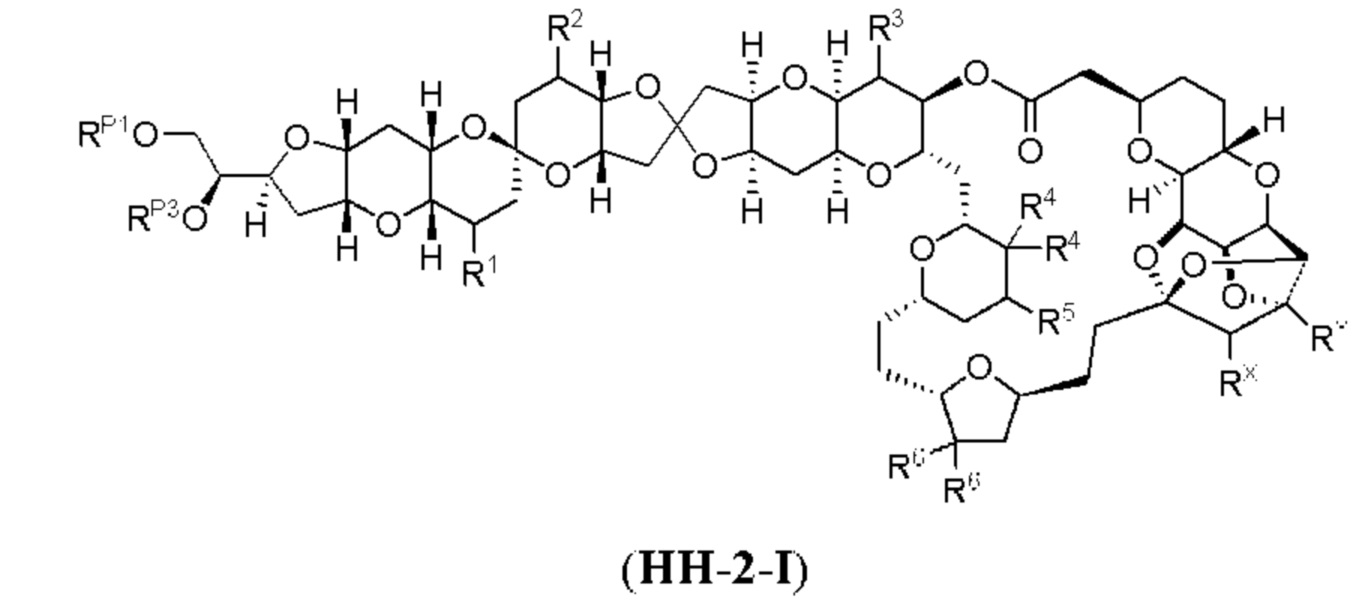
или его соли, причем способ включает в себя циклизацию соединения формулы (HH-2-II):
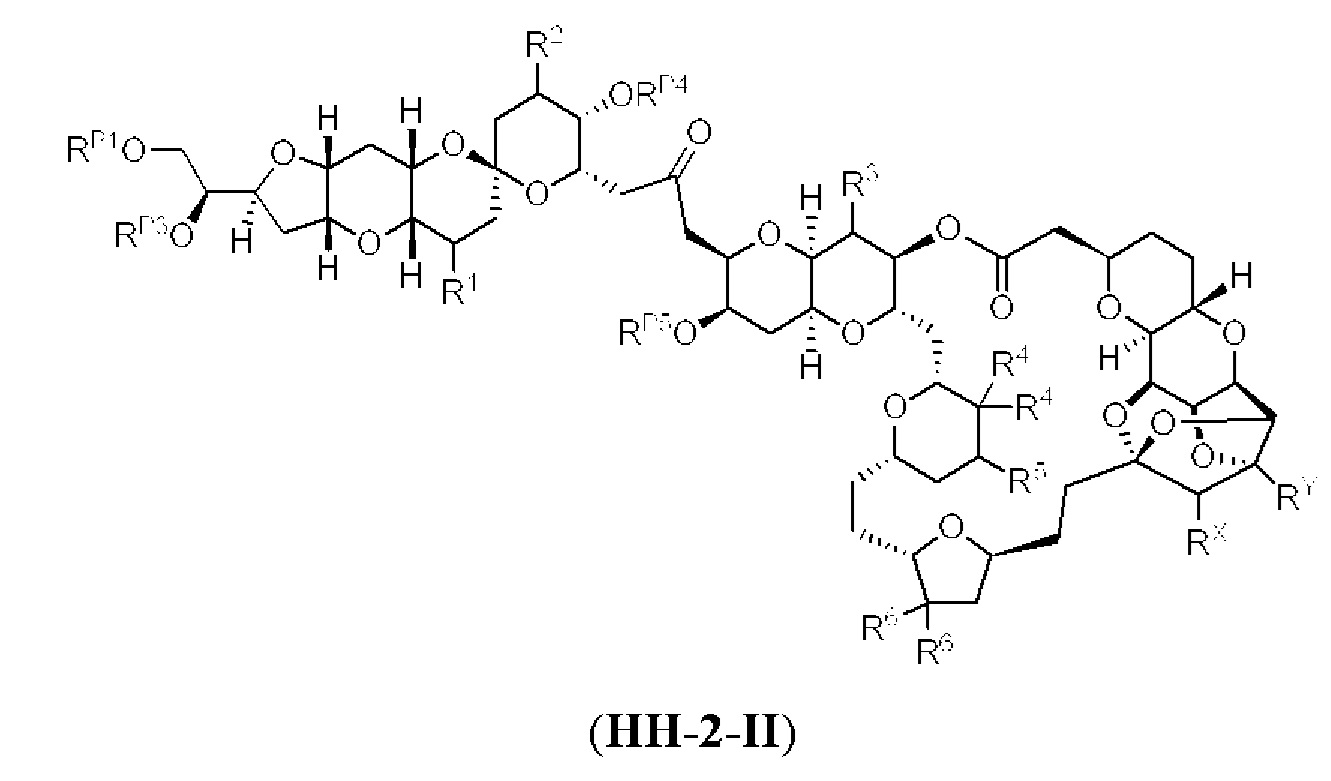
или его соли, где:
каждый из R1, R2, R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R4 образуют вместе: 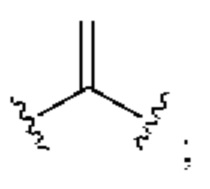
в каждом случае R6 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R6 образуют вместе: 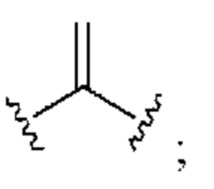
каждый из RP1, RP3, RP4 и RP5 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
RX представляет собой водород или -ORXa, где RXa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RY представляет собой водород или -ORYa, где RYa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
где RXa и RYa необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00143] Согласно определенным вариантам осуществления стадию циклизации соединения формулы (HH-2-II) или его соли проводят в присутствии кислоты. Кислота может представлять собой кислоту Льюиса или кислоту Брэнстеда. Согласно определенным вариантам осуществления кислота представляет собой кислоту Брэнстеда. Согласно определенным вариантам осуществления кислота представляет собой сульфоновую кислоту. Согласно определенным вариантам осуществления кислота представляет собой соль сульфоновой кислоты. Согласно определенным вариантам осуществления кислота представляет собой соль пиридиния. Согласно определенным вариантам осуществления кислота представляет собой иа/ад-толуолсульфонат пиридиния (PPTS). Согласно определенным вариантам осуществления кислота содержится в каталитическом количестве. Согласно определенным вариантам осуществления кислота содержится в стехиометрическом (например, приблизительно 1 эквивалент) или избыточном количестве (например, более 1 эквивалента). Согласно определенным вариантам осуществления кислота содержится в избыточном количестве (например, приблизительно 5 эквивалентов).
[00144] Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии PPTS. Согласно определенным вариантам осуществления указанную стадию проводят в растворителе, таком как CH2Cl2. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при температуре около комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят приблизительно при 20°С. Например, согласно определенным вариантам осуществления стадию циклизации проводят в следующих условиях: 5 эквивалентов PPTS в CH2Cl2 приблизительно при 20°С (например, в течение 2 часов).
[00145] Согласно определенным вариантам осуществления RP1 и RP2 представляют собой силильные защитные группы; и RP4 и RP5 представляют собой водород. Согласно определенным вариантам осуществления RP1 представляет собой TBS; RP2 представляет собой TES; и RP4 и RP5 представляют собой водород.
[00146] Согласно определенным вариантам осуществления соединение формулы (HH-2-II) представляет собой соединение формулы (HH-2-IIA):
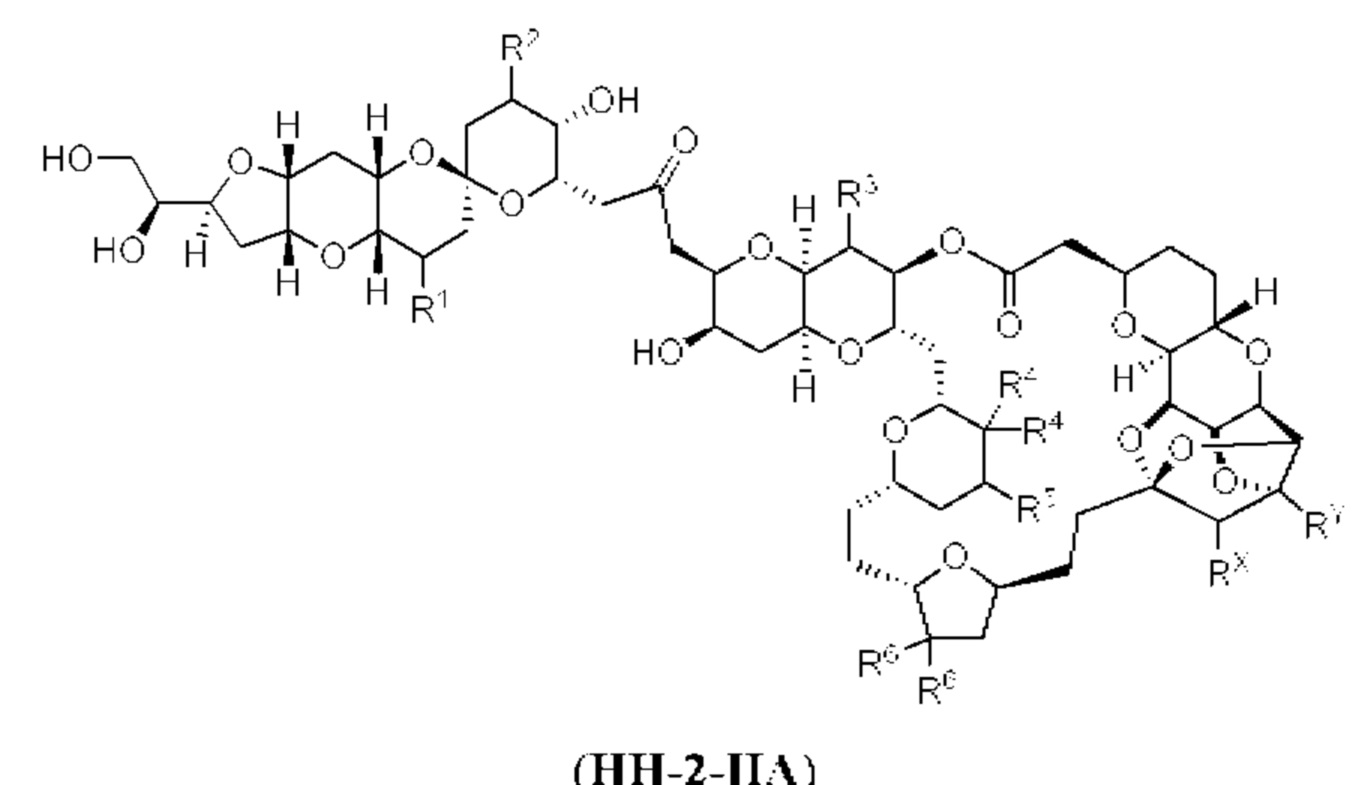
или его соль.
[00147] В настоящем документе раскрыт способ получения соединения формулы (HH-2-II):
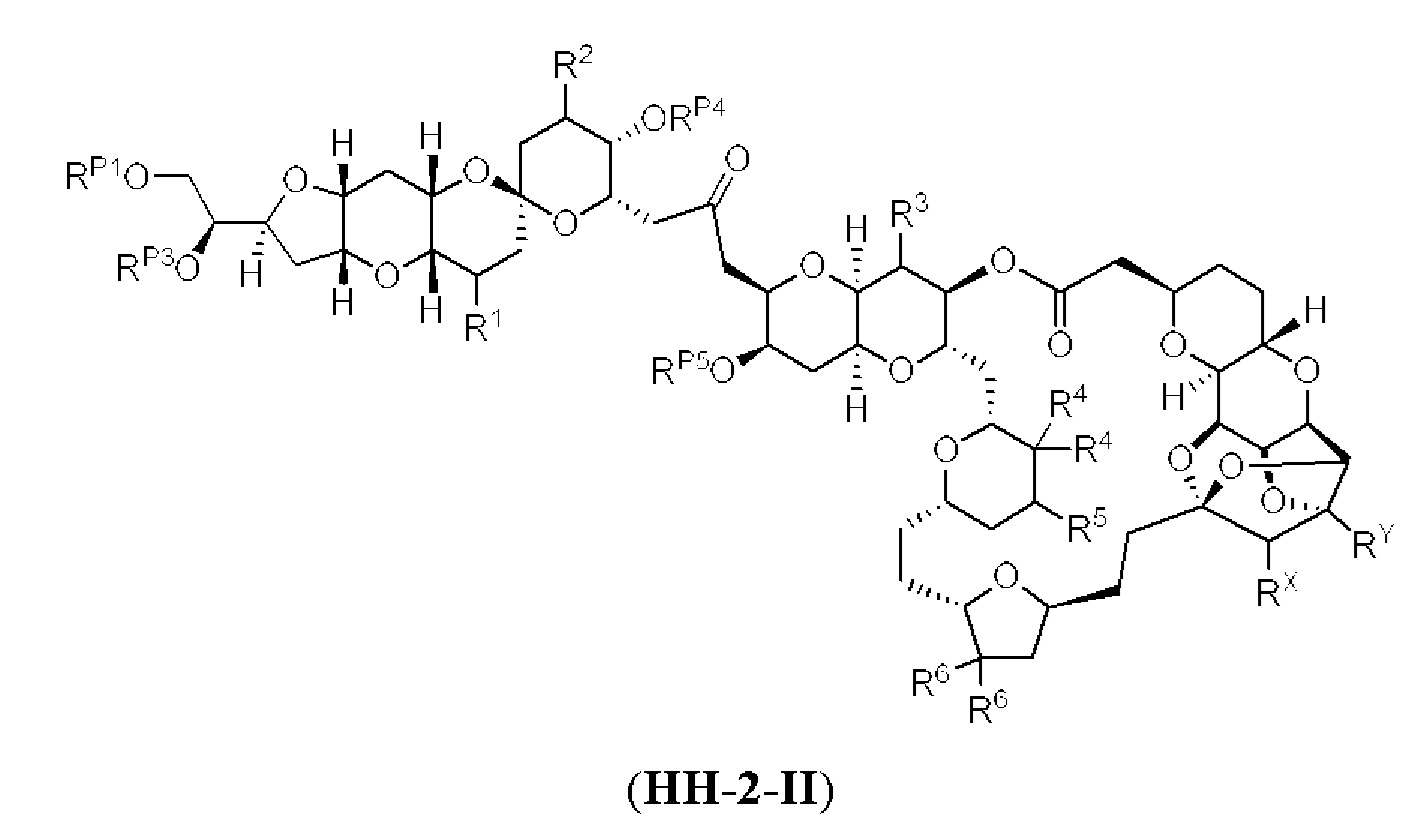
или его соли, причем способ включает в себя сочетание соединения формулы (L-2-16):
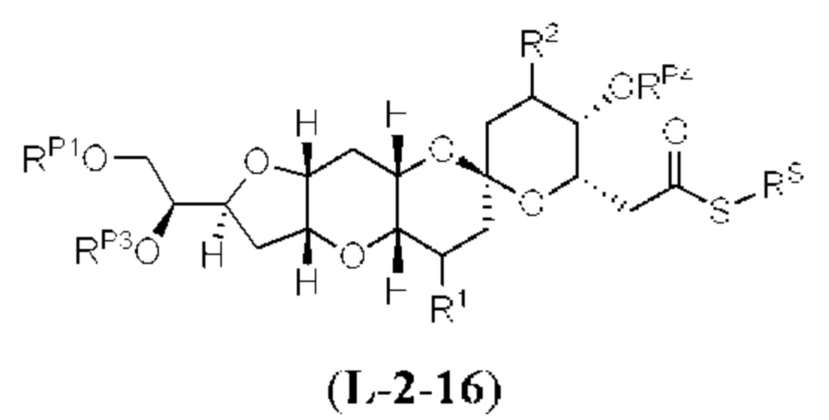
или его соли с соединением формулы (R-2-I):
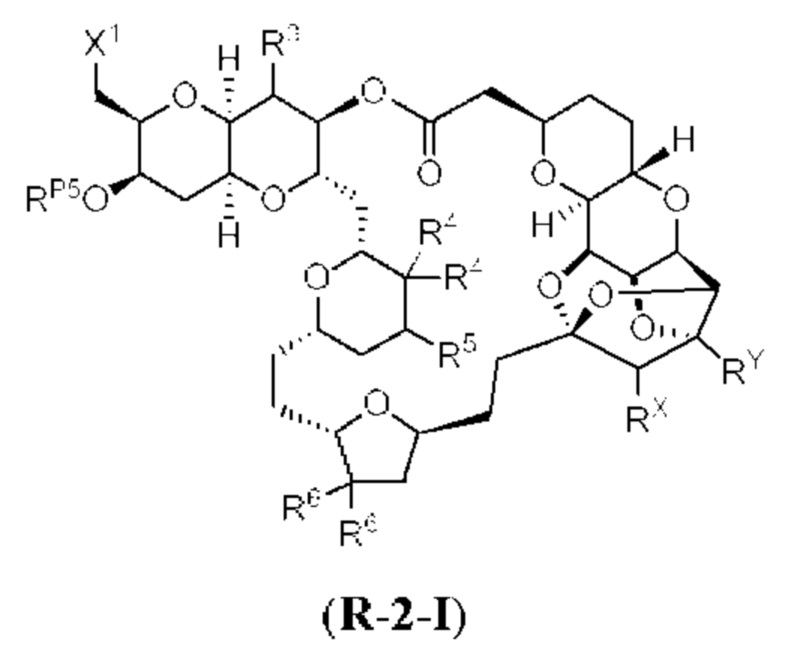
или его солью, где:
RS представляет собой необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил или необязательно замещенный гетероарил;
X1 представляет собой галоген или уходящую группу;
каждый из R1, R2, R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R4 образуют вместе: 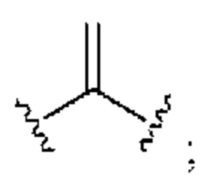
в каждом случае R6 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R6 образуют вместе: 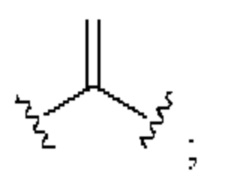
каждый из RP1, RP3, RP4 и RP5 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
RX представляет собой водород или -ORXa, где RXa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RY представляет собой водород или -ORYa, где RYa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
где RXa и RYa необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00148] Согласно определенным вариантам осуществления, стадия сочетания с получением соединения формулы (HH-2-II) представляет собой Ni/Zr-опосредованную кетолизацию, раскрытую в настоящем документе. Для сочетания могут быть использованы любые реагенты и условия, раскрытые в настоящем документе для Ni/Zr-опосредованной кетолизации. Согласно определенным вариантам осуществления Ni/Zr-опосредованную реакцию кетолизации проводят в присутствии комплекса никеля, комплекса циркония и металла-восстановителя. Реакцию также можно проводить в присутствии одного или нескольких дополнительных реагентов, таких как основание или акцептор протонов. Согласно определенным вариантам осуществления комплекс никеля представляет собой NiBr2(dtbbpy). Согласно определенным вариантам осуществления комплекс циркония представляет собой Cp2ZrCl2. Согласно определенным вариантам осуществления металл-восстановитель представляет собой цинк. Согласно определенным вариантам осуществления дополнительное основание или акцептор протонов представляет собой (t-Bu)2(Me)Py. Согласно определенным вариантам осуществления реакцию проводят в присутствии NiBr2(dtbbpy), Cp2ZrCl2 и металлического цинка. Согласно определенным вариантам осуществления реакцию проводят в присутствии NiBr2(dtbbpy), Cp2ZrCl2 и металлического цинка. Согласно определенным вариантам осуществления реакцию проводят в присутствии NiBr2(dtbbpy), Cp2ZrCl2, металлического цинка и (t-Bu)2(Ме)Ру. Согласно определенным вариантам осуществления реакцию проводят в полярном растворителе, таком как DMI (1,3-диметил-2-имидазолидинон). Согласно определенным вариантам осуществления реакцию проводят в смеси DMI и EtOAc (этилацетата). Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от комнатной температуры приблизительно до 100°С. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от комнатной температуры приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при температуре около комнатной температуры.
[00149] Например, согласно определенным вариантам осуществления сочетание проводят в следующих условиях: 30 мол. % NiBr2(dtbbpy), 3,0 эквивалента Cp2ZrCl2, 6,0 эквивалентов металлического цинка и 4,0 эквивалента (t-Bu)2(Me)Py, в DMI-EtOAc при комнатной температуре.
[00150] Согласно определенным вариантам осуществления RP1, RP2, RP3, RP4 и RP5 представляют собой силильные защитные группы. Согласно определенным вариантам осуществления RP1 и RP2 представляют собой TBS; и RP3, RP4 и RP5 представляют собой TES.
[00151] Согласно определенным вариантам осуществления способ получения соединения формулы (HH-2-II) дополнительно содержит одну или несколько стадий снятия защитных групп с одного или нескольких атомов кислорода соединения формулы (HH-2-II) (например, с получением соединения формулы (HH-2-IIA) или его соли). Согласно определенным вариантам осуществления полученное соединение или его соль затем циклизуют с получением соединения формулы (HH-2-I) или его соли. Согласно определенным вариантам осуществления стадию снятия защитных групп проводят в присутствии источника фторида (например, если один или несколько атомов кислорода защищены силильными группами). Примеры источников фторида раскрыты в настоящем документе.
[00152] После получения соединения формулы (HH-2-I) или его соли, могут проводиться одна или несколько дополнительных стадий (например, снятия защитных групп, введения защитных групп, замещения, присоединения, отщепления) с получением целевого соединения (например, гомогалихондрина А, В, С, или его аналога, промежуточного к ним соединения).
Синтез норгалихондринов
[00153] Ni/Zr-опосредованные реакции кетолизации, раскрытые в настоящем документе, могут применяться для получения норгалихондринов (например, норгалихондрина А, В, С) и его аналогов. Например, как представлено на Схеме 2С, путем сочетания «левой половины» формулы (L-2-15) с «правой половиной» формулы (R-2-I) посредством Ni/Zr-опосредованной кетолизации получают кетон формулы (NH-2-II), путем циклизации которого получают соединение формулы (NH-2-I), которое представляет собой норгалихондрин или его аналог, или промежуточное к нему соединение.
Схема 2С
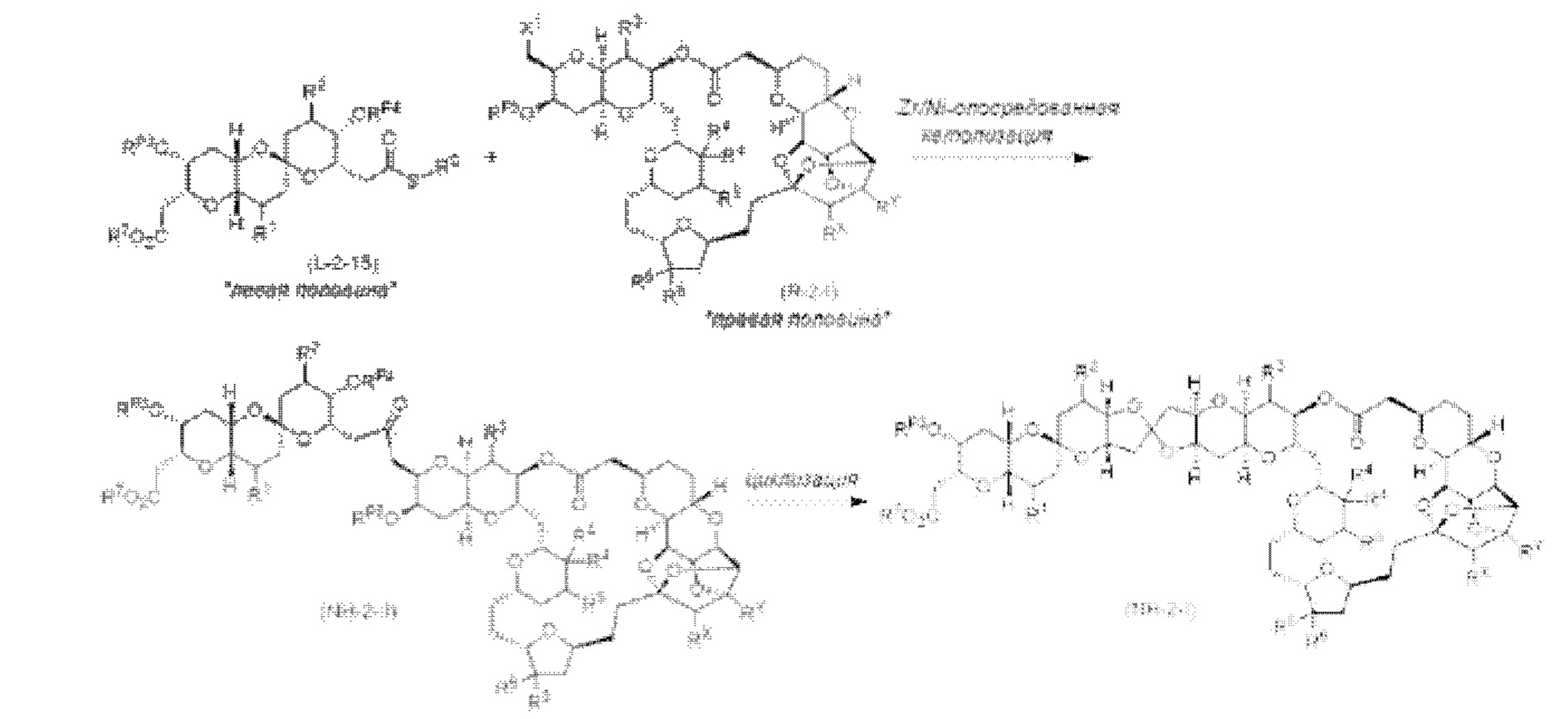
[00154] В настоящем документе раскрыт способ получения соединения формулы (NH-2-I):
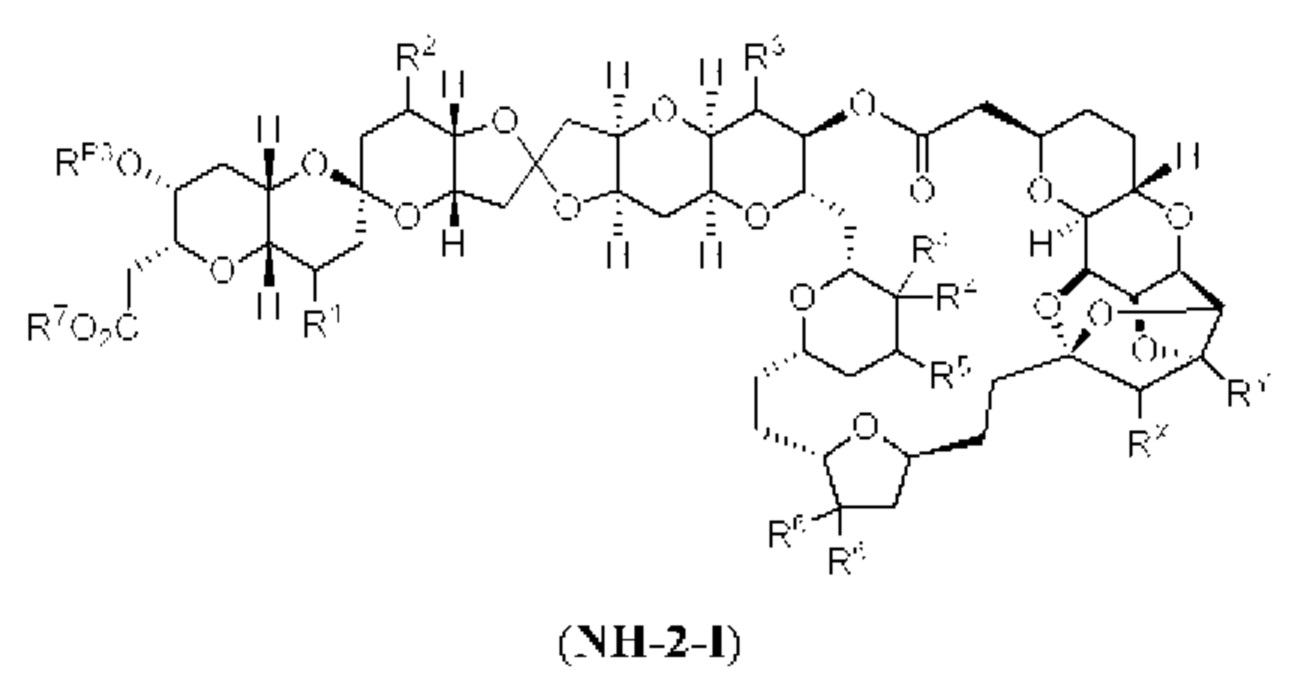
или его соли, причем способ включает в себя циклизацию соединения формулы (NH-2-II):
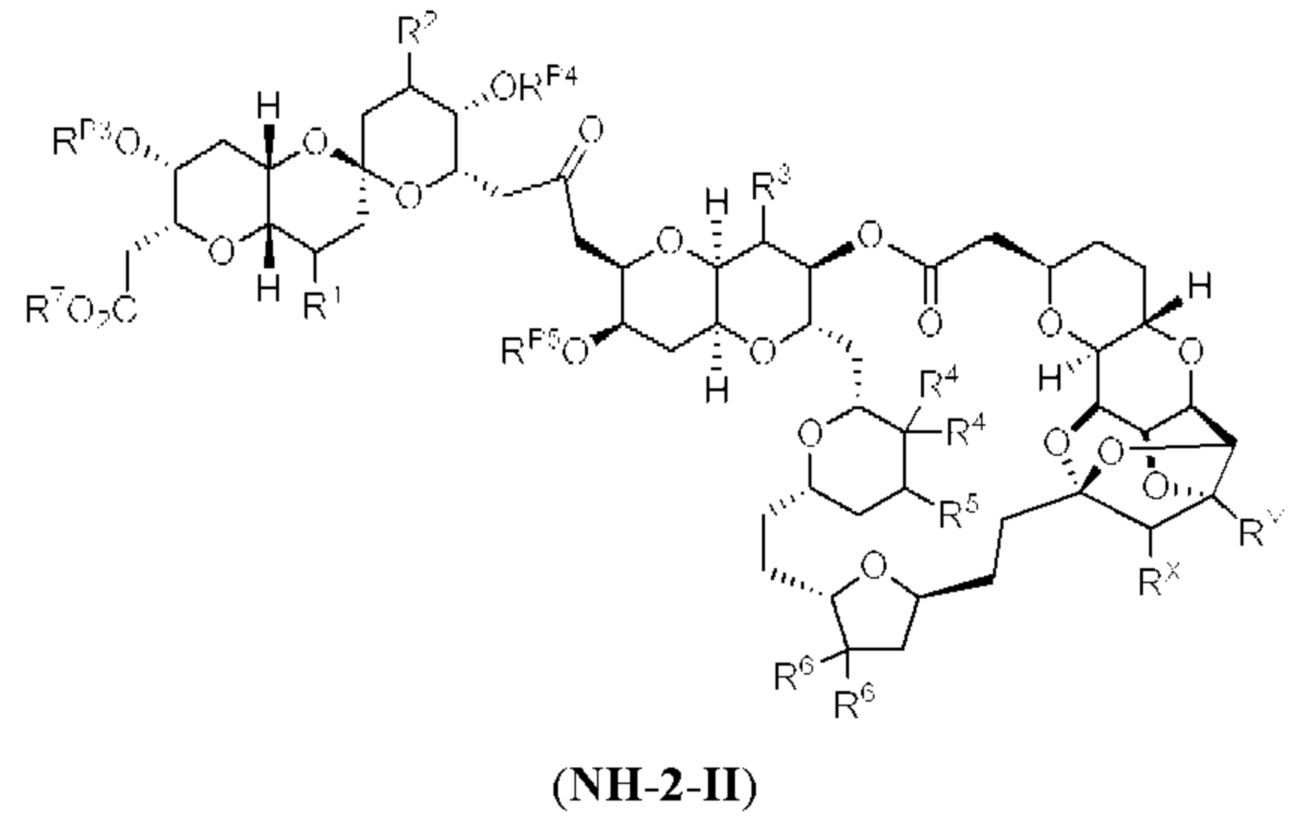
или его соли, где:
каждый из R1, R2, R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R4 образуют вместе: 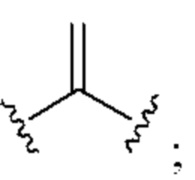
в каждом случае R6 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R6 образуют вместе: 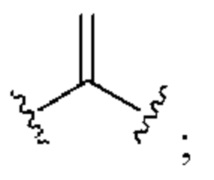
каждый из RP3, RP4 и RP5 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
R7 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу;
RX представляет собой водород или -ORXa, где RXa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RY представляет собой водород или -ORYa, где RYa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
где RXa и RYa необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00155] Согласно определенным вариантам осуществления стадию циклизации соединения формулы (NH-2-II) или его соли проводят в присутствии кислоты. Кислота может представлять собой кислоту Льюиса или кислоту Брэнстеда. Согласно определенным вариантам осуществления кислота представляет собой кислоту Брэнстеда. Согласно определенным вариантам осуществления кислота представляет собой сульфоновую кислоту. Согласно определенным вариантам осуществления кислота представляет собой соль сульфоновой кислоты. Согласно определенным вариантам осуществления кислота представляет собой соль пиридиния. Согласно определенным вариантам осуществления кислота представляет собой пара-толуолсульфонат пиридиния (PPTS). Согласно определенным вариантам осуществления кислота содержится в каталитическом количестве. Согласно определенным вариантам осуществления кислота содержится в стехиометрическом (например, приблизительно 1 эквивалент) или избыточном количестве (например, более 1 эквивалента). Согласно определенным вариантам осуществления кислота содержится в избыточном количестве (например, приблизительно 5 эквивалентов).
[00156] Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии PPTS. Согласно определенным вариантам осуществления указанную стадию проводят в растворителе, таком как CH2Cl2. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при температуре около комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят приблизительно при 20°С. Например, согласно определенным вариантам осуществления стадию циклизации проводят в следующих условиях: 5 эквивалентов PPTS в CH2Cl2 приблизительно при 20°С (например, в течение 2 часов).
[00157] Согласно определенным вариантам осуществления RP3 представляет собой силильную защитную группу; R7 представляет собой необязательно замещенный алкил; и RP4 и RP5 представляют собой водород. Согласно определенным вариантам осуществления RP3 представляет собой TES; R7 представляет собой метил; и RP4 и RP5 представляют собой водород.
[00158] Согласно определенным вариантам осуществления соединение формулы (NH-2-II) представляет собой соединение формулы (NH-2-IIA):
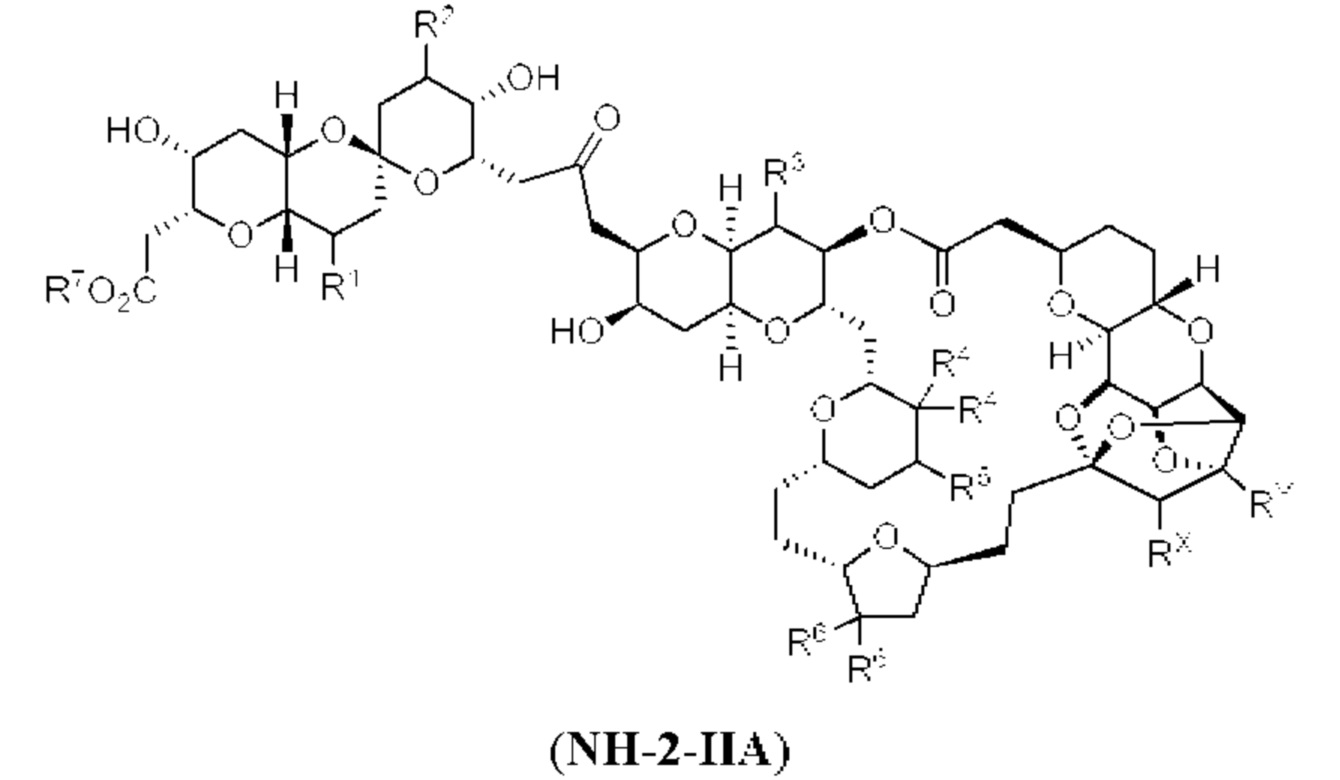
или его соль.
[00159] В настоящем документе раскрыт способ получения соединения формулы (NH-2-II):
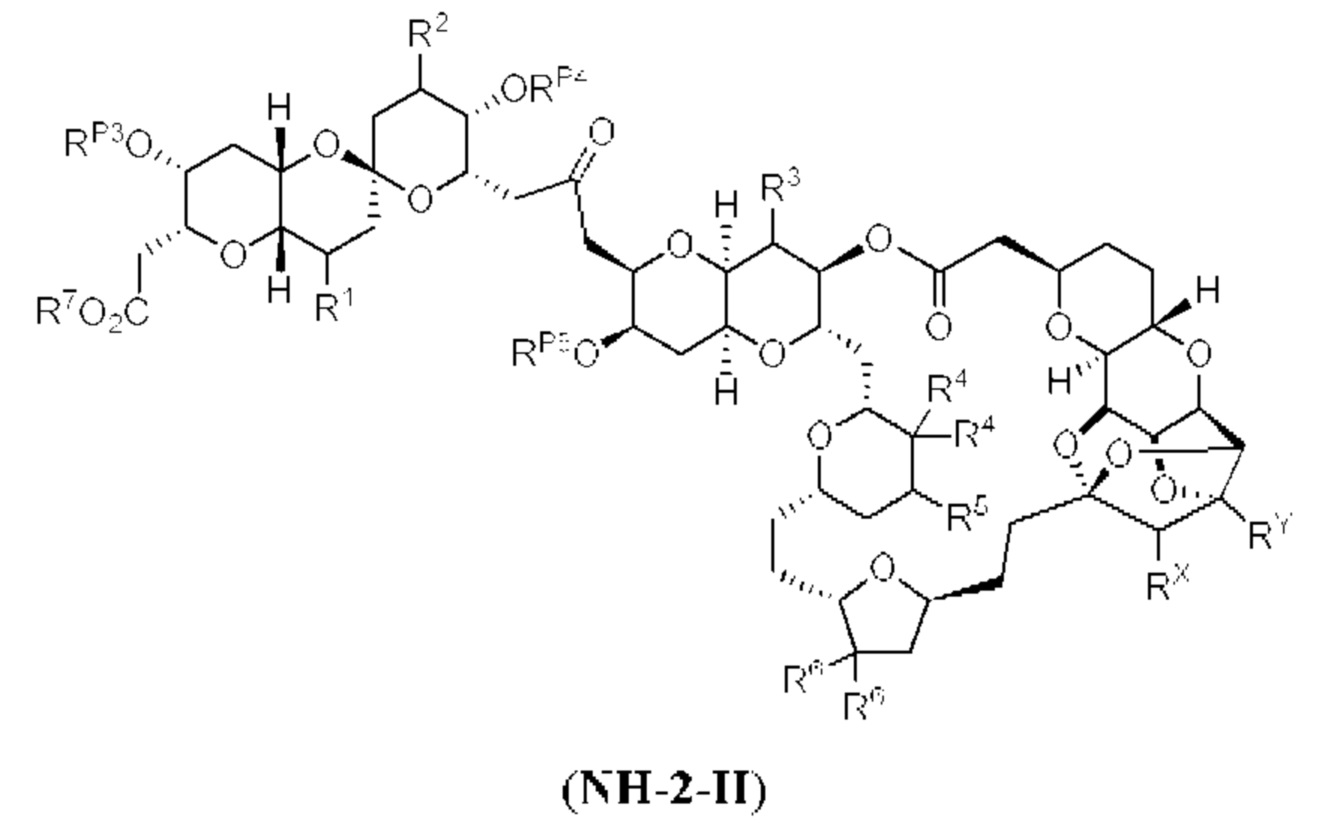
или его соли, причем способ включает в себя сочетание соединения формулы (L-2-15):
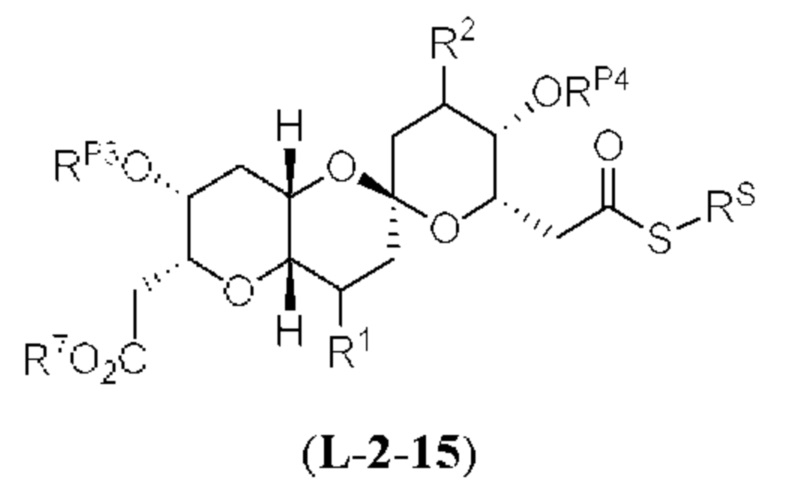
или его соли с соединением формулы (R-2-I):
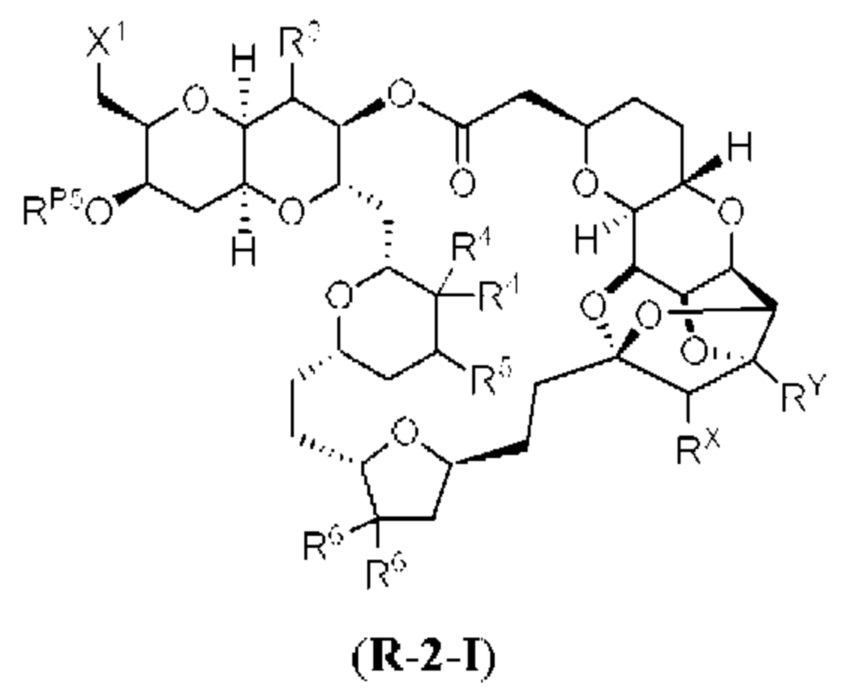
или его солью, где:
RS представляет собой необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил или необязательно замещенный гетероарил;
X1 представляет собой галоген или уходящую группу;
каждый из R1, R2, R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R4 образуют вместе: 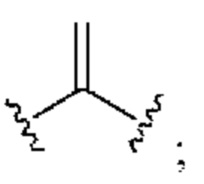
в каждом случае R6 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R6 образуют вместе: 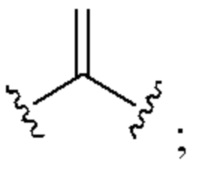
каждый из RP3, RP4 и RP5 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
R7 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу;
RX представляет собой водород или -ORXa, где RXa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RY представляет собой водород или -ORYa, где RYa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
где RXa и RYa необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00160] Согласно определенным вариантам осуществления, стадия сочетания с получением соединения формулы (NH-2-II) представляет собой Ni/Zr-опосредованную кетолизацию, раскрытую в настоящем документе. Для сочетания могут быть использованы любые реагенты и условия, раскрытые в настоящем документе для Ni/Zr-опосредованной кетолизации. Согласно определенным вариантам осуществления Ni/Zr-опосредованную реакцию кетолизации проводят в присутствии комплекса никеля, комплекса циркония и металла-восстановителя. Реакцию также можно проводить в присутствии одного или нескольких дополнительных реагентов, таких как основание или акцептор протонов. Согласно определенным вариантам осуществления комплекс никеля представляет собой NiBr2(dtbbpy). Согласно определенным вариантам осуществления комплекс циркония представляет собой Cp2ZrCl2. Согласно определенным вариантам осуществления металл-восстановитель представляет собой цинк. Согласно определенным вариантам осуществления дополнительное основание или акцептор протонов представляет собой (t-Bu)2(Ме)Ру. Согласно определенным вариантам осуществления реакцию проводят в присутствии NiBr2(dtbbpy), Cp2ZrCl2 и металлического цинка. Согласно определенным вариантам осуществления реакцию проводят в присутствии NiBr2(dtbbpy), Cp2ZrCl2 и металлического цинка. Согласно определенным вариантам осуществления реакцию проводят в присутствии NiBr2(dtbbpy), Cp2ZrCl2, металлического цинка и (t-Bu)2(Ме)Ру. Согласно определенным вариантам осуществления реакцию проводят в полярном растворителе, таком как DMI (1,3-диметил-2-имидазолидинон). Согласно определенным вариантам осуществления реакцию проводят в смеси DMI и EtOAc (этилацетата). Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от комнатной температуры приблизительно до 100°С. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от комнатной температуры приблизительно до 50°С.Согласно определенным вариантам осуществления реакцию проводят при температуре около комнатной температуры.
[00161] Например, согласно определенным вариантам осуществления сочетание проводят в следующих условиях: 30 мол. % NiBr2(dtbbpy), 3,0 эквивалента Cp2ZrCl2, 6,0 эквивалентов металлического цинка и 4,0 эквивалента (t-Bu)2(Ме)Ру в DMI-EtOAc при комнатной температуре.
[00162] Согласно определенным вариантам осуществления RP3 представляет собой силильную защитную группу; R7 представляет собой необязательно замещенный алкил; и RP4 и RP5 представляют собой силильные защитные группы. Согласно определенным вариантам осуществления RP3 представляет собой TES; R7 представляет собой метил; и RP4 и RP5 представляют собой TES.
[00163] Согласно определенным вариантам осуществления способ получения соединения формулы (NH-2-II) дополнительно содержит одну или несколько стадий снятия защитных групп с одного или нескольких атомов кислорода соединения формулы (NH-2-II) (например, с получением соединения формулы (NH-2-IIA), или его соль). Согласно определенным вариантам осуществления полученное соединение или его соль затем циклизуют с получением соединения формулы (NH-2-I) или его соли. Согласно определенным вариантам осуществления стадию снятия защитных групп проводят в присутствии источника фторида (например, если один или несколько атомов кислорода защищены силильными группами). Примеры источников фторид раскрыты в настоящем документе.
[00164] После получения соединения формулы (NH-2-I) или его соли, способ может содержать одну или несколько дополнительных стадий (например, снятия защитных групп, введения защитных групп, замещения, присоединения, отщепления) с получением целевого соединения (например, гомогалихондрина А, В, С, или его аналога).
Синтез дополнительных аналогов галихондрина
[00165] Способы получения дополнительных аналогов галихондрина раскрыты в настоящем документе. Ni/Zr-опосредованные реакции кетолизации, раскрытые в настоящем документе, могут применяться для получения дополнительных аналогов галихондрина. Например, как представлено на Схеме 2D, путем сочетания «левой половины» формулы (L-2-6) с «правой половиной» формулы (R-2-I) посредством Ni/Zr-опосредованной кетолизации получают кетон формулы (H3-2-II), путем циклизации которого получают соединение формулы (H3-2-I). Соединение формулы (H3-2-I) может быть подвергнуто дополнительной синтетической трансформации с получением целевого соединения.
Схема 2D
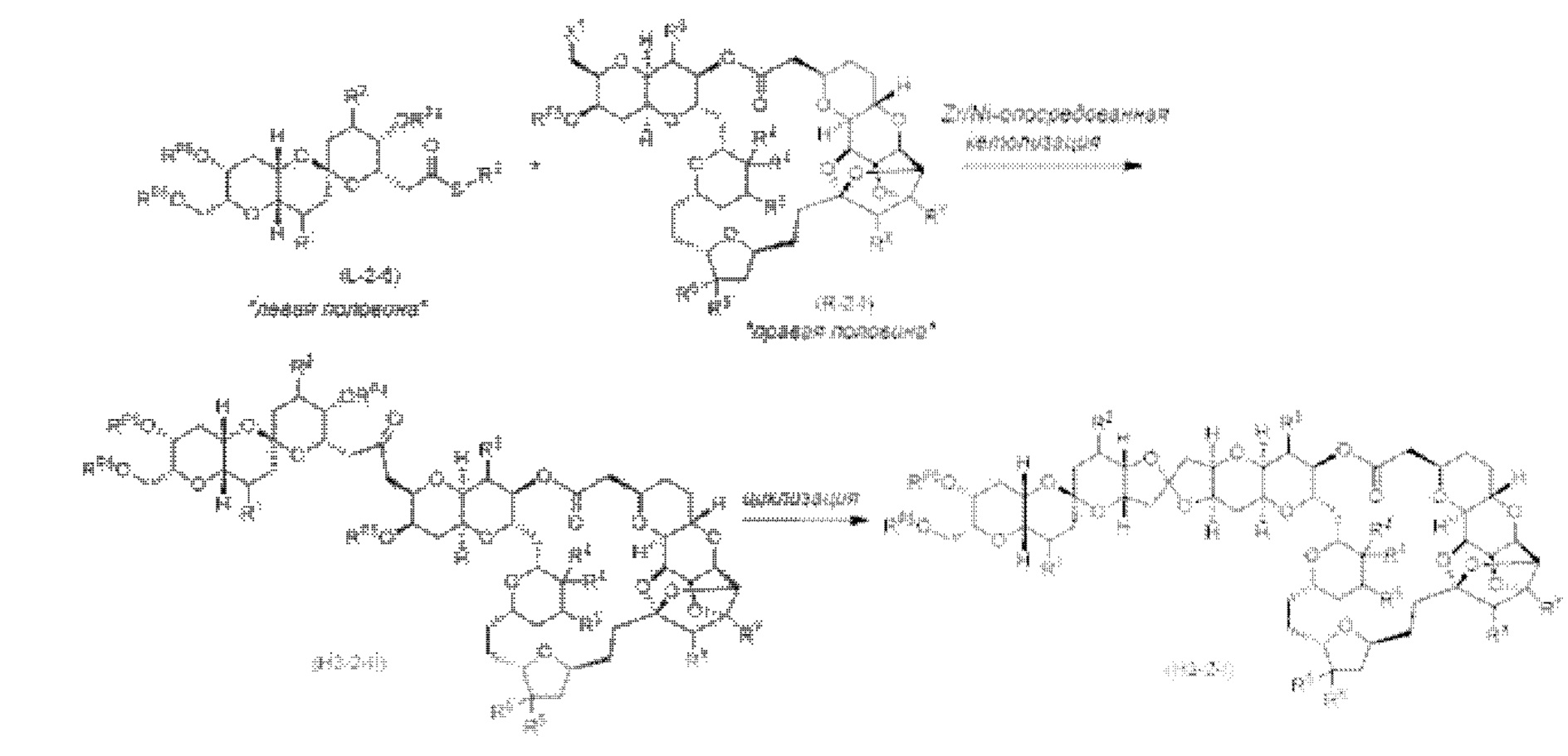
[00166] Как представлено на Схеме 2D, в настоящем документе раскрыт способ получения соединения формулы (H3-2-I):
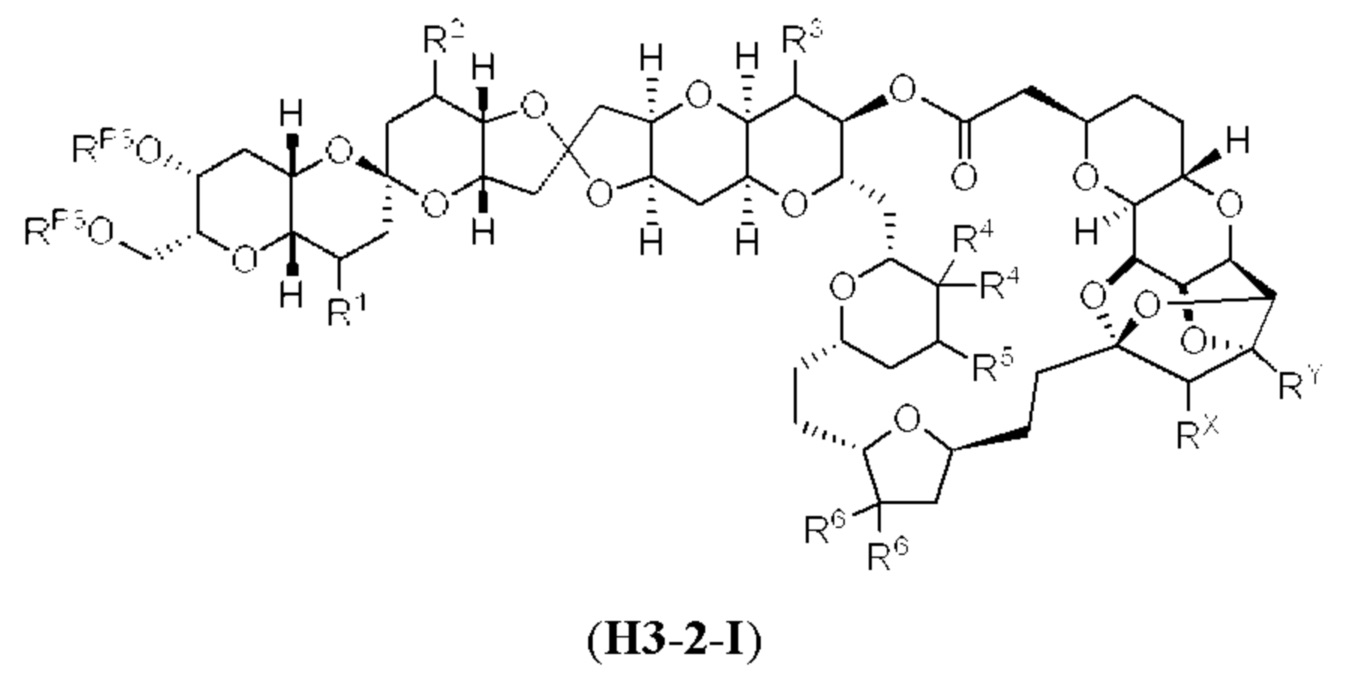
или его соли, причем способ включает в себя циклизацию соединения формулы (Н3-2-II):
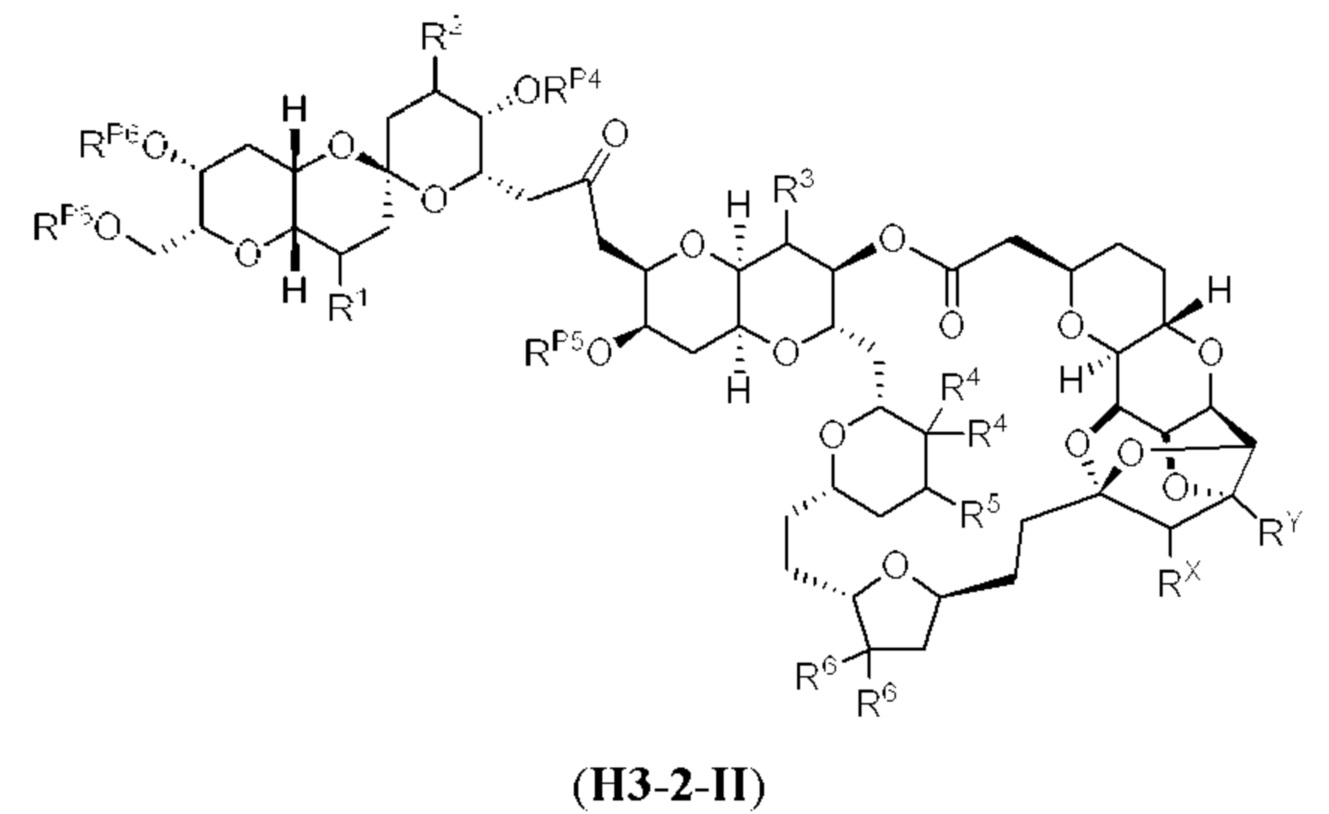
или его соли, где:
каждый из R1, R2, R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R4 образуют вместе: 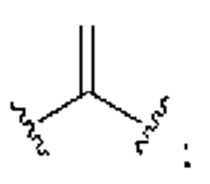
в каждом случае R6 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R6 образуют вместе: 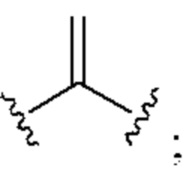
каждый из RP4, RP5 и RP6 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила;
RX представляет собой водород или -ORXa, где RXa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RY представляет собой водород или -ORYa, где RYa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
где RXa и RYa необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетеро циклила.
[00167] Согласно определенным вариантам осуществления соединение формулы (H3-2-II) представляет собой соединение формулы (H3-2-IIA):
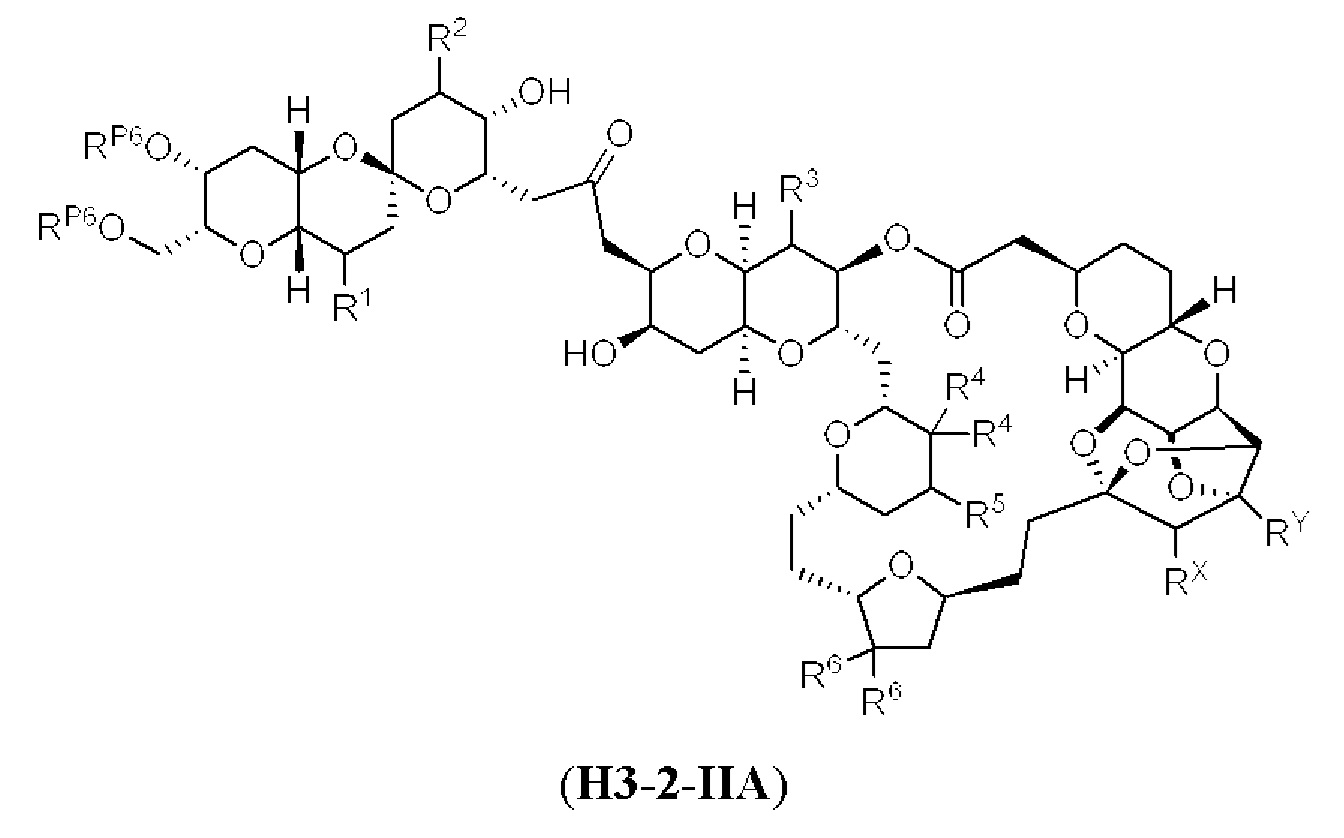
или его соль.
[00168] Согласно определенным вариантам осуществления способ представляет собой способ получения соединения (2):
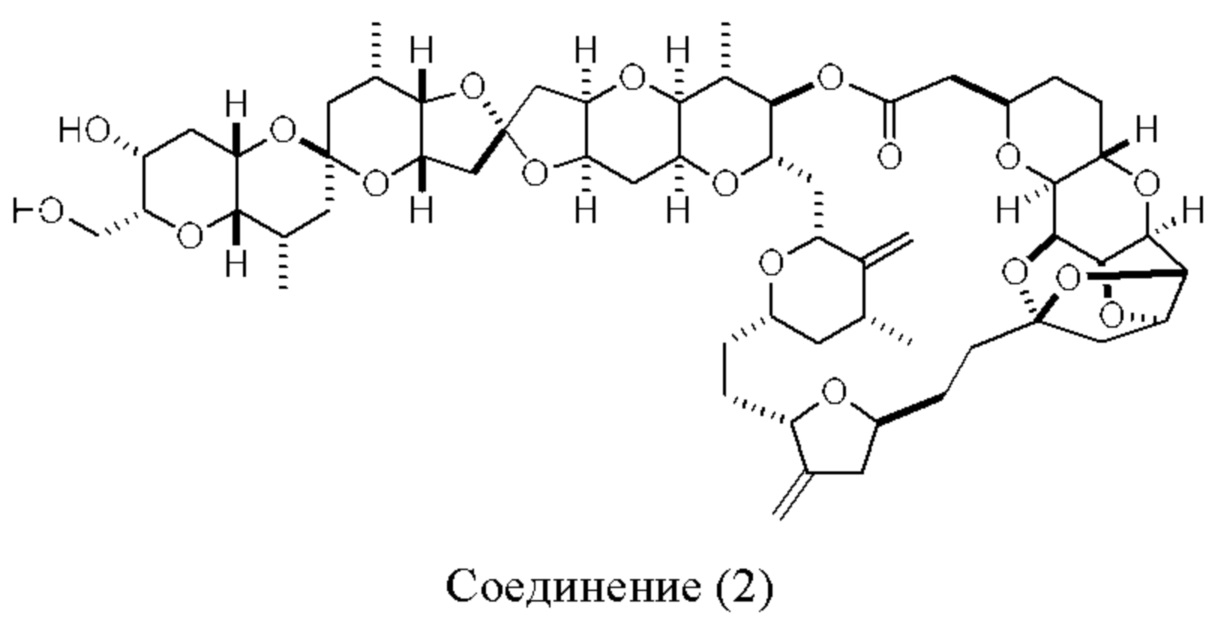
или его соли, причем способ включает в себя циклизацию соединения формулы:
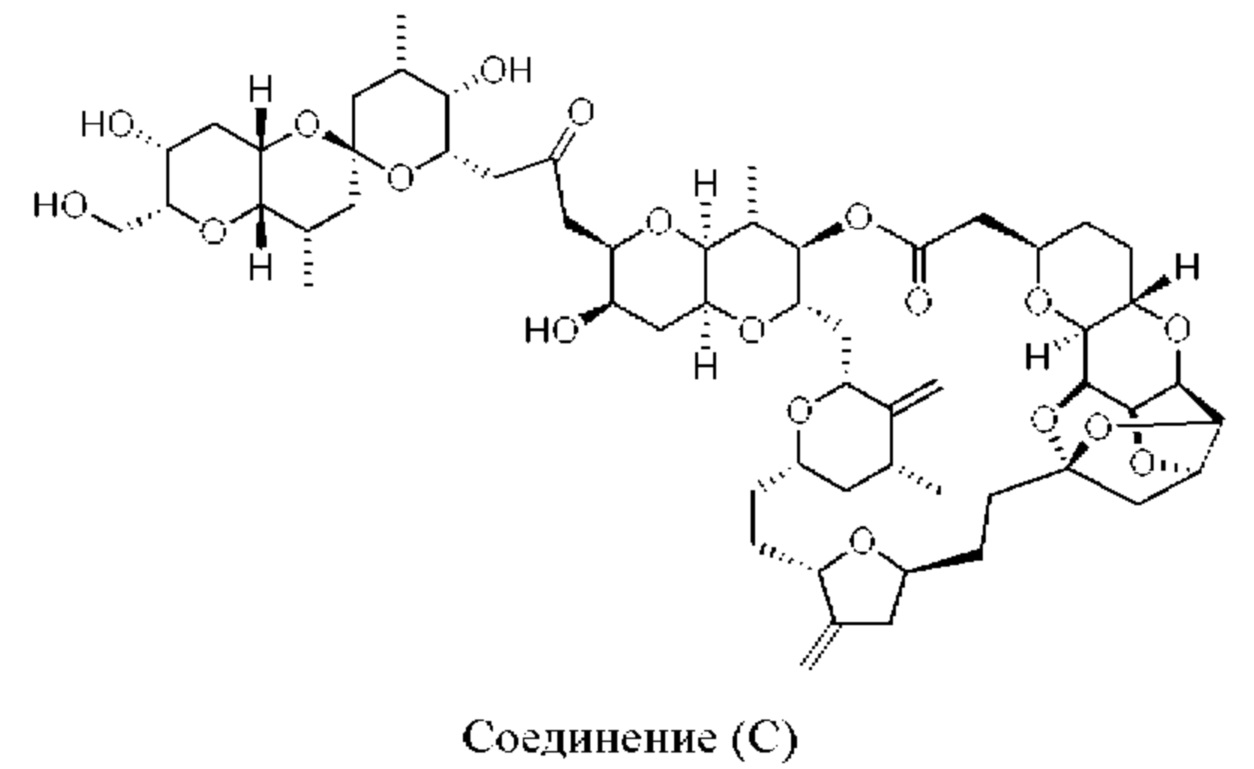
или его соли.
[00169] Согласно определенным вариантам осуществления стадию циклизации соединения формулы (H3-2-II), соединения (С) или его соли проводят в присутствии кислоты. Кислота может представлять собой кислоту Льюиса или кислоту Брэнстеда. Согласно определенным вариантам осуществления кислота представляет собой кислоту Брэнстеда. Согласно определенным вариантам осуществления кислота представляет собой сульфоновую кислоту. Согласно определенным вариантам осуществления кислота представляет собой соль сульфоновой кислоты. Согласно определенным вариантам осуществления кислота представляет собой соль пиридиния. Согласно определенным вариантам осуществления кислота представляет собой пара-толуолсульфонат пиридиния (PPTS). Согласно определенным вариантам осуществления кислота содержится в каталитическом количестве. Согласно определенным вариантам осуществления кислота содержится в стехиометрическом (например, приблизительно 1 эквивалент) или избыточном количестве (например, более 1 эквивалента). Согласно определенным вариантам осуществления кислота содержится в избыточном количестве (например, приблизительно 5 эквивалентов). Согласно определенным вариантам осуществления указанную стадию проводят в растворителе. Согласно определенным вариантам осуществления реакцию проводят в дихлорметане (DCM). Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят приблизительно при 20°С. Согласно определенным вариантам осуществления реакцию проводят при температуре около комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят приблизительно при 9-11°С.
[00170] Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии PPTS. Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии PPTS в DCM. Например, согласно определенным вариантам осуществления стадию циклизации проводят в следующих условиях: 5 эквивалентов PPTS в DCM приблизительно при 20°С (например, в течение 2 часов). Например, согласно определенным вариантам осуществления стадию циклизации проводят в следующих условиях: 5 эквивалентов PPTS в DCM приблизительно при 9-11°С (например, в течение 3 часов).
[00171] Согласно определенным вариантам осуществления два RP6 представляют собой кислород-защитные группы; и RP4 и RP5 представляют собой водород. Согласно определенным вариантам осуществления два RP6 объединены с образованием:  ; и RP4 и RP5 представляют собой водород. Согласно определенным вариантам осуществления два RP6 объединены с образованием:
; и RP4 и RP5 представляют собой водород. Согласно определенным вариантам осуществления два RP6 объединены с образованием:  и RP4 и RP5 представляют собой водород. Согласно определенным вариантам осуществления каждый из RP6, RP4 и RP5 представляют собой водород. Согласно определенным вариантам осуществления одна или несколько свободных гидроксильных групп соединения (С) замещена кислород-защитной группой (например, силильной защитной группой).
и RP4 и RP5 представляют собой водород. Согласно определенным вариантам осуществления каждый из RP6, RP4 и RP5 представляют собой водород. Согласно определенным вариантам осуществления одна или несколько свободных гидроксильных групп соединения (С) замещена кислород-защитной группой (например, силильной защитной группой).
[00172] Как представлено на Схеме 2D, в настоящем документе раскрыт способ получения соединения формулы (H3-2-II):
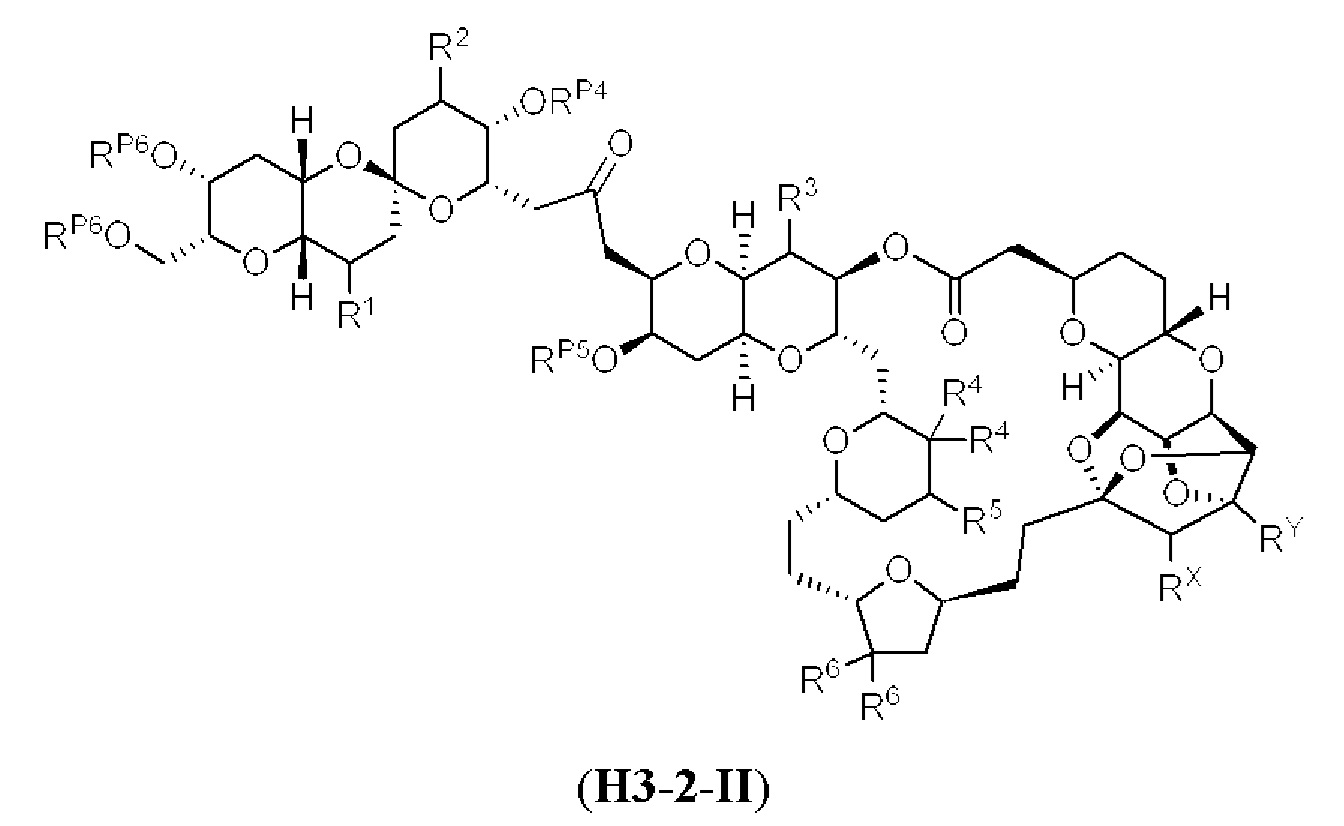
или его соли, причем способ включает в себя сочетание соединения формулы (L-2-6):
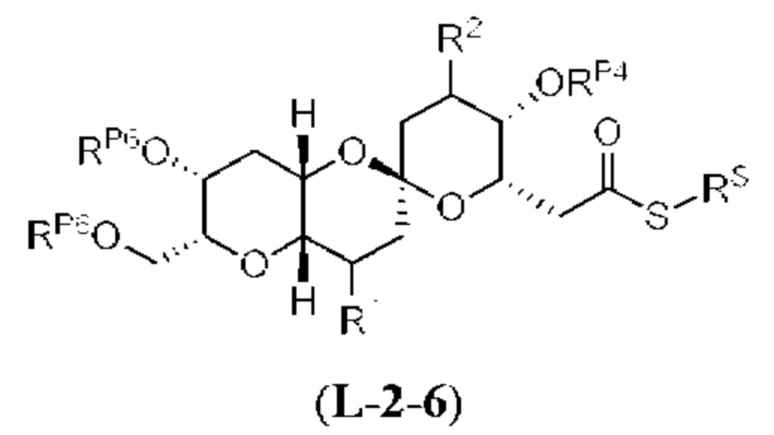
или его соли с соединением формулы (R-2-I):
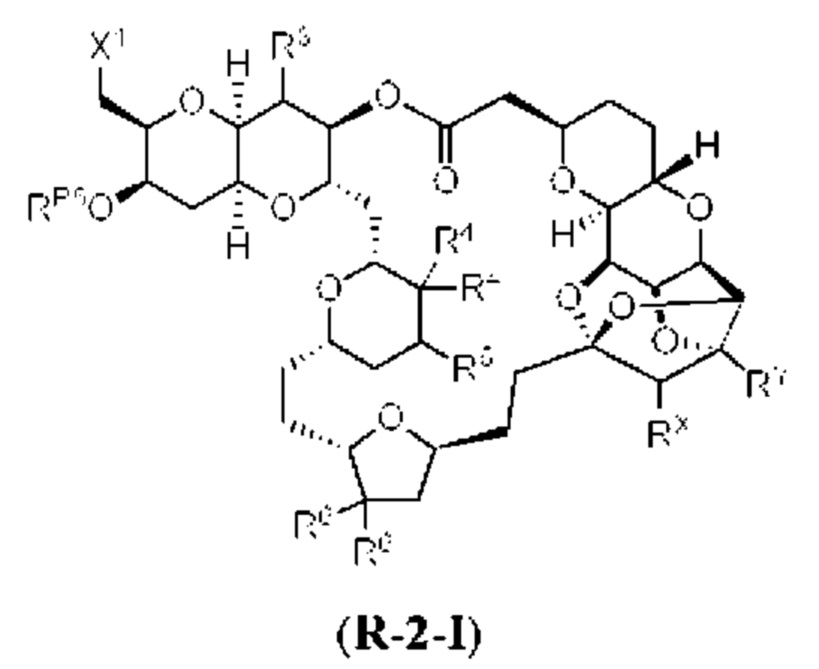
или его солью, где:
RS представляет собой необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил или необязательно замещенный гетероарил;
X1 представляет собой галоген или уходящую группу;
каждый из R1, R2, R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R4 образуют вместе: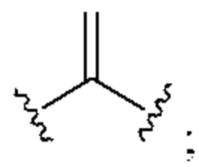
в каждом случае R6 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R6 образуют вместе: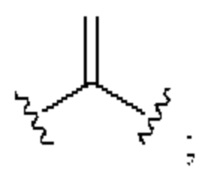
каждый из RP4, RP5 и RP6 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила;
RX представляет собой водород или -ORXa, где RXa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RY представляет собой водород или -ORYa, где RYa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
где RXa и RYa необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетеро циклила.
[00173] Согласно определенным вариантам осуществления способ включает в себя сочетание соединения формулы (E-L):
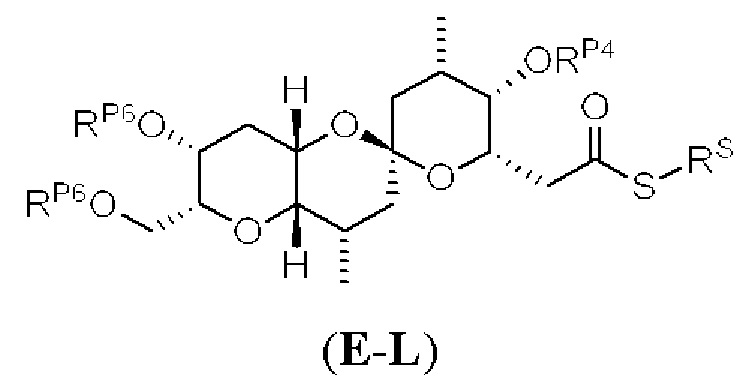
или его соли с соединением формулы (E-R):
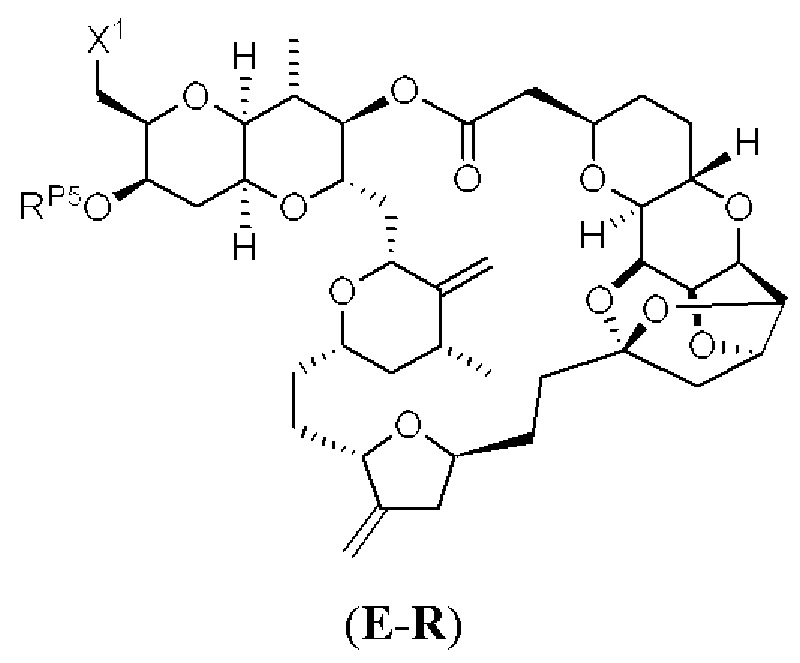
или его солью, с получением соединения формулы (Е-1):
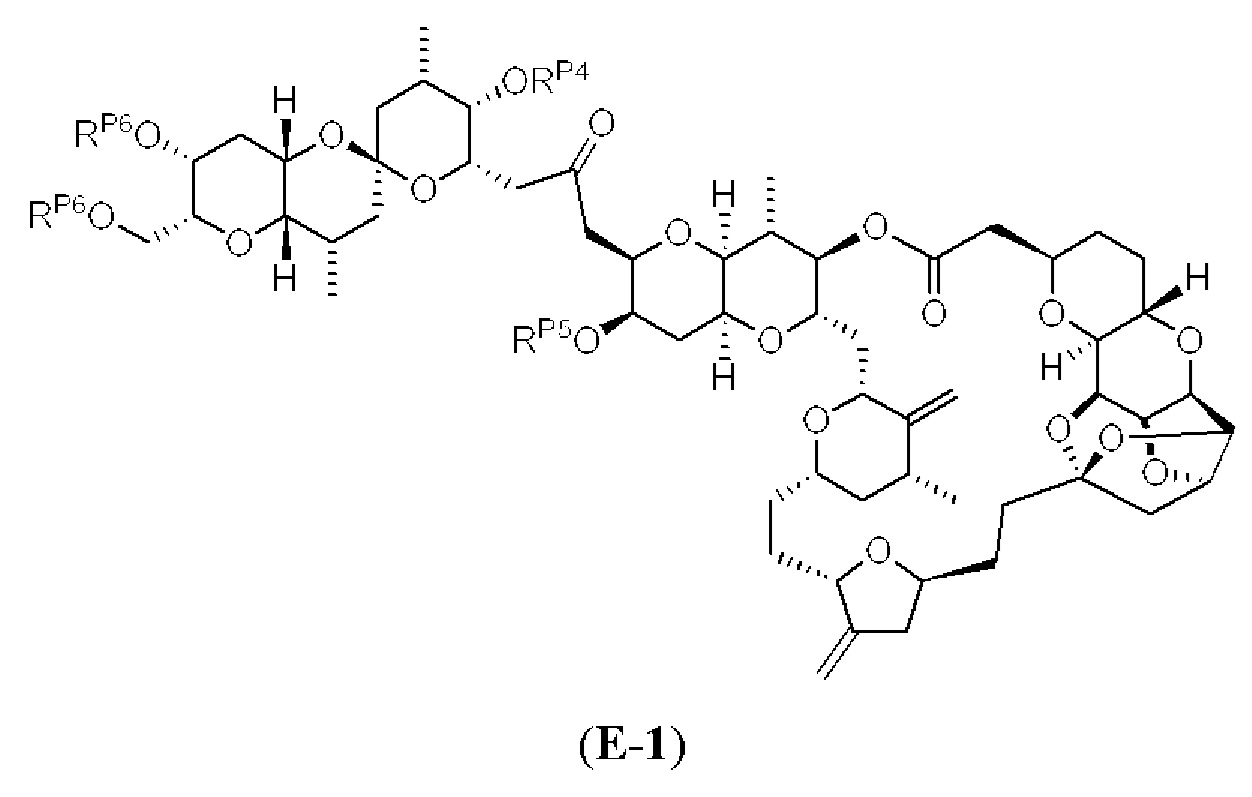
или его соли, где:
RS представляет собой необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил или необязательно замещенный гетероарил;
X1 представляет собой галоген или уходящую группу; и
каждый из RP4, RP5 и RP6 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00174] Согласно определенным вариантам осуществления, стадия сочетания с получением соединения формулы (H3-2-II), (Е-1) или его соли представляет собой Ni/Zr-опосредованную кетолизацию, раскрытую в настоящем документе. Для сочетания могут быть использованы любые реагенты и условия, раскрытые в настоящем документе для Ni/Zr-опосредованной кетолизации (см., например, представленный выше раздел «Ni/Zr-опосредованные реакции кетолизации».
[00175] Согласно определенным вариантам осуществления Ni/Zr-опосредованную реакцию кетолизации проводят в присутствии комплексов никеля и циркония. Согласно определенным вариантам осуществления Ni/Zr-опосредованную реакцию кетолизации проводят в присутствии комплекса никеля, комплекса циркония и металла-восстановителя.
[00176] Согласно определенным вариантам осуществления никель представляет собой комплекс никеля. Согласно определенным вариантам осуществления никель представляет собой комплекс никеля (II) или никеля (0). Согласно определенным вариантам осуществления комплекс никеля характеризуется формулой: NiX2•(лиганд); где X представляет собой галоген, и «лиганд» представляет собой бидентатный лиганд. Согласно определенным вариантам осуществления комплекс никеля используют после формирования комплекса источником никеля и «лигандом» в растворе. Согласно определенным вариантам осуществления источник никеля представляет собой NiCl2; «лиганд» представляет собой 4,4'-ди-трет-бутил-2,2'-дипиридил (tbbpy); и комплекс никеля представляет собой соединение формулы NiCl2•(tbbpy). Согласно определенным вариантам осуществления источник никеля представляет собой NiBR2; «лиганд» представляет собой 4,4'-ди-трет-бутил-2,2'-дипиридил (tbbpy); и комплекс никеля представляет собой соединение формулы NiBR2•(tbbpy).
[00177] Согласно определенным вариантам осуществления комплекс циркония представляет собой Cp2ZrCl2. Согласно определенным вариантам осуществления Cp2ZrCl2 содержится в стехиометрическом или избыточном количестве (например, в количестве 1-4 эквивалентов). Согласно определенным вариантам осуществления металл-восстановитель представляет собой металлический цинк. Согласно определенным вариантам осуществления металл-восстановитель представляет собой металлический марганец. Согласно определенным вариантам осуществления металлический цинк или марганец содержится в избыточном количестве. Реакцию также можно проводить в присутствии одного или нескольких дополнительных реагентов, таких как основание и/или акцептор протонов. Согласно определенным вариантам осуществления реакцию проводят в присутствии (t-Bu)2(Ме)Ру. Согласно определенным вариантам осуществления реакцию проводят в присутствии протонной губки (например, 1,8-бис(диметиламино)нафталина).
[00178] Согласно определенным вариантам осуществления реакцию проводят в присутствии NiBR2(dtbbpy), Cp2ZrCl2 и металлического цинка. Согласно определенным вариантам осуществления реакцию проводят в присутствии NiBR2(dtbbpy), Cp2ZrCl2 и металлического марганца. Согласно определенным вариантам осуществления реакцию проводят в присутствии NiBR2(dtbbpy), Cp2ZrCl2, металлического цинка и (t-Bu)2(Ме)Ру. Согласно определенным вариантам осуществления реакцию проводят в присутствии NiBr2(dtbbpy), Cp2ZrCl2, металлического марганца и (t-Bu)2(Ме)Ру.
[00179] Согласно определенным вариантам осуществления реакцию проводят в полярном растворителе, таком как DMI (1,3-диметил-2-имидазолидинон). Согласно определенным вариантам осуществления реакцию проводят в смеси DMI и EtOAc (этилацетата). Согласно определенным вариантам осуществления реакцию проводят в смеси DMI и этанола. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от комнатной температуры приблизительно до 100°С. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от комнатной температуры приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при температуре около комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят приблизительно при 30°С.
[00180] Например, согласно определенным вариантам осуществления сочетание проводят в следующих условиях: 30 мол. % NiBr2(dtbbpy), 3,0 эквивалента Cp2ZrCl2, 6,0 эквивалентов металлического цинка и 4,0 эквивалента (t-Bu)2(Ме)Ру в DMI-EtOAc при комнатной температуре.
[00181] Согласно определенным вариантам осуществления сочетание проводят в присутствии NiBr2(dtbbpy), Cp2ZrCl2 и металлического марганца в DMI. Например, согласно определенным вариантам осуществления сочетание проводят в следующих условиях: приблизительно 75 мол. % NiBr2(dtbbpy), 3,5 эквивалента Cp2ZrCl2 и 7 эквивалентов металлического марганца в DMI приблизительно при 30°С (например, в течение 4 часов).
[00182] Согласно определенным вариантам осуществления сочетание проводят путем осуществления взаимодействия соединения формулы (L-2-6) или его соли в присутствии соединения формулы (R-2-I) или его соли, Cp2ZrCl2 и металлического марганца; с последующим добавлением к реакционной смеси NiBr2(dtbbpy). Согласно определенным вариантам осуществления сочетание проводят путем осуществления взаимодействия соединения формулы (L-2-6) или его соли в присутствии соединения формулы (R-2-I) или его соли, Cp2ZrCl2 и металлического марганца в DMI; с последующим добавлением к реакционной смеси NiBr2(dtbbpy) в растворе DMI.
[00183] Согласно определенным вариантам осуществления сочетание проводят путем осуществления взаимодействия соединения формулы (E-L) или его соли в присутствии соединения формулы (R-L) или его соли, Cp2ZrCl2 и металлического марганца; с последующим добавлением к реакционной смеси NiBR2(dtbbpy). Согласно определенным вариантам осуществления сочетание проводят путем осуществления взаимодействия соединения формулы (E-L) или его соли в присутствии соединения формулы (R-L) или его соли, Cp2ZrCl2 и металлического марганца в DMI; с последующим добавлением к реакционной смеси NiBr2(dtbbpy) в растворе DMI.
[00184] Реакция сочетания с получением соединения формулы (H3-2-II), (Е-1) или его соли может проводиться с получением любого количества продукта. Согласно определенным вариантам осуществления реакцию проводят с получением более 1 г, 2 г, 5 г, 10 г, 20 г, 30 г, 50 г, 100 г, 200 г, 500 г или 1 кг продукта. Согласно определенным вариантам осуществления реакцию проводят с получением менее 1 г продукта. Согласно определенным вариантам осуществления реакцию проводят с получением от 1 г до 100 г продукта, включительно. Согласно определенным вариантам осуществления реакцию проводят с получением приблизительно 1 г, 2 г, 5 г, 10 г, 20 г, 30 г, 40 г, 50 г, 60 г, 70 г, 80 г, 90 г или 100 г продукта.
[00185] Согласно определенным вариантам осуществления X1 представляет собой галоген, и RS представляет собой необязательно замещенный пиридил. Согласно определенным вариантам осуществления X1 представляет собой -I. Согласно определенным вариантам осуществления RS представляет собой 2-пиридил. Согласно определенным вариантам осуществления X1 представляет собой -I; и RS представляет собой 2-пиридил.
[00186] Согласно определенным вариантам осуществления два RP6 объединены с образованием:  и RP4 и RP5 представляют собой силильные защитные группы. Согласно определенным вариантам осуществления два RP6 объединены с образованием:
и RP4 и RP5 представляют собой силильные защитные группы. Согласно определенным вариантам осуществления два RP6 объединены с образованием:  и RP4 и RP5 представляют собой TES.
и RP4 и RP5 представляют собой TES.
[00187] Согласно определенным вариантам осуществления способ получения соединения формулы (H3-2-II) дополнительно содержит одну или несколько стадий снятия защитных групп с одного или нескольких атомов кислорода (например, для удаления групп RP4, RP5 и/или RP6) соединения формулы (H3-2-II) (например, с получением соединения формулы (H3-2-IIA) или его соли). Согласно определенным вариантам осуществления полученное соединение или его соль могут быть затем использованы на стадии циклизации с получением соединения формулы (H3-2-I) или его соли. По аналогии, способ получения соединения формулы (Е-1) может дополнительно содержать одну или несколько стадий снятия защитных групп с одного или нескольких атомов кислорода (например, для удаления групп RP4, RP5 и/или RP6) соединения формулы (Е-1) (например, с получением соединения (С) или его соли). Согласно определенным вариантам осуществления полученное соединение или его соль могут быть затем использованы на стадии циклизации с получением соединения (2).
[00188] Согласно определенным вариантам осуществления стадию снятия защитных групп проводят в присутствии источника фторида (например, если RP4, RP5 и/или RP6 представляют собой силильные защитные группы). Примеры источников фторида раскрыты в настоящем документе. Согласно определенным вариантам осуществления источник фтора представляет собой TBAF. Согласно определенным вариантам осуществления стадию снятия защитных групп проводят в присутствии гидрохлорида имидазола. Согласно определенным вариантам осуществления RP4 и RP5 представляют собой TES; и стадию снятия защитных групп (для удаления RP4 и RP5) проводят в присутствии TBAF и гидрохлорида имидазола. Согласно определенным вариантам осуществления два RP6 объединены с образованием:  RP4 и RP5 представляют собой TES; и стадию снятия защитных групп (для удаления RP6, RP4 и RP5) проводят в присутствии TBAF и гидрохлорида имидазола. Согласно определенным вариантам осуществления реакцию проводят в растворителе, таком как THF.
RP4 и RP5 представляют собой TES; и стадию снятия защитных групп (для удаления RP6, RP4 и RP5) проводят в присутствии TBAF и гидрохлорида имидазола. Согласно определенным вариантам осуществления реакцию проводят в растворителе, таком как THF.
[00189] После получения соединения формулы (H3-2-I), (Е-1) или его соли, способ может содержать одну или несколько дополнительных стадий (например, снятия защитных групп, введения защитных групп, замещения, присоединения, отщепления) с получением целевого соединения.
Синтез амино-аналогов галихондринов
[00190] В настоящем документе раскрыты способы получения амино-аналогов галихондринов, таких как соединение формулы (Н3-А). Например, как представлено ниже на Схеме 4, соединения формулы (Н3-А) могут быть получены путем преобразования соединения формулы (Н3-ОН). Первичную гидроксильную группу (помечена * на Схеме 4) преобразуют до уходящей группы -ORL путем обработки соединения формулы (Н3-А) реагентом формулы XL-RL. Группа -ORL может быть затем заменена на амин или предшественник амина. Согласно определенным вариантам осуществления способ включает в себя замещение первичной группы -ORL азидом (-N3) (т.е., с получением соединения формулы (H3-N3)). Фрагмент азида может быть затем восстановлен до амина с получением соединения формулы (Н3-А).
Схема 83
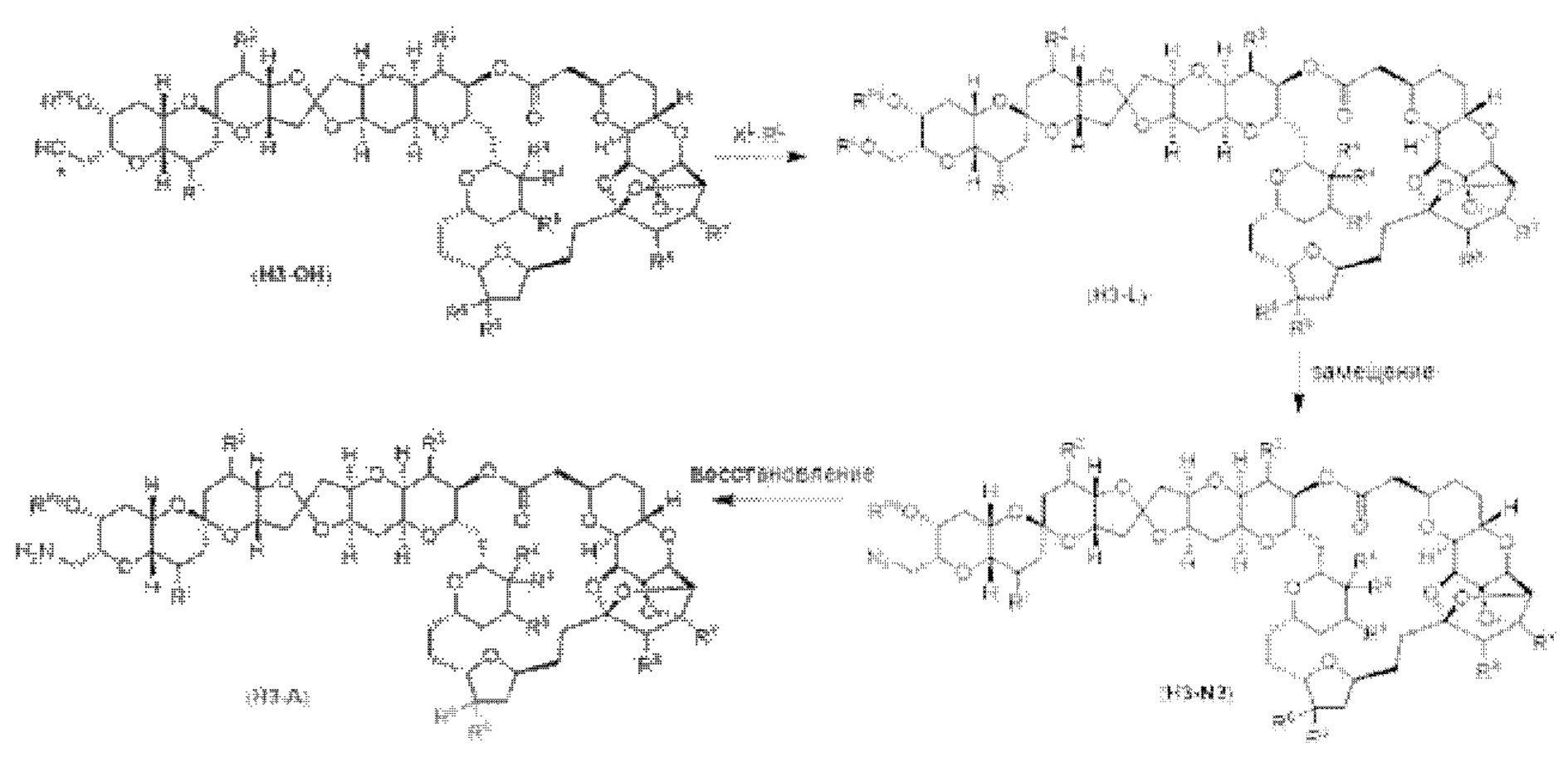
[00191] Согласно определенным вариантам осуществления соединение формулы (Н3-А) представляет собой соединение (1) или его соль. Поэтому, в настоящем документе раскрыты способы получения соединения (1) и его солей. Например, как представлено ниже на Схеме 2, соединение (1) может быть получено путем преобразования соединения (2) до соединения формулы (А). На этой стадии, первичную гидроксильную группу соединения (2) (помечена * на Схеме 2) преобразуют до уходящей группы -ORL путем обработки соединения (2) реагентом формулы XL-RL. Согласно определенным вариантам осуществления уходящая группа представляет собой сульфонат (т.е., RL представляет собой необязательно замещенный сульфонил). Группа -ORL может быть затем заменена на амин или предшественник амина. Согласно определенным вариантам осуществления способ включает в себя замещение первичной группы -ORL азидом (-N3) (т.е., с получением соединения формулы (В)). Фрагмент азида соединения формулы (В) может быть затем восстановлен до амина с получением соединения (1).
Схема 84
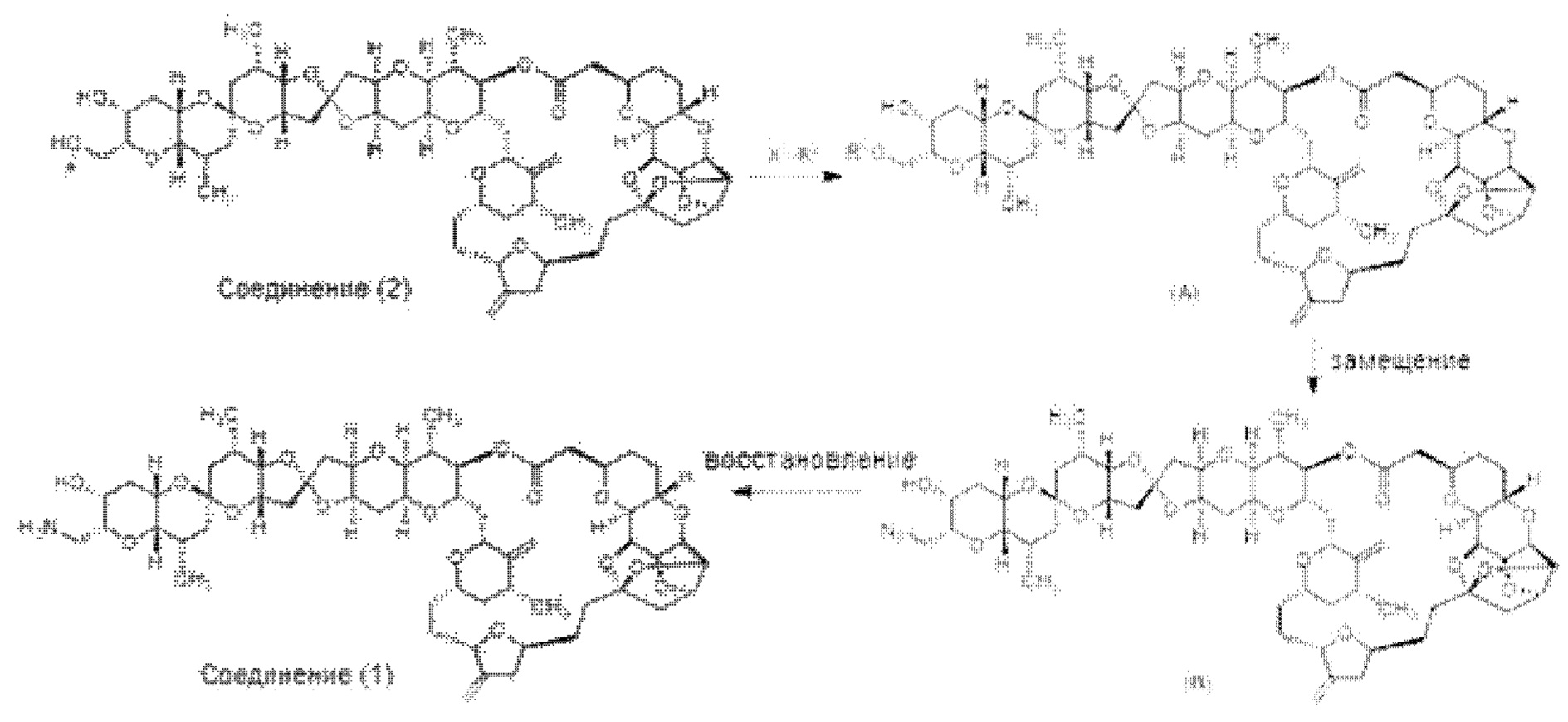
[00192] Как представлено выше на Схеме 4, в настоящем документе раскрыт способ получения соединения формулы (Н3-А):
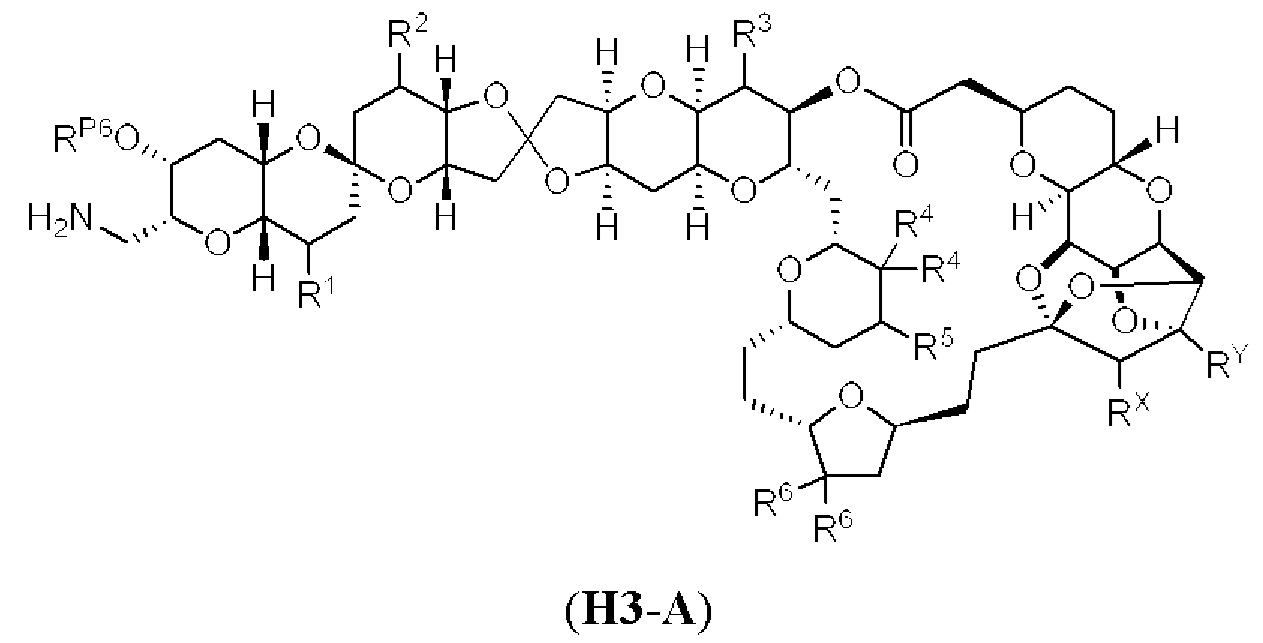
или его соли, причем способ включает в себя стадию восстановления соединения формулы (H3-N3):
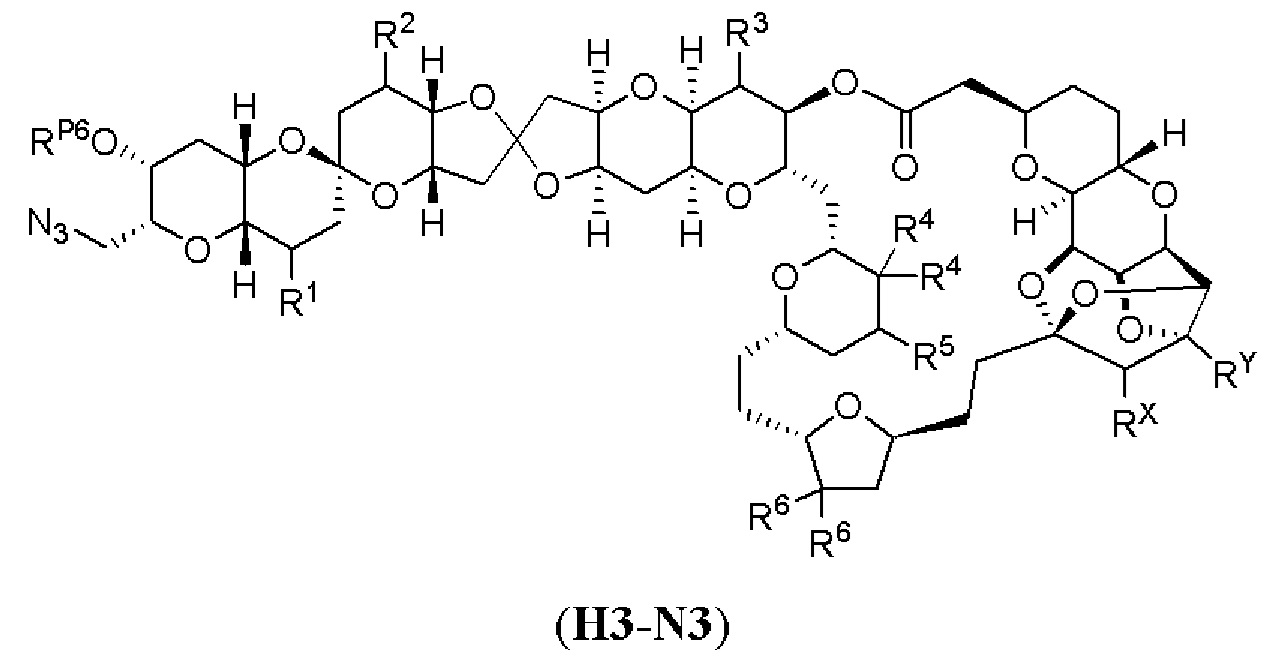
или его соли, где:
каждый из R1, R2, R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R4 образуют вместе: 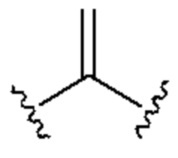 ;
;
в каждом случае R6 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R6 образуют вместе: 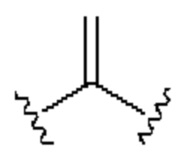 ;
;
каждый из RP4, RP5 и RP6 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
RX представляет собой водород или -ORXa, где RXa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RY представляет собой водород или -ORYa, где RYa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
где RXa и RYa необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетеро циклила.
[00193] Согласно определенным вариантам осуществления, представленным на Схеме 2, в настоящем документе раскрыт способ получения соединения (1):
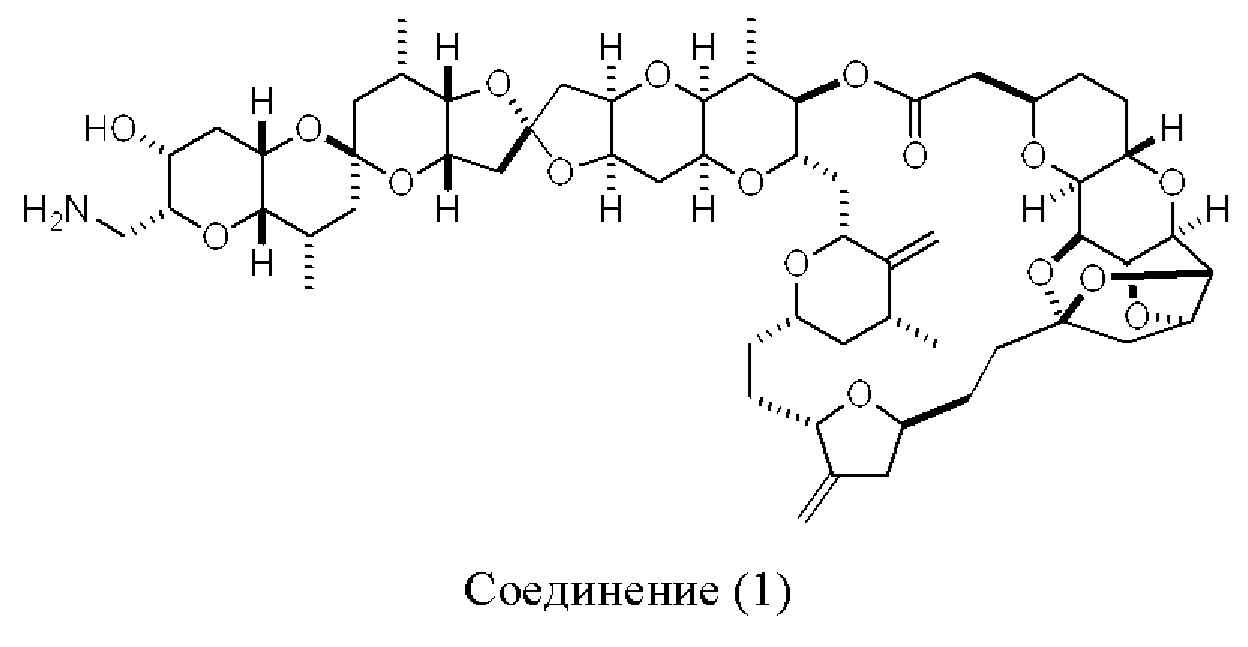
или его соли, причем способ включает в себя восстановление соединения формулы (В):
или его соли.
[00194] Стадия восстановления с получением соединения формулы (Н3-А), соединения (1) или его соли, может проводиться в присутствии любых реагентов или условий, способных восстановить азид до амина (см., например, Chem. Rev., 1988, 88 (2), рр 297-368). Согласно определенным вариантам осуществления стадию восстановления проводят в присутствии фосфинового реагента (т.е., реакция Штаудингера). Согласно определенным вариантам осуществления фосфин представляет собой триалкилфосфин. Согласно определенным вариантам осуществления фосфин представляет собой триарилфосфин. Согласно определенным вариантам осуществления фосфин представляет собой трифенилфосфин (Ph3P). Согласно определенным вариантам осуществления фосфиновый реагент представляет собой связанный с полимером фосфин. Согласно определенным вариантам осуществления фосфиновый реагент представляет собой связанный с полимером трифенилфосфин. Согласно определенным вариантам осуществления за обработкой фосфином следует обработка водой, например, обработка водными растворами.
[00195] Согласно определенным вариантам осуществления используют приблизительно 1 эквивалент фосфинового реагента. Согласно определенным вариантам осуществления используют более 1 эквивалента фосфинового реагента. Согласно определенным вариантам осуществления используют приблизительно 1-10 эквивалентов фосфинового реагента. Согласно определенным вариантам осуществления используют приблизительно 1-5 эквивалентов фосфинового реагента. Согласно определенным вариантам осуществления используют приблизительно 3 эквивалента фосфина. Согласно определенным вариантам осуществления реакцию проводят в растворителе. Согласно определенным вариантам осуществления реакцию проводят в THF. Согласно определенным вариантам осуществления реакцию проводят в THF и воде. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от комнатной температуры приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при температуре около комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят приблизительно при 25°С.
[00196] Согласно определенным вариантам осуществления реакцию проводят в присутствии связанного с полимером PPh3 в THF и воде. Согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 3 эквивалента связанного с полимером PPh3 в THF и воде приблизительно при 25°С (например, в течение 70 часов).
[00197] Согласно определенным вариантам осуществления продукт очищают и выделяют путем осаждения. Согласно определенным вариантам осуществления продукт очищают методом колоночной хроматографии. Согласно определенным вариантам осуществления продукт выделяют и сушат с использованием комбинации колоночной хроматографии и осаждения.
[00198] Согласно определенным вариантам осуществления RP6 представляет собой водород. Согласно определенным вариантам осуществления RP6 представляет собой кислород-защитную группу. Согласно определенным вариантам осуществления RP6 представляет собой силильную защитную группу. Согласно определенным вариантам осуществления одна или несколько свободных гидроксильных групп соединения (В) и соединения (1) замещена кислород-защитной группой (например, силильной защитной группой).
[00199] Другие реагенты и условия могут быть использованы для преобразования азида соединения (В) или соединения формулы (H3-N3) до амина. Например, согласно определенным вариантам осуществления стадию восстановления проводят в присутствии палладия и водорода (например, Pd/C и Н2). Согласно определенным вариантам осуществления стадию восстановления проводят в присутствии источника гидрида (т.е., Н-).
[00200] Как представлено на Схеме 4, в настоящем документе также раскрыт способ получения соединения формулы (H3-N3):
или его соли, причем способ включает в себя стадию осуществления взаимодействия соединения формулы (H3-L):
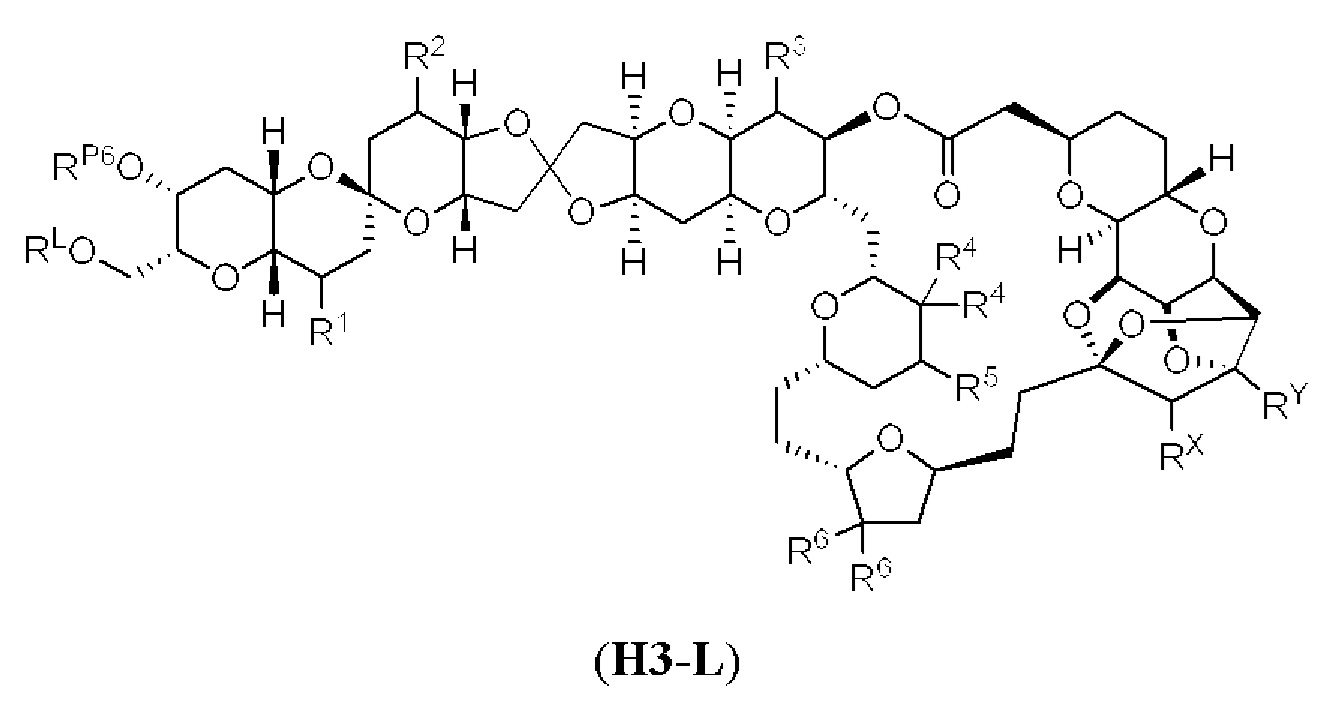
или его соли в присутствии азида с получением соединения формулы (H3-N3) или его соли, где:
RL представляет собой необязательно замещенный сульфонил, необязательно замещенный сульфинил, необязательно замещенный фосфорил или необязательно замещенный ацил;
каждый из R1, R2, R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R4 образуют вместе: 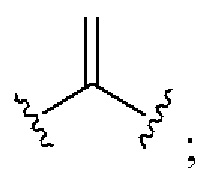
в каждом случае R6 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R6 образуют вместе: 
каждый из RP4, RP5 и RP6 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
RX представляет собой водород или -ORXa, где RXa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RY представляет собой водород или -ORYa, где RYa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
где RXa и RYa необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00201] Согласно определенным вариантам осуществления, представленным на Схеме 2, способ представляет собой способ получения соединения формулы (В):
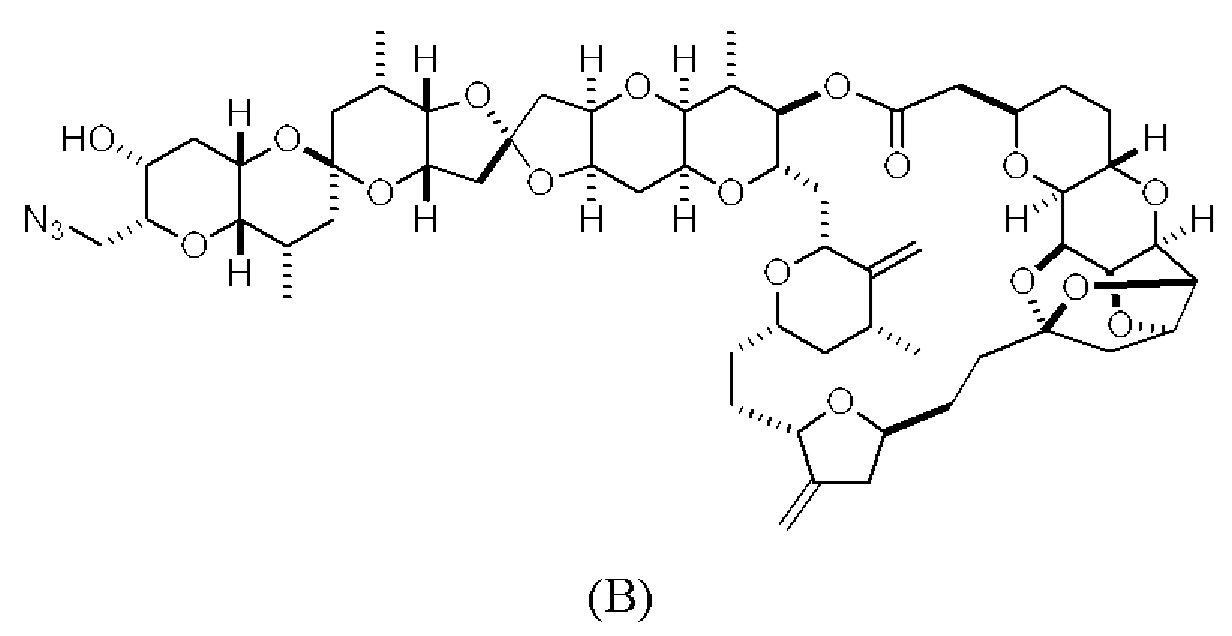
или его соли, причем способ включает в себя осуществление взаимодействия соединения формулы (А):
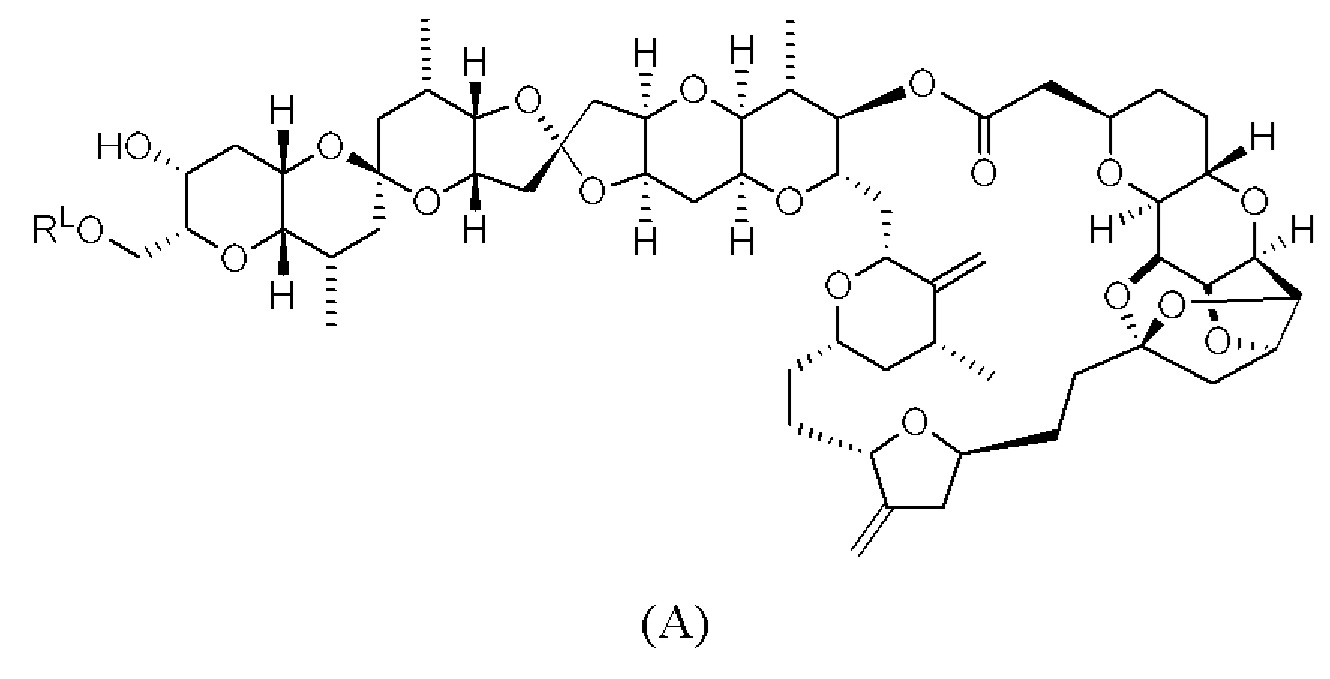
или его соли в присутствии азида, где:
RL представляет собой необязательно замещенный сульфонил, необязательно замещенный сульфинил, необязательно замещенный фосфорил или необязательно замещенный ацил.
[00202] Реакцию с получением соединения формулы (H3-N3), соединения (В) или его соли проводят в присутствии азида. Согласно определенным вариантам осуществления азид представляет собой соль азида. Согласно определенным вариантам осуществления азид представляет собой азид натрия (NaN3) или азид калия (KN3). Согласно определенным вариантам осуществления азид представляет собой азид тетраалкиламмония (т.е., [(алкил)4N]N3). Согласно определенным вариантам осуществления азид представляет собой азид тетрабутиламмония ([n-Bu4N]N3). Согласно определенным вариантам осуществления содержится приблизительно 1 эквивалент азида. Согласно определенным вариантам осуществления содержится более 1 эквивалента азида. Согласно определенным вариантам осуществления содержится приблизительно 1-10 эквивалентов азида. Согласно определенным вариантам осуществления содержится приблизительно 5-10 эквивалентов азида. Согласно определенным вариантам осуществления содержится приблизительно 8 эквивалентов азида.
[00203] Согласно определенным вариантам осуществления реакцию проводят в растворителе. Согласно определенным вариантам осуществления растворитель представляет собой полярный растворитель. Согласно определенным вариантам осуществления растворитель представляет собой неполярный растворитель. Согласно определенным вариантам осуществления растворитель представляет собой толуол. Согласно определенным вариантам осуществления реакцию проводят при температуре выше комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне при температуре от комнатной до приблизительно 150°С. Согласно определенным вариантам осуществления реакцию проводят приблизительно при 100°С.
[00204] Согласно определенным вариантам осуществления реакцию проводят в присутствии азида тетрабутиламмония ([n-Bu4N]N3) в толуоле. Согласно определенным вариантам осуществления реакцию проводят в присутствии азида тетрабутиламмония ([n-Bu4N]N3) в толуоле приблизительно при 100°С. Согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 8 эквивалентов азида тетрабутиламмония ([n-Bu4N]N3) в толуоле приблизительно при 100°С (например, в течение 5 часов).
[00205] Согласно определенным вариантам осуществления RP6 представляет собой водород, и RL представляет собой Ts. Согласно определенным вариантам осуществления RP6 представляет собой кислород-защитную группу, и RL представляет собой Ts. Согласно определенным вариантам осуществления RP6 представляет собой силильную защитную группу, и RL представляет собой Ts. Согласно определенным вариантам осуществления одна или несколько свободных гидроксильных групп соединения (А) и соединения (В) замещена кислород-защитной группой (например, силильной защитной группой).
[00206] Согласно определенным вариантам осуществления соединение формулы (А) представляет собой следующее соединение:
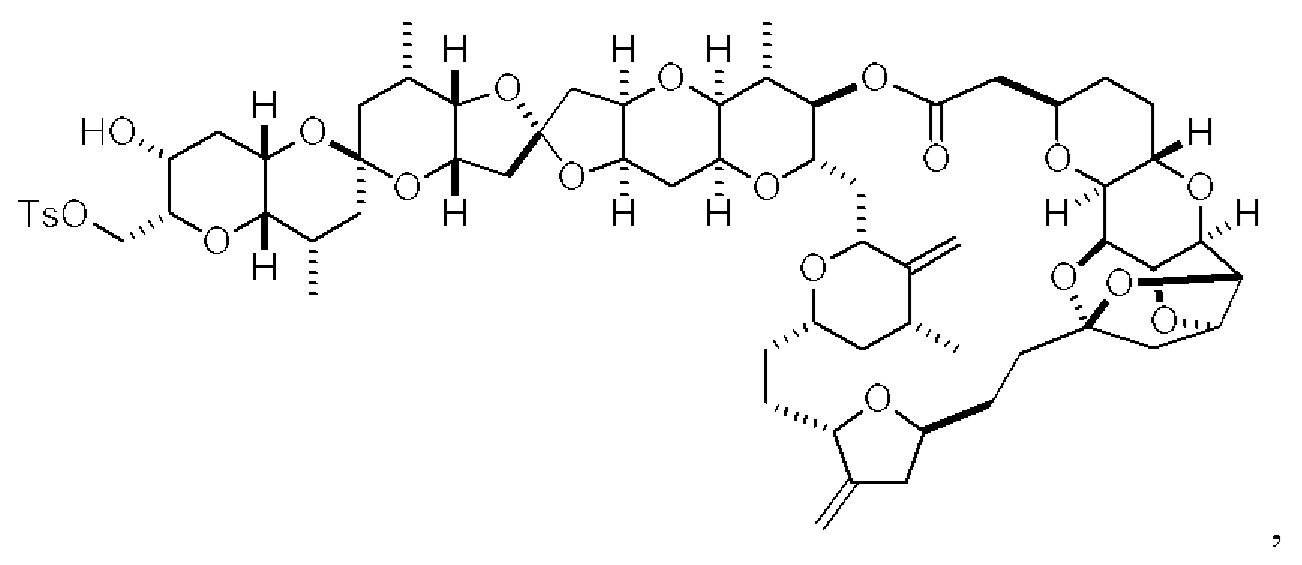
или его соль. «Ts» представляет собой тозильную группу формулы: 
[00207] В настоящем документе также раскрыт способ получения соединения формулы (H3-L):
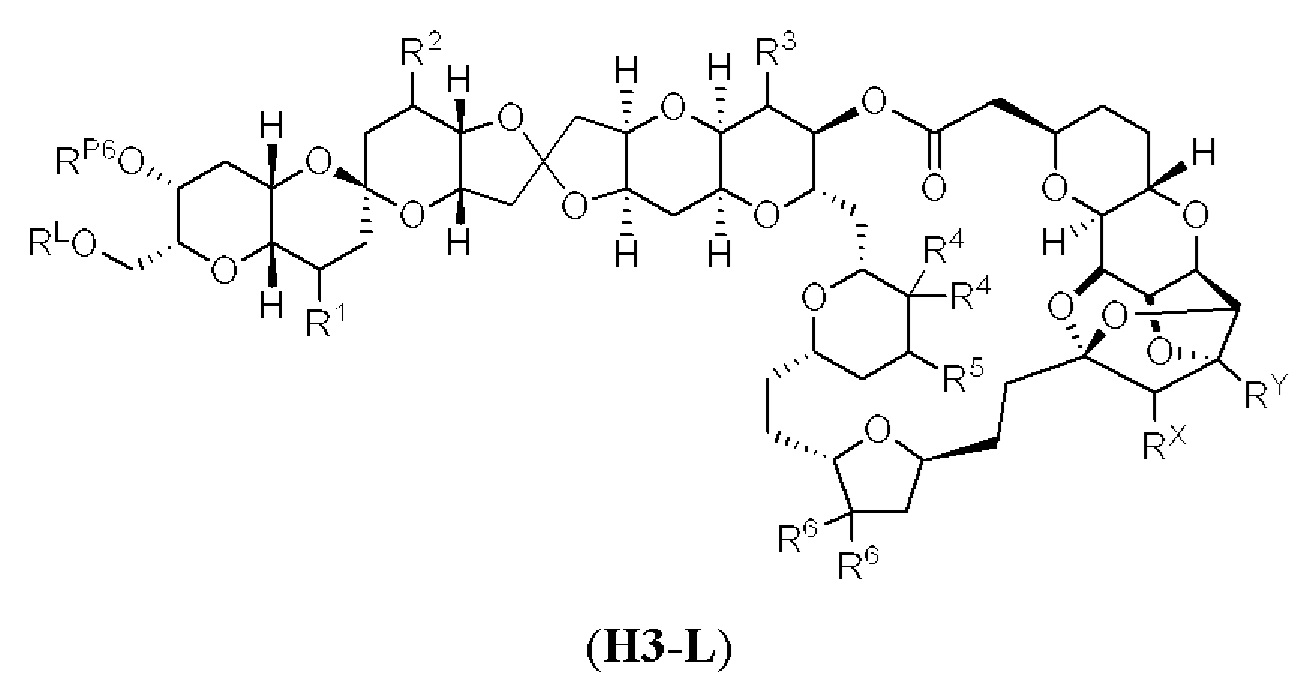
или его соли, причем способ включает в себя стадию осуществления взаимодействия соединения формулы (Н3-ОН):
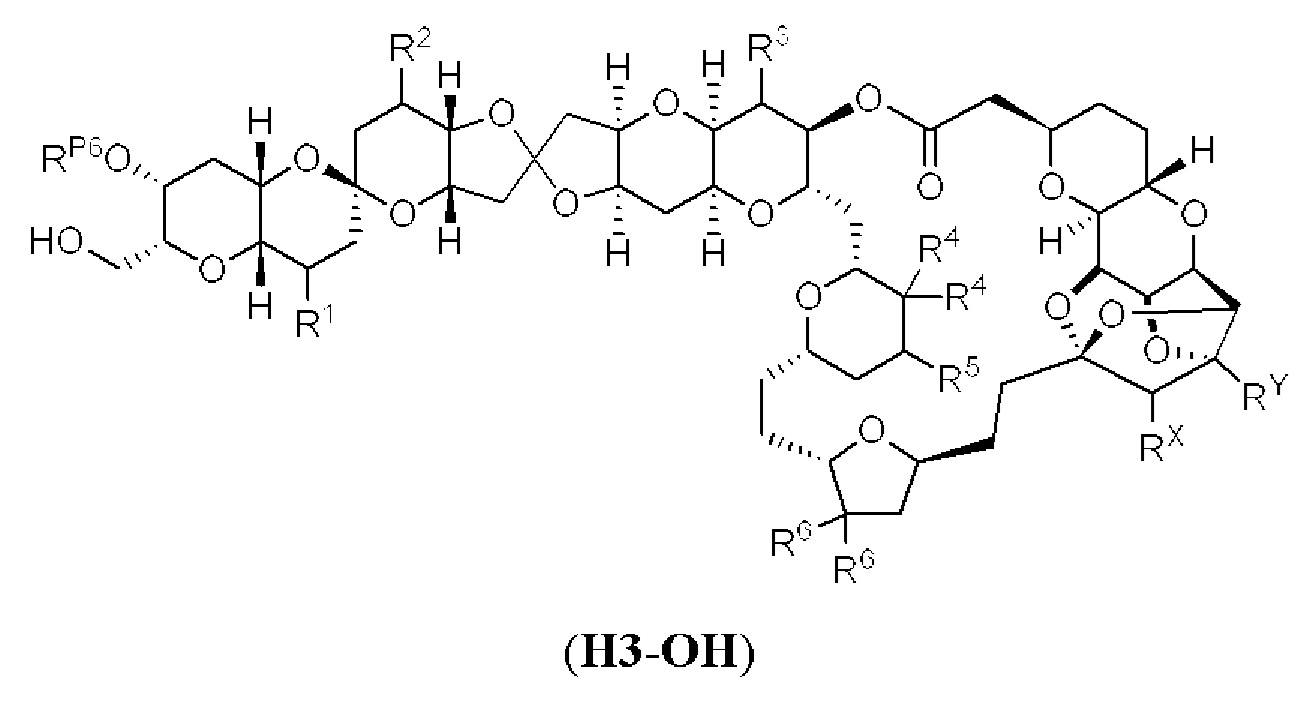
или его соли в присутствии реагента формулы XL-RL, с получением соединения формулы (H3-L) или его соли, где:
RL представляет собой необязательно замещенный сульфонил, необязательно замещенный сульфинил, необязательно замещенный фосфорил или необязательно замещенный ацил;
XL представляет собой галоген или уходящую группу;
каждый из R1, R2, R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R4 образуют вместе: 
в каждом случае R6 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R6 образуют вместе: 
каждый из RP4, RP5 и RP6 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
RX представляет собой водород или -ORXa, где RXa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RY представляет собой водород или -ORYa, где RYa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
где RXa и RYa необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетеро циклила.
[00208] Согласно определенным вариантам осуществления способ представляет собой способ получения соединения формулы (А):
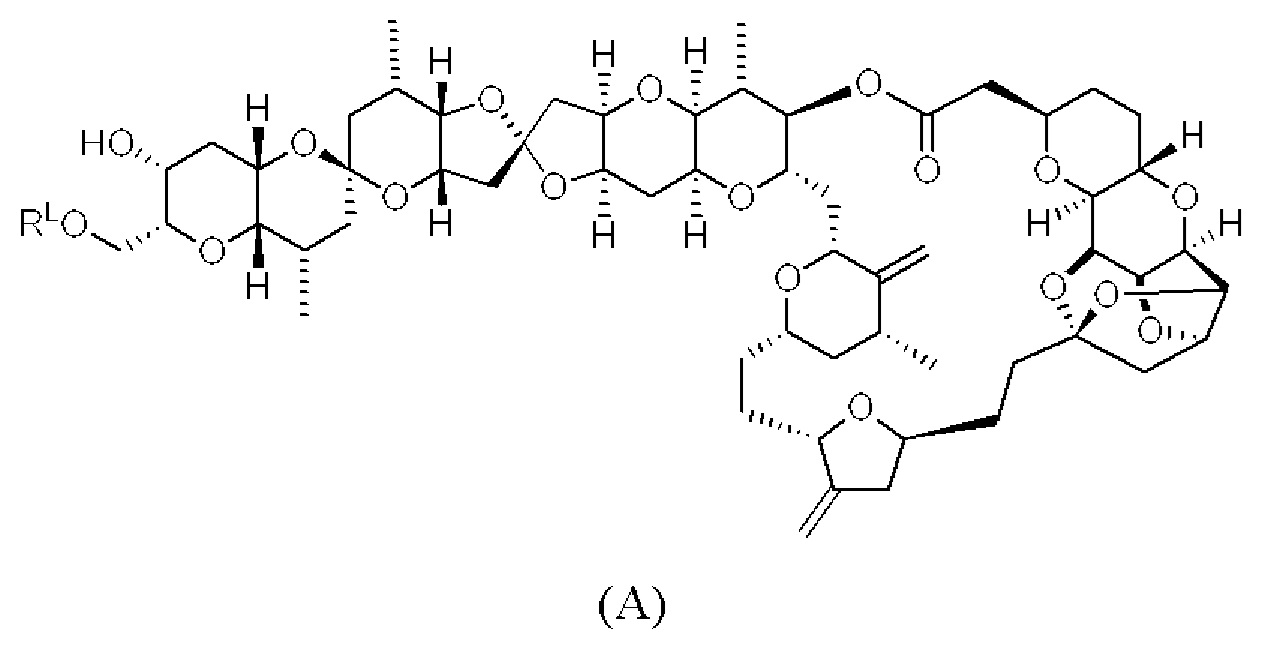
или его соли, причем способ включает в себя осуществление взаимодействия соединения (2):
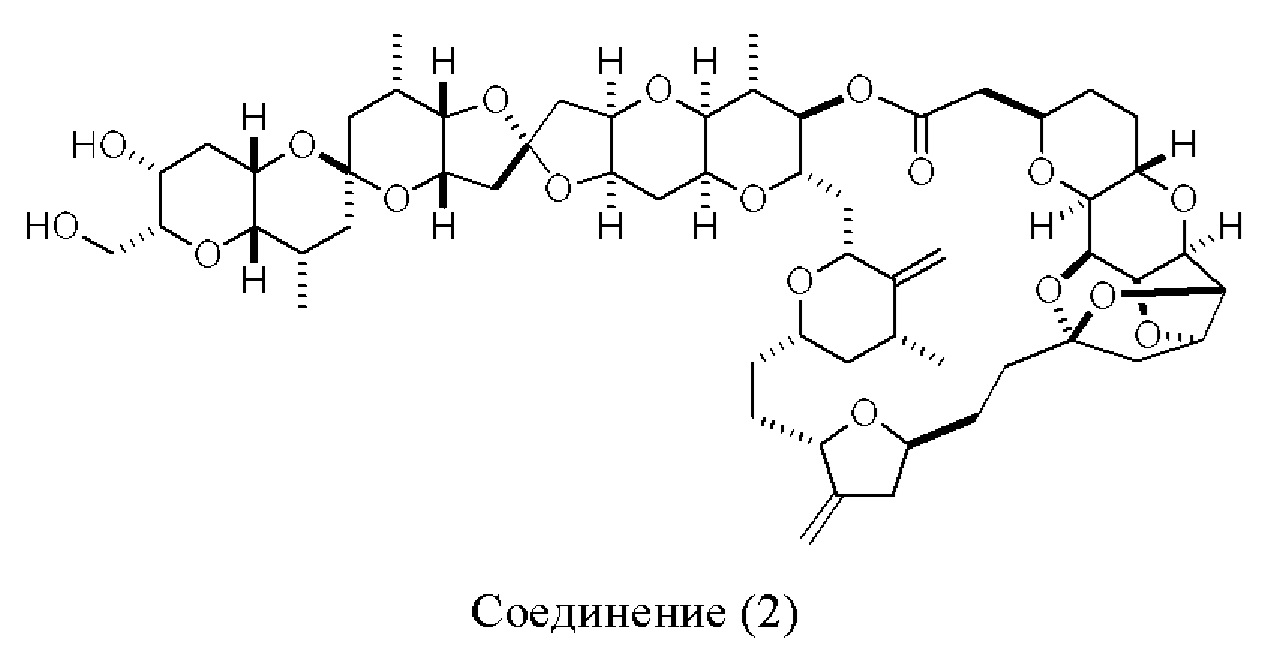
или его соли в присутствии реагента формулы XL-RL, где:
XL представляет собой галоген или уходящую группу; и
RL представляет собой необязательно замещенный сульфонил, необязательно замещенный сульфинил, необязательно замещенный фосфорил или необязательно замещенный ацил.
[00209] Реакцию с получением соединения формулы (H3-L), соединения (А) или его соли проводят в присутствии реагента формулы XL-RL. Итоговая трансформация приводит к преобразованию первичной гидроксильной группы исходного вещества до уходящей группы (например, сульфонильной уходящей группы) формулы -ORL.
[00210] Согласно определенным вариантам осуществления реагент формулы XL-RL представляет собой сульфонилирующий реагент. Сульфонилирующие реагенты, способные преобразовывать свободную гидроксильную группу до сульфонатной уходящей группы, известны из уровня техники. Согласно определенным вариантам осуществления реагент формулы XL-RL представляет собой сульфонилгалогенид (т.е., где RL представляет собой необязательно замещенный сульфонил). Согласно определенным вариантам осуществления реагент представляет собой тозилгалогенид (т.е., XL-Ts). Согласно определенным вариантам осуществления реагент представляет собой сульфонилхлорид (X1 представляет собой хлор, и RL представляет собой необязательно замещенный сульфонил). Согласно определенным вариантам осуществления реагент представляет собой тозилхлорид (TsCl). Согласно определенным вариантам осуществления используют приблизительно 1 эквивалент реагента. Согласно определенным вариантам осуществления используют более 1 эквивалента реагента. Согласно определенным вариантам осуществления используют приблизительно 3 эквивалента реагента.
[00211] Согласно определенным вариантам осуществления реакцию проводят в присутствии одного или нескольких дополнительных реагентов. Согласно определенным вариантам осуществления реакцию проводят в присутствии основания. Согласно определенным вариантам осуществления основание представляет собой азотное основание. Согласно определенным вариантам осуществления основание представляет собой аминовое основание. Согласно определенным вариантам осуществления основание представляет собой триалкиламиновое основание. Примеры аминового основания включают в себя без ограничения триэтиламин (TEA) и диизопропилэтиламин (DIPEA). Согласно определенным вариантам осуществления основание представляет собой триэтиламин (TEA). Согласно определенным вариантам осуществления основание представляет собой гетероциклическое основание. Примеры гетероциклических оснований включают в себя без ограничения пиридиновое и имидазольное основания. Согласно определенным вариантам осуществления используют приблизительно 1 эквивалент основания. Согласно определенным вариантам осуществления используют более 1 эквивалента основания. Согласно определенным вариантам осуществления используют избыток (например, приблизительно 6 эквивалентов) основания.
[00212] Согласно определенным вариантам осуществления реакцию проводят в присутствии кислоты Льюиса. Согласно определенным вариантам осуществления кислота Льюиса представляет собой оксид дибутилолова. Согласно определенным вариантам осуществления кислота Льюиса содержится в количестве 1 эквивалента или менее (например, 0,5 эквивалента).
[00213] Согласно определенным вариантам осуществления реакцию проводят в растворителе. Согласно определенным вариантам осуществления растворитель представляет собой дихлорметан (DCM). Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от комнатной температуры приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при температуре около комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят приблизительно при 25°С.
[00214] Согласно определенным вариантам осуществления реакцию проводят в присутствии TsCl, TEA и кислоты Льюиса. Согласно определенным вариантам осуществления реакцию проводят в присутствии TsCl, TEA и оксида дибутилолова. Согласно определенным вариантам осуществления реакцию проводят в присутствии TsCl, TEA и оксида дибутилолова в DCM. Согласно определенным вариантам осуществления реакцию проводят в присутствии TsCl, TEA и оксида дибутилолова в DCM приблизительно при 25°С. Согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 3 эквивалента TsCl, избыток TEA (например, приблизительно 6 эквивалентов) и менее 1 эквивалента оксида дибутилолова (например, 0,6 эквивалента) в DCM приблизительно при 25°С (например, в течение 3 часов).
[00215] Согласно определенным вариантам осуществления RP6 представляет собой водород, и RL представляет собой Ts. Согласно определенным вариантам осуществления RP6 представляет собой кислород-защитную группу, и RL представляет собой Ts. Согласно определенным вариантам осуществления RP6 представляет собой силильную защитную группу, и RL представляет собой Ts. Согласно определенным вариантам осуществления одна или несколько свободных гидроксильных групп соединения (А) и соединения (2) замещена кислород-защитной группой (например, силильной защитной группой).
[00216] Способы получения исходных веществ (т.е., соединений формулы (Н3-ОН), соединения (2) и их солей) раскрыты в настоящем документе, например, в подразделе, озаглавленном «Синтез дополнительных аналогов галихондрина».
Получение структурных элементов «правой половины»
[00217] В настоящем документе также раскрыты способы, применимые для получения структурных элементов «правой половины» галихондринов (например, галихондрина А, В, С; гомогалихондрина А, В, С, норгалихондрина А, В, С, и их аналогов). Например, как описано выше, соединения формулы (R-2-I) применимы в качестве структурных элементов правой половины. Как представлено ниже на Схеме 3А, соединение формулы (R-2-I) может быть получено путем замещения соединения формулы (R-4-11B) (т.е., замещения группы -ORP7 группой -X1). Соединение формулы (R-4-11B) может быть получено путем снятия защитных групп и повторного введения защитных групп одного или нескольких атомов кислорода соединения формулы (R-4-11A), преобразуя тем самым одну группу -ORP5 до группы -ORP7). Как также представлено на Схеме 3А, соединение формулы (R-4-11) может быть получено путем циклизации соединения формулы (R-4-10). Кроме того, соединение формулы (R-4-10) может быть получено путем сочетания соединения формулы (R-4-8) с соединением формулы (R-4-9).
Схема 3А
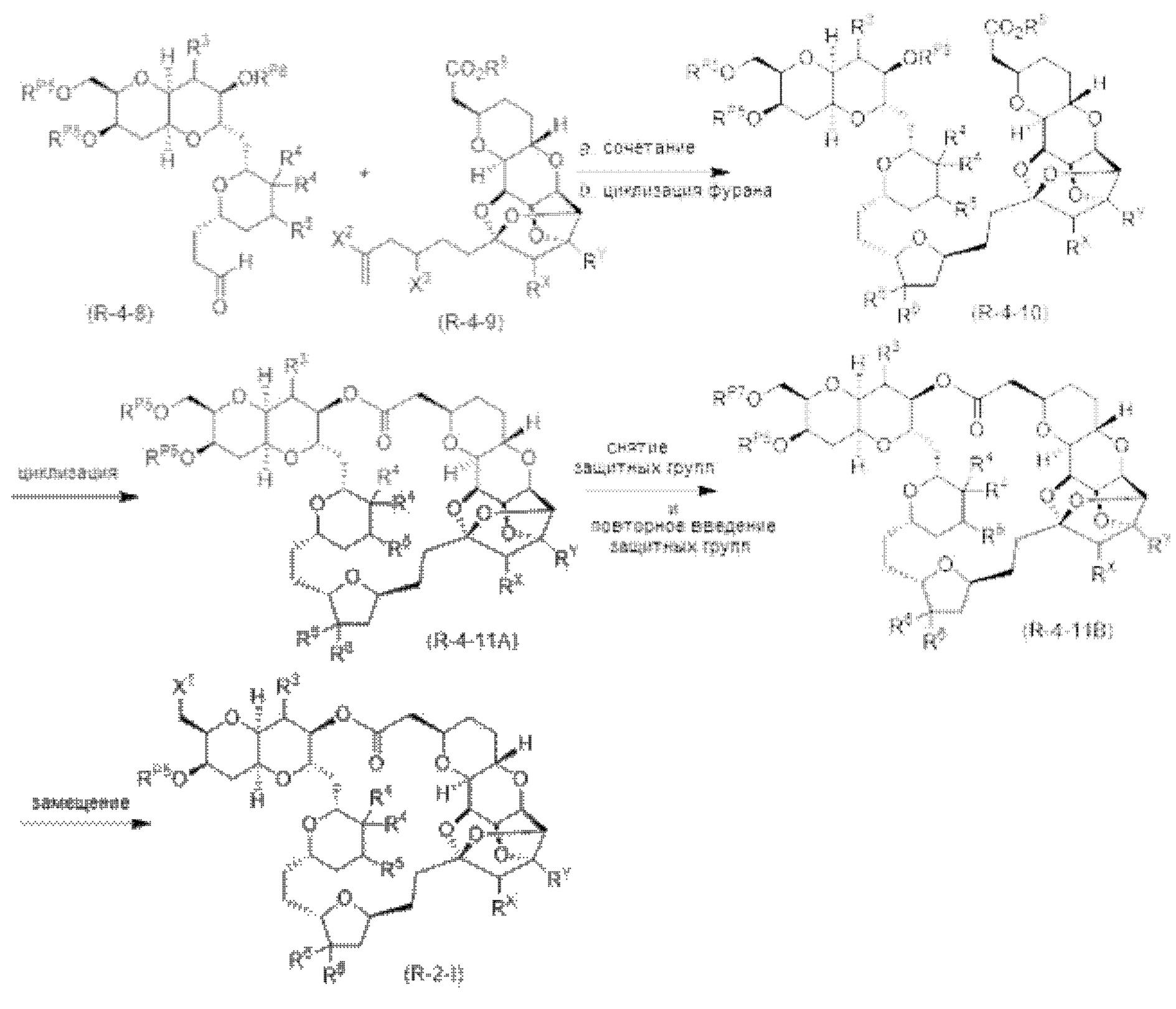
[00218] Как представлено на Схеме 3А, в настоящем документе раскрыт способ получения соединения формулы (R-2-I):
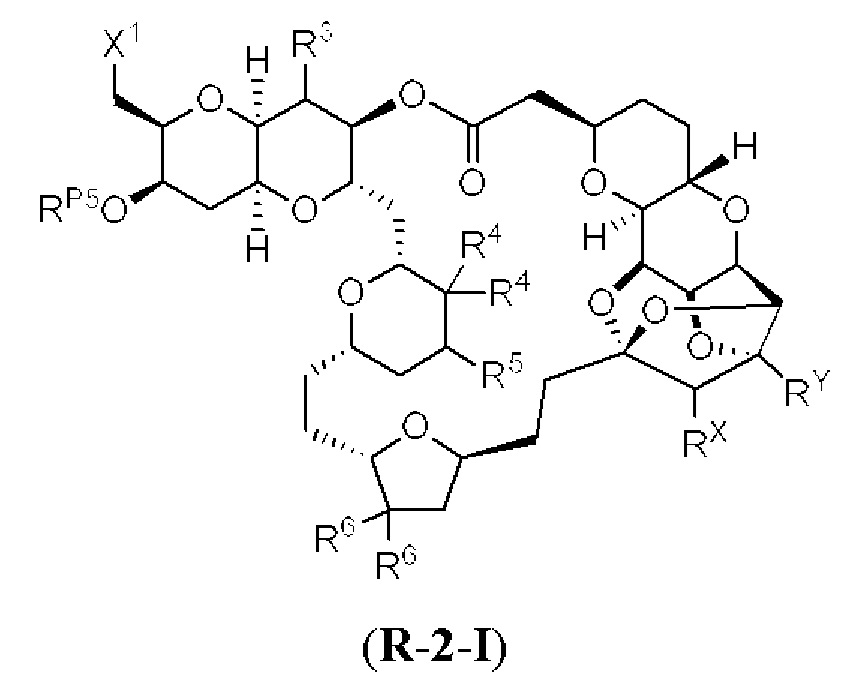
или его соли, причем способ включает в себя осуществление взаимодействия соединения формулы (R-4-11B):
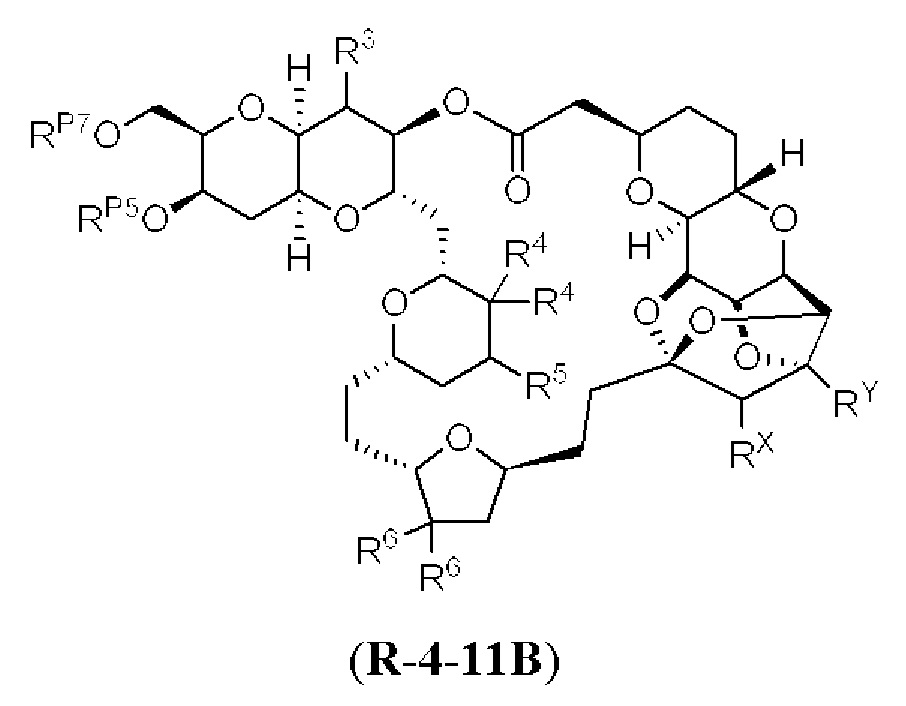
или его соли в присутствии нуклеофила с замещением тем самым группы -ORP7 группой -X1; где:
X1 представляет собой галоген или уходящую группу;
каждый из R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R4 образуют вместе: 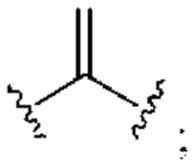
в каждом случае R6 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R6 образуют вместе: 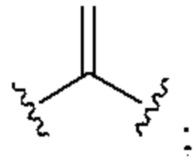
RP5 представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
RP7 представляет собой необязательно замещенный сульфонил, необязательно замещенный сульфинил, необязательно замещенный фосфорил, необязательно замещенный ацил или кислород-защитную группу;
где RP5 и RP7 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетеро циклила;
RX представляет собой водород или -ORXa, где RXa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RY представляет собой водород или -ORYa, где RYa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
где RXa и RYa необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетеро циклила.
[00219] Согласно определенным вариантам осуществления указанный способ представляет собой способ получения соединения формулы (E-R):
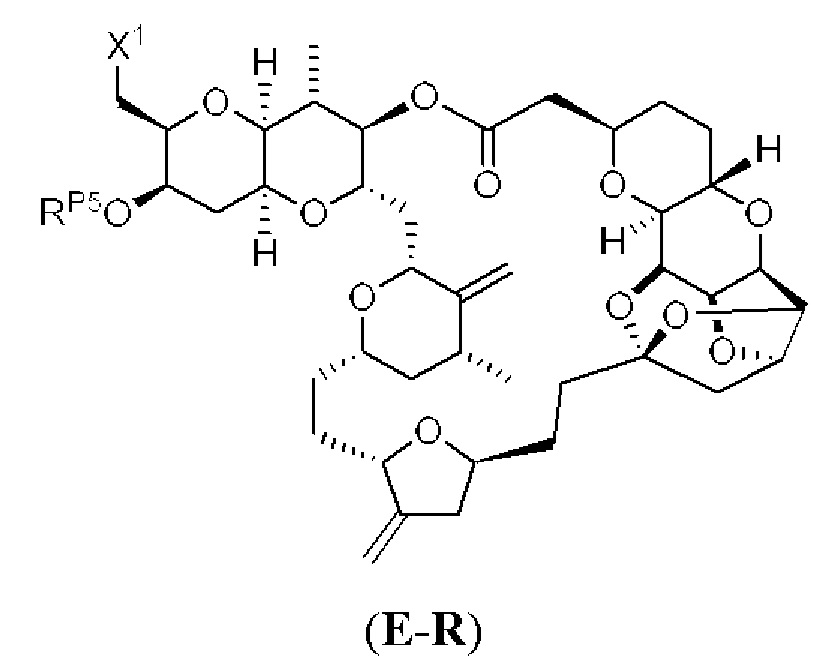
или его соли, причем способ включает в себя осуществление взаимодействия соединения формулы (E-R-1):
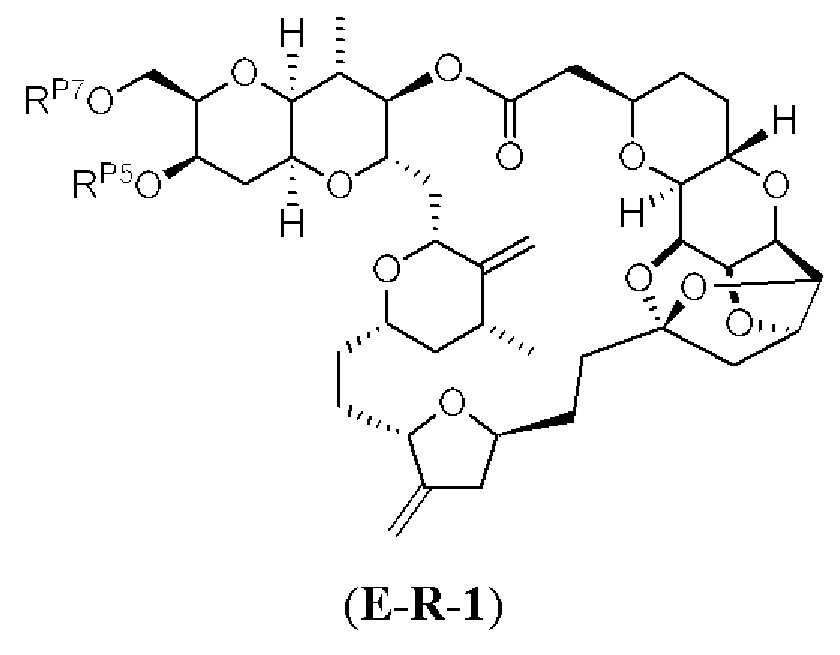
или его соли в присутствии нуклеофила с замещением тем самым группы -ORP7 группой -X1; где:
X1 представляет собой галоген или уходящую группу;
RP5 представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RP7 представляет собой необязательно замещенный сульфонил, необязательно замещенный сульфинил, необязательно замещенный фосфорил, необязательно замещенный ацил или кислород-защитную группу;
где RP5 и RP7 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00220] Как описано выше, способ получения соединения формулы (R-2-I), (E-R), или его соль, включает в себя стадию осуществления взаимодействия соединения формулы (R-4-11B) или его соли в присутствии нуклеофила с замещением тем самым уходящей группы -ORP7 группой -X1. Согласно определенным вариантам осуществления нуклеофил представляет собой анион галогенида (например, Cl-, Br-, I-, F-). Согласно определенным вариантам осуществления реакцию проводят в присутствии соли галогенида. Согласно определенным вариантам осуществления реакцию проводят в присутствии йодида (например, NaI, KI) с замещением тем самым уходящей группы -ORP7 группой -I. Согласно определенным вариантам осуществления йодид представляет собой йодид натрия (NaI). Согласно определенным вариантам осуществления реакцию проводят в присутствии NaI. Согласно определенным вариантам осуществления реакцию проводят в полярном растворителе (например, DMF или DMI). Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от комнатной температуры приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при температуре около комнатной температуры.
[00221] Согласно определенным вариантам осуществления реакцию проводят в присутствии NaI в DMI при температуре около комнатной температуры. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 5 эквивалентов NaI в DMF при комнатной температуре (например, в течение 2-5 часов). Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 5 эквивалентов NaI в DMI при комнатной температуре (например, в течение 2-5 часов).
[00222] Согласно определенным вариантам осуществления группа -ORP7 представляет собой уходящую группу. Согласно определенным вариантам осуществления группа -ORP7 представляет собой -О-сульфонил. Согласно определенным вариантам осуществления группа -ORP7 представляет собой -OMs. Согласно определенным вариантам осуществления группа -ORP7 представляет собой -OTs. Согласно определенным вариантам осуществления группа -ORP7 представляет собой -OTf. Согласно определенным вариантам осуществления группа -ORP7 представляет собой -О-ацил. Согласно определенным вариантам осуществления группа -ORP7 представляет собой -О-фосфорил. Согласно определенным вариантам осуществления RP5 представляет собой силильную защитную группу. Согласно определенным вариантам осуществления RP5 представляет собой TES. Согласно определенным вариантам осуществления -ORP7 представляет собой -OTf, и RP5 представляет собой TES.
[00223] Как представлено на Схеме 3А, соединение формулы (R-4-11B) может быть получено путем снятия защитных групп и повторного введения защитных групп одного или нескольких атомов кислорода соединения формулы (R-4-11A), преобразуя тем самым одну группу -ORP5 до группы -ORP7.
[00224] Например, согласно определенным вариантам осуществления в настоящем документе раскрыт способ получения соединения формулы (R-4-11B) или его соли, причем способ включает в себя:
(а) стадию снятия защитной группы с соединения формулы (R-4-11A):
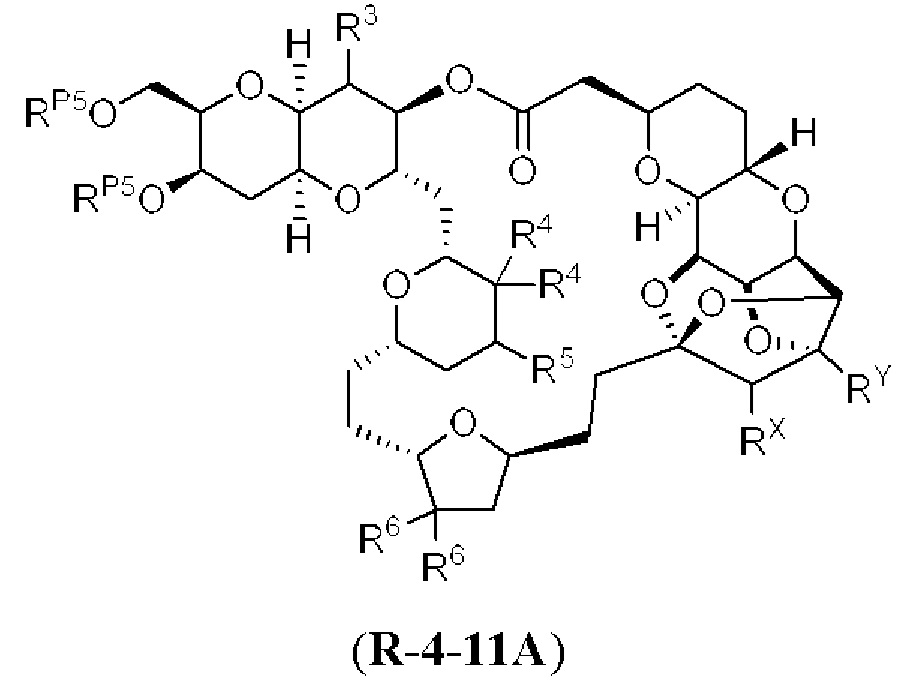
или его соли с получением соединения формулы (R-4-11C):
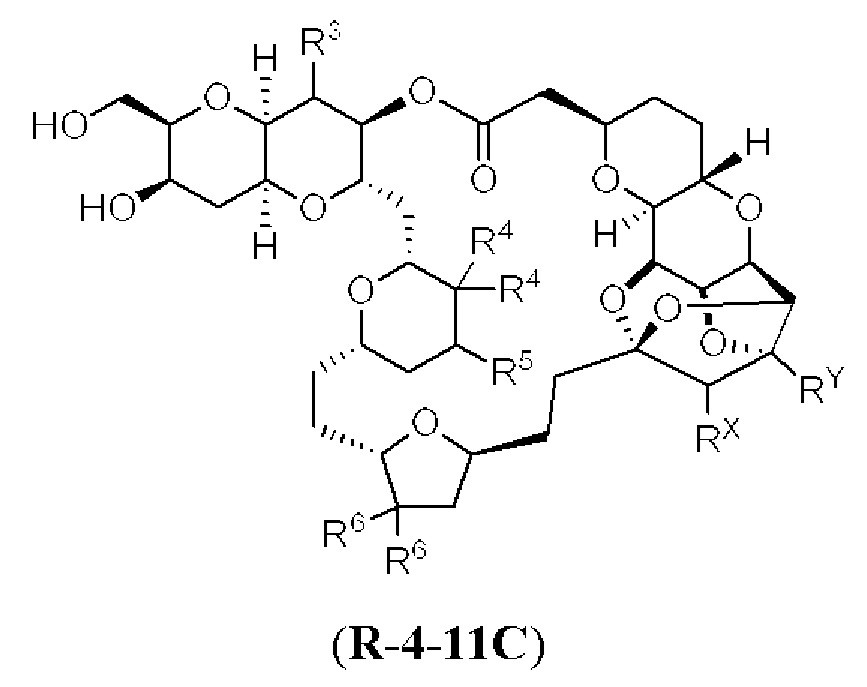
или его соли, а затем (b) одну или несколько стадий повторного введения защитных групп в соединение формулы (R-4-11C) или его соль с получением соединения формулы (R-4-11B) или его соли.
[00225] Согласно определенным вариантам осуществления указанный способ включает в себя:
(a) стадию снятия защитной группы с соединения формулы (E-R-2):
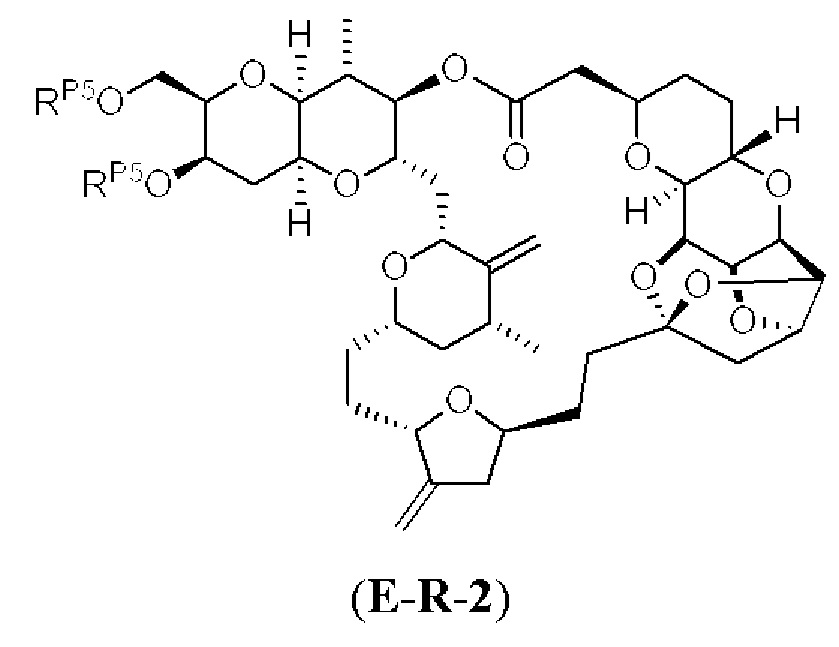
или его соли, с получением соединения формулы:
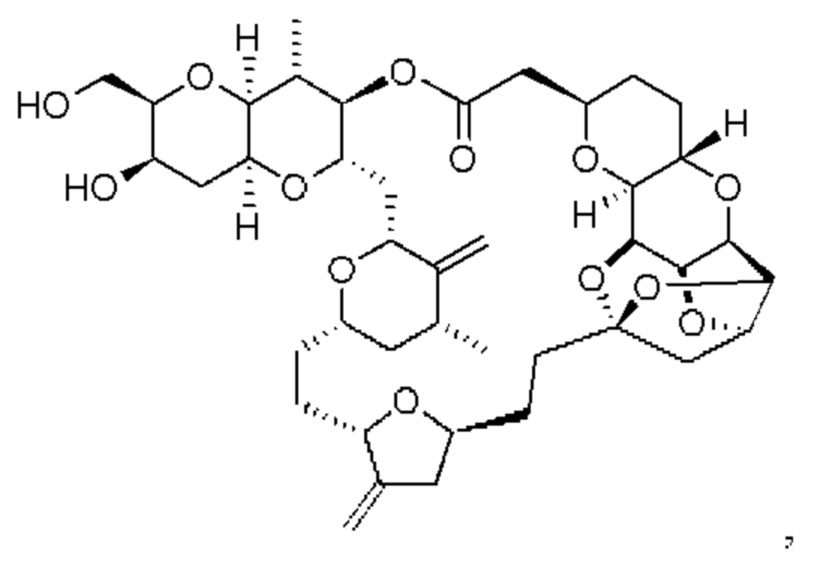
или его соли; и
(b) одну или несколько стадий повторного введения защитных групп в продукт стадии (а) с получением соединения формулы (E-R-1):
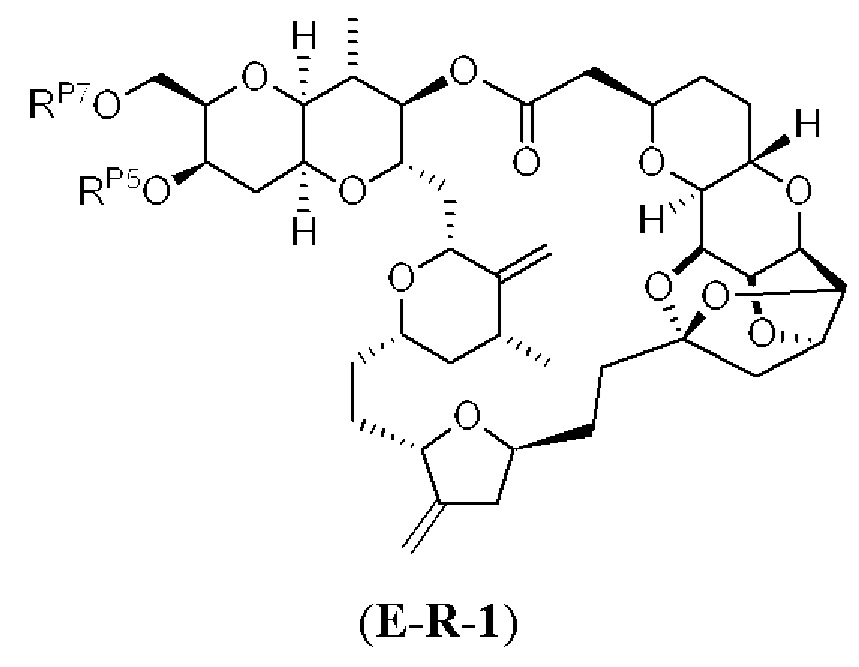
или его соли, где:
RP5 представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца; и
RP7 представляет собой необязательно замещенный сульфонил, необязательно замещенный сульфинил, необязательно замещенный фосфорил, необязательно замещенный ацил или кислород-защитную группу;
где RP5 и RP7 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00226] Как представлено выше, с соединений формулы (R-4-11A) и (E-R-2) могут быть сняты защитные группы для удаления групп RP5 (т.е., стадия (а)). Согласно определенным вариантам осуществления группы RP5 представляют собой силильные защитные группы; и стадию (а) проводят в присутствии источника фторида. Согласно определенным вариантам осуществления источник фтора представляет собой фторид тетрабутиламмония (TBAF). Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:  и стадию (а) проводят в присутствии кислоты. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:
и стадию (а) проводят в присутствии кислоты. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:  и стадию (а) проводят в присутствии кислоты. Согласно определенным вариантам осуществления кислота представляет собой пара-толуолсульфоновую кислоту (TsOH). Согласно определенным вариантам осуществления кислота представляет собой моногидрат пара-толуолсульфоновой кислоты (TsOH•H2O). Согласно определенным вариантам осуществления кислота содержится в каталитическом количестве.
и стадию (а) проводят в присутствии кислоты. Согласно определенным вариантам осуществления кислота представляет собой пара-толуолсульфоновую кислоту (TsOH). Согласно определенным вариантам осуществления кислота представляет собой моногидрат пара-толуолсульфоновой кислоты (TsOH•H2O). Согласно определенным вариантам осуществления кислота содержится в каталитическом количестве.
[00227] Согласно определенным вариантам осуществления стадию снятия защитных групп проводят в DCM и этаноле (например, ROH). Согласно определенным вариантам осуществления снятие защитных групп проводят в DCM и МеОН. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления снятие защитных групп проводят при температуре около комнатной температуры. Согласно определенным вариантам осуществления снятие защитных групп проводят приблизительно при 25°С.
[00228] Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:  и снятие защитных групп проводят в присутствии TsOH•H2O в DCM и спирте. Согласно определенным вариантам осуществления снятие защитных групп проводят в следующих условиях: каталитическое количество TsOH•H2O (например, 0,02 эквив.) в DCM и МеОН приблизительно при 25°С (например, в течение 4 часов).
и снятие защитных групп проводят в присутствии TsOH•H2O в DCM и спирте. Согласно определенным вариантам осуществления снятие защитных групп проводят в следующих условиях: каталитическое количество TsOH•H2O (например, 0,02 эквив.) в DCM и МеОН приблизительно при 25°С (например, в течение 4 часов).
[00229] Согласно определенным вариантам осуществления соединения формулы (R-4-11B) или (E-R-1) -ORP7 представляет собой сульфонатную уходящую группу, и RP5 представляет собой силильную защитную группу; и стадию (b) проводят в присутствии сульфонирующего реагента и основания (с введением тем самым RP7 в виде сульфонильной группы), а затем силилирующего реагента и основания (с введением тем самым RP5 в виде силильной группы). Согласно определенным вариантам осуществления сульфонирующий реагент представляет собой трифлирующий агент.Согласно определенным вариантам осуществления сульфонирующий реагент представляет собой Tf2O. Согласно определенным вариантам осуществления силилирующий реагент представляет собой TESOTf. Согласно определенным вариантам осуществления основание представляет собой аминовое или пиридиновое основание. Согласно определенным вариантам осуществления основание представляет собой 2,4,6-коллидин.
[00230] Согласно определенным вариантам осуществления стадии введения защитных групп проводят в растворителе. Согласно определенным вариантам осуществления растворитель представляет собой DCM. Согласно определенным вариантам осуществления стадии введения защитных групп проводят при температуре ниже комнатной температуры (например, приблизительно от -78°С до -40°С; приблизительно от -78°С до 0°С; приблизительно от -78°С до комнатной температуры).
[00231] Согласно определенным вариантам осуществления -ORP7 представляет собой -OTf, и RP5 представляет собой TES; и стадию (b) проводят в присутствии Tf2O и основания, а затем TESOTf и основания. Согласно определенным вариантам осуществления реакцию проводят в присутствии Tf2O и 2,4,6-коллидина в DCM, а затем добавляют TESOTf. Согласно определенным вариантам осуществления реакцию проводят в следующих условиях: приблизительно 1,4 эквивалента Tf2O и 5 эквивалентов 2,4,6-коллидина в DCM приблизительно при -78°С, а затем добавляют 1,4 эквивалента TESOTf и нагревают приблизительно до -40°С.
[00232] Как представлено на Схеме 3А, в настоящем документе также раскрыт способ получения соединения формулы (R-4-11A):
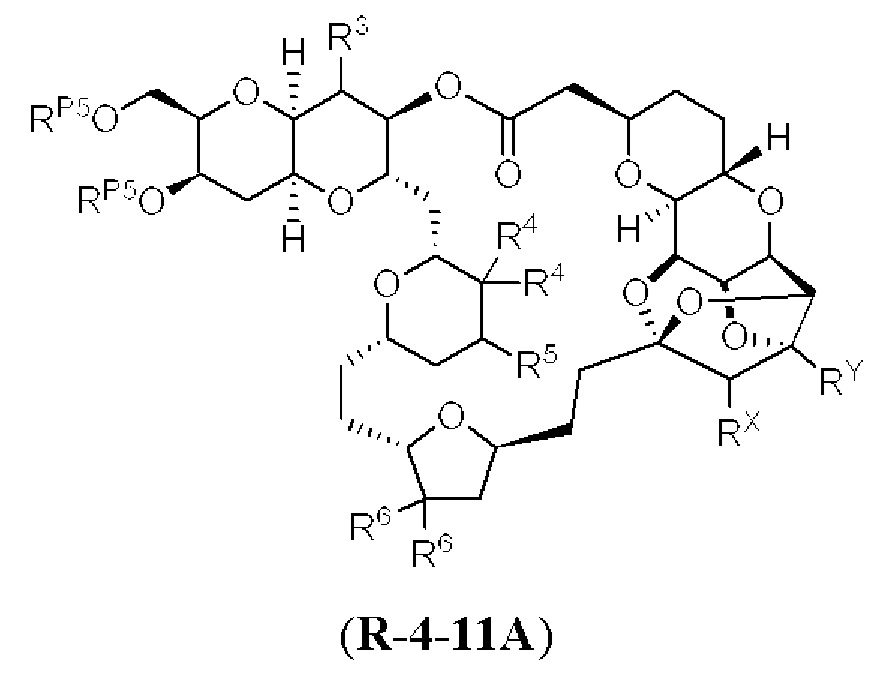
или его соли, причем способ включает в себя циклизацию соединения формулы (R-4-10):
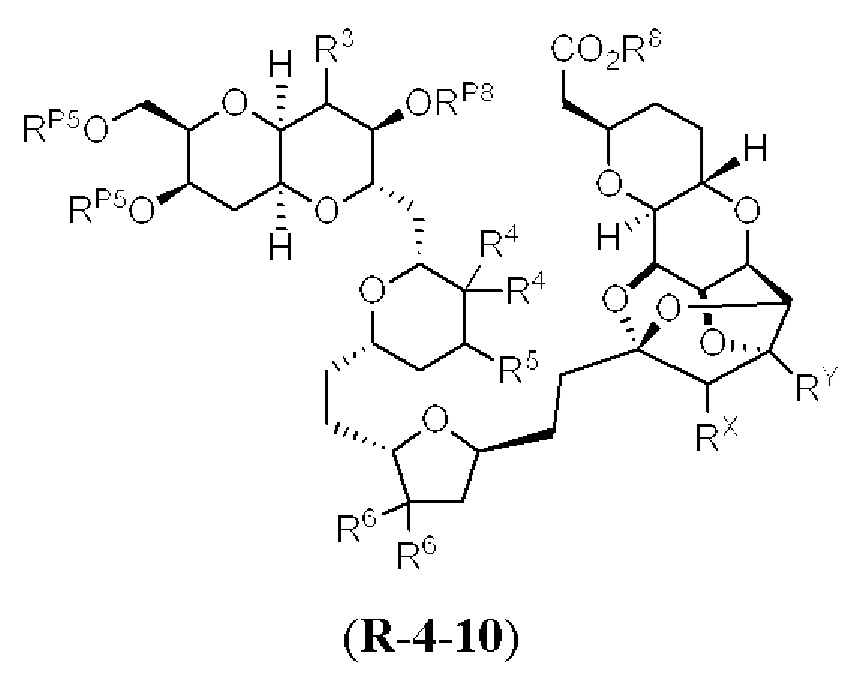
или его соли, где:
каждый из R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген, необязательно замещенный алкил, или две группы R4 образуют вместе: 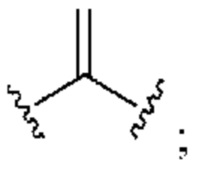
в каждом случае R6 независимо представляет собой водород, галоген, необязательно замещенный алкил, или две группы R6 образуют вместе: 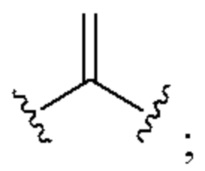
в каждом случае RP5 и RP8 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где два RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца;
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу;
RX представляет собой водород или -ORXa, где RXa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RY представляет собой водород или -ORYa, где RYa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
где RXa и RYa необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетеро циклила.
[00233] Согласно определенным вариантам осуществления способ включает в себя циклизацию соединения формулы (E-R-3):
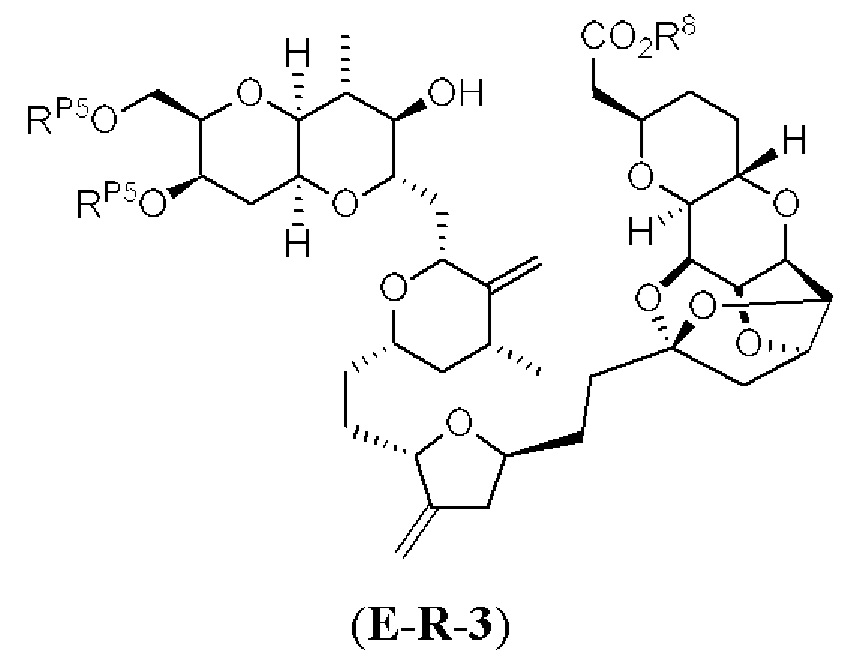
или его соли с получением соединения формулы (E-R-2):
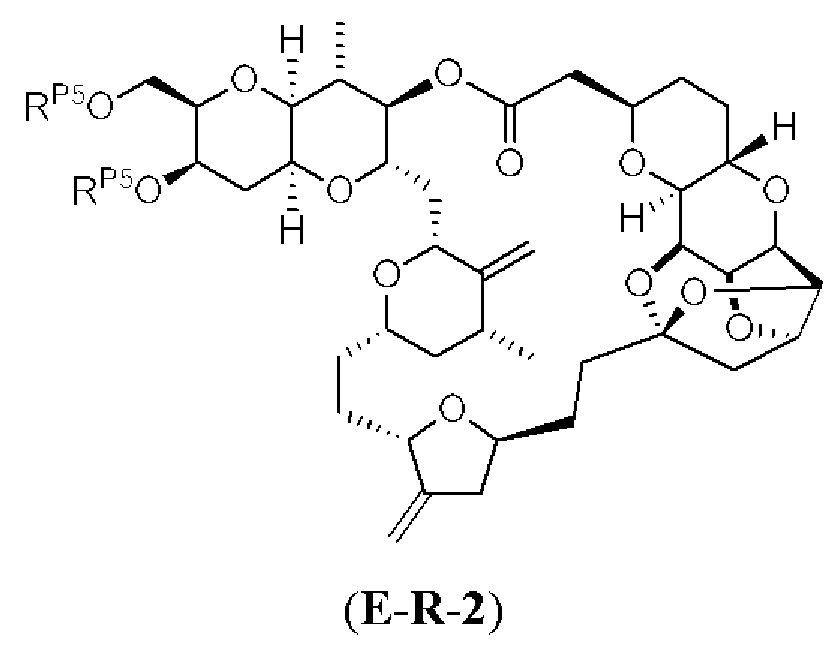
или его соли, где:
в каждом случае RP5 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00234] Согласно определенным вариантам осуществления стадию циклизации соединения формулы (R-4-10), (E-R-3) или его соли проводят в присутствии ангидридного реагента. Согласно определенным вариантам осуществления ангидридный реагент представляет собой бензойный ангидрид. Согласно определенным вариантам осуществления реагент представляет собой нитробензойный ангидрид. Согласно определенным вариантам осуществления ангидрид представляет собой 2-метил-6-нитробензойный ангидрид (MNBA). Ангидридный реагент может содержаться в каталитическом, стехиометрическом и избыточном количестве. Согласно определенным вариантам осуществления ангидридный реагент содержится в избытке (т.е., более 1 эквивалента) относительно соединения формулы (R-4-10) или (E-R-3). Согласно определенным вариантам осуществления ангидрид содержится в количестве приблизительно 3 эквивалентов.
[00235] Согласно определенным вариантам осуществления реакцию проводят в присутствии нуклеофильного реагента, способного активировать карбоксильную группу -CO2R8 или -СО2Н. Согласно определенным вариантам осуществления нуклеофильный реагент представляет собой пиридин. Согласно определенным вариантам осуществления нуклеофильный реагент представляет собой 4-диметиламинопиридин (DMAP). Согласно определенным вариантам осуществления нуклеофильный реагент содержится в избытке (т.е., более 1 эквивалента) относительно соединения формулы (R-4-10) или (E-R-3). Согласно определенным вариантам осуществления реагент содержится в количестве приблизительно 6 эквивалентов.
[00236] Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии основания. Согласно определенным вариантам осуществления основание представляет собой азотное основание. Согласно определенным вариантам осуществления основание представляет собой аминовое основание. Согласно определенным вариантам осуществления основание представляет собой триалкиламиновое основание (например, триметиламин, триэтиламин, трибутиламин, диизопропилэтиламин). Согласно определенным вариантам осуществления основание представляет собой гетероарильное основание (например, пиридин основание, имидазольное основание). Согласно определенным вариантам осуществления основание представляет собой диизопропилэтиламин (DIPEA). Согласно определенным вариантам осуществления основание содержится в избытке (т.е., более 1 эквивалента) относительно соединения формулы (R-4-10). Согласно определенным вариантам осуществления основание содержится в количестве приблизительно 6 эквивалентов.
[00237] Согласно определенным вариантам осуществления стадию циклизации проводят в растворителе (например, в толуоле). Согласно определенным вариантам осуществления реакцию проводят при температуре выше комнатной температуры. Согласно определенным вариантам осуществления снятие защитных групп проводят в DCM и МеОН. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от комнатной температуры приблизительно до 100°С. Согласно определенным вариантам осуществления реакцию проводят приблизительно при 70°С или 80°С.
[00238] Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии ангидридного реагента, нуклеофильного реагента и основания. Согласно определенным вариантам осуществления ангидридный реагент представляет собой 2-метил-6-нитробензойный ангидрид. Согласно определенным вариантам осуществления нуклеофильный реагент представляет собой DMAP. Согласно определенным вариантам осуществления основание представляет собой триалкиламиновое основание, такое как DIPEA. Согласно определенным вариантам осуществления указанную стадию проводят в присутствии 2-метил-6-нитробензойного ангидрида (MNBA), 4-диметиламинопиридина (DMAP) и диизопропилэтиламина (DIPEA).
[00239] Например, согласно определенным вариантам осуществления стадию циклизации проводят в следующих условиях: 6 эквивалентов MNBA, 12 эквивалентов DMAP и 6 эквивалентов DIPEA в толуоле приблизительно при 70°С. Например, согласно определенным вариантам осуществления стадию циклизации проводят в следующих условиях: 3 эквивалента MNBA, 6 эквивалентов DMAP и 6 эквивалентов DIPEA в толуоле приблизительно при 80°С (например, в течение 6 часов). Согласно определенным вариантам осуществления реакция предусматривает медленное добавление (т.е., добавление по каплям) к реакционной смеси соединения формулы (R-4-10) или (E-R-3) или его соли.
[00240] Согласно определенным вариантам осуществления соединение формулы (R-4-10) представляет собой соединение формулы (R-4-10A):
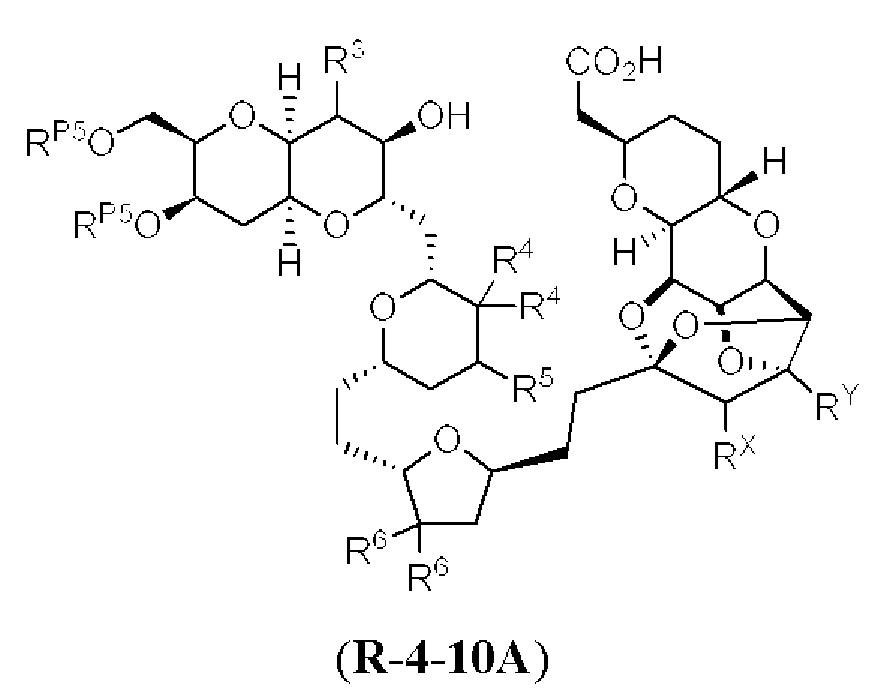
или его соль.
[00241] Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:  и R8 представляет собой водород. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:
и R8 представляет собой водород. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:  и R8 представляет собой водород.
и R8 представляет собой водород.
[00242] В настоящем документе также раскрыт способ получения соединения формулы (R-4-10):
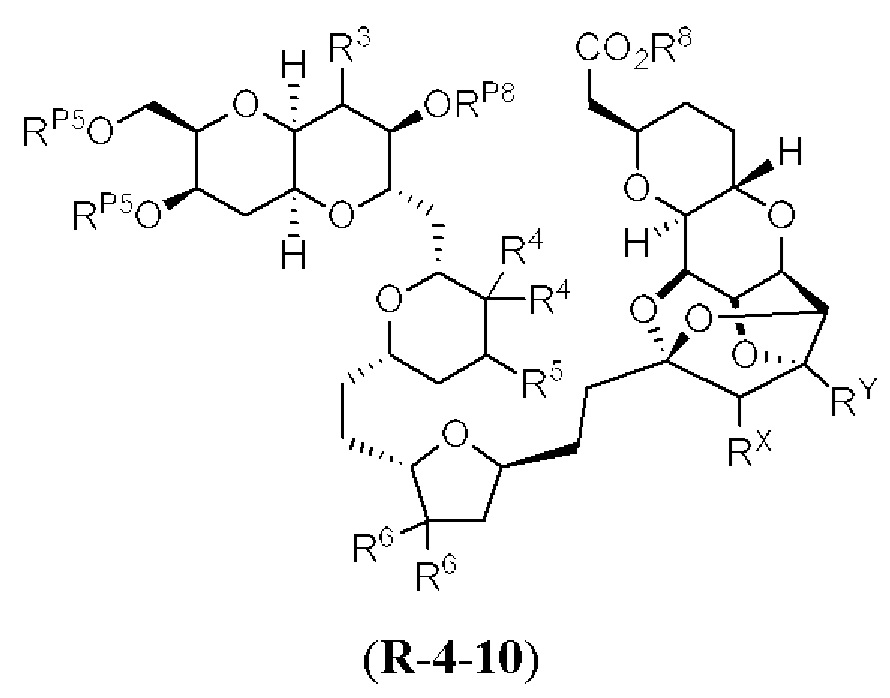
или его соли, причем способ включает в себя стадии:
(а) сочетания соединения формулы (R-4-8):
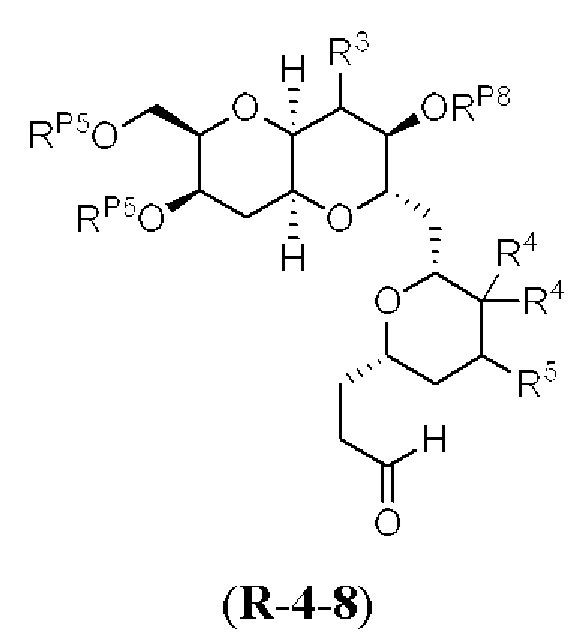
или его соли с соединением формулы (R-4-9):
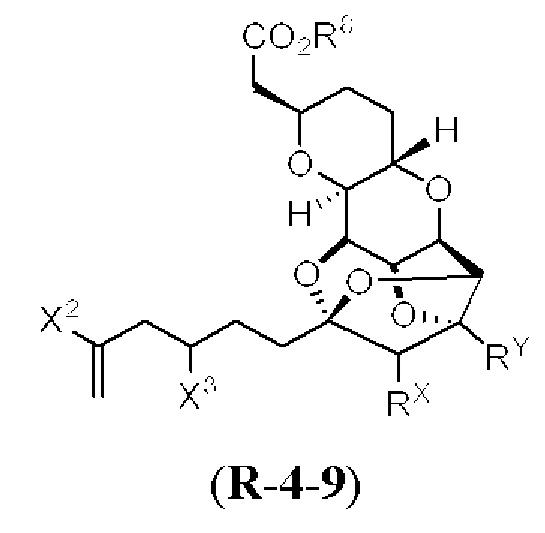
или его солью с получением соединения формулы (R-4-10B):
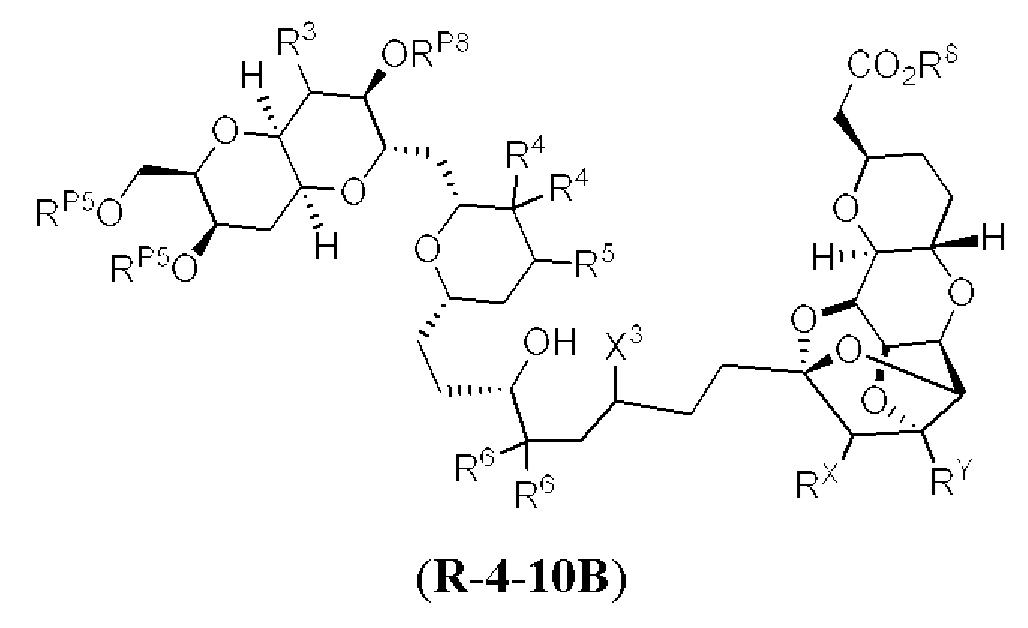
или его соль, а затем
(b) циклизации соединения формулы (R-4-10B) или его соли с получением соединения формулы (R-4-10) или его соли, где:
каждый из X3 и X2 независимо представляет собой галоген или уходящую группу;
каждый из R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R4 образуют вместе: 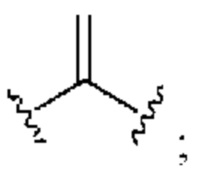
в каждом случае R6 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R6 образуют вместе: 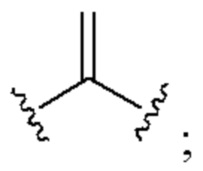
в каждом случае RP5 и RP8 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца;
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу;
RX представляет собой водород или -ORXa, где RXa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RY представляет собой водород или -ORYa, где RYa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
где RXa и RYa необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00243] Согласно определенным вариантам осуществления указанный способ включает в себя:
(а) стадию сочетания соединения формулы (E-R-4):
или его соли с соединением формулы (E-R-5):
или его солью с получением соединения формулы (E-R-6):
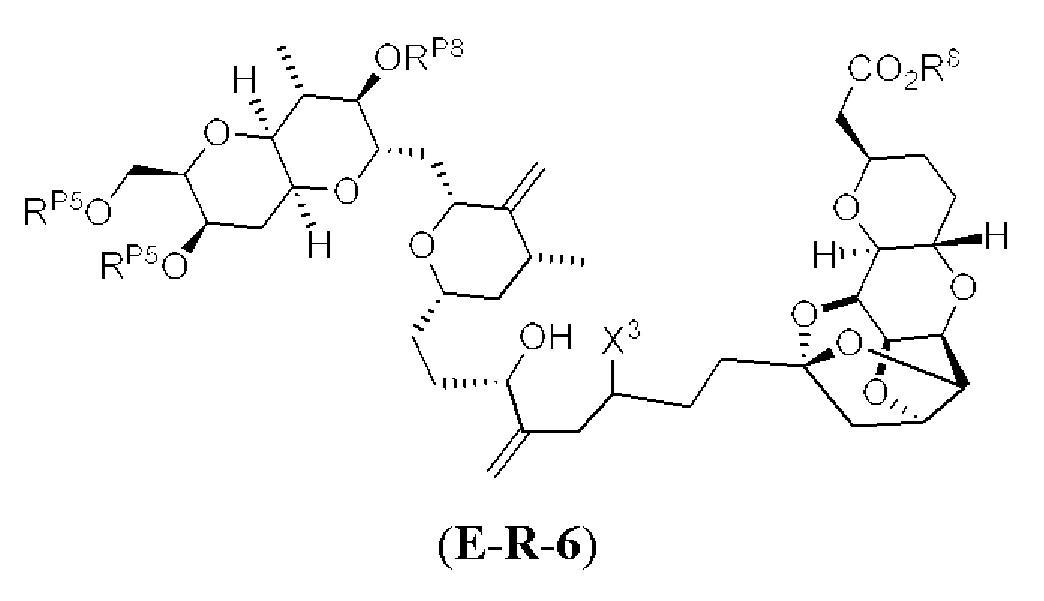
или его соль, а затем
(b) стадию циклизации соединения формулы (E-R-6) или его соли с получением соединения формулы (E-R-7):
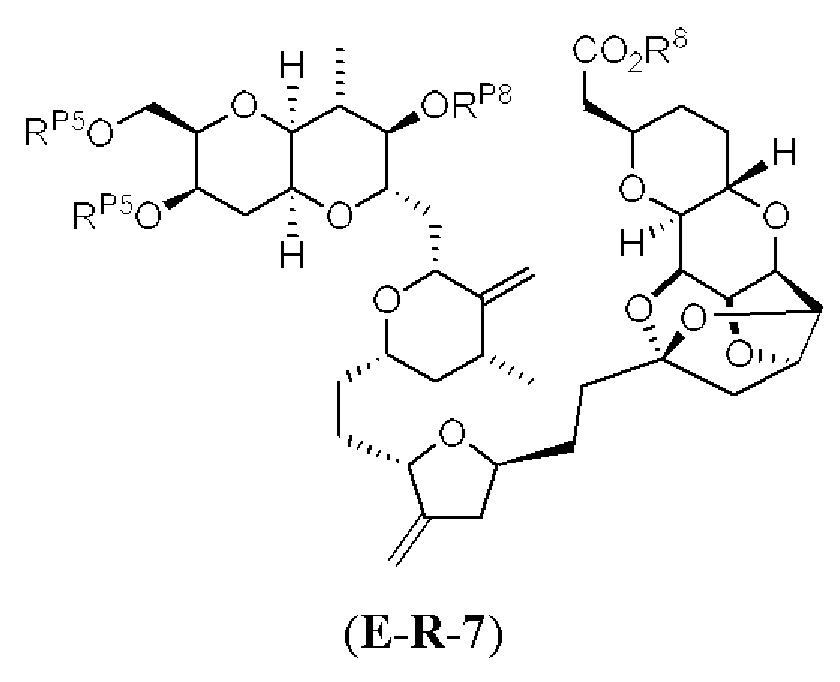
или его соли, где:
каждый из X3 и X2 независимо представляет собой галоген или уходящую группу;
в каждом случае RP5 и RP8 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00244] Согласно определенным вариантам осуществления представленная выше стадия (а) (с получением соединения формулы (R-4-10B), (E-R-6) или его соли) представляет собой Ni/Cr-опосредованную реакцию восстановительного сочетания; и представленная выше стадия (b) (с получением соединения формулы (R-4-10), (E-R-7) или его соли) представляет собой промотируемую кислотой или промотируемую основанием внутримолекулярную циклизацию фурана. Реагенты и условия для стадий (а) и (b) могут быть найдены, например, в публикациях международных заявок согласно РСТ WO 2016/176560, опубликованной 3 ноября 2016 года, и WO 2016/003975, 7 января 2016 года, полное содержание которых включено в настоящий документ посредством ссылки.
[00245] Ni/Cr-опосредованное восстановительное сочетание (т.е., стадию (а)) проводят в присутствии никеля и хрома. Согласно определенным вариантам осуществления никель представляет собой комплекс никеля. Примеры комплексы никеля включают в себя без ограничения комплексы, представленные на Фигуре 9В. Согласно определенным вариантам осуществления комплекс никеля представляет собой (Et)2Phen•NiCl2. Согласно определенным вариантам осуществления комплекс никеля представляет собой следующее соединение:
Согласно определенным вариантам осуществления комплекс никеля содержится в каталитическом количестве.
[00246] Согласно определенным вариантам осуществления хром представляет собой комплекс хрома. Согласно определенным вариантам осуществления комплекс хрома получают из соли хрома и хирального лиганда. Согласно определенным вариантам осуществления соль хрома представляет собой CrCl2 или CrCl3. Согласно определенным вариантам осуществления хиральный лиганд представляет собой хиральный сульфонамид. Примеры хиральных лигандов включают в себя без ограничения лиганды, представленные на Фигуре 9В. Согласно определенным вариантам осуществления хиральный лиганд представляет собой соединение (S)-4-G. Согласно определенным вариантам осуществления хиральный сульфонамидный лиганд представляет одно из следующих соединений:
или его соль. Согласно определенным вариантам осуществления комплекс хрома содержится в каталитическом количестве.
[00247] Ni/Cr-опосредованное восстановительное сочетание может проводиться в присутствии одного или нескольких дополнительных реагентов. Согласно определенным вариантам осуществления сочетание проводят в присутствии соли лития (например, LiCl или LiBr). Согласно определенным вариантам осуществления сочетание проводят в присутствии металла-восстановителя, такого как цинк или марганец (например, металлического цинка или марганца). Согласно определенным вариантам осуществления сочетание проводят в присутствии циркония (например, ZrCp2Cl2). Согласно определенным вариантам осуществления металл-восстановитель представляет собой металлический цинк. Согласно определенным вариантам осуществления металл представляет собой металлический марганец. Согласно определенным вариантам осуществления сочетание проводят в присутствии основания или акцептора протонов (например, 2,6-ди-трет-бутил-4-метилпиридина). Согласно определенным вариантам осуществления сочетание проводят в присутствии протонной губки (например, 1,8-бис(диметиламино)нафталина).
[00248] Согласно определенным вариантам осуществления реакцию проводят в растворителе. Согласно определенным вариантам осуществления растворитель представляет собой ацетонитрил (MeCN). Согласно определенным вариантам осуществления снятие защитных групп проводят в DCM и МеОН. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от комнатной температуры приблизительно до 100°С. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от комнатной температуры приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при температуре около комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят приблизительно при 30°С.
[00249] Согласно определенным вариантам осуществления Ni/Cr-опосредованное восстановительное сочетание может проводиться в присутствии комплекса никеля, соли хрома, сульфонамидного лиганда, соли лития, комплекса циркония, металла-восстановителя и основания или акцептора протонов. Согласно определенным вариантам осуществления стадию сочетания проводят в присутствии (Et)2Phen•NiCl2, CrCl2, (S)-4-G, LiCl, ZrCp2Cl2, металлического марганца и основания или акцептора протонов (например, 2,6-ди-трет-бутил-4-метилпиридина). Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 2 мол. % (Et)2Phen•NiCl2, 10 мол. % CrCl2, 10 мол. % лиганда (S)-4-G, 2 эквивалента LiCl, 2,5 эквивалента ZrCp2Cl2, избыток металлического марганца и 2,5 эквивалента 2,6-ди-трет-бутил-4-метилпиридина в MeCN при комнатной температуре (например, в течение 2 часов).
[00250] Согласно определенным вариантам осуществления Ni/Cr-опосредованное восстановительное сочетание может проводиться в присутствии комплекса никеля, а соли хрома, сульфонамидного лиганда, комплекса циркония, металла-восстановителя и основания или акцептора протонов. Согласно определенным вариантам осуществления сочетание проводят в присутствии: комплекса никеля формулы: 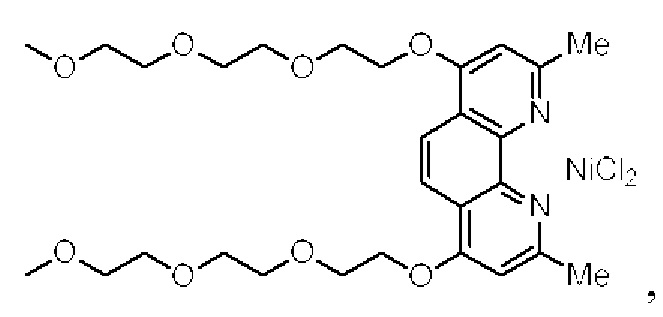 CrCl3, сульфонамидного лиганда формулы:
CrCl3, сульфонамидного лиганда формулы: 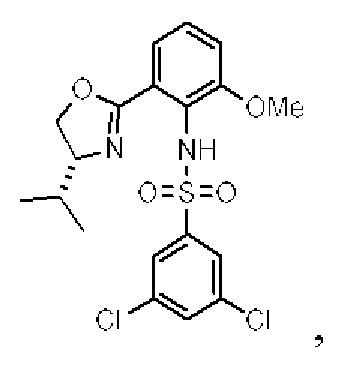 Cp2ZrCl2, металлического марганца и основания или акцептора протонов (например, 2,6-ди-трет-бутил-4-метилпиридина и/или протонной губки (например, 1,8-бис(диметиламино)нафталина)). Согласно определенным вариантам осуществления реакцию проводят в MeCN. Согласно определенным вариантам осуществления реакцию проводят приблизительно при 30°С. Например, сочетание может проводиться в следующих условиях: 3 мол. % комплекса никеля формулы:
Cp2ZrCl2, металлического марганца и основания или акцептора протонов (например, 2,6-ди-трет-бутил-4-метилпиридина и/или протонной губки (например, 1,8-бис(диметиламино)нафталина)). Согласно определенным вариантам осуществления реакцию проводят в MeCN. Согласно определенным вариантам осуществления реакцию проводят приблизительно при 30°С. Например, сочетание может проводиться в следующих условиях: 3 мол. % комплекса никеля формулы: 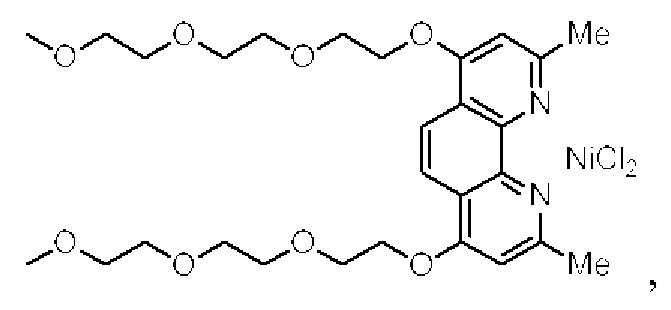 20 мол. % CrCl3, 20 мол. % сульфонамидного лиганда формулы:
20 мол. % CrCl3, 20 мол. % сульфонамидного лиганда формулы: 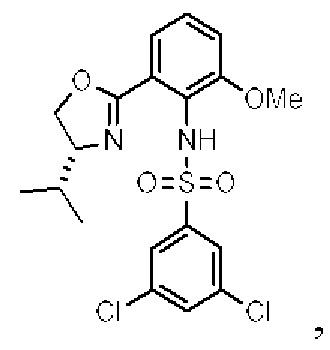 2,6 эквивалента Cp2ZrCl2, 2 эквивалента металлического марганца и 2 эквивалента 2,6-ди-трет-бутил-4-метилпиридина и протонной губки в MeCN приблизительно при 30°С.
2,6 эквивалента Cp2ZrCl2, 2 эквивалента металлического марганца и 2 эквивалента 2,6-ди-трет-бутил-4-метилпиридина и протонной губки в MeCN приблизительно при 30°С.
[00251] Согласно определенным вариантам осуществления стадию (b) (с получение соединения формулы (R-4-10), (E-R-7) или его соли) проводят в присутствии кислоты Льюиса. Согласно определенным вариантам осуществления кислота Льюиса представляет собой AgOTf. Согласно определенным вариантам осуществления кислота Льюиса представляет собой Ag2O. Согласно определенным вариантам осуществления кислота Льюиса представляет собой SrCO3. Кислота Льюиса может содержаться в каталитическом, стехиометрическом и избыточном количестве. Согласно другим вариантам осуществления стадию (b) проводят в присутствии основания. Согласно определенным вариантам осуществления основание представляет собой карбонат. Согласно определенным вариантам осуществления основание представляет собой карбонат калия (K2CO3).
[00252] Согласно определенным вариантам осуществления реакцию проводят в растворителе. Согласно определенным вариантам осуществления растворитель представляет собой МеОН. Согласно определенным вариантам осуществления растворитель представляет собой MeCN. Согласно определенным вариантам осуществления реакцию проводят в МеОН и воде. Согласно определенным вариантам осуществления реакцию проводят при температуре выше комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от комнатной температуры приблизительно до 100°С. Согласно определенным вариантам осуществления реакцию проводят при 50-60°С. Согласно определенным вариантам осуществления реакцию проводят приблизительно при 60°С. Согласно определенным вариантам осуществления реакцию проводят приблизительно при 55°С.
[00253] Согласно определенным вариантам осуществления в дополнение к влиянию на циклизацию фурана, реакционные условия достаточны для гидролиза сложного эфира -CO2R8 (где R8 представляет собой водород в продукте (E-R-7) или (R-4-10)).
[00254] Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 10 эквивалентов K2CO3 в MeCN при 60°С (например, в течение 3 часов). Согласно определенным вариантам осуществления реакцию проводят в присутствии K2CO3 в МеОН и воде приблизительно при 55°С. В качестве другого примера, реакция может проводиться в следующих условиях: 10 эквивалентов K2CO3 в МеОН и воде приблизительно при 55°С (например, в течение 23 часов).
[00255] Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:  RP8 представляет собой водород; и R8 представляет собой необязательно замещенный алкил или водород. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:
RP8 представляет собой водород; и R8 представляет собой необязательно замещенный алкил или водород. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:  RP8 представляет собой водород; и R8 представляет собой метил. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:
RP8 представляет собой водород; и R8 представляет собой метил. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:  RP8 представляет собой водород; и R8 представляет собой водород.
RP8 представляет собой водород; и R8 представляет собой водород.
[00256] Как представлено на Схеме 3В, соединение формулы (R-4-8) может быть получено путем восстановления сложноэфирного фрагмента (-CO2R8) соединения формулы (R-4-7) до альдегидного фрагмента. Соединение формулы (R-4-7) может быть получено путем сочетания соединения формулы (R-4-5B) с соединением формулы (R-4-6) с последующим образованием пиранового кольца посредством циклизации аддукта или формы аддукта со снятой защитой. В свою очередь, соединение формулы (R-4-5B) может быть получено путем восстановления сложноэфирного фрагмента (-CO2R8) соединения формулы (R-4-5A) до альдегидного фрагмента. Соединение формулы (R-4-5A) может быть получено путем циклизации соединения формулы (R-4-4), которое может быть получено путем сочетания соединения формулы (R-4-2) с олефином формулы (R-4-3). Как представлено на Схеме 3В, соединение формулы (R-4-2) может быть получено путем восстановления лактона соединения формулы (R-4-1).
Схема 3В
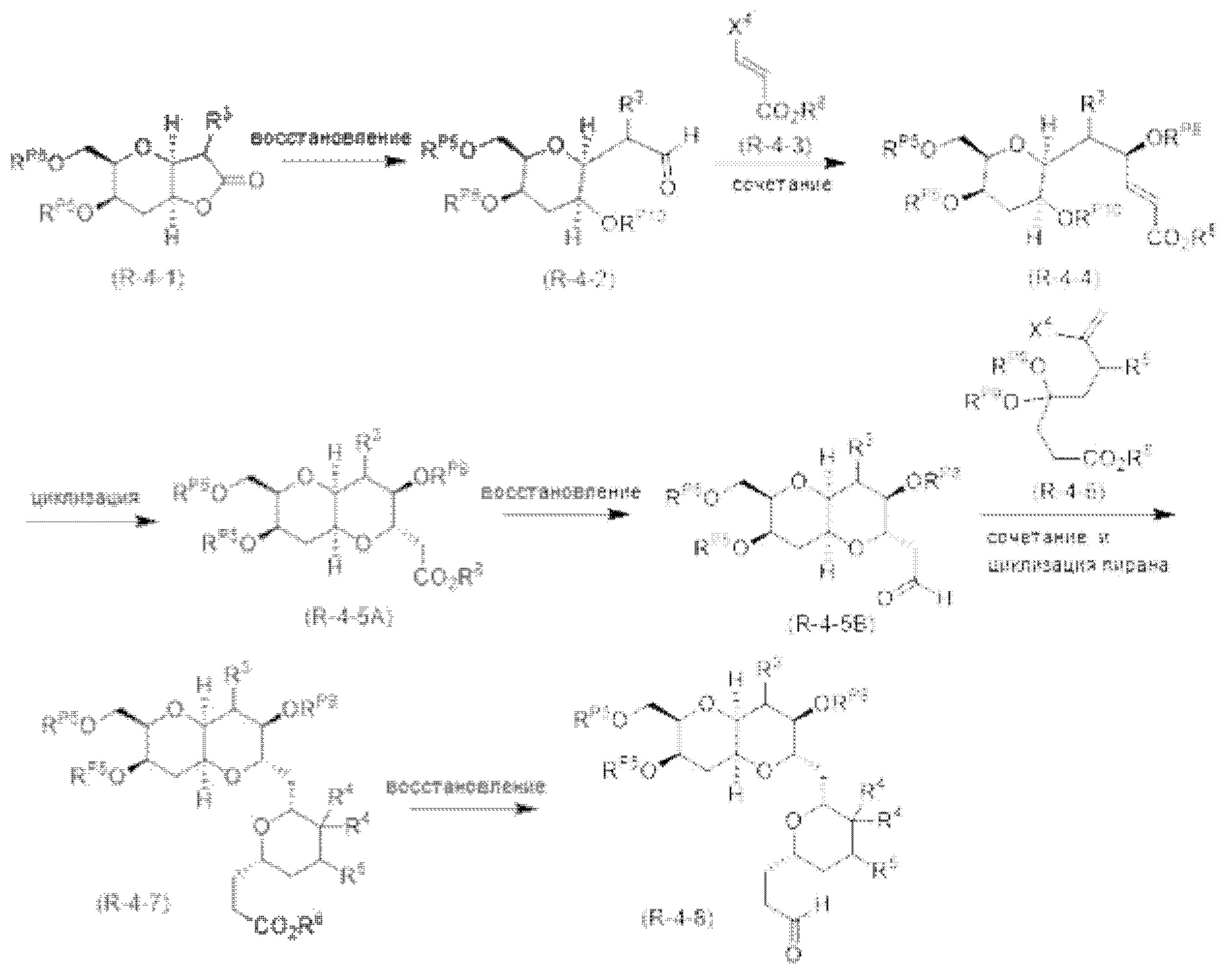
[00257] Как представлено на Схеме 3В, в настоящем документе раскрыт способ получения соединения формулы (R-4-8):
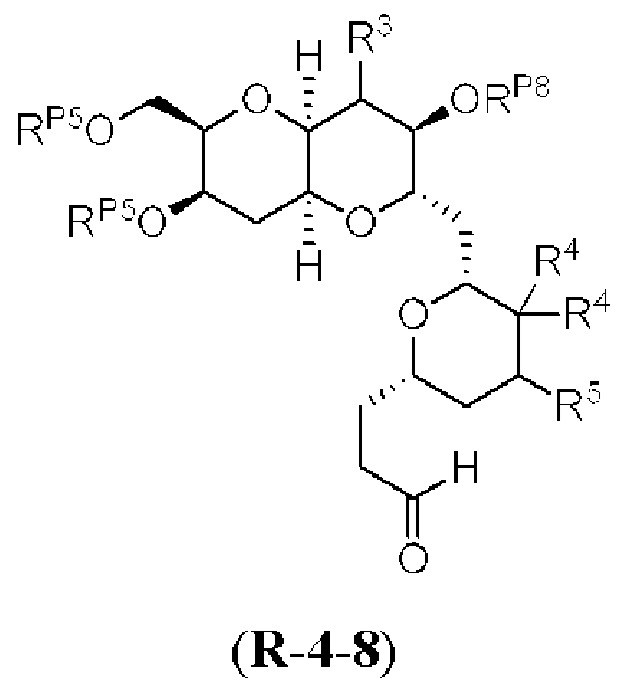
или его соли, причем способ включает в себя восстановление соединения формулы (R-4-7):
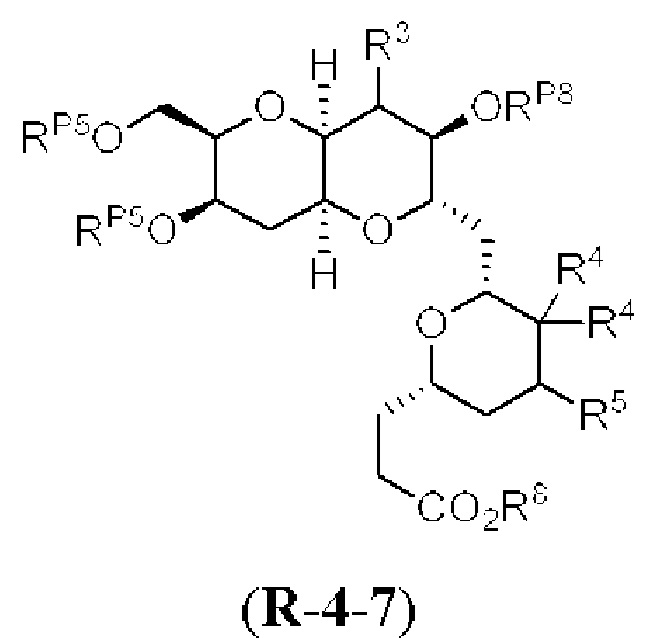
или его соли, где:
каждый из R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R4 образуют вместе: 
в каждом случае RP5 и RP8 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00258] Согласно определенным вариантам осуществления способ включает в себя стадию восстановления соединения формулы (E-R-8):
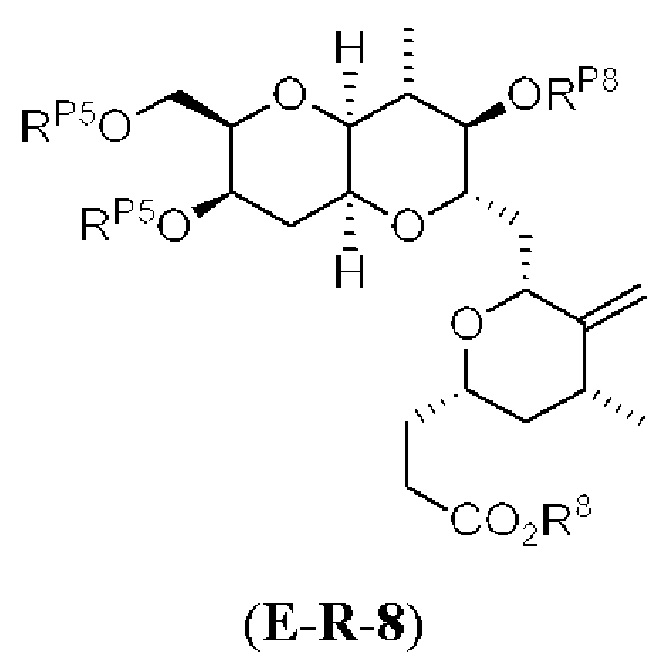
или его соли с получением соединения формулы (E-R-4):
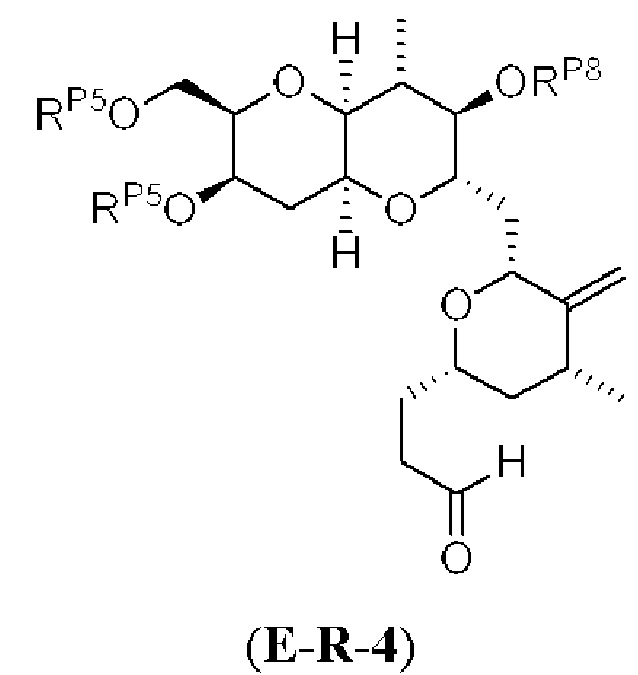
или его соли, где:
в каждом случае RP5 и RP8 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00259] На стадии восстановления соединения формулы (R-4-7), (E-R-8) или его соли сложноэфирную группу -CO2R8 преобразуют до альдегидной группы. Согласно определенным вариантам осуществления стадию восстановления проводят в присутствии источника гидрида (т.е., Н-). Любой источник гидрида, известный из уровня техники, может быть использован для данной трансформации. Примеры источников гидрида включают в себя без ограничения алюмогидрид лития (LAH), боргидрид натрия (NaBH4), боргидрид лития и гидрид диизобутилалюминия (DIBAL). Согласно определенным вариантам осуществления источник гидрида представляет собой гидрид диизобутилалюминия (DIBAL). Согласно определенным вариантам осуществления источник гидрида содержится в стехиометрическом или избыточном количестве.
[00260] Стадия восстановления может необязательно включать в себя восстановление фрагмента -CO2R8 до спирта, с последующим окисление полученного спирта до альдегида с получением соединения формулы (R-4-7), (E-R-8) или его соли.
[00261] Согласно определенным вариантам осуществления стадию восстановления проводят в присутствии DIBAL. Согласно определенным вариантам осуществления реакцию проводят в растворителе. Согласно определенным вариантам осуществления растворитель представляет собой DCM. Согласно определенным вариантам осуществления реакцию проводят при температуре ниже комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от -78°С приблизительно до комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от -78°С приблизительно до 0°С. Согласно определенным вариантам осуществления реакцию проводят приблизительно при -78°С. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: DIBAL в DCM приблизительно при -78°С. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: приблизительно 2,3 эквивалента DIBAL в DCM приблизительно при -78°С (например, в течение 1-2 часов).
[00262] Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:  RP8 представляет собой водород; и R8 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:
RP8 представляет собой водород; и R8 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:  RP8 представляет собой водород, и R8 представляет собой этил. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:
RP8 представляет собой водород, и R8 представляет собой этил. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:  RP8 представляет собой водород, и R8 представляет собой метил.
RP8 представляет собой водород, и R8 представляет собой метил.
[00263] Как представлено на Схеме 3В, в настоящем документе также раскрыт способ получения соединения формулы (R-4-7):
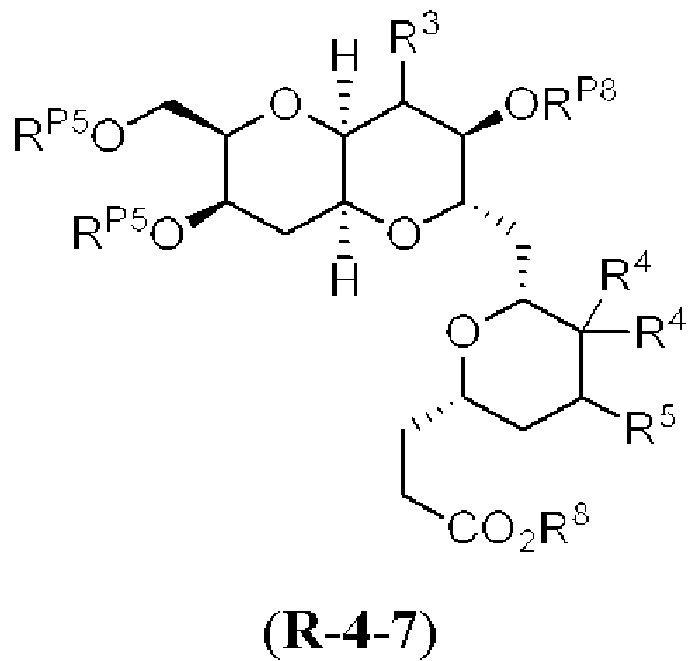
или его соли, причем способ включает в себя стадии:
(а) сочетание соединения формулы (R-4-5B):
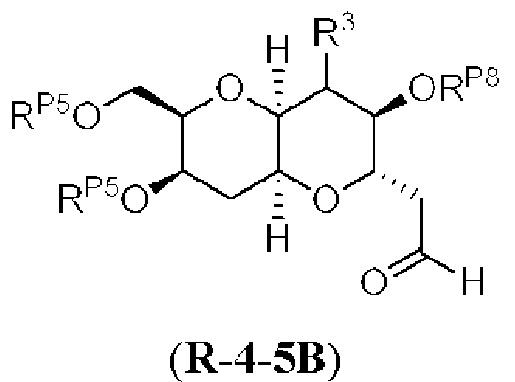
или его соли с соединением формулы (R-4-6):
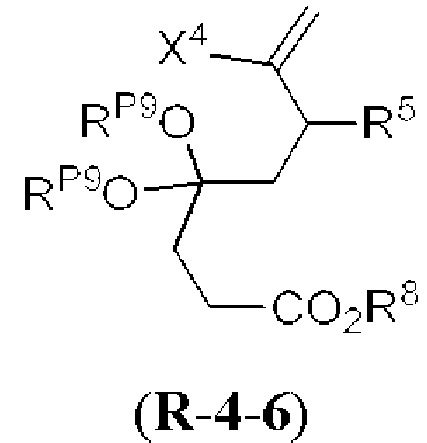
или его солью с получением соединения формулы (R-4-7A):
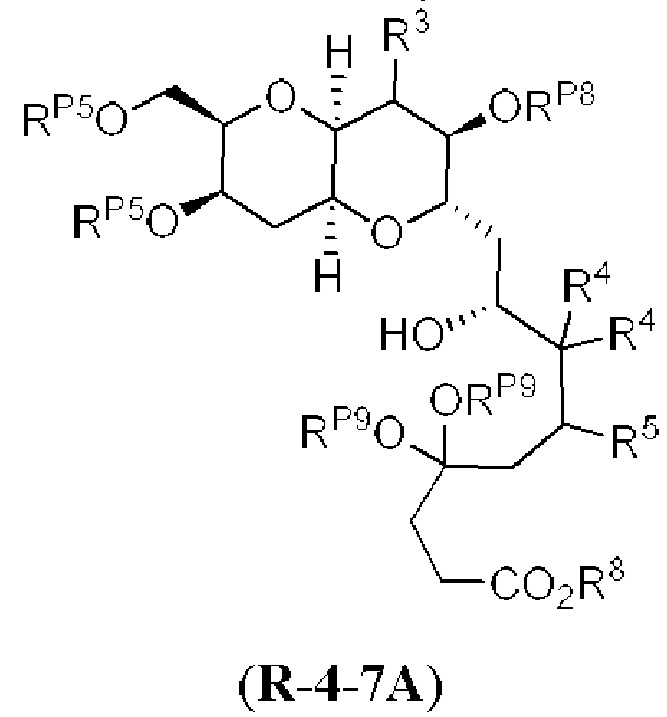
или его соли; и
(a-i) снятия защитных групп и циклизации соединения формулы (R-4-7A) или его соли с получением соединения формулы (R-4-7) или его соли; где:
каждый из R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R4 образуют вместе: 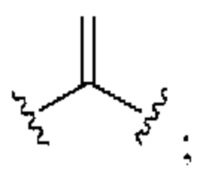
в каждом случае RP5, RP8 и RP9 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца; и где два RP9 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00264] Согласно определенным вариантам осуществления после стадии сочетания соединений формул (R-4-5B) и (R-4-6) (т.е., стадии (а)), указанный способ включает в себя:
(b) стадию снятия защитных групп с соединения формулы (R-4-7A) или его соли с получением соединения формулы (R-4-7B):
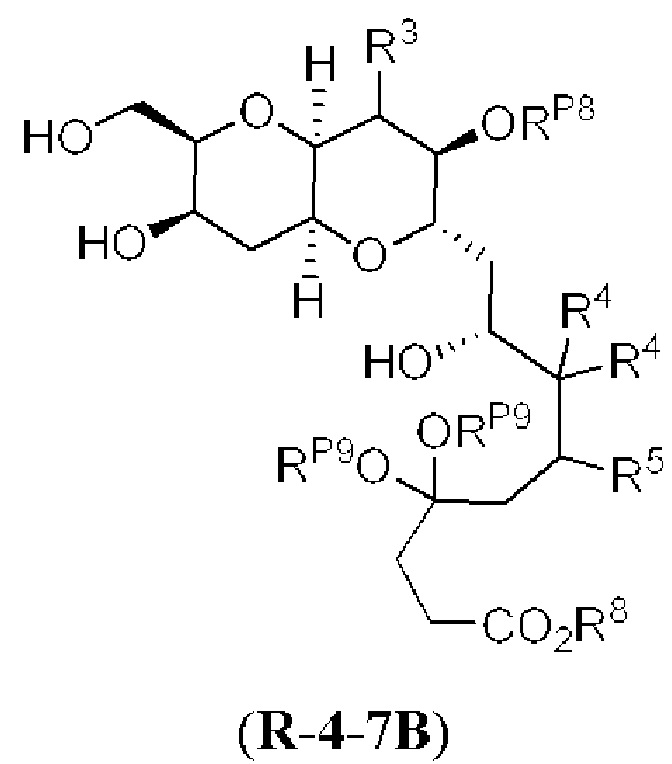
или его соли;
(c) стадию циклизации с получением соединения формулы (R-4-7C):
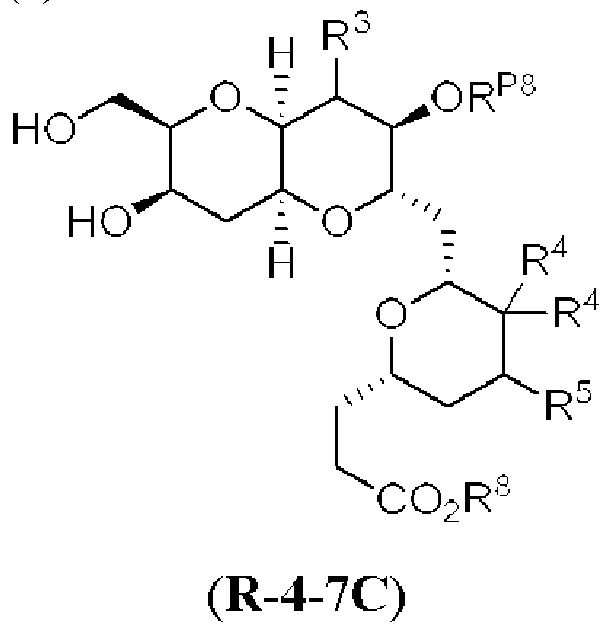
или его соли; и необязательно
(d) стадию повторного введения защитных групп в соединение формулы (R-4-7C) или его соль на один или несколько атомов кислорода с получением соединения формулы (R-4-7B):
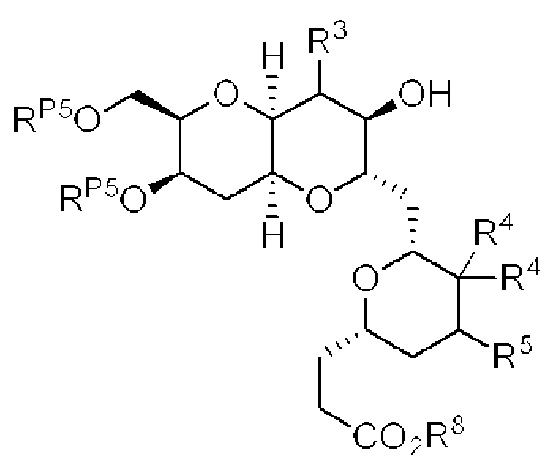
или его соли.
[00265] Согласно определенным вариантам осуществления указанный способ включает в себя:
(a) стадию сочетания соединения формулы (E-R-9):
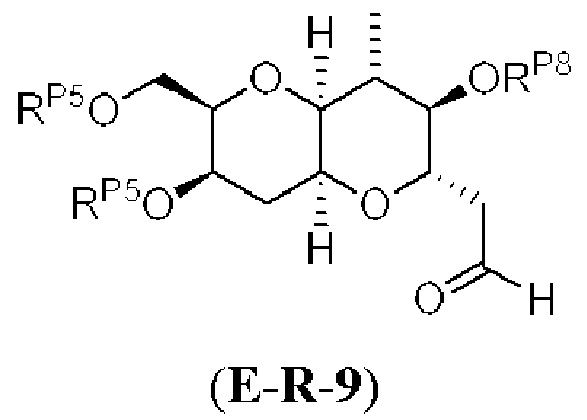
или его соли с соединением формулы (E-R-10):
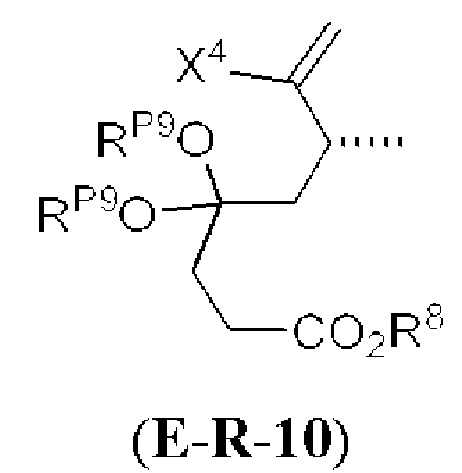
или его солью с получением соединения формулы (E-R-11):
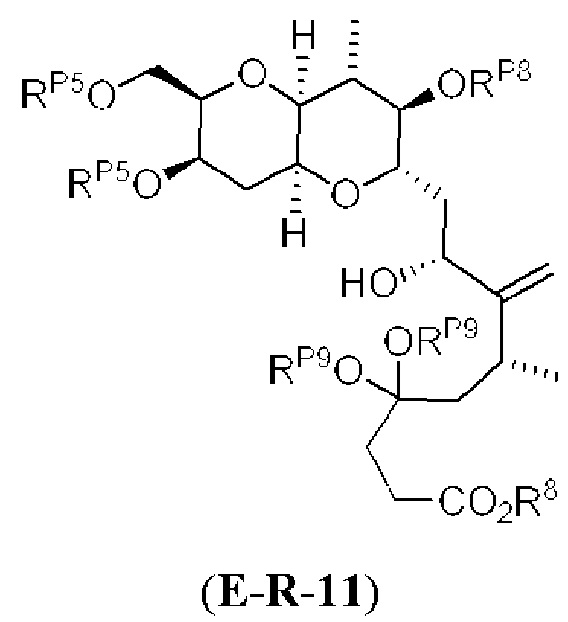
или его соли;
(b) стадию снятия защитных групп с соединения формулы (Е-R-11) или его соли в условиях, необходимых для снятия групп RP5 и RP8, с получением соединения формулы (Е-R-12):
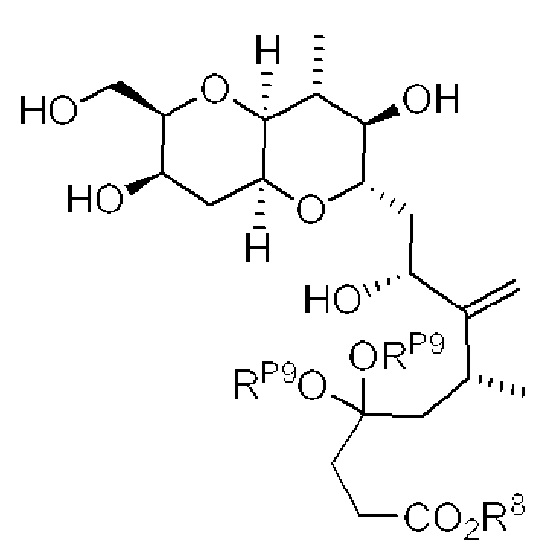
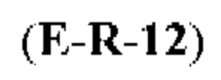
или его соли; и
(c) стадию снятия защитных групп и циклизации соединения формулы (E-R-12) или его соли с получением соединения формулы (E-R-13):
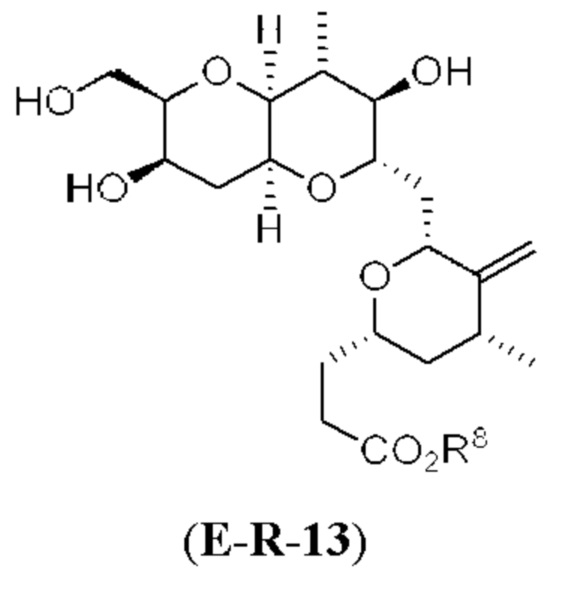
или его соли;
(d) стадию введения защитных групп в соединение формулы (E-R-13) или его соль с получением соединения формулы (E-R-14):
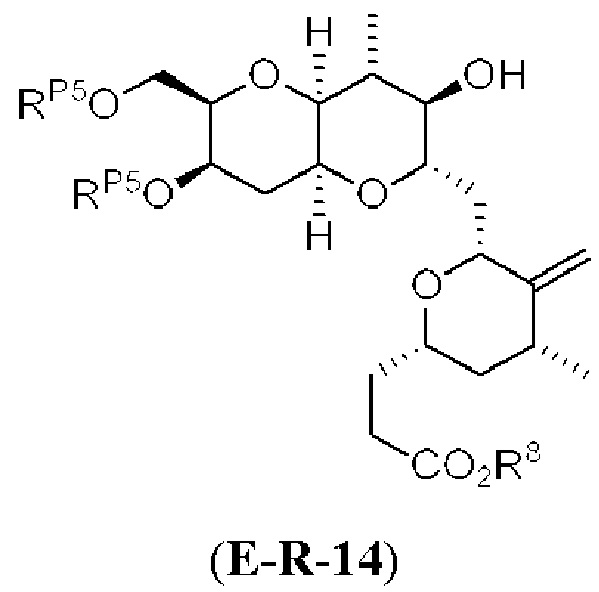
или его соли; где:
в каждом случае RP5, RP8 и RP9 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца; и где две группы RP9 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00266] Согласно определенным вариантам осуществления представленная выше стадия (а) (с получением соединения формулы (R-4-7A), (Е-R-11) или его соли) представляет собой Ni/Cr-опосредованную реакцию восстановительного сочетания; и стадия (a-i) или (с) (с получением соединения формулы (R-4-7), (E-R-13) или его соли) представляет собой снятие защитных групп с кеталя и промотированная кислотой внутримолекулярная циклизация пирана. Реагенты и условия для представленных выше стадий (a), (a-i) и/или (с) могут быть найдены, например, в публикациях международных заявок согласно РСТ WO 2016/176560, опубликованной 3 ноября 2016 года, и WO 2016/003975, опубликованной 7 января 2016 года; полное содержание которых включено в настоящий документ посредством ссылки.
[00267] Ni/Cr-опосредованное восстановительное сочетание (т.е., стадию (а)) проводят в присутствии никеля и хрома. Согласно определенным вариантам осуществления никель представляет собой комплекс никеля. Примеры комплексы никеля включают в себя без ограничения комплексы, представленные на Фигуре 9В. Согласно определенным вариантам осуществления комплекс никеля представляет собой (Et)2Phen⋅NiCl2. Согласно определенным вариантам осуществления комплекс никеля представляет собой следующее соединение:
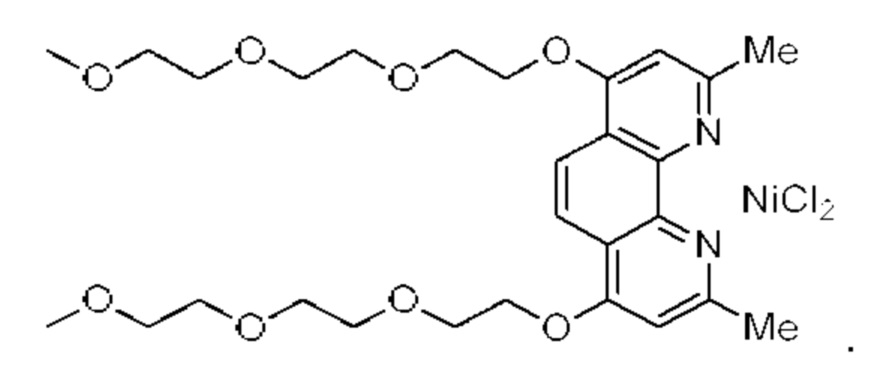
Согласно определенным вариантам осуществления комплекс никеля содержится в каталитическом количестве.
[00268] Согласно определенным вариантам осуществления хром представляет собой комплекс хрома. Согласно определенным вариантам осуществления комплекс хрома получают из соли хрома и хирального лиганда. Согласно определенным вариантам осуществления соль хрома представляет собой CrCl2 или CrCl3. Согласно определенным вариантам осуществления хиральный лиганд представляет собой хиральный сульфонамид. Примеры хиральных лигандов включают в себя без ограничения лиганды, представленные на Фигуре 9В. Согласно определенным вариантам осуществления хиральный лиганд представляет собой соединение (S)-4-G. Согласно определенным вариантам осуществления сульфонамидный лиганд представляет собой одно из следующих соединений:
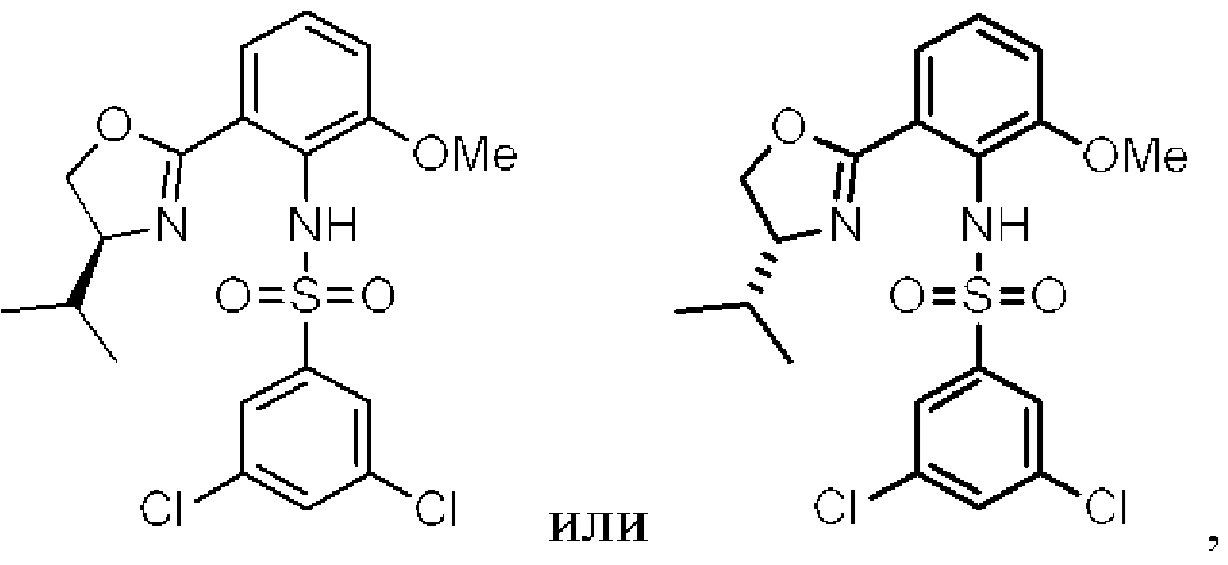
или его соль. Согласно определенным вариантам осуществления комплекс хрома содержится в каталитическом количестве.
[00269] Ni/Cr-опосредованное восстановительное сочетание может проводиться в присутствии одного или нескольких дополнительных реагентов. Согласно определенным вариантам осуществления сочетание проводят в присутствии соли лития (например, LiCl). Согласно определенным вариантам осуществления сочетание проводят в присутствии металла-восстановителя, такого как цинк или марганец (например, металлического цинка или марганца). Согласно определенным вариантам осуществления металл-восстановитель представляет собой металлический цинк. Согласно определенным вариантам осуществления металл-восстановитель представляет собой металлический марганец. Согласно определенным вариантам осуществления сочетание проводят в присутствии циркония (например, ZrCp2Cl2). Согласно определенным вариантам осуществления сочетание проводят в присутствии основания или акцептора протонов (например, 2,6-ди-трет-бутил-4-метилпиридина). Согласно определенным вариантам осуществления сочетание проводят в присутствии протонной губки (например, 1,8-бис(диметиламино)нафталина).
[00270] Согласно определенным вариантам осуществления реакцию проводят в растворителе. Согласно определенным вариантам осуществления растворитель представляет собой MeCN. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от комнатной температуры приблизительно до 100°С. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от комнатной температуры приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при температуре около комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят приблизительно при 40°С.
[00271] Согласно определенным вариантам осуществления Ni/Cr-опосредованное восстановительное сочетание может проводиться в присутствии комплекса никеля, соли хрома, сульфонамидного лиганда, соли лития, комплекса циркония, металла-восстановителя и основания или акцептора протонов. Согласно определенным вариантам осуществления стадию сочетания проводят в присутствии (Et)2Phen⋅NiCl2, CrCl2, (S)-4-F, LiCl, металлического марганца и ZrCp2Cl2. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 2 мол. % (Et)2Phen⋅NiCl2, 10 мол. % CrCl2, 10 мол. % лиганда (S)-4-F, 2 эквивалента LiCl, избыток металлического марганца, 2,5 эквивалента ZrCp2Cl2 в MeCN при комнатной температуре (например, в течение 3 часов).
[00272] Согласно определенным вариантам осуществления сочетание проводят в присутствии: комплекса никеля формулы: 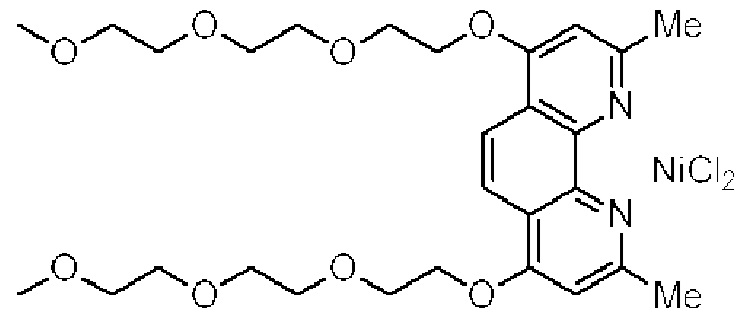 CrCl2, сульфонамидного лиганда формулы:
CrCl2, сульфонамидного лиганда формулы: 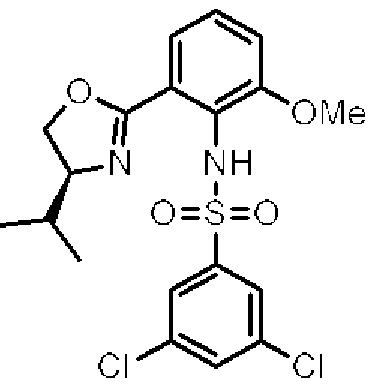 , Cp2ZrCl2, металлического марганца и основания или акцептора протонов (например, 2,6-ди-трет-бутил-4-метилпиридина и/или протонной губки (например, 1,8-бис(диметиламино)нафталина)). Согласно определенным вариантам осуществления реакцию проводят в MeCN приблизительно при 40°С. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 0,5 мол. % или более комплекса никеля формулы:
, Cp2ZrCl2, металлического марганца и основания или акцептора протонов (например, 2,6-ди-трет-бутил-4-метилпиридина и/или протонной губки (например, 1,8-бис(диметиламино)нафталина)). Согласно определенным вариантам осуществления реакцию проводят в MeCN приблизительно при 40°С. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 0,5 мол. % или более комплекса никеля формулы: 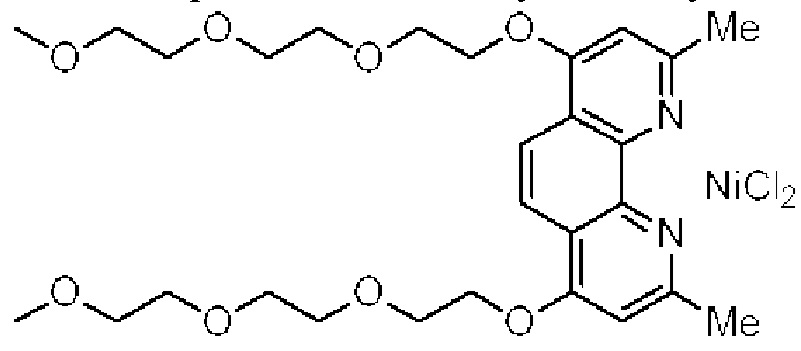 20 мол. % CrCl2, 20 мол. % сульфонамидного лиганда формулы:
20 мол. % CrCl2, 20 мол. % сульфонамидного лиганда формулы: 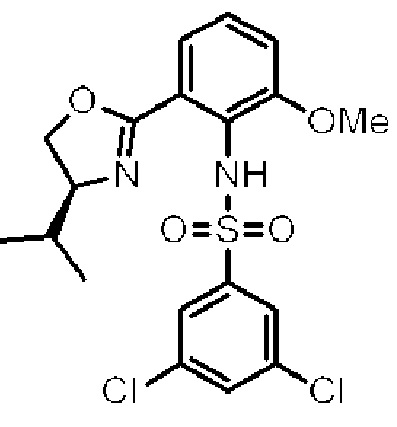 1,1 эквивалента Cp2ZrCl2, 4 эквивалента металлического марганца и протонной губки в MeCN приблизительно при 40°С (например, в течение 19 часов).
1,1 эквивалента Cp2ZrCl2, 4 эквивалента металлического марганца и протонной губки в MeCN приблизительно при 40°С (например, в течение 19 часов).
[00273] Согласно определенным вариантам осуществления RP5 и RP8 представляют собой силильные защитные группы; и снятие защитных групп на стадии (b) проводят в присутствии источника фторида. Согласно определенным вариантам осуществления источник фтора представляет собой фторид тетрабутиламмония (TBAF).
[00274] Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы: 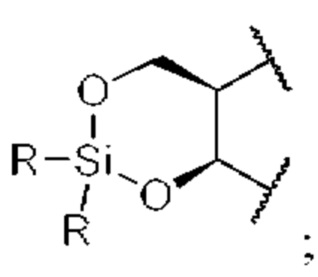 два RP9 объединены вместе с образованием:
два RP9 объединены вместе с образованием: 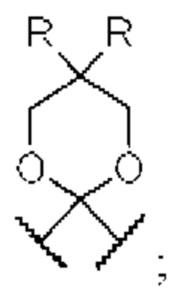 RP8 представляет собой необязательно замещенный бензил или необязательно замещенную силильную защитную группу; и R8 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:
RP8 представляет собой необязательно замещенный бензил или необязательно замещенную силильную защитную группу; и R8 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы: 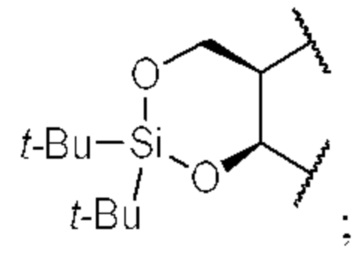 два RP9 объединены вместе с образованием
два RP9 объединены вместе с образованием 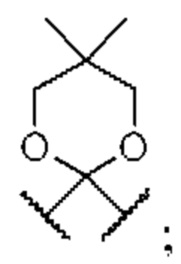 RP8 представляет собой МРМ; R8 представляет собой этил. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:
RP8 представляет собой МРМ; R8 представляет собой этил. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы: 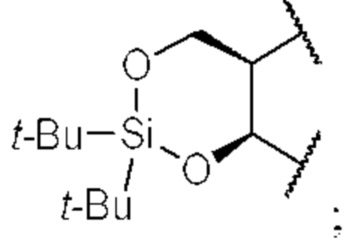 два RP9 объединены вместе с образованием
два RP9 объединены вместе с образованием 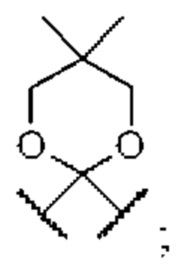 RP8 представляет собой TBS; и R8 представляет собой метил.
RP8 представляет собой TBS; и R8 представляет собой метил.
[00275] Снятие защитных групп с кеталя и промотированная кислотой внутримолекулярная циклизация пирана на стадиях (a-i) и (с) (с получением соединения формулы (R-4-7), (E-R-13) или его соли) включает в себя снятие защитных групп с кеталя исходного вещества с последующей реакцией циклизации с получением нового 6-членного цикла соединения формулы (R-4-7) или (E-R-13). Снятие защитных групп и циклизация может проводиться на одной и той же стадии, или на разных стадиях, и в другом порядке. Согласно определенным вариантам осуществления стадию снятия защитных групп и циклизации проводят в присутствии кислоты (например, кислоты Льюиса или кислоты Брэнстеда). Согласно определенным вариантам осуществления кислота представляет собой кислоту Льюиса. Согласно определенным вариантам осуществления стадию снятия защитных групп и циклизации проводят в присутствии источника гидрида.
[00276] Согласно определенным вариантам осуществления стадию снятия защитных групп и циклизации проводят в присутствии триалкилсилилсульфоната или триалкилсилилгалогенида. Согласно определенным вариантам осуществления стадию снятия защитных групп и циклизации проводят в присутствии триэтилсилилтрифторметилсульфоната (TESOTf). Согласно определенным вариантам осуществления стадию снятия защитных групп и циклизации проводят в присутствии триметилсилилтрифторметилсульфоната (TMSOTf). Согласно определенным вариантам осуществления TESOTf или TMSOTf содержится в стехиометрическом или избыточном количестве.
[00277] Согласно определенным вариантам осуществления стадию снятия защитных групп и циклизации проводят в присутствии триалкилсилана. Согласно определенным вариантам осуществления стадию снятия защитных групп и циклизации проводят в присутствии триэтилсилана (Et3SiH). Согласно определенным вариантам осуществления Et3SiH содержится в стехиометрическом или избыточном количестве.
[00278] Согласно определенным вариантам осуществления реакцию проводят в растворителе (например, CH2Cl2). Согласно определенным вариантам осуществления реакцию проводят при температуре ниже комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят приблизительно при 0°С. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от -78°С приблизительно до 0°С. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от -78°С приблизительно до комнатной температуры.
[00279] Согласно определенным вариантам осуществления стадию снятия защитных групп и циклизации проводят в присутствии кислоты Льюиса и источника гидрида. Согласно определенным вариантам осуществления реакцию проводят в присутствии TESOTf и триэтилсилана. Согласно определенным вариантам осуществления реакцию проводят в присутствии TESOTf и триэтилсилана в DCM приблизительно при 0°С. Согласно определенным вариантам осуществления реакцию проводят в присутствии TMSOTf и триэтилсилана. Согласно определенным вариантам осуществления реакцию проводят в присутствии TMSOTf и триэтилсилана в DCM при температуре в диапазоне приблизительно от -78°С приблизительно до 0°С. Согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 10 эквивалентов триэтилсилана, 5 эквивалентов TESOTf, в DCM приблизительно при 0°С (например, в течение 3 часов). В качестве другого примера, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 5 эквивалентов триэтилсилана, 5 эквивалентов TMSOTf, в DCM при температуре в диапазоне приблизительно от -78°С приблизительно до 0°С (например, в течение 1 часа).
[00280] Согласно определенным вариантам осуществления стадию повторного введения защитных групп в соединение формулы (R-4-7C), (E-R-13) или его соль (т.е., стадию (d)) проводят для введения групп RP5. Согласно определенным вариантам осуществления полученные группы RP5 объединены вместе с образованием следующей формулы:  Согласно определенным вариантам осуществления группы RP5 характеризуются следующей формулой:
Согласно определенным вариантам осуществления группы RP5 характеризуются следующей формулой: Согласно определенным вариантам осуществления реакцию проводят в присутствии кеталя или кетона и кислоты. Согласно определенным вариантам осуществления кеталь характеризуется формулой:
Согласно определенным вариантам осуществления реакцию проводят в присутствии кеталя или кетона и кислоты. Согласно определенным вариантам осуществления кеталь характеризуется формулой:  (2,2-диметоксипропан). Согласно определенным вариантам осуществления кислота представляет собой пара-толуолсульфонат пиридиния (PPTS). Согласно определенным вариантам осуществления реакцию проводят в присутствии 2,2-диметоксипропана и PPTS. Согласно определенным вариантам осуществления реакцию проводят в растворителе (например, THF). Согласно определенным вариантам осуществления реакцию проводят в присутствии 2,2-диметоксипропана и PPTS в THF приблизительно при 40°С. Согласно определенным вариантам осуществления введение защитных групп проводят в следующих условиях: 4 эквивалента 2,2,-диметоксипропана и 5 мол. % PPTS в THF приблизительно при 40°С (например, в течение 4-5 часов).
(2,2-диметоксипропан). Согласно определенным вариантам осуществления кислота представляет собой пара-толуолсульфонат пиридиния (PPTS). Согласно определенным вариантам осуществления реакцию проводят в присутствии 2,2-диметоксипропана и PPTS. Согласно определенным вариантам осуществления реакцию проводят в растворителе (например, THF). Согласно определенным вариантам осуществления реакцию проводят в присутствии 2,2-диметоксипропана и PPTS в THF приблизительно при 40°С. Согласно определенным вариантам осуществления введение защитных групп проводят в следующих условиях: 4 эквивалента 2,2,-диметоксипропана и 5 мол. % PPTS в THF приблизительно при 40°С (например, в течение 4-5 часов).
[00281] Согласно определенным вариантам осуществления соединение формулы (Е-R-14), (E-R-8), (R-4-7) или (R-4-7B) или его соль очищают посредством комбинации колоночной хроматографии на силикагеле, колоночной хроматографии на ODS (октадецилсилиле) и перекристаллизации.
[00282] Как также представлено на Схеме 3В, в настоящем документе раскрыт способ получения соединения формулы (R-4-5B):
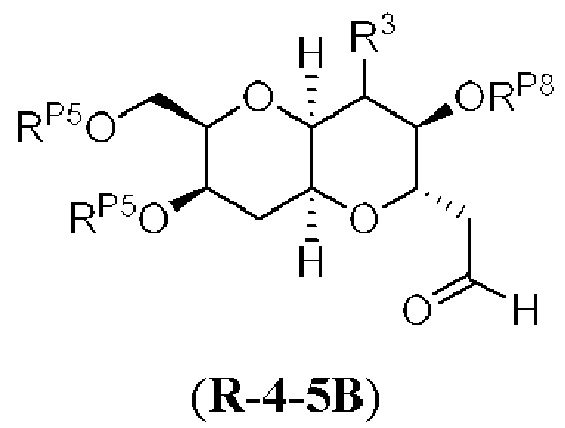
или его соли, причем способ включает в себя восстановление соединения формулы (R-4-5A):
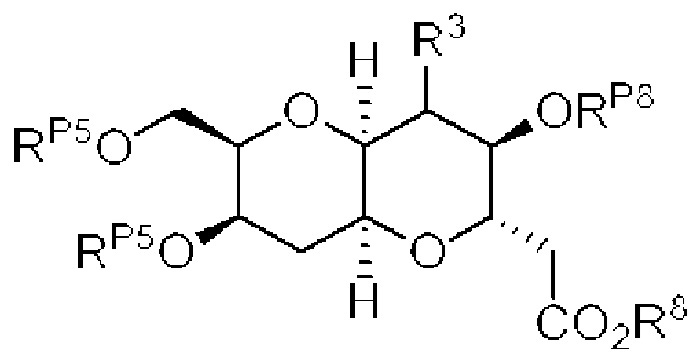
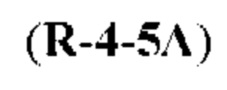
или его соли, где:
R3 представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае RP5 и RP8 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00283] Согласно определенным вариантам осуществления способ включает в себя восстановление соединения формулы (E-R-15):
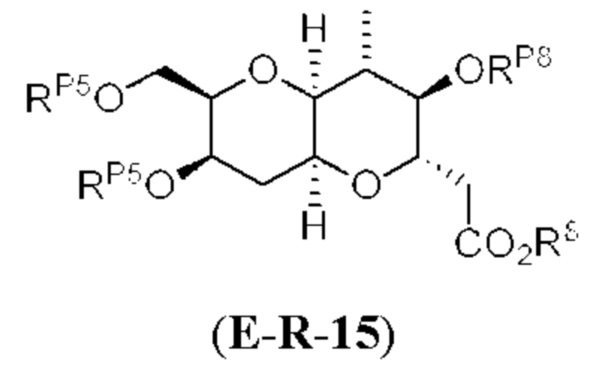
или его соли с получением соединения формулы (E-R-9):
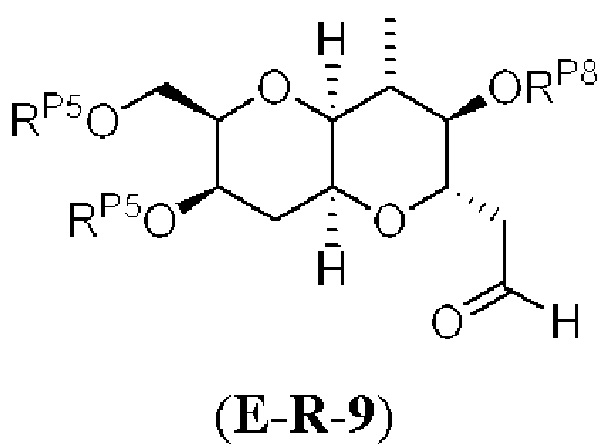
или его соли, где:
в каждом случае RP5 и RP8 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00284] На стадии восстановления соединения формулы (R-4-5A), (E-R-15) или его соли фрагмент -CO2R8 преобразуют до альдегида. Согласно определенным вариантам осуществления стадию восстановления проводят в присутствии источника гидрида (т.е., Н- ). Любой источник гидрида, известный из уровня техники, может быть использован для данной трансформации. Примеры источников гидрида раскрыты в настоящем документе. Согласно определенным вариантам осуществления источник гидрида представляет собой гидрид диизобутилалюминия (DIBAL). Согласно определенным вариантам осуществления в этой реакции используют стехиометрическое или избыточное количество DIBAL.
[00285] Стадия восстановления может необязательно включать в себя восстановление фрагмента -CO2R8 до спирта с последующим окислением полученного спирта до альдегида с получением соединения формулы (R-4-5B) или (E-R-9) или его соли.
[00286] Согласно определенным вариантам осуществления стадию восстановления проводят в присутствии DIBAL. Согласно определенным вариантам осуществления реакцию проводят в растворителе (например, DCM). Согласно определенным вариантам осуществления реакцию проводят при температуре ниже комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят приблизительно при -78°С. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от -70°С приблизительно до -78°С. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от -78°С приблизительно до 0°С. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от -78°С приблизительно до комнатной температуры. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: DIBAL в DCM при -78°С (например, в течение 1-2 часов). Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 2,3 эквивалента DIBAL в DCM при температуре от -70°С до -78°С (например, в течение 1-2 часов).
[00287] Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:  RP8 представляет собой необязательно замещенный бензил или необязательно замещенную силильную защитную группу; и R8 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:
RP8 представляет собой необязательно замещенный бензил или необязательно замещенную силильную защитную группу; и R8 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:  RP8 представляет собой МРМ; и R8 представляет собой метил. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:
RP8 представляет собой МРМ; и R8 представляет собой метил. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:  RP8 представляет собой TBS; и R8 представляет собой метил.
RP8 представляет собой TBS; и R8 представляет собой метил.
[00288] В настоящем документе также раскрыт способ получения соединения формулы (R-4-5A):
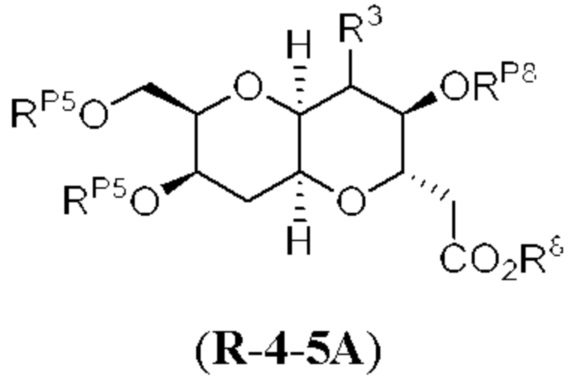
или его соли, причем способ включает в себя циклизацию соединения формулы (R-4-4):
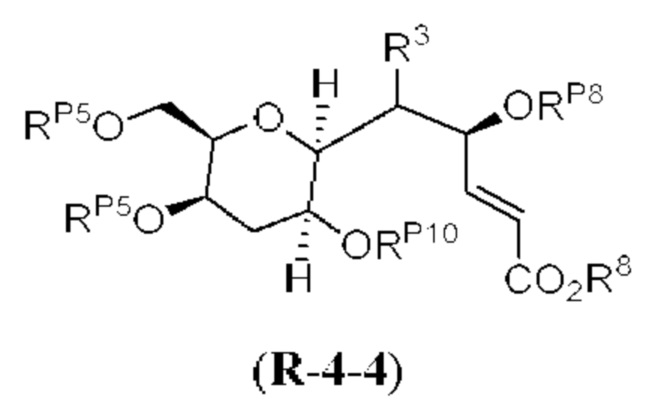
или его соли, где:
R3 представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае RP5, RP8 и RP10 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00289] Согласно определенным вариантам осуществления способ включает в себя стадию циклизации соединения формулы (E-R-16):
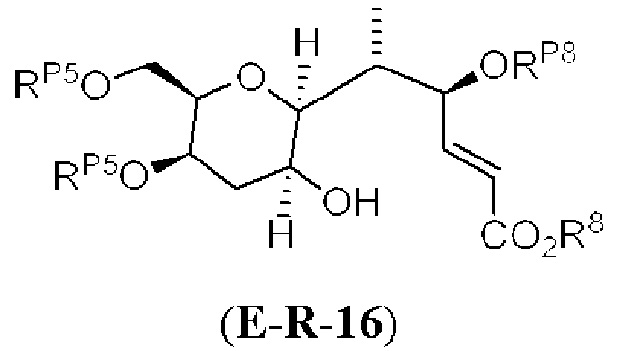
или его соли с получением соединения формулы (E-R-15):
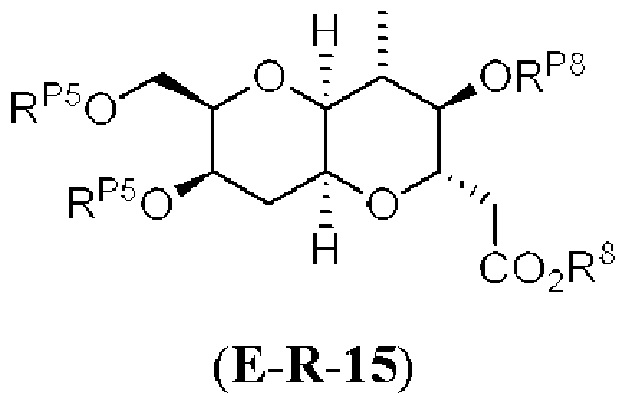
или его соли, где:
в каждом случае RP5 и RP8 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00290] Согласно определенным вариантам осуществления стадию циклизации соединения формулы (R-4-4) или (E-R-16) или его соли проводят в присутствии основания. Любое основание может быть использовано в данной реакции циклизации. Согласно определенным вариантам осуществления основание представляет собой фосфат. Согласно определенным вариантам осуществления основание представляет собой фосфат калия (K3PO4). Согласно определенным вариантам осуществления основание содержится в количестве 1 эквивалента или менее. Согласно определенным вариантам осуществления основание содержится в избыточном количестве.
[00291] Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии одного или нескольких дополнительных реагентов, таких как хелатор металлов. Согласно определенным вариантам осуществления реакцию проводят в присутствии краун-эфира (например, 18-краун-6). Согласно определенным вариантам осуществления реакцию проводят в присутствии 18-краун-6. Согласно определенным вариантам осуществления используют 1 эквивалент или менее 18-краун-6.
[00292] Согласно определенному варианту осуществления реакцию проводят в присутствии растворителя. Согласно определенным вариантам осуществления растворитель представляет собой толуол и/или МеОАс. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при температуре от 0°С до комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят при температуре около комнатной температуры.
[00293] Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии основания и краун-эфира. Согласно определенным вариантам осуществления реакцию проводят в присутствии K3PO4 и 18-краун-6. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 1 эквивалент K3PO4, 3 эквивалента 18-краун-6 в толуоле при комнатной температуре. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 0,3 эквивалента K3PO4, 0,9 эквивалента 18-краун-6 в толуоле и МеОАс приблизительно при 3°С (например, в течение 1-2 часов).
[00294] Согласно определенным вариантам осуществления соединение формулы (R-4-4) представляет собой соединение формулы (R-4-4A):
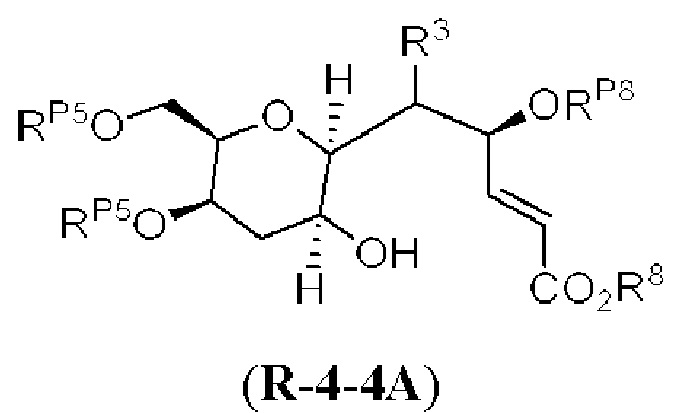
или его соль.
[00295] Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:  RP8 представляет собой необязательно замещенный бензил или необязательно замещенную силильную защитную группу; и R8 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:
RP8 представляет собой необязательно замещенный бензил или необязательно замещенную силильную защитную группу; и R8 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:  RP8 представляет собой МРМ; и R8 представляет собой метил. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:
RP8 представляет собой МРМ; и R8 представляет собой метил. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:  RP8 представляет собой TBS; и R8 представляет собой метил.
RP8 представляет собой TBS; и R8 представляет собой метил.
[00296] Согласно определенным вариантам осуществления соединение формулы (R-4-5A) или (E-R-15) или его соль очищают методом колоночной хроматографии на силикагеле и/или перекристаллизации.
[00297] В настоящем документе также раскрыт способ получения соединения формулы (R-4-4):
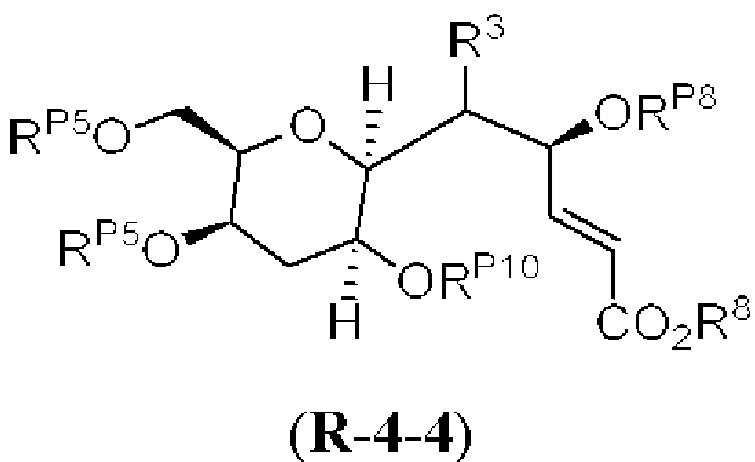
или его соли, причем способ включает в себя сочетание соединения формулы (R-4-2):
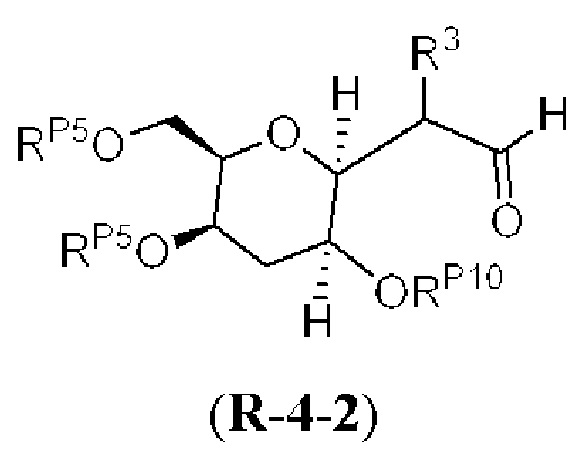
или его соли с соединением формулы (R-4-3):
или его солью, где:
X4 представляет собой галоген или уходящую группу;
R3 представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае RP5 и RP10 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00298] Согласно определенным вариантам осуществления сочетанием соединения формулы (R-4-2) и соединения формулы (R-4-3) получают соединение формулы (R-4-4A):
или его соль, и способ получения соединения формулы (R-4-4) или его соли включает в себя введение защитных групп на атом кислорода соединения формулы (R-4-4А) или его соли (например, для введения группы RP8). Указанный способ может дополнительно включать в себя стадию снятия защитных групп с соединения для снятия защитной группы RP10.
[00299] Согласно определенным вариантам осуществления способ включает в себя сочетание соединения формулы (E-R-17):
или его соли с соединением формулы (R-4-3):
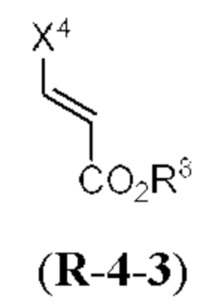
или его солью с получением соединения формулы (E-R-18):
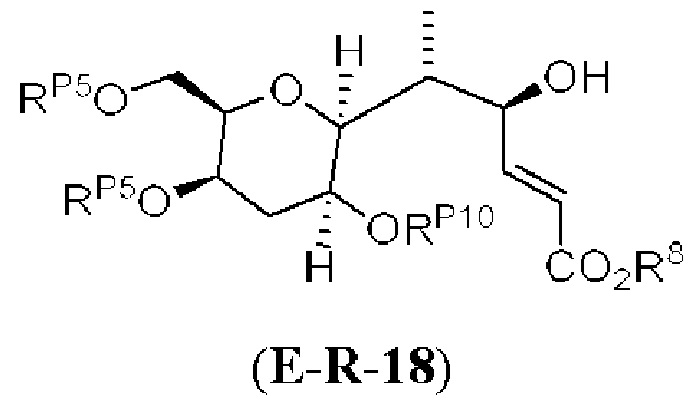
или его соли, где:
X4 представляет собой галоген или уходящую группу;
R3 представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае RP5 и RP10 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00300] Согласно определенным вариантам осуществления способ дополнительно включает в себя стадии (а) защиты свободной гидроксильной группы соединения формулы (E-R-18) или его соли; и (b) снятия защитной группы с полученного соединения для снятия группы RP10.
[00301] Согласно определенным вариантам осуществления сочетание соединения формулы (R-4-2) и соединения формулы (R-4-3) с получением соединения формулы (R-4-4) (или сочетание соединения формулы (E-R-17) и соединения формулы (R-4-3) с получением соединения формулы (E-R-18)) представляет собой Ni/Cr-опосредованное сочетание. Ni/Cr-опосредованное восстановительное сочетание проводят в присутствии никеля и хрома. Согласно определенным вариантам осуществления никель представляет собой комплекс никеля. Примеры комплексов никеля включают в себя без ограничения комплексы, представленные на Фигуре 9В. Согласно определенным вариантам осуществления комплекс никеля представляет собой (Me)2Phen(OMe)2⋅NiCl2. Согласно определенным вариантам осуществления комплекс никеля содержится в каталитическом количестве. Согласно определенным вариантам осуществления комплекс никеля представляет собой следующее соединение:
[00302] Согласно определенным вариантам осуществления хром представляет собой комплекс хрома. Согласно определенным вариантам осуществления комплекс хрома получают из соли хрома и хирального лиганда. Согласно определенным вариантам осуществления соль хрома представляет собой CrCl3 или CrCl2. Согласно определенным вариантам осуществления хиральный лиганд представляет собой хиральный сульфонамид. Примеры хиральных лигандов включают в себя без ограничения лиганды, представленные на Фигуре 9В. Согласно определенным вариантам осуществления хиральный лиганд представляет собой соединение (R)-4-E. Согласно определенным вариантам осуществления комплекс хрома содержится в каталитическом количестве. Согласно определенным вариантам осуществления сульфонамидный лиганд представляет собой одно из следующих соединений:
или его соль.
[00303] Ni/Cr-опосредованное восстановительное сочетание может проводиться в присутствии одного или нескольких дополнительных реагентов. Согласно определенным вариантам осуществления сочетание проводят в присутствии соли лития (например, LiCl). Согласно определенным вариантам осуществления сочетание проводят в присутствии металла-восстановителя, такого как цинк или марганец (например, металлического цинка или марганца). Согласно определенным вариантам осуществления сочетание проводят в присутствии циркония (например, ZrCp2Cl2). Согласно определенным вариантам осуществления сочетание проводят в присутствии основания или акцептора протонов (например, 2,6-ди-трет-бутил-4-метилпиридина или 2,6-лутидина). Согласно определенным вариантам осуществления сочетание проводят в присутствии протонной губки (например, 1,8-бис(диметиламино)нафталина).
[00304] Согласно определенным вариантам осуществления реакцию проводят в растворителе (например, MeCN). Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от комнатной температуры приблизительно до 100°С. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от комнатной температуры приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при температуре около комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят приблизительно при 30°С.
[00305] Согласно определенным вариантам осуществления Ni/Cr-опосредованное восстановительное сочетание может проводиться в присутствии комплекса никеля, соли хрома, сульфонамидного лиганда, соли лития, комплекса циркония, металла-восстановителя и основания или акцептора протонов. Согласно определенным вариантам осуществления стадию сочетания проводят в присутствии (Me)2Phen(OMe)2⋅NiCl2, CrCl2, лиганда (S)-4-Е, LiCl, металлического марганца, 2,6-лутидина и ZrCp2Cl2. Согласно определенным вариантам осуществления реакцию проводят в растворителе (например, MeCN). Согласно определенным вариантам осуществления реакцию проводят при температуре около комнатной температуры. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 2 мол. % (Me)2Phen(OMe)2⋅NiCl2, 10 мол. % CrCl2, 10 мол. % лиганда (S)-4-E, 2 эквивалента LiCl, 1,1 эквивалента Cp2ZrCl2, 1 эквивалент 2,6-лутидина и избыток марганца в MeCN при комнатной температуре.
[00306] Согласно определенным вариантам осуществления сочетание проводят в присутствии: комплекса никеля формулы: 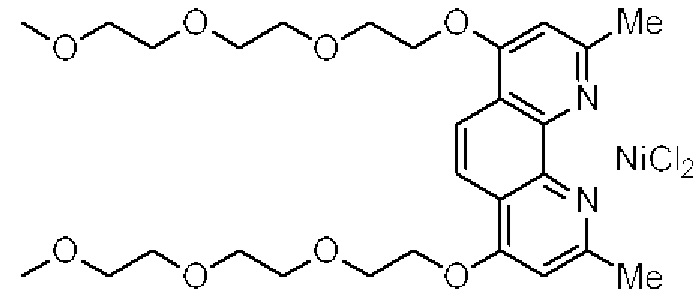 CrCl2, сульфонамидного лиганда формулы:
CrCl2, сульфонамидного лиганда формулы: 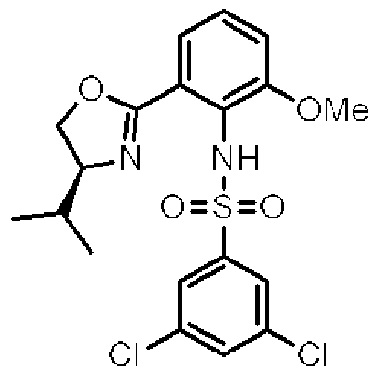 Cp2ZrCl2, металлического марганца и основания или акцептора протонов (например, 2,6-лутидина и/или протонной губки (например, 1,8-бис(диметиламино)нафталина)). Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 0,5 мол. % комплекса никеля формулы:
Cp2ZrCl2, металлического марганца и основания или акцептора протонов (например, 2,6-лутидина и/или протонной губки (например, 1,8-бис(диметиламино)нафталина)). Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 0,5 мол. % комплекса никеля формулы: 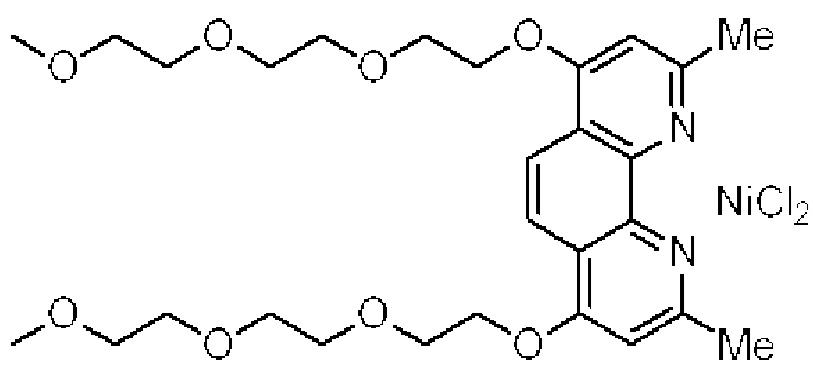 20 мл% CrCl2, 20 мол. % сульфонамидного лиганда формулы:
20 мл% CrCl2, 20 мол. % сульфонамидного лиганда формулы: 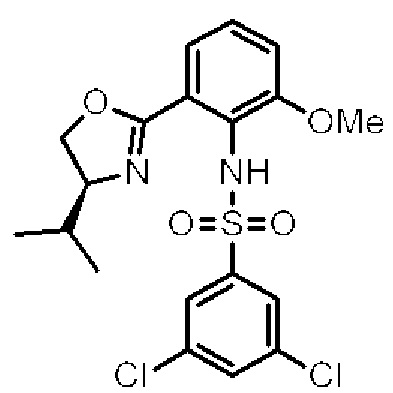 , 1,1 эквивалента Cp2ZrCl2, 4 эквивалента металлического марганца, 2 эквивалента 2,6-лутидина и протонной губки в MeCN приблизительно при 30°С (например, в течение 2-3 часов).
, 1,1 эквивалента Cp2ZrCl2, 4 эквивалента металлического марганца, 2 эквивалента 2,6-лутидина и протонной губки в MeCN приблизительно при 30°С (например, в течение 2-3 часов).
[00307] Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:  RP8 представляет собой необязательно замещенный бензил или необязательно замещенную силильную защитную группу; R8 представляет собой необязательно замещенный алкил; и RP10 представляет собой силильную защитную группу. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:
RP8 представляет собой необязательно замещенный бензил или необязательно замещенную силильную защитную группу; R8 представляет собой необязательно замещенный алкил; и RP10 представляет собой силильную защитную группу. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:  RP8 представляет собой МРМ; R8 представляет собой метил; и RP10 представляет собой TES. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:
RP8 представляет собой МРМ; R8 представляет собой метил; и RP10 представляет собой TES. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:  RP8 представляет собой TBS; R8 представляет собой метил; и RP10 представляет собой TES.
RP8 представляет собой TBS; R8 представляет собой метил; и RP10 представляет собой TES.
[00308] В настоящем документе раскрыт способ получения соединения формулы (R-4-2):
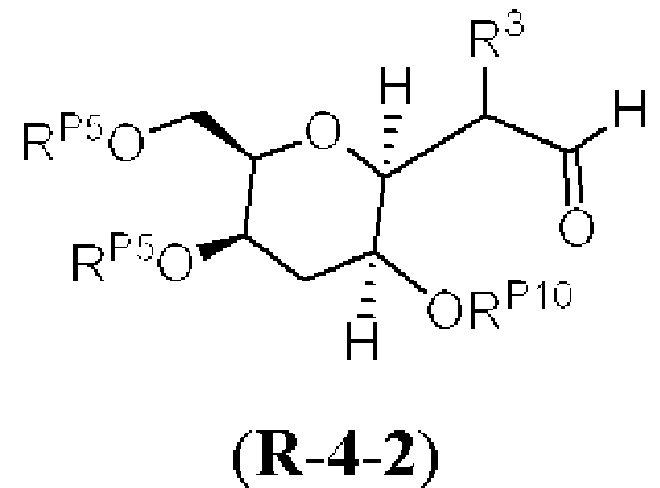
или его соли, причем способ включает в себя восстановление соединения формулы (R-4-1):
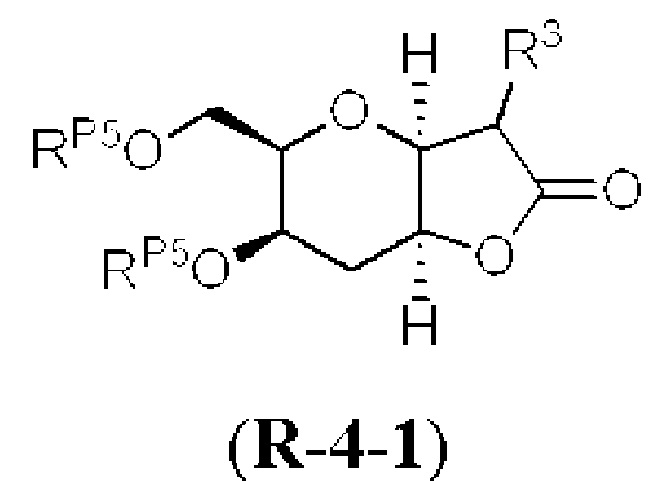
или его соли, где:
R3 представляет собой водород, галоген или необязательно замещенный алкил; и
в каждом случае RP5 и RP10 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца.
[00309] Согласно определенным вариантам осуществления способ получения соединения формулы (R-4-2) или его соли включает в себя стадии:
(а) восстановления соединения формулы (R-4-1):
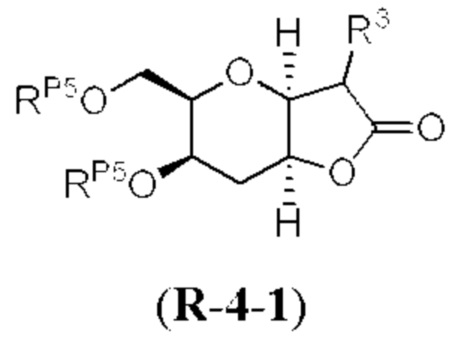
или его соли с получением соединения формулы (R-4-1A):
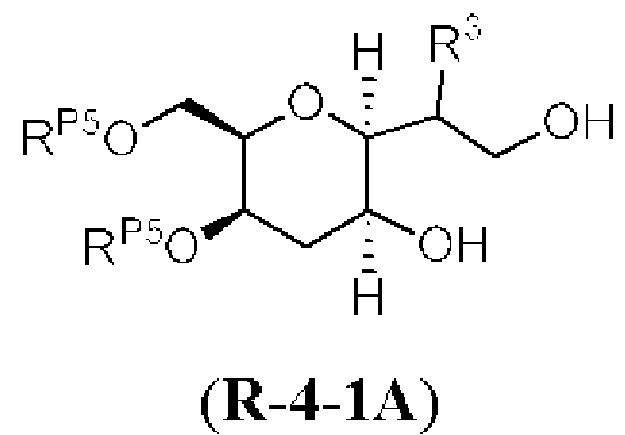
или его соли;
(b) введения защитной группы в соединение формулы (R-4-1) или его соль с получением соединения формулы (R-4-1B):
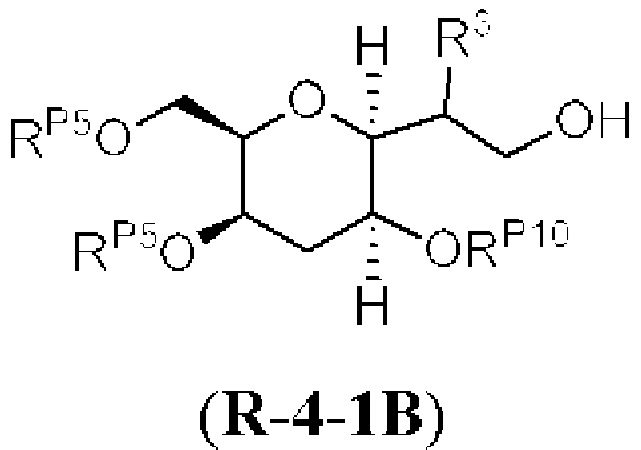
или его соли; и
(c) окисления соединения формулы (R-4-1B) или его соли с получением соединения формулы (R-4-2) или его соли.
[00310] На стадии восстановления соединения формулы (R-4-2) или его соли восстанавливается лактон указанного соединения. Согласно определенным вариантам осуществления стадию восстановления проводят в присутствии источника гидрида (т.е., Н-). Любой источник гидрида, известный из уровня техники, может быть использован для данной трансформации. Примеры источников гидрида раскрыты в настоящем документе. Согласно определенным вариантам осуществления источник гидрида представляет собой боргидрид лития (LiBH4). Согласно определенным вариантам осуществления стадия окисления (т.е., стадия (с)) включает в себя окисление по Сверну.
[00311] Согласно определенным вариантам осуществления стадию восстановления проводят в присутствии LiBH4. Согласно определенным вариантам осуществления реакцию проводят в растворителе, таком как диэтиловый эфир. Согласно определенным вариантам осуществления реакцию проводят приблизительно при 0°С. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: LiBH4 в диэтиловом эфире при 0°С.
[00312] Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы: 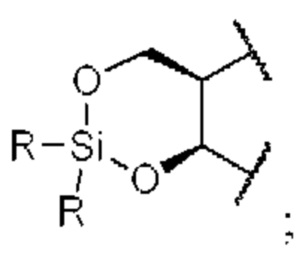 и RP10 представляет собой силильную защитную группу. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:
и RP10 представляет собой силильную защитную группу. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы: 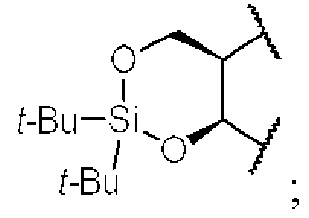 и RP10 представляет собой TES.
и RP10 представляет собой TES.
[00313] В настоящем документе также раскрыт альтернативный способ получения соединения формулы (R-4-2), или его соль, включающий в себя:
(a) стадию восстановления соединения формулы (R-4-1):
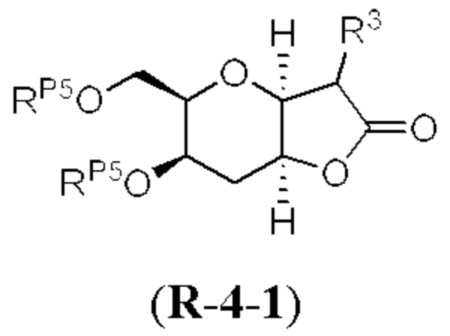
или его соли с получением соединения формулы (R-4-2):
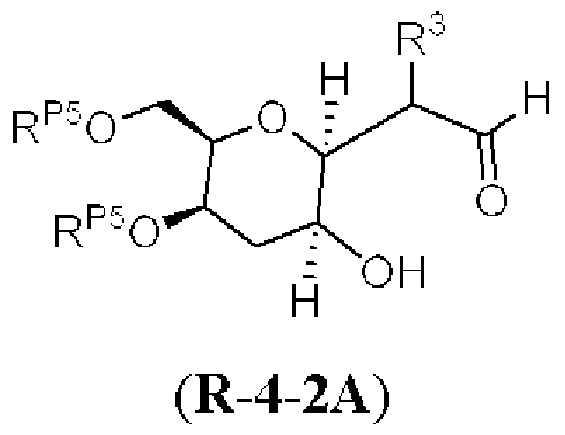
или его соли;
(b) стадию олефинирования соединения формулы (R-4-2A) или его соли с получением соединения формулы (R-4-2B):
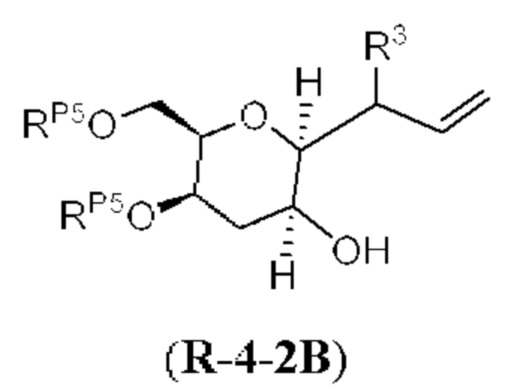
или его соли;
(c) стадию введения защитной группы в соединение формулы (R-4-2B) или его соль с получением соединения формулы (R-4-2C):
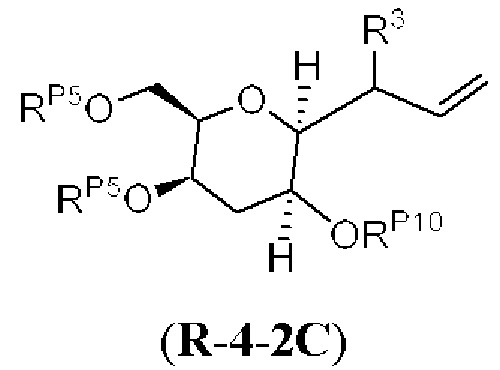
или его соли; и
(d) стадию окисления соединения формулы (R-4-2C) или его соли с получением соединения формулы (R-4-2):
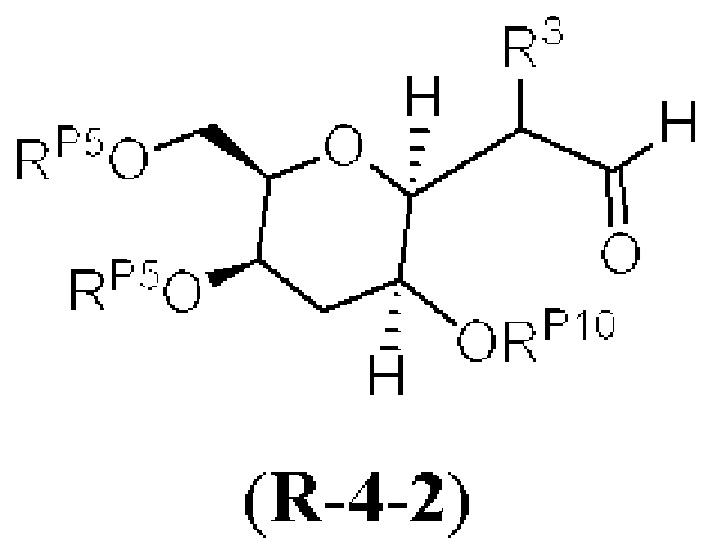
или его соли, где:
R3 представляет собой водород, галоген или необязательно замещенный алкил; и
в каждом случае RP5 и RP10 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца.
[00314] Согласно определенным вариантам осуществления указанный способ включает в себя:
(a) стадию восстановления соединения формулы (E-R-19):
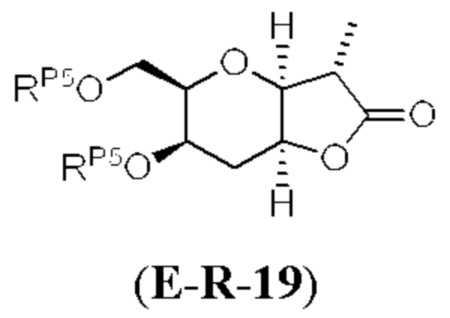
или его соли с получением соединения формулы (E-R-20):
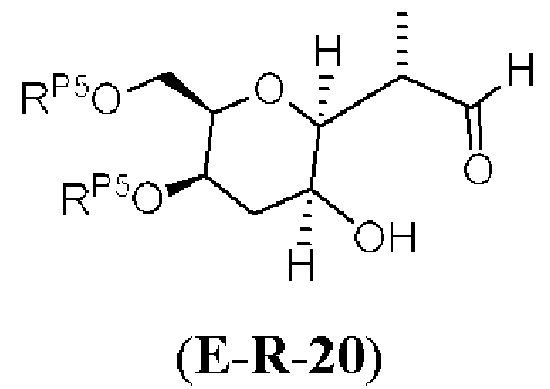
или его соли;
(b) стадию олефинирования соединения формулы (E-R-20) или его соли с получением соединения формулы (E-R-21):
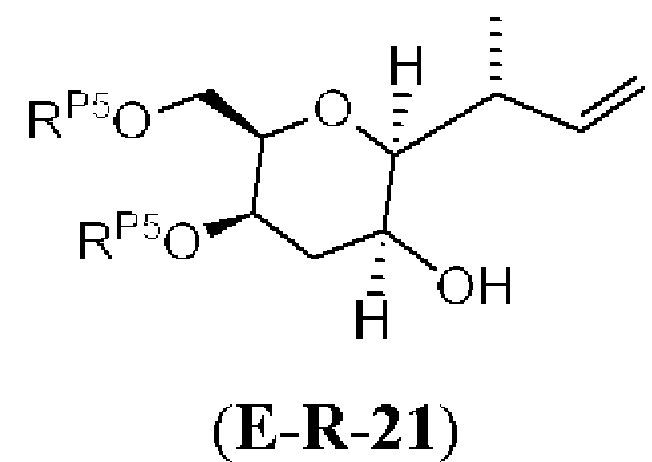
или его соли;
(c) стадию введения защитной группы в соединение формулы (E-R-21) или его соль с получением соединения формулы (E-R-22):
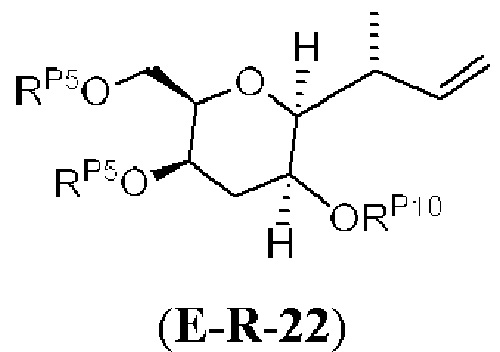
или его соли; и
(d) стадию окисления соединения формулы (E-R-22) или его соли с получением соединения формулы (E-R-17):
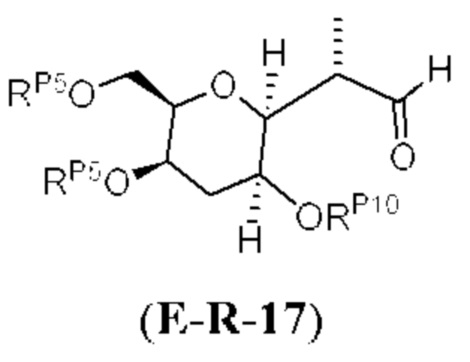
или его соли, где:
в каждом случае RP5 и RP10 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца.
[00315] Согласно определенным вариантам осуществления стадию восстановления соединения формулы (R-4-1), (E-R-19) или его соли (т.е., стадию (а)), проводят в присутствии источника гидрида. Примеры источников гидрида раскрыты в настоящем документе. Согласно определенным вариантам осуществления источник гидрида представляет собой боргидрид лития (LiBH4). Согласно определенным вариантам осуществления источник гидрида представляет собой гидрид диизобутилалюминия (DIBAL). Согласно определенным вариантам осуществления реакцию проводят в растворителе (например, в толуоле). Согласно определенным вариантам осуществления реакцию проводят в присутствии DIBAL в толуоле. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от комнатной температуры приблизительно до -78°С приблизительно до 0°С. Согласно определенным вариантам осуществления реакцию проводят в следующих условиях: приблизительно 1,3 эквивалента DIBAL в толуоле при температуре от -78 до -60°С (например, в течение менее 1 часа).
[00316] Согласно определенным вариантам осуществления стадию олефинирования соединения формулы (R-4-2A), (E-R-20) или его соли (т.е., стадию (b)), проводят в присутствии олефинирующего реагента и основания. Согласно определенным вариантам осуществления олефинирующий реагент представляет собой Ph3PCH3Br. Согласно определенным вариантам осуществления основание представляет собой алкоксид. Согласно определенным вариантам осуществления основание представляет собой t-BuOK. Согласно определенным вариантам осуществления стадию олефинирования проводят в присутствии Ph3PCH3Br и t-BuOK. Согласно определенным вариантам осуществления реакцию проводят в растворителе (например, THF). Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до комнатной температуры. Согласно определенным вариантам осуществления стадию олефинирования проводят в следующих условиях: 4 эквивалента Ph3PCH3Br, 3 эквивалента Z-BuOK в THF при температуре от 0 до 10°С (например, в течение менее 1 часа).
[00317] Согласно определенным вариантам осуществления RP10 представляет собой силильную защитную группу; и стадию (с) введения защитных групп проводят в присутствии силилирующего реагента и аминового основания. Согласно определенным вариантам осуществления RP10 представляет собой TES; и силилирующий реагент представляет собой TESOTf. Согласно определенным вариантам осуществления аминовое основание представляет собой триэтиламин (TEA). Согласно определенным вариантам осуществления стадию введения защитных групп проводят в присутствии TESOTf и TEA. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до комнатной температуры. Согласно определенным вариантам осуществления стадию введения защитных групп проводят в присутствии TESOTf и TEA в THF при температуре от 0 до 10°С (например, в течение менее 1 часа).
[00318] Согласно определенным вариантам осуществления стадия окисления соединения формулы (R-4-2C), (E-R-22) или его соли представляет собой окислительное расщепление по Джонсону-Лемье. Например, согласно определенным вариантам осуществления реакцию проводят в присутствии тетраоксида осмия (OsO4) или K2OsO4 и N-оксида N-метилморфолина (NMO). Согласно определенным вариантам осуществления реакцию проводят в присутствии перйодата натрия (NaIO4) или ацетата свинца Pb(ОАс)4. Согласно определенным вариантам осуществления реакцию проводят в присутствии тетраоксида осмия (OsO4) и N-оксида N-метилморфолина (NMO), а затем перйодата натрия (NaIO4). Согласно определенным вариантам осуществления стадию окисления проводят в присутствии THF, ацетона и/или воды. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Например, согласно определенным вариантам осуществления стадию окисления проводят в следующих условиях: 25 эквивалентов OsO4 и 3 эквивалента NMO в смеси THF/ацетон/вода при комнатной температуре (например, в течение 19 часов), с последующим добавлением 3 эквивалентов NaIO4 при комнатной температуре (например, в течение менее 1 часа).
Получение левых половин
[00319] Как описано в настоящем документе, получение галихондриновых продуктов природного происхождения и их аналогов может включать в себя сочетание фрагмента «левой половины» с фрагментом «правой половины». Способы, применимые для получения структурных элементов правой половины, раскрыты выше. Согласно другому аспекту настоящее изобретение относится к структурным элементам «левой половины» и способам, применимым для их получения.
Получение левых половин галихондринов
[00320] В настоящем документе раскрыты способы, применимые для получения структурных элементов «левой половины» галихондринов и их аналогов. Например, левые половины соединений галихондринового ряда (например, галихондрина А, В, С и их аналогов) могут быть получены, как представлено на Схеме 4А. Например, структурный элемент левой половины формулы (L-2-14) может быть получен путем тиолирования соединения формулы (L-5-17), которое может быть получено путем циклизации соединения формулы (L-5-16B). С этой целью, соединение формулы (L-5-16B) может быть получено путем циклизации соединения формулы (L-5-16A), которое может быть получено из промежуточного соединения формулы (L-5-15) посредством окисления и олефинирования. Как также представлено на Схеме 4А, промежуточное соединение формулы (L-5-15) может быть получено путем перегруппировки соединения формулы (L-5-14). Соединение формулы (L-5-14) может быть получено путем сочетания соединения формулы (L-5-12) с соединением формулы (L-5-5). Соединение формулы (L-5-12) может быть получено путем эпоксидирования соединения формулы (L-5-11), которое может быть получено путем сочетания соединения формулы (L-5-10) с соединением формулы (L-5-9).
Схема 4А
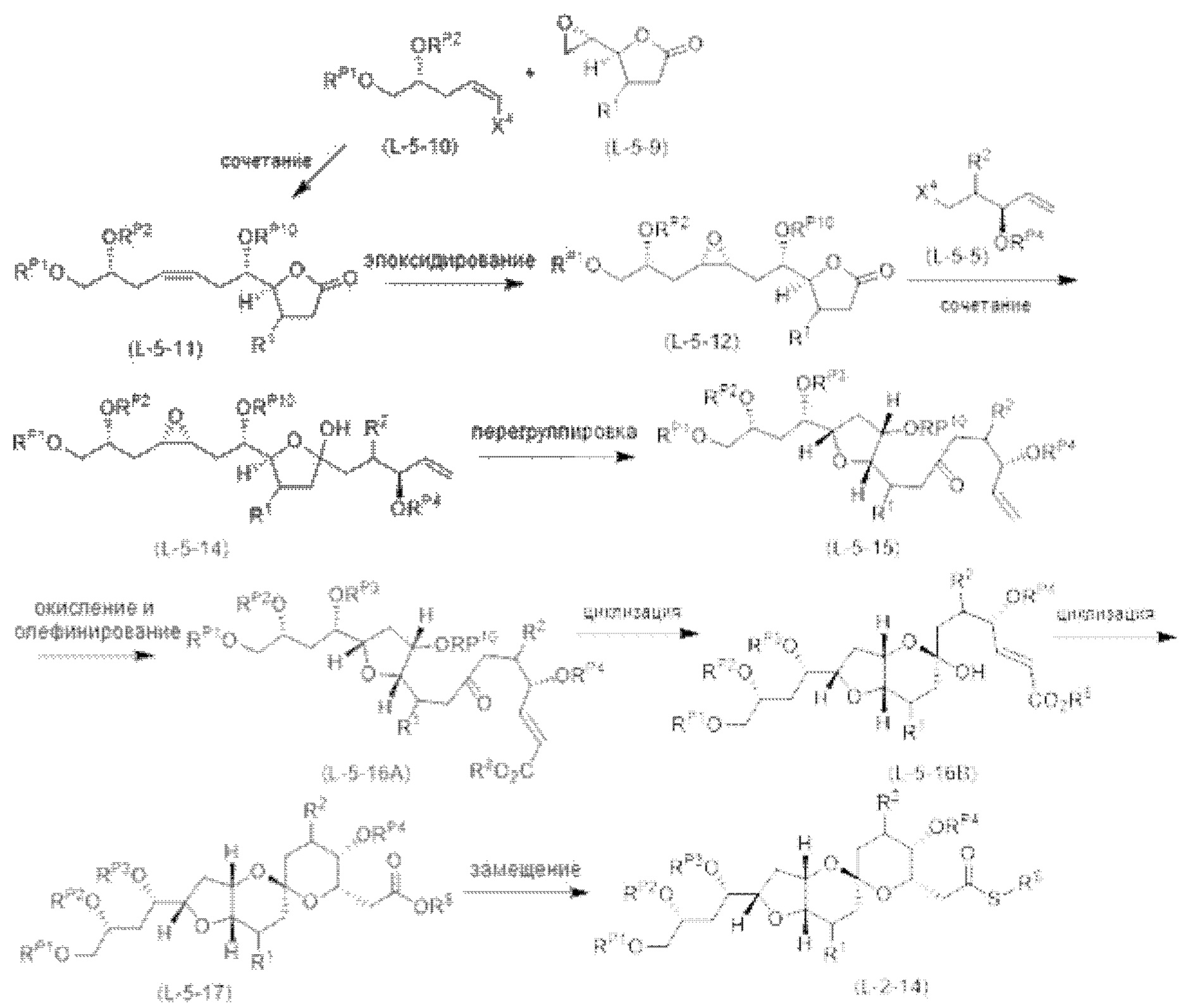
[00321] Как представлено на Схеме 4А, в настоящем документе раскрыт способ получения соединения формулы (L-2-14):
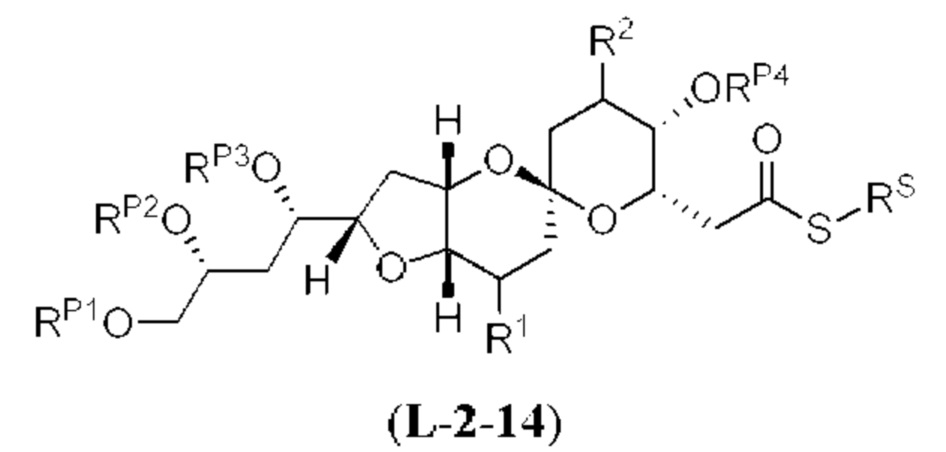
или его соли, причем способ включает в себя стадию осуществления взаимодействия соединения формулы (L-5-17):
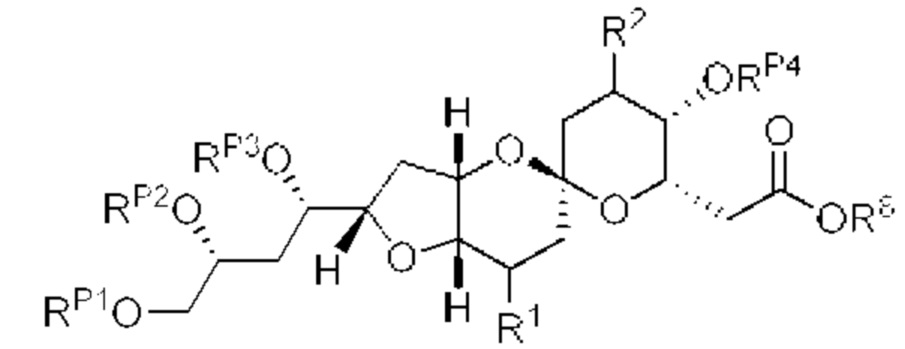
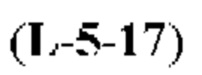
или его соли в присутствии тиолирующего агента; где:
RS представляет собой необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил или необязательно замещенный гетероарил;
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил;
RP1, RP2, RP3 и RP4 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00322] Как описано в настоящем документе, стадия формирования соединения формулы (L-2-14) включает в себя осуществление взаимодействия соединения формулы (L-5-17) в присутствии тиолирующего агента. С этой целью может быть использован любой тиолирующий агент, известный из уровня техники. Согласно определенным вариантам осуществления тиолирующий агент представляет собой дисульфид. Согласно определенным вариантам осуществления тиолирующий агент представляет собой соединение формулы (RSS)2. Согласно определенным вариантам осуществления тиолирующий агент представляет собой соединение формулы (пиридин-S)2. Согласно определенным вариантам осуществления тиолирующий агент представляет собой:  (Py-S)2.
(Py-S)2.
[00323] Согласно определенным вариантам осуществления стадию тиолирования соединения формулы (L-5-17) проводят в присутствии одного или нескольких дополнительных реагентов. Согласно определенным вариантам осуществления стадию тиолирования проводят в присутствии фосфинового реагента (например, трифенилфосфина (Ph3P)).
[00324] Согласно определенным вариантам осуществления стадию тиолирования проводят в присутствии дисульфида и фосфина. Согласно определенным вариантам осуществления реакцию проводят в присутствии (Py-S)2 и Ph3P. Согласно определенным вариантам осуществления реакцию проводят в растворителе, таком как CH2Cl2. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°C приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при комнатной температуре. Например, согласно определенным вариантам осуществления стадию тиолирования проводят в следующих условиях: 1,4 эквивалента (Py-S)2, 1,2 эквивалента Ph3P в CH2Cl2 при комнатной температуре (например, в течение 10-20 часов).
[00325] Согласно определенным вариантам осуществления способ тиолирования соединения формулы (L-5-17) или его соли включает в себя стадии:
(a) снятия защитной группы с соединения формулы (L-5-17) или его соли с получением соединения формулы (L-5-17B):
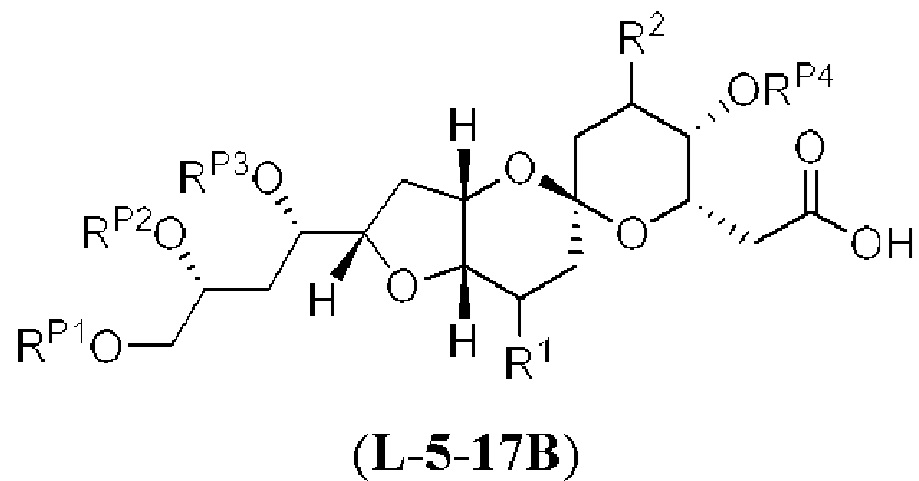
или его соли; и
(b) тиолирования соединения формулы (L-5-17B) или его соли с получением соединения формулы (L-2-14), или его соли.
[00326] Согласно определенным вариантам осуществления RP1, RP2, RP3 и RP4 представляют собой силильные защитные группы. Согласно определенным вариантам осуществления RP1 и RP2 представляют собой TBS; и RP3 и RP4 представляют собой TES.
[00327] Как также представлено на Схеме 4А, в настоящем документе раскрыт способ получения соединения формулы (L-5-17):
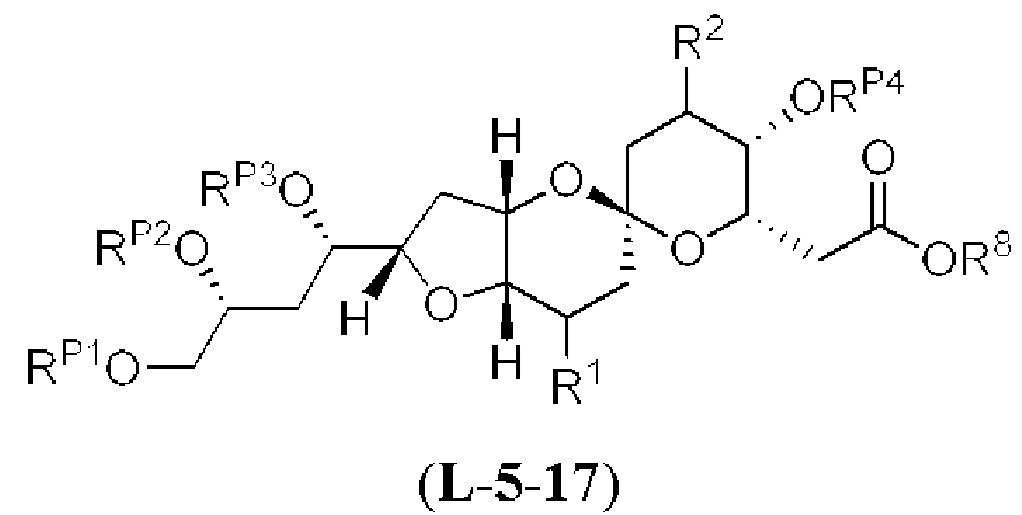
или его соли, причем способ включает в себя стадию циклизации соединения формулы (L-5-16B):
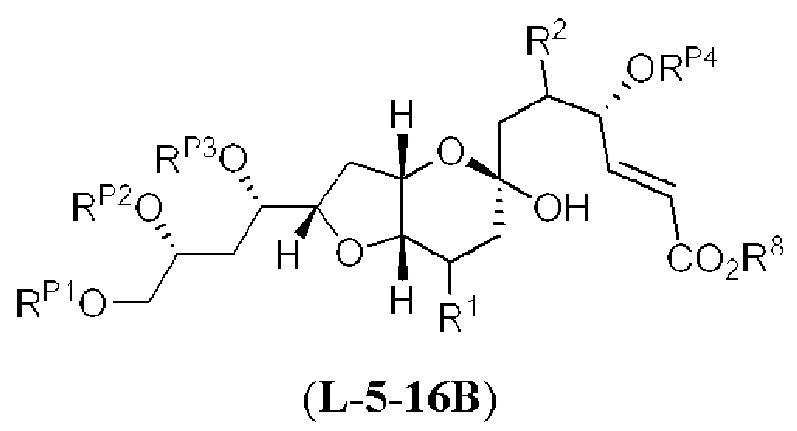
или его соли; где:
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил;
RP1, RP2, RP3 и RP4 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00328] Согласно определенным вариантам осуществления стадию циклизации соединения формулы (7-5-16В) проводят в присутствии основания. Согласно определенным вариантам осуществления основание представляет собой азотное основание. Согласно определенным вариантам осуществления основание представляет собой аминовое или амидное основание. Согласно определенным вариантам осуществления основание представляет собой амидиновое или гуанидиновое основание. Согласно определенным вариантам осуществления основание представляет собой амидиновое основание (например, 1,8-диазабицикло(5.4.0)ундец-7-ен (DBU)). Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии кислоты. Согласно определенным вариантам осуществления кислота представляет собой кислоту Льюиса. Согласно определенным вариантам осуществления кислота представляет собой кислоту Брэнстеда.
[00329] Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии соли лития (например, LiBr, LiCl). Стадия циклизации может проводиться в присутствии одного или нескольких дополнительных реагентов. Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии R8-ОАс. Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии BnOAc.
[00330] Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии соли лития и основания. Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии LiBr и DBU. Согласно определенным вариантам осуществления реакцию проводят в растворителе, таком как MeCN. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при комнатной температуре. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 10 эквивалентов LiBr, 5 эквивалентов DBU и 10 эквивалентов BnOAc в MeCN при комнатной температуре (например, в течение 10-20 часов).
[00331] Согласно определенным вариантам осуществления RP1, RP2 и RP3 представляют собой силильные защитные группы; и RP4 и RP8 представляют собой необязательно замещенный бензил. Согласно определенным вариантам осуществления RP1 и RP2 представляют собой TBS; RP3 представляет собой TES; RP4 представляет собой МРМ; и R8 представляет собой бензил.
[00332] Согласно определенным вариантам осуществления с соединения формулы (L-5-17) или его соли снимают защитные группы для удаления группы RP4 с получением соединения формулы (L-5-17C):
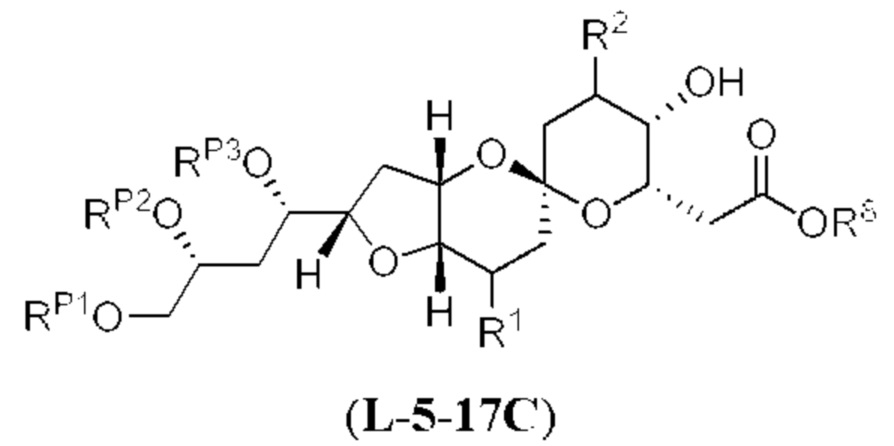
или его соли; и необязательно повторно вводят защитные группы (т.е., для замены группы RP4, например, с бензильной защитной группы (например, МРМ) на силильную защитную группу (например, на триалкилсилил, такой как триэтилсилил)).
[00333] В настоящем документе раскрыт способ получения соединения формулы (L-5-16В):
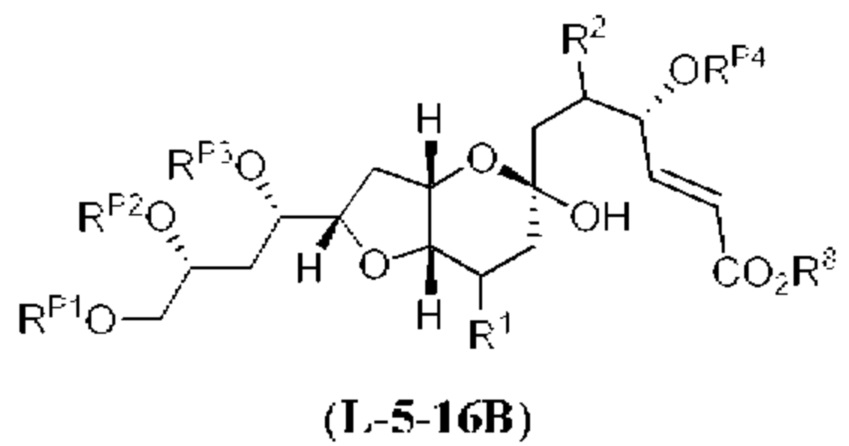
или его соли, причем способ включает в себя стадии:
(а) циклизации соединения формулы (L-5-15):
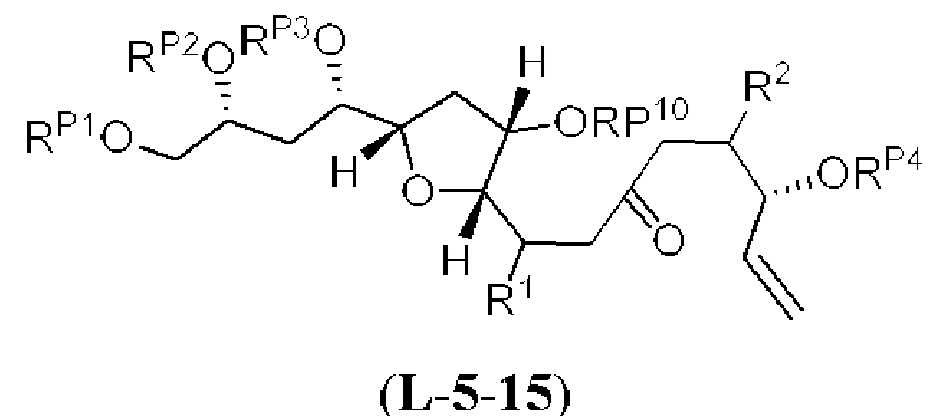
или его соли с получением соединения формулы (L-5-15B):
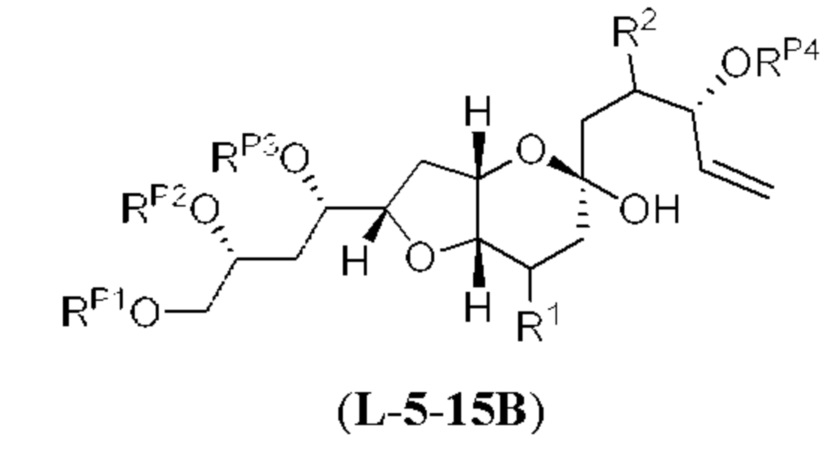
или его соли; и
(b) осуществления взаимодействия соединения формулы (L-5-15B) или его соли в присутствии олефина и катализатора метатезиса олефинов с получением соединения формулы (L-5-16B), где:
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил; и
RP1, RP2, RP3, RP4 и RP10 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу.
[00334] Согласно определенным вариантам осуществления олефин характеризуется формулой: 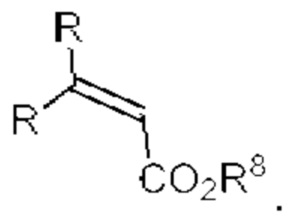 Кроме того, любой катализатор метатезиса олефинов, известный из уровня техники, может быть использован в реакции метатезиса с получением соединения формулы (L-5-16B).
Кроме того, любой катализатор метатезиса олефинов, известный из уровня техники, может быть использован в реакции метатезиса с получением соединения формулы (L-5-16B).
[00335] Согласно определенным вариантам осуществления RP1, RP2, RP10 и RP3 представляют собой силильные защитные группы; и RP4 представляет собой необязательно замещенный бензил. Согласно определенным вариантам осуществления RP1 и RP2 представляют собой TBS; и RP3 представляет собой TES; RP4 представляет собой МРМ; и RP10 представляет собой TES.
[00336] В настоящем документе раскрыт способ получения соединения формулы (L-5-16В):
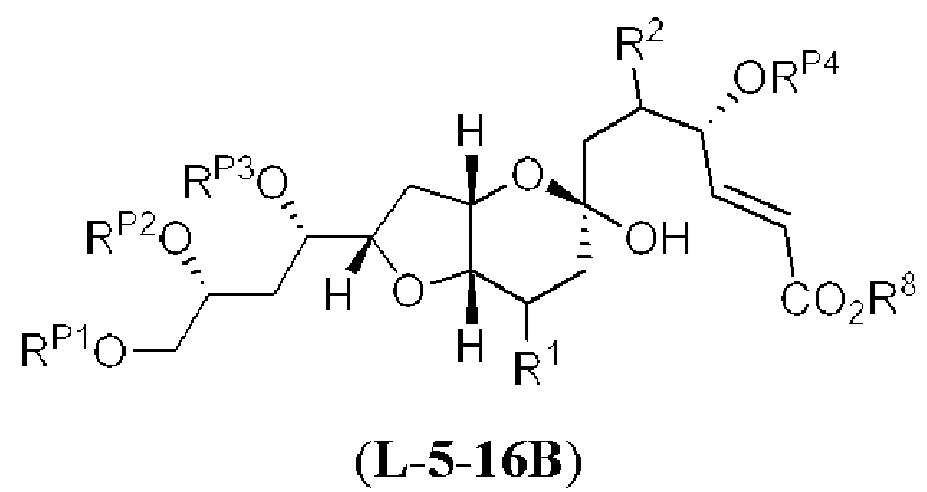
или его соли,
причем способ включает в себя стадию циклизации соединения формулы (L-5-16A):
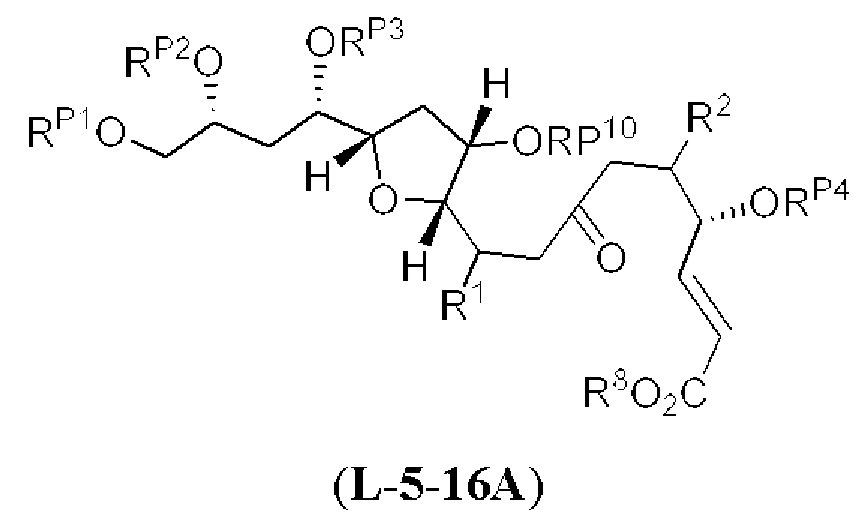
или его соли, где:
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил;
RP1, RP2, RP3, RP4 и RP10 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00337] Согласно определенным вариантам осуществления стадию циклизации соединения формулы (L-5-16A) или его соли проводят в присутствии основания. Согласно определенному варианту осуществления стадию циклизации проводят в присутствии кислоты (например, кислоты Льюиса или кислоты Брэнстеда). Согласно определенным вариантам осуществления кислота представляет собой фосфорную кислоту. Согласно определенным вариантам осуществления кислота представляет собой дифенилфосфат ((PhO)2P(=О)OH). Согласно определенным вариантам осуществления кислота содержится в каталитическом, стехиометрическом или избыточном количестве относительно соединения формулы (L-5-16A). Согласно определенным вариантам осуществления кислота содержится в каталитическом количестве (например, приблизительно 5 мол. %).
[00338] Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии дифенилфосфата. Согласно определенным вариантам осуществления стадию циклизации проводят в растворителе, таком как THF или смесь THF и H2O. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при температуре около комнатной температуры. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 5 мол. % дифенилфосфат в THF-H2O при комнатной температуре (например, приблизительно в течение 24 часов).
[00339] В настоящем документе также раскрыт способ получения соединения формулы (L-5-16A):
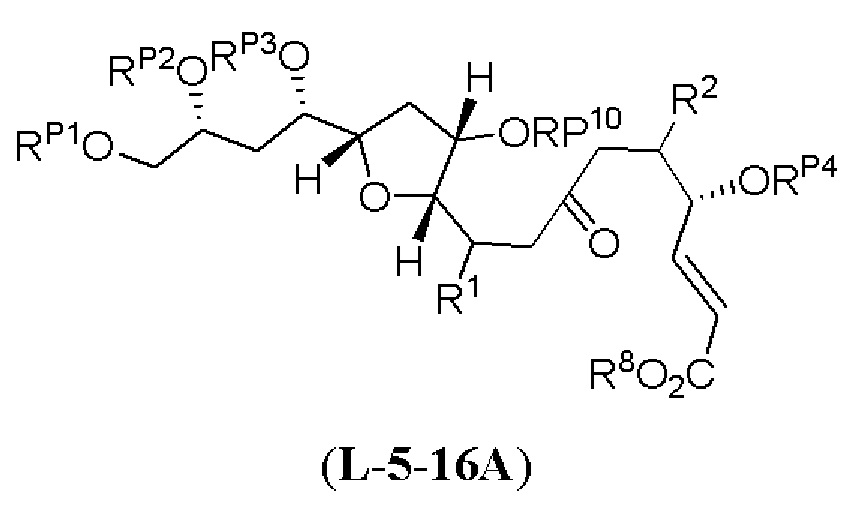
или его соли, причем способ включает в себя стадии:
(a) окисления соединения формулы (L-5-15):
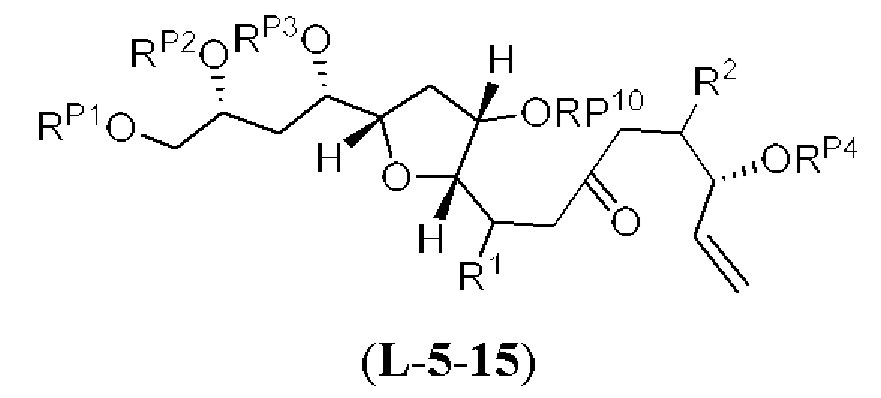
или его соли с получением соединения формулы (L-5-15B) или (L-5-15BB):
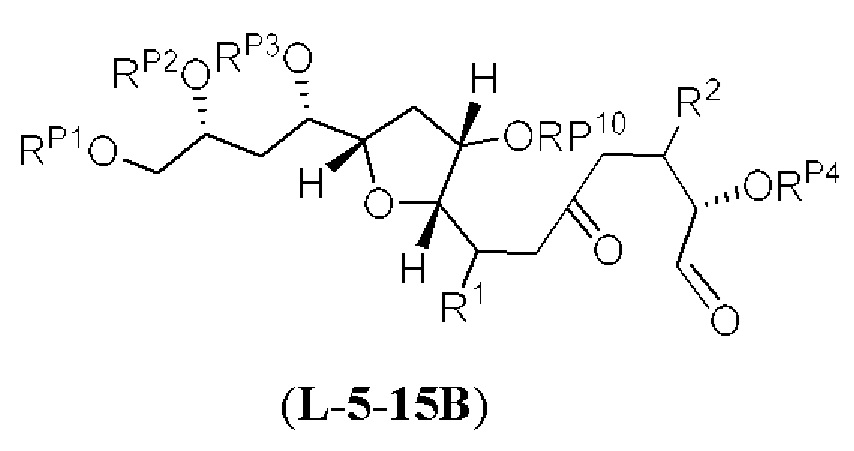
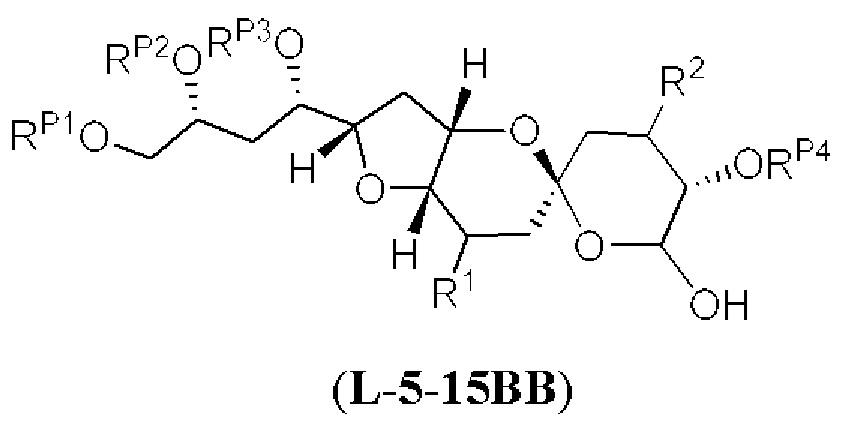
или его соли; и
(b) осуществления взаимодействия соединения формулы (L-5-15B) или (L-5-15BB) или его соли в присутствии олефинирующего реагента с получением соединения формулы (L-5-15C):
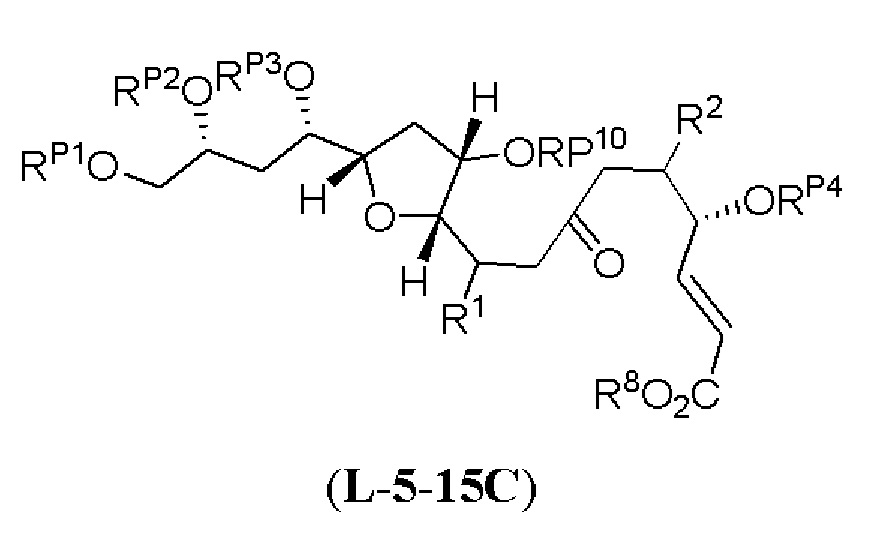
или его соли, где:
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил;
RP1, RP2, RP3, RP4 и RP10 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00340] Реакция на представленной выше стадии (а) представляет собой окислительное расщепление; реакция на стадии (b) представляет собой реакцию олефинирования. Согласно определенным вариантам осуществления окислительное расщепление проводят посредством озонолиза (например, в присутствии О3). Согласно определенным вариантам осуществления расщепление проводят в присутствии одного или нескольких реагентов, способных дигидроксилировать двойную связь (например, тетраокисда осмия (OsO4), N-оксида N-метилморфолина (NMMO)), а затем металла переменной валентности (например, комплекса свинца, такого как Pb(ОАс)4). Согласно определенным вариантам осуществления двойную связь дигидроксилируют путем обработки OsO4, NMMO и водой. Согласно определенным вариантам осуществления реакцию проводят в присутствии растворителя, такого как ацетон. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при комнатной температуре. Например, согласно определенным вариантам осуществления двойную связь дигидроксилируют в следующих условиях: 10 мол. % OsO4, 2 эквивалента NMMO и воды в ацетоне при комнатной температуре (например, в течение 20-25 часов). Затем, согласно определенным вариантам осуществления полученное соединение обрабатывают Pb(ОАс)4 и K2CO3 с получением альдегида или гемиацеталя. Например, согласно определенным вариантам осуществления указанную стадию проводят в следующих условиях: 1,2 эквивалента Pb(ОАс)4, 3 эквивалента K2CO3 в CH2Cl2 при комнатной температуре (например, приблизительно в течение 1 часа).
[00341] Согласно определенным вариантам осуществления олефинирование проводят в присутствии реагента Виттига или Хорнера-Уотсворта-Эммонса. Согласно определенным вариантам осуществления олефинирование проводят в присутствии реагента формулы: (RO)2P(O)CH2CO2R8. Согласно определенным вариантам осуществления реагент характеризуется формулой: (MeO)2P(O)CH2CO2R8 (например, (МеО)2Р(O)CH2CO2Bn). Согласно определенным вариантам осуществления олефинирование проводят в присутствии основания (например, фосфата, такого как K3PO4).
[00342] Согласно определенным вариантам осуществления олефинирование проводят в присутствии олефинирующего реагента формулы: (RO)2P(O)CH2CO2R8, и основания. Согласно определенным вариантам осуществления олефинирование проводят в присутствии (МеО)2Р(O)CH2CO2Bn и K3PO4. Согласно определенным вариантам осуществления реакцию проводят в растворителе, таком как толуол. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при комнатной температуре. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 4 эквивалента (МеО)2Р(O)CH2CO2Bn, 3 эквивалента K3PO4 в толуоле при комнатной температуре (например, приблизительно в течение 20-25 часов).
[00343] Согласно определенным вариантам осуществления RP1, RP2, RP3 и RP10 представляют собой силильные защитные группы; и RP4 и R8 представляют собой необязательно замещенный бензил. Согласно определенным вариантам осуществления RP1 и RP2 представляют собой TBS; RP3 и RP10 представляют собой TES; RP4 представляет собой МРМ; и R8 представляет собой бензил.
[00344] В настоящем документе раскрыт способ получения соединения формулы (L-5-15):
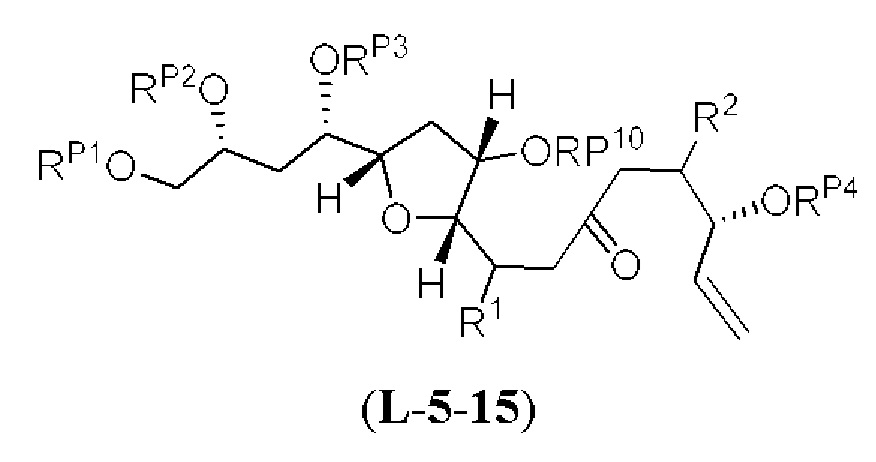
или его соли, причем способ включает в себя стадию осуществления взаимодействия соединения формулы (L-5-14):
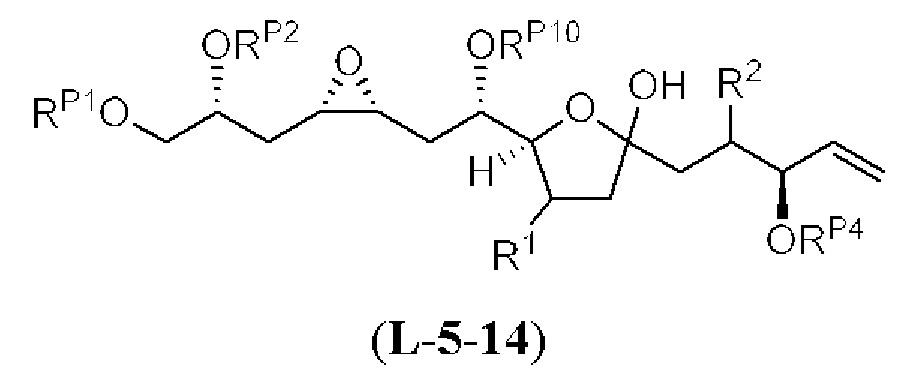
или его соли, в присутствии кислоты или основания, где:
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил; и
RP1, RP2, RP3, RP4 и RP10 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу.
[00345] Как описано выше, способ образования соединения формулы (L-5-15) или его соли включает в себя стадию осуществления взаимодействия соединения формулы (L-5-14) или его соли в присутствии кислоты или основания. Согласно определенным вариантам осуществления используют кислоту. Кислота может представлять собой кислоту Льюиса или кислоту Брэнстеда. Согласно определенным вариантам осуществления кислота представляет собой кислоту Брэнстеда. Согласно определенным вариантам осуществления кислота представляет собой фосфорную кислоту (например, фосфорную кислоту, дифенилфосфат). Согласно определенным вариантам осуществления кислота представляет собой дифенилфосфат ((PhO)2P(=O)OH). Согласно определенным вариантам осуществления реакцию проводят в растворителе, таком как толуол. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят приблизительно от 0°С до комнатной температуры. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 5 мол. % (PhO)2P(=O)OH в толуоле при температуре от 0°С до комнатной температуры (например, в течение 10-15 часов).
[00346] Согласно определенным вариантам осуществления соединение формулы (L-5-15) представляет собой соединение формулы (L-5-15A):
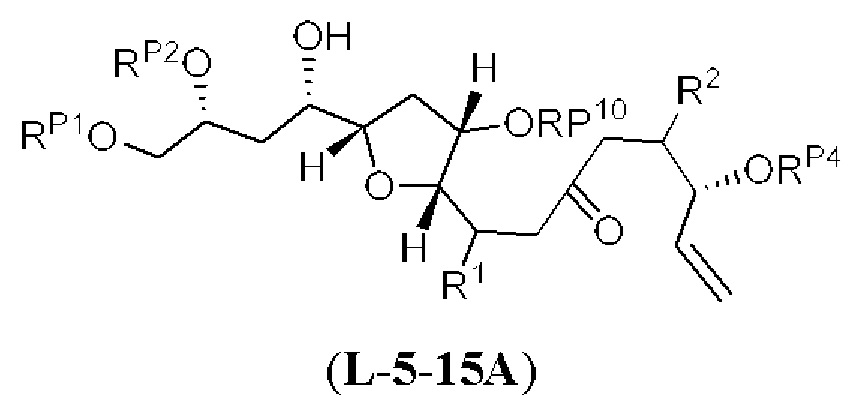
или его соль, и способ дополнительно включает в себя стадию введения защитной группы в соединение формулы (L-5-15A) или его соль с получением соединения формулы (L-5-15) (например, для введения группы RP3, где группа RP3 представляет собой кислород-защитную группу).
[00347] Согласно определенным вариантам осуществления RP1, RP2 и RP10 представляют собой силильные защитные группы; и RP4 представляет собой необязательно замещенный бензил. Согласно определенным вариантам осуществления RP1 и RP2 представляют собой TBS; RP10 представляет собой TES; и RP4 представляет собой МРМ.
[00348] Как представлено на Схеме 4А, в настоящем документе также раскрыт способ получения соединения формулы (L-5-14):
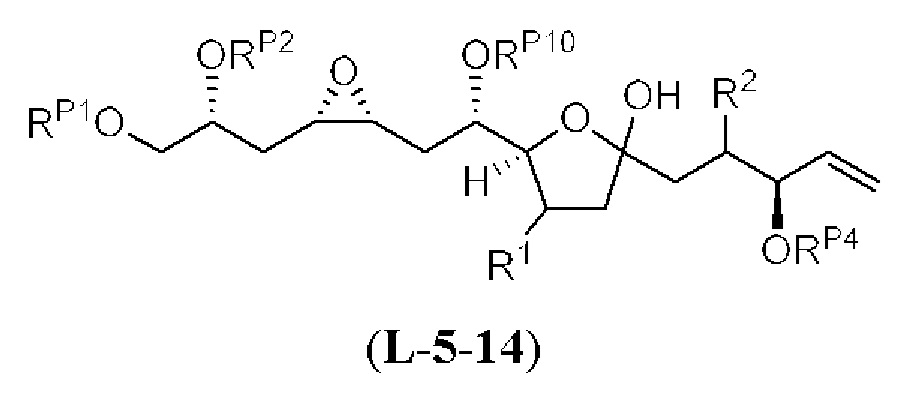
или его соли, причем способ включает в себя стадию сочетания соединения формулы (L-5-12):
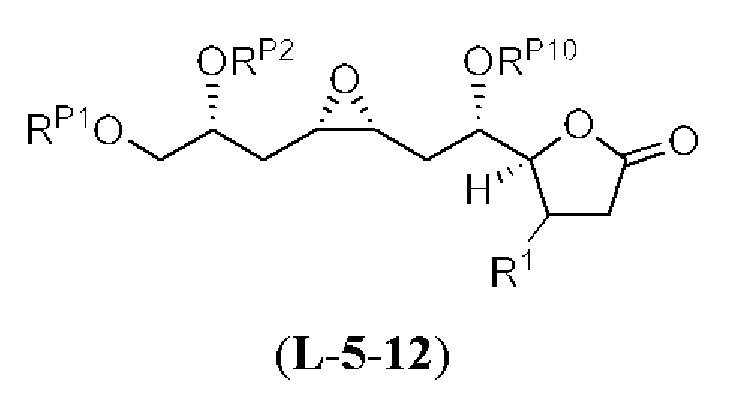
или его соли с соединением формулы (L-5-5):
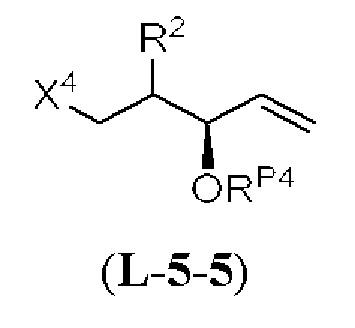
или его солью, где:
X4 представляет собой галоген или уходящую группу;
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил; и
RP1, RP2, RP4 и RP10 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу.
[00349] Согласно определенным вариантам осуществления сочетание соединения формулы (L-5-12) с соединением формулы (L-5-5) проводят в присутствии металлорганического реагента (например, для преобразования X4 до металла для добавления к соединению формулы (L-5-12)). Согласно определенным вариантам осуществления металлорганический реагент представляет собой реагент лития (например, для преобразования соединения формулы (L-5-5) до соединения формулы: 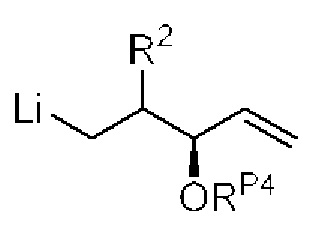 для добавления к соединению формулы (L-5-12)). Согласно определенным вариантам осуществления реагент лития представляет собой литийорганическое соединение (например, н-бутиллитий, трет-бутиллитий, втор-бутиллитий). Согласно определенным вариантам осуществления реагент лития представляет собой LiHMDS или LDA. Согласно определенным вариантам осуществления реакцию проводят в присутствии трет-бутиллития. Согласно определенным вариантам осуществления реакцию проводят в растворителе, таком как THF. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от -78°С приблизительно до 0°С. Согласно определенным вариантам осуществления реакцию проводят при температуре от -78°С до комнатной температуры. Например, согласно определенным вариантам осуществления реакцию проводят с 2,6 эквивалента трет-бутиллития в THF при температуре от -78°С до комнатной температуры (например, в течение менее 1 часа).
для добавления к соединению формулы (L-5-12)). Согласно определенным вариантам осуществления реагент лития представляет собой литийорганическое соединение (например, н-бутиллитий, трет-бутиллитий, втор-бутиллитий). Согласно определенным вариантам осуществления реагент лития представляет собой LiHMDS или LDA. Согласно определенным вариантам осуществления реакцию проводят в присутствии трет-бутиллития. Согласно определенным вариантам осуществления реакцию проводят в растворителе, таком как THF. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от -78°С приблизительно до 0°С. Согласно определенным вариантам осуществления реакцию проводят при температуре от -78°С до комнатной температуры. Например, согласно определенным вариантам осуществления реакцию проводят с 2,6 эквивалента трет-бутиллития в THF при температуре от -78°С до комнатной температуры (например, в течение менее 1 часа).
[00350] Согласно определенным вариантам осуществления RP1, RP2 и RP10 представляют собой силильные защитные группы; и RP4 представляет собой необязательно замещенный бензил. Согласно определенным вариантам осуществления RP1 и RP2 представляют собой TBS; RP10 представляет собой TES; и RP4 представляет собой МРМ.
[00351] В настоящем документе также раскрыт способ получения соединения формулы (L-5-12):
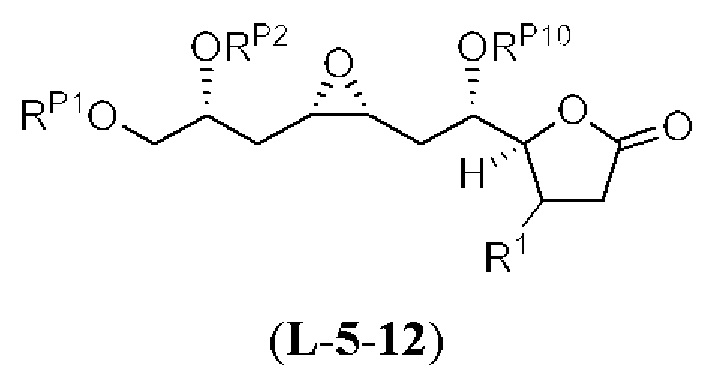
или его соли, причем способ включает в себя стадию эпоксидирования соединения формулы (L-5-11):
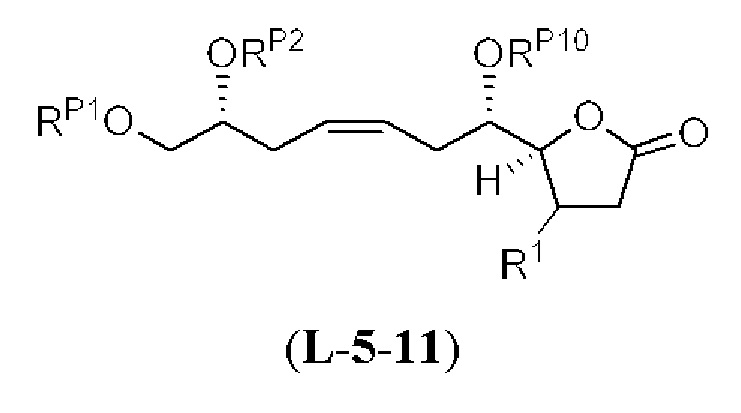
или его соли, где:
R1 представляет собой водород, галоген или необязательно замещенный алкил; и
RP1, RP2 и RP10 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу.
[00352] На стадии эпоксидирования, раскрытой выше, может использоваться любой эпоксидирующий реагент. Согласно определенным вариантам осуществления эпоксидирующий реагент представляет собой пероксикислоту (например, мета-СРВА). Согласно определенным вариантам осуществления эпоксидирующий реагент представляет собой металлоорганический реагент. Согласно определенным вариантам осуществления эпоксидирующий реагент представляет собой реагент титана (например, Ti(Oi-Pr)4). Согласно определенным вариантам осуществления эпоксидирующий реагент представляет собой реагент ванадия (например, VO(TMHD)2). Согласно определенным вариантам осуществления эпоксидирование представляет собой эпоксидирование по Шарплессу. Согласно определенным вариантам осуществления стадию эпоксидирования проводят в присутствии одного или нескольких дополнительных реагентов. Согласно определенным вариантам осуществления эпоксидирование проводят в присутствии пероксида (например, трет-BuOOH).
[00353] Согласно определенным вариантам осуществления стадию эпоксидирования проводят в присутствии реагента ванадия и пероксида. Согласно определенным вариантам осуществления реакцию проводят в присутствии VO(TMHD)2 и трет-BuOOH. Согласно определенным вариантам осуществления реакцию проводят в растворителе, таком как толуол. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при комнатной температуре. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 5 мол. % VO(TMHD)2 и 2 эквивалента трет-BuOOH в толуоле при комнатной температуре (например, в течение 1-10 часов).
[00354] Согласно определенным вариантам осуществления RP1, RP2 и RP10 представляют собой силильные защитные группы; и RP4 представляет собой необязательно замещенный бензил. Согласно определенным вариантам осуществления RP1 и RP2 представляют собой TBS; и RP10 представляет собой TES.
[00355] В настоящем документе также раскрыт способ получения соединения формулы (L-5-11):
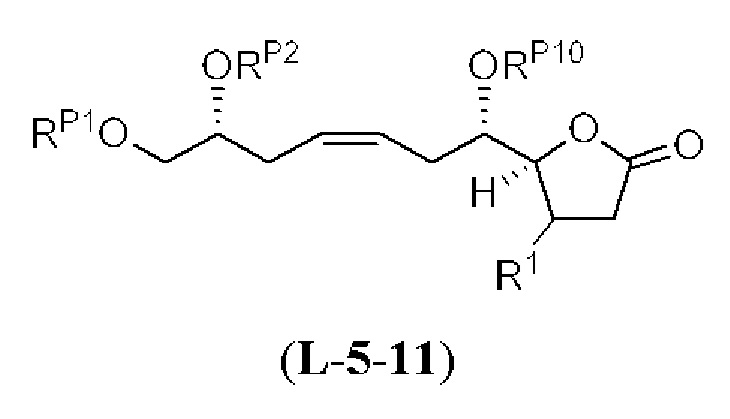
или его соли, причем способ включает в себя стадию сочетания соединения формулы (L-5-10):
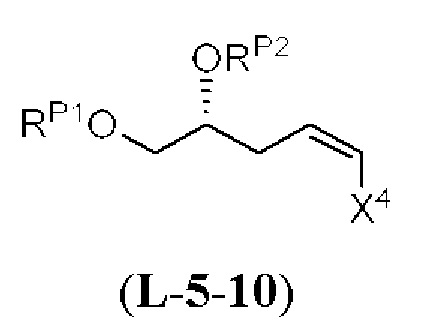
или его соли с соединением формулы (L-5-9):
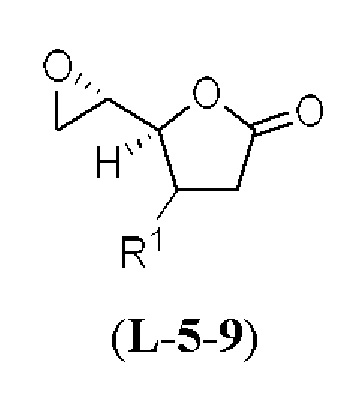
или его солью, где:
X4 представляет собой галоген или уходящую группу;
R1 представляет собой водород, галоген или необязательно замещенный алкил; и
RP1, RP2 и RP10 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу.
[00356] Согласно определенным вариантам осуществления сочетание соединения формулы (L-5-10) с соединением формулы (L-5-9) проводят в присутствии металла или металлорганического реагента (например, для преобразования X4 до металла для добавления к соединению формулы (L-5-9)). Согласно определенным вариантам осуществления реакцию проводят в присутствии меди. Согласно определенным вариантам осуществления медь представляет собой комплекс меди или соль меди. Согласно конкретному варианту осуществления источник меди представляет собой Li(тиенилCuCN). Согласно определенным вариантам осуществления реакцию проводят в присутствии реагента лития. Согласно определенным вариантам осуществления реагент лития представляет собой литийорганическое соединение (например, н-бутиллитий, трет-бутиллитий, втор-бутиллитий). Согласно определенным вариантам осуществления реагент лития представляет собой LiHMDS или LDA. Согласно определенным вариантам осуществления реакции проводят в присутствии реагента лития и реагента меди (например, для преобразования соединения формулы (L-5-10) до соединения формулы: 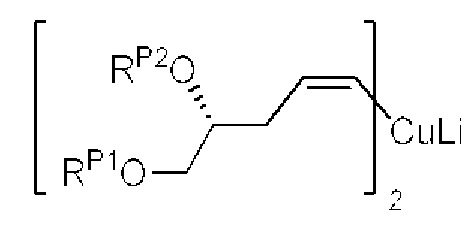 для добавления к соединению формулы (L-5-9)). Реакцию также можно проводить в присутствии кислоты Льюиса (например, BF3⋅Et2O).
для добавления к соединению формулы (L-5-9)). Реакцию также можно проводить в присутствии кислоты Льюиса (например, BF3⋅Et2O).
[00357] Согласно определенным вариантам осуществления стадию сочетания проводят в присутствии источника меди, металлорганического соединения и кислоты Льюиса. Согласно определенным вариантам осуществления реакцию проводят в присутствии Li(тиенилCuCN), н-бутиллития и BF3⋅Et2O. Согласно определенным вариантам осуществления реакцию проводят в растворителе, таком как Et2O. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от -78°С приблизительно до 0°С. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от -78°С приблизительно до комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят приблизительно при -78°С. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 2 эквивалента Li(тиенилCuCN), 1,75 эквивалента н-бутиллития и 1,6 эквивалента BF3⋅Et2O, в Et2O при -78°С (например, в течение 1 часа).
[00358] Согласно определенным вариантам осуществления RP1 и RP2 представляют собой силильные защитные группы; Согласно определенным вариантам осуществления RP1 и RP2 представляют собой TBS.
Получение левых половин гомогалихондринов
[00359] В настоящем документе также раскрыты структурные элементы «левой половины» гомогалихондринов (например, гомогалихондрина А, В, С) и их аналогов, таких как соединения формулы (L-2-16). Способы, применимые для получения структурных элементов левой половины гомогалихондринов (например, соединений формулы (L-2-16)), отражены на Схеме 4В. Например, соединение формулы (L-2-16) может быть получено путем тиолирования формулы (L-5-26), которое может быть получено посредством циклизации соединения формулы (L-5-25C). С этой целью, соединение формулы (L-5-25C) может быть получено путем окисления и олефинирования соединения формулы (L-5-25A). Как также представлено на Схеме 4В, путем сочетания соединения формулы (L-5-24) с соединением формулы (L-5-5) может быть получено соединение формулы (L-5-25A). Кроме того, соединение формулы (L-5-24) может быть получено путем гидроборирования, окисления и циклизации соединения формулы (L-5-23A), которое может быть получено путем эпоксидирования внутреннего олефина соединения формулы (L-5-22) с последующей циклизацией. Соединение формулы (L-5-22) может быть получено путем восстановления соединения формулы (L-5-21B), которое может быть получено путем восстановления и олефинирования нитрила формулы (L-5-21A). Нитрил может быть получен путем восстановления и олефинирования соединения формулы (L-5-3) с последующим замещением соединения формулы (L-5-20) (т.е., для преобразования группы -ORP7 до -CN).
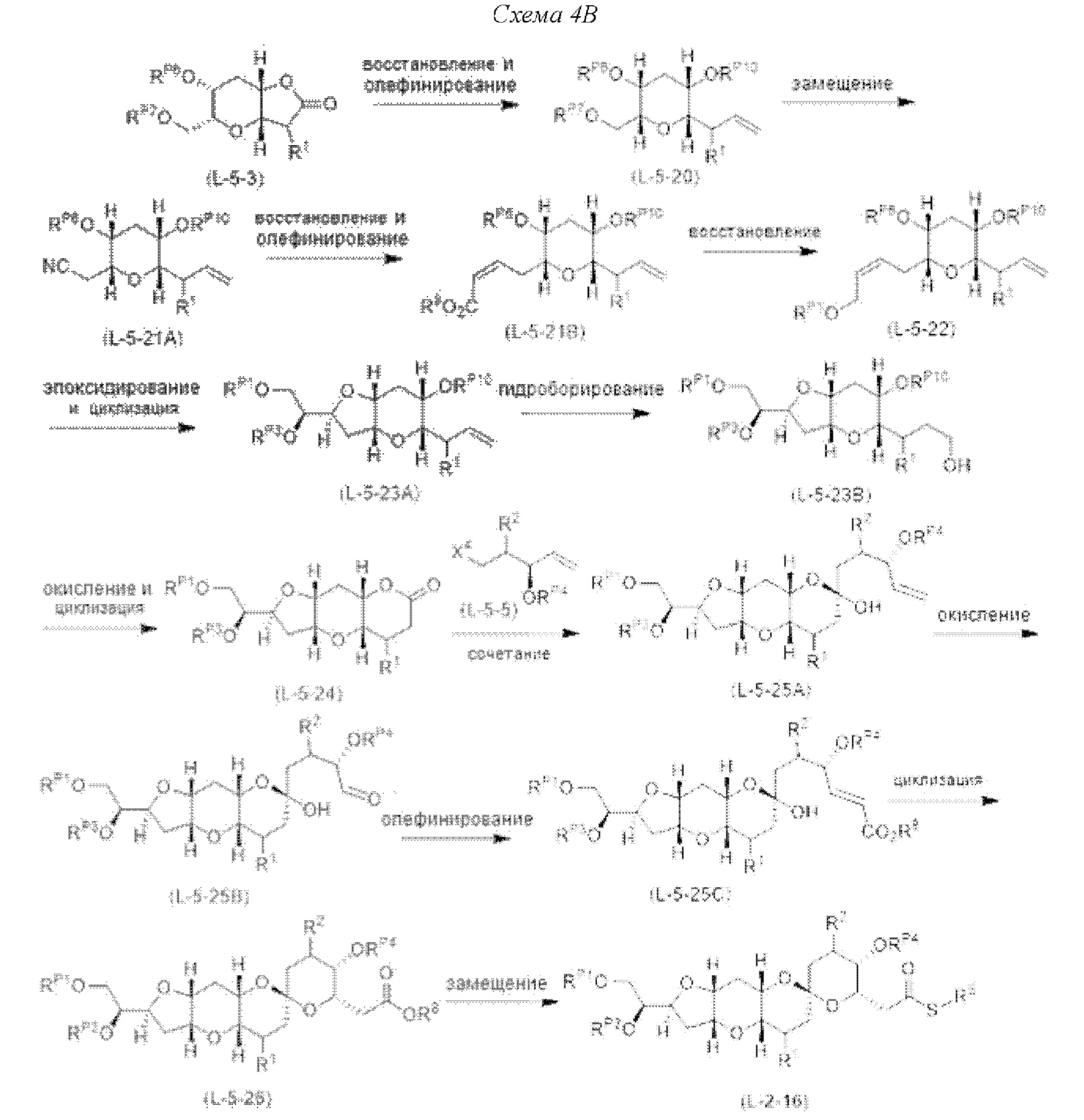
[00360] Как представлено на Схеме 4В, в настоящем документе раскрыт способ получения соединения формулы (L-2-16):
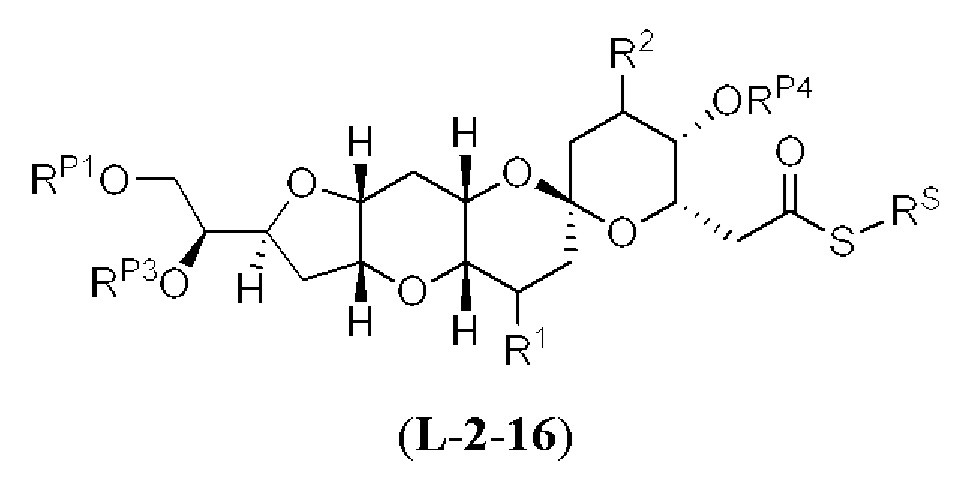
или его соли, причем способ включает в себя стадию осуществления взаимодействия соединения формулы (L-5-26):
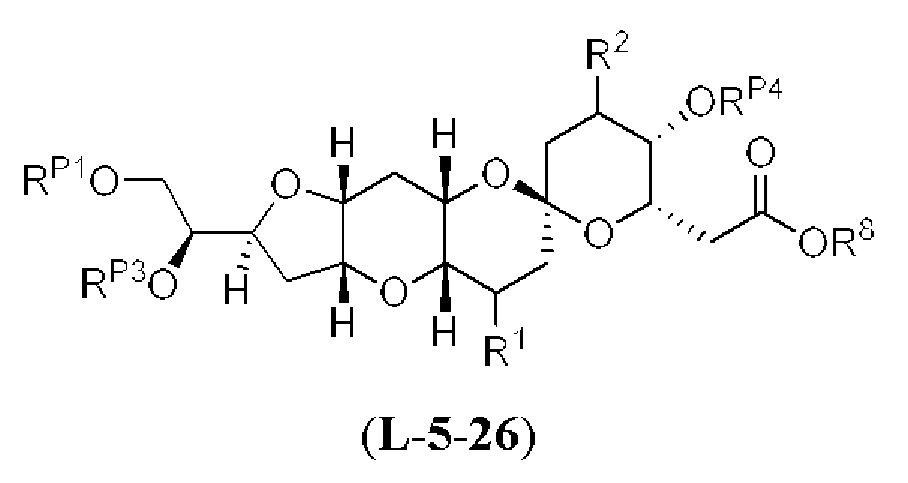
или его соли в присутствии тиолирующего агента; где:
RS представляет собой необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил или необязательно замещенный гетероарил;
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил;
каждый из RP1, RP3 и RP4 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00361] Как описано в настоящем документе, стадия формирования соединения формулы (L-2-16) включает в себя осуществление взаимодействия соединения формулы (L-5-26) в присутствии тиолирующего агента. С этой целью может быть использован любой тиолирующий агент, известный из уровня техники. Согласно определенным вариантам осуществления тиолирующий агент представляет собой дисульфид. Согласно определенным вариантам осуществления тиолирующий агент представляет собой соединение формулы (RSS)2. Согласно определенным вариантам осуществления тиолирующий агент представляет собой соединение формулы (пиридин-S)2. Согласно определенным вариантам осуществления тиолирующий агент представляет собой: 
[00362] Согласно определенным вариантам осуществления стадию тиолирования соединения формулы (L-5-26) проводят в присутствии одного или нескольких дополнительных реагентов. Согласно определенным вариантам осуществления стадию тиолирования проводят в присутствии фосфинового реагента (например, трифенилфосфина (Ph3P)).
[00363] Согласно определенным вариантам осуществления стадию тиолирования проводят в присутствии дисульфида и фосфина. Согласно определенным вариантам осуществления реакцию проводят в присутствии (Py-S)2 и Ph3P. Согласно определенным вариантам осуществления реакцию проводят в растворителе, таком как толуол. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при комнатной температуре. Например, согласно определенным вариантам осуществления стадию тиолирования проводят в следующих условиях: 1,2 эквивалента (Py-S)2, 3 эквивалента Ph3P в толуоле при комнатной температуре (например, в течение 10-20 часов).
[00364] Согласно определенным вариантам осуществления способ тиолирования соединения формулы (L-5-26) или его соли включает в себя стадии:
(a) снятия защитной группы с соединения формулы (L-5-26) или его соли с получением соединения формулы (L-5-26B):
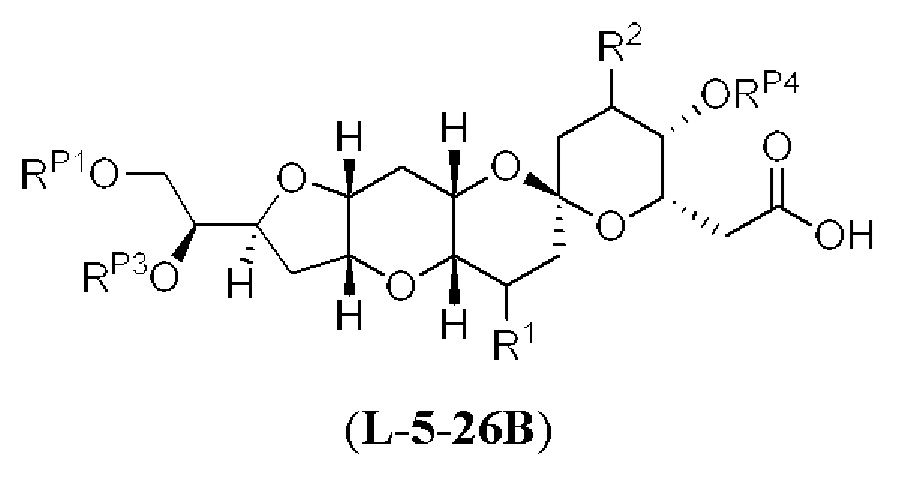
или его соли; и
(b) тиолирования соединения формулы (L-5-26B) или его соли с получением соединения формулы (L-2-6) или его соли.
[00365] Согласно определенным вариантам осуществления RP1, RP3 и RP4 представляют собой силильные защитные группы. Согласно определенным вариантам осуществления RP1 представляет собой TBS; и RP3 и RP4 представляют собой TES.
[00366] Как также представлено на Схеме 4В, в настоящем документе раскрыт способ получения соединения формулы (L-5-26):
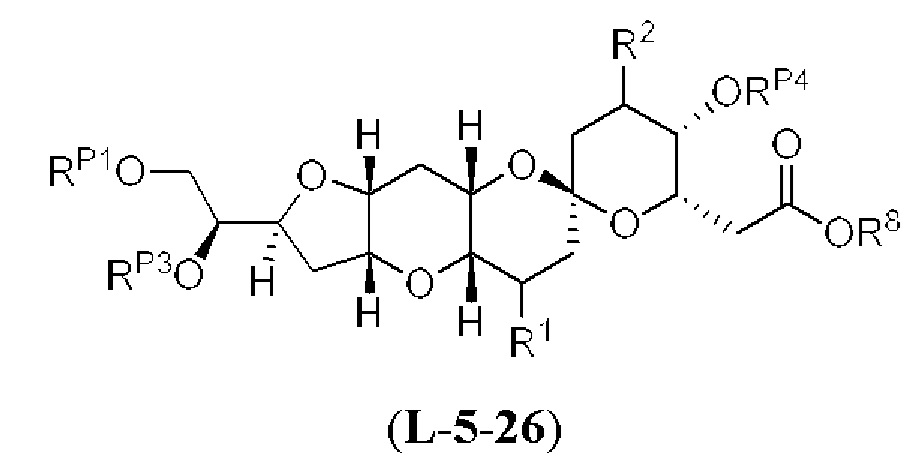
или его соли, причем способ включает в себя стадию циклизации соединения формулы (L-5-25C):
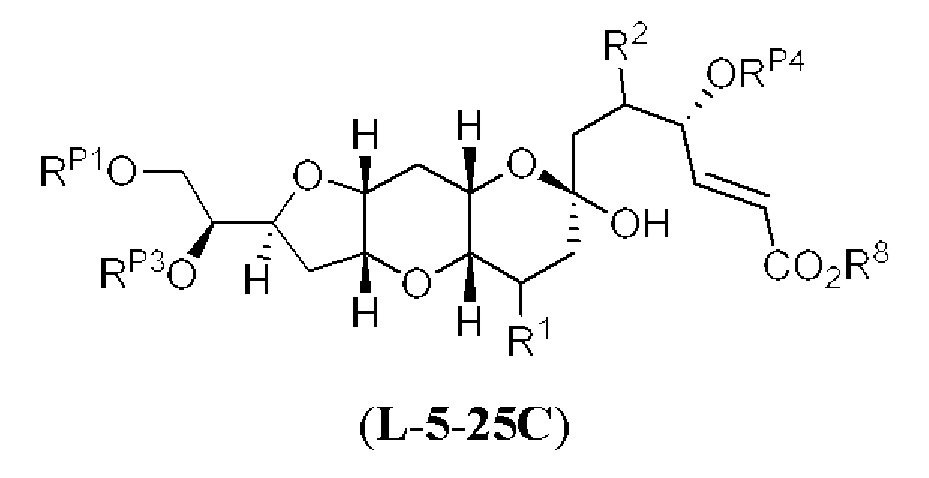
или его соли; где:
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил;
каждый из RP1, RP3 и RP4 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00367] Согласно определенным вариантам осуществления стадию циклизации соединения формулы (7-5-25С) проводят в присутствии основания. Согласно определенным вариантам осуществления основание представляет собой азотное основание. Согласно определенным вариантам осуществления основание представляет собой амидиновое, гуанидиновое основание. Согласно определенным вариантам осуществления основание представляет собой аминовое или амидное основание. Согласно определенным вариантам осуществления основание представляет собой амидиновое основание (например, 1,8-диазабицикло(5.4.0)ундец-7-ен (DBU)). Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии кислоты. Согласно определенным вариантам осуществления кислота представляет собой кислоту Льюиса. Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии соли лития (например, LiBr, LiCl). Стадия циклизации может проводиться в присутствии одного или нескольких дополнительных реагентов. Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии R8-OAc. Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии BnOAc.
[00368] Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии соли лития и основания. Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии LiBr и DBU. Согласно определенным вариантам осуществления реакцию проводят в растворителе, таком как MeCN. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при комнатной температуре. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 10 эквивалентов LiBr и 20 эквивалентов DBU в MeCN при комнатной температуре (например, в течение 10-20 часов).
[00369] Согласно определенным вариантам осуществления RP1 и RP3 представляют собой силильные защитные группы; RP4 представляет собой необязательно замещенный бензил; и R8 представляет собой необязательно замещенный бензил. Согласно определенным вариантам осуществления RP1 представляет собой TBS; RP3 представляет собой TES; RP4 представляет собой МРМ; и R8 представляет собой бензил.
[00370] Согласно определенным вариантам осуществления с соединения формулы (L-5-26) или его соли снимают защитную группу для удаления группы RP4 с получением соединения формулы (L-5-26B):
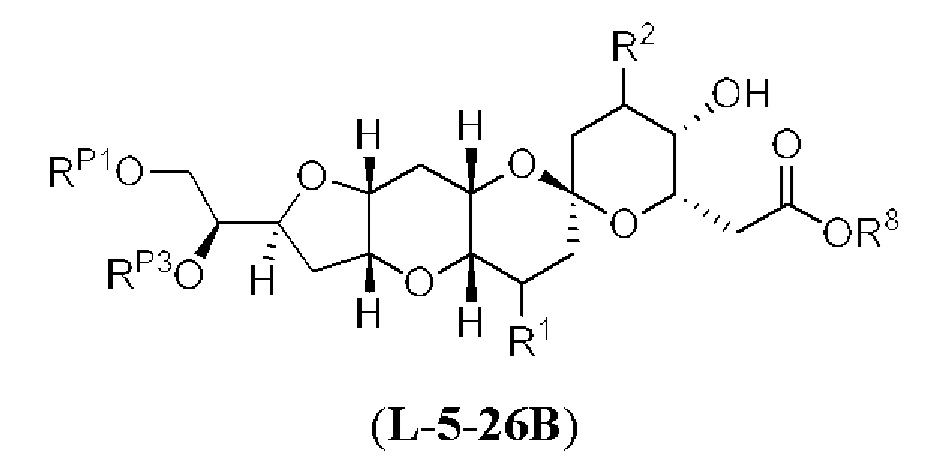
или его соли; и необязательно повторно вводят защитную группу (т.е., для замены группы RP4, например, с бензильной защитной группы (например, МРМ) на силильную защитную группу (например, триалкилсилил, такой как триэтилсилил).
[00371] В настоящем документе также раскрыт способ получения соединения формулы (L-5-25C):
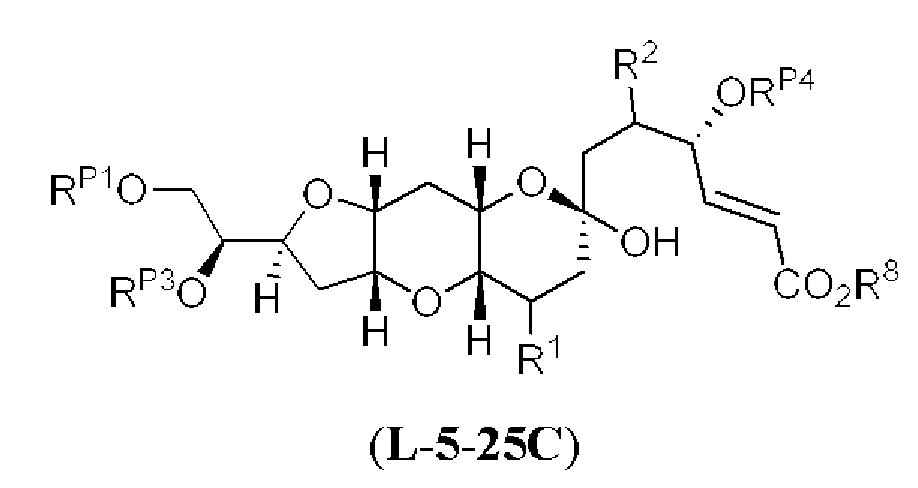
или его соли, причем способ включает в себя стадию осуществления взаимодействия соединения формулы (L-5-25A):
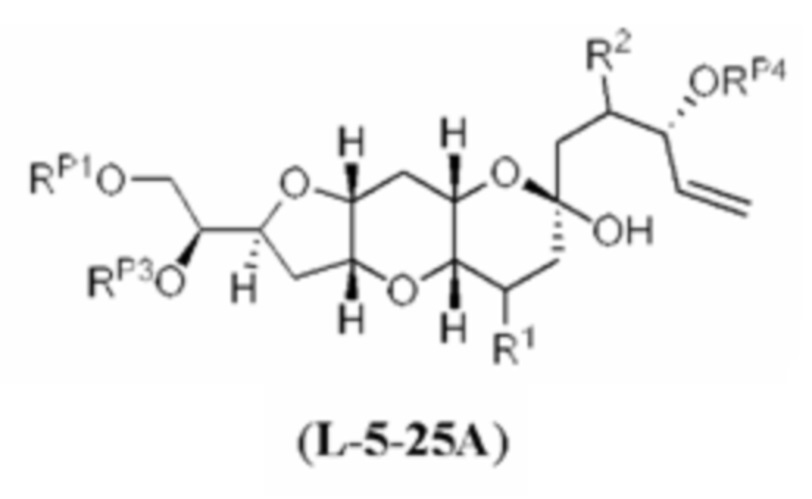
или его соли в присутствии олефина и катализатора метатезиса олефинов; где:
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил;
каждый из RP1, RP3 и RP4 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00372] Согласно определенным вариантам осуществления олефин характеризуется формулой: 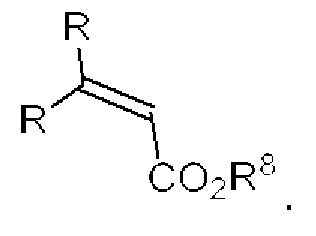 Затем, любой катализатор метатезиса олефинов, известный из уровня техники, может быть использован в реакции метатезиса с получением соединения формулы (L-5-25C).
Затем, любой катализатор метатезиса олефинов, известный из уровня техники, может быть использован в реакции метатезиса с получением соединения формулы (L-5-25C).
[00373] В настоящем документе также раскрыт альтернативный способ получения соединения формулы (L-5-25C):
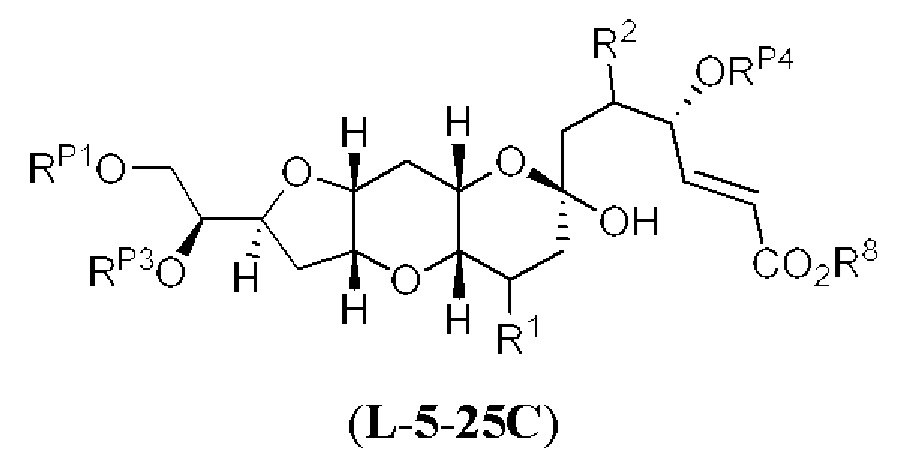
или его соли, причем способ включает в себя стадии:
(а) окисления соединения формулы (L-5-25A):
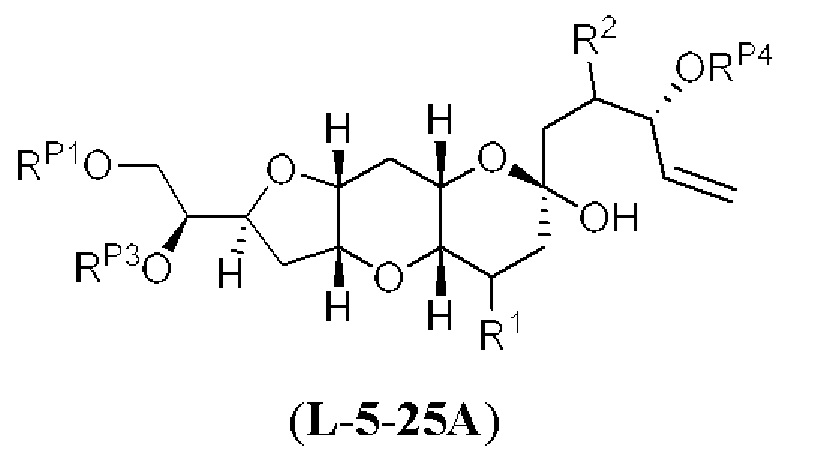
или его соли с получением соединения формулы (L-5-25B) или (L-5-25BB):
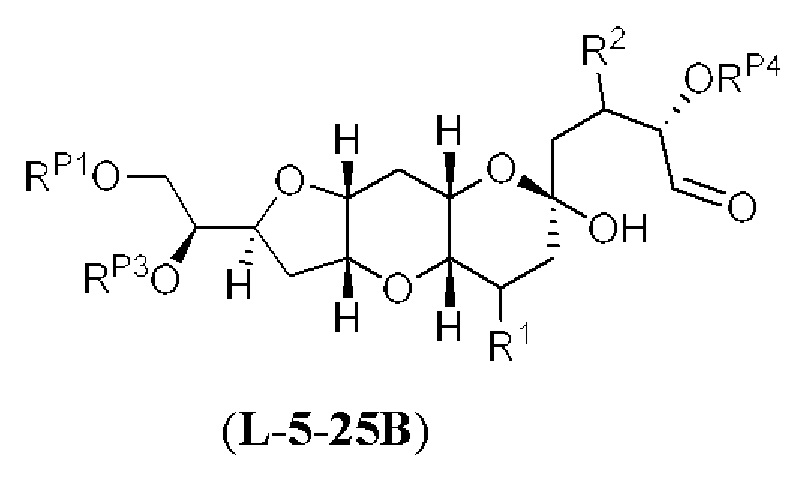
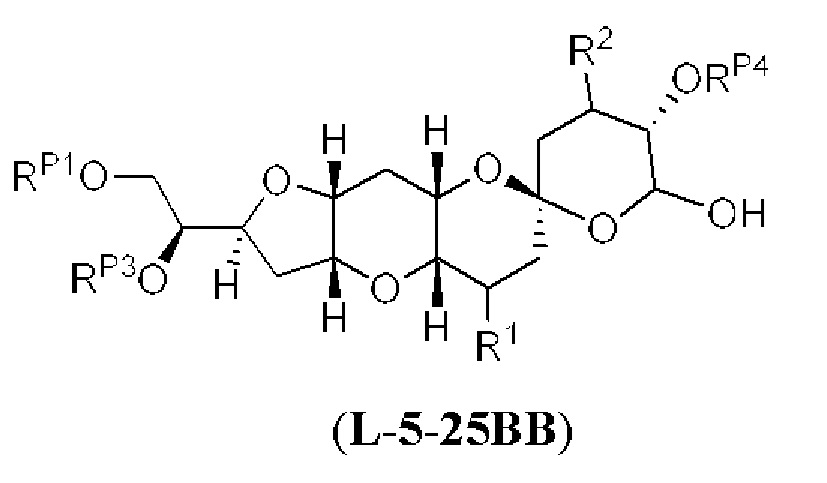
или его соли; и
(b) осуществления взаимодействия соединения формулы (L-5-25B) или (L-5-25BB) или его соли в присутствии олефинирующего реагента с получением соединения формулы (L-5-25C) или его соли.
[00374] Реакция на представленной выше стадии (а) представляет собой окислительное расщепление; реакция на стадии (b) представляет собой реакцию олефинирования. Согласно определенным вариантам осуществления окислительное расщепление проводят посредством озонолиза (например, в присутствии О3). Согласно определенным вариантам осуществления расщепление проводят в присутствии реагентов, способных дигидроксилировать двойную связь (например, тетраоксид осмия (OsO4), N-оксида N-метилморфолина (NMMO)), а затем металла переменной валентности (например, комплекса свинца, такого как Pb(ОАс)4).
[00375] Согласно определенным вариантам осуществления двойную связь дигидроксилируют путем обработки OsO4, NMMO и водой. Согласно определенным вариантам осуществления реакцию проводят в присутствии растворителя, такого как ацетон. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при комнатной температуре. Например, согласно определенным вариантам осуществления двойную связь дигидроксилируют в следующих условиях: 10 мол. % OsO4, 2 эквивалента NMMO и воды в ацетоне при комнатной температуре (например, в течение 1-5 часов). Затем, согласно определенным вариантам осуществления полученное соединение обрабатывают Pb(ОАс)4 и K2CO3 с получением альдегида или гемиацеталя. Например, согласно определенным вариантам осуществления указанную стадию проводят в следующих условиях: 1,5 эквивалента Pb(ОАс)4, 10 эквивалентов K2CO3 в CH2Cl2 при комнатной температуре (например, в течение менее 1 часа).
[00376] Согласно определенным вариантам осуществления олефинирование проводят в присутствии реагента Виттига или Хорнера-Уотсворта-Эммонса. Согласно определенным вариантам осуществления олефинирование проводят в присутствии реагента формулы: (RO)2P(O)CH2CO2R8. Согласно определенным вариантам осуществления реагент характеризуется формулой: (MeO)2P(O)CH2CO2R8 (например, (МеО)2Р(O)CH2CO2Bn). Согласно определенным вариантам осуществления олефинирование проводят в присутствии основания (например, фосфата, такого как K3PO4, или гидрида, такого как NaH).
[00377] Согласно определенным вариантам осуществления олефинирование проводят в присутствии олефинирующего реагента формулы: (RO)2P(O)CH2CO2R8, и основания. Согласно определенным вариантам осуществления олефинирование проводят в присутствии (МеО)2Р(O)CH2CO2Bn и NaH. Согласно определенным вариантам осуществления реакцию проводят в растворителе, таком как THF. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от -78°С приблизительно до комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят при 0°С. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 5 эквивалентов (МеО)2Р(O)CH2CO2Bn, 4 эквивалента NaH в THF при 0°С (например, приблизительно в течение 1-5 часов).
[00378] Согласно определенным вариантам осуществления RP1 и RP3 представляют собой силильные защитные группы; RP4 представляет собой необязательно замещенный бензил; и R8 представляет собой необязательно замещенный бензил. Согласно определенным вариантам осуществления RP1 представляет собой TBS; RP3 представляет собой TES; RP4 представляет собой МРМ; и R8 представляет собой бензил.
[00379] В настоящем документе также раскрыт способ получения соединения формулы (L-5-25A):
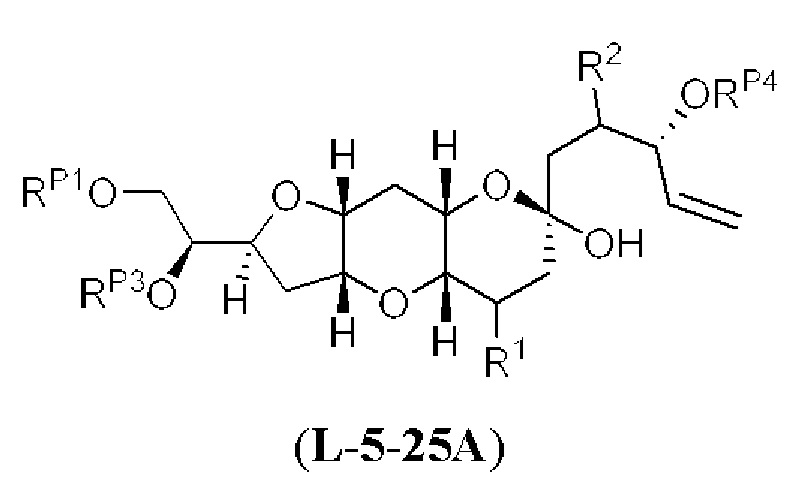
или его соли, причем способ включает в себя стадию сочетания соединения формулы (L-5-24):
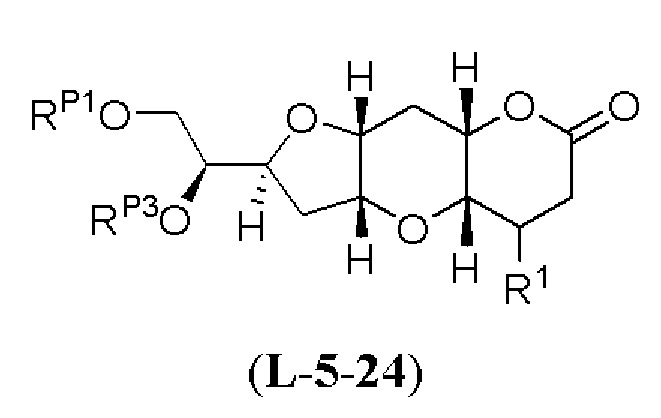
или его соли с соединением формулы (L-5-5):
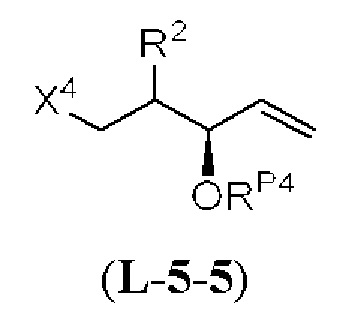
или его солью, где:
X4 представляет собой галоген или уходящую группу;
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил;
каждый из RP1, RP3 и RP4 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00380] Согласно определенным вариантам осуществления сочетание соединения формулы (L-5-24) с соединением формулы (L-5-5) проводят в присутствии металлорганического реагента (например, для преобразования X4 до металла для добавления к соединению формулы (L-5-24)). Согласно определенным вариантам осуществления металлорганический реагент представляет собой реагент лития (например, для преобразования соединения формулы (L-5-5) до соединения формулы: 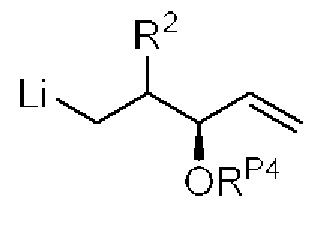 для добавления к соединению формулы (L-5-24)). Согласно определенным вариантам осуществления реагент лития представляет собой литийорганическое соединение (например, н-бутиллитий, трет-бутиллитий, втор-бутиллитий). Согласно определенным вариантам осуществления реагент лития представляет собой LiHMDS или LDA.
для добавления к соединению формулы (L-5-24)). Согласно определенным вариантам осуществления реагент лития представляет собой литийорганическое соединение (например, н-бутиллитий, трет-бутиллитий, втор-бутиллитий). Согласно определенным вариантам осуществления реагент лития представляет собой LiHMDS или LDA.
[00381] Согласно определенным вариантам осуществления реакцию проводят в присутствии трет-бутиллития. Согласно определенным вариантам осуществления реакцию проводят в растворителе, таком как THF. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от -78°С приблизительно до комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят приблизительно при -78°С. Например, согласно определенным вариантам осуществления реакцию проводят с 2,5 эквивалентами трет-бутиллития в THF при -78°С (например, в течение менее 1 часа).
[00382] Согласно определенным вариантам осуществления RP1 и RP3 представляют собой силильные защитные группы; и RP4 представляет собой необязательно замещенный бензил. Согласно определенным вариантам осуществления RP1 представляет собой TBS; RP3 представляет собой TES; и RP4 представляет собой МРМ.
[00383] В настоящем документе раскрыт способ получения соединения формулы (L-5-24):
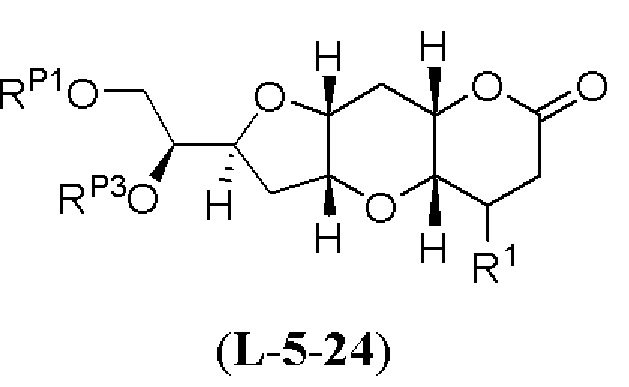
или его соли, причем способ включает в себя стадии:
(a) окисления соединения формулы (L-5-23B):
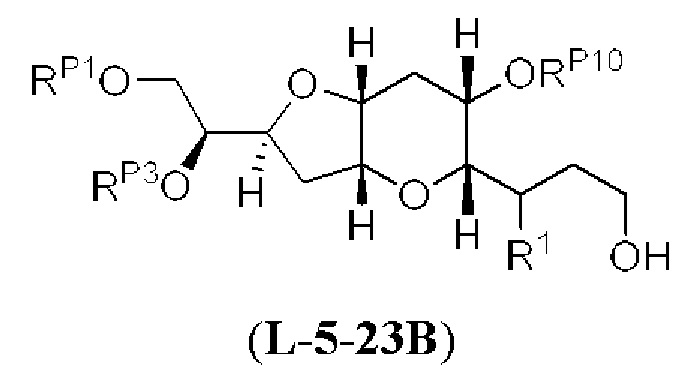
или его соли с получением соединения формулы (L-5-23C):
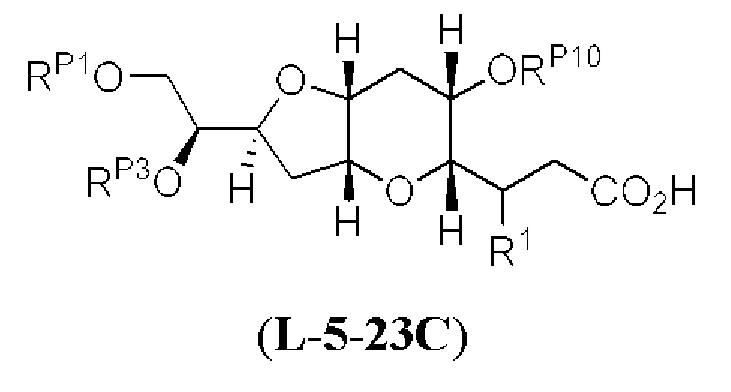
или его соли; и
(b) циклизации соединения формулы (L-5-23C) или его соли с получением соединения формулы (L-5-24) или его соли; где:
R1 представляет собой водород, галоген или необязательно замещенный алкил; и
каждый из RP1, RP3 и RP10 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу.
[00384] Стадию окисления соединения формулы (L-5-23B) проводят в присутствии окислителя. Согласно определенным вариантам осуществления окислитель представляет собой реагент гипервалентного йода. Согласно определенным вариантам осуществления окислитель представляет собой перйодинан (например, перйодинан Десс-Мартина). Согласно определенным вариантам осуществления окислитель представляет собой (диацетоксийод)бензол (PhI(OAc)2). Согласно определенным вариантам осуществления окисление проводят в присутствии одного или нескольких дополнительных реагентов. Согласно определенным вариантам осуществления окисление проводят в присутствии (2,2,6,6-тетраметилпиперидин-1-ил)оксила (TEMPO). Согласно определенным вариантам осуществления окисление проводят в присутствии TEMPO и гипервалентного йода. Согласно определенным вариантам осуществления окисление на стадии (а) и циклизацию на стадии (b) проводят на одной и той же стадии или в последующих стадиях. Согласно определенным вариантам осуществления циклизацию на стадии (b) проводят на отдельной стадии и в присутствии кислоты (например, кислоты Льюиса или кислоты Брэнстеда) или основания.
[00385] Согласно определенным вариантам осуществления стадию окисления проводят в присутствии PhI(ОАс)2 и TEMPO. Согласно определенным вариантам осуществления стадию окисления проводят в растворителе, таком как CH2Cl2. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления стадию окисления проводят при комнатной температуре. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 20 мол. % TEMPO, 3 эквивалента PhI(OAc)2 в CH2Cl2 при комнатной температуре (например, в течение 24-48 часов).
[00386] Согласно определенным вариантам осуществления RP1 и RP3 представляют собой силильные защитные группы; и RP10 представляет собой водород. Согласно определенным вариантам осуществления RP1 представляет собой TBS; RP3 представляет собой TES; и RP10 представляет собой водород.
[00387] В настоящем документе раскрыт способ получения соединения формулы (L-5-23В):
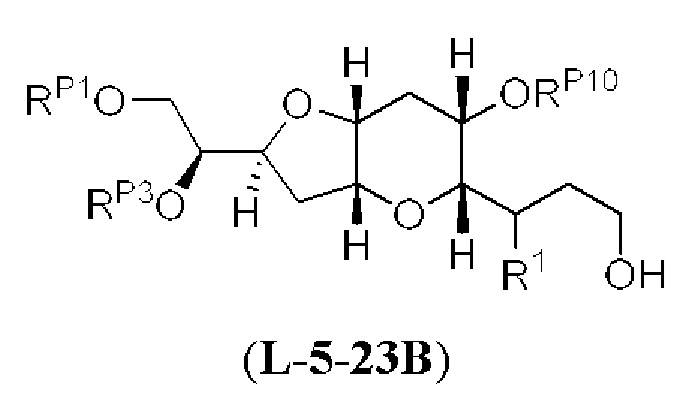
или его соли, причем способ включает в себя стадию гидратирования соединения формулы (L-5-23A):

или его соли; где:
R1 представляет собой водород, галоген или необязательно замещенный алкил; и
каждый из RP1, RP3 и RP10 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу.
[00388] Согласно определенным вариантам осуществления стадия гидратирования соединения формулы (L-5-23A) представляет собой реакцию гидроборирования. Для выполнения гидроборирования могут быть использованы любые реагенты и условия. Например, реакция может проводиться в присутствии борана (например, ВН3 или 9-BBN), а затем пероксида (например, Н2О2) или пербората (например, пербората натрия (NaBO3)). Согласно определенным вариантам осуществления реакцию проводят в присутствии 9-BBN. Согласно определенным вариантам осуществления реакция включает в себя добавление NaBO3⋅H2O.
[00389] Согласно определенным вариантам осуществления стадию гидратирования проводят в присутствии 9-BBN, а затем NaBO3⋅H2O. Согласно определенным вариантам осуществления реакцию проводят в растворителе, таком как THF. Согласно определенным вариантам осуществления реакцию проводят при 0°С до комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 3 эквивалента 9-BBN в THF, от 0°С до комнатной температуры (например, в течение 1 часа) с последующим добавлением водного NaBO3⋅H2O.
[00390] Согласно определенным вариантам осуществления RP1 и RP3 представляют собой силильные защитные группы; и RP10 представляет собой водород. Согласно определенным вариантам осуществления RP1 представляет собой TBS; RP3 представляет собой TES; и RP10 представляет собой водород.
[00391] В настоящем документе раскрыт способ получения соединения формулы (L-5-23А):
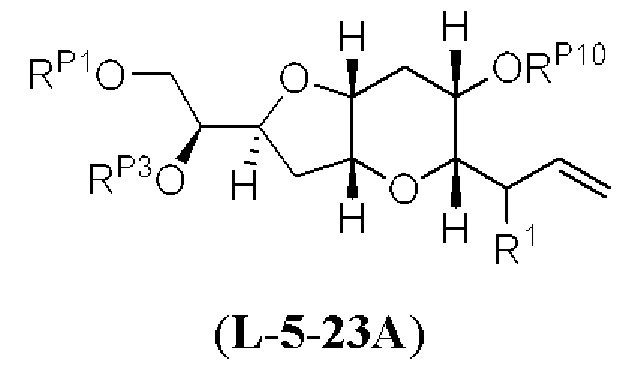
или его соли, причем способ включает в себя стадии:
(а) эпоксидирования соединения формулы (L-5-22):
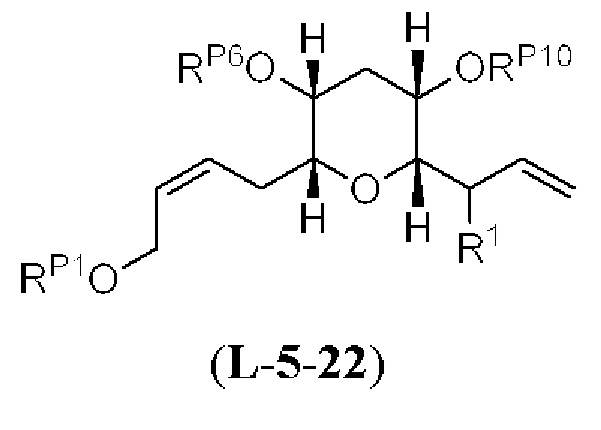
или его соли с получением соединения формулы (L-5-22A):
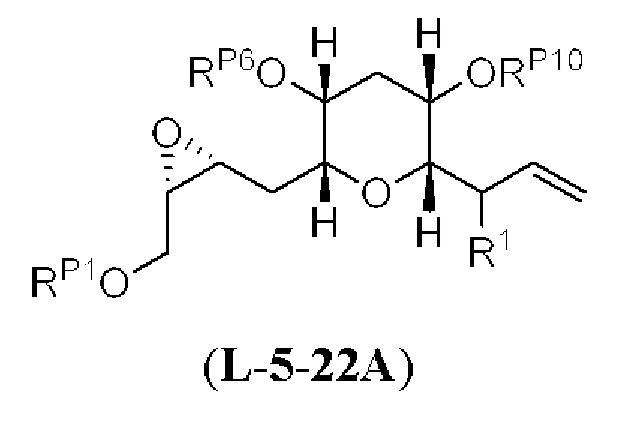
или его соли; и
(b) циклизации соединения формулы (L-5-22A) или его соли с получением соединения формулы (L-5-23A) или его соли.
[00392] На стадии эпоксидирования, описанной выше, может быть использован любой эпоксидирующий реагент. Согласно определенным вариантам осуществления эпоксидирующий реагент представляет собой пероксикислоту (например, мета-СРВА). Согласно определенным вариантам осуществления эпоксидирующий реагент представляет собой металлоорганический реагент. Согласно определенным вариантам осуществления эпоксидирующий реагент представляет собой реагент титана (например, Ti(Oi-Pr)4). Согласно определенным вариантам осуществления эпоксидирующий реагент представляет собой реагент ванадия (например, VO(TMHD)2). Согласно определенным вариантам осуществления эпоксидирование представляет собой эпоксидирование по Шарплессу. Согласно определенным вариантам осуществления представляет собой асимметрическое эпоксидирование (например, асимметрическое эпоксидирование по Шарплессу). Согласно определенным вариантам осуществления эпоксидирование проводят в присутствии одного или нескольких хиральных лигандов (например, (+)- или (-)-DET, (+)- или (-)-DIPT; где DET = диэтилтартрат, и DIPT = диизопропилтартрат). Согласно определенным вариантам осуществления стадию эпоксидирования проводят в присутствии одного или нескольких дополнительных реагентов. Согласно определенным вариантам осуществления эпоксидирование проводят в присутствии пероксида (например, трет-BuOOH).
[00393] Согласно определенным вариантам осуществления стадию эпоксидирования проводят в присутствии комплекса титана, тартратного лиганда и пероксида. Согласно определенным вариантам осуществления реакцию проводят в присутствии Ti(Oi-Pr)4, (+)-DET и трет-BuOOH. Согласно определенным вариантам осуществления реакцию проводят в присутствии молекулярных сит. Согласно определенным вариантам осуществления реакцию проводят в присутствии растворителя, такого как CH2Cl2. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от -78°С приблизительно до комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят приблизительно при -10°С. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 15 мол. % Ti(Oi-Pr)4, 20 мол. % (+)-DET, 1,5 эквивалента трет-BuOOH и 4 молекулярные сита в CH2Cl2 при -10°С (например, в течение 10-20 часов).
молекулярные сита в CH2Cl2 при -10°С (например, в течение 10-20 часов).
[00394] Согласно определенным вариантам осуществления RP6 и RP10 представляют собой силильные защитные группы; и RP1 представляет собой водород. Согласно определенным вариантам осуществления RP6 и RP10 представляют собой TBS; и RP1 представляет собой водород. Согласно определенным вариантам осуществления группа RP6 снимается перед стадией циклизации соединения формулы (L-5-22A).
[00395] Согласно определенным вариантам осуществления путем эпоксидирования/циклизации получаю соединение формулы (L-5-22B):
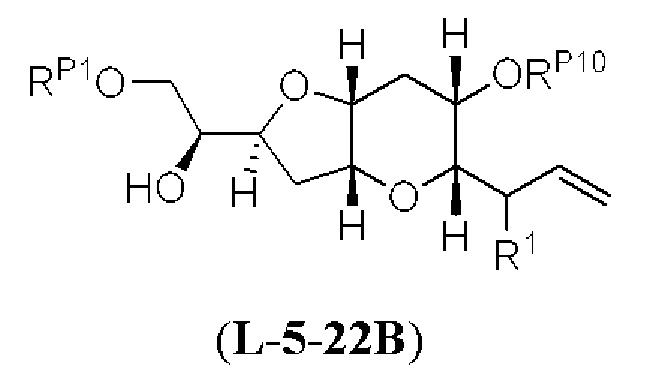
или его соль, в которое затем может быть введена защитная группа с получением соединения формулы (L-5-23A) или его соли (например, для введения группы RP3; где RP3 представляет собой кислород-защитную группу).
[00396] Как представлено на Схеме 4В, в настоящем документе раскрыт способ получения соединения формулы (L-5-22):
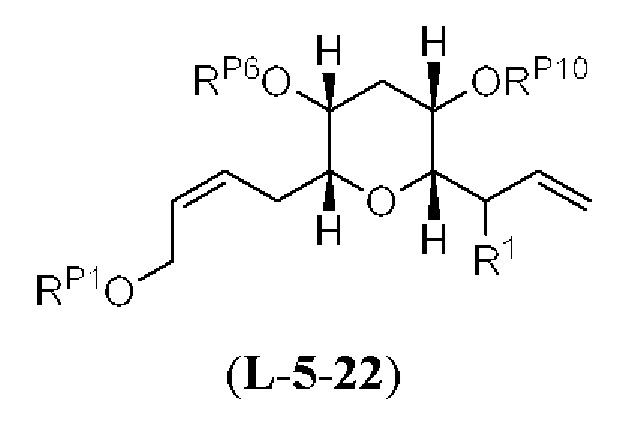
или его соли, причем способ включает в себя стадию восстановления соединения формулы (L-5-21B):
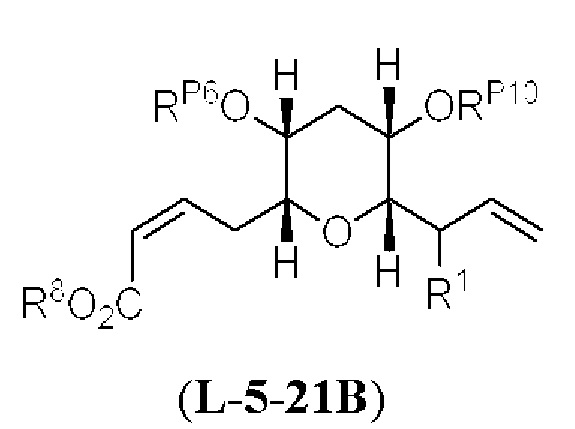
или его соли; где:
R1 представляет собой водород, галоген или необязательно замещенный алкил;
каждый из RP1, RP6 и RP10 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00397] На стадии восстановления соединения формулы (L-5-21B) или его соли фрагмент -CO2R8 преобразуют до группы -ORP1 (т.е., -ОН). Согласно определенным вариантам осуществления стадию восстановления проводят в присутствии источника гидрида (т.е., Н-). Любой источник гидрида, известный из уровня техники, может быть использован для данной трансформации. Примеры источников гидрида включают в себя без ограничения алюмогидрид лития, боргидрид натрия, боргидрид лития и гидрид диизобутилалюминия. Согласно определенным вариантам осуществления источник гидрида представляет собой гидрид диизобутилалюминия (DIBAL).
[00398] Согласно определенным вариантам осуществления стадию восстановления проводят в присутствии DIBAL. Согласно определенным вариантам осуществления реакцию проводят в растворителе (например, THF). Согласно определенным вариантам осуществления реакцию проводят при температуре ниже комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от -78°С приблизительно до комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят приблизительно при -78°С. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 4 эквивалента DIBAL в THF при -78°С (например, в течение менее 1 часа).
[00399] Согласно определенным вариантам осуществления RP6 и RP10 представляют собой силильные защитные группы; и R8 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления RP6 и RP10 представляют собой TBS; и R8 представляет собой метил.
[00400] Согласно определенным вариантам осуществления соединение формулы (L-5-22) представляет собой соединение формулы (L-5-22-C):
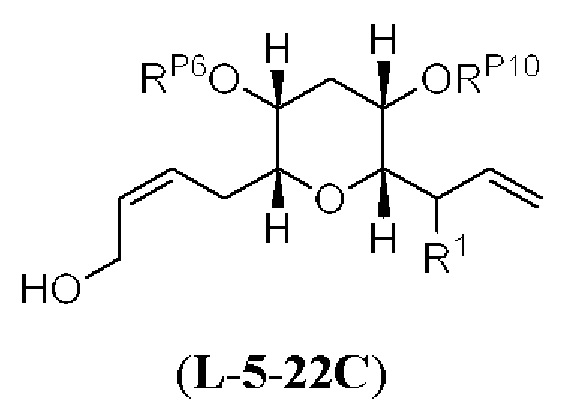
или его соль.
[00401] В настоящем документе также раскрыт способ получения соединения формулы (L-5-21B):
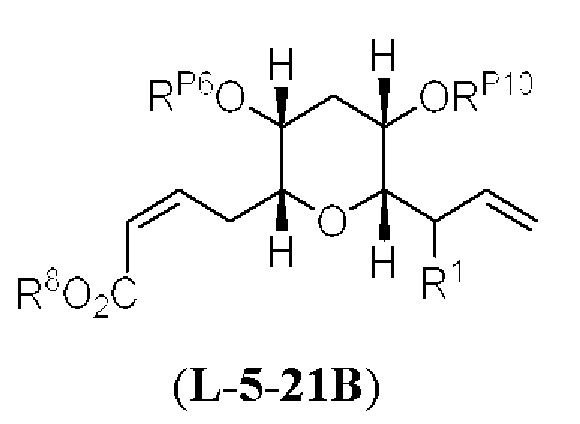
или его соли, причем способ включает в себя стадии:
(a) восстановления соединения формулы (L-5-21A):
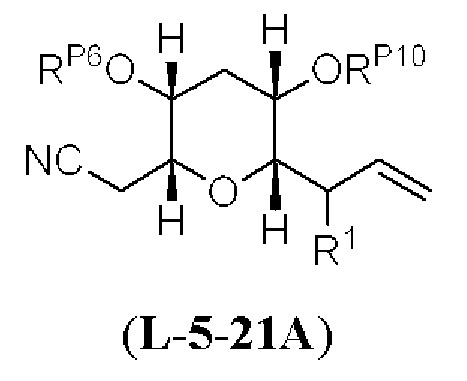
или его соли с получением соединения формулы (L-5-21C):
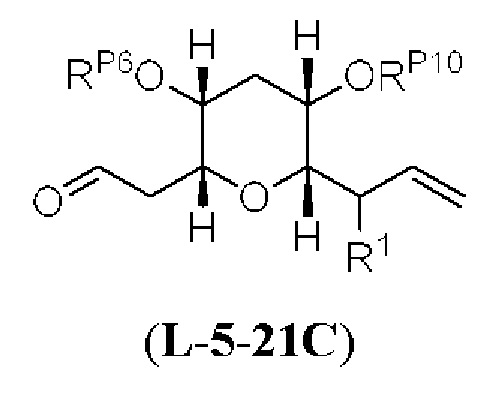
или его соли; и
(b) осуществления взаимодействия соединения формулы (L-5-21C) или его соли в присутствии олефинирующего реагента с получением соединения формулы (L-5-21B) или его соли.
[00402] На стадии восстановления соединения формулы (L-5-21A) или его соли (т.е., на представленной выше стадии (а)) фрагмент -CN преобразуется до альдегидной группы (т.е., -СНО). Согласно определенным вариантам осуществления стадию восстановления проводят в присутствии источника гидрида (т.е., Н-). Любой источник гидрида, известный из уровня техники, может быть использован для данной трансформации. Примеры источников гидрида включают в себя без ограничения алюмогидрид лития, боргидрид натрия, боргидрид лития и гидрид диизобутилалюминия. Согласно определенным вариантам осуществления источник гидрида представляет собой гидрид диизобутилалюминия (DIBAL). Стадию восстановления может необязательно включать в себя восстановление фрагмента -CN до спирта с последующим окислением полученного спирта до альдегида с получением соединения формулы (L-5-21C) или его соли.
[00403] Согласно определенным вариантам осуществления стадию восстановления проводят в присутствии DIBAL. Согласно определенным вариантам осуществления реакцию проводят в растворителе (например, в гексанах, CH2Cl2). Согласно определенным вариантам осуществления реакцию проводят при температуре ниже комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от -78°С приблизительно до комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят приблизительно при -78°С. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 1,1 эквивалента DIBAL в гексанах-CH2Cl2 при -78°С (например, в течение менее 1 часа).
[00404] Согласно определенным вариантам осуществления олефинирование соединения формулы (L-5-21C) или его соли (т.е., представленную выше стадию (b)) проводят в присутствии реагента Виттига или Хорнера-Уотсворта-Эммонса. Согласно определенным вариантам осуществления олефинирование проводят в присутствии реагента формулы: (RO)2P(O)CH2CO2R8. Согласно определенным вариантам осуществления реагент характеризуется формулой: (МеО)2Р(O)CH2CO2R8 (например, (МеО)2Р(O)CH2CO2Bn). Согласно определенным вариантам осуществления реагент характеризуется формулой: (CF3CH2O)2P(O)CH2CO2R8 (например, (CF3CH2O)2Р(O)СН2СО2Ме). Согласно определенным вариантам осуществления олефинирование проводят в присутствии основания. Согласно определенным вариантам осуществления основание представляет собой фосфат, такой как K3PO4. Согласно определенным вариантам осуществления основание представляет собой амидное основание. Согласно определенным вариантам осуществления основание представляет собой диизопропиламидное основание (например, LDA). Согласно определенным вариантам осуществления основание представляет собой гексаметилдисилазидное основание (например, LiHMDS, NaHMDS, KHMDS). Согласно определенным вариантам осуществления олефинирование проводят в присутствии одного или нескольких дополнительных реагентов. Согласно определенным вариантам осуществления олефинирование проводят в присутствии краун-эфира (например, 18-краун-6).
[00405] Согласно определенным вариантам осуществления олефинирование проводят в присутствии реагента формулы (RO)2P(O)CH2CO2R8 и основания. Согласно определенным вариантам осуществления реакцию проводят в присутствии (CF3CH2O)2Р(O)СН2СО2Ме и KHMDS. Согласно определенным вариантам осуществления содержится 18-краун-6. Согласно определенным вариантам осуществления реакцию проводят в растворителе (например, в THF). Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от -78°С приблизительно до комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят при -78°С. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 1,5 эквивалента (CF3CH2O)2P(O)CH2CO2Me, 1,5 эквивалента KHMDS, 8 эквивалентов 18-краун-6 в THF при -78°С (например, в течение менее 1 часа).
[00406] Согласно определенным вариантам осуществления RP6 и RP10 представляют собой силильные защитные группы; и R8 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления RP6 и RP10 представляют собой TBS; и R8 представляет собой метил.
[00407] В настоящем документе также раскрыт способ получения соединения формулы (L-5-21A):
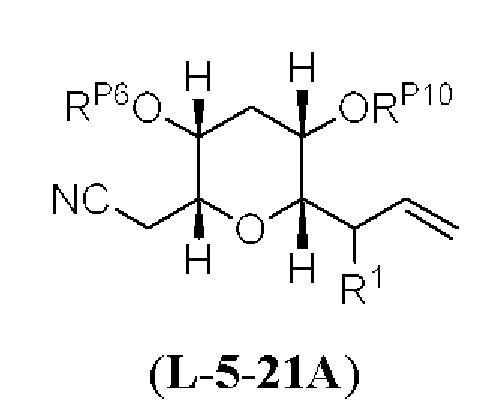
или его соли, причем способ включает в себя осуществление взаимодействия соединения формулы (L-5-20):
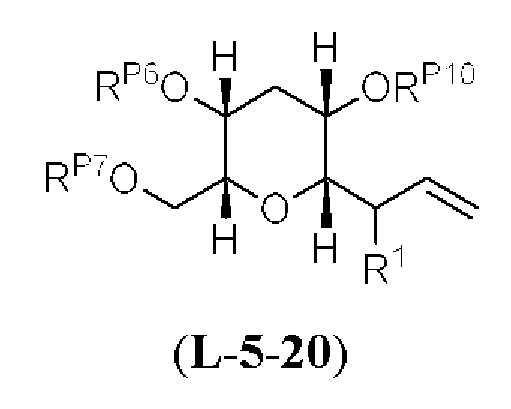
или его соли, в присутствии цианида; где:
R1 представляет собой водород, галоген или необязательно замещенный алкил;
каждый из RP6, RP7 и RP10 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и где -ORP7 представляет собой уходящую группу.
[00408] Способ получения соединения формулы (L-5-21A) или его соли включает в себя осуществление взаимодействия соединения формулы (L-5-20) или его соли в присутствии цианида. Согласно определенным вариантам осуществления цианид представляет собой соль цианида (например, NaCN, KCN, LiCN). Согласно определенным вариантам осуществления соль цианида представляет собой цианид натрия (NaCN). Реакционную смесь может проводиться в присутствии одного или нескольких дополнительных реагентов (например, краун-эфира). Согласно определенным вариантам осуществления реакцию проводят в присутствии NaCN в растворителе, таком как DMSO. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при комнатной температуре. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 20 эквивалентов NaCN в DMSO при комнатной температуре (например, в течение 1 часа).
[00409] Согласно определенным вариантам осуществления RP6 и RP10 представляют собой силильные защитные группы. Согласно определенным вариантам осуществления RP6 и RP10 представляют собой TBS.
Получение левых половин норгалихондринов
[00410] В настоящем документе раскрыт способ получения структурных элементов «левой половины» соединений норгалихондринового ряда (например, норгалихондрина А, В, С и их аналогов). Например, как представлено на Схеме 4С, структурные элементы левой половины формулы (L-2-15) могут быть получены путем преобразования сложного эфира (т.е., -CO2R8) соединения формулы (L-5-32) до фрагмента тиоэфира (т.е., -C(O)SRS). С этой целью, соединение формулы (L-5-32) может быть получено путем окисления соединения формулы (L-5-31), которое может быть получено путем циклизации соединения формулы (L-5-30). Соединение формулы (L-5-30) может быть получено посредством окислительного расщепления и олефинирования соединения формулы (L-5-28), которое может быть получено путем сочетания соединения формулы (L-5-27) с соединением формулы (L-5-5). Соединение формулы (L-5-27) может быть получено из промежуточного соединения формулы (L-5-21A), как описано в настоящем документе.
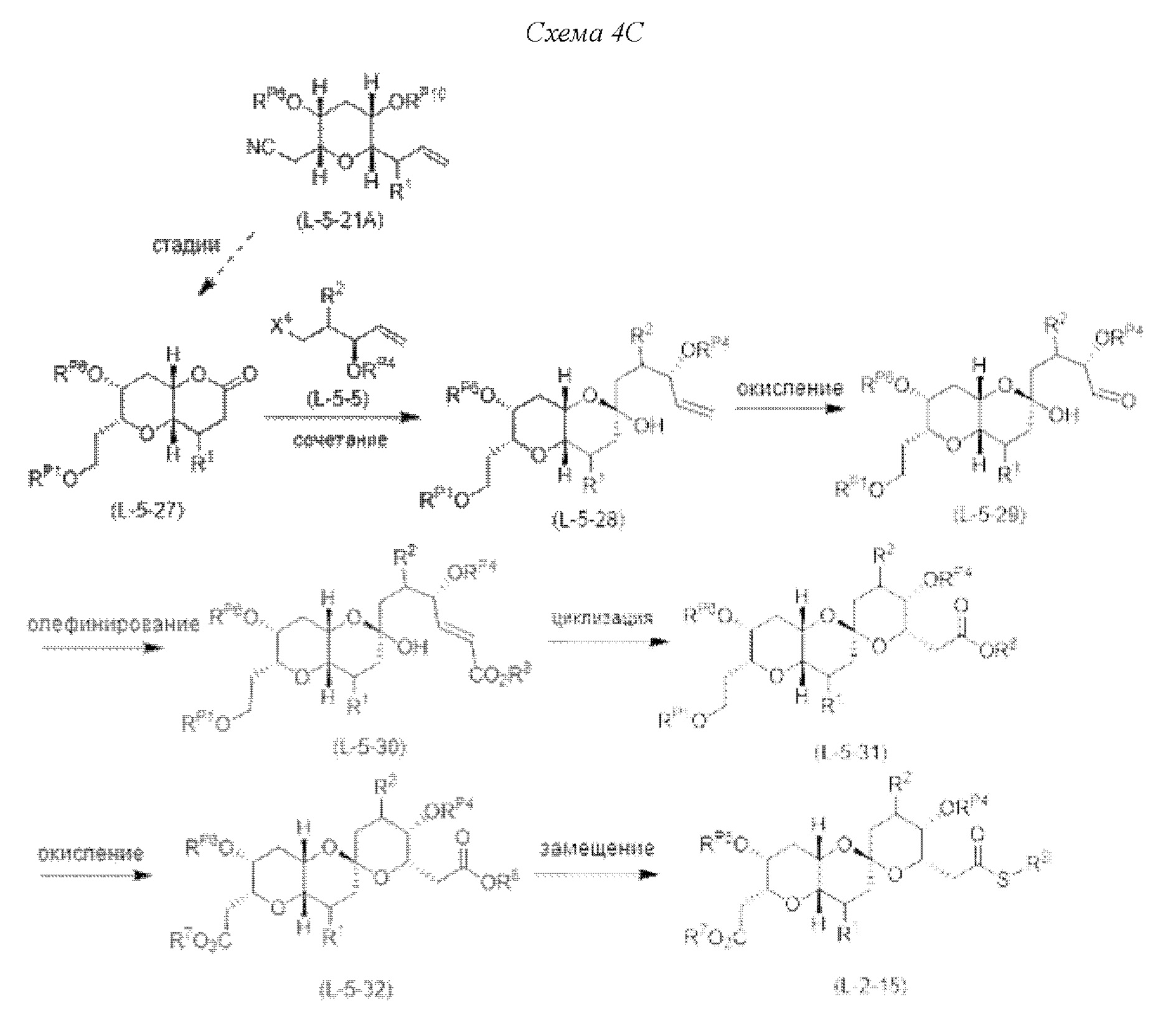
[00411] Как представлено на Схеме 4С, в настоящем документе раскрыт способ получения соединения формулы (L-2-15):
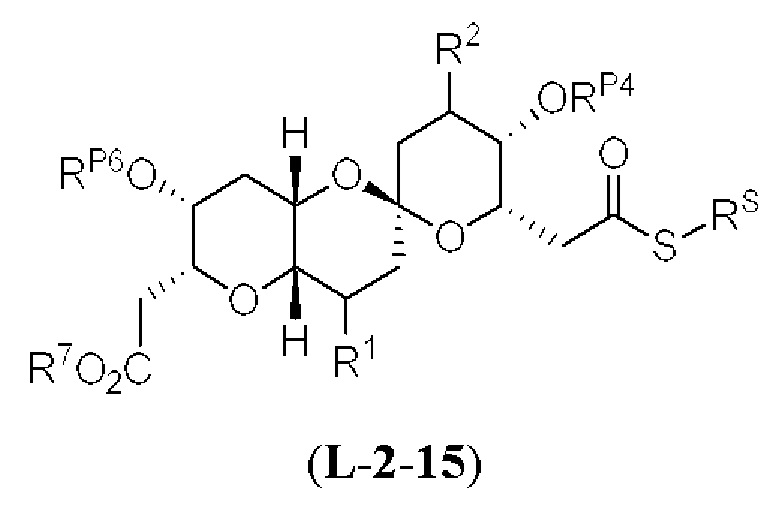
или его соли, причем способ включает в себя стадию осуществления взаимодействия соединения формулы (L-5-32):
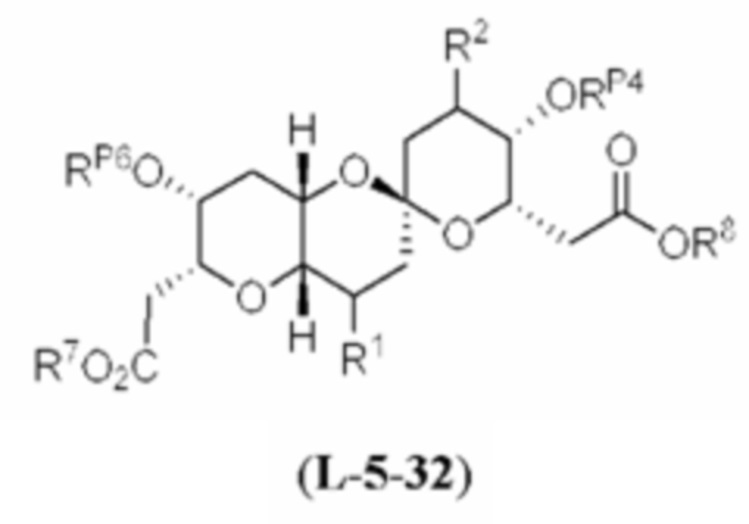
или его соли в присутствии тиолирующего агента; где:
RS представляет собой необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил или необязательно замещенный гетероарил;
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил;
в каждом случае RP4 и RP6 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
R7 и R8 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил или необязательно замещенный гетероарил.
[00412] Как описано в настоящем документе, стадия формирования соединения формулы (L-2-15) включает в себя осуществление взаимодействия соединения формулы (L-5-32) в присутствии тиолирующего агента. С этой целью может быть использован любой тиолирующий агент, известный из уровня техники. Согласно определенным вариантам осуществления тиолирующий агент представляет собой дисульфид. Согласно определенным вариантам осуществления тиолирующий агент представляет собой соединение формулы (RSS)2. Согласно определенным вариантам осуществления тиолирующий агент представляет собой соединение формулы (пиридин-S)2. Согласно определенным вариантам осуществления тиолирующий агент представляет собой: 
[00413] Согласно определенным вариантам осуществления стадию тиолирования соединения формулы (L-5-32) проводят в присутствии одного или нескольких дополнительных реагентов. Согласно определенным вариантам осуществления стадию тиолирования проводят в присутствии фосфинового реагента (например, трифенилфосфина (Ph3P)).
[00414] Согласно определенным вариантам осуществления стадию тиолирования проводят в присутствии дисульфида и фосфина. Согласно определенным вариантам осуществления реакцию проводят в присутствии (Py-S)2 и Ph3P. Согласно определенным вариантам осуществления реакцию проводят в растворителе, таком как толуол или CH2Cl2. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при комнатной температуре. Например, согласно определенным вариантам осуществления стадию тиолирования проводят в следующих условиях: 1,4 эквивалента (Py-S)2, 1,2 эквивалента Ph3P в толуоле при комнатной температуре (например, в течение 10-20 часов).
[00415] Согласно определенным вариантам осуществления способ тиолирования соединения формулы (L-5-32) или его соли включает в себя стадии:
(a) снятия защитной группы с соединения формулы (L-5-32) или его соли с получением соединения формулы (L-5-32B):
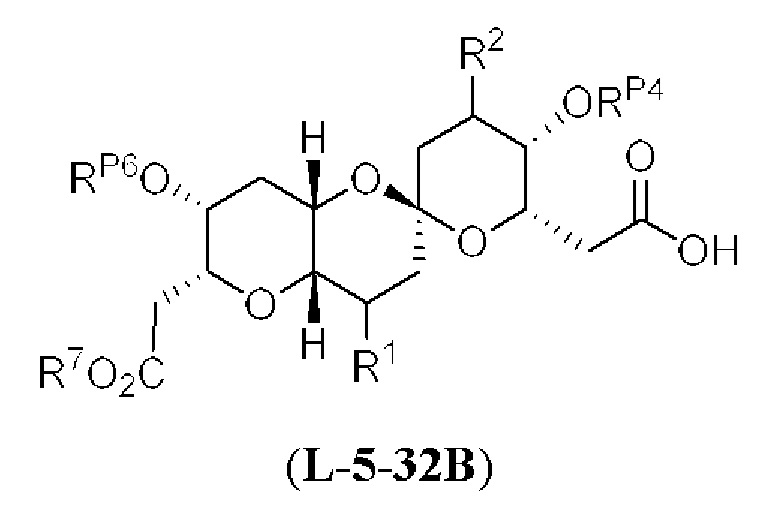
или его соли; и
(b) тиолирования соединения формулы (L-5-32B) или его соли с получением соединения формулы (L-2-15) или его соли.
[00416] Согласно определенным вариантам осуществления R7 представляет собой необязательно замещенный алкил; и RP6 и RP4 представляют собой силильные защитные группы. Согласно определенным вариантам осуществления R7 представляет собой необязательно замещенный алкил; RP6 и RP4 представляют собой TES.
[00417] В настоящем документе также раскрыт способ получения соединения формулы (L-5-32):
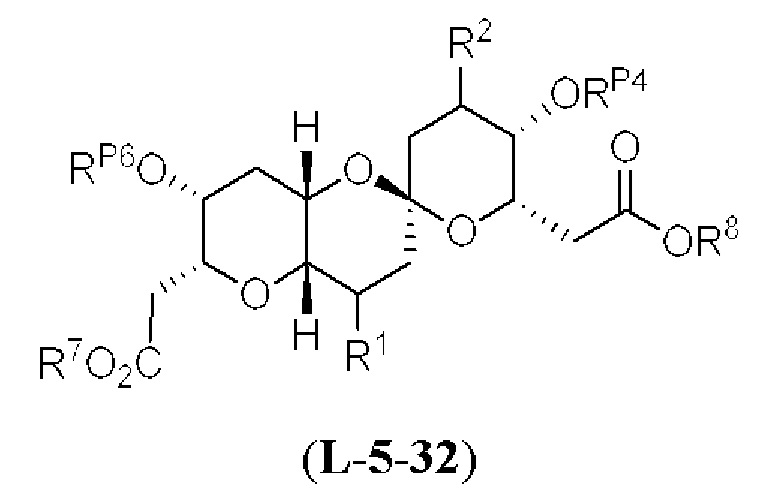
или его соли, причем способ включает в себя окисления соединения формулы (L-5-31):
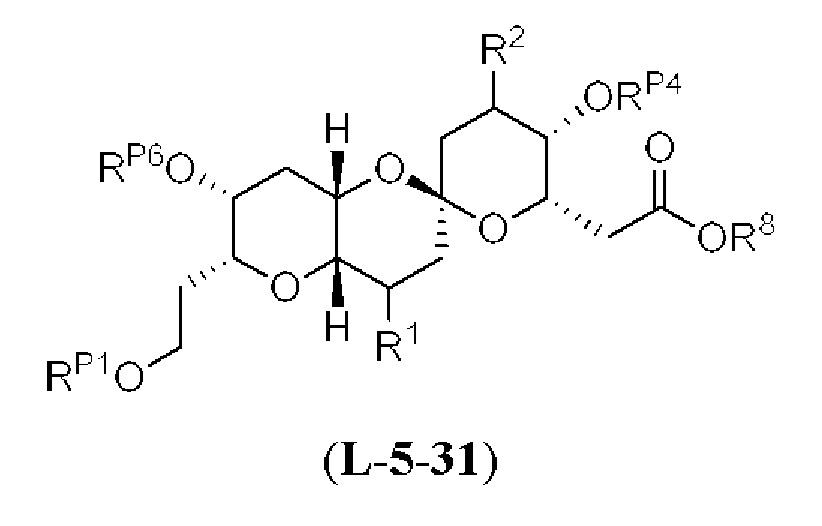
или его соли; где:
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил;
RP1, RP4 и RP6 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00418] Согласно определенным вариантам осуществления способ получения соединения формулы (L-5-32) или его соли включает в себя стадии:
(a) окисления соединения формулы (L-5-31B):
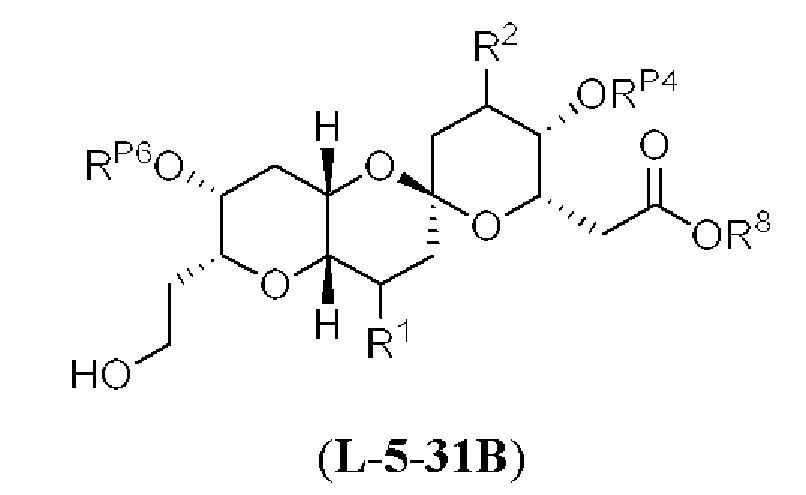
или его соли с получением соединения формулы (L-5-32C):
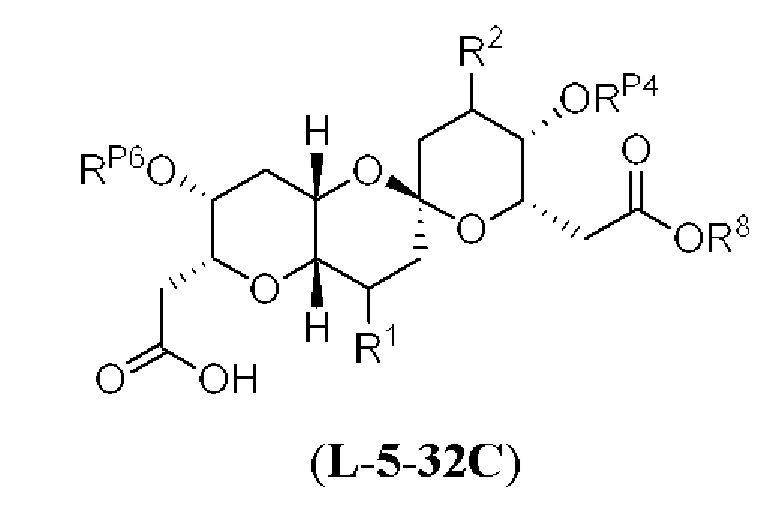
или его соли; и
(b) введение защитной группы в соединение формулы (L-5-32C) или его соль с получением соединения формулы (L-5-32) или его соли.
[00419] Любой способ может быть использован на стадии окисления соединения формулы (L-5-31) или (L-5-31B). Согласно определенным вариантам осуществления окисление проводят в присутствии перйодинана (например, перйодинана Десс-Мартина (DMP)). Согласно определенным вариантам осуществления окисление включает в себя окисление по Сверну. Согласно определенным вариантам осуществления окисление проводят в присутствии реагента хрома (например, хлорхромата пиридиния (РСС)). Согласно определенным вариантам осуществления стадия окисления включает в себя окисление по Пиннику, например, обработку реакционной смеси хлоритом (например, хлоритом натрия (NaClO2)). Согласно определенным вариантам осуществления окисление включает в себя проведение реакции в присутствии перйодинана (например, DMP), а затем хлорита (например, NaClO2). Согласно определенным вариантам осуществления окисление проводят в присутствии DMP и NaHCO3 в растворителе (например, CH2Cl2), а затем NaClO2 и NaH2PO4 в растворителе (например, t-BuOH/Н2О). Согласно определенным вариантам осуществления указанные реакции проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления указанные реакции проводят при температуре около комнатной температуры. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: (а) 2 эквивалента DMP, 10 эквивалентов NaHCO3 в CH2Cl2 при комнатной температуре (например, в течение менее 1 часа); а затем (b) 3 эквивалента NaClO2, 4 эквивалента NaH2PO4 с 2-метил-2-бутеном в t-BuOH и воде при комнатной температуре (например, в течение менее 1 часа).
[00420] Согласно определенным вариантам осуществления стадия введения защитной группы в соединение формулы (L-5-32C) включает в себя обработку соединения алкилирующим агентом. Согласно определенным вариантам осуществления алкилирующий агент представляет собой алкилгалогенид или реагент структуры: алкил-уходящая группа. Согласно определенным вариантам осуществления алкилирующий агент представляет собой реагент переноса метильной группы (например, диазометан, триметилсилилдиазометан (TMSCH2N2)).
[00421] Согласно определенным вариантам осуществления стадию введения защитных групп проводят в присутствии TMSCH2N2. Согласно определенным вариантам осуществления реакцию проводят в растворителе (например, в смеси бензол/МеОН). Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при температуре около комнатной температуры. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 3 эквивалента TMSCH2N2 в смеси бензол/МеОН при комнатной температуре (например, в течение 5 мин).
[00422] Согласно определенным вариантам осуществления R7 представляет собой необязательно замещенный алкил; и RP6 представляет собой силильную защитную группу; RP4 представляет собой необязательно замещенный бензил; и R8 представляет собой необязательно замещенный бензил. Согласно определенным вариантам осуществления R7 представляет собой метил; RP6 представляет собой TES; RP4 представляет собой МРМ; и R8 представляет собой бензил.
[00423] Согласно определенным вариантам осуществления с соединения формулы (L-5-32) или его соли снимают защитную группу для удаления группы RP4 с получением соединения формулы (L-5-32D):
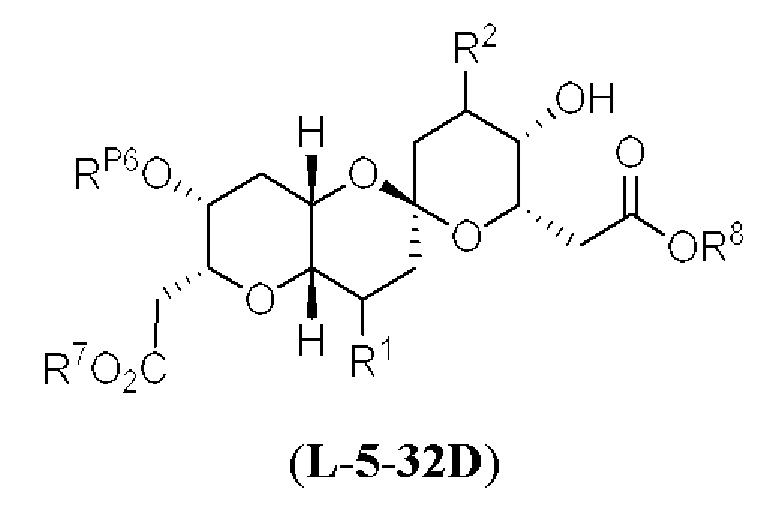
или его соли; и необязательно повторно вводят защитную группу (т.е., для замены группы RP4, например, с бензильной защитной группы (например, МРМ) на силильную защитную группу (например, триалкилсилил, такой как триэтилсилил).
[00424] Как представлено на Схеме 4С, в настоящем документе раскрыт способ получения соединения формулы (L-5-31):
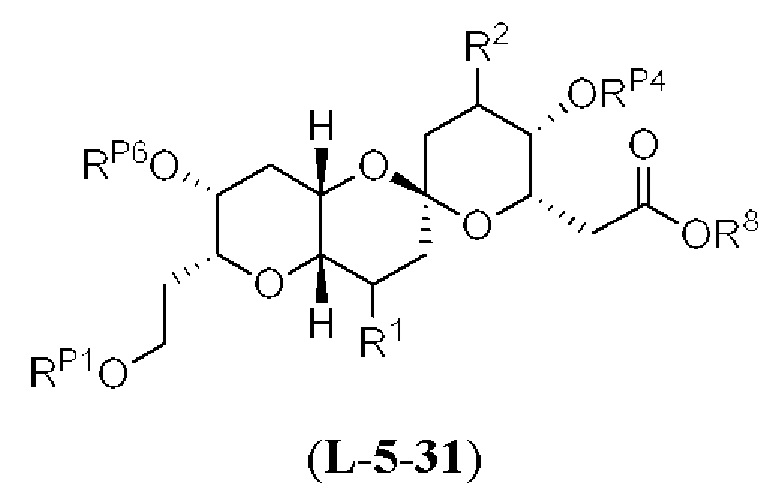
или его соли, причем способ включает в себя стадию циклизации соединения формулы (L-5-32A):
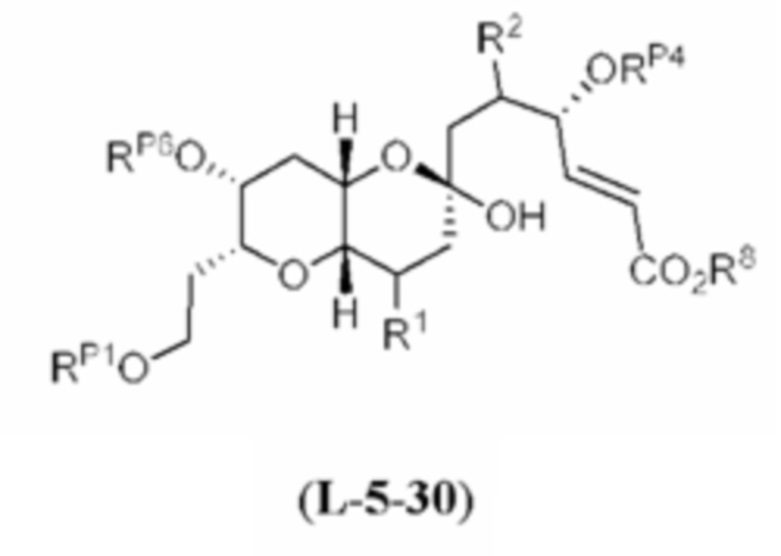
или его соли; где:
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил;
RP1, RP4 и RP6 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00425] Согласно определенным вариантам осуществления стадию циклизации соединения формулы (7-5-30) проводят в присутствии основания. Согласно определенным вариантам осуществления основание представляет собой азотное основание. Согласно определенным вариантам осуществления основание представляет собой амидиновое или гуанидиновое основание. Согласно определенным вариантам осуществления основание представляет собой амин или амид. Согласно определенным вариантам осуществления основание представляет собой амидиновое основание (например, 1,8-диазабицикло(5.4.0)ундец-7-ен (DBU)). Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии кислоты. Согласно определенным вариантам осуществления кислота представляет собой кислоту Льюиса. Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии соли лития (например, LiBr, LiCl). Стадия циклизации может проводиться в присутствии одного или нескольких дополнительных реагентов. Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии BnOAc.
[00426] Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии соли лития и основания. Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии LiBr и DBU. Согласно определенным вариантам осуществления реакцию проводят в растворителе, таком как MeCN. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при комнатной температуре. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 10 эквивалентов LiBr, 5 эквивалентов DBU и 2 эквивалента BnOAc в MeCN при комнатной температуре (например, в течение 10-20 часов).
[00427] Согласно определенным вариантам осуществления RP1 представляет собой силил; и RP6 представляет собой силильную защитную группу; RP4 представляет собой необязательно замещенный бензил; и R8 представляет собой необязательно замещенный бензил. Согласно определенным вариантам осуществления RP1 представляет собой TES; RP6 представляет собой TES; RP4 представляет собой МРМ; и R8 представляет собой бензил.
[00428] В настоящем документе также раскрыт способ получения соединения формулы (L-5-30):
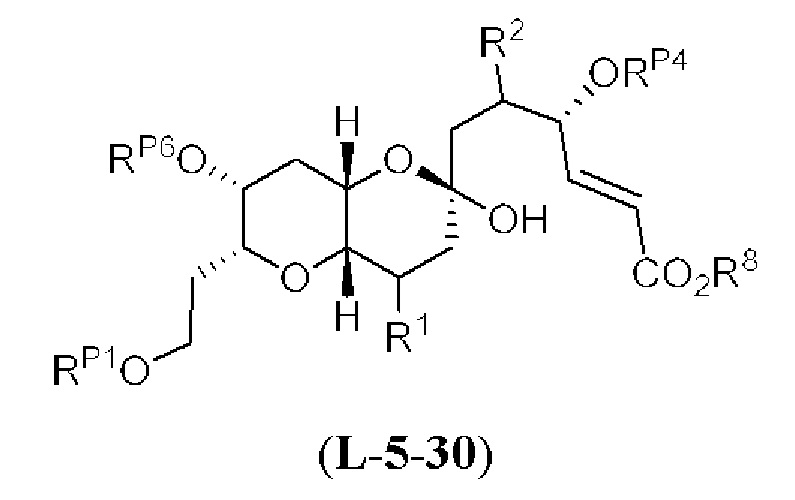
или его соли, причем способ включает в себя стадию осуществления взаимодействия соединения формулы (L-5-28):
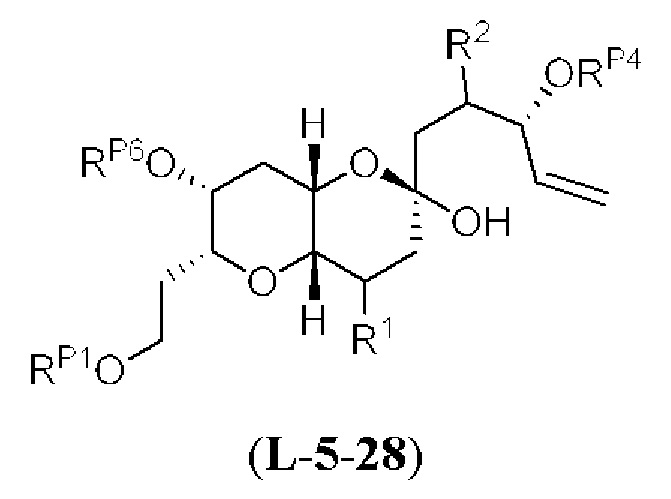
или его соли в присутствии олефина и катализатора метатезиса олефинов; где:
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил; и
RP1, RP4 и RP6 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00429] Согласно определенным вариантам осуществления олефин характеризуется формулой:  Затем, любой катализатор метатезиса олефинов, известный из уровня техники, может быть использован в реакции метатезиса с получением соединения формулы (L-5-30).
Затем, любой катализатор метатезиса олефинов, известный из уровня техники, может быть использован в реакции метатезиса с получением соединения формулы (L-5-30).
[00430] В настоящем документе также раскрыт альтернативный способ получения соединения формулы (L-5-30):
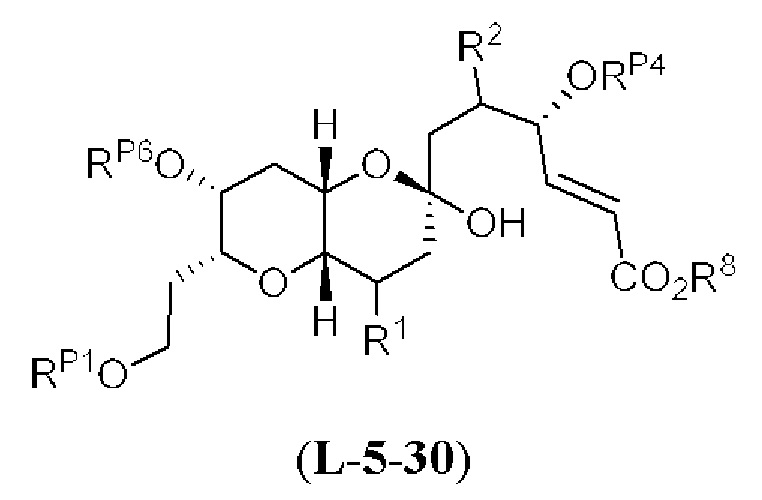
или его соли, причем способ включает в себя стадии:
(a) окисления соединения формулы (L-5-28):
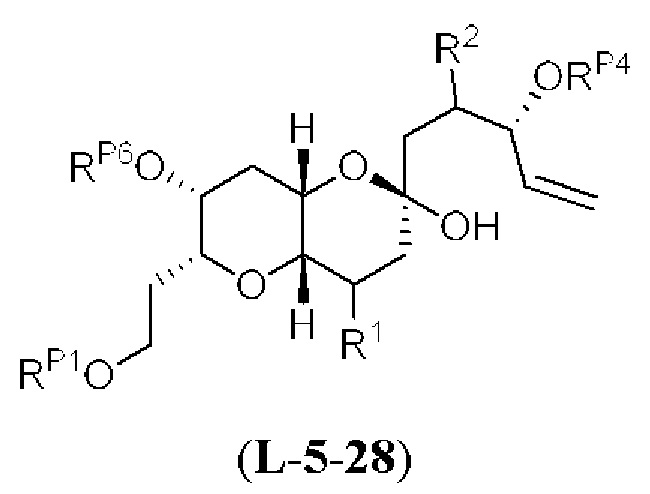
или его соли с получением соединения формулы (L-5-29) или (L-5-29B):
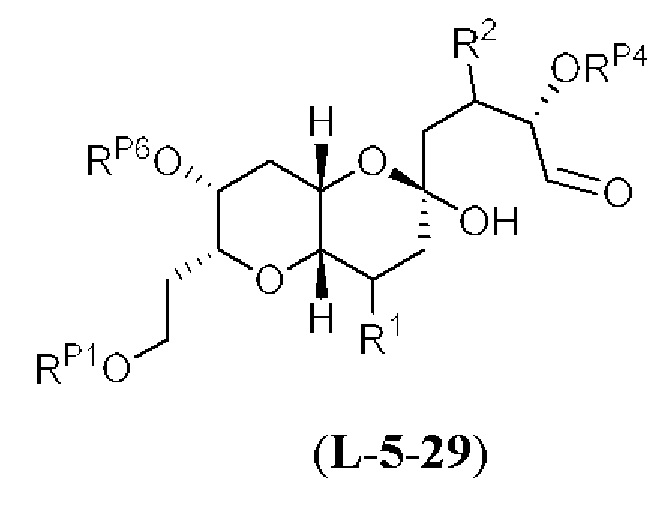
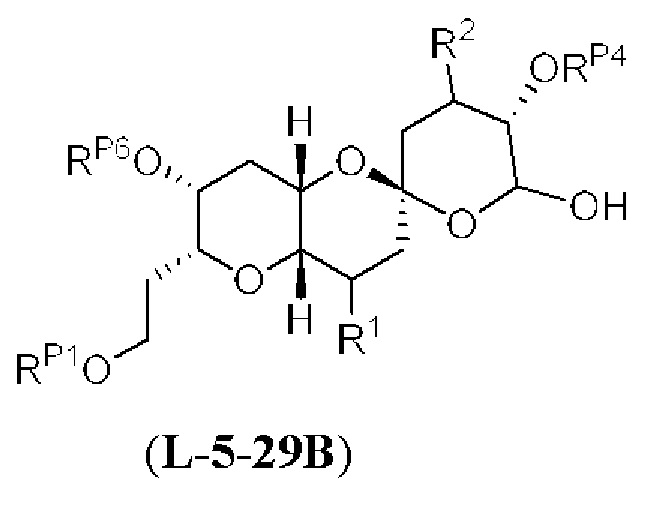
или его соли; и
(b) осуществления взаимодействия соединения формулы (L-5-29) или (L-5-29B) или его соли в присутствии олефинирующего реагента с получением соединения формулы (L-5-30) или его соли.
Реакция на представленной выше стадии (а) представляет собой окислительное расщепление; реакция на стадии (b) представляет собой реакцию олефинирования. Согласно определенным вариантам осуществления окислительное расщепление проводят посредством озонолиза (например, в присутствии О3). Согласно определенным вариантам осуществления расщепление проводят в присутствии реагентов, способных дигидроксилировать двойную связь (например, тетраоксида осмия (OsO4), N-оксида N-метилморфолина (NMMO)), а затем металла переменной валентности (например, комплекса свинца, такого как Pb(ОАс)4).
[00431] Согласно определенным вариантам осуществления двойную связь дигидроксилируют путем обработки OsO4, NMMO и водой. Согласно определенным вариантам осуществления реакцию проводят в присутствии растворителя, такого как ацетон. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при комнатной температуре. Например, согласно определенным вариантам осуществления двойную связь дигидроксилируют в следующих условиях: 5 мол. % OsO4, 2 эквивалента NMMO и воды в ацетоне при комнатной температуре (например, в течение 10-20 часов). Затем, согласно определенным вариантам осуществления полученное соединение обрабатывают Pb(ОАс)4 и K2CO3 с получением альдегида или гемиацеталя. Например, согласно определенным вариантам осуществления указанную стадию проводят в следующих условиях: 2 эквивалента Pb(ОАс)4, 10 эквивалентов K2CO3 в CH2Cl2 при комнатной температуре (например, в течение менее 1 часа).
[00432] Согласно определенным вариантам осуществления олефинирование проводят в присутствии реагента Виттига или Хорнера-Уотсворта-Эммонса. Согласно определенным вариантам осуществления олефинирование проводят в присутствии реагента формулы: (RO)2P(O)CH2CO2R8. Согласно определенным вариантам осуществления реагент характеризуется формулой: (MeO)2P(O)CH2CO2R8 (например, (МеО)2Р(O)CH2CO2Bn). Согласно определенным вариантам осуществления олефинирование проводят в присутствии основания (например, фосфата, такого как K3PO4).
[00433] Согласно определенным вариантам осуществления олефинирование проводят в присутствии олефинирующего реагента формулы: (RO)2P(O)CH2CO2R8 и основания. Согласно определенным вариантам осуществления олефинирование проводят в присутствии (МеО)2Р(O)CH2CO2Bn и K3PO4. Согласно определенным вариантам осуществления реакцию проводят в растворителе, таком как толуол. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при комнатной температуре. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 4 эквивалента (МеО)2Р(O)CH2CO2Bn, 3 эквивалента K3PO4 в растворителе при комнатной температуре (например, в течение 24-48 часов).
[00434] Согласно определенным вариантам осуществления RP1 представляет собой силил; и RP6 представляет собой силильную защитную группу; RP4 представляет собой необязательно замещенный бензил; и R8 представляет собой необязательно замещенный бензил. Согласно определенным вариантам осуществления RP1 представляет собой TES; RP6 представляет собой TES; RP4 представляет собой МРМ; и R8 представляет собой бензил.
[00435] В настоящем документе также раскрыт способ получения соединения формулы (L-5-28):
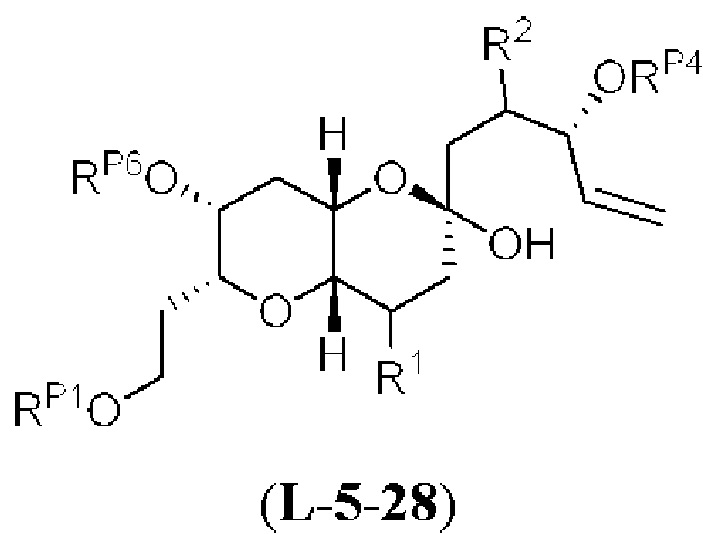
или его соли, причем способ включает в себя стадию сочетания соединения формулы (L-5-27):
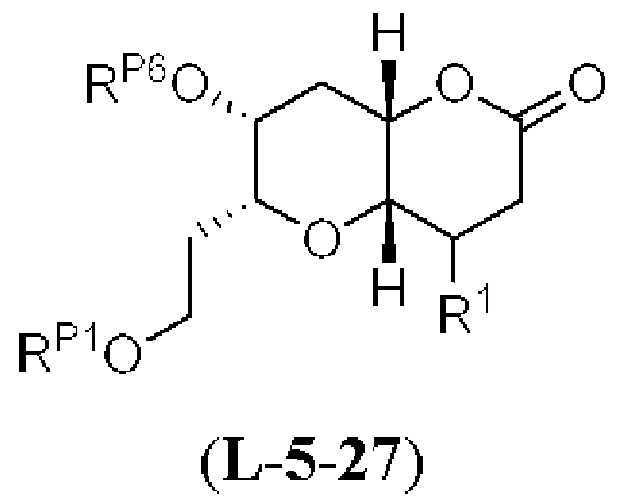
или его соли с соединением формулы (L-5-5):
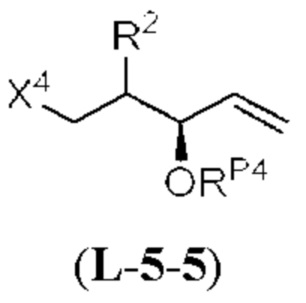
или его солью, где:
X4 представляет собой галоген или уходящую группу;
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил; и
в каждом случае RP1, RP4 и RP6 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00436] Согласно определенным вариантам осуществления сочетание соединения формулы (L-5-4) с соединением формулы (L-5-5) проводят в присутствии металлорганического реагента (например, для преобразования X4 до металла для добавления к соединению формулы (L-5-4)). Согласно определенным вариантам осуществления металлорганический реагент представляет собой реагент лития (например, для преобразования соединения формулы (L-5-5) до соединения формулы: 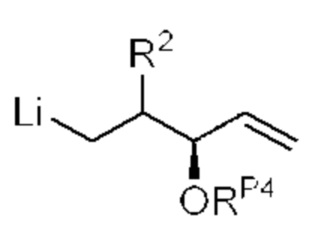 для добавления к соединению формулы (L-5-4)). Согласно определенным вариантам осуществления реагент лития представляет собой литийорганическое соединение (например, н-бутиллитий, трет-бутиллитий, втор-бутиллитий). Согласно определенным вариантам осуществления реагент лития представляет собой LiHMDS или LDA.
для добавления к соединению формулы (L-5-4)). Согласно определенным вариантам осуществления реагент лития представляет собой литийорганическое соединение (например, н-бутиллитий, трет-бутиллитий, втор-бутиллитий). Согласно определенным вариантам осуществления реагент лития представляет собой LiHMDS или LDA.
[00437] Согласно определенным вариантам осуществления реакцию проводят в присутствии трет-бутиллития. Согласно определенным вариантам осуществления реакцию проводят в растворителе, таком как толуол, THF, Et2O или их комбинация. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от -78°С приблизительно до комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят при -78°С. Например, согласно определенным вариантам осуществления реакцию проводят с 2,2 эквивалента трет-бутиллития в толуоле и Et2O при -78°С (например, в течение менее 1 часа).
[00438] Согласно определенным вариантам осуществления RP1 представляет собой силил; и RP6 представляет собой силильную защитную группу; RP4 представляет собой необязательно замещенный бензил; и R8 представляет собой необязательно замещенный бензил. Согласно определенным вариантам осуществления RP1 представляет собой TES; RP6 представляет собой TES; RP4 представляет собой МРМ; и R8 представляет собой бензил.
Получение левых половин аналогов галихондрина
[00439] В настоящем документе раскрыты способы, применимые для получения структурных элементов «левой половины» других аналогов галихондринов (например, соединений формулы (Н3-2-1)). Например, как представлено на Схеме 4D, структурные элементы в левой половины формулы (L-2-6) могут быть получены путем преобразования сложноэфирной группы (т.е., -CO2R8) соединения формулы (L-5-7B) до фрагмента тиофира (т.е., -C(O)SRS). Соединение формулы (L-5-7B) может быть получено путем циклизации соединения формулы (L-5-7A), которое может быть получено путем окислительного расщепления и олефинирования соединения формулы (L-5-6A). Соединение формулы (L-5-6А) может быть получено путем сочетания соединения формулы (L-5-4) с соединением формулы (L-5-5). Как также представлено на Схеме 4D, соединение формулы (L-5-4) может быть получено посредством гомологизации лактона формулы (L-5-3).
Схема 4D
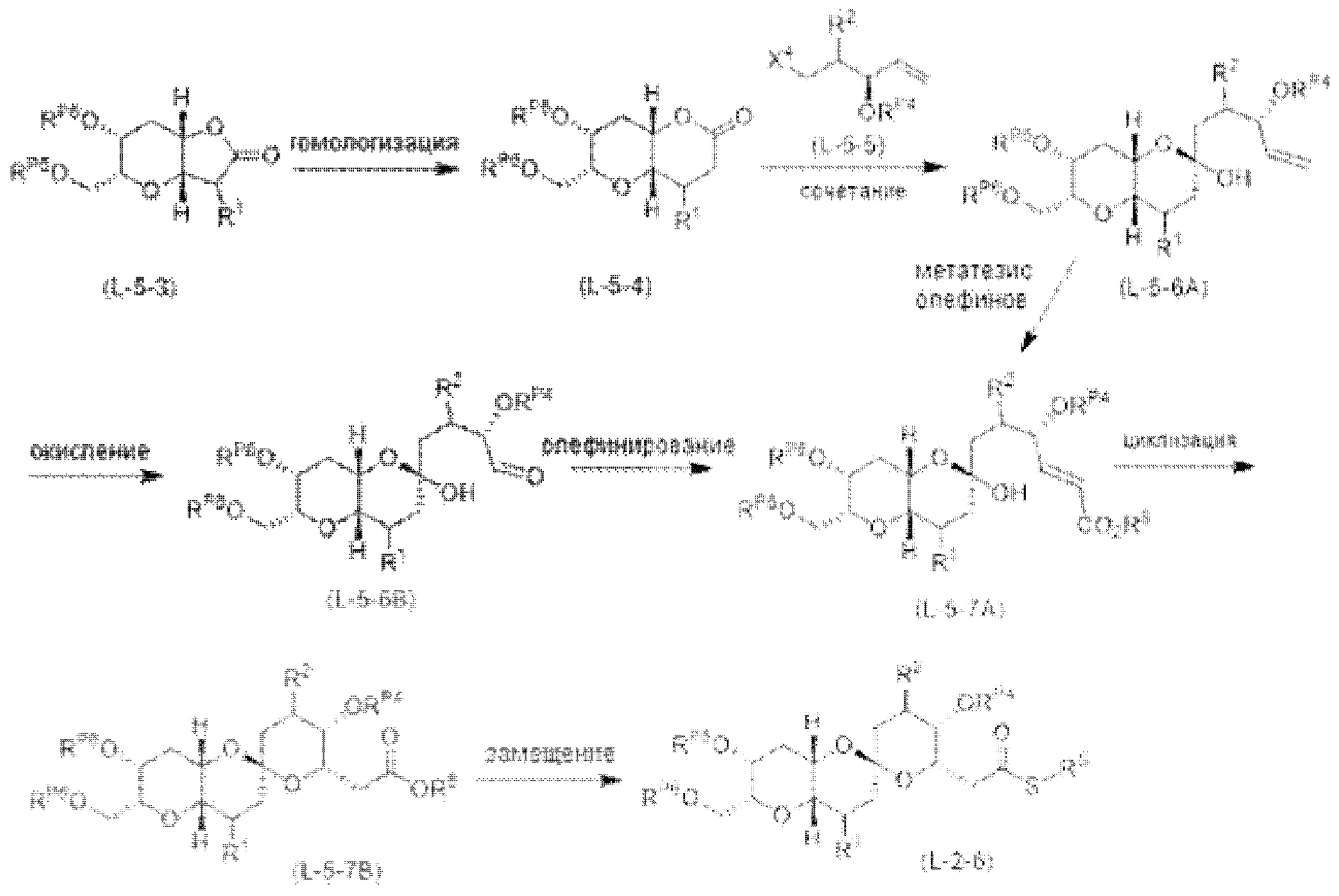
[00440] Как представлено на Схеме 4D, в настоящем документе раскрыт способ получения соединения формулы (L-2-6):
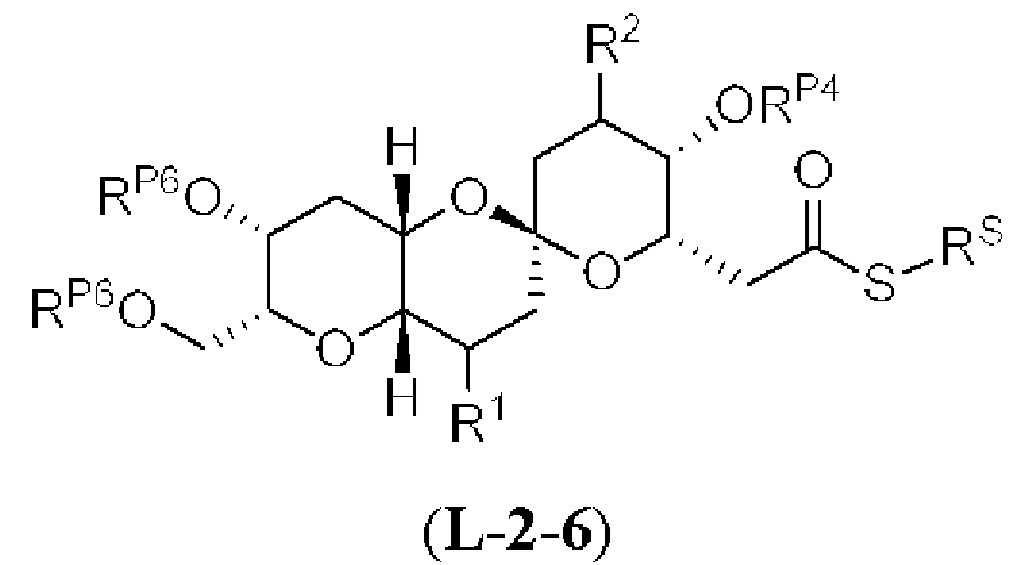
или его соли, причем способ включает в себя стадию осуществления взаимодействия соединения формулы (L-5-7B):
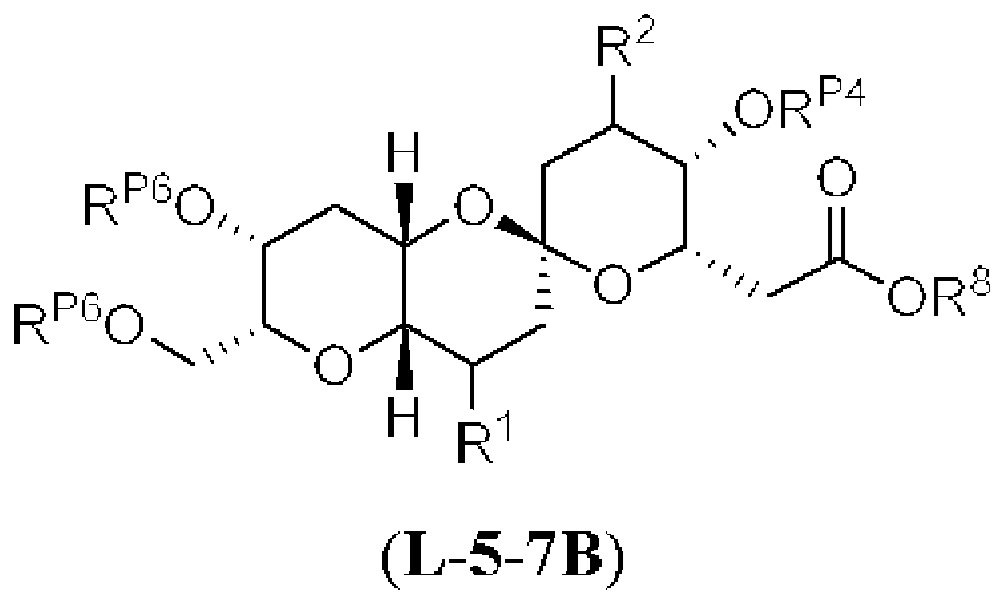
или его соли в присутствии тиолирующего агента; где:
RS представляет собой необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил или необязательно замещенный гетероарил;
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил;
в каждом случае RP4 и RP6 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00441] Согласно определенным вариантам осуществления способ представляет собой способ получения соединения формулы (E-L):
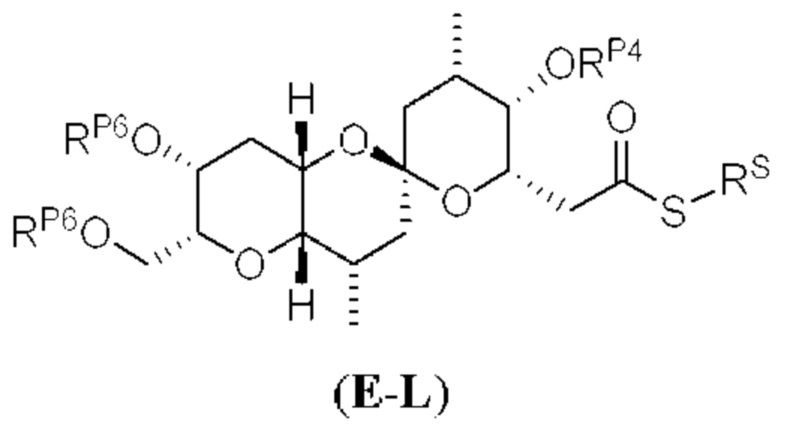
или его соли, причем способ включает в себя стадию осуществления взаимодействия соединения формулы (E-L-1):
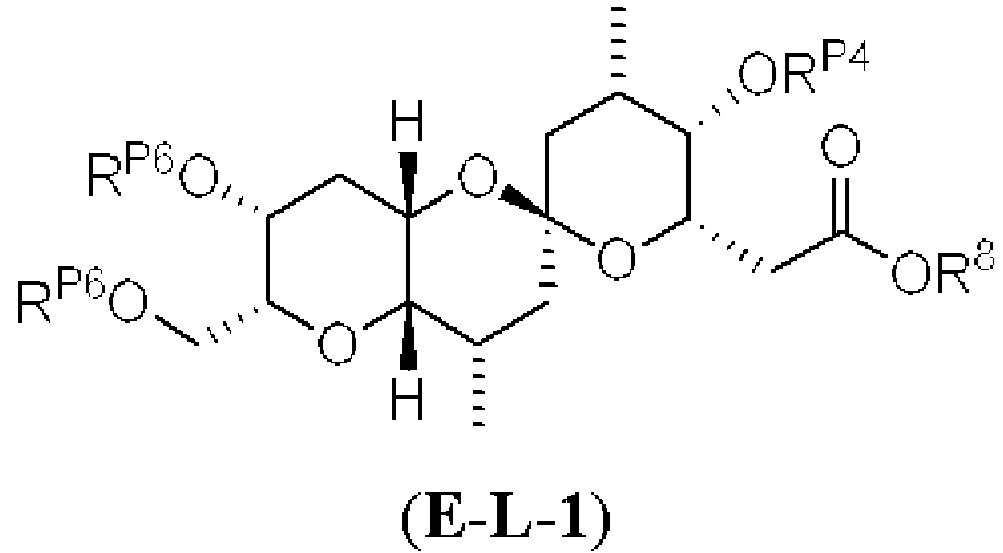
или его соли в присутствии тиолирующего агента; где:
RS представляет собой необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил или необязательно замещенный гетероарил;
в каждом случае RP4 и RP6 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00442] Как описано в настоящем документе, стадия формирования соединения формулы (L-2-6), (E-L) или его соли включает в себя осуществление взаимодействия соединения формулы (L-5-7B), (Е-L-1) или его соли в присутствии тиолирующего агента. С этой целью может быть использован любой тиолирующий агент, известный из уровня техники. Согласно определенным вариантам осуществления тиолирующий агент представляет собой дисульфид. Согласно определенным вариантам осуществления тиолирующий агент представляет собой соединение формулы (RSS)2. Согласно определенным вариантам осуществления тиолирующий агент представляет собой соединение формулы (пиридин-S)2. Согласно определенным вариантам осуществления тиолирующий агент представляет собой:  (2,2'-дипиридилсульфид). Согласно определенным вариантам осуществления тиолирующий реагент содержится в стехиометрическом или избыточном количестве (например, 1-2 эквивалента)
(2,2'-дипиридилсульфид). Согласно определенным вариантам осуществления тиолирующий реагент содержится в стехиометрическом или избыточном количестве (например, 1-2 эквивалента)
[00443] Согласно определенным вариантам осуществления стадию тиолирования проводят в присутствии одного или нескольких дополнительных реагентов. Согласно определенным вариантам осуществления стадию тиолирования проводят в присутствии фосфинового реагента. Согласно определенным вариантам осуществления фосфин представляет собой триалкилфосфин. Согласно определенным вариантам осуществления фосфин представляет собой триарилфосфин. Согласно определенным вариантам осуществления фосфин представляет собой PPh3. Согласно определенным вариантам осуществления фосфин представляет собой связанный с полимером PPh3. Согласно определенным вариантам осуществления фосфин содержится в стехиометрическом или избыточном количестве (например, 1-3 эквивалента).
[00444] Согласно определенным вариантам осуществления стадию тиолирования проводят в присутствии дисульфида и фосфина. Согласно определенным вариантам осуществления реакцию проводят в присутствии 2,2'-дипиридилсульфида и Ph3P. Согласно определенным вариантам осуществления реакцию проводят в растворителе. Согласно определенным вариантам осуществления растворитель представляет собой DCM. Согласно определенным вариантам осуществления растворитель представляет собой ацетонитрил. Согласно определенным вариантам осуществления реакцию проводят при температуре от 0°С до комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при комнатной температуре. Согласно определенным вариантам осуществления реакцию проводят в присутствии 2,2'-дипиридилсульфида и Ph3P в MeCN при температуре от 0°С до комнатной температуры.
[00445] Например, согласно определенным вариантам осуществления стадию тиолирования проводят в следующих условиях: 1,4 эквивалента 2,2'-дипиридилсульфида, 1,2 эквивалента Ph3P в DCM при комнатной температуре (например, в течение 10-20 часов). Например, согласно определенным вариантам осуществления стадию тиолирования проводят в следующих условиях: 1,2 эквивалента 2,2'-дипиридилсульфида, 2,3 эквивалента Ph3P в MeCN при температуре от 0°С до комнатной температуры (например, в течение 10-20 часов).
[00446] Согласно определенным вариантам осуществления два RP6 объединены с лежащими между ними атомами с образованием кольца формулы:  и RP4 представляет собой силильную защитную группу. Согласно определенным вариантам осуществления два RP6 объединены с лежащими между ними атомами с образованием кольца формулы:
и RP4 представляет собой силильную защитную группу. Согласно определенным вариантам осуществления два RP6 объединены с лежащими между ними атомами с образованием кольца формулы:  и RP4 представляет собой TES.
и RP4 представляет собой TES.
[00447] Согласно определенным вариантам осуществления способ тиолирования соединения формулы (L-5-7B) или его соли включает в себя:
(а) стадию снятия защитных групп с соединения формулы (L-5-7B) или его соли в условиях, необходимых для снятия групп RP4 и R8, с получением соединения формулы (L-5-7С):
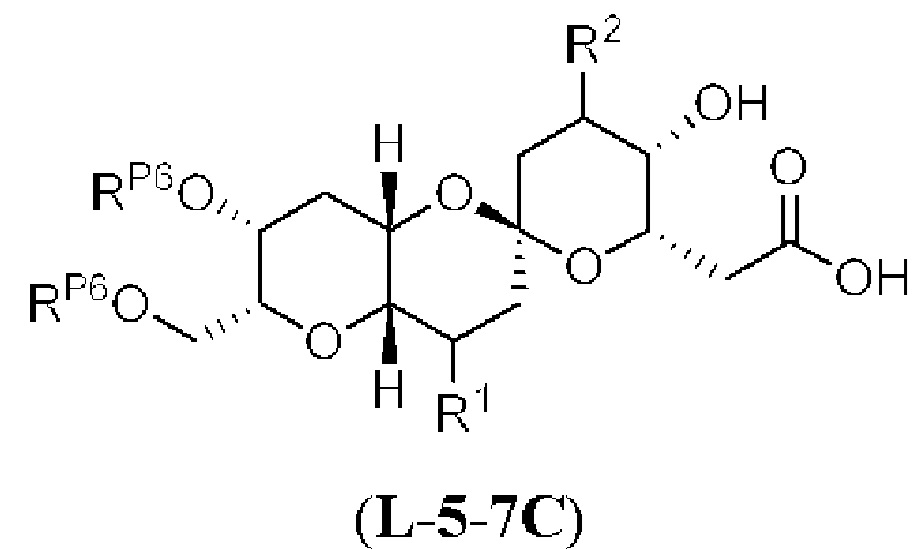
или его соли; и
(b) стадию введения защитной группы в соединение формулы (L-5-7C) или его соль с получением соединения формулы (L-5-7D):
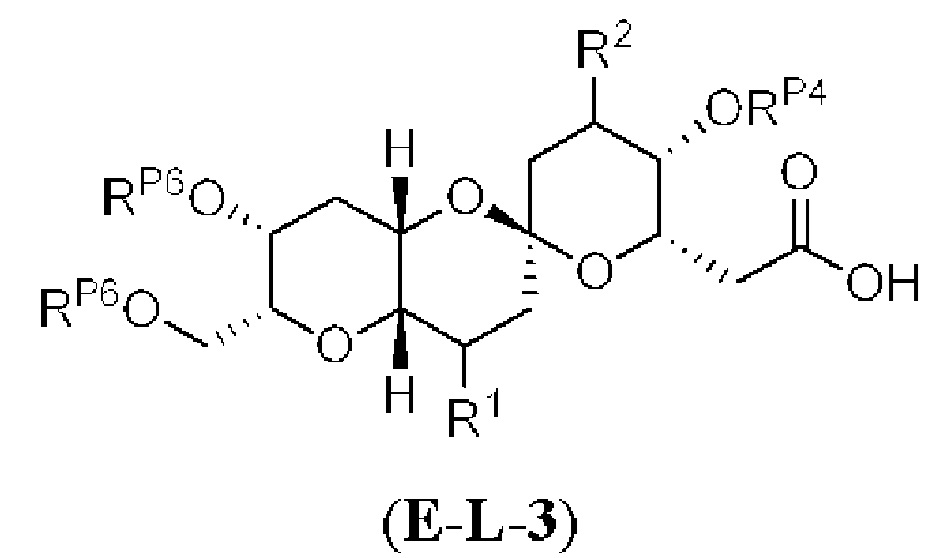
или его соли.
[00448] Согласно определенным вариантам осуществления указанный способ включает в себя:
(а) стадию снятия защитных групп с соединения формулы (Е-L-1) или его соли в условиях, необходимых для снятия групп RP4 и R8, с получением соединения формулы (Е-L-3):
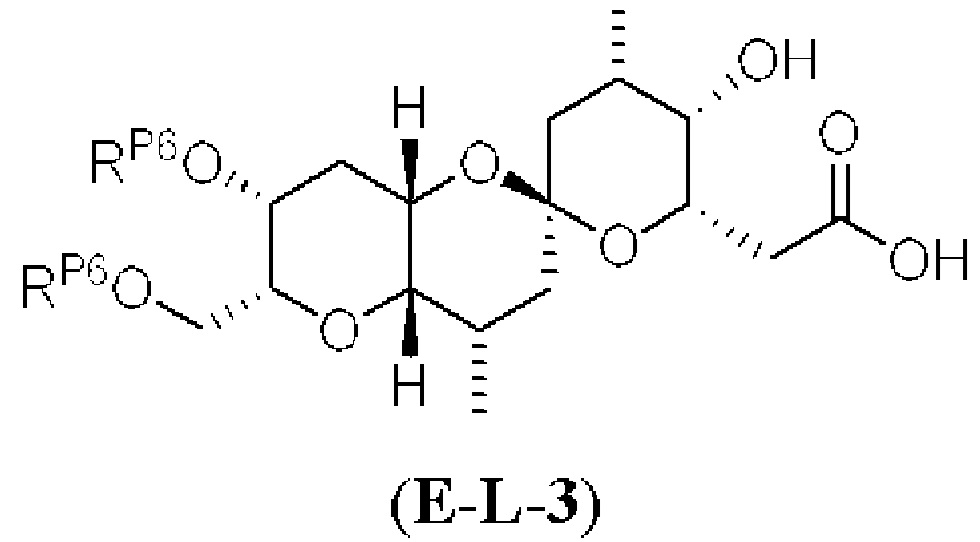
или его соли; и
(b) стадию введения защитной группы в соединение формулы (E-L-3) или его соль с получением соединения формулы (E-L-4):
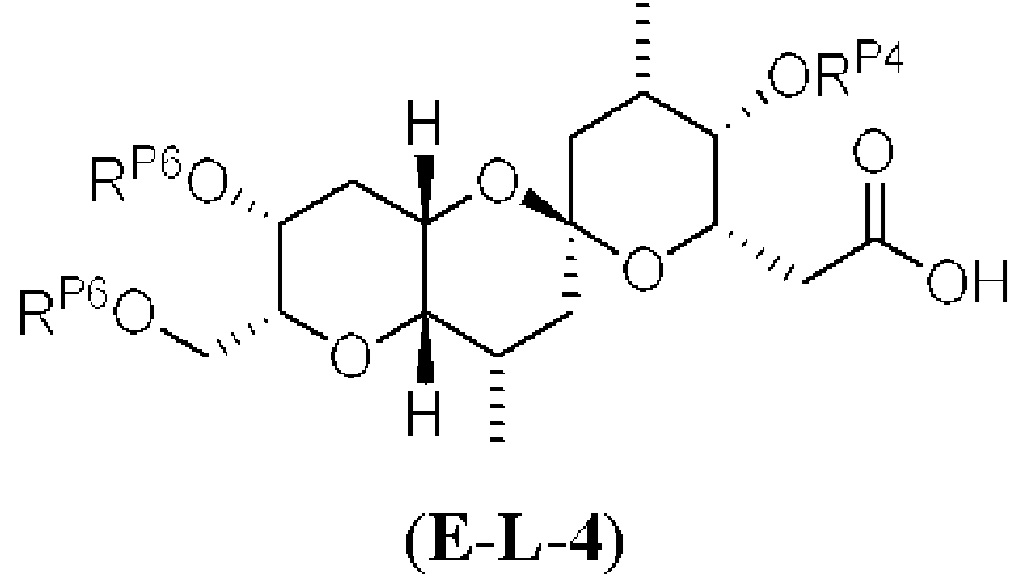
или его соли.
[00449] Согласно определенным вариантам осуществления применительно к соединению формулы (L-5-7B), (Е-L-1) или его соли, RP4 и R8 представляют собой необязательно замещенные бензильные защитные группы; и стадию снятия защитных групп (т.е., стадию (а)) проводят в присутствии Н2 и Pd/C. Согласно определенным вариантам осуществления RP4 представляет собой МРМ, и R8 представляет собой бензил (Bn); и стадию снятия защитных групп проводят в присутствии H2 и Pd/C. Согласно определенным вариантам осуществления стадию снятия защитных групп проводят в присутствии Н2 и Pd/C в i-PrOAc.
[00450] Согласно определенным вариантам осуществления применительно к соединению формулы (E-L-4), (L-5-7D) или его соли RP4 представляет собой силильную защитную группу; и стадию введения защитной группы (т.е., стадию (b)) проводят в присутствии силилирующего агента и основания. Согласно определенным вариантам осуществления RP4 представляет собой TES; и силилирующий реагент представляет собой TESCl. Согласно определенным вариантам осуществления основание представляет собой имидазол. Согласно определенным вариантам осуществления стадию введения защитных групп проводят в присутствии TESCl и имидазола. Согласно определенным вариантам осуществления стадию введения защитных групп проводят в присутствии TESCl и имидазола в DMF.
[00451] Согласно определенным вариантам осуществления соединения формул (Е-L-4), (L-5-7D) или их соли очищают методом хроматографии на силикагеле и/или другими способами очистки.
[00452] Как также представлено на Схеме 4D, в настоящем документе раскрыт способ получения соединения формулы (L-5-7B):
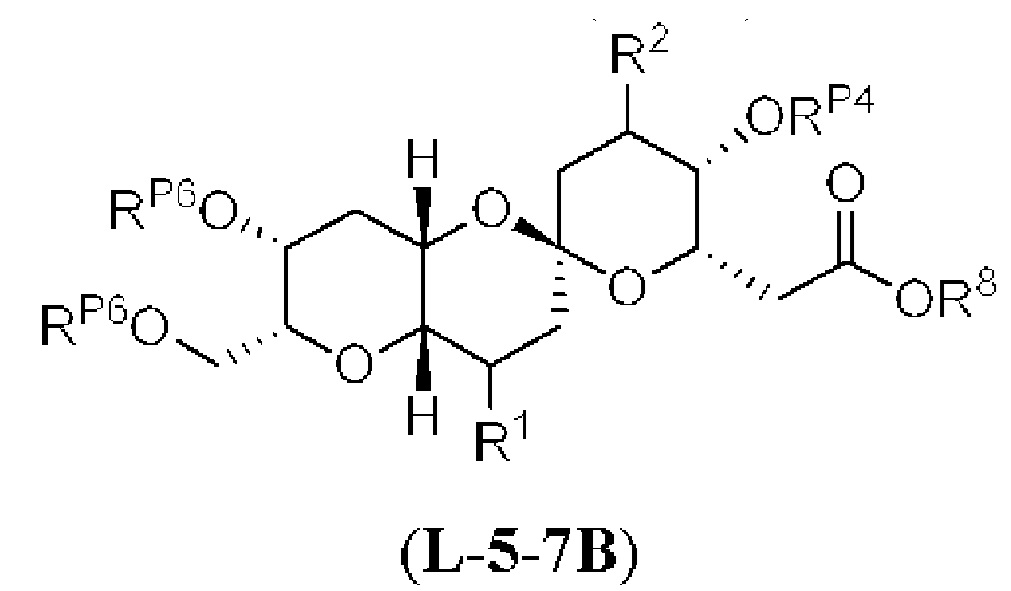
или его соли, причем способ включает в себя циклизацию соединения формулы (L-5-7А):
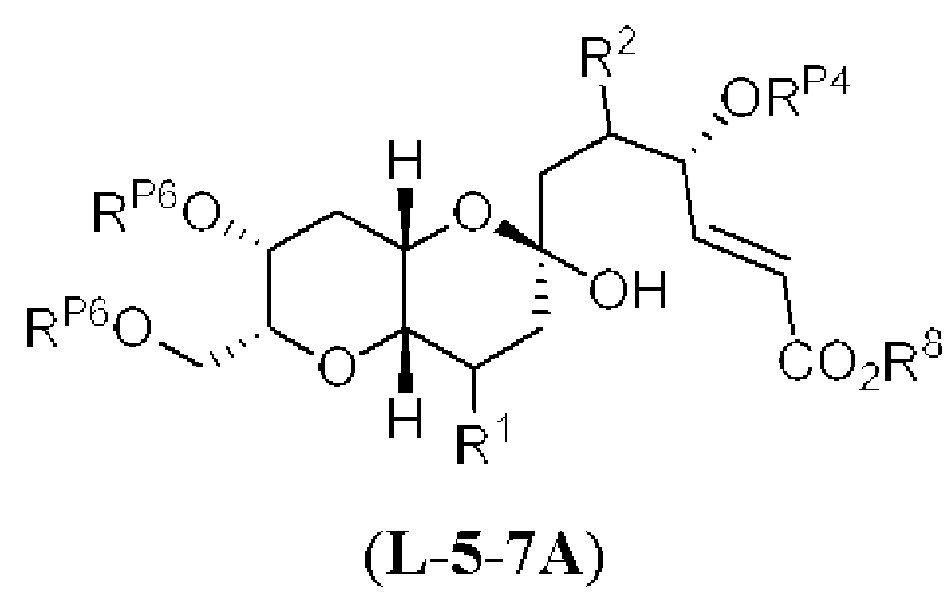
или его соли; где:
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил;
в каждом случае RP4 и RP6 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00453] Согласно определенным вариантам осуществления указанный способ включает в себя циклизацию соединения формулы (E-L-2):
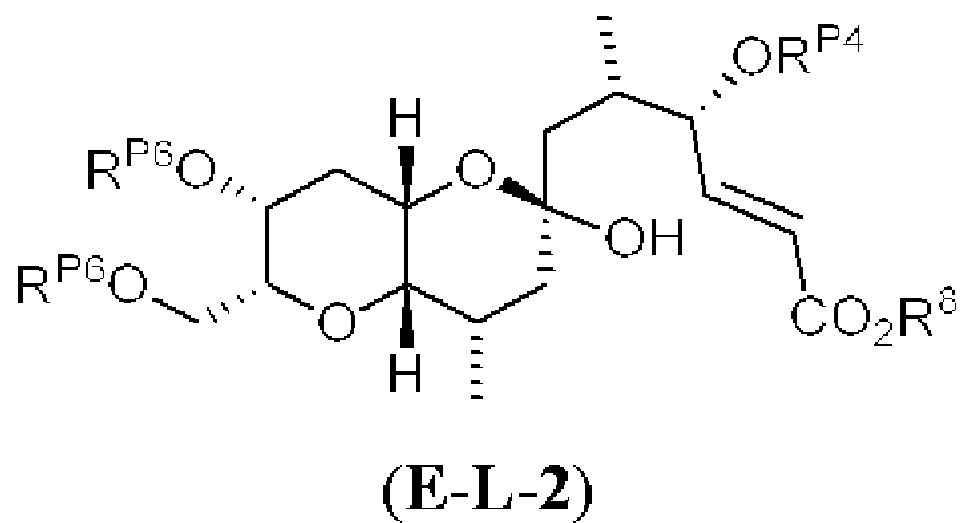
или его соли с получением соединения формулы (E-L-1):
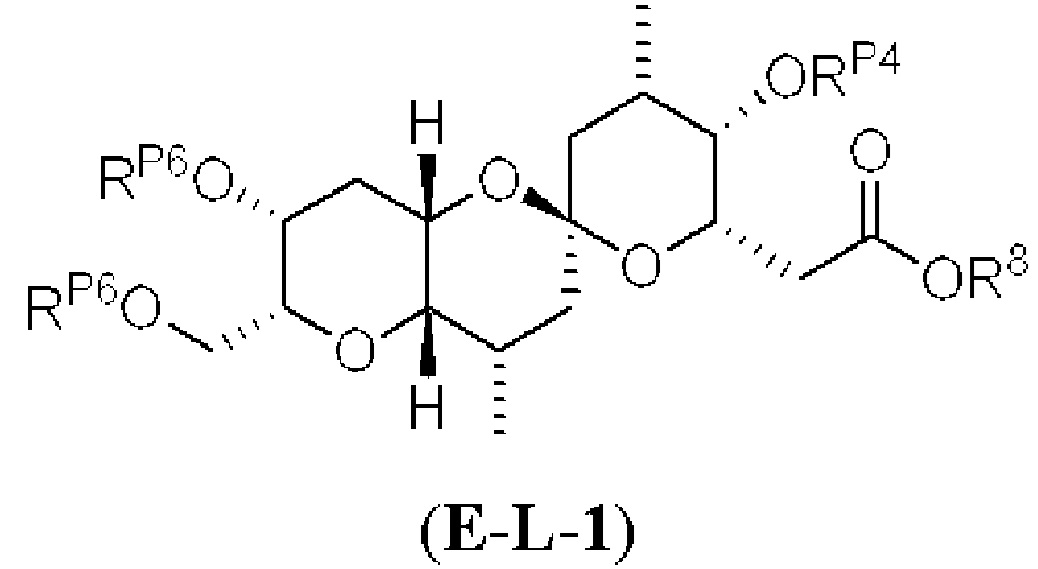
или его соли, где:
в каждом случае RP4 и RP6 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00454] Согласно определенным вариантам осуществления стадию циклизации соединения формулы (7-5-7A), (E-L-2) или его соли проводят в присутствии основания. Согласно определенным вариантам осуществления основание представляет собой азотное основание. Согласно определенным вариантам осуществления основание представляет собой амидиновое, гуанидиновое основание. Согласно определенным вариантам осуществления основание представляет собой аминовое или амидное основание. Согласно определенным вариантам осуществления основание представляет собой амидиновое основание (например, 1,8-диазабицикло(5.4.0)ундец-7-ен (DBU)). Согласно определенным вариантам осуществления основание представляет собой DBU. Согласно определенным вариантам осуществления основание используют в избыточном количестве.
[00455] Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии кислоты. Согласно определенным вариантам осуществления кислота представляет собой кислоту Льюиса.
[00456] Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии соли лития (например, LiBr, LiCl). Согласно определенным вариантам осуществления реакцию проводят в присутствии LiBr. Согласно определенным вариантам осуществления основание используют в избыточном количестве.
[00457] Стадия циклизации может проводиться в присутствии одного или нескольких дополнительных реагентов. Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии реагента формулы: R8OAc. Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии BnOAc. Согласно определенным вариантам осуществления реагент содержится в избыточном количестве.
[00458] Согласно определенным вариантам осуществления реакцию проводят в растворителе. Согласно определенным вариантам осуществления растворитель представляет собой MeCN. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при комнатной температуре. Согласно определенным вариантам осуществления реакцию проводят приблизительно при 30°С.
[00459] Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии соли лития и основания. Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии LiBr и DBU. Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии LiBr, DBU и R8OAc. Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии LiBr, DBU и BnOAc. Согласно определенным вариантам осуществления стадию циклизации проводят в присутствии LiBr, DBU и BnOAc в MeCN при температуре от комнатной температуры до температуры около 30°С.
[00460] Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 10 эквивалентов LiBr, 5 эквивалентов DBU и 10 эквивалентов BnOAc в MeCN при комнатной температуре (например, в течение 10-20 часов). Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 10 эквивалентов LiBr, 5 эквивалентов DBU и 5 эквивалентов BnOAc в MeCN при температуре от комнатной температуре до температуры около 30°С (например, приблизительно в течение 24 часов).
[00461] Согласно определенным вариантам осуществления два RP6 объединены с лежащими между ними атомами с образованием кольца формулы:  и RP4 и RP8 представляют собой необязательно замещенные бензильные группы. Согласно определенным вариантам осуществления два RP6 объединены с лежащими между ними атомами с образованием кольца формулы:
и RP4 и RP8 представляют собой необязательно замещенные бензильные группы. Согласно определенным вариантам осуществления два RP6 объединены с лежащими между ними атомами с образованием кольца формулы:  RP4 представляет собой МРМ; и RP8 представляет собой бензил.
RP4 представляет собой МРМ; и RP8 представляет собой бензил.
[00462] Согласно определенным вариантам осуществления с соединения формулы (L-5-7B) или его соли снимают защитную группу для удаления группы RP4 с получением соединения формулы (L-5-7D):
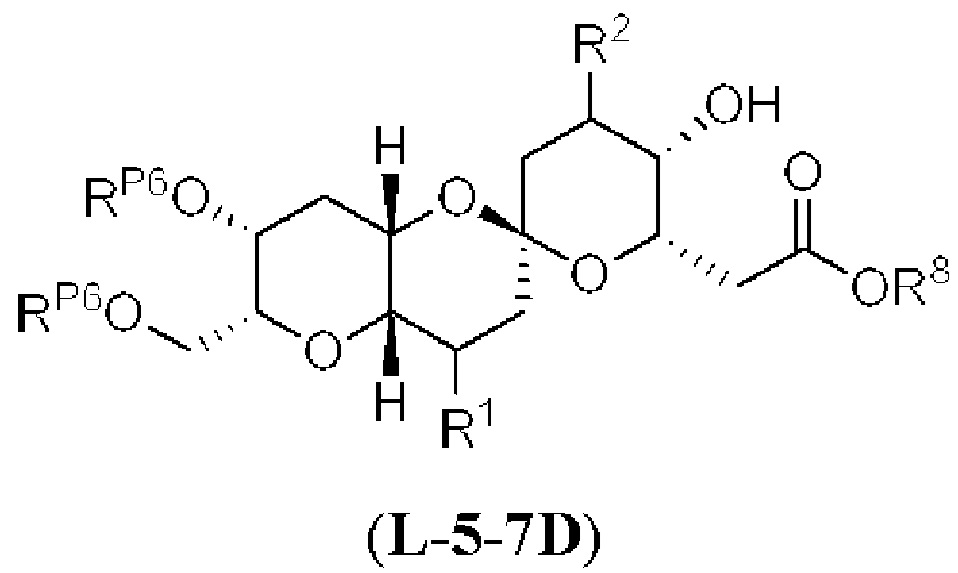
или его соли; и необязательно повторно вводят защитную группу (т.е., замены группы RP4, например, с бензильной защитной группы (например, МРМ) на силильную защитную группу (например, триалкилсилил, такой как триэтилсилил).
[00463] В настоящем документе также раскрыт способ получения соединения формулы (L-5-7A):
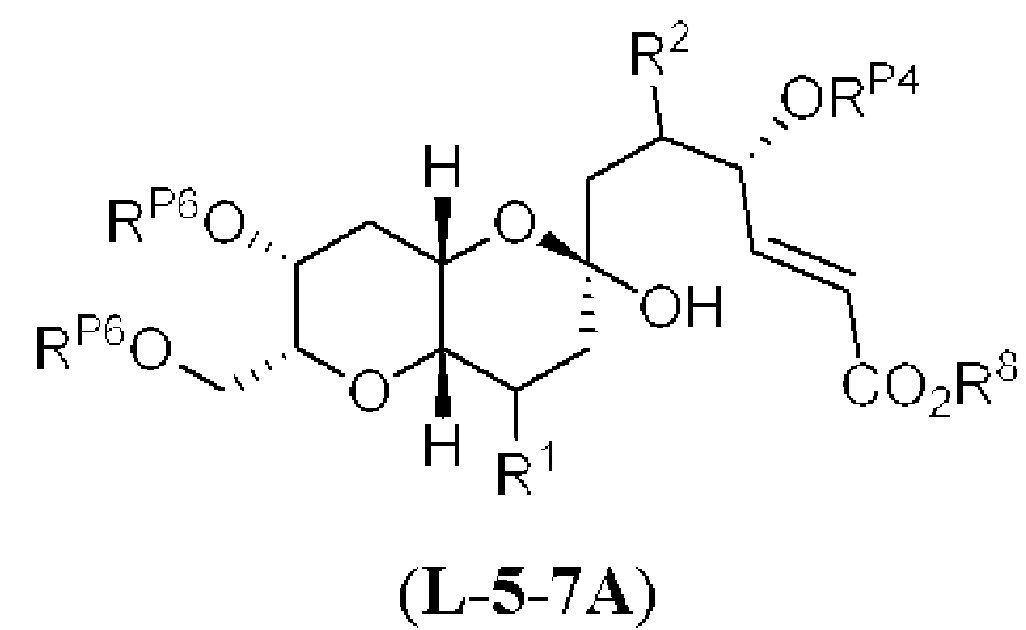
или его соли, причем способ включает в себя стадию осуществления взаимодействия соединения формулы (L-5-6A):
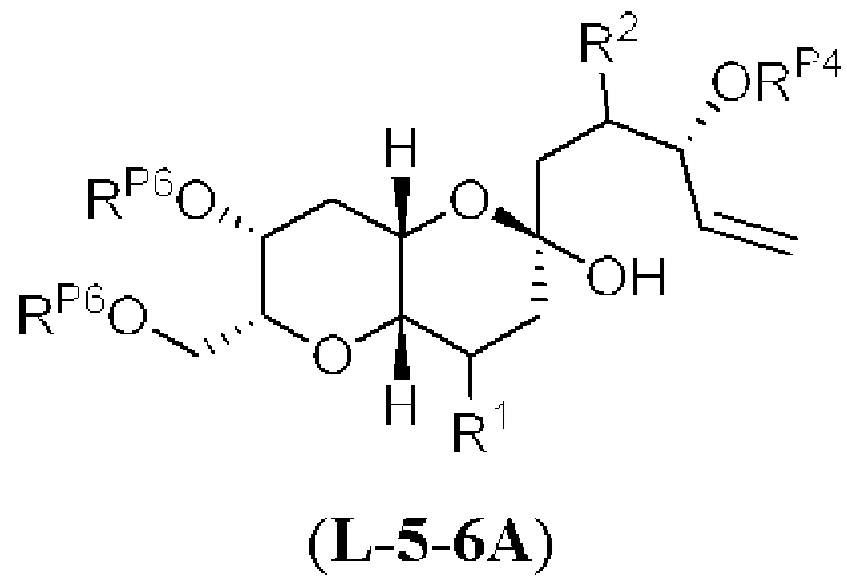
или его соли в присутствии олефина и катализатора метатезиса олефинов; где:
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил;
в каждом случае RP4 и RP6 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00464] Согласно определенным вариантам осуществления олефин характеризуется формулой:  Затем, любой катализатор метатезиса олефинов, известный из уровня техники, может быть использован в реакции метатезиса с получением соединения формулы (L-5-7A).
Затем, любой катализатор метатезиса олефинов, известный из уровня техники, может быть использован в реакции метатезиса с получением соединения формулы (L-5-7A).
[00465] В настоящем документе также раскрыт альтернативный способ получения соединения формулы (L-5-7A):
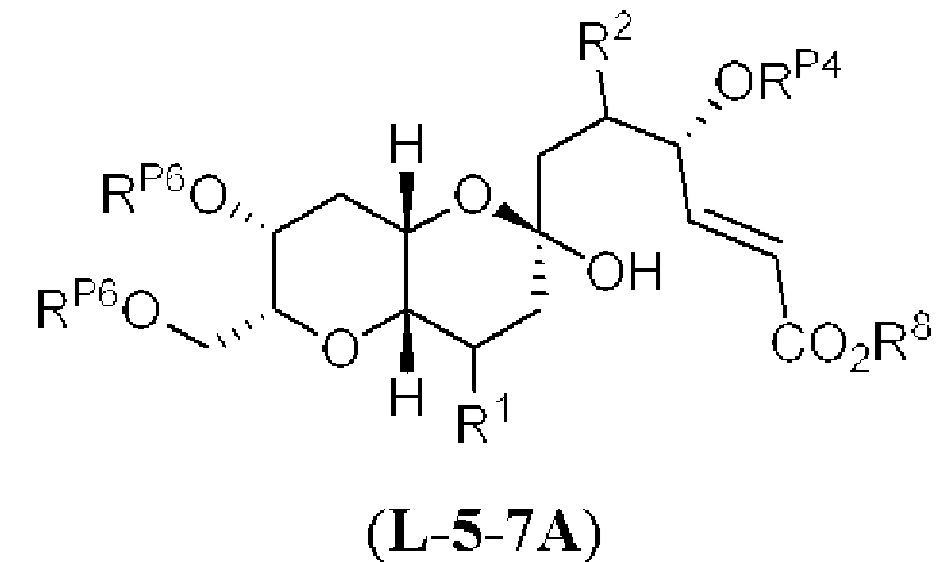
или его соли, причем способ включает в себя стадии:
(а) окисления соединения формулы (L-5-6A):
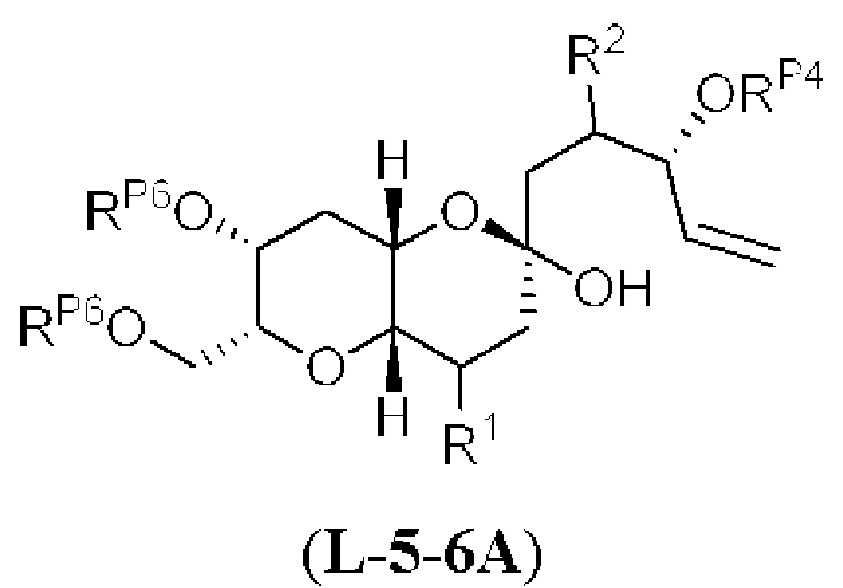
или его соли с получением соединения формулы (L-5-6B) и/или (L-5-6BB):
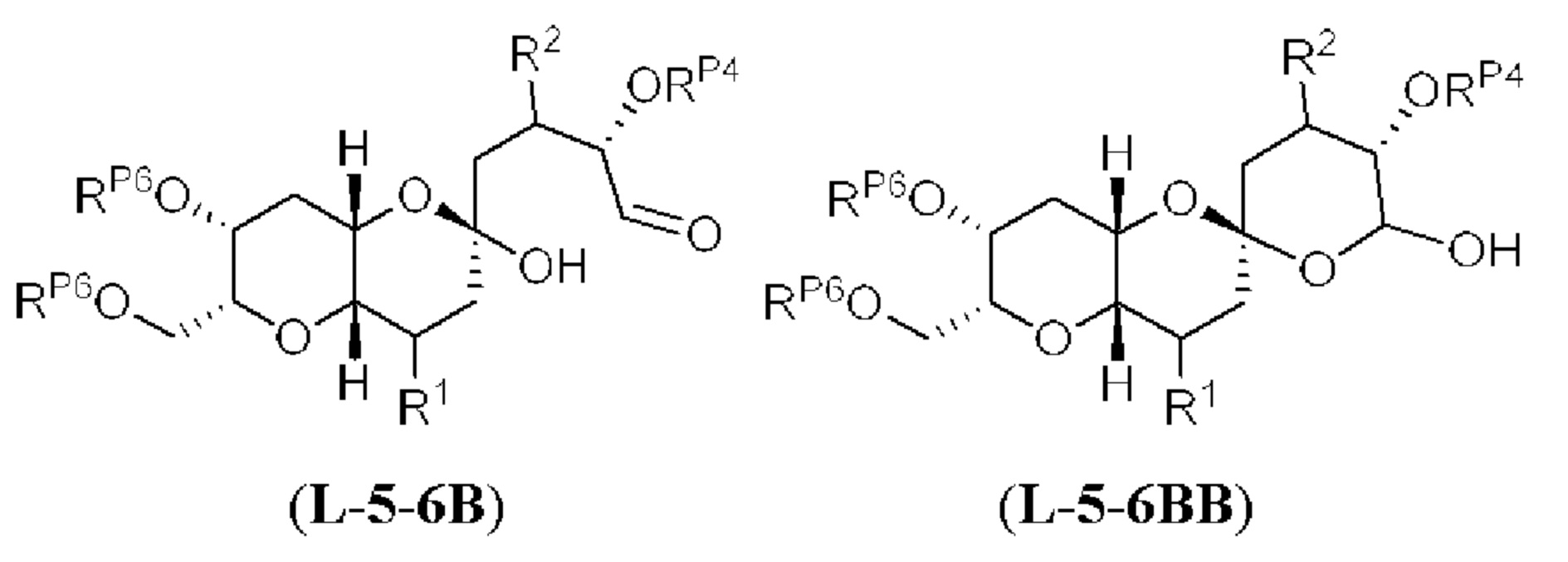
или его соли; и
(b) осуществления взаимодействия соединения формулы (L-5-6B) и/или (L-5-6BB) или его соли в присутствии олефинирующего реагента с получением соединения формулы (L-5-7A) или его соли.
[00466] Согласно определенным вариантам осуществления указанный способ включает в себя стадии:
(а) окисления соединения формулы (E-L-5):
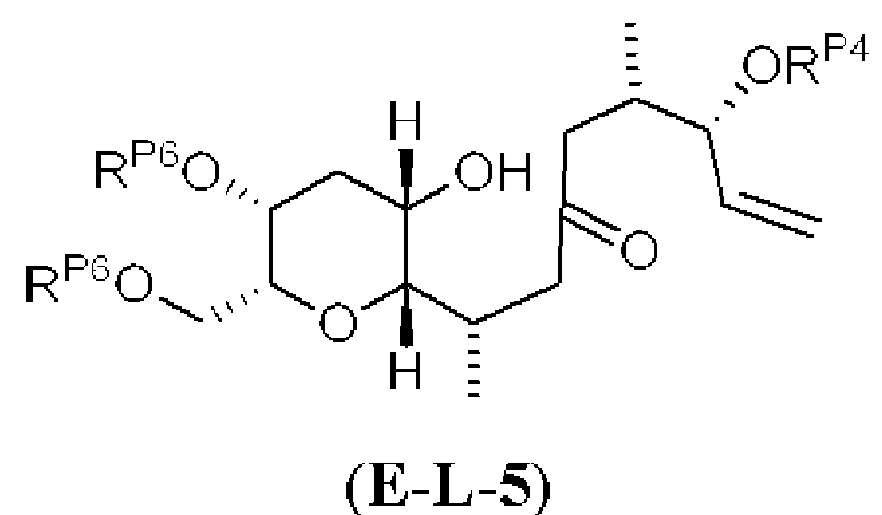
или его соли с получением соединения формулы (E-L-6):
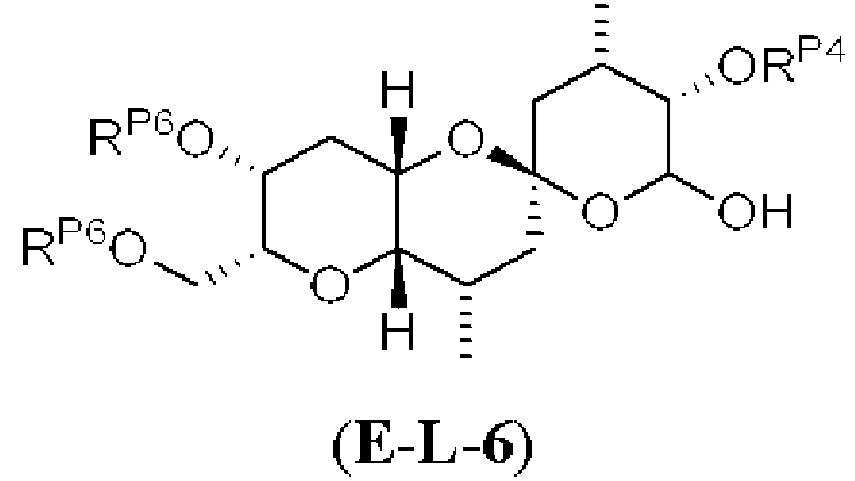
или его соли; и
(b) осуществления взаимодействия соединения формулы (E-L-6) или его соли в присутствии олефинирующего реагента с получением соединения формулы (E-L-2):
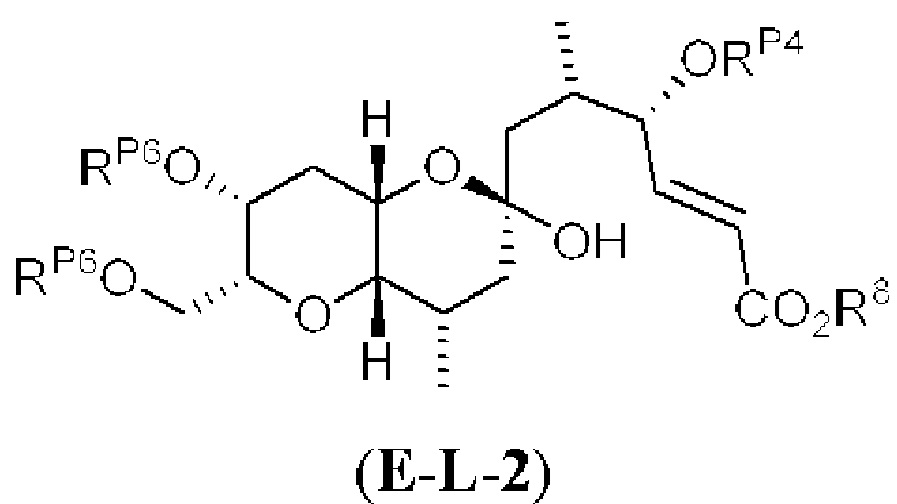
или его соли, где:
в каждом случае RP4 и RP6 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00467] Представленное выше окисление соединения формулы (L-5-6A), (E-L-5) или его соли (т.е., стадия (а)) представляет собой окислительное расщепление. Согласно определенным вариантам осуществления окислительное расщепление проводят посредством озонолиза (например, в присутствии О3). Согласно определенным вариантам осуществления окислительное расщепление представляет собой окислительное расщепление по Джонсону-Лемье. Например, согласно определенным вариантам осуществления расщепление проводят в присутствии реагентов, способных дигидроксилировать двойную связь (например, тетраоксида осмия (OSO4) и N-оксида N-метилморфолина (NMO); или дегидрата осмата калия (VI) (K2OsO4) и NMO), а затем металла переменной валентности (например, комплекса свинца, такого как Pb(ОАс)4). Согласно определенным вариантам осуществления расщепление проводят в присутствии реагентов, способных дигидроксилировать двойную связь (например, тетраоксида осмия (OsO4) и N-оксида N-метилморфолина (NMO); или дегидрата осмата калия (K2OsO4) и NMO), а затем перйодата натрия (NaIO4).
[00468] Согласно определенным вариантам осуществления двойную связь дигидроксилируют путем обработки OsO4, NMO и водой. Согласно определенным вариантам осуществления реакцию проводят в присутствии растворителя, такого как ацетон. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при комнатной температуре. Например, согласно определенным вариантам осуществления двойную связь дигидроксилируют в следующих условиях: 10 мол. % OsO4, 2 эквивалента NMO и вода в ацетоне при комнатной температуре (например, в течение 20-25 часов). Затем, согласно определенным вариантам осуществления полученное соединение обрабатывают Pb(ОАс)4 и K2CO3 с получением альдегида и/или гемиацеталя. Например, согласно определенным вариантам осуществления указанную стадию проводят в следующих условиях: 1,2 эквивалента Pb(ОАс)4, 3 эквивалента K2CO3 в CH2Cl2 при комнатной температуре (например, приблизительно в течение 1 часа).
[00469] Согласно определенным вариантам осуществления стадию окисления проводят в присутствии тетраоксида осмия (OsO4) или дегидрата осмата калия (VI) (K2OsO4) и NMO, а затем NaIO4. Согласно определенным вариантам осуществления стадию окисления проводят в присутствии дегидрата осмата калия (VI) (K2OsO4) и NMO, а затем NaIO4. Согласно определенным вариантам осуществления реакцию проводят в растворителе. Согласно определенным вариантам осуществления реакцию проводят в ацетоне и воде. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при температуре около комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят в присутствии K2OsO4 и NMO, а затем NaIO4, в ацетоне и воде при температуре около комнатной температуры. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: K2OsO4⋅2H2O и NMO, а затем NaIO4, в ацетоне и воде при температуре около комнатной температуры.
[00470] Согласно определенным вариантам осуществления олефинирование на стадии (b) проводят в присутствии реагента Виттига или Хорнера-Уотсворта-Эммонса. Согласно определенным вариантам осуществления олефинирование проводят в присутствии реагента формулы: (RO)2P(O)CH2CO2R8. Согласно определенным вариантам осуществления реагент характеризуется формулой: (МеО)2Р(O)CH2CO2R8 (например, (МеО)2Р(O)CH2CO2Bn). Согласно определенным вариантам осуществления олефинирование проводят в присутствии основания (например, фосфата, такого как K3PO4).
[00471] Согласно определенным вариантам осуществления олефинирование проводят в присутствии олефинирующего реагента формулы: (RO)2P(O)CH2CO2R8 и основания. Согласно определенным вариантам осуществления олефинирование проводят в присутствии (МеО)2Р(O)CH2CO2Bn и K3PO4. Согласно определенным вариантам осуществления реакцию проводят в растворителе, таком как толуол. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от 0°С приблизительно до 50°С. Согласно определенным вариантам осуществления реакцию проводят при комнатной температуре. Согласно определенным вариантам осуществления реакцию проводят приблизительно при 30°С. Согласно определенным вариантам осуществления олефинирование проводят в присутствии (МеО)2Р(O)CH2CO2Bn и K3PO4 в толуоле приблизительно при 30°С. Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 4 эквивалента (МеО)2Р(O)CH2CO2Bn, 3 эквивалента K3PO4 при комнатной температуре (например, приблизительно в течение 20-25 часов). Например, согласно определенным вариантам осуществления реакцию проводят в следующих условиях: 5 эквивалентов (МеО)2Р(O)CH2CO2Bn, 4 эквивалента K3PO4 приблизительно при 30°С (например, приблизительно в течение 1-3 суток).
[00472] Согласно определенным вариантам осуществления два RP6 объединены с лежащими между ними атомами с образованием кольца формулы:  и RP4 и RP8 представляют собой необязательно замещенные бензильные группы. Согласно определенным вариантам осуществления два RP6 объединены с лежащими между ними атомами с образованием кольца формулы:
и RP4 и RP8 представляют собой необязательно замещенные бензильные группы. Согласно определенным вариантам осуществления два RP6 объединены с лежащими между ними атомами с образованием кольца формулы:  RP4 представляет собой МРМ; и RP8 представляет собой бензил.
RP4 представляет собой МРМ; и RP8 представляет собой бензил.
[00473] В настоящем документе также раскрыт способ получения соединения формулы (L-5-6A):
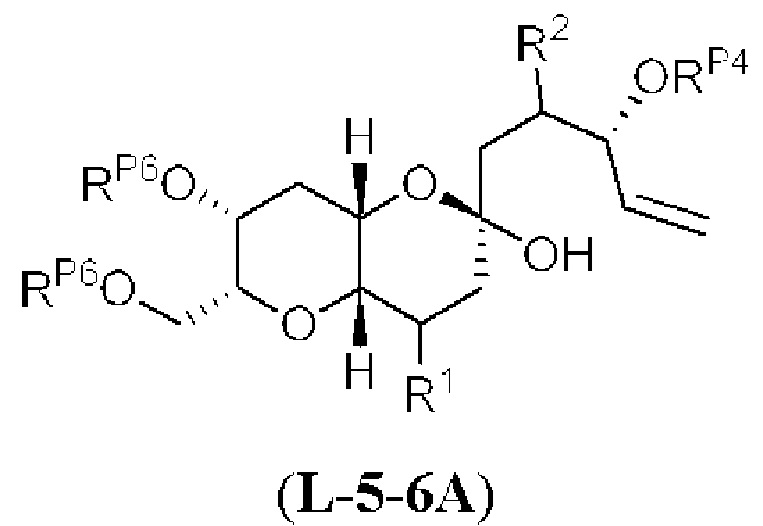
или его соли, причем способ включает в себя стадию сочетания соединения формулы (L-5-4):
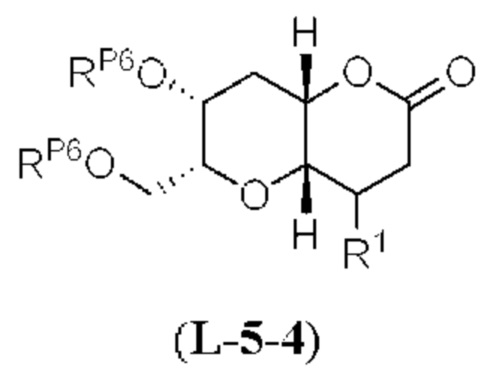
или его соли с соединением формулы (L-5-5):
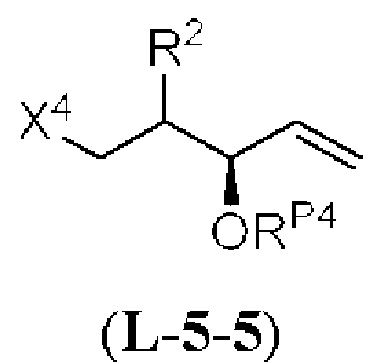
или его солью, где:
X4 представляет собой галоген или уходящую группу;
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил; и
в каждом случае RP4 и RP6 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00474] Согласно определенным вариантам осуществления указанный способ включает в себя стадию сочетания соединения формулы (E-L-7):
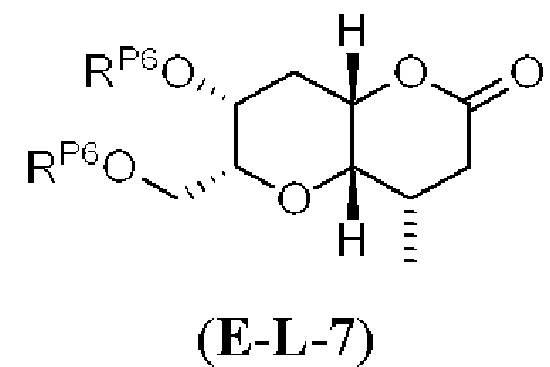
или его соли с соединением формулы (E-L-8):
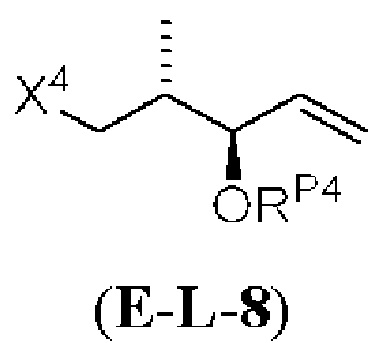
или его солью с получением соединения формулы (E-L-5):
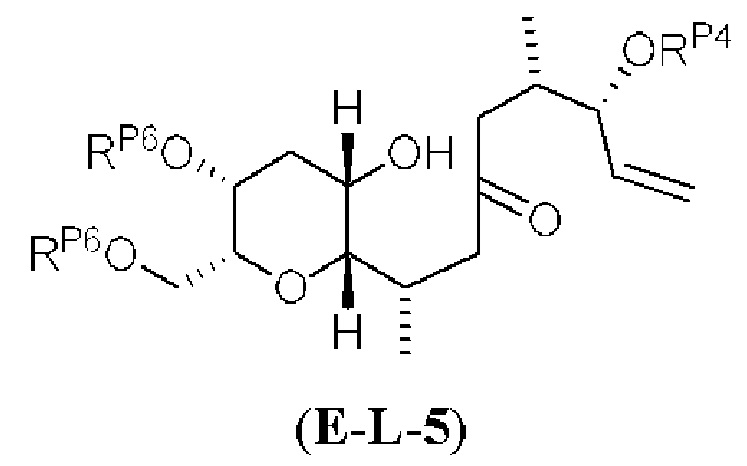
или его соли; где:
X4 представляет собой галоген или уходящую группу; и
в каждом случае RP4 и RP6 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00475] Согласно определенным вариантам осуществления сочетание соединения формулы (L-5-4) с соединением формулы (L-5-5) (или соединения формулы (E-L-7) и (Е-L-8)) проводят в присутствии металлорганического реагента (например, для преобразования X4 до металла для добавления к соединению формулы (L-5-4) или (E-L-7)). Согласно определенным вариантам осуществления металлорганический реагент представляет собой реагент лития (например, для преобразования соединения формулы (L-5-5) до соединения формулы: 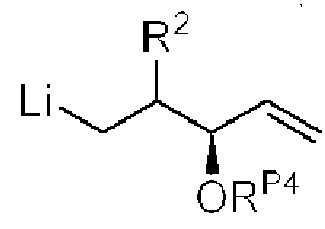 для добавления к соединению формулы (L-5-4); например, для преобразования соединения формулы (E-L-8) до соединения формулы:
для добавления к соединению формулы (L-5-4); например, для преобразования соединения формулы (E-L-8) до соединения формулы: 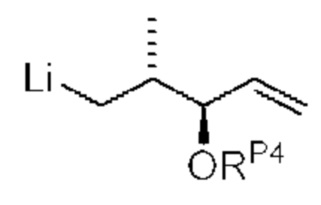 для добавления к соединению формулы (E-L-7)). Согласно определенным вариантам осуществления реагент лития представляет собой литийорганическое соединение (например, н-бутиллитий, трет-бутиллитий, втор-бутиллитий). Согласно определенным вариантам осуществления реагент лития представляет собой LiHMDS или LDA. Согласно определенным вариантам осуществления реагент лития представляет собой в втор-бутиллитий.
для добавления к соединению формулы (E-L-7)). Согласно определенным вариантам осуществления реагент лития представляет собой литийорганическое соединение (например, н-бутиллитий, трет-бутиллитий, втор-бутиллитий). Согласно определенным вариантам осуществления реагент лития представляет собой LiHMDS или LDA. Согласно определенным вариантам осуществления реагент лития представляет собой в втор-бутиллитий.
[00476] Согласно определенным вариантам осуществления реакцию проводят в присутствии трет-бутиллития. Согласно определенным вариантам осуществления реакцию проводят в растворителе, таком как THF. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от -78°С приблизительно до комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от -78°С приблизительно до 0°С. Например, согласно определенным вариантам осуществления реакцию проводят с 2,6 эквивалента трет-бутиллития в THF при температуре от -78°С до комнатной температуры (например, в течение менее 1 часа).
[00477] Согласно определенным вариантам осуществления реакцию проводят в присутствии втор-бутиллития. Согласно определенным вариантам осуществления реакцию проводят в THF. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от -78°С приблизительно до комнатной температуры. Согласно определенным вариантам осуществления реакцию проводят при температуре в диапазоне приблизительно от -78°С приблизительно до 0°С. Согласно определенным вариантам осуществления реакцию проводят с втор-бутиллитием в THF приблизительно при температуре от -78°С до комнатной температуры. Например, согласно определенным вариантам осуществления реакцию проводят приблизительно с 2 эквивалентами втор-бутиллития в THF при температуре от -78°С до комнатной температуры (например, в течение менее 1 часа).
[00478] Согласно определенным вариантам осуществления два RP6 объединены с лежащими между ними атомами с образованием кольца формулы: 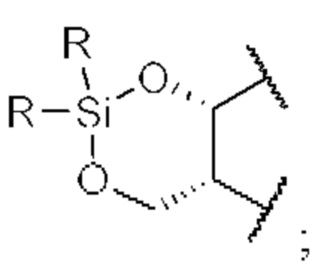 и RP4 представляет собой необязательно замещенный бензил. Согласно определенным вариантам осуществления два RP6 объединены с лежащими между ними атомами с образованием кольца формулы:
и RP4 представляет собой необязательно замещенный бензил. Согласно определенным вариантам осуществления два RP6 объединены с лежащими между ними атомами с образованием кольца формулы: 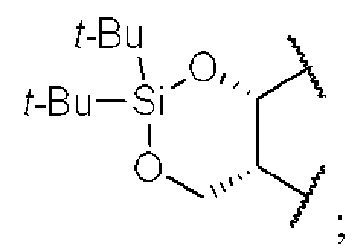 и RP4 представляет собой МРМ.
и RP4 представляет собой МРМ.
[00479] Как представлено на Схеме 4D, в настоящем документе раскрыт способ получения соединения формулы (L-5-4) из соединения формулы (L-5-3). Согласно определенным вариантам осуществления способ включает в себя стадии:
(a) восстановления соединения формулы (L-5-3):
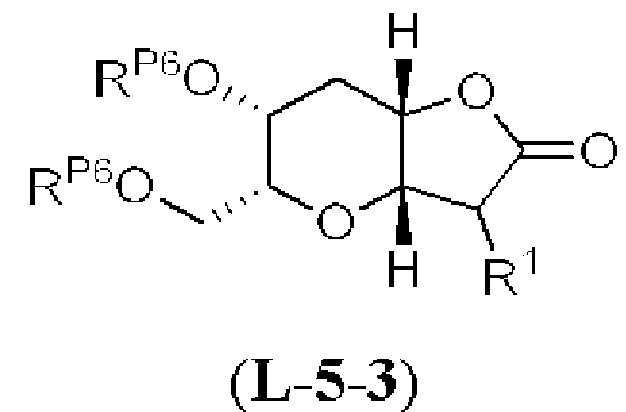
или его соли с получением соединения формулы (L-5-3A):
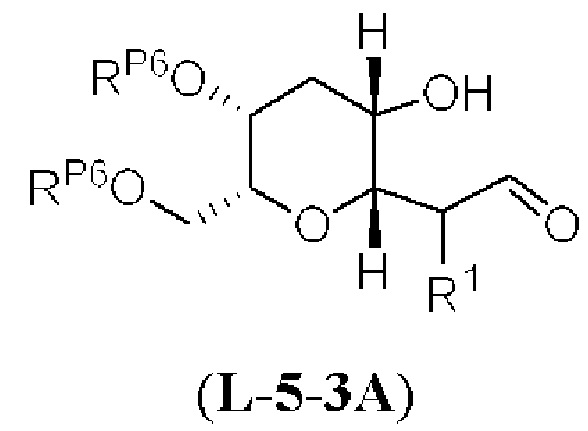
или его соли;
(b) олефинирования формулы (L-5-3A) или его соли с получением соединения формулы (L-5-3B):
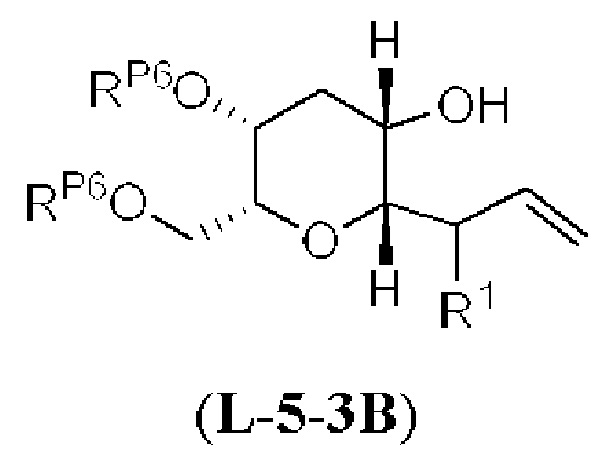
или его соли;
(c) гидратирования соединения формулы (L-5-3B) или его соли с получением соединения формулы (L-5-3C):
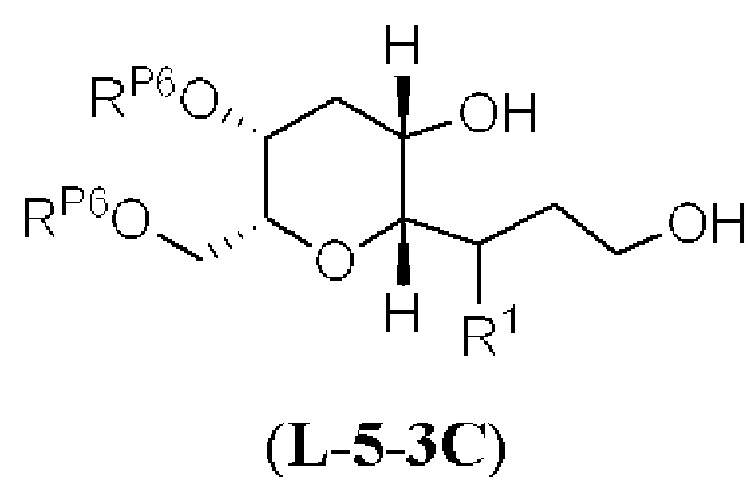
или его соли; и
(d) окисления и циклизации соединения формулы (L-5-3C) или его соли с получением соединения формулы (L-5-4):
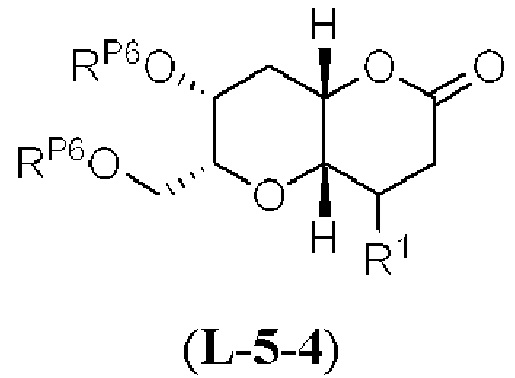
или его соли.
[00480] Стадию восстановления на представленной выше стадии (а) может проводиться в присутствии источника гидрида. Согласно определенным вариантам осуществления источник гидрида представляет собой DIBAL. Согласно определенным вариантам осуществления стадия олефинирования на представленной выше стадии (b) может проводиться в присутствии олефинирующего реагента (например, MePPh3Br). Согласно определенным вариантам осуществления стадию олефинирования проводят в присутствии основания (например, алкоксида, такого как f-BuOK). Согласно определенным вариантам осуществления стадия гидратирования на представленной выше стадии (с) представляет собой реакцию гидроборирования. Согласно определенным вариантам осуществления стадия гидроборирования включает в себя обработку 9-BBN, а затем NaBO3⋅H2O. Стадии окисления и циклизации на представленной выше стадии (d) могут проводиться на одной и той стадии или на последующих стадиях. Стадия окисления может проводиться в присутствии любых окислителей. Согласно определенным вариантам осуществления стадию окисления проводят в присутствии TEMPO и PhI(OAc)2. Согласно определенным вариантам осуществления стадию окисления проводят в присутствии NaHCO3.
[00481] Согласно определенным вариантам осуществления два RP6 объединены с лежащими между ними атомами с образованием кольца формулы: 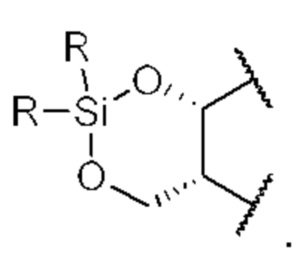 Согласно определенным вариантам осуществления два RP6 объединены с лежащими между ними атомами с образованием кольца формулы:
Согласно определенным вариантам осуществления два RP6 объединены с лежащими между ними атомами с образованием кольца формулы: 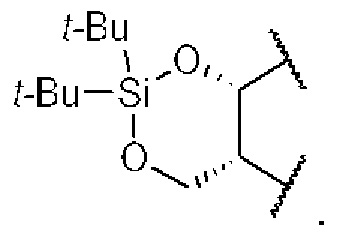
Общие реакционные параметры
[00482] Следующие варианты осуществления применяются в отношении всех способов синтеза, описанных выше и в настоящем документе.
[00483] В реакциях, раскрытых и описанных в настоящем документе, могут участвовать один или несколько реагентов. Согласно определенным вариантам осуществления реагент может присутствовать в каталитическом количестве. Согласно определенным вариантам осуществления каталитическое количество составляет 0-1 мол. %, 0-5 мол. %, 0-10 мол. %, 1-5 мол. %, 1-10 мол. %, 5-10 мол. %, 10-20 мол. %, 20-30 мол. %, 30-40 мол. %, 40-50 мол. %, 50-60 мол. %, 60-70 мол. %, 70-80 мол. %, 80-90 мол. % или 90-99 мол. %. Согласно определенным вариантам осуществления реагент может присутствовать в стехиометрическом количестве (т.е., приблизительно 1 эквивалент). Согласно определенным вариантам осуществления реагент может присутствовать в избыточном количестве (т.е., более чем 1 эквивалент). Согласно определенным вариантам осуществления избыточное количество составляет приблизительно 1,1, 1,2, 1,3, 1,4, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0, 4,5, 5,0, 5,5, 6,0, 6,5, 7,0, 7,5, 8,0, 8,5, 9,0, 9,5, 10, 15 или 20 эквивалентов. Согласно определенным вариантам осуществления избыточное количество составляет приблизительно 1,1-2, 2-3, 3-4, 4-5, 1,1-5, 5-10, 10-15, 15-20 или 10-20 эквивалентов. Согласно определенным вариантам осуществления избыточное количество составляет более чем 20 эквивалентов.
[00484] Реакция, описанная в настоящем документе, может проводиться при любой температуре. Согласно определенным вариантам осуществления реакцию проводят при комнатной температуре или около нее (к.т.) (21°С или 70°F). Согласно определенным вариантам осуществления реакцию проводят при температуре ниже комнатной температуры (например, от -100°С до 21°С). Согласно определенным вариантам осуществления реакцию проводят при температуре, равной -78°С или около нее. Согласно определенным вариантам осуществления реакцию проводят при температуре, равной -10°С или около нее. Согласно определенным вариантам осуществления реакцию проводят при температуре около 0°С. Согласно определенным вариантам осуществления реакцию проводят при температуре выше комнатной температуры. Согласно определенному варианту осуществления реакцию проводят при 30, 40, 50, 60, 70, 80, 110, 120, 130, 140 или 150°С. Согласно определенным вариантам осуществления реакцию проводят при температуре около 150°С.
[00485] Реакция, описанная в настоящем документе, может проводиться в растворителе или в смеси растворителей (т.е., сорастворителей). Растворители могут быть полярными или неполярными, протонными или апротонными. Любой растворитель может быть использован в реакциях, раскрытых в настоящем документе, и реакции не ограничиваются конкретными растворителями или комбинациями растворителей. Общеизвестные органические растворители, применимые в способах, описанных в настоящем документе, включают в себя без ограничения ацетон, ацетонитрил, бензол, бензонитрил, 1-бутанол, 2-бутанон, бутилацетат, трет-бутилметиловый эфир, сероуглерод, тетрахлорид углерода, хлорбензол, 1-хлорбутан, хлороформ, циклогексан, циклопентан, 1,2-дихлорбензол, 1,2-дихлорэтан, дихлорметан (DCM), N,N-диметилацетамид, N,N-диметилформамид (DMF), 1,3-диметил-3,4,5,6-тетрагидро-2-пиримидинон (DMPU), 1,4-диоксан, 1,3-диоксан, диэтиловый эфир, 2-этоксиэтиловый эфир, этилацетат, этиловый спирт, этиленгликоль, диметиловый эфир, гептан, н-гексан, гексаны, гексаметилфосфорамид (НМРА), 2-метоксиэтанол, 2-метоксиэтилацетат, метиловый спирт, 2-метилбутан, 4-метил-2-пентанон, 2-метил-1-пропанол, 2-метил-2-пропанол, 1-метил-2-пирролидинон, диметилсульфоксид (DMSO), нитрометан, 1-октанол, пентан, 3-пентанон, 1-пропанол, 2-пропанол, пиридин, тетрахлорэтилен, тетрагидрофуран (THF), 2-метилтетрагидрофуран, толуол, трихлорбензол, 1,1,2-трихлортрифторэтан, 2,2,4-триметилпентан, триметиламин, триэтиламин, N,N-диизопропилэтиламин, диизопропиламин, воду, орто-ксилол и пара-ксилол.
[00486] Реакция, описанная в настоящем документе, может проводиться в течение любого количества времени. Согласно определенным вариантам осуществления реакцию оставляют протекать в течение секунд, минут, часов или суток.
[00487] Способы, описанные в настоящем документе, могут быть использованы для получения соединений с любым химическим выходом. Согласно определенным вариантам осуществления соединение получают с выходом 1-10%, 10-20% 20-30%, 30-40%, 40-50%, 50-60%, 60-70%, 70-80%, 80-90% или 90-100%. Согласно определенным вариантам осуществления выход представляет собой выраженный в процентах выход после одной стадии синтеза. Согласно определенным вариантам осуществления выход представляет собой выраженный в процентах выход после более чем одной стадии синтеза (например, после 2, 3, 4 или 5 стадий синтеза).
[00488] Способы, описанные в настоящем документе, могут дополнительно содержать одну или несколько стадий очистки. Например, согласно определенным вариантам осуществления соединение, полученное согласно способу, описанному в настоящем документе, может быть очищено методом хроматографии, экстрагирования, фильтрования, осаждения, кристаллизации или любым другим способом, известным из уровня техники. Согласно определенным вариантам осуществления соединение или смесь переносят далее на следующую стадию синтеза без очистки (т.е., неочищенными).
[00489] Способ синтеза, раскрытый в настоящем документе, может проводиться в любом масштабе (т.е., с получением любого количества продукта). Согласно определенным вариантам осуществления способы применимы для мелкомасштабного синтеза или крупномасштабного способы производства. Согласно определенным вариантам осуществления реакцию, раскрытую в настоящем документе, проводят с получением менее 1 г продукта. Согласно определенным вариантам осуществления реакцию, раскрытую в настоящем документе, проводят с получением более 1 г, 2 г, 5 г, 10 г, 15 г, 20 г, 25 г, 30 г, 40 г, 50 г, 100 г, 200 г, 500 г или 1 кг продукта.
Соединения
[00490] Настоящее изобретение также относится к новым соединениям. Указанные соединения применимы для синтеза галихондринов, их аналогов и промежуточных к ним соединений. Согласно определенным вариантам осуществления соединения, раскрытые в настоящем документе, применимы для синтеза соединений формулы (Н3-А), таких как соединение (1), или промежуточных к нему соединений.
[00491] В настоящем документе раскрыты соединения формулы (H3-N3):
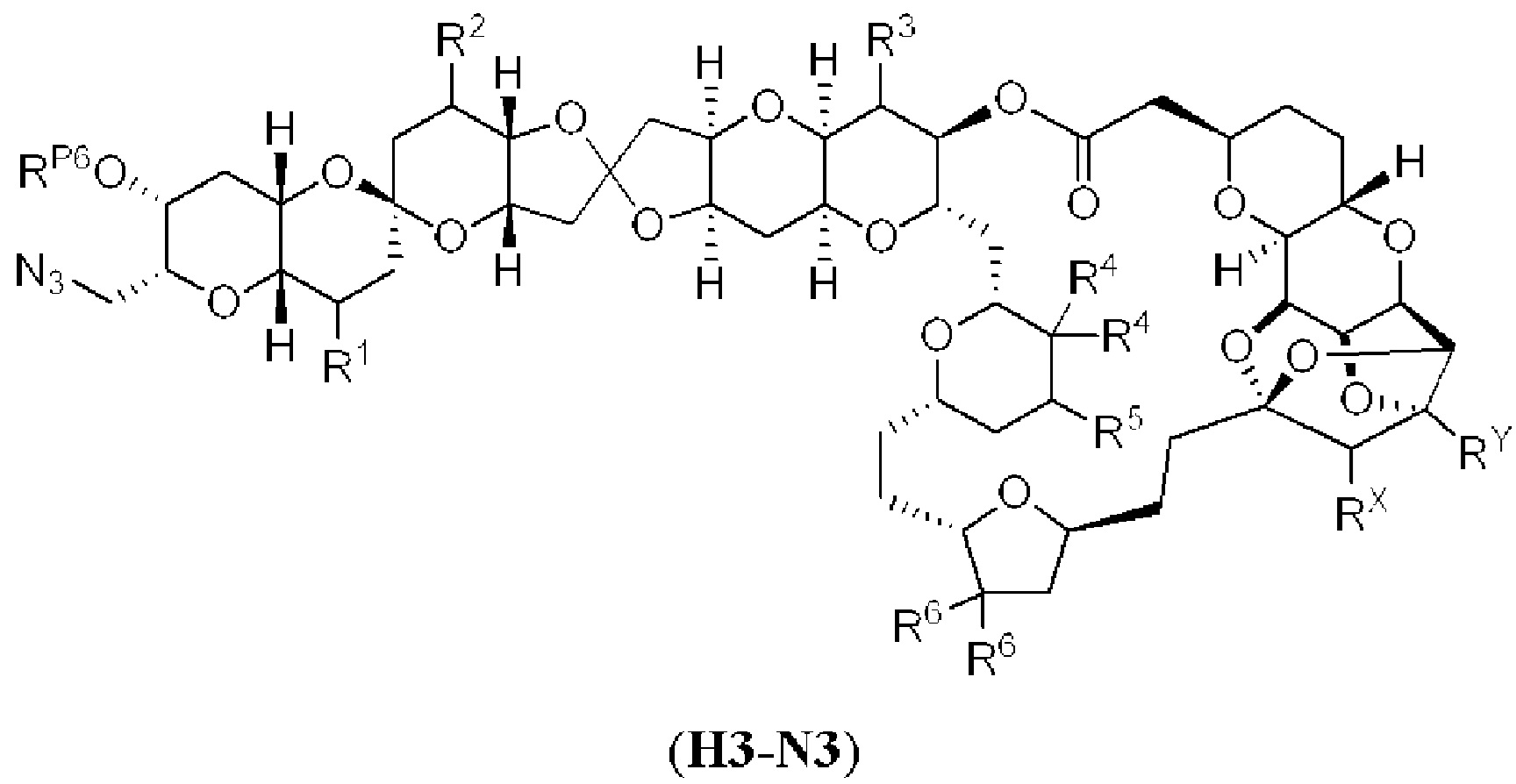
и их соли, где:
каждый из R1, R2, R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R4 образуют вместе: 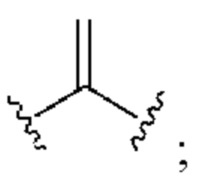
в каждом случае R6 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R6 образуют вместе: 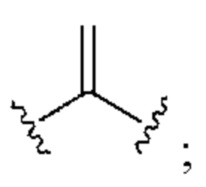
RP6 представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
RX представляет собой водород или -ORXa, где RXa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RY представляет собой водород или -ORYa, где RYa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
где RXa и RYa необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00492] Согласно определенным вариантам осуществления соединение представляет собой соединение следующей формулы:
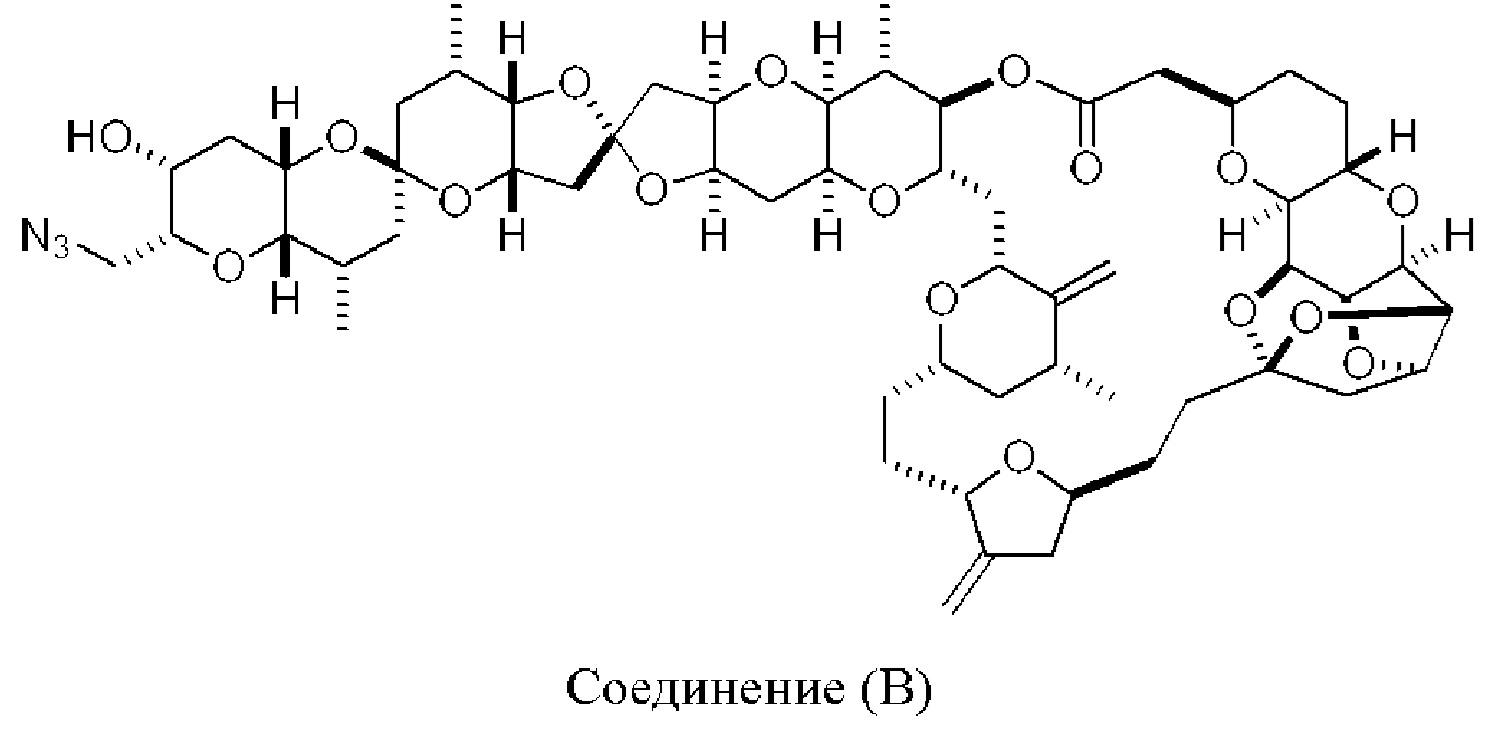
или его соль.
[00493] В настоящем документе раскрыты соединения формулы (H3-L):
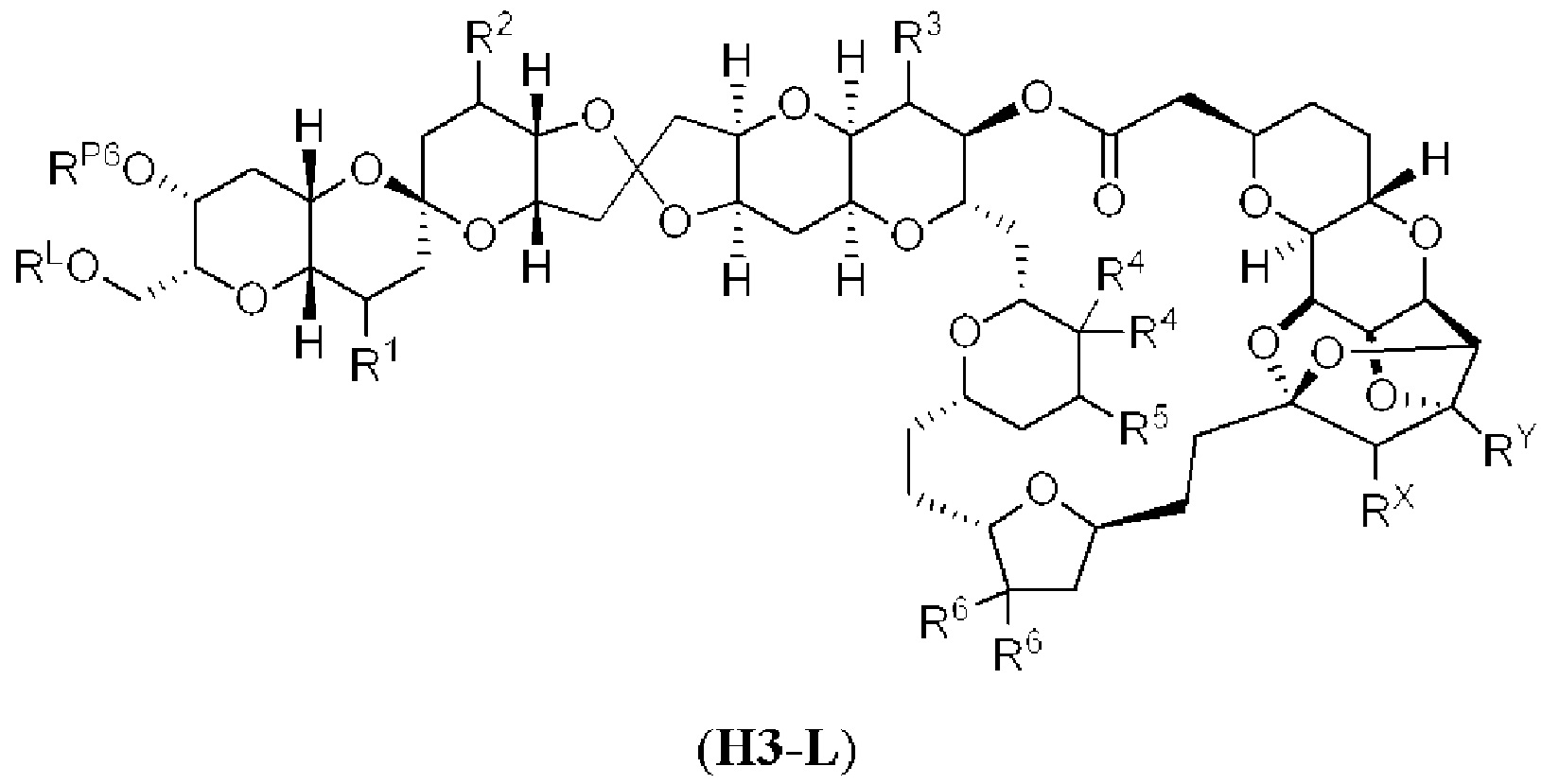
и их соли, где:
RL представляет собой необязательно замещенный сульфонил, необязательно замещенный сульфинил, необязательно замещенный фосфорил или необязательно замещенный ацил;
каждый из R1, R2, R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R4 образуют вместе: 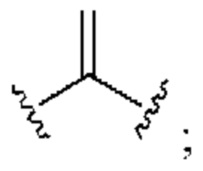
в каждом случае R6 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R6 образуют вместе: 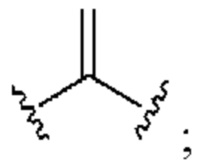
RP6 представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
RX представляет собой водород или -ORXa, где RXa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RY представляет собой водород или -ORYa, где RYa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
где RXa и RYa необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00494] Согласно определенным вариантам осуществления соединение представляет собой соединение формулы:
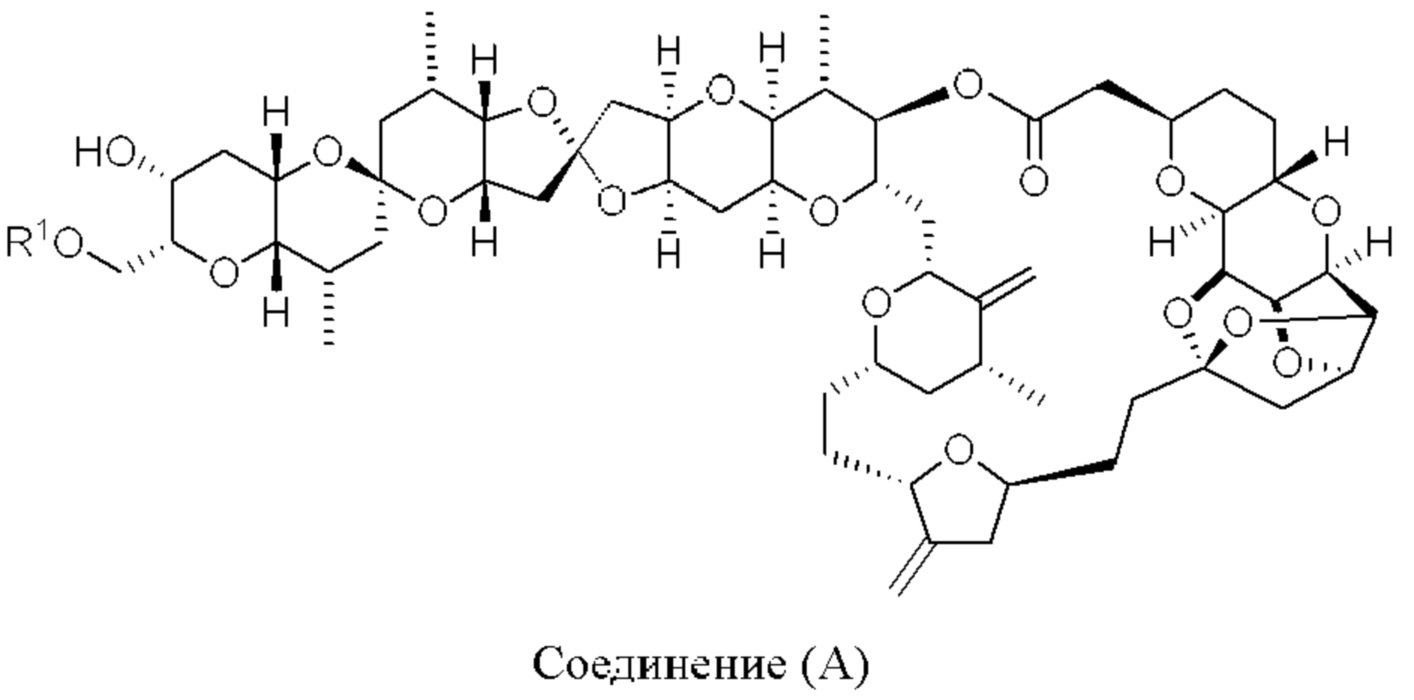
или его соль, где:
R1 представляет собой необязательно замещенный сульфонил, необязательно замещенный сульфинил, необязательно замещенный фосфорил или необязательно замещенный ацил.
[00495] В настоящем документе раскрыты соединения формулы (H-2-II):
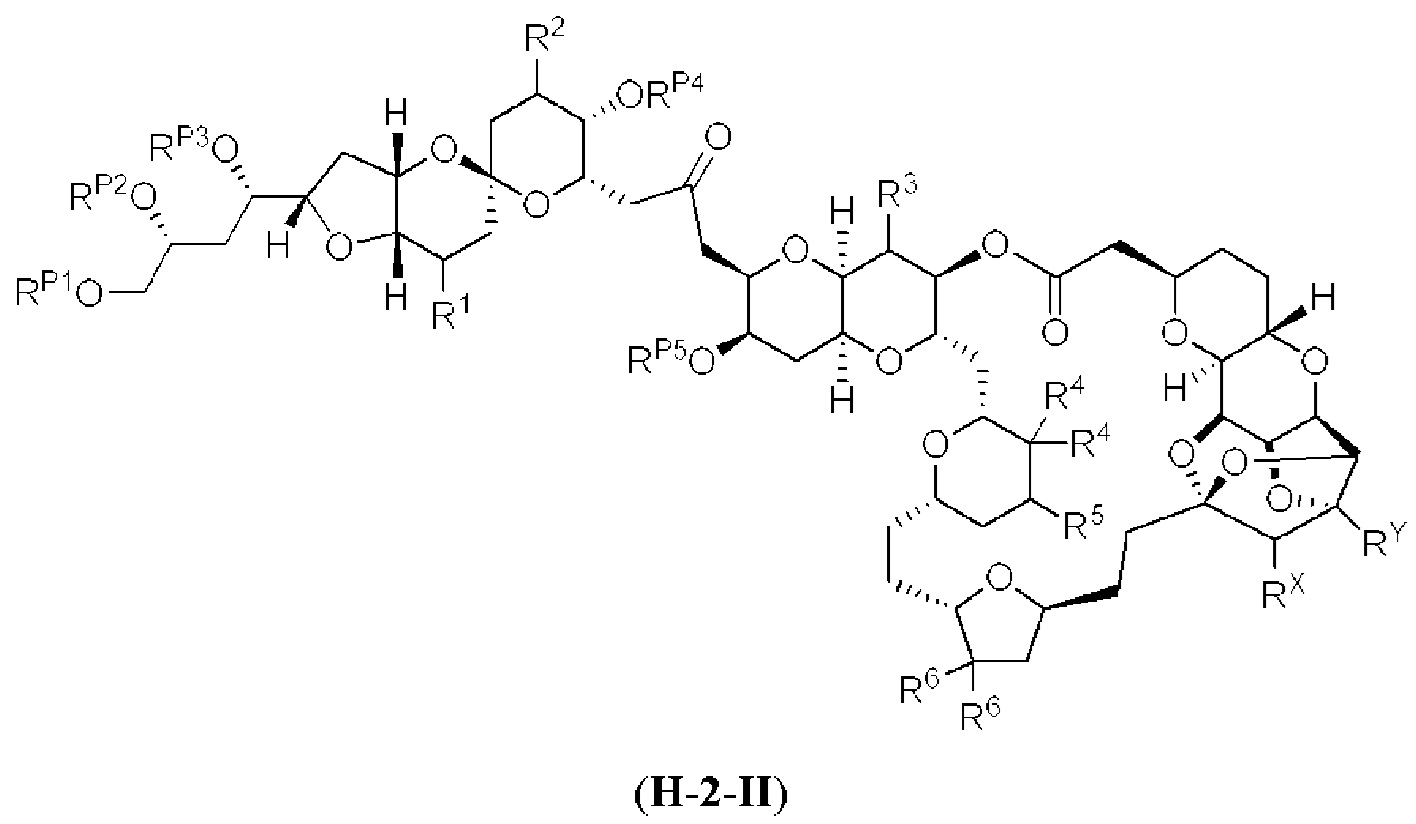
и их соли, где:
каждый из R1, R2, R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R4 образуют вместе: 
в каждом случае R6 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R6 образуют вместе: 
каждый из RP1, RP2, RP3, RP4 и RP5 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
RX представляет собой водород или -ORXa, где RXa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RY представляет собой водород или -ORYa, где RYa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
где RXa и RYa необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00496] В настоящем документе раскрыты соединения формулы (L-2-14):
и их соли, где:
RS представляет собой необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил или необязательно замещенный гетероарил;
каждый из R1 и R2 независимо представляет собой водород, галоген или необязательно замещенный алкил; и
каждый из RP1, RP2, RP3 и RP4 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу.
[00497] В настоящем документе раскрыты соединения формулы (R-2-I):
и их соли, где:
X1 представляет собой галоген или уходящую группу;
каждый из R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R4 образуют вместе: 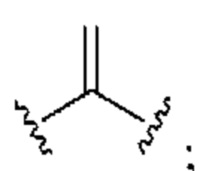
в каждом случае R6 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R6 образуют вместе: 
RP5 представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
RX представляет собой водород или -ORXa, где RXa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RY представляет собой водород или -ORYa, где RYa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
где RXa и RYa необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00498] Согласно определенным вариантам осуществления соединение представляет собой соединение формулы (E-R):
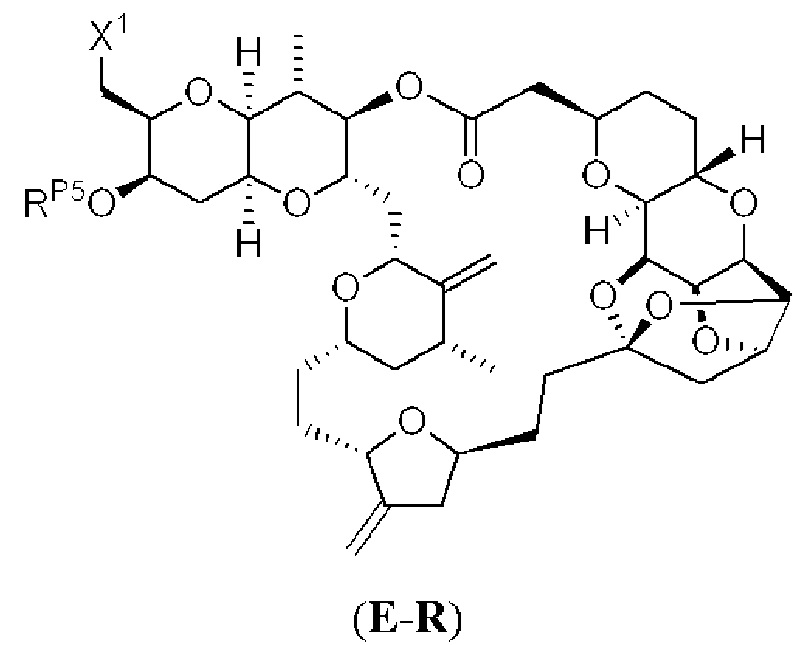
или его соль, где:
X1 представляет собой галоген или уходящую группу; и
RP5 представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу.
[00499] В настоящем документе раскрыты соединения формулы (HH-2-II):
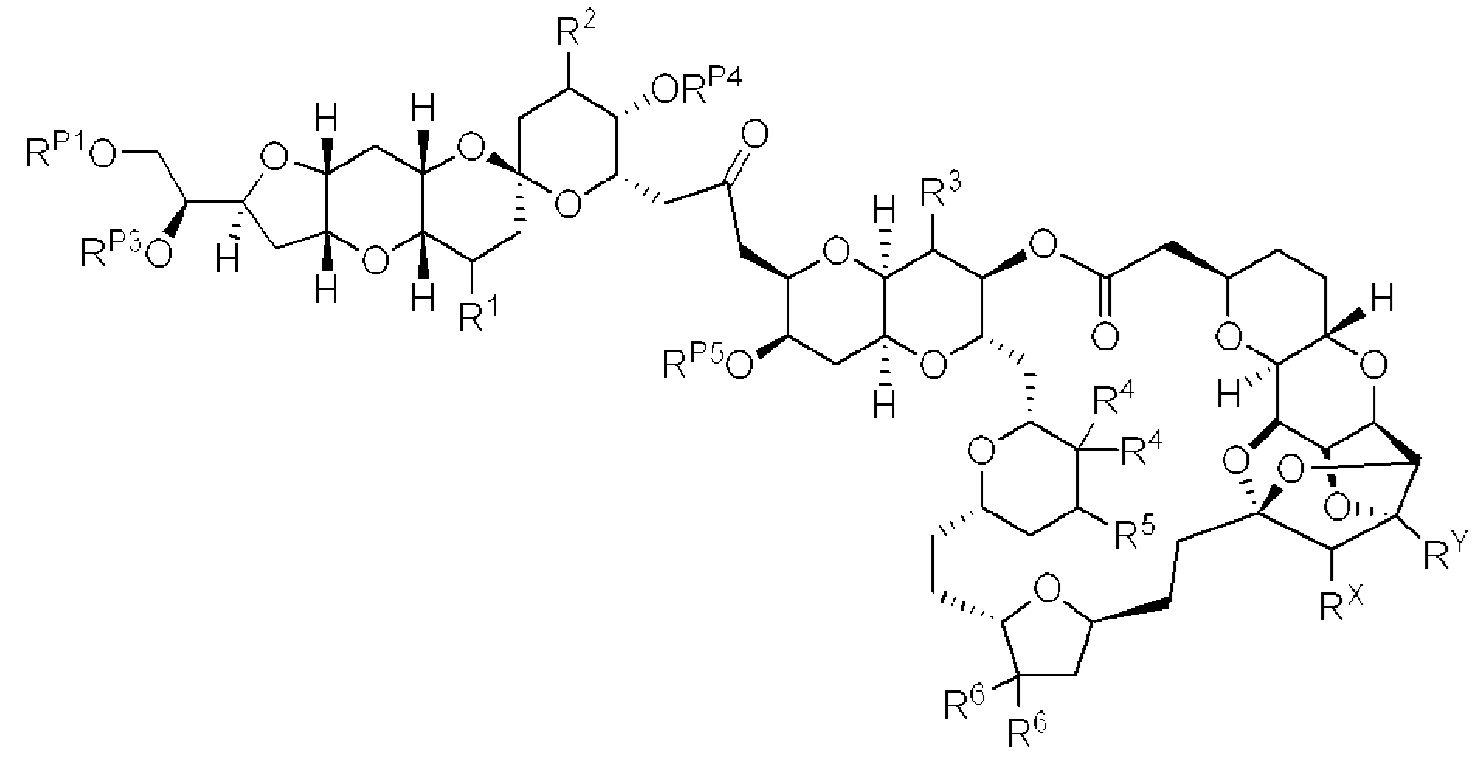
и их соли, где:
каждый из R1, R2, R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R4 образуют вместе: 
в каждом случае R6 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R6 образуют вместе: 
каждый из RP1, RP3, RP4 и RP5 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
RX представляет собой водород или -ORXa, где RXa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RY представляет собой водород или -ORYa, где RYa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
где RXa и RYa необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00500] В настоящем документе раскрыты соединения формулы (L-2-16):
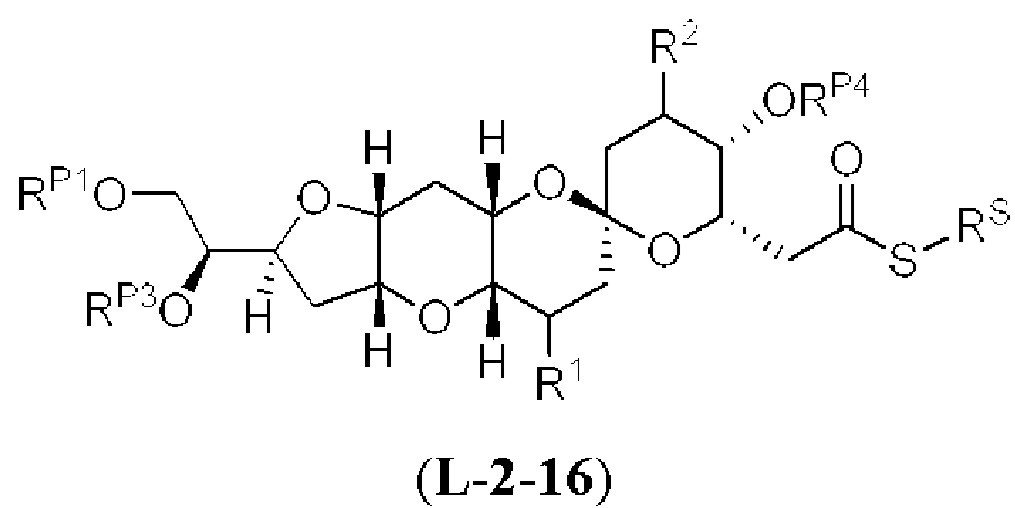
и их соли, где:
RS представляет собой необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил или необязательно замещенный гетероарил;
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил;
RP1, RP3 и RP4 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
RX представляет собой водород или -ORXa, где RXa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RY представляет собой водород или -ORYa, где RYa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
где RXa и RYa необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00501] В настоящем документе раскрыты соединения формулы (NH-2-II):
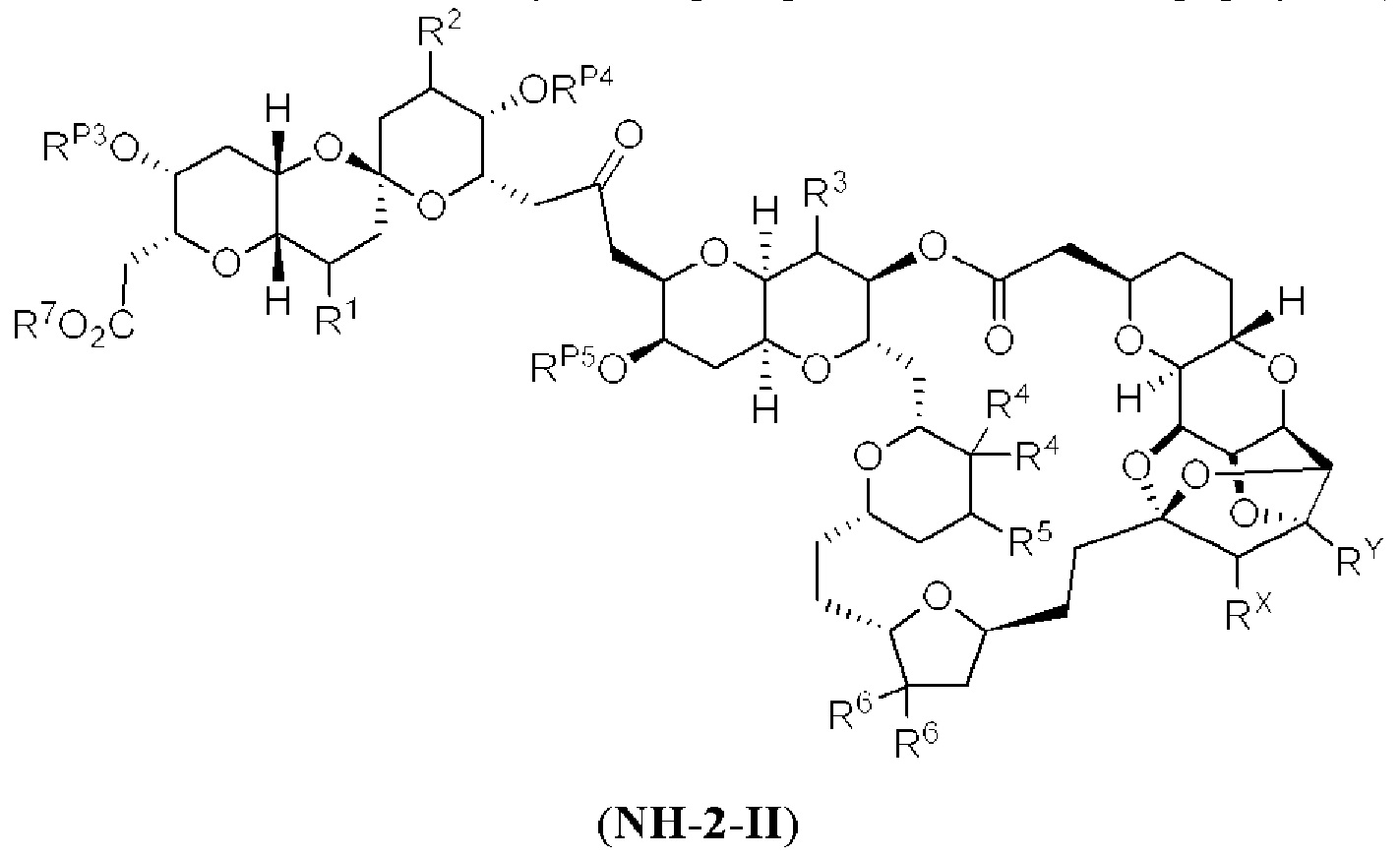
и их соли, где:
каждый из R1, R2, R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R4 образуют вместе: 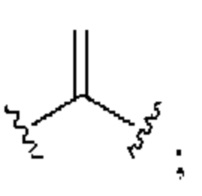
в каждом случае R6 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R6 образуют вместе: 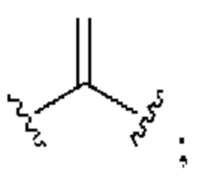
каждый из RP3, RP4 и RP5 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
R7 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу;
RX представляет собой водород или -ORXa, где RXa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RY представляет собой водород или -ORYa, где RYa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
где RXa и RYa необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00502] В настоящем документе раскрыты соединения формулы (L-2-15):
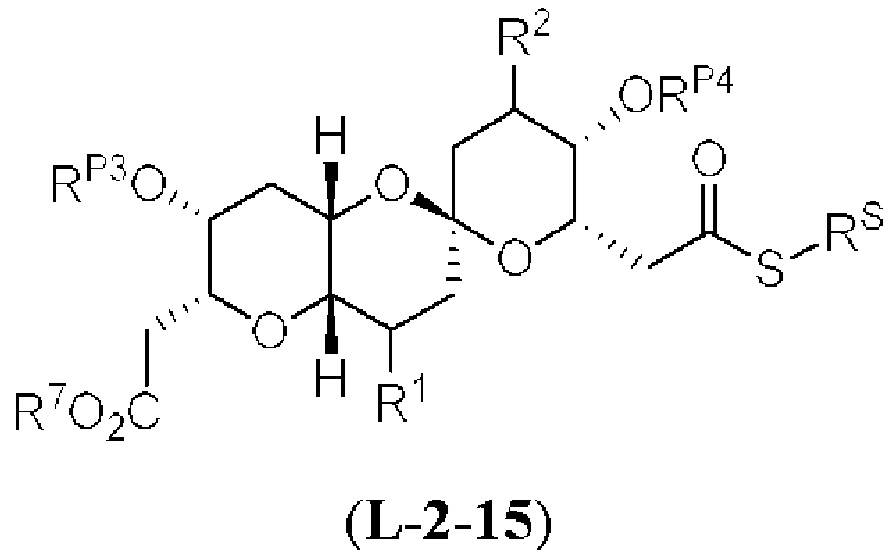
и их соли, где:
RS представляет собой необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил или необязательно замещенный гетероарил;
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил;
RP3 и RP4 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
R7 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00503] В настоящем документе раскрыты соединения формулы (H3-2-I):
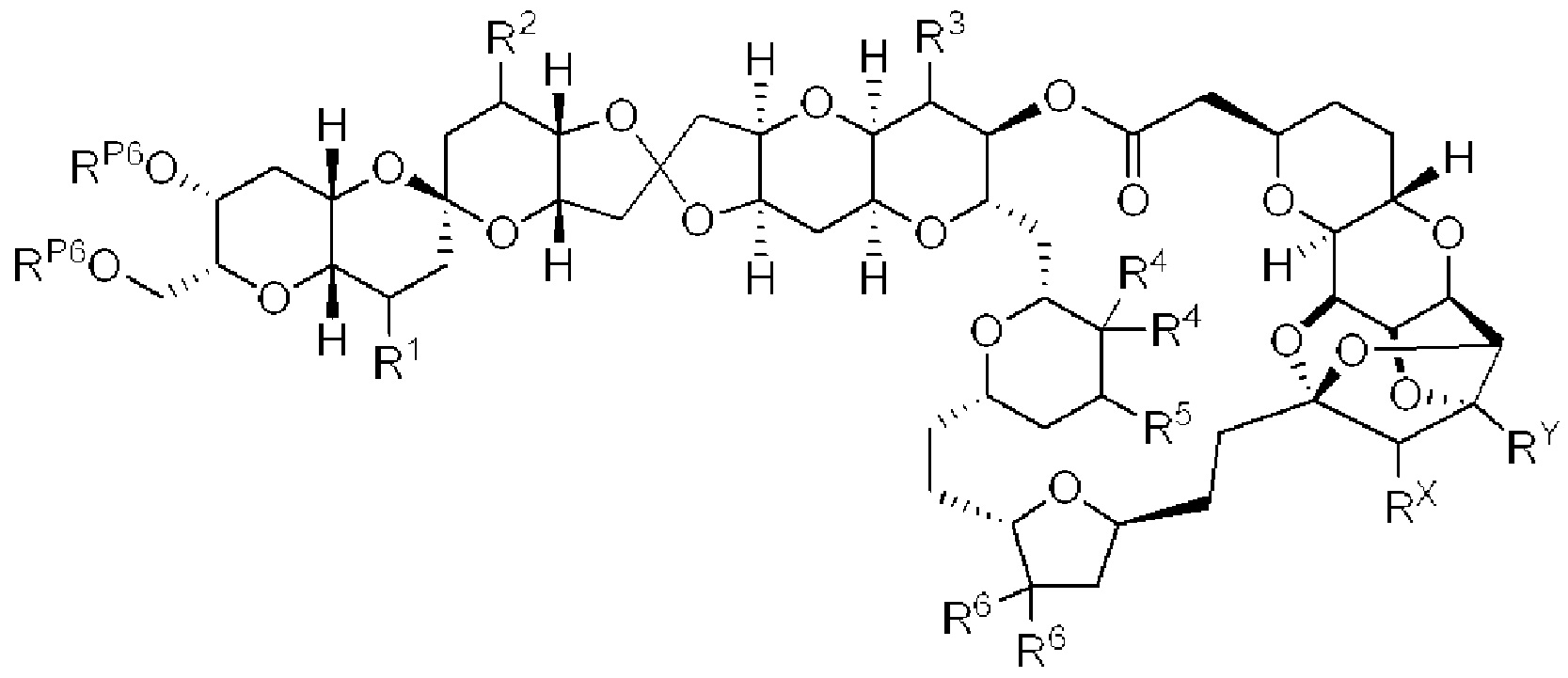
и их соли, где:
каждый из R1, R2, R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R4 образуют вместе: 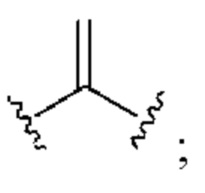
в каждом случае R6 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R6 образуют вместе: 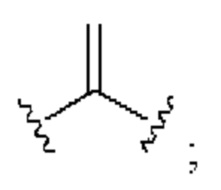
в каждом случае RP6 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила;
RX представляет собой водород или -ORXa, где RXa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RY представляет собой водород или -ORYa, где RYa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
где RXa и RYa необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00504] Согласно определенным вариантам осуществления соединение представляет собой соединение формулы:
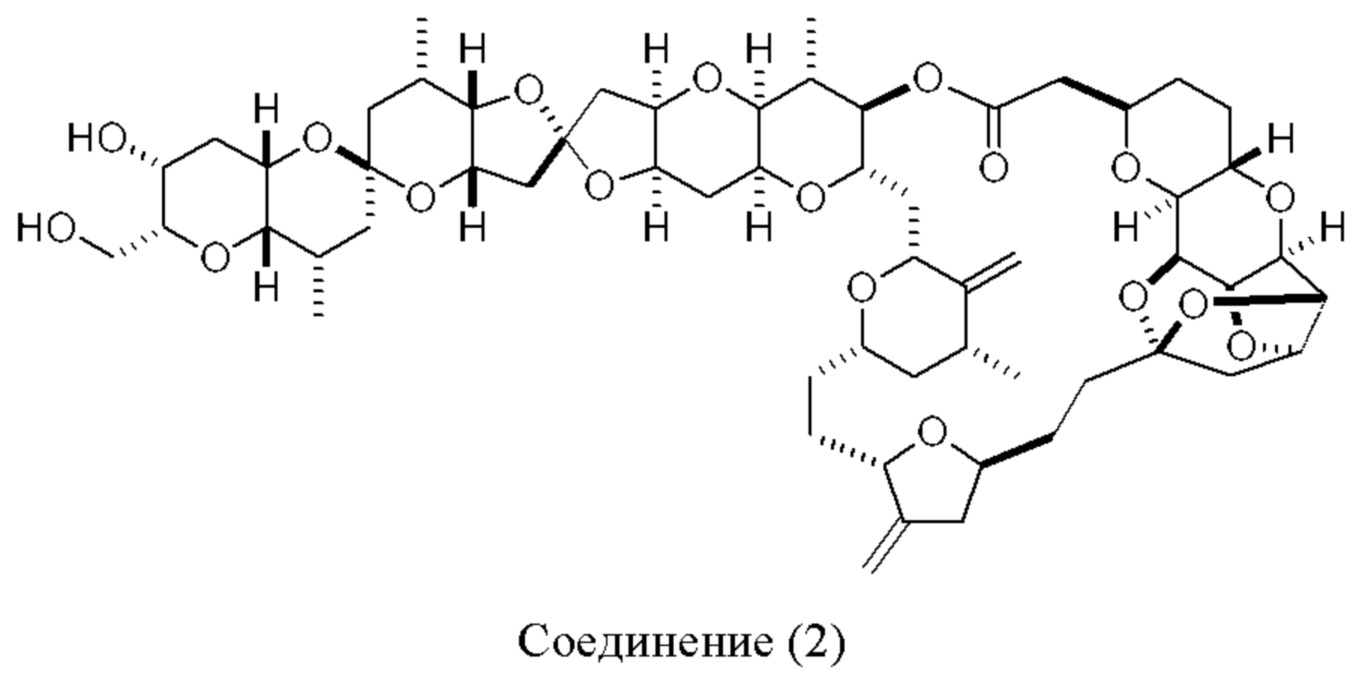
или его соль.
[00505] В настоящем документе раскрыты соединения формулы (H3-2-II):
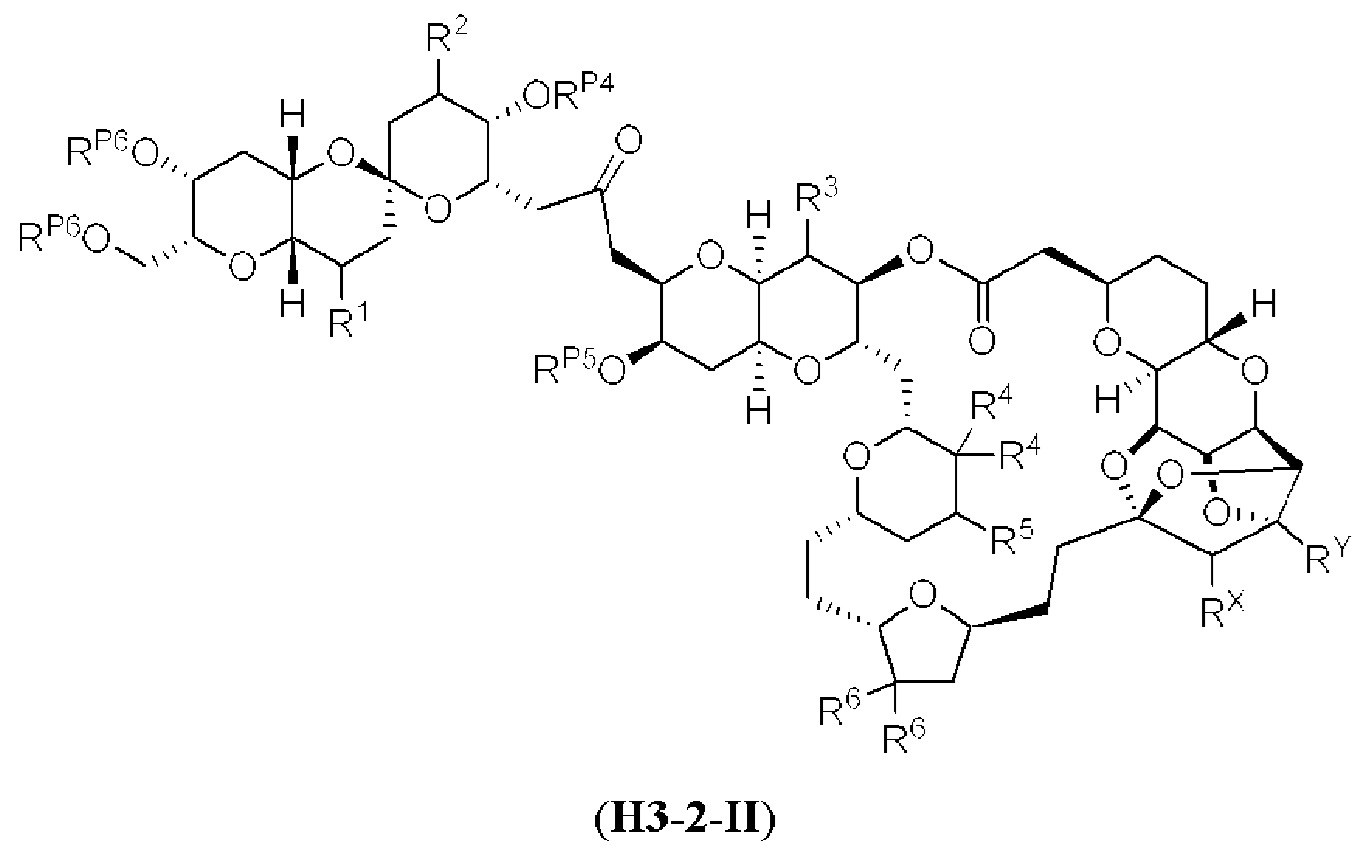
и их соли, где:
каждый из R1, R2, R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R4 образуют вместе: 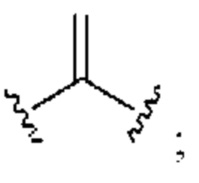
в каждом случае R6 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R6 образуют вместе: 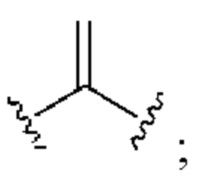
каждый из RP4, RP5 и RP6 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетеро циклила;
RX представляет собой водород или -ORXa, где RXa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RY представляет собой водород или -ORYa, где RYa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
где RXa и RYa необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00506] Согласно определенным вариантам осуществления соединение представляет собой соединение формулы (Е-1):
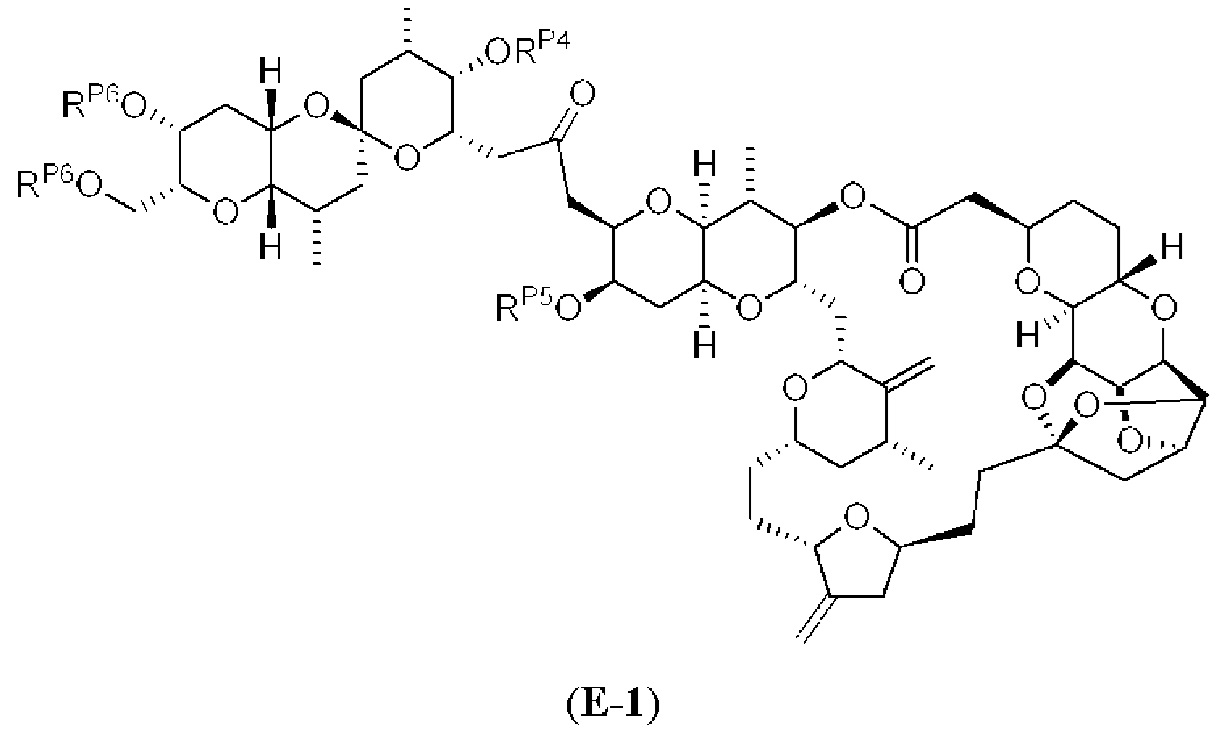
или его соль, где:
каждый из RP4, RP5 и RP6 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00507] Согласно определенным вариантам осуществления соединение представляет собой соединение формулы:
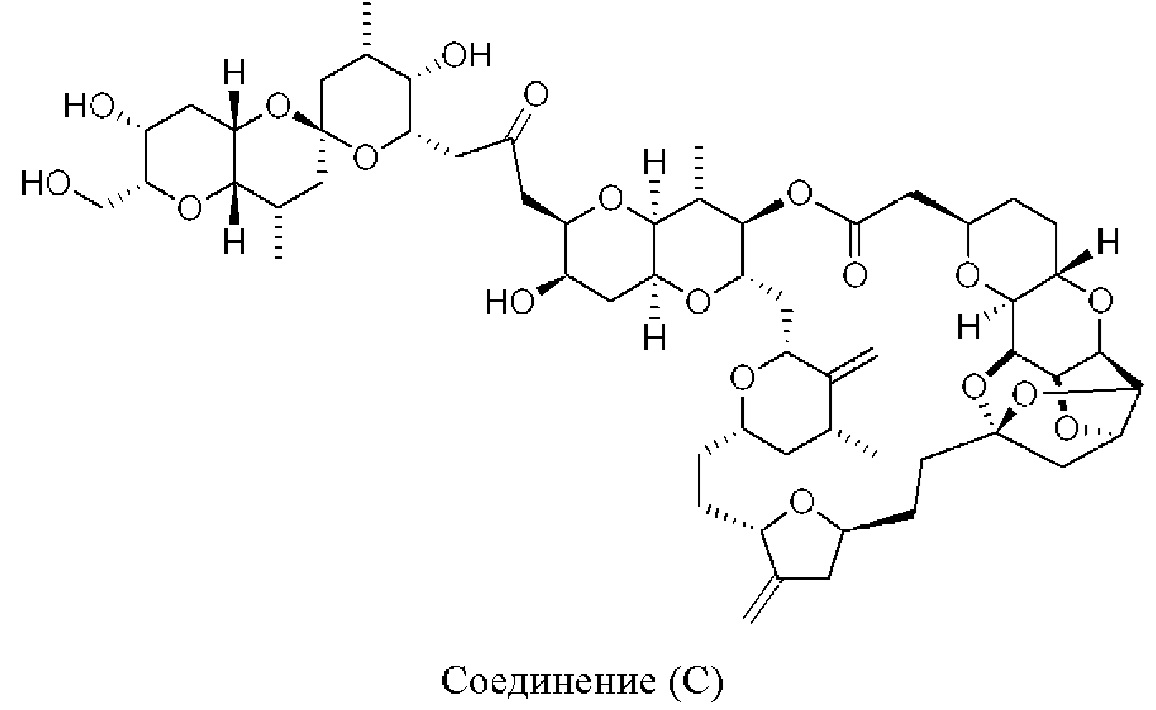
или его соль.
[00508] В настоящем документе раскрыты соединения формулы (L-2-6):
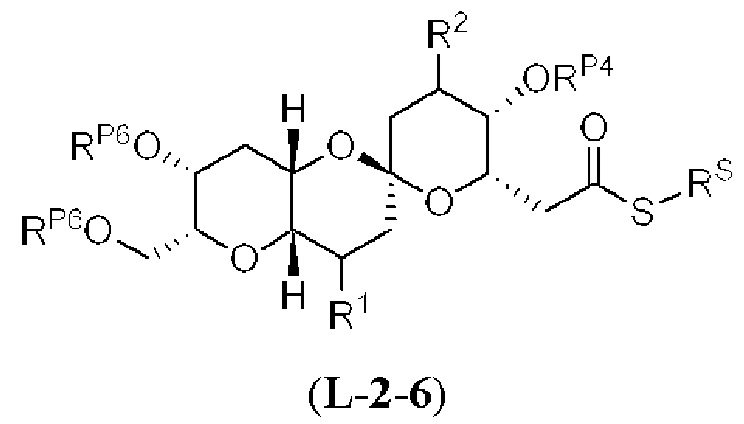
и их соли, где:
RS представляет собой необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил или необязательно замещенный гетероарил;
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил; и
каждый из RP4 и RP6 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00509] Согласно определенным вариантам осуществления соединение представляет собой соединение формулы (E-L):
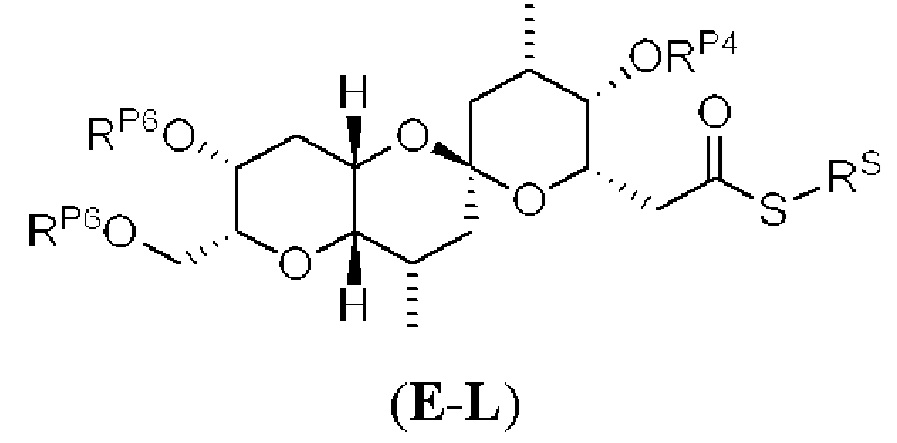
или его соль, где:
RS представляет собой необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил или необязательно замещенный гетероарил;
в каждом случае RP4 и RP6 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00510] Согласно определенным вариантам осуществления соединение представляет собой соединение формулы:
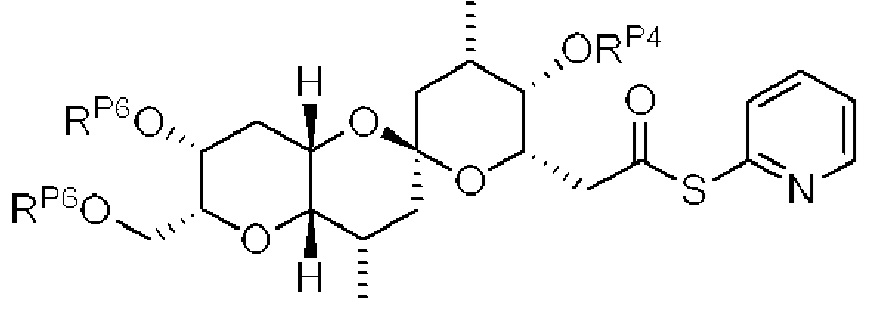
или его соль.
[00511] В настоящем документе раскрыты соединения формулы (R-4-11B):
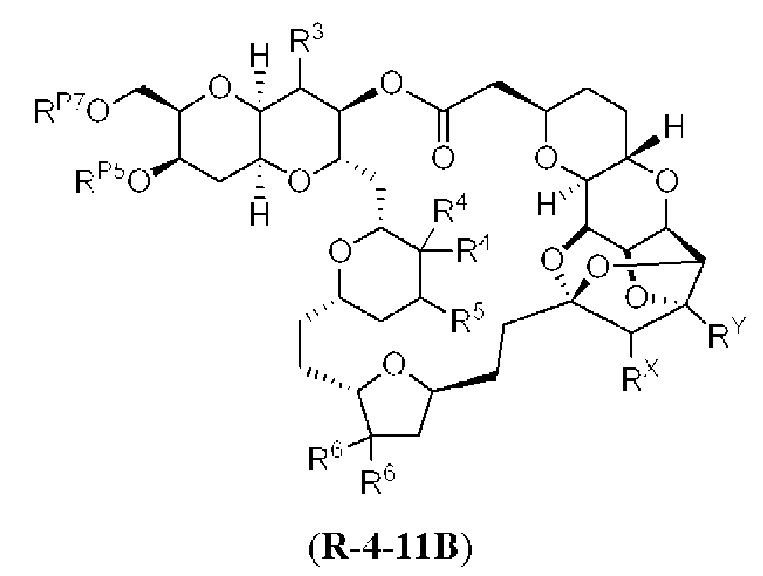
и их соли, где:
каждый из R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R4 образуют вместе: 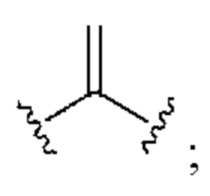
в каждом случае R6 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R6 образуют вместе: 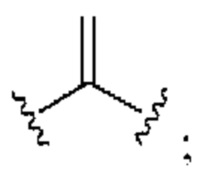
каждый из RP5 и RP7 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
RP7 представляет собой необязательно замещенный сульфонил, необязательно замещенный сульфинил, необязательно замещенный фосфорил, необязательно замещенный ацил или кислород-защитную группу;
где RP5 и RP7 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила;
RX представляет собой водород или -ORXa, где RXa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RY представляет собой водород или -ORYa, где RYa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
где RXa и RYa необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00512] Согласно определенным вариантам осуществления соединение представляет собой соединение формулы (E-R-1):
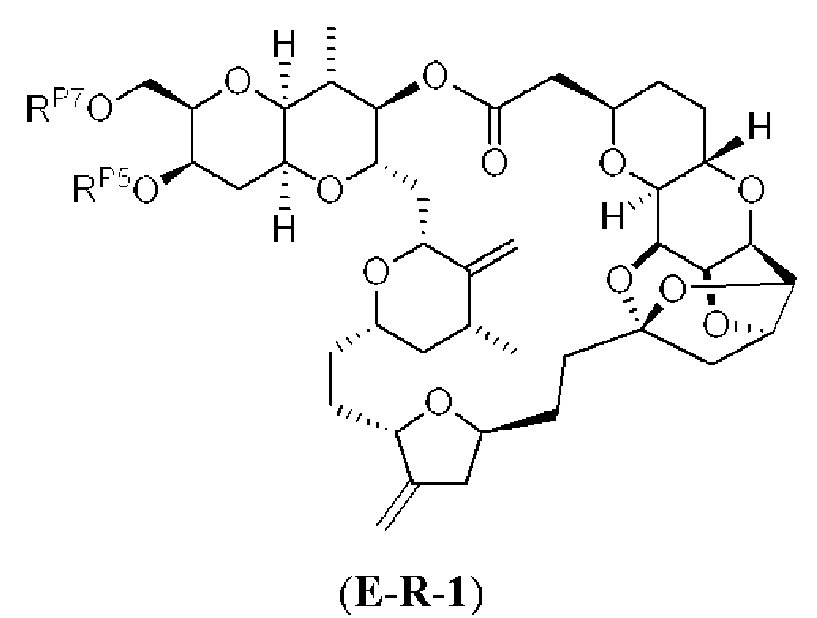
или его соль, где:
RP5 представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RP7 представляет собой необязательно замещенный сульфонил, необязательно замещенный сульфинил, необязательно замещенный фосфорил, необязательно замещенный ацил или кислород-защитную группу; и
где RP5 и RP7 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00513] В настоящем документе раскрыты соединения формулы (R-4-11A):
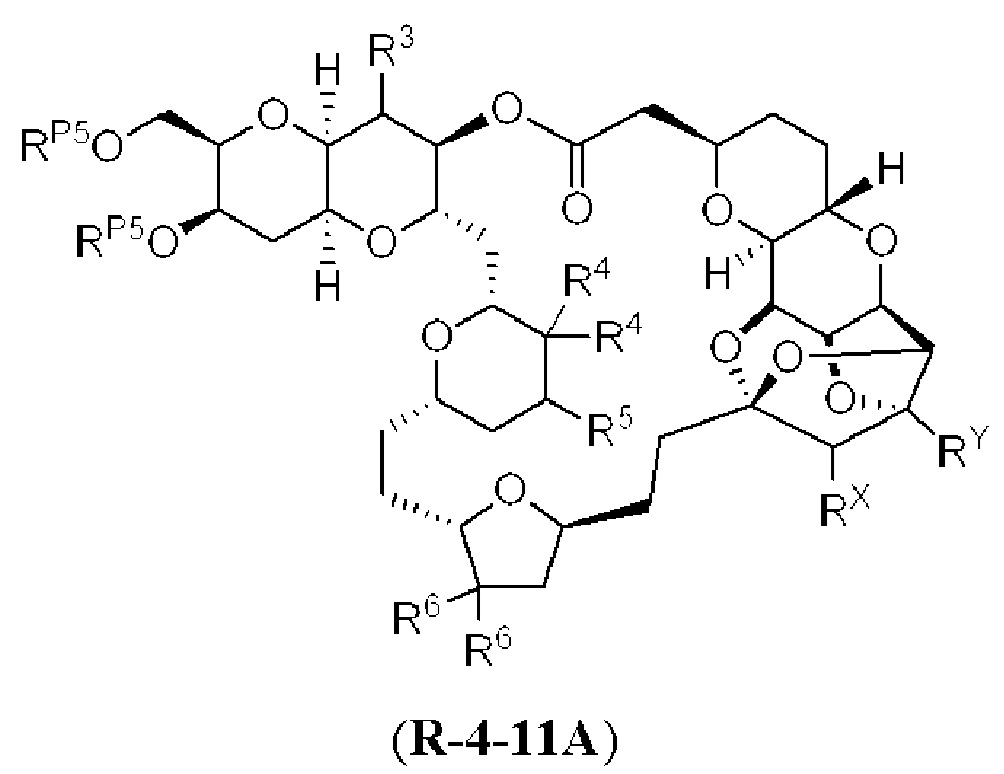
и их соли, где:
каждый из R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген, необязательно замещенный алкил, или две группы R4 образуют вместе: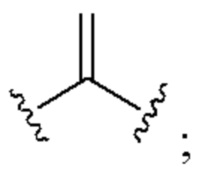
в каждом случае R6 независимо представляет собой водород, галоген, необязательно замещенный алкил, или две группы R6 образуют вместе: 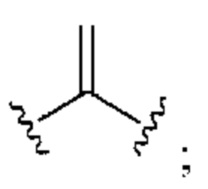
в каждом случае RP5 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца;
RX представляет собой водород или -ORXa, где RXa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RY представляет собой водород или -ORYa, где RYa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
где RXa и RYa необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00514] Согласно определенным вариантам осуществления соединение представляет собой соединение формулы (E-R-2):
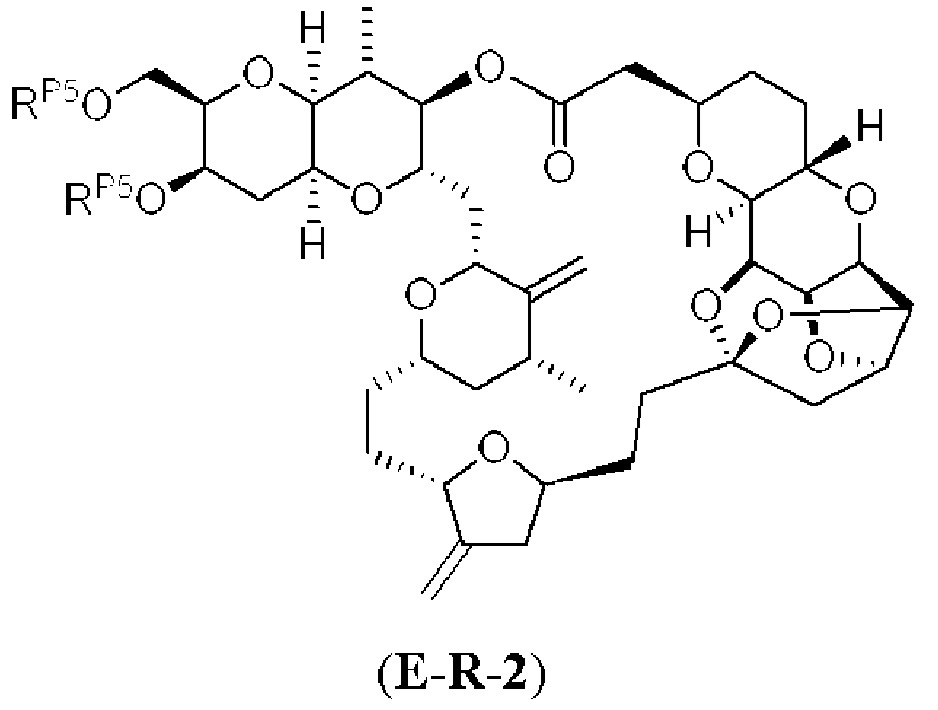
или его соль, где:
в каждом случае RP5 представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца.
[00515] В настоящем документе раскрыты соединения формулы (R-4-10):
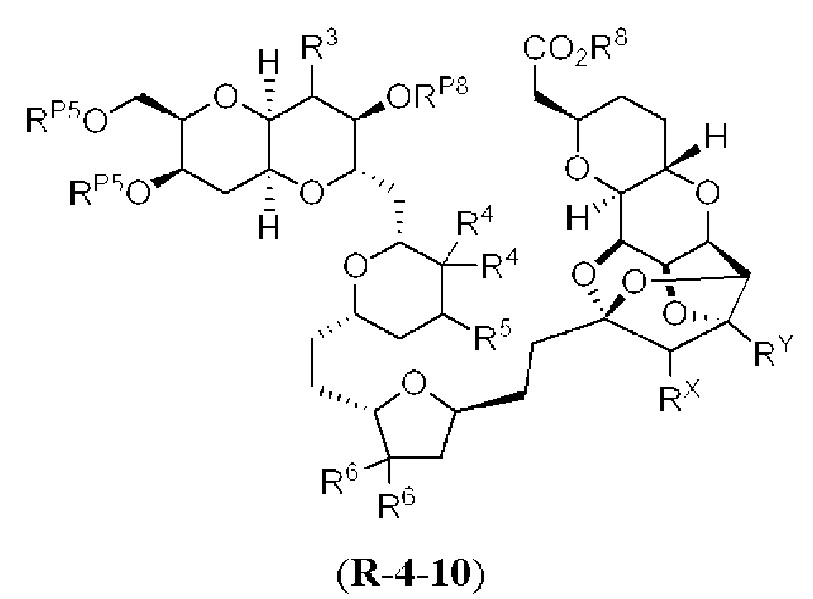
и их соли, где:
каждый из R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R4 образуют вместе:  ;
;
в каждом случае R6 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R6 образуют вместе:  ;
;
в каждом случае RP5 и RP8 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца;
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу;
RX представляет собой водород или -ORXa, где RXa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RY представляет собой водород или -ORYa, где RYa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
где RXa и RYa необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00516] Согласно определенным вариантам осуществления соединение представляет собой соединение формулы (E-R-7):
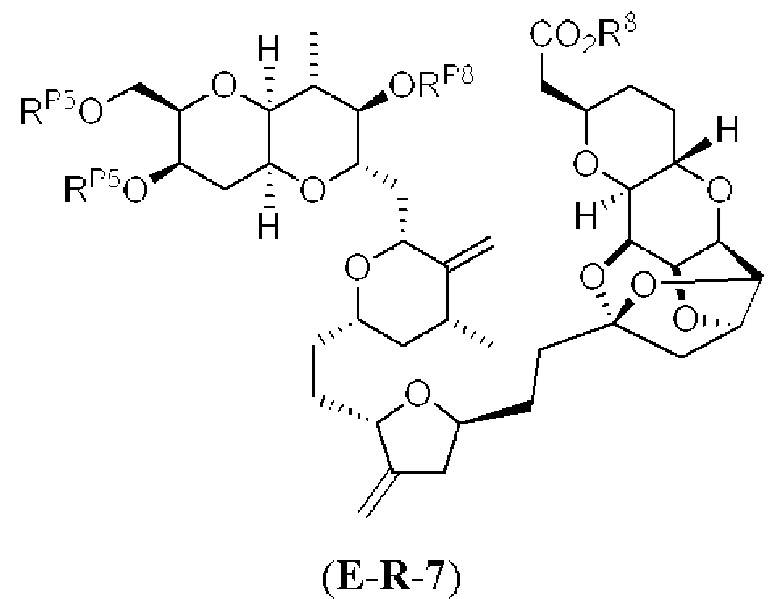
или его соль, где:
в каждом случае RP5 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00517] В настоящем документе раскрыты соединения формулы (R-4-8):
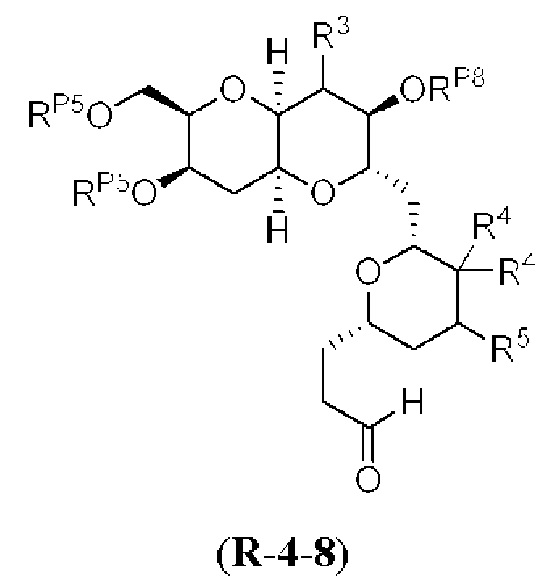
и их соли, где:
каждый из R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R4 образуют вместе:  , и
, и
в каждом случае RP5 и RP8 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца.
[00518] Согласно определенным вариантам осуществления соединение представляет собой соединение формулы (E-R-4):
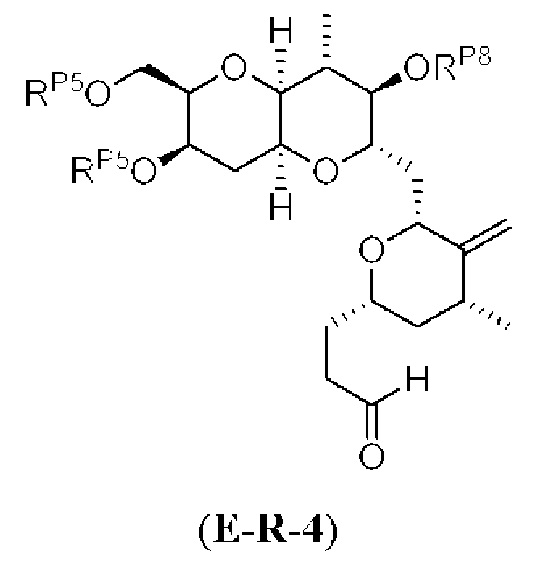
или его соль, где:
в каждом случае RP5 и RP8 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца.
[00519] В настоящем документе раскрыты соединения формулы (R-4-9):
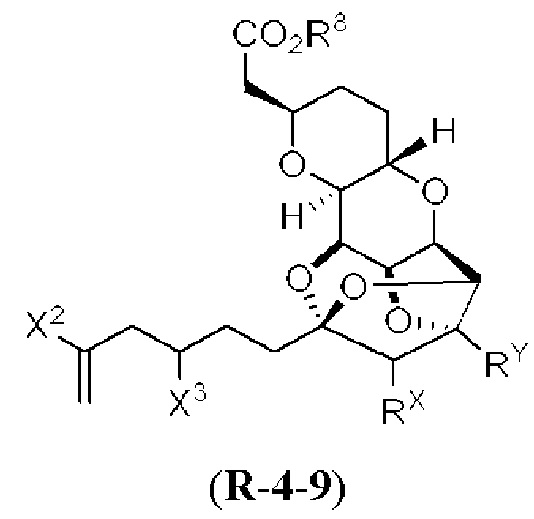
и их соли, где:
каждый из X3 и X2 независимо представляет собой галоген или уходящую группу;
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу;
RX представляет собой водород или -ORXa, где RXa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RY представляет собой водород или -ORYa, где RYa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
где RXa и RYa необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00520] В настоящем документе раскрыты соединения формулы (R-4-10B):
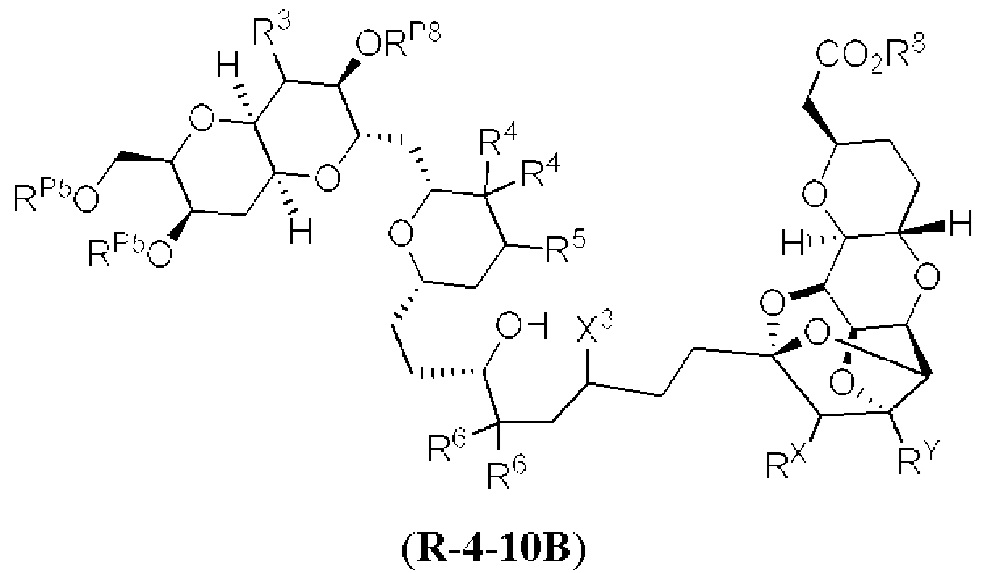
и их соли, где:
X3 представляет собой галоген или уходящую группу;
каждый из R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R4 образуют вместе: 
в каждом случае R6 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R6 образуют вместе: 
в каждом случае RP5 и RP8 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца;
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу;
RX представляет собой водород или -ORXa, где RXa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
RY представляет собой водород или -ORYa, где RYa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу;
где RXa и RYa необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00521] Согласно определенным вариантам осуществления соединение представляет собой соединение формулы (E-R-6):
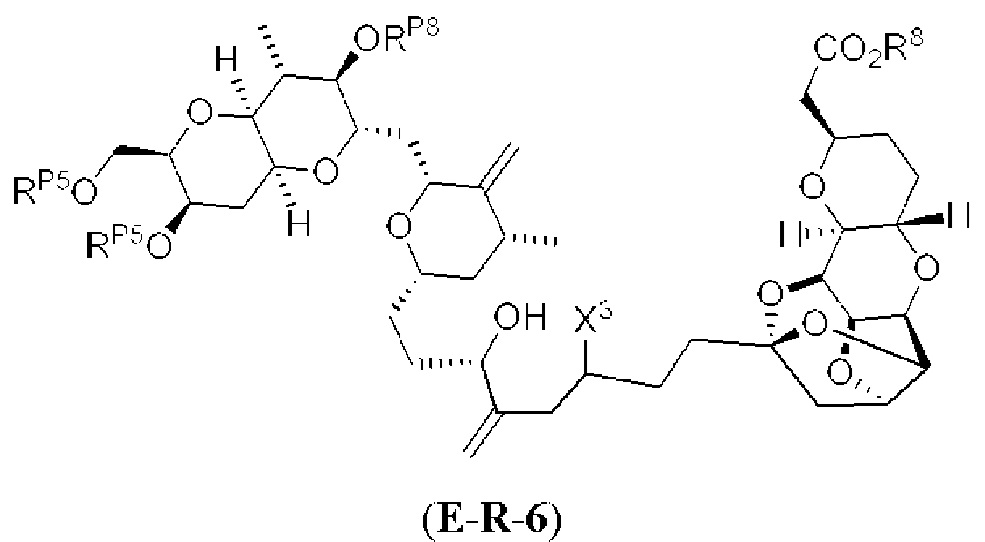
или его соль, где:
X3 представляет собой галоген или уходящую группу;
в каждом случае RP5 и RP8 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00522] В настоящем документе раскрыты соединения формулы (R-4-7):
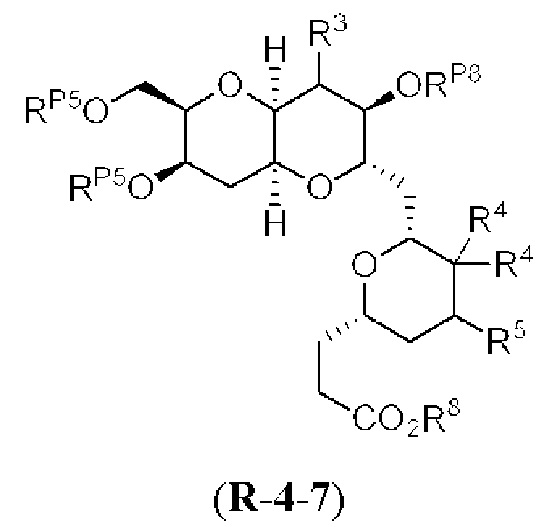
и их соли, где:
каждый из R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген, необязательно замещенный алкил, или две группы R4 образуют вместе: 
в каждом случае RP5 и RP8 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00523] Согласно определенным вариантам осуществления соединение представляет собой соединение формулы (E-R-8):
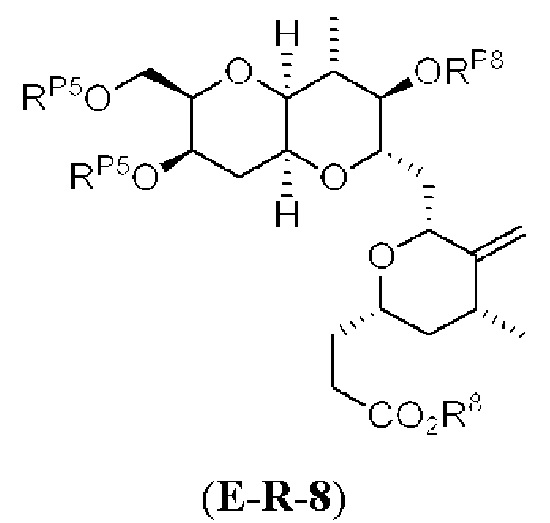
или его соль, где:
в каждом случае RP5 и RP8 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00524] В настоящем документе раскрыты соединения формулы (R-4-5B):
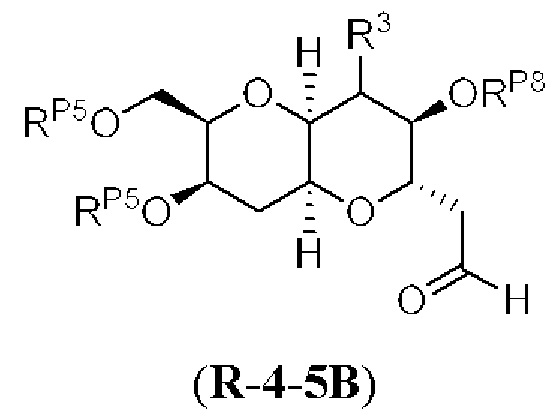
и их соли, где:
R3 представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае RP5 и RP8 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00525] Согласно определенным вариантам осуществления соединение представляет собой соединение формулы (E-R-9):
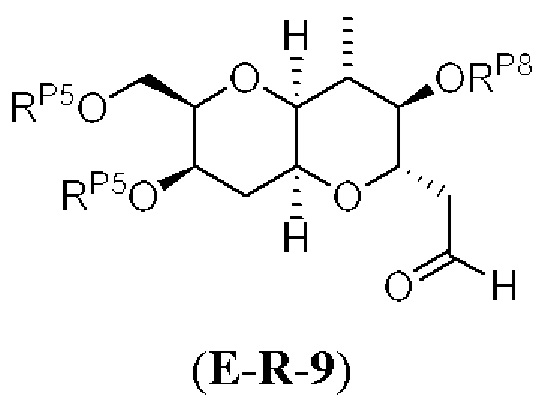
или его соль, где:
в каждом случае RP5 и RP8 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца.
[00526] В настоящем документе раскрыты соединения формулы (R-4-7A):
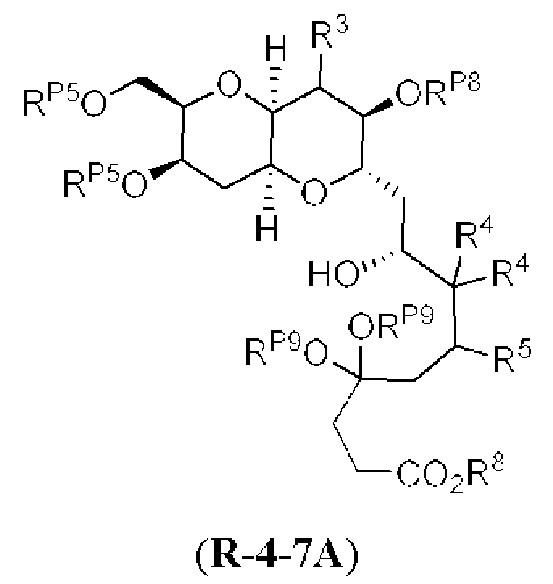
и их соли; где:
каждый из R3 и R5 независимо представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае R4 независимо представляет собой водород, галоген или необязательно замещенный алкил, или две группы R4 образуют вместе: 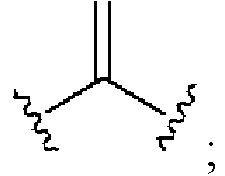
в каждом случае RP5, RP8 и RP9 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца; и где две группы RP9 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00527] Согласно определенным вариантам осуществления соединение представляет собой соединение формулы (E-R-11):
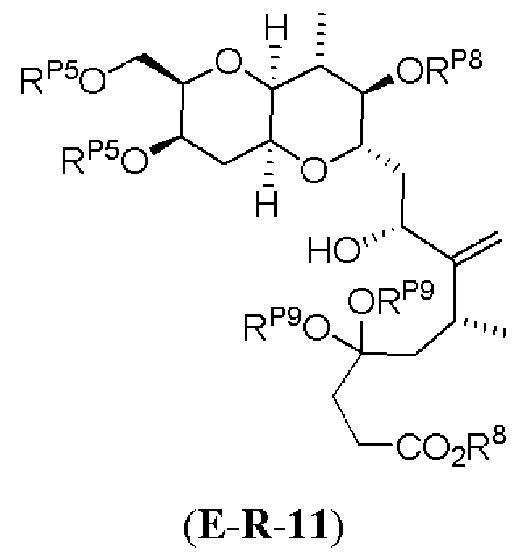
или его соль, где:
в каждом случае RP5, RP8 и RP9 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца; где две группы RP9 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца.
[00528] В настоящем документе раскрыты соединения формулы (R-4-5A):
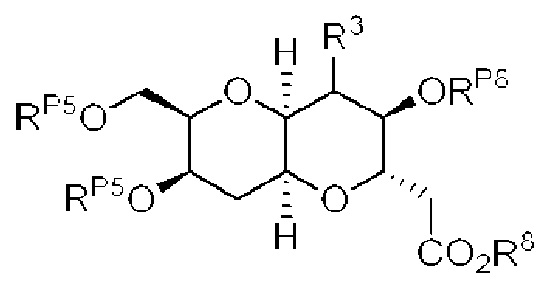

и их соли, где:
R3 представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае RP5 и RP8 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00529] Согласно определенным вариантам осуществления соединение представляет собой соединение формулы (E-R-15):
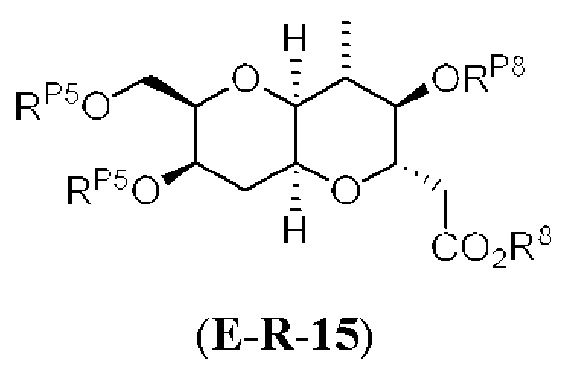
или его соль, где:
в каждом случае RP5 и RP8 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00530] В настоящем документе раскрыты соединения формулы (R-4-4):
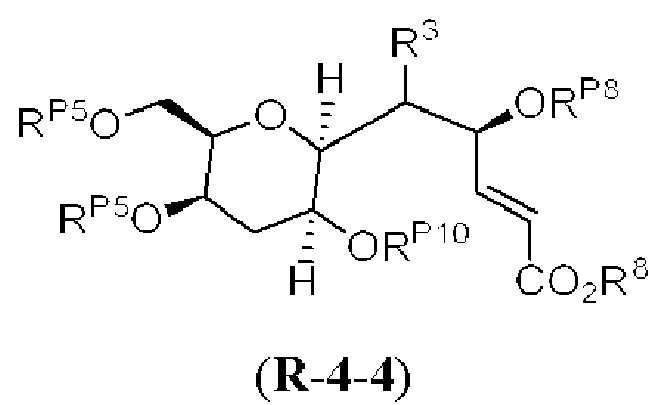
и их соли, где:
R3 представляет собой водород, галоген или необязательно замещенный алкил;
в каждом случае RP5, RP8 и RP10 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00531] Согласно определенным вариантам осуществления соединение представляет собой соединение формулы (E-R-16):
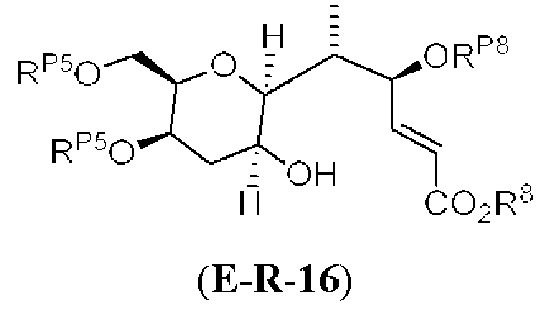
или его соль, где:
в каждом случае RP5 и RP8 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00532] В настоящем документе раскрыты соединения формулы (R-4-2):
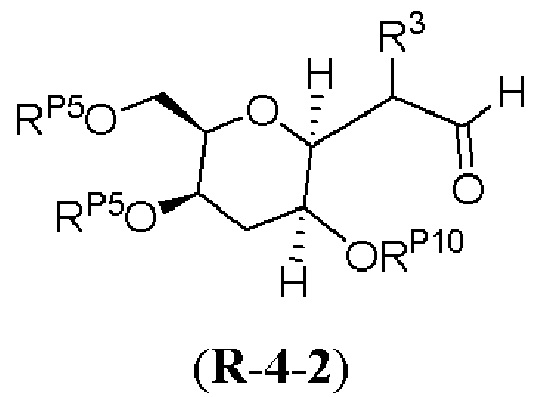
и их соли, где:
R3 представляет собой водород, галоген или необязательно замещенный алкил; и
в каждом случае RP5 и RP10 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца.
[00533] Согласно определенным вариантам осуществления соединение представляет собой соединение формулы (E-R-17):
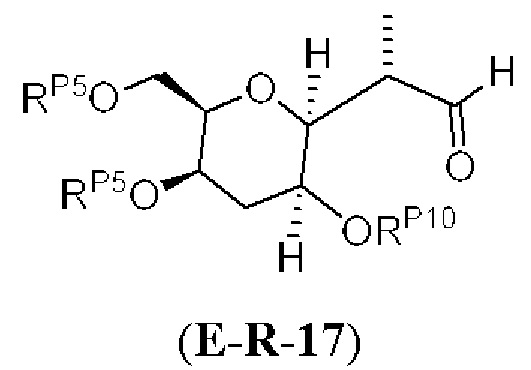
или его соль, где:
в каждом случае RP5 и RP10 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца.
[00534] В настоящем документе раскрыты соединения формулы (R-4-1):
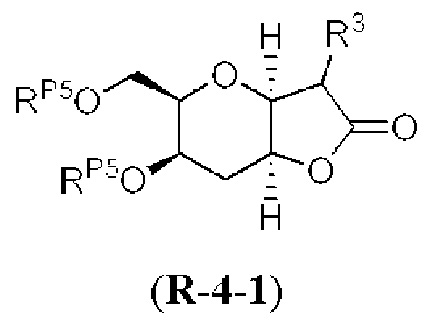
и их соли, где:
R3 представляет собой водород, галоген или необязательно замещенный алкил; и
RP5 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца.
[00535] Согласно определенным вариантам осуществления соединение представляет собой соединение формулы (E-R-19):
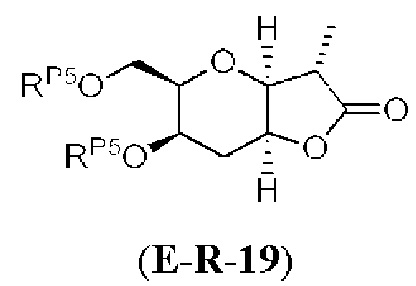
или его соль, где:
в каждом случае RP5 и RP10 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца.
[00536] В настоящем документе раскрыты соединения формулы (E-R-22):
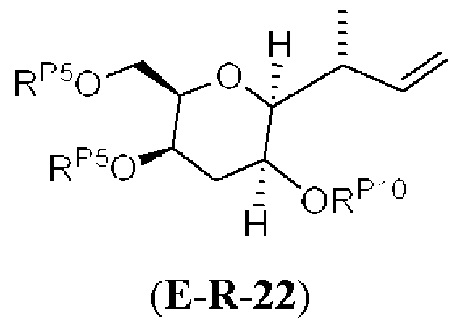
и их соли, где:
в каждом случае RP5 и RP10 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклильного кольца.
[00537] В настоящем документе раскрыты соединения формулы (L-5-17):
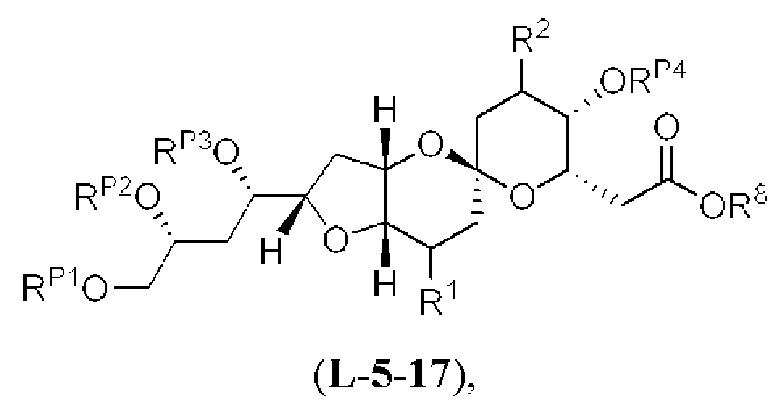
и их соли, где:
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил;
RP1, RP2, RP3 и RP4 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил или необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00538] В настоящем документе также раскрыты соединения формулы (L-5-16B):
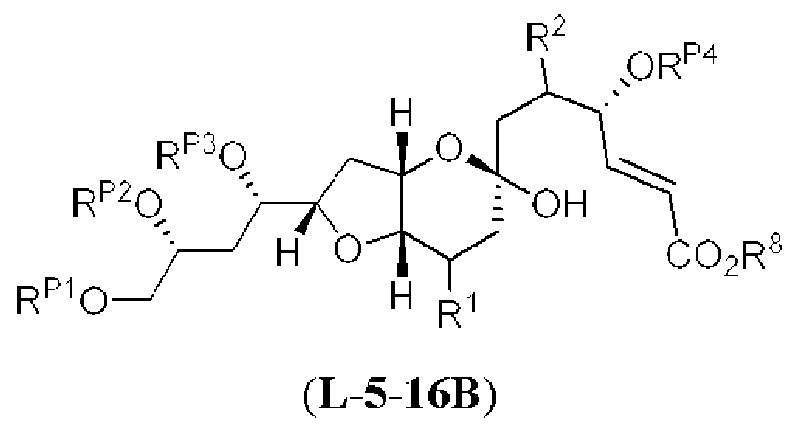
и их соли; где:
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил;
RP1, RP2, RP3 и RP4 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил или необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00539] В настоящем документе раскрыты соединения формулы (L-5-16A):
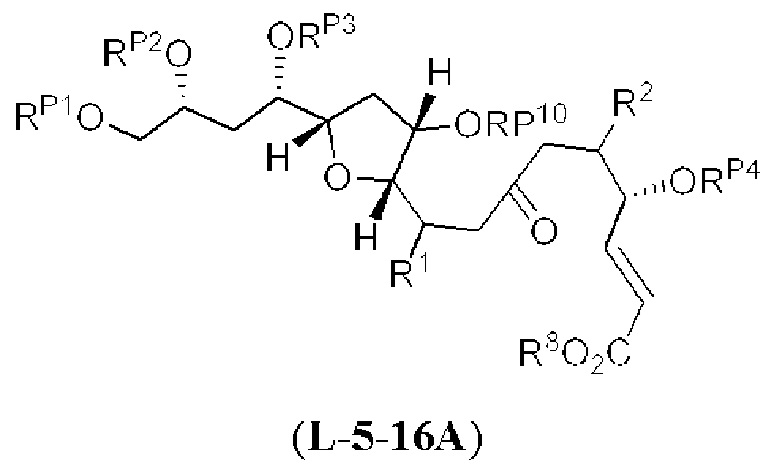
и их соли, где:
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил;
RP1, RP2, RP3, RP4 и RP10 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил или необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00540] В настоящем документе раскрыты соединения формулы (L-5-15):
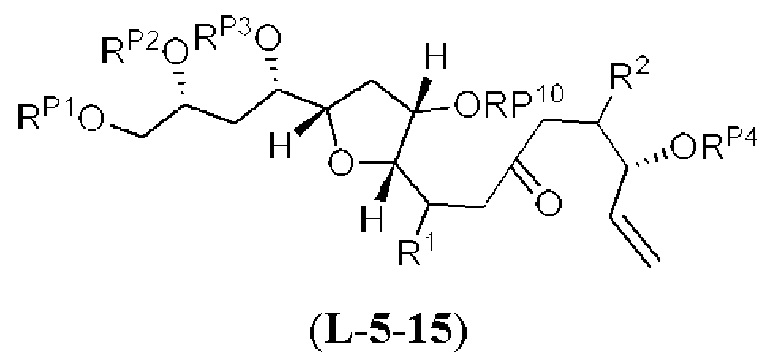
и их соли, где:
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил; и
RP1, RP2, RP3, RP4 и RP10 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу.
[00541] В настоящем документе также раскрыты соединения формулы (L-5-14):
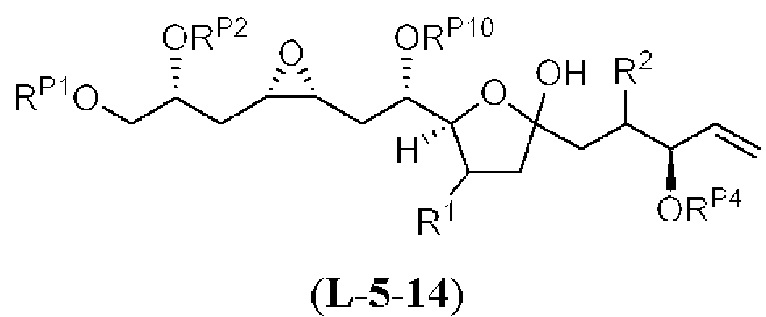
и их соли, где:
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил; и
RP1, RP2, RP4 и RP10 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу.
[00542] В настоящем документе раскрыты соединения формулы (L-5-12):
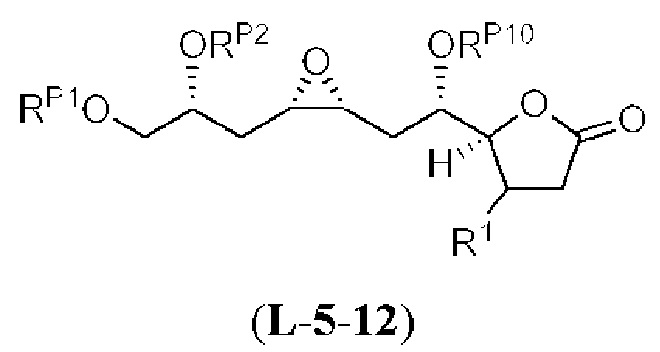
и их соли, где:
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил; и
RP1, RP2 и RP10 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу.
[00543] В настоящем документе раскрыты соединения формулы (L-5-11):
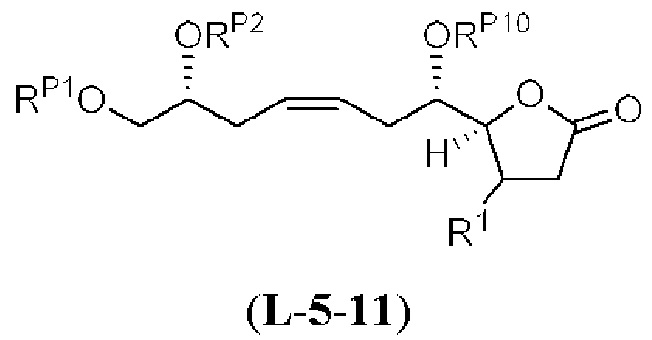
и их соли, где:
R1 представляет собой водород, галоген или необязательно замещенный алкил; и
RP1, RP2 и RP10 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу.
[00544] В настоящем документе также раскрыты соединения формулы (L-5-26):
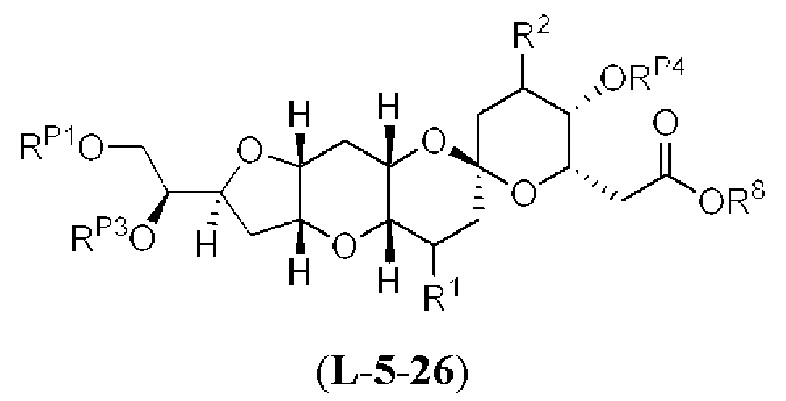
и их соли; где:
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил;
каждый из RP1, RP3 и RP4 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил или необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00545] В настоящем документе также раскрыты соединения формулы (L-5-25C):
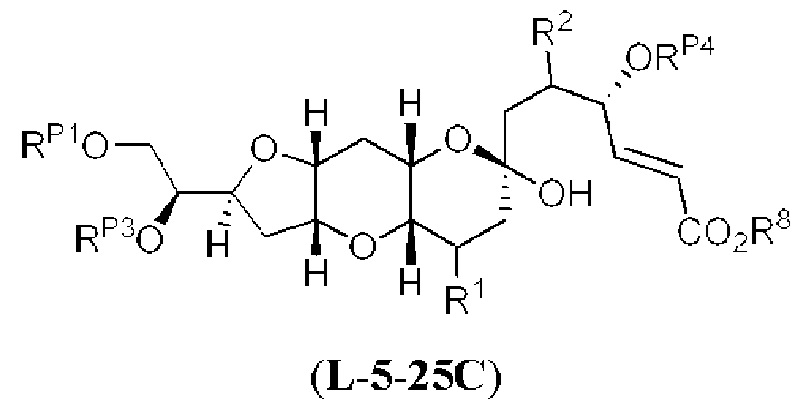
и их соли; где:
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил;
каждый из RP1, RP3 и RP4 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00546] В настоящем документе также раскрыты соединения формулы (L-5-25A):
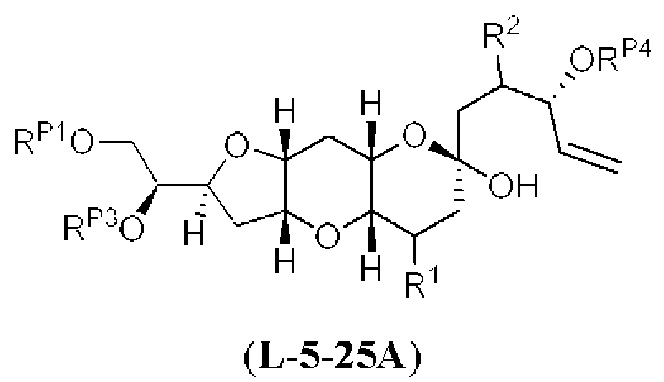
и их соли, где:
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил; и
каждый из RP1, RP3 и RP4 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу.
[00547] В настоящем документе раскрыты соединения формулы (L-5-24):
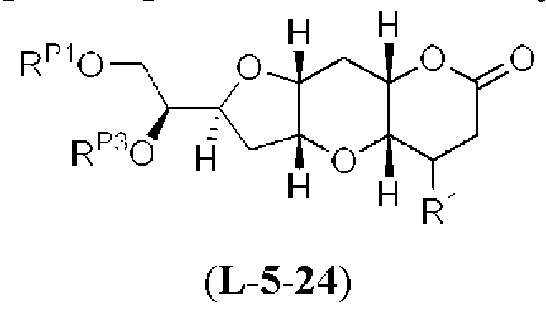
и их соли, где:
R1 представляет собой водород, галоген или необязательно замещенный алкил; и
каждый из RP1 и RP3 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу.
[00548] В настоящем документе раскрыты соединения формулы (L-5-23B):
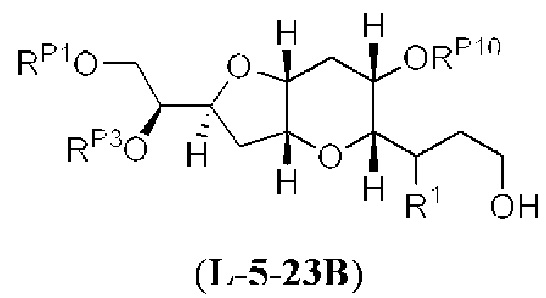
и их соли, где:
R1 представляет собой водород, галоген или необязательно замещенный алкил; и
каждый из RP1, RP3 и RP10 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу.
[00549] В настоящем документе также раскрыты соединения формулы (L-5-23C):
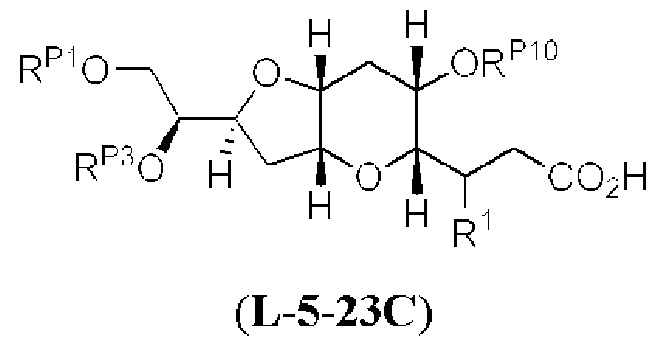
и их соли; где:
R1 представляет собой водород, галоген или необязательно замещенный алкил; и
каждый из RP1, RP3 и RP10 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу.
[00550] В настоящем документе раскрыты соединения формулы (L-5-23A):
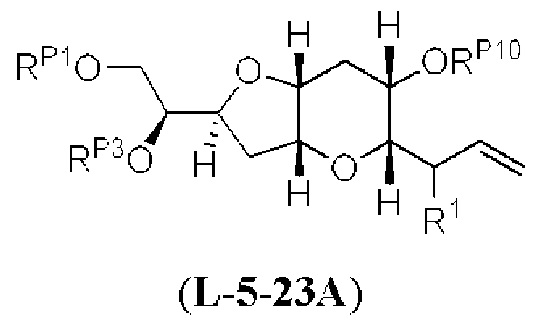
и их соли; где:
R1 представляет собой водород, галоген или необязательно замещенный алкил; и
каждый из RP1, RP3 и RP10 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу.
[00551] В настоящем документе раскрыты соединения формулы (L-5-22):
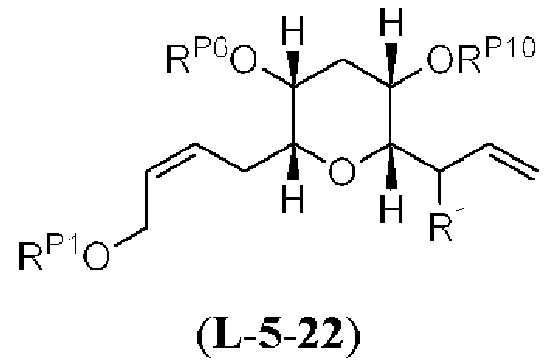
и их соли; где:
R1 представляет собой водород, галоген или необязательно замещенный алкил; и
каждый из RP1, RP3 и RP10 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу.
[00552] В настоящем документе также раскрыты соединения формулы (L-5-22A):
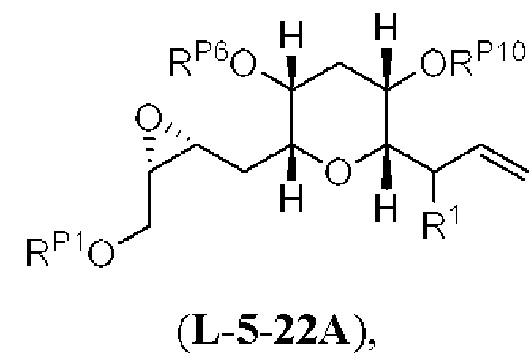
и их соль; где:
R1 представляет собой водород, галоген или необязательно замещенный алкил; и
каждый из RP1, RP3 и RP10 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу.
[00553] В настоящем документе раскрыты соединения формулы (L-5-21B):
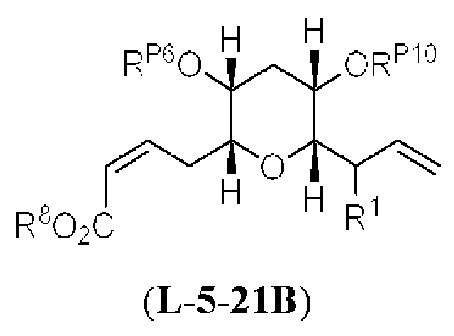
и их соли; где:
R1 представляет собой водород, галоген или необязательно замещенный алкил;
каждый из RP1, RP6 и RP10 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00554] В настоящем документе раскрыты соединения формулы (L-5-21A):
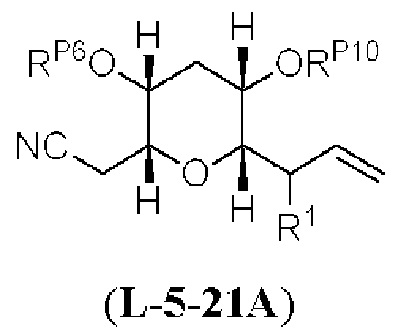
и их соли; где:
R1 представляет собой водород, галоген или необязательно замещенный алкил; и
каждый из RP6 и RP10 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу.
[00555] В настоящем документе раскрыты соединения формулы (L-5-32):
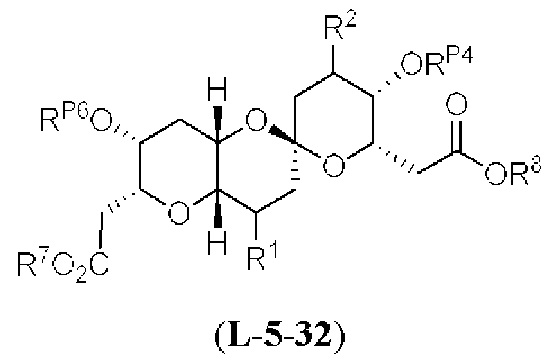
и их соли; где:
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил;
в каждом случае RP4 и RP6 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
R7 и R8 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00556] В настоящем документе также раскрыты соединения формулы (L-5-31):
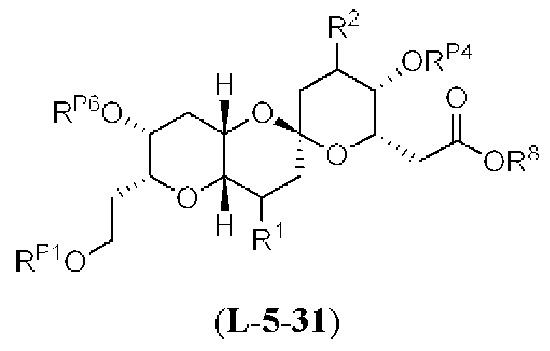
и их соли; где:
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил;
RP1, RP4 и RP6 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00557] В настоящем документе также раскрыты соединения формулы (L-5-32A):
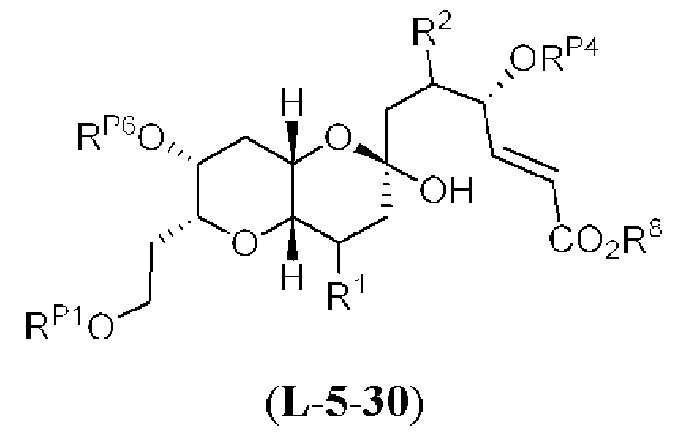
и их соли; где:
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил;
RP1, RP4 и RP6 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00558] В настоящем документе также раскрыты соединения формулы (L-5-28):
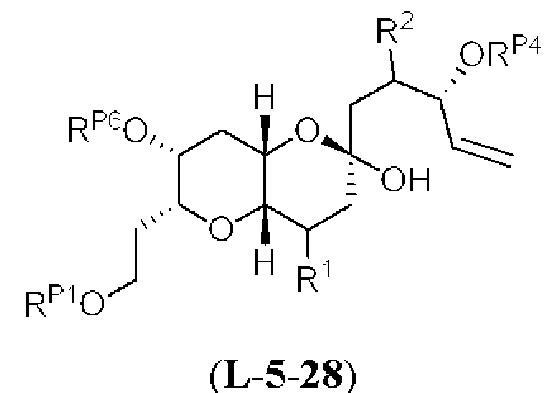
и их соли, где:
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил; и
RP1, RP4 и RP6 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00559] В настоящем документе раскрыты соединения формулы (L-5-27):
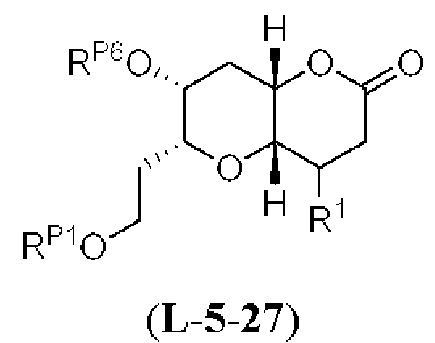
и их соли, где:
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил; и
в каждом случае RP4 и RP6 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу.
[00560] В настоящем документе раскрыты соединения формулы (L-5-7B):
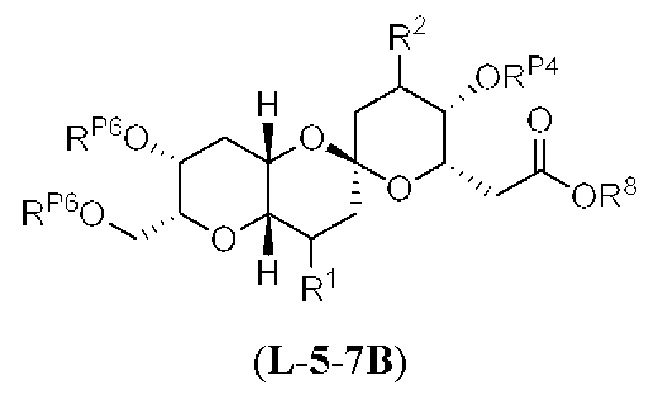
и их соли; где:
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил;
в каждом случае RP4 и RP6 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00561] Согласно определенным вариантам осуществления соединение представляет собой соединение формулы (E-L-1):
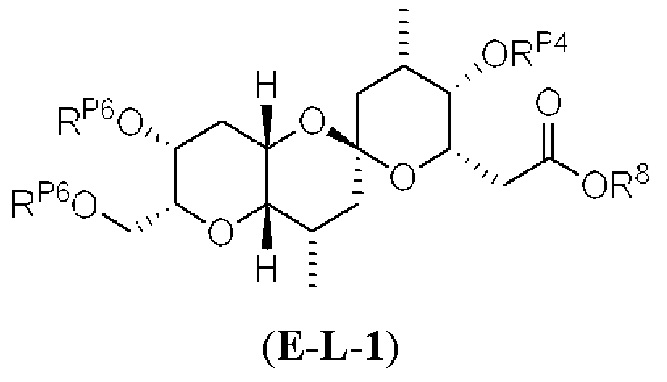
или его соль, где:
RS представляет собой необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил или необязательно замещенный гетероарил;
в каждом случае RP4 и RP6 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00562] В настоящем документе также раскрыты соединения формулы (L-5-7A):
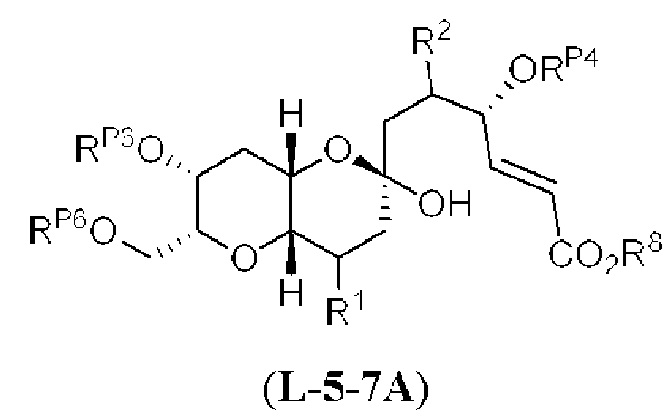
и их соли; где:
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил;
в каждом случае RP4 и RP6 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00563] Согласно определенным вариантам осуществления соединение представляет собой соединение формулы (E-L-2):
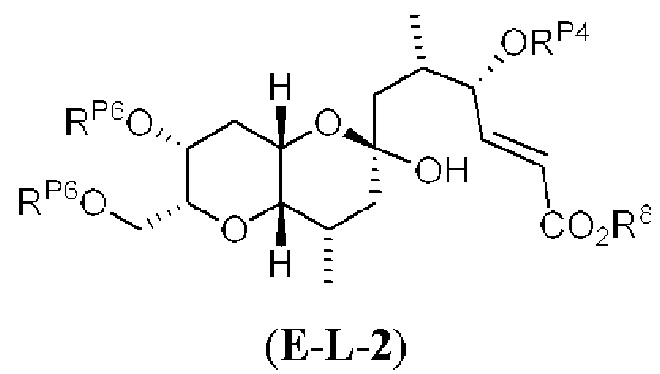
или его соль, где:
в каждом случае RP4 и RP6 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00564] В настоящем документе раскрыты соединения формулы (E-L-6):
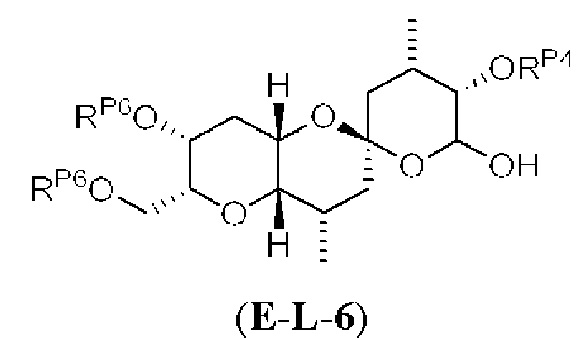
или их соль, где:
в каждом случае RP4 и RP6 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила; и
R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу.
[00565] В настоящем документе раскрыты соединения формулы (L-5-6A):
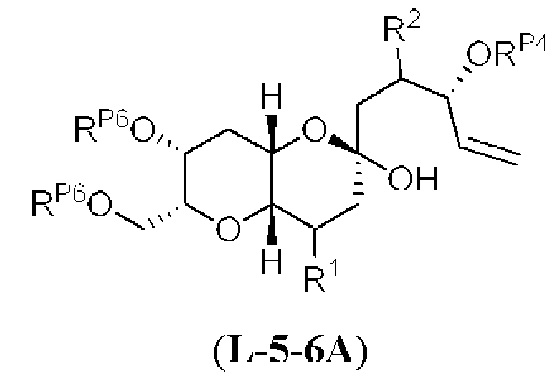
и их соли; где:
R1 и R2 независимо представляют собой водород, галоген или необязательно замещенный алкил; и
в каждом случае RP4 и RP6 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00566] Согласно определенным вариантам осуществления соединение представляет собой соединение формулы (E-L-5):
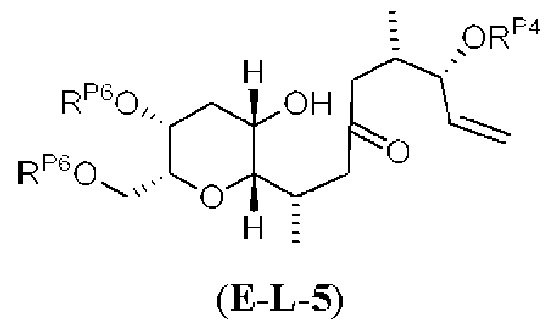
или его соль, где:
в каждом случае RP4 и RP6 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00567] В настоящем документе также раскрыты соединения формулы (L-5-4):
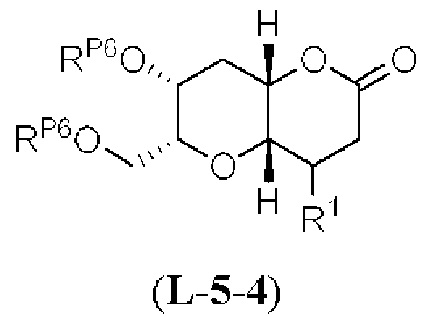
и их соли, где:
R1 независимо представляет собой водород, галоген или необязательно замещенный алкил; и
каждый RP6 независимо представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00568] Согласно определенным вариантам осуществления соединение представляет собой соединение формулы (E-L-7):
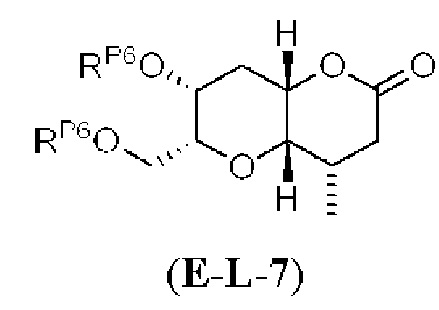
или его соль, где:
в каждом случае RP4 и RP6 независимо представляют собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
Группы RL, XL
[00569] Согласно определенным вариантам осуществления RL представляет собой необязательно замещенный сульфонил, необязательно замещенный сульфинил, необязательно замещенный фосфорил или необязательно замещенный ацил. Согласно определенным вариантам осуществления RL представляет собой необязательно замещенный сульфонил. Согласно определенным вариантам осуществления RL представляет собой необязательно замещенный сульфинил. Согласно определенным вариантам осуществления RL представляет собой необязательно замещенный фосфорил. Согласно определенным вариантам осуществления RL представляет собой необязательно замещенный ацил. Согласно определенным вариантам осуществления RL представляет собой -SO2-алкил. Согласно определенным вариантам осуществления RL представляет собой мезил (-SO2CH3; «Ms»). Согласно определенным вариантам осуществления RL представляет собой -SO2-арил. Согласно определенным вариантам осуществления RL представляет собой -SO2Ph. Согласно определенным вариантам осуществления RL представляет собой пара-толуолсульфонил (-SO2C6H4p-CH3; «тозил» или «Ts»). Согласно определенным вариантам осуществления RL представляет собой трифторметансульфонил (-SO2CF3; «трифлил» или «Tf»). Согласно определенным вариантам осуществления RL представляет собой пара-бромбензолсульфонил (-SO2C6H4p-Br; «брозил» или «Bs»), Согласно определенным вариантам осуществления RL представляет собой нонафторбутансульфонил (-OSO2(CF2)3CF3; «Nf»). Согласно определенным вариантам осуществления RL представляет собой 2- или 4-нитробензолсульфонил (-SO2C6H4p-NO2 или -SO2C6H4O-NO2; «нозил» или «Ns»). Согласно определенным вариантам осуществления RL представляет собой 2,2,2-трифторэтил-1-сульфонил. Согласно определенным вариантам осуществления RL представляет собой 5-(диметиламино)нафталин-1-сульфонил («дансил» или «Ds»).
[00570] В соответствии с определением в настоящем документе XL представляет собой галоген или уходящую группу. В соответствии с определением в настоящем документе согласно определенным вариантам осуществления XL представляет собой галоген. Согласно определенным вариантам осуществления XL представляет собой -Cl. Согласно определенным вариантам осуществления XL представляет собой -Br. Согласно определенным вариантам осуществления XL представляет собой -I.
Группа RS
[00571] В соответствии с определением в настоящем документе RS представляет собой необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил или необязательно замещенный гетероарил. Согласно определенным вариантам осуществления RS представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления RS представляет собой необязательно замещенный C1-6алкил. Согласно определенным вариантам осуществления RS представляет собой незамещенный C1-6алкил. Согласно определенным вариантам осуществления RS выбран из группы, состоящей из метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила и трет-бутила. Согласно определенным вариантам осуществления RS представляет собой необязательно замещенный карбоциклил. Согласно определенным вариантам осуществления RS представляет собой необязательно замещенный арил. Согласно определенным вариантам осуществления RS представляет собой необязательно замещенный гетероциклил. Согласно определенным вариантам осуществления RS представляет собой необязательно замещенный гетероарил. Согласно определенным вариантам осуществления RS представляет собой необязательно замещенный 6-членный гетероарил. Согласно определенным вариантам осуществления RS представляет собой необязательно замещенный 6-членный гетероарил, содержащий 1, 2 или 3 атома азота. Согласно определенным вариантам осуществления RS представляет собой необязательно замещенный пиридил. Согласно определенным вариантам осуществления RS представляет собой незамещенный пиридил (Ру). Согласно определенным вариантам осуществления RS представляет собой необязательно замещенный 2-пиридил. Согласно определенным вариантам осуществления RS представляет собой незамещенный 2-пиридил (2-Ру). Согласно определенным вариантам осуществления RS выбран из группы, состоящей из:  и
и  . Согласно определенным вариантам осуществления RS представляет собой
. Согласно определенным вариантам осуществления RS представляет собой  (сокращенно обозначаемый в настоящем документе как «2-Ру» или «Ру»).
(сокращенно обозначаемый в настоящем документе как «2-Ру» или «Ру»).
Группы X1, Х2, Х3 и X4
[00572] В соответствии с определением в настоящем документе X1 представляет собой галоген или уходящую группу. Согласно определенным вариантам осуществления X1 представляет собой галоген. Согласно определенным вариантам осуществления X1 представляет собой -Cl (т.е., хлорид). Согласно определенным вариантам осуществления X1 представляет собой -Br (т.е., бромид). Согласно определенным вариантам осуществления X1 представляет собой -I (т.е., йодид). Согласно определенным вариантам осуществления X1 представляет собой -F (т.е., фторид). Согласно определенным вариантам осуществления X1 представляет собой уходящую группу.
[00573] В соответствии с определением в настоящем документе X2 представляет собой галоген или уходящую группу. Согласно определенным вариантам осуществления X2 представляет собой галоген. Согласно определенным вариантам осуществления X2 представляет собой -Cl. Согласно определенным вариантам осуществления X2 представляет собой -Br. Согласно определенным вариантам осуществления X2 представляет собой -I. Согласно определенным вариантам осуществления X2 представляет собой -F. Согласно определенным вариантам осуществления X2 представляет собой уходящую группу.
[00574] В соответствии с определением в настоящем документе X3 представляет собой галоген или уходящую группу. Согласно определенным вариантам осуществления X3 представляет собой галоген. Согласно определенным вариантам осуществления X3 представляет собой -Cl. Согласно определенным вариантам осуществления X3 представляет собой -Br. Согласно определенным вариантам осуществления X3 представляет собой -I. Согласно определенным вариантам осуществления X3 представляет собой -F. Согласно определенным вариантам осуществления X3 представляет собой уходящую группу.
[00575] В соответствии с определением в настоящем документе X4 представляет собой галоген или уходящую группу. Согласно определенным вариантам осуществления X4 представляет собой галоген. Согласно определенным вариантам осуществления X4 представляет собой -Cl. Согласно определенным вариантам осуществления X4 представляет собой -Br. Согласно определенным вариантам осуществления X4 представляет собой -I. Согласно определенным вариантам осуществления X4 представляет собой -F. Согласно определенным вариантам осуществления X4 представляет собой уходящую группу.
Группы R1, R2, R3, R4, R5 и R6
[00576] В соответствии с определением в настоящем документе R1 представляет собой водород, галоген или необязательно замещенный алкил. Согласно определенным вариантам осуществления R1 представляет собой водород. Согласно определенным вариантам осуществления R1 представляет собой галоген. Согласно определенным вариантам осуществления R1 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления R1 представляет собой необязательно замещенный C1-6алкил. Согласно определенным вариантам осуществления R1 представляет собой незамещенный C1-6алкил. Согласно определенным вариантам осуществления R1 представляет собой необязательно замещенный C1-3алкил. Согласно определенным вариантам осуществления R1 представляет собой незамещенный C1-3алкил. Согласно определенным вариантам осуществления R1 выбран из группы, состоящей из метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила и трет-бутила. Согласно определенным вариантам осуществления R1 представляет собой метил.
[00577] В соответствии с определением в настоящем документе R2 представляет собой водород, галоген или необязательно замещенный алкил. Согласно определенным вариантам осуществления R2 представляет собой водород. Согласно определенным вариантам осуществления R2 представляет собой галоген. Согласно определенным вариантам осуществления R2 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления R2 представляет собой необязательно замещенный C1-6алкил. Согласно определенным вариантам осуществления R2 представляет собой незамещенный C1-6алкил. Согласно определенным вариантам осуществления R2 представляет собой необязательно замещенный C1-3алкил. Согласно определенным вариантам осуществления R2 представляет собой незамещенный C1-3алкил. Согласно определенным вариантам осуществления R2 выбран из группы, состоящей из метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила и трет-бутила. Согласно определенным вариантам осуществления R2 представляет собой метил.
[00578] В соответствии с определением в настоящем документе R3 представляет собой водород, галоген или необязательно замещенный алкил. Согласно определенным вариантам осуществления R3 представляет собой водород. Согласно определенным вариантам осуществления R3 представляет собой галоген. Согласно определенным вариантам осуществления R3 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления R3 представляет собой необязательно замещенный C1-6алкил. Согласно определенным вариантам осуществления R3 представляет собой незамещенный C1-6алкил. Согласно определенным вариантам осуществления R3 представляет собой необязательно замещенный C1-3алкил. Согласно определенным вариантам осуществления R3 представляет собой незамещенный C1-3алкил. Согласно определенным вариантам осуществления R3 выбран из группы, состоящей из метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила и трет-бутила. Согласно определенным вариантам осуществления R3 представляет собой метил.
[00579] В соответствии с определением в настоящем документе в каждом случае R4 независимо представляет собой водород, галоген или необязательно замещенный алкил; и два R4 необязательно образуют вместе 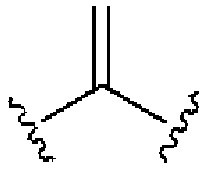 . Согласно определенным вариантам осуществления R4 представляет собой водород. Согласно определенным вариантам осуществления R4 представляет собой галоген. Согласно определенным вариантам осуществления R4 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления R4 представляет собой необязательно замещенный C1-6алкил. Согласно определенным вариантам осуществления R4 представляет собой незамещенный C1-6алкил. Согласно определенным вариантам осуществления R4 представляет собой необязательно замещенный C1-3алкил. Согласно определенным вариантам осуществления R4 представляет собой незамещенный C1-3алкил. Согласно определенным вариантам осуществления R4 выбран из группы, состоящей из метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила, и трет-бутила. Согласно определенным вариантам осуществления R4 представляет собой метил. Согласно определенным вариантам осуществления два R4 образуют вместе
. Согласно определенным вариантам осуществления R4 представляет собой водород. Согласно определенным вариантам осуществления R4 представляет собой галоген. Согласно определенным вариантам осуществления R4 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления R4 представляет собой необязательно замещенный C1-6алкил. Согласно определенным вариантам осуществления R4 представляет собой незамещенный C1-6алкил. Согласно определенным вариантам осуществления R4 представляет собой необязательно замещенный C1-3алкил. Согласно определенным вариантам осуществления R4 представляет собой незамещенный C1-3алкил. Согласно определенным вариантам осуществления R4 выбран из группы, состоящей из метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила, и трет-бутила. Согласно определенным вариантам осуществления R4 представляет собой метил. Согласно определенным вариантам осуществления два R4 образуют вместе  .
.
[00580] В соответствии с определением в настоящем документе R5 представляет собой водород, галоген или необязательно замещенный алкил. Согласно определенным вариантам осуществления R5 представляет собой водород. Согласно определенным вариантам осуществления R5 представляет собой галоген. Согласно определенным вариантам осуществления R3 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления R5 представляет собой необязательно замещенный C1-6алкил. Согласно определенным вариантам осуществления R5 представляет собой незамещенный C1-6алкил. Согласно определенным вариантам осуществления R5 представляет собой необязательно замещенный C1-3алкил. Согласно определенным вариантам осуществления R5 представляет собой незамещенный C1-3алкил. Согласно определенным вариантам осуществления R5 выбран из группы, состоящей из метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила и трет-бутила. Согласно определенным вариантам осуществления R5 представляет собой метил.
[00581] В соответствии с определением в настоящем документе в каждом случае R6 независимо представляет собой водород, галоген или необязательно замещенный алкил; и два R6 необязательно образуют вместе  . Согласно определенным вариантам осуществления R6 представляет собой водород. Согласно определенным вариантам осуществления R6 представляет собой галоген. Согласно определенным вариантам осуществления R6 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления R6 представляет собой необязательно замещенный C1-6алкил. Согласно определенным вариантам осуществления R6 представляет собой незамещенный C1-6алкил. Согласно определенным вариантам осуществления R6 представляет собой необязательно замещенный C1-3алкил. Согласно определенным вариантам осуществления R6 представляет собой незамещенный C1-3алкил. Согласно определенным вариантам осуществления R6 выбран из группы, состоящей из метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила и трет-бутила. Согласно определенным вариантам осуществления R6 представляет собой метил. Согласно определенным вариантам осуществления два R6 образуют вместе
. Согласно определенным вариантам осуществления R6 представляет собой водород. Согласно определенным вариантам осуществления R6 представляет собой галоген. Согласно определенным вариантам осуществления R6 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления R6 представляет собой необязательно замещенный C1-6алкил. Согласно определенным вариантам осуществления R6 представляет собой незамещенный C1-6алкил. Согласно определенным вариантам осуществления R6 представляет собой необязательно замещенный C1-3алкил. Согласно определенным вариантам осуществления R6 представляет собой незамещенный C1-3алкил. Согласно определенным вариантам осуществления R6 выбран из группы, состоящей из метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила и трет-бутила. Согласно определенным вариантам осуществления R6 представляет собой метил. Согласно определенным вариантам осуществления два R6 образуют вместе  .
.
Группы R7 и R8
[00582] В соответствии с определением в настоящем документе R7 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу. Согласно определенным вариантам осуществления R7 представляет собой водород. Согласно определенным вариантам осуществления R7 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления Согласно определенным вариантам осуществления R7 представляет собой необязательно замещенный C1-6алкил. Согласно определенным вариантам осуществления R7 представляет собой незамещенный C1-6алкил. Согласно определенным вариантам осуществления R7 представляет собой необязательно замещенный C1-3алкил. Согласно определенным вариантам осуществления R7 представляет собой незамещенный C1-3алкил. Согласно определенным вариантам осуществления R7 выбран из группы, состоящей из метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила и трет-бутила. Согласно определенным вариантам осуществления R7 представляет собой метил. Согласно определенным вариантам осуществления R7 представляет собой этил. Согласно определенным вариантам осуществления R7 представляет собой необязательно замещенный карбоциклил. Согласно определенным вариантам осуществления R7 представляет собой необязательно замещенный арил. Согласно определенным вариантам осуществления R7 представляет собой необязательно замещенный гетероциклил. Согласно определенным вариантам осуществления R7 представляет собой необязательно замещенный гетероарил. Согласно определенным вариантам осуществления R7 представляет собой необязательно замещенный ацил. Согласно определенным вариантам осуществления R7 представляет собой кислород-защитную группу. Согласно определенным вариантам осуществления R7 представляет собой необязательно замещенную бензильную защитную группу. Согласно определенным вариантам осуществления R7 представляет собой бензил (-CH2Ph; «Bn»).
[00583] В соответствии с определением в настоящем документе R8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный карбоциклил, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный гетероарил, необязательно замещенный ацил или кислород-защитную группу. Согласно определенным вариантам осуществления R8 представляет собой водород. Согласно определенным вариантам осуществления R8 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления Согласно определенным вариантам осуществления R8 представляет собой необязательно замещенный C1-6алкил. Согласно определенным вариантам осуществления R8 представляет собой незамещенный C1-6алкил. Согласно определенным вариантам осуществления R8 представляет собой необязательно замещенный C1-3алкил. Согласно определенным вариантам осуществления R8 представляет собой незамещенный C1-3алкил. Согласно определенным вариантам осуществления R8 выбран из группы, состоящей из метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила, и трет-бутила. Согласно определенным вариантам осуществления R8 представляет собой метил. Согласно определенным вариантам осуществления R8 представляет собой этил. Согласно определенным вариантам осуществления R8 представляет собой необязательно замещенный карбоциклил. Согласно определенным вариантам осуществления R8 представляет собой необязательно замещенный арил. Согласно определенным вариантам осуществления R8 представляет собой необязательно замещенный гетероциклил. Согласно определенным вариантам осуществления R8 представляет собой необязательно замещенный гетероарил. Согласно определенным вариантам осуществления R8 представляет собой необязательно замещенный ацил. Согласно определенным вариантам осуществления R8 представляет собой кислород-защитную группу. Согласно определенным вариантам осуществления R8 представляет собой необязательно замещенную бензильную защитную группу. Согласно определенным вариантам осуществления R8 представляет собой бензил (-CH2Ph; «Bn»).
Группы RX и RY
[00584] В соответствии с определением в настоящем документе RX представляет собой водород или -ORXa. Согласно определенным вариантам осуществления RX представляет собой водород. Согласно определенным вариантам осуществления RX представляет собой -ORXa.
[00585] В соответствии с общим определением в настоящем документе RXa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу. Согласно определенным вариантам осуществления RXa представляет собой водород. Согласно определенным вариантам осуществления RXa представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления RXa представляет собой необязательно замещенный ацил. Согласно определенным вариантам осуществления RXa представляет собой кислород-защитную группу. Согласно определенным вариантам осуществления RXa представляет собой необязательно замещенный аллил. Согласно определенным вариантам осуществления RXa представляет собой  (аллил).
(аллил).
[00586] В соответствии с определением в настоящем документе RY представляет собой водород или -ORYa. Согласно определенным вариантам осуществления RY представляет собой водород. Согласно определенным вариантам осуществления RY представляет собой -ORYa.
[00587] В соответствии с общим определением в настоящем документе RYa представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу. Согласно определенным вариантам осуществления RYa представляет собой водород. Согласно определенным вариантам осуществления RYa представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления RYa представляет собой необязательно замещенный ацил. Согласно определенным вариантам осуществления RYa представляет собой кислород-защитную группу. Согласно определенным вариантам осуществления RYa представляет собой необязательно замещенный аллил. Согласно определенным вариантам осуществления RYa представляет собой  (аллил).
(аллил).
[00588] Согласно определенным вариантам осуществления RXa и RYa объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклила. Согласно определенным вариантам осуществления RXa и RYa объединены вместе с лежащими между ними атомами с образованием необязательно замещенного 5-членного гетероциклила. Согласно определенным вариантам осуществления RXa и RYa объединены вместе с лежащими между ними атомами с образованием необязательно замещенного 1,3-диоксоланового кольца. Согласно определенным вариантам осуществления RXa и RYa объединены вместе с лежащими между ними атомами с образованием следующей структуры:  . Согласно определенным вариантам осуществления RXa и RYa объединены вместе с лежащими между ними атомами с образованием следующей структуры:
. Согласно определенным вариантам осуществления RXa и RYa объединены вместе с лежащими между ними атомами с образованием следующей структуры: 
Группы RP1, RP2, RP3, RP4, RF5, RP6, RP7, RP8, RP9 и RP10
[00589] В соответствии с определением в настоящем документе RP1 представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу. Согласно определенным вариантам осуществления RP1 представляет собой водород. Согласно определенным вариантам осуществления RP1 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления Согласно определенным вариантам осуществления RP1 представляет собой необязательно замещенный C1-6алкил. Согласно определенным вариантам осуществления RP1 представляет собой незамещенный C1-6алкил. Согласно определенным вариантам осуществления RP1 представляет собой необязательно замещенный C1-3алкил. Согласно определенным вариантам осуществления RP1 представляет собой незамещенный C1-3алкил. Согласно определенным вариантам осуществления RP1 выбран из группы, состоящей из метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила и трет-бутила. Согласно определенным вариантам осуществления RP1 представляет собой необязательно замещенный ацил. Согласно определенным вариантам осуществления RP1 представляет собой кислород-защитную группу. Согласно определенным вариантам осуществления RP1 представляет собой необязательно замещенный аллил. Согласно определенным вариантам осуществления RP1 представляет собой аллил. Согласно определенным вариантам осуществления RP1 представляет собой необязательно замещенный силил. Согласно определенным вариантам осуществления RP1 представляет собой триалкилсилил. Согласно определенным вариантам осуществления RP1 представляет собой триэтилсилил (-SiEt3; «TES»). Согласно определенным вариантам осуществления RP1 представляет собой триметилсилил (-SiMe3; «TMS»). Согласно определенным вариантам осуществления RP1 представляет собой трет-бутил-диметилсилил (-Sit-BuMe2; «TBS»). Согласно определенным вариантам осуществления RP1 представляет собой трет-бутал-дифенилсилил (-Sit-BuPh2; «TBDPS»). Согласно определенным вариантам осуществления RP1 представляет собой необязательно замещенную бензильную защитную группу. Согласно определенным вариантам осуществления RP1 представляет собой бензил (-CH2Ph; «Bn»). Согласно определенным вариантам осуществления RP1 представляет собой метоксибензильную защитную группу. Согласно определенным вариантам осуществления RP1 представляет собой пара-метоксибензил:  («МРМ» или «РМВ»).
(«МРМ» или «РМВ»).
[00590] Согласно определенным вариантам осуществления RP1 и RP2 объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00591] В соответствии с определением в настоящем документе RP2 представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу. Согласно определенным вариантам осуществления RP2 представляет собой водород. Согласно определенным вариантам осуществления RP2 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления RP2 представляет собой необязательно замещенный C1-6алкил. Согласно определенным вариантам осуществления RP2 представляет собой незамещенный C1-6алкил. Согласно определенным вариантам осуществления RP2 представляет собой необязательно замещенный C1-3алкил. Согласно определенным вариантам осуществления RP2 представляет собой незамещенный С1-3алкил. Согласно определенным вариантам осуществления RP2 выбран из группы, состоящей из метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила и трет-бутила. Согласно определенным вариантам осуществления RP2 представляет собой необязательно замещенный ацил. Согласно определенным вариантам осуществления RP2 представляет собой кислород-защитную группу. Согласно определенным вариантам осуществления RP2 представляет собой необязательно замещенный аллил. Согласно определенным вариантам осуществления RP2 представляет собой аллил. Согласно определенным вариантам осуществления представляет собой необязательно замещенный силил. Согласно определенным вариантам осуществления RP2 представляет собой триалкилсилил. Согласно определенным вариантам осуществления RP2 представляет собой триэтилсилил (-SiEt3; «TES»). Согласно определенным вариантам осуществления RP2 представляет собой триметилсилил (-SiMe3; «TMS»). Согласно определенным вариантам осуществления RP2 представляет собой трет-бутил-диметилсилил (-Sit-BuMe2; «TBS»). Согласно определенным вариантам осуществления RP2 представляет собой трет-бутил-дифенилсилил (-Sit-BuPh2; «TBDPS»). Согласно определенным вариантам осуществления RP2 представляет собой необязательно замещенную бензильную защитную группу. Согласно определенным вариантам осуществления RP2 представляет собой бензил (-Ch2Ph; «Bn»). Согласно определенным вариантам осуществления RP2 представляет собой метоксибензильную защитную группу. Согласно определенным вариантам осуществления RP2 представляет собой пара-метоксибензил:  («МРМ» или «РМВ»).
(«МРМ» или «РМВ»).
[00592] Согласно определенным вариантам осуществления RP3 и RP3 объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила.
[00593] В соответствии с определением в настоящем документе RP3 представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу. Согласно определенным вариантам осуществления RP3 представляет собой водород. Согласно определенным вариантам осуществления RP3 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления RP3 представляет собой необязательно замещенный C1-6алкил. Согласно определенным вариантам осуществления RP3 представляет собой незамещенный C1-6алкил. Согласно определенным вариантам осуществления RP3 представляет собой необязательно замещенный C1-3алкил. Согласно определенным вариантам осуществления RP3 представляет собой незамещенный C1-3алкил. Согласно определенным вариантам осуществления RP3 выбран из группы, состоящей из метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила и трет-бутила. Согласно определенным вариантам осуществления RP3 представляет собой необязательно замещенный ацил. Согласно определенным вариантам осуществления RP3 представляет собой кислород-защитную группу. Согласно определенным вариантам осуществления RP3 представляет собой необязательно замещенный аллил. Согласно определенным вариантам осуществления RP3 представляет собой аллил. Согласно определенным вариантам осуществления представляет собой необязательно замещенный силил. Согласно определенным вариантам осуществления RP3 представляет собой триалкилсилил. Согласно определенным вариантам осуществления RP3 представляет собой триэтилсилил (-SiEt3; «TES»). Согласно определенным вариантам осуществления RP3 представляет собой триметилсилил (-SiMe3; «TMS»). Согласно определенным вариантам осуществления RP3 представляет собой трет-бутилдиметилсилил (-Sit-BuMe2; «TBS»). Согласно определенным вариантам осуществления RP3 представляет собой трет-бутил-дифенилсилил (-Sit-BuPh2; «TBDPS»). Согласно определенным вариантам осуществления RP3 представляет собой необязательно замещенную бензильную защитную группу. Согласно определенным вариантам осуществления RP3 представляет собой бензил (-CH2Ph; «Bn»). Согласно определенным вариантам осуществления RP3 представляет собой метоксибензильную защитную группу. Согласно определенным вариантам осуществления RP3 представляет собой пара-метоксибензил:  («МРМ» или «РМВ»).
(«МРМ» или «РМВ»).
[00594] В соответствии с определением в настоящем документе RP4 представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу. Согласно определенным вариантам осуществления RP4 представляет собой водород. Согласно определенным вариантам осуществления RP4 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления RP4 представляет собой необязательно замещенный C1-6алкил. Согласно определенным вариантам осуществления RP4 представляет собой незамещенный C1-6алкил. Согласно определенным вариантам осуществления RP4 представляет собой необязательно замещенный C1-3алкил. Согласно определенным вариантам осуществления RP4 представляет собой незамещенный C1-3алкил. Согласно определенным вариантам осуществления RP4 выбран из группы, состоящей из метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила и трет-бутила. Согласно определенным вариантам осуществления RP4 представляет собой необязательно замещенный ацил. Согласно определенным вариантам осуществления RP4 представляет собой кислород-защитную группу. Согласно определенным вариантам осуществления RP4 представляет собой необязательно замещенный аллил. Согласно определенным вариантам осуществления RP4 представляет собой аллил. Согласно определенным вариантам осуществления представляет собой необязательно замещенный силил. Согласно определенным вариантам осуществления RP4 представляет собой триалкилсилил. Согласно определенным вариантам осуществления RP4 представляет собой триэтилсилил (-SiEt3; «TES»). Согласно определенным вариантам осуществления RP4 представляет собой триметилсилил (-SiMe3; «TMS»). Согласно определенным вариантам осуществления RP4 представляет собой трет-бутил-диметилсилил (-Sit-BuMe2; «TBS»). Согласно определенным вариантам осуществления RP4 представляет собой трет-бутил-дифенилсилил (-Sit-BuPh2; «TBDPS»). Согласно определенным вариантам осуществления RP4 представляет собой необязательно замещенную бензильную защитную группу. Согласно определенным вариантам осуществления RP4 представляет собой бензил (-CH2Ph; «Bn»). Согласно определенным вариантам осуществления RP4 представляет собой метоксибензильную защитную группу. Согласно определенным вариантам осуществления RP4 представляет собой пара-метоксибензил:  («МРМ» или «РМВ»).
(«МРМ» или «РМВ»).
[00595] В соответствии с определением в настоящем документе RP5 представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP5 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила. Согласно определенным вариантам осуществления RP5 представляет собой водород. Согласно определенным вариантам осуществления RP5 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления RP5 представляет собой необязательно замещенный C1-6алкил. Согласно определенным вариантам осуществления RP5 представляет собой незамещенный C1-6алкил. Согласно определенным вариантам осуществления RP5 представляет собой необязательно замещенный C1-3алкил. Согласно определенным вариантам осуществления RP5 представляет собой незамещенный C1-3алкил. Согласно определенным вариантам осуществления RP5 выбран из группы, состоящей из метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила и трет-бутила. Согласно определенным вариантам осуществления RP5 представляет собой необязательно замещенный ацил. Согласно определенным вариантам осуществления представляет собой кислород-защитную группу. Согласно определенным вариантам осуществления RP5 представляет собой необязательно замещенный аллил. Согласно определенным вариантам осуществления RP5 представляет собой аллил. Согласно определенным вариантам осуществления RP5 представляет собой необязательно замещенный силил. Согласно определенным вариантам осуществления RP5 представляет собой триалкилсилил. Согласно определенным вариантам осуществления RP5 представляет собой триэтилсилил (-SiEt3; «TES»). Согласно определенным вариантам осуществления RP5 представляет собой триметилсилил (-SiMe3; «TMS»). Согласно определенным вариантам осуществления RP5 представляет собой трет-бутил-диметилсилил (-Sit-BuMe2; «TBS»). Согласно определенным вариантам осуществления RP5 представляет собой трет-бутил-дифенилсилил (-Sit-BuPh2; «TBDPS»). Согласно определенным вариантам осуществления RP5 представляет собой необязательно замещенную бензильную защитную группу. Согласно определенным вариантам осуществления RP5 представляет собой бензил (-CH2Ph; «Bn»). Согласно определенным вариантам осуществления RP5 представляет собой метоксибензильную защитную группу. Согласно определенным вариантам осуществления RP5 представляет собой пара-метоксибензил:  («МРМ» или «РМВ»). Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием необязательно замещенного шестичленного гетероциклила. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:
(«МРМ» или «РМВ»). Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием необязательно замещенного шестичленного гетероциклила. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы: 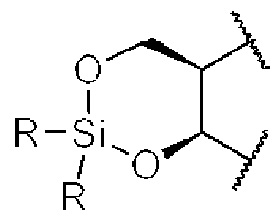 . Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:
. Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы: 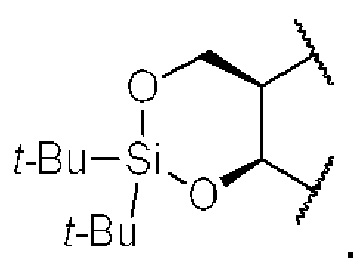 Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:
Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы: 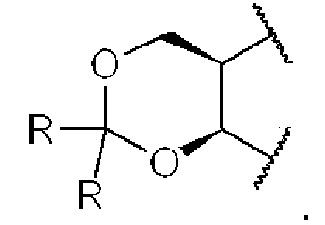 Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы:
Согласно определенным вариантам осуществления два RP5 объединены с лежащими между ними атомами с образованием кольца формулы: 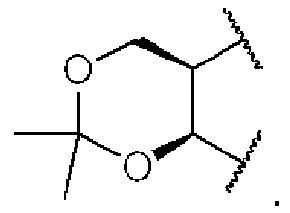
[00596] В соответствии с определением в настоящем документе RP6 представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу; где две группы RP6 необязательно объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила. Согласно определенным вариантам осуществления RP6 представляет собой водород. Согласно определенным вариантам осуществления RP6 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления RP6 представляет собой необязательно замещенный С1-6алкил. Согласно определенным вариантам осуществления RP6 представляет собой незамещенный C1-6алкил. Согласно определенным вариантам осуществления RP6 представляет собой необязательно замещенный С1-3алкил. Согласно определенным вариантам осуществления RP6 представляет собой незамещенный С1-3алкил. Согласно определенным вариантам осуществления RP6 выбран из группы, состоящей из метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила и трет-бутила. Согласно определенным вариантам осуществления RP6 представляет собой необязательно замещенный ацил. Согласно определенным вариантам осуществления RP6 представляет собой кислород-защитную группу. Согласно определенным вариантам осуществления RP6 представляет собой необязательно замещенный аллил. Согласно определенным вариантам осуществления RP6 представляет собой аллил. Согласно определенным вариантам осуществления RP6 представляет собой необязательно замещенный силил. Согласно определенным вариантам осуществления RP6 представляет собой триалкилсилил. Согласно определенным вариантам осуществления RP6 представляет собой триэтилсилил (-SiEt3; «TES»). Согласно определенным вариантам осуществления RP6 представляет собой триметилсилил (-SiMe3; «TMS»). Согласно определенным вариантам осуществления RP6 представляет собой трет-бутил-диметилсилил (-Sit-BuMe2; «TBS»). Согласно определенным вариантам осуществления RP6 представляет собой трет-бутил-дифенилсилил (-Sit-BuPh2; «TBDPS»). Согласно определенным вариантам осуществления RP6 представляет собой необязательно замещенную бензильную защитную группу. Согласно определенным вариантам осуществления RP6 представляет собой бензил (-CH2Ph; «Bn»). Согласно определенным вариантам осуществления RP6 представляет собой метоксибензильную защитную группу. Согласно определенным вариантам осуществления RP6 представляет собой пара-метоксибензил:  («МРМ» или «РМВ»). Согласно определенным вариантам осуществления два RP6 объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила. Согласно определенным вариантам осуществления два RP6 объединены с лежащими между ними атомами с образованием необязательно замещенного шестичленного гетероциклила. Согласно определенным вариантам осуществления два RP6 объединены с лежащими между ними атомами с образованием кольца формулы:
(«МРМ» или «РМВ»). Согласно определенным вариантам осуществления два RP6 объединены с лежащими между ними атомами с образованием необязательно замещенного гетероциклила. Согласно определенным вариантам осуществления два RP6 объединены с лежащими между ними атомами с образованием необязательно замещенного шестичленного гетероциклила. Согласно определенным вариантам осуществления два RP6 объединены с лежащими между ними атомами с образованием кольца формулы:  Согласно определенным вариантам осуществления два RP6 объединены с лежащими между ними атомами с образованием кольца формулы:
Согласно определенным вариантам осуществления два RP6 объединены с лежащими между ними атомами с образованием кольца формулы: 
[00597] В соответствии с определением в настоящем документе согласно определенным вариантам осуществления RP7 представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу. Согласно другим вариантам осуществления RP7 представляет собой необязательно замещенный сульфонил, необязательно замещенный сульфинил, необязательно замещенный фосфорил, необязательно замещенный ацил или кислород-защитную группу. Согласно определенным вариантам осуществления RP7 представляет собой необязательно замещенный сульфонил. Согласно определенным вариантам осуществления RP7 представляет собой мезил (-SO2CH3; «Ms»). Согласно определенным вариантам осуществления RP7 представляет собой тозил (-SO2C6H4p-CH3; «Ts»). Согласно определенным вариантам осуществления RP7 представляет собой трифлил (-SO2CF3; «Tf»). Согласно определенным вариантам осуществления RP7 представляет собой необязательно замещенный сульфинил. Согласно определенным вариантам осуществления RP7 представляет собой необязательно замещенный фосфорил. Согласно определенным вариантам осуществления RP7 представляет собой необязательно замещенный ацил.
[00598] Согласно определенным вариантам осуществления RP7 представляет собой водород. Согласно определенным вариантам осуществления RP7 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления представляет собой необязательно замещенный С1-6алкил. Согласно определенным вариантам осуществления RP7 представляет собой незамещенный C1-6алкил. Согласно определенным вариантам осуществления RP7 представляет собой необязательно замещенный С1-3-залкил. Согласно определенным вариантам осуществления RP7 представляет собой незамещенный С1-3алкил. Согласно определенным вариантам осуществления RP7 выбран из группы, состоящей из метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила и трет-бутила. Согласно определенным вариантам осуществления RP7 представляет собой необязательно замещенный ацил. Согласно определенным вариантам осуществления RP7 представляет собой кислород-защитную группу. Согласно определенным вариантам осуществления RP7 представляет собой необязательно замещенный аллил. Согласно определенным вариантам осуществления RP7 представляет собой аллил. Согласно определенным вариантам осуществления RP7 представляет собой необязательно замещенный силил. Согласно определенным вариантам осуществления RP7 представляет собой триал кил силил. Согласно определенным вариантам осуществления RP7 представляет собой триэтилсилил (-SiEt3; «TES»). Согласно определенным вариантам осуществления RP7 представляет собой триметилсилил (-SiMe3; «TMS»). Согласно определенным вариантам осуществления RP7 представляет собой трет-бутил-диметилсилил (-Sit-BuMe2; «TBS»). Согласно определенным вариантам осуществления RP7 представляет собой трет-бутил-дифенилсилил (-Sit-BuPh2; «TBDPS»). Согласно определенным вариантам осуществления RP7 представляет собой необязательно замещенную бензильную защитную группу. Согласно определенным вариантам осуществления RP7 представляет собой бензил (-CH2Ph; «Bn»). Согласно определенным вариантам осуществления RP7 представляет собой метоксибензильную защитную группу. Согласно определенным вариантам осуществления RP7 представляет собой пара-метоксибензил:  («МРМ» или «РМВ»).
(«МРМ» или «РМВ»).
[00599] В соответствии с определением в настоящем документе RP8 представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу. Согласно определенным вариантам осуществления RP8 представляет собой водород. Согласно определенным вариантам осуществления RP8 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления RP8 представляет собой необязательно замещенный С1-6алкил. Согласно определенным вариантам осуществления RP8 представляет собой незамещенный C1-6алкил. Согласно определенным вариантам осуществления RP8 представляет собой необязательно замещенный C1-3алкил. Согласно определенным вариантам осуществления RP8 представляет собой незамещенный C1-3алкил. Согласно определенным вариантам осуществления RP8 выбран из группы, состоящей из метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила и трет-бутила. Согласно определенным вариантам осуществления RP8 представляет собой необязательно замещенный ацил. Согласно определенным вариантам осуществления RP8 представляет собой кислород-защитную группу. Согласно определенным вариантам осуществления RP8 представляет собой необязательно замещенный аллил. Согласно определенным вариантам осуществления RP8 представляет собой аллил. Согласно определенным вариантам осуществления RP8 представляет собой необязательно замещенный силил. Согласно определенным вариантам осуществления RP8 представляет собой триал кил силил. Согласно определенным вариантам осуществления RP8 представляет собой триэтилсилил (-SiEt3; «TES»). Согласно определенным вариантам осуществления RP8 представляет собой триметилсилил (-SiMe3; «TMS»). Согласно определенным вариантам осуществления RP8 представляет собой трет-бутил-диметилсилил (-Sit-BuMe2; «TBS»). Согласно определенным вариантам осуществления RP8 представляет собой трет-бутил-дифенилсилил (-Sit-BuPh2; «TBDPS»). Согласно определенным вариантам осуществления RP8 представляет собой необязательно замещенную бензильную защитную группу. Согласно определенным вариантам осуществления RP8 представляет собой бензил (-CH2Ph; «Bn»). Согласно определенным вариантам осуществления RP8 представляет собой метоксибензильную защитную группу. Согласно определенным вариантам осуществления RP8 представляет собой пара-метоксибензил:  («МРМ» или «РМВ»).
(«МРМ» или «РМВ»).
[00600] В соответствии с определением в настоящем документе RP9 представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу. Согласно определенным вариантам осуществления RP9 представляет собой водород. Согласно определенным вариантам осуществления RP9 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления RP9 представляет собой необязательно замещенный С1-6алкил. Согласно определенным вариантам осуществления RP9 представляет собой незамещенный C1-6алкил. Согласно определенным вариантам осуществления RP9 представляет собой необязательно замещенный C1-3алкил. Согласно определенным вариантам осуществления RP9 представляет собой незамещенный С1-3алкил. Согласно определенным вариантам осуществления RP9 выбран из группы, состоящей из метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила и трет-бутила. Согласно определенным вариантам осуществления RP9 представляет собой необязательно замещенный ацил. Согласно определенным вариантам осуществления RP9 представляет собой кислород-защитную группу. Согласно определенным вариантам осуществления RP9 представляет собой необязательно замещенный аллил. Согласно определенным вариантам осуществления RP9 представляет собой аллил. Согласно определенным вариантам осуществления RP9 представляет собой необязательно замещенный силил. Согласно определенным вариантам осуществления RP9 представляет собой триал кил силил. Согласно определенным вариантам осуществления RP9 представляет собой триэтилсилил (-SiEt3; «TES»). Согласно определенным вариантам осуществления RP9 представляет собой триметилсилил (-SiMe3; «TMS»). Согласно определенным вариантам осуществления RP9 представляет собой трет-бутил-диметилсилил (-Sit-BuMe2; «TBS»). Согласно определенным вариантам осуществления RP9 представляет собой трет-бутил-дифенилсилил (-Sit-BuPh2; «TBDPS»). Согласно определенным вариантам осуществления RP9 представляет собой необязательно замещенную бензильную защитную группу. Согласно определенным вариантам осуществления RP9 представляет собой бензил (-CH2Ph; «Bn»). Согласно определенным вариантам осуществления RP9 представляет собой метоксибензильную защитную группу. Согласно определенным вариантам осуществления RP9 представляет собой пара-метоксибензил:  («МРМ» или «РМВ»). Согласно определенным вариантам осуществления два RP9 объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклила. Согласно определенным вариантам осуществления два RP9 объединены вместе с образованием
(«МРМ» или «РМВ»). Согласно определенным вариантам осуществления два RP9 объединены вместе с лежащими между ними атомами с образованием необязательно замещенного гетероциклила. Согласно определенным вариантам осуществления два RP9 объединены вместе с образованием  Согласно определенным вариантам осуществления два RP9 объединены вместе с образованием
Согласно определенным вариантам осуществления два RP9 объединены вместе с образованием 
[00601] В соответствии с определением в настоящем документе RP10 представляет собой водород, необязательно замещенный алкил, необязательно замещенный ацил или кислород-защитную группу. Согласно определенным вариантам осуществления RP10 представляет собой водород. Согласно определенным вариантам осуществления RP10 представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления RP10 представляет собой необязательно замещенный C1-6алкил. Согласно определенным вариантам осуществления RP10 представляет собой незамещенный C1-6алкил. Согласно определенным вариантам осуществления RP10 представляет собой необязательно замещенный C1-3алкил. Согласно определенным вариантам осуществления RP10 представляет собой незамещенный С1-3алкил. Согласно определенным вариантам осуществления RP10 выбран из группы, состоящей из метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила и трет-бутила. Согласно определенным вариантам осуществления RP10 представляет собой необязательно замещенный ацил. Согласно определенным вариантам осуществления RP10 представляет собой кислород-защитную группу. Согласно определенным вариантам осуществления RP10 представляет собой необязательно замещенный аллил. Согласно определенным вариантам осуществления RP10 представляет собой аллил. Согласно определенным вариантам осуществления RP10 представляет собой необязательно замещенный силил. Согласно определенным вариантам осуществления RP10 представляет собой триалкилсилил. Согласно определенным вариантам осуществления RP10 представляет собой триэтилсилил (-SiEt3; «TES»). Согласно определенным вариантам осуществления RP10 представляет собой триметилсилил (-SiMe3; «TMS»). Согласно определенным вариантам осуществления RP10 представляет собой трет-бутил-диметилсилил (-Sit-BuMe2; «TBS»). Согласно определенным вариантам осуществления RP10 представляет собой трет-бутил-дифенилсилил (-Sit-BuPh2; «TBDPS»). Согласно определенным вариантам осуществления RP10 представляет собой необязательно замещенную бензильную защитную группу. Согласно определенным вариантам осуществления RP10 представляет собой бензил (-CH2Ph; «Bn»). Согласно определенным вариантам осуществления RP10 представляет собой метоксибензильную защитную группу. Согласно определенным вариантам осуществления RP10 представляет собой пара-метоксибензил:  («МРМ» или «РМВ»).
(«МРМ» или «РМВ»).
Группа R
[00602] В соответствии с общим определением в настоящем документе R представляет собой водород или необязательно замещенный алкил. Согласно определенным вариантам осуществления R представляет собой водород. Согласно определенным вариантам осуществления R представляет собой необязательно замещенный алкил. Согласно определенным вариантам осуществления R представляет собой необязательно замещенный C1-6алкил. Согласно определенным вариантам осуществления R представляет собой незамещенный С1-6алкил. Согласно определенным вариантам осуществления R представляет собой необязательно замещенный C1-3алкил. Согласно определенным вариантам осуществления R представляет собой незамещенный С1-3алкил. Согласно определенным вариантам осуществления R выбран из группы, состоящей из метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутшт и трет-бутила.
ПРИМЕРЫ
Zr/Ni-опосредованные реакции кетолизации
[00603] Структура (S,S)-1-C может быть получена непосредственно посредством сочетания (S)-1-А с (S)-1-В (Фигура 2А). Хотя и будучи привлекательной, последовательность вызывает сложности. Например, основанный на анионах синтез кетонов может быть проблематичным по причине присутствия группы O-R в β- и β'-положениях. Концепция «обращения поляризации», представленная химией дитианов, является историческим решением этого типа проблемы (для обзора см., например, Seebach, D. Angew. Chem. Int. Ed. 1979, 18, 239; Corey, E.J.; Seeback, D. Angew. Chem. Int. Ed, 1965, 4, 1077; Seebach, D.; Corey, E. J. J. Org. Chem. 1975, 40, 231). Действительно, основанный на дитианах синтез кетонов был с успехом применен для синтеза продуктов природного происхождения сложного строения (для обзора см., например, Yus, М.; Najera, С.; Foubelo, F. Tetrahedron, 2003, 59, 6147; Smith, III. A.S.; Adams, C.M.; Acc. Chem. Rev. 2004, 37, 365). Тем не менее, был разработан прямой синтез кетонов, который может быть использован для синтеза кетонов, включая молекулы сложного строения. Наилучшим шансом достижения указанной цели мог бы быть основанный на радикалах, предпочтительно однореакторный, синтез кетонов. Сообщалось о похожем Zn/Pd-опосредованном однореакторном синтезе кетонов (см., например, Lee, J.Н.; Kishi, Y.J. Am. Chem. Soc. 2016, 138, 7178).
[00604] Недавно, Weix, Gong, Reisman и др. провели интенсивные исследования Ni-опосредованного однореакторного синтеза кетонов, нововведенного Mukaiyama в 1981 году (см., например, Onaka, М.; Matsuoka, Y.; Mukaiyama, Т. Chem. Lett. 1981, 531; Wotal, A.С; Weix, D.J. Org. Lett. 2012,14, 1476; Wotal, A.C.; Ribson, R.D.; Weix, D.J. Organometallics 2014, 33, 5874; Wu, F.; Lu, W.; Qian, Q.; Ren, Q.; Gong, H. Org. Lett. 2012, 14, 3044; Zhao, C.; Jia, X.; Wang, X.; Gong, H.J. Am. Chem. Soc. 2014, 136, 17645 и процитированные в нем ссылки; Cherney, А.Н.; Kadunce, N.Т.; Reisman, S.Е. J. Am. Chem. Soc. 2013, 135, 7442). Среди широкого ряда описанных субстратов, один конкретный пример, представленный Gong и сотр., предположил возможность того, что Ni-опосредованный однореакторный синтез кетонов сможет удовлетворить наши потребности (Фигура 2В). Для нашего исследования были произвольно выбраны субстраты, представленные на Фигуре 2С. Произвольно выбранные субстраты были протестированы в указанных трех условиях, продемонстрировав тем самым осуществимость предложенного сочетания, например, посредством протоколов Weix и Reisman. В то же время, стало очевидно, что для успешного применения Ni-опосредованного однореакторного синтеза кетонов при сочетании на поздних стадиях конвергентного синтеза молекул сложного строения требовались серьезные усовершенствования.
[00605] Более 15 лигандов были сначала протестированы на солюбилизирование NiCl2, обнаружив тем самым, что 4,4'-ди-трет-бутил-2,2'-бипиридин (dtbbpy) дает наилучший результат. Примечательно, что комплекс NiBr2•(dtbbpy) обнаружил лучшую эффективность сочетания, чем комплекс NiCl2•(dtbbpy) (см., например, Lu, Z.; Fu, G.С. Angew. Chem. Int. Ed. 2010, 49, 6676; Serrano, E.; Martin, R. Angew. Chem. Int. Ed. 2016, 55, 11207; Zhang, X.; MacMillan, D.W.C. J. Am. Chem. Soc. 2016, 138, 13862).
[00606] Среди изученных активированных форм карбоновой кислоты, сложный 2-тиопиридиновый эфир, о котором было впервые сообщено Mukaiyama, был найден наиболее эффективным для сочетания. Сложный 2-тиопиридиновый эфир был изначально использован Corey и Nicolaou (см., например, Corey, Е.J.; Nicolaou, K. С.J. J. Am. Chem. Soc. 1974, 96, 5614) и Gerlack и Thalmann (см., например, Gerlach, Н.; Thalmann, A. Helv. Chim. Acta 1974, 57, 2661) для их фундаментального труда по макролактонизации. Было обнаружено, что Mn (порошок) и Zn (порошок) являются эффективными металлами-восстановителями.
[00607] Среди множества протестированных систем растворителей наилучшим был найден 1,3-диметил-2-имидазолидинон (DMI). Смесь DMI и EtOAc (5:1) была наилучшей системой растворителей, если субстратны) проявляли плохую растворимость в DMI. Как и ожидалось, лучшие значения выхода сочетания достигали при более высоких концентрациях, причем обычная концентрация находилась в диапазоне С=0,1~0,5 М. При изучении эффектов добавок было обнаружено, что добавление 1 эквивалента эквивалент Cp2ZrCl2 кардинально увеличивало скорость сочетания; с Cp2ZrCl2 сочетание завершалось за считанные минуты или часы, по сравнению с протеканием в течение ночи или суток без Cp2ZrCl2. В дополнение, путем добавления Cp2ZrCl2 устранялось или подавлялось образование побочного продукта посредством (I→SPy)-обмена.
[00608] Наблюдаемое кардинальное увеличение скорости реакции указало на то, что Cp2ZrCl2 участвовал в лимитирующей скорость процесса стадии каталитической реакции. Два различных каталитических цикла были предложены для Ni-опосредованного однореакторного синтеза кетонов, а именно (1) каталитический цикл с участием промежуточного (L)Ni(алкил)2 и (2) каталитический цикл последовательного восстановления. Однако для объяснения полученных результатов был предложен новый механизм, состоящий из Ni-каталитического цикла, Zr-каталитического цикла и Zr→Ni трансметаллирования (Фигура 3А). Ni-каталитический цикл начинается с восстановления Ni(II)→Ni(0) цинком с последующим его окислительным присоединением к сложному 2-тиопиридиновому эфиру, т.е. 2-D→2-E→2-F. По причине сильной связи Zr-SR возможно, что Cp2ZrCl2 и/или соль Zr могут ускорять стадию 2-F→2-G, приводя тем самым к кардинальному увеличению скорости реакции. С другой стороны, второй каталитический цикл с участием Cp2ZrCl2; восстановления цинком Cp2ZrCl2 с получением низковалентных частиц Zr, может быть оперативным. В соответствии с фундаментальным трудом Schwartz, такие низковалентные частицы Zr оперативно ускоряют алкилйодид, т.е. Cp2ZrCl2→Cp2Zr→Cp2Zr-R (см., например, Williams, G.М.; Gell, К.I.; Schwartz, J.J. Am. Chem. Soc. 1980, 102, 3660; Williams, G.M.; Schwartz, J.J. Am. Chem. Soc. 1982, 104, 1122). Затем, Ni- и Zr-каталитические циклы сочетаются с Zr/Ni-трансметаллированием с получением 2-Н (для трансметаллирования алкенил-Zr→алкенил-Ni, см., например, Negishi, Е., Van Horn, D.Е. J. Am. Chem. Soc. 1977, 99, 3168; Loots, M.J., Schwartz, J.J. Am. Chem. Soc. 1977, 99, 8045). В общей сложности, Cp2ZrCl2 играет критически важную двоякую роль в этой схеме. Для проведения различий с предшествующим Ni-опосредованным способом, осуществляют это превращение в виде Zr/Ni-опосредованного синтеза кетонов.
[00609] Применительно к предложенному механизму были протестированы несколько общеизвестных акцепторов тиолов, обнаруживая лишь незначительный эффект на увеличение скорости сочетания, подтверждая тем самым предполагаемую двоякую роль Cp2ZrCl2. Как было отмечено, кардинальное увеличение скорости сочетания путем добавления Cp2ZrCl2 указывает на его участие в стадии, лимитирующей скорость реакции. Хотя экспериментальное подтверждение этому отсутствует, возможно, что лимитирующей скорость реакции стадией вполне вероятно является 1-F→1-G. Поэтому, алкилйодид принимает участие только после стадии, лимитирующей скорость реакции, что может объяснить причину того, что Zr/Ni-опосредованный синтез кетонов уникально отличается от Zn/Pd- и Fe/Cu-опосредованного синтеза кетонов. Как было отмечено, увеличение скорости сочетания путем добавления Cp2ZrCl2 указывает на его участие в стадии, лимитирующей скорость реакции. Поэтому, лимитирующей скорость реакции стадией вполне вероятно является 1-Е→1-F. Поэтому, алкилйодид принимает участие только после стадии, лимитирующей скорость реакции, что может объяснить причину того, что Zr/Ni-опосредованный синтез кетонов уникально отличается от Zn/Pd- и Fe/Cu-опосредованного синтеза кетонов.
[00610] Было протестировано поведение общеизвестных радикальных зондов (Фигура 3В). Наблюдения за 4е обнаружили радикальную природу реакции сочетания. С другой стороны, с 4a~d были получены нормальные кетоны, предполагая тем самым, что промежуточный радикал принимает участие только в течение очень короткого промежутка времени (для реакционной способности и стабильности/нестабильности частиц β-алкоксиалкил-Zr(IV), см., например, Buchwald, S.L.; Nielsen, R.В.; Dewan, J.С. Organometallics 1988, 7, 2324; Wipf, P.; Smitrovich, J.H. J. Org. Chem. 1991, 56, 6494).
[00611] Для установления типовых оптимальных условий, был изучен эффект молярного соотношения 1-1 (X=I) и 1-2 (Y=SPy) на эффективность сочетания в условиях NiBr2(dtbbpy) (5 мол. %), Cp2ZrCl2 (1,0 эквив.), Zn (избыток) в DMI (С: 0,5 М) при к.т., с получением следующих результатов: практический выход 89% для 1-1:1-2=1,5:1,0, 89% для 1-1:1-2=1,2:1,0, 85% для 1-1:1-2=1,1:1,0, 83% для 1-1:1-2=1,0:1,0, 75% для 1-1:1-2=0,8:1,0. Принимая во внимание все указанные наблюдения, для дальнейших исследований были выбраны следующие условия: NiBr2(dtbbpy) (5 мол. %), Cp2ZrCl2 (1 эквив.), Mn или Zn (избыток) в DMI или 5:1 DMI-EtOAc (С: 0,5~0,1 М) при ~20°С, с молярным соотношением нуклеофила и электрофила (1,2:1,0). Тем не менее, основываясь на размере молекул и сложности строения партнеров сочетания, молярное соотношение может быть соответствующим образом скорректировано без какого-либо заметного ущерба. На Фигуре 4 обобщены субстраты, содержащие OR или соответствующую группу в α-положении. Новым способом были получены целевые продукты с отличными значениями выхода.
[00612] На Фигуре 5А обобщены дополнительные примеры. Общеизвестные защитные группы продемонстрировали хорошую толерантность (а, Фигура 5А). Сочетание было эффективно для моно- и диметилированных субстратов в β-положении, а также монометилированных субстратов в α-положении, но не было эффективно для диметилированного в α-положении субстрата или субстрата-адамантила (b, Фигура 5А). Этот способ позволяет избирательно активировать и сочетать алкилйодид по сравнению с алкилбромидом или алкилхлоридом, а также арилбромидом (с, Фигура 5А). Как было упомянуто, данная реакция характеризуется радикальной природой, предполагая тем самым возможность того, что она может быть эффективна для субстратов, содержащих свободную гидроксильную и/или кислотную группу. Действительно, путем сочетания с указанными субстратами получали целевые продукты, но для практических применений объективно требовались дополнительные усовершенствования (d, Фигура 5А).
[00613] В завершение, для демонстрации применимости Zr/Ni-опосредованного однореакторного синтеза кетонов для структурного мотива, представленного на Фигуре 2, авторами изобретения было изучено сочетание (S)-1-11 с (S)-1-12 и (R)-1-12 и получены целевые продукты (S,S)-1-13 и (S,R)-1-13, соответственно (Фигура 5В). В процессе сочетания может быть утрачена стереохимическая чистота продуктов, а также исходных веществ, например, посредством обратной окси-реакции Михаэля/окси-реакции Михаэля. Экспериментально было обнаружено, что (S,S)-1-13 и (S,R)-1-13 обладают фактически идентичными спектрами 1H-ЯМР и характеризуются очень слабыми, но различимыми, спектрами 13С-ЯМР. С использованием спектров 13С-ЯМР, была изучена стереохимическая чистота (S,S)-1-13 и (S,R)-1-13, продемонстрировав тем самым, что при кетоновом сочетании стереохимическое диспропорционирование не происходит.
[00614] Было сообщено о новом Zr/Ni-опосредованном однореакторном синтезе кетонов, где Cp2ZrCl2 кардинально увеличивает скорость сочетания и, в то же самое время, подавляет образование побочных продуктов посредством (I→SPy)-обмена. В отличие от Zn/Pd- и Fe/Cu-опосредованных однореакторных синтезов кетонов было обнаружено, что указанный новый способ эффективен для нуклеофилов, содержащих OR или соответствующую группу в α-положении. Был предложен механизм, состоящий из Ni-каталитического цикла, Zr-каталитического цикла и Zr→Ni трансметаллирования, в котором Cp2ZrCl2 предположительно играет критически важную двоякую роль. Новый разработанный Zr/Ni-опосредованный способ дает реальную надежду на однореакторное получение кетона на поздних стадиях конвергентного синтеза молекул сложного строения.
Экспериментальные методики для реакций Ni/Zr-опосредованной кетолизации
[00615] Если не отмечено иное, то растворители реагенты соответствовали товарному качеству и использовались в полученном виде. Реакции с участием реагентов или промежуточных соединений, чувствительных к воздуху или влаге, проводили в инертной атмосфере азота или аргона в стеклянной посуде, которая была высушена в печи. Аналитическую тонкослойную хроматографию (TLC) проводили на предварительно покрытых TLC-пластинах производства Е. Merck, силикагель 60F-254, толщина слоя 0,25 мм. TLC-пластины визуализировали путем окрашивания AMCAN (молибдат аммония/нитрат церия-аммония), перманганатом калия или пара-анисовым альдегидом. Разделение методом флэш-хроматографии проводили на силикагеле 60 (40-63 мкм) производства Е. Merck, силикагеле 60N (сферический, нейтральный, 40-50 мкм) производства Kanto Chemical или Wakogel 50NH2 (38-63 мкм) производства Wako Pure Chemical Industry. Колоночную хроматографию среднего давления проводили с использованием YAMAZEN Smart Flash. Спектры ЯМР регистрировали на спектрометрах Varian Inova 600 МГц или Varian Inova 500 МГц. Химические сдвиги приводили в миллионных долях (м.д.). Остаточный пик растворителя использовали в качестве внутреннего стандарта (для спектров 1H-ЯМР: 7,26 м.д. в CDCl3, 7,16 м.д. в C6D6, 3,31 м.д. в CD3OD и 5,33 в CD2Cl2; для 13С-ЯМР: 77,0 м.д. в CDCl3, 128,0 м.д. в C6D6, 49,0 м.д. в CD3OD и 53,8 м.д. в CD2Cl2). Константы взаимодействия (J) приводили в Гц, и использовали следующие обозначения для расщепления: с для синглета, д для дублета, т для триплета, кв для квартета, м для мультиплета и ушир. для уширенного сигнала. Значения оптического вращения измеряли при 20°C с использованием поляриметра Perkin-Elmer 241. Спектры ИК регистрировали на спектрометре Bruker Alpha FT-IR. Эксперименты с ионизацией электрораспылением проводили на масс-спектрометре Platform II с ионизацией при атмосферном давлении производства Micromass Inc.
Общая методика для Ni/Zr-опосредованных реакций сочетания
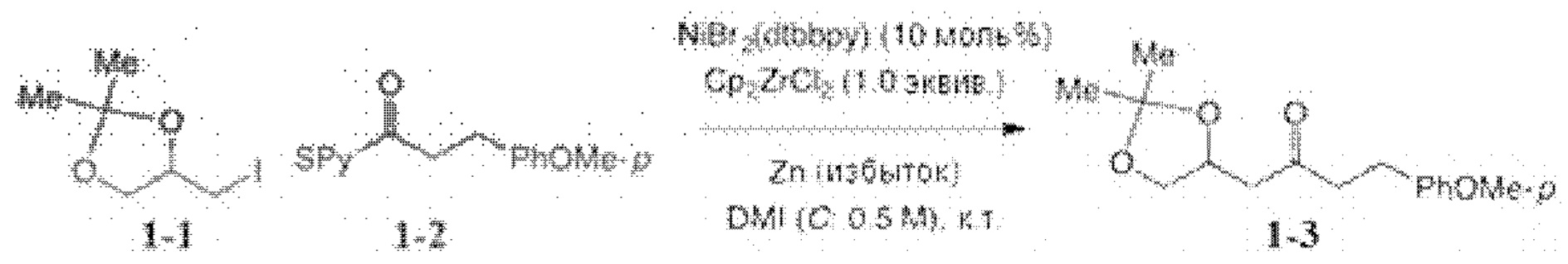
[00616] В перчаточной камере к раствору йодида 1-1 (29,1 мг, 0,12 ммоль, 1,2 экв.) и тиоэфира 1-2 (27,3 мг, 0,10 ммоль, 1,0 экв.) в DMI (0,2 мл, Sigma-aldrich, 99,5%) при комнатной температуре добавляли Cp2ZrCl2 (29,3 мг, 0,10 ммоль, 1,0 экв. Sigma-aldrich, 98%), Zn порошок (19,6 мг, 0,3 ммоль, 3,0 экв. Sigma-aldrich, использовали без какой-либо активации) и NiBr2⋅dtbbpy (4,8 мг, 0,01 ммоль, 10 мол. %, получение см. стр. 8). После перемешивания при той же температуре в течение минут-часов (отслеживали методом TLC), реакционную смесь удаляли из перчаточной камеры и разбавляли EtOAc и нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой этилацетатом. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на силикагеле с получением соединения 1-3 в виде бесцветного масла.
Экспериментальные методики для реакций, отображенных на фигуре 3В
[00617] В перчаточной камере к раствору йодида 4а-е (0,24 ммоль, 1,2 экв.) и тиоэфира 1-5 (54,6 мг, 0,20 ммоль, 1,0 экв.) либо в DMI (0,4 мл, Sigma-aldrich, 99,5%) либо в DMI/EtOAc (0,334 мл/0,066 мл) при комнатной температуре добавляли Cp2ZrCl2 (58,5 мг, 0,20 ммоль, 1,0 экв. Sigma-aldrich, 98%), Zn порошок (39,2 мг, 0,6 ммоль, 3,0 экв. Sigma-aldrich, использовали без какой-либо активации) и NiBr2⋅dtbbpy (9,7 мг, 0,02 ммоль, 10 мол. %, получение см. стр. 8). После перемешивания при той же температуре в течение 10 мин -1 ч (отслеживали методом TLC), реакционную смесь удаляли из перчаточной камеры и разбавляли EtOAc и нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой этилацетатом. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на силикагеле с получением соединений 4a-d, S1 в виде бесцветных масел. Примечание: в зависимости от растворимости субстратов в качестве растворителя использовали DMI или DMI/EtOAc.
1-(4-метоксифенил)нон-8-ен-3-он (6а)
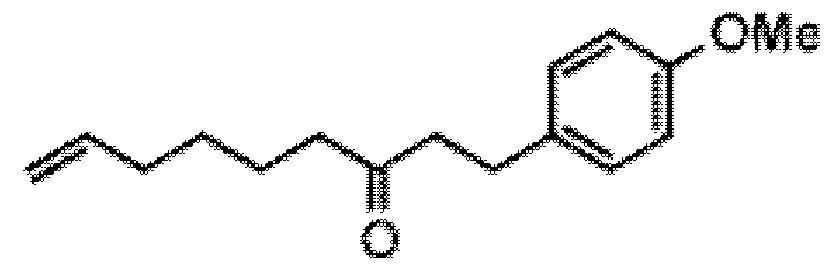
[00618] 42,1 мг (0,171 ммоль, 86%); IR (пленка) 2930, 2856, 1712, 1612, 1513, 1463, 1300, 1246, 1178, 1109, 1037, 910, 831 см-1; 1Н-ЯМР (600 МГц, CDCl3) δ=7,09 (д, J=8,4 Гц, 2Н), 6,82 (д, J=8,4 Гц, 2Н), 5,81-5,74 (м, 1Н), 4,99 (дд, J=17,4, 1,7 Гц, 1H), 4,94 (дд, J=10,2, 1,7 Гц, 1Н), 3,78 (с, 3Н), 2,83 (т, J=7,8 Гц, 2Н), 2,69 (т, J=7,8 Гц, 2Н), 2,38 (т, J=7,2 Гц, 2Н), 2,03 (кв, J=7,2 Гц, 2Н), 1,60-1,54 (м, 2Н), 1,38-1,32 (м, 2Н); 13С-ЯМР (126 МГц, CDCl3) δ=210.5, 158,1, 138,6, 133,3, 129,4, 114,8, 114,0, 55,4, 44,7, 43,0, 33,6, 29,1, 28,6, 23,4; HRMS (ESI) m/z рассчит. для С16Н23О2 [М+Н]+ 247,1708; обнаружено 247,1693.
(Z)-1-(4-метоксифенил)-9-фенилнон-8-ен-3-он (6b)
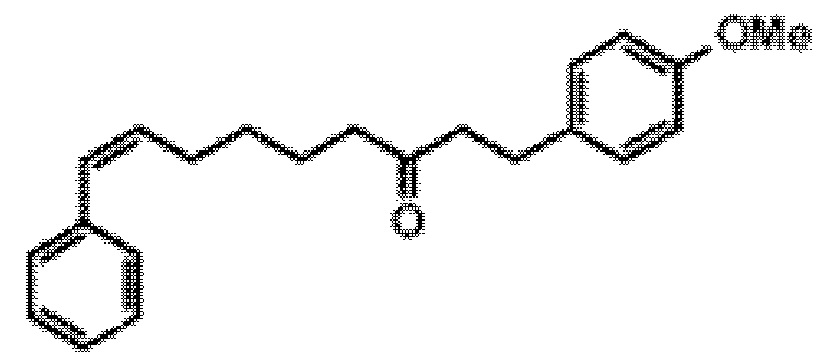
[00619] 59,8 мг, (0,186 ммоль, 93%); IR (пленка) 2931, 2859, 1712, 1612, 1513, 1594, 1463, 1447, 1408, 1373, 1300, 1246, 1178, 1101, 1036, 826, 771, 700 см-1; 1Н-ЯМР (600 МГц, CDCl3) δ=7,32 (т, J=7,8 Гц, 2Н), 7,25 (д, J=7,8 Гц, 2Н), 7,22 (т, J=7,8 Гц, 1H), 7,09 (д, J=9,0 Гц, 2Н), 6,82 (д, J=9,0 Гц, 2Н), 6,42 (д, J=11,4 Гц, 1H), 5,65-5,60 (м, 1Н), 3,78 (с, 3Н), 2,82 (т, J=7,2 Гц, 2Н), 2,66 (т, J=8,4 Гц, 2Н), 2,35 (т, J=7,8 Гц, 2Н), 2,32 (кв. д, J=7,2 Гц, 2,0 Гц, 2Н), 1,62-1,56 (м, 2Н), 1,44-1,38 (м, 2Н); 13С-ЯМР (126 МГц, CDCl3) δ=210,4, 158,1, 137,8, 133,3, 132.6, 129,4, 129,3, 128,9, 128,3, 126,6, 114,0, 55,4, 44,7, 42,9, 29,5, 29,1, 28,4, 23,5; HRMS (ESI) m/z рассчит. для C22H26NaO2 [M+Na]+ 345,1825; обнаружено 345, 1830.
1-(4-метоксифенил)-6-(1-(4-метоксифенил)этокси)гексан-3-он (6с)
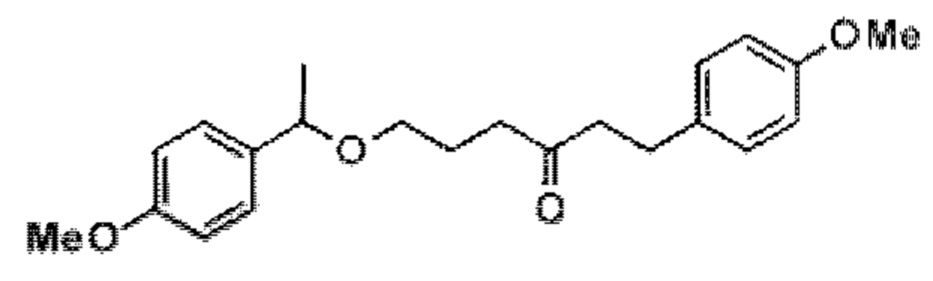
[00620] 61,6 мг, (0,173 ммоль, 87%); IR (пленка) 2953, 2932, 2836, 1712, 1612, 1512, 1464, 1442, 1369, 1301, 1287, 1245, 1177, 1099, 1035, 832 см-1; 1Н-ЯМР (600 МГц, CDCl3) δ=7,20 (д, J=8,4 Гц, 2Н), 7,08 (д, J=8,4 Гц, 2Н), 6,87 (д, J=8,4 Гц, 2Н), 6,82 (д, J=8,4 Гц, 2Н), 4,29 (кв, J=6,6 Гц, 1H), 3,80 (с, 3Н), 3,78 (с, 3Н), 3,28-3,20 (м, 2Н), 2,83-2,78 (м, 2Н), 2,70-2,66 (м, 2Н), 2,50-2,39 (м, 2Н), 1,84-1,77 (м, 2Н), 1,39 (д, J=6,6 Гц, 3Н); 13С-ЯМР (126 МГц, CDCl3) δ=210,1, 159,0, 158,0, 136,1, 133,3, 129,3, 127,5, 114,0, 113,9, 77,5, 67,4, 55,4, 44,7, 39,9, 29,0, 24,2, 24,1; HRMS (ESI) m/z рассчит. для C22H28NaO4 [M+Na]+ 379,1880; обнаружено 379,1885.
2-метокси-9-(4-метоксифенил)-7-оксононаннитрил (6d)
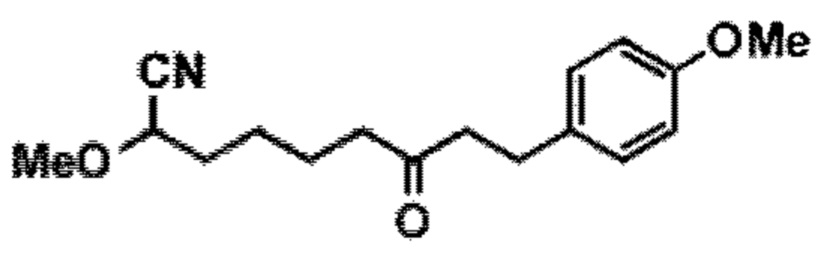
[00621] 52,3 мг (0,180 ммоль, 90%); IR (пленка) 2937, 2868, 2834, 1711, 1612, 1513, 1463, 1410, 1372, 1300, 1246, 1179, 1113, 1073, 1035, 829 см-1; 1Н-ЯМР (600 МГц, CDCl3) δ=7,09 (д, J=8,4 Гц, 2Н), 6,82 (д, J=8,4 Гц, 2Н), 4,02 (т, J=7,2 Гц, 1H), 3,78 (с, 3Н), 3,47 (с, 3Н), 2,83 (т, J=7,8 Гц, 2Н), 2,69 (т, J=7,8 Гц, 2Н), 2,39 (т, J=7,8 Гц, 2Н), 1,81 (кв, J=7,2 Гц, 2Н), 1,62-1,56 (м, 2Н), 1,47-1,41 (м, 2Н); 13С-ЯМР (126 МГц, CDCl3) δ=209,8, 158,1, 133,2, 129,4, 118,1, 114,0, 70,5, 58,1, 55,4, 44,7, 42,7, 33,3, 29,1, 24,4, 23,0; HRMS (ESI) m/z рассчит. для C17H24NO3 [М+Н]+ 290,1751; обнаружено 290,1760.
1-(4-метоксифенил)гепт-6-ен-3-он (S1, продукт из соединения 4е)
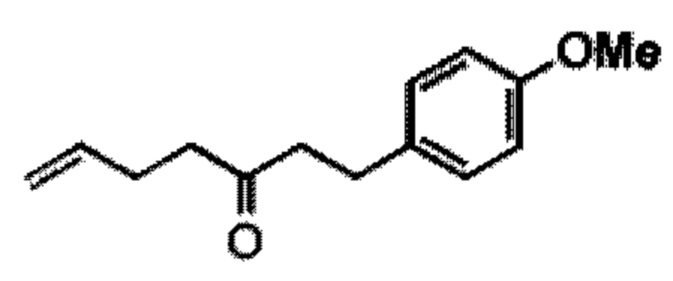
[00622] 33,8 мг (0,155 ммоль, 77%) IR (пленка) 2926, 1753, 1612, 1513, 1442, 1365, 1301, 1246, 1178, 1109, 1036, 911, 829 см-1; 1Н-ЯМР (500 МГц, CDCl3) δ=7,09 (д, J=8,5 Гц, 2Н), 6,82 (д, J=8,5 Гц, 2Н), 5,83-5,73 (м, 1Н), 5,01 (дд, J=17,5 Гц, 1,4 Гц, 1H), 4,97 (дд, J=10,0 Гц, 1,4 Гц, 1H), 3,78 (с, 3Н), 2,84 (т, J=7,5 Гц, 2Н), 2,70 (т, J=7,5 Гц, 2Н), 2,48 (т, J=7,5 Гц, 2Н), 2,31 (кв, J=7,5 Гц, 2Н); 13С-ЯМР (126 МГц, C6D6) δ=207,1, 158,6, 137,6, 133,6, 129,6, 115,0, 114,2, 54,7, 44,5, 41,8, 29,1, 28,0; HRMS (ESI) m/z рассчит. для C14H19O2 [М+Н]+ 219,1380; обнаружено 219,1374.
Подробности эксперимента для реакций, отображенных на фигуре 4
[00623] В перчаточной камере к раствору йодида 7а-m (0,24 ммоль, 1,2 экв.) и тиоэфира 1-5 (54,6 мг, 0,20 ммоль, 1,0 экв.) либо в DMI (0,4 мл, Sigma-aldrich, 99,5%), либо в DMI/EtOAc (0,334 мл/0,066 мл) при комнатной температуре добавляли Cp2ZrCl2 (58,5 мг, 0,20 ммоль, 1,0 экв. Sigma-aldrich, 98%), Zn порошок (39,2 мг, 0,6 ммоль, 3,0 экв. Sigma-aldrich, использовали без какой-либо активации) и NiBr2•dtbbpy (9,7 мг, 0,02 ммоль, 10 мол. %, получение см. стр. 8). После перемешивания при той же температуре в течение 10 мин - 2 ч (отслеживали методом TLC), реакционную смесь удаляли из перчаточной камеры и разбавляли EtOAc и нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой этилацетатом. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на силикагеле с получением соединений 8а-m в виде бесцветных масел или белых аморфных твердых веществ. Примечание 1: в зависимости от растворимости субстратов в качестве растворителя использовали DMI или DMI/EtOAc. Примечание 2: для синтеза соединений 8d и 8е перед добавлением Cp2ZrCl2 добавляли 2,0 экв. лутидина.
1-(2,2-диметил-1,3-диоксолан-4-ил)-4-(4-метоксифенил)бутан-2-он (8а)
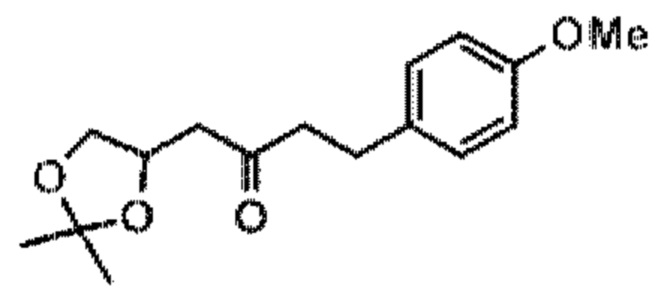
[00624] 51,7 мг (0,186 ммоль, 93%); IR (пленка) 3035, 2988, 2935, 1711, 1612, 1513, 1478, 1370, 1246, 1178, 1058, 1036, 829, 669 см-1; 1Н-ЯМР (500 МГц, CDCl3) δ=7,09 (д, J=8,5 Гц, 2Н), 6,81 (д, J=8,5 Гц, 2Н), 4,44 (квинт, J=6,0 Н, 1H), 4,15 (дд, J=8,5 Гц, 8,0 Гц, 1H), 3,77 (с, 3Н), 3,50 (дд, J=8,5 Гц, 8,0 Гц, 1H), 2,88-2,80 (м, 3Н), 2,76-2,71 (м, 2Н), 2,52 (дд, J=16,5 Гц, 7,0 Гц, 1Н) 1,38 (с, 3Н), 1,33 (с, 3Н); 13С-ЯМР (126 МГц, CDCl3) δ=207,8, 158,0, 132,8, 129,2, 113,9, 108,8, 71,7, 69,4, 55,2, 47,2, 45,2, 28,7, 26,9, 25,5; HRMS (ESI) m/z рассчит. для C16H22NaO4 [M+Na]+ 301,1410; обнаружено 301,1425.
1-((4S,5S)-5-(((трет-бутилдифенилсилил)окси)метил)-2,2-диметил-1,3-диоксолан-4-ил)-4-(4-метоксифенил)бутан-2-он (8b)
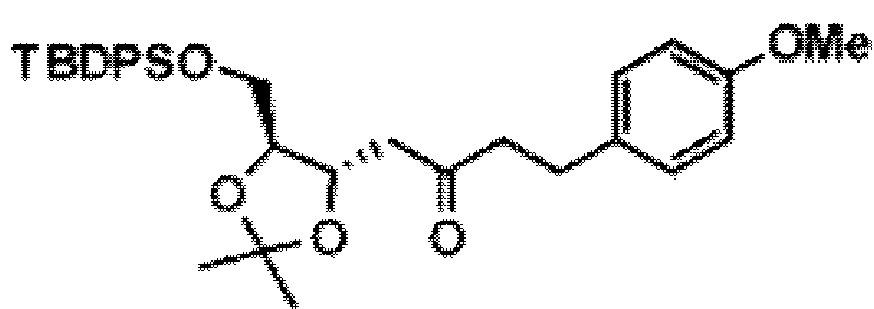
[00625] 102,3 мг (0,187 мг, 94%); 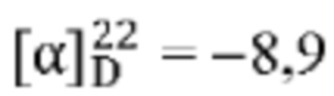 (с 1,8, CHCl3); IR (пленка) 2985, 2955, 2932, 2898,2858, 1716,1612, 1513, 1472, 1463, 1428, 1379, 1370, 1301, 1247, 1177, 1112, 1981, 1037, 998, 823, 787, 742, 704, 603, 505, 490 см-1; 1Н-ЯМР (500 МГц, CDCl3) δ=7,69-7,64 (м, 4Н), 7,45-7,35 (м, 6Н), 7,10 (д, J=8,5 Гц, 2Н), 6,82 (д, Г=8,5 Гц, 2Н), 4,42-4,37 (м, 1H), 3,84-3,71 (м, 3Н), 3,78 (с, 3Н), 2,85 (т, J=8,0 Гц, 2Н), 2,77-2,73 (м, 2Н), 2,69-2,65 (м, 2Н), 1,38 (с, 3Н), 1,37 (с, 3Н), 1,06 (с, 9Н); 13С-ЯМР (126 МГц, CDCl3) δ=207,4, 158,2, 135,8, 133,3, 133,2, 130,0, 129,5, 128,0, 114,1, 109,4, 80,6, 74,8, 64,3, 55,5, 46,7, 45,5, 28,8, 27,4, 27,1, 27,0, 19,4; HRMS (ESI) m/z рассчит. для C33H43O5Si [М+Н]+ 547,2874; обнаружено 547,2869.
(с 1,8, CHCl3); IR (пленка) 2985, 2955, 2932, 2898,2858, 1716,1612, 1513, 1472, 1463, 1428, 1379, 1370, 1301, 1247, 1177, 1112, 1981, 1037, 998, 823, 787, 742, 704, 603, 505, 490 см-1; 1Н-ЯМР (500 МГц, CDCl3) δ=7,69-7,64 (м, 4Н), 7,45-7,35 (м, 6Н), 7,10 (д, J=8,5 Гц, 2Н), 6,82 (д, Г=8,5 Гц, 2Н), 4,42-4,37 (м, 1H), 3,84-3,71 (м, 3Н), 3,78 (с, 3Н), 2,85 (т, J=8,0 Гц, 2Н), 2,77-2,73 (м, 2Н), 2,69-2,65 (м, 2Н), 1,38 (с, 3Н), 1,37 (с, 3Н), 1,06 (с, 9Н); 13С-ЯМР (126 МГц, CDCl3) δ=207,4, 158,2, 135,8, 133,3, 133,2, 130,0, 129,5, 128,0, 114,1, 109,4, 80,6, 74,8, 64,3, 55,5, 46,7, 45,5, 28,8, 27,4, 27,1, 27,0, 19,4; HRMS (ESI) m/z рассчит. для C33H43O5Si [М+Н]+ 547,2874; обнаружено 547,2869.
4-(4-метоксифенил)-1-(тетрагидро-2H-пиран-2-ил)бутан-2-он (8с)
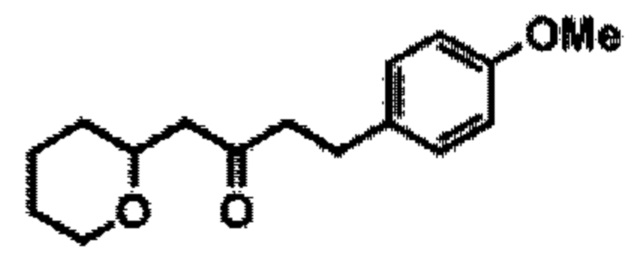
[00626] 49,1 мг (0,188 мг, 94%); IR (пленка) 2934, 2849, 1712, 1612, 1513, 1441, 1300, 1246, 1178, 1087, 1043, 828 см-1; 1Н-ЯМР (600 МГц, CDCl3) δ=7,09 (д, J=8,4 Гц, 2Н), 6,81 (д, J=8,4 Гц, 2Н), 3,91 (д, J=11,4 Гц, 1Н), 3,78 (с, 3Н), 3,77-3,72 (м, 1H), 3,41 (т, J=10,8 Гц, 1Н), 2,83 (т, J=7,8 Гц, 2Н), 2,74 (кв, J=5,4 Гц, 2Н), 2,64 (дд, J=15,6 Гц, 7,8 Гц, 1H), 2,36 (дд, J=15,6 Гц, 5,2 Гц, 1H), 1,80 (д, J=5,2 Гц, 1H), 1,58 (д, J=12,6 Гц, 1H), 1,53-1,46 (м, 3Н), 1,29-1,21 (м, 1H); 13С-ЯМР (126 МГц, CDCl3) δ=210,2, 158,1, 135,7, 133,9, 133,3, 129,8, 129,3, 127.8, 114,0, 63,1, 55,4, 44,7, 39,5, 29,1, 27,0, 26,7, 19,3; HRMS (ESI) m/z рассчит. для C16H23O3 [М+Н]+ 263,1642; обнаружено 263,1649.
4-(4-метоксифенил)-1-((2R,3R)-3-((триэтилсилил)окси)тетрагидро-2H-пиран-2-ил)бутан-2-он (8d)
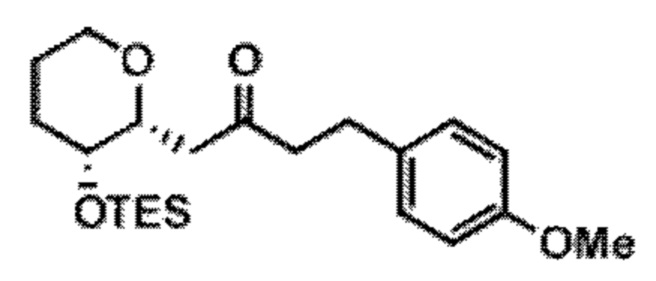
[00627] 73,4 мг (0,187 мг, 94%); 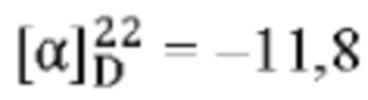 (с 1,0, CHCl3); IR (пленка) 2953, 2915, 2875, 1714, 1612, 1513, 1463, 1300, 1246, 1178, 1098, 1071, 1023, 828, 743 см-1; 1Н-ЯМР (500 МГц, CDCl3) δ=7,09 (д, J=8,4 Гц, 2Н), 6,81 (д, J=8,4 Гц, 2Н), 3,89 (д, J=14,3 Гц, 1Н), 3,81 (ддц, J=7,8, 7,5, 2,5 Гц, 1Н), 3,78 (с, 3Н), 3,71 (с, 1H), 3,43 (тд, J=14,4, 2,5 Гц, 1Н), 2,85-2,67 (м, 5Н), 2,44 (дд, J=19,8, 6,6 Гц, 1H), 1,96 (м, 1H), 1,81 (м, 1H), 1,71-1,63 (м, 1H), 1,32 (д, J=15,5 Гц, 1H), 0,95 (т, J=9,6 Гц, 9Н), 0,59 (кв, J=9,6 Гц, 6Н); 13С-ЯМР (126 МГц, CDCl3) δ 208,9, 158,0, 133,3, 129,4, 114,1, 76,2, 67,9, 67,5, 55,4, 45,8, 45,2, 31,3, 28,8, 20,6, 7,1, 5,1; HRMS (ESI) m/z рассчит. для C22H37O4Si [М+Н]+ 393,2461; обнаружено. 393,2449
(с 1,0, CHCl3); IR (пленка) 2953, 2915, 2875, 1714, 1612, 1513, 1463, 1300, 1246, 1178, 1098, 1071, 1023, 828, 743 см-1; 1Н-ЯМР (500 МГц, CDCl3) δ=7,09 (д, J=8,4 Гц, 2Н), 6,81 (д, J=8,4 Гц, 2Н), 3,89 (д, J=14,3 Гц, 1Н), 3,81 (ддц, J=7,8, 7,5, 2,5 Гц, 1Н), 3,78 (с, 3Н), 3,71 (с, 1H), 3,43 (тд, J=14,4, 2,5 Гц, 1Н), 2,85-2,67 (м, 5Н), 2,44 (дд, J=19,8, 6,6 Гц, 1H), 1,96 (м, 1H), 1,81 (м, 1H), 1,71-1,63 (м, 1H), 1,32 (д, J=15,5 Гц, 1H), 0,95 (т, J=9,6 Гц, 9Н), 0,59 (кв, J=9,6 Гц, 6Н); 13С-ЯМР (126 МГц, CDCl3) δ 208,9, 158,0, 133,3, 129,4, 114,1, 76,2, 67,9, 67,5, 55,4, 45,8, 45,2, 31,3, 28,8, 20,6, 7,1, 5,1; HRMS (ESI) m/z рассчит. для C22H37O4Si [М+Н]+ 393,2461; обнаружено. 393,2449
4-(4-метоксифенил)-1-((2R,3R)-3-((триметилсилил)окси)тетрагидро-2H-пиран-2-ил)бутан-2-он (8е)
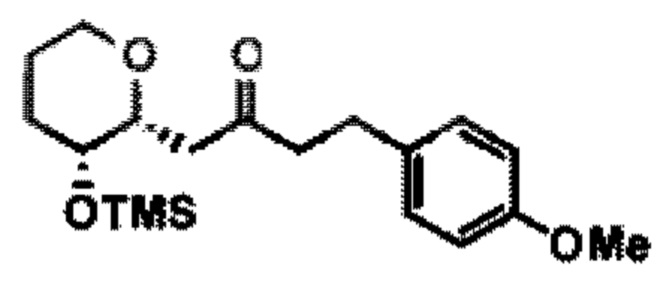
[00628] 61,9 мг (0,177 мг, 89%); 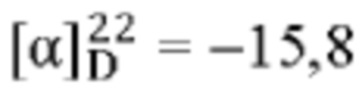 (с 1,0, CHCl3); IR (пленка) 2952, 2852, 2839 1713, 1612, 1513, 1441, 1409, 1300, 1247, 1178, 1137, 1098, 1071, 1023, 840, 763 см-1; 1Н-ЯМР (500 МГц, C6D6) δ=6,93 (д, J=8,4 Гц, 2Н), 6,81 (д, J=8,4 Гц, 2Н), 3,77 (ддд, J=6,0, 5,8, 1,5 Гц, 1H), 3,72 (д, J=10,2 Гц, 1Н), 3,44 (с, 1H), 3,27 (с, 3Н), 3,16 (ддд, J=11,2, 10,8, 1,5 Гц, 1H), 2,81 (м, 2Н), 2,71 (дд, J=15,0, 9,0 Гц, 1H), 2,52-2,46 (м, 1H), 2,44-2,38 (м, 1H), 2,26 (дд, J=15,0, 5,1 Гц, 1H), 1,90 (м, 1H), 1,53 (д, J=12,6 Гц, 1H), 1,26 (м, 1H), 0,87 (д, J=12,6 Гц, 1H), 0,00 (с, 9Н); 13С-ЯМР (126 МГц, C6D6) δ 207,3, 158,6, 133,5, 129,7, 114,3, 76,3, 67,7, 67,5, 54,7, 45,8, 45,4, 31,3, 29,0, 20,6, 0,2; HRMS (ESI) m/z рассчит. для C19H31O4Si [М+Н]+ 351,1992; обнаружено 351,1978.
(с 1,0, CHCl3); IR (пленка) 2952, 2852, 2839 1713, 1612, 1513, 1441, 1409, 1300, 1247, 1178, 1137, 1098, 1071, 1023, 840, 763 см-1; 1Н-ЯМР (500 МГц, C6D6) δ=6,93 (д, J=8,4 Гц, 2Н), 6,81 (д, J=8,4 Гц, 2Н), 3,77 (ддд, J=6,0, 5,8, 1,5 Гц, 1H), 3,72 (д, J=10,2 Гц, 1Н), 3,44 (с, 1H), 3,27 (с, 3Н), 3,16 (ддд, J=11,2, 10,8, 1,5 Гц, 1H), 2,81 (м, 2Н), 2,71 (дд, J=15,0, 9,0 Гц, 1H), 2,52-2,46 (м, 1H), 2,44-2,38 (м, 1H), 2,26 (дд, J=15,0, 5,1 Гц, 1H), 1,90 (м, 1H), 1,53 (д, J=12,6 Гц, 1H), 1,26 (м, 1H), 0,87 (д, J=12,6 Гц, 1H), 0,00 (с, 9Н); 13С-ЯМР (126 МГц, C6D6) δ 207,3, 158,6, 133,5, 129,7, 114,3, 76,3, 67,7, 67,5, 54,7, 45,8, 45,4, 31,3, 29,0, 20,6, 0,2; HRMS (ESI) m/z рассчит. для C19H31O4Si [М+Н]+ 351,1992; обнаружено 351,1978.
4-(4-метоксифенил)-1-((3aR,5R,5aS,8aS,8bR)-2,2,7,7-тетраметилтетрагидро-5H-бис([1,3]диоксоло)[4,5-b:4',5'-d]пиран-5-ил)бутан-2-он (8f)
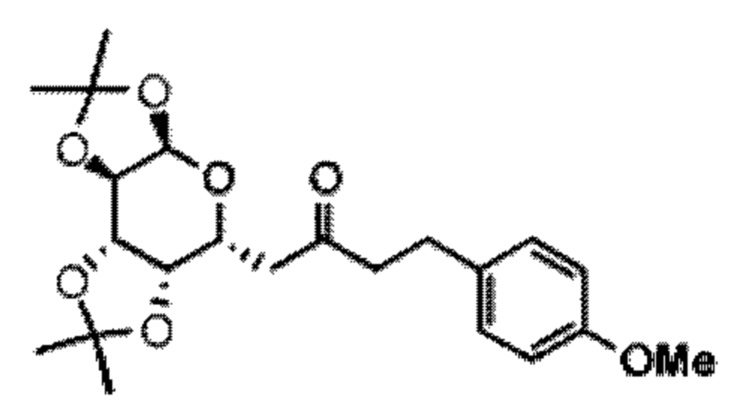
[00629] 75,7 мг (0,186 ммоль, 93%); 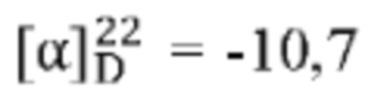 (с 1,0, CHCl3); IR (пленка) 2987, 2935, 1713, 1612, 1513,1465, 1382, 1456, 1382, 1372, 1246, 1211, 1178, 1099, 1066, 1037, 1000, 861, 547 см-1; 1Н-ЯМР (600 МГц, CDCl3) δ=7,09 (д, J=7,8 Гц, 2Н), 6,81 (д, J=7,8 Гц, 2Н), 5,46 (д, J=4,7 Гц, 1Н), 4,60 (дд, J=7,2, 2,5 Гц, 1H), 4,33-4,28 (м, 2Н), 4,18 (д, J=7,2 Гц, 1Н), 3,77 (с, 3Н), 2,85 (дд, J=6,4, 6,0 Гц, 2Н), 2,82-2,73 (м, 3Н), 2,65 (дд, J=17,2, 5,0 Гц, 1H), 1,58 (с, 3Н), 1,44 (с, 3Н), 1,33 (с, 6Н); 13С-ЯМР (151 МГц, CDCl3) δ=207,8, 158,1, 133,2, 129,4, 114,1, 109,3, 108,9, 96,5, 72,6, 70,9, 70,5, 64,2, 55,4, 45,4, 43,6, 28,7, 26,2, 25,2, 24,6; HRMS (ESI) m/z рассчит. для С22Н31О7 [М+Н]+ 407,2064; обнаружено 407,2050.
(с 1,0, CHCl3); IR (пленка) 2987, 2935, 1713, 1612, 1513,1465, 1382, 1456, 1382, 1372, 1246, 1211, 1178, 1099, 1066, 1037, 1000, 861, 547 см-1; 1Н-ЯМР (600 МГц, CDCl3) δ=7,09 (д, J=7,8 Гц, 2Н), 6,81 (д, J=7,8 Гц, 2Н), 5,46 (д, J=4,7 Гц, 1Н), 4,60 (дд, J=7,2, 2,5 Гц, 1H), 4,33-4,28 (м, 2Н), 4,18 (д, J=7,2 Гц, 1Н), 3,77 (с, 3Н), 2,85 (дд, J=6,4, 6,0 Гц, 2Н), 2,82-2,73 (м, 3Н), 2,65 (дд, J=17,2, 5,0 Гц, 1H), 1,58 (с, 3Н), 1,44 (с, 3Н), 1,33 (с, 6Н); 13С-ЯМР (151 МГц, CDCl3) δ=207,8, 158,1, 133,2, 129,4, 114,1, 109,3, 108,9, 96,5, 72,6, 70,9, 70,5, 64,2, 55,4, 45,4, 43,6, 28,7, 26,2, 25,2, 24,6; HRMS (ESI) m/z рассчит. для С22Н31О7 [М+Н]+ 407,2064; обнаружено 407,2050.
5-((трет-бутилдиметилсилил)окси)-7-((трет-бутилдифенилсилил)окси)-1-(4-метоксифенил)гептан-3-он (8g)
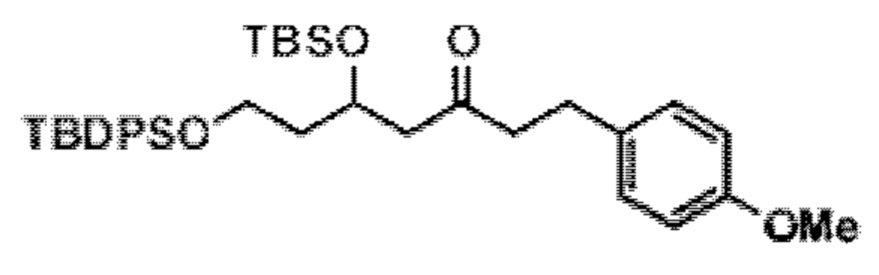
[00630] 103,4 мг, (0,171 ммоль, 86%); IR (пленка) 2955, 2930, 2893, 2856, 1716, 1513, 1472, 1428, 1361, 1248, 1178, 1111, 1084, 1038, 836, 776, 739, 702,615,505 см-1; 1Н-ЯМР (600 МГц, CDCl3) δ=7,68-7,65 (м, 4Н), 7,45-7,35 (м, 6Н), 7,09 (д, J=7,8 Гц, 2Н), 6,82 (д, J=7,8 Гц, 2Н), 4,42-4,37 (м, 1H), 3,78 (с, 3Н), 3,71 (т, J=6,0 Гц, 2Н), 2,85-2,79 (м, 1H), 2,72-2,68 (м, 1Н), 2,60 (дд, J=15,6 Гц, 6,6 Гц, 1H), 2,49 (дд, J=15,6 Гц, 4,8 Гц, 1H), 1,78-1,65 (м, 2Н), 1,06 (с, 9Н), 0,83 (с, 9Н), 0,03 (с, 3Н), 0,01 (с, 3Н); 13С-ЯМР (151 МГц, CDCl3) δ=209,0,158,0, 135,72, 135,69, 133,87, 133,84, 133,3, 129,75, 129,73, 129,3, 127,8, 114,0, 66,7, 60,5, 55,4, 50,5, 46,5, 40,3, 28,7, 27,0, 26,0, 19,3, 19,1, -4,5, -4,6; HRMS (ESI) m/z рассчит. для C36H53O4Si2 [М+Н]+ 605,3477; обнаружено 605,3464.
7-((трет-бутилдифенилсилил)окси)-5-метокси-1-(4-метоксифенил)гептан-3-он (8h)
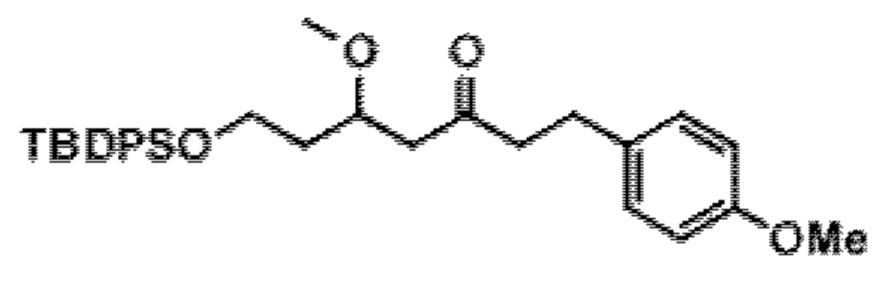
[00631] 94,8 мг (0,188 ммоль, 94%); IR (пленка) 2931, 2896, 2835, 1715, 1612, 1513, 1471, 1464, 1428, 1362, 1300, 1247, 1178, 1111, 1087, 1037, 823, 738, 703, 688, 622, 615, 505, 490, 429 см-1; 1Н-ЯМР (600 МГц, C6D6) δ=7,81-7,77 (м, 4Н), 7,26-7,22 (м, 6Н), 6,98 (д, J=8,5 Гц, 2Н), 6,77 (д, J=8,5 Гц, 2Н), 3,99-3,93 (м, 1H), 3,86-3,80 (м, 1H), 3,76-3,70 (м, 1H), 3,33 (с, 3Н), 3,10 (с, 3Н), 2,82 (т, J=8,0 Гц, 2Н), 2,44-2,36 (м, 3Н), 2,13 (дд, J=15,5 Гц, 4,8 Гц, 1H), 1,73-1,67 (м, 2Н), 1,18 (с, 9Н); 13С-ЯМР (126 МГц, C6D6) δ=207,3, 159,0, 136,4, 134,6, 134,0, 130,4, 130,0, 128,5, 114,0, 75,0, 61,1, 57,2, 55,1, 48,1, 46,1, 37,5, 29,4, 27,5, 17,8; HRMS (ESI) m/z рассчит. для C31H40NaO4Si [M+Na]+ 527,2588; обнаружено 527,2593.
1-((трет-бутилдифенилсилил)окси)-7-(4-метоксифенил)-5-оксогептан-3-илацетат (8i)
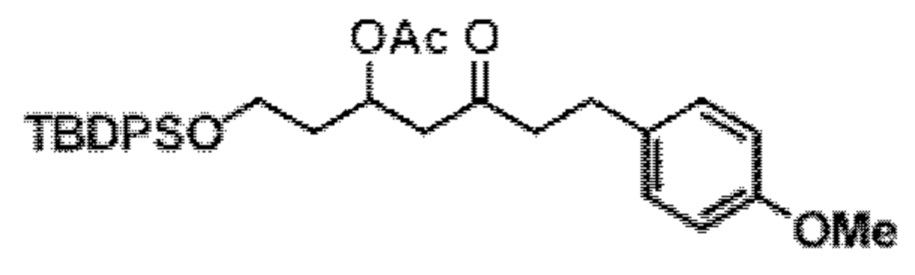
[00632] 90,0 мг (0,169 ммоль, 85%); IR (пленка) 2956, 2931, 2857, 1738, 1716, 1513, 1428, 1363, 1244, 1179, 1111, 1036, 824, 739, 704, 614, 505 см-1; 1Н-ЯМР (600 МГц, C6D6) δ=7,79-7,74 (м, 4Н), 7,26-7,21 (м, 6Н), 6,98 (д, J=7,8 Гц, 2Н), 6,77 (д, J=7,8 Гц, 2Н), 5,67-5,62 (м, 1Н), 3,73-3,64 (м, 2Н), 3,32 (с, 3Н), 2,79 (т, J=7,2 Гц, 2Н), 2,46 (дд, J=16,2 Гц, 6,6 Гц, 1H), 2,42-2,35 (м, 1H), 2,33-2,26 (м, 1H), 2,22 (дд, J=16,2 Гц, 6,6 Гц, 2Н), 1,86-1,79 (м, 1H), 1,78-1,72 (м, 1H), 1,62 (с, 3Н), 1,18 (с, 9Н); 13С-ЯМР (126 МГц, C6D6) δ=205,8, 170,0, 159,0, 136,4, 134,4, 133,8, 130,4, 130,0, 128,5, 114,6, 68,4, 60,8, 55,2, 47,7, 45,4, 37,4, 29,4, 27,4, 21,0, 19,8; HRMS (ESI) m/z рассчит. для C32H401NaO5Si [M+Na]+ 555,2537; обнаружено 555,2533.
((S)-7-((трет-бутилдиметилсилил)окси)-5-хлор-1-(4-метоксифенил)гептан-3-он (8j)
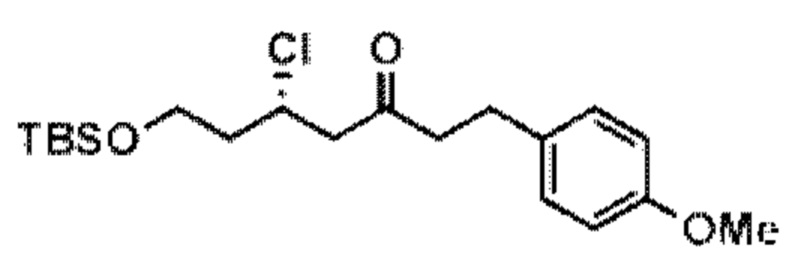
[00633] 28,4 мг (0,074 ммоль, 37%); 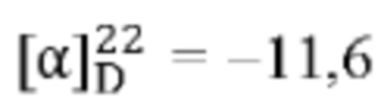 (с 0,5, CHCl3) IR (пленка) 2954, 2928, 2856, 1738, 1716, 1612, 1513, 1463, 1300, 1247, 1178, 1123, 1038, 838, 779 см-1; 1Н-ЯМР (600 МГц, CDCl3) δ=6,10 (д, J=7,8 Гц, 2Н), 6,82 (д, J=7,8 Гц, 2Н), 3,88 (м, 1Н), 3,78 (с, 3Н), 3,77 (дд, J=10,2, 5,1 Гц, 1Н), 3,67 (дд, J=10,2, 6,6 Гц, 1H), 2,85 (т, J=7,2 Гц, 2Н), 2,72 (т, J=7,2 Гц, 2Н), 2,68-2,55 (м, 2Н), 2,25-2,19 (м, 1H), 1,83-1,77 (м, 1H), 0,89 (с, 9Н), 0,07 (с, 6Н); 13С-ЯМР (126 МГц, C6D6) δ=209,3, 158,2, 133,1, 129,4, 114,1, 67,4, 62,2, 55,4, 44,8, 39,5, 29,1, 28.3, 26,0, 18,5, -5,9, -5,3; HRMS (ESI) m/z рассчит. для C20H34ClO3Si [М+Н]+ 385,1960; обнаружено 385,1943.
(с 0,5, CHCl3) IR (пленка) 2954, 2928, 2856, 1738, 1716, 1612, 1513, 1463, 1300, 1247, 1178, 1123, 1038, 838, 779 см-1; 1Н-ЯМР (600 МГц, CDCl3) δ=6,10 (д, J=7,8 Гц, 2Н), 6,82 (д, J=7,8 Гц, 2Н), 3,88 (м, 1Н), 3,78 (с, 3Н), 3,77 (дд, J=10,2, 5,1 Гц, 1Н), 3,67 (дд, J=10,2, 6,6 Гц, 1H), 2,85 (т, J=7,2 Гц, 2Н), 2,72 (т, J=7,2 Гц, 2Н), 2,68-2,55 (м, 2Н), 2,25-2,19 (м, 1H), 1,83-1,77 (м, 1H), 0,89 (с, 9Н), 0,07 (с, 6Н); 13С-ЯМР (126 МГц, C6D6) δ=209,3, 158,2, 133,1, 129,4, 114,1, 67,4, 62,2, 55,4, 44,8, 39,5, 29,1, 28.3, 26,0, 18,5, -5,9, -5,3; HRMS (ESI) m/z рассчит. для C20H34ClO3Si [М+Н]+ 385,1960; обнаружено 385,1943.
(R)-(5-(4-метоксифенил)-3-оксо-1-фенилпентил)карбамат (8k)
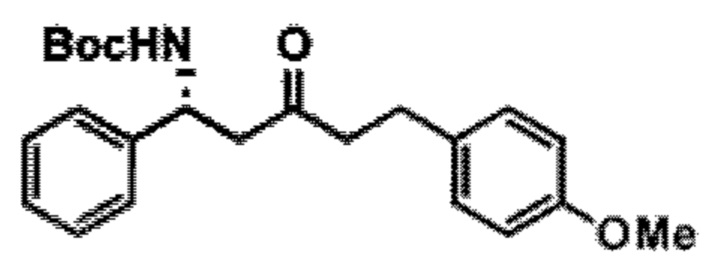
[00634] 69,6 мг (0,182 ммоль, 91%); 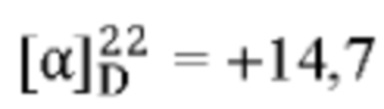 (с 0,3, CHCl3); IR (пленка) 3376, 2979, 2932, 1707, 1612, 1513, 1455, 1366, 1247, 1175, 1037, 819, 701 см-1; 1Н-ЯМР (600 МГц, CDCl3) δ=7,33-7,29 (м, 2Н), 7,27-7,22 (м, 3Н), 7,00 (д, J=8,4 Гц, 2Н), 6,78 (д, J=8,4 Гц, 2Н), 5,46 (ушир. с, 1H), 5,07 (ушир. с, 1H), 3,78 (с, 3Н), 3,00 (ушир. с, 1H), 2,85 (дд, J=17,4 Гц, 4,3 Гц, 1Н), 2,73 (т, J=7,8 Гц, 2Н), 2,69-2,62 (м, 1H), 2,59-2,52 (м, 1H), 1,41 (с, 9Н); 13С-ЯМР (126 МГц, CDCl3) δ=208,5, 158,1, 155,3, 141,7, 132,9, 129,3, 128,8, 127,5, 126,4, 114,0, 79,9, 55.4, 51,3, 48,8, 45,4, 28,7, 28,5; HRMS (ESI) m/z рассчит. для C23H29NNaO4 [M+Na]+ 406,1989; обнаружено 406,1980.
(с 0,3, CHCl3); IR (пленка) 3376, 2979, 2932, 1707, 1612, 1513, 1455, 1366, 1247, 1175, 1037, 819, 701 см-1; 1Н-ЯМР (600 МГц, CDCl3) δ=7,33-7,29 (м, 2Н), 7,27-7,22 (м, 3Н), 7,00 (д, J=8,4 Гц, 2Н), 6,78 (д, J=8,4 Гц, 2Н), 5,46 (ушир. с, 1H), 5,07 (ушир. с, 1H), 3,78 (с, 3Н), 3,00 (ушир. с, 1H), 2,85 (дд, J=17,4 Гц, 4,3 Гц, 1Н), 2,73 (т, J=7,8 Гц, 2Н), 2,69-2,62 (м, 1H), 2,59-2,52 (м, 1H), 1,41 (с, 9Н); 13С-ЯМР (126 МГц, CDCl3) δ=208,5, 158,1, 155,3, 141,7, 132,9, 129,3, 128,8, 127,5, 126,4, 114,0, 79,9, 55.4, 51,3, 48,8, 45,4, 28,7, 28,5; HRMS (ESI) m/z рассчит. для C23H29NNaO4 [M+Na]+ 406,1989; обнаружено 406,1980.
метил-(R)-2-((трет-бутоксикарбонил)амино)-6-(4-метоксифенил)-4-оксогексаноат (8l)
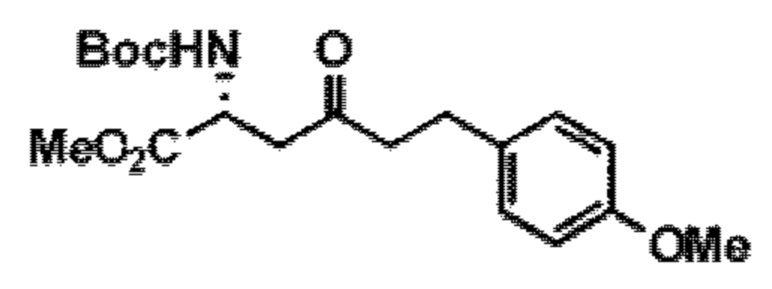
[00635] 62,8 мг (0,172 ммоль, 86%); 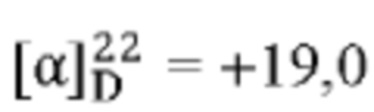 (с 0,8, CHCl3); IR (пленка) 3383, 2974, 2953, 2932, 1749, 1713, 1612, 1513, 1454, 1439, 1367, 1342, 1299, 1247, 1165, 1110, 1088, 1034, 830 см-1; 1Н-ЯМР (600 МГц, C6D6) δ=6,83 (д, J=8,4 Гц, 2Н), 6,74 (д, J=8,4 Гц, 2Н), 5,63 (ушир. с, 1H), 4,62 (ушир. с, 1H), 3,32 (с, 3Н), 3,27 (с, 3Н), 2,70 (д, J=19,2 Гц, 1H), 2,61 (кв, J=6,6 Гц, 2Н), 2,50 (д, J=19,2 Гц, 1H) 2,16-2,06 (м, 2Н), 1,42 (с, 9Н); 13С-ЯМР (126 МГц, C6D6) δ=207,7, 172,2, 159,0, 156,0, 133,4, 129,9, 114,6, 79,9, 55,1, 52,4, 50,4, 44,9, 44,7, 29,2, 28,7; HRMS (ESI) m/z рассчит. для C19H27NNaO6 [M+Na]+ 388,1731; обнаружено 388,1740.
(с 0,8, CHCl3); IR (пленка) 3383, 2974, 2953, 2932, 1749, 1713, 1612, 1513, 1454, 1439, 1367, 1342, 1299, 1247, 1165, 1110, 1088, 1034, 830 см-1; 1Н-ЯМР (600 МГц, C6D6) δ=6,83 (д, J=8,4 Гц, 2Н), 6,74 (д, J=8,4 Гц, 2Н), 5,63 (ушир. с, 1H), 4,62 (ушир. с, 1H), 3,32 (с, 3Н), 3,27 (с, 3Н), 2,70 (д, J=19,2 Гц, 1H), 2,61 (кв, J=6,6 Гц, 2Н), 2,50 (д, J=19,2 Гц, 1H) 2,16-2,06 (м, 2Н), 1,42 (с, 9Н); 13С-ЯМР (126 МГц, C6D6) δ=207,7, 172,2, 159,0, 156,0, 133,4, 129,9, 114,6, 79,9, 55,1, 52,4, 50,4, 44,9, 44,7, 29,2, 28,7; HRMS (ESI) m/z рассчит. для C19H27NNaO6 [M+Na]+ 388,1731; обнаружено 388,1740.
трет-бутил-(S)-(6-(4-метоксифенил)-4-оксо-1-фенилгексан-2-ил)карбамат (8m)
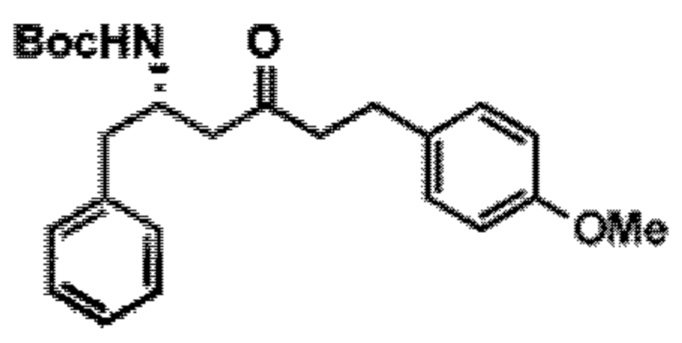
[00636] 71,9 мг (0,181 ммоль, 91%); 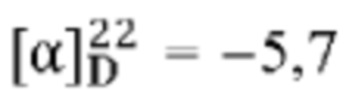 (с 1,1, CHCl3); IR (пленка) 3360, 2977, 2931, 1708, 1612, 1513, 1455, 1391, 1366, 1301, 1247, 1174, 1109, 1077, 1037, 824, 778, 702 см-1; 1Н-ЯМР (600 МГц, CDCl3) δ=7,29-7,25 (м, 2Н), 7,21 (т, J=7,2 Гц, 1H), 7,10 (д, J=7,2 Гц, 2Н), 7,08 (д, J=9,0 Гц, 2Н), 6,82 (д, J=9,0 Гц, 2Н), 5,04 (ушир. с, 1Н), 4,11 (ушир. с, 1Н), 3,78 (с, 3Н), 2,91 (ушир. с, 1H), 2,84-2,75 (м, 3Н), 2,71-2,58 (м, 2Н), 2,54 (д, J=4,9 Гц, 2Н), 1,40 (с, 9Н); 13С-ЯМР (126 МГц, CDCl3) δ=209,5, 158,1, 155,4, 138,2, 132,9, 129,4, 129,3, 128,7, 126,7, 114,1, 79,5, 55,4, 48,9, 45,6, 45,1, 40,4, 28,8, 28,5; HRMS (ESI) m/z рассчит. для C24H32NO4 [М+Н]+ 398,2331; обнаружено 398,2326.
(с 1,1, CHCl3); IR (пленка) 3360, 2977, 2931, 1708, 1612, 1513, 1455, 1391, 1366, 1301, 1247, 1174, 1109, 1077, 1037, 824, 778, 702 см-1; 1Н-ЯМР (600 МГц, CDCl3) δ=7,29-7,25 (м, 2Н), 7,21 (т, J=7,2 Гц, 1H), 7,10 (д, J=7,2 Гц, 2Н), 7,08 (д, J=9,0 Гц, 2Н), 6,82 (д, J=9,0 Гц, 2Н), 5,04 (ушир. с, 1Н), 4,11 (ушир. с, 1Н), 3,78 (с, 3Н), 2,91 (ушир. с, 1H), 2,84-2,75 (м, 3Н), 2,71-2,58 (м, 2Н), 2,54 (д, J=4,9 Гц, 2Н), 1,40 (с, 9Н); 13С-ЯМР (126 МГц, CDCl3) δ=209,5, 158,1, 155,4, 138,2, 132,9, 129,4, 129,3, 128,7, 126,7, 114,1, 79,5, 55,4, 48,9, 45,6, 45,1, 40,4, 28,8, 28,5; HRMS (ESI) m/z рассчит. для C24H32NO4 [М+Н]+ 398,2331; обнаружено 398,2326.
Экспериментальные методики для реакций, отображенных на фигуре 5А
[00637] В перчаточной камере к раствору йодида 9а-u (0,24 ммоль, 1,2 экв.) и тиоэфира 1-5 (54,6 мг, 0,20 ммоль, 1,0 экв.) либо в DMI (0,4 мл, Sigma-aldrich, 99,5%), либо в DMI/EtOAc (0,334 мл/0,066 мл) при комнатной температуре добавляли Cp2ZrCl2 (58,5 мг, 0,20 ммоль, 1,0 экв. Sigma-aldrich, 98%), Zn порошок (39,2 мг, 0,6 ммоль, 3,0 экв. Sigma-aldrich, использовали без какой-либо активации) и NiBr2•dtbbpy (9,7 мг, 0,02 ммоль, 10 мол. %, получение см. стр. 8). После перемешивания при той же температуре в течение 10 мин - 3 ч (отслеживали методом TLC), реакционную смесь удаляли из перчаточной камеры и разбавляли EtOAc и нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой этилацетатом. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на силикагеле с получением соединений 10а-u в виде бесцветных масел или белых аморфных твердых веществ. Примечание 1: в зависимости от растворимости субстратов в качестве растворителя использовали DMI или DMI/EtOAc. Примечание 2: для синтеза соединения 10с перед добавлением Cp2ZrCl2 добавляли 2,0 экв. лутидина. Примечание 3: в процессе синтеза соединений 10р-u использовали 1,5 экв. йодида 9р-u и 1,5 экв. Cp2ZrCl2.
6-((трет-бутилдифенилсилил)окси)-1-(4-метоксифенил)гексан-3-он (10а)
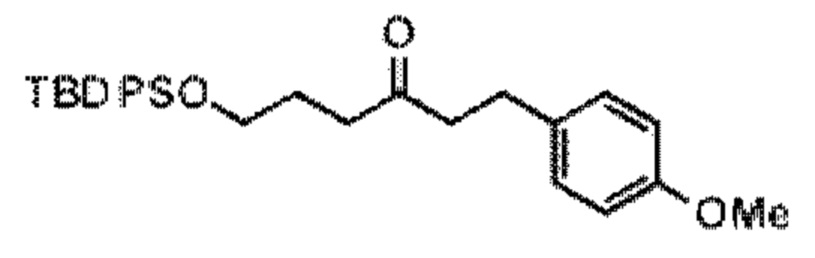
[00638] 87,9 мг (0,191 ммоль, 96%); IR (пленка) 2952, 2931, 2834, 1714, 1513, 1247, 1036, 975, 823, 688, 613, 487 см-1; 1Н-ЯМР (600 МГц, CDCl3) δ=7,66-7,64 (м, 4Н), 7,44-7,36 (м, 6Н), 7,09 (д, J=9,0 Гц, 2Н), 6,82 (д, J=9,0 Гц, 2Н), 3,78 (с, 3Н), 3,66 (т, J=5,9 Гц, 2Н), 2,83 (т, J=7,2 Гц, 2Н), 2,69 (т, J=7,8 Гц, 2Н), 2,51 (т, J=7,2 Гц, 2Н), 1,85-1,80 (м, 2Н), 1,05 (с, 9Н); 13С-ЯМР (151 МГц, CDCl3) δ=210,2, 158,1, 135,7, 133,9, 133,3, 129,8, 129,3, 127,8, 114,0, 63,1, 55,4, 44,7, 39,5, 29,1, 27,0, 26,7, 19,3; HRMS (ESI) m/z рассчит. для C29H37O3Si [M+H]+ 461,2506; обнаружено 461,2508.
6-((трет-бутилдиметилсилил)окси)-1-(4-метоксифенил)гексан-3-он (10b)
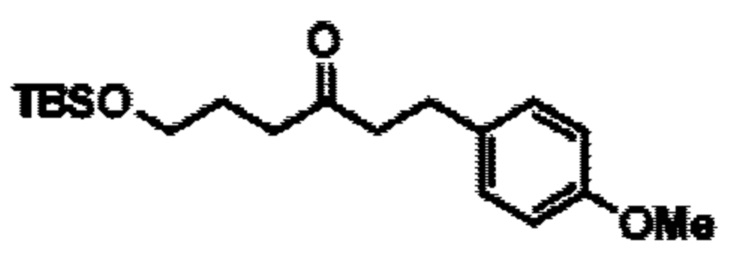
[00639] 63,8 мг (0,190 ммоль, 95%); IR (пленка) 2954, 2929, 2857, 1715, 1513, 1247, 1097, 1038, 835, 776 см-1; 1Н-ЯМР (600 МГц, CDCl3) δ=7,09 (д, J=9,0 Гц, 2Н), 6,82 (д, J=9,0 Гц, 2Н), 3,78 (с, 3Н), 3,59 (т, J=6,0 Гц, 2Н), 2,84 (т, J=7,2 Гц, 2Н), 2,71 (т, J=7,8 Гц, 2Н), 246 (т, J=7,2 Гц, 2Н), 1,79-1,74 (м, 2Н), 0,88 (с, 9Н), 0,03 (с, 6Н); 13С-ЯМР (151 МГц, CDCl3) δ=210,3, 158,1, 133,3, 129,4, 114,0, 62,3, 55,4, 44,8, 39,5, 29,1, 26,9, 26,1, 18,4, -5,2; HRMS (ESI) m/z рассчит. для C19H33O3Si [М+Н]+ 337,2193; обнаружено 337,2186.
1-(4-метоксифенил)-6-((триэтилсилил)окси)гексан-3-он (10с)
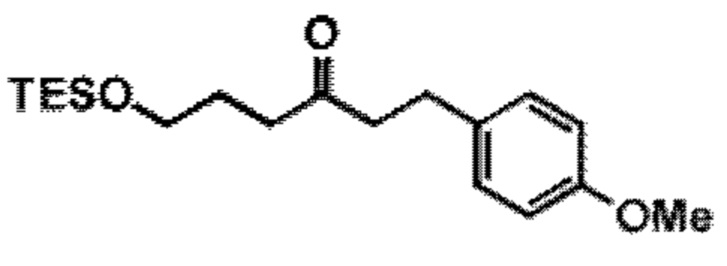
[00640] 61,5 мг (0,183 ммоль, 92%); IR (пленка) 2953, 2876, 2835, 1715, 1612, 1513, 1464, 1247, 1178, 1095, 1038, 1005, 826, 808, 743 см-1; 1Н-ЯМР (600 МГц, C6D6) δ=6,97 (д, J=8,4 Гц, 2Н), 6,77 (д, J=8,4 Гц, 2Н), 3,47 (т, J=5,9 Гц, 2Н), 3,33 (с, 3Н), 2,80 (т, J=7,8 Гц, 2Н), 2,31 (т, J=7,8 Гц, 2Н), 2,15 (т, J=7,2 Гц, 2Н), 1,80-1,75 (м, 2Н), 0,99 (т, J=7,2 Гц, 9Н), 0,58 (кв, J=7,2 Гц, 6Н); 13С-ЯМР (151 МГц, C6D6) δ=208,3, 159,0, 134,0, 130,0, 114,6, 62,4, 55,1, 44,9, 39,5, 29,6, 27,6, 7,5, 5,2; HRMS (ESI) m/z рассчит. для C19H33O3Si [М+Н]+ 337,2193; обнаружено 337,2186.
6-((4-метоксибензил)окси)-1-(4-метоксифенил)гексан-3-он (10d)
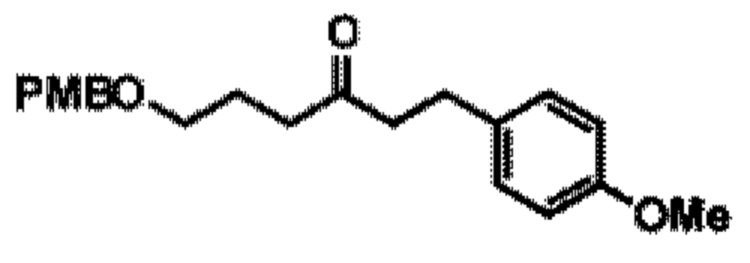
[00641] 64,9 мг (0,190 ммоль, 95%); IR (пленка) 2932, 2855, 2835, 1711, 1612, 1585, 1512, 1464, 1441, 1363, 1301, 1245, 1177, 1095, 1034, 819 см-1; 1Н-ЯМР 7,23 (д, J=9,0 Гц, 2Н), 7,08 (д, J=9,0 Гц, 2Н), 6,87 (д, J=9,0 Гц, 2Н), 6,81 (д, J=9,0 Гц, 2Н), 4,39 (с, 2Н), 3,80 (с, 3Н), 3,78 (с, 3Н), 3,43 (т, J=6,0 Гц, 2Н), 2,82 (т, J=7,2 Гц, 2Н), 2,68 (т, J=7,2 Гц, 2Н), 2,48 (т, J=7,2 Гц, 2Н), 1,89-1,84 (м, 2Н); 13С-ЯМР (126 МГц, CDCl3) δ=210,1, 159,3, 158,1, 133,3, 130,6, 129,39, 129,36, 114,0, 113,9, 72,6, 69,1, 55,40, 55,39, 44,7, 39,8, 29,0, 24,0; HRMS (ESI) m/z рассчит. для C21H26NaO4 [M+Na] 365,1723; обнаружено 365,1724.
1-(4-метоксифенил)-6-((тетрагидро-2H-пиран-2-ил)окси)гексан-3-он (10е)
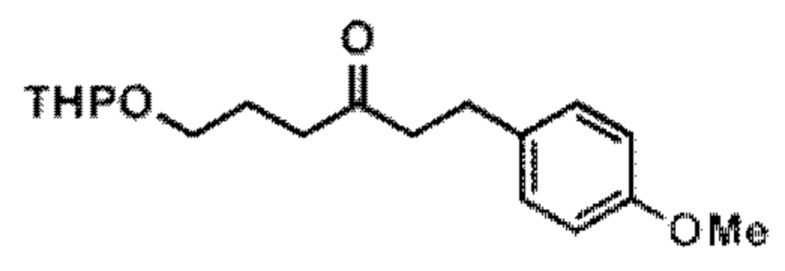
[00642] 55,4 мг (0,181 ммоль, 91%); IR (пленка) 2940, 2870, 1712, 1612, 1513, 1442, 1331, 1246, 1179, 1076, 1034, 991, 815 см-1; 1Н-ЯМР (600 МГц, CDCl3) δ=7,09 (д, J=9,0 Гц, 2Н), 6,81 (д, J=9,0 Гц, 2Н), 4,53 (с, 1H), 3,82 (т, J=9,6 Гц, 1H), 3,78 (с, 3Н), 3,71 (кв, J=6,0 Гц, 1Н), 3,48 (т, J=5,0 Гц, 1H), 3,38 (кв, J=6,0 Гц, 1H), 2,84 (т, J=7,8 Гц, 2Н), 2,72 (т, J=7,8 Гц, 2Н), 2,54-2,44 (м, 2Н), 1,89-1,83 (м, 2Н), 1,80 (д, J=8,4 Гц, 1H), 1,71-1,65 (м, 1Н), 1,58-1,48 (м, 4Н); 13С-ЯМР (151 МГц, CDCl3) δ=209,9, 157,9, 133,2, 129,2, 113,9,76,8, 66,5,62,4, 55,2, 44,6, 39,8, 30,7, 28,9, 25,4, 23,9, 19,7; HRMS (ESI) m/z рассчит. для C18H26NaO4 [M+Na]+ 329,1723; обнаружено 329,1722.
6-(4-метоксифенил)-4-оксогексилацетат (10f)
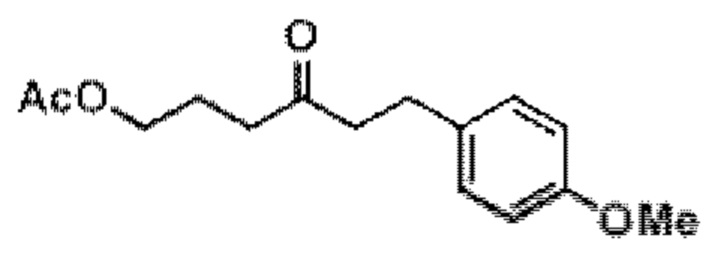
[00643] 49,9 мг (0,189 ммоль, 95%); IR (пленка) 2959, 2935, 1734, 1711, 1512, 1364, 1238, 1177, 1109, 1034, 761 см-1; 1Н-ЯМР (600 МГц, CDCl3) δ=7,09 (д, J=9,0 Гц, 2Н), 6,81 (д, J=9,0 Гц, 2Н), 4,03 (т, J=6,6 Гц, 2Н), 3,77 (с, 3Н), 2,84 (т, J=7,2 Гц, 2Н), 2,70 (т, J=7,2 Гц, 2Н), 2,45 (т, J=7,2 Гц, 2Н), 2,02 (с, 3Н), 1,92-1,86 (м, 2Н); 13С-ЯМР (151 МГц, CDCl3) δ=209,2, 171,2, 158,1, 133,1, 129,4, 114,0, 63,7, 55,4, 44,7, 39,3, 29,0, 22,7, 21,0; HRMS (ESI) m/z рассчит. для С15Н21О4 [M+H]+ 265,1434; обнаружено 265,1433.
6-((трет-бутилдифенилсилил)окси)-1-(4-метоксифенил)-5-метилгексан-3-он (10g)
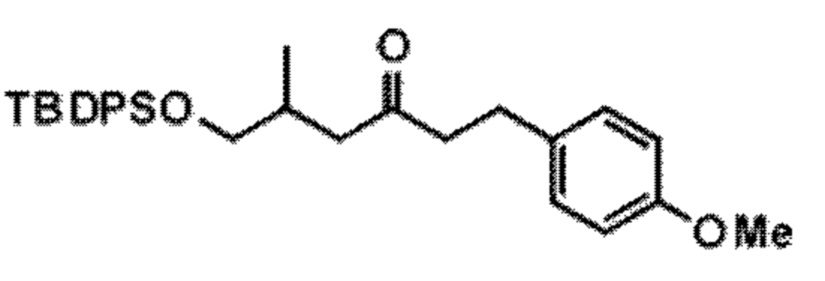
[00644] 85,4 мг (0,180 ммоль, 90%); IR (пленка) 2959, 2931, 2857, 1713, 1513, 1463, 1442, 1247, 1178, 1111, 1037, 824, 741, 702, 614, 506 см-1; 1Н-ЯМР (600 МГц, CDCl3) δ=7,66-7,63 (м, 4Н), 7,44-7,41 (м, 2Н), 7,40-7,36 (м, 4Н), 7,09 (д, J=9,0 Гц, 2Н), 6,82 (д, J=9,0 Гц, 2Н), 3,78 (с, 3Н), 3,52 (дд, J=9,6 Гц, 5,2 Гц, 1Н), 3,43 (дд, J=10,2 Гц, 6,6 Гц, 1H), 2,82 (т, J=8,4 Гц, 2Н), 2,68 (тд, J=7,8 Гц, 2,0 Гц, 2Н), 2,63 (дд, J=16,2 Гц, 5,2 Гц, 1H), 2,28-2,22 (м, 1H), 2,18 (дд, J=16,2 Гц, 16,0 Гц, 1H), 1,05 (с, 9Н), 0,88 (д, J=6,6 Гц, 3Н); 13С-ЯМР (126 МГц, CDCl3) δ=209,9, 157,9, 135,6, 133,7, 133,2, 129,6, 129,2, 127,7, 113,9, 68,3, 55,3, 46,8, 45,1, 32,0, 28,9, 26,9, 19,3, 16,8; HRMS (ESI) m/z рассчит. для C30H39O3Si [M+H]+ 475,2663; обнаружено 475,2654.
6-((трет-бутилдифенилсилил)окси)-1-(4-метоксифенил)-5,5-диметилгексан-3-он (10h)
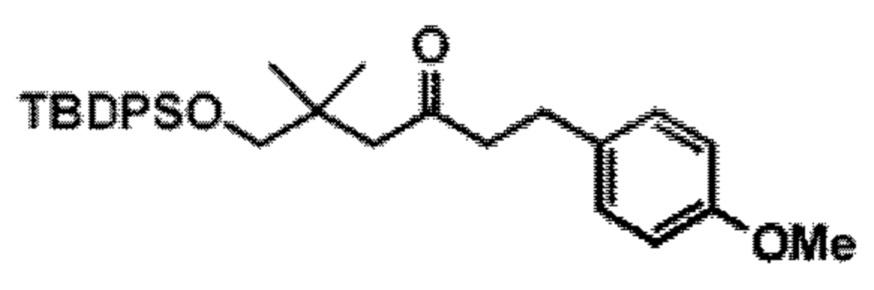
[00645] 88,4 мг (0,181 ммоль, 91%); IR (пленка) 2958, 2858, 1711, 1512, 1264, 1178, 907, 825, 731, 703, 650, 436 см-1; 1Н-ЯМР (600 МГц, CDCl3) δ=7,64-7,62 (м, 4Н), 7,44-7,41 (м, 2Н), 7,39-7,36 (м, 4Н), 7,09 (д, J=9,0 Гц, 2Н), 6,82 (д, J=9,0 Гц, 2Н), 3,78 (с, 3Н), 3,39 (с, 2Н), 2,79 (т, J=7,8 Гц, 2Н), 2,68 (т, J=7,8 Гц, 2Н), 2,42 (с, 2Н), 1,06 (с, 9Н), 0,97 (с, 6Н); 13С-ЯМР (126 МГц, CDCl3) δ=210,2, 158,0, 135,8, 133,8, 133,4, 129,8, 129,4, 127,8, 114,0, 72,2, 55,4, 50,2, 46,9, 36,3, 29,0, 27,1, 24,5, 19,6; HRMS (ESI) m/z рассчит. для C31H41O3Si [М+Н]+ 489,2819; обнаружено 489,2832.
6-((трет-бутилдифенилсилил)окси)-1-(4-метоксифенил)-4-метилгексан-3-он (10i)
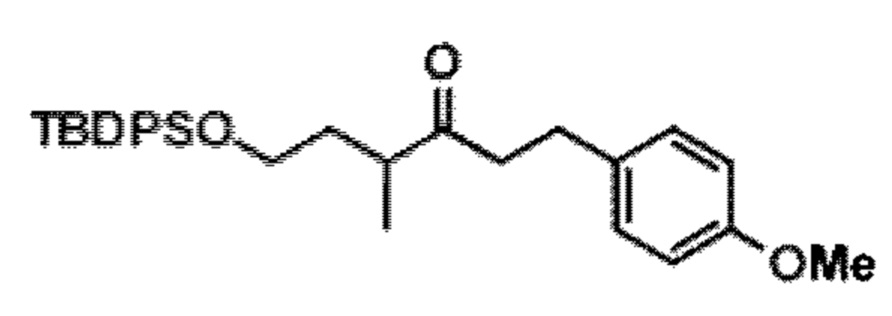
[00646] 90,1 мг (0,190 ммоль, 95%); IR (пленка) 2959, 2931, 2857, 1710, 1612, 1513, 1463, 1247, 1178, 1111, 1038, 823,740, 703, 614, 519 см-1; 1Н-ЯМР (600 МГц, CDCl3) δ=7,66-7,64 (м, 4Н), 7,45-7,41 (м, 2Н), 7,40 = 7,37 (м, 4Н), 7,09 (д, J=9,0 Гц, 2Н), 6,82 (д, J=9,0 Гц, 2Н), 3,79 (с, 3Н), 3,65 (т, J=6,6 Гц, 2Н), 2,84-2,70 (м, 5Н), 1,97-1,90 (м, 1H), 1,53-1,47 (м, 1Н), 1,06 (с, 9Н), 1,02 (д, J=7,2 Гц, 3Н); 13С-ЯМР (126 МГц, CDCl3) δ=213,6, 157,9, 135,6, 133,7, 133,4, 129,7, 129,3, 127,7, 113,9, 61,6, 55,3, 43,1, 42,9, 35,3, 28,9, 26,9, 19,2, 16,2; HRMS (ESI) m/z рассчит. для C30H39O3Si [М+Н]+ 475,2663; обнаружено 475,2657.
6-хлор-1-(4-метоксифенил)гексан-3-он (10l)
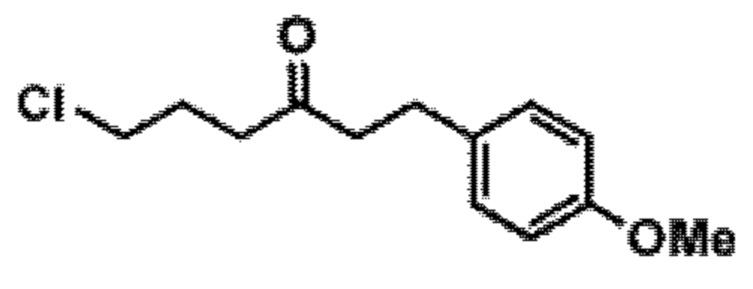
[00647] 46,0 мг (0,192 ммоль, 96%); IR (пленка) 2932, 2836, 1712, 1612, 1513, 1442, 1374, 1300, 1245, 1178, 1091, 1034, 829,546 см-1; 1Н-ЯМР (600 МГц, CDCl3) δ=7,10 (д, J=8,4 Гц, 2Н), 6,82 (д, J=8,4 Гц, 2Н), 3,78 (с, 3Н), 3,55 (т, J=6,6 Гц, 2Н), 2,85 (т, J=7,8 Гц, 2Н), 2,72 (т, J=7,8 Гц, 2Н), 2,58 (т, J=7,8 Гц, 2Н), 2,05-2,00 (м, 2Н); 13С-ЯМР (126 МГц, CDCl3) δ=209,1, 158,2, 133,0, 129,4, 114,1, 55,4, 44,8, 44,6, 29,7, 29,1, 26,4; HRMS (ESI) m/z рассчит. для C13H18ClO2 [М+Н]+ 241,0990; обнаружено 241,0998.
6-бром-1-(4-метоксифенил)гексан-3-он (10m)
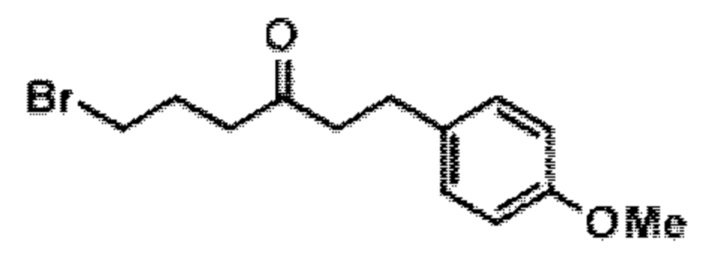
[00648] 54,3 мг (0,191 ммоль, 96%); IR (пленка) 2933, 2835, 1712, 1611, 1512, 1441, 1409, 1372, 1300, 1245, 1178, 1035, 828, 555 см-1; 1Н-ЯМР (600 МГц, CDCl3) δ=7,09 (д, J=8,4 Гц, 2Н), 6,82 (д, J=8,4 Гц, 2Н), 3,78 (с, 3Н), 3,42 (т, J=6,6 Гц, 2Н), 2,85 (т, J=7,8 Гц, 2Н), 2,72 (т, J=7,8 Гц, 2Н), 2,58 (т, J=7,8 Гц, 2Н), 2,13-2,08 (м, 2Н); 13С-ЯМР (126 МГц, CDCl3) δ=209,0, 158,1, 133,0, 129,4, 114,1, 55,4, 44,8, 40,9, 33,4, 29,1, 26,4; HRMS (ESI) m/z рассчит. для C13H18BrO2 [М+Н]+ 285,0485; обнаружено 285,0476.
6-(4-метоксифенил)-4-оксогексил 4-метилбензолсульфонат (10n)
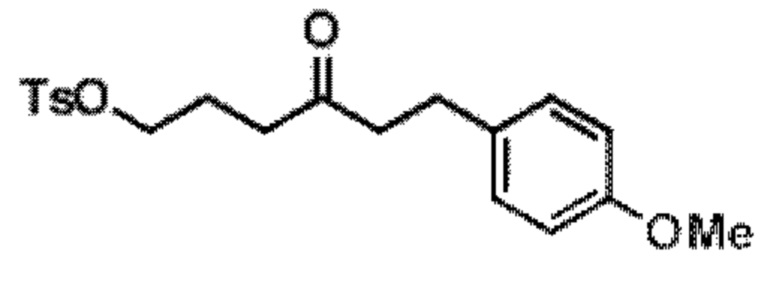
[00649] 61,7 мг (0,164 ммоль, 82%); IR (пленка) 2960, 2936, 1714, 1612, 1513, 1465, 1455, 1443, 1416, 1359, 1302, 1246, 1189, 1175, 1098, 1037, 1037, 1019, 963, 931, 921, 903, 830, 814, 795, 664, 543 см-1; 1Н-ЯМР (600 МГц, C6D6) δ=7,72 (д, J=8,4 Гц, 2Н), 6,94 (д, J=8,4 Гц, 2Н), 6,79 (д, J=8,4 Гц, 2Н), 6,69 (д, J=8,4 Гц, 2Н), 3,79 (т, J=6,6 Гц, 2Н), 3,34 (с, 3Н), 2,70 (т, J=7,2 Гц, 2Н), 2,14 (т, J=7,2 Гц, 2Н), 1,85 (т, J=6,6 Гц, 2Н), 1,82 (с, 3Н), 1,59-1,54 (м, 2Н); 13С-ЯМР (126 МГц, C6D6) δ=207,4, 159,0, 144,6, 134,7, 133,8, 130,2, 129,9, 114,6, 70,0, 55,2, 55,1, 44,7, 38,3, 29,5, 23,5, 21,5; HRMS (ESI) m/z рассчит. для C20H24NaO5S [M+Na]+ 399,1237; обнаружено 399,1221.
6-(4-бромфенил)-1-(4-метоксифенил)гексан-3-он (10о)
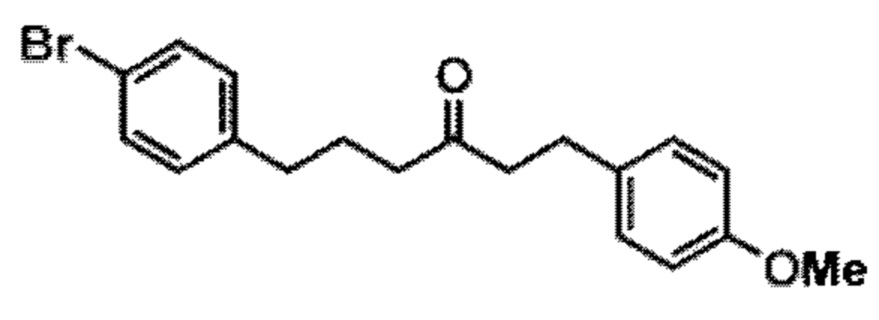
[00650] 57,6 мг (0,160 ммоль, 82%); IR (пленка) 2934, 1712, 1612, 1512, 1488, 1454, 1404, 1370, 1300, 1246, 1178, 1109, 1035, 1011, 824, 518 см-1; 1Н-ЯМР (600 МГц, CDCl3) δ=7,38 (д, J=8,4 Гц, 2Н), 7,08 (д, J=8,4 Гц, 2Н), 7,00 (д, J=8,4 Гц, 2Н), 6,81 (д, J=8,4 Гц, 2Н), 3,78 (с, 3Н), 2,82 (т, J=8,4 Гц, 2Н), 2,66 (т, J=8,4 Гц, 2Н), 2,53 (т, J=7,2 Гц, 2Н), 2,36 (т, J=7,2 Гц, 2Н), 1,88-1,82 (м, 2Н); 13С-ЯМР (151 МГц, CDCl3) δ=209,9, 158,1, 140,7, 133,2, 131,5, 130,3, 129,4, 119,8, 114,0, 55,4, 44,7, 42,1, 34,5, 29,0, 25,0; HRMS (ESI) m/z рассчит. для C19H21BrNaO2 [M+Na]+ 383,0617; обнаружено 383,0608.
6-гидрокси-1-(4-метоксифенил)гексан-3-он (10р)
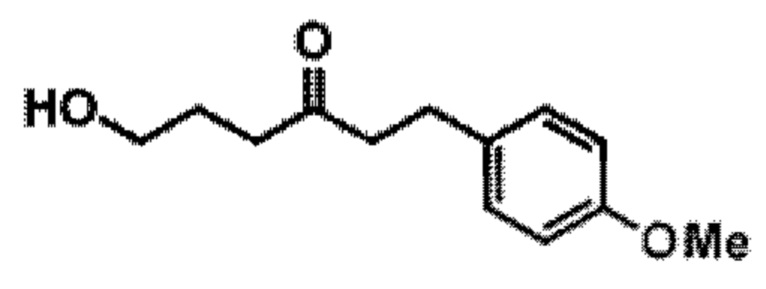
[00651] 27,3 мг (0,123 ммоль, 62%); IR (пленка) 3523-3306 (br), 2918, 1708, 1612, 1513, 1299, 1246, 1179, 1107, 1066, 848 см-1; 1Н-ЯМР (600 МГц, CDCl3) δ=7,10 (д, J=8,4 Гц, 2Н), 6,82 (д, J=8,4 Гц, 2Н), 3,78 (с, 3Н), 3,63 (т, J=6,6 Гц, 2Н), 2,85 (т, J=6,6 Гц, 2Н), 2,73 (т, J=6,6 Гц, 2Н), 2,53 (т, J=6,6 Гц, 2Н), 1,85-1,80 (м, 2Н); 13С-ЯМР (126 МГц, CDCl3) δ=210,9, 158,1, 133,1, 129,3, 114,1, 62,5, 55,4, 44,8, 39,9, 29,1, 26,5; HRMS (ESI) m/z рассчит. для С13Н17О2 [М+Н-Н2О]+ 205,1223; обнаружено 205,1223. Примечание: существует в виде смеси кетона и полуацеталя (30:1).
6-гидрокси-1-(4-метоксифенил)гептан-3-он (10q)
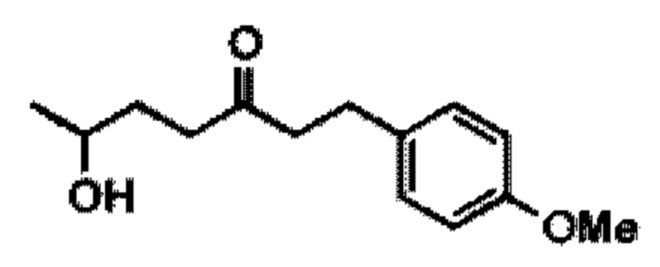
[00652] 30,9 мг (0,131 ммоль, 66%); IR (пленка) 3513-3300 (br), 2916, 1705, 1610, 1513, 1299, 1246, 1179, 1107, 1100, 1087, 845 см-1; 1Н-ЯМР (600 МГц, CDCl3) δ=7,10 (д, J=8,4 Гц, 2Н), 6,82 (д, J=8,4 Гц, 2Н), 3,78 (с, 3Н), 3,78-3,76 (м, 1H), 2,87-2,80 (м, 2Н), 2,77-2,68 (м, 2Н), 2,58-2,49 (м, 2Н), 1,65-1,55 (м, 2Н), 1,18 (д, J=5,2 Гц, 3Н); 13С-ЯМР (126 МГц, CDCl3) δ=211,1, 158,0, 133,4, 129,3, 114,1, 67,6, 55,4, 44,8, 39,5, 32,7 29,1, 23,9; HRMS (ESI) m/z рассчит. для C14H20O3 [М+Н]+ 237,1491; обнаружено 237,1485. Примечание: существует в виде смеси кетона и полуацеталя (20:1).
6-гидрокси-1-(4-метоксифенил)-6-метилгептан-3-он (10r)
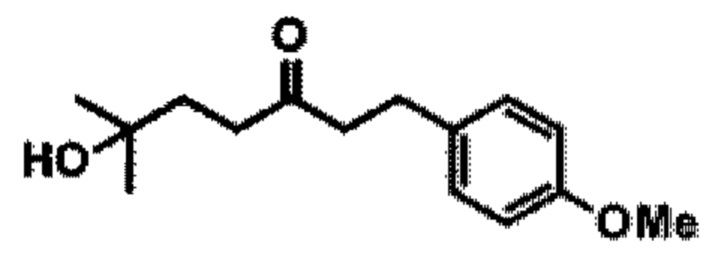
[00653] 24,8 мг (0,099 ммоль, 50%); IR (пленка) 3550-3450 (br), 2966, 2928, 1708, 1611, 1512, 1464, 1366, 1300. 1244, 1177, 1138, 1035, 822 см-1; 1Н-ЯМР (500 МГц, CDCl3) (представлены только пики кетона в смеси) δ=7,09 (д, J=8,4 Гц, 2Н), 6,82 (д, J=8,4 Гц, 2Н), 3,78 (с, 3Н), 2,84 (т, J=9,6 Гц, 2Н), 2,74 (т, J=9,6 Гц, 2Н), 2,52 (т, J=9,6 Гц, 2Н), 1,74 (t J=9,6 Гц, 2Н), 1,19 (с, 6Н); 13С-ЯМР (126 МГц, CDCl3) (представлены все пики в смеси) δ=210,9, 133,0, 129,2, 129,1, 113,9, 113,8, 70,1, 55,3, 44,8, 43,2, 38,0, 37,2, 36,6, 36,2, 30,4, 30,0, 29,4, 29,0 HRMS (ESI) m/z рассчит. для C15H23O3 [M+H]+ 251,1647; обнаружено 251,1639. Примечание: существует в виде смеси кетона и полуацеталя (2,5:1).
1-((2R,3R)-3-гидрокситетрагидро-2H-пиран-2-ил)-4-(4-метоксифенил)бутан-2-он (10s)
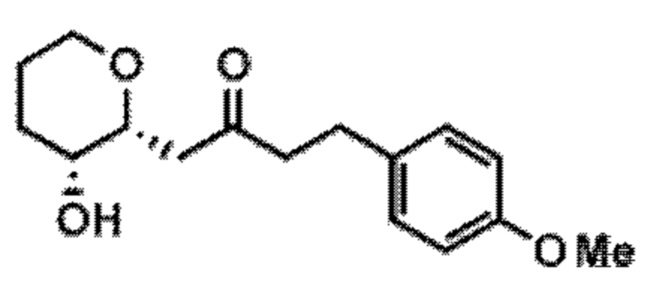
[00654] 25,3 мг (0,091 ммоль); спектры 1Н-ЯМР отражают комплексные смеси, которые рассматриваются как смесь кетона и двух изомеров полуацеталя. Спектр 1H-ЯМР соединения 10s представлен в Части 8 дополнительной документации. Для подтверждения структуры соединение 10s обрабатывали TESOTf (1,2 экв.) и 2,6-лутидином (1,5 экв.) в дихлорметане. Целевое соединение 8е выделяли в виде основного продукта с выходом 87%.
7-((трет-бутилдифенилсилил)окси)-5-гидрокси-1-(4-метоксифенил)гептан-3-он (10t)
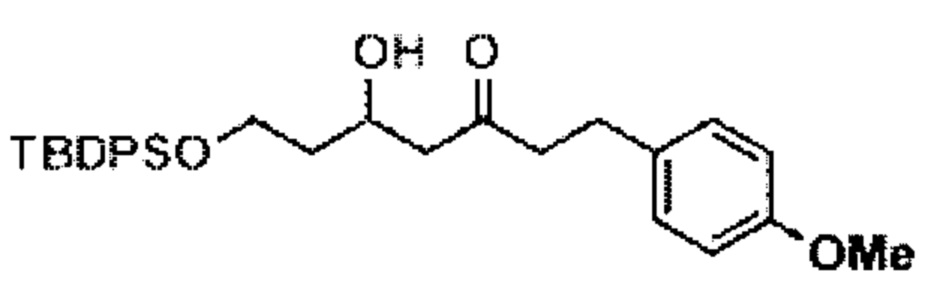
[00655] 40,7 мг (0,083 ммоль, 42%); IR (пленка) 3489 (br), 2930, 2857, 1711, 1612, 1513, 1471, 1428, 1301, 1247, 1178, 1111, 1038, 823, 739, 703, 689, 617, 504 см-1; 1Н-ЯМР (600 МГц, C6D6) δ=7,80-7,75 (м, 4Н), 7,25-7,20 (м, 6Н), 6,95 (д, J=9,0 Гц, 2Н), 6,78 (д, J=9,0 Гц, 2Н), 4,33-4,27 (м, 1H), 3,88-3,83 (м, 1Н), 3,80-3,76 (м, 1Н), 3,32 (с, 3Н), 3,28 (д, J=2,9 Гц, 1Н), 2,77-2,73 (м, 2Н), 2,27 (т, J=7,8 Гц, 2Н), 2,19 (дд, J=16,8 Гц, 9,0 Гц, 1Н), 2,02 (дд, J=16,8 Гц, 3,4 Гц, 2Н), 1,68-1,61 (м, 1H), 1,52-1,46 (м, 1H), 1,16 (с, 9Н); 13С-ЯМР (126 МГц, C6D6) δ=209,7, 159,0, 136,4, 134,3, 133,8, 130,4, 130,0, 114,6, 110,8, 110,7, 66,6, 62,5, 55,2, 50,1, 45,7, 39,6, 29,3, 27,5, 19,7; HRMS (ESI) m/z рассчит. для C30H39O4Si [М+Н]+ 491,2612; обнаружено 491,2604.
3-(((6-(4-метоксифенил)-4-оксогексил)окси)карбонил)бензойная кислота (10u)
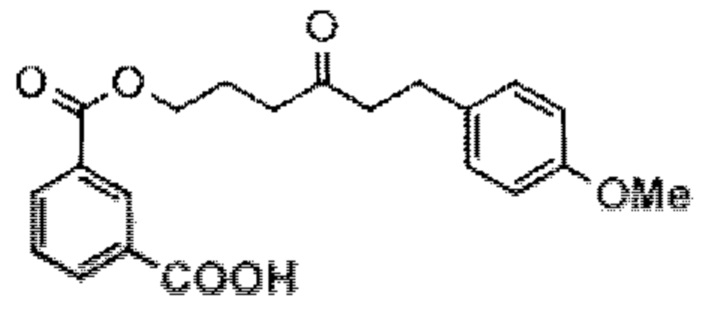
[00656] 42,9 мг (0,116 ммоль, 58%); IR (пленка) 2951, 2905, 2834, 1721, 1610, 1508, 1483, 14691, 1280, 1170, 1105, 1087, 845, 721 см-1; 1Н-ЯМР (600 МГц, CDCl3) δ=8,73 (с, 1H), 8,30 (д, J=5,6 Гц, 1H), 8,26 (д, J=5,6 Гц, 1Н),), 7,59 (т, J=5,6 Гц, 1Н), 7,08 (д, J=8,4 Гц, 2Н), 6,80 (д, J=8,4 Гц, 2Н), 4,35 (т, J=6,6 Гц, 2Н), 3,75 (с, 3Н), 2,86 (т, J=7,8 Гц, 2Н), 2,73 (т, J=7,8 Гц, 2Н), 2,56 (т, J=6,6 Гц, 2Н), 2,07 (м, 2Н); 13С-ЯМР (126 МГц, CDCl3) δ=209,2, 170,8, 165,8, 158,4, 134,8, 134,5, 133,0, 131,4, 131,0, 129,8, 129,4, 128,9, 114,0, 64,8, 55,4, 44,8, 39,4, 29,3, 22,9; HRMS (ESI) m/z рассчит. для C21H22NaO6 [M+Na]+ 393,1314; обнаружено 393,1303.
Экспериментальные методики для реакций, отображенных на фигуре 5В
[00657] В перчаточной камере к раствору йодида 1-12 (27,1 мг, 0,12 ммоль, 1,2 экв.) и тиоэфира 1-11 (23,7 мг, 0,10 ммоль, 1,0 экв.) в DMI (0,2 мл, Sigma-aldrich, 99,5%) при комнатной температуре добавляли Cp2ZrCl2 (29,3 мг, 0,10 ммоль, 1,0 экв. Sigma-aldrich, 98%), Zn порошок (19,6 мг, 0,3 ммоль, 3,0 экв. Sigma-aldrich, использовали без какой-либо активации) и NiBr2•dtbbpy (4,8 мг, 0,01 ммоль, 10 мол. %, получение см. стр. 8). После перемешивания при той же температуре в течение 40 мин (отслеживали методом TLC), реакционную смесь удаляли из перчаточной камеры и разбавляли EtOAc и нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой этилацетатом. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на силикагеле с получением соединения 1-13 в виде бесцветного масла.
1,3-бис(тетрагидро-2H-пиран-2-ил)пропан-2-он (соединение 1-13, смесь 1:1)
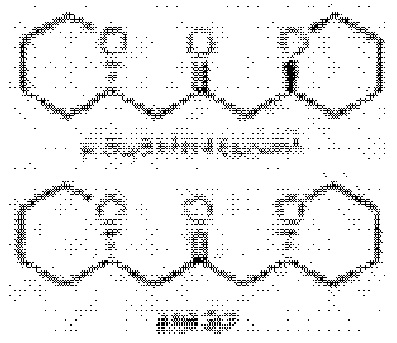
[00658] 19,4 мг (0,086 ммоль, 86%); IR (пленка) 2933, 2487, 1713, 1440, 1378, 1356, 1203, 1175, 1088 см-1; 1Н-ЯМР (600 МГц, CDCl3) δ=3,91 (д, J=9,2 Гц, 2Н), 3,79-3,73 (м, 2Н), 3,43 (дд, J=11,2, 10,8 Гц, 2Н), 2,67 (дд, J=14,8, 5,8 Гц, 2Н), 2,44 (дд, J=14,8, 5,8 Гц, 2Н), 1,80 (д, J=7,2 Гц, 2Н), 1,62-1,58 (м, 3Н), 1,52-1,46 (м, 5Н), 1,30-1,21 (м, 2Н); 13С-ЯМР (126 МГц, CDCl3) δ=207,7, 74,1, 68,7, 50,6, 50,4, 31,9, 25,9, 23,5 HRMS (ESI) m/z рассчит. для C13H22NaO3 [M+Na]+ 249,1467; обнаружено 249,1460.
1,3-бис((S)-тетрагидро-2H-пиран-2-ил)пропан-2-он [(S)-1-13]
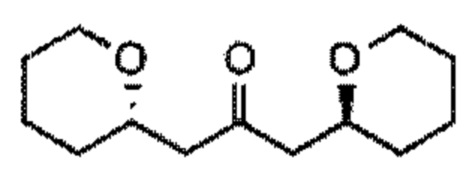
[00659] 20,2 мг (0,089 ммоль, 89%); 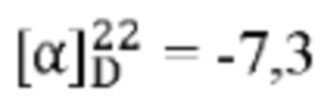 (с 0,74, CHCl3); 1Н-ЯМР (600 МГц, CDCl3) δ=3,91 (д, J=9,2 Гц, 2Н), 3,79-3,73 (м, 2Н), 3,43 (дд, J=11,2, 10,8 Гц, 2Н), 2,67 (дд, J=14,8, 5,8 Гц, 2Н), 2,44 (дд, J=14,8, 5,8 Гц, 2Н), 1,80 (д, J=7,2 Гц, 2Н), 1,62-1,58 (м, 3Н), 1,52-1,46 (м, 5Н), 1,30-1,21 (м, 2Н); 13С-ЯМР (126 МГц, CDCl3) δ=207,7, 74,1, 68,7, 50,6, 31,9, 25,9, 23,5 м.д.; HRMS (ESI) m/z рассчит. для C13H22NaO3 [M+Na]+ 249,1467; обнаружено 249,1463.
(с 0,74, CHCl3); 1Н-ЯМР (600 МГц, CDCl3) δ=3,91 (д, J=9,2 Гц, 2Н), 3,79-3,73 (м, 2Н), 3,43 (дд, J=11,2, 10,8 Гц, 2Н), 2,67 (дд, J=14,8, 5,8 Гц, 2Н), 2,44 (дд, J=14,8, 5,8 Гц, 2Н), 1,80 (д, J=7,2 Гц, 2Н), 1,62-1,58 (м, 3Н), 1,52-1,46 (м, 5Н), 1,30-1,21 (м, 2Н); 13С-ЯМР (126 МГц, CDCl3) δ=207,7, 74,1, 68,7, 50,6, 31,9, 25,9, 23,5 м.д.; HRMS (ESI) m/z рассчит. для C13H22NaO3 [M+Na]+ 249,1467; обнаружено 249,1463.
1-((R)-тетрагидро-2H-пиран-2-ил)-3-((S)-тетрагидро-2H-пиран-2-ил)пропан-2-он[(S,R)-1-13]
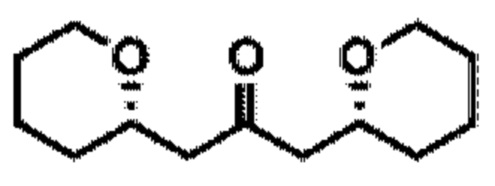
[00660] 19,2 мг (0,085 ммоль, 85%) из соединения (S)-1-11; 19,4 мг (0,086 ммоль, 86%) из соединения (R)-1-11. 1Н-ЯМР (600 МГц, CDCl3) δ=3,91 (д, J=9,2 Гц, 2Н), 3,79-3,73 (м, 2Н), 3,43 (дд, J=11,2, 10,8 Гц, 2Н), 2,67 (дд, J=14,8, 5,8 Гц, 2Н), 2,44 (дд, J=14,8, 5,8 Гц, 2Н), 1,80 (д, J=7,2 Гц, 2Н), 1,62-1,58 (м, 3Н), 1,52-1,46 (м, 5Н), 1,30-1,21 (м, 2Н); 13С-ЯМР (126 МГц, CDCl3) δ=207,7, 74,1, 68,7, 50,4, 31,9, 25,9, 23,5 м.д.; HRMS (ESI) m/z рассчит. для C13H22NaO3 [M+Na]+ 249,1467; обнаружено 249,1463.
1,3-бис((R)-тетрагидро-2H-пиран-2-ил)пропан-2-он [(R)-1-13]
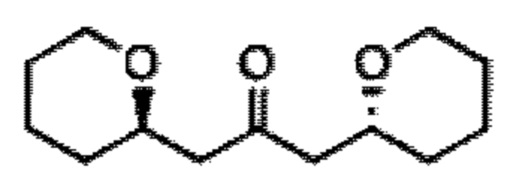
[00661] 19,0 мг (0,084 ммоль, 84%); 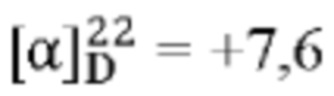 (с 0,77, CHCl3); 1Н-ЯМР (600 МГц, CDCl3) δ=3,91 (д, J=9,2 Гц, 2Н), 3,79-3,73 (м, 2Н), 3,43 (дд, J=11,2, 10,8 Гц, 2Н), 2,67 (дд, J=14,8, 5,8 Гц, 2Н), 2,44 (дд, J=14,8, 5,8 Гц, 2Н), 1,80 (д, J=7,2 Гц, 2Н), 1,62-1,58 (м, 3Н), 1,52-1,46 (м, 5Н), 1,30-1,21 (м, 2Н); 13С-ЯМР (126 МГц, CDCl3) δ=207,7, 74,1, 68,7, 50,6, 31,9, 25,9, 23,5 м.д.; HRMS (ESI) m/z рассчит. для C13H22NaO3 [M+Na]+ 249,1467; обнаружено 249,1455.
(с 0,77, CHCl3); 1Н-ЯМР (600 МГц, CDCl3) δ=3,91 (д, J=9,2 Гц, 2Н), 3,79-3,73 (м, 2Н), 3,43 (дд, J=11,2, 10,8 Гц, 2Н), 2,67 (дд, J=14,8, 5,8 Гц, 2Н), 2,44 (дд, J=14,8, 5,8 Гц, 2Н), 1,80 (д, J=7,2 Гц, 2Н), 1,62-1,58 (м, 3Н), 1,52-1,46 (м, 5Н), 1,30-1,21 (м, 2Н); 13С-ЯМР (126 МГц, CDCl3) δ=207,7, 74,1, 68,7, 50,6, 31,9, 25,9, 23,5 м.д.; HRMS (ESI) m/z рассчит. для C13H22NaO3 [M+Na]+ 249,1467; обнаружено 249,1455.
Синтез галихондринов и аналогов
[00662] Был разработан унифицированный, эффективный и масштабируемый синтез галихондринов с использованием Zr/Ni-опосредованного однореакторного синтеза кетонов в качестве конечной реакции сочетания. В предыдущем синтезе, ключевое промежуточное соединение для конструирования [6,6]- и [5,5]-спирокеталей представляло собой енон 2-3, который синтезировали посредством Ni/Cr-опосредованного сочетания 2-1 с 2-2 с отличным общим выходом (Фигура 7). Недавно было определено, что наилучшей комбинацией защитных групп в положениях С35, С41 и С48 является TES, TBS и TES, соответственно. В процессе данной трансформации, три хиральных центра вводятся в положения С38, С40 и С44, ср., 2-3→2-А→2-В→2-4. Основываясь на работе по синтезу кальцимицина, требуемая стереохимия должна быть предпочтительно сформирована в щелочных условиях (см., например, Negri, D.P.; Kishi, Y. Tetrahedron Lett., 1987, 28, 1063). Действительно, данный подход безупречно сработал для синтеза галихондринов А-С. Тем не менее, желателен альтернативный путь для конечной трансформации.
[00663] Кетон 2-В доступен посредством хорошо охарактеризованного альтернативного пути. Zr/Ni-опосредованный однореакторный синтез кетонов продемонстрировал потенциал для удовлетворения этих потребностей; более определенно, этот метод доказал эффективность для сочетания (S)-2-C+(S)-2-D→(Σ,Σ)-2-E. Необходимый кетон 2-В может быть синтезирован из йодида 2-5 и сложного 2-тиопиридинового эфира 2-6. Кетон 2-В может быть также получен посредством сочетания по связи С38-С39, но авторы сфокусировались на первом пути по причине общей эффективности синтеза 2-5. Осуществимость этого разрыва была продемонстрирована с использованием комбинации CH2I в положении С40 и C(=O)SPy в положении С38. Ру=2-пиридил.
[00664] Будучи вдохновлены успешным сочетанием ((S)-2-C+(S)-2-D→(Σ,Σ)-2-Е), начались исследования применимости предложенного синтеза. Для этого исследования была выбрана правая половина 2-5 галихондринов В. С35-защитная группа была выбрана по двум причинам, а именно (1) скорость кетонового сочетания с 2-5 была значительно выше, чем для соответствующего субстрата C35-TBS, и (2) снятие защитной группы с группы C35-TES на последующей стадии было заметно быстрее, чем для соответствующего субстрата C35-TBS. С другой стороны, левая половина 2-6 была выбрана по причине ее доступности в большем количестве во время предварительного исследования. С41-защитная группа была выбрана главным образом из-за простоты снятия защитной группы.
[00665] Целевой продукт 2-7 получили с первой попытки в условиях, использованных для сочетания ((S)-2-C+(S)-2-D→(Σ,Σ)-2-Е). Затем, для этого случая условия были оптимизированы. Во-первых, Cp2ZrCl2 был важен для ускорения кетонового сочетания и, в то же время, подавлял образование побочного продукта в положении С37посредством (I→SPy)-обмена. Во-вторых, было обнаружено, что смесь DMI и EtOAc 5:1 представляет собой наилучший растворитель. В-третьих, сочетание хорошо протекало при концентрации 0,1 М, хотя при более высокой концентрации, например при 0,4 М, протекала лучше. В четвертых, металлические Zn и Mn были обоюдно эффективны. В-пятых, 2,6-ди-трет-бутил-4-метилпиридина использовали для предотвращения частичного снятия защитных групп TES в процессе реакции и/или выделения продукта реакции. Наконец, как и ожидалось, эффективность сочетания зависела от молярного соотношения 2-5 и 2-6, например, выход составлял 84% для 2-5:2-6 = 1,0:1,3; 62% для 1,0:1,0; 71% для 1,0:1,2.
[00666] Принимая во внимание все указанные факторы, условия сочетания, указанные на Фигуре 7, представлены в качестве примера методики. Для всех сочетаний, использовали молярное соотношение 2-5:2-6 = 1,0:1,3, с учетом размера молекул и сложности строения 2-5 относительно 2-6. В этих условиях, проводили кетоновое сочетание в масштабе 0,5-1,0 г, с получением целевого продукта 2-7 со значениями выхода 80-90%.
[00667] В данном сочетании, три побочных продукта выделяли с очень малыми значениями выхода (значения выхода ~3%). После спектрометрического анализа 1Н-ЯМР, MS) было предположено, что указанные побочные продукты представляют собой 2-8, 2-9 и 2-10, соответственно. Первые два побочных продукта получали из 2-5, образование которых было неудивительно в свете результатов, обсуждавшихся для работ по разработке способа. Третий побочный продукт 2-10 был, по-видимому, получен из 2-6, образуясь, как предполагается, посредством Ni-опосредованного декарбонилирования, чья трансформация отражена на Фигуре 7.
[00668] Кетон 2-7 также может служить для модельного исследования на второй стадии синтеза, т.е. снятия защитных силильных групп с последующим катализируемым кислотой образованием [5,5]-спирокеталя. Как ожидается, С50/С52-диоксасилинановая группа в 2-7 может быть легко удалена путем обработки HF⋅Py с получением соответствующего диола. Путем обработки полученного С49/С52-диола TBAF (4 эквив.), забуференного пивалевой кислотой (2 эквив.), в течение 6 часов получали продукт с полностью снятыми защитными группами, подтверждая тем самым простоту снятия двух защитных групп TES в положениях С35 и С41. Эта трансформация была также проведена в одну стадию, т.е. путем обработки TBAF, забуференным пивалевой кислотой.
[00669] Полностью десилилированный продукт обрабатывали кислотой с получением 2-11; а именно, путем обработки PPTS в CH2Cl2 при комнатной температуре получали смесь 2-11 и его С38-эпи-11 (~5:1), которую разделяли методом обращенно-фазовой колоночной хроматографии среднего давления с получением 2-11 (общий выход 67% из 2-5) и С38-эпи-2-11 (общий выход 13% из 2-5). Описанные ранее способом С38-эпи-2-11 изомеризовали с получением дополнительного количества 2-11 (практический выход 9%), получая тем самым общий выход 76% 2-11 из 5. Структура 2-11 была найдена из данных спектроскопического анализа; спектры 1Н и 13С-ЯМР обнаружили прекрасное соответствие спектрам норгалихондрина В.
[00670] Результаты, представленные в предыдущей секции, убедительно доказали, что Zr/Ni-опосредованный однореакторный синтез кетонов должен привести к разработке унифицированного синтеза природных веществ галихондринового класса и их аналогов. Для экспериментальной демонстрации поли получены три типа правых и левых половин, соответственно (Фигура 8А). Комбинации указанных правых и левых половин должны давать все девять галихондринов (Фигура 8В).
[00671] Первый этап данного подхода заключался в применении Zr/Ni-опосредованного однореакторного синтеза кетонов для каждой комбинации. Кетоновое сочетание проводили в ранее определенных условиях с получением ожидаемых продуктов со значениями практического выхода 80-90%. Все кетоны были выделены методом колоночной хроматографии среднего давления (нейтральный силикагель) и полностью охарактеризованы. Результаты были фактически идентичны таковым, обнаруженным для 2-5+2-6→2-7, включая значения скорости сочетания, практических выходов и обнаруженных побочных продуктов. Например, сочетание (2-5+2-14) проводили в масштабе 200 мг 2-5 с получением ожидаемого целевого кетона с практическим выходом 88% вместе с тремя побочными продуктами 2-8, 2-9 и одного соответствующего 2-11 с малыми значениями выхода (~3%). Примечательно, было обнаружено, что С12-аллильная группа галихондринов С интактна в процессе синтеза кетонов.
[00672] Второй этап представлял собой снятие силильных защитных групп с последующим образованием [5,5]-спирокеталя в кислых условиях. Сначала был изучен синтез галихондрина В, где снятие силильных защитных групп и образование [5,5]-спирокеталя выполняли с TBAF, забуференным пивалевой кислотой, в DMF, а затем PPTS в CH2Cl2, с получением смеси галихондрина В и его С38-эпимера (~5:1). Обращенно-фазовая колоночная хроматография среднего давления была адаптирована для разделения/выделения с получением галихондрина В и С38-эпимера с отличным общим выходом; например, из 200 мг 2-5 получали 133 мг (68%) и 25 мг (13%) галихондрина В и С38-эпи-галихондрина В, соответственно. Ранее описанным способом С38-эпи-галихондрин В изомеризовали с получением дополнительно 17 мг галихондрина В (практический выход 9%). Таким образом, общий выход галихондрина В из 2-5 составил 77%. Сравнением спектров (HR-MS, 1Н и 13С-ЯМР) было подтверждено, что галихондрин В идентичен аутентичному образцу. Воспроизводимость всей трансформации была отличной, и не было отмечено никаких потенциальных проблем для масштабирования.
[00673] По аналогии проводили синтез галихондрина А (2-12+2-14→2-20). Для этого семейства требовалась дополнительная стадия для удаления С12/С13-анисилидена, а именно обработка PPTS в смеси изопропанола и 2,2-диметил-1,3-пропандиола. В процессе обработки кислотой соотношение галихондрина А и его С38-эпимера изменялось от ~5:1 до ~3:1. Как и ранее, С38-эпимер изомеризовали с получением галихондрина А из 2-12 с общим выходом 61%. Путем сравнения спектров подтверждали, что галихондрин А был идентичен аутентичному образцу.
[00674] Также проводили синтез галихондрина С (2-13+2-14→2-23). Для этого семейства требовалась дополнительная стадия для удаления аллильной группы в положении С12, что без осложнений достигалось способом, использованным в предыдущем синтезе. Синтетический галихондрин С и С38-эпимер выделяли с выходами 55% и 11%, соответственно. Путем сравнения спектров подтверждали, что галихондрин С был идентичен аутентичному образцу. Примечательно, что предпринятая TMSOTf-индуцированная изомеризация в CH2Cl2 не приводила к выходу галихондрина С.Этот феномен наблюдался для всех представителей подгруппы галихондрина С, но не для какого-либо представителя других подгрупп, указывая тем самым на то, что причина безуспешной изомеризации заключалась в химических свойствах полицикла галихондрина С. Спектроскопический анализ продукта, образованного в процессе предпринятой реакции, навел на мысль о перегруппировке полицикла галихондрина С до С12-кеталя.
[00675] Синтез для норгалихондринового ряда протекал с таким же успехом, хотя требовалась дополнительная стадия для гидролиза сложного метилового эфира в положении С53, что достигалось в условиях, использованных в предыдущей работе. Следует отметить, что для синтеза норгалихондрина С, индуцированный основанием гидролиз сложного метилового эфира проводили до снятия защитных аллильных групп по причине нестабильности полицикла галихондрина С в щелочных условиях. Сравнением спектров устанавливали, что полученные тем самым норгалихондрины А-С были идентичны аутентичным образцам.
[00676] В завершение, для гомогалихондринового ряда использовали кетоновый путь. Примечательно, что ранее описанный еноновый путь был не эффективен для синтеза гомогалихондринов; он был успешен только для гомогалихондрина А, но с очень малой эффективностью (практический выход 5%). К нашему удовольствию, был обнаружен новый путь синтеза, эффективный для полного синтеза всех гомогалихондринов; общая эффективность для гомогалихондринового ряда была сравнима с таковой для галихондринового и норгалихондринового рядов. Например, из 100 мг 2-5 получали 72 мг гомогалихондрина В (общий выход 75%). Сравнением спектров (HR-MS, 1Н и 13С-ЯМР) подтверждали, что гомогалихондрины А-С были идентичны аутентичным образцам. Воспроизводимость всей трансформации была отличной, и не было отмечено никаких потенциальных проблем для масштабирования.
[00677] Подводя итого, был осуществлен унифицированный, эффективный и масштабируемый синтез природных веществ галихондринового класса. Новый разработанный Zr/Ni-опосредованный однореакторный синтез кетонов использовали для сочетания правых и левых половин, причем было обнаружено, что Cp2ZrCl2 сыграл важнейшую роль для увеличения скорости реакции и, в то же самое время, подавления образования побочных продуктов. Галихондрины были получены из указанных кетонов по существу в результате двух операций, а именно десилилирования, а затем образования [5,5]-спирокеталя. Примечательно, что новый путь синтеза был с успехом применен для полного синтеза всех гомогалихондринов. Все галихондрины, синтезированные таким образом, были выделены в виде кристаллических твердых веществ. Для некоторых из них, авторы преуспели в выращивании монокристалла для рентгеновского анализа; на настоящий момент анализ завершен для галихондрина С, который был первым успешным рентгеновским анализом интактного галихондрина. Для демонстрации масштабируемости был выбран галихондрин В, и 150 мг галихондрина В (выход 77%) было получено из 200 мг правой половины 2-5.
Экспериментальные методики для синтеза галихондринов и аналогов
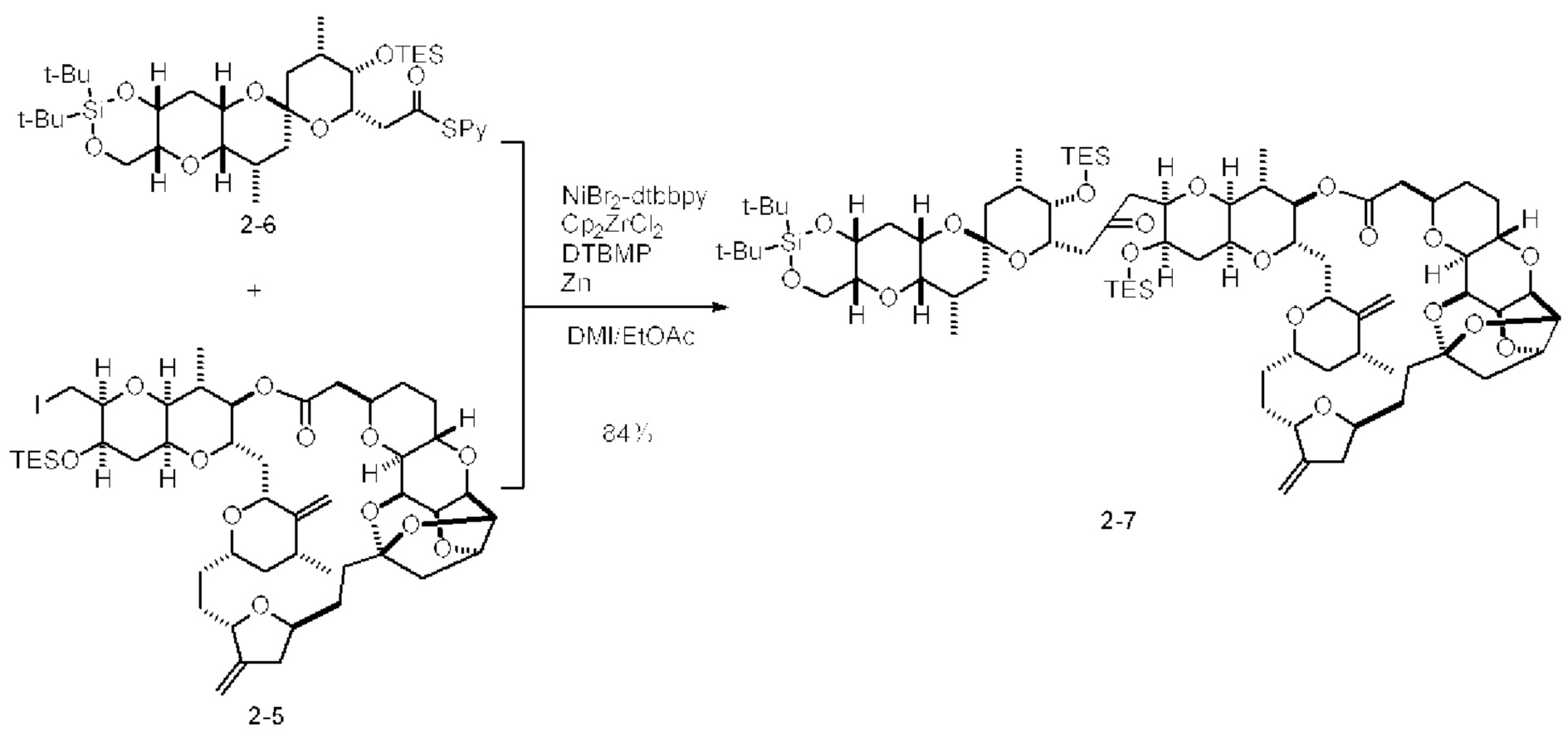
[00678] В перчаточной камере к смеси 2-5 (41,6 мг, 0,0424 ммоль, 1 экв.), 2-6 (39 мг, 0,0551 моль, 1,3 экв.), DTBMP (21,8 мг, 0,106 ммоль, 2,5 экв.), Zn (16,6 мг, 0,254 ммоль, 6 экв.) и Cp2ZrCl2 (24,8 мг, 0,0848 ммоль, 2 экв.) при комнатной температуре добавляли смесь (5:1) DMI-EtOAc (0,2 мл) и NiBr2⋅dtbbpy (7,2 мг, 0,0148 ммоль, 35 мол. %). После перемешивания в течение 1,5 ч при той же температуре, реакционную смесь удаляли из перчаточной камеры и гасили добавлением нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой Et2O. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали на системе очистки YAMAZEN с нейтральным силикагелем с получением 2-7 (51,7 мг, 0,0356 ммоль, 84%) в виде бесцветного аморфного твердого вещества. (2-7): [α]20D -59,7 (с 1,0, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 5,20 (1H, с), 5,10 (1H, с), 4,92 (1H, с), 4,84-4,74 (3Н, м), 4,68 (1H, д, J=10,6 Гц), 4,52 (1H, ддд, J=10,0, 10,0, 4,1 Гц), 4,35 (1H, м), 4,27 (1H, м), 4,21 (1H, д, J=12,3 Гц), 4,17-4,06 (4Н, м), 4,03-3,94 (4Н, м), 3,89 (1H, дд, J=6,5, 4,7 Гц), 3,84-3,70 (3Н, м), 3,64 (1H, дд, J=6,5, 4,1 Гц), 3,45 (1H, ддд, J=4,7, 4,7, 4,7 Гц), 3,33 (1H, с), 3,19 (1H, дд, J=16,4, 10,0 Гц), 3,14 (1H, дд, J=5,3, 4,1 Гц), 3,07-2,95 (3Н, м), 2,84-2,72 (3Н, м), 2,61 (1Н, дд, J=9,4, 1,8 Гц), 2,45-2,02 (15Н, м), 2,02-1,90 (2Н, м), 1,83 (1H, м), 1,79-1,66 (6Н, м), 1,59 (1H, ддд, J=14,1, 4,7, 4,7 Гц), 1,56-1,37 (6Н, м), 1,37-1,27 (10Н, м), 1,17 (3Н, д, J=7,0 Гц), 1,13 (9Н, с), 1,10-1,02 (22Н, м), 1,00 (3Н, д, J=6,5 Гц), 0,96 (3Н, д, J=6,5 Гц), 0,72-0,62 (12Н, м) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 206,9, 171,3, 153,0, 152,7, 110,0, 15,0, 103,7, 97,2, 82,4, 81,0, 78,3, 78,0, 77,8, 77,7, 77,6, 76,9, 76,2, 75,5, 74,8, 74,7 (х2), 74,2, 74,0, 73,8, 73,2, 70,4, 69,3, 68,6, 68,5, 67,3, 66,0, 64,7, 63,8, 48,6, 46,7, 46,3, 43,9, 41,3, 39,5, 39,2, 38,5, 37,7, 36,8, 36,6, 36,3, 35,5, 35,3, 32,5, 31,1, 30,7, 30,6, 30,4, 29,5, 29,1, 27,9, 27,7, 23,4, 21,0, 18,6, 18,1, 17,4, 16,4, 7,5, 7,3, 6,0, 5,3 м.д. IR (пленка): 2955, 2933, 2875, 1723, 1371, 1133, 1097, 1084, 1017 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C78H128NaO19Si3, 1475,8250; обнаружено, 1475,8251.
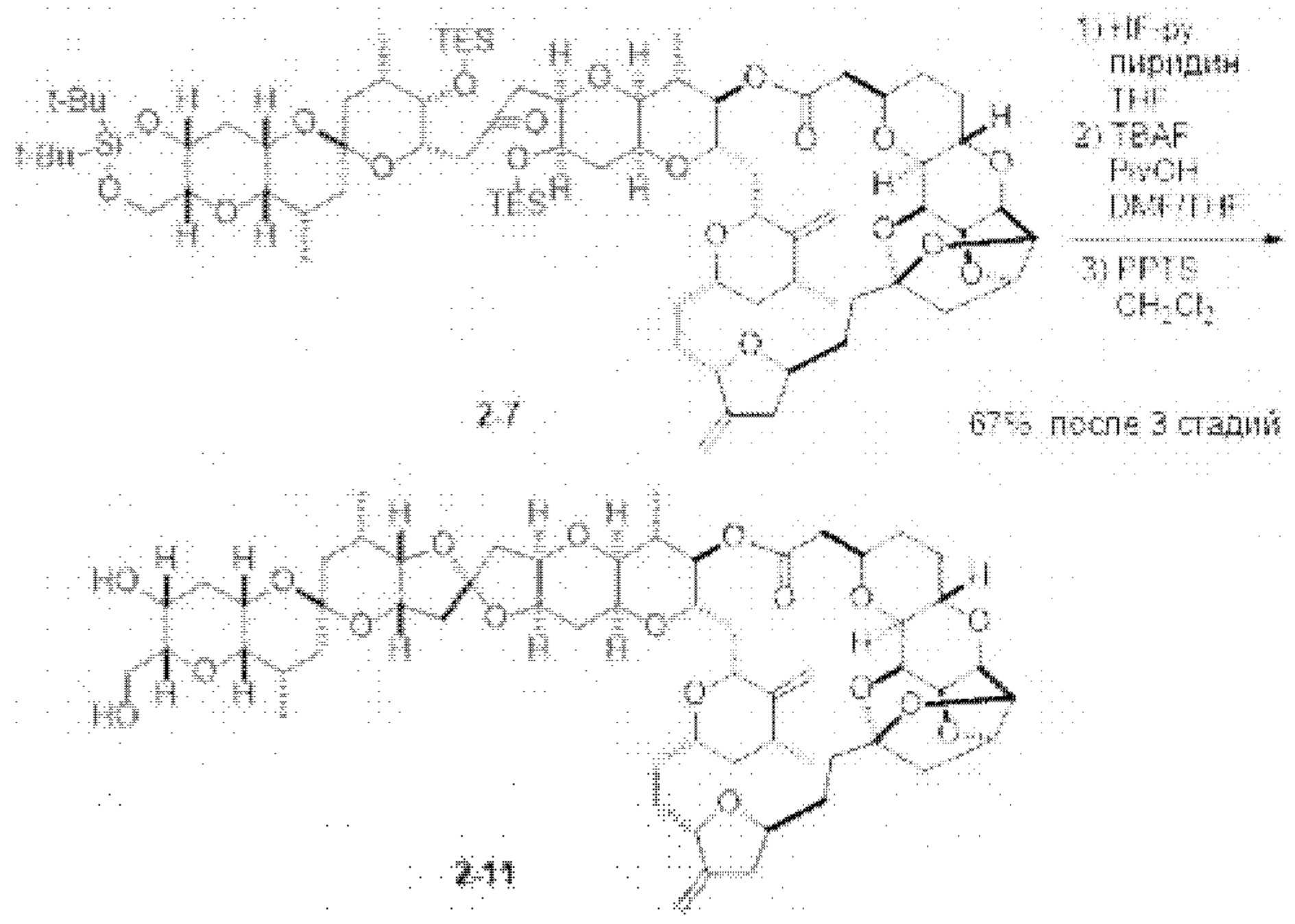
[00679] К перемешанному раствору 2-7 (108 мг, 0,0743 ммоль, 1 эквив.) в безводном THF (7,5 мл, 0,01 М) в пластиковой пробирке при 0°С добавляли забуференный пиридином раствор гидрофторида пиридиния (0,16 мл, 20 эквив.; свеже полученного из 0,20 мл гидрофторида пиридиния доступного от Aldrich, 0,60 мл пиридина). После перемешивания в течение 2 часов при той же температуре, реакционную смесь гасили добавлением нас. водн. NaHCO3 до завершения выделения газа. Водный слой экстрагировали EtOAc. Объединенную органическую фазу промывали солевым раствором, сушили над Na2SO4 и концентрировали в условиях пониженного давления. Неочищенное вещество использовали на следующей стадии без дополнительной очистки. К перемешанному раствору неочищенного диола (по расчетам 0,0743 ммоль, 1 эквив.) в DMF (3,7 мл, 0,02 М) при комнатной температуре добавляли забуференный раствор TBAF (0,37 мл, 5 эквив., свеже получен из 0,74 мл раствора TBAF (1Mb THF) и 38 мг PivOH). После перемешивания в течение 4 ч при той же температуре, добавляли СаСО3 (2,0 г) и DOWEX 50WX8-400 (2,0 г). После перемешивания в течение 1 ч при комнатной температуре, полученную смесь разбавляли EtOAc и фильтровали через слой Celite. Осадок на фильтре тщательно промывали EtOAc. Фильтрат концентрировали в условиях пониженного давления с получением неочищенного тетраола, который использовали на следующей стадии без дополнительной очистки. К перемешанному раствору неочищенного тетраола (по расчетам 0,0743 ммоль, 1 экв.) в CH2Cl2 (3,7 мл, 0,02 М) при комнатной температуре добавляли PPTS (93,3 мг, 0,371 ммоль, 5 эквив.). После перемешивания в течение 2,5 ч при той же температуре, реакционную смесь немедленно подвергали колоночной хроматографии на аминосиликагеле (100% EtOAc, затем 9% МеОН в EtOAc) с получением неочищенного 2-11 и его С38-эпимера. Смесь очищали на системе очистки YAMAZEN с ODS-колонкой (Rf градиент: от 10% MeCN в H2O до 100% MeCN) с получением 2-11 (53,1 мг, 0,0498 ммоль, 67% после 3 стадий) в виде белого твердого вещества и С38-эпи-2-11 (10,2 мг, 0,0096 ммоль, 13% после 3 стадий) в виде белого твердого вещества. (2-11): [α]20D -62,0 (с 0,30, МеОН). 1Н-ЯМР (600 МГц, CD3OD) δ: 5,06 (1H, с), 5,02 (1H, с), 4,88 (1Н, с), 4,81 (1Н, с), 4,70 (1H, дд, J=4,5, 4,5 Гц), 4,63 (1H, дд, J=7,8, 4,8 Гц), 4,60 (1H, дд, J=4,2, 4,2 Гц), 4,45 (1H, д, J=12,6 Гц), 4,33 (1Н, ддд, J=9,6, 9,6, 4,2 Гц), 4,30 (1H, м), 4,25-4,23 (1Н, м), 4,18 (1H, дд, J=6,6, 4,8 Гц), 4,13-4,06 (4Н, м), 3,99 (1Н, д, J=2,4 Гц), 3,90-3,86 (2Н, м), 3,81 (1Н, с), 3,72-3,69 (3Н, м), 3,61 (1H, д, J=10,8 Гц), 3,41 (1H, дд, J=6,0, 6,6 Гц), 3,22 (1H, ддд, J=6,6, 4,8, 4,8 Гц), 2,98 (1H, дд, J=10,4, 1,5 Гц), 2,82-2,79 (1H, м), 2,56 (1H, дд, J=17,4, 3,6 Гц), 2,45 (1H, дд, J=17,4, 1,8 Гц), 2,40 (1H, дд, J=13,2, 6,0 Гц), 2,38-2,25 (6Н, м), 2,22-2,16 (3Н, м), 2,11-1,97 (9Н, м), 1,94-1,90 (3Н, м), 1,86-1,80 (3Н, м), 1,74-1,67 (3Н, м), 1,60 (1H, ддд, J=12,0, 12,0, 6,0 Гц), 1,51-1,29 (9Н, м), 1,11 (3Н, д, J=7,8 Гц), 1,06 (3Н, д, J=7,8 Гц), 1,05-0,99 (1H, м), 0,95 (3Н, д, J=7,2 Гц), 0,94 (3Н, д, J=7,2 Гц) м.д. 13С-ЯМР (125 МГц, CD3OD) δ: 172,8, 153,3, 153,2, 114,8, 111,2, 105,7, 104,7, 98,6, 83,8, 82,4, 81,4, 80,6, 79,1, 78,0, 78,0, 77,9, 77,3, 77,3, 77,2, 76,3, 76,1, 75,8, 75,3, 75,0, 75,0, 74,9, 73,8, 72,7, 69,6, 68,5, 66,3, 65,7, 63,2, 49,4, 45,5, 44,9, 44,8, 41,2, 39,7, 38,2, 38,1, 37,8, 37,4, 37,2, 35,8, 35,4, 33,0, 31,8, 31,2, 31,0, 30,8, 30,1, 29,4, 27,3, 18,4, 18,1, 17,4, 15,8 м.д. FTIR (пленка): 3476, 2956, 2918, 2850, 1733, 1668, 1589, 1433, 1207, 1134, 1097, 1021 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C58H82O18Na, 1089,5393; обнаружено, 1089,5378.
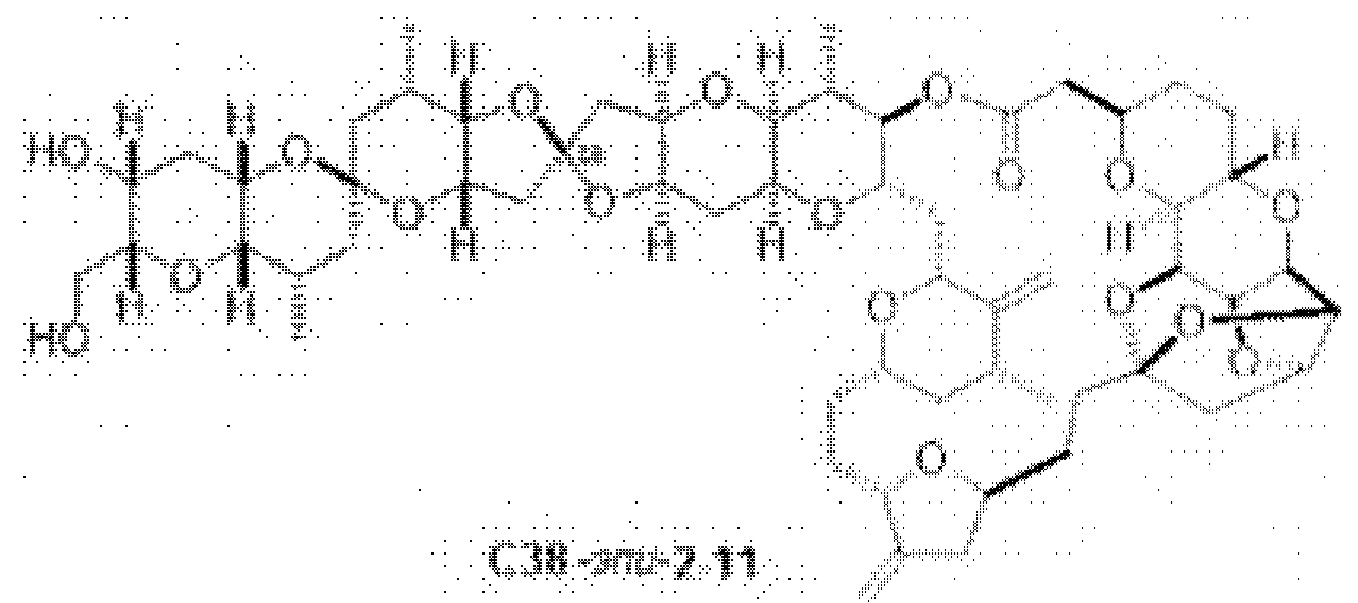
[00680] С38-эпи-2-11: [a]20D -68,3 (с 0,20, MeOH). 1Н-ЯМР (600 МГц, CD3OD) δ: 5,04 (1H, с), 5,00 (1Н, с), 4,87 (1H, с), 4,80 (1H, с), 4,72 (1H, дд, J=12,0, 7,2 Гц), 4,70 (1Н, дд, J=6,0, 5,4 Гц), 4,60 (1H, дд, J=5,4, 5,4 Гц), 4,43 (1H, д, J=12,0 Гц), 4,36 (1H, ддд, J=12,0, 12,0, 4,8 Гц), 4,27 (1H, м), 4,18-4,05 (6Н, м), 4,10 (1H, дд, J=5,4, 1,8 Гц), 3,91-3,84 (3Н, м), 3,78 (1H, с), 3,70-3,60 (4Н, м), 3,57 (1H, д, J=13,8 Гц), 3,42 (1H, дд, J=7,8, 6,6 Гц), 3,33 (1H, д, J=2,4 Гц), 3,32-3,31 (2Н, м), 3,16 (1H, дд, J=10,6, 7,6 Гц), 2,99 (1H, д, J=11,4 Гц), 2,84-2,79 (1H, м), 2,55 (1Н, дд, J=20,7, 10,5 Гц), 2,45 (1H, дд, J=20,7, 2,4 Гц), 2,35-1,90 (20Н, м), 1,86-1,70 (3Н, м), 1,74-1,51 (5Н, м), 1,51-1,29 (9Н, м), 1,10 (3Н, д, J=7,8 Гц), 1,03 (3Н, д, J=8,4 Гц), 1,05-0,99 (1H, м), 1,01 (3Н, д, J=7,8 Гц), 1,00 (3Н, д, J=7,8 Гц) м.д. 13С-ЯМР (125 МГц, CD3OD) δ: 172,8, 153,3, 152,8, 115,6, 111,3, 105,1, 104,7, 98,4, 83,8, 82,4, 81,5, 79,8, 79,2, 79,0, 78,9, 78,4, 77,9, 77,9, 77,0, 76,5, 76,1, 76,1, 76,0, 75,2, 75,2, 75,0, 74,7, 73,2, 73,2, 69,5, 68,5, 68,3, 66,3, 63,2, 49,5, 45,5, 45,0, 44,8, 41,2, 39,6, 38,7, 38,2, 38,2, 37,5, 37,4, 37,2, 35,4, 35,3, 34,6, 33,3, 31,8, 31,3, 31,0, 30,7, 30,1, 29,2, 27,0, 18,4, 18,3, 17,4, 15,2 м.д. FTIR (пленка): 3465, 2960, 2918, 2850, 1735, 1668, 1590, 1433, 1210, 1134, 1097, 1022 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C58H82O18Na, 1089,5393; обнаружено, 1089,5367. С38-эпи-2-11 эпимеризовали до 2-11 в соответствии со следующей методикой:
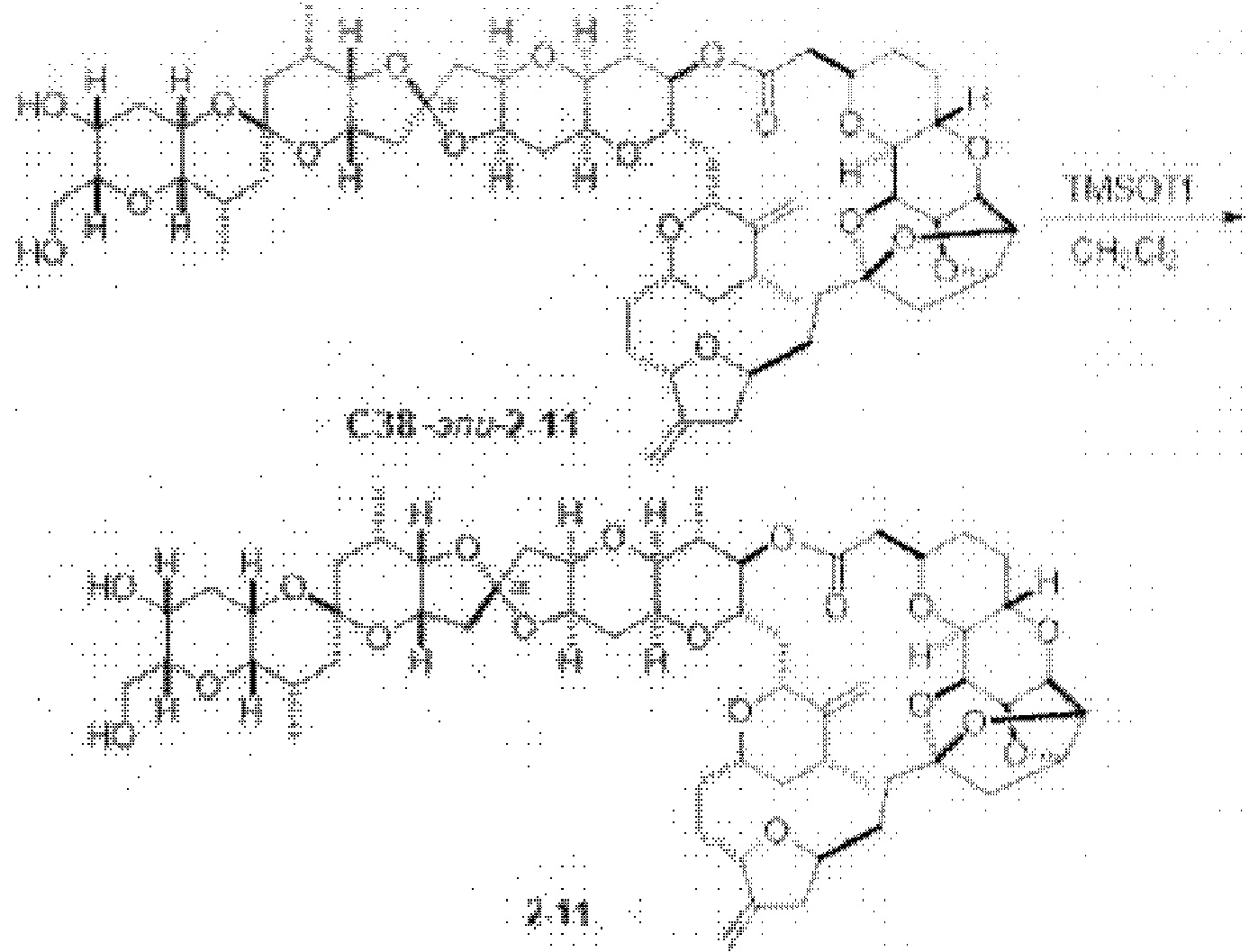
[00681] К раствору С38-эпи-2-11 (10,1 мг, 0,0095 ммоль, 1 экв.) в CH2Cl2 (4,7 мл) при -78°С добавляли TMSOTf (95 мкл, 0,525 ммоль, избыток). После перемешивания в течение 15 мин при той же температуре, реакционную смесь гасили добавлением нас. водн. NaHCO3. После перемешивания в течение 1 ч при 0°С, органический слой разделяли, и экстрагировали водный слой CH2Cl2. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Неочищенное вещество очищали на системе очистки YAMAZEN с ODS-колонкой (Rf градиент: от 10% MeCN в Н2О до 100% MeCN) с получением 2-11 (6,9 мг, 0,0065 ммоль, 68%) в виде белого твердого вещества.
[00682] Иллюстративная последовательность реакций для преобразования соединения (2) до соединения (1) представлена ниже на Схеме 3. Иллюстративные экспериментальные методики представлены ниже.
Схема 3
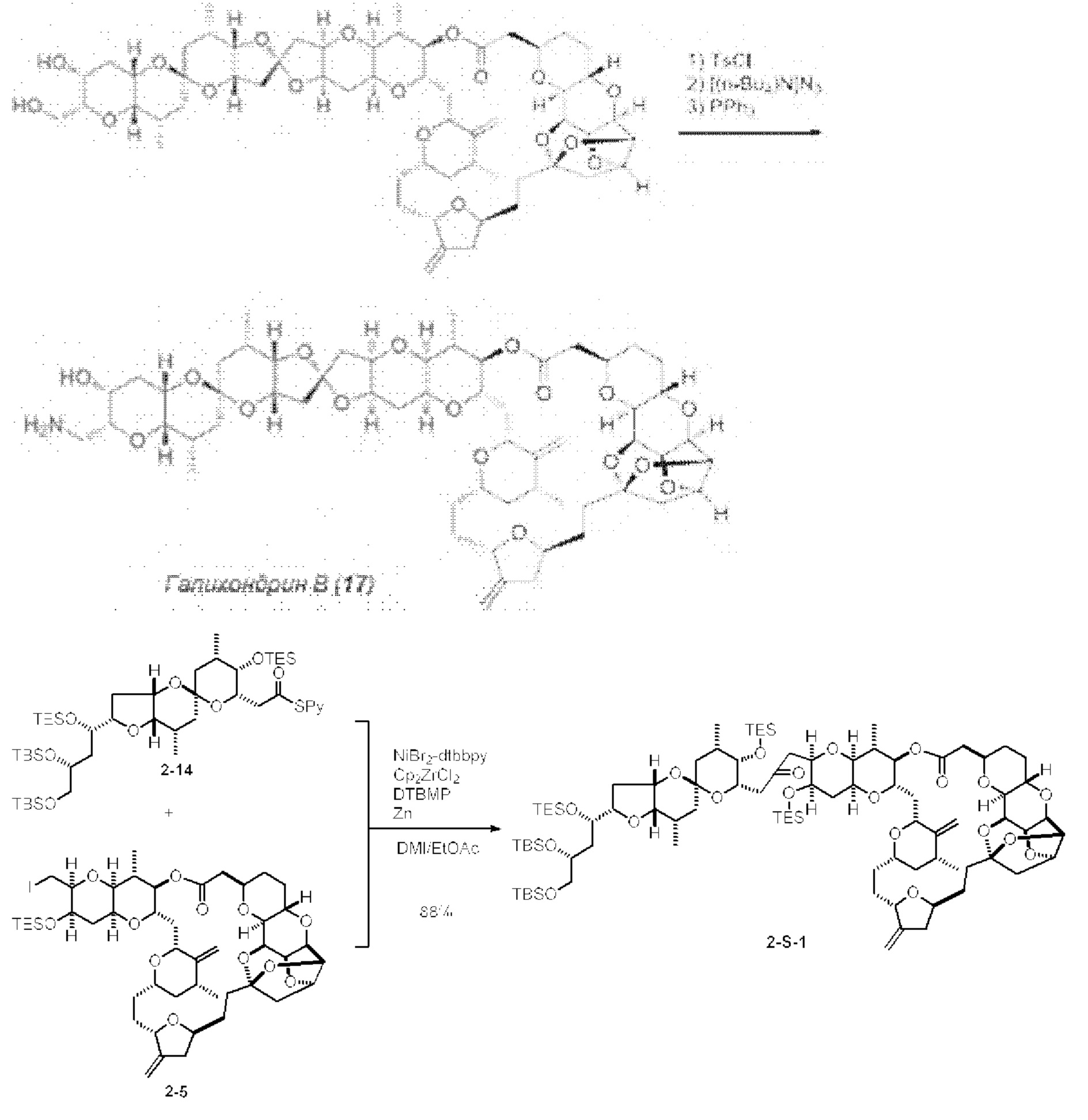
[00683] В перчаточной камере к раствору йодида 2-5 (200 мг, 0,203 ммоль, 1 экв.) и тиоэфира 2-14 (252,5 мг, 0,264 ммоль, 1,3 эквив.) в DMI (1,7 мл) и EtOAc (0,34 мл) при комнатной температуре добавляли DTBMP (167 мг, 0,816 ммоль, 4 экв.), Zn порошок (80,0 мг, 1,22 ммоль, 6 экв.), Cp2ZrCl2 (178,4 мг, 0,612 ммоль, 3 экв.) и NiBr2-dtbbpy (29,7 мг, 0,062 ммоль, 30 мол. %). После перемешивания в течение 1,5 ч при той же температуре, реакционную смесь удаляли из перчаточной камеры и разбавляли EtOAc и нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество очищали на системе очистки YAMAZEN на нейтральном силикагеле с получением кетона 2-S-1 (303 мг, 0,178 ммоль, 88%) в виде белого аморфного твердого вещества. (2-S-1): [α]20D -58,3 (с 1,20, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 5,21 (1Н, с), 5,11 (1Н, с), 4,94 (1Н, с), 4,85 (1Н, д, J=7,2 Гц), 4,81-4,78 (2Н, м), 4,69 (1Н, д, J=10,2 Гц), 4,54-4,51 (2Н, м), 4,36 (1Н, д, J=7,8 Гц), 4,27 (1Н, с), 4,24 (1Н, м), 4,18-4,13 (2Н, м), 4,10-4,07 (2Н, м), 3,93-3,88 (2Н, м), 3,83-3,81 (3Н, м), 3,78-3,75 (2Н, м), 3,63 (1Н, дд, J=6,0, 4,2 Гц), 3,44 (2Н, м), 3,33 (1Н, с), 3,19 (1Н, дд, J=16,2, 10,2 Гц), 3,16 (1Н, д, J=5,4 Гц), 3,11-3,02 (2Н, м), 2,78 (1Н, дд, J=16,8, 7,2 Гц), 2,60 (1Н, д, J=9,6 Гц), 2,49-2,43 (1Н, м), 2,41-2,31 (5Н, м), 2,28-2,24 (3Н, м), 2,19-1,96 (10Н, м), 1,93 (1Н, д, J=13,2 Гц), 1,87-1,64 (7Н, м), 1,61 (1Н, ддд, J=15,0, 4,8, 4,8 Гц), 1,56-1,43 (7Н, м), 1,40 (1Н, дд, J=13,2, 4,8 Гц), 1,33 (1Н, дд, J=9,6, 9,6 Гц), 1,18 (3Н, д, J=6,6 Гц), 1,15 (3Н, д, J=7,2 Гц), 1,12-1,04 (27Н, м), 1,10 (9Н, с), 1,04 (9Н, с), 1,00 (3Н, д, J=6,6 Гц), 0,96 (3Н, д, J=6,0 Гц), 0,78 (6Н, кв, J=8,0 Гц), 0,69-0,65 (12Н, м), 0,28 (6Н, с), 0,150 (3Н, с), 0,148 (3Н, с) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 206,8, 171,3, 153,0, 152,7, 110,0, 104,9, 103,8, 97,0, 82,4, 81,5, 81,0, 80,4, 78,4, 78,1, 77,6, 76,9, 75,5, 74,9, 74,7, 74,1, 74,0, 73,8, 72,9, 72,0, 71,8, 71,5, 70,5, 69,9, 68,4, 68,3, 65,9, 64,6, 48,6, 46,8, 46,3, 43,9, 41,3, 39,5, 39,3, 38,5, 38,2, 37,8, 36,4, 35,5, 35,4, 35,3, 32,5, 31,3, 30,7, 30,6, 29,0, 26,6, 26,3(×6), 26,3(×6), 18,7, 18,6, 18,5, 18,4, 18,1, 16,4, 7,4(×6), 7,4(×6), 7,3(×6), 6,0(×3), 5,7(×3), 5,3(×3), -4,0, -4,2, -5,1, -5,2 м.д. FTIR (пленка): 3450, 2936, 2864, 1734, 1642, 1547, 1147, 1112, 1055, 1021, 997 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C90H158O20Si5Na, 1722,0085; обнаружено, 1722,0061.
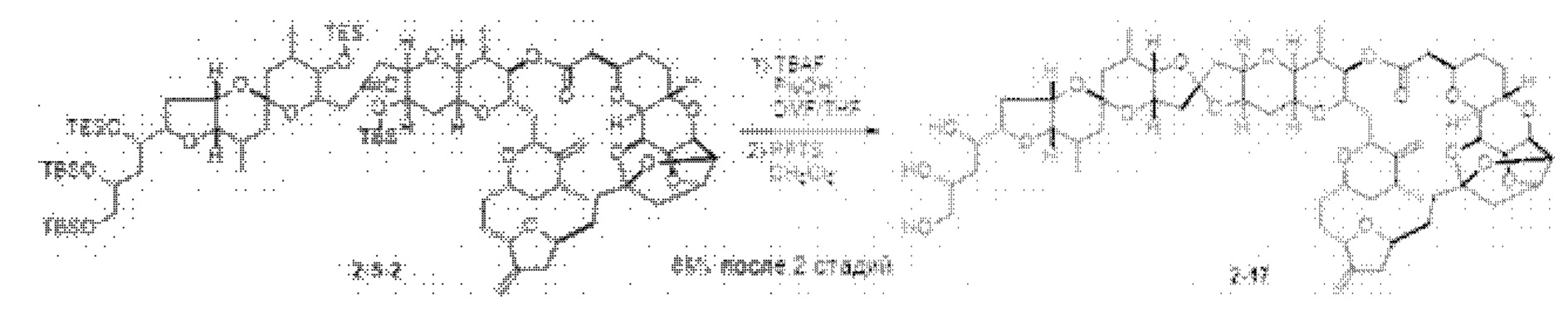
[00684] Забуференный раствор TBAF получали путем смешивания раствора TBAF (TCI #Т1125; 3,52 мл, 1 М в THF, 3,52 ммоль, 10 экв.) и PivOH (180 мг, 1,76 ммоль, 5 экв.). К перемешанному раствору 2-S-1 (303 мг, 0,178 ммоль, 1 эквив.) в DMF (8,8 мл) при комнатной температуре добавляли забуференный раствор TBAF. После перемешивания в течение 4 ч при той же температуре, добавляли СаСО3 (6,0 г) и DOWEX 50WX8-400 (6,0 г). После перемешивания в течение 2 ч при комнатной температуре, полученную смесь разбавляли EtOAc и фильтровали через слой Celite. Осадок на фильтре тщательно промывали EtOAc. Фильтрат концентрировали в условиях пониженного давления с получением неочищенного вещества, которое использовали на следующей стадии без дополнительной очистки. К перемешанному раствору неочищенного вещества (по расчетам 0,178 ммоль, 1 экв.) в CH2Cl2 (17,6 мл) при комнатной температуре добавляли PPTS (221,8 мг, 0,882 ммоль, 5 экв.). После перемешивания в течение 4 ч при той же температуре, реакционную смесь немедленно подвергали колоночной хроматографии на аминосиликагеле (100% EtOAc, затем 9% МеОН в EtOAc) с получением неочищенного 2-17 и его С38-эпимера. Смесь очищали на системе очистки YAMAZEN с ODS-колонкой (Rf градиент: от 10% MeCN в Н2О до 100% MeCN) с получением галихондрина В 17 (133,0 мг, 0,120 ммоль, 68% после 2 стадий) в виде белого кристаллического вещества и С38-эпи-17 (25,0 мг, 0,0225 ммоль, 13% после 2 стадий) в виде белого твердого вещества. Галихондрин В (17): [α]20D -62,3 (с 1,00, МеОН). т.пл.: 164-166°С (перекристаллизовывали из гексанов-CH2Cl2). 1H-ЯМР (600 МГц, CD3OD) δ: 5,07 (1Н, д, J=1,8 Гц), 5,02 (1Н, д, J=1,8 Гц), 4,89 (1Н, с), 4,81 (1Н, с), 4,70 (1Н, дд, J=4,8, 3,6 Гц), 4,63 (1Н, дд, J=7,2, 4,8 Гц), 4,60 (1Н, дд, J=4,2, 4,2 Гц), 4,45 (1Н, д, J=10,8 Гц), 4,33 (1Н, ддд, J=9,6, 9,6, 4,2 Гц), 4,30 (1Н, м), 4,25-4,23 (1Н, м), 4,18 (1Н, дд, J=6,6, 4,2 Гц), 4,13-4,05 (6Н, м), 3,99 (1Н, ддд, J=9,6, 4,8, 4,8 Гц), 3,90-3,85 (3Н, м), 3,71 (1Н, дд, J=10,2, 10,2 Гц), 3,70 (1Н, м), 3,61 (1Н, д, J=7,6 Гц), 3,56 (1H, s), 3,53 (1Н, дд, J=10,4, 4,2 Гц), 3,47 (1Н, дд, J=10,8, 6,0 Гц), 3,22 (1Н, дд, J=6,6, 4,8 Гц), 2,98 (1Н, дд, J=9,6, 2,4 Гц), 2,82-2,78 (1Н, м), 2,56 (1Н, дд, J=17,4, 9,6 Гц), 2,45 (1Н, дд, J=17,4, 2,4 Гц), 2,39 (1Н, дд, J=13,8, 5,7 Гц), 2,38-2,22 (7Н, м), 2,22-2,16 (2Н, м), 2,09-1,97 (7Н, м), 1,86-1,81 (3Н, м), 1,77-1,67 (4Н, м), 1,62-1,58 (2Н, м), 1,57-1,29 (9Н, м), 1,10 (3Н, д, J=6,6 Гц), 1,06 (3Н, д, J=6,6 Гц), 1,05-0,99 (1Н, м), 1,02 (3Н, д, J=6,6 Гц), 0,97 (3Н, д, J=6,6 Гц) м.д. 13С-ЯМР (125 МГц, CD3OD) δ: 172,8, 153,3, 153,2, 114,8, 111,3, 105,7, 104,8, 98,4, 83,8, 82,4, 81,3, 81,3, 80,7, 79,1, 78,1, 77,9, 77,9, 77,4, 77,2, 76,3, 76,1, 75,8, 75,4, 75,0, 75,0, 74,9, 73,7, 73,3, 73,1, 73,0, 71,6, 69,6, 67,2, 65,7, 49,4, 45,5, 44,9, 44,9, 41,2, 39,7, 37,9, 37,9, 37,8, 37,5, 37,5, 37,2, 36,3, 35,8, 33,0, 31,8, 31,3, 31,0, 30,8, 29,4, 27,1, 27,1, 18,4, 18,3, 18,1, 15,8 м.д. FTIR (пленка): 3460, 2936, 2864, 1736, 1642, 1557, 1167, 1122, 1105, 1054, 1041, 1021, 997 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C60H86O19Na, 1133,5656; обнаружено, 1133,5651.
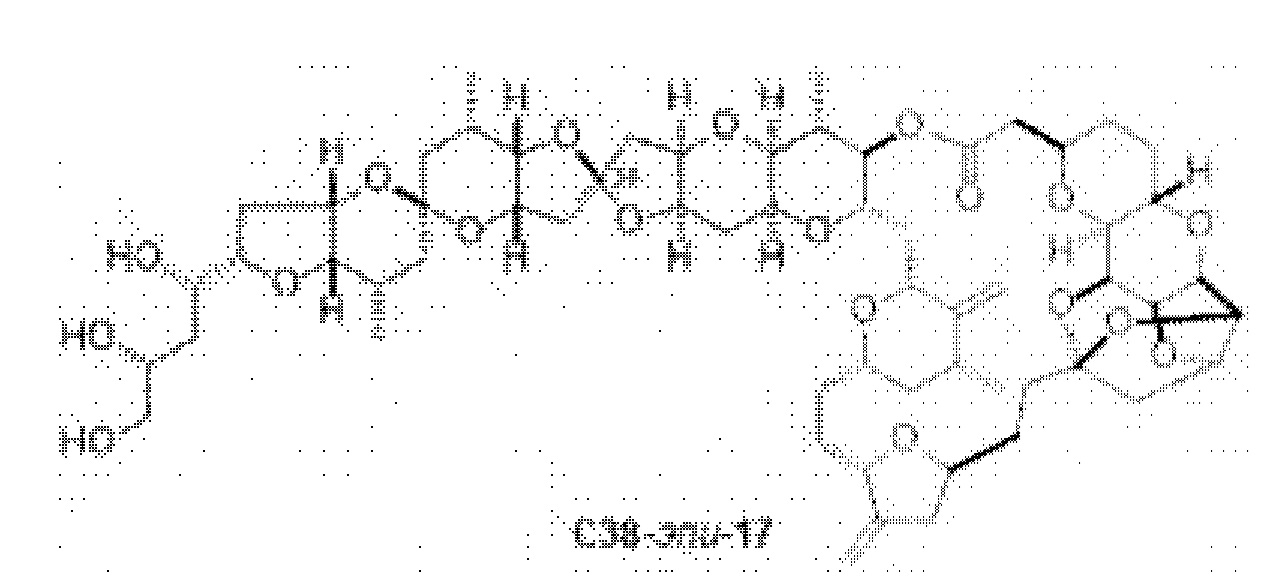
[00685] С38-эпи-галихондрин В: [α]20D -66,0 (с 1,00, МеОН). 1H-ЯМР (600 МГц, CD3OD) δ: 5,04 (1Н, с), 5,00 (1Н, с), 4,87 (1Н, с), 4,81 (1Н, с), 4,72 (1Н, дд, J=10,2, 6,6 Гц), 4,70 (1Н, дд, J=4,2, 4,2 Гц), 4,60 (1Н, дд, J=4,8, 4,8 Гц), 4,43 (1Н, д, J=10,8 Гц), 4,37 (1Н, ддд, J=12,0, 12,0, 4,8 Гц), 4,27 (1Н, м), 4,19-4,06 (8Н, м), 3,99 (1Н, ддд, J=9,6, 5,4, 4,2 Гц), 3,91-3,82 (4Н, м), 3,78 (1Н, ддд, J=14,4 4,8, 4,2 Гц), 3,64-3,56 (3Н, м), 3,53 (1Н, дд, J=11,4, 4,5 Гц), 3,46 (1Н, дд, J=11,4, 6,0 Гц), 3,34 (2Н, м), 3,17 (1Н, дд, J=8,7, 6,3 Гц), 2,99 (1Н, дд, J=9,6, 1,8 Гц), 2,84-2,79 (1Н, м), 2,55 (1Н, дд, J=16,8, 8,4 Гц), 2,47 (1Н, дд, J=16,8, 2,4 Гц), 2,35-1,93 (20Н, м), 1,86-1,82 (2Н, м), 1,79-1,70 (5Н, м), 1,67-1,33 (12Н, м), 1,10 (3Н, д, J=6,6 Гц), 1,04 (3Н, д, J=8,4 Гц), 1,05-0,99 (1Н, м), 1,02 (3Н, д, J=7,8 Гц), 1,00 (3Н, д, J=6,6 Гц) м.д. 13С-ЯМР (125 МГц, CD3OD) δ: 172,8, 153,3, 152,8, 115,5, 111,3, 105,1, 104,7, 98,2, 83,8, 82,4, 81,3, 81,1, 79,9, 79,2, 78,9, 78,9, 78,4, 77,9, 77,9, 76,5, 76,1, 76,1, 76,0, 75,2, 75,2, 74,7, 73,5, 73,3, 73,1, 73,0, 71,7, 69,5, 68,2, 67,1, 49,9, 45,6, 45,0, 44,7, 41,2, 39,6, 38,3, 38,2, 38,1, 37,5, 37,5, 37,2, 36,2, 35,4, 33,3, 31,8, 31,3, 30,9, 30,5, 30,2, 29,3, 27,1, 26,8, 18,4, 18,3, 15,2 м.д. FTIR (пленка): 3460, 2936, 2864, 1736, 1642, 1557, 1167, 1122, 1105, 1054, 1041, 1021, 997 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C60H86O19Na, 1133,5656; обнаружено, 1133,5651. С38-эпи-17 эпимеризовали до галихондрина В (17) в соответствии со следующей методикой:
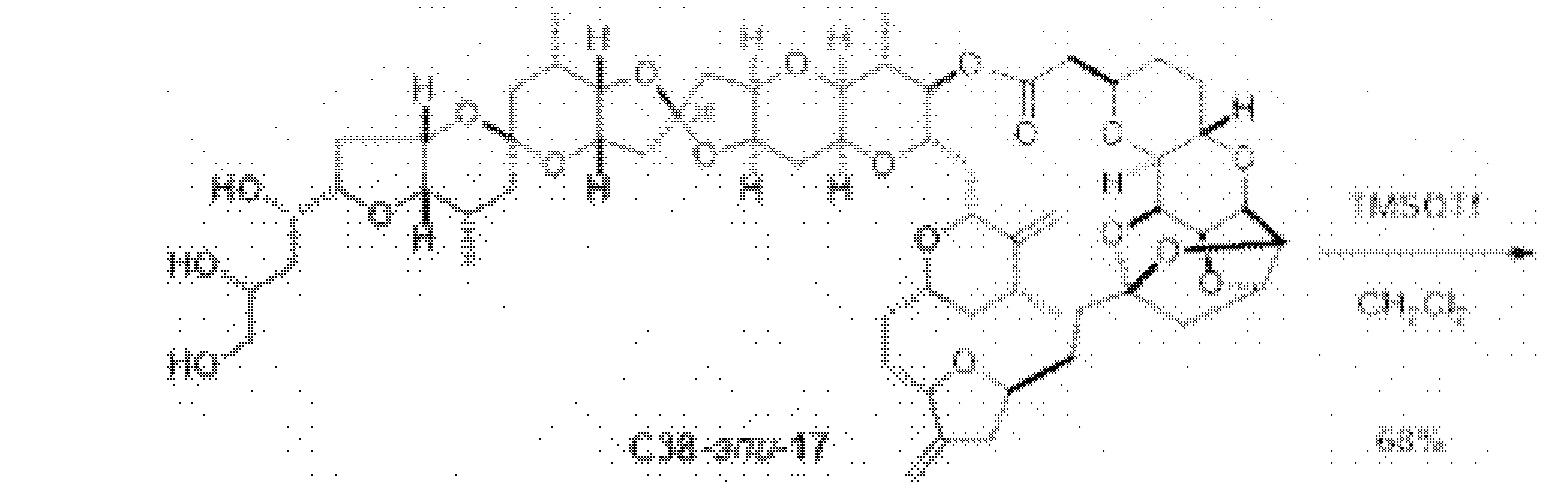
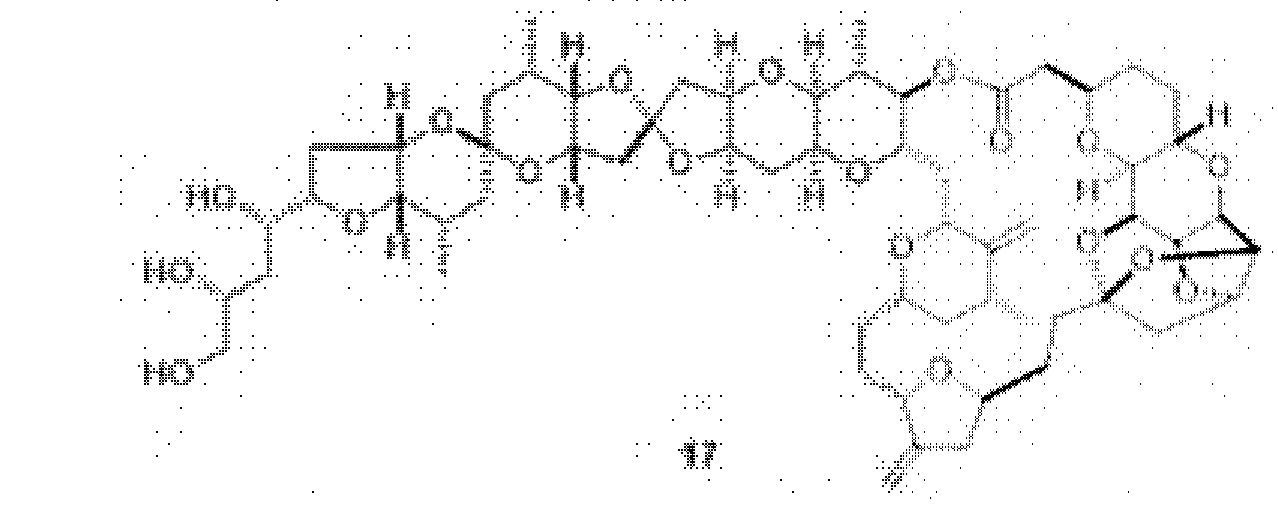
[00686] К раствору С38-эпи-17 (25,0 мг, 0,0225 ммоль, 1 экв.) в CH2Cl2 (11,2 мл) при -78°С добавляли TMSOTf (0,225 мл, 0,719 ммоль, избыток). После перемешивания в течение 15 мин, реакционную смесь гасили добавлением нас. водн. NaHCO3. После перемешивания в течение 1 ч при 0°С, органический слой разделяли, и экстрагировали водный слой CH2Cl2. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Неочищенное вещество очищали на системе очистки YAMAZEN с ODS-колонкой (Rf градиент: от 10% MeCN в Н2О до 100% MeCN) с получением галихондрина В (17) (17,1 мг, 0,0154 ммоль, 68%) в виде бесцветного твердого вещества.
Норгалихондрин В (18)
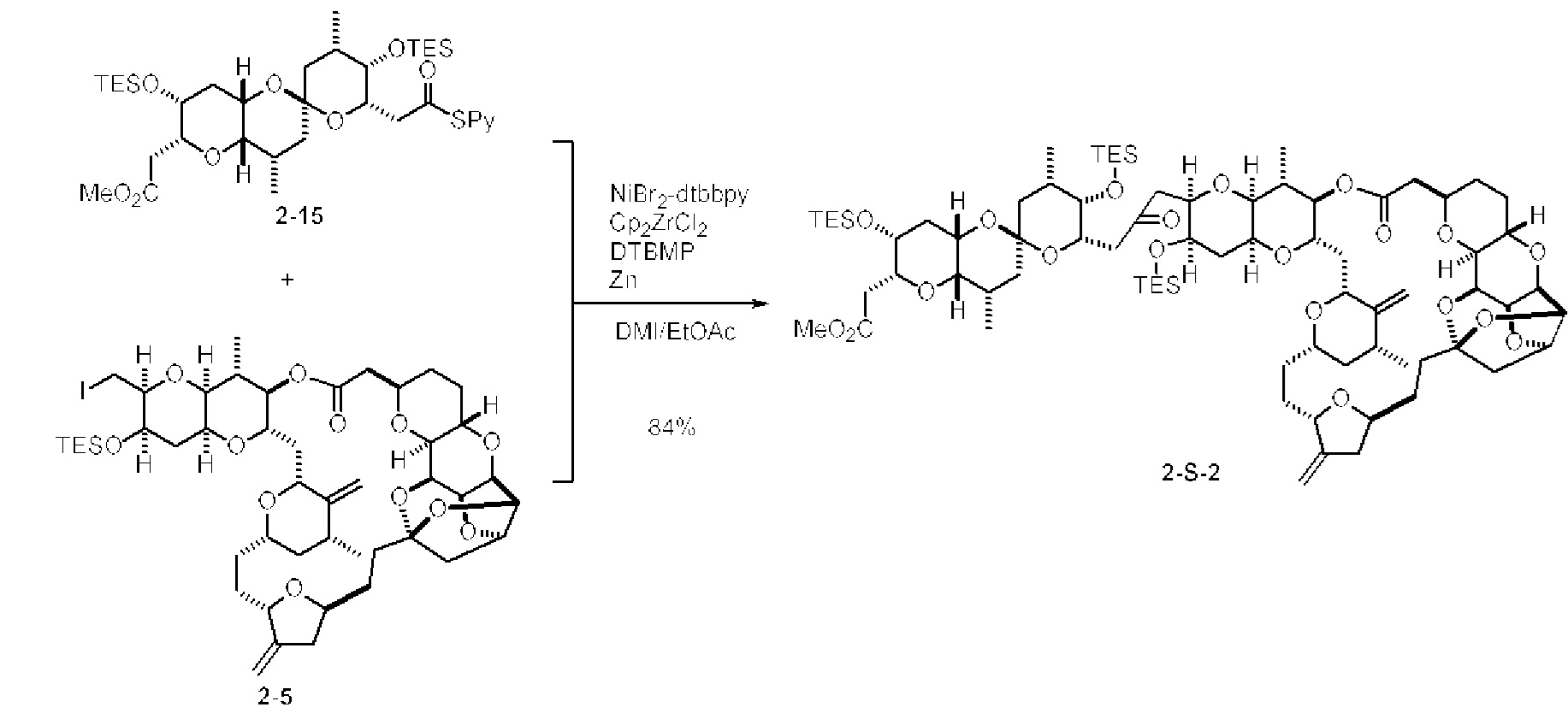
[00687] В перчаточной камере к раствору йодида 2-5 (100 мг, 0,102 ммоль, 1 экв.) и тиоэфира 2-16 (95,5 мг, 0,132 ммоль, 1,3 экв.) в DMI (0,85 мл) и EtOAc (0,17 мл) при комнатной температуре добавляли DTBMP (83,8 мг, 0,408 ммоль, 4 экв.), Zn порошок (40,0 мг, 0,612 ммоль, 6 экв.), Cp2ZrCl2 (89,4 мг, 0,306 ммоль, 3 экв.) и NiBr2-dtbbpy (14,9 мг, 0,0306 ммоль, 30 мол. %). После перемешивания в течение 1,5 ч при той же температуре, реакционную смесь удаляли из перчаточной камеры и разбавляли Et2O и нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой Et2O. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (0%, 15%, 25% EtOAc в гексанах) с получением кетона 2-S-2 (125,7 мг, 0,0856 ммоль, 84%) в виде бесцветного аморфного твердого вещества. (2-S-2): [α]20D -68,4 (с 1,00, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 5,21 (1Н, с), 5,11 (1Н, с), 4,94 (1Н, с), 4,85 (1Н, т, J=6,6 Гц), 4,81-4,77 (2Н, м), 4,69 (1Н, д, J=10,2 Гц), 4,52 (1Н, ддд, J=9,8, 9,8, 4,2 Гц), 4,36 (1Н, д, J=9,6 Гц), 4,27 (1Н, с), 4,14 (1Н, дд, J=4,2, 4,2 Гц), 4,11-4,06 (2Н, м), 4,03-3,97 (3Н, м), 3,89 (1Н, дд, J=5,7, 5,7 Гц), 3,84-3,72 (4Н, м), 3,78-3,68 (5Н, м), 3,64 (1Н, дд, J=6,3, 3,9 Гц), 3,59 (1Н, ушир. с), 3,45 (1Н, кв, J=4,0 Гц), 3,38 (3Н, с), 3,37 (1Н, с), 3,20-3,14 (2Н, м), 3,13 (1Н, с), 3,07 (1Н, дд, J=17,8, 6,0 Гц), 2,99 (1Н, дд, J=17,8, 6,0 Гц), 2,84 (1Н, дд, J=14,4, 7,8 Гц), 2,81-2,75 (2Н, м), 2,61 (1Н, д, J=10,2 Гц), 2,58 (1Н, дд, J=14,8, 5,4 Гц), 2,42-2,21 (7Н, м), 2,21-2,06 (5Н, м), 1,99 (1Н, дд, J=12,6, 12,6 Гц), 1,93 (1Н, д, J=13,2 Гц), 1,89-1,82 (1Н, м), 1,79-1,64 (3Н, м), 1,62-1,30 (9Н, м), 1,18 (3Н, д, J=6,6 Гц), 1,12-1,04 (31Н, м), 1,01 (3Н, д, J=6,6 Гц), 0,98 (3Н, д, J=6,6 Гц), 0,70-0,61 (18Н, м) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 206,9, 171,7, 171,3, 153,0, 152,6, 110,0, 104,9, 103,7, 96,9, 82,4, 81,0, 78,3, 78,0, 77,7, 77,2, 76,9, 76,5, 76,1, 75,5, 74,8, 74,70, 74,67, 74,1, 74,0, 73,8, 73,0, 70,3, 69,6, 68,4, 65,9, 65,7, 64,6, 64,5, 50,9, 48,6, 46,8, 46,3, 43,9, 41,3, 39,5, 39,3, 38,6, 37,5, 36,3, 35,5, 35,4, 32,5, 31,1, 31,0, 30,7, 30,6, 29,2, 29,0, 26,2, 18,6, 18,1, 17,2, 16,4, 7,4, 7,28, 7,25, 6,0, 5,4, 5,3 м.д.; FTIR (пленка): 2954, 2921, 2876, 1737, 1458, 1436, 1372, 1287, 1262, 1239, 1207, 1187, 1154, 1073, 740, 728 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C78H128O20Si3Na, 1491,8204; обнаружено, 1491,8181.
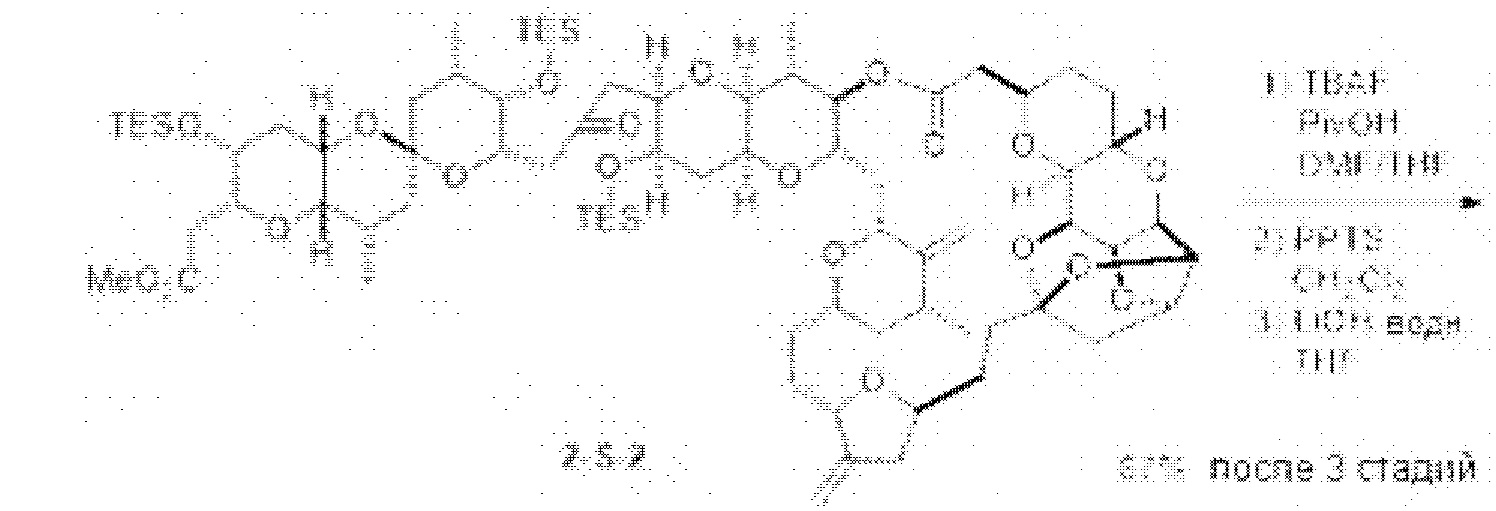
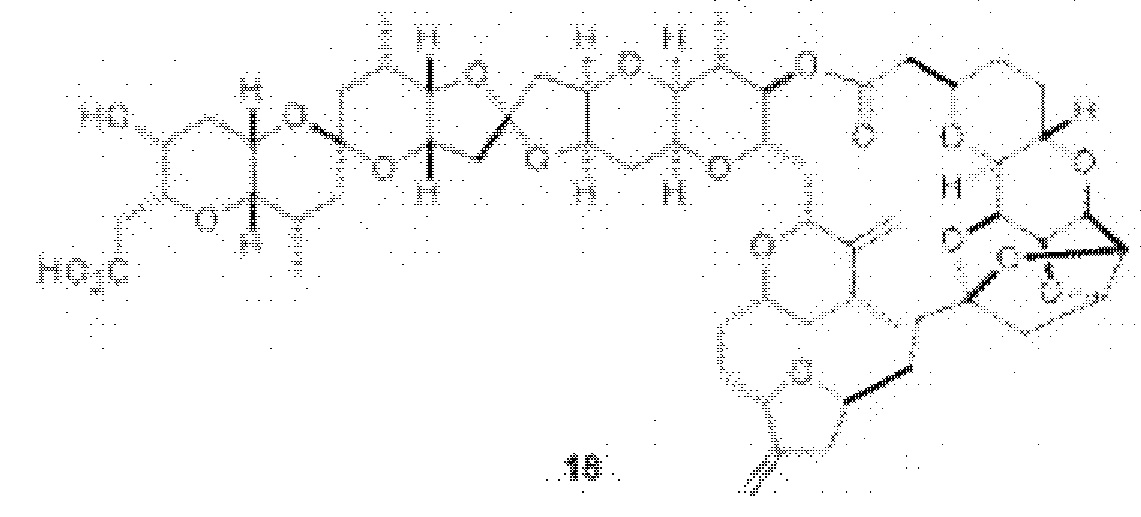
[00688] Забуференный раствор TBAF получали путем смешивания раствора TBAF (TCI #Т1125; 0,86 мл, 1 М в THF, 0,86 ммоль, 10 экв.) и PivOH (43,9 мг, 0,430 ммоль, 5 экв.). К перемешанному раствору кетона 2-S-2 (125,7 мг, 0,0856 ммоль, 1 экв.) в DMF (4,3 мл) при комнатной температуре добавляли забуференный раствор TBAF. После перемешивания в течение 6 ч при той же температуре, после разбавления 10 мл EtOAc добавляли СаСО3 (2,4 г) и DOWEX 50WX8-400 (2,4 г). После перемешивания в течение 1 ч при комнатной температуре, полученную смесь разбавляли EtOAc и фильтровали через слой Celite. Осадок на фильтре тщательно промывали EtOAc. Фильтрат концентрировали в условиях пониженного давления с получением неочищенного тетраола, который использовали на следующей стадии без дополнительной очистки. К перемешанному раствору неочищенного тетраола (по расчетам 0,0856 ммоль, 1 экв.) в CH2Cl2 (8,5 мл) при комнатной температуре добавляли PPTS (86,4 мг, 0,344 ммоль, 4 экв.). После перемешивания в течение 1 ч при той же температуре, реакционную смесь немедленно подвергали колоночной хроматографии на аминосиликагеле (CH2Cl2, затем 25%, 50%, 75%, затем 100% EtOAc в гексанах, затем 2% МеОН в EtOAc) с получением неочищенного сложного метилового эфира норгалихондрина В и его С38-эпимера. Соединение использовали на следующей стадии после концентрирования без дополнительной очистки.
К перемешанному раствору неочищенного сложного метилового эфира (по расчетам 0,0856 ммоль, 1 экв.) в THF (10 мл) при комнатной температуре добавляли 1 М Водн. LiOH (3,3 мл), 3 После перемешивания в течение 2 ч при той же температуре, реакционную смесь разбавляли 6,6 мл воды. Затем, из смеси на испарителе удаляли THF. После охлаждения реакционной смеси до 0°С, добавляли 1 М HCl водн. (3,3 мл), и оставляли реакционную смесь дополнительно перемешиваться в течение 2 мин. Полученную смесь экстрагировали EtOAc. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученную смесь очищали на системе очистки YAMAZEN с ODS-колонкой (Rf градиент: от 10% MeCN в Н2О до 100% MeCN) с получением норгалихондрина В (18) (62,4 мг, 0,0570 ммоль, 67% после 3 стадий) в виде бесцветного твердого вещества и 38-эпи-норгалихондрина В (С38-эпи-18) (8,4 мг, 0,0077 ммоль, 9% после 3 стадий) в виде бесцветного твердого вещества. Норгалихондрин В (18): [α]20D -54,6 (с 1,00, МеОН). 1Н-ЯМР (600 МГц, CD3OD) δ: 5,06 (1Н, д, J=1,5 Гц), 5,01 (1Н, д, J=1,5 Гц), 4,88 (1Н, с), 4,81 (1Н, д, J=1,5 Гц), 4,70 (1Н, т, J=4,0 Гц), 4,63 (1Н, дд, J=7,8, 4,7 Гц), 4,60 (1Н, т, J=4,0 Гц), 4,45 (1Н, д, J=9,6 Гц), 4,32 (1Н, тд, J=10,2, 4,6 Гц), 4,31-4,29 (1Н, м), 4,24 (1Н, ддд, J=11,2, 4,2, 1,8 Гц), 4,18 (1Н, дд, J=6,6, 4,8 Гц), 4,14-4,09 (3Н, м), 4,07 (1Н, дд, J=9,6, 9,3 Гц), 3,99 (1Н, дд, J=5,8, 2,4 Гц), 3,91-3,85 (2Н, м), 3,82-3,78 (2Н, м), 3,74-3,69 (2Н, м), 3,61 (1Н, д, J=10,4 Гц), 3,59-3,56 (1Н, м), 3,30 (1Н, м), 3,22 (1Н, дд, J=6,6, 5,1 Гц), 2,98 (1Н, дд, J=9,6, 1,8 Гц), 2,81 (1Н, ддд, J=16,0, 8,0, 2,1 Гц), 2,59 (1Н, дд, J=15,0, 7,8 Гц), 2,57-2,52 (2Н, м), 2,45 (1Н, дд, J=17,6, 1,8 Гц), 2,40 (1Н, дд, J=13,2, 6,2 Гц), 2,34-2,32 (2Н, м), 2,32-2,24 (4Н, м), 2,21-2,15 (3Н, м), 2,13-1,93 (8Н, м), 1,87-1,79 (2Н, м), 1,76-1,71 (3Н, м), 1,70-1,66 (1Н, м), 1,64-1,57 (1Н, м), 1,56-1,47 (4Н, м), 1,46-1,29 (5Н, м), 1,10 (3Н, д, J=6,6 Гц), 1,06 (3Н, д, J=7,0 Гц), 1,02 (1Н, д, J=12,0 Гц), 0,98 (3Н, д, J=7,2 Гц), 0,95 (3Н, д, J=7,2 Гц) м.д. 13С-ЯМР (150 МГц, CD3OD) δ: 172,8 (2С), 153,3, 153,2, 114,7, 111,2, 105,6, 104,8, 98,5, 83,8, 82,4, 80,6, 79,0, 78,1, 77,90, 77,85, 77,76, 77,4, 77,23, 77,18, 76,3, 76,1, 75,8, 75,4, 75,02, 74,98, 74,9, 73,7, 72,7, 69,6, 68,0, 67,8, 65,8, 49,4, 45,4, 44,9, 44,7, 41,2, 39,8, 38,22, 38,20, 38,0, 37,8, 37,5, 37,2, 35,7, 35,5, 33,0, 31,8, 31,3, 31,0, 30,8, 30,0, 29,4, 27,3, 18,4, 18,1, 17,3, 15,8 м.д. FTIR (пленка): 3480, 2926, 2873, 2853, 1736, 1676, 1565, 1395, 1334, 1265, 1207, 1188, 1152, 1134, 1118, 1086, 1072, 1045, 1020, 996 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C59H82O19Na, 117,5348; обнаружено 1117,5292.
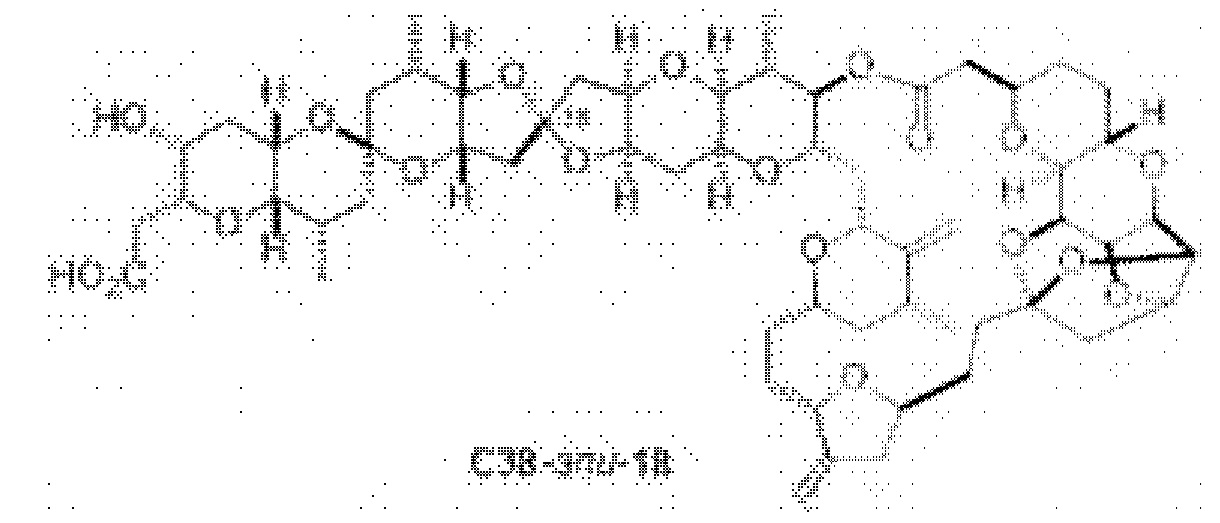
[00689] 38-эпи-норгалихондрин В (С38-эпи-18): [α]20D -69,7 (с 0,400, МеОН). 1Н-ЯМР (600 МГц, CD3OD) δ: 5,04 (1Н, д, J=1,5 Гц), 4,96 (1Н, д, J=1,5 Гц), 4,87 (1Н, д, J=1,5 Гц), 4,80 (1Н, с), 4,74-4,68 (2Н, м), 4,60 (1Н, т, J=4,5 Гц), 4,43 (1Н, д, J=9,6 Гц), 4,37 (1Н, тд, J=10,2, 4,6 Гц), 4,30-4,25 (1Н, м), 4,20-4,04 (4Н, м), 4,01 (1Н, дд, J=5,8, 2,4 Гц), 3,91-3,83 (2Н, м), 3,80 (1Н, т, J=7,8 Гц), 3,75 (1Н, ушир. с), 3,65-3,55 (2Н, м), 3,34 (1Н, м), 3,17 (1Н, дд, J=6,6, 5,0 Гц), 2,99 (1Н, дд, J=9,6, 1,8 Гц), 2,82 (1Н, ддд, J=16,0, 8,0, 2,1 Гц), 2,63-2,51 (2Н, м), 2,48 (1Н, дд, J=15,0, 7,8 Гц), 2,36-2,24 (4Н, м), 2,23-2,13 (4Н, м), 2,13-1,92 (5Н, м), 2,47 (1Н, дд, J=17,6, 1,8 Гц), 2,40 (1Н, дд, J=13,2, 6,2 Гц), 2,34-2,32 (2Н, м), 2,32-2,24 (4Н, м), 2,21-2,15 (2Н, м), 2,13-1,93 (6Н, м), 1,82 (1Н, тд, J=12,0, 2,0 Гц), 1,77 (1Н, д, J=12,0 Гц), 1,72 (1Н, д, J=12,0 Гц), 1,69-1,60 (2Н, м), 1,59-1,47 (3Н, м), 1,47-1,34 (4Н, м), 1,10 (3Н, д, J=6,6 Гц), 1,06 (1Н, д, J=12,0 Гц), 1,04 (3Н, д, J=7,0 Гц), 1,00 (3Н, д, J=7,2 Гц), 0,97 (3Н, д, J=7,2 Гц) м.д. 13С-ЯМР (150 МГц, CD3OD) δ: 172,9 (2С), 153,3, 152,9, 115,6, 111,4, 105,1, 104,7, 98,4, 83,8, 82,4, 79,9, 79,2, 79,0, 78,4, 78,0, 77,9, 77,1, 76,5, 76,1, 76,0, 75,2, 74,8, 73,3, 73,2, 69,5, 68,3, 68,0, 67,9, 45,6, 45,0, 44,7, 41,2, 38,9, 38,7, 38,3, 38,2, 37,5, 37,2, 35,5, 33,3, 31,8, 31,3, 31,0, 30,2, 30,0, 29,3, 27,0, 18,4, 18,3, 17,4, 15,2 м.д. FTIR (пленка): HRMS (ESI) m/z: [M+Na]+ рассчит. для C59H82O19Na, 117,5348; обнаружено 1117,5292. С38-эпи-18 эпимеризовали до норгалихондрина В (18) в соответствии со следующей методикой:
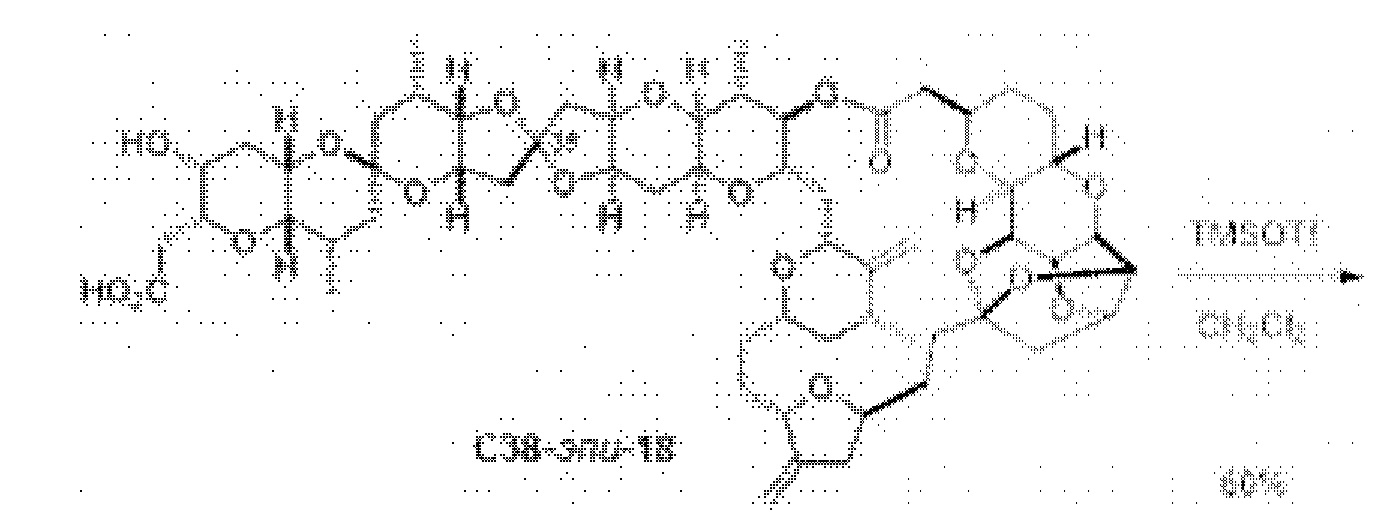
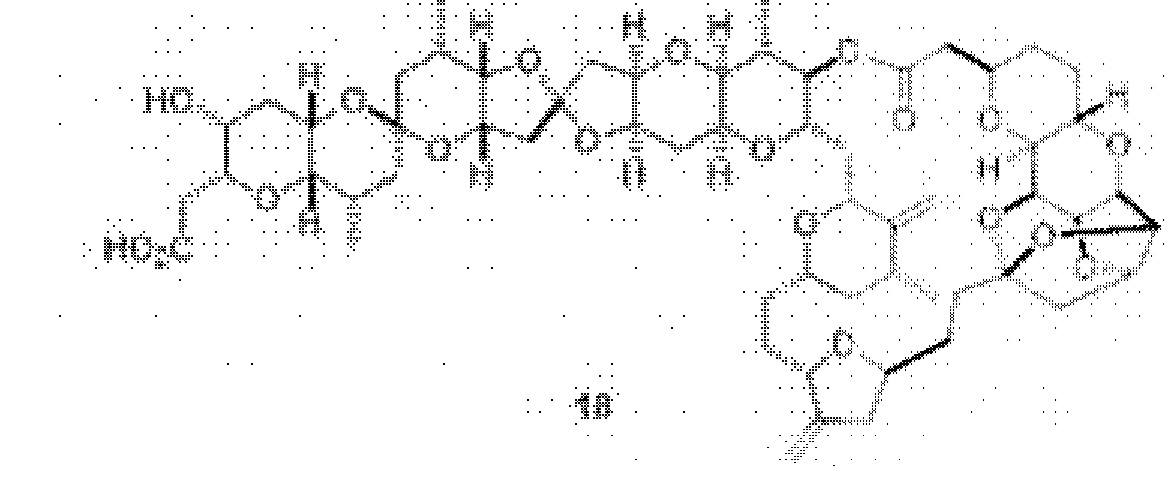
[00690] К раствору С38-эпи-18 (8,4 мг, 0,0077 ммоль, 1 экв.) в CH2Cl2 (3 мл) при -78°С добавляли TMSOTf (0,07 мл, 0,385 ммоль, избыток). После перемешивания в течение 15 мин при той же температуре, реакционную смесь гасили добавлением нас. водн. NaHCO3. После перемешивания в течение 1 ч при 0°С, органический слой разделяли, и экстрагировали водный слой CH2Cl2. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Неочищенное вещество очищали на системе очистки YAMAZEN с ODS-колонкой (Rf градиент: от 10% MeCN в Н2О до 100% MeCN) с получением норгалихондрина В (18) (5,0 мг, 0,0046 ммоль, 60%) в виде бесцветного твердого вещества.
Гомогалихондрин В (19)
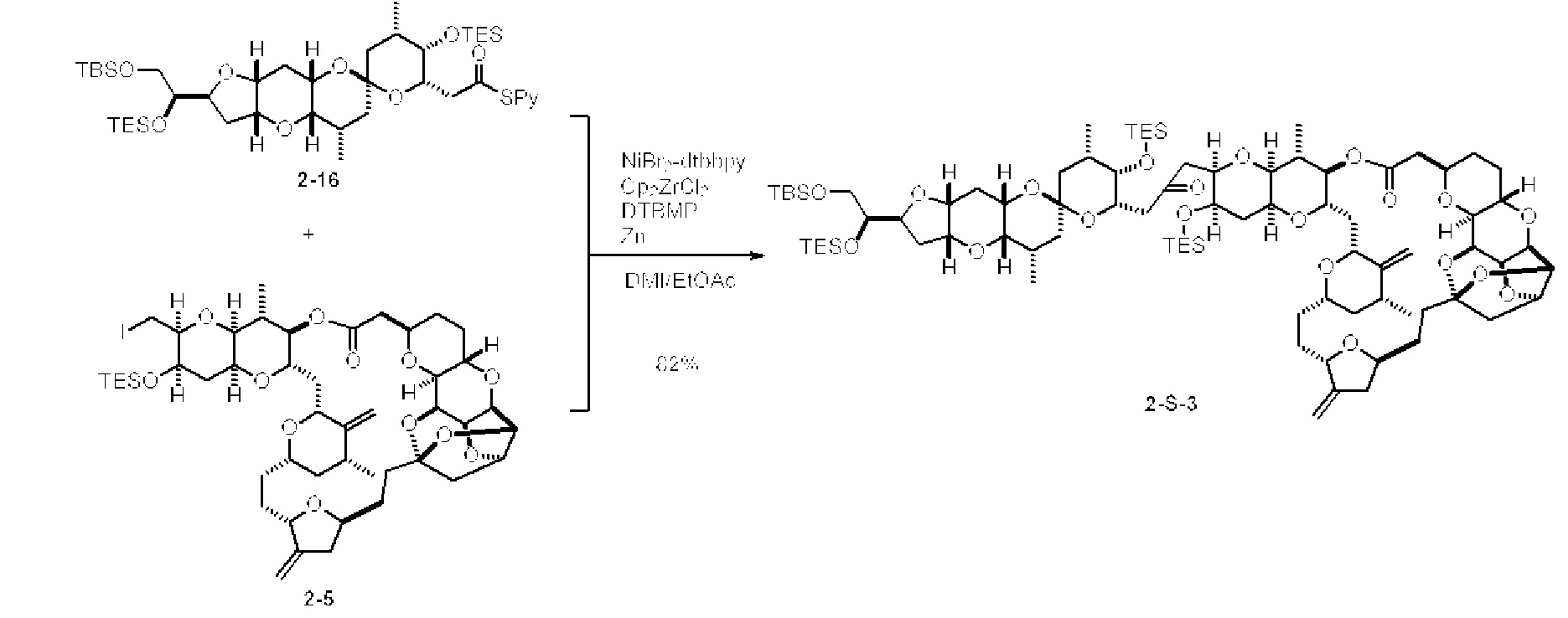
[00691] В перчаточной камере к раствору йодида 2-5 (103 мг, 0,105 ммоль, 1 экв.) и тиоэфира 2-16 (113 мг, 0,132 ммоль, 1,3 экв.) в DMI (0,85 мл) и EtOAc (0,17 мл) при комнатной температуре добавляли DTBMP (83,8 мг, 0,408 ммоль, 4 экв.), Zn порошок (40,0 мг, 0,612 ммоль, 6 экв.), Cp2ZrCl2 (89,4 мг, 0,306 ммоль, 3 экв.) и NiBr2-dtbbpy (14,9 мг, 0,0306 ммоль, 30 мол. %). После перемешивания в течение 1,5 ч при той же температуре, реакционную смесь удаляли из перчаточной камеры и разбавляли Et2O и нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой Et2O. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (0%, 9%, 17% EtOAc в гексанах) с получением кетона 2-S-3 (137 мг, 0,0857 ммоль, 82%) в виде бесцветного аморфного твердого вещества. В предварительном исследовании, в реакции сочетания йодида 5 (25,0 мг, 0,0254 ммоль) и тиоэфира 16 (30,0 мг, 0,0352 ммоль) получали целевой кетон (35,7 мг 0,0223 ммоль) с выходом 88%. (2-S-3): [α]20D -50,8 (с 1,00, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 5,21 (1Н, с), 5,11 (1Н, с), 4,93 (1Н, с), 4,85-4,78 (3Н, м), 4,69 (1Н, д, J=10,2 Гц), 4,52 (1Н, ддд, J=9,8, 9,8, 4,2 Гц), 4,47 (1Н, ддд, J=10,4, 5,3, 5,3 Гц), 4,34 (1Н, д, J=9,6 Гц), 4,27 (1Н, с), 4,14 (1Н, дд, J=4,2, 4,2 Гц), 4,11-4,07 (2Н, м), 4,02-4,00 (3Н, м), 3,89 (1Н, дд, J=5,7, 5,7 Гц), 3,84-3,80 (3Н, м), 3,78-3,68 (5Н, м), 3,64 (1Н, дд, J=6,3, 3,9 Гц), 3,45 (1Н, д, J=3,6 Гц), 3,29 (1Н, с), 3,20-3,16 (2Н, м), 3,06 (1Н, дд, J=17,6, 5,7 Гц), 3,01 (1Н, дд, J=17,6, 6,9 Гц), 2,93 (1Н, с), 2,80 (1Н, д, J=7,8 Гц), 2,77 (1Н, д, J=7,2 Гц), 2,61 (1Н, д, J=10,2 Гц), 2,46 (1Н, д, J=15,0 Гц), 2,39-2,22 (9Н, м), 2,20-2,05 (6Н, м), 1,98 (1Н, дд, J=12,6, 12,6 Гц), 1,93 (1Н, д, J=13,2 Гц), 1,87-1,84 (2Н, м), 1,75-1,65 (4Н, м), 1,62-1,30 (11Н, м), 1,18 (3Н, д, J=6,6 Гц), 1,12-1,04 (30Н, м), 1,04-1,03 (12Н, м), 0,96 (3Н, д, J=6,6 Гц), 0,77 (6Н, кв, J=8,0 Гц), 0,69-0,64 (12Н, м), 0,14 (3Н, с), 0,13 (3Н, с) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 206,7, 171,3, 153,0, 152,6, 110,0, 104,9, 103,7, 96,9, 82,4, 81,0, 79,1, 78,3, 78,0, 77,9, 77,7, 76,9, 76,8, 76,1, 75,5, 74,8, 74,7, 74,2, 74,1, 74,0, 73,8, 73,6, 73,0, 70,4, 69,3, 68,4, 66,1, 65,9, 64,7, 63,7, 48,6, 46,8, 46,3, 43,9, 41,3, 39,5, 39,3, 38,6, 37,7, 37,6, 36,5, 36,3, 35,5, 35,3, 32,5, 31,6, 31,1, 30,7, 30,65, 30,60, 29,5, 29,0, 26,2, 18,7, 18,6, 18,1, 17,6, 16,4, 7,5, 7,34, 7,28, 6,0, 5,7, 5,3, -5,1, -5,3 м.д. FTIR (пленка): 2953, 2927, 2875, 1720, 1459, 1086, 1015, 834, 725 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C85H144O20Si4Na, 1619,9220; обнаружено, 1619,9298.
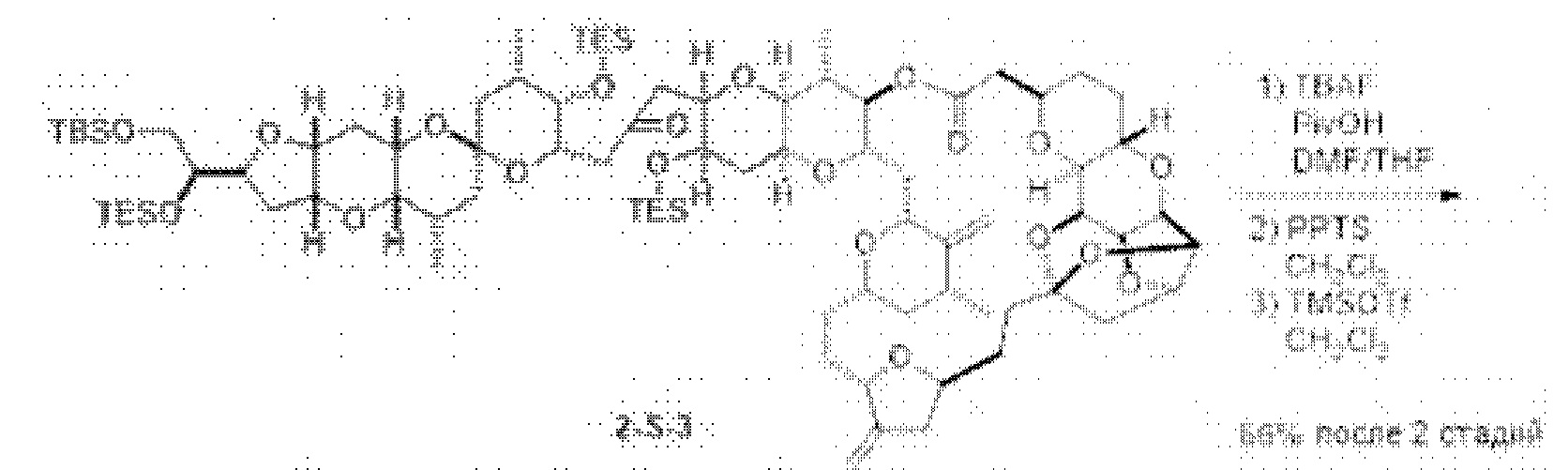
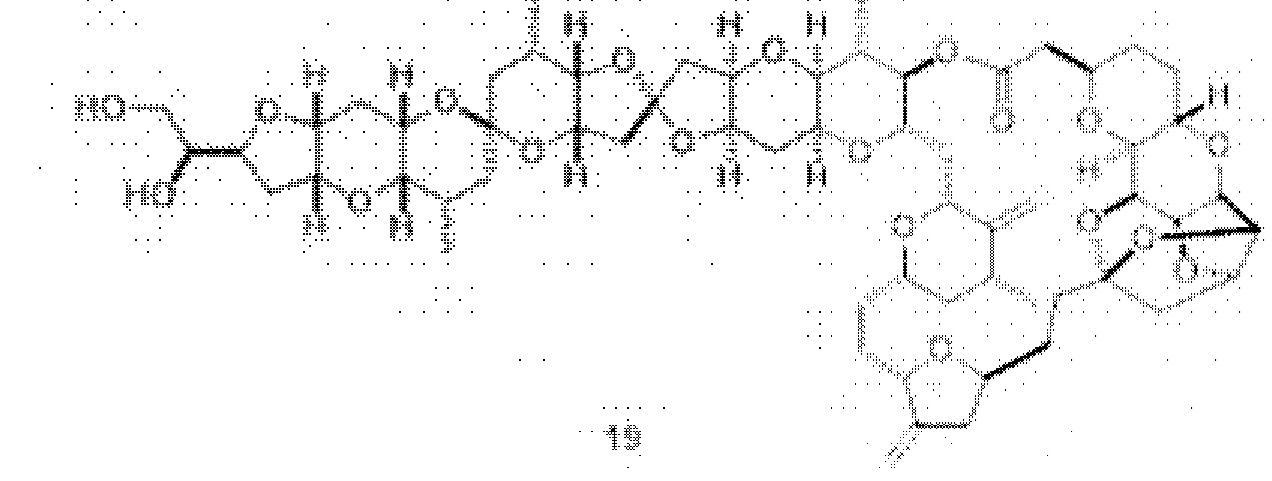
[00692] Забуференный раствор TBAF получали путем смешивания раствора TBAF (TCI #Т1125; 0,86 мл, 1 М в THF, 0,86 ммоль, 10 экв.) и PivOH (43,9 мг, 0,430 ммоль, 5 экв.). К перемешанному раствору кетона 2-S-3 (137 мг, 0,0857 ммоль, 1 экв.) в DMF (4,3 мл) при комнатной температуре добавляли забуференный раствор TBAF. После перемешивания в течение 7 ч при той же температуре, добавляли СаСО3 (2,4 г) и DOWEX 50WX8-400 (2,4 г). После перемешивания в течение 1 ч при комнатной температуре, полученную смесь разбавляли EtOAc и фильтровали через слой Celite. Осадок на фильтре тщательно промывали EtOAc. Фильтрат концентрировали в условиях пониженного давления с получением неочищенного тетраола, который использовали на следующей стадии без дополнительной очистки. К перемешанному раствору неочищенного тетраола (по расчетам 0,0857 ммоль, 1 экв.) в CH2Cl2 (8,6 мл) при комнатной температуре добавляли PPTS (108 мг, 0,430 ммоль, 5 экв.). После перемешивания в течение 1 ч при той же температуре, реакционную смесь немедленно подвергали колоночной хроматографии на аминосиликагеле (CH2Cl2, затем 25%, 50%, 75%, затем 100% EtOAc в гексанах, затем 2% МеОН в EtOAc) с получением неочищенного гомогалихондрина В и его С38-эпимера. Смесь очищали на системе очистки YAMAZEN с ODS-колонкой (Rf градиент: от 10% MeCN в Н2О до 100% MeCN) с получением гомогалихондрина В (19) (63,8 мг, 0,0568 ммоль, 66% после 2 стадий) в виде бесцветного твердого вещества и 38-эпи-гомогалихондрина В (С38-эпи-19) (14,4 мг, 0,0128 ммоль, 15% после 2 стадий) в виде бесцветного твердого вещества. Гомогалихондрин В (19): [α]20D -43,7 (с 1,02, МеОН). 1Н-ЯМР (600 МГц, CD3OD) δ: 5,06 (1Н, с), 5,01 (1Н, с), 4,88 (1Н, с), 4,81 (1Н, с), 4,70 (1Н, дд, J=4,5, 4,5 Гц), 4,63 (1Н, дд, J=7,8, 4,8 Гц), 4,60 (1Н, дд, J=4,5, 4,5 Гц), 4,45 (1Н, д, J=10,8 Гц), 4,33 (1Н, ддд, J=9,6, 9,6, 4,2 Гц), 4,30 (1Н, с), 4,25-4,21 (2Н, м), 4,18 (1Н, дд, J=5,7, 5,7 Гц), 4,06-4,13 (4Н, м), 4,02 (1Н, с), 3,95 (1Н, с), 3,87-3,88 (3Н, м), 3,71 (1Н, дд, J=10,2, 10,2 Гц), 3,66 (1Н, с), 3,61 (1Н, д, J=10,8 Гц), 3,55-3,60 (3Н, м), 3,50 (1Н, ддд, J=5,4, 5,4, 5,4 Гц), 3,21 (1Н, дд, J=5,7, 5,7 Гц), 3,12 (1Н, с), 2,98 (1Н, д, J=10,2 Гц), 2,80 (1Н, дд, J=9,0, 6,6 Гц), 2,56 (1Н, дд, J=17,4, 9,6 Гц), 2,45 (1Н, д, J=17,4 Гц), 2,39 (1Н, дд, J=13,2, 5,4 Гц), 2,38-2,24 (6Н, м), 2,22-2,13 (4Н, м), 2,09-1,97 (9Н, м), 1,90 (1Н, ддд, J=15,6, 4,2, 4,2 Гц), 1,80-1,84 (2Н, м), 1,74-1,67 (3Н, м), 1,60 (1Н, ддд, J=12,0, 12,0, 6,0 Гц), 1,51-1,29 (9Н, м), 1,10 (3Н, д, J=6,6 Гц), 1,05 (3Н, д, J=7,2 Гц), 1,05-0,99 (1Н, м), 0,95 (3Н, д, J=6,6 Гц), 0,94 (3Н, д, J=5,4 Гц) м.д. 13С-ЯМР (125 МГц, CDCl3) δ: 171,2, 151,8, 151,6, 112,4, 110,1, 104,4, 104,1, 96,6, 82,2, 81,1, 79,8, 78,4, 77,7, 77,6, 76,6, 76,29, 76,25, 75,4, 75,3, 75,1, 74,9, 74,8, 74,4, 73,9, 73,7, 73,5, 72,8, 71,9, 71,2, 70,8, 68,2, 66,7, 65,7, 63,7, 48,4, 43,4, 42,5, 40,4, 38,7, 37,3, 37,0, 36,92, 36,87, 36,6, 36,0, 34,4, 32,1, 31,4, 30,7, 30,1, 29,4, 29,0, 28,9, 28,2, 25,8, 18,0, 17,8, 17,1, 15,0 м.д. FTIR (пленка): 3460, 2926, 2874, 1736, 1652, 1567, 1187, 1132, 1105, 1074, 1041, 1021, 997 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C61H86O19Na, 1145,5656; обнаружено, 1145,5770.
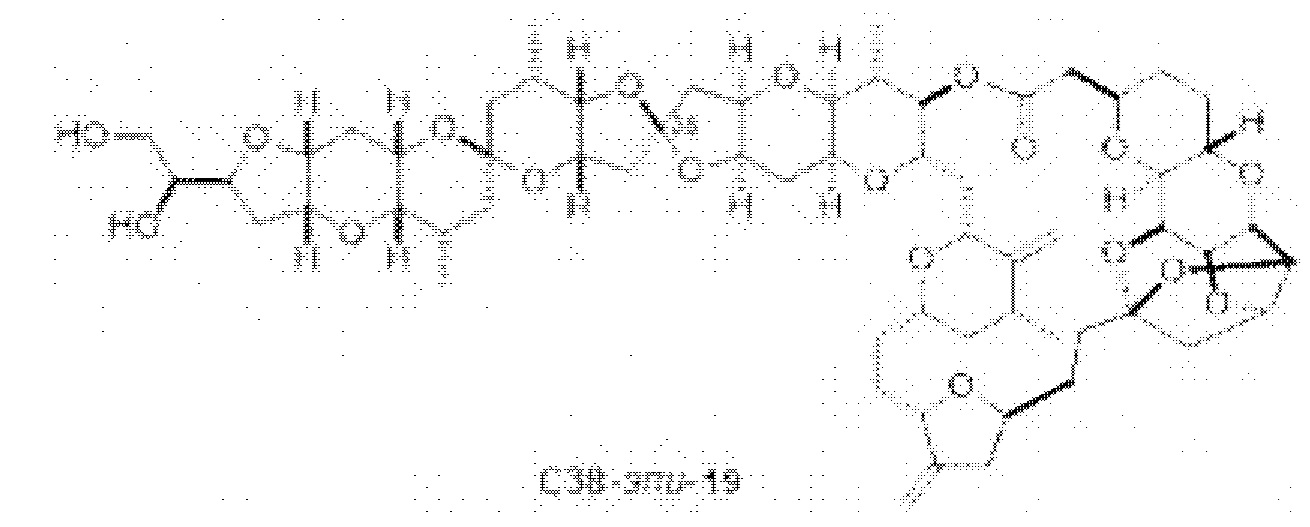
[00693] 38-эпи-гомогалихондрин В (С38-эпи-19): [α]20D -86,6 (с 0,860, МеОН). 1Н-ЯМР (600 МГц, CD3OD) δ: 5,04 (1Н, д, J=1,8 Гц), 4,96 (1Н, д, J=1,8 Гц), 4,87 (1Н, с), 4,80 (1Н, с), 4,72 (1Н, дд, J=10,2, 6,6 Гц), 4,70 (1Н, дд, J=4,2, 4,2 Гц), 4,60 (1Н, дд, J=4,5, 4,5 Гц), 4,44 (1Н, д, J=10,8 Гц), 4,37 (1Н, ддд, J=10,2, 10,2, 4,2 Гц), 4,28 (1Н, д, J=2,4 Гц), 4,23 (1Н, ддд, J=9,6, 4,8, 4,8 Гц), 4,19-4,05 (6Н, м), 4,02 (1Н, с), 3,98 (1Н, дд, J=4,8, 1,8 Гц), 3,91-3,85 (3Н, м), 3,81 (1Н, с), 3,63 (1Н, дд, J=10,5, 10,5 Гц), 3,59-3,56 (3Н, м), 3,54 (1Н, д, J=2,4 Гц), 3,51-3,47 (1Н, м), 3,17 (1Н, дд, J=8,4, 6,0 Гц), 3,15 (1Н, с), 2,99 (1Н, дд, J=9,6, 1,2 Гц), 2,83-2,79 (1Н, м), 2,56 (1Н, дд, J=17,0, 8,7 Гц), 2,47 (1Н, дд, J=17,0, 2,4 Гц), 2,35-1,93 (21Н, м), 1,91 (1Н, ддд, J=15,6, 4,5, 4,5 Гц), 1,83 (1Н, ддд, J=11,1, 11,1, 2,4 Гц), 1,77 (1Н, д, J=13,2 Гц), 1,71 (1Н, дд, 13,2, 2,4 Гц), 1,68-1,60 (2Н, м), 1,58-1,54 (1Н, м), 1,50-1,33 (7Н, м), 1,29 (1Н, дд, J=12,6, 4,2 Гц), 1,10 (3Н, д, J=7,2 Гц), 1,05-0,98 (1Н, м), 1,004 (3Н, д, J=7,2 Гц), 0,995 (3Н, д, J=6,6 Гц), 0,96 (3Н, д, J=7,2 Гц) м.д. 13С-ЯМР (125 МГц, CD3OD) δ: 172,9, 153,3, 152,8, 115,6, 111,3, 105,1, 104,7, 98,0, 83,8, 82,4, 80,2, 79,8, 79,2, 78,9, 78,5, 78,4, 77,9, 77,8, 76,5, 76,12, 76,09, 76,0, 75,7, 75,2, 75,1, 74,8, 74,4, 73,2, 72,9, 69,5, 68,3, 65,3, 65,1, 45,6, 45,0, 44,7, 41,2, 39,6, 38,6, 38,2, 38,1, 37,5, 37,2, 35,4, 33,3, 31,9, 31,8, 31,3, 30,9, 30,19, 30,16, 29,3, 26,8, 18,4, 17,7, 15,2 pm. FTIR (пленка): 3487, 2925, 2872, 1737, 1188, 1119, 1074, 1019, 996, 896, 735 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C61H86O19Na, 1145,5656; обнаружено, 1145,5631. С38-эпи-19 эпимеризовали до гомогалихондрина В (19) в соответствии со следующей методикой:
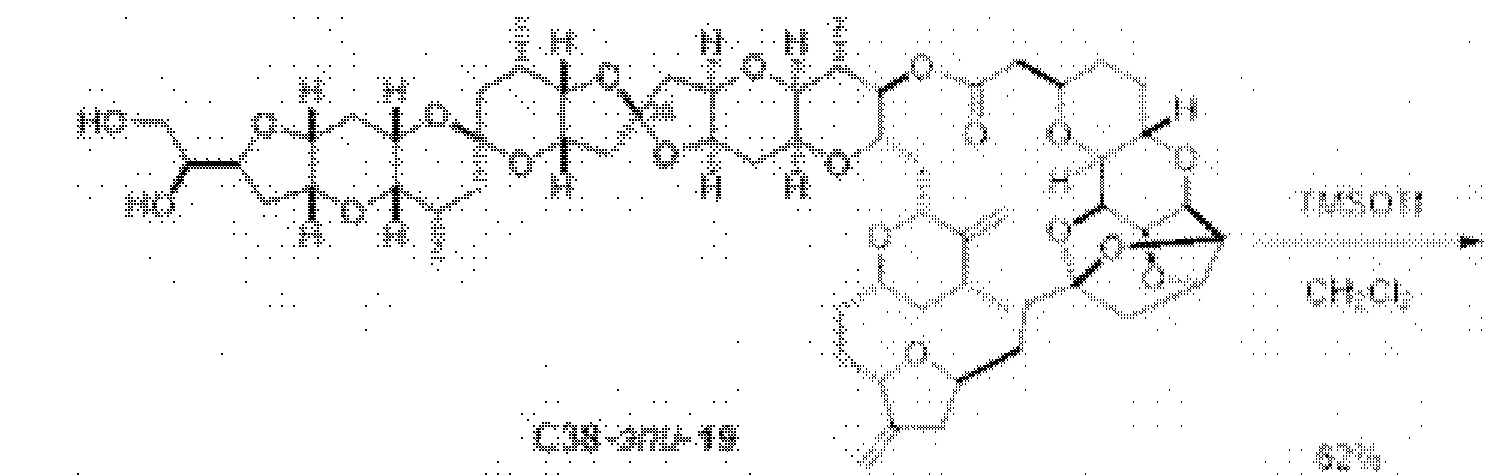
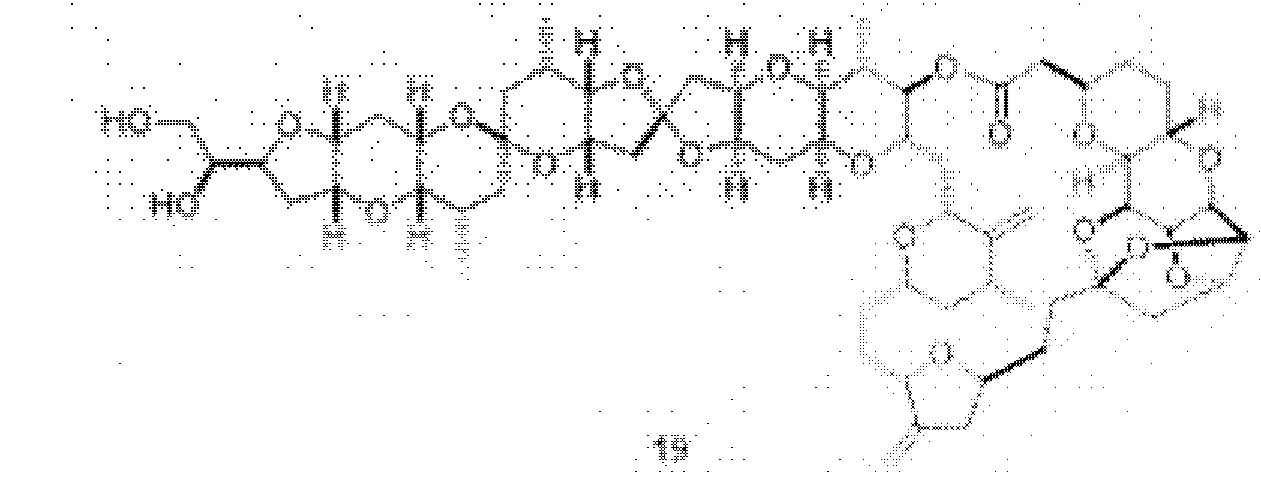
[00694] К раствору С38-эпи-19 (14,4 мг, 0,0128 ммоль, 1 экв.) в CH2Cl2 (6,4 мл) добавляли TMSOTf (0,13 мл, 0,719 ммоль, избыток). После перемешивания в при -78°С течение 15 мин при той же температуре, реакционную смесь гасили добавлением нас. водн. NaHCO3. После перемешивания в течение 1 ч при 0°С, органический слой разделяли, и экстрагировали водный слой CH2Cl2. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Неочищенное вещество очищали на системе очистки YAMAZEN с ODS-колонкой (Rf градиент: от 10% MeCN в H2O до 100% MeCN) с получением гомогалихондрина В (19) (8,9 мг, 0,00792 ммоль, 62%) в виде бесцветного твердого вещества.
Галихондрин А (20)
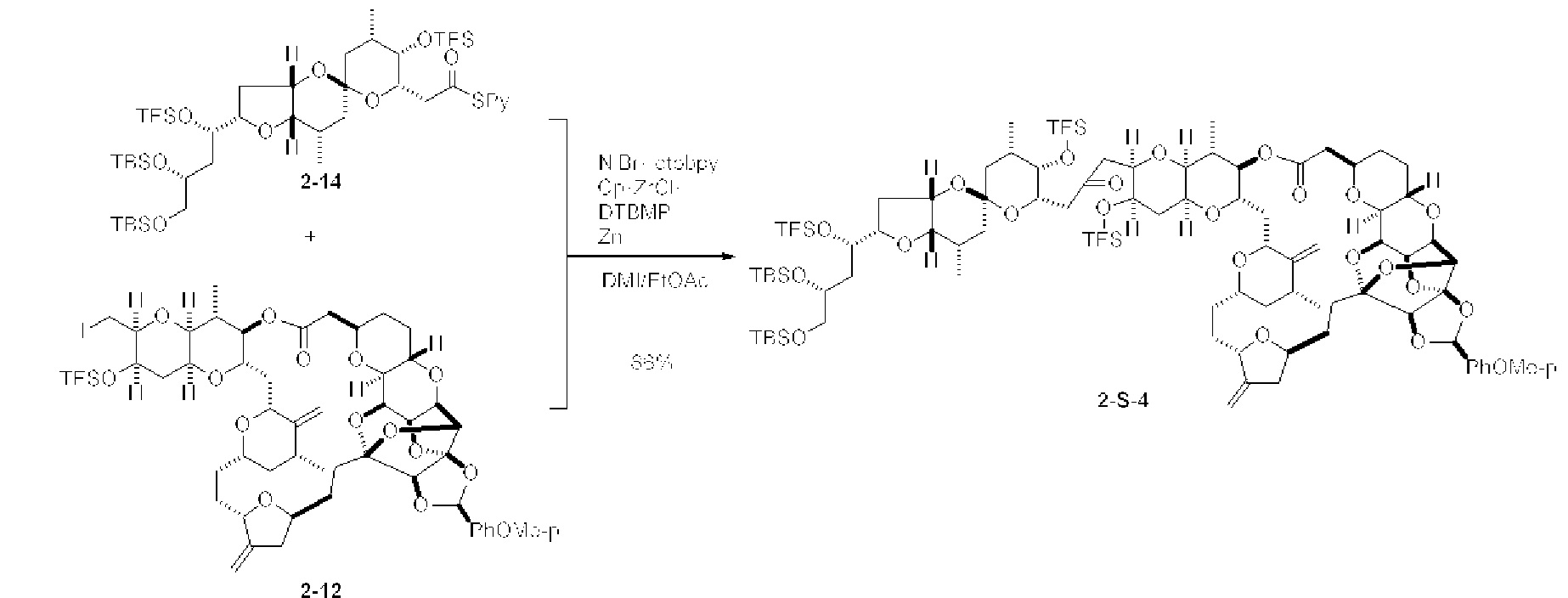
[00695] В перчаточной камере к раствору йодида 2-12 (100,0 мг, 0,0883 ммоль, 1 экв.) и тиоэфира 2-14 (109,5 мг, 0,115 ммоль, 1,3 экв.) в DMI (0,75 мл) и EtOAc (0,15 мл) при комнатной температуре добавляли DTBMP (72,5 мг, 0,353 ммоль, 4 экв.), Zn порошок (34,6 мг, 0,529 ммоль, 6 экв.), Cp2ZrCl2 (77,4 мг, 0,265 ммоль, 3 экв.) и NiBr2-dtbbpy (12,9 мг, 0,027 ммоль, 30 мол. %). После перемешивания в течение 1,5 ч при той же температуре, реакционную смесь удаляли из перчаточной камеры и разбавляли EtOAc и нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество очищали на системе очистки YAMAZEN на нейтральном силикагеле (0%, 9%, затем 20% EtOAc в гексанах) с получением кетона 2-S-4 (140,0 мг, 0,0756 ммоль, 86%) в виде бесцветного аморфного твердого вещества. (2-S-4): [α]20D -64,8 (с 1,00, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 7,35 (2Н, д, J=8,4 Гц), 6,72 (2Н, д, J=8,4 Гц), 6,07 (1Н, с), 5,19 (1Н, с), 5,08 (1Н, с), 4,94 (1Н, с), 4,84-4,79 (3Н, м), 4,66 (1Н, д, J=10,8 Гц), 4,51-4,46 (2Н, м), 4,39 (1Н, ушир. с), 4,35 (1Н, дд, J=5,4, 1,2 Гц), 4,33 (1Н, дд, J=8,4, 1,2 Гц), 4,23-4,21 (1Н, м), 4,14-4,11 (1Н, м), 3,83-3,80 (3Н, м), 4,05 (1Н, с), 4,03-3,95 (4Н, м), 3,91-3,87 (1Н, м), 3,82-3,79 (3Н, м), 3,76-3,71 (3Н, м), 3,46 (1Н, дд, J=8,4, 4,8 Гц), 3,41 (1Н, с), 3,31 (1Н, с), 3,24 (3Н, с), 3,18-3,13 (2Н, м), 3,07-2,99 (2Н, м), 2,76 (1Н, дд, J=16,8, 4,8 Гц), 2,74-2,70 (1Н, м), 2,52 (1Н, д, J=9,6 Гц), 2,47-2,41 (1Н, м), 2,37-2,29 (6Н, м), 2,27-2,18 (5Н, м), 2,13-1,92 (11Н, м), 1,83-1,46 (12Н, м), 1,38-1,27 (1Н, м), 1,18 (3Н, д, J=6,6 Гц), 1,12 (3Н, д, J=7,2 Гц), 1,09 (9Н, т, J=7,2 Гц), 1,08 (9Н, с), 1,07-1,03 (21Н, м), 1,02 (9Н, с), 0,94 (3Н, д, J=7,2 Гц), 0,76 (6Н, кв, J=7,8 Гц), 0,69-0,64 (12Н, м), 0,26 (6Н, с), 0,13 (3Н, с), 0,13 (3Н, с) м.д. 13С-ЯМР (125 МГц, C6D6) δ 206,7, 171,1, 161,4, 152,9, 152,7, 119,0, 114,1, 109,3, 109,0, 105,0, 103,8, 97,0, 90,2, 83,8, 81,5, 80,3, 78,4, 78,1, 77,9, 76,0, 76,0, 75,5, 74,8, 74,7, 74,2, 74,0, 73,6, 72,9, 72,0, 71,8, 71,5, 70,1, 69,8, 68,3, 68,3, 65,9, 64,6, 54,8, 46,8, 46,2, 44,0, 41,3, 39,5, 38,7, 38,2, 37,7, 36,4, 35,4, 35,4, 32,4, 31,0, 30,9, 30,7, 30,3, 27,6, 26,6, 26,3(×6), 26,3(×6), 18,7, 18,6, 18,5, 18,4, 18,1, 16,4, 7,4(×6), 7,3(×6), 7,3(×3), 7,3(×3), 6,0(×6), 5,7(×6), 5,3(×6) м.д. FTIR (пленка): 2955, 2917, 2876, 1736, 1648, 1519, 1253, 1096, 1032, 1009, 851 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C98H164O23Si5Na, 1849,0510; обнаружено, 1849,0490.
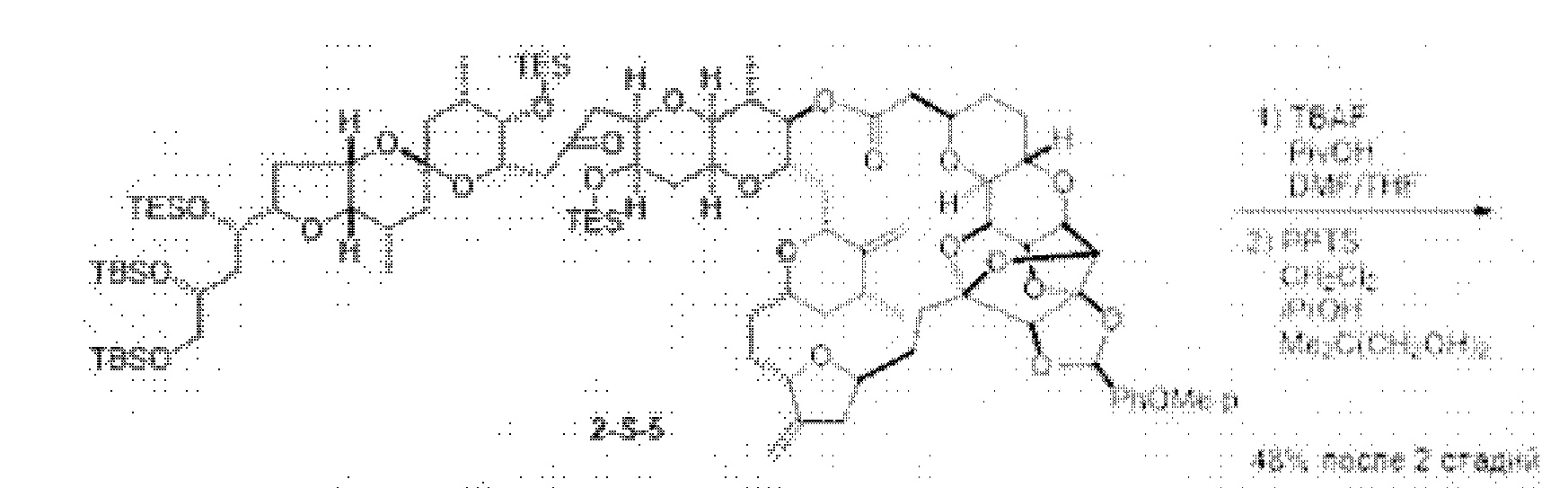
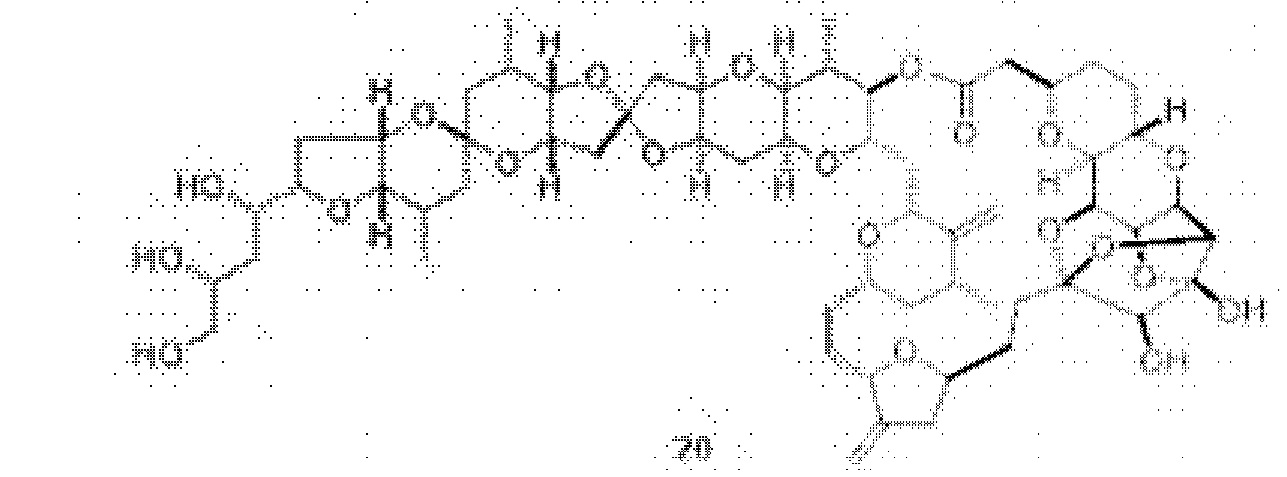
[00696] К перемешанному раствору 2-S-5 (138 мг, 0,0735 ммоль, 1 эквив.) в DMF (3,7 мл, 0,02 М) при комнатной температуре добавляли забуференный раствор TBAF (0,74 мл, 10 эквив., свеже получен из 1,48 мл раствора TBAF (1M в THF) и 75 мг PivOH). После перемешивания в течение 3 ч при той же температуре, добавляли СаСО3 (3,0 г) и DOWEX 50WX8-400 (3,0 г), 1 После перемешивания в течение 2 ч при комнатной температуре, полученную смесь разбавляли EtOAc и фильтровали через слой Celite. Осадок на фильтре тщательно промывали EtOAc. Фильтрат концентрировали в условиях пониженного давления с получением неочищенного вещества, которое использовали на следующей стадии без дополнительной очистки. К перемешанному раствору неочищенного вещества (по расчетам 0,0735 ммоль, 1 экв.) в CH2Cl2 (3,7 мл, 0,02 М) при комнатной температуре добавляли PPTS (184,6 мг, 0,735 ммоль, 10 эквив.). После перемешивания в течение 1,5 ч при той же температуре, анализ методом TLC указывал на исчезновение исходного вещества. К полученному раствору при той же температуре добавляли iPrOH (1,2 мл) и дополнительно PPTS (184,6 мг, 0,735 ммоль, 10 экв.). После перемешивания в течение 20 ч, реакционную смесь немедленно подвергали колоночной хроматографии на аминосиликагеле (CH2Cl2, затем 100% EtOAc, затем 16% МеОН в EtOAc) с получением неочищенного галихондрина А и его С-38-эпимера. Смесь очищали на системе очистки YAMAZEN с ODS-колонкой (Rf градиент: от 10% MeCN в H2O до 50% MeCN в H2O) с получением галихондрина А (20) (40,0 мг, 0,035 ммоль, 48% после 3 стадий) в виде белого кристаллического вещества и 38-эпи-галихондрина А (С38-эпи-20) (13,5 мг, 0,0118 ммоль, 16% после 3 стадий) в виде белого твердого вещества. Галихондрин А (20): [α]20D -73,2 (с 0,11, МеОН). т.пл.: 168-170°С (перекристаллизовывали из гексанов-CH2Cl2) 1H-ЯМР (600 МГц, CD3OD) δ: 5,08 (1Н, с), 5,03 (1Н, с), 4,88 (1Н, с), 4,82 (1Н, с), 4,62 (1Н, дд, J=7,2, 4,2 Гц), 4,45 (1Н, д, J=11,2 Гц), 4,37 (1Н, дд, J=4,8, 3,0 Гц), 4,32 (1Н, ддд, J=10,0, 10,0, 4,2 Гц), 4,32-4,28 (2Н, м), 4,25 (1Н, ддд, J=11,2, 4,4, 2,4 Гц), 4,20 (1Н, дд, J=3,2, 2,1 Гц), 4,14-4,07 (4Н, м), 4,05 (1Н, ддд, J=2,4, 2,4, 2,4 Гц), 3,99 (1Н, ддд, J=9,6, 4,8, 4,2 Гц), 3,91-3,84 (3Н, м), 3,78 (1Н, ддд, J=8,8, 4,8, 4,4 Гц), 3,75-3,70 (1Н, м), 3,69 (1Н, дд, J=2,3, 2,3 Гц,), 3,61 (1Н, д, J=11,7 Гц), 3,56 (1Н, дд, J=2,3, 1,8 Гц), 3,53 (1Н, с), 3,53 (1Н, дд, J=11,2, 4,7, Гц), 3,47 (1Н, дд, J=11,2, 6,5 Гц), 3,22 (1Н, дд, J=6,5, 4,7 Гц), 2,94 (1Н, дд, J=10,0, 2,3 Гц), 2,82 (1Н, дддд, J=15,8, 7,6, 4,7, 2,9 Гц), 2,57 (1Н, дд, J=17,9, 9,7 Гц), 2,45 (1Н, дд, J=17,9, 1,8 Гц), 2,40 (1Н, дд, J=13,2, 6,2 Гц), 2,36-2,24 (8Н, м), 2,20-2,13 (1Н, м), 2,10-1,97 (6Н, м), 1,92-1,79 (4Н, м), 1,78-1,67 (4Н, м), 1,60 (1Н, ддд, J=14,2, 8,4, 8,4 Гц), 1,56-1,42 (4Н, м), 1,42-1,28 (5Н, м), 1,10 (3Н, д, J=6,5 Гц), 1,06 (3Н, д, J=7,6 Гц), 1,02 (3Н, д, J=7,0 Гц), 1,04-0,98 (1Н, м), 0,97 (3Н, д, J=7,0 Гц) м.д. 13С-ЯМР (125 МГц, 12CD3OD) δ 172,8, 153,3, 153,1, 114,8, 113,4, 112,9, 105,7, 104,8, 98,4, 85,5, 82,3, 81,3, 81,2, 80,8, 79,0, 78,0, 77,9, 77,6, 77,4, 76,3, 76,0, 75,8, 75,5, 75,2, 75,1, 75,1, 73,8, 73,7, 73,3, 73,1, 73,0, 71,6, 69,6, 67,2, 65,6, 45,6, 45,0, 44,9, 41,1, 39,8, 37,9, 37,9, 37,8, 37,5, 37,5, 37,2, 36,3, 33,0, 31,8, 31,3, 31,3, 30,9, 30,8, 28,4, 27,1, 27,1, 18,4, 18,3, 18,1, 15,9 м.д. FTIR (пленка): 3429, 2925, 2872, 1736, 1454, 1372, 1269, 1191, 1129, 1109, 1073, 1020, 753 см-1. HRMS (ESI) m/z: [М+Н]+ рассчит. для C60H87C21, 1143,5734; обнаружено, 1143,5720.
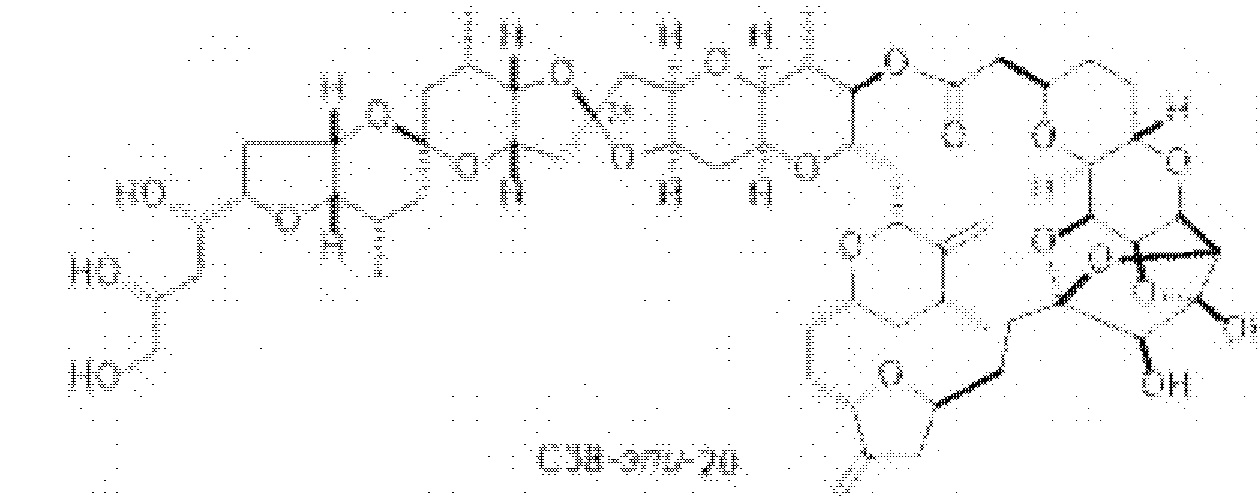
[00697] 38-эпи-Галихондрин А (С38-эпи-20): [α]20D -74,3 (с 0,50, МеОН). 1Н-ЯМР (600 МГц, CD3OD) δ: 5,04 (1Н, с), 4,96 (1Н, с), 4,87 (1Н, с), 4,81 (1Н, с), 4,72 (1Н, дд, J=10,2, 6,6 Гц), 4,43 (1Н, д, J=10,2 Гц), 4,38-4,31 (4Н, м), 4,37 (1Н, ддд, J=12,0, 12,0, 4,8 Гц), 4,20 (1Н, м), 4,18-4,06 (7Н, м), 3,99 (1Н, ддд, J=9,6, 5,4, 4,2 Гц), 3,91-3,83 (4Н, м), 3,78 (1Н, ддд, J=14,4 4,8, 4,2 Гц), 3,64 (1Н, д, J=9,6 Гц), 3,59-3,56 (2Н, м), 3,53 (1Н, дд, J=10,8, 4,5 Гц), 3,47 (1Н, дд, J=11,4, 6,0 Гц), 3,17 (1Н, дд, J=9,0, 6,6 Гц), 2,95 (1Н, дд, J=9,6, 1,8 Гц), 2,86-2,80 (1Н, м), 2,56 (1Н, дд, J=17,4, 9,6 Гц), 2,47 (1Н, дд, J=17,4, 2,4 Гц), 2,36-2,18 (9Н, м), 2,12-2,07 (3Н, м), 2,04-1,96 (4Н, м), 1,88-1,81 (3Н, м), 1,77-1,73 (2Н, м), 1,69-1,65 (2Н, м), 1,62-1,34 (10Н, м), 1,09 (3Н, д, J=6,6 Гц), 1,04 (3Н, д, J=8,4 Гц), 1,05-0,99 (1Н, м), 1,02 (3Н, д, J=7,8 Гц), 1,00 (3Н, д, J=6,6 Гц) м.д. 13С-ЯМР (125 МГц, CD3OD) δ: 172,9, 153,3, 152,8, 115,6, 113,3, 113,0, 105,1, 104,7, 98,3, 85,5, 82,4, 81,3, 81,1, 80,0, 79,1, 78,9, 78,9, 78,5, 77,9, 76,7, 76,1, 76,0, 75,9, 75,5, 75,3, 74,8, 73,9, 73,5, 73,3, 73,2, 73,2, 71,7, 69,5, 68,3, 67,2, 45,6, 44,9, 44,8, 41,2, 39,7, 38,3, 38,3, 38,1, 37,5, 37,5, 37,2, 36,2, 33,3, 31,8, 31,3, 31,0, 30,9, 29,9, 28,3, 27,1, 26,8, 18,4, 18,3, 18,3, 15,2 м.д. FTIR (пленка): 3439, 2925, 2872, 1736, 1454, 1372, 1279, 1192, 1119, 1073, 1020, 753 см-1. HRMS (ESI) m/z: [M+H]+ рассчит. для C60H87O21, 1143,5734; обнаружено, 1143,5721. С38-эпи-20 эпимеризовали до галихондрина А (20) в соответствии со следующей методикой:
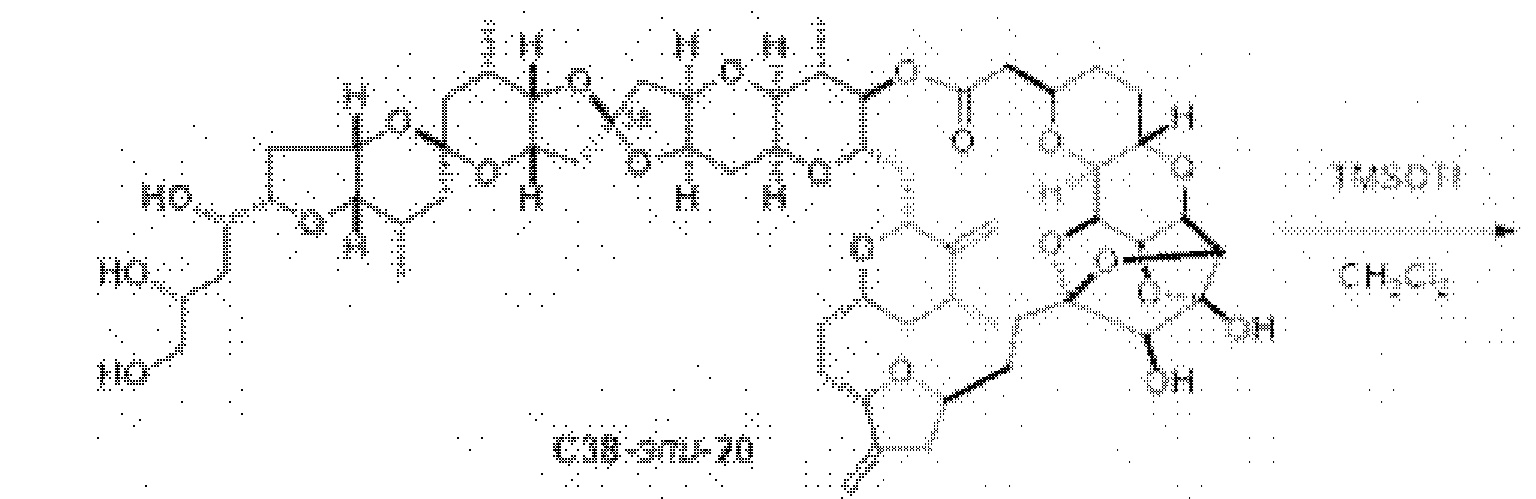
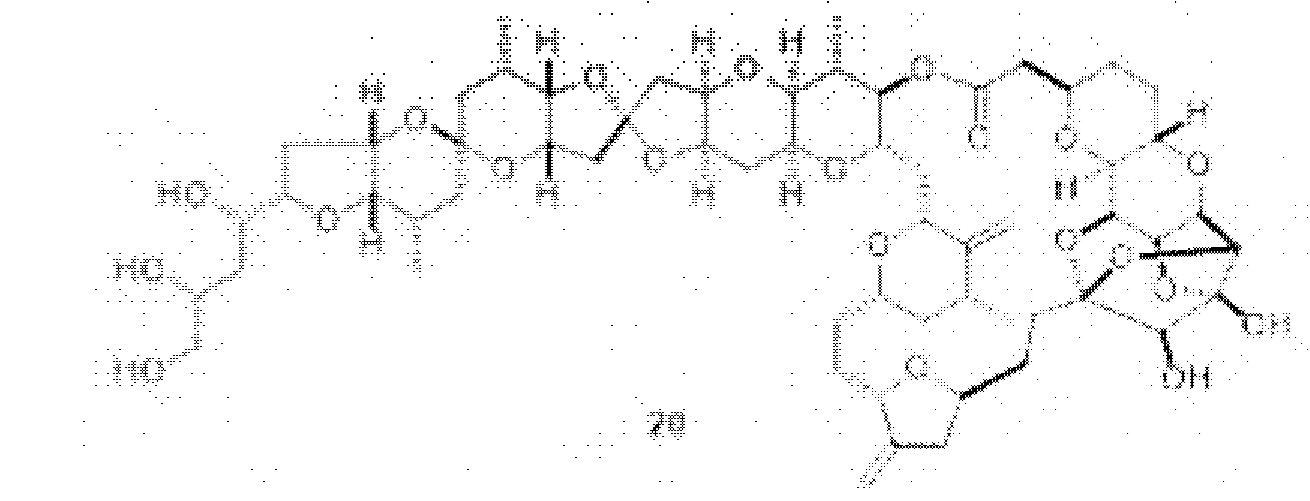
[00698] К перемешанному раствору С38-эпи-20 (13,0 мг, 0,0114 ммоль, 1 экв.) в CH2Cl2 (5,7 мл) при -78°С добавляли TMSOTf (0,114 мл, 0,631 ммоль, избыток). После перемешивания в течение 15 мин, реакционную смесь гасили добавлением нас. водн. NaHCO3. После перемешивания в течение 1 ч при 0°С, органический слой разделяли, и экстрагировали водный слой CH2Cl2. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Неочищенное вещество очищали на системе очистки YAMAZEN с ODS-колонкой (Rf градиент: от 10% MeCN в H2O до 50% MeCN в H2O) с получением галихондрина А (20) (11,3 мг, 0,00988 ммоль, 86%) в виде белого твердого вещества.
Норгалихондрин А (21)
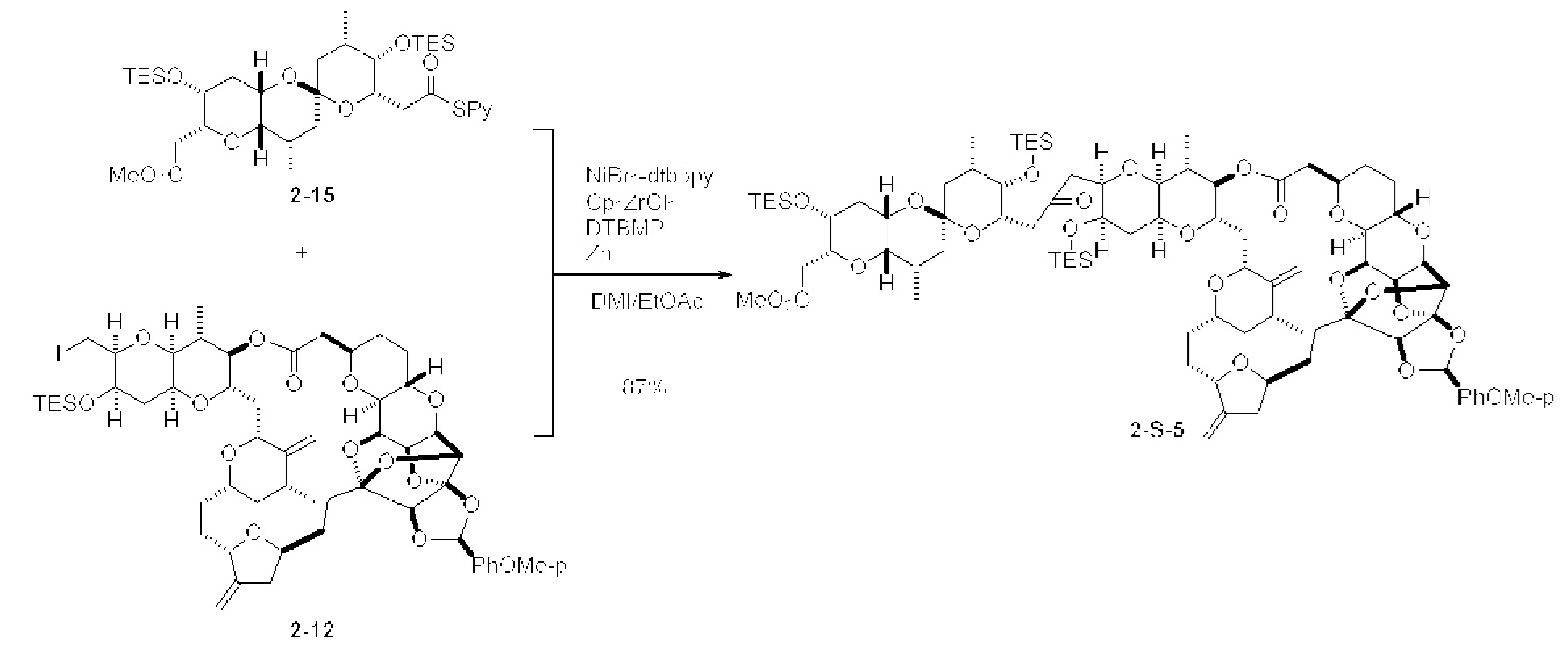
[00699] В перчаточной камере к раствору йодида 2-5 (55 мг, 0,0487 ммоль, 1 экв.) и тиоэфира 2-16 (45,9 мг, 0,0634 ммоль, 1,3 экв.) в DMI (0,4 мл) и EtOAc (0,08 мл) при комнатной температуре добавляли DTBMP (40 мг, 0,195 ммоль, 4 экв.), Zn порошок (19,0 мг, 0,292 ммоль, 6 экв.), Cp2ZrCl2 (42,7 мг, 0,146 ммоль, 3 экв.) и NiBr2-dtbbpy (7,1 мг, 0,0146 ммоль, 30 мол. %). После перемешивания в течение 1,5 ч при той же температуре, реакционную смесь удаляли из перчаточной камеры и разбавляли Et2O и нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой Et2O. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (0%, 15%, 25% EtOAc в гексанах) с получением кетона 2-S-5 (68,4 мг, 0,0423 ммоль, 87%) в виде бесцветного аморфного твердого вещества. 2-S-5: [α]20D -61,5 (с 1,00, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 7,36 (2Н, д, J=8,4 Гц), 6,73 (2Н, д, J=8,4 Гц), 6,08 (1Н, с), 5,22 (1Н, с), 5,11 (1Н, с), 4,96 (1Н, с), 4,84-4,80 (3Н, м), 4,69 (1Н, д, J=10,2 Гц), 4,50 (1Н, ддд, J=9,6, 9,3, 2,0 Гц), 4,41 (1Н, с), 4,39-4,34 (2Н, м), 4,06 (1Н, с), 4,05-3,96 (4Н, м), 3,84-3,77 (2Н, м), 3,77-3,70 (3Н, м), 3,58 (1Н, с), 3,45 (1Н, дд, J=8,4, 4,2 Гц), 3,37 (3Н, с), 3,35 (1Н, с), 3,22 (3Н, с), 3,20-3,14 (1Н, м), 3,11 (1Н, с), 3,07 (1Н, дд, J=17,4, 5,7 Гц), 2,99 (1Н, дд, J=17,4, 6,9 Гц), 2,84 (1Н, дд, J=14,4, 7,2 Гц), 2,78 (1Н, дд, J=14,8, 7,2 Гц), 2,76-2,70 (1Н, м), 2,57 (1Н, дд, J=15,0, 5,4 Гц), 2,53 (1Н, д, J=9,6 Гц), 2,43-2,20 (10Н, м), 2,16-2,06 (5Н, м), 2,06-2,01 (1Н, м), 1,98 (1Н, дд, J=12,0, 12,0 Гц), 1,87-1,80 (1Н, м), 1,78-1,63 (4Н, м), 1,62-1,44 (7Н, м), 1,38-1,30 (3Н, м), 1,20 (3Н, д, J=7,2 Гц), 1,13-1,02 (34Н, м), 0,98 (3Н, д, J=7,2 Гц), 0,71-0,60 (18Н, м) м.д. 13С-ЯМР (150 МГц, C6D6) δ: 206,9, 171,8, 171,2, 161,4, 153,0, 152,6, 128,8, 128,7, 119,0, 114,1, 109,3, 109,0, 105,1, 103,8, 96,9, 90,2, 83,8, 78,3, 78,1, 78,0, 77,2, 76,5, 76,1, 76,0, 75,5, 74,8, 74,7, 74,2, 74,0, 73,8, 73,6, 73,0, 70,1, 69,5, 68,4, 65,9, 65,7, 64,6, 64,5, 54,8, 50,9, 46,9, 46,3, 44,0, 41,3, 39,50, 38,7, 37,5, 37,2, 36,4, 36,3, 35,5, 32,4, 31,1, 31,0, 30,9, 30,3, 30,2, 29,2, 27,6, 18,6, 18,2, 17,3, 16,5, 7,5, 7,3, 7,2, 6,0, 5,4, 5,3 м.д. FTIR (пленка): 2953, 2934, 2876, 2104, 1738, 1518, 1458, 1373, 1304, 1154, 1090, 1033, 1014, 855, 830, 740 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C86H134O23Si3Na, 1641,8521; обнаружено, 1641,8591.
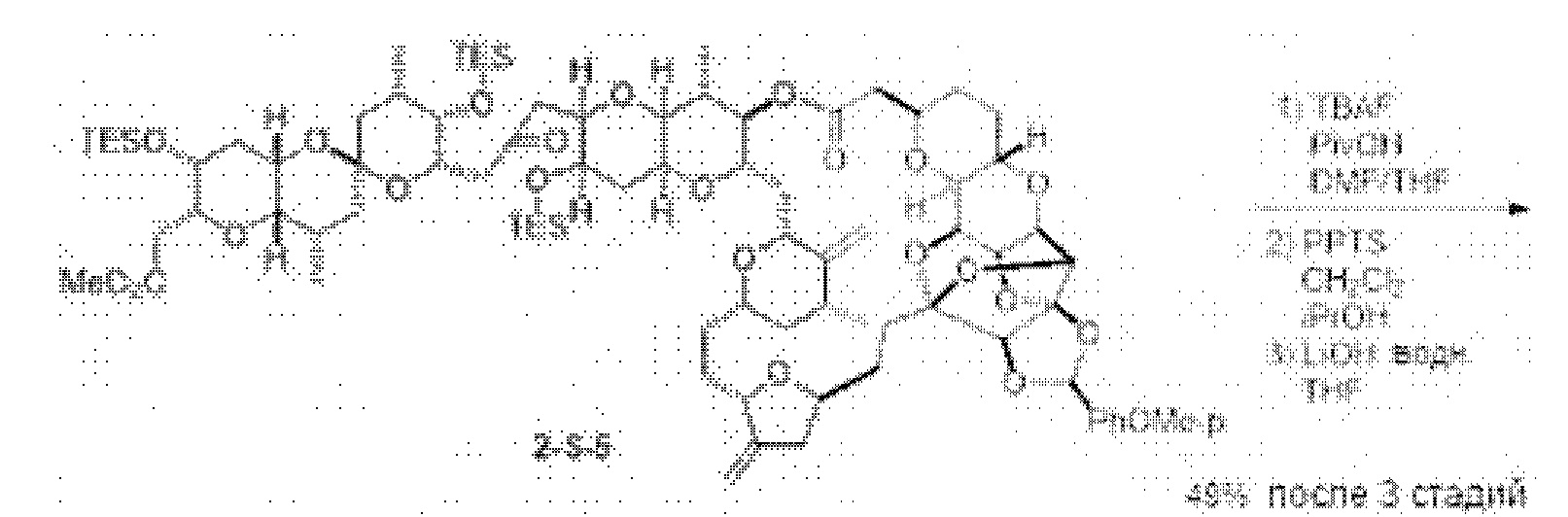
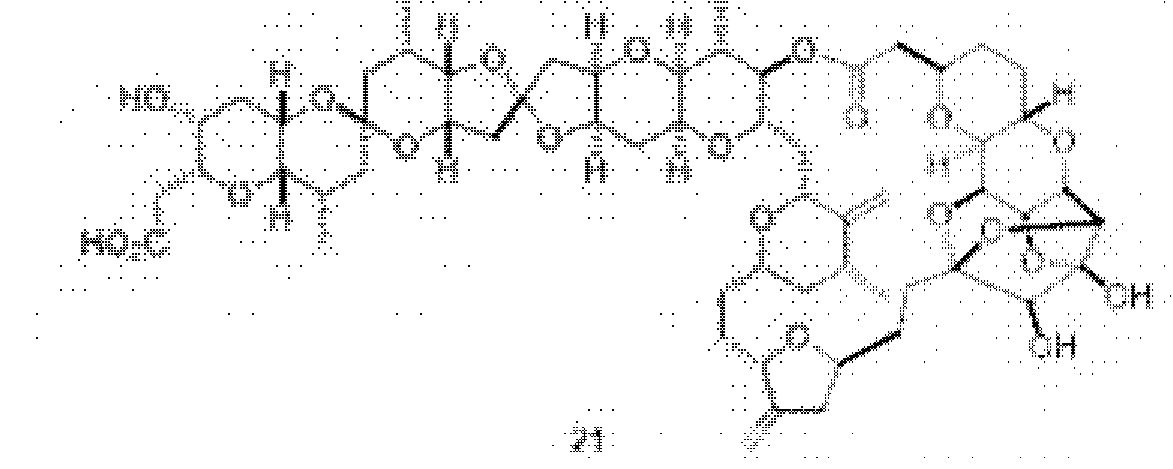
[00700] Забуференный раствор TBAF получали путем смешивания раствора TBAF (TCI #Т1125; 0,37 мл, 1 М в THF, 0,37 ммоль, 10 экв.) и PivOH (18,5 мг, 0,182 ммоль, 5 экв.). К перемешанному раствору кетона 2-S-5 (59 мг, 0,0364 ммоль, 1 экв.) в DMF (2,0 мл) при комнатной температуре добавляли забуференный раствор TBAF. После перемешивания в течение 6 ч при той же температуре, после разбавления 5 мл EtOAc добавляли СаСО3 (1,0 г) и DOWEX 50WX8-400 (1,0 г). После перемешивания в течение 1 ч при комнатной температуре, полученную смесь разбавляли EtOAc и фильтровали через слой Celite. Осадок на фильтре тщательно промывали EtOAc. Фильтрат концентрировали в условиях пониженного давления с получением неочищенного тетраола, который использовали на следующей стадии без дополнительной очистки. К перемешанному раствору неочищенного тетраола (по расчетам 0,0364 ммоль, 1 экв.) в CH2Cl2 (8,5 мл) при комнатной температуре добавляли PPTS (36,8 мг, 0,146 ммоль, 4 экв.). Спустя 1 ч, анализ методом TLC указывал на исчезновение исходного вещества. К полученному раствору при той же температуре добавляли iPrOH (0,4 мл) и дополнительно PPTS (46,0 мг, 0,183 ммоль, 5 экв.). После перемешивания в течение 12 ч при той же температуре, реакционную смесь немедленно подвергали колоночной хроматографии на аминосиликагеле (CH2Cl2, затем 25%, 50%, 75%, затем 100% EtOAc в гексанах, затем 2% МеОН в EtOAc) с получением неочищенного сложного метилового эфира норгалихондрина А и его С38-эпимера. Соединение использовали на следующей стадии после концентрирования без дополнительной очистки. К перемешанному раствору неочищенного сложного метилового эфира (по расчетам 0,0364 ммоль, 1 экв.) в THF (5 мл) при комнатной температуре добавляли 1 М Водн. LiOH (1,5 мл), 3 После перемешивания в течение 2 ч при той же температуре, реакционную смесь разбавляли водой (3 мл). Затем, из смеси на испарителе удаляли THF. После охлаждения реакционной смеси до 0°С, добавляли 1 М водн. HCl (1,5 мл), и оставляли реакционную смесь дополнительно перемешиваться в течение 2 мин. Полученную смесь экстрагировали EtOAc. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученную смесь очищали на системе очистки YAMAZEN с ODS-колонкой (Rf градиент: от 10% MeCN в Н2О до 100% MeCN) с получением норгалихондрина А (21) (20,2 мг, 0,0179 ммоль, 49% после 3 стадий) в виде бесцветного твердого вещества и 38-эпи-норгалихондрина А (С38-эпи-21) (9,8 мг, 0,0087 ммоль, 24% после 3 стадий) в виде бесцветного твердого вещества. Норгалихондрин А (21) [α]20D -70,3 (с 0,37, МеОН) 1Н-ЯМР (600 МГц, CD3OD) δ: 5,06 (1Н, с), 5,02 (1Н, с), 4,88 (1Н, с), 4,81 (1Н, с), 4,62 (1Н, дд, J=7,3, 4,7 Гц), 4,45 (1Н, д, J=9,6 Гц), 4,39-1,35 (1Н, м), 4,35-4,29 (3Н, м), 4,25 (1Н, ддд, J=11,2, 4,2, 1,8 Гц), 4,21 (1Н, дд, J=3,2, 2,4 Гц), 4,13-4,07 (3Н, м), 3,98 (1Н, д, J=2,l Гц), 3,91-3,86 (2Н, м), 3,82-3,76 (2Н, м), 3,74-3,69 (2Н, м), 3,63-3,58 (2Н, м), 3,53 (1Н, с), 3,33-3,28 (1Н, м), 3,22 (1Н, дд, J=6,6, 4,7 Гц), 2,93 (1Н, дд, J=9,6, 1,8 Гц), 2,83 (1Н, ддд, J=16,0, 8,0, 2,1 Гц), 2,58 (1Н, дд, J=16,2, 9,6 Гц), 2,53-2,47 (2Н, ушир. с), 2,44 (1Н, дд, J=17,6, 1,8 Гц), 2,39 (1Н, дд, J=13,2, 6,2 Гц), 2,36-2,23 (6Н, м), 2,20-2,12 (2Н, м), 2,11-1,99 (6Н, м), 1,94 (1Н, ддд, J=14,8, 3,0, 3,0 Гц), 1,90-1,79 (2Н, м), 1,76-1,66 (3Н, м), 1,57-1,47 (4Н, м), 1,43-1,31 (7Н, м), 1,10 (3Н, д, J=6,6 Гц), 1,06 (3Н, д, J=7,0 Гц), 1,04-1,03 (1Н, м), 0,98 (3Н, д, J=7,2 Гц), 0,96 (3Н, д, J=7,2 Гц) м.д. 13С-ЯМР (150 МГц, CD3OD) δ: 172,8 (2С), 153,3, 153,2, 114,8, 113,4, 112,9, 105,7, 104,8, 98,5, 85,5, 82,3, 80,7, 79,0, 78,8, 78,0 (2С), 77,6, 77,4, 77,3, 76,3, 76,0, 75,8, 75,5, 75,3, 75,1 (2С), 73,8, 73,7, 72,7, 69,6, 68,1, 68,0, 65,7, 45,5, 44,9 (2С), 41,1, 39,8, 38,2, 38,1, 37,8, 37,5, 37,1, 35,7, 33,0, 31,8, 31,34, 31,30, 30,8 (2С), 30,7, 30,1, 28,4, 27,3, 18,4, 18,1, 17,4, 15,8 м.д. FTIR (пленка): 3458, 2927, 2873, 1750, 1579, 1410, 1269, 1195, 1074, 1019, 991, 967 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C59H82O21Na, 1149,5246; обнаружено, 1149,5189.
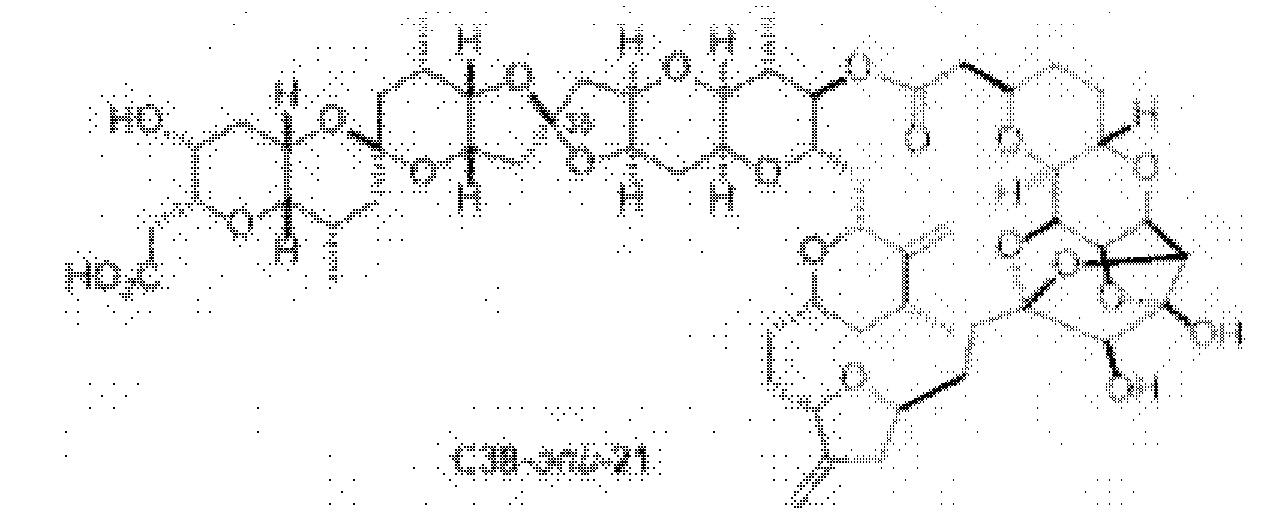
[00701] 38-эпи-норгалихондрин А (С38-эпи-21): [α]20D -83,8 (с 0,277, МеОН) δ: 5,05 (1Н, с), 4,96 (1Н, с), 4,87 (1Н, с), 4,80 (1Н, с), 4,62 (1Н, дд, J=9,6, 6,6 Гц), 4,43 (1Н, д, J=9,6 Гц), 4,39-4,33 (2Н, м), 4,32-4,29 (2Н, м), 4,20 (1Н, т, J=3,2 Гц), 4,17-4,05 (4Н, м), 4,00 (1Н, дд, J=5,4, 2,1 Гц), 3,93-3,83 (4Н, м), 3,79 (1Н, т, J=6,4 Гц), 3,75-3,73 (1Н, м), 3,67-3,56 (2Н, м), 3,52 (1Н, с), 3,34-3,32 (1Н, м), 3,17 (1Н, дд, J=9,6, 6,0 Гц), 2,94 (1Н, дд, J=9,6, 1,8 Гц), 2,83 (1Н, ддд, J=16,0, 8,0, 2,1 Гц), 2,56 (1Н, дд, J=16,2, 9,6 Гц), 2,53-2,47 (2Н, ушир. с), 2,47 (1Н, дд, J=17,6, 1,8 Гц), 2,35 (1Н, д, J=15,6 Гц), 2,33-2,17 (6Н, м), 2,14-2,06 (4Н, м), 2,05-1,95 (4Н, м), 1,92-1,80 (м, 3Н), 1,77-1,64 (3Н, м), 1,59-1,46 (4Н, м), 1,43-1,31 (7Н, м), 1,09 (3Н, д, J=6,6 Гц), 1,03 (3Н, д, J=7,0 Гц), 1,01-0,99 (1Н, м), 0,99 (3Н, д, J=7,2 Гц), 0,98 (3Н, д, J=7,2 Гц). 13С-ЯМР (125 МГц, CD3OD) 172,9 (2С), 153,4, 152,7, 115,6, 113,4, 113,0, 105,2, 104,7, 98,4, 85,5, 82,4, 79,9, 79,1, 79,0, 78,9, 78,8, 78,6, 78,0, 77,0, 76,7, 76,1, 75,9, 75,8, 75,6, 75,3, 74,8, 74,0, 73,3, 73,2, 69,5, 68,4, 68,2, 68,0, 65,9, 45,5, 44,9, 44,8, 41,2, 39,7, 38,6, 38,2, 38,1, 37,5, 37,2, 35,7, 33,2, 31,8, 31,3, 31,0, 30,9, 30,1, 29,9, 27,0, 18,4, 18,3, 17,5, 15,1 м.д. FTIR (пленка): 3500 (br), 2927, 2873, 1736, 1579, 1191, 1075, 1020, 1009, 882, 756 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C59H82O21Na, 1149,5246; обнаружено, 1149,5156. С38-эпи-21 эпимеризовали до норгалихондрина А (21) в соответствии со следующей методикой:
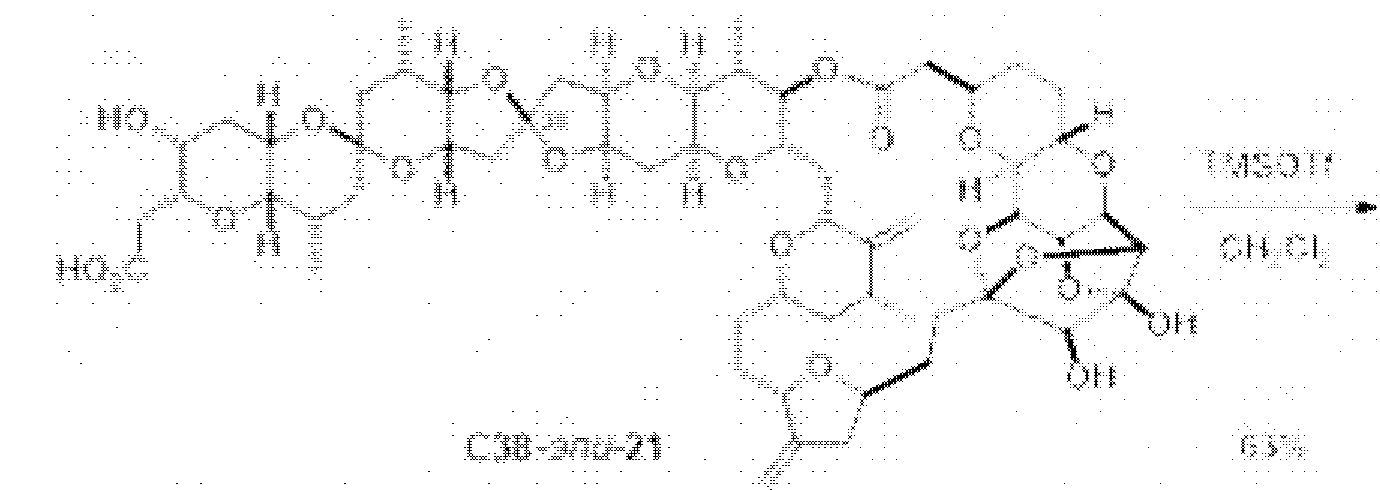
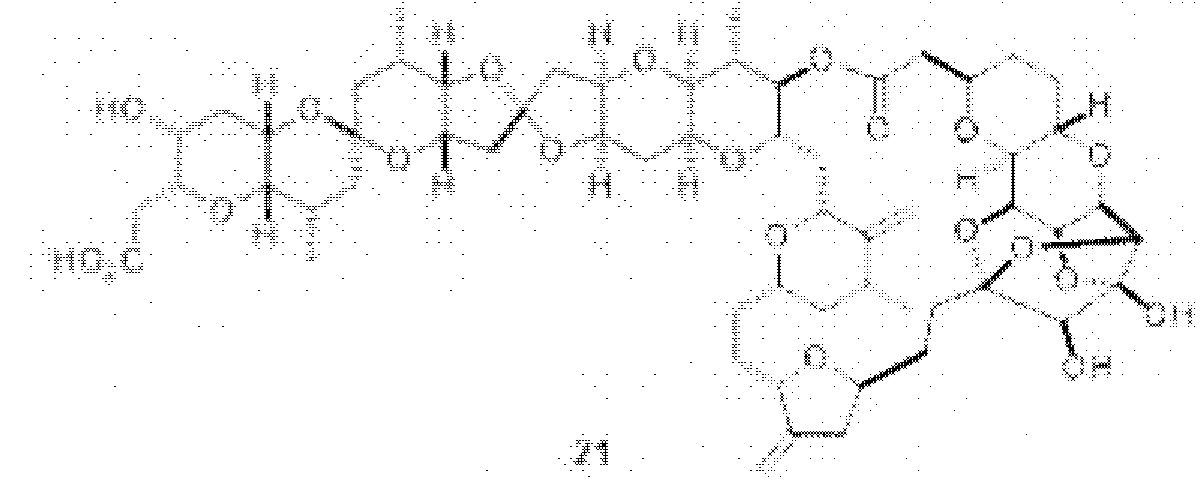
[00702] К раствору С38-эпи-21 (9,8 мг, 0,0087 ммоль, 1 экв.) в CH2Cl2 (3,5 мл) при -78°С добавляли TMSOTf (0,11 мл, 0,435 ммоль, избыток). После перемешивания в течение 15 мин, реакционную смесь гасили добавлением нас. водн. NaHCO3. После перемешивания в течение 1 ч при 0°С, органический слой разделяли, и экстрагировали водный слой CH2Cl2. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Неочищенное вещество очищали на системе очистки YAMAZEN с ODS-колонкой (Rf градиент: от 10% MeCN в Н2О до 100% MeCN) с получением норгалихондрина В (21) (6,2 мг, 0,0055 ммоль, 63%) в виде бесцветного твердого вещества.
Гомогалихондрин А (22)
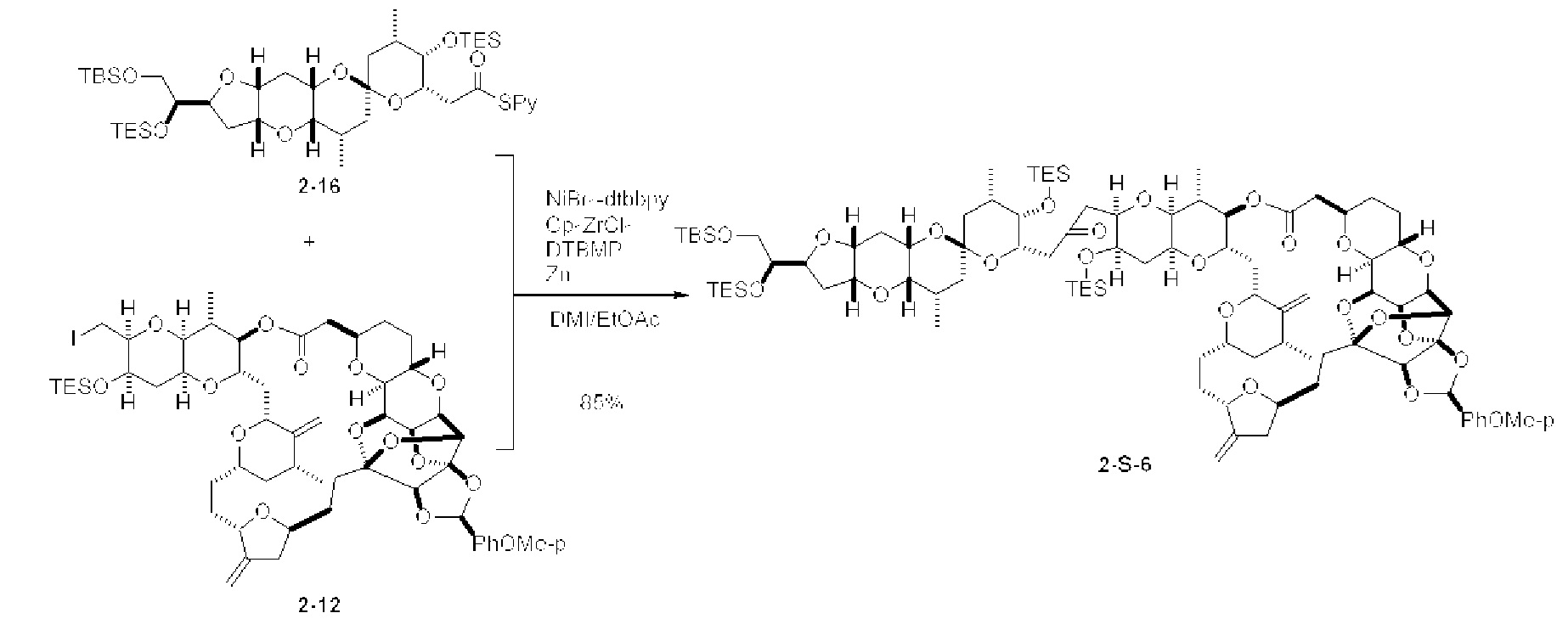
[00703] В перчаточной камере к раствору йодида 2-12 (57,0 мг, 0,0503 ммоль, 1 экв.) и тиоэфира 2-16 (55,7 мг, 0,0653 ммоль, 1,3 экв.) в DMI (0,42 мл) и EtOAc (80 мкл) при комнатной температуре добавляли DTBMP (41,3 мг, 0,201 ммоль, 4 экв.), Zn порошок (19,7 мг, 0,301 ммоль, 6 экв.), Cp2ZrCl2 (44,1 мг, 0,151 ммоль, 3 экв.) и NiBr2-dtbbpy (7,3 мг, 0,0150 ммоль, 30 мол. %). После перемешивания в течение 2 ч при той же температуре, реакционную смесь удаляли из перчаточной камеры и разбавляли Et2O и нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой Et2O. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (0%, 9%, затем 16% EtOAc в гексанах) с получением кетона 2-S-6 (74,8 мг, 0,0428 ммоль, 85%) в виде бесцветного аморфного твердого вещества. 2-S-6: [α]20D -73,0 (с 1,07, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 7,36 (2Н, д, J=8,4 Гц), 6,73 (2Н, д, J=8,4 Гц), 6,08 (1Н, с), 5,22 (1Н, с), 5,11 (1Н, с), 4,96 (1Н, с), 4,84-4,80 (3Н, м), 4,69 (1Н, д, J=10,2 Гц), 4,52-4,46 (2Н, м), 4,41 (1Н, с), 4,37 (1Н, дд, J=4,8, 1,2 Гц), 4,35 (1Н, д, J=10,2 Гц), 4,06-3,97 (5Н, м), 3,83-3,80 (3Н, м), 3,78-3,69 (69Н, м), 3,67 (1Н, с), 3,47 (1Н, дд, J=8,4, 4,2 Гц), 3,28 (1Н, с), 3,22 (3Н, с), 3,19-3,15 (2Н, м), 3,06 (1Н, дд, J=17,4, 5,7 Гц), 3,00 (1Н, дд, J=17,4, 6,9 Гц), 2,92 (1Н, д, J=1,8 Гц), 2,79 (1Н, дд, J=17,1, 7,5 Гц), 2,77-2,73 (1Н, м), 2,53 (1Н, д, J=9,6 Гц), 2,47 (1Н, д, J=15,6 Гц), 2,42-2,21 (10Н, м), 2,15-2,03 (6Н, м), 1,98 (1Н, дд, J=12,0, 12,0 Гц), 1,87-1,82 (2Н, м), 1,76-1,67 (4Н, м), 1,61-1,47 (6Н, м), 1,38-1,27 (3Н, м), 1,20 (3Н, д, J=7,8 Гц), 1,11 (9Н, т, J=8,1 Гц), 1,09 (3Н, д, J=6,6 Гц), 1,06-1,04 (21Н, м), 1,00 (9Н, с), 0,96 (3Н, д, J=6,0 Гц), 0,77 (6Н, кв, J=7,8 Гц), 0,70-0,65 (12Н, м), 0,14 (3Н, с), 0,13 (3Н, с) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 206,7, 171,1, 161,4, 153,0, 152,7, 128,73, 128,69, 119,0, 114,1, 109,3, 109,0, 105,1, 103,8, 96,9, 90,2, 83,8, 79,1, 78,4, 78,1, 77,99, 77,96, 76,8, 76,1, 76,0, 75,5, 74,8, 74,7, 74,2, 74,0, 73,8, 73,6, 73,1, 70,1, 69,3, 68,4, 66,2, 65,9, 64,6, 63,8, 54,8, 46,9, 46,3, 44,0, 41,3, 39,50, 39,45, 38,7, 37,7, 37,6, 36,5, 36,4, 35,5, 32,4, 31,6, 31,1, 30,9, 30,7, 30,3, 30,2, 29,6, 27,7, 26,2, 18,7, 18,6, 18,2, 17,6, 16,5, 7,5, 7,4, 7,3, 6,0, 5,7, 5,3, -5,1, -5,3 м.д. FTIR (пленка): 2953, 2927, 2875, 2104, 1724, 1615, 1518, 1459, 1373, 1306, 1251, 1092, 1032, 1010, 833, 742 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C93H150O23Si4Na, 1769,9537; обнаружено, 1769,9316.
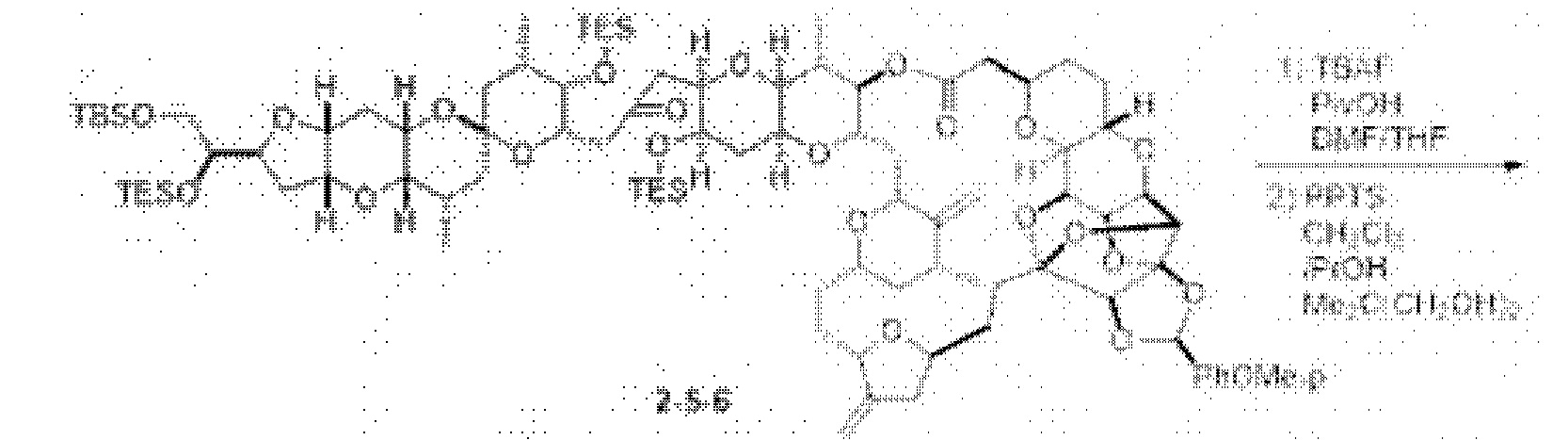
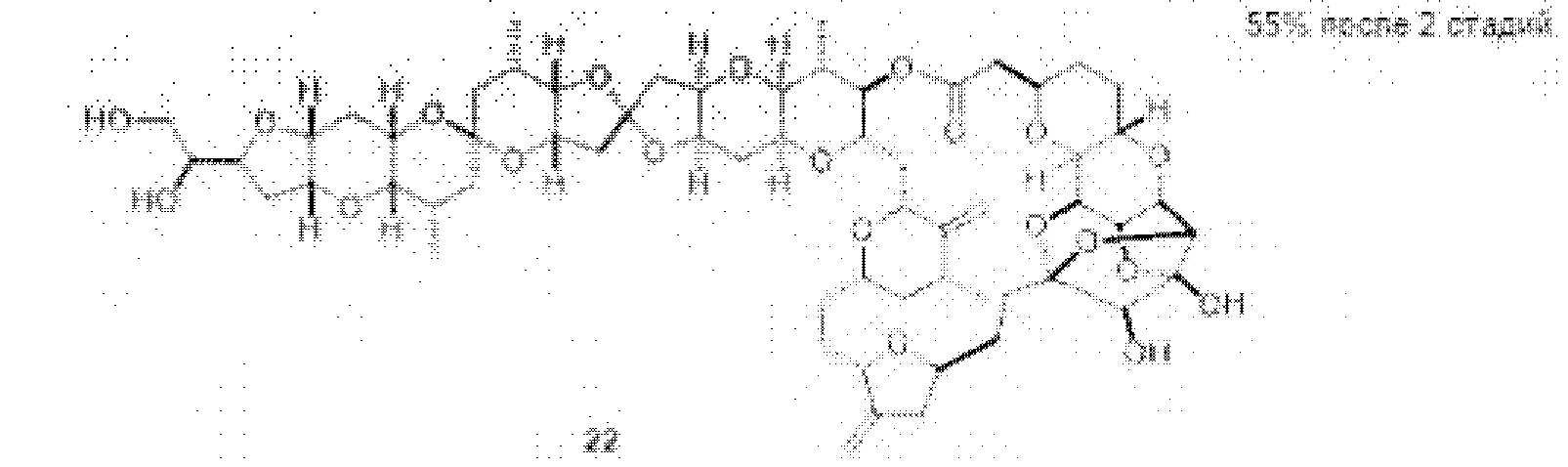
[00704] Забуференный раствор TBAF получали путем смешивания раствора TBAF (TCI #Т1125; 0,43 мл, 1 М в THF, 0,43 ммоль, 10 экв.) и PivOH (22,0 мг, 0,215 ммоль, 5 экв.). К раствору кетона S-6 (74,8 мг, 0,0428 ммоль, 1 экв.) в DMF (2,1 мл) при комнатной температуре добавляли забуференный раствор TBAF. После перемешивания в течение 7 ч при той же температуре, добавляли СаСО3 (1,5 г) и DOWEX 50WX8-400 (1,5 г). После перемешивания в течение 1 ч при той же температуре, полученную смесь разбавляли EtOAc и фильтровали через слой Celite. Осадок на фильтре тщательно промывали EtOAc. Фильтрат концентрировали в условиях пониженного давления с получением неочищенного тетраола, который использовали на следующей стадии без дополнительной очистки. К перемешанному раствору полученного выше тетраола (по расчетам 0,0428 ммоль, 1 экв.) в CH2Cl2 (2,1 мл) при комнатной температуре добавляли PPTS (53,8 мг, 0,214 ммоль, 5 экв.). Спустя 1 ч, анализ методом TLC указывал на исчезновение исходного вещества. К полученному раствору при той же температуре добавляли iPrOH (0,43 мл) и дополнительно PPTS (53,8 мг, 0,214 ммоль, 5 экв.). После перемешивания в течение 18 ч, реакционную смесь немедленно подвергали колоночной хроматографии на аминосиликагеле (CH2Cl2, затем 25%, 50%, 75%, затем 100% EtOAc в гексанах, затем 4% МеОН в EtOAc) с получением неочищенного гомогалихондрина А и его С-38-эпимера. Смесь очищали на системе очистки YAMAZEN с ODS-колонкой (Rf градиент: от 10% MeCN в H2O до 100% MeCN) с получением гомогалихондрина А (22) (27,2 мг, 0,0235 ммоль, 55% после 2 стадий) в виде бесцветного твердого вещества и 38-эин-гомогалихондрина А (С38-эии-22) (10,7 мг, 0,00926 ммоль, 22% после 2 стадий) в виде бесцветного твердого вещества. Гомогалихондрин А (22): [α]20D -80,3 (с 1,22, МеОН). 1Н-ЯМР (600 МГц, CD3OD) δ: 5,07 (1Н, с), 5,01 (1Н, с), 4,88 (1Н, с), 4,81 (1Н, с), 4,63 (1Н, дд, J=7,8, 4,8 Гц), 4,44 (1Н, д, J=4,8 Гц), 4,37 (1Н, с), 4,34-4,31 (3Н, м), 4,25-4,22 (2Н, м), 4,21 (1Н, дд, J=2,7, 2,7 Гц), 4,11-4,08 (3Н, м), 4,03 (1Н, с), 3,95 (1Н, с), 3,89-3,87 (3Н, м), 3,71 (1Н, дд, J=10,2, 10,2 Гц), 3,66 (1Н, с), 3,61-3,57 (4Н, м), 3,53 (1Н, с), 3,50 (1Н, дд, J=9,6, 4,8 Гц), 3,22 (1Н, дд, J=6,0, 6,0 Гц), 3,12 (1Н, с), 2,94 (1Н, д, J=10,2 Гц), 2,82 (1Н, дд, J=15,9, 5,7 Гц), 2,57 (1Н, дд, J=17,3, 9,3 Гц), 2,45 (1Н, д, J=17,3 Гц), 2,39 (1Н, дд, J=13,5, 5,7 Гц), 2,38-2,24 (6Н, м), 2,20-2,14 (3Н, м), 2,09-1,98 (8Н, м), 1,91-1,81 (4Н, м), 1,74-1,68 (3Н, м), 1,51-1,32 (9Н, м), 1,10 (3Н, д, J=6,6 Гц), 1,05 (3Н, д, J=7,2 Гц), 1,05-0,99 (1Н, м), 0,95 (3Н, д, J=6,6 Гц), 0,94 (3Н, д, J=6,0 Гц) м.д. 13С-ЯМР (125 МГц, 12CD3OD) δ: 172,8, 153,2, 153,0, 114,7, 113,3, 112,9, 105,7, 104,8, 98,1, 85,5, 82,3, 81,0, 79,8, 79,0, 78,4, 78,1, 77,9, 77,5, 76,3, 75,9, 75,8, 75,7, 75,5, 75,3, 74,5, 73,8, 73,7, 72,3, 69,6, 65,8, 65,2, 65,1, 49,9, 45,5, 44,9, 44,8, 41,1, 39,8, 38,1, 38,0, 37,8, 37,4, 37,23, 37,15, 33,0, 32,0, 31,8, 31,3, 30,8, 30,7, 30,1, 28,4, 27,1, 18,4, 18,2, 17,7 м.д. FTIR (пленка): 3398, 2927, 2873, 1736, 1372, 1269, 1187, 1129, 1074, 1020, 902, 753 см-1. HRMS (ESI) m/z: [M+NH4]+ рассчит. для C61H90NO21, 1172,6000; обнаружено, 1172,5982.
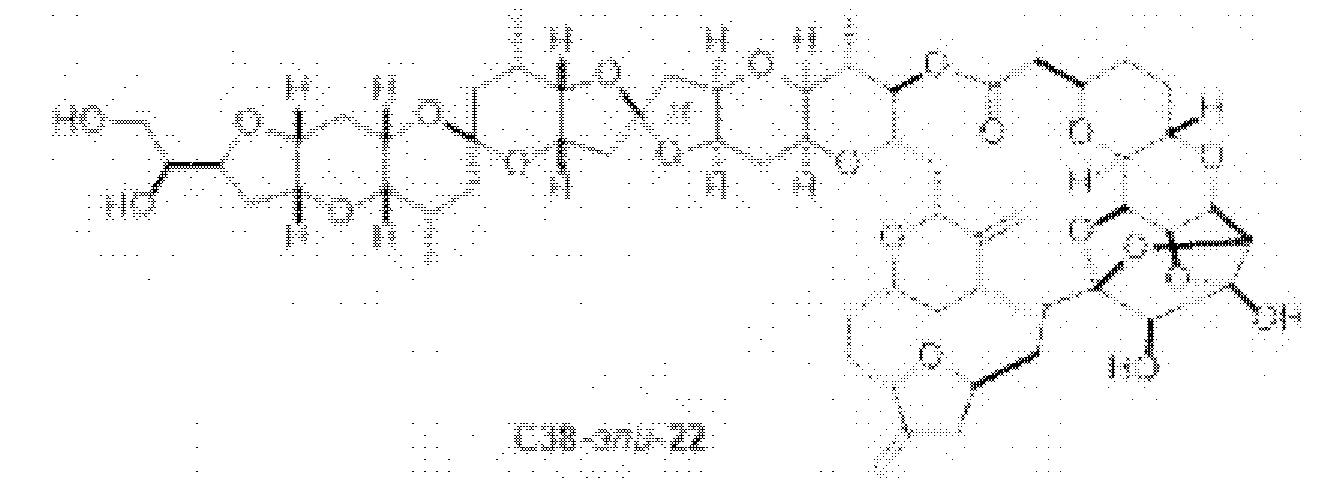
[00705] 38-эпи-гомогалихондрин А (С38-эпи-22): [α]20D -92,3 (с 0,573, МеОН). 1Н-ЯМР (600 МГц, CD3OD) δ: 5,04 (1Н, д, J=1,8 Гц), 4,96 (1Н, д, J=1,8 Гц), 4,87 (1Н, с), 4,80 (1Н, с), 4,72 (1Н, дд, J=10,5, 6,6 Гц), 4,43 (1Н, д, J=10,2 Гц), 4,37 (1Н, ддд, 3=9,6, 9,6, 4,2 Гц), 4,34 (1Н, с), 4,32-4,30 (2Н, м), 4,23 (1Н, ддд, J=10,2, 5,7, 4,5 Гц), 4,20 (1Н, дд, J=2,7, 2,7 Гц), 4,16-4,06 (4Н, м), 4,02 (1Н, с), 3,98 (1Н, дд, J=4,5, 2,1 Гц), 3,91-3,84 (3Н, м), 3,81 (1Н, дд, J=2,4, 2,4 Гц), 3,64 (1Н, дд, J=10,2, 10,2 Гц), 3,60-3,56 (3Н, м), 3,54 (1Н, д, J=3,0 Гц), 3,52 (1Н, с), 3,51-3,47 (1Н, м), 3,17 (1Н, дд, J=8,4, 6,0 Гц), 3,15 (1Н, д, J=1,8 Гц), 2,95 (1Н, дд, J=9,6, 1,8 Гц), 2,85-2,81 (1Н, м), 2,56 (1Н, дд, J=17,1, 9,0 Гц), 2,47 (1Н, дд, J=17,1, 2,4 Гц), 2,36-1,97 (19Н, м), 1,91 (1Н, ддд, J=15,9, 4,8, 4,8 Гц), 1,88-1,81 (2Н, м), 1,79-1,65 (3Н, м), 1,57-1,52 (1Н, м), 1,47 (1Н, дд, J=12,9, 12,9 Гц), 1,42-1,35 (6Н, м), 1,29 (1Н, дд, J=12,6, 4,8 Гц), 1,09 (3Н, д, J=6,6 Гц), 1,06-0,99 (1Н, м), 1,003 (3Н, д, J=7,2 Гц), 0,997 (3Н, д, J=6,6 Гц), 0,96 (3Н, д, J=7,2 Гц) м.д. 13С-ЯМР (125 МГц, CD3OD) δ: 172,9, 153,3, 152,7, 115,6, 113,3, 113,0, 105,1, 104,7, 97,9, 85,5, 82,4, 80,2, 79,8, 79,1, 78,88, 78,86, 78,5, 78,4, 77,8, 76,7, 76,1, 75,9, 75,83, 75,76, 75,5, 75,3, 75,1, 74,8, 74,4, 73,9, 73,2, 72,9, 69,5, 68,3, 65,3, 65,1, 45,6, 45,0, 44,8, 41,2, 39,7, 38,6, 38,3, 38,1, 37,5, 37,2, 33,3, 31,9, 31,7, 31,3, 31,0, 30,9, 30,1, 29,9, 28,3, 26,8, 18,4, 17,7, 15,2 м.д. FTIR (пленка): 3445, 2926, 2873, 1737, 1435, 1373, 1267, 1193, 1108, 1075, 1018, 897, 736 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C61H86O21Na, 1177,5536; обнаружено, 1177,5554. С38-эпи-22 эпимеризовали до гомогалихондрина А (22) согласно следующей методике:
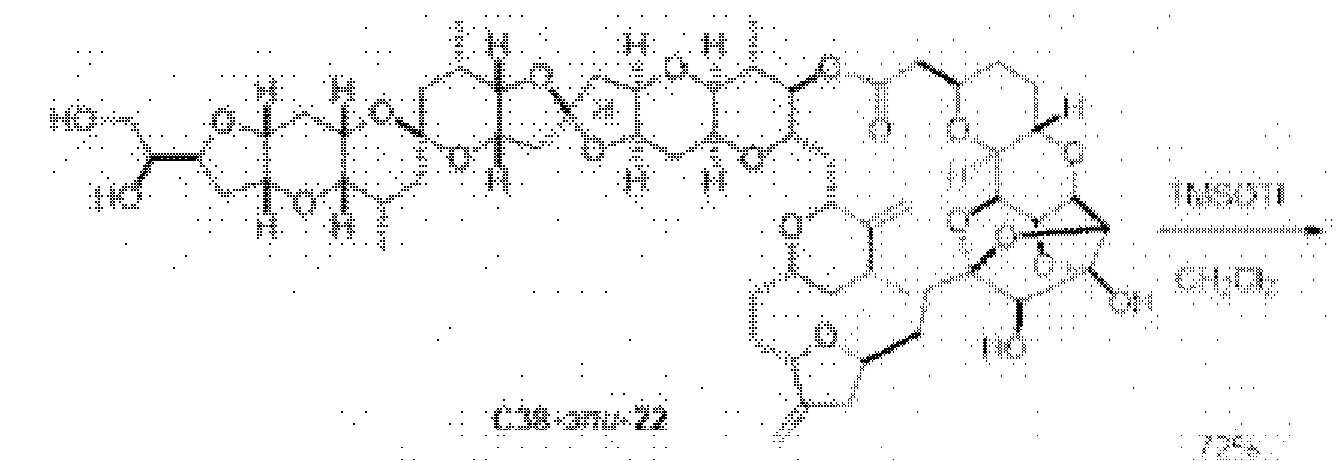
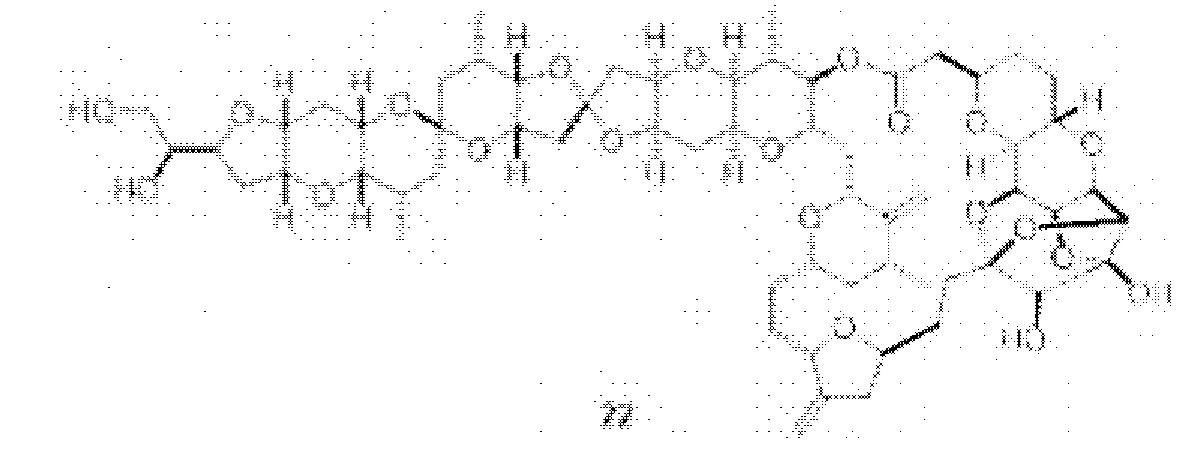
[00706] К раствору С38-эпи-22 (9,7 мг, 0,00840 ммоль, 1 экв.) в CH2Cl2 (4,2 мл) при -78°С добавляли TMSOTf (0,084 мл, 0,465 ммоль, избыток). После перемешивания в течение 15 мин, реакционную смесь гасили добавлением нас. водн. NaHCO3. После перемешивания в течение 1 ч при 0°С, органический слой разделяли, и экстрагировали водный слой CH2Cl2. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Неочищенное вещество очищали на системе очистки YAMAZEN с ODS-колонкой (Rf градиент: от 10% MeCN в Н2О до 100% MeCN) с получением гомогалихондрина А (22) (7,0 мг, 0,00606 ммоль, 72%) в виде бесцветного твердого вещества.
Галихондрин С (23)
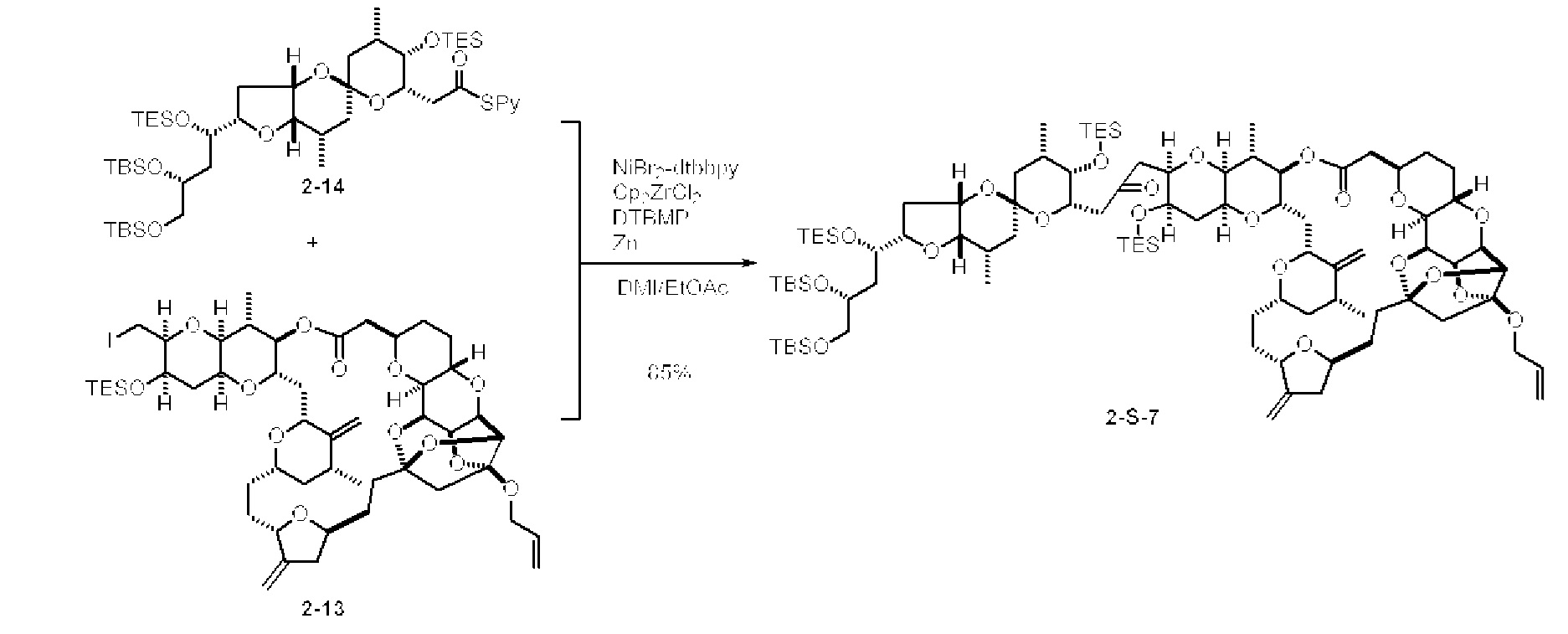
[00707] В перчаточной камере к раствору йодида 2-13 (100 мг, 0,0962 ммоль, 1 экв.) и тиоэфира 2-14 (119 мг, 0,1246 ммоль, 1,3 экв.) в DMI (0,80 мл) и EtOAc (0,16 мл) при комнатной температуре добавляли DTBMP (79 мг, 0,385 ммоль, 4 экв.), Zn порошок (37,7 мг, 0,576 ммоль, 6 экв.), Cp2ZrCl2 (84,4 мг, 0,289 ммоль, 3 экв.) и NiBr2-dtbbpy (14,0 мг, 0,0288 ммоль, 30 мол. %). После перемешивания в течение 1,5 ч при той же температуре, реакционную смесь удаляли из перчаточной камеры и разбавляли EtOAc и нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество очищали на системе очистки YAMAZEN на нейтральном силикагеле (0%, 9%, затем 15% EtOAc в гексанах) с получением кетона S-7 (143,2 мг, 0,0818 ммоль, 85%) в виде белого аморфного твердого вещества. 2-S-8: [α]20D -59,4 (с 1,25, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 5,75 (1Н, дддд, J=17,3, 10,5, 5,1, 5,1 Гц), 5,21 (1Н, с), 5,15 (1Н, ддд, J=17,3, 1,8, 1,8 Гц), 5,12 (1Н, с), 4,97 (1Н, ддд, J=10,5, 1,8, 1,8 Гц), 4,94 (1Н, с), 4,85 (1Н, дд, J=7,2, 7,2 Гц), 4,81-4,79 (2Н, м), 4,67 (1Н, д, J=10,2 Гц), 4,54-4,50 (2Н, м), 4,37-4,36 (2Н, м), 4,32 (1Н, д, J=4,2 Гц), 4,26-4,23 (1Н, м), 4,17-4,14 (1Н, м), 4,11 (1Н, дд, J=6,6, 4,8 Гц), 4,06-3,99 (3Н, м), 3,93-3,88 (2Н, м), 3,84-3,74 (7Н, м), 3,70 (1Н, дд, J=13,2, 6,0 Гц), 3,44-3,43 (2Н, м), 3,33 (1Н, с), 3,19 (1Н, дд, J=17,6, 6,3 Гц), 3,16 (1Н, дд, J=17,6, 6,6 Гц), 3,11-3,02 (2Н, м), 2,77 (1Н, дд, J=10,8, 2,4 Гц), 2,57 (1Н, д, J=9,6 Гц), 2,49-2,44 (1Н, м), 2,40-2,23 (9Н, м), 2,18-2,02 (9Н, м), 1,96 (1Н, дд, J=13,8, 6,0 Гц), 1,86-1,66 (7Н, м), 1,61 (1Н, ддд, J=15,0, 4,8, 4,8 Гц), 1,55-1,47 (5Н, м), 1,36-1,32 (3Н, м), 1,19 (3Н, д, J=7,2 Гц), 1,15 (3Н, д, J=6,6 Гц), 1,11 (9Н, т, J=8,0 Гц), 1,10 (9Н, с), 1,09 (9Н, т, J=8,4 Гц), 1,07 (9Н, т, J=8,4 Гц), 1,04 (9Н, с), 1,01 (3Н, д, J=7,2 Гц), 0,96 (3Н, д, J=7,2 Гц), 0,77 (6Н, кв, J=7,8 Гц), 0,70-0,65 (12Н, м), 0,28 (6Н, с), 0,15 (6Н, с) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 206,8, 171,3, 152,9, 152,6, 134,6, 116,6, 116,2, 109,3, 104,9, 103,8, 97,0, 83,3, 81,5, 80,4, 78,4, 77,9, 77,6, 75,9, 75,4, 75,1, 75,0, 75,0, 74,9, 74,7, 74,1, 74,0, 73,8, 72,8, 72,0, 71,8, 71,5, 70,4, 69,9, 68,4, 68,3, 65,9, 64,6, 51,7, 46,8, 46,3, 43,9, 41,2, 39,4, 39,3, 38,5, 38,2, 37,8, 36,4, 35,9, 35,4, 35,3, 32,5, 31,1, 30,7, 30,6, 30,5, 28,5, 26,6, 26,3(×6), 26,3(×6), 18,7, 18,6, 18,5, 18,4, 18,1, 16,4, 7,4(×6), 7,4(×6), 7,3(×6), 6,0(×3), 5,7(×3), 5,3(×3), -4,0, -4,2, -5,1, -5,2 м.д. FTIR (пленка): 2953, 2928, 2876, 1732, 1461, 1410, 1372, 1253, 1079, 1034, 1006, 834, 740 см-1. HRMS (ESI) m/z: [М+Н]+ рассчит. для C93H162O21Si5Na, 1778,0347; обнаружено, 1778,0332.
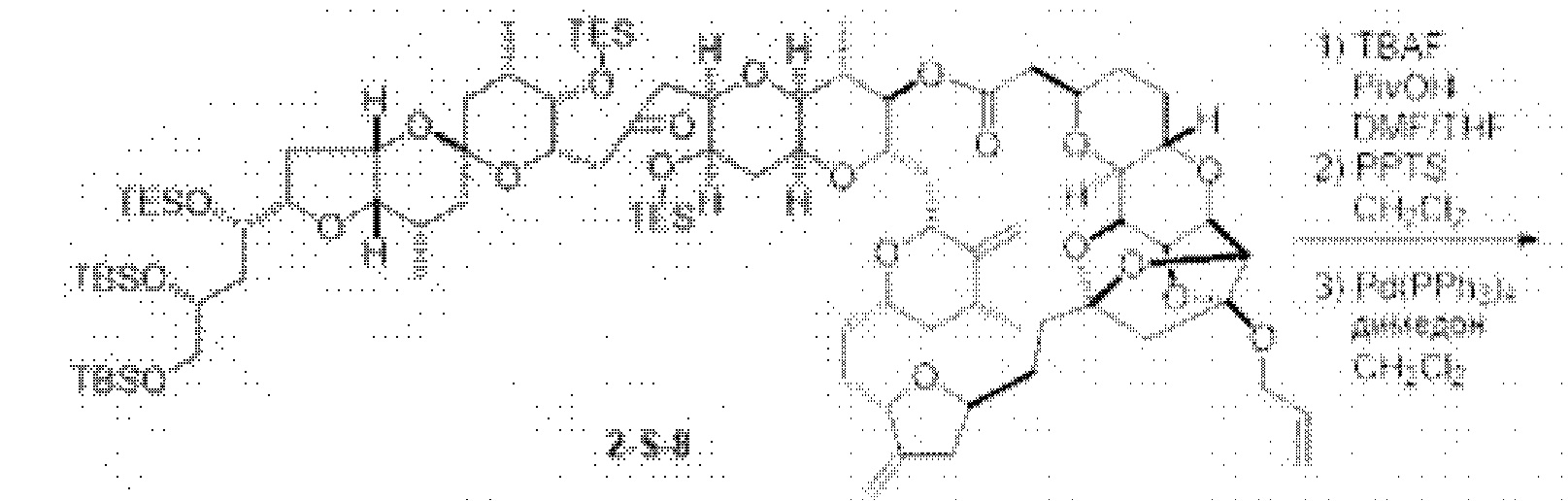
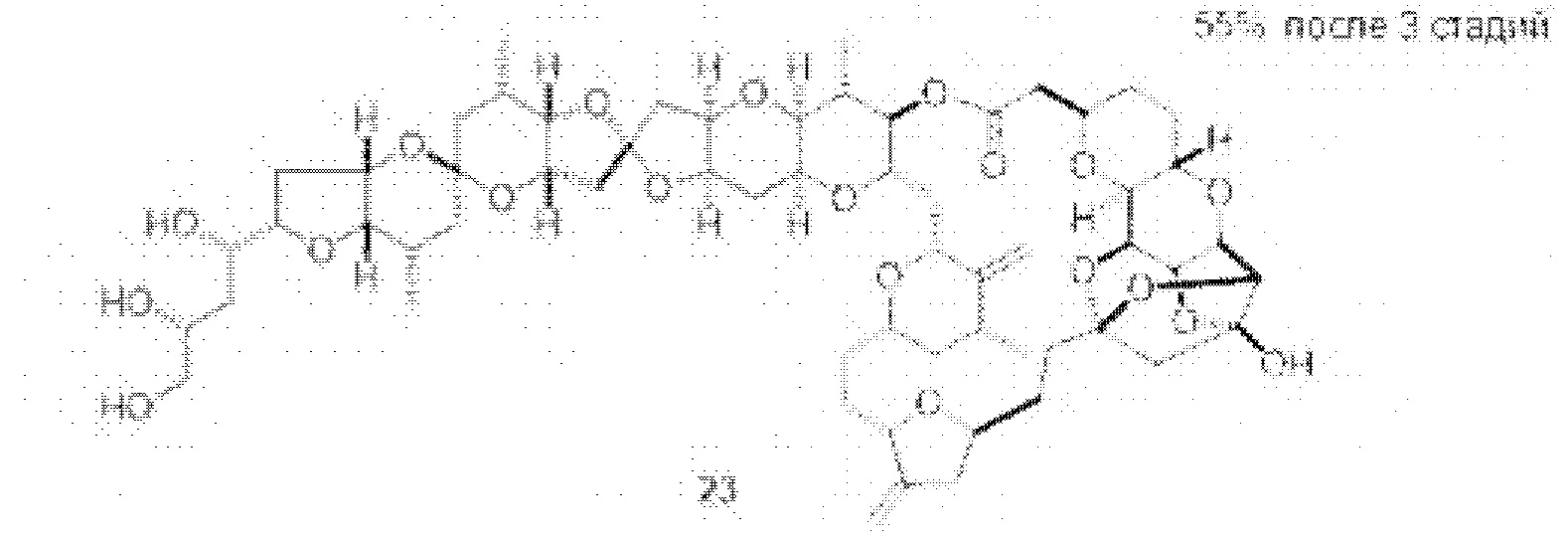
[00708] К перемешанному раствору 2-S-8 (141 мг, 0,0803 ммоль, 1 эквив.) в DMF (4,0 мл, 0,02 М) при комнатной температуре добавляли забуференный раствор TBAF (0,80 мл, 10 эквив., свеже получен из 1,60 мл раствора TBAF (1 M в THF) и 81,6 мг PivOH). После перемешивания в течение 3 ч при той же температуре, добавляли СаСО3 (3,0 г) и DOWEX 50WX8-400 (3,0 г), 1 После перемешивания в течение 2 ч при комнатной температуре, полученную смесь разбавляли EtOAc и фильтровали через слой Celite. Осадок на фильтре тщательно промывали EtOAc. Фильтрат концентрировали в условиях пониженного давления с получением неочищенного вещества, которое использовали на следующей стадии без дополнительной очистки. К перемешанному раствору полученного выше тетраола (по расчетам 0,0803 ммоль, 1 экв.) в CH2Cl2 (8 мл) при комнатной температуре добавляли PPTS (100 мг, 0,402 ммоль, 5 экв.). После перемешивания в течение 3 ч при той же температуре, реакционную смесь немедленно подвергали колоночной хроматографии на аминосиликагеле (CH2Cl2, затем 50%, 75%, затем 100% EtOAc в гексанах, затем 9% МеОН в EtOAc) с получением неочищенного спирокеталя, который использовали на следующей стадии без дополнительной очистки. К смеси полученного выше неочищенного спирокеталя (по расчетам 0,0803 ммоль, 1 экв.), димедона (22,5 мг, 0,160 ммоль, 2 эквив.) и Pd(PPh3)4 (9,3 мг, 0,00803 ммоль, 10 мол. %) при комнатной температуре добавляли дегазированный CH2Cl2 (8 мл). После перемешивания в течение 4 ч при той же температуре, полученный раствор немедленно подвергали колоночной хроматографии на аминосиликагеле (CH2Cl2, затем 50%, 100% EtOAc в гексанах, затем 9% МеОН в EtOAc) с получением неочищенного галихондрин С и его С-38-эпимера. Смесь очищали на системе очистки YAMAZEN с ODS-колонкой (Rf градиент: от 10% MeCN в H2O до 100% MeCN) с получением галихондрина С (23) (48,1 мг, 0,0427 ммоль, 55% после 3 стадий) в виде белого кристаллического вещества и 38-эпи-галихондрина С (С38-эпи-23) (9,5 мг, 0,00843 ммоль, 11% после 3 стадий) в виде бесцветного твердого вещества. Галихондрин С (23): [α]20D -66,8 (с 0,25, МеОН). 1Н-ЯМР (600 МГц, CD3OD) δ: 5,07 (1Н, с), 5,01 (1Н, с), 4,88 (1Н, с), 4,81 (1Н, с), 4,62 (1Н, дд, J=7,2, 4,4 Гц), 4,43 (1Н, д, J=11,2 Гц), 4,42-4,38 (1Н, м), 4,34-4,27 (3Н, м), 4,24 (1Н, ддд, J=11,2, 4,4, 2,0 Гц), 4,17 (1Н, дд, J=3,8, 1,0 Гц), 4,14-4,06 (4Н, м), 4,05 (1Н, ддд, J=2,0, 2,0, 2,0 Гц), 3,99 (1Н, ддд, J=9,4, 4,3, 4,3 Гц), 3,92-3,82 (3Н, м), 3,77 (1Н, ддд, J=8,4, 4,4, 4,2 Гц), 3,74-3,66 (2Н, м), 3,61 (1Н, д, J=11,2 Гц), 3,58-3,55 (1Н, м), 3,53 (1Н, дд, J=11,2, 4,4 Гц), 3,46 (1Н, дд, J=11,2, 6,4 Гц), 3,22 (1Н, дд, J=6,4, 4,8 Гц), 2,94 (1Н, дд, J=9,8, 2,0 Гц), 2,84-2,75 (1Н, м), 2,55 (1Н, дд, J=17,6, 9,2 Гц), 2,45 (1Н, дд, J=17,6, 2,4 Гц), 2,39 (1Н, дд, J=13,2, 6,3 Гц), 2,36-2,21 (9Н, м), 2,20-2,02 (5Н, м), 2,01-1,94 (2Н, м), 1,89-1,78 (3Н, м), 1,78-1,56 (6Н, м), 1,56-1,20 (11Н, м), 1,10 (3Н, д, J=6,3 Гц), 1,06 (3Н, д, J=6,8 Гц), 1,05-0,99 (1Н, м), 1,02 (3Н, д, J=7,2 Гц), 0,97 (3Н, д, J=6,8 Гц). 13С-ЯМР (125 МГц, CD3OD) δ: 172,8, 153,3, 153,1, 114,8, 114,2, 110,4, 105,7, 104,7, 98,4, 86,2, 81,3, 81,2, 80,8, 79,0, 78,0, 78,0, 77,4, 77,2, 76,4, 76,3, 76,1, 75,8, 75,3, 75,0, 74,9, 74,7, 73,8, 73,3, 73,1, 73,0, 71,6, 69,5, 67,2, 65,7, 53,7, 45,5, 44,9, 44,9, 41,2, 39,7, 38,0, 37,9, 37,8, 37,5, 37,5, 37,2, 36,3, 36,2, 33,0, 31,8, 31,2, 31,0, 30,8, 29,0, 27,1, 27,0, 18,4, 18,3, 18,1, 15,8. FTIR (пленка): 3422, 2926, 2873, 1736, 1436, 1310, 1186, 1117, 1074, 1021, 995, 910, 755 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C60H86O20Na, 1149,5605; обнаружено, 1149,5614.
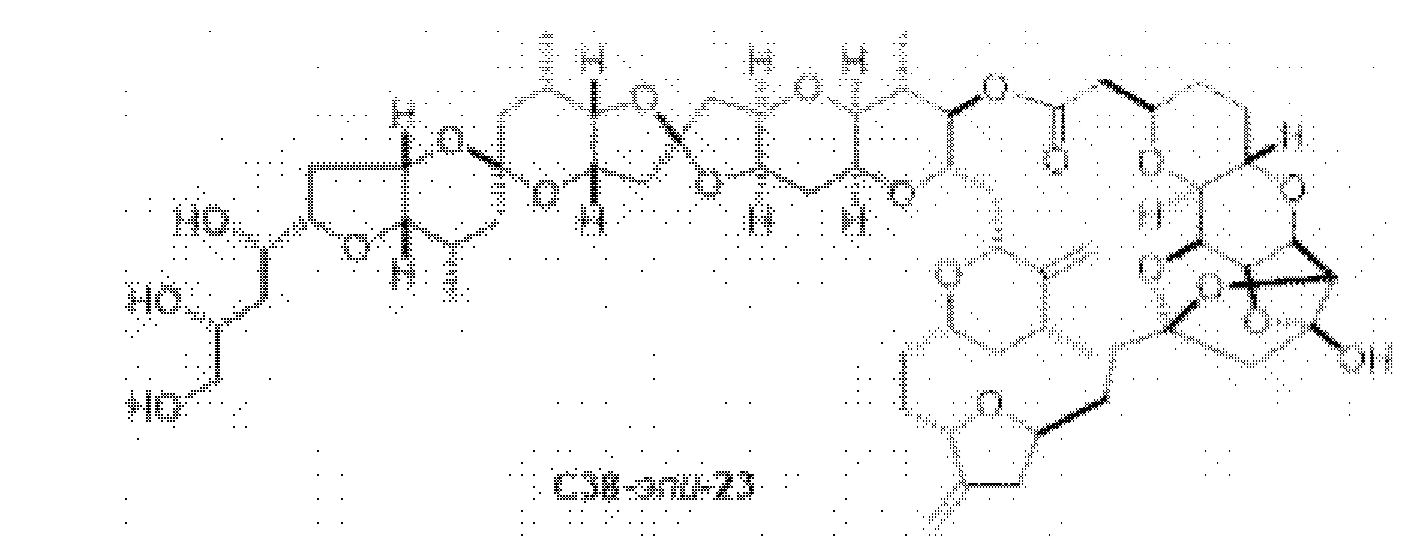
[00709] 38-эпи-Галихондрин С (С38-эпи-23): [α]20D -69,6 (с 0,46, МеОН). 1Н-ЯМР (600 МГц, CD3OD) δ: 5,03 (1Н, с), 4,95 (1Н, с), 4,87 (1Н, с), 4,81 (1Н, с), 4,72 (1Н, дд, J=10,2, 6,6 Гц), 4,41 (1Н, д, J=11,4 Гц), 4,38-4,32 (2Н, м), 4,32-4,28 (2Н, м), 4,17-4,06 (6Н, м), 3,99 (1Н, ддд, J=9,6, 5,4, 4,2 Гц), 3,90-3,83 (4Н, м), 3,78 (1Н, ддд, J=14,4 4,8, 4,2 Гц), 3,63-3,56 (3Н, м), 3,53 (1Н, дд, J=11,6, 4,5 Гц), 3,47 (1Н, дд, J=10,8, 6,0 Гц), 3,17 (1Н, дд, J=9,0, 6,0 Гц), 2,95 (1Н, дд, 3=9,6,1,8 Гц), 2,86-2,80 (1Н, м), 2,54 (1Н, дд, J=16,8, 8,4 Гц), 2,47 (1Н, дд, J=16,8, 2,4 Гц), 2,34-2,08 (12Н, м), 2,12-2,07 (3Н, м), 2,04-1,96 (4Н, м), 1,88-1,81 (2Н, м), 1,79-1,29 (15Н, м), 1,10 (3Н, д, J=6,0 Гц), 1,04 (3Н, д, J=8,4 Гц), 1,05-0,99 (1Н, м), 1,02 (3Н, д, J=6,6 Гц), 1,00 (3Н, д, J=6,6 Гц) м.д. 13С-ЯМР (125 МГц, CD3OD) δ: 172,9, 153,3, 152,8, 115,6, 114,2, 110,5, 105,1, 104,7, 98,3, 86,2, 81,3, 81,1, 80,0, 79,2, 78,9, 78,9, 78,4, 77,9, 76,6, 76,4, 76,1, 76,0, 75,9, 75,2, 74,9, 74,8, 73,6, 73,3, 73,2, 73,1, 71,7, 69,4, 68,3, 67,2, 53,7, 45,6, 44,9, 44,7, 41,2, 39,6, 38,3, 38,3, 38,1, 37,5, 37,5, 37,2, 36,2, 36,0, 33,3, 31,7, 31,2, 30,9, 30,2, 28,9, 27,1, 26,8, 18,4, 18,3, 18,3, 15,2. м.д. FTIR (пленка): 3427, 2925, 2872, 1736, 1662, 1553, 1436, 1311, 1188, 1117, 1075, 1023, 996, 898, 735 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C60H86C20Na, 1149,5605; обнаружено, 1149,5618.
Норгалихондрин С (24)
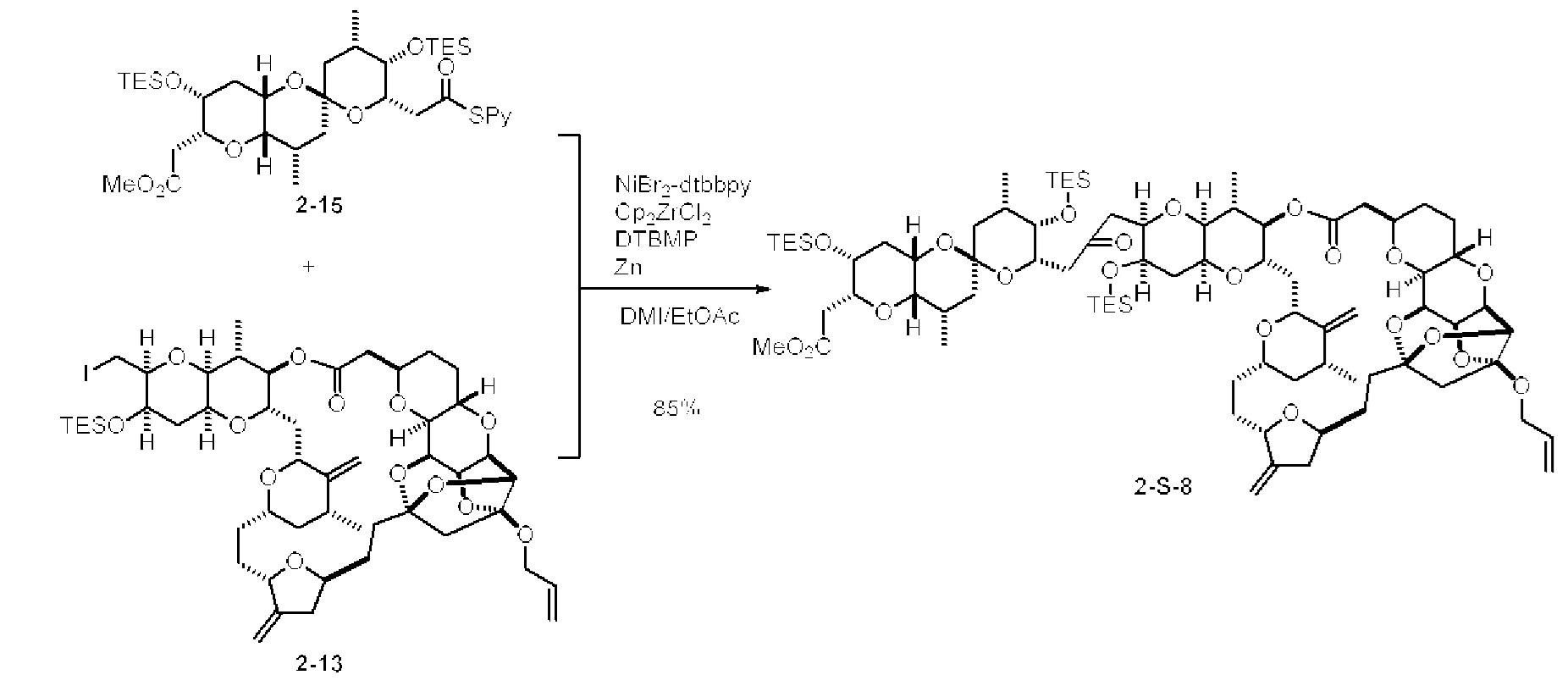
[00710] В перчаточной камере к раствору йодида 2-13 (50 мг, 0,0482 ммоль, 1 экв.) и тиоэфира 2-15 (45,4 мг, 0,0627 ммоль, 1,3 экв.) в DMI (0,4 мл) и EtOAc (0,08 мл) при комнатной температуре добавляли DTBMP (39,5 мг, 0,193 ммоль, 4 экв.), Zn порошок (18,8 мг, 0,289 ммоль, 6 экв.), Cp2ZrCl2 (42,2 мг, 0,144 ммоль, 3 экв.) и NiBr2-dtbbpy (7,0 мг, 0,0144 ммоль, 30 мол. %). После перемешивания в течение 1,5 ч при той же температуре, реакционную смесь удаляли из перчаточной камеры и разбавляли Et2O и нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой Et2O. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (0%, 15%, 25% EtOAc в гексанах) с получением кетона 2-S-8 (62,4 мг, 0,0409 ммоль, 85%) в виде бесцветного аморфного твердого вещества. (S-8): [α]20D -64,8 (с 1,00, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 5,75 (1Н, дддд, J=17,3, 10,5, 5,1, 5,1 Гц), 5,21 (1Н, с), 5,15 (1Н, ддд, J=17,3, 1,8, 1,8 Гц), 5,11 (1Н, с), 4,97 (1Н, ддд, J=10,5, 1,8, 1,8 Гц), 4,94 (1Н, с), 4,87-4,82 (1Н, м), 4,82-4,77 (2Н, м), 4,67 (1Н, д, J=10,8 Гц), 4,52 (1Н, ддд, J=10,2, 10,2, 4,8 Гц), 4,38-4,33 (2Н, м), 4,32 (1Н, J=4,6 Гц), 4,11 (1Н, дд, J=6,9, 5,1 Гц), 4,07-3,97 (4Н, м), 3,84-3,78 (4Н, м), 3,77-3,68 (3Н, м), 3,58 (1Н, д, J=1,2 Гц), 3,43 (1Н, ддд, J=4,5, 4,5, 4,5 Гц), 3,37 (4Н, с), 3,36 (1Н, с), 3,21-3,11 (3Н, м), 2,86-2,81 (1Н, м), 2,80-2,74 (2Н, м), 2,59-2,54 (2Н, м), 2,42-2,35 (3Н, м), 2,34-2,22 (8Н, м), 2,20-2,04 (7Н, м), 1,97 (1Н, дд, J=13,8, 13,5 Гц,), 1,87-1,80 (1Н, м), 1,78-1,63 (4Н, м), 1,62-1,44 (7Н, м), 1,38-1,30 (2Н, м), 1,19 (3Н, д, J=7,2 Гц), 1,13-1,02 (31Н, м), 1,01 (3Н, д, J=7,2 Гц), 0,99 (3Н, д, J=7,2 Гц), 0,71-0,60 (18Н, м) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 206,9, 171,8, 171,3, 152,9, 152,6, 134,6, 116,6, 116,2, 109,3, 105,0, 103,8, 96,9, 83,3, 78,3, 77,9, 77,7, 77,2, 76,5, 76,0, 75,4, 75,1, 75,0, 74,9, 74,6, 74,1, 74,0, 73,8, 73,0, 70,4, 69,6, 68,4, 66,0, 65,9, 64,6, 64,5 51,7, 50,9, 46,8, 46,3, 43,9, 41,2, 39,5, 39,3, 38,6, 37,7, 37,2, 36,4, 36,3, 35,9, 35,4, 32,5, 31,1, 31,0, 30,7, 30,5, 29,2, 28,5, 18,6, 18,2, 17,3, 16,5, 7,5, 7,3, 7,2, 6,0, 5,4, 5,3 м.д. FTIR (пленка): 2953, 2913, 2876, 1737, 1458, 1372, 1337, 1312, 1280, 1208, 1186, 1155, 1119, 1085, 1072, 1035, 1012, 823, 736 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C81H132O21Si3Na, 1547,8467; обнаружено, 1547,8524.
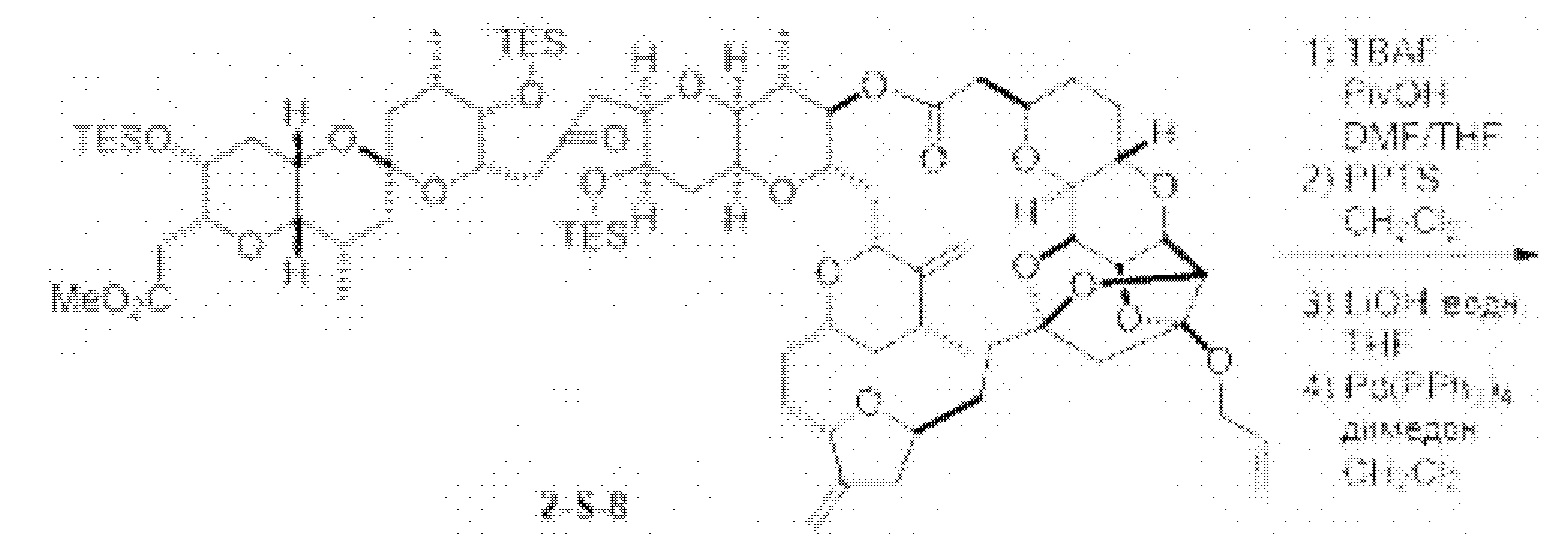
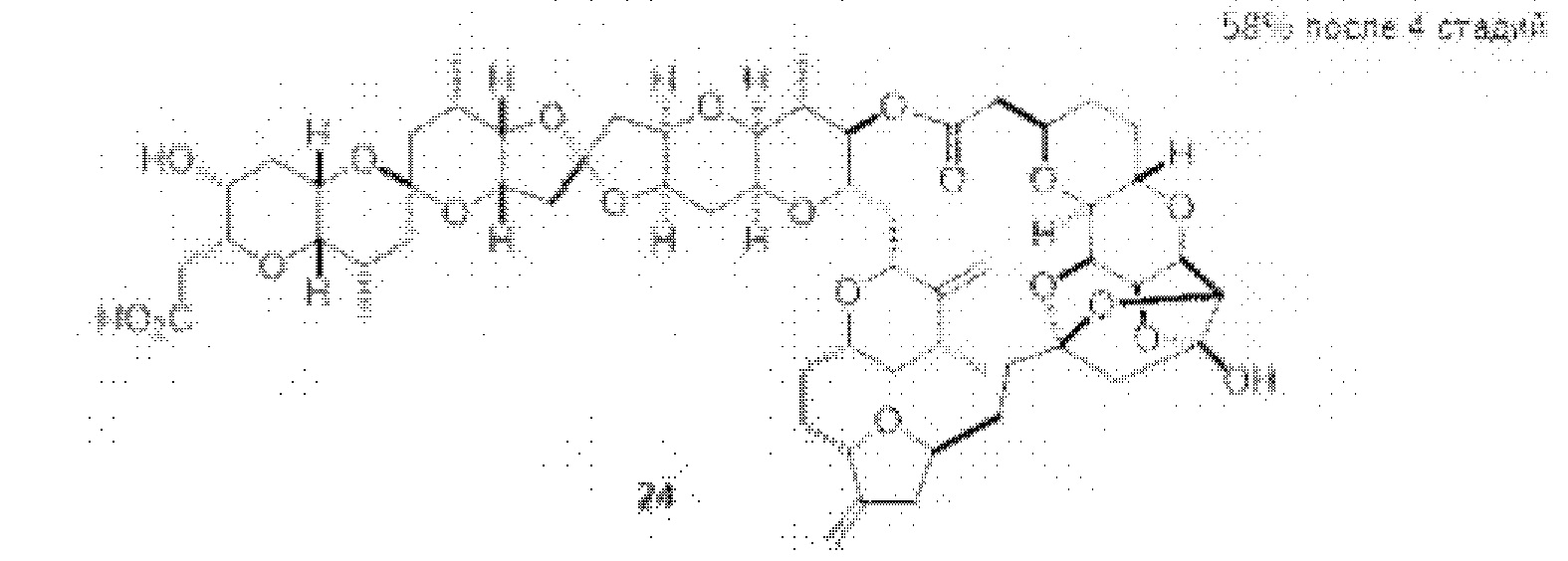
[00711] Забуференный раствор TBAF получали путем смешивания раствора TBAF (TCI #Т1125; 0,33 мл, 1 М в THF, 0,33 ммоль, 10 экв.) и PivOH (16,7 мг, 0,164 ммоль, 5 экв.). К перемешанному раствору кетона 2-S-8 (50 мг, 0,0328 ммоль, 1 экв.) в DMF (2,0 мл) при комнатной температуре добавляли забуференный раствор TBAF. После перемешивания в течение 6 ч при той же температуре, после разбавления 5 мл EtOAc добавляли СаСО3 (1,0 г) и DOWEX 50WX8-400 (1,0 г). После перемешивания в течение 1 ч при комнатной температуре, полученную смесь разбавляли EtOAc и фильтровали через слой Celite. Осадок на фильтре тщательно промывали EtOAc. Фильтрат концентрировали в условиях пониженного давления с получением неочищенного тетраола, который использовали на следующей стадии без дополнительной очистки. К перемешанному раствору неочищенного тетраола (по расчетам 0,0328 ммоль, 1 экв.) в CH2Cl2 (8,5 мл) при комнатной температуре добавляли PPTS (33,1 мг, 0,132 ммоль, 4 экв.). Спустя 1 ч, анализ методом TLC указывал на исчезновение исходного вещества. Реакционную смесь немедленно подвергали колоночной хроматографии на аминосиликагеле (CH2Cl2, затем 25%, 50%, 75%, затем 100% EtOAc в гексанах, затем 2% МеОН в EtOAc) с получением неочищенного аллил-замещенного сложного метилового эфира норгалихондрина С и его С38-эпимера. Соединение использовали на следующей стадии после концентрирования без дополнительной очистки. К перемешанному раствору неочищенного сложного метилового эфира (по расчетам 0,0328 ммоль, 1 экв.) в THF (5 мл) при комнатной температуре добавляли 1,3 мл aqueous 1 М LiOH. После перемешивания в течение 1,5 ч при той же температуре, реакционную смесь разбавляли 3 мл воды. Затем, из смеси на испарителе удаляли THF. После охлаждения реакционной смеси до 0°С, немедленно добавляли 1,5 мл, 1 М водного HCl, а затем 10 мл водного буферного раствора (рН 7). Полученную смесь экстрагировали EtOAc. Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученную смесь переносили на следующую стадию без дополнительной очистки. К смеси полученной неочищенной кислоты (по расчетам 0,0328 ммоль, 1 экв.), димедона (9,2 мг, 0,0656 ммоль, 2 экв.) и Pd(PPh3)4 (5,7 мг, 0,00492 ммоль, 15 мол. %) при комнатной температуре добавляли CH2Cl2 (4,0 мл). После перемешивания в течение 3 ч при той же температуре, полученный раствор разбавляли DMF (3 мл). После удаления DCM на испарителе, смесь очищали на системе очистки YAMAZEN с ODS-колонкой (Rf градиент: от 10% MeCN в H2O до 100% MeCN) с получением норгалихондрина С (24) (21,0 мг, 0,019 ммоль, 58% после 4 стадий) в виде бесцветного твердого вещества. 38-эпи-Гомогалихондрин С (С38-эпи-24) разлагался в процессе концентрирования с неразделяемым остатком реагента после ODS-колонки. Норгалихондрин С (24): [α]20D -61,2 (с 0,300, МеОН) 1Н-ЯМР (600 МГц, CD3OD) δ: 5,06 (1Н, с), 5,01 (1Н, с), 4,88 (1Н, с), 4,81 (1Н, с), 4,62 (1Н, дд, J=7,2, 4,8 Гц), 4,43 (1Н, д, J=10,8 Гц), 4,42-4,39 (1Н, м), 4,34-4,27 (3Н, м), 4,24 (1Н, ддд, J=11,2, 4,2, 1,8 Гц), 4,17 (1Н, дд, J=4,2 Гц), 4,11 (2Н, ушир. с), 4,09-4,05 (1Н, м), 3,98 (1Н, ушир. с), 3,91-3,85 (2Н, м), 3,82-3,76 (2Н, м), 3,73-3,67 (2Н, м), 3,62-3,57 (2Н, м), 3,53 (1Н, с), 3,31 (1Н, м), 3,21 (1Н, дд, J=6,6, 4,7 Гц), 2,94 (1Н, д, J=9,6 Гц), 2,81 (1Н, дд, J=15,0, 6,6 Гц), 2,55 (1Н, дд, J=16,2, 9,6 Гц), 2,52-2,48 (2Н, ушир. с), 2,45 (1Н, д, J=17,6), 2,39 (1Н, дд, J=13,2, 6,2 Гц), 2,33 (2Н, ушир. с), 2,31-2,23 (5Н, м), 2,19-1,99 (6Н, м), 1,99-1,94 (2Н, м), 1,92 (1Н, д, J=13,2 Гц), 1,90-1,79 (2Н, м), 1,76-1,63 (3Н, м), 1,54-1,46 (4Н, м), 1,46-1,26 (7Н, м), 1,10 (3Н, д, J=6,0 Гц), 1,06 (3Н, д, J=6,6 Гц), 1,02 (1Н, д, J=12,0 Гц), 0,98 (3Н, д, J=7,2 Гц), 0,96 (3Н, д, J=7,2 Гц). 13С-ЯМР (150 МГц, CD3OD) δ: 172,8 (2С), 153,3, 153,2, 114,8, 114,2, 110,4, 105,7, 104,8, 98,5, 86,2, 80,7, 80,6, 79,1, 79,0, 78,0 (2С), 77,2 (2С), 76,3 (2С), 76,0, 75,8, 75,3, 75,0, 74,9, 74,7, 73,8, 73,7, 72,7 (2С), 69,5, 68,1, 68,0, 65,7, 53,6, 45,5, 44,9, 41,1, 39,7, 38,2, 38,1, 37,8, 37,5, 37,1, 36,7, 35,7, 33,0, 31,8, 31,2, 32,0, 30,8, 30,0, 29,0, 27,3, 18,4, 18,1, 17,4, 15,8. FTIR (пленка): 3480, 2953, 2932, 2923, 1733, 1317, 1189, 1119, 1073, 1011, 995, 964, 914, 555 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C59H82O20Na, 1113,5297; обнаружено, 1133,5248.
Гомогалихондрин С (25)
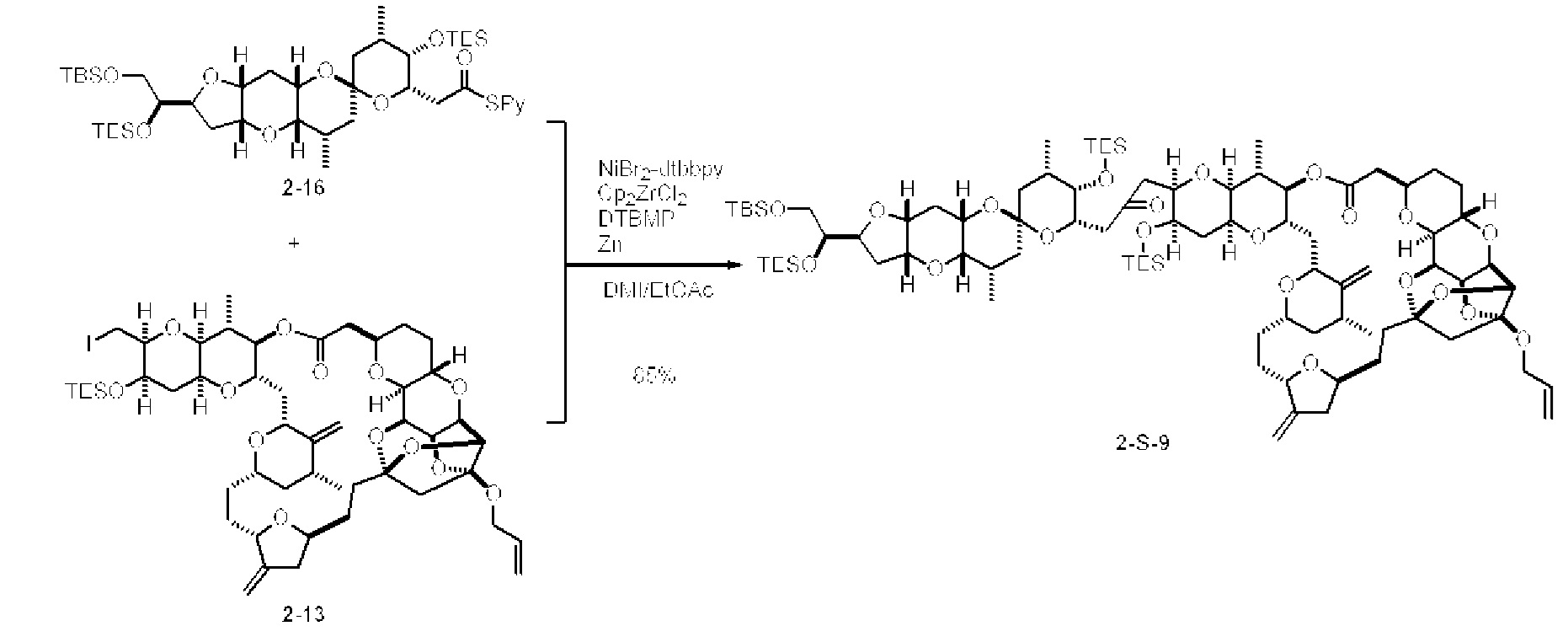
[00712] В перчаточной камере к раствору йодида 2-13 (52,1 мг, 0,0501 ммоль, 1 экв.) и тиоэфира 2-16 (55,5 мг, 0,0651 ммоль, 1,3 экв.) в DMI (0,40 мл) и EtOAc (80 мкл) при комнатной температуре добавляли DTBMP (39,5 мг, 0,192 ммоль, 4 экв.), Zn порошок (18,9 мг, 0,289 ммоль, 6 экв.), Cp2ZrCl2 (42,2 мг, 0,144 ммоль, 3 экв.) и NiBr2-dtbbpy (7,0 мг, 0,0144 ммоль, 30 мол. %). После перемешивания в течение 4 ч при той же температуре, реакционную смесь удаляли из перчаточной камеры и разбавляли Et2O и нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой Et2O. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (0%, 9%, 13%, затем 17% EtOAc в гексанах) с получением кетона 2-S-9 (70,5 мг, 0,0426 ммоль, 85%) в виде бесцветного аморфного твердого вещества. 2-S-9: [α]20D -64,0 (с 0,800, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 5,75 (1Н, дддд, J=17,3, 10,5, 5,1, 5,1 Гц), 5,21 (1Н, с), 5,15 (1Н, ддд, J=17,3, 1,8, 1,8 Гц), 5,12 (1Н, с), 4,97 (1Н, ддд, J=10,5, 1,8, 1,8 Гц), 4,94 (1Н, с), 4,86-4,79 (3Н, м), 4,67 (1Н, д, J=10,8 Гц), 4,52 (1Н, ддд, J=10,2, 10,2, 4,8 Гц), 4,48 (1Н, ддд, J=10,2, 5,4, 5,4 Гц), 4,37 (1Н, дд, J=3,9, 3,0 Гц), 4,35 (1Н, дд, J=10,2, 1,8 Гц), 4,32 (1Н, д, J=3,6 Гц), 4,11 (1Н, дд, J=6,9, 5,1 Гц), 4,06-3,98 (4Н, м), 3,84-3,79 (5Н, м), 3,78-3,75 (2Н, м), 3,73-3,67 (4Н, м), 3,45 (1Н, ддд, J=4,5, 4,5, 4,5 Гц), 3,28 (1Н, с), 3,21-3,16 (2Н, м), 3,07 (1Н, дд, J=17,6, 6,3 Гц), 3,01 (1Н, дд, J=17,6, 6,6 Гц), 2,93 (1Н, д, J=2,4 Гц), 2,80-2,76 (2Н, м), 2,57 (1Н, дд, J=9,9, 2,1 Гц), 2,47 (1Н, д, J=16,2 Гц), 2,40-2,23 (9Н, м), 2,23-2,05 (6Н, м), 1,98 (1Н, дддд, J=14,1, 11,7, 4,0, 4,0 Гц), 1,89-1,82 (2Н, м), 1,77-1,68 (4Н, м), 1,61 (1Н, ддд, J=14,4, 4,8, 4,8 Гц), 1,58 (1Н, дд, J=12,9, 3,9 Гц), 1,55-1,47 (5Н, м), 1,36-1,32 (3Н, м), 1,19 (3Н, д, J=7,8 Гц), 1,11 (9Н, т, J=8,0 Гц), 1,09 (3Н, д, J=6,6 Гц), 1,07 (9Н, т, J=8,4 Гц), 1,05 (9Н, т, J=8,4 Гц), 1,02-1,01 (12Н, м), 0,96 (3Н, д, J=7,2 Гц), 0,77 (6Н, кв, J=7,8 Гц), 0,69-0,65 (12Н, м), 0,14 (3Н, с), 0,13 (3Н, с) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 206,8, 171,3, 153,0, 152,6, 134,6, 116,6, 116,2, 109,3, 104,39, 103,8, 96,9, 83,3, 79,1, 78,4, 78,0, 77,9, 77,7, 76,8, 76,0, 75,5, 75,1, 75,0, 74,9, 74,7, 74,22, 74,16, 74,1, 73,8, 73,6, 73,0, 70,4, 69,4, 68,4, 66,2, 65,9, 64,6, 63,8, 51,7, 46,8, 46,3, 43,9, 41,2, 39,5, 39,3, 38,6, 37,7, 37,6, 36,5, 36,4, 35,9, 35,3, 32,5, 31,6, 31,1, 30,72, 30,67, 30,5, 29,6, 28,6, 26,2, 18,7, 18,6, 18,1, 17,6, 16,4, 7,5, 7,4, 7,3, 6,0, 5,7, 5,3, -5,1, -5,3 м.д. FTIR (пленка): 2953, 2928, 2875, 1730, 1554, 1459, 1372, 1310, 1238, 1185, 1155, 1077, 1034, 1012, 834, 740 см-1. HRMS (ESI) m/z: [М+Н]+ рассчит. для C88H149O21Si4, 1653,9663; обнаружено, 1653,9702.
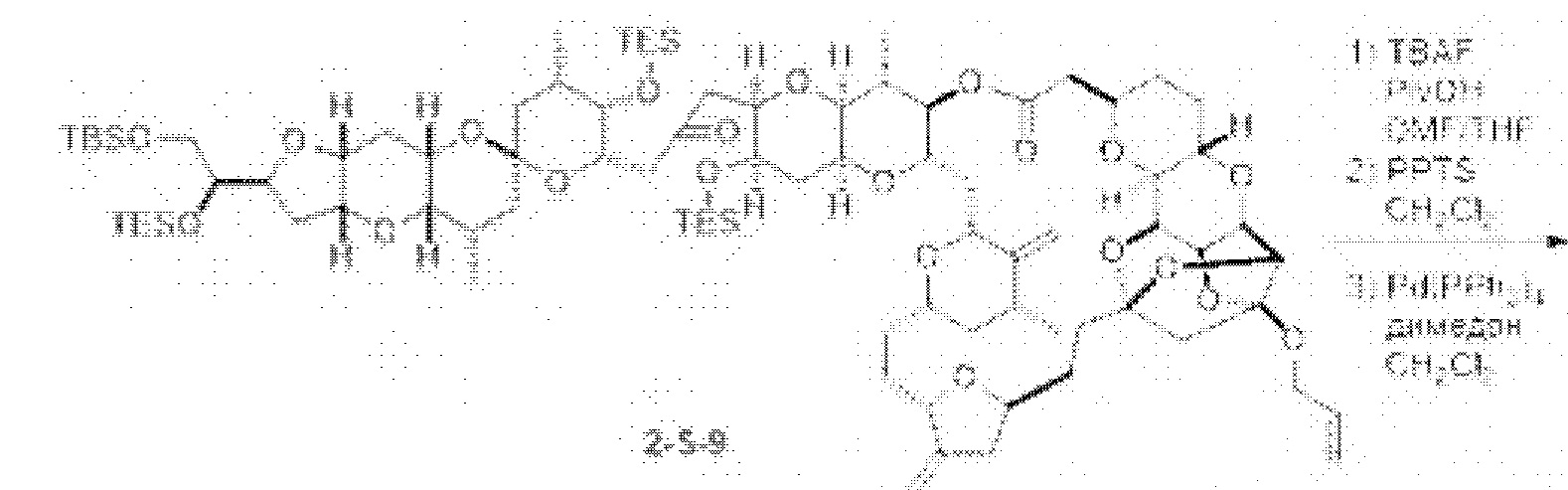
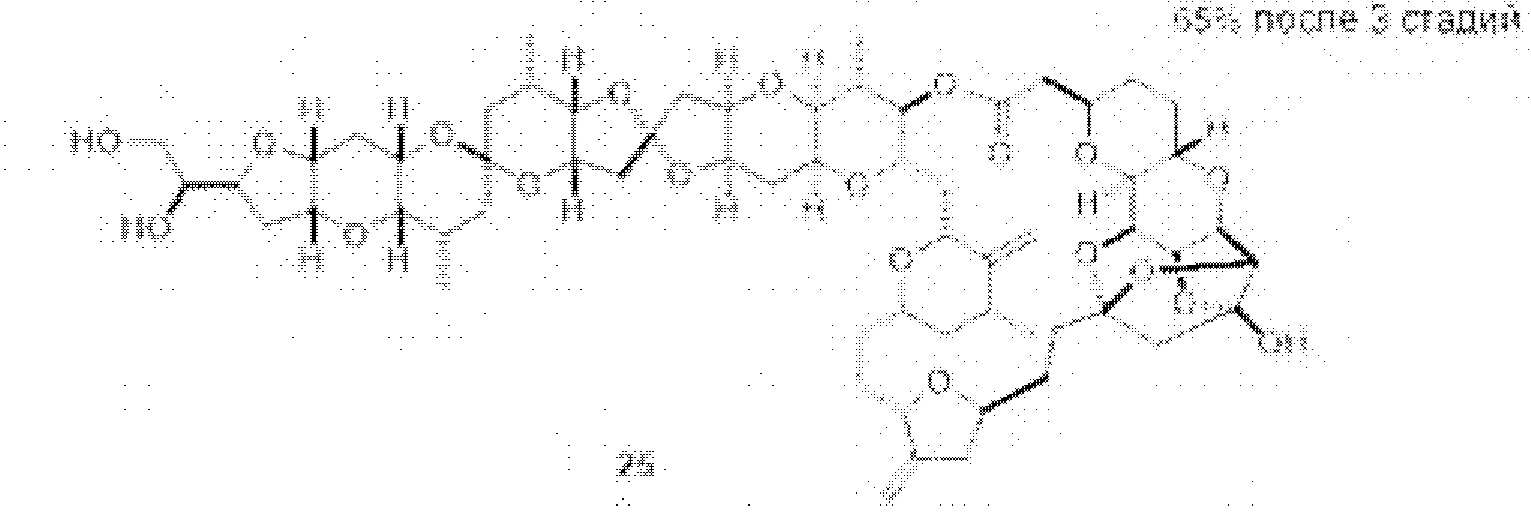
[00713] Забуференный раствор TBAF получали путем смешивания раствора TBAF (TCI #Т1125; 0,43 мл, 1 М в THF, 0,43 ммоль, 10 экв.) и PivOH (22,0 мг, 0,215 ммоль, 5 экв.). К перемешанному раствору кетона 2-S-9 (70,5 мг, 0,0426 ммоль) в DMF (2,1 мл) при комнатной температуре добавляли забуференный раствор TBAF. После перемешивания в течение 8 ч при той же температуре, добавляли СаСО3 (1,5 г) и DOWEX 50WX8-400 (1,5 г). После перемешивания в течение 1 ч при той же температуре, полученную смесь разбавляли EtOAc и фильтровали через слой Celite. Осадок на фильтре тщательно промывали EtOAc. Фильтрат концентрировали в условиях пониженного давления с получением неочищенного тетраола, который использовали на следующей стадии без дополнительной очистки. К перемешанному раствору полученного выше (по расчетам 0,0426 ммоль, 1 экв.) в CH2Cl2 (4,3 мл) при комнатной температуре добавляли PPTS (53,5 мг, 0,213 ммоль, 5 экв.). После перемешивания в течение 1 ч при той же температуре, реакционную смесь немедленно подвергали колоночной хроматографии на аминосиликагеле (CH2Cl2, затем 25%, 50%, 75%, затем 100% EtOAc в гексанах, затем 2% МеОН в EtOAc) с получением неочищенного спирокеталя, который использовали на следующей стадии без дополнительной очистки.
К смеси полученного выше неочищенного спирокеталя (по расчетам 0,0426 ммоль, 1 экв.), димедона (11,9 мг, 0,0849 ммоль, 2 экв.) и Pd(PPh3)4 (4,9 мг, 0,00424 ммоль, 10 мол. %) при комнатной температуре добавляли CH2Cl2 (4,3 мл). После перемешивания в течение 8 ч при той же температуре, полученный раствор немедленно подвергали колоночной хроматографии на аминосиликагеле (CH2Cl2, затем 25%, 50%, 77%, затем 100% EtOAc в гексанах, затем 3% МеОН в EtOAc) с получением неочищенного гомогалихондрина С и его С-38-эпимера. Смесь очищали на системе очистки YAMAZEN с ODS-колонкой (Rf градиент: от 10% MeCN в H2O до 100% MeCN) с получением гомогалихондрина С (25) (31,7 мг, 0,0278 ммоль, 65% после 3 стадий) в виде бесцветного твердого вещества и 38-эпи-гомогалихондрина С (С38-эпи-25) (5,1 мг, 0,00448 ммоль, 11% после 3 стадий) в виде бесцветного твердого вещества. Гомогалихондрин С (25): [α]20D -57,9 (с 0,53, CH2Cl2). 1Н-ЯМР (600 МГц, CD3OD) δ: 5,06 (1Н, д, J=1,8 Гц), 5,01 (1Н, с), 4,88 (1Н, с), 4,81 (1Н, д, J=1,2 Гц), 4,63 (1Н, дд, J=7,8, 4,8 Гц), 4,43 (1Н, д, J=9,6 Гц), 4,40 (1Н, с), 4,34-4,28 (3Н, м), 4,25-4,22 (2Н, м), 4,17 (1Н, д, J=4,2 Гц), 4,13-4,09 (2Н, м), 4,07 (1Н, дд, J=7,8, 7,8 Гц), 4,02 (1Н, с), 3,95 (1Н, с), 3,90-3,86 (3Н, м), 3,70 (1Н, дд, J=10,5, 10,5 Гц), 3,66 (1Н, дд, J=2,7, 2,7 Гц), 3,60 (1Н, д, J=11,4 Гц), 3,59-3,57 (3Н, м), 3,50 (1Н, дд, J=10,5, 5,1 Гц), 3,21 (1Н, дд, J=7,2, 4,8 Гц), 3,12 (1Н, д, J=2,4 Гц), 2,95 (1Н, д, J=10,2, 1,8 Гц), 2,82-2,79 (1Н, м), 2,55 (1Н, дд, J=17,9, 9,3 Гц), 2,45 (1Н, дд, J=17,9, 2,4 Гц), 2,39 (1Н, дд, J=13,2, 6,0 Гц), 2,37-2,24 (8Н, м), 2,20-1,96 (1H, м), 1,90 (1Н, ддд, J=15,6, 4,8, 4,8 Гц), 1,84-1,80 (2Н, м), 1,74 (1Н, с), 1,72 (1Н, с), 1,68-1,64 (2Н, м), 1,51-1,29 (9Н, м), 1,10 (3Н, д, J=6,0 Гц), 1,05 (3Н, д, J=7,2 Гц), 1,04-0,99 (1Н, м), 0,95 (3Н, д, J=7,2 Гц), 0,94 (3Н, д, J=6,6 Гц) м.д. 13С-ЯМР (125 МГц, CDCl3) δ: 171,2, 151,7, 151,4, 113,2, 112,4, 109,3, 104,5, 104,2, 96,6, 84,4, 79,8, 79,4, 77,6, 77,1, 76,3, 76,2, 75,3, 75,1, 74,8, 74,7, 74,4, 73,8, 73,7, 73,5, 72,8, 72,0, 71,2, 70,8, 68,1, 66,1, 65,3, 63,6, 52,4, 43,4, 42,5, 40,4, 38,7, 37,2, 36,94, 36,89, 36,8, 36,5, 36,0, 34,9, 32,0, 31,3, 30,6, 30,0, 29,4, 29,0, 28,9, 27,7, 25,8, 18,0, 17,7, 17,1, 15,0 м.д. FTIR (пленка): 3422, 2926, 2873, 1736, 1436, 1310, 1186, 1117, 1074, 1021, 995, 910, 755 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C61H86O20Na, 1161,5605; обнаружено, 1161,5587.
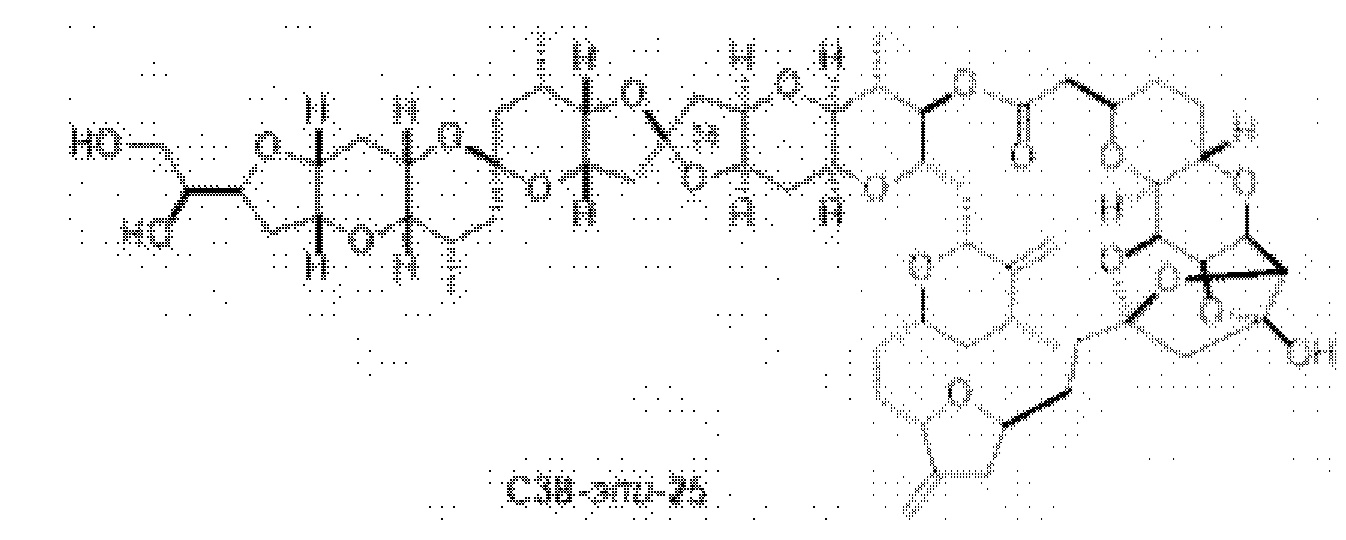
[00714] 38-эпи-гомогалихондрин С (С38-эпи-25): [α]20D -88,2 (с 0,34, CH2Cl2). 1Н-ЯМР (600 МГц, CD3OD) δ: 5,04 (1Н, д, J=1,8 Гц), 4,95 (1Н, д, J=2,4 Гц), 4,87 (1Н, с), 4,81 (1Н, с), 4,72 (1Н, дд, J=10,2, 6,6 Гц), 4,42 (1Н, д, J=10,8 Гц), 4,38 (1Н, с), 4,36 (1Н, ддд, J=10,4, 10,4, 4,5 Гц), 4,32-4,28 (2Н, м), 4,23 (1Н, ддд, J=10,1, 5,9, 4,2 Гц), 4,17-4,09 (4Н, м), 4,08-4,05 (1Н, м), 4,03 (1Н, с), 3,98 (1Н, дд, J=4,8, 1,8 Гц), 3,89-3,84 (3Н, м), 3,81 (1Н, дд, J=2,4, 2,4 Гц), 3,63-3,56 (4Н, м), 3,54 (1Н, д, J=3,0 Гц), 3,50 (1Н, дд, J=10,2, 5,4 Гц), 3,17 (1Н, дд, J=9,0, 6,6 Гц), 3,15 (1Н, с), 2,96 (1Н, дд, J=9,9, 2,1 Гц), 2,83-2,79 (1Н, м), 2,54 (1Н, дд, J=17,4, 8,4 Гц), 2,47 (1Н, дд, J=17,4, 2,7 Гц), 2,36-1,89 (23Н, м), 1,83 (1Н, ддд, J=12,0, 12,0, 2,4 Гц), 1,78-1,75 (1Н, м), 1,72-1,67 (2Н, м), 1,64 (1Н, ддд, J=12,0, 3,0, 3,0 Гц), 1,58-1,53 (1Н, м), 1,49-1,28 (8Н, м), 1,10 (3Н, д, J=6,0 Гц), 1,05-0,98 (1Н, м), 1,00 (3Н, д, J=7,2 Гц), 0,998 (3Н. d. J=6,6 Гц), 0,96 (3Н, д, J=7,2 Гц) м.д. 13С-ЯМР (125 МГц, CD3OD) δ: 172,9, 153,3, 152,8, 115,6, 114,2, 110,5, 105,1, 104,7, 98,0, 86,2, 80,3, 79,8, 79,2, 78,9, 78,5, 78,4, 77,8, 76,6, 76,4, 76,1, 76,0, 75,9, 75,8, 75,2, 75,1, 74,9, 74,8, 74,4, 73,2, 72,9, 69,4, 68,4, 65,3, 65,1, 53,7, 45,6, 45,0, 44,8, 41,2, 39,6, 38,6, 38,3, 38,2, 37,5, 37,2, 36,0, 33,3, 31,9, 31,7, 31,2, 30,9, 30,2, 28,9, 26,8, 18,4, 17,7, 15,2 м.д. FTIR (пленка): 34,7, 2925, 2872, 1736, 1662, 1553, 1436, 1311, 1188, 1117, 1075, 1023, 996, 898, 735 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C61H86C20Na, 1161,5605; обнаружено, 1161,5618.
Синтез правых половин
[00715] Синтез структурного элемента С27-С37 обобщен на Фигуре 9А. Во-первых, для сочетания альдегида 4-2 с метил-β-йодакрилатом (4-3) в присутствии Cr-катализатора (10 мол. %), полученного из (R)-4-E (Фигура 9B), используют каталитическую асимметрическую Ni/Cr-опосредованную реакцию с получением аллильного спирта с выходом 93% со стереоселективностью 19:1 (см., например, Namba, K.; Kishi, Y. Org. Lett. 2004, 6, 5031; Guo, Н.; Dong, C.-G.; Kim, D.-S.; Urabe, D.; Wang, J.; Kim, J.Т.; Liu, X.; Sasaki, Т.; Kishi, Y. J. Am. Chem. Soc. 2009, 131, 15387). Во-вторых, для конструирования тетрагидропиранового кольца с требуемой стереохимией по положению С29 используют окси-реакцию Михаэля. В предыдущей работе высказано предположение, что этот процесс может достигаться с высокой стереоселективностью. Действительно, при обработке 4-4 смесью K3PO4/18-краун-6/толуол имеет место мягкая циклизация при окси-реакции Михаэля с получением исключительно целевого стереоизомера (см., например, Aicher, Т.D.; Buszek, K.R.; Fang, F.G.; Forsyth, С.J.; Jung, S. H.; Kishi, Y.; Scola, P.M. Tetrahedron Lett. 1992, 33, 1549). Сложный метиловый эфир затем восстанавливают DIBAL с получением альдегида 5, субстрата для последующей каталитической асимметрической Ni/Cr-опосредованной реакции сочетания с формированием связи С19-С20.
[00716] На Фигуре 10А обобщен синтез структурного элемента С20-С37 из 4-5. Критически важной трансформацией в данной последовательности являлось каталитическое асимметрическое Ni/Cr-опосредованное сочетание для введения хирального центра в положение С27, с последующей восстановительной циклизацией для введения хирального центра в положение С23. Суммарный результат стереохимии предложенной трансформации заслуживает комментария. Стереохимия в положении С27 создавалась под влиянием хирального Cr-катализатора, полученного из хирального сульфонамида. Посредством комбинаторного подхода, (S)-4-F был определен как наилучший лиганд для субстратов, близкородственных 4-6 (см., например, Guo, Н.; Dong, C.-G.; Kim, D.-S.; Urabe, D.; Wang, J.; Kim, J.Т.; Liu, X.; Sasaki, Т.; Kishi, Y. J. Am. Chem. Soc. 2009, 131, 15387). Было обнаружено, что тот же Cr-катализатор равно эффективен в настоящем случае; сочетание (4-5→4-6) проводили в присутствии 10 мол. % Cr-катализатора и 2 мол. % (Et)2Phen(H)2•NiCl2 с получением ожидаемого аллильного спирта со стереоселективностью >40:1 (1Н-ЯМР). Для способствования 1Н-ЯМР-анализу, аутентичный образец нецелевого аллильного спирта получали с Cr-катализатором, полученным из (R)-сульфонамида.
[00717] Последующая восстановительная циклизация ожидалась стереоселективной с получением целевого продукта, как было продемонстрировано на близкородственных субстратах (см., например, Lewis, М.D.; Cha, J.K.; Kishi, Y. J. Am. Chem. Soc. 1982, 104, 4976; Dong, C.-G.; Henderson, J. A.; Kaburagi, Y.; Sasaki, Т.; Kim, D.-S.; Kim, J. Т.; Urabe, D.; Guo, H.; Kishi, Y. J. Am. Chem. Soc. 2009, 131, 15642). Тем не менее, предлагаемая трансформация вызывала обеспокоенность по причине присутствия диоксасилинановой группы. Экспериментально было обнаружено, что целевой продукт действительно получается при восстановительной циклизации в качестве основного продукта, н сопровождается побочными продуктами, возникающими, по-видимому, в результате реакций по диоксасилинановой группе. С целью избежать осложнения по причине нежелательной(ых) побочной(ых) реакции(й), с диоксасилинановой группы сначала снимали защиту путем обработки TBAF-AcOH, а затем подвергали восстановительной циклизации с получением практически единственного продукта. Нецелевой аллиловый спирт получали посредством получали посредством сочетания 4-5 с 4-6 в присутствии Cr-катализатора, полученного из (S)-4-A. Продукт на этой стадии представлял собой триол, поскольку группа МРМ в положении С30 отщеплялась в ходе процесса. В соответствии со стандартной методикой, в положения С35 и С37 спиртов селективно вводились защитные группы с получением 6-членного ацетонида 4-7.
[00718] Наблюдаемый результат стереохимии объяснялся стереоэлектронным эффектом в совокупности с конформационным анализом. Вследствие стереоэлектронного эффекта, восстановитель достигает иона оксония предпочтительно из положения, являющегося результатом транс-диаксиальной конфигурации между вновь обрадованной связью и неподеленной парой электронов кислорода иона оксония 4-А (Фигура 10В). Для ясности, С27-олефиновый углерод замещается насыщенным углеродом в ионах оксония 4-А-С, и ион оксония 4-С представляет его противоположность. По аналогии, доступ из нижнего положения также наталкивается на стереоэлектронный эффект. Тем не менее, доступ сверху является более предпочтительным по сравнению с доступом снизу, поскольку первый вариант приводит непосредственно к продукту в конформации «кресло», тогда как последний вариант приводит к продукту в конформации «ванны». По-видимому, для реагента не существует серьезного стерического затруднения для доступа с верхней лицевой стороны. Восстановительной циклизацией нецелевого аллильного спирта получают смесь тетрагидропиранов 2:1. Полученный результат снова объяснялся стереоэлектронным эффектом в совокупности с конформационным анализом, ср. ионы оксония 4-В и 4-С на Фигуре 10В. Два варианта восстановления, отраженные для 4-В и 4-С, приводят непосредственно к продукту в конформации «кресло», но оба доступа страдают от 1,3-диаксиального взаимодействия либо группы С25-Ме, либо группы С29-CH2. Этот анализ объясняет слабую стереоселективность при восстановительной циклизации в ряду нецелевых аллильных спиртов. По причине слабой стереоселективности, наблюдаемой при восстановительной циклизации нецелевых аллильных спиртов, общая стереоселективность 4-5+4-6→4-7 становится выше, чем стереоселективность, достигаемая каталитическим асимметрическим Ni/Cr-опосредованным сочетанием. В завершение, сложный этиловый эфир в 4-7 восстанавливали DIBAL с получением альдегида 4-8, синтетического промежуточного соединения для последующей Ni/Cr-опосредованной реакции сочетания с формированием связи С19-С20 галихондринов А-С. Примечательно, что без защиты гидроксильной группы в положении С30, восстановление DIBAL протекает мягко и чисто с получением целевого 4-8 с выходом 89% вместе с ~5% чрезмерно восстановленного первичного спирта.
[00719] При каталитическом асимметрическом Ni/Cr-опосредованном сочетании 4-8 с 4-9-В формируется связь С19-С20 (Фигура 11) (см., например, Yan, W.; Li, Z.; Kishi, Y. J. Am. Chem. Soc. 2015, 137, 6219; Li, Z.; Yan, W.; Kishi, Y. Am. Chem. Soc. 2015, 137, 6226). Следует отметить, что альдегид 4-8 содержит свободную гидроксильную группу в положении С30. Демонстрация того, что каталитический цикл Ni/Cr-опосредованной реакции мог бы функционировать с субстратом, содержащим свободную гидроксильную группу, не имеет прецедента. Тем не менее, такая вероятность рассматривалась по причине того, что таким способом могли бы быть сэкономлены две стадии синтеза, а именно введение защитной группы и снятие защитной группы с гидроксильной группы в положении С30. В этой связи, следует отметить, что в каталитическом асимметрическом Ni/Cr-опосредованном сочетании Cp2ZrCl2 используется в качестве агента, отделяющего продукта от комплекса Cr (см., например, Namba, K.; Kishi, Y. Org. Lett. 2004, 6, 5031), тем самым наводя на мысль о возможности использования Cp2ZrCl2 в качестве маскирующего агента для свободной гидроксильной группы in situ. Такая возможность была экспериментально протестирована; при добавлении Cp2ZrCl2 (2,5 эквив.) и 2,6-ди-трет-бутил-4-метилпиридина (2,5 эквив.) каталитическое асимметрическое сочетание 4-8 с 4-9-В протекало мягко с получением целевого продукта с отличным выходом.
[00720] Будучи воодушевлены успешным сочетанием 4-8, содержащим свободную гидроксильную группу, было протестировано сочетание с винилйодидом, содержащим свободную группу карбоновой кислоты в положении С1. К удивлению, каталитическое асимметрическое Ni/Cr-опосредованное сочетание 4-8 действительно привело к получению целевого продукта с выходом ~50%. Сочетание с 4-9-В использовали для дальнейших исследований.
[00721] Адаптировав комбинаторный подход, был определен отвечающий требованиям сульфонамидный лиганд. Скрининг лигандов проводили в присутствии Cr-катализатора, полученного из CrCl2 (10 мол. %), сульфонамида (13 мол. %), акцептора протонов (12 мол. %) и (Ме)6Phen•NCl2 в MeCN при комнатной температуре. Посредством этого скрининга были определены три иллюстративных сульфонамидов, а именно (S)-4-I (диастереоизомерное соотношение = 19:1), (S)-4-G (диастереоизомерное соотношение = 29:1) и (S)-4-H (диастереоизомерное соотношение = 24:1). Затем, из общего выхода 4-8→4-11-В был установлен выход реакции сочетания для указанных трех лигандов, а именно 73% для (S)-4-I, 65% для (S)-4-G, и 67% для (S)-4-Н. Указанные значения общего выхода были основаны на экспериментах с использованием в качестве исходного вещества 1,65 г, 250 мг и 250 мг 7 и (S)-4-I, (S)-4-G и (S)-4-H, соответственно. Основываясь на этом результате, для препаративных целей использовали сульфонамид (S)-4-I. Примечательно, что в отличие от первого и второго сочетаний, в этом Ni/Cr-опосредованном сочетании используется структурно сложный нуклеофил. Существенно, что эффективность сочетания была замечательной даже при использовании молярного соотношения 4-7:4-8=1,0:1,1.
[00722] Следующая задача заключалась в SN2-циклизации С20 спирта и С17 хлорида с образованием метилентетрагидрофуранового кольца. Если в субстрате содержалась(лись) неустойчивая(ые) в основании функциональная(ые) группа(а), то с различными основаниями легко достигалась такая циклизация с образованием 5-членного кольца (см., например, Lee, J. Н.; Li, Z.; Osawa, A.; Kishi, Y. J. Am. Chem. Soc. 2016, 138, 16248). После индуцированной основанием циклизации, сложный метиловый эфир в положении С1 гидролизовали водным основанием с получением секо-кислоты 4-10-В. Например, при синтезе галихондрина А, такую трансформацию достигают за 2 раздельные стадии, а именно AgOTf/Ag2O в THF и LiOH в водном МеОН. В настоящей работе, такую трансформацию проводят в однореакторной реакции. Полученную тем самым секо-кислоту подвергают макролактонизации с реагентом Shiina с получением кристаллического С1-С37-макролактонового ацетонида 4-11-В с превосходным выходом (см., например, Shiina, I.; Kubota, М.; Ibuka, R. Tetrahedron Lett. 2002, 43, 7535; Shiina, I.; Mukaiyama, T. Chem. Lett. 1994, 677; Shiina, I. Bull Chem. Soc. Jpn. 2014, 87 196). Структуру 4-11-В подтверждали посредством рентгеновского анализа его С35/С37-диола, т.е. продукта стадии с-1 (Фигура 12).
[00723] Для препаративной цели, трансформацию 4-8+4-9-В→4-10-В→11-В проводили без очистки/выделения промежуточных соединений. Макролактон 4-11-В выделяли методом флэш-хроматографии на силикагеле (нейтральный силикагель) с общим выходом 73% из 4-8 в мультиграммовом масштабе.
[00724] 1H-ЯМР-анализ показал, что полученный тем самым 4-11-В был загрязнен ~5% его С20-эпимера, показывая тем самым, что общая стереоселективность для данной трансформации составила ~20:1. Данное вещество использовали далее с полученной чистотой; а именно, 4-11-В трансформировали до йодида 4-12-В в результате 4-стадийной/2-реакторной методики: (1) p-TsOH/MeOH-CH2Cl2, (2) Tf2O/лутидин/CH2Cl2, с последующим добавлением TESOTf, а затем NaI в DMF. Продукт выделяли методом флэш-хроматографии на силикагеле (нейтральный силикагель) с получением 4-12-В с 92% общим выходом. 1H-ЯМР-анализ показал, что полученный тем самым 4-12-В был загрязнен ~5% его С20-эпимера. Хотя 4-12-В был кристаллическим, также было сложно удалить минорный стереоизомер путем перекристаллизации. Поэтому, минорный С20-диастереоизомер удаляли методом препаративной HPLC (ZORBAX SIL; введение 300~500 мг) с получением 4-12-В (т.пл.: 158~160°С), который использовали для синтеза галихондринов семейства В.
[00725] На Фигуре 13 обобщен синтез правой половины галихондринов семейства А. Для синтеза использовали путь синтеза, разработанный для галихондринов семейства В, с двумя модификациями. Во-первых, использовали 4-9-А вместо 4-9-В. Во-вторых, перед Ni/Cr-опосредованной реакцией сочетания С35/С37-защитную группу в 8 заменяли на соответствующую бис-TBS, поскольку анисилиденовая группа в 4-9-А была неустойчива в кислоте и не могла сохраниться в условиях водной кислоты; с-1 на Фигуре 11. Как и в предыдущем случае, минорный стереоизомер, возникающий при Ni/Cr-опосредованном сочетании, удаляли методом препаративной HPLC.
[00726] На Фигуре 14 обобщен синтез правой половины галихондринов семейства С. Для синтеза использовали путь синтеза, разработанный для галихондринов семейства В, за исключением одного: для Ni/Cr-опосредованного сочетания вместо 4-9-В использовали 4-9-С. Синтез протекал без каких-либо неожиданных сложностей с получением правой половины 4-12-С (т. пл.: 84-6°С) с общей эффективностью, очень сходной с эффективностью для галихондринов семейства В. Как и в предыдущем случае, минорный стереоизомер, возникающий при Ni/Cr-опосредованном сочетании, удаляли методом препаративной HPLC.
[00727] В приведенных синтезах, семь хиральных центров вводились в положения С17, С20, С23, С25, С27, С29 и С30. Доступность аутентичного(ных) образца(ов) нецелевого(вых) стереоизомера(ов) будет способствовать анализу чистоты и стереоселективности для данного этапа. Из них, хиральные центры в положениях С20, С27 и С30 вводили под влиянием хиральных Cr-катализаторов, полученных из (R)-4-E, (R)-4-F и (S)-4-I. Поэтому, аутентичный образец нецелевых минорных стереоизомеров, образованных в каждом из каталитических асимметрических Ni/Cr-опосредованных сочетаний, был легко получен посредством сочетания в присутствии (S)-4-Е, (S)-4-F и (R)-4-I. На практике, с использованием Cr-катализатора, полученного из (S)-Е или (R)-E, для каждого сочетания получали антипод. Хиральные центры в положениях С17 и С25 имели брали происхождение от хиральных центров, присутствующих в структурных элементах С1-С19 и С20-С26. Поэтому, путем использования структурного элемента С17-эпи-С1-С19 получали стереоизомер по положению С17, тогда как путем использования антипода структурного элемента С20-С26 получали минорные стереоизомеры по положению С25. Анализ стереохимии проводили в сравнении с указанными аутентичными образцами.
[00728] Правые половины галихондринов А-С синтезировали путем сочетания общеизвестного структурного элемента С20-С37 4-8 со структурным элементом С1-С19 4-9-А, 4-9-В, и 4-9-С, соответственно. Для формирования трех связей С-С использовали каталитическое асимметрическое Ni/Cr-опосредованное сочетание. Для всех случаев, стереохимию вводили под влиянием Cr-катализаторов, полученных из хиральных сульфонамидов, определенных посредством комбинаторного подхода. Для сочетаний (4-2+4-3), (4-5+4-6) и (4-7+4-8) стереоселективность, составляющая 19:1, >40:1 и ~20:1, достигалась за счет Cr-катализаторов, полученных из (R)-4-E, (R)-4-F и (S)-4-I, соответственно. В отличие от первого и второго сочетаний, в третьем сочетании использовался структурно сложный нуклеофил. Было продемонстрировано, что эффективность сочетания была превосходной даже при использовании молярного соотношения 4-8:4-9А~С = 1,0:1,1. В дополнение, третье сочетание достигалось с субстратом, содержащим свободную гидроксильную группу. Продукты, полученные в результате Ni/Cr-опосредованных сочетаний, преобразовывали до правых половин галихондринов А-С с превосходными значениями общего выхода. Правые половины галихондринов А-С (4-12А через 4-12С) синтезировали в 28, 24 и 24 стадии из коммерчески доступного D-галакталя со значениями общего выхода 13,4%, 21,1% и 16,7%, соответственно.
Экспериментальные методики для синтеза правых половин
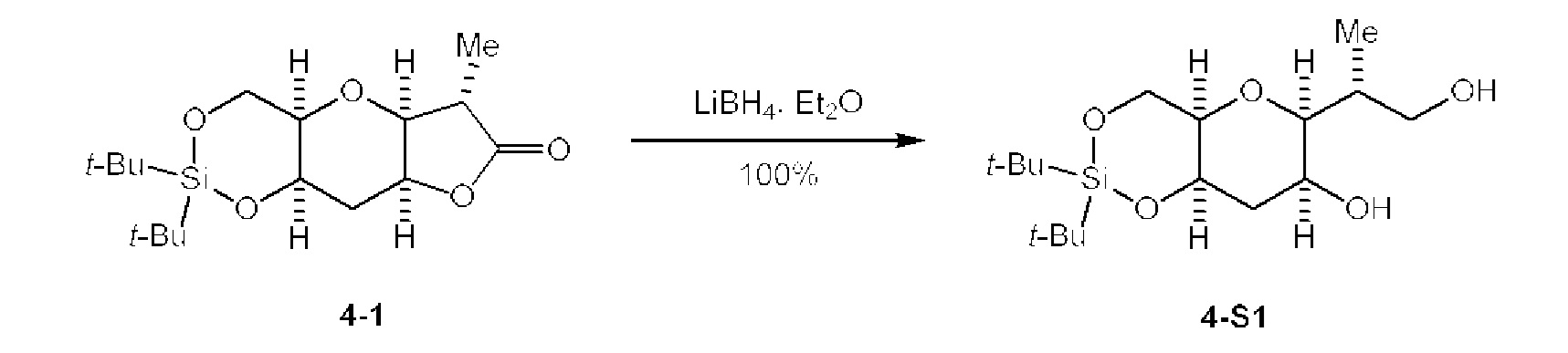
[00729] К перемешанному раствору 4-1 (4,0 г, 11,7 ммоль, 1 экв.) в Et2O (100 мл) при 0°С добавляли боргидрид лития (510 мг, 23,4 ммоль, 2 экв.). После перемешивания в течение 8 ч при комнатной температуре, реакционную смесь осторожно гасили добавлением нас. водн. NH4Cl при 0°С и перемешивали в течение 30 мин. Органический слой разделяли, и экстрагировали водную фазу EtOAc. Объединенный органический слой промывали солевым раствором, сушили над Na2SO4 и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной флэш-хроматографии на силикагеле (33%, затем 100% EtOAc в гексанах) с получением диола (4,1 г, 11,8 ммоль, колич.) в виде белого твердого вещества. Полученные данные спектроскопии соответствовали данным, которые ранее приводились в литературе (см., например, Chen, C.-L.; Namba, K.; Kishi, Y. Org. Lett. 2009, 11, 409-412).
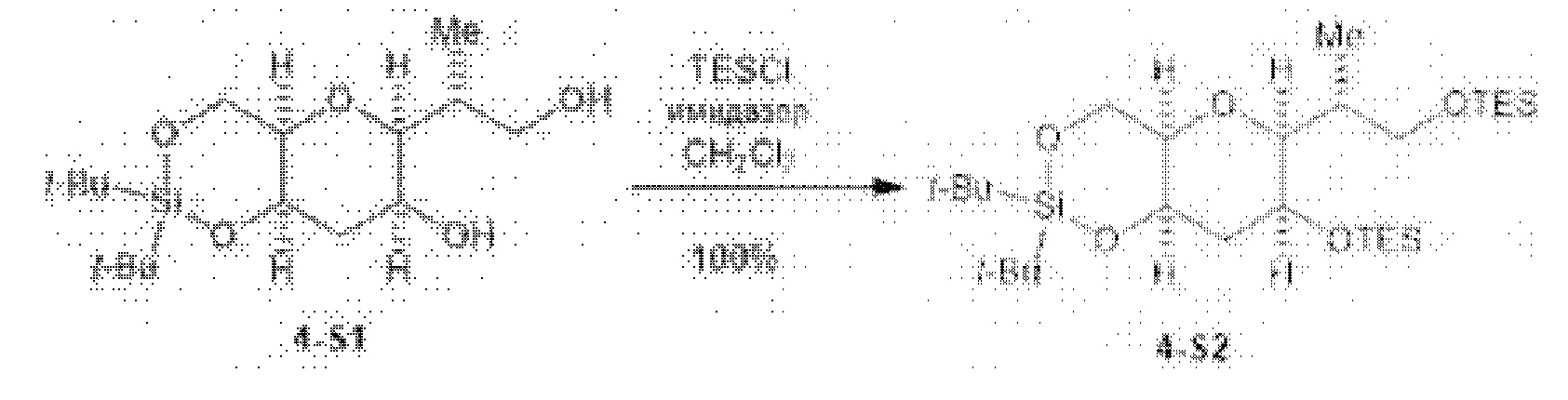
[00730] К перемешанному раствору диола (4,1 г, рассчит.11,7 ммоль, 1 экв.) в CH2Cl2 (57 мл) при комнатной температуре добавляли имидазол (4,8 г, 70,2 ммоль, 6 экв.) и TESCl (5,9 мл, 35,1 ммоль, 3 экв.). После перемешивания в течение 12 ч при той же температуре, реакционную смесь гасили добавлением нас. водн. NaHCO3 при 0°С и перемешивали в течение 30 мин. Органический слой разделяли, и экстрагировали водную фазу смесью гексаны/EtOAc (1:1). Объединенный органический слой промывали солевым раствором, сушили над Na2SO4 и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной флэш-хроматографии на силикагеле (0%, затем 3% EtOAc в гексанах) с получением бис-TES 4-S2 (6,8 г, 11,8 ммоль, колич.) в виде бесцветного масла. 4-S2: [α]20D +1,1 (с 1,0, CHCl3). 1H-ЯМР (600 МГц, CDCl3) δ: 4,23 (1H, м), 4,21 (1H, дд, J=12,6, 2,4 Гц), 4,17 (1H, дд, J=12,6, 1,8 Гц), 3,77 (1H, ддд, J=4,2, 2,4, 1,8 Гц), 3,53 (1H, дд, J=10,2, 5,4 Гц), 3,50 (1H, дд, J=10,2, 5,4 Гц), 3,29 (1H, дд, J=6,6, 1,8 Гц), 3,20 (1H, ушир. с), 2,16 (1H, ддд, J=14,4, 2,4, 2,4 Гц), 1,99 (1H, квдт, J=7,2, 6,6, 5,4 Гц), 1,74 (1H, ддд, J=14,4, 4,2, 4,2 Гц), 1,05 (9Н, с), 1,03 (3Н, д, J=7,2 Гц), 1,02 (9Н, с), 0,98 (9Н, т, J=8,4 Гц), 0,94 (9Н, т, J=8,4 Гц), 0,70-0,55 (12Н, м) м.д. 13С-ЯМР (150 МГц, CDCl3) δ: 81,1, 77,1, 68,2, 67,8, 65,5, 64,9, 38,8, 37,4, 27,8, 27,2, 23,3, 20,6, 13,2, 7,0, 6,8, 5,1, 4,4 м.д. FTIR (пленка): 2954, 2875, 1465, 1239, 1168, 1104, 1082, 1036, 1007, 927, 826, 772, 723, 649, 442 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C29H62O5Si3Na, 597, 3797; обнаружено, 597, 3807.
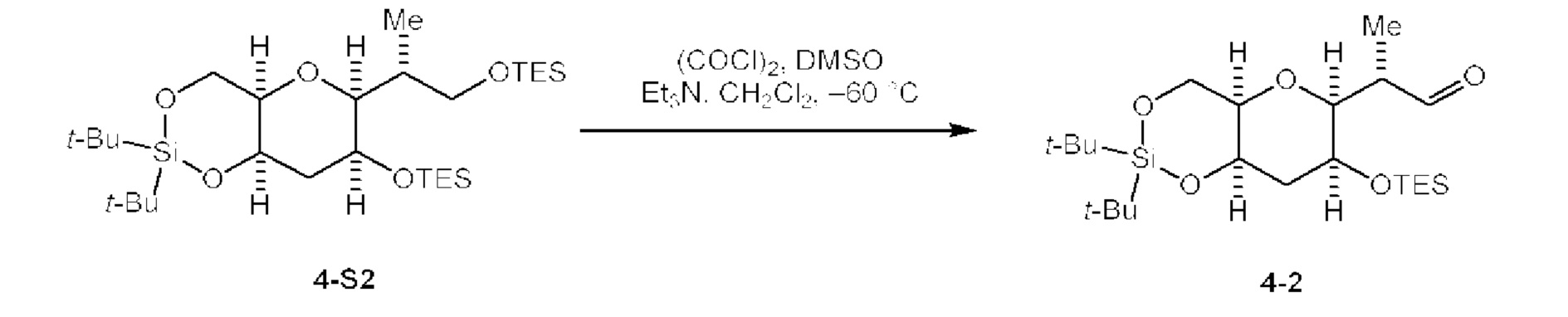
[00731] К перемешанному раствору (COCl)2 (7,5 мл, 88,6 ммоль, 5 экв.) в CH2Cl2 (250 мл) при -78°С добавляли раствор DMSO (12,4 мл, 174 ммоль, 10 экв.) в CH2Cl2 (10 мл). После перемешивания в течение 30 мин при той же температуре, в реакционную смесь вводили раствор 4-S2 (10,0 г, 17,4 ммоль, 1 экв.) в CH2Cl2 (30 мл). После перемешивания в течение 2 ч при -60°С, к смеси при -78°С добавляли Et3N (42 мл, 305 ммоль, 17 экв.), и нагревали до 0°С в течение 30 мин. После перемешивания в течение 15 мин при 0°С, смесь гасили добавлением нас. водн. NH4Cl. Органический слой разделяли, и экстрагировали водную фазу EtOAc. Объединенный органический слой промывали солевым раствором, сушили над Na2SO4 и концентрировали в условиях пониженного давления. Остаток фильтровали через слой силикагеля (гексаны/EtOAc = 1:1) с получением неочищенного альдегида 4-2 в виде бледно-желтого масла. Полученное неочищенное вещество использовали в последующей реакции без дополнительной очистки.
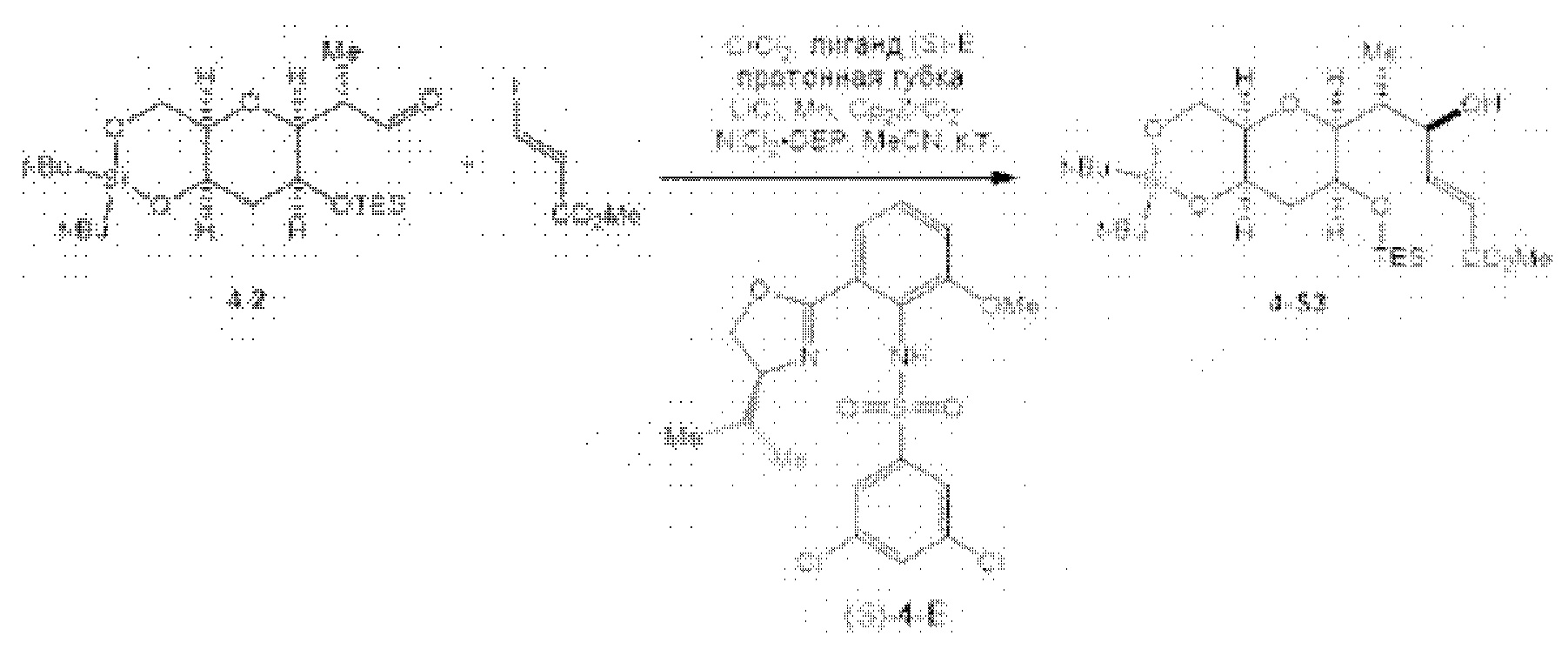
[00732] К смеси CrCl2 (257 мг, 2,1 ммоль, 12 мол. %), (S)-сульфонамидного лиганда [i-Pr, PhCl2, ОМе] (1,08 г, 2,4 ммоль, 14 мол. %) и акцептора протонов (522 мг, 2,4 ммоль, 14 мол.%) в перчаточной камере добавляли MeCN (44 мл), и перемешивали реакционный раствор в течение 3 ч при комнатной температуре. В отдельной колбе, полученный выше неочищенный 4-2 (по расчетам 17,4 ммоль, 1 экв.), метил-3-йодакрилат (3,7 г, 17,4 ммоль, 1 экв.), NiCl2⋅DMP(OMe)2 (138 мг, 0,348 ммоль, 2 мол. %), LiCl (1,48 мг, 34,8 ммоль, 2 экв.), Mn (3,8 г, 70 ммоль, 4 экв.), Cp2ZrCl2 (5,6 г, 19,1 ммоль, 1,1 экв.) и 2,6-лутидин (4,1 мл, 34,8 ммоль, 2 экв.) смешивали вместе, и переносили в колбу раствор комплекса Cr (26 мл). Спустя 30 мин, дополнительно добавляли метил-3-йодакрилат (1,8 г, 8,7 ммоль, 0,5 экв.) и раствор комплекса Cr (11 мл). После перемешивания в течение 45 мин, к смеси добавляли оставшийся раствор комплекса Cr (7 мл). После перемешивания в течение 15 мин, реакционную смесь удаляли из перчаточной камеры и разбавляли EtOAc. После добавления флорисила, полученную суспензию энергично перемешивали в течение 1 ч. Смесь фильтровали через тонкий слой силикагеля (EtOAc). После удаления растворителя в условиях пониженного давления, остаток очищали методом колоночной флэш-хроматографии на силикагеле (3%, затем 25% EtOAc в гексанах) с получением аллильного спирта 4-S3 (8,8 г, 16,2 ммоль, 93% после 2 стадий, диастереоизомерное соотношение = 16:1 на основании соотношения интегрирования 1H-ЯМР) в виде бледно-желтого масла. 4-S3: [α]20D -1,3 (с 1,0, CHCl3). 1H-ЯМР (600 МГц, C6D6) δ: 7,18 (1H, дд, J=15,6, 3,6 Гц), 6,32 (1H, дд, J=15,6, 2,4 Гц), 4,39 (1Н, ушир. с), 4,15 (1H, дд, J=12,6, 1,2 Гц), 3,94 (1H, дд, J=12,6, 2,4 Гц), 3,89 (1H, ушир. с), 3,66 (1H, ддд, J=4,2, 2,4, 1,2 Гц), 3,43 (3Н, с), 3,18 (1H, дд, J=6,6, 1,2 Гц), 2,66 (1H, ушир. с), 2,13 (1H, квдд, J=6,6, 6,6, 1,8 Гц), 2,02 (1H, ддд, J=15,0, 2,4, 2,4 Гц), 1,99 (1Н, д, J=4,2 Гц), 1,29 (1H, м), 1,28 (9Н, с), 1,12 (9Н, с), 1,10 (3Н, д, J=6,6 Гц), 1,06-1,00 (9Н, м), 0,74-0,61 (6Н, м) м.д. 13С-ЯМР (150 МГц, CDCl3) δ: 166,6, 150,2, 128,3, 120,5, 82,2, 77,4, 72,1, 68,2, 67,7, 65,6, 51,1, 40,3, 38,7, 28,0, 27,6, 23,5, 20,9, 9,8, 7,3, 5,4 м.д. IR (пленка): 3501, 2952, 2876, 1725, 1706, 1659, 1474, 1167 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C27H52O7Si2Na, 567, 3144; обнаружено, 567, 3157.

[00733] К перемешанной суспензии аллильного спирта 4-S3 (5,65 г, 10,4 ммоль, 1 экв.) и La(OTf)3 (640 мг, 1,1 ммоль, 10 мол. %) в толуоле (21 мл) шприцевым насосом в течение 5,5 ч добавляли MPMOC(NH)CCl3 (6,0 г, 21 ммоль, 2 экв.). После перемешивания дополнительно в течение 30 мин, смесь гасили добавлением нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водную фазу EtOAc. Объединенный органический слой промывали солевым раствором, сушили над Na2SO4 и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной флэш-хроматографии на силикагеле (3%, затем 17% EtOAc в гексанах) с получением МРМ-эфира S-3 в виде частично разделимой смеси с остатками реагентов. 4-S4: [α]20D +20,9 (с 1,0, CHCl3). 1Н-ЯМР (600 МГц, CDCl3) δ: 7,20 (2Н, д, J=8,4 Гц), 6,89 (1H, дд, J=16,2, 6,0 Гц), 6,87 (2Н, д, J=8,4 Гц), 6,03 (1H, дд, J=16,2, 1,2 Гц), 4,56 (1H, д, J=11,4 Гц), 4,20 (1H, д, J=11,4 Гц), 4,19 (1H, ушир. с), 4,18 (1H, дд, J=12,0, 2,4 Гц), 4,11 (1H, дд, J=12,0, 1,2 Гц), 3,96 (1H, ддд, J=6,0, 2,4, 1,2 Гц), 3,80 (3Н, с), 3,77 (3Н, с), 3,45 (1H, ддд, J=4,2, 2,4, 1,2 Гц), 3,27 (1H, дд, J=7,2, 1,2 Гц), 3,14 (1H, ушир. с), 2,10 (1Н, дквд, J=7,2, 6,6, 2,4 Гц), 2,08 (1H, ддд, J=14,4, 2,4, 2,4 Гц), 1,61 (1H, ддд, J=14,4, 4,2, 4,2 Гц), 1,03 (9Н, с), 1,01 (3Н, д, J=6,6 Гц), 1,00 (9Н, с), 0,98-0,94 (9Н, м), 0,65-0,50 (6Н, м) м.д. 13С-ЯМР (150 МГц, CDCl3) δ: 166,7, 159,3, 147,7, 130,2, 129,3, 121,4, 113,7, 80,6, 77,9, 76,9, 70,5, 68,0, 67,5, 64,9, 55,2, 51,6, 38,6, 27,7, 27,2, 23,2, 20,5, 10,3,7,0, 5,1 м.д. IR (пленка): 2950, 2875, 1726, 1659, 1612, 1513, 1168 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C35H60O8Si2Na, 687, 3719; обнаружено, 687, 3706.
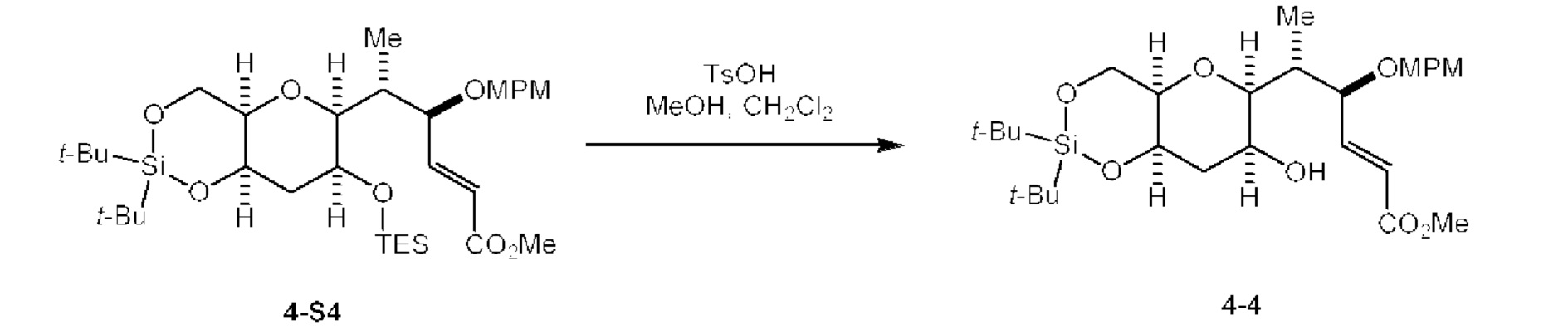
[00734] Данное селективное снятие защитного TES-эфира может быть выполнено, следуя двум различным методикам. Селективное снятие защитной группы с TsOH⋅H2O: К перемешанному раствору представленного выше МРМ-эфира 4-S4 (по расчетам 10,4 ммоль, 1 экв.) в CH2Cl2 (20 мл) и МеОН (10 мл) при комнатной температуре добавляли TsOH⋅H2O (10 мг, 0,0525 ммоль, 0,5 мол. %). После перемешивания в течение 30 мин при той же температуре, каждые 30 мин дополнительно добавляли TsOH⋅Н2О (20×3 мг, 0,450 ммоль, 3 мол. %), и перемешивали содержащую продукт смесь в течение 4 ч. Реакционную смесь гасили добавлением нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой промывали солевым раствором, сушили над Na2SO4 и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной флэш-хроматографии на силикагеле (3%, затем 33% EtOAc в гексанах) с получением вторичного спирта 4-4 (5,04 г, 9,15 ммоль, 88% после 2 стадий) в виде бесцветного масла, который был загрязнен небольшим количеством остатка реагентов. Селективное снятие защитной группы с HFIP: Раствор представленного выше МРМ-эфира 4-S4 (~6 г) в 1,1,1,3,3,3-гексафтор-2-пропаноле (40 мл) и H2O (4 мл) перемешивали в течение 10 ч при комнатной температуре. Реакционную смесь концентрировали, и очищали содержащий продукт остаток методом колоночной флэш-хроматографии на силикагеле (3%, затем 33% EtOAc в гексанах) с получением вторичного спирта 4-4 (4,2 г, 7,63 ммоль, ~79% после 2 стадий) в виде бесцветного масла. 4-4: [α]20D +18,8 (с 1,0, CHCl3). 1Н-ЯМР (600 МГц, CDCl3) δ: 7,20 (2Н, д, J=12,0 Гц), 6,95 (1H, дд, J=16,2, 4,8 Гц), 6,86 (2Н, д, J=12,0 Гц), 6,07 (1H, дд, J=16,2, 1,2 Гц), 4,54 (1H, д, J=12,0 Гц), 4,35 (1H, дд, J=3,0, 3,0 Гц), 4,22 (1Н, дд, J=12,6, 3,0 Гц), 4,19 (1Н, д, J=12,0 Гц), 4,18 (1H, м), 4,16 (1H, дд, J=12,6, 1,2 Гц), 3,80 (3Н, с), 3,76 (3Н, с), 3,53 (1H, д, J=10,8 Гц), 3,45 (1H, ддд, J=10,8, 3,0, 3,0 Гц), 3,27 (1H, ушир. с), 3,24 (1H, д, J=8,4 Гц), 2,19 (1H, ддд, J=14,4, 3,0, 3,0 Гц), 2,14 (1H, дквд, J=8,4, 6,6, 2,4 Гц), 1,57 (1H, ддд, J=14,4, 3,0, 3,0 Гц), 1,03 (9Н, с), 1,02 (3Н, д, J=6,6 Гц), 1,02 (9Н, с) м.д. 13С-ЯМР (150 МГц, CDCl3) δ: 166,7, 159,3, 148,1, 130,2, 129,4, 121,6, 113,8, 82,1, 77,1, 76,6, 70,6, 69,3, 68,6, 64,4, 55,3, 51,6, 38,3, 36,7, 27,7, 27,2, 23,1, 20,3, 10,9 м.д. IR (пленка): 3538, 2938, 2859, 1725, 1658, 1612, 1514, 1251 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C29H46O8SiNa, 573, 2854; обнаружено, 573, 2846.
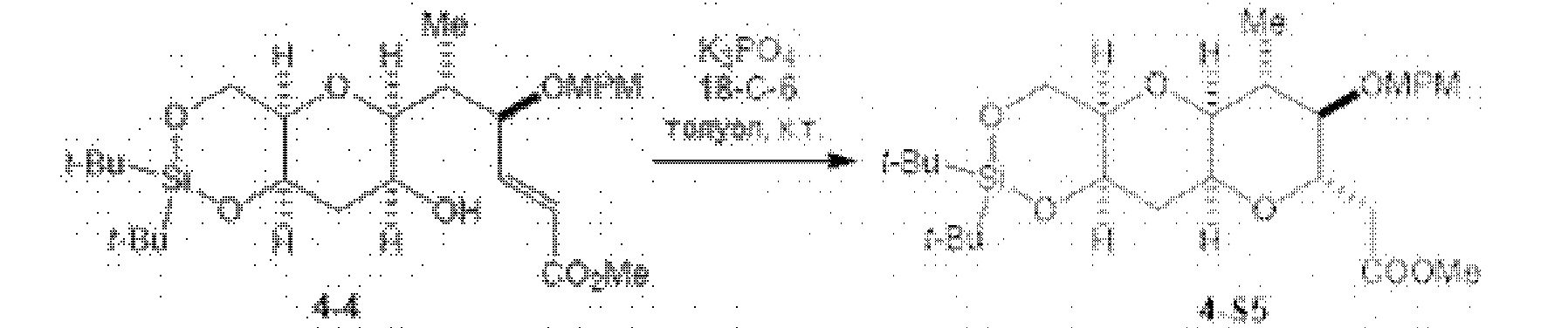
[00735] К перемешанному раствору 4-4 (2,80 г, 5,08 ммоль, 1 экв.) в толуоле (340 мл) при комнатной температуре добавляли 18-краун-6 (2,69 г, 10,2 ммоль, 2 экв.) и K3PO4 (21,6 г, 102 ммоль, 20 экв.). После перемешивания в течение 14 ч при той же температуре, дополнительно добавляли 18-краун-6 (671 мг, 2,54 ммоль, 0,5 экв.). После перемешивания в течение 5 ч при той же температуре, реакционную смесь гасили добавлением нас. водн. NH4Cl. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной флэш-хроматографии с получением 4-S5 (2,64 г, 4,79 ммоль, 94%) в виде бесцветного масла. 4-S5: [α]20D -25,8 (с 1,0, CHCl3). 1Н-ЯМР (600 МГц, CDCl3) δ: 7,25 (2Н, д, J=8,4 Гц), 6,88 (1H, d J=8,4 Гц), 4,56 (1H, д, J=10,2 Гц), 4,45 (1H, д, J=10,2 Гц), 4,29 (1H, ддд, J=7,8, 4,2, 4,2 Гц), 4,14 (1H, дд, J=12,0, 6,0 Гц), 4,07 (1H, дд, J=12,0, 3,0 Гц), 3,98 (1H, ддд, J=9,6, 7,8, 3,6 Гц), 3,82-3,77 (4Н, м), 3,66 (3Н, с), 3,60 (1H, ддд, J=6,0, 4,2, 3,0 Гц), 3,40 (1H, дд, J=7,8, 4,8 Гц), 3,14 (1Н, дд, J=9,6, 9,6 Гц), 2,67 (1H, дд, J=15,6, 3,6 Гц), 2,48 (1H, дд, J=15,6, 7,8 Гц), 2,11 (1H, ддд, J=13,2, 7,8, 7,8 Гц), 2,00-1,92 (2Н, м), 1,21 (3Н, д, J=7,2 Гц), 1,03 (9Н, с), 1,01 (9Н, с) м.д. 13С-ЯМР (150 МГц, CDCl3) δ: 171,6, 159,4, 129,9, 129,7, 113,9, 80,4, 78,6, 73,7, 73,0, 72,4, 68,9, 66,9, 65,1, 55,3, 51,6, 39,5, 37,8, 31,9, 27,4, 27,1, 22,2, 20,8, 16,1 м.д. IR (пленка): 2934, 2858, 1740, 1612, 1514, 1250 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C29H46O8SiNa, 573, 2854; обнаружено, 573, 2847.
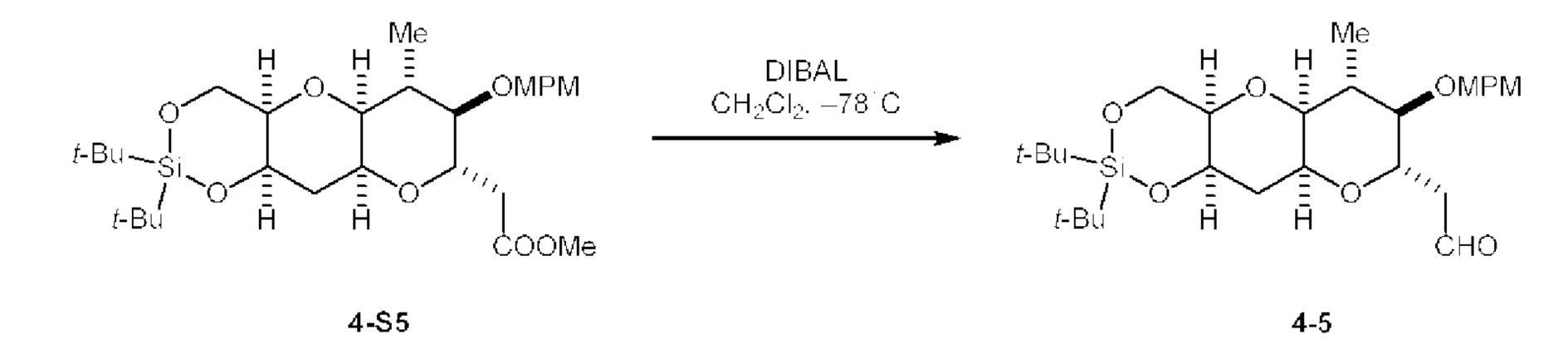
[00736] К перемешанному раствору 4-S5 (5,0 г, 9,07 ммоль, 1 экв.) в толуоле (100 мл) при -78°С по каплям добавляли раствор DIBAL (11,3 мл, 1 M в гексанах, 11,3 ммоль, 1,2 экв.). После перемешивания в течение 1,5 ч при той же температуре, реакционную смесь гасили добавлением ацетона (0,3 мл). Смесь перемешивали в течение 15 мин и добавляли нас. водн. сегнетову соль. После перемешивания в течение 3 ч при комнатной температуре смесь разбавляли EtOAc. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (5%, 20%, затем 33% EtOAc в гексанах) с получением 4-5 (4,37 г, 8,49 ммоль, 94%) в виде бесцветного аморфного твердого вещества. 4-5: [α]20D -37,3 (с 1,0, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 9,51 (1H, т, J=2,4 Гц), 7,21 (2Н, м), 6,82 (2Н, м), 4,33 (1H, д, J=10,6 Гц), 4,24 (1Н, д, J=10,6 Гц), 4,17 (1H, дд, J=12,3, 3,5 Гц), 4,11 (1H, м), 3,99-3,91 (2Н, м), 3,31 (3Н, с), 3,26 (1H, м), 3,0 (1H, дд, J=7,0, 4,1 Гц), 2,91 (1H, м), 2,81 (1H, дд, J=10,6, 9,4 Гц), 2,40 (1H, м), 2,34 (1H, м), 2,18-2,08 (2Н, м), 1,54 (1Н, дт, J=14,1, 5,3 Гц), 1,24 (9Н, с), 1,18 (3Н, д, J=7,0 Гц), 1,13 (9Н, с) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 200,1, 160,6, 131,2, 130,4, 114,7, 81,4, 80,8, 74,5, 74,4, 73,3, 69,1, 68,2, 66,0, 55,4, 47,9, 40,9, 34,2, 28,4, 28,1, 23,6, 21,6, 17,3 м.д.. IR (пленка): 2933, 2857, 1725, 1514, 1250, 1078 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C28H44O7SiNa, 543, 7272; обнаружено, 543, 2750.
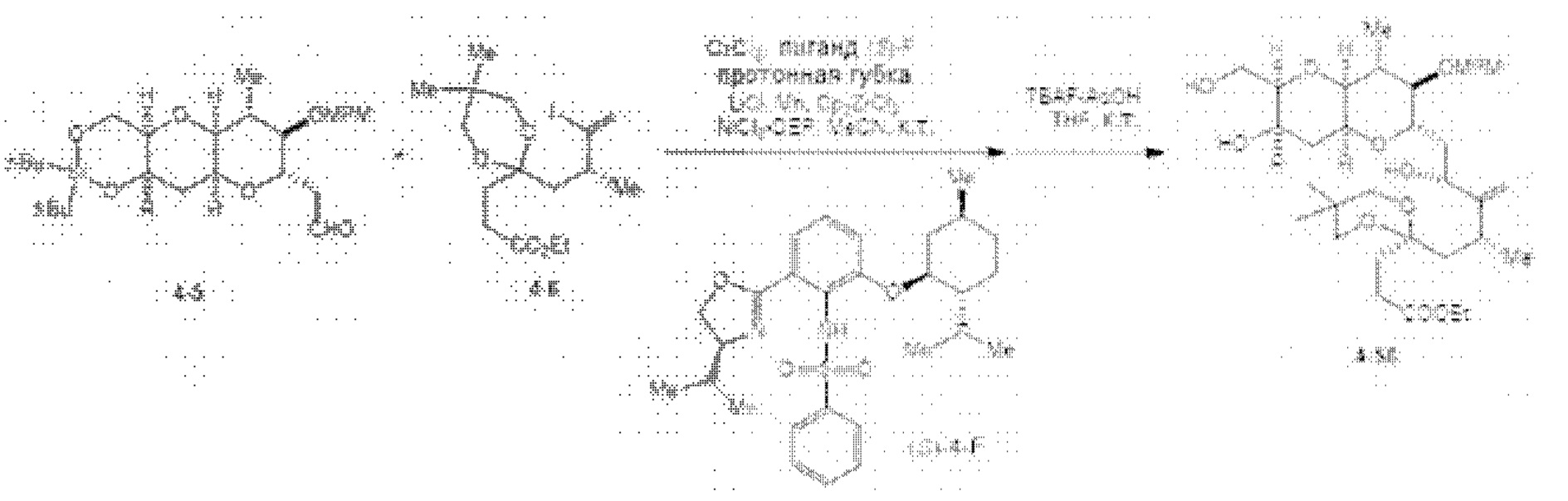
[00737] В перчаточной камере к смеси CrCl2 (104 мг, 0,849 ммоль, 10 мол. %), (S)-сульфонамидного лиганда (465 мг, 0,934 ммоль, 11 мол. %) и акцептора протонов (200 мг, 0,934 ммоль, 11 мол. %) добавляли MeCN (28 мл), и перемешивали полученный раствор в течение 1 ч при комнатной температуре. В отдельной колбе, смешивали вместе 4-5 (4,37 г, 8,49 ммоль, 1 экв.), 4-6 (5,22 г, 12,7 ммоль, 1,5 экв.), LiCl (720 мг, 17,0 ммоль, 2 экв.), Mn (932 мг, 17,0 ммоль, 2 экв.), Cp2ZrCl2 (2,48 г, 8,49 ммоль, 1 экв.) и NiCl2⋅DEP (331 мг, 0,849 ммоль, 10 мол. %). Затем, в колбу переносили раствор комплекса Cr, и энергично перемешивали полученную смесь в течение 3 ч при комнатной температуре. Реакционную смесь удаляли из перчаточной камеры и разбавляли EtOAc (100 мл). Добавляли водный серинат калия (0,5 М, 100 мл) и нас. водн. NaHCO3 (100 мл), и перемешивали полученную смесь в течение 1 ч. Суспензию фильтровали через слой Celite. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением неочищенного аллильного спирта, который использовали на следующей стадии без дополнительной очистки. Забуференный раствор TBAF получали путем смешивания раствора TBAF (21 мл, 1 M в THF, 21,0 ммоль, 2,5 экв.) и АсОН (0,608 мл, 10,6 ммоль, 1,25 экв.) при комнатной температуре. К перемешанному раствору неочищенного спирта (по расчетам 8,49 ммоль) в THF (100 мл) при 0°С добавляли раствор TBAF-AcOH. Реакционную смесь перемешивали в течение 1 ч при той же температуре, а затем гасили добавлением нас.водн. NH4Cl. Смесь разбавляли EtOAc. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (20%, 50%, затем 100% EtOAc в гексанах) с получением 4-S6 (4,45 г, 6,69 ммоль, 79% после 2 стадий) в виде бесцветного масла. 4-S6: [α]20D -23,9 (с 1,0, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 7.29 (2Н, м), 6,86 (2Н, м), 5,45 (1H, с), 5,01 (1H, с), 4,52 (1H, ушир. д, J=5,9 Гц), 4,47 (1H, д, J=11,2 Гц), 4,43 (1H, м), 4,38 (1H, д, J=11,2 Гц), 4,02-3,95 (3Н, м), 3,87 (2Н, м), 3,57 (1H, ушир. с), 3,43 (1H, ушир. с), 3,37-3,30 (4Н, м), 3,25 (2Н, м), 3,07 (1Н, м), 2,98 (1Н, дд, J=7,6, 6,5 Гц), 2,93 (1H, м), 2,61 (1Н, м), 2,55 (2Н, т, J=7,9 Гц), 2,29 (1H, м), 2,24-2,14 (2Н, м), 2,12 (1H, ддд, J=14,2, 3,2, 3,2 Гц), 2,02 (2Н, м), 2,07-1,98 (2Н, м), 1,90-1,80 (3Н, м), 1,30 (3Н, д, J=7,0 Гц), 1,18 (1H, м), 0,99 (3Н, т, J=7,0 Гц), 0,89 (3Н, д, J=7,6 Гц), 0,74 (3Н, с), 0,69 (3Н, с) м.д., 13С-ЯМР (125 МГц, C6D6) δ: 173,7, 159,8, 159,3, 131,1, 129,5, 114,1, 107,9, 100,0, 81,0, 80,1, 79,5, 75,7, 74,5, 72,2, 70,12, 70,11, 64,8, 64,4, 63,5, 60,2, 54,8, 41,5, 38,9, 38,8, 35,2, 31,3, 30,5, 29,4, 28,9, 22,9, 22,8, 22,7, 17,8, 14,3 м.д. IR (пленка): 3470, 2956, 2871, 1732, 1514, 1248, 1081, 1035 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C36H56O11Na, 687,3715; обнаружено, 687, 3715.
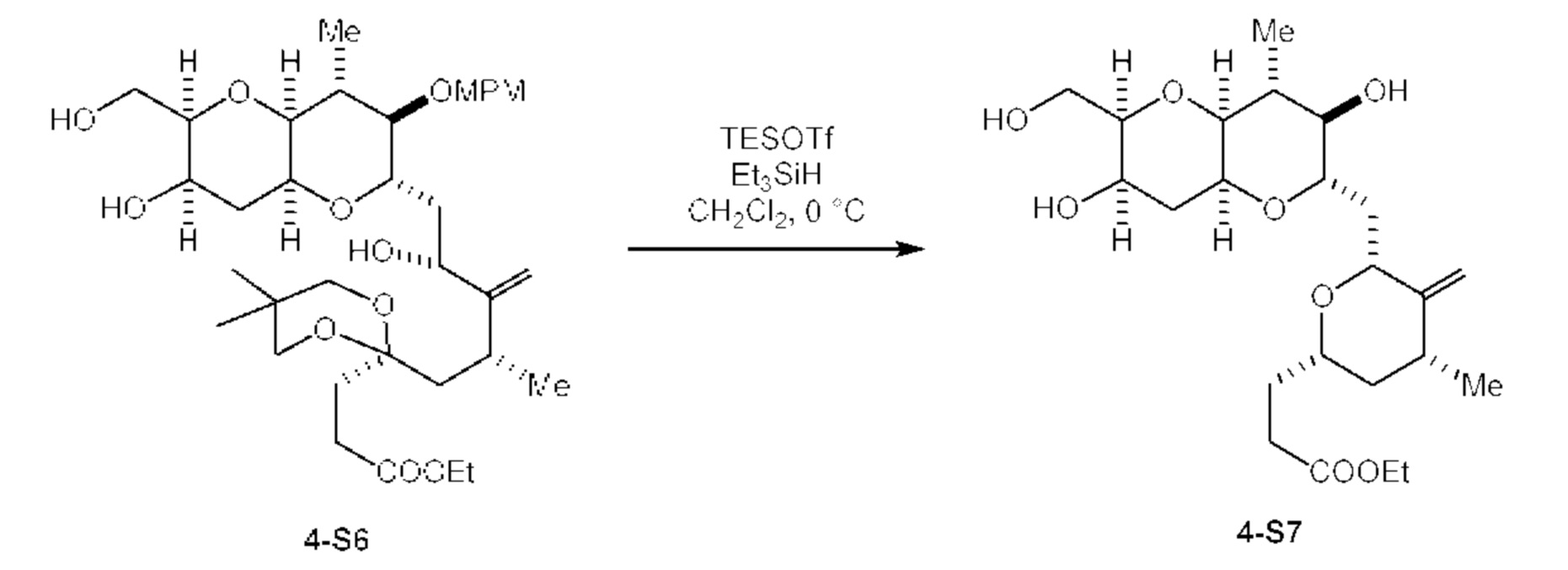
[00738] К перемешанному раствору 4-S6 (4,45 г, 6,69 ммоль, 1 экв.) и TESH (10,7 мл, 66,9 ммоль, 10 экв.) в CH2Cl2 (90 мл) при 0°С по каплям добавляли TESOTf (7,58 мл, 33,5 ммоль, 5 экв.). После перемешивания в течение 3 ч, смесь вливали в нас.водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой CH2Cl2. Объединенный органический слой промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (10%, 50%, затем 100% EtOAc в гексанах) с получением 4-S7(2,57 г, 5,81 ммоль, 87%) в виде бесцветного масла 4-S7: [α]20D -29,1 (с 1,0, МеОН). 1Н-ЯМР (600 МГц, C6D6) δ: 4,77 (1H, с), 4,75 (1Н, д, J=1,8 Гц), 4,39 (1H, м), 4,27-4,14 (2Н, м), 4,03 (1H, м), 3,95 (1H, м), 3,88 (1H, ддд, J=11,9, 7,8, 4,4 Гц), 3,78 (1H, дд, J=8,2, 4,1 Гц), 3,57 (1H, м), 3,52 (1Н, м), 3,46 (1H, ддд, J=7,5, 3,6, 3,6 Гц), 3,41 (1H, м), 3,03 (1H, дд, J=5,0 Гц), 2,91 (1Н, ушир. с), 2,88 (1H, ушир. с), 2,44 (2Н, м), 2,25 (1H. м), 2,07-1,85 (4Н, м), 1,76-1,65 (2Н, м), 1,31 (1H, ддд, J=12,8, 4,3, 1,8 Гц), 1,16 (1H, ддд, J=15,0, 3,1, 3,1 Гц), 1,02 (3Н, т, J=7,0 Гц), 0,95-0,87 (4Н, м), 0,85 (3Н, д, J=7,6 Гц) (протон одной ОН потерян) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 173,5, 151,2, 104,6, 80,9, 78,6, 77,2, 76,7, 76,5, 71,0, 65,5, 63,5, 62,6, 60,3, 42,7, 38,7, 35,9, 35,0, 32,4, 31,3, 30,7, 18,0, 16,2, 14,3 м.д.. IR (пленка): 3435, 2928, 1729, 1420, 1253, 1165, 1092, 1048, 639 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C23H38O8Na, 465, 2459; обнаружено, 465, 2460.
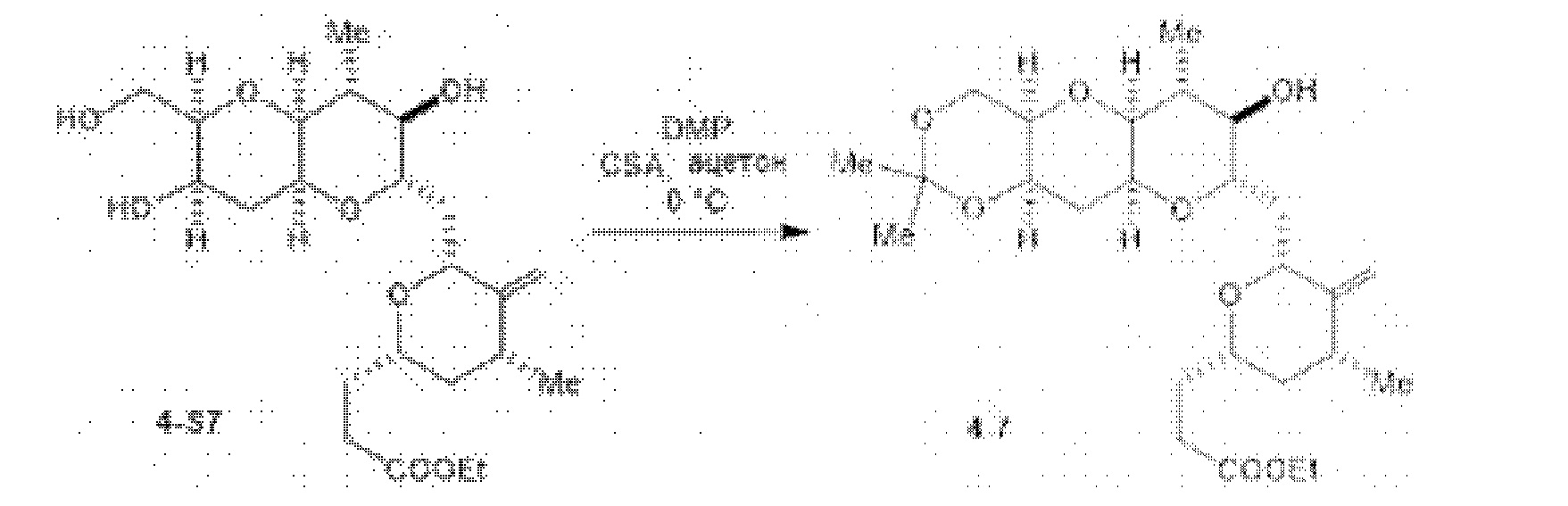
[00739] К перемешанному раствору 4-S7 (1,83 г, 4,14 ммоль, 1 экв.) и 2,2-диметоксипропана (37,6 мл, 306 ммоль, 30 экв.) в ацетоне (100 мл) при 0°С добавляли CSA (236 мг, 1,02 ммоль, 10 мол. %). После перемешивания в течение 30 мин, смесь нагревали до комнатной температуры и перемешивали в течение 4 ч. Реакционную смесь гасили добавлением Et3N (2 мл), разбавляли EtOAc и перемешивали в течение 30 мин. Затем, смесь вливали в нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток пропускали через слой силикагеля (EtOAc) с получением неочищенного ацетонида 4-7 в виде бесцветного масла. Полученное неочищенное вещество использовали в последующей реакции без дополнительной очистки. Чистый ацетонид 4-7 (239 мг, 0,495 ммоль) выделяли с выходом 91% из диола (241 мг, 0,545 ммоль). Продукт получали в виде бесцветного масла. 4-7: [α]20D -19,0 (с 1,05, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 4,91 (1H, с), 4,72 (1H, с), 4,39-4,36 (1H, м), 4,09 (1H, дд, J=7,2, 4,2 Гц), 4,01-3,98 (2Н, м), 3,75 (1H, дд, J=12,6, 2,4 Гц), 3,68 (1H, дд, J=7,8, 4,5 Гц), 3,63 (1H, дд, J=12,3, 2,7 Гц), 3,52 (1H, с), 3,45-3,40 (2Н, м), 3,37 (1H, д, J=7,2 Гц), 3,17 (1H, дд, J=3,6, 3,6 Гц), 2,71 (1H, дд, J=5,4, 3,0 Гц), 2,47-2,44 (2Н, м), 2,28-2,13 (4Н, м), 1,96-1,92 (1H, м), 1,74-1,66 (2Н, м), 1,48 (3Н, с), 1,41 (1H, ддд, J=14,4, 4,5, 4,5 Гц), 1,32-1,30 (1H, м), 1,21 (3Н, с), 1,17 (3Н, д, J=7,2 Гц), 1,00 (3Н, т, J=6,9 Гц), 0,94-0,87 (1H, м), 0,87 (3Н, д, J=6,6 Гц) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 173,2, 151,3, 104,7, 98,4, 78,3, 76,7, 75,8, 73,9, 70,2, 64,1, 63,7, 62,9, 60,0, 42,9, 40,6, 36,0, 34,5, 32,8, 31,2, 30,6, 28,8, 19,7, 18,0, 16,5, 14,3 м.д. FTIR (пленка): 3502, 2957, 2926, 2874, 1733, 1457, 1373, 1250, 1181, 1084, 1057, 1039, 977, 906, 836 см-1. HRMS (ESI) m/z: [M+NH4]+ рассчит. для C26H46NO8, 500, 3218; обнаружено, 500, 3248.
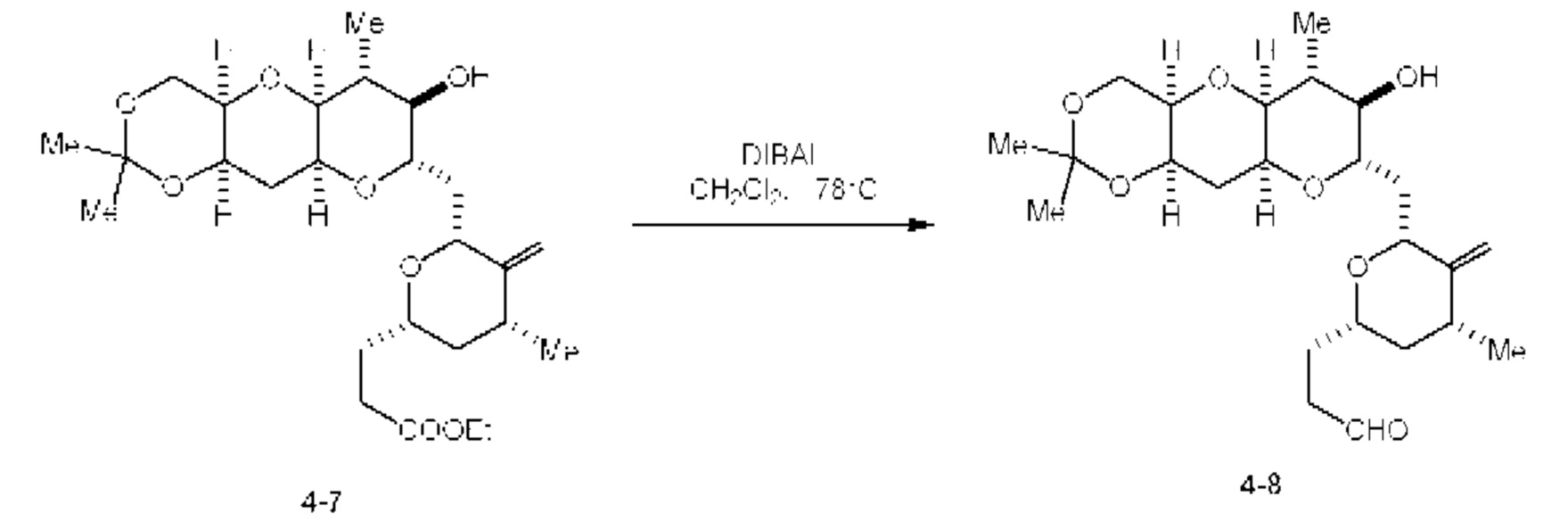
[00740] К перемешанному раствору 4-7 (по расчетам 10,2 ммоль) в СH2Сl2 (200 мл) при -78°С по каплям добавляли DIBAL (22 мл, 22,4 ммоль, 2,2 экв.). После перемешивания в течение 1,5 ч при той же температуре, реакционную смесь гасили добавлением ацетона (0,30 мл) и перемешивали в течение 15 мин при -78°С. Затем, добавляли нас. водн. сегнетову соль, и нагревали смесь до комнатной температуры. После перемешивания в течение 3 ч, смесь разбавляли EtOAc. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток объединяли с другим неочищенным веществом (~400 мг) и очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (5%, 20%, затем 33% EtOAc в гексанах) с получением альдегида 4-8 (4,1 г, 82-90% после 2 стадий) в виде бесцветного аморфного твердого вещества. Реакция с одной загрузкой: К раствору 4-7 (206 мг, 0,427 ммоль, 1 экв.) в CH2Cl2 (8,5 мл) при -78°С по каплям добавляли DIBAL (0,94 мл 1,0 М в гексанах, 0,939 ммоль, 2,2 экв.). После перемешивания в течение 50 мин при той же температуре, реакционную смесь гасили добавлением ацетона (0,30 мл) и МеОН (0,30 мл). Затем, добавляли 20% водн. сегнетову соль, и перемешивали смесь в течение 2 ч при комнатной температуре. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (5%, 20%, затем 33% EtOAc в гексанах) с получением 4-8 (167 мг, 0,381 ммоль, 89%) в виде бесцветного аморфного твердого вещества. 4-8: [α]20D -17,3 (с 1,0, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 9,46 (1H, т, J=1,5 Гц), 4,92 (1H, с), 4,73 (1H, д, J=1,8 Гц), 4,41 (1H, дд, J=5,9 Гц), 4,02 (1H, дд, J=7,6, 4,7 Гц), 3,74 (1H, дд, J=12,3, 2,9 Гц), 3,66 (1H, дд, J=7,6, 4,1 Гц), 3,60 (1H, дд, J=12,3, 3,5 Гц), 3,48 (1H, м), 3,39 (1H, м), 3,32 (1Н, м), 3,27 (1H, м), 3,12 (1H, дд, J=3,5, 3,5 Гц), 2,64 (1H, м), 2,34-2,11 (6Н, м), 1,91 (1H, м), 1,53-1,45 (4Н, м), 1,38 (1H, ддд, J=14,1, 4,7, 4,7 Гц), 1,24 (1H, ддд, J=12,6, 4,4, 2,3 Гц), 1,19 (3Н, с), 1,11 (3Н, д, J=7,6 Гц), 0,89 (3Н, д, J=6,5 Гц), 0,86 (1H, дд, J=24,6, 12,3 Гц) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 201,0, 151,2, 104,8, 98,4, 78,2, 76,6, 75,9, 74,2, 73,8, 70,2, 63,9, 63,2, 63,0, 42,9, 40,38, 40,36, 36,0, 34,5, 33,0, 29,0, 28,4, 19,5, 18,0, 16,4 м.д.. IR (пленка): 3506, 2923, 2852, 1723, 1374, 1112, 1086, 908 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C24H38O7Na, 461,2510; обнаружено, 461,2512.
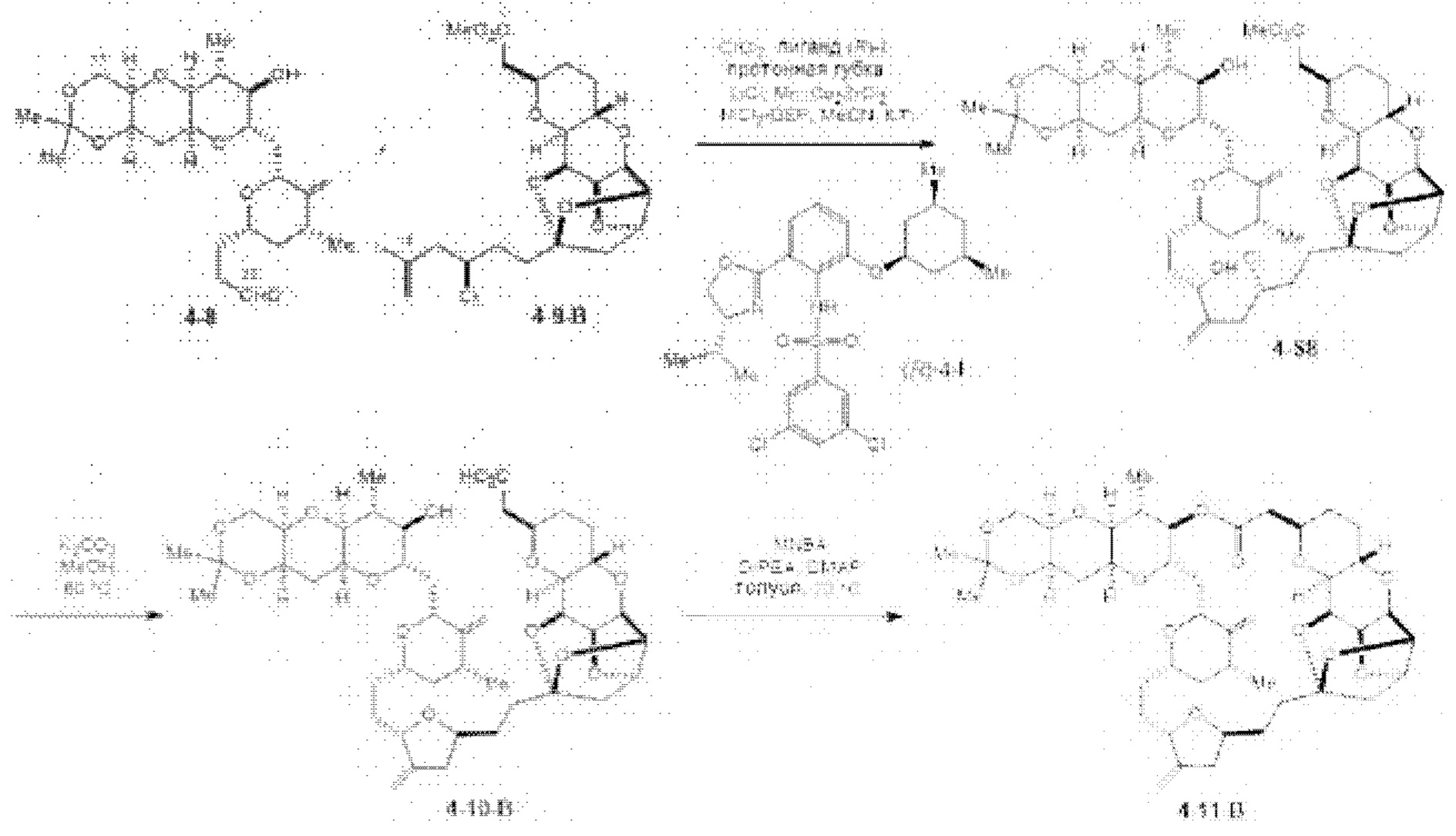
[00741] В перчаточной камере к смеси CrCl2 (46,2 мг, 0,376 ммоль, 10 мол. %), (R)-сульфонамидного лиганда (264 мг, 0,491 ммоль, 13 мол. %) и акцептора протонов (97 мг, 0,453 ммоль, 12 мол. %) добавляли MeCN (9,4 мл), и перемешивали реакционный раствор в течение 1 ч при комнатной температуре. В отдельной колбе, смешивали 4-8 (1,65 г, 3,76 ммоль, 1 экв.), 4-9-В (2,30 г, 4,14 ммоль, 1,1 экв.), DTBMP (1,93 г, 9,40 ммоль, 2,5 экв.), LiCl (319 мг, 7,52 ммоль, 2 экв.), Mn (826 мг, 15,0 ммоль, 4 экв.), Cp2ZrCl2 (2,75 г, 9,40 ммоль, 2,5 экв.) и NiCl2⋅DEP (27,5 мг, 0,0752 ммоль, 2 мол. %), а затем переносили в эту колбу раствор комплекса Cr. После перемешивания в течение 1 ч при комнатной температуре, реакционную смесь удаляли из перчаточной камеры и разбавляли EtOAc (15 мл). Добавляли водн. серинат калия (0,5 М, 15 мл) и нас. NaHCO3 водн. (15 мл). После перемешивания в течение 1 ч, полученную суспензию фильтровали через слой Celite. Органический слой разделяли, водный слой экстрагировали EtOAc и промывали солевым раствором. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением неочищенного диола, который использовали на следующей стадии без дополнительной очистки. К перемешанному раствору неочищенного диола (по расчетам 3,76 ммоль, 1 экв.) в МеОН (75 мл) добавляли K2CO3 (5,2 г, 37,6 ммоль, 10 экв.). Реакционную смесь нагревали до 60°С и перемешивали в течение 15 ч. Затем, добавляли Н2О (7,5 мл). После перемешивания дополнительно в течение 3 ч при той же температуре, смесь охлаждали до комнатной температуры, фильтровали через слой Celite и концентрировали в условиях пониженного давления. К остатку добавляли EtOAc, нас.водн. NH4Cl и солевой раствор. Органический слой разделяли, и экстрагировали водную фазу EtOAc. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением неочищенной секо-кислоты 10-В, которую использовали на следующей стадии без дополнительной очистки. Макролактонизацию тестировали в условиях по Shiina и в условиях по Ямагучи. Макролактонизация по Shiina: К перемешанному раствору MNBA (7,8 г, 22,6 ммоль, 6 экв.) в толуоле (2,5 л) при 70°С добавляли DMAP (5,5 г, 45,1 ммоль, 12 экв.). Раствор неочищенного 4-10-В (по расчетам 3,76 ммоль, 1 экв.) и DIPEA (3,9 мл, 22,6 ммоль, 6 экв.) в толуоле (200 мл) добавляли шприцевым насосом к раствору MNBA в течение 15 ч. После завершения добавления, шприц промывали толуолом (40 мл). После перемешивания дополнительно в течение 30 мин, реакционную смесь охлаждали до комнатной температуры и концентрировали в условиях пониженного давления. Остаток растворяли в CH2Cl2 и последовательно промывали 0,5 М HCl и нас. водн. NaHCO3. Органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (13%, 25%, 33%, 50%, 67%, затем 100% EtOAc в гексанах) с получением 4-11-В (2,19 г, 2,74 ммоль, 73% после 3 стадий) в виде бесцветного твердого вещества. Полученный продукт представлял собой смесь диастереоизомеров по стереоцентру С-20 (диастереоизомерное соотношение = 19:1, определяли методом 1H-ЯМР) Макролактонизация по Ямагучи: К перемешанному раствору неочищенного 4-10-В (по расчетам 0,456 ммоль) в THF (4,6 мл) добавляли NEt3 (0,159 мл, 1,14 ммоль, 2,5 экв.) и 2,4,6-трихлорбензоилхлорид (139 мг, 0,57 ммоль, 1,25 экв.). Смесь перемешивали в течение 2 ч, а затем фильтровали через слой Celite, который промывали толуолом (35,4 мл). В отдельной колбе при 80°С DMAP (334 мг, 2,74 ммоль, 6 экв.) растворяли в толуоле (290 мл, 1,6 мМ). Раствор смешанного ангидрида шприцевым насосом переносили в раствор DMAP в течение 13 ч. Реакционную смесь охлаждали до комнатной температуры и гасили добавлением нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (13%, 25%, 33%, 50%, 67%, затем 100% EtOAc в гексанах) с получением 4-11-В (124 мг, 0,155 ммоль, 34% после 3 стадий) в виде бесцветного твердого вещества. 4-11-В: [α]20D -72,5 (с 1,09, CHCl3). т. пл.: 188-189°С (перекристаллизовывали из CH2Cl2-EtOAc). 1Н-ЯМР (600 МГц, C6D6) δ: 5,22 (1H, ушир. с), 5,08 (1H, д, J=1,8 Гц), 5,00 (1H, ддд, J=10,6, 7,6, 2,9 Гц), 4,94 (1H, с), 4,82 (1Н, дд, J=7,6, 5,3 Гц), 4,76 (1Н, ушир. с), 4,68 (1H, ушир. д, J=10,0 Гц), 4,55 (1H, ддд, J=10,3, 10,3, 4,1 Гц), 4,30 (1H, дд, 3=4,1, 1,8 Гц), 4,17-4,07 (3Н, м), 3,98 (1H, м), 3,90 (1H, дд, J=6,5, 4,7 Гц), 3,85 (1H, ушир. д, J=10,6 Гц), 3,81 (1H, дд, J=11,7, 4,1 Гц), 3,73 (1H, м), 3,69 (1H, дд, J=12,0, 3,8 Гц), 3,65 (1H, дд, J=6,5, 4,1 Гц), 3,58-3,50 (2Н, м), 3,05 (1Н, дд, J=3,3, 3,3 Гц), 2,85 (1H, дд, J=16,4, 7,0 Гц), 2,76 (1H, м), 2,72 (1Н, м), 2,62 (1H, дд, J=9,4, 1,8 Гц), 2,50-2,36 (3Н, м), 2,34-2,22 (3Н, м), 2,22-2,03 (5Н, м), 1,97-1,85 (3Н, м), 1,72 (1H, дддд, J=9,8, 9,8, 9,8, 4,7 Гц), 1,62-1,27 (11Н, м), 1,26-1,21 (6Н, м), 1,06 (1H, дд, J=23,5, 12,3 Гц), 0,97 (3Н, д, J=6,5 Гц) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 171,3, 152,9, 152,7, 110,0, 105,0, 103,8, 98,7, 82,3, 81,0, 78,2, 78,1, 77,3, 76,9, 76,4, 76,1, 75,1, 74,7, 74,3 (х2), 74,0, 70,4, 69,9, 68,5, 64,1, 63,9, 62,4, 48,5, 43,8, 41,5, 39,4, 39,3, 38,8, 36,3, 35,6, 32,5, 32,4, 31,11, 31,09, 30,62, 29,3, 28,5, 20,3, 18,1, 16,4 м.д.. IR (пленка): 2923, 2869, 1725, 1188, 1118, 1086, 755 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C44H62O13Na, 821,4083; обнаружено, 821,4084.
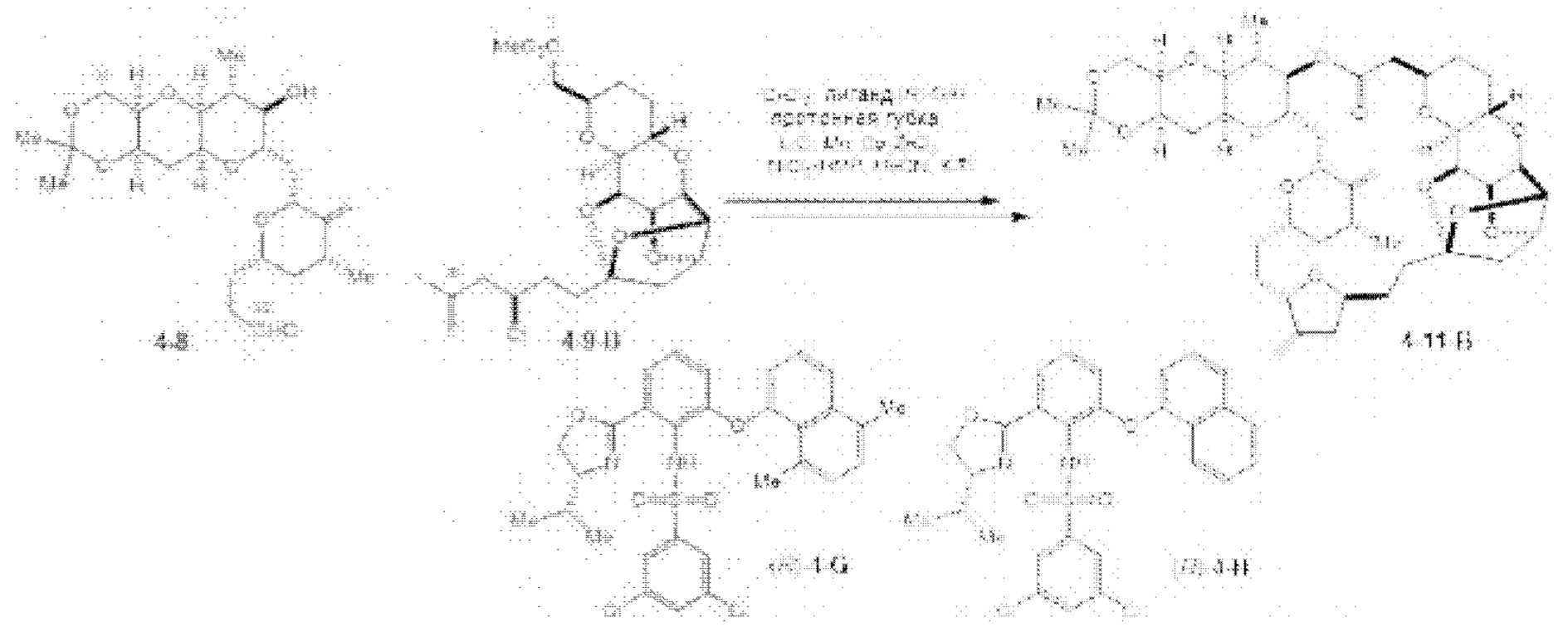
[00742] Ni/Cr-опосредованное сочетание 4-8 с 4-9-В в присутствии Cr-катализатора, полученного из (R)-4-G и (R)-4-H, проводили следующим образом: В перчаточной камере к смеси CrCl2 (7,0 мг, 10 мол. %), сульфонамида (R)-G (43,2 мг, 13 мол. %), акцептора протонов (14,7 мг, 12 мол. %) и LiCl (24,1 мг, 0,57 ммоль, 1,0 экв.) добавляли MeCN (1,4 мл, 0,4 М), и перемешивали в течение 1 ч при к.т. В отдельной колбе смешивали 4-8 (250 мг, 0,57 ммоль, 1,0 экв.), 4-9-В (350 мг, 0,63 ммоль, 1,1 экв.), DTBMP (290 мг, 1,43 ммоль, 2,5 экв.), Mn (125 мг, 2,28 ммоль, 4,0 экв.) и Cp2ZrCl2 (0,42 г, 1,43 ммоль, 2,5 экв.), и затем переносили в эту колбу раствор комплекса Cr. После перемешивания в течение 1 мин, добавляли HMP⋅NiCl2 (2,2 мг, 1 мол. %; допированный в LiCl). Дополнительно добавляли HMP⋅NiCl2 (2,2 мг, 1 мол. %; допированный в LiCl) через 1 и 2 ч, соответственно. Реакционную смесь перемешивали всего в течение 3 ч при к.т. Реакционную смесь удаляли из перчаточной камеры и разбавляли EtOAc (10 мл). Добавляли водный серинат калия (0,5 М, 3 мл) и насыщенный водный NaHCO3 (3 мл). После перемешивания в течение 1 ч, полученную суспензию фильтровали через слой Celite. Фильтрат экстрагировали EtOAc, промывали нас. NaCl, сушили над Na2SO4, фильтровали и концентрировали. С использованием методики, представленной для сочетания с сульфонамидом (R)-4-G, неочищенный продукт преобразовывали до макролактона 4-11-В; таким образом, получали 296 мг 4-11-В (общий выход 65%; диастереоизомерное соотношение = 29:1) из 250 мг 4-8.
[00743] Ni/Cr-опосредованное сочетание с Cr-катализатором, полученным из (R)-4-Н, проводили с использованием той же самой методики; получали 305 мг 4-11-В (общий выход 67%; диастереоизомерное соотношение = 24:1) из 250 мг 4-8.
[00744] Сульфонамиды (R)-4-G, (R)-4-H и (R)-4-1 синтезировали посредством общей схемы, представленной ниже. В качестве примера, ниже представлен синтез (R)-4-G.
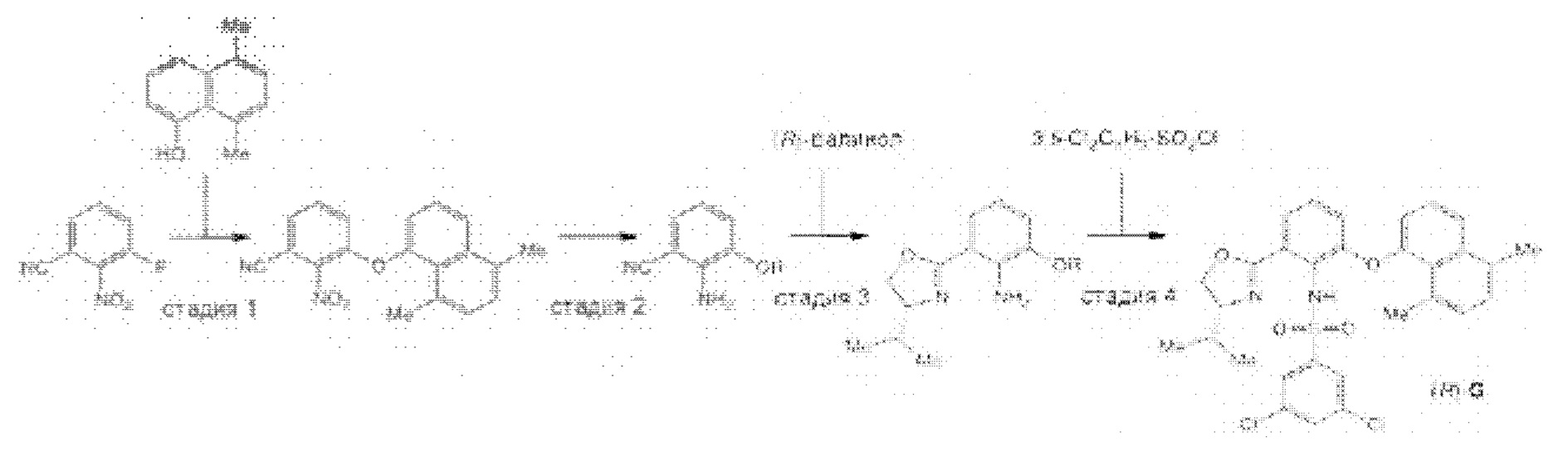
[00745] Стадия 1: К взвеси NaH (5,56 г, 60% в минеральном масле, 140 ммоль, 3,0 экв.) в безводном THF (100 мл) при 0°С при перемешивании в течение 1 ч добавляли 5,8-диметилнафтол (8,00 г, 46,5 ммоль, 1,0 экв.). Затем, шприцем добавляли 3-фтор-2-нитробензонитрил (8,50 г, 51,2 ммоль, 1,1 экв.), растворенный в THF (50 мл). Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 3 ч при комнатной температуре, после чего гасили добавлением воды при 0°С. Органический растворитель (THF) удаляли в вакууме, и экстрагировали взвесь EtOAc (2×100 мл). Объединенные органические слои промывали солевым раствором, водой, сушили над Na2SO4 и фильтровали. Растворитель удаляли в вакууме с получением 16,1 г неочищенного продукта, который очищали методом колоночной хроматографии с использованием смеси EtOAc:гексаны (10:90) с получением чистого красного твердого вещества (12,20 г, 38,4 ммоль, 82%). 1Н-ЯМР (600 МГц, CDCl3) δ: 7,96 (1H, дд, J=8,5, 1,1 Гц), 7,48 (1H, дд, J=8,4, 7,5 Гц), 7,46-7,40 (2Н, м), 7,30-7,24 (1H, м), 7,19 (1H, д, J=7,1 Гц), 7,08 (1H, дд, J=7,5, 1,1 Гц), 6,97-6,91 (1H, м), 2,69 (3Н, с), 2,66 (3Н, с) м.д. 13С-ЯМР (125 МГц, CDCl3) δ: 151,6, 151,5, 142,3, 135,6, 132,7, 130,9, 129,7, 127,7, 126,7, 126,5, 125,3, 123,5, 122,8, 117,6, 113,6, 108,0, 23,6, 20,1 м.д. IR (чистое вещество) ν 2963, 2929, 2242, 1599, 1573, 1442, 1357, 1263, 1135, 997, 908, 824, 793, 750, 729 см-1. HRMS (ESI) рассчит. для C19H14N2O3Na [М+Na]+: 341,0897, обнаружено 341,0903.
[00746] Стадия 2: К раствору полученного выше продукта (12,20 г, 38,4 ммоль, 1,0 экв.) в безводном EtOAc (150 мл) добавляли АсОН (17,5 мл, 307 ммоль, 8,0 экв.), а затем Pd/C (0,61 г, 5,8 ммоль, 0,015 экв.). Подсоединяли баллон с водородом. После перемешивания реакционной смеси в течение 4 ч, взвесь фильтровали через Celite, к фильтрату добавляли смесь солевого раствора и нас.NaHCO3 (1:1), осторожно экстрагировали EtOAc (2×50 мл), органический растворитель удаляли в вакууме, и очищали неочищенный продукт методом колоночной хроматографии с использованием смеси EtOAc:гексаны (5:95) с получением чистого желтого твердого вещества (9,69 г, 33,6 ммоль, выход 88%). 1Н-ЯМР (600 МГц, CDCl3) δ: 7,85 (1H, дд, J=8,5, 1,2 Гц), 7,43 (1H, дд, J=8,5, 7,5 Гц), 7,28-7,23 (1Н, м), 7,18 (1H, дд, J=7,1, 1,0 Гц), 7,13 (1Н, дд, J=7,9, 1,4 Гц), 6,96 (1Н, дд, J=7,6, 1,1 Гц), 6,67 (1Н, дд, J=8,0, 1,4 Гц), 6,59 (1H, т, J=7,9 Гц), 4,74 (1Н, с), 2,75 (3Н, с), 2,68 (3Н, с). 13С-ЯМР (125 МГц, CDCl3) δ: 153,3, 145,5, 141,7, 135,6, 132,5, 131,7, 129,1, 127,4, 126,6, 126,0, 125,4, 121,7, 120,9, 117,8, 117,3, 115,9, 96,7, 23,9, 20,1. IR (чистое вещество) ν 3477, 3366, 2963, 2930, 2218, 1621, 1481, 1232, 1140, 969, 824, 750, 731 см-1.
[00747] Стадия 3: К раствору полученного выше продукта (9,60 г, 33,3 ммоль, 1,0 экв.) в безводном хлорбензоле (80 мл) при комнатной температуре добавляли ZnCl2 (9,09 г, 66.7 ммоль, 2,0 экв.) и (R)-валинол (6,9 г, 66,7, 2,0 экв.). Раствор нагревали с обратным холодильником в течение 30 ч и гасили добавлением воды. Взвесь обрабатывали NH4OH (50 мл) при перемешивании в течение 30 мин и экстрагировали EtOAc (3×50 мл). Объединенные органические слои промывали солевым раствором и водой, сушили над Na2SO4 и фильтровали. Растворитель удаляли в вакууме, и очищали неочищенный продукт методом колоночной хроматографии с использованием смеси EtOAc:гексаны (15:85) с получением чистого светло-желтого твердого вещества (10,43 г, 27,9 ммоль, 84%). [α]D20 -22,9 (с=1,0, CHCl3). 1Н-ЯМР (600 МГц, CDCl3) δ: 7,78 (1H, дд, J=8,5, 1,1 Гц), 7,51 (1H, дд, J=8,1, 1,5 Гц), 7,39 (1H, т, J=8,0 Гц), 7,25 (1H, дд, J=7,1, 0,9 Гц), 7,18 (1H, дд, J=7,2, 1,1 Гц), 6,97-6,92 (1H, м), 6,72 (1H, дд, J=7,8, 1,4 Гц), 6,56 (2Н, т, J=7,9 Гц), 6,51 (1H, с), 4,38 (1H, дд, J=9,5, 8,2 Гц), 4,15 (1H, ддд, J=9,5, 8,1, 6,8 Гц), 4,05 (1H, т, J=8,1 Гц), 2,87 (3Н, с), 2,68 (3Н, с), 1,89-1,78 (1H, м, J=6,6 Гц), 1,08 (3Н, д, J=6,7 Гц), 0,98 (3Н, д, J=6,8 Гц) м.д. 13С-ЯМР (125 МГц, CDCl3) δ: 163,6, 154,8, 144,8, 140,9, 135,5, 132,4, 132,2, 128,7, 127,2, 126,5, 125,5, 124,2, 120,5, 120,1, 115,1, 114,4, 110,2, 73,1, 69,0, 33,3, 24,5, 20,2, 19,1, 18,7 м.д. IR (чистое вещество) ν 3478, 3282, 2958, 1634, 1592, 1551, 1472, 1362, 1228, 1192, 1075, 981, 823, 734 см-1. HRMS (ESI) рассчит. для C24H26Cl2N2O2 [М+Н]+: 375, 2067, обнаружено 375, 2051.
[00748] Стадия 4: К раствору полученного выше продукта (10,41 г, 27,8 ммоль, 1,0 экв.) в безводном пиридине (70 мл) добавляли 5,5-дихлорбензолсульфонилхлорид (10,26 г, 41.8 ммоль, 1,5 эквив.) и DMAP (36 мг, 0,3 ммоль, 0,01 экв.). Раствор перемешивали при комнатной температуре в течение ночи, после чего гасили добавлением воды. Смесь экстрагировали EtOAc (2×50 мл), и промывали объединенные органические слои 1н HCl (3×50 мл), солевым раствором и водой. Органический слой сушили над Na2SO4 и фильтровали. Растворитель удаляли в вакууме с получением неочищенного продукта, который очищали методом колоночной хроматографии с использованием смеси EtOAc:гексаны (15:85) с получением чистого белого твердого вещества (R)-4-G (12,82 г, 22,0 ммоль, 83%). Путем перекристаллизации из смеси EtOAc/гексаны получали 10,31 г белых кристаллов. (R)-4-G: [α]D20 -12,1 (с = 1,0, CHCl3). т.пл. = 138-140°С. 1Н-ЯМР (600 МГц, CDCl3) δ: 12,71 (1H, с), 7,78 (2Н, с), 7,56 (4Н, ушир. с), 7,45-7,42 (2Н, м), 7,19-7,14 (3Н, м,), 7,02 (4Н, с), 7,01-6,97 (4Н, м), 6,90 (2Н, ушир. с), 6,85 (2Н, с), 6,80 (2Н, с), 4,48 (1H, дд, J=9,6, 8,3 Гц), 4,25 (1H, ушир. с), 4,17 (2Н, т, J=8,2 Гц), 2,64 (1,3Н, с), 2,37 (1,7Н, с), 2,18 (3Н, с), 1,92 (1H, м), 1,15 (3Н, с), 1,04 (3Н, с) м.д. 13С-ЯМР (125 МГц, CDCl3) δ: 163,4, 152,1, 150,7, 145,0, 135,4, 134,7, 132,2, 131,3, 130,9, 128,7, 127,0, 126,5, 125,2, 124,8, 124,6, 123,6, 123,1, 122,3, 121,7, 121,0, 118,3, 116,9, 115,9, 72,7, 70,1, 33,3, 23,2, 20,1, 18,8 м.д. IR (чистое вещество) ν 3078, 2959, 2929, 1639, 1571, 1464, 1339, 1265, 1164, 1134, 989, 923, 801, 746, 669, 576 см-1. HRMS (ESI) рассчит. для C30H28Cl2N2O4S [М+Н]+: 583, 1220, обнаружено 583, 1233;
[00749] С использованием той же самой методики синтезировали сульфонамиды (R)-4-Н и (R)-4-I. (R)-4-Н: [α]D20 -9,1 (с = 1,0, CHCl3). т.пл. = 117-119°С. 1Н-ЯМР (500 МГц, CDCl3) δ: 12,77 (1H, с), 7,85-7,78 (1H, м), 7,67-7,59 (2Н, м), 7,59-7,55 (2Н, м), 7,47 (1H, ддд, J=8,2, 6,9, 1,3 Гц), 7,40-7,30 (2Н, м), 7,02 (1H, т, J=8,0 Гц), 6,89-6,82 (3Н, м), 4,49 (1H, дд, J=9,6, 8,3 Гц,), 4,25 (1Н, ддд, J=9,6, 8,1, 6,8 Гц), 4,17 (1H, т, J=8,3 Гц), 1,97-1,86 (1H, м, J=6,8 Гц), 1,15 (3Н, д, J=6,7 Гц), 1,04 (3Н, д, J=6,7 Гц) м.д. 13С-ЯМР (125 МГц, CDCl3) δ 163,5, 150,9, 150,2, 145,3, 134,9, 131,1, 127,7, 126,8, 126,6, 126,1, 125,7, 124,8, 124,7, 124,6, 124,3, 123,9, 121,8, 121,5, 118,4, 114,1, 72,8, 70,3, 33,4, 18,9 м.д. IR (чистое вещество) ν 3076, 2959, 2929, 1639, 1571, 1465, 1389, 1339, 1268, 1165, 1134, 1078, 980, 800, 739, 580 см-1. HRMS (ESI) рассчит. для C28H25Cl2N2O4S [М+Н]+: 555,0907, обнаружено 555,0915. (R)-4-I. [α]D20 +13,4 (с = 1,0, CHCl3). т.пл. = 96-98°С. 1HNMR (600 МГц, CDCl3) δ: 12,27 (1Н, ушир. с), 7,86-7,94 (2Н, м), 7,50-7,54 (1H, м), 7,43 (1H, д, J=7,8, Гц), 7,13 (1H, т, J=8,1 Гц), 7,01 (1H, д, J=8,3 Гц), 4,40-4,48 (1H, м), 4,06-4,20 (3Н, м), 1,83-1,91 (1H, м), 1,79 (1H, ушир. д, J=12,2 Гц), 1,71 (1H, ушир. д, J=12,2 Гц,), 1,55 (1H, м), 1,31-1,43 (2Н, м), 1,10 (3Н, д, J=6,6 Гц), 0,99 (3Н, д, J=6,6 Гц), 0,85 (3Н, д, J=6,8 Гц), 0,87 (3Н, д, J=6,8 Гц), 0,40 (1Н, кв, J=12,0 Гц), 0,25 (1H, кв, J=12,0 Гц), 0,20 (1H, кв, J=12,0 Гц); 13С-ЯМР (125 МГц, CDCl3) δ: 163,4, 150,5, 146,3, 135,3, 131,5, 128,9, 125,2, 124,8, 120,8, 119,1, 117,2, 76,7, 72,6, 69,8, 42,9, 39,1, 39,0, 33,1, 30,4, 30,4, 22,0, 18,7, 18,6. IR (чистое вещество) ν 3079, 2951, 2926, 2869, 1638, 1571, 1467, 1337, 1269, 1165, 1014, 940, 801, 744, 606, 577 см-1. HRMS (ESI) m/z 539,1556 [(M+H)]+; рассчит. для C26H33Cl2N2O4S: 539, 1533].
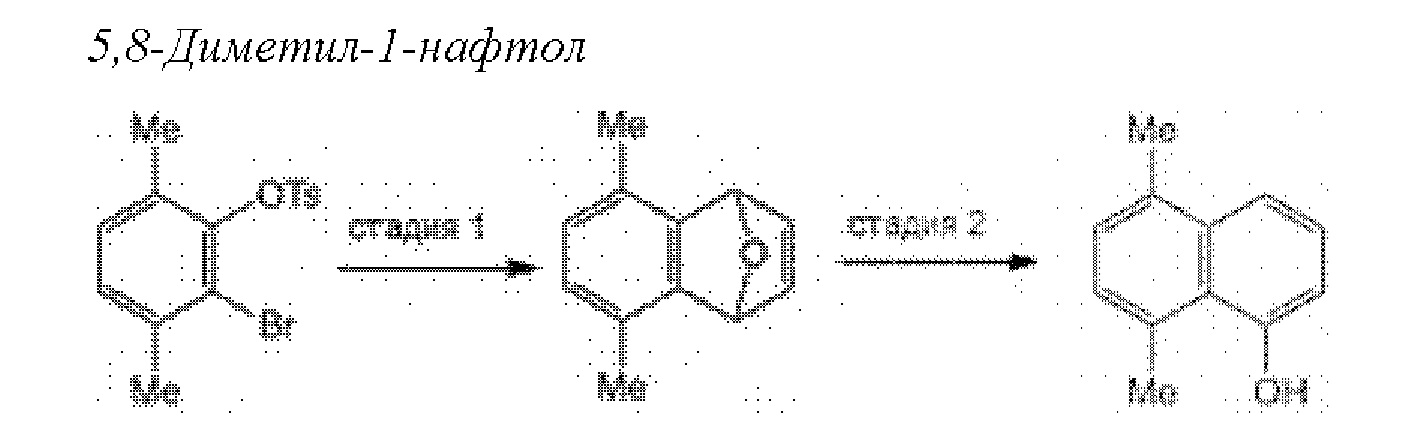
[00750] Стадия 1: Перемешанный раствор бромтозилата (см., например, Velder, J.; Robert, Т.; Weidner, I.; Neudcrfl, J. M. Adv. Synth. Catal. 2008, 350, 1309) (20,0 г, 56,5 ммоль, 1,0 эквив.) и свеже перегнанного фурана (34 мл, 452 ммоль, 8,0 эквив.) в 150 мл THF охлаждали в атмосфере азота до -78°С, и по каплям добавляли H-BuLi (34 мл, 84,7 ммоль, 2,5 М, 1,5 эквив.). Перемешивание продолжали в течение 10 ч, в процессе чего раствор оставляли нагреваться до комнатной температуры (см., например, Jung, K. Y.; Koreeda, М. J. Org. Chem. 1989, 54, 5667). Реакционную смесь гасили добавлением нескольких капель насыщенного водного раствора хлорида аммония. Растворитель упаривали, и поглощали полученный коричневатый остаток 200 мл диэтилового эфира. Эфирный раствор промывали солевым раствором (100 мл) и водой (100 мл), и сушили над безводным Na2SO4. Путем выпаривания растворителя в условиях пониженного давления с последующей очисткой методом колоночной флэш-хроматографии на силикагеле с этилацетатом/гексанами (1:9) в качестве элюента получали аддукт в виде светло-желтого твердого вещества (8,64 г, 50,2 ммоль, 88%). 1Н-ЯМР (600 МГц, CDCl3) δ: 7,03 (2Н, дд, J=1,0, 1,0 Гц), 6,72 (2Н, с), 5,8 (2Н, дд, J=1,0, 1,0 Гц), 2,3 (6Н, с) м.д.
[00751] Стадия 2: К раствору Cu(OTf)2 (0,358 г, 0,99 ммоль) в безводном DCE (10 мл) при 4°С в атмосфере азота добавляли полученный выше аддукт (3,41 г, 19,8 ммоль) в DCE (10 мл). Полученную смесь перемешивали при к.т. до завершения реакции (отслеживание методом TLC). Смесь затем гасили добавлением Н2О (20 мл), экстрагировали CH2Cl2 (50 мл) и сушили над Na2SO4. Полученный тем самым неочищенный продукт очищали методом колоночной флэш-хроматографии на силикагеле с метиленхлоридом/гексанами (2:3) в качестве элюента с получением 5,8-диметил-1-нафтола в виде белого кристаллического твердого вещества (2,67 г, 15,5 ммоль, 77%). т.пл. = 76-78°С; 1Н-ЯМР (600 МГц, CDCl3) δ: 7,55 (1H, дд, J=8,5, 1,1 Гц), 7,33-7,23 (1H, м), 7,17 (1H, дд, J=7,1, 1,0 Гц), 7,09 (1H, дд, J=7,1, 1,0 Гц), 6,75 (1H, дд, J=7,4, 1,1 Гц), 5,19 (1H, с), 2,92 (3Н, с), 2,61 (3Н, с) м.д. 13С-ЯМР (125 МГц, CDCl3) δ: 154,3, 135,5, 132,9, 131,8, 127,7, 126,9, 125,4, 123,8, 117,6, 110,2, 24,8, 20,2 м.д. IR (чистое вещество) ν 3322, 3032, 2930, 2898, 1589, 1461, 1413, 1277, 1240, 1138, 897, 737 см-1.
син,син,син-3,5-Диметилциклогексан-1-ол
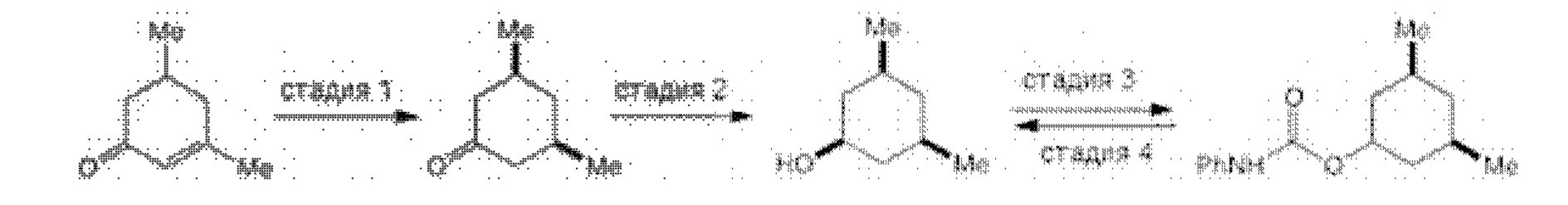
[00752] Стадия 1: К раствору 3,5-диметилциклогексанона (21,0 г, 169 ммоль, 1,0 экв.) в изопропаноле (210 мл) добавляли Pd/C (влажный, Degussa, 5% масс. %; 1,2 г, 8,46 ммоль, 0,05 экв.). Внутреннюю атмосферу заменяли на H2 (баллон). Реакционную смесь перемешивали в атмосфере Н2 (баллон) при комнатной температуре в течение 2 ч. Неочищенную реакционную смесь фильтровали через слой Celite, и разбавляли фильтрат 100 мл воды. Кетон экстрагировали пентаном (3×150 мл). Объединенные органические слои промывали водой (2×100 мл), сушили над Na2SO4 и концентрировали в условиях пониженного давления, с получением 21,3 г неочищенного продукта (соотношение син:анти = 33:1 согласно 1H-ЯМР-анализу). Неочищенный продукт 2 использовали на следующей стадии без дополнительной очистки.
[00753] Стадия 2: К раствору 3,5-диметилциклогексанона (~21,0 г, 0,17 моль, 1,0 экв.) в безводных гексанах (315 мл) добавляли безводный изопропанол (129 мл, 1,70 моль, 10 экв.), а затем при 10°С в атмосфере N2 добавляли металлический натрий (24,4 г, 102 ммоль, 6,00 экв.). Полученный раствор энергично перемешивали при этой температуре, медленно нагревали до комнатной температуры и перемешивали дополнительно в течение 2 ч. Реакционную смесь гасили добавлением водного HCl (100 мл, 3,0 М) при 0°С, разбавляли Et2O (100 мл), и разделяли органический слой. Водный слой экстрагировали Et2O (3×200 мл). Объединенные органические слои сушили над Na2SO4 и концентрировали в условиях пониженного давления с получением 19,1 г неочищенного продукта (диастереоизомерное соотношение составляло >45:1 согласно 1H-ЯМР). Полученный тем самым продукт очищали путем перекристаллизации его фенилуретана.
[00754] Стадия 3: К раствору неочищенного спирта (19,1 г, 149 ммоль, 1 эквив.) в CH2Cl2 (200 мл) добавляли фенилизоцианат (19,4 мл, 179 ммоль, 1,2 эквив.), а затем DMAP (0,98 г, 7,46 ммоль, 0,05 экв.). Полученную смесь перемешивали при комнатной температуре в течение 15 ч. После завершения реакции (согласно TLC), реакционную смесь фильтровали через слой силикагеля и концентрировали в условиях пониженного давления. Неочищенный остаток растворяли в EtOAc и разбавляли большим избытком гексанов. Раствор оставляли отстаиваться в течение ночи при 0°С, и в осадок выпадали белые кристаллы. Кристаллы собирали путем фильтрования и промывали холодными гексанами с получением уретана (31,22 г; общий выход 75% из 3,5-диметилциклогексанона; диастереоизомерное соотношение = ~200:1). т.пл. 95-97°С (справ. 106-107°С)6. 1Н-ЯМР (500 МГц, CDCl3) δ: 7,38-7,34 (2Н, м), 7,28 (2Н, т, J=15 Гц), 7,05 (1H, т, J=15 Гц) 6,52 (1H, ушир.), 4,7 (1H, м), 2,04 (1H, дд, J=3,4 Гц, 3,2 Гц), 1,63 (1H, дт, J1 = 14 Гц, J2 = 1,2 Гц), 1,57-1,52 (2Н, м), 0,96 (2Н, м), 0,94 (6Н, д, J=6,6 Гц), 0,56 (1H, кв, J=12 Гц,). 13С-ЯМР (125 МГц, CDCl3) δ: 153,3, 138,1, 128,9, 123,2, 118,5, 73,9, 42,9, 40,2, 30,6, 22,1. IR (чистое вещество) ν 3313, 2949, 2925, 1702, 1598, 1539, 1442, 1312, 1221, 1052, 751, 691 см-1. HRMS (ESI) m/z. (M+Na)+ рассчит. для C15H21NO2Na, 270, 1484; обнаружено, 270, 1464.
[00755] Стадия 4: Раствор уретана (31,2 г, 126,2 ммоль) в 10% NaOH/MeOH (320 мл) нагревали до 60°С и перемешивали в течение 18 ч при этой температуре. После завершения реакции, реакционную смесь разбавляли EtOAc/гексанами (1:1) и промывали H2O, 1н HCl (3×100 мл) и солевым раствором, сушили и концентрировали. Путем перегонки неочищенного продукта получали чистый син,син,син-3,5-диметилциклогексан-1-ол (14,42 г; бесцветная жидкость; выход 90%). 1Н-ЯМР (500 МГц, CDCl3) δ: 3,60 (1H, м), 1,92 (2Н, м), 1,58 (1H, м), 1,49-1,42 (3Н, м), 0,92 (1H, д, J=7,8 Гц), 0,82 (2Н, кв, J=15 Гц), 0,51(1Н, кв, J=15 Гц) м.д. 13С-ЯМР (125 МГц, CDCl3) δ: 70,3, 44,0, 43,1, 30,7, 22,2 м.д.
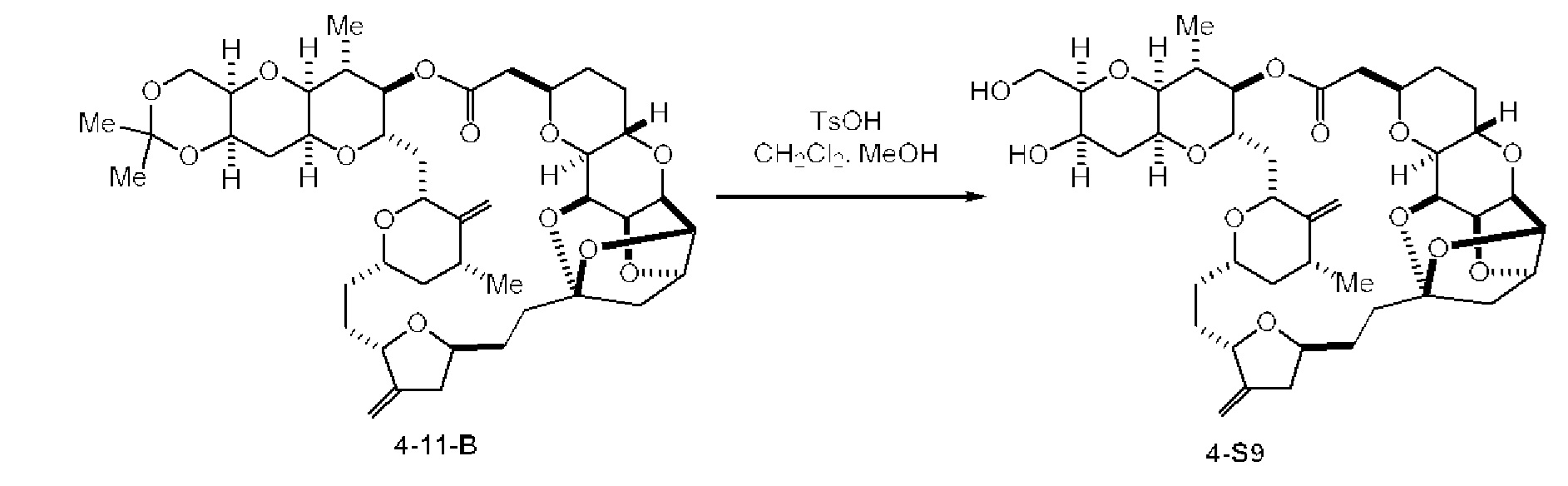
[00756] К перемешанному раствору 4-11-В (1,42 г, 1,78 ммоль, 1 экв., диастереоизомерное соотношение = ~20:1) в CH2Cl2 (8,9 мл) и МеОН (8,9 мл, 0,2 М) при комнатной температуре добавляли TsOH⋅H2O (16,9 мг, 0,089 ммоль, 5 мол. %). После перемешивания в течение 1 ч, реакционную смесь гасили добавлением Et3N (0,1 мл) и концентрировали в условиях пониженного давления. Остаток растворяли в EtOAc и нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением неочищенного диола 4-S9, который использовали на следующей стадии без дополнительной очистки. Для аналитических целей, методом диффузии из паровой фазы получали монокристалл 4-S9 (CH2Cl2-Et2O) (см. Фигура 14В). 4-S9: [α]20D -69,5 (с 1,02, CHCl3). т. пл.: 239-241°С (перекристаллизовывали из CH2Cl2-Et2O). 1Н-ЯМР (600 МГц, CD2Cl2) δ: 5,03 (1H, с), 4,95 (1H, с), 4,84 (1Н, с), 4,81 (1H, с), 4,66 (1H, дд, J=4,5, 4,5 Гц), 4,56 (1H, дд, J=4,5, 4,5 Гц), 2,54 (1Н, дд, J=3,9, 3,9 Гц), 4,38 (1H, д, J=10,2 Гц), 4,33 (1Н, д, J=10,8 Гц), 4,29 (1H, s), 4,23 (1Н, ддд, J=9,9, 9,9, 4,2 Гц), 4,16 (1H, дд, J=5,7, 5,7 Гц), 4,09 (1H, дд, J=7,8, 7,8 Гц), 4,03 (1H, дд, J=6,3, 3,9 Гц), 3,87 (1H, с), 3,84-3,79 (2Н, м), 3,71-3,62 (4Н, м), 3,50-3,43 (2Н, м), 3,64 (1H, дд, J=6,6, 4,2 Гц), 3,32 (1H, с), 2,89 (1H, дд, J=9,3, 1,5 Гц), 2,81-2,77 (1H, м), 2,51 (1H, дд, J=17,1, 9,9 Гц), 2,37 (1Н, дд, J=17,1, 2,1 Гц), 2,35-2,32 (2Н, м), 2,26 (1H, д, J=15,0 Гц), 2,23-2,07 (4Н, м), 2,05-2,03 (1Н, м), 1,96-1,91 (2Н, м), 1,88-1,78 (3Н, м), 1,72-1,65 (2Н, м), 1,56 (1H, ддд, J=12,3, 12,3, 4,8 Гц), 1,51-1,31 (5Н, м), 1,17-1,13 (1H, м), 1,15 (3Н, д, J=7,2 Гц), 1,10-1,03 (1H, м), 1,10 (3Н, д, J=6,6 Гц) м.д. 13С-ЯМР (125 МГц, CD2Cl2) δ: 171,2, 153,2, 152,4, 110,3, 104,7, 104,4, 82,9, 81,7, 80,2, 78,1, 77,6, 77,5, 77,1, 75,9, 75,5, 74,7, 74,5, 74,4, 74,3, 73,9, 73,8, 68,9, 66,1, 64,4, 63,9, 48,8, 44,2, 41,0, 39,2, 37,1, 36,4, 35,9, 35,3, 35,2, 31,9, 31,7, 31,3, 30,8, 29,1, 18,3, 16,9 м.д. FTIR (пленка): 3502, 2926, 2854, 1734, 1189, 1135, 1071, 1020, 995, 753 см-1. HRMS (ESI) m/z: [M+NH4]+ рассчит. для C41H62NO13, 776, 4216; обнаружено, 776, 4230.
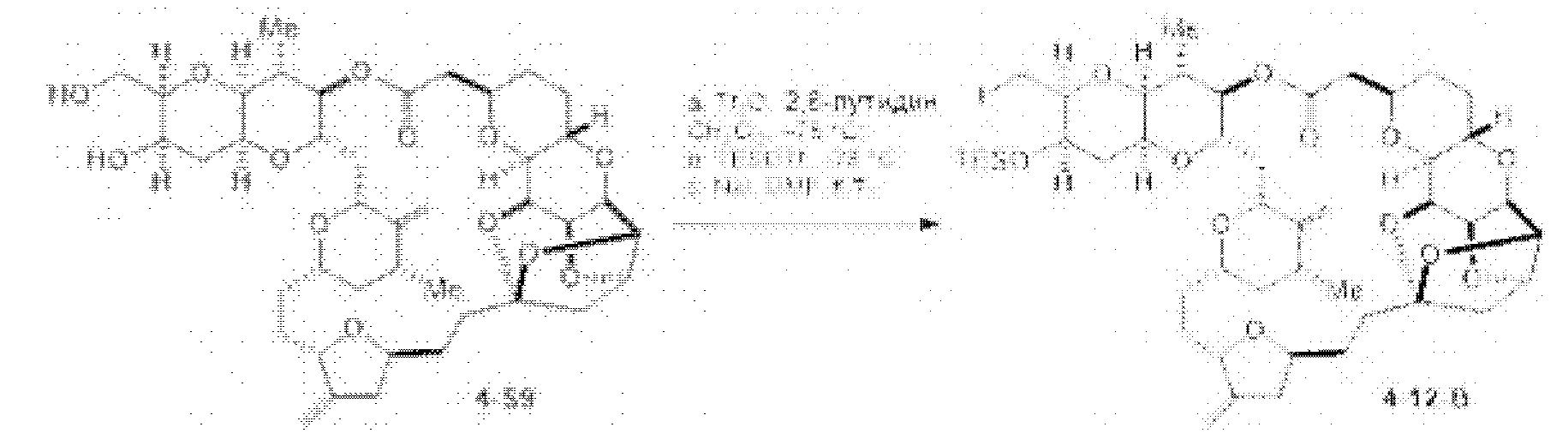
[00757] К перемешанному раствору 4-S9 (неочищ., рассчит. 1,78 ммоль) в CH2Cl2 (17,8 мл) добавляли 2,6-лутидин (1,04 мл, 8,93 ммоль, 5 экв.). Смесь охлаждали до -78°С, а затем добавляли Tf2O (0,36 мл, 2,14 ммоль, 1,2 экв.). После перемешивания в течение 15 мин при той же температуре, добавляли TESOTf (0,60 мл, 2,65 ммоль, 1,5 экв.). Реакционную смесь нагревали до 0°С на бане со льдом. После перемешивания дополнительно в течение 20 мин, к реакционной смеси добавляли DMF (35,6 мл) и NaI (1,33 г, 8,87 ммоль, 5 экв.). Полученную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 2,5 ч. Затем, реакционную смесь гасили добавлением нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой ТВМЕ. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (9%, 13%, 17%, затем 25% EtOAc в гексанах) с получением йодида 4-12-В (1,64 г, 1,67 ммоль, 94% после 2 стадий), который представлял собой смесь С20-эпимера (диастереоизомерное соотношение = ~25:1) в виде бесцветного твердого вещества. С20-эпимер разделяли путем очистки методом HPLC (колонка: DuPont Instruments ZORBAL SIL 21,2 мм × 25 см (880952-101), растворитель: 10% iPrOH в гексанах, скорость потока: 10,0 мл/мин, обнаружение: УФ при 254 нм и 220 нм, tR (целевой) = 19 мин.
tR(С20-эпимер) = 25 мин). 4-12-В: [α]20D -33,2 (с 1,0, CHCl3). т.пл.: 158-160°С (перекристаллизовывали из гексанов-iPrOH). 1Н-ЯМР (600 МГц, C6D6) δ: 5,17 (1Н, с), 5,12 (1H, д, J=1,8 Гц), 4,92 (1 Hm с), 4,78 (3Н, м), 4,67 (1Н, ушир. д, J=10,0 Гц), 4,53 (1H, ддд, J=10,0, 10,0, 4,1 Гц), 4,27 (1H, дд, J=3,5, 1,8 Гц), 4,14 (1H, дд, J=4,7, 4,7 Гц), 4,10 (1Н, дд, J=4,7, 4,7 Гц), 4,06 (1H, м), 4,00 (1H, м), 3,89 (1H, дд, J=6,5, 4,7 Гц), 3,79 (1H, д, J=11,2 Гц), 3,75-3,67 (2Н, м), 3,64 (1H, дд, J=6,5, 4,1 Гц), 3,36-3,28 (3Н, м), 3,20 (1H, ддд, J=6,7, 6,7, 1,8 Гц), 3,03 (1H, дд, J=4,7, 3,5 Гц), 2,78 (1H, дд, J=16,7, 7,3 Гц), 2,71 (1H, м), 2,60 (1Н, дд, J=9,7, 2,1 Гц), 2,41-2,23 (5Н, м), 2,23-1,90 (8Н, м), 1,84 (1H, м), 1,73 (1H, м), 1,58-1,27 (8Н, м), 1,17 (3Н, д, J=7,0 Гц), 1,08 (1H, дд, J=24,1, 12,3 Гц), 1,02 (9Н, т, J=7,9 Гц), 0,99 (3Н, д, J=6,5 Гц), 0,67 (6Н, кв, J=8,2 Гц) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 171,4, 153,0, 152,6, 110,0, 105,0, 103,6, 82,4, 81,0, 80,0, 78,7, 78,0, 77,7, 76,9, 76,1, 75,6, 74,8, 74,7, 74,08, 74,06, 73,9, 70,1, 68,5, 64,9, 64,0, 48,6, 43,9, 41,4, 39,4, 39,3, 39,0, 36,3, 36,2, 35,5, 32,5, 31,1, 30,7, 30,6, 29,0, 18,1 16,6, 73,2, 5,7, 5,4 м.д. IR (пленка): 2951, 2874, 1726, 1087, 1016, 996, 907, 753 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C47H71IO12SiNa, 1005, 3652; обнаружено, 1005, 3649.
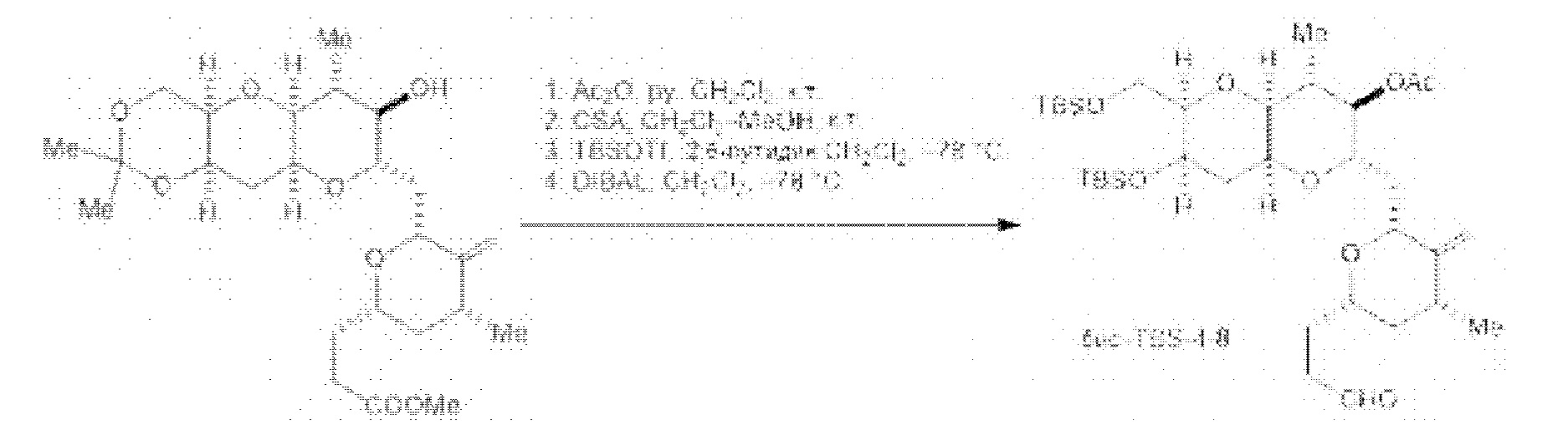
[00758] К перемешанному раствору спирта (1,30 г, 2,77 ммоль) в CH2Cl2 (26 мл) при 0°С добавляли пиридин (1,35 мл, 16,6 ммоль), уксусный ангидрид (0,79 мл, 8,3 ммоль). Реакционную смесь перемешивали в течение 1 ч при комнатной температуре, при 0°С добавляли МеОН, и дополнительно перемешивали в течение 5 ч при комнатной температуре. К реакционной смеси добавляли нас. водн. NaHCO3, и трижды экстрагировали водную фазу CH2Cl2. Объединенные органические фазы сушили над Na2SO4 и упаривали. Неочищенный продукт очищали методом колоночной флэш-хроматографии на силикагеле (3% EtOAc в гексанах) с получением ацетата (1,35 г, 2,64 ммоль, 96%) в виде тусклого масла
[00759] К перемешанному раствору ацетата (1,35 г, 2,64 ммоль, 1 экв.) в CH2Cl2 (26 мл) и МеОН (26 мл) при комнатной температуре добавляли CSA (30,7 мг, 0,089 ммоль, 5 мол. %). После перемешивания в течение 3 ч, реакционную смесь гасили добавлением Et3N (0,2 мл) и концентрировали в условиях пониженного давления. Остаток растворяли в EtOAc и нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Это неочищенный остаток использовали в последующей реакции без дополнительной очистки.
[00760] К смеси спирта (2,644 ммоль, 1 экв.) и 2,6-лутидина (2,2 мл, 18,7 ммоль) в CH2Cl2 (30 мл) при -78°С по каплям добавляли TBSOTf (2,15 мл, 9,3 ммоль), и перемешивали реакционную смесь в течение 30 мин при той же температуре, после чего добавляли нас. водн. NaHCO3. Водную фазу дважды экстрагировали CH2Cl2, объединенные органические фазы сушили над Na2SO4 и концентрировали в условиях пониженного давления. Неочищенное вещество соединяли с насосом высокого вакуума для удаления оставшегося 2,6-лутидина. Полученный остаток очищали методом колоночной флэш-хроматографии на силикагеле (10%, затем 20% EtOAc в гексанах) с получением TBS-эфира (1,83 г, 99% после 2 стадий) в виде тусклого масла.
[00761] К раствору бис-TBS-эфира (1,40 г, 2,0 ммоль, 1 экв.) в CH2Cl2 (20 мл) при -78°С по каплям добавляли DIBAL (5 мл 1,0 М в гексанах, 5 ммоль, 2,5 экв.). После перемешивания в течение 30 мин при той же температуре, реакционную смесь гасили добавлением ацетона (0,30 мл) и МеОН (0,30 мл). Затем, добавляли 20% водн. сегнетову соль, и перемешивали смесь в течение 2 ч при комнатной температуре. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (5%, 20%, затем 33% EtOAc в гексанах) с получением бис-TBS-4-8 (1,105 г, 1,76 ммоль, 88%) в виде бесцветного аморфного твердого вещества. бис-TBS-4-8: [α]20D -22,4 (с=1,0, CDCl3). 1H-ЯМР (600 МГц, C6D6) δ: 9,40 (1H, ушир. с), 4,89 (1H, ушир. с), 4,73 (1H, ушир. д, J=1,9 Гц), 4,29 (1H, кв, J=5,6 Гц), 3,88 (1H, т, J=6,1 Гц), 3,83 (2Н, д, J=6,2 Гц), 3,68 (1H, тд, J=3,5, 1,6 Гц), 3,60 (1H, тд, J=3,7, 2,1 Гц), 3,59-3,50 (1H, м), 3,36 (1H, т, J=5,6 Гц), 3,26 (1H, тд, J=6,2, 1,7 Гц), 3,24-3,18 (1H, м), 3,05 (1H, т, J=2,4 Гц), 2,32-2,25 (1H, м), 2,17-2,05 (4Н, м), 2,00 (1H, дт, J=14,6, 3,4 Гц,), 1,94-1,83 (1H, м), 1,48-1,34 (2Н, м), 1,27 (1H, дт, J=14,5, 3,9 Гц), 1,22-1,17 (1H, м), 1,01 (9Н, с), 1,0 (3Н, д, J=6,0 Гц), 0,97 (9Н, с), 0,86 (3Н, д, J=6,5 Гц), 0,84-0,76 (1H, м), 0,11 (3Н, с), 0,10 (6Н, с), 0,05 (3Н, с). 13С-ЯМР (125 МГц, C6D6) δ: 200,2, 150,8, 128,2, 104,4, 80,9, 78,9, 76,4, 75,7, 74,4, 72,1, 64,2, 63,4, 62,6, 42,4, 39,8, 39,4, 35,6, 35,4, 32,6, 27,9, 25,8, 25,7, 18,2, 18,1, 17,7, 16,2, -4,3, -5,2, -5,3, -5,4. IR (чистое вещество) ν 3518, 2955, 2928, 2855, 1726, 1471, 1462, 1372, 1252, 1092, 836, 755 см-1. HRMS (ESI) рассчит. для C33H63O7Si2 [М+Н]+: 627, 4107, обнаружено 627, 4108.
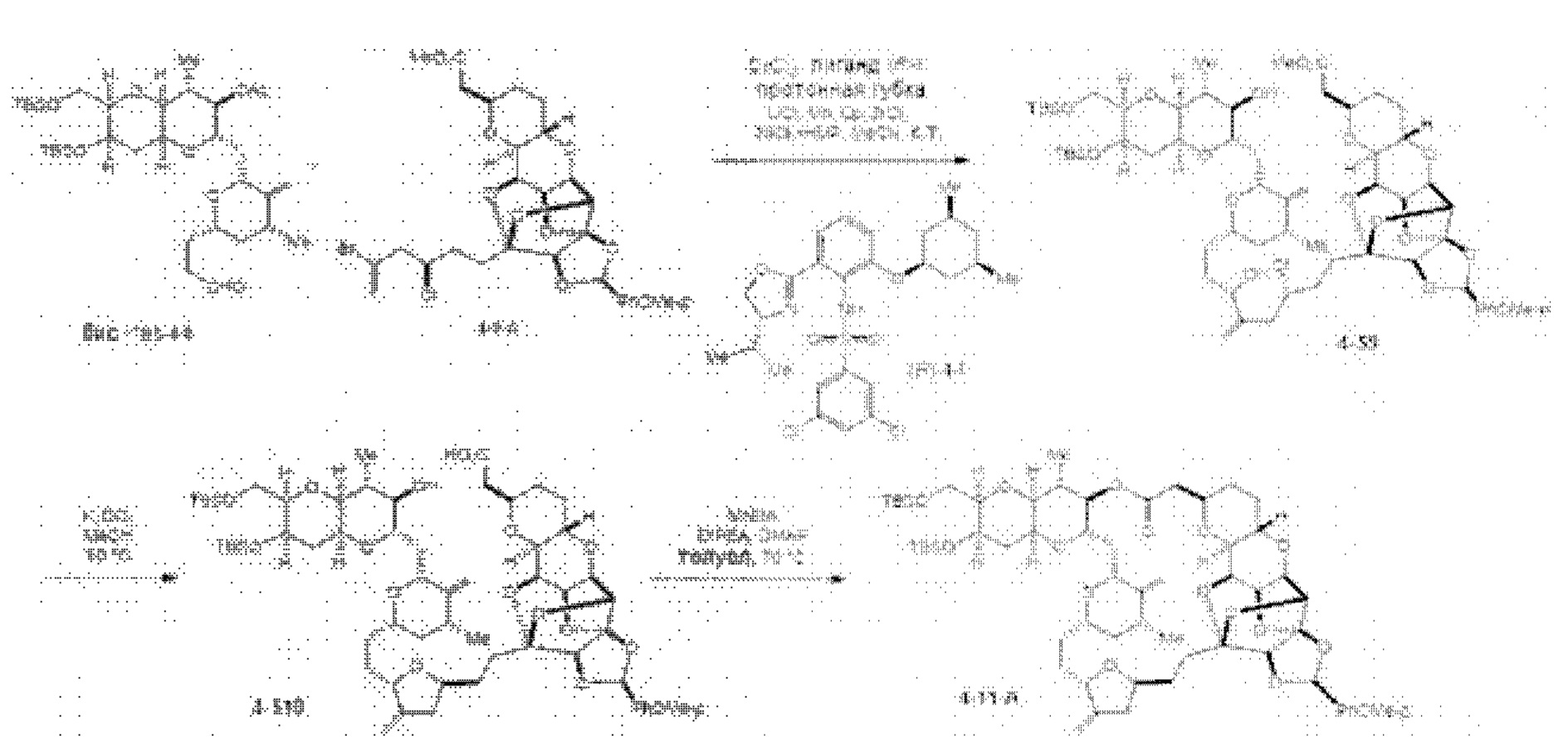
[00762] В перчаточной камере к смеси CrCl2 (3,9 мг, 10 мол. %), сульфонамидного лиганда (R)-I (24,1 мг, 13 мол. %), акцептора протонов (8,2 мг, 12 мол. %) и LiCl (13,2 мг, 0,32 ммоль, 1,0 экв.) добавляли MeCN (0,8 мл, 0,4 М), и перемешивали в течение 1 ч при к.т. В отдельной колбе, смешивали бис-TBS-4-8 (0,20 г, 0,32 ммоль, 1,0 экв.), 4-9-А (0,23 г, 0,35 ммоль, 1,1 экв.), DTBMP (0,16 г, 0,79 ммоль, 2,5 экв.), Mn (70,1 мг, 1,28 ммоль, 4,0 экв.) и Cp2ZrCl2 (0,23 г, 0,79 ммоль, 2,5 экв.), переносил полученный выше раствор комплекса Cr, перемешивали смесь в течение 1 мин, а затем добавляли NiCl2⋅HMP (1,3 мг, 2 мол. %, 0,02 экв., допированный в LiCl). Дополнительно добавляли NiCl2⋅HMP (каждого по 1,3 мг, 2 мол. %, 0,01 экв., дважды, допированный в LiCl) через 1 и 2 ч, соответственно. Полную реакционную смесь перемешивали в течение 3,5 ч при к.т. Реакционную смесь удаляли из перчаточной камеры и разбавляли EtOAc (10 мл). Добавляли водный серинат калия (0,5 М, 2 мл) и насыщенный водный NaHCO3 (2 мл). После перемешивания в течение 1 ч, полученную суспензию фильтровали через слой Celite. Фильтрат экстрагировали EtOAc, промывали нас. NaCl, сушили над Na2SO4, фильтровали и концентрировали. Без проведения дополнительной очистки, неочищенный продукт использовали на следующей стадии.
[00763] К раствору 4-S9 (согласно подсчетам 0,32 ммоль, 1,0 экв.) в МеОН (8 мл) добавляли K2CO3 (0,44 г, 3,2 ммоль, 10,0 экв.). Реакционную смесь нагревали до 60°С и перемешивали в течение 15 ч. Затем, добавляли Н2О (0,4 мл). После перемешивания дополнительно в течение 3 ч при той же температуре, смесь охлаждали до комнатной температуры, фильтровали через слой Celite и концентрировали. Остаток растворяли в EtOAc, нас. NH4Cl и нас. NaCl. Смесь пять раз экстрагировали EtOAc. Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Без проведения дополнительной очистки, неочищенный продукт использовали в последующей реакции.
[00764] К раствору MNBA3 (реагент Shiina, 0,658 г, 1,91 ммоль, 6,0 экв.) в горячем толуоле (200 мл) при 70°С добавляли DMAP (0,47 г, 3,83 ммоль, 12,0 экв.). К реакционной смеси в течение 15 ч посредством шприцевого насоса добавляли раствор карбоновой кислоты S10 (согласно подсчетам 0,32 ммоль, 1,0 экв.) и DIPEA (0,66 мл, 3,83 ммоль, 12,0 экв.) в толуоле (20 мл). После завершения добавления, шприц промывали толуолом (20 мл), и перемешивали дополнительно в течение 30 мин. Реакционную смесь охлаждали до комнатной температуры и концентрировали. Остаток растворяли в CH2Cl2 и последовательно промывали 0,5 М HCl и нас. NaHCO3. Органический слой сушили над Na2SO4, фильтровали и концентрировали. Методом флэш-хроматографии (нейтральный SiO2, гексаны/EtOAc = 40/1, 20/1, 5/1, затем 4/1) получали белое кристаллическое твердое вещество 4-11-А (211 мг, 0,19 ммоль, 54% после 3 стадий). Общую стереоселективность (диастереоизомерное соотношение = 25:1) устанавливали из спектра 1Н-ЯМР полученного 4-11-А.
[00765] В условиях, представленных на стр. S18, проводили Ni/Cr-опосредованное сочетание бис-TBS-4-8 с 4-9-А в присутствии Cr-катализатора, полученного из (R)-4-G и (R)-4-H. Следуя представленной выше методике, неочищенный продукт сочетания преобразовывали до макролактонового ацетонида с определением общего выхода и стереоселективности; сульфонамид (R)-4-H получали из бис-TBS-4-8 (200 мг масштаб) с общим выходом 58% и диастереоизомерным соотношением = 28:1, тогда как сульфонамид (R)-4-G получали из бис-TBS-4-8 (200 мг масштаб) с общим выходом 58% и диастереоизомерным соотношением = 27:1. 11-А: [α]20D -54,8 (с = 1,0, CDCl3). т. пл. = 88-89°С. 1Н-ЯМР (600 МГц, C6D6) δ: 7,31 (2Н, д, J=8,8 Гц), 6,68 (2Н, д, J=8,7 Гц), 6,03 (1H, с), 5,11 (1H, ушир. с), 5,02 (1H, ушир. с), 4,89 (1H, ушир. с), 4,76 4,71 (3Н, м), 4,61 (1H, д, J=10,4 Гц), 4,44 (1H, тд, J=10,5, 10,0, 4,3 Гц), 4,36 (1H, ушир. с), 4,32 (1H, дт, J=5,3, 0,9 Гц), 3,4 (1H, кв, J=3,9 Гц), 3,26 (1H, тд, J=6,2, 1,9 Гц), 3,19 (3Н, с), 3,09 (1Н, дд, J=4,7, 3,1 Гц), 2,72 (1H, дд, J=16,8, 7,7 Гц), 2,62 (1H, ддт, J=15,5, 7,7, 2,4 Гц), 2,48 (1H, дд, J=9,5, 1,8 Гц), 2,35 (1H, дд, J=16,8, 4,4 Гц), 2,32-2,18 (6Н, м),1,97 (1H, дт, J=11,6, 3,9 Гц), 1,88 (1H, ддт, J=14,2, 11,4, 3,1 Гц), 1,77 (1Н, тт, J=13,6, 3,7 Гц), 1,70-1,62 (1H, м), 1,49 (1H, дддд, J=11,9, 7,3, 5,6, 2,5 Гц), 1,43 (2Н, дт, J=12,5, 2,8 Гц), 1,37 (1H, дт, J=14,6, 4,5 Гц), 1,33-1,19 (3Н, м), 1,16 (3Н, д, J=7,3 Гц), 1,14-1,0 (2Н, М), 0,99 (9Н, с), 0,98 (9Н, с), 0,14 (3Н, с), 0,12 (6Н, с), 0,09 (3Н, с) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 170,7, 161,0, 152,6, 152,4, 128,4, 128,3, 118,6, 113,7, 108,9, 108,6, 104,6, 103,4, 89,8, 83,4, 79,7, 78,0, 77,8, 77,4, 75,8, 75,6, 75,4, 74,4, 73,9, 73,6, 73,5, 73,4, 69,7, 68,0, 64,13, 64,09, 63,3, 54,4, 43,7, 40,9, 39,2, 39,0, 38,2, 36,0, 35,3, 31,9, 30,9, 30,5, 29,97, 29,9, 27,3, 26,0, 25,9, 25,8, 18,3, 17,8, 16,4, -4,3, -5,0, -5,3, -5,4 м.д. IR (чистое вещество) ν 2952, 2927, 2855, 1732, 1615, 1518, 1251, 1092, 1010, 834, 775, 756 см-1. HRMS (ESI) рассчит. для C61H92NaO16Si2 [M+Na]+: 1159,7774, обнаружено 1159,7816.
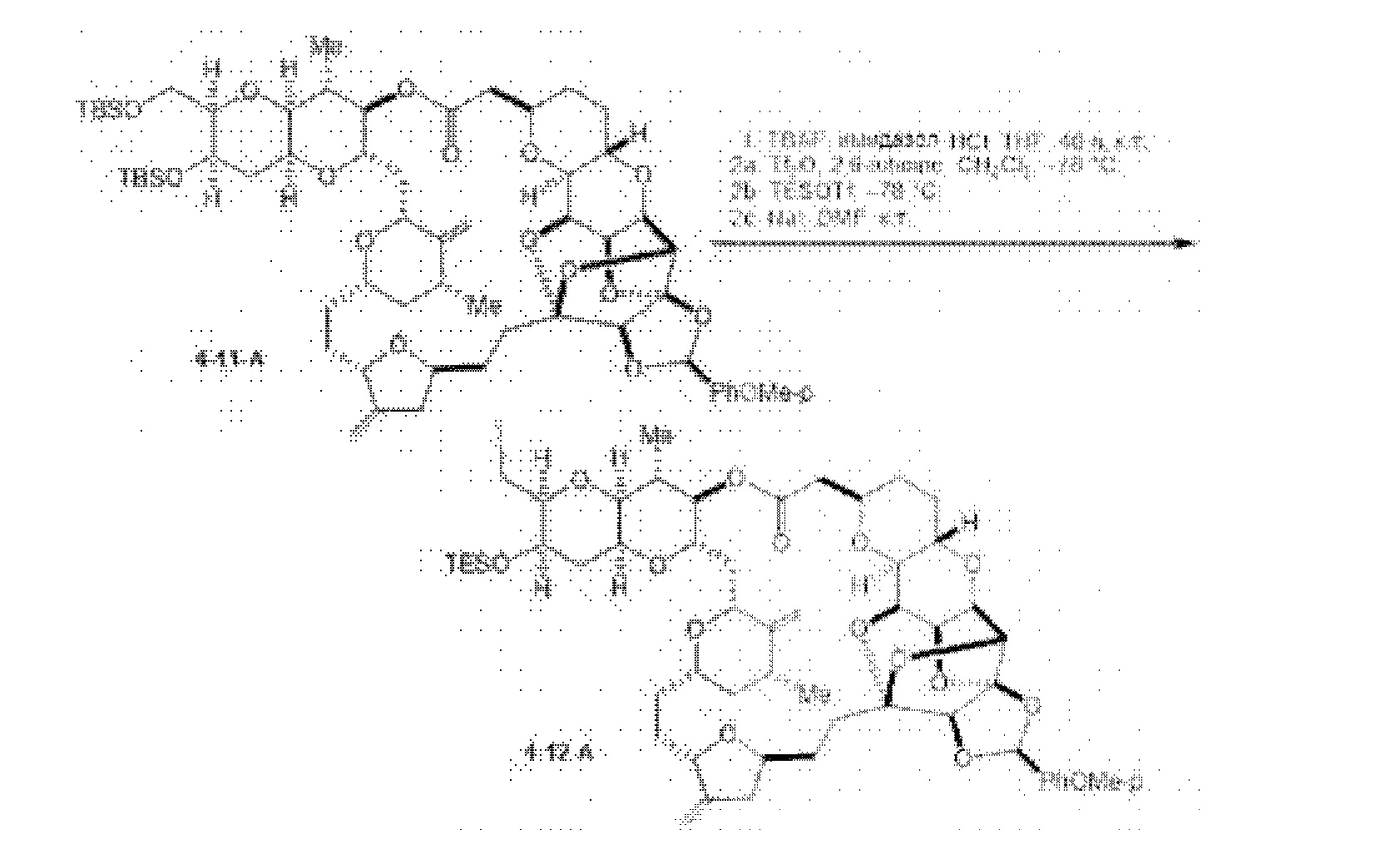
[00766] К раствору 4-11-А (720 мг, 0,633 ммоль) в THF (12,7 мл) при комнатной температуре добавляли раствор TBAF (0,95 М в THF, забуференный 0,5 эквив. имидазола гидрохлорида, 3,2 мл, 3,17 ммоль). После перемешивания в течение 40 ч при комнатной температуре, растворитель удаляли струей газообразного азота, и снова растворяли в EtOAc и воде. Водный слой четыре раза экстрагировали EtOAc, объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали. Без проведения дополнительной очистки, неочищенный продукт использовали в последующей реакции.
[00767] К перемешанному раствору неочищенного диола (согласно подсчетам 0,633 ммоль) в CH2Cl2 (6,3 мл) добавляли 2,6-лутидин (0,733 мл, 6,33 ммоль, 10 экв.). Смесь охлаждали до -78°С, а затем добавляли Tf2O (0,13 мл, 0,760 ммоль, 1,2 экв.). После перемешивания в течение 15 мин при той же температуре, добавляли TESOTf (0,23 мл, 1,01 ммоль, 1,6 экв.). Реакционную смесь нагревали до 0°С на бане со льдом. После перемешивания дополнительно в течение 20 мин, к реакционной смеси добавляли DMF (12,6 мл) и NaI (0,475 г, 3,17 ммоль, 5 экв.). Полученную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 2,5 ч. Затем, реакционную смесь гасили добавлением нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой ТВМЕ. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (9%, 20%, 30%, затем 40% EtOAc в гексанах) с получением йодида 4-12-А (595 мг, 0525 ммоль, 83% после 2 стадий), который представлял собой смесь С20-эпимер (диастереоизомерное соотношение = ~20:1) в виде бесцветного твердого вещества. С20-эпимер разделяли путем очистки методом HPLC (колонка: DuPont Instruments ZORBAL SIL 21,2 мм × 25 см (880952-101), растворитель: 3% iPrOH в гексанах, скорость потока: 10,0 мл/мин, обнаружение: УФ при 254 нм и 220 нм, tR(целевой) = 17 мин. tR(C20-эпимер) = 21 мин). 4-12-А: белое твердое вещество, [α]20D -50,0 (с 0,65, CHCl3). т.пл.: 115-117°С (перекристаллизовывали из H2O-iPrOH). 1Н-ЯМР (600 МГц, C6D6) δ: 7,36 (2Н, д, J=8,8 Гц), 6,73 (2Н, д, J=8,8 Гц), 6,09 (1H, с), 5,17 (1Н, с), 5,11 (1H, д, J=1,2 Гц), 4,94 (1H, с), 4,80-4,77 (3Н, м), 4,66 (1H, ушир. д, J=11,2 Гц), 4,49 (1H, ддд, J=11,2, 11,2, 4,2 Гц), 4,40 (1Н, д, J=1,8 Гц), 4,37 (1H, дд, J=5,4, 1,2 Гц), 4,06 (1H, с), 4,01 (1H, дд, J=6,0, 6,0 Гц), 4,00-3,96 (2Н, м), 3,79 (1H, д, J=11,4 Гц), 3,73-3,68 (3Н, м), 3,36-3,28 (3Н, м), 3,22 (3Н, с), 3,20 (1H, ддд, J=6,6, 6,6, 1,8 Гц), 3,04 (1H, дд, J=4,2, 3,0 Гц), 2,77 (1Н, дд, J=16,2, 7,8 Гц), 2,66-2,62 (1H, м), 2,51 (1Н, дд, J=9,9, 1,5 Гц), 2,39-2,24 (6Н, м), 2,19-1,94 (7Н, м), 1,85-1,82 (1H, м), 1,76-1,71 (1H, м), 1,55-1,27 (6Н, м), 1,18 (3Н, д, J=7,2 Гц), 1,08 (1H, дд, J=12,6, 11,4 Гц), 1,03 (9Н, т, J=7,9 Гц), 1,01 (3Н, д, J=6,5 Гц), 0,70 (6Н, кв, J=8,2 Гц) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 171,2, 161,4, 153,0, 152,6, 119,0, 114,1, 109,3, 109,0, 105,1, 103,7, 90,3, 83,8, 79,8, 78,7, 78,1, 77,9, 76,0, 75,6, 74,7, 74,1, 74,0, 73,8, 73,7, 69,9, 68,4, 64,8, 64,0, 54,8, 44,0, 41,4, 39,4, 39,4, 39,0, 36,4, 36,3, 32,4, 31,1, 30,9, 30,3, 30,2, 27,6, 18,2, 16,6, 7,3(×3), 5,7, 5,3(×3) м.д. IR (пленка): 2953, 2935, 2875, 1731, 1615, 1518, 1251, 1092, 1011, 907, 831 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C55H77IO15SiNa, 1155,3969; обнаружено, 1155,3987.
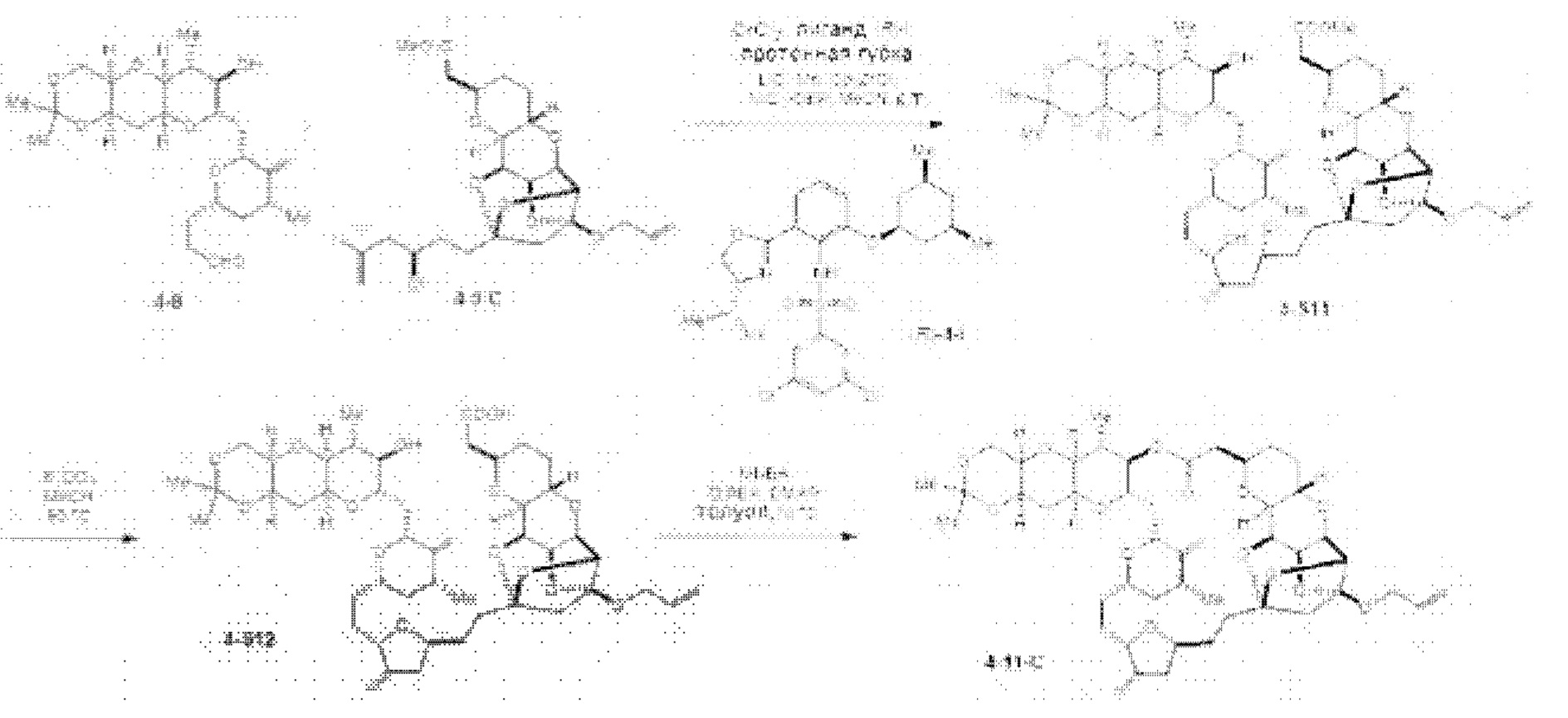
[00768] В перчаточной камере к смеси CrCl2 (7,0 мг, 10 мол. %), сульфонамидного лиганда (R)-4-I (43,2 мг, 13 мол. %), акцептора протонов (14,7 мг, 12 мол. %) и LiCl (24,1 мг, 0,57 ммоль, 1,0 экв.) добавляли MeCN (1,4 мл, 0,4 М), и перемешивали в течение 1 ч при к.т. В отдельной колбе, смешивали 4-8 (0,25 г, 0,57 ммоль, 1,0 экв.), 4-9-С (0,35 г, 0,63 ммоль, 1,1 экв.), DTBMP (0,29 г, 1,43 ммоль, 2,5 экв.), Mn (125 мг, 2,28 ммоль, 4,0 экв.) и Cp2ZrCl2 (0,42 г, 1,43 ммоль, 2,5 экв.), переносили полученный выше раствор комплекса Cr, смесь перемешивали в течение 1 мин, а затем добавляли NiCl2⋅DEP (2,2 мг, 1 мол. %, 0,01 экв., допированный в LiCl). Дополнительно добавляли NiCl2⋅DEP (по 2,2 мг каждого, 1 мол. %, 0,01 экв., дважды, допированный в LiCl) через 1 и 2 ч, соответственно. Полную реакционную смесь перемешивали в течение 3 ч при к.т.Реакционную смесь удаляли из перчаточной камеры и разбавляли EtOAc (10 мл). Добавляли водный серинат калия (0,5 М, 3 мл) и насыщенный водный NaHCO3 (3 мл). После перемешивания в течение 1 ч, полученную суспензию фильтровали через слой Celite. Фильтрат экстрагировали EtOAc, промывали нас. NaCl, сушили над Na2SO4, фильтровали и концентрировали. Без проведения дополнительной очистки, неочищенный продукт использовали на следующей стадии.
[00769] К раствору 4-S11 (согласно подсчетам 0,57 ммоль, 1,0 экв.) в МеОН (10 мл) добавляли K2CO3 (0,79 г, 5,71 ммоль, 10,0 экв.). Реакционную смесь нагревали до 60°С и перемешивали в течение 15 ч. Затем, добавляли Н2О (0,6 мл). После перемешивания дополнительно в течение 3 ч при той же температуре, смесь охлаждали до комнатной температуры, фильтровали через слой Celite и концентрировали. Остаток растворяли в EtOAc, нас. NH4Cl, и нас. NaCl (корректировали до рН=~7 добавлением нескольких капель 1н HCl). Смесь пять раз экстрагировали EtOAc. Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Без проведения дополнительной очистки, неочищенный продукт использовали в последующей реакции.
[00770] К раствору MNBA (1,18 г, 3,43 ммоль, 6,0 экв.) в горячем толуоле (380 мл) при 70°С добавляли DMAP (0,84 г, 6,85 ммоль, 12,0 экв.). Креакционной смеси посредством шприцевого насоса в течение 15 ч добавляли раствор карбоновой кислоты 4-S12 (согласно подсчетам 0,57 ммоль, 1,0 экв.) и DIPEA (1,2 мл, 6,85 ммоль, 12,0 экв.) в толуоле (27 мл). После завершения добавления, шприц промывали толуолом (20 мл), и перемешивали дополнительно в течение 30 мин. Реакционную смесь охлаждали до комнатной температуры и концентрировали. Остаток растворяли в CH2Cl2 и последовательно промывали 0,5 М HCl и нас. NaHCO3. Органический слой сушили над Na2SO4, фильтровали и концентрировали. Методом флэш-хроматографии (нейтральный SiO2, гексаны/EtOAc = 7/1, 5/1, 3/1, 1/1, 1/2, затем 1/3) получали белое кристаллическое твердое вещество 4-11-С (307 мг, 0,36 ммоль, 61% после 3 стадий). Общую стереоселективность (диастереоизомерное соотношение = 17:1) устанавливали из спектра 1Н-ЯМР полученного 4-11-С.4-11-С: [α]20D -52,2 (с=1,0, CDCl3). т.пл. = 157-158°С. 1Н-ЯМР (600 МГц, C6D6) δ: 5,71 (1H, ддт, J=17,3, 10,6, 5,3 Гц), 5,18 (1H, ушир. с), 5,11 (1H, дкв, J=17,3, 1,7 Гц), 5,05 (1H, кв, J=2,2 Гц), 5,02-4,91 (2Н, м), 4,90 (1H, с), 4,77 (1H, дд, J=7,7, 5,0 Гц), 4,72 (1H, д, J=1,8 Гц), 4,62 (1Н, дт, J=10,3, 2,4 Гц), 4,54-4,47 (1H, м), 4,35 (1H, дд, J=4,2, 2,0 Гц), 4,30-4,26 (1H, м), 4,11-4,00 (2Н, м), 3,94 (1H, м), 3,83-3,73 (3Н, м), 3,72-3,62 (м, 3Н), 3,53-3,45 (2Н, м), 3,00 (1H, дд, J=5,1, 4,0 Гц), 2,80 (1H, дд, J=16,5, 7,2 Гц), 2,73-2,63 (2Н, м), 2,53 (1H, дд, J=9,6, 2,1 Гц), 2,46-2,37 (2Н, м), 2,29 (2Н, дт, J=19,4, 7,2, 4,9, 2,1 Гц), 2,25-2,09 (4Н, м), 2,09-1,98 (4Н, м), 1,92-1,80 (2Н, м), 1,75-1,62 (1H, м), 1,56-1,40 (4Н, м), 1,40-1,23 (3Н, м), 1,19 (5Н, д, J=6,9 Гц), 1,02 (1H, тд, J=12,4, 11,0 Гц), 0,93 (2Н, д, J=6,4 Гц) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 170,9, 152,5, 152,3, 134,3, 116,3, 115,9, 108,9, 104,6, 103,4,98,4, 82,9, 77,9, 77,6, 76,9, 75,9, 75,7, 74,7, 74,7, 73,9, 73,7, 73,6, 70,0, 69,5, 68,1, 65,6, 63,7, 63,5, 62,1, 51,3, 43,4, 41,1, 39,0, 38,9, 38,4, 35,9, 35,6, 32,2, 31,9, 30,7, 30,7, 30,1, 28,5, 28,1, 19,8, 17,8, 16,1 м.д. IR (чистое вещество) v 2925, 2867, 1729, 1373, 1311, 1186, 1118, 1073, 995,911, 832, 756 см-1. HRMS (ESI) рассчит. для C47H66NaO14 [M+Na]+: 877, 4345, обнаружено 821, 4353.
[00771] В условиях, представленных на стр. S18, проводили Ni/Cr-опосредованное сочетание бис-TBS-4-8 с 4-9-С в присутствии Cr-катализатора, полученного из (R)-4-G и (R)-4-H. Следуя представленной выше методике, неочищенный продукт сочетания преобразовывали до макролактонового ацетонида с определением общего выхода и стереоселективности; сульфонамид (R)-4-H получали из 8 (250 мг масштаб) с общим выходом 63% и диастереоизомерным соотношением = 20:1, тогда как сульфонамид (R)-4-G получали из 8 (250 мг масштаб) с общим выходом 63% и диастереоизомерным соотношением = 21:1.

[00772] К перемешанному раствору 4-11-С (700 г, 0,819 ммоль, 1 экв., диастереоизомерное соотношение = ~20:1) в CH2Cl2 (8,2 мл) и МеОН (8,2 мл) при комнатной температуре добавляли p-TsOH-H2O (3,1 мг, 0,016 ммоль, 2 мол. %). После перемешивания в течение 1 ч, реакционную смесь гасили добавлением Et3N (0,1 мл) и концентрировали в условиях пониженного давления. Остаток растворяли в EtOAc и нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением неочищенного диола, который использовали на следующей стадии без дополнительной очистки.
[00773] К перемешанному раствору неочищенного диола (согласно подсчетам 0,819 ммоль) в CH2Cl2 (8,2 мл) добавляли 2,6-лутидин (0,57 мл, 4,91 ммоль, 6 экв.). Смесь охлаждали до -78°С, а затем добавляли Tf2O (0,18 мл, 1,1 ммоль, 1,2 экв.). После перемешивания в течение 15 мин при той же температуре, добавляли TESOTf (0,30 мл, 1,31 ммоль, 1,5 экв.). Реакционную смесь нагревали до 0°С на бане со льдом. После перемешивания дополнительно в течение 20 мин, к реакционной смеси добавляли DMF (16,4 мл) и NaI (650 г, 4,43 ммоль, 5 экв.). Полученную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 6 ч. Затем, реакционную смесь гасили добавлением нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой ТВМЕ. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (9%, 13%, 20%, затем 30% EtOAc в гексанах) с получением йодида 4-12-С (689 мг, 0,663 ммоль, 81% после 2 стадий), который представлял собой смесь С20-эпимера (диастереоизомерное соотношение = ~20:1) в виде бесцветного твердого вещества. С20-эпимер разделяли путем очистки методом HPLC (колонка: DuPont Instruments ZORBAL SIL 21,2 мм × 25 см (880952-101), растворитель: 2% iPrOH в гексанах, скорость потока: 10,0 мл/мин, обнаружение: УФ при 254 нм и 220 нм, tR(целевой) = 22,8 мин. tR(C20-эпимер) = 28,0 мин). 4-12-С: бесцветное твердое вещество, [α]20D -46,8 (с 1,0, CHCl3). т.пл.: 84-86°С (перекристаллизовывали из Н2О-iPrOH). 1Н-ЯМР (600 МГц, C6D6) δ: 5,75 (1H, дддд, J=17,3, 10,5, 5,1, 5,1 Гц), 5,15 (1H, ддд, J=17,4, 1,8, 1,8 Гц), 5,14 (1H, с), 5,11 (1H, с), 4,97 (1H, ддд, J=10,2, 1,8, 1,8 Гц), 4,90 (1H, с), 4,77-4,72 (3Н, м), 4,62 (1H, д, J=11,2 Гц), 4,49 (1H, ддд, J=10,2, 10,2, 4,4 Гц), 4,35 (1H, ддд, J=1,8, 1,8, 1,8 Гц), 4,31 (1Н, д, J=4,8 Гц), 4,11 (1H, дд, J=6,6, 4,8 Гц), 4,0-3,97 (1Н, м), 3,83-3,80 (1H, м), 3,74 (1H, д, J=11,4 Гц), 3,72 (1H, ддд, J=5,4, 1,8, 1,8 Гц), 3,70-3,67 (2Н, м), 3,32-3,27 (3Н, м), 3,19 (1H, ддд, J=6,6, 6,6, 1,8 Гц), 3,03 (1H, дд, J=4,8, 3,6 Гц), 2,74 (1H, дд, J=17,4, 7,8 Гц), 2,71-2,67 (1H, м), 2,56 (1Н, дд, J=9,6, 1,8 Гц), 2,33 (1Н, дд, J=16,8, 4,2 Гц), 2,29-2,20 (5Н, м), 2,23-1,97 (8Н, м), 1,93-1,89 (1H, м), 1,72-1,66 (1H, м), 1,53-1,28 (8Н, м), 1,14 (3Н, д, J=7,2 Гц), 1,05 (1H, дд, J=12,6, 10,8 Гц), 1,00 (9Н, т, J=8,4 Гц), 0,98 (3Н, д, J=7,2 Гц), 0,66 (6Н, кв, J=7,8 Гц) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 171,4, 153,0, 152,6, 134,6, 128,3, 116,6, 116,2, 109,3, 105,0, 103,7, 83,3, 79,8, 78,6, 77,9, 77,7, 76,0, 75,6, 75,1, 75,0, 74,7, 74,1, 73,9, 70,0, 68,4, 65,9, 64,9, 63,9, 51,7, 43,9, 41,3, 39,4, 39,3, 38,9, 36,3, 36,2, 35,9, 32,5, 31,1, 30,7, 30,5, 28,5, 18,1, 16,6, 7,3(×3), 5,7, 5,3(×3) м.д. IR (пленка): 2952, 2948, 2875, 1733, 1457, 1338, 1218, 1138, 1073, 831 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C50H75IO13SiNa, 1061, 3914; обнаружено, 1061, 3919.
Синтез левых половин
[00774] Один из центральных вопросов заключался в том, как сконструировать [6,6]-спирокеталь стереоселективным способом. Основываясь на прецедентах, использовали окси-реакцию Михаэля Е→F в щелочных условиях (Фигура 15). Первый прецедент был обнаружен в работе по синтезу полиэфирного антибиотика (-)-А23187 (кальцимицина) (см., например, Negri, D.P.; Kishi, Y. Tetrahedron Lett., 1987, 28, 1063); под воздействием каталитического количества NaOMe, G преобразовывался исключительно до Н, стереохимия которого соответствовала таковой для F.
[00775] Второй прецедент был обнаружен в синтезах галихондрина. В качестве модельного исследования оригинального енонового пути, исследовали окси-реакцию Михаэля на I; при обработке DBU и LiCl в CH2Cl2, из I селективно получали J, который изомеризовался до K при обработке DBU и LiCl в MeCN или DBU и LiBr в CH2Cl2. В качестве альтернативы, K получали непосредственно из I при обработке основанием Хунига, LiBr в CH2Cl2 MeCN. Данные результаты указывают на то, что J представлял собой кинетически контролируемый продукт, тогда как K представлял собой термодинамически контролируемый продукт. Стереохимию J и K устанавливали из NOE-экспериментов; в частности, в J-a выраженный кросс-пик наблюдали между С39-Н и С48-Н, тогда как в K-а выраженный кросс-пик обнаруживали между С40-Н и С48-Н, ср. красные двусторонние стрелки.
[00776] Основываясь на известных из литературы данных относительно A-values (конформационную свободную энергию заместителя) для циклогексана и тетрагидропирана, энергии дестабилизации при 1,3-диаксиальном взаимодействии и энергии дестабилизации при конфигурации «ванна», был сделан несложный расчет относительной стабильности J и K. Предпочтительной конформацией K предположительно является K-а, тогда как для J такой является J-a, J-b или конформер «полуванна» (не показан). Для простоты анализа, использовали конформеры K-а, J-a и J-b. Около структуры, указанной точечной рамкой, все они характеризуются одним и тем же структурным расположением, включая двойную стереоэлектронную стабилизацию. Поэтому, этот структурный фрагмент был исключен из анализа. Как сообщалось, A-value для Ме-группы в 2-положении тетрагидропирана составляет 2,86 ккал/моль, которое приблизительно в 1,6 раз превышает A-value для Ме-группы циклогексана (см., например, Eliel, Е.L.; Hargrave, K.D.; Pietrusiewicz, K.М.; Manoharan, М.J. Am. Chem. Soc. 1982, 104, 3635). Известно, что 1,3-диаксиальное взаимодействие CH2R/ОМе на циклогексане приблизительно равно 1,9 ккал/моль, что будет составлять ~3 ккал/моль (1,6×1,9 ккал/моль) на тетрагидропиране (см., например, Corey, Е.J.; Feiner, N. F. J. Org. Chem. 1980, 45, 765, и процитированные в нем ссылки). В дополнение, была произведена оценка, что конформер «ванна» циклогексана и тетрагидропирана дестабилизируются при 5,5 и 3,9 ккал/моль, соответственно, относительно соответствующего конформера «кресло». Таким образом, мы может предположить, что дестабилизация вследствие конформации «ванна» для J-b будет в диапазоне 3,9-5,5 ккал/моль (см., например, Eliel, Е.L.; Allinger, N.L. Angyal, S.J.; Morrison, G.A. Conformational Analysis; John Wiley: New York, 1965, p 244). Принимая в расчет указанные факторы, K является по предварительным оценкам более энергетически предпочтительным по сравнению с J на 3~4 ккал/моль.
[00777] Для тестирования осуществимости предложенного выше плана синтеза, сначала по двум причинам был изучен синтез 2-пиридилтиоэфира 8. Во-первых, γ-лактон 3 было легко получить из 2, который представлял собой исходное вещество для синтеза структурного элемента С27-С37 и был доступен для получения из D-галакталя (1) в большом количестве (см., например, Chen, C.-L.; Namba, K.; Kishi, Y. Org. Lett. 2009, 11, 409). Во-вторых, 2-пиридилтиоэфир 8 должен был представлять собой хороший субстрат для изучения последующего Zr/Ni-опосредованного однореакторного синтеза кетонов.
[00778] На Фигуре 16 обобщен синтез 8 из γ-лактона 3. Так, γ-лактон 3 был преобразован непосредственно до 5-лактона 4 с отличным общим выходом. Сочетания 4 и 5-5 достигали путем медленного добавления t-BuLi к смеси двух субстратов в THF. Ненасыщенную бензилэфирную группу вводили в 6 в 3 стадии, а именно (1) дигидроксилирования концевого олефина, (2) окислительного расщепления, и (3) реакции Хорнера-Эммонса, с получением 7 с отличным общим выходом. В качестве альтернативы, трансформацию 6 до 7 осуществляли в одну стадию при помощи метатезиса (см., например, Trnka, Т.М.; Grubbs, R.Н. Асc. Chem. Res. 2001, 34, 18; Schrock, R.R. Adv. Syn. Catal. 2007, 349, 41; Hoveyda, A.H.; Zhugralin, A.R. Nature 2007, 450, 243; Araki, M.; Sakata, S.; Takei, H.; Mukaiyama, T. Bull. Chem. Soc. Jpn. 1974, 47, 1777). По причине рентабельности для препаративной цели была выбрана первая трехстадийная методика.
[00779] Поведение 7 в окси-реакции Михаэля было аналогично случаю с преобразованием I до K. При обработке DBU и LiBr в MeCN при комнатной температуре, из 7 сначала получали смесь 2:1 кинетически- и термодинамически-контролируемых продуктов, которая в течение 12 часов при комнатной температуре уравновешивалась почти исключительно до термодинамически контролируемого продукта. В этой трансформации, бензиловый эфир был частично гидролизован, но было обнаружено, что гидролиз бензилового эфира полностью подавлялся добавлением BnOAc. В препаративной работе, при обработке DBU (5 эквив.)/LiBr (10 эквив.)/BnOAc (10 эквив.) из 7 получали целевой термодинамически-контролируемый продукт с отличным общим выходом. Стереохимию продукта окси-реакции Михаэля подтверждали в NOE-экспериментах; выраженный кросс-пик наблюдали между С40-Н и С48-Н. В завершение, в 4 стадии проводили необходимую корректировку функциональных групп, а именно (1) снятие защитной МРМ группы с С41, (2) введение защитной TES группы на полученный спирт, (3) дебензилирование, и (4) образование тиоэфира. Полученный тем самым 2-пиридилтиоэфир 8 был полностью охарактеризован и был обнаружен стабильным при хранении при -20°С в темноте. Общий выход 8 из 3 составил >50% в 5-г масштабе получения.
[00780] На Фигуре 17 обобщен синтез левой половины в галихондриновом ряду. Этот синтез был разработан на основе знания, полученного при синтезе структурного элемента С38-С52, обсуждавшегося в предыдущем разделе, в комбинации с оригинальным синтезом левой половины галихондрина В. Эпокси-γ-лактон 9 синтезировали из L-гулоно-γ-лактона способом, описанным в 1992 году (см., например, Buszek, K.R.; Fang, F.G.; Forsyth, С.J.; Jung, S.Н.; Kishi, Y.; Scola, P.M.; Yoon, S.K. Tetrahedron Lett. 1992, 33, 1553), тогда как цис-винилйодид 5-10 получали из коммерчески доступного (S)-глицидола в 4 стадии. Затем, 9 и 10 сочетали с использованием стандартной Cu-опосредованной химии. С использованием 1,8 эквивалента 10, γ-лактон 11 выделяли с выходом 81%. Гомоаллильный спирт в 11 эпоксидировали VO(TMHD)2-опосредованным методом по Sharpless, с последующей TES-защитой С48 положения спирта с получением из 11 эпокси-γ-лактона 12 с общим выходом 85% и стереоселективностью >50:1 (см., например, Sharpless, K.В.; Michaelson, R. С. J. Am. Chem. Soc. 1973, 95, 6136). Последующее сочетание 12 с 5 наилучшим образом достигается путем добавления t-BuLi к смеси субстратов в THF с получением 13 с выходом 85%, который существует в виде смеси кетола (основной) и кетоспирта (минорный). Было обнаружено, что среди протестированных кислот (PhO)2P(=O)OH является наиболее эффективной в облегчении раскрытия внутримолекулярного эпоксикольца защищенным спиртом по положению С47. С незначительными модификациями трансформации, отраженной на Фигуре 16, 14 преобразовывали до левой половины 17. Так, концевой олефин 14 преобразовывали до ненасыщенного бензилового эфира 16. В этом ряду, было необходимо снятие защитной группы с С48 положения спирта; при обработке (PhO)2Р(=O)ОН две группы TES в 14 селективно удалялись с получением 15.
[00781] Ненасыщенный бензиловый эфир 15 подвергали окси-реакции Михаэля в условиях оптимизированных с 7 (Фигура 16) с получением целевого продукта 16 с выходом 86%. Было обнаружено, что стереохимическое поведение 16 в окси-реакции Михаэля было сходным с поведением 7, включая общую стереоселективность и уравновешивание кинетически контролируемого продукта до термодинамически контролируемого продукта. Тем не менее, в этом ряду один минорный побочный продукт выделяли с выходом ~8%. Спектроскопический анализ (HRMS, 1Н- и 13C-NMR, IR) навел на мысль, что этот продукт представляет собой 18, который получается, по-видимому, посредством атаки ненасыщенного бензилового эфира карбоанионом, ср. красная стрелка в L. Структурная информация относительно 18 сразу предположила возможность устранения или подавления образования побочного продукта с использованием органокатализаторов, о которых сообщалось Asano, Matsubara и сотр. (см., например, Yoneda, N.; Fukata, Y.; Asano, K.; Matsubara, S. Angew. Chem. Int. Ed, 2015, 54, 15497). Действительно, добавление нехиральной тиомочевины М дало ожидаемый эффект с получением смеси 2:1 двух диастереоизомеров без наличия 18. В принципе, хиральная тиомочевина должна усиливать преимущественное образование одного из двух диастереоизомеров. Однако на практике, индукция асимметрии с хиральными органокатализаторами была лишь умеренной. Так, смесь 2:1 подвергали условиям уравновешивания с получением из 15 почти исключительно 16 с общим выходом 93%. Очевидно, уравновешивание происходило посредством обратной окси-реакции Михаэля/окси-реакции Михаэля. Однако примечательно, что на стадии уравновешивания не образовывалось обнаруживаемого количества 18. По сравнению с 7, 15 структурно характеризуется одной дополнительной свободной гидроксильной группой в положении С51. Эта дополнительная свободная гидроксильная группа может влиять на общий выход в окси-реакции Михаэля, поскольку она проводится в щелочных условиях. Тем не менее было продемонстрировано, что субстрат с С51-спиртом, защищенным TBS, в действительности проявляет профили реакционной способности, фактически идентичные таковым для 15. В завершение, левую половину 17 в галихондринов ом ряду получали без осложнений из 16 с общим выходом 82%.
[00782] На Фигуре 18 обобщен синтез левой половины в гомо галихондринов ом ряду. Как и в прошлом случае, был основан на знании, полученном в предыдущей работе (см., например, Fang, F.G.; Kishi, Y.; Matelich, M.С.; Scola, P.M. Tetrahedron Lett. 1992, 33, 1557). Синтез начинался с γ-лактона 3, который трансформировали до 21 через 20 стандартными синтетическими операциями. Для стереоселективного введения фрагмента С53-С55 использовали асимметрическое эпоксидирование по Шарплессу (см., например, Katsuki, Т.; Sharpless, K.В. J. Am. Chem. Soc. 1980, 102, 5974). А именно, путем асимметрического эпоксидирования аллильного спирта 21 с последующей обработкой кислотой получали триол 22 с отличным общим выходом. Основываясь на абсолютной стереохимии эпоксида, введенного посредством асимметрического эпоксидирования по Sharpless, стереохимию 22 определяли соответствующей, что подтверждали рентгеновским анализом его моно-3,5-динитробензоата по положению С55. Этот эксперимент доказал стереохимию по С53/С54, ранее предложенную по результатам ЯМР-анализа для гомогалихондринов. Триол 22 преобразовывали до δ-лактона 23, а затем до ненасыщенного бензилового эфира 24 с хорошим общим выходом. Общее поведение 24 во внутримолекулярной окси-реакции Михаэля с конструированием [6,6]-спирокеталя было аналогично поведению, наблюдавшемуся для 15. В завершение, 2-пиридилтиоэфир 26 был защищен от 25, как и ранее.
[00783] На Фигуре 19 обобщен синтез левой половины в нор галихондриновом ряду. Этот синтез проводили, как и в предыдущих случаях, с двумя модификациями. Во-первых, концевой С53 в нор галихондринов ом ряду представлял собой карбоновую кислоту, которую вводили посредством окисления первичного спирта, селективно полученного из 29. Во-вторых, для защиты спирта в положении С50 выбирали группу TES. Примечательно, было обнаружено, что поведение ненасыщенного бензилового эфира 28 в трансформации при окси-реакции Михаэля фактически идентично поведению для 7. Синтезированный тем самым 2-пиридилтиоэфир 32 был выделен методом хроматографии на нейтральном силикагеле и полностью охарактеризован.
Экспериментальные методики для синтеза левых половин
Аналоги галихондрина
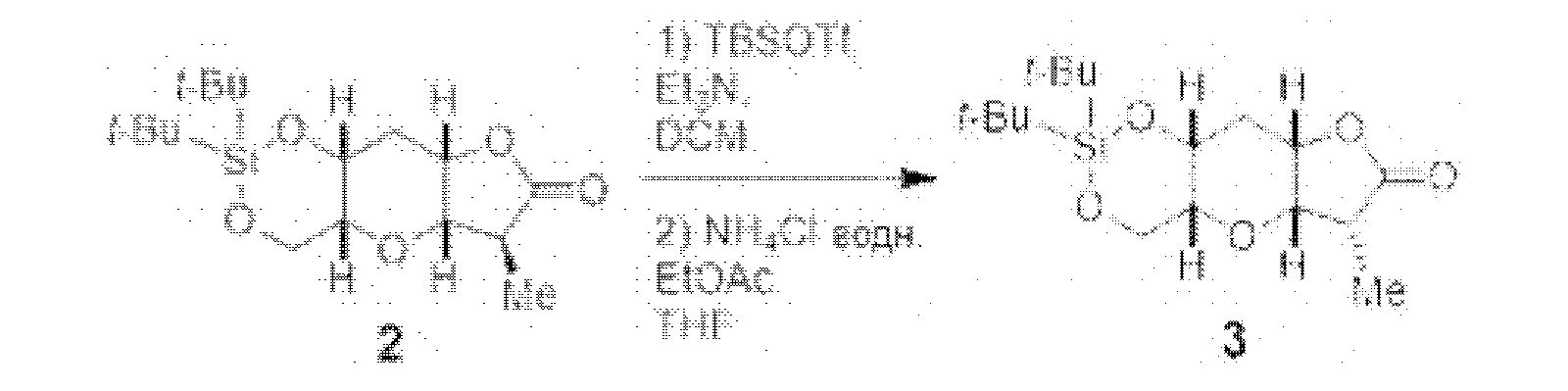
[00784] К перемешанному раствору лактона2 (10,0 г, 29,2 ммоль, 1 экв.) и Et3N (20,0 мл, 143 ммоль, 5,0 экв.) в CH2Cl2 (100 мл) при 0°С добавляли TBSOTf (17,0 мл, 74,0 ммоль, 2,5 экв.). После перемешивания в течение 3 ч при комнатной температуре, реакционную смесь гасили добавлением нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой CH2Cl2. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество использовали в последующей реакции без дополнительной очистки.
Неочищенный силиленоловый эфир (по расчетам 29,2 ммоль, 1 экв.) растворяли в смеси EtOAc (200 мл), THF (30 мл) и нас. водн. NH4Cl (300 мл). После перемешивания в течение 3 ч при 50°С, смесь охлаждали до комнатной температуры. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Неочищенный лактон перекристаллизовывали из CH2Cl2/гексанов с получением лактона 3 (9,68 г после 1-ой перекристаллизации и 300 мг после 2-ой перекристаллизации: всего 9,98 г, 29,1 ммоль, 100% после 2 стадий) в виде бесцветного кристаллического вещества.
Полученные спектроскопические данные соответствовали данным, ранее сообщавшимся в литературе.

[00785] К перемешанному раствору 3 (4,3 г, 12,6 ммоль, 1 экв.) в CH2Cl2 (63 мл) при -78°С добавляли раствор DIBAL (16,4 мл, 1,0 М в гексанах, 16,4 ммоль, 1,3 экв.). После перемешивания в течение 40 мин, реакционную смесь гасили добавлением МеОН при той же температуре. Затем, добавляли 10% водн. сегнетову соль. Смесь перемешивали в течение 2 ч при комнатной температуре с получением прозрачной двухфазной смеси. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением неочищенного лактола, который использовали на следующей стадии без дополнительной очистки. К суспензии Ph3PCH3Br (18,0 г, 50,4 ммоль, 4 экв.) в THF (50 мл) при 0°С добавляли t-BuOK (4,24 г, 37,8 ммоль, 3 экв.). Раствор неочищенного лактола (по расчетам 12,6 ммоль) в THF (13 мл) добавляли к реакционной смеси, и затем удаляли баню со льдом. После перемешивания в течение 1,5 ч при комнатной температуре, реакционную смесь гасили добавлением нас.водн. NH4Cl. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток растворяли в гексанах-EtOAc (10:1) и пропускали через слой силикагеля (9% EtOAc в гексанах) с получением S-1 (4,15 г, 12,1 ммоль, 96% после 2 стадий) в виде бесцветного твердого вещества. S-1: [α]20D -36,8 (с 1,14, CHCl3). т.пл.: 90-93°С (перекристаллизовывали из гексанов). 1Н-ЯМР (600 МГц, C6D6) δ: 6,19 (1H, ддд, J=17,3, 10,6, 6,7 Гц), 5,20-5,11 (2Н, м), 4,13 (1H, д, J=12,3 Гц), 3,93 (1H, дд, J=2,9, 2,9 Гц), 3,84 (1H, дд, J=12,3, 2,9 Гц), 3,71 (1H, д, J=10,6 Гц), 3,58 (1H, м), 3,00 (1H, м), 2,74 (1Н, д, J=9,4 Гц), 2,64 (1H, д, J=2,9 Гц), 2,18 (1H, ддд, J=14,7, 2,9, 2,9 Гц), 1,18 (9Н, с), 1,15 (1H, ддд, J=14,7, 3,2, 3,2 Гц), 1,08 (3Н, д, J=6,5 Гц), 1,05 (9Н, с) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 142,6, 113,5, 85,5, 76,5, 69,7, 68,6, 64,2, 38,6, 36,9, 27,9, 27,5, 23,3, 20,6, 15,0 м.д. FTIR (пленка): 3503, 2960, 2933, 2858, 1474, 1132, 1091, 1022, 950, 908, 844, 825, 766, 651 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C18H34O4SiNa, 365,2119; обнаружено, 365,2116.

[00786] При комнатной температуре S-1 (4,66 г, 13,6 ммоль, 1 экв.) растворяли в растворе 9-BBN (68 мл 0,5 М в THF, 34 ммоль, 2,5 экв.). После перемешивания в течение 1,5 ч при той же температуре, добавляли H2O (68 мл) и NaBO3⋅H2O (20,4 г, 204 ммоль, 15 экв.). После перемешивания в течение 2 ч при той же температуре, реакционную смесь фильтровали через бумагу для фильтрования. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной флэш-хроматографии на силикагеле (9%, 25%, затем 50% EtOAc в гексанах) с получением S-2 (4,94 г, 13,7 ммоль, колич.) в виде бесцветного аморфного твердого вещества. S-2: [α]20D -7,6 (с 1,01, CHCl3). 1H-ЯМР (600 МГц, C6D6) δ 4,33 (1H, м), 4,16 (1H, дд, J=12,3, 2,4 Гц), 4,11 (1H, м), 3,67 (1H, ушир. с), 3,63 (1H, дт, J=10,7, 6,4, 6,4 Гц), 3,59-3,45 (2Н, м), 3,27 (1H, м), 2,95 (1H, д, J=9,4 Гц), 2,26 (1H, дт, J=14,7, 2,9 Гц), 2,02 (1H, м), 1,93 (1H, ушир.), 1,70 (1H, дддд, J=13,6, 6,6, 6,6, 6,6 Гц), 1,65 (1H, дт, J=14,7, 2,9, 2,9 Гц), 1,51 (1H, м), 0,95 (9Н, с), 0,94 (9Н, с), 0,86 (3Н, д, J=7,0 Гц). 13С-ЯМР (125 МГц, C6D6) δ: 86,3, 76,6, 69,7, 68,5, 64,3, 61,1, 38,3, 36,9, 32,2, 27,9, 27,4, 23,3, 20,5, 16,6 м.д. FTIR (пленка): 3525, 2933, 2859, 1473, 1145, 1091, 1053, 1023, 954, 869, 839, 826, 764, 651, 447 см-1. HRMS (ESI) m/z: [М+Н]+ рассчит. для C18H37O5Si, 361,2405; обнаружено, 361,2415.

[00787] К перемешанному раствору S-2 (по расчетам 13,6 ммоль) в CH2Cl2 (136 мл) добавляли NaHCO3 (11,4 г, 136 ммоль, 10 экв.). Смесь охлаждали до 4°С, а затем добавляли PhI(ОАс)2 (13,1 г, 40,8 ммоль, 3 экв.) и TEMPO (213 мг, 1,36 ммоль, 10 мол. %). После перемешивания в течение 15 ч при той же температуре, реакционную смесь гасили добавлением 10% Na2S2O3 водн. и нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной флэш-хроматографии на силикагеле (0%, 9%, 17%, затем 33% EtOAc в гексанах) с получением 4 (4,68 г, 13,1 ммоль, 97% после 2 стадий) в виде бесцветного твердого вещества. 4: [α]20D -12,7 (с 2,29, CHCl3). т.пл.: 147-150°С (перекристаллизовывали из гексанов-EtOAc). 1H-ЯМР (600 МГц, C6D6) δ 4,11 (1H, дд, J=12,9, 1,2 Гц), 3,96 (1Н, дд, J=12,6, 3,2 Гц), 3,89 (1H, м), 3,43 (1Н, м), 2,55 (1H, м), 2,53 (1H, м), 2,43 (1H, дд, J=17,0, 13,5 Гц), 2,28-2,20 (2Н, м), 1,29 (1Н, м), 1,21 (9Н, с), 1,13-1,07 (10Н, м), 0,76 (3Н, д, J=6,5 Гц). 13С-ЯМР (150 МГц, C6D6) δ: 169,0, 77,1, 75,0, 73,3, 68,0, 66,5, 35,9, 33,9, 31,3, 28,1, 27,2, 23,4, 20,4, 16,7 м.д. FTIR (пленка): 2933, 2857, 1727, 1474, 1364, 1180, 1136, 1109, 1045, 976, 829, 770, 645, 443 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C18H32NaO5Si, 379,1911; обнаружено, 379,1912.
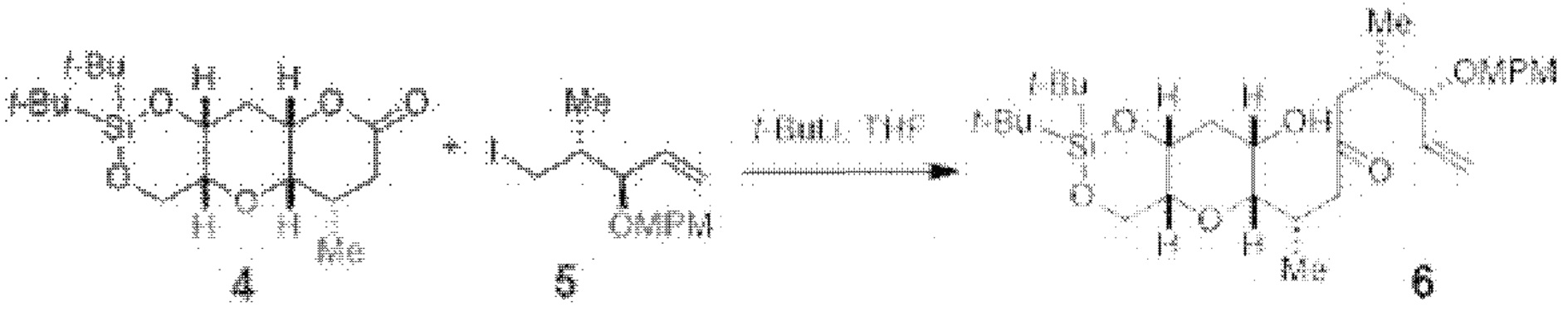
[00788] Раствор 4 (1,0 г, 2,80 ммоль) и 5 (1,36 г, 3,93 ммоль, 1,4 экв.) в THF дегазировали путем барботирования Ar. К раствору при -78°С в течение 10 мин по каплям добавляли раствор t-BuLi (4,23 мл 1,7 М в пентане, 7,29 ммоль, 2,6 экв.). После перемешивания в течение 15 мин при той же температуре, реакционную смесь гасили добавлением нас. водн. NH4Cl. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной флэш-хроматографии на силикагеле (10%, затем 30% EtOAc в гексанах) с получением 6 (1,46 г, 2,53 ммоль, 90%) в виде бесцветного масла. 6 получали в виде равновесной смеси кетоновой и кеталевой форм (соотношение ~4:1 в C6D6). Далее приведены спектральные данные только для основной кетоновой формы 6: [α]20D -17,4 (с 1,44, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 7,26 (2Н, д, J=8,7 Гц), 6,83 (2Н, д, J=8,7 Гц), 5,63 (1H, ддд, J=17,1, 10,8, 7,8 Гц), 5,14-5,09 (2Н, м), 4,53 (1H, д, J=11,4 Гц), 4,21 (1H, д, J=11,4 Гц), 4,10 (1H, д, J=12,6 Гц), 3,93 (1H, дд, J=2,7, 2,1 Гц), 3,85 (1H, дд, J=12,6, 3,0 Гц), 3,64 (1H, д, J=10,2 Гц), 3,57 (1Н, д, J=10,8 Гц), 3,48 (1H, дд, J=7,2, 7,2 Гц), 3,34 (3Н, с), 2,81-2,68 (4Н, м), 2,64 (1Н, с), 2,50-2,46 (1H, м), 2,28 (1H, дд, J=15,3, 7,5 Гц), 2,24 (1H, дд, J=16,5, 8,7 Гц), 2,15 (1H, ддд, J=14,4, 2,7, 2,7 Гц), 1,16 (9Н, с), 1,16-1,13 (1H, м), 1,04 (9Н, с), 1,02 (3Н, д, J=6,6 Гц), 0,97 (3Н, д, J=7,2 Гц) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 209,1, 159,6, 137,8, 131,3, 129,5, 118,1, 114,0, 84,9, 84,2, 76,5, 70,2, 69,7, 68,5, 64,1, 54,8, 47,3, 46,2, 37,0, 34,1, 31,4, 27,9, 27,5, 23,3, 20,5, 16,5, 16,1 м.д. FTIR (пленка): 3527, 2933, 2858, 1708, 1613, 1513, 1473, 1247, 1146, 1091, 1022, 956, 652, 447 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C32H52NaO7Si, 599,3375; обнаружено, 599,3376.
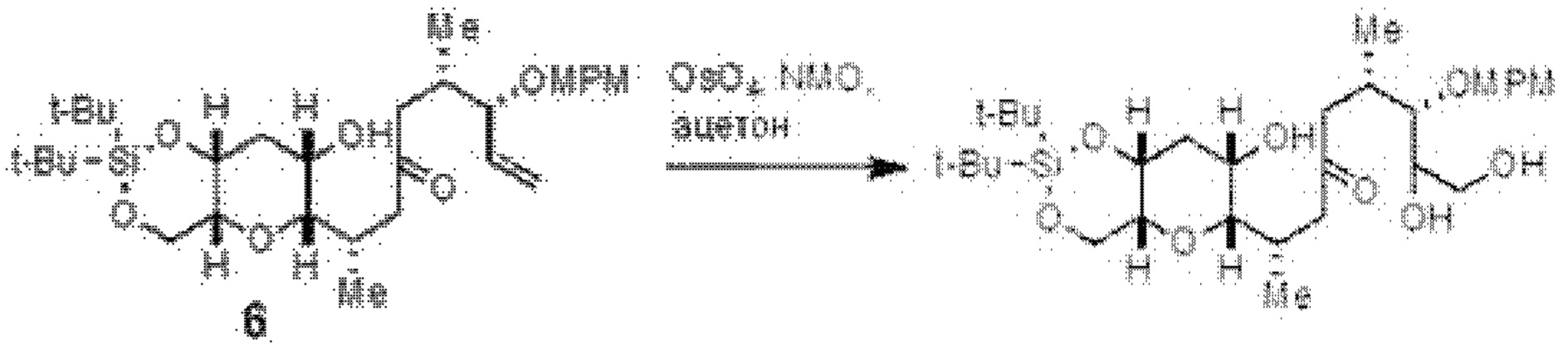
[00789] К перемешанному раствору 6 (1,0 г, 1,73 ммоль, 1 экв.) в ацетоне (17,4 мл) при комнатной температуре добавляли NMMO (405 мг, 3,46 ммоль, 2 экв.) и раствор OsO4 (8,8 мл, 0,02 М в H2O, 0,173 ммоль, 10 мол. %). После перемешивания в течение 21 ч при той же температуре, смесь разбавляли водой. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток пропускали через слой силикагеля (EtOAc) и концентрировали в условиях пониженного давления. Полученное неочищенное вещество использовали в последующей реакции без дополнительной очистки. К перемешанному раствору диола (по расчетам 1,73 ммоль) в CH2Cl2 (17,3 мл) при комнатной температуре добавляли K2CO3 (717 мг, 5,19 ммоль, 3 экв.) и Pb(ОАс)4 (920 мг, 2,08 ммоль, 1,2 экв.). После перемешивания в течение 1 ч при той же температуре, реакционную смесь пропускали через слой силикагеля (EtOAc). Фильтрат концентрировали в условиях пониженного давления. Остаток очищали методом колоночной флэш-хроматографии на силикагеле (0%, 9%, 17%, затем 25% EtOAc в гексанах) с получением S-3 (826 мг, 1,43 ммоль, 83% после 2 стадий) в виде бесцветного масла. S-3 получали в виде равновесной смеси гемиацеталя (соотношение ~4:1 в C6D6). S-3: [α]20D -39,3 (с 1,01, CHCl3). 1H-ЯМР (600 МГц, C6D6) δ: 7,19-7,16 (2Н, м), 6,78-6,75 (2Н, м), 5,41 (0,2Н, дд, 11,1, 1,5 Гц), 4,93 (0,8Н, дд, J=13,2, 1,8 Гц), 4,54 (0,8Н, д, J=10,8 Гц), 4,44 (0,2Н, д, J=11,4 Гц), 4,31 (0,8Н, д, J=10,8 Гц), 4,26 (0,2Н, д, J=11,4 Гц), 4,21-4,17 (1,2Н, м), 3,99 (0,8Н, дд, J=12,3, 2,7 Гц), 3,98 (0,2Н, дд, J=12,6, 3,6 Гц), 3,90-3,89 (0,8Н, м), 3,87-3,86 (0,2Н, м), 3,69 (0,2Н, д, J=10,8 Гц), 3,62 (0,8Н, д, J=4,2 Гц), 3,36 (0,8Н, д, J=12,6 Гц), 3,62 (0,8Н, д, 4,2 Гц), 3,36 (0,8Н, д, J=12,6 Гц), 3,29 (0,6Н, с), 3,28 (2,4Н, с), 3,19 (0,8Н, с), 2,81 (0,2Н, д, J=3,0 Гц), 2,77 (0,8Н, д, J=2,4 Гц), 2,63 (0,8Н, дд, J=1,5, 1,5 Гц), 2,61 (0,2Н, дд, J=1,8, 1,8 Гц), 2,47-2,42 (0,2Н, м), 2,34-2,25 (1,8Н, м), 2,09 (0,8Н, ддд, J=15,0, 1,8, 1,8 Гц), 2,00 (0,2Н, ддд, J=15,0, 1,8, 1,8 Гц), 1,91-1,88 (0,4Н, м), 1,74-1,61 (2,8Н, м), 1,53-1,49 (1Н, м), 1,42 (0,2Н, ддд, J=15,6, 4,2, 4,2 Гц), 1,36 (0,8Н, ддд, J=15,0, 4,5, 4,5 Гц), 1,29 (7,2Н, с), 1,27 (1,8Н, с), 1,14 (7,2Н, с), 1,13 (1,8Н, с), 1,07 (0,6Н, д, J=6,6 Гц), 1,03 (2,4Н, д, J=7,2 Гц), 1,01 (2,4Н, д, J=7,2 Гц), 1,00 (0,6Н, д, J=6,6 Гц) м.д. 13С-ЯМР(125 МГц, C6D6) δ: 159,9, 159,7, 131,2, 129,6, 129,5, 128,5, 114,3, 114,0, 99,0, 98,4, 93,9, 91,2, 80,2, 78,6, 77,5, 77,4, 76,0, 72,2, 68,6, 68,5, 67,2, 67,0, 64,7, 64,0, 54,7, 38,5, 37,5, 37,4, 36,9, 36,4, 36,3, 29,5, 29,0, 27,8, 27,6, 23,41, 23,38, 23,1, 20,9, 17,9, 17,5, 17,2 м.д. FTIR (пленка): 3512, 2931,2856, 1612, 1514, 1474, 1246, 1195, 1127, 1094, 1043, 1014, 966, 942, 828, 769, 735, 651, 441 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C31H50NaO8Si, 601,3167; обнаружено, 601,3168.
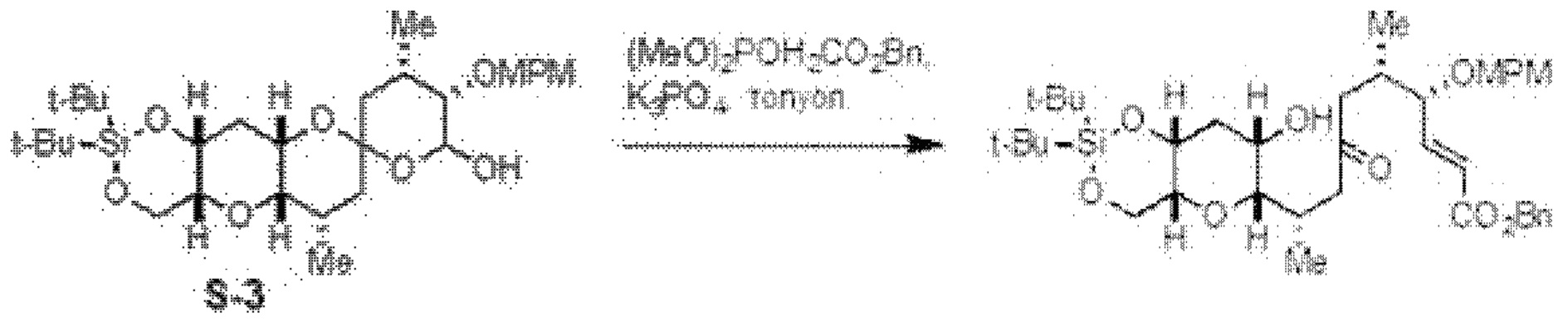
[00790] К перемешанному раствору S-3 (208 мг, 0,359 ммоль, 1 экв.) в толуоле (3,6 мл) при комнатной температуре добавляли бензил диметилфосфоноацетат (0,30 мл, 1,44 ммоль, 4 экв.) и K3PO4 (232 мг, 1,08 ммоль, 3 экв.). После перемешивания в течение 23 ч при той же температуре, реакционную смесь пропускали через слой силикагеля (50% EtOAc в гексанах) с получением неочищенного ненасыщенного сложного эфира (7) (в виде смеси ~3:1 E/Z изомеров). Неочищенное вещество использовали в последующей реакции без дополнительной очистки.
[00791] К перемешанному раствору неочищенного 7 (по расчетам 0,359 ммоль, 1 экв.), BnOAc (541 мг, 3,6 ммоль, 10 экв.) и LiBr (313 мг, 3,6 ммоль, 10 экв.) в MeCN (3,6 мл) при комнатной температуре добавляли DBU (0,269 мкл, 1,80 ммоль, 5 экв.). После перемешивания в течение 12 ч при той же температуре, реакционную смесь гасили добавлением нас. водн. NH4Cl. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением неочищенного спироацеталя, который использовали на следующей стадии без дополнительной очистки. К перемешанному раствору неочищенного спироацеталя (по расчетам 0,359 ммоль) в CH2Cl2 (3,6 мл) и фосфатном буфере (рН=7, 0,7 мл) добавляли DDQ (163 мг, 0,72 ммоль, 2 экв.). После перемешивания в течение 40 мин, реакционную смесь гасили добавлением 10% Na2S2O3 водн. и нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой CH2Cl2. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной флэш-хроматографии на силикагеле (0%, 9%, 13%, затем 17% EtOAc в гексанах) с получением спирта S-4 (160 мг, 0,271 ммоль, 75% после 3 стадий) в виде бесцветного масла. S-4: [α]20D -51,3 (с 1,0, CHCl3). 1H-ЯМР (600 МГц, C6D6) δ: 7,24-7,01 (5Н, м), 5,07 (1H, д, J=12,3 Гц), 4,98 (1H, д, J=12,3 Гц), 4,30 (1H, м), 4,22 (1H, д, J=12,9 Гц), 4,16 (1H, дд, J=10,0, 2,9 Гц), 4,00 (1H, дд, J=12,6, 2,6 Гц), 3,93 (1H, м), 3,87 (1H, м), 2,99 (1H, д, J=8,2 Гц), 2,92-2,84 (2Н, м), 2,71 (1H, ушир. с), 2,32 (1H, дд, J=16,1, 3,2 Гц), 2,28 (1H, д, J=15,3 Гц), 2,18 (1H, м), 2,11 (1H, м), 1,74 (1H, дд, J=13,5, 4,1 Гц), 1,66 (1H, дд, J=12,9, 12,9 Гц), 1,55 (1H, ддд, J=15,4, 4,5, 4,5 Гц), 1,36-1,20 (11Н, м), 1,13 (9Н, с), 1,05 (3Н, д, J=7,0 Гц), 0,92 (3Н, д, J=6,5 Гц) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 171,6, 136,7, 128,7, 128,5, 126,9, 92,3, 77,52, 77,48, 70,5, 69,4, 68,6, 67,2, 66,1, 63,7, 37,42, 37,38, 36,5, 36,4, 29,8, 29,1, 27,8, 27,6, 23,4, 20,9, 17,6, 17,4 м.д. IR (пленка): 3473, 2957, 2931, 2857, 1736, 1131, 1017, 974 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C32H50NaO8Si, 613,3167; обнаружено, 613,3169.

[00792] К перемешанному раствору S-4 (141 мг, 0,239 ммоль, 1 экв.) в CH2Cl2 (2,4 мл, 0,1 М) при комнатной температуре добавляли имидазол (65 мг, 0,96 ммоль, 4 экв.) и TESCl (80,2 мкл, 0,48 ммоль, 2 экв.). После перемешивания в течение 16 ч при той же температуре, реакционную смесь гасили добавлением МеОН. Смесь концентрировали, пропускали через слой силикагеля (25% EtOAc в гексанах) и концентрировали в условиях пониженного давления с получением неочищенного TES-эфира, который использовали на следующей стадии без дополнительной очистки.
[00793] К перемешанному раствору неочищенного TES-эфира (по расчетам 0,239 ммоль) в EtOAc (3,5 мл) добавляли влажный 10% Pd/C (15 мг). Реакционную смесь перемешивали при комнатной температуре при давлении 1 атм водорода в течение 45 мин. Смесь дегазировали и заполняли N2, пропускали через слой силикагеля (EtOAc) и концентрировали в условиях пониженного давления с получением неочищенной кислоты, которую использовали на следующей стадии без дополнительной очистки.
[00794] К перемешанному раствору неочищенной кислоты (по расчетам 0,239 ммоль) в CH2Cl2 (2,4 мл, 0,1 М) при комнатной температуре добавляли PPh3 (94 мг, 0,389 ммоль, 1,2 экв.) и (PyS)2 (73,7 мг, 0,335 ммоль, 1,4 экв.). После перемешивания в течение 17 ч при той же температуре, реакционную смесь концентрировали в условиях пониженного давления. Остаток очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (0%, 9%, затем 17% EtOAc в гексанах) с получением тиоэфира 8 (162 мг, 0,229 ммоль, 96% после 3 стадий), который содержал 2% (PyS)2. Загрязнение дисульфидом удаляли путем проведения дополнительной колоночной хроматографии (0%, 1%, 2%, 3%, затем 9% EtOAc в CH2Cl2) или HPLC (колонка: DuPont Instruments ZORBAL SIL 21,2 мм × 25 см (880952-101), растворитель: 3% iPrOH в гексанах, скорость потока: 10,0 мл/мин, обнаружение: УФ при 254 нм и 220 нм, tR=15 мин. Продукт получали в виде бледно-желтой пены. 8: [α]20D -74,3 (с 1,0, CHCl3). 1H-ЯМР (500 МГц, C6D6) δ: 8,33 (1H, м), 7,52 (1H, м), 6,94 (1H, м), 6,47 (1H, м), 4,25-4,16 (2Н, м), 3,99 (1H, дд, J=12,4, 2,7 Гц), 3,97-3,91 (2Н, м), 3,27 (1H, м), 3,19 (1H, ушир. с), 2,91 (1H, м), 2,72 (1H, ушир. с), 2,59 (1H, дд, J=14,9, 2,2 Гц), 2,34 (2Н, д, J=14,6 Гц), 2,24 (1H, м), 1,77-1,60 (4Н, м), 1,52 (1H, м), 1,31 (9Н, с), 1,13 (9Н, с), 1,04-0,96 (12Н, м), 0,93 (3Н, м), 0,59 (6Н, кв, J=7,8 Гц) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 194,7, 152,7, 150,6, 136,5, 128,5, 123,1, 97,4, 77,7, 77,5, 72,5, 70,0, 68,6, 67,3, 63,9, 47,8, 37,5, 36,7, 36,5, 30,5, 29,1, 27,8, 27,7, 23,4, 21,0, 18,5, 17,3, 7,4, 5,9 м.д.. IR (пленка): 2955, 2931, 2874, 2857, 1708, 1132, 1035, 974 см-1. HRMS (ESI) m/z: [М+Н]+ рассчит. для C36H62O7SSi2, 708,3780; обнаружено, 708,3779.
Левые половины галихондрина

[00795] К раствору (S)-глицидола S6 (6,70 г, 90,0 ммоль; AK Scientific) в дихлорметане (250 мл) при 0°С добавляли имидазол (7,40 г, 108 ммоль) и TBSCl (14,9 г, 99,0 ммоль). Реакционную смесь перемешивали в течение 6 ч при комнатной температуре, после чего гасили добавлением воды (200 мл), и разделяли полученные два слоя. Органический слой сушили над безводным Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением неочищенного масла. Путем очистки на SiO2 (гексаны/этилацетат = 50/1) получали S7 в виде прозрачного масла (16,2 г, 95%). S7: 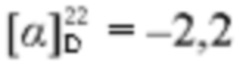 (с 1,0, CHCl3); 1Н-ЯМР (500 МГц, CDCl3) δ: 3,85 (1H, дд, J=9,6, 3,2 Гц), 3,66 (1H, дд, J=11,9, 5,0 Гц), 3,09 (1H, ддд, J=7,5, 4,4, 3,0 Гц), 2,77 (1H, дд, J=5,1, 4,5 Гц), 2,64 (1H, дд, J=5,2, 2,6 Гц), 0,9 (9Н, с), 0,09 (3Н, с), 0,08 (3Н, с) м.д. 13С-ЯМР (125 МГц, CDCl3) δ: 63,7, 52,4, 44,4, 25,8, 18,3, -5,3, -5,4 м.д. HRMS (ESI) m/z: [М+Н]+ рассчит. для C9H21O2Si 189,1305; обнаружено 189,1299.
(с 1,0, CHCl3); 1Н-ЯМР (500 МГц, CDCl3) δ: 3,85 (1H, дд, J=9,6, 3,2 Гц), 3,66 (1H, дд, J=11,9, 5,0 Гц), 3,09 (1H, ддд, J=7,5, 4,4, 3,0 Гц), 2,77 (1H, дд, J=5,1, 4,5 Гц), 2,64 (1H, дд, J=5,2, 2,6 Гц), 0,9 (9Н, с), 0,09 (3Н, с), 0,08 (3Н, с) м.д. 13С-ЯМР (125 МГц, CDCl3) δ: 63,7, 52,4, 44,4, 25,8, 18,3, -5,3, -5,4 м.д. HRMS (ESI) m/z: [М+Н]+ рассчит. для C9H21O2Si 189,1305; обнаружено 189,1299.

[00796] Раствор триметилсилилацетилена (23,8 мл, 167 ммоль; Oakwood) в безводном THF (76,0 мл) охлаждали до -78°С в атмосфере Ar и обрабатывали н-BuLi (2,50 М в гексане, 61,3 мл, 159 ммоль). Спустя 30 мин, по каплям добавляли BF3⋅OEt2 (18,9 мл, 159 ммоль), а затем при -78°С медленно добавляли раствор эпоксида S7 (15,0 г, 79,7 ммоль) в THF (30,0 мл). Реакционную смесь перемешивали в течение 1 ч при той же температуре, после чего добавляли нас. NaHCO3 (100 мл) и диэтиловый эфир (300 мл). Полученный двухфазный раствор нагревали до к.т., и разделяли слои. Органический слой сушили над безводным Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением неочищенного масла. Путем очистки на SiO2 (гексаны/этилацетат = 10/1) получали S8 в виде прозрачного масла (20,5 г, 90%). S8: 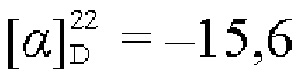 (с 1,0, CHCl3); 1H-ЯМР (500 МГц, CDCl3): δ 3,82-3,78 (1H, м), 3,73 (1H, дд, J=10,0, 4,5 Гц), 3,67 (1Н, дд, J=9,5, 5,5 Гц), 2,52-2,44 (2Н, м), 0,92 (9Н, с), 0,16 (9Н, с), 0,10 (6Н, с) м.д. 13С-ЯМР (125 МГц, CDCl3): δ 102,8, 87,0, 70,1, 65,4, 25,9, 24,5, 18,3, 0,02, -5,4, -5,4 м.д. HRMS (ESI) m/z: [M+Na]+ рассчит. для C14H30NaO2Si2 309,1677; обнаружено 309,1677.
(с 1,0, CHCl3); 1H-ЯМР (500 МГц, CDCl3): δ 3,82-3,78 (1H, м), 3,73 (1H, дд, J=10,0, 4,5 Гц), 3,67 (1Н, дд, J=9,5, 5,5 Гц), 2,52-2,44 (2Н, м), 0,92 (9Н, с), 0,16 (9Н, с), 0,10 (6Н, с) м.д. 13С-ЯМР (125 МГц, CDCl3): δ 102,8, 87,0, 70,1, 65,4, 25,9, 24,5, 18,3, 0,02, -5,4, -5,4 м.д. HRMS (ESI) m/z: [M+Na]+ рассчит. для C14H30NaO2Si2 309,1677; обнаружено 309,1677.
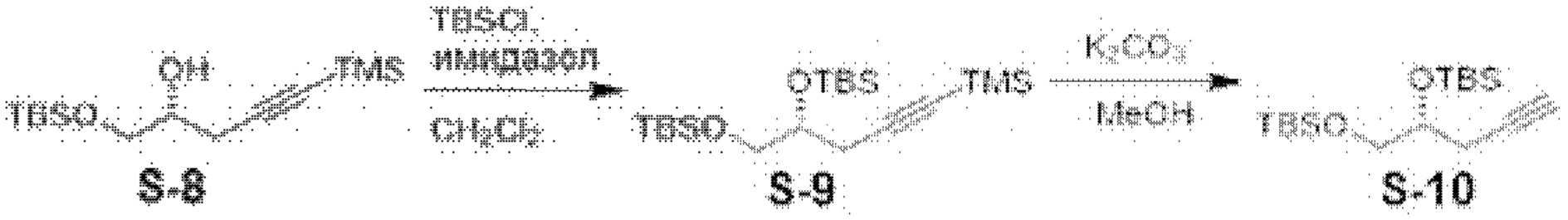
[00797] К раствору спирта S8 (20,5 г, 71,5 ммоль) и имидазола (7,3 г, 107 ммоль) в дихлорметане (300 мл) при 0°С добавляли TBSCl (14,0 г, 92,9 ммоль). Реакционную смесь перемешивали в течение 6 ч при к.т., после чего добавляли воду (100 мл). Смесь экстрагировали гексанами (200 мл), органический слой сушили над безводным Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением неочищенного продукта S9, который использовали на следующей стадии без дополнительной очистки.
[00798] Раствор S9 в метаноле (240 мл) обрабатывали карбонатом калия (11,9 г, 85,8 ммоль) при к.т. Спустя 6 ч, реакционную смесь разбавляли гексанами (200 мл) и фильтровали через слой Celite®. Путем концентрирования в условиях пониженного давления получали неочищенное масло, которое подвергали очистке на SiO2 (гексаны/этилацетат = 50/1) с получением S10 в виде прозрачного масла (21,2 г, 90% после 2 стадий). S10: 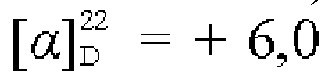 (с 1,0, CHCl3). 1Н-ЯМР (500 МГц, CDCl3) δ: 3,81 (1H, квинт, J=5,5 Гц), 3,53-3,52 (2Н, м), 2,46 (1Н, ддд, J=14,0, 5,5, 2,5 Гц), 2,29 (1H, ддд, J=14,0, 6,0, 2,5 Гц), 1,94 (1H, т, J=2,5), 0,89 (18Н, с), 0,12 (3Н, с), 0,08 (3Н, с), 0,06 (3Н, с), 0,05 (3Н, с). 13С-ЯМР (125 МГц, CDCl3) δ: 81,7, 71,8, 69,6, 66,4, 25,9, 25,8, 24,3, 18,3, 18,1, -4,5, -4,7, -5,4, -5,4 м.д. FTIR (пленка): 2955, 2929, 2886, 2857, 2124, 1472, 1361, 1253, 1116, 1078, 832, 773, 637 см-1. HRMS (ESI) m/z: [М+Н]+ рассчит. для C17H37O2Si2 329,2327; обнаружено 329,2328.
(с 1,0, CHCl3). 1Н-ЯМР (500 МГц, CDCl3) δ: 3,81 (1H, квинт, J=5,5 Гц), 3,53-3,52 (2Н, м), 2,46 (1Н, ддд, J=14,0, 5,5, 2,5 Гц), 2,29 (1H, ддд, J=14,0, 6,0, 2,5 Гц), 1,94 (1H, т, J=2,5), 0,89 (18Н, с), 0,12 (3Н, с), 0,08 (3Н, с), 0,06 (3Н, с), 0,05 (3Н, с). 13С-ЯМР (125 МГц, CDCl3) δ: 81,7, 71,8, 69,6, 66,4, 25,9, 25,8, 24,3, 18,3, 18,1, -4,5, -4,7, -5,4, -5,4 м.д. FTIR (пленка): 2955, 2929, 2886, 2857, 2124, 1472, 1361, 1253, 1116, 1078, 832, 773, 637 см-1. HRMS (ESI) m/z: [М+Н]+ рассчит. для C17H37O2Si2 329,2327; обнаружено 329,2328.

[00799] Безводный трихлорид индия (16,4 г, 74,0 ммоль; Alfa Aesar 99,99%) помещали в колбу и нагревали тепловой пушкой в вакууме в течение 3 мин, 3 Соль индия растворяли в THF (220 мл) при 0°С в атмосфере аргона. Раствор становился белой суспензией при охлаждении -78°С. Затем, к суспензии при -78°С по каплям добавляли DIBAL (1,0 M в гексане, 71,3 мл, 71,3 ммоль). Смесь перемешивали в течение 2,5 ч с получением гидрида дихлориндия. К реакционной смеси добавляли S10 (18,1 г, 54,8 ммоль) и триэтилборан (1,0 М раствор в гексане, 11,0 мл, 11,0 ммоль; Aldrich), и перемешивали полученную смесь в течение 4,5 ч при -78°С. К реакционной смеси добавляли йод (41,8 г, 164 ммоль) в THF (80,0 мл). После перемешивания в течение 20 мин при -78°С, реакционную смесь вливали в насыщенный раствор NaHCO3. Для расходования избытка йода добавляли раствор Na2S2O3. Затем, добавляли насыщенный раствор тартрата калия-натрия, и энергично перемешивали в течение 1 ч. Смесь дважды экстрагировали гексаном и этилацетатом (4:1, 1000 мл). Органический слой сушили над безводным Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением неочищенного масла. Путем очистки на SiO2 (гексаны/этилацетат = 100/1) получали 10 в виде прозрачного масла (21,3 г, 85%, Z/E > 99:1)2. 10: бесцветное масло. 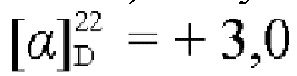 (с 0,9, CHCl3). 1Н-ЯМР (500 МГц, CDCl3) δ: 6,29-6,24 (2Н, м), 3,77 (1H, квинт, J=5,4 Гц), 3,51 (1H, дд, J=10,2, 6,6 Гц), 3,40 (1H, дд, J=10,2, 6,6 Гц), 0,88 (9Н, с), 0,86 (9Н, с), 0,05 (3Н, с), 0,04 (3Н, с), 0,04 (3Н, с), 0,03 (3Н, с) м.д. 13С-ЯМР (125 МГц, CDCl3) δ: 138,0, 83,7, 71,9, 67,0, 39,8, 26,0, 25,9, 18,4, 18,1, -4,4, -4,7, -5,3, -5,3 м.д. FTIP (пленка): 2954, 2928, 2885, 2857, 1610, 1471, 1389, 1306, 1113, 1081, 831, 772 см-1. HRMS (ESI) m/z: [М+Н]+ рассчит. для C17H38IO2Si2 457,1450; обнаружено 457,1455.
(с 0,9, CHCl3). 1Н-ЯМР (500 МГц, CDCl3) δ: 6,29-6,24 (2Н, м), 3,77 (1H, квинт, J=5,4 Гц), 3,51 (1H, дд, J=10,2, 6,6 Гц), 3,40 (1H, дд, J=10,2, 6,6 Гц), 0,88 (9Н, с), 0,86 (9Н, с), 0,05 (3Н, с), 0,04 (3Н, с), 0,04 (3Н, с), 0,03 (3Н, с) м.д. 13С-ЯМР (125 МГц, CDCl3) δ: 138,0, 83,7, 71,9, 67,0, 39,8, 26,0, 25,9, 18,4, 18,1, -4,4, -4,7, -5,3, -5,3 м.д. FTIP (пленка): 2954, 2928, 2885, 2857, 1610, 1471, 1389, 1306, 1113, 1081, 831, 772 см-1. HRMS (ESI) m/z: [М+Н]+ рассчит. для C17H38IO2Si2 457,1450; обнаружено 457,1455.

[00800] К раствору винилйодида 10 (5,79 г, 12,7 ммоль, 1,8 эквив.) в безводном Et2O (64 мл) при -78°С в атмосфере Ar по каплям добавляли н-BuLi (2,52 М в гексане, 4,8 мл, 1,75 эквив.; Aldrich), и перемешивали прозрачную смесь в течение 1 ч при той же температуре. При -78°С в течение 10 мин медленно добавляли 2-тиенилцианокупрат лития (0,25 М в THF, 53,4 мл, 2,0 эквив.; Aldrich), перемешивали в течение 30 мин, после чего добавляли BF3⋅Et2O (0,87 мл, 7,04 ммоль, 1,6 эквив.). Спустя 20 мин, при -78°С по каплям добавляли раствор эпоксида 9 (1000 мг, 7,04 ммоль, 1,0 эквив.) в безводном Et2O (5,0 мл), и перемешивали желтую реакционную смесь в течение 1 ч при той же температуре. Реакционную смесь при 0°С гасили медленным добавлением смеси нас. водн. NH4Cl (90 мл) и 30% водн. NH4OH (10 мл), и перемешивали 2 ч при к.т. Двухфазную смесь разбавляли Et2O (200 мл), слои разделяли, органический слой сушили над Na2SO4 и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной флэш-хроматографии на силикагеле (25% EtOAc в гексанах) с получением 11 в виде масла (2,69 г, 81%). 11: 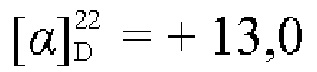 (с 1,0, CDCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 5,74 (1H, дд, J=10,8, 8,4 Гц,), 5,47 (1H, дд, J=10,8, 7,8 Гц), 3,83-3,79 (м, 1H), 3,63 (1H, дд, J=9,9, 5,1 Гц), 3,56 (1H, дд, J=10,2, 6,6 Гц), 3,45 (1H, дд, J=6,0, 2,4 Гц), 3,25-3,24 (1H, м), 2,50-2,35 (3Н, м), 2,37 (1H, дд, J=16,8, 9,0 Гц), 2,23-2,14 (2Н, м), 1,95 (1H, д, J=6,0 Гц), 1,59 (1H, дд, J=17,1, 8,1 Гц), 1,00 (9Н, с), 0,99 (9Н, с), 0,53 (3Н, д, J=7,2 Гц,), 0,13 (3Н, с), 0,12 (3Н, с), 0,10 (3Н, с), 0,09 (3Н, с) м.д. 13С-ЯМР (150 МГц, C6D6) δ: 175,5, 129,6, 127,1, 87,8, 73,3, 70,9, 67,3, 36,8, 32,8, 32,5, 31,3, 26,1 (×3), 26,2 (×3), 18,6, 18,4, 18,1, -4,2, -4,4, -5,1, -5,2 м.д. FTIP (пленка): 3450, 2958, 2930, 2858, 1778, 1472, 1428, 1389, 1361, 1252, 1113, 835,776, 738, 703 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C24H48O5NaSi2+ 495,2932; обнаружено 495,2940.
(с 1,0, CDCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 5,74 (1H, дд, J=10,8, 8,4 Гц,), 5,47 (1H, дд, J=10,8, 7,8 Гц), 3,83-3,79 (м, 1H), 3,63 (1H, дд, J=9,9, 5,1 Гц), 3,56 (1H, дд, J=10,2, 6,6 Гц), 3,45 (1H, дд, J=6,0, 2,4 Гц), 3,25-3,24 (1H, м), 2,50-2,35 (3Н, м), 2,37 (1H, дд, J=16,8, 9,0 Гц), 2,23-2,14 (2Н, м), 1,95 (1H, д, J=6,0 Гц), 1,59 (1H, дд, J=17,1, 8,1 Гц), 1,00 (9Н, с), 0,99 (9Н, с), 0,53 (3Н, д, J=7,2 Гц,), 0,13 (3Н, с), 0,12 (3Н, с), 0,10 (3Н, с), 0,09 (3Н, с) м.д. 13С-ЯМР (150 МГц, C6D6) δ: 175,5, 129,6, 127,1, 87,8, 73,3, 70,9, 67,3, 36,8, 32,8, 32,5, 31,3, 26,1 (×3), 26,2 (×3), 18,6, 18,4, 18,1, -4,2, -4,4, -5,1, -5,2 м.д. FTIP (пленка): 3450, 2958, 2930, 2858, 1778, 1472, 1428, 1389, 1361, 1252, 1113, 835,776, 738, 703 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C24H48O5NaSi2+ 495,2932; обнаружено 495,2940.
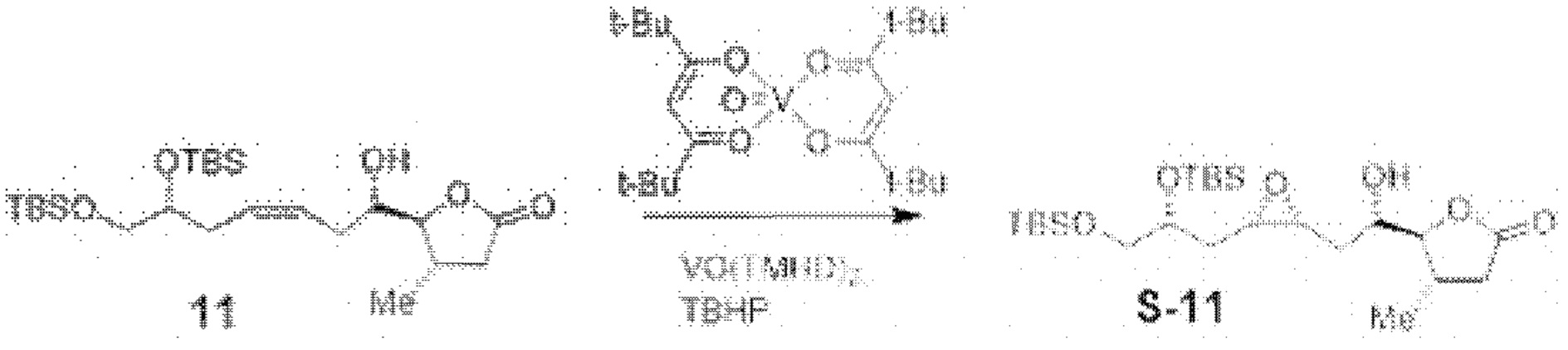
[00801] К раствору алкена 11 (490 мг, 1,04 ммоль, 1,0 эквив.) в толуоле (10 мл) добавляли VO(TMHD)2 (23 мг, 5 мол. %) и трет-бутиловый гидропероксид (ТВНР) (5,5 М в декане, 380 мкл, 2,0 эквив.; Aldrich) с получением красноватого раствора. Реакционную смесь перемешивали в течение 5,5 ч при к.т., после чего гасили добавлением нас. Na2S2O3/NaHCO3 (об./об. = 1:1). Полученную двухфазную смесь разбавляли Et2O (10 мл), и разделяли слои. Органический слой сушили над безводным Na2SO4, концентрировали и сушили методом колоночной флэш-хроматографии на силикагеле (33% EtOAc в гексанах) с получением S11 в виде бесцветного масла (450 г, 89%, диастереоизомерное соотношение > 50:1). S11: 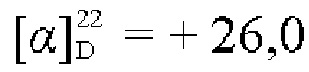 (с 1,0, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 3,92 (1H, квинт, J=5,4 Гц,), 3,70 (1H, дд, J=10,2, 5,1 Гц), 3,66-3,62 (2Н, м), 3,76 (1H, дд, J=9,9, 6,3 Гц), 3,14-3,11 (2Н, м), 2,97 (1H, дт, J=14,4, 4,2 Гц), 2,47 (1Н, дд, J=18,0, 9,6 Гц), 2,31-2,24 (1H, м), 1,84 (1H, дт, J=14,4, 4,8 Гц), 1,77-1,62 (4Н, м), 0,97 (9Н, с), 0,96 (9Н, с), 0,67 (3Н, д, J=6,6 Гц), 0,12 (3Н, с), 0,11 (3Н, с), 0,08 (3Н, с), 0,07 (3Н, с) м.д. 13С-ЯМР (150 МГц, C6D6) δ: 176,1, 88,3, 72,2, 70,5, 67,5, 53,7, 53,4, 36,8, 33,2, 31,9, 31,2, 26,2 (×3), 26,1 (×3), 18,6, 18,5, 18,4, -4,2, -4,6, -5,2, -5,2 м.д. FTIP (пленка): 3450, 2955, 2929, 2857, 1779, 1472, 1463, 1388, 1361, 1253, 1115, 835, 776, 738 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C24H48O6NaSi2+ 511,2882; обнаружено 511,2877.
(с 1,0, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 3,92 (1H, квинт, J=5,4 Гц,), 3,70 (1H, дд, J=10,2, 5,1 Гц), 3,66-3,62 (2Н, м), 3,76 (1H, дд, J=9,9, 6,3 Гц), 3,14-3,11 (2Н, м), 2,97 (1H, дт, J=14,4, 4,2 Гц), 2,47 (1Н, дд, J=18,0, 9,6 Гц), 2,31-2,24 (1H, м), 1,84 (1H, дт, J=14,4, 4,8 Гц), 1,77-1,62 (4Н, м), 0,97 (9Н, с), 0,96 (9Н, с), 0,67 (3Н, д, J=6,6 Гц), 0,12 (3Н, с), 0,11 (3Н, с), 0,08 (3Н, с), 0,07 (3Н, с) м.д. 13С-ЯМР (150 МГц, C6D6) δ: 176,1, 88,3, 72,2, 70,5, 67,5, 53,7, 53,4, 36,8, 33,2, 31,9, 31,2, 26,2 (×3), 26,1 (×3), 18,6, 18,5, 18,4, -4,2, -4,6, -5,2, -5,2 м.д. FTIP (пленка): 3450, 2955, 2929, 2857, 1779, 1472, 1463, 1388, 1361, 1253, 1115, 835, 776, 738 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C24H48O6NaSi2+ 511,2882; обнаружено 511,2877.

[00802] К раствору S11 (450 мг, 0,92 ммоль, 1,0 эквив.) и имидазола (251 мг) в дихлорметане (9,2 мл) при 0°С добавляли TESCl (308 мкл). Реакционную смесь перемешивали в течение 1 ч при 0°С, после чего гасили добавлением нас. NaHCO3. Двухфазную смесь разбавляли дихлорметаном, и разделяли слои. Органический слой сушили над безводным Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением неочищенного масла. Путем очистки на SiO2 (9% EtOAc в гексанах) получали 12 в виде прозрачного масла (528 мг, 95%). 12: 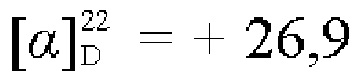 (с 1,0, CHCl3). 1Н-ЯМР (500 МГц, C6D6) δ: 3,97 (1H, квинт, J=5,4 Гц,), 3,94 (1H, дд, J=5,0, 3,5 Гц), 3,89-3,85 (1H, м), 3,76 (1H, дд, J=10,0, 5,5 Гц), 3,65 (1H, дд, J=10,5, 6,0 Гц), 3,15 (1H, дт, J=7,5, 4,0 Гц), 2,92 (1H, дт, J=9,0, 4,0 Гц), 2,40 (1H, дд, J=17,2, 9,2 Гц), 2,13-2,09 (1H, м), 2,04 (1H, ддд, J=14,0, 7,5, 3,5 Гц), 1,95 (1H, ддд, J=14,5, 5,5, 4,5 Гц), 1,71-1,64 (2Н, м), 1,59 (1H, ддд, J=13,5, 8,0, 4,5 Гц), 1,00 (9Н, с), 0,98 (9Н, с), 0,97 (9Н, т, J=8,5 Гц), 0,68 (3Н, д, J=6,5 Гц,), 0,58 (6Н, кв, J=8,0 Гц,), 0,14 (3Н, с), 0,13 (3Н, с), 0,11 (3Н, с), 0,09 (3Н, с) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 175,3, 86,9, 72,2, 71,7, 67,7, 53,7, 52,4, 36,8, 33,5, 32,4, 31,2, 26,2 (×3), 26,1 (×3), 19,2, 18,6, 18,3, 7,1, 7,0, 6,3, 5,3, -4,2, -4,7, -5,2, -5,2 м.д. FTIP (пленка): 2955, 2929, 2878, 2857, 1781, 1472, 1463, 1388, 1361, 1250, 1097, 1005, 832, 774, 735 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C30H62O6NaSi3+ 625,3746; обнаружено 625,3748.
(с 1,0, CHCl3). 1Н-ЯМР (500 МГц, C6D6) δ: 3,97 (1H, квинт, J=5,4 Гц,), 3,94 (1H, дд, J=5,0, 3,5 Гц), 3,89-3,85 (1H, м), 3,76 (1H, дд, J=10,0, 5,5 Гц), 3,65 (1H, дд, J=10,5, 6,0 Гц), 3,15 (1H, дт, J=7,5, 4,0 Гц), 2,92 (1H, дт, J=9,0, 4,0 Гц), 2,40 (1H, дд, J=17,2, 9,2 Гц), 2,13-2,09 (1H, м), 2,04 (1H, ддд, J=14,0, 7,5, 3,5 Гц), 1,95 (1H, ддд, J=14,5, 5,5, 4,5 Гц), 1,71-1,64 (2Н, м), 1,59 (1H, ддд, J=13,5, 8,0, 4,5 Гц), 1,00 (9Н, с), 0,98 (9Н, с), 0,97 (9Н, т, J=8,5 Гц), 0,68 (3Н, д, J=6,5 Гц,), 0,58 (6Н, кв, J=8,0 Гц,), 0,14 (3Н, с), 0,13 (3Н, с), 0,11 (3Н, с), 0,09 (3Н, с) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 175,3, 86,9, 72,2, 71,7, 67,7, 53,7, 52,4, 36,8, 33,5, 32,4, 31,2, 26,2 (×3), 26,1 (×3), 19,2, 18,6, 18,3, 7,1, 7,0, 6,3, 5,3, -4,2, -4,7, -5,2, -5,2 м.д. FTIP (пленка): 2955, 2929, 2878, 2857, 1781, 1472, 1463, 1388, 1361, 1250, 1097, 1005, 832, 774, 735 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C30H62O6NaSi3+ 625,3746; обнаружено 625,3748.
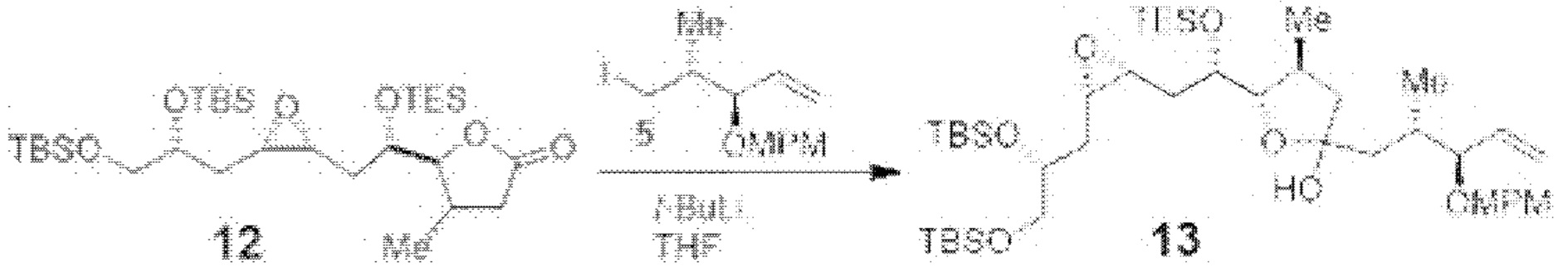
[00803] Раствор 12 (193 мг, 0,32 ммоль) и 5 (155 мг, 0,45 ммоль, 1,4 экв.) в THF дегазировали путем барботирования Ar. К раствору при -78°С в течение 10 мин по каплям добавляли раствор t-BuLi (0,49 мл, 1,7 М в пентане, 14,6 ммоль, 2,6 экв.). После перемешивания в течение 15 мин при той же температуре, реакционную смесь гасили добавлением нас. водн. NH4Cl. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной флэш-хроматографии на силикагеле (10%, затем 30% EtOAc в гексанах) с получением 13 (225 мг, 0,27 ммоль, 85%) в виде бесцветного масла. 13 получали в виде равновесной смеси кетоновой и кеталевой форм (соотношение ~1:1).

[00804] К раствору 13 (500 мг, 0,607 ммоль) в 10,1 мл толуола при 0°С добавляли (PhO)2P(=O)OH (15,2 мг в 2 мл толуола). Полученную смесь перемешивали при комнатной температуре в течение 12 ч, после чего гасили добавлением 5 мл насыщенного водного NaHCO3. Органический слой удаляли, и трижды экстрагировали водный слой этилацетатом (30 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Полученное масло затем растворяли в 6 мл дихлорметана, после чего при 0°С добавляли имидазол (413 мг, 6,07 ммоль) и TESCl (509 мкл, 3,04 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 ч, после чего гасили добавлением 5 мл насыщенного водного NH4Cl. Органический слой удаляли, и трижды экстрагировали водный слой этилацетатом (30 мл). Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали. Остаток очищали методом колоночной флэш-хроматографии на силикагеле (9% EtOAc в гексанах) с получением 14 в виде прозрачного масла (484 мг, 85% после 2 стадий). 14: 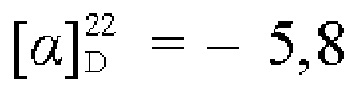 (с 1,1, CHCl3). 1H-ЯМР (600 МГц, C6D6) δ: 7,24 (1H, д, J=8,4 Гц), 6,82 (1H, д, J=9,0 Гц), 5,63 (1H, ддд, J=17,4, 10,8, 7,8 Гц), 5,13 (1H, дд, J=8,4, 3,0 Гц), 5,10 (1H, д, J=10,2 Гц), 4,54 (1H, д, J=10,8 Гц), 4,27-4,24 (1H, м), 4,21 (1H, д, J=7,6 Гц), 4,06-4,03 (1H, м), 4,00-3,98 (1H, м), 3,83 (1H, дд, J=10,5, 3,3 Гц), 3,76 (1H, кв, J=4,8 Гц), 3,72 (1H, дд, J=10,2, 6,0 Гц), 3,49 (1H, т, J=6,9 Гц), 3,33 (3Н, с), 3,12 (1H, дд, J=8,4, 4,2 Гц), 3,04 (1H, дд, J=16,8, 3,0 Гц), 2,77-2,71 (2Н, м), 2,59-2,53 (1H, м), 2,36 (1H, дд, J=16,2, 10,2 Гц), 2,31 (1H, дд, J=16,8, 9,0 Гц), 2,00-1,91 (2Н, м), 1,76 (1H, ддд, J=12,6, 7,8, 3,6 Гц), 1,59 (1H, ддд, J=12,6, 7,2, 2,4 Гц), 1,14 (9Н, т, J=7,8 Гц), 1,08 (9Н, с), 1,03 (9Н, с), 1,01 (3Н, д, J=5,4 Гц), 0,99 (1H, т, J=8,4 Гц), 0,82 (3Н, кв, J=7,8 Гц), 0,81 (3Н, кв, J=7,8 Гц), 0,57 (6Н, кв, J=7,8 Гц,), 0,28 (3Н, с), 0,28 (3Н, с), 0,15 (6Н, с) м.д. 13С-ЯМР (150 МГц, C6D6) δ: 208,4, 159,7, 137,8, 131,4, 129,5, 118,1, 114,0, 87,4, 84,1, 81,3, 72,7, 72,2, 71,3, 70,3, 68,2, 54,8, 47,6, 46,4, 39,1, 39,0, 33,9, 28,9, 26,3 (×6), 18,7, 18,5, 17,4, 16,6, 7,9, 7,2, 5,8, 5,3, -3,9, -4,2, -5,0, -5,1 м.д. FTIP (пленка): 2956, 2932, 2880, 2855, 1713, 1615, 1514, 1463, 1381, 1361, 1249, 1079, 1039, 944, 833, 775, 736 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C50H96O8NaSi4+ 959,6074; обнаружено 959,6070.
(с 1,1, CHCl3). 1H-ЯМР (600 МГц, C6D6) δ: 7,24 (1H, д, J=8,4 Гц), 6,82 (1H, д, J=9,0 Гц), 5,63 (1H, ддд, J=17,4, 10,8, 7,8 Гц), 5,13 (1H, дд, J=8,4, 3,0 Гц), 5,10 (1H, д, J=10,2 Гц), 4,54 (1H, д, J=10,8 Гц), 4,27-4,24 (1H, м), 4,21 (1H, д, J=7,6 Гц), 4,06-4,03 (1H, м), 4,00-3,98 (1H, м), 3,83 (1H, дд, J=10,5, 3,3 Гц), 3,76 (1H, кв, J=4,8 Гц), 3,72 (1H, дд, J=10,2, 6,0 Гц), 3,49 (1H, т, J=6,9 Гц), 3,33 (3Н, с), 3,12 (1H, дд, J=8,4, 4,2 Гц), 3,04 (1H, дд, J=16,8, 3,0 Гц), 2,77-2,71 (2Н, м), 2,59-2,53 (1H, м), 2,36 (1H, дд, J=16,2, 10,2 Гц), 2,31 (1H, дд, J=16,8, 9,0 Гц), 2,00-1,91 (2Н, м), 1,76 (1H, ддд, J=12,6, 7,8, 3,6 Гц), 1,59 (1H, ддд, J=12,6, 7,2, 2,4 Гц), 1,14 (9Н, т, J=7,8 Гц), 1,08 (9Н, с), 1,03 (9Н, с), 1,01 (3Н, д, J=5,4 Гц), 0,99 (1H, т, J=8,4 Гц), 0,82 (3Н, кв, J=7,8 Гц), 0,81 (3Н, кв, J=7,8 Гц), 0,57 (6Н, кв, J=7,8 Гц,), 0,28 (3Н, с), 0,28 (3Н, с), 0,15 (6Н, с) м.д. 13С-ЯМР (150 МГц, C6D6) δ: 208,4, 159,7, 137,8, 131,4, 129,5, 118,1, 114,0, 87,4, 84,1, 81,3, 72,7, 72,2, 71,3, 70,3, 68,2, 54,8, 47,6, 46,4, 39,1, 39,0, 33,9, 28,9, 26,3 (×6), 18,7, 18,5, 17,4, 16,6, 7,9, 7,2, 5,8, 5,3, -3,9, -4,2, -5,0, -5,1 м.д. FTIP (пленка): 2956, 2932, 2880, 2855, 1713, 1615, 1514, 1463, 1381, 1361, 1249, 1079, 1039, 944, 833, 775, 736 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C50H96O8NaSi4+ 959,6074; обнаружено 959,6070.

[00805] К раствору 14 (1,80 г, 1,92 ммоль, 1,0 эквив.) в ацетоне (19,2 мл) добавляли NMMO (449 мг, 3,84 ммоль, 2,0 эквив.) и водный раствор OsO4 (4,88 мл, 0,096 ммоль, 5 мг/мл Н2О, 5 мол. %). Реакционную смесь перемешивали в течение 15 ч, а затем гасили добавлением водн. Na2SO3. Смесь дважды экстрагировали EtOAc, сушили над Na2SO4, фильтровали и концентрировали. Остаток пропускали через слой SiO2 с EtOAc и концентрировали. Неочищенное вещество использовали в последующей реакции без дополнительной очистки.
[00806] К раствору диола (согласно подсчетам 1,92 ммоль, 1,0 эквив.) в DCM (19,2 мл) добавляли K2CO3 (2,66 г, 19,2 ммоль, 10 эквив.) и Pb(ОАс)4 (1,36 г, 3,07 ммоль, 1,6 эквив.). После перемешивания в течение 1 ч, реакционную смесь пропускали через слой SiO2 с EtOAc и концентрировали. Неочищенное вещество использовали в последующей реакции без дополнительной очистки.
[00807] К раствору альдегида (согласно подсчетам 1,92 ммоль, 1,0 эквив.) в толуоле (19,2 мл) при комнатной температуре добавляли (МеО)2Р(=O)CH2CO2Bn (2,0 мл, 9,6 ммоль, 5,0 эквив.) и K3PO4 (4,08 г, 19,2 ммоль, 10 эквив.). После перемешивания дополнительно в течение 12 ч, реакционную смесь пропускали через слой SiO2 с EtOAc/гексанами (1/1) и концентрировали с получением S12 (1,65 г, 1,51 ммоль, 82% после 3 стадий, смесь E/Z изомеров ~8:1). S12: 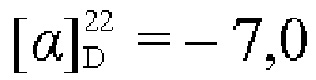 (с 0,9, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 7,24 (2Н, д, J=7,2 Гц), 7,15 (2Н, д, J=8,4 Гц), 7,10 (2Н, дд, J=7,2, 7,2 Гц), 7,05 (1H, т, J=7,2 Гц), 7,00 (1H, дд, J=15,5, 6,3 Гц), 6,59 (2Н, д, J=8,4 Гц), 6,13 (1H, д, J=15,5 Гц), 5,10 (1H, д, J=12,0 Гц), 5,06 (1H, д, J=12,0 Гц), 4,30 (1Н, д, J=12,0 Гц), 4,27-4,24 (1H, м), 4,03 (1H, д, J=12,0 Гц), 4,00-3,97 (1H, м), 3,97-3,94 (1H, м), 3,78 (1H, дд, J=10,6, 3,8 Гц), 3,71 (1Н, кв, J=7,8 Гц), 3,65 (1Н, дд, J=16,8, 6,6 Гц), 3,55 (1H, т, J=6,9 Гц), 3,27 (3Н, с), 3,05 (1H, дд, J=12,6, 4,2 Гц), 2,93 (1H, дд, J=16,8, 3,0 Гц), 2,66-2,61 (1H, м), 2,50-2,44 (2Н, м), 2,21 (1H, дд, J=8,4, 8,4 Гц), 2,19 (1H, дд, J=8,4, 8,4 Гц), 2,00-1,88 (2Н, м), 1,70 (1H, ддд, J=12,6, 7,8, 3,6 Гц), 1,55 (1H, ддд, J=12,6, 7,2, 2,4 Гц), 1,08 (9Н, т, J=7,8 Гц), 1,03 (9Н, с), 0,98 (9Н, с), 0,96 (3Н, д, J=5,4 Гц), 0,93 (1Н, т, J=8,4 Гц), 0,88 (3Н, кв, J=7,8 Гц), 0,76 (3Н, кв, J=7,8 Гц), 0,52 (6Н, кв, J=7,8 Гц,), 0,23 (6Н, с), 0,20 (6Н, с) м.д. 13С-ЯМР (150 МГц, C6D6)5: 207,8, 165,5, 159,8, 147,7, 136,6, 130,6, 129,6, 128,69, 128,66, 128,3, 123,3, 114,0, 87,3, 81,6, 81,2, 72,6, 72,1, 71,2, 68,2, 66,4, 54,7, 47,6, 45,7, 39,0, 38,96, 33,5, 28,8, 26,2 (×6), 18,6, 18,4, 17,2, 16,5, 7,4, 7,2, 5,8, 5,2, -4,0, -4,3, -5,1, -5,2 м.д. FTIP (пленка): 2954, 2929, 2876, 2856, 1720, 1655, 1612, 1514, 1462, 1381, 1301, 1249, 1158, 1079, 1005, 835, 776, 740 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C50H96O8NaSi4+ 959,6074; обнаружено 959,6070.
(с 0,9, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 7,24 (2Н, д, J=7,2 Гц), 7,15 (2Н, д, J=8,4 Гц), 7,10 (2Н, дд, J=7,2, 7,2 Гц), 7,05 (1H, т, J=7,2 Гц), 7,00 (1H, дд, J=15,5, 6,3 Гц), 6,59 (2Н, д, J=8,4 Гц), 6,13 (1H, д, J=15,5 Гц), 5,10 (1H, д, J=12,0 Гц), 5,06 (1H, д, J=12,0 Гц), 4,30 (1Н, д, J=12,0 Гц), 4,27-4,24 (1H, м), 4,03 (1H, д, J=12,0 Гц), 4,00-3,97 (1H, м), 3,97-3,94 (1H, м), 3,78 (1H, дд, J=10,6, 3,8 Гц), 3,71 (1Н, кв, J=7,8 Гц), 3,65 (1Н, дд, J=16,8, 6,6 Гц), 3,55 (1H, т, J=6,9 Гц), 3,27 (3Н, с), 3,05 (1H, дд, J=12,6, 4,2 Гц), 2,93 (1H, дд, J=16,8, 3,0 Гц), 2,66-2,61 (1H, м), 2,50-2,44 (2Н, м), 2,21 (1H, дд, J=8,4, 8,4 Гц), 2,19 (1H, дд, J=8,4, 8,4 Гц), 2,00-1,88 (2Н, м), 1,70 (1H, ддд, J=12,6, 7,8, 3,6 Гц), 1,55 (1H, ддд, J=12,6, 7,2, 2,4 Гц), 1,08 (9Н, т, J=7,8 Гц), 1,03 (9Н, с), 0,98 (9Н, с), 0,96 (3Н, д, J=5,4 Гц), 0,93 (1Н, т, J=8,4 Гц), 0,88 (3Н, кв, J=7,8 Гц), 0,76 (3Н, кв, J=7,8 Гц), 0,52 (6Н, кв, J=7,8 Гц,), 0,23 (6Н, с), 0,20 (6Н, с) м.д. 13С-ЯМР (150 МГц, C6D6)5: 207,8, 165,5, 159,8, 147,7, 136,6, 130,6, 129,6, 128,69, 128,66, 128,3, 123,3, 114,0, 87,3, 81,6, 81,2, 72,6, 72,1, 71,2, 68,2, 66,4, 54,7, 47,6, 45,7, 39,0, 38,96, 33,5, 28,8, 26,2 (×6), 18,6, 18,4, 17,2, 16,5, 7,4, 7,2, 5,8, 5,2, -4,0, -4,3, -5,1, -5,2 м.д. FTIP (пленка): 2954, 2929, 2876, 2856, 1720, 1655, 1612, 1514, 1462, 1381, 1301, 1249, 1158, 1079, 1005, 835, 776, 740 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C50H96O8NaSi4+ 959,6074; обнаружено 959,6070.
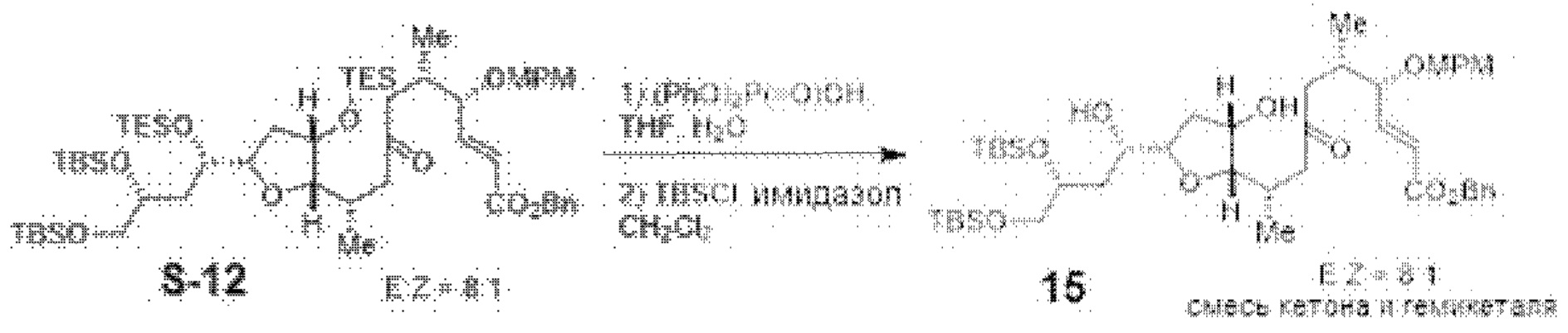
[00808] К раствору S12 (1,65 г, 1,51 ммоль, 1 экв.) в THF-H2O (4:1, 0,05 М) при 0°С добавляли (PhO)2P(=O)OH (113 мг, 0,45 ммоль, 0,3 экв.). Полученную смесь перемешивали при комнатной температуре в течение 24 ч, после чего гасили добавлением 5 мл насыщенного водного NaHCO3. Органический слой удаляли, и трижды экстрагировали водный слой этилацетатом (30 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Полученное масло затем растворяли в 6 мл дихлорметана, после чего при 0°С добавляли имидазол (414 мг, 7,55 моль, 5 экв.) и TBSCl (274 мг, 1,81 ммоль, 1,2 экв.). Полученную смесь перемешивали при комнатной температуре в течение 1 часа, после чего гасили добавлением 5 мл насыщенного водного NH4Cl. Органический слой удаляли, и трижды экстрагировали водный слой этилацетатом (30 мл). Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали. Путем очистки на SiO2 (30% EtOAc в гексанах) получали 15 в виде прозрачного масла (1,02 г, 1,21 ммоль, 80% после 2 стадий). 15 получали в виде равновесной смеси кетоновой и кеталевой форм (соотношение ~1:1 в C6D6) вместе со смесью E/Z изомеров ~8:1.
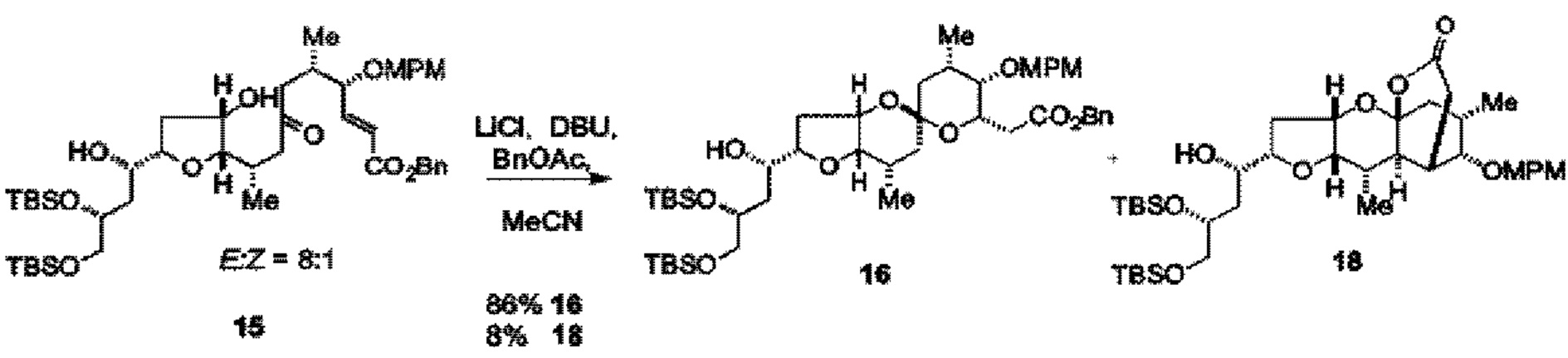
[00809] К раствору 15 (600 мг, 0,711 ммоль, 1 экв.), BnOAc (122 мкл, 0,711 ммоль, 1 экв.) и LiCl (302 мг, 7,11 ммоль, 10 экв.) в MeCN (14,2 мл, 0,05 М) добавляли DBU (2,13 мл, 14,2 ммоль, 20 экв.). После перемешивания в течение 12 ч при комнатной температуре, реакционную смесь наносили на слой SiO2 и промывали EtOAc. Смесь концентрировали и сушили над SiO2 (25% EtOAc в гексанах) с получением 16 (516 мг, 0,612 ммоль, 86%, диастереоизомерное соотношение = 22:1) вместе с побочным продуктов 18 (48 мг, 0,057 ммоль, 8%). 16: 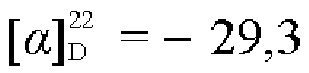 (с 1,0, CHCl3). 1H-ЯМР (600 МГц, C6D6) δ: 7,23 (2Н, д, J=7,1 Гц), 7,19 (2Н, д, J=8,4 Гц), 7,11 (2Н, дд, J=7,5, 7,1 Гц), 7,06 (1Н, дд, J=7,5, 7,5 Гц), 6,76 (2Н, д, J=8,4 Гц), 5,09 (1H, д, J=12,0 Гц), 5,00 (1H, д, J=12,0 Гц), 4,27-4,21 (2Н, м), 4,15 (2Н, д, J=7,6 Гц), 3,95-3,77 (4Н, м), 3,36 (1H, дд, J=6,3, 3,6 Гц), 3,26 (1H, дд, J=10,2, 2,4 Гц), 3,25 (3Н, с), 2,89 (1Н, дд, J=15,0, 10,2 Гц), 2,77 (1H, с), 2,19 (1Н, дд, J=16,2, 3,0 Гц), 2,18-2,09 (1H, м), 2,08-2,02 (1H, м), 1,93-1,84 (2Н, м), 1,57 (1H, т, J=12,9 Гц), 1,49 (1H, т, J=12,9 Гц), 1,38 (1H, дд, J=12,0, 3,0 Гц), 1,31 (1H, дд, J=12,8, 3,0 Гц), 1,14 (9Н, т, J=7,8 Гц), 1,08 (9Н, с), 1,03 (9Н, с), 1,01 (3Н, д, J=5,4 Гц), 0,88 (1H, т, J=8,4 Гц), 0,82 (3Н, кв, J=7,8 Гц), 0,81 (3Н, кв, J=7,8 Гц), 0,57 (6Н, кв, J=7,8 Гц,), 0,28 (3Н, с), 0,28 (3Н, с), 0,15 (6Н, с) м.д. 13С-ЯМР (150 МГц, C6D6) δ: 171,5, 159,8, 136,6, 131,0, 129,7, 128,8, 128,7, 128,4, 114,0, 97,4, 80,5, 79,8, 78,1, 75,4, 72,2, 71,9, 70,7, 70,2, 67,9, 66,2, 54,7, 39,0, 37,9, 37,5, 37,0, 35,7, 30,5, 26,3 (×6), 18,7, 18,5, 18,2, 18,0, 7,2, 4,9, -4,0, -4,4, -5,1, -5,1 м.д. FTIP (пленка): 3545, 2956, 2927, 2856, 1736, 1613, 1514, 1462, 1381, 1303, 1249, 1096, 1038, 944, 835, 777 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C46H74O10NaSi2+ 865,4713; обнаружено 865,4723. 18 (продукт С-присоединения Михаэля):
(с 1,0, CHCl3). 1H-ЯМР (600 МГц, C6D6) δ: 7,23 (2Н, д, J=7,1 Гц), 7,19 (2Н, д, J=8,4 Гц), 7,11 (2Н, дд, J=7,5, 7,1 Гц), 7,06 (1Н, дд, J=7,5, 7,5 Гц), 6,76 (2Н, д, J=8,4 Гц), 5,09 (1H, д, J=12,0 Гц), 5,00 (1H, д, J=12,0 Гц), 4,27-4,21 (2Н, м), 4,15 (2Н, д, J=7,6 Гц), 3,95-3,77 (4Н, м), 3,36 (1H, дд, J=6,3, 3,6 Гц), 3,26 (1H, дд, J=10,2, 2,4 Гц), 3,25 (3Н, с), 2,89 (1Н, дд, J=15,0, 10,2 Гц), 2,77 (1H, с), 2,19 (1Н, дд, J=16,2, 3,0 Гц), 2,18-2,09 (1H, м), 2,08-2,02 (1H, м), 1,93-1,84 (2Н, м), 1,57 (1H, т, J=12,9 Гц), 1,49 (1H, т, J=12,9 Гц), 1,38 (1H, дд, J=12,0, 3,0 Гц), 1,31 (1H, дд, J=12,8, 3,0 Гц), 1,14 (9Н, т, J=7,8 Гц), 1,08 (9Н, с), 1,03 (9Н, с), 1,01 (3Н, д, J=5,4 Гц), 0,88 (1H, т, J=8,4 Гц), 0,82 (3Н, кв, J=7,8 Гц), 0,81 (3Н, кв, J=7,8 Гц), 0,57 (6Н, кв, J=7,8 Гц,), 0,28 (3Н, с), 0,28 (3Н, с), 0,15 (6Н, с) м.д. 13С-ЯМР (150 МГц, C6D6) δ: 171,5, 159,8, 136,6, 131,0, 129,7, 128,8, 128,7, 128,4, 114,0, 97,4, 80,5, 79,8, 78,1, 75,4, 72,2, 71,9, 70,7, 70,2, 67,9, 66,2, 54,7, 39,0, 37,9, 37,5, 37,0, 35,7, 30,5, 26,3 (×6), 18,7, 18,5, 18,2, 18,0, 7,2, 4,9, -4,0, -4,4, -5,1, -5,1 м.д. FTIP (пленка): 3545, 2956, 2927, 2856, 1736, 1613, 1514, 1462, 1381, 1303, 1249, 1096, 1038, 944, 835, 777 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C46H74O10NaSi2+ 865,4713; обнаружено 865,4723. 18 (продукт С-присоединения Михаэля): 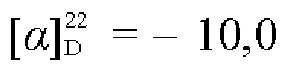 (с 0,95, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 7,14 (1H, д, J=8,4 Гц), 6,82 (1H, д, J=9,0 Гц), 4,18 (1H, д, J=12,0 Гц), 4,18-4,15 (1H, м), 4,12 (1H, д, J=12,0 Гц), 4,06 (1H, дд, J=4,8, 1,8 Гц), 3,95-3,92 (1H, м), 3,83-3,78 (1H, м), 3,77-3,71 (1H, м), 3,34 (3Н, с), 3,06 (1H, дд, J=3,0, 2,4 Гц), 2,91 (1H, дд, J=4,8, 2,4 Гц), 2,82 (1H, дд, J=3,0, 3,0 Гц), 2,21 (1H, дд, J=12,6, 2,4 Гц), 2,17 (1H, дд, J=19,2, 8,4 Гц), 2,02 (1H, дд, J=8,1, 3,3 Гц), 1,90-1,83 (3Н, м), 1,80-1,74 (2Н, м), 1,70 (1H, ддд, J=14,4, 9,6, 4,8 Гц), 1,56-1,52 (1H, м), 1,35-1,30 (2Н, м), 1,03 (9Н, с), 0,99 (9Н, с), 0,81 (3Н, д, J=6,6 Гц), 0,78 (1H, д, J=6,0 Гц), 0,16 (6Н, с), 0,11 (3Н, с), 0,10 (3Н, с) м.д. 13С-ЯМР (125 МГц, C6D6): δ 169,1, 159,8, 131,0, 129,3, 129,3, 114,1, 114,1, 103,9, 81,1, 80,5, 79,7, 72,9, 71,8, 71,1, 70,8, 67,7, 54,8, 40,7, 38,2, 35,1, 33,0, 30,6, 29,5, 29,2, 27,4, 26,2 (×6), 16,8, 14,4, -4,2, -4,5, -5,1, -5,2 м.д. FTIP (пленка): 3507, 2954, 2929, 2879, 2856, 1732, 1612, 1513, 1462, 1382, 1363, 1210, 1158, 1068, 1004, 944, 834, 777 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C46H74O10NaSi2+ 865,4713; обнаружено 865,4721.
(с 0,95, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 7,14 (1H, д, J=8,4 Гц), 6,82 (1H, д, J=9,0 Гц), 4,18 (1H, д, J=12,0 Гц), 4,18-4,15 (1H, м), 4,12 (1H, д, J=12,0 Гц), 4,06 (1H, дд, J=4,8, 1,8 Гц), 3,95-3,92 (1H, м), 3,83-3,78 (1H, м), 3,77-3,71 (1H, м), 3,34 (3Н, с), 3,06 (1H, дд, J=3,0, 2,4 Гц), 2,91 (1H, дд, J=4,8, 2,4 Гц), 2,82 (1H, дд, J=3,0, 3,0 Гц), 2,21 (1H, дд, J=12,6, 2,4 Гц), 2,17 (1H, дд, J=19,2, 8,4 Гц), 2,02 (1H, дд, J=8,1, 3,3 Гц), 1,90-1,83 (3Н, м), 1,80-1,74 (2Н, м), 1,70 (1H, ддд, J=14,4, 9,6, 4,8 Гц), 1,56-1,52 (1H, м), 1,35-1,30 (2Н, м), 1,03 (9Н, с), 0,99 (9Н, с), 0,81 (3Н, д, J=6,6 Гц), 0,78 (1H, д, J=6,0 Гц), 0,16 (6Н, с), 0,11 (3Н, с), 0,10 (3Н, с) м.д. 13С-ЯМР (125 МГц, C6D6): δ 169,1, 159,8, 131,0, 129,3, 129,3, 114,1, 114,1, 103,9, 81,1, 80,5, 79,7, 72,9, 71,8, 71,1, 70,8, 67,7, 54,8, 40,7, 38,2, 35,1, 33,0, 30,6, 29,5, 29,2, 27,4, 26,2 (×6), 16,8, 14,4, -4,2, -4,5, -5,1, -5,2 м.д. FTIP (пленка): 3507, 2954, 2929, 2879, 2856, 1732, 1612, 1513, 1462, 1382, 1363, 1210, 1158, 1068, 1004, 944, 834, 777 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C46H74O10NaSi2+ 865,4713; обнаружено 865,4721.
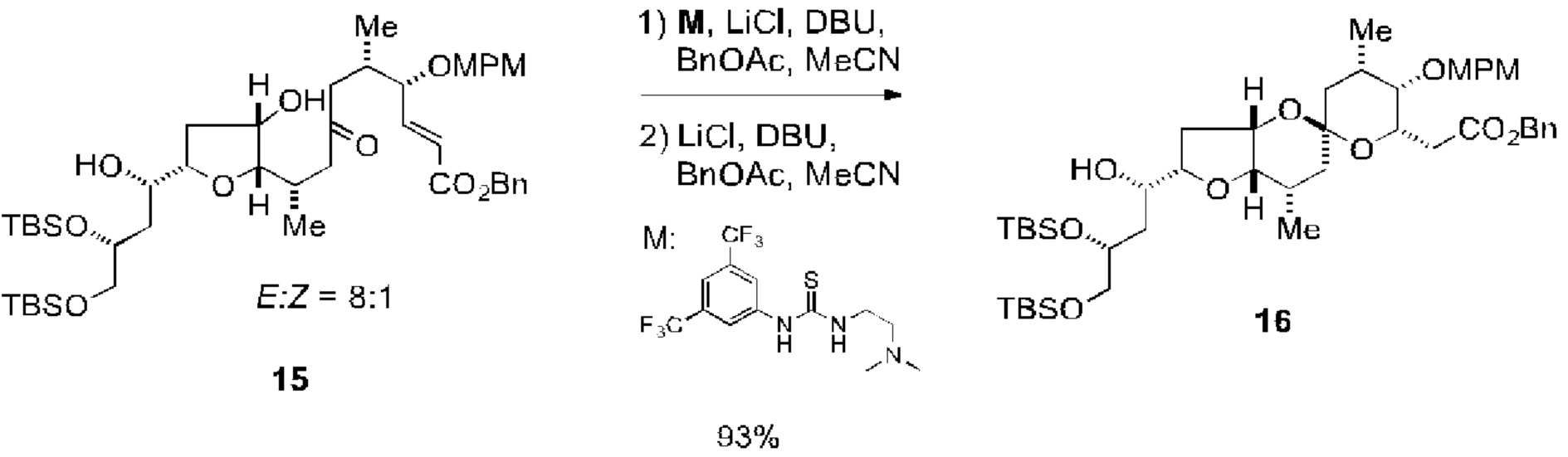
[00810] К раствору 15 (60 мг, 0,071 ммоль, 1 экв.), тиомечевинному катализатору М (12,7 мг, 0,036 ммоль, 0,5 экв.), BnOAc (12 мкл, 0,0710 ммоль, 1 экв.) и LiCl (30,2 мг, 0,711 ммоль, 10 экв.) в MeCN (1,4 мл, 0,05 М) добавляли DBU (0,21 мл, 1,42 ммоль, 20 экв.). После перемешивания в течение 2 ч при комнатной температуре, реакционную смесь наносили на слой SiO2 и промывали 33% EtOAc в гексанах. Смесь концентрировали и растворяли в 1,4 мл дихлорметана, после чего добавляли BnOAc (12 мкл, 0,0710 ммоль, 1 экв.), LiCl (30,2 мг, 0,711 ммоль, 10 экв.) и DBU (0,21 мл, 1,42 ммоль, 20 экв.). После перемешивания в течение 24 ч при комнатной температуре, реакционную смесь наносили на слой SiO2 и промывали EtOAc. Смесь концентрировали и сушили над SiO2 (25% EtOAc в гексанах) с получением 16 (55,8 мг, 0,066 ммоль, 93%, диастереоизомерное соотношение>25:1).
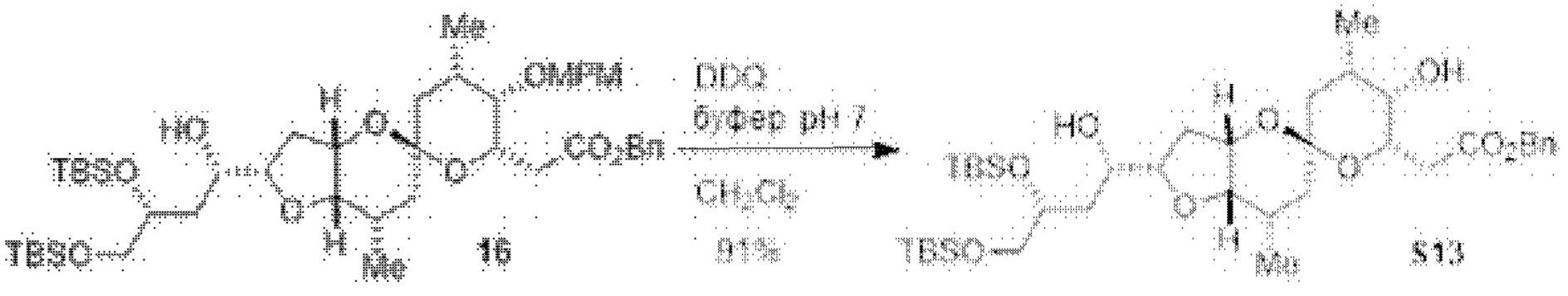
[00811] К раствору 16 (650 мг, 0,77 ммоль) в дихлорметане (15 мл) и фосфатном буфере (рН=7, 2,5 мл) добавляли DDQ (437 мг, 1,93 ммоль). После перемешивания в течение 40 мин, реакционную смесь гасили добавлением 10% водного Na2S2O3 и насыщенного водного NaHCO3. Смесь дважды экстрагировали DCM, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (33% EtOAc в гексанах) с получением S13 (518 мг, 0,72 ммоль, 93%) в виде бесцветного масла. S13: 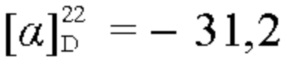 (с 4,0, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 7,23 (2Н, д, J=7,1 Гц), 7,11 (2Н, дд, J=1,5, 7,1 Гц), 7,06 (1Н, дд, J=1,5, 7,5 Гц), 5,09 (1H, д, J=12,0 Гц), 5,00 (1H, д, J=12,0 Гц), 4,22-4,18 (2Н, м), 4,02 (1H, ддд, J=6,6, 3,6, 1,2 Гц), 3,95-3,74 (4Н, м), 3,26 (1H, д, J=2,4 Гц), 3,22 (1H, дд, J=2,4, 2,4 Гц), 2,87 (1H, д, J=8,4 Гц), 2,78 (1H, дд, J=15,9, 10,9 Гц), 2,21 (1H, дд, J=14,6, 3,0 Гц), 2,11-2,06 (1H, м), 2,00-1,92 (3Н, м), 1,85-1,78 (1H, м), 1,49 (1H, т, J=12,9 Гц), 1,30 (1H, дд, J=14,4, 4,8 Гц), 1,17 (1H, дд, J=14,4, 4,8 Гц), 1,15 (1H, д, J=4,0 Гц), 1,11 (1H, д, J=12,6 Гц), 1,00 (3Н, д, J=6,6 Гц), 0,99 (9Н, с), 0,96 (9Н, с), 0,75 (3Н, д, J=6,6 Гц), 0,15 (3Н, с), 0,12 (3Н, с), 0,08 (3Н, с), 0,07 (3Н, с) м.д. 13С-ЯМР (150 МГц, C6D6) δ: 171,4, 128,8, 128,7, 128,4, 97,2, 80,5, 79,6, 72,1, 71,9, 70,7, 70,1, 69,9, 67,8, 66,2, 38,9, 37,3, 37,0, 37,0, 35,6, 30,0, 26,3 (×6), 18,6, 18,4, 18,2, 17,5, -4,1, -4,5, -5,1, -5,1 м.д. FTIP (пленка): 3560, 2955, 2928, 2856, 1737, 1471, 1376, 1361, 1252, 1099, 1016, 835, 777 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C38H66O9NaSi2+ 745,4138; обнаружено 745,4143.
(с 4,0, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 7,23 (2Н, д, J=7,1 Гц), 7,11 (2Н, дд, J=1,5, 7,1 Гц), 7,06 (1Н, дд, J=1,5, 7,5 Гц), 5,09 (1H, д, J=12,0 Гц), 5,00 (1H, д, J=12,0 Гц), 4,22-4,18 (2Н, м), 4,02 (1H, ддд, J=6,6, 3,6, 1,2 Гц), 3,95-3,74 (4Н, м), 3,26 (1H, д, J=2,4 Гц), 3,22 (1H, дд, J=2,4, 2,4 Гц), 2,87 (1H, д, J=8,4 Гц), 2,78 (1H, дд, J=15,9, 10,9 Гц), 2,21 (1H, дд, J=14,6, 3,0 Гц), 2,11-2,06 (1H, м), 2,00-1,92 (3Н, м), 1,85-1,78 (1H, м), 1,49 (1H, т, J=12,9 Гц), 1,30 (1H, дд, J=14,4, 4,8 Гц), 1,17 (1H, дд, J=14,4, 4,8 Гц), 1,15 (1H, д, J=4,0 Гц), 1,11 (1H, д, J=12,6 Гц), 1,00 (3Н, д, J=6,6 Гц), 0,99 (9Н, с), 0,96 (9Н, с), 0,75 (3Н, д, J=6,6 Гц), 0,15 (3Н, с), 0,12 (3Н, с), 0,08 (3Н, с), 0,07 (3Н, с) м.д. 13С-ЯМР (150 МГц, C6D6) δ: 171,4, 128,8, 128,7, 128,4, 97,2, 80,5, 79,6, 72,1, 71,9, 70,7, 70,1, 69,9, 67,8, 66,2, 38,9, 37,3, 37,0, 37,0, 35,6, 30,0, 26,3 (×6), 18,6, 18,4, 18,2, 17,5, -4,1, -4,5, -5,1, -5,1 м.д. FTIP (пленка): 3560, 2955, 2928, 2856, 1737, 1471, 1376, 1361, 1252, 1099, 1016, 835, 777 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C38H66O9NaSi2+ 745,4138; обнаружено 745,4143.

[00812] К раствору S13 (495 мг, 0,685 ммоль) в дихлорметане (7 мл) добавляли имидазол (233 мг, 3,43 ммоль) и TESCl (0,35 мл, 2,06 ммоль). После перемешивания в течение 2 ч при комнатной температуре, реакционную смесь гасили добавлением МеОН. Смесь концентрировали и сушили методом колоночной флэш-хроматографии на нейтральном силикагеле (10% EtOAc в гексанах) с получением S14 (632 мг, 0,66 ммоль, 96%) в виде бесцветного масла. S14: 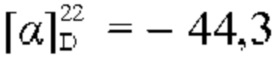 (с 1,0, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 7,23 (2Н, д, J=7,1 Гц), 7,11 (2Н, дд, J=1,5, 7,1 Гц), 7,06 (1Н, дд, J=1,5, 7,5 Гц), 5,09 (1H, д, J=12,0 Гц), 5,00 (1H, д, J=12,0 Гц), 4,23 (1H, дд, J=5,1, 2,1 Гц), 4,20-4,16 (1H, м), 4,11 (1H, дд, J=9,6, 2,4 Гц), 4,08 (1H, ддд, J=9,6, 7,2, 3,0 Гц), 3,83 (1H, ддд, J=8,4, 5,4, 5,4 Гц), 3,76 (1H, дд, J=10,2, 3,0 Гц), 3,70 (1Н, дд, J=10,2, 5,4 Гц), 3,21 (1Н, с), 3,19 (1H, д, J=3,0 Гц), 2,84 (1H, дд, J=15,6, 10,2 Гц), 2,25 (1H, дд, J=15,0, 3,6 Гц), 2,22-2,16 (1H, м), 2,15-2,11 (1H, м), 1,96 (1H, ддд, J=13,8, 8,4, 3,0 Гц), 1,88 (1H, ддд, J=13,6, 9,6, 6,0 Гц), 1,83 (1H, дд, J=13,8, 6,0 Гц), 1,73 (1H, ддд, J=13,8, 9,0, 4,2 Гц), 1,59 (1H, т, J=13,2 Гц), 1,52 (1H, т, J=13,2 Гц), 1,40 (1H, т, J=4,2 Гц), 1,37 (1H, т, J=4,2 Гц), 1,06 (9Н, т, J=7,8 Гц), 1,04 (9Н, с), 1,00 (3Н, д, J=6,6 Гц), 0,98 (9Н, с), 0,92 (1Н, т, J=8,4 Гц), 0,87 (3Н, д, J=7,2 Гц), 0,74 (6Н, т, J=8,4 Гц), 0,53 (6Н, т, J=8,8 Гц), 0,22 (3Н, с), 0,22 (3Н, с), 0,09 (6Н, с) м.д. 13С-ЯМР (150 МГц, C6D6) δ: 171,4, 136,7, 128,9, 128,7, 128,4, 97,0, 81,4, 80,3, 72,2, 72,1, 71,7, 71,5, 70,3, 68,3, 66,3, 38,3, 38,2, 37,6, 37,6, 35,4, 30,7, 26,3 (×6), 18,6, 18,4, 18,2, 18,2, 7,4, 7,3, 5,8, 5,7, -4,1, -4,2, -5,1, -5,2 м.д. FTIP (пленка): 2954, 2928, 2877, 2857, 1740, 1471, 1388, 1361, 1211, 1160, 1099, 1081, 1039, 944, 834 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C50H96O8NaSi4+ 959,6074; обнаружено 959,6070.
(с 1,0, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 7,23 (2Н, д, J=7,1 Гц), 7,11 (2Н, дд, J=1,5, 7,1 Гц), 7,06 (1Н, дд, J=1,5, 7,5 Гц), 5,09 (1H, д, J=12,0 Гц), 5,00 (1H, д, J=12,0 Гц), 4,23 (1H, дд, J=5,1, 2,1 Гц), 4,20-4,16 (1H, м), 4,11 (1H, дд, J=9,6, 2,4 Гц), 4,08 (1H, ддд, J=9,6, 7,2, 3,0 Гц), 3,83 (1H, ддд, J=8,4, 5,4, 5,4 Гц), 3,76 (1H, дд, J=10,2, 3,0 Гц), 3,70 (1Н, дд, J=10,2, 5,4 Гц), 3,21 (1Н, с), 3,19 (1H, д, J=3,0 Гц), 2,84 (1H, дд, J=15,6, 10,2 Гц), 2,25 (1H, дд, J=15,0, 3,6 Гц), 2,22-2,16 (1H, м), 2,15-2,11 (1H, м), 1,96 (1H, ддд, J=13,8, 8,4, 3,0 Гц), 1,88 (1H, ддд, J=13,6, 9,6, 6,0 Гц), 1,83 (1H, дд, J=13,8, 6,0 Гц), 1,73 (1H, ддд, J=13,8, 9,0, 4,2 Гц), 1,59 (1H, т, J=13,2 Гц), 1,52 (1H, т, J=13,2 Гц), 1,40 (1H, т, J=4,2 Гц), 1,37 (1H, т, J=4,2 Гц), 1,06 (9Н, т, J=7,8 Гц), 1,04 (9Н, с), 1,00 (3Н, д, J=6,6 Гц), 0,98 (9Н, с), 0,92 (1Н, т, J=8,4 Гц), 0,87 (3Н, д, J=7,2 Гц), 0,74 (6Н, т, J=8,4 Гц), 0,53 (6Н, т, J=8,8 Гц), 0,22 (3Н, с), 0,22 (3Н, с), 0,09 (6Н, с) м.д. 13С-ЯМР (150 МГц, C6D6) δ: 171,4, 136,7, 128,9, 128,7, 128,4, 97,0, 81,4, 80,3, 72,2, 72,1, 71,7, 71,5, 70,3, 68,3, 66,3, 38,3, 38,2, 37,6, 37,6, 35,4, 30,7, 26,3 (×6), 18,6, 18,4, 18,2, 18,2, 7,4, 7,3, 5,8, 5,7, -4,1, -4,2, -5,1, -5,2 м.д. FTIP (пленка): 2954, 2928, 2877, 2857, 1740, 1471, 1388, 1361, 1211, 1160, 1099, 1081, 1039, 944, 834 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C50H96O8NaSi4+ 959,6074; обнаружено 959,6070.
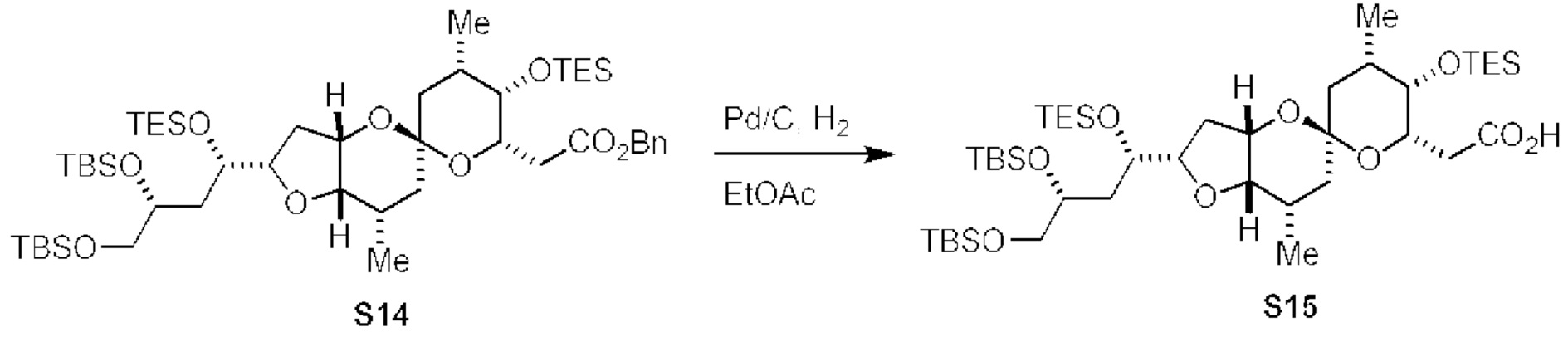
[00813] К раствору S14 (330 мг, 0,347 ммоль) в EtOAc (3,5 мл) добавляли Pd/C (33 мг, 10 масс. %). Реакционную колбу заполняли H2 из баллона, и перемешивали в течение 45 мин при комнатной температуре. Смесь пропускали через слой SiO2 с EtOAc и концентрировали. Неочищенную кислоту S15 использовали в последующей реакции без дополнительной очистки.
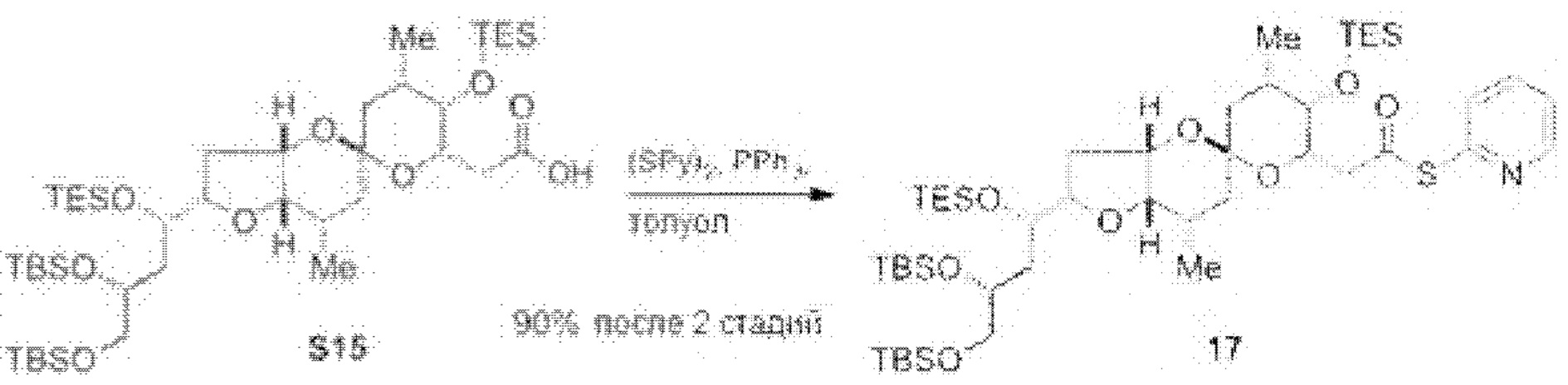
[00814] К раствору неочищенной кислоты S15 (согласно подсчетам 0,347 ммоль) в толуоле (3,5 мл) добавляли PPh3 (118 мг, 0,45 ммоль, 1,3 экв.) и (PyS)2 (107 мг, 0,49 ммоль, 1,4 экв.), 2 После перемешивания в течение 3 ч при комнатной температуре, реакционную смесь концентрировали. Путем колоночной флэш-хроматографии остатка (нейтральный SiO2, гексаны/EtOAc = 1/0, 10/1, 5/1) получали 17 (297 мг, 0,312 ммоль, 90% после 2 стадий) в виде бесцветного масла. 17: 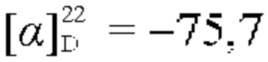 (с 0,4, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 8,32 (1H, дд, J=4,2, 1,8 Гц), 7,54 (1H, д, J=7,8 Гц), 6,96 (1H, ддд, J=7,8, 7,8, 1,4 Гц), 6,47 (1H, дд, J=7,8, 4,2 Гц), 4,34 (1H, дд, J=6,0, 1,8 Гц), 4,24-4,21 (1H, м), 4,17 (1H, дд, J=10,2, 2,4 Гц), 4,12 (1H, дд, J=9,0, 6,6, 3,0 Гц), 3,85 (1Н, дт, J=9,0, 6,0 Гц), 3,80 (1Н, дд, J=10,8, 3,0 Гц), 3,74 (1H, дд, J=10,8, 4,0 Гц), 3,36 (1H, дд, J=2,4, 2,4 Гц), 3,23 (1H, дд, J=14,7, 9,6 Гц), 3,15 (1H, с), 2,59-2,55 (1H, м), 2,53 (1H, дд, J=14,4, 3,0 Гц), 2,16-2,11 (1H, м), 2,00 (1H, ддд, J=13,8, 9,0, 3,0 Гц), 1,94 (1Н, ддд, J=13,8, 9,0, 5,4 Гц), 1,88 (1H, дд, J=13,8, 6,0 Гц), 1,77 (1H, ддд, J=13,2, 8,4, 4,2 Гц), 1,65 (1H, дд, J=13,2, 12,6 Гц), 1,60 (1H, дд, J=13,2, 12,6 Гц), 1,52 (1Н, дд, J=13,2, 4,8 Гц), 1,44 (1H, дд, J=12,9, 3,4 Гц), 1,10 (9Н, т, J=8,4 Гц), 1,09 (9Н, с), 1,07 (3Н, д, J=7,2 Гц), 1,03 (9Н, с), 0,99 (9Н, т, J=7,8 Гц), 0,91 (3Н, д, J=6,6 Гц), 0,77 (6Н, кв, J=7,8 Гц), 0,57 (6Н, кв, J=7,8 Гц), 0,27 (6Н, с), 0,137 (3Н, с), 0,136 (3Н, с) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 194,7, 152,6, 150,6, 136,5, 129,8, 123,2, 97,2, 81,4, 80,4, 72,3, 72,0, 71,9, 71,5, 70,5, 68,3, 47,6, 38,2, 37,7, 37,6, 35,3, 30,7, 26,3(×3), 26,3(×3), 18,6, 18,5, 18,5, 18,3, 7,4(×6), 5,8(×2), 5,7(×6), -4,0, -4,2, -5,1, -5,2 м.д. FTIR (пленка): 2956, 2926, 2877, 1716, 1573, 1471, 1251, 837 775, 775, 728 см-1. HRMS (ESI) m/z: [М+Н]+ рассчит. для C48H92NO8SSi4, 954,5615; обнаружено, 954,5612.
(с 0,4, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 8,32 (1H, дд, J=4,2, 1,8 Гц), 7,54 (1H, д, J=7,8 Гц), 6,96 (1H, ддд, J=7,8, 7,8, 1,4 Гц), 6,47 (1H, дд, J=7,8, 4,2 Гц), 4,34 (1H, дд, J=6,0, 1,8 Гц), 4,24-4,21 (1H, м), 4,17 (1H, дд, J=10,2, 2,4 Гц), 4,12 (1H, дд, J=9,0, 6,6, 3,0 Гц), 3,85 (1Н, дт, J=9,0, 6,0 Гц), 3,80 (1Н, дд, J=10,8, 3,0 Гц), 3,74 (1H, дд, J=10,8, 4,0 Гц), 3,36 (1H, дд, J=2,4, 2,4 Гц), 3,23 (1H, дд, J=14,7, 9,6 Гц), 3,15 (1H, с), 2,59-2,55 (1H, м), 2,53 (1H, дд, J=14,4, 3,0 Гц), 2,16-2,11 (1H, м), 2,00 (1H, ддд, J=13,8, 9,0, 3,0 Гц), 1,94 (1Н, ддд, J=13,8, 9,0, 5,4 Гц), 1,88 (1H, дд, J=13,8, 6,0 Гц), 1,77 (1H, ддд, J=13,2, 8,4, 4,2 Гц), 1,65 (1H, дд, J=13,2, 12,6 Гц), 1,60 (1H, дд, J=13,2, 12,6 Гц), 1,52 (1Н, дд, J=13,2, 4,8 Гц), 1,44 (1H, дд, J=12,9, 3,4 Гц), 1,10 (9Н, т, J=8,4 Гц), 1,09 (9Н, с), 1,07 (3Н, д, J=7,2 Гц), 1,03 (9Н, с), 0,99 (9Н, т, J=7,8 Гц), 0,91 (3Н, д, J=6,6 Гц), 0,77 (6Н, кв, J=7,8 Гц), 0,57 (6Н, кв, J=7,8 Гц), 0,27 (6Н, с), 0,137 (3Н, с), 0,136 (3Н, с) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 194,7, 152,6, 150,6, 136,5, 129,8, 123,2, 97,2, 81,4, 80,4, 72,3, 72,0, 71,9, 71,5, 70,5, 68,3, 47,6, 38,2, 37,7, 37,6, 35,3, 30,7, 26,3(×3), 26,3(×3), 18,6, 18,5, 18,5, 18,3, 7,4(×6), 5,8(×2), 5,7(×6), -4,0, -4,2, -5,1, -5,2 м.д. FTIR (пленка): 2956, 2926, 2877, 1716, 1573, 1471, 1251, 837 775, 775, 728 см-1. HRMS (ESI) m/z: [М+Н]+ рассчит. для C48H92NO8SSi4, 954,5615; обнаружено, 954,5612.
Левые половины гомогалихондринов
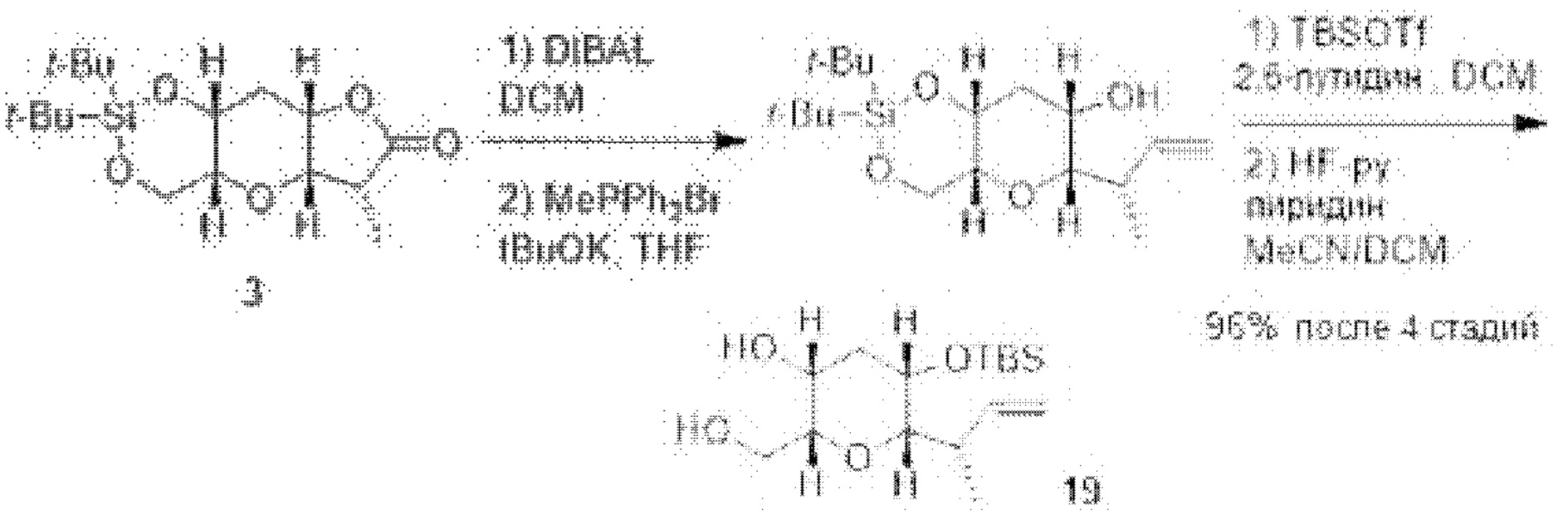
[00815] К перемешанному раствору лактона 3 (5,01 г, 14,6 ммоль, 1 экв.) в CH2Cl2 (70 мл) при -78°С в течение 15 мин добавляли раствор DIBAL (19,0 мл, 1 M в гексанах, 19,0 ммоль, 1,3 экв.). После перемешивания в течение 15 мин при той же температуре, последовательно добавляли МеОН (2,0 мл), нас. водн. сегнетову соль (70 мл) и EtOAc (70 мл). Полученный раствор перемешивали в течение 2 ч при комнатной температуре с получением прозрачного двухфазного раствора. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением неочищенного лактола в виде бесцветного твердого вещества, которое использовали на следующей стадии без дополнительной очистки.
[00816] К перемешанной суспензии MePPh3Br (21,0 г, 58,8 ммоль, 4 экв.) в THF (50 мл) при 0°С добавляли tBuOK (4,9 г, 43,7 ммоль, 3 экв.). После перемешивания в течение 1 ч при комнатной температуре, желтый раствор повторно охлаждали до 0°С. К этому раствору илида добавляли раствор неочищенного лактола (по расчетам 14,6 ммоль, 1 экв.) в THF (25 мл). После перемешивания в течение 20 мин при комнатной температуре, реакционную смесь гасили добавлением нас. водн. NH4Cl (50 мл) и Н2О (20 мл). После добавления Et2O (100 мл) органический слой разделяли. Водный слой экстрагировали Et2O. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество растворяли в минимальном количестве CH2Cl2 (~5 мл) и пропускали через слой силикагеля (20% EtOAc в гексанах). Фильтрат концентрировали в условиях пониженного давления с получением неочищенного спирта в виде бесцветного твердого вещества, которое использовали на следующей стадии без дополнительной очистки.
[00817] К перемешанному раствору неочищенного спирта (по расчетам 14,6 ммоль, 1 экв.) и 2,6-лутидина (3,4 мл, 29,2 ммоль, 2 экв.) в CH2Cl2 (70 мл) при 0°С добавляли TBSOTf (4,4 мл, 19,2 ммоль 1,3 экв.). После перемешивания в течение 30 мин при 0°С, баню со льдом удаляли, и перемешивали реакционную смесь дополнительно в течение 30 мин при комнатной температуре. Реакционную смесь гасили добавлением солевого раствора и разбавляли Et2O (200 мл). Органический слой разделяли и последовательно промывали 1н HCl, нас. водн. NaHCO3 и солевым раствором. Органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением неочищенного TBS-эфира в виде бледно-желтого масла, которое использовали на следующей стадии без дополнительной очистки.
[00818] Забуференный HF⋅Py раствор получали путем добавления HF⋅Py (3,0 мл ~70% HF в пиридине, ~114 ммоль, ~8 экв.) к смеси пиридина (15 мл) и MeCN (20 мл) при 0°С. К перемешанному раствору неочищенного TBS-эфира (по расчетам 14,6 ммоль, 1 экв.) в MeCN (50 мл) и CH2Cl2 (30 мл) при -10°С в течение 15 мин добавляли забуференный HF⋅Py раствор. После перемешивания в течение 30 мин при той же температуре, реакционную смесь нагревали до комнатной температуры. После перемешивания в течение 1 ч при той же температуре, смесь охлаждали до 0°С и осторожно гасили добавлением нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на силикагеле (25%, затем 50% EtOAc в гексанах) с получением диола 19 (4,43 г, 14,0 ммоль, 96% после 4 стадий) в виде бесцветного аморфного твердого вещества. 19: [α]20D -36,7 (с 1,06, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 6,01 (1H, ддд, J=16,9, 10,5, 6,2 Гц), 5,10 (1H, д, J=16,9 Гц), 5,05 (1H, д, J=10,5 Гц), 4,04 (1H, ддд, J=11,1, 7,8, 3,0 Гц), 3,77 (1Н, ддд, J=11,1, 9,2, 4,4 Гц), 3,57 (1Н, ушир. с), 3,51-3,46 (2Н, м), 3,18 (1H, дд, J=7,5, 4,5 Гц), 2,68-2,66 (2Н, м), 2,01 (1H, дд, J=8,4, 3,0 Гц), 1,95 (1H, ддд, J=14,6, 2,7, 2,7 Гц), 1,12 (1H, ддд, J=14,6, 2,7, 2,7 Гц), 0,90 (9Н, S), 0,82 (3Н, д, J=5,4 Гц), 0,07 (3Н, с), -0,06 (3Н, с) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 141,9, 114,0, 84,2, 81,7, 66,9, 65,7, 63,4, 38,1, 37,1, 25,9, 18,2, 15,7, -3,8, -5,1 м.д. FTIR (пленка): 3527, 3259, 2960, 2929, 2858, 1256, 1090, 1056, 879, 776 см-1. HRMS (ESI) m/z: [М+Н]+ рассчит. для C16H33O4Si, 317,2143; обнаружено, 317,2145.
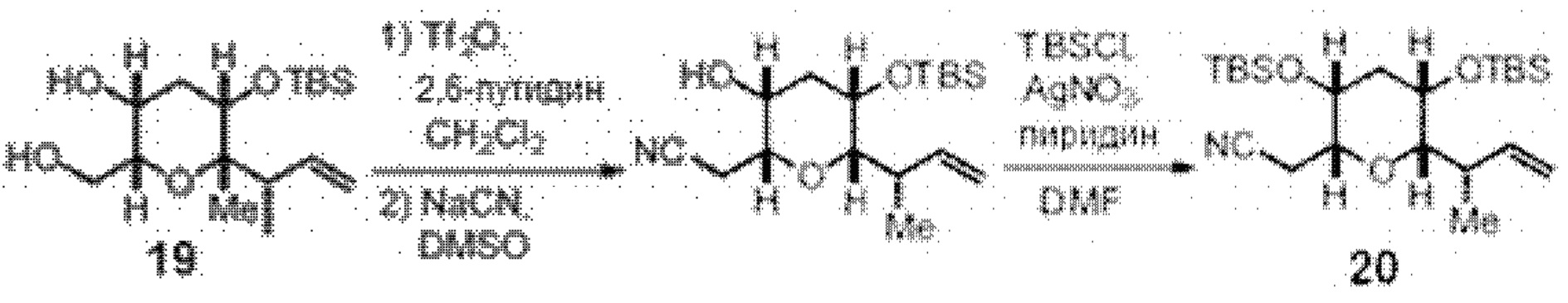
[00819] К перемешанному раствору диола 19 (7,30 г, 23,1 ммоль, 1 экв.) и 2,6-лутидина (10,8 мл, 92,7 ммоль, 4 экв.) в CH2Cl2 (150 мл) при -78°С добавляли Tf2O (4,7 мл, 27,9 ммоль, 1,2 экв.). После перемешивания в течение 10 мин при той же температуре, реакционную смесь гасили добавлением МеОН (1,0 мл) и солевого раствора (100 мл). После добавления Et2O (500 мл), органический слой отделяли от водного слоя и последовательно промывали 1н HCl и солевым раствором. Органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением неочищенного трифлата в виде винно-красного масла, которое немедленно растворяли в DMSO (150 мл) без дополнительной очистки.
[00820] К раствору неочищенного трифлата (по расчетам 23,1 ммоль, 1 экв.) в DMSO при комнатной температуре добавляли NaCN (11,3 г, 230 ммоль, 10 экв.). После перемешивания в течение 1 ч при той же температуре, реакционную смесь фильтровали через бумагу, и тщательно промывали осадок на фильтре EtOAc. Фильтрат промывали Н2О и солевым раствором. Органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток пропускали через слой силикагеля (20% EtOAc в гексанах) с получением неочищенного нитрила в виде розового масла, которое использовали на следующей стадии без дополнительной очистки.
[00821] К перемешанному раствору неочищенного нитрила (по расчетам 23,1 ммоль, 1 экв.) и пиридина (15,0 мл, 186 ммоль, 8 экв.) в DMF (80 мл) при 0°С добавляли TBSCl (10,4 г, 69,0 ммоль, 3 экв.) и AgNO3 (11,8 г, 69,5 ммоль, 3 экв.). После перемешивания в течение 30 мин при 0°С, охлаждающую баню удаляли, и перемешивали реакционную смесь в течение 18 ч при комнатной температуре. Реакционную смесь разбавляли Et2O (100 мл) и фильтровали через слой Celite. Осадок на фильтре промывали тщательно Et2O. Фильтрат промывали Н2О и солевым раствором. Органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на силикагеле (0%, затем 10% EtOAc в гексанах) с получением бис-TBS 20 (8,87 г, 20,2 ммоль, 87% после 3 стадий) в виде бесцветного твердого вещества. 20: [α]20D -6,7 (с 1,07, CHCl3). т.пл.: 65-67°С (перекристаллизовывали из Et2O). 1H-ЯМР (600 МГц, C6D6) δ: 6,31 (1H, ддд, J=17,4, 10,8, 6,6 Гц), 5,19 (1H, д, J=10,8 Гц), 5,15 (1H, д, J=17,4 Гц), 3,52 (1H, ушир. с), 3,23-3,22 (1H, м), 3,11 (1H, ддд, J=8,0, 5,9, 2,0 Гц), 2,82-2,77 (1Н, м), 2,66 (1Н, д, J=9,6 Гц), 2,40 (1Н, дд, J=16,8, 7,8 Гц), 2,07 (1H, дд, J=16,8, 5,4 Гц), 1,80 (1Н, ддд, J=15,4, 2,7, 2,7 Гц), 1,32 (1H, ддд, J=15,4, 4,7, 4,7 Гц), 0,98 (9Н, с), 0,93 (3Н, д, J=6,6 Гц), 0,89 (9Н, с), 0,10 (3Н, с), 0,01 (3Н, с), -0,01 (3Н, с), -0,07 (3Н, с) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 141,7, 117,9, 113,9, 85,2, 77,1, 65,0, 64,4, 38,3, 37,2, 26,4, 20,6, 18,4, 18,3, 15,9, -2,5, -3,5, -5,00, -5,03 м.д. FTIR (пленка): 2955, 2930, 2886, 2857, 1473, 1388, 1254, 1139, 1099, 1022, 835, см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C23H45NO3Si2Na, 462,2830; обнаружено, 462,2831.
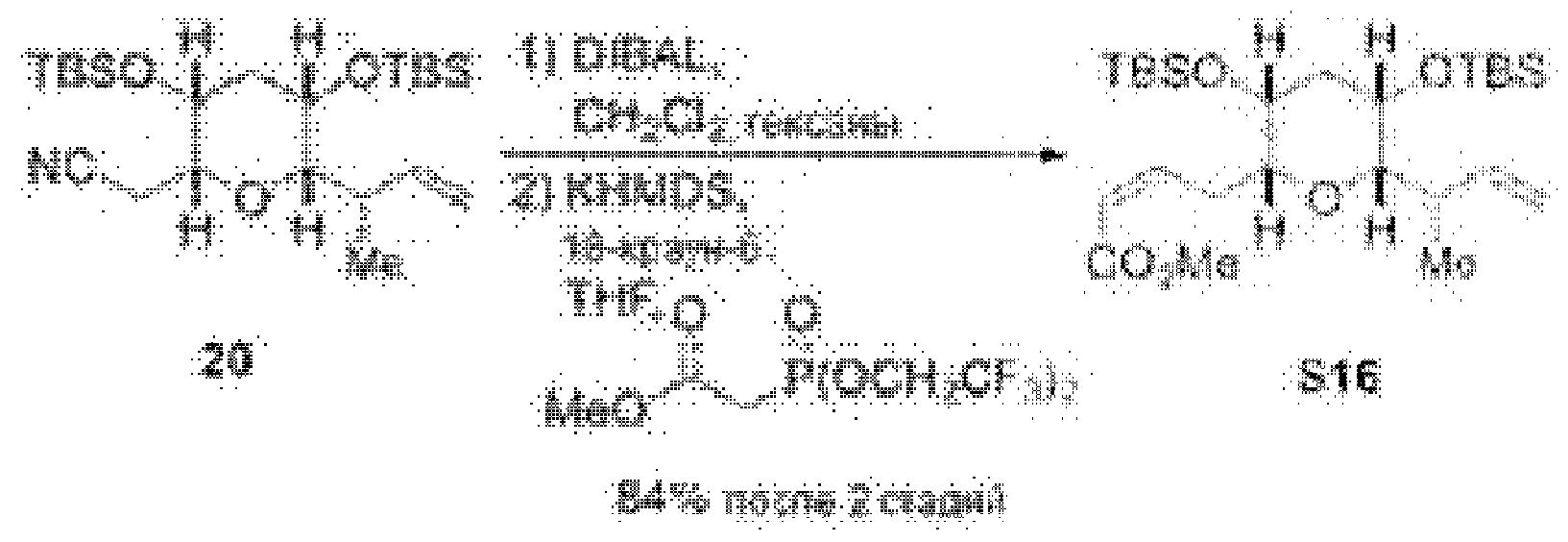
[00822] К перемешанному раствору бис-TBS 20 (8,77 г, 19,9 ммоль, 1 экв.) в гексанах (150 мл) и CH2Cl2 (50 мл) при -78°С добавляли раствор DIBAL (22,0 мл, 1 М в гексанах, 22,0 ммоль, 1,1 экв.). После перемешивания в течение 30 мин при той же температуре, реакционную смесь гасили добавлением МеОН (1,0 мл) и нас. водн. сегнетовой соли (200 мл). Смесь перемешивали в течение 1,5 ч при комнатной температуре с получением прозрачной двухфазной смеси. Органический слой разделяли, и экстрагировали водный слой Et2O. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество пропускали через слой силикагеля (20% EtOAc в гексанах) с получением неочищенного альдегида в виде бесцветного масла, которое использовали на следующей стадии без дополнительной очистки.
[00823] К перемешанному раствору метил-бис(2,2,2-трифторэтил)фосфоноацетата (6,3 мл, 29,8 ммоль, 1,5 экв.) и 18-краун-6 эфира (42,0 г, 159 ммоль, 8 экв.) в THF (400 мл) при -78°С добавляли раствор KHMDS (60 мл 0,5 М в толуоле, 30 ммоль, 1,5 экв.). После перемешивания в течение 30 мин при -78°С, полученную смесь добавляли к раствору неочищенного альдегида (по расчетам 19,9 ммоль, 1 экв.) в THF (100 мл), и перемешивали в течение 30 мин при той же температуре. Реакционную смесь гасили добавлением нас. водн. NH4Cl и разбавляли гексанами (400 мл). Органический слой разделяли, и экстрагировали водный слой Et2O/гексанами (1:1). Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на силикагеле (0%, затем 2% EtOAc в гексанах) с получением α,β-ненасыщенного сложного эфира S16 (8,37 г, 16,8 ммоль, 84% после 2 стадий) в виде бесцветного масла. Получали исключительно Z-изомер. S16: [α]20D +42,0 (с 1,03, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 6,67-6,63 (1Н, м), 6,16 (1H, ддд, J=11,6, 10,2, 6,6 Гц), 5,91 (1H, дд, J=11,1, 1,5 Гц), 5,11 (1H, дд, J=17,6, 1,5 Гц), 5,09 (1H, дд, J=10,2, 1,5 Гц). 3,60 (1H, д, 1,8 Гц), 3,454-3,447 (1H, м), 3,34 (3Н, с), 3,34-3,30 (1H, м), 3,13 (1H, д, 10,8 Гц), 3,03-2,97 (1H, м), 2,89-2,83 (1H, м), 2,68 (1H, д, 9,0 Гц), 1,92 (1Н, д, 14,6 Гц), 1,45 (1H, ддд, 14,6, 4,5, 4,5 Гц), 1,03 (9Н, с), 1,01 (9Н, с), 0,93 (3Н, д, J=7,2 Гц), 0,19 (3Н, с), 0,16 (3Н, с), 0,12 (3Н, с), 0,04 (3Н, с) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 166,6, 149,3, 142,6, 119,9, 113,4, 85,3, 81,0, 66,7, 64,7, 50,5, 39,0, 37,6, 32,5, 26,7, 26,4, 18,6, 18,5, 15,9, -2,3, -3,6, -4,6, -5,0 м.д. FTIR (пленка): 2951, 2929, 2857, 1723, 1644, 1253, 1091, 951, 836, 771 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C26H50O5Si2Na, 521,3089; обнаружено, 521,3087.
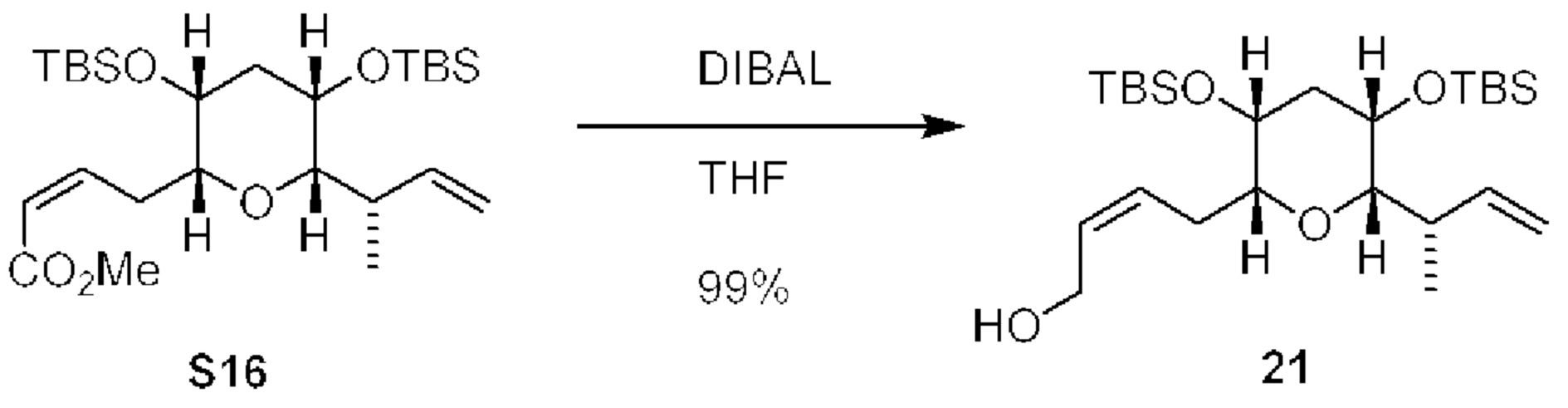
[00824] К перемешанному раствору сложного эфира S16 (8,30 г, 16,6 ммоль, 1 экв.) в THF (200 мл) при -78°С добавляли раствор DIBAL (66 мл, 1 M в гексанах, 66,0 ммоль, 4 экв.). После перемешивания в течение 10 мин при той же температуре, реакционную смесь нагревали до 0°С и перемешивали дополнительно в течение 30 мин. Реакционную смесь гасили добавлением ацетона (5,0 мл) и нас. водн. сегнетовой соли (200 мл). Полученную смесь перемешивали в течение 2 ч при комнатной температуре с получением прозрачного двухфазного раствора. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на силикагеле (11% EtOAc в гексанах) с получением аллилового спирта 21 (7,72 г, 16,4 ммоль, 99%) в виде бесцветного твердого вещества. 21: [α]20D -16,6 (с 1,00, CHCl3). т.пл.: 60-62°С (перекристаллизовывали из Et2O). 1Н-ЯМР (600 МГц, C6D6) δ: 6,24 (1H, ддд, J=17,4, 10,5, 6,9 Гц), 5,83-5,81 (1Н, м), 5,77-5,74 (1H, м), 5,18-5,14 (2Н, м), 4,23-4,20 (1H, м), 4,14-4,10 (1H, м), 3,62 (1H, д, J=1,2 Гц), 3,349-3,345 (1H, м), 3,05 (1H, д, J=9,6 Гц), 2,89-2,80 (2Н, м), 2,72 (1H, д, J=9,0 Гц), 1,96 (1H, дд, J=14,4, 6,6 Гц), 1,91 (1H, ддд, J=14,6, 2,4, 2,4 Гц), 1,78-1,77 (1H, м), 1,49 (1Н, ддд, J=14,6, 4,7, 4,7 Гц), 1,01 (18Н, с), 0,95 (3Н, д, J=7,2 Гц), 0,15 (3Н, с), 0,08 (3Н, с), 0,05 (3Н, с), 0,004 (3Н, с) м.д. 13С-ЯМР(125 МГц, C6D6) δ: 142,4, 131,4, 129,2, 113,6, 85,1, 80,6, 66,7, 65,0, 58,8, 39,1, 37,5, 30,5, 26,5, 26,4, 18,53, 18,50, 16,0, -2,3, -3,5, -4,7, -5,0 м.д. FTIR (пленка): 2952, 2929, 2855, 1463, 1252, 1138, 1003, 833, 768 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C25H50O4Si2Na, 493,3140; обнаружено, 493,3142.
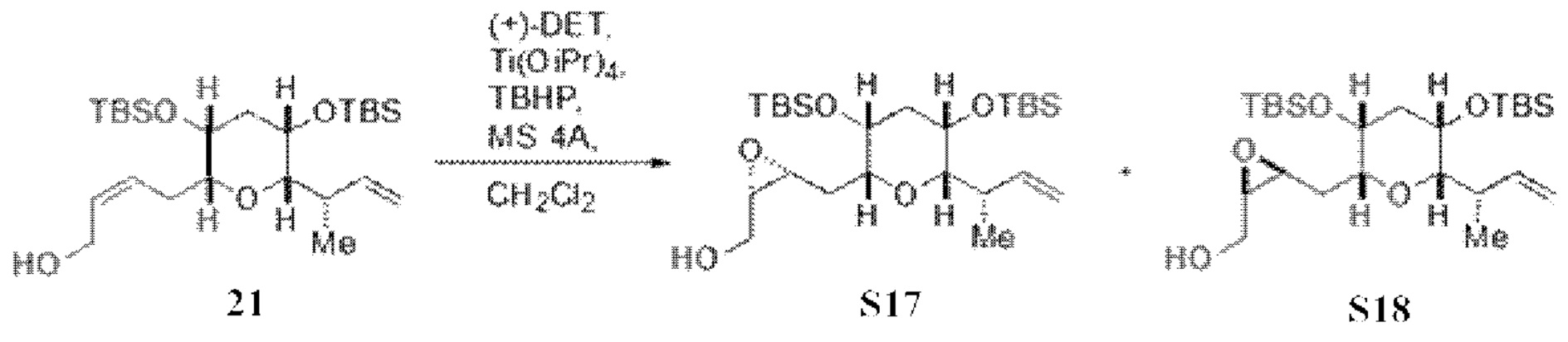
[00825] К перемешанной суспензии молекулярных сит  (1,5 г, активированный порошок) в CH2Cl2 (50 мл) при -20°С добавляли Ti(OiPr)4 (0,72 мл, 2,43 ммоль, 15 мол. %) и раствор (+)-DET (0,55 мл, 3,21 ммоль, 20 мол. %) в CH2Cl2 (5,0 мл). После перемешивания в течение 15 мин при той же температуре, к реакционной смеси добавляли раствор ТВНР (4,5 мл ~5,5 М в декане, молекулярные сита 4А, ~24,8 ммоль, ~1,5 экв.), и перемешивали в течение 30 мин. В отдельной колбе, раствор аллилового спирта 21 (7,65 г, 16,2 ммоль, 1 экв.) в CH2Cl2 (80 мл) охлаждали до -78°С. К охлажденному раствору аллилового спирта через канюлю добавляли представленный выше раствор катализатора, и промывали CH2Cl2 (30 мл). После перемешивания в течение 10 мин при -78°С, реакционную смесь нагревали до -10°С и перемешивали в течение 15 ч. Реакционную колбу удаляли с охлаждающей бани, и при перемешивании добавляли к холодному реакционной смеси Et2O (200 мл), а затем добавляли нас. водн. Na2SO4 (2,5 мл). После перемешивания в течение 2 ч при комнатной температуре, смесь фильтровали через слой Celite, и тщательно промывали осадок на фильтре EtOAc. После удаления растворителя в условиях пониженного давления, полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на силикагеле (0%, 5%, 10%, 11%, затем 20% EtOAc в гексанах) с получением эпоксиспирта S17 (6,81 г, 14,0 ммоль, 86%) в виде бесцветного твердого вещества и его нецелевого диастереоизомера S18 (862 мг, 1,77 ммоль, 11%) в виде бесцветного твердого вещества. S17: [α]20D -26,0 (с 1,08, CHCl3). т.пл.: 78-79°С (перекристаллизовывали из гексанов/EtOAc). 1Н-ЯМР (600 МГц, C6D6) δ: 6,09-6,03 (1H, м), 5,21 (1H, д, J=18,0 Гц), 5,11 (1H, д, J=10,8 Гц), 3,92-3,88 (1H, м), 3,65 (1H, ддд, J=11,4, 7,8, 3,0 Гц), 3,58 (1H, с), 3,239-3,235 (1H, м), 3,17-3,12 (2Н, м), 3,08 (1Н, J=4,1, 4,1, 4,1 Гц), 2,78-2,71 (2Н, м), 2,64 (1Н, д, J=9,6 Гц), 2,13 (1H, ддд, J=14,1, 11,4, 8,4 Гц), 1,84 (1H, ддд, J=15,0, 2,4, 2,4 Гц), 1,57-1,53 (1H, м), 1,41 (1H, ддд, J=15,0, 4,2, 4,2 Гц), 1,01 (9Н, с), 0,98 (9Н, с), 0,90 (3Н, д, J=6,6 Гц), 0,13 (3Н, с), 0,03 (3Н, с), 0,02 (3Н, с), -0,06 (3Н, с) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 142,1, 114,1, 85,35, 85,33, 78,8, 66,2, 64,5, 60,9, 56,1, 54,7, 38,8, 37,6, 30,3, 26,5, 26,3, 18,4, 16,0, -2,3, -3,7, -4,8, -5,1 м.д. FTIR (пленка): 2952, 2929, 2856, 1252, 1011, 833, 768 см-1. HRMS (ESI) m/z: [M+NH4]+ рассчит. для C25H54NO5Si2, 504,3535; обнаружено, 504,3527. Диастереоизомер S18: [α]20D +11,9 (с 1,00, CHCl3). т.пл.: 89-91°С (перекристаллизовывали из Et2O). 1Н-ЯМР (600 МГц, C6D6) δ: 6,19 (1H, ддд, J=17,4, 10,7, 6,9 Гц), 5,17 (1H, ддд, J=17,4, 1,8, 1,8 Гц), 5,12 (1H, д, J=10,7 Гц), 3,70-3,68 (1H, м), 3,65 (1H, ддд, J=11,4, 6,0, 6,0 Гц), 3,59 (1H, ддд, J=11,4, 5,4, 5,4 Гц), 3,49 (1H, дд, J=8,4, 4,8 Гц), 3,44 (1H, ддд, J=7,8, 4,2, 4,2 Гц), 3,41 (1H, ддд, J=8,4, 3,6, 3,6 Гц), 3,02 (1H, дд, J=10,8, 5,4 Гц), 2,89-2,83 (1H, м), 2,76 (1H, дд, J=10,2, 2,4 Гц), 2,44 (1H, ддд, J=13,8, 8,4, 5,1 Гц), 1,95 (1H, ддд, J=14,4, 4,8, 3,6 Гц), 1,65 (1H, ддд, J=14,4, 4,8, 4,8 Гц), 1,57 (1H, ддд, J=14,4, 7,8, 3,6 Гц), 1,59-1,50 (1Н, м), 1,04 (9Н, с), 0,98-0,97 (12Н, м), 0,16 (3Н, с), 0,07 (3Н, с), 0,06 (3Н, с), 0,00 (3Н, с) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 142,3, 113,7, 84,4, 79,2, 66,5, 65,3, 60,7, 56,0, 54,5, 39,1, 37,4, 30,9, 26,4, 26,3, 18,5, 18,4, 15,9, -2,5, -3,8, -4,8, -5,0 м.д. FTIR (пленка): 3448, 2953, 2929, 2857, 1463, 1253, 1128, 1088, 1005, 902, 833, 770, 735 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C25H50O5Si2Na, 509,3089; обнаружено, 509,3088.
(1,5 г, активированный порошок) в CH2Cl2 (50 мл) при -20°С добавляли Ti(OiPr)4 (0,72 мл, 2,43 ммоль, 15 мол. %) и раствор (+)-DET (0,55 мл, 3,21 ммоль, 20 мол. %) в CH2Cl2 (5,0 мл). После перемешивания в течение 15 мин при той же температуре, к реакционной смеси добавляли раствор ТВНР (4,5 мл ~5,5 М в декане, молекулярные сита 4А, ~24,8 ммоль, ~1,5 экв.), и перемешивали в течение 30 мин. В отдельной колбе, раствор аллилового спирта 21 (7,65 г, 16,2 ммоль, 1 экв.) в CH2Cl2 (80 мл) охлаждали до -78°С. К охлажденному раствору аллилового спирта через канюлю добавляли представленный выше раствор катализатора, и промывали CH2Cl2 (30 мл). После перемешивания в течение 10 мин при -78°С, реакционную смесь нагревали до -10°С и перемешивали в течение 15 ч. Реакционную колбу удаляли с охлаждающей бани, и при перемешивании добавляли к холодному реакционной смеси Et2O (200 мл), а затем добавляли нас. водн. Na2SO4 (2,5 мл). После перемешивания в течение 2 ч при комнатной температуре, смесь фильтровали через слой Celite, и тщательно промывали осадок на фильтре EtOAc. После удаления растворителя в условиях пониженного давления, полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на силикагеле (0%, 5%, 10%, 11%, затем 20% EtOAc в гексанах) с получением эпоксиспирта S17 (6,81 г, 14,0 ммоль, 86%) в виде бесцветного твердого вещества и его нецелевого диастереоизомера S18 (862 мг, 1,77 ммоль, 11%) в виде бесцветного твердого вещества. S17: [α]20D -26,0 (с 1,08, CHCl3). т.пл.: 78-79°С (перекристаллизовывали из гексанов/EtOAc). 1Н-ЯМР (600 МГц, C6D6) δ: 6,09-6,03 (1H, м), 5,21 (1H, д, J=18,0 Гц), 5,11 (1H, д, J=10,8 Гц), 3,92-3,88 (1H, м), 3,65 (1H, ддд, J=11,4, 7,8, 3,0 Гц), 3,58 (1H, с), 3,239-3,235 (1H, м), 3,17-3,12 (2Н, м), 3,08 (1Н, J=4,1, 4,1, 4,1 Гц), 2,78-2,71 (2Н, м), 2,64 (1Н, д, J=9,6 Гц), 2,13 (1H, ддд, J=14,1, 11,4, 8,4 Гц), 1,84 (1H, ддд, J=15,0, 2,4, 2,4 Гц), 1,57-1,53 (1H, м), 1,41 (1H, ддд, J=15,0, 4,2, 4,2 Гц), 1,01 (9Н, с), 0,98 (9Н, с), 0,90 (3Н, д, J=6,6 Гц), 0,13 (3Н, с), 0,03 (3Н, с), 0,02 (3Н, с), -0,06 (3Н, с) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 142,1, 114,1, 85,35, 85,33, 78,8, 66,2, 64,5, 60,9, 56,1, 54,7, 38,8, 37,6, 30,3, 26,5, 26,3, 18,4, 16,0, -2,3, -3,7, -4,8, -5,1 м.д. FTIR (пленка): 2952, 2929, 2856, 1252, 1011, 833, 768 см-1. HRMS (ESI) m/z: [M+NH4]+ рассчит. для C25H54NO5Si2, 504,3535; обнаружено, 504,3527. Диастереоизомер S18: [α]20D +11,9 (с 1,00, CHCl3). т.пл.: 89-91°С (перекристаллизовывали из Et2O). 1Н-ЯМР (600 МГц, C6D6) δ: 6,19 (1H, ддд, J=17,4, 10,7, 6,9 Гц), 5,17 (1H, ддд, J=17,4, 1,8, 1,8 Гц), 5,12 (1H, д, J=10,7 Гц), 3,70-3,68 (1H, м), 3,65 (1H, ддд, J=11,4, 6,0, 6,0 Гц), 3,59 (1H, ддд, J=11,4, 5,4, 5,4 Гц), 3,49 (1H, дд, J=8,4, 4,8 Гц), 3,44 (1H, ддд, J=7,8, 4,2, 4,2 Гц), 3,41 (1H, ддд, J=8,4, 3,6, 3,6 Гц), 3,02 (1H, дд, J=10,8, 5,4 Гц), 2,89-2,83 (1H, м), 2,76 (1H, дд, J=10,2, 2,4 Гц), 2,44 (1H, ддд, J=13,8, 8,4, 5,1 Гц), 1,95 (1H, ддд, J=14,4, 4,8, 3,6 Гц), 1,65 (1H, ддд, J=14,4, 4,8, 4,8 Гц), 1,57 (1H, ддд, J=14,4, 7,8, 3,6 Гц), 1,59-1,50 (1Н, м), 1,04 (9Н, с), 0,98-0,97 (12Н, м), 0,16 (3Н, с), 0,07 (3Н, с), 0,06 (3Н, с), 0,00 (3Н, с) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 142,3, 113,7, 84,4, 79,2, 66,5, 65,3, 60,7, 56,0, 54,5, 39,1, 37,4, 30,9, 26,4, 26,3, 18,5, 18,4, 15,9, -2,5, -3,8, -4,8, -5,0 м.д. FTIR (пленка): 3448, 2953, 2929, 2857, 1463, 1253, 1128, 1088, 1005, 902, 833, 770, 735 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C25H50O5Si2Na, 509,3089; обнаружено, 509,3088.
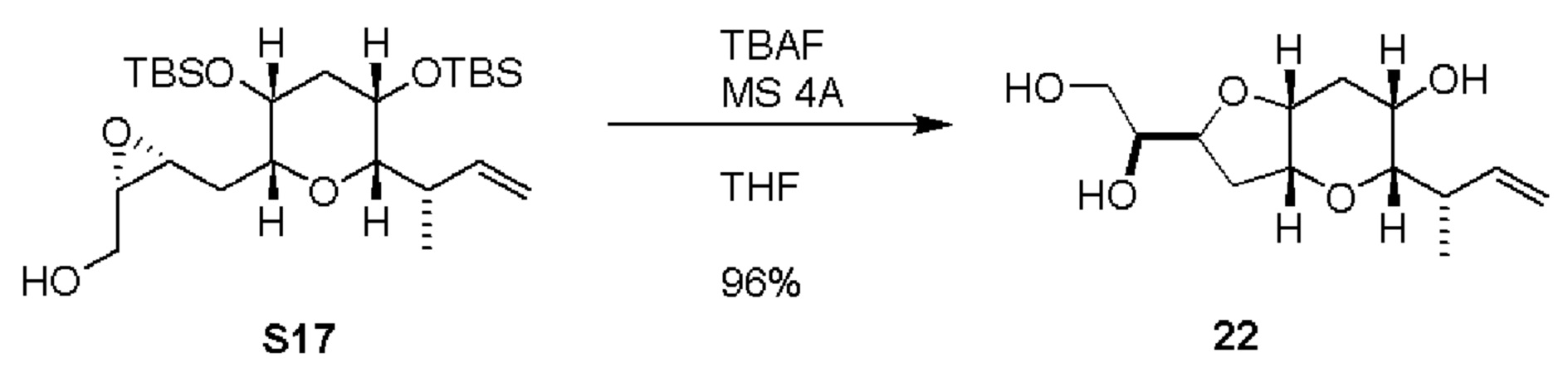
[00826] К перемешанному раствору эпоксиспирта S17 (6,73 г, 13,8 ммоль, 1 экв.) в THF (20,0 мл) при комнатной температуре добавляли молекулярные сита  (4,0 г, активированные гранулы) и раствор TBAF (80,0 мл, 1 M в THF, 80,0 ммоль, 5,8 экв.). После перемешивания в течение 12 ч при той же температуре, последовательно добавляли СаСО3 (20,0 г), DOWEX 50WX8-400 (60,0 г), МеОН (10 мл) и THF (100 мл). После перемешивания в течение 1,5 ч при комнатной температуре, смесь фильтровали через слой Celite, и тщательно промывали фильтрат EtOAc. После удаления растворителя в условиях пониженного давления, полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на силикагеле (CH2Cl2, затем EtOAc) с получением триола 22 (3,73 г, 13,3 ммоль, 96%) в виде бесцветного аморфного твердого вещества. 22: [α]20D -64,8 (с 1,00, CHCl3). 1Н-ЯМР (600 МГц, CD3OD) δ: 5,96 (1H, ддд, J=17,5, 10,5, 7,1 Гц), 5,03 (1H, ддд, 17,5, 1,6, 1,6 Гц), 4,97 (1H, ддд, J=10,5, 1,6, 1,5 Гц), 4,35 (1H, ддд, 9,5, 6,9, 4,1 Гц), 4,05 (1H, д, J=3,0 Гц), 3,93 (1H, с), 3,73 (1H, дд, J=3,0, 3,0 Гц), 3,61 (1H, дд, J=11,1, 5,7 Гц), 3,57 (1H, дд, 11,1, 5,7 Гц), 3,46 (1H, дд, J=6,0, 6,0, 4,2 Гц), 3,01 (1Н, д, J=9,0 Гц), 2,50-2,44 (1Н, м), 2,31 (1H, ддд, J=15,5, 2,4, 2,4 Гц), 2,09 (1H, ддд, 13,2, 9,2, 3,8 Гц), 2,04 (1Н, дд, J=13,2, 6,6 Гц), 1,89 (1Н, ддд, J=15,5, 3,8, 3,8 Гц), 0,99 (3Н, д, J=7,2 Гц) м.д. 13С-ЯМР (125 МГц, CD3OD) δ: 143,5, 113,8, 82,8, 79,3, 79,0, 77,4, 74,9, 64,8, 64,6, 39,4, 36,6, 33,1, 15,6 м.д. FTIR (пленка): 3387, 2935, 2886, 1638, 1415, 1093, 1032, 838 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C13H22O5Na, 281,1359; обнаружено, 281,1359. Стереохимию триола 22 подтверждали методом рентгеновского кристаллографического анализа его 3,5-динитробензоатного производного S19.
(4,0 г, активированные гранулы) и раствор TBAF (80,0 мл, 1 M в THF, 80,0 ммоль, 5,8 экв.). После перемешивания в течение 12 ч при той же температуре, последовательно добавляли СаСО3 (20,0 г), DOWEX 50WX8-400 (60,0 г), МеОН (10 мл) и THF (100 мл). После перемешивания в течение 1,5 ч при комнатной температуре, смесь фильтровали через слой Celite, и тщательно промывали фильтрат EtOAc. После удаления растворителя в условиях пониженного давления, полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на силикагеле (CH2Cl2, затем EtOAc) с получением триола 22 (3,73 г, 13,3 ммоль, 96%) в виде бесцветного аморфного твердого вещества. 22: [α]20D -64,8 (с 1,00, CHCl3). 1Н-ЯМР (600 МГц, CD3OD) δ: 5,96 (1H, ддд, J=17,5, 10,5, 7,1 Гц), 5,03 (1H, ддд, 17,5, 1,6, 1,6 Гц), 4,97 (1H, ддд, J=10,5, 1,6, 1,5 Гц), 4,35 (1H, ддд, 9,5, 6,9, 4,1 Гц), 4,05 (1H, д, J=3,0 Гц), 3,93 (1H, с), 3,73 (1H, дд, J=3,0, 3,0 Гц), 3,61 (1H, дд, J=11,1, 5,7 Гц), 3,57 (1H, дд, 11,1, 5,7 Гц), 3,46 (1H, дд, J=6,0, 6,0, 4,2 Гц), 3,01 (1Н, д, J=9,0 Гц), 2,50-2,44 (1Н, м), 2,31 (1H, ддд, J=15,5, 2,4, 2,4 Гц), 2,09 (1H, ддд, 13,2, 9,2, 3,8 Гц), 2,04 (1Н, дд, J=13,2, 6,6 Гц), 1,89 (1Н, ддд, J=15,5, 3,8, 3,8 Гц), 0,99 (3Н, д, J=7,2 Гц) м.д. 13С-ЯМР (125 МГц, CD3OD) δ: 143,5, 113,8, 82,8, 79,3, 79,0, 77,4, 74,9, 64,8, 64,6, 39,4, 36,6, 33,1, 15,6 м.д. FTIR (пленка): 3387, 2935, 2886, 1638, 1415, 1093, 1032, 838 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C13H22O5Na, 281,1359; обнаружено, 281,1359. Стереохимию триола 22 подтверждали методом рентгеновского кристаллографического анализа его 3,5-динитробензоатного производного S19.
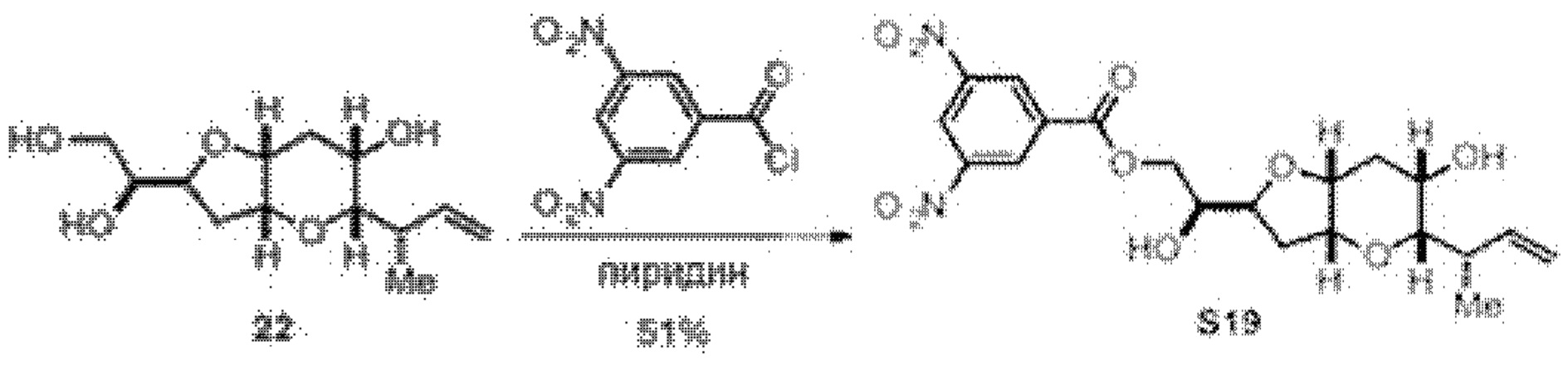
[00827] К перемешанному раствору триола 22 (16,4 мг, 0,0635 ммоль) в пиридине (0,50 мл) при комнатной температуре добавляли 3,5-динитробензоилхлорид (20,0 мг, 0,0867 ммоль, 1,4 экв.). После перемешивания в течение 5 ч при той же температуре, полученную реакционную смесь разбавляли EtOAc и промывали последовательно 1н HCl, нас. водн. NaHCO3 и солевым раствором. Органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество очищали методом PTLC (EtOAc) с получением динитробензоата S19 (14,7 мг, 0,0325 ммоль, 51%) в виде бесцветного твердого вещества. Путем перекристаллизации из гексанов/EtOAc получали монокристалл, подходящий для исследований рентгеновской дифракции. S19: [α]20D -51,3 (с 0,735, CHCl3). т.пл.: 127-129°С (перекристаллизовывали из гексанов/EtOAc). 1H-ЯМР (600 МГц, C6D6) δ: 8,70 (2Н, д, J=2,1 Гц), 8,48 (1H, т, J=2,1 Гц), 6,13 (1H, ддд, J=16,5, 10,3, 6,9 Гц), 5,18 (1Н, д, J=16,5 Гц), 5,14 (1H, д, J=10,3 Гц), 4,28 (1H, дд, J=11,4, 7,2 Гц), 4,00-3,95 (2Н, м), 3,55 (1H, ддд, J=10,2, 3,0, 3,0 Гц), 3,48 (1H, д, J=3,0 Гц), 3,38 (1H, с), 3,29-3,26 (1H, м), 2,97 (1H, д, J=10,8 Гц), 2,86-2,82 (1H, м), 2,61 (1H, д, J=9,0 Гц), 2,22 (1H, д, J=15,3 Гц), 2,01-1,96 (1H, м), 1,86 (1H, дд, J=12,8, 6,9 Гц), 1,68 (1H, ддд, J=12,8, 9,6, 3,6 Гц), 1,20 (1H, ддд, J=15,3, 3,3, 3,3 Гц), 1,03 (3Н, д, J=7,2 Гц) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 162,7, 148,3, 142,5, 133,0, 128,8, 122,1, 113,8, 82,1, 78,0, 77,6, 77,2, 71,4, 68,4, 63,5, 38,7, 36,1, 32,3, 15,3 м.д. FTIR (пленка): 3489, 3423, 3100, 2919, 1733, 1545, 1345, 1282, 1170, 1095,921, 721 см-1. HRMS (ESI) m/z: [M+NH4]+ рассчит. для C20H28N3O10, 470,1769; обнаружено, 470,1779.
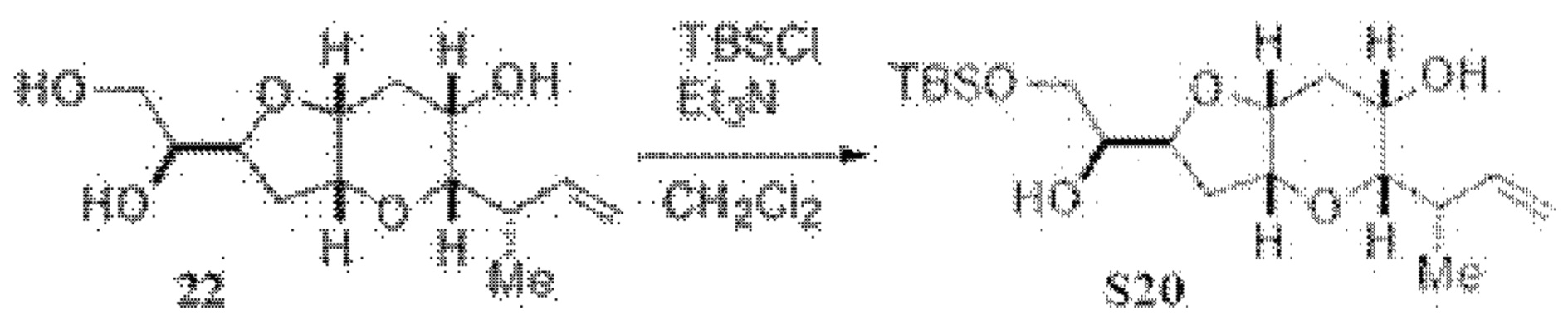
[00828] К перемешанному раствору триола 22 (480 мг, 1,71 ммоль, 1 экв.) в CH2Cl2 (9,0 мл) при комнатной температуре добавляли Et3N (0,95 мл, 6,82 ммоль, 4 экв.) и TBSCl (385 мг, 2,55 ммоль, 1,5 экв.). После перемешивания в течение 5 ч, к реакционной смеси добавляли TBSCl (200 мг, 1,33 ммоль, 0,8 экв.) и перемешивали дополнительно в течение 15 ч. Реакционную смесь гасили добавлением нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на силикагеле (17%, затем 25% EtOAc в гексанах) с получением TBS-эфира S20 (633 мг, 1,70 ммоль, 99%) в виде бесцветного твердого вещества. S20: [α]20D -41,6 (с 1,00, CHCl3). т.пл.: 55-58°С (перекристаллизовывали из Et2O). 1Н-ЯМР (600 МГц, CD3OD) δ: 5,97 (1H, ддд, J=17,4, 10,5, 7,5 Гц), 5,04 (1H, д, J=17,4 Гц), 4,98 (1H, д, J=10,5 Гц), 4,41-4,38 (1H, м), 4,05 (1H, с), 3,93 (1H, с), 3,73 (1H, с), 3,72-3,66 (2Н, м), 3,45 (1H, дд, 9,3, 5,7 Гц), 3,02 (1H, д, J=9,0 Гц), 2,50-2,44 (1H, м), 2,32 (1H, д, J=15,2 Гц), 2,13 (1Н, ддд, J=13,1, 9,6, 3,4 Гц), 2,04 (1H, дд, J=13,1, 7,2 Гц), 1,89 (1Н, ддд, J=15,2, 3,3, 3,3 Гц), 0,99 (3Н, д, J=7,2 Гц), 0,92 (9Н, с), 0,09 (6Н, с) м.д. 13С-ЯМР (125 МГц, CD3OD) δ: 143,4, 113,9, 82,8, 79,3, 78,6, 77,6, 74,8, 65,7, 65,0, 39,5, 36,5, 33,0, 26,4, 19,2, 15,6, -5,2, -5,3 м.д. FTIR (пленка): 3504, 2953, 2930, 2886, 2857, 1255, 1095, 837, 755 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C19H36O5SiNa, 395,2224; обнаружено, 395,2225.
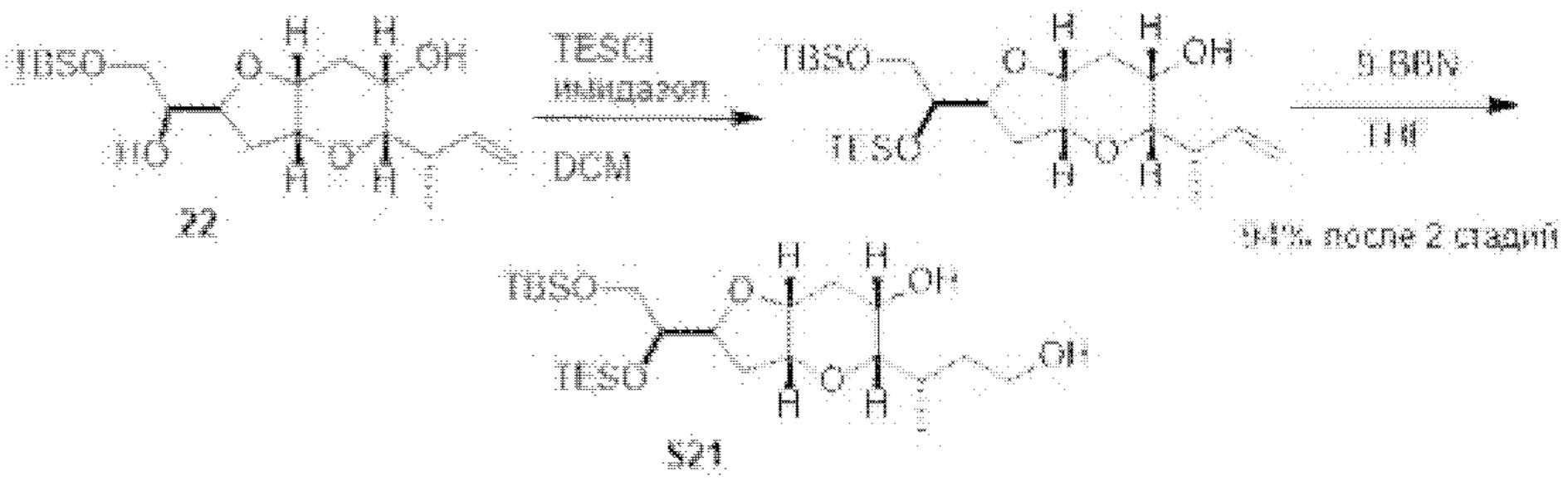
[00829] К перемешанному раствору TBS-эфира S20 (540 мг, 1,45 ммоль, 1 экв.) в CH2Cl2 (20 мл) при 0°С добавляли имидазол (300 мг, 4,41 ммоль, 3 экв.) и TESCl (0,29 мл, 1,73 ммоль, 1,2 экв.). После перемешивания в течение 15 мин при 0°С, реакционную смесь гасили добавлением солевого раствора. После разделения органического слоя, водный слой экстрагировали Et2O. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток растворяли в гексанах и фильтровали через слой силикагеля (20% EtOAc в гексанах) с получением неочищенного TES-эфира в виде бледно-желтого масла, которое использовали на следующей стадии без дополнительной очистки.
[00830] Неочищенный TES-эфир (по расчетам 1,45 ммоль, 1 экв.) охлаждали до 0°С и растворяли в предварительно охлажденном растворе 9-BBN (9,0 мл 0,5 М в THF, 4,50 ммоль, 3 экв., ~5°С). После перемешивания в течение 5 мин при 0°С, баню со льдом удаляли, и перемешивали реакционную смесь в течение 1 ч при комнатной температуре. Реакционную смесь охлаждали до 0°С и гасили добавлением Н2О (10 мл). После добавления NaBO3⋅Н2О (2,60 г, 26,0 ммоль, 18 экв.) при той же температуре, полученную смесь энергично перемешивали в течение 1 ч при комнатной температуре. Смесь разбавляли солевым раствором (10 мл) и EtOAc (20 мл). Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (CH2Cl2, затем 0%, 9%, 17%, 20%, 25%, затем 33% EtOAc в гексанах) с получением диола S21 (689 мг, 1,36 ммоль, 94% после 2 стадий) в виде бесцветного масла. S21: [α]20D +3,27 (с 1,04, CHCl3). 1Н-ЯМР (600 МГц, CD3OD) δ: 4,36 (1H, ддд, J=8,1, 8,1, 3,6 Гц), 4,07 (1H, д, J=3,0 Гц), 3,90 (1H, с), 3,73 (1H, с), 3,70 (1H, дд, J=9,9, 6,3 Гц), 3,68-3,59 (4Н, м), 2,96 (1Н, д, J=9,6 Гц), 2,29 (1Н, д, J=15,0 Гц), 2,09 (1H, ддд, J=13,2, 9,0, 4,2 Гц), 2,04 (1H, дд, J=13,2, 6,6 Гц), 2,03-1,98 (1H, м), 1,91-1,87 (2Н, м), 1,40-1,34 (1H, м), 0,98 (9Н, т, J=7,8 Гц), 0,92-0,90 (12Н, м), 0,65 (6Н, кв, J=7,8 Гц), 0,084 (3Н, с), 0,079 (3Н, с) м.д. 13С-ЯМР (125 МГц, CD3OD) δ: 83,3, 78,4, 79,2, 77,5, 76,8, 66,2, 65,1, 61,5, 37,4, 36,5, 33,0, 32,3, 26,44, 26,38, 19,2, 15,7, 7,3, 6,0, -5,2 м.д. FTIR (пленка): 3518, 2952, 2931, 2876, 1252, 1092, 835, 777, 741 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C25H52O6Si2Na, 527,3195; обнаружено, 527,3194.
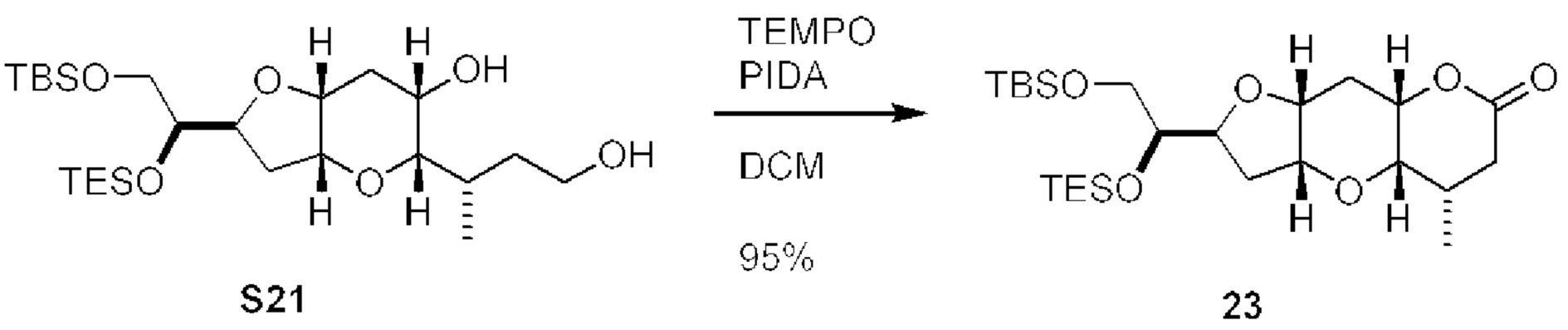
[00831] К перемешанному раствору диола S21 (202 мг, 0,400 ммоль) в CH2Cl2 (5,0 мл) при комнатной температуре добавляли TEMPO (12,5 мг, 20 мол. %) и PIDA (390 мг, 3 экв.). После перемешивания в течение 36 ч, реакционную смесь гасили добавлением нас. водн. NaHCO3 и нас. водн. Na2S2O3. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (0%, 9%, 20%, 25%, затем 33% EtOAc в гексанах) с получением лактона 23 (191 мг, 0,381 ммоль, 95%) в виде бесцветного масла. 23: [α]20D -30,0 (с 1,02, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 4,44-4,41 (1H, м), 3,95-3,92 (1H, м), 3,85-3,82 (1H, м), 3,70-3,66 (2Н, м), 3,54 (1H, д, J=1,8 Гц), 3,46 (1H, ушир. с), 2,52 (1H, с), 2,36-2,31 (2Н, м), 2,16 (1H, дд, J=18,0, 6,0 Гц), 2,05-2,00 (1H, м), 1,90 (1H, дд, J=12,9, 6,6 Гц), 1,34-1,30 (1H, м), 1,17 (1Н, ддд, J=15,8, 3,9,3,9 Гц), 1,04 (9Н, т, J=7,8 Гц), 1,00 (9Н, с), 0,76 (3Н, д, J=6,6 Гц), 0,68 (6Н, кв, J=7,8 Гц), 0,18 (3Н, с), 0,15 (3Н, с) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 168,4, 78,2, 77,9, 75,8, 73,8, 73,0, 71,4, 65,8, 35,6, 33,0, 31,3, 30,9, 26,2, 18,6, 16,7, 7,2, 5,6, -5,2 -5,3 м.д. FTIR (пленка): 2953, 2929, 2877, 1730, 1461, 1246, 1117, 1085, 1002, 856, 776, 741, 668 см-1. HRMS (ESI) m/z: [M+H]+ рассчит. для C25H49O6Si2, 501,3062; обнаружено, 501,3063.
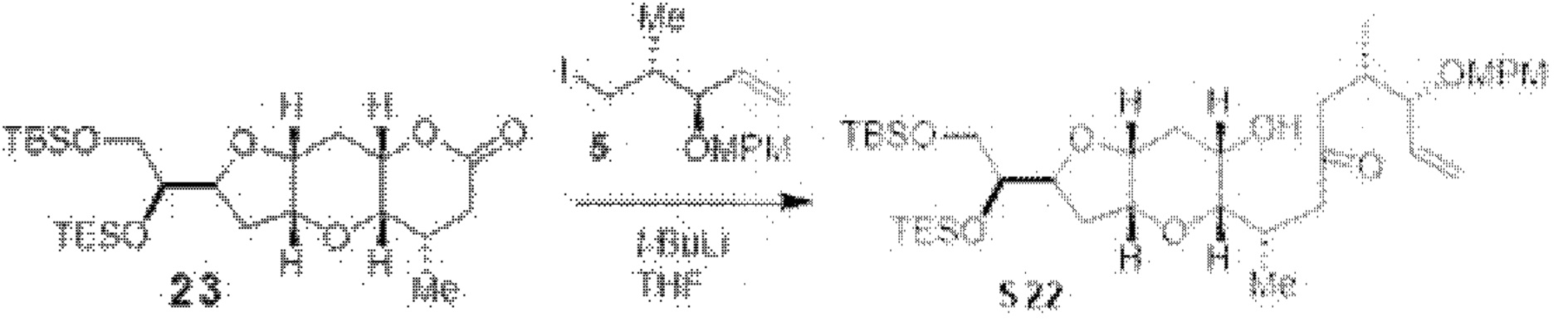
[00832] К перемешанному раствору лактона 23 (467 мг, 0,932 ммоль) и йодида (420 мг, 1,3 экв.) в THF (6,0 мл) при -78°С в течение 20 мин добавляли раствор tBuLi (1,3 мл 1,7 М в пентане, 2,21 ммоль, 2,5 экв.). После перемешивания в течение 30 мин, реакционную смесь гасили добавлением нас. водн. NH4Cl и перемешивали в течение 10 мин при комнатной температуре. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (0%, 5%, 7%, затем 17% EtOAc в гексанах) с получением кетона, который содержал небольшое количество примесей. Чистое соединение, которое существует в виде равновесной смеси кетона и гемиацеталя (соотношение ~10:1 в C6D6), получали для аналитических целей методом PTLC (гексаны/EtOAc = 2:1). Далее представлены спектральные данные только для только для основной кетоновой формы S22. S22: [α]20D -1,4 (с 1,13, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 7,28 (2Н, д, J=8,1 Гц), 6,85 (2Н, д, J=8,1 Гц), 5,64 (1Н, ддд, J=16,8, 9,0, 7,5 Гц), 5,13 (1H, д, J=9,0 Гц), 5,11 (1H, д, J=16,8 Гц), 4,57 (1H, д, J=11,4 Гц), 4,49 (1H, ддд, J=6,3, 6,3, 3,3 Гц), 4,23 (1Н, д, J=10,8 Гц), 3,83 (1Н, дд, J=9,9, 6,3 Гц), 3,75 (1H, дд, J=10,8, 6,0 Гц), 3,74 (1Н, с), 3,63 (1Н, д, J=3,0 Гц), 3,60-3,55 (2Н, м), 3,47 (1Н, дд, J=7,5, 7,5 Гц), 3,37 (1H, д, J=10,8 Гц), 3,33 (3Н, с), 2,79 (1H, дд, J=16,8, 4,2 Гц), 2,77-2,69 (3Н, м), 2,52-2,50 (1H, м), 2,30 (1H, д, J=15,6 Гц), 2,24 (1H, дд, J=16,8, 7,5 Гц), 2,20 (1H, дд, J=16,8, 8,7 Гц), 2,04 (1H, дд, J=12,9, 6,9 Гц), 1,96 (1H, ддд, J=12,6, 9,0, 4,2 Гц), 1,24 (1H, ддд, J=15,3, 3,0, 3,0 Гц), 1,12 (1H, дд, J=8,4, 8,4 Гц), 1,01 (9Н, т, J=7,8 Гц), 10,1-0,95 (6Н, м), 0,95 (9Н, с), 0,63 (6Н, кв, J=7,8 Гц), 0,09 (3Н, с), 0,08 (3Н, с) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 208,7, 159,6, 137,9, 131,3, 129,5, 119,0, 114,0, 84,1, 82,0, 78,2, 78,1, 76,7, 75,8, 70,2, 65,5, 63,7, 54,8, 47,8, 46,0, 35,6, 34,0, 32,4, 31,4, 26,1, 18,5, 16,6, 16,3, 7,2, 5,5, -5,3 м.д. FTIR (пленка): 3518, 2953, 2932, 2876, 1709, 1613, 1514, 1463, 1413, 1248, 1092, 1037, 835, 778, 741 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C39H68O8Si2Na, 743,4345; обнаружено, 743,4414.
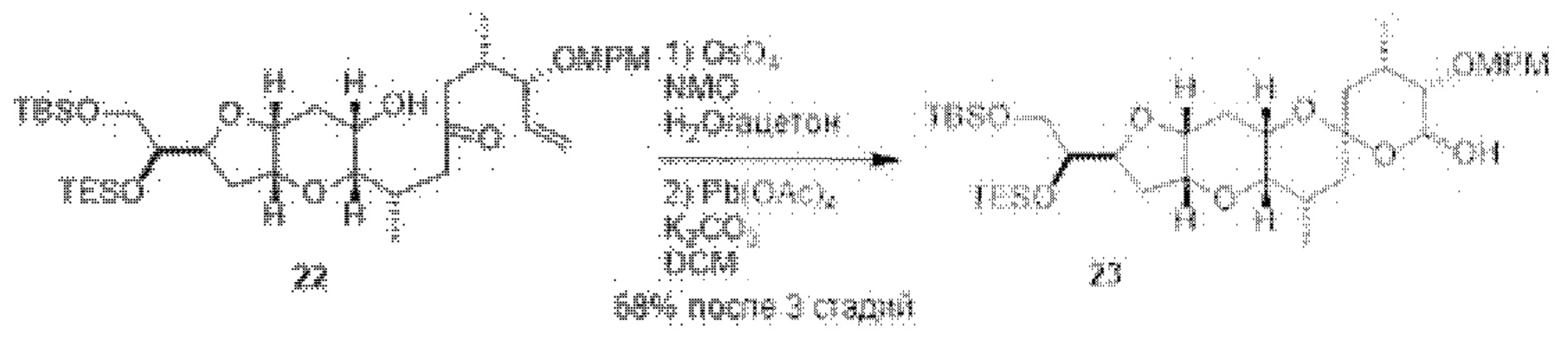
[00833] К перемешанному раствору неочищенного кетона (по расчетам 0,932 ммоль, 1 экв.) в ацетоне (5,0 мл) при комнатной температуре добавляли раствор OsO4 (5,0 мл 0,02 М в Н2О, 0,100 ммоль, 10 мол. %) и NMO (220 мг, 1,89 ммоль, 2 экв.). После перемешивания в течение 4 ч при той же температуре, реакционную смесь гасили добавлением N2SO3 (1,5 г) и разбавляли солевым раствором. После перемешивания в течение 30 мин при комнатной температуре, органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением неочищенного диола в виде коричневого масла, которое использовали на следующей стадии без дополнительной очистки.
[00834] К раствору неочищенного диола (по расчетам 0,932 ммоль, 1 экв.) в CH2Cl2 (19 мл) при комнатной температуре добавляли K2CO3 (1,3 г, 9,41 ммоль, 10 экв.) и Pb(ОАс)4 (620 мг, 1,40 ммоль, 1,5 экв.). После перемешивания в течение 15 мин при той же температуре, реакционную смесь разбавляли гексанами/EtOAc (2:1) и фильтровали через слой SiO2 (33% EtOAc в гексанах). После выпаривания органического растворителя, полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (0%, 5%, 9%, 13%, затем 17% EtOAc в гексанах) с получением гемиацеталя S23 (461 мг, 0,638 ммоль, 68% после 3 стадий) в виде бледно-коричневого масла. Продукт получали в виде равновесной смеси гемиацеталя (соотношение -3:7 в C6D6). S23: [α]20D -35,8 (с 1,04, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 7,17-7,15 (2Н, м), 6,80-6,74 (2Н, м), 5,44 (0,3Н, дд, J=11,7, 1,5 Гц), 4,92 (0,7Н, дд, J=12,6, 1,5 Гц), 4,52 (0,7Н, д, J=11,1 Гц), 4,45-4,39 (1,3Н, м), 4,32 (0,7Н, д, J=11,1 Гц), 4,23 (0,3Н, д, J=11,4 Гц), 4,09 (0,3Н, д, J=3,0 Гц), 3,95 (0,3Н, д, J=10,8 Гц), 3,83-3,80 (1H, м), 3,77-3,74 (1H, м), 3,69-3,60 (3Н, м), 3,56 (0,7Н, д, J=4,2 Гц), 3,33 (0,3Н, с), 3,29-3,27 (4Н, м), 3,16 (0,7Н, с), 2,74-2,72 (1Н, м), 2,62-2,56 (0,3Н. м), 2,35-2,25 (1,7Н, м), 2,18 (0,7Н, д, J=15,0 Гц), 2,10-2,00 (1,3Н, м), 1,92-1,80 (1,3Н, м), 1,72-1,59 (1,7Н, м), 1,54 (0,7Н, дд, J=12,6, 4,2 Гц), 1,51-1,48 (1H, м), 1,45-1,38 (1H, м), 1,11-1,07 (9,9Н, м), 1,04-0,98 (14,1Н, м), 0,77-0,72 (6Н, м), 0,121-0,09 (6Н, м) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 159,9, 159,7, 131,2, 129,7, 129,5, 114,2, 114,0, 98,9, 98,2, 93,8, 91,3, 80,1, 79.1, 79,0, 78,5, 77,8, 77,7, 76,8, 76,0, 74,1, 73,9, 73,4, 73,1, 72,2, 66,1, 64,8, 64,0, 54,7, 38,4, 38.2, 37,7, 37,3, 36,4, 31,5, 31,3, 29,7, 29,2, 26,2, 26,1, 23,2, 18,6, 17,8, 17,5, 17,44, 17,39, 7,3, 7,2, 5,7, 5,5, -5,1, -5,3 м.д. FTIR (пленка): 3507, 2953, 2928, 2874, 1514, 1462, 1248, 1090, 1035, 1013, 835, 776, 742 см-1. HRMS (ESI) m/z: [M+NH4]+ рассчит. для C38H70NO9S12, 740,4584; обнаружено, 740,4608.
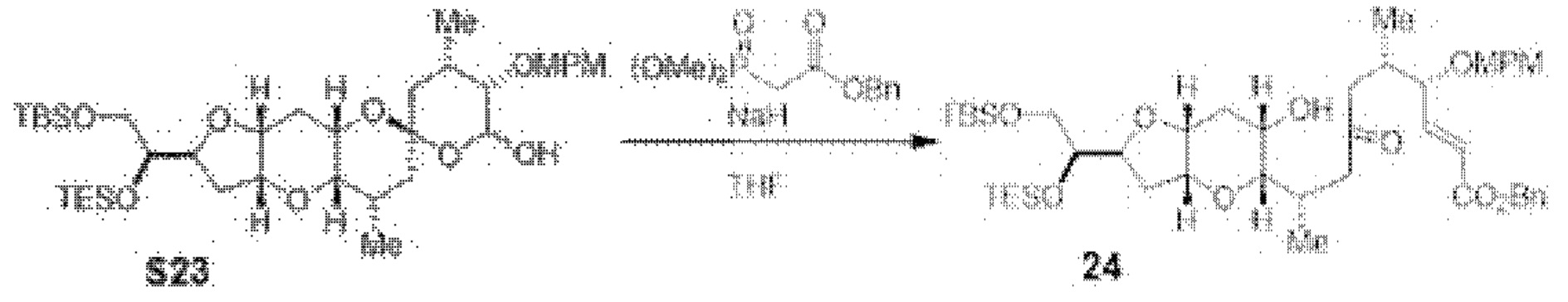
[00835] К перемешанному раствору гемиацеталя S23 (461 мг, 0,638 ммоль, 1 экв.) и бензилдиметилфосфоноацетата (0,67 мл, 3,19 ммоль, 5 экв.) в THF (26,0 мл) при 0°С добавляли NaH (100 мг 60% в минеральном масле, 2,50 ммоль, 4 экв.). После перемешивания в течение 3 ч при той же температуре, реакционную смесь гасили добавлением нас. водн. NH4Cl. Органический слой разделяли, и экстрагировали водный слой гексанами/EtOAc (1:1). Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (0%, 5%, 9%, 13%, затем 17% EtOAc в гексанах) с получением ненасыщенного сложного эфира 24 (479 мг, 0,560 ммоль, 88%) в виде бесцветного масла. 24: [α]20D -21,7 (с 1,00, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 7,24 (2Н, д, J=7,2 Гц), 7,15 (2Н, д, J=8,4 Гц), 7,10 (2Н, дд, J=7,2, 7,2 Гц), 7,05 (1H, т, J=7,2 Гц), 7,04 (1Н, дд, J=15,5, 6,3 Гц), 6,79 (2Н, д, J=8,4 Гц), 6,20 (1H, д, J=15,5 Гц), 5,14 (1H, д, J=12,0 Гц), 5,10 (1H, д, J=12,0 Гц), 4,48 (1H, ддд, J=8,1, 8,1, 3,4 Гц), 4,38 (1H, д, J=12,0 Гц), 4,10 (1H, д, J=12,0 Гц), 3,83 (1H, дд, J=9,9, 6,3 Гц), 3,77-3,74 (2Н, м), 3,63-3,59 (3Н, м), 3,55 (1H, ддд, J=10,8, 3,0, 3,0 Гц), 3,35-3,32 (4Н, м), 2,70-2,64 (3Н, м), 2,54 (1Н, дд, J=16,8, 4,8 Гц), 2,47-2,43 (1Н, м), 2,29 (1H, д, J=15,6 Гц), 2,15-2,08 (2Н, м), 2,04-1,95 (2Н, м), 1,25 (1H, ддд, J=15,0, 3,6, 3,6 Гц), 1,10 (1H, дд, J=7,8, 7,8 Гц), 1,01 (9Н, т, J=8,1 Гц), 0,95 (9Н, с), 0,92 (3Н, д, J=6,6 Гц), 0,86 (3Н, д, J=6,6 Гц), 0,64 (6Н, кв, J=8,1 Гц), 0,08 (3Н, с), 0,07 (3Н, с) м.д. 13С-ЯМР (150 МГц, C6D6) δ: 208,2, 165,6, 159,8, 147,8, 136,6, 130,6, 129,7, 128,70, 128,66, 128,3, 123,3, 114,1, 81,9, 81,5, 78,2, 78,1, 76,7, 75,9, 71,1, 66,4, 65,5, 63,7, 54,7, 47,6, 45,5, 35,6, 33,6, 32,4, 31,4, 26,1, 18,5, 16,4, 16,3, 7,2, 5,5, -5,3 м.д. FTIR (пленка): 3526, 2953, 2933, 2876, 1719, 1612, 1513, 1462, 1249, 1160, 1093, 1036, 836, 778, 741, 697 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C47H74O10Si2Na, 877,4713; обнаружено, 877,4713.
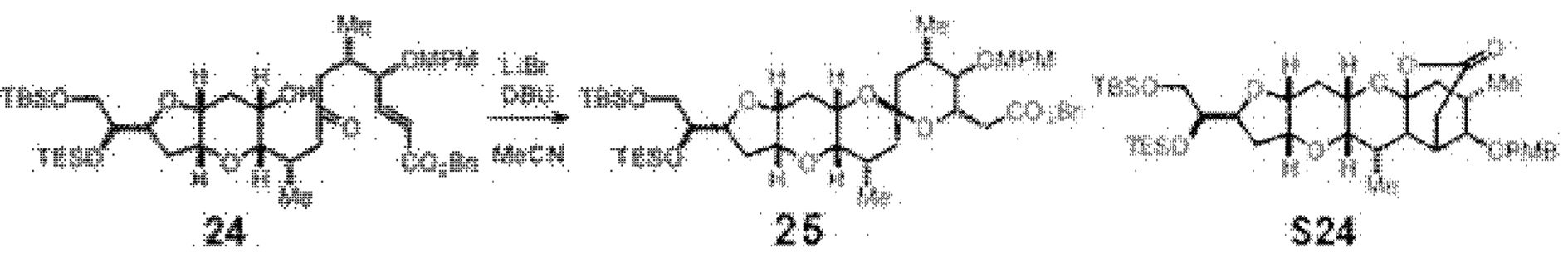
[00836] К перемешанному раствору ненасыщенного сложного эфира 24 (132 мг, 0,154 ммоль, 1 экв.) в MeCN (3,0 мл) при комнатной температуре добавляли LiBr (134 мг, 1,54 ммоль, 10 экв.) и DBU (0,46 мл, 3,08 ммоль, 20 экв.). После перемешивания в течение 11 ч при той же температуре, к реакционной смеси добавляли гексаны (3,0 мл) и Н2О (3,0 мл). Органический слой разделяли, и экстрагировали водный слой гексанами. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (0%, 5%, 6%, затем 9% EtOAc в гексанах) с получением спирокеталя 25 (92,1 мг, 0,108 ммоль, 70%) в виде бесцветного масла и продукта С-присоединения Михаэля S24 (6,7 мг, 0,00897 ммоль, 6%) в виде бесцветного масла. 25: [α]20D -32,5 (с 1,00, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 7,23 (2Н, д, J=7,1 Гц), 7,19 (2Н, д, J=8,4 Гц), 7,11 (2Н, дд, J=7,5, 7,1 Гц), 7,06 (1H, дд, J=7,5, 7,5 Гц), 6,76 (2Н, д, J=8,4 Гц), 5,09 (1H, д, J=12,0 Гц), 5,00 (1H, д, J=12,0 Гц), 4,44 (1H, ддд, J=10,2, 4,8, 4,8 Гц), 4,31 (1H, д, J=10,2 Гц), 4,23-4,21 (2Н, м), 3,83-3,79 (2Н, м), 3,75 (дд, J=10,2, 6,0 Гц), 3,72-3,68 (3Н, м), 3,30 (3Н, с), 2,96 (1H, дд, J=15,6, 9,6 Гц), 2,85 (1H, с), 2,80 (1H, д, J=2,4 Гц), 2,38-2,35 (2Н, м), 2,28 (1H, дд, J=15,6, 3,6 Гц), 2,17-2,13 (1H, м), 2,05 (1H, дд, J=12,3, 6,3 Гц), 1,85 (1H, ддд, J=13,2, 9,6, 4,2 Гц), 1,70-1,62 (2Н, м), 1,59-1,55 (2Н, м), 1,43 (1H, дд, J=13,2, 4,2 Гц), 1,11 (9Н, т, J=8,1 Гц), 1,01 (3Н, д, J=4,2 Гц), 1,00-0,99 (12Н, м), 0,76 (6Н, кв, J=8,1 Гц), 0,120 (3Н, с), 0,116 (3Н, с) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 171,6, 159,7, 136,8, 131,3, 129,7, 128,72, 128,66, 114,0, 97,0, 79,1, 78,5, 77,9, 76,8, 75,3, 74,2, 73,5, 69,6, 66,15, 66,06, 63,7, 54,7, 38,2, 37,7, 37,3, 36,5, 31,5, 30,6, 29,3, 26,2, 18,6, 18,2, 17,6, 7,4, 5,7, -5,1, -5,3 м.д. FTIR (пленка): 2954, 2928, 2874, 1737, 1514, 1462, 1249, 1088, 1018, 836, 742 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C47H74O10Si2Na, 877,4713; обнаружено, 877,4712. Продукт С-присоединения Михаэля S25: [α]20D -79,5 (с 0,855, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 7,10 (2Н, д, J=8,7 Гц), 6,79 (2Н, д, J=8,7 Гц), 4,42 (1H, ддд, J=9,6, 6,2, 3,5 Гц), 4,20 (1H, д, J=12,0 Гц), 4,11 (1Н, д, J=12,0 Гц), 3,87 (1H, дд, J=10,2, 6,0 Гц), 3,78 (1Н, дд, J=10,2, 5,4 Гц), 3,69-3,66 (3Н, м), 3,61 (1Н, дд, J=2,7, 2,7 Гц), 3,32 (3Н, с), 2,86 (1H, дд, J=3,3, 3,3 Гц), 2,62 (1H, д, J=2,4 Гц), 2,38 (1H, дд, J=12,6, 3,0 Гц), 2,30 (1H, д, J=15,6 Гц), 2,23 (1H, дд, J=19,2, 7,8 Гц), 2,05 (1H, ддд, J=13,6, 3,6, 3,6 Гц), 1,99-1,89 (4Н, м), 1,81 (1H, д, J=19,2 Гц), 1,63-1,58 (1H, м), 1,30-1,25 (2Н, м), 1,06 (9Н, т, J=7,8 Гц), 0,98 (9Н, с), 0,84 (3Н, д, J=6,6 Гц), 0,82 (3Н, д, J=6,0 Гц), 0,70 (6Н, кв, J=7,8 Гц), 0,114 (3Н, с), 0,112 (3Н, с) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 169,7, 159,7, 131,1, 129,4, 114,0, 104,9, 80,6, 78,7, 78,2, 76,1, 74,0, 73,7, 71,1, 65,9, 65,2, 54,7, 40,8, 36,0, 33,1, 30,9, 30,7, 30,5, 29,5, 29,4, 26,2, 18,6, 16,9, 13,9, 7,3, 5,6, -5,1,-5,2 м.д. FTIR (пленка): 2954,2931,2876, 1729, 1612, 1514, 1462, 1302, 1247, 1205, 1157, 1133, 1090,1038, 992, 937, 835, 777, 742 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C40H66O9Si2Na, 769,4138; обнаружено, 769,4146.
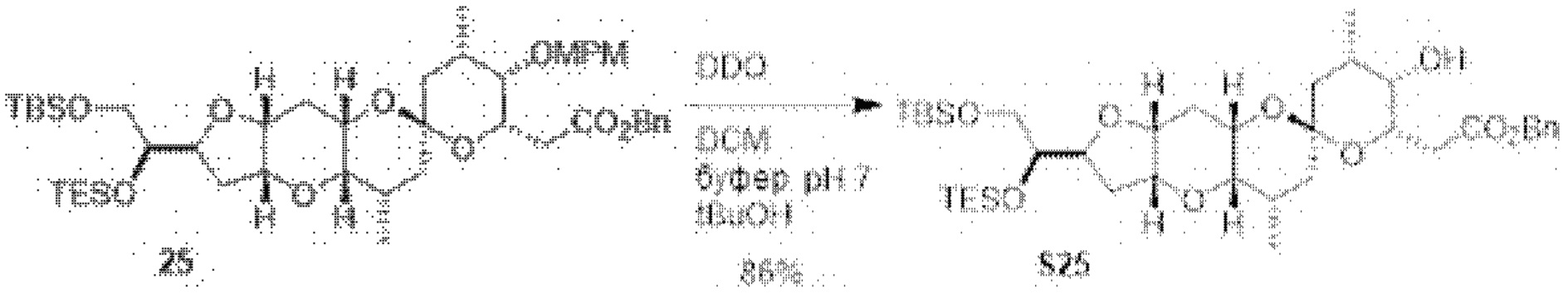
[00837] К перемешанному раствору МРМ-эфира 25 (248 мг, 0,290 ммоль, 1 экв.) в CH2Cl2 (6,0 мл), фосфатном буфере (0,60 мл, рН 7) и tBuOH (0,60 мл) при комнатной температуре добавляли DDQ (200 мг, 0,881 ммоль, 3 экв.). После перемешивания в течение 15 мин при той же температуре, реакционную смесь гасили добавлением нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой CH2Cl2. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (0%, 7%, затем 9% EtOAc в гексанах) с получением спирта S25 (183 мг, 0,249 ммоль, 86%) в виде бесцветного масла. S25: [α]20D -45,6 (с 1,01, CHCl3). 1H-ЯМР (600 МГц, C6D6) δ: 7,21 (2Н, д, J=7,5 Гц), 7,11 (2Н, дд, J=7,5, 7,5 Гц), 7,06 (1H, т, J=7,5 Гц), 5,07 (1Н, д, J=12,6 Гц), 4,97 (1Н, д, J=12,6 Гц), 4,43 (1H, ддд, J=10,2, 5,3, 5,3 Гц), 4,14 (1Н, дд, J=9,6, 3,0 Гц), 3,82 (1H, дд, J=9,6, 5,4 Гц), 3,77-3,74 (2Н, м), 3,70-3,67 (3Н, м), 2,96 (1H, д, J=8,4 Гц), 2,86 (1H, дд, J=15,6, 10,2 Гц), 2,77 (1H, д, J=1,8 Гц), 2,33-2,28 (2Н, м), 2,22-2,17 (1H, м), 2,12-2,04 (2Н, м), 1,86 (1H, ддд, J=12,8, 10,2, 4,2 Гц), 1,61 (1Н, дд, J=12,9, 12,9 Гц), 1,09 (9Н, т, J=7,9 Гц), 1,05 (3Н, д, J=6,6 Гц), 0,99 (9Н, с), 0,93 (3Н, д, J=7,2 Гц), 0,75 (6Н, кв, J=7,9 Гц), 0,12 (3Н, с), 0,12 (3Н, с) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 171,5, 136,7, 128,64, 128,57, 97,0, 79,0, 77,9, 76,8, 74,1, 73,3, 70,5, 69,3, 66,09, 66,06, 63,7, 37,4, 37,31, 37,27, 36,4, 30,2, 29,2, 26,2, 18,6, 17,65, 17,62, 7,3, 5,7, -5,1, -5,3 м.д. FTIR (пленка): 3469, 2953, 2928, 2874, 1736, 1498, 1251, 1128, 1017, 835,776, 740 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C39H66O9Si2Na, 757,4138; обнаружено, 757,4135.

[00838] К перемешанному раствору спирта S25 (183 мг, 0,249 ммоль, 1 экв.) в CH2Cl2 (3,0 мл при комнатной температуре) добавляли имидазол (50,0 мг, 0734 ммоль, 3 экв.) и TESCl (60 мкл, 0,357 ммоль, 1,5 экв.). После перемешивания в течение 4 ч при той же температуре, реакционную смесь гасили добавлением нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (0%, 3%, затем 5% EtOAc в гексанах) с получением TES-эфира S26 (205 мг, 0,241 ммоль, 97%) в виде бесцветного масла. S26: [α]20D -49,1 (с 1,00, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 7,26 (2Н, д, J=7,2 Гц), 7,10 (2Н, дд, J=7,2, 7,2 Гц), 7,05 (1H, т, J=7,2 Гц), 5,14 (1H, д, J=12,3 Гц), 5,02 (1H, д, J=12,3 Гц), 4,46 (1H, ддд, J=9,8, 5,1, 5,1 Гц), 4,17 (1H, дд, J=10,2, 3,0 Гц), 3,84-3,80 (2Н, м), 3,77 (1H, дд, J=10,2, 5,4 Гц), 3,73 (1H, д, J=1,8 Гц), 3,71-3,69 (2Н, м), 3,22 (1Н, с), 2,92 (1H, дд, J=15,3, 9,1 Гц), 2,80 (1H, с), 2,38 (1H, д, J=15,6 Гц), 2,30-2,27 (2Н, м), 2,16-2,11 (1H, м), 2,06 (1H, дд, J=12,9, 6,3 Гц), 1,87 (1H, ддд, J=13,2, 9,6, 4,2 Гц), 1,69-1,61 (2Н, м), 1,59 (1H, ддд, J=15,2, 4,7, 4,7 Гц), 1,53 (1H, дд, J=12,6, 3,6 Гц), 1,46 (1H, дд, J=12,3, 3,9 Гц), 1,11 (9Н, т, J=7,9 Гц), 1,00 (9Н, с), 1,00-0,95 (12Н, м), 0,93 (3Н, д, J=7,2 Гц), 0,76 (6Н, кв, J=7,9 Гц), 0,56 (6Н, кв, J=7,9 Гц), 0,131 (3Н, с), 0,127 (3Н, с) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 171,6, 136,8, 128,75, 128,67, 128,3, 96,9, 79,0, 77,9, 76,8, 74,2, 73,6, 72,4, 69,9, 66,2, 66,1, 63,6, 38,3, 37,5, 37,4, 36,4, 31,5, 30,7, 29,3, 26,2, 18,6, 17,5, 7,4, 5,8, 5,7, -5,1, -5,3 м.д. FTIR (пленка): 2953, 2928, 2875, 1738, 1498, 1240, 1033, 1001, 974, 834, 737, 677 см-1. HRMS (ESI) m/z: [М+Н]+ рассчит. для C45H81O9Si3, 849,5183; обнаружено, 849,5184.
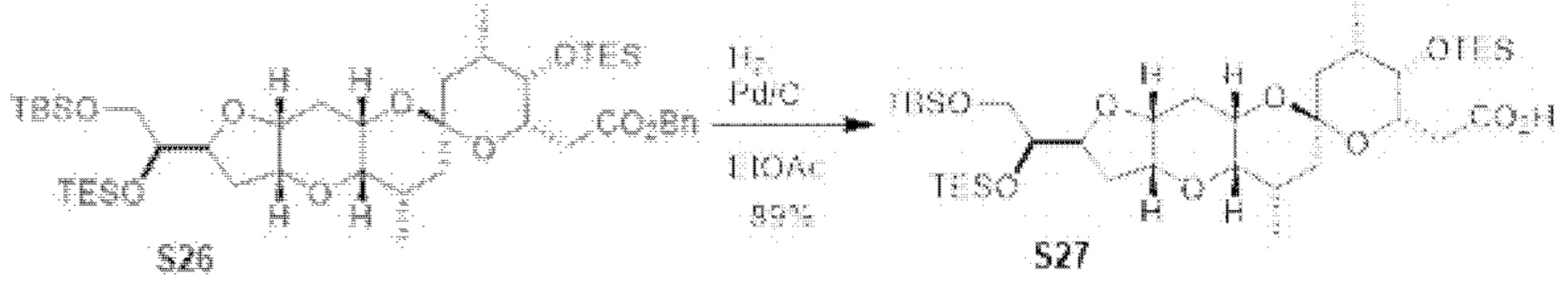
[00839] К перемешанному раствору бензилового эфира S26 (230 мг, 0,271 ммоль, 1 экв.) в EtOAc (10,0 мл) при комнатной температуре добавляли влажный 10% Pd/C (23 мг, 10% масс/масс). Реакционную смесь перемешивали при давлении 1 атм водорода в течение 2 ч. Полученную смесь фильтровали через слой Celite (EtOAc). Органический растворитель удаляли в условиях пониженного давления с получением неочищенной смеси, которую очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (0%, 5%, затем 33% EtOAc в гексанах) с получением карбоновой кислоты S27 (183 мг, 0,241 ммоль, 89%) в виде бесцветного масла. S27: [α]20D -54,8 (с 1,06, CHCl3). 1Н-ЯМР (500 МГц, C6D6) δ: 4,45 (1H, ддд, J=10,0, 5,0, 5,0 Гц), 4,12 (1Н, дд, J=9,8, 2,8 Гц), 3,89 (1H, д, J=3,5 Гц), 3,81 (1H, дд, J=11,0, 5,0 Гц), 3,76-3,73 (2Н, м), 3,70-3,67 (2Н, м), 3,24 (1H, с), 2,89 (1H, д, J=1,5 Гц), 2,87 (1H, дд, J=16,0, 3,0 Гц), 2,40 (1Н, д, J=15,5 Гц), 2,34 (1Н, дд, J=16,0, 3,0 Гц), 2,32-2,21 (2Н, м), 2,04 (1H, дд, J=12,8, 5,8 Гц), 1,87 (1H, ддд, J=13,5, 9,5, 4,0 Гц), 1,70-1,62 (3Н, м), 1,53 (1H, дд, J=12,5, 4,0 Гц), 1,47 (1H, дд, J=13,0, 4,0 Гц), 1,09 (9Н, т, J=8,0 Гц), 1,00 (3Н, д, J=7,0 Гц), 0,99 (9Н, с), 0,97 (9Н, т, J=8,0 Гц), 0,92 (3Н, д, J=7,0 Гц), 0,75 (6Н, кв, J=8,0 Гц), 0,57 (6Н, кв, J=8,0 Гц), 0,120 (3Н, с), 0,115 (3Н, с) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 178,1, 97,1, 79,0, 77,9, 76,7, 74,3, 73,6, 72,3, 69,6, 66,1, 63,8, 38,0, 37,5, 37,4, 36,4, 31,5, 30,7, 29,4, 26,2, 18,6, 17,5, 7,3, 5,8, 5,7, -5,1, -5,3 м.д. FTIR (пленка): 3120, 2953, 2928, 2875, 1731, 1713, 1461, 1415,1309, 1078,1033, 1004, 833,776, 724 см-1. HRMS (ESI) m/z: [М+Н]+ рассчит. для C38H75O9Si3, 759,4713; обнаружено, 759,4724.

[00840] К перемешанному раствору карбоновой кислоты S27 (183 мг, 0,241 ммоль, 1 экв.) в толуоле (1,2 мл) при комнатной температуре добавляли PPh3 (190 мг, 0,724 ммоль, 3 экв.) и (PyS)2 (64,0 мг, 0,290 ммоль, 1,2 экв.). После перемешивания в течение 12 ч при той же температуре, полученную реакционную смесь немедленно подвергали колоночной хроматографии на нейтральном силикагеле (0%, 3%, 5%, затем 6% EtOAc в гексанах) с получением пиридинтиолового эфира 26 (199 мг, 0,233 ммоль, 97%) в виде бледно-желтого масла. 26: [α]20D -65,7 (с 1,00, CHCl3). 1H-ЯМР (600 МГц, C6D6) δ: 8,33 (1H, дд, J=5,0, 1,4 Гц), 7,54 (1H, д, J=8,1 Гц), 6,96 (1Н, ддд, J=8,1, 7,6, 1,4 Гц), 6,47 (1Н, дд, J=7,6, 5,0 Гц), 4,45 (1H, ддд, J=9,8, 5,1, 5,1 Гц), 4,17 (1H, дд, J=10,2, 2,4 Гц), 3,88 (1H, д, J=3,6 Гц), 3,81 (1H, дд, J=10,5, 5,1 Гц), 3,75 (1H, дд, J=10,5, 5,7 Гц), 3,71-3,65 (3Н, м), 3,25 (1H, дд, J=15,0, 10,2 Гц), 3,10 (1H, с), 2,82 (1H, д, J=1,8 Гц), 2,53 (1H, дд, J=15,0, 2,4 Гц), 2,39-2,34 (2Н, м), 2,27-2,23 (1H, м), 2,04 (1H, дд, J=12,9, 5,7 Гц), 1,85 (1Н, ддд, J=13,4, 9,8, 3,8 Гц), 1,70-1,60 (3Н, м), 1,54-1,50 (2Н, м), 1,10 (9Н, т, J=7,8 Гц), 0,99-0,97 (21Н, м), 0,91 (3Н, д, J=6,0 Гц), 0,75 (6Н, кв, J=8,0 Гц), 0,56 (6Н, кв, J=7,8 Гц), 0,121 (3Н, с), 0,119 (3Н, с) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 194,6, 152,8, 150,6, 136,5, 129,8, 123,1, 97,1, 79,0, 77,9, 76,8, 74,2, 73,6, 72,5, 69,9, 66,1, 63,8, 47,8, 37,5, 37,4, 36,4, 31,4, 30,7, 29,3, 26,2, 18,6, 18,5, 17,5, 7,4, 7,3, 5,9, 5,7, -5,1, -5,3 м.д. FTIR (пленка): 2953, 2928, 2875, 1708, 1572, 1420, 1250, 1033, 1001, 834, 775, 736, 723 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C43H77NO8SSi3Na, 874,4570; обнаружено, 874,4573.
Левые части норгалихондринов

[00841] К перемешанному раствору диола 19 (3,65 г, 11,6 ммоль, 1 экв.) и 2,6-лутидин (5,4 мл, 46,4 ммоль, 4 экв.) в CH2Cl2 (75 мл) при -78°С добавляли Tf2O (2,4 мл, 27,9 ммоль, 1,2 экв.). После перемешивания в течение 10 мин при той же температуре, реакционную смесь гасили добавлением МеОН (0,5 мл) и солевого раствора (50 мл). После добавления Et2O (250 мл), органический слой отделяли от водного слоя и последовательно промывали 1н HCl и солевым раствором. Органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением неочищенного трифлата в виде винно-красного масла, которое растворяли в DMSO (75 мл) немедленно без дополнительной очистки.
[00842] К раствору неочищенного трифлата (согласно подсчетам 11,6 ммоль, 1 экв.) в DMSO при комнатной температуре добавляли NaCN (5,7 г, 115 ммоль, 10 экв.). После перемешивания в течение 1 ч при той же температуре, реакционную смесь фильтровали через бумагу, и тщательно промывали осадок на фильтре EtOAc. Фильтрат промывали H2O и солевым раствором. Органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной флэш-хроматографии на силикагеле (0%, 5%, 10%, затем 25% EtOAc в гексанах) с получением S15 (3,26 г, 10,1 ммоль, 87% после 2 стадий) в виде бесцветного масла. S15: [α]20D -24,0 (с 1,00, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 6,18 (1H, м), 5,15 (1Н, д, J=9,6 Гц), 5,11 (1H, д, J=15,4 Гц), 3,48 (1H, с), 3,39 (1H, д, J=11,4 Гц), 3,21 (1H, д, J=11,4 Гц), 2,97 (1Н, дд, J=6,6,6,4 Гц), 2,61-2,55 (2Н, м), 2,33 (1H, дд, J=16,2, 8,4 Гц), 2,09 (1Н, дд, J=15,0, 7,8 Гц), 1,88 (1H, д, J=15,2 Гц), 0,99 (1Н, д, J=12,6 Гц), 0,88 (9Н, с), 0,80 (3Н, д, J=5,8 Гц), 0,03 (3Н, с), -0,09 (3Н, с) м.д. 13С-ЯМР (150 МГц, C6D6) δ: 141,2, 117,6, 114,1, 84,7, 76,9, 66,4, 65,8, 37,5, 36,3, 25,8, 20,4, 18,1, 15,3, -4,0, -5,1 м.д. FTIR (пленка): 3515, 2956, 2930, 2897, 2858, 1473, 1433, 1365, 1255, 1168, 1122, 1082, 1046, 995, 978, 940, 834, 775, 736, 688, 474 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C17H31NO3SiNa, 348,1965; обнаружено, 348,1969.

[00843] К перемешанному раствору S15 (3,25 г, 10,0 ммоль, 1 экв.) в CH2Cl2 (150 мл) при -78°С в атмосфере Ar добавляли раствор DIBAL (45 мл, 1 M в гексанах, 45,0 ммоль, 4,5 экв.). После перемешивания в течение 30 мин при той же температуре, добавляли 150 мл нас. водн. сегнетовой соли, и оставляли температуру расти до комнатной температуры. После перемешивания в течение 1 ч при той же температуре, смесь разбавляли EtOAc. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением неочищенного альдегида, которое использовали на следующей стадии без дополнительной очистки.
[00844] К перемешанному раствору неочищенного альдегида (по расчетам 10,0 ммоль, 1 экв.) в CH2Cl2 (150 мл) при 0°С добавляли NaBH4 (1,89 г, 50,0 ммоль, 5 экв.). После перемешивания в течение 30 мин при комнатной температуре, реакционную смесь гасили добавлением АсОН (2,8 мл), и концентрировали полученную смесь в условиях пониженного давления. Остаток пропускали через слой силикагеля (5% МеОН в CH2Cl2) с получением неочищенного спирта, который использовали в последующей реакции после концентрирования без дополнительной очистки.
[00845] К перемешанному раствору неочищенного спирта (по расчетам 10,0 ммоль, 1 экв.) в CH2Cl2 (100 мл) при 0°С добавляли 2,6-лутидин (3,75 г, 35,0 ммоль, 3,5 экв.) и TESOTf (7,93 г, 30,0 ммоль, 3 экв.). После перемешивания в течение 30 мин при комнатной температуре, добавляли МеОН (1 мл), и разбавляли смесь 200 мл CH2Cl2. Полученную смесь промывали 1н HCl и нас. водн. NaHCO3 Органический слой сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной флэш-хроматографии на силикагеле (0%, 5%, 10%, затем 15% EtOAc в гексанах) с получением S28 (5,03 г, 9,00 ммоль, 90% после 3 стадий) в виде бесцветного масла. S28: [α]20D +3,4 (с 1,00, CHCl3). 1H-ЯМР (600 МГц, C6D6) δ: 6,27 (1H, м), 5,17 (1H, ддд, J=17,4 1,8, 1,6 Гц), 5,16 (1H, дд, J=10,8, 1,8 Гц), 4,00 (1H, м), 3,82 (1H, м), 3,67 (1H, квинт, J=2,0 Гц), 3,49 (1H, ддд, J=10,8, 1,8, 1,6 Гц), 2,89 (1H, м), 2,84 (1H, дд, J=9,0, 1,8 Гц), 2,18 (1H, м), 1,94 (1H, ддд, J=15,8, 2,3, 2,0 Гц), 1,65 (1H, м), 1,54 (1H, дт, J=15,6, 4,4 Гц), 1,03 (9Н, с), 1,022 (9Н, с), 1,020 (9Н, с), 0,98 (3Н, д, J=6,6 Гц), 0,17 (3Н, с), 0,15 (3Н, с), 0,12 (3Н, с), 0,08 (3Н, с), 0,06 (3Н, с), 0,02 (3Н, с) м.д. 13С-ЯМР (150 МГц, C6D6) δ: 143,0, 113,4, 85,1, 77,4, 66,3, 65,0, 60,3, 39,3, 37,8, 36,1, 18,6, 18,5, 16,1, -2,2, -3,4, -4,7, -5,00, -5,02, -5,10 м.д. FTIR (пленка): 2953, 2928, 2844, 2856, 1472, 1462, 1387, 1251, 1020, 958, 938, 886, 808, 768, 705, 674, 662 см-1. HRMS (ESI) m/z: [М+Н]+ рассчит. для C29H63O4Si3, 559,4034; обнаружено, 559,4063.

[00846] К перемешанному раствору S28 (4,9 г, 8,78 ммоль, 1 экв.) в THF (16 мл) при 0°С добавляли раствор 9-BBN (17,6 мл 0,5 М в THF, 8,8 ммоль, 2 экв.). После перемешивания в течение 1 ч при комнатной температуре, добавляли 2н водн. NaOH (21 мл), а затем при 0°С очень медленно 9 М водн. Н2О2. После перемешивания в течение 30 мин при комнатной температуре, полученную смесь гасили добавлением нас. водн. Na2S2O3. Органический слой разделяли, и экстрагировали водный слой Et2O. Объединенный органический слой сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Неочищенный продукт очищали методом колоночной флэш-хроматографии на силикагеле (0%, 5%, 10%, затем 20% EtOAc в гексанах) с получением S29 (4,61 г, 7,99 ммоль, 91%) в виде белого твердого вещества.

[00847] К перемешанному раствору спирта S29 (1,6 г, 2,81 ммоль, 1 экв.) в THF/CH3CN/H2O (3,5 мл/13 мл/13 мл) при комнатной температуре добавляли TEMPO (220 мг, 1,41 ммоль, 0,5 экв.) и PhI(ОАс)2 (4,53 г, 14,1 ммоль, 5 экв.). После перемешивания в течение 5 ч при той же температуре, полученную смесь гасили добавлением нас. водн. Na2S2O3. Органический слой разделяли, и экстрагировали водный слой Et2O. Объединенный органический слой сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Неочищенный продукт очищали методом колоночной флэш-хроматографии на силикагеле (0%, 5%, 10%, затем 25% EtOAc в гексанах) с получением кислоты S30 (1,49 г, 2,53 ммоль, 90%) в виде аморфного твердого вещества. S30: [α]20D +34,0 (с 1,00, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 3,90 (1H, тд, J=9,6, 4,2 Гц), 3,79 (1H, м), 3,61 (1H, с), 3,46 (1H, д, J=10,8 Гц), 3,40 (1H, с), 3,01 (1H, дд, J=16,2, 4,2 Гц), 2,82 (1H, д, J=4,2 Гц), 2,66 (1H, м), 2,35 (1H, дд, J=16,2, 1,2 Гц), 2,15 (1H, м), 1,89 (1H, д, J=14,4 Гц), 1,65 (1H, м), 1,49 (1H, дт, J=14,4, 4,9 Гц), 1,04 (9Н, с), 1,03 (9Н, с), 1,02 (9Н, с), 0,96 (3Н, д, J=7,2 Гц), 0,15 (3Н, с), 0,14 (3Н, с), 0,13 (3Н, с), 0,08 (3Н, с), 0,06 (3Н, с), 0,01 (3Н, с) м.д. 13С-ЯМР (150 МГц, C6D6) δ: 180,2, 84,1, 77,6, 67,3, 64,9, 60,6, 39,4, 37,8, 36,0, 30,8, 26,7, 26,5, 26,3, 18,6, 18,5, 18,4, 16,8, -2,6, -3,4, -4,8, -5,0, -5,1, -5,2 м.д. FTIR (пленка): 2953, 2929, 2885, 2857, 1708, 1472, 1463, 1386, 1253, 1098, 1020, 938, 886, 772 см-1. HRMS (ESI) m/z: [М+Н]+ рассчит. для C29H63O6Si3, 591,3927; обнаружено, 591,3921.
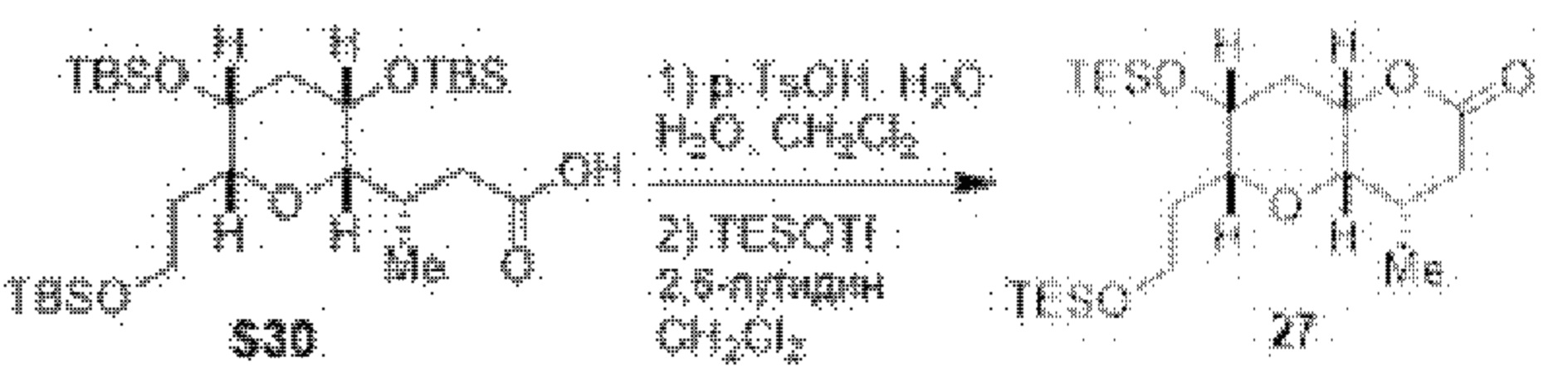
[00848] К перемешанному раствору кислоты S30 (2,50 г, 4,23 ммоль, 1 экв.) в CH2Cl2 (40 мл) при комнатной температуре добавляли p-TsOH⋅H2O (805 мг, 4,23 ммоль, 1 экв.) и Н2О (0,76 мл, 42,3 ммоль, 10 экв.). После перемешивания в течение 24 ч при той же температуре, полученную смесь немедленно концентрировали в условиях пониженного давления с получением неочищенного лактона. Неочищенный продукт использовали на следующей стадии без какой-либо очистки.
[00849] К перемешанному раствору неочищенного лактона (по расчетам 4,23 ммоль, 1 экв.) в CH2Cl2 (100 мл) при 0°С добавляли 2,6-лутидин (5,43 г, 50,8 ммоль, 12 экв.) и TESOTf (11,2 г, 42,3 ммоль, 10 экв.). После перемешивания в течение 1 ч при комнатной температуре, добавляли МеОН (3 мл), и разбавляли смесь 200 мл CH2Cl2. Полученную смесь промывали нас. водн. NH4Cl и нас. водн. NaHCO3. Органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной флэш-хроматографии на силикагеле (0%, 5%, 10%, затем 15% EtOAc в гексанах) с получением бис-TES 27 (1,46 г, 3,20 ммоль, 76% после 2 стадий) в виде бесцветного масла. 27: [α]20D +25,5 (с 1,00, CHCl3). 1H-ЯМР (600 МГц, C6D6) δ: 3,80 (1H, тд, J=9,6, 4,4 Гц), 3,70 (1H, м), 3,61 (1H, с), 3,37 (1H, дд, J=10,2, 3,0 Гц), 3,33 (1H, с), 2,82 (1H, с), 2,46 (1H, дд, J=17,2, 12,0 Гц), 2,13 (1H, дд, J=17,2, 4,6 Гц), 2,09-2,02 (2Н, м), 1,67 (1H, м), 1,32 (1Н, м), 1,20 (1H, дт, J=14,4, 4,5 Гц), 1,09-1,01 (18Н, м), 0,79 (3Н, д, J=6,6 Гц), 0,75-0,61 (12Н, м) м.д. 13С-ЯМР (150 МГц, C6D6) δ: 168,5, 75,6, 74,3, 73,4, 66,2, 59,2, 36,3, 36,0, 33,0, 31,4, 26,2, 16,6, 7,2, 5,3, 4,8 м.д. FTIR (пленка): 2954, 2934, 2911, 2876, 1734, 1459, 1414, 1376, 1239, 1197, 1097, 1032, 938, 780, 726 см-1. HRMS (ESI) m/z: [М+Н]+ рассчит. для C23H47O5Si2, 459,2957; обнаружено, 459,2946.
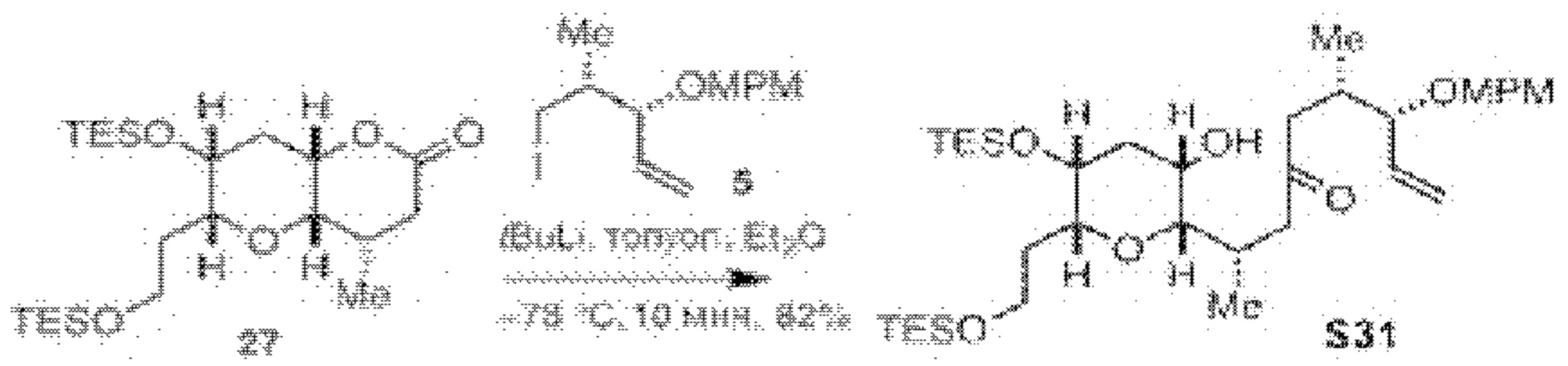
[00850] К перемешанному раствору йодида 5 (1,21 г, 3,50 ммоль, 1,3 экв.) в Et2O (30 мл, барботировали Ar) при -78°С в атмосфере Ar добавляли раствор t-BuLi (3,5 мл 1,7 М в пентане, 5,92 ммоль, 2,2 экв.). После перемешивания в течение 5 мин при той же температуре, при -78°С в атмосфере Ar полученную смесь переносили через канюлю перемешанный раствор лактона 27 (1,23 г, 2,69 ммоль, 1 экв.) в толуоле (30 мл, барботировали Ar). После перемешивания в течение 10 мин при той же температуре, полученную смесь гасили добавлением нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Неочищенный продукт очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (0%, 5%, 10%, затем 15% EtOAc в гексанах) с получением смеси кетона/гемикеталя S31 (1,48 г, 2,19 ммоль, 82%) в виде бесцветного масла. S31: [α]20D +2,8 (с 1,00, CHCl3). 1H-ЯМР (500 МГц, C6D6) δ: 7,27 (2Н, д, J=9,6 Гц), 6,85 (2Н, д, J=9,6 Гц), 5,64 (1H, м), 5,16-5,05 (2Н, м), 4,55 (1Н, д, J=13,8 Гц), 4,23 (1Н, д, J=13,8 Гц), 3,94-3,87 (1Н, м), 3,84-3,78 (1Н, м), 3,70-3,61 (2Н, м), 3,49 (1Н, т, J=7,8 Гц), 3,44 (1Н, д, J=11,4 Гц), 3,40 (1Н, с), 3,34 (3Н, с), 2,98 (1H, дд, J=18,0, 3,6 Гц), 2,91-2,85 (1Н, м), 2,81 (1Н, д, J=10,8 Гц), 2,74 (1Н, дд, J=18,0, 3,6 Гц), 2,55-2,48 (1Н, м), 2,30-2,18 (2Н, м), 2,13-2,05 (1Н, м), 2,02 (1Н, дт, J=17,4, 2,0 Гц), 1,68-1,60 (1Н, м), 1,28 (1Н, дт, J=17,4, 2,0 Гц), 1,08 (9Н, т, J=8,4 Гц), 0,99 (3Н, д, J=7,8 Гц), 0,97 (3Н, д, J=7,8 Гц), 0,93 (9Н, т, J=8,4 Гц), 0,70 (6Н, кв, J=8,4 Гц), 0,51 (6Н, кв, J=8,4 Гц) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 208,9, 159,7, 137,9, 131,4, 129,5, 117,9, 114,0, 84,6, 84,0, 77,0, 70,2, 69,7, 65,0, 59,7, 54,8, 47,9, 46,0, 37,7, 36,5, 34,0, 31,3, 16,5, 16,2, 7,2, 7,0, 5,0, 4,9 м.д. FTIR (пленка): 3523, 2955, 2935, 2912, 2876, 1711, 1613, 1514, 1459, 1413, 1376, 1301, 1247, 1085, 1003, 819, 743 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C37H66O7Si2Na, 701,4245; обнаружено, 701,4268.
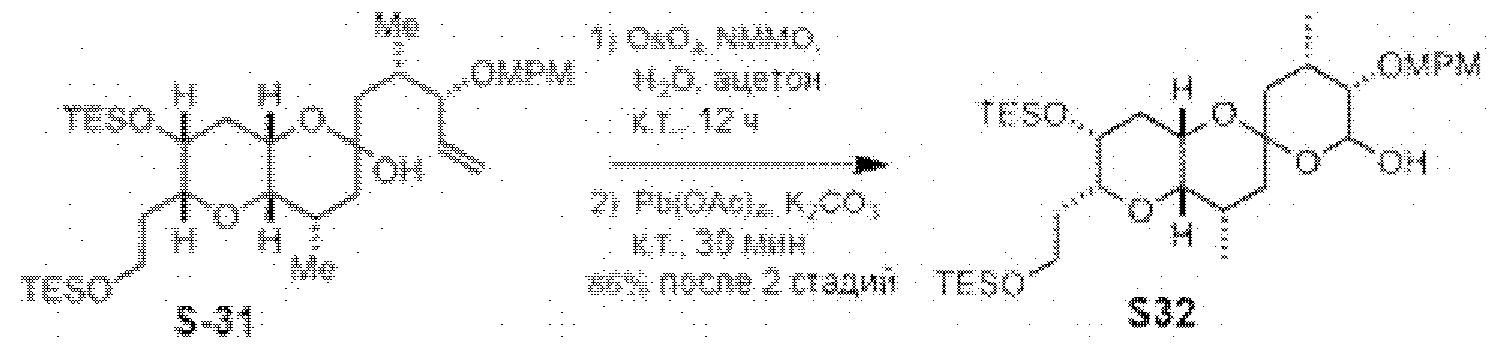
[00851] К перемешанному раствору S31 (1,17 г, 1,73 ммоль, 1 экв.) в ацетоне (17,3 мл) при комнатной температуре добавляли NMMO (405 мг, 3,46 ммоль, 2 экв.) и раствор OsO4 (4,4 мл 0,02 М в Н2О, 0,088 ммоль, 5 мол. %). После перемешивания в течение 12 ч при той же температуре, смесь разбавляли водой. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток пропускали через слой силикагеля (EtOAc) и концентрировали в условиях пониженного давления с получением неочищенного диола, который использовали на следующей стадии без дополнительной очистки.
[00852] К перемешанному раствору диола (по расчетам 1,73 ммоль, 1 экв.) в CH2Cl2 (17,3 мл) при комнатной температуре добавляли K2CO3 (2,39 г, 17,3 ммоль, 10 экв.) и Pb(ОАс)4 (1,53 г, 3,46 ммоль, 2 экв.). После перемешивания в течение 1 ч при той же температуре, реакционную смесь пропускали через слой силикагеля (EtOAc). Фильтрат концентрировали в условиях пониженного давления. Остаток очищали методом колоночной флэш-хроматографии на силикагеле (0%, 9%, 17%, затем 25% EtOAc в гексанах) с получением S32 (1,0 г, 1,48 ммоль, 86% после 2 стадий) в виде бесцветного масла. S32 получали в виде равновесной смеси гемиацеталя. S32: [α]20D -20,0 (с 1,00, CHCl3). 1H-ЯМР (600 МГц, C6D6) δ: 7,16 (2Н, д, J=8,4 Гц), 6,76 (2Н, д, J=8,4 Гц), 5,44 (0,28Н, д, J=9,6 Гц), 4,91 (0,72Н, д, J=9,6 Гц), 4,54 (0,72Н, д, J=9,6 Гц), 4,46 (0,28Н, д, J=9,6 Гц), 4,36 (0,72Н, д, J=9,6 Гц), 4,26 (0,28Н, д, J=9,6 Гц), 4,11 (0,28Н, с), 3,98-3,86 (1,28Н, м), 3,85-3,76 (1Н, м), 3,60 (0,78Н, с), 3,46-3,36 (2Н, м), 3,30 (0,84Н, с), 3,29 (2,16Н, с), 3,22 (0,28Н, с), 3,20 (0,72Н, с), 2,99 (0,28Н, с), 2,96 (0,72Н, с), 2,64 (0,28Н, м), 2,34 (1,72Н, м), 2,23-2,11 (1Н, м), 1,92-1,76 (1,28Н, м), 1,76-1,60 (3,27Н, м), 1,54 (1Н, м), 1,50-1,40 (2Н, м), 1,15-0,98 (24Н, м), 0,74-0,54 (12Н, м) м.д. 13С-ЯМР (125 МГц, C6D6) δ: 159,9, 131,2, 129,7, 129,6, 114,3, 114,0, 99,0, 98,2, 93,9, 91,3, 80,1, 78,5, 76,4, 76,3, 76,0, 75,9, 75,8, 72,1, 67,0, 66,9, 66,0, 65,2, 59,6, 59,5, 54,7, 38,5, 38,4, 37,8, 37,7, 36,6, 36,4, 30,1, 29,0, 23,5, 17,8, 17,5, 17,3, 7,3, 7,2, 5,5, 5,4, 4,8 м.д. FTIR (пленка): 2953, 2931, 2910, 2874, 1514, 1459, 1247, 1208, 1192, 1166, 1134, 1095, 1029, 1007, 967, 819, 742, 726 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C36H64O8Si2Na, 703,4037; обнаружено, 703,4047.

[00853] К перемешанному раствору S32 (700 мг, 1,029 ммоль, 1 экв.) в толуоле (10 мл) при комнатной температуре добавляли бензилдиметилфосфоноацетат (0,86 мл, 4,116 ммоль, 4 экв.) и K3PO4 (660 мг, 3,087 ммоль, 3 экв.). После перемешивания в течение 36 ч при той же температуре, реакционную смесь пропускали через слой силикагеля (50% EtOAc в гексанах) с получением неочищенного 28, который дополнительно очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (0%, 5%, 6%, затем 9% EtOAc в гексанах) с получением смеси EIZ изомеров 28 ~8:1 (776 мг, 0,956 ммоль, 93%) в виде бесцветного масла. Некоторое количество E-изомера выделяли с целью охарактеризования путем дальнейшей хроматографии. Смесь EIZ изомеров использовали непосредственно на следующей стадии. 28: [α]20D -2,2 (с 1,00, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 7,24 (2Н, д, J=7,8 Гц), 7,15 (2Н, д, J=7,8 Гц), 7,11 (2Н, т, J=7,8 Гц), 7,05 (1Н, м), 6,79 (2Н, д, J=7,8 Гц), 6,19 (1Н, д, J=15,6 Гц), 5,12 (2Н, кв, J=12,0 Гц), 4,37 (1Н, д, J=12,0 Гц), 4,11 (1Н, д, J=12,0 Гц), 3,92-3,87 (1Н, м), 3,83-3,78 (1Н, м), 3,68-3,57 (3Н, м), 3,46-3,41 (2Н, м), 3,33 (3Н, с), 2,91 (1Н, дд, J=15,0, 2,0 Гц), 2,85-2,78 (2Н, м), 2,52 (1Н, дд, J=17,4, 4,5 Гц), 2,49-2,44 (1Н, м), 2,21-2,10 (2Н, м), 2,08 (1Н, тд, J=10,2, 6,0 Гц), 2,03 (1Н, д, J=14,4 Гц), 1,68-1,61 (1Н, м), 1,29 (1Н, д, J=14,4 Гц), 1,07 (9Н, т, J=8,4 Гц), 0,97 (3Н, д, J=7,8 Гц), 0,93 (9Н, т, J=8,4 Гц), 0,86 (3Н, д, J=7,8 Гц), 0,69 (6Н, кв, J=8,4 Гц), 0,52 (6Н, кв, J=8,4 Гц) м.д. 13С-ЯМР (150 МГц, C6D6) δ: 208,3, 165,6, 159,8, 147,8, 136,7, 130,7, 129,7, 128,7, 128,6, 128,3, 123,3, 114,0, 84,5, 81,6, 76,9, 71,2, 69,6, 66,4, 65,0, 59,6, 54,8, 47,8, 45,6, 37,8, 36,5, 33,7, 31,2, 16,3, 16,2 7,2, 7,0, 5,1, 4,9 м.д. FTIR (пленка): 3511, 2954, 2912, 2876, 1720, 1514, 1458, 1413, 1376, 1248, 1165, 1085, 1004, 820, 743, 729, 698 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C45H72O9Si2Na, 835,4613; обнаружено, 835,4622.
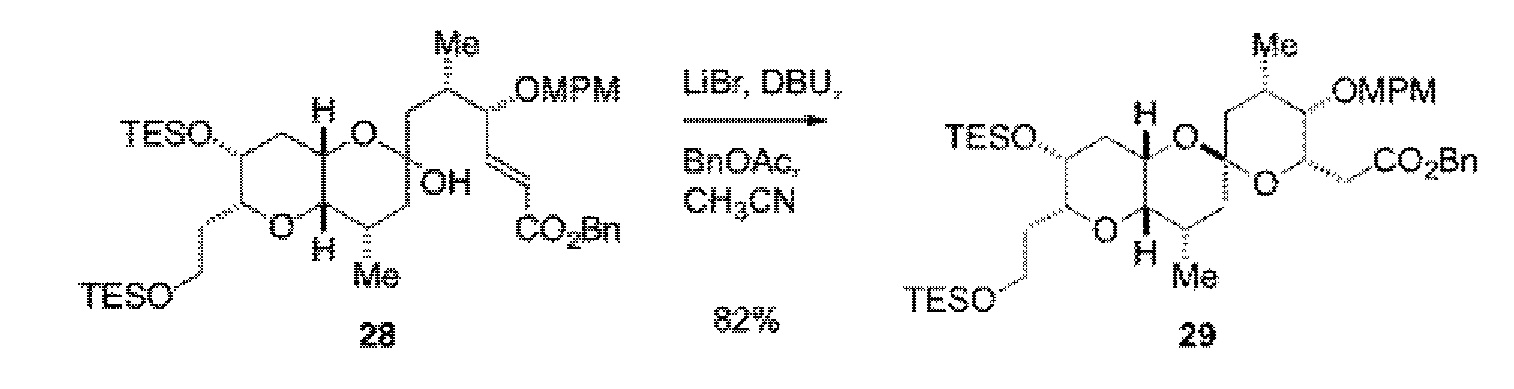
[00854] К перемешанному раствору ненасыщенного эфира 28 (800 мг, 0,985 ммоль, 1 экв.) в MeCN (3,0 мл) при комнатной температуре добавляли BnOAc (296 мг, 1,97 ммоль, 2 экв.), LiBr (857 мг, 9,85 ммоль, 10 экв.) и DBU (0,74 мл, 4,93 ммоль, 5 экв.). После перемешивания в течение 12 ч при той же температуре, к реакционной смеси добавляли гексаны (3,0 мл) и Н2О (3,0 мл). Органический слой разделяли, и экстрагировали водный слой гексанами. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (0%, 5%, 6%, затем 9% EtOAc в гексанах) с получением спирокеталя 29 (658 мг, 0,810 ммоль, 82%) в виде бесцветного масла. 29: [α]20D -28,1 (с 1,00, CHCl3). 1H-ЯМР (600 МГц, C6D6) δ: 7,24 (2Н, д, J=7,8 Гц), 7,20 (2Н, д, J=7,8 Гц), 7,13 (2Н, т, J=7,8 Гц), 7,09 (1Н, кв, J=7,8 Гц), 6,77 (2Н, д, J=7,8 Гц), 5,09 (1Н, д, J=14,4 Гц), 5,00 (1Н, д, J=14,4 Гц), 4,33 (1Н, д, J=11,0 Гц), 4,28-4,21 (2Н, м), 3,94 (1Н, м), 3,88-3,78 (2Н, м), 3,48 (1Н, д, J=10,8 Гц), 3,42 (1Н, м), 3,30 (3Н, с), 3,04 (1Н, с), 2,97 (1Н, дд, J=14,4, 10,8 Гц), 2,90 (1Н, с), 2,38 (1Н, м), 2,31 (1Н, дд, J=17,0, 2,5 Гц), 2,26-2,16 (2Н, м), 2,04 (1Н, д, J=15,0 Гц), 1,77-1,64 (3Н, м), 1,61-1,55 (2Н, м), 1,42 (1Н, дд, J=12,6, 3,1 Гц), 1,12-1,04 (21Н, м), 1,02 (3Н, д, J=6,6 Гц), 0,67 (12Н, кв, J=8,4 Гц) м.д. 13С-ЯМР(150 МГц, C6D6) δ: 171,7, 159,7, 136,8, 131,3, 129,7, 128,8, 128,6, 128,3, 114,0, 97,0, 78,6, 76,4, 76,2, 75,3, 69,8, 67,2, 66,1, 64,9, 59,6, 54,7, 38,2, 37,7, 37,4, 36,7, 36,4, 30,9, 29,2, 18,2, 17,4, 7,3, 7,2, 5,5, 4,9 м.д. FTIR (пленка): 2953, 2978, 2911, 2874, 1736, 1613, 1514, 1458, 1414, 1396, 1371, 1303, 1246, 11246, 1207, 1190, 1165, 1128, 1095, 1032, 1010, 974, 822, 741, 727, 698, 671 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C45H72O9Si2Na, 835,4613; обнаружено, 835,4598.
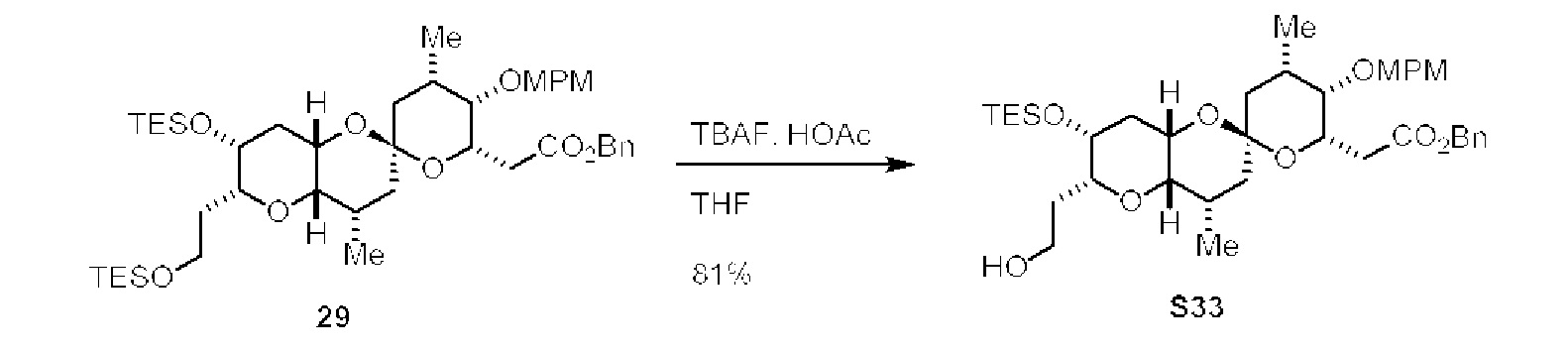
[00855] К перемешанному раствору TES-эфира 29 (600 мг 0,738 ммоль, 1 экв.) в CH2Cl2 (5 мл) при 0°С добавляли TBAF (1,107 мл, 1 М раствор в THF, 1,107 ммоль, 1,5 экв.). После перемешивания в течение 5 ч при той же температуре, реакционную смесь без концентрирования непосредственно подвергали колоночной флэш-хроматографии на нейтральном силикагеле (0%, 5%, затем 10% EtOAc в гексанах) с получением сложного эфира S33 (418 мг, 0,598 ммоль, 81%) в виде бесцветного масла. S33: [α]20D -46,0 (с 1,00, CHCl3). 1H-ЯМР (600 МГц, C6D6) δ: 7,24 (2Н, д, J=7,8 Гц), 7,20 (2Н, д, J=7,8 Гц), 7,13 (2Н, т, J=7,8 Гц), 7,09 (1Н, кв, J=7,8 Гц), 6,77 (2Н, д, J=7,8 Гц), 5,09 (1Н, д, J=14,4 Гц), 5,00 (1Н, д, J=14,4 Гц), 4,33 (1Н, д, J=l1,0 Гц), 4,28-4,21 (2Н, м), 3,85-3,79 (2Н, м), 3,77-3,72 (1Н, м), 3,29 (3Н, с), 3,21 (1Н, д, J=8,4 Гц), 2,99-2,93 (2Н, м), 2,88 (1Н, с), 2,36 (1Н, с), 2,28 (1Н, дд, J=16,2, 3,0 Гц), 2,24 (1Н, м), 2,16-2,08 (2Н, м), 2,01 (1Н, д, J=13,8 Гц), 1,69-1,54 (3Н, м), 1,50 (1Н, дт, J=13,8, 2,1 Гц), 1,36 (2Н, дд, J=12,6, 3,0 Гц), 1,08 (9Н, т, J=8,4 Гц), 1,03 (3Н, д, J=7,2 Гц), 0,97 (3Н, д, J=7,2 Гц), 0,65 (6Н, кв, J=8,4 Гц) м.д. 13С-ЯМР (150 МГц, C6D6) δ: 171,7, 159,8, 136,8, 131,2, 129,7, 128,7, 128,6, 128,3, 114,0, 97,0, 80,1, 78,5, 76,6, 75,3, 69,8, 66,9, 66,1, 64,6, 61,3, 54,8, 38,1, 37,7, 37,3, 36,4, 35,1, 30,9, 28,9, 18,2, 17,6, 7,3, 5,5 м.д. FTIR (пленка): 2954, 2928, 2911, 2874, 1736, 1612, 1514, 1457, 1420, 1304, 1247, 1208, 1163, 1086, 1064, 1038, 1010, 821, 740, 699 см-1. HRMS (ESI) m/z: [М+Н]+ рассчит. для C39H59O9Si, 699,3923; обнаружено, 699,3937.
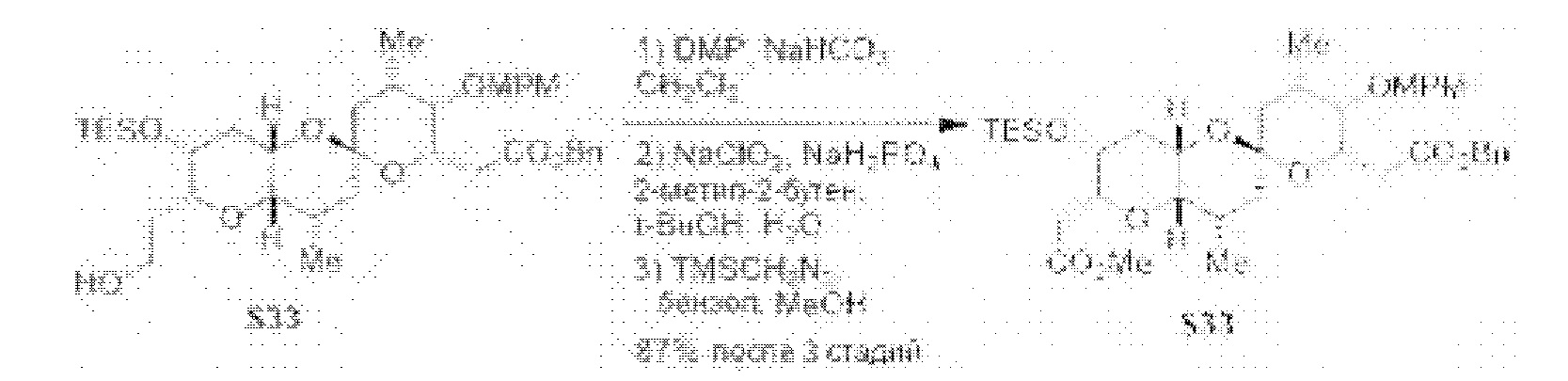
[00856] К перемешанному раствору спирта S33 (400 мг, 0,573 ммоль, 1 экв.) в CH2Cl2 (10 мл) при комнатной температуре последовательно добавляли NaHCO3 (480 мг, 5,73 ммоль, 10 экв.) и перйодинан Десс-Мартина (486 мг, 1,146 ммоль, 2 экв.). После перемешивания в течение 30 мин при той же температуре, реакционную смесь гасили добавлением нас.водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой CH2Cl2. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество пропускали через a SiO2 с получением неочищенного альдегида, который использовали на следующей стадии без дополнительной очистки. К перемешанному раствору неочищенного альдегида (согласно подсчетам 0,573 ммоль, 1 экв.) в смешанном растворителе (9 мл t-BuOH, 2 мл воды и 2 мл 2-метил-2-бутена) при комнатной температуре последовательно добавляли NaH2PO3⋅Н2О (316 мг, 2,292 ммоль, 4 экв.) и NaClO2 (156 мг, 1,719 ммоль, 3 экв.). После перемешивания в течение 30 мин при той же температуре, реакционную смесь гасили добавлением нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученную неочищенную кислоту использовали на следующей стадии без дополнительной очистки. К перемешанному раствору неочищенной кислоты (согласно подсчетам 0,573 ммоль, 1 экв.) в смешанном растворителе (15 мл бензола и 3 мл МеОН) при комнатной температуре добавляли раствор TMSCH2N2 (0,81 мл 2 М в Et2O, 1,72 ммоль, 3 экв.). После перемешивания в течение 5 мин при той же температуре, реакционную смесь гасили добавлением НОАс (0,1 мл) при 0°С. После концентрирования, полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (0%, 3%, затем 5% EtOAc в гексанах) с получением сложного эфира 30 (362 мг, 0,499 ммоль, 87% после 3 стадий) в виде бесцветного масла. 30: [α]20D -35,6 (с 1,00, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 7,24 (2Н, д, J=7,8 Гц), 7,20 (2Н, д, J=7,8 Гц), 7,13 (2Н, т, J=7,8 Гц), 7,09 (1Н, кв, J=7,8 Гц), 6,77 (2Н, д, J=7,8 Гц), 5,09 (1Н, д, J=14,4 Гц), 5,00 (1Н, д, J=14,4 Гц), 4,33 (1Н, д, J=11,0 Гц), 4,28-4,21 (2Н, м), 3,78 (1Н, с), 3,74 (1Н, д, J=8,4 Гц), 3,59 (1Н, с), 3,38 (3Н, с), 3,30 (3Н, с), 2,99 (1Н, с), 2,95 (1Н, дд, J=12,2, 10,8 Гц), 2,91 (1Н, с), 2,83 (1Н, дд, J=16,2, 7,2 Гц), 2,58 (1Н, дд, J=16,2, 6,0 Гц), 2,36 (1Н, с), 2,31 (1Н, дд, J=16,2, 3,2 Гц), 2,13 (1Н, с), 2,01 (1Н, д, J=15,0 Гц), 1,66 (2Н, тд, J=12,6, 2,0 Гц), 1,58-1,51 (2Н, м), 1,38 (1Н, дд, J=12,6, 3,2 Гц), 1,06 (9Н, т, J=8,4 Гц), 1,05 (3Н, д, J=6,0 Гц), 1,00 (3Н, д, J=6,0 Гц), 0,64 (6Н, кв, J=8,4 Гц) м.д. 13С-ЯМР (150 МГц, C6D6) δ: 171,8, 171,7, 159,7, 136,7, 131,3, 129,7, 128,8, 128,7, 128,3, 114,0, 97,0, 78,5, 77,1, 76,4, 75,3, 69,8, 66,1, 65,7, 64,4, 54,8, 50,9, 38,0, 37,7, 37,3, 37,2, 36,2, 30,9, 28,9, 18,2, 17,6, 7,3, 5,4 м.д. FTIR (пленка): 2952, 2924, 2874, 2854, 1737, 1613, 1514, 1457, 1436, 1397, 1371, 1302, 1246, 1207, 1163, 1085, 1038, 944, 738, 698 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C40H58O10SiNa, 749,3697; обнаружено, 749,3720.
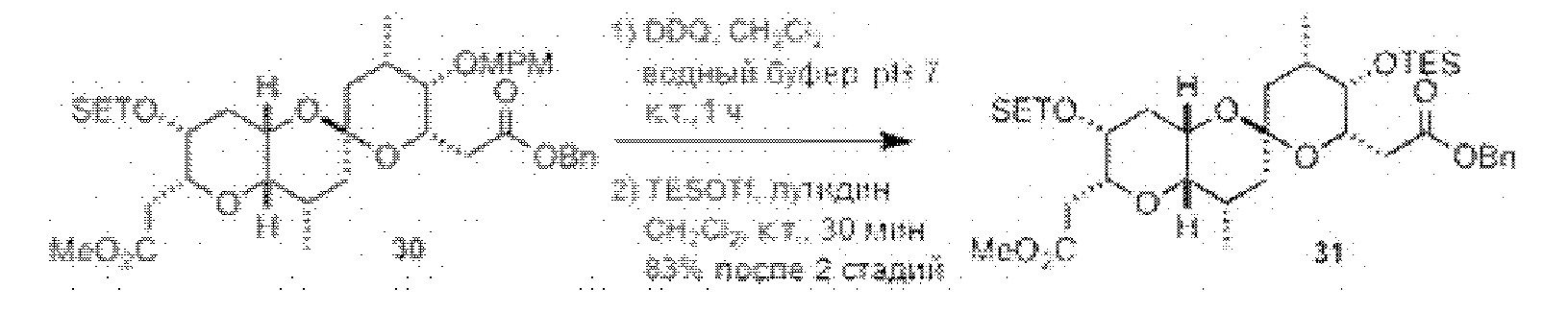
[00857] К перемешанному раствору МРМ-эфира 30 (350 мг, 0,482 ммоль, 1 экв.) в CH2Cl2 (10 мл) и фосфатном буфере (3 мл, рН 7) при комнатной температуре добавляли DDQ (219 мг, 0,964 ммоль, 2 экв.). После перемешивания в течение 1 ч при той же температуре, реакционную смесь гасили добавлением нас.водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой CH2Cl2. Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество пропускали через SiO2 с получением неочищенного спирта, который использовали на следующей стадии без дополнительной очистки.
[00858] К перемешанному раствору неочищенного спирта (по расчетам 0,482 ммоль, 1 экв.) в CH2Cl2 (5,0 мл) при комнатной температуре добавляли 2,6-лутидин (129 мг, 1,205 ммоль, 2,5 экв.) и TESOTf (255 мг, 0,964 ммоль, 2 экв.) с удерживанием на водяной бане. После перемешивания в течение 30 мин при той же температуре, реакционную смесь гасили добавлением нас. водн. NaHCO3. Органический слой разделяли, и экстрагировали водный слой EtOAc.Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Полученное неочищенное вещество очищали методом колоночной флэш-хроматографии на нейтральном силикагеле (0%, 3%, затем 5% EtOAc в гексанах) с получением TES-эфира 31 (288 мг, 0,400 ммоль, 97%) в виде бесцветного масла. 31: [α]20D -52,1 (с 1,00, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 7,26 (2Н, д, J=7,8 Гц), 7,11 (2Н, т, J=7,8 Гц), 7,05 (1Н, кв, J=7,8 Гц), 5,09 (1Н, д, J=14,4 Гц), 5,00 (1Н, д, J=14,4 Гц), 4,18 (1Н, дд, J=10,2, 4,0 Гц), 3,80 (1Н, с), 3,74 (1Н, тд, J=6,6, 1,5 Гц), 3,61 (1Н, с), 3,38 (3Н, с), 3,29 (1Н, с), 2,98 (1Н, с), 2,91 (1Н, дд, J=13,8, 12,0 Гц), 2,84 (1Н, дд, J=15,0, 8,4 Гц), 2,60 (1Н, дд, J=15,0, 5,5 Гц), 2,35-2,29 (2Н, м), 2,15-2,07 (1Н, м), 2,03 (1Н, дд, J=15,0, 3,0 Гц), 1,68 (1Н, т, J=13,8 Гц), 1,64 (1Н, т, J=13,8 Гц), 1,58-1,51 (2Н, м), 1,40 (1Н, дд, J=13,2, 4,3 Гц), 1,07 (9Н, т, J=8,4 Гц), 0,99 (3Н, д, J=7,2 Гц), 0,96 (3Н, д, J=7,2 Гц), 0,95 (9Н, т, J=8,4 Гц), 0,65 (6Н, кв, J=8,4 Гц), 0,56 (6Н, кв, J=8,4 Гц) м.д. 13С-ЯМР (150 МГц, C6D6) δ: 171,8, 171,6, 136,7, 128,8, 128,7, 128,3, 96,9, 77,2, 76,4, 72,5, 70,1, 66,2, 65,6, 64,4, 38,3, 37,5, 37,4, 37,2, 36,3, 31,0, 28,9, 18,5, 17,1, 7,3, 7,2, 5,8, 5,4 м.д. FTIR (пленка): 2955, 2925, 2876, 1739, 1457, 1372, 1304, 1266, 1240, 1208, 1160, ИЗО, 1086, 1063, 1036, 947, 856, 740, 697 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C38H64O9Si2Na, 743,3987; обнаружено, 743,4003.
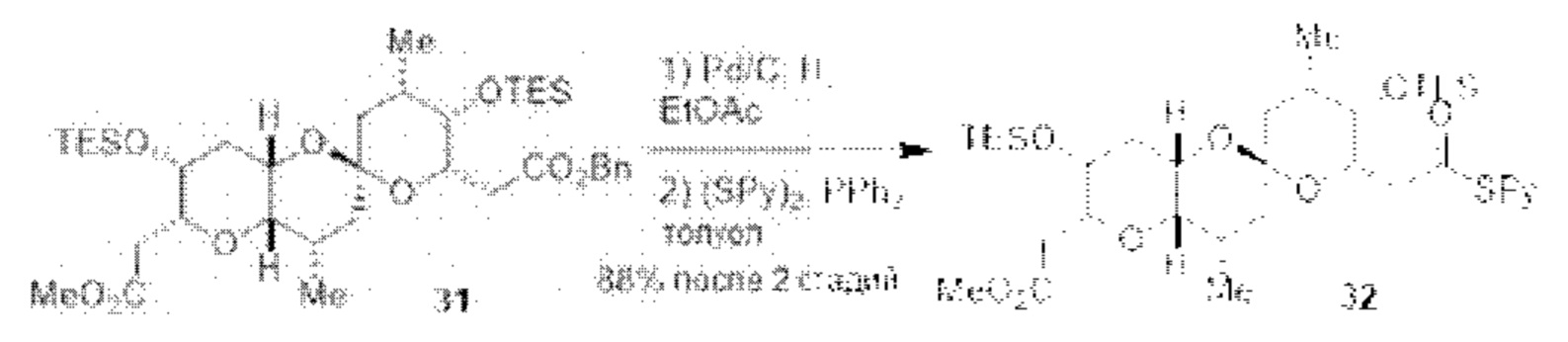
[00859] К перемешанному раствору бензилового эфира 31 (250 мг, 0,347 ммоль, 1 экв.) в EtOAc (10,0 мл) при комнатной температуре добавляли влажный 10% Pd/C (25 мг, 10% масс/масс). Реакционную смесь перемешивали при давлении 1 атм водорода в течение 2 ч при той же температуре. Полученную смесь фильтровали через слой Celite (EtOAc). Органический растворитель удаляли в условиях пониженного давления с получением неочищенной кислоты, которую использовали на следующей стадии без дополнительной очистки.
[00860] К перемешанному раствору неочищенной карбоновой кислоты (по расчетам 0,347 ммоль, 1 экв.) в толуоле (1,2 мл) при комнатной температуре добавляли PPh3 (110 мг, 0,416 ммоль, 1,2 экв.) и (PyS)2 (107 мг, 0,486 ммоль, 1,4 экв.). После перемешивания в течение 12 ч при той же температуре, полученную реакционную смесь немедленно подвергали колоночной хроматографии на нейтральном силикагеле (0%, 3%, 5%, затем 6% EtOAc в гексанах) с получением пиридинтиолового эфира 5-32 (221 мг, 0,306 ммоль, 88% после 2 стадий) в виде бесцветного масла. 5-32: [α]20D -62,1 (с 1,0, CHCl3). 1Н-ЯМР (600 МГц, C6D6) δ: 8,32 (1Н, дд, J=4,5, 1,3 Гц), 7,52 (1Н, д, J=7,8 Гц), 6,97 (1Н, тд, J=7,8, 1,5 Гц), 6,48 (1Н, м), 4,19 (1Н, дд, J=9,6, 2,8 Гц), 3,88 (1Н, т, J=1,6 Гц), 3,72 (1Н, м), 3,58 (1Н, т, J=1,6 Гц), 3,37 (3Н, с), 3,23 (1Н, дд, J=13,8, 10,2 Гц), 3,17 (1Н, ушир. с), 3,04 (1Н, J=2,4 Гц, 1Н), 2,82 (1Н, дд, J=13,8, 7,2 Гц), 2,59-2,53 (2Н, м), 2,41-2,34 (1Н, м), 2,27 (1Н, м), 2,03 (1Н, дт, J=14,4, 2,4 Гц), 1,70 (1Н, т, J=13,2 Гц), 1,63 (1Н, т, J=13,2 Гц), 1,59 (1Н, дт, J=15,0, 3,5 Гц), 1,53 (1Н, дд, J=13,2, 5,2 Гц), 1,45 (1Н, дд, J=13,2, 5,2 Гц), 1,06 (9Н, т, J=8,4 Гц), 1,00 (3Н, д, J=6,0 Гц), 0,98 (9Н, т, J=8,4 Гц), 0,93 (3Н, д, J=6,6 Гц), 0,64 (6Н, кв, J=8,4, 1,1 Гц), 0,56 (6Н, кв, J=8,4 Гц) м.д. 13С-ЯМР (150 МГц, C6D6) δ: 194,7, 152,7, 150,6, 136,5, 128,5, 123,1, 97,4, 77,7, 77,5, 72,5, 70,0, 68,6, 67,3, 63,9, 47,8, 37,5, 36,7, 36,5, 30,5, 29,1, 27,8, 27,7, 23,4, 21,0, 18,5, 17,3,7,4, 5,9 м.д.. IR (пленка): 2955, 2931,2874, 2857, 1708, 1132, 1035, 974 см-1. HRMS (ESI) m/z: [M+Na]+ рассчит. для C36H61NO8SSi2Na, 746,3554; обнаружено, 746,3578.
Дополнительные экспериментальные методики для получения соединения (1) и других соединений
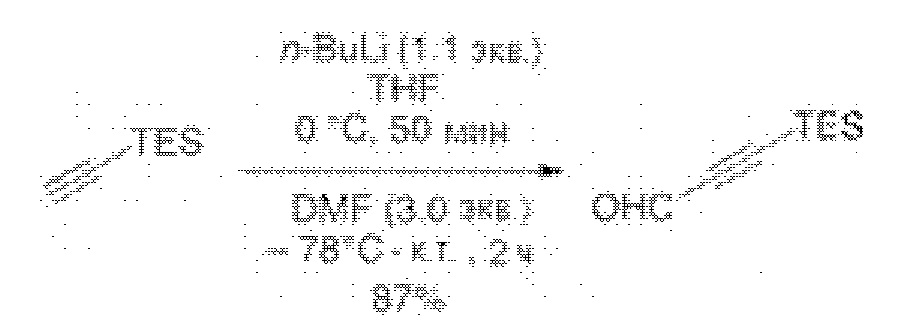
[00861] К перемешанному раствору (триэтилсилил)ацетилена (25,7 г, 183 ммоль) в THF (250 мл) при 0°С в течение 20 мин по каплям добавляли н-BuLi (2,5 М в гексане, 80,0 мл, 201 ммоль). После перемешивания в течение 50 мин, при -78°С к смеси добавляли DMF (42,0 мл, 549 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 2 ч. Реакционную смесь гасили добавлением 3 М HCl (185 мл) при 0°С. Смесь разбавляли EtOAc (260 мл), четыре раза промывали Н2О (190 мл) и один раз солевым раствором. Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали в условиях пониженного давления. В завершение, неочищенное масло очищали путем перегонки (~63°С) с получением целевого альдегида (26,9 г, 160 ммоль, 87%) в виде бесцветного масла; 1Н-ЯМР (400 МГц, CDCl3) δ 9,18 (с, 1Н), 1,02 (т, J=7,6 Гц, 9Н), 0,69 (кв, J=7,6 Гц, 6Н); 13С-ЯМР (100 МГц, CDCl3) δ 176,8, 103,5, 101,6, 7,2, 3,7; IR (чистое вещество) 2958, 2877, 2151, 1667, 995, 723, 677.
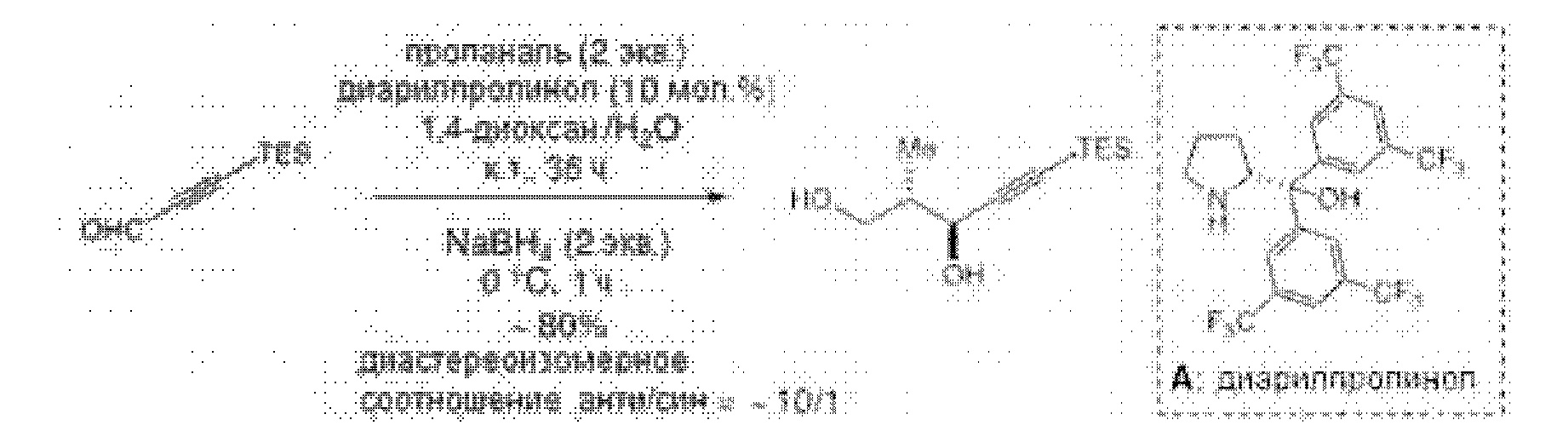
[00862] К перемешанной смеси алкинилальдегида (25,4 г, 151 ммоль), пропаналя (21,7 мл, 302 ммоль) и воды (8,20 мл, 453 ммоль) в 1,4-диоксане (150 мл) добавляли диарилпролинол А (7,90 г, 15,1 ммоль; Hayashim Y.; Itoh, Т.; Aratake, S.; Ishikawa, H. Angew, Chem. Int. Ed. 2008, 47, 2082). После перемешивания в течение 36 ч при комнатной температуре, при 0°С к смеси добавляли NaBH4 (11,4 г, 302 ммоль). После перемешивания в течение 1 ч при 0°С, реакционную смесь гасили добавлением Н2О (54 мл), солевым раствором (320 мл), и пять раз экстрагировали реакционную смесь EtOAc. Объединенные органические экстракты сушили над безводным сульфатом натрия, фильтровали и концентрировали в условиях пониженного давления. Полученное масло фильтровали через слой силикагеля (450 г) и промывали смесью гексаны/EtOAc = 10/1, затем 1/1. Фильтрат снова концентрировали в условиях пониженного давления. Остаток (27,7 г, ~121 ммоль, ~80%) подвергали следующей реакции без дополнительной очистки.
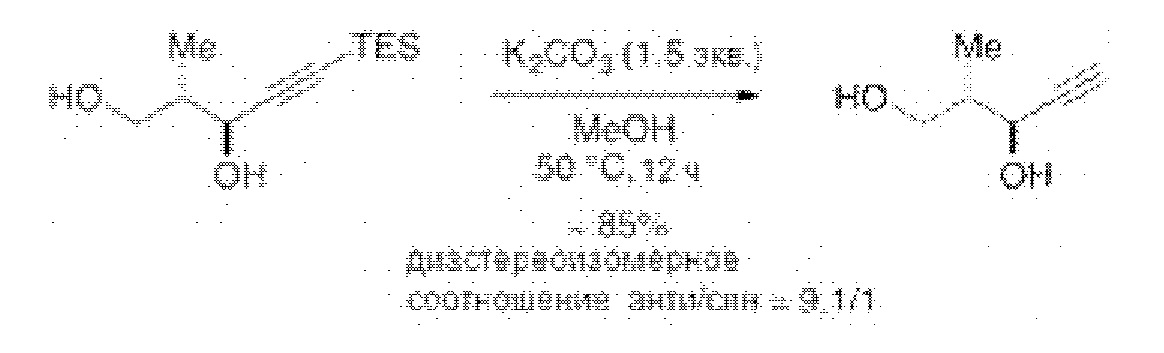
[00863] К перемешанному раствору неочищенного диола (27,7 г, ~121 ммоль) в МеОН (400 мл) при комнатной температуре добавляли K2CO3 (25,2 г, 182 ммоль). Полученную смесь нагревали при 50°С и перемешивали в течение 12 ч. После охлаждения до комнатной температуры, растворитель удаляли в условиях пониженного давления. Полученное масло разбавляли CH2Cl2 и фильтровали через слой силикагеля (130 г) для удаления K2CO3. Осадок промывали CH2Cl2/МеОН = 10/1, и концентрировали фильтрат в условиях пониженного давления. Полученное масло снова фильтровали через слой силикагеля (160 г) и промывали смесью гексаны/EtOAc = 5/1, затем 1/2. Фильтрат снова концентрировали в условиях пониженного давления. Остаток (11,7 г, ~103 ммоль, ~85%) подвергали следующей реакции без дополнительной очистки.
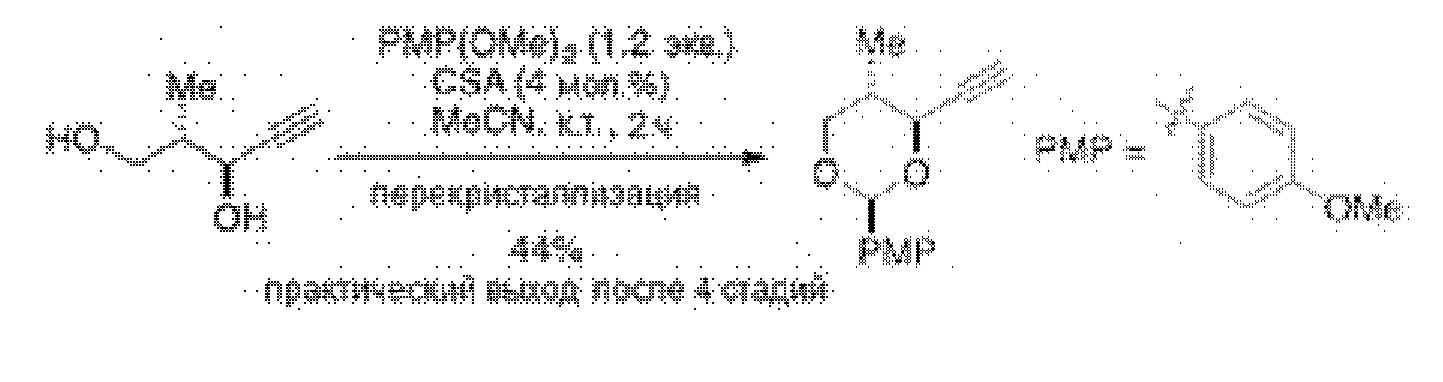
[00864] К перемешанной смеси неочищенного диола (11,7 г, -103 ммоль) и пара-метоксибензилидендиметилацеталя (22,0 мл, 124 ммоль) в MeCN (180 мл) при комнатной температуре добавляли каталитическое количество CSA (0,96 г, 4,12 ммоль). После перемешивания в течение 2 ч, реакционную смесь гасили добавлением Et3N (2,9 мл, 20,6 ммоль), фильтровали через слой силикагеля (70 г), промывали CH2Cl2 и концентрировали в условиях пониженного давления. Остаток очищали путем перекристаллизации из гексанов/CH2Cl2 с получением целевого анти-соединения (15,5 г, 66,8 ммоль, 44% после 4 стадий из алкинилальдегида) в виде белого чистого кристаллического вещества; [α]D20 +3,00 (с 1,0, МеОН); 1Н-ЯМР (400 МГц, CDCl3) δ 7,42 (д, J=8,4 Гц, 2Н), 6,88 (д, J=8,4 Гц, 2Н), 5,43 (с, 1Н), 4,21-4,15 (м, 2Н), 3,80 (с, 3Н), 3,51 (дд, J=11,2, 11,2 Гц, 1Н), 2,53 (д, J=2,4 Гц, 1Н), 2,19-2,17 (м, 1Н), 0,95 (д, J=7,2 Гц, 3Н); 13С-ЯМР (100 МГц, CDCl3) δ 160,1, 130,2, 127,6, 113,6, 101,5, 80,7, 74,3, 73,7, 72,7, 55,3, 35,1, 12,5; IR (чистое вещество) 3263, 2963, 2838, 1614, 1519, 1247, 1024, 997, 834.
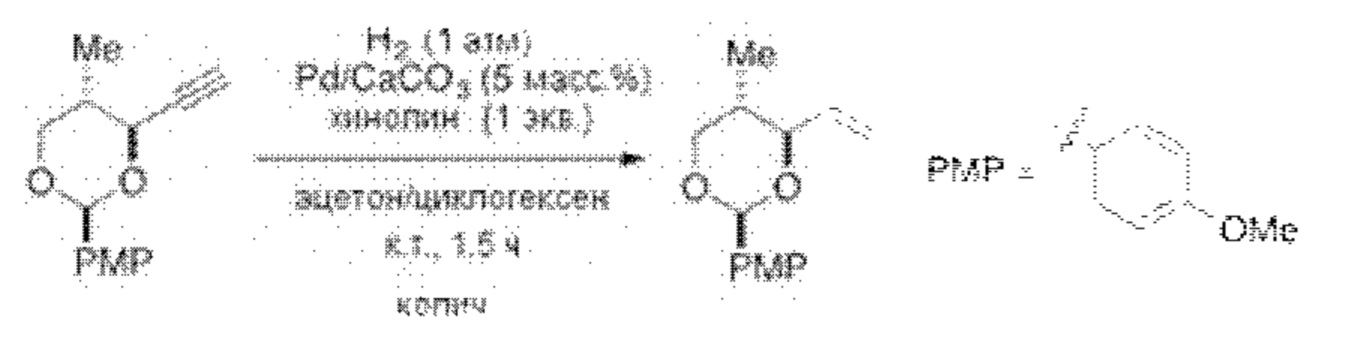
[00865] К перемешанному раствору алкина (15,5 г, 66,8 ммоль) в смеси ацетона (480 мл) и циклогексена (160 мл) при комнатной температуре добавляли хинолин (7,90 мл, 66,8 ммоль) и 5 масс. % «отравленного» Pb Pd/СаСО3 (0,775 г, 5 масс. %). В содержащую смесь колбу при комнатной температуре загружали водород (1 атм), энергично перемешивали в течение 1,5 ч и фильтровали через слой Celite. Осадок на фильтре промывали EtOAc, и концентрировали фильтрат в условиях пониженного давления. Остаток фильтровали через слой силикагеля (230 г) и промывали смесью гексаны/EtOAc = 20/1. Фильтрат концентрировали снова в условиях пониженного давления с получением чистого алкена (15,6 г, 66,7 ммоль, колич.); белое твердое вещество; [α]D20 +65,4 (с 1,0, CHCl3); 1Н-ЯМР (400 МГц, CDCl3) δ 7,44 (д, J=8,8 Гц, 2Н), 6,89 (д, J=8,8 Гц, 2Н), 5,94-5,85 (м, 1Н), 5,51 (с, 1Н), 5,36 (д, J=17,2 Гц, 1Н), 5,26 (д, J=10,4 Гц, 1Н), 4,16 (дд, J=11,6, 4,8 Гц, 1Н), 3,89 (дд, J=11,4, 4,8 Гц, 1Н), 3,80 (с, 3Н), 3,54(дд, J=11,6, 11,4 Гц, 1Н), 1,93-1,87 (м, 1Н), 0,79 (д, J=6,8 Гц, 3Н); 13С-ЯМР (100 МГц, CDCl3) δ 159,9, 136,0, 131,0, 127,5, 118,0, 113,6, 101,0, 84,7, 73,0, 55,3,33,9, 12,3; IR (чистое вещество) 2965, 1612, 1516, 1248, 1140, 1034, 815.
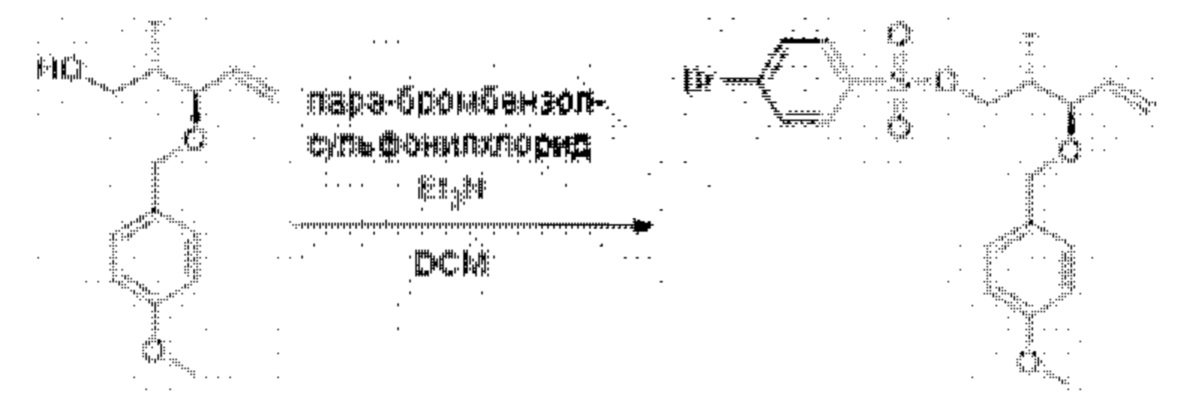
[00866] К перемешанному раствору исходного вещества (445 г, 1,885 моль) в дихлорметане (750 мл) в атмосфере N2 при комнатной температуре добавляли Et3N (790 мл, 5,656 моль). К этой смеси при температуре ниже 41°С по каплям добавляли раствор пара-бромбензолсульфонилхлорида (730 г, 2,828 моль) в дихлорметане (600 мл). После перемешивания в течение 2 ч при 35-40°С, смесь вливали в смесь н-гептана (2 л) и воды (1,5 л), и перемешивали в течение 5 мин с получением двухфазной смеси. Разделенный водный слой дважды экстрагировали смесью н-гептан/EtOAc = 2/1 (об./об.). Объединенный органический слой промывали 1 М водн. HCl и насыщенным водн. NaHCO3. Органический слой концентрировали в условиях пониженного давления с получением неочищенного вещества в виде твердого вещества. К этому твердому веществу добавляли МТВЕ (870 мл) и н-гептан (2,6 л) и нагревали до 49°С для растворения твердого вещества. Смесь медленно охлаждали до комнатной температуры и перемешивали в течение 16 ч. После дополнительного перемешивания при температуре ниже 3°С в течение 1 ч, полученную суспензию фильтровали и промывали холодной смесью н-гептан/МТВЕ = 9/1 (об./об.). Кристаллические вещества сушили в условиях пониженного давления при 30°С с получением целевого соединения (740,6 г, 1,626 моль, 86%). 1H-ЯМР (500 МГц, CDCl3) δ м.д. 7,75 (2Н, д, J=8,5 Гц), 7,67 (2Н, д, J=8,5 Гц), 7,14 (2Н, д, J=8,5 Гц), 6,86 (2Н, д, J=8,5 Гц), 5,60-5,67 (1Н, м), 5,33 (1Н, дд, J=10,5, 2,0 Гц), 5,23 (1Н, д, J=17,5 Гц), 4,46 (1Н, д, J=11,0 Гц), 4,14 (1Н, д, J=11,0 Гц), 4,14 (1Н, дд, J=9,0, 4,0 Гц), 4,10 (1Н, дд, J=9,0, 4,0 Гц), 3,82 (3Н, с), 3,57 (1Н, дд, J=8,0, 8,0 Гц), 1,92-2,00 (1Н, м), 0,90 (3Н, д, J=7,0 Гц).
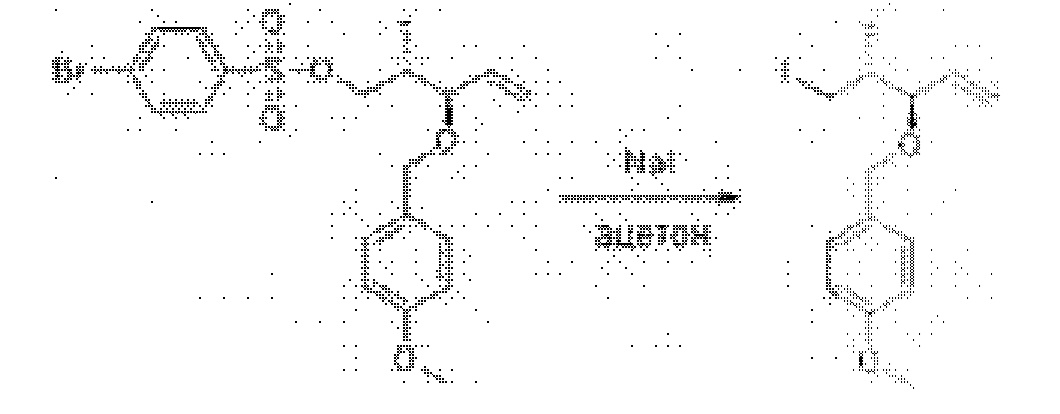
[00867] К перемешанному раствору исходного вещества (730,6 г, 1,604 моль) в ацетоне (2,2 л) при комнатной температуре в атмосфере N2 добавляли NaI (721 г, 4,813 моль) и нагревали до 45°С. После перемешивания в течение 2,5 ч, смесь охлаждали до температуры ниже 30°С с последующим добавлением н-гептана (2,2 л) и воды (2,2 л) с получением двухфазной смеси. Органический слой разделяли, и дважды экстрагировали водный слой смесью н-гептан/EtOAc = 4/1 (об./об.). Объединенный органический слой промывали смесью, содержащей 6% водный раствор NaHCO3 и 3% водн. Na2S2O3. Органический слой концентрировали в условиях пониженного давления и подвергали азеотропной перегонке с н-гептаном. Остаток очищали методом колоночной хроматографии на нейтральном силикагеле (10 кг, элюент: 0%, 2%, затем 5% EtOAc в н-гептане). Собранные фракции концентрировали с получением целевого продукта (551 г, 1,591 моль, 99%). 1H-ЯМР (500 МГц, CDCl3) δ м.д. 7,28 (2Н, д, J=9,0 Гц), 6,88 (2Н, д, J=9,0 Гц), 5,69-5,76 (1Н, м), 5,35 (1Н, дд, J=10,0, 1,5 Гц), 5,29 (1Н, д, J=17,5 Гц), 4,51 (1Н, д, J=11,0 Гц), 4,28 (1Н, д, 11,0 Гц), 3,82 (3Н, с), 3,53 (1Н, дд, J=8,0, 8,0 Гц), 3,46 (1Н, дд, J=9,0, 6,0 Гц), 3,34 (1Н, дд, J=9,0, 3,5 Гц), 1,51-1,59 (1Н, м), 0,94 (3Н, д, J=7,0 Гц).

[00868] К перемешанному раствору лактона (500 г, 1,46 моль) в толуоле (5 л) в атмосфере N2 при -71~-62°С добавляли раствор DIBAL (1,83 л 1 М в толуоле, 1,83 моль). После перемешивания в течение 15 мин, реакционную смесь гасили добавлением EtOAc (500 мл) при -69~-65°С. Затем, смесь нагревали до -23°С, и при -23~8°С добавляли 30% водн. сегнетову соль (5 л). Смесь перемешивали в течение 30 мин при комнатной температуре с получением двухфазной смеси. Органический слой разделяли и последовательно промывали водой и 5% водн. NaCl. Объединенные водные слои экстрагировали EtOAc. Объединенные органические слои концентрировали и дважды подвергали азеотропной перегонке с толуолом в условиях пониженного давления с получением неочищенного лактола, который использовали на следующей стадии без дополнительной очистки.
[00869] К суспензии Ph3PCH3Br (2086 г, 5,84 моль) в THF (4 л) в атмосфере N2 при 3°С добавляли t-BuOK (491,5 г, 4,38 моль). Раствор неочищенного лактола (по расчетам 1,46 моль) в THF (1 л) при 1~9°С добавляли в реакционную смесь. После перемешивания в течение 20 мин при 3~7°С, реакционную смесь гасили добавлением воды (125 мл) при температуре ниже 14°С. Затем, добавляли iPrOAc (5 л) и воду (2,4 л) с получением двухфазной смеси. Органический слой разделяли и промывали 5% водн. NaCl. Органический слой концентрировали в условиях пониженного давления. Остаток добавляли к толуолу (1 л) и н-гептану (1 л) и перемешивали в течение 16 ч при 0°С. Выпавшее в осадок твердое вещество удаляли путем фильтрования, и концентрировали фильтрованный раствор в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на нейтральном силикагеле (3,0 кг, элюент: 0%, 5%, 7%, 9%, затем 12% EtOAc в н-гептане) с получением целевого соединения (440 г, 1,28 моль, 88% после 2 стадий). 1Н-ЯМР (500 МГц, CDCl3) δ: 5,70-5,77 (1Н, ддд, J=17, 10,5, 8,0 Гц), 5,18 (1Н, ддд, J=17, 1,5, 1,5 Гц), 5,05 (1Н, дд, J=10,5, 1,5 Гц), 4,42 (1Н, дд, J=3,0, 3,0 Гц), 4,27 (1Н, дд, J=15, 2,5 Гц), 4,23 (1Н, дд, J=15, 1,5 Гц), 3,70-3,74 (1Н, м), 3,62 (1Н, д, J=10,5 Гц), 3,32 (1Н, м), 2,97 (1Н, дд, 3=9,5, 1,3 Гц), 2,72-2,80 (1Н, м), 2,33 (1Н, ддд, J=15,0, 3,0, 3,0 Гц), 1,67 (1Н, ддд, 15,0, 3,0, 3,0 Гц), 1,12 (3Н, д, J=6,5 Гц), 1,07 (9Н, с), 1,06 (9Н, с)

[00870] К перемешанному раствору исходного вещества (440 г, 1,28 моль) в THF (3,7 л) при 20°С в атмосфере N2 добавляли триэтиламин (367 мл, 2,63 моль) и охлаждали до 3°С. К этой смеси при температуре ниже 7°С по каплям добавляли TESOTf (354 мл, 1,54 моль), и перемешивали в течение 8 мин при той же температуре. Реакционную смесь гасили добавлением 3,5% водн. NaHCO3 (4,4 л) при температуре ниже 18°С с последующим добавлением EtOAc (2,2 л) и н-гептана (2,2 л) с получением двухфазной смеси. Органический слой разделяли и промывали 5% водн. NaCl. Органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением неочищенного вещества, которое использовали на следующей стадии без дополнительной очистки.
[00871] Раствор неочищенного вещества (по расчетам 1,28 моль) в THF (2,1 л) и ацетоне (2,1 л) добавляли к NMO (464 г, 3,96 моль) с последующим добавлением водой (0,5 л) при комнатной температуре. К этой смеси добавляли 4% водн. OsO4 (194 мл, 32 ммоль), и перемешивали в течение 19 ч при комнатной температуре. Затем, к этой смеси добавляли воду (2,1 л) и NaIO4 (847 г, 3,96 моль) и дополнительно перемешивали в течение 70 мин при комнатной температуре. К этой смеси добавляли н-гептан (2,9 л) и воду (1,2 л), и перемешивали в течение 5 мин при комнатной температуре с получением двухфазной смеси. Органический слой разделяли, и экстрагировали водный слой н-гептаном. Объединенные органические слои добавляли к 20% водн. Na2SO3, и перемешивали полученную двухфазную смесь в течение 30 мин при комнатной температуре. Органический слой разделяли и последовательно промывали 10% водн. Na2SO3, водой, 5% водн. NaCl. Органический слой сушили над Na2SO4, фильтровали, концентрировали в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на нейтральном силикагеле (5,9 кг, элюент: 0%, 5%, затем 10% EtOAc в н-гептане). Собранные фракции концентрировали, и отверждали полученный альдегид путем охлаждения на бане со льдом в воде с получением альдегида (502,8 г, 1,10 моль, 86% после 2 стадий). 1Н-ЯМР (500 МГц, CDCl3) δ: 9,84 (1Н, с), 4,29-4,31 (1Н, м), 4,28 (1Н, дд, J=12,5, 3,0 Гц), 4,21 (1Н, дд, J=12,5, 1,5 Гц), 3,86-3,88 (1Н, м), 3,57 (1Н, дд, J=7,5, 2,5 Гц), 3,29-3,32 (1Н, м), 2,80-2,86 (1Н, дкв, J=7,5 Гц, 7,5 Гц), 2,21-2,25 (1Н, ддд, J=15,0, 2,5, 2,5 Гц), 1,77-1,81 (1Н, ддд, J=15,0, 4,0, 4,0 Гц), 1,16 (3Н, д, J=7,5 Гц), 1,07 (9Н, с), 1,04 (9Н, с), 0,96-1,00 (9Н, м), 0,58-0,67 (6Н, м).
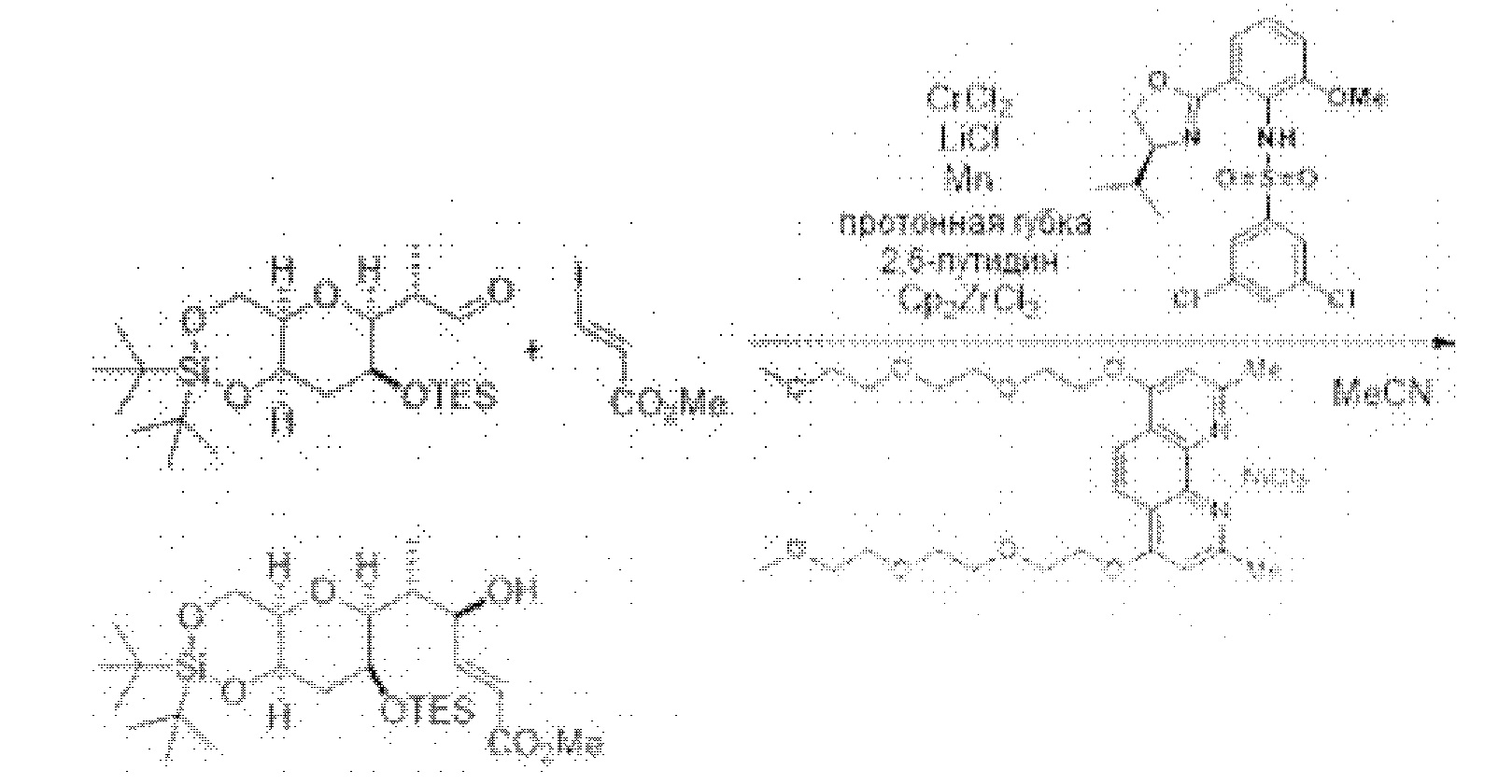
[00872] В перчаточной камере в хорошо высушенную круглодонную колбу добавляли CrCl2 (22 мг, 0,18 ммоль), протонную губку (42 мг, 0,20 ммоль), сульфонамидный лиганд (88 мг, 0,20 ммоль) и безводный MeCN (3,0 мл). Смесь перемешивали в перчаточной камере при комнатной температуре.
[00873] В другой колбе к альдегиду (500 мг, 0,90 ммоль) добавляли толуол. После азеотропного удаления толуола, колбу переносили в перчаточную камеру с последующим добавлением винилйодида (477 мг, 2,25 ммоль), Mn (198 мг, 3,60 ммоль), LiCl (76 мг, 1,80 ммоль), Cp2ZrCl2 (289 мг, 0,99 ммоль) и 2,6-лутидина (0,21 мл, 1,80 ммоль). В эту колбу добавляли полученный выше раствор Cr с последующим добавлением Ni-катализатора (3,0 мг, 4,5 мкмоль). Смесь энергично перемешивали в течение 145 мин при 30°С. Колбу убирали из перчаточной камеры, и при комнатной температуре добавляли к этой смеси Florisil® (1 г). После разбавления смесью н-гептан/EtOAc = 1/1 (об./об.) (5 мл) суспензию энергично перемешивали в течение 35 мин при комнатной температуре и пропускали через слой нейтрального силикагеля (5 г). Целевой продукт элюировали EtOAc, и концентрировали собранный раствор в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на нейтральном силикагеле (10 г, элюент: 0%, 10%, 20%, 33%, затем 50% EtOAc в н-гептане). Собранные фракции концентрировали с получением целевого продукта (462 мг, 0,85 ммоль, 94%).
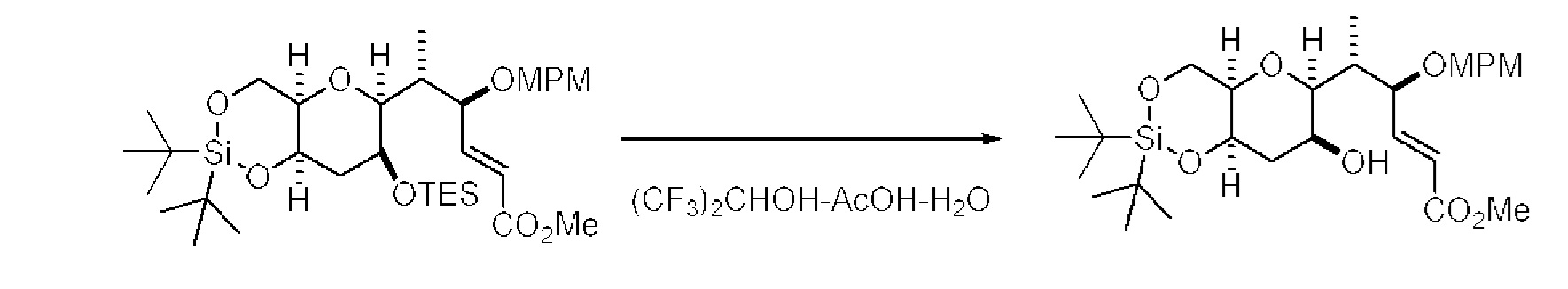
[00874] К перемешанному раствору исходного вещества (636,6 г, 0,957 моль) в гексафторизопропаноле (HFIP) (1,6 л) и воде (160 мл) при 5°С в атмосфере N2 добавляли АсОН (55 мл, 0,957 моль). Смесь перемешивали в течение 30 мин при температуре ниже 5°С и 3 ч при комнатной температуре. Реакционную смесь гасили добавлением 5% водн. NaHCO3 (5 л) с последующим добавлением н-гептана (5 л). После разделения органического слоя, водный слой и HFIP-слой объединяли и дважды экстрагировали н-гептаном. Три органических слоя объединяли и промывали 5% водн. NaCl. Органический слой сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали методом колоночной хроматографии на нейтральном силикагеле (8,5 кг, элюент: 0%, 9,1%, 11%, затем 17% EtOAc в н-гептане). Собранные фракции концентрировали с получением целевого спирта (480 г, 0,871 моль, 91%).
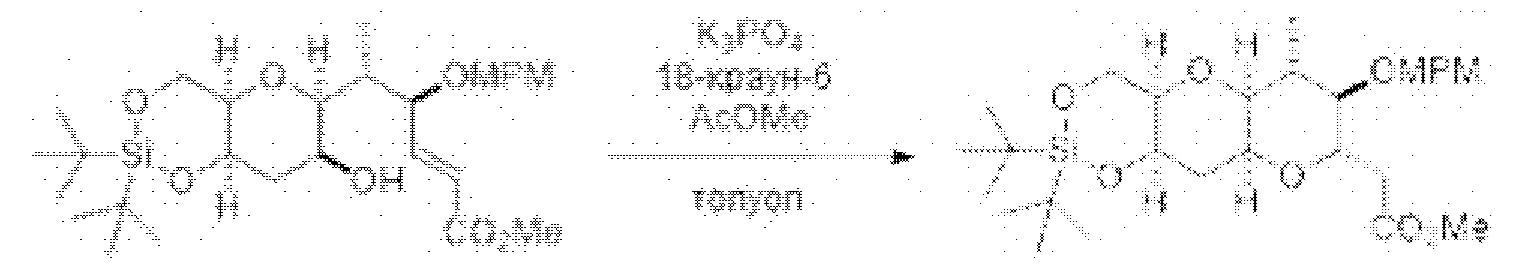
[00875] Исходное вещество (480,0 г, 0,872 моль) дважды подвергали азеотропной перегонке с толуолом (1,4 л) и добавляли толуол (4,8 л). После добавления МеОАс (480 мл), смесь охлаждали до 1°С и держали в атмосфере N2 до использования. В другую колбу добавляли K3PO4 (92,5 г, 0,436 моль), 18-краун-6 (345,5 г, 1,307 моль) и МеОН (480 мл). Эту смесь обрабатывали ультразвуком в течение 20 мин и концентрировали в условиях пониженного давления. Полученную смесь трижды подвергали азеотропной перегонке с толуолом (480 мл), добавляли к смеси толуол (2,4 л) и фильтровали. Фильтрованный раствор по каплям добавляли к раствору полученного выше исходного вещества при температуре ниже 4°С. После перемешивания в течение 16 мин при температуре ниже 5°С, смесь вливали в охлажденную воду (2,4 л) с последующим добавлением iPrOAc (2,4 л), воды (2,4 л) и NaCl (100 г) с получением двухфазной смеси. Разделенный органический слой промывали 5% водн. NaCl. Органический слой сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали методом колоночной хроматографии на нейтральном силикагеле (8,6 кг, элюент: 0%, 9,1%, 17%, 25%, затем 33% EtOAc в н-гептане). Чистые фракции концентрировали с получением продукта окси-реакции Михаэля (293 г, 0,531 моль, 61% после 2 стадий).
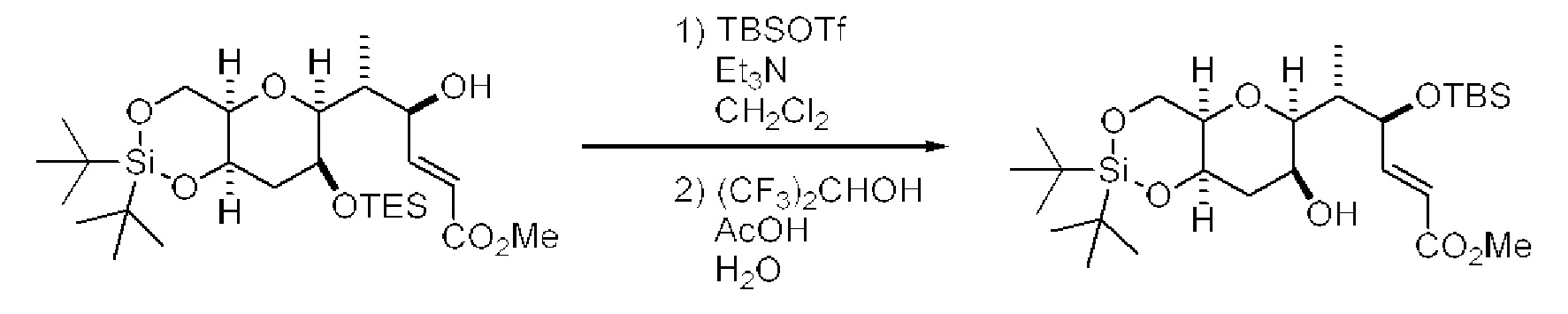
[00876] К перемешанному раствору исходного вещества (41,3 г, 75,8 ммоль) в дихлорметане (206 мл) при 1°С в атмосфере N2 добавляли Et3N (25,4 мл, 181,9 ммоль). К этой смеси при температуре ниже 10°С по каплям добавляли TBSOTf (20,9 мл, 91,0 ммоль). После перемешивания в течение 30 мин при 0°С, реакционную смесь гасили добавлением 10% водн. NaHCO3 (206 мл) при температуре ниже 17°С. Смесь экстрагировали н-гептаном, и промывали полученную органическую фазу водой и 5% водн. NaCl. Органический слой сушили над Na2SO4, фильтровали и концентрировали с получением неочищенного масла, которое использовали на следующей стадии без дополнительной очистки. К этому неочищенному веществу (по расчетам 75,8 ммоль) добавляли HFIP (124 мл) и воду (12,5 мл). После охлаждения до 4°С, добавляли АсОН (4,4 мл), и перемешивали полученную смесь в течение 30 мин при 0°С и еще 1,5 ч при комнатной температуре в атмосфере N2. Смесь гасили добавлением 5% водн. NaHCO3 (400 мл) с последующим добавлением и-гептана (400 мл) с получением двухфазной смеси. Органическую фазу разделяли и промывали 5% водн. NaCl. Органический слой сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали методом колоночной хроматографии на нейтральном силикагеле (750 г, элюент: 0%, 4,8%, 9,1%, затем 11% EtOAc в н-гептане). Собранные фракции концентрировали с получением целевого продукта (40,5 г, 74,2 ммоль, 98%). 1H-ЯМР (500 МГц, CDCl3) δ: 7,01 (1Н, дд, J=16,0, 5,0 Гц), 5,98 (1Н, дд, J=16,0, 2,5 Гц), 4,43-4,45 (1Н, м), 4,40 (1Н, дд, J=2,5, 2,5 Гц), 4,23 (1Н, дд, J=13,0, 3,0 Гц), 4,16 (1Н, дд, J=13,0, 1,0 Гц), 3,75 (3Н, с), 3,73-3,76 (1Н, м), 3,59 (1Н, д, J=11,0 Гц), 3,28-3,29 (2Н, м), 2,33 (1Н, ддд, J=14,5, 2,5, 2,5 Гц), 2,10-2,18 (1Н, м), 1,73 (1Н, ддд, J=15,0, 3,5, 3,5 Гц), 1,04-1,06 (21Н, м), 0,90 (9Н, с), 0,03 (3Н, с), 0,02 (3Н, с).

[00877] В атмосфере N2 в колбу добавляли K3PO4 (0,624 г, 2,94 ммоль), 18-краун-6 (2,33 г, 8,82 ммоль) и МеОН (15 мл), и обрабатывали ультразвуком в течение 6 мин. После концентрирования смеси в условиях пониженного давления, смесь трижды подвергали азеотропной перегонке с толуолом (20 мл). Остаток добавляли к толуолу (15 мл) и держали в атмосфере N2 при комнатной температуре.
[00878] В другой колбе исходное вещество (5,34 г, 9,80 ммоль) дважды подвергали азеотропной перегонке с толуолом (53 мл), и добавляли к остатку толуол (53 мл), а затем МеОАс (5,3 мл). После охлаждения смеси при температуре ниже 3°С, к раствору исходного вещества при температуре ниже 3°С в течение 40 мин по каплям добавляли полученный выше раствор, содержащий K3PO4. Смесь вливали в холодную смесь EtOAc/вода = 1/1 (об./об.) (106 мл) с получением двухфазной смеси. Органический слой разделяли, и экстрагировали водный слой EtOAc. Объединенный органический слой промывали водой и 5% водн. NaCl. Разделенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на нейтральном силикагеле (80 г, элюент: 0%, 5%, 7%, 10%, затем 15% EtOAc в н-гептане). Собранные фракции концентрировали с получением целевого продукта (4,35 г, 7,98 ммоль, 81%). 1H-ЯМР (500 МГц, CDCl3) δ: 4,30 (1Н, ддд, J=8,0, 3,5, 3,5 Гц), 4,13 (1Н, дд, J=12,5, 5,5 Гц), 4,09 (1Н, дд, J=12,5, 3,0 Гц) 3,87 (1Н, ддд, J=9,0. 9,0, 3,0 Гц), 3,79 (1Н, ддд, J=1,5, 4,5, 4,5 Гц), 3,70 (3Н, с), 3,60 (1Н, ддд, J=5,5, 3,5, 3,5 Гц), 3,34 (1Н, дд, J=8,0, 5,0 Гц), 3,30 (1Н, дд, J=10,0, 8,5 Гц), 2,71 (1Н, дд, J=14,5, 3,0 Гц), 2,41 (1Н, дд, J=14,5, 10,0 Гц), 2,11 (1Н, ддд, J=13,5, 8,0, 8,0 Гц), 1,98 (1Н, ддд, J=13,5, 4,5, 4,5 Гц), 1,77-1,85 (1Н, м), 1,10 (3Н, д, J=6,5 Гц), 1,06 (9Н, с), 1,02 (9Н, с), 0,90 (9Н, с), 0,09 (3Н, с), 0,06 (3Н, с).
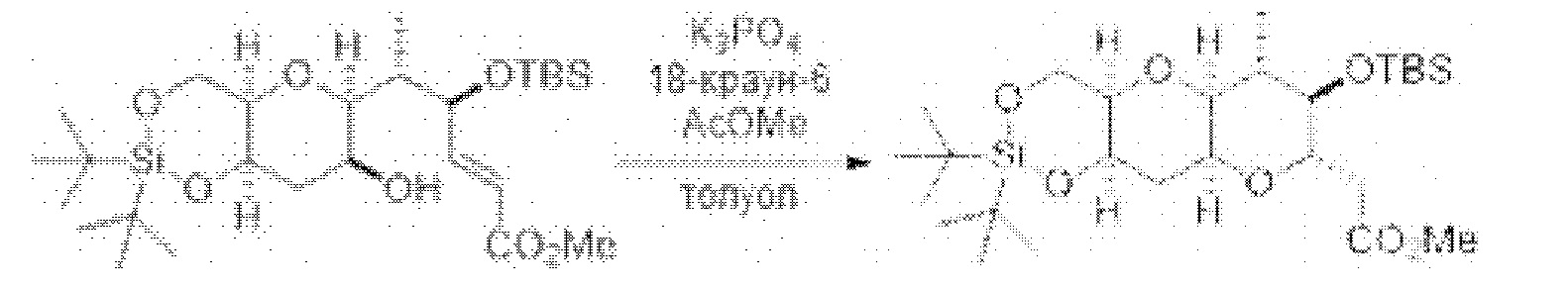
[00879] В атмосфере N2 в колбу добавляли K3PO4 (4,73 г, 22,27 ммоль), 18-краун-6 (17,66 г, 66,81 ммоль) и МеОН (120 мл), и обрабатывали ультразвуком в течение 8 мин. После концентрирования смеси в условиях пониженного давления, смесь трижды подвергали азеотропной перегонке с толуолом (120 мл). Остаток добавляли к толуолу (150 мл) и держали в атмосфере N2 при комнатной температуре до использования.
[00880] В другой колбе исходное вещество (40,45 г, 74,24 ммоль) дважды подвергали азеотропной перегонке с толуолом (120 мл), и добавляли к остатку толуол (400 мл), а затем МеОАс (40 мл). После охлаждения смеси при температуре ниже 3°С, к раствору исходного вещества при температуре ниже 3°С в течение 90 мин по каплям добавляли полученный выше раствор, содержащий K3PO4. Смесь вливали в холодную смесь EtOAc/вода=1/1 (об./об.) (800 мл) с получением двухфазной смеси. Органический слой разделяли, и экстрагировали водный слой EtOAc (200 мл). Объединенный органический слой промывали 5 масс. % водн. NaCl. Разделенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на нейтральном силикагеле (600 г, элюент: 0%, 9%, 11%, затем 14% EtOAc в н-гептане). Собранные фракции концентрировали с получением целевого продукта (23,36 г, 42,9 ммоль) в виде бесцветного масла. Затем, неразделимые фракции объединяли, и удаляли растворитель в условиях пониженного давления. Остаток повторно очищали методом колоночной хроматографии на нейтральном силикагеле (300 г, элюент: 0%, 9%, 11%, затем 14% EtOAc в н-гептане). Собранные фракции концентрировали с получением целевого продукта (9,90 г, 18,17 ммоль) в виде бесцветного масла. Оба целевых соединения объединяли с получением целевого продукта (33,26 г, 61,04 ммоль, 82%).
[00881] Целевой продукт (6,13 г, 11,25 ммоль) добавляли к МеОН (50 мл), и подвергали смесь азеотропной перегонке в условиях пониженного давления при 40°С. Полученное в остатке твердое вещество добавляли к МеОН (36,8 мл), и нагревали взвесь до 50°С. После того, как взвесь становилась прозрачным раствором, раствор охлаждали до 35°С и добавляли затравочный кристалл. После того, как смесь становилась мутной, ее перемешивали при комнатной температуре в течение 30 мин, а затем добавляли к смеси воду (7,4 мл). После перемешивания при комнатной температуре в течение 3 ч, сформированный кристалл собирали путем аспирации и промывали холодной смесью МеОН/вода = 5/1 (об./об.) (40 мл). Кристалл сушили при 40°С в условиях пониженного давления в течение 2 ч с получением целевого продукта (5,48 г, 10,06 ммоль, 89%). 1Н-ЯМР (500 МГц, CDCl3) δ: 4,30 (1Н, ддд, J=8,0, 3,5, 3,5 Гц), 4,13 (1Н, дд, J=12,5, 5,5 Гц), 4,09 (1Н, дд, J=12,5, 3,0 Гц) 3,87 (1Н, ддд, J=9,0. 9,0, 3,0 Гц), 3,79 (1Н, ддд, J=7,5, 4,5, 4,5 Гц), 3,70 (3Н, с), 3,60 (1Н, ддд, J=5,5, 3,5, 3,5 Гц), 3,34 (1Н, дд, J=8,0, 5,0 Гц), 3,30 (1Н, дд, J=10,0, 8,5 Гц), 2,71 (1Н, дд, J=14,5, 3,0 Гц), 2,41 (1Н, дд, J=14,5, 10,0 Гц), 2,11 (1Н, ддд, J=13,5, 8,0, 8,0 Гц), 1,98 (1Н, ддд, J=13,5, 4,5, 4,5 Гц), 1,77-1,85 (1Н, м), 1,10 (3Н, д, J=6,5 Гц), 1,06 (9Н, с), 1,02 (9Н, с), 0,90 (9Н, с), 0,09 (3Н, с), 0,06 (3Н, с).

[00882] Исходное вещество (12 г, 22,02 ммоль) дважды подвергали азеотропной перегонке с толуолом (36 мл), и добавляли к остатку толуол (240 мл). После охлаждения смеси при температуре ниже -70°С, к смеси при -73~-71°С в атмосфере N2 добавляли раствор DIBAL (26,4 мл, 1M в толуоле, 26,43 ммоль). После перемешивания в течение 32 мин, реакционную смесь гасили добавлением ацетона (12 мл) при -75~-74°С. Затем, смесь нагревали до -30°С, и добавляли 30 масс. % водн. сегнетову соль (180 мл) при -29~4°С. Смесь перемешивали в течение 3 ч при комнатной температуре с получением двухфазной смеси. Органический слой разделяли и промывали 5 масс. % водн. NaCl. Разделенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением неочищенного альдегида (14,18 г), 100% которого использовали в следующей реакции без дополнительной очистки.
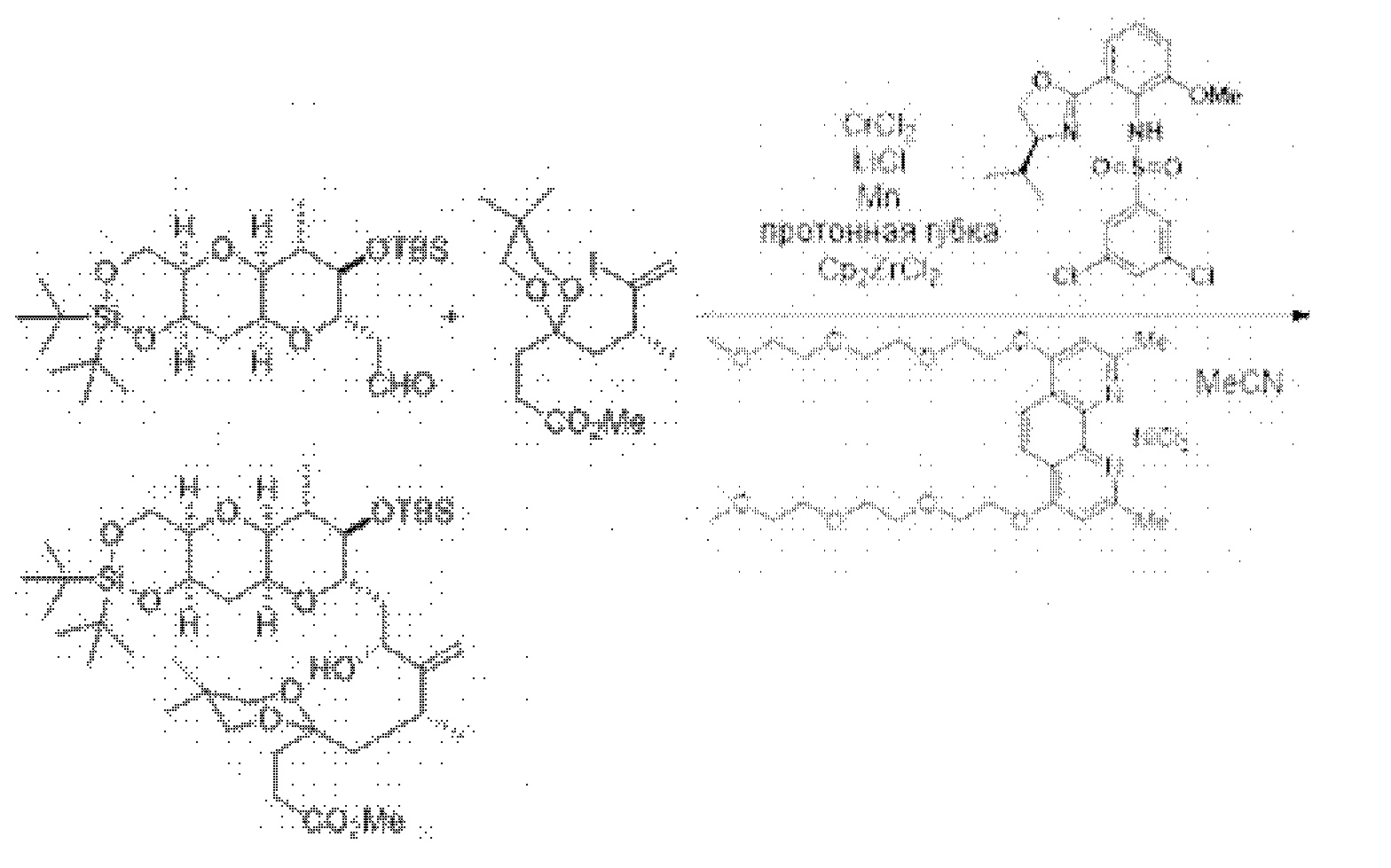
[00883] В перчаточной камере в хорошо высушенную круглодонную колбу добавляли CrCl2 (541 мг, 4,41 ммоль), протонную губку (1,04 г, 4,85 ммоль), сульфонамидный лиганд (2,15 г, 4,85 ммоль). После извлечения колбы из перчаточной камеры в атмосфере N2 добавляли безводный MeCN (90,7 мл). Смесь перемешивали при комнатной температуре до использования.
[00884] В другой колбе к альдегиду (11,34 г, 22,03 ммоль) и винилйодиду (10,47 г, 26,43 ммоль) добавляли толуол. После азеотропного удаления толуола (дважды), к оставшимся смесям добавляли Mn (4,84 г, 88,10 ммоль), LiCl (1,87 г, 44,05 ммоль) и Cp2ZrCl2 (7,08 г, 24,23 ммоль), а затем продували колбу N2. В эту колбу добавляли полученный выше раствор Cr. После нагревания смеси до 40°С, добавляли раствор Ni-катализатора (730 мкл (полученного заранее в виде 100 мг/мл в MeCN), 0,11 ммоль). В процессе энергичного перемешивания в течение 19 ч при 40°С, дополнительно 6 раз добавляли Ni-катализатор (Y. Kishi et.al, Journal of the American Chemical Society (2015), 137(19), 6219-6225) (365 мкл, 0,06 ммоль) для завершения реакции. Смесь добавляли к iPrOAc (120 мл), а затем при 40°С добавляли 5 масс. % NaHCO3 и 5 масс. % водный раствор D,L-серина (120 мл). После перемешивания в течение 4 ч при 40°С, смесь охлаждали до комнатной температуры и пропускали через Celite (25 г) с промыванием iPrOAc (600 мл) с получением двухфазной смеси. Органический слой разделяли, и промывали органический слой 5 масс. % водн. NaHCO3, водой и 5% водн. NaCl. Разделенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением неочищенного целевого продукта (25,26 г), 100% которого использовали в следующей реакции без дополнительной очистки.
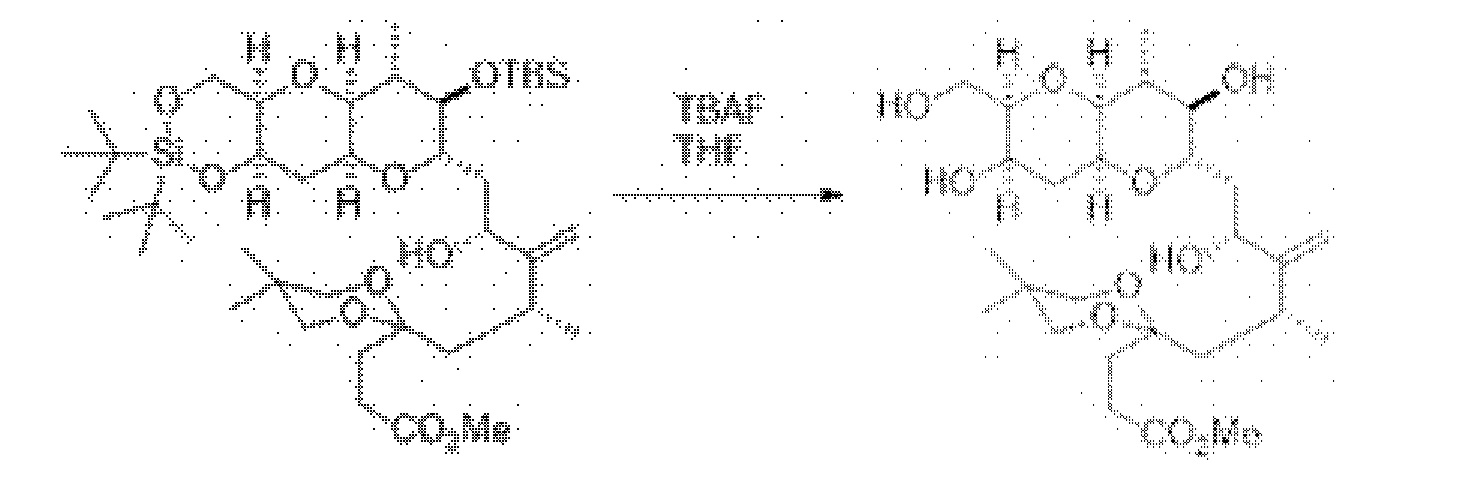
[00885] К перемешанному раствору исходного вещества (17,3 г, 22,03 ммоль) в THF (52 мл) при 0°С добавляли TBAF (88 мл, 1Mb THF, 88,13 ммоль). После перемешивания в течение 15 ч при комнатной температуре, к смеси добавляли EtOAc (180 мл), а затем 10 масс. % водн. NH4Cl (180 мл) с получением двухфазной смеси. Органический слой разделяли, и дважды экстрагировали водный слой EtOAc (180 мл). Объединенный органический слой промывали насыщенным водн. NaCl. Разделенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на NH-силикагеле (120 г, элюент: 0%, 20%, 50%, 100% EtOAc в н-гептане, а затем 5% МеОН в EtOAc). Собранные фракции концентрировали с получением целевого продукта (17,46 г, включая примеси), 100% которого использовали в следующей реакции без дополнительной очистки.
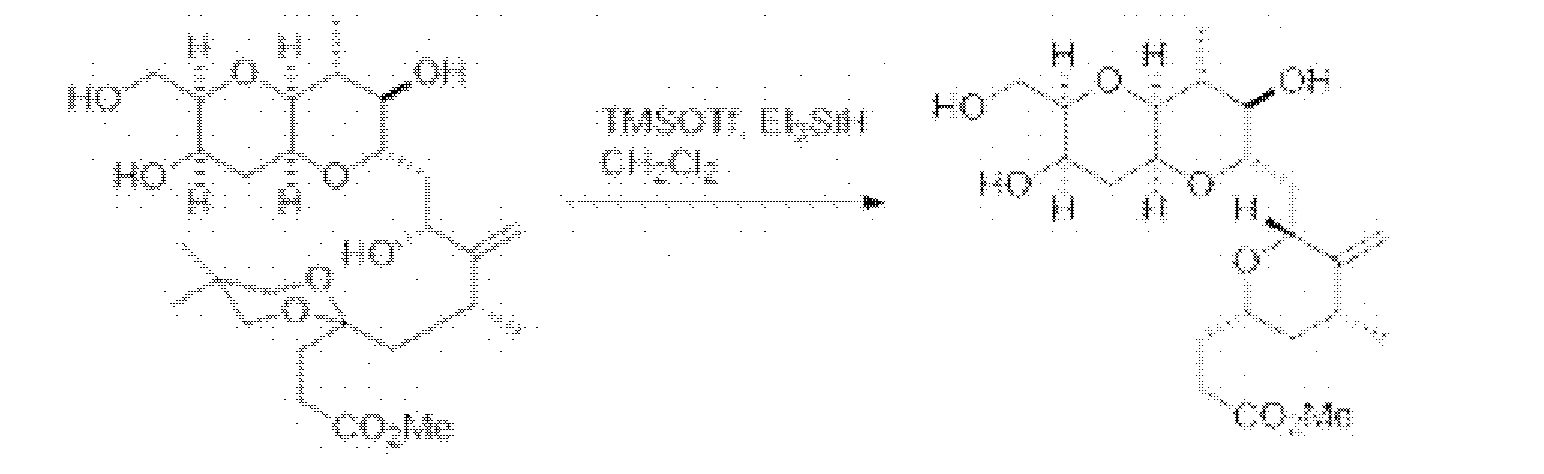
[00886] Исходное вещество (11,69 г, 22,03 ммоль) дважды подвергали азеотропной перегонке с толуолом (35 мл), и добавляли к остатку CH2Cl2 (117 мл), а затем Et3SiH (17,6 мл, 110,14 ммоль) при к.т. После охлаждения смеси при температуре ниже -70°С, к смеси при -72~-70°С в атмосфере N2 добавляли TMSOTf (16,0 мл, 88,11 ммоль). После перемешивания в течение 30 мин, реакционную смесь нагревали до 0°С. После перемешивания в течение 27 мин при 0°С, реакционную смесь гасили добавлением воды (117 мл) при температуре ниже 14°С, а затем перемешивали смесь при комнатной температуре. После перемешивания в течение 25 мин, добавляли насыщенный водн. NaHCO3 (58 мл), и перемешивали смесь в течение 25 мин при комнатной температуре с получением двухфазной смеси. Органический слой разделяли, и экстрагировали водный слой CH2Cl2 (117 мл). Объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением неочищенного целевого продукта (18,95 г), 100% которого использовали в следующей реакции без дополнительной очистки.
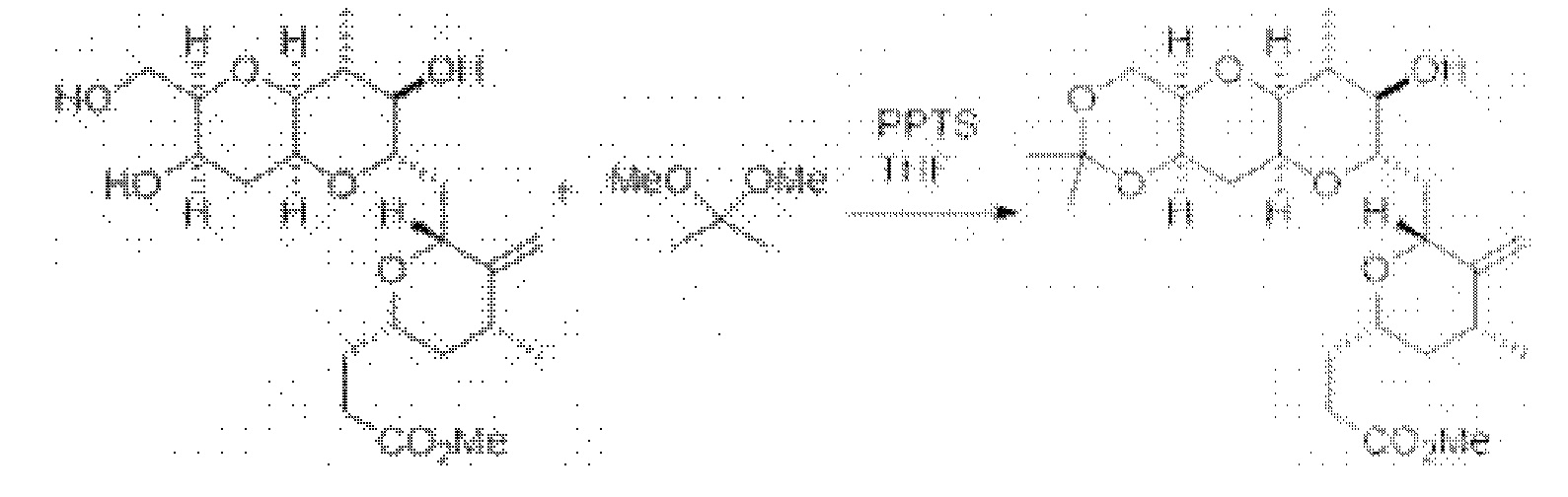
[00887] Исходное вещество (9,44 г, 22,03 ммоль) дважды подвергали азеотропной перегонке с толуолом (30 мл), и добавляли к остатку THF (94 мл), 2,2-диметоксипропан (10,84 мл, 88,13 ммоль) и PPTS (277 мг, 1,10 ммоль) при комнатной температуре. После перемешивания при 40°С в атмосфере N2 в течение 4,5 ч, реакционную смесь охлаждали до комнатной температуры, а затем разбавляли реакционную смесь EtOAc (100 мл), а затем насыщенным водн. NaHCO3 (100 мл). После перемешивания в течение 15 мин, получали двухфазную смесь. Органический слой разделяли, и экстрагировали водный слой EtOAc (100 мл). Объединенный органический слой промывали насыщенным водн. NaCl. Разделенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением неочищенного целевого продукта (18,95 г)
[00888] Неочищенный целевой продукт (18,95 г) очищали методом хроматографии на ODS-колонке на YMC-GEL (100 г, элюент: 3%, 40% MeCN в воде). Собранные фракции экстрагировали CH2Cl2 (500 мл + 250 мл), объединенный органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления с получением целевого продукта (12,00 г, включая примеси).
[00889] Неочищенный целевой продукт (12,00 г) очищали методом колоночной хроматографии на нейтральном силикагеле (150 г, элюент: 0%, 20%, 33%, 50%, и 66% EtOAc в н-гептане). Собранные фракции концентрировали с получением неочищенного целевого продукта (4,56 г, включая примеси).
[00890] Неочищенный целевой продукт (4,56 г) добавляли к смеси н-гексан/EtOAc = 9/1 (об./об.) (45 мл), и нагревали взвесь до 60°С. После того, как взвесь становилась прозрачным раствором, раствор охлаждали до 45°С и добавляли затравочный кристалл. После того, как смесь становилась мутной, ее перемешивали при комнатной температуре в течение 50 мин, а затем перемешивали смесь при 0°С в течение 65 мин, а затем при -10°С в течение 17,5 ч. Сформированный кристалл собирали путем аспирации и промывали холодным н-гексаном (13,5 мл). Кристалл сушили при 40°С в условиях пониженного давления с получением целевого продукта (3,57 г, 7,62 ммоль, 35% после 5 стадий). 1H-ЯМР (500 МГц, CDCl3) δ: 4,88 (1Н, с), 4,82 (1H, д, J=2,0 Гц), 4,18 (1Н, кв, J=5,5 Гц), 4,03 (1Н, дд, J=12,5, 3,0 Гц), 4,00-3,95 (2Н, м), 3,88 (1Н, дд, 3=6,0, 4,0 Гц), 3,86 (1Н, дд, J=12,0, 2,5 Гц), 3,67 (3Н, с), 3,64-3,57 (1Н, м), 3,55 (1Н, д, J=8,5 Гц), 3,42 (1Н, т, J=3,0 Гц), 3,36 (1Н, дт, J=8,0, 5,5 Гц), 3,26 (1Н, кв, J=2,5 Гц), 2,54-2,40 (2Н, м), 2,33-2,23 (1Н, м), 2,19-2,11 (2Н, м), 2,10-2,00 (2Н, м), 1,86-1,68 (4Н, м), 1,44 (3Н, с), 1,43 (3Н, с), 1,16 (3Н, д, J=8,0 Гц), 1,15-1,09 (1Н, м), 1,08 (3Н, д, J=6,0 Гц).
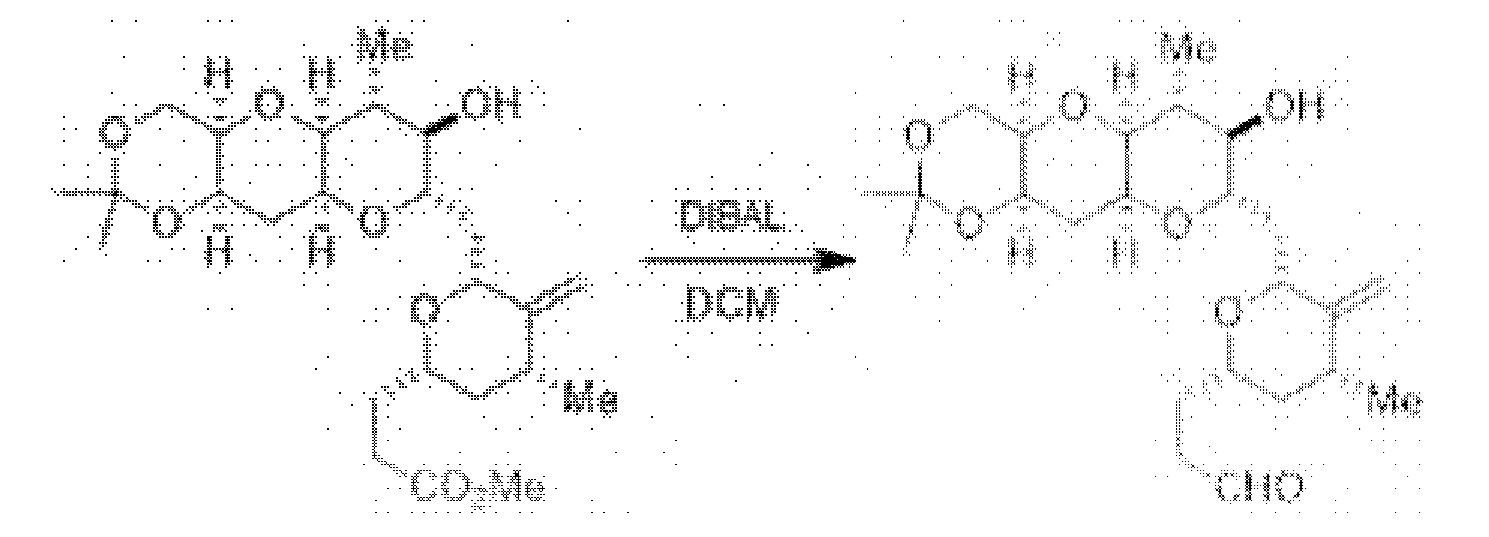
[00891] К перемешанному раствору исходного вещества (52,0 г, 0,11 моль) в дихлорметане (1,04 л) при -74,3~-71,5°С в атмосфере N2 добавляли раствор DIBAL (253 мл, 1M в толуоле, 0,255 моль). После перемешивания в течение 76 мин, реакционную смесь гасили добавлением ацетона (24,5 мл) при -75,2~-73,8°С. После перемешивания дополнительно в течение 9 мин, к реакционной смеси при -74,2~-73,5°С добавляли МеОН (27,0 мл), а затем добавляли ВНТ (52,0 мг). Затем, смесь нагревали до -20°С и добавляли к 40 масс. % водн. сегнетовой соли (1,04 кг), а затем добавляли к смеси EtOAc (936 мл). Смесь перемешивали в течение 85 мин при комнатной температуре с получением двухфазной смеси. Органический слой разделяли и повторно экстрагировали EtOAc (520 мл). Объединенный органический слой промывали 20 масс. % водн. NaCl (520 г). После добавления ВНТ (52,0 мг), органический слой концентрировали и подвергали азеотропной перегонке с толуолом (208 мл) и MeCN (156 мл) в условиях пониженного давления с получением неочищенного альдегида, который использовали на следующей стадии без дополнительной очистки (предположительный выход 90%, 0,1 моль).
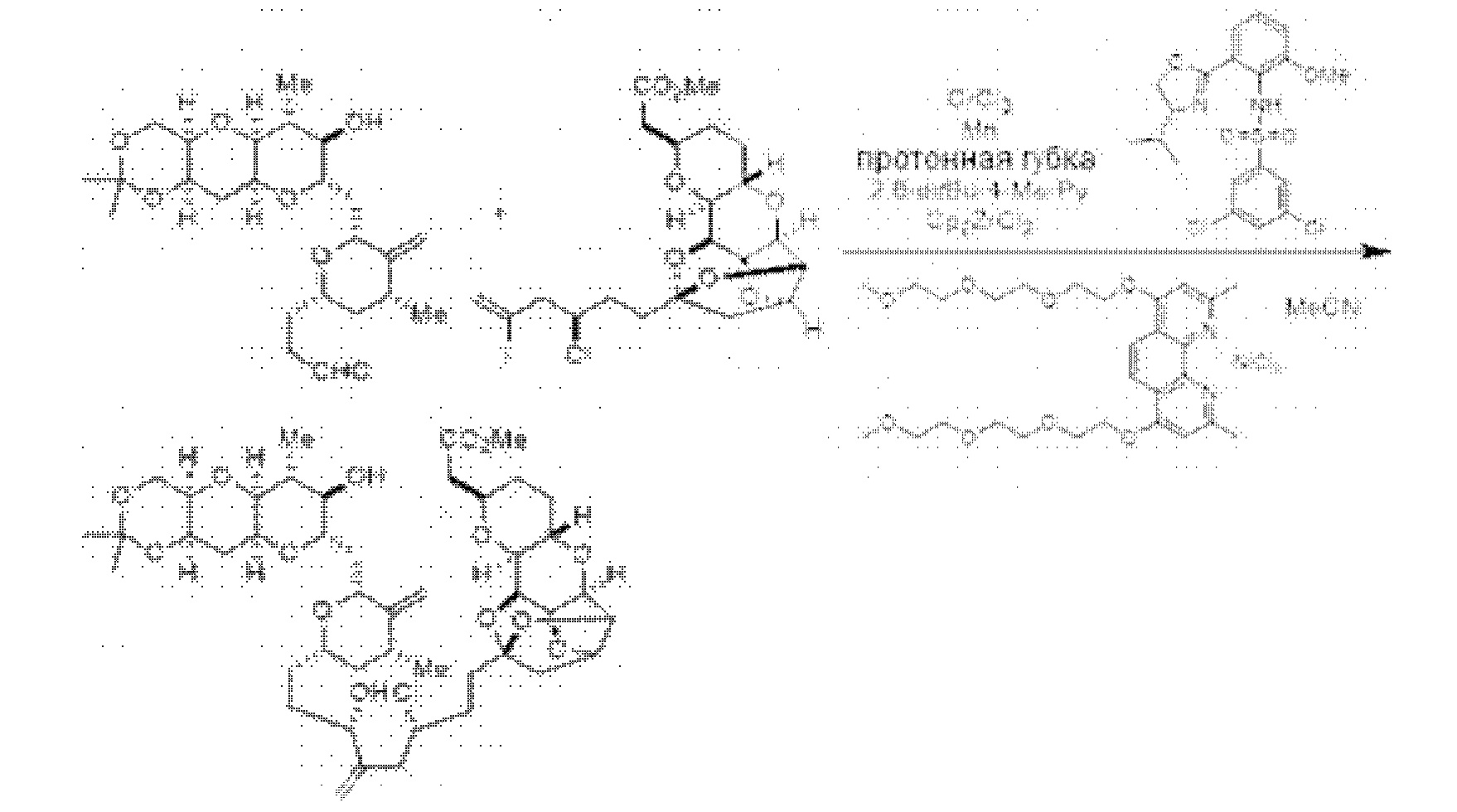
[00892] В реактор загружали CrCl3 (3,16 г, 20 ммоль), протонную губку (4,71 г, 22 ммоль), сульфонамидный лиганд (9,74 г, 22 ммоль), Mn (11,0 г, 200 ммоль) и Cp2ZrCl2 (75,9 г, 260 ммоль), затем продували реактор аргоном. В реактор добавляли безводный MeCN (263 мл), и перемешивали в течение 70 мин при 30°С. К реакционной смеси добавляли Ni-комплекс (662 мг, 1,0 ммоль) в безводном MeCN (6,6 мл). Затем, добавляли смесь альдегида (43,8 г, 100 ммоль), винилйодида (63,2 г, 114 ммоль) и 2,6-ди-трет-бутил-2-метилпиридина (41,0 г, 200 ммоль) в безводном MeCN (131 мл), которые заранее подвергали азеотропной перегонке с MeCN (219 мл). После добавления субстратов, дважды добавляли Ni-комплекс (661 мг, 1,0 ммоль) в безводном MeCN (6,57 мл) для завершения реакции. К реакционной смеси добавляли толуол (876 мл), затем охлаждали до 0°С. К смеси приблизительно при 14°С в течение 20 мин добавляли воду (788 мл) и 20 масс. % водн. лимонную кислоту (87,5 г). После удаления водного слоя, органический слой пропускали через Hyflo Supercel (35,0 г), а затем промывали толуолом (876 мл). Объединенный органический слой промывали 33% водн. MeCN (876 мл), азатем смешанным раствором 5 масс. % водн. NaHCO3 - 10 масс. % водн. Na2SO4 (438 г). Органический слой концентрировали в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (1900 г, элюент: 10%, 25%, 50%, 67%, затем 100% EtOAc в н-гептане). Собранные фракции концентрировали с получением целевого продукта (79,4 г, 92 ммоль, 82% после 2 стадий), 1Н-ЯМР (500 МГц, CDCl3) δ: 5,16 (1Н, с), 4,97 (1Н, с), 4,87 (1Н, с), 4,82 (1Н, с), 4,70 (1Н, т, J=4,7 Гц), 4,63 (1Н, т, J=4,5 Гц), 4,43 (1Н, д, J=l,8 Гц), 4,18-4,33 (4Н, м), 3,93-4,10 (5Н, м), 3,78-3,92 (3Н, м), 3,68 (3Н, с), 3,59 (1Н, д, J=3,0 Гц), 3,19-3,48 (3Н, м), 2,85-2,98 (2Н, м), 2,56-2,71 (2Н, м), 2,48 (1Н, дд, 15,1, 6,0 Гц), 2,41 (1Н, дд, J=15,6, 5,8 Гц), 1,93-2,33 (11Н, м), 1,51-1,92 (10Н, м), 1,36-1,50 (8Н, м), 1,14 (3Н, д, J=7,5 Гц), 1,08 (3Н, д, J=6,3 Гц).
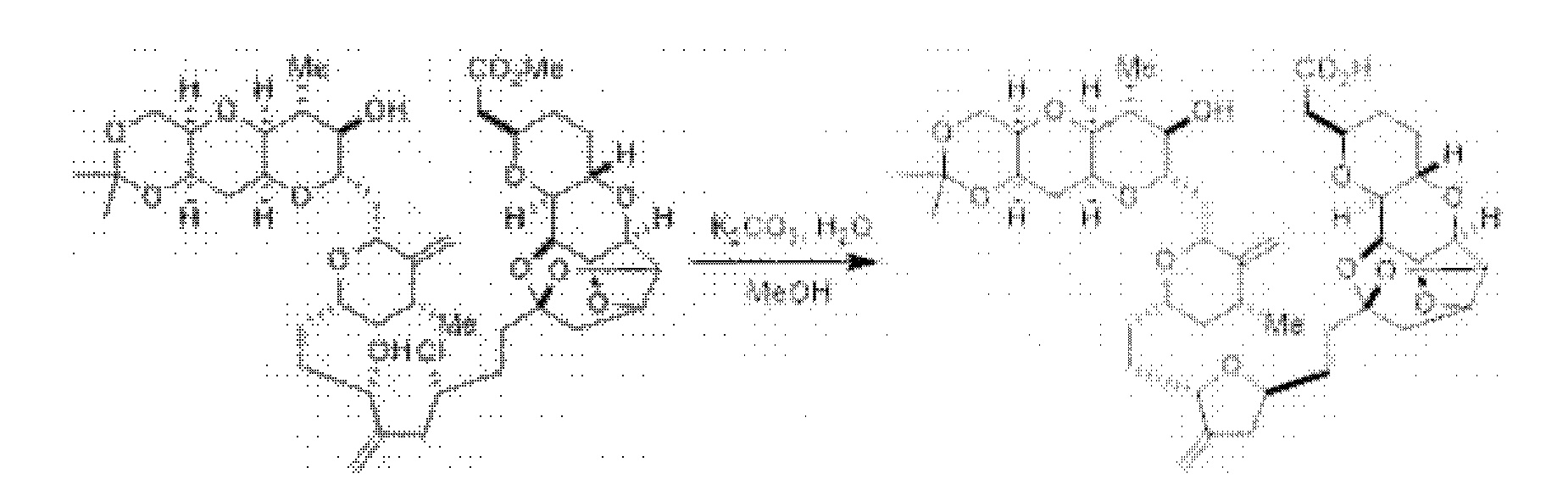
[00893] К перемешанному раствору исходного вещества (79,3 г, 91,4 ммоль) в МеОН (793 мл) при комнатной температуре в атмосфере N2 добавляли K2CO3 (63,2 г, 0,457 моль). После нагревания до 55°С, смесь перемешивали в течение 3 ч, а затем при той же температуре добавляли воду (24,7 мл, 1,37 моль). После перемешивания в течение 20 ч, реакционную смесь охлаждали до комнатной температуры, а затем добавляли толуол (1,59 л) и воду (1,59 л). Водный слой дважды промывали толуолом (1,59 л). К полученному водному слою добавляли дихлорметан (1,59 л) и 25 масс. % водн. NH4Cl (2,38 кг). После разделения двух слоев, водный слой повторно экстрагировали дихлорметаном (2,38 л). Объединенный органический слой концентрировали и подвергали азеотропной перегонке с толуолом (397 мл) с получением неочищенной секо-кислоты, которую использовали на следующей стадии без дополнительной очистки.
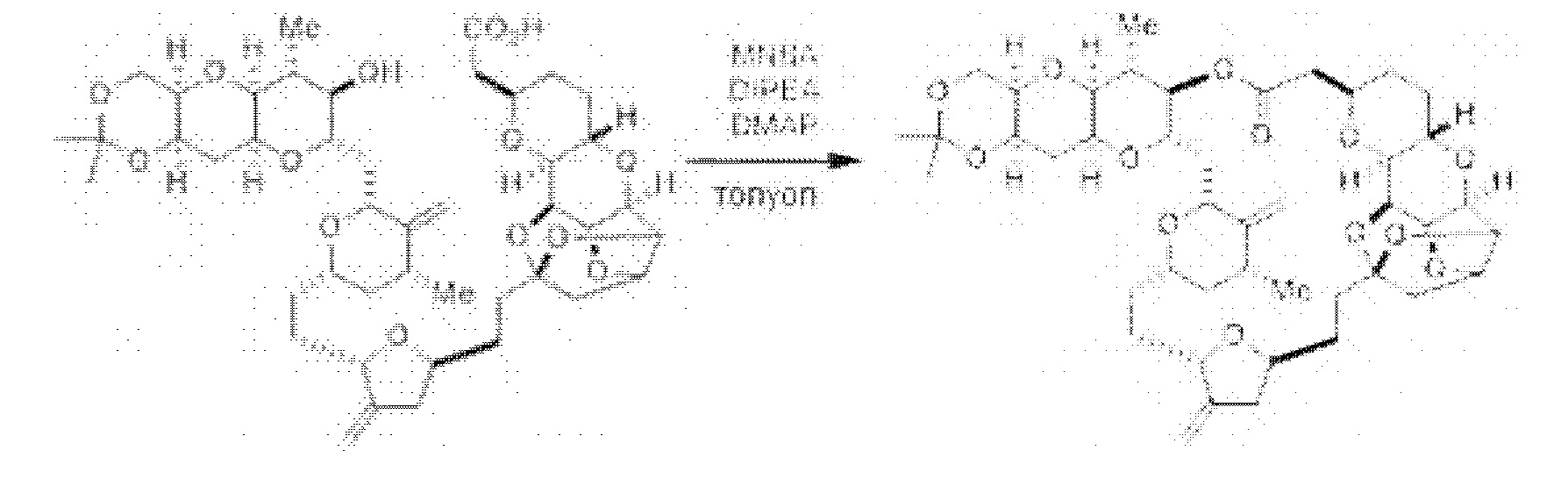
[00894] К перемешанному раствору N,N-диметиламинопиридина (DMAP, 67,0 г, 549 ммоль) в толуоле (5,60 л) при 25°С в атмосфере N2 добавляли N,N-диизопропил-этиламин (DIPEA, 95,6 мл, 549 ммоль) и 2-метил-6-нитробензойный ангидрид (MNBA, 94,4 г, 274 ммоль), а затем нагревали до 80°С. К смеси в течение 6 ч по каплям добавляли исходное вещество (74,7 г, 91,4 ммоль) в толуоле (1,49 л). После охлаждения до 25°С смесь дважды промывали 50 об. % водн. DMF (1,49 л). Вторые 50% DMF водного слоя повторно экстрагировали толуолом (500 мл). Объединенный органический слой дважды промывали 20 масс. % водн. NH4Cl (1,49 кг), каждый водный слой повторно экстрагировали EtOAc (750 мл). Объединенный органический слой промывали 20 масс. % водн. NaCl (374 г) и повторно экстрагировали EtOAc (750 мл). Объединенный органический слой концентрировали и подвергали азеотропной перегонке с MeCN (200 мл). Остаток растворяли в дихлорметане (448 мл) и концентрировали. Полученный сильно концентрированный раствор в дихлорметане добавляли к MeCN (1,05 л) при 0°С в атмосфере N2. Полученный осадок фильтровали и промывали MeCN (224 мл), а затем сушили при 40°С с получением целевого макролактона (41,5 г, 51,9 ммоль, 56,8% после 2 стадий).
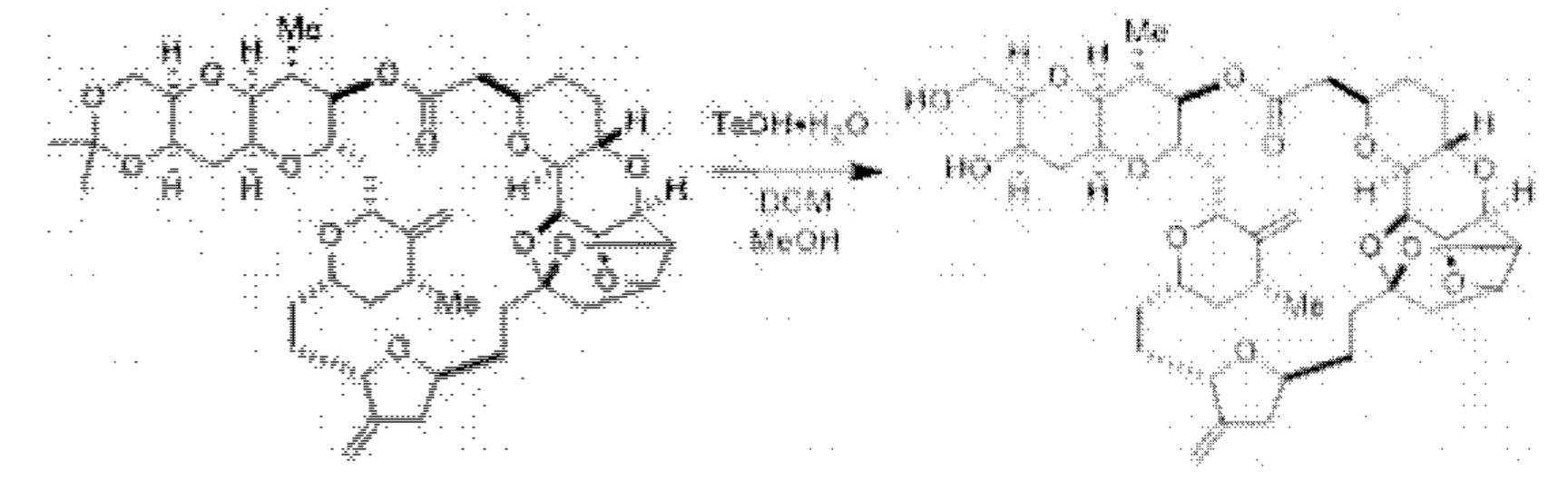
[00895] К перемешанному раствору исходного вещества (40,5 г, 50,7 ммоль) в дихлорметане (312 мл) и МеОН (579 мл) при 25°С в атмосфере N2 добавляли моногидрат пара-толуолсульфоновой кислоты (194 мг, 1,01 ммоль) в течение 4 ч. Реакционную смесь пропускали через NH-силикагель (40,5 г), а затем промывали смесь дихлорметаном (1,01 л) и МеОН (1,01 л). Объединенный фильтрат концентрировали и дважды подвергали азеотропной перегонке с толуолом (81 мл) с получением целевого диола, который использовали на следующей стадии без дополнительной очистки.
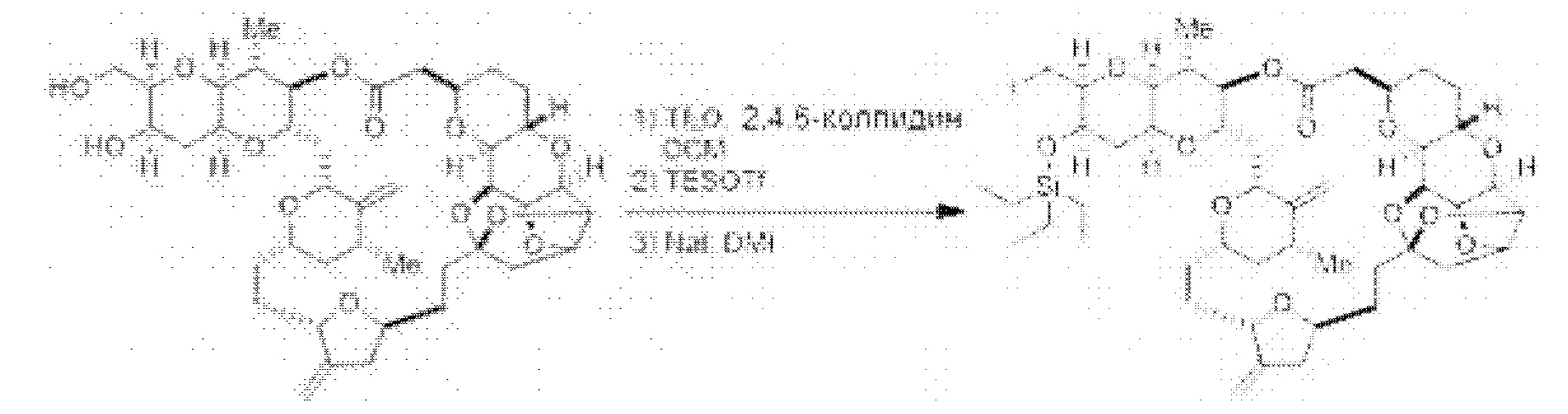
[00896] К раствору исходного вещества (238 мг, 0,313 ммоль) и 2,4,6-коллидина (207 мкл, 1,57 ммоль) в безводном дихлорметане (2,38 мл) при -78°С в атмосфере N2 добавляли трифторметансульфоновый ангидрид (Tf2O, 73,7 мкл, 0,438 ммоль). После перемешивания в течение 10 мин, к реакционной смеси добавляли триэтилсилил-трифторметансульфонат (TESOTf, 99 мкл, 0,438 ммоль), а затем нагревали до -40°С. После перемешивания в течение 70 мин, добавляли NaI (235 мг, 1,57 ммоль) и 1,3-диметил-2-имидазолидинон (DMI, 4,75 мл), а затем нагревали до комнатной температуры. После перемешивания в течение 4 ч, к реакционной смеси добавляли толуол (7,13 мл) и холодную воду (4,75 мл). После разделения водного слоя, органический слой промывали водой (4,75 мл), 5 масс. % водн. лимонной кислотой (2,38 мл), а затем смешанным 5 масс. % водн. NaHCO3 - 10 масс. % водн. Na2SO4 раствором (1,19 мл). Органический слой концентрировали в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (6 г, элюент: 10%, 20%, затем 30% EtOAc в н-гептане). Собранные фракции концентрировали.
Остаток при 0°С кристаллизовали из дихлорметана (0,24 мл) и 1-пропанола (4,75 мл). Полученный осадок фильтровали и промывали 1-пропанолом с получением целевого йодида (250 мг, 0,254 ммоль).
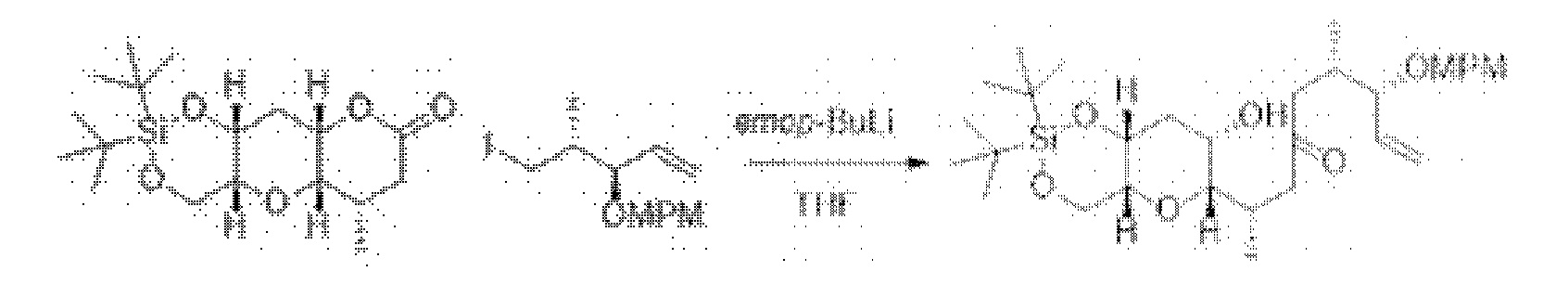
[00897] К смеси лактона (55 г, 154 ммоль) и йодида (58,75 г, 170 ммоль) добавляли THF (550 мл), и охлаждали реакционную смесь на бане с сухим льдом в EtOH. При -73,2~-58,5°С в течение 33 мин постепенно добавляли фтор-BuLi (1,03 М раствор в циклогексане, 315 мл, 324 ммоль) и перемешивали в течение 30 мин. После добавления нас. NH4Cl (550 мл) при -74,2~-11,2°С в течение 3 мин, баню с сухим льдом удаляли. Реакционную смесь разбавляли AcOEt (550 мл) и водой (220 мл) и перемешивали на водяной бане в течение 40 мин. Полученные слои разделяли, органический слой промывали нас. NaCl (165 мл), и концентрировали разделенный органический слой в условиях вакуума. Остаток подвергали азеотропной перегонке с н-гептаном (110 мл × 3). Остаток очищали методом колоночной хроматографии на нейтральном силикагеле (1,1 кг, элюент: 0%, 5%, 10%, 15%, затем 25% EtOAc в н-гептане) с получением целевого соединения (71,82 г, 125 ммоль, 81%).
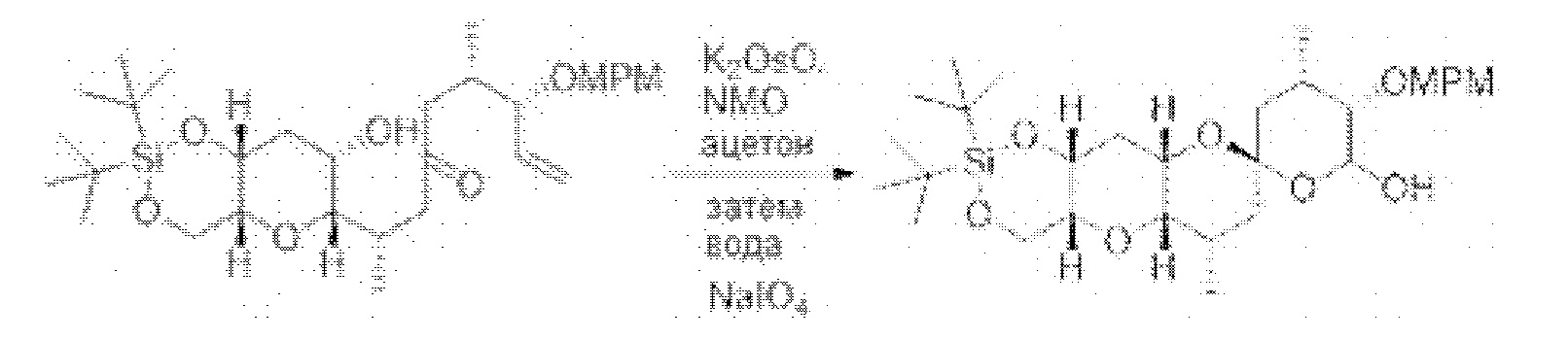
[00898] К раствору исходного вещества (71,72 г, 124 ммоль) в ацетоне (215 мл) и воде (29 мл) при комнатной температуре добавляли NMO (29,1 г, 249 ммоль) и K2OsO4⋅2H2O (содержание ~50%, 0,182 г, 0,247 ммоль), и перемешивали в течение 24,5 ч. Реакционную смесь перемешивали на водяной бане и разбавляли ацетоном (143 мл) и водой (103 мл), затем добавляли NaIO4 (53,2 т, 249 ммоль) и воду (40 мл для промывки) и перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь разбавляли AcOEt (215 мл), н-гептаном (215 мл) и водой (430 мл). Полученное нерастворимое вещество удаляли декантированием, а затем путем фильтрования через комок ваты. Фильтрат разделяли и водный слой экстрагировали смесью н-гептан/AcOEt = 1/1 (об./об.) (286 мл). Объединенный органический слой дважды промывали нас. Na2S2O3 (215 мл), промывали нас. NaCl (143 мл) и концентрировали в условиях вакуума. Остаток пропускали через слой нейтрального силикагеля (143 г, элюент: 66% EtOAc в н-гептане) с получением целевого соединения (71,3 г, 123 ммоль, 99%).
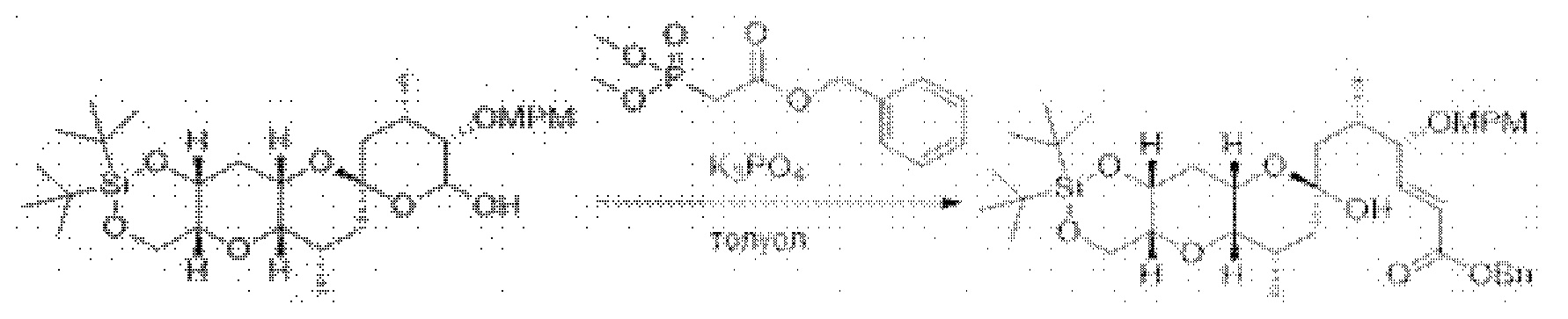
[00899] К смеси исходного вещества (71,23 г, 123 ммоль) и K3PO4 (78,4 г, 369 ммоль) в толуоле (214 мл) добавляли диметил(бензилоксикарбонил)метилфосфонат (127,1 г, 492 ммоль). Реакционную смесь продували N2 (баллон) и перемешивали при 30°С в течение 48 ч. Дополнительно добавляли K3PO4 (26,13 г, 123 ммоль) и диметил(бензилоксикарбонил)метилфосфонат (26,1 мл, 123 ммоль), и перемешивали при 30°С в течение 26 ч. Реакционную смесь охлаждали на водяной бане, разбавляли МТВЕ (712 мл) и гасили добавлением нас. NH4Cl (50 мл) при 21~36°С. Реакционную смесь охлаждали на бане со льдом в воде, и последовательно добавляли нас. NH4Cl (662 мл) и воду (214 мл). Полученные слои разделяли, и экстрагировали водный слой МТВЕ (712 мл). Объединенный органический слой промывали нас. NaCl (356 мл) и концентрировали в условиях вакуума. Остаток подвергали азеотропной перегонке с толуолом (178 мл). Остаток очищали методом колоночной хроматографии на нейтральном силикагеле (1,1 кг, элюент: 0%, 8%, 15%, затем 25% EtOAc в н-гептане) с получением целевого соединения (72,63 г, 102 ммоль, 83%, смесь E/Z изомеров), 1Н-ЯМР (500 МГц, CDCl3) δ: 7,30-7,44 (5Н, м), 7,23 (2Н, д, J=8,6 Гц), 6,84-6,92 (3Н, м), 6,06 (1Н, дд, J=15,9, 1,2 Гц), 5,18-5,24 (2Н, м), 4,50 (1Н, д, J=11,6 Гц), 4,39 (1Н, т, J=2,8 Гц), 4,27 (1Н, д, J=11 Гц), 4,18-4,24 (1Н, м), 4,10-4,16 (1Н, м), 3,81 (3Н, с), 3,72-3,79 (2Н, м), 3,60 (1Н, д, J=10,4 Гц), 3,26 (1Н, м), 3,01-3,06 (1Н, м), 2,73 (1Н, дд, J=15,0, 4,6 Гц), 2,44-2,59 (2Н, м), 2,21-2,39 (4Н, м), 1,72 (1Н, дт, J=14,7, 3,1 Гц), 1,05 (18Н, с), 0,91 (6Н, дд, J=14,7, 6,7 Гц).
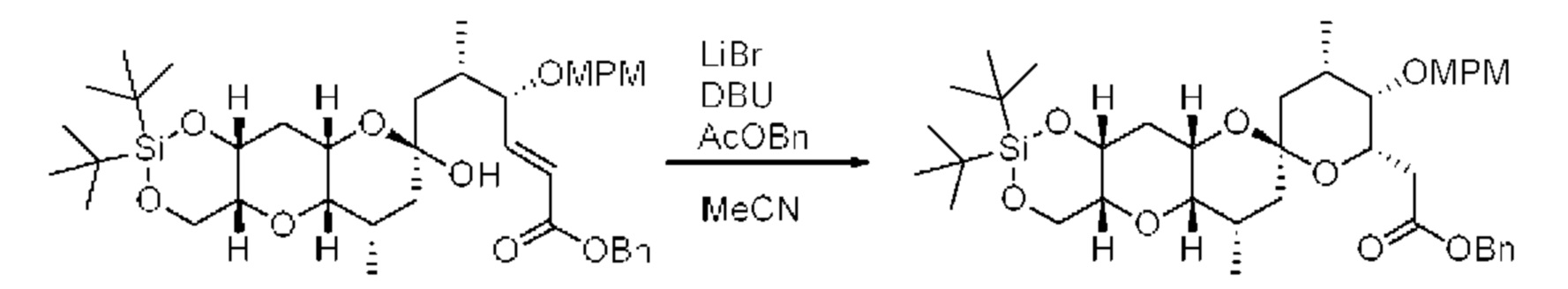
[00900] Раствор исходного вещества (72,5 г, 102 ммоль) и AcOBn (72,9 мл, 510 ммоль) в MeCN (1087 мл) охлаждали на бане со льдом в воде. При 10,1~16,5°С в течение 3 мин добавляли LiBr (88,5 г, 1019 ммоль), и при 11,8~15,4°С добавляли DBU (76,1 мл, 510 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Затем, реакционную смесь перемешивали при 30°С в течение 23 ч. Реакционную смесь охлаждали на бане со льдом в воде, разбавляли МТВЕ (362 мл) и гасили при 7,4~13,7°С добавлением нас. NH4Cl (362 мл) и воды (145 мл). Полученные слои разделяли, органический слой промывали нас.NaCl (254 мл) и сушили над безводным Na2SO4. После фильтрования, фильтрат концентрировали в условиях вакуума. Остаток очищали методом колоночной хроматографии на нейтральном силикагеле (1,1 кг, элюент: 0%, 3%, 10%, 20%, затем 35% МТВЕ в н-гептане) с получением целевого соединения (64,07 г, 90 ммоль, 88%). 1Н-ЯМР (500 МГц, CDCl3) δ: 7,31-7,40 (5Н, м), 7,23-7,27 (2Н, м), 6,86 (2Н, д, J=8,6 Гц), 5,01-5,18 (2Н, м), 4,41-4,57 (2Н, м), 4,24-4,33 (1Н, м), 4,16-4,22 (2Н, м), 4,08 (1Н, ддд, J=9,3, 4,7, 1,2 Гц), 3,80 (3Н, с), 3,51-3,54 (1Н, м), 3,25 (1Н, ушир. с), 3,15-3,20 (1Н, м), 2,97 (1Н, д, J=2,5 Гц), 2,72 (1Н, дд, J=15,6, 9,5 Гц), 2,28-2,42 (2Н, м), 2,07 (1Н, дт, J=15,3, 1,8 Гц), 1,87-2,00 (1Н, м), 1,69 (1Н, дт, J=15,3, 4,6 Гц), 1,45-1,58 (3Н, м), 1,36-1,42 (1Н, м), 1,05 (9Н, с), 1,03 (9Н, с), 0,95 (3Н, д, J=6,7 Гц), 0,89 (3Н, д, J=6,7 Гц).
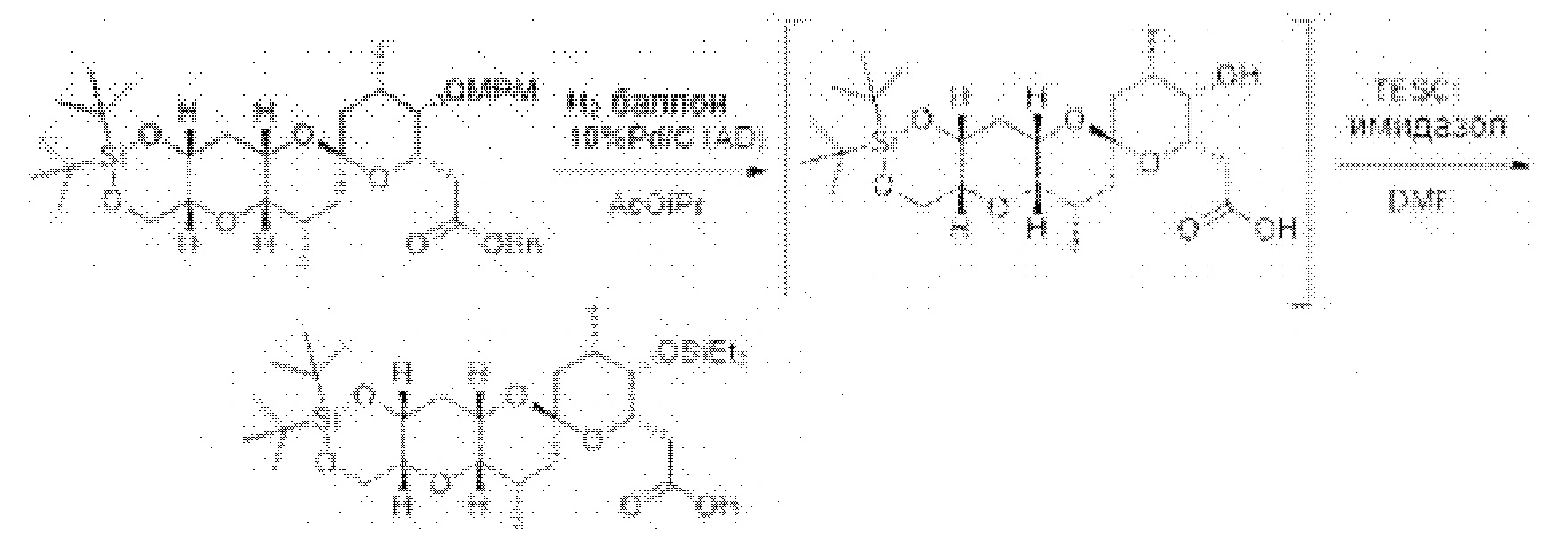
[00901] Исходное вещество (64 г, 90 ммоль) растворяли в iPrOAc (1280 мл) и продували N2 (баллон). Добавляли 10% Pd/C (AD, Kawaken Fine Chemicals, 6,4 г), продували H2 (баллон) и перемешивали при комнатной температуре в течение 24 ч. Катализатор фильтровали через Hyflo Supercel (64 г) и промывали iPrOAc (1280 мл). Фильтрат концентрировали приблизительно до половины объема. Добавляли iPrOAc (1280 мл), и концентрировали приблизительно до половины объема. Снова добавляли iPrOAc (1280 мл), и концентрировали приблизительно до половины объема. К оставшемуся раствору добавляли DMF (500 мл), и концентрировали в условиях вакуума в течение 1 ч до удаления iPrOAc с получением целевой секо-кислоты в виде раствора в DMF (~500 мл). Этот раствор секо-кислоты (по расчетам 90 ммоль) разбавляли DMF (140 мл), и добавляли имидазол (36,77 г, 540 ммоль). Реакционную смесь охлаждали на бане со льдом в воде, и при 2,1~4,2°С в течение 13 мин медленно добавляли TESCl (45,3 мл, 270 ммоль), а затем перемешивали на водяной бане в течение 80 мин. Реакционную смесь охлаждали на бане со льдом в воде, гасили добавлением нас. NaHCO3 (384 мл) при 4,8~13,8°С в течение 24 мин и перемешивали на водяной бане в течение 1 ч. Реакционную смесь разбавляли н-гептаном (640 мл) и водой (768 мл), и разделяли полученные слои. Органический слой последовательно промывали нас. NH4Cl (384 мл), водой (640 мл), 10% NaCl (384 мл) и концентрировали в условиях вакуума. Остаток очищали методом колоночной хроматографии на нейтральном силикагеле (640 г, элюент: 0%, затем 67% МТВЕ в н-гептане) с получением целевого соединения (61,55 г). К этому соединению добавляли циклопентилметиловый эфир (32 мл) и MeCN (94 мл), и нагревали при 50°С для растворения твердого вещества. К этому раствору в течение 1 ч медленно добавляли MeCN (514 мл). Смесь медленно охлаждали до комнатной температуры и перемешивали в течение 2 ч. После дополнительного перемешивания при 0°С в течение 1 ч, продолжали перемешивание при -20°С в течение 14 ч. Полученную суспензию фильтровали и промывали холодным (~-20°С) MeCN (92 мл). Кристаллические вещества сушили в условиях пониженного давления при 40°С с получением целевого соединения (47,68 г, 78 ммоль, 86%) в виде белого твердого вещества. 1H-ЯМР (500 МГц, CDCl3) δ: 4,13-4,31 (3Н, м), 3,96-4,06 (1Н, м), 3,49-3,65 (2Н, м), 3,12-3,24 (2Н, м), 2,69 (1Н, дд, J=15,8, 10,0 Гц), 2,39 (1Н, дд, J=15,8, 3,7 Гц), 2,20-2,31 (1Н, м), 2,08-2,15 (1Н, м), 1,98-2,07 (1Н, м), 1,81 (1Н, дт, J=15,2, 4,4 Гц), 1,47-1,57 (3Н, м), 1,39-1,45 (1Н, м), 1,03 (9Н, с), 1,02 (9Н, с), 0,94-0,99 (12Н, м), 0,86 (3Н, д, J=6,9 Гц), 0,59-0,66 (6Н, м).
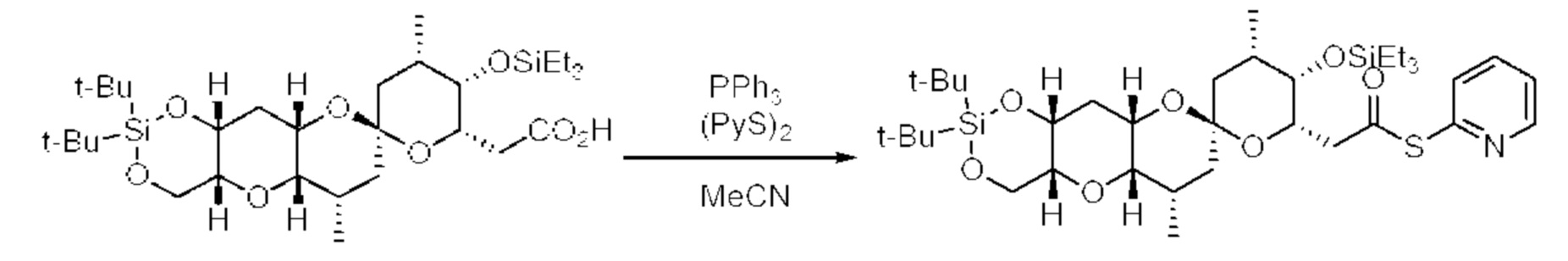
[00902] К раствору исходного вещества (35,1 г, 57,1 ммоль) и трифенилфосфина (35,8 г, 136 ммоль) в безводном ацетонитриле (350 мл) при 0°С (баня) в атмосфере азота добавляли 2,2'-дипиридиддисульфид (15,1 г, 68,5 ммоль). После нагревания до 25°С, смесь перемешивали в течение 17,5 ч, и гасили реакционную смесь добавлением н-гептана (1050 мл) и воды (350 мл) с получением двухфазной смеси. Органический слой разделяли и 5 раз промывали 75 об. % водн. раствором ацетонитрила (351 мл) и один раз насыщенным водным раствором хлорида натрия (175 мл). Затем, органический слой концентрировали досуха. Остаток очищали методом колоночной хроматографии на силикагеле (1900 г, элюент: 0%, 10% этилацетат в н-гептане) с получением целевого соединения (38,6 г, 54,5 ммоль, 96%).
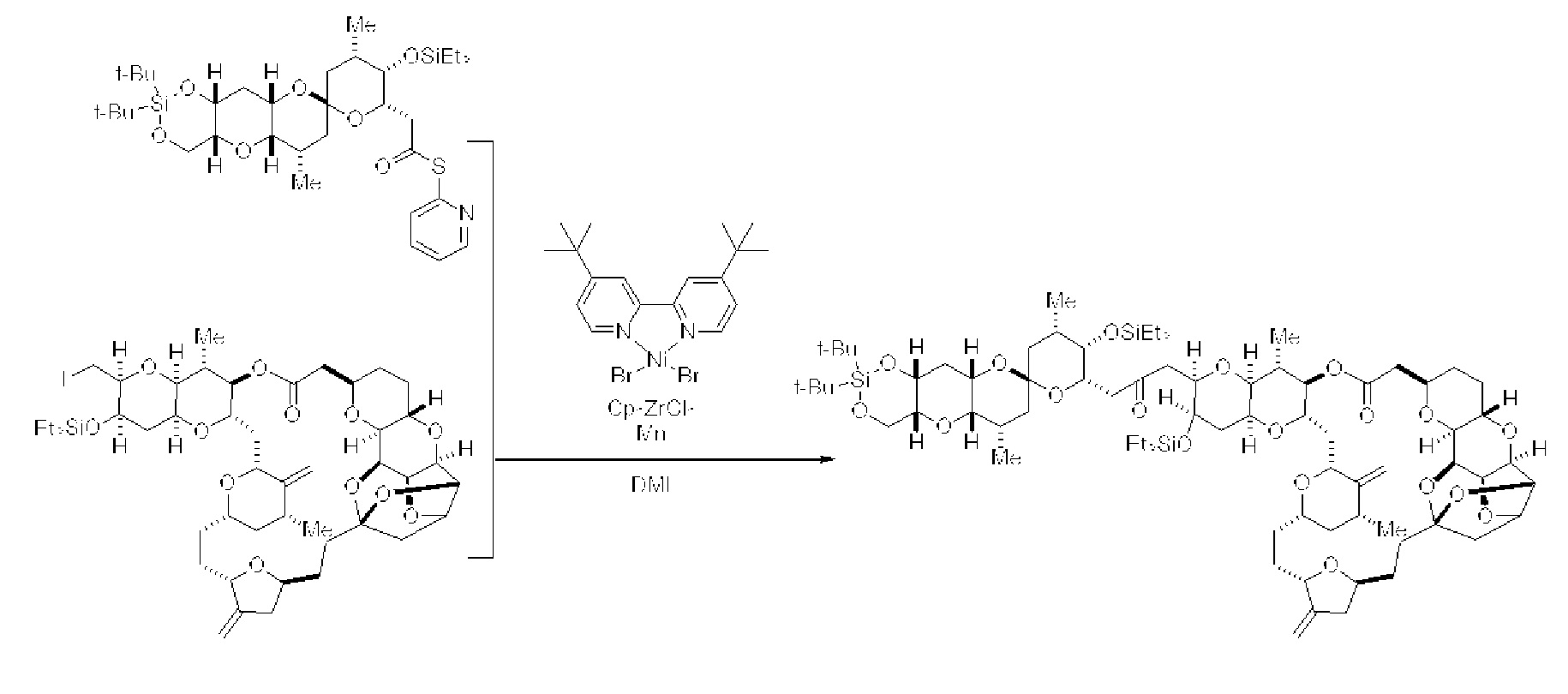
[00903] Получение раствора никелевого катализатора. Раствор бромида никеля (II) (5,00 г, 22,9 ммоль) и 4,4'-ди-трет-бутил-2,2'-дипиридила (6,15 г, 22,9 ммоль) в безводном этаноле (100 мл) перемешивали при 80°С в течение 18 ч в атмосфере аргона. После охлаждения реакционной смеси до комнатной температуры, реакционную смесь концентрировали досуха. Остаток сушили в условиях вакуума при 150°С (баня) в течение 70 ч. Затем, добавляли безводный DMI (62 мл) с получением раствора никелевого катализатора (использовали в виде 0,37 моль/л; см., например, Dr. Daniel J. Weix et. al., Chem. Eur. J. 2016, 22, 11564-11567)
[00904] Реакция сочетания. К раствору йодида (30,1 г, 30,6 ммоль), тиоэфира (30,4 г, 42,9 ммоль), дихлорида бис(циклопентадиенил)циркония(IV) (31,3 г, 107 ммоль) и марганца (11,7 г, 214 ммоль) в безводном DMI (270 мл) в атмосфере аргона добавляли полученный выше раствор никелевого катализатора (30 мл, 0,37 моль/л в DMI, 11,1 ммоль). После перемешивания при 30°С (баня) в течение 4 ч в атмосфере аргона, реакционную смесь гасили добавлением гептана (600 мл), 10 масс. % водного раствора лимонной кислоты (600 мл) при температуре ниже 22°С (баня 0°С). Затем, добавляли Celite®545 (15,0 г), и перемешивали смесь при 0°С в течение 1 ч. Затем, смесь пропускали через тонкий слой Celite®545 (60,0 г), и промывали слой Celite®545 гептаном (1500 мл) с получением двухфазной смеси. Водный слой разделяли и экстрагировали гептаном (90 мл). Объединенный органический слой промывали смешанным раствором 5 масс. % водн. бикарбоната натрия и 10 масс. % водн. сульфата натрия (150 мл), а затем концентрировали досуха. Остаток очищали методом колоночной хроматографии на силикагеле (1500 г, элюент: 10%, затем 30% этилацетат в гептане) с получением целевого соединения (36,6 г, 25,2 ммоль, 82%).
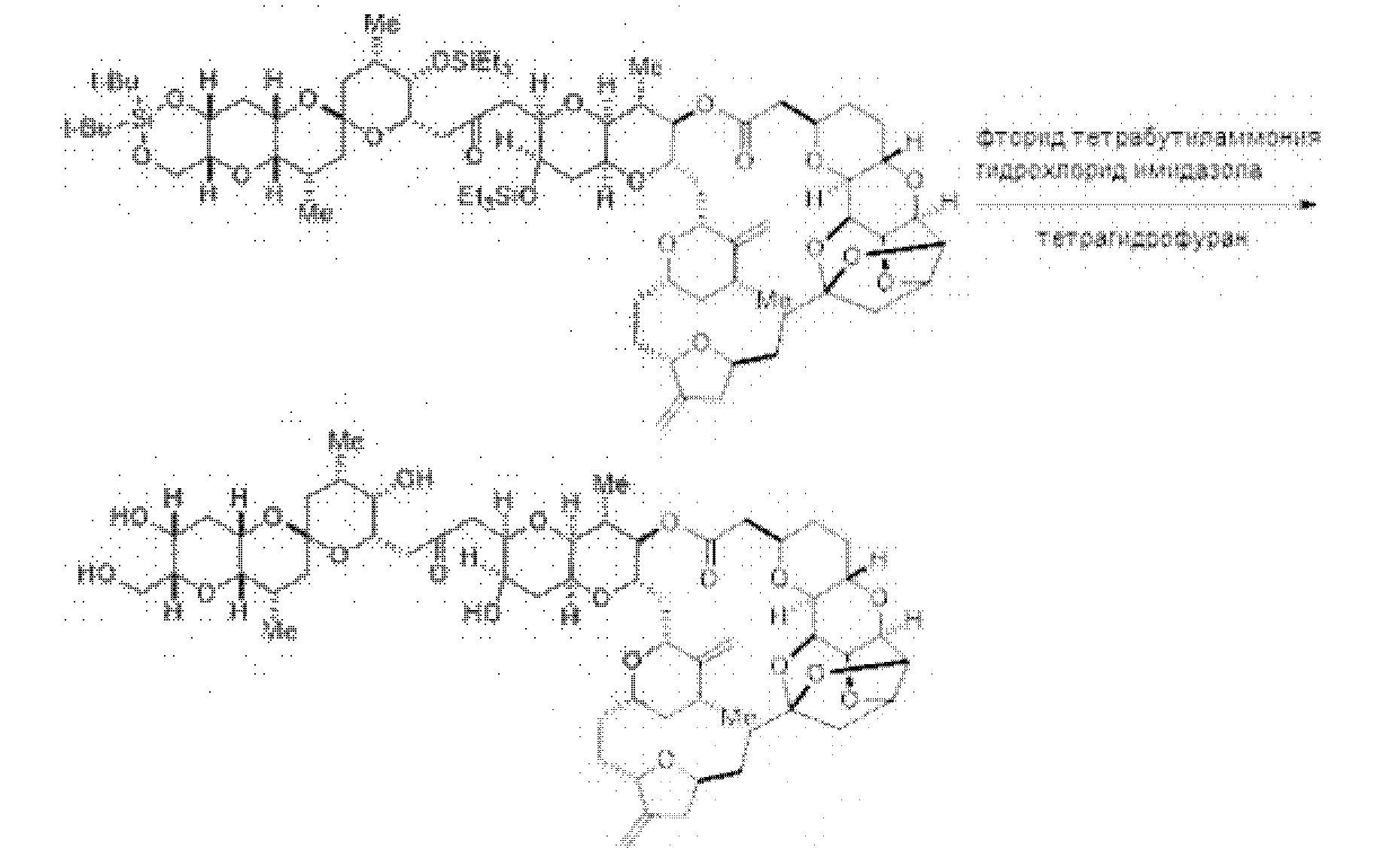
[00905] К раствору исходного вещества (35,5 г, 24,4 ммоль) в THF (365 мл) при 25°С (баня) в атмосфере азота добавляли смесь гидрохлорида имидазол (12,9 г, 123 ммоль) и фторида тетрабутиламмония (244 мл, 1,0 моль/л в THF, 244 ммоль). После перемешивания при 25°С в течение 19 ч, реакционную смесь гасили добавлением толуола (710 мл) и 10 масс. % водного раствора хлорида натрия (710 мл) с получением двухфазной смеси. Водный слой разделяли и экстрагировали толуолом (178 мл). Объединенный органический слой промывали водой (71 мл), а затем концентрировали досуха. Остаток очищали методом колоночной хроматографии на силикагеле (1500 г, элюент: 10% до 100% этилацетат в гептане, затем 10% метанол в этилацетате) с получением целевого соединения (25,5 г, 23,5 ммоль, 96%).
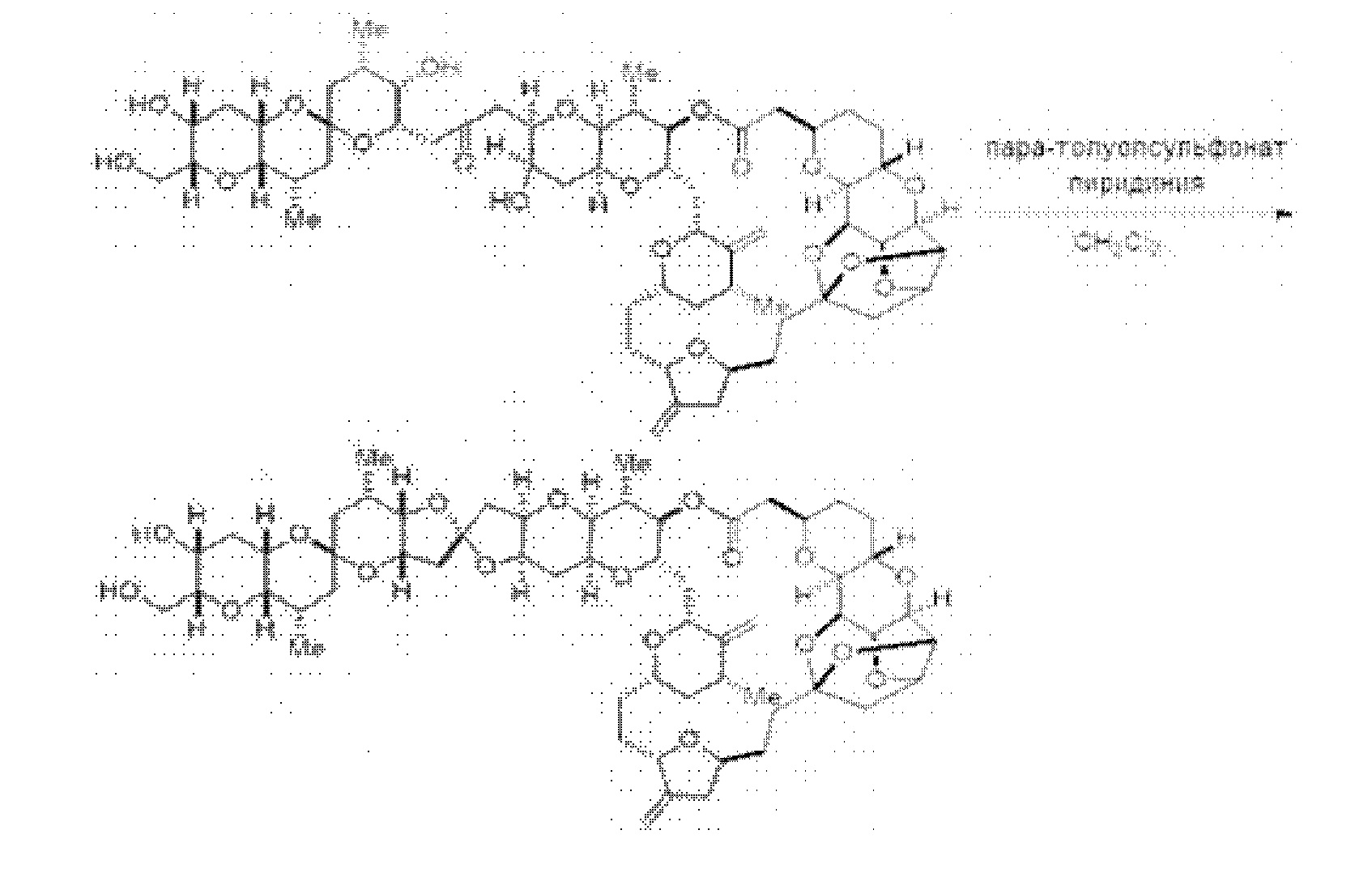
[00906] К раствору целевого соединения (25,4 г, 23,4 ммоль) в дихлорметане (765 мл) при 10°С в атмосфере азота добавляли пара-толуолсульфонат пиридиния (29,5 г, 117 ммоль). После перемешивания при 9-11°С в течение 3 ч, реакционную смесь гасили добавлением воды (508 мл) с получением двухфазной смеси. Водный слой повторно экстрагировали дихлорметаном (25 мл). Объединенный органический слой промывали водой (508 мл), а затем смешанным раствором 5 масс. % водн. бикарбоната натрия и 10 масс. % водн. сульфата натрия (127 мл). Затем, органический слой концентрировали досуха. Остаток очищали методом колоночной хроматографии на силикагеле (1500 г, элюент: 10%, 95%, 100% этилацетат в гептане) с получением целевого соединения (23,8 г). Это соединение снова очищали методом колоночной хроматографии на ODS (950 г, элюент: 30%, 65%, 100% ацетонитрил в воде). Фракции, содержащие целевое соединение, объединяли, и до некоторой степени удаляли ацетонитрил в условиях пониженного давления. Полученный водный раствор экстрагировали этилацетатом (1524 мл + 762 мл), и концентрировали объединенный органический слой досуха с получением целевого соединения (18,1 г, 17,0 ммоль, 73%).
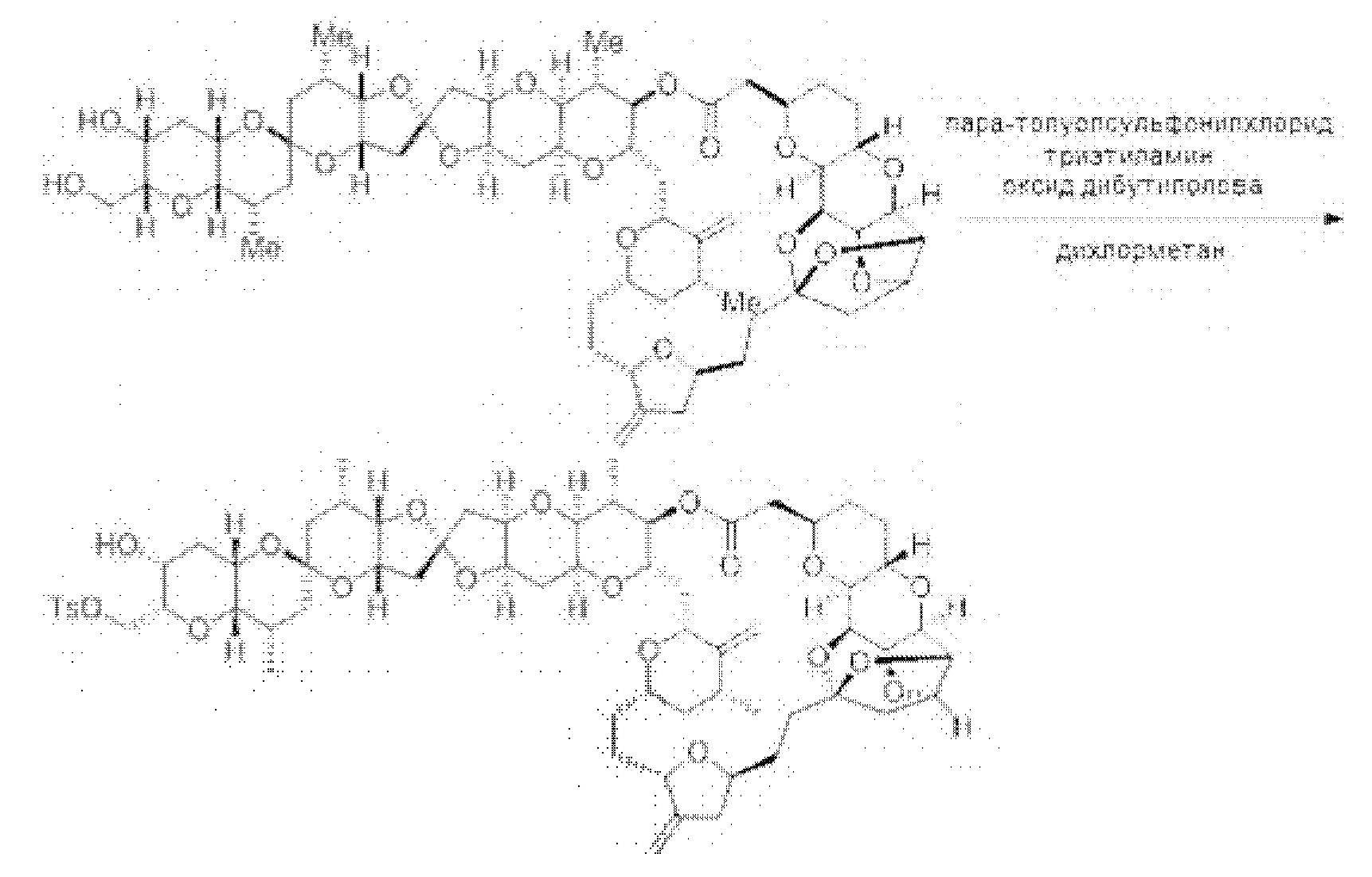
[00907] К раствору исходного вещества (15,2 г, 14,2 ммоль) в дихлорметане (30 мл) при 25°С последовательно добавляли триэтиламин (12,3 мл, 88,5 ммоль), оксид дибутилолова (2,13 г, 8,56 ммоль) и пара-толуолсульфонилхлорид (8,16 г, 42,8 ммоль). После перемешивания при 25°С в течение 3 ч, реакционную смесь пропускали через стеклянный фильтр. Фильтрат непосредственно очищали методом колоночной хроматографии на силикагеле (750 г, элюент: 10%, 30%, 50%, 70%, 85% этилацетат в гептане) с получением целевого соединения (17,4 г, 14,2 ммоль, колич.). 1H-ЯМР (600 МГц, бензол-d6) δ м.д. 0,86 (д, J=6,8 Гц, 3Н) 0,95 (д, J=6,8 Гц, 3Н) 1,00-1,05 (м, 4Н) 1,07-1,17 (м, 4Н) 1,19 (ушир. тд, J=14,7, 3,0 Гц, 1Н) 1,26-1,49 (м, 8Н) 1,54 (т, J=13,0 Гц, 1Н) 1,61-1,67 (м, 2Н) 1,75-2,39 (м, 25Н) 2,62-2,75 (м, 5Н) 3,25 (ушир. с, 1Н) 3,27 (ушир. с, 1Н) 3,35 (т, J=6,0 Гц, 1Н) 3,39 (дт, J=10,8, 5,6 Гц, 1Н) 3,44 (ушир. д, J=11,0 Гц, 1Н) 3,50 (д, J=11,3 Гц, 1Н) 3,55 (ушир. с, 1Н) 3,62 (дд, 3=6,2, 4,3 Гц, 1Н) 3,78 (ушир. т, J=9,6 Гц, 1Н) 3,83 (ушир. т, J=6,0 Гц, 1Н) 3,86-3,96 (м, 3Н) 3,99-4,11 (м, 3Н) 4,14 (м, 1Н) 4,27 (ушир. с, 1Н) 4,36-4,44 (м, 2Н) 4,49 (м, 1Н) 4,55-4,61 (м, 2Н) 4,80 (с, 1Н) 4,86-4,91 (м, 2Н) 4,95 (ушир. с, 1Н) 5,02 (ушир. с, 1Н) 6,65 (д, J=7,9 Гц, 2Н) 7,80 (д, J=7,9 Гц, 2Н).
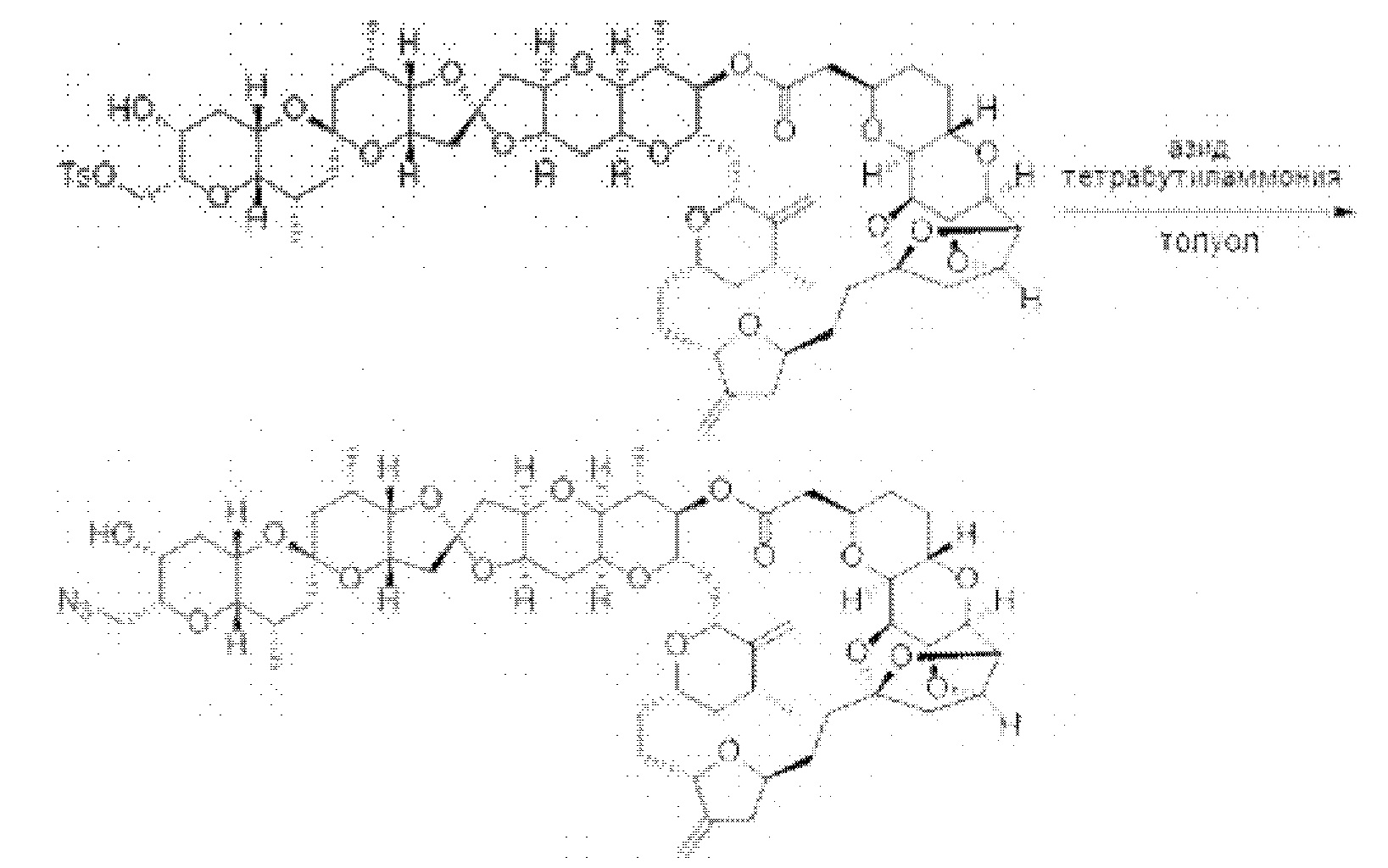
[00908] К раствору исходного вещества (17,3 г, 14,2 ммоль) в толуоле (121 мл) при комнатной температуре в атмосфере азота добавляли азид тетрабутиламмония (32,2 г, 113 ммоль). После перемешивания при 100°С (баня) в течение 5 ч, реакционную смесь охлаждали до комнатной температуры, и добавляли тетрагидрофуран (52 мл) с получением гомогенного раствора. Раствор непосредственно очищали методом колоночной хроматографии на силикагеле (750 г, элюент: 10%, 50%, 70%, 80% этилацетат в гептане) с получением целевого соединения (15,5 г, 14,2 ммоль, колич.). 1H-ЯМР (600 МГц, бензол-d6) δ м.д. 0,97-1,05 (м, 9Н) 1,08-1,37 (м, 8Н) 1,39-1,55 (м, 5Н) 1,58-1,71 (м, 3Н) 1,78-1,88 (м, 2Н) 1,91-2,08 (м, 8Н) 2,09-2,40 (м, 13Н) 2,62-2,75 (м, 4Н) 2,78 (д, J=2,3 Гц, 1Н) 2,97 (дд, J=13,0, 4,0 Гц, 1Н) 3,09 (дд, J=8,3, 3,8 Гц, 1Н) 3,26 (ушир. д, J=11,3 Гц, 1Н) 3,30 (т, J=2,6 Гц, 1Н) 3,32 (ушир. с, 1Н) 3,40 (дт, J=10,8, 5,6 Гц, 1Н) 3,56 (д, J=11,0 Гц, 1Н) 3,58-3,65 (м, 3Н) 3,78 (ушир. дд, J=10,8, 8,9 Гц, 1Н) 3,83 (ушир. дд, J=7,2, 5,7 Гц, 1Н) 3,86-3,99 (м, 3Н) 4,01-4,11 (м, 3Н) 4,14 (т, J=4,5 Гц, 1Н) 4,28 (дд, J=3,8, 1,5 Гц, 1Н) 4,50 (м, 1Н) 4,56-4,62 (м, 2Н) 4,80 (ушир. с, 1Н) 4,86-4,92 (м, 2Н) 4,96 (ушир. д, J=1,9 Гц, 1Н) 5,02 (ушир. д, J=1,5 Гц, 1Н).
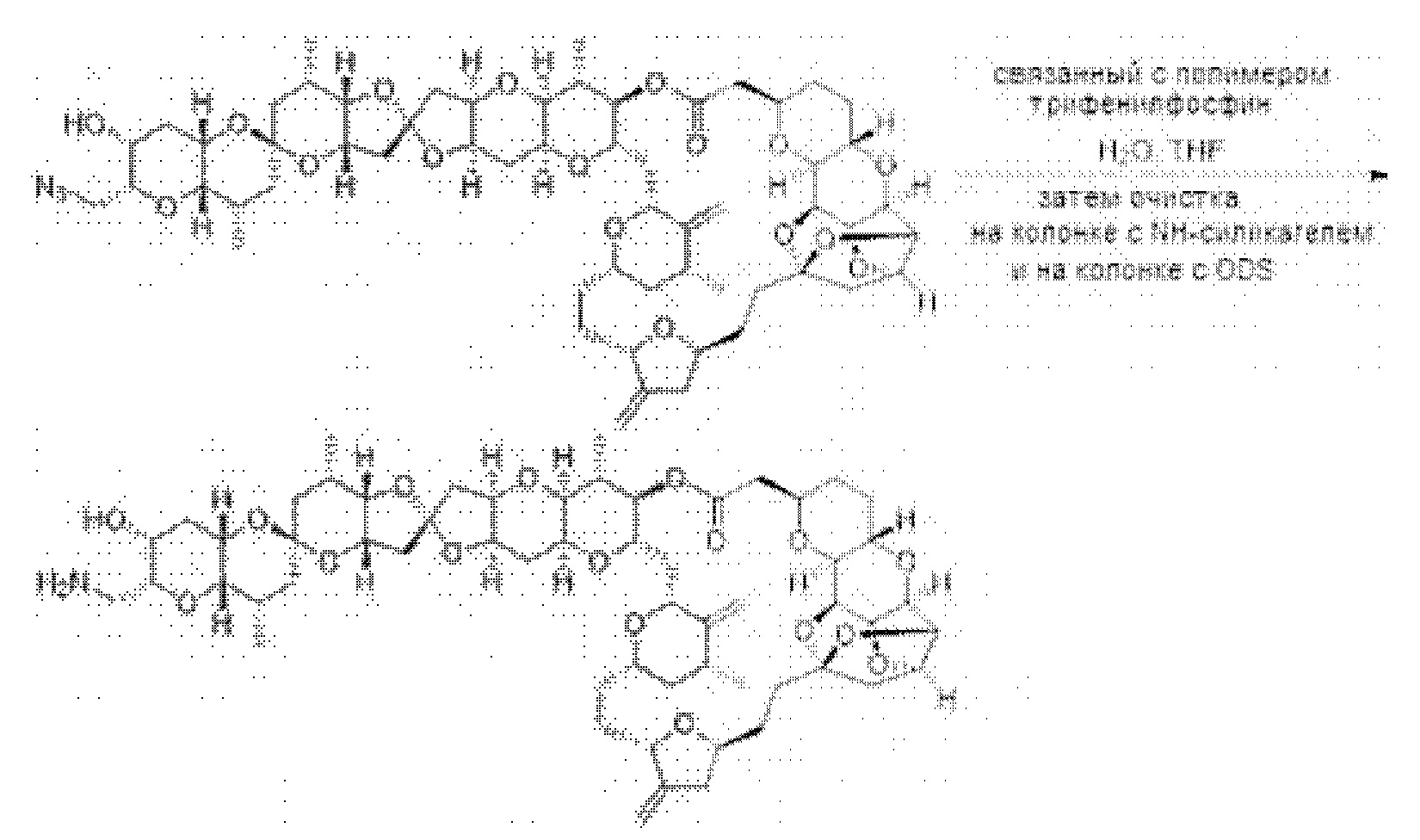
[00909] К раствору исходного вещества (15,4 г, 14,1 ммоль) в смеси THF (92 мл) и воды (10 мл) при 25°С добавляли связанный с полимером трифенилфосфин (20,4 г, 2,07 ммоль/г, 42,2 ммоль). После перемешивания при 25°С в течение 70 ч, реакционную смесь пропускали через стеклянный фильтр. Фильтрат концентрировали досуха. Остаток очищали методом колоночной хроматографии на NH-силикагеле (900 г, элюент: 50%, 100% МТВЕ в гептане, затем 3%, 10% метанол в МТВЕ) с получением целевого соединения (14,1 г, 13,2 ммоль, 94%) в виде белого твердого вещества. Целевое соединение дополнительно очищали методом колоночной хроматографии на ODS (400 г, элюент: 1%, 70%, 100% 0,05 об. % уксусная кислота/ацетонитрил в 0,05 об. % уксусная кислота/вода). Фракции, содержащие целевое соединение, объединяли, и добавляли дихлорметан (3304 мл), 20 масс. % водный раствор хлорида натрия (661 мл) и насыщенный водный раствор бикарбоната натрия (1322 мл) с получением двухфазной смеси. Затем, водный слой экстрагировали дихлорметаном (830 мл). Объединенный органический слой промывали водой (165 мл) и концентрировали досуха с получением целевого соединения (12,4 г, 11,6 ммоль, 88%). После растворения соединения в дихлорметане (25 мл) и пентане (25 мл), половину раствора добавляли к пентану (984 мл) при 0°С при перемешивании для осаждения целевого соединения. После удаления приблизительно 271 мл растворителя в условиях несколько сниженного давления, добавляли пентан (246 мл). После удаления приблизительно 246 мл растворителя в условиях несколько сниженного давления, добавляли пентан (246 мл). К этой смеси добавляли оставшуюся половину раствора целевого соединения при 0°С при перемешивании для дополнительного осаждения целевого соединения. После удаления приблизительно 271 мл растворителя в условиях несколько сниженного давления, добавляли пентан (246 мл). После удаления приблизительно 246 мл растворителя в условиях несколько сниженного давления, добавляли пентан (246 мл). Полученную в результате взвесь фильтровали, сушили при 40°С с получением целевого соединения (11,5 г, 93%). 1H-ЯМР (600 МГц, метанол-d4) δ м.д. 0,98 (д, J=7,2 Гц, 3Н) 1,00 (д, J=6,8 Гц, 3Н) 1,02 (м, 1Н) 1,05 (д, J=6,8 Гц, 3Н) 1,09 (д, J=6,4 Гц, 3Н) 1,28-1,45 (м, 5Н) 1,46-1,59 (м, 4Н) 1,57-1,63 (м, 1Н) 1,65-1,71 (м, 1Н) 1,70-1,75 (м, 2Н) 1,79-1,86 (м, 2Н) 1,91 (дт, J=14,9, 3,1 Гц, 1Н) 1,94-2,11 (м, 8Н) 2,14-2,34 (м, 9Н) 2,39 (дд, J=13,2, 6,0 Гц, 1Н) 2,44 (дд, J=17,4, 1,9 Гц, 1Н) 2,56 (дд, J=17,6, 9,6 Гц, 1Н) 2,69 (дд, J=13,2, 4,2 Гц, 1Н) 2,79 (ддкв, J=15,9, 7,6, 2,0 Гц, 1Н) 2,92 (дд, J=13,2, 8,3 Гц, 1Н) 2,97 (дд, J=9,6, 1,7 Гц, 1Н) 3,21 (дд, J=6,4, 4,9 Гц, 1Н) 3,29 (м, 1Н) 3,34 (дд, J=8,3, 4,15 Гц, 1Н) 3,58 (ушир. с, 1Н) 3,60 (ушир. д, J=11,3 Гц, 1Н) 3,68-3,73 (м, 2Н) 3,80 (ушир. с, 1Н) 3,84-3,90 (м, 2Н) 3,98 (д, J=2,3 Гц, 1Н) 4,03-4,13 (м, 4Н) 4,17 (дд, J=6,4, 4,9 Гц, 1Н) 4,24 (ддд, J=11,3, 4,5, 1,5 Гц, 1Н) 4,29 (дд, 3=4,0, 1,9 Гц, 1Н) 4,32 (тд, J=10,2, 4,2 Гц, 1Н) 4,44 (ушир. д, J=11,0 Гц, 1Н) 4,59 (т, J=4,5 Гц, 1Н) 4,62 (дд, J=7,4, 4,7 Гц, 1Н) 4,69 (т, J=4,7 Гц, 1Н) 4,80 (ушир. с, 1Н) 4,87 (с, 1Н) 5,00 (ушир. с, 1Н) 5,05 (ушир. д, J=1,1 Гц, 1Н).
Эквиваленты и объем
[0001] Если не указано обратное или из контекста не очевидно иное, то в формуле изобретения неопределенные и определенный артикли могут означать один или несколько. Если не указано обратное или из контекста не очевидно иное, то пункты формулы изобретения и описания, которые содержат союз «или» между одним или несколькими представителями группы считаются удовлетворительными, если один, несколько или все представители группы присутствуют в данном продукте или процессе, используются в них или иным образом имеют к ним отношение. Настоящее изобретение включает в себя варианты осуществления, в которых только один представитель группы присутствует в данном продукте или процессе, используется в них или иным образом имеет к ним отношение. Настоящее изобретение включает в себя варианты осуществления, в которых несколько или все представители группы присутствуют в данном продукте или процессе, используются в них или иным образом имеют к ним отношение.
[0002] Кроме того, настоящее изобретение охватывает все варианты, комбинации и перестановки, при которых одно или несколько ограничений, элементов, условий и описательных выражений из одного или нескольких из перечисленных пунктов формулы изобретения привносятся в другой пункт формулы изобретения. Например, любой пункт формулы изобретения, который зависит от другого пункта формулы изобретения, может быть модифицирован с целью включения одного или нескольких ограничений, обнаруженных в любом другом пункте формулы изобретения, который зависит от того же самого базового пункта формулы изобретения. В том случае, если элементы представлены в виде перечней, например, в формате группы Маркуша, то также раскрывается каждая подгруппа элементов, и любой(ые) элемент(ы) может(гут) быть удален(ы) из группы. Следует понимать, что если настоящее изобретение или аспекты настоящего изобретения указаны в общих чертах как включающие в себя отдельные элементы и/или характерные черты, то определенные варианты осуществления настоящего изобретения или аспекты настоящего изобретения состоят, или по существу состоят, из таких элементов и/или характерных черт. Для целей упрощения, такие варианты осуществления не излагаются в тех же определенных выражениях в настоящем документе.
[0003] Также следует отметить, что термины «включающий в себя» и «содержащий» рассматриваются как открытые и предоставляют возможность включать дополнительные элементы или стадии. В тех случаях, когда приводятся диапазоны значений, граничные значения считаются включенными. Кроме того, если не указано иное, или иное не очевидно из контекста и понимания средним специалистом в данной области техники, то в различных вариантах осуществления изобретения значения, которые выражены в виде диапазонов значений, могут принимать любое конкретное значение или поддиапазон в пределах указанных диапазонов значений, с точность до десятой части значения нижней границы диапазона, если только контекстом явно не определено иное.
[0004] В настоящей заявке приводятся ссылки на различные выданные патенты, опубликованные патентные заявки, статьи в журналах и другие публикации, которые все включены в настоящий документ посредством ссылки. В случае конфликта между любой из включенных ссылок и настоящим описанием, описание будет иметь преобладающую силу. Кроме того, любой конкретный вариант осуществления настоящего изобретения, который подпадает под известный уровень техники, может быть в явном виде исключен из одного или нескольких пунктов формулы изобретения. Поскольку такие варианты осуществления расцениваются как известные среднему специалисту в данной области техники, они могут быть исключены, даже если такое исключение не указано в явном виде в настоящем документе. Любой конкретный вариант осуществления настоящего изобретения может быть исключен из любого пункта формулы изобретения, по любым основаниям, связанным или не связанным с существованием известного уровня техники.
[0005] Специалисты в данной области техники смогут определить или будут способны установить с использованием лишь стандартных экспериментов множество эквивалентов конкретных вариантов осуществления, описанных в настоящем документе. Объем вариантов осуществления настоящего изобретения, описанных в настоящем документе, не предназначен для ограничения представленного выше раскрытия, а скорее соответствует представленному в прилагаемой формуле изобретения. Специалистам в данной области техники следует понимать, что различные изменения и модификации могут быть сделаны в настоящем описании без отступления от существа или объема настоящего изобретения, определенного в прилагаемой формуле изобретения.