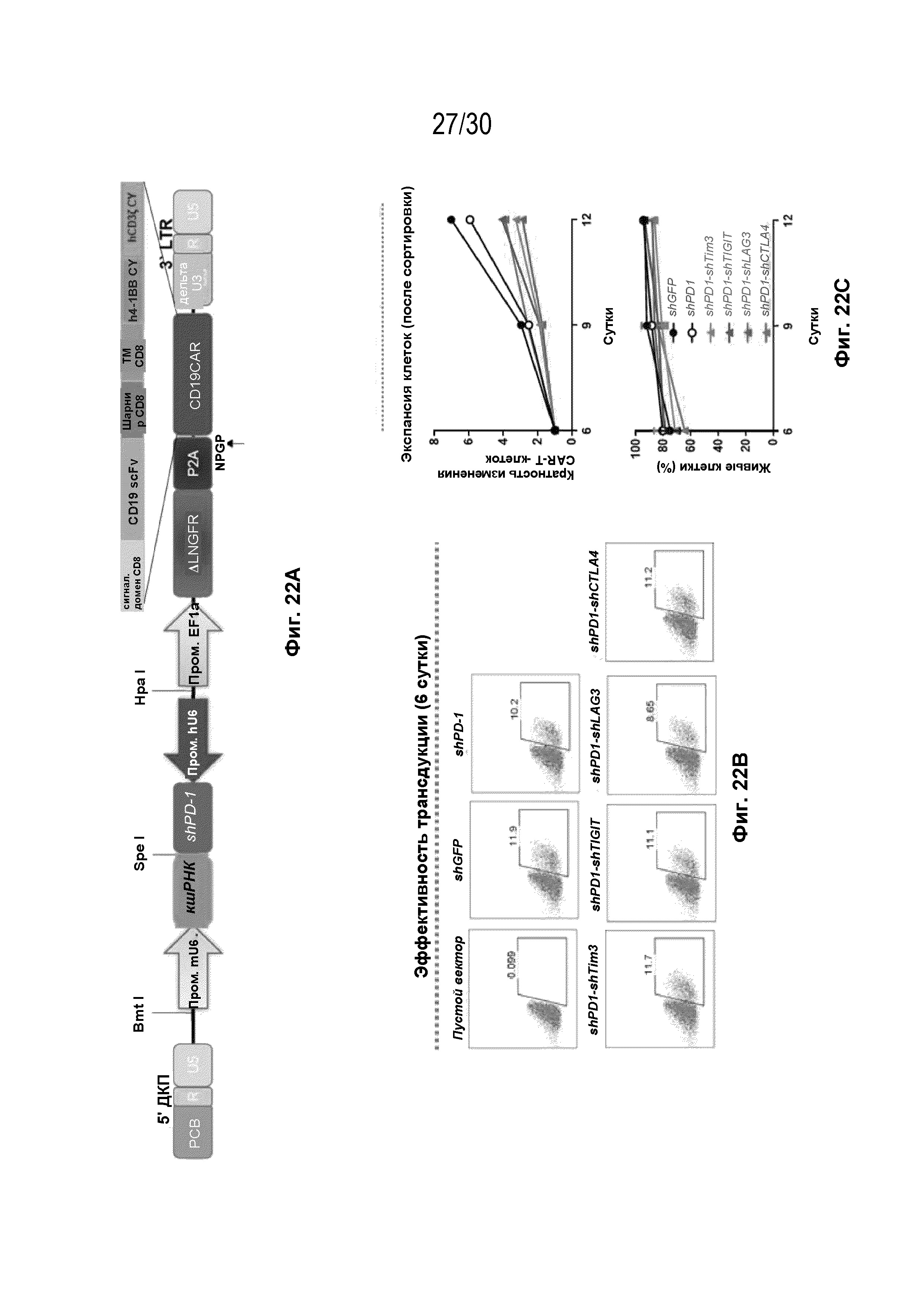
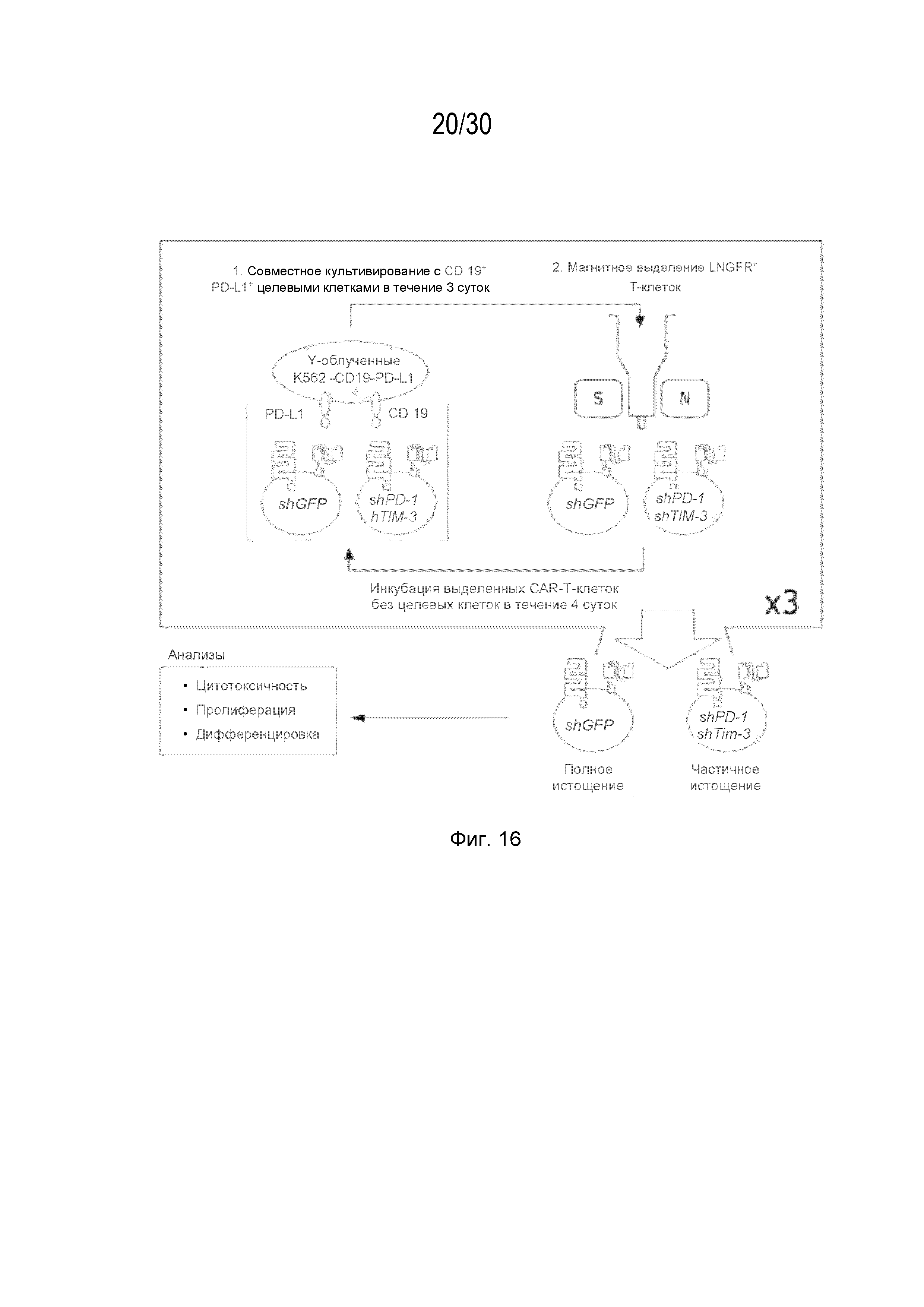
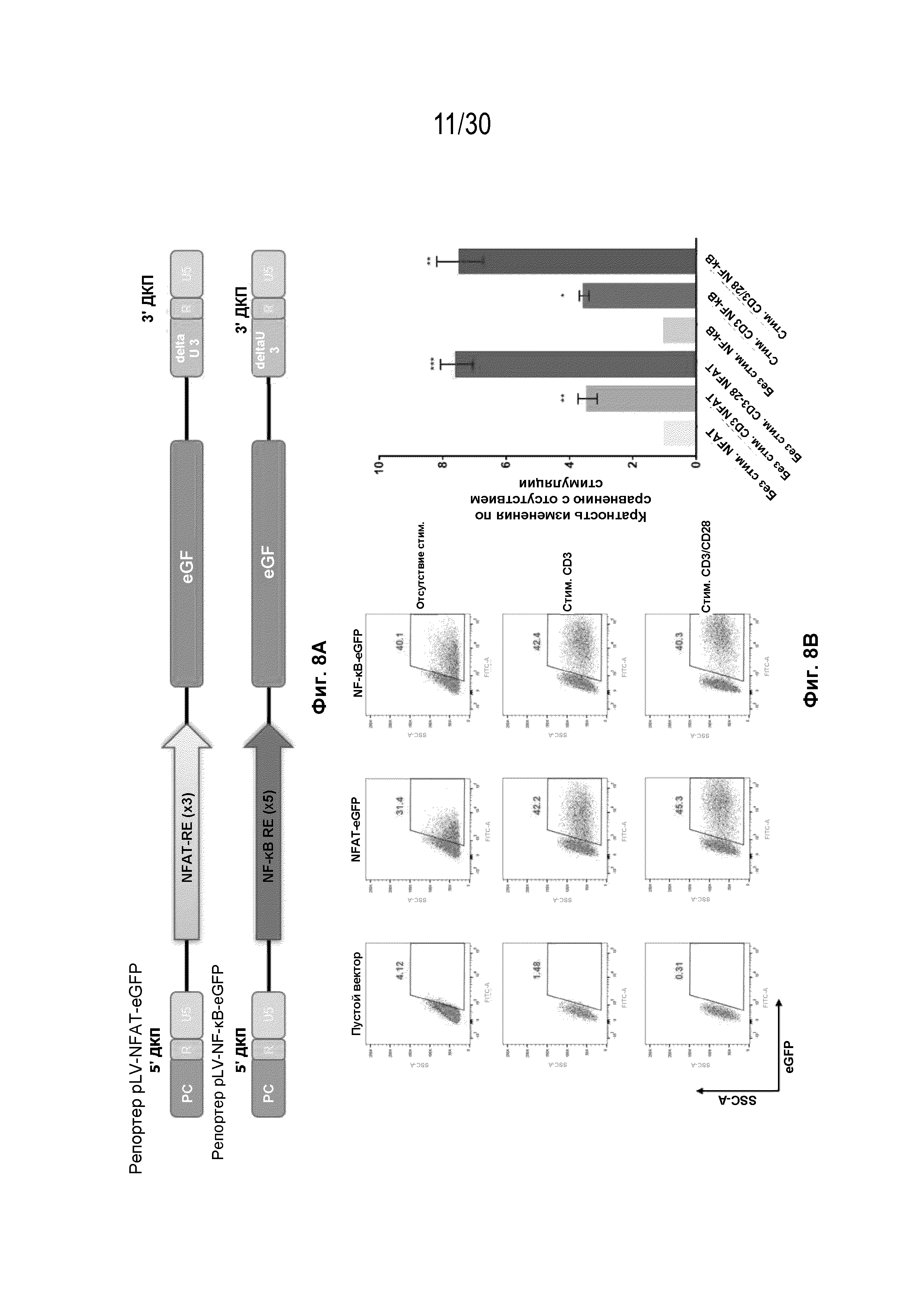
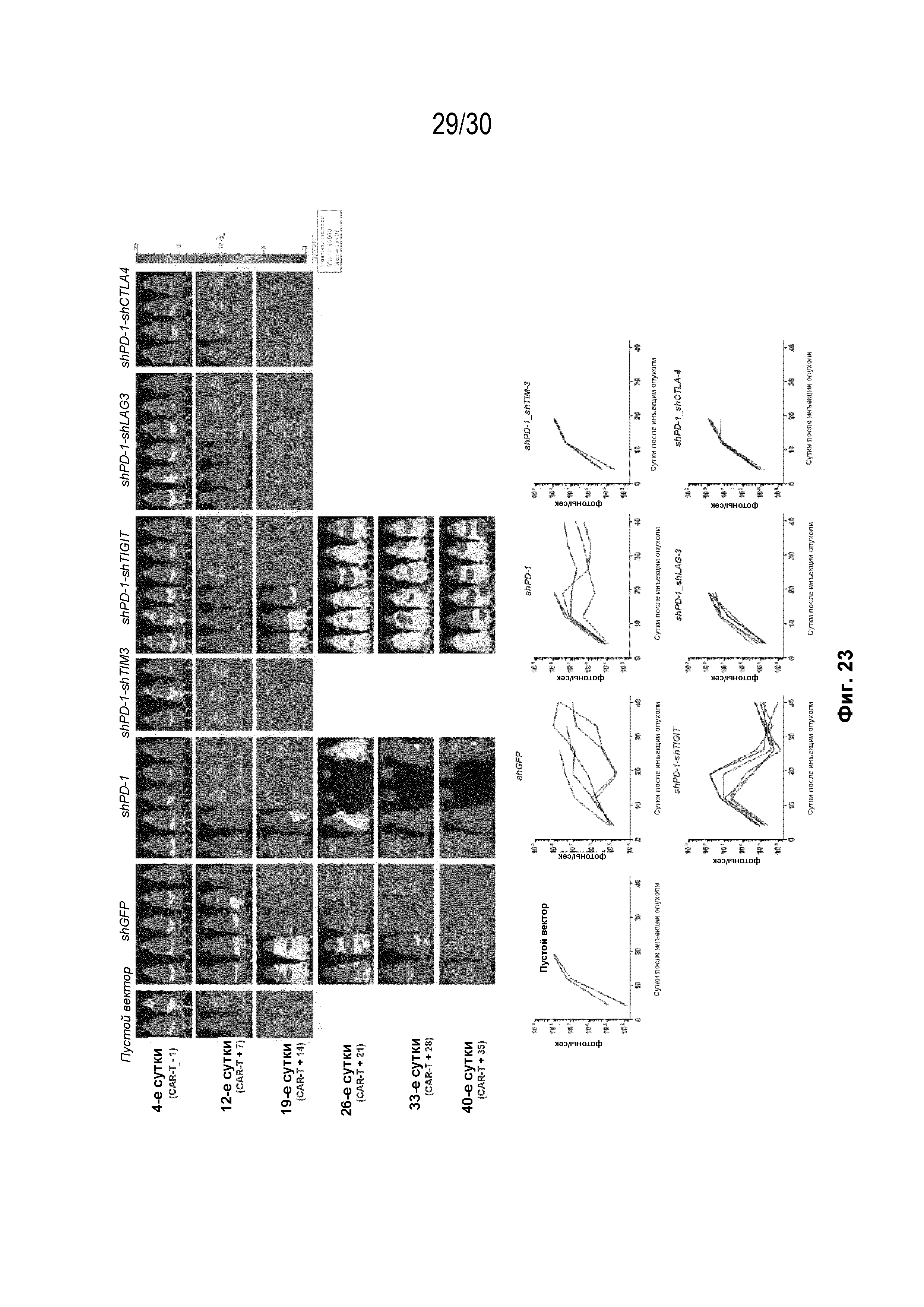
Результат интеллектуальной деятельности: УЛУЧШЕННЫЕ ИММУННЫЕ КЛЕТКИ С ДВОЙНОЙ кшРНК И КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ
Вид РИД
Изобретение
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Данная заявка испрашивает приоритет по заявке на патент Кореи № 10-2018-0004238, поданной 12 января 2018 года, содержание которой полностью включено в данный документ посредством ссылки.
ССЫЛКА НА ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТИ, ПРЕДСТАВЛЕННЫЙ В ЭЛЕКТРОННОМ ВИДЕ
[0002] Данная заявка включает в себя посредством ссылки перечень последовательностей, представленный вместе с этой заявкой, в виде текстового файла с названием 14570-001-228_SEQ_LISTING.txt, созданного 5 января 2019 года, и имеет размер 88751 байт.
ОБЛАСТЬ ТЕХНИКИ
[0003] Данное изобретение в целом относится к области иммунотерапии злокачественного новообразования. Например, данное изобретение в целом относится к иммунной клетке, содержащей генетически сконструированный антигенный рецептор, который специфически связывается с целевым антигеном, и агент генетического разрушения, который уменьшает или способен уменьшить экспрессию в иммунной клетке гена, который ослабляет функцию иммунной клетки.
УРОВЕНЬ ТЕХНИКИ
[0004] Противораковой терапии с использованием иммунных клеток путем выделения Т-клеток или NK-клеток (натуральных клеток-киллеров) из организма пациента или донора, культивирования этих клеток in vitro, и последующего введения их обратно в организм пациента в настоящее время уделяется много внимания как новому способу терапии злокачественного новообразования. В частности, сообщается, что иммунные клетки, в которые вносят новую генетическую информацию с использованием вирусов и т. д. с последующим культивированием в процессе культивирования in vitro, обладают более сильным противораковым действием по сравнению с клетками, которым этого не делают. В данном документе генетическая информация, вводимая в Т-клетки, как правило, представляет собой химерный антигенный рецептор (далее CAR) или моноклональный Т-клеточный рецептор (далее mTCR), модифицированный так, чтобы иметь высокую аффинность к целевому антигену. Эти модифицированные иммунные клетки распознают и атакуют раковые клетки, которые экспрессируют целевой антиген и индуцируют гибель клеток, не ограничиваясь присущими им антигенными специфичностями. Способ генетической модификации Т-клеток с использованием CAR был впервые предложен Eshhar et al. в 1989 году и был назван как «Т-клеточное тельце» (T-body).
[0005] В данном документе предложены композиции иммунных клеток и способы, которые решают проблемы традиционных аналогичных способов терапии иммунными клетками, упомянутых выше, в которых указанные проблемы накладывают большое экономическое бремя на пациентов из-за их высокой стоимости, воздействуют на Т-клетки, отличные от CAR-T, и создают риск возникновения симптомов аутоиммунных заболеваний и синдрома высвобождения цитокинов. Вкратце, например, в данном документе описаны способы их получения с высокими показателями выхода и низкими производственными затратами. Кроме того, благодаря ингибированию молекул, которые подавляют функцию иммунных клеток с более высокой вероятностью и эффективностью, описание, приведенное в данном документе, удовлетворяет требованиям технологии в обеспечении эффективной клеточной терапии. Техническая проблема, на решение которой направлено данное описание, не ограничивается технической проблемой, изложенной выше, и для специалистов в данной области техники должны быть очевидны другие технические проблемы, не упомянутые ниже.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0006] В данном документе предложены векторы, иммунные клетки, фармацевтические композиции, содержащие иммунные клетки, и композиции, содержащие иммунные клетки. В данном документе также предложены способы получения иммунных клеток и способы лечения и применения иммунных клеток.
[0007] В одном аспекте в данном документе предложены векторы. В некоторых вариантах осуществления предложен вектор, содержащий последовательность оснований, кодирующую два типа коротких шпилечных РНК (кшРНК), которые ингибируют экспрессию генов, которые ослабляют функцию иммунных клеток, и последовательность оснований, кодирующую химерный антигенный рецептор (CAR) ил Т-клеточный рецептор (TCR), например, моноклональный Т-клеточный рецептор (mTCR). В некоторых вариантах осуществления мишень CAR или TCR, например, mTCR, представляет собой опухолевый антиген человека, выбранный из числа антигенов, проявляющих повышенную экспрессию при злокачественном новообразовании, или из мутированных форм антигена, обнаруженных при злокачественном новообразовании, например, в раковых клетках, раковой ткани и/или микроокружении опухоли.
[0008] В некоторых вариантах осуществления экспрессия двух типов кшРНК характеризуется тем, что они, соответственно, регулируются двумя разными промоторами.
[0009] В некоторых вариантах осуществления два промотора представляют собой промоторы РНК-полимеразы III. В некоторых вариантах осуществления два промотора представляют собой промоторы U6, например, промоторы U6, полученные из разных видов. В некоторых вариантах осуществления два промотора ориентированы в одном направлении относительно друг друга в векторе. В некоторых вариантах осуществления два промотора ориентированы в разных направлениях относительно друг друга в векторе. Например, в определенном варианте осуществления промоторы ориентированы в направлении голова к голове. В другом варианте осуществления промоторы ориентированы в направлении хвост к хвосту.
[0010] В некоторых вариантах осуществления ген, ослабляющий функцию иммунных клеток, представляет собой рецептор или лиганд иммунной контрольной точки.
[0011] В некоторых вариантах осуществления рецептор или лиганд иммунной контрольной точки выбран из группы, состоящей из PD1, PD-L1, CTLA4, TIM3, CEACAM (CEACAM-1, CEACAM-3 или CEACAM-5), LAG 3, VISTA, BTLA, TIGIT, LAIR1, CD160, CD96, MerTK и 2B4.
[0012] В некоторых вариантах осуществления ген, ослабляющий функцию иммунных клеток, выбран из группы, состоящей из FAS, CD45, PP2A, SHIP1, SHIP2, DGK-альфа, DGK-дзета, Cbl-b, CD147, LRR1, TGFBR1, ИЛ-10R альфа, KLGR1, DNMT3A и A2aR.
[0013] В некоторых вариантах осуществления используются два типа кшРНК, которые нацелены на ген или гены, которые ослабляют функцию иммунных клеток. В некоторых вариантах осуществления два типа кшРНК или нацелены на один ген, который ослабляет функцию иммунных клеток, или они нацелены на разные гены, которые ослабляют функцию иммунных клеток. В некоторых вариантах осуществления два типа кшРНК нацелены на PD-1. В некоторых вариантах осуществления, включающих два типа кшРНК, одна кшРНК нацелена на PD-1, а вторая кшРНК нацелена на TIM-3. В некоторых вариантах осуществления, включающих два типа кшРНК, одна кшРНК нацелена на PD-1, а вторая кшРНК нацелена на TIGIT.
[0014] кшРНК образует шпилечную структуру, которая содержит смысловую последовательность кшРНК и антисмысловую последовательность кшРНК. В некоторых вариантах осуществления последовательность оснований, кодирующая кшРНК, описанную в данном документе, содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 2-219. В некоторых вариантах осуществления последовательность оснований, кодирующая кшРНК, описанную в данном документе, содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 2-219, причем указанная последовательность кодирует смысловую последовательность кшРНК. В некоторых вариантах осуществления последовательность оснований, кодирующая кшРНК, описанную в данном документе, содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 2-219, причем указанная последовательность кодирует антисмысловую последовательность кшРНК.
[0015] В некоторых вариантах осуществления вектор содержит любую одну из последовательностей оснований SEQ ID NO: 220 или 221. В некоторых вариантах осуществления вектор представляет собой плазмидный вектор или вирусный вектор, например, лентивирусный вектор, например, ретровирусный вектор, аденовирусный вектор или вектор на основе аденоассоциированного вируса.
[0016] В другом аспекте в данном документе предложены иммунные клетки, содержащие вектор, экспрессирующий CAR или TCR, например, mTCR, и при этом экспрессия целевых генов для двух типов кшРНК снижена до 40% или менее, чем у контрольной группы, которая не экспрессирует кшРНК для целевого гена. В некоторых вариантах осуществления иммунная клетка выбрана из Т-клеток и NK-клеток человеческого происхождения.
[0017] В другом аспекте в данном документе предложены фармацевтические композиции для иммунотерапии пациентов-людей, содержащие иммунные клетки, описанные выше. В некоторых вариантах осуществления иммунную клетку первоначально получают от пациента. В некоторых вариантах осуществления у пациента имеется опухоль или злокачественное новообразование, при которых обнаруживается увеличение или изменение уровней ракового антигена, на который нацеливается CAR или TCR, например, mTCR, экспрессируемый в клетке.
[0018] В другом аспекте в данном документе предложены иммунные клетки, содержащие генетически сконструированный антигенный рецептор, который специфически связывается с целевым антигеном, и агент генетического разрушения, снижающий или способный снижать экспрессию в иммунной клетке гена, который ослабляет функцию иммунных клеток.
[0019] В другом аспекте в данном документе предложена иммунная клетка, содержащая генетически сконструированный антигенный рецептор, который специфически связывается с целевым антигеном, и агент генетического разрушения, снижающий или способный снижать экспрессию в иммунной клетке гена, который ослабляет функцию иммунной клетки.
[0020] В некоторых вариантах осуществления генетически сконструированный антигенный рецептор представляет собой химерный антигенный рецептор (CAR) или Т-клеточный рецептор (TCR).
[0021] В некоторых вариантах осуществления генетически сконструированный антигенный рецептор представляет собой CAR. В некоторых вариантах осуществления CAR содержит внеклеточный антигенраспознающий домен, трансмембранный домен и внутриклеточной домен сигнальной трансдукции. В некоторых вариантах осуществления внеклеточный антигенраспознающий домен CAR специфически связывается с целевым антигеном.
[0022] В некоторых вариантах осуществления внутриклеточный домен сигнальной трансдукции CAR содержит внутриклеточный домен дзета-цепи CD3 (CD3ζ). В некоторых вариантах осуществления внутриклеточной домен сигнальной трансдукции CAR дополнительно содержит костимулирующую молекулу. В некоторых вариантах осуществления костимулирующая молекула выбрана из группы, состоящей из ICOS, 0X40, CD137 (4-1BB), CD27 и CD28. В некоторых вариантах осуществления костимулирующая молекула представляет собой CD137 (4-1BB). В некоторых вариантах осуществления костимулирующая молекула представляет собой CD28.
[0023] В некоторых вариантах осуществления генетически сконструированный антигенный рецептор представляет собой TCR. В некоторых вариантах осуществления TCR представляет собой моноклональный TCR (mTCR).
[0024] В некоторых вариантах осуществления целевой антиген экспрессируется в или на поверхности раковой клетки, раковой ткани и/или в микроокружении опухоли.
[0025] В некоторых вариантах осуществления целевой антиген выбран из группы, состоящей из: 5T4 (трофобластический гликопротеин), 707-AP, 9D7, AFP (α-фетопротеин), AlbZIP (андроген-индуцируемый bZIP), HPG1 (специфический к простате человека ген-1), α5β1-интегрина, α5β6-интегрина, α-метилацил-коэнзим А рацемазы, ART-4 (АДФ рибозилтрансферазы-4), B7H4 (ингибитор активации Т-клеток 1, содержащий вариабельный иммуноглобулиноподобный домен), BAGE-1 (В меланомный антиген-1), BCL-2 (В-клеточный ХЛЛ/лимфома-2), BING-4 ( WD-повтор домена 46), CA 15-3/CA 27-29 (муцин 1), CA 19-9 (раковый антиген 19-9), CA 72-4 (раковый антиген 72-4), CA125 (раковый антиген 125), кальретикулина, CAMEL (ЦТЛ-распознаваемый антиген на меланоме), CASP-8 (каспаза 8), катепсина B, катепсина L, CD19 (кластер дифференцировки 19), CD20, CD22, CD25, CD30, CD33, CD4, CD52, CD55, CD56, CD80, CEA (раковый эмбриональный антиген SG8), CLCA2 (канал-переносчик-2 для ионов хлора), CML28 (опухолевый антиген хронического миелолейкоза 28), коактозин-подобного белка, коллагена XXIII, COX-2 (циклооксигеназа-2), CT-9/BRD6 (раково-тестикулярный антиген 9), Cten (С-концевой тензиноподобный белок), циклина B1, циклина D1, cyp-B, CYPB1 (цитохром p450 семейство 1, подсемейство b, тип 1), DAM-10/MAGE-B1 (ассоциированный с меланомой антиген B1), DAM-6/MAGE-B2, EGFR/Her1 (рецептор эпидермального фактора роста), EMMPRIN (басигин), EpCam, EphA2 (эфрин-рецептор A2), EphA3, ErbB3 (рецептор тирозинкиназы 3 Erb-B2), EZH2 (усилитель субъединицы zeste гомолога 2 policomb-репрессивного комплекса 2), FGF-5 (фактор роста фибробластов 5), FN (фибронектин), Fra-1 (Fos-связанный антиген-1), G250/CAIX (карбоангидраза 9), GAGE-1 (G антиген-1), GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE-7b, GAGE-8, GDEP (ген, дифференциально экспрессируемый в простате), GnT-V (глюконаткиназа), gp100 (специфический для линии меланоцитов антиген GP100), GPC3 (глипикан-3), HAGE (спиральный антиген), HAST-2 (член 1 семейство сульфотрансферазы 1A), гепсина, Her2/neu/ErbB2 (Erb-B2 рецептор тирозинкиназы 2), HERV-K-MEL, HNE (медуллазин), гомеобокса NKX 3.1, HOM-TES-14/SCP-1, HOM-TES-85, HPV-E6, HPVE7, HST-2 (сиртуин-2), hTERT, iCE (каспаза 1), IGF-1R (рецептор инсулиноподобного фактора роста-1), ИЛ-13Ra2 (α-2-субъединица рецептора интерлейкина-13), ИЛ-2R (рецептор интерлейкина-2), ИЛ-5 (интерлейкин-5), незрелого рецептора ламинина, калликреина-2, калликреина-4, Ki67, KIAA0205 (лизофосфатидилглицерол-ацилтрансфераза 1), KK-LC-1 (антиген-1 рака легкого кита-кюсю (kita-kyushu)), KM-HN-1, LAGE-1 (L-антиген, член 1 семейства белков LAGE), ливина, MAGE-A1, MAGE-A10, MAGE-A12, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A9, MAGE-B1, MAGE-B10, MAGE-B16, MAGEB17, MAGE-B2, MAGE-B3, MAGE-B4, MAGE-B5, MAGE-B6, MAGE-C1, MAGE-C2, MAGE-C3, MAGE-D1, MAGE-D2, MAGE-D4, MAGE-E1, MAGE-E2, MAGE-F1, MAGE-H1, MAGEL2 (антиген меланомы семейства L2), маммаглобина A, MART-1/Melan-A (антиген меланомы, распознаваемый Т-клетками-1), MART-2, белка матрикса 22, MC1R (рецептор меланокортина-1 ), М-КСФ (макрофагальный колониестимулирующий фактор), мезотелина, MG50/PXDN (пероксидазина), MMP 11 (матриксная металлопротеиназа 11), MN/CA IX-антигена (карбоангидраза 9), MRP-3 (ассоциированный с множественной лекарственной устойчивостью белок-3), MUC1 (муцин 1), MUC2, NA88-A (псевдоген 1 VENT-подобного гомеобокса 2), N-ацетилглюкозаминилтрансферазы-V, Neo-PAP (нео-поли(А)-полимераза), NGEP (новый ген, экспрессируемый в простате), NMP22 (белок ядерного матрикса 22), NPM/ALK (нуклеофосмин), NSE (нейронспецифическая энолаза), NY-ESO-1, NY-ESO-B, OA1 (QTL-1 остеоартрита), OFA-iLRP (раково-эмбриональный антиген-незрелый рецептор ламинина), OGT (O-GlcNAc-трансфераза), OS-9 (лектин эндоплазматического ретикулюма), остеокальцина, остеопонтина, p15 (ингибитор CDK 2B), p53, PAGE-4 (семейство P-антигена, член-4), PAI-1 (ингибитор активатора плазминогена 1), PAI-2, PAP (простатическая кислая фосфатаза), PART-1 (транскрипт-1, регулируемый андрогеном простаты), PATE (белок-1, экспрессируемый простатой и яичками), PDEF (полученный из простаты фактор Ets), Pim-1-киназы (сайт-1 интеграции провирусов), Pin1 (пептидил-пролил-цис-транс-изомераза-1), POTE (экспрессируемый в простате, яичнике, яичке и плаценте), PRAME (преимущественно экспрессируемый антиген при меланоме), простеина, протеиназы-3, PSA (простат-специфический антиген), PSCA (антиген стволовых клеток простаты), PSGR (простат-специфический рецептор, связанный с G-белком), PSM, PSMA (простат-специфический мембранный антиген), RAGE-1 (ассоциированный с опухолью антиген почечных карцином), RHAMM/CD168, RU1 (почечный убиквитарный белок-1), RU2, SAGE (антиген саркомы), SART-1 (антиген-1 плоскоклеточной карциномы, распознаваемый Т-клетками), SART-2, SART-3, Sp17 (белок спермы 17), SSX-1 (член-1 семейства SSX), SSX-2/HOM-MEL-40, SSX-4, STAMP-1 (металлоредуктаза STEAP2), STEAP, сурвивина, сурвивина-213, TA-90 (опухоль-ассоциированный антиген-90), TAG-72 (опухоль-ассоциированный гликопротеин-72), TARP(белок TCRγ с альтернативной рамкой считывания), TGFb (трансформирующий фактор роста β), TGFbR11 (рецептор-11 трансформирующего фактора роста β), TGM-4 (трансглютаминаза 4), TRAG-3(ген-3 устойчивости к таксолу), TRG (γ-локус рецептора Т-клеток), TRP-1 (транзиторный рецепторный потенциал 1), TRP-2/6b, TRP-2/INT2, Trp-p8, тирозиназы, UPA (урокиназный активатор плазминогена), VEGF (фактор роста сосудистого эндотелия A), VEGFR-2/FLK-1, и WT1 (белок опухоли Вильмса 1). В некоторых вариантах осуществления целевой антиген представляет собой CD19 или CD22. В некоторых вариантах осуществления целевой антиген представляет собой CD19.
[0026] В некоторых вариантах осуществления целевой антиген представляет собой раковый антиген, экспрессия которого повышена в или на поверхности раковой клетки, раковой ткани и/или в микроокружении опухоли.
[0027] В некоторых вариантах осуществления целевой антиген выбран из группы, состоящей из: α-актинина-4/m, ARTC1/m, bcr/abl, бета-катенина/m, BRCA1/m, BRCA2/m, CASP-5/m, CASP-8/m, CDC27/m, CDK4/m, CDKN2A/m, CML66, COA-1/m, DEK-CAN, EFTUD2/m, ELF2/m, ETV6-AML1, FN1/m, GPNMB/m, HLA-A*0201-R170I, HLA-A11/m, HLA-A2/m, HSP70-2M, KIAA0205/m, K-Ras/m, LDLR-FUT, MART2/m, ME1/m, MUM-1/m, MUM-2/m, MUM-3/m, миозина класса 1/m, neo-PAP/m, NFYC/m, N-Ras/m, OGT/m, OS-9/m, p53/m, Pml/RARa, PRDX5/m, PTPRX/m, RBAF600/m, SIRT2/m, SYTSSX-1, SYT-SSX-2, TEL-AML1, TGFbRII, и TPI/m; и при этом целевой антиген представляет собой мутированную форму ракового антигена, экспрессируемого в или на поверхности раковой клетки, раковой ткани и/или в микроокружении опухоли.
[0028] В некоторых вариантах осуществления экспрессия гена, который ослабляет функцию иммунной клетки, вызывает одно или более из следующего:
i) ингибирование пролиферации иммунной клетки;
ii) индукция клеточной гибели иммунной клетки;
iii) ингибирование способности иммунной клетки распознавать целевой антиген и/или активироваться;
iv) индукция дифференцировки иммунной клетки в клетку, которая не индуцирует иммунный ответ на целевой антиген;
v) ослабление реакций иммунной клетки на молекулу, которая способствует иммунному ответу иммунной клетки; или
vi) усиление реакций иммунной клетки на молекулу, которая подавляет иммунный ответ иммунной клетки.
[0029] В некоторых вариантах осуществления ген, который ослабляет функцию иммунной клетки, выбран из группы, состоящей из: PD1, PD-L1, CTLA4, TIM3, CEACAM (CEACAM-1, CEACAM-3 или CEACAM-5), LAG 3, VISTA, BTLA, TIGIT, LAIR1, CD160, CD96, MerTK, 2B4, FAS, CD45, PP2A, SHP1, SHP2, DGK-альфа, DGK-дзета, Cbl-b, Cbl-c, CD148, LRR1, TGFBR1, ИЛ-10RA, KLGR1, DNMT3A, и A2aR.
[0030] В некоторых вариантах осуществления ген, который ослабляет функцию иммунной клетки, усиливает реакции иммунной клетки на молекулу, которая подавляет иммунный ответ иммунной клетки.
[0031] В некоторых вариантах осуществления ген, который усиливает реакции иммунной клетки на молекулу, которая подавляет иммунный ответ иммунной клетки, кодирует рецептор или лиганд иммунной контрольной точки.
[0032] В некоторых вариантах осуществления рецептор или лиганд иммунной контрольной точки выбран из группы, состоящей из PD1, PD-L1, CTLA4, TIM3, CEACAM (CEACAM-1, CEACAM-3 или CEACAM-5), LAG 3, VISTA, BTLA, TIGIT, LAIR1, CD160, CD96, MerTK и 2B4.
[0033] В некоторых вариантах осуществления агент генетического разрушения снижает экспрессию гена в иммунной клетке, который ослабляет функцию иммунной клетки на по меньшей мере 30, 40, 50, 60, 70, 80, 90 или 95% по сравнению с иммунной клеткой в отсутствие агента генетического разрушения.
[0034] В некоторых вариантах осуществления агент генетического разрушения снижает экспрессию гена, который усиливает реакции иммунной клетки на молекулу, которая подавляет иммунный ответ иммунной клетки.
[0035] В некоторых вариантах осуществления агент генетического разрушения снижает экспрессию гена, который кодирует рецептор или лиганд иммунной контрольной точки.
[0036] В некоторых вариантах осуществления агент генетического разрушения снижает экспрессию гена, выбранного из группы, состоящей из: PD1, PD-L1, CTLA4, TIM3, CEACAM (CEACAM-1, CEACAM-3 или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, CD96, MerTK и 2B4.
[0037] В некоторых вариантах осуществления агент генетического разрушения снижает экспрессию гена, который ослабляет функцию иммунной клетки посредством РНК-интерференции (РНКи). В некоторых вариантах осуществления более чем один агент генетического разрушения снижает экспрессию гена, который ослабляет функцию иммунной клетки в иммунной клетке посредством РНКи.
[0038] В некоторых вариантах осуществления агенты генетического разрушения нацелены на один ген, который ослабляет функцию иммунной клетки, или нацелены на разные гены, которые ослабляют функцию иммунной клетки, причем первый агент генетического разрушения нацелен на первый ген, а второй агент генетического разрушения нацелен на второй ген или в любой их комбинации.
[0039] В некоторых вариантах осуществления РНКи опосредуется короткой шпилечной РНК (кшРНК). В некоторых вариантах осуществления РНКи опосредуется более чем одной кшРНК. В некоторых вариантах осуществления РНКи опосредуется двумя кшРНК.
[0040] В некоторых вариантах осуществления две кшРНК нацелены на PD-1. В некоторых вариантах осуществления первая кшРНК нацелена на PD-1, а вторая кшРНК нацелена на TIM-3. В некоторых вариантах осуществления первая кшРНК нацелена на PD-1, а вторая кшРНК нацелена на CTLA-4. В некоторых вариантах осуществления первая кшРНК нацелена на PD-1, а вторая кшРНК нацелена на LAG-3. В некоторых вариантах осуществления первая кшРНК нацелена на PD-1, а вторая кшРНК нацелена на TIGIT.
[0041] В некоторых вариантах осуществления иммунная клетка содержит нуклеотидные последовательности, которые кодируют кшРНК. В некоторых вариантах осуществления иммунная клетка содержит нуклеотидные последовательности, которые кодируют более одной кшРНК. В некоторых вариантах осуществления иммунная клетка содержит нуклеотидные последовательности, которые кодируют две кшРНК. Если не указано иное, используемые в данном документе термины «последовательность оснований» и «нуклеотидная последовательность» являются взаимозаменяемыми.
[0042] В некоторых вариантах осуществления нуклеотидные последовательности, кодирующие кшРНК, содержат последовательности, выбранные из группы, состоящей из SEQ ID NO: 2-219 и 238-267.
[0043] В некоторых вариантах осуществления нуклеотидные последовательности, кодирующие кшРНК, находятся в векторе.
[0044] В некоторых вариантах экспрессия разных кшРНК, соответственно, регулируется разными промоторами. В некоторых вариантах экспрессия двух разных кшРНК, соответственно, регулируется двумя разными промоторами. В некоторых вариантах осуществления два разных промотора представляют собой промоторы РНК-полимеразы III. В некоторых вариантах осуществления два промотора представляют собой промоторы U6. В некоторых вариантах осуществления промоторы U6 получают от разных видов. В некоторых вариантах осуществления два промотора ориентированы в разных направлениях относительно друг друга. Например, в определенном варианте осуществления промоторы ориентированы в направлении голова к голове. В другом варианте осуществления промоторы ориентированы в направлении хвост к хвосту.
[0045] В некоторых вариантах осуществления каждый из генетически сконструированного антигенного рецептора и агента генетического разрушения экспрессируется из вектора. В некоторых вариантах осуществления генетически сконструированный антигенный рецептор и агент генетического разрушения экспрессируются из одного и того же вектора.
[0046] В некоторых вариантах осуществления вектор представляет собой плазмидный вектор или вирусный вектор. В некоторых вариантах осуществления вирусный вектор представляет собой лентивирусный вектор или аденовирусный вектор. В некоторых вариантах осуществления лентивирусный вектор представляет собой ретровирусный вектор.
[0047] В некоторых вариантах осуществления иммунная клетка выбрана из группы, состоящей из Т-клетки и натуральной клетки-киллера (NK). В некоторых вариантах осуществления иммунная клетка представляет собой Т-клетку. В некоторых вариантах осуществления T-клетка представляет собой CD4+ T-клетку или CD8+ T-клетку.
[0048] В некоторых вариантах осуществления иммунная клетка содержит нуклеотидные последовательности, которые кодируют две кшРНК и CAR в одном и том же векторе. В некоторых вариантах осуществления каждая из двух кшРНК регулируется двумя разными промоторами РНК-полимеразы III, ориентированными в разных направлениях относительно друг друга. Например, в определенном варианте осуществления промоторы ориентированы в направлении голова к голове. В другом варианте осуществления промоторы ориентированы в направлении хвост к хвосту. В некоторых вариантах осуществления CAR нацелен на CD19, первая кшРНК нацелена на PD-1, а вторая кшРНК нацелена на TIGIT.
[0049] В другом аспекте в данном документе предложен способ получения иммунной клетки, включающий введение в иммунную клетку одновременно или последовательно в любом порядке:
(1) гена, кодирующего генетически сконструированный антигенный рецептор, который специфически связывается с целевым антигеном; и
(2) агента генетического разрушения, снижающего или способного снижать экспрессию в иммунной клетке гена, который ослабляет функцию иммунной клетки,
тем самым получая иммунную клетку, в которой экспрессируется генетически сконструированный антигенный рецептор, и снижается экспрессия гена, который ослабляет функцию иммунной клетки.
[0050] В некоторых вариантах осуществления генетически сконструированный антигенный рецептор представляет собой химерный антигенный рецептор (CAR) или Т-клеточный рецептор (TCR).
[0051] В некоторых вариантах осуществления генетически сконструированный антигенный рецептор представляет собой CAR. В некоторых вариантах осуществления CAR содержит внеклеточный антигенраспознающий домен, трансмембранный домен и внутриклеточной домен сигнальной трансдукции. В некоторых вариантах осуществления внеклеточный антигенраспознающий домен CAR специфически связывается с целевым антигеном.
[0052] В некоторых вариантах осуществления внутриклеточный домен сигнальной трансдукции CAR содержит внутриклеточный домен дзета-цепи CD3 (CD3ζ). В некоторых вариантах осуществления внутриклеточной домен сигнальной трансдукции CAR дополнительно содержит костимулирующую молекулу. В некоторых вариантах осуществления костимулирующая молекула выбрана из группы, состоящей из ICOS, 0X40, CD137 (4-1BB), CD27 и CD28. В некоторых вариантах осуществления костимулирующая молекула представляет собой CD137 (4-1BB). В некоторых вариантах осуществления костимулирующая молекула представляет собой CD28.
[0053] В некоторых вариантах осуществления генетически сконструированный антигенный рецептор представляет собой TCR. В некоторых вариантах осуществления TCR представляет собой моноклональный TCR (mTCR).
[0054] В некоторых вариантах осуществления целевой антиген экспрессируется в или на поверхности раковой клетки, раковой ткани и/или в микроокружении опухоли.
[0055] В некоторых вариантах осуществления целевой антиген выбран из группы, состоящей из:
5T4 (трофобластический гликопротеин), 707-AP, 9D7, AFP (α-фетопротеин), AlbZIP (андроген-индуцируемый bZIP), HPG1 (специфический к простате человека ген-1), α5β1-интегрина, α5β6-интегрина, α --метилацил-коэнзим А рацемазы, ART-4 (АДФ рибозилтрансферазы-4), B7H4 (ингибитор активации Т-клеток 1, содержащий вариабельный иммуноглобулиноподобный домен), BAGE-1 (В меланомный антиген-1), BCL-2 (В-клеточный ХЛЛ/лимфома-2), BING-4 ( WD-повтор домена 46), CA 15-3/CA 27-29 (муцин 1), CA 19-9 (раковый антиген 19-9), CA 72-4 (раковый антиген 72-4), CA125 (раковый антиген 125), кальретикулина, CAMEL (ЦТЛ-распознаваемый антиген на меланоме), CASP-8 (каспаза 8), катепсина B, катепсина L, CD19 (кластер дифференцировки 19), CD20, CD22, CD25, CD30, CD33, CD4, CD52, CD55, CD56, CD80, CEA (раковый эмбриональный антиген SG8), CLCA2 (канал-переносчик-2 для ионов хлора), CML28 (опухолевый антиген хронического миелолейкоза 28), коактозин-подобного белка, коллагена XXIII, COX-2 (циклооксигеназа-2), CT-9/BRD6 (раково-тестикулярный антиген 9), Cten (С-концевой тензиноподобный белок), циклина B1, циклина D1, cyp-B, CYPB1 (цитохром p450 семейство 1, подсемейство b, тип 1), DAM-10/MAGE-B1 (ассоциированный с меланомой антиген B1), DAM-6/MAGE-B2, EGFR/Her1 (рецептор эпидермального фактора роста), EMMPRIN (басигин), EpCam, EphA2 (эфрин-рецептор A2), EphA3, ErbB3 (рецептор тирозинкиназы 3 Erb-B2), EZH2 (усилитель субъединицы zeste гомолога 2 policomb-репрессивного комплекса 2), FGF-5 (фактор роста фибробластов 5), FN (фибронектин), Fra-1 (Fos-связанный антиген-1), G250/CAIX (карбоангидраза 9), GAGE-1 (G антиген-1), GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE-7b, GAGE-8, GDEP (ген, дифференциально экспрессируемый в простате), GnT-V (глюконаткиназа), gp100 (специфический для линии меланоцитов антиген GP100), GPC3 (глипикан-3), HAGE (спиральный антиген), HAST-2 (член 1 семейство сульфотрансферазы 1A), гепсина, Her2/neu/ErbB2 (Erb-B2 рецептор тирозинкиназы 2), HERV-K-MEL, HNE (медуллазин), гомеобокса NKX 3.1, HOM-TES-14/SCP-1, HOM-TES-85, HPV-E6, HPVE7, HST-2 (сиртуин-2), hTERT, iCE (каспаза 1), IGF-1R (рецептор инсулиноподобного фактора роста-1), ИЛ-13Ra2 (α-2-субъединица рецептора интерлейкина-13), ИЛ-2R (рецептор интерлейкина-2), ИЛ-5 (интерлейкин-5), незрелого рецептора ламинина, калликреина-2, калликреина-4, Ki67, KIAA0205 (лизофосфатидилглицерол-ацилтрансфераза 1), KK-LC-1 (антиген-1 рака легкого кита-кюсю (kita-kyushu)), KM-HN-1, LAGE-1 (L-антиген, член 1 семейства белков LAGE), ливина, MAGE-A1, MAGE-A10, MAGE-A12, MAGEA2, MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A9, MAGE-B1, MAGE-B10, MAGE-B16, MAGEB17, MAGE-B2, MAGE-B3, MAGE-B4, MAGE-B5, MAGE-B6, MAGE-C1, MAGE-C2, MAGE-C3, MAGE-D1, MAGE-D2, MAGE-D4, MAGE-E1, MAGE-E2, MAGE-F1, MAGE-H1, MAGEL2 (антиген меланомы семейства L2), маммаглобина A, MART-1/Melan-A (антиген меланомы, распознаваемый Т-клетками-1), MART-2, белка матрикса 22, MC1R (рецептор меланокортина-1 ), М-КСФ (макрофагальный колониестимулирующий фактор), мезотелина, MG50/PXDN (пероксидазина), MMP 11 (матриксная металлопротеиназа 11), MN/CA IX-антигена (карбоангидраза 9), MRP-3 (ассоциированный с множественной лекарственной устойчивостью белок-3), MUC1 (муцин 1), MUC2, NA88-A (псевдоген 1 VENT-подобного гомеобокса 2), N-ацетилглюкозаминилтрансферазы-V, Neo-PAP (нео-поли(А)-полимераза), NGEP (новый ген, экспрессируемый в простате), NMP22 (белок ядерного матрикса 22), NPM/ALK (нуклеофосмин), NSE (нейронспецифическая энолаза), NY-ESO-1, NY-ESO-B, OA1 (QTL-1 остеоартрита), OFA-iLRP (раково-эмбриональный антиген-незрелый рецептор ламинина), OGT (O-GlcNAc-трансфераза), OS-9 (лектин эндоплазматического ретикулюма), остеокальцина, остеопонтина, p15 (ингибитор CDK 2B), p53, PAGE-4 (семейство P-антигена, член-4), PAI-1 (ингибитор активатора плазминогена 1), PAI-2, PAP (простатическая кислая фосфатаза), PART-1 (транскрипт-1, регулируемый андрогеном простаты), PATE (белок-1, экспрессируемый простатой и яичками), PDEF (полученный из простаты фактор Ets), Pim-1-киназы (сайт-1 интеграции провирусов), Pin1 (пептидил-пролил-цис-транс-изомераза-1), POTE (экспрессируемый в простате, яичнике, яичке и плаценте), PRAME (преимущественно экспрессируемый антиген при меланоме), простеина, протеиназы-3, PSA (простат-специфический антиген), PSCA (антиген стволовых клеток простаты), PSGR (простат-специфический рецептор, связанный с G-белком), PSM, PSMA (простат-специфический мембранный антиген), RAGE-1 (ассоциированный с опухолью антиген почечных карцином), RHAMM/CD168, RU1 (почечный убиквитарный белок-1), RU2, SAGE (антиген саркомы), SART-1 (антиген-1 плоскоклеточной карциномы, распознаваемый Т-клетками), SART-2, SART-3, Sp17 (белок спермы 17), SSX-1 (член-1 семейства SSX), SSX-2/HOM-MEL-40, SSX-4, STAMP-1 (металлоредуктаза STEAP2), STEAP, сурвивина, сурвивина-213, TA-90 (опухоль-ассоциированный антиген-90), TAG-72 (опухоль-ассоциированный гликопротеин-72), TARP(белок TCRγ с альтернативной рамкой считывания), TGFb (трансформирующий фактор роста β), TGFbR11 (рецептор-11 трансформирующего фактора роста β), TGM-4 (трансглютаминаза 4), TRAG-3(ген-3 устойчивости к таксолу), TRG (γ-локус рецептора Т-клеток), TRP-1 (транзиторный рецепторный потенциал 1), TRP-2/6b, TRP-2/INT2, Trp-p8, тирозиназы, UPA (урокиназный активатор плазминогена), VEGF (фактор роста сосудистого эндотелия A), VEGFR-2/FLK-1, и WT1 (белок опухоли Вильмса 1). В некоторых вариантах осуществления целевой антиген представляет собой CD19 или CD22. В некоторых вариантах осуществления целевой антиген представляет собой CD19.
[0056] В некоторых вариантах осуществления целевой антиген представляет собой раковый антиген, экспрессия которого повышена в или на поверхности раковой клетки, раковой ткани и/или в микроокружении опухоли.
[0057] В некоторых вариантах осуществления целевой антиген выбран из группы, состоящей из:
α-актинина-4/m, ARTC1/m, bcr/abl, бета-катенина/m, BRCA1/m, BRCA2/m, CASP-5/m, CASP-8/m, CDC27/m, CDK4/m, CDKN2A/m, CML66, COA-1/m, DEK-CAN, EFTUD2/m, ELF2/m, ETV6-AML1, FN1/m, GPNMB/m, HLA-A*0201-R170I, HLA-A11/m, HLA-A2/m, HSP70-2M, KIAA0205/m, K-Ras/m, LDLR-FUT, MART2/m, ME1/m, MUM-1/m, MUM-2/m, MUM-3/m, миозина класса 1/m, neo-PAP/m, NFYC/m, N-Ras/m, OGT/m, OS-9/m, p53/m, Pml/RARa, PRDX5/m, PTPRX/m, RBAF600/m, SIRT2/m, SYTSSX-1, SYT-SSX-2, TEL-AML1, TGFbRII, и TPI/m; и при этом целевой антиген представляет собой мутированную форму ракового антигена, экспрессируемого в или на поверхности раковой клетки, раковой ткани и/или в микроокружении опухоли.
[0058] В некоторых вариантах осуществления экспрессия гена, который ослабляет функцию иммунной клетки, вызывает одно или более из следующего:
i) ингибирование пролиферации иммунной клетки;
ii) индукция клеточной гибели иммунной клетки;
iii) ингибирование способности иммунной клетки распознавать целевой антиген и/или активироваться;
iv) индукция дифференцировки иммунной клетки в клетку, которая не индуцирует иммунный ответ на целевой антиген;
v) ослабление реакций иммунной клетки на молекулу, которая способствует иммунному ответу иммунной клетки; или
vi) усиление реакций иммунной клетки на молекулу, которая подавляет иммунный ответ иммунной клетки.
[0059] В некоторых вариантах осуществления ген, который ослабляет функцию иммунной клетки, выбран из группы, состоящей из: PD1, PD-L1, CTLA4, TIM3, CEACAM (CEACAM-1, CEACAM-3 или CEACAM-5), LAG 3, VISTA, BTLA, TIGIT, LAIR1, CD160, CD96, MerTK, 2B4, FAS, CD45, PP2A, SHP1, SHP2, DGK-альфа, DGK-дзета, Cbl-b, Cbl-c, CD148, LRR1, TGFBR1, ИЛ-10RA, KLGR1, DNMT3A, и A2aR.
[0060] В некоторых вариантах осуществления ген, который ослабляет функцию иммунной клетки, усиливает реакции иммунной клетки на молекулу, которая подавляет иммунный ответ иммунной клетки.
[0061] В некоторых вариантах осуществления ген, который усиливает реакции иммунной клетки на молекулу, которая подавляет иммунный ответ иммунной клетки, кодирует рецептор или лиганд иммунной контрольной точки.
[0062] В некоторых вариантах осуществления рецептор или лиганд иммунной контрольной точки выбран из группы, состоящей из PD1, PD-L1, CTLA4, TIM3, CEACAM (CEACAM-1, CEACAM-3 или CEACAM-5), LAG 3, VISTA, BTLA, TIGIT, LAIR1, CD160, CD96, MerTK и 2B4.
[0063] В некоторых вариантах осуществления агент генетического разрушения снижает экспрессию гена в иммунной клетке, который ослабляет функцию иммунной клетки на по меньшей мере 30, 40, 50, 60, 70, 80, 90 или 95% по сравнению с иммунной клеткой в отсутствие агента генетического разрушения.
[0064] В некоторых вариантах осуществления агент генетического разрушения снижает экспрессию гена, который усиливает реакции иммунной клетки на молекулу, которая подавляет иммунный ответ иммунной клетки.
[0065] В некоторых вариантах осуществления агент генетического разрушения снижает экспрессию гена, который кодирует рецептор или лиганд иммунной контрольной точки.
[0066] В некоторых вариантах осуществления агент генетического разрушения снижает экспрессию гена, выбранного из группы, состоящей из: PD1, PD-L1, CTLA4, TIM3, CEACAM (CEACAM-1, CEACAM-3 или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, CD96, MerTK и 2B4.
[0067] В некоторых вариантах осуществления агент генетического разрушения снижает экспрессию гена, который ослабляет функцию иммунной клетки посредством РНК-интерференции (РНКи). В некоторых вариантах осуществления более чем один агент генетического разрушения снижает экспрессию гена, который ослабляет функцию иммунной клетки в иммунной клетке посредством РНКи.
[0068] В некоторых вариантах осуществления агенты генетического разрушения нацелены на один ген, который ослабляет функцию иммунной клетки, или нацелены на разные гены, которые ослабляют функцию иммунной клетки, причем первый агент генетического разрушения нацелен на первый ген, а второй агент генетического разрушения нацелен на второй ген или в любой их комбинации.
[0069] В некоторых вариантах осуществления РНКи опосредуется короткой шпилечной РНК (кшРНК). В некоторых вариантах осуществления РНКи опосредуется более чем одной кшРНК. В некоторых вариантах осуществления РНКи опосредуется двумя кшРНК.
[0070] В некоторых вариантах осуществления две кшРНК нацелены на PD-1. В некоторых вариантах осуществления первая кшРНК нацелена на PD-1, а вторая кшРНК нацелена на TIM-3. В некоторых вариантах осуществления первая кшРНК нацелена на PD-1, а вторая кшРНК нацелена на CTLA-4. В некоторых вариантах осуществления первая кшРНК нацелена на PD-1, а вторая кшРНК нацелена на LAG-3. В некоторых вариантах осуществления первая кшРНК нацелена на PD-1, а вторая кшРНК нацелена на TIGIT.
[0071] В некоторых вариантах осуществления иммунная клетка содержит нуклеотидные последовательности, которые кодируют кшРНК. В некоторых вариантах осуществления иммунная клетка содержит нуклеотидные последовательности, которые кодируют более одной кшРНК. В некоторых вариантах осуществления иммунная клетка содержит нуклеотидные последовательности, которые кодируют две кшРНК.
[0072] В некоторых вариантах осуществления нуклеотидные последовательности, кодирующие кшРНК, содержат последовательности, выбранные из группы, состоящей из SEQ ID NO: 2-219 и 238-267.
[0073] В некоторых вариантах осуществления нуклеотидные последовательности, кодирующие кшРНК, находятся в векторе.
[0074] В некоторых вариантах экспрессия разных кшРНК, соответственно, регулируется разными промоторами. В некоторых вариантах экспрессия двух разных кшРНК, соответственно, регулируется двумя разными промоторами. В некоторых вариантах осуществления два разных промотора представляют собой промоторы РНК-полимеразы III. В некоторых вариантах осуществления два промотора представляют собой промоторы U6. В некоторых вариантах осуществления промоторы U6 получают от разных видов. В некоторых вариантах осуществления два промотора ориентированы в разных направлениях относительно друг друга. Например, в определенном варианте осуществления промоторы ориентированы в направлении голова к голове. В другом варианте осуществления промоторы ориентированы в направлении хвост к хвосту.
[0075] В некоторых вариантах осуществления каждый из генетически сконструированного антигенного рецептора и агента генетического разрушения экспрессируется из вектора. В некоторых вариантах осуществления генетически сконструированный антигенный рецептор и агент генетического разрушения экспрессируются из одного и того же вектора.
[0076] В некоторых вариантах осуществления вектор представляет собой плазмидный вектор или вирусный вектор. В некоторых вариантах осуществления вирусный вектор представляет собой лентивирусный вектор или аденовирусный вектор. В некоторых вариантах осуществления лентивирусный вектор представляет собой ретровирусный вектор.
[0077] В некоторых вариантах осуществления иммунная клетка выбрана из группы, состоящей из Т-клетки и натуральной клетки-киллера (NK). В некоторых вариантах осуществления иммунная клетка представляет собой Т-клетку. В некоторых вариантах осуществления T-клетка представляет собой CD4+ T-клетку или CD8+ T-клетку.
[0078] В некоторых вариантах осуществления иммунная клетка содержит нуклеотидные последовательности, которые кодируют две кшРНК и CAR в одном и том же векторе. В некоторых вариантах осуществления каждая из двух кшРНК регулируется двумя разными промоторами РНК-полимеразы III, ориентированными в разных направлениях относительно друг друга. Например, в определенном варианте осуществления промоторы ориентированы в направлении голова к голове. В другом варианте осуществления промоторы ориентированы в направлении хвост к хвосту. В некоторых вариантах осуществления CAR нацелен на CD19, первая кшРНК нацелена на PD-1, а вторая нацелена на TIGIT.
[0079] В другом аспекте в данном документе предложена композиция, содержащая сконструированную иммунную клетку. В другом аспекте в данном документе предложена фармацевтическая композиция, содержащая иммунную клетку и фармацевтически приемлемый носитель.
[0080] В другом аспекте в данном документе предложен способ лечения, включающий введение субъекту, имеющему заболевание или патологические состояние, иммунной клетки или композиции. В некоторых вариантах осуществления генетически сконструированный антигенный рецептор специфически связывается с антигеном, связанным с заболеванием или патологическим состоянием. В некоторых вариантах осуществления заболевание или патологическое состояние представляет собой злокачественное новообразование или опухоль.
[0081] В другом аспекте в данном документе предложены иммунные клетки или композиции для применения при лечении заболевания или патологического состояния. В другом аспекте в данном документе предложено применение иммунной клетки или композиции в изготовлении лекарственного препарата для лечения заболевания или патологического состояния. В некоторых вариантах осуществления генетически сконструированный антигенный рецептор специфически связывается с антигеном, связанным с заболеванием или патологическим состоянием. В некоторых вариантах осуществления заболевание или патологическое состояние представляет собой злокачественное новообразование или опухоль.
Дополнительные неограничивающие варианты осуществления представлены ниже.
1. Вектор, содержащий:
последовательность оснований, кодирующую два типа коротких шпилечных РНК (кшРНК), которые ингибируют экспрессию по меньшей мере одного гена, ослабляющего функцию иммунных клеток, и
последовательность оснований, кодирующую химерный антигенный рецептор (CAR) или моноклональный Т-клеточный рецептор (mTCR).
2. Вектор по варианту осуществления 1, отличающийся тем, что экспрессия двух типов кшРНК характеризуется тем, что они, соответственно, регулируются двумя разными промоторами.
3. Вектор по варианту осуществления 2, отличающийся тем, что два промотора представляют собой промоторы РНК-полимеразы III.
4. Вектор по варианту осуществления 2, отличающийся тем, что два промотора представляют собой промоторы U6, полученные из разных видов.
5. Вектор по варианту осуществления 2, отличающийся тем, что два промотора ориентированы в разных направлениях относительно друг друга в векторе.
6. Вектор по варианту осуществления 1, отличающийся тем, что ген, ослабляющий функцию иммунных клеток, представляет собой рецептор или лиганд иммунной контрольной точки.
7. Вектор по варианту осуществления 6, отличающийся тем, что рецептор или лиганд иммунной контрольной точки выбран из группы, состоящей из PD1, PD-L1, CTLA4, TIM3, CEACAM (CEACAM-1, CEACAM-3 или CEACAM-5), LAG 3, VISTA, BTLA, TIGIT, LAIR1, CD160, CD96, MerTK и 2B4.
8. Вектор по варианту осуществления 1, отличающийся тем, что ген, ослабляющий функцию иммунных клеток, выбран из группы, состоящей из FAS, CD45, PP2A, SHIP1, SHIP2, DGK-альфа, DGK-дзета, Cbl-b, CD147, LRR1, TGFBR1, ИЛ-10R альфа, KLGR1, DNMT3A и A2aR.
9. Вектор по варианту осуществления 1, отличающийся тем, что два типа кшРНК нацелены на один ген, который ослабляет функцию иммунных клеток, или при этом два типа кшРНК нацелены на разные гены, которые ослабляют функцию иммунных клеток.
10. Вектор по варианту осуществления 1, отличающийся тем, что два типа кшРНК нацелены на PD-1.
11. Вектор по варианту осуществления 1, отличающийся тем, что из двух типов кшРНК i) одна кшРНК нацелена на PD-1, а вторая кшРНК нацелена на TIM-3, или ii) одна кшРНК нацелена на PD-1, а вторая кшРНК нацелена на TIGIT.
12. Вектор по варианту осуществления 1, отличающийся тем, что из двух типов кшРНК последовательность оснований, кодирующая одну кшРНК, содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 2-219, и последовательность оснований, кодирующую вторую кшРНК, содержит другую последовательность, выбранную из группы, состоящей из SEQ ID NO: 2-219.
13. Вектор по варианту осуществления 1, отличающийся тем, что мишень для CAR или mTCR представляет собой опухолевый антиген человека, экспрессия которого повышена в раковой клетке, раковой ткани и/или микроокружении опухоли, или мутантную форму антигена, обнаруженную в раковой клетке, раковой ткани и/или микроокружении опухоли.
14. Вектор согласно варианту осуществления 1, отличающийся тем, что вектор содержит последовательность оснований SEQ ID NO: 220 или 221.
15. Вектор по варианту осуществления 1, отличающийся тем, что вектор представляет собой плазмидный вектор, лентивирусный вектор, аденовирусный вектор, вектор на основе аденоассоциированного вируса или ретровирусный вектор.
16. Иммунная клетка, содержащая вектор в соответствии с вариантом осуществления 1, отличающаяся тем, что экспрессия одного или более генов снижена до 40% или менее, чем их экспрессия в отсутствие кшРНК.
17. Иммунная клетка по варианту осуществления 16, отличающаяся тем, что иммунная клетка представляет собой человеческую Т-клетку или натуральную клетку-киллер (NK).
18. Фармацевтическая композиция, содержащая иммунную клетку по любому из вариантов осуществления 1-17.
19. Фармацевтическая композиция по варианту осуществления 18 для лечения пациента, нуждающегося в иммунной терапии, отличающаяся тем, что иммунную клетку первоначально получают от пациента.
20. Фармацевтическая композиция по варианту осуществления 19, отличающаяся тем, что у пациента имеется опухоль или злокачественное новообразование, при которых обнаруживается мишень и/или увеличение или изменение уровней мишени CAR или mTCR, экспрессируемых в иммунной клетке.
21. Иммунная клетка, содержащая генетически сконструированный антигенный рецептор, который специфически связывается с целевым антигеном, и агент генетического разрушения, снижающий или способный снижать экспрессию в иммунной клетке гена, который ослабляет функцию иммунной клетки.
22. Иммунная клетка по варианту осуществления 21, отличающаяся тем, что генетически сконструированный антигенный рецептор представляет собой химерный антигенный рецептор (CAR) или Т-клеточный рецептор (TCR).
23. Иммунная клетка по варианту осуществления 22, отличающаяся тем, что генетически сконструированный антигенный рецептор представляет собой CAR.
24. Иммунная клетка по варианту осуществления 23, отличающаяся тем, что CAR содержит внеклеточный антигенраспознающий домен, трансмембранный домен и внутриклеточной домен сигнальной трансдукции.
25. Иммунная клетка по варианту осуществления 24, отличающаяся тем, что внеклеточный антигенраспознающий домен CAR специфически связывается с целевым антигеном.
26. Иммунная клетка по варианту осуществления 24, отличающаяся тем, что внутриклеточный домен сигнальной трансдукции CAR содержит внутриклеточный домен дзета-цепи CD3 (CD3ζ).
27. Иммунная клетка по варианту осуществления 26, отличающаяся тем, что внутриклеточной домен сигнальной трансдукции CAR дополнительно содержит костимулирующую молекулу.
28. Иммунная клетка по варианту осуществления 27, отличающаяся тем, что костимулирующая молекула выбрана из группы, состоящей из ICOS, 0X40, CD137 (4-1BB), CD27, и CD28.
29. Иммунная клетка по варианту осуществления 28, отличающаяся тем, что костимулирующая молекула представляет собой CD137 (4-1BB).
30. Иммунная клетка по варианту осуществления 28, отличающаяся тем, что костимулирующая молекула представляет собой CD28.
31. Иммунная клетка по варианту осуществления 22, отличающаяся тем, что генетически сконструированный антигенный рецептор представляет собой TCR.
32. Иммунная клетка по варианту осуществления 31, отличающаяся тем, что TCR представляет собой моноклональный TCR (mTCR).
33. Иммунная клетка по варианту осуществления 31 или 32, отличающаяся тем, что целевой антиген экспрессируется в или на поверхности раковой клетки, раковой ткани и/или в микроокружении опухоли.
34. Иммунная клетка по варианту осуществления 33, отличающаяся тем, что целевой антиген выбран из группы, состоящей из:
5T4 (трофобластический гликопротеин), 707-AP, 9D7, AFP (α-фетопротеин), AlbZIP (андроген-индуцируемый bZIP), HPG1 (специфический к простате человека ген-1), α5β1-интегрина, α5β6-интегрина, α --метилацил-коэнзим А рацемазы, ART-4 (АДФ рибозилтрансферазы-4), B7H4 (ингибитор активации Т-клеток 1, содержащий вариабельный иммуноглобулиноподобный домен), BAGE-1 (В меланомный антиген-1), BCL-2 (В-клеточный ХЛЛ/лимфома-2), BING-4 ( WD-повтор домена 46), CA 15-3/CA 27-29 (муцин 1), CA 19-9 (раковый антиген 19-9), CA 72-4 (раковый антиген 72-4), CA125 (раковый антиген 125), кальретикулина, CAMEL (ЦТЛ-распознаваемый антиген на меланоме), CASP-8 (каспаза 8), катепсина B, катепсина L, CD19 (кластер дифференцировки 19), CD20, CD22, CD25, CD30, CD33, CD4, CD52, CD55, CD56, CD80, CEA (раковый эмбриональный антиген SG8), CLCA2 (канал-переносчик-2 для ионов хлора), CML28 (опухолевый антиген хронического миелолейкоза 28), коактозин-подобного белка, коллагена XXIII, COX-2 (циклооксигеназа-2), CT-9/BRD6 (раково-тестикулярный антиген 9), Cten (С-концевой тензиноподобный белок), циклина B1, циклина D1, cyp-B, CYPB1 (цитохром p450 семейство 1, подсемейство b, тип 1), DAM-10/MAGE-B1 (ассоциированный с меланомой антиген B1), DAM-6/MAGE-B2, EGFR/Her1 (рецептор эпидермального фактора роста), EMMPRIN (басигин), EpCam, EphA2 (эфрин-рецептор A2), EphA3, ErbB3 (рецептор тирозинкиназы 3 Erb-B2), EZH2 (усилитель субъединицы zeste гомолога 2 policomb-репрессивного комплекса 2), FGF-5 (фактор роста фибробластов 5), FN (фибронектин), Fra-1 (Fos-связанный антиген-1), G250/CAIX (карбоангидраза 9), GAGE-1 (G антиген-1), GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE-7b, GAGE-8, GDEP (ген, дифференциально экспрессируемый в простате), GnT-V (глюконаткиназа), gp100 (специфический для линии меланоцитов антиген GP100), GPC3 (глипикан-3), HAGE (спиральный антиген), HAST-2 (член 1 семейство сульфотрансферазы 1A), гепсина, Her2/neu/ErbB2 (Erb-B2 рецептор тирозинкиназы 2), HERV-K-MEL, HNE (медуллазин), гомеобокса NKX 3.1, HOM-TES-14/SCP-1, HOM-TES-85, HPV-E6, HPVE7, HST-2 (сиртуин-2), hTERT, iCE (каспаза 1), IGF-1R (рецептор инсулиноподобного фактора роста-1), ИЛ-13Ra2 (α-2-субъединица рецептора интерлейкина-13), ИЛ-2R (рецептор интерлейкина-2), ИЛ-5 (интерлейкин-5), незрелого рецептора ламинина, калликреина-2, калликреина-4, Ki67, KIAA0205 (лизофосфатидилглицерол-ацилтрансфераза 1), KK-LC-1 (антиген-1 рака легкого кита-кюсю (kita-kyushu)), KM-HN-1, LAGE-1 (L-антиген, член 1 семейства белков LAGE), ливина, MAGE-A1, MAGE-A10, MAGE-A12, MAGEA2, MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A9, MAGE-B1, MAGE-B10, MAGE-B16, MAGEB17, MAGE-B2, MAGE-B3, MAGE-B4, MAGE-B5, MAGE-B6, MAGE-C1, MAGE-C2, MAGE-C3, MAGE-D1, MAGE-D2, MAGE-D4, MAGE-E1, MAGE-E2, MAGE-F1, MAGE-H1, MAGEL2 (антиген меланомы семейства L2), маммаглобина A, MART-1/Melan-A (антиген меланомы, распознаваемый Т-клетками-1), MART-2, белка матрикса 22, MC1R (рецептор меланокортина-1 ), М-КСФ (макрофагальный колониестимулирующий фактор), мезотелина, MG50/PXDN (пероксидазина), MMP 11 (матриксная металлопротеиназа 11), MN/CA IX-антигена (карбоангидраза 9), MRP-3 (ассоциированный с множественной лекарственной устойчивостью белок-3), MUC1 (муцин 1), MUC2, NA88-A (псевдоген 1 VENT-подобного гомеобокса 2), N-ацетилглюкозаминилтрансферазы-V, Neo-PAP (нео-поли(А)-полимераза), NGEP (новый ген, экспрессируемый в простате), NMP22 (белок ядерного матрикса 22), NPM/ALK (нуклеофосмин), NSE (нейронспецифическая энолаза), NY-ESO-1, NY-ESO-B, OA1 (QTL-1 остеоартрита), OFA-iLRP (раково-эмбриональный антиген-незрелый рецептор ламинина), OGT (O-GlcNAc-трансфераза), OS-9 (лектин эндоплазматического ретикулюма), остеокальцина, остеопонтина, p15 (ингибитор CDK 2B), p53, PAGE-4 (семейство P-антигена, член-4), PAI-1 (ингибитор активатора плазминогена 1), PAI-2, PAP (простатическая кислая фосфатаза), PART-1 (транскрипт-1, регулируемый андрогеном простаты), PATE (белок-1, экспрессируемый простатой и яичками), PDEF (полученный из простаты фактор Ets), Pim-1-киназы (сайт-1 интеграции провирусов), Pin1 (пептидил-пролил-цис-транс-изомераза-1), POTE (экспрессируемый в простате, яичнике, яичке и плаценте), PRAME (преимущественно экспрессируемый антиген при меланоме), простеина, протеиназы-3, PSA (простат-специфический антиген), PSCA (антиген стволовых клеток простаты), PSGR (простат-специфический рецептор, связанный с G-белком), PSM, PSMA (простат-специфический мембранный антиген), RAGE-1 (ассоциированный с опухолью антиген почечных карцином), RHAMM/CD168, RU1 (почечный убиквитарный белок-1), RU2, SAGE (антиген саркомы), SART-1 (антиген-1 плоскоклеточной карциномы, распознаваемый Т-клетками), SART-2, SART-3, Sp17 (белок спермы 17), SSX-1 (член-1 семейства SSX), SSX-2/HOM-MEL-40, SSX-4, STAMP-1 (металлоредуктаза STEAP2), STEAP, сурвивина, сурвивина-213, TA-90 (опухоль-ассоциированный антиген-90), TAG-72 (опухоль-ассоциированный гликопротеин-72), TARP(белок TCRγ с альтернативной рамкой считывания), TGFb (трансформирующий фактор роста β), TGFbR11 (рецептор-11 трансформирующего фактора роста β), TGM-4 (трансглютаминаза 4), TRAG-3(ген-3 устойчивости к таксолу), TRG (γ-локус рецептора Т-клеток), TRP-1 (транзиторный рецепторный потенциал 1), TRP-2/6b, TRP-2/INT2, Trp-p8, тирозиназы, UPA (урокиназный активатор плазминогена), VEGF (фактор роста сосудистого эндотелия A), VEGFR-2/FLK-1, и WT1 (белок опухоли Вильмса 1).
35. Иммунная клетка по варианту осуществления 35, отличающаяся тем, что целевой антиген представляет собой CD19 или CD22.
36. Иммунная клетка по варианту осуществления 36, отличающаяся тем, что целевой антиген представляет собой CD19.
37. Иммунная клетка по любому из вариантов осуществления 34-36, отличающаяся тем, что целевой антиген представляет собой раковый антиген, экспрессия которого повышена в или на поверхности раковой клетки, раковой ткани и/или в микроокружении опухоли.
38. Иммунная клетка по варианту осуществления 33, отличающаяся тем, что целевой антиген выбран из группы, состоящей из:
α-актинина-4/m, ARTC1/m, bcr/abl, бета-катенина/m, BRCA1/m, BRCA2/m, CASP-5/m, CASP-8/m, CDC27/m, CDK4/m, CDKN2A/m, CML66, COA-1/m, DEK-CAN, EFTUD2/m, ELF2/m, ETV6-AML1, FN1/m, GPNMB/m, HLA-A*0201-R170I, HLA-A11/m, HLA-A2/m, HSP70-2M, KIAA0205/m, K-Ras/m, LDLR-FUT, MART2/m, ME1/m, MUM-1/m, MUM-2/m, MUM-3/m, миозина класса 1/m, neo-PAP/m, NFYC/m, N-Ras/m, OGT/m, OS-9/m, p53/m, Pml/RARa, PRDX5/m, PTPRX/m, RBAF600/m, SIRT2/m, SYTSSX-1, SYT-SSX-2, TEL-AML1, TGFbRII, и TPI/m; и
при этом целевой антиген представляет собой раковый антиген, который представляет собой мутированную форму антигена, экспрессируемого в или на поверхности раковой клетки, раковой ткани и/или в микроокружении опухоли.
39. Иммунная клетка по любому из вариантов осуществления 21-38, отличающаяся тем, что экспрессия гена, который ослабляет функцию иммунной клетки, вызывает одно или более из следующего:
i) ингибирование пролиферации иммунной клетки;
ii) индукция клеточной гибели иммунной клетки;
iii) ингибирование способности иммунной клетки распознавать целевой антиген и/или подвергаться активации;
iv) индукция дифференцировки иммунной клетки в клетку, которая не индуцирует иммунный ответ на целевой антиген;
v) ослабление реакций иммунной клетки на молекулу, которая способствует иммунному ответу иммунной клетки; или
vi) усиление реакции иммунной клетки на молекулу, которая подавляет иммунный ответ иммунной клетки.
40. Иммунная клетка по варианту осуществления 39, отличающаяся тем, что ген, который ослабляет функцию иммунной клетки, выбран из группы, состоящей из: PD1, PD-L1, CTLA4, TIM3, CEACAM (CEACAM-1, CEACAM-3 или CEACAM-5), LAG 3, VISTA, BTLA, TIGIT, LAIR1, CD160, CD96, MerTK, 2B4, FAS, CD45, PP2A, SHP1, SHP2, DGK-альфа, DGK-дзета, Cbl-b, Cbl-c, CD148, LRR1, TGFBR1, ИЛ-10RA, KLGR1, DNMT3A, и A2aR.
41. Иммунная клетка по варианту осуществления 39, отличающаяся тем, что где ген, который ослабляет функцию иммунной клетки, усиливает реакцию иммунной клетки на молекулу, которая подавляет иммунный ответ иммунной клетки.
42. Иммунная клетка по варианту осуществления 41, отличающаяся тем, что ген, который усиливает реакцию иммунной клетки на молекулу, которая подавляет иммунный ответ иммунной клетки, кодирует рецептор или лиганд иммунной контрольной точки.
43. Иммунная клетка по варианту осуществления 42, отличающаяся тем, что рецептор или лиганд иммунной контрольной точки выбран из группы, состоящей из PD1, PD-L1, CTLA4, TIM3, CEACAM (CEACAM-1, CEACAM-3 или CEACAM-5), LAG 3, VISTA, BTLA, TIGIT, LAIR1, CD160, CD96, MerTK и 2B4.
44. Иммунная клетка по любому из вариантов осуществления 21-43, отличающаяся тем, что агент генетического разрушения снижает экспрессию гена в иммунной клетке, который ослабляет функцию иммунной клетки на по меньшей мере 30, 40, 50, 60, 70, 80, 90 или 95% по сравнению с иммунной клеткой в отсутствие агента генетического разрушения.
45. Иммунная клетка по варианту осуществления 44, отличающаяся тем, что агент генетического разрушения снижает экспрессию гена, который усиливает реакцию иммунной клетки на молекулу, которая подавляет иммунный ответ иммунной клетки.
46. Иммунная клетка по варианту осуществления 45, отличающаяся тем, что агент генетического разрушения снижает экспрессию гена, который кодирует рецептор или лиганд иммунной контрольной точки.
47. Иммунная клетка по варианту осуществления 46, отличающаяся тем, что агент генетического разрушения снижает экспрессию гена, выбранного из группы, состоящей из: PD1, PD-L1, CTLA4, TIM3, CEACAM (CEACAM-1, CEACAM-3 или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, CD96, MerTK, и 2B4.
48. Иммунная клетка по любому из вариантов осуществления 45-47, отличающаяся тем, что агент генетического разрушения снижает экспрессию гена, который ослабляет функцию иммунной клетки посредством РНК-интерференции (РНКи).
49. Иммунная клетка по варианту осуществления 48, отличающаяся тем, что более чем один агент генетического разрушения снижает экспрессию гена, который ослабляет функцию иммунной клетки в иммунной клетке посредством РНКи.
50. Иммунная клетка по варианту осуществления 49, отличающаяся тем, что агенты генетического разрушения нацелены на один ген, который ослабляет функцию иммунной клетки, или при этом различные агенты генетического разрушения нацелены на разные гены, которые ослабляют функцию иммунной клетки, например, при этом первый агент генетического разрушения нацелен на первый ген, а второй агент генетического разрушения нацелен на второй ген.
51. Иммунная клетка по любому из вариантов осуществления 48-50, отличающаяся тем, что РНКи опосредуется короткой шпилечной РНК (кшРНК).
52. Иммунная клетка по варианту осуществления 51, отличающаяся тем, что РНКи опосредуется более чем одной кшРНК.
53. Иммунная клетка по варианту осуществления 52, отличающаяся тем, что РНКи опосредуется двумя кшРНК.
54. Иммунная клетка по любому из вариантов осуществления 52-53, отличающаяся тем, что две кшРНК нацелены на PD-1.
55. Иммунная клетка по любому из вариантов осуществления 52-53, отличающаяся тем, что первая кшРНК нацелена на PD-1, а вторая кшРНК нацелена на TIM-3.
56. Иммунная клетка по любому из вариантов осуществления 52-53, отличающаяся тем, что первая кшРНК нацелена на PD-1, а вторая кшРНК нацелена на CTLA-4.
57. Иммунная клетка по любому из вариантов осуществления 52-53, отличающаяся тем, что первая кшРНК нацелена на PD-1, а вторая кшРНК нацелена на LAG-3.
58. Иммунная клетка по любому из вариантов осуществления 52-53, отличающаяся тем, что первая кшРНК нацелена на PD-1, а вторая кшРНК нацелена на TIGIT.
59. Иммунная клетка по любому из вариантов осуществления 51-58, отличающаяся тем, что иммунная клетка содержит нуклеотидные последовательности, которые кодируют кшРНК.
60. Иммунная клетка по варианту осуществления 59, отличающаяся тем, что иммунная клетка содержит нуклеотидные последовательности, которые кодируют более одной кшРНК.
61. Иммунная клетка по варианту осуществления 59, отличающаяся тем, что иммунная клетка содержит нуклеотидные последовательности, которые кодируют две кшРНК.
62. Иммунная клетка по любому из вариантов осуществления 59-61, отличающаяся тем, что нуклеотидная последовательность, кодирующая кшРНК, содержит нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2-219 и 238-267.
63. Иммунная клетка по любому из вариантов осуществления 59-62, отличающаяся тем, что нуклеотидная последовательность, кодирующая кшРНК, присутствует в векторе.
64. Иммунная клетка по любому из вариантов осуществления 63, отличающаяся тем, что экспрессия разных кшРНК регулируется разными промоторами.
65. Иммунная клетка по варианту осуществления 64, отличающаяся тем, что экспрессия двух разных кшРНК регулируется двумя разными промоторами.
66. Иммунная клетка по варианту осуществления 65, отличающаяся тем, что два разных промотора представляют собой промоторы РНК-полимеразы III.
67. Иммунная клетка по варианту осуществления 66, отличающаяся тем, что два промотора представляют собой промоторы U6.
68. Иммунная клетка по варианту осуществления 67, отличающаяся тем, что промоторы U6 получают из разных видов.
69. Иммунная клетка по любому из вариантов осуществления 65-68, отличающаяся тем, что два промотора ориентированы в разных направлениях относительно друг друга.
70. Иммунная клетка по любому из вариантов осуществления 21-69, отличающаяся тем, что каждый из генетически сконструированного антигенного рецептора и агента(ов) генетического разрушения экспрессируется из вектора.
71. Иммунная клетка по варианту осуществления 70, отличающаяся тем, что генетически сконструированный антигенный рецептор и агент(ы) генетического разрушения экспрессируются из одного и того же вектора.
72. Иммунная клетка по любому из вариантов осуществления 70-71, отличающаяся тем, что вектор представляет собой плазмидный вектор или вирусный вектор.
73. Иммунная клетка по варианту осуществления 72, отличающаяся тем, что вирусный вектор представляет собой лентивирусный вектор, аденовирусный вектор или вектор на основе аденоассоциированного вируса.
74. Иммунная клетка по варианту осуществления 73, отличающаяся тем, что лентивирусный вектор представляет собой ретровирусный вектор.
75. Иммунная клетка по любому из вариантов осуществления 21-74, отличающаяся тем, что иммунная клетка выбрана из группы, состоящей из Т-клетки и натуральной клетки-киллера (NK).
76. Иммунная клетка по варианту осуществления 75, отличающаяся тем, что иммунная клетка представляет собой Т-клетку.
77. Иммунная клетка по варианту осуществления 76, отличающаяся тем, что Т-клетка представляет собой CD4+ Т-клетку или CD8+ Т-клетку.
78. Иммунная клетка по любому из вариантов осуществления 76 или 77, отличающаяся тем, что иммунная клетка содержит нуклеотидные последовательности, которые кодируют две кшРНК и CAR или mTCR в одном и том же векторе.
79. Иммунная клетка по варианту осуществления 78, отличающаяся тем, что каждая из двух кшРНК регулируется двумя разными промоторами РНК-полимеразы III, ориентированными в разных направлениях относительно друг друга.
80. Иммунная клетка по варианту осуществления 79, отличающаяся тем, что CAR нацелен на CD19, первая кшРНК нацелена на PD-1, а вторая кшРНК нацелена на TIGIT.
81. Способ получения иммунной клетки, включающий введение в иммунную клетку одновременно или последовательно в любом порядке:
(1) гена, кодирующего генетически сконструированный антигенный рецептор, который специфически связывается с целевым антигеном; и
(2) агента генетического разрушения, причем агент генетического разрушения, или его экспрессия, снижает или способна снижать экспрессию в иммунной клетке гена, который ослабляет функцию иммунной клетки,
тем самым получая иммунную клетку, в которой экспрессируется генетически сконструированный антигенный рецептор, и снижается экспрессия гена, который ослабляет функцию иммунной клетки.
82. Способ по варианту осуществления 81, отличающийся тем, что генетически сконструированный антигенный рецептор представляет собой химерный антигенный рецептор (CAR) или Т-клеточный рецептор (TCR).
83. Способ по варианту осуществления 82, отличающийся тем, что генетически сконструированный антигенный рецептор представляет собой CAR.
84. Способ по варианту осуществления 83, отличающийся тем, что CAR содержит внеклеточный антигенраспознающий домен, трансмембранный домен и внутриклеточной домен сигнальной трансдукции.
85. Способ по варианту осуществления 84, отличающийся тем, что внеклеточный антигенраспознающий домен CAR специфически связывается с целевым антигеном.
86. Способ по варианту осуществления 84, отличающийся тем, что внутриклеточный домен сигнальной трансдукции CAR содержит внутриклеточный домен дзета-цепи CD3 (CD3ζ).
87. Способ по варианту осуществления 86, отличающийся тем, что внутриклеточной домен сигнальной трансдукции CAR дополнительно содержит костимулирующую молекулу.
88. Способ по варианту осуществления 87, отличающийся тем, что костимулирующая молекула выбрана из группы, состоящей из ICOS, 0X40, CD137 (4-1BB), CD27, и CD28.
89. Способ по варианту осуществления 88, отличающийся тем, что костимулирующая молекула представляет собой CD137 (4-1BB).
90. Способ по варианту осуществления 88, отличающийся тем, что костимулирующая молекула представляет собой CD28.
91. Способ по варианту осуществления 82, отличающийся тем, что генетически сконструированный антигенный рецептор представляет собой TCR.
92. Способ по варианту осуществления 91, отличающийся тем, что TCR представляет собой моноклональный TCR (mTCR).
93. Способ по любому из вариантов осуществления 81-92, отличающаяся тем, что целевой антиген экспрессируется в или на поверхности раковой клетки, раковой ткани и/или в микроокружении опухоли.
94. Способ по варианту осуществления 93, отличающийся тем, что целевой антиген выбран из группы, состоящей из:
5T4 (трофобластический гликопротеин), 707-AP, 9D7, AFP (α-фетопротеин), AlbZIP (андроген-индуцируемый bZIP), HPG1 (специфический к простате человека ген-1), α5β1-интегрина, α5β6-интегрина, α --метилацил-коэнзим А рацемазы, ART-4 (АДФ рибозилтрансферазы-4), B7H4 (ингибитор активации Т-клеток 1, содержащий вариабельный иммуноглобулиноподобный домен), BAGE-1 (В меланомный антиген-1), BCL-2 (В-клеточный ХЛЛ/лимфома-2), BING-4 ( WD-повтор домена 46), CA 15-3/CA 27-29 (муцин 1), CA 19-9 (раковый антиген 19-9), CA 72-4 (раковый антиген 72-4), CA125 (раковый антиген 125), кальретикулина, CAMEL (ЦТЛ-распознаваемый антиген на меланоме), CASP-8 (каспаза 8), катепсина B, катепсина L, CD19 (кластер дифференцировки 19), CD20, CD22, CD25, CD30, CD33, CD4, CD52, CD55, CD56, CD80, CEA (раковый эмбриональный антиген SG8), CLCA2 (канал-переносчик-2 для ионов хлора), CML28 (опухолевый антиген хронического миелолейкоза 28), коактозин-подобного белка, коллагена XXIII, COX-2 (циклооксигеназа-2), CT-9/BRD6 (раково-тестикулярный антиген 9), Cten (С-концевой тензиноподобный белок), циклина B1, циклина D1, cyp-B, CYPB1 (цитохром p450 семейство 1, подсемейство b, тип 1), DAM-10/MAGE-B1 (ассоциированный с меланомой антиген B1), DAM-6/MAGE-B2, EGFR/Her1 (рецептор эпидермального фактора роста), EMMPRIN (басигин), EpCam, EphA2 (эфрин-рецептор A2), EphA3, ErbB3 (рецептор тирозинкиназы 3 Erb-B2), EZH2 (усилитель субъединицы zeste гомолога 2 policomb-репрессивного комплекса 2), FGF-5 (фактор роста фибробластов 5), FN (фибронектин), Fra-1 (Fos-связанный антиген-1), G250/CAIX (карбоангидраза 9), GAGE-1 (G антиген-1), GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE-7b, GAGE-8, GDEP (ген, дифференциально экспрессируемый в простате), GnT-V (глюконаткиназа), gp100 (специфический для линии меланоцитов антиген GP100), GPC3 (глипикан-3), HAGE (спиральный антиген), HAST-2 (член 1 семейство сульфотрансферазы 1A), гепсина, Her2/neu/ErbB2 (Erb-B2 рецептор тирозинкиназы 2), HERV-K-MEL, HNE (медуллазин), гомеобокса NKX 3.1, HOM-TES-14/SCP-1, HOM-TES-85, HPV-E6, HPVE7, HST-2 (сиртуин-2), hTERT, iCE (каспаза 1), IGF-1R (рецептор инсулиноподобного фактора роста-1), ИЛ-13Ra2 (α-2-субъединица рецептора интерлейкина-13), ИЛ-2R (рецептор интерлейкина-2), ИЛ-5 (интерлейкин-5), незрелого рецептора ламинина, калликреина-2, калликреина-4, Ki67, KIAA0205 (лизофосфатидилглицерол-ацилтрансфераза 1), KK-LC-1 (антиген-1 рака легкого кита-кюсю (kita-kyushu)), KM-HN-1, LAGE-1 (L-антиген, член 1 семейства белков LAGE), ливина, MAGE-A1, MAGE-A10, MAGE-A12, MAGEA2, MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A9, MAGE-B1, MAGE-B10, MAGE-B16, MAGEB17, MAGE-B2, MAGE-B3, MAGE-B4, MAGE-B5, MAGE-B6, MAGE-C1, MAGE-C2, MAGE-C3, MAGE-D1, MAGE-D2, MAGE-D4, MAGE-E1, MAGE-E2, MAGE-F1, MAGE-H1, MAGEL2 (антиген меланомы семейства L2), маммаглобина A, MART-1/Melan-A (антиген меланомы, распознаваемый Т-клетками-1), MART-2, белка матрикса 22, MC1R (рецептор меланокортина-1 ), М-КСФ (макрофагальный колониестимулирующий фактор), мезотелина, MG50/PXDN (пероксидазина), MMP 11 (матриксная металлопротеиназа 11), MN/CA IX-антигена (карбоангидраза 9), MRP-3 (ассоциированный с множественной лекарственной устойчивостью белок-3), MUC1 (муцин 1), MUC2, NA88-A (псевдоген 1 VENT-подобного гомеобокса 2), N-ацетилглюкозаминилтрансферазы-V, Neo-PAP (нео-поли(А)-полимераза), NGEP (новый ген, экспрессируемый в простате), NMP22 (белок ядерного матрикса 22), NPM/ALK (нуклеофосмин), NSE (нейронспецифическая энолаза), NY-ESO-1, NY-ESO-B, OA1 (QTL-1 остеоартрита), OFA-iLRP (раково-эмбриональный антиген-незрелый рецептор ламинина), OGT (O-GlcNAc-трансфераза), OS-9 (лектин эндоплазматического ретикулюма), остеокальцина, остеопонтина, p15 (ингибитор CDK 2B), p53, PAGE-4 (семейство P-антигена, член-4), PAI-1 (ингибитор активатора плазминогена 1), PAI-2, PAP (простатическая кислая фосфатаза), PART-1 (транскрипт-1, регулируемый андрогеном простаты), PATE (белок-1, экспрессируемый простатой и яичками), PDEF (полученный из простаты фактор Ets), Pim-1-киназы (сайт-1 интеграции провирусов), Pin1 (пептидил-пролил-цис-транс-изомераза-1), POTE (экспрессируемый в простате, яичнике, яичке и плаценте), PRAME (преимущественно экспрессируемый антиген при меланоме), простеина, протеиназы-3, PSA (простат-специфический антиген), PSCA (антиген стволовых клеток простаты), PSGR (простат-специфический рецептор, связанный с G-белком), PSM, PSMA (простат-специфический мембранный антиген), RAGE-1 (ассоциированный с опухолью антиген почечных карцином), RHAMM/CD168, RU1 (почечный убиквитарный белок-1), RU2, SAGE (антиген саркомы), SART-1 (антиген-1 плоскоклеточной карциномы, распознаваемый Т-клетками), SART-2, SART-3, Sp17 (белок спермы 17), SSX-1 (член-1 семейства SSX), SSX-2/HOM-MEL-40, SSX-4, STAMP-1 (металлоредуктаза STEAP2), STEAP, сурвивина, сурвивина-213, TA-90 (опухоль-ассоциированный антиген-90), TAG-72 (опухоль-ассоциированный гликопротеин-72), TARP(белок TCRγ с альтернативной рамкой считывания), TGFb (трансформирующий фактор роста β), TGFbR11 (рецептор-11 трансформирующего фактора роста β), TGM-4 (трансглютаминаза 4), TRAG-3(ген-3 устойчивости к таксолу), TRG (γ-локус рецептора Т-клеток), TRP-1 (транзиторный рецепторный потенциал 1), TRP-2/6b, TRP-2/INT2, Trp-p8, тирозиназы, UPA (урокиназный активатор плазминогена), VEGF (фактор роста сосудистого эндотелия A), VEGFR-2/FLK-1, и WT1 (белок опухоли Вильмса 1).
95. Способ по варианту осуществления 95, отличающийся тем, что целевой антиген представляет собой CD19 или CD22.
96. Способ по варианту осуществления 96, отличающийся тем, что целевой антиген представляет собой CD19.
97. Способ по любому из вариантов осуществления 94-96, отличающийся тем, что целевой антиген представляет собой раковый антиген, при этом раковый антиген представляет собой антиген, экспрессия которого повышена в или на поверхности раковой клетки, раковой ткани и/или в микроокружении опухоли.
98. Способ по варианту осуществления 93, отличающийся тем, что целевой антиген выбран из группы, состоящей из:
α-актинина-4/m, ARTC1/m, bcr/abl, бета-катенина/m, BRCA1/m, BRCA2/m, CASP-5/m, CASP-8/m, CDC27/m, CDK4/m, CDKN2A/m, CML66, COA-1/m, DEK-CAN, EFTUD2/m, ELF2/m, ETV6-AML1, FN1/m, GPNMB/m, HLA-A*0201-R170I, HLA-A11/m, HLA-A2/m, HSP70-2M, KIAA0205/m, K-Ras/m, LDLR-FUT, MART2/m, ME1/m, MUM-1/m, MUM-2/m, MUM-3/m, миозина класса 1/m, neo-PAP/m, NFYC/m, N-Ras/m, OGT/m, OS-9/m, p53/m, Pml/RARa, PRDX5/m, PTPRX/m, RBAF600/m, SIRT2/m, SYTSSX-1, SYT-SSX-2, TEL-AML1, TGFbRII, и TPI/m; и
при этом целевой антиген представляет собой раковый антиген, причем раковый антиген представляет собой мутированную форму антигена, экспрессируемого в или на поверхности раковой клетки, раковой ткани и/или в микроокружении опухоли.
99. Способ по любому из вариантов осуществления 81-98, отличающийся тем, что экспрессия гена, который ослабляет функцию иммунной клетки, вызывает одно или более из следующего:
i) ингибирование пролиферации иммунной клетки;
ii) индукция клеточной гибели иммунной клетки;
iii) ингибирование способности иммунной клетки распознавать целевой антиген и/или активироваться;
iv) индукция дифференцировки иммунной клетки в клетку, которая не индуцирует иммунный ответ на целевой антиген;
v) ослабление реакции иммунной клетки на молекулу, которая способствует иммунному ответу иммунной клетки; или
vi) усиление реакции иммунной клетки на молекулу, которая подавляет иммунный ответ иммунной клетки.
100. Способ по варианту осуществления 99, отличающаяся тем, что ген, который ослабляет функцию иммунной клетки, выбран из группы, состоящей из: PD1, PD-L1, CTLA4, TIM3, CEACAM (CEACAM-1, CEACAM-3 или CEACAM-5), LAG 3, VISTA, BTLA, TIGIT, LAIR1, CD160, CD96, MerTK, 2B4, FAS, CD45, PP2A, SHP1, SHP2, DGK-альфа, DGK-дзета, Cbl-b, Cbl-c, CD148, LRR1, TGFBR1, ИЛ-10RA, KLGR1, DNMT3A, и A2aR.
101. Способ по варианту осуществления 99, отличающийся тем, что где ген, который ослабляет функцию иммунной клетки, усиливает реакцию иммунной клетки на молекулу, которая подавляет иммунный ответ иммунной клетки.
102. Способ по варианту осуществления 101, отличающийся тем, что ген, который усиливает реакцию иммунной клетки на молекулу, которая подавляет иммунный ответ иммунной клетки, кодирует рецептор или лиганд иммунной контрольной точки.
103. Способ по варианту осуществления 102, отличающийся тем, что рецептор или лиганд иммунной контрольной точки выбран из группы, состоящей из PD1, PD-L1, CTLA4, TIM3, CEACAM (CEACAM-1, CEACAM-3 или CEACAM-5), LAG 3, VISTA, BTLA, TIGIT, LAIR1, CD160, CD96, MerTK и 2B4.
104. Способ по любому из вариантов осуществления 81-103, отличающийся тем, что агент генетического разрушения снижает экспрессию гена в иммунной клетке, который ослабляет функцию иммунной клетки на по меньшей мере 30, 40, 50, 60, 70, 80, 90 или 95% по сравнению с иммунной клеткой в отсутствие агента(ов) генетического разрушения.
105. Способ по варианту осуществления 104, отличающийся тем, что агент генетического разрушения снижает экспрессию гена, который усиливает реакцию иммунной клетки на молекулу, которая подавляет иммунный ответ иммунной клетки.
106. Способ по варианту осуществления 105, отличающийся тем, что агент генетического разрушения снижает экспрессию гена, который кодирует рецептор или лиганд иммунной контрольной точки.
107. Способ по варианту осуществления 106, отличающийся тем, что агент генетического разрушения снижает экспрессию гена, выбранного из группы, состоящей из: PD1, PD-L1, CTLA4, TIM3, CEACAM (CEACAM-1, CEACAM-3 или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, CD96, MerTK, и 2B4.
108. Способ по любому из вариантов осуществления 105-107, отличающийся тем, что агент генетического разрушения снижает экспрессию гена, который ослабляет функцию иммунной клетки посредством РНК-интерференции (РНКи).
109. Способ по варианту осуществления 108, отличающийся тем, что более чем один агент генетического разрушения снижает экспрессию гена, который ослабляет функцию иммунной клетки в иммунной клетке посредством РНКи.
110. Способ по варианту осуществления 109, отличающийся тем, что агенты генетического разрушения нацелены на один ген, который ослабляет функцию иммунной клетки, или нацелены на разные гены, которые ослабляют функцию иммунной клетки, причем первый агент генетического разрушения нацелен на первый ген, а второй агент генетического разрушения нацелен на второй ген или в любой их комбинации.
111. Способ по любому из вариантов осуществления 108-110, отличающийся тем, что РНКи опосредуется короткой шпилечной РНК (кшРНК).
112. Способ по варианту осуществления 111, отличающийся тем, что РНКи опосредуется более чем одной кшРНК.
113. Способ по варианту осуществления 112, отличающийся тем, что РНКи опосредуется двумя кшРНК.
114. Способ по варианту осуществления 112 или 113, отличающийся тем, что две кшРНК нацелены на PD-1.
115. Способ по варианту осуществления 112 или 113, отличающийся тем, что первая кшРНК нацелена на PD-1, а вторая кшРНК нацелена на TIM-3.
116. Способ по варианту осуществления 112 или 113, отличающийся тем, что первая кшРНК нацелена на PD-1, а вторая кшРНК нацелена на CTLA-4.
117. Способ по варианту осуществления 112 или 113, отличающийся тем, что первая кшРНК нацелена на PD-1, а вторая кшРНК нацелена на LAG-3.
118. Способ по варианту осуществления 112 или 113, отличающийся тем, что первая кшРНК нацелена на PD-1, а вторая кшРНК нацелена на TIGIT.
119. Способ по любому из вариантов осуществления 111-118, отличающийся тем, что иммунная клетка содержит нуклеотидные последовательности, которые кодируют кшРНК.
120. Способ по варианту осуществления 119, отличающийся тем, что иммунная клетка содержит нуклеотидные последовательности, которые кодируют более одной кшРНК.
121. Способ по варианту осуществления 119, отличающийся тем, что иммунная клетка содержит нуклеотидные последовательности, которые кодируют две кшРНК.
122. Способ по любому из вариантов осуществления 119-121, отличающийся тем, что нуклеотидные последовательности, кодирующие кшРНК, содержат последовательности, выбранные из группы, состоящей из SEQ ID NO: 2-219 и 238-267.
123. Способ по любому из вариантов осуществления 119-122, отличающийся тем, что нуклеотидные последовательности, кодирующие кшРНК, присутствует в векторе.
124. Способ по варианту осуществления 123, отличающийся тем, что экспрессия разных кшРНК, соответственно, регулируется разными промоторами.
125. Способ по варианту осуществления 124, отличающийся тем, что экспрессия двух разных кшРНК, соответственно, регулируется двумя разными промоторами.
126. Способ по варианту осуществления 125, отличающийся тем, что два разных промотора представляют собой промоторы РНК-полимеразы III.
127. Способ по варианту осуществления 126, отличающийся тем, что два промотора представляют собой промоторы U6.
128. Способ по варианту осуществления 127, отличающийся тем, что промоторы U6 получают из разных видов.
129. Способ по любому из вариантов осуществления 125-128, отличающийся тем, что два промотора ориентированы в разных направлениях относительно друг друга.
130. Способ по любому из вариантов осуществления 81-129, отличающийся тем, что каждый из генетически сконструированного антигенного рецептора и агента(ов) генетического разрушения экспрессируется из вектора.
131. Способ по варианту осуществления 130, отличающийся тем, что генетически сконструированный антигенный рецептор и агент(ы) генетического разрушения экспрессируются из одного и того же вектора.
132. Способ по любому из вариантов осуществления 130-131, отличающийся тем, что вектор представляет собой плазмидный вектор или вирусный вектор.
133. Способ по варианту осуществления 132, отличающийся тем, что вирусный вектор представляет собой лентивирусный вектор, аденовирусный вектор или вектор на основе аденоассоциированного вируса.
134. Способ по варианту осуществления 133, отличающийся тем, что лентивирусный вектор представляет собой ретровирусный вектор.
135. Способ по любому из вариантов осуществления 81-134, отличающийся тем, что иммунная клетка выбрана из группы, состоящей из Т-клетки и натуральной клетки-киллера (NK).
136. Способ по варианту осуществления 135, отличающийся тем, что иммунная клетка представляет собой Т-клетку.
137. Способ по варианту осуществления 136, отличающийся тем, что Т-клетка представляет собой CD4+ T-клетку или CD8+ T-клетку.
138. Способ по любому из вариантов осуществления 136 или 137, отличающийся тем, что иммунная клетка содержит нуклеотидные последовательности, которые кодируют две кшРНК и CAR в одном и том же векторе.
139. Способ по варианту осуществления 138, отличающийся тем, что каждая из двух кшРНК регулируется двумя разными промоторами РНК-полимеразы III, ориентированными в разных направлениях относительно друг друга.
140. Способ по варианту осуществления 139, отличающийся тем, что CAR нацелен на CD19, первая кшРНК нацелена на PD-1, а вторая кшРНК нацелена на TIGIT.
141. Композиция, содержащая иммунную клетку по любому из вариантов осуществления 21-80.
142. Фармацевтическая композиция, содержащая иммунную клетку по любому из вариантов осуществления 21-80 и фармацевтически приемлемый носитель.
143. Способ лечения, включающий введение субъекту, имеющему заболевание или патологическое состояние, нуждающемуся в иммунотерапии, иммунной клетки по любому из вариантов осуществления 21-80 или композиции по варианту осуществления 141 или 142.
144. Способ по варианту осуществления 143, отличающийся тем, что генетически сконструированный антигенный рецептор специфически связывается с антигеном, связанным с заболеванием или патологическим состоянием.
145. Способ по варианту осуществления 143 или 144, отличающийся тем, что заболевание или патологическое состояние представляет собой злокачественное новообразование, например, опухоль.
146. Иммунная клетка по любому из вариантов осуществления 21-80 или композиция по вариантам осуществления 141-142 для применения при лечении заболевания или патологического состояния.
147. Применение иммунной клетки по любому из вариантов осуществления 21-80 или композиции по вариантам осуществления 121-122 в изготовлении лекарственного препарата для лечения заболевания или патологического состояния.
148. Иммунные клетки или композиция по варианту осуществления 146, или применение по варианту осуществления 147, отличающиеся тем, что генетически сконструированный антигенный рецептор специфически связывается с антигеном, связанным с заболеванием или патологическим состоянием.
149. Применение, композиция или иммунная клетка по варианту осуществления 147 или варианту осуществления 148, отличающиеся тем, что заболевание или патологическое состояние представляет собой злокачественное новообразование, например, опухоль.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0082] Фиг. 1A-1E. Генерация CAR-T-клеток с блокадой внутриклеточной части PD-1. (Фиг. 1A) Схема векторов CAR «два в одном». (Фиг. 1B-C) Экспрессию LNGFR и CAR анализировали через 4 суток после трансдукции. (Фиг. 1D) CAR-T-клетки сортировали с использованием магнитных гранул LNGFR и высевали при 2 × 105/мл. Совокупное количество CAR-Т-клеток оценивали при помощи окрашивания трипановым синим. (Фиг. 1E) LNGFR+ CAR T-клетки смешивали с γ-облученным NALM-6 без экзогенных цитокинов.
[0083] Фиг. 2. Влияние типов промотора Pol Ⅲ на блокаду внутриклеточной части PD-1.
[0084] Фиг. 3A-3B. In vitro цитотоксичность и пролиферация при стимуляции CD19 и PD-L1 с помощью блокады PD-1. (Фиг. 3А) LNGFR+ CAR-Т-клетки смешивают с живыми NALM-6 или NALM-6-PDL1 при соотношении E: T 1:1, 0,3:1, 0.1:1. (Фиг. 3В). LNGFR+ CAR-Т-клетки смешивали с γ-облученными NALM-6-PDL1, NALM-6-PDL1-CD80 или K562-CD19-PDL1 в соотношении E: T 1:1 без экзогенных цитокинов.
[0085] Фиг. 4. Противоопухолевая функция CAR-T-клеток in vivo с блокадой внутриклеточной части PD-1.
[0086] Фиг. 5A. Снижение выработки цитокинов in vivo при разрушении внутриклеточной части PD-1 в CAR-T-клетках. На Фиг. 5B показана замедленная in vivo экспансия CAR-T-клеток с разрушением внутриклеточной части PD-1.
[0087] Фиг. 6A-6B. Функция CD28/CD3ζ или 4-1BB/CD3ζ CAR-T-клеток в разрушении внутриклеточной части PD-1. (Фиг. 6А) Схема векторов G28z, GBBz, P28z и PBBz. (Фиг. 6В) Анализ методом проточной цитометрии, демонстрирующий экспрессию LNGFR трансдуцированных Т-клеток через 4 суток после трансдукции.
[0088] Фиг. 7A-7B. Уровень экспрессии PD-1 при костимуляции CD28 или 4-1BB. (Фиг. 7А) LNGFR+ CAR-Т-клетки инкубировали с γ-облученным NALM-6 или K562-CD19 без экзогенных цитокинов. Экспрессию PD-1 LNGFR+ CAR-Т-клетками анализировали через 3 суток после инкубации. (Фиг. 7B) Количественные результаты ПЦР в реальном времени, выполненные с праймерами PD-1.
[0089] Фиг. 8A-8B. Создание системы репортеров NFAT или NF-κB. (Фиг. 8A) Схема репортерных векторов NFAT-RE 3x-eGFP и NF-κB-RE 5x-eGFR. (Фиг. 8В) Изменение кратности репортерной активности, рассчитанное с использованием гСИФ eGFP LNGFR+ CAR-T-клеток.
[0090] Фиг. 9A-9B. Активированный сигналинг NFAT при костимуляции CD28, но не при костимуляции 4-1BB. (Фиг. 9А) Репортер-трансдуцированные Т-клетки повторно стимулировали и трансдуцировали G28z или GBBz. (Фиг. 9B) Уровень мРНК целевых генов NFAT в CAR-клетках оценивали при помощи кПЦР.
[0091] Фиг. 10. Активированный сигналинг NF-κB при костимуляции CD28 и 4-1BB.
[0092] Фиг. 11A-11C. Интенсивность сигналинга ТФР-β G28z CART немного выше BBz CART. (Фиг. 11А) Фосфорилированный SMAD2/3 в CAR-T-клетках анализировали с помощью проточной цитометрии с внутриклеточным окрашиванием после инкубации с NALM-6 в соотношении клеток E: T 1:1 в течение 4 часов или 24 часов. (Фиг. 11В) Анализ методом проточной цитометрии, демонстрирующий экспрессию PD-1 в G28z и GBBz CAR T-клетках с 10 нг/мл рекомбинантного человеческого ТФР-β1. (Фиг. 11C) Уровень мРНК ТФР-β1, TGFBR1 и TGFBR2 в CAR-T-клетках оценивали при помощи кПЦР.
[0093] Фиг. 12A-12B. Сохраняет цитотоксичность и пролиферативную способность in vitro PBBz CAR-Т-клеток при повторной стимуляции CD19 и PD-L1. (Фиг. 12А) Цитотоксичность. Вверху, после магнитной сортировки LNGFR, 12-суточные первичные LNGFR+ CAR-T-клетки были смешаны с NALM-6-PDL1 в соотношении E: T 1:1, 0,3:1, 0,1:1. Внизу LNGFR+ CAR-T-клетки стимулировали γ-облученным K562-CD19-PDL1 в соотношении E: T 1:1. (Фиг. 12В) LNGFR+ CAR Т-клетки многократно стимулировали в смеси с γ-облученными NALM-6-PDL1-CD80 или K562-CD19-PDL1 в соотношении E: T 1:1 без экзогенных цитокинов.
[0094] Фиг.13A-13C. Менее чувствительны к опосредованной ТФР-бета дисфункции и слабо генерируется в in vitro регуляторными Т-клетками, полученными из CARТ, в PBBz CAR-Т-клетках. (Фиг. 13A) Опосредованное ТФР-бета подавление пролиферации CAR-T. (Фиг. 13B) Чувствительность к ТФР-бета для индукции Трег. (Фиг. 13C) Влияние PDL1/PD-1 на индукцию Трег.
[0095] Фиг. 14. Непрерывное ингибирование прогрессирования лейкоза PBBz CAR-T-клетками.
[0096] Фиг. 15. Диаграмма состава двух типов векторов, кодирующих два типа кшРНК, один из которых ингибирует экспрессию PD-1, а второй из которых ингибирует экспрессию TIM-3, и кассету экспрессии CD19 CAR.
[0097] Фиг. 16. Схема процесса получения CAR-T-клеток, в которой клетки δLNGFR-CART19/mU6-shTIM-3 →← shPD-1-hU6 и клетки δLNGFR-CART19/shTIM-3-mU6←→hU6-shPD-1 были получены и выделены как описано в данном документе.
[0098] Фиг. 17. Данные проточной цитометрии от CAR-T-клеток, содержащих векторы, проиллюстрированные на Фиг. 15 (клетки δLNGFR-CART19/mU6-shTIM-3→←shPD-1-hU6 и клетки δLNGFR-CART19/shTIM-3-mU6←→hU6-shPD-1).
[0099] Фиг. 18A-18B. Фиг. 18A. Данные проточной цитометрии для клеток δLNGFR-CART19/mU6-shTIM-3→←shPD-1-hU6 и клеток δLNGFR-CART19/shTIM-3-mU6←→hU6-shPD-1, полученных с использованием способов в Примере 8. Фиг. 18В. Экспрессия PD-1 и TIM-3 в CAR-T-клетках.
[00100] Фиг. 19. Данные проточной цитометрии, в которой CAR-T-клетки многократно стимулировали с использованием целевых клеток, после чего степень дифференцировки клеток подтверждали с использованием антител к CD45RA и CCR7.
[00101] Фиг. 20A-20C. Оценка CAR-T-клеток, полученных с использованием способов в Примере 8. Фиг. 20А: эффективность трансдукции. Фиг. 20B: способность к пролиферации. Фиг. 20C: Жизнеспособность.
[00102] Фиг. 21A-21C. Селекция кшРНК, нацеленных на CTLA-4, LAG-3, TIGIT и TIM-3. Фиг. 21А: 2-суточные CD3/CD28-стимулированные Т-клетки электропорируют 21-мерными киРНК, нацеленными на CTLA-4, LAG-3, TIGIT и TIM-3. киРНК-опосредованная эффективность нокдауна была подтверждена через 2 суток после трансфекции. Штриховка: на основе последовательности выбранных киРНК были сконструированы векторы «два в одном», экспрессирующие CAR и кшРНК. Штриховка указывает на первоначально выбранные киРНК. Фиг. 21B: Т-клетки трансдуцировали векторами «два в одном», содержащими кшРНК, нацеленными на CTLA-4, LAG-3, TIGIT или TIM-3, и сортировали с помощью магнитных гранул LNGFR. Количество LNGFR+ CAR-Т-клеток измеряли каждые 3 суток после высева при 2 × 105/мл. Фиг. 21C: Экспрессия Tim3 (%).
[00103] Фиг. 22A-22E. Генерация CAR-Т-клеток с разрушением двух иммунных контрольных точек. (Фиг. 22A) Схема двойных векторов «два в одном». Фиг. 22B: % LNGFR+ T-клеток анализировали через 4 суток после трансдукции двойным вектором «два в одном». (Фиг. 22C) CAR-T-клетки с двойным KD (нокдаун) сортировали и высевали при 2 × 105/мл. Совокупное количество CAR-Т-клеток измеряли при помощи окрашивания трипановым синим. (Фиг. 22D-22E) Экспрессию LAG-4, PD-1, TIGIT или TIM-3 в LNGFR+ CAR-T-клетках анализировали через 3 суток после γ-облучения совместной культуры NALM-6 или K562-CD19. Экспрессию CTLA-4 анализировали с помощью проточной цитометрии с внутриклеточным окрашиванием.
[00104] Фиг. 23. Лечение CD19+ гемобластоза in vivo с использованием CAR-T-клеток с двойным KD, нацеленных на две иммунные контрольные точки.
[00105] Фиг. 24. Лечение рака на модели солидной опухоли с использованием CAR-T-клеток с двойным KD, нацеленных на PD-1 и TIGIT.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[00106] Особенности данного описания изложены, в частности, в прилагаемой формуле изобретения. Лучшее понимание особенностей и преимуществ данного изобретения будет получено на основе следующего подробного описания, в котором изложены иллюстративные варианты осуществления, в которых используются принципы изобретения. Для облегчения полного понимания описания, изложенного в данном документе, ниже приведен ряд терминов.
[00107] Вкратце, в одном аспекте в данном документе описаны векторы, содержащие: последовательность оснований, кодирующую два типа коротких шпилечных РНК (кшРНК), которые ингибируют экспрессию одного или более генов, которые ослабляют функцию иммунных клеток, включая рецепторы и лиганды иммунных контрольных точек, и последовательность оснований, кодирующую антигенный рецептор, такой как химерный антигенный рецептор (CAR) или Т-клеточный рецептор (TCR), например, моноклональный Т-клеточный рецептор (mTCR); иммунная клетка, содержащая генетически сконструированный антигенный рецептор, который специфически связывается с целевым антигеном, и один или более агентов генетического разрушения, которые снижают или способны снижать экспрессию в иммунной клетке гена или генов, которые ослабляют функцию иммунной клетки; способы получения иммунной клетки; композиция или фармацевтическая композиция, содержащая иммунные клетки, например, для иммунотерапии пациентов-людей; и способ лечения, включающий введение иммунной клетки субъекту, имеющему заболевание или патологическое состояние. Поскольку иммунная клетка, композиция или фармацевтическая композиция содержат один или более агентов генетического разрушения, например, кодируют две кшРНК, которые снижают экспрессию двух генов молекул иммунных контрольных точек, которые могут активироваться раковыми клетками для ослабления функции иммунных клеток, можно устранить серьезные и системные нежелательные явления, такие как синдром высвобождения цитокинов или симптомы аутоиммунных заболеваний, которые могут возникнуть в результате использования отдельного ингибитора для этих генов, а также снизить нагрузку из-за увеличения стоимости лечения в результате дорогостоящих аналогичных способов терапии, при этом обеспечивая более эффективную клеточную терапию, чем в тех случаях, когда экспрессируется только одна кшРНК.
1. Общие методики
[00108] Методики и процедуры, описанные в данном документе или на которые он ссылается, включают те, которые в целом хорошо известны и/или обычно применяются с использованием традиционной методологии специалистами в данной области техники, такие как, например, широко используемые методологии, описанные в Sambrook et al., Molecular Cloning: A Laboratory Manual (4th ed. 2012); Current Protocols in Molecular Biology (Ausubel et al. eds., 2003); Therapeutic Monoclonal Antibodies: From Bench to Clinic (An ed. 2009); Monoclonal Antibodies: Methods and Protocols (Albitar ed. 2010); и Antibody Engineering том 1 и 2 (Kontermann and Dübel eds., 2nd ed. 2010). Molecular Biology of the Cell (6th Ed., 2014).
2. Определения
[00109] Если не указано иное, все технические и научные термины, употребляемые в данном документе, имеют такое же значение, которое обычно понимается специалистом в данной области техники. В целях интерпретации этого описания применяется следующее описание терминов и во всех случаях, когда это целесообразно, термины, употребляемые в единственном числе, также включают множественное число и наоборот. Все патенты, заявки, опубликованные заявки и другие публикации в полном объеме включены посредством ссылки. В случае, когда какое-либо из приведенных описаний терминов противоречит любому документу, включенному в данный документ посредством ссылки, приоритет имеет описание термина, приведенное ниже.
[00110] Термины, используемые в данном описании, используются только для объяснения конкретных вариантов осуществления и не предназначены для ограничения объема данного изобретения. Выражения в единственном числе, если в контексте не указано иное, включают выражения во множественном числе. Следует понимать, что данное изобретение не ограничено конкретной методологией, протоколами, реагентами и т. п., описанными в данном документе, поскольку таковые могут изменяться. Используемая в данном документе терминология применяется только для описания конкретных вариантов осуществления и не предназначена для ограничения объема данного изобретения, который определен исключительно формулой изобретения.
[00111] В контексте данного документа форма единственного числа используется в данном документе для обозначения одного или более чем одного (т. е. по меньшей мере одного) грамматического объекта. В качестве примера, «элемент» означает один элемент или более одного элемента.
[00112] Использование альтернативы (например, «или») следует понимать как означающее один из вариантов, оба варианта или любую из комбинаций в качестве альтернативы.
[00113] Термин «и/или» следует понимать как означающий или одну, или обе альтернативы.
[00114] В контексте данного документа термин «около» или «приблизительно» относится к численности, уровню, значению, числу, частоте, проценту, величине, размеру, количеству, массе или длине, которые варьируются вплоть до 15%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2% или 1% по сравнению с эталонной численностью, уровнем, значением, числом, частотой, процентом, величиной, размером, количеством, массой или длиной. В одном варианте осуществления термин «около» или «приблизительно» относится к диапазону количества, уровня, значения, числа, частоты, процента, величины, размера, количества, массы или длины в ± 15%, ± 10%, ± 9%, ± 8%, ± 7%, ± 6%, ± 5%, ± 4%, ± 3%, ± 2% или ± 1% относительно эталонной численности, уровня, значения, числа, частоты, процента, величины, размера, количества, веса или длины.
[00115] В тексте этого описания отсылка к «одному варианту осуществления», «варианту осуществления», «конкретному варианту осуществления», «связанному варианту осуществления», «определенному варианту осуществления», «дополнительному варианту осуществления» или «еще одному варианту осуществления» или их комбинации или подобному означает, что конкретные признак, структура или характеристика, описанные в связи с этим вариантом осуществления, включены по меньшей мере в один вариант осуществления данного изобретения. Таким образом, появления вышеупомянутых фраз в различных местах в этом описании необязательно все относятся к одному и тому же варианту осуществления. Кроме того, конкретные признаки, структуры или характеристики могут быть подходящим образом скомбинированы в одном или более вариантах осуществления.
[00116] «Конструкт» относится к макромолекуле или комплексу молекул, содержащих полинуклеотид, для доставки в целевую клетку или in vitro или in vivo. В контексте данного документа термин «вектор» относится к любому конструкту нуклеиновой кислоты, способной направлять доставку или перенос чужеродного генетического материала в целевые клетки, где он может быть реплицирован и/или экспрессирован. В контексте данного документа термин «вектор» содержит конструкт, подлежащий доставке. Вектор может представлять собой линейную или кольцевую молекулу. Вектор может быть интегрирующим или неинтегрирующим. Основные типы векторов включают, но не ограничиваются ими, плазмиды, эписомальный вектор, вирусные векторы, космиды и искусственные хромосомы. Вирусные векторы включают, но не ограничиваются ими, аденовирусный вектор, вектор на основе аденоассоциированного вируса, ретровирусный вектор, лентивирусный вектор, вектор на основе вируса Сендай и тому подобное.
[00117] Вектор «два в одном», как описано в данном документе, представляет собой вектор, который содержит последовательность оснований, кодирующую одну или более коротких шпилечных РНК (кшРНК), которые ингибируют экспрессию гена или генов, которые ослабляют функцию иммунных клеток, и последовательность оснований, кодирующую химерный антигенный рецептор (CAR) или Т-клеточный рецептор, например, моноклональный Т-клеточный рецептор (mTCR). Двойной вектор «два в одном», как описано в данном документе, представляет собой вектор, который содержит последовательность оснований, кодирующую два типа коротких шпилечных РНК (кшРНК), которые ингибируют экспрессию генов, которые ослабляют функцию иммунных клеток, и последовательность оснований, кодирующую любой из химерного антигенного рецептора (CAR) и Т-клеточного рецептора, например, моноклонального Т-клеточного рецептора (mTCR). Двойные векторы «два в одном», описанные в данном документе, представляют собой форму вектора «два в одном».
[00118] «РНКи» (также известный как посттранскрипционный сайленсинг генов (PTGS), подавление или косупрессия) представляет собой процесс посттранскрипционного сайленсинга генов, в котором молекулы РНК специфическим для последовательности образом ингибируют экспрессию генов, как правило, вызывая разрушение специфических молекул мРНК. Активные компоненты РНКи представляют собой короткие/маленькие двухцепочечные РНК (дцРНК), называемые короткими интерферирующими РНК (киРНК), которые, как правило, содержат 15-30 нуклеотидов (например, 19-25, 19-24 или 19-21 нуклеотидов) и 2-нуклеотидных 3'-липких конца и соответствует последовательности нуклеиновой кислоты целевого гена. Эти виды коротких РНК могут естественным образом продуцироваться in vivo с помощью Dicer-опосредованного расщепления более крупных дцРНК, и они являются функциональными в клетках млекопитающих. Плазмиды экспрессии ДНК могут быть использованы для стабильной экспрессии дуплексов киРНК или дцРНК согласно данному описанию в клетках и достижения длительного ингибирования экспрессии целевого гена. В одном аспекте смысловая и антисмысловая цепи дуплекса киРНК обычно связаны короткой спейсерной последовательностью, приводящей к экспрессии структуры типа «стебель-петля», называемой короткой шпилечной РНК (кшРНК). Шпилька распознается и расщепляется Dicer, таким образом генерируя зрелые молекулы киРНК.
[00119] Термин «кшРНК» относится к молекуле РНК, в которой некоторые самокомплементарные последовательности образуют плотную шпилечную структуру со своим стеблем. Молекула РНК может иметь длину около 80 п.о. Когда кшРНК экспрессируется в клетке, она проходит через серию стадий, превращаясь в короткую интерферирующую РНК (киРНК), которая действует в качестве гида для сайленсинга генов. Не вдаваясь в подробности, когда экспрессируется кшРНК, она процессируется комплексами Drosha в клетке, превращаясь в пре-кшРНК, которая затем транспортируется за пределы ядра, где она подвергается дальнейшему процессингу при помощи Dicer для превращения в киРНК, а затем переходит в одноцепочечное состояние и загружается в RISC-комплекс (РНК-индуцируемый сайленсинг-комплекс). При этом антисмысловая цепь киРНК действует в качестве гида для RISC-комплекса, что присоединиться к мРНК целевого гена, и когда комплекс RISC, который присоединен таким образом, разрезает мРНК, то происходит сайленсинг гена. Поскольку кшРНК в целевом гене обеспечивает сайленсинг гена, который сохраняется и специфичен в отношении определенного гена, она включена в вектор с целью ингибирования целевого гена.
[00120] Термин «промотор» относится к расположенной против хода транскрипции области гена, участвующей в начале транскрипции гена. Описанные выше два типа кшРНК также обуславливают регуляцию экспрессии промотором. При этом экспрессия двух типов кшРНК может быть охарактеризована тем, что они регулируются двумя разными промоторами, соответственно. Если клонирование происходит с идентичными последовательностями оснований с использованием повторяющихся вставок, то весьма вероятно, что надлежащее клонирование не произойдет из-за связывания между этими идентичными последовательностями оснований, что приведет к рекомбинации или делеции. Промоторы могут представлять собой промотор РНК-полимеразы I, промотор РНК-полимеразы II или промотор РНК-полимеразы III, в зависимости от того, какая РНК-полимераза присоединяется к промотору и начинает транскрипцию. Два указанных выше промотора могут быть охарактеризованы тем, что они представляют собой промоторы РНК-полимеразы III (далее промотор pol III). Промоторы Pol III могут быть сделаны так, чтобы точно транскрибироваться от 5'-конца к 3'-концу без присоединения кэпа на 5'-конце или поли(A)-хвоста на 3'-конце РНК, которая транскрибируется с регуляцией промотором. Типы промотора pol III включают, но не ограничиваются ими, промотор U6, промотор H1 и промотор 7SK и т.д.
[00121] В контексте данного документа термин «G28z» относится к конструкту, который содержит кассету экспрессии shGFP, костимулирующий домен CD28 и домен CD3ζ (Фиг. 6A). Более конкретно, в термине «G28z» «G» обозначает shGFP; «28» обозначает CD28; «z» обозначает CD3ζ. Следуя той же схеме, термин «P28z», используемый в данном документе, относится к конструкту, который содержит кассету экспрессии shPD-1, костимулирующий домен CD28 и домен CD3ζ (Фиг. 6A), где «P» обозначает shPD-1, «28» обозначает «CD28 », а «z» обозначает CD3ζ. В контексте данного документа термин «GBBz» относится к конструкту, который содержит кассету экспрессии shGFP, костимулирующий домен 4-1BB и домен CD3ζ (Фиг. 6A), где «G» обозначает shGFP; «BB» обозначает 4-1BB; «z» обозначает CD3ζ. Используемый в данном документе термин «PBBz» относится к конструкту, который содержит кассету экспрессии shPD-1, костимулирующий домен 4-1BB и домен CD3ζ (Фиг. 6A), где «P» обозначает shPD-1; «BB» обозначает 4-1BB; «z» обозначает CD3ζ.
[00122] «CAR», как правило, представляет собой набор полипептидов, которые, когда они присутствуют на иммунной клетке, вызывают специфичность иммунной клетки к целевой клетке (как правило, раковой клетке), вызывая при этом сигнальную трансдукцию в клетке. Как минимум, CAR содержит внеклеточный антигенраспознающий домен, который распознает целевой антиген, который будет описан ниже, трансмембранный домен и внутриклеточной домен сигнальной трансдукции, причем внутриклеточной домен сигнальной трансдукции получен из стимулирующих молекул или костимулирующих молекул, которые будут описаны ниже. Набор, содержащий полипептиды, может быть присоединен или может иметь форму, в которой они присоединяются через переключатель, который димеризуется посредством стимуляции. Стимулирующая молекула может представлять собой дзета-цепь TCR, описанную выше. «CD19 CAR» представляет собой CAR, который нацелен на раковый антиген CD19.
[00123] В контексте данного документа термин «Т-клеточный рецептор (TCR)» относится к белковому рецептору на Т-клетках, который состоит из гетеродимера цепи альфа (α) и бета (β), хотя в некоторых клетках TCR состоит из цепи гамма и дельта (γ/δ). В некоторых вариантах осуществления TCR может быть модифицирован, например, в любой клетке, содержащей TCR, включая вспомогательную T-клетку, цитотоксическую T-клетку, T-клетку памяти, регуляторную T-клетку, натуральный T-киллер и гамма/дельта T-клетку.
[00124] В контексте данного документа термин «моноклональный Т-клеточный рецептор (mTCR)» относится к Т-клеточному рецептору (TCR), который генетически модифицирован для специфического нацеливания на определенный антиген. Его также можно назвать антигенспецифическим TCR. Сообщается, что Т-клетки, имеющие mTCR, используются в иммунотерапии, такой как адоптивная Т-клеточная терапия, для вирусной инфекции и злокачественного новообразования. В некоторых аспектах в качестве стратегии для получения Т-клеток с определенной антигенспецифичностью был использован ретровирусный перенос химерных конструктов на основе одноцепочечных антител (scFv). По большей части химерные конструкты scFv были связаны с внутриклеточными сигнальными доменами FcR-гамма или CD3-дзета для индукции эффекторной функции Т-клеток. Домен CD3-дзета был объединен с сигнальными доменами костимулирующих молекул, таких как CD28, 4-1BB или OX40. Моноклональные T-клеточные рецепторы (mTCR) и их применения в терапии злокачественного новообразования описаны в Stauss et al., 2007, Molecular Therapy, 15(10):1744-50, Zhang and Morgan, 2012, Advanced Drug Delivery Reviews, 64(8): 756-762, и Liddy et al., 2012, Nature Medicine, 18(6):980-7, содержание каждого из которых включено в данный документ посредством ссылки во всей своей полноте.
[00125] В контексте данного документа термин «δLNGFR» относится к LNGFR (низкоаффинному рецептору фактора роста нервов) без цитоплазматического домена, используемого для очистки клеток, в которых имеет место описанная выше вставка.
[00126] «Иммунная клетка» может быть охарактеризована в данном документе как выбранная, но не ограничиваясь этим, из лимфоцитов, таких как Т-киллеры, Т-хелперы, гамма/дельта Т-клетки и В-клетки, натуральные киллеры, тучные клетки, эозинофилы, базофилы; и фагоцитарные клетки включают макрофаги, нейтрофилы и дендритные клетки. Т-клетки включают CD4+ T-клетки и CD8+ T-клетки.
[00127] В контексте данного документа термины «Т-лимфоцит» и «Т-клетка» используются взаимозаменяемо и относятся к основному типу лейкоцитов, который завершает созревание в тимусе и который выполняет различные функции в иммунной системе, включая идентификацию специфических чужеродных антигенов в организме и активацию и дезактивацию других иммунных клеток. Т-клетка может представлять собой любую Т-клетку, такую как культивируемая Т-клетка, например, первичная Т-клетка или Т-клетка из культивируемой линии Т-клеток, например, Jurkat, SupT1 и т.д., или Т-клетка, полученная от млекопитающего. Т-клетка может представлять собой CD3+ клетки. Т-клетка может представлять собой любой тип Т-клетки и может иметь любую стадию развития, включая, но не ограничиваясь этим, CD4+/CD8+ дважды положительные Т-клетки, CD4+ Т-хелперы (например, Th1- и Th2-клетки), CD8+ Т-клетки (например, цитотоксические Т-клетки), мононуклеарные клетки периферической крови (МКПК), лейкоциты периферической крови (PBL), инфильтрирующие опухоли лимфоциты (TIL), T-клетки памяти, наивные T-клетки, регуляторные T-клетки, гамма/дельта T-клетки (γδ T-клетки), и тому подобное. Дополнительные типы Т-хелперов включают клетки, такие как Th3- (Treg), Th17-, Th9- или Tfh-клетки. Дополнительные типы T-клеток памяти включают такие клетки, как T-клетки центральной памяти (Tcm-клетки), эффекторные T-клетки памяти (Tem-клетки и TEMRA-клетки). Т-клетка также может относиться к генетически сконструированной Т-клетке, такой как Т-клетка, модифицированная для экспрессии Т-клеточного рецептора (TCR) или химерного антигенного рецептора (CAR). Т-клетка также может быть дифференцирована из стволовой клетки или клетки-предшественника.
[00128] «CD4+ T-клетки» относится к субпопуляции T-клеток, которые экспрессируют CD4 на своей поверхности и связаны с клеточно-опосредованным иммунным ответом. Они характеризуются профилями секреции после стимуляции, которые могут включать секрецию цитокинов, таких как ИФН-гамма, ФНО-альфа, ИЛ-2, ИЛ-4 и ИЛ-10. «CD4» представляют собой гликопротеины массой 55 кДа, первоначально определяемые как антигены дифференцировки на Т-лимфоцитах, но также обнаруживаемые в других клетках, включая моноциты/макрофаги. Антигены CD4 являются членами семейства супергенов иммуноглобулинов и участвуют в качестве элементов ассоциативного распознавания в ограниченных ГКГС класса II (главный комплекс гистосовместимости) иммунных реакциях. На Т-лимфоцитах они определяют субпопуляцию хелпер/индуктор.
[00129] «CD8+ T-клетки» относится к субпопуляции T-клеток, которые экспрессируют CD8 на своей поверхности, ограничены по ГКГС класса I и функционируют как цитотоксические T-клетки. Молекулы «CD8» являются дифференцировочными антигенами, обнаруженными на тимоцитах и цитотоксических Т-лимфоцитах и Т-супрессорах. Антигены CD8 являются членами семейства супергенов иммуноглобулинов и являются элементами ассоциативного распознавания во взаимодействиях, ограниченных главным комплексом гистосовместимости класса I.
[00130] В контексте данного документа термин «NK-клетка» или «натуральная клетка-киллер» относится к субпопуляции лимфоцитов периферической крови, определяемой по экспрессии CD56 или CD16 и отсутствием Т-клеточного рецептора (CD3). В контексте данного документа термины «адаптивная NK-клетка» и «NK-клетка памяти» являются взаимозаменяемыми и относятся к субпопуляции NK-клеток с CD3- и CD56+ фенотипом, экспрессирующим по меньшей мере один из NKG2C и CD57 и, необязательно, CD16, но не экспрессирующим один или более из следующего: PLZF, SYK, FceRɣ и EAT-2. В некоторых вариантах осуществления выделенные субпопуляции CD56+ NK-клеток включают экспрессию CD16, NKG2C, CD57, NKG2D, лигандов NCR, NKp30, NKp40, NKp46, активирующих и ингибирующих KIR, NKG2A и/или DNAM-1. CD56+ может быть слабо или сильно экспрессироваться.
[00131] В контексте данного документа термин «иммунные контрольные точки» относится к молекулам, которые существуют в иммунной системе и способны включать или выключать иммунный ответ. Первоначально они являются защитным механизмом для регуляции чрезмерной активации иммунных клеток, которая вызывает гибель клеток или аутоиммунный ответ. Эти молекулы иммунных контрольных точек могут быть в целом разделены на молекулы стимулирующих иммунных контрольных точек, которые усиливают иммунный ответ, и молекулы ингибирующих иммунных контрольных точек, которые ингибируют иммунный ответ. Например, рецептор и лиганды иммунной контрольной точки могут быть выбраны из группы, состоящей из PD1 (белок программируемой клеточной смерти 1), PD-L1 (лиганд-1 белка программируемой клеточной гибели), CTLA4 (цитотоксический Т-лимфоцит-ассоциированный белок 4), TIM- 3 (белок 3, содержащий домены T-клеточного иммуноглобулина и муцина), CEACAM (молекула адгезии клеток, связанная с раковым эмбриональным антигеном, включая три подтипа CEACAM-1, CEACAM-3 или CEACAM-5), LAG3 (ген активации лимфоцитов-3), VISTA (V-доменный супрессор активации Т-клеток), BTLA (B- и T-лимфоцитарный аттенюатор), TIGIT (T-клеточный иммунорецептор с доменами Ig и ITIM), LAIR1 (связанный с лейкоцитами иммуноглобулин-подобный рецептор 1), CD160 (кластер дифференцировки 160), CD96 (кластер дифференцировки 96), MerTK (протоонкогенная тирозинпротеинкиназа MER) и 2B4 (лиганд, индуцирующий активацию NK-клеток), и, например, могут быть выбраны между PD1 и TIM3.
[00132] Термин «культура» или «клеточная культура» относится к поддержанию, росту и/или дифференцировке клеток в условиях in vitro. «Среда для культивирования клеток», «среда для культивирования» (в каждом отдельном случае «среда»), «добавка» и «добавка к среде» относятся к питательным композициям, в которых культивируют клеточные культуры. Термин «культивировать» или «поддерживать» относится к поддержанию, размножению (росту) и/или дифференцировке клеток вне ткани или тела, например, в стерильной пластиковой (или покрытой пластиком) чашке Петри или колбе для культивирования клеток. Для «культивирования» или «поддержания» можно использовать среду для культивирования в качестве источника питательных веществ, гормонов и/или других факторов, полезных для размножения и/или поддержания клеток.
[00133] «Фармацевтическая композиция» для иммунотерапии пациентов-людей, описанная в данном документе, содержит иммунные клетки. Поскольку очевидно, что в дополнение к клеткам к фармацевтической композиции могут быть добавлены другие фармацевтически приемлемые соли, носители, вспомогательные вещества, наполнители, и другие добавки и т. д., которые могут дополнительно улучшить иммунный ответ, подробное их описание будет опущено.
[00134] Термин «субъект» относится к любому животному (например, млекопитающему), включая, но не ограничиваясь этим, людей, приматов, псовых, кошачьих, грызунов, и тому подобное, которое должно быть получателем конкретного лечения. Как правило, термины «субъект» и «пациент» используются в данном документе взаимозаменяемо по отношению к субъекту-человеку.
[00135] Термины «лечение» или «лечить» относятся к подавлению, устранению, уменьшению и/или ослаблению симптома, тяжести симптома и/или частоте появления симптома заболевания, подлежащего лечению. Используемые здесь термины «лечат», «лечение» и «процесс лечения» также относятся к уменьшению или ослаблению прогрессирования, тяжести и/или продолжительности заболевания или патологического состояния, возникающего в результате применения одного или более способов лечения.
[00136] «Эффективное количество» или «терапевтически эффективное количество» используются в данном документе взаимозаменяемо и относятся к количеству соединения, препарата, материала или композиции, например, Т-клеток, как описано в данном документе, эффективному для достижения конкретного биологического результата. Такие результаты могут включать, но не ограничиваются ими, ингибирование злокачественного новообразования, определяемое любыми способами, подходящими для использования в данной области техники.
[00137] Термины «вводить» или «введение» относятся к действию, состоящему в инъекции или ином варианте физической доставки вещества в том виде, в котором оно существует за пределами организма, в организм пациента, например, путем мукозальной, интрадермальной, внутривенной, внутримышечной доставки, и/или любому другому способу физической доставки, описанному в данном документе или известному в данной области техники.
3. Векторы «два в одном», нацеленные на одну или более иммунных контрольных точек
[00138] Опухолевые клетки экспрессируют различные иммунные контрольные точки, например, лиганды контрольных точек. Следовательно, даже если одна иммунная контрольная точка ингибируется, может быть трудно ожидать устойчивого эффекта CAR-T из-за активации других иммунных контрольных точек. Комбинацию моноклональных антител в основном использовали для подавления множества иммунных контрольных точек, и о ее противоопухолевом эффекте сообщалось постоянно (J Clin Invest., 2015, Chauvin JM; PNAS, 2010, Curran MA; Blood, 2018, Wierz M; Cancer cell. 2014, Johnston RJ). Однако было известно, что терапевтические антитела могут систематически индуцировать избыточный иммунный ответ. Кроме того, CAR-T-клеточная терапия также связана с угрожающим жизни синдромом высвобождения цитокинов (CRS) и нейротоксичностью (Nat Rev Clin Oncol, 2017, Neelapu SS), предполагая, что комбинация CAR-T терапии и терапии антителами может максимизировать потенциальные побочные эффекты. Кроме того, традиционные аналогичные способы терапии иммунными клетками возлагают на пациентов еще большое экономическое бремя из-за их высокой стоимости и того, что они также воздействуют на Т-клетки, отличные от CAR-T, и создают риск возникновения симптомов аутоиммунных заболеваний и синдрома высвобождения цитокинов. Данное изобретение было разработано для решения вышеуказанных проблем.
[00139] В одном варианте осуществления в данном документе предложен вектор «два в одном», причем вектор содержит: последовательность оснований, кодирующую один или более типов коротких шпилечных РНК (кшРНК), которые ингибируют экспрессию генов, которые ослабляют функцию иммунных клеток, и последовательность оснований, кодирующую химерный антигенный рецептор (CAR), Т-клеточный рецептор, такой как моноклональный Т-клеточный рецептор (mTCR).
[00140] Вектор может быть выбран из ДНК, РНК, плазмиды, лентивирусного вектора, аденовирусного вектора и ретровирусного вектора. Например, лентивирусный вектор и ретровирусные векторы могут вставлять гены в геномную ДНК клеток, обеспечивая стабильную экспрессию генов. В некоторых вариантах осуществления, например, лентивирусный вектор «два в одном», например, двойной вектор «два в одном» можно использовать для передачи генов при помощи вектора в геном клеток.
[00141] В некоторых вариантах осуществления предложен вектор, содержащий последовательность оснований, кодирующую два типа коротких шпилечных РНК (кшРНК), которые ингибируют экспрессию генов, которые ослабляют функцию иммунных клеток, и последовательность оснований, кодирующую любой из химерного антигенного рецептора (CAR) и Т-клеточного рецептора, например, моноклонального Т-клеточного рецептора (mTCR).
[00142] В некоторых вариантах осуществления экспрессия двух типов кшРНК характеризуется тем, что они, соответственно, регулируются двумя разными промоторами. В некоторых вариантах осуществления два промотора представляют собой промоторы РНК-полимеразы III. В некоторых вариантах осуществления два промотора представляют собой промоторы U6, полученные из разных видов. В некоторых вариантах осуществления два промотора ориентированы в разных направлениях относительно друг друга в векторе. Например, в определенном варианте осуществления промоторы ориентированы в направлении голова к голове. В другом варианте осуществления промоторы ориентированы в направлении хвост к хвосту. В некоторых вариантах осуществления ген, ослабляющий функцию иммунных клеток, представляет собой рецептор или лиганд иммунной контрольной точки.
[00143] В некоторых вариантах осуществления рецептор или лиганд иммунной контрольной точки выбран из группы, состоящей из PD1, PD-L1, CTLA4, TIM3, CEACAM (CEACAM-1, CEACAM-3 или CEACAM-5), LAG 3, VISTA, BTLA, TIGIT, LAIR1, CD160, CD96, MerTK и 2B4. В некоторых вариантах осуществления ген, ослабляющий функцию иммунных клеток, выбран из группы, состоящей из FAS, CD45, PP2A, SHIP1, SHIP2, DGK-альфа, DGK-дзета, Cbl-b, CD147, LRR1, TGFBR1, ИЛ-10R альфа, KLGR1, DNMT3A и A2aR.
[00144] В некоторых вариантах осуществления два типа кшРНК или нацелены на разные части одного гена, который ослабляет функцию иммунных клеток, или они нацелены на разные гены, которые ослабляют функцию иммунных клеток. В некоторых вариантах осуществления два типа кшРНК нацелены на разные части PD-1. В некоторых вариантах осуществления два типа кшРНК нацелены на PD-1 и TIM-3, соответственно. В некоторых вариантах осуществления последовательности оснований, кодирующие два типа кшРНК, содержат разные последовательности, выбранные из группы, состоящей из SEQ ID NO: 2-219.
[00145] В некоторых вариантах осуществления мишень CAR или TCR, например, mTCR, представляет собой опухолевый антиген человека, выбранный из числа раковых антигенов при злокачественном новообразовании с повышенным уровнем или из мутированных форм ракового антигена, обнаруженного при злокачественном новообразовании.
[00146] В некоторых вариантах осуществления вектор содержит любую одну из последовательностей оснований SEQ ID NO: 220 или 221. В некоторых вариантах осуществления вектор выбран из ДНК, РНК, плазмиды, лентивирусного вектора, аденовирусного вектора и ретровирусного вектора.
3.1 РНК-интерференция и короткая шпилечная РНК
[00147] РНКи (также известная как посттранскрипционный сайленсинг генов (PTGS), подавление или косупрессия) представляет собой процесс посттранскрипционного сайленсинга генов, в котором молекулы РНК специфическим для последовательности образом ингибируют экспрессию генов, как правило, вызывая разрушение специфических молекул мРНК. Активные компоненты РНКи представляют собой короткие/маленькие двухцепочечные РНК (дцРНК), называемые короткими интерферирующими РНК (киРНК), которые, как правило, содержат 15-30 нуклеотидов (например, 19-25, 19-24 или 19-21 нуклеотидов) и 2-нуклеотидных 3'-липких конца и соответствует последовательности нуклеиновой кислоты целевого гена. Эти виды коротких РНК могут естественным образом продуцироваться in vivo с помощью Dicer-опосредованного расщепления более крупных дцРНК, и они являются функциональными в клетках млекопитающих. Плазмиды экспрессии ДНК можно использовать для стабильной экспрессии дуплексов киРНК или дцРНК, описанных в данном документе, в клетках и достижения длительного ингибирования экспрессии целевого гена. В одном аспекте смысловая и антисмысловая цепи дуплекса киРНК обычно связаны короткой спейсерной последовательностью, приводящей к экспрессии структуры типа «стебель-петля», называемой короткой шпилечной РНК (кшРНК). Шпилька распознается и расщепляется Dicer, таким образом генерируя зрелые молекулы киРНК.
[00148] В контексте данного документа короткая шпилечная РНК (кшРНК) представляет собой молекулу РНК, в которой некоторые самокомплементарные последовательности образуют плотную шпилечную структуру со своим стеблем. Молекулы кшРНК, описанные в данном документе, могут иметь длину от около 40 до 120 нуклеотидов, например, длину от около 70 до 90 нуклеотидов. В иллюстративном варианте осуществления кшРНК может иметь длину 80 нуклеотидов. кшРНК моделируют на основе микроинтерферирующей РНК (миРНК), эндогенного триггера пути РНКи (Lu et al., 2005, Advances in Genetics 54: 117-142, Fewell et al., 2006, Drug Discovery Today 11: 975-982). Когда кшРНК экспрессируется в клетке, она проходит через серию стадий, превращаясь в короткую интерферирующую РНК (киРНК), которая действует в качестве гида для сайленсинга генов. Не вдаваясь в подробности, когда экспрессируется кшРНК, она процессируется комплексами Drosha в клетке, превращаясь в пре-кшРНК, которая затем транспортируется за пределы ядра, где она подвергается дальнейшему процессингу Dicer для превращения в киРНК, а затем переходит в одноцепочечное состояние и загружается в RISC (РНК-индуцируемый сайленсинг-комплекс). При этом антисмысловая цепь киРНК действует в качестве гида для RISC-комплекса, что присоединиться к мРНК целевого гена, и когда комплекс RISC, который присоединен таким образом, разрезает мРНК, то происходит сайленсинг гена. Поскольку кшРНК в целевом гене обеспечивает сайленсинг гена, который сохраняется и специфичен в отношении определенного гена, она включена в вектор с целью ингибирования целевого гена.
[00149] Естественно экспрессируемые молекулы малых РНК, называемые микроРНК (миРНК), вызывают сайленсинг генов путем регуляции экспрессии мРНК. миРНК, содержащие RISC, нацелены на мРНК, имеющие полную комплементарность последовательности с нуклеотидами 2-7 в 5'-области миРНК, которая называется затравочной областью, и другими парами оснований с ее 3'-областью. Опосредованное миРНК снижение экспрессии генов может быть вызвано расщеплением целевых мРНК, ингибированием трансляции целевых мРНК или разрушением мРНК. Направленные на миРНК последовательности обычно расположены в 3'-НТО целевых мРНК. Одна миРНК может быть нацелена на более чем 100 транскриптов от различных генов, а на одну мРНК могут быть нацелены разные миРНК.
[00150] Дуплексы киРНК или дцРНК, нацеленные на специфическую мРНК, могут быть сконструированы и синтезированы in vitro и введены в клетки для активации процессов РНКи. Elbashir et al. продемонстрировали, что 21-нуклеотидные дуплексы киРНК (называемые короткими интерферирующими РНК) способны вызывать мощный и специфический нокдаун генов без индукции иммунного ответа в клетках млекопитающих (Elbashir SM et al., Nature, 2001, 411, 494-498). Начиная с этого первичного отчета, посттранскрипционный сайленсинг генов при помощи киРНК быстро превратился в мощный инструмент генетического анализа в клетках млекопитающих и обладает потенциалом для создания новых терапевтических средств.
[00151] Молекулы РНКи, которые были разработаны для нацеливания против последовательности нуклеиновой кислоты, которая кодирует белки с полиглутаминовыми повторами, которые вызывают заболевания, связанные с полиглутаминовой экспансией, такие как болезнь Хантингтона, описаны в патентах США №№ 9169483 и 9181544 и международной патентной публикации № WO2015179525, содержание каждой из которых включено в данный документ посредством ссылки во всей их полноте. В каждом из патентов США №№ 9169483 и 9181544 и международной патентной публикации № WO2015179525 предложены выделенные дуплексы РНК, содержащие первую цепь РНК (например, 15 смежных нуклеотидов) и вторую цепь РНК (например, комплементарную по меньшей мере 12 смежным нуклеотидам первой цепи), причем дуплекс РНК имеет длину от 15 до 30 пар оснований. Первая цепь РНК и вторая цепь РНК могут быть функционально связаны с помощью петли РНК (~4-50 нуклеотидов) с образованием шпилечной структуры, которая может быть вставлена в кассету экспрессии. Неограничивающие примеры участков петли включают SEQ ID NO: 9-14 из патента США № 9169483, содержание которого полностью включено в данный документ посредством ссылки. Неограничивающие примеры цепей РНК, которые можно использовать, или полной последовательности, или части последовательности, для образования дуплексов РНК, включают SEQ ID NO: 1-8 из патента США № 9169483 и SEQ ID NO: 1-11, 33 -59, 208-210, 213-215 и 218-221 из патента США № 9181454, содержание каждого из которых включено в данный документ посредством ссылки во всей своей полноте. Неограничивающие примеры молекул РНКи включают SEQ ID NO: 1-8 из патента США № 9169483, SEQ ID NO: 1-11, 33-59, 208-210, 213-215 и 218-221 из патента США №. 9115544 и SEQ ID NO: 1, 6, 7 и 35-38 из международной патентной публикации № WO2015179525, содержание каждого из которых включено в данный документ посредством ссылки во всей их полноте.
[00152] Синтезированные in vitro молекулы киРНК могут быть введены в клетки для активации РНКи. Экзогенный дуплекс киРНК, когда он вводится в клетки, аналогично эндогенным дцРНК, может быть собран с образованием РНК-индуцируемого сайленсинг-комплекса (RISC), мультиединичного комплекса, который взаимодействует с последовательностями РНК, которые комплементарны одной из двух цепей дуплекса киРНК (т. е. антисмысловой цепи). В ходе этого процесса смысловая цепь (или сопровождающая цепь) киРНК удаляется из комплекса, в то время как антисмысловая цепь (или направляющая цепь) киРНК сопоставляется с ее комплементарной РНК. В частности, мишени киРНК-содержащих RISC-комплексов представляют собой мРНК, имеющие точную комплементарность последовательностей. Затем киРНК-опосредованный сайленсинг гена происходит путем расщепления, высвобождения и деградации мишени.
[00153] Дуплекс киРНК, состоящий из смысловой цепи, гомологичной целевой мРНК, и антисмысловой цепи, которая комплементарна целевой мРНК, дает гораздо большее преимущество с точки зрения эффективности разрушения целевой РНК по сравнению с использованием одноцепочечных (оц)-киРНК (например, антисмысловой цепи РНК или антисмысловых олигонуклеотидов). Во многих случаях требуется более высокая концентрация оц-киРНК для достижения оптимальной активности сайленсинга гена соответствующего дуплекса.
[00154] В данной области техники имеются методические указания для конструирования киРНК. В этих методических указаниях, как правило, рекомендуется получение 19-нуклеотидного дуплексного участка, симметричных 2-3 нуклеотидных 3'-липких концов, 5'-фосфатных и 3'-гидроксильных групп, нацеленных на область в гене, которую нужно подвергнуть сайленсингу. Другие правила, которые могут определять предпочтение последовательности киРНК, включают, но не ограничиваются, (i) A/U на 5'-конце антисмысловой цепи; (ii) G/C на 5'-конце смысловой цепи; (iii) по меньшей мере пять остатков A/U в одной трети 5'-концевой области антисмысловой цепи; и (iv) отсутствие какого-либо участка GC длиной более 9 нуклеотидов. В соответствии с этим соображением вместе со специфической последовательностью целевого гена могут быть легко разработаны высокоэффективные молекулы киРНК, необходимые для подавления экспрессии целевого гена млекопитающих.
[00155] Как указано в данном документе, вектор «два в одном» содержит последовательность оснований, кодирующую один или более типов коротких шпилечных РНК (кшРНК), которые ингибируют экспрессию одного или более генов, которые ослабляют функцию иммунных клеток, и последовательность оснований, кодирующую любой один из химерного антигенного рецептора (CAR) или Т-клеточного рецептора, например, моноклонального Т-клеточного рецептора (mTCR).
[00156] В некоторых вариантах осуществления последовательность оснований кодирует один тип кшРНК, который ингибирует экспрессию гена, который ослабляет функцию иммунных клеток. В некоторых вариантах осуществления последовательность оснований кодирует два типа кшРНК, которые ингибируют экспрессию двух генов, которые ослабляют функцию иммунных клеток, при этом вектор можно обозначить как двойной вектор «два в одном». В других вариантах осуществления последовательность оснований кодирует более двух типов кшРНК, которые ингибируют экспрессию более двух генов, которые ослабляют функцию иммунных клеток.
[00157] В некоторых вариантах осуществления два или более типов кшРНК могут быть охарактеризованы тем, что они нацелены на один ген, например, на разные части одного гена, что ослабляет функцию иммунных клеток. Например, два или более типов кшРНК могут нацеливаться на PD-1, например, на разные части PD-1. В других вариантах осуществления два или более типов кшРНК могут быть охарактеризованы тем, что они нацелены на разные гены, которые ослабляют функцию иммунных клеток, например, нацелены на PD-1 и TIM-3.
[00158] В иллюстративных вариантах осуществления последовательности оснований, кодирующие два или более типов кшРНК, могут быть охарактеризованы тем, что они содержат разные последовательности, выбранные из группы, состоящей из SEQ ID NO: 2-219 и 238-267, например, они могут содержать разные выбранные последовательности из группы, состоящей из SEQ ID NO:2-117 и 238-267, например, они могут содержать разные последовательности, выбранные из группы, состоящей из SEQ ID NO: 2-12, 70-75 и 266-267.
[00159] В некоторых вариантах экспрессия двух типов кшРНК может быть охарактеризована тем, что они регулируются двумя разными промоторами, соответственно, чтобы минимизировать артефакты рекомбинации или делеции во время клонирования.
[00160] В некоторых вариантах осуществления промоторы могут представлять собой промотор РНК-полимеразы I, промотор РНК-полимеразы II или промотор РНК-полимеразы III, в зависимости от того, какая РНК-полимераза присоединяется к промотору и начинает транскрипцию. Два указанных выше промотора могут быть охарактеризованы тем, что они представляют собой промоторы РНК-полимеразы III (далее промоторы pol III). Промоторы Pol III могут быть сделаны так, чтобы точно транскрибироваться от 5'-конца к 3'-концу без присоединения кэпа на 5'-конце или поли(A)-хвоста на 3'-конце РНК, которая транскрибируется с регуляцией промотором. Типы промотора pol III включают, но не ограничиваются ими, промотор U6, промотор H1 и промотор 7SK и т. д. Два промотора, включенные в вектор, могут быть разными, выбранными из промоторов pol III, включая три типа, указанных выше, и, если выбираются одни и те же типы промоторов, они могут быть получены из разных видов. Например, два промотора могут представлять собой промоторы U6, например, промоторы U6, полученные из разных видов, такие как промоторы U6, полученные от людей и мышей. Поскольку транскрипт, созданный промотором U6, остается в ядре, считается, что это может привести к тому, что комплекс Drosha, который находится в ядре, будет способствовать процессу, в котором кшРНК превращается в пре-кшРНК.
[00161] В некоторых вариантах осуществления два или более промоторов могут быть охарактеризованы тем, что они ориентированы в разных направлениях относительно других в векторе. Например, в определенном варианте осуществления промоторы ориентированы в направлении голова к голове (→←). В другом варианте осуществления промоторы ориентированы в направлении хвост к хвосту (←→). В двойном векторе «два в одном» ориентация вектора в разных направлениях означает, что когда транскрибируются соответствующие кшРНК, экспрессия которых регулируется двумя промоторами, направления, в которых движутся РНК-полимеразы, ориентированы в разных направлениях в одной молекуле нуклеиновой кислоты. В иллюстративном варианте осуществления два промотора могут находиться в направлениях →← (Фиг. 15A). В другом иллюстративном варианте осуществления два промотора могут находиться в направлениях ←→ (Фиг. 15B). Например, два промотора могут принимать направления →← в векторе.
[00162] В некоторых вариантах осуществления экспрессия целевых генов одного или более типов кшРНК снижается до около 90% или менее от экспрессии контрольной группы, например, экспрессия целевых генов снижается до около 80% или менее, около 70% или менее, около 60% или менее, около 50% или менее, около 40% или менее, около 30% или менее, около 20% или менее, и около 10% или менее от экспрессии контрольной группы.
[00163] Как правило, кшРНК конструируют так, чтобы она имела последовательность, имеющую высокую гомологию с частью последовательности мРНК ее целевого гена (далее последовательность оснований смысловой кшРНК), последовательность, способную образовывать острую шпильку, и последовательность, комплементарную последовательности, имеющей высокую гомологию (далее последовательность оснований антисмысловой кшРНК). Нековалентные связи между самокомплементарными частями образуют структуру стебля, и когда кшРНК экспрессируется и процессируется в клетке, последовательность оснований антисмысловой кшРНК действует как гид для мРНК целевого гена в процессе сайленсинга генов. Например, последовательности оснований кассеты, используемые в данном документе для экспрессии кшРНК, могут содержать структуру NNNNNNNNNNNNNNNNNNNNN (21 оснований) - последовательность петли - NNNNNNNNNNNNNNNNNNNN (19 оснований). В одном варианте осуществления участок из 21 основания кодирует последовательности оснований смысловой кшРНК, а участок из 19 оснований является комплементарным или существенно комплементарным участку из 21 основания и кодирует последовательности оснований антисмысловой кшРНК. В другом варианте осуществления участок из 19 основания кодирует последовательности оснований смысловой кшРНК, а участок из 21 оснований является комплементарным или существенно комплементарным участку из 19 основания и кодирует последовательности оснований антисмысловой кшРНК. Следовательно, при экспрессии полученная РНК образует структуру стебля и петли. В некоторых вариантах осуществления такие последовательности оснований смысловой или антисмысловой кшРНК для целевого гена (человеческого происхождения), которые могут быть включены в кассету, выбраны из группы, состоящей из SEQ ID NO: 1-219. В конкретных вариантах осуществления последовательности оснований кассеты, используемые в данном документе для экспрессии кшРНК, могут быть выбраны из группы, состоящей из SEQ ID NO: 220-224.
[00164] В некоторых вариантах осуществления вся последовательность оснований кшРНК может быть расположена в 3'-концевой области промотора U6 мыши или человека, а TTTTT, необходимый для терминации транскрипции промотором U6, может быть расположен в 3'-концевой области всех последовательностей оснований кшРНК.
[00165] В некоторых вариантах осуществления последовательности нуклеиновых кислот соответствующих кшРНК могут, в дополнение к последовательностям, описанным в данном документе, содержать последовательности нуклеиновых кислот, проявляющие по меньшей мере 50%, конкретно по меньшей мере 70%, более конкретно по меньшей мере 80%, еще более конкретно по меньшей мере 90%, и наиболее конкретно по меньшей мере 95% гомологии последовательностей с этими последовательностями. Сообщалось, что это связано с тем, что в случае киРНК (короткой интерферирующей РНК) и кшРНК, которые процессируются внутри клетки с образованием, в частности, киРНК, что незначительная мутация, особенно мутация в 5'-концевой области, является допустимой, вызывая нормальный нокдаун целевого гена, и что мутации киРНК и кшРНК, которые имеют структуру, сходную со структурой миРНК, играющей роль в сайленсинге генов, более эффективно индуцирует нокдаун целевого гена. Кроме того, при использовании векторов специалистам в данной области техники очевидны вариации в векторе, то есть добавление, модификация или делеция последовательностей оснований, которые могут происходить в процессе клонирования для введения определенной последовательности в вектор, или изменения или введения компонентов для повышения простоты использования вектора в той степени, в которой экспрессируется предполагаемый ген.
[00166] Существуют различные механизмы действия генов, которые ослабляют функцию иммунных клеток. Примеры включают ингибирование пролиферации иммунных клеток или вызывание гибели клеток, уменьшение реакций с молекулами, с которыми иммунные клетки должны реагировать, чтобы активироваться, ингибирование экспрессии генов, необходимых иммунным клеткам для распознавания мишеней реакции, и вызывание дифференциации в различные типы иммунной клетки для выполнения другой функции, а не вызывания иммунного ответа на конкретную мишень. Иллюстративные примеры включают, но не ограничиваются ими, молекулы, связанные с иммунными контрольными точками, которые будут рассмотрены ниже.
[00167] В некоторых вариантах осуществления ген, ослабляющий функцию иммунных клеток, можно охарактеризовать тем, что он представляет собой рецептор или лиганд иммунной контрольной точки. Иммунные контрольные точки представляют собой молекулы, которые существуют в иммунной системе и способны включать или выключать иммунный ответ. Их можно рассматривать как защитные механизмы для регуляции чрезмерной активации иммунных клеток, которая вызывает гибель клеток или аутоиммунный ответ. Эти молекулы иммунных контрольных точек могут быть в целом разделены на молекулы стимулирующих иммунных контрольных точек, которые усиливают иммунный ответ, и молекулы ингибирующих иммунных контрольных точек, которые ингибируют иммунный ответ. Сообщается, что многие раковые клетки избегают иммунной системы, активируя сигналы ингибирующей иммунной контрольной точки, особенно рецепторы и лиганды ингибирующей иммунной контрольной точки на иммунных клетках. Соответственно, иммунная клеточная терапия, нацеленная на конкретное злокачественное новообразование, может быть эффективной, если сделать это уклоняющееся действие злокачественных новообразований неэффективным, и это может быть достигнуто путем ингибирования активации рецепторов ингибирующей иммунной контрольной точки и их лигандов или путем снижения их экспрессии. Например, рецептор и лиганды иммунной контрольной точки могут быть выбраны из группы, состоящей из PD1 (белок программируемой клеточной смерти 1), PD-L1 (лиганд-1 белка программируемой клеточной гибели), CTLA4 (цитотоксический Т-лимфоцит-ассоциированный белок 4), TIM- 3 (белок 3, содержащий домены T-клеточного иммуноглобулина и муцина), CEACAM (молекула адгезии клеток, связанная с раковым эмбриональным антигеном, включая три подтипа CEACAM-1, CEACAM-3 или CEACAM-5), LAG3 (ген активации лимфоцитов-3), VISTA (V-доменный супрессор активации Т-клеток), BTLA (B- и T-лимфоцитарный аттенюатор), TIGIT (T-клеточный иммунорецептор с доменами Ig и ITIM), LAIR1 (связанный с лейкоцитами иммуноглобулин-подобный рецептор 1), CD160 (кластер дифференцировки 160), CD96 (кластер дифференцировки 96), MerTK (протоонкогенная тирозинпротеинкиназа MER) и 2B4 (лиганд, индуцирующий активацию NK-клеток), и, например, могут быть выбраны из PD1, TIM3 и TIGIT.
[00168] В других вариантах осуществления ген, ослабляющий функцию иммунных клеток, можно охарактеризовать тем, что он кодирует рецептор, который может стимулировать AICD (клеточную смерть, индуцированную активацией), действуя в качестве негативного регулятора для Т-лимфоцитов, которые были активированы путем повторной стимуляции с помощью TCR, например, FAS (также известный как CD95, APO-1 или апоптозный антиген-1). В некоторых вариантах осуществления ген, ослабляющий функцию иммунных клеток, может быть охарактеризован тем, что он кодирует факторы, которые подавляют сигнальную активацию TCR, например, факторы могут быть выбраны из CD45, PP2A, SHP1, SHP2, DGK-альфа, DGK-дзета, Cbl -b, Cbl-c и CD148. В некоторых вариантах осуществления ген, ослабляющий функцию иммунных клеток, может быть охарактеризован тем, что он кодирует белок, который подавляет эффективность CAR и/или TCR, например, mTCR посредством подавления сигнала 4-1BB, где 4-1BB представляет собой описанную в данном документе костимулирующую молекулу TCR, например, LRR1 (содержащий лейцин-богатые повторы белок 1). В некоторых вариантах осуществления ген, ослабляющий функцию иммунных клеток, может быть охарактеризован тем, что он кодирует рецептор, лигандом которого является цитокин, который подавляет Т-клетки, например, TGFBR1 (рецептор 1 трансформирующего фактора роста бета) и ИЛ-10R-альфа (альфа-субъединица ИЛ-10R). В некоторых вариантах осуществления ген, ослабляющий функцию иммунных клеток, может быть охарактеризован тем, что он кодирует рецептор, который ингибирует пролиферативную способность и цитотоксичность Т-клеток и NK-клеток, например, KLGR1 (лектиноподобный рецептор G1 киллерных клеток). В некоторых вариантах осуществления ген, ослабляющий функцию иммунных клеток, можно охарактеризовать тем, что он кодирует регулятор, связанный с метилированием новой ДНК, который, как сообщается, подавляет истощение Т-клеток при нокауте (KO), например, TNMT3a (ДНК-метилтрансфераза 3-альфа). В некоторых вариантах осуществления ген, ослабляющий функцию иммунных клеток, может быть охарактеризован тем, что он кодирует аденозиновый рецептор, который присутствует в избытке в микроокружении опухоли, который при активации может ингибировать клеточную токсичность и способность Т-клеток продуцировать цитокины, например, A2aR (аденозиновый рецептор подтипа A2a).
[00169] В некоторых вариантах осуществления ген, ослабляющий функцию иммунных клеток, может быть охарактеризован тем, что он выбран из группы, состоящей из FAS, CD45, PP2A, SHP1, SHP2, DGK-альфа, DGK-дзета, Cbl-b, Cbl-c, CD148, LRR1, TGFBR1, ИЛ-10RA, KLGR1, DNMT3A и A2aR.
3.2 Химерный антигенный рецептор (CAR) и Т-клеточный рецептор, например, моноклональный Т-клеточный рецептор (mTCR).
[00170] Как указано в данном документе, вектор «два в одном» содержит последовательность оснований, кодирующую один или более типов коротких шпилечных РНК (кшРНК), которые ингибируют экспрессию одного или более генов, которые ослабляют функцию иммунных клеток, и последовательность оснований, кодирующую любой один из химерного антигенного рецептора (CAR) или Т-клеточного рецептора, например, моноклонального Т-клеточного рецептора (mTCR).
[00171] CAR, как правило, представляет собой набор полипептидов, которые, когда они присутствуют на иммунной клетке, вызывают специфичность иммунной клетки к целевой клетке (как правило, раковой клетке), вызывая при этом сигнальную трансдукцию в клетке. Как минимум, CAR содержит внеклеточный антигенраспознающий домен, который распознает целевой антиген, который будет описан ниже, трансмембранный домен и внутриклеточной домен сигнальной трансдукции, причем внутриклеточной домен сигнальной трансдукции получен из стимулирующих молекул или костимулирующих молекул.
[00172] Структура CAR, обычно применяемая сегодня в клинических целях, содержит домен одноцепочечного вариабельного фрагмента (далее scFv), который придает специфичность антигену, спейсерный домен, регулирующий расстояние между scFv и клеточной мембраной, трансмембранный домен и внутриклеточный сигнальный домен (далее ISD). ISD, в свою очередь, содержит костимулирующий домен (CD28, CD137 или OX40), который способствует пролиферации in vivo и долгой жизни одной или более Т-клеток, и сигнальный домен TCR (CD3-дзета, CD3ζ), который способствует активации Т-клеток. Т-клетки, модифицированные для экспрессии CAR, которые были получены таким образом, могут быть активированы путем распознавания раковых клеток, которые экспрессируют целевой антиген с высокой специфичностью, эффективно индуцируют гибель таких раковых клеток, одновременно экспоненциально размножаются в организме и остаются живыми в течение продолжительного времени. Например, когда пациенту с В-клеточным лейкозом вводили CAR-T-клетки (CART-19), полученные для нацеливания на CD19, специфический для В-клеток антиген, сообщалось, что эти клетки пролиферировали в 1000-10000 раз и оставались живыми в организме в течение нескольких лет. В результате CART-19 продемонстрировал 90% - ный полный ответ в клиническом исследовании, проведенном с участием больных в терминальной стадии острого лимфобластного лейкоза (В-ОЛЛ), которым проводили традиционную химиотерапию и др., и которая оказалась не эффективной, что привело к редкому случаю лицензирования глобальной фармацевтической компании на ранней стадии инициированных исследователем клинических испытаний. Он стал первым агентом CAR-T-клеточной терапии, получившим одобрение FDA США в 2017 году, и после этого был также утвержден второй CAR-T.
[00173] На поверхности иммунных клеток, например, Т-клеток, существуют рецепторы иммунных контрольных точек, такие как CTLA-4 (цитотоксический Т-лимфоцит-ассоциированный белок 4) или PD-1 (белок программируемой клеточной смерти 1). Эти рецепторы изначально являются защитными механизмами для регуляции чрезмерной активации и гибели Т-клеток или запуска аутоиммунных реакций. Однако сообщается, что раковые клетки, особенно солидные злокачественные опухоли, используют это, чтобы избежать Т-клеточного иммунологического надзора. Например, если раковая клетка экспрессирует PD-L1 (лиганд-1 белка программируемой клеточной гибели) на поверхности, Т-клетка, которая экспрессирует PD-1, рецептор для него, распознает раковую клетку и активируется, но вскоре сигнал ингибирования активации от PD-1 истощается. Для предотвращения ингибирования активности Т-клеток сигналами от этих рецепторов иммунной контрольной точки были разработаны моноклональные антитела к CTLA4 или PD-1 и т. д., которые ингибируют передачу сигнала целевыми рецепторами иммунной контрольной точки. Терапевтические средства, которая улучшает общую иммунную функцию Т-клеток путем блокирования иммунных контрольных точек с использованием этих ингибиторов рецепторов иммунных контрольных точек, также демонстрирует эффективность против различных солидных злокачественных новообразований.
[00174] Поскольку клетки CAR-T в конечном счете также являются терапией, основанной на цитотоксичности активированных Т-клеток, наличие иммуносупрессивной среды вокруг CAR-T-клеток действует как серьезное препятствие для их терапевтического эффекта. Фактически, в отличие от своих терапевтических эффектов, проявляемых при В-клеточном лейкозе, CAR-T-клетки, приготовленные для нацеливания на солидные опухоли, редко демонстрировали обнадеживающие терапевтические эффекты. Предполагается, что это связано с тем, что солидные опухоли, в отличие от гемобластозов, создают иммуносупрессивное микроокружение опухоли для подавления активности и пролиферации CAR-T-клеток. Кроме того, даже в случае В-клеточных гемобластозов, и сообщалось, что в отличие от пациентов с острым лимфобластным лейкозом (ОЛЛ), из которых почти 90% отвечали на терапию с использованием CART-19, терапевтические эффекты были относительно меньшими у пациентов с лимфомой (от 20 до 50% ответа) или с хроническим лимфобластным лейкозом (ХЛЛ, около 20% ответа).
[00175] Кроме того, сообщалось, что в микроокружении опухоли, образованном лимфомой, экспрессируются PD-L1 и другие иммуносупрессивные лиганды, поэтому функция Т-клеток внутри раковой ткани истощается. Кроме того, сообщалось, что Т-клетки, полученные от пациентов с ХЛЛ, уже были в значительной степени истощены, с высокой степенью экспрессии рецепторов иммунных контрольных точек, таких как PD-1, CD160 и CD244.
[00176] Сообщалось о результатах доклинических испытаний, демонстрирующих, что одновременное использование анти-CTLA или анти-PD-1 ингибирующих антител с CAR-T-клетками для восстановления этой пониженной активности CAR-T-клеток улучшает противораковый эффект, и в настоящее время с использованием этих комбинаций проводятся клинические испытания. Однако проблема такой одновременной терапии антителами и CAR-T-клетками заключается в том, что антитела, распространяющиеся по всему телу, воздействуют не только на CAR-T-клетки, но и на все другие T-клетки, которые присутствуют в организме, что может привести к серьезным и системным нежелательным реакциям, таким как синдром высвобождения цитокинов, а также симптомы аутоиммунных заболеваний. Другой проблемой, на которую было указано, является повышенная стоимость лечения из-за одновременного использования дорогостоящей терапии антителами с клеточной терапией.
[00177] Соответственно, в последнее время предпринимались попытки регулировать экспрессию генов в клетках, чтобы обеспечить подавление иммунных контрольных точек CAR-T-клеток. Международная патентная заявка WO2016/069282 раскрывает композиции и способы получения модифицированной Т-клетки с нуклеиновой кислотой, способной подавлять экспрессию эндогенного гена, выбранной из группы, состоящей из α-цепи TCR, β-цепи TCR, β-2-микроглобулина и FAS, дополнительно содержащей нуклеиновую кислоту, кодирующую модифицированный Т-клеточный рецептор (TCR), имеющий аффинность к поверхностному антигену на целевой клетке, или электропорированную нуклеиновую кислоту, кодирующую химерный антигенный рецептор (CAR). В публикации говорится, что генные ножницы, такие как CRISPR/Cas9, могут быть использованы для подавления экспрессии эндогенных генов, но способ получения CAR-T-клеток, раскрытый в патентной публикации, довольно сложен и имеет проблемы с низким выходом продукции и высокой стоимостью производства.
[00178] Между тем, международная патентная публикация WO2015/090230 раскрывает, что один тип короткой шпилечной РНК (кшРНК), ингибирующей молекулу, которая дополнительно подавляет функцию Т-клеток, может использоваться в клетках, экспрессирующих CAR. Поскольку стоимость клеточной терапии высока, пациент сталкивается с различными трудностями в случае неудачи. Однако один тип кшРНК не может эффективно ингибировать активность таких целевых молекул. В некоторых вариантах осуществления набор, содержащий полипептиды, может быть присоединен. В некоторых вариантах осуществления набор, содержащий полипептид, может быть в форме, в которой он присоединяется через переключатель, который димеризуется посредством стимуляции. В некоторых вариантах осуществления CAR может представлять собой слитый белок, который содержит внеклеточный антигенраспознающий домен, трансмембранный домен и внутриклеточной домен сигнальной трансдукции. В других вариантах осуществления слитый белок CAR может дополнительно содержать лидерную последовательность на N-конце, и лидерная последовательность может быть вырезана в процессе экспрессии CAR и закрепления в клеточной мембране.
[00179] TCR, например, mTCR, описанный в данном документе, может содержать цепь, выбранную из цепей α, β, γ и δ. В некоторых вариантах осуществления цепи способны распознавать целевой антиген, который будет описан ниже, CD3 и дзета-цепь, и дополнительно костимулирующую молекулу, причем костимулирующая молекула может быть выбрана из ICOS, OX40, CD137 (4-1BB), CD27 или CD28.
[00180] В некоторых вариантах осуществления ретровирусный перенос химерных конструктов на основе одноцепочечных антител (scFv) можно использовать для получения TCR, например, mTCR с определенной антигенспецифичностью. В других вариантах осуществления химерные конструкты scFv могут быть связаны с внутриклеточными сигнальными доменами FcR-гамма или CD3ζ для индукции эффекторной функции Т-клеток. В домене CD3ζ могут быть объединены сигнальные домены костимулирующих молекул, причем взаимодействие с антителом может запускать эффекторную функцию Т-клеток, а также доставлять костимулирующие сигналы. В дополнительных вариантах осуществления костимулирующие молекулы могут быть выбраны из CD28, 4-1BB и OX40.
[00181] В некоторых вариантах осуществления векторы «два в одном» могут содержать домен CD3ζ, в котором цепи TCR, например, mTCR, могут образовывать комплекс через нековалентные связи с CD3 и дзета (ζ)-цепью. Когда антиген распознается посредством сайта распознавания антигена цепей, CD3 и дзета-цепи посылают сигналы в цитоплазму иммунных клеток, в которых экспрессируется такой комплекс TCR, вызывая функциональную активацию.
[00182] В некоторых вариантах осуществления внутриклеточной домен сигнальной трансдукции может дополнительно содержать один или более функциональных доменов сигнальной трансдукции, полученных из костимулирующих молекул. В некоторых вариантах осуществления стимулирующая молекула может представлять собой дзета-цепь TCR, описанную выше.
[00183] CAR и TCR, например, mTCR представляют собой рецепторы клеточной поверхности. В некоторых вариантах осуществления мишень для CAR или TCR, например, mTCR, может быть охарактеризована тем, что она представляет собой раковый антиген, экспрессия которого специфически увеличивается при злокачественном новообразовании. В некоторых вариантах осуществления мишень для CAR или TCR, например, mTCR, может быть охарактеризована тем, что она представляет собой раковый антиген, который присутствует в мутированных формах при злокачественном новообразовании.
[00184] В некоторых вариантах осуществления мишенью для CAR или TCR, например, mTCR, может быть опухолевый антиген человека, экспрессия которого повышена при злокачественном новообразовании, подлежащем лечению. Например, мишень может быть выбрана из 5T4 (трофобластический гликопротеин), 707-AP, 9D7, AFP (α-фетопротеин), AlbZIP (андроген-индуцируемый bZIP), HPG1 (специфический к простате человека ген-1), α5β1-интегрина, α5β6-интегрина, α --метилацил-коэнзим А рацемазы, ART-4 (АДФ рибозилтрансферазы-4), B7H4 (ингибитор активации Т-клеток 1, содержащий вариабельный иммуноглобулиноподобный домен), BAGE-1 (В меланомный антиген-1), BCL-2 (В-клеточный ХЛЛ/лимфома-2), BING-4 ( WD-повтор домена 46), CA 15-3/CA 27-29 (муцин 1), CA 19-9 (раковый антиген 19-9), CA 72-4 (раковый антиген 72-4), CA125 (раковый антиген 125), кальретикулина, CAMEL (ЦТЛ-распознаваемый антиген на меланоме), CASP-8 (каспаза 8), катепсина B, катепсина L, CD19 (кластер дифференцировки 19), CD20, CD22, CD25, CD30, CD33, CD4, CD52, CD55, CD56, CD80, CEA (раковый эмбриональный антиген SG8), CLCA2 (канал-переносчик-2 для ионов хлора), CML28 (опухолевый антиген хронического миелолейкоза 28), коактозин-подобного белка, коллагена XXIII, COX-2 (циклооксигеназа-2), CT-9/BRD6 (раково-тестикулярный антиген 9), Cten (С-концевой тензиноподобный белок), циклина B1, циклина D1, cyp-B, CYPB1 (цитохром p450 семейство 1, подсемейство b, тип 1), DAM-10/MAGE-B1 (ассоциированный с меланомой антиген B1), DAM-6/MAGE-B2, EGFR/Her1 (рецептор эпидермального фактора роста), EMMPRIN (басигин), EpCam, EphA2 (эфрин-рецептор A2), EphA3, ErbB3 (рецептор тирозинкиназы 3 Erb-B2), EZH2 (усилитель субъединицы zeste гомолога 2 policomb-репрессивного комплекса 2), FGF-5 (фактор роста фибробластов 5), FN (фибронектин), Fra-1 (Fos-связанный антиген-1), G250/CAIX (карбоангидраза 9), GAGE-1 (G антиген-1), GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE-7b, GAGE-8, GDEP (ген, дифференциально экспрессируемый в простате), GnT-V (глюконаткиназа), gp100 (специфический для линии меланоцитов антиген GP100), GPC3 (глипикан-3), HAGE (спиральный антиген), HAST-2 (член 1 семейство сульфотрансферазы 1A), гепсина, Her2/neu/ErbB2 (Erb-B2 рецептор тирозинкиназы 2), HERV-K-MEL, HNE (медуллазин), гомеобокса NKX 3.1, HOM-TES-14/SCP-1, HOM-TES-85, HPV-E6, HPVE7, HST-2 (сиртуин-2), hTERT, iCE (каспаза 1), IGF-1R (рецептор инсулиноподобного фактора роста-1), ИЛ-13Ra2 (α-2-субъединица рецептора интерлейкина-13), ИЛ-2R (рецептор интерлейкина-2), ИЛ-5 (интерлейкин-5), незрелого рецептора ламинина, калликреина-2, калликреина-4, Ki67, KIAA0205 (лизофосфатидилглицерол-ацилтрансфераза 1), KK-LC-1 (антиген-1 рака легкого кита-кюсю (kita-kyushu)), KM-HN-1, LAGE-1 (L-антиген, член 1 семейства белков LAGE), ливина, MAGE-A1, MAGE-A10, MAGE-A12, MAGEA2, MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A9, MAGE-B1, MAGE-B10, MAGE-B16, MAGEB17, MAGE-B2, MAGE-B3, MAGE-B4, MAGE-B5, MAGE-B6, MAGE-C1, MAGE-C2, MAGE-C3, MAGE-D1, MAGE-D2, MAGE-D4, MAGE-E1, MAGE-E2, MAGE-F1, MAGE-H1, MAGEL2 (антиген меланомы семейства L2), маммаглобина A, MART-1/Melan-A (антиген меланомы, распознаваемый Т-клетками-1), MART-2, белка матрикса 22, MC1R (рецептор меланокортина-1 ), М-КСФ (макрофагальный колониестимулирующий фактор), мезотелина, MG50/PXDN (пероксидазина), MMP 11 (матриксная металлопротеиназа 11), MN/CA IX-антигена (карбоангидраза 9), MRP-3 (ассоциированный с множественной лекарственной устойчивостью белок-3), MUC1 (муцин 1), MUC2, NA88-A (псевдоген 1 VENT-подобного гомеобокса 2), N-ацетилглюкозаминилтрансферазы-V, Neo-PAP (нео-поли(А)-полимераза), NGEP (новый ген, экспрессируемый в простате), NMP22 (белок ядерного матрикса 22), NPM/ALK (нуклеофосмин), NSE (нейронспецифическая энолаза), NY-ESO-1, NY-ESO-B, OA1 (QTL-1 остеоартрита), OFA-iLRP (раково-эмбриональный антиген-незрелый рецептор ламинина), OGT (O-GlcNAc-трансфераза), OS-9 (лектин эндоплазматического ретикулюма), остеокальцина, остеопонтина, p15 (ингибитор CDK 2B), p53, PAGE-4 (семейство P-антигена, член-4), PAI-1 (ингибитор активатора плазминогена 1), PAI-2, PAP (простатическая кислая фосфатаза), PART-1 (транскрипт-1, регулируемый андрогеном простаты), PATE (белок-1, экспрессируемый простатой и яичками), PDEF (полученный из простаты фактор Ets), Pim-1-киназы (сайт-1 интеграции провирусов), Pin1 (пептидил-пролил-цис-транс-изомераза-1), POTE (экспрессируемый в простате, яичнике, яичке и плаценте), PRAME (преимущественно экспрессируемый антиген при меланоме), простеина, протеиназы-3, PSA (простат-специфический антиген), PSCA (антиген стволовых клеток простаты), PSGR (простат-специфический рецептор, связанный с G-белком), PSM, PSMA (простат-специфический мембранный антиген), RAGE-1 (ассоциированный с опухолью антиген почечных карцином), RHAMM/CD168, RU1 (почечный убиквитарный белок-1), RU2, SAGE (антиген саркомы), SART-1 (антиген-1 плоскоклеточной карциномы, распознаваемый Т-клетками), SART-2, SART-3, Sp17 (белок спермы 17), SSX-1 (член-1 семейства SSX), SSX-2/HOM-MEL-40, SSX-4, STAMP-1 (металлоредуктаза STEAP2), STEAP, сурвивина, сурвивина-213, TA-90 (опухоль-ассоциированный антиген-90), TAG-72 (опухоль-ассоциированный гликопротеин-72), TARP(белок TCRγ с альтернативной рамкой считывания), TGFb (трансформирующий фактор роста β), TGFbR11 (рецептор-11 трансформирующего фактора роста β), TGM-4 (трансглютаминаза 4), TRAG-3(ген-3 устойчивости к таксолу), TRG (γ-локус рецептора Т-клеток), TRP-1 (транзиторный рецепторный потенциал 1), TRP-2/6b, TRP-2/INT2, Trp-p8, тирозиназы, UPA (урокиназный активатор плазминогена), VEGF (фактор роста сосудистого эндотелия A), VEGFR-2/FLK-1, и WT1 (белок опухоли Вильмса 1) или может представлять собой мутированную форму опухолевого антигена человека, обнаруженного в подлежащем лечению раке, выбранную из α-актина 4/m, ARTC1/m, bcr/abl, бета-катенина/m, BRCA1/m, BRCA2/m, CASP-5/m, CASP-8/m, CDC27/m, CDK4/m, CDKN2A/m, CML66, COA-1/m, DEK-CAN, EFTUD2/m, ELF2/m, ETV6-AML1, FN1/m, GPNMB/m, HLA-A*0201-R170I, HLA-A11/m, HLA-A2/m, HSP70-2M, KIAA0205/m, K-Ras/m, LDLR-FUT, MART2/m, ME1/m, MUM-1/m, MUM-2/m, MUM-3/m, миозина класса 1/m, neo-PAP/m, NFYC/m, N-Ras/m, OGT/m, OS-9/m, p53/m, Pml/RARa, PRDX5/m, PTPRX/m, RBAF600/m, SIRT2/m, SYTSSX-1, SYT-SSX-2, TEL-AML1, TGFbRII и TPI/m. Например, целевой антиген может быть выбран между CD19 или CD22.
3.3 Компоненты векторов «два в одном»
[00185] Как указано в данном документе, вектор «два в одном» содержит последовательность оснований, кодирующую один или более типов коротких шпилечных РНК (кшРНК), которые ингибируют экспрессию одного или более генов, которые ослабляют функцию иммунных клеток, и последовательность оснований, кодирующую химерный антигенный рецептор (CAR) или Т-клеточный рецептор (TCR), например, моноклональный Т-клеточный рецептор (mTCR).
[00186] В некоторых вариантах осуществления векторы «два в одном» могут содержать последовательности, кодирующие факторы, которые способствуют вставке последовательностей в геном клетки-хозяина. В некоторых вариантах осуществления последовательности расположены на одном или обоих концах вектора гена. В некоторых вариантах последовательности представляют собой ДКП (длинные концевые повторы).
[00187] В некоторых вариантах осуществления векторы «два в одном» могут содержать домен, кодирующий белки, которые используются для очистки клеток, в которых произошла вставка, описанная выше. В некоторых вариантах осуществления домен представляет собой домен δLNGFR, причем δLNGFR представляет собой LNGFR (низкоаффинный рецептор фактора роста нервов) без цитоплазматического домена, используемого для очистки клеток, где произошла вставка, описанная выше.
[00188] В некоторых вариантах осуществления векторы «два в одном» могут содержать промоторы, которые индуцируют экспрессию как δLNGFR, так и CAR, характеризуемые устойчивой экспрессией, например, промотор EF1α, индуцирующий экспрессию как δLNGFR, так и CD19 CAR, как показано на Фиг. 22А. В других вариантах осуществления, δLNGFR и CD19 CAR сначала транскрибируются в форме, в которой они находятся в одной мРНК. В таких вариантах осуществления, где два или более цистронов находятся в одной и той же мРНК, между ними может быть вставлен IRES (внутренний участок посадки рибосомы), чтобы вызвать экспрессию обоих цистронов. Однако IRES является чрезмерно длинным, и было сообщено, что эффективность экспрессии расположенного по ходу транскрипции цистрона снижается. В некоторых вариантах осуществления для преодоления таких недостатков могут использоваться компоненты, отличные от IRES, например, P2A (пептид 2a), в котором во время трансляции рибосома проходит без образования пептидной связи на C-конце P2A, что позволяет экспрессироваться расположенному по ходу транскрипции гену позже.
[00189] Некоторые иллюстративные векторы «два в одном» представляют собой векторы «два в одном», приведенные на Фиг. 1, 6, 14 и 22А, причем вектор содержит любую одну из последовательностей оснований SEQ ID 220 или 221. Иллюстративные векторы, которые содержат последовательности оснований SEQ ID 220 и 221, могут иметь структуру, приведенную на Фиг. 1А и 1В. Некоторые иллюстративные плазмиды перечислены в таблице 1.

[00190] В некоторых вариантах осуществления последовательности оснований, включенные в вектор, описанный выше, и последовательности нуклеиновых кислот соответствующих кшРНК могут, в дополнение к последовательностям, описанным в данном документе, содержать последовательности нуклеиновых кислот, проявляющие по меньшей мере 50%, конкретно по меньшей мере 70%, более конкретно по меньшей мере 80%, еще более конкретно по меньшей мере 90%, и наиболее конкретно по меньшей мере 95% гомологии последовательностей с этими последовательностями. Сообщалось, что это связано с тем, что в случае киРНК (короткой интерферирующей РНК) и кшРНК, которые процессируются внутри клетки с образованием, в частности, киРНК, что незначительная мутация, особенно мутация в 5'-концевой области, является допустимой, вызывая нормальный нокдаун целевого гена, и что мутации киРНК и кшРНК, которые имеют структуру, сходную со структурой миРНК, играющей роль в сайленсинге генов, более эффективно индуцирует нокдаун целевого гена. Кроме того, при использовании векторов специалистам в данной области техники очевидны вариации в векторе, то есть добавление, модификация или делеция последовательностей оснований, которые могут происходить в процессе клонирования для введения определенной последовательности в вектор, или изменения или введения компонентов для повышения простоты использования вектора в той степени, в которой экспрессируется предполагаемый ген.
4. Получение и оценка CAR-T-клеток, нацеленных на одну или более иммунных контрольных точек
[00191] Как указано в данном документе, вектор «два в одном» содержит последовательность оснований, кодирующую один или более типов коротких шпилечных РНК (кшРНК), которые ингибируют экспрессию генов, которые ослабляют функцию иммунных клеток, и последовательность оснований, кодирующую любой один из химерного антигенного рецептора (CAR) и Т-клеточного рецептора (TCR), например, моноклонального Т-клеточного рецептора (mTCR). Вектор может быть использован для получения иммунных клеток, имеющих ингибированную экспрессию генов, которые ослабляют функцию иммунных клеток. В некоторых вариантах осуществления вектор выбран из группы, состоящей из ДНК, РНК, плазмиды, лентивирусного вектора, аденовирусного вектора и ретровирусного вектора.
[00192] В одном аспекте описанная в данном документе иммунная клетка отличается тем, что она содержит указанный выше вектор и экспрессирует CAR или TCR, например, mTCR, и при этом экспрессия целевых генов одного или более типов кшРНК снижается. В некоторых вариантах осуществления экспрессия целевых генов одного или более типов кшРНК снижается до около 90% или менее от экспрессии контрольной группы, например, экспрессия целевых генов снижается до около 80% или менее, около 70% или менее, около 60% или менее, около 50% или менее, около 40% или менее, около 30% или менее, около 20% или менее, и около 10% или менее от экспрессии контрольной группы. В некоторых вариантах осуществления иммунная клетка выбрана из Т-клеток и NK-клеток человеческого происхождения.
[00193] В другом аспекте в данном документе предложены способы. В некоторых вариантах осуществления предложен способ получения иммунной клетки, включающий введение в иммунную клетку одновременно или последовательно в любом порядке: (1) гена, кодирующего генетически сконструированный антигенный рецептор, который специфически связывается с целевым антигеном; и (2) агента генетического разрушения, снижающего или способного уменьшать экспрессию в иммунной клетке гена, который ослабляет функцию иммунной клетки, тем самым получая иммунную клетку, в которой экспрессируется генетически сконструированный антигенный рецептор, и снижается экспрессия гена, который ослабляет функцию иммунной клетки.
[00194] В некоторых вариантах осуществления генетически сконструированный антигенный рецептор представляет собой химерный антигенный рецептор (CAR) или Т-клеточный рецептор (TCR). В некоторых вариантах осуществления генетически сконструированный антигенный рецептор представляет собой CAR. В некоторых вариантах осуществления CAR содержит внеклеточный антигенраспознающий домен, трансмембранный домен и внутриклеточной домен сигнальной трансдукции.
[00195] В некоторых вариантах осуществления внеклеточный антигенраспознающий домен CAR специфически связывается с целевым антигеном.
[00196] В некоторых вариантах осуществления внутриклеточный домен сигнальной трансдукции CAR содержит внутриклеточный домен дзета-цепи CD3 (CD3ζ). В некоторых вариантах осуществления внутриклеточной домен сигнальной трансдукции CAR дополнительно содержит костимулирующую молекулу.
[00197] В некоторых вариантах осуществления костимулирующая молекула выбрана из группы, состоящей из ICOS, OX40, CD137 (4-1BB), CD27 и CD28. В некоторых вариантах осуществления костимулирующая молекула представляет собой CD137 (4-1BB). В некоторых вариантах осуществления костимулирующая молекула представляет собой CD28.
[00198] В некоторых вариантах осуществления целевой антиген экспрессируется на поверхности раковой клетки, раковой ткани и/или в микроокружении опухоли. В некоторых вариантах осуществления целевой антиген представляет собой или раковый антиген, экспрессия которого повышена, или мутированную форму ракового антигена в раковой клетке, раковой ткани и/или микроокружении опухоли.
[00199] В некоторых вариантах осуществления раковый антиген, экспрессия которого повышена в раковой клетке, раковой ткани и/или микроокружении опухоли, выбран из группы, состоящей из: 5T4 (трофобластический гликопротеин), 707-AP, 9D7, AFP (α-фетопротеин), AlbZIP (андроген-индуцируемый bZIP), HPG1 (специфический к простате человека ген-1), α5β1-интегрина, α5β6-интегрина, α --метилацил-коэнзим А рацемазы, ART-4 (АДФ рибозилтрансферазы-4), B7H4 (ингибитор активации Т-клеток 1, содержащий вариабельный иммуноглобулиноподобный домен), BAGE-1 (В меланомный антиген-1), BCL-2 (В-клеточный ХЛЛ/лимфома-2), BING-4 ( WD-повтор домена 46), CA 15-3/CA 27-29 (муцин 1), CA 19-9 (раковый антиген 19-9), CA 72-4 (раковый антиген 72-4), CA125 (раковый антиген 125), кальретикулина, CAMEL (ЦТЛ-распознаваемый антиген на меланоме), CASP-8 (каспаза 8), катепсина B, катепсина L, CD19 (кластер дифференцировки 19), CD20, CD22, CD25, CD30, CD33, CD4, CD52, CD55, CD56, CD80, CEA (раковый эмбриональный антиген SG8), CLCA2 (канал-переносчик-2 для ионов хлора), CML28 (опухолевый антиген хронического миелолейкоза 28), коактозин-подобного белка, коллагена XXIII, COX-2 (циклооксигеназа-2), CT-9/BRD6 (раково-тестикулярный антиген 9), Cten (С-концевой тензиноподобный белок), циклина B1, циклина D1, cyp-B, CYPB1 (цитохром p450 семейство 1, подсемейство b, тип 1), DAM-10/MAGE-B1 (ассоциированный с меланомой антиген B1), DAM-6/MAGE-B2, EGFR/Her1 (рецептор эпидермального фактора роста), EMMPRIN (басигин), EpCam, EphA2 (эфрин-рецептор A2), EphA3, ErbB3 (рецептор тирозинкиназы 3 Erb-B2), EZH2 (усилитель субъединицы zeste гомолога 2 policomb-репрессивного комплекса 2), FGF-5 (фактор роста фибробластов 5), FN (фибронектин), Fra-1 (Fos-связанный антиген-1), G250/CAIX (карбоангидраза 9), GAGE-1 (G антиген-1), GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE-7b, GAGE-8, GDEP (ген, дифференциально экспрессируемый в простате), GnT-V (глюконаткиназа), gp100 (специфический для линии меланоцитов антиген GP100), GPC3 (глипикан-3), HAGE (спиральный антиген), HAST-2 (член 1 семейство сульфотрансферазы 1A), гепсина, Her2/neu/ErbB2 (Erb-B2 рецептор тирозинкиназы 2), HERV-K-MEL, HNE (медуллазин), гомеобокса NKX 3.1, HOM-TES-14/SCP-1, HOM-TES-85, HPV-E6, HPVE7, HST-2 (сиртуин-2), hTERT, iCE (каспаза 1), IGF-1R (рецептор инсулиноподобного фактора роста-1), ИЛ-13Ra2 (α-2-субъединица рецептора интерлейкина-13), ИЛ-2R (рецептор интерлейкина-2), ИЛ-5 (интерлейкин-5), незрелого рецептора ламинина, калликреина-2, калликреина-4, Ki67, KIAA0205 (лизофосфатидилглицерол-ацилтрансфераза 1), KK-LC-1 (антиген-1 рака легкого кита-кюсю (kita-kyushu)), KM-HN-1, LAGE-1 (L-антиген, член 1 семейства белков LAGE), ливина, MAGE-A1, MAGE-A10, MAGE-A12, MAGEA2, MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A9, MAGE-B1, MAGE-B10, MAGE-B16, MAGEB17, MAGE-B2, MAGE-B3, MAGE-B4, MAGE-B5, MAGE-B6, MAGE-C1, MAGE-C2, MAGE-C3, MAGE-D1, MAGE-D2, MAGE-D4, MAGE-E1, MAGE-E2, MAGE-F1, MAGE-H1, MAGEL2 (антиген меланомы семейства L2), маммаглобина A, MART-1/Melan-A (антиген меланомы, распознаваемый Т-клетками-1), MART-2, белка матрикса 22, MC1R (рецептор меланокортина-1 ), М-КСФ (макрофагальный колониестимулирующий фактор), мезотелина, MG50/PXDN (пероксидазина), MMP 11 (матриксная металлопротеиназа 11), MN/CA IX-антигена (карбоангидраза 9), MRP-3 (ассоциированный с множественной лекарственной устойчивостью белок-3), MUC1 (муцин 1), MUC2, NA88-A (псевдоген 1 VENT-подобного гомеобокса 2), N-ацетилглюкозаминилтрансферазы-V, Neo-PAP (нео-поли(А)-полимераза), NGEP (новый ген, экспрессируемый в простате), NMP22 (белок ядерного матрикса 22), NPM/ALK (нуклеофосмин), NSE (нейронспецифическая энолаза), NY-ESO-1, NY-ESO-B, OA1 (QTL-1 остеоартрита), OFA-iLRP (раково-эмбриональный антиген-незрелый рецептор ламинина), OGT (O-GlcNAc-трансфераза), OS-9 (лектин эндоплазматического ретикулюма), остеокальцина, остеопонтина, p15 (ингибитор CDK 2B), p53, PAGE-4 (семейство P-антигена, член-4), PAI-1 (ингибитор активатора плазминогена 1), PAI-2, PAP (простатическая кислая фосфатаза), PART-1 (транскрипт-1, регулируемый андрогеном простаты), PATE (белок-1, экспрессируемый простатой и яичками), PDEF (полученный из простаты фактор Ets), Pim-1-киназы (сайт-1 интеграции провирусов), Pin1 (пептидил-пролил-цис-транс-изомераза-1), POTE (экспрессируемый в простате, яичнике, яичке и плаценте), PRAME (преимущественно экспрессируемый антиген при меланоме), простеина, протеиназы-3, PSA (простат-специфический антиген), PSCA (антиген стволовых клеток простаты), PSGR (простат-специфический рецептор, связанный с G-белком), PSM, PSMA (простат-специфический мембранный антиген), RAGE-1 (ассоциированный с опухолью антиген почечных карцином), RHAMM/CD168, RU1 (почечный убиквитарный белок-1), RU2, SAGE (антиген саркомы), SART-1 (антиген-1 плоскоклеточной карциномы, распознаваемый Т-клетками), SART-2, SART-3, Sp17 (белок спермы 17), SSX-1 (член-1 семейства SSX), SSX-2/HOM-MEL-40, SSX-4, STAMP-1 (металлоредуктаза STEAP2), STEAP, сурвивина, сурвивина-213, TA-90 (опухоль-ассоциированный антиген-90), TAG-72 (опухоль-ассоциированный гликопротеин-72), TARP(белок TCRγ с альтернативной рамкой считывания), TGFb (трансформирующий фактор роста β), TGFbR11 (рецептор-11 трансформирующего фактора роста β), TGM-4 (трансглютаминаза 4), TRAG-3(ген-3 устойчивости к таксолу), TRG (γ-локус рецептора Т-клеток), TRP-1 (транзиторный рецепторный потенциал 1), TRP-2/6b, TRP-2/INT2, Trp-p8, тирозиназы, UPA (урокиназный активатор плазминогена), VEGF (фактор роста сосудистого эндотелия A), VEGFR-2/FLK-1, и WT1 (белок опухоли Вильмса 1).
[00200] В некоторых вариантах осуществления целевой антиген представляет собой CD19 или CD22. В некоторых вариантах осуществления целевой антиген представляет собой CD19.
[00201] В некоторых вариантах осуществления мутированная форма опухолевого антигена выбрана из группы, состоящей из: α-актинина-4/m, ARTC1/m, bcr/abl, бета-катенина/m, BRCA1/m, BRCA2/m, CASP-5/m, CASP-8/m, CDC27/m, CDK4/m, CDKN2A/m, CML66, COA-1/m, DEK-CAN, EFTUD2/m, ELF2/m, ETV6-AML1, FN1/m, GPNMB/m, HLA-A*0201-R170I, HLA-A11/m, HLA-A2/m, HSP70-2M, KIAA0205/m, K-Ras/m, LDLR-FUT, MART2/m, ME1/m, MUM-1/m, MUM-2/m, MUM-3/m, миозина класса 1/m, neo-PAP/m, NFYC/m, N-Ras/m, OGT/m, OS-9/m, p53/m, Pml/RARa, PRDX5/m, PTPRX/m, RBAF600/m, SIRT2/m, SYTSSX-1, SYT-SSX-2, TEL-AML1, TGFbRII, и TPI/m.
[00202] В некоторых вариантах осуществления экспрессия гена, который ослабляет функцию иммунной клетки, вызывает одно или более из следующего: i) ингибирует пролиферацию иммунной клетки; ii) вызывает гибель иммунной клетки; iii) ингибирует функцию молекулы, необходимую иммунной клетке для распознавания целевого антигена и/или активации; iv) индуцирует дифференцировку иммунной клетки в другой тип, который выполняет другую функцию вместо того, чтобы вызывать иммунный ответ на целевой антиген; v) уменьшает реакции иммунной клетки с молекулой, которая способствует иммунному ответу иммунной клетки; или vi) усиливает реакцию иммунной клетки с молекулой, которая подавляет иммунный ответ иммунной клетки.
[00203] В некоторых вариантах осуществления ген, который ослабляет функцию иммунной клетки, выбран из группы, состоящей из: PD1, PD-L1, CTLA4, TIM3, CEACAM (CEACAM-1, CEACAM-3 или CEACAM-5), LAG 3, VISTA, BTLA, TIGIT, LAIR1, CD160, CD96, MerTK, 2B4, FAS, CD45, PP2A, SHP1, SHP2, DGK-альфа, DGK-дзета, Cbl-b, Cbl-c, CD148, LRR1, TGFBR1, ИЛ-10RA, KLGR1, DNMT3A, и A2aR. В некоторых вариантах осуществления ген, который ослабляет функцию иммунной клетки, усиливает реакции иммунной клетки с молекулой, которая подавляет иммунный ответ иммунной клетки. В некоторых вариантах осуществления ген, который усиливает реакции иммунной клетки с молекулой, которая подавляет иммунный ответ иммунной клетки, кодирует рецептор или лиганд иммунной контрольной точки.
[00204] В некоторых вариантах осуществления рецептор или лиганд иммунной контрольной точки выбран из группы, состоящей из PD1, PD-L1, CTLA4, TIM3, CEACAM (CEACAM-1, CEACAM-3 или CEACAM-5), LAG 3, VISTA, BTLA, TIGIT, LAIR1, CD160, CD96, MerTK и 2B4.
[00205] В некоторых вариантах осуществления агент генетического разрушения снижает экспрессию гена в иммунной клетке, который ослабляет функцию иммунной клетки на по меньшей мере 30, 40, 50, 60, 70, 80, 90 или 95% по сравнению с иммунной клеткой в отсутствие агента генетического разрушения. В некоторых вариантах осуществления агент генетического разрушения снижает экспрессию гена, который усиливает реакции иммунной клетки с молекулой, которая подавляет иммунный ответ иммунной клетки. В некоторых вариантах осуществления агент генетического разрушения снижает экспрессию гена, который кодирует рецептор или лиганд иммунной контрольной точки. В некоторых вариантах осуществления агент генетического разрушения снижает экспрессию гена, выбранного из группы, состоящей из: PD1, PD-L1, CTLA4, TIM3, CEACAM (CEACAM-1, CEACAM-3 или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, CD96, MerTK и 2B4.
[00206] В некоторых вариантах осуществления агент генетического разрушения снижает экспрессию гена, который ослабляет функцию иммунной клетки посредством РНК-интерференции (РНКи). В некоторых вариантах осуществления более чем один агент генетического разрушения снижает экспрессию гена, который ослабляет функцию иммунной клетки в иммунной клетке посредством РНКи. В некоторых вариантах осуществления агенты генетического разрушения нацелены на разные части одного гена, который ослабляет функцию иммунной клетки, нацелены на разные гены, которые ослабляют функцию иммунной клетки, или в любой их комбинации. В некоторых вариантах осуществления РНКи опосредуется короткой шпилечной РНК (кшРНК). В некоторых вариантах осуществления РНКи опосредуется более чем одной кшРНК.
[00207] В некоторых вариантах осуществления РНКи опосредуется двумя кшРНК. В некоторых вариантах осуществления две кшРНК нацелены на разные части PD-1. В некоторых вариантах осуществления две кшРНК нацелены на PD-1 и TIM-3, соответственно. В некоторых вариантах осуществления две кшРНК нацелены на PD-1 и CTLA-4, соответственно. В некоторых вариантах осуществления две кшРНК нацелены на PD-1 и LAG-3, соответственно. В некоторых вариантах осуществления две кшРНК нацелены на PD-1 и TIGIT, соответственно.
[00208] В некоторых вариантах осуществления последовательности оснований, кодирующие кшРНК, содержат последовательности, выбранные из группы, состоящей из SEQ ID NO: 1-219 и 238-267.
[00209] В некоторых вариантах экспрессия разных кшРНК, соответственно, регулируется разными промоторами. В некоторых вариантах экспрессия двух разных кшРНК, соответственно, регулируется двумя разными промоторами. В некоторых вариантах осуществления два разных промотора представляют собой промоторы РНК-полимеразы III. В некоторых вариантах осуществления два промотора представляют собой промоторы U6, полученные из разных видов. В некоторых вариантах осуществления два промотора ориентированы в разных направлениях относительно друг друга.
[00210] В некоторых вариантах осуществления каждый из генетически сконструированного антигенного рецептора и агента генетического разрушения экспрессируется из вектора. В некоторых вариантах осуществления генетически сконструированный антигенный рецептор и агент генетического разрушения экспрессируются из одного и того же вектора. В некоторых вариантах осуществления вектор выбран из группы, состоящей из ДНК, РНК, плазмиды, лентивирусного вектора, аденовирусного вектора и ретровирусного вектора. В некоторых вариантах осуществления вектор представляет собой лентивирусный вектор.
[00211] Иммунная клетка может быть охарактеризована тем, что она выбрана из лимфоцитов, таких как Т-киллеры, Т-хелперы, гамма/дельта Т-клетки и В-клетки, натуральные киллеры, тучные клетки, эозинофилы, базофилы; и фагоцитарные клетки включают макрофаги, нейтрофилы и дендритные клетки. Т-клетки включают CD4+ T-клетки и CD8+ T-клетки. В некоторых вариантах осуществления B-клеточная лимфома представляет собой диффузную крупноклеточную В-клеточную лимфому (DLBCL), первичную медиастинальную B-клеточную лимфому (PMBL), лимфому Ходжкина (HL), неходжкинскую лимфому, медиастинальную лимфому серой зоны или HL с нодулярным склерозом. В некоторых вариантах осуществления Т-клеточная лимфома представляет собой анапластическую крупноклеточную лимфому (ALCL), периферическую Т-клеточную лимфому, без дополнительного уточнения (PTCL-NOS), или ангиоиммунобластную Т-клеточную лимфому (AITL). В предпочтительном варианте осуществления иммунная клетка может быть выбрана из человеческих Т-клеток или Т-лимфоцитов и натуральных киллеров (NK). В некоторых вариантах осуществления иммунная клетка представляет собой Т-клетку. В некоторых вариантах осуществления T-клетка представляет собой CD4+ T-клетку или CD8+ T-клетку.
[00212] В некоторых вариантах осуществления иммунные клетки получают из клеток, первоначально полученных от субъекта. В некоторых вариантах осуществления субъект может представлять собой человека. В некоторых вариантах осуществления человек может представлять собой здорового донора. В других вариантах осуществления субъект может быть охарактеризован как имеющий опухоль или злокачественное новообразование, при котором обнаруживается увеличение или изменение уровней ракового антигена, на который нацеливается CAR или TCR, например, mTCR, экспрессируемый в клетке. В некоторых вариантах осуществления клетки могут быть получены и размножены, как правило, с использованием способов, описанных, например, в патентах США № 6352694; 6534055; 6905680; 6692964; 5858358; 6887466; 6905681; 7144575; 7067318; 7172869; 7232566; 7175843; 5883223; 6905874; 6797514; 6867041; и публикации заявки на патент США № 20060121005.
[00213] В некоторых вариантах осуществления получают CAR-T-клетки. В других вариантах осуществления получение CAR-T-клеток включает стадию обеспечения моноклональных клеток периферической крови. В других вариантах осуществления моноклональные клетки периферической крови могут быть отделены от образцов цельной крови. В некоторых вариантах осуществления получение CAR-T-клеток, описанных в данном документе, включает стадию стимуляции моноклональных клеток периферической крови с использованием антител. Например, агент, обеспечивающий первичный стимулирующий сигнал, представляет собой антитело против CD3 или его антигенсвязывающий фрагмент, а агент, обеспечивающий костимулирующий сигнал, представляет собой антитело против CD28 или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления получение CAR-T-клеток, описанных в данном документе, включает стадию трансдукции CAR, причем CAR может нацеливаться на любую мишень, описанную в данном документе, и на любые другие известные цели CAR, например, CAR может представлять собой CD19 CAR, который нацелен на CD19. В других вариантах осуществления полученные CAR-T-клетки выделяют.
[00214] Условия, подходящие для культуры Т-клеток, включают подходящие среды (например, минимальные питательные среды или среды RPMI 1640 или X-vivo 15 (Lonza)), которые могут содержать факторы, необходимые для пролиферации и жизнеспособности, включая сыворотку (например, эмбриональную бычью или человеческую сыворотку), интерлейкин-2 (ИЛ-2), инсулин, ИФН-γ, ИЛ-4, ИЛ-7, ГМ-КСФ, ИЛ-10, ИЛ-12, ИЛ-15, ТФР-β и ФНО-α или любые другие добавки для роста клеток известны специалисту в данной области техники. Другие добавки для роста клеток включают, но не ограничиваются ими, сурфактант, плазманат и восстановители, такие как N-ацетилцистеин и 2-меркаптоэтанол. Среды может включать RPMI 1640, AIM-V, DMEM, MEM, a-MEM, F-12, X-Vivo 15 и X-Vivo 20, Optimizer, с добавлением аминокислот, пирувата натрия и витаминов, или без сыворотки, или с добавлением соответствующего количества сыворотки (или плазмы) или определенного набора гормонов и/или количества цитокинов, достаточного для роста и экспансии Т-клеток. Антибиотики, например, пенициллин и стрептомицин, включают только в экспериментальные культуры, но не в культуры клеток, которые должны быть введены субъекту. Целевые клетки поддерживают в условиях, необходимых для поддержания роста, например, при подходящей температуре (например, 37°C) и атмосфере (например, воздух плюс 5% CO2). Также может быть желательно несколько циклов стимуляции, так что время культивирования Т-клеток может составлять 60 суток или более.
[00215] Т-клетки, которые подвергали стимуляции в течение различных периодов времени, могут обладать различными характеристиками. Например, типичные продукты мононуклеарных клеток крови или продукты мононуклеарных клеток периферической крови после афереза содержат популяцию Т-хелперных клеток (TH, CD4+), которая больше, чем популяция цитотоксических или супрессорных Т-клеток (TC, CD8+). Экспансия Т-клеток ex vivo посредством стимуляции рецепторов CD3 и CD28 приводит к получению популяции Т-клеток, которая до приблизительно 8-9 суток состоит преимущественно из TH-клеток, тогда как приблизительно через 8-9 суток популяция T-клеток содержит возрастающую популяцию TC-клеток. Соответственно, в зависимости от цели лечения, может быть полезным введение субъекту популяции Т-клеток, состоящей преимущественно из Т-клеток. Аналогично, если была выделена антиген-специфическая субпопуляция TC-клеток, может быть полезно размножение этой субпопуляции до большего количества. Более того, в дополнение к маркерам CD4 и CD8 во время процесса экспансии клеток значительно изменяются другие фенотипические маркеры, но в значительной степени воспроизводимо. Таким образом, такая воспроизводимость обеспечивает возможность адаптации продукта активированных Т-клеток к конкретным целям.
[00216] Можно использовать различные анализы для оценки CAR-T-клеток, такие как, но не ограничиваясь ими, анализы способности к экспансии после стимуляции антигеном, способности к сохранению экспансии Т-клеток в отсутствие повторной стимуляции, а также анализы противораковой активности в соответствующих условиях in vitro и на животных моделях. Анализы более подробно описаны ниже.
[00217] В некоторых вариантах осуществления Вестерн-блот анализ экспрессии CAR в первичных Т-клетках можно использовать для обнаружения присутствия мономеров и димеров. См., например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009).
[00218] В некоторых вариантах осуществления экспансия CAR+ T-клеток in vitro после стимуляции антигеном может быть измерена при помощи проточной цитометрии. Например, смесь CD4+ и CD8+ Т-клеток стимулируют αCD3/αCD28 иАПК с последующей трансдукцией лентивирусными векторами, экспрессирующими GFP, под контролем промоторов, подлежащих анализу. Иллюстративные промоторы включают промоторы гена IE ЦМВ, EF-1 альфа, убиквитина С или фосфоглицерокиназы (PGK). Флуоресценцию GFP оценивают на 6 сутки культивирования в субпопуляциях CD4+ и/или CD8+ Т-клеток при помощи проточной цитометрии. См, например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). Альтернативно, смесь CD4+ и CD8+ Т-клеток стимулируют с помощью магнитных гранул, покрытых αCD3/αCD28 на 0 сутки и трансдуцируют с помощью CAR на 1 сутки, используя бицистронный лентивирусный вектор, экспрессирующий CAR, вместе с eGFP с помощью последовательности ухода с рибосомы 2А. Культуры повторно стимулируют, например, клетками K562, экспрессирующими hCD32 и 4-lBBL, в присутствии антител против CD3 и против CD28 (K562-BBL-3/28) после промывки. Экзогенный ИЛ-2 добавляют к культурам через сутки в концентрации 100 МЕ/мл. GFP+ T-клетки подсчитывают при помощи проточной цитометрии с использованием подсчета на основе гранул. См, например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). Также можно измерить устойчивую экспансию CAR+ T-клеток в отсутствие повторной стимуляции.
[00219] Оценка пролиферации клеток и выработки цитокинов была описана ранее, например, у Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). Вкратце, оценку CAR-опосредованной пролиферации проводят в титрационных микропланшетах путем смешивания промытых Т-клеток с целевыми клетками, такими как клетки K562-Meso, Ovcar3, Ovcar8, SW1990, Panc02.03 или CD32 и CD137 (KT32-BBL) для конечного соотношения Т-клетки: целевые клетки 1:1. Моноклональные антитела против CD3 (клон OKT3) и против CD28 (клон 9.3) добавляют в культуры с клетками KT32-BBL в качестве положительного контроля для стимуляции пролиферации Т-клеток, поскольку эти сигналы поддерживают длительную экспансию CD8+ Т-клеток ex vivo. Т-клетки в культурах подсчитывают с использованием флуоресцентных гранул CountBright ™ (Invitrogen, Карслбад, Калифорния) и проточной цитометрии, как описано производителем. CAR+ Т-клетки идентифицируют путем экспрессии GFP, используя Т-клетки, которые были сконструированы с использованием экспрессирующих CAR лентивирусных векторов, связанных с eGFP-2A. Экспрессию CD4+ и CD8+ на Т-клетках также одновременно определяют с помощью специфических моноклональных антител (BD Biosciences). Измерения цитокинов выполняют в супернатантах, собранных через 24 часа после повторной стимуляции, используя набор для количественного определения растворимых форм цитокинов human TH1/TH2 cytokine cytometric bead array kit (BD Biosciences, Сан-Диего, Калифорния) в соответствии с инструкциями производителя. Флуоресценцию оценивают с помощью проточного цитометра FACScalibur, а данные анализируют в соответствии с инструкциями производителя.
[00220] Цитотоксичность можно оценить при помощи способов, описанных в данном документе, например, в примерах, или при помощи стандартного анализа высвобождения 51Cr (Milone et al., Molecular Therapy 17(8): 1453-1464 (2009)). Вкратце, целевые клетки (например, клетки BHK или CHO) загружают 51 Cr (как NaCr04, New England Nuclear, Бостон, Массачусетс) при 37°C в течение 2 часов при частом перемешивании, дважды промывают в полной среде RPMI и помещают в титрационные микропланшеты. Эффекторные Т-клетки смешивают с целевыми клетками в лунках в полной среде RPMI в различных соотношениях эффекторных клеток с целевыми клетками (E:T). Готовят также дополнительные лунки, содержащие только среду (спонтанное высвобождение, СВ) или 1% раствор детергента тритон-Х 100 (полное высвобождение, ПВ). Через 4 часа инкубации при температуре 37°C собирают супернатант из каждой лунки. Затем измеряют высвобожденный 51Cr с помощью счетчика гамма-частиц (Packard Instrument Co., Уолтем, Массачусетс). Каждое условие выполняют по меньшей мере в трех повторностях, а процентное содержание лизиса подсчитывают, используя следующую формулу: % лизиса = (ER- SR) / (TR - SR), где ER представляет среднее значение высвобожденного 51Cr для каждого экспериментального условия. Также можно использовать альтернативные анализы цитотоксичности, такие как анализы цитотоксичности на основе проточной цитометрии.
[00221] Другие анализы, в том числе те, которые описаны в разделе «Примеры» в данном документе, а также те, которые известны в данной области техники, также могут быть использованы для оценки CAR-T-клеток, полученных в соответствии с данным документом.
[00222] В некоторых вариантах осуществления иммунные клетки, полученные в соответствии с данным документом, могут участвовать в иммунном ответе на заболевания, при которых экспрессируются антигены, на которые нацелены два типа кшРНК, и CAR или TCR, например, mTCR. В дополнительных вариантах осуществления иммунные клетки можно использовать для обеспечения фармацевтической композиции для иммунотерапии пациентов-людей. В некоторых вариантах осуществления фармацевтическая композиция может иметь терапевтический эффект на заболевание-мишень без необходимости применения ингибиторов иммунной контрольной точки, которые могут вызывать тяжелые побочные реакции и дополнительно обременять пациента высокими затратами.
[00223] В некоторых вариантах осуществления иммунные клетки можно использовать в качестве терапевтических агентов для иммунных клеток; такие иммунные клетки, как правило, используются для лечения злокачественных новообразований, но не ограничиваются ими. В дополнительных вариантах осуществления, чтобы обучить эти иммунные клетки распознавать злокачественные опухоли, их модифицируют, чтобы они экспрессировали рецепторы клеточной поверхности, которые нацелены на раковые антигены.
[00224] В другом аспекте в данном документе предложены композиции, содержащие сконструированные иммунные клетки, описанные выше.
5. Лечение с использованием CAR-T-клеток, которые нацелены на одну или более иммунных контрольных точек
[00225] Как указано в данном документе, вектор «два в одном» содержит последовательность оснований, кодирующую один или более типов коротких шпилечных РНК (кшРНК), которые ингибируют экспрессию генов, которые ослабляют функцию иммунных клеток, и последовательность оснований, кодирующую любой один из химерного антигенного рецептора (CAR) и Т-клеточного рецептора (TCR), например, моноклонального Т-клеточного рецептора (mTCR). Используя вектор в соответствии с одним вариантом осуществления, могут быть получены иммунные клетки, причем иммунные клетки имеют сниженную экспрессию рецептора иммунной контрольной точки и экспрессируют CAR или TCR, например, mTCR, специфический для целевых молекул. Указанные иммунные клетки могут быть использованы для обеспечения фармацевтической композиции для иммунотерапии.
[00226] Разнообразные заболевания могут быть облегчены путем введения иммунных клеток, как описано в данном документе, субъекту, подходящему для адоптивной иммунотерапии. В некоторых вариантах осуществления полученные CAR-T-клетки, как предусмотрено, предназначены для аллогенной адоптивной клеточной терапии. Кроме того, в данном документе предложено терапевтическое применение композиций, описанных в данном документе, включающее введение композиции субъекту, подходящему для адоптивной клеточной терапии, причем субъект имеет аутоиммунное расстройство; гематобластоз; солидную опухоль; или инфекцию, связанную с ВИЧ, РСВ, ВЭБ, ЦМВ, аденовирусом или полиомавирусом BK.
[00227] Примеры гемобластозов включают, но не ограничиваются ими, острые и хронические лейкозы (острый миелогенный лейкоз (ОМЛ), острый лимфобластный лейкоз (ОЛЛ), хронический миелогенный лейкоз (ХМЛ), лимфомы, неходжкинскую лимфому (НХЛ), болезнь Ходжкина, множественную миелому и миелодиспластические синдромы. Примеры солидных злокачественных новообразований включают, но не ограничиваются ими, рак головного мозга, предстательной железы, молочной железы, легкого, толстой кишки, матки, кожи, печени, кости, поджелудочной железы, яичника, яичек, мочевого пузыря, почек, головы, шеи, желудка, шейки матки, прямой кишки, гортани и пищевода. Примеры различных аутоиммунных расстройств включают, но не ограничиваются ими, очаговую алопецию, аутоиммунную гемолитическую анемию, аутоиммунный гепатит, дерматомиозит, диабет (тип 1), некоторые формы ювенильного идиопатического артрита, гломерулонефрит, болезнь Грейвса, синдром Гийена-Барре, идиопатическую тромбоцитопеническую пурпуру, миастению гравис, некоторые формы миокардита, рассеянный склероз, пузырчатку/пемфигоид, пернициозную анемию, узелковый полиартериит, полимиозит, первичный билиарный цирроз, псориаз, ревматоидный артрит, склеродермию/системный склероз, синдром Шегрена, системную красную волчанку, эритематоз, некоторые формы тиреоидита, некоторые формы увеита, витилиго, гранулематоз с полиангиитом (Вегенера). Примеры вирусных инфекций включают, но не ограничиваются ими, расстройства, связанные с ВИЧ (вирусом иммунодефицита человека), ВПЧ (вирусом простого герпеса), KSHV (герпесвирусом, связанным с саркомой Капоши), РСВ (респираторно-синцитиальным вирусом), ВЭБ (вирусом Эпштейна-Барра), ЦМВ (цитомегаловирусом), ВВО (вирусом ветряной оспы), аденовирусом, лентивирусом, полиомавирусом BK.
[00228] Острый лейкоз характеризуется быстрым размножением незрелых клеток крови. Эта скученность делает костный мозг неспособным производить здоровые клетки крови. Острые формы лейкоза могут возникать у детей и молодых людей. На самом деле, это более распространенная причина смерти детей в США, чем любой другой вид злокачественных новообразований. При остром лейкозе требуется немедленное лечение в связи с быстрым прогрессированием и накоплением злокачественных клеток, которые затем попадают в кровоток и распространяются на другие органы организма. Вовлечение центральной нервной системы (ЦНС) встречается редко, хотя заболевание может иногда вызывать паралич черепных нервов. Хронический лейкоз отличается чрезмерным накоплением относительно зрелых, но все еще ненормальных клеток крови. Как правило, прогрессирование происходит в течение от нескольких месяцев до нескольких лет, клетки вырабатываются с гораздо большей скоростью, чем нормальные клетки, в результате чего в крови образуется много аномальных белых кровяных телец. Хронический лейкоз чаще встречается у пожилых людей, но теоретически может встречаться в любой возрастной группе. Принимая во внимание, что острый лейкоз должен лечиться немедленно, хронические формы иногда проверяются в течение некоторого времени перед лечением, чтобы гарантировать максимальную эффективность терапии. Кроме того, заболевания классифицируются на лимфоцитарные или лимфобластные, которые указывают на то, что раковое изменение произошло в типе клеток костного мозга, которые обычно продолжают формировать лимфоциты, и миелогенные или миелоидные, которые указывают на то, что раковое изменение произошло в типе клеток костного мозга, которые обычно продолжают формировать эритроциты, некоторые типы белых клеток и тромбоциты (см. лимфоидные клетки и миелоидные клетки).
[00229] Острый лимфобластный лейкоз (также известный как острый лимфобластный лейкоз, или ОЛЛ) является наиболее распространенным типом лейкоза у маленьких детей. Эта болезнь также поражает взрослых, особенно в возрасте 65 лет и старше. Хронический лимфолейкоз (ХЛЛ) чаще всего поражает взрослых в возрасте старше 55 лет. Иногда он встречается у молодых взрослых, но почти никогда не поражает детей. Острый миелогенный лейкоз (также известный как острый миелолейкоз, или ОМЛ) встречается чаще у взрослых, чем у детей. Этот тип лейкоза ранее называли «острым нелимфобластным лейкозом». Хронический миелогенный лейкоз (ХМЛ) встречается в основном у взрослых. У очень небольшого числа детей также развивается эта болезнь.
[00230] Лимфома представляет собой тип злокачественного новообразования, которое возникает в лимфоцитах (тип лейкоцитов в иммунной системе позвоночных). Существует много типов лимфомы. По данным Национального института здравоохранения США, лимфомы составляют около пяти процентов всех случаев рака в Соединенных Штатах, а лимфома Ходжкина, в частности, составляет менее одного процента всех случаев злокачественных новообразований в Соединенных Штатах. Поскольку лимфатическая система является частью иммунной системы организма, пациенты с ослабленной иммунной системой, например, из-за ВИЧ-инфекции, или определенных лекарственных средств, или медикаментозного лечения, также имеют более высокую частоту возникновения лимфомы.
[00231] В XIX и XX веках это заболевание называлось «болезнью Ходжкина», так как оно было открыто Томасом Ходжкиным в 1832 году. В общем лимфому, как правило, подразделяют на лимфому Ходжкина и неходжкинскую лимфому (все другие типы лимфомы). Научная классификация типов лимфом является более детальной. Хотя в более ранних классификациях они относились к гистиоцитарным лимфомам, в более новых классификациях они определяются как происходящие из B-, T- или NK-клеток.
[00232] Когда фармацевтическую композицию вводят пациенту со злокачественной опухолью, в которой экспрессируется целевая молекула CAR или TCR, например, mTCR, фармацевтическая композиция может распознавать злокачественную опухоль и обладать иммунной активностью без активации генов, которые ослабляют функцию иммунных клеток по отношению к раковым клеткам, и без таких проблем, как истощение из-за ингибирующего активацию сигналинга, вызванного тем самым.
[00233] В некоторых вариантах осуществления вышеуказанная фармацевтическая композиция, содержащая иммунные клетки, способна более эффективно подавлять экспрессию рецепторов иммунной контрольной точки, одновременно обеспечивая максимальную эффективность противораковой терапии иммунными клетками, при этом химерные антигенные рецепторы могут функционировать. В других вариантах осуществления, поскольку в фармацевтической композиции используются клетки, в которых экспрессия рецепторов иммунной контрольной точки подавлена, как описано выше, можно устранить серьезные и системные побочные реакции, такие как синдром высвобождения цитокинов или симптомы аутоиммунных заболеваний, которые могут возникнуть в результате использования отдельного ингибитора для рецептора иммунной контрольной точки, а также бремя, связанное с увеличением стоимости лечения в результате одновременного использования дорогостоящей терапии антителами с клеточной терапией.
[00234] Поскольку очевидно, что в дополнение к клеткам к фармацевтической композиции могут быть добавлены другие фармацевтически приемлемые соли, носители, вспомогательные вещества, наполнители, и другие добавки и т. д., которые могут дополнительно улучшить иммунный ответ, подробное их описание будет опущено.
[00235] В некоторых вариантах осуществления фармацевтическая композиция содержит две CAR-T-клетки, нацеленные на две иммунные контрольные точки, как описано в данном документе. Например, двойные иммунные контрольные точки могут быть выбраны из группы, состоящей из PD1 (белок программируемой клеточной смерти 1), PD-L1 (лиганд-1 белка программируемой клеточной гибели), CTLA4 (цитотоксический Т-лимфоцит-ассоциированный белок 4), TIM- 3 (белок 3, содержащий домены T-клеточного иммуноглобулина и муцина), CEACAM (молекула адгезии клеток, связанная с раковым эмбриональным антигеном, включая три подтипа CEACAM-1, CEACAM-3 или CEACAM-5), LAG3 (ген активации лимфоцитов-3), VISTA (V-доменный супрессор активации Т-клеток), BTLA (B- и T-лимфоцитарный аттенюатор), TIGIT (T-клеточный иммунорецептор с доменами Ig и ITIM), LAIR1 (связанный с лейкоцитами иммуноглобулин-подобный рецептор 1), CD160 (кластер дифференцировки 160), CD96 (кластер дифференцировки 96), MerTK (протоонкогенная тирозинпротеинкиназа MER) и 2B4 (лиганд, индуцирующий активацию NK-клеток), и, например, могут быть выбраны между PD1 и TIM3.
[00236] В некоторых вариантах осуществления типы целевых иммунных контрольных точек влияют на противоопухолевый эффект фармацевтической композиции. Например, фармацевтическая композиция, нацеленная на PD-1 и TIM3, может демонстрировать другой уровень противоопухолевого эффекта по сравнению с фармацевтической композицией, нацеленной на PD-1 и TIGIT. В других вариантах осуществления указанное различие в противоопухолевом эффекте является непредсказуемым из известных знаний об противоопухолевом эффекте других лекарственных средств, нацеленных на ту же иммунную контрольную точку, например, других лекарственных средств, которые могут включать антитело, нацеленное на иммунную контрольную точку. В некоторых вариантах осуществления нацеливание на определенные две иммунные контрольные точки может вызывать неожиданно высокий противоопухолевый эффект. В иллюстративном варианте осуществления (пример 10) CAR-T-клетки, нацеленные на PD-1 и TIGIT, демонстрируют неожиданно превосходный противоопухолевый эффект по сравнению с другими двойными KD CAR-T-клетками, нацеленными на комбинации PD-1 и CTLA-4, PD-1 и LAG-3, и PD-1 и TIM-3.
[00237] В одном аспекте композиция, описанная в данном документе, может быть предоставлена в единичной дозированной форме, причем каждая дозированная единица, например, инъекция, содержит заранее определенное количество композиции, отдельно или в подходящей комбинации с другими активными агентами. В контексте данного документа термин единичная дозированная форма относится к физически дискретным единицам, подходящим в качестве единичных доз для людей и животных, причем каждая единичная дозированная форма содержит заданное количество композиции, описанной в данном документе, отдельно или в комбинации с другими активными агентами, рассчитанными в количестве, достаточном для достижения желаемого эффекта, в комбинации с фармацевтически приемлемым разбавителем, носителем или наполнителем там, где это необходимо. Спецификации для новых единичных дозированных форм клеток или композиций, описанных в данном документе, зависят от конкретной фармакодинамики, связанной с фармацевтической композицией у конкретного субъекта.
[00238] В некоторых вариантах осуществления предпочтительная лекарственная форма для клеток или композиций, описанных в данном документе, может быть определена на основе содержания данного описания и общих знаний о методах изготовления и в соответствии с предполагаемым путем введения, способом доставки и целевой дозой. Несмотря на способ введения, эффективная доза может быть рассчитана в соответствии с массой тела пациента, площадью поверхности или размером органа. Расчеты для определения соответствующих доз введения для терапии с использованием соответствующих лекарственных форм, указанных в данной спецификации, а также дополнительной очистки проводятся ежедневно в данной области техники и включены в объем работ, выполняемых ежедневно в данной области техники. Соответствующие дозы введения могут быть определены с помощью соответствующих данных о зависимости между дозой и эффектом.
[00239] Фармацевтические композиции, описанные в данном документе, могут быть использованы отдельно или в комбинации с другими известными агентами, полезными для лечения злокачественного новообразования. Независимо от того, доставляются ли они по отдельности или в комбинации с другими агентами, фармацевтические композиции, описанные в данном документе, могут доставляться различными путями и в различные органы и ткани организма млекопитающего, в частности, человека, для достижения определенного эффекта. Специалисту в данной области техники будет понятно, что, хотя для введения можно использовать более одного пути, конкретный путь может обеспечить более немедленную и более эффективную реакцию, чем другой путь. Например, внутрикожная доставка может иметь преимущество в использовании относительно ингаляции для лечения меланомы. Местная или системная доставка может быть достигнута путем введения, включающего нанесение или инстилляцию препарата в полости тела, ингаляцию или инсуффляцию аэрозоля, или путем парентерального введения, включающего внутримышечное, внутривенное, интрапортальное, внутрипеченочное, перитонеальное, подкожное или внутрикожное введение. Иллюстративный путь введения субъекту включает внутривенную (в/в) инъекцию и регионарное (внутриопухолевое, внутрибрюшинное) введение. В некоторых вариантах осуществления фармацевтическую композицию можно вводить путем инфузии в солидную опухоль.
[00240] В некоторых вариантах осуществления в дополнение к генетически сконструированным иммунным клеткам, предложенным в данном документе, дополнительный терапевтический агент, содержащий антитело или фрагмент антитела, который нацелен на антиген, связанный с патологическим состоянием, заболеванием или показанием, может использоваться с этими эффекторными клетками в комбинированной терапии. В некоторых вариантах осуществления антитело представляет собой моноклональное антитело. В некоторых вариантах осуществления антитело представляет собой гуманизированное антитело, гуманизированное моноклональное антитело или химерное антитело. В некоторых вариантах осуществления антитело или фрагмент антитела специфически связывается с вирусным антигеном. В других вариантах осуществления антитело или фрагмент антитела специфически связывается с опухолевым антигеном. В некоторых вариантах осуществления антитела, подходящие для комбинированного лечения в качестве дополнительного терапевтического агента к введенным генетически сконструированным иммунным клеткам, включают, но не ограничиваются ими, анти-CD20 (ритуксимаб, велтузумаб, офатумумаб, ублитуксимаб, окаратузумаб, обинутузумаб), анти-HER2 (трастузумаб, пертузумаб), анти-CD52 (алемтузумаб), анти-EGFR (цертуксимаб), анти-GD2 (динутуксимаб), анти-PDL1 (авелумаб), анти-CD38 (даратумумаб, изатуксимаб, MOR202), анти-CD123 (7G3, CSL362), анти-SLAMF7 (элотузумаб); и их гуманизированные или Fc-модифицированные варианты или фрагменты, или их функциональные эквиваленты и биологические аналоги.
[00241] Желательно, чтобы эффективное количество или достаточное количество выделенных трансдуцированных Т-клеток присутствовало в композиции и вводилось субъекту таким образом, чтобы они формировали длительные специфические противоопухолевые ответы для уменьшения размера опухоли или устранения роста или повторного роста опухоли, чем в противном случае привело бы отсутствие такого лечения. Желательно, чтобы количество трансдуцированных Т-клеток, повторно введенных в организм субъекта, приводило к 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 98% или 100% уменьшению размера опухоли по сравнению с другими аналогичными условиями, при которых трансдуцированные Т-клетки отсутствуют.
[00242] Соответственно, для количества вводимых трансдуцированных Т-клеток должен учитываться путь введения и он должно быть таким, чтобы вводилось достаточное количество трансдуцированных Т-клеток для достижения желаемого терапевтического ответа. Кроме того, количества каждого активного агента, включенного в композиции, описанные в данном документе (например, количество на каждую клетку, с которой необходимо приводить в контакт, или количество на определенную массу тела), могут варьироваться в различных применениях. В общем, концентрация трансдуцированных Т-клеток у субъекта, подвергаемого лечению, желательно должна быть достаточной для обеспечения по меньшей мере от около 1×106 до около 1×109 трансдуцированных Т-клеток, еще более желательно от около 1×107 до около 5×108 трансдуцированных Т-клеток, хотя может быть использовано любое подходящее количество: или выше, например, более 5 × 108 клеток, или ниже, например, менее 1 × 107 клеток. Схема применения может быть основана на хорошо зарекомендовавших себя способах лечения на основе клеток (см., например, Topalian and Rosenberg, 1987; патент США № 4690915), или может использоваться альтернативная стратегия непрерывной инфузии.
[00243] Эти значения обеспечивают общие рекомендации в отношении диапазона трансдуцированных Т-клеток, которые должны использоваться практикующим врачом при оптимизации описанных в данном документе способов. Перечисление в данном документе таких диапазонов никоим образом не исключает использование более высокого или более низкого количества компонента, что может быть оправдано в конкретном применении. Например, фактическая доза и схема приема могут варьироваться в зависимости от того, вводится ли композиции в комбинации с другими фармацевтическими композициями или в зависимости от индивидуальных различий в фармакокинетике, расположении лекарственного средства и метаболизме. Специалист в данной области техники может легко внести любые необходимые корректировки в соответствии с требованиями конкретной ситуации.
[00244] В набор может быть включена любая из композиций, описанных в данном документе. В некоторых вариантах осуществления CAR-T-клетки предложены в наборе, который также может содержать реагенты, подходящие для экспансии клеток, такие как среды, иАПК, факторы роста, антитела (например, для сортировки или определения характеристик CAR-T-клеток) и/или плазмиды, кодирующие CAR или транспозазу.
[00245] В неограничивающем примере, конструкция, экспрессирующая химерный рецептор, один или более реагентов для создания конструкции экспрессирующей химерный рецептор, клетки для трансфекции экспрессирующей конструкции и/или один или более инструментов для получения аллогенных клеток для трансфекции экспрессирующей конструкции (таким инструментом может быть шприц, пипетка, щипцы и/или любой подобный медицинский прибор).
[00246] В некоторых вариантах осуществления в наборе предложена экспрессирующая конструкция для устранения эндогенной экспрессии α/β TCR, один или более реагентов для получения конструкции и/или CAR+ T-клетки. В некоторых вариантах осуществления включены экспрессирующие конструкции, которые кодируют нуклеазу(ы) с цинковыми пальцами. В некоторых аспектах набор включает реагенты или прибор для электропорации клеток.
[00247] Наборы могут содержать одну или более подходящих разделенных на аликвоты композиций, описанных в данном документе, или реагенты для получения композиций, как описано в данном документе. Компоненты наборов могут быть упакованы или в водной среде, или в лиофилизированной форме. Контейнерные средства наборов могут включать по меньшей мере один флакон, пробирку, колбу, флакон, шприц или другие контейнерные средства, в которые может быть помещен компонент, и в некоторых вариантах осуществления соответствующим образом разделен на аликвоты. Если в наборе имеется более одного компонента, набор также обычно содержит второй, третий или другой дополнительный контейнер, в который дополнительные компоненты могут быть помещены отдельно. Тем не менее во флаконе могут содержаться различные комбинации компонентов. Описанные в данном документе наборы также обычно содержат средства для размещения конструкции химерного рецептора и любых других контейнеров с реагентами в закрывающемся контейнере для коммерческой продажи. Такие контейнеры могут включать пластмассовые контейнеры, полученные с помощью формования с раздувом или литья под давлением, в которые, например, помещаются нужные флаконы.
[00248] В одном аспекте в данном документе предложены фармацевтические композиции, содержащие иммунную клетку, описанную выше, и фармацевтически приемлемый носитель. В другом аспекте в данном документе предложены фармацевтические композиции для иммунотерапии пациентов-людей, содержащие иммунные клетки, описанные выше. В некоторых вариантах осуществления иммунную клетку первоначально получают от пациента. В некоторых вариантах осуществления у пациента имеется опухоль или злокачественное новообразование, при которых обнаруживается увеличение или изменение уровней ракового антигена, на который нацеливается CAR или TCR, например, mTCR, экспрессируемый в клетке.
[00249] В другом аспекте в данном документе предложены способы. В некоторых вариантах осуществления предложены способы лечения, включающие введение субъекту, имеющему заболевание или патологическое состояние, иммунной клетки, описанной выше, или композиции, описанной выше. В некоторых вариантах осуществления генетически сконструированный антигенный рецептор специфически связывается с антигеном, связанным с заболеванием или патологическим состоянием. В некоторых вариантах осуществления заболевание или патологическое состояние представляет собой злокачественное новообразование или опухоль.
[00250] В другом аспекте в данном документе предложены иммунные клетки и композиции. В некоторых вариантах осуществления предложены иммунные клетки и композиции, описанные выше, для применения при лечении заболевания или патологического состояния.
[00251] В другом аспекте в данном документе предложено применение иммунных клеток или композиций. В некоторых вариантах осуществления предложено применение иммунных клеток или композиций, описанных выше, при изготовлении лекарственного препарата для применения в способе лечения заболевания или патологического состояния. В некоторых вариантах осуществления генетически сконструированный антигенный рецептор специфически связывается с антигеном, связанным с заболеванием или патологическим состоянием. В некоторых вариантах осуществления заболевание или патологическое состояние представляет собой злокачественное новообразование или опухоль.
[00252] Приведенное выше описание данного изобретения предназначено для примера, и специалисты в данной области техники должны понимать, что данное изобретение может быть легко модифицировано в некоторые другие формы без изменения технической идеи или существенных характеристик данного изобретения. Соответственно, варианты осуществления, описанные выше, следует понимать как иллюстративные и не ограничивающие во всех аспектах. Например, соответствующие составляющие элементы, которые описаны как объединенные, могут выполняться отдельно, и аналогичным образом, составляющие элементы, которые описываются как выполняемые отдельно, могут выполняться вместе.
[00253] Объем данного изобретения представлен прилагаемой формулой изобретения, и все модифицированные или измененные формы, полученные из значения и объема формулы изобретения и эквивалентных ей концепций, должны интерпретироваться как входящие в объем данного изобретения.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
|
ПРИМЕРЫ
[00254] Примеры, относящиеся к данному изобретению, описаны ниже. В большинстве случаев могут быть использованы альтернативные методы. Примеры предназначены для иллюстрации и не являются ограничивающими объем изобретения.
Общие способы
[00255] Клеточные линии и культура. Клеточные линии Nalm-6, Nalm-6GL (экспрессирующие GFP и люциферазу светлячка), K562, K562-CD19, IM-9, Raji, Daudi культивировали в RPMI-1640 с добавлением 10% инактивированной нагреванием фетальной бычьей сыворотки и 2 мМ L-глутамина и 1% пенициллина/стрептомицина в инкубаторе с увлажнением с 5% CO2 при 37 °C. Клеточную линию Lenti-X™ 293T приобретали у Takara и культивировали в DMEM с добавлением 10% инактивированной нагреванием фетальной бычьей сыворотки (FBS), 2 мМ L-глютамина, 0,1 мМ заменимых аминокислот, 1 мМ пирувата натрия и 1% пенициллина/стрептомицина. Для получения линий D19+ PD-L1+ клеток, клетки K562-CD19 или NALM-6-GL трансдуцировали лентивирусом, кодирующим человеческий PD-L1 (NM_014143.3). Линию клеток Nalm-6-PDL1-CD80 получали путем трансдукции клеток Nalm-6-PDL1 лентивирусом, кодирующим CD80 человека (NM_005191.3).
[00256] Плазмидный конструкт. Конструирование вектора pLV-CD19-BBz, содержащего анти-CD19 scFv (FMC63), шарнирную и трансмембранную области CD8α и цитоплазматические домены 4-1BB (CD137) и CD3ζ, было описано ранее (PNAS, 2016, Ma JSY). Для получения pLV-CD19-28z цитоплазматический домен 4-1BB заменяли на последовательность костимулирующего домена CD28 человека. Для обнаружения и очистки трансдуцированных CAR-T-клеток последовательность δLNGFR (CD271 с усеченным цитоплазматическим доменом) амплифицировали из вектора pMACS-δLNGFR (Milteny Biotec) и вставляли перед CAR-трансгеном через последовательность P2A, чтобы получить pLV-δLNGFR-CD19-28z или pLV-δLNGFR-CD19-BBz.
[00257] Для генерации лентивирусных (LV) векторов «два в одном», которые кодируют как кассеты экспрессии CAR, так и кшРНК, синтезировали экспрессирующую кшРНК кассету, содержащую кшРНК (линкерная последовательность; TTCAAGAGA, последовательность терминации; TTTTT) и промоторы Pol (mU6, hU6 или hH1), и субклонировали в CAR-кодирующие лентивирусные векторы в область, расположенную выше против хода транскрипции от центрального полипуринового тракта (cPPT). Для получения двойных векторов «два в одном», экспрессирующих две кшРНК разными промоторами (mU6 и hU6), последовательность MCS BstZ171-Xba1-Nde1-Bmt1-Spe1 была вставлена в вектор pLV-hU6-shPD-1_δLNGFR-CD19-BBz далее по ходу транскрипции от промотора hU6. Фрагменты второй кассеты mU6-shRNA субклонировали в MCS.
[00258] Для создания репортерных векторов последовательность NFAT RE x3, полученную из репортера pGL2_NFAT-Luc (addgene № 10959), амплифицируют с помощью ПЦР. NF-kB-RE 5x (5'-GGGAATTTCC-3') и последовательность miniP были синтезированы (IDT Technologies). Промотор EF-1a вектора pLV-eGFP был заменен этими репортерными фрагментами для получения репортерных векторов pLV-NFAT-RE 3x-eGFP или pLV-NF-kB-RE 5x-eGFP.
[00259] Выбор последовательностей миРНК или кшРНК. Последовательности-кандидаты 21-мерных киРНК, которые специфичны для ингибирующих контрольных иммунных точек (CTLA-4, LAG-3, TIGIT и TIM-3), были разработаны с использованием программ BLOCK-iT™ RNAi Designer или Sfold перед синтезом. РНК-олигомеры. киРНК, нацеленные на CTLA-4, были выбраны из группы, состоящей из SEQ ID NO: 255-260. киРНК, нацеленные на LAG-3, были выбраны из группы, состоящей из SEQ ID NO: 244-254. киРНК, нацеленные на TIGIT, были выбраны из группы, состоящей из SEQ ID NO: 238-243. киРНК, нацеленные на TIM-3, были выбраны из группы, состоящей из SEQ ID NO: 261-264) (IDT Technologies). Для анализа кинетики экспрессии иммунных контрольных точек МКПК стимулировали активатором Dynabeads Human T-Activator CD3/CD28 (Thermofisher) или 4 мкг/мл антитела против CD3 и 2 мкг/мл антитела против CD28 в присутствии человеческого рекомбинантного ИЛ-2. Уровни экспрессии иммунных контрольных точек анализировали в течение 12 суток (3 сутки, 6 сутки и 12 сутки). Для выбора оптимальных последовательностей киРНК через 2 суток после стимуляции МКПК электропорировали олигомерами киРНК с использованием Neon® Transfection System (Thermofisher). Эффективность нокдауна киРНК измеряли через 2 суток после трансфекции при помощи проточной цитометрии. 2-3 последовательности киРНК были отобраны для каждой иммунной контрольной точки на основе их эффективности и были преобразованы в формат киРНК для генерации двойных лентивирусных векторов «два в одном». Для подтверждения эффективности нокдауна, опосредованного кшРНК, трансдуцированные лентивирусом Т-клетки стимулировали γ-облученными клетками K562-CD19 в соотношении 1:1 в течение 3 суток и анализировали на уровни экспрессии иммунных контрольных точек при помощи проточной цитометрии.
[00260] Проточная цитометрия. Уровень экспрессии анти-CD19 CAR анализировали с помощью AF647-конъюгированного антитела против мышиного F(ab') (115-606-072, Jackson ImmunoResearch) или биотин-конъюгированного rhCD19-Fc (CD9-H5259, ACRO Biosystems) в комбинации с AF647-конъюгированным стрептавидином (405237, Biolegend). Экспрессию δLNGFR анализировали с помощью АРС- или FITC- конъюгированного антитела против CD271 (ME20.4-1.H4; Mitenyi Biotec). Экспрессию иммунных контрольных точек в CAR-T-клетках измеряли при помощи обычной проточной цитометрии с использованием следующих антител: PD-1 (PE, клон J105; Thermofisher), TIM-3 (PE, клон 344823; R&D systems), LAG-3 (PE, клон 7H2C65; Biolgend), TIGIT (PE, клон MBSA43; Thermofisher).
[00261] Экспрессию CTLA-4 на CAR-T-клетках анализировали с помощью проточной цитометрии с внутриклеточным окрашиванием после инкубации с облученными клетками NALM-6 или K562-CD19 в соотношении E: T 1:1 в течение 3 суток. Клетки фиксировали/пермеабилизировали раствором Cytofix/Cytoperm™ (BD Bioscience) с последующим окрашиванием антителом против человеческого CD152 (CTLA-4) (PE, клон BNI3; Biolegend).
[00262] Экспрессию стимулирующих или лигандов ингибирующих иммунных контрольных точек на опухолевых клетках анализировали с использованием следующих антител: CD80 (PE, клон 2D10; Biolgend), CD86 (BV421, клон 2331 (FUN-1); BD Bioscience), PD-L1 (APC, клон 29E.2A3; Biolgend), HLA-DR (PE, клон L243; Biolgend), CD112 (PE, клон TX31; Biolgend), CD155 (PE, клон SKⅡ.4; Biolgend).
[00263] Для анализа влияния ТФР-β на экспрессию PD-1 CAR-T-клетки стимулировали облученными клетками NALM-6 в течение 3 суток в присутствии 10 нг/мл рекомбинантного человеческого ТФР-β1 (R & D systems) до измерения экспрессии PD-1 при помощи проточной цитометрии.
[00264] Анализ статуса фосфорилирования SMAD2/3 при помощи проточной цитометрии с внутриклеточным окрашиванием. Для определения статуса фосфорилирования SMAD2/3, CAR-T-клетки инкубировали с клетками NALM-6 в соотношении клеток E: T 1:1 в течение 4 часов или 24 часов. Клетки фиксировали с помощью Lyse/Fix Buffer (BD Bioscience) с последующей пермеабилизацией с помощью Perm Buffer® (BD Bioscience). Статус фосфорилирования на LNGFR+CAR-T-клетках определяли с помощью антитела против человеческого Smad2(pS465/pS467)/Smad3 (pS423/pS425) (PE, клон O72-670; BD Bioscience).
[00265] Обнаружение индуцированных регуляторных Т-клеток. Индукцию регуляторных Т-клеток (CD4+CD25+FOXP3+), полученных из CAR-T-клеток, анализировали путем внутриклеточного окрашивания после совместного культивирования с клетками NALM-6 в течение 3 суток. Клетки, которые были зафиксированы и пермеабилизированы, с помощью буфера для окрашивания Foxp3/Transcription Factor Staining Buffer (Thermofisher) были окрашены следующими антителами: анти-CD4 (BV605, клон OKT4; Biolgend), анти-CD25 (FITC, клон VT-072; Biolgend) и анти-FOXP3 (APC, клон 236A/E7; Thermofisher).
[00266] Анализ пролиферации CAR-T. CAR-T-клетки, экспрессирующие поверхностный маркер δLNGFR, сортировали при помощи магнитных гранул (Miltenyi Biotec). LNGFR+CAR-T-клетки (1 × 106; > 95% чистоты) стимулировали γ-облученными клетками K562-CD19-PDL1 (1 × 106) каждые 6 суток в отсутствие цитокинов. Кратность экспансии CAR-T-клеток рассчитывали путем подсчета клеток на 6, 12 и 18 сутки при помощи способа вытеснения трипанового синего.
[00267] In vitro цитотоксичность CAR-T-клеток. Цитотоксичность CAR-T-клеток определяли с использованием системы прижизненного клеточного анализа Incucyte S3. Целевые клетки NALM-6 или NALM-6-PDL1, которые конститутивно экспрессируют GFP, высевали в 96-луночный планшет с плотностью 1 × 105 клеток на лунку в трех повторностях. LNGFR+CAR-T-клетки добавляли в каждую лунку в соотношении E: T 1:1, 0,3:1, 0,1:1. Изменение интенсивности GFP в каждой лунке в режиме реального времени регистрировали каждые 2 часа в виде интегральной интенсивности зеленого объекта (средняя арифметическая интенсивность GFP х мкм2/лунки). Процент относительной интегрированной интенсивности зеленого объекта рассчитывали по следующей формуле: (общая интегрированная интенсивность GFP в каждой временной точке/общая интегрированная интенсивность GFP в начальной временной точке)*100.
[00268] Репортерный анализ NFAT и NF-κB. Для определения специфической активности фактора транскрипции NFAT в CAR-T-клетках, МКПК, которые стимулировали 4 мкг/мл анти-CD3 и 2 мкг/мл антителами против CD28 в присутствии человеческого рекомбинантного ИЛ-2 (300 МЕ/мл) в течение 2 суток, сначала трансдуцировали лентивирусом, кодирующим репортерный ген NFAT-RE x3-eGFP. Через восемь суток после трансдукции все клетки повторно стимулировали антителом против CD3 и против CD28 в присутствии человеческого рекомбинантного ИЛ-2 (300 МЕ/мл) в течение 2 суток. Активированные клетки разделяли на две отдельные лунки и трансдуцировали различным CAR-кодирующим лентивирусом (CD19-28z или CD19-BBz). Через 6 суток все клетки в каждой лунке совместно инкубировали с клетками NALM-6 в соотношении 1:1. Репортерную активность NFAT в CAR-T-клетках определяли по значению гСИФ сигнала eGFP в LNGFR+ CAR-T популяциях (20-25% от общего числа CD3+ клеток) в 24- и 48-часовой момент времени. Удельную активность фактора транскрипции NF-κB в CAR-T-клетках измеряли по аналогичной процедуре, но с использованием лентивируса, кодирующего репортерный ген NNF-κB-RE x5-eGFP.
[00269] Количественная ПЦР в реальном времени. 3 × 106 LNGFR+ G28z или GBBz CAR-T-клетки совместно культивировали с CD19+ целевыми клетками NALM-6 в соотношении 1:1. После 4 и 48 часов совместного культивирования LNGFR+CAR-T-клетки сортировали с использованием сортера MoFlo Astrios (Beckman Coulter). мРНК из LNGFR+ CAR-T-клеток выделяли с помощью набора RNeasy mini kit (Qiagen) и обратно транскрибировали в кДНК с использованием набора QuantiTect Reverse Transcription Kit (Qiagen). Количественную ПЦР в реальном времени проводили по протоколу SYBR с использованием системы обнаружения ПЦР в реальном времени CFX96 (Biorad) и мастер-микса для ПЦР в реальном времени SYBR Green Realtime PCR Master Mix (TOYOBO). Последовательности праймеров для обнаружения 18s рРНК содержат SEQ ID NO: 268 и 269. Последовательности праймеров для обнаружения PDCD1 содержат SEQ ID NO: 270 и 271. Последовательности праймеров для обнаружения ИЛ-2 содержат SEQ ID NO: 272 и 273. Последовательности праймеров для обнаружения ИЛ-4 содержат SEQ ID NO: 274 и 275. Последовательности праймеров для обнаружения ИЛ-17A содержат SEQ ID NO: 276 и 277. Последовательности праймеров для обнаружения CD25 содержат SEQ ID NO: 278 и 279. Последовательности праймеров для обнаружения CTLA4 содержат SEQ ID NO: 280 и 281. Последовательности праймеров для обнаружения FOXP3 содержат SEQ ID NO: 282 и 283. Последовательности праймеров для обнаружения ТФР-бета1 содержат SEQ ID NO: 284 и 285. Последовательности праймеров для обнаружения TGFBR1 содержат SEQ ID NO: 286 и 287. Последовательности праймеров для обнаружения TGFBR2 содержат SEQ ID NO: 288 и 289.
[00270] Количество целевой мРНК было нормализовано к эндогенной эталонной 18s рРНК: δCt (образец) = Ct (ген мишени) - Ct (18s рРНК). Сравнительный метод Ct был применен для анализа относительного кратного изменения целевой мРНК по сравнению с условием без стимуляции на основе следующего уравнения: 2-δδCt=2^-(δCt[стимулированный] - δCt[нестимулированный]).
[00271] Эксперименты на животных. Все процедуры, описанные в данном документе, были одобрены Институциональным комитетом по уходу за животными и их использованию при KAIST. Для получения CD19+ модели гемобластоза, мышам NSG (в возрасте от 4 до 6 недель) внутривенно инъецировали 1×106 CD19+ лейкозных клеток NALM-6, которые сконструированы для экспрессии EGFP-слитой люциферазы светлячка, а также человеческого PDL1 (клетки NALM6-GL-PDL1). CAR-T-клетки получали из образцов цельной крови здоровых доноров, следуя процедурам, описанным выше. На 4 сутки после трансдукции CAR-T-клетки сортировали и дополнительно размножали в течение 6 суток до инъекции мышам. Через пять суток после инъекции клеток NALM6-GL-PDL1 мышам внутривенно вводили 2,5 или 1 × 106 CAR-T-клеток. Биолюминесцентную визуализации NALM6-GL-PDL1 у мышей фиксировали с помощью Xenogen IVIS Spectrum, а сигналы количественно определяли как излучение в представляющей интерес области (фотон/с) с использованием программного обеспечения Living Image (Perkin Elmer). Для модели солидной опухоли мышам NSG подкожно инъецировали 5 × 106 клеток IM-9 (CD19+ PD-L1+CD155+). LNGFR+CAR-T-клетки вводят мышам внутривенно через 14 суток после инъекции опухолевых клеток (объем опухоли приблизительно 150-300 мм3). Опухоли контролировали каждую неделю путем измерения штангенциркулем, а объем оценивали как (длина × ширина2)/2.
Пример 1. Способы получения и оценки векторов «два в одном», экспрессирующих CART19 и кшРНК, нацеленных на PD-1
[00272] В этом примере описаны способы получения и оценки векторов «два в одном», экспрессирующих CART19, и кшРНК, ингибирующих экспрессию PD-1.
[00273] Для генерации лентивирусных векторов «два в одном», которые кодируют как кассеты экспрессии CAR, так и кшРНК, синтезировали экспрессирующие кшРНК кассеты, содержащие кшРНК (линкерная последовательность; TTCAAGAGA, последовательность терминации; TTTTT) и промоторы Pol (mU6, hU6 или hH1), и субклонировали в CAR-кодирующие лентивирусные векторы в область, расположенную выше против хода транскрипции от центрального полипуринового тракта (cPPT). Был сконструирован лентивирусный вектор, который спонтанно экспрессирует CART19 на основе 4-1BB с помощью промотора EF-1α и направленную на PD-1 кшРНК с помощью промотора mU6 (Фиг. 1A и 1B).
[00274] Для отбора нацеленной на PD-1 кшРНК были использованы три кандидата кшРНК. shPD-1 № 1 продемонстрировал удивительно эффективное ингибирующее действие на экспрессию PD-1 (Фиг. 1F), не влияя на экспрессию CAR (Фиг. 1C), гомеостатическую экспансию (Фиг. 1D), статус дифференцировки и композицию CD4/CD8. (Фиг. 1F). Сообщалось, что уровень экспрессии кшРНК может быть различным в зависимости от типов промотора Pol III (Mol Ther., 2006, Irvin S.Y. Chen). Поэтому оценивали влияние промоторов mU6, hU6 или hH1 на экспрессию PD-1. mU6 и hu6 имели сходную эффективность KD, но у hH1 было меньше (Фиг. 2).
[00275] Лентивирусные векторы «два в одном», полученные в соответствии с данным документом, продемонстрировали неожиданно эффективное ингибирование экспрессии PD-1, поэтому они могут быть использованы при получении модифицированных PD-1 KD CAR-T-клеток в следующем примере.
Пример 2. Способы получения и оценки in vitro PD-1 KD CAR-T-клеток
[00276] В этом примере описаны способы получения и оценки in vitro модифицированных PD-1 KD CAR-T-клеток.
[00277] Мононуклеарные клетки периферической крови отделяли от образцов цельной крови здоровых доноров методом центрифугирования в градиенте плотности Ficoll-Paque Plus (GE Healthcare). Эти клетки стимулировали 4 мкг/мл связанного с планшетом антитела против CD3 (клон ОКТ3; клетка BioX) и 2 мкг/мл растворимого антитела против CD28 (клон CD28.2; клетка BioX) в присутствии 300 МЕ/мл человеческого рекомбинантного ИЛ-2 (BMIKOREA). Для получения рекомбинантного лентивируса 6×105 клеток 293T в 2,5 мл ростовой среды (DMEM с добавлением 10% FBS, 2 мМ L-глутамина, 0,1 мМ заменимых аминокислот и 1 мМ пирувата натрия) высевали в 6-луночный планшет за 24 часа до этого для трансфекции. Клетки трансфицировали смесью упаковочных векторов (pMDL, pRev, pMDG.1) и вектора для переноса, используя 10 мкл Lipofectamine2000 (Thermofisher). Через двое суток после трансфекции культуральный супернатант, содержащий лентивирус, собирали и центрифугировали при 1800 об/мин в течение 5 минут. Активированные Т-клетки смешивали с вирусным супернатантом в присутствии протаминсульфата (1 мкг/мл), центрифугировали при 1000 × g в течение 90 минут и инкубировали в течение ночи при 37 °С. На следующие сутки культуральный супернатант аспирировали и заменяли свежей PRMI-1640 с добавлением 10% FBS, 2 мМ L-глутамина, 0,1 мМ заменимых аминокислот, 1 мМ пирувата натрия и 55 мкМ β-меркаптоэтанола. Трансдуцированные Т-клетки культивировали при плотности ниже 1 × 106 клеток/мл в RPMI-1640 с добавлением 10% инактивированной нагреванием FBS и 2 мМ L-глутамина и 1% пенициллин/стрептомицин, средах для культивирования Т-клеток, содержащих человеческий рекомбинантный ИЛ-2 (300 МЕ/мл), которые пополняли каждые 2-3 суток.
[00278] Исследовали in vitro литическую и пролиферативную активность shPD-1 CAR-T-клеток. Nalm-6-PDL1 или K562-CD19-PDL1 использовали в качестве CD19+PDL1+ целевых клеток. Сначала была исследована длительная литическая активность с использованием системы визуализации в реальном времени IncuCyte. Когда CAR-T-клетки смешивали с клетками NALM-6, CAR-T-клетки ДТ (shGFP) и PD-1 KD CAR-T-клетки (shPD-1) имели сходную литическую активность. Однако CAR-T-клетки shPD-1 проявили удивительно более эффективную литическую активность, чем клетки shGFP CAR, когда CAR-T-клетки культивировали с клеткой NALM-6-PDL1 (Фиг. 3А). Было также обнаружено, что BBz CAR-T-клетки без кассеты кшРНК и shGFP CAR-T-клетки неожиданно сохраняют сходную цитотоксичность, что позволяет предположить, что сама экспрессия кшРНК мало влияет на активность CAR-T-клеток.
[00279] Затем оценивали пролиферативную активность CAR-T-клеток, многократно подвергавшихся воздействию антигена CD19 и PD-L1. shPD-1 CAR-T клетки достигли в 4-5 раз большей пролиферативной активности T-клеток против мишени K562-CD19-PDL1, чем shGFP CAR-T-клетки в отсутствие экзогенного ИЛ-2 (Фиг. 3B). Известно, что костимулирующие лиганды способствуют оптимальной экспансии Т-клеток и нередко экспрессируются в опухолевых клетках. Чтобы исследовать, влияет ли экспрессия костимулирующего лиганда в целевых клетках на пролиферацию клеток при повторной стимуляции, было исследовано, экспрессируется ли CD80, типичный костимулирующий лиганд, в целевых клетках. K562-CD19 экспрессировал CD80, но не Nalm-6 (Фиг. 3C). Было обнаружено, что CD80-сверхэкспрессирующий NALM-6-PDL1 (NALM-6-PDL1-CD80) позволяет CAR-T-клеткам пролиферировать при повторной стимуляции. CD80 может способствовать пролиферации CART при повторной стимуляции in vitro (Фиг. 3B). В совокупности было подтверждено, что разрушение внутриклеточной части PD-1 неожиданно эффективно способствует функциональному улучшению in vitro CD19-специфических CAR-T-клеток при повторной стимуляции CAR и PDL1.
[00280] В этом примере модифицированные PD-1 KD CAR-T-клетки, полученные с использованием векторов «два в одном», описанных в примере 1, продемонстрировали удивительный уровень усиления литической и пролиферативной активности in vitro по сравнению с CAR-T-клетками ДТ, таким образом, их терапевтический потенциал дополнительно оценивали на мышиных моделях in vivo, несущих CD19+PDL1+ опухоль крови, в приведенном ниже примере.
Пример 3: Способы лечения CD19+ гемобластоза in vivo с использованием PD-1 KD CAR-T клеток
[00281] В этом примере описаны способы лечения CD19+ гемобластоза in vivo с использованием PD-1 KD CAR-T-клеток.
[00282] Для получения CD19+ модели гемобластоза, мышам NSG (в возрасте от 4 до 6 недель) внутривенно инъецировали 1×106 CD19+ лейкозных клеток NALM-6, которые сконструированы для экспрессии EGFP-слитой люциферазы светлячка, а также человеческого PDL1 (клетки NALM6-GL-PDL1). CAR-T-клетки получали из образцов цельной крови здоровых доноров, следуя процедурам, описанным выше. На 4 сутки после трансдукции CAR-T-клетки сортировали и дополнительно размножали в течение 6 суток до инъекции мышам. Через пять суток после инъекции клеток NALM6-GL-PDL1 мышам внутривенно вводили 1 × 106 CAR-T-клеток. Биолюминесцентную визуализацию NALM6-GL-PDL1 у мышей фиксировали с помощью Xenogen IVIS Spectrum, а сигналы количественно определяли как излучение в представляющей интерес области (фотон/с) с использованием программного обеспечения Living Image (Perkin Elmer). Мыши, получавшие лечение shPD-1 CAR-T-клетками, имели неожиданно равномерное снижение опухолевой нагрузки по сравнению с shGFP CAR-T-клетками (Фиг. 4). Кроме того, было обнаружено, что два типа промотора, экспрессирующего кшРНК, обладают сходным противоопухолевым эффектом, и сама экспрессия кшРНК неожиданно не влияет на противоопухолевый эффект.
[00283] Изучение влияние разрушения внутриклеточной части PD-1 CAR-T-клеток на выработку цитокинов in vivo. Периферическую кровь отдельных мышей получали через 24 и 72 часа после введения CAR-T. Плазму собирали из периферической крови при помощи центрифугирования в течение 5 минут при 300 × g при комнатной температуре. Уровень цитокинов in vivo анализируют с помощью набора Human Th1/Th2 Cytokine Kit (BD Bioscience), следуя инструкциям производителя. Разрушение внутриклеточной части PD-1 CAR-T-клеток неожиданно снижало выработку цитокинов in vivo (Фиг. 5A).
[00284] Для исследования влияния разрушения внутриклеточной части PD-1 CAR-T-клеток на in vivo экспансию CAR-T-клеток, селезенку отдельных мышей получали через 3 или 20 суток после инъекции CAR-T. Процент CAR-T-клеток (Live/Dead-CD3+) или NALM-6-PDL1 (Live/Dead-GFP+) оценивали при помощи проточной цитометрии. Разрушение внутриклеточной части PD-1 в клетке неожиданно задерживает in vivo экспансию CAR-T-клеток (Фиг. 5B).
[00285] Разрушение внутриклеточной части PD-1 CAR-T-клеток, достигнутое при помощи векторной системы «два в одном», описанной в данном документе, показало неожиданно высокий уровень усиления противоопухолевого эффекта in vivo CD19-специфических CAR-T-клеток в отношении CD19+PDL1+ опухоли. Таким образом, PD-1 KD CAR-T-клетки были дополнительно использованы в способах в следующих примерах.
Пример 4: Оценка окружения костимулирующих молекул в сигналинге PD-1
[00286] В этом примере описывается оценка окружающей среды костимулирующих молекул, включая CD28 и 4-1BB, в сигналинге PD-1.
[00287] Было исследовано, как разрушение внутриклеточной части PD-1 влияет на функцию CD28/CD3ζ или 4-1BB/CD3ζ CAR-T-клеток (Фиг. 6A). Были впервые получены G28z, GBBz, P28z и PBBz CAR-T-клетки. Эти CAR-Tклетки аналогичным образом трансдуцировали (Фиг. 6B). Уровень экспрессии PD-1 был выше в G28z CAR-T-клетках, чем в GBBz CAR-T-клетках, а уровень PD-1 в P28z был выше, чем в PBBz (Фиг. 7A). Также было установлено, что этот отличающийся уровень белка PD-1 обусловлен уровнем транскрипции (Фиг. 7B). Было выдвинуто предположение, что каждый костимулирующий домен имеет различную интенсивность активации факторов, участвующих в транскрипции PD-1. Среди транскрипционных факторов, вовлеченных в транскрипцию PD-1, NFAT и NF-κB, были значительно вовлечены в транскрипцию PD-1, а SMAD2/3 были вовлечены в транскрипцию PD-1 в присутствии экзогенного ТФР-β, который является основным иммуносупрессивным фактором микроокружения опухоли (Cancer Discov., 2016, Benjamine V. Park). Активность NFAT или NF-kB исследовали во время стимуляции CAR. Был сконструирован лентивирусный вектор с репортером «элемент ответа NFAT (NFAT-RE x3) -eGFP» или с классическим репортером «элемент ответ N-κB(NF-κB RE x5)-eGFP. Была показана NFAT- или NF-kB RE-опосредованная индукция eGFP (Фиг. 8A и 8B). Репортер-трансдуцированные Т-клетки повторно стимулируют и дополнительно трансдуцируют G28z или GBBz. Было обнаружено, что трансдуцированные G28z CAR-T-клетки с репортером NFAT (G28z-NFAT) имели слегка повышенный уровень активности NFAT по сравнению с GBBz-NFAT (Фиг. 9A), и уровень мРНК целевых генов NFAT также был выше у G28z (Фиг. 9B). Тем не менее трансдуцированные G28z CAR-T-клетки c репортером NF-κB (G28z-NF-κB) сходны по активности NFAT с GBB-NF-κB (Фиг. 10). Для исследования активности SMAD2/3 каждой CAR-T-клетки, G28z или GBBz CAR-T-клетки во время стимуляции CAR обрабатывали ТФР-β. Было обнаружено, что фосфорилирование SMAD2/3 G28z CART немного выше BBz CART (Фиг. 11A), а степень увеличения экспрессии PD-1 при обработке ТФР-β выше для G28z, чем для GBBz (кратность изменения для G28z 2,39±0,031, для GBBz 1,61+0,034) (Фиг. 11B). Было исследовано, связано ли это различие с различиями в уровнях экспрессии элементов сигналинга ТФР-β. Было обнаружено, что ТФР-β и рецептор 1 ТФР-β (TGFBR1) существенно не различались между двумя CART, но рецептор 2 ТФР-β (TGFBR2) экспрессировался на более высоком уровне в CD28z (Фиг. 11C).
[00288] В этом примере оценивали окружение костимулирующих молекул, включая CD28 и 4-1BB, в сигналинге PD-1. Костимуляция CD28 сильно индуцировала сигналинг, связанный с транскрипцией PD-1, и индукция могла быть связана с активацией сигналинга NFAT и ТФР-β. Индукция костимуляции CD28 была сильнее, чем индукция костимуляции 4-1BB.
Пример 5: Способы конструирования и оценки PD-1 KD CAR-T клеток
[00289] В этот примере описаны способы конструирования и оценки PD-1 KD CAR-T-клеток.
[00290] Для имитации условий in vivo CAR-T-клеток с многократными последовательными контактами антигена и лиганда иммунной контрольной точки, CAR-T-клетки совместно культивировали с CD19+ PDL1+ целевыми клетками без экзогенных цитокинов. В первичных CAR-T-клетках группы PD-1 KD CAR-T демонстрировали неожиданно более высокую литическую активность, чем группы CAR-T ДТ, но не было различий в литической активности между группами CAR-T на основе CD28 и 4-1BB (Фиг. 12А). После 2-й повторной стимуляции CAR-T-клеток, G28z CAR-T-клетки теряли способность к размножению после второй стимуляции, таким образом анализировали литическую активность 3 CAR-T-клеток. PBBz и P28z CAR-T-клетки обладали неожиданно более высокой литической активностью при повторном воздействии антигена и PD-L1, чем GBBz CAR-T-клетки. PBBz CAR-T-клетки продемонстрировали неожиданно более высокую способность сохранять литическую функцию, чем P28z CAR-T-клетки (Фиг. 12A). Эта тенденция также наблюдалась в анализе пролиферации клеток (Фиг. 12B). В совокупности применение костимулирующего домена 4-1BB с PD-1 KD CART способствует сохранению цитотоксичности и пролиферативной способности in vitro по сравнению с применением костимулирующего домена CD28. PBBz CAR-T-клетки демонстрируют замедленное истощение при повторном воздействии CD19 и PD-L1.
[00291] Было рассмотрено возможное влияние иммуносупрессивного механизма на BBz CAR-T-клетки. CD28 CAR-T-клетки были более чувствительны к ТФР-β, чем BBz CART (Фиг. 11), поэтому GBBz CAR-T-клетки сравнивали с G28z CAR-T-клетками в отношении того, насколько их антигенспецифическая пролиферация будет подавлена ТФР-β. Хотя во время стимуляции CAR без ТФР-β между двумя CAR-T-клетками не наблюдали значительного различия в пролиферации, в отличие от GBBz CAR-T-клеток у G28z CAR-T-клеток была значительно снижена пролиферация (Фиг. 13A).
[00292] Сообщалось, что ТФР-β не только ингибирует пролиферацию, но и глубоко вовлечен в индукцию регуляторных Т-клеток (JEM, 2003, WanJun Chen; Science, 2003, Shohei Hori; Blood, 2007, Dat Q. Tran). Чтобы исследовать, отличается ли индукция Трег между G28z и BBz CAR-T-клетками в отсутствие экзогенных ТФР-β, G28z и BBz CAR-T-клетки культивировали с целевыми клетками NALM-6 в течение 3 суток. G28z CAR-T-клеток in vitro имели в два-три раза больший % CD4+CD25+FOXP3+ Трег по сравнению с GBBz CAR-T-клетками (Фиг. 13B). Этот результат согласуется с увеличением экспрессии связанных с Трег генов, таких как CD25 и FOXP3 (Фиг. 9B). Затем наблюдали и сравнивали изменения в % Трег после обработки ТФР-β. Было показано, что ТФР-β значительно увеличивал % Трег среди 28z CAR-T-клеток, но не влиял на % Трег среди BBz CAR-T-клеток (Фиг. 13B). Был сделан вывод, что костимуляция CD28 имеет больший потенциал индуцировать Трег, чем костимуляция 4-1BB, и, если присутствует ТФР-β, ее потенциал дополнительно возрастает. Было исследовано, влияет ли разрушение внутриклеточной части PD-1 на индукцию Трег. P28z и PBBz CAR-T-клетки имели в два-три раза более низкий % Tрег по сравнению с G28z и GBBz, соответственно. В частности, PBBz имел самый низкий % Трег (Фиг. 13C). Наконец, исследовали процент Трег при условии, что сигналинг PD-1/PD-L1 был активирован. Было исследовано изменение % Трег после совместного культивирования NALM-6 или NALM-6-PDL1. Было обнаружено, что сигналинг PD-1/PDL1 существенно не влияет на индукцию Трег, полученных из CAR-T (Фиг. 13С), предполагая, что уровни экспрессии внутриклеточного PD-1 связаны с образованием Трег. Был сделан вывод, что PBBz CAR-T-клетки могут быть неожиданным образом нечувствительными к иммуносупрессивному механизму.
[00293] В этом примере PBBz CAR-T-клетки продуцировались и демонстрировали замедленное истощение при повторном воздействии CD19 и PD-L1. PBBz CAR-T-клетки также неожиданным образом ускользают от иммуносупрессивного механизма. Таким образом, эти клетки дополнительно оценивали на их противоопухолевый эффект in vivo.
Пример 6: Способы лечения CD19+ гемобластоза in vivo с использованием PBBz CAR-T-клеток
[00294] В этом примере описаны способы лечения CD19+ гемобластоза in vivo с использованием PBBz CAR-T-клеток.
[00295] Модель CD19+опухоли крови получали как описано в примере 3. Сравнивали противоопухолевый эффект G28z, GBBz, P28z и PBBz CAR-T-клеток с таковым у CD19+ клеток B-ОЛЛ in vivo. CAR-T-клетки вводят в разовой дозе 2,5 × 106 на 4 сутки после инфузии целевых клеток. In vivo визуализацию мышей, несущих NALM6-GL-PDL1, выполняли с помощью Xenogen IVIS Spectrum и количественно определяли как излучение в представляющей интерес области (фотон/сек). Как показано на Фиг. 14, PD-1 KD CART-клетки (PBBz или P28z) демонстрируют превосходный противоопухолевый эффект по сравнению с CAR-T-клетками ДТ (GBBz или G28z). В частности, PBBz CAR-T-клетки ингибировали прогрессирование лейкоза в течение более длительных периодов, чем другие три CAR-T-клетки. CAR-T-клетки ДТ имели сильный противоопухолевый ответ, но не имели устойчивого противоопухолевого ответа. С другой стороны, PD-1 KD CAR-T в начальные периоды демонстрировали слабый, но постоянный противоопухолевый ответ, что позволяет предположить, что разрушение PD-1 в CAR-T-клетках может потенциально снизить риск для CRS. PBBz CAR-T-клетки обладают неожиданно лучшим противоопухолевым эффектом in vivo, чем P28z.
Пример 7: Способы получения двойных векторов «два в одном», имеющих 2 типа кассет кшРНК, вводимых в направлениях →← или ←→
[00296] В этом примере описываются способы получения двойных векторов «два в одном», в которых 2 типа кассет кшРНК вводятся в направлениях ←→ (shTIM-3-mU6←→hU6-shPD-1) или в направлениях →←(mU6-shTIM-3→←shPD-1-hU6) и экспрессируют shPD-1, shTIM-3 и CD19-CAR, одновременно.
[00297] Для конструирования лентивируса, в котором экспрессия кшРНК для PD-1 (далее shPD-1), кшРНК для TIM-3 (далее shTIM-3) и CD19-CAR регулируются промотором U6 человека (далее hU6), промотором U6 мыши (далее mU6) и промотором EF1-α, соответственно. Плазмиду, в которой оба типа кшРНК экспрессируются одновременно, получали таким образом, чтобы соответствующие кассеты кщРНК располагались в направлении →← (mU6-shTIM-3→←shPD-1-hU6) и в направлении ←→ (shTIM-3-mU6←→hU6-shPD-1) (Фиг. 15). С этой целью (1) вставляли сайт множественного клонирования (MCS), (2) осуществляли конверсию промотора U6 мыши shPD-1 в промотор U6 человека, (3) вставляли shTIM-3 и (4) осуществляли клонирование, такое как переключение положений shTIM-3 и shPD-1.
[00298] Для вставки MCS в mU6-shPD-1 3'-часть pLV-δLNGFR_P2A_CD19-CAR_mU6-shPD-1 (плазмида ID № 2) и праймеры, содержащие SEQ ID NO:228 и 229, использовали для получения продукта ПЦР (416 п.н.), при этом сайт распознавания рестриктазы Hpa1 mU6-shPD-1 3' модифицировали в сайт множественного клонирования BsgZ171-Xba1-Nde-1-Bmt1-Spe1. После этого продукт ПЦР обрабатывали рестриктазами BstZ17y и Hpa1, а плазмиду ID № 2 обрабатывали рестриктазой Hpa1 и CIP, после чего использовали лигирование по тупым концам для получения pLV-δLNGFR-P2A-CD19-CAR-mU6-shPD-1_MCS (плазмиды И № 4), включая основную последовательность shPD-1-mU6-MCS (кассета кшРНК SEQ ID NO.223).
[00299] После этого конструировали плазмиду так, чтобы shPD-1 экспрессировалась под контролем промотора U6 человека вместо промотора U6 мыши. Плазмиду LentiCRISPR V2 использовали с праймерами, содержащими SEQ ID NO: 230 и 231, чтобы получить продукт ПЦР, содержащий промотор U6 человека. Продукт ПЦР обрабатывали рестриктазой Hpa1 и Spe1, а затем лигировали плазмидой ID № 4, обработанной рестриктазой Hpa1 и Spe1, для получения pLV-δLNGFR_P2A_CD19-CAR_hU6-shPD-1_MSC (плазмида ID № 5), содержащей последовательность оснований hU6-shPD-1 (SEQ ID NO: 224). Предполагалось вставить кассету mU6-shTIM-3 в плазмиду ID № 5, чтобы сконструировать плазмиду, которая одновременно экспрессирует shTIM-3 и shPd-1.
[00300] Продукт ПЦР, содержащий кассету mU6-shtim-3, был получен с использованием плазмиды ID №3 и праймеров, содержащих SEQ ID NO: 232 и 233. После обработки продукта ПЦР рестриктазами Bmt1 и Spe1 его лигировали с плазмидой ID № 5, обработанной рестриктазами Bmt1 и Spe1, для получения pLV-δLNGFR_P2A_CD19-CAR mU6-shTIM-3 →← shPD-1-hU6 (плазмиды ID № 6), содержащей последовательность оснований в направлении →← (mU6-shTIM-3 →← shPD-1-hU6) (SEQ ID NO: 220).
[00301] Для создания плазмиды, в которой два типа кассет кшРНК расположены в направлениях ←→ (shTIM-3-mU6 ←→ hU6-shPD-1), плазмиду ID № 6 и праймеры, содержащие SEQ ID NO: 234 и 235, использовали для получения продукта ПЦР. После обработки рестриктазой Spe1 и Hpa1 его вставляли в плазмиду ID № 4, обработанную теми же рестриктазами, для получения pLV-δLNGFR-P2A-CD19-CAR-shPD-1-hU6-MCS (плазмида ID № 7). После этого плазмиду ID №6 и праймеры, содержащие SEQ ID NO: 236 и 237, использовали для получения продукта ПЦР. После обработки рестриктазой Bmt1 и Spe1 его лигировали с плазмидой ID № 7, обработанной тем же рестриктазой, чтобы в конечном итоге получить pLV-δLNGFR-P2A-CD19-CAR_shTIM-3-mU6 ←→ hU6-shPD-1 (плазмида ID № 8), содержащую последовательность оснований ←→ (shTIM-3-mU6 ←→ hU6-shPD-1) (SEQ ID NO: 221).
[00302] Лентивирусные векторы «два в одном», в которых 2 типа кассет кшРНК вводятся в направлениях ←→ или →←, полученные согласно данному документу, могут быть использованы в получении модифицированных PD-1 KD CAR-T-клеток в следующих примерах.
Пример 8. Способы получения и оценки in vitro PD-1 KD CAR-T-клеток
[00303] В этом примере описаны способы получения и оценки in vitro CAR-T-клеток с двойным KD, в которых shPD-1, shTIM-3 и CD19-CAR экспрессируются одновременно.
[00304] Плазмиды ID № 1 (pLV-δLNGFR_P2A_CD19-CAR_mU6-shGFP), № 6 (pLV-δLNGFR_P2A_CD19-CAR_mU6-shTIM-3→←shPD-1-hU6) и № 8 (pLV-δLNGFR_P2A_CD19-CAR_shTIM-3-mU6←→hU6-shPD-1) в таблице 1, и упаковочные плазмиды pMDL g/p, pRSVrev и pMDG.1 были трансфицированы в T-клетки HEK293 с использованием липофектамина, и по истечении 48 часов получали среду для культивирования клеток, включая лентивирус. Используя раствор Ficoll-Paque, мононуклеарные клетки периферической крови (МКПК) выделяли из крови человека, и антитела, нацеленные на CD3 и CD28 человека, использовали для специфической активации Т-клеток. Через один-два дня после начальной активации Т-клеток, их трансдуцировали с использованием ранее полученного вируса. Полученные CAR-T-клетки затем культивировали с использованием среды для культивирования AIM-V, содержащей 5% человеческой плазмы и человеческого ИЛ-2. На шестые сутки после трансдукции систему MACSelect LNGFR (miltenyibiotec, Германия) использовали для получения чистых CAR-T-клеток, а антитело, нацеленное на LNGFR, использовали для выделения LNGFR+ CAR-T-клеток с помощью проточного цитометра. Далее клетки, полученные с использованием плазмид ID № 1, № 6 и № 8, обозначены как δLNGFRCART19/shGFP (или shGFP/CART19), δLNGFR-CART19/mU6-shTIM-3 →← shPD-1-hU6 (или shPD -1_shTIM-3/CART19) и δLNGFR-CART19/shTIM-3-mU6 ←→ hU6-shPD-1, соответственно (Фиг. 16).
[00305] Для приготовления контрольных CAR-T-клеток, содержащих кассеты mU6-shPD-1, mU6-TIM-3 и shPD-1-hU6, соответственно, плазмиды ID № 2 (pLV-δLNGFR_P2A_CD19-CAR_mU6-shPD-1), № 3 (pLV -δLNGFR_P2A_CD19-CAR_mU6-shTIM-3) и № 7 (pLV-δLNGFR_P2A_CD19-CAR_shPD-1-hU6_MCS) в таблице 1, и упаковочные плазмиды pMDL g/p, pRSVrev и pMDG.1 трансфицировали в T-клетки HEK293 с использованием липофектамина. Через 48 часов получали среду для культивирования клеток, включая лентивирус. Используя раствор Ficoll-Paque, мононуклеарные клетки периферической крови (МКПК) выделяли из крови человека, и антитела, нацеленные на CD3 и CD28 человека, использовали для специфической активации Т-клеток. Через один-два дня после начальной активации Т-клеток, их трансдуцировали с использованием ранее полученного вируса. Полученные CAR-T-клетки затем культивировали с использованием среды для культивирования AIM-V, содержащей 5% человеческой плазмы и человеческого ИЛ-2. На шестые сутки после трансдукции систему MACSelect LNGFR (miltenyibiotec, Германия) использовали для получения чистых CAR-T-клеток, а антитело, нацеленное на LNGFR, использовали для выделения LNGFR+ CAR-T-клеток с помощью проточного цитометра. Далее клетки, полученные с использованием плазмид ID № 2, № 3 и № 7, обозначены как δLNGFR-CART19/shPD-1 (или shPD-1/CART19), δLNGFR-CART19/shTIM-3 (или shTIM-3/CART19) и δLNGFRCART19/shPD-1-hU6, соответственно.
[00306] Для измерения чистоты полученных в соответствии с данным документом CAR-T-клеток с двойным KD, проточную цитометрию выполняли с использованием антител, направленных на LNGFR, для клеток, полученных выше. Как показано на Фиг. 17, было получено около 80% LNGFR+ CAR-T-клеток.
[00307] Было измерено снижение экспрессии PD-1 и TIM-3 в CAR-T-клетках с двойным KD, полученных в соответствии с данным документом, и устойчивое снижение их экспрессии. CAR-T-клетки с двойным KD стимулировали в течение трех суток антителом, направленным на CD3 и CD28 человека, для индукции экспрессии PD-1 и TIM-3. После этого экспрессию PD-1 и TIM-3 в CAR-T-клетках с двойным KD анализировали с помощью проточной цитометрии с использованием антител, нацеленных на CAR, PD-1 и TIM-3. Как показано на Фиг. 18A и 18B, анализ влияния двух одновременно экспрессируемых типов кшРНК на снижение экспрессии PD-1 и TIM-3 показал, что степень снижения экспрессии PD-1 и TIM-3, наблюдаемая в CD19-CAR-T-клетке, экспрессирующей shPD-1 и shTIM-3 одновременно, была аналогична степени снижения в CD19-CAR-T-клетке, в которой экспрессируется только shPD-1 или shTIM-3.
[00308] Было определено влияние CAR-T клеток с двойным KD, полученных в соответствии с данным документом, на дифференцировку. Для определения степени дифференцировки PD-1 и TIM-3 для CAR-T клеток с двойным KD, выполняли проточную цитометрию с использованием антител, направленных на CD45RA и CCR7. Как показано на Фиг. 19, в клетках δLNGFR-CART19/shPD-1, подвергнутых повторной стимуляции антигеном, наблюдается увеличение количества терминально дифференцированных T-клеток TEMRA (CCR7-CD45RA+) по сравнению с δLNGFR-CART19 /shGFP. С другой стороны, δLNGFR-CART19/mU6-shTIM-3→←shPD-1-hU6, к которым был добавлен shTIM-3, содержат больше подтипов TN (CCR7+CD45RA+) T-клеток, TCM (CCR7+CD45RA-) T-клеток и TEM (CCR7-CD45RA-) Т-клеток, чем δLNGFR-CART19/shPD-1. Поскольку сходные результаты наблюдаются и с клетками δLNGFR-CART19/shTIM-3, можно сказать, что сниженная способность к дифференцировке клеток δLNGFR-CART19/mU6-shTIM-3→←shPD-1-hU6 возникает вследствие подавления TIM-3, и, соответственно, можно сказать, что эффект shTIM-3 имеет приоритет над эффектом shPD-1 с точки зрения влияния на дифференцировку клеток. Поскольку известно, что менее дифференцированные подтипы Т-клеток могут способствовать улучшению противораковой терапевтической активности Т-клеток, ожидается, что клетки δLNGFR-CART19/mU6-shTIM-3→←shPD-1-hU6 будут демонстрировать лучшую противораковую эффективность in vivo, чем клетки δLNGFR-CART19/shPD-1.
[00309] Сравнивали эффективность трансдукции, способность к пролиферации и жизнеспособность CAR-T-клеток с двойным KD, в которые были введены векторы CD19-CAR, содержащие кассеты кшРНК с различной ориентацией. Для CAR-T-клеток, полученных в соответствии с данным документом, проточную цитометрию проводили с использованием антитела к LNTFR для клеток с использованием плазмид, содержащих кассеты в направлении →← (mU6-shTIM-3→←shPD-1-hU6) и направлении ←→ (shTIM-3-mU6←→hU6-shPD-1). Для анализа жизнеспособности клеток проводили окрашивание трипановым синим и определяли соотношение неокрашенных клеток. Как показано на Фиг. 20A-20C, по сравнению с клетками, в которых используется направление кассет →←, (δLNGFR-CART19/mU6-shTIM-3→←shPD-1-hU6), клетки, в которых используется направление кассет ←→, (δLNGFR-CART19/shTIM-3-mU6←→hU6-shPD-1), имели неожиданные проблемы с получением трансдуцированных клеток, а трансдуцированные Т-клетки обладали низкой способностью к пролиферации и жизнеспособностью.
[00310] В этом примере описаны способы получения CAR-T-клеток с двойным KD, в которых shPD-1, shTIM-3 и CD19-CAR экспрессируются одновременно. CAR-T-клетки с двойным KD были получены с использованием полученных в соответствии с данным документом лентивирусных векторов «два в одном», содержащих 2 типа кассет кшРНК, вводимых в направлениях →← или ←→. По сравнению с клетками, в которых используется направление кассет ←→, клетки, в которых используется направление кассеты →←, (δLNGFR-CART19/mU6-shTIM-3→←shPD-1-hU6), показали удивительно более высокую пролиферативную способность и жизнеспособность и, по этой причине, использовались в следующих примерах.
Пример 9: Способы получения двойных векторов «два в одном» и CAR-T-клеток с двойным KD
[00311] В этом примере описаны способы получения двойных векторов «два в одном» и CAR-T-клеток с двойным KD.
[00312] Для создания двойных векторов «два в одном», экспрессирующих две кшРНК разными промоторами (mU6 и hU6), сайт множественного клонирования BstZ171-Xba1-Nde1-Bmt1-Spe1 (MCS) вставляли в вектор pLV-hU6-shPD-1_δLNGFR-CD19-BBz далее походу транскрипции от промотора hU6. Фрагменты второй кассеты mU6-кшРНК субклонировали в MCS. Чтобы ограничить блокаду нескольких иммунных контрольных точек только CAR-T-клетками был разработан вектор «два в одном» для экспрессии двух кшРНК промоторами mU6 и hU6 Pol Ⅲ для репрессии экспрессии двух иммунных контрольных точек CAR-T-клеток. Чтобы найти эффективные киРНК, нацеленные на CTLA-4, LAG-3, TIGIT или TIM-3, киРНК электропорировали в CD3/CD28-стимулированные Т-клетки. Были выбраны две или более эффективных киРНК (Фиг. 21А). Вектор «два в одном» для CAR-T-клеток с нокдауном CTLA-4, LAG-3, TIGIT или TIM-3 конструировали путем трансформации 21-мерных киРНК в формат кшРНК и, наконец, отбирали каждую иммунную контрольную точку, нацеленную на кшРНК (shCTLA-4: № 1; shLAG-3: № 1278; shTIGIT: № 739; shTIM-3: № 3), которые значительно подавляют экспрессию и меньше влияют на экспансию CAR-T (Фиг. 21B-C). Наконец, PD-1_CTLA-4, PD-1_LAG-3, PD-1_TIGIT или PD-1_TIM-3 CAR-T-клетки конструировали с помощью двойного вектора «два в одном» (Фиг. 22A-22E). Все CAR-T клетки с двойным KD были менее размножены по сравнению с CAR-T-клетками с одиночным KD PD-1 (Фиг. 22C). Эти результаты также наблюдались для CAR-T-клеток с одиночным KD (Фиг. 21B).
[00313] В этом примере получали двойные векторы «два в одном». CAR-T-клетки с двойным KD получали с использованием двух векторов «два в одном», и их терапевтический потенциал дополнительно оценивали на мышиной модели in vivo, несущей CD19+PDL1+ опухоль крови, и на модели солидной опухоли в приведенном ниже примере.
Пример 10. Способы лечения CD19+ гемобластоза in vivo с использованием CAR-T-клеток с двойным KD, нацеленных на PD-1 и TIGIT
[00314] В этом примере описываются способы лечения CD19+ гемобластоза in vivo с использованием CAR-T-клеток с двойным KD, нацеленных на две иммунные контрольные точки, включая следующие комбинации: PD-1 и CTLA-4, PD-1 и LAG-3, PD-1 и TIGIT, и PD-1 и TIM-3.
[00315] Модель CD19+ опухоли крови получали как описано в примере 3. Был оценен противоопухолевый эффект CAR-T-клеток с KD PD-1_CTLA-4, PD-1_LAG-3, PD-1_TIGIT или PD-1_TIM-3 против CD19+ модели B-ОЛЛ модели. Каждый тип CAR-T-клеток вводили в однократной дозе 1 × 106 через 5 суток после инфузии целевых клеток. Было обнаружено, что PD-1_TIGIT KD CAR-T-клетки демонстрируют неожиданно превосходящий противоопухолевый эффект по сравнению с другими CAR-T клетками с двойным KD (Фиг. 23). Таким образом, PD-1_TIGIT KD CAR-T-клетки в модели солидной опухоли были дополнительно оценены в следующем примере.
Пример 11. Способы лечения на модели солидной опухоли с использованием CAR-T-клеток с двойным KD, нацеленных на PD-1 и TIGIT
[00316] В этом примере описаны способы лечения злокачественного новообразования на модели солидной опухоли с использованием CAR-T-клеток с двойным KD, нацеленных на PD-1 и TIGIT.
Для получения модели солидной опухоли, мышам NSG в возрасте от 4 до 6 недель подкожно вводили 5 × 106 клеток IM-9 (CD19+ PD-L1+CD155+). Как только опухоли достигали объема 150~250мм3, CAR-T-клетки вводили внутривенно в однократной дозе 3×106. Опухоли отслеживали каждую неделю путем измерения штангенциркулем, а объем оценивали как (длина × ширина2)/2. Как показано на модели опухоли крови (Nalm-6-PDL1), PD-1_TIGIT KD CAR-T-клетки также были неожиданным образом наиболее эффективны против модели солидной опухоли (IM-9) (Фиг. 24). Блокада внутриклеточной части PD-1_TIGIT обладает неожиданным образом более высоким уровнем противоопухолевого эффекта, чем блокада PD-1.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> CUROCELL CO. LTD.
KOREA ADVANCED INSTITUTE OF SCIENCE AND TECHNOLOGY
<120> УЛУЧШЕННЫЕ ИММУННЫЕ КЛЕТКИ С ДВОЙНОЙ КШРНК И КОМПОЗИЦИИ,
СОДЕРЖАЩИЕ ИХ
<130> 14570-001-228
<140> будет назначено
<141> Подан вместе с заявкой
<150> KR 10-2018-0004238
<151> 12.01.2018
<160> 289
<170> PatentIn версия 3.5
<210> 1
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой GFP для
РНК-интерференции
<400> 1
tctcggcatg gacgagctgt a 21
<210> 2
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой PD-1 для
РНК-интерференции
<400> 2
tggaacccat tcctgaaatt a 21
<210> 3
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой PD-1 для
РНК-интерференции
<400> 3
ggaacccatt cctgaaatta t 21
<210> 4
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой PD-1 для
РНК-интерференции
<400> 4
gaacccattc ctgaaattat t 21
<210> 5
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой PD-1 для
РНК-интерференции
<400> 5
acccattcct gaaattattt a 21
<210> 6
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой PD-1 для
РНК-интерференции
<400> 6
cccattcctg aaattattta a 21
<210> 7
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой PD-1 для
РНК-интерференции
<400> 7
ccttccctgt ggttctatta t 21
<210> 8
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой PD-1 для
РНК-интерференции
<400> 8
cttccctgtg gttctattat a 21
<210> 9
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой PD-1 для
РНК-интерференции
<400> 9
ttccctgtgg ttctattata t 21
<210> 10
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой PD-1 для
РНК-интерференции
<400> 10
tccctgtggt tctattatat t 21
<210> 11
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой PD-1 для
РНК-интерференции
<400> 11
ccctgtggtt ctattatatt a 21
<210> 12
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой PD-1 для
РНК-интерференции
<400> 12
cctgtggttc tattatatta t 21
<210> 13
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TIM-3 для
РНК-интерференции
<400> 13
gatgaaaggg atgtgaatta t 21
<210> 14
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TIM-3 для
РНК-интерференции
<400> 14
gggagcctcc ctgatataaa t 21
<210> 15
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TIM-3 для
РНК-интерференции
<400> 15
ggaattcgct cagaagaaa 19
<210> 16
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TIM-3 для
РНК-интерференции
<400> 16
ggaccaaact gaagctatat t 21
<210> 17
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TIM-3 для
РНК-интерференции
<400> 17
agaactttgg tttcctttaa t 21
<210> 18
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TIM-3 для
РНК-интерференции
<400> 18
atgaaaggga tgtgaattat t 21
<210> 19
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TIM-3 для
РНК-интерференции
<400> 19
tcttatcttc ggcgctttaa t 21
<210> 20
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TIM-3 для
РНК-интерференции
<400> 20
cttatcttcg gcgctttaat t 21
<210> 21
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TIM-3 для
РНК-интерференции
<400> 21
ttatcttcgg cgctttaatt t 21
<210> 22
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TIM-3 для
РНК-интерференции
<400> 22
gaggagccca atgagtatta t 21
<210> 23
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TIM-3 для
РНК-интерференции
<400> 23
aggagcccaa tgagtattat t 21
<210> 24
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TIM-3 для
РНК-интерференции
<400> 24
atagatccaa ccaccttatt t 21
<210> 25
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TIM-3 для
РНК-интерференции
<400> 25
atgtcattgc ctctgtattt a 21
<210> 26
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TIM-3 для
РНК-интерференции
<400> 26
tgtcattgcc tctgtattta a 21
<210> 27
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TIM-3 для
РНК-интерференции
<400> 27
accaccatgc ccagctaatt t 21
<210> 28
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TIM-3 для
РНК-интерференции
<400> 28
tgttgagatt taggcttatt t 21
<210> 29
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TIM-3 для
РНК-интерференции
<400> 29
gaccaaactg aagctatatt t 21
<210> 30
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TIM-3 для
РНК-интерференции
<400> 30
aggccttcag caatctatat t 21
<210> 31
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TIM-3 для
РНК-интерференции
<400> 31
ggccttcagc aatctatatt a 21
<210> 32
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TIM-3 для
РНК-интерференции
<400> 32
gagtggtccc taaacttaaa t 21
<210> 33
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TIM-3 для
РНК-интерференции
<400> 33
agtggtccct aaacttaaat t 21
<210> 34
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TIM-3 для
РНК-интерференции
<400> 34
gtggtcccta aacttaaatt t 21
<210> 35
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TIM-3 для
РНК-интерференции
<400> 35
ctaacacaaa tatccacat 19
<210> 36
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой LAG-3 для
РНК-интерференции
<400> 36
tcagcagccc agtccaaata a 21
<210> 37
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой LAG-3 для
РНК-интерференции
<400> 37
cagcagccca gtccaaataa a 21
<210> 38
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой LAG-3 для
РНК-интерференции
<400> 38
tcaacgtctc catcatgtat a 21
<210> 39
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой LAG-3 для
РНК-интерференции
<400> 39
caacgtctcc atcatgtata a 21
<210> 40
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой LAG-3 для
РНК-интерференции
<400> 40
ctggagacaa tggcgacttt a 21
<210> 41
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой LAG-3 для
РНК-интерференции
<400> 41
ctcagcagcc cagtccaaat a 21
<210> 42
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой LAG-3 для
РНК-интерференции
<400> 42
agcagcccag tccaaataaa c 21
<210> 43
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CTLA-4 для
РНК-интерференции
<400> 43
gggatcaaag ctatctatat a 21
<210> 44
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CTLA-4 для
РНК-интерференции
<400> 44
ggatcaaagc tatctatata a 21
<210> 45
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CTLA-4 для
РНК-интерференции
<400> 45
ggcaacggaa cccagattta t 21
<210> 46
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CTLA-4 для
РНК-интерференции
<400> 46
tgaagaagag agtccatatt t 21
<210> 47
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CTLA-4 для
РНК-интерференции
<400> 47
ttggatgcgg aacccaaatt a 21
<210> 48
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CTLA-4 для
РНК-интерференции
<400> 48
agcatcactt gggattaata t 21
<210> 49
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CTLA-4 для
РНК-интерференции
<400> 49
tgatgtgggt caaggaatta a 21
<210> 50
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CTLA-4 для
РНК-интерференции
<400> 50
agcgagggag aagactatat t 21
<210> 51
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CTLA-4 для
РНК-интерференции
<400> 51
tttacgtatg agacgtttat a 21
<210> 52
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой BTLA для
РНК-интерференции
<400> 52
gctcctgtat agtttacttc c 21
<210> 53
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой BTLA для
РНК-интерференции
<400> 53
ggaaattaac ctggttgatg c 21
<210> 54
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой BTLA для
РНК-интерференции
<400> 54
gcaccaacag aatatgcatc c 21
<210> 55
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой BTLA для
РНК-интерференции
<400> 55
gctcaacagg atgtcaaata a 21
<210> 56
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой BTLA для
РНК-интерференции
<400> 56
gcatcttgct gttcttctta c 21
<210> 57
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой BTLA для
РНК-интерференции
<400> 57
gcatttgtgg acaacttatg t 21
<210> 58
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CD160 для
РНК-интерференции
<400> 58
ggaacgcgac taaacttaat c 21
<210> 59
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CD160 для
РНК-интерференции
<400> 59
gatgttcacc ataagccaag t 21
<210> 60
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CD160 для
РНК-интерференции
<400> 60
gcaagatgag tctgactatg g 21
<210> 61
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CD160 для
РНК-интерференции
<400> 61
ggcacagaga agaatgcaac a 21
<210> 62
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CD160 для
РНК-интерференции
<400> 62
gggaagagat gctaaatata c 21
<210> 63
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CD160 для
РНК-интерференции
<400> 63
gcaaatcagt gtaatccttg a 21
<210> 64
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой VISTA для
РНК-интерференции
<400> 64
gcaacttctc catcaccatg c 21
<210> 65
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой VISTA для
РНК-интерференции
<400> 65
gcaaagatgc accatccaac t 21
<210> 66
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой VISTA для
РНК-интерференции
<400> 66
gcggatggac agcaacattc a 21
<210> 67
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой VISTA для
РНК-интерференции
<400> 67
ggacacttct gagtatgaag c 21
<210> 68
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой VISTA для
РНК-интерференции
<400> 68
gggaaccaca atgcacgaaa g 21
<210> 69
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой VISTA для
РНК-интерференции
<400> 69
ggtgctttcc aacacacttt c 21
<210> 70
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TIGIT для
РНК-интерференции
<400> 70
gcttctggcc atttgtaatg c 21
<210> 71
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TIGIT для
РНК-интерференции
<400> 71
gggagtactt ctgcatctat c 21
<210> 72
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TIGIT для
РНК-интерференции
<400> 72
gctgcatgac tacttcaatg t 21
<210> 73
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TIGIT для
РНК-интерференции
<400> 73
taacgtggat cttgatcata a 21
<210> 74
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TIGIT для
РНК-интерференции
<400> 74
ggagacatac acaggccttc a 21
<210> 75
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TIGIT для
РНК-интерференции
<400> 75
gcatttgggc cttgatctac c 21
<210> 76
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой 2B4 для
РНК-интерференции
<400> 76
gacaggttgc aaggcagttc t 21
<210> 77
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой 2B4 для
РНК-интерференции
<400> 77
gggagtgcct cttcagttac a 21
<210> 78
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой 2B4 для
РНК-интерференции
<400> 78
ggacgaggag gttgacatta a 21
<210> 79
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой 2B4 для
РНК-интерференции
<400> 79
gaggagaaag aggaaggaga a 21
<210> 80
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой 2B4 для
РНК-интерференции
<400> 80
gcccttcctt caatagcact a 21
<210> 81
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой 2B4 для
РНК-интерференции
<400> 81
ggttgactgc atttctagac t 21
<210> 82
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой PD-L1 для
РНК-интерференции
<400> 82
gcatttgctg aacgcattta c 21
<210> 83
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой PD-L1 для
РНК-интерференции
<400> 83
gctgcactaa ttgtctattg g 21
<210> 84
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой PD-L1 для
РНК-интерференции
<400> 84
ggatccagtc acctctgaac a 21
<210> 85
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой PD-L1 для
РНК-интерференции
<400> 85
gcacatcctc caaatgaaag g 21
<210> 86
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой PD-L1 для
РНК-интерференции
<400> 86
ggattctcaa cctgtggttt a 21
<210> 87
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой PD-L1 для
РНК-интерференции
<400> 87
ggtgcttggt ctcctctata a 21
<210> 88
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CEACAM-1 для
РНК-интерференции
<400> 88
gcacagtact cctggcttat c 21
<210> 89
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CEACAM-1 для
РНК-интерференции
<400> 89
gcaacaggac cacagtcaag a 21
<210> 90
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CEACAM-1 для
РНК-интерференции
<400> 90
gcaacaccac cctcagcata a 21
<210> 91
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CEACAM-1 для
РНК-интерференции
<400> 91
gcctgttcag agcactcatt c 21
<210> 92
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CEACAM-1 для
РНК-интерференции
<400> 92
gcagtaatgc cttctcctat t 21
<210> 93
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CEACAM-1 для
РНК-интерференции
<400> 93
gcaccttggt gcttagctag a 21
<210> 94
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CEACAM-3 для
РНК-интерференции
<400> 94
gcttccatct atgaggaatt g 21
<210> 95
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CEACAM-3 для
РНК-интерференции
<400> 95
gccagagaac cagctataag t 21
<210> 96
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CEACAM-3 для
РНК-интерференции
<400> 96
gggtccctga tgaatatctg g 21
<210> 97
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CEACAM-3 для
РНК-интерференции
<400> 97
ggcttgcagg gaaagtgaat g 21
<210> 98
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CEACAM-3 для
РНК-интерференции
<400> 98
gcttgcaggg aaagtgaatg g 21
<210> 99
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CEACAM-3 для
РНК-интерференции
<400> 99
agcttccatc tatgaggaat t 21
<210> 100
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CEACAM-5 для
РНК-интерференции
<400> 100
ggaatccaga acgaattaag t 21
<210> 101
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CEACAM-5 для
РНК-интерференции
<400> 101
ggctgattga tgggaacatc c 21
<210> 102
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CEACAM-5 для
РНК-интерференции
<400> 102
ggactacagt caagacaatc a 21
<210> 103
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CEACAM-5 для
РНК-интерференции
<400> 103
ggaccctcac tctattcaat g 21
<210> 104
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CEACAM-5 для
РНК-интерференции
<400> 104
gctactggcc gcaataattc c 21
<210> 105
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CEACAM-5 для
РНК-интерференции
<400> 105
gctctttgta tgacagaata c 21
<210> 106
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CD96 для
РНК-интерференции
<400> 106
ggtccaaggt caccaataag a 21
<210> 107
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CD96 для
РНК-интерференции
<400> 107
gcaaccatac gatagaaata g 21
<210> 108
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CD96 для
РНК-интерференции
<400> 108
ggttctgaaa tttcctcaac a 21
<210> 109
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CD96 для
РНК-интерференции
<400> 109
gcaagatatc cagctacatc t 21
<210> 110
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CD96 для
РНК-интерференции
<400> 110
gcaactcacc ctcttccatc t 21
<210> 111
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CD96 для
РНК-интерференции
<400> 111
gctgcattcc ctaagataat t 21
<210> 112
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой LAIR1 для
РНК-интерференции
<400> 112
gggacagtag atccacatac a 21
<210> 113
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой LAIR1 для
РНК-интерференции
<400> 113
ggacaacagt cacaatgagc a 21
<210> 114
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой LAIR1 для
РНК-интерференции
<400> 114
ggctgttgat gttctagaga g 21
<210> 115
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой LAIR1 для
РНК-интерференции
<400> 115
gcagacaagg ccacagtcaa t 21
<210> 116
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой LAIR1 для
РНК-интерференции
<400> 116
ggaggtttct aaccagcatc c 21
<210> 117
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой LAIR1 для
РНК-интерференции
<400> 117
gccttgagac tgtgctatac a 21
<210> 118
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой KLRG1 для
РНК-интерференции
<400> 118
ccaagcccag aatgactatg g 21
<210> 119
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой KLRG1 для
РНК-интерференции
<400> 119
gccttcttgt tcttgccttg t 21
<210> 120
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой KLRG1 для
РНК-интерференции
<400> 120
gcttctgact gcagttcttc t 21
<210> 121
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой KLRG1 для
РНК-интерференции
<400> 121
gctggatgaa atatggtaac c 21
<210> 122
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой KLRG1 для
РНК-интерференции
<400> 122
ggaaatgagc ctgctccaag t 21
<210> 123
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой KLRG1 для
РНК-интерференции
<400> 123
ggattggtct gaggaacaat t 21
<210> 124
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой FAS для
РНК-интерференции
<400> 124
gccaagaagg gaaggagtac a 21
<210> 125
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой FAS для
РНК-интерференции
<400> 125
gccaattcca ctaattgttt g 21
<210> 126
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой FAS для
РНК-интерференции
<400> 126
ggttctcatg aatctccaac t 21
<210> 127
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой FAS для
РНК-интерференции
<400> 127
gctggagtca tgacactaag t 21
<210> 128
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой FAS для
РНК-интерференции
<400> 128
gcctggtttg gagatactaa c 21
<210> 129
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой FAS для
РНК-интерференции
<400> 129
ggaaccacct aaagaacttc c 21
<210> 130
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой Cbl-b для
РНК-интерференции
<400> 130
ccgcgttgat ttaaagaaag a 21
<210> 131
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой Cbl-b для
РНК-интерференции
<400> 131
gcctgataca tatcagcatt t 21
<210> 132
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой Cbl-b для
РНК-интерференции
<400> 132
gcggaattgg aatttcttag c 21
<210> 133
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой Cbl-b для
РНК-интерференции
<400> 133
gcacgactac agaaatatag c 21
<210> 134
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой Cbl-b для
РНК-интерференции
<400> 134
tttccggtta agttgcactc g 21
<210> 135
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой Cbl-b для
РНК-интерференции
<400> 135
gcctggatct aattcagaaa g 21
<210> 136
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой LRR1 для
РНК-интерференции
<400> 136
gaaagccact gttcggttaa a 21
<210> 137
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой LRR1 для
РНК-интерференции
<400> 137
tcctgtggat atctgtctaa g 21
<210> 138
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой LRR1 для
РНК-интерференции
<400> 138
ggctcataga ggctgtaatg t 21
<210> 139
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой LRR1 для
РНК-интерференции
<400> 139
gggcttgtcc gagttgatat g 21
<210> 140
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой LRR1 для
РНК-интерференции
<400> 140
aagatttgga taccgcaaaa a 21
<210> 141
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой LRR1 для
РНК-интерференции
<400> 141
gtggtactga agcacctatt a 21
<210> 142
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TGFBR1 для
РНК-интерференции
<400> 142
gcttgttcag agaacaattg c 21
<210> 143
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TGFBR1 для
РНК-интерференции
<400> 143
ggagattgtt ggtacccaag g 21
<210> 144
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TGFBR1 для
РНК-интерференции
<400> 144
gcagctaggc ttacagcatt g 21
<210> 145
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TGFBR1 для
РНК-интерференции
<400> 145
ggtcctttct gtgcactatg a 21
<210> 146
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TGFBR1 для
РНК-интерференции
<400> 146
ggtggtagct aaagaacatt c 21
<210> 147
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой TGFBR1 для
РНК-интерференции
<400> 147
ggacctgtct acaggtgatc t 21
<210> 148
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой DNMT3A для
РНК-интерференции
<400> 148
gccaaggtca ttgcaggaat g 21
<210> 149
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой DNMT3A для
РНК-интерференции
<400> 149
gcagaacaag cccatgattg a 21
<210> 150
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой DNMT3A для
РНК-интерференции
<400> 150
cccaaggtca aggagattat t 21
<210> 151
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой DNMT3A для
РНК-интерференции
<400> 151
gcagaagtgc cggaacattg a 21
<210> 152
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой DNMT3A для
РНК-интерференции
<400> 152
gcgtcacaca gaagcatatc c 21
<210> 153
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой DNMT3A для
РНК-интерференции
<400> 153
ccggctcttc tttgagttct a 21
<210> 154
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой A2aR для
РНК-интерференции
<400> 154
cagaacgtca ccaactactt t 21
<210> 155
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой A2aR для
РНК-интерференции
<400> 155
ccatgctagg ttggaacaac t 21
<210> 156
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой A2aR для
РНК-интерференции
<400> 156
ccaagtggcc tgtctctttg a 21
<210> 157
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой A2aR для
РНК-интерференции
<400> 157
ggtgtctatt tgcggatctt c 21
<210> 158
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой A2aR для
РНК-интерференции
<400> 158
agaccttccg caagatcatt c 21
<210> 159
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой A2aR для
РНК-интерференции
<400> 159
tccttagcca tgagctcaag g 21
<210> 160
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой Cbl-c для
РНК-интерференции
<400> 160
gaaagtactg tggacacatg t 21
<210> 161
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой Cbl-c для
РНК-интерференции
<400> 161
gcacgtgtcc atcttcgagt t 21
<210> 162
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой Cbl-c для
РНК-интерференции
<400> 162
ggccaacact cctcaagaac t 21
<210> 163
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой Cbl-c для
РНК-интерференции
<400> 163
ggcttctacc tctacccaga t 21
<210> 164
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой Cbl-c для
РНК-интерференции
<400> 164
ggccatggac tccacatttg a 21
<210> 165
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой Cbl-c для
РНК-интерференции
<400> 165
ggccgtgagt atctaccagt t 21
<210> 166
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой DGK-альфа для
РНК-интерференции
<400> 166
gccagaagac aagttagaat t 21
<210> 167
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой DGK-альфа для
РНК-интерференции
<400> 167
gctctggaag ttccagtata t 21
<210> 168
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой DGK-альфа для
РНК-интерференции
<400> 168
ggaaatgatc tggctcgatg c 21
<210> 169
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой DGK-альфа для
РНК-интерференции
<400> 169
gcaaagatcc tcaaggattt a 21
<210> 170
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой DGK-альфа для
РНК-интерференции
<400> 170
ggatgcctct attgctcatc g 21
<210> 171
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой DGK-альфа для
РНК-интерференции
<400> 171
gctatggtac ttcgaatttg c 21
<210> 172
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой DGK-дзета для
РНК-интерференции
<400> 172
ggaagggatt ccagcagaag t 21
<210> 173
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой DGK-дзета для
РНК-интерференции
<400> 173
gcaaggagat tgtggccatc a 21
<210> 174
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой DGK-дзета для
РНК-интерференции
<400> 174
gggcatcctt caagaggaag t 21
<210> 175
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой DGK-дзета для
РНК-интерференции
<400> 175
gcaaagatca tccagtcttt c 21
<210> 176
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой DGK-дзета для
РНК-интерференции
<400> 176
gctggagatg taccgcaaag t 21
<210> 177
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой DGK-дзета для
РНК-интерференции
<400> 177
gcacaggatg agatttatat c 21
<210> 178
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой MerTK для
РНК-интерференции
<400> 178
ggaagaccac atacaggaaa c 21
<210> 179
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой MerTK для
РНК-интерференции
<400> 179
gcattggtgt ttcctgcatg a 21
<210> 180
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой MerTK для
РНК-интерференции
<400> 180
gcacacggtt gggtagatta t 21
<210> 181
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой MerTK для
РНК-интерференции
<400> 181
gggtctgtaa tggaaggaaa t 21
<210> 182
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой MerTK для
РНК-интерференции
<400> 182
gcatgttgcg agatgacatg a 21
<210> 183
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой MerTK для
РНК-интерференции
<400> 183
gcagaccgag tctacacaag t 21
<210> 184
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой SHP1 для
РНК-интерференции
<400> 184
gcaccatcat ccacctcaag t 21
<210> 185
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой SHP1 для
РНК-интерференции
<400> 185
ggtcacccac atcaaggtca t 21
<210> 186
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой SHP1 для
РНК-интерференции
<400> 186
gggcaagaac cgctacaaga a 21
<210> 187
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой SHP1 для
РНК-интерференции
<400> 187
ggaacaaatg cgtcccatac t 21
<210> 188
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой SHP1 для
РНК-интерференции
<400> 188
gcctggactg tgacattgac a 21
<210> 189
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой SHP1 для
РНК-интерференции
<400> 189
gaacctgcac actaagaaca a 21
<210> 190
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой SHP2 для
РНК-интерференции
<400> 190
gcagatccta cctctgaaag g 21
<210> 191
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой SHP2 для
РНК-интерференции
<400> 191
gcaatgacgg caagtctaaa g 21
<210> 192
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой SHP2 для
РНК-интерференции
<400> 192
ggaactgaaa tacgacgttg g 21
<210> 193
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой SHP2 для
РНК-интерференции
<400> 193
gcgtgttagg aacgtcaaag a 21
<210> 194
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой SHP2 для
РНК-интерференции
<400> 194
gctcatgact atacgctaag a 21
<210> 195
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой SHP2 для
РНК-интерференции
<400> 195
ggagagaacg gtctggcaat a 21
<210> 196
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой PP2A для
РНК-интерференции
<400> 196
gcagctgaac gagaaccaag t 21
<210> 197
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой PP2A для
РНК-интерференции
<400> 197
ggagactgtg actcttcttg t 21
<210> 198
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой PP2A для
РНК-интерференции
<400> 198
ggaatgccaa cgtttggaaa t 21
<210> 199
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой PP2A для
РНК-интерференции
<400> 199
ggatcgttta caggaagttc c 21
<210> 200
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой PP2A для
РНК-интерференции
<400> 200
gcctttgtat gtggaagtat a 21
<210> 201
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой PP2A для
РНК-интерференции
<400> 201
gcctgctgta tttatagtaa c 21
<210> 202
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CD45 для
РНК-интерференции
<400> 202
gctgcacatc aaggagtaat t 21
<210> 203
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CD45 для
РНК-интерференции
<400> 203
gctggaaata ctctggttag a 21
<210> 204
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CD45 для
РНК-интерференции
<400> 204
ggagcttgtt gaaagggatg a 21
<210> 205
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CD45 для
РНК-интерференции
<400> 205
gcagaatact ggccgtcaat g 21
<210> 206
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CD45 для
РНК-интерференции
<400> 206
ggttatgttg tcaagctaag g 21
<210> 207
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CD45 для
РНК-интерференции
<400> 207
gcagaaccca aggaattaat c 21
<210> 208
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CD148 для
РНК-интерференции
<400> 208
ggtgtaacat cacaggctta c 21
<210> 209
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CD148 для
РНК-интерференции
<400> 209
gccatagagt tcaggacaaa t 21
<210> 210
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CD148 для
РНК-интерференции
<400> 210
gcaattctcg ggtagaaata a 21
<210> 211
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CD148 для
РНК-интерференции
<400> 211
gctggcttca ccaacattac c 21
<210> 212
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CD148 для
РНК-интерференции
<400> 212
gggagcaaat catctgcatt c 21
<210> 213
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой CD148 для
РНК-интерференции
<400> 213
gcgactcaaa tatcaccttg a 21
<210> 214
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой ИЛ-10R для
РНК-интерференции
<400> 214
gctcctgagg tatggaatag a 21
<210> 215
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой ИЛ-10R для
РНК-интерференции
<400> 215
gcaaatgaca catatgaaag c 21
<210> 216
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой ИЛ-10R для
РНК-интерференции
<400> 216
ggtctaaaga ggagtgcatc t 21
<210> 217
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой ИЛ-10R для
РНК-интерференции
<400> 217
gggctatttg aaacaggatc c 21
<210> 218
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой ИЛ-10R для
РНК-интерференции
<400> 218
gctgtaggaa tggaagcttc a 21
<210> 219
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> частичная последовательность кшРНК, включенная в целевой ИЛ-10R для
РНК-интерференции
<400> 219
gcttgtgttt gctgctaatg t 21
<210> 220
<211> 726
<212> ДНК
<213> Искусственная последовательность
<220>
<223> mU6-shTIM-3-><-shPD-1-hU6
<400> 220
gttaacaagg tcgggcagga agagggccta tttcccatga ttccttcata tttgcatata 60
cgatacaagg ctgttagaga gataattaga attaatttga ctgtaaacac aaagatatta 120
gtacaaaata cgtgacgtag aaagtaataa tttcttgggt agtttgcagt tttaaaatta 180
tgttttaaaa tggactatca tatgcttacc gtaacttgaa agtatttcga tttcttggct 240
ttatatatct tgtggaaagg acgaaacacc gcctgtggtt ctattatatt atttcaagag 300
aataatataa tagaaccaca ggtttttgac tagtcaaaaa ggaattcgct cagaagaaat 360
ctcttgaatt tcttctgagc gaattccaaa caaggctttt ctccaaggga tatttatagt 420
ctcaaaacac acaattactt tacagttagg gtgagtttcc ttttgtgctg ttttttaaaa 480
taataattta gtatttgtat ctcttataga aatccaagcc tatcatgtaa aatgtagcta 540
gtattaaaaa gaacagatta tctgtctttt atcgcacatt aagcctctat agttactagg 600
aaatattata tgcaaattaa ccggggcagg ggagtagccg agcttctccc acaagtctgt 660
gcgagggggc cggcgcgggc ctagagatgg cggcgtcgga tcgctagcca tatgtctaga 720
gtatac 726
<210> 221
<211> 726
<212> ДНК
<213> Искусственная последовательность
<220>
<223> shTIM-3-mU6<-->hU6-shPD-1
<400> 221
gttaaccaaa aacctgtggt tctattatat tattctcttg aaataatata atagaaccac 60
aggcggtgtt tcgtcctttc cacaagatat ataaagccaa gaaatcgaaa tactttcaag 120
ttacggtaag catatgatag tccattttaa aacataattt taaaactgca aactacccaa 180
gaaattatta ctttctacgt cacgtatttt gtactaatat ctttgtgttt acagtcaaat 240
taattctaat tatctctcta acagccttgt atcgtatatg caaatatgaa ggaatcatgg 300
gaaataggcc ctcttcctgc ccgaccttac tagtgatccg acgccgccat ctctaggccc 360
gcgccggccc cctcgcacag acttgtggga gaagctcggc tactcccctg ccccggttaa 420
tttgcatata atatttccta gtaactatag aggcttaatg tgcgataaaa gacagataat 480
ctgttctttt taatactagc tacattttac atgataggct tggatttcta taagagatac 540
aaatactaaa ttattatttt aaaaaacagc acaaaaggaa actcacccta actgtaaagt 600
aattgtgtgt tttgagacta taaatatccc ttggagaaaa gccttgtttg gaattcgctc 660
agaagaaatt caagagattt cttctgagcg aattcctttt tggctagcca tatgtctaga 720
gtatac 726
<210> 222
<211> 385
<212> ДНК
<213> Искусственная последовательность
<220>
<223> последовательность оснований кассеты кшРНК
<220>
<221> прочий_признак
<222> (323)..(343)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (353)..(373)
<223> n представляет собой a, c, g или t
<400> 222
gttaacgatc cgacgccgcc atctctaggc ccgcgccggc cccctcgcac agacttgtgg 60
gagaagctcg gctactcccc tgccccggtt aatttgcata taatatttcc tagtaactat 120
agaggcttaa tgtgcgataa aagacagata atctgttctt tttaatacta gctacatttt 180
acatgatagg cttggatttc tataagagat acaaatacta aattattatt ttaaaaaaca 240
gcacaaaagg aaactcaccc taactgtaaa gtaattgtgt gttttgagac tataaatatc 300
ccttggagaa aagccttgtt tgnnnnnnnn nnnnnnnnnn nnnttcaaga gannnnnnnn 360
nnnnnnnnnn nnntttttgg ttaac 385
<210> 223
<211> 409
<212> ДНК
<213> Искусственная последовательность
<220>
<223> последовательность оснований mU6-shPD-1 MCS
<400> 223
gttaacgatc cgacgccgcc atctctaggc ccgcgccggc cccctcgcac agacttgtgg 60
gagaagctcg gctactcccc tgccccggtt aatttgcata taatatttcc tagtaactat 120
agaggcttaa tgtgcgataa aagacagata atctgttctt tttaatacta gctacatttt 180
acatgatagg cttggatttc tataagagat acaaatacta aattattatt ttaaaaaaca 240
gcacaaaagg aaactcaccc taactgtaaa gtaattgtgt gttttgagac tataaatatc 300
ccttggagaa aagccttgtt tgcctgtggt tctattatat tatttcaaga gaataatata 360
atagaaccac aggtttttga ctagtgctag ccatatgtct agagtatac 409
<210> 224
<211> 328
<212> ДНК
<213> Искусственная последовательность
<220>
<223> последовательность оснований hU6-shPD-1
<400> 224
gttaacaagg tcgggcagga agagggccta tttcccatga ttccttcata tttgcatata 60
cgatacaagg ctgttagaga gataattaga attaatttga ctgtaaacac aaagatatta 120
gtacaaaata cgtgacgtag aaagtaataa tttcttgggt agtttgcagt tttaaaatta 180
tgttttaaaa tggactatca tatgcttacc gtaacttgaa agtatttcga tttcttggct 240
ttatatatct tgtggaaagg acgaaacacc gcctgtggtt ctattatatt atttcaagag 300
aataatataa tagaaccaca ggtttttg 328
<210> 225
<211> 468
<212> Белок
<213> Искусственная последовательность
<220>
<223> CD22-CAR
<400> 225
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Asn
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Thr Tyr Tyr Arg Ser Lys Trp Tyr Asn Asp Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Glu Val Thr Gly Asp Leu Glu Asp Ala Phe Asp
100 105 110
Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr
130 135 140
Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile
145 150 155 160
Thr Cys Arg Ala Ser Gln Thr Ile Trp Ser Tyr Leu Asn Trp Tyr Gln
165 170 175
Gln Arg Pro Gly Lys Ala Pro Asn Leu Leu Ile Tyr Ala Ala Ser Ser
180 185 190
Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Arg Gly Ser Gly Thr
195 200 205
Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala Glu Asp Phe Ala Thr
210 215 220
Tyr Tyr Cys Gln Gln Ser Tyr Ser Ile Pro Gln Thr Phe Gly Gln Gly
225 230 235 240
Thr Lys Leu Glu Ile Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro
245 250 255
Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys
260 265 270
Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala
275 280 285
Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu
290 295 300
Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys
305 310 315 320
Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr
325 330 335
Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly
340 345 350
Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala
355 360 365
Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg
370 375 380
Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu
385 390 395 400
Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn
405 410 415
Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met
420 425 430
Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly
435 440 445
Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala
450 455 460
Leu Pro Pro Arg
465
<210> 226
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<223> CD19-CAR
<400> 226
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu
20 25 30
Ser Ala Ser Leu Gly Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln
35 40 45
Asp Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr
50 55 60
Val Lys Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Val Pro
65 70 75 80
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile
85 90 95
Ser Asn Leu Glu Gln Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly
100 105 110
Asn Thr Leu Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Thr
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
130 135 140
Val Lys Leu Gln Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln Ser
145 150 155 160
Leu Ser Val Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly
165 170 175
Val Ser Trp Ile Arg Gln Pro Pro Arg Lys Gly Leu Glu Trp Leu Gly
180 185 190
Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ala Leu Lys Ser
195 200 205
Arg Leu Thr Ile Ile Lys Asp Asn Ser Lys Ser Gln Val Phe Leu Lys
210 215 220
Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Ile Tyr Tyr Cys Ala Lys
225 230 235 240
His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Ser Val Thr Val Ser Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 227
<211> 782
<212> Белок
<213> Искусственная последовательность
<220>
<223> Дельта LNGFR_P2A_CD19-CAR
<400> 227
Met Gly Ala Gly Ala Thr Gly Arg Ala Met Asp Gly Pro Arg Leu Leu
1 5 10 15
Leu Leu Leu Leu Leu Gly Val Ser Leu Gly Gly Ala Lys Glu Ala Cys
20 25 30
Pro Thr Gly Leu Tyr Thr His Ser Gly Glu Cys Cys Lys Ala Cys Asn
35 40 45
Leu Gly Glu Gly Val Ala Gln Pro Cys Gly Ala Asn Gln Thr Val Cys
50 55 60
Glu Pro Cys Leu Asp Ser Val Thr Phe Ser Asp Val Val Ser Ala Thr
65 70 75 80
Glu Pro Cys Lys Pro Cys Thr Glu Cys Val Gly Leu Gln Ser Met Ser
85 90 95
Ala Pro Cys Val Glu Ala Asp Asp Ala Val Cys Arg Cys Ala Tyr Gly
100 105 110
Tyr Tyr Gln Asp Glu Thr Thr Gly Arg Cys Glu Ala Cys Arg Val Cys
115 120 125
Glu Ala Gly Ser Gly Leu Val Phe Ser Cys Gln Asp Lys Gln Asn Thr
130 135 140
Val Cys Glu Glu Cys Pro Asp Gly Thr Tyr Ser Asp Glu Ala Asn His
145 150 155 160
Val Asp Pro Cys Leu Pro Cys Thr Val Cys Glu Asp Thr Glu Arg Gln
165 170 175
Leu Arg Glu Cys Thr Arg Trp Ala Asp Ala Glu Cys Glu Glu Ile Pro
180 185 190
Gly Arg Trp Ile Thr Arg Ser Thr Pro Pro Glu Gly Ser Asp Ser Thr
195 200 205
Ala Pro Ser Thr Gln Glu Pro Glu Ala Pro Pro Glu Gln Asp Leu Ile
210 215 220
Ala Ser Thr Val Ala Gly Val Val Thr Thr Val Met Gly Ser Ser Gln
225 230 235 240
Pro Val Val Thr Arg Gly Thr Thr Asp Asn Leu Ile Pro Val Tyr Cys
245 250 255
Ser Ile Leu Ala Ala Val Val Val Gly Leu Val Ala Tyr Ile Ala Phe
260 265 270
Lys Arg Trp Gly Ser Gly Ala Thr Asn Phe Ser Leu Leu Lys Gln Ala
275 280 285
Gly Asp Val Glu Glu Asn Pro Gly Pro Ala Leu Pro Val Thr Ala Leu
290 295 300
Leu Leu Pro Leu Ala Leu Leu Leu His Ala Ala Arg Pro Asp Ile Gln
305 310 315 320
Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly Asp Arg Val
325 330 335
Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr Leu Asn Trp
340 345 350
Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile Tyr His Thr
355 360 365
Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser
370 375 380
Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln Glu Asp Ile
385 390 395 400
Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr Thr Phe Gly
405 410 415
Gly Gly Thr Lys Leu Glu Ile Thr Gly Gly Gly Gly Ser Gly Gly Gly
420 425 430
Gly Ser Gly Gly Gly Gly Ser Glu Val Lys Leu Gln Glu Ser Gly Pro
435 440 445
Gly Leu Val Ala Pro Ser Gln Ser Leu Ser Val Thr Cys Thr Val Ser
450 455 460
Gly Val Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro
465 470 475 480
Arg Lys Gly Leu Glu Trp Leu Gly Val Ile Trp Gly Ser Glu Thr Thr
485 490 495
Tyr Tyr Asn Ser Ala Leu Lys Ser Arg Leu Thr Ile Ile Lys Asp Asn
500 505 510
Ser Lys Ser Gln Val Phe Leu Lys Met Asn Ser Leu Gln Thr Asp Asp
515 520 525
Thr Ala Ile Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr
530 535 540
Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Thr
545 550 555 560
Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser
565 570 575
Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly
580 585 590
Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp
595 600 605
Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile
610 615 620
Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys
625 630 635 640
Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys
645 650 655
Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val
660 665 670
Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn
675 680 685
Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val
690 695 700
Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg
705 710 715 720
Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys
725 730 735
Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg
740 745 750
Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys
755 760 765
Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
770 775 780
<210> 228
<211> 47
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой клонирующий праймер #1 для ПЦР
<400> 228
ggtatactct agacatatgg ctagcactag tcaaaaacct gtggttc 47
<210> 229
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный клонирующий праймер #1 для ПЦР
<400> 229
ttgtaccgtt aacgatccga cgccgc 26
<210> 230
<211> 102
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой клонирующий праймер #2 для ПЦР
<400> 230
tgactagtca aaaacctgtg gttctattat attattctct tgaaataata taatagaacc 60
acaggcggtg tttcgtcctt tccacaagat atataaagcc aa 102
<210> 231
<211> 50
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный клонирующий праймер #2 для ПЦР
<400> 231
gtaccgttaa caaggtcggg caggaagagg gcctatttcc catgattcct 50
<210> 232
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой клонирующий праймер #3 для ПЦР
<400> 232
aggactagtc aaaaaggaat tcgctcagaa gaaatctct 39
<210> 233
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный клонирующий праймер #3 для ПЦР
<400> 233
ctagctagcg atccgacgcc gccatct 27
<210> 234
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой клонирующий праймер #4 для ПЦР
<400> 234
atgttaacca aaaacctgtg gttctattat attattctct tg 42
<210> 235
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный клонирующий праймер #4 для ПЦР
<400> 235
tcactagtaa ggtcgggcag gaagagggcc tatt 34
<210> 236
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой клонирующий праймер #5 для ПЦР
<400> 236
taggccctca ctagtgatcc gacgccgcc 29
<210> 237
<211> 38
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный клонирующий праймер #5 для ПЦР
<400> 237
ctagctagcc aaaaaggaat tcgctcagaa gaaatctc 38
<210> 238
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TIGIT-268
<400> 238
gcttctggcc atttgtaatg c 21
<210> 239
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TIGIT-2
<400> 239
gggagtactt ctgcatctat c 21
<210> 240
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TIGIT-739
<400> 240
gctgcatgac tacttcaatg t 21
<210> 241
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TIGIT-1
<400> 241
taacgtggat cttgatcata a 21
<210> 242
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TIGIT-1386
<400> 242
ggagacatac acaggccttc a 21
<210> 243
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TIGIT-1750
<400> 243
gcatttgggc cttgatctac c 21
<210> 244
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> LAG3-138
<400> 244
ccagctttcc agctttcctc t 21
<210> 245
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> LAG3-503
<400> 245
gatctcagcc ttctgcgaag a 21
<210> 246
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> LAG3-1092
<400> 246
gcttcaacgt ctccatcatg t 21
<210> 247
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> LAG3-1221
<400> 247
ggtctttcct cactgccaag t 21
<210> 248
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> LAG3-1278
<400> 248
ctggagacaa tggcgacttt a 21
<210> 249
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> LAG3-1379
<400> 249
gccactgtca cattggcaat c 21
<210> 250
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> LAG3-1465
<400> 250
tccagtatct ggacaagaac g 21
<210> 251
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> LAG3-1616
<400> 251
gcagcagtgt acttcacaga g 21
<210> 252
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> LAG3-1702
<400> 252
gctgtttctc atccttggtg t 21
<210> 253
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> LAG3-1751
<400> 253
gcctttggct ttcacctttg g 21
<210> 254
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> LAG3-1954
<400> 254
tcagcagccc agtccaaata a 21
<210> 255
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> CTLA4-3
<400> 255
ggtggagctc atgtacccac c 21
<210> 256
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> CTLA4-1
<400> 256
cccaaattac gtgtactaca a 21
<210> 257
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> CTLA4-1058
<400> 257
gcatcacttg ggattaatat g 21
<210> 258
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> CTLA4-1154
<400> 258
gcgagggaga agactatatt g 21
<210> 259
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> CTLA4-1309
<400> 259
gccagtgatg ctaaaggttg t 21
<210> 260
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> CTLA4-1686
<400> 260
ggtggtatct gagttgactt g 21
<210> 261
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Tim3-1
<400> 261
gatgaaaggg atgtgaatta t 21
<210> 262
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Tim3-2
<400> 262
gggagcctcc ctgatataaa t 21
<210> 263
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Tim3-3
<400> 263
ggaattcgct cagaagaaa 19
<210> 264
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Tim3-4
<400> 264
ggaccaaact gaagctatat t 21
<210> 265
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> PD1-1
<400> 265
cctgtggttc tattatatta t 21
<210> 266
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> PD1-2
<400> 266
gcctagagaa gtttcaggga a 21
<210> 267
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> PD1-3
<400> 267
cattgtcttt cctagcggaa t 21
<210> 268
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямая 18s рРНК
<400> 268
gattaagtcc ctgccctttg 20
<210> 269
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратная 18s рРНК
<400> 269
gttcacctac ggaaaccttg 20
<210> 270
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой PDCD1
<400> 270
cctccacctt tacacatgcc 20
<210> 271
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный PDCD1
<400> 271
cttactgcct cagcttccct 20
<210> 272
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой IL2
<400> 272
ccaagaaggc cacagaactg a 21
<210> 273
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный IL2
<400> 273
gttgtttcag atccctttag ttccag 26
<210> 274
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой IL4
<400> 274
actttgaaca gcctcacaga g 21
<210> 275
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный IL4
<400> 275
ccgagttgac cgtaacagac at 22
<210> 276
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой IL17A
<400> 276
caaccgatcc acctcacctt 20
<210> 277
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный IL17A
<400> 277
ggcactttgc ctcccagat 19
<210> 278
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой CD25
<400> 278
cacaagctct gccactcgga a 21
<210> 279
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный CD25
<400> 279
tgcagtgacc tggaaggctc 20
<210> 280
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой CTLA4
<400> 280
ctacctgggc ataggcaacg 20
<210> 281
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный CTLA4
<400> 281
ccccgaacta actgctgcaa 20
<210> 282
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой FOXP3
<400> 282
gaaacagcac attcccagag ttc 23
<210> 283
<211> 17
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный FOXP3
<400> 283
atggcccagc ggatgag 17
<210> 284
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой TGF-бета1
<400> 284
cccagcatct gcaaagctc 19
<210> 285
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный TGF-бета1
<400> 285
gtccttgcgg aagtcaatgt 20
<210> 286
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой TGFBR1
<400> 286
acatgattca gccacagata cc 22
<210> 287
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный TGFBR1
<400> 287
gcatagatgt cagcacgttt g 21
<210> 288
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой TGFBR2
<400> 288
acgtgttgag agatcgagg 19
<210> 289
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный TGFBR2
<400> 289
cccagcactc agtcaacgtc 20
<---