Результат интеллектуальной деятельности: БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА, СПЕЦИФИЧЕСКИЕ К PD1 И TIM3
Вид РИД
Изобретение
Область, к которой относится настоящее изобретение
Настоящее изобретение относится к биспецифическим антителам, включающим первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, прежде всего к биспецифическим антителам, которые связываются с TIM3 с меньшей связывающей аффинностью по сравнению со связывающей аффинностью с PD1. Настоящее изобретение кроме того относится к способам получения таких соединений и к способам их применения.
Предшествующий уровень техники
Важность иммунной системы в защите против рака основана на ее способности распознавать, и разрушать аномальные клетки. Однако, некоторые опухолевые клетки способны уклоняться от иммунной системы, вызывая состояние подавления иммунного ответа (Zitvogel и др., Nature Reviews Immunology, 6, сс. 715-727 (2006)). Один пример механизма подавления иммунного ответа, присутствующего у опухоленесущих хозяев, заключается в ускорении дисфункции и истощения Т клеток. Основное внимание было направлено на Т клетки при попытках использовать для лечения эндогенную противоопухолевую иммунную систему за счет способности Т клеток к селективному распознаванию пептидов, образующихся из белков во всех отделах клетки, их способности к прямому распознаванию и уничтожению антигенэкспрессирующих клеток (эффекторными CD8+ Т клетками, известными также под названием цитотоксичных Т лимфоцитов (CTL)) и их способности вызывать обратный иммунный ответ (с использованием хелперных CD4+ Т клеток), что объединяет адаптивный и врожденный эффекторные механизмы. Истощенные Т клетки не способны к пролиферации и проявлению эффекторных функций, таких как цитотоксичность и секреция цитокинов, в ответ на стимуляцию антигеном. Дальнейшие исследования показали, что истощенные Т клетки характеризуются замедленной экспрессией ингибиторной молекулы PD-1 (белок 1 запланированной гибели клеток), и такая блокада взаимодействий PD-1 и PD-L1 (лиганд PD-1) может обращать истощение Т клеток и восстановить антиген-специфический ответ Т клеток у мыши, инфицированной LCMV (Barber и др., Nature, 439, сс. 682-687 (2006)). Однако направленное воздействие на путь PD-1-PD-L1 в отдельности не всегда приводит к обращению истощения Т клеток (Gehring и др., Gastroenterology, 137, сс. 682-690) (2009)), что указывает на предположительное участие других молекул в истощении Т клеток (Sakuishi J., Experimental. Med., 207, сс. 2187-2194 (2010)).
TIM-3 представляет собой молекулу, изначально идентифицированную как селективно экспрессирующуюся на секретирующих интерферон-γ (ИНФ-γ) клетках Th1 и Tc1 (Monney и др., Nature, 415, сс. 536-541 (2002)). Взаимодействие TIM-3 с его лигандом, галектином-9, запускает гибель Т клеток TIM-3+. Таким образом, оба TIM-3 и PD-1 могут функционировать в качестве отрицательных регуляторов ответных реакций Т клеток. Было установлено, что TIM-3 маркируют наиболее подавленную или бифункциональную популяцию Т клеток CD8+ в доклинических моделях, как солидных опухолей, так и гематологических опухолей (Sakuishi J., Experimental. Med., 207, сс. 2187-2194 (2010), Zhou, Blood, 117, сс. 4501-4510 (2011), Majeti R. и др., PNAS, 106, сс. 3396-3401 (2009)). В данных моделях, все Т CD8+ TIM-3+ Т клетки совместно экспрессируют PD1, и эти клетки с двойной экспрессией характеризуются большим количеством дефектов, как в прогрессировании клеточного цикла, так и в продуцировании эффекторных цитокинов (интерлейкин-2 (IL)-2, TNF, и ИНФ-γ) по сравнению с клетками, экспрессирующими PD1 в отдельности. Таким образом, путь TIM-3 может действовать совместно с путем PD-1 для ускорения развития острого бифункционального фенотипа в Т клетках CD8+ при раке. Таким образом, следует ожидать, что объединенное направленное воздействие на пути TIM-3 и PD1 будет высокоэффективным для контроля роста опухоли.
TIM3 представляет собой белок человека, который принадлежит к подсемейству иммуноглобулинов и семейству белков TIM. В организме человека, как и в организме мыши, TIM-3 экспрессируется на Т клетках, а также на клетках фагоцитов, таких как макрофаги и дендритные клетки. Связывание TIM3 с лигандом белка (например, с галектином-9) может ингибировать ответ Th1 по механизму индукции апоптоза, и тем самым приводить к индукции периферической толерантности. Снижение экспрессии TIM3 человека с использованием малой интерферирующей РНК (миРНК) или ингибирование TIM3 человека с использованием блокирующих антител увеличивает секрецию интерферона-α из CD4 положительных Т клеток, поддерживая ингибиторную роль TIM3 в Т клетках человека. В фагоцитах TIM3 также функционирует в качестве рецептора для распознавания апоптотических клеток. Анализ клинических образцов от пациентов с аутоиммунными заболеваниями показывает отсутствие экспрессии TIM3 в CD4 положительных клетках. Прежде всего, в клонах Т клеток из цереброспинальной жидкости пациентов с рассеянным склерозом уровень экспрессии TIM3 снижается, а уровень секреции ИНФ-γ повышается по сравнению с клонами от здоровых доноров (Koguchi K. и др., J. Exp. Med., 203, сс. 1413-1418 (2006)). Существуют сообщения о связи TIM-3 с аллергическими заболеваниями или астмой (заявки WO 96/27603 и WO 2003/063792).
Примеры моноклональных антител анти-TIM3 включают моноклональные крысиные антитела против TIM3 человека (клон 344823, фирмы R&D Systems) и моноклональные мышиные антитела против TIM-3 человека (клон F38-2E2, фирмы R&D Systems). В заявке WO 2013/06490 описаны антитела анти-TIM3, которые характеризуются быстрой интернализацией, а их иммуноконъюгаты использовали для лечения рака и снижения воспаления. В патенте США 2012/189617 описаны антитела анти-TIM-3, которые проявляют большую эффекторную активность, такую как зависимую от антител клеточную цитотоксичность (активность ADCC) при заболеваниях, связанных с клетками, экспрессирующими TIM3 человека.
Белок программирования гибели клеток 1 (PD-1 или CD279) представляет собой ингибиторный член семейства рецепторов CD28, которое также включает CD28, CTLA-4, ICOS и BTLA. PD-1 является рецептором, расположенным на поверхности клеток, и экспрессируется на активированных В клетках, Т клетках и миелоидных клетках (Okazaki и др., Curr. Opin. Immunol., 14, сс. 391779-391782 (2002), Bennett и др., J. Immunol., 170, сс. 711-718 (2003)). В структурном отношении PD-1 является трансмембранным белком мономерного типа 1, содержащим один вариабельно-подобный внеклеточный домен иммуноглобулина и цитоплазматический домен, содержащий иммунорецепторный тирозиновый ингибиторный мотив (ITIM) и иммунорецепторный тирозиновый мотив переключения (ITSM). Активированные Т клетки временно экспрессируют PD1, но гиперэкспрессия PD1 замедлена, и его лиганд PDL1 способствует иммунному истощению, что приводит к персистенции вирусных инфекций, уклонению опухолей от иммунной системы, повышению инфицированности и смертности. Экспрессия PD1 индуцируется при распознавании антигена рецептором Т клеток, а их экспрессия поддерживается главным образом за счет непрерывной передачи сигнала от рецептора Т клеток. После продолжительного воздействия антигена повторное метилирование локуса PD1 не происходит, что приводит к непрерывной гиперэкспрессии. Блокировка пути PD1 может восстановить функциональность истощенных Т клеток при раке и хронических вирусных инфекциях (Sheridan, Nature Biotechnology, 30, сс. 729-730 (2012)). Моноклональные антитела к PD-1 описаны, например, в заявках WO 2003/042402, WO 2004/004771, WO 2004/056875, WO 2004/072286, WO 2004/087196, WO 2006/121168, WO 2006/133396, WO 2007/005874, WO 2008/083174, WO 2008/156712, WO 2009/024531, WO 2009/014708, WO 2009/101611, WO 2009/114335, WO 2009/154335, WO 2010/027828, WO 2010/027423, WO 2010/029434, WO 2010/029435, WO 2010/036959, WO 2010/063011, WO 2010/089411, WO 2011/066342, WO 2011/110604, WO 2011/110621, WO 2012/145493, WO 2013/014668, WO 2014/179664 и WO 2015/112900.
Было установлено также, что блокировка обоих PD1 и TIM3 может восстановить антибактериальные иммунные ответные реакции, например, у пациентов с острым алкогольным гепатитом (ААН). Лимфоциты таких пациентов экспрессируют высокие уровни иммунных ингибиторных рецепторов, продуцируют низкие уровни интерферона-γ (ИНФ-γ) и повышают продуцирование IL10 за счет продолжительного воздействия эндотоксина. Эти эффекты могут обращать блокировку PD1 и TIM3, что повышает активность Т клеток и нейтрофилов (Markwick и др., Gastroenterology, 148, сс. 590-602 (2015)).
Биспецифические антитела против TIM3 и PD1 для иммунотерапии при хронических иммунных состояниях уже описаны в заявке WO 2011/159877. Однако, существует необходимость в разработке новых биспецифических антител, которые не только одновременно связываются с PD1 и TIM3 и таким образом селективно целенаправленно воздействуют на Т клетки, экспрессирующие оба PD1 и TIM3, но также и исключают блокировку TIM3 на других клетках, таких как клетки врожденного иммунитета, например, наивные дендритные клетки (DC) и моноциты. Биспецифические антитела по настоящему изобретению не только эффективно блокируют PD1 и TIM3 на Т клетках, которые сверхэкспрессируют PD1 и TIM3, но и являются высокоселективными в отношении этих клеток, что способствует исключению побочных эффектов при введении высоко активных антител TIM3.
Краткое содержание настоящего изобретения
В одном объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где
указанный первый антигенсвязывающий участок, который специфично связывается с PD1, включает:
VH домен, включающий:
(i) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 37,
(ii) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 38, и
(iii) HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 39, и
VL домен, включающий:
(i) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 40,
(ii) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 41, и
(iii) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 42, и
указанный второй антигенсвязывающий участок, который специфично связывается с TIM3, включает:
(a) VH домен, включающий:
(i) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 1,
(ii) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 2, и
(iii) HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 3, и
VL домен, включающий:
(i) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 4 или SEQ ID NO: 11 или SEQ ID NO: 12,
(ii) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 5, и
(iii) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 6, или
(б) VH домен, включающий:
(i) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 17,
(ii) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 18, и
(iii) HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 19, и
VL домен, включающий:
(i) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 20,
(ii) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 21, и
(iii) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 22, или
(в) VH домен, включающий:
(i) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 29,
(ii) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 30, и
(iii) HVR-H3 включающую аминокислотную последовательность SEQ ID NO: 31, и
VL домен, включающий:
(i) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 32,
(ii) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 33, и
(iii) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 34.
В еще одном объекте настоящего изобретения биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, является двухвалентным.
В другом объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где биспецифическое антитело связывается с TIM3 с низкой аффинностью, а с PD1 связывается с высокой аффинностью. В предпочтительном объекте в настоящем изобретении предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где биспецифическое антитело связывается с TIM3 со связывающей аффинностью, которая по меньшей мере в 50 раз меньше по сравнению со связывающей аффинностью с PD1, более предпочтительно со связывающей аффинностью, которая по крайней мере в 100 раз меньше по сравнению со связывающей аффинностью с PD1. В одном предпочтительном варианте связывающую аффинность (KD) определяют с использованием метода поверхностного плазмонного резонанса (как описано, например, в примере 12.)
В еще одном объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где
указанный первый антигенсвязывающий участок, который специфично связывается с PD1, включает:
(а) VH домен, включающий аминокислотную последовательность SEQ ID NO: 43, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 44, или
(б) VH домен, включающий аминокислотную последовательность SEQ ID NO: 45, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 46, или
(в) VH домен, включающий аминокислотную последовательность SEQ ID NO: 45, VL домен, включающий аминокислотную последовательность SEQ ID NO: 47, или
(г) VH домен, включающий аминокислотную последовательность SEQ ID NO: 45, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 48, или
(д) VH домен, включающий аминокислотную последовательность SEQ ID NO: 45, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 49,
и указанный второй антигенсвязывающий участок, который специфично связывается с TIM3, включает
(а) VH домен, включающий аминокислотную последовательность SEQ ID NO: 7, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 8, или
(б) VH домен, включающий аминокислотную последовательность SEQ ID NO: 9, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 10, или
(в) VH домен, включающий аминокислотную последовательность SEQ ID NO: 13, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 14, или
(г) VH домен, включающий аминокислотную последовательность SEQ ID NO: 15, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 16, или
(д) VH домен, включающий аминокислотную последовательность SEQ ID NO: 23, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 24, или
(е) VH домен, включающий аминокислотную последовательность SEQ ID NO: 25, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 26, или
(ж) VH домен, включающий аминокислотную последовательность SEQ ID NO: 27, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 28, или
(з) VH домен, включающий аминокислотную последовательность SEQ ID NO: 35, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 36.
В предпочтительном объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где
указанный первый антигенсвязывающий участок, который специфично связывается с PD1, включает VH домен, включающий аминокислотную последовательность SEQ ID NO: 45, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 46,
и указанный второй антигенсвязывающий участок, который специфично связывается с TIM3, включает VH домен, включающий аминокислотную последовательность SEQ ID NO: 15, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 16, или VH домен, включающий аминокислотную последовательность SEQ ID NO: 25, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 26.
Прежде всего в настоящем изобретении предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где
указанный первый антигенсвязывающий участок, который специфично связывается с PD1, включает:
VH домен, включающий:
(i) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 37,
(ii) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 38, и
(iii) HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 39, и
VL домен, включающий:
(i) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 40,
(ii) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 41, и
(iii) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 42, и
указанный второй антигенсвязывающий участок, который специфично связывается с TIM3, включает VH домен, включающий:
(i) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 17,
(ii) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 18, и
(iii) HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 19, и
VL домен, включающий
(i) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 20,
(ii) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 21, и
(iii) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 22.
В более предпочтительном объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где указанный первый антигенсвязывающий участок, который специфично связывается с PD1, включает VH домен, включающий аминокислотную последовательность SEQ ID NO: 45, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 46, и указанный второй антигенсвязывающий участок, который специфично связывается с TIM3, включает VH домен, включающий аминокислотную последовательность SEQ ID NO: 25, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 26.
В предпочтительном объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где биспецифическое антитело связывается с TIM3 со связывающей аффинностью, которая по крайней мере в 50 раз меньше по сравнению со связывающей аффинностью с PD1, более предпочтительно со связывающей аффинностью, которая крайней мере в 100 раз меньше по сравнению со связывающей аффинностью с PD1.
В другом объекте настоящего изобретения биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, представляет собой антитело человека, гуманизированное антитело или химерное антитело. Прежде всего, оно представляет собой гуманизированное или химерное антитело.
В другом объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где биспецифическое антитело включает Fc домен, первый Fab фрагмент, включающий антигенсвязывающий участок, который специфично связывается с PD1, и второй Fab фрагмент, включающий антигенсвязывающий участок, который специфично связывается с TIM3.
Предпочтительно Fc домен представляет собой Fc домен IgG, более предпочтительно Fc домен представляет собой Fc домен IgG1 или Fc домен IgG4.
В одном объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где Fc домен включает одну или более аминокислотных замен, что снижает связывание с Fc рецептором, прежде всего с Fcγ рецептором. Предпочтительно Fc домен представляет собой подкласс IgG1 человека с аминокислотными мутациями L234A, L235A и P329G (нумерация по EU индексу Кабата).
В другом объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где Fc домен включает модификацию, ускоряющую ассоциацию первой и второй субъединиц Fc домена.
В одном объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где первая субъединица Fc домена включает выступы, а вторая субъединица Fc домена включает впадины согласно методу "выступы-во-впадины". В предпочтительном объекте первая субъединица Fc домена включает аминокислотные замены S354C и T366W (EU нумерация), а вторая субъединица Fc домена включает аминокислотные замены Y349C, T366S и Y407V (нумерация по EU индексу Кабата).
В еще одном объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где в одном из Fab фрагментов вариабельные домены VL и VH заменены друг на друга таким образом, что VH домен является частью легкой цепи, а VL домен представляет собой часть тяжелой цепи. Предпочтительно в биспецифическом антителе в первом Fab фрагменте, включающем антигенсвязывающий участок, который специфично связывается с PD1, вариабельные домены VL и VH заменены друг на друга.
В другом объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где в одном из Fab фрагментов в консервативном домене CL аминокислота в положении 124 заменена независимо на лизин (K), аргинин (R) или гистидин (Н) (нумерация по EU индексу Кабата), и в консервативном домене СН1 аминокислоты в положениях 147 и 213 заменены независимо на глутаминовую кислоту (Е) или аспарагиновую кислоту (D) (нумерация по EU индексу Кабата). В предпочтительном объекте в биспецифическом антителе во втором Fab фрагменте, включающем антигенсвязывающий участок, который специфично связывается с TIM3, в консервативном домене CL аминокислота в положении 124 заменена независимо на лизин (K), аргинин (R) или гистидин (Н) (нумерация по EU индексу Кабата), и в консервативном домене СН1 аминокислоты в положениях 147 и 213 заменены независимо на глутаминовую кислоту (Е) или аспарагиновую кислоту (D) (нумерация по EU индексу Кабата).
В другом объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, включающее:
(а) первую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 50, первую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 52,
вторую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 51, и вторую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 53, или
(б) первую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 54, первую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 56,
вторую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 55, и вторую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 57, или
(в) первую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 58, первую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 60,
вторую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 59, и вторую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 61, или
(г) первую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 62, первую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 64,
вторую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 63, и вторую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 65, или
(д) первую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 66, первую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 68,
вторую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 67, и вторую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 69.
В предпочтительном объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, включающее:
(а) первую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 50, первую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 52,
вторую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 51, и вторую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 53, или
(б) первую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 54, первую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 56,
вторую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 55, и вторую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 57, или
(в) первую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 58, первую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 60,
вторую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 59, и вторую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 61, или
(г) первую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 62, первую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 64,
вторую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 63, вторую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 65, или
(д) первую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 66, первую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 68,
вторую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 67, вторую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 69.
В другом объекте настоящего изобретения предлагается полинуклеотид, кодирующий биспецифическое антитело, как описано выше. Кроме того, в настоящем изобретении предлагается вектор, прежде всего вектор экспрессии, включающий полинуклеотид по настоящему изобретению и прокариотическую или эукариотическую клетку, включающую полинуклеотид или вектор по настоящему изобретению. В некоторых вариантах клетка хозяина представляет собой эукариотическую клетку, предпочтительно клетку млекопитающих.
В другом объекте настоящего изобретения предлагается способ получения биспецифического антитела, включающего первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, как описано выше в данном контексте, включающий стадии а) трансформации клетки-хозяина векторами, включающими полинуклеотиды, кодирующие указанные биспецифическое антитела, б) культивирования клетки-хозяина в условиях, пригодных для экспрессии биспецифического антитела и в) выделения биспецифического антитела из культуры. В настоящее изобретение также включено биспецифическое антитело, полученное способом по настоящему изобретению.
В настоящем изобретении дополнительно предлагается фармацевтическая композиция, включающая биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, как описано в данном контексте, и по крайней мере один фармацевтически приемлемый эксципиент.
В настоящем изобретении предлагается также биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, как описано в данном контексте, или фармацевтическая композиция, содержащая биспецифическое антитело, для применения в качестве лекарственного средства.
В другом объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, как описано в данном контексте, или фармацевтическая композиция, содержащая биспецифическое антитело, для применения
i) при модуляции иммунных ответных реакций, таких как восстановление активности Т клеток,
ii) при стимуляции иммунной ответной реакции или функции,
iii) при лечении инфекционных заболеваний,
iv) при лечении рака,
v) при замедлении прогрессирования рака,
vi) при продлении жизни пациенту, страдающему от рака.
В одном объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, как описано в данном контексте, или фармацевтическая композиция, содержащая биспецифическое антитело, для применения при лечении заболевания у индивидуума, нуждающегося в таком лечении. В особом объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, или фармацевтическая композиция, содержащая биспецифическое антитело, для применения при лечении рака. В другом особом объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, или фармацевтическая композиция, содержащая биспецифическое антитело, для применения при модуляции иммунной ответной реакции. В другом объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, или фармацевтическая композиция, содержащая биспецифическое антитело, для применения при лечении хронической вирусной инфекции.
Предлагается также применение биспецифического антитела, включающего первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, как описано в данном контексте, для получения лекарственного средства, предназначенного для лечения заболевания у индивидуума, нуждающегося в таком лечении, прежде всего для получения лекарственного средства для лечения рака, а также способ лечения заболевания индивидуума, который включает введение указанному индивидууму терапевтически эффективного количества композиции, включающей биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, как описано в данном контексте, в фармацевтически приемлемой форме. В особом объекте заболеванием является рак. В другом особом объекте заболеванием является хроническая вирусная инфекция. В другом объекте предлагается способ модуляции иммунной ответной реакции у индивидуума, включающий введение указанному индивидууму терапевтически эффективного количества композиции, включающей биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, как описано в данном контексте, в фармацевтически приемлемой форме. В любом из приведенных выше объектов индивидуумом предпочтительно является млекопитающее, прежде всего человек.
В настоящем изобретении также предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, как описано в данном контексте, или фармацевтическая композиция, включающая биспецифическое антитело, для применения при профилактике или лечении рака, где биспецифическое антитело вводят в комбинации с химиотерапевтическим агентом, лучевой терапией и/или другими агентами, которые используют в иммунотерапии рака.
Кроме того в настоящем изобретении предлагается способ ингибирования роста опухолевых клеток у индивидуума, включающий введение указанному индивидууму терапевтически эффективного количества биспецифического антитела, включающего первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, как описано в данном контексте, для ингибирования роста опухолевых клеток. Индивидуумом предпочтительно является млекопитающее, прежде всего человек.
Краткое описание фигур
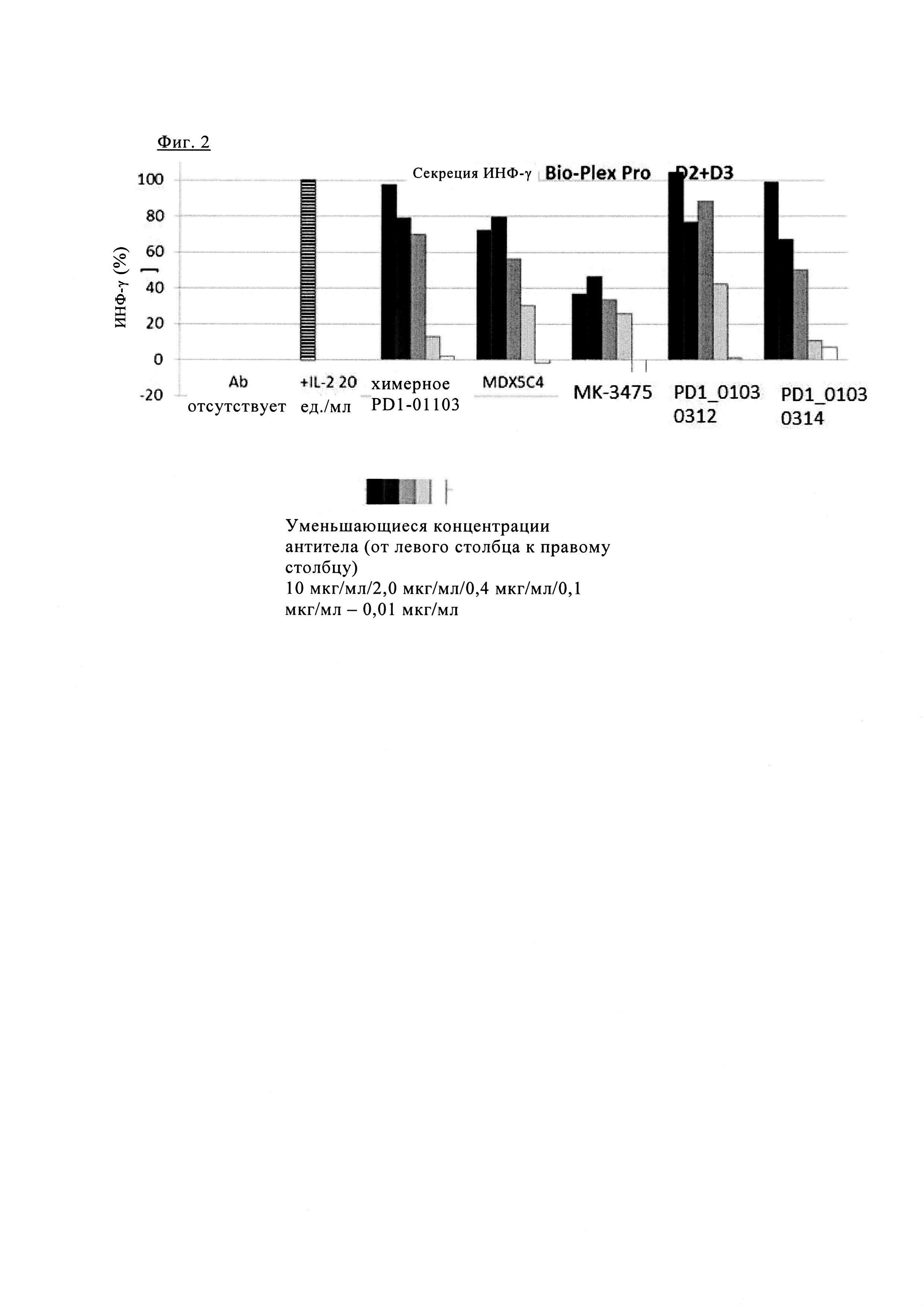
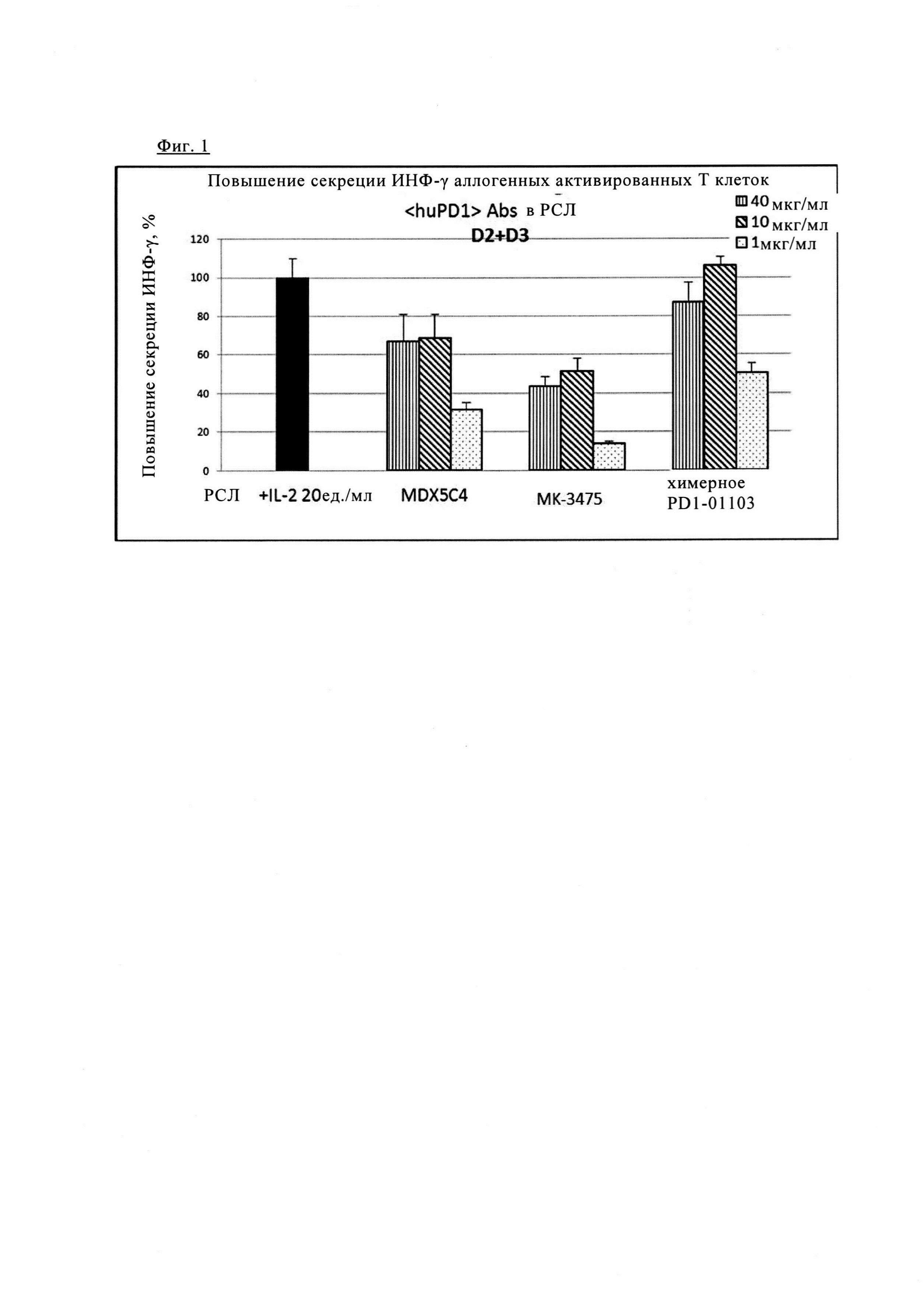
Фиг. 1. Блокада PD1 химерным PD1-0103 значительно повышает секрецию ИНФ-γ при аллогенной стимуляции первичных Т клеток человека.
Фиг. 2. Блокада PD1 химерным PD1-0103 значительно увеличивает секрецию интерферона-γ (ИНФ-γ) при аллогенной стимуляции первичных Т клеток человека.
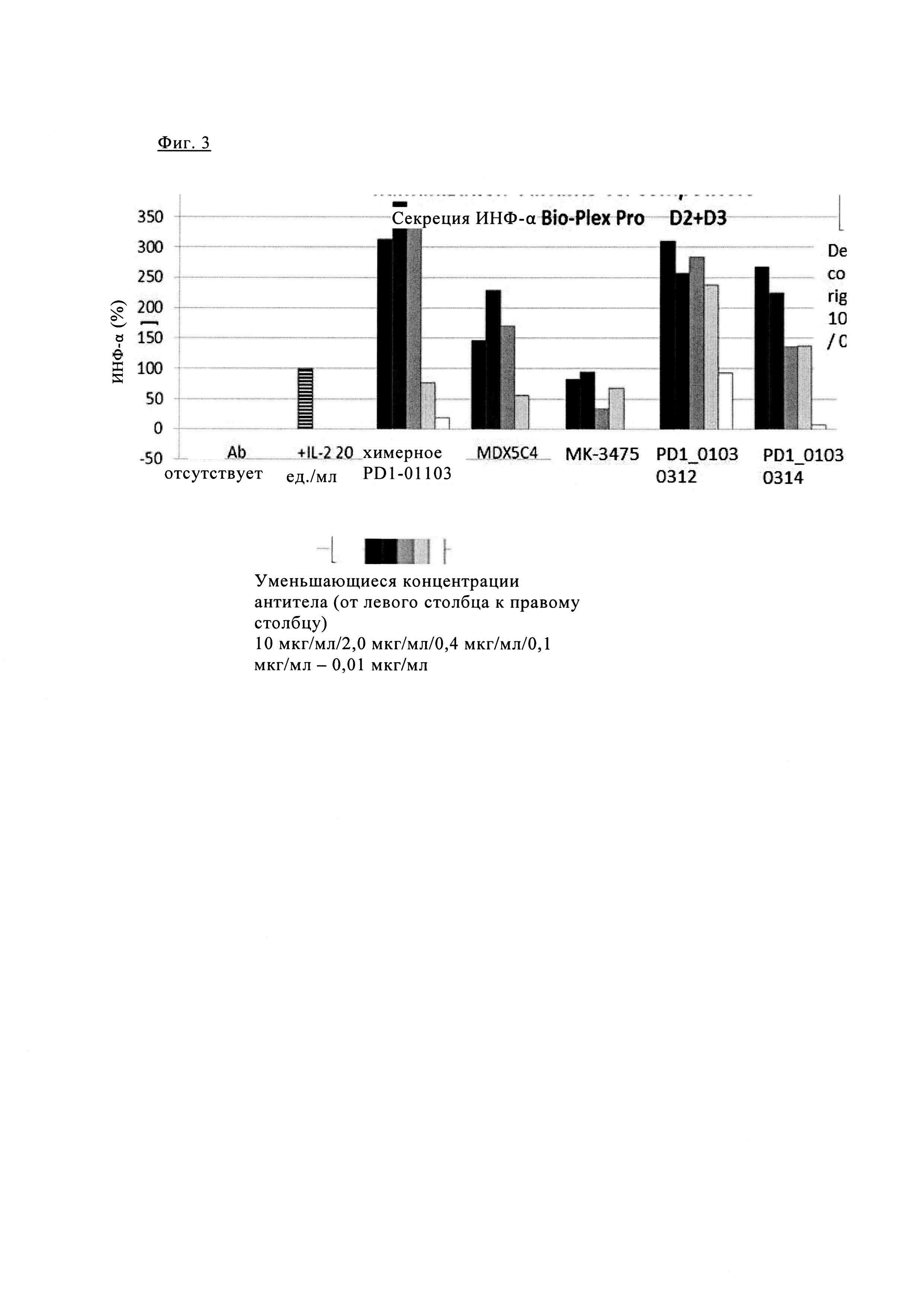
Фиг. 3. Блокада PD1 химерным PD1-0103 значительно увеличивает секрецию α-фактора некроза опухоли (TNF) при аллогенной стимуляции первичных Т клеток человека.
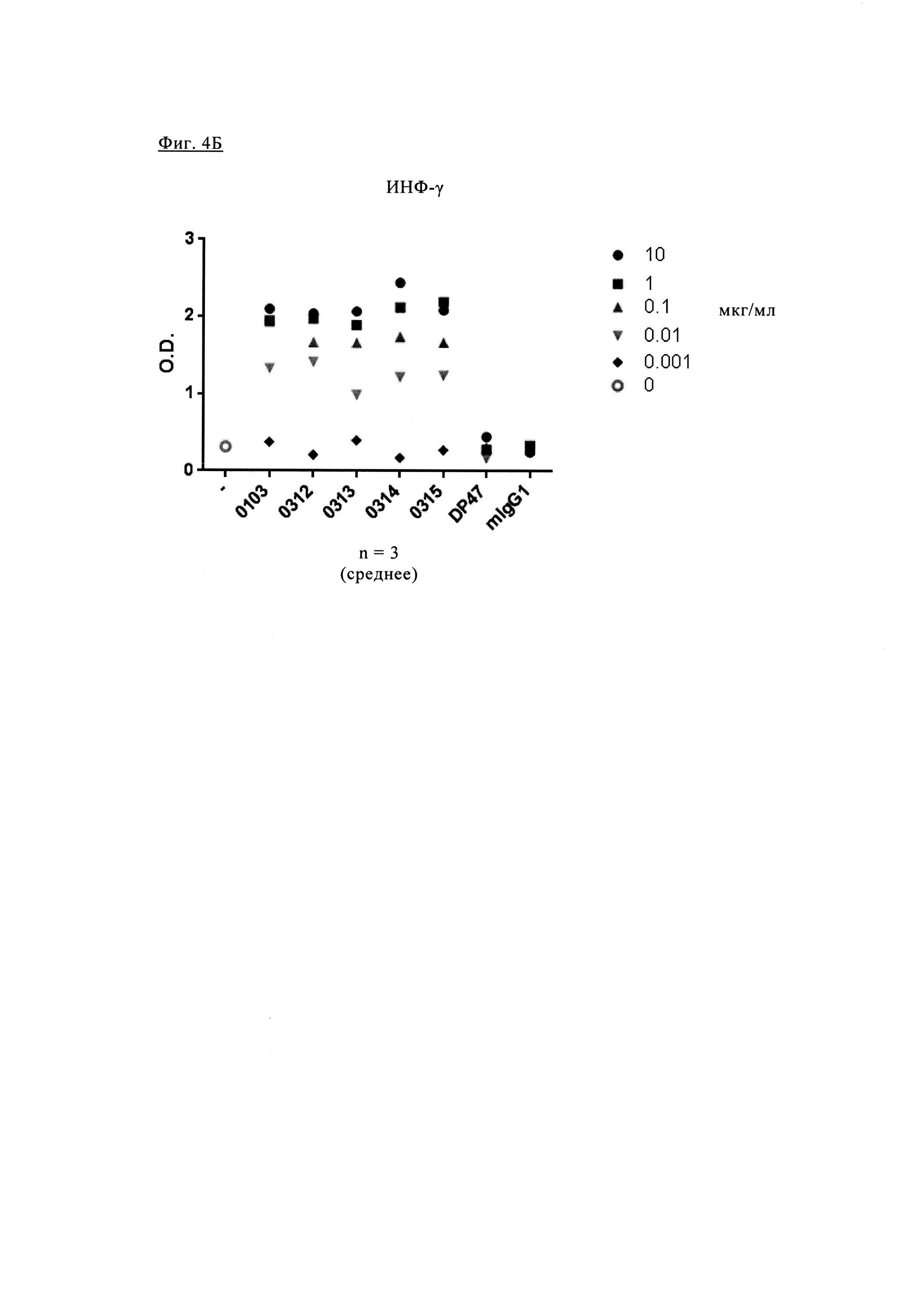
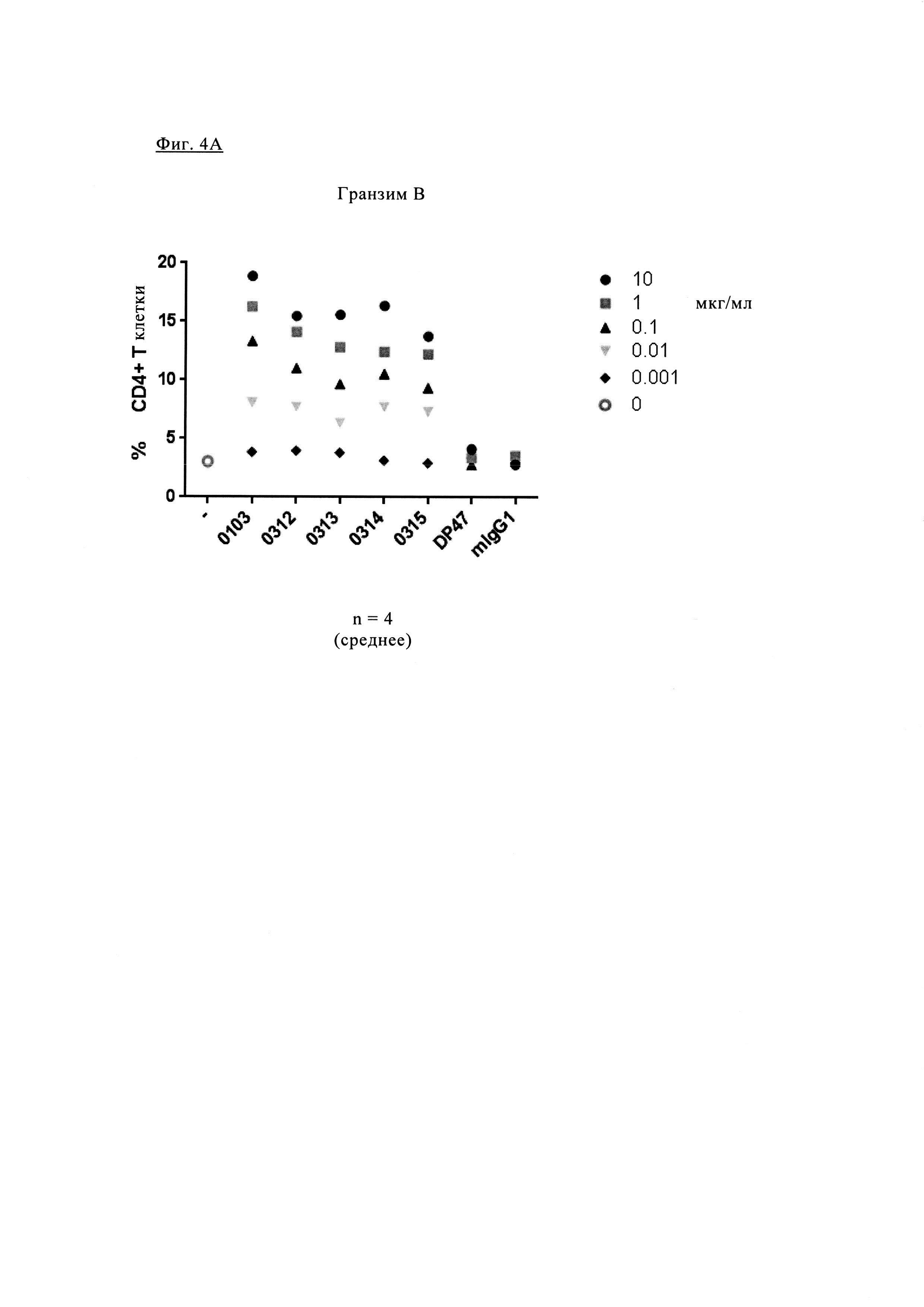
Фиг. 4А. Частота попадания в группу Т клеток CD4, продуцирующих гранзим В. Фиг. 4Б. Количество ИНФ-γ, определенного по поглощению (оптическая плотность, O.D.) в супернатанте РСЛ в присутствии увеличивающихся концентраций различных антител анти-PD-1.
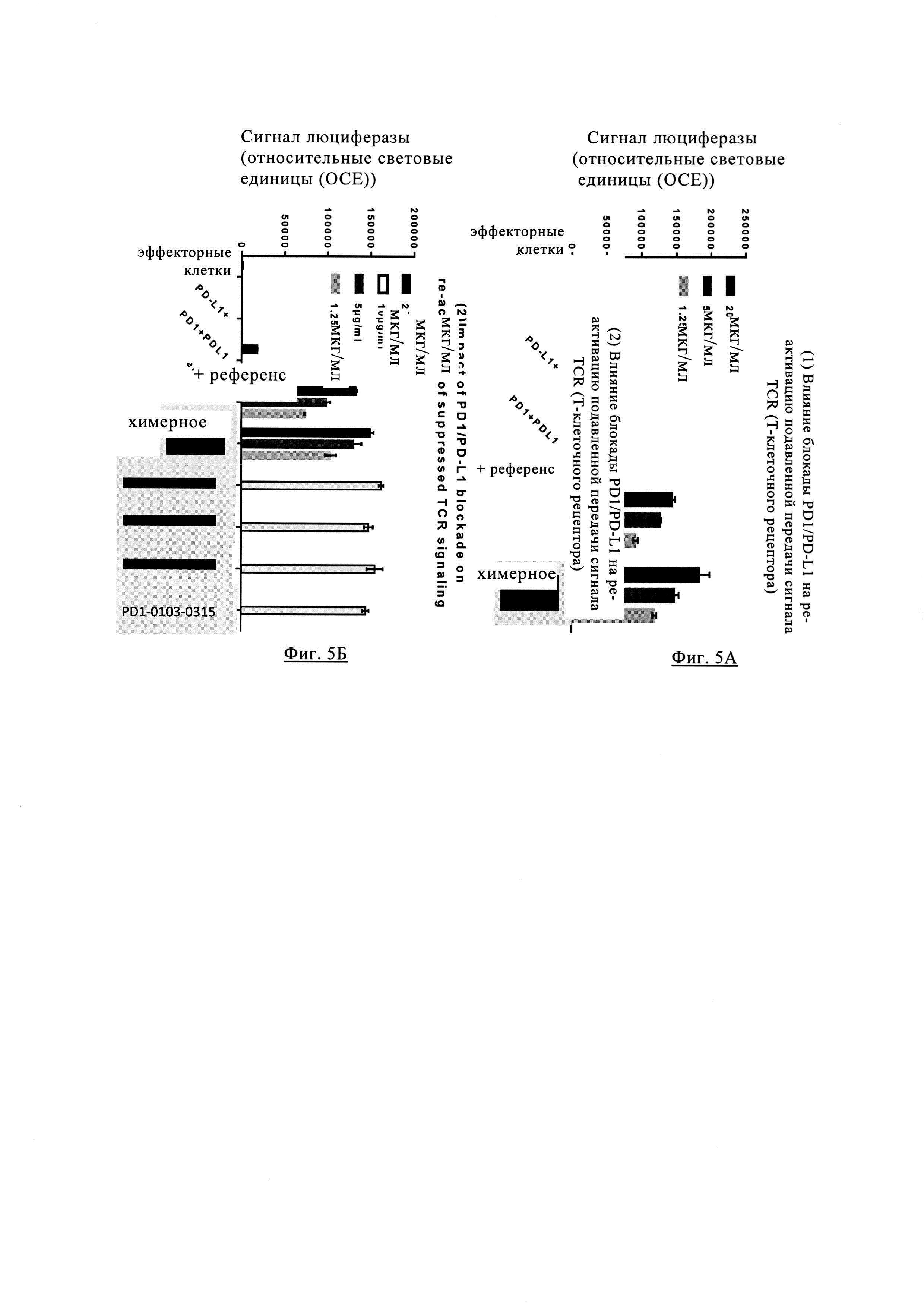
Фиг. 5А. Влияние блокады PD1/PD-L1 на повторную активацию подавленной передачи сигнала рецептора Т клеток в присутствии различных антител анти-PD-1.
Фиг. 5Б. Влияние блокады PD1/PD-L1 на повторную активацию подавленной передачи сигнала рецептора Т клеток в присутствии различных антител анти-PD-1.
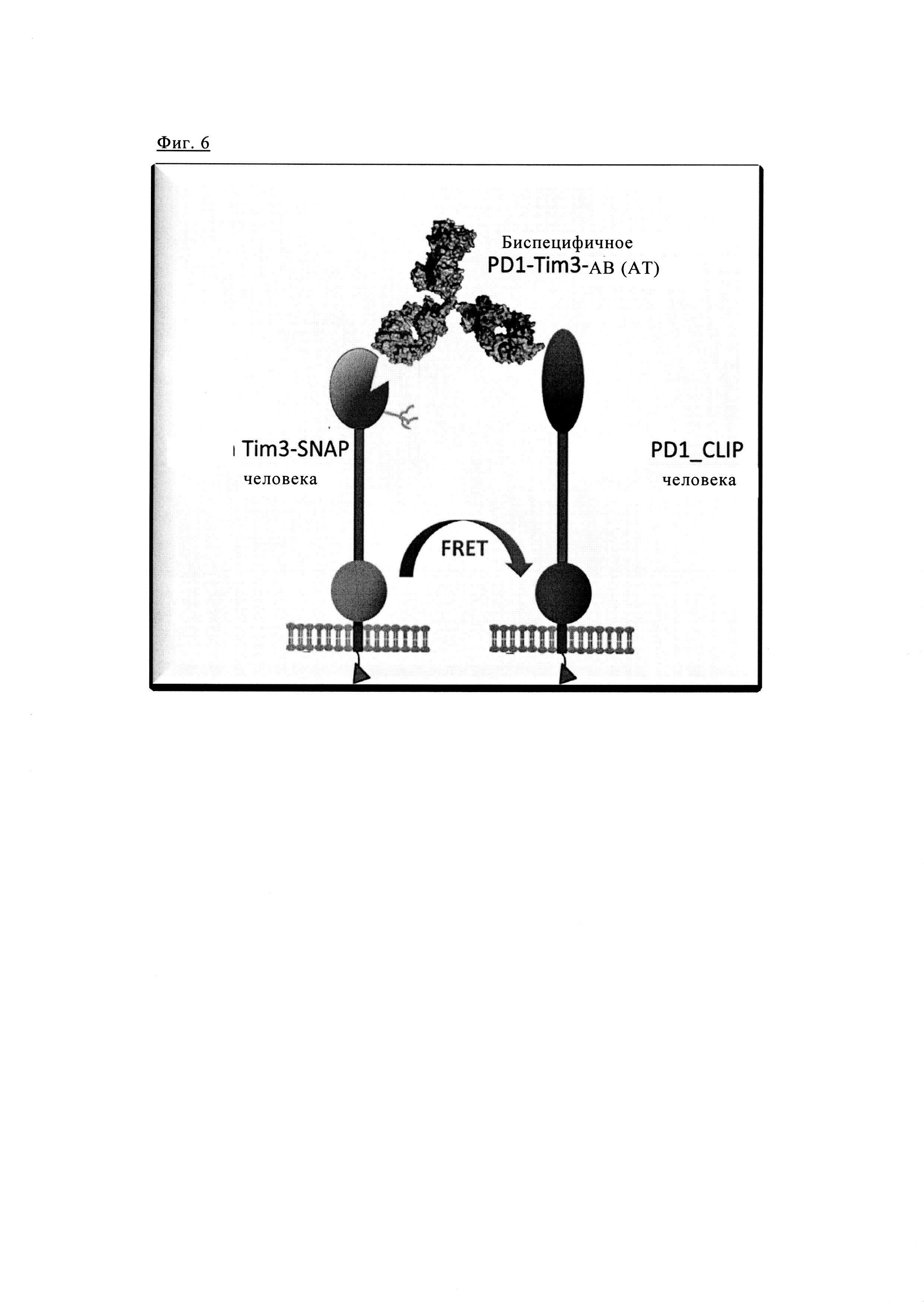
Фиг. 6. Схематическое изображение анализа FRET для одновременного связывания биспецифических антител анти-PD1/TIM3 с рекомбинантными клетками.
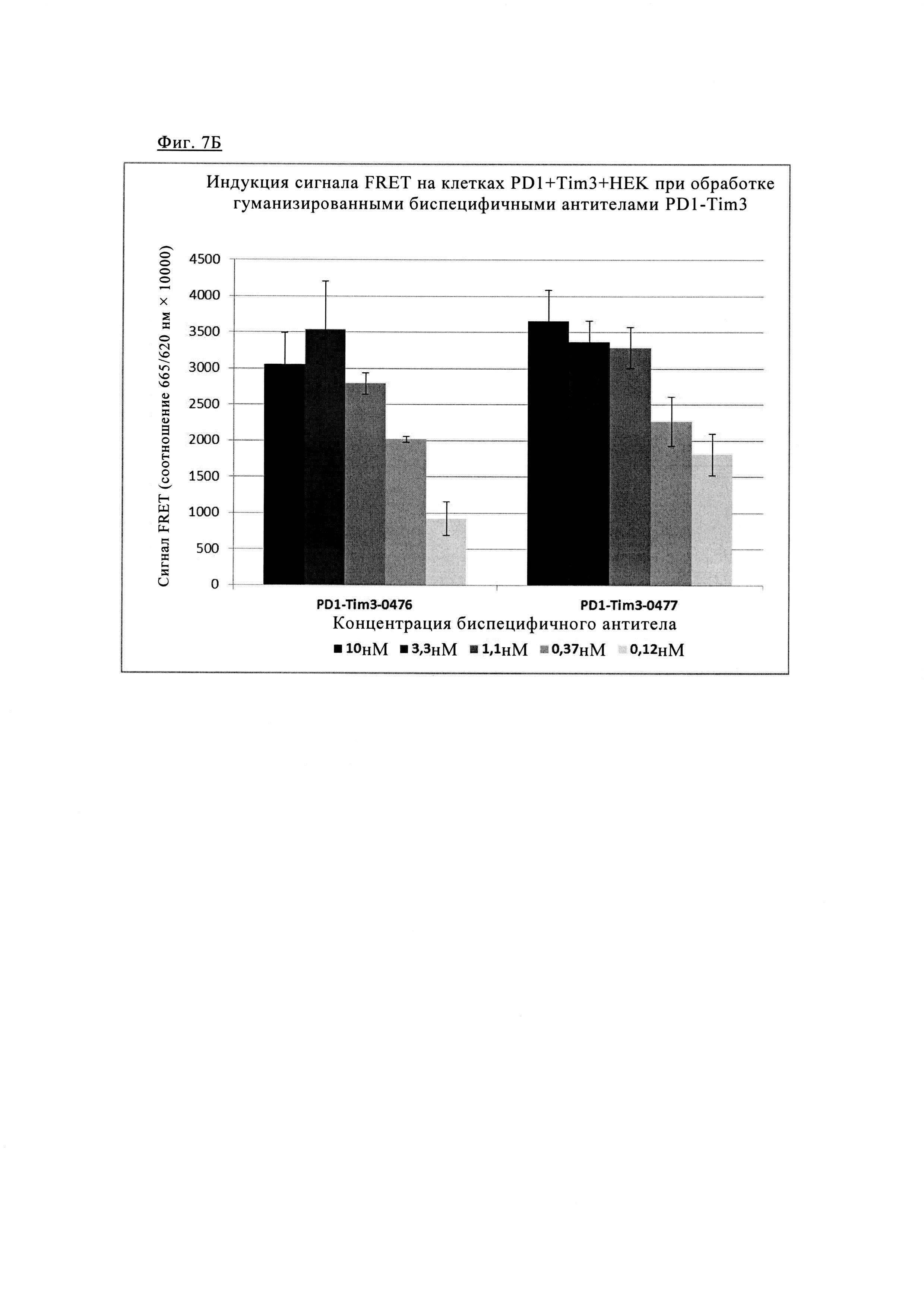
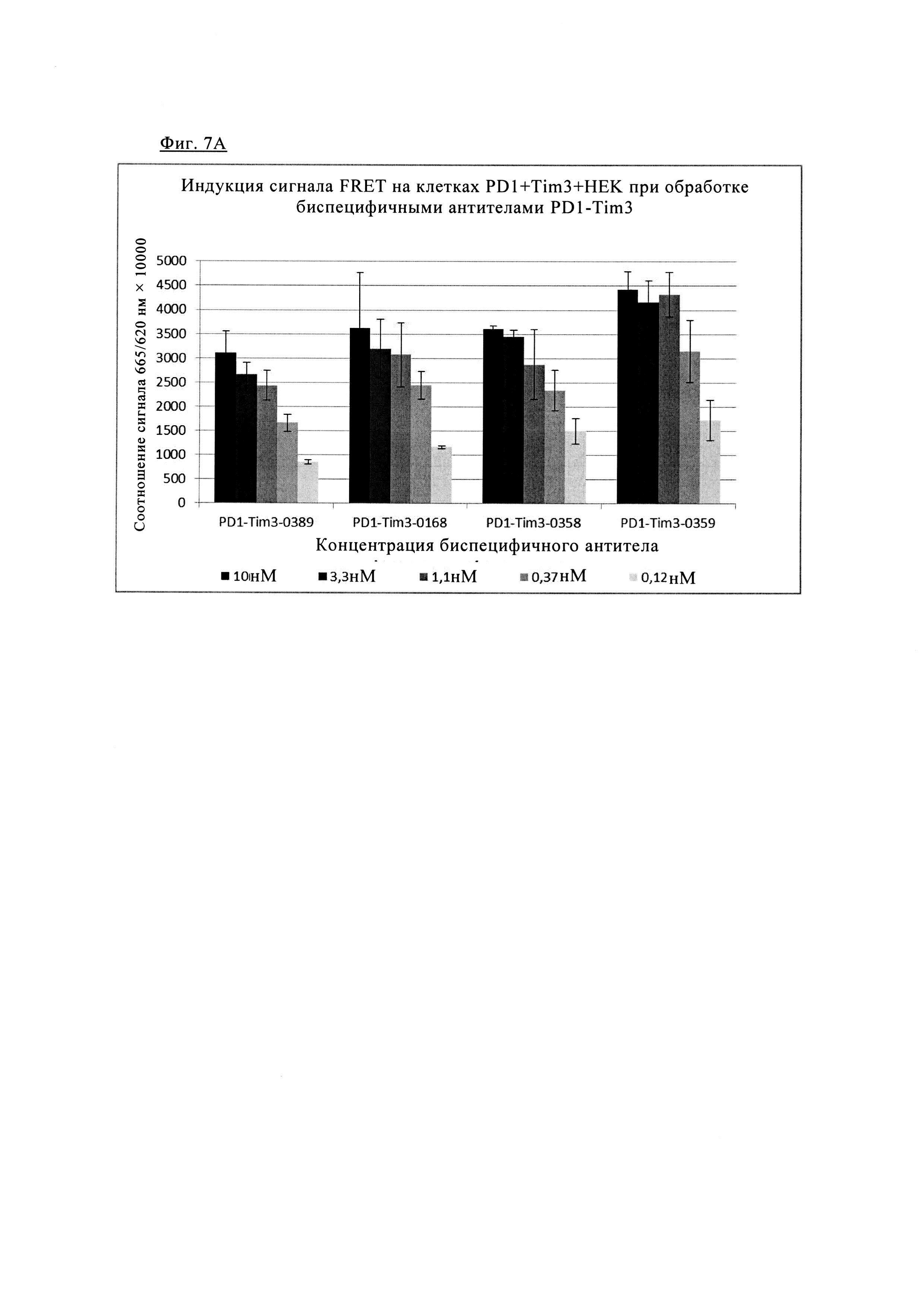
Фиг. 7. Индукция сигнала FRET после обработки/связывания различных биспецифических антител PD1/TIM3 на клетках, экспрессирующих PD1 и TIM3: клетки HEK293, дважды трансфектированные PD1 SNAP TIM3 CLIP, окрашивали 100 нМ раствором SNAP-Lumi4-Tb (Cisbio) и 100 нМ раствором Clip-Red (Cisbio) в течение 1 ч при 37° в буферном растворе Tag-Lite (Cisbio). После промывки меченые клетки инкубировали с указанными биспецифическими антителами анти-PD1/TIM3 (0-10 нМ) (гуманизированные биспецифическое варианты показаны на фиг. 7Б в течение 1 ч при 4°С, измеряли время разрешенную флуоресценцию при 665/620 нм на ридере BMG Pherastar (обозначенную как средняя величина +/- СО сигнала FRET (соотношение 665/620 нм × 10000), n=3). Фиг. 7А. Форматы 1+1 (антитела PD1TIM3_0389 и PD1TIM3_0168) по сравнению с конструктами 2+2 (PD1TIM3_0358 + PD1TIM3_0359). Фиг. 7Б. Гуманизированные биспецифическое варианты (PD1TIM3_0476 и PD1TIM3_477).
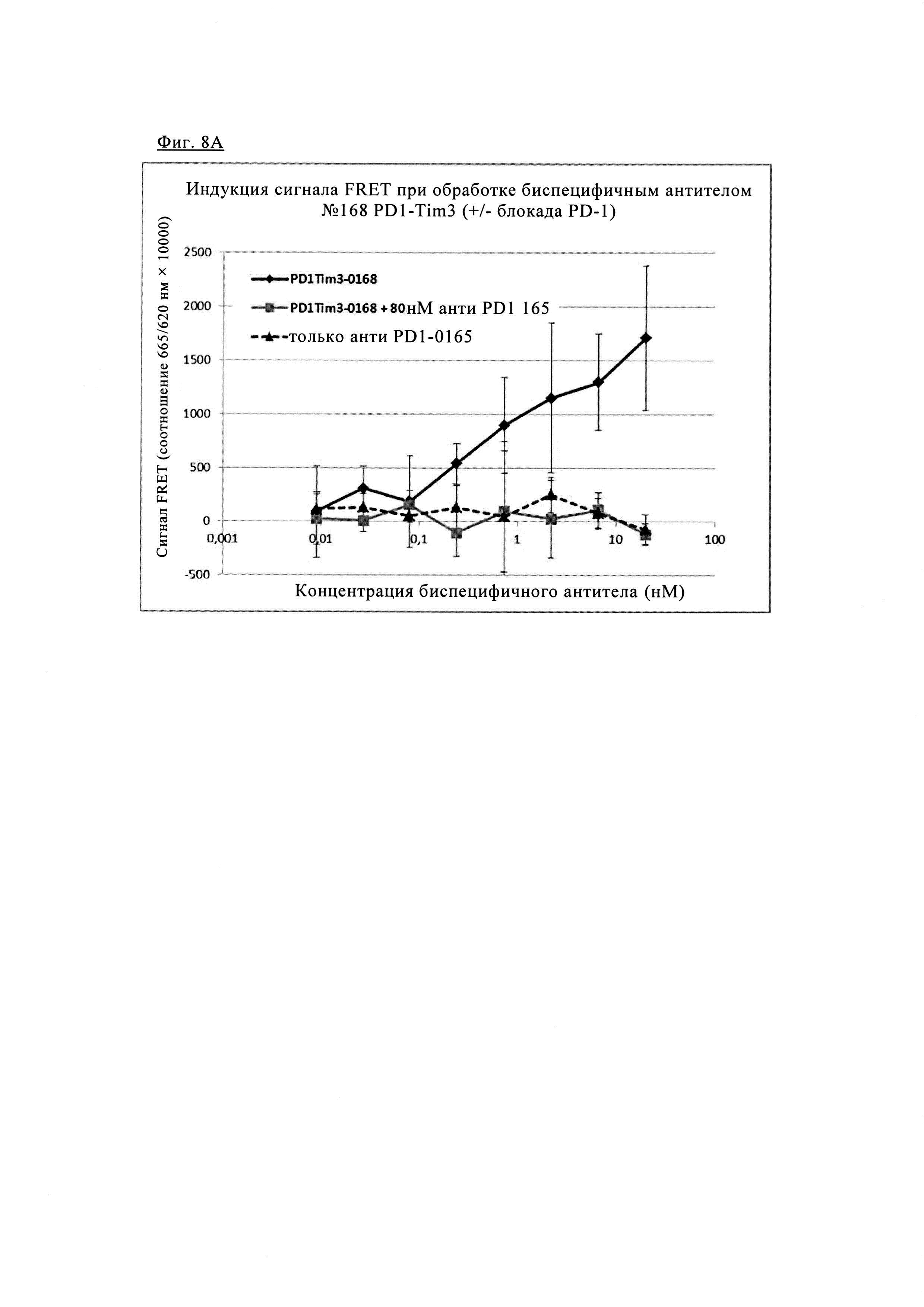
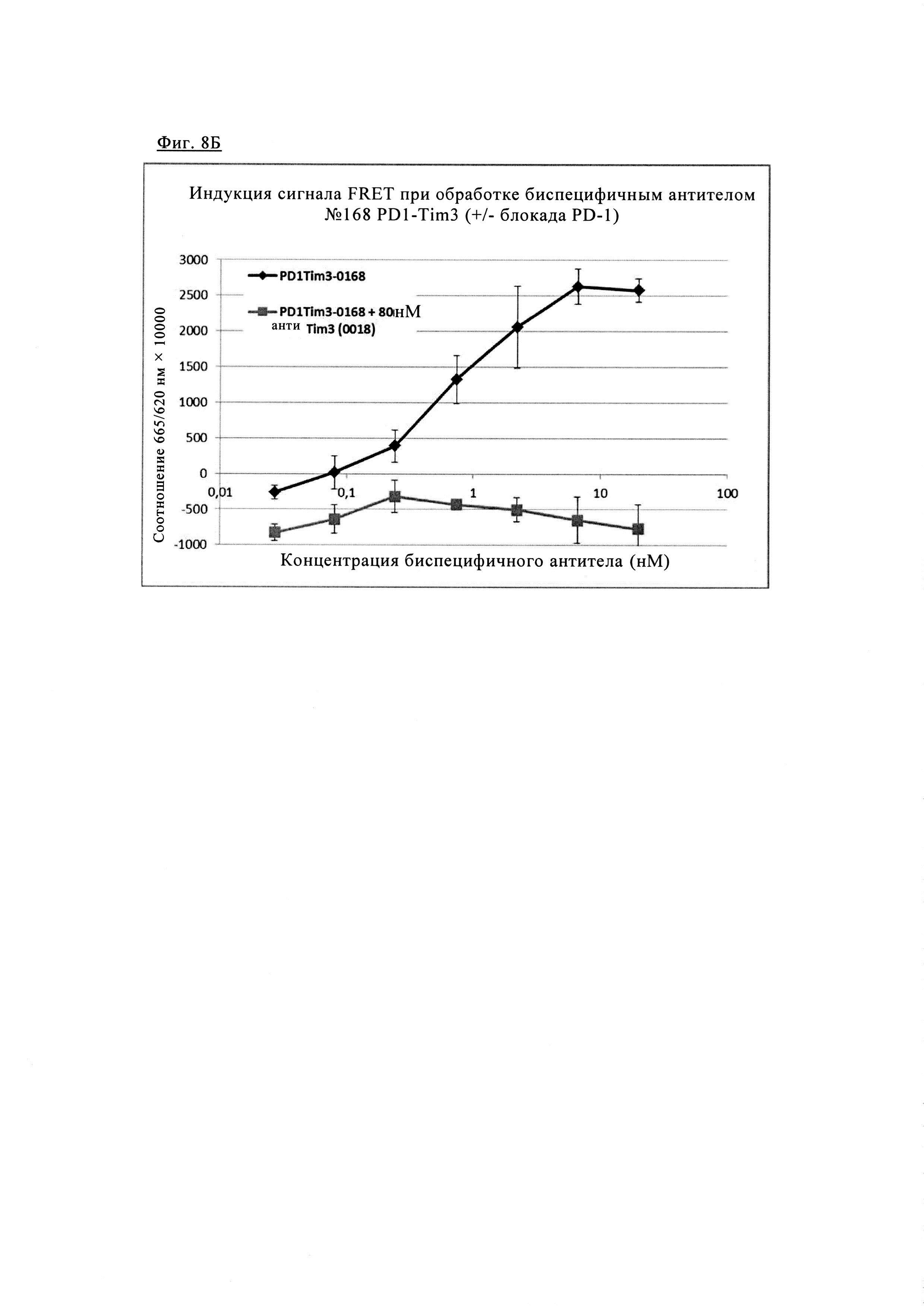
Фиг 8. Анализ FRET для одновременного связывания биспецифических антител анти-PD1/TIM3 1+1 PD1TIM3-0168: PD1, меченные SNAP, и клетки TIM3, меченные CLIP (как описано выше), окрашивали 100 нМ раствором SNAP-Lumi4-Tb и 100 нМ раствором Clip-Red. После промывки меченные клетки инкубировали с биспецифическими антителами анти-PD1/TIM3 #0168 (при указанных концентрациях) в течение 1 ч при 4°С, измеряли время разрешенную флуоресценцию при 665/620 нм на ридере BMG Pherastar (линии черного цвета). Чтобы выделить специфичность сигнала FRET, индуцированного биспецифическими антителами, добавляли либо моноклональные антитела анти-PD1 (#0165, фиг. 8А) либо блокирующие антитела анти-TIM3 (#0018, фиг. 8Б) для конкуренции, приводящей к практически полному исключению сигнала FRET (кривые серого цвета). Обработка антителами анти-PD1 в отдельности не приводила к индукции FRET (пунктирные линии, только на левой диаграмме).
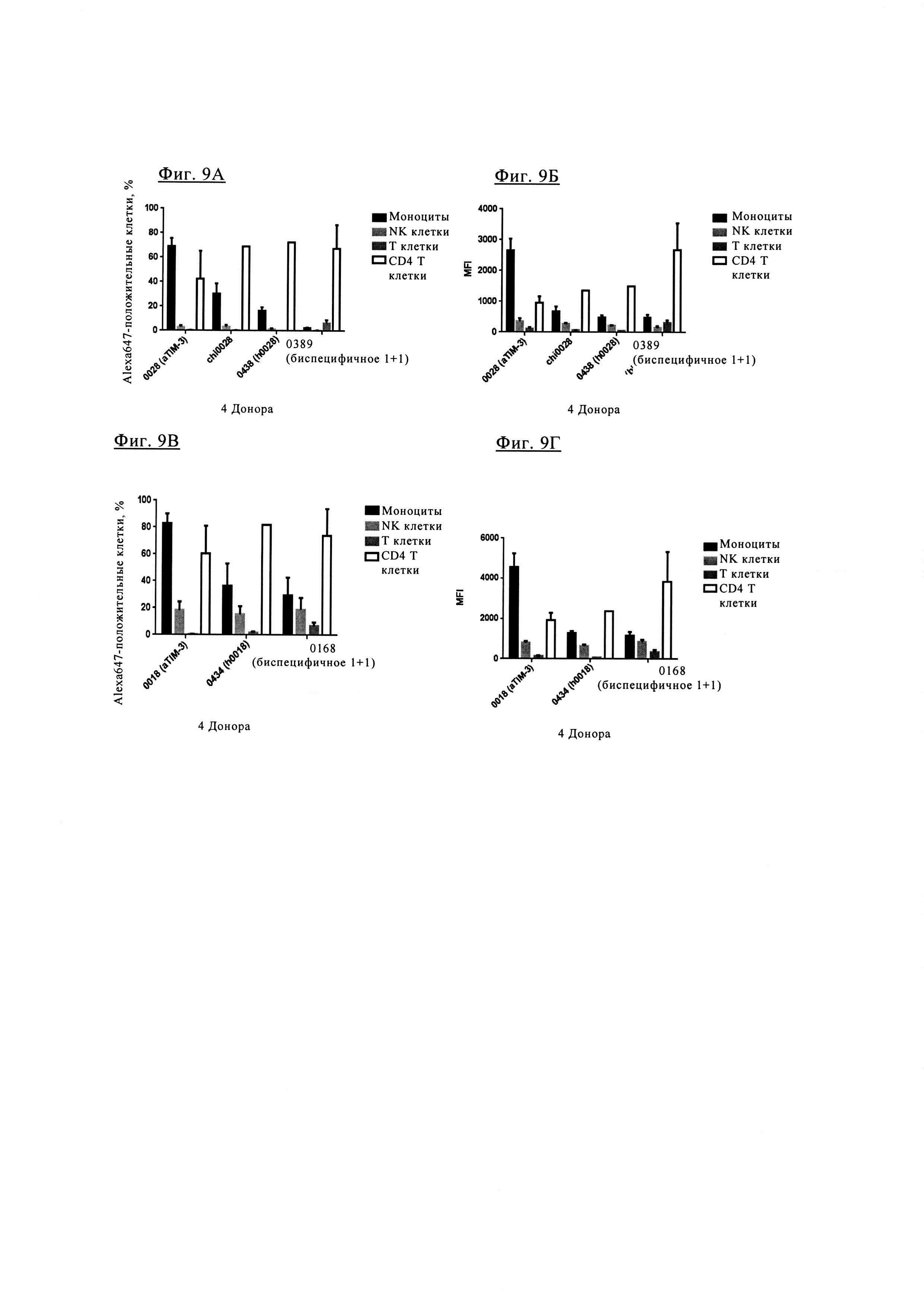
Фиг. 9А. Биспецифическое антитело 1+1 PD1TIM3-0389 характеризуется отношением связывания с положительными Т клетками CD4+ (PD1+, TIM3+), аналогичным отношению химерных антител TIM3_0028 (chi0028) и гуманизированных антител TIM3-0438 (0438), но меньшим связыванием с моноцитами, NK клетками и Т клетками CD3+.
Фиг. 9Б. Биспецифическое антитела 1+1 PD1TIM3-0389 характеризуются значительно большим средним флуоресцентным сигналом (MFI) для связывания с CD4+ положительными Т-клетками (PD1+, TIM3+) по сравнению с химерными антителами TIM3_0028 (chi0028) и гуманизированными антителами TIM3-0438 (0438).
Фиг. 9В. Связывание биспецифических антител 1+1 PD1TIM3-0168 с CD4+ положительными Т клетками (PD1+, TIM3+) не отличается от связывания с химерными антителами TIM3_0018 (TIM3-chi0018) и гуманизированными антителами TIM3-0434 (0434).
Фиг. 9Г. Биспецифическое антитела 1+1 PD1TIM3-0168 характеризуются только незначительным повышением MFI для связывания с CD4+ положительными Т клетками (PD1+, TIM3+).
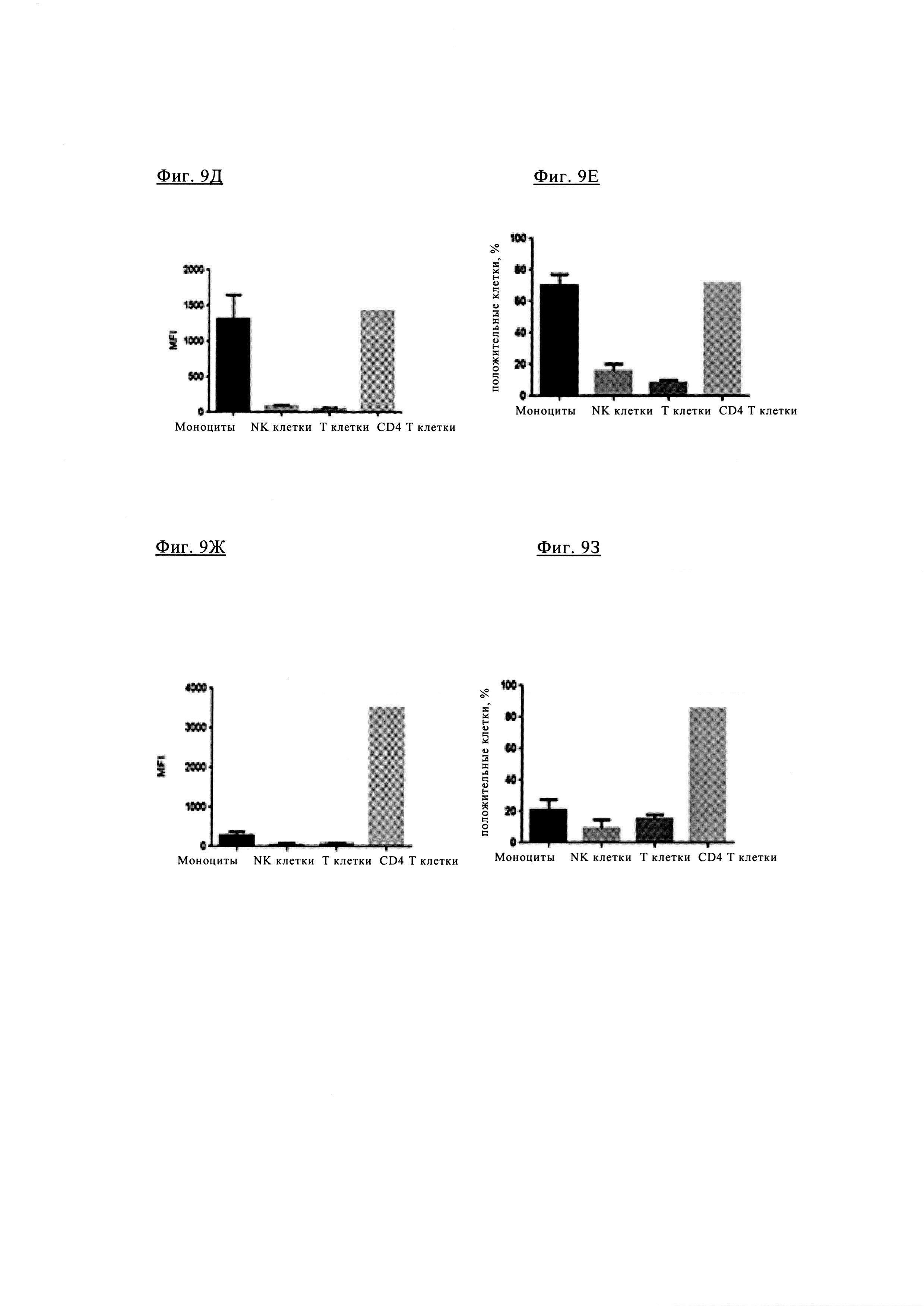
Фиг. 9Д и фиг. 9Е. Антитело анти-TIM3 TIM3-0038 характеризуется связыванием, как с моноцитами, так и с Т клетками CD4+.
Фиг. 9Ж и фиг. 9З. Биспецифическое антитело 1+1 PD1TIM3-0166 (на основе химерных антител PD1-0103//TIM3-0038) характеризуются значительно сниженным связыванием с моноцитами (по сравнению с исходными антителами анти-TIM3 TIM3_0038, см. фиг. 4Д и фиг. 4Е, но сохраняет значительное связывание с Т клетками CD4+.
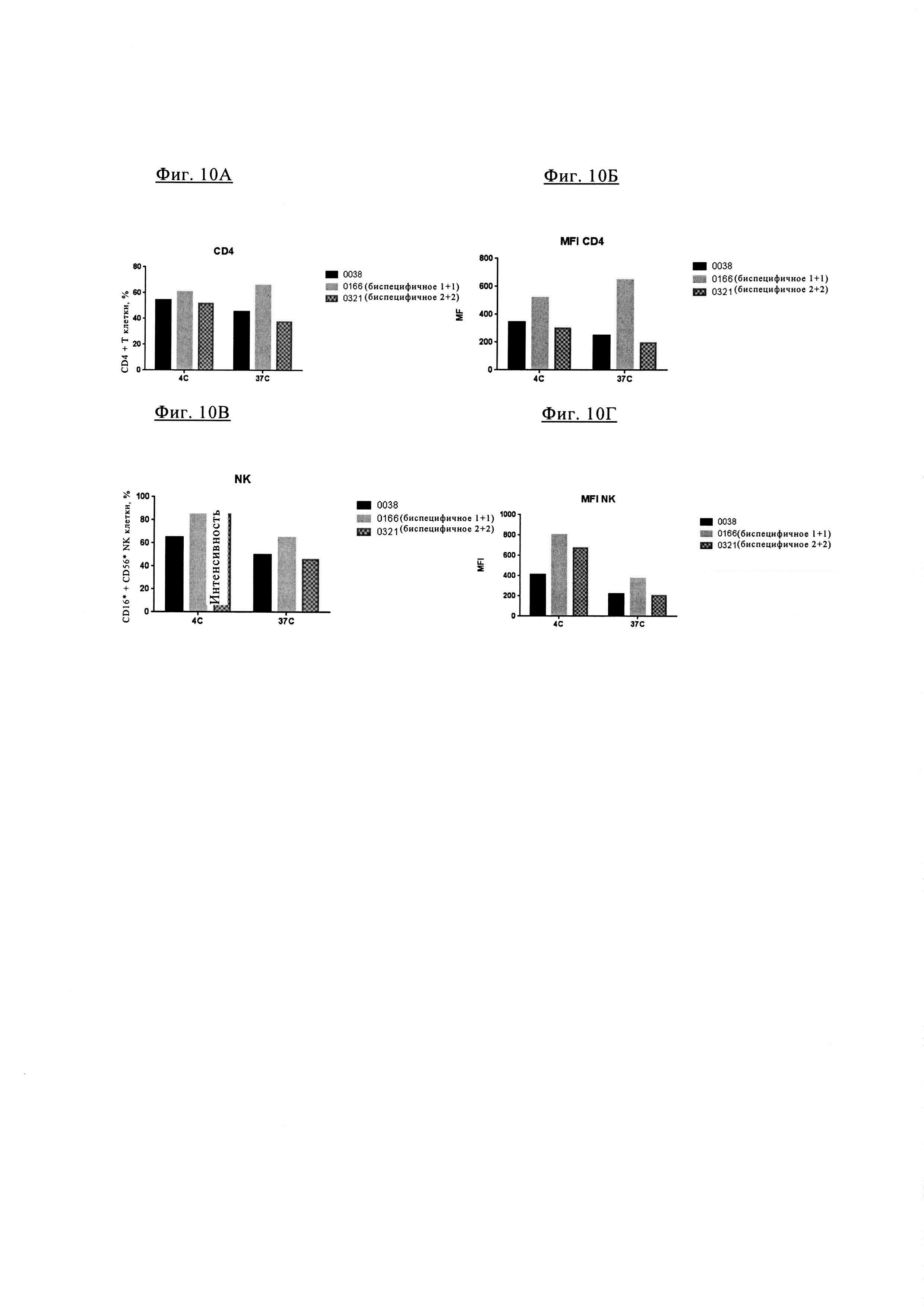
Фиг. 10А-10Г. Биспецифическое антитела 1+1 PD1TIM3-0166 (на основе химерных антител PD1-0103//TIM3-0038) характеризуются сниженной интернализацией по сравнению с биспецифическими антителами 2+2 PD1TIM3-0321 (также на основе химерных антител PD1-0103//TIM3-0038, но содержащих 2 антигенсвязывающих участка для PD и 2 антигенсвязывающих участка для TIM3) и по сравнению с исходными антителами TIM3-0038 на активированных Т клетках CD4+ и на активированных NK клетках.
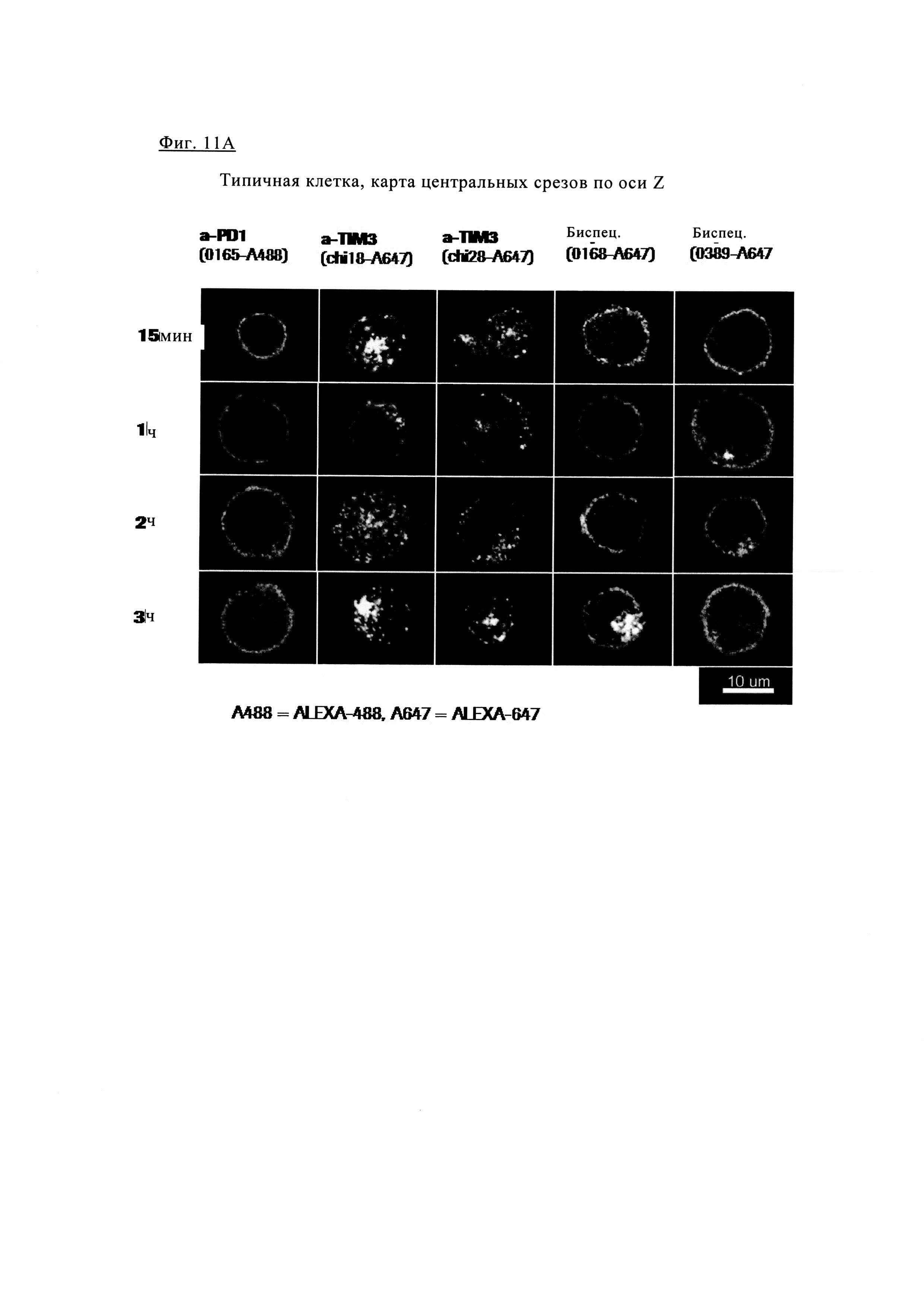
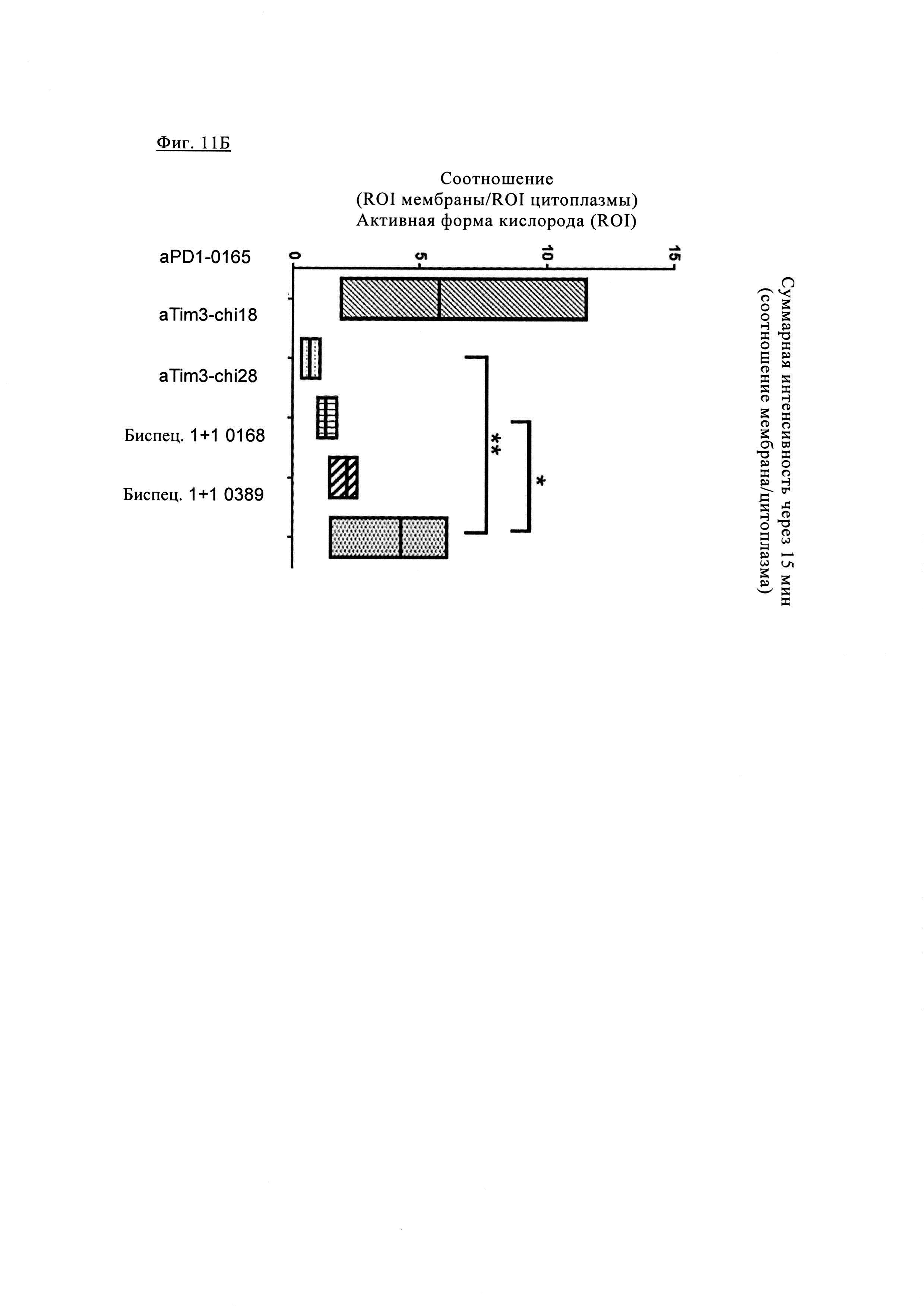
Фиг. 11А. Анализ в течение времени показывает, что содержание биспецифических антител и антител PD1 повышается в мембране по сравнению с внеклеточной кластеризацией антител TIM3.
Обозначения антител на фиг. 11А: TIM3 (chi18-А647 означает химерные антитела TIM3_0018, меченные AlexaA647), a-TIM3 (chi28-А647 означает химерные антитела TIM3_0028, меченные AlexaA647), биспец. (0168-А647 означает антитела 1+1 PD1TIM3_0168 (на основе химерных антител PD1-0103/TIM3-0018) меченных AlexaA647) биспец. (0389-А647 означает антитела 1+1 PD1TIM3_0389 (на основе химерных антител PD1-0103/TIM3-0028) меченных Alexa 647) и a-PD1 (0165-А488 означает химерные антитела PD1-0103, меченные Alexa488).
Антитело анти-PD1 и биспецифическое антитела 1+1 PD1TIM3_0389 (Биспец. 0389) характеризуются очень низкой интернализацией даже через 3 ч, в то время как интернализация других биспецифических антител 1+1 PD1TIM3_0168 (Биспец. 0168) более высокая. Более высокой интернализацией характеризуется антитело aTIM3 Ab 0028, при этом наибольшая интернализация наблюдается для антитела aTIM3-0018.
Фиг. 11Б. Химерное антитело PD1-0103 (aPD1-0165) характеризуется очень низкой интернализацией, в то время как высокоаффинное химерное антитело TIM3_0018 (aTIM3-chi18) характеризуется значительной интернализацией при связывании с TIM3 даже через 15 мин. Интернализация для химерных антител TIM3_0028 (aTIM3-chi28) с низкой аффинностью связывания незначительно снижается. Биспецифическое антитела 1+1 АВ 0168 (состоящие из антител aPD1-0165 с высокоаффинным линкером и высокоаффинного TIM3-0018) характеризуются значительно сниженной интернализацией. Биспецифическое антитела 1+1 АВ 0389 (состоящие из химерных антител PD1-0103 (aPD1-0165) с высокоаффинным линкером и высокоаффинным TIM3_0028 (aTIM3-0028) характеризуются значительно сниженной интернализацией. Это может быть связано с двухвалентным связыванием с PD1 и TIM3, при этом высокая аффинность связывания с PD1 удерживает антитело у поверхности клетки.
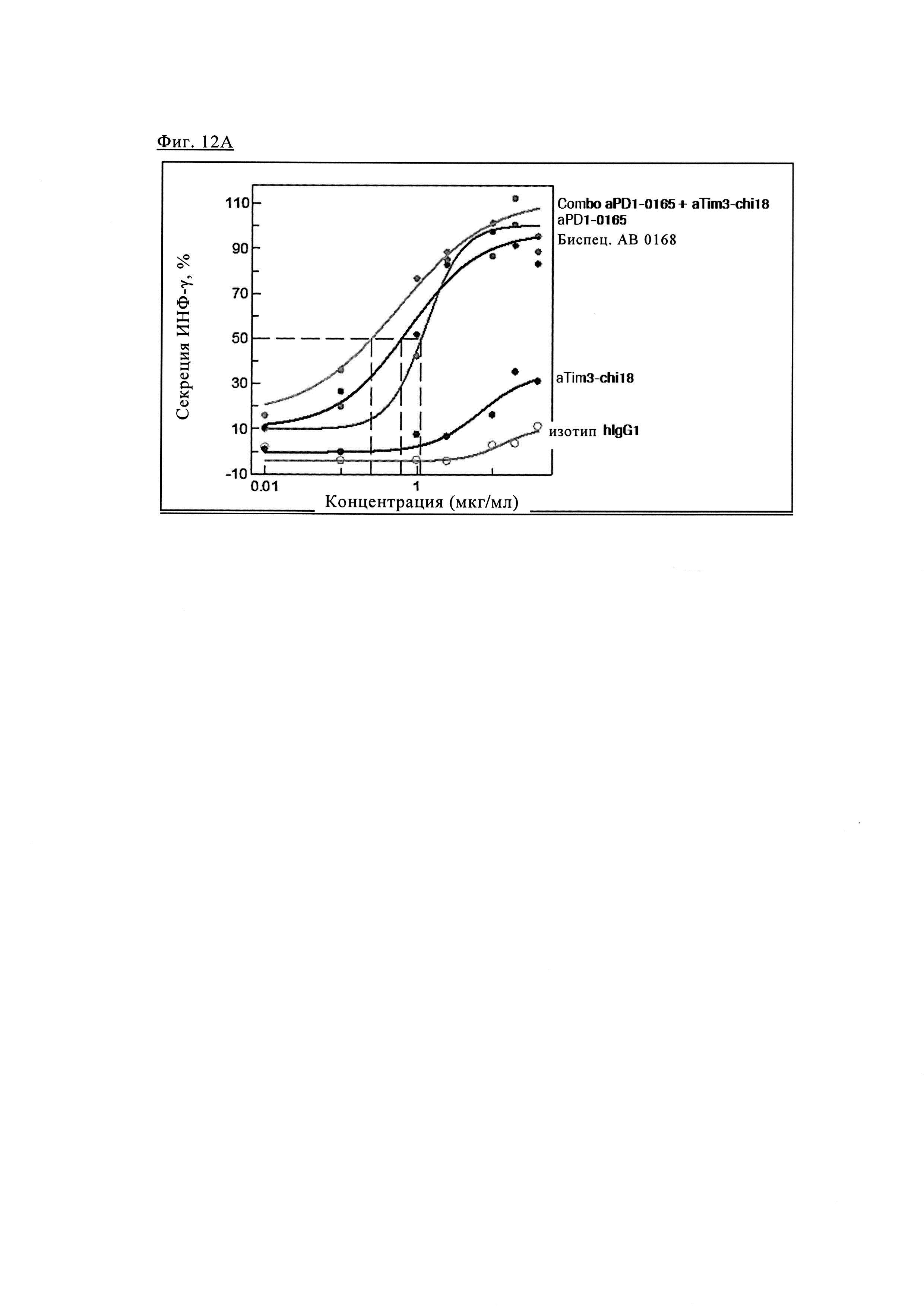
Фиг. 12А. Эффективность биспецифических антител PD1-TIM3 1+1 PD1TIM3_0168 (на основе химерных антител PD1-0103/TIM3-0018 (означает АВ 0168) по сравнению с химерными антителами PD1-0103 (=PD1-0165) и химерными антителами TIM3_0018 (=TIM3-chi18) и их комбинациями.
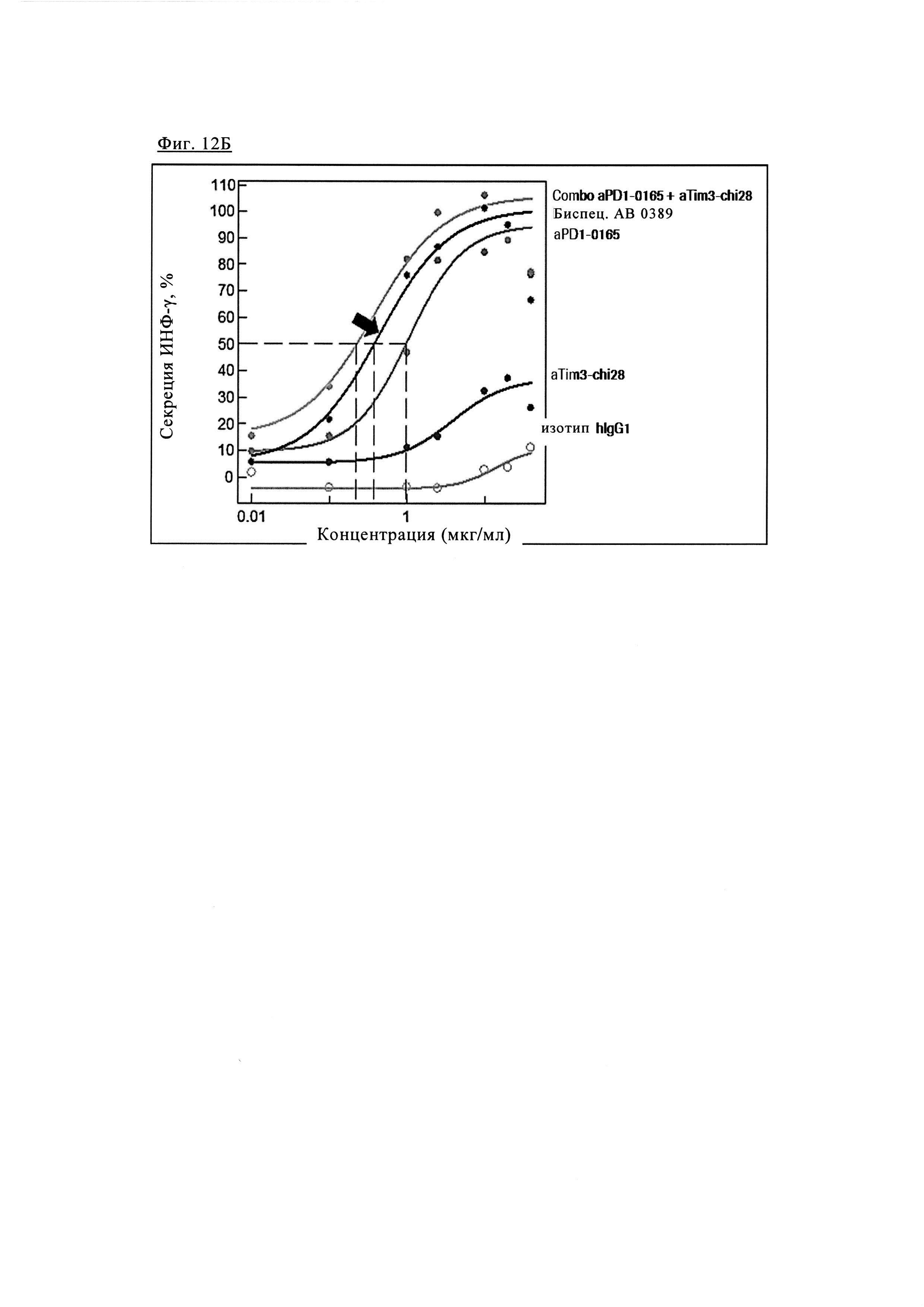
Фиг. 12Б. Эффективность биспецифических антител PD1-TIM3 1+1 PD1TIM3_0389 (на основе химерных антител PD1-0103 / TIM3-0028 (= Bispec АВ 0389) по сравнению с химерными антителами PD1-0103 (=PD1-0165) и химерными антителами TIM3_0028 (=TIM3-chi28) и их комбинациями.
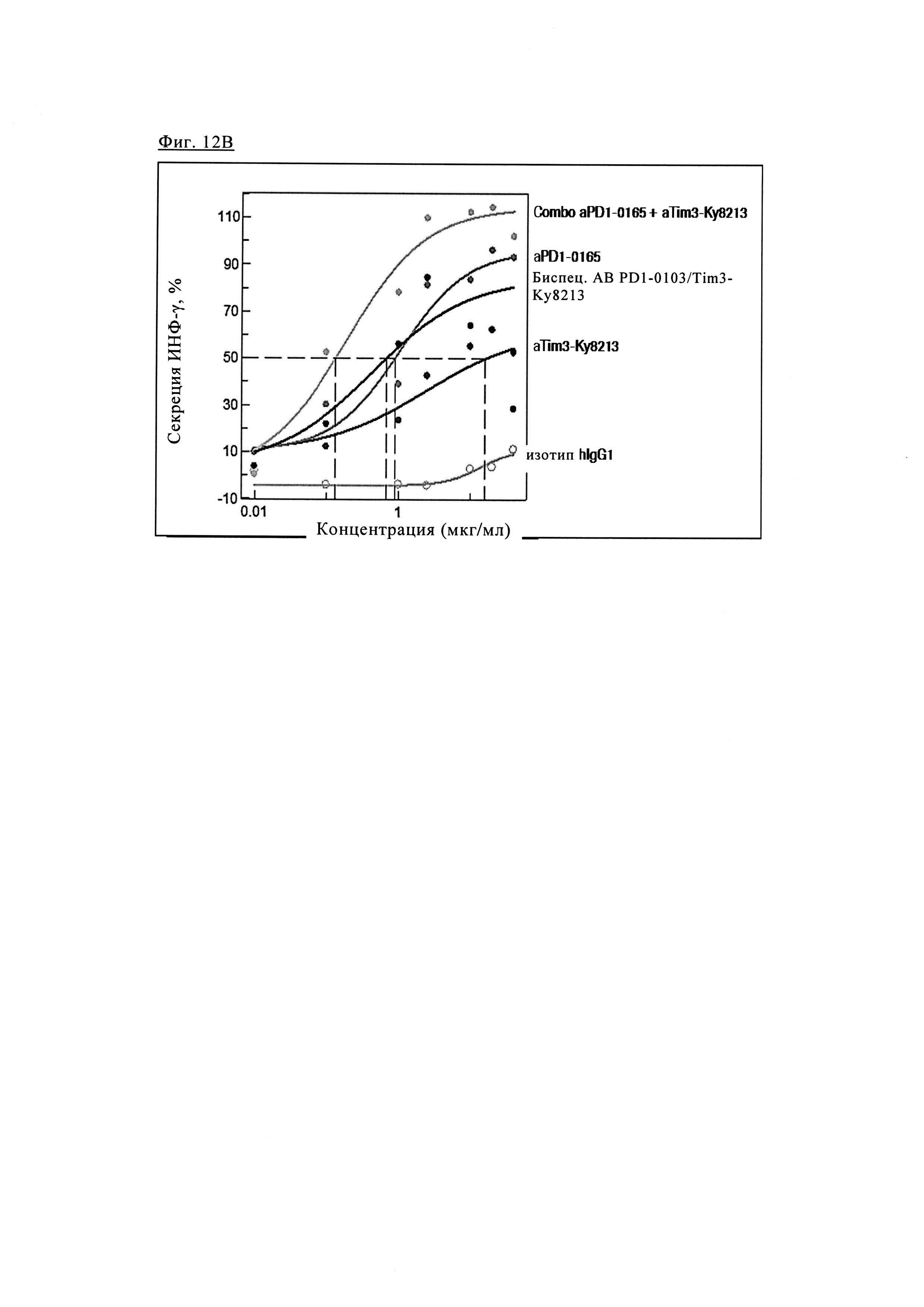
Фиг. 12В. Эффективность биспецифических антител PD1-TIM3 1+1 PD1-0103/Ky8213 (на основе химерных антител PD1-0103 / и антител анти-TIM3 Ky8213, описанных в патенте США 20120189617 (см. антитело 8213, например, пример 33), которые получали аналогично тому, как описано в примере 1, в виде 1+1 CrossMab) по сравнению с химерными антителами PD1-0103 (=PD1-0165) и антителами анти-TIM3-Ky8213 (как описано в патенте США 20120189617 (см. антитело 8213) например, пример 33) и их комбинациями.
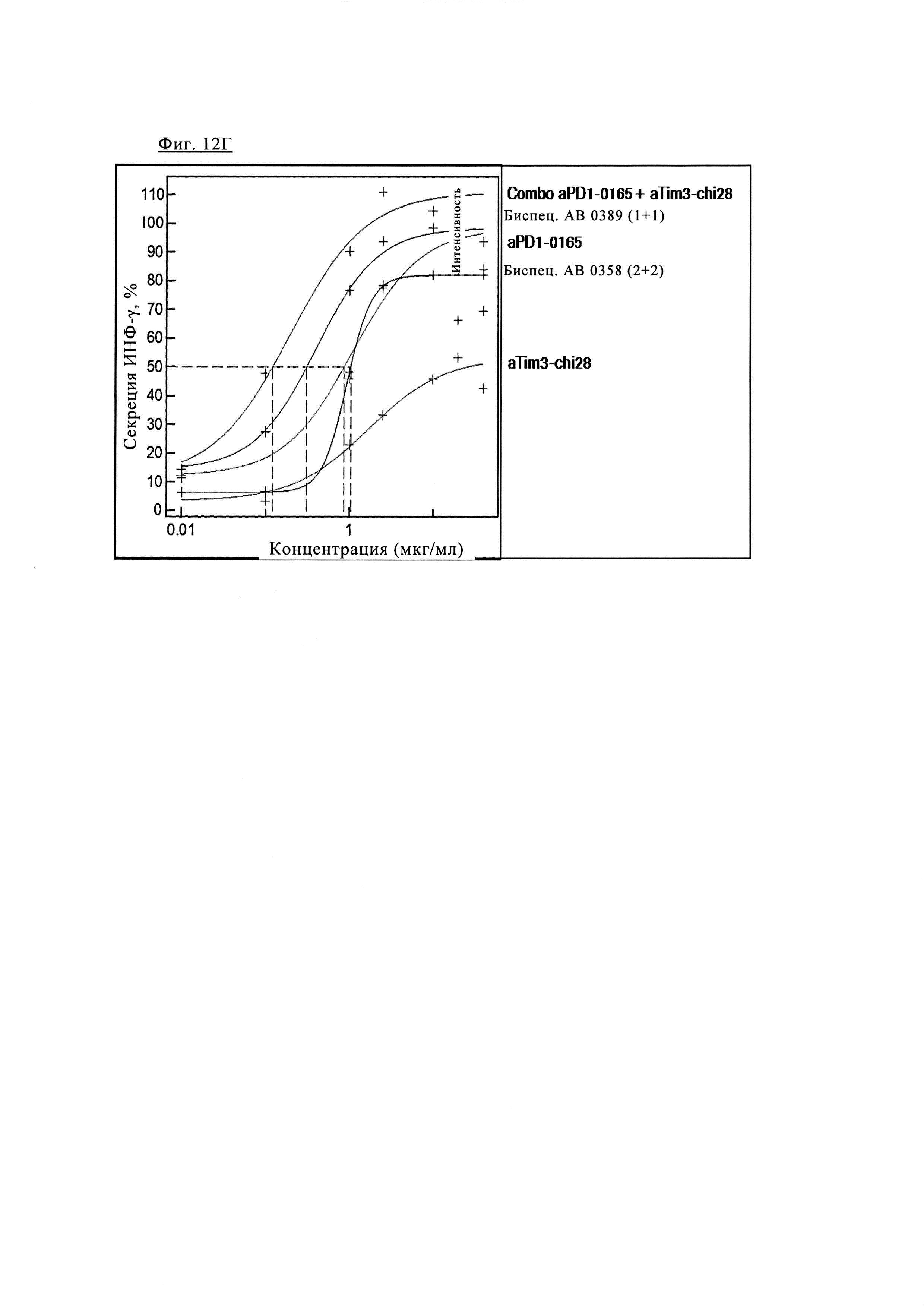
Фиг. 12Г. Эффективность биспецифических антител PD1-TIM3 1+1 PD1TIM3_0389 (на основе химерных антител PD1-0103/TIM3-0028 (=Bispec АВ 0389 (1+1))) по сравнению с биспецифическими антителами PD1-TIM3 2+2 PD1TIM3_0358 на основе химерных антител PD1-0103/TIM3-0028 (=Bispec АВ 0358 (2+2)), а также химерными антителами PD1-0103 (=PD1-0165) и химерными антителами TIM3_0028 (=TIM3-chi28) и их комбинациями.
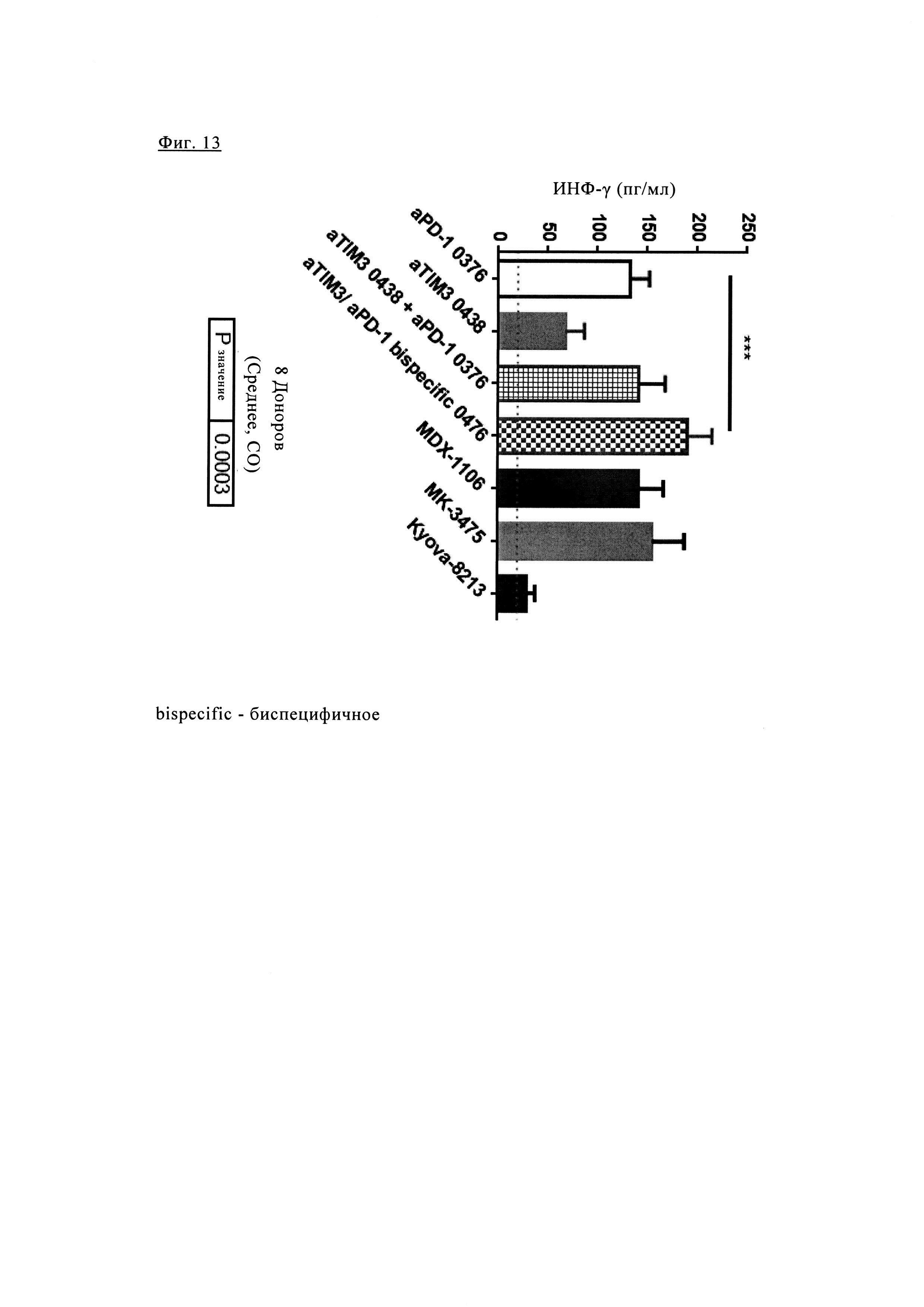
Фиг. 13. Обработка биспецифическими антителами PD1-TIM3 1+1 PD1TIM3_0476 значительно повышает способность Т клеток CD4 высвобождать ИНФ-γ по сравнению с обработкой антителами PD1 или TIM3 в отдельности и даже по сравнению с обработкой исходными антителами PD1_0376 и антителами TIM3_0438. Т клетки CD4 совместно культивировали с линией опухолевых клеток, экспрессирующей MHCII. Биспецифическое антитела PD1-TIM3 1+1 PD1TIM3_0476 исследовали по сравнению с антителами PD1 aPD1_0376, MDX-1106 (ниволумаб) и MK-3475 (пембролизумаб), антителами TIM3 aTIM3_0438 и Kyowa-8213 (как описано в заявке WO 2011/155697) и по сравнению с комбинацией антител анти-PD1 aPD1-0376 и анти-TIM3 aTIM3_0438.
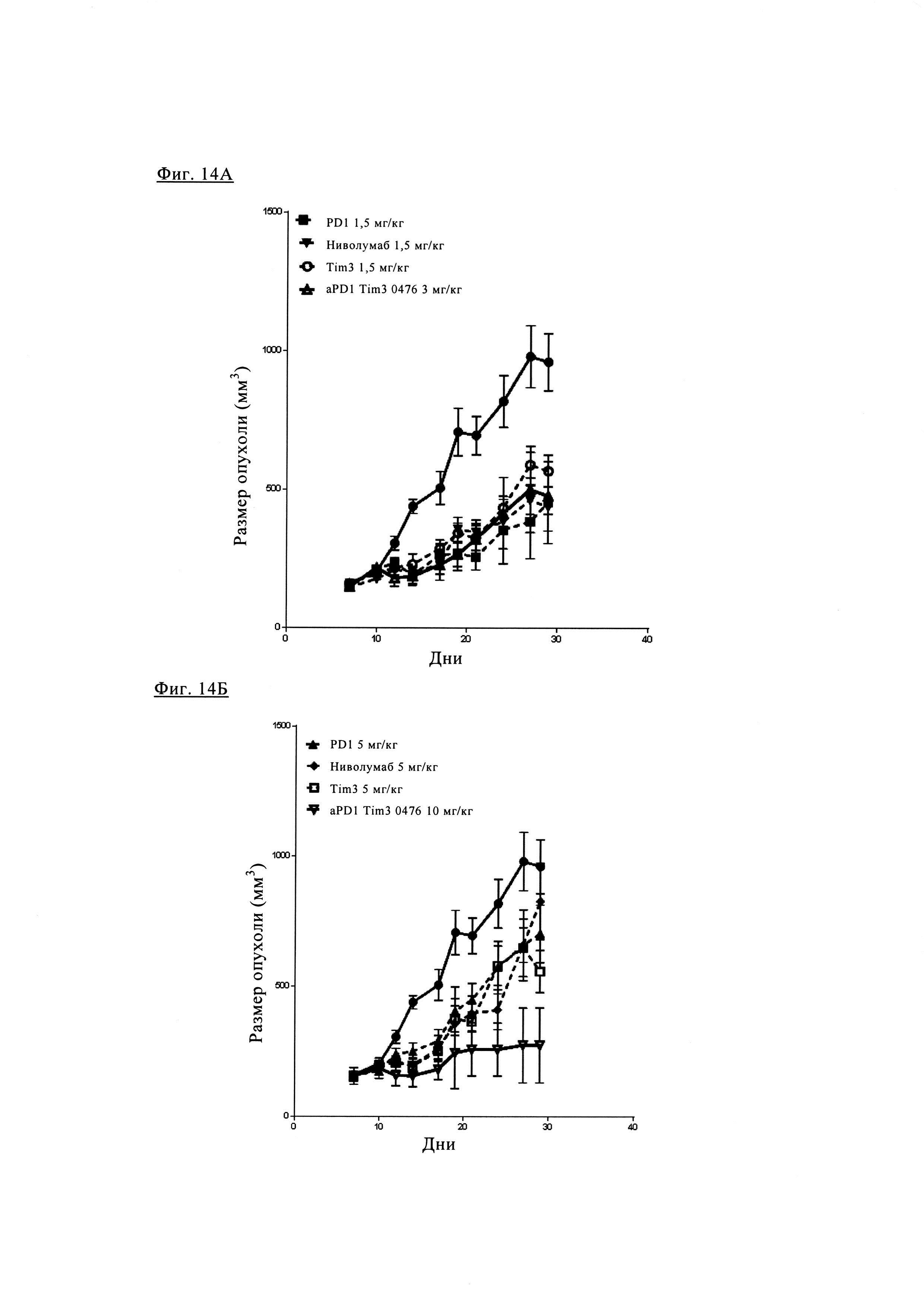
Фиг. 14А и фиг. 14Б. Результаты исследования эффективности биспецифических антител PD1-TIM3 1+1 (0476) по сравнению с антителами PD1 или TIM3 в отдельности с использованием самок мышей с подавленным иммунитетом (NOG), сенсибилизированных клетками MKN45 и снабженных РВМС от здорового донора (человека) показаны на фиг. 14А и фиг. 14Б. Графики представляют собой измерение среднего размера опухоли (в группе лечения) включая стандартную ошибку среднего размера опухоли в течение 30 сут. Кривые, обозначенные закрашенными кружками, соответствуют возрастанию размера опухоли без лечения (носитель). На фиг. 14А показан рост опухоли при лечении меньшей дозой (1,5 мг/кг антител PD1_0376, 1,5 мг/кг ниволумаба, 1,5 мг/кг антител TIM3_0438 или 3 мг/кг биспецифических антител 1+1 PD1TIM3_0476), на фиг. 14Б показан рост опухоли при более высоких дозах (5 мг/кг антител PD1_0376, 5 мг/кг ниволумаба, 5 мг/кг антител TIM3_0438 или 10 мг/кг биспецифических антител 1+1 PD1TIM3_0476).
Подробное описание настоящего изобретения
Определения
Если не указано иное, технические и научные термины, использованные в данном контексте, имеют те же значения, что и обще используемые термины в данной области техники. Данные термины использованы для понимания данного описания и эти термины, использованные в единственном числе, означают также и множественное число, и наоборот.
Термин "антигенсвязывающая молекула", использованный в данном контексте, в самом широком смысле означает молекулу, которая специфично связывается с антигенной детерминантой. Примеры антигенсвязывающих молекул включают антитела, фрагменты антител и связывающиеся с каркасными областями антигена белки.
Термин "антитело", использованный в данном контексте в самом широком смысле, означает различные структуры антител, включая, но, не ограничиваясь только ими, моноклональные антитела, поликлональные антитела, моноспецифические и полиспецифические антитела (например, биспецифическое антитела), а также фрагменты антител при условии, что они проявляют требуемую антигенсвязывающую активность.
Термин "моноклональное антитело", использованный в данном контексте, означает антитело, полученное из популяции в значительной степени гомогенных антител, то есть индивидуальных антител, включающих популяцию, которая является идентичной и/или связывается с аналогичным эпитопом, за исключением возможных вариантов антител, например, содержащих природные мутации или мутации, возникающие в процессе получения моноклональных антител, при этом такие варианты обычно присутствуют в следовых количествах. И наоборот, в отличие от получения поликлональных антител, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое из полученных моноклональных антител направлено против одной детерминанты на антигене.
Термин "моноспецифическое антитело", использованный в данном контексте, означает антитело, содержащее один или более участков связывания с одним и тем же эпитопом одного и того же антигена. Термин "биспецифическое антитело" означает, что антитело способно специфично связываться по крайней мере с двумя различными антигенными детерминантами, например, два участка связывания, каждый из которых образован парой вариабельного домена тяжелой цепи (VH) антитела и вариабельного домена легкой цепи (VL) антитела, связывающимися с различными антигенами или различными эпитопами одного и того же антигена. Такое биспецифическое антитело характеризуется форматом 1+1. Другие форматы биспецифических антител включают форматы 2+1 (включающие 2 участка связывания для первого антигена или эпитопа и один участок связывания для второго антигена или эпитопа) или форматы 2+2 (включающие 2 участка связывания для первого антигена или эпитопа и 2 участка связывания для второго антигена или эпитопа). Обычно биспецифическое антитело включает два участка связывания с антигеном, каждый из которых является специфичным для различных антигенных детерминант.
Термин "валентность", использованный в данном контексте, означает присутствие определенного числа участков связывания в связывающейся с антигеном молекуле. Аналогичным образом, термины "двухвалентный", "четырехвалентный" и "шестивалентный" означают присутствие двух участков связывания, четырех участков связывания и шести участков связывания, соответственно, в составе молекулы, связывающей антиген. Биспецифическое антитела по настоящему изобретению являются по крайней мере "двухвалентными", и могут быть "трехвалентными" или "мультивалентными" (например, "четырехвалентными" или "шестивалентными"). В конкретном объекте настоящего изобретения антитела по настоящему изобретению включают два или более участков связывания и являются биспецифическими. Таким образом, антитела могут быть биспецифическими даже в тех случаях, когда антитело содержит более двух участков связывания (т.е. когда антитело является трехвалентным или мультивалентным). Прежде всего, настоящее изобретение относится к биспецифическими двухвалентным антителам, характеризующимся наличием одного участка связывания для каждого антигена, с которым они специфично связываются.
Термины "полноразмерное антитело", "интактное антитело" и "целое антитело", использованные в настоящем контексте, являются взаимозаменяемыми и означают антитело, структура которого в основном близка к структуре природного антитела. Термин "природные антитела" означает молекулы природного иммуноглобулина" с различной структурой. Например, природные антитела класса IgG представляют собой гетеротетрамерные гликопротеины молекулярной массы приблизительно 150000 Да, состоят из двух легких цепей и двух тяжелых цепей, соединенных дисульфидной связью. От N-концевого фрагмента до С-концевого фрагмента каждая тяжелая цепь содержит вариабельную область (VH), которую также называют вариабельным тяжелым доменом или вариабельным доменом тяжелой цепи, за которым следуют три консервативных домена (CH1, СН2, и СН3), которые также называют консервативными областями тяжелой цепи. Аналогичным образом, от N-концевого фрагмента до С-концевого фрагмента каждая легкая цепь содержит вариабельную область (VL), которую также называют вариабельным легким доменом или вариабельным доменом легкой цепи, за которым следует консервативный домен легкой цепи (CL), который также называют консервативной областью легкой цепи. Тяжелую цепь антитела можно отнести к одному из 5 типов, которыми являются α (IgA), δ (IgD), ε (IgE), γ (IgG) или μ (IgM), некоторые из которых можно далее подразделить на подтипы, например, γ1 (IgG1), γ2 (IgG2), γ3 (IgG3), γ4 (IgG4), α1 (IgA1) и α2 (IgA2). Легкую цепь антитела можно отнести к одному из двух типов, которые называются каппа (κ) и лямбда (λ), на основании аминокислотной последовательности их консервативного домена.
Термин "фрагмент антитела" означает молекулу, отличную от интактного антитела, которая содержит часть интактного антитела, которая связывается с интактным антителом. Примеры фрагментов антител включают, но, не ограничиваясь только ими, Fv, Fab, Fab', Fab'-SH, F(ab')2, диатела, триатела, тетратела, кросс-Fab фрагменты, линейные антитела, молекулы одноцепочечных антител (например, scFv), мультиспецифические антитела, образованные из фрагментов антител и однодоменных антител. Обзор определенных фрагментов антител представлен в работе Hudson и др., Nat. Med., 9, сс. 129-134 (2003). Обзор scFv фрагментов представлен в работе, например,  , The Pharmacology of Monoclonal Antibodies, т. 113, Rosenburg and Moore (ред.), Springer-Verlag, Нью-Йорк, сс. 269-315 (1994), в заявке WO 93/16185 и в патентах США №№5571894 и 5587458. Описание Fab и F(ab')2 фрагментов, содержащих остатки эпитопа, связывающегося с рецептором реутилизации и характеризующихся повышенным периодом полураспада in vivo, приведено в патенте США №5869046. Диатела представляют собой фрагменты антител с двумя антигенсвязывающими участками, которые могут быть двухвалентными или биспецифическими, см. например, ЕР 404097, WO 1993/01161, статьи Hudson и др., Nat. Med., 9, сс. 129-134 (2003) и Hollinger и др., Proc. Natl. Acad. Sci. USA, 90, сс. 6444-6448 (1993). Триатела и тетратела описаны также в работе Hudson и др., Nat. Med., 9, сс. 129-134 (2003). Однодоменные антитела представляют собой фрагменты антител, содержащие весь или часть вариабельного домена тяжелой цепи или весь или часть вариабельного домена легкой цепи антитела. В некоторых вариантах осуществления настоящего антитела однодоменным антителом является однодоменное антитело человека (Domantis, Inc., Waltham, MA, см., например, патент США 6248516 В1). Кроме того, фрагменты антител включают одноцепочечные полипептиды со свойствами VH домена, а именно способные ассоциировать вместе с VL доменом, или со свойствами VL домена, а именно, способные ассоциировать вместе с VH доменом и связываться с участком связывания функционального антигена, обеспечивая таким образом антигенсвязывающее свойство полноразмерных антител. Фрагменты антител можно получать по различным методикам, включая, но, не ограничиваясь только ими, протеолитическое расщепление интактных антител и продуцирование рекомбинантными клетками хозяина (например, Е.coli или фаг), как описано в данном контексте.
, The Pharmacology of Monoclonal Antibodies, т. 113, Rosenburg and Moore (ред.), Springer-Verlag, Нью-Йорк, сс. 269-315 (1994), в заявке WO 93/16185 и в патентах США №№5571894 и 5587458. Описание Fab и F(ab')2 фрагментов, содержащих остатки эпитопа, связывающегося с рецептором реутилизации и характеризующихся повышенным периодом полураспада in vivo, приведено в патенте США №5869046. Диатела представляют собой фрагменты антител с двумя антигенсвязывающими участками, которые могут быть двухвалентными или биспецифическими, см. например, ЕР 404097, WO 1993/01161, статьи Hudson и др., Nat. Med., 9, сс. 129-134 (2003) и Hollinger и др., Proc. Natl. Acad. Sci. USA, 90, сс. 6444-6448 (1993). Триатела и тетратела описаны также в работе Hudson и др., Nat. Med., 9, сс. 129-134 (2003). Однодоменные антитела представляют собой фрагменты антител, содержащие весь или часть вариабельного домена тяжелой цепи или весь или часть вариабельного домена легкой цепи антитела. В некоторых вариантах осуществления настоящего антитела однодоменным антителом является однодоменное антитело человека (Domantis, Inc., Waltham, MA, см., например, патент США 6248516 В1). Кроме того, фрагменты антител включают одноцепочечные полипептиды со свойствами VH домена, а именно способные ассоциировать вместе с VL доменом, или со свойствами VL домена, а именно, способные ассоциировать вместе с VH доменом и связываться с участком связывания функционального антигена, обеспечивая таким образом антигенсвязывающее свойство полноразмерных антител. Фрагменты антител можно получать по различным методикам, включая, но, не ограничиваясь только ими, протеолитическое расщепление интактных антител и продуцирование рекомбинантными клетками хозяина (например, Е.coli или фаг), как описано в данном контексте.
При расщеплении интактных антител папаином образуются два идентичных антигенсвязывающих фрагмента, которые называют "Fab фрагментами", каждый из которых содержит вариабельные домены легкой и тяжелой цепей, а также консервативный домен легкой цепи и первый консервативный домен тяжелой цепи (СН1). Таким образом, термин "Fab фрагмент", использованный в данном контексте, означает фрагмент антитела, содержащий фрагмент легкой цепи, включающий VL домен и консервативный домен легкой цепи (CL), и VH домен и первый консервативный домен (СН1) тяжелой цепи. Fab' фрагменты отличаются от Fab фрагментов добавлением нескольких остатков в С-концевом фрагменте СН1 домена тяжелой цепи, включая один или более цистеинов из шарнирной области антитела. Fab'-SH фрагменты представляют собой Fab' фрагменты, в которых остаток(ки) цистеина консервативных доменов содержит свободную тиольную группу. При обработке пепсином образуется F(ab')2 фрагмент, содержащий 2 антигенсвязывающих участка (2 Fab фрагмента) и часть Fc области.
Термин "кросс-Fab фрагмент" или "xFab фрагмент" или "кроссоверный Fab фрагмент" означает Fab фрагмент, в котором либо вариабельные области, либо консервативные области тяжелой и легкой цепи заменены друг на друга. В биспецифических антителах по настоящему изобретению возможно и включено использование композиций двух различных цепей кроссоверного Fab фрагмента. С одной стороны, вариабельные области тяжелой и легкой цепей Fab заменены, то есть кроссоверный Fab фрагмент включает пептидную цепь, состоящую из вариабельной области легкой цепи (VL) и консервативной области тяжелой цепи (СН1), и пептидную цепь, состоящую из вариабельной области тяжелой цепи (VH) и консервативной области легкой цепи (CL). Такие кроссоверные Fab фрагменты обозначают также CrossFab (VLVH). С другой стороны, когда консервативные области тяжелой и легкой цепей Fab заменены друг на друга, то кроссоверный Fab фрагмент включает пептидную цепь, состоящую из вариабельной области тяжелой цепи (VH) и консервативной области легкой цепи (CL), и пептидную цепь, состоящую из вариабельной области легкой цепи (VL) и консервативной области тяжелой цепи (СН1). Такой кроссоверный Fab фрагмент обозначают также CrossFab (CLCH1).
"Одноцепочечный Fab фрагмент" или "scFab" представляет собой полипептид, состоящий из вариабельного домена тяжелой цепи антитела (VH), консервативного домена 1 антитела (СН1), вариабельного домена легкой цепи антитела (VL), консервативного домена легкой цепи антитела (CL) и линкера, где указанные домены антитела и указанный линкер располагаются в следующем порядке при направлении от N-концевого фрагмента к С-концевому фрагменту: a) VH-CH1-линкер-VL-CL, б) VL-CL-линкер-VH-СН1, в) VH-CL-линкер-VL-CH1 или г) VL-CH1-линкер-VH-CL, и где указанный линкер представляет собой полипептид, включающий по крайней мере 30 аминокислот, предпочтительно от 32 до 50 аминокислот. Указанные одноцепочечные Fab фрагменты стабилизированы за счет природной дисульфидной связи между CL доменом и СН1 доменом. Кроме того такие одноцепочечные молекулы Fab могут быть дополнительно стабилизированы за счет образования межцепных дисульфидных связей при введении остатков цистеина (например, в положение 44 в вариабельной тяжелой цепи и в положение 100 в вариабельной легкой цепи по нумерации Кабата).
Термин "одноцепочечный кроссоверный Fab фрагмент" или "x-scFab" означает полипептид, состоящий из вариабельного домена тяжелой цепи антитела (VH), консервативного домена 1 антитела (СН1), вариабельного домена легкой цепи антитела (VL), консервативного домена легкой цепи антитела (CL) и линкера, где указанные домены антитела и указанный линкер располагаются в следующем порядке при направлении от N-концевого фрагмента к С-концевому фрагменту: а) VH-CL-линкер-VL-СН1 и б) VL-CH1-линкер-VH-CL, где VH и VL вместе образуют антигенсвязывающий участок, который специфично связывается с антигеном, и где указанный линкер представляет собой полипептид, состоящий по крайней мере из 30 аминокислот. Кроме того такие молекулы x-scFab могут быть дополнительно стабилизированы за счет образования межцепных дисульфидных связей при введении остатков цистеина (например, в положение 44 в вариабельной тяжелой цепи и в положение 100 в вариабельной легкой цепи по нумерации Кабата).
Термин "одноцепочечный вариабельный (scFv) фрагмент" означает гибридный белок вариабельных областей тяжелой (VH) и легкой цепей (VL) антитела, связанных через короткий пептидный линкер, содержащий от 10 до приблизительно 25 аминокислот. Линкер обычно обогащен глицином для придания ему гибкости, а также серином или треонином для придания растворимости и может либо соединять N-концевой фрагмент VH с С-концевым фрагментом VL, либо наоборот. Этот белок сохраняет специфичность исходного антитела, несмотря на удаление консервативных областей и введение линкера. Антитела scFv описаны, например, в работе Houston J.S., Methods in Enzymol., 203, сс. 46-96 (1991)). Кроме того, фрагменты антител включают одноцепочечные полипептиды со свойствами VH домена, а именно способные ассоциироваться вместе с VL доменом, или со свойствами VL домена, а именно способные ассоциироваться вместе с VH доменом и связываться с участком связывания функционального антигена и, таким образом, обеспечивая антигенсвязывающее свойство полноразмерных антител.
"Белки, связывающиеся с каркасными областями антигена" известны в данной области техники, например, фибронектин и сконструированные белки с анкириновым повтором (DARPin), которые используют в качестве альтернативных каркасных областей для антигенсвязывающих доменов, см., например, Gebauer и Skerra, Engineered protein scaffolds as next-generation antibody therapeutics, Curr. Opin. Chem. Biol., 13, cc. 245-255 (2009) и Stumpp и др., Darpins: A new generation of protein therapeutics, Drug Discovery Today, 13, cc. 695-701 (2008). В одном объекте настоящего изобретения белок, связывающийся с каркасной областью антигена, выбирают из группы, включающей CTLA-4 (эвитело), липокалины (Anticalin), молекулу - производное А белка, такую как Z домен А белка (аффитело), А домен (Avimer/Maxibody), сывороточный трансферрин (транс-тело), сконструированный белок с анкириновым повтором (DARPin), вариабельный домен легкой или тяжелой цепи антитела (однодоменное антитело, sdAb), вариабельный домен тяжелой цепи антитела (нанотело, aVH), фрагменты VNAR, фибронектин (AdNectin), домен лектина типа С (тетранектин), вариабельный домен нового рецептора антигена β-лактамазы (фрагменты VNAR), γ-кристаллин или убиквитин человека (молекулы аффилина), домен ингибиторов протеазы человека Кунитца, микротела, такие как белки семейства ноттин, пептидные аптамеры и фибронектин (аднектин).
CTLA-4 (цитотоксичный ассоциированный с Т лимфоцитом антиген 4) представляет собой рецептор семейства CD28, в основном экспрессирующийся на Т клетках CD4+. Его внеклеточный домен содержит вариабельный домен, подобный изгибу Ig. Петли, соответствующие CDR областям антител, можно заменить на гетерогенную последовательность для обеспечения различных связывающих свойств. Молекулы CTLA-4, сконструированные для получения различных связывающих специфичностей, известны также под названием эвитела (например, патент США 7166697 В1). Размер эвител близок к размеру изолированной вариабельной области антитела (например, домена антитела). Более подробно они описаны в работе Journal of Immunological Methods, 248, 1-2, сс. 31-45 (2001). Липокалины представляют собой семейство внеклеточных белков, которые переносят небольшие гидрофобные молекулы, такие как стероиды, билины, ретиноиды и липиды. Они характеризуются жесткой вторичной β-складчатой структурой с рядом петель на открытом конце конической структуры, которую можно сконструировать для связывания с различными мишенями-антигенами. Размер антикалинов составляет от 160 до 180 аминокислот и они являются производными липокалинов. Более подробно антикалины описаны в статье Biochim. Biophys. Acta, 1482, сс. 337-350 (2000), в патентах США 7250297 В1 и 20070224633. Аффитело представляет собой каркасную область А белка стафилококка золотистого Staphylococcus aureus, который можно модифицировать для связывания с антигеном. Домен состоит из трех-спирального узла приблизительно из 58 аминокислот. Библиотеки получают при рандомизации поверхностных остатков. Более подробно аффитела описаны в статье Protein Eng. Des. Sel., 17, сс. 455-462 (2004) и в патенте ЕР 1641818 А1. Авимеры представляют собой белки из семейства каркасных областей А домена. Нативные домены приблизительно из 35 аминокислот формируют определенную структуру, связанную дисульфидными мостиками. Многообразие генерируется за счет шаффлинга (перестановки) природных вариаций, которые характеризуются для семейства А домена. Подробности представлены в работах Nature Biotechnology, 23, 12, сс. 1556-1561 (2005) и Expert Opinion on Investigational Drugs, 16, 6, сс. 909-917 (июль 2007 г). Трансферрин представляет собой мономерный сывороточный транспортный гликопротеин. Трансферрины конструируют для связывания с различными антигенами-мишенями при встраивании пептидных последовательностей в наружную петлю, доступную для встраивания. Примеры сконструированных трасферриновых каркасных областей включают транс-тело, которое более подробно описано в работе J. Biol. Chem., 274, сс. 24066-24073 (1999). Сконструированные белки с анкириновым повтором (DARPin) являются производными семейства белков, которые опосредуют присоединение интегральных мембранных белков к цитоскелету. Отдельный анкириновый повтор представляет собой мотив из 33 остатков, содержащий 2 α-спирали и β-поворот. Их можно сконструировать для связывания с различными антигенами-мишенями при рандомизации остатков в первой α-спирали и β-повороте каждого повтора. Их связующую границу раздела можно увеличить при увеличении числа модулей (метод созревания аффинности). Подробное описание приведено в следующих документах J. Mol. Biol., 332, сс. 489-503 (2003), PNAS 100, 4, сс. 1700-1705 (2003) и J. Mol. Biol., 369, сс. 1015-1028 (2007) и в патенте США 20040132028 А1.
Однодоменное антитело представляет собой фрагмент антитела, состоящий из отдельного мономерного вариабельного домена антитела. Первые отдельные домены являются производными вариабельного домена тяжелой цепи верблюжьего антитела (нанотела или VHH фрагменты). Кроме того, термин "однодоменное антитело" включает автономный вариабельный домен автономной тяжелой цепи человека (aVH) или VNAR фрагменты акул. Фибронектин представляет собой каркасную область, которую можно сконструировать для связывания с антигеном. Аднектины состоят из основной цепи природной аминокислотной последовательности десятого домена из 15 повторяющихся звеньев фибронектина человека типа III (FN3). Три петли на одном конце β-сэндвича можно сконструировать для придания аднектину специфичного распознавания требуемой терапевтической мишени. Подробности описаны в работах Protein Eng. Des. Sel., 18, сс. 435-444 (2005), в патенте США 20080139791, заявке WO 2005056764 и в патенте США 6818418 В1. Пептидные аптамеры представляют собой комбинаторные молекулы распознавания, состоящие из консервативного каркасного белка, обычно тиоредоксина (TrxA), который содержит структурно ограниченную вариабельную пептидную петлю, введенную в активный участок. Подробности описаны в работе Expert Opin. Biol. Ther., 5, сс. 783-797 (2005). Микротела являются производными природных микробелков, содержащих от 25 до 50 аминокислот с 3-4 цистеиновыми связями, примеры микробелков включают KalataBI, конотоксин и кноттины. Микробелки содержат петлю, которую можно сконструировать для включения до 25 аминокислот, не оказывая влияния на общую конформацию микробелка. Подробная информация по конструированию доменов кноттина приведена в заявке WO 2008098796.
Термин "антигенсвязывающая молекула, которая связывается с тем же самым эпитопом", использованный для обозначения референс-молекулы, означает антигенсвязывающую молекулу, которая блокирует связывание референс-молекулы с ее антигеном по данным конкурентного метода анализа на 50% или более, и наоборот, референс-молекула блокирует связывание антигенсвязывающей молекулы с ее антигеном по данным конкурентного метода анализа на 50% или более.
Термин "антигенсвязывающий участок", использованный в настоящем контексте, означает часть антигенсвязывающей молекулы, которая специфично связывается с антигенной детерминантой. Более подробно, термин "антигенсвязывающий участок" означает участок антитела, который включает область, специфично связывающуюся с частью или с целым антигеном и являющуюся комплементарной им. Если антиген является крупной молекулой, то антигенсвязывающая молекула может связываться только с определенной частью антигена, которая называется эпитопом. Антигенсвязывающий участок связывания может представлять собой, например, один или более вариабельных доменов (которые называют также вариабельными областями). Предпочтительно антигенсвязывающий участок включает вариабельную область легкой цепи (VL) и вариабельную область тяжелой цепи антитела (VH). В одном объекте осуществления настоящего изобретения антигенсвязывающий участок способен связываться со своим антигеном и блокировать или частично блокировать его функцию. Антигенсвязывающие участки, которые специфично связываются с PD1 или TIM-3, включают антитела и их фрагменты, как будет описано ниже в данном контексте. Кроме того, антигенсвязывающие участки могут включать белки, связывающиеся с каркасным антигеном, например, связывающие домены, которые полученные на основе сконструированных повторных белков или требуемых повторных доменах (см., например, заявку WO 2002/020565).
Термин "антигенная детерминанта", использованный в данном контексте, является синонимом терминов "антиген" и "эпитоп" и означает участок (например, непрерывная последовательность аминокислот или конформационная конфигурация из различных не соседних аминокислот) макромолекулы полипептида, с которым связывается антигенсвязывающий участок, при этом образуется комплекс антигенсвязывающего участка и антигена. Пригодные антигенные детерминанты можно найти, например, на поверхности опухолевых клеток, на поверхности инфицированных вирусом клеток, на поверхности клеток, ассоциированных с другими заболеваниями, на поверхности иммунных клеток, в свободной форме в сыворотке крови и/или во внеклеточной матрице (ЕСМ). Белками, используемыми в качестве антигенов по настоящему изобретению, могут быть любые природные формы белков из любых позвоночных, включая млекопитающих, таких как приматы (например, человек) и грызуны (например, мыши и крысы), если не указано иное. В предпочтительном варианте осуществления настоящего изобретения антигеном является белок человека. Термин "специфичный белок по настоящему изобретению" означает "полноразмерный" непроцессированный белок, а также любую форму белка, которая образуется в результате процессинга в клетке. Данный термин также означает природные варианты белка, например, сплайс-варианты или аллельные варианты.
Термин "специфичное связывание" означает, что связывание селективно для антигена и может не включать нежелательные или неспецифичные взаимодействия. Способность антигенсвязывающей молекулы связываться со специфичным антигеном можно измерить либо с использованием иммуноферментного анализа (ИФА) или другой методики, известной специалистам в данной области техники, например, поверхностного плазмонного резонанса (ППР) (анализ на приборе BIAcore) (Liljeblad и др., Glyco. J., 17, сс. 323-329 (2000)), и стандартных анализов связывания (Heeley, Endocr. Res., 28, сс. 217-229 (2002)). В одном варианте осуществления настоящего изобретения степень связывания антигенсвязывающей молекулы с неродственным белком составляет приблизительно менее 10% от связывания антигенсвязывающей молекулы с антигеном, по данным, например, метода поверхностного плазмонного резонанса (ППР). В некоторых вариантах молекула, которая связывается с антигеном, характеризуется константой диссоциации (Kd) ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ или ≤0,001 нМ (например, 10-7 М или менее, например, от 10-7 М до 10-13 М, например, от 10-9 М до 10-13 М).
Термин "аффинность" или " связывающая аффинность" означает силу суммарных общих нековалентных взаимодействий между одним участком связывания молекулы (например, антитела) и его компонентом связывания (например, антигеном). Если не указано иное, термин "связывающая аффинность", использованный в данном контексте, отражает взаимодействие 1:1 между членами пары связывания (например, антитела и антигена). Аффинность молекулы X к ее компоненту Y в основном можно представить константой диссоциации (Kd), которая означает отношение констант скоростей диссоциации и ассоциации (koff и kon, соответственно). Таким образом, эквивалентные аффинности могут включать различные константы скорости, при условии, что сохраняются те же самые отношения констант скорости. Аффинность можно измерять стандартными методами, известными в данной области техники, включая описанные в данном контексте. Предпочтительным методом измерения аффинности является поверхностный плазмонный резонанс (ППР).
Термин "высокая аффинность" антитела, использованный в данном контексте, означает антитело с Kd 10-9 М или менее и даже более предпочтительно 10-10 М или менее, для антигена-мишени. Термин "низкая аффинность" антитела означает антитело с Kd 10-8 или более.
Термин "аффинность зрелого антитела" означает антитело с одним или более изменениями в одном или более гипервариабельных областях (HVR), по сравнению с исходным антителом, в котором отсутствуют такие изменения, которые приводят к улучшению аффинности антитела в отношении антигена.
Термины "биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM-3", "биспецифическое антитело, которое специфично связывается с PD1 и TIM-3", "биспецифическая антигенсвязывающая молекула, специфичная к PD1 и TIM-3" в данном контексте используют взаимозаменяемо и они означают биспецифическое антитело, способное связываться с PD1 и TIM-3 с достаточной аффинностью таким образом, что антитело является пригодным для применения в качестве диагностического и/или лекарственного агента для направленного воздействия на PD1 и TIM-3.
Термин «PD1», известный также под названием белок 1 запрограммированной смерти клетки, представляет собой мембранный белок типа I, содержащий 288 аминокислот, который впервые был описан в 1992 г (Ishida и др., EMBO J., 11, сс. 3887-3895 (1992)). PD-1 является членом обширного семейства CD28/CTLA-4 Т клеточных регуляторов и содержит 2 лиганда, PD-L1 (В7-Н1, CD274) и PD-L2 (B7-DC, CD273). Структура белка включает внеклеточный домен IgV, за которым следует трансмембранная область внутриклеточный хвост. Внутриклеточный хвост содержит 2 участка фосфорилирования, расположенных в иммунорецепторном ингибиторном тирозиновом мотиве и в иммунорецепторном переключательном тирозиновом мотиве, что позволяет предположить, что PD-1 отрицательно регулирует сигналы TCR. Это согласуется со связыванием фосфатаз SHP-1 и SHP-2 с цитоплазматическим участком PD-1 при связывании лиганда. В то время как PD-1 не экспрессируется на нативных Т клетках, наблюдается его регуляция повышением активности после опосредованной рецептором Т клеток (TCR) активацией, а также его наблюдается экспрессия на активированных и истощенных Т клетках (Agata и др., Int. Immunology, 8, сс. 765-772 (1996)). Такие истощенные Т клетки характеризуются бифункциональным фенотипом и неспособны на соответствующую ответную реакцию. Несмотря на то, что PD-1 характеризуется относительно широким профилем экспрессии, его наиболее важная роль вероятно заключается в выполнении функции совместного ингибиторного рецептора на Т клетках (Chinai и др., Trends in Pharmacological Sciences, 36, сс. 587-595 (2015)). Таким образом, современные терапевтические подходы направлены на блокировку взаимодействия PD-1 с его лигандами для увеличения ответной реакции Т клеток. Термины "запрограммированная смерть 1", "запрограммированная смерть клетки 1", "белок PD-1," "PD-1, "PD1," "PDCD1," "hPD-1" и "hPD-I" можно использовать взаимозаменяемо и они включают варианты, изоформы, гомологи PD-1 человека и аналоги, содержащие о крайней мере один общий с PD-1 эпитоп. Аминокислотная последовательность PD1 человека представлена в базе данных UniProt (www.uniprot.org), номер доступа Q15116 (SEQ ID NO: 89).
Термины "антитело анти-PD1" и "антитело, включающее антигенсвязывающий участок, который связывается с PD1" означают антитело, связывающееся с PD1, прежде всего с полипептидом PD1, который экспрессируется на поверхности клетки с достаточной аффинностью таким образом, что антитело можно использовать в качестве диагностического и/или терапевтического агента для направленного воздействия на PD1. В одном варианте степень связывания антитела анти-PD1 с неродственным белком, который не является PD белком, составляет менее приблизительно 10% от связывания антитела с PD1, по данным измерений, например, методом радиоиммуноанализа (RIA) или проточной цитометрии (FACS) или методом ППР с использованием системы биосенсора, такой как Biacore®. В некоторых вариантах антигенсвязывающий белок, который связывается с PD1 человека, характеризуется величиной KD связывающей аффинности с PD1 человека ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ, или ≤0,001 нМ (например, 10-8 М или менее, например, от 10-8 М до 10-13 М, например, от 10-9 М до 10-13 М). В одном предпочтительном варианте соответствующую величину связывающей аффинности KD определяли методом ППР с использованием внеклеточного домена (ECD) PD1 человека (PD1-ECD) для связывающей аффинности PD1. Термин "антитело анти-PD1" означает также биспецифическое антитела, которые способны связываться с PD1 и вторым антигеном.
Термин "TIM3", сокращенно "молекула 3, содержащая домен Т клеточного иммуноглобулина и муцина", который обозначают также TIM-3, HAVCR2, KIM-3, TIMD3 и FLJ14428, означает поверхностный белок специфической Т хелперной клетки, который регулирует активацию макрофагов и тяжесть воспалительного состояния. TIM3 также связан с раком, прежде всего с раковыми стволовыми клетками. Нуклеотидная и белковая последовательности TIM3 известны для многих видов. Например, аминокислотная последовательность человека представлена в базе данных Uniprot, номер доступа Q8TDQ0 (SEQ ID NO: 93). Белок человека характеризуется внеклеточным доменом, содержащим Ig-подобный домен и домен муцина (также включающий О- и N-связанные сайты гликозилирования), включающий приблизительно 22-202 аминокислот, трансмембранный домен (203-223 аминокислот), и внутриклеточный домен (цитоплазматический) (аминокислоты 224-301). Для белка TIM3 человека с последовательностью SEQ ID NO: 93, внеклеточный домен содержит приблизительно 22-202 аминокислоты, трансмембранный домен содержит приблизительно 203-223 аминокислоты и цитоплазматический домен содержит приблизительно 224-301 аминокислоту. Термин "TIM3" включает варианты, изоформы, видовые гомологи TIM3 человека и его аналоги, содержащие по крайней мере один эпитоп, общий с TIM3.
Термины "антитело анти-TIM3" и "антитело, включающее антигенсвязывающий участок, который связывается с TIM3" означают антитело, связывающееся с TIM3, прежде всего с полипептидом TIM3, который экспрессируется на поверхности клетки, с достаточной аффинностью таким образом, что антитело можно использовать в качестве диагностического и/или терапевтического агента для направленного воздействия на TIM3. В одном варианте степень связывания антитела анти-TIM3 с неродственным белком, который не является TIM3, составляет менее приблизительно 10% от связывания антитела с TIM3, по данным измерений, например, методом радиоиммуноанализа (RIA) или проточной цитометрии (FACS) или методом ППР с использованием системы биосенсора, такой как Biacore®. В некоторых вариантах антигенсвязывающий белок, который связывается с TIM3 человека, характеризуется величиной связывающей аффинности KD с TIM3 человека ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ, или ≤0,001 нМ (например, 10-7 М или менее, например, от 10-8 М до 10-13 М, например, от 10-9 М до 10-13 М). В одном предпочтительном варианте соответствующая величина связывающей аффинности KD определяли ППР с использованием внеклеточного домена (ECD) TIM3 человека (TIM3-ECD) для связывающей аффинности PD1. Термин "антитело анти-TIM3" означает также биспецифическое антитела, способные связываться с TIM3 и вторым антигеном.
Термин "блокирующее антитело" или "антагонист антитела" означает антитело, которое ингибирует или снижает биологическую активность связывающегося с ним антигена. В некоторых вариантах блокирующие антитела или антагонисты антител частично или полностью ингибируют биологическую активность антигена. Например, биспецифическое антитела по настоящему изобретению блокируют передачу сигнала через PD-1 и TIM-3 таким образом, чтобы восстановить функциональную ответную реакцию от Т клеток (например, пролиферацию, продуцирование цитокинов, гибель клеток-мишеней) от состояния дисфункции до стимуляции антигена.
Термин "вариабельная область" или "вариабельный домен" означают домен тяжелой или легкой цепи антитела, который принимает участие в связывании антигенсвязывающей молекулы с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) нативного антитела обычно характеризуются одинаковой структурой, при этом каждый домен включает 4 консервативных каркасных области (FR) и 3 гипервариабельные области (HVR). См., например, Kindt и др., Kuby Immunology, 6е изд., Freeman W.H. and Co., с. 91 (2007). Для обеспечения антигенсвязывающей специфичности может быть достаточно одного VH или VL домена.
Термин "гипервариабельная область" или "HVR," использованный в настоящем контексте, означает каждую из областей вариабельного домена антитела, которые характеризуются гипервариабельной последовательностью и/или образуют структурно определенные петли ("гипервариабельные петли"). В основном, нативные четырехцепочечные антитела содержат шесть HVR, три в VH домене (H1, Н2, Н3) и три в VL домене (L1, L2, L3). HVR обычно содержат аминокислотные остатки из гипервариабельных петель и/или из "определяющих комплементарность областей" (CDR), причем последние характеризуются более высокой вариабельностью и/или принимают участие в распознавании антигена. Примеры гипервариабельных петель расположены в следующих положениях аминокислотных остатков 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (Н2) и 96-101 (Н3) (Chothia и Lesk, J. Mol. Biol., 196, cc. 901-917 (1987)). Примеры областей CDR (CDR-L1, CDR-L2, CDR-L3, CDR-H1, CDR-H2 и CDR-Н3) расположены в следующих положениях аминокислотных остатков 24-34 L1, 50-56 L2, 89-97 L3, 31-35В H1, 50-65 Н2 и 95-102 Н3 (Kabat и др., Sequences of Proteins of Immunological Interest, 5е изд., Public Health Service, National Institutes of Health, Bethesda, MD (1991)). Термин "гипервариабельные области (HVR)" означает также определяющие комплементарность области (CDR), и данные термины используют в данном контексте взаимозаменяемо при описании участков вариабельной области, которые образуют антигенсвязывающие участки. Данная область описана в документах Kabat и др., U.S. Dept. of Health and Human Services, "Sequences of Proteins of Immunological Interest" (1983) и Chothia и др., J. Mol. Biol., 196, cc. 901-917 (1987), где определения включают перекрывание или подгруппы аминокислотных остатков при сравнении друг с другом. Тем не менее, применение каждого определения для обозначения CDR антитела или его вариантов включено в значение термина, как определено в настоящем контексте. Соответствующие аминокислотные остатки, которые означают CDR, как определено в каждой из цитированных выше ссылок, представлены ниже в табл. А для сравнения. Точные номера остатков, означающих конкретные CDR, изменяются в зависимости от последовательности и размера CDR. Специалисты в данной области техники могут определить остатки, включающие конкретную CDR данной вариабельной области аминокислотной последовательности антитела.
1 Нумерация всех определений CDR в табл. А представлена согласно системе нумерации, определенной в работе Kabat и др. (см. ниже).
2 Сокращение "AbM" со строчной буквой "b", использованное в табл. А, означает CDR, как определено с помощью программного обеспечения для моделирования структуры антител Oxford Molecular's "AbM".
В работе Kabat и др. определена также система нумерации для последовательностей вариабельной области, которая является пригодной для любого антитела. Специалист в данной области техники способен однозначно применить данную систему "нумерации Кабата" к любой последовательности вариабельной области без любых экспериментальных данных, не относящихся к самой последовательности. Термин "нумерация Кабата", использованный в данном контексте, означает систему нумерации, установленную в работе Kabat и др., U.S. Dept. of Health and Human Services, "Sequence of Proteins of Immunological Interest" (1983). Если не указано иное, то нумерация положений определенных аминокислотных остатков в вариабельной области антитела соответствует системе нумерации Кабата.
За исключением CDR1 в VH, CDR области обычно содержат аминокислотные остатки, которые образуют гипервариабельные петли. CDR области также включают "определяющие специфичность остатки", или "SDR," которые представляют собой остатки, контактирующие с антигеном. SDR содержатся в CDR областях, которые называют abbriviated-CDR или a-CDR. Примеры a-CDR областей (a-CDR-L1, a-CDR-L2, a-CDR-L3, a-CDR-H1, a-CDR-Н2 и a-CDR-Н3) находятся в положениях аминокислотных остатков 31-34 L1, 50-55 L2, 89-96 L3, 31-35В H1, 50-58 Н2 и 95-102 Н3 (см. статью Almagro и Fransson, Front. Biosci., 13, cc. 1619-1633 (2008)). Если не указано иное, остатки HVR и другие остатки в вариабельном домене (например, остатки FR) в данном контексте пронумерованы в соответствии с работой Kabat и др.
Термин "каркасная область" или "FR" означает остатки вариабельного домена, отличающиеся от остатков гипервариабельной области (HVR). FR область вариабельного домена обычно состоит из четырех FR доменов: FR1, FR2, FR3 и FR4. Соответственно, последовательности HVR и FR обычно находятся в следующей последовательности в VH (или VL): FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
Термин "акцепторная каркасная область человека", использованный в данном контексте, означает каркасную область, включающую аминокислотную последовательность каркасной области вариабельного домена легкой цепи (VL) или каркасную область вариабельного домена тяжелой цепи (VH), полученную из каркасной области иммуноглобулина человека или консенсусной каркасной области человека, как определено ниже. Акцепторная каркасная область человека, полученная из каркасной области иммуноглобулина человека или консенсусной каркасной области человека, может включать аналогичную аминокислотную последовательность или может содержать изменения в аминокислотной последовательности. В некоторых вариантах, число изменений аминокислот составляет 10 или менее, 9 или менее, 8 или менее, 7 или менее, 6 или менее, 5 или менее, 4 или менее, 3 или менее, или 2 или менее. В некоторых вариантах, акцепторная каркасная область человека VL состоит из идентичной последовательности каркасной области иммуноглобулина человека VL или последовательности консенсусной каркасной области человека.
Термин "химерное антитело" означает антитело, в котором часть тяжелой и/или легкой цепи получена из конкретного источника или видов, в то время как оставшаяся часть тяжелой и/или легкой цепи получена из другого источника или видов.
Термин "класс" антитела означает тип консервативного домена или консервативной области, характерный для тяжелой цепи антитела. Существует 5 основных классов антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них дополнительно подразделяются на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Консервативные домены тяжелой цепи, соответствующие различным классам иммуноглобулинов, называются α, δ, ε, γ, и μ, соответственно.
Термин "гуманизированное антитело" означает химерное антитело, включающее аминокислотные остатки из HVR областей, не относящиеся к человеку и аминокислотные остатки из FR областей человека. В определенных вариантах гуманизированное антитело включает в основном по крайней мере все из одного, и обычно из двух вариабельных доменов, в которых все или практически все HVR области (например, CDR области) соответствуют областям антитела, не относящегося к человеку, а также все или практически все FR области соответствуют областям антитела человека. Гуманизированное антитело необязательно может включать по крайней мере часть консервативной области, полученной из антитела человека. Термин "гуманизированная форма антитела", например, антитела не человека, означает антитело, которое подвергалось гуманизации. Другие формы "гуманизированных антител" по настоящему изобретению представляют собой антитела, в которых консервативную область дополнительно модифицировали или изменяли по сравнению с исходным антителом, при этом получали свойства по настоящему изобретению, прежде всего в отношении связывания с C1q и/или Fc рецептором (FcR).
Термин "антитело человека" означает антитело, которое включает аминокислотную последовательность, соответствующую последовательности антитела, продуцируемого человеком или клеткой человека, или полученной из не относящегося к человеку источника, использующего антитела человека, или последовательностей, кодирующих другие антитела человека. Данное определение антитела человека не включает гуманизированные антитела, содержащие антигенсвязывающие остатки, не относящиеся к человеку.
Термин "моноклональное антитело", использованный в данном контексте, означает антитело, полученное из популяции в значительной степени гомогенных антител, то есть индивидуальных антител, включающих популяцию, идентичную и/или связывающуюся с тем же самым эпитопом, за исключением возможного варианта антител, например, содержащих природные мутации или образующихся при получении моноклональных антител, при этом такие варианты обычно присутствуют в незначительных количествах. В отличие от препаратов поликлональных антител, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело в препарате моноклональных антител направлено против одной детерминанты на антигене. Таким образом, определение "моноклональный" означает тип антитела, а именно антитело, полученное в основном из гомогенной популяции антител, и не следует понимать, что антитело должно быть получено любым конкретным способом. Например, моноклональные антитела по настоящему изобретению можно получать различными методами, включая, но, не ограничиваясь только ими, метод гибридом, методы рекомбинантных ДНК, методы фагового дисплея и методы, использующие трансгенных животных, содержащих все или часть локусов иммуноглобулина человека, при этом указанные методы и другие типичные методы получения моноклональных антител описаны в данном контексте.
Термин "Fc домен" или "Fc область", использованный в данном контексте, означает С-концевую область тяжелой цепи антитела, содержащую по крайней мере часть консервативной области. Термин включает природные последовательности Fc областей и вариант Fc областей. Прежде всего Fc область тяжелой цепи IgG человека расположена от Cys226, или от Pro230, до С-концевого остатка тяжелой цепи. Однако С-концевой лизин (Lys447) Fc области может как присутствовать, так и отсутствовать. Аминокислотные последовательности тяжелых цепей всегда включают С-концевой лизин, однако варианты без С-концевого лизина включены в настоящее изобретение.
Fc домен IgG включает IgG СН2 и IgG СН3 домены. "СН2 домен" Fc домена IgG человека обычно расположен от аминокислотного остатка в положении приблизительно 231 до аминокислотного остатка приблизительно в положении 340. В одном варианте к СН2 домену присоединена углеводная цепь. СН2 домен по настоящему изобретению может представлять собой СН2 домен или вариант СН2 домена с природной последовательностью. Термин "СН3 домен" означает последовательность от С-концевого остатка до СН2 домена в Fc области (то есть от аминокислотного остатка в положении приблизительно 341 до аминокислотного остатка в положении приблизительно 441 в составе IgG). СН3 область по настоящему изобретению может представлять собой СН3 домен или вариант СН3 домена с природной последовательностью (например, СН3 домен с встроенной "выпуклостью" ("выступом") в одной из их цепей и соответственно встроенной "полостью" ("впадиной") в другой из их цепей, см. патент США 5821333, включенный в данное описание в качестве ссылки). Такой вариант СН3 доменов можно использовать для осуществления гетеродимеризации двух неидентичных тяжелых цепей антител, как описано в данном контексте. Если не указано иное, нумерация аминокислотных остатков в Fc домене или консервативной области осуществляется согласно EU системе нумерации, также называемой EU индексом, как описано в работе Kabat и др., Sequences of Proteins of Immunological Interest, 5е изд., Public Health Service, National Institutes of Health, Bethesda, MD (1991).
Методика "выступ-во-впадину" описана, например, в патентах США 5731168 и 7695936, статьях Ridgway и др., Prot. Eng., 9, сс. 617-621 (1996) и Carter, J. Immunol. Meth., 248, сс. 7-15 (2001). В основном, способ включает встраивание выпуклости ("выступа") в первый полипептид и соответствующей полости ("впадины") во второй полипептид таким образом, чтобы выпуклость располагалась в полости, обеспечивая образование гетеродимера и затрудняя образование гомодимера. Выступы получают при замене малых боковых цепей аминокислот на поверхности первого полипептида на боковые цепи большого размера (например, тирозин или триптофан). Соответствующие впадины идентичного или меньшего размера по сравнению с выступами получают во втором полипептиде при замене аминокислот с боковыми цепями большого размера на меньшие (например, аланин или треонин). Выступ и впадину можно получить при изменении кодирующей полипептид нуклеиновой кислоты, например, с использованием сайт-специфичного мутагенеза или синтеза пептидов. В особом варианте модификация выступа включает замену аминокислоты T366W в одной из двух субъединиц Fc домена, а модификация впадины включает замены аминокислот T366S, L368A и Y407V в другой из двух субъединиц Fc домена. В другом особом варианте субъединица Fc домена, включающая модификацию выступа, дополнительно включает аминокислотную замену S354C, а субъединица Fc домена, включающая модификацию впадины, дополнительно включает аминокислотную замену Y349C. Введение таких двух остатков цистеина приводит к образованию дисульфидных связей между двумя субъединицами Fc области, таким образом дополнительно стабилизируя димер (Carter, J. Immunol. Methods, 248, сс. 7-15 (2001)).
Термин "область, эквивалентная Fc области иммуноглобулина" означает природные аллельные варианты Fc области иммуноглобулина и варианты, содержащие изменения, которые образуют замены, вставки или делеции, но которые не снижают в значительной степени способность иммуноглобулина опосредовать эффекторные функции (такие как антителозависимая клеточная цитотоксичность). Например, одну или более аминокислот можно удалить из N-концевого фрагмента или С-концевого фрагмента Fc домена иммуноглобулина без значительной потери биологической функции. Такие варианты можно выбирать согласно общим правилам, известным в данной области техники, которые оказывают минимальное влияние на активность (см., например, Bowie J.U. и др., Science, 247, сс. 1306-13010 (1990)).
Термин "эффекторные функции" означает такие биологические функции, которые связаны с Fc доменом антитела, которые изменяются в зависимости от изотипа антитела. Примеры эффекторных функций антитела включают: связывание с C1q и комплементарно зависимую от комплемента цитотоксичность (CDC), связывание с Fc рецептором, антителозависимую клеточную цитотоксичность (ADCC), антителозависимый клеточный фагоцитоз (ADCP), секрецию цитокинов, опосредуемый иммунным комплексом захват антигена антиген-презентирующими клетками, регуляцию с пониженной активностью рецепторов поверхности клетки (например, рецептора В клеток) и активацию В клеток.
Термин "активирующий Fc рецептор" означает Fc рецептор, который после взаимодействия с Fc доменом антитела вызывает передачу сигналов, которые стимулируют содержащую рецептор клетку осуществлять эффекторные функции. Активирующие Fc рецепторы включают FcγRIIIa (CD16a), FcγRI (CD64), FcγRIIa (CD32) и FcαRI (CD89). Предпочтительным активирующим Fc рецептором является FcγRIIIa человека (см. UniProt, номер доступа Р08637, версия 141).
Термин "пептидный линкер" означает пептид, содержащий одну или более аминокислот, обычно приблизительно от 2 до 20 аминокислот. Пептидные линкеры известны в данной области техники или описаны в данном контексте. Пригодные не иммуногенные пептидные линкеры включают, например, (G4S)n, (SG4)n или G4(SG4)n пептидные линкеры, где "n" обычно означает число от 1 до 10, обычно от 2 до 4 и предпочтительно 2.
Термин "гибридный" или "присоединенный" означает, что компоненты (например, антигенсвязывающий участок и Fc домен) соединены пептидными связями либо напрямую, либо через один или более пептидных линкеров.
Термин "аминокислота", используемый в данном контексте, означает группу природных карбоновых α-аминокислот, включающих аланин (трехбуквенный код: ala, однобуквенный код: А), аргинин (arg, R), аспарагин (asn, N), аспарагиновую кислоту (asp, D), цистеин (cys, С), глутамин (gln, Q), глутаминовую кислоту (glu, Е), глицин (gly, G), гистидин (his, Н), изолейцин (ile, I), лейцин (leu, L), лизин (lys, K), метионин (met, М), фенилаланин (phe, F), пролин (pro, Р), серии (ser, S), треонин (thr, Т), триптофан (trp, W), тирозин (tyr, Y) и валин (val, V).
Термин "идентичности аминокислотной последовательности в процентах (%)" в отношении референсного полипептида (белка) означает процент аминокислотных остатков в сравниваемой последовательности, которые являются идентичными аминокислотным остаткам в референсной полипептидной последовательности после выравнивания последовательностей и введения при необходимости гэпов для достижения максимального процента идентичности последовательностей, не учитывая любые консервативные замены как часть идентичности последовательности. Выравнивание для определения процента идентичности аминокислотной последовательности можно осуществить различными способами, которые известны в данной области техники, например, с использованием общедоступного программного обеспечения, такого как BLAST, BLAST-2, ALIGN. SAWI или Megalign (DNASTAR). Специалисты в данной области техники могут определить соответствующие параметры для выравнивания последовательностей, включая различные алгоритмы, необходимые для обеспечения максимального выравнивания на протяжении всей длины сравниваемых последовательностей. Однако, для целей настоящего изобретения величины идентичности аминокислотной последовательности в % получали с использованием программного обеспечения для сравнения последовательностей ALIGN-2. Автором программного обеспечения ALIGN-2 для сравнения последовательностей является фирма Genentech Inc., и код источника заполняли с использованием документации пользователя в офисе U.S. Copyright Office, Washington D.C., 20559, США, где его регистрировали под регистрационным номером U.S. Copyright Registration No. TXU510087. Программное обеспечение ALIGN-2 является общедоступным на фирме Genentech, Inc., South San Francisco, Калифорния, или его можно составить по исходному коду. Программное обеспечение ALIGN-2 можно также составить для использования в операционной системе UNIX, включая цифровую версию UNIX V4.0D. Все параметры сравнения последовательностей установлены в программном обеспечении ALIGN-2 и не изменяются. В случаях, когда программное обеспечения ALIGN-2 используют для сравнения последовательностей аминокислот, идентичность данной аминокислотной последовательности А в % по сравнению с данной аминокислотной последовательностью В (которую в другом варианте можно назвать как данная аминокислотная последовательность А, которая имеет или включает определенную % идентичность аминокислотной последовательности в % по сравнению с данной аминокислотной последовательностью В) рассчитывают по следующей формуле:
100 × частное X/Y
где X означает число аминокислотных остатков, рассчитанных как идентичные совпадения при сравнении последовательностей А и B в программе ALIGN-2, и где Y означает общее число аминокислотных остатков в последовательности В. Следует понимать, что если длина аминокислотной последовательности А не равна длине аминокислотной последовательности В, то идентичность аминокислотной последовательности в % при сравнении А с В не равна идентичности аминокислотной последовательности в % при сравнении В с А. Если не указано иное, все значения идентичности аминокислотных последовательностей, использованные в данном контексте, были получены, как описано в предыдущем абзаце, с использованием программного обеспечения ALIGN-2.
В некоторых объектах предлагаются варианты аминокислотных последовательностей биспецифических антител по настоящему изобретению. Например, может возникнуть необходимость улучшить связывающую аффинность и/или другие биологические свойства биспецифических антител. Варианты аминокислотных последовательностей биспецифических антител можно получать при введении соответствующих модификаций в нуклеотидную последовательность, кодирующую молекулы или с использованием синтеза пептидов. Такие модификации включают, например, делеции и/или вставки и/или замены остатков в аминокислотных последовательностях антитела. Для получения конечного конструкта можно использовать любые комбинации делеций, вставок или замен при условии, что конечный конструкт обладает требуемыми характеристиками, например, антигенсвязывающими свойствами. Сайты для заместительного мутагенеза включают HVR область и каркасные области (FR). Консервативные замены приведены в табл. Б под названием "Предпочтительные замены" и далее обсуждаются со ссылкой на классы аминокислотных боковых цепей (1)-(6). Аминокислотные замены можно вводить в исследуемую молекулу и в продуктах определять требуемую активность, например, сохраненное/улучшенное связывание с антигеном, сниженную иммуногенность или улучшенные ADCC или CDC.
Аминокислоты могут быть сгруппированы по общим свойствам боковых цепей:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile,
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln,
(3) кислотные: Asp, Glu,
(4) основные: His, Lys, Arg,
(5) остатки, влияющие на ориентацию цепей: Gly, Pro,
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замены означают замену члена одного из этих классов на другой класс.
Термин "варианты аминокислотной последовательности" означает значительные варианты, в которых введены аминокислотные замены одного или более остатков в гипервариабельной области исходной антигенсвязывающей молекулы (например, гуманизированном антителе или антителе человека). Обычно, конечный вариант(ы), выбранный(е) для дальнейшего исследования, включает модификации (например, улучшения) определенных биологических свойств (например, повышенная аффинность, сниженная иммуногенность) по сравнению с исходной антигенсвязывающей молекулой и/или в значительной степени сохраняет определенные биологические свойства исходной антигенсвязывающей молекулы. Типичный вариант с заменой включает антитело со зрелой аффинностью, которое можно получить, например, по методикам созревания аффинности с использованием фагового дисплея, таким, как описано в данном контексте. Краткое описание метода: проводят мутации одного или более остатков HVR и вариант антигенсвязывающей молекулы отражают на фаг и определяют конкретную биологическую активность (например, связывающую аффинность). В некоторых вариантах замены, вставки и делеции можно осуществлять в составе одной или более HVR при условии, что такие изменения не приведут к значительному снижению способности антигенсвязывающей молекулы связываться с антигеном. Например, в HVR можно осуществить консервативные изменения (например, консервативные замены, описанные в данном контексте), которые не приводят к значительному снижению связывающей аффинности. Пригодный метод идентификации остатков или областей антитела, которые можно выбрать для мутагенеза, называется "аланинсканирующим мутагенезом", как описано в статье Cunningham и Wells, Science, 244, сс. 1081-1085 (1989). Согласно данному методу остаток или группу с остатками-мишенями (например, заряженные остатки, такие как Arg, Asp, His, Lys и Glu) идентифицируют и заменяют на нейтральную или отрицательно заряженную аминокислоту (например, аланин или полиаланин) для оценки влияния такого изменения на взаимодействие антитела с антигеном. Можно осуществлять дополнительные замены в положениях аминокислот, которые проявляют функциональную чувствительность к исходным заменам. В другом варианте, или дополнительно, можно использовать кристаллическую структуру комплекса антигена с антигенсвязывающей молекулой для идентификации контактирующих точек между антителом и антигеном. Такие контактирующие остатки и соседние остатки можно выбрать в качестве мишеней для модификации. Варианты можно исследовать на наличие требуемых свойств.
Вставки в аминокислотные последовательности включают присоединение последовательностей длиной от одного остатка до полипептидов, содержащих сто и более остатков, к N- или С-концевому фрагменту, а также вставки одного или более аминокислотных остатков внутри последовательности. Примеры концевых вставок включают биспецифическое антитела с N-концевым остатком метионина. Другие варианты вставок включают присоединение полипептида к N- или С-концевому фрагменту, что повышает период полураспада биспецифического антитела в сыворотке.
В определенных объектах биспецифическое антитела, предлагаемые по настоящему изобретению, изменяют для повышения или снижения степени гликозилирования антитела. Гликозилированные варианты молекул легко получить при изменении аминокислотной последовательности таким образом, что вставить или удалить один или более участков гликозилирования, например, можно изменять углеводы, присоединенные к Fc домену. Природные антитела, которые продуцируются обычно в клетках млекопитающих, обычно включают разветвленный двухантенный олигосахарид, который обычно присоединен через N-связь к Asn297 СН2 домена Fc области. См., например, Wright и др., TIBTECH, 15, сс. 26-32 (1997). Олигосахарид может содержать различные углеводы, например, маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, присоединенную к GlcNAc на "стебле" двухантенной олигосахаридной структуры. В некоторых вариантах модификации олигосахарида в биспецифических антителах по настоящему изобретению можно проводить для конструирования вариантов с улучшенными определенными свойствами. В одном объекте предлагаются варианты биспецифических антител с углеводной структурой, обедненной фукозой, присоединенной (напрямую или косвенно) к Fc домену. Такие фукозолированные варианты характеризуются улучшенной функцией ADCC, см. например, публикацию патента США 2003/0157108 (Presta L.) или 2004/0093621 (Kyowa Hakko Kogyo Co., Ltd). Другие варианты биспецифических антител по настоящему изобретению включают антитела с разделенными на 2 части олигосахаридами, например, в которых двухантенный олигосахарид, присоединенный к Fc домену, разделен на 2 части остатком GlcNAc. Такие варианты могут характеризоваться сниженным фукозилированием и/или улучшенной функцией ADCC, см., например, заявку WO 2003/011878 (Jean-Mairet и др.), патенты США 6602684 (Umana и др.) и 2005/0123546 (Umana и др.). Предлагаются также варианты, содержащие по крайней мере один остаток галактозы в олигосахариде, присоединенном к Fc области. Такие варианты антител могут характеризоваться улучшенной функцией CDC и описаны, например, в заявках WO 1997/30087 (Patel и др.), WO 1998/58964 (Raju S.) и WO 1999/22764 (Raju S.).
В некоторых вариантах можно получить сконструированные цистеиновые варианты биспецифических антител по настоящему изобретению, например, "thioMAb", в которых один или более остатков молекулы заменены на остатки цистеина. В предпочтительных вариантах замененные остатки находятся в доступных участках молекулы. При замене таких остатков на цистеин реакционноспособные тиольные группы таким образом будут расположены в доступных участках антитела, и их можно использовать для конъюгирования антитела с другими фрагментами, такими как лекарственные фрагменты или фрагменты линкер-лекарственное средство, для конструирования иммунноконъюгата. В определенных вариантах любой один или более приведенных ниже остатков можно заменять на цистеин: V205 (нумерация по Кабату) в легкой цепи, А118 (EU нумерация) в тяжелой цепи и S400 (EU нумерация) в тяжелой цепи Fc области. Сконструированные антигенсвязывающие молекулы цистеина можно получить согласно тому, как описано в патенте США 7521541.
В определенных объектах биспецифическое антитела по настоящему изобретению можно дополнительно модифицировать для введения в них дополнительных небелковых фрагментов, известных в данной области техники и общедоступных. Фрагменты, пригодные для модификации антител, включают, но, не ограничиваясь только ими, водорастворимые полимеры. Неограничивающие примеры водорастворимых полимеров включают, но, не ограничиваясь только ими, полиэтиленгликоль (ПЭГ), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилена и малеинового ангидрида, полиаминокислоты (гомополимеры и статистические сополимеры) и декстран или поли(н-винилпирролидон)полиэтиленгликоль, гомополимеры пропиленгликоля, сополимеры пропиленоксида и этиленоксида, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси. Пропиональдегид полиэтиленгликоля характеризуется преимуществами при получении за счет его стабильности в воде. Полимер может характеризоваться любой молекулярной массой и может быть разветвленным или неразветвленным. Количество полимеров, присоединенных к антителу, может изменяться, и если присоединено более одного полимера, то они могут быть одинаковыми или различными. Обычно, число и/или тип полимеров, которые используют для модификации, определяют с учетом следующих факторов, включающих, но, не ограничиваясь только ими, конкретные свойства или функции улучшаемого антитела, возможность использовать производное биспецифического антитела в лечении при определенных условиях и т.п.
В другом объекте предлагаются конъюгаты антитела и небелкового фрагмента, которые можно селективно нагревать при облучении. В одном варианте в качестве небелкового фрагмента используют углеродную нанотрубку (Kam N.W. и др., Proc. Natl. Acad. Sci. USA, 102, сс. 11600-11605 (2005)). Облучение может характеризоваться любой длиной волны и включать, но, не ограничиваясь только ими, длины волн, которые не оказывают отрицательное действие на обычные клетки, но в результате такого облучения нагревается небелковый фрагмент до температуры, при которой происходит гибель клеток, соседних с конъюгатом антитела и небелкового фрагмента.
Термин "иммуноконъюгат" означает антитело, конъюгированное с одной или более гетерологичных молекул, включая, но, не ограничиваясь только им, цитотоксичный агент.
Термин "полинуклеотид" означает изолированную молекулу нуклеиновой кислоты или конструкт, например, матричную РНК (мРНК), вирусную РНК или плазмидную РНК (пРНК). Полинуклеотид может включать обычную фосфодиэфирную связь или необычную связь (например, амидную связь, например, такую, которая присутствует в пептидных нуклеиновых кислотах (ПНК)). Термин "молекула нуклеиновой кислоты" означает любой один или более сегментов нуклеиновой кислоты, например, фрагменты ДНК или РНК, присутствующие в полинуклеотиде.
Термин «изолированная» молекула нуклеиновой кислоты или полинуклеотида означает молекулу нуклеиновой кислоты, ДНК или РНК, выделенную из ее природной среды. Например, рекомбинантный полинуклеотид, кодирующий полипептид, содержащийся в векторе, рассматривается как изолированный для целей настоящего изобретения. Другие примеры изолированных полинуклеотидов включают рекомбинантные полинуклеотиды, содержащиеся в гетерологичных клетках-хозяина, или очищенные (частично или практически полностью) полинуклеотиды в растворе. Изолированный полинуклеотид включает молекулу полинуклеотида, содержащуюся в клетках, которые обычно содержат молекулу полинуклеотида, но молекула полинуклеотида находится вне хромосомы в месте локализации хромосомы, которое отличается от локализации его природной хромосомы. Изолированные молекулы РНК включают транскрипты РНК in vivo или in vitro по настоящему изобретению, а также отрицательные и положительные формы цепей и двухцепочечные формы. Изолированные полинуклеотиды или нуклеиновые кислоты по настоящему изобретению кроме того включают синтетические молекулы. Кроме того полинуклеотид или нуклеиновая кислота могут являться регуляторным элементом, таким как промотор, рибосом связывающий сайт или терминатор транскрипции, или включать его.
Нуклеиновая кислота или полинуклеотид с нуклеотидной последовательностью, идентичность которой по сравнению с эталонной полинуклеотидной последовательностью по настоящему изобретению составляет по крайней мере 95%, означает, что нуклеотидная последовательность идентична эталонной последовательности за исключением того, что полинуклеотидная последовательность может включать вплоть до пяти точечных мутаций на каждые 100 нуклеотидов эталонной нуклеотидной последовательности. Другими словами, чтобы получить полинуклеотид с нуклеотидной последовательностью, идентичность которой с эталонной нуклеотидной последовательностью составляет по крайней мере 95%, можно удалить или заменить на другой нуклеотид вплоть до 5% нуклеотидов в эталонной последовательности, или вплоть до 5% нуклеотидов от общего числа нуклеотидов в эталонной последовательности можно вставить в эталонную последовательность. Эти изменения эталонной последовательности можно проводить в 5'- или 3'-концевых положениях эталонной нуклеотидной последовательности или в любом положении между этими концевыми положениями, рассеянные либо индивидуально среди остатков в эталонной последовательности, или в одной или более соседних групп в эталонной последовательности. На практике идентичность конкретной нуклеотидной последовательности с нуклеотидной последовательностью по настоящему изобретению, которая может составлять по крайней мере 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%, можно определять стандартным методом с использованием известных компьютерных программ, таких как программы, описанные выше для полипептидов (например, ALIGN-2).
Термин «кассета экспрессии» относится к полинуклеотиду, полученному рекомбинантным или синтетическим методом, с набором специфических элементов нуклеиновых кислот, которые позволяют осуществлять транскрипцию конкретной нуклеиновой кислоты в клетке-мишени. Рекомбинантную кассету экспрессии можно включить в плазмиду, хромосому, митохондриальную ДНК, пластидную ДНК, вирус или фрагмент нуклеиновой кислоты. Обычно часть рекомбинантной кассеты экспрессии экспрессионного вектора включает, наряду с другими последовательностями, последовательность нуклеиновой кислоты, предназначенной для транскрипции, и промотор. В некоторых вариантах кассета экспрессии по настоящему изобретению включает полинуклеотидные последовательности, которые кодируют биспецифическое, антигенсвязывающие соединения по настоящему изобретению или их фрагменты.
Термин «эффективное количество» агента означает количество, которое требуется для осуществления физиологического изменения в клетке или ткани, в которые его вводят.
Термин «терапевтически эффективное количество» агента, например, фармацевтической композиции, означает количество, проявляющее эффективность в дозировках и в течение периодов времени, когда достигается требуемый лечебный или профилактический результат. Терапевтически эффективное количество агента, например, устраняет, снижает, замедляет развитие, сводит к минимуму или предотвращает отрицательные действия заболевания.
«Индивидуум» или «субъект» означает млекопитающее. Млекопитающие включают, но, не ограничиваясь только ими, домашних животных (например, крупный рогатый скот, овцы, собаки, кошки и лошади), приматов (например, человек и приматы, не относящиеся к человеку, такие как обезьяны), кроликов и грызунов (например, мыши и крысы). Прежде всего индивидуумом или субъектом является человек.
Термин «фармацевтическая композиция» означает состав, который в указанной форме обеспечивает биологическую активность активного ингредиента, содержащегося в этом составе и проявляющего эффективность, и который не содержит никаких дополнительных компонентов, оказывающих неприемлемую токсичность на организм субъекта, которому вводят этот состав.
«Фармацевтически приемлемый носитель» означает ингредиент в фармацевтической композиции, который не является активным ингредиентом и который не оказывает токсическое действие на субъект. Фармацевтически приемлемый носитель включает, но, не ограничиваясь только ими, буферное вещество, эксципиент, стабилизатор или консервант.
Использованный в данном контексте термин «лечение» (и его грамматические варианты, такие как «лечебный» или «терапия») означают клиническое вмешательство с целью изменить природный ход заболевания у индивидуума, нуждающегося в лечении, которое можно осуществлять либо для профилактики, либо в ходе клинической патологии. Требуемые действия лечения включают, но, не ограничиваясь только ими, профилактику возникновения или рецидива заболевания, снижение интенсивности симптомов, снижение любых прямых или косвенных патологических последствий заболевания, профилактику метастазирования, снижение скорости прогрессирования заболевания, смягчение или облегчение патологического состояния, а также ремиссию или улучшенный прогноз. В некоторых вариантах биспецифическое, связывающее активирующий Т клетки антиген соединение по настоящему изобретению используют для замедления развития заболевания или для замедления прогрессирования заболевания.
Термин «вкладыш в упаковке» означает инструкции, обычно содержащиеся в упаковке терапевтических продуктов, которые содержат информацию о показаниях, применении, дозировке, введении, комбинированной терапии, противопоказаниях и/или предупреждения в отношении применения таких терапевтических продуктов.
Термин "рак", используемый в данном контексте, означает пролиферативные заболевания, такие как лимфомы, лимфоцитарные лейкозы, рак легкого, немелкоклеточный рак легких (NSCL), бронхиолоальвеолярноклеточный рак легкого, рак костей, рак поджелудочной железы, рак кожи, рак головы и шеи, меланома кожи или интраокулярная меланома, рак матки, рак яичника, рак прямой кишки, рак анальной области, рак желудка, рак желудочно-кишечного тракта, карцинома ободочной кишки, рак молочной железы, рак матки, карцинома фалоппиевых труб, карцинома эндометрия, рак шейки матки, карцинома влагалища, рак наружных половых органов, болезнь Ходжкина, рак пищевода, рак тонкой кишки, рак эндокринной системы, рак щитовидной железы, рак паращитовидной железы, рак надпочечника, саркома мягкой ткани, рак уретры, рак полового члена, рак предстательной железы, рак мочевого пузыря, рак почки или уретры, почечно-клеточная карцинома, карцинома почечной лоханки, мезотелиома, печеночно-клеточный рак, рак желчных протоков, новообразования центральной нервной системы (ЦНС), опухоли спинного мозга, глиома стволового тела мозга, мультиформная глиобластома, астроцитомы, шванномы, эпендимоны, медуллобластомы, менингиомы, плоскоклеточная карцинома, аденома гипофиза и саркома Юинга, включая рефракторные формы всех перечисленных выше раков, или комбинация одного или более перечисленных выше раков.
Биспецифическое антитела по настоящему изобретению
В настоящем изобретении предлагаются новые биспецифическое антитела, включающие первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM-3, характеризующиеся предпочтительными перспективными свойствами, такими как продуцируемость, стабильность, связывающая аффинность, биологическая активность, специфическая активность в отношении определенных Т клеток, направленная эффективность и сниженная токсичность. Прежде всего такие биспецифическое антитела связываются с PD1 с высокой аффинностью, а с TIM-3 связываются с низкой аффинностью.
А. Примеры биспецифических антител, которые связываются с PD1 и TIM-3
В одном объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где
указанный первый антигенсвязывающий участок, который специфично связывается с PD1, включает:
VH домен, включающий:
(i) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 37,
(ii) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 38, и
(iii) HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 39, и
VL домен, включающий:
(i) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 40,
(ii) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 41, и
(iii) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 42, и
указанный второй антигенсвязывающий участок, который специфично связывается с TIM3, включает:
(а) VH домен, включающий:
(i) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 1,
(ii) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 2, и
(iii) HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 3, и
VL домен, включающий:
(i) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 4 или SEQ ID NO: 11 или SEQ ID NO: 12,
(ii) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 5, и
(iii) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 6, или
(б) VH домен, включающий:
(i) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 17,
(ii) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 18, и
(iii) HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 19, и
VL домен, включающий:
(i) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 20,
(ii) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 21, и
(iii) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 22, или
(в) VH домен, включающий:
(i) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 29,
(ii) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 30, и
(iii) HVR-H3 включающую аминокислотную последовательность SEQ ID NO: 31, и
VL домен, включающий:
(i) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 32,
(ii) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 33, и
(iii) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 34.
В конкретном объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где
указанный первый антигенсвязывающий участок, который специфично связывается с PD1, включает:
VH домен, включающий:
(i) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 37,
(ii) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 38, и
(iii) HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 39, и
VL домен, включающий:
(i) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 40,
(ii) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 41, и
(iii) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 42, и
указанный второй антигенсвязывающий участок, который специфично связывается с TIM3, включает:
VH домен, включающий:
(i) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 1,
(ii) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 2, и
(iii) HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 3, и
VL домен, включающий:
(i) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 12,
(ii) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 5, и
(iii) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 6.
В другом конкретном объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где
указанный первый антигенсвязывающий участок, который специфично связывается с PD1, включает:
VH домен, включающий:
(i) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 37,
(ii) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 38, и
(iii) HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 39, и
VL домен, включающий:
(i) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 40,
(ii) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 41, и
(iii) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 42, и
указанный второй антигенсвязывающий участок, который специфично связывается с TIM3, включает:
VH домен, включающий:
(i) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 17,
(ii) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 18, и
(iii) HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 19, и
VL домен, включающий:
(i) HVR-L1, включающая аминокислотную последовательность SEQ ID NO: 20,
(ii) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 21, и
(iii) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 22.
В другом объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где
указанный первый антигенсвязывающий участок, который специфично связывается с PD1, включает:
(а) VH домен, включающий аминокислотную последовательность SEQ ID NO: 43, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 44, или
(б) VH домен, включающий аминокислотную последовательность SEQ ID NO: 45, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 46, или
(в) VH домен, включающий аминокислотную последовательность SEQ ID NO: 45, VL домен, включающий аминокислотную последовательность SEQ ID NO: 47, или
(г) VH домен, включающий аминокислотную последовательность SEQ ID NO: 45, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 48, или
(д) VH домен, включающий аминокислотную последовательность SEQ ID NO: 45, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 49,
и указанный второй антигенсвязывающий участок, который специфично связывается с TIM3, включает:
(а) VH домен, включающий аминокислотную последовательность SEQ ID NO: 7, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 8, или
(б) VH домен, включающий аминокислотную последовательность SEQ ID NO: 9, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 10, или
(в) VH домен, включающий аминокислотную последовательность SEQ ID NO: 13, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 14, или
(г) VH домен, включающий аминокислотную последовательность SEQ ID NO: 15, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 16, или
(д) VH домен, включающий аминокислотную последовательность SEQ ID NO: 23, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 24, или
(е) VH домен, включающий аминокислотную последовательность SEQ ID NO: 25, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 26, или
(ж) VH домен, включающий аминокислотную последовательность SEQ ID NO: 27, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 28, или
(з) VH домен, включающий аминокислотную последовательность SEQ ID NO: 35, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 36.
В другом объекте биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, представляет собой антитело человека, гуманизированное или химерное антитело. Предпочтительным является гуманизированное антитело.
В одном объекте настоящего изобретения предлагается гуманизированное биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где
указанный первый антигенсвязывающий участок, который специфично связывается с PD1, включает:
(а) VH домен, включающий аминокислотную последовательность SEQ ID NO: 45, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 46, или
(б) VH домен, включающий аминокислотную последовательность SEQ ID NO: 45, VL домен, включающий аминокислотную последовательность SEQ ID NO: 47, или
(в) VH домен, включающий аминокислотную последовательность SEQ ID NO: 45, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 48, или
(г) VH домен, включающий аминокислотную последовательность SEQ ID NO: 45, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 49,
и указанный второй антигенсвязывающий участок, который специфично связывается с TIM3, включает:
(а) VH домен, включающий аминокислотную последовательность SEQ ID NO: 13, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 14, или
(б) VH домен, включающий аминокислотную последовательность SEQ ID NO: 15, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 16, или
(в) VH домен, включающий аминокислотную последовательность SEQ ID NO: 23, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 24, или
(г) VH домен, включающий аминокислотную последовательность SEQ ID NO: 25, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 26, или
(д) VH домен, включающий аминокислотную последовательность SEQ ID NO: 27, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 28.
В предпочтительном объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где
указанный первый антигенсвязывающий участок, который специфично связывается с PD1, включает VH домен, включающий аминокислотную последовательность SEQ ID NO: 45, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 46,
и указанный второй антигенсвязывающий участок, который специфично связывается с TIM3, включает VH домен, включающий аминокислотную последовательность SEQ ID NO: 15, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 16, или VH домен, включающий аминокислотную последовательность SEQ ID NO: 25, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 26.
Предпочтительно в настоящем изобретении предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где
указанный первый антигенсвязывающий участок, который специфично связывается с PD1, включает:
VH домен, включающий:
(i) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 37,
(ii) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 38, и
(iii) HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 39, и
VL домен, включающий:
(i) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 40,
(ii) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 41, и
(iii) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 42, и
указанный второй антигенсвязывающий участок, который специфично связывается с TIM3, включает VH домен, включающий:
(i) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 17,
(ii) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 18, и
(iii) HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 19, и
VL домен, включающий:
(i) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 20,
(ii) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 21, и
(iii) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 22.
Более конкретно, в настоящем изобретении предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где указанный первый антигенсвязывающий участок, который специфично связывается с PD1, включает VH домен, включающий аминокислотную последовательность SEQ ID NO: 45, и VL домен, включающий аминокислотную последовательность, которую выбирают из группы, включающей SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48 и SEQ ID NO: 49, и указанный второй антигенсвязывающий участок, который специфично связывается с TIM3, включает VH домен, включающий аминокислотную последовательность SEQ ID NO: 25, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 26.
Более конкретно, в настоящем изобретении предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где указанный первый антигенсвязывающий участок, который специфично связывается с PD1, включает VH домен, включающий аминокислотную последовательность SEQ ID NO: 45, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 46, и указанный второй антигенсвязывающий участок, который специфично связывается с TIM3, включает VH домен, включающий аминокислотную последовательность SEQ ID NO: 25, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 26.
В другом объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где указанный первый антигенсвязывающий участок, который специфично связывается с PD1, включает VH домен, включающий аминокислотную последовательность SEQ ID NO: 45, и VL домен, включающий аминокислотную последовательность, которую выбирают из группы, включающей SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48 и SEQ ID NO: 49, и указанный второй антигенсвязывающий участок, который специфично связывается с TIM3, включает VH домен, включающий аминокислотную последовательность SEQ ID NO: 27, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 28.
В одном объекте биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, является двухвалентным. Это означает, что биспецифическое антитело включает первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3 (формат 1+1).
В другом объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где биспецифическое антитело связывается с TIM3 с низкой аффинностью, а с PD1 связывается с высокой аффинностью. В предпочтительном объекте в настоящем изобретении предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где связывающая аффинность биспецифического антитела в отношении TIM3 по меньшей мере в 50 раз ниже по сравнению со связывающей аффинностью в отношении PD1, более предпочтительно по крайней мере в 100 раз ниже по сравнению со связывающей аффинностью в отношении PD1. В одном предпочтительном варианте связывающую аффинность (KD) определяют с использованием поверхностного плазменного резонанса (как описано, например, в примере 12.)
В одном объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где
указанный первый антигенсвязывающий участок, который специфично связывается с PD1 с высокой аффинностью, включает:
(а) VH домен, включающий аминокислотную последовательность SEQ ID NO: 43, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 44, или
(б) VH домен, включающий аминокислотную последовательность SEQ ID NO: 45, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 46, или
(в) VH домен, включающий аминокислотную последовательность SEQ ID NO: 45, VL домен, включающий аминокислотную последовательность SEQ ID NO: 47, или
(г) VH домен, включающий аминокислотную последовательность SEQ ID NO: 45, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 48, или
(д) VH домен, включающий аминокислотную последовательность SEQ ID NO: 45, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 49,
и указанный второй антигенсвязывающий участок, который специфично связывается с TIM3 с низкой аффинностью, включает:
(а) VH домен, включающий аминокислотную последовательность SEQ ID NO: 23, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 24, или
(б) VH домен, включающий аминокислотную последовательность SEQ ID NO: 25, VL домен, включающий аминокислотную последовательность SEQ ID NO: 26, или
(в) VH домен, включающий аминокислотную последовательность SEQ ID NO: 27, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 28.
В особом объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где указанный первый антигенсвязывающий участок, который специфично связывается с PD1 с высокой аффинностью, включает VH домен, включающий аминокислотную последовательность SEQ ID NO: 45, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 46, и указанный второй антигенсвязывающий участок, который специфично связывается с TIM3 с низкой аффинностью, включает VH домен, включающий аминокислотную последовательность SEQ ID NO: 25, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 26.
В другом объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где биспецифическое антитело включает Fc домен, первый Fab фрагмент, включающий антигенсвязывающий участок, который специфично связывается с PD1, и второй Fab фрагмент, включающий антигенсвязывающий участок, который специфично связывается с TIM3.
Предпочтительно Fc домен представляет собой Fc домен IgG, более предпочтительно Fc домен представляет собой Fc домен IgG1 или Fc домен IgG4.
В другом объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, включающее:
(а) первую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 50, первую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 52,
вторую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 51, и вторую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 53, или
(б) первую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 54, первую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 56,
вторую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 55, и вторую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 57, или
(в) первую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 58, первую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 60,
вторую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 59, и вторую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 61, или
(г) первую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 62, первую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 64,
вторую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 63, и вторую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 65, или
(д) первую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 66, первую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 68,
вторую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 67, и вторую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 69.
В предпочтительном объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, включающее:
(а) первую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 50, первую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 52,
вторую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 51, вторую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 53, или
(б) первую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 54, первую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 56,
вторую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 55, вторую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 57, или
(в) первую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 58, первую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 60,
вторую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 59, вторую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 61, или
(г) первую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 62, первую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 64,
вторую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 63, вторую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 65, или
(д) первую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 66, первую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 68,
вторую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 67, вторую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 69.
Более предпочтительно в настоящем изобретении предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, включающее первую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 62, первую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 64, вторую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 63, и вторую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 65.
В другом объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, включающее первую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 66, первую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 68, вторую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 67, и вторую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 69.
В другом объекте биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, является четырехвалентным. В одном объекте биспецифическое антитело включает два антигенсвязывающих участка, которые специфично связываются с PD1, и два антигенсвязывающих участка, которые специфично связываются с TIM3 (формат 2+2).
В одном объекте биспецифическое антитело по настоящему изобретению включает:
(а) две легких цепи и две тяжелых цепи антитела, включающего два Fab фрагмента, включающих антигенсвязывающие участки, которые специфично связываются с TIM3,
(б) два дополнительных Fab фрагмента, включающих антигенсвязывающие участки, которые специфично связываются с PD1, где каждый из указанных дополнительных Fab фрагментов присоединен через пептидный линкер к С-концевому фрагменту тяжелой цепи по п. (а).
В предпочтительном объекте пептидным линкером является (G4S)4. В другом объекте два дополнительных Fab фрагмента, включающих антигенсвязывающие участки, которые специфично связываются с PD1, представляют собой кроссоверные Fab фрагменты, где вариабельные домены VL и VH заменены друг на друга, и VL-CH цепи каждая присоединена через пептидный линкер к С-концевому фрагменту тяжелой цепи по п. (а).
В другом объекте настоящего изобретения предлагается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, включающее:
(а) две тяжелые цепи, каждая из которых включает аминокислотную последовательность SEQ ID NO: 70, первую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 71, и вторую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 72, или
(б) две тяжелые цепи, каждая из которых включает аминокислотную последовательность SEQ ID NO: 73, первую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 74, и вторую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 75, или
(в) две тяжелые цепи, каждая из которых включает аминокислотную последовательность SEQ ID NO: 76, первую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 77, и вторую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 78.
Модификации Fc домена, снижающие связывание с Fc рецептором и/или эффекторную функцию
В некоторых объектах одну или более аминокислотных модификаций можно вводить в Fc область антитела по настоящему изобретению, при этом получают вариант Fc области. Вариант Fc области может включать последовательность Fc области человека (например, Fc область IgG1, IgG2, IgG3 или IgG4 человека), включающую аминокислотную модификацию (например, замену) в одном или более положениях аминокислот.
В приведенном ниже разделе описаны предпочтительные объекты биспецифических антигенсвязывающих молекул по настоящему изобретению, включающих модификации Fc домена, снижающие связывание с Fc рецептором и/или эффекторную функцию. В одном объекте настоящее изобретение относится к биспецифическому антителу, включающему первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где Fc домен содержит одну или более аминокислотных замен, которые снижают связывание с Fc рецептором, прежде всего с Fcγ рецептором. Прежде всего, Fc домен представляет собой подкласс IgG1 человека с аминокислотными мутациями L234A, L235A и P329G (нумерация по EU индексу Кабата).
Fc домен придает благоприятные фармакокинетические свойства биспецифическими антителам по настоящему изобретению, включая продолжительный период полураспада в сыворотке, что способствует хорошему накоплению в ткани-мишени и благоприятному коэффициенту распределения в ткани/крови. В то же время он может, однако, приводить к нежелательному направленному взаимодействию биспецифических антител по настоящему изобретению с клетками, экспрессирующие Fc рецепторы, а не к связыванию с предпочтительными антигенпрезентирующими клетками. Соответственно, в предпочтительных вариантах Fc домен биспецифических антител по настоящему изобретению характеризуется сниженной связывающей аффинностью в отношении Fc рецептора и/или сниженной эффекторной функцией по сравнению с Fc доменом природного IgG, прежде всего Fc доменом IgG1, или Fc доменом IgG4. Более предпочтительно Fc доменом является Fc домен IgG1.
В одном таком объекте Fc домен (или биспецифическая антигенсвязывающая молекула по настоящему изобретению, включающая указанный Fc домен) характеризуется связывающей аффинностью менее 50%, предпочтительно менее 20%, более предпочтительно менее 10% и наиболее предпочтительно менее 5% по сравнению с Fc доменом природного IgG1 (или биспецифической антигенсвязывающей молекулой по настоящему изобретению, включающей Fc домен природного IgG1) и/или характеризуется эффекторной функцией менее 50%, предпочтительно менее 20%, более предпочтительно менее 10% и наиболее предпочтительно менее 5% по сравнению с Fc доменом природного IgG1 (или биспецифической антигенсвязывающей молекулой по настоящему изобретению, включающей Fc домен природного IgG1). В одном объекте Fc домен (или биспецифическая антигенсвязывающая молекула по настоящему изобретению, включающая указанный Fc домен) не связывается в значительной степени с Fc рецептором и/или не индуцирует эффекторную функцию. В предпочтительном объекте Fc рецептор представляет собой Fcγ рецептор. В одном объекте Fc рецептором является Fc рецептор человека. В одном объекте Fc рецептор представляет собой активирующий Fc рецептор. В особом объекте Fc рецептором является активирующий Fcγ рецептор человека, более предпочтительно FcγRIIIa, FcγRI или FcγRIIa рецептор человека, наиболее предпочтительно FcγRIIIa рецептор человека. В одном объекте Fc рецептор представляет собой ингибирующий Fc рецептор. В особом варианте Fc рецептором является ингибирующий Fcγ рецептор человека, более предпочтительно FcγRIIB рецептор человека. В одном объекте эффекторной функцией является одна или более из следующих активностей CDC, ADCC, ADCP и секреция цитокинов. В предпочтительном объекте эффекторной функцией является ADCC. В одном объекте Fc домен характеризуется в значительной степени аналогичной связывающей аффинностью по сравненью с неонатальным Fc рецептором (FcRn), по сравнению с Fc доменом природного IgG1. В значительной степени аналогичное связывание с FcRn достигается в случае, когда Fc домен (или биспецифическая антигенсвязывающая молекула по настоящему изобретению, включающая указанный Fc домен) характеризуется связывающей аффинностью приблизительно более 70%, предпочтительно приблизительно более 80%, более предпочтительно приблизительно более 90% связывающей аффинности Fc домена природного IgG1 (или биспецифической антигенсвязывающей молекулой по настоящему изобретению, включающей Fc домен природного IgG1) по сравнению с FcRn.
В предпочтительном объекте Fc домен конструируют для получения сниженной связывающей аффинности к Fc рецептору и/или сниженной эффекторной функции по сравнению с несконструированным Fc доменом. В предпочтительном объекте Fc домен биспецифической антигенсвязывающей молекулы по настоящему изобретению содержит одну или более аминокислотных мутаций, которые снижают связывающую аффинность Fc домена к Fc рецептору и\или эффекторную функцию. Обычно одна или более одинаковых аминокислотных мутаций присутствуют в каждой из двух субъединиц Fc домена. В одном объекте аминокислотные мутации снижают связывающую аффинность Fc домена к Fc рецептору. В другом объекте аминокислотная мутация снижает связывающую аффинность Fc домена к Fc рецептору по крайней мере в 2 раза, по крайней мере в 5 раз или по крайней мере в 10 раз. В одном объекте биспецифическая антигенсвязывающая молекула по настоящему изобретению, включающая сконструированный Fc домен, характеризуется связывающей аффинностью к Fc рецептору менее 20%, предпочтительно менее 10%, более предпочтительно менее 5% связывающей аффинностью Fc рецептора по сравнению с биспецифическими антителами по настоящему изобретению, включающими несконструированный Fc домен. В предпочтительном объекте Fc рецептор представляет собой Fcγ рецептор. В других объектах Fc рецептором является Fc рецептор человека. В одном объекте Fc рецептор представляет собой ингибирующий Fc рецептор. В особом варианте Fc рецептором является ингибирующий Fcγ рецептор человека, более предпочтительно FcγRIIB рецептор человека. В одном объекте Fc рецептор представляет собой активирующий Fc рецептор. В особом объекте Fc рецептором является активирующий Fcγ рецептор человека, более предпочтительно FcγRIIIa, FcγRI или FcγRIIa рецептор человека, наиболее предпочтительно FcγRIIIa рецептор человека. Предпочтительно снижается связывание к каждому из указанных рецепторов. В некоторых объектах связывающая аффинность к компоненту комплемента, особенно связывающая аффинность к C1q, также снижается. В одном объекте связывающая аффинность к неонатальному Fc рецептору (FcRn) не снижается. В значительной степени аналогичное связывание к FcRn, то есть сохранение связывающей аффинности Fc домена к указанному рецептору, достигается, когда Fc домен (или биспецифическая антигенсвязывающая молекула по настоящему изобретению, включающая указанный Fc домен) проявляет связывающую аффинность на уровне приблизительно более 70% по сравнению со связыванием несконструированной формы Fc домена (или биспецифическая антигенсвязывающей молекулы по настоящему изобретению, включающей указанный Fc домен) с FcRn. Fc домен или биспецифическая антигенсвязывающая молекула по настоящему изобретению, включающая указанный Fc домен, может проявлять аффинность на уровне приблизительно более 80% и даже приблизительно более 90% по сравнению с указанной аффинностью. В некоторых вариантах Fc домен биспецифического антитела по настоящему изобретению конструируют для снижения эффекторной функции по сравнению с несконструированным Fc доменом. Сниженная эффекторная функция включает, но, не ограничиваясь только ими, одно или более следующих свойств: сниженная комплемент зависимая-цитотоксичность (CDC), сниженная антителозависимая клеточная цитотоксичность (ADCC), сниженный антитело-зависимый клеточный фагоцитоз (ADCP), сниженная секреция цитокинов, снижение опосредованного иммунным комплексом захвата антигена антигенпрезентирующими клетками, сниженное связывание с NK клетками, сниженное связывание с макрофагами, сниженное связывание с моноцитами, сниженное связывание с полиморфноядерными клетками, снижение прямой передачи сигналов, индуцирующих апоптоз, сниженное созревание дендритных клеток или сниженный прайминг Т клеток.
Антитела со сниженной эффекторной функцией включают антитела с заменой одного или более следующих остатков 238, 265, 269, 270, 297, 327 и 329 в Fc области (патент США 6737056). Такие Fc мутантные формы включают Fc мутантные формы с заменами двух или более следующих аминокислот в положениях 265, 269, 270, 297 и 327, включая так называемый Fc мутант "DANA" с заменами остатков 265 и 297 на аланин (патент США 7332581). Определенные варианты антител с улучшенным или сниженным связыванием с FcR описаны в работах, например, в патенте США 6737056, заявке WO 2004/056312 и статье Shields R.L. и др., J. Biol. Chem., 276, сс.6591-6604 (2001).
В одном объекте настоящего изобретения Fc домен включает замены аминокислот в положениях Е233, L234, L235, N297, Р331 и Р329. В некоторых объектах Fc домен включает замены аминокислот в положениях L234A и L235A ("LALA"). В одном таком варианте Fc домен представляет собой Fc домен IgG1, предпочтительно Fc домен IgG1 человека. В одном объекте Fc домен включает замену аминокислоты в положении Р329. В более конкретном объекте замены аминокислот включают Р329А или P329G, предпочтительно P329G. В одном варианте Fc домен включает замену аминокислоты в положении Р329, и кроме того замену аминокислоты выбирают из группы, включающей Е233Р, L234A, L235A, L235E, N297A, N297D или P331S. В более предпочтительных вариантах Fc домен включает следующие аминокислотные мутации L234A, L235A и P329G ("P329G LALA"). Комбинация замен "P329G LALA" практически полностью исключает связывание Fcγ рецептора с Fc доменом IgG1, как описано в заявке РСТ № WO 2012/130831 А1. В указанном документе описаны также методы получения таких Fc доменов и методы оценки их свойств, таких как связывание с Fc рецептором или их эффекторные свойства. Таким антителом является IgG1 с мутациями L234A и L235A или с мутациями L234A, L235A и P329G (нумерация по EU индексу Кабата, Kabat и др., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, (1991)).
В одном объекте биспецифическое антитело по настоящему изобретению включает (все положения пронумерованы по EU индексу Кабата) (i) гомодимерную Fc область подкласса IgG1 человека необязательно с мутациями P329G, L234A и L235A, или (ii) гомодимерную Fc область подкласса IgG4 человека необязательно с мутациями P329G, S228P и L235E, или (iii) гомодимерную Fc область подкласса IgG1 человека необязательно с мутациями P329G, L234A, L235A, I253A, Н310А, и Н435А, или необязательно с мутациями P329G, L234A, L235A, Н310А, Н433А, и Y436A, или (iv) гетеродимерную Fc область, где одна полипептидная Fc область включает мутацию T366W, а другая полипептидная Fc область включает мутации T366S, L368A и Y407V, или где одна полипептидная Fc область включает мутации T366W и Y349C, а другая полипептидная Fc область включает мутации T366S, L368A, Y407V и S354C, или где одна полипептидная Fc область включает мутации T366W и S354C, а другая полипептидная Fc область включает мутации T366S, L368A, Y407V и Y349C, или (v) гетеродимерную Fc область подкласса IgG1 человека, где обе полипептидные Fc области включают мутации P329G, L234A и L235A, и одна полипептидная Fc область включает мутацию T366W, а другая полипептидная Fc область включает мутации T366S, L368A и Y407V, или где одна полипептидная Fc область включает мутации T366W и Y349C, а другая полипептидная Fc область включает мутации T366S, L368A, Y407V, и S354C, или где одна полипептидная Fc область включает мутации T366W и S354C, а другая полипептидная Fc область включает мутации T366S, L368A, Y407V и Y349C.
В одном объекте Fc домен представляет собой Fc домен IgG4. В более подробном варианте Fc доменом является Fc домен IgG4, включающий аминокислотную замену в положении S228 (нумерация по Кабату), предпочтительно аминокислотную замену S228P. В другом варианте Fc домен представляет собой Fc домен IgG4, включающий аминокислотные замены L235E, S228P и P329G. Такая аминокислотная замена снижает in vivo обмен Fab плеч в антителах IgG4 (см. Stubenrauch и др.. Drug Metabolism and Disposition, 38, cc. 84-91 (2010)). Таким образом, в одном объекте настоящего изобретения предлагается биспецифическое антитело, включающее (все положения пронумерованы по EU индексу по Кабату) гетеродимерную Fc область подкласса IgG4 человека, где обе полипептидные Fc области включают мутации P329G, S228P и L235E, и одна полипептидная Fc область включает мутацию Т T366W, а другая полипептидная Fc область включает мутации T366S, L368A и Y407V, или где одна полипептидная Fc область включает мутации T366W и Y349C, а другая полипептидная Fc область включает мутации T366S, L368A, Y407V и S354C, или где одна полипептидная Fc область включает мутации T366W и S354C, а другая полипептидная Fc область включает мутации T366S, L368A, Y407V и Y349C.
Антитела с увеличенными временами полураспада и улучшенным связыванием с неонатальным Fc рецептором (FcRn), который отвечает за перенос материнских IgG к плоду (статьи Guyer R.L. и др., J. Immunol., 117, cc. 587-593 (1976) и Kim J.K. и др., J. Immunol., 24, cc. 2429-2434 (1994)), описаны в патенте США 2005/0014934. Такие антитела включают Fc область с одной или более заменами, которые улучшают связывание Fc области с FcRn. Такие Fc варианты включают варианты замен одного или более остатков в Fc области: 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 или 434, например, замену остатка 434 в Fc области 434 (патент США 7371826). См. также документы Duncan A.R. и Winter G., Nature, 322, ее. 738-740 (1988), патенты США 5648260, 5624821 и заявку WO 94/29351, в которых описаны другие примеры вариантов Fc области.
Связывание с Fc рецепторами легко определить, например, с использованием методов ИФА или ППР и с использованием стандартных приборов, таких как BIAcore (GE Healthcare), a Fc рецепторы можно получать методом рекомбинантной экспрессии. В данном контексте описан такой пригодный метод связывания. В другом варианте связывающую аффинность Fc доменов или активирующие клетки биспецифическое антигенсвязывающие молекулы, содержащие Fc домен для Fc рецепторов, можно оценить с использованием известных клеточных линий, экспрессирующих определенные Fc рецепторы, такие как NK клетки человека, экспрессирующие FcγIIIa рецептор человека. Эффекторную функцию Fc домена или биспецифических антител по настоящему изобретению, включающих Fc домен, можно оценивать методами, известными в данной области техники. Пригодный способ измерения ADCC описан в данном контексте. Другие примеры анализов in vitro для оценки ADCC исследуемой молекулы описаны в патенте США №5500362, в статьях Hellstrom и др., Proc. Natl. Acad. Sci. USA, 83, cc. 7059-7063 (1986) и Hellstrom и др., Proc. Natl. Acad. Sci. USA, 82, cc. 1499-1502 (1985), в патенте США №5821337, в статье Bruggemann и др., J. Exp. Med., 166, cc. 1351-1361 (1987). В другом варианте можно использовать нерадиоактивные методы анализа (см., например, нерадиоактивный метод определения цитотоксичности ACTI™ для проточной цитометрии (CellTechnology, Inc. Mountain View, CA), и нерадиоактивный метод определения цитотоксичности CytoTox® 96 (Promega, Madison, WI)). Пригодные эффекторные клетки для таких анализов включают моноядерные клетки периферической крови (РВМС) и природные клетки-киллеры (NK). В другом варианте или дополнительно, активность ADCC исследуемой молекулы можно оценивать in vivo, например, на модели животных, такой как описано в работе Clynes и др., Proc. Natl. Acad. Sci. USA, 95, cc. 652-656 (1998).
Модификации Fc домена, способствующие гетеродимеризации
Биспецифическое антигенсвязывающие молекулы по настоящему изобретению включают различные антигенсвязывающие участки, присоединенные к одной или другой из двух субъединиц Fc домена, вследствие чего две субъединицы Fc домена могут содержать две неидентичные полипептидные цепи. Рекомбинантная коэкспрессия таких полипептидов и последующая димеризация приводят к образованию нескольких возможных комбинаций двух полипептидов. Для улучшения выхода и чистоты биспецифических антител по настоящему изобретению при рекомбинантном продуцировании предпочтительно введение в Fc домен биспецифических антигенсвязывающих молекул по настоящему изобретению модификации, способствующей ассоциации требуемых полипептидов.
Соответственно, предпочтительные объекты настоящего изобретения относятся к биспецифическому антителу, включающему первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где Fc домен содержит модификацию, способствующую ассоциации первой и второй субъединиц Fc домена. Участок наиболее интенсивного белок-белкового взаимодействия между двумя субъединицами Fc домена IgG человека расположен в СН3 домене Fc домена. Таким образом, в одном объекте модификацию осуществляют в СН3 домене Fc домена.
В особом объекте указанная модификация представляет собой, так называемую модификацию "выступ-во-впадину", включающую модификацию "выступ" в одной из двух субъединиц Fc домена и модификацию "впадина" в другой из двух субъединиц Fc домена. Таким образом, настоящее изобретение относится к биспецифическому антителу, включающему первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где первая субъединица Fc домена содержит выступы, а вторая субъединица Fc домена содержит впадины согласно методу выступ-во-впадину. В предпочтительном объекте первая субъединица Fc домена содержит аминокислотные замены S354C и T366W (EU нумерация), и вторая субъединица Fc домена содержит аминокислотные замены Y349C, T366S и Y407V (нумерация по EU индексу Кабата).
Технология выступ-во-впадину описана, например, в патентах США №№5731168, 7695936, работах Ridgway и др., Prot. Eng., 9, cc.617-621 (1996) и Carter, J. Immunol. Meth., 248, cc. 7-15 (2001). Обычно данный способ включает введение выпуклости ("выступа") на границе раздела первого полипептида и соответствующую полость ("впадину") на границе раздела второго полипептида, таким образом, что выпуклость может быть расположена в полости для ускорения образования гетеродимера и затруднения образования гомодимера. Выпуклости конструируют при замене небольших боковых цепей аминокислот на большие по размеру боковые цепи (например, тирозин и триптофан). Компенсирующие полости идентичного или меньшего размера по сравнению с размером выпуклостей создают на поверхности второго полипептида при замене боковых групп аминокислот большого размера на меньшие (например, аланин или треонин).
Соответственно, в одном объекте в СН3 домене первой субъединицы Fc домена биспецифических антигенсвязывающих молекул по настоящему изобретению аминокислотный остаток заменяют на аминокислотный остаток с боковой цепью большего объема, при этом получают выпуклость в СН3 домене первой субъединицы, которая размещается в полости СН3 домена второй субъединицы, и в СН3 домене второй субъединицы Fc домена аминокислотный остаток заменяют на аминокислотный остаток с боковой цепью меньшего объема, при этом получают полость в СН3 домене второй субъединицы, в которой размещается выпуклость в СН3 домене первой субъединицы. Выпуклость и полость можно получать при изменении нуклеиновой кислоты, кодирующей полипептиды, например, например, сайт-специфичным мутагенезом, или пептидным синтезом. В особом объекте в СН3 домене первой субъединицы Fc домена остаток треонина в положении 366 заменен на остаток триптофана (T366W), и в СН3 домене второй субъединицы Fc домена остаток тирозина в положении 407 заменен на остаток валина (Y407V). В одном объекте во второй субъединице Fc домена дополнительно остаток треонина в положении 366 заменен на остаток серина (T366S) и остаток лейцина в положении 368 заменен на остаток аланина (L368A).
В другом объекте в первой субъединице Fc домена дополнительно остаток серина в положении 354 заменен на остаток цистеина (S354C), и во второй субъединице Fc домена дополнительно остаток тирозина в положении 349 заменен на остаток цистеина (Y349C). Введение таких двух остатков цистеина приводит к образованию дисульфидной связи между двумя субъединицами Fc домена, дополнительно стабилизируя димер (Carter J., Immunol. Methods, 248, cc. 7-15 (2001)). В конкретном объекте первая субъединица Fc домена включает аминокислотные замены S354C и T366W (EU нумерация), а вторая субъединица Fc домена включает аминокислотные замены Y349C, T366S и Y407V (нумерация по EU индексу Кабата).
В других вариантах или дополнительно можно использовать другие методики выступ-во-впадину, как описано в ЕР 1870459. В одном варианте мультиспецифическое антитело включает мутации R409D и K370E в СН3 домене "цепь с выступом" и мутации D399K и E357K в СН3 домене "цепь с впадиной" (нумерация по EU индексу Кабата).
В одном объекте биспецифическое антитело включает мутацию T366W в СН3 домене "цепь с выступом" и мутации T366S, L368A и Y407V в СН3 домене "цепь с впадиной" и дополнительно мутации R409D и K370E в СН3 домене "цепь с выступом" и мутации D399K и Е357K в СН3 домене "цепь с впадиной" (нумерация по EU индексу Кабата).
В одном объекте биспецифическое антитело включает мутации Y349C и T366W в одном из двух СН3 доменов и мутации S354C, T366S, L368A и Y407V в другом из двух СН3 доменов, или мультиспецифическое антитело включает мутации Y349C и T366W в одном из двух СН3 доменов и мутации S354C, T366S, L368A и Y407V в другом из двух СН3 доменов, а также дополнительно включает мутации R409D и K370E в СН3 домене "цепь с выступом" и мутации D399K и Е357К в СН3 домене "цепь с впадиной" (нумерация по EU индексу Кабата).
В другом объекте модификация, ускоряющая ассоциацию первой и второй субъединиц Fc домена, включает модификацию, опосредованную электростатическими эффектами, например, как описано в публикации РСТ WO 2009/089004. Обычно данная методика включает замену одного или более аминокислотных остатков на границе раздела двух субъединиц Fc домена на заряженные аминокислотные остатки таким образом, что образование гомодимера становится электростатически невыгодным процессом, а гетеродимеризация становится электростатически выгодным процессом.
Кроме методики "выступ-во-впадину" в данной области техники известны другие методики модификации СН3 доменов тяжелых цепей мультиспецифического антитела для обеспечения гетеродимеризации. Данные методики, особенно описанные в WO 96/27011, WO 98/050431, ЕР 1870459, WO 2007/110205, WO 2007/147901, WO 2009/089004, WO 2010/129304, WO 2011/90754, WO 2011/143545, WO 2012/058768, WO 2013/157954 и WO 2013/096291, рассматриваются в данном контексте в качестве альтернативы методике "выступ-во-впадину" в комбинации с биспецифическими антителом.
В одном объекте в биспецифическом антителе использовали подход, описанный в ЕР 1870459, для обеспечения гетеродимеризации первой тяжелой цепи и второй тяжелой цепи мультиспецифического антитела. Данный подход основан на введении заряженных аминокислот с противоположными зарядами в определенные аминокислотные положения на поверхности раздела СН3/СН3 доменов между первой и второй тяжелыми цепями.
Соответственно, в данном объекте в третичной структуре мультиспефического антитела СН3 домен первой тяжелой цепи и СН3 домен второй тяжелой цепи образуют поверхность раздела, которая расположена между соответствующими СН3 доменами антитела, где соответствующие аминокислотные последовательности СН3 домена первой тяжелой цепи и аминокислотная последовательность СН3 домена второй тяжелой цепи включают набор аминокислот, расположенных на указанной поверхности раздела в третичной структуре антитела, где в составе набора аминокислот, которые расположены на поверхности раздела СН3 домена одной тяжелой цепи, первая аминокислота заменена на положительно заряженную аминокислоту, и в составе набора аминокислот, которые расположены в поверхности раздела СН3 домена другой тяжелой цепи, вторая аминокислота заменена на отрицательно заряженную аминокислоту. Биспецифическое антитело по данному объекту в данном контексте также обозначают как "СН3(+/-)-сконструированное биспецифическое антитело" (где знак "+/-" означает противоположно заряженные аминокислоты, введенные в соответствующие СН3 домены).
В одном объекте в СН3(+/-)-сконструированном биспецифическом антителе положительно заряженную аминокислоту выбирают из K, R и Н, и отрицательно заряженную аминокислоту выбирают из Е или D.
В одном объекте в СН3(+/-)-сконструированном биспецифическом антителе положительно заряженную аминокислоту выбирают из K и R, и отрицательно заряженную аминокислоту выбирают из Е или D.
В одном объекте в СН3(+/-)-сконструированном биспецифическом антителе положительно заряженной аминокислотой является K, и отрицательно заряженной аминокислотой является Е.
В одном объекте в СН3(+/-)-сконструированном биспецифическом антителе в СН3 домене одной тяжелой цепи аминокислота R в положении 409 заменена на D и аминокислота К заменена на Е, и в СН3 домене другой тяжелой цепи аминокислота D в положении 399 заменена на К и аминокислота Е в положении 357 заменена на К (нумерация по EU индексу Кабата).
В одном объекте использовали подход, описанный в заявке WO 2013/157953, для обеспечения гетеродимеризации первой тяжелой цепи и второй тяжелой цепи мультиспецифического антитела. В одном варианте в СН3 домене одной тяжелой цепи аминокислота Т в положении 366 заменена на К, и в СН3 домене другой тяжелой цепи аминокислота L в положении 351 заменена на D (нумерация по EU индексу Кабата). В другом варианте в СН3 домене одной тяжелой цепи аминокислота Т в положении 366 заменена на К, и аминокислота L в положении 351 заменена на К, а в СН3 домене другой тяжелой цепи аминокислота L в положении 351 заменена на К (нумерация по EU индексу Кабата).
В другом варианте в СН3 домене одной тяжелой цепи аминокислота Т в положении 366 заменена на К, и аминокислота L в положении 351 заменена на К и в СН3 домене другой тяжелой цепи аминокислота L в положении 351 заменена на D (нумерация по EU индексу Кабата). Кроме того, по крайней мере одна из следующих замен включена в СН3 домен другой тяжелой цепи: аминокислота Y в положении 349 заменена на Е, аминокислота Y в положении 349 заменена на D и аминокислота L в положении 368 заменена на Е (нумерация по EU индексу Кабата). В одном варианте аминокислота L в положении 368 заменена на Е (нумерация по EU индексу Кабату).
В одном объекте использовали подход, описанный в заявке WO 2012/058768 для обеспечения гетеродимеризации первой тяжелой цепи и второй тяжелой цепи мультиспецифического антитела. В одном объекте в СН3 домене одной тяжелой цепи аминокислота L в положении 351 заменена на Y и аминокислота Y в положении 407 заменена на А, и в СН3 домене другой тяжелой цепи аминокислота Т в положении 366 заменена на А и аминокислота К в положении 409 заменена на F (нумерация по EU индексу Кабата). В другом варианте кроме упомянутых выше замен в СН3 домене другой тяжелой цепи по крайней мере одна из аминокислот в положениях 411 (исходно Т), 399 (исходно D), 400 (исходно S), 405 (исходно F), 390 (исходно N) и 392 (исходно К) заменена (нумерация по EU индексу по Кабату). Предпочтительными заменами являются:
- замена аминокислоты Т в положении 411 на аминокислоту, выбранную из N, R, Q, К, D, Е и W (нумерация по EU индексу Кабата),
- замена аминокислоты D в положении 399 на аминокислоту, выбранную из R, W, Y и K (нумерация по EU индексу Кабата),
- замена аминокислоты S в положении 400 на аминокислоту, выбранную из Е, D, R и K (нумерация по EU индексу Кабата),
- замена аминокислоты F в положении 405 на аминокислоту, выбранную из I, М, Т, S, V и W (нумерация по EU индексу Кабата),
- замена аминокислоты N в положении 390 на аминокислоту, выбранную из R, K и D (нумерация по EU индексу Кабата) и
- замена аминокислоты K в положении 392 на аминокислоту, выбранную из V, М, R, L, F и Е (нумерация по EU индексу Кабата).
В другом объекте биспецифическое антитело конструируют согласно заявке WO 2012/058768), то есть в СН3 домене одной тяжелой цепи аминокислота L в положении 351 заменена на Y и аминокислота Y в положении 407 заменена на А, и в СН3 домене другой тяжелой цепи аминокислота Т в положении 366 заменена на V и аминокислота K в положении 409 заменена на F (нумерация по EU индексу Кабата). В другом варианте осуществления мультиспецифического антитела в СН3 домене одной тяжелой цепи аминокислота Y в положении 407 заменена на А, и в СН3 домене другой тяжелой цепи аминокислота Т в положении 366 заменена на А и аминокислота K в положении 409 заменена на F (нумерация по EU индексу Кабата). В последнем упомянутом варианте в СН3 домене одной тяжелой цепи аминокислота K в положении 392 заменена на Е, и аминокислота Т в положении 411 заменена на Е, и аминокислота D в положении 399 заменена на R и аминокислота S в положении 400 заменена на R (нумерация по EU индексу Кабата).
В одном объекте использовали подход, описанный в заявке WO 2011/143545, для обеспечения гетеродимеризации первой тяжелой цепи и второй тяжелой цепи мультиспецифического антитела. В одном объекте аминокислотные модификации в СН3 доменах обеих тяжелых цепей вводили в положениях 368 и/или 409 (нумерация по EU индексу Кабата).
В одном объекте использовали подход, описанный в заявке WO 2011/090762, для обеспечения гетеродимеризации первой тяжелой цепи и второй тяжелой цепи мультиспецифического антитела. В заявке WO 2011/090762 описаны аминокислотные модификации согласно методике "выступ-во-впадину" (КМ). В одном варианте в CH3 домене одной тяжелой цепи аминокислота Т в положении 366 заменена на W, и в СН3 домене другой тяжелой цепи аминокислота Y в положении 407 заменена на А (нумерация по EU индексу Кабата). В другом варианте в СН3 домене одной тяжелой цепи аминокислота Т в положении 366 заменена на Y, и в СН3 домене другой тяжелой цепи аминокислота Y в положении 407 заменена на Т (нумерация по EU индексу Кабата).
В одном объекте использовали подход, описанный в заявке WO 2009/089004 для обеспечения гетеродимеризации первой тяжелой цепи и второй тяжелой цепи мультиспецифического антитела. В одном варианте в СН3 домене одной тяжелой цепи аминокислота K или N в положении 392 заменена на отрицательно заряженную аминокислоту (в одном варианте на Е или D, в одном предпочтительном варианте на D), и в СН3 домене другой тяжелой цепи аминокислота D в положении 399, аминокислота Е или D в положении 356 или аминокислота Е в положении 357 заменены на положительно заряженную аминокислоту (в одном варианте на K или R, в одном предпочтительном варианте на K, в одном предпочтительном варианте аминокислоты в положениях 399 или 356 заменены на K) (нумерация по EU индексу Кабата). В одном другом варианте кроме упомянутых выше замен в СН3 домене одной тяжелой цепи аминокислота K или R в положении 409 заменена на отрицательно заряженную аминокислоту (в одном варианте на Е или D, в другом предпочтительном варианте на D) (нумерация по EU индексу Кабата). В еще одном объекте, кроме упомянутых выше замен в СН3 домене одной тяжелой цепи, аминокислота K в положении 439 и/или аминокислота K в положении 370 независимо друг от друга заменены на отрицательно заряженную аминокислоту (в одном предпочтительном варианте на Е на D, в другом предпочтительном варианте на D) (нумерация по EU индексу Кабата).
В одном объекте использовали подход, описанный в заявке WO 2007/147901 для обеспечения гетеродимеризации первой тяжелой цепи и второй тяжелой цепи мультиспецифического антитела. В одном варианте в СН3 домене одной тяжелой цепи аминокислота K в положении 253 заменена на Е, аминокислота D в положении 282 заменена на K и аминокислота K в положении 322 заменена на D, и в СН3 домене другой тяжелой цепи аминокислота D в положении 239 заменена на K, аминокислота Е в положении 240 заменена на K и аминокислота K в положении 292 заменена на D (нумерация по EU индексу Кабата).
С-концевой фрагмент тяжелой цепи биспецифического антитела, как описано в данном контексте, может представлять собой полноразмерный С-концевой фрагмент, содержащий аминокислотные остатки PGK. С-концевой фрагмент тяжелый цепи может представлять собой укороченный С-концевой фрагмент, из которого были удалены одна или две С-концевые аминокислоты. В одном предпочтительном варианте С-концевой фрагмент тяжелой цепи представляет собой укороченный С-концевой фрагмент, содержащий аминокислотные остатки PG.
В одном из всех объектов, описанных в данном контексте, биспецифическое антитело, включающее тяжелую цепь, включающую С-концевой СН3 домен, как описано в данном контексте, включает С-концевой дипептид глицин-лизин (G446 и K447, нумерация по EU индексу Кабата). В одном из всех объектов, описанных в данном контексте, биспецифическое антитело, включающее тяжелую цепь, включающую С-концевой СН3 домен, как описано в данном контексте, включает С-концевой остаток глицина (G446, нумерация по EU индексу Кабата).
Модификации Fab доменов
В одном объекте настоящее изобретение относится к биспецифическому антителу, включающему первый Fab фрагмент, который специфично связывается с PD1, и второй Fab фрагмент, который специфично связывается с TIM3, где в одном из Fab фрагментов заменены друг на друга либо вариабельные домены VH и VL, либо консервативные домены СН1 и CL. Биспецифическое антитела получают по методике Crossmab.
Мультиспецифические антитела с заменой/обменом доменов в одном связывающем плече (CrossMabVH-VL или CrossMabCH-CL) подробно описаны в заявке WO 2009/080252 и работе Schaefer W. и др., PNAS, 108, Icc. 1187-1191 (2011). Они явно снижают образование побочных продуктов, которое связано с ошибочным спариванием легкой цепи по отношению к первому антигену с неправильной тяжелой цепью по отношению ко второму антигену (по сравнению с подходами без указанного обмена доменов).
В предпочтительном объекте настоящее изобретение относится к биспецифическому антителу, включающему первый Fab фрагмент, который специфично связывается с PD1, и второй Fab фрагмент, который специфично связывается с TIM3, где в одном из Fab фрагментов вариабельные домены VH и VL заменены друг на друга таким образом, что VH домен является частью легкой цепи, а VL домен является частью тяжелой цепи. В предпочтительном объекте биспецифическими антителом является антитело, в котором первый Fab фрагмент, включающий антигенсвязывающий участок, который специфично связывается с PD1, вариабельные домены VL и VH заменены друг на друга.
В одном объекте для дополнительного улучшения правильного спаривания биспецифическое антитело, включающее первый Fab фрагмент, который специфично связывается с PD1, и второй Fab фрагмент, который специфично связывается с TIM3, могут содержать различные заряженные аминокислотные замены (так называемые «заряженные остатки»). Такие модификации включены в перекрестные или неперекрестные СН1 и CL домены.
В предпочтительном объекте настоящее изобретение относится к биспецифическому антителу, включающему первый Fab фрагмент, который специфично связывается с PD1, и второй Fab фрагмент, который специфично связывается с TIM3, где в одном из Fab фрагментов в консервативном CL домене аминокислота в положении 124 независимо заменена на лизин (К), аргинин (R) или гистидин (Н) (нумерация согласно EU индекса Кабата), и в консервативном СН1 домене аминокислоты в положениях 147 и 213 независимо заменены на глутаминовую кислоту (Е) или аспарагиновую кислоту (D) (нумерация согласно EU индексу Кабата). В предпочтительном объекте биспецифическими антителом является антитело, где во втором Fab фрагменте, включающем антигенсвязывающий участок, специфично связывающийся с TIM3, в консервативном CL домене аминокислота в положении 124 независимо заменена на лизин (К), аргинин (R) или гистидин (Н) (нумерация согласно EU индекса Кабата), и в консервативном СН1 домене аминокислоты в положениях 147 и 213 независимо заменены на глутаминовую кислоту (Е) или аспарагиновую кислоту (D) (нумерация согласно EU индексу Кабатау).
В предпочтительном объекте настоящее изобретение относится к биспецифическому антителу, включающему первый Fab фрагмент, который специфично связывается с PD1, и второй Fab фрагмент, который специфично связывается с TIM3, где в одном из CL доменов аминокислота в положении 123 (нумерация по EU индексу) заменена на аргинин (R) и аминокислота в положении 124 (нумерация по EU индексу) заменена на лизин (K) и где в одном из СН1 доменов аминокислоты в положениях 147 (нумерация по EU индексу) и 213 (нумерация по EU индексу) заменена на глутаминовую кислоту (Е). В предпочтительном объекте биспецифическими антителом является антитело, в котором во втором Fab фрагменте, включающем антигенсвязывающий участок, специфично связывающийся с TIM3, аминокислота в положении 123 (нумерация по EU индексу) заменена на аргинин (R) и аминокислота в положении 124 (нумерация по EU индексу) заменена на лизин (K) и где в одном из СН1 доменов аминокислоты в положении 147 (нумерация по EU индексу) и в положении 213 (нумерация по EU индексу) заменена на глутаминовую кислоту (Е).
В другом объекте биспецифическое антитело представляет собой двухвалентное антитело, включающее:
а) первую легкую цепь и первую тяжелую цепь антитела, специфично связывающегося с первым антигеном, и
б) вторую легкую цепь и вторую тяжелую цепь антитела, специфично связывающегося со вторым антигеном, где вариабельные домены VL и VH второй легкой цепи и второй тяжелой цепи заменены друг на друга.
Антитело по п. а) не содержит модификаций, как описано в п. в), а тяжелая цепь и легкая цепь по п. а) являются изолированными цепями.
В антителе по п. б) в легкой цепи вариабельный домен VL легкой цепи заменен на вариабельный домен VH тяжелой цепи указанного антитела, и вариабельный домен VH тяжелой цепи заменен на вариабельный домен VL легкой цепи указанного антитела.
В одном объекте (i) в консервативном домене CL первой легкой цепи по п. а) аминокислота в положении 124 (нумерация по Кабату) заменена на положительно заряженную аминокислоту, и где в консервативном домене СН1 первой тяжелой цепи по п. а) аминокислота в положении 147 или аминокислота в положении 213 (нумерация согласно EU индекса Кабата) заменена на отрицательно заряженную кислоту, и (ii) в консервативном домене CL второй легкой цепи по п. б) аминокислота в положении 124 (нумерация по Кабату) заменена на положительно заряженную кислоту, и где в консервативном домене СН1 второй тяжелой кислоты по п. б) аминокислота в положении 147 или аминокислота в положении 213 (нумерация по EU индексу Кабата) заменена на отрицательно заряженную аминокислоту.
В другом объекте (i) в консервативном домене CL первой легкой цепи по п. а) аминокислота в положении 124 заменена независимо на лизин (K), аргинин (R) или гистидин (Н) (нумерация по Кабату) (в одном предпочтительном варианте заменена независимо на лизин (К) или аргинин (R)), и где в консервативном домене СН1 первой тяжелой цепи по п. а) аминокислота в положении 147 или аминокислота в положении 213 заменена независимо на глутаминовую кислоту (Е) или аспарагиновую кислоту (D) (нумерация по EU индексу Кабата), или (ii) в консервативном домене CL второй легкой цепи по п. б) аминокислота в положении 124 заменена независимо на лизин (K), аргинин (R) или гистидин (Н) (нумерация по Кабату) (в одном предпочтительном варианте независимо на лизин (К) или аргинин (R)), и где в консервативном домене СН1 второй легкой цепи по п. б) аминокислота в положении 147 или аминокислота в положении 213 заменена независимо на глутаминовую кислоту (Е) или аспарагиновую кислоту (D) (нумерация согласно EU индексу Кабата).
В одном объекте в консервативном домене CL второй тяжелой цепи аминокислоты в положениях 124 и 123 заменены на К (нумерация согласно индексу EU Кабата).
В одном объекте в консервативном домене CL второй тяжелой цепи аминокислота в положении 123 заменена на R и аминокислота в положении 124 заменена на К (нумерация согласно индексу EU Кабата).
В одном объекте в консервативном домене СН1 второй легкой цепи аминокислоты в положениях 147 и 213 заменены на Е (нумерация согласно индексу EU Кабата).
В одном объекте в консервативном домене CL первой легкой цепи аминокислоты в положениях 124 и 123 заменены на К, и в консервативном домене СН1 первой тяжелой цепи аминокислоты в положениях 147 и 213 заменены на Е (нумерация согласно индексу EU Кабата).
В одном объекте в консервативном домене CL первой легкой цепи аминокислота в положении 123 заменена на R и аминокислота в положении 124 заменена на К, и в консервативном домене СР1 первой тяжелой цепи обе аминокислоты в положениях 147 и 213 заменены на Е (нумерация согласно индексу EU Кабата).
В одном объекте в консервативном домене CL второй тяжелой цепи аминокислоты в положениях 124 и 123 заменены на К, и где в консервативном домене СН1 второй легкой цепи аминокислоты в положениях 147 и 213 заменены на Е, и в вариабельном домене VL первой легкой цепи аминокислота в положении 38 заменена на К, и в вариабельном домене VH первой тяжелой цепи аминокислота в положении 39 заменена на Е, и в вариабельном домене VL второй тяжелой цепи аминокислота в положении 38 заменена на К, и в вариабельном домене VH второй легкой цепи аминокислота в положении 39 заменена на Е (нумерация согласно индексу EU Кабата).
В одном объекте биспецифическими антителом является двухвалентное антитело, включающее
а) первую легкую цепь и первую тяжелую цепь антитела, специфично связывающегося с первым антигеном, и
б) вторую легкую цепь и вторую тяжелую цепь антитела, специфично связывающегося со вторым антигеном, где вариабельные домены VL и VH второй легкой цепи и второй тяжелой цепи заменены друг на друга, и где консервативные домены CL и СН1 второй легкой цепи и второй тяжелой цепи заменены друг на друга.
Антитело по п. а) не содержит модификаций, описанных в п. б), и тяжелая цепь и легкая цепь по п. а) представляют собой изолированные цепи. В антителе по п. б) в легкой цепи вариабельный домен VL легкой цепи заменен на вариабельный домен VH тяжелой цепи указанного антитела, и консервативный домен CL легкой цепи заменен на консервативный домен СН1 тяжелой цепи указанного антитела, и вариабельный домен VH тяжелой цепи заменен на вариабельный домен VL легкой цепи, и консервативный домен СН1 тяжелой цепи заменен на консервативный домен CL легкой цепи указанного антитела.
В одном объекте биспецифическим антителом является двухвалентное антитело, включающее:
а) первую легкую цепь и первую тяжелую цепь антитела, специфично связывающегося с первым антигеном, и
б) вторую легкую цепь и вторую тяжелую цепь антитела, специфично связывающегося со вторым антигеном, где консервативные домены CL и СН1 второй легкой цепи и второй тяжелой цепи заменены друг на друга.
Антитело по п. а) не содержит модификаций, описанных в п. б), и тяжелая цепь и легкая цепь по п. а) представляют собой изолированные цепи. В антителе по п. б) консервативный домен CL легкой цепи заменен на консервативный домен СН1 тяжелой цепи указанного антитела, и консервативный домен СН1 тяжелой цепи заменен на консервативный домен CL легкой цепи указанного антитела.
В одном объекте мультиспецифическим антителом является мультиспецифическое антитело, включающее:
а) полноразмерное антитело, специфично связывающееся с первым антигеном и состоящее из двух тяжелых цепей антитела и двух легких цепей антитела, и
б) один, два, три или четыре одноцепочечных Fab фрагментов, специфично связывающихся с одним-четырьмя другими антигенами (то есть со вторым и/или третьим и/или четвертым и/или пятым антигеном, предпочтительно специфично связывающихся с одним другим антигеном, то есть со вторым антигеном),
где указанные одноцепочечные Fab фрагменты по п. б) присоединены к полноразмерному антителу по п. а) через пептидный линкер к С- или N-концевому фрагменту тяжелой или легкой цепи указанного полноразмерного антитела.
В одном объекте один или два идентичных одноцепочечных Fab фрагмента, связывающихся со вторым антигеном, присоединены к полноразмерному антителу через пептидный линкер к С-концевому фрагменту тяжелой или легкой цепи указанного полноразмерного антитела.
В одном объекте один или два идентичных одноцепочечных Fab фрагмента, связывающихся со вторым антигеном, присоединены к полноразмерному антителу через пептидный линкер к С-концевому фрагменту тяжелых цепей указанного полноразмерного антитела.
В одном объекте один или два идентичных одноцепочечных Fab фрагмента, связывающихся со вторым антигеном, присоединены к полноразмерному антителу через пептидный линкер к С-концевому фрагменту легких цепей указанного полноразмерного антитела.
В одном объекте один или два идентичных одноцепочечных Fab фрагмента, связывающихся со вторым антигеном, присоединены к полноразмерному антителу через пептидный линкер к С-концевому фрагменту каждой тяжелой или легкой цепи указанного полноразмерного антитела.
В одном объекте один или два идентичных одноцепочечных Fab фрагмента, связывающихся со вторым антигеном, присоединены к полноразмерному антителу через пептидный линкер к С-концевому фрагменту каждой тяжелой цепи указанного полноразмерного антитела.
В одном объекте один или два идентичных одноцепочечных Fab фрагмента, связывающихся со вторым антигеном, присоединены к полноразмерному антителу через пептидный линкер к С-концевому фрагменту каждой легкой цепи указанного полноразмерного антитела.
В одном объекте биспецифическое антитело является трехвалентным антителом, включающим:
а) полноразмерное антитело, специфично связывающееся с первым антигеном и содержащее две тяжелые цепи антитела и две легкие цепи антитела,
б) первый полипептид, состоящий из
ба) вариабельного домена тяжелой цепи (VH) антитела, или
бб) вариабельного домена тяжелой цепи (VH) антитела и консервативного домена 1 (СН1) антитела,
где указанный первый полипептид присоединен к N-концевому фрагменту его VH домена через пептидный линкер к С-концевому фрагменту одной из двух тяжелых цепей указанного полноразмерного антитела,
в) второй полипептид, состоящий из
ва) вариабельного домена легкой цепи (VL) антитела, или
вб) вариабельного домена легкой цепи (VL) антитела и консервативного домена легкой цепи (CL) антитела, и
где указанный второй полипептид присоединен к N-концевому фрагменту его VL домена через пептидный линкер к С-концевому фрагменту другой из двух тяжелых цепей указанного полноразмерного антитела,
где вариабельный домен тяжелой цепи (VH) антитела первого полипептида и вариабельный домен легкой цепи (VL) антитела второго полипептида вместе образуют антигенсвязывающий участок, специфично связывающийся со вторым антигеном.
В одном объекте вариабельный домен тяжелой цепи (VH) антитела полипептида по п. б) и вариабельный домен легкой цепи (VL) антитела полипептида по п. в) соединены и стабилизированы через межцепную дисульфидную связь между следующими положениями:
(i) положение 44 вариабельного домена тяжелой цепи и положение 100 вариабельного домена легкой цепи, или
(ii) положение 105 вариабельного домена тяжелой цепи и положение 43 вариабельного домена легкой цепи, или
(iii) положение 101 вариабельного домена тяжелой цепи и положение 100 вариабельного домена легкой цепи (нумерация по EU индексу Кабата).
Методики введения неприродных дисульфидных связей для стабилизации описаны, например, в документах WO 94/029350, Rajagopal V. и др., Prot. Eng., сс. 1453-1459 (1997), Kobayashi Н. и др., Nucl. Med. Biol., 25, сс. 387-393 (1998) и Schmidt М. и др., Oncogene, 18, сс. 1711-1721 (1999). В одном варианте необязательная дисульфидная связь между вариабельными доменами полипептидов по п. б) и п. в) образована между вариабельным доменом тяжелой цепи в положении 44 и вариабельным доменом легкой цепи в положении 100. В одном варианте необязательная дисульфидная связь между вариабельными доменами полипептидов по п. б) и п. в) образована между вариабельным доменом тяжелой цепи в положении 105 и вариабельным доменом легкой цепи в положении 43 (нумерация по Кабату). В одном варианте предпочтительным является трехвалентное биспецифическое антитело, не содержащее указанной необязательной дисульфильфидной стабилизации между VH и VL доменами одноцепочечных Fab фрагментов.
В одном объекте биспецифическое антитело является триспецифическим или тетраспецифическим антителом, включающим:
а) первую легкую цепь и первую тяжелую цепь полноразмерного антитела, специфично связывающегося с первым антигеном, и
б) вторую (модифицированную) легкую цепь и вторую (модифицированную) тяжелую цепь полноразмерного антитела, которое специфично связывается со вторым антигеном, где вариабельные домены VL и VH заменены друг на друга и/или где консервативные домены CL и СН1 заменены друг на друга, и
в) где от одного до четырех антигенсвязывающих пептидов, которые специфично связываются с одним или двумя другими антигенами (то есть с третьим и/или четвертым антигеном), присоединены через пептидный линкер к С- или N-концевому фрагменту легких цепей или тяжелых цепей по п. а) и/или п. б).
Антитело по п. а) не содержит модификаций, описанных в п. б), а тяжелая и легкая цепь по п. а) представляют собой изолированные цепи.
В одном объекте триспецифическое или тетраспецифическое антитело включает один или два антигенсвязывающих пептидов по п. в), которые специфично связываются с одним или двумя другими антигенами.
В одном объекте антигенсвязывающие пептиды выбирают из группы, состоящей из scFv фрагмента и scFab фрагмента.
В одном объекте антигенсвязывающие пептиды представляют собой scFv фрагменты.
В одном объекте антигенсвязывающие пептиды представляют собой scFab фрагменты.
В одном объекте антигенсвязывающие пептиды присоединены к С-концевому фрагменту тяжелых цепей по п. а) и/или п. б).
В одном объекте три специфическое или тетра специфическое антитело включает один или два антигенсвязывающих пептида по п. в), которые специфично связываются с одним другим антигеном.
В одном объекте три специфическое или тетра специфическое антитело включает два идентичных антигенсвязывающих пептида по п. в), которые специфично связываются с третьим антигеном. В одном предпочтительном варианте такие два идентичные антигенсвязывающие пептиды оба связаны через один и тот же пептидный линкер к С-концевому фрагменту тяжелых цепей по п. а) или п. б). В одном предпочтительном варианте два идентичных антигенсвязывающих пептида являются scFv фрагментом или scFab фрагментом.
В одном объекте три специфическое или тетра специфическое антитело включает два антигенсвязывающих пептида по п. в), которые специфично связываются с третьим и четвертым антигеном. В одном предпочтительном варианте такие два антигенсвязывающие пептиды оба присоединены через один и тот же пептидный линкер к С-концевому фрагменту тяжелых цепей по п. а) или п. б). В одном предпочтительном варианте два идентичных антигенсвязывающих пептида являются scFv фрагментом или scFab фрагментом.
В одном объекте биспецифическое антитело является биспецифическим тетравалентным антителом, включающим:
а) две легкие цепи и две тяжелые цепи антитела, которое специфично связывается с первым антигеном (и включает два Fab фрагмента),
б) два дополнительных Fab фрагмента антитела, которое специфично связывается со вторым антигеном, где указанные Fab фрагменты оба присоединены через пептидный линкер к С- или N-концевому фрагменту тяжелых цепей по п. а), и
где в Fab фрагментах осуществлены следующие модификации:
(i) в обоих Fab фрагментах по п. а), или в обоих Fab фрагментах по п. б), вариабельные домены VL и VH заменены друг на друга и/или консервативные домены CL и СН1 заменены друг на друга, или
(ii) в обоих Fab фрагментах по п. а) вариабельные домены VL и VH заменены друг на друга, и консервативные домены CL и СН1 заменены друг на друга, и в обоих Fab фрагментах по п. б) вариабельные домены VL и VH заменены друг на друга, или консервативные домены CL и СН1 заменены друг на друга, или
(iii) в обоих Fab фрагментах по п. а) вариабельные домены VL и VH заменены друг на друга, или консервативные домены CL и СН1 заменены друг на друга, и в обоих Fab фрагментах по п. б) вариабельные домены VL и VH заменены друг на друга, и консервативные домены CL и СН1 заменены друг на друга, или
(iv) в обоих Fab фрагментах по п. а) вариабельные домены VL и VH заменены друг на друга, и в обоих Fab фрагментах по п. б) консервативные домены CL и СН1 заменены друг на друга, или
(v) в обоих Fab фрагментах по п. а) консервативные домены CL и СН1 заменены друг на друга, и в обоих Fab фрагментах по п. б) вариабельные домены VL и VH заменены друг на друга.
В одном объекте указанные дополнительные Fab фрагменты оба присоединены через пептидный линкер к С-концевому фрагменту тяжелых цепей по п. а) или к N-концевому фрагменту по п. а).
В одном объекте указанные дополнительные Fab фрагменты оба присоединены через пептидный линкер к С-концевому фрагменту тяжелых цепей по п. а).
В одном объекте указанные дополнительные Fab фрагменты оба присоединены через пептидный линкер к N-концевому фрагменту тяжелых цепей по п. а).
В одном объекте в Fab фрагментах осуществлены следующие модификации: в обоих Fab фрагментах по п. а), или в обоих Fab фрагментах по п. б), вариабельные домены VL и VH заменены друг на друга, и/или консервативные домены CL и СН1 заменены друг на друга.
В одном объекте биспецифическое антитело является тетравалентным антителом, включающим:
а) (модифицированную) тяжелую цепь первого антитела, специфично связывающегося с первым антигеном и включающим первую пару VH-CH1 доменов, где к С-концевому фрагменту указанной тяжелой цепи присоединен через пептидный линкер N-концевой фрагмент второй пары VH-CH1 доменов,
б) две легкие цепи указанного первого антитела по п. а),
в) (модифицированную) тяжелую цепь второго антитела, специфично связывающегося со вторым антигеном и включающим первую пару VH-CL доменов, где к С-концевому фрагменту указанной тяжелой цепи присоединен через пептидный линкер N-концевой фрагмент второй пары VH-CL доменов,
г) две (модифицированные) легкие цепи указанного второго антитела по п. в), каждая из которых включает пару CL-CH1 доменов.
В одном объекте биспецифическое антитело включает:
а) тяжелую цепь и легкую цепь первого полноразмерного антитела, специфично связывающегося с первым антигеном, и
б) тяжелую цепь и легкую цепь второго полноразмерного антитела, которое специфично связывается со вторым антигеном, где N-концевой фрагмент тяжелой цепи присоединен к С-концевому фрагменту легкой цепи через пептидный мостик.
Антитело по п. а) не содержит модификаций, описанных в п. б), и тяжелая цепь и легкая цепь представляют собой изолированные цепи.
В одном объекте биспецифическое антитело включает
а) полноразмерное антитело, специфично связывающееся с первым антигеном и содержащее две тяжелые цепи антитела и две легкие цепи антитела, и
б) Fv фрагмент, специфично связывающийся со вторым антигеном, включающим VH2 домен и VL2 домен, где оба домена соединены друг с другом через дисульфидную связь,
где только либо VH2 домен, либо VL2 домен присоединен через пептидный линкер к тяжелой или легкой цепи полноразмерного антитела, специфично связывающегося с первым антигеном.
В биспецифическом антителе тяжелые цепи и легкие цепи по п. а) представляют собой изолированные цепи.
В одном объекте домены, отличные от VH2 домена или VL2 домена, не связаны через пептидный линкер с тяжелой или легкой цепью полноразмерного антитела, специфично связывающегося с первым антигеном.
Во всех объектах, как описано в данном контексте, первая легкая цепь включает VL домен и CL домен, и первая тяжелая цепь включает VH домен, СН1 домен, шарнирную область, СН2 домен и СН3 домен.
В одном объекте биспецифическое антитело представляет собой трехвалентное антитело, включающее:
а) два Fab фрагмента, специфично связывающихся с первым антигеном,
б) один кроссоверный Fab фрагмент, специфично связывающийся со вторым антигеном, в котором СН1 и CL домены заменены друг на друга,
в) одну Fc-область, включающую первую тяжелую цепь Fc области, а также Fc область первой тяжелой цепи и Fc область второй тяжелой цепи,
где С-концевой фрагмент СН1 доменов двух Fab фрагментов присоединены к N-концевому фрагменту полипептидов Fc области тяжелой цепи, и где С-концевой фрагмент CL домена кроссоверного Fab фрагмента присоединен к N-концевому фрагменту VH домена одного из Fab фрагментов.
В одном объекте биспецифическое антитело представляет собой трехвалентное антитело, включающее %:
а) два Fab фрагмента, специфично связывающихся с первым антигеном,
б) один кроссоверный Fab фрагмент, специфично связывающийся со вторым антигеном, в котором СН1 и CL домены заменены друг на друга
в) одну Fc область, включающую Fc область первой тяжелой цепи и Fc область второй тяжелой цепи,
где С-концевой фрагмент СН1 домена первого Fab фрагмента присоединен к N-концевому фрагменту одного из полипептидов Fc области тяжелой цепи, а С-концевой фрагмент CL домена кроссоверного Fab фрагмента присоединен к N-концевому фрагменту полипептида Fc области другой тяжелой цепи, и где С-концевой фрагмент домена второго Fab фрагмента присоединен к N-концевому фрагменту VH домена первого Fab фрагмента или к N-концевому фрагменту VH домена кроссоверного Fab фрагмента.
В одном объекте биспецифическое антитело включает:
а) полноразмерное антитело, специфично связывающееся с первым антигеном и включающее две тяжелые цепи антитела и две легкие цепи антитела и
б) Fab фрагмент, специфично связывающий со вторым антигеном, включающий VH2 домен и VL2 домен, включающий фрагмент тяжелой цепи и фрагмент легкой цепи, где во фрагменте легкой цепи вариабельный домен VL2 легкой цепи заменен на вариабельный домен VH2 тяжелой цепи указанного антитела, и во фрагменте тяжелой цепи вариабельный домен VH2 тяжелой цепи заменен на вариабельный домен VL2 легкой цепи указанного антитела
где фрагмент Fab тяжелой цепи введен между СН1 доменом одной из тяжелых цепей полноразмерного антитела и соответствующей Fc областью полноразмерного антитела, а N-концевой фрагмент Fab фрагмента легкой цепи присоединен к С-концевому фрагменту легкой цепи полноразмерного антитела, которая спарена с тяжелой цепью полноразмерного антитела, в которое введен Fab фрагмент тяжелой цепи.
В одном объекте биспецифическое антитело включает:
а) полноразмерное антитело, специфично связывающееся с первым антигеном и включающее две тяжелые цепи антитела и две легкие цепи антитела и
б) Fab фрагмент, специфично связывающийся со вторым антигеном, включающим VH2 домен и VL2 домен, включающие фрагмент тяжелой цепи и фрагмент легкой цепи, где во фрагменте легкой цепи вариабельный домен VL2 легкой цепи заменен на вариабельный домен VH2 тяжелой цепи указанного антитела, и во фрагменте тяжелой цепи вариабельный домен VH2 тяжелой цепи заменен на вариабельный домен VL2 легкой цепи указанного антитела, и где С-концевой фрагмент Fab фрагмента тяжелой цепи присоединен к N-концевому фрагменту одной из тяжелых цепей полноразмерного антитела, и С-концевой фрагмент Fab фрагмента легкой цепи присоединен к N-концевому фрагменту легкой цепи полноразмерного антитела, конъюгированного с тяжелой цепью полноразмерного антитела, с которым конъюгирован фрагмент тяжелой цепи Fab фрагмента.
Полинуклеотиды
В настоящем изобретении кроме того предлагаются изолированные полинуклеотиды, кодирующие биспецифическое антитело, как описано в данном контексте, или их фрагменты.
В некоторых вариантах полинуклеотидом или нуклеиновой кислотой является ДНК. В других вариантах полинуклеотидом по настоящему изобретению является РНК, например, в форме матричной РНК (мРНК). РНК по настоящему изобретению может являться одноцепочечной или двухцепочечной.
Б. Рекомбинантные методы
Биспецифическое антитела, предложенные в данном контексте, можно получать с использованием рекомбинантных методов и композиций, например, как описано в патенте США №4816567. В одном объекте предлагается изолированная нуклеиновая кислота, кодирующая биспецифическое антитело, описанное в данном контексте. Такая нуклеиновая кислота может кодировать аминокислотную последовательность, включающую VL антигенсвязывающих участков, и/или аминокислотную последовательность, включающую VH антигенсвязывающих участков, которые специфично связываются с PD1 и TIM-3, соответственно (например, в легкой и/или тяжелой цепях антитела). В другом объекте предлагается один или более векторов (например, векторы экспрессии), включающие указанную нуклеиновую кислоту. В другом объекте предлагается клетка-хозяин, включающая указанную нуклеиновую кислоту. В одном таком объекте клетка-хозяина включает (например, трансформирована с его помощью): (1) вектор, включающий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, включающую VL антитела, и аминокислотную последовательность, включающую VH антитела, или (2) первый вектор, включающий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, включающую VL антитела, и второй вектор, включающий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, включающую VH антитела. В одном объекте клеткой-хозяина является эукариотическая клетка, например, клетка яичника китайского хомяка (СНО) или лимфоидная клетка (например, клетки Y0, NS0, Sp20). В одном объекте предлагается способ получения биспецифического антитела, где метод включает культивирование клетки-хозяина, включающей нуклеиновую кислоту, кодирующую антитело, как описано выше, в условиях, пригодных для экспрессии антитела, и необязательно выделение антитела из клетки-хозяина (или из культуральной среды клетки-хозяина).
Для рекомбинантного получения биспецифических антител, включающих первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM-3, как описано в данном контексте, нуклеиновую кислоту, кодирующую биспецифическое антитела, например, как описано выше, изолируют и встраивают в один или более векторов для последующего клонирования и/или экспрессии в клетке-хозяина. Такую нуклеиновую кислоту легко изолировать и секвенировать с использованием стандартных методик (например, с использованием олигонуклеотидных зондов, способных специфично связываться с генами, кодирующими тяжелые и легкие цепи антитела).
Пригодные клетки-хозяина для клонирования или для экспрессии кодирующих антитело векторов включают прокариотические и эукариотические клетки, описанные в данном контексте. Например, антитела можно получать в бактериях, предпочтительно, если отсутствует необходимость в гликозилировании и Fc эффекторной функции. Экспрессия фрагментов антител и полипептидов в бактериях описана, например, в патентах США №№5648237, 5789199 и 5840523. (См. также статью Charlton K.А. в книге Methods in Molecular Biology, т. 248, Lo, В.K.С. (под ред.), Humana Press, Totowa, NJ, cc. 245-254 (2003), в которой описана экспрессия фрагментов антител в бактериях Е.Coli). После экспрессии антитело можно выделить из бактериальной клеточной пасты в виде растворимой фракции с последующей очисткой.
Кроме прокариот, эукариотические микроорганизмы, такие как нитчатые грибы или дрожжи, являются пригодными в качестве хозяев клонирования или экспрессии для кодирующих антитело векторов, включая штаммы грибов или дрожжей, пути гликозилирования которых были «гуманизированы», что приводит к продуцированию антитела, профиль гликозилирования которого полностью или частично соответствует профилю гликозилирования белков человека (см. статью Gerngross T.U., Nat. Biotech., 22, cc. 1409-1414 (2004) и статью Li Н. и др., Nat. Biotech., 24, cc. 210-215 (2006)).
Пригодными клетками-хозяина для экспрессии гликозилированных антител являются также клетки из многоклеточных организмов (беспозвоночных и позвоночных). Примеры клеток беспозвоночных включают клетки растений и насекомых. Было идентифицировано множество бакуловирусных штаммов, которые можно использовать для конъюгирования с клетками насекомых, прежде всего для трансфекции клеток Spodoptera frugiperda.
В качестве хозяев также можно использовать культуры клеток растений, см., например, патенты США №№5959177, 6040498, 6420548, 7125978 и 6417429 (в которых описана методика PLANTIBODIES™ получения антител в трансгенных растениях).
В качестве хозяев также можно использовать клетки позвоночных. Например, можно использовать клеточные линии млекопитающих, адаптированных для роста в суспензиях. Другие примеры пригодных линий клеток-хозяина млекопитающих включают клеточную линию почек обезьяны CV1, трансформированную SV40 (COS-7), линию эмбриональных клеток почек человека (клетки 293 или 293, как описано, например, в статье Graham F.L. и др., J. Gen Virol., 36, сс. 59-74 (1977)), клетки почек новорожденных хомяков (ВНK), клетки Sertoli мыши (ТМ4 клетки, как описано, например, в статье Mather J.Р., Biol. Reprod., 23, сс. 243-252 (1980)), клетки почек обезьяны (CV1), клетки почек африканской зеленой мартышки (VERO-76), клетки карциномы шейки матки человека (HELA), клетки почки собаки (MDCK), клетки печени крысы линии buffalo (BRL 3А), клетки легкого человека (W138), клетки печени человека (Hep G2), клетки опухоли молочной железы мыши (ММТ 060562), клетки TRI, как описано, например, в статье Mather J.Р. и др., Annals N.Y. Acad. Sci., 383, сс. 44-68 (1982), клетки MRC 5 и клетки FS4. Другие пригодные линии клеток-хозяина млекопитающих включают клетки яичника китайского хомячка (СНО), включая клетки DHFR- СНО (Urlaub G. и др., Proc. Natl. Acad. Sci. USA, 77, сс. 4216-4220 (1980)) и клеточные линии миеломы, такие как Y0, NS0 и Sp2/0. Обзор определенных линий клеток-хозяина, пригодных для получения антител, приведен, например, в работе Yazaki Р. и Wu A.M., Methods in Molecular Biology, т. 248, Lo, B.K.C. (под ред.), Humana Press, Totowa, NJ, cc. 255-268 (2004).
В. Методы анализа
Биспецифическое антитела, включающие первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM-3, которые предлагаются в настоящем изобретении, можно идентифицировать, подвергать скринингу или характеризовать для оценки их физических/химических свойств и/или биологической активности с использованием различных методов, известных в данной области техники.
1. Методы анализа аффинности
Аффинность биспецифических антигенсвязывающих молекул, антител и фрагментов антител, предлагаемых в настоящем изобретении, в отношении соответствующих антигенов можно определять с использованием методов, описанных в разделе Примеры с использованием ППР и стандартных приборов, таких как Biacore® (GE Healthcare), а рецепторы и белки-мишени можно получить методом рекомбинантной экспрессии. Конкретный иллюстративный и типичный вариант осуществления настоящего изобретения для измерения связывающей аффинности описан в примерах 1б, 5 или 12. Согласно одному объекту KD измеряют с использованием ППР на приборе BIACORE® Т100 (GE Healthcare) при 25°С.
2. Методы анализа связывания и другие анализы
В одном объекте антитело по настоящему изобретению исследуют на его антигенсвязывающую активность, например, с использованием стандартных методов, таких как ИФА, вестерн-блоттинг и т.п. Связывание биспецифических антител, предлагаемых в настоящем изобретении, с соответствующим рекомбинантным антигеном или с антиген-презентирующими клетками можно оценить с использованием ИФА, как описано в примере 12.
В другом объекте в настоящем изобретении предлагается анализ на основе клеток TR-FRET для определения одновременного связывания форматов биспецифических антител с двумя различными рецепторами, присутствующими на одной клетке. Выбранная методика Tag-lite technology представляет собой комбинацию классического TR-FRET (время разрешенный перенос энергии флуоресцентного резонанса) и методики SNAP-tag (например, New England Biolabs, CISBIO), которая позволяет включать метку в антигены, присутствующие на поверхности клетки, с использованием флуоресцентного донорного или акцепторного красителя. Анализ описан в примере 13.
В другом объекте моноядерные клетки свежей периферической крови (РВМС) используют в анализе связывания с другими моноядерными клетками периферической крови (РВМС), такими как моноциты, NK клетки и Т клетки.
В еще одном объекте конкурентные анализы можно использовать для идентификации антитела, которое конкурирует со специфичным антителом или антигенсвязывающим участком за связывание с мишенью, соответственно. В определенных вариантах такое конкурирующее антитело связывается с тем же эпитопом (например, линейным или конформационным эпитопом), с которым связывается биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, по настоящему изобретению. Подробные типичные методы картирования эпитопа, с которым связывается антитело, приведены в статье Morris, "Epitope Mapping Protocols" в книге Methods in Molecular Biology, т. 66, Humana Press, Totowa, NJ (1996).
В типичном конкурентном анализе иммобилизованный PD1 или TIM3 инкубируют в растворе, включающем первое меченое антитело, которое связывается с PD1 или TIM3, и второе не-меченное антитело, которое исследуют на его способность конкурировать с первым антителом за связывание с PD1 или TIM3. Второе антитело может присутствовать в супернатанте гибридомы. Для контроля иммобилизованный PD1 или TIM3 инкубируют в растворе, включающем первое меченное антитело, но не содержащем второе не-меченное антитело. После инкубации в условиях, обеспечивающих связывание первого антитела с PD1 или TIM3, избыток несвязанного антитела удаляют и измеряют количество метки, ассоциированной с иммобилизованным PD1 или TIM3. Если количество метки, ассоциированной с иммобилизованным PD1 или TIM3, значительно снижено в исследуемом образце по сравнению с контрольным образцом, то это указывает, что второе антитело конкурирует с первым антителом за связывание с PD1 или TIM3 (см. Harlow и Lane, Antibodies: А Laboratory Manual, гл. 14, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY (1988)).
3. Методы анализа активности
В одном объекте предлагаются анализы для идентификации биспецифического антитела, включающего первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, и характеризующегося биологической активностью. Биологическая активность может включать, например, способность увеличивать активацию и/или пролиферации различных иммунных клеток, прежде всего Т клеток, секрецию иммунно-модулирующих цитокинов, таких как ИНФ-α или TNF-α, блокировку пути PD1, блокировку пути TIM3, гибель опухолевых клеток. Предлагаются также антитела, характеризующиеся такой биологической активностью in vivo и/или in vitro.
В определенных объектах антитело по настоящему изобретению исследуют на его биологическую активность. В одном объекте предлагается анализ иммунных клеток, в котором измеряют активацию лимфоцитов от одного индивидуума (донор X) в отношении лимфоцитов от другого индивидуума (донор Y). В реакции смешанных лимфоцитов (РСЛ) оценивают эффект блокировки пути PD1 в лимфоцитарных эффекторных клетках. В этом анализе Т клетки исследуют на активацию и секрецию их ИНФ-γ в присутствии или отсутствии биспецифических антител по настоящему изобретению. Более подробно анализ описан в примере 16.
Г. Иммуноконъюгаты
В настоящем изобретении предлагаются также иммуноконъюгаты, включающие биспецифическое антитело по настоящему изобретению, конъюгированное с одним или более цитотоксичных агентов, таких как химиотерапевтические агенты или лекарственные средства, ингибирующие рост агенты, токсины (например, белковые токсины, ферментативно активные токсины из бактериальных, грибковых, растительных или животных источников или их фрагменты) или радиоактивные изотопы.
В одном объекте иммуноконъюгат представляет собой конъюгат антитело-лекарственное средство (ADC), в котором антитело конъюгировано с одним или более лекарственных средств, включающих, но, не ограничиваясь только ими, майтанзиноид (см. патенты США №№5208020, 5416064 и патент ЕР 0425235 В1), ауристатин, такой как фрагменты лекарственного средства монометилауристатина DE и DF (ММАЕ и MMAF) (см. патенты США №№5635483 и 5780588 и 7498298), доластатин, каличеамицин или их производные (см. патенты США №№5712374, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001 и 5877296, статьи Hinman и др., Cancer Res., 53, сс. 3336-3342 (1993) и Lode и др., Cancer Res., 58, сс.2925-2928 (1998)), антрациклин, такой как дауномицин или доксорубицин (см. статьи Kratz и др., Current Med. Chem., 13, сс. 477-523 (2006), Jeffrey и др., Bioorganic & Med. Chem. Letters, 16, сс. 358-362 (2006), Torgov и др., Bioconj. Chem., 16, сс. 717-721 (2005), Nagy и др., Proc. Natl. Acad. Sci. USA, 97, cc. 829-834 (2000), Dubowchik и др., Bioorg. & Med. Chem. Letters, 12, cc. 1529-1532 (2002), King и др., J. Med. Chem., 45, cc. 4336-4343 (2002) и патент США №6630579), метотрексат, виндезин, таксан, такой как доцетаксел, паклитаксел, ларотаксель, тезетаксел и ортатаксель, трихотецен и СС1065.
В другом варианте иммуноконъюгат включает антитело, как описано в данном контексте, конъюгированное с ферментативно активным токсином или его фрагментом, включающим, но, не ограничиваясь только ими, цепь А дифтерийного токсина, несвязывающие активные фрагменты дифтерийного токсина, цепь А экзотоксина (из Pseudomonas aeruginosa), цепь А рицина, цепь А абрина, цепь А модецина, α-сарцин, белки Aleurites fordii, белки диантина, белки Phytolaca americana (PAPI, РАРII и PAP-S), ингибитор momordica charantia, курцин, кротин, ингибитор sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены.
В другом варианте иммуноконъюгат включает антитело, как описано в данном контексте, конъюгированное с радиоактивным атомом, при этом образуется радиоконъюгат. Для получения радиоконъюгатов пригодно множество радиоактивных изотопов. Примеры включают At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu. При использовании радиоконъюгата для детектирования он может включать радиоактивный атом для сцинтиграфических исследований, например, Тс99 или I123, или спиновую метку для визуализации ядерного магнитного резонанса (ЯМР) (также известная под названием магнитная резонансная визуализация, мрв), такую как иод-123, иод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Конъюгаты антитела и цитотоксичного агента можно получать с использованием ряда бифункциональных связывающихся с белком агентов, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как гидрохлорид диметиладипимидата), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаровый альдегид), бис-азидосоединения (такие как бис(пара-азидобензоил)гександиамин), производные бис-диазония (такие как бис(пара-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицин можно получить, как описано в работе Vitetta и др., Science, 238, с. 1098 (1987). Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPА) представляет собой пример хелатирующего агента для конъюгации радионуклида с антителом (см. заявку WO 94/11026). В качестве линкера можно использовать "отщепляющийся линкер", ускоряющий высвобождение цитотоксичного лекарственного средства в клетку. Например, можно использовать кислотолабильный линкер, чувствительный к пептидазе линкер, фотолабильный линкер, диметиловый линкер или дисульфидсодержащий линкер (статья Chari и др., Cancer Res., 52, сс. 127-131 (1992), патент США №5208020).
Иммуноконъюгаты или ADC, описанные в данном контексте, включают, но, не ограничиваясь только ими, конъюгаты, полученные с использованием сшивающих реагентов, включающих, но, не ограничиваясь только ими, BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, МРВН, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC и сульфо-SMPB и SVSB (сукцинимидил(4-винилсульфон)бензоат), которые являются коммерческими продуктами (например, фирмы Pierce Biotechnology, Inc., Rockford, IL., США).
Д. Методы и композиции для диагностики и детектирования
В определенных объектах можно использовать любые биспецифическое антитела, включающие первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM-3, описанные в данном контексте, для детектирования присутствия обоих PD1 и TIM3 в биологическом образце. Термин "детектирование", использованный в данном контексте, означает качественное или количественное детектирование. В некоторых вариантах биологический образец включает клетку или ткань, такие как стволовые раковые клетки AML.
В одном объекте предлагается биспецифическое антитело для применения в методе диагноза или детектирования. В другом объекте предлагается метод детектирования присутствия обоих PD1 и TIM3 в биологическом образце. В некоторых вариантах метод включает контактирование биологического образца с биспецифическим антителом, как описано в данном контексте, в условиях, обеспечивающих связывание биспецифического антитела с обоими PD1 и TIM3, и детектирование формирования комплекса между биспецифическим антителом и обоими антигенами. Таким методом является метод in vitro или in vivo. В одном варианте биспецифическое антитело используют для выбора субъектов, пригодных для лечения биспецифическим антителом, включающим первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM-3, например, где PD1 и TIM3 являются биомаркерами для выбора пациентов.
В некоторых объектах предлагаются меченные биспецифическое антитела. Метки включают, но, не ограничиваясь только ими, метки или остатки, которые определяются напрямую (такие как флуоресцентные, хромофорные, электронноплотные, хемилюминисцентные и радиоактивные), а также остатки, такие как ферменты или лиганды, которые определяются ненапрямую, например, с использованием ферментативной реакции или молекулярного взаимодействия. Примеры меток включают, но, не ограничиваясь только ими, радиоизотопы 32Р, 14С, 125I, 3Н и 131I, флуорофоры, такие как редкоземельные хелаты или флуоресцеин и его производные, родамин и его производные, дансил, умбеллиферон, люциферазы, такие как светлячковая люцифераза и бактериальная люцифераза (патент США 4737456), люциферин, 2,3-дигидрофталазиндионы, пероксидаза хрена (HRP), щелочная фосфатаза, β-галактозидаза, глюкоамилаза, лизоцим, сахариноксидазы, например, глюкозоксидаза, галактозоксидаза и глюкоза-6-фосфатдегидрогеназа, гетероциклические оксидазы, такие как уриказа и ксантиноксидаза, соединенные с ферментом, который использует пероксид водорода для окисления прекурсора красителя, такого как HRP, лактопероксидаза или микропероксидаза, биотин/авидин, спиновые метки, метки бактериофага или стабильные свободные радиткалы.
Е. Фармацевтические композиции, составы и способы введения
В другом объекте настоящего изобретения предлагаются фармацевтические композиции, включающие любые биспецифическое антитела, включающие первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM-3, описанные в данном контексте, например, для применения в любом из описанных ниже способов лечения. В одном варианте фармацевтическая композиция включает любые биспецифическое антитела, описанные в данном контексте, и по крайней мере один фармацевтически приемлемый эксципиент. В другом варианте фармацевтическая композиция включает любые биспецифическое антитела, описанные в данном контексте, и по крайней мере один дополнительный лекарственный агент, например, как описано ниже.
Фармацевтические композиции по настоящему изобретению включают терапевтически эффективное количество одного или более биспецифических антител, растворенных или диспергированных в фармацевтически приемлемом эксципиенте. Словосочетание "фармацевтически или фармакологически приемлемый" относится к химическим соединениям и композициям, которые в основном нетоксичны для реципиентов при используемых дозах и концентрациях, т.е. не оказывают неблагоприятную, аллергическую или другую нежелательную реакцию при введении животному, такому как, например, человек. Получение фармацевтической композиции, содержащей по крайней мере одно биспецифическое антитело и необязательно дополнительный активный ингредиент, известный специалистам в данной области техники с учетом настоящего описания, как представлено в книге Remington's Pharmaceutical Sciences, 18ое изд., Mack Printing Company (1990), включенной в настоящее описание в качестве ссылки. Предпочтительно композициями являются лифилизированные составы или водные растворы. Термин "фармацевтически приемлемый эксципиент", использованный в данном контексте, включает любые растворители, буферные вещества, дисперсионные среды, покрытия, ПАВ, антиоксиданты, консерванты (например, противобактериальные агенты, противогрибковые агенты), изотонические агенты, соли, стабилизаторы и их комбинации, известные специалистам в данной области техники.
Парентеральные композиции включают композиции, предназначенные для введения инъекцией, например, подкожной, внутрикожной, внутриочаговой, внутривенной, внутриартериальной, внутримышечной, интратекальной или внутрибрюшинной инъекцией. Для введения с использованием инъекции биспецифическое антитела по настоящему изобретению можно получать в виде водных растворов, предпочтительно в физиологически совместимых буферных растворах, таких как раствор Хэнкса, раствор Рингера или физиологический солевой буферный раствор. Раствор может содержать вспомогательные агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. В другом варианте, биспецифическое антитела можно получать в виде порошка, предназначенного для получения перед применением состава с использованием пригодного носителя, такого как стерильная апирогенная вода. Стерильные растворы для инъекций получают при введении гибридных белков по настоящему изобретению в требуемом количестве в соответствующий растворитель при необходимости с другими ингредиентами, перечисленными ниже. Стерильность можно легко обеспечить, например, фильтрованием через стерильные фильтрационные мембраны. Обычно дисперсии получают при введении различных стерилизованных активных ингредиентов в стерильный носитель, который содержит дисперсионную среду-основу и/или другие ингредиенты. В случае стерильных порошков для получения стерильных инъекционных растворов, суспензий или эмульсий, предпочтительными методами получения являются сушка в вакууме или лиофильная сушка, с использованием которых получают порошкообразный активный ингредиент и любой дополнительный активный ингредиент из предварительно отфильтрованной в стерильных условиях жидкой среды. В жидкую среду при необходимости вводят буферные вещества и перед инъекцией жидкую среду получают изотонический раствор с использованием достаточного количества соли или глюкозы. Композиция должна быть стабильной в условиях получения и хранения, и должна храниться в условиях, препятствующих контаминации микроорганизмами, такими как бактерии и грибы. Следует понимать, что загрязнение эндотоксинами необходимо поддерживать на минимально безопасном уровне, например, менее 0,5 нг/мг белка. Пригодные фармацевтически приемлемые эксципиенты включают, но, не ограничиваясь только ими, буферные вещества, такие как фосфат, цитрат и соли других органических кислот, антиоксиданты, включающие аскорбиновую кислоту и метионин, консерванты (такие как хлорид октадецилдиметилбензиламмония, хлорид гексаметония, хлорид бензалкония, хлорид бензетония, фенол, бутиловый или бензиловый спирт, алкилпарабены, такие как метил- или пропилпарабен, катехол, резорцин, циклогексанол, 3-пентанол, и мета-крезол), низкомолекулярные полипептиды (менее приблизительно 10 остатков), белки, такие как сывороточный альбумин, желатин или иммуноглобулины, гидрофильные полимеры, такие как поливинилпирролидон, аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин, моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины, хелатирующие агенты, такие как ЭДТУ, сахара, такие как сахароза, маннит, трегалоза или сорбит, солеобразующие противоионы, такие как натрий, комплексы металлов (например, комплексы Zn-белок) и/или неионные ПАВ, такие как полиэтиленгликоль (ПЭГ). Водные суспензии для инъекций могут содержать соединения, повышающие вязкость суспензии, такие как натриевая соль карбоксиметилцеллюлозы, сорбит, декстран и т.п. Необязательно, суспензия может содержать пригодные стабилизаторы или агенты, повышающие растворимость соединений, что обеспечивает получение высококонцентрированных растворов. В другом варианте суспензии активных соединений можно получать в виде пригодных масляных суспензий для инъекций. Пригодные липофильные растворители или носители включают нелетучие масла, такие как кунжутное масло или синтетические сложные эфиры жирных кислот, такие как этилолеаты или триглицериды, или липосомы.
Активные ингредиенты можно инкапсулировать в микрокапсулы, полученные, например, методом коацервации или межфазной полимеризацией, например, микрокапсулы на основе гидроксиметилцеллюлозы или желатина или микрокапсулы на основе полиметилметакрилата, соответственно в коллоидной системе для доставки лекарственных средств (например, липосомы, микросферы на основе альбумина, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Данные методики описаны в книге Remington's Pharmaceutical Sciences (18ое изд., Mack Printing Company (1990)). Можно получать препараты с замедленным высвобождением. Пригодные примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие полипептид, при этом матрицы находятся в форме формованных изделий, например, пленок или микрокапсул. В предпочтительных вариантах можно обеспечить пролонгированную абсорбцию инъектируемой композиции при использовании в композициях агентов, замедляющих абсорбцию, таких как например, моностеарат алюминия, желатин или их комбинации.
Примеры фармацевтически приемлемых эксципиентов, описанных в данном контексте, кроме того включают агенты для диспергирования интерстициальный лекарственных средств, такие как растворимые нейтрально активные гликопротеины гиалуронидазы (sHASEGP), например, растворимые гликопротеины гиалуронидазы РН-20 человека, такие как rHuPH20 (HYLENEX®, Baxter International, Inc.). Некоторые примеры sHASEGPs и способы их применения, включая rHuPH20, описаны в публикациях патентов США №№2005/0260186 и 2006/0104968. В одном объекте sHASEGP объединен с одной или более дополнительных гликозаминогликаназ, таких как хондроитиназы.
Примеры лиофилизированных составов антител описаны в патенте США №6267958. Водные составы антител включают описанные в патенте США №6171586 и заявке WO 2006/044908, при этом в последней описаны составы, включающие ацетат-гистидинсодержащие буферные вещества.
Кроме композиций, описанных ранее, биспецифическое антитела можно перерабатывать в депо-препараты. Составы с таким длительным интервалом действия можно вводить с использованием имплантации (например, подкожно или внутримышечно) или внутримышечной инъекцией. Таким образом, например, биспецифическое антитела можно получать в виде полимерных или гидрофобных материалов (например, в виде эмульсии в приемлемом масле) или ионо-обменных смол, или в виде труднорастворимых производных, таких как малорастворимая соль.
Фармацевтические композиции, включающие биспецифическое антитела по настоящему изобретению, можно получать с использованием стандартных методов смешивания, растворения, эмульгирования, инкапсулирования, включения в матрицу или лиофилизации. Фармацевтические композиции можно получать стандартными способами с использованием одного или более фармацевтически приемлемых носителей, разбавителей, эксципиентов или вспомогательных веществ, которые ускоряют переработку белков в препараты, которые можно использовать в фармацевтике. Надлежащий вид препарата зависит от выбранного способа введения.
Биспецифическое антитела можно перерабатывать композицию в виде свободной кислоты или основания, в нейтральной форме или в форме соли. Фармацевтически приемлемые соли представляют собой соли, которые в значительной степени сохраняют биологическую активность свободной кислоты или основания. Такие соли включают кислотно-аддитивные соли, например, соли, образующиеся с участием свободных аминогрупп белковой композиции, или которые образуются при взаимодействии с неорганическими кислотами, такими как, например, хлористоводородная или фосфорная кислота, или органическими кислотами, такими как уксусная, щавелевая, винная или миндальная кислота. Соли, образованные с участием свободных карбоксильных групп, могут также быть получены из неорганических оснований, таких как, например, гидроксиды натрия, калия, аммония, кальция или трехвалентного железа, или из органических оснований, таких как изопропиламин, триметиламин, гистидин или прокаин. Фармацевтические соли являются более растворимыми в водных и других протонных растворителях по сравнению с соответствующими формами свободных оснований.
При необходимости, если для конкретного показания, подлежащего лечению, необходимо несколько ингредиентов с комплементарными активностями, не оказывающих неблагоприятных воздействий друг на друга, то композиция по настоящему изобретению может также содержать более одного активного ингредиента. Такие активные ингредиенты обычно присутствуют в комбинации в количествах, эффективных для требуемых целей.
Составы, предназначенные для введения vivo, обычно являются стерильными. Стерильность легко обеспечить, например, при фильтровании через стерильные фильтрационные мембраны.
Ж. Методы лечения и терапевтические композиции
Любые биспецифическое антитела, включающие первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM-3, описанные в настоящем изобретении, можно использовать в способах лечения.
Для применения в способах лечения биспецифическое антитела, включающие первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM-3, описанные в настоящем контексте, можно перерабатывать в композиции, дозировать и вводить способом, в соответствии с правилами надлежащей медицинской практики. Рассматриваемые факторы в данном контексте включают конкретное нарушение, подлежащее лечению, конкретное млекопитающее, нуждающемуся в лечении, клиническое состояние для индивидуального пациента, причину нарушения, участок, в который необходимо доставить агент, способ введения, схему введения и другие факторы, известные в медицинской практике.
В одном объекте предлагаются биспецифическое антитела, включающие первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM-3, описанные в данном контексте, для применения в качестве лекарственного средства. В других объектах предлагаются биспецифическое антитела, включающие первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM-3, описанные в данном контексте, для применения для лечения заболевания, прежде всего для применения для лечения рака. В некоторых вариантах предлагаются биспецифическое антитела, включающие первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM-3, описанные в данном контексте, для применения в способе лечения. В одном варианте осуществления настоящего изобретения предлагаются биспецифическое антитела, включающие первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM-3, описанные в данном контексте, для применения при лечении заболевания у индивидуума, нуждающегося в указанном лечении. В некоторых вариантах осуществления настоящего изобретения предлагаются биспецифическое антитела, включающие первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM-3, описанные в данном контексте, для применения в способе лечении заболевания у индивидуума, страдающего от заболевания, включающем введение индивидууму терапевтически эффективного количества биспецифического антитела. В некоторых вариантах заболеванием, подлежащим для лечения, является рак. В другом объекте заболеванием, нуждающимся в лечении, является хроническая вирусная инфекция, такая как HIV, HBV, HCV, HSV1, CMV, LCMV или EBV. Субъектом, пациентом или индивидуумом, нуждающимся в лечении, обычно является млекопитающее, предпочтительно человек.
В другом объекте настоящего изобретения предлагается применение биспецифических антител, включающих первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM-3, описанные в данном контексте, для получения или изготовления лекарственного средства для лечения заболевания у индивидуума, нуждающегося в указанном лечении. В одном варианте лекарственное средство предназначено для применения в способе лечения заболевания, включающие введение индивидууму, страдающему от заболевания, терапевтически эффективного количества лекарственного средства.
В некоторых вариантах заболеванием, предназначенным для лечения, является пролиферативное заболевание, предпочтительно рак. Примеры рака включают рак мочевого пузыря, рак мозга, рак головы и шеи, рак поджелудочной железы, рак легкого, рак молочной железы, рак яичника, рак матки, рак шейки матки, рак эндометрия, рак пищевода, рак ободочной кишки, колоректальный рак, рак прямой кишки, рак желудка, рак предстательной железы, рак крови, рак кожи, плоскоклеточную карциному, рак костей и рак почки. Другие расстройства, связанные с пролиферацией клеток, которые можно лечить с использованием биспецифических антител, включающих первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM-3, по настоящему изобретению включают, но, не ограничиваясь только ими, новообразования, расположенные в брюшной полости, костях, молочной железе, пищеварительной системе, печени, поджелудочной железе, брюшине, эндокринных железах (надпочечнике, паращитовидной железе, гипофизе, яичках, яичнике, вилочковой железе, щитовидной железе), глазе, голове и шее, нервной системе (центральной и периферической), лимфатической системе, области таза, коже, мягких тканях, селезенке, торакальной области и мочеполовой системе. Такие нарушения также включают предраковые состояния или раковые очаги и метастазы. В некоторых объектах рак выбирают из группы, включающей почечно-клеточный рак, рак кожи, рак легкого, колоректальный рак, рак молочной железы, рак мозга, рак головы и шеи. В других объектах рак выбирают из карциномы, лимфомы (например, лимфома Ходжкина и не-Ходжкина), бластомы, саркомы и лейкоза. В другом варианте рак, предназначенный для лечения, выбирают из плоскоклеточного рака, мелкоклеточного рака легкого, немелкоклеточного рака легкого, аденокарциномы легкого, плоскоклеточной карциномы легкого, рака брюшной полости, печеночноклеточного рака, рака желудочно-кишечного тракта, рака поджелудочной железы, глиомы, рака шейки матки, рака яичника, рака печени, рака мочевого пузыря, гепатомы, рака молочной железы, рака ободочной кишки, колоректального рака, карциномы эндометрия или матки, карциномы слезной железы, рака почки, рака печени, рака предстательной железы, рака вульвы, рака щитовидной железы, карциномы печени, лейкоза и других лимфопролиферативных расстройств и различных видов рака головы и шеи.
В другом объекте заболеванием, подлежащим лечению, является хроническая вирусная инфекция. Термин "хроническая вирусная инфекция" относится к субъекту, страдающему или инфицированному хроническим вирусом. Примеры хронических вирусных инфекций включают вирус иммунодефицита человека (ВИЧ), вирусную инфекцию гепатита В (HBV), вирусную инфекцию гепатита С (HCV), вирус простого герпеса 1 (HSV1), цитомегаловирус (CMV), лимфатический хориоменингиальный вирус (LCMV) или вирус Эпштейна-Барра (EBV).
Специалистам в данной области техники следует понимать, что во многих случаях биспецифическая молекула не может обеспечить излечение, а только оказывает частичное благоприятное действие. В некоторых вариантах физиологическое изменение частичным благоприятным действием, рассматривают в качестве терапевтически благоприятного эффекта. Таким образом, в некоторых вариантах количество биспецифического антитела, которое обеспечивает физиологическое изменение, рассматривают в качестве "эффективного количества" или "терапевтически эффективного количества".
В другом объекте настоящего изобретения предлагается способ лечения заболевания у индивидуума, включающий введение указанному индивидууму терапевтически эффективного количества биспецифических антител, включающих первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM-3, по настоящему изобретению. В одном варианте композицию, включающую биспецифическое антитело по настоящему изобретению в фармацевтически приемлемой форме, вводят указанному индивидууму. В определенных вариантах заболеванием, подлежащим лечению, является пролиферативное расстройство. В предпочтительном варианте заболеванием является рак. В некоторых вариантах способ кроме того включает введение индивидууму терапевтически эффективного количества по крайней мере одного лекарственного средства, например, противоракового агента, если заболеванием, подлежащим лечению, является рак. В другом объекте заболеванием является хроническая вирусная инфекция. "Индивидуумом" по любому из описанных выше вариантов является млекопитающее, предпочтительно человек.
Для профилактики или лечения заболевания соответствующая доза биспецифических антител, включающих первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM-3, по настоящему изобретению (при использовании в отдельности или в комбинации с одним или более других дополнительных лекарственных средств) зависит от типа заболевания, подлежащего лечению, способа введения, массы тела пациента, типа гибридного белка, степени тяжести и течения болезни, при этом биспецифическое антитело вводят для профилактических или лечебных целей, предшествующих или одновременных терапевтических вмешательств, в зависимости от истории болезни пациента и ответной реакции на гибридный белок в соответствии с мнением лечащего врача. Практикующий врач, отвечающий за введение, в любом случае определяет концентрацию активного ингредиента(ов) в композиции и дозу(ы) для конкретного субъекта. В данном изобретении предлагаются различные схемы дозировки, включающие, но, не ограничиваясь только ими, однократное или многократное введение в различные временные интервалы, струйное вливание, импульсное вливание.
Биспецифическое антитела, включающие первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM-3, описанные в данном контексте, обычно вводят пациенту с использованием однократного или многократного введения. В зависимости от типа и степени тяжести заболевания изначальный вариант дозы биспецифического антитела, вводимой пациенту, составляет приблизительно от 1 мкг/кг до 15 мг/кг (например, от 0,1 мг/кг до 10 мг/кг) биспецифического антитела, например, с использованием однократного или многократных введений или непрерывного вливания. Одна стандартная суточная доза может включать приблизительно от 1 мкг/кг до 100 мг/кг или более, в зависимости от факторов, упомянутых выше. При повторных введениях в течение нескольких дней или более в зависимости от состояния лечение обычно продолжают, пока не достигается требуемое подавление симптомов заболевания. Один пример дозы биспецифического антитела включает приблизительно от 0,005 мг/кг до приблизительно 10 мг/кг. Другие примеры дозы находятся в интервале приблизительно 1 мкг/кг массы тела, приблизительно 5 мкг/кг массы тела, приблизительно 10 мкг/кг массы тела, приблизительно 50 мкг/кг массы тела, приблизительно 100 мкг/кг массы тела, приблизительно 200 мкг/кг массы тела, приблизительно 350 мкг/кг массы тела, приблизительно 500 мкг/кг массы тела, приблизительно 1 мг/кг массы тела, приблизительно 5 мг/кг массы тела, приблизительно 10 мг/кг массы тела, приблизительно 50 мг/кг массы тела, приблизительно 100 мг/кг массы тела, приблизительно 200 мг/кг массы тела, приблизительно 350 мг/кг массы тела, приблизительно 500 мг/кг массы тела, до приблизительно 1000 мг/кг массы тела на одно или более введений, а также в любых интервалах, рассчитанных на основании указанных выше доз. Можно вводить дозу в интервале приблизительно от 5 мкг/кг до приблизительно 100 мг/кг массы тела, приблизительно от 5 мкг/кг до приблизительно 500 мг/кг массы тела и т.п., и таким образом, пациенту можно вводить одну или более доз приблизительно 0,5 мг/кг, 2,0 мг/кг, 5,0 мг/кг или 10 мг/кг (или любые комбинации указанных доз).
Такие дозы можно вводить с определенной периодичностью, например, каждую неделю или каждые три недели (например, таким образом, чтобы пациент получал приблизительно от 2 до приблизительно 20, или например, приблизительно 6 доз гибридного белка). Можно вводить начальную дозу с высоким содержанием соединения и затем вводить одну или более доз с более низким содержанием соединения. Однако, можно использовать другие схемы дозировки. Эффективность такого лечения легко регистрировать с использованием стандартных методов и анализов.
Биспецифическое антитела, включающие первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM-3, описанные в данном контексте, можно в основном использовать в количестве, эффективном для достижения требуемой цели. При использовании для лечения или профилактики состояния заболевания биспецифическое антитела по настоящему изобретению или фармацевтические композиции на их основе вводят или применяют в терапевтически эффективном количестве. Специалист в данной области техники может определить терапевтически эффективное количество, прежде всего с учетом подробного описания, приведенного в данном контексте.
Для системного введения терапевтически эффективную дозу можно изначально оценить по данным анализов in vitro, таких как анализы с использованием клеточной культуры. Подобрать дозу можно на моделях животных для оценки интервала циркулирующей концентрации, включающего величину IC50, определенную с использованием клеточной культуры. Данную информацию можно использовать для более точного определения пригодных доз для введения человеку.
Исходные дозы можно также оценить с использованием данных, полученных in vivo, например, на моделях животных с использованием методик, известных в данной области техники. Специалист в данной области техники может оптимизировать введение человеку на основе данных, полученных на моделях животных.
Величину и интервал дозировки можно подбирать индивидуально для обеспечения уровней биспецифического антитела в плазме, достаточных для поддержания терапевтического эффекта. Обычные дозы для введения пациентам инъекцией составляют приблизительно от 0,1 до 50 мг/кг/сутки, обычно приблизительно от 0,5 до 1 мг/кг/сутки. Терапевтически эффективные уровни в плазме можно обеспечить при введении нескольких доз каждый день. Уровни в плазме можно измерять, например, с использованием ЖХВР.
В случаях местного введения или селективного накопления эффективная локальная концентрация может быть не связана с концентрацией в плазме. Специалисты в данной области техники способны оптимизировать терапевтически эффективные локальные дозы без проведения чрезмерно большого количества дополнительных экспериментов.
Терапевтически эффективная доза биспецифического антитела по настоящему изобретению в целом обеспечивает лечебный эффект без существенного токсического воздействия. Токсичность и терапевтическую эффективность гибридного белка можно определить по стандартным фармацевтическим методикам с использованием клеточной культуры или экспериментальных животных. Можно использовать анализы на основе клеточной культуры или экспериментов на моделях животных для определения значений LD50 (летальная доза для 50% популяции) и ED50 (терапевтически эффективная доза для 50% популяции). Соотношение между токсическим и терапевтическим эффектами представляет собой терапевтический индекс и обозначается LD50/ED50. Предпочтительными являются биспецифическое антитела с высоким терапевтическим индексом. В одном варианте биспецифическое антитела по настоящему изобретению характеризуются высоким терапевтическим индексом. Можно использовать данные, полученные с использованием анализов на клеточных культурах или экспериментов на моделях животных для определения интервала доз, пригодных для человека. Дозы предпочтительно находятся в интервале циркулирующих концентраций, который включает ED50 с низкой токсичностью или ее отсутствием. Дозы могут изменяться в данном интервале в зависимости от ряда факторов, например, формы используемой дозы, используемого способа введения, состояния субъекта и т.п. Точный состав, способ введения и дозу может подобрать лечащий врач с учетом состояния пациента (см., например, Fingl и др., The Pharmacological Basis of Therapeutics, гл. 1, с. 1 (1975), полностью включенную в данное описание в качестве ссылки).
Лечащий врач пациентов, проходящих курс лечения биспецифическими антителами по настоящему изобретению, может определить способ и время завершения, прерывания или подбора метода введение препаратов из-за их токсичности, дисфункции органа и т.п. В другом варианте лечащий врач также может определить способ для обеспечения более высоких уровней лекарственного средства в случае, когда клинический ответ был недостаточным (исключая токсичность). Величина вводимой дозы при лечении расстройства, подлежащего лечению, может изменяться в зависимости от тяжести состояния, подлежащего лечению, способа введения и т.п. Степень тяжести состояния можно оценить частично, например, стандартными прогностическими методами анализа. Кроме того, доза и, возможно, частота введения лекарственного средства также могут изменяться в зависимости от возраста, массы тела пациента и реакции отдельного пациента на лекарственное средство.
Другие агенты и способы лечения
Биспецифическое антитела, включающие первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM-3, описанные в данном контексте, можно вводить при лечении в комбинации с одним или более агентами. Например, гибридный белок по настоящему изобретению можно вводить совместно по крайней мере с одним дополнительным лекарственным агентом. Термин "лекарственный агент" означает любой агент, который можно вводить для лечения симптома или заболевания у индивидуума, нуждающегося в таком лечении. Такое дополнительное лекарственное средство может включать любые активные ингредиенты, пригодные для конкретного показания, подлежащего лечению, предпочтительно ингредиенты с комплементарными активностями, которые не оказывают неблагоприятных эффектов друг на друга.
Такие другие агенты обычно присутствуют в комбинации в количествах, эффективных для требуемой цели. Эффективное количество таких других агентов зависит от количества используемого гибридного белка, типа нарушения или способа лечения и других факторов, описанных выше. Семейство лигандов TNF, тримерсодержащих антигенсвязывающих молекул обычно используют в аналогичных дозах и с такими же способами введения, как описано в данном контексте, или приблизительно от 1 до 99% от доз, описанных в данном контексте, или в любой дозе и с любым способом введения, эмпирически/клинически определенными как пригодные.
Такое комбинированное лечение, описанное выше, включает комбинированное введение (когда два или более лекарственных средства включены в одну или в отдельные композиции) или отдельное введение, при котором введение биспецифического антитела может осуществляться до введения, одновременно с ним и/или после введения дополнительного лекарственного средства и/или адъюванта.
З. Изделия
В другом объекте настоящего изобретения предлагается изделие, содержащее материалы, пригодные для лечения, профилактики и/или диагностики расстройств, описанных выше. Изделие содержит контейнер и этикетку или вкладыш-инструкцию, вложенную в упаковку или распечатанную на контейнере. Пригодные контейнеры включают, например, бутылочки, флаконы, шприцы, пакеты для растворов для внутривенного вливания, и т.д. Контейнеры можно изготовить из множества материалов, таких как стекло или пластик. Контейнер содержит композицию, которая сама по себе или в комбинации с другой композицией проявляет эффективность при лечении, профилактике и/или диагностике состояния, а также может быть снабжен зоной доступа (например, контейнер может представлять собой пакет для раствора для внутривенного введения или флакон с пробкой, прокалываемой иглой для подкожной инъекции). По крайней мере, один активный агент в композиции представляет собой биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM-3, выше описанное в данном контексте. На этикетке или вкладыше-инструкции указано, что композиция используется для лечения выбранных состояний. Кроме того, изделие может содержать (а) первый контейнер, содержащий композицию, которая содержит биспецифическое, связывающее активирующий Т клетки антиген соединение по изобретению и (б) второй контейнер, содержащий композицию, которая содержит дополнительный цитотоксический агент или иное лекарственное средство. Изделие в указанном варианте осуществления настоящего изобретения может дополнительно содержать вкладыш-инструкцию, в которой указано, что композиции можно использовать для лечения конкретного состояния. В другом варианте или дополнительно изделие может дополнительно содержать второй (или третий) контейнер, содержащий фармацевтически приемлемый буферный раствор, такой как бактериостатическая вода для инъекций (BWFI), фосфатно-солевой буферный раствор (ФСБ), раствор Рингера и раствор декстрозы. Также он может включать другие материалы, требуемые с коммерческой или пользовательской точки зрения, включая другие буферные растворы, разбавители, фильтры, иглы и шприцы.
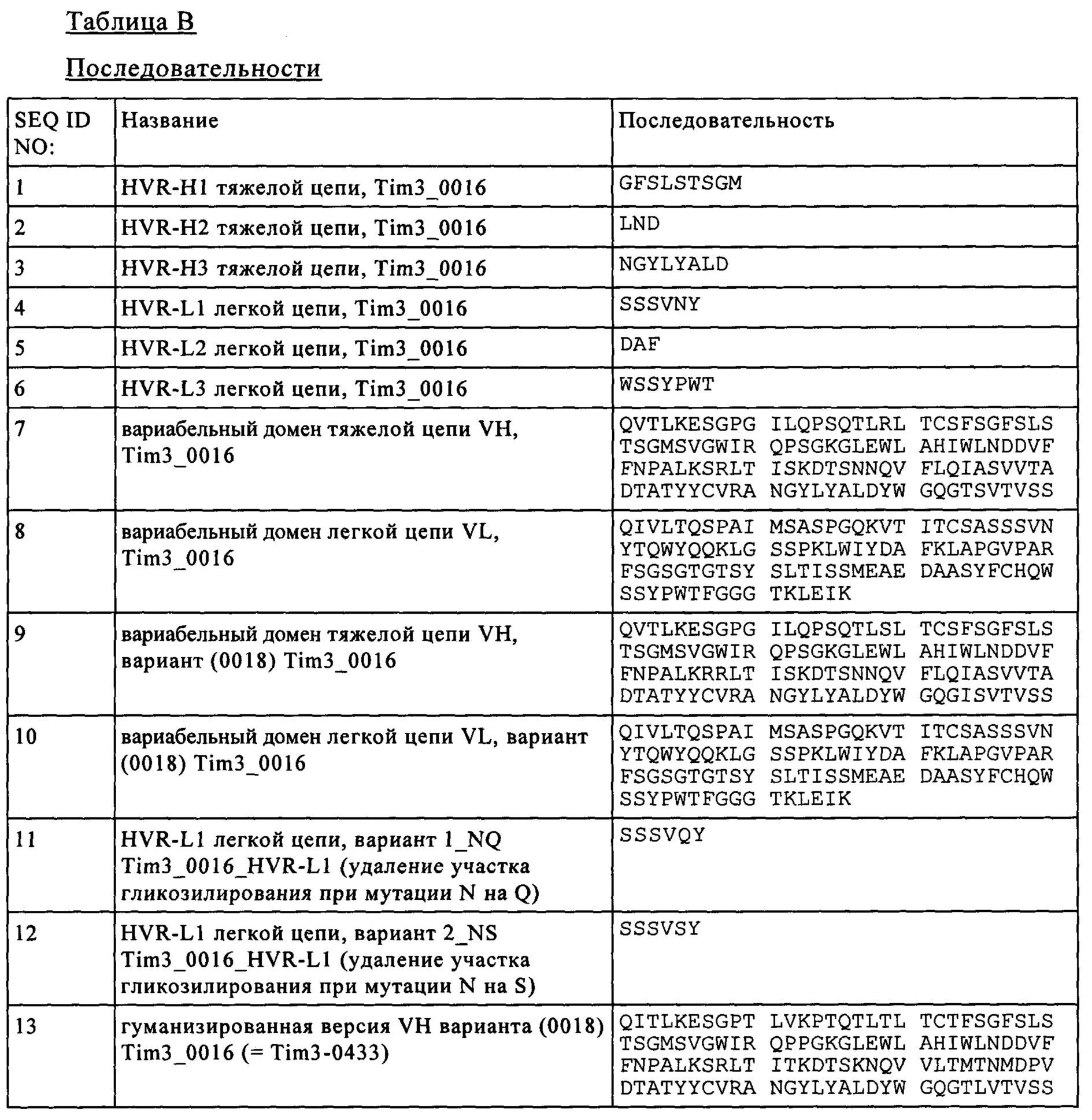
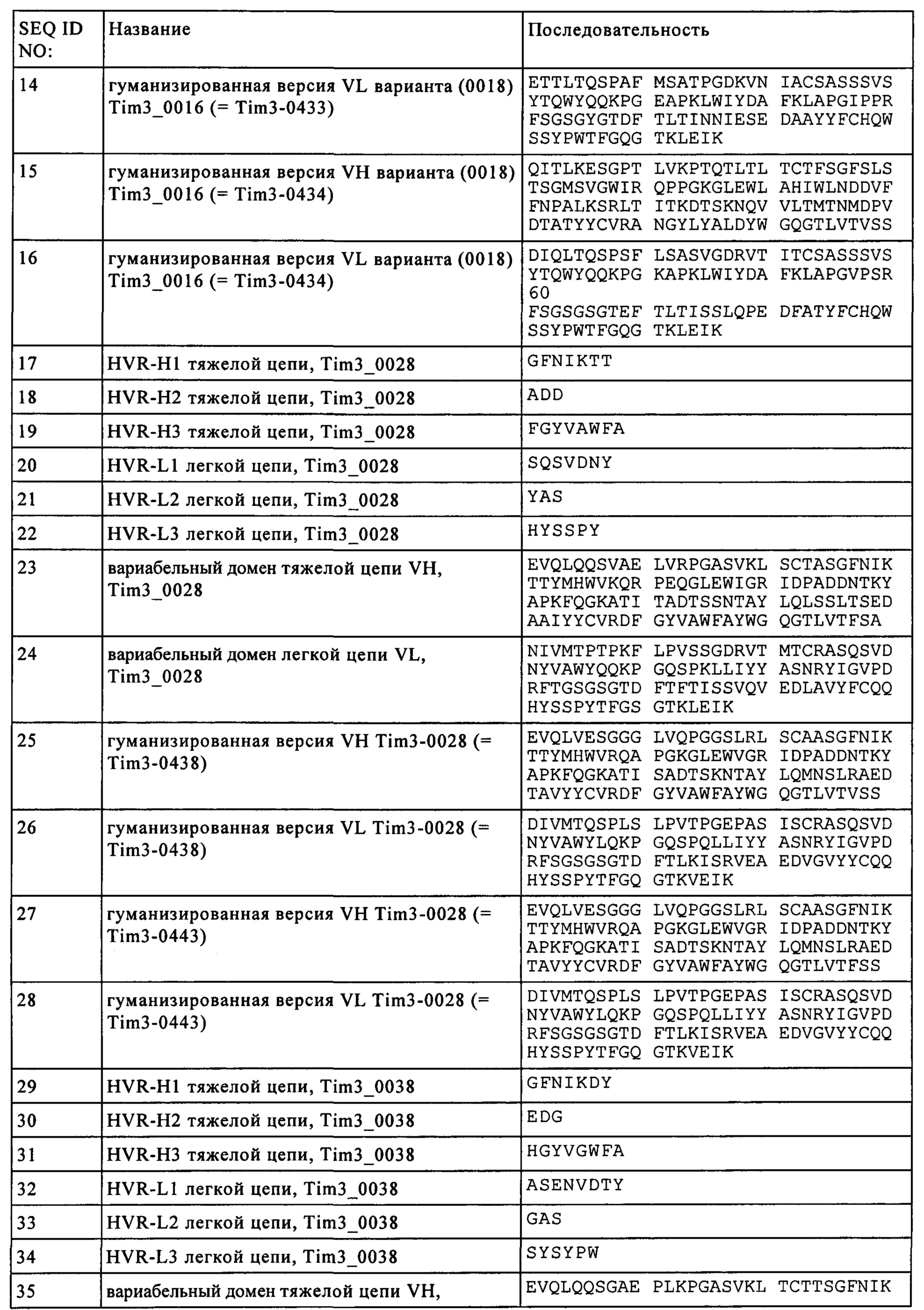
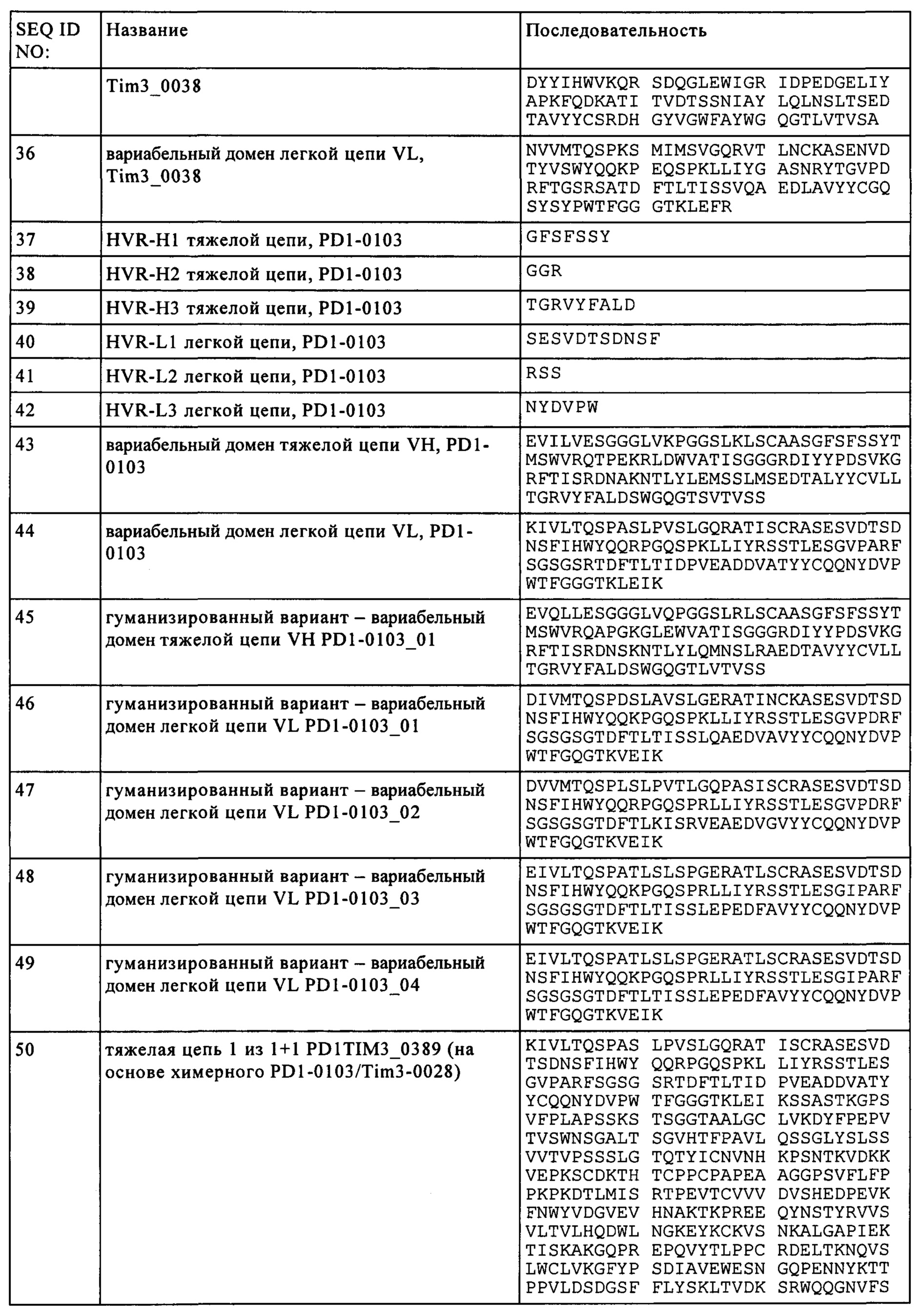
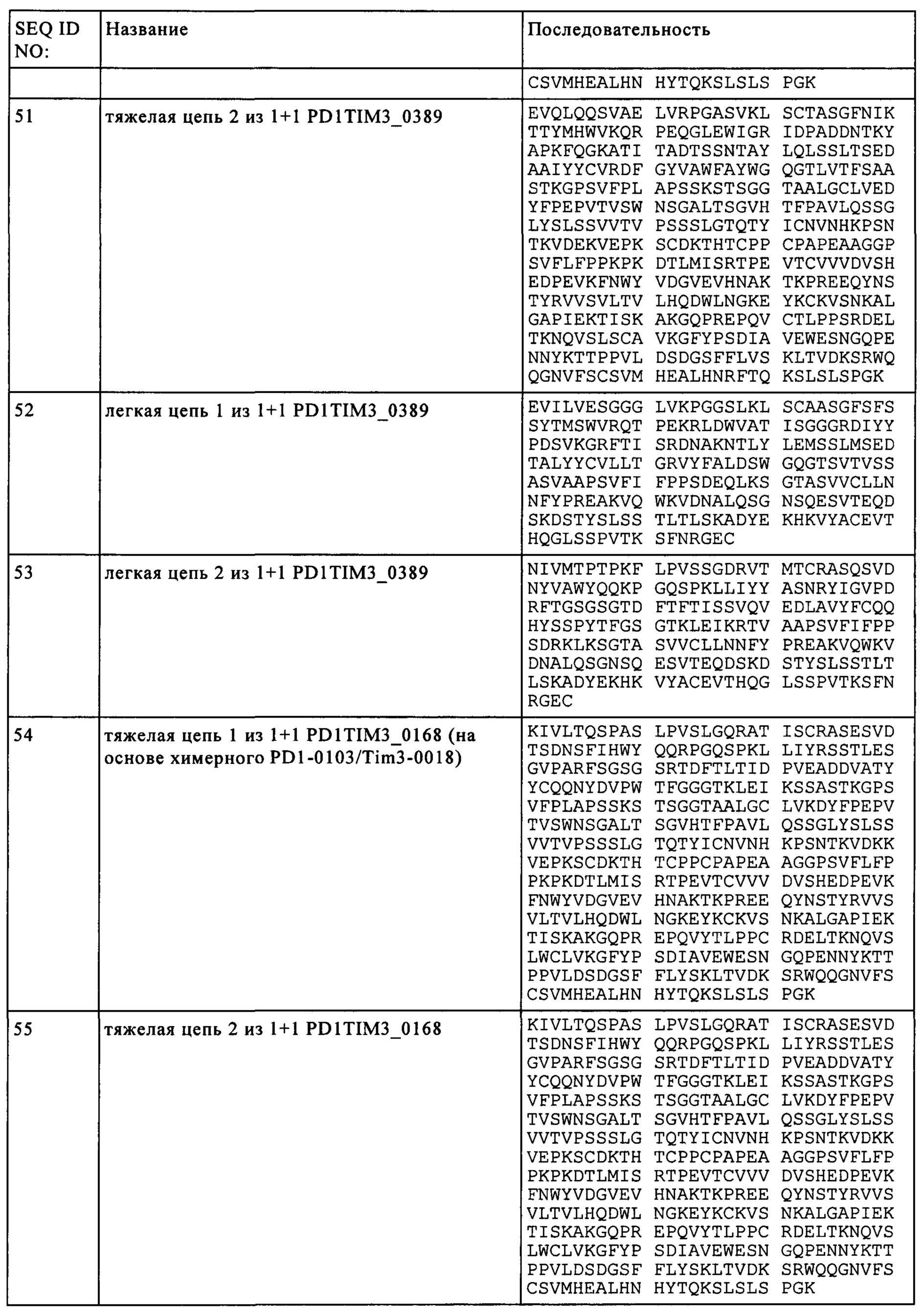
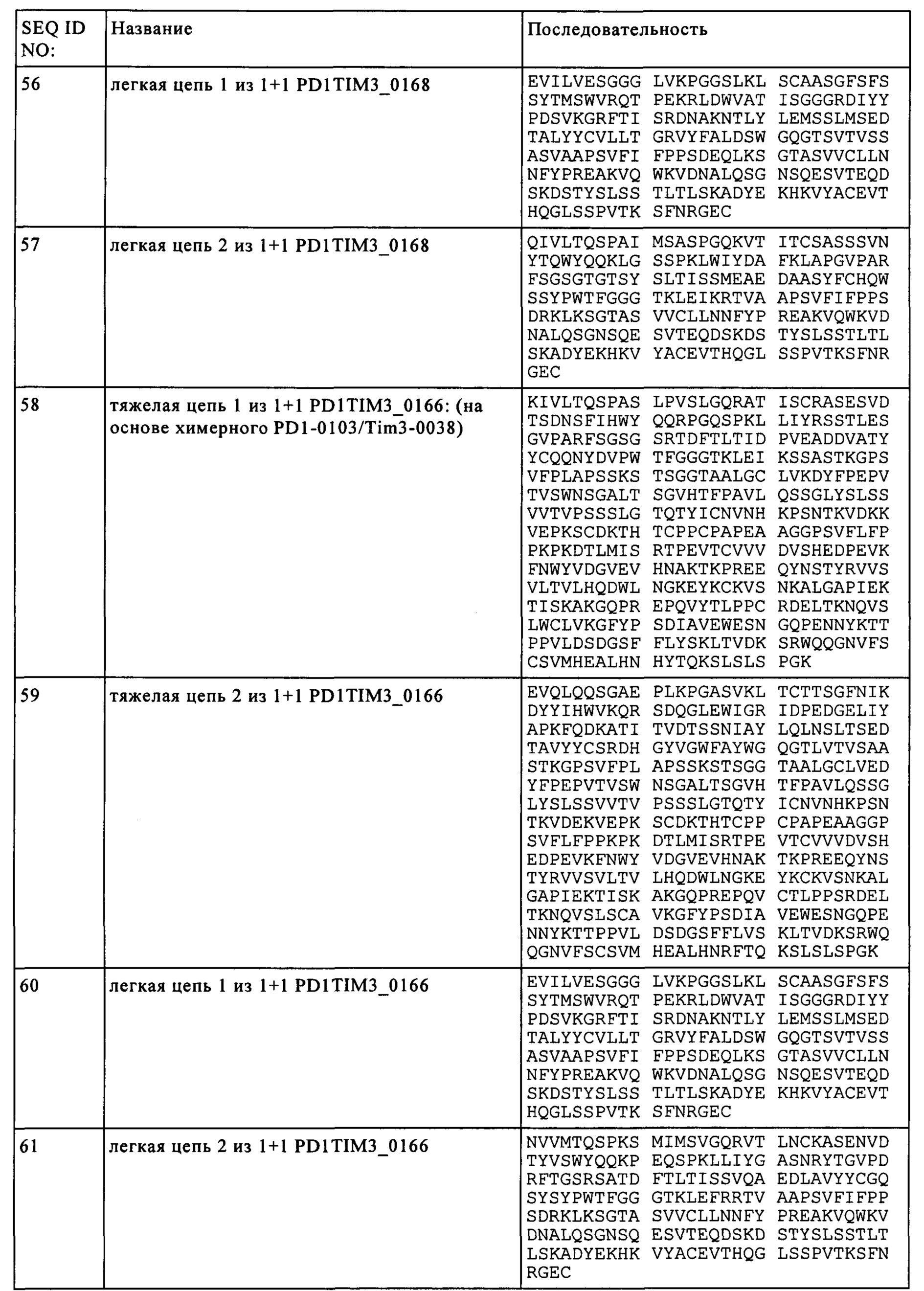
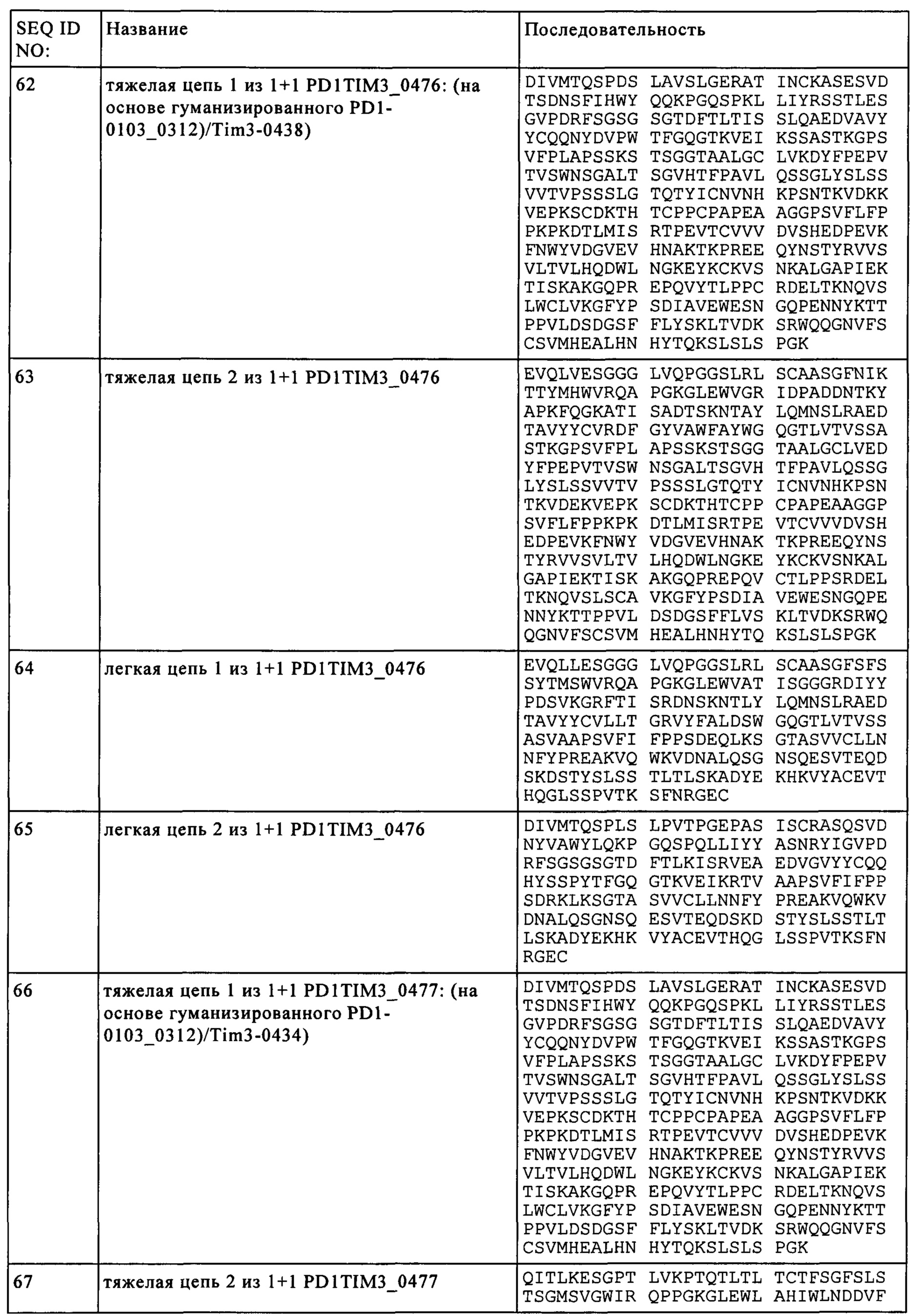
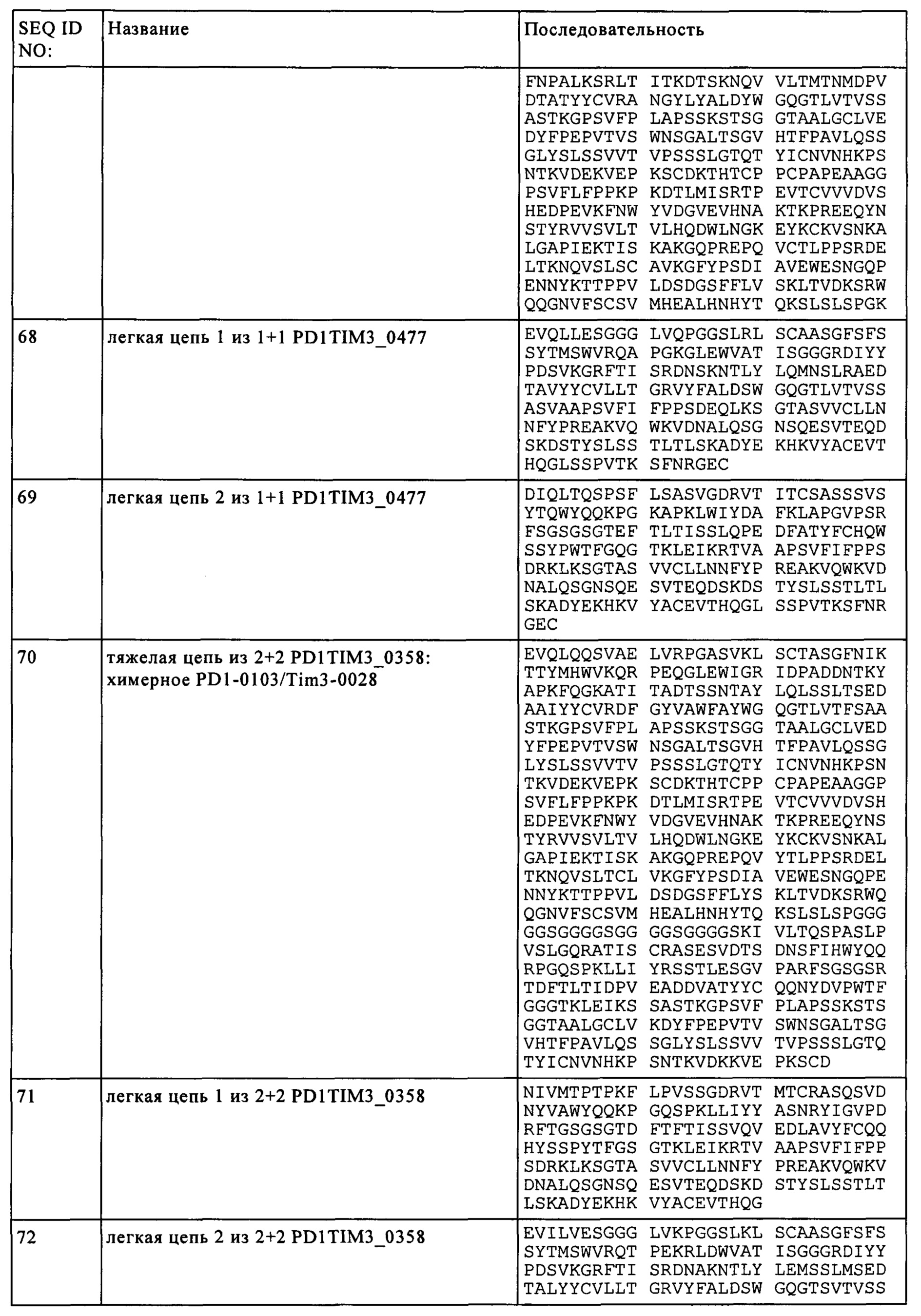

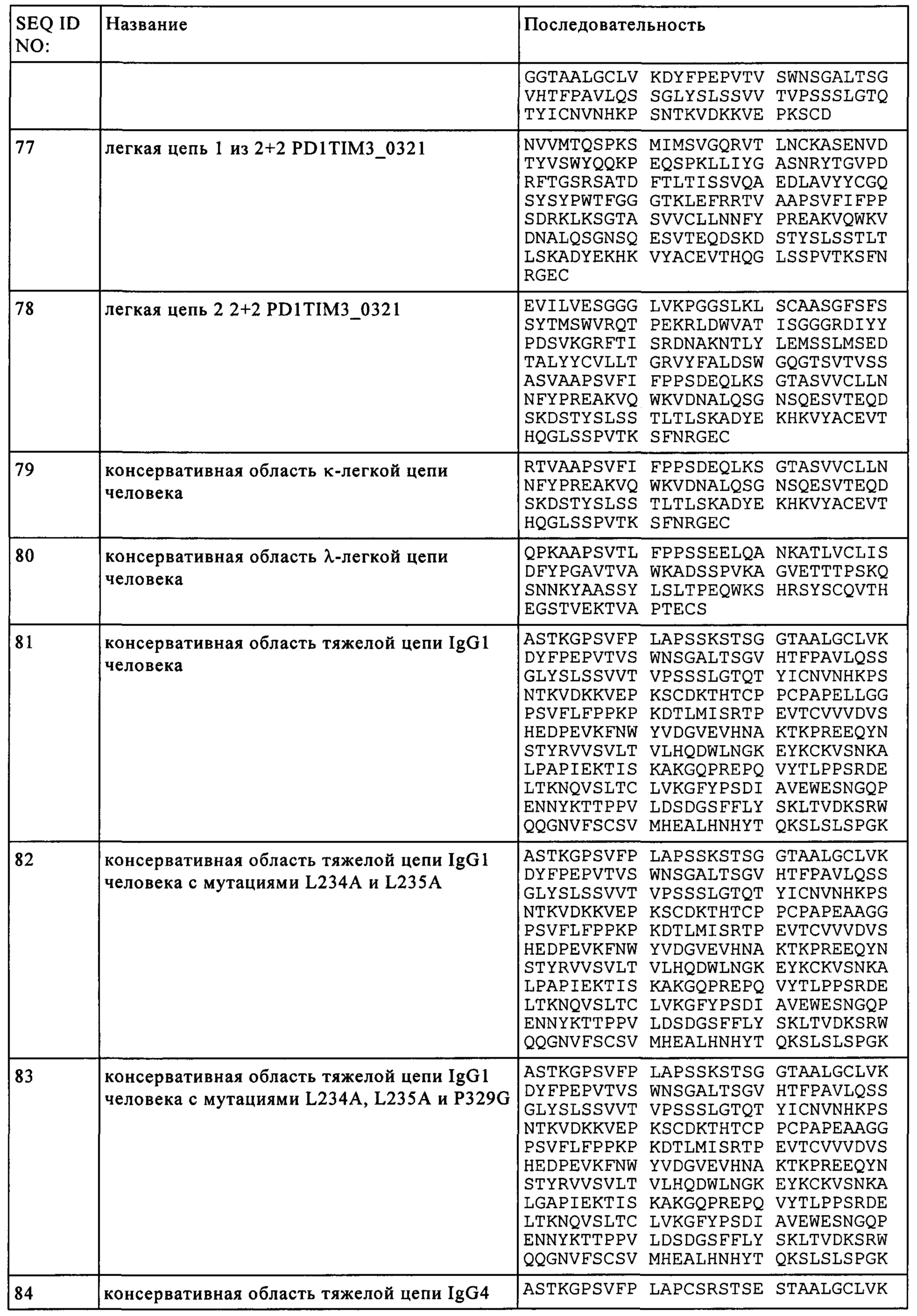
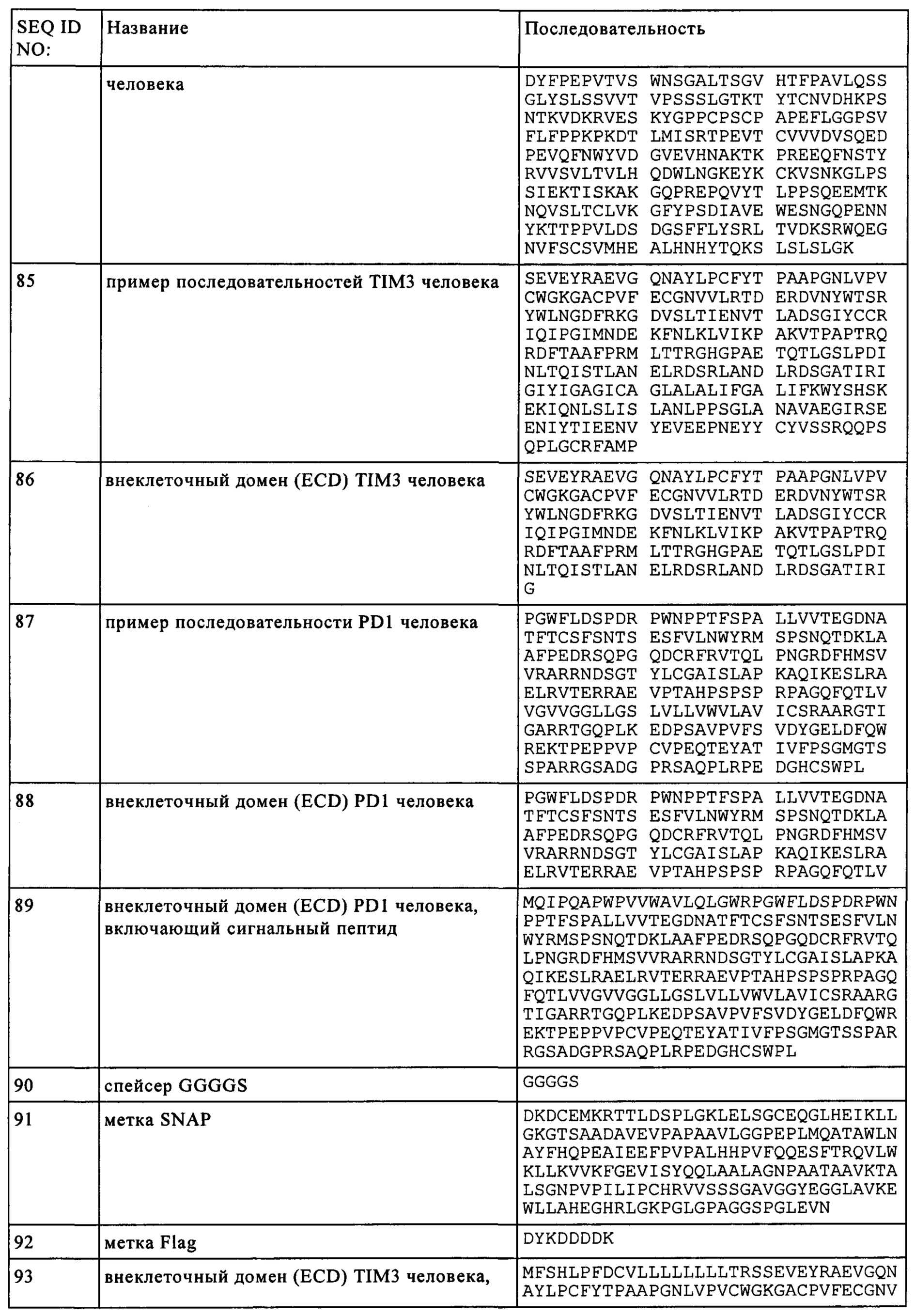

В описанных ниже особых вариантах осуществления настоящего изобретения перечислены следующие компоненты.
1. Биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфически связывается с PD1, и второй антигенсвязывающий участок, который специфически связывается с TIM3, где
указанный первый антигенсвязывающий участок, который специфически связывается с PD1, включает:
VH домен, включающий:
(i) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 37,
(ii) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 38, и
(iii) HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 39, и
VL домен, включающий:
(i) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 40,
(ii) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 41, и
(iii) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 42, и
указанный второй антигенсвязывающий участок, который специфически связывается с TIM3, включает:
(а) VH домен, включающий:
(i) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 1,
(ii) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 2, и
(in) HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 3, и
VL домен, включающий:
(i) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 4 или SEQ ID NO: 11 или SEQ ID NO: 12,
(ii) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 5, и
(iii) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 6, или
(б) VH домен, включающий:
(i) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 17,
(ii) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 18, и
(iii) HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 19, и
VL домен, включающий:
(i) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 20,
(ii) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 21, и
(iii) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 22, или
(в) VH домен, включающий:
(i) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 29,
(ii) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 30, и
(iii) HVR-H3 включающую аминокислотную последовательность SEQ ID NO: 31, и
VL домен, включающий:
(i) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 32,
(ii) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 33, и
(iii) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 34.
2. Биспецифическое антитело, включающее первый антигенсвязывающий участок, который специфично связывается с PD1, и второй антигенсвязывающий участок, который специфично связывается с TIM3, где аффинность связывания биспецифического антитела с TIM3 по крайней мере в 50 раз ниже по сравнению со связыванием с PD1, более предпочтительно по крайней мере в 100 раз ниже по сравнению со связыванием с PD1.
3. Биспецифическое антитело, как описано выше в данном контексте, где указанный первый антигенсвязывающий участок, который специфично связывается с PD1, включает:
(а) VH домен, включающий аминокислотную последовательность SEQ ID NO: 43, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 44, или
(б) VH домен, включающий аминокислотную последовательность SEQ ID NO: 45, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 46, или
(в) VH домен, включающий аминокислотную последовательность SEQ ID NO: 45, VL домен, включающий аминокислотную последовательность SEQ ID NO: 47, или
(г) VH домен, включающий аминокислотную последовательность SEQ ID NO: 45, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 48, или
(д) VH домен, включающий аминокислотную последовательность SEQ ID NO: 45, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 49,
и указанный второй антигенсвязывающий участок, который специфично связывается с TIM3, включает:
(а) VH домен, включающий аминокислотную последовательность SEQ ID NO: 7, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 8, или
(б) VH домен, включающий аминокислотную последовательность SEQ ID NO: 9, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 10, или
(в) VH домен, включающий аминокислотную последовательность SEQ ID NO: 13, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 14, или
(г) VH домен, включающий аминокислотную последовательность SEQ ID NO: 15, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 16, или
(д) VH домен, включающий аминокислотную последовательность SEQ ID NO: 23, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 24, или
(е) VH домен, включающий аминокислотную последовательность SEQ ID NO: 25, VL домен, включающий аминокислотную последовательность SEQ ID NO: 26, или
(ж) VH домен, включающий аминокислотную последовательность SEQ ID NO: 27, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 28, или
(з) VH домен, включающий аминокислотную последовательность SEQ ID NO: 35, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 36.
4. Биспецифическое антитело, как описано выше в данном контексте, где
указанный первый антигенсвязывающий участок, который специфично связывается с PD1, включает VH домен, включающий аминокислотную последовательность SEQ ID NO: 45, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 46,
и указанный второй антигенсвязывающий участок, который специфично связывается с TIM3, включает VH домен, включающий аминокислотную последовательность SEQ ID NO: 15, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 16, или VH домен, включающий аминокислотную последовательность SEQ ID NO: 25, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 26.
5. Биспецифическое антитело, как описано выше в данном контексте, где
указанный первый антигенсвязывающий участок, который специфично связывается с PD1, включает VH домен, включающий аминокислотную последовательность SEQ ID NO: 45, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 46,
и указанный второй антигенсвязывающий участок, который специфично связывается с TIM3, включает VH домен, включающий аминокислотную последовательность SEQ ID NO: 25, и VL домен, включающий аминокислотную последовательность SEQ ID NO: 26.
6. Биспецифическое антитело, как описано выше в данном контексте, где биспецифическое антитело представляет собой антитело человека, гуманизированное или химерное антитело.
7. Биспецифическое антитело, как описано выше в данном контексте, где биспецифическое антитело включает Fc домен, первый Fab фрагмент, включающий антигенсвязывающий участок, который специфично связывается с PD1, и второй Fab фрагмент, включающий антигенсвязывающий участок, который специфично связывается с TIM3.
8. Биспецифическое антитело, как описано выше в данном контексте, где Fc домен представляет собой Fc домен IgG, прежде всего Fc домен IgG1 или Fc домен IgG4.
9. Биспецифическое антитело, как описано выше в данном контексте, где Fc домен включает одну или более аминокислотных замен, что снижает связывание с Fc рецептором, прежде всего с Fcγ рецептором.
10. Биспецифическое антитело, как описано выше в данном контексте, где Fc домен представляет собой Fc домен подкласса IgG1 человека с аминокислотными мутациями L234A, L235A и P329G (нумерация по EU индексу Кабата).
11. Биспецифическое антитело, как описано выше в данном контексте, где Fc домен включает модификацию, ускоряющую ассоциацию первой и второй субъединиц Fc домена.
12. Биспецифическое антитело, как описано выше в данном контексте, где первая субъединица Fc домена включает выступы, а вторая субъединица Fc домена включает впадины согласно способу выступы-во-впадины.
13. Биспецифическое антитело, как описано выше в данном контексте, где первая субъединица Fc домена включает аминокислотные замены S354C и T366W (EU нумерация), а вторая субъединица Fc домена включает аминокислотные замены Y349C, T366S и Y407V (нумерация по EU индексу Кабата).
14. Биспецифическое антитело, как описано выше в данном контексте, где в одном из Fab фрагментов вариабельные домены VL и VH заменены друг на друга таким образом, что VH домен является частью легкой цепи, а VL домен представляют собой часть тяжелой цепи.
15. Биспецифическое антитело, как описано выше в данном контексте, где в первом Fab фрагменте, включающем антигенсвязывающий участок, который специфично связывается с PD1, вариабельные домены VL и VH заменены друг на друга.
16. Биспецифическое антитело, как описано выше в данном контексте, где в одном из Fab фрагментов в консервативном домене CL аминокислота в положении 124 заменена независимо на лизин (K), аргинин (R) или гистидин (Н) (нумерация EU по индексу Кабата), и в консервативном домене СН1 аминокислоты в положениях 147 и 213 заменены независимо на глутаминовую кислоту (Е) или аспарагиновую кислоту (D) (нумерация по EU индексу Кабата).
17. Биспецифическое антитело, как описано выше в данном контексте, где во втором Fab фрагменте, включающем антигенсвязывающий участок, который специфично связывается с TIM3, в консервативном домене CL аминокислота в положении 124 заменена независимо на лизин (K), аргинин (R) или гистидин (Н) (нумерация по EU индексу Кабата), и в консервативном домене СН1 аминокислоты в положениях 147 и 213 заменены независимо на глутаминовую кислоту (Е) или аспарагиновую кислоту (D) (нумерация по EU индексу Кабата).
18. Биспецифическое антитело, как описано выше в данном контексте, включающее:
(а) первую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 50, первую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 52,
вторую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 51, и вторую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 53, или
(б) первую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 54, первую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 56,
вторую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 55, и вторую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 57, или
(в) первую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 58, первую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 60,
вторую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 59, и вторую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 61, или
(г) первую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 62, первую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 64,
вторую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 63, и вторую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 65, или
(д) первую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 66, первую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 68,
вторую тяжелую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 67, и вторую легкую цепь, включающую аминокислотную последовательность, идентичность которой составляет по крайней мере 95% по сравнению с последовательностью SEQ ID NO: 69.
19. Биспецифическое антитело, как описано выше в данном контексте, включающее:
(а) первую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 50, первую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 52,
вторую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 51, вторую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 53, или
(б) первую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 54, первую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 56,
вторую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 55, вторую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 57, или
(в) первую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 58, первую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 60,
вторую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 59, вторую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 61, или
(г) первую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 62, первую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 64,
вторую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 63, вторую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 65, или
(д) первую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 66, первую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 68,
вторую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 67, вторую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 69.
20. Полинуклеотид, кодирующий биспецифическое антитело, как описано выше в данном контексте.
21. Вектор, предпочтительно вектор экспрессии, включающий полинуклеотид, как описано выше в данном контексте.
22. Прокариотическую или эукариотическую клетку-хозяина, включающую полинуклеотид, как описано выше в данном контексте, или вектор, как описано выше в данном контексте.
23. Способ получения биспецифического антитела, как описано выше в данном контексте, включающий следующие стадии: а) трансформация клетки-хозяина векторами, включающими полинуклеотиды, кодирующие указанное биспецифическое антитело, б) культивирование клетки-хозяина в условиях, пригодных для экспрессии биспецифического антитела и в) выделение биспецифического антитела из культуральной среды.
24. Фармацевтическая композиция, включающая биспецифическое антитело, как описано выше в данном контексте, и по крайней мере один фармацевтически приемлемый эксципиент.
25. Биспецифическое антитело, как описано выше в данном контексте, или фармацевтическая композиция, как описано выше в данном контексте, для применения в качестве лекарственного средства.
26. Биспецифическое антитело, как описано выше в данном контексте, или фармацевтическая композиция, как описано выше в данном контексте, для применения:
i) при модуляции иммунных ответных реакций, таких как восстановление активности Т клеток,
ii) при стимуляции иммунной ответной реакции или функции,
iii) при лечении инфекционных заболеваний,
iv) при лечении рака,
v) при замедлении прогрессирования рака,
vi) при продлении жизни пациенту, страдающему от рака.
27. Биспецифическое антитело, как описано выше в данном контексте, или фармацевтическая композиция, как описано выше в данном контексте, для применения при профилактике или лечении рака.
28. Биспецифическое антитело, как описано выше в данном контексте, или фармацевтическая композиция, как описано выше в данном контексте, для применения при лечении хронической вирусной инфекции.
29. Биспецифическое антитело, как описано выше в данном контексте, или фармацевтическая композиция, как описано выше в данном контексте, для применения при профилактике или лечении рака, где биспецифическое антитело вводят в комбинации с химиотерапевтическим агентом, лучевой терапией и/или другими агентами, которые используют в иммунотерапии рака.
30. Способ подавления роста опухолевых клеток у индивидуума, включающий введение индивидууму эффективного количества биспецифического антитела, как описано выше в данном контексте, для подавления роста опухолевых клеток.
Примеры
Приведенные ниже примеры представляют собой примеры методов и композиций по настоящему изобретению. Следует понимать, что на практике можно осуществлять любые другие варианты осуществления настоящего изобретения с учетом общего описания, представленного ниже.
Материалы и основные методы
Основная информация, относящаяся к нуклеотидным последовательностям легких и тяжелых цепей иммуноглобулинов человека, представлена в книге Kabat E.A. и др., Sequences of Proteins of Immunological Interest, 5е изд., Public Health Service, National Institutes of Health, Bethesda, MD (1991). Аминокислоты цепей антител пронумерованы и приведены в соответствии с системой нумерации Кабата (Kabat E.A. и др., Sequences of Proteins of Immunological Interest, 5е изд., Public Health Service, National Institutes of Health, Bethesda, MD (1991)), как описано выше.
Методы рекомбинантных ДНК
В настоящем изобретении использовали стандартные методы работы с ДНК, как описано в книге Sambrook J. и др., Molecular Cloning: A laboratory manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, Нью-Йорк (1989). Реагенты молекулярной биологии использовали согласно инструкциям фирм-производителей.
Синтез генов
Требуемые сегменты генов получали из олигонуклеотидов, полученных химическим синтезом. Сегменты генов длиной 600-1800 пар оснований, которые фланкировали при отщеплении с использованием сайтов расщепления сингулярной рестрикционной эндонуклеазы, объединяли с использованием аннелирующих и лигирующих олигонуклеотидов, включая амплификацию ПЦР и последовательное клонирование через указанные сайты расщепления, например, KpnI/SacI или AscI/PacI в векторе клонирования pGA4 на основе pPCRScript (Stratagene). Последовательности ДНК фрагментов субклонированного гена подтверждали секвенированием ДНК. Фрагменты синтезированных генов систематизировали согласно прилагаемым спецификациям (Geneart, Regensburg, Германия).
Определение последовательностей ДНК
Последовательности ДНК определяли двухцепочечным секвенированием на приборе MediGenomix GmbH (Martinsried, Германия) или Sequiserve GmbH (Vaterstetten, Германия).
Анализ последовательностей ДНК и белков и организация данных по секвенированию
Для создания, картирования, анализа, аннотации и иллюстрации последовательностей использовали программное обеспечения GCG (Genetics Computer Group, Мэдисон, Висконсин), версию 10.2, и  Vector NT1 Advance suite, версию 8.0.
Vector NT1 Advance suite, версию 8.0.
Векторы экспрессии
Для экспрессии описанных антител использовали варианты плазмид экспрессии для временной экспрессии в клетках (например, HEK293) на основе организации кДНК в присутствии или в отсутствии промотора CMV - Интрона А, или геномной организации в присутствии промотора CMV.
Кроме кассеты экспрессии антитела векторы содержат:
- источник репликации, позволяющий осуществлять репликацию данной плазмиды в Е.Coli, и
- ген β-лактамазы, придающий в Е.Coli устойчивость к ампициллину. Единица транскрипции гена антитела состоит из следующих элементов:
- уникальный(ые) сайт(ы) рестрикции на 5' конце,
- немедленно-ранний энхансер и промотор из цитамегаловируса человека,
- расположенная за Интроном А последовательность в случае организации кДНК,
- 5' не-транслируемый участок гена антитела человека,
- сигнальная последовательность тяжелой цепи иммуноглобулина,
- цепь антитела человека (дикого типа или с обменом доменов) или в виде кДНК или в виде геномной организации с иммуноглобулином экзон-интронной структуры,
- 3' не-транслируемый участок с сигнальной последовательностью полиаденилирования и
- уникальный(ые) участок(ки) рестрикции на 3' конце.
Гибридные гены, содержащие цепи антитела, как описано ниже, получали в ходе ПЦР и/или при синтезе гена и собирали с использованием стандартных рекомбинантных методов и технологий при присоединении сегментов соответствующей нуклеиновой кислоты, например, с использованием уникальных сайтов рестрикции в соответствующих векторах. Последовательности субклонированных нуклеиновых кислот подтверждали секвенированием ДНК. Для временной трансфекции препаративные количества плазмид получали при получении плазмид из трансформированных культур Е.Coli (Nucleobond AX, Macherey-Nagel).
Методы клеточных культур
Использовали стандартные методы клеточных культур, как описано в книге Current Protocols in Cell Biology, под ред. Bonifacino J.S., Dasso M., Harfbrd J.B., Lippincott-Schwartz J., Yamada K.M., John Wiley & Sons, Inc. (2000).
Мультиспецифические антитела экспрессировали при совместной трансфекции соответствующих плазмид экспрессии на клетках HEK293-EBNA или HEK29-F в суспензии в фазе адгезивного роста, как описано ниже.
Временная трансфекция в системе HEK293
Все антитела и биспецифическое антитела получали временной трансфекцией на клетках 293F с использованием системы Freestyle system (ThermoFisher). Для этого клетки 293F культивировали в среде F17, трансфектировали с использованием 293Free (Novagene) и через 4 ч добавляли 4 мМ VPA и Feed 7, а через 16 ч добавляли 0,6% глюкозу. Затем использовали набор Expi293F™ Expression System Kit (ThermoFisher). Для этого клетки Expi293F™ культивировали в среде для экспрессии Expi293™ с использованием набора ExpiFectamine™ 293 Transfection Kit согласно инструкциям фирмы-изготовителя. Вследствие улучшенной стабильности и чистоты, а также сниженной тенденции к агрегации биспецифических антител CrossMAbVh-VL с заряженными парами аминокислот, дополнительно введенными на границу раздела CH1/CL (см. расположение соответствующих последовательностей для дополнительной информации), подбор соотношения плазмид не проводили. Следовательно, для совместной трансфекции плазмид LC, НС, перекрестной плазмиды LC и перекрестной плазмиды НС использовали относительное соотношение плазмид 1:1:1:1 для 1+1 CrossMab или 1:1:1 для 2+2 CrossMab. Супернатанты клеток собирали через 7 сут и очищали по стандартным методикам.
Определение белка
Концентрацию белка в очищенных антителах и производных определяли по оптической плотности (ОП) при 280 нм с использованием коэффициента молярной экстинкции, рассчитанного на основе аминокислотной последовательности, как описано в статье Расе и др., Protein Science, 4, ее. 2411-1423 (1995).
Определение концентрации антител в супернатантах
Концентрацию антител и производных в супернатантах клеточных культур оценивали иммунопреципитацией с использованием агарозных гранул с иммобилизованным А белком (Roche). Агарозные гранулы (60 мкл) с А белком 3 раза промывали раствором TBS-NP40 (50 мМ Трис, рН 7,5, 150 мМ NaCl, 1% Nonidet-P40). Затем на агарозные гранулы с А белком, предварительно уравновешенные в растворе TBS-NP40, наносили 1-15 мл супернатанта клеточной культуры. После инкубирования в течение 1 ч при комнатной температуре гранулы промывали на колонке Ultrafree-MC-filter (Amicon) один раз 0,5 мл TBS-NP40, 2 раза 0,5 мл 2 × фосфатно-солевым буферным раствором (2× ФСБ, Roche) и кратковременно 4 раза 0,5 мл 100 мМ раствором цитрата натрия (рН 5,0). Связанное антитело элюировали при добавлении 35 мкл буферного раствора для элюции образцов NuPAGE® LDS (Invitrogen). Половину объема образца смешивали с агентом для восстановления образцов NuPAGE® или оставляли в невосстановленном состоянии, соответственно, и нагревали в течение 10 мин при 70°С. Затем 5-30 мкл наносили на полиакриламидный гель для электрофореза 4-12% NuPAGE® Bis-Tris SDS-ПААГ (Invitrogen) (в смеси с буферным раствором MOPS для электрофореза SDS-ПААГ в невосстанавливающих условиях и буферным раствором MES с антиоксидантной добавкой NuPAGE® (Invitrogen) для электрофореза SDS-ПААГ в восстанавливающих условиях) и окрашивали красителем Coomassie Blue.
Концентрацию антител и производных в супернатантах клеточных культур количественно измеряли методом аффинной хроматографии ВЭЖХ. Краткое описание метода: супернатанты клеточных культур, содержащие антитела и производные, связанные с А белком, наносили на колонку Applied Biosystems Poros A/20 в 200 мМ KH2PO4, 100 мМ цитрата натрия (рН 7,4) и элюировали из сорбента буферным раствором 200 мМ Nad, 100 мМ лимонной кислоты (рН 2,5) в системе Agilent HPLC 1100. Элюированный белок определяли количественно по поглощению в УФ-области и интегрированием площадей пиков. Очищенное референс-антитело IgG1 служило стандартом.
В другом варианте концентрацию антител и производных в супернатантах клеточных культур определяли с использованием метода «сэндвич-ИФА» (ИФА-IgG). Краткое описание метода: лунки 96-луночных микротитрационных планшетов StreptaWell High Bind Strepatavidin (Roche) покрывали 100 мкл/лунка биотинилированных антител против IgG человека F(ab')2<h-Fcγ>BI (Dianova) при концентрации 0,1 мкг/мл в течение 1 ч при комнатной температуре или в течение ночи при 4°С и последовательно промывали 3 раза 200 мкл/лунка ФСБ, 0,05% Твин (PBST, Sigma). Затем в лунки добавляли 100 мкл/лунка серийные разведения супернатантов клеточных культур в ФСБ (Sigma), содержащих соответствующие антитела, и инкубировали в течение 1-2 ч на качалке для микротитрационных планшетов при комнатной температуре. Лунки промывали 3 раза 200 мкл/лунка PBST и связанное антитело детектировали 100 мкл F(ab')2<h-Fcγ>POD (Dianova) при концентрации 0,1 мкг/мл в качестве детектируемого антитела в течение 1-2 ч на качалке для микротитрационных планшетов при комнатной температуре. Несвязанное детектируемое антитело отмывали 3 раза 200 мкл/лунка PBST и связанное детектируемое антитело определяли при добавлении 100 мкл ABTS /лунка. Определение поглощения проводили на спектрофотометре Tecan Fluor при длине волны 405 нм (длина волны сравнения 492 нм).
Очистка белков
Белки очищали из отфильтрованных супернатантов клеточных культур согласно стандартным протоколам. Краткое описание метода: антитела наносили на колонку с сефарозой с иммобилизованным белком A (GE healthcare) и промывали ФСБ. Элюцию антител проводили при рН 2,8 с последующей немедленной нейтрализацией образца. Агрегаты белка отделяли от мономерных антител гель-проникающей хроматографией (Superdex 200, GE Healthcare) в ФСБ или в 20 мМ гистидине, 150 мМ NaCl рН 6,0. Фракции мономерного антитела объединяли, концентрировали (при необходимости) с использованием, например, центрифужного концентратора MILLIPORE Amicon Ultra (номинальное отсечение по молекулярной массе (НОММ) = 30), замораживали и хранили при -20°С или -80°С. Часть образцов использовали для последующего анализа и характеристики белков, например, с использованием электрофореза в полиакриламидном геле SDS-ПААГ, гель-проникающей хроматографии (ГПХ) или масс-спектрометрии.
Электрофорез в полиакриламидном геле SDS-ПААГ
Гелевую систему NuPAGE® Pre-Cast (Invitrogen) использовали согласно инструкции фирмы-производителя. Более конкретно, использовали 10% или 4-12% гели NuPAGE® Novex® Bis-TRIS Pre-Cast (pH 6,4) и NuPAGE® MES (в восстанавливающих условиях, с буферной антиоксидантной добавкой NuPAGE®) или электродный буферный раствор MOPS (в невосстанавливающих условиях).
Аналитическая гель-проникающая хроматография
Гель-проникающую хроматографию (ГПХ) проводили для исследования агрегированного и олигомерного состояния антител в режиме ВЭЖХ. Краткое описание метода: антитела, очищенные на колонке с А белком, наносили на колонку Tosoh TSKgel G3000SW в 300 мМ NaCl, 50 мМ KH2PO4/K2HPO4, pH 7,5 в системе Agilent HPLC 1100 или на колонку с сорбентом Superdex 200 (GE Healthcare) в 2 × ФСБ в системе Dionex HPLC. Элюированный белок количественно оценивали по поглощению в УФ области и по площади пиков. В качестве стандарта использовали набор BioRad Gel Filtration Standard 151-1901.
Масс-спектрометрия
В данном разделе описана характеристика мульти специфичных антител с обменом VH/VL (VH/VL CrossMabs) с учетом их правильной сборки. Ожидаемые первичные структуры определяли масс-спектрометрией с ионизацией электрораспылением (MC-ESI), анализировали интактные антитела CrossMabs и дегликозилированные/расщепленные плазмином или в другом варианте дегликозилированные/частично расщепленные LysC антитела CrossMabs.
Антитела VH/VL CrossMabs дегликозилировали N-гликозидазой F в фосфатном буферном растворе или в трис-буферном растворе при 37°С в течение 17 ч при концентрации белка 1 мг/мл. Расщепление плазмином или частичное расщепление LysC (Roche) проводили с использованием 100 мкг дегликозилированных антител VH/VL CrossMabs в трис-буферном растворе при рН 8 и комнатной температуре в течение 120 ч и при 37°С в течение 40 мин, соответственно. Перед проведением анализа методом масс-спектрометрии образцы обессоливали с использованием ВЭЖХ на колонке Sephadex G25 (GE Healthcare). Общую массу определяли методом MC-ESI в системе maXis 4G UHR-QTOF MS (Bruker Daltonik), снабженной источником TriVersa NanoMate (Advion).
Определение связывания и связывающей аффинности мультиспецифических антител с соответствующими антигенами с использованием поверхностного плазмонного резонанса (ППР) (BIACORE)
Связывание полученных антител с соответствующими антигенами исследовали с использованием ППР в системе BIACORE (GE Healthcare Biosciences АВ, Uppsala, Швеция). Краткое описание метода: для измерения аффинности кроличьи антитела IgG против человека, JIR 109-005-098 иммобилизовали на чипе СМ5 методом аминной конденсации для презентации антител против соответствующего антигена. Связывание проводили в буферном растворе HBS (HBS-P (10 мМ HEPES, 150 мМ NaCl, 0,005% Твин 20, рН 7,4)) при 25°С (или в другом варианте при 37°С). Антиген (R&D Systems или очищенный в лабораторных условиях) добавляли в раствор при различных концентрациях. Связывание измеряли при введении антигена в течение от 80 с до 3 мин, диссоциацию измеряли при промывке поверхности чипа буферным раствором HBS в течение от 3 до 10 мин и величину KD оценивали с использованием модели связывания Лэнгмюра 1:1. Отрицательные контрольные данные (например, кривые для буферных растворов) вычитали из кривых для образцов для коррекции на внутрисистемный дрейф базовой линии и снижения сигнала шума. Для анализа сенсограмм и расчета данных связывания использовали соответствующее программное обеспечение Biacore Evaluation.
Антитела TIM3
Пример 1a
Получение антител анти-TIM3
Иммунизация мышей
Мышей NMRI иммунизировали генетическим методом с использованием плазмидного вектора экспрессии, кодирующего полноразмерный Tim-3 человека при внутрикожном введении 100 мкг вектора ДНК (плазмида 15304_hTIM3-f1) с последующей электропорацией (2 прямоугольных пульса по 1000 В/см, продолжительность 0,1 мс, интервал 0,125 с, затем 4 прямоугольных пульса по 287,5 В/см, продолжительность 10 мс, интервал 0,125 с). Мышей иммунизировали 6 раз в дни 0, 14, 28, 42, 56, 70 и 84. Кровь забирали в дни 36, 78 и 92 и получали сыворотку, которую использовали для определения титра методом ИФА (см. ниже). Животных с наиболее высокими титрами отбирали для повторной иммунизации в день 96 при внутривенной инъекции 50 мкг рекомбинантного химерного Tim-3-Fc человека, и моноклональные антитела выделяли методом гибридом при гибридизации спленоцитов с линией миеломных клеток через 3 дня после повторной иммунизации.
Определение сывороточных титров (ИФА)
Рекомбинантный химерный Tim-3-Fc человека иммобилизовали на 96-луночном планшете NUNC Maxisorp при концентрации 0,3 мкг/мл в количестве 100 мкл/лунка в ФСБ, затем планшет блокировали 2% раствором Crotein С в ФСБ в количестве 200 мкл/лунка и наносили серийные разведения антисыворотки в двойном повторе в 0,5% растворе Crotein С в ФСБ в количестве 100 мкл/лунка и определяли связывание с конъюгатом козьих антител к иммуноглобулину мыши и пероксидазы хрена (HRP) (Jackson Immunoresearch/Dianova 115-036-071, 1/16000). На всех стадиях планшеты инкубировали в течение 1 ч при 37°С. Между всеми стадиями планшеты промывали 3 раза 0,05% раствором твин 20 в ФСБ. Сигнал получали при добавлении растворимого субстрата ВМ Blue POD (Roche) в количестве 100 мкл/лунка и реакцию останавливали при добавлении 1 М HCl в количестве 100 мкл/лунка. Поглощение регистрировали при 450 нм против 690 нм в качестве контроля. Титр определяли по разведению антисыворотки в лунке, которое соответствует полумаксимальному сигналу.
Пример 1б
Характеристика антител анти-TIM3
ИФА TIM3
Планшеты Nunc-Maxi Sorp Streptavidine (MicroCoat #11974998/MC1099) покрывали раствором TIM3-ECD-His-Biotin (биотинилированный в присутствии лигазы BirA) в количестве 25 мкл/лунка и инкубировали при комнатной температуре в течение 1 ч при встряхивании при 400 об/мин. После промывки (3×90 мкл/лунка буферным раствором PBST) в лунки добавляли 25 мкл образцов aTIM3 или разведения референс-антитела (1:2) aTIM3 F38-2E2 (Biolegend) и инкубировали в течение 1 ч при КТ. После промывки (3×90 мкл/лунка буферным раствором PBST) добавляли антитела овцы против иммуноглобулина мыши POD (GE NA9310V) в количестве 25 мкл/лунка при разведении 1:9000 и инкубировали при комнатной температуре в течение 1 ч при встряхивании при 400 об/мин. После промывки (4×90 мкл/лунка буферным раствором PBST) добавляли субстрат ТМВ (Calbiochem, #CL07) в количестве 25 мкл/лунка и инкубировали до оптической плотности 1,5-2,5. Затем реакцию останавливали при добавлении 1 М раствора соляной кислоты в количестве 25 мкл/лунка. Измерение проводили при 370/492 нм.
Результаты ИФА представлены в виде величин ЕС50 [нг/мл] в итоговой табл. 1 ниже.
Клеточный ИФА для TIM3
Клеточную линию СНО-K1 (в фазе адгезивного роста) стабильно трансфектировали плазмидой 15312_hTIM3-f1_pUC_Neo, кодирующей полноразмерный TIM3 человека, и селекцию к G418 (маркер устойчивости к неомицину на плазмиде) проводили при концентрации 1,2×10E6 клеток/мл в 384-луночных планшетах с плоским дном при инкубации в течение ночи.
На следующий день добавляли 25 мкл/лунка образца TIM3 или референс-антитела aTIM3 F38-2E2, не содержащего азид (Biolegend, 354004) и инкубировали в течение 2 ч при 4°С (для исключения интернализации). После промывки (3×90 мкл/лунка PBST (BIOTEK Washer: Prog. 29, 1×90) клетки фиксировали удалением остаточного буферного раствора и добавлением в количестве 50 мкл/лунка 0,05% глутарового альдегида: разведение 1:500 25% глутарового альдегида (Sigma, Cat. No: G5882) в 1×ФСБ и инкубировали в течение 1 ч при комнатной температуре. После промывки (3×90 мкл/лунка PBST (BIOTEK Washer, Prog. 21, 3×90 GreinLysin) добавляли 25 мкл/лунка вторичного антитела для детекции (антитело овцы против мышиного иммуноглобулина POD, конъюгат пероксидазы хрена и POD, связанный с фрагментом F(ab')2, GE NA9310) с последующей инкубацией в течение 2 ч при комнатной температуре при встряхивании при 400 об/мин. После промывки (3×90 мкл/лунка PBST (BIOTEK Washer: Prog. 21, 3×90 GreinLysin) добавляли 25 мкл/лунка раствора субстрата ТМВ (Roche 11835033001) и инкубировали до получения оптической плотности 1,5-2,5. Затем реакцию останавливали при добавлении 1 М раствора соляной кислоты в количестве 25 мкл/лунка. Измерение проводили при 370/492 нм.
Результаты клеточного ИФА представлены в виде величин ЕС50 CHO-TIM3 [нг/мл] в итоговой табл. 1 ниже.
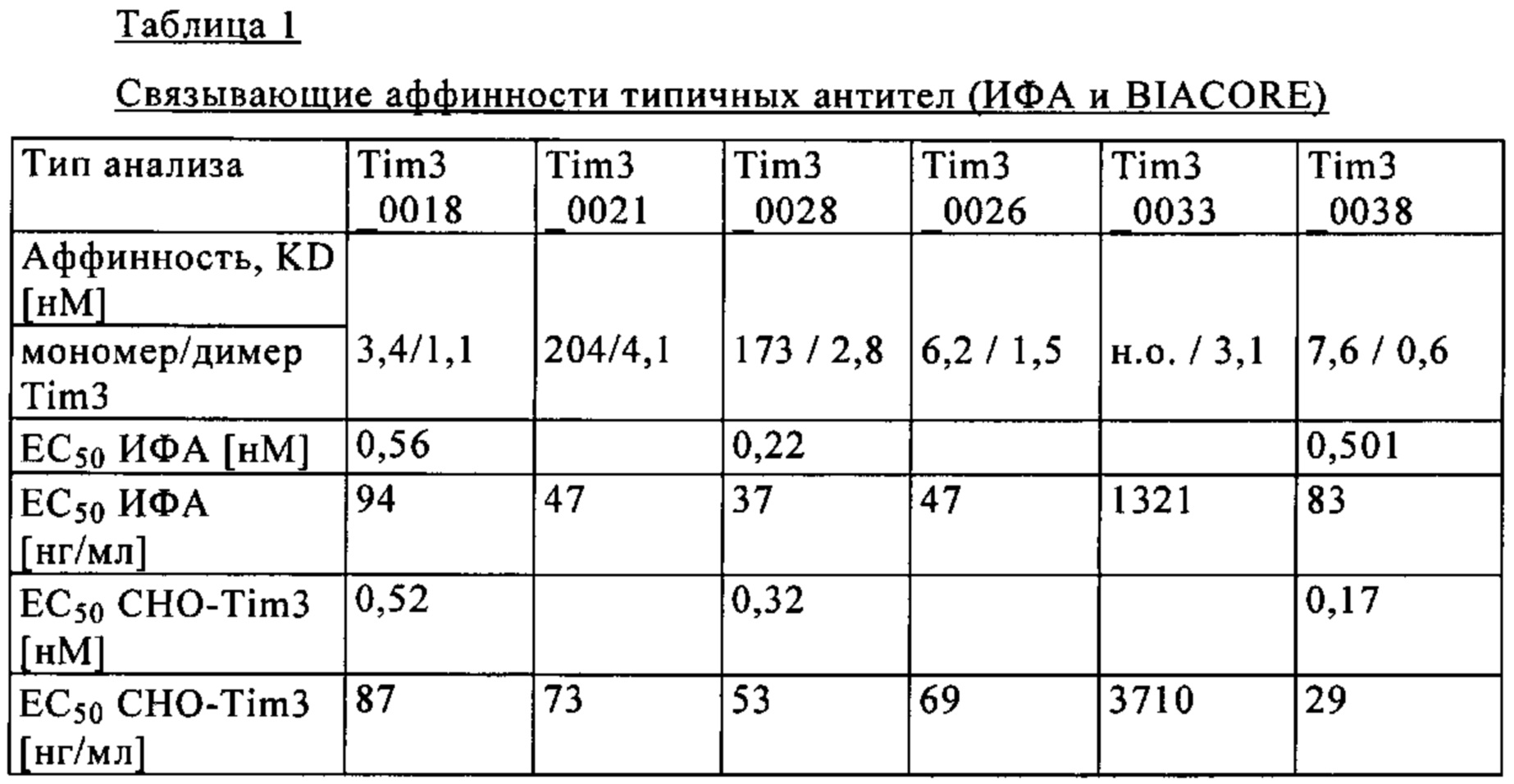
Характеристика антител TIM3 методом BIAcore
Анализ на основе поверхностного плазмонного резонанса (ППР) использовали для определения кинетических параметров связывания между несколькими связующими агентами TIM3 мыши, а также коммерческими сравнительными связующими агентами TIM3 человека. Таким образом, антимышиный IgG иммобилизовали методом аминной конденсации с поверхностью сенсорного чипа СМ5 (BIAcore). Затем образцы инкубировали с чипом, и в результате мономерный TIM3-ECD человека и яванских макак (hu/cy) и меченный Fc димер TIM3-ECD связывались с чипом. Поверхность сенсорного чипа регенерировали после каждого цикла анализа. После завершения анализа определяли константу равновесия KD при аппроксимации данных с использованием модели взаимодействия Лэнгмюра 1:1.
При сорбции на сенсорный чип СМ5 30 мкг/мл антимышиных антител IgG (GE Healthcare #BR-1008-38) регистрировали приблизительно 12000 условных единиц ответной реакции в системе BIAcore В4000 при рН 5,0 с использованием аминной конденсации (GE Healthcare), при этом сорбцию осуществляли в зонах 1, 2, 4 и 5 проточных ячеек 1-4 (в зонах 1, 5 определяли активность, а зоны 2, 4 использовали в качестве сравнения).
Буферные растворы для образцов и анализа представляли собой HBS-EP+ (0,01 М HEPES, 0,15 М NaCl, 3 мМ ЭДТУ, 0,05% об./об. детергента Surfactant Р20, рН 7,4). Температура проточной ячейки составляла 25°С и температура камеры с образцом составляла 12°С. Перед исследованием систему промывали буферным раствором для анализа.
Образцы вводили в течение 30 с при концентрации 200 мкг/мл и сорбировали в зоны 1 и 5 каждой проточной ячейки, что обеспечивало возможность параллельного измерения 8 образцов. Затем вводили полный набор различных (мономерный TIM3-ECD яванских макак, TIM3-ECD человека и гибридный димерный TIM3-ECD человека с Fc человека) концентраций вводили на поверхность каждого образца в течение 240 с последующей диссоциацией в течение 30/1800 с). После каждого цикла анализа (сорбция образца, зоны 1 и 5 - введение TIM3 ECD) проводили регенерацию ячеек при введении в течении 30 с глицина-HCl, рН 1,7. Скорость потока составляла 30 мкл/мин в течение всего цикла.
И наконец, данные с двойным контролем аппроксимировали с использованием модели взаимодействия Лэнгмюра 1:1 и программного обеспечения BIAcore В4000 Evaluation. Полученные величины аффинности к мономерному TIM3-ECD яванских макак, мономерному TIM3-ECD человека и гибридному димерному TIM3-ECD человека с Fc человека представлены в табл. 2а. Аффинность димера TIM3 человека по всей видимости зависит от авидности и, следовательно, превышает аффинность мономерного huTIM3.
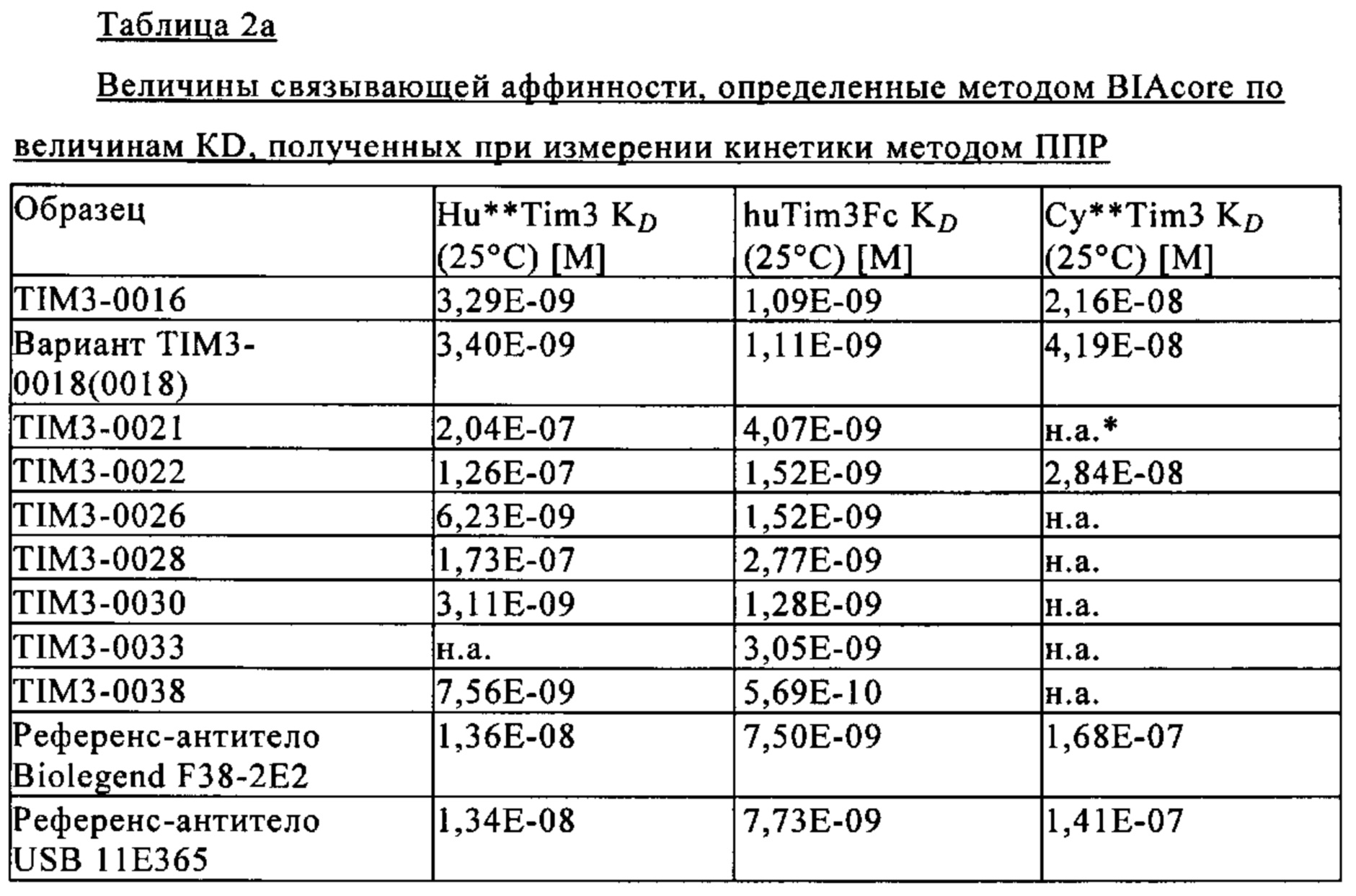
* н.а. - означает невозможность аппроксимации, обычно в связи с отсутствием или слабым связыванием
** hu (человека), су (яванских макак)
Определение аффинности к TIM3 методом ППР (химерный TIM3-0016 вариант (0018) и гуманизированные версии)
Белок А иммобилизовали с использованием аминной конденсации на поверхность сенсорного чипа (Biacore) СМ5. Затем образцы инкубировали, и в результате TIM3-ECD человека связывался с чипом. Поверхность сенсорного чипа регенерировали после каждого аналитического цикла. Константу равновесия и кинетические константы получали аппроксимацией данных с использованием модели взаимодействия Лэнгмюра 1:1.
При сорбции на сенсорный чип СМ5 20 мкг/мл белка А регистрировали приблизительно 2000 условных единиц ответной реакции в зонах 1, 2, 4 и 5 проточных ячеек в системе BIAcore В4000 при использовании набора связывания методом аминной конденсации (GE Healthcare).
Буферные растворы для образцов и анализа представляли собой HBS-EP+ (0,01 М HEPES, 0,15 М NaCl, 3 мМ ЭДТУ, 0,05% об./об. детергента Surfactant Р20, рН 7,4). Температура проточной ячейки составляла 25°С и температура камеры с образцом составляла 12°С. Перед исследованием систему промывали буферным раствором для анализа.
Различные образцы вводили в течение 30 с при концентрации 10 нМ и они последовательно связывались в зонах 1 и 5 во всех проточных ячейках. Затем полный набор разведений мономерного TIM3-ECD человека (600 нМ, 200 нМ, 66,7 нМ, 2×22,2 нМ, 7,4 нМ, 2,5 нМ и 2×0 нМ) последовательно наносили на поверхность каждого образца в течение 300 с. После введения каждого антигена проводили диссоциацию в течение 12 с/1000 с и 2 стадии регенерации по 30 с с использованием раствора глицин-HCl, рН 1,5, причем на последней стадии проводили стабилизацию после каждого введения в течение 20 с.
И наконец, данные с двойным контролем аппроксимировали с использованием модели взаимодействия Лэнгмюра 1:1 и программного обеспечения BIAcore В4000 Evaluation. Полученные величины KD представлены в табл. 2б.
Определение аффинности к TIM3 методом ППР (химерный TIM3-0028 и гуманизированные версии)
Fc домен IgG против человека иммобилизовали с использованием аминной конденсации на поверхность сенсорного чипа (Biacore) СМ5. Затем образцы инкубировали, и в результате TIM3-ECD человека связывался с чипом. Поверхность сенсорного чипа регенерировали после каждого аналитического цикла. Константу равновесия и кинетические константы получали аппроксимацией данных с использованием модели взаимодействия Лэнгмюра 1:1.
При сорбции на сенсорный чип СМ5 10 мкг/мл белка А регистрировали приблизительно 2500 условных единиц ответной реакции в зонах 1, 2, 4 и 5 проточных ячеек в системе BIAcore В4000 при использовании набора связывания методом аминной конденсации (GE Healthcare).
Буферные растворы для образцов и анализа представляли собой HBS-EP+ (0,01 М HEPES, 0,15 М NaCl, 3 мМ ЭДТУ, 0,05% об./об. детергента Surfactant Р20, рН 7,4). Температура проточной ячейки составляла 25°С и температура камеры с образцом составляла 12°С. Перед исследованием систему промывали буферным раствором для анализа.
Различные образцы вводили в течение 30 с при концентрации 10 нМ и они последовательно связывались в зонах 1 и 5 во всех проточных ячейках. Затем полный набор разведений мономерного TIM3-ECD человека (600 нМ, 200 нМ, 66,7 нМ, 2×22,2 нМ, 7,4 нМ, 2,5 нМ и 2×0 нМ) последовательно наносили на поверхность каждого образца в течение 300 с. После введения каждого антигена проводили диссоциацию в течение 12 с/700 с и 2 стадии регенерации по 30 с с использованием раствора 3 М MgCl2, причем на последней стадии проводили дополнительную промывку после каждого введения.
И наконец, данные с двойным контролем аппроксимировали с использованием модели взаимодействия Лэнгмюра 1:1 и программного обеспечения BIAcore В4000 Evaluation. Полученные величины KD представлены в табл. 2б.

Пример 2
Получение производных антител анти-TIM3
Производные химерных антител
Химерные антитела TIM3 получали при амплификации вариабельных областей тяжелой и легкой цепей мышиных антител анти-TIM3: вариант TIM3-0016 (0018), TIM3-0021, TIM3-0022, TIM3-0026, TIM3-0028, TIM3-0030 и TIM3-0033, TIM3-0038 методом ПЦР и при клонировании их в векторы экспрессии тяжелых цепей в качестве гибридных белков с каркасными цепями IgG1 человека / СН1-шарнирная область-СН2-СН3 человека с мутациями LALA и PG (замена лейцина 234 на аланин, замена лейцина 235 на аланин, замена пролина 329 на глицин), что позволило подавить эффекторные функции, а также в векторы экспрессии легких цепей в качестве гибридных белков в С-каппа человека. Затем плазмиды LC и НС совместно трансфектировали в клетки HEK293 и через 7 сут очищали из супернатантов по стандартным методикам очистки антител.
Удаление участка гликозилирования NYT: модификация в положении 1 HVR-L1 в антигенах TIM3-0016, варианте TIM3_0016 (0018 или TIM3_0018) при замене N на Q или S
Мутации в составе вариабельной области легкой цепи TIM3_0016 и варианта TIM3_0016 (0018) получали сайтнаправленным мутагенезом in vitro (набор Agilent "Quick Change Lightning Site-directed Mutagenesis Kit") согласно инструкциям фирмы-изготовителя. С использованием данного метода остаток аспарагина (N) в мотиве участка гликозилирования NYT легкой цепи HVR-L1 (SEQ ID NO: 4) заменяли на глутамин (Q) (при этом получали SEQ ID NO: 11=TIM3_0016_HVR-L1 вариант 1_NQ) или, в другом варианте, аспарагин (N) заменяли на серии (S) (при этом получали SEQ ID NO: 12=TIM3_0016_HVR-L1 вариант 2_NS). В обоих случаях проводили успешную модификацию в мотиве участка гликозилирования NYT. Плазмиды LC и НС, кодирующие указанные варианты, совместно трансфектировали в клетки HEK293, очищали через 7 сут из супернатантов по стандартным методикам очистки антител.
Полученные мутанты исследовали методом ИФА на наличие TIM3 человека (hu), TIM3 яванских макак (cyno) и методом клеточного ИФА с использованием адгезивных клеток СНО-K1, экспрессирующих полноразмерный TIM3 человека.
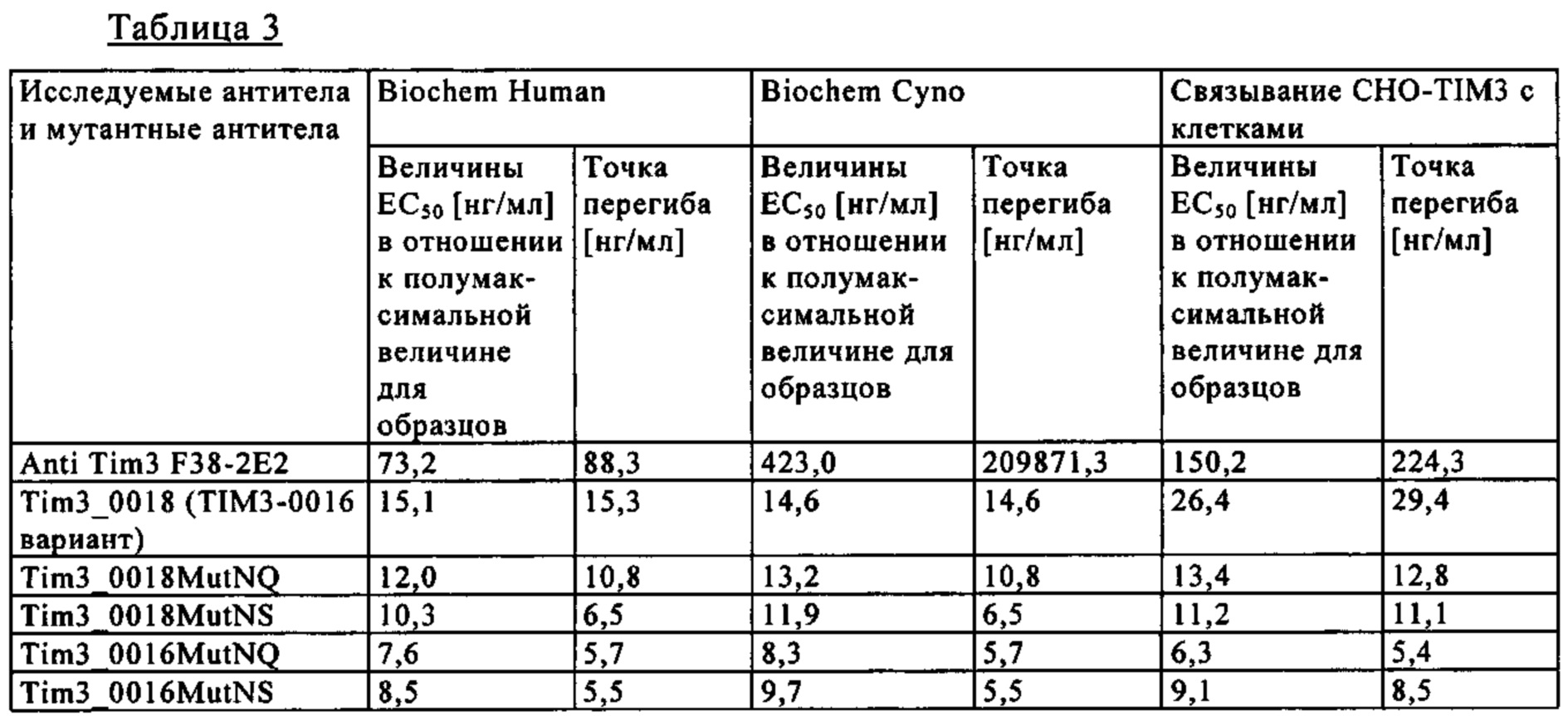
Было установлено, что все полученные мутанты характеризуются даже более высоким функциональным связыванием с TIM3 человека (hu), cyno TIM3 или TIMR человека в клетках СНО по сравнению с исходными антителами TIM3_0016 или вариантом антитела TIM3_0016 TIM3_0018, соответственно.
Гуманизированные производные антител
Гуманизация VH и VL доменов варианта мышиных анти-TIM3-0016 (0018) и анти-TIM3_0028
На основе аминокислотной последовательности VH и VL доменов а) варианта TIM3_0016 (0018) антитела анти-TIM3 (с аминокислотными последовательностями 6 HVR, в которых в легкой цепи использовали вариант 2_NS HVR-L1 (удаление сайта гликозилирования при мутации N на S) получали варианты TIM3-0433 и TIM3-0434 гуманизированных антител анти-TIM3, и на основе аминокислотной последовательности VH и VL доменов б) получали антитела TIM3_0028 анти-TIM3 и варианты TIM3-0438 и TIM3-0443 гуманизированных антител-TIM3.
Аминокислотные последовательности гуманизированных вариабельных областей тяжелой и легкой цепей восстанавливали в ДНК и полученную кДНК (GenArt) синтезировали и затем клонировали в векторы экспрессии тяжелой цепи в качестве гибридных каркасных областей IgG1 человека / СН1-шарнирных областей-СН2-СН3 человека с мутациями LALA и PG (замена лейцина 234 на аланин, замена лейцина 235 на аланин, замена пролина 329 на глицин), что позволило подавить эффекторные функции, или в векторы экспрессии легкой цепи в качестве гибридных белков с С-каппа человека. Плазмиды LC и НС совместно трансфектировали в клетки HEK293 и очищали через 7 сут из супернатантов по стандартным методикам очистки антител. Ниже представлены названия полученных гуманизованных антител TIM3.



Пример 3
Влияние антител анти-TIM-3 человека на продуцирование цитокинов в условиях реакции смешанных лимфоцитов (РСЛ)
Реакцию смешанных лимфоцитов использовали для демонстрации эффекта блокировки пути TIM-3 в клетках эффекторных лимфоцитов. В данном исследовании оценивали активацию и секрецию ИНФ-γ в Т клетках в присутствии или отсутствии моноклональных анти-TIM-3.
Лимфоциты человека выделяли из периферической крови здорового донора центрифугированием в градиенте плотности с использованием набора Leukosep (Greiner Bio One, 227 288). Краткое описание метода: гепаринизированную кровь разбавляли трехкратным объемом ФСБ и аликвотные части разбавленной крови по 25 мл помещали в пробирки Leukosep объемом 50 мл. После центрифугирования при 800 g в течение 15 мин при комнатной температуре (без перерыва) содержащие лимфоциты фракции собирали, промывали ФСБ и использовали непосредственно для анализа или ресуспендировали в среде для замораживания (10% ДМСО, 90% ЭТС) при концентрации 1,0Е+07 клеток/мл и хранили в жидком азоте. В анализе РСЛ использовали соотношение мишень/иммуноотвечающая клетка 1:1 (т.е. каждая культура РСЛ содержала 2,0Е+05 РВМС от каждого донора в общем объеме 200 мкл. Моноклональные антитела анти-TIM3 TIM3_0016, вариант TIM3_0016 (TIM3_0018), TIM3_0021, TIM3_0022, TIM3_0026, TIM3_0028, TIM3_0030, TIM3_0033, TIM3_0038 и F38-2E2 (BioLegend) добавляли в каждую культуру при различных концентрациях антител. В качестве отрицательного контроля использовали отсутствие антител или контрольный изотип антител и в качестве положительного контроля использовали rec hu IL-2 (20 ЕИ/мл). Клетки культивировали в течение 6 сут при 37°С. Через 6 сут по 100 мкл среды отбирали из каждой среды для измерения содержания цитокинов. Уровни ИНФ-γ измеряли с использованием набора OptEIA ELISA (BD Biosciences).
Результаты представлены в табл. 6 (секреция/высвобождение ИНФ-γ). Моноклональные антитела анти-TIM-3 ускоряют активацию Т-клеток и секрецию ИНФ-γ зависимым от концентрации способом. Антитела анти-TIM3, TIM3_0021, TIM3_0022, TIM3_0028 и TIM3_0038 снижают высвобождение воспалительного цитокина ИНФ-γ в большей степени по сравнению с антителами F38-2E2. Антитела TIM3_0016, вариант TIM3_0016 (TIM3_0018), TIM3_0033 и TIM3_0038 характеризуются аналогичным высвобождением по сравнению с антителами F38-2E2. Наоборот, культуры, содержащие контрольный изотип антител, не характеризовались возрастанием секреции ИНФ-γ.
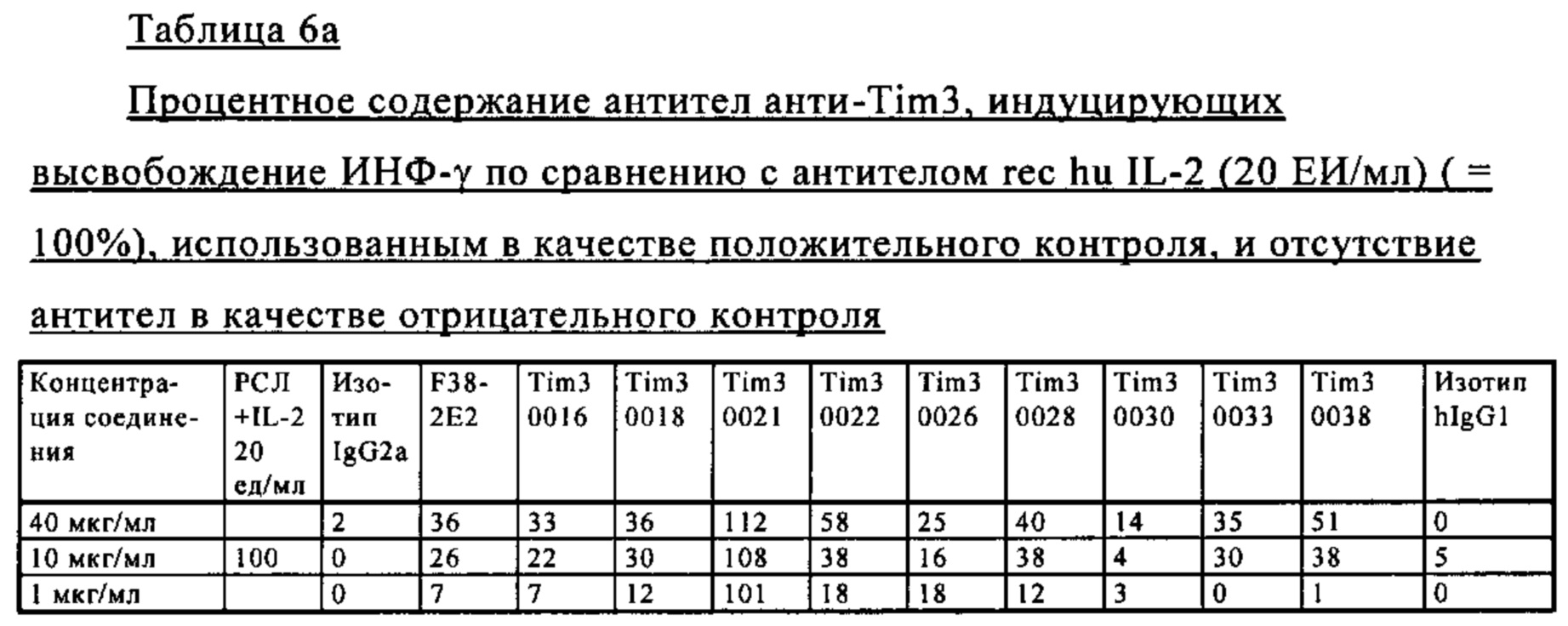
В следующих экспериментах определяли величины ЕС50 следующих химерных и гуманизированных антител (полученных, как описано выше) в комбинации с 0,1 мкг/мл моноклональных анти-PD1: химерных антител chi_TIM3_018 и их гуманизированных версий TIM3-433 и TIM3-434, химерные антитела chi_TIM3_028 и их гуманизированные версии TIM3-438 и TIM3-443 с различными смесями лимфоцитов от доноров (D2 и D3, или D1 и D5, соответственно). Результаты приведены в табл. 6б.
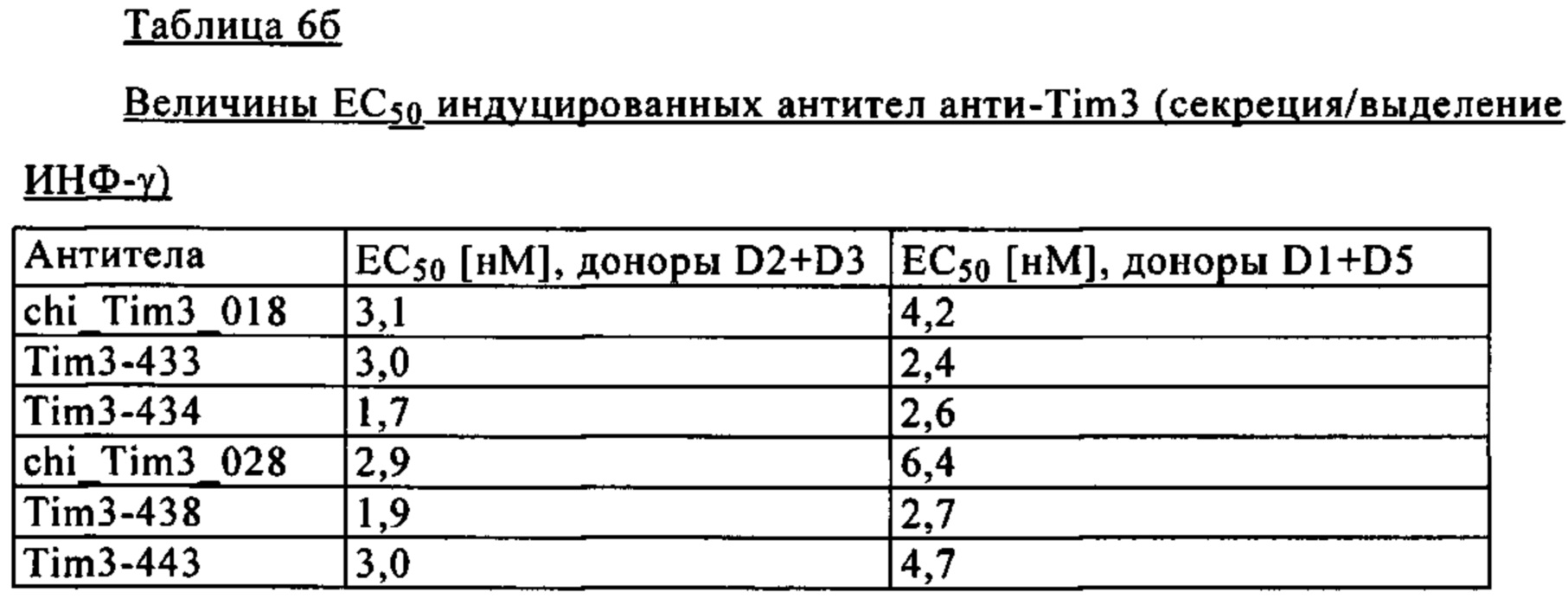
Антитела PD1
Пример 4
Иммунизация мышей
Мышей NMRI иммунизовали генетический методом с использованием плазмидного вектора экспрессии, кодирующего полноразмерное антитело PD-1 человека, при внутрикожном введении 100 мкг векторной ДНК (плазмиды 15300_hPD1-f1) с последующей электропорацией (2 прямоугольных пульса по 1000 В/см продолжительностью по 0,1 мс и с интервалом 0,125 с, затем 4 прямоугольных пульса по 287,5 В/см продолжительностью 10 мс с интервалом 0,125 с. Мышей иммунизировали 6 раз в дни 0, 14, 28, 42, 56, 70 и 84. Забор крови осуществляли в дни 36, 78 и 92 и получали сыворотку, которую использовали для определения титра методом ИФА (см. ниже). Животных с самыми высокими титрами отбирали для повторной иммунизации в день 96 при внутривенной инъекции 50 мкг рекомбинантного химерного антитела PD1 человека с Fc человека, и моноклональные антитела выделяли методом гибридом при гибридизации спленоцитов с линией миеломных клеток 3 после повторной иммунизации.
Определение титров в сыворотке (ИФА)
Рекомбинантные антитела PD1 человека с химерным Fc человека иммобилизовали на 96-луночном планшете NUNC Maxisorp при концентрации 0,3 мкг/мл в количестве 100 мкл/лунка в ФСБ, а затем проводили блокировку планшета раствором 2% Crotein С в ФСБ в количестве 200 мкл/лунка, получали серийные разведения антисыворотки в двойных повторах в растворе 0,5% Crotein С в ФСБ в количестве 100 мкл/лунка, и определяли связывание с конъюгатом антител с пероксидазой хрена (HRP) (Jackson Immunoresearch/Dianova 115-036-071, 1/16000). На всех стадиях планшеты инкубировали в течение 1 ч при 37°С. Между всеми стадиями планшеты промывали 3 раза 0,05% раствором Твин 20 в ФСБ. Сигнал получали при добавлении растворимого субстрата ВМ Blue POD (Roche) в количестве 100 мкл/лунка и реакцию останавливали при добавлении 1 М HCl в количестве 100 мкл/лунка. Поглощение определяли при 450 нм по сравнению с поглощением при 690 нм в качестве сравнения. Титр определяли по разведению антисыворотки в лунке, которое соответствует полумаксимальному сигналу.
Пример 5
Характеристика антител анти-PD1/связывания антител анти-PD1 с PD1 человека
ИФА PD1 человека
На планшеты Nunc maxisorp с нанесенным стрептавидином (MicroCoat #11974998001) наносили биотинилированные антитела PD1-ECD-AviHis в количестве 25 мкл/лунка и инкубировали при 4°С в течение ночи. После промывки (3×90 мкл/лунка буферным раствором PBST) добавляли 25 мкл образцов анти PD1 или референс-антител (анти-PD1 человека, Roche/ани-PD1 мыши, Biolegend, каталожный номер: 329912) и инкубировали в течение 1 ч при КТ. После промывки (3×90 мкл/лунка буферным раствором PBST) добавляли 25 мкл/лунка козьих антител против иммуноглобулина человека H+L-POD (JIR, JIR109-036-088)/овечьих антител POD против иммуноглобулина мыши (GE Healthcare, NA9310) в разведении 1:2000/1:1000 и инкубировали при КТ в течение 1 ч при встряхивании. После промывки (3×90 мкл/лунка буферным раствором PBST) добавляли субстрат ТМВ (Roche, каталожный номер 11835033001) 25 мкл/лунка и инкубировали до оптической плотности 2-3. Измерение проводили при 370/492 нм.
Результаты ИФА представлены в виде величин ЕС50 (нг/мл) в итоговых табл. 7 и 8 ниже.
Клеточный ИФА антител PD1
Адгезивную клеточную линию СНО-К1 стабильно трансфектировали плазмидой 15311_hPD1-f1_pUC_Neo, кодирующей полноразмерное антитело PD1 человека, и проводили селекцию с G418 (маркер устойчивости к неомицину на плазмиде) при концентрации 0,01×10Е6 клеток/лунка в 384-луночном планшете с плоским дном и инкубировали в течение ночи.
На следующий день добавляли 25 мкл/лунка образец PD1 или анти-PD1 человека (Roche)/референс-антитела анти-PD1 мыши (Biolegend; каталожный номер: 329912) и инкубировали в течение 2 ч при 4°С (для исключения интернализации). После аккуратной промывки (1×90 мкл/лунка PBST) клетки фиксировали при добавлении 0,05% глутарового альдегида в количестве 30 мкл/лунка (Sigma, каталожный номер G5882, 25%), разбавленного 1× буферным раствором ФСБ, и инкубировали в течение 10 мин при КТ. После промывки (3×90 мкл/лунка PBST) добавляли вторичные антитела в количестве 25 мкл/лунка для определения козьих антител против иммуноглобулина человека H+L-POD (JIR, JIR109-036-088)/овечьих антител против иммуноглобулина мыши POD (GE NA9310) с последующей инкубацией в течение 1 ч при КТ при встряхивании. После промывки (3×90 мкл/лунка PBST) добавляли раствор субстрата ТМВ в количестве 25 мкл/лунка (Roche 11835033001) и инкубировали до оптической плотности 1,0-2,0. Измерение проводили при 370/492 нм.
Результаты клеточного ИФА представлены в виде величин ЕС50 CHO-PD1 (нг/мл) в итоговой табл. 8 ниже.
ИФА PD1 яванских макак (cyno)
На планшеты Nunc maxisorp с нанесенным стрептавидином (MicroCoat #11974998001) наносили биотинилированные cyno PD1-ECD-Biotin в количестве 25 мкл/лунка и инкубировали при 4°С в течение ночи. После промывки (3×90 мкл/лунка буферным раствором PBST) добавляли 25 мкл образцов анти PD1 или референс-антител (анти-PD1 человека Roche) и инкубировали в течение 1 ч при КТ при встряхивании. После промывки (3×90 мкл/лунка буферным раствором PBST) добавляли 25 мкл/лунка козьи антитела против иммуноглобулина человека H+L-POD (JIR, JIR109-036-088) в разведении 1:1000 и инкубировали при КТ в течение 1 ч при встряхивании. После промывки (3×90 мкл/лунка буферным раствором PBST) добавляли 25 мкл/лунка субстрата ТМВ (Roche каталожный номер 11835033001) и инкубировали до оптической плотности 2-3. Измерение проводили при 370/492 нм.
Результаты ИФА представлены в виде величин ЕС50 (нг/мл) в итоговых табл. 7 и 8 ниже.
Анализ с заменой лиганда 1 PD
На планшеты Nunc maxisorp с нанесенным стрептавидином (MicroCoat #11974998001) наносили биотинилированные PD1-ECD-AviHis в количестве 25 мкл/лунка и инкубировали при 4°С в течение ночи. После промывки (3×90 мкл/лунка буферным раствором PBST) добавляли 25 мкл образцов анти PD1 или референс-антител (анти-PD1 мыши, Biolegend, каталожный номер 329912) и инкубировали в течение 1 ч при КТ при встряхивании. После промывки (3×90 мкл/лунка буферным раствором PBST) добавляли 25 мкл/лунка PD-L1 (рекомбинантный В7-Н1 человека/химерный PD-L1 Fc, 156-В7, R&D) и инкубировали в течение 1 ч при КТ при встряхивании. После промывки (3×90 мкл/лунка буферным раствором PBST) добавляли 25 мкл/лунка козьих антител против иммуноглобулина человека H+L-POD (JIR, JIR109-036-088) в разведении 1:1000 и инкубировали при КТ в течение 1 ч при встряхивании. После промывки (3×90 мкл/лунка буферным раствором PBST) добавляли 25 мкл/лунка субстрата ТМВ (Roche, каталожный номер 11835033001) и инкубировали до оптической плотности 2-3. Измерение проводили при 370/492 нм.
Результаты ИФА представлены в виде величин ЕС50 (нг/мл) в итоговой табл. 7 ниже.
Анализ с заменой на лиганд 2 PD1
На планшеты Nunc maxisorp с нанесенным стрептавидином (MicroCoat #11974998001) наносили биотинилированные PD1-ECD-AviHis в количестве 25 мкл/лунка и инкубировали при 4°С в течение ночи. После промывки (3×90 мкл/лунка буферным раствором PBST) добавляли 25 мкл образцов анти PD1 или референс-антител (анти-huPD1 мыши, Roche) и инкубировали в течение 1 ч при КТ при встряхивании. После промывки (3×90 мкл/лунка буферным раствором PBST) добавляли 25 мкл/лунка PD-L2 (рекомбинантный B7-DC человека/химерный PD-L2 Fc, 1224-PL-100, R&D) и инкубировали в течение 1 ч при КТ при встряхивании. После промывки (3×90 мкл/лунка буферным раствором PBST) добавляли 25 мкл/лунка козьи антитела против иммуноглобулина человека H+L-POD (JIR, JIR109-036-088) в разведении 1:2000 и инкубировали при КТ в течение 1 ч при встряхивании. После промывки (3×90 мкл/лунка буферным раствором PBST) добавляли 25 мкл/лунка субстрата ТМВ (Roche, каталожный номер 11835033001) и инкубировали до оптической плотности 2-3. Измерение проводили при 370/492 нм.
Результаты ИФА представлены в виде величин ЕС50 (нг/мл) в итоговой табл. 7 ниже.
Картирование эпитопов с использованием ИФА/конкурентный анализ связывания
На планшеты Nunc maxisorp (Nunc #464718) наносили иммобилизованные связывающие антитела (козьи антитела против IgG мыши, JIR, 115-006-071) в количестве 25 мкл/лунка и инкубировали при 4°С в течение ночи. После промывания (3×90 мкл/лунка буферным раствором PBST) планшеты блокировали раствором PDS, содержащим 2% BSA, при комнатной температуре в течение 1 ч при встряхивании. После промывки (3×90 мкл/лунка буферным раствором PBST) добавляли 25 мкл/лунка образцов мышиных антител анти-PD1 и инкубировали в течение 1 ч при КТ при встряхивании. После промывки (3×90 мкл/лунка буферным раствором PBST) связывающие антитела блокировали при добавлении мышиных IgG (JIR, 015-000-003) в количестве 30 мкл/лунка в течение 1 ч при КТ при встряхивании. В то же время биотинилированные PD1-ECD-AviHis предварительно инкубировали со вторым образцом антитела в течение 1 ч при КТ при встряхивании. После промывки аналитического планшета (3×90 мкл/лунка буферным раствором PBST) смесь антител PD1 переносили на аналитический планшет и инкубировали при КТ в течение 1 ч при встряхивании. После промывки (3×90 мкл/лунка буферным раствором PBST) добавляли 25 мкл/лунка стрептавидина POD (Roche, #11089153001) в разведении 1:4000 и инкубировали при КТ в течение 1 ч при встряхивании. После промывки (3×90 мкл/лунка буферным раствором PBST) добавляли 25 мкл/лунка субстрата ТМВ (Roche, каталожный номер 11835033001) и инкубировали до оптической плотности 1,5-2,5. Измерение проводили при 370/492 нм. Группы эпитопов определяли иерархической кластеризацией по сравнению с референс-антителами.


Исследование гуманизированных антител анти-PD-1 с использованием метода Biacore
Анализ на основе поверхностного плазмонного резонанса (ППР) использовали для определения кинетических параметров связывания нескольких связующих агентов PD1 и коммерческих референс-агентов связывания PD1 человека. Следовательно, антитела анти-IgG человека иммобилизовали методом аминной конденсации с поверхностью сенсорного чипа (Biacore) СМ5. Затем образцы связывались с чипом и антителами hu PD1-ECD. Поверхность сенсорного чипа регенерировали после каждого цикла анализа. И наконец, константу равновесия, и кинетические константы получали аппроксимацией данных с использованием модели взаимодействия Лэнгмюра 1:1.
При сорбции на сенсорный чип СМ5 20 мкг/мл IGg (GE Healthcare #BR-1008-39) регистрировали приблизительно 2000 условных единиц ответной реакции в зонах 1 и 2 (в другом варианте 3 и 4) проточных ячеек в системе BIAcore В4000 при использовании набора связывания методом аминной конденсации (GE Healthcare).
Буферные растворы для образцов и анализа представляли собой HBS-EP+ (0,01 М HEPES, 0,15 М NaCl, 3 мМ ЭДТУ, 0,05% об./об. Детергент Surfactant Р20, рН 7,4). Температура проточной ячейки составляла 25°С и температура камеры с образцом составляла 12°С. Перед исследованием систему промывали буферным раствором для анализа.
Различные образцы вводили в течение 20 с при концентрации 10 нМ и они последовательно связывались со второй проточной ячейкой. Затем полный набор концентраций PD1-ECD человека (144 нМ, 48 нМ, 66 нМ, 5,33 нМ, 1,78 нМ, 0,59 нМ, 0,20 нМ и 0 нМ) последовательно наносили на поверхность каждого образца в течение 120 с. После введения каждого антигена проводили диссоциацию в течение 30 с/300 с и 2 стадии регенерации по 30 с с использованием раствора 3 М раствора глицин-MgCl2, причем на последней стадии проводили дополнительную промывку после каждого введения в течение 20 с.
И наконец, данные с двойным контролем аппроксимировали с использованием модели взаимодействия Лэнгмюра 1:1 и программного обеспечения BIAcore В4000 Evaluation. Полученные величины KD, ka и kd представлены в табл. 9.
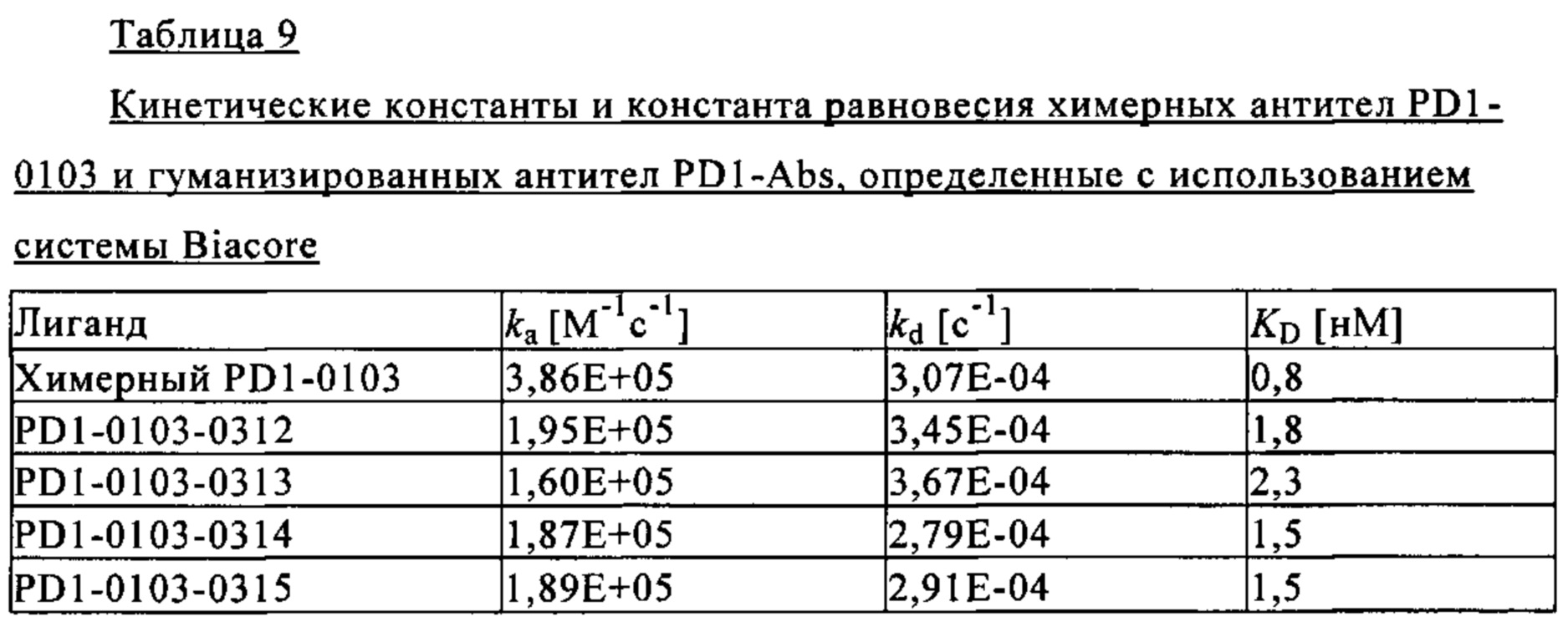
Как следует из табл. 9, все гуманизированные версии химерного PD1-0103 (получение описано в примере 6) характеризуются кинетическими свойствами, аналогичными исходным антителам (химерные PD1-0103).
Кинетика
Сенсор СМ5 серии S устанавливали в системе Biacore 4000, зоны обрабатывали гидродинамическим способом согласно инструкции фирмы-изготовителя.
Поликлональные кроличьи антитела IgG<IgGFCγM>R (Jackson ImmunoResearch Laboratories Inc.) иммобилизовали при 10000 Ru в зонах 1 и 5 в проточных ячейках 1, 2, 3 и 4. Ассоциацию осуществляли по реакции EDC/NHS согласно инструкциям фирмы-изготовителя. Остальные зоны в проточных ячейках использовали для сравнения. Буферным раствором для образцов являлся системный буферный раствор, содержащий 1 мг/мл карбоксиметилдекстрана.
В одном варианте анализ проводили при 25°С. В другом варианте анализ проводили при 37°С. 50 нМ каждого моноклонального антитела мыши иммобилизовали на поверхности сенсора при инъекции в течение 1 мин при скорости 10 мкл/мин. Затем последовательно вводили соответствующие антигены при концентрации 100 нМ, 2×33 нМ, 11 нМ, 4 нМ, 1 нМ и системный буферный раствор 0 нМ при скорости 30 мкл/мин в течение 4 мин для осуществления ассоциации. Диссоциацию регистрировали в течение дополнительных 4 мин. Систему связывания регенерировали с использованием введения в течение 3 мин 10 мМ глицина, рН 1,5, со скоростью 30 мкл/мин. Соответствующие кинетические данные рассчитывали с использованием программного обеспечения Biacore согласно инструкции фирмы-изготовителя.
Картирование эпитопов
Сенсор Biacore САР устанавливали в прибор Biacore 4000 и подготавливали к работе по инструкции фирмы-производителя. В качестве приборного буферного раствора использовали HBS-ET (10 мМ HEPES рН 7,4, 150 мМ NaCl, 3 мМ EDTA, 0,005% мас./об. Твин 20). Прибор использовали при 25°С.
Все образцы разбавляли системным буферным раствором. Биотинилированный антиген PD1-ECD-AviHis с молекулярной массой 35 кДа иммобилизовали на сенсоре САР при 200 относительных единиц ответной реакции при введении в течение 1 мин и скорости 30 мкл/мин в проточные ячейки 1, 2, 3 и 4 в зоны 1 и 5. Зоны 2, 3 и 4 использовали в качестве зон сравнения. В другом варианте биотинилированный антиген PD1-ECD-AviHis с молекулярной массой 35 кДа иммобилизовали на сенсоре САР при 200 относительных единиц ответной реакции аналогичным образом.
Затем последовательно вводили первичное антитело в количестве 100 нМ в течение 3 мин со скоростью 30 мкл/мин и вторичное антитело в количестве 100 нМ в течение 3 мин со скоростью 30 мкл/мин. Первичное антитело вводили до полного насыщения поверхности презентированного антигена. При завершении фаз введения первичного и вторичного антитела устанавливали параметры "Binding Late" (BL) для контроля регистрации отклика на связывание соответствующих антител. Рассчитывали молярное соотношение, т.е. соотношение между откликом на связывание вторичного антитела "BL2" и откликом на связывание первичного антитела "BL1". Молярное соотношение использовали в качестве индикатора доступности антигена для вторичного антитела при завершении комплексообразования антигена с первичным антителом.
Комплексы полностью удаляли с поверхности сенсора при введении в течение 2 мин со скоростью 30 мкл/мин 2 М гидрохлорида гуанидина в 250 мМ NaOH буферном растворе для регенерации согласно рекомендациям фирмы-изготовителя, с последующим введением системного буферного раствора в течение 1 мин со скоростью 30 мкл/мин.
Пример 6
Влияние различных антител анти-PD-1 на продуцирование цитокина в реакции смешанных лимфоцитов (РСЛ)
3А) Реакция смешанных лимфоцитов (РСЛ) представляет собой анализ иммунных клеток, в котором определяют активацию лимфоцитов от одного индивидуума (донор X) до лимфоцитов другого индивидуума (донор Y). Реакцию смешанных лимфоцитов использовали для демонстрации эффекта блокировки пути PD1 на эффекторные клетки-лимфоциты. В ходе анализа Т клетки тестировали на активацию и их секрецию ИНФ-γ в присутствии или отсутствии моноклональных анти-PD1.
Для осуществления аллогенной РСЛ одноядерные клетки периферической крови (РВМС) по крайней мере от четырех здоровых доноров неизвестного типа HLA выделяли центрифугированием в градиенте плотности с использованием системы Leukosep (Greiner Bio One, 227 288). Краткое описание метода: образцы гепаринизированной крови разбавляли тремя объемами ФСБ и аликвотные части по 25 мл разбавленной крови наслаивали в пробирки Leukosep объемом 50 мл. После центрифугирования при 800×g в течение 15 мин при комнатной температуре (непрерывно) отбирали фракции, содержащие лимфоциты, промывали ФСБ и использовали непосредственно для функционального анализа и ресуспендировали в среде для замораживания (10% ДМСО, 90% ЭТС) при концентрации 1,0Е+07 клеток/мл и хранили в жидком азоте. Индивидуальные реакции РСЛ в двух направлениях проводили при смешивании РВМС от двух различных доноров в соотношении стимулирующая клетка/иммунореактивная клетка 1:1 и совместное культивирование осуществляли по крайней мере в двойном повторе в 96-луночных планшетах с плоским дном в течение 6 сут при 37°С, 5% CO2, в присутствии или отсутствии различных концентраций очищенных моноклональных антител анти-PD1 PD1-0050, PD1-0069, PD1-0073, PD1-0078, PD1-0098, PD1-0102, PD1-0103. В качестве референс-антител анти-PD1 синтезировали антитела, содержащие VH и VL домены ниволумаба (который также называют MDX-5C4 или MDX-1106) или пембролизумаба (который также называют MK-3475 или Org 1.09А), и клонировали IgG1 с каркасными областями (с мутациями L234A, L235A и P329G (EU индекс Кабата)). В качестве отрицательного контроля использовали отсутствие антитела или изотип контрольного антитела и в качестве положительного контроля использовали rec hu IL-2 (20 Ед/мл). Через 6 дней из каждой культуры отбирали по 100 мкл среды для измерения содержания цитокина. Уровни ИНФ-γ определяли с использованием набора OptEIA ELISA (BD Biosciences).
Результаты представлены в табл. 10 (секреция/высвобождение ИНФ-γ). Моноклональные антитела анти-PD1 ускоряют активацию Т-клеток и секрецию ИНФ-γ зависимым от концентрации способом. Величину повышения секреции ИНФ-γ в процентах рассчитывали в отношении продуцирования ИНФ-γ в условиях РСЛ без добавления блокирующих моноклональных антител (базальная аллогенная стимуляция, индуцирующая величину ИНФ-γ в виде Е-с) и в условиях РСЛ при добавлении 20 Ед/мл hu IL-2 (положительный контроль = 100% величина ИНФ-γ в виде Е+с) и рассчитывали согласно формуле: Относительная стимуляция [%] = ((Еобразец-Е-с) / (Е+с-Е-с) * 100.
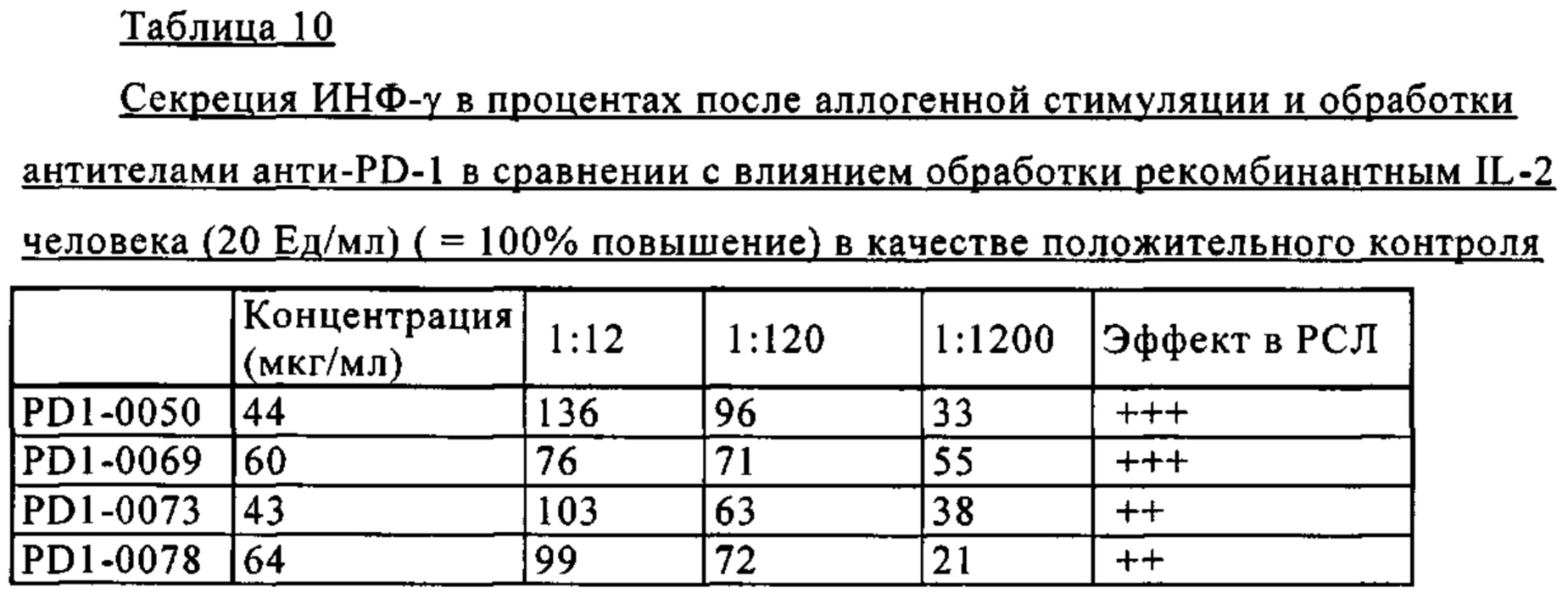
Несколько блокирующих антител PD1, такие как PD1-0050, PD1-0069, PD1-0073, PD1-0078, PD1-0098, PD1-0102, PD1-0103, проявляли значительную иммуномодулирующую активность, выражающуюся в увеличении секреции интерферона-гамма (ИНФ-γ) (данные показаны не для всех антител).
3Б) В следующем эксперименте оценивали химерный PD1-0103 (изотип IgG1 человека с мутациями L234A, L235A и P329G (EU индекс по Кабату)). Блокировка PD1 химерным PD1-0103 в значительной степени увеличивает секрецию ИНФ-γ в присутствии аллогенно стимулированных первичных Т клеток человека. Химерный PD1-0103 является более эффективных по сравнению с референс-антителами анти-PD1 (см. фиг. 1).
Для сравнения синтезировали референс-антитела анти-PD1, содержащие домены VH и VL ниволумаба (который также называют MDX5C4 или MDX-1106) или пембролизумаба (который также называют MK-3475 или Org 1.09А), и клонировали IgG1 человека с каркасными областями (с мутациями L234A, L235A и P329G (EU индекс по Кабату)).
3В) В дополнительных экспериментах оценивали иммуномодулирующую активность гуманизированных вариантов антител анти-PD-1 PD1-0103 (гуманизированные антитела PD1-0103-0312, PD1-0103-0314, см. фиг. 2 и 3, а также пример 9 ниже) а) высвобождение ИНФ-γ (секрецию) и б) высвобождение TNF-α (секрецию) методом РСЛ, как описано выше. Влияние химерного антитела PD1-0103 и его гуманизированных версий сравнивали с влиянием референс-антител анти-PD1, содержащих домены VH и VL ниволумаба (который также называют MDX5C4 или MDX-1106) или пембролизумаба (который также называют MK-3475 или Org 1.09А) с каркасными областями IgG1 человека (с мутациями L234A, L235A и P329G (EU индекс по Кабату)). Через 6 сут анализа РСЛ отбирали по 50 мкл супернатанта культуры и множественные цитокины определяли в одной культуре с использованием набора для анализа Bio-Plex Pro™ Human Cytokine Th1/Th2 (Bio-Rad Laboratories Inc.) (данные представлены не для всех цитокинов).
Химерное антитело PD1-0103 и его гуманизированные версии (PD1-0103_0312 и PD1-0103_0314) оказались более эффективными по сравнению с референс-антителами анти-PD1 в увеличении активации Т клеток и секреции ИНФ-γ (см. фиг. 2).
Боле того, химерное антитело PD1-0103 и его гуманизированные варианты увеличивают фактор некроза опухоли альфа (TNF-α) (см. фиг. 3) и секрецию IL-12 (данные не показаны) в присутствии презентирующих в антигене клеток и увеличивают способность моноцитов/макрофагов или презентирующих в антиген клеток стимулировать Т клетки.
Пример 7
Влияние блокировки анти-PD-1 на цитотоксичное высвобождение гранзима В и секрецию ИНФ-γ CD4 Т клетками человека, совместно культивированных с аллогенными зрелыми дендритными клетками
Для дополнительного исследования влияния обработки анти-PD-1 в аллогенном эксперименте авторы разработали метод анализа, согласно которому свежеочищенные CD4 Т клетки совместно культивировали в течение 5 сут в присутствии полученных из моноцитов аллогенных зрелых дендритных клеток (mDC). Моноциты выделяли из свежих РВМС за 1 неделю при адгезии к пластику с последующим удалением не адгезивных клеток. Затем получали незрелые DC из моноцитов при их культивировании в течение 5 сут в среде, содержащей GM-CSF (50 нг/мл) и IL-4 (100 нг/мл). Для индукции созревания iDC в культуральную среду добавляли TNF-α, IL-1β и IL-6 (каждый по 50 нг/мл) в течение 2 дополнительных сут. Зрелость DC оценивали при измерении их поверхностной экспрессии главного комплекса гистосовместимости II (MHCII), CD80, CD83 и CD86 методом проточной цитометрии (LSRFortessa, BD Biosciences).
В день минимальной реакции смешанных лимфоцитов (мРСЛ) CD4 Т клетки обогащали с использованием микрогранулярного набора (Miltenyi Biotec) из 108 РВМС, полученных от несвязанного донора. Перед культивированием в CD4 Т клетки включали метку с использованием 5 мкМ карбоксифлуоресцеин-сукцинимидилового эфира (CFSE). 105 CD4 Т клеток наносили на 96-луночный планшет одновременно с зрелыми алло-DC (5:1) в присутствии или отсутствии блокирующего антитела анти-PD1 (либо PD1-0103, химерного PD1-0103, или гуманизированных антител PD1-0103-0312, PD1-0103-0313, PD1-0103-0314, PD1-0103-0315, обозначенных как 0312, 0313, 0314, 0315 на фиг. 4А и 4В), при концентрации 10 мкг/мл, если на фигурах не указано иное.
Через 5 сут супернатанты клеточных культур собирали, использовали позже для измерения уровней ИНФ-γ с использованием ИФА (R&D systems) и культивировали клетки при 37°С в течение дополнительных 5 ч в присутствии Golgi Plug (Brefeldin А) и Golgi Stop (Monensin). Затем клетки промывали, окрашивали на поверхности антителом против CD4 человека и фиксирующим красителем Live/Dead Aqua (Invitrogen) перед фиксацией/пермеабилизацией буферным раствором Fix/Perm (BD Bioscience). Для гранзима В (BD Bioscience), ИНФ-γ и IL-2 (обе фирмы Bioscience) проводили внутриклеточное прокрашивание.
Исследовали также различные концентрации гуманизированных вариантов PD1-0103 (гуманизированных антител PD1-0103-0312, PD1-0103-0313, PD1-0103-0314, PD1-0103-0315, сокращенно называемых 0312, 0313, 0314, 0315 на фигурах, см. также пример 9 ниже), и было установлено, что они характеризуются в равной степени хорошими свойствами в увеличении уровней гранзима В ИНФ-γ. DP47 представляет собой несвязывающийся IgG человека с мутациями LALA в участке Fc для исключения распознавания рецептором FcγR, и его использовали в качестве отрицательного контроля. Результаты представлены на фиг. 4А и 4Б.
Пример 8
Производные химерных антител
Химерные антитела PD1 получали при амплификации вариабельных областей тяжелой и легкой цепей мышиных антител анти-PD1 PD1-0098, PD1-0103 с использованием ПЦР и клонировании их в векторы экспрессии тяжелых цепей в виде гибридных белков с каркасными областями IgG1 человека / СН1-шарнирная цепь-СН2-СН3 человека с мутациями L234A, L235A и P329G (EU индекс Кабата)) (лейцин 234 на аланин, лейцин 235 на аланин, пролин 329 на глицин), исключая эффекторные функции, и в векторы экспрессии легких цепей в виде гибридных белков с С-каппа человека. Плазмиды LC и НС совместно трансфектировали в клетки HEK293 и через 7 сут очищали из супернатантов по стандартным методам очистки антител. Химерным антителам PD1 присваивали новые названия: химерное антитело chiPD1-0098 (chiPD1-0098) и химерное антитело PD1-0103 (chiPD1-0103). Для сравнения синтезировали референс-антитела анти-PD1, содержащие VH и VL домены ниволумаба (который также называют MDX-5C4 или MDX-1106) и пембролизумаба (который также называют MK-3475 или Org 1.09А), и клонировали с каркасными цепями IgG1 человека (с мутациями L234A, L235A и P329G (EU индекс Кабата)).
Пример 9
Получение, экспрессия и очистка гуманизированных вариантов антител анти-PD1 PD-0103 (huMab PD-0103) и их характеристики
Гуманизация VH и VL доменов мышиных антител анти-PD1 0103
На основании аминокислотной последовательности мышиных VH и VL доменов антител анти-PD1 PD1-0103 (SEQ ID NO: 43 и 44) получали гуманизированные варианты антител анти-PD1.
Гуманизированный вариант VH получали на основе зародышевой линии человека IMGT_hVH_3_23 в комбинации с J-элементом зародышевой линии IGHJ5-01 человека с несколькими мутациями (что приводит к получению SEQ ID NO: 45).
Гуманизированные варианты VL получали на основе зародышевых линий IMGT_hVK_4_1, IMGT_hVK_2_30, IMGT_hVK_3_11 и IMGT_hVK_1_39 человека в комбинации с J-элементом IGKJ1-01 человека. Различные мутации приводят к получению гуманизированных вариантов SEQ ID NO: 46 - SEQ ID NO: 49.
Гуманизированные аминокислотные последовательности для вариабельных областей тяжелой и легкой цепей PD1-0103 повторно транслировали в ДНК и полученную кДНК синтезировали (GenArt) и затем клонировали в векторы экспрессии тяжелой цепи в виде гибридных белков с каркасными цепями IgG1 человека / СН1-шарнирная область-СН2-СН3 человека с мутациями LALA и PG (лейцин 234 на аланин, лейцин 235 на аланин, пролин 329 на глицин), исключая эффекторные функции, или в векторы экспрессии легкой цепи в виде гибридных белков с С-каппа человека. Затем плазмиды LC и НС совместно трансфектировали в клетки HEK293 и через 7 сут очищали из супернатантов по стандартным методам очистки антител. Полученные гуманизированные антитела PD1 получали следующие названия.


Гуманизированные варианты антител PD1-0103 и исходные химерные антитела PD1-0103 характеризовали, как описано выше. Результаты представлены в табл. 13.
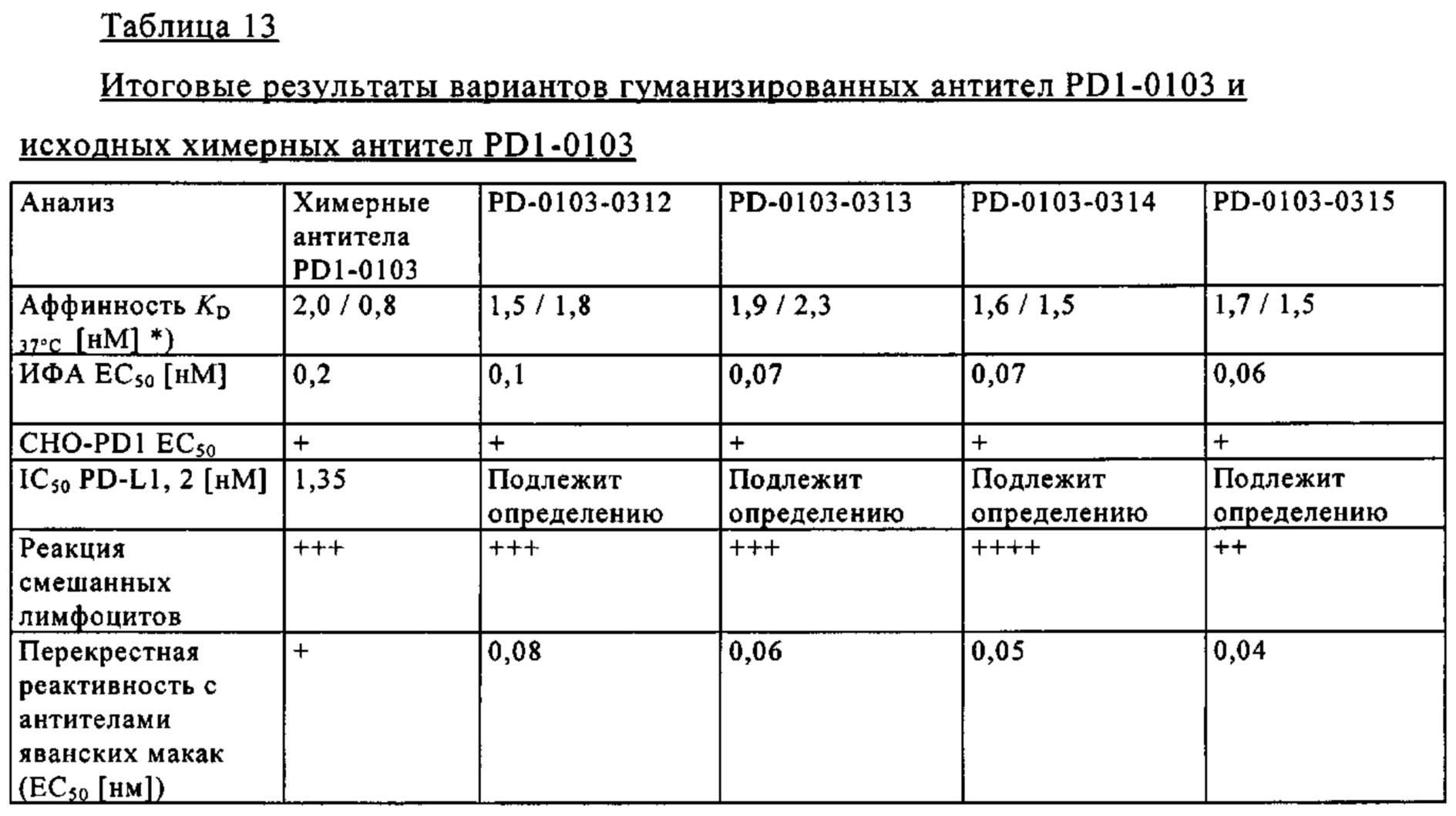
Пример 10
Нейтрализующая способность антител PD-1
Для оценки нейтрализующей способности полученных в лаборатории антител PD-1 при имитации сохранения подавленной ответной реакции Т клеток использовали коммерческий анализ с использованием репортерной системы PD1/PD-L1 (Promega). Данная система состояла из PD1+ клетки NFAT Юркат и аналога PD-L1+ СНО, который также позволяет получить сигнал активации. В принципе, репортерная система основана на трех стадиях: (1) активация NFAT, опосредованная TCR, (2) ингибирование сигнала NFAT после активации оси PD-1/PD-L1 и (3) восстановление сигнала NFAT блокирующими антителами PD-1.
Материалы и методы:
- Среда PD-L1: PAN Biotech (#Р04-03609), ЭБС (10%) и L-Gln (4 мМ).
- Среда для анализа: RPMI 1640 (#31870, Invitrogen), 25 мМ HEPES, 2 мМ L-Gln, ЭБС (2%).
- Клетки, использованные для данного анализа (оба типа клеток фирмы Promega).
- Клетки PD-L1+ СНО (номер партии #139147): 2-3×104 клеток/96 лунок.
- PD-1+ клетки NFAT Юркат (номер партии #133024: 3,5×104 клеток/лунка.
В день 1 клетки +PD-L1 размораживали, высеивали при указанной концентрации клеток в указанной выше среде и культивировали в течение ночи при 37°С и 5% СО2. На следующий день среду удаляли и клетки +PD-L1 инкубировали с полученными антителами при указанных концентрациях (в среде для анализа). Параллельно, клетки PD-1+ NFAT Jurkat размораживали и указанные выше количества клеток трансфектировали клетками +PD-L1 и совместно культивировали с клетками +PD-L1. После инкубации в течение 6 ч при 37°С и 5% CO2 субстрат Bio-Glo нагревали до комнатной температуры (в течение 1-2 ч перед добавлением). Планшет с клеточной культурой вынимали из инкубатора и охлаждали до комнатной температуры (10 мин) перед добавлением раствора Bio-Glo в количестве 80 мкл на 1 лунку, инкубировали в течение 5-10 мин перед измерением люминисценции на ридере Tecan Infinite согласно инструкциям фирмы-изготовителя набора. Результаты представлены на фиг. 5А и 5Б, на которых показано сохранение опосредованного PD-1/PD-L1 подавления сигнала NFAT различными антителами PD-1 после стимуляции TCR: (фиг. 5А). Для химерного PD1_0103 показан воспроизводимый наилучший эффект по сравнению с референс-антителом. В качестве референс-антитела синтезировали антитело анти-PD1, содержащее домены VH и VL ниволумаба (который также называют MDX-5C4 или MDX-1106), и клонировали с каркасными цепями IgG1 человека (с мутациями L234A, L235A и P329G (EU индекс Кабата)). Фиг. 5Б: для четырех гуманизированных вариантов PD1_0103 показана аналогичная способность получения прототипа антитела in vitro, которая лишь незначительно превышала способность референс-антитела.
Биспецифическое антитела PD1/TIM3
Пример 11А
Продуцирование и экспрессия мультиспецифических антител, связывающихся с PD1 и TIM3, которые содержат домен с обменом/заменой VH/VL (CrossMAbVh-VL) в одном плече связывания и с единичными заменами на заряженные аминокислоты на границе раздела CH1/CL
В этом примере получали мультиспецифические антитела, связывающиеся с PD1 человека и TIM3 человека, как описано в разделе Общие методы по стандартным методикам молекулярной биологии, и временно экспрессировали в 293F клеток Expi293F, как описано выше. Мультиспецифические антитела 1+1 CrossMAbVh-Vl описаны также в заявке WO 2009/080252. Мультиспецифические антитела экспрессировали с использованием плазмид экспрессии, содержащих нуклеиновые кислоты, кодирующие аминокислотные последовательности, представленные в табл. 14а.

Для всех конструктов использовали методику гетеродимеризации "выступы во впадины" с заменой типичного выступа (T366W) в первом домене СН3 и соответствующими заменами впадин (T366S, L368A и Y410V) во втором домене СН3 (аналогично двум другим дополнительно введенным остаткам цистеина S354C/Y349'C) (содержащимися в соответствующей последовательности тяжелой цепи (НС), указанной выше).
Пример 11Б
Продуцирование и экспрессия мультиспецифических антител, связывающихся с PD1 и TIM3, содержащим домен с обменом/заменой VH/VL (2+2 CrossMAbVh-VL) в двух плечах связывания и с единичными заменами на заряженные аминокислоты на границе раздела CH1/CL
В этом примере получали мультиспецифические антитела, связывающиеся с PD1 человека и TIM3 человека, как описано в разделе Общие методы по стандартным методикам молекулярной биологии, и временно экспрессировали в 293F клеток Expi293F, как описано выше. Мультиспецифические антитела 2+2 CrossMAbVH-VL описаны в заявке WO 2010/145792. Мультиспецифические антитела экспрессировали с использованием плазмид экспрессии, содержащих нуклеиновые кислоты, кодирующие аминокислотные последовательности, представленные в табл. 14б.

Пример 11В
Очистка и характеристика мультиспецифические антител, связывающихся с PD1 и TIM3
Мультиспецифические антитела, экспрессированные, как описано выше, очищали из супернатнта комбинацией аффинной хроматографии с иммобилизованным белком А и гель-проникающей хроматографии (ГПХ). Для всех мультиспецифических антител наблюдались хорошие выходы и стабильное продуцирование. Для идентификации полученных продуктов проводили масс-спектрометрический анализ и для определения аналитических свойств, таких как чистота, использовали методы электрофореза SDS-ПААГ (ЭФ-SDS), и определяли содержание мономера и стабильность.
Масс-спектрометрия
Ожидаемые первичные структуры анализировали масс-спектрометрией с ионизационным распылением (MC-ESI) дегликозилированных интактных антител CrossMabs и дегликозилированных/расщепленных плазмином или в другом варианте дегликозилированных/частично расщепленных LysC CrossMabs.
VH/VL CrossMabs дегликозилировали с использованием N-гликозидазы F в фосфатном буферном растворе или трис-буферном растворе при 37°C в течение 17 ч при концентрации 1 мг/мл. Расщепление плазмином или частичное расщепление LysC (Roche) проводили с использованием 100 мкг дегликозилированного VH/VL CrossMabs в буферном растворе трис, pH 8, при комнатной температуре в течение 120 ч и при 37°C в течение 40 мин, соответственно. Перед масс-спектрометрией образцы обессоливали с использованием HPLC на колонке Sephadex G25 (GE Healthcare). Общую массу определяли методом MC-ESI в системе maXis 4G UHR-QTOF MS (Bruker Daltonik), снабженной источником TriVersa NanoMate (Advion).
Стабильность мультиспецифических антител
Для оценки стабильности конструктов антител оценивали термостабильность и температуру начала агрегации согласно следующей методике. Образцы указанных антител получали при концентрации 1 мг/мл в 20 мМ смеси гистидина с хлоридом гистидина, 140 мМ NaCl, pH 6,0, переносили в микрокюветы объемом 10 мкл и регистрировали данные статического светорассеяния и флуоресценции при длине волны возбуждения лазера при 266 нм на приборе Optim 1000 (Avacta Inc.), при нагревании образцов со скоростью 0,1°C/мин от 25°C до 90°C.
Температуру начала агрегации (Tagg) определяли как температуру, при которой интенсивность рассеиваемого света начинала увеличиваться. Температуру плавления (Tm) определяли как точку перегиба на графике зависимости интенсивности флуоресценции от длины волны. Результаты представлены в табл. 15.
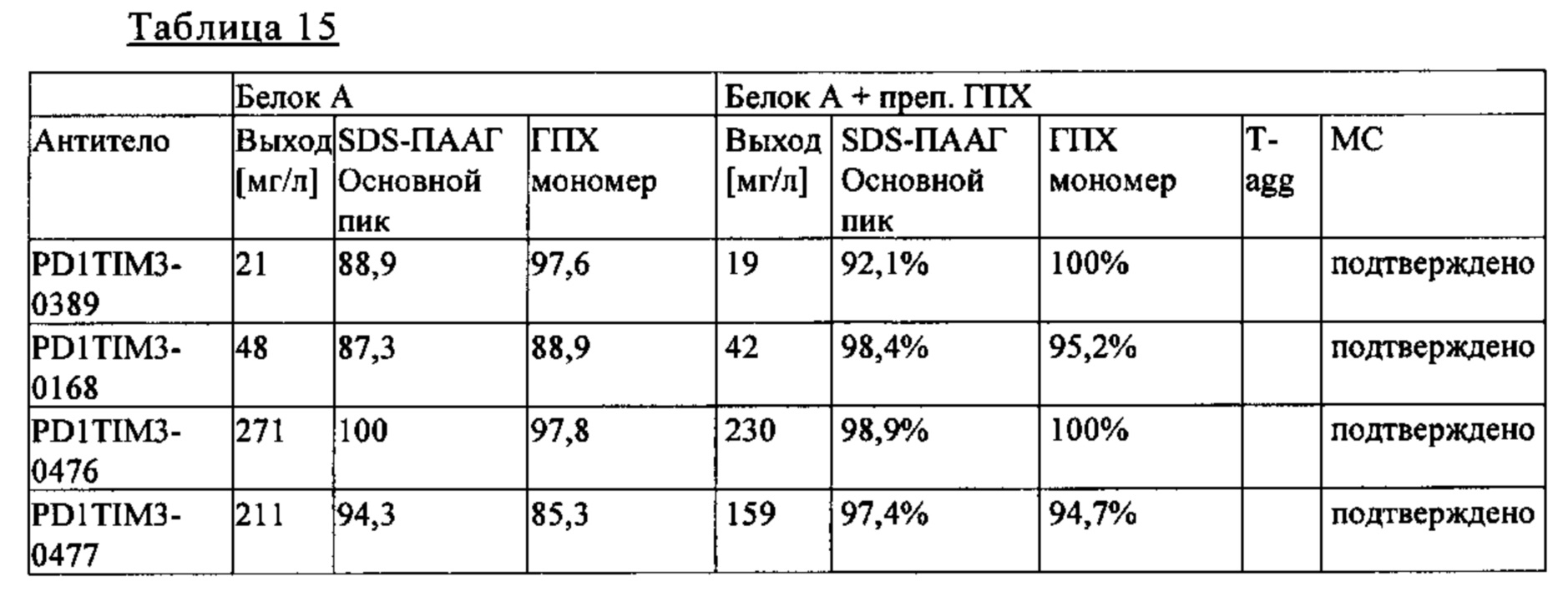
Пример 12
Характеристики мультиспецифических антител анти-PD1-TIM3
Связывание по данным ИФА
ИФА для hu PD1
На планшеты Nunc maxisorp с нанесенным стрептавидином (MicroCoat #11974998001) наносили биотинилированные PD1-ECD-AviHis в количестве 25 мкл/лунка при концентрации 500 нг/мл и инкубировали при 4°C в течение ночи. После промывки (3×90 мкл/лунка буферным раствором PBST) добавляли 25 мкл образцов анти-PD1 при повышающихся концентрациях и инкубировали в течение 1 ч при КТ. После промывки (3×90 мкл/лунка буферным раствором PBST) добавляли 25 мкл/лунка козьих антител против иммуноглобулина человека H+L-POD (JiR, JIR109-036-088) в разведении 1:5000 и инкубировали при КТ в течение 1 ч при встряхивании. После промывки (3×90 мкл/лунка буферным раствором PBST) добавляли 25 мкл/лунка субстрата ТМВ (Roche, каталожный номер 11835033001) и инкубировали до оптической плотности 2-3. Измерение проводили при 370/492 нм.
ИФА hu TIM3
На планшеты Nunc maxisorp с нанесенным стрептавидином (MicroCoat #11974998001) наносили биотинилированные TIM3-ECD-AviHis в количестве 25 мкл/лунка при концентрации 60 нг/мл и инкубировали при 4°C в течение ночи. После промывки (3×90 мкл/лунка буферным раствором PBST) добавляли 25 мкл образцов антител анти-PD1 при повышающихся концентрациях и инкубировали в течение 1 ч при КТ. После промывки (3×90 мкл/лунка буферным раствором PBST) добавляли 25 мкл/лунка козьих антител против иммуноглобулина человека H+L-POD (JIR, JIR109-036-088) в разведении 1:5000 и инкубировали при КТ в течение 1 ч при встряхивании. После промывки (3×90 мкл/лунка буферным раствором PBST) добавляли 25 мкл/лунка субстрата ТМВ (Roche, каталожный номер 11835033001) и инкубировали до оптической плотности 2-3. Измерение проводили при 370/492 нм.
Результаты ИФА приведены в виде величин ЕС50 [нМ] в табл. 16.
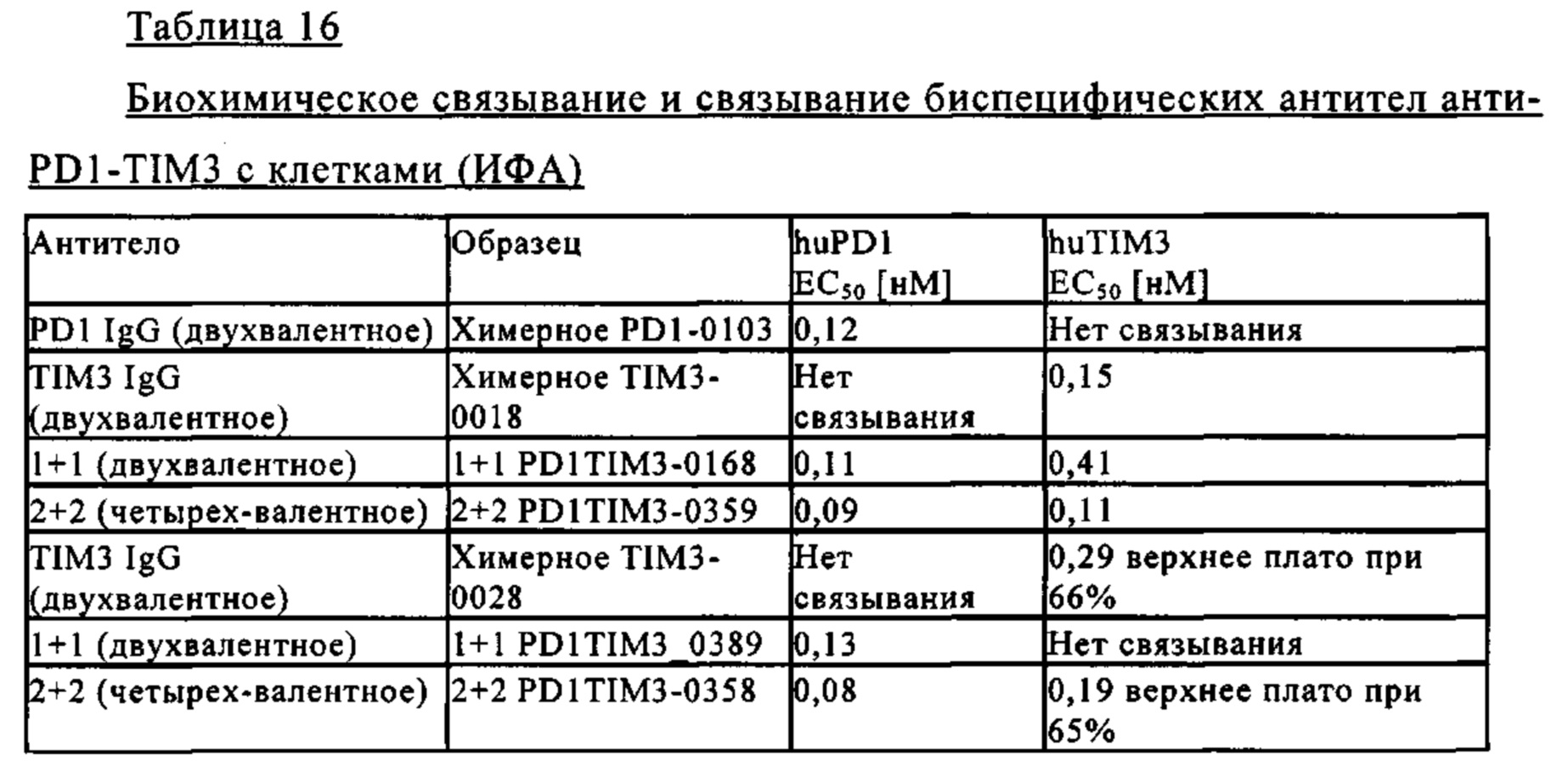
Авидное связывание (т.е. связывание с двумя плечами) наблюдали для антител, которые являются двухвалентными для TIM3 (химерное антитело TIM3-0018, 2+2 PD1TIM3-0359, химерное антитело TIM3-0028, 2+2 PD1TIM3-0358). Более высокие величины ЕС50 для 1+1 CrossMabs наблюдали для одновалентного (по отношению к TIM3), неавидного связывания с нанесенным антигеном. Авидные эффекты не наблюдались для связывания с PD1. Для двухвалентного и четрыхвалентного форматов наблюдались сопоставимые величины ЕС50.
Связывание по данным метода Biacore
Антигенсвязывающие свойства мультиспецифических антител, которые связываются с PD1 и TIM3
Связывание мультиспецифических антител с соответствующими им антигенами - мишенями, т.е. PD1 и TIM3, оценивали с использованием метода Biacore®.
Связывание с PD1 оценивали согласно следующей методике.
Антитело против Fc IgG человека иммобилизовали методом аминной конденсации на поверхность сенсорного чипа (Biacore) СМ5. Затем образцы связывались с чипом и с ними связывался hu PD1-ECD. Поверхность сенсорного чипа регенерировали после каждого цикла анализа. Константу равновесия и кинетические константы получали аппроксимацией данных с использованием модели взаимодействия Лэнгмюра 1:1.
Приблизительно 10000 условных единиц ответной реакции (ЕО) при связывании 20 мкг/мл IGg анти-человека (GE Healthcare #BR-1008-39) с чипом регистрировали во всех проточных ячейках сенсорного чипа СМ5 в приборе Biacore Т200 при pH 5,0 с использованием набора для аминной конденсации (GE Healthcare).
Образец и буферный раствор для анализа представляли собой HBS-EP+ (0,01 М HEPES, 0,15 М NaCl, 3 мМ ЭДТУ, 0,05% об./об. детергента Surfactant Р20, pH 7,4). Температура проточной ячейки составляла 25°C и температура камеры с образцом составляла 12°C. Перед исследованием систему промывали буферным раствором для анализа.
Различные образцы вводили в течение 15 с при концентрации 10 нМ и они последовательно связывались с проточными ячейками 2, 3 и 4. Затем полный набор концентраций PD1-ECD человека (300 нМ, 100 нМ, 2×33,3 нМ, 11,1 нМ, 3,7 нМ, 1,2 нМ и 2×0 нМ) пропускали через поверхность каждого образца в течение 300 с. За введением каждого антигена следовало время диссоциации 10/600 с и 2 стадии регенерации по 30 c с использованием 3 М раствора MgCl2, и на последней стадии включали "дополнительную промывку после введения" образца с использованием буферного раствора. И наконец, данные с двойным контролем аппроксимировали с использованием модели взаимодействия Лэнгмюра 1:1 и программного обеспечения Biacore Т200 Evaluation. Полученные величины KD, ka и kd представлены в табл. 17.
Связывание TIM3 оценивали согласно следующей методике.
Антитело против Fab igG человека иммобилизовали с использованием аминной конденсации на поверхность сенсорного чипа (Biacore) СМ5. Затем образцы связывались с чипом и с ними связывался hu TIM3-ECD. Поверхность сенсорного чипа регенерировали после каждого цикла анализа. Константу равновесия и кинетические константы получали аппроксимацией данных с использованием модели взаимодействия Лэнгмюра 1:1.
Приблизительно 10000 условных единиц ответной реакции (ЕО) при связывании 20 мкг/мл антител IGg против Fab человека (GE Healthcare #28-9583-25) с чипом регистрировали во всех проточных ячейках сенсорного чипа СМ5 в приборе Biacore Т200 при рН 5,0 с использованием набора для аминной конденсации (GE Healthcare). Образец и буферный раствор для анализа представляли собой HBS-EP+ (0,01 М HEPES, 0,15 М NaCl, 3 мМ ЭДТУ, 0,05% об./об. детергента Surfactant Р20, pH 7,4). Температура проточной ячейки составляла 25°C и температура камеры с образцом составляла 12°C. Перед исследованием систему промывали буферным раствором для анализа.
Различные образцы вводили в течение 30 с при концентрации 10 нМ и они последовательно связывались с проточными ячейками 2, 3 и 4. Затем полный набор концентраций TIM3-ECD человека (600 нМ, 200 нМ, 2×66,7 нМ, 22,2 нМ, 7,4 нМ и 2×0 нМ) пропускали над поверхностью каждого образца в течение 200 с. За введением каждого антигена следовало время диссоциации 10/600 с и 2 стадии регенерации по 30 с использованием гидрохлорида глицина, pH 2,1, на последней стадии включали "дополнительную промывку после введения" образца буферным раствором для анализа. И наконец, данные с двойным контролем аппроксимировали с использованием модели взаимодействия Лэнгмюра 1:1 и программного обеспечения Biacore Т200. Полученные величины KD, ka и kd представлены в табл. 17.
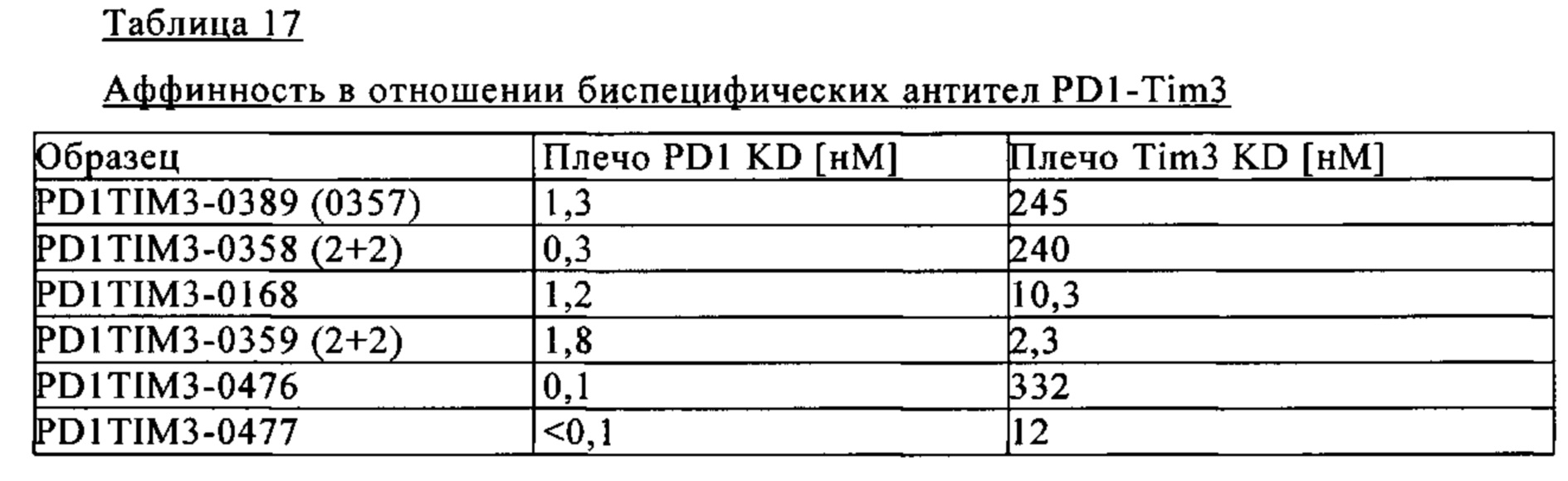
Все исследованные антитела специфично связываются с обеими мишенями, PD1 и TIM3, и характеризуются антигенсвязывающей аффинностью к антигенам на наномолярном уровне.
Пример 13
Анализ FRET одновременно связывания антител биспецифических антител PD1/TIM3 с рекомбинантными клетками
В данном примере описана разработка анализа на основе клеток TR-FRET для определения одновременного связывания форматов биспецифических антител с двумя различными рецепторами, презентированными на одной клетке. Выбранная методика Tag-lite представляет собой комбинацию классической методики TR-FRET (время разрешенный флуоресцентный индуктивно-резонансный перенос энергии) и методики SNAP-tag (например, New England Biolabs, CISBIO), которая позволяет включать метку в антигены, презентированные на поверхности клетки, с помощью флуоресцентного донорного или акцепторного красителя.
Цель оценки по данной методике
Данный анализ предназначен для демонстрации одновременного связывания биспецифических антител анти-PD1/TIM3 с клетками, экспрессирующими оба рецептора PD1 и TIM3 в виде рекомбинантных гибридных белков, состоящих из внеклеточных доменов (ECD) данного рецептора и метки, с которой может связываться флуоресцентный краситель. В присутствии биспецифического антитела PD1-TIM3, которое может связываться с обоими меченными рецепторами, белки располагаются в области, близкой для обмена энергиями между двумя красителями FRET (см. фиг. 6).
Получение рекомбинантных клеток PD1+TIM3+HEK
Для получения ДНК использовали стандартные методы, такие как методы, описанные в книге Sambrook и др., Molecular cloning: A laboratory manual; Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York (1989). Для клонирования вариантов PD1 и TIM3 в участок, близкий к области ТМ рецептора, вставляли метки SNAP или CLIP, и цитоплазматический домен удаляли, оставляя 7 аминокислот, и заменяли на метку Flag.
Временная трансфекция
Клетки HEK293 совместно трансфектировали в присутствии реагента 293free (Novagen) и сывороточной средой Opti-MEM® I Reduced Serum Media (Life Technologies) в культуре объемом 30 мл с использованием двух плазмид одновременно (общее количество ДНК составляло 15 мкг). Краткое описание метода: клетки HEK293 временно трансфектировали следующими плазмидами, кодирующими гибридный белок, содержащий PD1 или TIM3 ECD и метку SNAP или CLIP, как описано в литературе.
ID плазмиды и референс-образцы, например, PD1-SNAP, TIM3-CLIP (комбинацию PD1-CLIP и TIM3-SNAP конструировали и экспрессировали, но в результате получали только очень низкие сигналы FRET).
Плазмиды:
a) PD1-SNAP (в направлении от 5' к 3'):
- нуклеиновая кислота, кодирующая внеклеточный домен PD1 человека, включая сигнальный пептид (остатки 1-170 последовательности SEQ ID NO: 89 (30),
- нуклеиновая кислота, кодирующая спейсер GGGGS (SEQ ID NO: 90),
- нуклеиновая кислота, кодирующая SNAP из pSNAP (Т7)2 (без N-концевого остатка метионина), который является мутантной формой гена человека для 06-алкилгуанидин-ДНК-алкилтрансферазы (hAGT). (По сравнению с hAGT дикого типа, метка SNAP белка содержит мутации C26A, K125A, A127T, R128A, G131K, G132T, M134L, R135S, C150S, N157G, S159E, и после G182 последовательность укорочена) (SEQ ID NO: 91),
- нуклеиновая кислота, кодирующая спейсер GGGGS (SEQ ID NO: 90),
- нуклеиновая кислота, кодирующая трансмембранный PD1 человека и цитоплазматический домен (остатки 171-191 последовательности SEQ ID NO: 89),
- нуклеиновая кислота, кодирующая спейсер GGGGS (SEQ ID NO: 90),
- нуклеиновая кислота, кодирующая метку Flag (DYKDDDDK; SEQ ID NO: 92).
6) TIM3-CLIP (в направлении от 5' к 3'):
- нуклеиновая кислота, кодирующая внеклеточный домен TIM3 человека, включая сигнальный пептид (остатки 1-202 последовательности SEQ ID NO: 93)
- нуклеиновая кислота, кодирующая спейсер GGGGS (SEQ ID NO: 90),
- нуклеиновая кислота, кодирующая CLIP из pCLIPf (без N-концевого остатка метионина), который является мутантной формой гена человека для O6-алкилгуанидин-ДНК-алкилтрансферазы (hAGT) (SEQ ID NO: 94),
- нуклеиновая кислота, кодирующая спейсер GGGGS (SEQ ID NO: 90),
- нуклеиновая кислота, кодирующая трансмембранный TIM3 человека и цитоплазматический домен (остатки 203-230 последовательности SEQ ID NO: 93)
- нуклеиновая кислота, кодирующая спейсер GGGGS (SEQ ID NO: 90),
- нуклеиновая кислота, кодирующая метку Flag (DYKDDDDK; SEQ ID NO: 92).
После трансфекции клетки инкубировали во флаконах для качалки до конечного использования в анализе FACS (24-48 ч после трансфекции) или в экспериментах FRET (через 48 ч).
Подтверждение экспрессии PD1 TIM3 во временно трансфектированных клетках HEK293 (FACS)
Через 24-48 ч после временной трансфекции клеток Hek293 клетки анализировали на наличие экспрессии PD1 и TIM3: Обычно 1-3×105 однократно или двукратно трансфектированных клеток окрашивали в течение 30 мин во льду при концентрации 10 мкг/мл, промывали 2 раза ФСБ/2% ЭТС и анализировали в системе FacsCanto II с использованием:
PD1-FITC Biolegend 329904, клон EH12.2H7) или PD1-PE (R&D #FAB1086P) и/или
TIM3-PE (R&D FAB2365P клон 344823).
Описание введения меток и анализа FRET с биспецифическими антителами анти-PD1/TIM3
Трансфектированные клетки седиментировали и ресуспендировали при плотности 1×106 клеток/мл в буферном растворе TaqLite (Cisbio). Затем клетки окрашивали 100 нМ SNAP-Lumi4-Tb (Cisbio) и 100 нМ Clip-Red (Cisbio) в течение 1 ч при 37°C в буферном растворе Tag-Lite (Cisbio). После промывки и ресуспендирования в ФСБ/2% ЭТС, приблизительно 50000 клеток (в объеме 50 мкл) высеивали в белые 96-луночные планшеты с плоским дном (Costar) перед добавлением контроля (например, одно специфический референс-изотип) или в клетки добавляли биспецифическое антитела при конечной концентрации 0,001-10 нМ. В некоторых экспериментах исходные моноклональные антитела сшивали через козий Fc против иммуноглобулина человека (конечная концентрация 20 нМ, данные не показаны). После инкубации в течение 1 ч при 4°C или комнатной температуре измеряли время разрешенную флуоресценцию при длине волны 665/620 нм на ридере BMG Pherastar или Tecan Infinite M1000 Pro с использованием стандартных параметров, предоставленных фирмой производителем. Необязательно клетки, меченные SNAP-Lumi4-Tb и 100 нМ Clip-Red, хранили при -80°C или в жидком азоте и быстро размораживали для экспериментов FRET.
Результаты
Характеризация различных биспецифических антител и форматов антител для одновременного связывания с рецептором и сшивки по данным индукции FRET.
Клетки НЕК, экспрессирующие PD1 и TIM3, обрабатывали, как описано выше, для измерения сигнала FRET после одновременного связывания с рецептором при инкубации с титрованными количествами различных биспецифических антител (0,12-10 нМ).
Все биспецифическое антитела индуцировали сигнал FRET в клетках, экспрессирующих PD-1-TIM3 дозозависимым способом. Между форматами 1+1 (антитела #389 и 168) по сравнению с конструктами 2+2 (358+359) не наблюдалось значительного различия, как видно на фиг. 7А.
Кроме того, два биспецифических формата на основе антител TIM3, гуманизированных PD1 (#476 и 477), оценивали на их способность индуцировать FRET в клетках после обработки. Как показано на фиг. 7Б, оба конструкта индуцировали значительный сигнал FRET в клетках PD1+TIM3+HEK, что указывает на одновременное связывание функциональным способом.
Для демонстрации специфичности сигнала FRET, индуцированного одновременным связыванием биспецифического антитела, для конкуренции добавляли моноклональные IgG только с одной специфичностью.
В клетки PD1, меченные SNAP, и в клетки TIM3, меченные CLIP (как описано выше), вводили метки 100 нМ SNAP-Lumi4-Tb и 100 нМ Clip-Red. После промывки меченные клетки инкубировали с биспецифическими антителами анти-PD1/TIM3 #0168 [при указанных концентрациях] в течение 1 ч при 4°C перед измерением время разрешенной флуоресценции при длине волны 665/620 нм на ридере BMG Pherastar (черные линии). Для выявления специфичности сигнала FRET после обработки биспецифическими антителами для конкуренции добавляли моноклональные антитела анти-PD1 (#0165, фиг. 8А, кривая серого цвета) или моноклональные антитела Tim-3 (#0018, фиг. 8Б, кривая серого цвета), что приводило к практически полному исключению сигнала FRET. Исходные (моноспецифические) антитела анти-PD-1 в отдельности не индуцировали FRET (пунктирные линии).
Индукцию сигнала FRET исключали также в присутствии исходных антител TIM3 (0018, кривые серого цвета), добавленных параллельно с биспецифическими антителами (фиг. 8Б).
Пример 14
Связывание антител с различными мононуклеарными клетками периферической крови (РВМС)
Анализ связывания
Свеж изолированные клетки РВМС или поликлонально активированные в течение 3 суток CD4 Т клетки (нанесенные на планшете антитела анти-CD3 и растворимые антитела анти-CD28, каждые при концентрации 1 мкг/мл, оба фирмы BD Pharmingen) окрашивали либо красителем Alexa 647, либо напрямую конъюгированными с анти-TIM-3 или -TIM-3/анти-PD-1 биспецифическими антителами в течение 1 ч при 4°C. Затем клетки промывали для удаления несвязанных антител и окрашивали поверхностным маркером в течение 30 мин при 4°C для выделения моноцитов (CD14+(BD Pharmingen)), NK клеток (CD16+ (eBioscience), CD56+ (BioLegend) и CD3-) и T клеток (CD3+ n(eBioscience)) перед фиксацией реагентом BD Cell Fix. Клетки получали в системе LSRFortessa, BD Biosciences. Результаты, полученные для биспецифических антител по сравнению с антителами анти-TIM3, представлены на фиг. 9А-93.
Пример 15
Интернализация
Пример 15А
Поликлонально активированные CD4 Т клетки в течение 3 сут, предварительно культивированные со связанными на планшете антителами анти-CD3 (1 мг/мл) и растворимыми антителами анти-CD28 (1 мг/мл), инкубировали в присутствии биспецифических антител анти-TIM-3 или анти-TIM-3/анти-PD-1 (в двух повторах) в течение 30 мин при 4°C. Затем клетки промывали, разделяли на 2 группы, одну из которых инкубировали в течение еще 3 ч при 37°C, а в другую немедленно окрашивали меченным вторичным антителом (eBioscience) перед фиксацией реагентом BD Cell Fix. После инкубации в течение 3 ч вторую группу клеток перед фиксацией также окрашивали меченным вторичным антителом.
Клетки получали в системе LSRFortessa (BD Biosciences) и сравнивали уровни экспрессии определяемого антитела на поверхности клетки в двух группах. Результаты представлены на фиг. 10А-10Г. Биспецифическое антитела 1+1 PD1TIM3-0166 (на основе химерных антител PD1-0103/TIM3-0038) характеризовались сниженной интернализацией по сравнению с биспецифическими антителами 2+2 PD1TIM3-0321 (также на основе химерных антител PD1-0103/TIM3-0038, но содержащих 2 антигенсвязывающих участка для PD и 2 для TIM3) и по сравнению с исходными антителами TIM3-0038 на активированных CD4+ Т клетках и на активированных клетках NK.
Пример 192В
Визуализация локализации и интернализации антител с использованием флуоресцентной конфокальной микроскопии
Активированные CD4 положительные клетки окрашивали реагентом CMFDA (Molecular Probes, Life technologies), кроме окрашивания антитела а-PD1, и наносили на круглые покровные стекла, обработанные поли-L-лизином (Sigma). Клетки выдерживали для адсорбции в течение 30 мин при 37°C, затем добавляли флуоресцентно меченные антитела (1 мкг/мл: а-TIM3 (chi18-А647 = химерное TIM3_0018, меченное AlexaA647), a-TIM3 (chi28-A647 = химерное TIM3_0028, меченное AlexaA647), Bispec (0168-А647 = 1+1 PD1TIM3_0168 (на основе химерного PD1-0103 / TIM3-0018), меченное AlexaA647) и Bispec (0389-А647 = 1+1 PD1TIM3_0389 (на основе химерного PD1-0103 / TIM3-0028), меченное Alexa 647) и a-PD1 (0165-А488 = химерное PD1-0103, меченное Alexa488) непосредственно в питательную среду в течение различного времени (15 мин, 1 ч, 2 ч, 3 ч). Охлажденный ФСБ (Lonza) использовали для остановки реакции и для удаления несвязанных антител. Затем клетки фиксировали (BD Cytofix) в течение 20 мин и промывали дважды буферным раствором для промывки (буферный раствор для окрашивания BD). После перенесения покровных стекол на сухую поверхность их помещали на предметные стекла с гистологической средой (Fluoromount G, eBioscience) и выдерживали в темноте при 4°C перед проявлением. Интенсивность флуоресцетного сигнала от мембранного ROI, клеток с высоким содержанием мишеней, делили на интенсивность флуоресцентного сигнала от цитоплазматического ROI тех же клеток, при этом получали соотношение, которое приведено на диаграмме. Для сравнения образцов использовали односторонний анализ One Way ANOVA (*=р<0,05, **=р<0,001). Флуоресцентную конфокальную микроскопию проводили на инвертированном приборе LSM 700 фирмы Zeiss с масляным объективом 60х. Изображения получали с использованием программного обеспечения Zen (Zeiss), установленном на микроскоп. Анализ изображений осуществляли с использованием программного обеспечения Imaris (Bitplane, Oxford Instrument) и статистический анализ проводили с использованием программного обеспечения GraphPad Prism (Graphpad Software). Анализ в течение времени, показывающий высокую локализацию в мембране как биспецифического, так и PD1 антитела по сравнению с внутриклеточной кластеризацией антител TIM3, показан на фиг. 11А и 11Б. Антитела анти-PD1 и Bispec 0389 характеризовались только очень низкой интернализацией даже через 3 ч, в то время как для другого антитела Bispec 0168 наблюдалась более высокая интернализация. Высокая интернализация наблюдалась для TIM3 Ab 0028 и наибольшая интернализация - для антитела TIM3-0018.
Пример 16
Активация Т клеток с использованием анализа на основе реакции смешанных лимфоцитов (РСЛ)
Реакция смешанных лимфоцитов (РСЛ) представляет собой иммуноклеточный анализ, в котором оценивают активацию лимфоцитов одного индивидуума (донор X) лимфоцитами другого индивидуума (донор Y). Смешанную реакцию лимфоцитов использовали для демонстрации эффекта блокировки пути PD1 к эффекторным клеткам лимфоцитов. В данном анализе оценивали активацию Т клеток и секрецию ИНФ-γ в присутствии или в отсутствии моноклональных биспецифических антител анти-PD1/TIM3.
Для проведения аллогенной РСЛ моноядерные клетки периферической крови (РВМС) от по крайней мере 4 здоровых донора неизвестного типа выделяли центрифугированием в градиенте плотности с использованием Leukosep (Greiner Bio One, 227 288). Краткое описание метода: гепаринизированную кровь разбавляли трехкратным объемом ФСБ и аликвотные части разбавленной крови по 25 мл наслаивали в пробирки Leukosep объемом 50 мл. После центрифугирования при 800 g в течение 15 мин при комнатной температуре (без перерыва) содержащие лимфоциты фракции собирали, промывали ФСБ и использовали непосредственно для функционального анализа или ресуспендировали в среде для замораживания (10% ДМСО, 90% ЭБС) при концентрации 1,0Е+07 клеток/мл и хранили в жидком азоте. Индивидуальные двухсторонние реакции РСЛ проводили при смешивании РВМС от двух различных доноров при соотношении стимулирующие клетки/клетки ответной реакции 1:1 и совместное культивирование проводили по крайней мере в двойном повторе в 96-луночных планшетах с плоским дном в течение 6 сут при 37°C, 5% CO2, в присутствии или в отсутствии различных концентраций очищенных биспецифических антител PD1-TIM3 или их исходных моноспецифических антител (в отдельности или в комбинации). В качестве отрицательного контроля использовали отсутствие антител или контрольный изотип антител, а в качестве положительного контроля использовали rec hu IL-2 (20 Ед/мл). Через 6 сут из каждой среды отбирали по 100 мкл для измерения цитокина. Уровни ИНФ-γизмеряли с использованием набора OptEIA ELISA (BD Biosciences).
Результаты представлены в табл. 18А-18Г (высвобождение/секреция ИНФ-γ). Биспецифическое антитела PD1-TIM3 ускоряют активацию Т-клеток и секрецию ИНФ-γ зависимым от концентрации способом. Величину повышения секреции ИНФ-γ в % рассчитывали в отношении продуцирования ИНФ-γв условиях РСЛ без добавления любых блокирующих моноклональных антител (базальная аллогенная стимуляция индуцированного ИНФ-γ в виде Е-с) и СРЛ с добавлением 20 Ед/мл rec hu IL-2 (положительный контроль = 100% величина ИНФ-γ Е+с) и рассчитывали по формуле: Относительная стимуляция [%]=((Пример - Е-с)/(Е+с - Е-с)*100.
Проводили 4 отдельных эксперимента.
В эксперименте 1 оценивали способность биспецифических антител PD1-TIM3 1+1 PD1TIM3_0168 (на основе химерного PD1-0103 / TIM3-0018 (=АВ 0168) по сравнению с химерным PD1-0103 (=PD1-0165) и химерного TIM3_0018 (=TIM3-chi18) и их комбинаций. Результаты представлены на фиг. 12А и в табл. 18А.
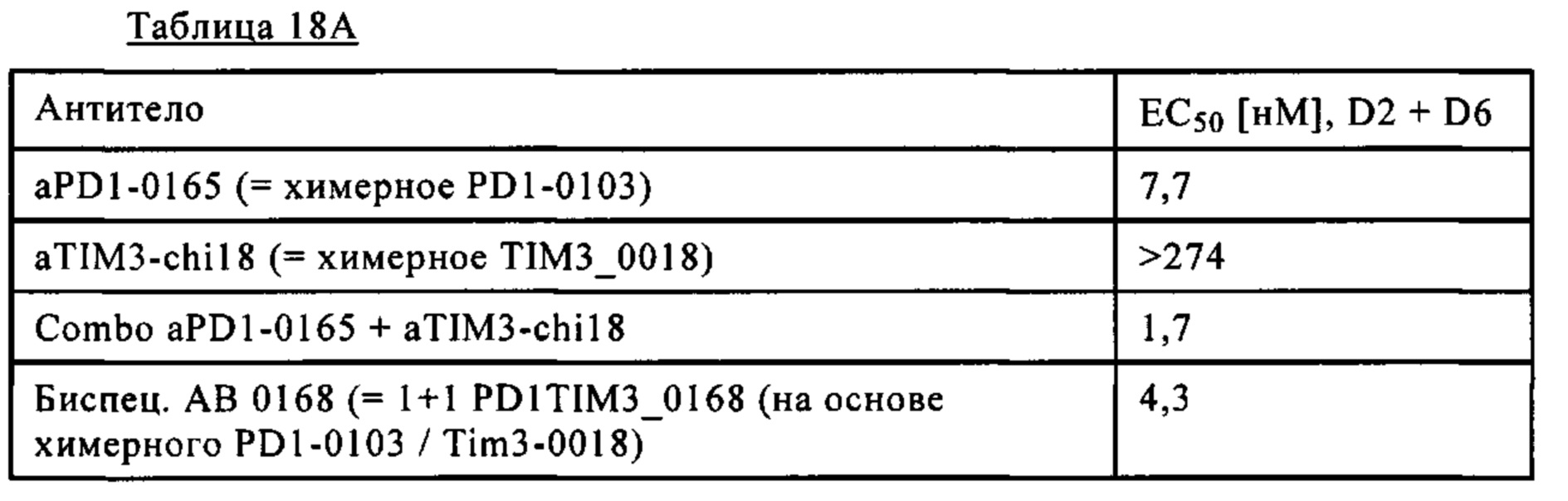
В эксперименте 2 оценивали способность биспецифичность антител PD1-TIM3 1+1 PD1TIM3_0389 (на основе химерных антител PD1-0103 / TIM3-0028 (=Биспец. АВ 0389) в сравнении с химерными антителами PD1-0103 (=PD1-0165) и химерными антителами TIM3_0028 (=TIM3-chi28) и их комбинациями. Результаты показаны на фиг. 12Б и в табл. 18Б.

В эксперименте 3 оценивали способность биспецифических антител PD1-TIM3 1+1 PD1-0103 / Ky8213 (на основе химерных антител PD1-0103 / и анти-TIM3 Ky8213, как описано в патенте США 2012/0189617 (см. антитело 8213, например, в примере 33), которые получали аналогично тому, как описано в примере 1 в виде 1+1 CrossMab) в сравнении с химерными антителами PD1-0103 (=PD1-0165) и анти-TIM3-Ky8213 (как описано в заявке США 2012/0189617 (см. антитело 8213) например, в примере 33) и их комбинаций. Результаты показаны на фиг. 12В и в табл. 18В.
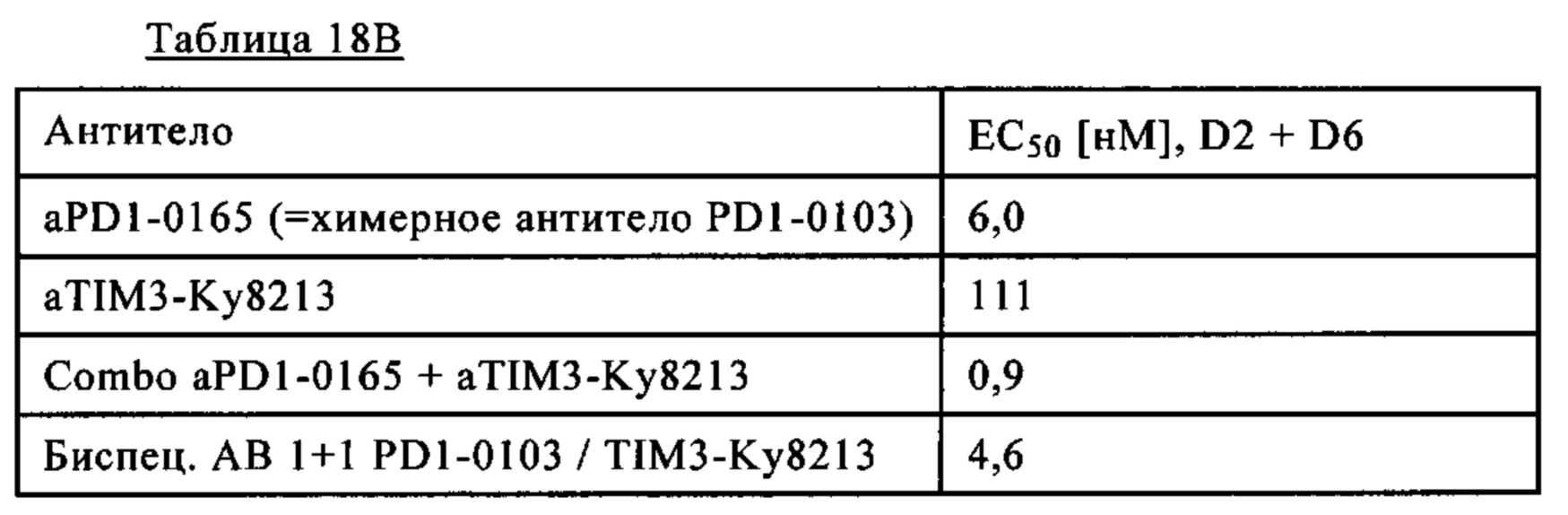
В эксперименте 4 оценивали способность биспецифических антител PD1-TIM3 1+1 PD1TIM3_0389 (на основе химерных антител PD1-0103 / TIM3-0028 (= Биспец. АВ 0389 (1+1)) в сравнении с биспецифическими антителами PD1-TIM3 2+2 PD1TIM3_0358 на основе химерных антител PD1-0103 / TIM3-0028 (= Биспец. АВ 0358 (2+2)), и химерных антител PD1-0103 (= PD1-0165) и TIM3_0028 (=TIM3-chi28) и их комбинаций. Результаты показаны на фиг. 12Г и в табл. 18Г.

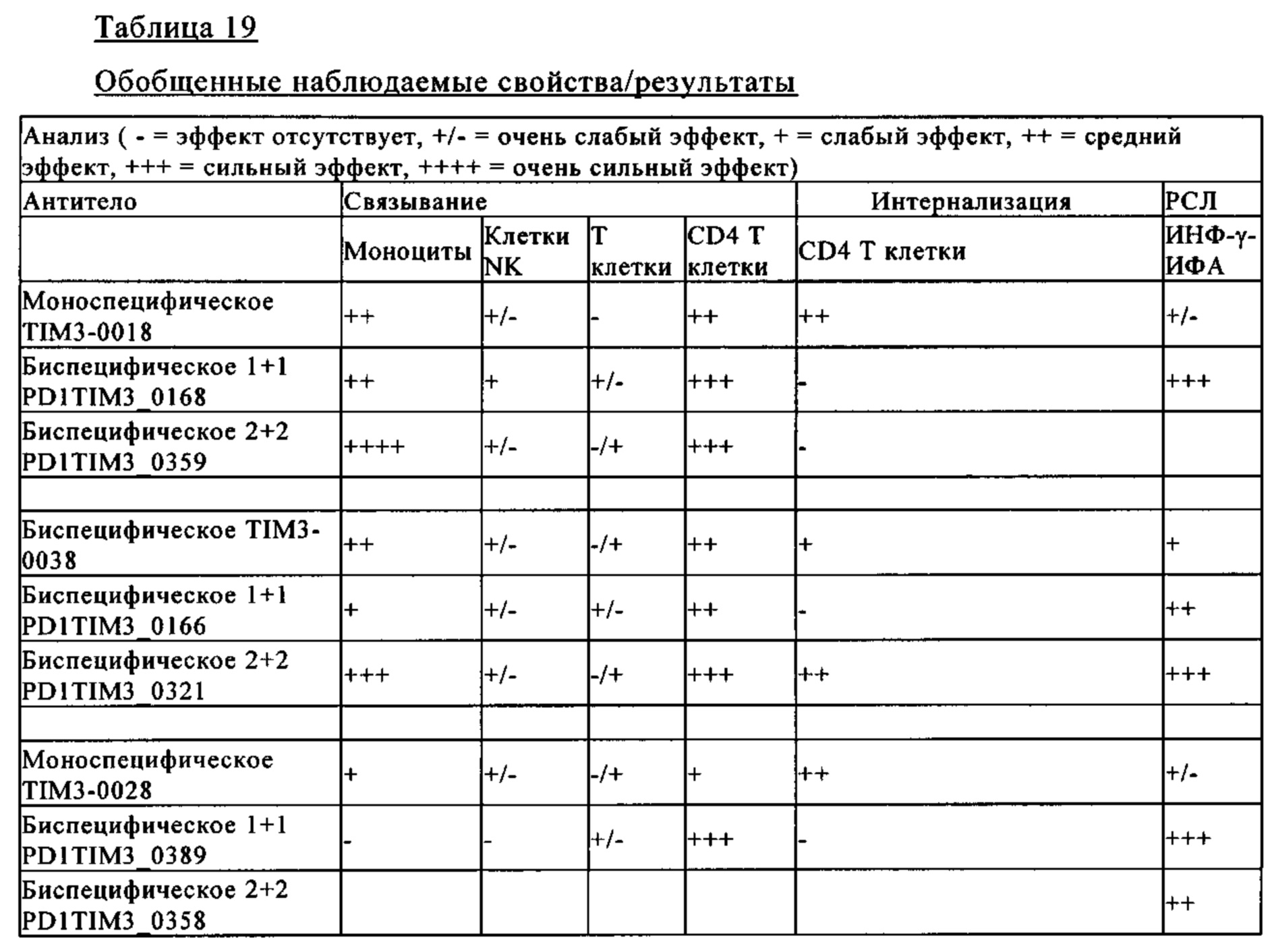
Пример 17
Совместное культивирование антиген-специфичных CD4 Т клеток с лимфобластоидной клеточной линией В ARH77
Для исследования влияния блокировки анти-PD-1 на CD4 Т клетки в присутствии клеточной линии опухолевых клеток, экспрессирующих MHCII, авторы разработали метод анализа, в котором свежеочищанные CD4 Т клетки совместно культивировали в течение 5 сут в присутствии бессмертной лимфобластной клеточной линии В клеток вируса Эпштейна-Барра (ARH77). В день с минимальной реакцией смешанных лимфоцитов (мРСЛ) CD4 Т клетки обогащали с использованием набора микрогранул (Miltenyi Biotec) до 108 РВМС, полученных от здорового донора. Перед культивированием в CD4 Т клетки включали метку 5 мМ карбоксифлуоресцеинсукцинимидилового эфира (CFSE). 105 CD4 Т клеток затем вносили в лунки 96-луночных планшетов вместе с линией В клеток (5:1) в присутствии или отсутствии блокирующих антител анти-PD1 (гуманизированных антител PD-10376, ниволумаба или пембролизумаба), антител анти-TIM3 (гуманизированных антител анти-TIM3 0438 или Kyowa-8213) или биспецифических антител-PD-1 / TIM3 (гуманизированных антител 0476) при концентрации 10 мкг/мл. Через 5 сут собирали супернатанты клеточных культур, которые использовали для определения уровней ИНФ-γ методом ИФА (R&D systems).
Как показано на фиг. 13, неожиданно было установлено, что обработка антителами анти-PD-1 значительно повышает способность CD4 Т клеток продуцировать ИНФ-γ при сравнении с необработанными CD4 Т клетками (пунктирная линия). В данном анализе антитела анти-PD-1 0376 были в равной степени способны служить в качестве референс-антител при индукции секреции ИНФ-γ CD4 Т-клетками, в то время как антитела анти-TIM3 0438 в отдельности оказывают только минимальное влияние и даже более значительное по сравнению с контрольными антителами Kyowa-8213.
Неожиданно было установлено, что биспецифическое антитела 0476 оказались более эффективными по сравнению с комбинацией исходных антител, антителами анти-PD1 0376 в отдельности и референс-антителами в отношении индукции секреции ИНФ-γ CD4 Т клетками (Р<0,01, односторонний анализ ANOVA).
Пример 18
Улучшенная эффективность биспецифических антител PD1-TIM3 in vivo
Самок мышей с подавленным иммунитетом (NOG) возрастом 6-8 недель в начале экспериментов сенсибилизировали подкожной инъекцией 106 клеток MKN45 (линия клеток карциномы желудка человека, экспрессирующая высокий уровень CEA) в день 0 в присутствии матригеля при соотношении 1:1. В день 7 выделяли РВМС от здорового донора человека: гепаринизированную кровь человека разбавляли в соотношении ~ 2:1 фосфатно-солевым буферным раствором (ФСБ, Gibco) и переносили в подготовленные пробирки Leucosep объемом 50 мл, каждая из которых содержала по 15 мл Histopaque-1077 (Sigma Aldrich). После центрифугирования (30 мин, 450×g, КТ, без остановки), полосы РВМС собирали пипеткой объемом 5 мл. Клетки переносили в пробирки объемом 50 мл и промывали ФСБ (центрифугировали при 350×g, 10 мин). Стадию промывки повторяли (центрифугирование при 300×g, 10 мин). После центрифугирования (10 мин, 350×g), клетки ресуспендировали в среде RPMI. 10 РВМС вводили внутривенно мышам NOG, при этом создавали химерную модель мышь-человек. В день 0 начинали курс еженедельного лечения (носитель или лечение соединением, выбранным из анти-PD1 (0376), ниволумабам, анти-TIM3 (0438) или анти PD1-TIM3 (0476)) введением внутрибрюшинной инъекцией. Лечение биспецифическими антителами PD1-TIM3 (3 или 10 мг/кг, незакрашенные треугольники) сравнивали с лечением эквимолярной концентрацией (1,5 или 5 мг/кг) антитела PD1 (0376), ниволумаба и антитела TIM3 (0438) каждого в отдельности. Размер опухолей измеряли штангенциркулем в мм в течение периода 30 дней каждые 2-3 дня. Измеренные объемы опухолей представлены в виде средней величины на группу мышей на фиг. 14А и 14Б.
Все виды лечения свидетельствуют о способности контроля роста опухоли по сравнению с группой, получавшей носитель. Ингибирование только PD1 (антителами PD1 (0376) или антителами, полученными в лаборатории, ниволумабом или только антителами TIM3 (0438)) приводило к аналогичной эффективности контроля роста опухоли. Эти результаты свидетельствуют о том, что с помощью блокировки PD1 или TIM3 можно увеличить противоопухолевую ответную реакцию. Однако, возрастание ингибирования роста опухолей можно наблюдать, если оба PD1 и TIM3 связываются с биспецифическим антителом PD1-TIM3. В то время как при низкой концентрации различие в росте опухоли между лечением биспецифическими антителами и другим лечением не наблюдается, при высоких дозах ингибирование обоими PD1 и TIM3 при лечении биспецифическими антителами PD1-TIM3 приводит к значительному ингибированию роста опухоли.