Результат интеллектуальной деятельности: АНТИТЕЛА ПРОТИВ ТРАНСФЕРРИНОВОГО РЕЦЕПТОРА, ОБЛАДАЮЩИЕ ИНДИВИДУАЛИЗИРОВАННОЙ АФФИННОСТЬЮ
Вид РИД
Изобретение
Область изобретения
Настоящее изобретение относится к антителам против трансферринового рецептора с запланированными скоростями диссоциации в отношении человеческого трансферринового рецептора и к их применению в качестве челночного модуля гематоэнцефалического барьера.
Предшествующий уровень техники
Проникновение в мозг лекарственных средств против неврологических расстройств, таких как большие биотерапевтические лекарственные средства или низкомолекулярные лекарственные средства, имеющие слабое проникновение в мозг, строго ограничивается обширным и непроницаемым гематоэнцефалическим барьером (ГЭБ), наряду с другими клеточными компонентами в нейроваскулярной единице (НВЕ). Тестировали многие стратегии для преодоления этого препятствия, и одной из них является применение путей трансцитоза, опосредованных эндогенными рецепторами, экспрессируемыми на эндотелии мозговых капилляров (рецептор гематоэнцефалического барьера). Против данных рецепторов были сконструированы рекомбинантные белки, такие как моноклональные антитела или пептиды, для обеспечения опосредованной рецептором доставки биотерапевтических средств в мозг. Однако остаются неисследованными стратегии для максимизации поглощения в мозг при минимизации неправильной сортировки в пределах мозговых эндотелиальных клеток (МЭК) и степень накопления в пределах определенных органелл (особенно в органеллах, которые приводят к деградации биотерапевтического средства) в МЭК.
Моноклональные антитела и другие биотерапевтические средства имеют огромный терапевтический потенциал для лечения патологии в центральной нервной системе (ЦНС). Однако их доступ в мозг предотвращается ГЭБ. Предыдущие исследования проиллюстрировали то, что очень маленькая процентная доля (приблизительно 0,1%) IgG, инъецированного в кровоток, способна проникать в компартмент ЦНС (Felgenhauer, Klin. Wschr. 52 (1974) 1158-1164). Это будет определенно ограничивать любой фармакологический эффект из-за низкой концентрации антитела в пределах ЦНС.
Ранее было обнаружено то, что процентная доля антитела, которое распределяется в ЦНС, могла быть увеличена посредством применения рецепторов ГЭБ (т.е. трансферринового рецептора, инсулинового рецептора и тому подобных) (см., например, WO 95/02421).
Следовательно, существует потребность в системах доставки лекарственных средств против неврологических расстройств через ГЭБ для эффективной челночной доставки лекарственных средств в мозг.
В WO 2014/033074 описывается челнок гематоэнцефалического барьера.
В WO 2014/189973 описываются антитела против трансферринового рецептора и способы их применения. Кроме того, описывается то, что нацеливание на рецептор ГЭБ с использованием традиционного специфичного высокоаффинного антитела обычно приводило к ограниченному увеличению транспорта через ГЭБ. Позднее обнаружили то, что величина поглощения и распределения антитела в ЦНС обратно связана с его аффинностью связывания в отношении рецептора ГЭБ среди исследованных антител против ГЭБ. Например, низкоаффинное антитело к трансферриновому рецептору (TfR), дозированное при терапевтических уровнях дозы, значительно улучшает транспорт через ГЭБ и удерживание в ЦНС антитела против TfR относительно более высокоаффинного антитела против TfR и делает возможным более легкое достижение терапевтических концентраций в ЦНС (Atwal et al., Sci. Transl. Med. 3 (2011) 84ra43). Доказательство такого транспорта через ГЭБ было достигнуто с использованием биспецифичного антитела, которое связывается и с TfR, и с β-секретазой (ВАСЕ1) - ферментом расщепления белка-предшественника амилоида (АРР). Одна системная доза биспецифичного антитела против TfR/BACE1, сконструированного с использованием низкоаффинного антитела, не только приводила к значимому поглощению антитела в мозг, но также кардинально уменьшала уровни мозгового Аβ1-40 по сравнению с одним моноспецифичным антителом против ВАСЕ1, свидетельствуя о том, что проникновение через ГЭБ влияет на эффективность антитела против ВАСЕ1 (Atwal et al., Sci. Transl. Med. 3 (2011) 84ra43; Yu et al., Sci. Transl. Med. 3 (2011) 84ra44).
Кроме того, тщательная неклиническая оценка безопасности моноклональных антител (mAb), предназначенных для терапевтического применения, является очень важной из-за увеличивающейся сложности аспектов инженерии антител и варьирования, вызванного разнообразием клеточных систем рекомбинантной продукции для получения антител. Кроме того, сложная структура, уникальные биологические функции и более длительные периоды полувыведения mAb по сравнению с традиционными низкомолекулярными лекарственными средствами увеличивают внимание к безопасности, помимо опасений из-за длительного клинического применения mAb для лечения хронических заболеваний (Lynch, C.M., et al., mAbs 1 (2009)2-11; Kim, S.J., et al., Mol. Cells 20 (2005) 17-29).
Общей целью неклинических исследований в отношении mAb является определение токсикологических свойств рассматриваемого mAb и предоставление информации для разработки продукта. Главными целями неклинической оценки являются (1) идентификация органов-мишеней в отношении токсичности и определение того, является ли токсичность обратимой после лечения, (2) идентификация безопасной исходной дозы для человеческих клинических испытаний Фазы I и последующих схем повышения дозы, (3) предоставление информации для отслеживания параметров безопасности в клинических испытаниях и (4) предоставление данных по безопасности для поддержки заявленного на этикетке продукта. Для достижения данных целей проводятся неклинические исследования как in vitro, так и in vivo, нацеленные на определение и понимание фармакологических свойств антитела (Lynch, C.M., et al., mAbs 1 (2009) 2-11; Cavagnaro, J.A., In: Cavagnaro, J.A. (Ed.) "Preclinical safety evaluation of biopharmaceuticals"; Hoboken, NJ: Wiley 2008; 45-65).
Для успешной некпинической оценки безопасности mAb следует выбирать самые релевантные виды животных для тестирования токсичности (Lynch, C.M., et al., mAbs 1 (2009) 2-11; Chapman, K., et al., Nat. Rev. Drug Discov. 6 (2007) 120-126). Релевантным видом является вид, у которого антитело является фармакологически активным, должен присутствовать или экспрессироваться антиген-мишень, и профиль тканевой перекрестной реактивности должен быть аналогичным человеческому (Lynch, C.M., et al., mAbs 1 (2009) 2-11; Chapman, K., et al., Nat. Rev. Drug Discov. 6 (2007) 120-126; Subramanyam, M. and Mertsching, E., In: Cavagnaro J.A. (Ed.); Preclinical safety evaluation of biopharmaceuticals. Hoboken, NJ: Wiley 2008; 181-205; Hall, W.C., et al., In: Cavagnaro, J.A. (Ed.); Preclinical safety evaluation of biopharmaceuticals. Hoboken, NJ: Wiley 2008; 207-240). Посредством применения иммунохимических или функциональных анализов может быть идентифицирован релевантный вид животных, у которого экспрессируется желательный эпитоп, и который демонстрирует профиль тканевой перекрестной реактивности, аналогичный человеческим тканям (Lynch, C.M., et al., mAbs 1 (2009) 2-11; Hall, W.C., et al., In: Cavagnaro, J.A. (Ed.); Preclinical safety evaluation of biopharmaceuticals. Hoboken, NJ: Wiley 2008; 207-240). Исследования перекрестной реактивности у видов, которые являются полезными в данном процессе, включают иммуногистохимический обзор тканей от разных видов с использованием имеющихся в продаже многовидовых тканевых микрочипов (Lynch, C.M., et al., mAbs 1 (2009) 2-11; Hall, W.C., et al., In: Cavagnaro, J.A. (Ed.); Preclinical safety evaluation of biopharmaceuticals. Hoboken, NJ: Wiley 2008; 207-240). В качестве альтернативы, оценка связывания антител с клетками от данных животных посредством сортировки флюоресцентно-активированных клеток (FACS) типично является более чувствительной, чем иммуногистохимический анализ срезов тканей (Lynch, С.М., et al., mAbs 1 (2009) 2-11; Subramanyam, M. and Mertsching, E., In: Cavagnaro J.A. (Ed.); Preclinical safety evaluation of biopharmaceuticals. Hoboken, NJ: Wiley 2008; 181-205). Следует сравнить последовательности ДНК и аминокислот антигена-мишени среди видов; следует определить гомологию между видами (Lynch, С.М., et al., mAbs 1 (2009) 2-11; Subramanyam, M. and Mertsching, E., In: Cavagnaro J.A. (Ed.); Preclinical safety evaluation of biopharmaceuticals. Hoboken, NJ: Wiley 2008; 181-205).
Кроме того, биораспределение, функция и структура антигена должны быть сравнимыми между релевантными видами животных и человеком для обеспечения оценки токсичности, возникающей из-за связывания антитела с антигеном-мишенью, которую называют токсичностью на мишени (Lynch, С.М., et al., mAbs 1 (2009) 2-11; 19,20). Кроме того, сильные сходства в тканевом распределении антигена-мишени у видов животных и человека делают более вероятным то, что органы-мишени токсичности, идентифицированные у животных, будут прогнозировать потенциальные токсичности у человека. Отсутствие сходства в тканевом распределении антигена между видом животного и человеком не полностью исключает применение данного вида животного для исследований токсичности, но данные различия должны приниматься во внимание для оценки риска у человека. В том, что касается плотности или аффинности антигена, абсолютная эквивалентность между животной моделью и человеком аналогичным образом не требуется. Обоснование релевантности выбранного вида для тестирования токсичности должно быть включено в документ для подачи в регулирующий орган. При использовании только одного вида для оценки безопасности оправданием служит краткое изложение экспериментов, которые демонстрируют отстутствие дополнительных релевантных видов (Lynch, С.М., et al., mAbs1 (2009) 2-11).
Если моноклональное антитело, предназначенное для терапевтического применения, не имеет перекрестной реактивности с видом животных, должно использоваться либо имитирующее антитело, либо другой вид в качестве модели. Таким образом, имитирующие антитела являются потенциальным решением в отношении возможного ограниченного тестирования безопасности с гуманизированными моноклональными антителами с ограниченной видовой перекрестной реактивностью. Однако в настоящее время нет определенных критериев, по которым следовало бы судить о потенциальном имитирующем антителе до его применения в определении вопросов безопасности в отношении клинического агента (Regulatory Toxicology and Pharmacology Volume 40, Issue 3, December 2004, Pages 219-226).
Таким образом, для идентификации животной модели для конкретного mAb следует принять во внимание приведенные выше соображения. Тем не менее необходимо, чтобы рассматриваемое mAb имело перекрестную реактивность с антигеном-мишенью тестируемого вида. В противном случае даже самые подходящие тестируемые виды не могут использоваться. Следовательно, имеется потребность в mAb, которые не имеют внутривидовой перекрестной реактивности, но имеют межвидовую перекрестную реактивность в отношении его мишени у человека и у вида, предназначенного для неклинических испытаний.
В ЕР 2708560 описывается антитело, специфично распознающее трансферриновый рецептор. В FR 2953841 описываются антитела против трансферринового рецептора и их применения для иммунотерапии железозависимых опухолей. В US 2009/162359 описываются двухвалентные биспецифичные антитела.
Краткое изложение сущности изобретения
Обнаружили то, что антитела против трансферринового рецептора, как описано в данном документе, можно использовать в качестве челночного модуля гематоэнцефалического барьера для доставки мозгового эффекторного соединения через гематоэнцефалический барьер в мозг. В некоторых воплощениях челночный модуль гематоэнцефалического барьера представляет собой одновалентное связывающее соединение, которое специфично связывается с трансферриновым рецептором. Антитела против трансферринового рецептора, как описано в данном документе, при использовании в качестве челночного модуля гематоэнцефалического барьера, являются полезными, например, для диагностики или лечения неврологических расстройств, таких как болезнь Альцгеймера, болезнь Паркинсона и болезнь Альцгеймера с сопутствующей болезнью Паркинсона.
В данном документе описываются антитела против трансферринового рецептора, которые специфично связываются с человеческим трансферриновым рецептором (huTfR) и трансферриновым рецептором яванского макака (cyTfR). В некоторых воплощениях антитело против трансферринового рецептора
- связывается с человеческим трансферриновым рецептором (huTfR) и трансферриновым рецептором яванского макака (cyTfR);
- имеет скорость диссоциации в отношении человеческого трансферринового рецептора, которая равна или меньше, чем (т.е. самое большее равна) скорости диссоциации антитела против трансферринового рецептора 128.1 в отношении трансферринового рецептора яванского макака, при этом скорости диссоциации определяются поверхностным плазменным резонансом, и при этом антитело против трансферринового рецептора 128.1 имеет вариабельный домен тяжелой цепи SEQ ID NO 64 и вариабельный домен легкой цепи SEQ ID NO 65;
- связывается со скоростью диссоциации в отношении человеческого трансферринового рецептора, которая составляет от 0,1 1/с до 0,005 1/с включительно.
Одним аспектом, как описано в данном документе, является антитело против трансферринового рецептора, которое специфично связывается с человеческим трансферриновым рецептором и трансферриновым рецептором яванского макака, которое содержит:
i) гуманизированный вариабельный домен тяжелой цепи, полученный из вариабельного домена тяжелой цепи SEQ ID NO 01, и
ii) гуманизированный вариабельный домен легкой цепи, полученный из вариабельного домена легкой цепи SEQ ID NO 26,
где данное антитело имеет скорость диссоциации в отношении человеческого трансферринового рецептора, которая равна или меньше, чем (т.е. самое большее равна) скорости диссоциации антитела против трансферринового рецептора 128.1 в отношении трансферринового рецептора яванского макака,
при этом скорости диссоциации определяются поверхностным плазменным резонансом, и при этом антитело против трансферринового рецептора 128.1 имеет вариабельный домен тяжелой цепи SEQ ID NO 64 и вариабельный домен легкой цепи SEQ ID NO 65.
В одном воплощении скорость диссоциации в отношении человеческого трансферринового рецептора составляет от 0,1 1/с до 0,005 1/с включительно.
В одном воплощении антитело имеет в положении 80 вариабельного домена легкой цепи аминокислотный остаток пролина (Р) (нумерация согласно Kabat).
В одном воплощении антитело имеет в положении 91 вариабельного домена легкой цепи аминокислотный остаток аспарагина (N) (нумерация согласно Kabat).
В одном воплощении антитело имеет в положении 93 вариабельного домена легкой цепи аминокислотный остаток аланина (А) (нумерация согласно Kabat).
В одном воплощении антитело имеет в положении 100g вариабельного домена тяжелой цепи аминокислотный остаток серина (S) (нумерация согласно Kabat).
В одном воплощении антитело имеет в положении 100g вариабельного домена тяжелой цепи аминокислотный остаток глутамина (Q) (нумерация согласно Kabat).
В одном воплощении антитело имеет в положении 65 вариабельного домена тяжелой цепи аминокислотный остаток серина (S) (нумерация согласно Kabat).
В одном воплощении антитело имеет в положении 105 вариабельного домена тяжелой цепи аминокислотный остаток глутамина (Q) (нумерация согласно Kabat).
В одном воплощении антитело имеет в положении 80 вариабельного домена легкой цепи аминокислотный остаток пролина (Р), в положении 91 вариабельного домена легкой цепи аминокислотный остаток аспарагина (N), в положении 93 вариабельного домена легкой цепи аминокислотный остаток аланина (А), в положении 100g вариабельного домена тяжелой цепи аминокислотный остаток серина (S), в положении 65 вариабельного домена тяжелой цепи аминокислотный остаток серина (S) и в положении 105 вариабельного домена тяжелой цепи аминокислотный остаток глутамина (Q) (нумерация согласно Kabat).
В одном воплощении антитело имеет в положении 80 вариабельного домена легкой цепи аминокислотный остаток пролина (Р), в положении 91 вариабельного домена легкой цепи аминокислотный остаток аспарагина (N), в положении 93 вариабельного домена легкой цепи аминокислотный остаток аланина (А), в положении 100g вариабельного домена тяжелой цепи аминокислотный остаток глутамина (Q), в положении 65 вариабельного домена тяжелой цепи аминокислотный остаток серина (S) и в положении 105 вариабельного домена тяжелой цепи аминокислотный остаток глутамина (Q) (нумерация согласно Kabat).
Одним аспектом, как описано в данном документе, является антитело против трансферринового рецептора, содержащее: (a) HVR-H1 (гипервариабельная область 1 тяжелой цепи), содержащую аминокислотную последовательность SEQ ID NO 66; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO 68; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO 71, 72 или 73; (г) HVR-L1 (гипервариабельная область 1 легкой цепи), содержащую аминокислотную последовательность SEQ ID NO 75; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO 76; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO 78.
В одном предпочтительном воплощении антитело против трансферринового рецептора содержит (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO 66; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO 68; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO 72; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO 75; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO 76; и (е) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO 78.
Одним аспектом, как описано в данном документе, является антитело против трансферринового рецептора, которое специфично связывается с человеческим трансферриновым рецептором (huTfR), содержащее:
i) последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%-ную идентичность последовательности с аминокислотной последовательностью SEQ ID NO 24, и
ii) вариабельный домен легкой цепи (VL), имеющий по меньшей мере 90%-ную идентичность последовательности с аминокислотной последовательностью SEQ ID NO 37,
где данное антитело имеет примерно такую же скорость диссоциации, что и антитело, содержащее вариабельный домен тяжелой цепи (VH) последовательности SEQ ID NO 24 и вариабельный домен легкой цепи (VL) последовательности SEQ ID NO 37.
В одном воплощении скорость диссоциации в отношении человеческого трансферринового рецептора составляет от 0,1 1/с до 0,005 1/с включительно.
Одним предпочтительным аспектом, как описано в данном документе, является антитело против трансферринового рецептора, которое специфично связывается с человеческим трансферриновым рецептором (huTfR), содержащее:
i) последовательность вариабельного домена тяжелой цепи (VH), имеющую аминокислотную последовательность SEQ ID NO 24, и
ii) вариабельный домен легкой цепи (VL), имеющий аминокислотную последовательность SEQ ID NO 37.
В одном воплощении всех аспектов данное антитело представляет собой мультиспецифичное антитело, имеющее по меньшей мере одну специфичность связывания в отношении трансферринового рецептора и по меньшей мере одну специфичность связывания в отношении терапевтической мишени. В одном воплощении антитело содержит первый антигенсвязывающий сайт, который связывается с трансферриновым рецептором, и второй антигенсвязывающий сайт, который связывается с мозговым антигеном. В другом воплощении мозговой антиген выбран из группы, состоящей из человеческого Абета, рецептора эпидермального фактора роста (EGFR), человеческого рецептора 2 эпидермального фактора роста (HER2), человеческого альфа-синуклеина, человеческого тау, который фосфорилирован на остатке тирозина или серина, человеческого CD20, белка-предшественника амилоида (АРР) и человеческой глюкоцереброзидазы. В одном предпочтительном воплощении данное мультиспецифичное антитело связывается с обоими из следующих:
i) трансферриновый рецептор и Абета, или
ii) трансферриновый рецептор и CD20, или
iii) трансферриновый рецептор и альфа-синуклеин, или
iv) трансферриновый рецептор и фосфо-тау, или
v) трансферриновый рецептор и HER2, или
vi) трансферриновый рецептор и глюкоцереброзидаза.
В одном воплощении антитело представляет собой биспецифичное антитело, содержащее по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 24 и вариабельного домена легкой цепи SEQ ID NO 37, образующую сайт связывания в отношении трансферринового рецептора, и по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 81 и вариабельного домена легкой цепи SEQ ID NO 82 сайта связывания в отношении человеческого Абета.
В одном воплощении антитело представляет собой биспецифичное антитело, содержащее по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 24 и вариабельного домена легкой цепи SEQ ID NO 37, образующую сайт связывания в отношении трансферринового рецептора, и по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 79 и вариабельного домена легкой цепи SEQ ID NO 80 сайта связывания в отношении человеческого CD20. В одном воплощении вариабельная область тяжелой цепи содержит замену аминокислотного остатка в положении 11 по Kabat на любую аминокислоту, но не лейцин. В одном воплощении данная замена включает замену аминокислотного остатка в положении 11 по Kabat на неполярную аминокислоту. В одном предпочтительном воплощении данная замена включает замену аминокислотного остатка в положении 11 по Kabat в вариабельном домене тяжелой цепи SEQ ID NO 79 на аминокислотный остаток, выбранный из группы, состоящей из валина, лейцина, изолейцина, серина и фенилаланина.
В одном воплощении антитело представляет собой биспецифичное антитело, содержащее по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 24 и вариабельного домена легкой цепи SEQ ID NO 37, образующую сайт связывания в отношении трансферринового рецептора, и по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 83 и вариабельного домена легкой цепи SEQ ID NO 84 сайта связывания в отношении человеческого альфа-синуклеина.
В одном воплощении антитело представляет собой биспецифичное антитело, содержащее по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 24 и вариабельного домена легкой цепи SEQ ID NO 37, образующую сайт связывания в отношении трансферринового рецептора, и по меньшей мере одну пару гуманизированного вариабельного домена тяжелой цепи, полученного из SEQ ID NO 85, и гуманизированного вариабельного домена легкой цепи, полученного из SEQ ID NO 86, сайта связывания в отношении человеческого альфа-синуклеина.
В одном воплощении антитело представляет собой биспецифичное антитело, содержащее по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 24 и вариабельного домена легкой цепи SEQ ID NO 37, образующую сайт связывания в отношении трансферринового рецептора, и по меньшей мере одну пару гуманизированного вариабельного домена тяжелой цепи, полученного из SEQ ID NO 87, и гуманизированного вариабельного домена легкой цепи, полученного из SEQ ID NO 88, сайта связывания в отношении человеческого альфа-синуклеина.
В одном воплощении антитело представляет собой биспецифичное антитело, содержащее по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 24 и вариабельного домена легкой цепи SEQ ID NO 37, образующую сайт связывания в отношении трансферринового рецептора, и по меньшей мере одну пару гуманизированного вариабельного домена тяжелой цепи, полученного из SEQ ID NO 89, и гуманизированного вариабельного домена легкой цепи, полученного из SEQ ID NO 90, сайта связывания в отношении человеческого альфа-синуклеина.
В одном воплощении антитело представляет собой биспецифичное антитело, содержащее по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 24 и вариабельного домена легкой цепи SEQ ID NO 37, образующую сайт связывания в отношении трансферринового рецептора, и по меньшей мере одну пару гуманизированного вариабельного домена тяжелой цепи, происходящего из SEQ ID NO 91, и гуманизированного вариабельного домена легкой цепи, происходящего из SEQ ID NO 92, сайта связывания в отношении человеческого альфа-синуклеина.
В одном воплощении антитело представляет собой биспецифичное антитело, содержащее по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 24 и вариабельного домена легкой цепи SEQ ID NO 37, образующую сайт связывания в отношении трансферринового рецептора, и по меньшей мере одну пару гуманизированного вариабельного домена тяжелой цепи, происходящего из SEQ ID NO 93, и гуманизированного вариабельного домена легкой цепи, происходящего из SEQ ID NO 94, сайта связывания в отношении человеческого альфа-синуклеина.
В одном воплощении антитело представляет собой биспецифичное антитело, содержащее по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 24 и вариабельного домена легкой цепи SEQ ID NO 37, образующую сайт связывания в отношении трансферринового рецептора, и сайт связывания в отношении i) глюкоцереброзидазы, которая имеет аминокислотную последовательность SEQ ID NO 97, или ii) функционального варианта SEQ ID NO 97, имеющего по меньшей мере 70%-ную идентичность последовательности, или iii) функционального варианта SEQ ID NO 97, имеющего одну или более чем одну мутацию, делецию или вставку аминокислоты, или iv) усеченного функционального варианта SEQ ID NO 97, имеющего по меньшей мере один аминокислотный остаток на N-конце или С-конце или в пределах удаленной аминокислотной последовательности, или v) комбинацию iii) и iv).
В одном воплощении всех аспектов данное антитело содержит
i) гомодимерную область Fc человеческого подкласса IgG1, возможно с мутациями P329G, L234A и L235A или
ii) гомодимерную область Fc человеческого подкласса IgG4, возможно с мутациями P329G, S228P и L235E или
iii) гетеродимерную область Fc, в которой
а) один полипептид области Fc содержит мутацию T366W, и другой полипептид области Fc содержит мутации T366S, L368A и Y407V или
б) один полипептид области Fc содержит мутации T366W и Y349C, и другой полипептид области Fc содержит мутации T366S, L368A, Y407V и S354C, или
в) один полипептид области Fc содержит мутации T366W и S354C, и другой полипептид области Fc содержит мутации T366S, L368A, Y407V и Y349C,
или
iv) гетеродимерную область Fc человеческого подкласса IgG4, в которой оба полипептида области Fc содержат мутации P329G, L234A и L235A, и
а) один полипептид области Fc содержит мутацию T366W, и другой полипептид области Fc содержит мутации T366S, L368A и Y407V или
б) один полипептид области Fc содержит мутации T366W и Y349C, и другой полипептид области Fc содержит мутации T366S, L368A, Y407V и S354C, или
в) один полипептид области Fc содержит мутации T366W и S354C, и другой полипептид области Fc содержит мутации T366S, L368A, Y407V и Y349C,
или
v) гетеродимерную область Fc человеческого подкласса IgG4, в которой оба полипептида области Fc содержат мутации P329G, S228P и L235E, и
а) один полипептид области Fc содержит мутацию T366W, и другой полипептид области Fc содержит мутации T366S, L368A и Y407V или
б) один полипептид области Fc содержит мутации T366W и Y349C, и другой полипептид области Fc содержит мутации T366S, L368A, Y407V и S354C, или
в) один полипептид области Fc содержит мутации T366W и S354C, и другой полипептид области Fc содержит мутации T366S, L368A, Y407V и Y349C.
В одном воплощении всех аспектов антитело представляет собой CrossMab.
Одним аспектом, как описано в данном документе, является антитело против трансферринового рецептора, содержащее:
i) вариабельный домен тяжелой цепи, выбранный из группы, состоящей из SEQ ID NO 52, 53, 54, 55, 56, 57 и 58, и вариабельный домен легкой цепи, выбранный из группы, состоящей из SEQ ID NO 60, 61, 62 и 63,
или
ii) вариабельный домен тяжелой цепи, выбранный из группы, состоящей из SEQ ID NO 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 и 25, и вариабельный домен легкой цепи, выбранный из группы, состоящей из SEQ ID NO 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46 и 47.
Одним аспектом, как описано в данном документе, является фармацевтический препарат, содержащий антитело, как описано в данном документе, и фармацевтически приемлемый носитель.
Одним аспектом, как описано в данном документе, является антитело, как описано в данном документе, для применения в качестве лекарственного средства.
Одним аспектом, как описано в данном документе, является применение антитела, как описано в данном документе, в изготовлнии лекарственного средства для лечения неврологического расстройства.
В одном воплощении неврологическое расстройство выбрано из группы, состоящей из невропатического расстройства, нейродегенеративного заболевания, рака, расстройства, связанного с глазным заболеванием, конвульсивного расстройства, лизосомальной болезни накопления, амилоидоза, вирусного или микробного заболевания, ишемии, поведенческого расстройства, воспаления ЦНС, болезни Альцгеймера, болезни Паркинсона, рассеянного склероза, CD20-позитивного рака с метастазами в мозг и Her2-позитивного рака с метастазами в мозг.
Одним аспектом, как описано в данном документе, является применение антитела, как описано в данном документе, в изготовлении лекарственного средства для транспортировки одного или более чем одного соединения через гематоэнцефалический барьер (ГЭБ).
Описание графических материалов
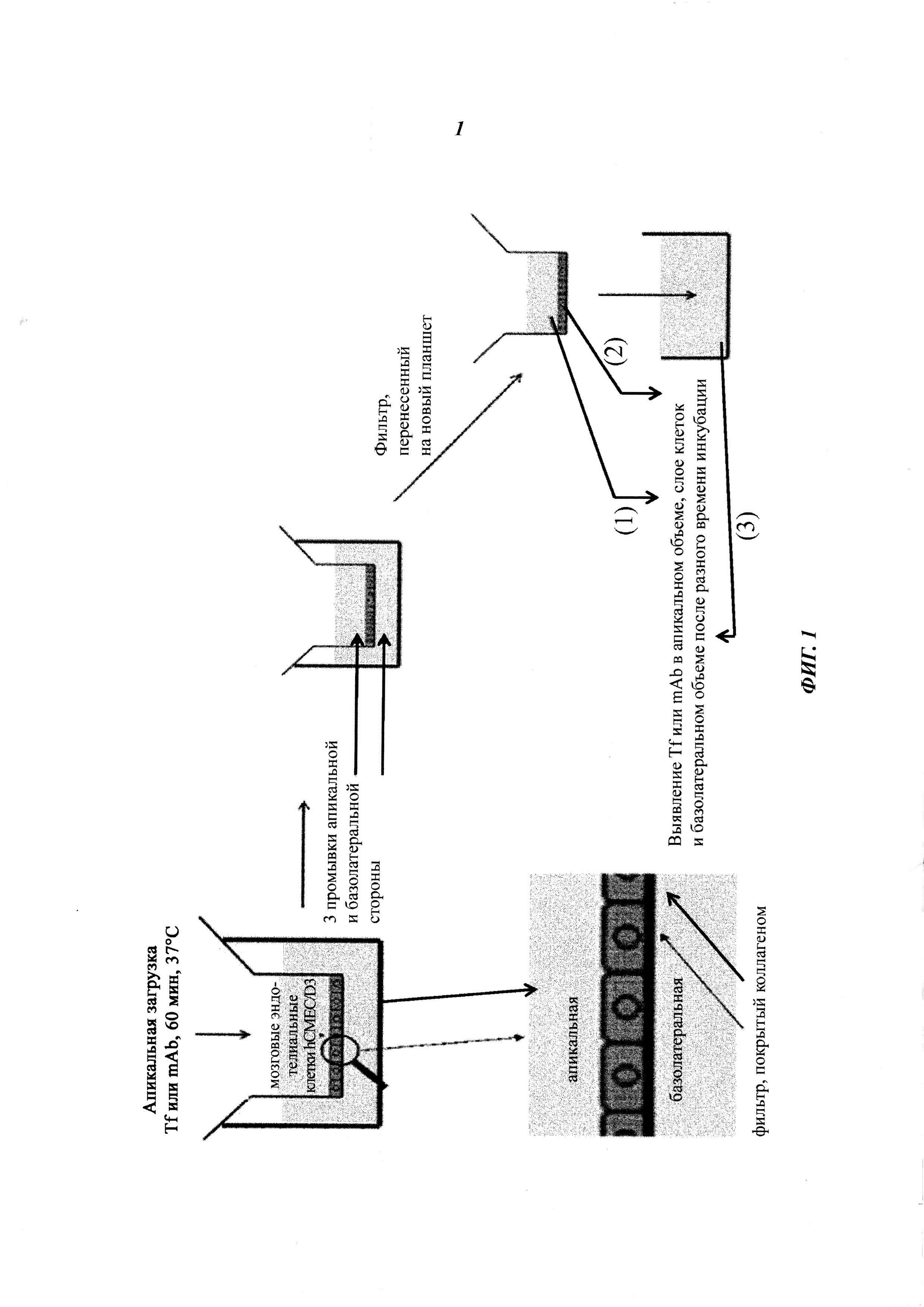
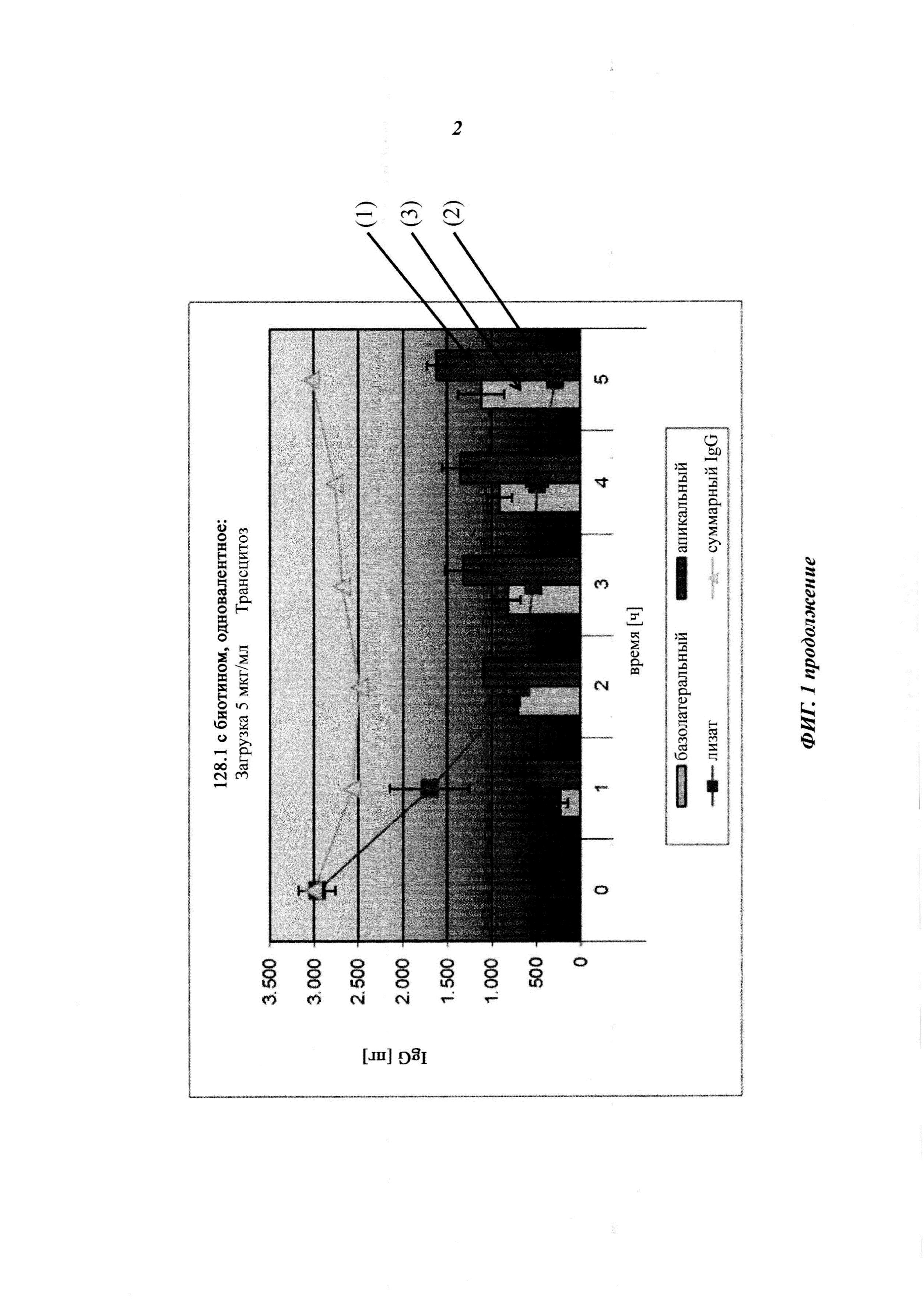
Фиг. 1: схема анализа трансцитоза.
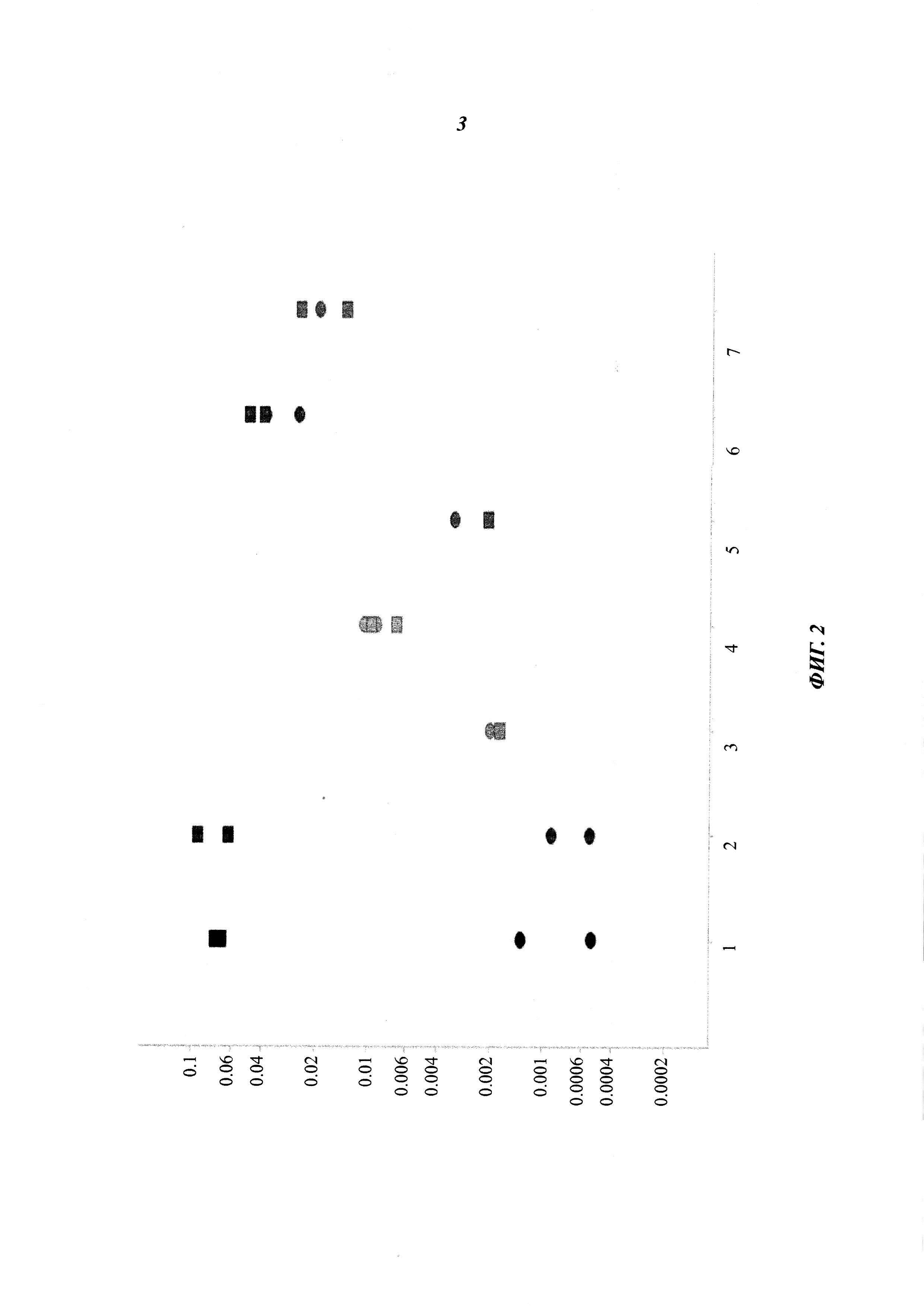
Фиг. 2: скорости диссоциации разных антител против трансферринового рецептора, определенные при 25°C с использованием BIAcore; 1: 128.1; 2: 128.1, слитое с антителом mAb86 против pTau; 3: 567; 4: 932; 5: 567, слитое с антителом mAb86 против pTau; 6: 1026; 7: 1027; квадраты: связывание с трансферриновым рецептором яванского макака; круг: связывание с человеческим трансферриновым рецептором; ордината: скорость диссоциации [1/с].
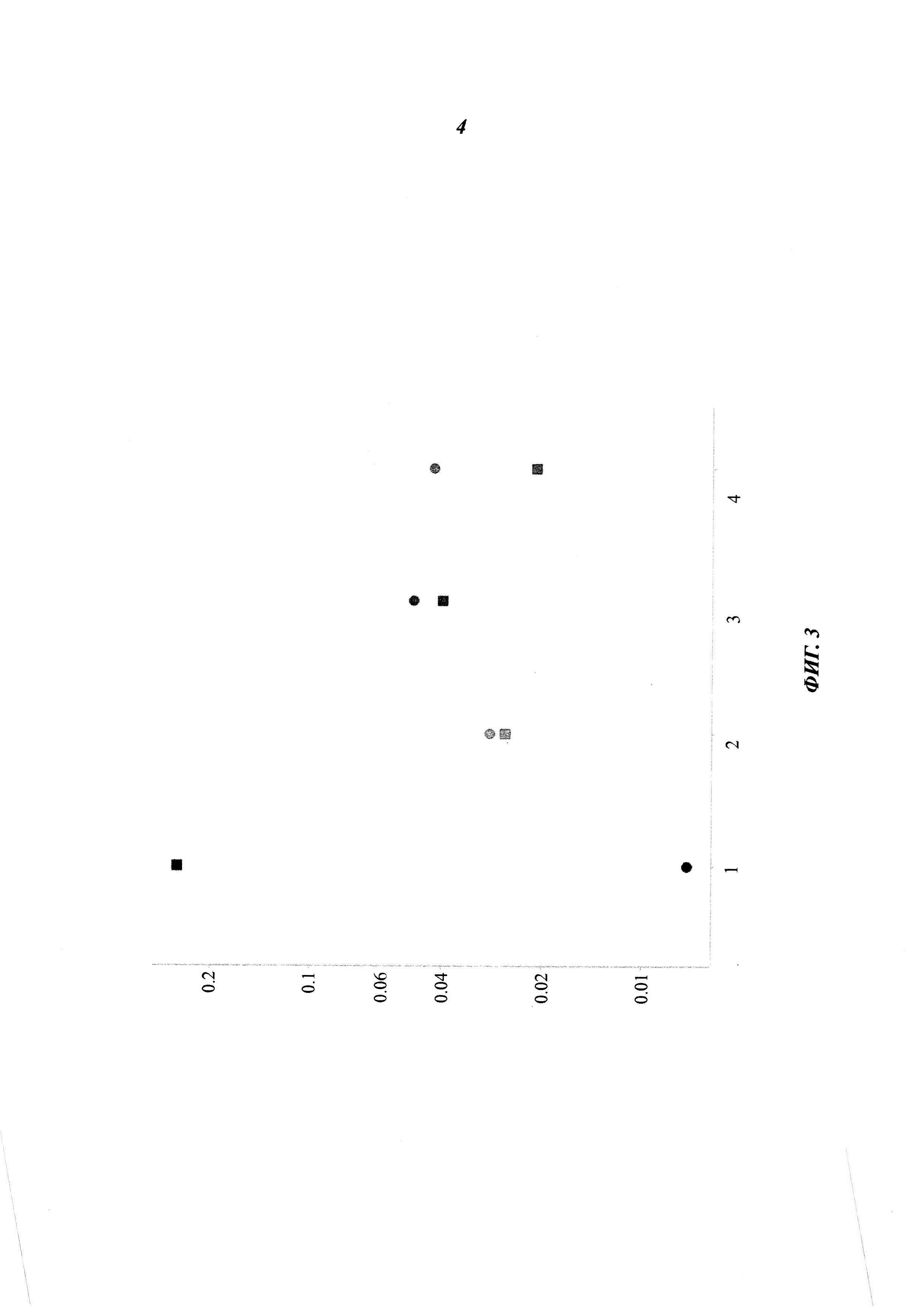
Фиг. 3: скорости диссоциации разных антител против трансферринового рецептора, определенные при 37°C с использованием BIAcore; 1: 128.1; 2: 932; 3: 1026; 4: 1027; квадраты: связывание с трансферриновым рецептором яванского макака; круг: связывание с человеческим трансферриновым рецептором; ордината: скорость диссоциации [1/с].
Подробное описание воплощений изобретения
В данном документе описан гуманизированный вариант кроличьего антитела 299, демонстрирующий сильный трансцитоз в анализе трансцитоза согласно Примеру 8, который имеет перекрестную реактивность в отношении трансферринового рецептора человека и яванского макака, т.е. специфично связывается с обоими ортологами трансферринового рецептора, который демонстрирует хорошее окрашивание клеток, и который имеет аналогичный период полувыведения (отражаемый скоростью диссоциации), что и мышиное антитело 128.1 в отношении трансферринового рецептора яванского макака и трансферринового рецептора человека.
Одним аспектом, как описано в данном документе, является гуманизированное антитело, которое специфично связывается с трансферриновым рецептором человека, где данное антитело содержит:
в вариабельном домене тяжелой цепи HVR (гипервариабельная область) SEQ ID NO 66, 68 и 72,
и
в вариабельном домене легкой цепи HVR SEQ ID NO 75, 76 и 78.
В одном воплощении гуманизированное антитело содержит вариабельный домен тяжелой цепи SEQ ID NO 24 и вариабельный домен легкой цепи SEQ ID NO 37.
В одном воплощении у гуманизированного антитела выключена эффекторная функция.
В одном воплощении гуманизированное антитело специфично связывается с трансферриновым рецептором человека и с трансферриновым рецептором яванского макака.
В одном воплощении гуманизированное антитело представляет собой:
а) полноразмерное антитело человеческого подкласса IgG1 или
б) полноразмерное антитело человеческого подкласса IgG4, или
в) полноразмерное антитело человеческого подкласса IgG1 с мутациями L234A, L235A и P329G,
г) полноразмерное антитело человеческого подкласса IgG4 с мутациями S228P, L235E и, возможно, P329G,
д) полноразмерное антитело человеческого подкласса IgG1 с мутациями L234A, L235A и P329G в обеих тяжелых цепях, и с мутациями T366W и S354C в одной тяжелой цепи и мутациями T366S, L368A, Y407V и Y349C в соответствующей другой тяжелой цепи, или
е) полноразмерное антитело человеческого подкласса IgG4 с мутациями S228P, L235E и, возможно, P329G в обеих тяжелых цепях, и с мутациями T366W и S354C в одной тяжелой цепи и мутациями T366S, L368A, Y407V и Y349C в соответствующей другой тяжелой цепи.
Одним аспектом, как описано в данном документе, является биспецифичное антитело, содержащее:
i) первый сайт связывания, содержащий вариабельный домен тяжелой цепи SEQ ID NO 24 и вариабельный домен легкой цепи SEQ ID NO 37,
и
ii) второй сайт связывания, выбранный из следующих:
а) вариабельный домен тяжелой цепи SEQ ID NO 81 и вариабельный домен легкой цепи SEQ ID NO 82, или
б) вариабельный домен тяжелой цепи SEQ ID NO 83 и вариабельный домен легкой цепи SEQ ID NO 84, или
в) вариабельный домен тяжелой цепи SEQ ID NO 85 и вариабельный домен легкой цепи SEQ ID NO 86, или
г) вариабельный домен тяжелой цепи SEQ ID NO 87 и вариабельный домен легкой цепи SEQ ID NO 88, или
д) вариабельный домен тяжелой цепи SEQ ID NO 91 и вариабельный домен легкой цепи SEQ ID NO 92, или
е) вариабельный домен тяжелой цепи SEQ ID NO 89 и вариабельный домен легкой цепи SEQ ID NO 90, или
ж) вариабельный домен тяжелой цепи SEQ ID NO 93 и вариабельный домен легкой цепи SEQ ID NO 94, или
з) вариабельный домен тяжелой цепи SEQ ID NO 79 и вариабельный домен легкой цепи SEQ ID NO 80.
Одним аспектом, как описано в данном документе, является фармацевтический препарат, содержащий антитело, как описано в данном документе, и, возможно, фармацевтически приемлемый носитель.
Одним аспектом, как описано в данном документе, является антитело, как описано в данном документе, для применения в качестве лекарственного средства.
Одним аспектом, как описано в данном документе, является антитело, как описано в данном документе, для применения в лечении неврологического расстройства.
Одним аспектом, как описано в данном документе, является применение антитела, как описано в данном документе, в изготовлении лекарственного средства.
Одним аспектом, как описано в данном документе, является способ лечения, включающий введение антитела, как описано в данном документе, для лечения неврологического расстройства.
I. Определения
Термин «акцепторная человеческая каркасная область» для целей данного документа представляет собой каркасную область, содержащую аминокислотную последовательность каркасной области вариабельного домена легкой цепи (VL) или каркасной области вариабельного домена тяжелой цепи (VH), происходящую из каркасной области человеческого иммуноглобулина или человеческой консенсусной каркасной области, как определено ниже. Акцепторная человеческая каркасная область, «происходящая из» каркасной области человеческого иммуноглобулина или человеческой консенсусной каркасной области, может содержать такую же аминокислотную последовательность, как и они, или она может содержать изменения аминокислотной последовательности. В некоторых воплощениях число изменений аминокислот составляет 10 или меньше, 9 или меньше, 8 или меньше, 7 или меньше, 6 или меньше, 5 или меньше, 4 или меньше, 3 или меньше, или 2 или меньше. В некоторых воплощениях акцепторная человеческая каркасная область VL является идентичной по последовательности последовательности каркасной области VL человеческого иммуноглобулина или последовательности человеческой консенсусной каркасной области.
Термин «аффинность» относится к силе общей суммы нековалентных взаимодействий между одним сайтом связывания молекулы (например, антитела) и ее партнером связывания (например, антигеном). Если не указано иное, термин «аффинность связывания» в том виде, в котором он используется в данном документе, относится к собственной аффинности связывания, которая отражает взаимодействие 1:1 между членами пары связывания (например, антителом и антигеном). Аффинность молекулы Х в отношении ее партнера Y обычно может быть представлена константой диссоциации (Kd). Аффинность может быть измерена обычными способами, известными в данной области, включающими способы, описанные в данном документе. Конкретные иллюстративные и типичные воплощения для измерения аффинности связывания описываются далее.
Термин антитело «с созревшей аффинностью» относится к антителу с одним или более чем одним изменением в одной или более чем одной гипервариабельной области (HVR) по сравнению с родительским антителом, которое не обладает такими изменениями, причем такие изменения приводят к улучшению аффинности антитела в отношении антигена.
Термин «антитело» используется в данном документе в самом широком смысле и охватывает разные структуры антител, включая моноклональные антитела, поликлональные антитела, мультиспецифичные антитела (например, биспецифичные антитела) и фрагменты антител, но не ограничиваясь ими, при условии, что они демонстрируют желательную активность связывания антигена.
Термин «фрагмент антитела» относится к молекуле, отличной от интактного антитела, которая содержит часть интактного антитела, которая связывается с антигеном, с которым связывается интактное антитело. Примеры фрагментов антитела включают Fv, Fab, Fab', Fab'-SH, F(ab')2; диатела; линейные антитела; одноцепочечные молекулы антител (например, scFv) и мультиспецифичные антитела, образованные из фрагментов антител, но не ограничиваются ими.
Термин «химерное» антитело относится к антителу, в котором часть тяжелой и/или легкой цепи происходит из конкретного источника или вида, тогда как остальная тяжелая и/или легкая цепь происходит из другого источника или вида.
«Класс» антитела относится к типу константного домена или константной области, которым обладает его тяжелая цепь. Существуют пять главных классов антител: IgA, IgD, IgE, IgG и IgM, и несколько из них могут дополнительно подразделяться на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют разным классам иммуноглобулинов, называются α, δ, ε, γ и μ соответственно.
Термин «эффекторные функции» относится к тем биологическим активностям, приписываемым области Fc антитела, которые варьируют в зависмости от класса антитела. Примеры эффекторных функций антитела включают: связывание с C1q и комплементзависимую цитотоксичность (CDC); связывание с рецептором Fc; антителозависимую клеточную цитотоксичность (ADCC); фагоцитоз; понижающую регуляцию рецепторов поверхности клетки (например, рецептора В-клеток) и активацию В-клеток.
«Эффективное количество» агента, например, фармацевтического препарата, относится к эффективному количеству в необходимых дозировках и в течение необходимых периодов времени для достижения желательного терапевтического или профилактического результата.
Термин «область Fc» используется в данном документе для определения С-концевой области тяжелой цепи иммуноглобулина, которая содержит по меньшей мере часть константной области. Данный термин включает области Fc с природной последовательностью и варианты области Fc. В одном воплощении область Fc тяжелой цепи человеческого IgG простирается от Cys226 или от Pro230 до карбоксильного конца тяжелой цепи. Однако С-концевой лизин (Lys447) области Fc может присутствовать или может отсутствовать. Если в данном документе не определено иначе, нумерация аминокислотных остатков в области Fc или в константной области осуществляется согласно системе нумерации EU, также именуемой индекс EU, как описано в Kabat, E.A. et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991), NIH Publication 91-3242.
«Каркасная область» или «FR» относится к остаткам вариабельного домена, отличным от остатков гипервариабельной области (HVR). FR вариабельного домена обычно состоит из четырех FR доменов: FR1, FR2, FR3 и FR4. Соответственно, последовательности HVR и FR обычно появляются в VH (или VL) в следующей последовательности: FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
Термины «полноразмерное антитело», «интактное антитело» и «полное антитело» используются в данном документе взаимозаменяемо для названия антитела, имеющего по существу аналогичную структуру структуре природного антитела, или имеющего тяжелые цепи, которые содержат область Fc, как определено в данном документе.
Термины «клетка-хозяин», «линия клеток-хозяев» и «культура клеток-хозяев» используются взаимозаменяемо и относятся к клеткам, в которые была введена экзогенная нуклеиновая кислота, включая потомство таких клеток. Клетки-хозяева включают «трансформантов» и «трансформированные клетки», которые включают первичные трансформированные клетки и потомство, полученное от них, независимо от числа пассажей. Потомство может не быть полностью идентичным родительской клетке по содержанию нуклеиновых кислот, но может содержать мутации. Сюда включено мутантное потомство, которое имеет такую же функцию или биологическую активность, на которую осуществляется скрининг или отбор у исходно трансформированной клетки.
«Человеческая консенсусная каркасная область» представляет собой каркасную область, которая представляет собой чаще всего встречающиеся аминокислотные остатки в наборе последовательностей каркасных областей VL или VH человеческого иммуноглобулина. В общем, набор последовательностей VL или VH человеческого иммуноглобулина происходит из подгруппы последовательностей вариабельного домена. Обычно данная подгруппа последовательностей представляет собой такую же подгруппу, что и в Kabat, E.A. et al., Sequences of Proteins of Immunological Interest, 5th ed., Bethesda MD (1991), NIH Publication 91-3242, Vols. 1-3. В одном воплощении для VL данной подгруппой является подгруппа каппа I, такая же, как и в Kabat et al., выше. В одном воплощении для VH данной подгруппой является подгруппа III, такая же, как и в Kabat et al., выше.
Термин «гуманизированное» антитело относится к химерному антителу, содержащему аминокислотные остатки из HVR, не являющихся человеческими, и аминокислотные остатки из человеческих FR. В некоторых воплощениях гуманизированное антитело будет содержать по существу все из по меньшей мере одного и типично двух вариабельных доменов, в которых все или по существу все из HVR (например, CDR (область, определяющая комплементарность)) соответствуют HVR антитела, не являющегося человеческим, и все или по существу все FR соответствуют FR человеческого антитела. Гуманизированное антитело возможно может содержать по меньшей мере часть константной области антитела, происходящей из человеческого антитела. Термин «гуманизированная форма» антитела, например, антитела, не являющегося человеческим, относится к антителу, которое подверглось гуманизации.
Термин «гипервариабельная область» или «HVR» в том виде, в котором он используется в данном документе, относится к каждой из областей вариабельного домена антитела, которые являются гипервариабельными по последовательности («области, определяющие комплементарность» или «CDR») и образуют структурно определенные петли («гипервариабельные петли»), и/или содержат остатки, контактирующие с антигеном («контакты с антигеном»). В общем, антитела содержат шесть HVR: три в VH (Н1, Н2, Н3) и три в VL (L1, L2, L3).
HVR в данном документе включают:
(а) гипервариабельные петли, находящиеся в аминокислотных остатках 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (Н1), 53-55 (Н2) и 96-101 (Н3) (Chothia, C. and Lesk, A.M., J. Mol. Biol. 196 (1987) 901-917);
(б) CDR, находящиеся в аминокислотных остатках 24-34 (L1), 50-56 (L2), 89-97 (L3), 31-35b (H1), 50-65 (Н2) и 95-102 (Н3) (Kabat, E.A. et al., Sequences of Proteins of Immunological Interest, 5th ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991), NIH Publication 91-3242);
(в) контакты с антигеном, находящиеся в аминокислотных остатках 27с-36 (L1), 46-55 (L2), 89-96 (L3), 30-35b (H1), 47-58 (Н2) и 93-101 (Н3) (MacCallum et al. J. Mol. Biol. 262: 732-745 (1996)); и
(г) комбинации (а), (б) и/или (в), включающие аминокислотные остатки HVR 46-56 (L2), 47-56 (L2), 48-56 (L2), 49-56 (L2), 26-35 (H1), 26-35b (H1), 49-65 (Н2), 93-102 (Н3) и 94-102 (Н3).
Если не указано иное, остатки HVR и другие остатки в вариабельном домене (например, остатки FR) нумеруются в данном документе согласно Kabat et al., выше.
«Индивид» или «субъект» представляет собой млекопитающее. Млекопитающие включают домашних животных (например, коров, овец, кошек, собак и лошадей), приматов (например, человека и приматов, не являющихся человеком, таких как обезьяны), кроликов и грызунов (например, мышей и крыс), но не ограничиваются ими. В некоторых воплощениях индивид или субъект представляет собой человека.
«Выделенное» антитело представляет собой антитело, которое было отделено от компонента его природного окружения. В некоторых воплощениях антитело очищают до чистоты, большей, чем 95% или 99% при определении, например, электрофоретическими (например, SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия), изоэлектрофокусировка (IEF), капиллярный электрофорез) или хроматографическими (например, ионообменная ВЭЖХ (высокоэффективная жидкостная хроматография) или ВЭЖХ с обращенной фазой) способами. Относительно обзора способов оценки чистоты антител, см., например, Flatman, S. et al., J. Chromatogr. В 848 (2007) 79-87.
Термин «выделенная» нуклеиновая кислота относится к молекуле нуклеиновой кислоты, которая была отделена от компонента ее природного окружения. Выделенная нуклеиновая кислота включает молекулу нуклеиновой кислоты, содержащуюся в клетках, которые обычно содержат данную молекулу нуклеиновой кислоты, но данная молекула нуклеиновой кислоты присутствует внехромосомно или в участке хромосомы, который отличается от ее природного хромосомного участка.
Термин «моноклональное антитело» в том виде, в котором он используется в данном документе, относится к антителу, полученному из популяции по существу гомогенных антител, т.е. индивидуальные антитела, составляющие популяцию, являются идентичными и/или связываются с тем же самым эпитопом, за исключением возможных вариантов антител, например, содержащих встречающиеся в природе мутации или возникающих во время получения препарата моноклонального антитела, причем такие варианты обычно присутствуют в минорных количествах. В отличие от препаратов поликлональных антител, которые типично включают разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело препарата моноклональных антител направлено против одной детерминанты на антигене. Таким образом, модификатор «моноклональный» указывает на характер антитела как полученного из по существу гомогенной популяции антител, и его не следует истолковывать как требующий продукции антитела каким-либо конкретным способом. Например, моноклональные антитела, подлежащие применению согласно настоящему избретению, можно получать целым рядом методик, включающих способ гибридомы, способы генной инженерии, способы фагового дисплея и способы с использованием трансгенных животных, содержащих все локусы человеческого иммуноглобулина или их часть, но не ограничивающихся ими, причем такие способы и другие типичные способы для получения моноклональных антител описываются в данном документе.
Термин «природные антитела» относится к встречающимся в природе молекулам иммуноглобулинов с варьирующими структурами. Например, природные антитела IgG представляют собой гетеротетрамерные гликопротеины с молекулярной массой примерно 150000 Дальтон, состоящие из двух идентичных легких цепей и двух идентичных тяжелых цепей, которые связаны дисульфидными связями. От N- до С-конца каждая тяжелая цепь имеет вариабельную область (VH), также именуемую вариабельный тяжелый домен или вариабельный домен тяжелой цепи, с последующими тремя константными доменами (СН1, СН2 и CH3). Аналогичным образом, от N- до С-конца каждая легкая цепь имеет вариабельную область (VL), также именуемую вариабельный легкий домен или вариабельный домен легкой цепи, с последующим константным легким доменом (CL). Легкая цепь антитела может быть приписана к одному из двух типов, именуемых каппа (κ) и лямбда (λ), на основе аминокислотной последовательности ее константного домена.
Термин «листок-вкладыш в упаковке» используется для названия инструкций, традиционно включаемых в имеющиеся в продаже упаковки терапевтических продуктов, которые содержат информацию о показаниях, применении, дозировке, введении, комбинированной терапии, противопоказаниях и/или предупреждениях, касающихся применения таких терапевтических продуктов.
«Процент (%) идентичности аминокислотной последовательности» по отношению к контрольной последовательности полипептида определяется как процентная доля аминокслотных остатков в последовательности-кандидате, которые являются идентичными аминокислотным остаткам в контрольной последовательности полипептида, после выравнивания данных последовательностей и, если необходимо, введения пробелов для достижения максимального процента идентичности последовательности, и не рассматривая любые консервативные замены как часть идентичности последовательности. Выравнивание для целей определения процента идентичности аминокислотной последовательности может достигаться разными способами, которые находятся в пределах квалификации в данной области, например, с использованием общедоступных компьютерных программ, таких как программы BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определять подходящие параметры для выравнивания последовательностей, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Для целей данного документа, однако, значения % идентичности аминокислотной последовательности получаются с использованием компьютерной программы сравнения последовательностей ALIGN-2. Авторство компьютерной программы сравнения последовательностей ALIGN-2 принадлежит Genentech, Inc., и исходный код с пользовательской документацией был подан в Бюро регистрации авторских прав США, Washington D.C., 20559, где он зарегестрирован под регистрационным № авторского права США TXU510087. Программа ALIGN-2 является общедоступной от Genentech, Inc., Южный Сан-Франциско, Калифорния, или может быть составлена из исходного кода. Программу ALIGN-2 следует составлять для применения в операционной системе UNIX, включая цифровую UNIX V4.0D. Все параметры сравнения последовательностей устанавливаются программой ALIGN-2 и не варьируют.
В ситуациях, когда ALIGN-2 применяется для сравнений аминокислотных последовательностей, % идентичности аминокислотной последовательности данной аминокислотной последовательности А с или относительно данной аминокислотной последовательности Б (что может быть альтернативно сформулировано как данная аминокислотная последовательность А, которая имеет или содержит определенный % идентичности аминокислотной последовательности с или относительно данной аминокислотной последовательности Б) рассчитывается следующим образом:
100 умножить на долю X/Y
где Х представляет собой число аминокислотных остатков, подсчитанных как идентичные совпадения, посредством программы выравнивания последовательностей ALIGN-2 в выравнивании А и Б данной программой, и где Y представляет собой общее число аминокислотных остатков в Б. Будет понятно то, что когда длина аминокислотной последовательности А не равна длине аминокислотной последовательности Б, % идентичности аминокислотной последовательности А с Б не будет равен % идентичности аминокислотной последовательности Б с А. Если конкретно не утверждается иное, все значения % идентичности аминокислотной последовательности, используемые в данном документе, как описано в непосредственно предшествующем абзаце, получены с использованием компьютерной программы ALIGN-2.
Термин «фармацевтический препарат» относится к препарату, который находится в такой форме, чтобы обеспечивать эффективную биологическую активность содержащегося в нем активного ингредиента, и который не содержит дополнительных компонентов, которые являются неприемлемо токсичными для субъекта, которому вводился бы препарат.
Термин «фармацевтически приемлемый носитель» относится к ингредиенту в фармацевтическом препарате, отличному от активного ингредиента, который является нетоксичным для субъекта. Фармацевтически приемлемый носитель включает буфер, эксципиент, стабилизатор или консервант, но не ограничивается ими.
Термин «лечение» (и его грамматические вариации, такие как «лечить» или «осуществление лечения») в том виде, в котором он используется в данном документе, относится к клиническому вмешательству в попытке изменить природный ход индивида, которого лечат, и оно может осуществляться либо для профилактики, либо по ходу клинической патологии. Желательные эффекты лечения включают предупреждение появления или рецидива заболевания, облегчение симптомов, уменьшение любых прямых или опосредованных патологических последствий заболевания, предупреждение метастазов, уменьшение скорости прогрессирования заболевания, уменьшение интенсивности или временное ослабление болезненного состояния и ремиссия или улучшенный прогноз, но не ограничиваются ими. В некоторых воплощениях антитела по изобретению используются для задержки развития заболевания или для замедления прогрессирования заболевания.
Термин «вариабельная область» или «вариабельный домен» относится к домену тяжелой или легкой цепи антитела, который участвует в связывании антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL соответственно) природного антитела обычно имеют аналогичные структуры, причем каждый домен содержит четыре консервативные каркасные области (FR) и три гипервариабельные области (HVR). (См., например, Kindt, T.J., et al. Kuby Immunology, 6th ed., W.H. Freeman and Co., N.Y. (2007), страница 91). Один домен VH или VL может быть достаточным для придания специфичности связывания с антигеном. Кроме того, антитела, которые связываются с конкретным антигеном, могут быть выделены с использованием домена VH или VL из антитела, которое связывается с антигеном, для скрининга библиотеки комплементарных доменов VL или VH соответственно. См., например, Portolano, S. et al., J. Immunol. 150 (1993) 880-887; Clackson, T. et al., Nature 352 (1991) 624-628). Нумерация аминокислотных остатков в вариабельной области (вариабельной области легкой цепи и тяжелой цепи) будет осуществляться согласно Kabat (Kabat, E.A. et al., Sequences of Proteins of Immunological Interest, 5th ed., Bethesda MD (1991), NIH Publication 91-3242, Vols. 1-3).
Термин «вектор» в том виде, в котором он используется в данном документе, относится к молекуле нуклеиновой кислоты, способной размножать другую нуклеиновую кислоту, с которой он связан. Данный термин включает вектор в качестве структуры самореплицирующейся нуклеиновой кислоты, а также вектор, включенный в геном клетки-хозяина, в которую он был введен. Определенные векторы способны управлять экспрессией нуклеиновых кислот, с которыми они связаны функциональным образом. Такие векторы называются в данном документе «экспрессионными векторами».
Термин «гематоэнцефалический барьер» (ГЭБ) обозначает физиологический барьер между периферическим кровообращением и мозгом и спинным мозгом, который образуется посредством плотных контактов в пределах плазматических мембран эндотелия капилляров мозга, создающих плотный барьер, который ограничивает транспорт молекул в мозг, даже очень маленьких молекул, таких как мочевина (60 Дальтон). ГЭБ в пределах мозга, гематоспинномозговой барьер в пределах спинного мозга и гематоретинальный барьер в пределах сетчатки представляют собой смежные капиллярные барьеры в пределах ЦНС, и в данном документе они совокупно называются гематоэнцефалический барьер или ГЭБ. ГЭБ также охватывает барьер между кровью и ЦСЖ (цереброспинальная жидкость) (хориоидное сплетение), где данный барьер состоит из эпендимных клеток, а не из эндотелиальных клеток капилляров.
Термин «центральная нервная система» (ЦНС) обозначает комплекс нервных тканей, который контролирует функции организма, и включает мозг и спинной мозг.
Термин «рецептор гематоэнцефалического барьера» (РГЭБ) обозначает внеклеточный мембраносвязанный рецепторный белок, экспрессируемый на эндотелиальных клетках мозга, который способен транспортировать молекулы через ГЭБ или использоваться для транспорта экзогенно введенных молекул. Примеры РГЭБ включают рецептор трансферрина (TfR), рецептор инсулина, рецептор инсулиноподобного фактора роста (IGF-R), рецепторы липопротеинов низкой плотности, включающие, без ограничения, белок 1, родственный рецептору липопротеинов низкой плотности (LRP1), белок 8, родственный рецептору липопротеинов низкой плотности (LRP8), и гепаринсвязывающий фактор роста, подобный эпидермальному фактору роста (HB-EGF), но не ограничиваются ими. Типичный РГЭБ представляет собой трансферриновый рецептор (TfR).
Термин «мозговое эффекторное соединение» обозначает молекулу, которая подлежит транспортировке в мозг через ГЭБ. Данное эффекторное соединение типично имеет характерную терапевтическую активность, которую желательно доставлять в мозг. Эффекторные соединения включают лекарственные средства против неврологических расстройств и цитотоксические агенты, такие как, например, полипептиды и антитела, в частности, моноклональные антитела или их фрагменты, направленные на мозговую мишень.
Термин «одновалентное связывающее соединение» обозначает молекулу, способную специфично связываться в режиме одновалентного связывания с РГЭБ. Гематоэнцефалический челночный модуль и/или конъюгат, как описано в данном документе, характеризуются присутствием одной единицы одновалентного связывающего соединения, т.е. гематоэнцефалический челночный модуль и/или конъюгат по настоящему изобретению содержит точно одну единицу одновалентного связывающего соединения. Одновалентное связывающее соединение включает полипептиды, полноразмерные антитела, фрагменты антител, включающие фрагменты Fab, Fab', Fv, молекулы одноцепочечных антител, такие как, например, одноцепочечные Fab, scFv, но не ограничивается ими. Одновалентное связывающее соединение, например, может представлять собой каркасный белок, сконструированный с использованием технологий современного уровня техники, подобных фаговому дисплею или иммунизации. Одновалентное связывающее соединение также может представлять собой полипептид. В некоторых воплощениях одновалентное связывающее соединение содержит домен Ig CH2-CH3 и одноцепочечный Fab (scFab), направленный на рецептор гематоэнцефалического барьера. scFab связан с С-концевым концом домена Ig CH2-CH3 посредством линкера. В некоторых воплощениях scFab направлен на трансферриновый рецептор.
Термин «режим одновалентного связывания» обозначает специфичное связывание с РГЭБ, где взаимодействие между одновалентным связывающим соединением и РГЭБ происходит через один одиночный эпитоп. Режим одновалентного связывания предотвращает любую димеризацию/мультимеризацию РГЭБ из-за одной точки взаимодействия с эпитопом. Режим одновалентного связывания предотвращает то, что изменяется внутриклеточная сортировка РГЭБ.
Термин «эпитоп» обозначает любую полипептидную детерминанту, способную к специфичному связыванию с антителом. В некоторых воплощениях эпитопные детерминанты включают химически активные поверхностные группировки молекул, таких как аминокислоты, боковые цепи сахаров, фосфорил или сульфонил, и, в некоторых воплощениях, могут иметь специфические трехмерные структурные характеристики и/или специфические характеристики заряда. Эпитоп представляет собой область антигена, с которой связывается антитело.
«Рецептор трансферрина» (TfR) представляет собой трансмембранный гликопротеин (с молекулярной массой примерно 180000 Да), который состоит из двух связанных дисульфидной связью субъединиц (каждая с кажущейся молекулярной массой примерно 90000 Да), и он участвует в поглощении железа у позвоночных. В одном воплощении TfR в данном документе представляет собой человеческий TfR, содержащий аминокислотную последовательность, как описано в Schneider et al. (Nature 311 (1984) 675-678).
Термин «визуализирующий агент» обозначает соединение, которое имеет одно или более чем одно свойство, которое обеспечивает выявление его присутствия и/или локализации прямо или опосредованно. Примеры таких визуализирующих агентов включают белки и низкомолекулярные соединения, включающие меченое соединение, которое обеспечивает выявление.
Термины «антиген ЦНС» и «мозговая мишень» обозначают антиген и/или молекулу, экспрессируемую в ЦНС, включая мозг, которые могут служить в качестве мишени для антитела или маленькой молекулы. Примеры такого антигена и/или молекулы включают, без ограничения: бета-секретазу 1 (ВАСЕ1), амилоид бета (Абета), рецептор эпидермального фактора роста (EGFR), человеческий рецептор 2 эпидермального фактора роста (HER2), Таu, аполипопротеин Е4 (АроЕ4), альфа-синуклеин, CD20, хантингтин, прионный белок (PrP), киназу 2 с повторами, обогащенными лейцином (LRRK2), паркин, пресенилин 1, пресенилин 2, гамма-секретазу, рецептор смерти 6 (DR6), белок-предшественник амилоида (АРР), рецептор нейротрофина (p75NTR), глюкоцереброзидазу и каспазу 6.
Термин «который специфично связывается» обозначает антитело, селективно или предпочтительно связывающееся с антигеном. Аффинность связывания обычно определяется с использованием стандартного анализа, такого как анализ Скэтчарда или методика поверхностного плазменного резонанса (например, с использованием BIACORE®).
Термин «соединение СН2-CH3 Ig» в том виде, в котором он используется в данном документе, относится к белковому соединению, происходящему из доменов СН2 или CH3 иммуноглобулина. «Соединение СН2-CH3 Ig» содержит два полипептида «СН2-CH3», образующих димер. Данный иммуноглобулин может представлять собой IgG, IgA, IgD, IgE или IgM. В одном воплощении соединение СН2-CH3 Ig было получено из иммуноглобулина IgG и называется в данном документе «соединение СН2-CH3 IgG». Данный термин включает природную последовательность доменов СН2-CH3 и варианты доменов СН2-CH3. В одном воплощении «соединение СН2-CH3 Ig» происходит из домена СН2-CH3 тяжелой цепи человеческого IgG, который простирается от Cys226 или от Pro230 до карбоксильного конца тяжелой цепи. Однако С-концевой лизин (Lys447) области Fc может присутствовать или может не присутствовать. Если в данном документе не определено иначе, нумерация аминокислотных остатков в области домена СН2-CH3 или константной области осуществляется согласно системе нумерации EU, также именуемой индекс EU, как описано в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
«Конъюгат» представляет собой слитый белок по настоящему изобретению, конъюгированный с одной или более чем одной гетерологичной молекулой, включающей метку, лекарственное средство против неврологического расстройства или цитотоксический агент, но не ограничивающейся ими.
Термин «линкер» обозначает химический линкер или одноцепочечный пептидный линкер, который ковалентно связывает разные соединения челночного модуля гематоэнцефалического барьера и/или слитый полипептид, и/или конъюгат, как описано в данном документе. Линкер, например, соединяет мозговое эффекторное соединение с одновалентным связывающим соединением. Например, если одновалентное связывающее соединение содержит соединение СН2-CH3 Ig и scFab, направленный на рецептор гематоэнцефалического барьера, тогда линкер конъюгирует scFab с С-концевым концом соединения СН2-CH3 Ig. Линкер, конъюгирующий мозговое эффекторное соединение с одновалентным связывающим соединением (первый линкер), и линкер, соединяющий scFab с С-концевым концом домена СН2-CH3 Ig (второй линкер), могут быть одинаковыми или разными.
Можно использовать одноцепочечные пептидные линкеры, содержащие от одного до двадцати аминокислотных остатков, связанных пептидными связями. В некоторых воплощениях аминокислоты выбраны из двадцати встречающихся в природе аминокислот. В некоторых других воплощениях одна или более чем одна аминокислота выбрана из глицина, аланина, пролина, аспарагина, глутамина и лизина. В других воплощениях линкер представляет собой химический линкер. В некоторых воплощениях линкер представляет собой одноцепочечный пептидный линкер с аминокислотной последовательностью с длиной по меньшей мере 25 аминокислотных остатков, в одном предпочтительном воплощении - с длиной от 32 до 50 аминокислотных остатков. В одном воплощении пептидный линкер представляет собой линкер (GxS)n с G - глицином, S - серином, (х равен 3, n равен 8, 9 или 10) или (х равен 4, n равен 6, 7 или 8), в одном воплощении с х, равным 4, n, равным 6 или 7, в одном предпочтительном воплощении с х, равным 4, n, равным 7. В одном воплощении линкер представляет собой (G4S)4 (SEQ ID NO 95). В одном воплощении линкер представляет собой (G4S)6G2 (SEQ ID NO 96).
Конъюгирование может проводиться с использованием целого ряда химических линкеров. Например, одновалентное связывающее соединение или слитый полипептид и мозговое эффекторное соединение могут быть конъюгированы с использованием целого ряда бифункциональных белковых связывающих агентов, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональных производных имидоэфиров (таких как диметиладипимидат HCl), активных сложных эфиров (таких как дисукцинимидилсуберат), альдегидов (таких как глутаральдегид), бис-азидосоединения (такие как бис-(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазониябензоил)-этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Линкер может представлять собой «расщепляемый линкер», облегчающий высвобождение эффекторного соединения при доставке в мозг. Например, могут использоваться кислотолабильный линкер, пептидазочувствительный линкер, фотолабильный линкер, диметильный линкер или дисульфидсодержащий линкер (Chari et al., Cancer Res. 52 (1992) 127-131; US 5208020).
Ковалентное конъюгирование может быть либо непосредственным, либо через линкер. В некоторых воплощениях непосредственное конъюгирование осуществляется путем конструирования полипептидного слияния (т.е. посредством генетического слияния двух генов, кодирующих одновалентное связывающее соединение в отношении РГЭБ и эффекторное соединение, и экспрессируемого в виде одного полипептида (полипептидной цепи)). В некоторых воплощениях непосредственное конъюгирование осуществляется путем образования ковалентной связи между реакционноспособной группой на одной из двух частей одновалентного связывающего соединения в отношении РГЭБ и соответствующей группой или акцептором на мозговом эффекторном соединении. В некоторых воплощениях непосредственное конъюгирование осуществляется путем модификации (т.е. генетической модификации) одной из двух молекул, подлежащих конъюгированию, для включения реакционноспособной группы (в качестве неограничивающих примеров сульфгидрильной группы или карбоксильной группы), которая образует ковалентное присоединение к другой молекуле, подлежащей конъюгированию при подходящих условиях. В качестве одного неограничивающего примера молекула (т.е. аминокислота) с желательной реакционноспособной группой (т.е. остатком цистеина) может быть введена, например, в одновалентное связывающее соединение к антителу против РГЭБ, и дисульфидная связь образуется с неврологическим лекарственным средством. Способы ковалентного конъюгирования нуклеиновых кислот с белками также известны в данной области (т.е. фотопоперечное связывание, см., например, Zatsepin et al. Russ. Chem. Rev. 74 (2005) 77-95). Конъюгирование также может осуществляться с использованием целого ряда линкеров. Например, одновалентное связывающее соединение и эффекторное соединение могут быть конъюгированы с использованием целого ряда бифункциональных белковых связывающих агентов, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис-(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазониябензоил)-этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные фторные соединения (такие как 1,5-дифтор-2,4-динитробензол). Также могут использоваться пептидные линкеры, содержащие от одного до двадцати аминокислотных остатков, связанных пепидными связями. В некоторых таких воплощениях аминокислотные остатки выбраны из двадцати встречающихся в природе аминокислот. В некоторых других таких воплощениях один или более чем один аминокислотный остаток выбран из глицина, аланина, пролина, аспарагина, глутамина и лизина. Линкер может представлять собой «расщепляемый линкер», облегчающий высвобождение эффекторного соединения при доставке в мозг. Например, могут использоваться кислотолабильный линкер, пептидазочувствительный линкер, фотолабильный линкер, диметильный линкер или дисульфидсодержащий линкер (Chari et al, Cancer Res. 52 (1992) 127-131; US 5208020).
II. Композиции и способы
Для описания молекулярных взаимодействий обычно используются равновесные константы диссоциации (KD). Она используется как мера силы взаимодействия (например, аффинности) двух молекул друг с другом. Таким образом, значение KD представляет собой меру силы двухмолекулярного взаимодействия.
Но значение KD, как таковое, не описывает кинетику молекулярного взаимодействия, т.е. из значения KD нельзя вывести, с одной стороны, как быстро две молекулы связываются друг с другом (константа скорости ассоциации или «скорость ассоциации») и, с другой стороны, как быстро молекулы диссоциируют (константа скорости диссоциации или «скорость диссоциации»). Характеристика бимолекулярных взаимодействий только по их значению KD пренебрегает тем фактом, что идентичное значение KD может быть составлено крайне разными (разные порядки значения) скоростей ассоциации и диссоциации, так как значение KD представляет собой их отношение.
Но скорости ассоциации и диссоциации являются важными для описания характеристик связывания молекул. Скорость диссоциации является особенно важной, так как она характеризует продолжительность связывания, например, антитела с его антигеном. Длительная скорость диссоциации коррелирует с медленной диссоциацией образовавшегося комплекса, тогда как короткая скорость диссоциации коррелирует с быстрой диссоциацией.
Для того чтобы иметь долговременное (т.е. требующее менее частого дозирования) или индивидуализированное (например, зависящее от окружающих условий) взаимодействие, скорости диссоциации должны быть определены экспериментально. Это даже более важно, так как практически невозможно прогнозировать скорость диссоциации. Кроме того, корреляция между скоростью диссоциации и аффинностью связывания является плохой, как описано выше. Например, из-за того, что значение KD является отношением скорости ассоциации и диссоциации, даже слабые связывающие агенты могут оставаться длительно связанными с их мишенями, тогда как сильные связывающие агенты могут быстро диссоциировать.
Типичным бутылочным горлышком в проектах получения антител является ранжирование многих кандидатов, полученных после пэннинга, на основе силы связывания антитела. В идеале, такой способ будет работать без предшествующего мечения антигенов и с неочищенными бактериальными лизатами. Ylera, F., et al. (Anal. Biochem. 441 (2013) 208-213) описали способ скрининга скорости диссоциации для отбора высокоаффинных антител против лекарственного средства неочищенных лизатов Escherichia coli, содержащих одновалентные фрагменты Fab. Они имеют выбранную скорость диссоциации в качестве параметра ранжирования, так как скорость диссоциации, среди других вещей, является зависимой от концентрации. Они выбрали одновалентный формат для избежания эффектов авидности во время ранжирования скорости диссоциации и определения аффинности в том виде, в котором они наблюдались бы с полноразмерным IgG. Ylera et al. обнаружили то, что клон с наилучшей скоростью диссоциации был идентифицирован посредством стадии ранжирования koff, но не был бы идентифицирован с использованием только силы сигнала ELISA в качестве критерия селекции.
Murray, J.B., et al. (J. Med. Chem. 57 (2014) 2845-2850) описали скрининг скорости диссоциации (ORS) посредством поверхностного плазмонного резонанса в качестве эффективного способа кинетического отбора наилучших образцов для ведущего химического пространства из неочищенных продуктов реакции. Описывается то, что константа скорости диссоциации - kd (скорость диссоциации) является компонентом связывания лиганд-белок с наиболее значимым потенциалом для увеличения эффективности соединения. Авторы действительно описывают то, что кинетическое измерение аффинности во всей программе открытия лекарственных средств является более информативным, чем равновесное определение аффинности в стационарном состоянии. Например, соединение с 10-кратно меньшей скоростью ассоциации и диссоциации не распознавалось бы как отличное при оценке посредством равновесных измерений аффинности. Кроме того, авторы обнаружили то, что данные, определенные с использованием прибора BIAcore T200, демонстрируют среднее различие kd между неочищенными и очищенными образцами 19%, аналогичным образом, данные, определенные с использованием более старого прибора BIAcore T100, имели 15% различие. Авторы наблюдают то, что kd отличаются в среднем только на 30% при сравнении между инструментами и во времени. Это демонстрирует то, что загрязнение следами предыдущего образца, долговременное хранение и отличающееся оборудование имеют умеренный эффект на наблюдаемые kd. В самом деле, эти маленькие отклонения kd близко отражают различия, наблюдаемые в исследованиях во многих лабораториях, где было описано то, что варьирование составляет от 14% до 40%, в зависимости от системы (Murray, J.B., et al., J. Med. Chem. 57 (2014) 2845-2850; Katsamba, P.S., et al., Anal. Biochem. 352 (2006)208-221).
В WO 2014/189973 описаны антитела против трансферринового рецептора и способы их применения. Дополнительно описано то, что нацеливание на рецептор ГЭБ традиционного специфичного высокоаффинного антитела обычно приводило к ограниченному увеличению транспорта через ГЭБ. Позднее обнаружили то, что величина поглощения антитела в и распределения в ЦНС обратно связана с его аффинностью связывания в отношении рецептора ГЭБ среди исследованных антител против ГЭБ. Например, малоаффинное антитело к трансферриновому рецептору (TfR), дозированное при терапевтических уровнях дозы, значительно увеличивает транспорт через ГЭБ и удерживание в ЦНС антитела против TfR относительно более высокоаффинного антитела против TfR и делает возможным более легкое достижение терапевтических концентраций в ЦНС (Atwal et al., Sci. Transl. Med. 3 (2011) 84ra43). Доказательства такого транспорта через ГЭБ добивались с использованием биспецифичного антитела, которое связывается и с TfR, и с расщепляющим ферментом белка-предшественника амилоида (АРР) - β-секретазой (ВАСЕ1). Одна системная доза биспецифичного антитела против TfR/BACE1, сконструированного с использованим низкоаффинного антитела, не только приводила к значимому поглощению антитела в мозг, но также кардинально уменьшала уровни мозгового Аβ1-40 по сравнению с одним моноспецифичным антителом против ВАСЕ1, свидетельствуя о том, что проникновение через ГЭБ влияет на эффективность антитела против ВАСЕ1 (Atwal et al., Sci. Transl. Med. 3 (2011) 84ra43; Yu et al., Sci. Transl. Med. 3 (2011) 84ra44).
Доступные данные и эксперименты подчеркивают несколько причинных механизмов, лежащих в основе возрастающего поглощения антитела в ЦНС с использованием подхода с менее аффинным антителом.
Во-первых, высокоаффинные антитела против рецептора ГЭБ (РГЭБ) (например, антитело против TfR из Atwal et al. и Yu et al., выше) ограничивают поглощение в мозг посредством быстрого насыщения РГЭБ в сосудистой системе мозга, таким образом, уменьшая общее количество антитела, поглощенного в мозг, и также ограничивая его распределение в сосудистой системе. Удивительно то, что уменьшение аффинности в отношении РГЭБ улучшает поглощение в мозг и распределение в мозге с надежным сдвигом, наблюдаемым в локализации от сосудистой системы к нейронам и ассоциированным нейропилям в пределах ЦНС. Обнаружили то, что аффинность должна быть ниже определенного верхнего уровня и выше определенного нижнего уровня.
Во-вторых, предполагается то, что меньшая аффинность антитела в отношении РГЭБ ухудшает способность антитела возвращаться на сосудистую сторону ГЭБ через РГЭБ со стороны ЦНС мембраны, так как общая аффинность антитела в отношении РГЭБ является низкой, и местная концентрация антитела на стороне ЦНС ГЭБ является ненасыщающей из-за быстрого рассеивания антитела в компартменте ЦНС.
В третьих, in vivo, и как наблюдалось для системы TfR, антитела с меньшей аффинностью в отношении РГЭБ не подвергаются клиренсу из системы также эффективно, как и антитела с большей аффинностью в отношении РГЭБ и, таким образом, остаются в более высоких концентрациях в системе кровообращения, чем их более высокоаффинные аналоги. Это имеет преимущество, так как уровни менее аффинного антитела в системе кровообращения поддерживаются на терапевтических уровнях в течение более длительного периода времени, чем более высокоаффинного антитела, что, следовательно, улучшает поглощение антитела в мозг в течение более длительного периода времени. Кроме того, это улучшение в площади под кривой концентрации относительно времени как в плазме, так и в мозгу может уменьшать частоту дозирования в клинике, что имело бы потенциальную пользу не только для соблюдения пациентом схемы и режима лечения, и удобства пациента, но также и в уменьшении любых потенциальных побочных эффектов или эффектов вне мишени антитела и/или терапевтического соединения, связанного с ним.
В этих предыдущих исследованиях использовались мышиные антитела, которые специфично связывались с мышиным TfR, но которые специфично не распознавали TfR примата или человека. Соответственно, в данном документе предложены антитела и их функциональные части, которые действительно специфично распознают и TfR примата, особенно яванского макака, и TfR человека для того, чтобы облегчать исследования безопасности и эффективности у приматов с использованием антител до терапевтического или диагностического применения у людей.
Тщательная неклиническая оценка безопасности моноклональных антител (mAb), предназначенных для терапевтического применения, является очень важной из-за возрастающей сложности аспектов инженерии антител и изменчивости, индуцированной разнообразием клеточных систем рекомбинантной продукции для получения антител. Кроме того, сложная структура, уникальные биологические функции и более продолжительные периоды полувыведения mAb по сравнению с традиционными низкомолекулярными лекарственными средствами усиливают факторы, которые необходимо учитывать в связи с безопасностью, помимо опасений из-за длительного клинического применения mAb для лечения хронических заболеваний (Lynch, C.M., et al., mAbs 1 (2009) 2-11; Kim, S.J., et al., Mol. Cells 20 (2005) 17-29).
Общей целью неклинических исследований в отношении mAb является определение токсикологических свойств рассматриваемого mAb и предоставление информации для разработки продукта. Главными целями неклинической оценки являются (1) идентификация органов-мишеней для токсичности и определение того, является ли токсичность обратимой после лечения, (2) идентификация безопасной исходной дозы для человеческих клинических испытаний Фазы I и последующих схем повышения дозы, (3) предоставление информации для отслеживания параметров безопасности в клинических испытаниях и (4) предоставление данных по безопасности для поддержки данных на этикетке продукта. Для того, чтобы достигнуть данных целей проводятся неклинические исследования как in vitro, так и in vivo, нацеленные на определение и понимание фармакологических свойств антитела (Lynch, C.M., et al., mAbs 1 (2009) 2-11; Cavagnaro, J.A., In: Cavagnaro, J.A. (Ed.) "Preclinical safety evaluation of biopharmaceuticals"; Hoboken, NJ: Wiley 2008; 45-65).
Для успешной неклинической оценки безопасности mAb следует выбирать наиболее релевантные виды животных для тестирования токсичности (Lynch, C.M., et al., mAbs 1 (2009) 2-11; Chapman, K., et al., Nat. Rev. Drug Discov. 6 (2007) 120-126). Релевантным видом является вид, в котором антитело является фармакологически активным, должен присутствовать или экспрессироваться антиген-мишень, и профиль тканевой перекрестной реактивности должен быть аналогичным профилю у человека (Lynch, C.M., et al., mAbs 1 (2009) 2-11; Chapman, K., et al., Nat. Rev. Drug Discov. 6 (2007) 120-126; Subramanyam, M. and Mertsching, E., In: Cavagnaro J.A. (Ed.); Preclinical safety evaluation of biopharmaceuticals. Hoboken, NJ: Wiley 2008; 181-205; Hall, W.C., et al., In: Cavagnaro, J.A. (Ed.); Preclinical safety evaluation of biopharmaceuticals. Hoboken, NJ: Wiley 2008; 207-240). С использованием иммунохимических или функциональных анализов могут быть идентифицированы релевантные виды животных, которые экспрессируют желательный эпитоп и демонстрируют профиль тканевой перекрестной реактивности, аналогичный человеческим тканям (Lynch, C.M., et al., mAbs 1 (2009) 2-11; Hall, W.C., et al., In: Cavagnaro, J.A. (Ed.); Preclinical safety evaluation of biopharmaceuticals. Hoboken, NJ: Wiley 2008; 207-240). Исследования перекрестной реактивности у видов, которые являются полезными в данном способе, включают иммуногистохимический обзор тканей из целого ряда видов с использованием имеющихся в продаже многовидовых тканевых микрочипов (Lynch, C.M., et al., mAbs 1 (2009) 2-11; Hall, W.C., et al., In: Cavagnaro, J.A. (Ed.); Preclinical safety evaluation of biopharmaceuticals. Hoboken, NJ: Wiley 2008; 207-240). В качестве альтернативы, оценка связывания антитела с клетками из данных животных посредством сортировки флюоресцентно-активированных клеток (FACS) типично является более чувствительной, чем иммуногистохимический анализ срезов тканей (Lynch, C.M., et al., mAbs 1 (2009) 2-11; Subramanyam, M. and Mertsching, E., In: Cavagnaro J.A. (Ed.); Preclinical safety evaluation of biopharmaceuticals. Hoboken, NJ: Wiley 2008; 181-205). Следует сравнивать среди видов последовательности ДНК и аминокислот антигена-мишени; следует определять гомологию между видами (Lynch, C.M., et al., mAbs 1 (2009) 2-11; Subramanyam, M. and Mertsching, E., In: Cavagnaro J.A. (Ed.); Preclinical safety evaluation of biopharmaceuticals. Hoboken, NJ: Wiley 2008; 181-205).
Кроме того, биораспределение, функция и структура антигена должны быть сравнимыми между релевантными видами животных и человеком для обеспечения оценки токсичности, возникающей в результате связывания антитела с антигеном-мишенью, которая называется токсичностью на мишени (Lynch, C.M., et al., mAbs 1 (2009) 2-11; 19, 20). Кроме того, сильные сходства в тканевом распределении антигена-мишени у видов животных и человека делают более вероятным то, что органы-мишени токсичности, идентифицированные у животных, будут прогнозировать потенциальные токсичности у человека. Недостаток сходства в тканевом распределении антигена между видами животных и человеком не исключает полностью виды животных для исследований токсичности, но данные различия должны быть приняты во внимание для оценки риска у человека. В том, что касается плотности или аффинности в отношении антигена, абсолютная эквивалентность между животной моделью и человеком аналогичным образом не требуется. Подтверждение релевантности видов, отобранных для тестирования токсичности, должно быть включено в документ для подачи в регулирующий орган. При использовании для оценки безопасности только одного вида, требуется краткое изложение экспериментов, которые демонстрируют отсутствие дополнительных релевантных видов (Lynch, C.M., et al., mAbs 1 (2009) 2-11).
Если монокпональное антитело, предназначенное для терапевтического применения, не имеет видовой перекрестной реактивности, следует использовать либо имитирующее антитело, либо другой вид в качестве модели. Таким образом, имитирующие антитела являются потенциальным решением в отношении возможного ограниченного тестирования безопасности с гуманизированными моноклональными антителами с ограниченной видовой перекрестной реактивностью. Однако в настоящее время нет определенных критериев, посредством которых следовало бы судить о потенциальном имитирующем антителе до его применения в определении вопросов безопасности в отношении клинического агента (Regulatory Toxicology and Pharmacology, том 40, номер 3, декабрь 2004, страницы 219-226).
Таким образом, для идентификации животной модели для конкретного mAb следует принять во внимание приведенные выше соображения. Но тем не менее, необходимо, чтобы рассматриваемое mAb имело перекрестную реактивность с антигеном-мишенью тестируемого вида. В противном случае, не могут использоваться даже самые подходящие тестируемые виды. Следовательно, имеется потребность в mAb, у которых нет внутривидовой перекрестной реактивности, но имеется межвидовая перекрестная реактивность в отношении их мишени у человека и вида, предназначенного для неклинических испытаний.
А. Типичные антитела против трансферрина
В данном документе описываются антитела против трансферринового рецептора, которые имеют скорость диссоциации в отношении связывания с человеческим трансферриновым рецептором, которая находится в пределах определенного интервала, для того чтобы обеспечивать надлежащий челночный перенос через ГЭБ. Обнаружили то, что данный интервал, с одной стороны, определяется скоростью диссоциации мышиного антитела 128.1 против трансферринового рецептора (аминокислотные последовательности вариабельного домена приводятся в SEQ ID NO 64 и 65), определенной поверхностным плазменным резонансом, в отношении трансферринового рецептора яванского макака, и, с другой стороны, 5% данной скорости диссоциации (т.е. в 20 раз более медленная диссоциация). В одном воплощении скорость диссоциации в отношении человеческого трансферринового рецептора составляет от 0,1 1/с до 0,005 1/с включительно.
Гуманизированные антитела клона 299, как описано в данном документе, не были доступными посредством применения стандартных методик гуманизации. В аминокислотную последовательность требовалось ввести нестандартные мутации для того, чтобы получить гуманизированное антитело со скоростями диссоциации в отношении трансферринового рецептора в пределах намеченного интервала от 0,1 1/с до 0,005 1/с включительно. Это особенно важно, поскольку антитела, как описано в данном документе, разрабатываются для перечечения человеческого гематоэнцефалического барьера для челночного переноса терапевтического груза в мозг.
Обнаружили то, что для получения подходящего и возможного для разработки гуманизированного антитела два аминокислотных остатка цистеина в легкой цепи родительского кроличьего антитела должны были быть заменены аминокислотным остатком пролина и аспарагина соответственно. Кроме того, для нахождения в пределах данного интервала скорости диссоциации, остаток серина, присутствующий в середине кроличьей CDRL3, должен быть заменен остатком аланина.
Дополнительно было обнаружено то, что полезно изменять аминокислотные остатки в тяжелой цепи в положениях 65, 100g и 105 (нумерация согласно Kabat).
Вся нумерация в том виде, в котором она используется в данном документе, основывается на схеме нумерации вариабельного домена Kabat.
Клон 299 кроличьего антитела против трансферрина демонстрировал сравнимые свойства со свойствами антитела 128.1 против трсферринового рецептора. Это можно видеть из следующей Таблицы.
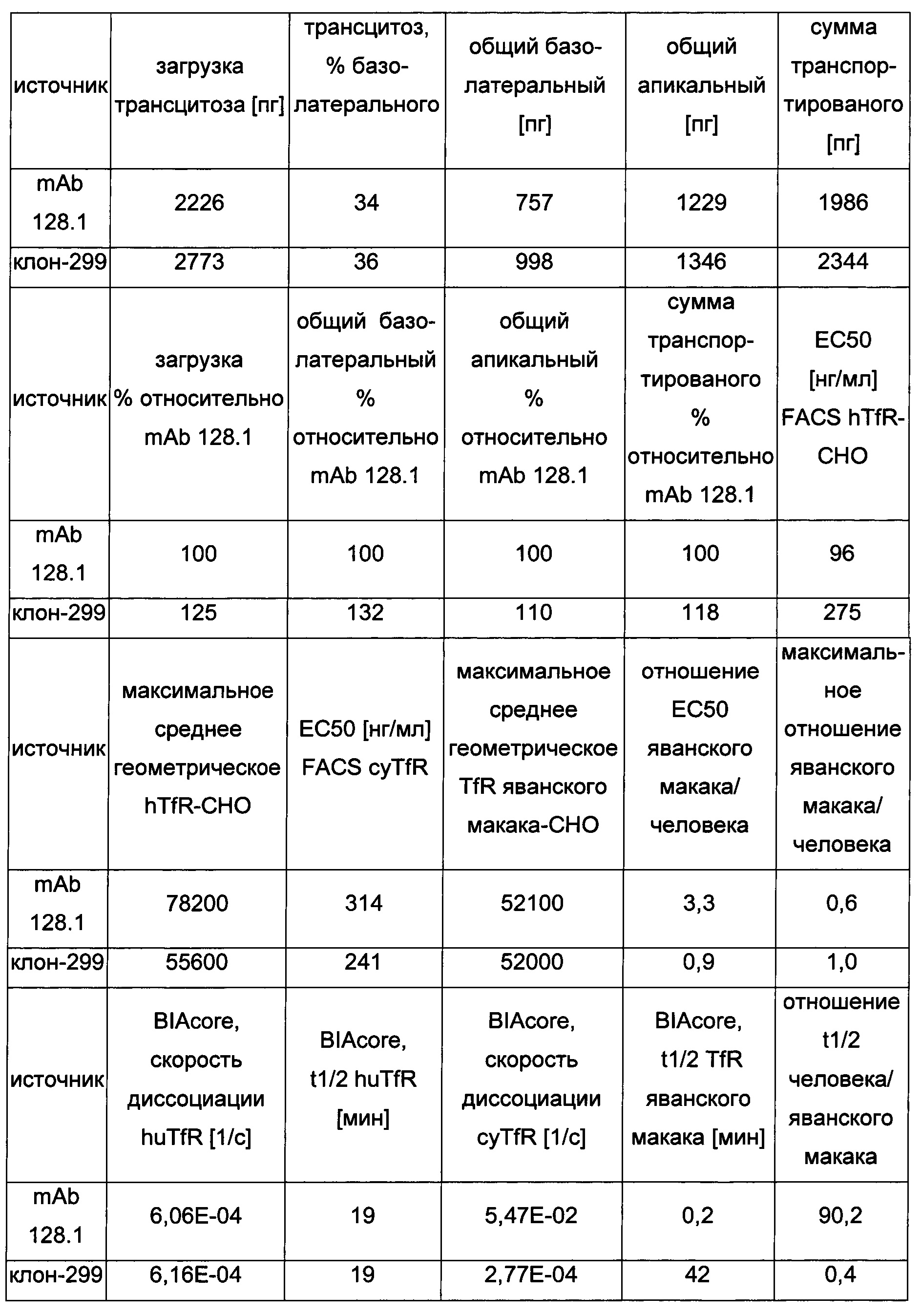
В следующей Таблице показаны скорости диссоциации гуманизированных вариантов вариабельного домена кроличьей легкой цепи клона 299 в комбинации с гуманизированными вариантами вариабельного домена кроличьей тяжелой цепи клона 299. Партнером связывания (определяется при 25°С) был человеческий трансферриновый рецептор.
Комбинация VH23 с VL9 была выбрана в качестве исходной точки для дальнейшего конструирования для разработки сайта связывания, который более близко отражает свойства связывания антитела 128.1 с трансферриновым рецептором яванского макака, по отношению к связыванию с человеческим трансферриновым рецептором.
В следующей Таблице для сравнения показаны скорости диссоциации разных типичных вариантов VH23 и VL9, а также разных других гуманизированных вариантов вариабельного домена в отношении человеческого трансферринового рцептора (определенные согласно Примеру 14, 25°С).
контроль: 128.1 - 7,78Е-02 (определено для трансферринового рецептора яванского макака).
В следующей Таблице для сравнения показаны кинетические данные разных типичных вариантов VH23 и VL9 (определенные согласно Примеру 13).
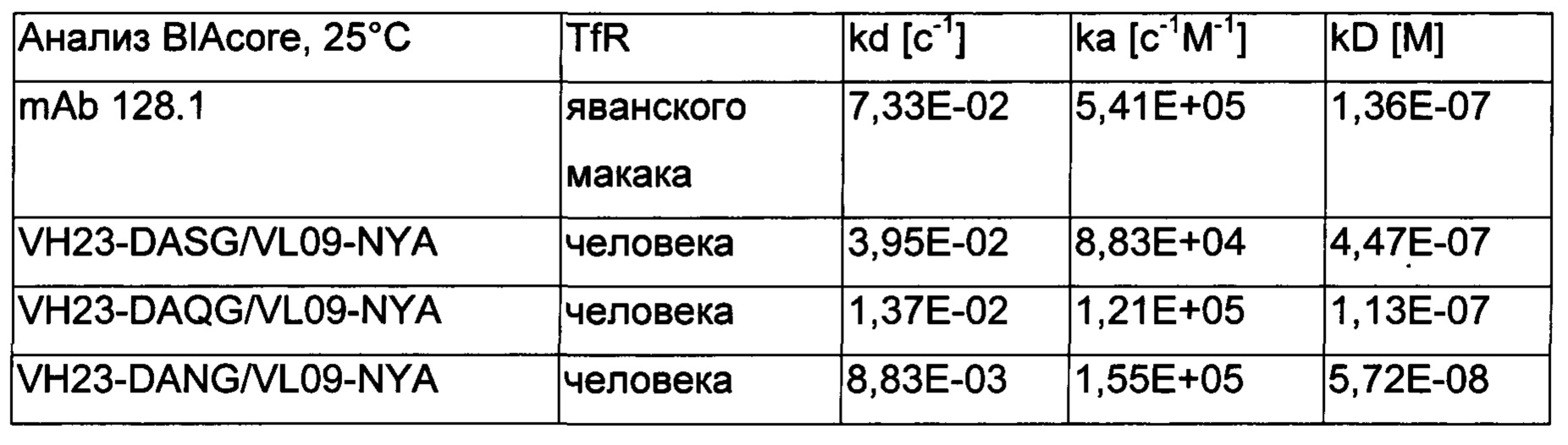
В следующей Таблице показаны скорости диссоциации гуманизированных вариантов вариабельного домена мышиной легкой цепи клона 494 в комбинации с гуманизированными вариантами вариабельного домена мышиной тяжелой цепи клона 494. Партнером связывания был человеческий трансферриновый рецептор.
Более подробно, в одном аспекте данное изобретение отчасти основано на данных о том, что антитело против трансферринового рецептора, как описано в данном документе, может быть использовано в качестве челночного модуля гематоэнцефалического барьера для доставки мозгового эффекторного соединения через гематоэнцефалический барьер в мозг. В некоторых воплощениях челночный модуль гематоэнцефалического барьера представляет собой одновалентное связывающее соединение, которое специфично связывается с трансферриновым рецептором. Антитела против трансферринового рецептора, как описано в данном документе, при использовании в качестве челночного модуля гематоэнцефалического барьера, являются полезными, например, для диагностики или лечения неврологических расстройств, таких как болезнь Альцгеймера, болезнь Паркинсона и совместное заболевание болезнью Альцгеймера с болезнью Паркинсона.
Обнаружили то, что антитело, содержащее вариабельный домен тяжелой цепи SEQ ID NO 24 и вариабельный домен легкой цепи SEQ ID NO 37, отражает по отношению к человеческому трансферриновому рецептору свойства связывания мышиного антитела 128.1 в отношении трансферринового рецептора яванского макака в том, что касается скорости диссоциации связывания.
Соответственно, один аспект, как описано в данном документе, представляет собой выделенное антитело, которое связывается с человеческим трансферриновым рецептором (huTfR) и трансферриновым рецептором яванского макака (cyTfR), где данное антитело имеет определенную поверхностным плазменным резонансом скорость диссоциации в отношении человеческого трансферринового рецептора от 0,1 1/с до 0,005 1/с.
Другим аспектом, как описано в данном документе, является применение антитела или фрагмента антитела, которое связывается с человеческим трансферриновым рецептором (huTfR) и трансферриновым рецептором яванского макака (cyTfR), где данное антитело имеет определенную поверхностным плазменным резонансом скорость диссоциации в отношении человеческого трансферринового рецептора от 0,1 1/с до 0,005 1/с, для доставки терапевтического соединения через гематоэнцефалический барьер.
В одном воплощении скорость диссоциации определяется при 500; 250; 125; 62,5; 31,25; 15,625 и 0 нМ.
В одном воплощении скорость диссоциации определяется с использованием чипа поверхностного плазмонного резонанса с биотиновой поверхностью и подвижным буфером 1× PBS (фосфатно-солевой буферный раствор), дополненным 250 мМ хлоридом натрия, при скорости тока 10 мкл/мин.
В одном воплощении ассоциация отслеживается в течение 180 секунд, и диссоциация отслеживается в течение 600 секунд.
В одном воплощении скорость диссоциации определяется на BIAcore T200.
В одном воплощении скорость диссоциации составляет от 0,08 1/с до 0,008 1/с.
В одном воплощении всех аспектов скорость диссоциации определяется при 25°С.
В одном воплощении всех аспектов скорость диссоциации представляет собой скорость диссоциации, определенную при 25°С.
Одним аспектом, как описано в данном документе, является антитело против трансферринового рецептора, которое специфично связывается с человеческим трансферриновым рецептором (huTfR) и трансферриновым рецептором яванского макака (cyTfR), которое содержит: i) гуманизированный вариабельный домен тяжелой цепи, полученный из вариабельного домена тяжелой цепи SEQ ID NO 1, и ii) гуманизированный вариабельный домен легкой цепи, полученный из вариабельного домена легкой цепи SEQ ID NO 26, где вариабельный домен легкой цепи имеет в положении 80 аминокислотный остаток пролина (Р), в положении 91 аминокислотный остаток аспарагина (N) и в положении 93 аминокислотный остаток аланина (А) (нумерация согласно Kabat).
В одном воплощении данное антитело дополнительно имеет в вариабельном домене тяжелой цепи в положении 100g аминокислотный остаток серина (S) (нумерация согласно Kabat).
В одном воплощении данное антитело дополнительно имеет в вариабельном домене тяжелой цепи в положении 65 аминокислотный остаток серина (S) (нумерация согласно Kabat).
В одном воплощении данное антитело дополнительно имеет в вариабельном домене тяжелой цепи в положении 105 аминокислотный остаток глутамина (Q) (нумерация согласно Kabat).
Одним аспектом, как описано в данном документе, является антитело против трансферринового рецептора, которое специфично связывается с человеческим трансферриновым рецептором (huTfR) и трансферриновым рецептором яванского макака (cyTfR), которое содержит: i) гуманизированный вариабельный домен тяжелой цепи, полученный из вариабельного домена тяжелой цепи SEQ ID NO 1, и ii) гуманизированный вариабельный домен легкой цепи, полученный из вариабельного домена легкой цепи SEQ ID NO 26, где данное антитело имеет скорость диссоциации в отношении человеческого трансферринового рецептора в единицах 1/с, которая равна или меньше, чем (т.е. самое большее составляет) скорость диссоциации антитела 128.1 против трансферринового рецептора в единицах 1/с в отношении трансферринового рецептора яванского макака, при этом скорости диссоциации определяются поверхностным плазменным резонансом, и при этом антитело 128.1 против трансферринового рецептора имеет вариабельный домен тяжелой цепи SEQ ID NO 64 и вариабельный домен легкой цепи SEQ ID NO 65.
В одном воплощении данное антитело имеет скорость диссоциации в отношении человеческого трансферринового рецептора в единицах 1/с, которая i) равна или меньше, чем (т.е. самое большее составляет) скорость диссоциации в единицах 1/с антитела 128.1 против трансферринового рецептора в отношении трансферринового рецептора яванского макака, ii) равна или больше, чем (т.е. по меньшей мере составляет) 5% скорости диссоциации в единицах 1/с антитела 128.1 против трансферринового рецептора в отношении трансферринового рецептора яванского макака.
Одним аспектом, как описано в данном документе, является антитело против трансферринового рецептора, которое специфично связывается с человеческим трансферриновым рецептором (huTfR) и трансферриновым рецептором яванского макака (cyTfR). В некоторых воплощениях антитело против трансферринового рецептора
- связывается с человеческим трансферриновым рецептором (huTfR) и трансферриновым рецептором яванского макака (cyTfR);
- имеет скорость диссоциации в отношении человеческого трансферринового рецептора в единицах 1/с, которая равна или меньше, чем (т.е. самое большее составляет) скорость диссоциации антитела 128.1 против трансферринового рецептора в отношении трансферринового рецептора яванского макака, при этом скорости диссоциации определяются поверхностным плазменным резонансом, и при этом антитело 128.1 против трансферринового рецептора имеет вариабельный домен тяжелой цепи SEQ ID NO 64 и вариабельный домен легкой цепи SEQ ID NO 65;
- связывается с человеческим трансферриновым рецептором со скоростью диссоциации, которая составляет от 0,1 1/с до 0,005 1/с включительно.
В одном аспекте в данном документе предложено антитело против трансферринового рецептора, содержащее по меньшей мере одну, две, три, четыре, пять или шесть HVR, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO 66; (б) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO 68; (в) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO 71, 72 или 73; (г) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO 75; (д) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO 76; и (е) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO 78.
В одном аспекте согласно данному изобретению предложено антитело, содержащее по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (а) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO 66; (б) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO 68; и (в) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO 71 или 72, или 73. В одном аспекте согласно данному изобретению предложено антитело, содержащее по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (а) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO 66; (б) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO 68; и (в) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO 72. В одном аспекте согласно данному изобретению предложено антитело, содержащее по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO 66; (б) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO 68; и (в) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO 73. В одном воплощении антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO 71 или 72, или 73. В другом воплощении антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO 71 или 72, или 73, и HVR-L3, содержащую аминокислотную последовательность SEQ ID NO 78. В другом воплощении антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO 71 или 72, или 73, HVR-L3, содержащую аминокислотную последовательность SEQ ID NO 78, и HVR-H2, содержащую аминокислотную последовательность SEQ ID NO 68. В другом воплощении антитело содержит (а) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO 66; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO 68; и (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO 72.
В другом аспекте согласно данному изобретению предложено антитело, содержащее по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO 75; (б) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO 76; и (в) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO 78. В одном воплощении антитело содержит (а) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO 75; (б) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO 76; и (в) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO 78.
В другом аспекте антитело по изобретению содержит (а) домен VH, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (i) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO 66; (ii) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO 68; и (iii) HVR-H3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO 71 или 72, или 73; и (б) домен VL, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (i) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO 75; (ii) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO 76; и (в) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO 78.
В другом аспекте согласно изобретению предложено антитело, содержащее (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO 66; (б) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO 68; (в) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO 72; (г) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO 75; (д) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO 76; и (е) HVR-L3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO 78.
В любом из приведенных выше воплощений антитело против трансферринового рецептора является гуманизированным. В одном воплощении антитело против трансферринового рецептора содержит такие же HVR, как и в любом из приведенных выше воплощений, и дополнительно содержит акцепторную человеческую каркасную область, например, каркасную область человеческого иммуноглобулина или человеческую консенсусную каркасную область.
В другом аспекте антитело против трансферринового рецептора содержит последовательность вариабельного домена (VH) тяжелой цепи, имеющую по меньшей мере 90%-ную, 91%-ную, 92%-ную, 93%-ную, 94%-ную, 95%-ную, 96%-ную, 97%-ную, 98%-ную, 99%-ную или 100%-ную идентичность последовательности с аминокислотной последовательностью SEQ ID NO 24 и имеющую примерно такую же скорость диссоциации, что и антитело, содержащее последовательность вариабельного домена тяжелой цепи (VH) SEQ ID NO 24. В некоторых воплощениях последовательность VH, имеющая по меньшей мере 90%-ную, 91%-ную, 92%-ную, 93%-ную, 94%-ную, 95%-ную, 96%-ную, 97%-ную, 98%-ную или 99%-ную идентичность, содержит замены (например, консервативные замены), вставки или делеции относительно эталонной последовательности, но антитело против трансферринового рецептора, содержащее данную последовательность, сохраняет способность связываться с трансферриновым рецептором с такой же скоростью диссоциации. В некоторых воплощениях в SEQ ID NO 24 всего было заменено, вставлено и/или подвергнуто делеции от 1 до 10 аминокислот. В некоторых воплощениях замены, вставки или делеции происходят в областях вне HVR (т.е. в FR). Возможно антитело против трансферринового рецептора содержит последовательность VH SEQ ID NO 24, включающую посттрансляционные модификации данной последовательности. В конкретном воплощении данная VH содержит одну, две или три HVR, выбранных из: (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO 66; (б) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO 68; и (в) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO 72.
В другом аспекте предложено антитело против трансферринового рецептора, где данное антитело содержит вариабельный домен легкой цепи (VL), имеющий по меньшей мере 90%-ную, 91%-ную, 92%-ную, 93%-ную, 94%-ную, 95%-ную, 96%-ную, 97%-ную, 98%-ную, 99%-ную или 100%-ную идентичность последовательности с аминокислотной последовательностью SEQ ID NO 37, и имеющий примерно такую же скорость диссоциации, что и антитело, содержащее последовательность вариабельного домена легкой цепи (VL) SEQ ID NO 37. В некоторых воплощениях последовательность VL, имеющая по меньшей мере 90%-ную, 91%-ную, 92%-ную, 93%-ную, 94%-ную, 95%-ную, 96%-ную, 97%-ную, 98%-ную или 99%-ную идентичность, содержит замены (например, консервативные замены), вставки или делеции относительно эталонной последовательности, но антитело против трансферринового рецептора, содержащее данную последовательность, сохраняет способность связываться с трансферриновым рецептором с такой же скоростью диссоциации. В некоторых воплощениях в SEQ ID NO 37 всего было заменено, вставлено и/или подвергнуто делеции от 1 до 10 аминокислот. В некоторых воплощениях замены, вставки или делеции происходят в областях вне HVR (т.е. в FR). Возможно антитело против трансферринового рецептора содержит в SEQ ID NO 37 последовательность VL, включающую посттрансляционные модификации данной последовательности. В конкретном воплощении данная VL содержит одну, две или три HVR, выбранных из: (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO 75; (б) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO 76; и (в) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO 78.
В другом аспекте предложено антитело против трансферринового рецептора, где данное антитело содержит такой же VH, как и в любых из воплощений, предложенных выше, и такой же VL, как и в любых из воплощений, предложенных выше. В одном воплощении антитело содержит последовательности VH и VL в SEQ ID NO 24 и SEQ ID NO 37 соответственно, включающие посттрансляционные модификации данных последовательностей.
В другом аспекте изобретения антитело против трансферринового рецептора согласно любому из приведенных выше воплощений представляет собой моноклональное антитело, включающее химерное, гуманизированное или человеческое антитело. В одном воплощении антитело против трансферринового рецептора представляет собой фрагмент антитела, например, фрагмент Fv, Fab, Fab', scFv, диатело или F(ab')2. В другом воплощении данное антитело представляет собой полноразмерное антитело, например, интактное антитело IgG1 или другой класс, или изотип антитела, как определено в данном документе.
В одном воплощении всех аспектов антитело связано с терапевтическим соединением.
В другом воплощении всех аспектов антитело связано с визуализирующим агентом или с меткой.
В другом воплощении антитело представляет собой мультиспецифичное антитело, и терапевтическое соединение, возможно, образует одну часть мультиспецифичного антитела. В одном таком воплощении мультиспецифичное антитело содержит первый антигенсвязывающий сайт, который связывается с TfR, и второй антигенсвязывающий сайт, который связывается с мозговым антигеном. В одном таком аспекте мозговой антиген выбран из группы, состоящей из следующих: бета-секретаза 1 (ВАСЕ1), Абета, рецептор эпидермального фактора роста (EGFR), рецептор 2 человеческого эпидермального фактора роста (HER2), тау, аполипопротеин Е (АроЕ), альфа-синуклеин, CD20, хантингтин, прионовый белок (PrP), киназа 2 с лейцинбогатыми повторами (LRRK2), паркин, пресенилин 1, пресенилин 2, гамма секретаза, рецептор смерти 6 (DR6), белок-предшественник амилоида (АРР), рецептор нейротрофина р75 (p75NTR), глюкоцереброзидаза и каспаза 6. В другом воплощении мультиспецифичное антитело связывается и с TfR, и с ВАСЕ1. В другом воплощении мультиспецифичное антитело связывается и с TfR, и с Абета. В другом воплощении мультиспецифичное антитело связывается и с TfR, и с альфа-синуклеином. В другом воплощении мультиспецифичное антитело связывается и с TfR, и с CD20. В другом воплощении мультиспецифичное антитело связывается и с TfR, и с глюкоцереброзидазой. В другом воплощении терапевтическое соединение представляет собой лекарственное средство против неврологического расстройства.
В одном аспекте приведенного выше воплощения согласно изобретению предложен фармацевтический препарат, содержащий любое из вышеупомянутых антител и фармацевтически приемлемый носитель.
В одном аспекте приведенного выше воплощения согласно изобретению предложено любое из вышеупомянутых антител для применения в качестве лекарственного средства.
В другом аспекте приведенного выше воплощения согласно изобретению предложено применение любого из вышеупомянутых антител в изготовлении лекарственного средства для лечения неврологического расстройства. В одном воплощении данное неврологическое расстройство выбрано из группы, состоящей из невропатического расстройства, нейродегенеративного заболевания, рака, расстройства, связанного с глазным заболеванием, эпилепсии, лизосомной болезни накопления, амилоидоза, вирусного или микробного заболевания, ишемии, расстройства поведения и воспаления ЦНС.
В другом аспекте приведенного выше воплощения согласно изобретению предложено любое из вышеупомянутых антител для применения в лечении неврологического расстройства. В одном воплощении данное неврологическое расстройство выбрано из группы, состоящей из невропатического расстройства, нейродегенеративного заболевания, рака, расстройства, связанного с глазным заболеванием, эпилепсии, лизосомной болезни накопления, амилоидоза, вирусного или микробного заболевания, ишемии, расстройства поведения и воспаления ЦНС.
В другом аспекте приведенного выше воплощения согласно изобретению предложено любое из вышеупомянутых антител для применения в транспортировке одного или более чем одного соединения через ГЭБ.
В другом аспекте приведенного выше воплощения предложено применение любого из вышеупомянутых антител в изготовлении лекарственного средства для транспортировки одного или более чем одного соединения через ГЭБ.
В одном аспекте приведенного выше воплощения предложен способ транспортировки соединения через ГЭБ у субъекта, включающий экспонирование любого из вышеупомянутых антител ГЭБ таким образом, что антитело транспортирует связанное с ним соединение через ГЭБ. В одном воплощении ГЭБ находится у человеческого субъекта. В одном воплощении вводится антитело, связанное с соединением, в терапевтической дозе. В одном воплощении данная терапевтическая доза является насыщающей TfR. В другом воплощении введение антитела осуществляется в дозе и/или частота дозирования калибруется для минимизации острых клинических симптомов введения антитела.
В другом аспекте приведенного выше воплощения предложен способ увеличения экспонирования ЦНС субъекта соединению, включающий экспонирование любого из вышеупомянутых антител ГЭБ таким образом, что антитело транспортирует связанное с ним соединение через ГЭБ. В одном воплощении ГЭБ находится у человеческого субъекта. В одном воплощении вводится антитело, связанное с соединением, в терапевтической дозе. В одном воплощении данная терапевтическая доза является насыщающей TfR. В другом воплощении введение антитела осуществляется в дозе и/или частота дозирования калибруется для минимизации острых клинических симптомов введения антитела.
В одном аспекте приведенного выше воплощения предложен способ увеличения удерживания в ЦНС соединения, введенного субъекту, включающий экспонирование любого из вышеупомянутых антител ГЭБ таким образом, что увеличивается удерживание в ЦНС соединения. В одном воплощении вводится антитело, связанное с соединением, в терапевтической дозе. В одном воплощении данная терапевтическая доза является насыщающей TfR. В другом воплощении введение антитела осуществляется в дозе и/или частота дозирования калибруется для минимизации острых клинических симптомов введения антитела.
В одном аспекте приведенного выше воплощения предложен способ лечения неврологического расстройства у млекопитающего, включающий лечение млекопитающего любым из вышеупомянутых антител. В одном воплощении данное неврологическое расстройство выбрано из группы, состоящей из невропатического расстройства, нейродегенеративного заболевания, рака, расстройства, связанного с глазным заболеванием, эпилепсии, лизосомной болезни накопления, амилоидоза, вирусного или микробного заболевания, ишемии, расстройства поведения и воспаления ЦНС. В одном воплощении неврологическое расстройство наблюдается у человеческого субъекта. В одном воплощении вводится антитело, связанное с соединением, в терапевтической дозе. В одном воплощении данная терапевтическая доза является насыщающей TfR. В другом воплощении введение антитела осуществляется в дозе и/или частота дозирования калибруется для минимизации острых клинических симптомов введения антитела.
В одном воплощении у антитела модифицируется одно или более чем одно свойство, выбранное из эффекторной функции области Fc антитела, функции активации комплемента антитела и аффинности антитела в отношении TfR.
В одном воплощении данное свойство представляет собой эффекторную функцию области Fc антитела.
В одном воплощении данное свойство представляет собой функцию активации комплемента антитела.
В одном воплощении данное свойство представляет собой аффинность антитела в отношении TfR.
В одном воплощении эффекторная функция или функция активации комплемента была уменьшена или устранена по отношению к антителу дикого типа того же самого изотипа. В одном воплощении эффекторная функция уменьшается или устраняется способом, выбранным из уменьшения гликозилирования антитела, модификации изотипа антитела на изотип, который имеет пониженную или отсутствующую в природе эффекторную функцию, и модификации области Fc.
В одном воплощении эффекторная функция уменьшается или устраняется посредством уменьшения гликозилирования антитела. В одном воплощении гликозилирование антитела уменьшается способом, выбранным из следующих: продукция антитела в среде, которая не обеспечивает гликозилирование дикого типа; удаление углеводных групп, уже присутствующих на антителе; и модификация антитела таким образом, что гликозилирование дикого типа не происходит.
В одном воплощении гликозилирование антитела уменьшается продукцией антитела в среде, которая не обеспечивает гликозилирование дикого типа, такой как продукция в системе продукции, не являющейся клетками млекопитающего, или где антитело продуцируется синтетически. В одном воплощении антитело продуцируется в системе продукции, не являющейся клетками млекопитающего. В другом воплощении антитело производится синтетически.
В одном воплощении гликозилирование антитела уменьшается посредством модификации антитела таким образом, что гликозилирование дикого типа не происходит, как, например, при которой область Fc антитела содержит мутацию в положении 297 таким образом, что остаток аспарагина дикого типа в данном положении заменяется другой аминокислотой, которая препятствует гликозилированию в данном положении.
В одном воплощении эффекторная функция уменьшается или устраняется посредством по меньшей мере одной модификации области Fc. В одном воплощении эффекторная функция или функция активации комплемента уменьшается или устраняется делецией всей или части области Fc, или посредством инженерии антитела таким образом, что оно не включает область Fc или область, не являющуюся Fc, компетентную в отношении эффекторной функции или функции активации комплемента. В одном воплощении по меньшей мере одна модификация области Fc выбрана из следующих: точечная мутация области Fc для ухудшения связывания с одним или более чем одним рецептором Fc, выбранная из следующих положений: 238, 239, 248, 249, 252, 254, 265, 268, 269, 270, 272, 278, 289, 292, 293, 294, 295, 296, 297, 298, 301, 303, 322, 324, 327, 329, 333, 30 335, 338, 340, 373, 376, 382, 388, 389, 414, 416, 419, 434, 435, 437, 438, и 439; точечная мутация области Fc для ухудшения связывания с C1q, выбранная из следующих положений: 270, 322, 329 и 321; устранение некоторой части или всей области Fc и точечная мутация в положении 132 домена СН1. В одном воплощении данная модификация представляет собой точечную мутацию области Fc для ухудшения связывания с C1q, выбранную из следующих положений: 270, 322, 329 и 321. В другом воплощении данной модификацией является устранение некоторой части или всей области Fc. В другом воплощении функция запуска комплемента уменьшается или устраняется посредством делеции всей области Fc или ее части, или посредством инженерии антитела таким образом, что оно не включает область Fc, которая занята в пути комплемента. В одном воплощении антитело выбрано из Fab или одноцепочечного антитела. В другом воплощении модифицируется область антитела, не являющаяся Fc, с уменьшением или устранением активации пути комплемента антителом. В одном воплощении модификацией является точечная мутация области СН1 для ухудшения связывания с С3. В одном воплощении точечная мутация находится в положении 132 (см., например, Vidarte et al., J. Biol. Chem. 276 (2001) 38217-38223).
В одном аспекте приведенного выше воплощения аффинность антитела в отношении TfR уменьшается при измерении относительно антитела дикого типа того же самого изотипа, не имеющего пониженную аффинность в отношении TfR. В одном таком аспекте антитело имеет KD или IC50 (полумаксимальная ингибирующая концентрация) в отношении TfR от примерно 1 пМ до примерно 100 мкМ.
В одном воплощении у антитела, как описано в данном документе, выключена эффекторная функция. В одном воплощении антитело не имеет эффекторной функции. В одном воплощении антитело принадлежит к человеческому подклассу IgG1 и имеет мутации L234A, L235A и P329G в обеих тяжелых цепях (нумерация согласно индексу EU по Kabat).
В одном воплощении антитело представляет собой:
а) полноразмерное антитело человеческого подкласса IgG1 или
б) полноразмерное антитело человеческого подкласса IgG4, или
в) полноразмерное антитело человеческого подкласса IgG1 с мутациями L234A, L235A и P329G,
г) полноразмерное антитело человеческого подкласса IgG4 с мутациями S228P, L235E и, возможно, P329G,
д) полноразмерное антитело человеческого подкласса IgG1 с мутациями L234A, L235A и P329G в обеих тяжелых цепях и мутациями T366W и S354C в одной тяжелой цепи и мутациями T366S, L368A, Y407V и Y349C в соответствующей другой тяжелой цепи, или
е) полноразмерное антитело человеческого подкласса IgG4 с мутациями S228P и, возможно, P329G в обеих тяжелых цепях и мутациями T366W и S354C в одной тяжелой цепи и мутациями T366S, L368A, Y407V и Y349C в соответствующей другой тяжелой цепи.
В одном аспекте приведенного выше воплощения согласно изобретению предложен фармацевтический препарат, содержащий любое из вышеупомянутых антител и фармацевтически приемлемый носитель.
В одном аспекте приведенного выше воплощения согласно изобретению предложено любое из вышеупомянутых антител для применения в качестве лекарственного средства.
В другом аспекте приведенного выше воплощения согласно изобретению предложено применение любого из вышеупомянутых антител в изготовлении лекарственного средства для лечения неврологического расстройства. В одном воплощении неврологическое расстройство выбрано из группы, состоящей из невропатического расстройства, нейродегенеративного заболевания, рака, расстройства, связанного с глазным заболеванием, эпилепсии, лизосомной болезни накопления, амилоидоза, вирусного или микробного заболевания, ишемии, расстройства поведения и воспаления ЦНС.
В другом аспекте приведенного выше воплощения согласно изобретению предложено любое из вышеупомянутых антител для применения в лечении неврологического расстройства. В одном воплощении данное неврологическое расстройство выбрано из группы, состоящей из невропатического расстройства, нейродегенеративного заболевания, рака, расстройства, связанного с глазным заболеванием, эпилепсии, лизосомной болезни накопления, амилоидоза, вирусного или микробного заболевания, ишемии, расстройства поведения и воспаления ЦНС.
В другом аспекте приведенного выше воплощения согласно изобретению предложено любое из вышеупомянутых антител для применения в транспортировке одного или более чем одного соединения через ГЭБ.
В другом аспекте приведенного выше воплощения предложено применение любого из вышеупомянутых антител в изготовлении лекарственного средства для транспортировки одного или более чем одного соединения через ГЭБ.
В одном аспекте приведенного выше воплощения предложен способ транспортировки соединения через ГЭБ у субъекта, включающий экспонирование любого из вышеупомянутых антител ГЭБ таким образом, что антитело транспортирует связанное с ним соединение через ГЭБ. В одном воплощении ГЭБ находится у человеческого субъекта. В одном воплощении антитело, связанное с соединением, вводится в терапевтической дозе. В одном воплощении данная терапевтическая доза является насыщающей TfR. В другом воплощении введение антитела осуществляется в дозе и/или при частоте дозирования, откалиброванных для минимизации острых клинических симптомов введения антитела.
В другом аспекте приведенного выше воплощения предложен способ увеличения степени воздействия соединения на ЦНС субъекта, включающий экспонирование любого из вышеупомянутых антител ГЭБ таким образом, что антитело транспортирует связанное с ним соединение через ГЭБ. В одном воплощении ГЭБ находится у человеческого субъекта. В одном воплощении антитело, связанное с соединением, вводится в терапевтической дозе. В одном воплощении данная терапевтическая доза является насыщающей TfR. В другом воплощении введение антитела осуществляется в дозе и/или при частоте дозирования, откалиброванных для минимизации острых клинических симптомов введения антитела.
В одном аспекте приведенного выше воплощения предложен способ увеличения удерживания в ЦНС соединения, введенного субъекту, включающий экспонирование любого из вышеупомянутых антител ГЭБ таким образом, что увеличивается удерживание соединения в ЦНС. В одном воплощении ГЭБ находится у человеческого субъекта. В одном воплощении антитело, связанное с соединением, вводится в терапевтической дозе. В одном воплощении данная терапевтическая доза является насыщающей TfR. В другом воплощении введение антитела осуществляется в дозе и/или при частоте дозирования, откалиброванных для минимизации острых клинических симптомов введения антитела.
В одном аспекте приведенного выше воплощения предложен способ лечения неврологического расстройства у млекопитающего, включающий лечение млекопитающего любым из вышеупомянутых антител. В одном воплощении неврологическое расстройство выбрано из группы, состоящей из невропатического расстройства, нейродегенеративного заболевания, рака, расстройства, связанного с глазным заболеванием, эпилепсии, лизосомной болезни накопления, амилоидоза, вирусного или микробного заболевания, ишемии, расстройства поведения и воспаления ЦНС. В другом таком аспекте неврологическое расстройство наблюдается у человеческого субъекта. В одном воплощении антитело, связанное с соединением, вводится в терапевтической дозе. В одном воплощении данная терапевтическая доза является насыщающей TfR. В другом воплощении введение антитела осуществляется в дозе и/или при частоте дозирования, откалиброванных для минимизации острых клинических симптомов введения антитела.
В другом воплощении предложен способ уменьшения клиренса соединения, введенного субъекту, где данное соединение связано с антителом, которое с низкой аффинностью связывается с TfR таким образом, что уменьшается клиренс соединения.
В другом воплощении предложен способ оптимизации фармакокинетики и/или фармакодинамики соединения для того, чтобы оно было эффективным в ЦНС субъекта, где данное соединение связано с антителом, которое с низкой аффинностью связывается с TfR, и данное антитело выбрано таким образом, что его аффинность в отношении TfR после связывания с соединением приводит к такому уровню транспорта антитела, конъюгированного с соединением, через ГЭБ, который оптимизирует фармакокинетику и/или фармакодинамику соединения в ЦНС.
В другом аспекте антитело против трансферринового рецептора согласно любому из приведенных выше аспектов и воплощений может включать любую из характеристик, одиночно или в комбинации, как описано в Разделах 1-5 ниже.
1. Аффинность антитела
В одном воплощении Kd измеряется посредством анализа связывания радиоактивно меченого антигена (RIA). В одном воплощении RIA проводится с Fab версией интересующего антитела и его антигеном. Например, аффинность связывания Fab в отношении антигена в растворе измеряется посредством уравновешивания Fab с минимальной концентрацией меченного 125I антигена в присутствии рядов титрования немеченого антигена, затем захватывая связанный антиген планшетом, покрытым антителом против Fab (см., например, Chen, Y. et al., J. Mol. Biol. 293 (1999) 865-881). Для установления условий для анализа многолуночные планшеты MICROTITER® (Thermo Scientific) покрывают в течение ночи 5 мкг/мл захватывающего антитела против Fab (Cappel Labs) в 50 мМ карбонате натрия (рН 9,6) и затем блокируют 2% (масс./об.) бычьего сывороточного альбумина в PBS в течение двух-пяти часов при комнатной температуре (приблизительно 23°С). В неадсорбирующем планшете (Nunc #269620) 100 пМ или 26 пМ [125I]-антиген смешивается с серийными разведениями интересующего Fab (например, согласно оценке антитела против VEGF (фактор роста эндотелия сосудов) - Fab-12 - в Presta, L.G. et al., Cancer Res. 57 (1997) 4593-4599). Интересующий Fab затем инкубируется в течение ночи; однако, инкубация может продолжаться в течение более длительного периода (например, примерно 65 часов) для обеспечения того, что достигается равновесие. Затем смеси переносятся в захватывающий планшет для инкубации при комнатной температуре (например, в течение одного часа). Раствор затем удаляют и планшет промывают восемь раз 0,1% полисорбата 20 (TWEEN-20®) в PBS. При высыхании планшетов добавляют 150 мкл/лунку сцинтиллятора (MICROSCINT-20™; Packard), и в планшетах осуществляют счет на гамма-счетчике TOPCOUNT™ (Packard) в течение десяти минут. Для применения в анализах конкурентного связывания выбирают концентрации каждого Fab, которые дают связывание, меньшее чем или равное 20% от максимального связывания.
Согласно другому воплощению Kd измеряется с использованием анализа поверхностного плазменного резнанаса BIACORE®. Например, анализ с использованием BIACORE®-2000 или BIACORE®-3000 (BIAcore, Inc., Piscataway, NJ) проводится при 25°C с использованием чипов СМ5 с иммобилизованным антигеном при ~10 единицах ответа (RU). В одном воплощении биосенсорные чипы с карбоксиметилированным декстраном (СМ5, BIACORE, Inc.) активируются N-этил-N'-(3-диметиламинопропил)-карбодиимидагидрохлоридом (EDC) и N-гидроксисукцинимидом (NHS) согласно инструкциям поставщика. Антиген разводится 10 мМ ацетатом натрия, рН 4,8, до 5 мкг/мл (~ 0,2 мкМ) перед инъекцией при скорости тока 5 мкл/минуту с достижением приблизительно 10 единиц ответа (RU) связавшегося белка. После инъекции антигена инъецируется 1 М этаноламин для блокирования непрореагировавших групп. Для измерений кинетики инъецируются двухкратные серийные разведения Fab (от 0,78 нМ до 500 нМ) в PBS (фосфатно-солевой буферный раствор) с 0,05% поверхностно-активного вещества полисорбат 20 (TWEEN-20™) (PBST) при 25°С при скорости тока приблизительно 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) рассчитываются с использованием простой модели связывания Лангмюра один к одному (BIACORE® Evaluation Software, версия 3.2) посредством одновременной аппроксимации сенсограмм ассоциации и диссоциации. Равновесная константа диссоциации (KD) рассчитывается как отношение koff/kon (см., например, Chen, Y. et al., J. Mol. Biol. 293 (1999) 865-881). Если скорость ассоциации, определенная описанным выше поверхностным плазменным резонансом, превышает 106 М-1 с-1, тогда скорость ассоциации может быть определена посредством применения методики гашения флуоресценции, в которой измеряется увеличение или уменьшение интенсивности испускания флуоресценции (возбуждение - 295 нм; испускание - 340 нм, полоса пропускания - 16 нм) 20 нМ антитела против антигена (в виде Fab) в PBS, рН 7,2, при 25°С в присутствии возрастающих концентраций антигена при измерении в спектрометре, таком как спектрофотометр, оснащенный остановленной струей (Aviv Instruments), или спектрофотометр серии 8000 SLM-AMINCO™ (ThermoSpectronic) с кюветой с перемешиванием.
2. Фрагменты антител
В некоторых воплощениях антитело, предложенное в данном документе, представляет собой фрагмент антитела. Фрагменты антитела включают фрагменты Fab, Fab', Fab'-SH, F(ab')2, Fv и scFv, и другие фрагменты, описанные ниже, но не ограничиваются ими. Для обзора определенных фрагментов антител, см. Hudson, P.J. et al., Nat. Med. 9 (2003) 129-134. Для обзора фрагментов scFv см., например, Plueckthun, A., In; The Pharmacology of Monoclonal Antibodies, Vol. 113, Rosenburg and Moore (eds.), Springer-Verlag, New York (1994), pp. 269-315; см. также WO 93/16185; US 5571894 и US 5587458. Для обсуждения фрагментов Fab и F(ab')2, содержащих остатки эпитопа, связываемого рецептором утилизации и имеющих повышенные периоды полувыведения in vivo, см. US 5869046.
Диатела представляют собой фрагменты антител с двумя антигенсвязывающими сайтами, которые могут быть двухвалентными или биспецифичными. См., например, ЕР 0404097; WO 1993/01161; Hudson, P.J. et al., Nat. Med. 9 (2003) 129-134; и Holliger, P. et al., Proc. Natl. Acad. Sci. USA 90 (1993) 6444-6448. Триатела и тетратела также описываются в Hudson, P.J. et al., Nat. Med. 9 (20039129-134).
Однодоменные антитела представляют собой фрагменты антител, содержащие весь вариабельный домен тяжелой цепи антитела или его часть, или весь вариабельный домен легкой цепи антитела или его часть. В некоторых воплощениях однодоменное антитело представляет собой человеческое однодоменное антитело (Domantis, Inc., Waltham, MA; см., например, US 6248516).
Фрагменты антитела могут быть получены разными методиками, включающими протеолитическое расщепление интактного антитела, а также продукцию рекомбинантными клетками-хозяевами (например, Е.coli или фагом), но не ограничивающимися ими, как описано в данном документе.
3. Химерные и гуманизированные антитела
В некоторых воплощениях антитело, предложенное в данном документе, представляет собой химерное антитело. Определенные химерные антитела описываются, например, в US 4816567; и Morrison, S.L. et al., Proc. Natl. Acad. Sci. USA 81 (1984) 6851-6855). В одном примере химерное антитело содержит вариабельную область, не являющуюся человеческой (например, вариабельную область, происходящую от мыши, крысы, хомяка, кролика или примата, не являющегося человеком, такого как обезьяна), и человеческую константную область. В другом воплощении химерное антитело представляет собой антитело «с переключением класса», у котрого класс или подкласс был изменен от класса или подкласса родительского антитела. Химерные антитела включают их антигенсвязывающие фрагменты.
В некоторых воплощениях химерное антитело представляет собой гуманизированное антитело. Типично антитело, не являющееся человеческим, гуманизируют для уменьшения иммуногенности у человека, при сохранении специфичности и аффинности родительского антитела, не являющегося человеческим. В общем, гуманизированное антитело содержит один или более чем один вариабельный домен, в котором HVR, например, CDR (или их части) происходят из антитела, не являющегося человеческим, и FR (или их части) происходят из последовательностей человеческого антитела. Гуманизированное антитело возможно также будет содержать по меньшей мере часть человеческой константной области. В некоторых воплощениях некоторые остатки FR в гуманизированном антителе заменены соответствующими остатками из антитела, не являющегося человеческим (например, антитела, из которого происходят остатки HVR), например, для восстановления или улучшения специфичности или аффинности антитела.
Обзор гуманизированных антител и способов их получения делается, например, в Almagro, J.C. and Fransson, J., Front. Biosci. 13 (2008) 1619-1633, и они дополнительно описываются, например, в Riechmann, I. et al., Nature 332 (1988) 323-329; Queen, С. et al., Proc. Natl. Acad. Sci. USA 86 (1989) 10029-10033; US 5821337, US 7527791, US 6982321 и US 7087409; Kashmiri, S.V. et al., Methods 36 (2005) 25-34 (описывающей пересадку области, определяющей специфичность (SDR)); Padlan, E.A., Mol. Immunol. 28 (1991) 489-498 (описывающей «изменение поверхности (вариабельного домена)» (resurfacing)); Dall'Acqua, W.F. et al., Methods 36 (2005) 43-60 (описывающей «перетасовку FR»); и Osbourn, J. et al., Methods 36 (2005) 61-68 и Klimka, A. et al., Br. J. Cancer 83 (2000) 252-260 (описывающей подход «направленного отбора» для перетасовки FR).
Человеческие каркасные области, которые можно использовать для гуманизации, включают каркасные области, отобранные с использованием способа «наилучшей аппроксимации» (см., например, Sims, M.J. et al., J. Immunol. 151 (1993) 2296-2308; каркасные области, происходящие из консенсусной последовательности вариабельных областей легкой или тяжелой цепи конкретной подгруппы человеческих антител (см., например, Carter, P. et al., Proc. Natl. Acad. Sci. USA 89 (1992) 4285-4289; и Presta, L.G. et al., J. Immunol. 151 (1993) 2623-2632); человеческие зрелые (соматически мутировавшие) каркасные области или человеческие каркасные области зародышевой линии (см., например, Almagro, J.C. and Fransson, J., Front. Biosci. 13 (2008) 1619-1633); и каркасные области, полученные в результате скрининга библиотек FR (см., например, Васа, М. et al., J. Biol. Chem. 272 (1997) 10678-10684 и Rosok, M.J. et al., J. Biol. Chem. 271 (19969 22611-22618), но не ограничиваются ими.
4. Мультиспецифичные антитела
В некоторых воплощениях антитело, предложенное в данном документе, представляет собой мультиспецифичное антитело, например, биспецифичное антитело. Мультиспецифичные антитела представляют собой моноклональные антитела, которые имеют специфичности связывания в отношении по меньшей мере двух разных сайтов. В некоторых воплощениях одна из специфичностей связывания направлена в отношении трансферринового рецептора, и другая - в отношении любого другого антигена. Биспецифичные антитела также могут использоваться для локализации цитотоксических агентов в клетках, которые экспрессируют трансферриновый рецептор. Биспецифичные антитела можно получать в виде полноразмерных антител или фрагментов антител.
Методики получения мультиспецифичных антител включают рекомбинантную соэкспрессию двух пар тяжелой цепи-легкой цепи иммуноглобулина, имеющих разные специфичности (см. Milstein, С. and Cuello, А.С., Nature 305 (1983) 537-540, WO 93/08829 и Traunecker, A. et al., EMBO J. 10 (1991) 3655-3659), и генетическую инженерию «выступ во впадину» (см., например, US 5731168), но не ограничиваются ими. Мультиспецифичные антитела также можно получать инженерией эффектов электростатического наведения для получения Fc-гетеродимерных молекул антитела (WO 2009/089004); поперечным связыванием двух или более чем двух антител или фрагментов (см., например, US 4676980 и Brennan, M. et al., Science 229 (1985) 81-83); применением лейциновых молний для получения биспецифичных антител (см., например, Kostelny, S.A. et al., J. Immunol. 148 (1992) 1547-1553; применением технологии «диатела» для получения биспецифичных фрагментов антител (см., например, Holliger, P. et al., Proc. Natl. Acad. Sci. USA 90 (1993) 6444-6448); применением димеров одноцепочечных Fv (scFv) (см., например, Gruber, M et al., J. Immunol. 152 (1994) 5368-5374); и получением триспецифичных антител, как описано, например, в Tutt, A. et al., J. Immunol. 147 (1991) 60-69).
В данный документ также включены генетически модифицированные антитела с тремя или более чем тремя функциональными антигенсвязывающими сайтами, включающие «антитела-осьминоги» (см., например, US 2006/0025576).
Антитело или фрагмент в данном документе также включает «Fab двойного действия» или «DAF», содержащий антигенсвязывающий сайт, который связывается с трансферриновым рецептором, а также с другим, отличным антигеном (см., например, US 2008/0069820).
Антитело или фрагмент в данном документе также включает мультиспецифичные антитела, описанные в WO 2009/080251, WO 2009/080252, WO 2009/080253, WO 2009/080254, WO 2010/112193, WO 2010/115589, WO 2010/136172, WO 2010/145792 и WO 2010/145793.
В одном воплощении всех аспектов, как описано в данном документе, антитело против трансферринового рецептора представляет собой биспецифичное антитело.
Одним аспектом, как описано в данном документе, является двухвалентное, биспецифичное антитело, содержащее:
а) первую легкую цепь и первую тяжелую цепь антитела, специфично связывающуюся с первым антигеном, и
б) вторую легкую цепь и вторую тяжелую цепь антитела, специфично связывающуюся со вторым антигеном, где вариабельные домены VL и VH второй легкой цепи и второй тяжелой цепи заменяют друг друга,
где первый антиген или второй антиген представляет собой человеческий трансферриновый рецептор.
Антитело согласно а) не содержит модификацию, как описано согласно б), и тяжелая цепь и легкая цепь согласно а) представляют собой изолированные цепи.
В антителе согласно б)
в пределах легкой цепи
вариабельный домен легкой цепи VL заменен вариабельным доменом тяжелой цепи VH указанного антитела,
и
в пределах тяжелой цепи
вариабельный домен тяжелой цепи VH заменен вариабельным доменом легкой цепи VL указанного антитела.
В одном воплощении
i) в константном домене CL первой легкой цепи согласно а) аминокислота в положении 124 (нумерация согласно Kabat) заменена положительно заряженной аминокислотой, и где в константном домене СН1 первой тяжелой цепи согласно а) аминокислота в положении 147 или аминокислота в положении 213 (нумерация согласно индексу EU по Kabat) заменена отрицательно заряженной аминокислотой,
или
ii) в константном домене CL второй легкой цепи согласно б) аминокислота в положении 124 (нумерация согласно Kabat) заменена положительно заряженной аминокислотой, и где в константном домене СН1 второй тяжелой цепи согласно б) аминокислота в положении 147 или аминокислота в положении 213 (нумерация согласно индексу EU по Kabat) заменена отрицательно заряженной аминокислотой.
В одном предпочтительном воплощении
i) в константном домене CL первой легкой цепи согласно а) аминокислота в положении 124 независимо заменена лизином (K), аргинином (R) или гистидином (Н) (нумерация согласно Kabat) (в одном предпочтительном воплощении - независимо лизином (K) или аргинином (R)), и где в константном домене СН1 первой тяжелой цепи согласно а) аминокислота в положении 147 или аминокислота в положении 213 независимо заменена глутаминовой кислотой (Е) или аспарагиновой кислотой (D) (нумерация согласно индексу EU по Kabat),
или
ii) в константном домене CL второй легкой цепи согласно б) аминокислота в положении 124 независимо заменена лизином (K), аргинином (R) или гистидином (Н) (нумерация согласно Kabat) (в одном предпочтительном воплощении - независимо лизином (K) или аргинином (R)), и где в константном домене СН1 второй тяжелой цепи согласно б) аминокислота в положении 147 или аминокислота в положении 213 независимо заменена глутаминовой кислотой (Е) или аспарагиновой кислотой (D) (нумерация согласно индексу EU по Kabat).
В одном воплощении в константном домене CL второй тяжелой цепи аминокислоты в положении 124 и 123 заменяются на K (нумерация согласно индексу EU по Kabat).
В одном воплощении в константном домене СН1 второй легкой цепи аминокислоты в положении 147 и 213 заменяются на Е (нумерация согласно индексу EU по Kabat).
В одном предпочтительном воплощении в константном домене CL первой легкой цепи аминокислоты в положении 124 и 123 заменяются на K, и в константном домене СН1 первой тяжелой цепи аминокислоты в положении 147 и 213 заменяются на Е (нумерация согласно индексу EU по Kabat).
В одном воплощении в константном домене CL второй тяжелой цепи аминокислоты в положении 124 и 123 заменяются на K, и где в константном домене СН1 второй легкой цепи аминокислоты в положении 147 и 213 заменяются на Е, и в вариабельном домене VL первой легкой цепи аминокислота в положении 38 заменяется на K, и в вариабельном домене VH первой тяжелой цепи аминокислота в положении 39 заменяется на Е, в вариабельном домене VL второй тяжелой цепи аминокислота в положении 38 заменяется на K, и в вариабельном домене VH второй легкой цепи аминокислота в положении 39 заменяется на Е (нумерация согласно индексу EU по Kabat).
Одним аспектом, как описано в данном документе, является двухвалентное, биспецифичное антитело, содержащее:
а) первую легкую цепь и первую тяжелую цепь антитела, специфично связывающуюся с первым антигеном, и
б) вторую легкую цепь и вторую тяжелую цепь антитела, специфично связывающуюся со вторым антигеном, где вариабельные домены VL и VH второй легкой цепи и второй тяжелой цепи заменяют друг друга, и где константные домены CL и СН1 второй легкой цепи и второй тяжелой цепи заменяют друг друга,
где первый антиген или второй антиген представляет собой человеческий трансферриновый рецептор.
Антитело согласно а) не содержит модификацию, как описано согласно б), и тяжелая цепь и легкая цепь согласно а) представляют собой изолированные цепи.
В антителе согласно б)
в пределах легкой цепи
вариабельный домен легкой цепи VL заменен вариабельным доменом тяжелой цепи VH указанного антитела, и константный домен легкой цепи CL заменен константным доменом тяжелой цепи СН1 указанного антитела;
и
в пределах тяжелой цепи
вариабельный домен тяжелой цепи VH заменен вариабельным доменом легкой цепи VL указанного антитела, и константный домен тяжелой цепи СН1 заменен константным доменом легкой цепи CL указанного антитела.
Одним аспектом, как описано в данном документе, является двухвалентное, биспецифичное антитело, содержащее:
а) первую легкую цепь и первую тяжелую цепь антитела, специфично связывающиеся с первым антигеном, и
б) вторую легкую цепь и вторую тяжелую цепь антитела, специфично связывающиеся со вторым антигеном, где константные домены CL и СН1 второй легкой цепи и второй тяжелой цепи заменяют друг на друга,
где первый антиген или второй антиген представляет собой человеческий трансферриновый рецептор.
Антитело согласно а) не содержит модификацию, как описано согласно б), и тяжелая цепь и легкая цепь согласно а) представляют собой изолированные цепи.
В антителе согласно б)
в пределах легкой цепи
константный домен легкой цепи CL заменен константным доменом тяжелой цепи СН1 указанного антитела;
и в пределах тяжелой цепи
константный домен тяжелой цепи СН1 заменен константным доменом легкой цепи CL указанного антитела.
Одним аспектом, как описано в данном документе, является мультиспецифичное антитело, содержащее:
а) полноразмерное антитело, специфично связывающееся с первым антигеном и состоящее из двух тяжелых цепей антитела и двух легких цепей антитела, и
б) один, два, три или четыре одноцепочечных фрагмента Fab, специфично связывающихся с одним-четырьмя дополнительными антигенами (т.е. вторым и/или третьим, и/или четвертым, и/или пятым антигеном, предпочтительно специфично связывающихся с одним дополнительным антигеном, т.е. со вторым антигеном),
в котором указанные одноцепочечные фрагменты Fab согласно б) слиты с указанным полноразмерным антителом согласно а) через пептидный линкер на С- или N-конце тяжелой или легкой цепи указанного полноразмерного антитела,
где первый антиген или один из дополнительных антигенов представляет собой человеческий трансферриновый рецептор.
В одном воплощении один или два идентичных одноцепочечных фрагмента Fab, связывающихся со вторым антигеном, слиты с указанным полноразмерным антителом через пептидный линкер на С-конце тяжелой или легкой цепей указанного полноразмерного антитела.
В одном воплощении один или два идентичных одноцепочечных фрагмента Fab, связывающихся со вторым антигеном, слиты с указанным полноразмерным антителом через пептидный линкер на С-конце тяжелых цепей указанного полноразмерного антитела.
В одном воплощении один или два идентичных одноцепочечных фрагмента Fab, связывающихся со вторым антигеном, слиты с указанным полноразмерным антителом через пептидный линкер на С-конце легких цепей указанного полноразмерного антитела.
В одном воплощении два идентичных одноцепочечных фрагмента Fab, связывающихся со вторым антигеном, слиты с указанным полноразмерным антителом через пептидный линкер на С-конце каждой тяжелой или легкой цепи указанного полноразмерного антитела.
В одном воплощении два идентичных одноцепочечных фрагмента Fab, связывающихся со вторым антигеном, слиты с указанным полноразмерным антителом через пептидный линкер на С-конце каждой тяжелой цепи указанного полноразмерного антитела.
В одном воплощении два идентичных одноцепочечных фрагмента Fab, связывающихся со вторым антигеном, слиты с указанным полноразмерным антителом через пептидный линкер на С-конце каждой легкой цепи указанного полноразмерного антитела.
Одним аспектом, как описано в данном документе, является трехвалентное биспецифичное антитело, содержащее:
а) полноразмерное антитело, специфично связывающееся с первым антигеном и состоящее из двух тяжелых цепей антитела и двух легких цепей антитела,
б) первый полипептид, состоящий из
ба) вариабельного домена тяжелой цепи антитела (VH),
или
бб) вариабельного домена тяжелой цепи антитела (VH) и константного домена 1 антитела (СН1),
где указанный первый полипептид слит N-концом его домена VH через пептидный линкер с С-концом одной из двух тяжелых цепей указанного полноразмерного антитела,
в) второй полипептид, состоящий из
ва) вариабельного домена легкой цепи антитела (VL),
или
вб) вариабельного домена легкой цепи антитела (VL) и константного домена легкой цепи антитела (CL),
где указанный второй полипептид слит N-концом домена VL через пептидный линкер с С-концом другой из двух тяжелых цепей указанного полноразмерного антитела,
и
где вариабельный домен тяжелой цепи антитела (VH) первого полипептида и вариабельный домен легкой цепи антитела (VL) второго полипептида совместно образуют антигенсвязывающийся сайт, специфично связывающийся со вторым антигеном,
и
где первый антиген или второй антиген представляет собой человеческий трансферриновый рецептор.
В одном воплощении вариабельный домен тяжелой цепи антитела (VH) полипептида согласно б) вариабельный домен легкой цепи антитела (VL) полипептида согласно в) связаны и стабилизируются посредством межцепочечного дисульфидного мостика посредством введения дисульфидной связи между следующими положениями:
i) положением 44 вариабельного домена тяжелой цепи и положением 100 вариабельного домена легкой цепи или
ii) положением 105 вариабельного домена тяжелой цепи и положением 43 вариабельного домена легкой цепи, или
iii) положением 101 вариабельного домена тяжелой цепи и положением 100 вариабельного домена легкой цепи (нумерация всегда согласно индексу EU по Kabat).
Методики введения неприродных дисульфидных мостиков для стабилизации описываются, например, в WO 94/029350, Rajagopal, V., et al., Prot. Eng. (1997) 1453-59; Kobayashi, H., et al., Nuclear Medicine & Biology, Vol. 25, (1998) 387-393; или Schmidt, M., et al., Oncogene (1999) 18 1711-1721. В одном воплощении возможная дисульфидная связь между вариабельными доменами полипептидов согласно б) и в) находится между положением 44 вариабельного домена тяжелой цепи и положением 100 вариабельного домена легкой цепи. В одном воплощении возможная дисульфидная связь между вариабельными доменами полипептидов согласно б) и в) находится между положением 105 вариабельного домена тяжелой цепи и положением 43 вариабельного домена легкой цепи (нумерация всегда согласно Kabat). В одном воплощении предпочтительным является трехвалентное биспецифичное антитело без указанной возможной дисульфидной стабилизации между вариабельными доменами VH и VL одноцепочечных фрагментов Fab.
Одним аспектом, как описано в данном документе, является триспецифичное или тетраспецифичное антитело, содержащее:
а) первую легкую цепь и первую тяжелую цепь полноразмерного антитела, которая специфично связывается с первым антигеном, и
б) вторую (модифицированную) легкую цепь и вторую (модифицированную) тяжелую цепь полноразмерного антитела, которая специфично связывается со вторым антигеном, где вариабельные домены VL и VH заменяют друг друга и/или где константные домены CL и СН1 заменяют друг друга, и
в) где от одного до четырех антигенсвязывающих пептидов, которые специфично связываются с одним или двумя дополнительными антигенами (т.е. с третьим и/или четвертым антигеном), слиты через пептидный линкер с C- или N-концом легких цепей или тяжелых цепей а) и/или б),
где первый антиген или второй антиген, или один из дополнительных антигенов представляет собой человеческий трансферриновый рецептор.
Антитело согласно а) не содержит модификацию, как описано согласно б), и тяжелая цепь, и легкая цепь согласно а) представляют собой изолированные цепи.
В одном воплощении триспецифичное или тетраспецифичное антитело содержит согласно в) один или два антигенсвязывающих пептида, которые специфично связываются с одним или двумя дополнительными антигенами.
В одном воплощении антигенсвязывающие пептиды выбраны из группы фрагмента scFv и фрагмента scFab.
В одном воплощении антигенсвязывающие пептиды представляют собой фрагменты scFv.
В одном воплощении антигенсвязывающие пептиды представляют собой фрагменты scFab.
В одном воплощении антигенсвязывающие пептиды слиты с С-концом тяжелых цепей а) и/или б).
В одном воплощении триспецифичное или тетраспецифичное антитело содержит согласно в) один или два антигенсвязывающих пептида, которые специфично связываются с одним дополнительным антигеном.
В одном воплощении триспецифичное или тетраспецифичное антитело содержит согласно в) два идентичных антигенсвязывающих пептида, которые специфично связываются с третьим антигеном. В одном предпочтительном воплощении такие два идентичных антигенсвязывающих пептида оба слиты посредством одинакового пептидного линкера с С-концом тяжелых цепей а) и б). В одном предпочтительном воплощении два идентичных антигенсвязывающих пептида представляют собой либо фрагмент scFv, либо фрагмент scFab.
В одном воплощении триспецифичное или тетраспецифичное антитело содержит согласно в) два антигенсвязывающих пептида, которые специфично связываются с третьим и с четвертым антигеном. В одном воплощении указанные два антигенсвязывающих пептида слиты через одинаковый пептидный соединитель с С-концом тяжелых цепей а) и б). В одном предпочтительном воплощении указанные два антигенсвязывающих пептида представляют собой либо фрагмент scFv, либо фрагмент scFab.
Одним аспектом, как описано в данном документе, является биспецифичное четырехвалентное антитело, содержащее:
а) две легкие цепи и две тяжелые цепи антитела, которые специфично связываются с первым антигеном (и содержат два фрагмента Fab),
б) два дополнительных фрагмента Fab антитела, которые специфично связываются со вторым антигеном, где указанные дополнительные фрагменты Fab оба слиты через пептидный линкер либо с C-, либо с N-концами тяжелых цепей а),
и
где во фрагментах Fab были проведены следующие модификации
i) в обоих фрагментах Fab а) или в обоих фрагментах Fab б) вариабельные домены VL и VH заменяют друг друга, и/или константные домены CL и СН1 заменяют друг друга,
или
ii) в обоих фрагментах Fab а) вариабельные домены VL и VH заменяют друг друга, и константные домены CL и СН1 заменяют друг друга,
и
в обоих фрагментах Fab б) вариабельные домены VL и VH заменяют друг друга, или константные домены CL и СН1 заменяют друг друга,
или
iii) в обоих фрагментах Fab а) вариабельные домены VL и VH заменяют друг друга, или константные домены CL и СН1 заменяются друг друга,
и
в обоих фрагментах Fab б) вариабельные домены VL и VH заменяют друг друга, и константные домены CL и СН1 заменяют друг друга,
или
iv) в обоих фрагментах Fab а) вариабельные домены VL и VH заменяют друг друга, и в обоих фрагментах Fab б) константные домены CL и СН1 заменяют друг друга,
или
v) в обоих фрагментах Fab а) константные домены CL и СН1 заменяют друг друга, и в обоих фрагментах Fab б) вариабельные домены VL и VH заменяют друг друга,
где первый антиген или второй антиген представляет собой человеческий трансферриновый рецептор.
В одном воплощении указанные дополнительные фрагменты Fab оба слиты через пептидный линкер либо с С-концами тяжелых цепей а), либо с N-концами тяжелых цепей а).
В одном воплощении указанные дополнительные фрагменты Fab оба слиты через пептидный линкер с С-концами тяжелых цепей а).
В одном воплощении указанные дополнительные фрагменты Fab оба слиты через пептидный соединитель с N-концами тяжелых цепей а).
В одном воплощении во фрагментах Fab осуществляются следующие модификации:
i) в обоих фрагментах Fab а) или в обоих фрагментах Fab б) вариабельные домены VL и VH заменяются друг на друга,
и/или
константные домены CL и СН1 заменяют друг друга.
В одном воплощении во фрагментах Fab осуществляются следующие модификации:
i) в обоих фрагментах Fab а) вариабельные домены VL и VH заменяют друг друга,
и/или
константные домены CL и СН1 заменяют друг друга.
В одном воплощении во фрагментах Fab осуществляются следующие модификации:
i) в обоих фрагментах Fab а) константные домены CL и СН1 заменяют друг друга.
В одном воплощении во фрагментах Fab осуществляются следующие модификации:
i) в обоих фрагментах Fab б) вариабельные домены VL и VH заменяют друг друга,
и/или
константные домены CL и СН1 заменяют друг друга.
В одном воплощении во фрагментах Fab осуществляются следующие модификации:
i) в обоих фрагментах Fab б) константные домены CL и СН1 заменяют друг друга.
Одним аспектом, как описано в данном документе, является биспецифичное четырехвалентное антитело, содержащее:
а) (модифицированную) тяжелую цепь первого антитела, которая специфично связывается с первым антигеном и содержит первую пару доменов VH-CH1, в которой с С-концом указанной тяжелой цепи слит N-конец второй пары доменов VH-CH1 указанного первого антитела через пептидный линкер,
б) две легкие цепи указанного первого антитела а),
в) (модифицированную) тяжелую цепь второго антитела, которая специфично связывается со вторым антигеном и содержит первую пару доменов VH-CL, в которой с С-концом указанной тяжелой цепи слит N-конец второй пары доменов VH-CL указанного второго антитела через пептидный линкер, и
г) две (модифицированные) легкие цепи указанного второго антитела в), причем каждая из них содержит пару доменов CL-CH1,
где первый антиген или второй антиген представляет собой человеческий трансферриновый рецептор.
Одним аспектом, как описано в данном документе, является биспецифичное антитело, содержащее:
а) тяжелую цепь и легкую цепь первого полноразмерного антитела, которое специфично связывается с первым антигеном, и
б) тяжелую цепь и легкую цепь второго полноразмерного антитела, которое специфично связывается со вторым антигеном, где N-конец тяжелой цепи соединяется с С-концом легкой цепи через пептидный линкер,
где первый антиген или второй антиген представляет собой человеческий трансферриновый рецептор.
Антитело согласно а) не содержит модификацию, как описано согласно б), и тяжелая цепь и легкая цепь представляют собой выделенные цепи.
Одним аспектом, как описано в данном документе, является биспецифичное антитело, содержащее:
а) полноразмерное антитело, специфично связывающееся с первым антигеном и состоящее из двух тяжелых цепей антитела и двух легких цепей антитела, и
б) фрагмент Fv, специфично связывающийся со вторым антигеном, содержащий домен VH2 и домен VL2, в котором оба домена соединяются друг с другом посредством дисульфидного мостика,
где только либо домен VH2, либо домен VL2 слит через пептидный линкер с тяжелой или легкой цепью полноразмерного антитела, специфично связывающегося с первым антигеном,
где первый антиген или второй антиген представляет собой человеческий трансферриновый рецептор.
В данном биспецифичном антителе тяжелые цепи и легкие цепи согласно а) представляют собой изолированные цепи.
В одном воплощении другой из домена VH2 или домена VL2 не слит через пептидный линкер с тяжелой или легкой цепью полноразмерного антитела, специфично связывающегося с первым антигеном.
Во всех аспектах, как описано в данном документе, первая легкая цепь содержит домен VL и домен CL, и первая тяжелая цепь содержит домен VH, домен СН1, шарнирную область, домен СН2 и домен CH3.
Одним аспектом, как описано в данном документе, является биспецифичное трехвалентное антитело, содержащее:
а) два фрагмента Fab, которые специфично связываются с первым антигеном,
б) один фрагмент CrossFab, который специфично связывается со вторым антигеном, в котором домены СН1 и CL заменяют друг друга,
в) одну область Fc, содержащую первую область Fc тяжелой цепи и вторую область Fc тяжелой цепи,
где С-концы доменов СН1 двух фрагментов Fab соединяются с N-концами полипептидов тяжелой цепи области Fc, и
где С-конец домена CL фрагмента CrossFab соединяется с N-концом домена VH одного из фрагментов Fab,
и
где первый антиген или второй антиген представляет собой человеческий трансферриновый рецептор.
Одним аспектом, как описано в данном документе, является биспецифичное трехвалентное антитело, содержащее:
а) два фрагмента Fab, которые специфично связываются с первым антигеном,
б) один фрагмент CrossFab, который специфично связывается со вторым антигеном, в котором домены СН1 и CL заменяют друг друга,
в) одну область Fc, содержащую первую тяжелую цепь области Fc и вторую тяжелую цепь области Fc,
где С-конец домена СН1 первого фрагмента Fab соединяется с N-концом одного из полипептидов тяжелой цепи области Fc, и С-конец домена CL фрагмента CrossFab соединяется с N-концом другого полипептида тяжелой цепи области Fc, и
где С-конец домена СН1 второго фрагмента Fab соединяется с N-концом домена VH первого фрагмента Fab или с N-концом домена VH фрагмента CrossFab, и
где первый антиген или второй антиген представляет собой человеческий трансферриновый рецептор.
Одним аспектом, как описано в данном документе, является биспецифичное антитело, содержащее:
а) полноразмерное антитело, специфично связывающееся с первым антигеном и состоящее из двух тяжелых цепей антитела и двух легких цепей антитела, и
б) фрагмент Fab, специфично связывающийся со вторым антигеном, содержащий домен VH2 и домен VL2, содержащий фрагмент тяжелой цепи и фрагмент легкой цепи, где
в пределах фрагмента легкой цепи
вариабельный домен легкой цепи VL2 заменяется на вариабельный домен тяжелой цепи VH2 указанного антитела,
и
в пределах фрагмента тяжелой цепи
вариабельный домен тяжелой цепи VH2 заменяется на вариабельный домен легкой цепи VL2 указанного антитела,
где фрагмент Fab тяжелой цепи вставлен между доменом СН1 одной из тяжелых цепей полноразмерного антитела и соответствующей областью Fc полноразмерного антитела, и N-конец легкой цепи фрагмента Fab конъюгирован с С-концом легкой цепи полноразмерного антитела, которая образует пару с тяжелой цепью полноразмерного антитела, в которую был вставлен фрагмент Fab тяжелой цепи, и
где первый антиген или второй антиген представляет собой человеческий трансферриновый рецептор.
Одним аспектом, как описано в данном документе, является биспецифичное антитело, содержащее:
а) полноразмерное антитело, специфично связывающееся с первым антигеном и состоящее из двух тяжелых цепей антитела и двух легких цепей антитела, и
б) фрагмент Fab, специфично связывающийся со вторым антигеном, содержащий домен VH2 и домен VL2, содержащий фрагмент тяжелой цепи и фрагмент легкой цепи, где
в пределах фрагмента легкой цепи
вариабельный домен легкой цепи VL2 заменен на вариабельный домен тяжелой цепи VH2 указанного антитела,
и
в пределах фрагмента тяжелой цепи
вариабельный домен тяжелой цепи VH2 заменен на вариабельный домен легкой цепи VL2 указанного антитела,
где С-конец фрагмента тяжелой цепи фрагмента Fab конъюгирован с N-концом одной из тяжелых цепей полноразмерного антитела, и С-конец фрагмента легкой цепи фрагмента Fab конъюгирован с N-концом легкой цепи полноразмерного антитела, которая образует пару с тяжелой цепью полноразмерного антитела, с которой конъюгирован фрагмент тяжелой цепи фрагмента Fab, и
где первый антиген или второй антиген представляет собой человеческий трансферриновый рецептор.
В одном воплощении всех аспектов антитело, как описано в данном документе, представляет собой мультиспецифичное антитело, которое требует гетеродимеризации по меньшей мере двух полипептидов тяжелой цепи, и где антитело специфично связывается с человеческим трансферриновым рецептором и вторым антигеном, не являющимся человеческим трансферриновым рецептором.
Было описано несколько подходов для модификаций CH3 для того, чтобы поддерживать гетеродимеризацию, например, в WO 96/27011, WO 98/050431, ЕР 1870459, WO 2007/110205, WO 2007/147901, WO 2009/089004, WO 2010/129304, WO 2011/90754, WO 2011/143545, WO 2012/058768, WO 2013/157954, WO 2013/096291, которые включены в данный документ посредством ссылки. Типично в подходах, известных в данной области, и домен CH3 первой тяжелой цепи, и домен CH3 второй тяжелой цепи генетически модифицированы комплементарным образом таким образом, что тяжелая цепь, содержащая один генетически модифицированный домен CH3, больше не может гомодимеризоваться с другой тяжелой цепью той же самой структуры (например, первая тяжелая цепь с генетически модифицированным CH3 больше не может гомодимеризоваться с другой первой тяжелой цепью с генетически модифицированным CH3; и вторая тяжелая цепь с генетически модифицированным CH3 больше не может гомодимеризоваться с другой второй тяжелой цепью с генетически модифицированным CH3). Посредством этого тяжелая цепь, содержащая один генетически модифицированный домен CH3, принуждается к гетеродимеризации с другой тяжелой цепью, содержащей домен CH3, которая генетически модифицирована комплементарным образом. Для этого воплощения изобретения домен CH3 первой тяжелой цепи и домен CH3 второй тяжелой цепи генетически модифицируются комплементарным образом посредством аминокислотных замен таким образом, что первая тяжелая цепь и вторая тяжелая цепь принуждаются к гетеродимеризации, тогда как первая тяжелая цепь и вторая тяжелая цепь больше не могут гомодимеризоваться (например, по стерическим причинам).
В данной области известны разные подходы для поддержки гетеродимеризации тяжелых цепей, которые были процитированы и включены выше, и они рассматриваются как другие альтернативы, используемые в мультиспецифичном антителе по изобретению, которое содержит «неспаренную область Fab», полученную из первого антитела, которая специфично связывается с первым антигеном, и «спаренную область Fab», полученную из второго антитела, которая специфично связывается со вторым антигеном, в комбинации с конкретными аминокислотными заменами, описанными выше для данного изобретения.
Домены CH3 мультиспецифичного антитела, как описано в данном документе, могут быть изменены посредством технологии «выступ во впадину», которая подробно описана с несколькими примерами, например, в WO 96/027011, Ridgway, J.B., et al., Protein Eng. 9 (1996) 617-621 и Merchant, A.M., et al., Nat. Biotechnol. 16 (1998) 677-681. В данном способе взаимодействующие поверхности двух доменов CH3 изменяют для увеличения гетеродимеризации обеих тяжелых цепей, содержащих данные два домена CH3. Каждый из двух доменов CH3 (двух тяжелых цепей) может быть «выступом», тогда как другой - «впадиной». Введение дисульфидного мостика дополнительно стабилизирует гетеродимеры (Merchant, А.М., et al., Nature Biotech. 16 (1998) 677-681; Atwell, S., et al., J. Mol. Biol. 270 (1997) 26-35) и увеличивает выход.
В одном предпочтительном воплощении мультиспецифичное антитело, как описано в данном документе, содержит мутацию T366W в домене CH3 «цепи выступа» и мутации T366S, L368A, Y407V в домене CH3 «цепи впадины» (нумерация согласно индексу EU по Kabat). Также может быть использован дополнительный межцепоченый дисульфидный мостик между доменами CH3 (Merchant, A.M., et al., Nature Biotech. 16 (1998) 677-681), например, посредством введения мутации Y349C в домен CH3 «цепи выступа» и мутации Е356С или мутации S354C в домен CH3 «цепи впадины». Таким образом, в другом предпочтительном воплощении мультиспецифичное антитело, как описано в данном документе, содержит мутации Y349C и T366W в одном из двух доменов CH3 и мутации Е356С, T366S, L368A и Y407V в другом из двух доменов CH3, или мультиспецифичное антитело, как описано в данном документе, содержит мутации Y349C и T366W в одном из двух доменов CH3 и мутации S354C, T366S, L368A и Y407V в другом из двух доменов CH3 (дополнительная мутация Y349C в одном домене CH3 и дополнительная мутация Е356С или S354C в другом домене CH3, образующая межцепочечный дисульфидный мостик) (нумерация согласно индексу EU по Kabat).
Но также альтернативно или дополнительно можно использовать другие технологии «выступа во впадину», как описано ЕР 1870459 А1. В одном воплощении мультиспецифичное антитело, как описано в данном документе, содержит мутации R409D и K370E в домене CH3 «цепи выступа» и мутации D399K и E357K в домене CH3 «цепи впадины» (нумерация согласно индексу EU по Kabat).
В одном воплощении мультиспецифичное антитело, как описано в данном документе, содержит мутацию T366W в домене CH3 «цепи выступа» и мутации T366S, L368A и Y407V в домене CH3 «цепи впадины», и дополнительно мутации R409D и K370E в домене CH3 «цепи выступа» и мутации D399K и E357K в домене CH3 «цепи впадины» (нумерация согласно индексу EU по Kabat).
В одном воплощении мультиспецифичное антитело, как описано в данном документе, содержит мутации Y349C и T366W в одном из двух доменов CH3 и мутации S354C, T366S, L368A и Y407V в других двух доменах CH3, или мультиспецифичное антитело, как описано в данном документе, содержит мутации Y349C и T366W в одном из двух доменов CH3 и мутации S354C, T366S, L368A и Y407V в других двух доменах CH3 и дополнительно мутации R409D и K370E в домене CH3 «цепи выступа» и мутации D399K и E357K в домене CH3 «цепи впадины» (нумерация согласно индексу EU по Kabat).
Помимо «технологии выступ во впадину» в данной области известны другие методики для модификации доменов CH3 тяжелых цепей мультиспецифичного антитела для усиления гетеродимеризации. Данные технологии, особенно технологии, описанные в WO 96/27011, WO 98/050431, ЕР 1870459, WO 2007/110205, WO 2007/147901, WO 2009/089004, WO 2010/129304, WO 2011/90754, WO 2011/143545, WO 2012/058768, WO 2013/157954 и WO 2013/096291, рассматриваются здесь в качестве альтернатив «технологии выступ во впадину» в сочетании с мультиспецифичным антителом, как описано в данном документе.
В одном воплощении мультиспецифичного антитела, как описано в данном документе, для поддержки гетеродимеризации первой тяжелой цепи и второй тяжелой цепи мультиспецифичного антитела используется подход, описанный в ЕР 1870459. Данный подход основывается на введении заряженных аминокислот с противоположными зарядами в конкретные положения аминокислот на поверхности контакта доменов CH3/CH3 между обеими - первой и второй тяжелыми цепями.
Соответственно, данное воплощение относится к мультиспецифичному антителу, как описано в данном документе, где в третичной структуре антитела домен CH3 первой тяжелой цепи и домен CH3 второй тяжелой цепи образуют поверхность контакта, которая расположена между соответствующими доменами CH3 антитела, где каждая из соответствующих аминокислотных последовательностей домена CH3 первой тяжелой цепи и домена CH3 второй тяжелой цепи содержит набор аминокислот, которые расположены в пределах указанной поверхности контакта в третичной структуре антитела, где из набора аминокислот, которые расположены на поверхности контакта в домене CH3 одной тяжелой цепи первая аминокислота заменена на положительно заряженную аминокислоту, и из набора аминокислот, которые расположены на поверхности контакта в домене CH3 другой тяжелой цепи вторая аминокислота заменена на отрицательно заряженную аминокислоту. Мультиспецифичное антитело согласно данному воплощению в данном документе также называется «CH3(+/-)-генетически модифицированное мультиспецифичное антитело» (где сокращение «+/-» обозначает противоположно заряженные аминокислоты, которые были введены в соответствущие домены CH3).
В одном воплощении указанного CH3(+/-)-генетически модифицированного мультиспецифичного антитела, как описано в данном документе, положительно заряженная аминокислота выбрана из K, R и Н, и отрицательно заряженная аминокислота выбрана из Е или D.
В одном воплощении указанного CH3(+/-)-генетически модифицированного мультиспецифичного антитела, как описано в данном документе, положительно заряженная аминокислота выбрана из K и R, и отрицательно заряженная аминокислота выбрана из Е или D.
В одном воплощении указанного CH3(+/-)-генетически модифицированного мультиспецифичного антитела, как описано в данном документе, положительно заряженная аминокислота представляет собой K, и отрицательно заряженная аминокислота представляет собой Е.
В одном воплощении указанного CH3(+/-)-генетически модифицированного мультиспецифичного антитела, как описано в данном документе, в домене CH3 одной тяжелой цепи аминокислота R в положении 409 заменена на D, и аминокислота K в положении заменена на Е, и в домене CH3 другой тяжелой цепи аминокислота D в положении 399 заменена на K, и аминокислота Е в положении 357 заменена на K (нумерация согласно индексу EU по Kabat).
В одном воплощении мультиспецифичного антитела, как описано в данном документе, для поддержки гетеродимеризации первой тяжелой цепи и второй тяжелой цепи мультиспецифичного антитела используется подход, описанный в WO 2013/157953. В одном воплощении указанного мультиспецифичного антитела, как описано в данном документе, в домене CH3 одной тяжелой цепи аминокислота Т в положении 366 заменена на K, и в домене CH3 другой тяжелой цепи аминокислота L в положении 351 заменена на D (нумерация согласно индексу EU по Kabat). В другом воплощении указанного мультиспецифичного антитела, как описано в данном документе, в домене CH3 одной тяжелой цепи аминокислота Т в положении 366 заменена на K, и аминокислота L в положении 351 заменена на K, и в домене CH3 другой тяжелой цепи аминокислота L в положении 351 заменена на D (нумерация согласно индексу EU по Kabat).
В другом воплощении указанного мультиспецифичного антитела, как описано в данном документе, в домене CH3 одной тяжелой цепи аминокислота Т в положении 366 заменена на K, и аминокислота L в положении 351 заменена на K, и в домене CH3 другой тяжелой цепи аминокислота L в положении 351 заменена на D (нумерация согласно индексу EU по Kabat). Дополнительно в домене CH3 другой тяжелой цепи содержится по меньшей мере одна из следующих замен: аминокислота Y в положении 349 заменена на Е, аминокислота Y в положении 349 заменена на D, и аминокислота L в положении 368 заменена на Е (нумерация согласно индексу EU по Kabat). В одном воплощении аминокислота L в положении 368 заменена на Е (нумерация согласно индексу EU по Kabat).
В одном воплощении мультиспецифичного антитела, как описано в данном документе, для поддержки гетеродимеризации первой тяжелой цепи и второй тяжелой цепи мультиспецифичного антитела используется подход, описанный в WO 2012/058768. В одном воплощении указанного мультиспецифичного антитела, как описано в данном документе, в домене CH3 одной тяжелой цепи аминокислота L в положении 351 заменена на Y, и аминокислота Y в положении 407 заменена на А, и в домене CH3 другой тяжелой цепи аминокислота Т в положении 366 заменена на А, и аминокислота K в положении 409 заменена на F (нумерация согласно индексу EU по Kabat). В другом воплощении в домене CH3 другой тяжелой цепи, помимо вышеупомянутых замен, заменена по меньшей мере одна из аминокислот в положениях 411 (исходно Т), 399 (исходно D), 400 (исходно S), 405 (исходно F), 390 (исходно N) и 392 (исходно K) (нумерация согласно индексу EU по Kabat). Предпочтительными заменами являются следующие:
- замена аминокислоты Т в положении 411 аминокислотой, выбранной из N, R, Q, K, D, Е и W (нумерация согласно индексу EU по Kabat),
- замена аминокислоты D в положении 399 аминокислотой, выбранной из R, W, Y и K (нумерация согласно индексу EU по Kabat),
- замена аминокислоты S в положении 400 аминокислотой, выбранной из Е, D, R и K (нумерация согласно индексу EU по Kabat),
- замена аминокислоты F в положении 405 аминокислотой, выбранной из I, М, Т, S, V и W (нумерация согласно индексу EU по Kabat),
- замена аминокислоты N в положении 390 аминокислотой, выбранной из R, K и D (нумерация согласно индексу EU по Kabat) и
- замена аминокислоты K в положении 392 аминокислотой, выбранной из V, М, R, L, F и Е (нумерация согласно индексу EU по Kabat).
В другом воплощении указанного мультиспецифичного антитела, как описано в данном документе (генетически модифицированное согласно WO 2012/058768), в домене CH3 одной тяжелой цепи аминокислота L в положении 351 заменена на Y, и аминокислота Y в положении 407 заменена на А, и в домене CH3 другой тяжелой цепи аминокислота Т в положении 366 заменена на V, и аминокислота K в положении 409 заменена на F (нумерация согласно индексу EU по Kabat). В другом воплощении указанного мультиспецифичного антитела, как описано в данном документе, в домене CH3 одной тяжелой цепи аминокислота Y в положении 407 заменена на А, и в домене CH3 другой тяжелой цепи аминокислота Т в положении 366 заменена на А, и аминокислота K в положении 409 заменена на F (нумерация согласно индексу EU по Kabat). В указанном последнем вышеупомянутом воплощении в домене CH3 указанной другой тяжелой цепи аминокислота K в положении 392 заменена на Е, аминокислота Т в положении 411 заменена на Е, аминокислота D в положении 399 заменена на R, и аминокислота S в положении 400 заменена на R (нумерация согласно индексу EU по Kabat).
В одном воплощении мультиспецифичного антитела, как описано в данном документе, для поддержки гетеродимеризации первой тяжелой цепи и второй тяжелой цепи мультиспецифичного антитела используется подход, описанный в WO 2011/143545. В одном воплощении указанного мультиспецифичного антитела, как описано в данном документе, в домены CH3 обеих тяжелых цепей вводятся модификации аминокислот в положениях 368 и/или 409 (нумерация согласно индексу EU по Kabat).
В одном воплощении мультиспецифичного антитела, как описано в данном документе, для поддержки гетеродимеризации первой тяжелой цепи и второй тяжелой цепи мультиспецифичного антитела используется подход, описанный в WO 2011/090762. WO 2011/090762 относится к модификациям аминокислот согласно технологии «выступ во впадину». В одном воплощении указанного CH3(KiH)-генетически модифицированного мультиспецифичного антитела, как описано в данном документе, в домене CH3 одной тяжелой цепи аминокислота Т в положении 366 заменена на W, и в домене CH3 другой тяжелой цепи аминокислота Y в положении 407 заменена на А (нумерация согласно индексу EU по Kabat). В другом воплощении указанного CH3(KiH)-генетически модифицированного мультиспецифичного антитела, как описано в данном документе, в домене CH3 одной тяжелой цепи аминокислота Т в положении 366 заменена на Y, и в домене CH3 другой тяжелой цепи аминокислота Y в положении 407 заменена на Т (нумерация согласно индексу EU по Kabat).
В одном воплощении мультиспецифичного антитела, как описано в данном документе, которое принадлежит к изотипу IgG2, для поддержки гетеродимеризации первой тяжелой цепи и второй тяжелой цепи мультиспецифичного антитела используется подход, описанный в WO 2011/090762.
В одном воплощении мультиспецифичного антитела, как описано в данном документе, для поддержки гетеродимеризации первой тяжелой цепи и второй тяжелой цепи мультиспецифичного антитела используется подход, описанный в WO 2009/089004. В одном воплощении указанного мультиспецифичного антитела, как описано в данном документе, в домене CH3 одной тяжелой цепи аминокислота K или N в положении 392 заменена на отрицательно заряженную аминокислоту (в одном предпочтительном воплощении - на Е или D, в одном предпочтительном воплощении - на D), и в домене CH3 другой тяжелой цепи аминокислота D в положении 399, аминокислота Е или D в положении 356, или аминокислота Е в положении 357 заменена на положительно заряженную аминокислоту (в одном предпочтительном воплощении - на K или R, в одном предпочтительном воплощении - на K, в одном предпочтительном воплощении аминокислоты в положениях 399 или 356 заменены на K) (нумерация согласно индексу EU по Kabat). В одном дополнительном воплощении, помимо вышеупомянутых замен, в домене CH3 одной тяжелой цепи аминокислота K или R в положении 409 заменена на отрицательно заряженную аминокислоту (в одном предпочтительном воплощении - на Е или D, в одном предпочтительном воплощении - на D) (нумерация согласно индексу EU по Kabat). В еще одном другом воплощении, помимо или в качестве альтернативы вышеупомянутым заменам, в домене CH3 одной тяжелой цепи аминокислота K в положении 439 и/или аминокислота K в положении 370 независимо друг от друга заменены на отрицательно заряженную аминокислоту (в одном предпочтительном воплощении - на Е или D, в одном предпочтительном воплощении - на D) (нумерация согласно индексу EU по Kabat).
В одном воплощении мультиспецифичного антитела, как описано в данном документе, для поддержки гетеродимеризации первой тяжелой цепи и второй тяжелой цепи мультиспецифичного антитела используется подход, описанный в WO 2007/147901. В одном воплощении указанного мультиспецифичного антитела, как описано в данном документе, в домене CH3 одной тяжелой цепи аминокислота K в положении 253 заменена на Е, аминокислота D в положении 282 заменена на K, и аминокислота K в положении 322 заменена на D, и в домене CH3 другой тяжелой цепи аминокислота D в положении 239 заменена на K, аминокислота Е в положении 240 заменена на K, и аминокислота K в положении 292 заменена на D (нумерация согласно индексу EU no Kabat).
В одном воплощении мультиспецифичного антитела, как описано в данном документе, для поддержки гетеродимеризации первой тяжелой цепи и второй тяжелой цепи мультиспецифичного антитела используется подход, описанный в WO 2007/110205.
В одном воплощении всех аспектов и воплощений, как описано в данном документе, мультиспецифичное антитело представляет собой биспецифичное антитело или триспецифичное антитело. В одном предпочтительном воплощении изобретения мультиспецифичное антитело представляет собой биспецифичное антитело.
В одном воплощении всех аспектов, как описано в данном документе, антитело представляет собой двухвалентное или трехвалентное антитело. В одном воплощении данное антитело представляет собой двухвалентное антитело.
В одном воплощении всех аспектов, как описано в данном документе, мультиспецифичное антитело имеет структуру константного домена антитела типа IgG. В одном другом воплощении всех аспектов, как описано в данном документе, мультиспецифичное антитело характеризуется тем, что указанное мультиспецифичное антитело принадлежит к человеческому подклассу IgG1 или к человеческому подклассу IgG1 с мутациями L234A и L235A. В одном другом воплощении всех аспектов, как описано в данном документе, мультиспецифичное антитело характеризуется тем, что указанное мультиспецифичное антитело принадлежит к человеческому подклассу IgG2. В одном другом воплощении всех аспектов, как описано в данном документе, мультиспецифичное антитело характеризуется тем, что указанное мультиспецифичное антитело принадлежит к человеческому подклассу IgG3. В одном другом воплощении всех аспектов, как описано в данном документе, мультиспецифичное антитело характеризуется тем, что указанное мультиспецифичное антитело принадлежит к человеческому подклассу IgG4 или к человеческому подклассу IgG4 с дополнительной мутацией S228P. В одном другом воплощении всех аспектов, как описано в данном документе, мультиспецифичное антитело характеризуется тем, что указанное мультиспецифичное антитело принадлежит к человеческому подклассу IgG1 или к человеческому подклассу IgG4. В одном другом воплощении всех аспектов, как описано в данном документе, мультиспецифичное антитело характеризуется тем, что указанное мультиспецифичное антитело принадлежит к человеческому подклассу IgG1 с мутациями L234A и L235A (нумерация согласно индексу EU по Kabat). В одном другом воплощении всех аспектов, как описано в данном документе, мультиспецифичное антитело характеризуется тем, что указанное мультиспецифичное антитело принадлежит к человеческому подклассу IgG1 с мутациями L234A, L235A и P329G (нумерация согласно индексу EU по Kabat). В одном другом воплощении всех аспектов, как описано в данном документе, мультиспецифичное антитело характеризуется тем, что указанное мультиспецифичное антитело принадлежит к человеческому подклассу IgG4 с мутациями S228P и L235E (нумерация согласно индексу EU по Kabat). В одном другом воплощении всех аспектов, как описано в данном документе, мультиспецифичное антитело характеризуется тем, что указанное мультиспецифичное антитело принадлежит к человеческому подклассу IgG4 с мутациями S228P, L235E и P329G (нумерация согласно индексу EU по Kabat).
В одном воплощении всех аспектов, как описано в данном документе, антитело, содержащее тяжелую цепь, включающую домен CH3, как определено в данном документе, содержит дополнительный С-концевой глицин-лизиновый дипептид (G446 и K447, нумерация согласно индексу EU по Kabat). В одном воплощении всех аспектов, как описано в данном документе, антитело, содержащее тяжелую цепь, включающую домен CH3, как определено в данном документе, содержит дополнительный С-концевой остаток глицина (G446, нумерация согласно индексу EU по Kabat).
5. Варианты антител
В некоторых воплощениях рассматриваются предложенные в данном документе варианты аминокислотной последовательности антител. Например, может быть желательным улучшение аффинности связывания и/или других биологических свойств антитела. Варианты аминокислотной последовательности антитела могут быть получены введением подходящих модификаций в нуклеотидную последовательность, кодирующую антитело, или посредством пептидного синтеза. Такие модификации включают, например, делеции из и/или вставки в, и/или замены остатков в пределах аминокислотных последовательностей антитела. Можно сделать любую комбинацию делеции, вставки и замены для получения конечной конструкции, при условии, что данная конечная конструкция обладает желательными характеристиками, например, связывания антигена.
а) Варианты с заменой, вставкой и делецией
В некоторых воплощениях предложены варианты антитела, имеющие одну или более чем одну аминокислотную замену. Интересующие сайты для мутагенеза, приводящего к заменам, включают HVR и FR. Консервативные замены показаны в Таблице 1 под заголовком «консервативные замены». В Таблице 1 предложены более существенные замены под заголовком «типичные замены», и, как описано далее ниже по отношению к классам боковых цепей аминокислот. В интересующее антитело могут быть введены аминокислотные замены, и продукты подвергаются скринингу в отношении желательной активности, например, сохраненного/улучшенного связывания антигена, пониженной иммуногенности или улучшенной ADCC или CDC.
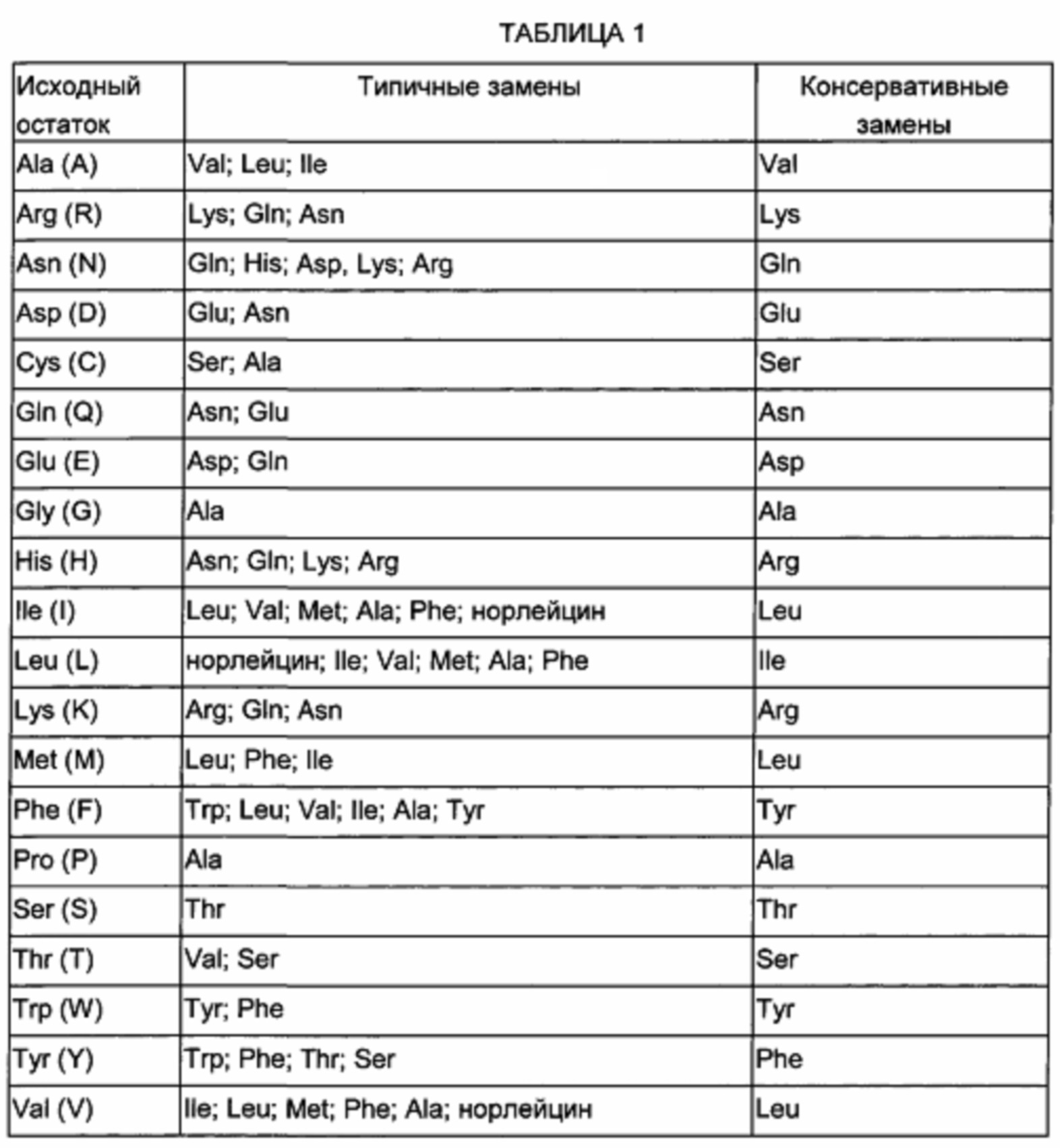
Аминокислоты могут быть сгруппированы согласно общим свойствам боковой цепи:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислотные: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замены будут влечь за собой замену члена одного из данных классов на другой класс.
Один тип варианта с заменами включает замену одного или более чем одного остатка гипервариабельной области родительского антитела (например, гуманизированного или человеческого антитела). В общем, полученный(ные) в результате вариант(ты), отобранный(ные) для дальнейшего исследования, будет(дут) иметь модификации (например, улучшения) некоторых биологических свойств (например, повышенную аффинность, пониженную иммуногенность) относительно родительского антитела и/или будет(дут) иметь по существу сохраняющиеся определенные биологические свойства родительского антитела. Типичным вариантом с заменами является антитело с созревшей аффинностью, которое может быть с удобством получено, например, с использованием методик созревания аффинности на основе фагового дисплея, таких как методики, описанные в данном документе. Вкратце, один или более чем один остаток HVR мутируется, варианты антитела подвергаются дисплею на фаге и подвергаются скринингу на определенную биологическую активность (например, аффинность связывания).
Изменения (например, замены) могут быть сделаны в HVR, например, для улучшения аффинности антитела. Такие изменения могут быть сделаны в «горячих точках» HVR, т.е. остатках, кодируемых кодонами, которые с высокой частотой подвергаются мутации во время процесса соматического созревания (см., например, Chowdhury, P.S., Methods Mol. Biol. 207 (2008) 179-196), и/или остатках, которые контактируют с антигеном, причем полученные в результате варианты VH или VL тестируются на аффинность связывания. Созревание аффинности посредством конструирования и повторного отбора из вторичных библиотек было описано, например, в Hoogenboom, H.R. et al. in Methods in Molecular Biology 178 (2002) 1-37. В некоторых воплощениях созревания аффинности в выбранные для созревания вариабельные гены вводится разнообразие посредством любого из целого ряда способов (например, ПЦР (полимеразная цепная реакция), склонная к ошибкам, перетасовка цепи или мутагенез, управляемый олигонуклеотидом). Затем создается вторичная библиотека. Данная библиотека затем подвергается скринингу для идентификации любых вариантов антитела с желательной аффинностью. Другой способ введения разнообразия включает подходы, направленные на HVR, в которых рандомизируются несколько остатков HVR (например, 4-6 остатков за раз). Остатки HVR, участвующие в связывании антигена, могут быть специфично идентифицированы, например, с использованием мутагенеза на основе аланинового сканирования или моделирования. В частности, часто в качестве мишени используются CDR-H3 и CDR-L3.
В некоторых воплощениях замены, вставки или делеции могут происходить в пределах одной или более чем одной HVR, при условии, что такие изменения по существу не уменьшают способность антитела к связыванию антигена. Например, в HVR могут быть сделаны консервативные изменения (например, консервативные замены, как предложено в данном документе), которые по существу не уменьшают аффинность связывания. Такие изменения, например, могут быть вне остатков, контактирующих с антигеном в HVR. В некоторых воплощениях вариантов последовательностей VH и VL, предложенных выше, каждая HVR либо является неизменной, либо содержит не больше, чем одну, две или три аминокислотные замены.
Полезный способ идентификации остатков или областей антитела, которые могут служить в качестве мишени для мутагенеза, называется «мутагенезом на основе аланинового сканирования», как описано Cunningham, B.C. and Wells, J.A., Science 244 (1989) 1081-1085. В данном способе остаток или группа остатков-мишеней (например, заряженных остатков, таких как Arg, Asp, His, Lys и Glu) идентифицируется и заменяется нейтральной или отрицательно заряженной аминокислотой (например, аланином или полиаланином) для определения того, подвергается ли влиянию взаимодействие антитела с антигеном. Дополнительные замены могут быть введены в положениях аминокислот, демонстрирующих функциональную чувствительность к исходным заменам. В качестве альтернативы или дополнительно, может быть определена кристаллическая структура комплекса антиген-антитело для идентификации контактных точек между антителом и антигеном. Такие контактные остатки и соседние остатки могут служить в качестве мишени или устраняться в качестве кандидатов для замены. Варианты могут быть подвергнуты скринингу для определения того, имеют ли они желательные свойства.
Вставки в аминокислотную последовательность включают амино- и/или карбоксиконцевые слияния, варьирующие по длине от одного остатка до полипептидов, содержащих сто или более чем сто остатков, а также вставки внутри последовательности одиночных или многих аминокислотных остатков. Примеры концевых вставок включают антитело с N-концевым метионильным остатком. Другие вставочные варианты молекулы антитела включают слияние с N- или С-концом антитела фермента (например, для ADEPT (антителоопосредованная терапия с использованием ферментов и пролекарств)) или полипептида, который увеличивает период полувыведения антитела в сыворотке.
б) Варианты по гликозилированию
В некоторых воплощениях предложенное в данном документе антитело изменяют для увеличения или уменьшения степени, в которой гликозилируется антитело. Добавление или делеция сайтов гликозилирования в антителе могут с удобством осуществляться посредством изменения аминокислотной последовательности таким образом, что создается или удаляется один или более чем один сайт гликозилирования.
Когда антитело содержит область Fc, может быть изменен углевод, присоединенный к ней. Природные антитела, продуцированные клетками млекопитающих, типично содержат разветвленный двухантенный олигосахарид, который обычно присоединен N-связью к Asn297 домена СН2 области Fc (см., например, Wright, A. and Morrison, S.L, TIBTECH 15 (1997) 26-32). Данный олигосахарид может включать разные углеводы, например, маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, присоединенную к GlcNAc в «стволе» структуры двухантенного олигосахарида. В некоторых воплощениях могут быть сделаны модификации олигосахарида в антителе по изобретению для того, чтобы создать варианты антитела с некоторыми улучшенными свойствами.
В одном воплощении предложены варианты антитела, имеющие структуру углевода, в которой отсутствует фукоза, присоединенная (прямо или опосредованно) к области Fc. Например, количество фукозы в таком антителе может составлять от 1% до 80%, от 1% до 65%, от 5% до 65% или от 20% до 40%. Количество фукозы определяется посредством расчета среднего количества фукозы в пределах цепи сахара на Asn297 относительно суммы всех гликоструктур, присоединенных к Asn297 (например, сложных, гибридных и высокоманнозных структур), при измерении масс-спектрометрией MALDI-TOF (времяпролетная масс-спектрометрия с лазерной ионизацией и десорбцией из жидкой матрицы), как описано, например, в WO 2008/077546. Asn297 относится к остатку аспарагина, расположеному примерно в положении 297 в области Fc (EU нумерация остатков области Fc); однако, Asn297 также может быть расположен примерно в плюс/минус 3 аминокислотах выше или ниже положения 297, т.е. между положениями 294 и 300, из-за минорных вариаций последовательности в антителах. Такие фукозилированные варианты могут иметь улучшенную функцию ADCC. См., например, US 2003/0157108; US 2004/0093621. Примеры публикаций, относящихся к «дефукозилированным» или «дефицитным по фукозе» вариантам антител включают: US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO 2005/053742; WO 2002/031140; Okazaki, A. et al., J. Mol. Biol. 336 (2004) 1239-1249; Yamane-Ohnuki, N. et al., Biotech. Bioeng. 87 (2004) 614-622. Примеры линий клеток, способных продуцировать дефукозилированные антитела, включают клетки СНО (яичники китайского хомяка) Leс13, дефицитные по фукозилированию белка (Ripka, J. et al., Arch. Biochem. Biophys. 249 (1986) 533-545; US 2003/0157108 и WO 2004/056312, особенно в Примере 11), и нокаутные линии клеток, такие как нокаутные клетки СНО по гену альфа-1,6-фукозилтрансферазы, FUT8 (см., например, Yamane-Ohnuki, N. et al., Biotech. Bioeng. 87 (2004) 614-622; Kanda, Y. et al., Biotechnol. Bioeng. 94 (2006) 680-688 и WO 2003/085107).
Кроме того, предложены варианты антител с разделенными надвое олигосахаридами, например, в которых двухантенный олигасахарид, присоединенный к области Fc антитела, разделен надвое GlcNAc. Такие варианты антител могут иметь пониженное фукозилирование и/или улучшенную функцию ADCC. Примеры таких вариантов антител описываются, например, в WO 2003/011878; US 6602684 и US 2005/0123546. Также предложены варианты антител с по меньшей мере одним остатком галактозы в олигосахариде, присоединенном к области Fc. Такие варианты антител могут иметь улучшенную функцию CDC. Такие варианты антител описываются, например, в WO 1997/30087; WO 1998/58964 и WO 1999/22764.
в) Варианты области Fc
В некоторых воплощениях в область Fc антитела, предложенного в данном документе, могут быть введены одна или более чем одна аминокислотная модификация, генерируя, посредством этого, вариант области Fc. Данный вариант области Fc может содержать последовательность человеческой области Fc (например, области Fc человеческого IgG1, IgG2, IgG3 или IgG4), содержащую аминокислотную модификацию (например, замену) в одном или более чем одном положении аминокислоты.
В некоторых воплощениях согласно данному изобретению рассматривается вариант антитела, который обладает некоторыми, но не всеми эффекторными функциями, которые делают его желательным кандидатом для применений, в которых важным является период полувыведения антитела in vivo, тем не менее, определенные эффекторные функции (такие как комплемент и ADCC) не являются необходимыми или являются вредными. Могут проводиться анализы цитотоксичности in vitro и/или in vivo для подтверждения уменьшения/устранения активностей CDC и/или ADCC. Например, анализы связывания с рецептором Fc (FcR) могут проводиться для обеспечения того, что у антитела отсутствует связывание с FcγR (следовательно, вероятно отсутствует активность ADCC), но сохраняется способность к связыванию с FcRn. У первичных клеток для опосредования ADCC - клеток NK - экспрессируется только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гематопоэтических клетках обобщена в Таблице 3 на странице 464 Ravetch, J.V. and Kinet, J.P., Annu. Rev. Immunol. 9 (1991) 457-492. Неограничивающие примеры анализов in vitro для оценки активности ADCC интересующей молекулы описываются в US 5500362 (см., например, Hellstrom, I. et al., Proc. Natl. Acad. Sci. USA 83 (1986) 7059-7063 и Hellstrom, I. et al., Proc. Natl. Acad. Sci. USA 82 (1985) 1499-1502); US 5821337 (см. Bruggemann, M. et al., J. Exp. Med. 166 (1987) 1351-1361). В качестве альтернативы, можно использовать способы нерадиоактивного анализа (см., например, нерадиоактивный анализ цитотоксичности ACTI™ для проточной цитометрии (CellTechnology, Inc. Mountain View, CA; и нерадиоактивный анализ цитотоксичности CytoTox 96® (Promega, Madison, WI). Полезные эффекторные клетки для таких анализов включают одноядерные клетки периферической крови (РВМС) и клетки-природные киллеры (NK). Альтернативно или дополнительно, активность ADCC интересующей молекулы можно оценивать in vivo, например, в такой животной модели, как модель, раскрытая в Clynes, R. et al., Proc. Natl. Acad. Sci. USA 95 (1998) 652-656. Также можно проводить анализы связывания C1q для подтверждения того, что антитело не способно связываться с C1q и, следовательно, не имеет активности CDC. См., например, ELISA связывания C1q и С3с в WO 2006/029879 и WO 2005/100402. Для оценки активации комплемента можно проводить анализ CDC (см., например, Gazzano-Santoro, H. et al., J. Immunol. Methods 202 (1996) 163-171; Cragg, M.S. et al., Blood 101 (2003) 1045-1052 и Cragg, M.S. and M.J. Glennie, Blood 103 (2004) 2738-2743). Связывание с FcRn и определения клиренса/периода полувыведения in vivo также можно проводить с использованием способов, известных в данной области (см., например, Petkova, S.B. et al., Int. Immunol. 18 (2006: 1759-1769).
Антитела с пониженной эффекторной функцией включают антитела с заменой одного или более чем одного остатка области Fc 238, 265, 269, 270, 297, 327 и 329 (US 6737056). Такие мутанты Fc включают мутантов Fc с заменами в двух или более чем двух положениях аминокислот 265, 269, 270, 297 и 327, включая так называемый мутант Fc «DANA» с заменой остатков 265 и 297 на аланин (US 7332581).
Описаны некоторые варианты антител с улучшенным или уменьшенным связыванием с FcR (см., например, US 6737056; WO 2004/056312 и Shields, R.L. et al., J. Biol. Chem. 276 (2001) 6591-6604).
В некоторых воплощениях вариант антитела содержит область Fc с одной или более чем одной аминокислотной заменой, которая улучшает ADCC, например, с заменами в положениях 298, 333 и/или 334 области Fc (EU нумерация остатков).
В некоторых воплощениях в области Fc делаются изменения, которые приводят к измененным (т.е. либо улучшенным, либо уменьшенным) связыванию с C1q и/или комплементзависимой цитотоксичности (CDC), например, как описано в US 6194551, WO 99/51642 и Idusogie, E.E. et al., J. Immunol. 164 (2000) 4178-4184.
Антитела с увеличенными периодами полувыведения и улучшенным связыванием с неонатальным рецептором Fc (FcRn), который отвечает за перенос материнских IgG в плод (Guyer, R.L. et al., J. Immunol. 117 (1976) 587-593 и Kim, J.K. et al., J. Immunol. 24 (1994) 2429-2434), описываются в US 2005/0014934. Данные антитела содержат область Fc с одной или более чем одной заменой в ней, которая улучшается связывание области Fc с FcRn. Такие варианты Fc включают варианты с заменами в одном или более чем одном остатке Fc: 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 или 434, например, с заменой остатка 434 области Fc (US 7371826).
См. также Duncan, A.R. and Winter, G., Nature 322 (1988) 738-740; US 5648260; US 5624821 и WO 94/29351 относительно других примеров вариантов области Fc.
г) Варианты антител, модифицированные по цистеину
В некоторых воплощениях может быть желательным создание антител, модифицированных по цистеину, например, «тиоМАб», в которых один или более чем один остаток антитела заменен остатком цистеина. В конкретных воплощениях замененные остатки встречаются в доступных сайтах антитела. Посредством замены данных остатков на цистеин реакционноспособные тиольные группы располагаются в доступных сайтах антитела и могут быть использованы для конъюгирования антитела с другими группировками, такими как группировки лекарственных средств или группировки линкер-лекарственное средство, с созданием иммуноконъюгата, как описано в данном документе далее. В некоторых воплощениях любой один или более чем один из следующих остатков может быть заменен на цистеин: V205 (нумерация по Kabat) легкой цепи; А118 (нумерация EU) тяжелой цепи и S400 (нумерация EU) тяжелой цепи области Fc. Антитела, модифицированные по цистеину, могут быть получены, как описано, например, в US 7521541.
д) Производные антител
В некоторых воплощениях предложенное в данном документе антитело может быть дополнительно модифицировано так, чтобы оно содержало дополнительные небелковые группировки, которые известны в данной области и являются легкодоступными. Группировки, подходящие для дериватизации антитела, включают водорастворимые полимеры, но не ограничиваются ими. Неограничивающие примеры водорастворимых полимеров включают полиэтиленгликоль (PEG), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1, 3-диоксолан, поли-1,3,6-триоксан, сополимер этилена/малеинового ангидрида, полиаминокислоты (либо гомополимеры, либо случайные сополимеры) и декстран или поли(н-винилпирролидон)полиэтиленгликоль, гомополимеры пропиленгликоля, сополимеры полипропиленоксида/этиленоксида, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси, но не ограничиваются ими. Полиэтиленгликольпропиональдегид может иметь преимущества в производстве из-за его стабильности в воде. Полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Число полимеров, присоединенных к антителу, может варьировать, и, при присоединении более чем одного полимера, они могут быть одинаковыми или разными молекулами. В общем, число и/или тип полимеров, используемых для дериватизации, могут определяться на основе соображений, включающих конкретные свойства или функции антитела, подлежащие улучшению, но не ограничивающиеся ими, независимо от того, будет ли производное антитела использоваться в терапии при определенных условиях, и т.д.
В другом воплощении предложены конъюгаты антитела и небелковой группировки, которая может быть селективно нагрета под воздействием радиации. В одном воплощении небелковая группировка представляет собой углеродную нанотрубку (Kam, N.W. et al., Proc. Natl. Acad. Sci. USA 102 (2005) 11600-11605). Радиация может иметь любую длину волны и включает длины волн, которые не причиняют вреда обычным клетках, но которые нагревают небелковую группировку до температуры, при которой умерщвляются клетки, приближенные к небелковой группировке антитела, но не ограничивается ими.
Б. Челночные модули гематоэнцефалического барьера
В одном воплощении всех аспектов антитело представляет собой мультиспецифичное антитело, имеющее по меньшей мере одну специфичность связывания в отношении трансферринового рецептора и по меньшей мере одну специфичность связывания в отношении терапевтической мишени. В одном воплощении антитело содержит первый антигенсвязывающий сайт, который связывается с трансферриновым рецептором, и второй антигенсвязывающий сайт, который связывается с мозговым антигеном. В другом воплощении мозговой антиген выбран из группы, стостящей из Абета, рецептора эпидермального фактора роста (EGFR), рецептора 2 человеческого эпидермального фактора роста (HER2), альфа-синуклеина, CD20, глюкоцереброзидазы или белка-предшественника амилоида (АРР). В одном предпочтительном воплощении мультиспецифичное антитело связывается с обоими из следующих:
i) трансферриновый рецептор и Абета, или
ii) трансферриновый рецептор и CD20, или
iii) трансферриновый рецептор и альфа-синуклеин, или
iv) трансферриновый рецептор и фосфо-тау, или
v) трансферриновый рецептор и HER2, или
vi) трансферриновый рецептор и глюкоцереброзидаза.
В одном воплощении антитело представляет собой биспецифичное антитело, содержащее по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 24 и вариабельного домена легкой цепи SEQ ID NO 37, образующую сайт связывания в отношении трансферринового рецептора, и по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 81 и вариабельного домена легкой цепи SEQ ID NO 82 сайта связывания в отношении Абета.
В одном воплощении антитело представляет собой биспецифичное антитело, содержащее по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 24 и вариабельного домена легкой цепи SEQ ID NO 37, образующую сайт связывания в отношении трансферринового рецептора, и по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 79 и вариабельного домена легкой цепи SEQ ID NO 80 сайта связывания в отношении человеческого CD20. В одном воплощении вариабельная область тяжелой цепи содержит замену аминокислотного остатка в положении 11 по Kabat на любую аминокислоту, но не лейцин. В одном воплощении данная замена включает замену аминокислотного остатка в положении 11 по Kabat на неполярную аминокислоту. В одном предпочтительном воплощении данная замена включает замену аминокислотного остатка в положении 11 по Kabat в вариабельном домене тяжелой цепи SEQ ID NO 79 на аминокислотный остаток, выбранный из группы, состоящей из валина, лейцина, изолейцина, серина и фенилаланина.
В одном воплощении антитело представляет собой биспецифичное антитело, содержащее по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 24 и вариабельного домена легкой цепи SEQ ID NO 37, образующую сайт связывания в отношении трансферринового рецептора, и по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 83 и вариабельного домена легкой цепи SEQ ID NO 84 сайта связывания в отношении человеческого альфа-синуклеина.
В одном воплощении антитело представляет собой биспецифичное антитело, содержащее по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 24 и вариабельного домена легкой цепи SEQ ID NO 37, образующую сайт связывания в отношении трансферринового рецептора, и по меньшей мере одну пару гуманизированного вариабельного домена тяжелой цепи, полученного из SEQ ID NO 85, и гуманизированного вариабельного домена легкой цепи, полученного из SEQ ID NO 86, сайта связывания в отношении человеческого альфа-синуклеина.
В одном воплощении антитело представляет собой биспецифичное антитело, содержащее по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 24 и вариабельного домена легкой цепи SEQ ID NO 37, образующую сайт связывания в отношении трансферринового рецептора, и по меньшей мере одну пару гуманизированного вариабельного домена тяжелой цепи, полученного из SEQ ID NO 87, и гуманизированного вариабельного домена легкой цепи, полученного из SEQ ID NO 88, сайта связывания в отношении человеческого альфа-синуклеина.
В одном воплощении антитело представляет собой биспецифичное антитело, содержащее по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 24 и вариабельного домена легкой цепи SEQ ID NO 37, образующую сайт связывания в отношении трансферринового рецептора, и по меньшей мере одну пару гуманизированного вариабельного домена тяжелой цепи, полученного из SEQ ID NO 89, и гуманизированного вариабельного домена легкой цепи, полученного из SEQ ID NO 90, сайта связывания в отношении человеческого альфа-синуклеина.
В одном воплощении антитело представляет собой биспецифичное антитело, содержащее по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 24 и вариабельного домена легкой цепи SEQ ID NO 37, образующую сайт связывания в отношении трансферринового рецептора, и по меньшей мере одну пару гуманизированного вариабельного домена тяжелой цепи, происходящего из SEQ ID NO 91, и гуманизированного вариабельного домена легкой цепи, происходящего из SEQ ID NO 92, сайта связывания в отношении человеческого альфа-синуклеина.
В одном воплощении антитело представляет собой биспецифичное антитело, содержащее по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 24 и вариабельного домена легкой цепи SEQ ID NO 37, образующую сайт связывания в отношении трансферринового рецептора, и по меньшей мере одну пару гуманизированного вариабельного домена тяжелой цепи, происходящего из SEQ ID NO 93, и гуманизированного вариабельного домена легкой цепи, происходящего из SEQ ID NO 94, сайта связывания в отношении человеческого альфа-синуклеина.
В одном воплощении антитело представляет собой биспецифичное антитело, содержащее по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 24 и вариабельного домена легкой цепи SEQ ID NO 37, образующую сайт связывания в отношении трансферринового рецептора, и сайт связывания в отношении человеческой глюкоцереброзидазы.
В одном воплощении антитело представляет собой биспецифичное антитело, содержащее по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 7 и вариабельного домена легкой цепи SEQ ID NO 34, образующую сайт связывания в отношении трансферринового рецептора, и по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 83 и вариабельного домена легкой цепи SEQ ID NO 84 сайта связывания в отношении человеческого альфа-синуклеина.
В одном воплощении антитело представляет собой биспецифичное антитело, содержащее по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 7 и вариабельного домена легкой цепи SEQ ID NO 34, образующую сайт связывания в отношении трансферринового рецептора, и по меньшей мере одну пару гуманизированного вариабельного домена тяжелой цепи, происходящего из SEQ ID NO 85 и гуманизированного вариабельного домена легкой цепи, происходящего из SEQ ID NO 86 сайта связывания в отношении человеческого альфа-синуклеина.
В одном воплощении антитело представляет собой биспецифичное антитело, содержащее по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 7 и вариабельного домена легкой цепи SEQ ID NO 34, образующую сайт связывания в отношении трансферринового рецептора, и по меньшей мере одну пару гуманизированного вариабельного домена тяжелой цепи, происходящего из SEQ ID NO 87, и гуманизированного вариабельного домена легкой цепи, происходящего из SEQ ID NO 88, сайта связывания в отношении человеческого альфа-синуклеина.
В одном воплощении антитело представляет собой биспецифичное антитело, содержащее по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 7 и вариабельного домена легкой цепи SEQ ID NO 34, образующую сайт связывания в отношении трансферринового рецептора, и по меньшей мере одну пару гуманизированного вариабельного домена тяжелой цепи, происходящего из SEQ ID NO 89, и гуманизированного вариабельного домена легкой цепи, происходящего из SEQ ID NO 90, сайта связывания в отношении человеческого альфа-синуклеина.
В одном воплощении антитело представляет собой биспецифичное антитело, содержащее по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 7 и вариабельного домена легкой цепи SEQ ID NO 34, образующую сайт связывания в отношении трансферринового рецептора, и по меньшей мере одну пару гуманизированного вариабельного домена тяжелой цепи, происходящего из SEQ ID NO 91 и гуманизированного вариабельного домена легкой цепи, происходящего из SEQ ID NO 92, сайта связывания в отношении человеческого альфа-синуклеина.
В одном воплощении антитело представляет собой биспецифичное антитело, содержащее по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 7 и вариабельного домена легкой цепи SEQ ID NO 34, образующую сайт связывания в отношении трансферринового рецептора, и по меньшей мере одну пару гуманизированного вариабельного домена тяжелой цепи, происходящего из SEQ ID NO 93, и гуманизированного вариабельного домена легкой цепи, происходящего из SEQ ID NO 94, сайта связывания в отношении человеческого альфа-синуклеина.
В одном воплощении антитело представляет собой биспецифичное антитело, содержащее по меньшей мере одну пару вариабельного домена тяжелой цепи SEQ ID NO 7 и вариабельного домена легкой цепи SEQ ID NO 34, образующую сайт связывания в отношении трансферринового рецептора, и сайт связывания в отношении человеческой глюкоцереброзидазы.
Одновалентные связывающие соединения, которые специфично связываются с рецептором гематоэнцефалического барьера, могут быть охарактеризованы в отношении их свойств связывания и трансцитоза:
- эффективное клеточное связывание с клетками, экспрессирующими РГЭБ, в качестве одновалентного связывающего соединения,
- эффективный трансцитоз in vitro в качестве одновалентного связывающего соединения,
- перекрестная реактивность в отношении антигенов человека-яванского макака (например, в экспериментах BIAcore и FACS (флуоресцентная сортировка клеток)).
Скрининг на трансцитоз можно проводить в анализе на основе hCMEC/D3. Данный анализ можно проводить в режиме импульсного мечения. Мозговые эндотелиальные клетки hCMEC/D3 инкубируются с одновалентным связывающим соединением в течение 1 часа, затем промываются, и в 0 часов и 4 часа после промывки определяются следующие параметры:
i) количество одновалентного связывающего соединения, поглощенного в клетки на протяжении стадии загрузки,
ii) базолатеральное количество одновалентного связывающего соединения через 4 часа после загрузки и промывки;
iii) апикальное количество одновалентного связывающего соединения через 4 часа после загрузки и промывки;
iv) количество одновалентного связывающего соединения в клетках (посредством лизиса в клетках) через 0 часов и 4 часа после загрузки и промывки;
v) общее количество одновалентного связывающего соединения через 0 часов и 4 часа после загрузки и промывки.
Для того чтобы быть подходящим в качестве одновалентного связывающего соединения в челночном модуле гематоэнцефалического барьера, как описано в данном документе, антитело против трансферринового рецептора (например, в виде одновалентного связывающего соединения) должно: i) поглощаться клетками hCMEC/D3 (эндоцитоз), ii) транспортироваться из клеток hCMEC/D3 (экзоцитоз) и iii) быть стабильным в клетках hCMEC/D3 (нет транспорта или слабый транспорт в эндосому для деградации).
Таким образом, в одном воплощении одновалентное связывающее соединение характеризуется в анализе на основе hCMEC/D3 по i) (существенному) поглощению в клетки hCMEC/D3 на протяжении одночасового периода загрузки, ii) высвобождению в апикальный и/или базолатеральный компартмент после периода загрузки и стадии промывки в пределах 4 часов после промывки и iii) низкой скорости (внутриклеточной) деградации.
В одном воплощении загрузка осуществляется в концентрации одновалентного связывающего соединения примерно 2,67 мкг/мл в течение одного часа.
Обнаружили то, что одновалентное связывающее соединение для того, чтобы быть подходящим в качестве одновалентного связывающего соединения челночного модуля гематоэнцефалического барьера, как описано в данном документе, должно демонстрировать в вышеописанном анализе на основе hCMEC/D3 следующие пороговые значения;
i) количество одновалентного связывающего соединения, поглощенного в клетки во время стадии загрузки - 400 пг или более,
ii) базолатеральное количество одновалентного связывающего соединения через 4 часа после загрузки и промывки - 100 пг или более, и
iii) апикальное количество одновалентного связывающего соединения через 4 часа после загрузки и промывки - 150 пг или более.
Мышиное антитело 128.1 против человеческого трансферринового рецептора (относительно последовательностей вариабельной области, см. WO 93/10819 и SEQ ID NO 64 и 65) может быть принято в качестве контроля. В данном случае одновалентное связывающее соединение для того, чтобы быть подходящим в качестве одновалентного связывающего соединения челночного модуля гематоэнцефалического барьера, как описано в данном документе, должно демонстрировать в вышеописанном анализе на основе hCMEC/D3 следующие пороговые значения:
i) количество одновалентного связывающего соединения, поглощенного в клетки во время стадии загрузки 60% или более от загрузки антитела 128.1,
ii) базолатеральное количество одновалентного связывающего соединения через 4 часа после загрузки и промывки - 60% или более от базолатерального количества антитела 128.1; и
iii) апикальное количество одновалентного связывающего соединения через 4 часа после загрузки и промывки - 60% или более от апикального количества антитела 128.1.
Анализ на основе hCMEC/D3 может быть проведен следующим образом (это в одном воплощении всех аспектов, как описано в данном документе):
Среда и добавки для hCMEC/D3 (см. WO 2006/056879 и Weksler, B.B., et al., FASEB J. 19 (2005) 1872-1874) может быть приобретена у Lonza. Клетки hCMEC/D3 (пассажи 26-29) культивируются/могут культивироваться до конфлюентности на покровных стеклах (микроскопических), покрытых коллагеном, или в колбах в среде ЕВМ2, содержащей 2,5% FBS (фетальная телячья сыворотка), четверть поставленных факторов роста, и полностью дополненной поставленными гидрокортизоном, гентамицином и аскорбиновой кислотой.
Для всех анализов трансцитоза используются/могут быть использованы вставки фильтра из PET (полиэтилентерефталат) мембраны с порами высокой плотности (1×108 пор/см2) (размер пор 0,4 мкм, диаметр 12 мм) в 12-луночных планшетах для культуры клеток. Рассчитывается, что объемы сред составляют 400 мкл и 1600 мкл для апикальной и базолатеральной камер соответственно. Апикальные камеры вставок фильтра покрываются/могут быть покрыты коллагеном I хвоста крысы (7,5 мкг/см2), с последующим покрытием фибронектином (5 мкг/мл), причем каждая инкубация длится в течение одного часа при RT (комнатная температура). Клетки hCMEC/D3 выращиваются/могут быть выращены до конфлюентных монослоев (~2×105 клеток/см2) в течение 10-12 суток в среде ЕВМ2. Пустые фильтры блокируются/могут быть заблокированы в PBS (фосфатно-солевой буферный раствор), содержащем 1% BSA (бычий сывороточный альбумин), в течение 1 часа или в течение ночи (о/n) перед анализом и затем калибруются в течение по меньшей мере 1 часа в ЕВМ2 до анализа.
Анализ (относительно схемы анализа см. Фиг. 1) проводили в бессывороточной среде ЕМВ2, которую в иных случаях растворяли, как описано в данном документе. В сутки анализа клетки голодали в отношении сыворотки в течение 60 мин для истощения природного лиганда рассматриваемого рецептора гематоэнцефалического барьера. Вставки фильтра с клетками или без них (но блокированные в течение ночи в полной среде) апикально инкубировали с рассматриваемыми моноклональными антителами (одновалентное связывающее соединение) в течение 1 часа при 37°С. Монослои промывали при комнатной тепературе (RT) в бессывороточной среде апикально (400 мкл) и базолатериально (1600 мкл) три раза каждый раз в течение 3-5 мин. Предварительно нагретую среду добавляли в апикальную камеру, и фильтры переносили в свежий 12-луночный планшет (блокированный в течение ночи PBS, содержащим 1% BSA), содержащий 1600 мкл предварительно нагретой среды. В этот момент фильтры с клетками или без клеток лизировали в 500 мкл буфера RIPA для того, чтобы определить поглощение специфичного антитела (одновалентного связывающего соединения). Остающиеся фильтры инкубировали при 37°С или при 4°С, и образцы отбирали в разные моменты времени для определения апикального и/или базолатерального высвобождения антитела (одновалентного связывающего соединения). Содержание антитела в образцах можно количественно измерять с использованием высокочувствительного ELISA на IgG (см. Пример 9). Для каждого момента времени должны быть получены данные от двух пустых фильтров и трех клеточных культур на фильтре.
В. Способы и композиции генной инженерии
Антитела могут быть получены с использованием способов и композиций генной инженерии, например, как описано в US 4816567. В одном воплощении предложена выделенная нуклеиновая кислота, кодирующая антитело против трансферриного рецептора, описанное в данном документе. Такая нуклеиновая кислота может кодировать аминокислотную последовательность, содержащую VL, и/или аминокислотную последовательность, содержащую VH антитела (например, легкую и/или тяжелую цепи антитела). В другом воплощении предложен один или более чем один вектор (например, экспрессионный вектор), содержащий такую нуклеиновую кислоту. В другом воплощении предложена клетка-хозяин, содержащая такую нуклеиновую кислоту. В одном таком воплощении клетка-хозяин содержит (например, была трансформирована): (1) вектором, содержащим нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и аминокислотную последовательность, содержащую VH антитела, или (2) первый вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и второй вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VH антитела. В одном воплощении клетка-хозяин является эукариотической, например, клеткой яичника китайского хомяка (СНО) или лимфоидной клеткой (например, клеткой Y0, NS0, Sp20). В одном воплощении предложен способ получения антитела против трансферриного рецептора, где данный способ включает культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую антитело, как предложено выше, при подходящих условиях для экспрессии антитела и, возможно, выделение антитела из клетки-хозяина (или культуральной среды клеток-хозяев).
Для рекомбинантной продукции антитела против трансферриного рецептора нуклеиновую кислоту, кодирующую антитело, например, как описано выше, выделяют и вставляют в один или более чем один вектор для дальнейшего клонирования и/или экспрессии в клетке-хозяине. Такую нуклеиновую кислоту можно легко выделять и секвенировать с использованием традиционных методик (например, посредством применения олигонуклеотидных зондов, которые способны к специфичному связыванию с генами, кодирующими тяжелую и легкую цепи антитела).
Подходящие клетки-хозяева для клонирования или экспрессии векторов, кодирующих антитело, включают прокариотические или эукариотические клетки, описанные в данном документе. Например, антитела могут быть продуцированы в бактериях, в частности, когда не требуются гликозилирование и эффекторная функция Fc. Относительно экспрессии фрагментов антитела и полипептидов в бактериях, см., например, US 5648237, US 5789199 и US 5840523. (См. также Charlton, K.A., In: Methods in Molecular Biology, Vol. 248, Lo, B.K.C. (ed.), Humana Press, Totowa, NJ (2003), pp. 245-254, описывающую экспрессию фрагментов антитела в E. coli.). После экспрессии антитело может быть выделено из пасты бактериальных клеток в растворимой фракции и может быть дополнительно очищено.
Помимо прокариотов, подходящими хозяевами клонирования или экспрессии для векторов, кодирующих антитело, являются эукариотические микробы, такие как нитчатые грибки или дрожжи, включающие штаммы грибков и дрожжей, пути гликозилирования которых были «гуманизированы», приводя к продукции антитела с частично или полностью человеческой картиной гликозилирования. См. Gerngross, T.U., Nat. Biotech. 22 (2004) 1409-1414 и Li, H. et al., Nat. Biotech. 24 (2006) 210-215.
Подходящие клетки-хозяева для экспрессии гликозилированного антитела также происходят из многоклеточных организмов (беспозвоночных и позвоночных). Примеры клеток безпозвоночных включают клетки растений и насекомых. Были идентифицированы многочисленные бакуловирусные штаммы, которые можно использовать в сочетании с клетками насекомых, в частности, для трансфекции клеток Spodoptera frugiperda.
Культуры клеток растений также можно использовать в качестве хозяев. См., например, US 5959177, US 6040498, US 6420548, US 7125978 и US 6417429 (описывающие технологию PLANTIBODIES™ для продуцирования антител в трансгенных растениях).
В качестве хозяев также можно использовать клетки позвоночных. Например, могут быть полезными линии клеток млекопитающих, которые адаптированы для роста в суспензии. Другими примерами полезных линий клеток-хозяев млекопитающих являются линия почки обезьяны CV1, трансформированная SV40 (COS-7); линия эмбриональной почки человека (293 или клетки 293, как описано, например, в Graham, F.L. et al., J. Gen Virol. 36 (1977) 59-74); клетки эмбриональной почки хомяка (BHK); мышиные клетки сертоли (клетки ТМ4, как описано, например, в Mather, J.P., Biol. Reprod. 23 (1980) 243-252); клетки почки обезьяны (CV1); клетки почки африканской зеленой мартышки (VERO-76); клетки карциномы шейки матки человека (HELA); клетки почки собаки (MDCK); клетки печени серой крысы (BRL 3А); клетки легкого человека (W138); клетки печени человека (Нер G2); клетки опухоли молочной железы мыши (ММТ 060562); клетки TRI, как описано, например, в Mather, J.P. et al., Annals N.Y. Acad. Sci. 383 (1982) 44-68; клетки MRC 5 и клетки FS4. Другие полезные линии клеток-хозяев млекопитающих включают клетки яичника китайского хомяка (СНО), включающие клетки СНО DHFR- (негативные по дегидрофолатредуктазе) (Urlaub, G. et al., Proc. Natl. Acad. Sci. USA 77 (1980) 4216-4220), и миеломные линии клеток, такие как Y0, NS0 и Sp2/0. Относительно обзора определенных линий клеток-хозяев млекопитающих, подходящих для продукции антител, см., например, Yazaki, P. and Wu, A.M., Methods in Molecular Biology, Vol. 248, Lo, B.K.C. (ed.), Humana Press, Totowa, NJ (2004), pp. 255-268.
Г. Анализы
Предложенные в данном документе антитела против трансферринового рецептора могут быть идентифицированы, подвергнуты скринингу или охарактеризованы на их физические/химические свойства и/или биологические активности посредством разных анализов, известных в данной области.
1. Анализ связывания
В одном аспекте антитело по изобретению тестируется на его антигенсвязывающую активность, например, посредством известных способов, таких как ELISA, alphaLISA, вестерн-блоттинга, микромножества антител или метода чипов с обращенной фазой и т.д.
В типичном анализе ELISA или alphaLISA трансферриновый рецептор в растворе (супернатант клеток, лизаты клеток или тканей, жидкости организма и т.д.) связывается захватывающим антителом, которое специфично связывается с первым эпитопом на трансферриновом рецепторе, или с трансферриновым рецептором в определенной конформации, и выявляющим антителом, связанным с выявляющим соединением, которое специфично связывается со вторым эпитопом или конформацией трансферринового рецептора. Показатель основывается на выявляющем соединении (хемилюминисценция, флуоресценция, люминисценция, индуцированная переносом энергии, и т.д.).
В случае антительного чипа антитела наносятся в виде пятен на стеклянные или нитроцеллюлозные чипы. Данные чипы блокируют и инкубируют с раствором, содержащим трансферриновый рецептор, промывают для удаления несвязавшихся антител, и связавшиеся антитела выявляют соответствующим флуоресцентно меченым вторичным антителом. Флуоресцентный сигнал измеряется посредством сканера флуоресцентных чипов. Аналогичным образом, для чипа с обращенной фазой рекомбинантный трансферриновый рецептор, супернатант клеток, лизаты клеток или тканей, жидкости организма и т.д. наносятся в виде пятен на стеклянные или нитроцеллюлозные чипы. Данные чипы блокируют, и индивидуальные чипы инкубируют с антителом против специфического эпитопа на трансферриновом рецепторе. Несвязавшиеся антитела отмывают, и связавшиеся антитела выявляют соответствующим флуоресцентно меченым вторичным антителом. Флуоресцентный сигнал измеряется посредством сканера флуоресцентных чипов (Dernick, G., et al., J. Lipid Res. 52 (2011) 2323-2331).
Д. Способы и композиции для диагностики и выявления
В некоторых воплощениях любое из предложенных в данном документе антител против трансферринового рецептора является полезным для выявления присутствия человеческого трансферринового рецептора в биологическом образце. Термин «выявление» в том виде, в котором он используется в данном документе, охватывает количественное или качественное выявление. В некоторых воплощениях биологический образец содержит клетку или ткань, такую как мозговая ткань.
В одном воплощении предложено антитело против трансферринового рецептора для применения в способе диагностики или выявления. В другом аспекте предложен способ выявления присутствия трансферринового рецептора в биологическом образце. В некоторых воплощениях данный способ включает приведение биологического образца в контакт с антителом против трансферринового рецептора, как описано в данном документе, при пермиссивных условиях для связывания антитела против трансферринового рецептора с трансферриновым рецептором и выявление того, образуется ли комплекс между антителом против трансферринового рецептора и трансферриновым рецептором. Такой способ может представлять собой способ in vitro или in vivo. В одном воплощении антитело против трансферринового рецептора используется для отбора субъектов, подходящих для терапии антителом против трансферринового рецептора, например, где трансферриновый рецептор представляет собой биомаркер для отбора пациентов.
Типичные расстройства, которые можно диагностировать с использованием антитела по изобретению включают нейродегенерацию с накоплением в мозгу железа типа 1 (NBIA1), синдром Бредбери-Эгглстона, синдром Дауна, комплекс Гуам и несколько расстройств с тельцами Леви, таких как деменция с тельцами Леви (DLBD), вариант болезни Альцгеймера с тельцами Леви (LBVAD), некоторые формы болезни Гоше и деменцию при болезни Паркинсона (PDD).
В некоторых воплощениях предложены меченые антитела против трансферринового рецептора. Метки включают метки или группировки, которые выявляются непосредственно (такие как флуоресцентные, хромофорные, элекронноплотные, хемилюминисцентные и радиоативные метки), а также группировки, такие как ферменты или лиганды, которые выявляются опосредованно, наример, через ферментативную реакцию или молекулярное взаимодействие, но не ограничиваются ими. Типичные метки включают радиоизотопы 32P, 14С, 125I, 3H и 131I, флуорофоры, такие как хелаты редкоземельных металлов или флуоресцеин и их производные, родамин и его производные, дансил, умбеллиферон, люциферазы, например, люциферазу светляка и бактериальную люциферазу (US 4737456), люциферин, 2,3-дигидрофталазиндионы, пероксидазу хрена (HRP), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизоцим, сахаридоксидазы, например, глюкозооксидазу, галактозооксидазу и глюкозо-6-фосфатдегидрогеназу, гетероциклические оксидазы, такие как уриказу и ксантиноксидазу, связанные с ферментом, который использует пероксид водорода для окисления предшественника красителя, таким как HRP (пероксидаза хрена), лактопероксидаза или микропероксидаза, биотин/авидин, спиновые метки, бактериофаговые метки, стабильные свободные радикалы и тому подобное, но не ограничиваются ими.
Е. Фармацевтические препараты
Фармацевтические препараты антитела против трансферринового рецептора, как описано в данном документе, получают смешиванием такого антитела, имеющего желательную степень чистоты, с одним или более чем одним возможным фармацевтически приемлемым носителем (Remington's Pharmaceutical Sciences, 16th edition, Osol, A. (ed.) (1980)), в форме лиофилизированных препаратов или водных растворов. Фармацевтически приемлемые носители обычно являются нетоксичными для реципиентов в применяемых дозировках и концентрациях и включают: буферы, такие как фосфатный, цитратный и на основе других органических кислот; антиоксиданты, включающие аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмония хлорид; гексаметония хлорид; бензалкония хлорид; бензэтония хлорид; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил или пропилпарабен; катехин; резорцин; циклогексанол; 3-пентанол и м-крезол); низкомолекулярные (меньше, чем примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поли(винилпирролидон); аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включающие глюкозу, маннозу или декстрины; хелаторы, такие как EDTA (этилендиаминтетрауксусная кислота); сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как полиэтиленгликоль (PEG), но не ограничиваются ими. Типичные фармацевтически приемлемые носители в данном документе дополнительно включают агенты для диспергирования лекарственного средства в кишечнике, такие как растворимые нейтрально-активные гиалуронидазные гликопротеины (sHASEGP), например, человеческие растворимые гиалуронидазные гликопротеины РН-20, такие как rhuPH20 (HYLENEX®, Baxter International, Inc.). Некоторые типичные sHASEGP и способы применения, включая rhuPH20, описываются в US 2005/0260186 и US 2006/0104968. В одном аспекте sHASEGP объединяется с одной или более чем одной дополнительной гликозаминогликаназой, такой как хондроитиназа.
Типичные лиофилизированные препараты антител описываются в US 6267958. Водные препараты антител включают препараты, описанные в US 6171586 и WO 2006/044908, причем последние препараты включают гистидин-ацетатный буфер.
Описанный в данном документе препарат также может содержать более чем один активный ингредиент, необходимый для конкретного показания, которое лечат, предпочтительно ингредиенты с взаимодополняющими активностями, которые не оказывают вредного влияния друг на друга. Такие активные ингредиенты, подходящим образом, присутствуют в комбинации в количествах, которые являются эффективными для намеченной цели.
Активные ингредиенты могут быть захвачены в микрокапсулы, полученные, например, методиками коацервации или посредством полимеризации на границе раздела фаз, например, в гидроксиметилцеллюлозные или желатиновые микрокапсулы и в поли-(метилметакрилатные) микрокапсулы соответственно, в коллоидные системы доставки лекарственного средства (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методики раскрыты в Remington's Pharmaceutical Sciences, 16th edition, Osol, A. (ed.) (1980).
Могут быть получены препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие антитело, которые находятся в виде формованных предметов, например, пленок или микрокапсул.
Препараты, подлежащие применению для введения in vivo, обычно являются стерильными. Стерильность может легко достигаться, например, посредством фильтрования через мембраны для стерилизующего фильтрования.
Ж. Терапевтические способы и композиции
Любое из предложенных в данном документе антител против TfR можно использовать в терапевтических способах. В одном аспекте предложено антитело против TfR для применения в качестве лекарственного средства. Например, согласно изобретению предложен способ транспортировки терапевтического соединения через гематоэнцефалический барьер, включающий экспонирование антитела против TfR, связанного с терапевтическим соединением (например, мультиспецифичного антитела, которое связывается и с TfR, и с мозговым антигеном), ГЭБ таким образом, что данное антитело транспортирует терапевтическое соединение, связанное с ним, через ГЭБ. В другом примере согласно изобретению предложен способ транспортировки лекарственного средства против неврологического расстройства через гематоэнцефалический барьер, включающий экспонирование антитела против TfR по изобретению, связанного с лекарственным средством против мозгового расстройства (например, мультиспецифичного антитела, которое связывается и с TfR, и с мозговым антигеном), ГЭБ таким образом, что данное антитело транспортирует лекарственное средство против неврологического расстройства, связанное с ним, через ГЭБ. В одном воплощении ГЭБ находится у млекопитающего (например, человека), например, человека, который имеет неврологическое расстройство, включающее, без ограничения: болезнь Альцгеймера (AD), инсульт, деменцию, мышечную дистрофию (MD), рассеянный склероз (MS), боковой амиотрофический склероз (ALS), муковисцидоз, синдром Ангельмана, синдром Лиддла, болезнь Паркинсона, болезнь Пика, болезнь Паджета, рак, травматическое повреждение мозга и т.д. В одном воплощении неврологическое расстройство выбрано из: нейропатии, амилоидоза, рака (например, с участием ЦНС или мозга), глазного заболевания или расстройства, вирусной или микробной инфекции, воспаления (например, ЦНС или мозга), ишемии, нейродегенеративного заболевания, эпилепсии, расстройства поведения, лизосомной болезни накопления и т.д. Антитела по изобретению особенно подходят для лечения таких неврологических расстройств из-за их способности транспортировать один или более чем один ассоциированный активный ингредиент/связанное терапевтическое соединение через ГЭБ и в ЦНС/мозг, где у таких расстройств находится их молекулярная, клеточная или вирусная/микробная основа. Невропатические расстройства представляют собой заболевания или нарушения нервной системы, характеризуемые неподходящей или неконтролируемой нервной сигнализацией или ее отсутствием, и включают хроническую боль (включая ноцицептивную боль), боль, вызванную повреждением тканей организма, включающую боль, связанную с раковым заболеванием, невропатическую боль (боль, вызванная нарушениями в нервах, спинном мозге или головном мозге) и психогенную боль (полностью или главным образом связанную с психологическим расстройством), головную боль, мигрень, нейропатию и симптомы и синдромы, часто сопровождающие такие невропатические расстройства, такие как головокружение или тошнота, но не ограничиваются ими.
Против невропатического расстройства может быть выбрано неврологическое лекарственное средство, которое представляет собой анальгетик, включающий наркотический/опиоидный анальгетик (т.е. морфин, фентанил, гидрокодон, меперидин, метадон, оксиморфон, пентазоцин, пропоксифен, трамадол, кодеин и оксикодон), но не ограничивающийся ими, нестероидное противовоспалительное лекарственное средство (NSAID) (т.е. ибупрофен, напроксен, диклофенак, дифлунизал, этодолак, фенопрофен, флурбипрофен, индометацин, кеторолак, мефенамовая кислота, мелоксикам, набуметон, оксапрозин, пироксикам, сулиндак и толметин), кортикостероид (т.е. кортизон, преднизон, преднизолон, дексаметазон, метилпреднизолон и триамцинолон), агент против мигрени (т.е. суматриптин, альмотриптан, фроватриптан, суматриптан, ризатриптан, элетриптан, золмитриптан, дигидроэрготамин, элетриптан и эрготамин), ацетаминофен, салицилат (т.е. аспирин, холина салицилат, салицилат магния, дифлунизал и салсалат), противоконвульсивное средство (т.е. карбамазепин, клоназепам, габапентин, ламотригин, прегабалин, тиагабин и топирамат), анестетик (т.е. изофлуран, трихлорэтилен, галотан, севофлуран, бензокаин, хлорпрокаин, кокаин, циклометикаин, диметокаин, пропоксикаин, прокаин, новокаин, пропаракаин, тетракаин, артикаин, бупивакаин, картикаин, цинхокаин, этидокаин, левобупивакаин, лидокаин, мепивакаин, пиперокаин, прилокаин, ропивакаин, тримекаин, сакситоксин и тетродотоксин) и ингибитор СОХ-2 (циклооксигеназа-2) (т.е. целекоксиб, рофекоксиб и валдекоксиб). Против невропатического расстройства с участием головокружения может быть выбрано неврологическое лекарственное средство, которое представляет собой агент против головокружения, включающий меклизин, дифенгидрамин, прометазин и диазепам, но не ограничивающийся ими. Против невропатического расстройства с участием тошноты может быть выбрано неврологическое лекарственное средство, которое представляет собой агент против тошноты, включающий прометазин, хлорпромазин, прохлорперазин, триметобензамид и метоклопрамид, но не ограничивающийся ими.
Амилоидозы представляют собой группу заболеваний и расстройств, ассоциированных с внеклеточными белковыми отложениями в ЦНС, включающих вторичный амилоидоз, возрастной амилоидоз, болезнь Альцгеймера (AD), легкие когнитивные нарушения (МСl), деменцию с тельцами Леви, синдром Дауна, наследственный геморрагический инсульт с амилоидозом (голландского типа), комплекс болезни Паркинсона-деменции Гуам, мозговую амилоидную ангиопатию, болезнь Гентингтона, прогрессирующий супрануклеарный паралич, рассеянный склероз, болезнь Крейтцфельда-Якоба, болезнь Паркинсона, трансмиссивную губчатую энцефалопатию, деменцию, связанную с ВИЧ, боковой амиотрофический склероз (ALS), миозит с тельцами включения (IBM) и глазные заболевания, связанные с отложением бета-амилоида (т.е. макулярная дегенерация, оптическая нейропатия, связанная с друзами, и катаракта).
Против амилоидоза может быть выбрано неврологическое лекарственное средство, которое включает антитело или другую связывающую молекулу (включающую маленькую молекулу, пептид, аптамер или другой белковый связывающий агент, но не ограничивающуюся ими), которая специфично связывается с мишенью, выбранной из следующих: бета-секретаза, тау, пресенилин, белок-предшественник амилоида или его части, пептид амилоида-бета или его олигомеры или волокна, рецептор смерти 6 (DR6), рецептор конечных продуктов усиленного гликирования (RAGE), паркин и хантингтин, но не ограничивается ими; ингибитор холинэстеразы (т.е. галантамин, донэпезил, ривастигмин и такрин); антагонист рецептора NMDA (N-метил-D-аспартат) (т.е. мемантин); агент, устраняющий моноамины (т.е. тетрабеназин); эрголоид мезилат; антихолинергический агент против паркинсонизма (т.е. процикпидин, дифенгидрамин, тригексилфенидил, бензтропин, бипериден и тригексифенидил); дофаминергический агент против паркинсонизма (т.е. энтакапон, селегилин, прамипексол, бромокриптин, ротиготин, селегилин, ропинирол, расагилин, апоморфин, карбидопа, леводопа, перголид, толкапон и амантадин); тетрабеназин; противовоспалительное средство (включающее нестероидное противовоспалительное лекарственное средство (т.е. индометицин и другие соединения, перечисленные выше), но не ограничивающееся им; гормон (т.е. эстроген, прогестерон и лейпролид); витамин (т.е. фолат и никотинамид); димеболин; гомотаурин (т.е. 3-аминопропансульфоновая кислота; 3APS); модулятор активности серотонинового рецептора (т.е. ксалипроден); интерферон и глюкокортикоид.
Раковые заболевания ЦНС характеризуются нарушенной пролиферацией одной или более чем одной клетки ЦНС (т.е. нервной клетки) и включают глиому, мультиформную глиобластому, менингиому, астроцитому, невриному слухового нерва, хондрому, олигодендроглиому, медуллобластомы, ганглиоглиому, шванному, нейрофиброму, нейробластому и экстрадуральные, интрамедуллярные, интрадуральные опухоли или метастазы в ЦНС периферических опухолей, таких как CD20- или HER2-позитивные раковые заболевания, но не ограничиваются ими.
Против ракового заболевания может быть выбрано неврологическое лекарственное средство, которое представляет собой химиотерапевтический агент.
Примеры химиотерапевтических агентов включают алкилирующие агенты, такие как тиотепа и циклофосфамид ЦИТОКСАН®; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включающие алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеламин; ацетогенины (особенно буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, МАРИНОЛ®); бета-лапахон; лапахол; колхицины; бетулиновую кислоту; камптотецин (включая синтетический аналог топотекан (ГИКАМТИН®); СРТ-11 (иринотекан, КАМПТОСАР®); ацетилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; каллистатин; СС-1065 (включая его синтетические аналоги адозелезин, карцелезин и бизелезин); подофиллотоксин; подофиллиновую кислоту; тенипозид; криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги, KW-2189 и СВ1-ТМ1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлорэтамин, мехлорэтамина оксида гидрохлорид, мелфалан, новэмбихин, фенестерин, преднимустин, трофосфамид, урацила иприт; нитрозомочевины, такие как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, особенно калихеамицин гaммa1I и калихеамицин омегаI1 (см., например, Agnew. Chem. Intl. Ed. Engl., 33 (1994) 183-186); динемицин, включая динемицин А; эсперамицин; а также хромофор неокарциностатин и родственные хромофоры хромопротеиновых энедииновых антибиотиков), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин АДРИАМИЦИН® (включая, морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин С, микофеноловую кислоту, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пуринов, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидинов, такие как анцитабин, азацитидин, 6-25 азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолон пропионат, эпитиостанол, мепитиостан, тестолактон; антиадреналовые агенты, такие как аминоглутетимид, митотан, трилостан; наполнитель на основе фолиевой кислоты, такой как фролиновая кислота; ацеглатон; альдофосфамида гликозид; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демекольцин; диазиквон; эльфорнитин; эллиптиния ацетат; эпотилон; этоглуцид; нитрат галлия; гидроксимочевину; лентинан; лонидаинин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2''-трихлортриэтиламин; трихотецены (особенно токсин Т-2, верракурин А, роридин А и ангвидин); уретан; виндезин (ЭЛДИЗИН®, ФИЛДЕЗИН®); дакарбазин; манномустин; митобронитол; митолактол; 5 пипоброман; гацитозин; арабинозид ("Ara-С"); тиотепа; таксоиды, например, пакпитаксел ТАКСОЛ® (Bristol-Myers-Squibb Oncology, Princeton, N.J.), сконструированный на основе альбумина препарат наночастиц паклитаксела АБРАКСАН™, не содержащий кремофор (American Pharmaceutical Partners, Шаумберг, Иллинойс) и доксетаксел ТАКСОТЕР® ( Rorer, Antony, Франция); хлоранбуцил; гемцитабин (ГЕМЗАР®); 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин (ВЕЛБАН®); платина; этопозид (VP-16); ифосфамид; митоксантрон; винкристин (ОНКОВИН®); оксалиплатин; лейкововин; винорелбин (НАВЕЛБИН®); новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; капецитабин (КСЕЛОДА®); фармацевтически приемлемые соли, кислоты или производные любого из указанных выше; а также комбинации двух или более чем двух из указанных выше, такие как CHOP, сокращение для комбинированной терапии из циклофосфамида, доксорубицина, винкристина и преднизолона, и FOLFOX, сокращение для схемы лечения оксалиплатином (ЭЛОКСАТИН™), в сочетании с 5-FU и лейкововином.
Rorer, Antony, Франция); хлоранбуцил; гемцитабин (ГЕМЗАР®); 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин (ВЕЛБАН®); платина; этопозид (VP-16); ифосфамид; митоксантрон; винкристин (ОНКОВИН®); оксалиплатин; лейкововин; винорелбин (НАВЕЛБИН®); новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; капецитабин (КСЕЛОДА®); фармацевтически приемлемые соли, кислоты или производные любого из указанных выше; а также комбинации двух или более чем двух из указанных выше, такие как CHOP, сокращение для комбинированной терапии из циклофосфамида, доксорубицина, винкристина и преднизолона, и FOLFOX, сокращение для схемы лечения оксалиплатином (ЭЛОКСАТИН™), в сочетании с 5-FU и лейкововином.
Также включенными в данное определение химиотерапевтических агентов являются антигормональные агенты, которые действуют посредством регуляции, уменьшения, блокирования или ингибирования эффектов гормонов, которые могут стимулировать рост злокачественной опухоли, и они часто используются в форме системного лечения или лечения всего организма. Они сами могут представлять собой гормоны. Примеры включают антиэстрогены и селективные модуляторы рецептора эстрогена (SERM), включая, например, тамоксифен (включая тамоксифен НОЛВАДЕКС®), ралоксифен ЭВИСТА®, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен ФАРЕСТОН®; антипрогестероны; понижающие регуляторы рецептора эстрогена (ERD); агенты, которые выполняют функцию подавления или прекращения работы яичников, например агонисты рилизинг-фактора лютеинизирующего гормона (LHRH), такие как леупролида ацетат ЛУПРОН® и ЭЛИГАРД®, гозерелина ацетат, бузерелина ацетат и триптерелин; другие антиандрогены, такие как флутамид, нилутамид и бикалутамид; и ингибиторы ароматазы, которые ингибируют фермент ароматазу, который регулирует продукцию эстрогена в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглутетимид, мегестрола ацетат МЕГЕЙС®, экземестан АРОМАСИН®, форместан, фадрозол, ворозол РИВИЗОР®, летрозол ФЕМАРА® и анастрозол АРИМИДЕКС®. Кроме того, такое определение химиотерапевтических средств включает бисфосфонаты, такие как клодронат (например, БОНЕФОС® или ОСТАК®), этидронат ДИДРОКАЛ®, NE-58095, золедроновую кислоту/золедронат ЗОМЕТА®, алендронат ФОСАМАКС®, памидронат АРЕДИЯ®, тилудронат 5 СКЕЛИД® или ризедронат АКТОНЕЛ®; а также троксацитабин (1,3-диоксолановый аналог нуклеозида цитозина); антисмысловые олигонуклеотиды, в частности антисмысловые олигонуклеотиды, которые ингибируют экспрессию генов путей сигнализации, вовлеченных в нарушенную пролиферацию клеток, например, таких как PKC-альфа, Raf, H-Ras и рецептор эпидермального фактора роста (EGF-R); вакцины, такие как вакцина ТЕРАТОП® и вакцины гемотерапии, например вакцину АЛЛОВЕКТИН®, вакцину ЛЕУВЕКТИН® и вакцину ВАКСИД®; ингибитор топоизомеразы 1 ЛУРТОТЕКАН®; rmRH АБАРЕЛИКС®; лапатиниба дитозилат (двойной низкомолекулярный ингибитор тирозинкиназы ErbB-2 и EGFR, также известный как GW572016); и фармацевтически приемлемые соли, кислоты или производные любого из приведенных выше.
Другой группой соединений, которые можно выбрать в качестве неврологических лекарственных средств для лечения или предупреждения рака, являются противораковые иммуноглобулины (включающие трастузумаб, пертузумаб, бевацизумаб, алемтузумаб, цетуксимаб, гемтузумаб озогамицин, ибритумомаб тиуксетан, панитумумаб и ритуксимаб, но не ограничивающиеся ими). В некоторых случаях можно использовать антитела в сочетании с токсичной меткой или конъюгат для нацеливания на и умерщвления желательных клеток (т.е. раковых клеток), включая тозитумомаб с радиоактивной меткой 131I или трастузумаб эмтанзин, но не ограничиваясь ими.
Глазными заболеваниями или расстройствами являются заболевания или расстройства глаза, который для целей данного документа считается органом ЦНС, отделенным ГЭБ. Глазные заболевания или расстройства включают расстройства склеры, роговицы, радужки и цилиарного тела (т.е. склерит, кератит, язву роговицы, царапину на роговице, снежную слепоту, ожог глаз, поверхностный точечный кератит Тайджесона, неоваскуляризацию роговицы, дистрофию Фукса, кератоконус, сухой кератоконъюнктивит, ирит и увеит), расстройства хрусталика (т.е. катаракта), расстройства сосудистой оболочки и сетчатки (т.е. отслойка сетчатки, ретиношизис, гипертензивная ретинопатия, диабетическая ретинопатия, ретинопатия, ретинопатия недоношенных, возрастная макулярная дегенерация, макулярная дегенерация (влажная или сухая), эпиретинальная мембрана, пигментная дегенерация сетчатки и макулярный отек), глаукому, плавающие частички, расстройства зрительного нерва и зрительных путей (т.е. наследственная оптическая нейропатия Лебера и друзы диска зрительного нерва), расстройства глазных мышц/бинокулярной двигательной аккомодации/лучепреломления (т.е. косоглазие, офтальмопарез, прогрессирующая внешняя офтальмоплегия, эзотропия, экзотропия, гиперметропия, миопия, астигматизм, анизометропия, пресбиопия и офтальмоплегия), нарушения зрения и слепоту (т.е. амблиопия, врожденный амавроз Левера, скотома, дальтонизм, ахроматопсия, никталопия, слепота, речная слепота и микроофтальмия/колобома), покраснение глаз, зрачок Аргилла Робертсона, кератомиозит, ксерофтальмию и анданиридию, но не ограничиваются ими.
Против глазного заболевания или расстройства может быть выбрано неврологическое лекарственное средство, которое представляет собой антиангиогенный глазной агент (т.е. бевацизумаб, ранибизумаб и пегаптаниб), глазной агент против глаукомы (т.е. карбахол, эпинефрин, демекария бромид, апраклонидин, бримонидин, бринзоламид, левобунолол, тимолол, бетаксолол, дорзоламид, биматопрост, картеолол, метипранолол, дипивефрин, травопрост и латанопрост), ингибитор карбоангидразы (т.е. метазоламид и ацетазоламид), глазной антигистаминный препарат (т.е. нафазолин, фенилэфрин и тетрагидрозолин), глазную смазку, глазной стероид (т.е. фторметолон, преднизолон, лотепреднол, дексаметазон, дифлупреднат, римексолон, флуоцинолон, медризон и триамцинолон), глазной анестетик (т.е. лидокаин, пропаракаин и тетракаин), глазное противоинфекционное средство (т.е. левофлоксацин, гатифлоксацин, ципрофлоксацин, моксифлоксацин, хлорамфеникол, бацитрацин/полимиксин В, сульфацетамид, тобрамицин, азитромицин, бесифлоксацин, норфлоксацин, сульфизоксазол, гентамицин, идоксуридин, эритромицин, натамицин, грамицидин, неомицин, офлоксацин, трифлуридин, ганцикловир, видарабин), глазной противовоспалительный агент (т.е. непафенак, кеторолак, флурбипрофен, супрофен, циклоспорин, триамцинолон, диклофенак и бромфенак) и глазное антигистаминное или противозастойное средство (т.е. кетотифен, олопатадин, эпинастин, нафазолин, кромолин, тетрагидрозолин, пемироласт, бепотастин, нафазолин, фенилэфрин, недокромил, лодоксамид, фенилэфрин, эмедастин и азеластин).
Вирусные или микробные инфекции ЦНС включают инфекции, вызванные вирусами (т.е. вирусом гриппа, ВИЧ (вирус иммунодефицита человека), полиовирусом, вирусом краснухи), бактериями (т.е. Neisseria sp., Streptococcus sp., Pseudomonas sp., Proteus sp., E.coli, S. aureus, Pneumococcus sp., Meningococcus sp., Haemophilus sp. и Mycobacterium tuberculosis) и другими микроорганизмами, такими как грибки (т.е. дрожжи, Cryptococcus neoformans), паразитами (т.е. Toxoplasma gondii) или амебами, но не ограничивающиеся ими, приводящими к патофизиологиям ЦНС, включающим менингит, энцефалит, миелит, васкулит и абсцесс, которые могут быть острыми или хроническими, но не ограничивающимся ими.
Против вирусного или микробного заболевания может быть выбрано неврологическое лекарственное средство, которое включает противовирусное соединение (включающее, противовирусное средство адамантан (т.е. римантадин и амантадин), противовирусный интерферон (т.е. пег-интерферон альфа-2b), но не ограничивающееся ими), антагонист рецептора хемокина (т.е. маравирок), ингибитор переноса нити интегразой (т.е. ралтегравир), ингибитор нейраминидазы (т.е. оселтамивир и занамивир), ненуклеозидный ингибитор обратной транскриптазы (т.е. эфавиренз, этравирин, делавирдин и невирапин), нуклеозидные ингибиторы обратной транскриптазы (тенофовир, абакавир, ламивудин, зидовудин, ставудин, энтекавир, эмтрицитабин, адефовир, залцитабин, телбивудин и диданозин), ингибитор протеазы (т.е. дарунавир, атазанавир, фосампренавир, типранавир, ритонавир, нелфинавир, ампренавир, индинавир и саквинавир), пуриновый нуклеозид (т.е. валацикловир, фамцикловир, ацикловир, рибавирин, ганцикловир, валганцикловир и цидофовир) и разнообразные противовирусные средства (т.е. энфувиртид, фоскарнет, паливизумаб и фомивирсен)), антибиотик (включающий аминопенициллин (т.е. амоксициллин, ампициллин, оксациллин, нафциллин, клоксациллин, диклоксациллин, флукоксациллин, темоциллин, азлоциллин, карбенициллин, тикарциллин, мезлоциллин, пиперациллин и бакампициллин), цефалоспорин (т.е. цефазолин, цефалексин, цефалотин, цефамандол, цефтриаксон, цефотаксим, цефподоксим, цефтазидим, цефадроксил, цефрадин, лоракарбеф, цефотетан, цефуроксим, цефпрозил, цефаклор и цефокситин), карбапенем/пенем (т.е. имипенем, меропенем, эртапенем, фаропенем и дорипенем), монобактам (т.е. азтреонам, тигемонам, норкардицин А и табтоксинин-бета-лактам, ингибитор беталактамазы (т.е. клавулановая кислота, тазобактам и сульбактам) в сочетании с другим бета-лактамовым антибиотиком, аминогликозид (т.е. амикацин, гентамицин, канамицин, неомицин, нетилмицин, стрептомицин, тобрамицин и паромомицин), ансамицин (т.е. гелданамицин и гербимицин), карбацефем (т.е. лоракарбеф), гликопептиды (т.е. тейкопланин и ванкомицин), макролид (т.е. азитромицин, кларитромицин, диритромицин, эритромицин, рокситромицин, тролеандомицин, телитромицин и спектиномицин), монобактам (т.е. азтреонам), хинолон (т.е. ципрофлоксацин, эноксацин, гатифлоксацин, левофлоксацин, ломефлоксацин, моксифлоксацин, норфлоксацин, офлоксацин, тровафлоксацин, грепафлоксацин, спарфлоксацин и темафлоксацин), сульфонамид (т.е. мафенид, сульфонамидохризоидин, сульфацетамид, сульфадиазин, сульфаметизол, сульфаниламид, сульфасалазин, сульфизоксазол, триметоприм, триметоприм и сульфаметоксазол), тетрациклин (т.е. тетрациклин, демеклоциклин, доксициклин, миноциклин и окситетрациклин), антинеопластический или цитотоксический антибиотик (т.е. доксорубицин, митоксантрон, блеомицин, даунорубицин, дактиномицин, эпирубицин, идарубицин, пликамицин, митомицин, пентостатин и валрубицин), но не ограничивающийся ими, разнообразные антибактериальные соединения (т.е. бацитрацин, колистин и полимиксин В)), противогрибковое средство (т.е. метронидазол, нитазоксанид, тинидазол, хлорохин, йодхинол и паромомицин) и противопаразитарные средства (включающие хинин, хлорохин, амодиахин, пириметамин, сульфадоксин, прогуанил, мефлохин, атоваквон, примаквин, артемесинин, галофантрин, доксициклин, клиндамицин, мебендазол, пирантела памоат, тиабендазол, диэтилкарбамазин, ивермектин, рифампин, амфотерицин В, меларсопрол, эфорнитин и альбендазол, но не ограничивающиеся ими.
Воспаление ЦНС включает воспаление, которое вызвано повреждением ЦНС, которое может быть физическим повреждением (т.е. из-за катастрофы, хирургического вмешательства, травмы мозга, повреждения спинного мозга, сотрясения) и повреждением, обусловленным или связанным с одним или более чем одним другим заболеванием или расстройством ЦНС (т.е. абсцессом, раковым заболеванием, вирусной или микробной инфекцией), но не ограничивается ими.
Против воспаления ЦНС может быть выбрано неврологическое лекарственное средство, которое направлено на само воспаление (т.е. нестероидный противовоспалительный агент, такой как ибупрофен или напроксен), или лекарственное средство, которое лечит лежащую в основе причину воспаления (т.е. противовирусный или противораковый агент).
Термин «ишемия ЦНС» в том виде, в котором он используется в данном документе, относится к группе расстройств, относящихся к нарушенным току крови или характеристикам сосудов в мозгу или к их причинам, и включает очаговую ишемию мозга, общую ишемию мозга, инсульт (т.е. подпаутинное кровоизлияние и внутримозговое кровоизлияние) и аневризму, но не ограничивается ими.
Против ишемии может быть выбрано неврологическое лекарственное средство, которое включает тромболитик (т.е. урокиназа, альтеплаза, ретеплаза и тенектеплаза), ингибитор агрегации тромбоцитов (т.е. аспирин, цилостазол, клопидогрел, прасугрел и дипиридамол), статин (т.е. ловастатин, правастатин, флувастатин, росувастатин, аторвастатин, симвастатин, церивастатин и питавастатин) и соединение для улучшения кровотока или гибкости сосудов, включающее, например, лекарственные средства против кровяного давления, но не ограничивается ими.
Нейродегенеративные заболевания представляют собой группу заболеваний и расстройств, ассоциированных с потерей функции или смертью нервных клеток в ЦНС, и они включают адренолейкодистрофию, болезнь Александера, болезнь Альпера, боковой амиотрофический склероз, атаксию-телеангиэктазию, болезнь Баттена, кокаиновый синдром, кортикобазальную дегенерацию, дегенерацию, вызванную или ассоциированную с амилоидозом, наследственную атаксию Фридрейха, лобно-височную лобарную дегенерацию, болезнь Кеннеди, множественную системную атрофию, рассеянный склероз, первичный боковой склероз, прогрессирующий надъядерный паралич, спинальную мышечную атрофию, поперечный миелит, болезнь Рефсума и спинально-церебеллярную атаксию, но не ограничиваются ими.
Против нейродегенеративного заболевания может быть выбрано неврологическое лекарственное средство, которое представляет собой гормон роста или нейротрофический фактор; примеры включают нейротрофический фактор головного мозга (BDNF), фактор роста нервов (NGF), нейротрофин-4/5, фактор роста фибробластов (FGF)-2 и другие FGF, нейротрофин (NT)-3, эритропоэтин (ЕРО), фактор роста гепатоцитов (HGF), эпидермальный фактор роста (EGF), трансформирующий фактор роста (TGF)-альфа, TGF-бета, фактор роста эндотелия сосудов (VEGF), антагонист рецептора интерлейкина-1 (IL-1ra), цилиарный нейротрофический фактор (CNTF), глиальный нейротрофический фактор (GDNF), нейротурин, фактор роста тромбоцитов (PDGF), херегулин, нейрегулин, артемин, персефин, интерлейкины, нейротрофический фактор глиальной линии клеток (GFR), гранулоцитарный колониестимулирующий фактор (GCSF), гранулоцитарно-макрофагальный CSF, нетрины, кардиотрофин-1, хеджхоги, фактор, ингибирующий лейкоз (LIF), мидкин, плейотрофин, морфогенные белки кости (BMP), нетрины, сапозины, семафорины и фактор стволовых клеток (SCF), но не ограничиваются ими.
Конвульсивные заболевания и расстройства ЦНС включают неподходящее и/или ненормальное электрическое проведение в ЦНС, и включают эпилепсию (т.е. малые эпилептические припадки, атонические эпилептические припадки, доброкачественную детскую эпилепсию, детскую абсансную эпилепсию, кпонические судороги, сложные парциальные припдки, лобнодолевую эпилепсию, фебрильные судороги, младенческие судороги, юношескую миоклоническую эпилепсию, юношескую абсансную эпилепсию, синдром Леннокса-Гасто, синдром Ландау-Клеффнера, синдром Драве, синдром Отахара, синдром Веста, миоклонические припадки, митохондриальные расстройства, прогрессирующие миоклонические эпилепсии, психогенные припадки, рефлекторную эпилепсию, синдром Расмуссена, простые парциальные припадки, вторичные генерализованные припадки, височную эпилепсию, тонико-клонические припадки, тонические судороги, психомоторные судороги, лимбическую эпилепсию, парциальные пароксизмы, пароксизмы с генерализованным началом, эпилептический статус, абдоминальную эпилепсию, акинетические припадки, автономные припадки, массовую двухстороннюю миоклонию, катамениальную эпилепсию, атонический припадок, эмоциональные эпилептические припадки, фокальные эпилептические припадки, эпилептические припадки смеха, джексоновский марш, болезнь Лафора, моторные эпилептические припадки, мультифокальные эпилептические припадки, ночные эпилептические припадки, фоточувствительные эпилептические припадки, псевдоэпилептические припадки, сенсорные эпилептические припадки, трудноуловимые эпилептические припадки, ролландическая эпилепсия, абстинентные эпилептические припадки и зрительные рефлекторные эпилептические припадки), но не ограничиваются ей.
Против конвульсивного расстройства может быть выбрано неврологическое лекарственное средство, которое представляет собой противосудорожное или противоэпилептическое средство, включающее барбитуратные противосудорожные средства (т.е. примидон, метарбитал, мефобарбитал, аллобарбитал, амобарбитал, апробарбитал, алфенал, барбитал, браллобарбитал и фенобарбитал), бензодиазепиновые противосудорожные средства (т.е. диазепам, клоназепам и лоразепам), карбаматные противосудорожные средства (т.е. фелбамат), противосудорожные средства на основе ингибитора карбоангидразы (т.е. ацетазоламид, топирамат и зонизамид), дибензазепиновые противосудорожные средства (т.е. руфинамид, карбамазепин и окскарбазепин), противосудорожные средства на основе производного жирной кислоты (т.е. дивалпроэкс и вальпроевая кислота), аналоги гамма-аминомасляной кислоты (т.е. прегабалин, габапентин и вигабатрин), ингибиторы обратного захвата гамма-аминомасляной кислоты (т.е. тиагабин), ингибиторы трансаминазы гамма-аминомасляной кислоты (т.е. вигабатрин), гидантоиновые противосудорожные средства (т.е. фенитоин, этотоин, фосфенитоин и мефенитоин), разнообразные противосудорожные средства (т.е. лакозамид и сульфат магния), прогестины (т.е. прогестерон), оксазолидиндионовые противосудорожные средства (т.е. параметадион и триметадион), пирролидиновые противосудорожные средства (т.е. леветирацетам), сукцинимидные противосудорожные средства (т.е. этосуксимид и метсуксимид), триазиновые противосудорожные средства (т.е. ламотригин) и противосудорожные средства на основе мочевины (т.е. фенацемид и фенэтурид).
Расстройства поведения представляют собой расстройства ЦНС, отличающиеся нарушенным поведением в части пораженного субъекта, и включают расстройства сна (т.е. бессонница, парасомнии, ночные кошмары, расстройства циркадного ритма сна и нарколепсия), расстройства настроения (т.е. депрессия, суицидальная депрессия, тревожность, хронические аффективные расстройства, фобии, панические атаки, обсессивно-компульсивное расстройство, гиперактивное расстройство с дефицитом внимания (ADHD), синдром дефицита внимания (ADD), синдром хронической усталости, агорафобия, посттравматическое стрессовое расстройство, биполярное расстройство), расстройства питания (т.е. анорексия или булимия), психозы, расствойства поведения, связанные с развитием (т.е. аутизм, синдром Ретта, синдром Аспергера), расстройства личности и психотические расстройства (т.е. шизофрения, бредовое расстройство и тому подобные), но не ограничиваются ими.
Против расстройства поведения может быть выбрано неврологическое лекарственное средство, выбранное из соединения, модифицирующего поведение, включающего атипическое антипсихотическое средство (т.е. рисперидон, оланзапин, априпипразол, кветиапин, палиперидон, асенапин, клозапин, илоперидон и зипразидон), фенотиазиновое антипсихотическое средство (т.е. прохлорперазин, хлорпромазин, флуфеназин, перфеназин, трифлуоперазин, тиоридазин и мезоридазин), тиоксантен (т.е. тиотиксен), разнообразные антипсихотические средства (т.е. пимозид, литий, молиндон, галоперидол и локсапин), селективный ингибитор обратного захвата серотонина (т.е. циталопрам, эсциталопрам, пароксетин, флуоксетин и сертралин), ингибитор обратного захвата серотонина-норэпинефрина (т.е. дулоксетин, венлафаксин, десвенлафаксин, трициклический антидепрессант (т.е. доксэпин, кломипрамин, амоксапин, нортриптилин, амитриптилин, тримипрамин, имипрамин, протриптилин и десипрамин), тетрациклический антидепрессант (т.е. миртазапин и мапротилин), фенилпиперазиновый антидепрессант (т.е. тразодон и нефазодон), ингибитор моноаминоксидазы (т.е. изокарбоксазид, фенелзин, селегилин и транилципромин), бензодиазепин (т.е. алпразолам, эстазолам, флуразептам, клоназепам, лоразепам и диазепам), ингибитор обратного захвата норэпинефрина-дофамина (т.е. бупропион), стимулятор ЦНС (т.е. фентермин, диэтилпропион, метамфетамин, декстроамфетамин, амфетамин, метилфенидат, дексметилфенидат, лисдексамфетамин, модафинил, пемолин, фендиметразин, бензфетамин, фендиметразин, армодафинил, диэтилпропион, кафеин, атомоксетин, доксапрам и мазиндол), нейролептик/седативное/снотворное средство (включающее барбитурат (т.е. секобарбитал, фенобарбитал и мефобарбитал), бензодиазепин (как описано выше) и разнообразные нейролептики/седативные/снотворные средства (т.е. дифенгидрамин, оксибат натрия, залеплон, гидроксизин, хлоралгидрат, аолпидем, буспирон, доксэпин, эсзопиклон, рамелтеон, мепробамат и этклорвинол), но не ограничивающееся ими), секретин (см., например, Ratliff-Schaub et al. Autism 9 (2005) 256-265), опиоидный пептид (см., например, Cowen et al., J. Neurochem. 89 (2004) 273-285) и нейропептид (см., например, Hethwa et al. Am. J. Physiol. 289 (2005) E301-305), но не ограничивающегося ими.
Лизосомные болезни накопления представляют собой метаболические расстройства, которые в некоторых случаях ассоциированы с ЦНС или имеют симптомы, специфичные для ЦНС; такие расстройства включают болезнь Тэя-Сакса, болезнь Гоше, болезнь Фабри, мукополисахаридоз (типов I, II, III, IV, V, VI и VII), гликогеноз, GM1-ганглиозидоз, метахроматическую лейкодистрофию, болезь Фарбера, лейкодистрофию Канавана и нейрональные цероидные липофусцинозы типов 1 и 2, болезнь Ниманна-Пика, болезнь Помпе и болезнь Краббе, но не ограничиваются ими.
Против лизосомной болезни накопления может быть выбрано неврологическое лекарственное средство, которое само по себе имеет или иным образом имитирует активность фермента, которая ослаблена при заболевании. Типичные рекомбинантные ферменты для лечения лизосомных болезней накопления включают болезни, изложенные, например, в публикации заявки на патент США №2005/0142141 (т.е. альфа-L20 идуронидаза, идуронат-2-сульфатаза, N-сульфатаза, альфа-N-ацетилглюкозаминидаза, N-ацетилгалактозамин-6-сульфатаза, бета-галактозидаза, арилсульфатаза В, бета-глюкуронидаза, кислая альфа-глюкозидаза, глюкоцереброзидаза, альфа-галактозидаза А, гексозаминидаза А, кислая сфингомиелиназа, бета-галактоцереброзидаза, арилсульфатаза А, кислая церамидаза, аспартоацилаза, пальмитоил-протеинтиоэстераза 1 и трипептидиламинопептидаза 1), но не ограничиваются ими.
В одном аспекте антитело по изобретению используется для выявления неврологического расстройства до проявления симптомов и/или для оценки тяжести или продолжительности заболевания или расстройства. В одном аспекте антитело обеспечивает выявление и/или визуализацию неврологического расстройства, включая визуализацию посредством радиографии, томографии или магнитно-резонансной томографии (МРТ).
В одном аспекте предложено низкоаффинное антитело против TfR по изобретению для применения в качестве лекарственного средства. В других аспектах предложено низкоаффинное антитело против TfR для применения в лечении неврологического заболевания или расстройства (например, болезни Альцгеймера) без обеднения эритроцитами (т.е. ретикулоцитами). В некоторых воплощениях предложено модифицированное низкоаффинное антитело против TfR для применения в способе лечения, как описано в данном документе. В некоторых воплощениях согласно изобретению предложено низкоаффинное антитело против TfR, модифицированное для улучшения его безопасности для применения в способе лечения индивида, имеющего неврологическое заболевание или расстройство, включающем введение данному индивиду эффективного количества антитела против TfR (возможно связанного с лекарственным средством против неврологического расстройства). В одном таком воплощении данный способ дополнительно включает введение индивиду эффективного количества по меньшей мере одного дополнительного терапевтического агента. В других воплощениях согласно изобретению предложено антитело против TfR, модифицированное для улучшения его безопасности для применения в уменьшении или ингибировании образования амилоидных бляшек у пациента, подверженного риску или страдающего от неврологического заболевания или расстройства (например, болезни Альцгеймера). «Индивид» согласно любому из приведенных выше воплощений возможно представляет собой человека. В некоторых аспектах антитело против TfR по изобретению для применения в способах по изобретению улучшает поглощение лекарственного средства против неврологического расстройства, с которым оно связано.
В другом аспекте согласно изобретению предложено применение низкоаффинного антитела против TfR по изобретению в изготовлении или получении лекарственного средства. В одном воплощении данное лекарственное средство предназначено для лечения неврологического заболевания или расстройства. В другом воплощении данное лекарственное средство предназначено для применения в способе лечения неврологического заболевания или расстройства, включающем введение индивиду, имеющему неврологическое заболевание или расстройство, эффективного количества лекарственного средства. В одном таком воплощении данный способ дополнительно включает введение индивиду эффективного количества по меньшей мере одного дополнительного терапевтического агента.
В другом аспекте согласно изобретению предложен способ лечения болезни Альцгеймера. В одном воплощении данный способ включает введение индивиду, имеющему болезнь Альцгеймера, эффективного количества мультиспецифичного антитела по изобретению, которое связывается и с ВАСЕ1, и с TfR или и с Абета, и с TfR. В одном таком воплощении данный способ дополнительно включает введение индивиду эффективного количества по меньшей мере одного дополнительного терапевтического агента. «Индивид» согласно любому из приведенных выше воплощений может представлять собой человека.
Антитела против TfR по изобретению можно использовать в терапии либо одни, либо в комбинации с другими агентами. Например, антитело против TfR по изобретению можно вводить совместно с по меньшей мере одним дополнительным терапевтическим агентом. В некоторых воплощениях дополнительный терапевтический агент представляет собой терапевтический агент, эффективный для лечения того же самого или отличного неврологического расстройства, что и антитело против TfR, используемое для лечения. Типичные дополнительные терапевтические агенты включают разные неврологические лекарственные средства, описанные выше, ингибиторы холинэстеразы (такие как донепезил, галантамин, ровастигмин и такрин), антагонисты рецептора NMDA (такие как мемантин), ингибиторы агрегации бета-пептида амилоида, антиоксиданты, модуляторы γ-секретазы, имитаторы фактора роста нервов (NGF) или генотерапию NGF, агонисты PPARγ, ингибиторы HMS-КoA-редуктазы (статины), ампакины, блокаторы кальциевых каналов, антагонисты рецептора GABA (гамма-аминомасляная кислота), ингибиторы киназы гликогенсинтазы, внутривенный иммуноглобулин, агонисты мускаринового рецептора, модуляторы никотинового рецептора, активная или пассивная иммунизация бета-пептидов амилоида, ингибиторы фосфодиэстеразы, антагонисты рецептора серотонина и антитела против бета-пептида амилоида, но не ограничиваются ими. В некоторых воплощениях по меньшей мере один дополнительный терапевтический агент выбран по его способности облегчать один или более чем один побочный эффект неврологического лекарственного средства.
В некоторых других таких воплощениях по меньшей мере один дополнительный терапевтический агент выбран по его способности ингибировать или предупреждать активацию пути комплемента при введении антитела против TfR. Примеры таких терапевтических агентов включают агенты, которые препятствуют способности антитела против TfR связываться с или активировать путь комплемента, и агенты, которые ингибируют одно или более чем одно молекулярное взаимодействие в пределах пути комплемента, и они в общем описываются в Mollnes and Kirschfink (Molec. Immunol. 43 (2006) 107-121), содержание которой прямо включено в данный документ посредством ссылки, но не ограничиваются ими.
Такие комбинированные терапии, отмеченные выше и в данном документе, охватывают комбинированное введение (где два или более чем два терапевтических агента включены в тот же самый или в отдельные препараты) и раздельное введение, причем в данном случае введение антитела по изобретению может происходить до, одновременно с и/или после введения дополнительного терапевтического агента и/или адъюванта. В одном воплощении введение антитела против TfR и введение дополнительного терапевтического агента происходит в пределах примерно одного месяца или в пределах примерно одной, двух или трех недель, или в пределах примерно одних, двух, трех, четырех, пяти или шести суток друг от друга. Антитела по изобретению также можно использовать в комбинации с другими интервенционными терапиями, такими как лучевая терапия, поведенческая терапия или другие терапии, известные в данной области и подходящие против неврологического расстройства, подлежащего лечению или предупреждению, но не ограничивающимися ими.
Антитело против TfR по изобретению (и любой дополнительный терапевтический агент) можно вводить любыми подходящими способами, включая перентеральный, внутрилегочный и интраназальный, и, если это желательно для местного лечения, введение в область поражения. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Дозирование может осуществляться любым подходящим путем, например, инъекциями, такими как внутривенные или подкожные инъекции, отчасти в зависимости от того является ли введение кратковременным или хроническим. В данном документе рассматриваются разные схемы дозирования, включающие однократные или многократные введения на протяжении разных моментов времени, болюсное введение и импульсную инфузию, но не ограничивающиеся ими.
Антитела по изобретению готовили бы, дозировали и вводили способом, согласующимся с надлежащей медицинской практикой. В данном контексте факторы для принятия во внимание включают конкретное расстройство, которое лечат, конкретное млекопитающее, которое лечат, клиническое состояние индивидуального пациента, причину расстройства, сайт доставки агента, способ введения, схему введения и другие факторы, известные практикующим врачам.
Антитело не обязательно должно быть, но возможно приготовлено с одним или более чем одним агентом, используемым в настоящее время для предупреждения или лечения рассматриваемого расстройства или для предупреждения, облегчения или уменьшения интенсивности одного или более чем одного побочного эффекта введения антитела. Эффективное количество таких других агентов зависит от количества антитела, присутствующего в препарате, типа расстройства или лечения и других факторов, обсуждавшихся выше. Они обычно используются в таких же дозировках и с использованием таких же путей введения, что и описанные в данном документе, или примерно от 1 до 99% от дозировок, описанных в данном документе, или в любой дозировке и посредством любого пути, который эмпирически/клинически определен как подходящий.
Для предупреждения или лечения заболевания подходящая дозировка антитела по изобретению (при использовании его одного или в комбинации с одним или более чем одним другим дополнительным терапевтическим агентом) будет зависеть от типа заболевания, подлежащего лечению, типа антитела, тяжести и хода заболевания, того, вводится ли антитело в профилактических или терапевтических целях, предыдущей терапии, клинической истории пациента, ответа на антитело и решения лечащего врача. Антитело подходящим образом вводится пациенту за один раз или на протяжении серии обработок. В зависимости от типа и тяжести заболевания исходной кандидатной дозировкой для введения пациенту может быть примерно от 1 мкг/кг до 15 мг/кг (например, 0,1 мг/кг - 10 мг/кг) антитела, независимо от того, например, осуществляется ли оно одним или более чем одним раздельным введением или непрерывной инфузией. Одна типичная суточная дозировка может варьировать от примерно 1 мкг/кг до 100 мг/кг или более, в зависимости от факторов, упомянутых выше. Для повторных введений в течение нескольких суток или дольше, в зависимости от условия, лечение обычно поддерживалось бы до желательного подавления симптомов заболевания. Одна типичная дозировка антитела находилась бы в интервале от примерно 0,05 мг/кг до примерно 40 мг/кг. Таким образом, пациенту может вводиться одна или более чем одна доза примерно 0,5 мг/кг, 2,0 мг/кг, 4,0 мг/кг, 5,0 мг/кг, 7,5 мг/кг, 10 мг/кг, 15 мг/кг, 20 мг/кг, 25 мг/кг, 30 мг/кг, 35 мг/кг или 40 мг/кг (или любая их комбинация). Такие дозы могут вводиться периодически, например, каждую неделю или каждые три недели (например, таким образом, что пациент получает от примерно двух до примерно двадцати или, например, примерно шесть доз антитела). Может вводиться исходная более высокая загрузочная доза, с последующими одной или более чем одной меньшими дозами. Однако могут быть полезными другие схемы дозировки. Будет понятно то, что одним способом уменьшения влияния введения антител против TfR на популяции ретикулоцитов является модификация количества или расписания доз таким образом, что в кровотоке присутствуют общие меньшие количества циркулирующего антитела для взаимодействия с ретикулоцитами. В одном неограничивающем примере можно вводить меньшую дозу антител против TfR с большей частотой, чем вводилась бы более высокая доза. Используемая дозировка может быть сбалансирована между необходимым количеством антитела для доставки в ЦНС (которое само связано с аффинностью части антитела, специфичной в отношении антигена ЦНС), аффинностью данного антитела в отношении TfR и тем, является(ются) ли соединение(ния), защищающее(щие) эритроциты (т.е. ретикулоциты), стимулирующее(щие) рост и развитие или ингибирующее(щие) путь комплемента вводимыми совместно или серийно с антителом. Прогресс данной терапии легко отслеживается традиционными методиками и анализами, как описано в данном документе, и как известно в данной области.
Понятно то, что любой из приведенных выше препаратов или терапевтических способов может осуществляться с использованием иммуноконъюгата по изобретению вместо или помимо антитела против TfR.
III. Изделия
В другом аспекте изобретения предложено изделие, содержащее вещества, полезные для лечения, предупреждения и/или диагностики описанных выше расстройств. Изделие содержит контейнер и этикетку или листок-вкладыш в упаковке на или ассоциированные с контейнером. Подходящие контейнеры включают, например, бутыли, флаконы, шприцы, мешки с в.в. (внутривенный) раствором и т.д. Контейнеры могут быть сделаны из целого ряда материалов, таких как стекло или пластмасса. Контейнер содержит композицию, которая сама или в комбинации с другой композицией является эффективной для лечения, предупреждения и/или диагностики состояния, и может иметь стерильный порт доступа (например, контейнер может представлять собой мешок для внутривенного раствора или флакон, имеющий пробку, поддающуюся прокалыванию подкожной инъекционной иглой). По меньшей мере один активный агент в композиции представляет собой антитело по изобретению. На этикетке или листке-вкладыше в упаковке указано то, что композиция используется для лечения выбранного состояния. Кроме того, изделие может содержать (а) первый контейнер с содержащейся в нем композицией, где данная композиция содержит антитело по изобретению; и (б) второй контейнер с содержащейся в нем композицией, где данная композиция содержит дополнительный цитотоксический или иной теапевтический агент. Изделие в данном воплощении изобретения может дополнительно содержать листок-вкладыш в упаковке, на котором указано то, что композиции могут быть использованы для лечения конкретного состояния. Альтернативно или дополнительно, изделие может дополнительно содержать второй (или третий) контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекции (BWFI), фосфатно-солевой буферный раствор, раствор Рингера и раствор декстрозы. Оно может дополнительно включать другие материалы, желательные с коммерческой или пользовательской точки зрения, включающие другие буферы, разбавители, фильтры, иглы и шприцы.
Понятно, что любое из приведенных выше изделий может включать иммуноконъюгат по изобретению вместо или помимо антитела против трансферринового рецептора.
IV. ПРИМЕРЫ
Следующее представляет собой примеры способов и композиций по изобретению. Понятно, что можно практиковать разные другие воплощения, принимая во внимание общее описание, приведенное выше.
Материалы и методы
Методики генной инженерии
Для манипуляции с ДНК использовали стандартные способы, как описано в Sambrook, J. et al., Molecular cloning: A laboratory manual; Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1989. Молекулярно-биологические реактивы использовали согласно инструкциям изготовителя.
Синтез генов и олигонуклеотидов
Желательные сегменты генов получали химическим синтезом в Geneart GmbH (Регенсбург, Германия). Синтезированные фрагменты генов клонировали в плазмиду Е. coli для размножения/амплификации. Последовательности ДНК субклонированных фрагментов генов подтверждали секвенированием ДНК. В качестве альтернативы, короткие фрагменты синтетической ДНК собирали посредством отжига химически синтезированных олигонуклеотидов или посредством ПЦР. Соответствующие олигонуклеотиды были получены Metabion GmbH (Планегг-Мартинсрид, Германия).
Реактивы
Все имеющиеся в продаже химические реактивы, антитела и наборы использовали в том виде, в котором они были предоставлены, согласно протоколу изготовителя, если не утверждается иное.
Пример 1
Иммунизация кроликов и мышей
Иммунизация мышей
Мышей NMRI иммунизировали генетически с использованием плазмидного экспрессионного вектора, кодирующего полноразмерный человеческий TfR или TfR яванского макака, посредством внутрикожного введения 100 мкг ДНК вектора, с последующей электропорацией (2 квадратных импульса 1000 В/см, продолжительность 0,1 мс, интервал 0,125 с; с последующими 4 квадратными импульсами 287,5 В/см, продолжительность 10 мс, интервал 0,125 с. Мыши получали либо 6, либо 7 последовательных иммунизации в сутки 0, 14, 28, 42, 56, 70 и 84. Четвертую и шестую иммунизации проводили с использованием вектора, кодирующего TfR яванского макака; вектор, кодирующий TfR человека, использовали для всех других иммунизаций. Кровь отбирали в сутки 36, 78 и 92, и получали сыворотку, которую использовали для определения титра посредством ELISA (см. ниже). Животных с наивысшими титрами отбирали для повторной иммунизации в сутки 96 посредством внутривенной инъекции либо 106 человеческих клеток TF-1, либо 50 мкг рекомбинантного человеческого растворимого TfR, не имеющего спирального домена (внеклеточный домен человеческого TfR, начинающийся Leu122, заканчивающийся Asn608, экспрессируемый в клетках HEK293F в виде N-концевого слияния с человеческой областью Fc и очищенный аффинной хроматографией на белке А и гель-фильтрацией), и моноклональные антитела выделяли методикой гибридомы на основе их способности связываться с трансферриновым рецептором человека и яванского макака, экспрессируемым на поверхности стабильно трансфицированных клеток СНО-K1 (см. Пример 3).
Иммунизация кроликов
Белых новозеландских кроликов или трансгенных кроликов, экспрессирующих репертуар гуманизированных антител, иммунизировали генетически с использованием плазмидного экспрессионного вектора, кодирующего полноразмерный человеческий TfR или TfR яванского макака, посредством внутрикожного введения 400 мкг ДНК вектора, с последующей электропорацией (5 квадратных импульсов 750 В/см, продолжительность 10 мс, интервал 1 с). Кролики получали 6 последовательных иммунизаций в сутки 0, 14, 28, 56, 84 и 112. Четвертую и шестую иммунизации проводили с использованием вектора, кодирующего TfR яванского макака; вектор, кодирующий TfR человека, использовали для всех других иммунизаций. Кровь (10% оценочного общего объема крови) отбирали в сутки 35, 63, 91 и 119. Получали сыворотку, которую использовали для определения титра посредством ELISA (см. ниже), и выделяли одноядерные клетки периферической крови, которые использовали в качестве источника антигенспецифичных В-клеток в способе клонирования В-клеток (см. Пример 2).
Определение сывороточных титров (ELISA)
Человеческий рекомбинантный растворимый TfR (R&D Systems, Кат. №2474-TR) иммобилизовали на 96-луночном планшете NUNC Maxisorp в концентрации 3 мкг/мл, 100 мкл/лунку в PBS (фосфатно-солевой буферный раствор), с последующими: блокированием планшета 2% кротеином С в PBS, 200 мкл/лунку; нанесением серийных разведений антисыворотки в двойных повторностях в 0,5% кротеине С в PBS, 100 мкл/лунку; выявлением (1) антителом козы против мышиного антитела, конъюгированным с HRP (пероксидаза хрена) (Jackson Immunoresearch/Dianova 115-036-071; 1/16 000) для всех мышиных сывороток, (2) антителом осла против кроличьего IgG, конъюгированным с HRP (Jackson Immunoresearch/Dianova 711-036-152; 1/16 000) для всех кроличьих сывороток, (3) кроличьим антителом против человеческого IgG (Pierce/Thermo Scientific 31423; 1/5000) только для сывороток из трансгенных кроликов, (4) биотинилированным антителом козы против цепи каппа человека (Southern Biotech/Biozol 2063-08, 1/5000) и стрептавидином-HRP только для сывороток из трансгенных кроликов; разведенных в 0,5% кротеине С в PBS, 100 мкл/лунку. Для всех этапов планшеты инкубировали в течение 1 ч при 37°С. Между всеми этапами планшеты 3 раза промывали 0,05% Tween 20 в PBS. Сигнал проявляли добавлением растворимого субстрата POD (пероксидаза) ВМ Blue (Roche), 100 мкл/лунку; и останавливали развитие реакции добавлением 1 М HCl, 100 мкл/лунку. Поглощение считывали при 450 нм по сравнению с 690 нм в качестве контроля. Титр определяли как разведение антисыворотки, приводящее к полумаксимальному сигналу.
Пример 2
Клонирование В-клеток из кроликов
Выделение кроличьих одноядерных клеток периферической крови (РВМС)
Вкратце, образцы крови отбирали у 6 животных (2 кролика дикого типа (wt) и 4 трансгенных (tg) кролика). Данные кролики происходили из 2 разных кампаний иммунизации: первая кампания с 2 wt и 2 tg кроликами и вторая кампания с 2 tg кроликами (см. также пример «Иммунизация кроликов»). Цельную кровь, содержащую EDTA, двухкратно разводили 1× PBS (РАА, Пашинг, Австрия) перед центрифугированием в градиенте плотности с использованием лимфолита для млекопитающих (Cedarlane Laboratories, Burlington, Онтарио, Канада) согласно спецификациям изготовителя. РВМС дважды промывали 1× PBS.
Среда EL-4 B5
Использовали RPMI 1640 (Pan Biotech, Aidenbach, Германия), дополненную 10% FCS (фетальная телячья сыворотка) (Hyclone, Logan, UT, США), 2 мМ глутамином, раствором 1% пенициллина/стрептомицина (РАА, Pasching, Австрия), 2 мМ пируватом натрия, 10 мМ HEPES (PAN Biotech, Aidenbach, Германия) и 0,05 мМ β-меркаптоэтанолом (Gibco, Paisley, Шотландия).
Истощение популяции клеток
Первая кампания иммунизации: стерильные 6-луночные планшеты (уровня качества для культуры клеток), покрытые конфлюентным монослоем клеток СНО (яичники китайского хомяка), использовали для истощения популяции макрофагов/моноцитов через неспецифичную адгезию, а также неспецифично связывающиеся лимфоциты.
Вторая кампания иммунизации: стадию истощения популяции с использованием лунок, покрытых клетками СНО, опускали, так как авторы изобретения не могли исключать того, что были бы истощены те В-клетки, продуцирующие антитела, которые являются перекрестно реагирующими с антителами хомяка против трансферринового рецептора. Следовательно, использовали пустые стерильные 6-луночные планшеты (уровня качества для культуры клеток) для истощения популяции макрофагов и моноцитов через неспецифичную адгезию, обеспечивая потенциальные В-лимфоциты, продуцирующие поверхностные антитела, перекрестно реагирующие с антигенами хомяка (и, возможно, перекрестно реагирующие с антигенами мыши), для достижения следующего этапа в последовательности операций.
Для каждой кампании иммунизации: каждую лунку заполняли максимум 4 мл среды и вплоть до 6×106 РВМС от иммунизированного кролика и давали связываться в течение 1 ч при 37°С в инкубаторе. Для стадии пэннинга антигена использовали клетки в супернатанте (лимфоциты периферической крови (PBL)).
Обогащение В-клеток на человеческом трансферриновом рецепторе
В 6-луночные планшеты для культуры ткани, покрытые монослоем клеток СНО, позитивных в отношении человеческого трансферринового рецептора, высевали вплоть до 6×106 PBL на 4 мл среды и давали связываться в течение 1 ч при 37°С в инкубаторе. Неприкрепившиеся клетки удаляли тщательной промывкой лунок 1× PBS 1-2 раза. Остающиеся липкие клетки отделяли трипсином в течение 10 мин при 37°С в инкубаторе. Трипсинизацию останавливали средой EL-4 B5. До иммунофлуоресцентного окрашивания клетки выдерживали на льду.
Иммунофлуоресцентное окрашивание и проточная цитометрия
Для сортировки одиночных клеток использовали антитело против IgG, конъюгированное с FITC (флуоресцеинизотиоцианат) (AbD Serotec, Дюссельдорф, Германия). Для окрашивания поверхности клетки со стадии истощения популяции и обогащения инкубировали с антителом против IgG, конъюгированным с FITC, в PBS и инкубировали в течение 45 минут в темноте при 4°С. После окрашивания РВМС дважды промывали ледяным PBS. Наконец, РВМС ресуспендировали в ледяном PBS и немедленно подвергали анализам FACS. Перед анализами FACS добавляли пропидия йодид в концентрации 5 мкг/мл (BD Pharmingen, Сан-Диего, СА, США) для различения между мертвыми и живыми клетками.
Для сортировки одиночных клеток использовали Becton Dickinson FACSAria, оснащенную компьютером и программой FACSDiva (BD Biosciences, США).
Культивирование В-клеток
Культивирование кроличьих В-клеток проводили способом, аналогичным способу, описанному Zubler et al. (1985). Вкратце, одиночные сортированные кроличьи В-клетки инкубировали в 96-луночных планшетах с 200 мкл/лунку среды EL-4 B5, содержащей клетки Pansorbin (1:100000) (Calbiochem (Merck), Дармштадт, Германия), 5% супернатанта кроличьих тимоцитов (загрузка TSN-M13 (10242), MicroCoat, Бернрид, Германия) и гамма-облученные клетки мышиной тимомы EL-4-В5 (2,5×104/лунку) в течение 7 суток в атмосфере 5% CO2 в инкубаторе при 37°С. Супернатанты культуры В-клеток удаляли для скрининга, и остающиеся клетки немедленно отбирали и замораживали при -80°С в 100 мкл буфера RLT (Qiagen, Хильден, Германия).
Пример 3
Идентификация антител человека и яванского макака, связывающихся с TfR, последством клеточного ELISA
Для скрининга кроличьих В-клеток или супернатантов мышиной гибридомы на антитела, распознающие TfR человека и яванского макака, использовали клеточный ELISA (твердофазный иммуноферметный анализ) стабильно трансфицированных клеток СНО-K1. Стабильных трансфектантов получали посредством трансфицирования клеток СНО-K1 экспрессионными плазмидами, содержащими экспрессионные кассеты для TfR человека и яванского макака, а также для неомицин-фосфотрансферазы. После трансфекции клетки разводили в ростовой среде, содержащей 500 мкг/мл G418 (Life Techologies). После появления растущих клонов клетки отделяли, окрашивали MEM-75 (Abcam) или 13Е4 (Life Technologies) и вторичными антителами, меченными РЕ (фосфоэстераза), на TfR человека или яванского макака, и сильно флуоресцирующие клетки, сортировали в виде одиночных клеток в лунки 96-луночного планшета (FACS Aria). После 7 суток роста клоны вновь проверяли на экспрессию TfR, и лучше всего экспрессирующие клоны отбирали для экспериментов с клеточным ELISA.
Вкратце, 15000 клеток на лунку высевали в 384-луночный планшет и инкубировали в течение 18 ч при 37°С, 5% CO2. Супернатант удаляли с использованием автоматического промывочного устройства (BIOTEK), и в каждую лунку добавляли 30 мкл супернатанта, содержащего антитело, с последующими 24 мкл ростовой среды. После 2 часов инкубации лунки опустошали, и добавляли 30 мкл 0,05%-ного глутаральдегида в PBS на 45 мин при RT (комнатная температура). После 3 промывок PBS/0,025% Tween 20 (PBST) добавляли 30 мкл антитела против кроличьего антитела, конъюгированного с HRP (пероксидаза хрена), или антитела против мышиного антитела, конъюгированного с HRP (Southern Biotech), разведенных 1:5000 в блокирующем буфере, и планшеты инкубировали в течение 1 часа при RT. Лунки промывали 6 раз PBST, сигнал генерировался с использованием 30 мкл ТМВ (тетраметилбензидин) на лунку, и поглощение измеряли при 450 нм.
Пример 4
Клонирование и экспрессия антител против TfR
Методики генной инженерии
Для манипуляции с ДНК использовали стандартные способы, как описано в Sambrook, J. et al., Molecular cloning: A laboratory manual; Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1989. Молекулярно-биологические реактивы использовали согласно инструкциям изготовителя.
Синтез генов и олигонуклеотидов
Желательные сегменты генов получали химическим синтезом в Geneart GmbH (Регенсбург, Германия). Синтезированные фрагменты генов клонировали в плазмиду Е. coli для размножения/амплификации. Последовательности ДНК субклонированных фрагментов генов подтверждали секвенированием ДНК. В качестве альтернативы, короткие фрагменты синтетической ДНК собирали посредством отжига химически синтезированных олигонуклеотидов или посредством ПЦР. Соответствующие олигонуклеотиды были получены Metabion GmbH (Планегг-Мартинсрид, Германия).
ПЦР-амплификация V-доменов
Общую РНК получали из лизата В-клеток (ресуспендированного в буфере RLT - Qiagen - кат. №79216) с использованием набора NucleoSpin 8/96 RNA (Macherey&Nagel; 740709.4, 740698) согласно протоколу изготовителя. РНК элюировали 60 мкл воды, не содержащей РНКазы. 6 мкл РНК использовали для получения кДНК посредством реакции обратной транскриптазы с использованием суперсмеси для синтеза первой нити Superscript III (Invitrogen 18080-400) и олиго-dT-праймера согласно инструкциям изготовителя. Все стадии проводили на системе Hamilton ML Star. Для амплификации вариабельных областей тяжелой и легкой цепи (VH и VL) иммуноглобулина использовали 4 мкл кДНК с суперсмесью AccuPrime (Invitrogen 12344-040) в конечном объеме 50 мкл с использованием праймеров rbHC.up и rbHC.do для тяжелой цепи, rbLC.up и rbLC.do для легкой цепи кроличьих В-клеток дикого типа, и BcPCR_FHLC_leader.fw и BcPCR_huCkappa.rev для легкой цепи трансгенных кроличьих В-клеток (см. Таблицу ниже). Все прямые праймеры были специфичными в отношении сигнального пептида (соответственно VH и VL), тогда как обратные праймеры были специфичными в отношении константных областей (соответственно VH и VL). Условия ПЦР для RbVH плюс RbVL были следующими: горячий старт при 94°С в течение 5 мин; 35 циклов по 20 с при 94°С, 20 с при 70°С, 45 с при 68°С и конечное удлинение при 68°С в течение 7 мин. Условия ПЦР для HuVL были следующими: горячий старт при 94°С в течение 5 мин; 40 циклов по 20 с при 94°С, 20 с при 52°С, 45 с при 68°С и конечное удлинение при 68°С в течение 7 мин.

8 мкл из 50 мкл раствора ПЦР загружали на 48 Е-гель 2% (Invitrogen G8008-02). Позитивные реакции ПЦР подвергали очистке с использованием набора NucleoSpin Extract II (Macherey&Nagel; 740609250) согласно протоколу изготовителя и элюировали в 50 мкл элюирующего буфера. Все стадии очистки проводили на системе Hamilton ML Starlet.
Рекомбинантная экспрессия кроличьих моноклональных двухвалентных антител
Для рекомбинантной экспрессии кроличьих моноклональных двухвалентных антител ПЦР-продукты, кодирующие VH или VL, клонировали в виде кДНК в экспрессионные векторы посредством способа клонирования с «липкими» концами (RS Haun et al., BioTechniques (1992) 13, 515-518; MZ Li et al., Nature Methods (2007) 4, 251-256). Данные экспрессионные векторы содержали экспрессионную кассету, состоящую из 5' промотора CMV (цитомегаловирус), включающего интрон А, и 3' последовательность полиаденилирования BGH. Помимо экспрессионной кассеты плазмиды содержали репликатор, происходящий из pUC18, и ген бета-лактамазы, придающий устойчивость к ампициллину, для амплификации плазмиды в Е. coli. Использовали три варианта базовой плазмиды: одну плазмиду, содержащую константную область кроличьего IgG, сконструированную для принятия областей VH, тогда как две дополнительные плазмиды содержат константную область LC каппа кролика или человека для принятия областей VL.
Линеаризованные экспрессионные плазмиды, кодирующие константную область каппа или гамма и вставки VL/VH, амплифицировали посредством ПЦР с использованием перекрывающихся праймеров.
Очищенные ПЦР-продукты инкубировали с ДНК-полимеразой Т4, которая генерировала однонитевые «липкие» концы. Данную реакцию останавливали добавлением dCTP (дезоксицитозинтрифосфат).
На следующей стадии плазмиду и вставку объединяли и инкубировали с recA, которая индуцировала сайт-специфичную рекомбинацию. Рекомбинантные плазмиды трансформировали в Е. coli. На следующие сутки выросшие колонии собирали и тестировали на правильную рекомбинированную плазмиду посредством получения плазмиды, рестрикционного анализа и секвенирования ДНК.
Для экспрессии антитела выделенные плазмиды НС и LC временно сотрансфицировали в клетки HEK293, и супернатанты отбирали через 1 неделю.
Получение векторов для экспрессии кроличьих моноклональных одновалентных антител
Для рекомбинантной экспрессии отобранных кандидатов в качестве моноклональных одновалентных антител кроличьи константные области всех цепей VH превращали в человеческие константные области, заключающие мутацию, приводящую к выступу, в сегменте CH3. Для цепей VL, полученных из кроличьих В-клеток дикого типа, кроличьи константные области С каппа превращали в человеческие. Для амплификации вариабельных областей тяжелой и легкой цепи иммуноглобулина использовали 4 мкл кДНК отобранных кандидатов с суперсмесью AccuPrime (Invitrogen 12344-040) в конечном объеме 50 мкл с использованием прямых праймеров, специфичных в отношении сигнального пептида, и обратных праймеров, специфичных в отношении области CDR3-J, с перекрывающейся последовательностью (на 3'-конце) (20 п.о.), гомологичной человеческим константным областям (соответственно VH и VL). Условия ПЦР для амплификации цепи VH и VL были следующими: горячий старт при 94°С в течение 5 мин; 35 циклов по 20 с при 94°С, 20 с при 68°С, 45 с при 68°С и конечное удлинение при 68°С в течение 7 мин.
ПЦР-продукты, кодирующие VH или VL, клонировали в экспрессионные векторы в виде кДНК посредством способа клонирования с липкими концами (RS Haun et al., BioTechniques (1992) 13, 515-518; MZ Li et al., Nature Methods (2007) 4, 251-256). Данные экспрессионные векторы содержали экспрессионную кассету, состоящую из 5' промотора CMV, включающего интрон А, и 3' последовательность полиаденилирования BGH. Помимо экспрессионной кассеты плазмиды содержали репликатор, происходящий из pUC18, и ген бета-лактамазы, придающий устойчивость к ампициллину, для амплификации плазмиды в E. coli. Использовали два варианта базовой плазмиды: одну плазмиду, содержащую константную область человеческого IgG, сконструированную для принятия новой амплифицированной цепи VH, и вторую плазмиду, содержащую человеческую константную область LC каппа для принятия области VL.
Линеаризованные экспрессионные плазмиды, кодирующие константную область каппа или гама и вставки VL/VH, амплифицировали посредством ПЦР с использованием перекрывающихся праймеров.
Очищенные ПЦР-продукты инкубировали с ДНК-полимеразой Т4, которая генерировала однонитевые «липкие» концы. Данную реакцию останавливали добавлением dCTP.
На следующей стадии плазмиду и вставку объединяли и инкубировали с recA, которая индуцировала сайт-специфичную рекомбинацию. Рекомбинантные плазмиды трансформировали в Е. coli. На следующие сутки выросшие колонии собирали и тестировали на правильную рекомбинированную плазмиду посредством получения плазмиды, рестрикционного анализа и секвенирования ДНК.
Пример 5
Временная экспрессия одновалентных антител против TfR
Антитела получали in vivo во временно трансфицированных клетках HEK293 (полученные из линии клеток человеческой эмбриональной почки 293), культивированных в среде F17 (Invitrogen Corp.). Для трансфекции использовали трансфекционный реактив «293-Free» (Novagen). Антитела и модифицированные молекулы на основе антител, как описано выше, экспрессировали из индивидуальных экспрессионных плазмид. Трансфекции проводили, как определено в инструкциях изготовителя. Супернатанты культуры клеток, содержащие рекомбинантный белок, отбирали через три-семь суток после трансфекции. Супернатанты хранили при пониженной температуре (например, -80°С) до очистки.
Общая информацию относительно рекомбинантной экспрессии человеческих иммуноглобулинов, например, в клетках HEK293, приводится в: Meissner, P. et al., Biotechnol. Bioeng. 75 (2001) 197-203.
Пример 6
Высокопроизводительная очистка неполных антител против трансферринового рецептора
50 мл осветленных супернатантов, содержащих неполные антитела, в планшетах с 96 глубокими лунками загружали на 200 мкл колонки MabSelectSuRe. После стадий промывки PBS при рН 7,4 белки элюировали 2,5 мМ HCl с использованием системы Tecan/Atoll, что приводило к 0,5 мл элюата. Элюат нейтрализовали 2 М Tris, рН 8. Очищенные белки количественно измеряли с использованием спектрофотометра Nanodrop и анализировали CE-SDS (капиллярный электрофорез с додецилсульфатом натрия) при денатурирующих и восстанавливающих условиях и аналитической SEC (гель-фильтрация). Для получения белка с высокой чистотой (больше 95%) большая часть антител должна быть очищена далее посредством гель-фильтрации для отделения от половины антитела, антител выступ-выступ и агрегатов более высокого порядка. Далее 500 мкл образцов инъецировали на Superdex200 10/300GL в 20 мМ гистидине, содержащем 140 мМ NaCl, рН 6,0, с использованием Dionex UltiMate 3000. Данный способ обеспечивает фракционирование 25-30 образцов в сутки и, следовательно, позволяет обрабатывать большее число хитов скрининга в формате неполного антитела. Фракции объединяли и вновь анализировали, как описано выше.
Пример 7
Культура клеток hCMEC/D3 для анализов трансцитоза
Среду и добавки для hCMEC/D3 (Weksler, В.В. et al., FASEB J. 19 (2005), 1872-1874) приобретали у Lonza. Клетки hCMEC/D3 (пассажи 26-29) культивировали до конфлюентности на покровных стеклах, покрытых коллагеном (микроскопия), или в колбах в среде ЕВМ2, содержащей 2,5% FBS (фетальная телячья сыворотка), четверть поставленных факторов роста и полностью дополненной поставленными гидрокортизоном, гентамицином и аскорбиновой кислотой.
Для всех анализов трансцитоза использовали вставки фильтра на основе PET мембраны с высокой плотностью пор (1×108 пор/см2) (0,4 мкм, диаметр 12 мм) в 12-луночных планшетах для культуры клеток. Рассчитывали, что оптимальные объемы сред составляли 400 мкл и 1600 мкл для апикальных и базолатеральных камер соответственно. Апикальные камеры вставок фильтра покрывали коллагеном I хвоста крысы (7,5 мкг/см2), с последующим фибронектином (5 мкг/мл), причем каждая инкубация длилась в течение 1 часа при RT. Клетки hCMEC/D3 выращивали до конфлюентных монослоев (приблизительно 2×105 клеток/см2) в течение 10-12 суток в среде ЕМВ2.
Пример 8
Анализ трансцитоза одновалентных антител
Весь анализ проводили в бессывороточной среде ЕВМ2, которую в иных отношениях разводили, как описано в Примере 1. Вставки фильтра с клетками инкубировали апикально с одновалентными антителами (концентрация: 2,67 мкг/мл) в течение 1 часа при 37°С, после чего отбирали все апикальные и базолатеральные среды. Из данных значений рассчитывали параклеточный ток. Монослои промывали при RT в бессывороточной среде апикально (400 мкл) и базолатерально (1600 мкл) 3 раза по 3-5 мин. Все промывки отбирали для отслеживания эффективности удаления несвязавшегося антитела. В апикальную камеру добавляли предварительно нагретую среду, и фильтры переносили в свежий 12-луночный планшет (блокированный в течение ночи PBS, содержащим 1% BSA), содержащий 1600 мкл предварительно нагретой среды. В данный момент клетки на фильтрах лизировали в 500 мкл буфера RIPA для того, чтобы определить поглощение специфичного антитела. Остальные фильтры инкубировали при 37°С, и образцы отбирали в разные моменты времени для определения апикального и/или базолатерального высвобождения антитела. Содержание антитела в образцах количественно измеряли с использованием высокочувствительного ELISA на IgG (см. Пример 3). Для каждого момента времени получали данные от трех культур клеток на фильтре.
Пример 9
Чувствительный ELISA на IgG после анализа трансцитоза
Всю процедуру проводили при RT с использованием автоматического промывочного устройства для стадий промывки. 384-луночный планшет покрывали 30 мкл/лунку 1 мкг/мл Fcγ-специфичного антитела против человеческого/мышиного IgG в PBS в течение 2 часов, с последующей 1-часовой инкубацией в блокирующем буфере PBS, содержащем 1% BSA или 1% CroteinC для анализов человеческого и мышиного IgG соответственно. На планшет добавляли и инкубировали в течение 2 часов серийно разведенные образцы из анализа трансцитоза и стандартные концентрации антитела, использованные в анализе трансцитоза. После четырех промывок добавляли 30 мкл/лунку 50 нг/мл антитела против человеческого/мышиного F(ab)2, конъюгированного с биотином, в блокирующем буфере и инкубировали в течение еще 2 часов. После 6 промывок добавляли 30 мкл/лунку 50 нг/мл (анализ huIgG) или 100 нг/мл (анализ mIgG) поли-HRP40-стрептавидин (Fitzgerald; в PBS, содержащий 1% BSA и 0,05% Tween-20) и инкубировали в течение 30 мин. После 4 промывок иммунные комплексы выявляли добавлением 30 мкл/лунку хемилюминисцентного субстрата ВМ (Roche). Люминисцентный сигнал измеряли с использованием люминисцентного планшет-ридера, и концентрацию рассчитывали с использованием аппроксимированной стандартной кривой. Чувствительность анализа варьировала от 10 пг/мл до 10 нг/мл.
Пример 10
Картирование эпитопов посредством клеточного ELISA клеток СНО, трансфицированных мутантами hTfR
Для того чтобы иметь возможность определять области эпитопов на человеческом трансферриновом рецепторе (hTfR), вводили мутации в последовательность hTfR в положениях, где кластер экспонированных на поверхности аминокислот имеет другие аминокислоты в выровненной последовательности мышиного TfR (см. Таблицу ниже), следуя тому принципу, что, несмотря на значимую гомологию между человеческим и мышиным TfR (77%-ная идентичность), не известны антитела, направленные на внеклеточную часть, которые демонстрируют хорошую перекрестную реактивность между обоими ортологами. Клонирование плазмид с соответствующими мутациями описывается выше. Для картирования связывания связывающих агентов в отношении человеческого TfR с данными эпитопами, клетки СНО-K1 временно трансфицировали желательными плазмидами, и связывание антитела измеряли в клеточном ELISA. Вкратце, 104 клеток высаживали на лунку 96-луночного планшета за сутки до эксперимента в нормальную ростовую среду (RPMI/10% FCS). На другие сутки среду заменяли на OPTI-MEM с пониженным содержанием сыворотки (Gibco), и в лунки добавляли 10 мкл смеси 1200 мкл OPTI-MEM, 12 мкг плазмидной ДНК и 12 мкл трансфекционного реактива XtremeGENE (Roche) после 30 минут предынкубации. Клетки инкубировали в течение 2 суток при 37°С/7,5% CO2, затем среду удаляли, и добавляли антитела против TfR в концентрациях от 1 нМ до 100 нМ в ростовой среде, с последующей 2 ч инкубацией при 4°С. Затем растворы антител заменяли на 0,05% глутаральдегида в PBS, и клетки фиксировали в течение 15 мин при RT, затем дважды промывали PBS и инкубировали с вторичным антителом против человеческого Fc, конъюгированным с HRP (BioRad; 1:2000 в блокирующем реактиве ELISA (Roche)) в течение 1,5 часов при RT. Сигнал получали после 3 промывок PBS, используя 50 мкл ТМВ на лунку, и поглощение измеряли при 450 нм.

Пример 11
Основанный на поверхностном плазмоном резонансе анализ связывания в отношении взаимодействия человеческий TfR-антитело
Эксперимент по связыванию проводили на BIAcore В 4000 (GE Healthcare), оснащенном сенсорным чипом С1 (GE Healthcare, кат. №BR1005-35), предобработанным антителом против Fab человека (GE Healthcare, кат. №28-9583-25), с использованием методики на основе стандартной химии аминного связывания согласно руководству поставщика.
Для кинетических измерений опытное антитело иммобилизовали, применяя контактное время 60 секунд и скорость тока 10 мкл/мин, в фосфатно-солевом буферном растворе, рН 7,4, 0,05% Tween 20 при 25°С. Рекомбинантный меченный His6 человеческий трансферриновый рецептор (R&D systems, кат. №2474-TR-050) наносили в возрастающих концентрациях, и сигнал отслеживали с течением времени. Записывали средний интервал времени: 150 секунд времени ассоциации и 600 секунд времени диссоциации при скорости тока 30 мкл/мин. Данные аппроксимировали с использованием модели связывания 1:1 (изотерма Лангмюра).
Пример 12
Гуманизация доменов VH и VL мышиного и кроличьего антитела против трансферринового рецептора
Антитела против трансферринового рецептора, не являющиеся человеческими, гуманизировали следующим образом: на основе характеристики кодирующих последовательностей и аминокислотных последовательностей, которые составляют домены VH и VL не являющихся человеческими антител класса IgG1 с легкой цепью каппа против трансферринового рецептора, получали соответствующее гуманизированное антитело против трансферринового рецептора посредством пересадки CDR обратных/прямых мутаций на основе комбинации каркасной области человеческой зародышевой линии VH4_3 и VK1_10 для клона 299.
Пример 13
Способ определения аффинности в отношении рецептора TfR человека/яванского макака
В данном примере описывается способ определения аффинностей человеческого трансферринового рецептора для сравнения характеристик диссоциации.
Для всех анализов использовали набор Biotin CAPture от GE Healthcare (инструкция 28-9242-34 АВ). Во-первых, чип регидратировали посредством его установки в прибор BIAcore T200. После этого чип оставляли в режиме ожидания с пропусканием подвижного буфера в течение ночи. Для подготовки поверхности реактив Biotin CAPture разводили 1:100 в подвижном буфере (1× PBS, дополненный 0,25 М NaCl). Данный раствор инъецировали на проточные ячейки 1-4 в течение 360 с со скоростью тока 2 мкл/мин. Затем поверхность сенсора доводили до кондиции тремя одноминутными инъекциями регенерирующего раствора, предоставленного в наборе Biotin CAPture. Это необходимо было сделать для процедуры установки или для первого раза, или после хранения. 100 нМ раствор монобиотинилированного трансферринового рецептора человека или яванского макака, соответственно, должен быть инъецирован на проточную ячейку 2 в течение 30 с при скорости тока 10 мкл/мин. Для определения аффинности применяли инъекции шести концентраций (500; 250; 125; 62,5; 31,25; 15,625 и 0 нМ). Их инъецировали на «проточную ячейку hu-TfR» (например, проточную ячейку 2, полученную, как описано выше) со временем инъекции 180 с (ассоциация) и скоростью тока 10 мкл/мин. После 600 с фазы диссоциации поверхность регенерировали согласно инструкциям изготовителя с использованием регенерирующего раствора, предоставленного в наборе Biotin CAPture, и проводили следующий цикл.
Кинетические данные оценивали с использованием программы оценки BIAcore T200. В особенности, принимали во внимание константы скорости диссоциации разных связующих агентов в отношении человеческого трансферринового рецептора после применения модели связывания Лангмюра 1:1.
Пример 14
Относительное ранжирование на В4000 диссоциации от трансферринового рецептора человека/яванского макака
Сенсорный чип CAP (предоставленный в наборе Biotin CAPture, серия S #28-9202-34 GE) устанавливали в систему BIAcore B4000, нормировали и адресовали гидродинамическим способом согласно инструкциям изготовителя. В первом цикле реактив CAP (в том виде, в котором он предоставлен в наборе) адресовали в пятно 1, 2, 4 и 5 со скоростью тока 10 мкл/мин в течение 300 с. Захват человеческого трансферринового рецептора происходил в пятне 1 (биотинилированный человеческий трансферриновый рецептор) и в пятне 5 (биотинилированный трансферриновый рецептор яванского макака) со скоростью тока 10 мкл/мин и контактным временем 30 с. Рецепторы разводили до концентрации 50 нМ подвижным буфером (1× PBS #28995084, GE Healthcare, дополненный 0,25 М NaCl). Антитела инъецировали во все проточные ячейки в рядах концентраций 100 нМ, 50 нМ, 25 нМ и 0 нМ в течение 180 с при скорости тока 30 мкл/мин. Было установлено время диссоциации 300 с. Регенерацию всего комплекса из чипа CAP проводили с использованием регенерирующего раствора, предоставленного в наборе Biotin CAPture (120 с со скоростью тока 10 мкл/мин). Для контроля концентрации активного белка осуществляли второй цикл в пятне 5 с использованием биотинилированного белка A (#P2165-2MG, SIgma) со скоростью тока 10 мкл/мин и контактным временем 30 с. В данном контрольном цикле пятно 1 оставляли пустым. С антителами и регенерацией манипулировали подобно циклу 1. Релевантные кинетические данные рассчитывали с использованием программы оценки BIAcore B4000. Диссоциацию от человеческого трансферринового рецептора определяли, применяя аппроксимацию диссоциации 1:1.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> F. Hoffmann-La Roche AG
<120> АНТИТЕЛА ПРОТИВ ТРАНСФЕРРИНОВОГО РЕЦЕПТОРА, ОБЛАДАЮЩИЕ ИНДИВИДУАЛИЗИРОВАННОЙ АФФИННОСТЬЮ
<130> P32937
<150> EP15173508.1
<151> 2015-06-24
<150> EP15176084.0
<151> 2015-07-09
<160> 97
<170> PatentIn version 3.5
<210> 1
<211> 122
<212> PRT
<213> Oryctolagus cuniculus
<400> 1
Gln Ser Met Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Thr Pro
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Ser Tyr Ala
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Tyr Ile Trp Ser Gly Gly Ser Thr Asp Tyr Ala Ser Trp Ala Lys Gly
50 55 60
Arg Phe Thr Ile Ser Lys Thr Ser Thr Thr Val Asp Leu Lys Ile Thr
65 70 75 80
Ser Pro Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Arg Arg Tyr
85 90 95
Gly Thr Ser Tyr Pro Asp Tyr Gly Asp Ala Asn Gly Phe Asp Pro Trp
100 105 110
Gly Pro Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 2
<211> 122
<212> PRT
<213> Artificial Sequence
<220>
<223> anti-TfR mAb 567 VH (=humanized 299 VH_basic)
<400> 2
Gln Ser Met Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Thr Pro
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Ser Tyr Ala
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Tyr Ile Trp Ser Gly Gly Ser Thr Asp Tyr Ala Ser Trp Ala Lys Gly
50 55 60
Arg Phe Thr Ile Ser Lys Thr Ser Thr Thr Val Asp Leu Lys Ile Thr
65 70 75 80
Ser Pro Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Arg Arg Tyr
85 90 95
Gly Thr Ser Tyr Pro Asp Tyr Gly Asp Ala Asn Gly Phe Asp Pro Trp
100 105 110
Gly Pro Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 3
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-001 VH humanization variant
<400> 3
Val Gln Leu Val Glu Thr Gly Gly Gly Leu Ile Gln Pro Gly Gly Ser
1 5 10 15
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Ser Ser Tyr Ala
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Gly
35 40 45
Tyr Ile Trp Ser Gly Gly Ser Thr Asp Tyr Ala Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
85 90 95
Arg Tyr Gly Thr Ser Tyr Pro Asp Tyr Gly Asp Ala Asn Gly Phe Asp
100 105 110
Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 4
<211> 125
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-002 VH humanization variant
<400> 4
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu Ile Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Tyr Ile Trp Ser Gly Gly Ser Thr Asp Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Arg Tyr Gly Thr Ser Tyr Pro Asp Tyr Gly Asp Ala Asn Gly Phe
100 105 110
Asp Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 5
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-005 VH humanization variant
<400> 5
Gln Ser Met Glu Glu Thr Gly Gly Gly Leu Ile Gln Pro Gly Gly Ser
1 5 10 15
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Ser Ser Tyr Ala
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Gly
35 40 45
Tyr Ile Trp Ser Gly Gly Ser Thr Asp Tyr Ala Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
85 90 95
Arg Tyr Gly Thr Ser Tyr Pro Asp Tyr Gly Asp Ala Asn Gly Phe Asp
100 105 110
Pro Trp Gly Pro Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 6
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-006 VH humanization variant
<400> 6
Gln Gln Leu Val Glu Thr Gly Gly Gly Leu Ile Gln Pro Gly Gly Ser
1 5 10 15
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Ser Ser Tyr Ala
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Tyr Ile Trp Ser Gly Gly Ser Thr Asp Tyr Ala Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
85 90 95
Arg Tyr Gly Thr Ser Tyr Pro Asp Tyr Gly Asp Ala Asn Gly Phe Asp
100 105 110
Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 7
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-007 VH humanization variant_DANG
<400> 7
Gln Gln Leu Val Glu Thr Gly Gly Gly Leu Ile Gln Pro Gly Gly Ser
1 5 10 15
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Ser Ser Tyr Ala
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Tyr Ile Trp Ser Gly Gly Ser Thr Asp Tyr Ala Ser Trp Ala Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
85 90 95
Arg Tyr Gly Thr Ser Tyr Pro Asp Tyr Gly Asp Ala Asn Gly Phe Asp
100 105 110
Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 8
<211> 122
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-008 VH humanization variant
<400> 8
Gln Gln Leu Val Glu Thr Gly Gly Gly Leu Ile Gln Pro Gly Gly Ser
1 5 10 15
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Ser Ser Tyr Ala
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Tyr Ile Trp Ser Gly Gly Ser Thr Asp Tyr Ala Ser Trp Ala Lys Gly
50 55 60
Arg Phe Thr Ile Ser Lys Thr Ser Thr Thr Leu Tyr Leu Gln Met Asn
65 70 75 80
Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Arg Tyr
85 90 95
Gly Thr Ser Tyr Pro Asp Tyr Gly Asp Ala Asn Gly Phe Asp Pro Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 9
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-009 VH humanization variant_DANG
<400> 9
Gln Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
1 5 10 15
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr Ala
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Gly
35 40 45
Tyr Ile Trp Ser Gly Gly Ser Thr Asp Tyr Ala Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys
85 90 95
Arg Tyr Gly Thr Ser Tyr Pro Asp Tyr Gly Asp Ala Asn Gly Phe Asp
100 105 110
Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 10
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-009 VH humanization variant_DASG
<400> 10
Gln Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
1 5 10 15
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr Ala
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Gly
35 40 45
Tyr Ile Trp Ser Gly Gly Ser Thr Asp Tyr Ala Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys
85 90 95
Arg Tyr Gly Thr Ser Tyr Pro Asp Tyr Gly Asp Ala Ser Gly Phe Asp
100 105 110
Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 11
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-009 VH humanization variant_DAQG
<400> 11
Gln Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
1 5 10 15
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr Ala
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Gly
35 40 45
Tyr Ile Trp Ser Gly Gly Ser Thr Asp Tyr Ala Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys
85 90 95
Arg Tyr Gly Thr Ser Tyr Pro Asp Tyr Gly Asp Ala Gln Gly Phe Asp
100 105 110
Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 12
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-011 VH humanization variant
<400> 12
Gln Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
1 5 10 15
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Ser Ser Tyr Ala
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Gly
35 40 45
Tyr Ile Trp Ser Gly Gly Ser Thr Asp Tyr Ala Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
85 90 95
Arg Tyr Gly Thr Ser Tyr Pro Asp Tyr Gly Asp Ala Asn Gly Phe Asp
100 105 110
Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 13
<211> 125
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-012 VH humanization variant
<400> 13
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Ser Tyr
20 25 30
Ala Met Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Trp Ser Gly Gly Ser Thr Asp Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Arg Tyr Gly Thr Ser Tyr Pro Asp Tyr Gly Asp Ala Asn Gly Phe
100 105 110
Asp Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 14
<211> 125
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-013 VH humanization variant
<400> 14
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Ser Tyr
20 25 30
Ala Met Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Trp Ser Gly Gly Ser Thr Asp Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Val Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Arg Tyr Gly Thr Ser Tyr Pro Asp Tyr Gly Asp Ala Asn Gly Phe
100 105 110
Asp Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 15
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-015 VH humanization variant
<400> 15
Gln Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr
1 5 10 15
Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Ser Tyr Ala
20 25 30
Met Ser Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Tyr Ile Trp Ser Gly Gly Ser Thr Asp Tyr Asn Pro Ser Leu Lys Ser
50 55 60
Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Val Ser Leu Lys
65 70 75 80
Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Arg
85 90 95
Arg Tyr Gly Thr Ser Tyr Pro Asp Tyr Gly Asp Ala Asn Gly Phe Asp
100 105 110
Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 16
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-016 VH humanization variant
<400> 16
Gln Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr
1 5 10 15
Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Ser Tyr Ala
20 25 30
Met Ser Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Tyr Ile Trp Ser Gly Gly Ser Thr Asp Tyr Asn Pro Ser Leu Lys Ser
50 55 60
Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Val Ser Leu Lys
65 70 75 80
Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Arg
85 90 95
Arg Tyr Gly Thr Ser Tyr Pro Asp Tyr Gly Asp Ala Asn Gly Phe Asp
100 105 110
Pro Trp Gly Pro Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 17
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-017 VH humanization variant
<400> 17
Gln Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr
1 5 10 15
Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Ser Tyr Ala
20 25 30
Met Ser Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Tyr Ile Trp Ser Gly Gly Ser Thr Asp Tyr Asn Pro Ser Leu Lys Ser
50 55 60
Arg Val Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val Ser Leu Lys
65 70 75 80
Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Arg
85 90 95
Arg Tyr Gly Thr Ser Tyr Pro Asp Tyr Gly Asp Ala Asn Gly Phe Asp
100 105 110
Pro Trp Gly Pro Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 18
<211> 125
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-018 VH humanization variant
<400> 18
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Ser Tyr
20 25 30
Ala Met Ser Trp Ile Arg Gln His Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Trp Ser Gly Gly Ser Thr Asp Tyr Ala Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Arg Tyr Gly Thr Ser Tyr Pro Asp Tyr Gly Asp Ala Asn Gly Phe
100 105 110
Asp Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 19
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-019 VH humanization variant
<400> 19
Gln Ser Met Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln Thr
1 5 10 15
Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Ser Tyr Ala
20 25 30
Met Ser Trp Ile Arg Gln His Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Tyr Ile Trp Ser Gly Gly Ser Thr Asp Tyr Ala Pro Ser Leu Lys Ser
50 55 60
Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu Lys
65 70 75 80
Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Arg
85 90 95
Arg Tyr Gly Thr Ser Tyr Pro Asp Tyr Gly Asp Ala Asn Gly Phe Asp
100 105 110
Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 20
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-020 VH humanization variant
<400> 20
Gln Ser Met Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln Thr
1 5 10 15
Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Ser Tyr Ala
20 25 30
Met Ser Trp Ile Arg Gln His Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Tyr Ile Trp Ser Gly Gly Ser Thr Asp Tyr Ala Pro Ser Leu Lys Ser
50 55 60
Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Val Ser Leu Lys
65 70 75 80
Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Arg
85 90 95
Arg Tyr Gly Thr Ser Tyr Pro Asp Tyr Gly Asp Ala Asn Gly Phe Asp
100 105 110
Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 21
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-021 VH humanization variant
<400> 21
Gln Ser Met Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln Thr
1 5 10 15
Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Ser Tyr Ala
20 25 30
Met Ser Trp Ile Arg Gln His Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Tyr Ile Trp Ser Gly Gly Ser Thr Asp Tyr Ala Ser Trp Ala Lys Ser
50 55 60
Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Val Ser Leu Lys
65 70 75 80
Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Arg
85 90 95
Arg Tyr Gly Thr Ser Tyr Pro Asp Tyr Gly Asp Ala Asn Gly Phe Asp
100 105 110
Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 22
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-022 VH humanization variant
<400> 22
Gln Ser Met Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln Thr
1 5 10 15
Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Ser Tyr Ala
20 25 30
Met Ser Trp Val Arg Gln His Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Tyr Ile Trp Ser Gly Gly Ser Thr Asp Tyr Ala Ser Trp Ala Lys Ser
50 55 60
Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Val Ser Leu Lys
65 70 75 80
Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Arg
85 90 95
Arg Tyr Gly Thr Ser Tyr Pro Asp Tyr Gly Asp Ala Asn Gly Phe Asp
100 105 110
Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 23
<211> 122
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-023 VH humanization variant_DANG
<400> 23
Gln Ser Met Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln Thr
1 5 10 15
Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Ser Tyr Ala
20 25 30
Met Ser Trp Ile Arg Gln His Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Tyr Ile Trp Ser Gly Gly Ser Thr Asp Tyr Ala Ser Trp Ala Lys Ser
50 55 60
Arg Val Thr Ile Ser Lys Thr Ser Thr Thr Val Ser Leu Lys Leu Ser
65 70 75 80
Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Arg Arg Tyr
85 90 95
Gly Thr Ser Tyr Pro Asp Tyr Gly Asp Ala Asn Gly Phe Asp Pro Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 24
<211> 122
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-023 VH humanization variant_DASG
<400> 24
Gln Ser Met Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln Thr
1 5 10 15
Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Ser Tyr Ala
20 25 30
Met Ser Trp Ile Arg Gln His Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Tyr Ile Trp Ser Gly Gly Ser Thr Asp Tyr Ala Ser Trp Ala Lys Ser
50 55 60
Arg Val Thr Ile Ser Lys Thr Ser Thr Thr Val Ser Leu Lys Leu Ser
65 70 75 80
Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Arg Arg Tyr
85 90 95
Gly Thr Ser Tyr Pro Asp Tyr Gly Asp Ala Ser Gly Phe Asp Pro Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 25
<211> 122
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-023 VH humanization variant_DAQG
<400> 25
Gln Ser Met Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln Thr
1 5 10 15
Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Ser Tyr Ala
20 25 30
Met Ser Trp Ile Arg Gln His Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Tyr Ile Trp Ser Gly Gly Ser Thr Asp Tyr Ala Ser Trp Ala Lys Ser
50 55 60
Arg Val Thr Ile Ser Lys Thr Ser Thr Thr Val Ser Leu Lys Leu Ser
65 70 75 80
Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Arg Arg Tyr
85 90 95
Gly Thr Ser Tyr Pro Asp Tyr Gly Asp Ala Gln Gly Phe Asp Pro Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 26
<211> 110
<212> PRT
<213> Oryctolagus cuniculus
<400> 26
Ala Tyr Asp Met Thr Gln Thr Pro Ala Ser Val Glu Val Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Lys Cys Gln Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Gln Arg Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Thr Leu Ala Ser Gly Val Ser Ser Arg Phe Lys Gly
50 55 60
Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Glu Cys
65 70 75 80
Ala Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Cys Tyr Ser Ser Ser Asn
85 90 95
Val Asp Asn Thr Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105 110
<210> 27
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> anti-TfR mAb 567 VL (=humanized 299 VL_basic)
<400> 27
Ala Tyr Asp Met Thr Gln Thr Pro Ala Ser Val Glu Val Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Lys Cys Gln Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Gln Arg Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Thr Leu Ala Ser Gly Val Ser Ser Arg Phe Lys Gly
50 55 60
Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Glu Ser
65 70 75 80
Ala Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Ser Ser Asn
85 90 95
Val Asp Asn Thr Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105 110
<210> 28
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> 567 VL humanization variant_PNYA
<400> 28
Ala Tyr Asp Met Thr Gln Thr Pro Ala Ser Val Glu Val Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Lys Cys Gln Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Gln Arg Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Thr Leu Ala Ser Gly Val Ser Ser Arg Phe Lys Gly
50 55 60
Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Glu Pro
65 70 75 80
Ala Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Asn Tyr Ala Ser Ser Asn
85 90 95
Val Asp Asn Thr Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105 110
<210> 29
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-001 VL humanization variant
<400> 29
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Ser Ser Asn
85 90 95
Val Asp Asn Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 30
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-002 VL humanization variant_SYS
<400> 30
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Ser Ser Asn
85 90 95
Val Asp Asn Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 31
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-003 VL humanization variant
<400> 31
Ala Tyr Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Ser Ser Asn
85 90 95
Val Asp Asn Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 32
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-004 VL humanization variant
<400> 32
Ala Tyr Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Ser Ser Asn
85 90 95
Val Asp Asn Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 33
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-005 VL humanization variant
<400> 33
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Ser Ser Asn
85 90 95
Val Asp Asn Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 34
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-006 VL humanization variant_SYS
<400> 34
Ala Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Ser Ser Asn
85 90 95
Val Asp Asn Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 35
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-007 VL humanization variant
<400> 35
Ala Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Ser Ser Asn
85 90 95
Val Asp Asn Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 36
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-008 VL humanization variant
<400> 36
Ala Tyr Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Ser Ser Asn
85 90 95
Val Asp Asn Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 37
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-009 VL humanization variant_NYA
<400> 37
Ala Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Asn Tyr Ala Ser Ser Asn
85 90 95
Val Asp Asn Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 38
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-009 VL humanization variant_SYA
<400> 38
Ala Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ala Ser Ser Asn
85 90 95
Val Asp Asn Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 39
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-009 VL humanization variant_NYS
<400> 39
Ala Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Asn Tyr Ser Ser Ser Asn
85 90 95
Val Asp Asn Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 40
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-009 VL humanization variant_GYS
<400> 40
Ala Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Tyr Ser Ser Ser Asn
85 90 95
Val Asp Asn Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 41
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-009 VL humanization variant_CYS
<400> 41
Ala Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Cys Tyr Ser Ser Ser Asn
85 90 95
Val Asp Asn Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 42
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-010 VL humanization variant
<400> 42
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Ser Ser Asn
85 90 95
Val Asp Asn Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 43
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-012 VL humanization variant_HYS
<400> 43
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Ser Ser Ser Asn
85 90 95
Val Asp Asn Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 44
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-014 VL humanization variant
<400> 44
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Gln Arg Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Thr Leu Ala Ser Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ser Tyr Ser Ser Ser Asn
85 90 95
Val Asp Asn Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 45
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-015 VL humanization variant_AYS
<400> 45
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Ile Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Thr Leu Ala Ser Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ala Tyr Ser Ser Ser Asn
85 90 95
Val Asp Asn Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 46
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-017 VL humanization variant_TYS
<400> 46
Ala Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Thr Tyr Ser Ser Ser Asn
85 90 95
Val Asp Asn Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 47
<211> 119
<212> PRT
<213> Mus musculus
<400> 47
Glu Val Gln Leu Gln Gln Ser Gly Ala Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Pro Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Ile Gln Arg Pro Glu Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asp Thr Lys Cys Asp Pro Lys Phe
50 55 60
Gln Val Lys Ala Thr Ile Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Leu Gln Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Val Arg Asp Tyr Leu Tyr Pro Tyr Tyr Phe Asp Phe Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser
115
<210> 48
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> 494 VH variant D52A
<400> 48
Glu Val Gln Leu Gln Gln Ser Gly Ala Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Pro Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Ile Gln Arg Pro Glu Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Ala Pro Ala Asn Gly Asp Thr Lys Ser Asp Pro Lys Phe
50 55 60
Gln Val Lys Ala Thr Ile Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Leu Gln Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Val Arg Asp Tyr Leu Tyr Pro Tyr Tyr Phe Asp Phe Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser
115
<210> 49
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> 494 VH variant D52L
<400> 49
Glu Val Gln Leu Gln Gln Ser Gly Ala Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Pro Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Ile Gln Arg Pro Glu Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Leu Pro Ala Asn Gly Asp Thr Lys Ser Asp Pro Lys Phe
50 55 60
Gln Val Lys Ala Thr Ile Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Leu Gln Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Val Arg Asp Tyr Leu Tyr Pro Tyr Tyr Phe Asp Phe Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser
115
<210> 50
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> 494 VH variant D31G
<400> 50
Glu Val Gln Leu Gln Gln Ser Gly Ala Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Pro Ala Ser Gly Phe Asn Ile Lys Gly Thr
20 25 30
Tyr Ile His Trp Val Ile Gln Arg Pro Glu Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asp Thr Lys Ser Asp Pro Lys Phe
50 55 60
Gln Val Lys Ala Thr Ile Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Leu Gln Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Val Arg Asp Tyr Leu Tyr Pro Tyr Tyr Phe Asp Phe Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser
115
<210> 51
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> 494 VH variant L101A
<400> 51
Glu Val Gln Leu Gln Gln Ser Gly Ala Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Pro Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Ile Gln Arg Pro Glu Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asp Thr Lys Ser Asp Pro Lys Phe
50 55 60
Gln Val Lys Ala Thr Ile Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Leu Gln Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Val Arg Asp Tyr Ala Tyr Pro Tyr Tyr Phe Asp Phe Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser
115
<210> 52
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> 494-001 VH humanization variant
<400> 52
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Ile Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asp Thr Lys Ser Asp Pro Lys Phe
50 55 60
Gln Val Arg Val Thr Ile Thr Ala Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Tyr Leu Tyr Pro Tyr Tyr Phe Asp Phe Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 53
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> 494-002 VH humanization variant
<400> 53
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Ile Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asp Thr Lys Ser Ala Pro Lys Phe
50 55 60
Gln Val Arg Val Thr Ile Thr Ala Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Tyr Leu Tyr Pro Tyr Tyr Phe Asp Phe Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 54
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> 494-003 VH humanization variant
<400> 54
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Ile Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asp Thr Lys Ser Asp Pro Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Tyr Leu Tyr Pro Tyr Tyr Phe Asp Phe Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 55
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> 494-004 VH humanization variant
<400> 55
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Ile Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asp Thr Lys Ser Asp Pro Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Tyr Leu Tyr Pro Tyr Tyr Phe Asp Phe Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 56
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> 494-005 VH humanization variant
<400> 56
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Ile Gln Arg Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asp Thr Lys Ser Asp Pro Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Tyr Leu Tyr Pro Tyr Tyr Phe Asp Phe Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 57
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> 494-006 VH humanization variant
<400> 57
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Ile Gln Arg Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asp Thr Lys Ser Asp Pro Ser Leu
50 55 60
Gln Ser Arg Val Thr Ile Ser Ala Asp Thr Ser Lys Asn Gln Ala Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Tyr Leu Tyr Pro Tyr Tyr Phe Asp Phe Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 58
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> 494-007 VH humanization variant
<400> 58
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Ile Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asp Thr Lys Ser Asp Pro Ser Val
50 55 60
Gln Val Arg Ala Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Tyr Leu Tyr Pro Tyr Tyr Phe Asp Phe Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 59
<211> 107
<212> PRT
<213> Mus musculus
<400> 59
Lys Ile Val Met Thr Gln Ser Pro Lys Ser Met Ser Met Ser Val Gly
1 5 10 15
Glu Arg Val Thr Leu Asn Cys Arg Ala Ser Glu Ser Val Asp Thr Tyr
20 25 30
Val Ser Trp Tyr Gln Gln Lys Pro Glu Gln Ser Pro Glu Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Ala Thr Asp Phe Thr Leu Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Asp Tyr Tyr Cys Gly Gln Thr Tyr Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 60
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> 494-001 VL humanization variant
<400> 60
Lys Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Ser Val Asp Thr Tyr
20 25 30
Val Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Asn Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Asp Tyr Tyr Cys Gly Gln Thr Tyr Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 61
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> 494-002 VL humanization variant
<400> 61
Lys Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Thr Tyr
20 25 30
Val Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Asp Tyr Tyr Cys Gly Gln Thr Tyr Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 62
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> 494-003 VL humanization variant
<400> 62
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Thr Tyr
20 25 30
Val Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Asp Tyr Tyr Cys Gly Gln Thr Tyr Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 63
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> 494-004 VL humanization variant
<400> 63
Lys Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Thr Tyr
20 25 30
Val Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Asn Arg Tyr Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Asp Tyr Tyr Cys Gly Gln Thr Tyr Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 64
<211> 118
<212> PRT
<213> Mus musculus
<400> 64
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Thr Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asn Pro His Asn Gly Gly Thr Asp Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Tyr Tyr Tyr Tyr Ser Leu Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 65
<211> 106
<212> PRT
<213> Mus musculus
<400> 65
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Ile Arg Tyr Ile
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Arg Leu Ile Tyr
35 40 45
Asp Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys His Gln Arg Asn Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105
<210> 66
<211> 7
<212> PRT
<213> Oryctolagus cuniculus
<400> 66
Gly Phe Ser Leu Ser Ser Tyr
1 5
<210> 67
<211> 5
<212> PRT
<213> Oryctolagus cuniculus
<400> 67
Ser Tyr Ala Met Ser
1 5
<210> 68
<211> 5
<212> PRT
<213> Oryctolagus cuniculus
<400> 68
Trp Ser Gly Gly Ser
1 5
<210> 69
<211> 16
<212> PRT
<213> Oryctolagus cuniculus
<400> 69
Tyr Ile Trp Ser Gly Gly Ser Thr Asp Tyr Ala Ser Trp Ala Lys Gly
1 5 10 15
<210> 70
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-000 HVR-H2 Kabat G65S
<400> 70
Tyr Ile Trp Ser Gly Gly Ser Thr Asp Tyr Ala Ser Trp Ala Lys Ser
1 5 10 15
<210> 71
<211> 17
<212> PRT
<213> Oryctolagus cuniculus
<400> 71
Arg Tyr Gly Thr Ser Tyr Pro Asp Tyr Gly Asp Ala Asn Gly Phe Asp
1 5 10 15
Pro
<210> 72
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-000 HVR-H3 DASG
<400> 72
Arg Tyr Gly Thr Ser Tyr Pro Asp Tyr Gly Asp Ala Ser Gly Phe Asp
1 5 10 15
Pro
<210> 73
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-000 HVR-H3 DAQG
<400> 73
Arg Tyr Gly Thr Ser Tyr Pro Asp Tyr Gly Asp Ala Gln Gly Phe Asp
1 5 10 15
Pro
<210> 74
<211> 11
<212> PRT
<213> Oryctolagus cuniculus
<400> 74
Gln Ala Ser Gln Ser Ile Ser Ser Tyr Leu Ser
1 5 10
<210> 75
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-000 HVR-L1 RAA
<400> 75
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Ala
1 5 10
<210> 76
<211> 7
<212> PRT
<213> Oryctolagus cuniculus
<400> 76
Arg Ala Ser Thr Leu Ala Ser
1 5
<210> 77
<211> 12
<212> PRT
<213> Oryctolagus cuniculus
<400> 77
Gln Gln Cys Tyr Ser Ser Ser Asn Val Asp Asn Thr
1 5 10
<210> 78
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> 299-000 HVR-L3 NYA
<400> 78
Gln Gln Asn Tyr Ala Ser Ser Asn Val Asp Asn Thr
1 5 10
<210> 79
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> anti-CD20 antibody VH
<400> 79
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Tyr Ser
20 25 30
Trp Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Phe Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Val Phe Asp Gly Tyr Trp Leu Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 80
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> anti-CD20 antibody VL
<400> 80
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Ser
20 25 30
Asn Gly Ile Thr Tyr Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Gln Met Ser Asn Leu Val Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Asn
85 90 95
Leu Glu Leu Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 81
<211> 126
<212> PRT
<213> Homo sapiens
<400> 81
Gln Val Glu Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Asn Ala Ser Gly Thr Arg Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Lys Gly Asn Thr His Lys Pro Tyr Gly Tyr Val Arg Tyr
100 105 110
Phe Asp Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 82
<211> 108
<212> PRT
<213> Homo sapiens
<400> 82
Asp Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Val Pro Ala Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Ile Tyr Asn Met Pro
85 90 95
Ile Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 83
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<223> humanized anti-alpha synuclein acntibody 9E4 VH
<400> 83
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ser Ile Ser Ser Gly Gly Gly Ser Thr Tyr Tyr Pro Asp Asn Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Ala Gly Ile Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 84
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> humanized anti-alpha synuclein acntibody 9E4 VL
<400> 84
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ser Ile Gln Thr Leu Leu Tyr Ser
20 25 30
Ser Asn Gln Lys Asn Tyr Leu Ala Trp Phe Gln Gln Lys Pro Gly Lys
35 40 45
Ala Pro Lys Leu Leu Ile Tyr Trp Ala Ser Ile Arg Lys Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Pro Glu Asp Leu Ala Thr Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Ser Tyr Pro Leu Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 85
<211> 115
<212> PRT
<213> Mus musculus
<400> 85
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Lys Pro Gly Thr
1 5 10 15
Ser Val Gln Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Met Asn Trp Ile Lys Ala Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Thr Asn Pro Asn Asn Gly Tyr Thr Asp Tyr Asn Gln Arg Phe
50 55 60
Lys Asp Lys Ala Ile Leu Thr Ala Asp Lys Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met His Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Ser Gly Gly His Leu Ala Tyr Trp Gly Gln Gly Thr Val Val Thr
100 105 110
Val Ser Ala
115
<210> 86
<211> 112
<212> PRT
<213> Mus musculus
<400> 86
Asp Val Val Met Thr Gln Ile Pro Leu Tyr Leu Ser Val Ser Pro Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Phe His Ser
20 25 30
Lys Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Asn Arg Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Gly Val Glu Ala Glu Asp Leu Gly Val Tyr Phe Cys Ser Gln Ser
85 90 95
Ala His Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Arg
100 105 110
<210> 87
<211> 115
<212> PRT
<213> Mus musculus
<400> 87
Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Thr Ser
1 5 10 15
Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Ser Tyr Tyr
20 25 30
Ile His Trp Val Lys Gln Ser Pro Gly Gln Gly Leu Glu Trp Ile Gly
35 40 45
Trp Ile Tyr Pro Gly Ser Gly Asn Thr Lys Tyr Ser Glu Lys Phe Lys
50 55 60
Gly Lys Ala Thr Leu Thr Ala Asp Thr Ser Ser Ser Thr Ala Tyr Met
65 70 75 80
Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys Ala
85 90 95
Arg Asp Gly Cys Tyr Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser
115
<210> 88
<211> 111
<212> PRT
<213> Mus musculus
<400> 88
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Lys Ala Ser Gln Ser Val Asp Tyr Asp
20 25 30
Gly Asp Ser Tyr Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Phe Leu Ile Cys Ala Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Asn Ile His
65 70 75 80
Pro Val Glu Glu Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Ser Asn
85 90 95
Glu Asp Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 89
<211> 115
<212> PRT
<213> Oryctolagus cuniculus
<400> 89
Gln Ser Val Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Thr Pro
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Ile Asn Ser Tyr Ala
20 25 30
Met Ile Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Ile Gly
35 40 45
Val Ile Tyr Pro Ser Gly Asn Thr Tyr Tyr Ala Asn Trp Ala Lys Gly
50 55 60
Arg Phe Thr Val Ser Arg Thr Ser Thr Thr Val Asp Leu Lys Ile Thr
65 70 75 80
Ser Pro Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Arg Arg Asp
85 90 95
Gly Thr Asp Lys Thr Phe Asn Ile Trp Gly Pro Gly Thr Leu Val Thr
100 105 110
Val Ser Leu
115
<210> 90
<211> 112
<212> PRT
<213> Oryctolagus cuniculus
<400> 90
Gln Val Leu Thr Gln Thr Pro Ser Pro Val Ser Ala Ala Val Gly Gly
1 5 10 15
Thr Val Thr Ile Asn Cys Gln Ala Ser Gln Asn Val Tyr Gly Asp Asn
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu
35 40 45
Ile Tyr Glu Ala Ser Lys Leu Ala Ser Gly Val Pro Pro Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Asp Val Gln
65 70 75 80
Cys Asp Asp Ala Ala Thr Tyr Tyr Cys Gln Gly Glu Phe Leu Cys Thr
85 90 95
Thr Ser Asp Cys Phe Thr Phe Gly Gly Gly Thr Gly Val Val Val Arg
100 105 110
<210> 91
<211> 119
<212> PRT
<213> Oryctolagus cuniculus
<400> 91
Gln Ser Val Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Thr Pro
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Ile Asp Leu Ser Arg Tyr Ala
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Val Ile Asn Ser Ser Gly Ala Thr Tyr Tyr Ala Ser Trp Ala Lys Gly
50 55 60
Arg Phe Thr Ile Ser Glu Thr Ser Thr Thr Val Glu Leu Lys Ile Thr
65 70 75 80
Ser Pro Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Arg Trp Thr
85 90 95
Tyr Asp Asp Tyr Gly Asp Phe Gln Gly Phe Asn Ile Trp Gly Pro Gly
100 105 110
Thr Leu Val Thr Val Ser Leu
115
<210> 92
<211> 111
<212> PRT
<213> Oryctolagus cuniculus
<400> 92
Ala Val Leu Thr Gln Thr Pro Ser Pro Val Ser Ala Ala Val Gly Gly
1 5 10 15
Thr Val Thr Ile Ser Cys Gln Ser Ser Gln Ser Val Tyr Asn Asn Asn
20 25 30
Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu
35 40 45
Ile Tyr Arg Ala Ser Lys Leu Ala Ser Gly Val Pro Ser Arg Phe Lys
50 55 60
Gly Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln
65 70 75 80
Cys Asp Asp Ala Ala Thr Tyr Tyr Cys Leu Gly Gly Tyr Asp Asp Asp
85 90 95
Ala Asp Met Gly Ala Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105 110
<210> 93
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<223> heavy chain variable domain
<400> 93
Gln Ser Leu Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Thr Pro
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Ile Asp Leu Ser Arg Asp Thr
20 25 30
Met Ile Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Ile Gly
35 40 45
Ser Ile Tyr Thr Asp Ser Gly Asn Thr Trp Tyr Ala Ser Trp Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Lys Thr Ser Ser Thr Thr Val Asp Leu Arg
65 70 75 80
Ile Thr Ser Pro Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Arg
85 90 95
Asn Phe Ser Val Trp Gly Pro Gly Thr Leu Val Thr Val Ser Leu
100 105 110
<210> 94
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> light chain variable domain
<400> 94
Gln Val Leu Thr Gln Thr Pro Ser Pro Val Ser Ala Ala Val Gly Gly
1 5 10 15
Thr Val Thr Ile Asn Cys Gln Ala Ser Gln Ser Val Tyr Asn Ser Asp
20 25 30
Arg Leu Ala Trp Phe Gln Gln Met Arg Gly Gln Pro Pro Lys Leu Leu
35 40 45
Ile Tyr Asp Val Ser Lys Leu Ala Ser Gly Val Pro Ser Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Asp Val Gln
65 70 75 80
Cys Asp Asp Ala Ala Thr Tyr Tyr Cys Leu Gly Gly Tyr Asp Cys Ser
85 90 95
Ser Ala Glu Cys Asn Val Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105 110
<210> 95
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> peptidic linker
<400> 95
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser
20
<210> 96
<211> 32
<212> PRT
<213> Artificial Sequence
<220>
<223> peptidic linker
<400> 96
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
20 25 30
<210> 97
<211> 536
<212> PRT
<213> Homo sapiens
<400> 97
Met Glu Phe Ser Ser Pro Ser Arg Glu Glu Cys Pro Lys Pro Leu Ser
1 5 10 15
Arg Val Ser Ile Met Ala Gly Ser Leu Thr Gly Leu Leu Leu Leu Gln
20 25 30
Ala Val Ser Trp Ala Ser Gly Ala Arg Pro Cys Ile Pro Lys Ser Phe
35 40 45
Gly Tyr Ser Ser Val Val Cys Val Cys Asn Ala Thr Tyr Cys Asp Ser
50 55 60
Phe Asp Pro Pro Thr Phe Pro Ala Leu Gly Thr Phe Ser Arg Tyr Glu
65 70 75 80
Ser Thr Arg Ser Gly Arg Arg Met Glu Leu Ser Met Gly Pro Ile Gln
85 90 95
Ala Asn His Thr Gly Thr Gly Leu Leu Leu Thr Leu Gln Pro Glu Gln
100 105 110
Lys Phe Gln Lys Val Lys Gly Phe Gly Gly Ala Met Thr Asp Ala Ala
115 120 125
Ala Leu Asn Ile Leu Ala Leu Ser Pro Pro Ala Gln Asn Leu Leu Leu
130 135 140
Lys Ser Tyr Phe Ser Glu Glu Gly Ile Gly Tyr Asn Ile Ile Arg Val
145 150 155 160
Pro Met Ala Ser Cys Asp Phe Ser Ile Arg Thr Tyr Thr Tyr Ala Asp
165 170 175
Thr Pro Asp Asp Phe Gln Leu His Asn Phe Ser Leu Pro Glu Glu Asp
180 185 190
Thr Lys Leu Lys Ile Pro Leu Ile His Arg Ala Leu Gln Leu Ala Gln
195 200 205
Arg Pro Val Ser Leu Leu Ala Ser Pro Trp Thr Ser Pro Thr Trp Leu
210 215 220
Lys Thr Asn Gly Ala Val Asn Gly Lys Gly Ser Leu Lys Gly Gln Pro
225 230 235 240
Gly Asp Ile Tyr His Gln Thr Trp Ala Arg Tyr Phe Val Lys Phe Leu
245 250 255
Asp Ala Tyr Ala Glu His Lys Leu Gln Phe Trp Ala Val Thr Ala Glu
260 265 270
Asn Glu Pro Ser Ala Gly Leu Leu Ser Gly Tyr Pro Phe Gln Cys Leu
275 280 285
Gly Phe Thr Pro Glu His Gln Arg Asp Phe Ile Ala Arg Asp Leu Gly
290 295 300
Pro Thr Leu Ala Asn Ser Thr His His Asn Val Arg Leu Leu Met Leu
305 310 315 320
Asp Asp Gln Arg Leu Leu Leu Pro His Trp Ala Lys Val Val Leu Thr
325 330 335
Asp Pro Glu Ala Ala Lys Tyr Val His Gly Ile Ala Val His Trp Tyr
340 345 350
Leu Asp Phe Leu Ala Pro Ala Lys Ala Thr Leu Gly Glu Thr His Arg
355 360 365
Leu Phe Pro Asn Thr Met Leu Phe Ala Ser Glu Ala Cys Val Gly Ser
370 375 380
Lys Phe Trp Glu Gln Ser Val Arg Leu Gly Ser Trp Asp Arg Gly Met
385 390 395 400
Gln Tyr Ser His Ser Ile Ile Thr Asn Leu Leu Tyr His Val Val Gly
405 410 415
Trp Thr Asp Trp Asn Leu Ala Leu Asn Pro Glu Gly Gly Pro Asn Trp
420 425 430
Val Arg Asn Phe Val Asp Ser Pro Ile Ile Val Asp Ile Thr Lys Asp
435 440 445
Thr Phe Tyr Lys Gln Pro Met Phe Tyr His Leu Gly His Phe Ser Lys
450 455 460
Phe Ile Pro Glu Gly Ser Gln Arg Val Gly Leu Val Ala Ser Gln Lys
465 470 475 480
Asn Asp Leu Asp Ala Val Ala Leu Met His Pro Asp Gly Ser Ala Val
485 490 495
Val Val Val Leu Asn Arg Ser Ser Lys Asp Val Pro Leu Thr Ile Lys
500 505 510
Asp Pro Ala Val Gly Phe Leu Glu Thr Ile Ser Pro Gly Tyr Ser Ile
515 520 525
His Thr Tyr Leu Trp Arg Arg Gln
530 535
<---