КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ РАКА
Вид РИД
Изобретение
ССЫЛКА НА ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ, ПОДАННЫЙ В ЭЛЕКТРОННОМ ВИДЕ
[0001] В настоящую заявку включен с помощью ссылки Перечень последовательностей, поданный с настоящей заявкой в машиночитаемой форме (CRF) в виде текстового файла под названием "[DOCKET NO.] _SeqList", созданного 1 мая 2015 г. и имеющего размер 19718 байт.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[0002] Раковые стволовые клетки (CSC), как предполагает их название, представляют собой подгруппу раковых клеток с характеристиками плюрипотентности и неограниченного самообновления, как у стволовых клеток. Соответственно считается, что эта субпопуляция клеток отвечает за образование опухоли и адаптацию к ее окружению. Некоторые данные в настоящее время указывают на то, что CSC, вероятно, отвечают за устойчивость к лекарственным препаратам, метастазирование и рецидив рака, в частности в случаях с минимальной остаточной болезнью. Действительно, недавние клинические данные показали, что доля клеток рака молочной железы, которые выживали после стандартной терапии, была повышена среди клеток, несущих сигнатуру CSC (Creightonetal., 2009). В аналогичном исследовании пациенты с делецией 5q MDS, как было обнаружено, также имели остаточные популяции злокачественных стволовых клеток в своем костном мозге, несмотря на наступление клинической и цитогенетической ремиссий (Tehranchietal., 2010). В настоящее время считается, что при многих клинических показаниях, несмотря на начальный терапевтический ответ, сохранение подгруппы устойчивых раковых клеток может приводить к рецидиву и потенциально метастазированию.
[0003] С момента своего первоначального обнаружения раковые стволовые клетки были обнаружены и подтверждены во многих типах опухолей. После первоначальной идентификации CSC в модели AML (Lapidotetal., 1994), CSC были открыты и подтверждены в ряде гематологических и солидных злокачественных опухолей. Первые данные о CSC в солидных опухолях были получены из рака молочной железы, где CSC, как было обнаружено, характеризовались фенотипом CD44+/CD24- поверхностного маркера (Al-Hajjetal., 2003). Также были хорошо описаны CSC в случае рака поджелудочной железы. Несмотря на то, что в разных отчетах CSC поджелудочной железы идентифицируют либо как Epcam+/CD44+/CD24+ (Lietal., 2007), либо как CD133+ (Hermannetal., 2007), авторы настоящего изобретения более всего прослеживают связь тройной положительной сигнатуры Epcam+/CD44+/CD24+ с онкогенным фенотипом CSC (vanVlerkenetal., 2013). В ряде отчетов CSC выявлены при колоректальном раке, и в исследовании выявлено происхождение стволовых клеток у мыши в случаях опухолей кишечника и колоректальных опухолей (Barkeretal., 2009). Тем не менее, в уровне техники в данной области не достигнуто согласие относительно фенотипа маркера поверхности в случаях колоректальных CSC человека. Несмотря на то, что сообщалось о многих маркерах поверхности, таких как CD66 (Gemeietal., 2013), LGR5 (Hirschetal., 2014), CD44 и CD133 (Wangetal., 2012), в данной области отсутствует какое-либо надежное подтверждение того, что любой из этих фенотипов маркеров поверхности может соответствовать колоректальным CSC человека, способствуя тому, чтобы с помощью других методик, таких как рост неадгезивных гранул (например, колосфер в случае колоректальных CSC), найти практическое применение при обнаружении наличия CSC.
[0004] Препараты, которые целенаправленно воздействуют на CSC, появляются в виде критического компонента любой успешной терапии против рака. Современные исследования показывают, что CSC отвечают за устойчивость к химическому воздействию, метастазирование и в конечном итоге рецидив рака, даже после изначального успешного терапевтического вмешательства. Несмотря на то, что CSC управляются теми же основными путями самообновления, которые управляют плюрипотентностью эмбриональных стволовых клеток, информация о других клеточных путях, которые управляют активностью CSC, ограничена.
[0005] Доступность дополнительных композиций и способов лечения форм рака, в том числе способов ослабления онкогенности рака и ингибирования или уничтожения раковых клеток, таких как раковые стволовые клетки (например, индуцирующие апоптоз или дифференцировку), будет обеспечивать больше вариантов терапии и обладать потенциалом для лучших клинических результатов, таких как ремиссия заболевания и/или улучшение качества жизни пациента.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0006] В одном аспекте настоящее раскрытие относится к способу ингибирования пролиферации раковой стволовой клетки (CSC), предусматривающему приведение CSC в контакт с ингибитором CCL20 и/или ингибитором CCR6 в количестве, эффективном для ингибирования пролиферации и/или ослабления выживания CSC.
[0007] В одном аспекте настоящее раскрытие относится к способу лечения терапевтически устойчивой формы рака у субъекта, который ранее получал терапию и который нуждается в лечении, предусматривающему введение субъекту ингибитора CCL20 и/или ингибитора CCR6 в количестве, эффективном для ингибирования или уничтожения раковых стволовых клеток (CSC), присутствующих при терапевтически устойчивой форме рака. В некоторых вариантах осуществления способ может предусматривать введение субъекту ингибитора CCL20 и/или ингибитора CCR6 в количестве, эффективном для индукции дифференцировки раковых стволовых клеток (CSC), присутствующих при терапевтически устойчивой форме рака.
[0008] В одном аспекте настоящее раскрытие относится к способу лечения терапевтически устойчивой формы рака у субъекта, который ранее получал терапию и который нуждается в лечении, предусматривающему введение субъекту ингибитора CCL20 и/или ингибитора CCR6 в количестве, эффективном для лечения терапевтически устойчивой формы рака.
[0009] В одном аспекте настоящее раскрытие относится к способу лечения рака, который предусматривает раковые стволовые клетки (CSC), при этом способ предусматривает введение субъекту, нуждающемуся в лечении, ингибитора CCL20 и/или ингибитора CCR6 в количестве, эффективном для целенаправленного воздействия и ингибирования или уничтожения CSC при раке. В некоторых вариантах осуществления способ может предусматривать введение субъекту ингибитора CCL20 и/или ингибитора CCR6 в количестве, эффективном для индукции дифференцировки раковых стволовых клеток (CSC), присутствующих при раке.
[0010] В одном аспекте настоящее раскрытие относится к способу лечения рака, который предусматривает раковые стволовые клетки (CSC), при этом способ предусматривает введение субъекту, нуждающемуся в лечении, ингибитора CCL20 и/или ингибитора CCR6 в количестве, эффективном для лечения рака.
[0011] В одном аспекте настоящее раскрытие относится к способу лечения рака у субъекта, у которого имеется рекуррентная или рецидивирующая форма рака, предусматривающему введение субъекту ингибитора CCL20 и/или ингибитора CCR6 в количестве, эффективном для ингибирования или уничтожения CSC при раке. В некоторых вариантах осуществления способ может предусматривать введение субъекту ингибитора CCL20 и/или ингибитора CCR6 в количестве, эффективном для индукции дифференцировки раковых стволовых клеток (CSC), присутствующих в рекуррентной или рецидивирующей форме рака.
[0012] В одном аспекте настоящее раскрытие относится к способу лечения рака у субъекта, у которого имеется рекуррентная или рецидивирующая форма рака, предусматривающему введение субъекту ингибитора CCL20 и/или ингибитора CCR6 в количестве, эффективном для лечения рака.
[0013] В одном аспекте настоящее раскрытие относится к способу предупреждения повторного проявления или рецидива рака, предусматривающему введение субъекту, нуждающемуся в предупреждении повторного проявления или рецидива рака, ингибитора CCL20 и/или ингибитора CCR6 в количестве, эффективном для предупреждения повторного проявления или рецидива рака.
[0014] В дополнительном аспекте настоящее раскрытие относится к способу снижения риска рецидива рака у субъекта, у которого имеется рак, предусматривающему введение субъекту ингибитора CCL20 и/или ингибитора CCR6 в количестве, эффективном для ингибирования или уничтожения CSC при раке, в результате чего снижается риск рецидива рака у субъекта. В некоторых вариантах осуществления способ может предусматривать введение субъекту ингибитора CCL20 и/или ингибитора CCR6 в количестве, эффективном для индукции дифференцировки раковых стволовых клеток (CSC), присутствующих при раке, и для снижения риска повторного проявления или рецидива рака.
[0015] В другом аспекте настоящее раскрытие относится к способу устранения раковой стволовой клетки (CSC), предусматривающему приведение CSC в контакт с ингибитором CCL20 и/или ингибитором CCR6 в количестве, эффективном для удаления CSC.
[0016] В одном аспекте настоящее раскрытие относится к способу избирательного уменьшения числа раковых стволовых клеток (CSC) в популяции раковых клеток, предусматривающему приведение популяции раковых клеток в контакт с ингибитором CCL20 и/или ингибитором CCR6 в количестве, эффективном для ингибирования или уничтожения CSC в популяции раковых клеток. В некоторых вариантах осуществления способ может предусматривать введение субъекту ингибитора CCL20 и/или ингибитора CCR6 в количестве, эффективном для индукции дифференцировки раковых стволовых клеток (CSC) в популяции раковых клеток и для уменьшения числа CSC.
[0017] В дополнительном аспекте настоящее раскрытие предусматривает способ ослабления или ингибирования роста опухоли, предусматривающий приведение опухоли в контакт с ингибитором CCL20 и/или ингибитором CCR6 в количестве, эффективном для ослабления или ингибирования роста опухоли. В связанном аспекте настоящее раскрытие предусматривает способ ослабления или ингибирования роста опухоли у пациента, предусматривающий введение пациенту ингибитора CCL20 и/или ингибитора CCR6 в количестве, эффективном для ослабления или ингибирования роста опухоли.
[0018] В другом аспекте настоящее раскрытие предусматривает способ уменьшения размера опухоли, предусматривающий приведение опухоли в контакт с ингибитором CCL20 и/или ингибитором CCR6 в количестве, эффективном для уменьшения размера опухоли. В связанном аспекте настоящее раскрытие относится к способу уменьшения размера опухоли у пациента, предусматривающему введение пациенту ингибитора CCL20 и/или ингибитора CCR6 в количестве, эффективном для уменьшения размера опухоли.
[0019] В другом аспекте настоящее раскрытие предусматривает способ ингибирования, ослабления или предупреждения инвазивности или метастазирования опухоли, предусматривающий приведение опухоли в контакт с ингибитором CCL20 и/или ингибитором CCR6 в количестве, эффективном для ингибирования, ослабления или предупреждения инвазивности или метастазирования опухоли. В связанном аспекте настоящее раскрытие относится к способу ингибирования, ослабления или предупреждения инвазивности или метастазирования опухоли у пациента, предусматривающему введение пациенту ингибитора CCL20 и/или ингибитора CCR6 в количестве, эффективном для ингибирования, ослабления или предупреждения инвазивности или метастазирования опухоли.
[0020] Настоящее раскрытие также относится к одному или нескольким вариантам применения ингибитора CCL20 и/или ингибитора CCR6 или их комбинации в композиции, включающей в себя терапевтические и фармацевтические композиции. В вариантах осуществления варианты применения и композиции предусматривают ингибитор(-ы) в количествах, эффективных для обеспечения осуществления различных способов, описанных в данном документе. В вариантах осуществления один или несколько вариантов применения относятся к вариантам применения для получения лекарственного препарата для лечения (например, уничтожения, устранения, ингибирования, уменьшения прогрессирования и/или скорости прогрессирования пролиферации клеток, уменьшения прогрессирования и/или скорости прогрессирования состояния заболевания, уменьшения способности самообновления и увеличения количества (например, индуцирования дифференцировки)) одной или нескольких из опухолей, раковых стволовых клеток и/или форм рака, описанных в данном документе.
[0021] В другом аспекте настоящее раскрытие предусматривает способы диагностики, прогнозирования, количественного определения, обнаружения и/или выявления присутствия раковой стволовой клетки (CSC) в образце, содержащем раковые клетки, где способ предусматривает:
приведение образца в контакт со средством, которое связывается с последовательностью нуклеиновой кислоты CCL20 или аминокислотной последовательностью CCL20;
выявление присутствия или отсутствия связывания между средством и последовательностью нуклеиновой кислоты CCL20 или аминокислотной последовательностью CCL20 и
обнаружение присутствия CSC в образце при выявлении связывания между средством и последовательностью нуклеиновой кислоты CCL20 или аминокислотной последовательностью CCL20.
[0022] В вариантах осуществления данного аспекта способ дополнительно может предусматривать одно или несколько из следующего:
определение количества последовательности нуклеиновой кислоты CCL20 или аминокислотной последовательности CCL20 в образце;
сравнение количества последовательности нуклеиновой кислоты CCL20 или аминокислотной последовательности CCL20 с эталонным уровнем нуклеиновой кислоты CCL20 или аминокислоты CCL20 и/или
обнаружение присутствия CSC в образце, в случае если выявленное количество является большим, чем эталонный уровень.
[0023] В еще одних дополнительных вариантах осуществления способ может предусматривать средство, содержащее выявляемый фрагмент. В некоторых вариантах осуществления средство может содержать последовательность нуклеиновой кислоты, которая гибридизуется по меньшей мере с частью последовательности нуклеиновой кислоты CCL20 в жестких условиях гибридизации. В некоторых вариантах осуществления средство может содержать антитело, которое специфически связывается по меньшей мере с частью аминокислотной последовательности CCL20.
[0024] В различных вариантах осуществления вышеуказанных аспектов способы относятся к опухоли, и/или CSC, или популяции CSC, экспрессирующим CCL20. В некоторых вариантах осуществления вышеуказанных аспектов способы относятся к опухоли, и/или CSC, или популяции CSC, экспрессирующим CCR6. В дополнительных вариантах осуществления опухоль, и/или CSC, или популяция CSC могут содержать сферообразующие CSC.
[0025] В различных вариантах осуществления вышеуказанных аспектов способы относятся к опухоли и/или раку, выбранным из колоректального рака, рака поджелудочной железы, рака легкого, рака головы и шеи, рака желудка, гепатоцеллюлярной карциномы и рака молочной железы.
[0026] Аспекты и варианты осуществления, описанные в данном документе, относятся к способам, которые предусматривают ингибитор CCL20, ингибитор CCR6 или комбинацию ингибиторов CCL20 и/или CCR6. В некоторых вариантах осуществления ингибитор содержит антитело, которое связывает CCL20, антитело, которое связывает CCR6, низкомолекулярный ингибитор CCL20, низкомолекулярный ингибитор CCR6, siRNA, которая гибридизуется с нуклеиновой кислотой, кодирующей CCL20, или siRNA, которая гибридизуется с нуклеиновой кислотой, кодирующей CCR6, или любую их комбинацию.
[0027] Вышеуказанные аспекты и варианты осуществления также относятся к способам, вариантам применения и композициям, которые дополнительно предусматривают дополнительную терапию для лечения заболеваний, связанных с ангиогенезом, онкогенезом и формами рака, и могут предусматривать терапевтический режим, такой как, например, химиотерапия, лучевая терапия, иммунотерапия или любое другое активное средство или терапия, которые известны из уровня техники.
[0028] Другие аспекты описания и иллюстративных графических материалов, следующих после описания, будут очевидными для специалиста в данной области техники.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0029] С целью иллюстрации настоящего раскрытия в графических материалах изображены отдельные аспекты настоящего раскрытия. Тем не менее, настоящее раскрытие не ограничено точными схемами и средствами из аспектов, изображенных на графических материалах.
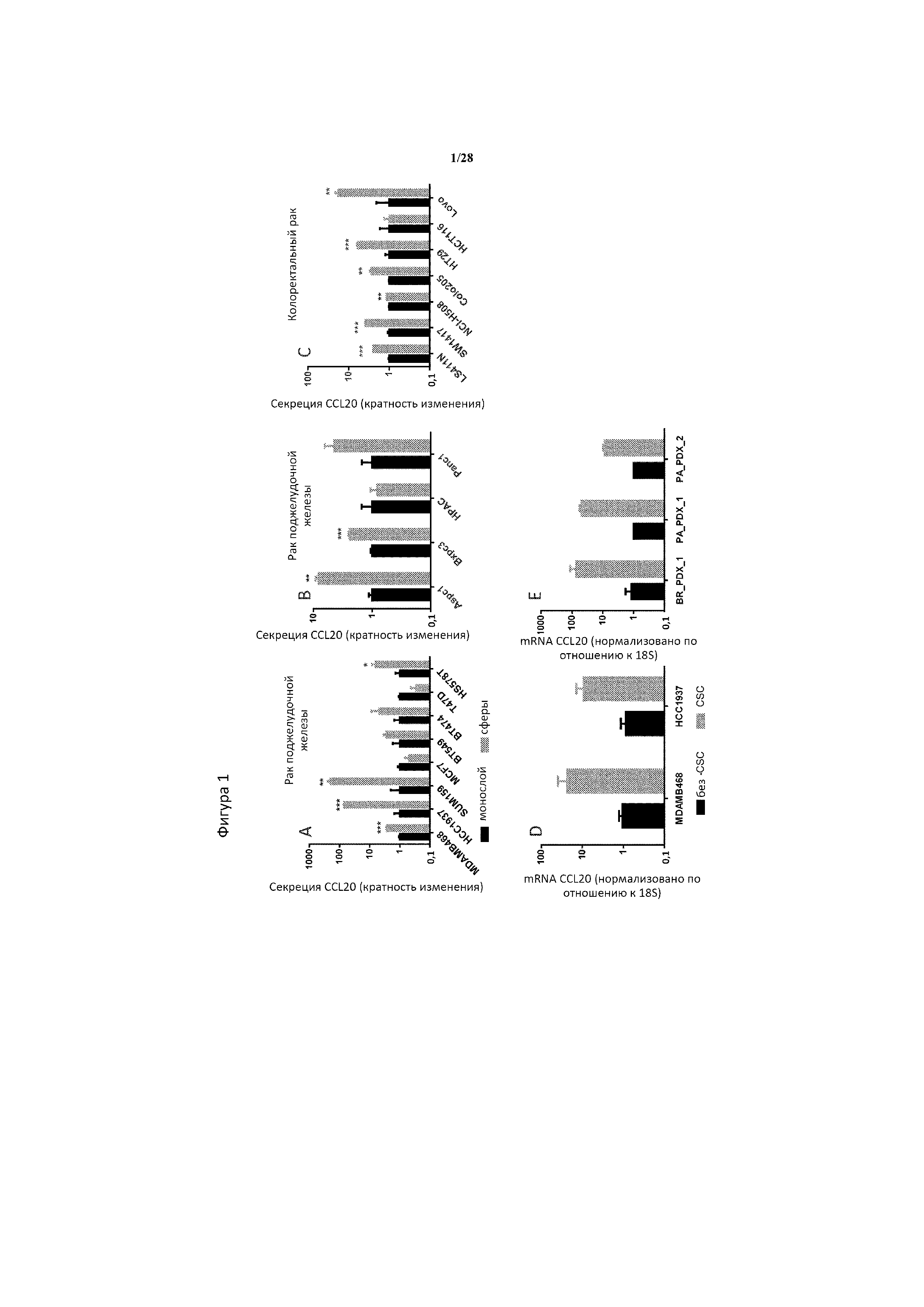
[0030] На фигуре 1A-1E показано, что CSC характеризуются повышенной экспрессией CCL20 по сравнению с клетками, не являющимися CSC. Сферическая культура с высоким содержанием CSC активирует секрецию CCL20 по сравнению со стандартной монослойной культурой в 4 из 8 исследуемых линий рака молочной железы (A), 2 из 4 исследуемых линий рака поджелудочной железы (B) и 6 из 7 исследуемых линией колоректального рака (C). Уровни CCL20 измеряли в пикограммах/миллилитрах (пг/мл) из кондиционированной среды клеток в культуре через 4 дня с помощью ELISA, и затем уровни CCL20 в пг/мл переводили в кратное изменение по сравнению с клетками той же линии, культивированными в монослое. Выделенные с помощью FACS CD44high/+ CD24low/- CSC из 2 клеточных линий молочной железы (MDAMB468 и HCC1937) характеризовались повышенными уровнями mRNA CCL20 по сравнению с CD44low/- CD24low/-, не относящимися к CSC, выделенными из тех же линий (D). Аналогично, выделенные CSC в моделях ксенотрансплантатов пациентов (PDX) из 1 образца молочной железы (BR_PDX_1) и 2 образцов поджелудочной железы (PA_PDX_1 и PA_PDX_2) также характеризовались повышенными уровнями mRNA CCL20 по сравнению с клетками, не являющимися CSC, выделенными из той же линии (E). CSC для моделей PDX молочной железы выявляли в виде Epcam+ CD44+ CD24-, и для моделей PDX поджелудочной железы - в виде Epcam+ CD44+ CD24+, в то время как клетки молочной железы, не являющиеся CSC, в модели PDX представляли собой Epcam+ CD44- CD24-, а клетки поджелудочной железы, не являющиеся CSC, представляли собой Epcam- CD44- CD24-. Для панелей A-C, n=3 биологические повторности/условие/клеточная линия; ***, ** и * означают статистическую значимость p<0,001, p<0,01 и p<0,05 соответственно между сферами и монослойной культурой, как определено с помощью t-критерия. Для панелей D и E, n=2 технические повторности/условие/клеточная линия. RE=относительная экспрессия значений Ct, нормализованных по отношению к 18S рибосомальной РНК и выраженных по отношению к уровням клеток, не являющихся CSC.
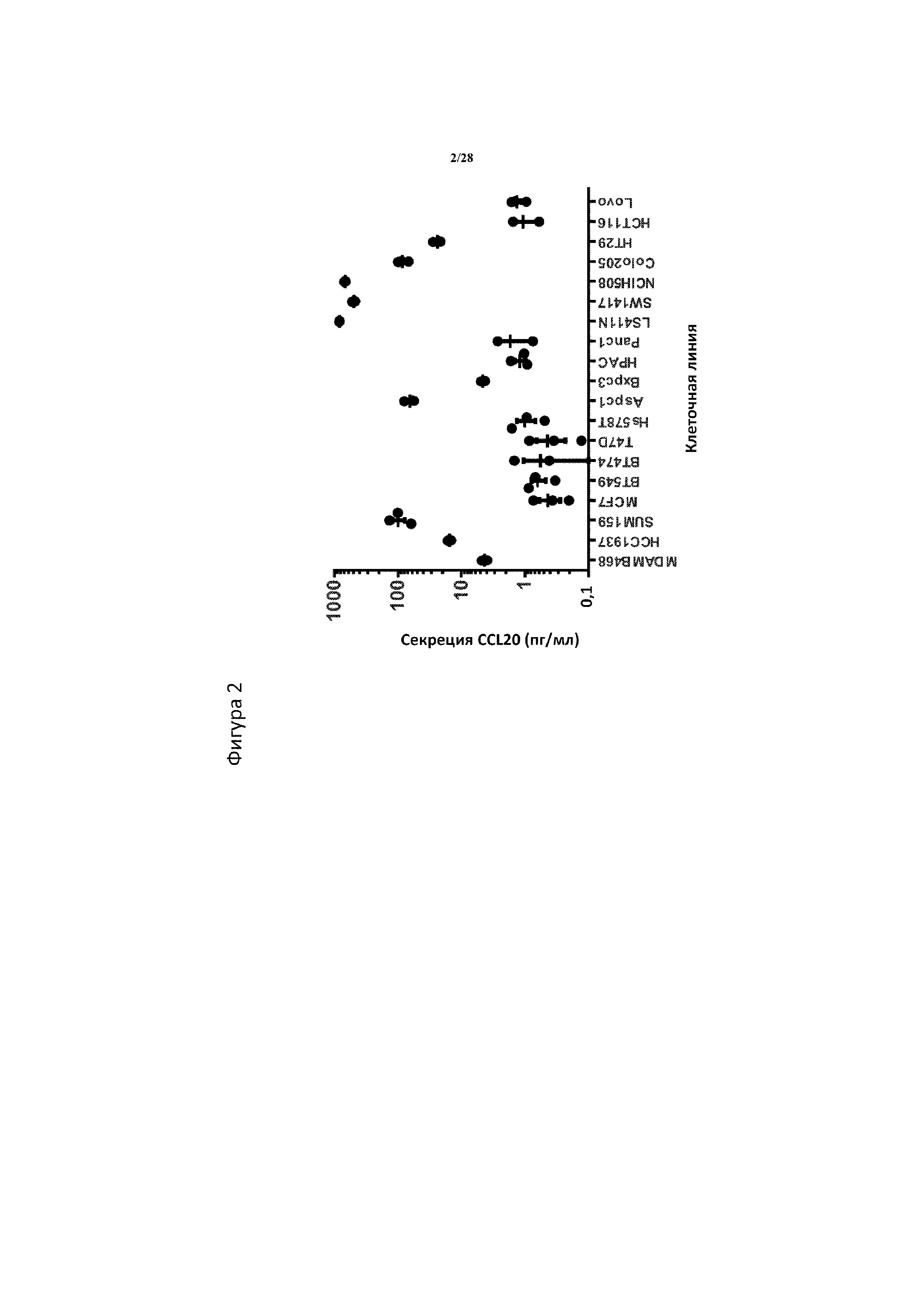
[0031] На фигуре 2 показана секреция CCL20 в сферической культуре. Среднее ±SEM для уровней CCL20 измеряли в кондиционированных средах сферических культивированных клеток, собранных на 4-й день. Абсолютные уровни CCL20 измеряли с помощью ELISA по отношению к стандартной кривой. N=3 биологические повторности/клеточная линия.
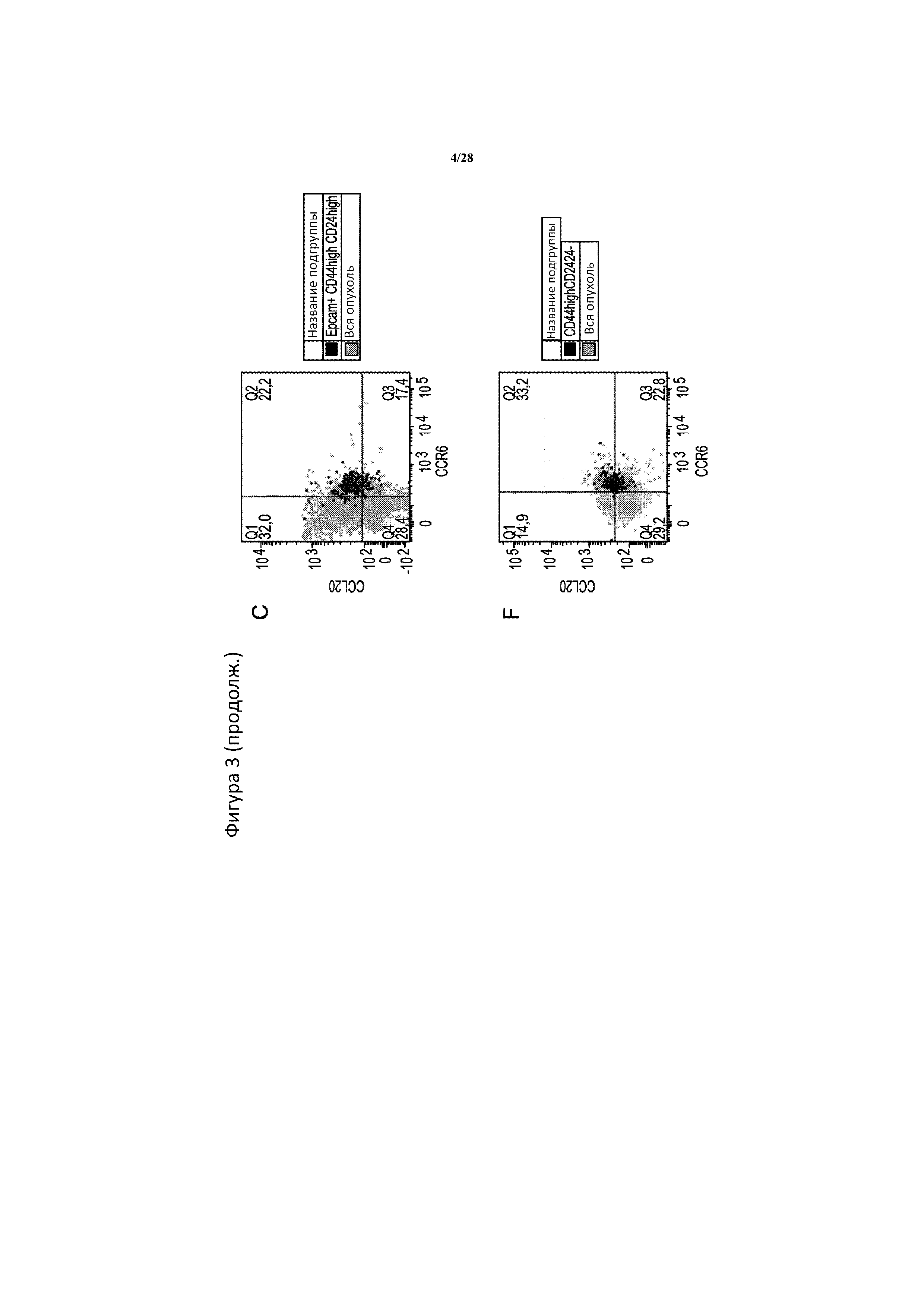
[0032] На фигуре 3A-3F показано, что CSC непосредственно совместно локализуются с фенотипом CCL20+. CSC из монослойной культуры модели поджелудочной железы Bxpc3 определяют как Epcam+ CD44high CD24high с помощью проточной цитометрии (A), в то время как CSC молочной железы из монослойной модели HCC1937 определяют как CD44high CD24- (D). Как в Bxpc3 (B), так и в HCC1937 (E) обнаружено, что CSC характеризуются 1,5-кратной экспрессией CCL20 по сравнению со средним значением во всей популяции опухолевых клеток (полная опухоль), как определено с помощью средней интенсивности флуоресценции (среднее: Comp-APC A) APC-меченых антител к CCL20. Кроме того, как в Bxpc3 (C), так и в HCC1937 (F), CSC, представленные в виде черных точек, по-видимому главным образом перекрываются с популяцией клеток CCL20+ CCR6+, как определено с помощью многоцветной проточной цитометрии. Рассеивание всех опухолевых клеток представлено для сравнения в виде серых точек.
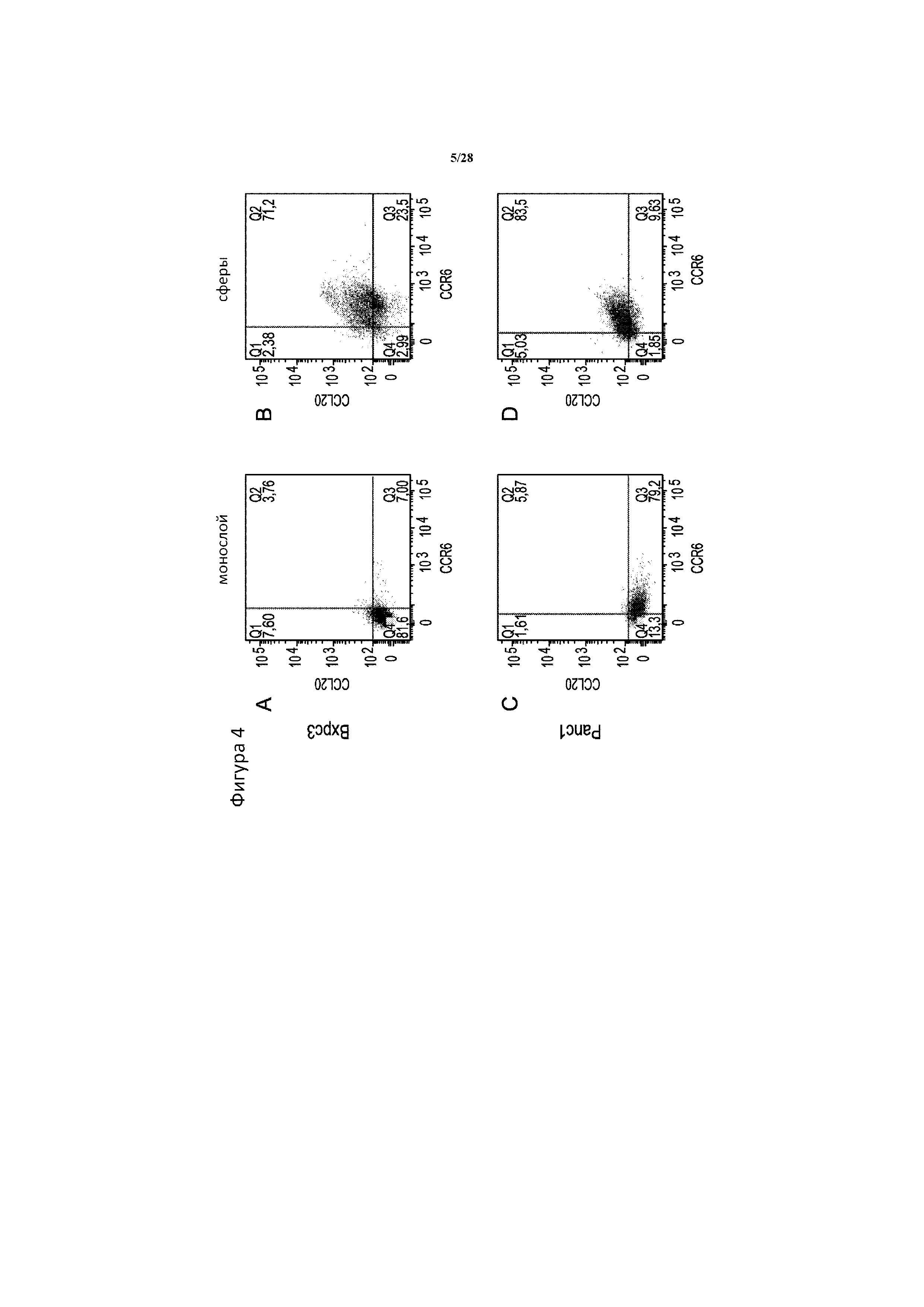
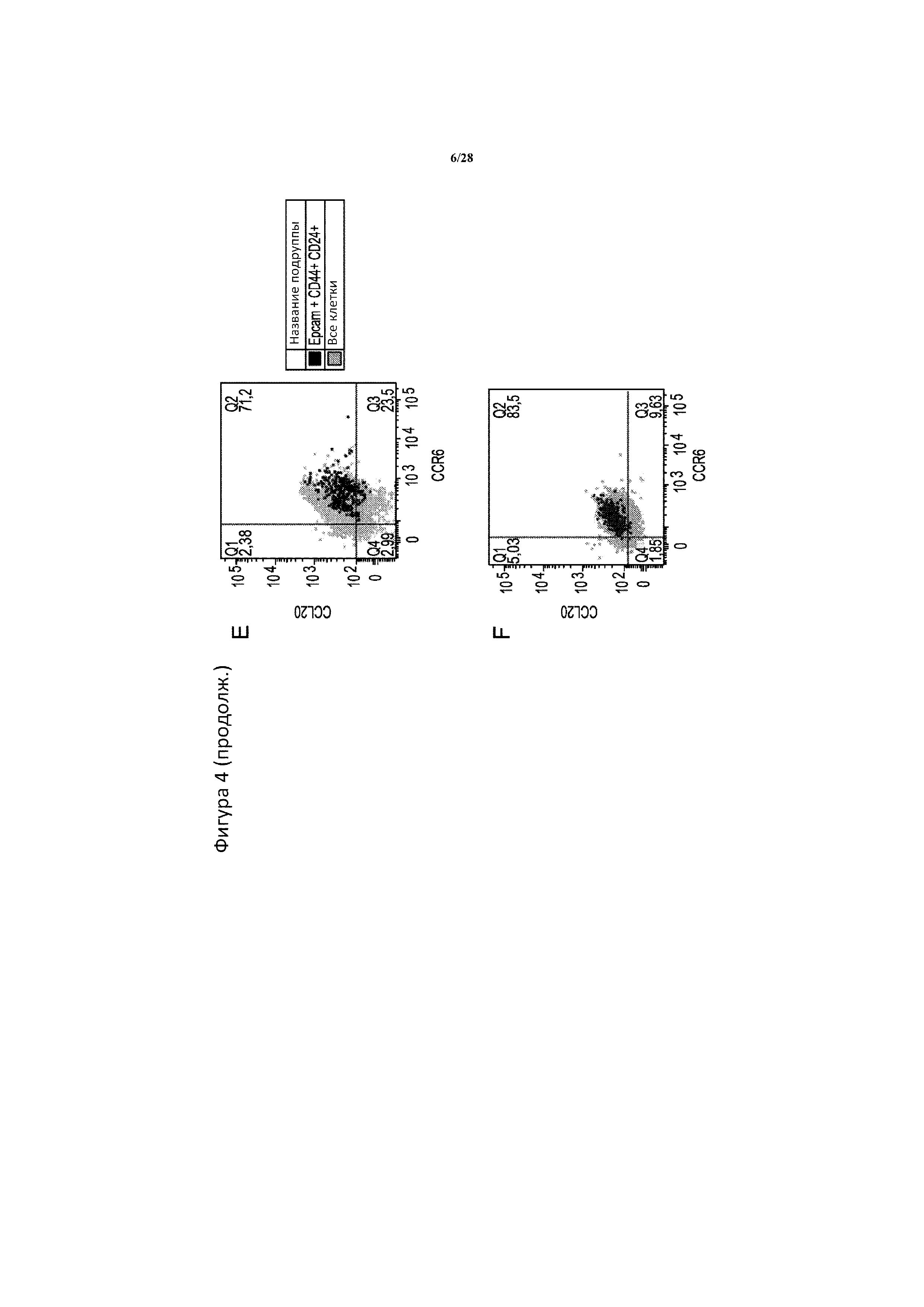
[0033] На фигуре 4A-4F показано, что обогащенная CSC сферическая культура вызывает резкое увеличение количества популяции CCL20+CCR6+. Частота CCL20+CCR6+ резко возрастает в моделях рака поджелудочной железы Bxpc3 (A, B) и Panc1 (C, D), в случае если клетки культивируют в условиях образования сфер (B, D), по сравнению с монослойной культурой (A, C), как определено с помощью многоцветной проточной цитометрии. Кроме того, CSC поджелудочной железы, определенные из сферической культуры как Epcam+CD44+CD24+, представленные в виде черных точек, перекрываются главным образом с популяцией CCL20+CCR6+ в моделях Bxpc3 (E) и Panc1 (F). Рассеивание всех опухолевых клеток представлено для сравнения в виде серых точек.
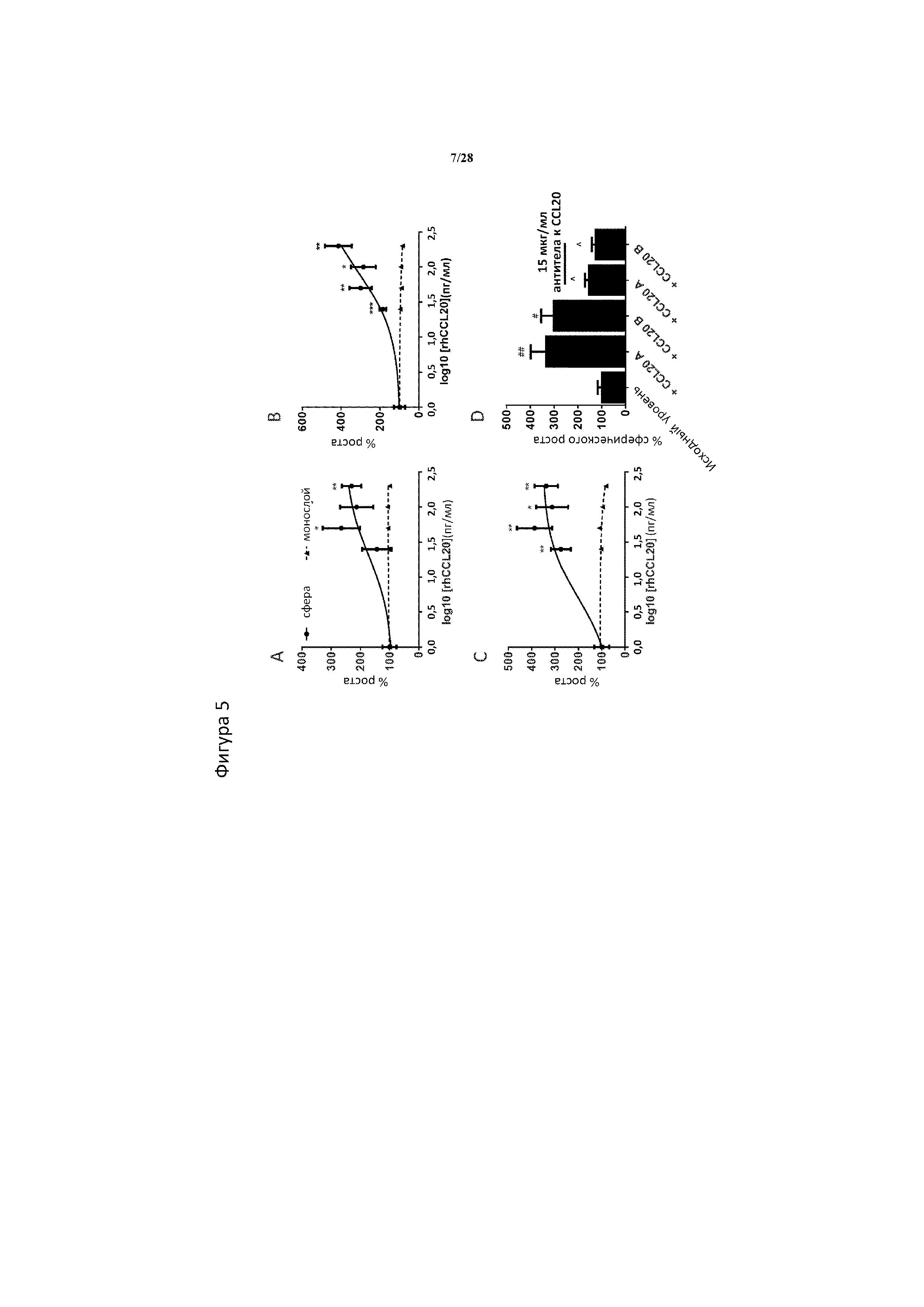
[0034] На фигуре 5A-5D показано, что добавление очищенного CCL20 к культуре активирует рост обогащенных CSC сферических сфер, но не культивируемых клеток стандартного монослоя. В моделях рака поджелудочной железы Bxpc3 (A), рака поджелудочной железы Aspc1 (B) и рака молочной железы SUM159 (C) проводили стимулирование рекомбинантным CCL20 человека (rhCCL20) при 0, 25, 50, 100 и 200 пг/мл в течение 4 дней как в сферической, так и в монослойной культуре, при этом CCL20 вводили во время посева. На клетках BT549 (D) показано, что потенциирование CCL20 сферического роста наблюдается при применении CCL20 из 2 отдельных коммерческих источников, R&D systems (CCL20 A) и Life Technologies (CCL20 B), при этом в обоих случаях введение выполняли при 50 пг/мл. Специфичность CCL20 в опосредовании этой стимуляции роста подтверждали в случае если добавление моноклонального антитела к CCL20 при 15 мкг/мл сводило данный эффект к нулю как в случае CCL20 A, так и в случае CCL20 B (D). При этом n=5 биологических повторностей/обработка/клеточная линия. ***, ** и * означают статистическую значимость p<0,001, p<0,01 и p<0,05 соответственно между сферами и монослойной культурой при соответствующих концентрациях CCL20, как определено с помощью t-теста. ## и # означают статистическую значимость p<0,01 и p<0,05 соответственно между исходными и стимулированными CCL20 сферами, и ^ означает статистическую разницу p<0,05 между стимулированными CCL20 клетками при добавлении и без добавления антитела к CCL20, как определено с помощью 1-факторного ANOVA с применением критерия Тьюки для множественных сравнений.
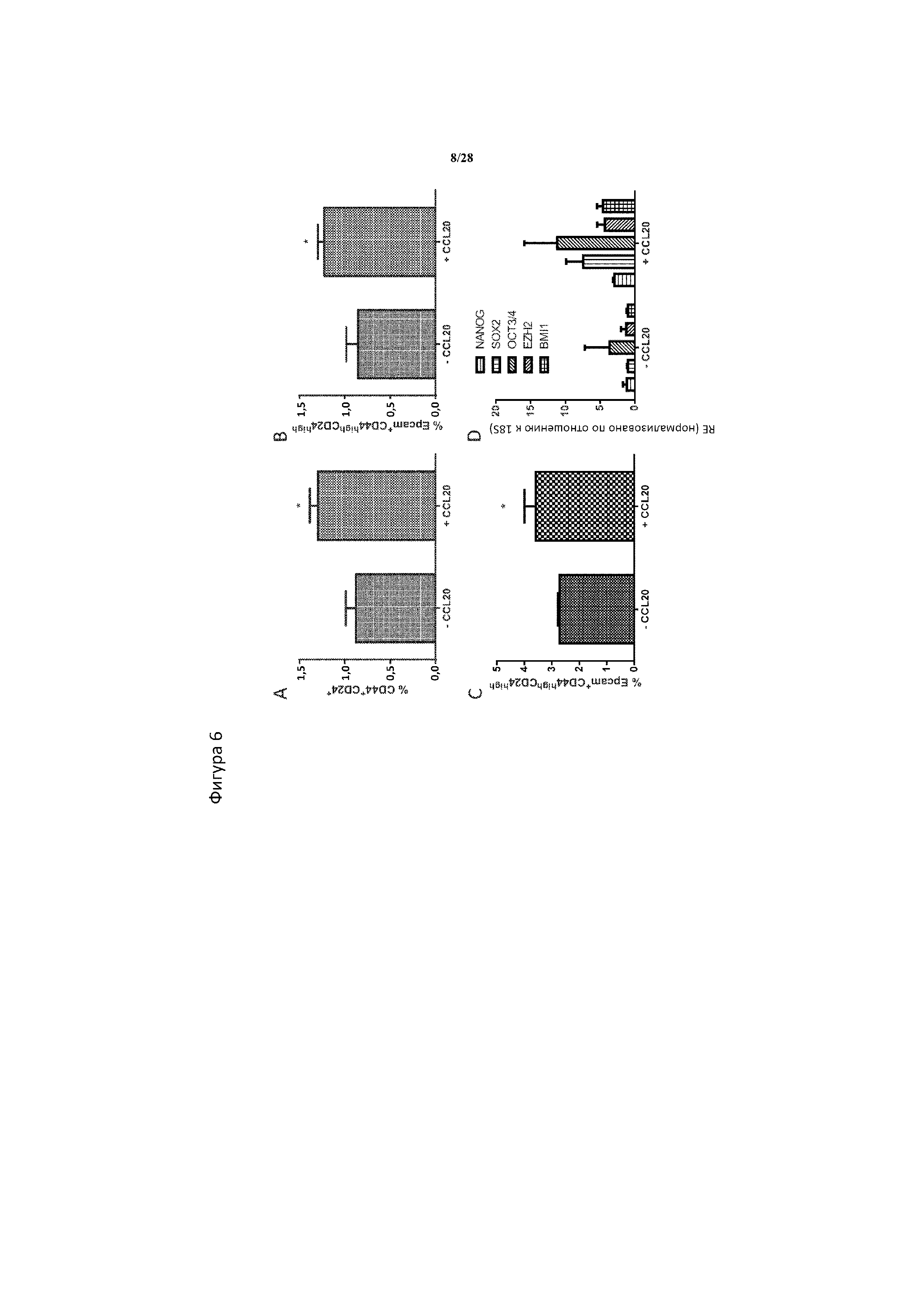
[0035] На фигуре 6A-6D показано, что стимуляция раковых клеток CCL20 непосредственно повышает частоту CSC в культуре. Добавление 200 пг/мл рекомбинантного CCL20 человека к клеткам в сферической культуре непосредственно повышает процент CSC через 4 дня в моделях рака молочной железы и рака поджелудочной железы, наблюдаемый в (A) клетках рака молочной железы MDAMB468, характеризуемых как CD44+ CD24-, (B) в клетках рака поджелудочной железы Bxpc3 и (C) в клетках рака поджелудочной железы Aspc1, характеризуемых в обоих случаях как Epcamhigh CD44high CD24high. Сферы Bxpc3, стимулируемые в течение 4 дней 200 пг/мл, характеризуются соответствующим повышением экспрессии генов стволовости NANOG, SOX2, OCT3/4, BMI1 и EZH2 (D). Панели A-C, n=3 биологические повторности/обработка/клеточная линия. * означает статистическую значимость p<0,05 между клетками, обработанными и не обработанными CCL20, как определено с помощью одностороннего t-критерия. Панель D, n=2 технические повторности/обработка; RE=относительная экспрессия значений Ct, нормализованных по отношению к 18S рибосомальной РНК и выраженных по отношению к уровням -CCL20.
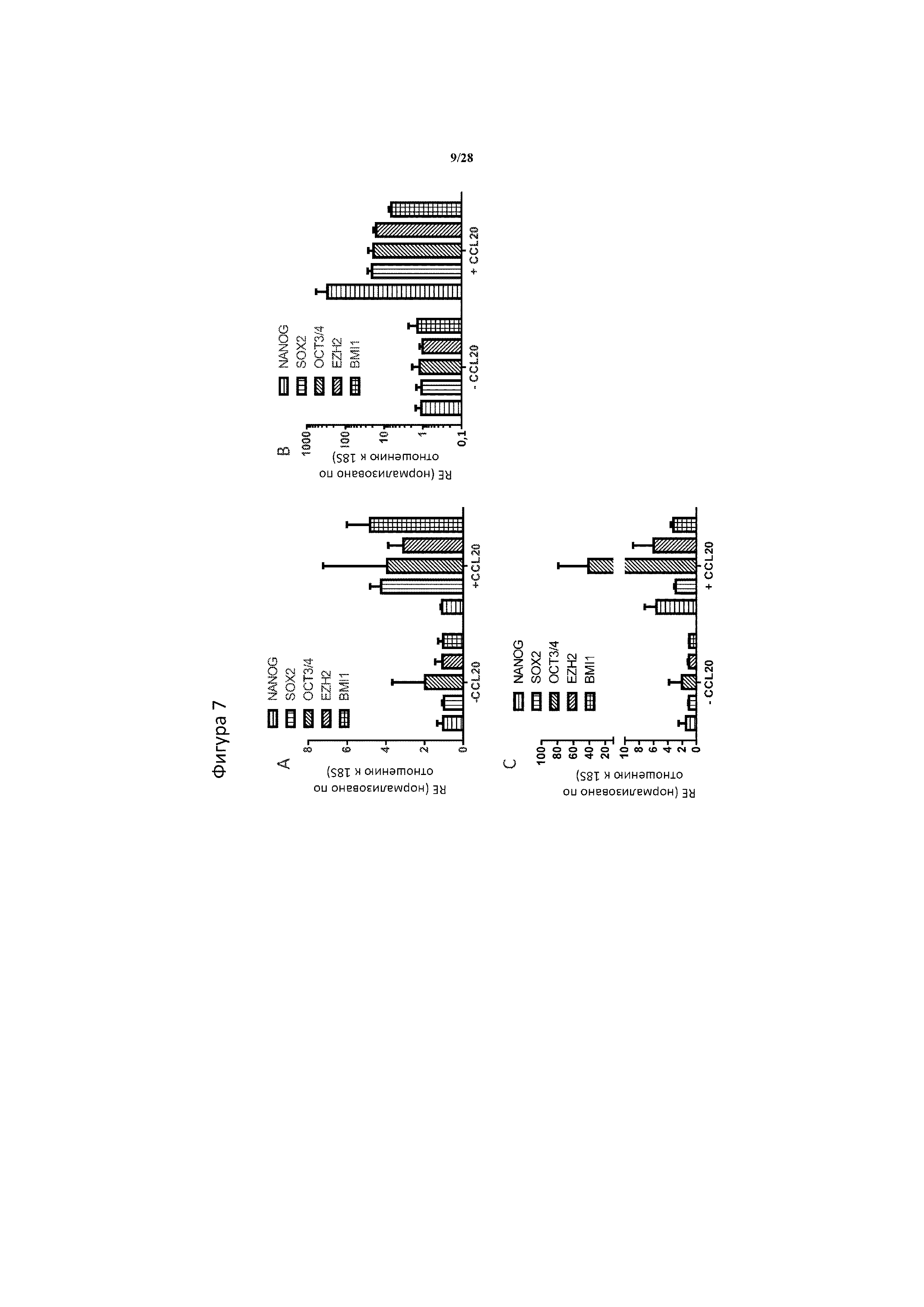
[0036] На фигуре 7A-7C показано, что стимуляция сфер CCL20 индуцирует экспрессию генов стволовости. Относительная экспрессия (RE) генов стволовости NANOG, SOX2, OCT3/4, EZH2 и BMI1 в сферах Hs578T (A), Panc1 (B) и SUM159 (C), обрабатываемых в течение 4 дней 100 пг/мл рекомбинантного CCL20 человека (+ CCL20) по сравнению с необработанными сферами (-CCL20). RE=относительная экспрессия значений Ct, нормализованных по отношению к 18S рибосомальной РНК и выраженных по отношению к уровням -CCL20. N=2 технические повторности/обработка/клеточная линия.
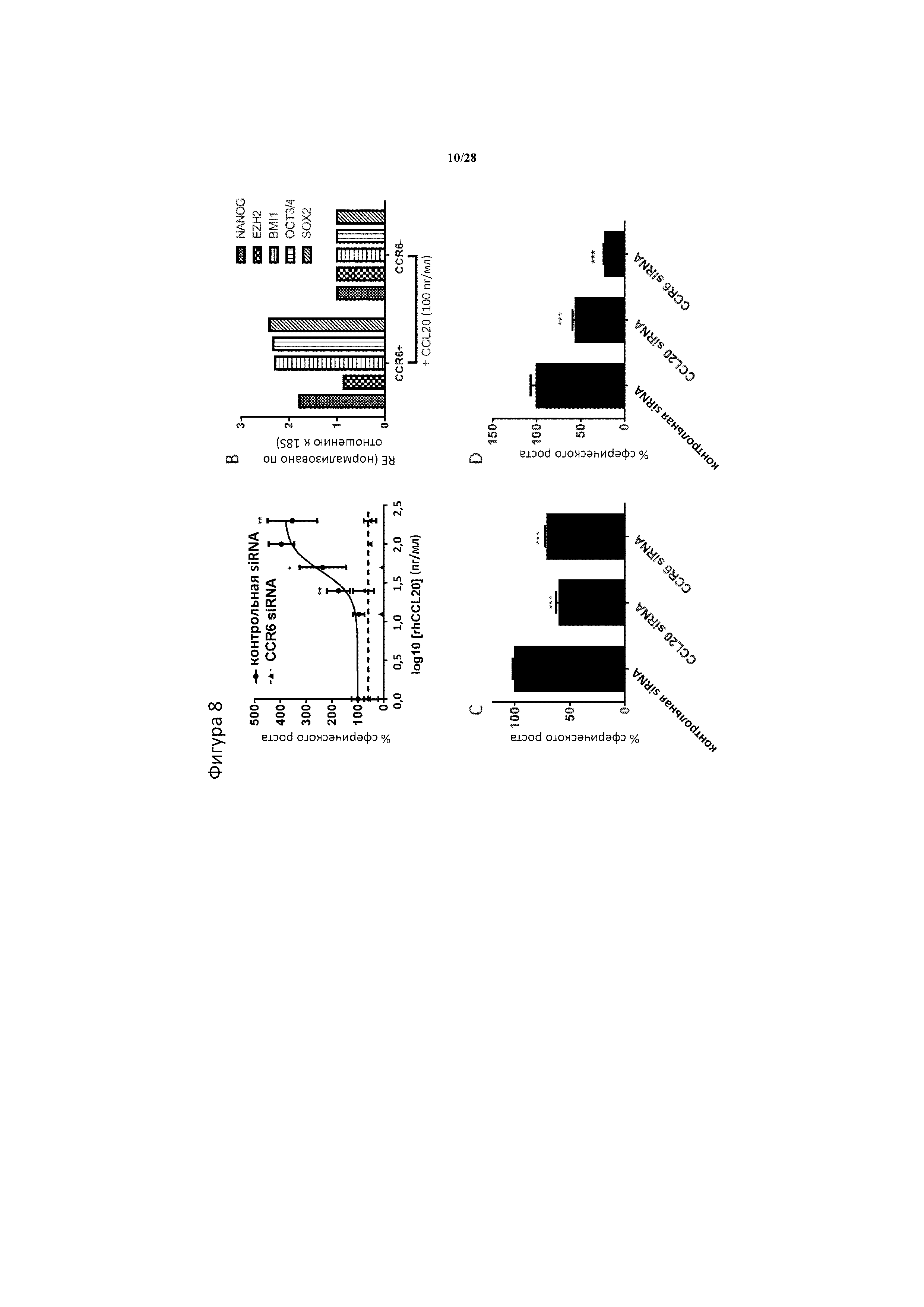
[0037] На фигуре 8A-8D показано, что CCL20 регулирует CSC с помощью передачи сигнала через его рецептор CCR6. (A) рекомбинантный CCL20 человека (rhCCL20) утрачивает способность стимулировать сферический рост через 4 дня после начала обработки в клетках колоректального рака Lovo после нокдауна CCR6 20 нМ siRNA, в то время как клетки, трансфицированные нецелевой контрольной siRNA (20 нМ) сохраняли ростовую ответную реакцию на CCL20. (B) клетки CCR6+ характеризуются повышением экспрессии генов стволовости через 48 часов после стимуляции CCL20 (100 пг/мл) по сравнению с CCR6- клетками, выделенными в модели колоректального рака NCIH508. (C-D) подавление оси CCL20-CCR6 либо с помощью нокдауна CCL20, либо CCR6 (20 нМ siRNA), приводило к аналогичному уровню ингибирования сферического роста клеток колоректального рака NCIH508 (C) и раковых клеток молочной железы Hs578T (D) по отношению к обработке контрольной siRNA (20 нМ). Панель A, n=5 биологических повторностей/условие. ***, ** и * означают статистическую значимость p<0,001, p<0,01 и p<0,05 соответственно между клетками, трансцифированными контрольной siRNA, и клетками, трансфицированными siRNA CCR6, при соответствующих концентрациях CCL20, как определено с помощью t-теста. Панель В, RE=относительная экспрессия значений Ct, нормализованных по отношению к 18S рибосомальной РНК и выраженных по отношению к уровням CCR6-. Панель C, n=5 биологических повторностей/обработка. *** означает статистическую значимость p<0,001 относительно контрольной siRNA, как определено с помощью 1-факторного ANOVA с применением критерия Тьюки для множественных сравнений.
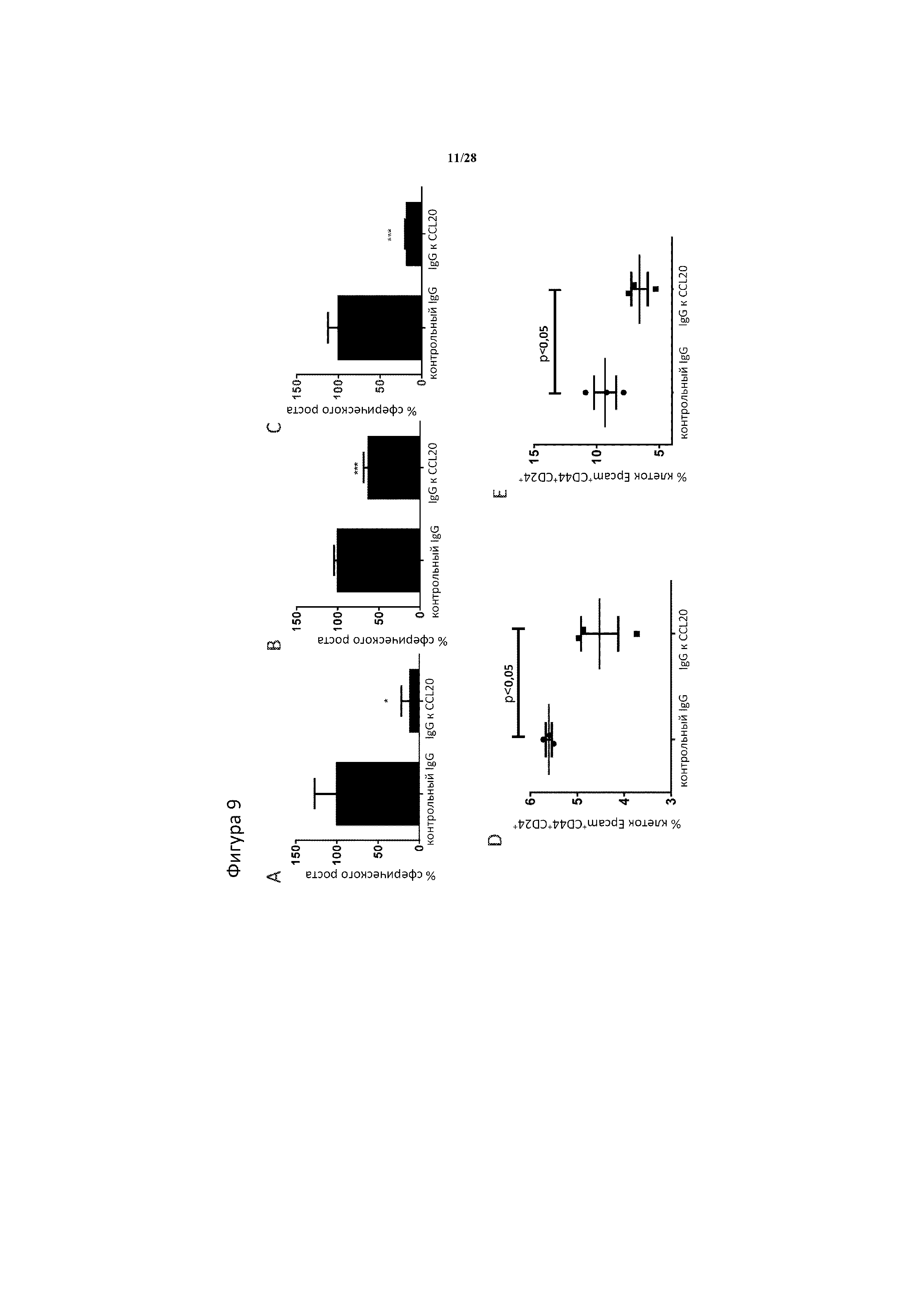
[0038] На фигуре 9A-9E показано, что обработка нейтрализующим моноклональным антителом к CCL20 значимо уменьшает число CSC, измеренное с помощью сферического роста и проточной цитометрии. Сферический рост снижается через 4 дня после обработки 10 мкг/мл IgG к CCL20 по сравнению с обработкой 10 мкг/мл IgG изотипического контроля в (A) клетках рака молочной железы Hs578T, (B) в клетках колоректального рака NCIH508 и (C) в клетках рака поджелудочной железы Panc 1. Обработка однократной дозой 10 мкг/мл IgG к CCL20 снижает процент Epcam+CD44+CD24+ CSC поджелудочной железы в сферах Bxpc3 (D) и Panc1 (E) по сравнению с обработкой IgG изотипического контроля в той же дозе, составляющей 10 мкг/мл. Панели A-C, n=5 биологические повторности/обработка/клеточная линия. Панели D-E, n=3 биологические повторности/обработка/клеточная линия. ***, ** и * означают статистическую значимость p<0,001, p<0,01 и p<0,05 между клетками, обработанными соответственно контрольными IgG и IgG к CCL20, как определено с помощью t-теста.
[0039] На фигуре 10 показано, что обработка нейтрализующим моноклональным антителом к CCL20 значимо ингибирует хемотаксическую миграцию T-клеток CD4+ в направлении CCL20. T-клетки CD4+ выделяли из крови здоровых доноров-людей и оставляли мигрировать по направлению к 10 нМ рекомбинантному CCL20 человека с 30 нМ изотипического IgG или IgG к CCL20 в планшетах для миграции системы Transwell с поликарбонатным фильтром и 5 мкM порами в течение 3 часов. При этом n=3 биологические повторности/обработка/донор. ** и *** означают статистическую значимость p<0,01 и p<0,001 соответственно между изотипическими IgG и IgG к CCL20, как определено с помощью t-теста.
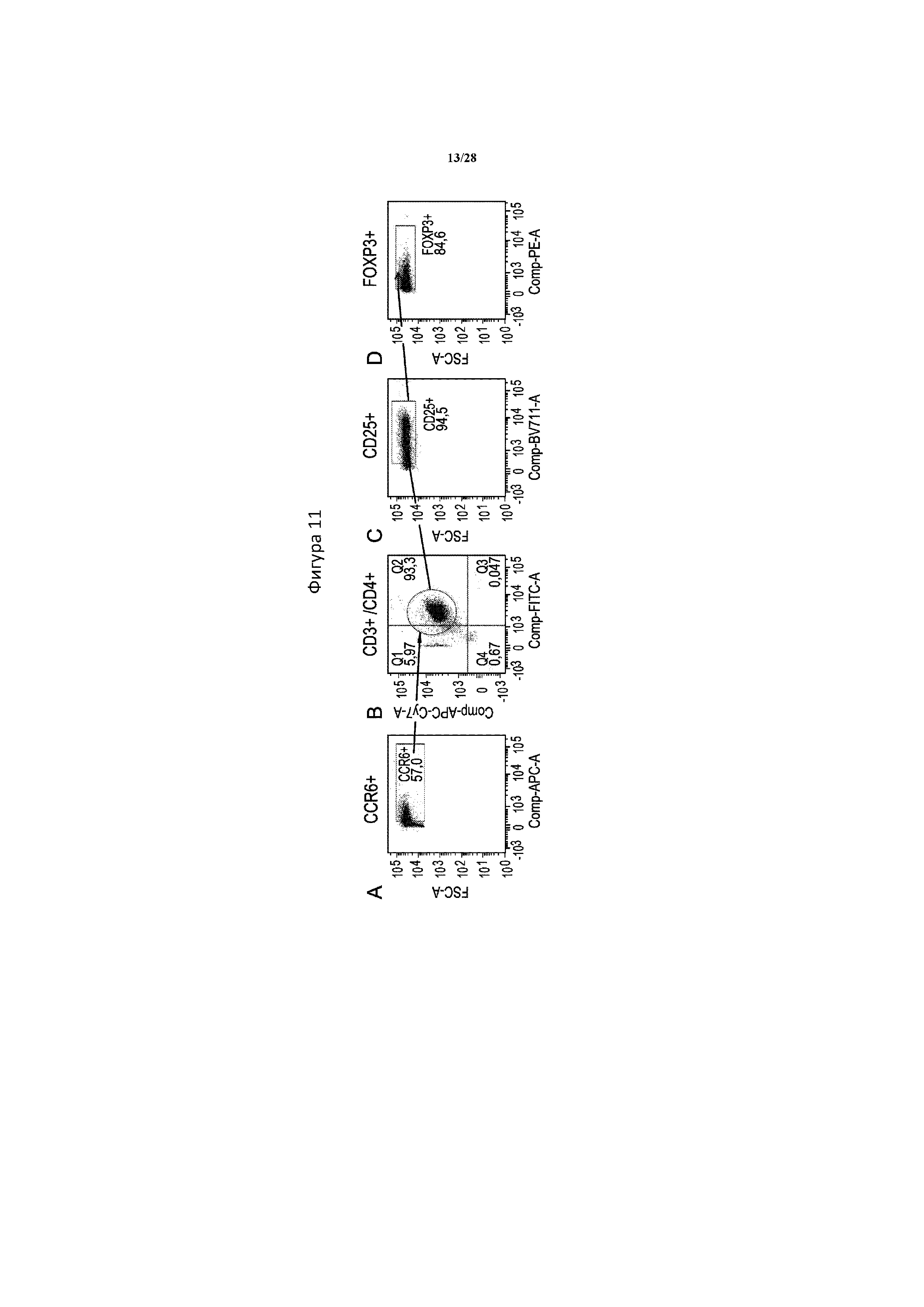
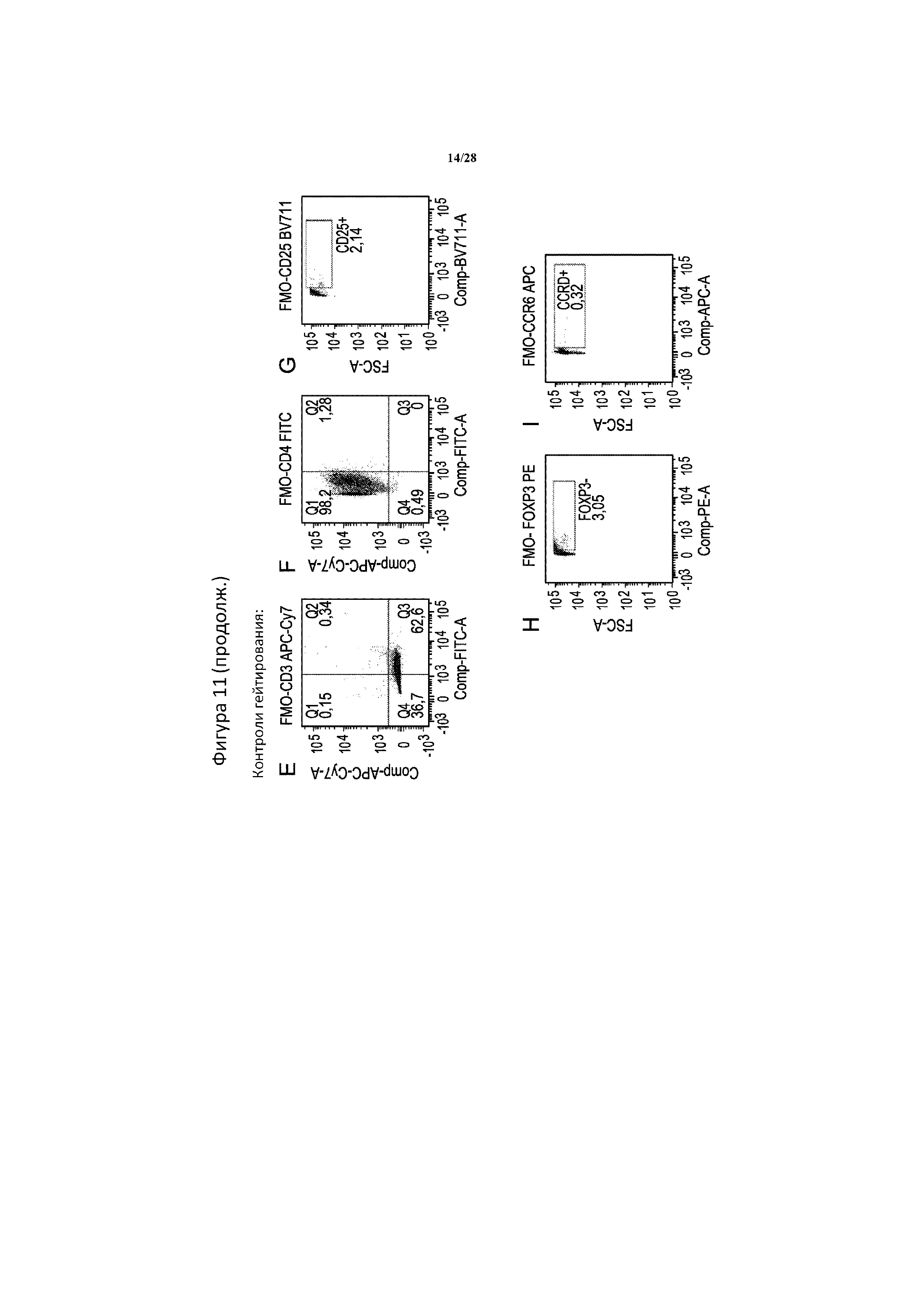
[0040] На фигуре 11A-11I показан многопараметрический проточно-цитометрический анализ фенотипа TR1. 57% живых клеток в популяции окрашены положительно на CCR6 (A). Из этих клеток CCR6+ 93% составляли CD3+/CD4+ (B). Из клеток CD3+/CD4+ 94% составляли CD25+ (C), и из клеток CD25+, как было подтверждено, 85% составляли FOXP3+ (D). Положительное гейтирование по сравнению с отрицательным определяли с помощью полного окрашивания без одной метки (FMO -), при этом образцы содержали все красители в панели за исключением CD3 (E), CD4 (F), CD25 (G), FoxP3 (H) или CCR6 (I).
[0041] На фигуре 12A-12C показано, что клетки TR1 мигрируют в направлении CCL20, секретируемых CSC. Хемотаксическое притяжение клеток TR1 в направлении 100 нМ CCL20 определяли с помощью анализа миграции системы Transwell по сравнению с неспецифической миграцией (без CCL20), и сравнивали с ингибированием миграции в результате добавления нейтрализующего IgG к CCL20 (667 нМ) (A). Концентрация CCL20 в кондицированированной среде CSC (CSC CM), полученной из сферической культуры клеток NCIH508, определяли с помощью ELISA. Уровни CCL20 в неиспользованных средах SCM наносили на график для сравнения, чтобы убедиться в том, что CCL20 продуцировался из CSC NCIH508 (B). Хемотаксическое притяжение клеток TR1 в направлении CM с CSC определяли с помощью анализа миграции системы Transwell по сравнению с неспецифической миграцией (без CCL20), и сравнивали с подавлением миграции в результате добавления нейтрализующего IgG к CCL20 (667 нМ) или IgG изотипического контроля (667 нМ). При этом n=4 повторностей/обработка.
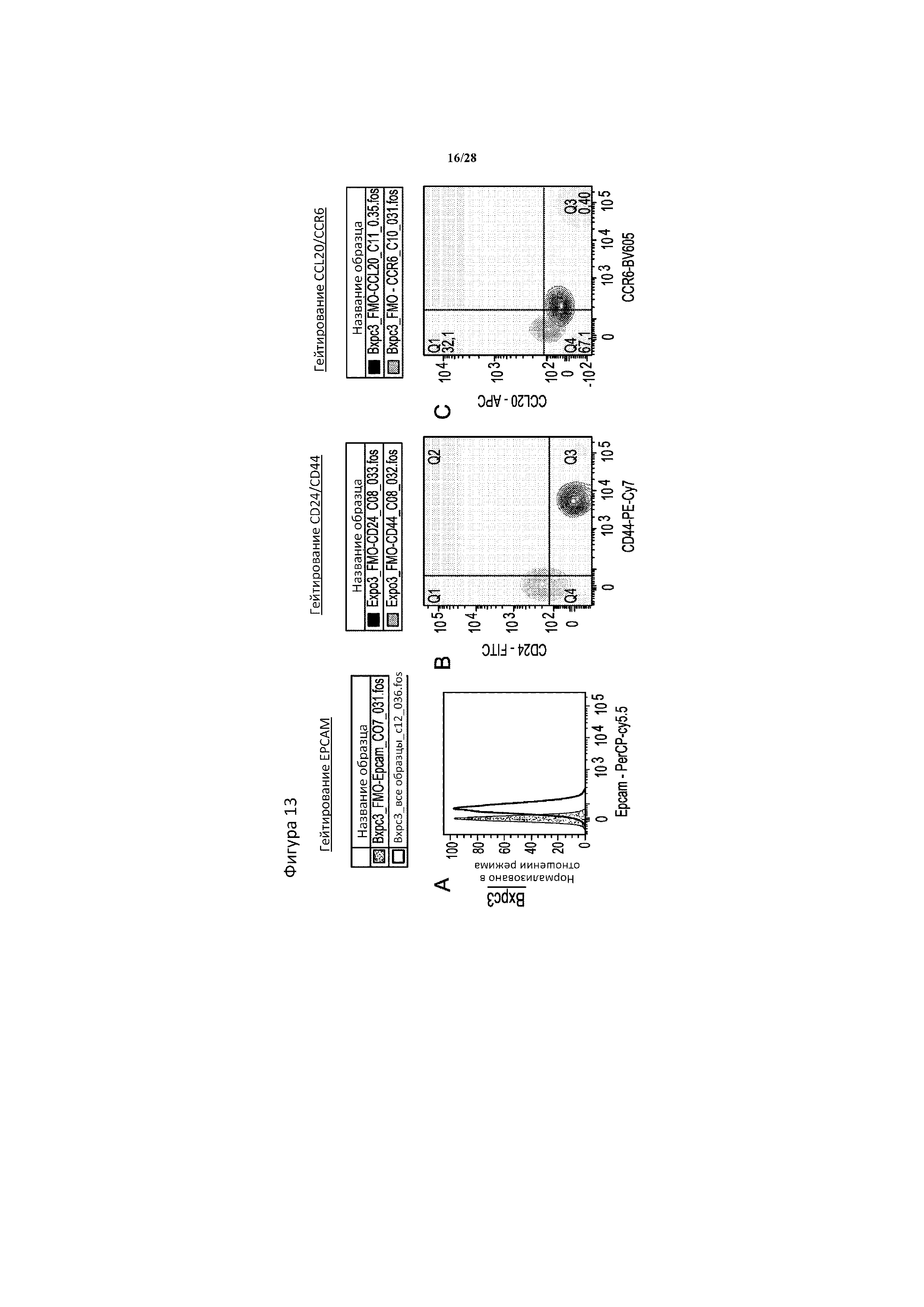
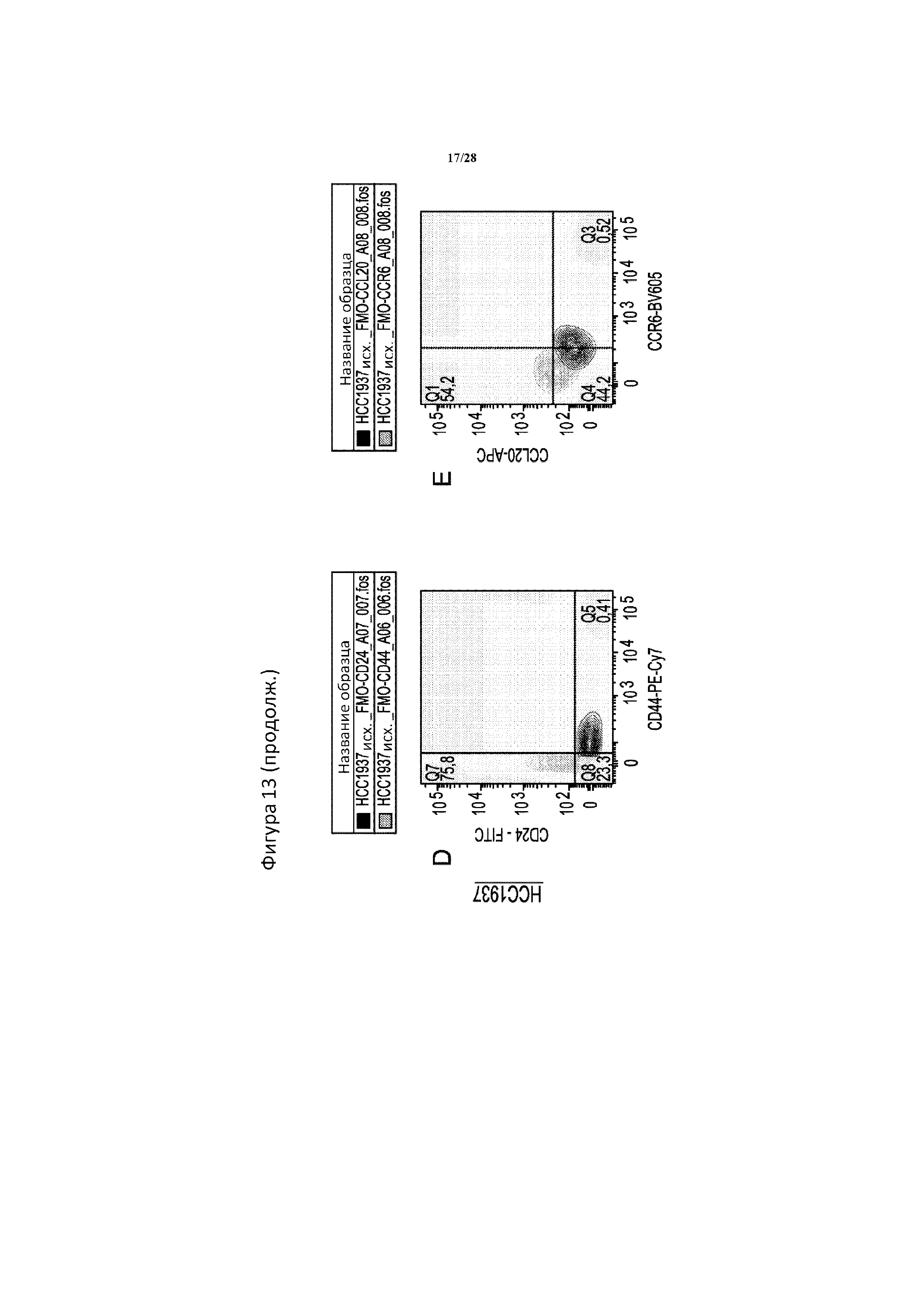
[0042] На фигуре 13A-13E показан контроль гейтирования в случае данных проточной цитометрии для Bxpc3 и HCC1937, исходя из фиг. 3. Полные окрашивания за исключением одной метки (FMO) использовали для определения положительных и отрицательных гейтов для каждого белка в экспериментах с применением многоцветной проточной цитометрии. Клетки Bxpc3 (верхний ряд, A-C) окрашивали с помощью 5-цветной панели для Epcam, CD24, CD44, CCL20 и CCR6, в то время как клетки HCC1937 (нижний ряд, D-E) окрашивали с помощью 4-цветной панели для всех приведенных выше, за исключением Epcam. (A) полное окрашивание за исключением Epcam (FMO - Epcam) (пунктирная линия, серая штриховка) сравнивали с полноокрашенным образцом (сплошная линия, белая штриховка). (B, D) полное окрашивание за исключением CD44 (FMO -CD44) обозначено серым цветом, а полное окрашивание за исключением CD24 (FMO -CD24) обозначено зеленым цветом. (C, E) полное окрашивание за исключением CCL20 (FMO - CCL20) обозначено черным цветом, а полное окрашивание за исключением CCR6 (FMO -CCR6) обозначено серым цветом.
[0043] На фигуре 14A-14B показан контроль гейтирования в случае данных проточной цитометрии для Bxpc3 и Panc1, исходя из фиг. 4. Культивируемые в монослое и сферические клетки Bxpc3 и Panc1 окрашивали с помощью 5-цветной панели для Epcam, CD24, CD44, CCL20 и CCR6. Для каждого эксперимента контроль гейтирования выполняли в клетках, культивируемых в монослое. Полное окрашивание за исключением CCL20 (FMO -CCL20) обозначено серым цветом, в то время как полное окрашивание за исключением CCR6 (FMO -CCR6) обозначено черным цветом, как для культивируемых в монослое клеток Bxpc3 (A), так и для клеток Panc1 (B).
[0044] На фигуре 15A-15D показан контроль гейтирования в случае данных проточной цитометрии для Bxpc3 и Panc1flow, исходя из фиг. 9 D, E. Сферические культивируемые клетки Bxpc3 (A, B) и Panc1 (C, D) окрашивали с помощью 5-цветной панели для Epcam, CD24, CD44, CCL20 и CCR6. Для каждого эксперимента контроль гейтирования выполняли в клетках, культивируемых в монослое. (A, С) полное окрашивание за исключением Epcam (FMO - Epcam) (пунктирная линия, серая штриховка) сравнивали с полноокрашенным образцом (сплошная линия, белая штриховка). (B, D) полное окрашивание за исключением CD24 (FMO -CD24) обозначено черным цветом, в то время как полное окрашивание за исключением CD44 (FMO -CD44) обозначено серым цветом.
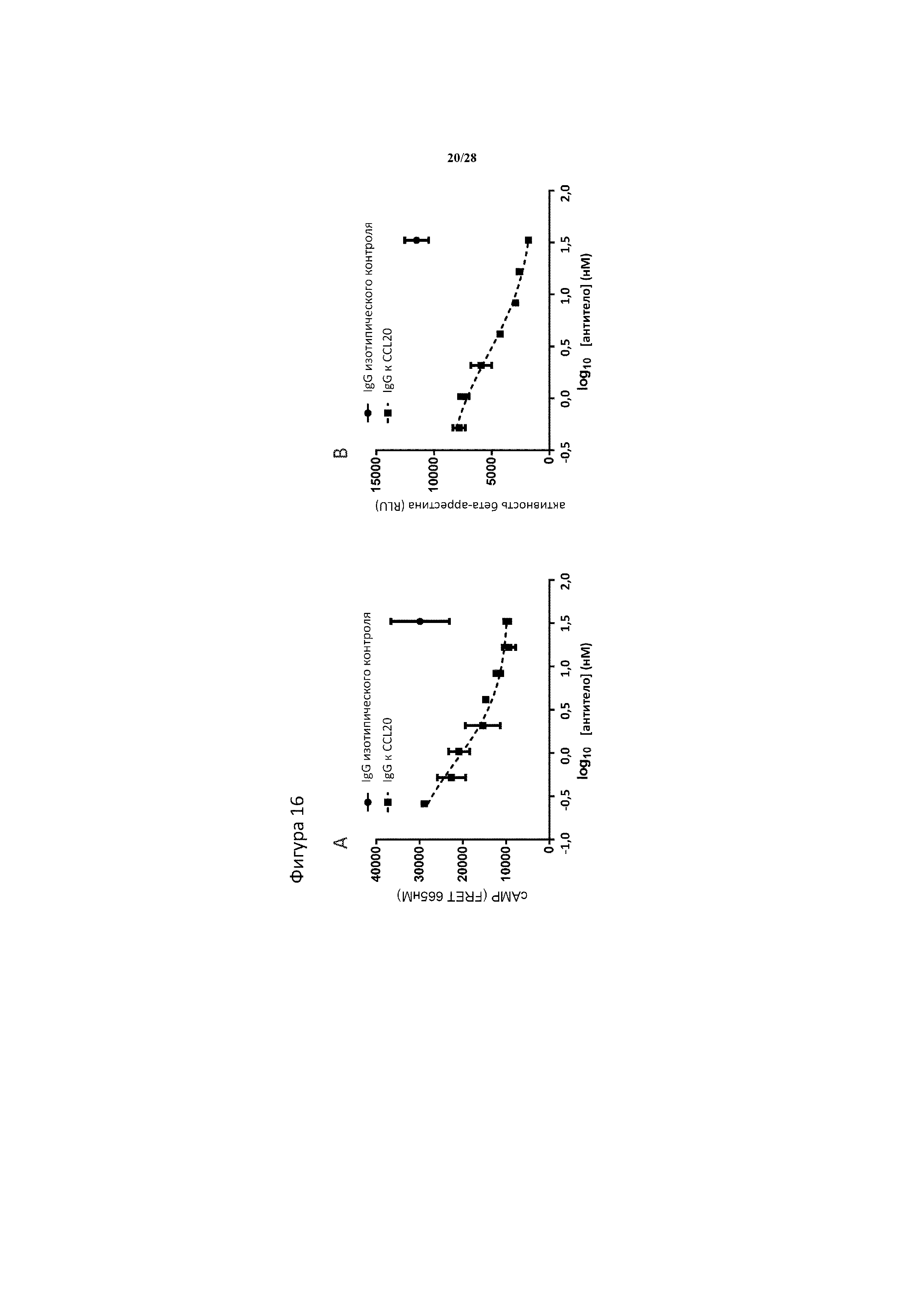
[0045] На фигуре 16A-16B изображено как IgG к CCL20 нейтрализует CCL20-стимулированную активность пути CCR6, измеренную с помощью (A) cAMP и (B) активности бета-аррестина. Анализ cAMP выполняли с помощью клеток Ad293, сверхэкспрессирующих CCR6 человека, стимулированных 1 нМ CCL20 и 4 мМ форсколином, в то время как анализ бета-аррестина выполняли с помощью клеток CHOKI, сверхэкспрессирующих CCR6 человека, стимулированных 6 нМ CCL20. При этом n=2 технические повторности/доза/анализ.
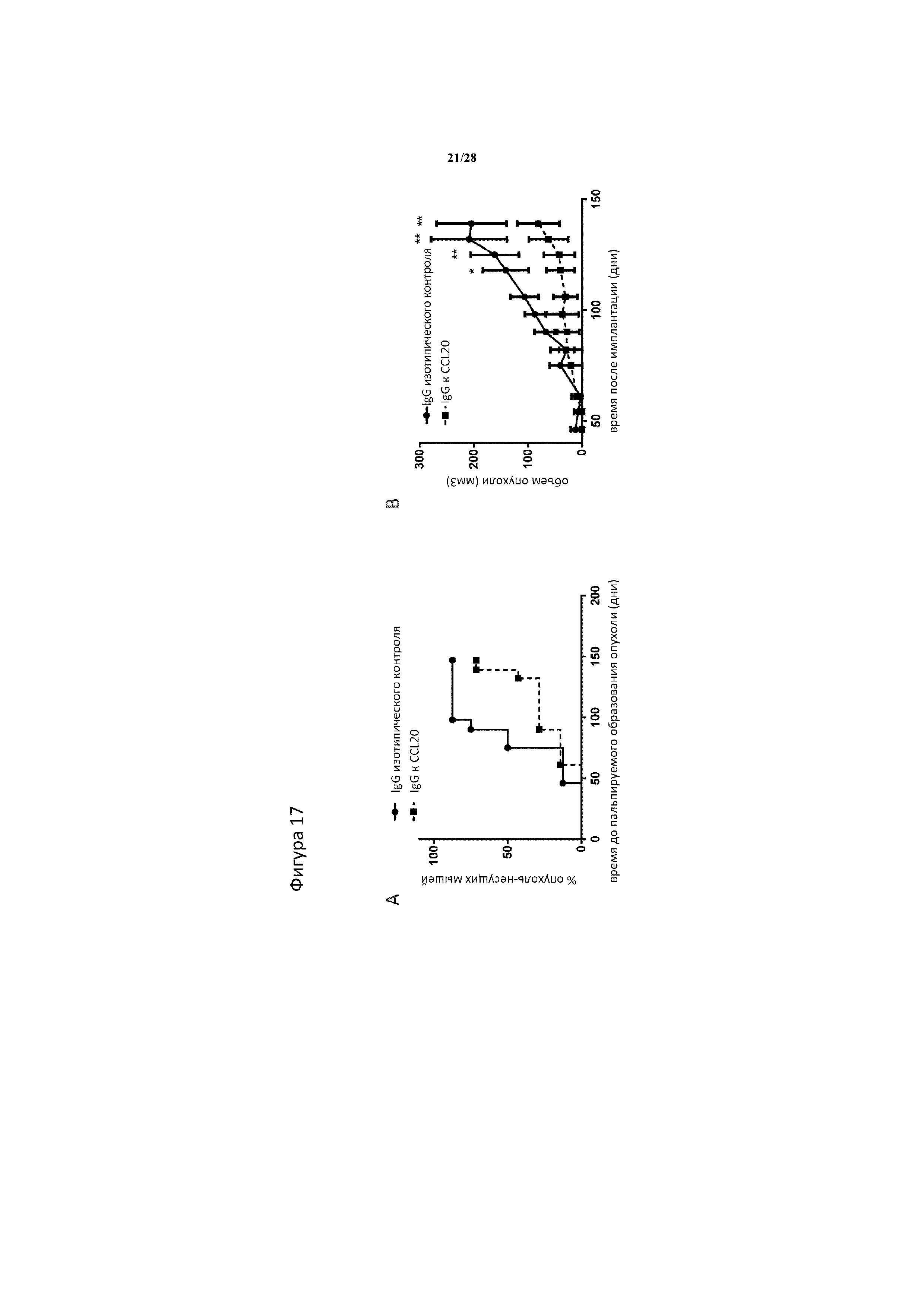
[0046] На фигуре 17A-17B показано, что (A) частота приживания опухолей Panc1 (% опухоль-несущих животных) снижается, если сферы Panc1 предварительно обрабатывают 10 мкг/мл IgG к CCL20 по сравнению со сферами Panc1, которые предварительно обрабатывают 10 мкг/мл изотипического IgG в течение 4 дней in-vitro перед введением опухоли, при этом приживание опухоли измеряют, начиная с первого случая пальпируемого опухолевого образования. (B) предварительная обработка сфер Panc1 10 мкг/мл IgG к CCL20 перед введением приводит к значительно ослабленному опухолевому росту по сравнению с предварительно обработанными изотипическим IgG сферами Panc1 (10 мкг/мл). На панели A медианное время приживания опухоли определяли с помощью анализа выживаемости Каплана-Мейера. На панели B ** и * означают статическую значимость p<0,01 и p<0,05 между обработанными изотипическими IgG и IgG к CCL20 опухолями, соответственно, как определено с помощью 2-факторного ANOVA.
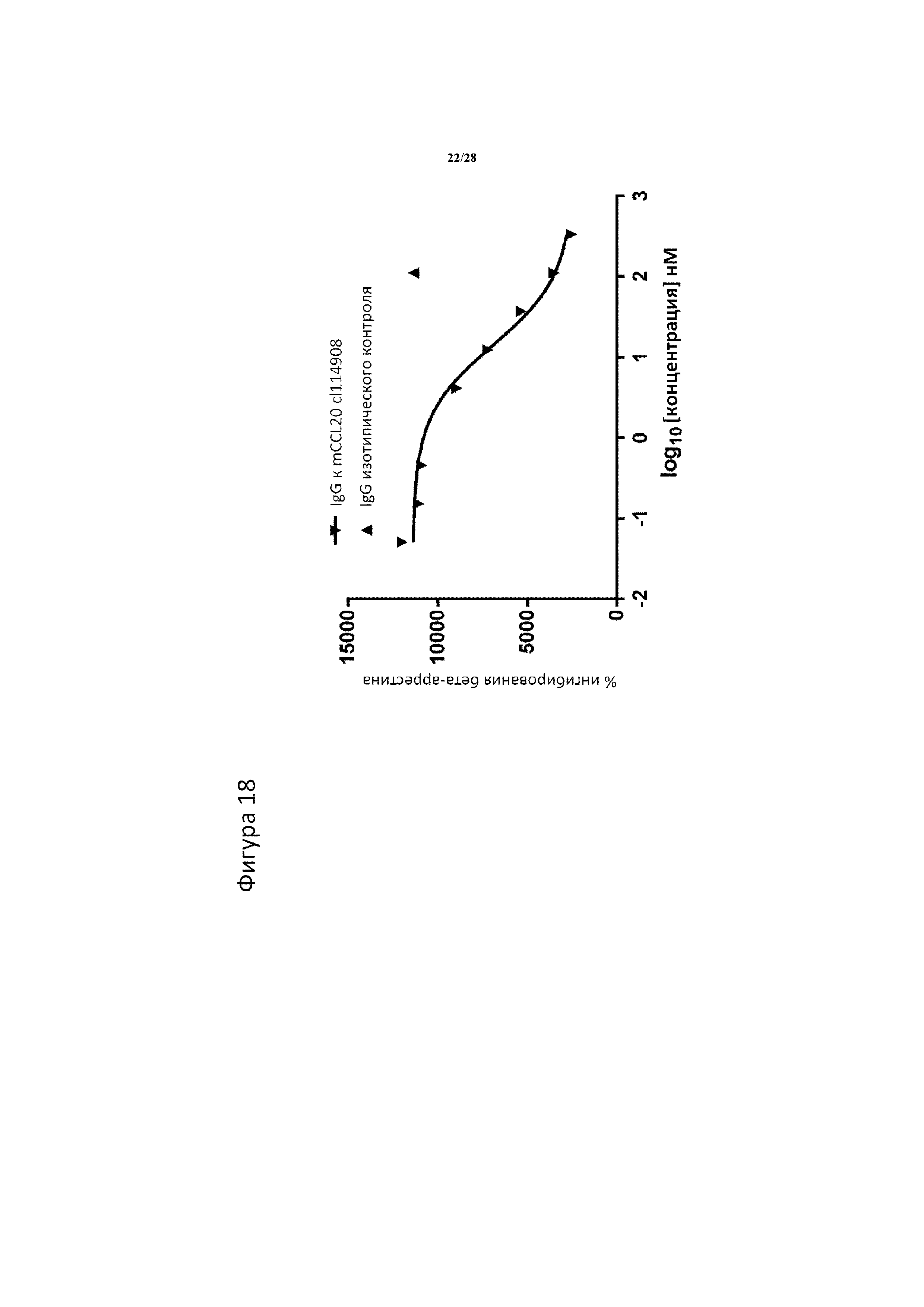
[0047] На фигуре 18 показано, что IgG к CCL20 мыши (клон 114908) нейтрализует CCL20-стимулированную активность пути CCR6, измеренную с помощью активности бета-аррестина. Анализ выполняли с помощью клеток CHOKI, сверхэкспрессирующих CCR6 мыши, стимулированных 1,2 нМ CCL20 мыши.
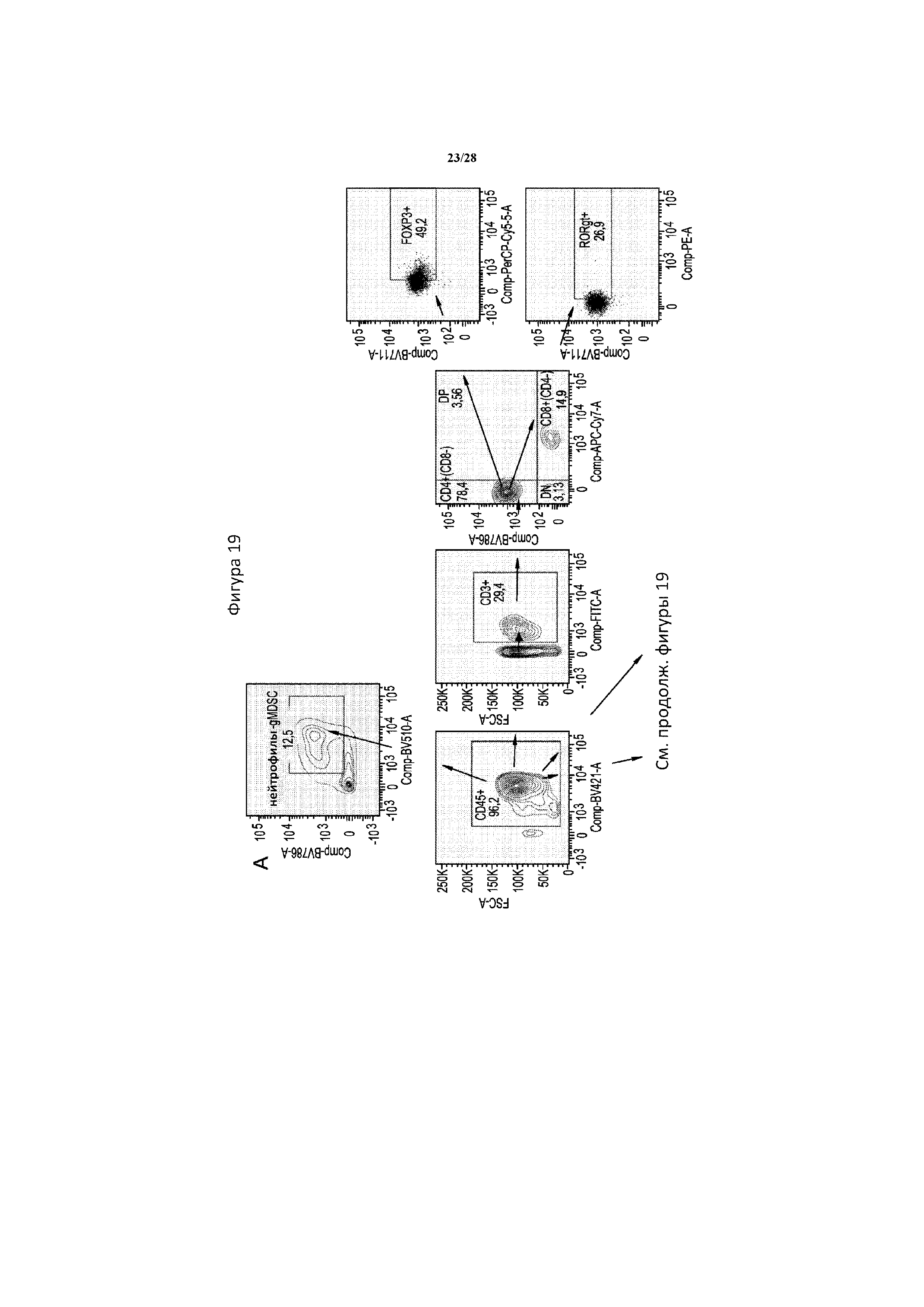
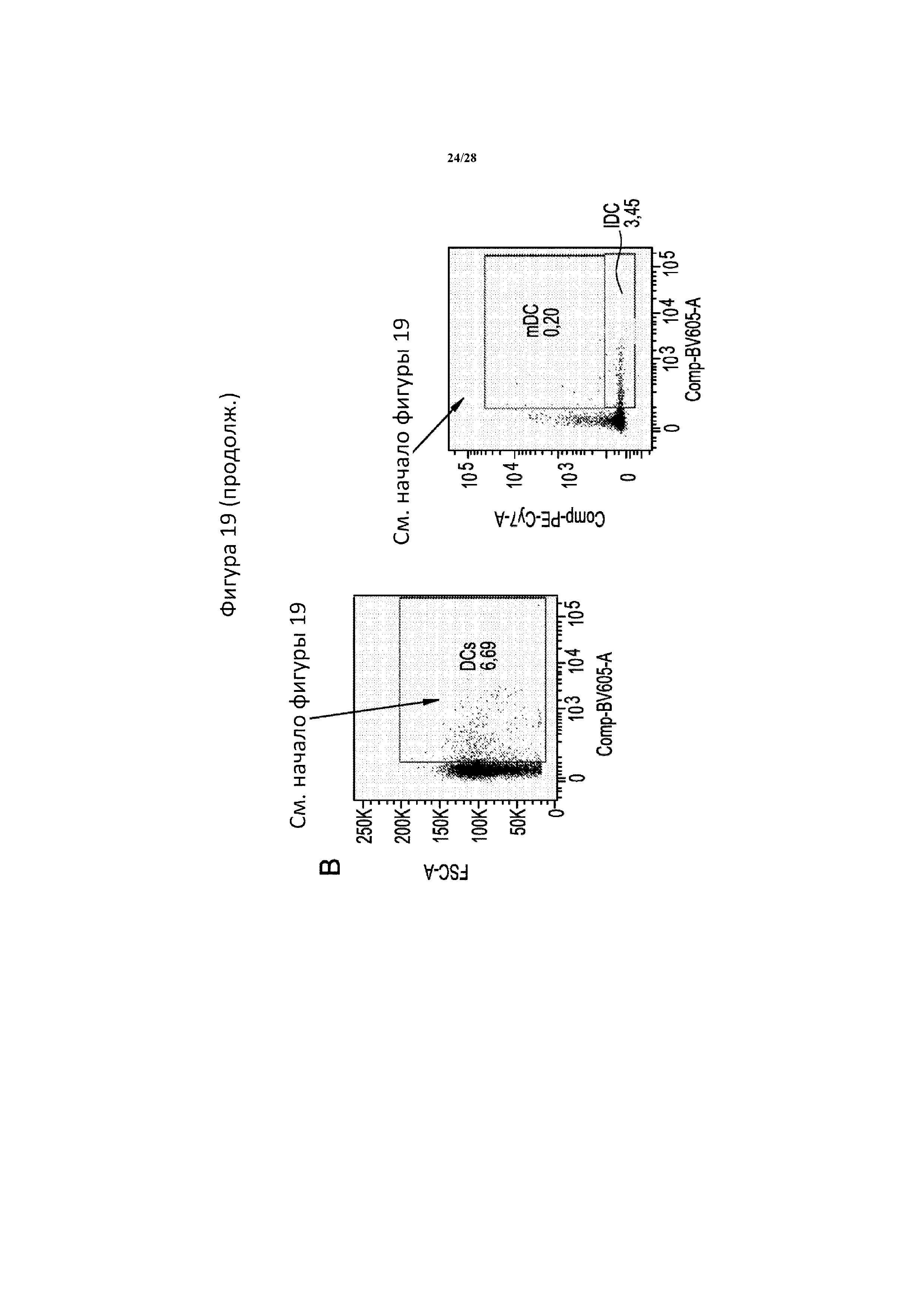
[0048] На фигуре 19 показана типичная диаграмма проточной цитометрии, на которой обозначено гейтирование и анализ иммунных клеток в селезенке. Клетки сначала гейтировали в отношении cd45 в качестве панлейкоцитарного маркера. Затем T-клетки выявляли с помощью окрашивания cd3, дендритные клетки - с помощью cd11c в случае всех клеток или cd11c/cd83 с целою разделения зрелых и незрелых дендритных клеток, и супрессорные клетки нейтрофильного и гранулоцитарного происхождения (gMDSC) -с помощью cd11b/ly6g. T-клетки Cd3+ дополнительно разделяли в зависимости от окрашивания cd4 и cd8, и затем клетки cd4+ разделяли на клетки foxp3+ Treg или rorgt+ Th17. Все гейты определяли с помощью контролей FMO и поддерживали постоянными во всех образцах.
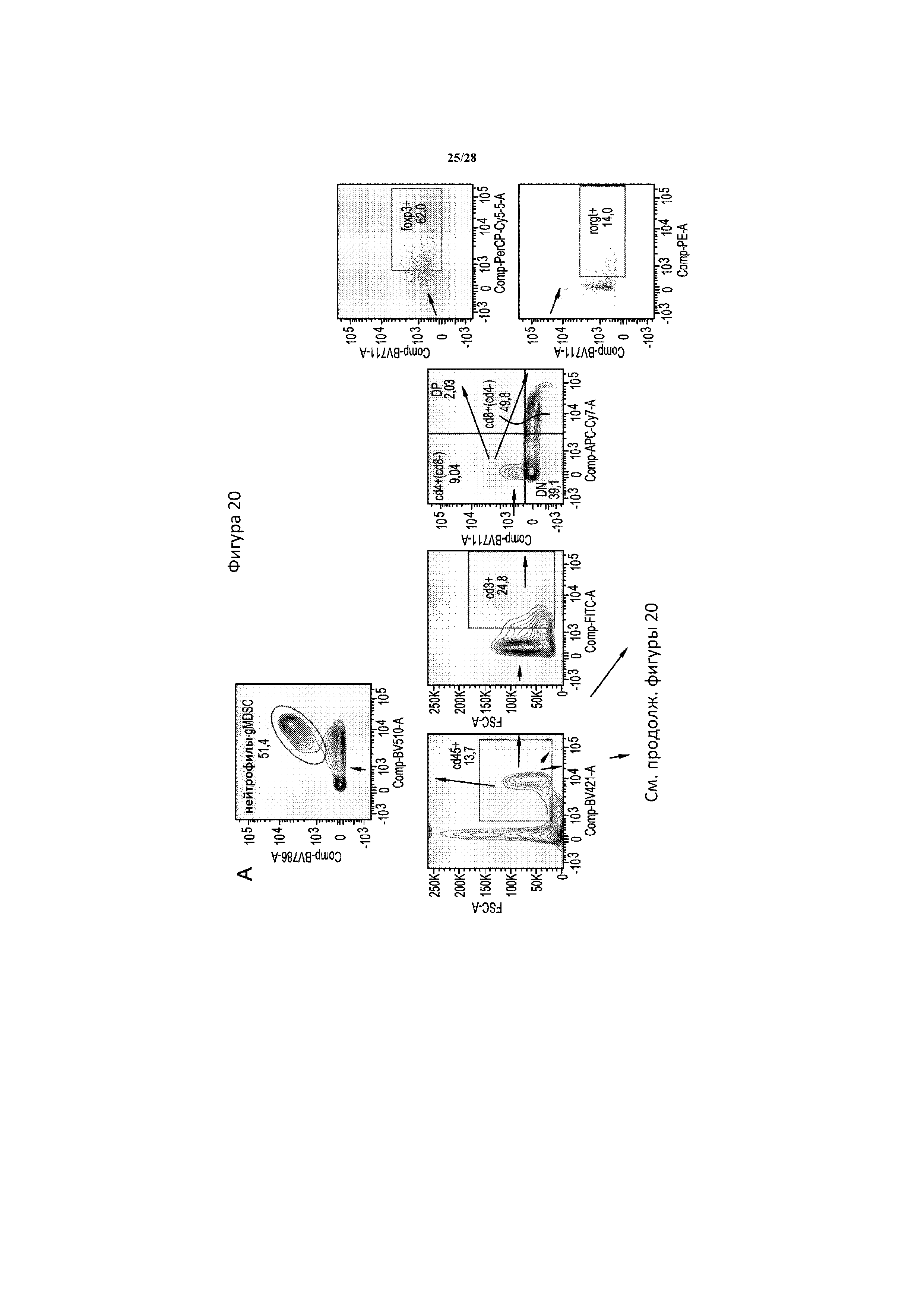
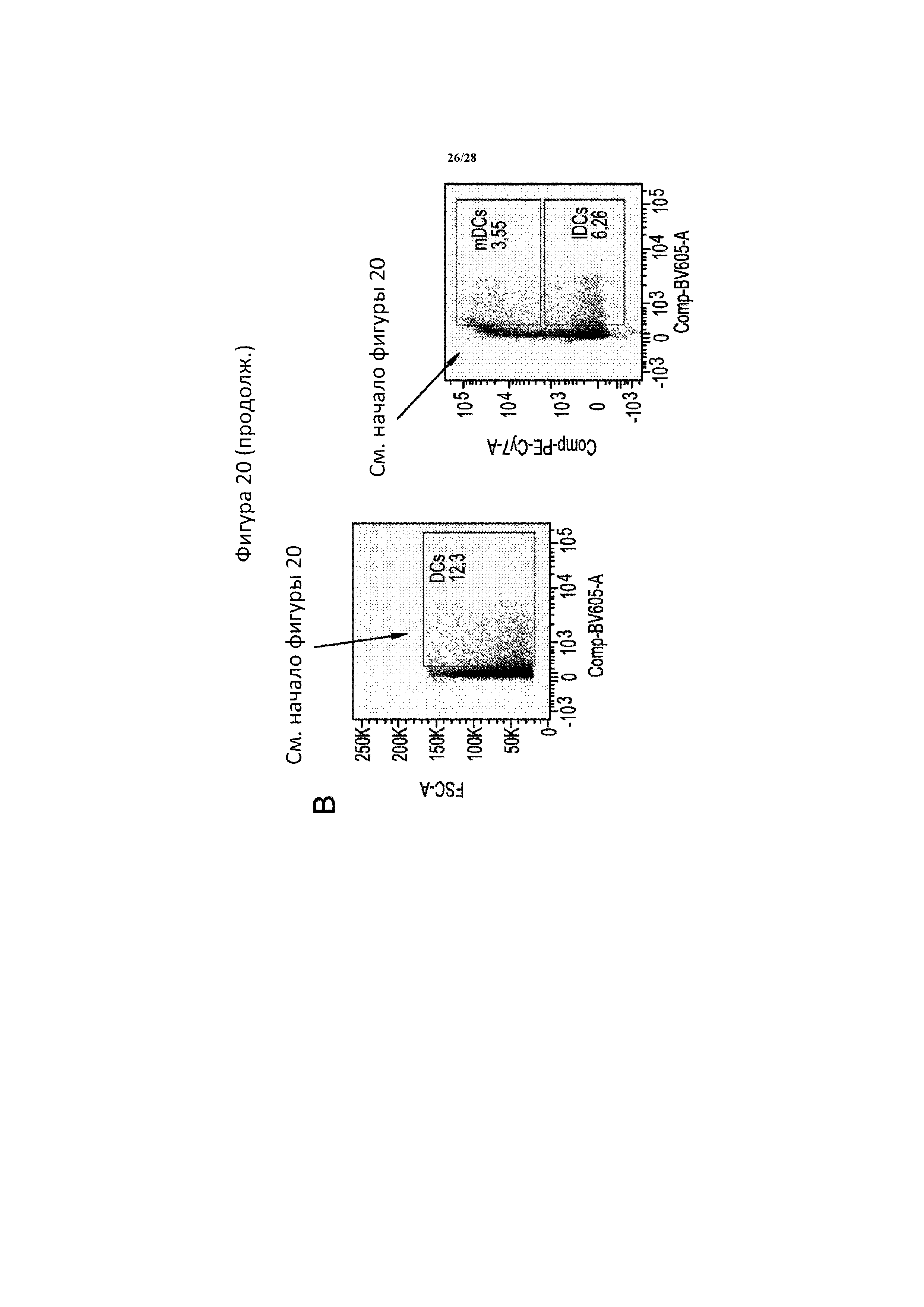
[0049] На фигуре 20 показана типичная диаграмма проточной цитометрии, на которой обозначено гейтирование и анализ иммунных клеток в опухоли. Клетки сначала гейтировали в отношении cd45 в качестве панлейкоцитарного маркера. Затем T-клетки выявляли с помощью окрашивания cd3, дендритные клетки - с помощью cd11c в случае всех клеток или cd11c/cd83 с целью разделения зрелых и незрелых дендритных клеток, и супрессорные клетки нейтрофильного и гранулоцитарного происхождения (gMDSC) -с помощью cd11b/ly6g. T-клетки Cd3+ дополнительно разделяли в зависимости от окрашивания cd4 и cd8, и затем клетки cd4+ разделяли на клетки foxp3+ Treg или rorgt+ Th17. Все гейты определяли с помощью контролей FMO и поддерживали постоянными во всех образцах.
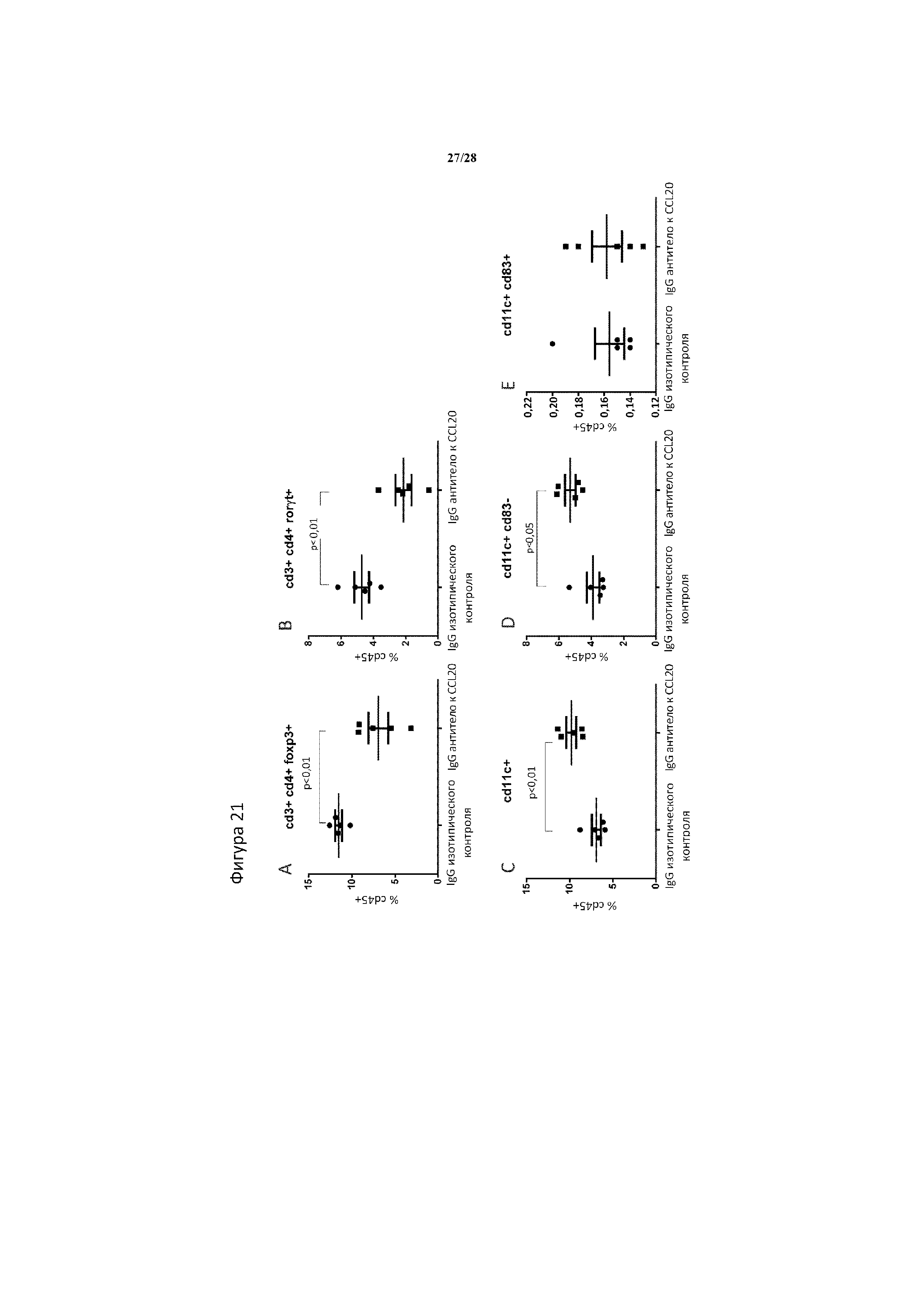
[0050] На фигуре 21A-21E показана частота популяций иммунных клеток в селезенках 4T1 опухоль-несущих мышей, которым вводили 10 мг на кг IgG к CCL20 мыши или IgG изотипического контроля, два раза в неделю в количестве 4 доз. (A) клетки cd3+ cd4+ foxp3+ Treg, (B) клетки cd3+ cd4+ rorγt+ Th17, (C) все дендритные клетки cd11b+, (D) незрелые дендритные клетки cd11b+ cd83- и (E) зрелые дендритные клетки cd11b+ cd83+. Частоты всех клеток обозначены в виде % от всех лейкоцитов (клетки cd45+). При этом n=5 животных/группа. Статистическую значимость определяли с помощью двустороннего t-критерия Стьюдента.
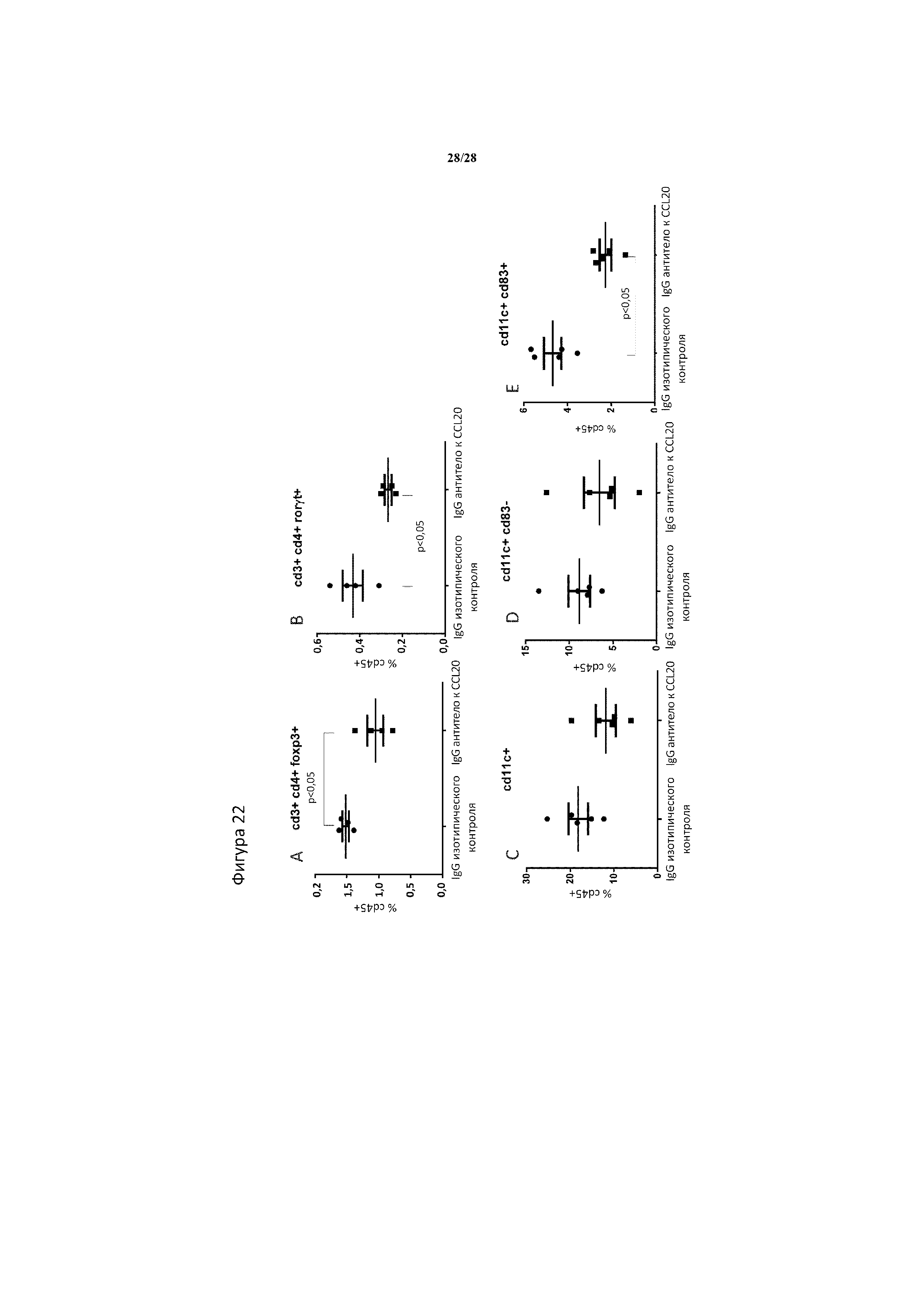
[0051] На фигуре 22A-22E показана частота популяций иммунных клеток в опухолях 4T1 опухоль-несущих мышей, которым вводили 10 мг на кг IgG к CCL20 мыши или IgG изотипического контроля, два раза в неделю в количестве 4 доз. (A) клетки cd3+ cd4+ foxp3+ Treg, (B) клетки cd3+ cd4+ rorγt+ Th17, (C) все дендритные клетки cd11b+, (D) незрелые дендритные клетки cd11b+ cd83- и (E) зрелые дендритные клетки cd11b+ cd83+. Частоты всех клеток обозначены в виде % от всех лейкоцитов (клетки cd45+). При этом n=5 животных/группа. Статистическую значимость определяли с помощью двустороннего t-критерия Стьюдента.
ПОДРОБНОЕ ОПИСАНИЕ
[0052] Как описано в данном документе, авторы настоящего изобретения предлагают описание, которое впервые показывает, что CCL20 сверхэкспрессируется CSC и является функционально релевантным по отношению к таковым. Несмотря на то, что в отчетах отсылали к потенциальной экспрессии CCL20 в некоторых формах рака, в отчетах не выявляли и не связывали экспрессию и функцию CCL20 с каким-либо фенотипом CSC, что обеспечивает новые и неожиданные способы лечения рака и ингибирования CSC. Как показано в определенных аспектах и неограничивающих вариантах осуществления, раскрытых в данном документе, новые способы, с помощью которых целенаправленно воздействуют и ингибируют активность CCL20, являются полезными и эффективными против форм рака, которые содержат и проявляют клетки, имеющие фенотип CSC. В некоторых иллюстративных вариантах осуществления способы и средства, раскрытые в данном документе, можно применять для целенаправленного воздействия на формы рака, содержащие CSC, которые экспрессируют CCL20 и/или CCR6, в том числе, например, рак поджелудочной железы, колоректальный рак, гепатоцеллюлярную карциному, рак желудка, рак легкого, рак головы и шеи и рак молочной железы. Таким образом, настоящее раскрытие предусматривает новые стратегии целенаправленного воздействия, которые включают способы и средства, которые ингибируют CSC и могут быть использованы для ингибирования и/или лечения различных форм рака у пациентов, страдающих от рака, и улучшения качества жизни.
[0053] Настоящее раскрытие включает описание и обзор анализа mRNA на уровне всего генома в отношении CSC молочной железы, в котором неожиданно определили, что изменения экспрессии гена CCL20, по-видимому, коррелируют непосредственно с обогащением или подавлением CSC (vanVlerkenetal., 2013). Хемокиновый (C-C-мотив) лиганд 20 (CCL20) также часто называется воспалительным белком макрофагов 3-альфа (MIP-3α) или хемокином печени, регулируемым активацией (LARC) (Schutyseretal., 2003). CCL20 обычно функционирует в виде хемотаксического фактора для рекрутинга T-, B- и незрелых дендритных клеток, и образуется главным образом клетками печени, легкого и желудочно-кишечного тракта (Schutyseretal., 2003). Хемокиновый рецептор 6 (CCR6) был обнаружен в качестве рецептора для CCL20 (Babaetal., 1997) и к настоящему времени по-прежнему является единственным функциональным рецептором, обнаруженным для лиганда CCL20. Несмотря на его роль в рекрутинге иммунных клеток, некоторые данные указывали на ассоциацию в отношении CCL20 в случае рака. В одном отчете указывали на CCL20 как фактор, содействующий патогенезу рака поджелудочной железы, при этом авторы сделали заключение о прямом эффекте CCL20 в отношении стимулирования роста рака поджелудочной железы (Kleeffetal., 1999). В то время как раннее выявление было связано с раком поджелудочной железы, наибольшее число фактов в настоящее время связывают экспрессию CCL20 с колоректальным раком (Ghadjaretal., 2009). Действительно, в недавнем исследовании были предложены высокие уровни CCL20 в сыворотке в качестве биомаркера неблагоприятного прогноза при колоректальном раке (Iwataetal., 2013). Авторы настоящего изобретения обнаружили CCL20 в моделях рака молочной железы, что было подтверждено объективными данными, которые показывают, что CCL20 может непосредственно влиять на миграцию и пролиферацию раковых клеток молочной железы (Marsiglianteetal., 2013). Несмотря на то, что в некоторых отчетах указывают на непосредственный аутокринный эффект оси CCL20-CCR6 на опухолевые клетки, в большинстве отчетов предполагается, что сверхэкспрессия CCL20 опухолевыми клетками способствует рекрутингу иммунных клеток. Хотя настоящее раскрытие подразумевает аутокринную функцию CCL20 в отношении CSC, настоящее раскрытие также предусматривает то, что секреция CCL20 с помощью CSC может способствовать рекрутингу опухолевого иммунного инфильтрата. Например, данные указывают на то, что Treg (Chen et al. 2011, Liu et al. 2011, Zhang et al. 2014) и Th17-клетки (Yu et al. 2015), в частности, будут предрасположены к образованию опухолевого инфильтрата в ответ на продукцию CCL20, в дополнение к B-клеткам и дендритным клеткам, которые также вероятно мобилизуются в направлении CCL20, продуцируемого CSC.
[0054] Как раскрыто в данном документе, авторами настоящего изобретения обнаруживается роль хемокинового (C-C-мотив) лиганда 20 (CCL20) в росте и активности CSC, результат, который является совершенно новым для биологии CSC. Настоящее раскрытие предусматривает иллюстративные варианты осуществления, демонстрирующие, что CSC типичных моделей рака молочной железы, поджелудочной железы и колоректального рака сверхэкспрессируют CCL20, и что CCL20, в свою очередь, может управлять самообновлением и пролиферацией CSC с помощью передачи сигнала через своей рецептор CCR6, также экспрессируемый на CSC. Нейтрализация CCL20 моноклональным антителом оказывает значительный эффект в отношении подавления CSC, подтверждая значительный потенциал видов терапии, целенаправленно воздействующих на данный хемокин для уменьшения CSC в опухоли.
[0055] Прежде чем продолжить описание настоящего раскрытия более подробно, следует понимать, что настоящее раскрытие не ограничивается конкретными композициями или стадиями способа, поскольку они могут варьироваться. Следует отметить, что используемые в данном описании и прилагаемой формуле изобретения формы единственного числа включают определяемые объекты во множественном числе, если из контекста явно не следует иное.
[0056] Если не определено иное, то все технические и научные термины, используемые в данном документе, имеют то же значение, которое обычно понимается специалистом в данной области техники, к которой относится настоящее изобретение. Например, Concise Dictionary of Biomedicine and Molecular Biology, Juo, Pei-Show, 2nd ed., 2002, CRC Press; The Dictionary of Cell and Molecular Biology, 3rd ed., 1999, Academic Press и Oxford Dictionary Of Biochemistry And Molecular Biology, Revised, 2000, Oxford University Press, обеспечивают специалиста общим словарем многих терминов и выражений, используемых в настоящем изобретении.
[0057] Термины "приблизительно" и "примерно" в контексте настоящего изобретения означают интервал точности, который специалист в данной области техники будет понимать как такой, который все еще обеспечивает технический эффект изучаемой характеристики. Термин обычно охватывает отклонение от указанного числового значения на приблизительно +/- 10% или приблизительно +/- 5%.
[0058] Определение процента идентичности между двумя последовательностями предпочтительно выполняют с помощью математического алгоритма Karlin и Altschul (1993) Proc. Natl. Acad. Sci USA 90: 5873-5877. Такой алгоритм включен, например, в программы BLASTn и BLASTp у Altschul et al, 1990, J. Mol. Biol. 215: 403-410, доступные на веб-сайте NCBI. Определение процента идентичности обычно выполняют с помощью стандартных параметров программ BLASTn и BLASTp.
[0059] Аминокислоты могут называться в данном документе по их общеизвестным трехбуквенным символам либо по однобуквенным символам, рекомендованным комиссией по биохимической номенклатуре IUPAC-IUB. Аналогично, нуклеотиды могут называться по их общепринятым однобуквенным кодам.
[0060] Термины "антитело" и "антитела", используемые в данном документе, также известные как иммуноглобулины, охватывают моноклональные антитела (в том числе полноразмерные моноклональные антитела), поликлональные антитела, полиспецифичные антитела, образованные по меньшей мере из двух различных эпитопсвязывающих фрагментов (например полиспецифичные антитела, например PCT-публикация WO 2009/018386, PCT-заявка № PCT/US2012/045229, включенные в данный документ с помощью ссылки во всей их полноте), biMab, антитела человека, гуманизированные антитела, верблюжьи антитела, одноцепочечные Fv (scFv), одноцепочечные антитела, однодоменные антитела, доменные антитела, Fab-фрагменты, фрагменты F(аb')2, фрагменты антител, которые проявляют требуемую биологическую активность (например антигенсвязывающая часть), дисульфидно-связанные Fv (dsFv) и антиидиотипические (anti-Id) антитела (в том числе например anti-Id-антитела к антителам по настоящему изобретению), внутриклеточные антитела и эпитопсвязывающие фрагменты любого из вышеупомянутого. В частности, антитела включают в себя молекулы иммуноглобулинов и иммунологически активные фрагменты молекул иммуноглобулинов, т. е. молекулы, которые содержат по меньшей мере один антигенсвязывающий участок. Антитела также включают в себя слияния пептидов с антителами или их частями, как например белок, слитый с Fc-доменом. Молекулы иммуноглобулинов могут быть любого изотипа (например, IgG, IgE, IgM, IgD, IgA и IgY), субизотипа (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или аллотипа (например Gm, например, G1m(f, z или x), G2m(n), G3m(g, b или c), Am, Em, и Km(1, 2 или 3)). Антитела могут быть получены от любого млекопитающего, в том числе без ограничения людей, обезьян, свиней, лошадей, кроликов, собак, котов, мышей и т. д., или других животных, таких как птицы (например, куры).
[0061] Термины "хемокиновый рецептор CCR6" или "рецептор CCR6", или "CCR6" и "хемокиновый лиганд 20" или "CCL20", используемые в данном документе, относятся к биологическим молекулам (молекулам нуклеиновых кислот и аминокислотным молекулам), которые известны из уровня техники. Специалист в данной области техники сможет определить полинуклеотидную или аминокислотную последовательности рецептора CCR6 и CCL20, а также любые ортологичные и сплайс-вариантные изоформы CCR6 и CCL20 из любой базы данных последовательностей (например, базы данных NCBI).
[0062] В некоторых вариантах осуществления термины "рецептор CCR6" или "CCL20" относятся к рецептору CCR6 и CCL20, и в определенных вариантах осуществления относятся к рецептору CCR6 человека и CCL20 человека. Как отмечено выше, последовательности рецептора CCR6 человека доступны из баз данных последовательностей общего пользования, например таких как база данных NCBI (номер доступа NM_004367.5 (транскриптный вариант 1; SEQ ID NO:1, кодирующий SEQ ID NO:2) или NM_031409.3 (транскриптный вариант 2; SEQ ID NO: 3, кодирующий SEQ ID NO:4). Аналогично, последовательности CCL20 человека являются общедоступными (номер доступа в NCBI NM_004591.2 (транскриптный вариант 1; SEQ ID NO:5, кодирующий SEQ ID NO:6) или NM_001130046.1 (транскриптный вариант 2; SEQ ID NO:7, кодирующий SEQ ID NO:8). Другие ортологи и варианты будут известны и/или подлежат выявлению специалисту в данной области техники.
[0063] CCR6 иногда также называют антигеном CD196 или CD196. Ряд других терминов для CCR6 использовали в данной области техники с различной частотой, в том числе, например, CC-CKR-6, C-C- CKR-6, хемокиновый (C-C-мотив) рецептор 6, хемокиновый (C-C) рецептор 6, C-C хемокиновый рецептор 6 типа, CKRL3, CKR-L3, хемокин-подобный рецептор 3, STRL22, CMKBR6, рецептор 29, связанный с G-белком, GPR29, семиспиральный трансмембранный рецептор, лимфоцитарный рецептор 22, GPRCY4, GPR-CY4, DRY6, LARC-рецептор и BN-1.
[0064] Аналогично, CCL20 или хемокин 20 с C-C-мотивом, также известен как воспалительный белок макрофагов 3α (MIP3 α, MIP3-альфа, MIP3A, MIP3a, MIP-3a), хемокин, регулируемый печенью и активацией (LARC), CC-хемокин LARC, SCYA20, малый индуцибельный цитокин A20, малый индуцибельный цитокин подсемейства А (Cys-Cys), член 20, ST38, CKb4, бета-хемокин Exodus-1, бета-хемокин Exodus-1 или exodus-1. Как отмечено выше, CCL20 представляет собой хемокин CC-типа весом 9 кДа, который экспрессируется конститутивно при очень низких уровнях кератиноцитами в различных тканях (например, коже, слизистой оболочке кишечника, печени). Несмотря на многообразие системы хемокинов человека, CCL20 является единственным лигандом своего рецептора, CCR6. Экспрессия CCL20 была описана при множестве новообразований человека, в том числе колоректальной аденокарциноме, аденокарциномах легкого, поджелудочной железы и молочной железы человека, злокачественной глиоме, лейкозе, лимфоме и меланоме. Однако к настоящему времени и до настоящего раскрытия роль CCL20 in vivo, в частности в контексте рака и терапии рака, не была установлена.
A. Способы
[0065] Настоящее раскрытие предусматривает ряд аспектов и вариантов осуществления применительно к способам, которые включают ингибитор CCL20 или ингибитор CCR6, или их комбинацию. Как описано в данном документе, эти аспекты и варианты осуществления охватывают различные способы применительно к заболеванию, в том числе способы лечения, способы предупреждения, способы ингибирования и/или замедления прогрессирования, способы снижения риска рецидива или повторного проявления заболевания, способы целенаправленного воздействия на определенные клеточные популяции и/или уничтожения таковых; способы индуцирования дифференцировки и/или ослабления способности самообновления и увеличения количества CSC; способы выявления, диагностики и/или количественного определения определенных клеточных популяций и/или заболеваний, в том числе определения стадии заболевания и способов контроля и/или прогноза заболевания.
[0066] В вариантах осуществления настоящее раскрытие предусматривает способ ингибирования пролиферации раковой стволовой клетки (CSC), включающий приведение CSC в контакт с ингибитором CCL20 и/или ингибитором CCR6 в количестве, эффективном для ингибирования пролиферации и/или ослабления выживания CSC. В вариантах осуществления способ предусматривает введение эффективного количества ингибитора CCR6, который является селективным в отношении CCR6. В некоторых вариантах осуществления способ предусматривает введение эффективного количества ингибитора CCL20, который является селективным в отношении CCL20. В некоторых вариантах осуществления ингибитор селективно ингибирует биохимический каскад или ось CCR6/CCL20. Термин "селективный" при использовании в связи с терминами "ингибитор" или "ингибирует" относится к соединению (например, небольшой молекуле или биологической молекуле, как описано в данном документе), которое характеризуется повышенной ингибирующей активностью в отношении мишени, например CCR6 или CCL20, по сравнению с ингибирующей активностью в отношении других биомолекул.
[0067] В вариантах осуществления настоящее раскрытие относится к способу лечения терапевтически устойчивой формы рака у субъекта, который ранее получал терапию и который нуждается в лечении, предусматривающему введение субъекту ингибитора CCL20 и/или ингибитора CCR6 в количестве, эффективном для ингибирования или уничтожения раковых стволовых клеток (CSC) и/или индукции дифференцировки в CSC, присутствующих при терапевтически устойчивой форме рака.
[0068] В дополнительных вариантах осуществления настоящее раскрытие относится к способу лечения терапевтически устойчивой формы рака у субъекта, который ранее получал терапию и который нуждается в лечении, предусматривающему введение субъекту ингибитора CCL20 и/или ингибитора CCR6 в количестве, эффективном для лечения терапевтически устойчивой формы рака.
[0069] В других вариантах осуществления настоящее раскрытие относится к способу лечения рака, который предусматривает раковые стволовые клетки (CSC), при этом способ предусматривает введение субъекту, нуждающемуся в лечении, ингибитора CCL20 и/или ингибитора CCR6 в количестве, эффективном для целенаправленного воздействия и ингибирования или уничтожения CSC и/или индукции дифференцировки в CSC при раке.
[0070] В других вариантах осуществления настоящее раскрытие относится к способу лечения рака, который предусматривает раковые стволовые клетки (CSC), при этом способ предусматривает введение субъекту, нуждающемуся в лечении, ингибитора CCL20 и/или ингибитора CCR6 в количестве, эффективном для лечения рака.
[0071] В дополнительных вариантах осуществления настоящее раскрытие относится к способу лечения рака у субъекта, у которого имеется рекуррентная или рецидивирующая форма рака, предусматривающему введение субъекту ингибитора CCL20 и/или ингибитора CCR6 в количестве, эффективном для ингибирования или уничтожения CSC и/или индукции дифференцировки в CSC при раке.
[0072] В дополнительных вариантах осуществления настоящее раскрытие относится к способу лечения рака у субъекта, у которого имеется рекуррентная или рецидивирующая форма рака, предусматривающему введение субъекту ингибитора CCL20 и/или ингибитора CCR6 в количестве, эффективном для лечения рака.
[0073] Другие варианты осуществления настоящего раскрытия относятся к способу предупреждения повторного проявления или рецидива рака, предусматривающему введение субъекту, нуждающемуся в предупреждении повторного проявления или рецидива рака, ингибитора CCL20 и/или ингибитора CCR6 в количестве, эффективном для предупреждения повторного проявления или рецидива рака.
[0074] В дополнительных вариантах осуществления настоящее раскрытие относится к способу снижения риска рецидива рака у субъекта, у которого имеется рак, предусматривающему введение субъекту ингибитора CCL20 и/или ингибитора CCR6 в количестве, эффективном для ингибирования или уничтожения CSC и/или индукции дифференцировки в CSC при раке, в результате чего снижается риск рецидива рака у субъекта.
[0075] В вариантах осуществления настоящее раскрытие относится к способу устранения раковой стволовой клетки (CSC), предусматривающему приведение CSC в контакт с ингибитором CCL20 и/или ингибитором CCR6 в количестве, эффективном для удаления CSC.
[0076] В некоторых вариантах осуществления настоящее раскрытие относится к способу избирательного уменьшения числа раковых стволовых клеток (CSC) в популяции раковых клеток, предусматривающему приведение популяции раковых клеток в контакт с ингибитором CCL20 и/или ингибитором CCR6 в количестве, эффективном для ингибирования или уничтожения CSC и/или индукции дифференцировки в CSC в популяции раковых клеток. Таким образом, ингибиторы можно вводить субъекту, нуждающемуся в лечении и/или находящемуся в контакте с некоторым количеством CSC, в количестве, достаточном для препятствования дальнейшей пролиферации CSC. В некоторых вариантах осуществления ингибиторы можно вводить в количестве, эффективном для снижения числа CSC с помощью индуцирования гибели клеток (апоптоза) в популяции CSC. В еще одних вариантах осуществления ингибиторы можно вводить в количестве, эффективном для снижения числа CSC с помощью индуцирования клеточной дифференцировки в популяции CSC. Соответственно, в некоторых вариантах осуществления ингибиторы предусмотрены в количествах, которые могут необязательно индуцировать апоптоз в CSC, однако в количествах, которые являются эффективными для снижения или дерегуляции способности CSC к самообновлению и увеличению клеточной популяции CSC в субъекте или онкогенной ткани с помощью индуцирования дифференцировки CSC. Ингибиторы могут быть также предусмотрены в количестве, которое является эффективным для нарушения "ниши" CSC таким образом, что ниша CSC больше неспособна поддерживать CSC и/или регенерацию опухолевой ткани.
[0077] В некоторых вариантах осуществления настоящее раскрытие предусматривает способ ослабления или ингибирования роста опухоли, предусматривающий приведение опухоли в контакт с ингибитором CCL20 и/или ингибитором CCR6 в количестве, эффективном для ослабления или ингибирования роста опухоли. В связанном аспекте настоящее раскрытие предусматривает способ ослабления или ингибирования роста опухоли у пациента, предусматривающий введение пациенту ингибитора CCL20 и/или ингибитора CCR6 в количестве, эффективном для ослабления или ингибирования роста опухоли.
[0078] В дополнительных вариантах осуществления настоящее раскрытие предусматривает способ уменьшения размера опухоли, предусматривающий приведение опухоли в контакт с ингибитором CCL20 и/или ингибитором CCR6 в количестве, эффективном для уменьшения размера опухоли. В связанном аспекте настоящее раскрытие относится к способу уменьшения размера опухоли у пациента, предусматривающему введение пациенту ингибитора CCL20 и/или ингибитора CCR6 в количестве, эффективном для уменьшения размера опухоли.
[0079] В некоторых вариантах осуществления настоящее раскрытие предусматривает способ ингибирования, ослабления или предупреждения инвазивности или метастазирования опухоли, предусматривающий приведение опухоли в контакт с ингибитором CCL20 и/или ингибитором CCR6 в количестве, эффективном для предупреждения, ослабления или ингибирования инвазивности или метастазирования опухоли. В связанном аспекте настоящее раскрытие предусматривает способ ингибирования, ослабления или предупреждения инвазивности или метастазирования опухоли у пациента, включающий введение пациенту ингибитора CCL20 и/или ингибитора CCR6 в количестве, эффективном для предупреждения, ослабления или ингибирования инвазивности или метастазирования опухоли.
[0080] В вариантах осуществления, предусмотренных настоящим раскрытием, способы относятся к опухоли, и/или CSC, или популяции CSC, экспрессирующим CCL20. В некоторых вариантах осуществления способы относятся к опухоли, и/или CSC, или популяции CSC, экспрессирующим CCR6. В некоторых вариантах осуществления способы относятся к опухоли, и/или CSC, или популяции CSC, экспрессирующим CCR6 или CCL20. В дополнительных вариантах осуществления опухоль, и/или CSC, или популяция CSC могут содержать сферообразующие CSC.
[0081] В различных вариантах осуществления вышеуказанных аспектов способы относятся к лечению субъекта в отношении опухолевого заболевания и/или ракового заболевания. В некоторых вариантах осуществления рак выбран из форм рака пищеварительной системы или желудочно-кишечного тракта (например, рака анального отверстия; рака желчного протока; рака внепеченочного желчного протока; рака аппендикса; карциноидной опухоли, желудочно-кишечного рака; рака толстой кишки; колоректального рака, в том числе колоректального рака у детей; рака пищевода, в том числе рака у детей; рака желчного пузыря; рака желудка (желудочного рака), в том числе рака желудка у детей; гепатоцеллюлярного рака (например, гепатоцеллюлярной карциномы), в том числе (первичного) гепатоцеллюлярного рака у взрослых и гепатоцеллюлярного рака у детей; рака поджелудочной железы, в том числе рака поджелудочной железы у детей; саркомы, рабдомиосаркомы; рака островковых клеток поджелудочной железы; рака прямой кишки и рака тонкого кишечника); рака легкого (например, немелкоклеточного рака легкого (NSCLC) и мелкоклеточного рака легкого (SCLC)); рака головы и шеи (например, рака губы и ротовой полости; рака ротовой полости, в том числе рака ротовой полости у детей; гипофарингеального рака; рака гортани, в том числе рака гортани у детей; метастатического плоскоклеточного рака шеи со скрытой первичной опухолью; рака рта; рака носовой полости и околоносовых пазух; рака носоглотки, в том числе рака носоглотки у детей; рака ротоглотки; рака паращитовидной железы; рака глотки; рака слюнных желез, в том числе рака слюнных желез у детей; рака горла и рака щитовидной железы); рака яичника и молочной железы.
[0082] Термин "субъект", используемый в данном документе, включает человека и нечеловекоподобных животных, в частности млекопитающих. Примеры субъектов включают субъектов-людей, например пациента-человека, у которого имеется нарушение, например нарушение, описанное в данном документе, такое как рак, или здорового субъекта. Термин "нечеловекоподобное животное" включает всех позвоночных, например, не принадлежащих к млекопитающим (таких как куры, амфибии, рептилии) и млекопитающих, таких как приматы, отличные от человека, домашние и/или сельскохозяйственные животные (такие как овцы, собаки, кошки, коровы, свиньи и т. д.) и грызуны (такие как мыши, крысы, хомяки, морские свинки и т. д.). В конкретных вариантах осуществления субъектом является пациент-человек.
[0083] Термины "лечение" или "лечить" относятся как к терапевтическому лечению, так и к профилактическим или превентивным мерам. К субъектам, нуждающимся в лечении, относят тех, у которых уже есть нарушение, а также тех, которые предрасположены к нарушению, или тех, у которых требуется предупредить развитие нарушения. При использовании со ссылкой на заболевание или субъекта, нуждающегося в лечении, термины соответственно включают без ограничения приостановление или замедление прогрессирования заболевания, ремиссию заболевания, профилактику симптомов, уменьшение симптомов и/или тяжести заболевания или уменьшение продолжительности заболевания по сравнению с субъектом, не получавшим лечение. В вариантах осуществления в способах лечения можно ослаблять один или несколько клинических признаков конкретного заболевания, подлежащего лечению. Определенные варианты осуществления в отношении к способам лечения заболевания или состояния, ассоциированных с CSC, которые экспрессируют CCL20 и/или CCR6, а также CSC, имеющими активированный каскад или ось CCR6/CCL20, предусматривают введение терапевтически эффективных количеств соединения, которое ингибирует CCR6, CCL20, или как CCR6, так и CCL20, а также их фармацевтических композиций. В вариантах осуществления способ лечения может относиться к любому способу, с помощью которого предотвращают дальнейшее прогрессирование заболевания и/или симптомов, устраняют заболевание, замедляют или ослабляют дальнейшее прогрессирование заболевания и/или симптомов, или обращают заболевание и/или клинические симптомы, ассоциированные с CSC и формами рака, ассоциированными с CSC, которые экспрессируют CCR6 и/или CCL20.
[0084] В некоторых вариантах осуществления способы могут предусматривать терапевтически эффективное количество средства, которое является достаточным для остановки или замедления прогрессирования рака. В дополнительных вариантах осуществления терапевтически эффективное количество представляет собой количество, достаточное для уменьшения числа раковых клеток, в том числе CSC у субъекта (например, уничтожение раковых клеток, и/или подавление пролиферации раковых клеток, и/или индуцирование дифференцировки CSC). Способы контроля пролиферации раковых клеток и прогрессирования рака у субъекта (например, размер опухоли, содержание клеток, биохимические маркеры, вторичные показатели и др.) описаны в данном документе и могут также включать методики, общеизвестные из уровня техники.
[0085] Как описано в данном документе, некоторые варианты осуществления предусматривают способ лечения, который предусматривает введение ингибитора совместно с лучевой терапией, хирургическим вмешательством, иммунотерапией или другими химиотерапевтическими средствами. В некоторых вариантах осуществления способ предусматривает введение терапевтически эффективного количества ингибитора CCL20 в комбинации с дополнительным противораковым средством. В других вариантах осуществления способ предусматривает введение терапевтически эффективного количества ингибитора CCR6 в комбинации с дополнительным противораковым средством. Самые разнообразные противораковые (т. е. антинеопластические) средства известны из уровня техники и включают, например, алкилирующие средства, антиметаболиты, природные антинеопластические средства, гормональные антинеопластические средства, ингибиторы ангиогенеза, реагенты дифференцировки, ингибиторы РНК, антитела или иммунотерапевтические средства, средства генной терапии, низкомолекулярные ингибиторы ферментов, модификаторы биологического отклика, ингибиторы микротрубочек, ингибиторы ответа на повреждение ДНК, антиметастатические средства и другие химиотерапевтические средства.
[0086] Термины "введение" или "вводимый", используемые в данном документе, относятся к предоставлению, приведению в контакт и/или доставке соединения или соединений подходящим путем с целью достижения требуемого эффекта. Введение может включать в себя без ограничения пероральное, сублингвальное, парентеральное (например, внутривенную, подкожную, внутрикожную, внутримышечную, внутрисуставную, внутриартериальную, интрасиновиальную, внутригрудинную, интратекальную, внутриочаговую или внутричерепную инъекции), трансдермальное, местное, трансбуккальное, ректальное, вагинальное, назальное, офтальмическое, посредством ингаляции и имплантов.
[0087] Термин "совместно введенный", используемый в данном документе, относится к одновременному или последовательному введению нескольких соединений или средств. Первое соединение или средство можно вводить до введения второго соединения или средства, совместно с таковым или после такового. Первое соединение или средство и второе соединение или средство можно вводить одновременно или последовательно в тот же день, или можно вводить последовательно в пределах 1 дня, 2 дней, 3 дней, 4 дней, 5 дней, 6 дней, 1 недели, 2 недель, 3 недель или одного месяца по отношению друг к другу. Соответственно, соединения или средства вводят совместно в течение периода времени, в котором каждое из соединений или средств оказывает по меньшей мере некоторый физиологический эффект и/или характеризуется остаточной эффективностью.
[0088] Термин "приведение в контакт", используемый в данном документе в выражении "приведение клетки в контакт", относится к приведению клетки в контакт непосредственно или опосредованного in vitro, ex vivo или in vivo (т. е. в субъекте, таком как млекопитающее, в том числе люди, мыши, крысы, кролики, кошки и собаки). Приведение клетки в контакт, которое также может включать "введение клетки в реакцию с" или "воздействие" на клетку ингибирующего соединения может происходить в результате общего введения соединения или средства субъекту или добавления или введения ингибитора в сосуд, содержащий клетку, или ткань, или жидкость, содержащую клетку или ткань. Таким образом, приведение клетки в контакт с ингибитором может относиться к введению ингибитора субъекту, в ткань, или область субъекта, или ткань, которая содержит клетку (например, клетку CSC в локализованной области или системе в субъекте (например, лимфатической, сердечно-сосудистой и др.)), и он может физически не контактировать с целевой клеткой. Приведение в контакт охватывает введение в клетку, ткань, млекопитающее, субъекта, пациента или человека. Кроме того, приведение клетки в контакт предусматривает добавление средства в клеточную культуру. Другие подходящие способы могут предусматривать внесение или введение средства в клетку, ткань, млекопитающего, субъекта или пациента с помощью подходящих процедур и путей введения, как описано в данном документе или иным образом известно из уровня техники.
[0089] Настоящее раскрытие также относится к одному или нескольким вариантам применения ингибитора CCL20 и/или ингибитора CCR6 или их комбинации в композиции, включающей в себя терапевтические и фармацевтические композиции. В вариантах осуществления варианты применения и композиции предусматривают ингибитор(-ы) в количествах, эффективных для обеспечения осуществления различных способов, описанных в данном документе. В вариантах осуществления один или несколько вариантов применения относятся к вариантам применения для получения лекарственного препарата для лечения (например, уничтожения, устранения, ингибирования, уменьшения прогрессирования и/или скорости прогрессирования пролиферации клеток, уменьшения способности самообновления и/или увеличения количества клеток (CSC), уменьшения прогрессирования и/или скорости прогрессирования состояния заболевания), одного или нескольких типов опухолей, раковых стволовых клеток и/или форм рака, описанных в данном документе.
Способы выявления
[0090] В некоторых аспектах и вариантах осуществления способы, раскрытые в данном документе, предусматривают и/или включают один или несколько способов, полезных при выявлении, определении и/или количественном определения раковой стволовой клетки (CSC). В некоторых вариантах осуществления способ предусматривает выявление, обнаружение и/или определение количества CCL20 и/или CCR6 в биологическом образце, содержащем CSC. В некоторых вариантах осуществления способы предусматривают диагностику, прогнозирование, количественное определение, обнаружение и/или выявление присутствия раковой стволовой клетки (CSC) в образце, содержащем раковые клетки, при этом способ предусматривает одно или несколько из следующего:
приведение образца в контакт со средством, которое связывается с последовательностью нуклеиновой кислоты CCL20 или аминокислотной последовательностью CCL20;
выявление присутствия или отсутствия связывания между средством и последовательностью нуклеиновой кислоты CCL20 или аминокислотной последовательностью CCL20 и/или
обнаружение присутствия CSC в образце при выявлении связывания между средством и последовательностью нуклеиновой кислоты CCL20 или аминокислотной последовательностью CCL20.
[0091] В некоторых вариантах осуществления способы предусматривают диагностику, прогнозирование, количественное определение, обнаружение и/или выявление присутствия раковой стволовой клетки (CSC) в образце, содержащем раковые клетки, при этом способ предусматривает одно или несколько из следующего:
приведение образца в контакт со средством, которое связывается с последовательностью нуклеиновой кислоты CCR6 или аминокислотной последовательностью CCR6;
выявление присутствия или отсутствия связывания между средством и последовательностью нуклеиновой кислоты CCR6 или аминокислотной последовательностью CCR6 и/или
обнаружение присутствия CSC в образце при выявлении связывания между средством и последовательностью нуклеиновой кислоты CCR6 или аминокислотной последовательностью CCR6.
[0092] В этих способах стадии можно применять отдельно или в любых последовательностях комбинаций друг с другом или другими методиками, общеизвестными из уровня техники. В некоторых вариантах осуществления данного аспекта способ дополнительно может предусматривать одно или несколько из следующего:
определение количества последовательности нуклеиновой кислоты CCL20 и/или CCR6 или аминокислотной последовательности CCL20 и/или CCR6 в образце;
сравнение количества последовательности нуклеиновой кислоты CCL20 и/или CCR6 или аминокислотной последовательности CCL20 и/или CCR6 с эталонным уровнем нуклеиновой кислоты CCL20 и/или CCR6 или аминокислоты CCL20 и/или CCR6; и/или
обнаружение присутствия CSC в образце, в случае если выявленное количество является большим, чем эталонный уровень.
[0093] В еще одних дополнительных вариантах осуществления способ может предусматривать средство, содержащее выявляемый фрагмент. В некоторых вариантах осуществления средство может содержать последовательность нуклеиновой кислоты, которая гибридизуется по меньшей мере с частью последовательности нуклеиновой кислоты CCL20 и/или CCR6 в жестких условиях гибридизации. В некоторых вариантах осуществления средство может содержать антитело, которое специфически связывается по меньшей мере с частью аминокислотной последовательности CCL20 и/или CCR6.
[0094] В различных вариантах осуществления вышеуказанных аспектов способы относятся к опухоли, и/или CSC, или популяции CSC, экспрессирующим CCL20. В некоторых вариантах осуществления вышеуказанных аспектов способы относятся к опухоли, и/или CSC, или популяции CSC, экспрессирующим CCR6. В дополнительных вариантах осуществления опухоль, и/или CSC, или популяция CSC могут содержать сферообразующие CSC.
[0095] В дополнение к способам, описанным в данном документе, которые полезны для выявления, обнаружения и/или количественного определения CSC в образце, эти аспекты и варианты осуществления также могут предусматривать любой способ и методику, которые доступны специалисту в данной области техники. В качестве неограничивающих примеров, CSC можно обнаруживать, выявлять и выделять с использованием методик, в том числе проточной цитометрии на основе маркеров клеточной поверхности, которые экспрессируются в определенных CSC или являются специфичными для определенных CSC; выявления фенотипов побочных популяций (SP) с помощью исключения красителя (например, Hoechst 33342, как раскрыто у Moserle, L., et al., Cancer Res. (2008) 68; 5658-5668); способности расти/пролиферировать в виде подвижных сфер в бессывороточной среде (например, раскрытых в данном документе, а также у Ryback, A.P., et al., Biochim. Biophys. Acta (2011) 1813; 683-694); и определения активности конкретных ферментов, например таких как активность альдегиддегидрогеназы, и уровней маркеров группы polycomb, в том числе маркера гетерохроматина группы polycomb, уровней H3K27me3 и энхансерного белка группы polycomb zeste 2 (EZH2).
[0096] В некоторых вариантах осуществления, например, сообщали о повышенной экспрессии и активности альдегиддегидрогеназы (ALDH) в предшественниках клеток рака различных линий (например, гемопоэтических, молочной железы, эндотелиальных, мезенхимальных, нервных), и при этом в связи с различными аспектами и вариантами осуществления данного документа можно применять методики и коммерчески доступные наборы (например, ALDEFLUOR™, Stemcell Technologies). Аналогично, несмотря на то, что в настоящее время отсутствуют универсально экспрессируемые маркеры клеточной поверхности для обнаружения CSC, ряд маркеров поверхности были ассоциированы с CSC и ассоциированными типами опухолей, в том числе, например, ALDH, CD13, CD15, CD24, CD44, CD90, CD117, CD133, CD166, CD326, (см., например, Xia, P., Curr Stem Cell Res Ther. (2014) Mar; 9(2): 102-11; Shimamura, M., et al., Endocr. J., (2014) 61(5):481-90; Tirino, V., et al., FASEB J., (2013) Jan; 27(1):13-24).
[0097] В некоторых вариантах осуществления, из-за отсутствия универсальных маркеров поверхности для выявления или обнаружения CSC в образце, способы выявления, обнаружения и/или количественного определения предусматривают методики культивирования клеток, включающие сферические культуры и анализы роста, такие как раскрытие в данном документе или иным образом известные из уровня техники.
B. Ингибиторы
[0100] Способы, варианты применения и композиции, описанные в данном документе, предусматривают варианты осуществления в отношении средств, способных ингибировать, понижающе регулировать или устранять активность и/или экспрессию CCR6 и/или CCL20, или любую комбинацию одного или нескольких из этих ингибирующих средств. При условии, что средство обладает ингибирующей функцией (например, ингибирует экспрессию и/или активность CCR6, CCL20, или как CCR6, так и CCL20), ингибирующее средство можно выбрать из любого класса соединений. Например, ингибиторы можно выбрать из группы, состоящей из полипептида, который ингибирует CCR6 и/или CCL20, небольшой молекулы, которая ингибирует CCR6 и/или CCL20, полипептида, который ингибирует CCR6 и/или CCL20, аптамера, который ингибирует CCR6 и/или CCL20, антитела, которое ингибирует CCR6 и/или CCL20, или антисмысловой молекулы или молекулы siRNA, которая ингибирует CCR6 и/или CCL20. Таким образом, ингибиторы, используемые в данном документе, относятся к любому соединению, которое уменьшает, ингибирует, снижает или устраняет экспрессию и/или функцию релевантной молекулы (например, CCR6 и/или CCL20), или средства, подходящего для нейтрализации, ослабления или ингибирования экспрессии или функции молекулы. Ингибиторы, описанные в данном документе, могут вызывать действие с помощью механизма, включающего например связывание с CCR6 и/или CCL20. При связывании, ингибитор может, например, ингибировать взаимодействие CCR6 и/или CCL20 с рецептором или лигандом таким образом, что CCR6 или CCL20 не могут активировать рецептор или не могут быть активированы лигандом. В других вариантах осуществления средство(-а), способное(-ые) ингибировать активность CCR6 и/или CCL20, может(могут) ингибировать хемотаксическую активность, может(могут) связывать белки и снижать биодоступность, или возможны любые их комбинации.
[0101] В некоторых вариантах осуществления ингибитор может представлять собой полипептид или небольшую молекулу, способные связываться с CCR6 или CCL20, или обеими, и может быть обнаружен с помощью любой методики, общепринятой в данной области техники (например, скрининга библиотек низкомолекулярных соединений или полипептидов). Как правило, термин "небольшая молекула", используемый в данном документе, относится к небольшим органическим молекулам, имеющим низкий молекулярный вес. Небольшая молекула может представлять собой синтетическое соединение, которое, как известно, не встречается в природе, или встречающееся в природе соединение, выделенное из природных источников или известное как встречающееся в них, например таких как клетки, растения, грибы, животные и т. п. В некоторых вариантах осуществления небольшая молекула может иметь молекулярный вес, составляющий менее 5000 Дальтон, менее 4000 Дальтон, менее 3000 Дальтон, менее 2000 Дальтон, менее 1000 Дальтон или менее 800 Дальтон. В таких вариантах осуществления небольшая молекула обычно имеет молекулярный вес, составляющий более чем приблизительно 100 Дальтон.
[0102] То, способна ли небольшая молекула или полипептид связываться с CCR6 или CCL20 можно определить с помощью любой стандартной методики или анализа, а также методик и анализов, описанных в данном документе. Например, методики могут предусматривать дрожжевой двугибридный анализ или биохимический анализ, например такой как анализ с "опусканием", анализ коиммунопреципитации, иммуноферментный твердофазный анализ (ELISA), количественный анализ радиолигандного связывания, анализ с использованием плазмонного резонанса или любой другой способ, стандартно применяемый в данной области техники. Обычно при применении анализов с "опусканием" или с использованием плазмонного резонанса полезно сливать или иным образом связывать по меньшей мере один из белков с меткой аффинности, такой как HIS-метка, GST-метка, или другим выявляемым фрагментом, обычно применяемым в данной области техники. Способен ли полипептид или любое другое соединение, подлежащее исследованию, ингибировать активность CCR6 и/или CCL20, можно определить с помощью измерения активности мембраносвязанного с полипептида. Соответственно, полипептид способен ингибировать активность CCR6 и/или CCL20.
[0103] В вариантах осуществления ингибитор может представлять собой "аптамер", который относится к ДНК, РНК или пептидному аптамеру, характеризующемуся специфичностью по отношению к CCR6 или по отношению к CCL20. Полинуклеотидный аптамер содержит в любом месте от приблизительно 10 до приблизительно 300 нуклеотидов в длину. Обычно длина аптамера находится в диапазоне от приблизительно 30 до приблизительно 100 нуклеотидов, и в некоторых вариантах осуществления длина может находиться в диапазоне от приблизительно 10 до 60 нуклеотидов. Аптамеры можно получить с помощью любого известного способа, в том числе синтетических, рекомбинантных способов и способов очистки, и можно применять в отдельности или в комбинации с другими аптамерами, специфичными по отношению к CCR6 или по отношению к CCL20.
[0104] В некоторых вариантах осуществления ингибитор может представлять собой антитело, которое специфически связывается с CCR6 или CCL20. В некоторых вариантах осуществления антитело может представлять собой моноклональное или поликлональное антитело, или полиспецифическую антисыворотку. В таких вариантах осуществления антитело может также включать в себя варианты или фрагменты, такие как, например, одноцепочечные антитела, диатела, минитела, одноцепочечные Fv-фрагменты (sc(Fv)), sc(Fv)2 антитела, Fab-фрагменты или F(ab')2-фрагменты, при условии, что вариант или фрагмент сохраняет свойства специфического связывания с мишенью (например, CCR6 или CCL20).
[0105] В других вариантах осуществления ингибитор может представлять собой антисмысловую молекулу, содержащую полинуклеотид, который является комплементарным по меньшей мере части mRNA CCR6 или mRNA CCL20, или обеим. В некоторых вариантах осуществления антисмысловая молекула является подходящей для применения в способах, в которых ингибируют трансляцию mRNA в клетке. Антисмысловая молекула может содержать ДНК, РНК, или как ДНК, так и РНК, а также химически модифицированные нуклеиновые кислоты. Кроме того, в некоторых вариантах осуществления антисмысловая молекула может быть однонитевой или двухнитевой. Антисмысловая молекула может содержать от приблизительно 10 до приблизительно 500 нуклеотидов, и в некоторых вариантах осуществления длина может составлять любое число, например, находиться в диапазоне от приблизительно 11 до приблизительно 200 нуклеотидов, от приблизительно 12 до приблизительно 100 нуклеотидов, от приблизительно 13 до приблизительно 75 нуклеотидов, от приблизительно 14 до приблизительно 50 нуклеотидов, от приблизительно 15 до приблизительно 40 нуклеотидов, от приблизительно 16 до приблизительно 30 нуклеотидов или от приблизительно 17 до приблизительно 25 нуклеотидов. Специалисту в данной области техники будет понятно, что этими диапазонами представлены иллюстративные варианты осуществления.
[0106] В некоторых вариантах осуществления ингибитор может содержать молекулу siRNA, которая ослабляет или ингибирует экспрессию CCR6 или CCL20, или как CCR6, так и CCL20. В некоторых вариантах осуществления молекула siRNA может представлять собой однонитевую или двухнитевую молекулу siRNA, которая содержит последовательность, способную гибридизоваться с mRNA CCR6, mRNA CCL20, или обеими, и индуцировать РНК-интерференцию иди другой антисмысловой механизм, который ослабляет или ингибирует экспрессию белка. Молекулы siRNA могут содержать любую последовательность, которая способствует тому, чтобы молекула siRNA индуцировала РНК-интерференцию, приводящую к ослаблению или подавлению экспрессии белка CCR6 или белка CCL20. Длина молекулы siRNA может в некоторых вариантах осуществления составлять от приблизительно 10 до 100, от 12 до 80, от 14 до 60, от 16 до 50, от 17 до 40 нуклеотидов. Соответственно, длина siRNA находится в диапазоне, варьирующем от 18 до 30 нуклеотидов, и в определенных вариантах осуществления от приблизительно 18 до приблизительно 26 нуклеотидов.
[0107] В вариантах осуществления, предусматривающих ингибирующую молекулу нуклеиновой кислоты, такие ингибиторы могут связываться с целевой последовательностью нуклеиновой кислоты CCR6 или CCL20 в жестких условиях связывания. Термины "жесткие условия", "жесткие условия связывания" или "жесткие условия гибридизации" относятся к условиям, при которых полинуклеотид будет гибридизоваться с целевой последовательностью, в более высокой поддающейся выявлению степени, чем с другими последовательностями (например, по меньшей мере в 2 раза по сравнению с фоном). Один неограничивающий пример жестких условий предусматривает таковые, в которых выполняют гибридизацию в 50% формамиде, 1 M NaCl, 1% SDS при 37°C, и промывку в 0,1x SSC при 60-65°C.
[0108] Принимая во внимание полинуклеотидную последовательность CCR6 или CCL20, ингибирующая молекула нуклеиновой кислоты может быть сконструирована с помощью мотивов и направлена на область, которая, как можно предполагать, является эффективной в отношении ингибирующей активности, с помощью стандартных методик в данной области техники.
[0109] Альтернативно или дополнительно можно применять любые дополнительные способы, которые пригодны для определения активности CCR6 и/или CCL20 и которые доступны специалисту в данной области техники. Ингибиторы, полезные в различных аспектах и вариантах осуществления, описанных в данном документе, могут ингибировать активность CCR6 и/или CCL20 по меньшей мере на 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, более предпочтительно по меньшей мере на 80%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% при сравнении с контролем. В конкретных вариантах осуществления ингибиторы являются эффективными в ингибировании активности CCR6 и/или CCL20 по меньшей мере на 50%, по меньшей мере 60% или по меньшей мере 70%. В других вариантах осуществления ингибиторы могут ингибировать активность CCR6 и/или CCL20 по меньшей мере на значение от 85% до приблизительно 100%, по меньшей мере от 90% до приблизительно 100%, по меньшей мере от 95% до приблизительно 100% или на приблизительно 100%.
[0110] В вариантах осуществления ингибиторы можно комбинировать в композиции, которая содержит одно или несколько дополнительных активных средств, подходящих для лечения или предупреждения опухолевого заболевания и/или рака. Некоторые неограничивающие примеры этих активных соединений включают химиотерапевтические средства, общеизвестные из уровня техники, такие как, например, темозоломид, адриамицин, доксорубицин, эпирубицин, 5-фторурацил, цитозин арабинозид ("Ara-C"), циклофосфамид, тиотепу, бусульфан, цитоксин, таксоиды (например, паклитаксел), токсотер, метотрексат, цисплатин, мелфалан, винбластин, блеомицин, этопозид, ифосфамид, митомицин C, митоксантрон, винкристин, винорелбин, карбоплатин, тенипозид, дауномицин, карминомицин, аминоптерин, дактиномицин, митомицины, мелфалан и другие родственные азотистые иприты и гормональные средства, которые принимают участие в регуляции или ингибировании гормонального действия на опухоли, такие как тамоксифен и онапристон.
C. Фармацевтические композиции и составы
[0111] В некоторых аспектах настоящее раскрытие предусматривает фармацевтические композиции. Эти фармацевтические композиции могут представлять собой композиции, содержащие ингибитор CCL20, ингибитор CCR6, комбинацию ингибитора CCL20 и CCR6 или любые другие их комбинации. Эти фармацевтические композиции также могут представлять собой композиции, содержащие фармацевтически приемлемый наполнитель. В отдельных аспектах фармацевтические композиции по настоящему раскрытию используются в качестве лекарственного препарата.
[0112] В определенных аспектах ингибиторы, раскрытые в данном документе, могут быть составлены с фармацевтически приемлемым носителем, наполнителем или стабилизатором в виде фармацевтических композиций. В определенных аспектах эти фармацевтические композиции являются подходящими для введения человеку или нечеловекоподобному животному, посредством любого одного или нескольких путей введения с использованием способов, известных из уровня техники. Как будет понятно специалисту в данной области техники, путь и/или способ введения будет варьироваться в зависимости от требуемых результатов. Термин "фармацевтически приемлемый носитель" означает один или несколько нетоксичных материалов, которые не препятствуют эффективности биологической активности активных ингредиентов. Как правило, такие препараты могут содержать соли, буферные средства, консерванты, совместимые носители и, необязательно, другие терапевтические средства. Эти фармацевтически приемлемые препараты также могут содержать совместимые твердые или жидкие наполнители, разбавители или инкапсулирующие вещества, которые являются подходящими для введения в организм человека. Другие представленные носители, наполнители и/или добавки, которые можно использовать в составах, описанных в данном документе, включают, например, ароматизирующие вещества, противомикробные средства, подсластители, антиоксиданты, антистатики, липиды, белковые наполнители, такие как сывороточный альбумин, желатин, казеин, солеобразующие противоионы, такие как натрий, и им подобные. Эти и дополнительные известные фармацевтические носители, наполнители и/или добавки, подходящие для использования в композициях, описанных в данном документе, известны в данной области техники, например такие, которые перечислены в "Remington: The Science & Practice Pharmacy", 21st ed., Lippincott Williams & Wilkins, (2005), и в "Physician's Desk Reference", 60th ed., Medical Economics, Montvale, N.J. (2005). Фармацевтически приемлемые носители нужно выбирать так, чтобы они были подходящими в плане требуемого или необходимого способа введения, растворимости и/или стабильности.
[0113] В одном аспекте составы по настоящему раскрытию являются апирогенными составами, которые практически свободны от эндотоксинов и/или аналогичных пирогенных веществ. Эндотоксины включают токсины, которые заключены внутри микроорганизма и выпускаются только тогда, когда микроорганизмы разрушаются или умирают. Пирогенные вещества также включают индуцирующий повышение температуры термостабильные вещества (гликопротеины) из внешней мембраны бактерий и других микроорганизмов. Оба эти вещества могут вызывать повышение температуры, гипотонию и шок при введении людям. Из-за возможных вредных эффектов даже низкие количества эндотоксинов должны быть удалены из фармацевтических лекарственных растворов для внутривенного введения. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США ("FDA") установило верхний предел в 5 единиц эндотоксина (EU) на дозу на килограмм веса тела в период, продолжительностью один час, для внутривенных введений лекарственных средств (The United States Pharmacopeial Convention, Pharmacopeial Forum 26 (1):223 (2000)). В отдельных конкретных аспектах уровни эндотоксинов и пирогенов в композиции составляют менее 10 EU/мг, или менее 5 EU/мг, или менее 1 EU/мг, или менее 0,1 EU/мг, или менее 0,01 EU/мг, или менее 0,001 EU/мг.
[0114] При использовании для введения in vivo составы по настоящему раскрытию должны быть стерильными. Составы по настоящему раскрытию можно стерилизовать различными способами стерилизации, в том числе стерилизацией фильтрованием, ионизирующим излучением и т. д. В одном аспекте состав является простерилизован фильтрацией с использованием предварительно простерилизованным 0,22-микронного фильтра. Стерильные композиции для инъекций могут быть составлены в соответствии со стандартной фармацевтической практикой, как описано в "Remington: The Science & Practice Pharmacy", 21st ed., Lippincott Williams & Wilkins, (2005).
[0115] В вариантах осуществления данного аспекта терапевтические композиции могут быть составлены для конкретных путей введения, таких как пероральное, назальное, легочное, местное (включая трансбуккальное и сублингвальное), ректальное, вагинальное и/или парентеральное введение. Формулировки "парентеральное введение" и "вводимый парентерально", используемые в данном документе, относятся к способам введения, отличным от энтерального и местного введения, обычно с помощью инъекции, и включают без ограничения внутривенную, внутримышечную, внутриартериальную, интратекальную, внутрикапсульную, интраорбитальную, внутрисердечную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, субкутикулярную, внутрисуставную, подкапсулярную, субарахноидальную, интраспинальную, эпидуральную и интрастернальную инъекции и инфузии. Составы по настоящему раскрытию, которые пригодны для местного или трансдермального введения, включают порошки, спреи, мази, пасты, кремы, лосьоны, гели, растворы, пластыри и средства для ингаляции. Ингибиторы и другие активные средства можно смешивать в стерильных условиях с фармацевтически приемлемым носителем и с любыми консервантами, буферами или пропеллентами, которые могут потребоваться (см., например, патент США № 7378110; № 7258873; № 7135180; заявку на патент США № 2004-0042972; и № 2004-0042971).
[0116] Составы в целях удобства могут быть представлены в стандартной лекарственной форме, и могут быть получены любым способом, известным в области фармации. Фактические уровни дозировки активных ингредиентов в фармацевтических композициях по настоящему раскрытию можно изменять таким образом, чтобы получить количество активного ингредиента, которое эффективно для достижения требуемого терапевтического ответа у конкретного пациента, состава и способа введения, который не является токсичным для пациента (например, "терапевтически эффективное количество"). Выбранный уровень дозировки будет зависеть от разнообразных фармакокинетических факторов, включающих активность конкретных используемых композиций, путь введения, время введения, скорость экскреции конкретного используемого соединения, длительность лечения, другие лекарственные средства, соединения и/или материалы, используемые в комбинации с конкретными используемыми композициями, возраст, пол, вес, состояние, общее состояние здоровья и анамнез пациента, подлежащего лечению, и подобные факторы, хорошо известные в области медицины. Эти дозировки можно вводить ежедневно, еженедельно, каждые две недели, ежемесячно или менее часто, например каждые полгода, в зависимости от дозы, способа введения, нарушения или симптома(-ов), подлежащих лечению, и характеристик отдельных субъектов. Дозировки также можно вводить посредством непрерывной инфузии (например, посредством насоса). Вводимая доза может также зависеть от пути введения. Например, для подкожного введения может требоваться более высокая дозировка, чем для внутривенного введения. Как отмечено выше, любой общепринятый режим дозирования (например, 1-10 мг/кг вводят с помощью инъекции ежедневно или два раза в неделю) может быть приспособлен и являться подходящим для лечения пациентов-людей с раковой опухолью.
[0117] Раскрытие аналогично предусматривает, что можно создать составы, подходящие для применения в диагностике и исследованиях. Концентрацию активного средства в таких составах, а также присутствие или отсутствие наполнителей и/или пирогенов, можно выбирать, исходя из конкретной задачи запланированного применения.
D. Наборы
[0118] Другой аспект настоящего раскрытия относится к набору. В одном аспекте набор содержит любое из вышеописанных ингибиторов, реагентов, композиций или фармацевтических композиций, а также инструкции или маркировку, указывающие на соответствующее применение или введение. Необязательно набор может также включать в себя один или нескольких контейнеров, и/или шприцов, или других устройств для облегчения доставки или применения. Настоящее раскрытие предполагает, что в набор можно поместить все компоненты или любое подмножество компонентов для проведения анализов с целью исследований, анализов с целью диагностики и/или введения терапевтически эффективных количеств. Аналогично, набор может включать в себя инструкции для получения конъюгата, например с помощью образования ковалентной связи между ингибитором по настоящему раскрытию и терапевтическим или диагностическим фрагментами в подходящих условиях для образования конъюгата. В качестве дополнительного примера в способе терапии набор для применения может содержать раствор, содержащий фармацевтический состав на основе ингибитора(-ов) CCL20 или/и CCR6, или лиофилизированный препарат на основе одного или нескольких ингибиторов, а также инструкции для введения композиции пациенту, нуждающемуся в этом, и/или для восстановления лиофилизированного продукта.
[0119] Настоящее раскрытие также охватывает готовый упакованный и маркированный фармацевтический продукт. Это готовое изделие включает соответствующую стандартную лекарственную форму в соответствующей емкости или контейнере, таком как стеклянный флакон или другой контейнер, который герметично запечатан. В случае дозированных форм, подходящих для парентерального введения, активный компонент является стерильным и подходящим для введения в виде раствора, не содержащего частиц. В определенных аспектах состав является подходящим для внутривенного введения, например для внутривенной инфузии человеку или животному.
[0120] В конкретном аспекте составы по настоящему раскрытию составлены в отдельных однодозовых емкостях в виде стерильной жидкости. Иллюстративные контейнеры включают без ограничения флаконы, бутыли, предварительно наполненные шприцы, IV пакеты, блистерные упаковки (содержащие одну или несколько пилюль). Необязательно, совместно с таким контейнером(-ами) может прилагаться уведомление в форме, предписанной государственным органом, регулирующим изготовление, применение или продажу фармацевтических или биологических продуктов, и при этом уведомление отражает разрешение органа в отношении производства, применения или продажи для диагностики и/или введения человеку.
[0121] Как и в случае любого фармацевтического продукта, упаковочный материал и контейнер разработаны для защиты стабильности продукта во время хранения и транспортировки. Кроме того, продукты по настоящему раскрытию включают инструкции для применения или другой информационный материал, который советует врачу, специалисту или пациенту, как правильно предупредить или лечить рассматриваемое заболевание или нарушение. Другими словами, готовое изделие включает инструктирующие средства, которые указывают или предлагают режим дозирования, включая без ограничения действующие дозы, процедуры мониторинга и т. д., а также другую информацию о мониторинге.
[0122] Набор для диагностических анализов может содержать раствор, содержащий ингибитор CCL20 и/или CCR6, раскрытый в данном документе, или альтернативно или дополнительно реагенты для выявления присутствия CCL20 и/или CCR6. Различные реагенты можно метить согласно способам, известным из уровня техники и описанным в данном документе, включая без ограничения метки, такие как низкомолекулярные флуоресцентные маркеры, белки, такие как биотин, GFP или другие флуоресцентные белки, или эпитопные последовательности, такие как his или myc. Аналогично, в набор могут быть включены первичные антитела, используемые для выявления CCL20 и/или CCR6. Первичные антитела могут быть направлены на последовательности CCL20 и/или CCR6, или метки, маркеры или эпитопы, которыми мечены CCL20 и/или CCR6. В свою очередь, первичные антитела могут быть маркированы для выявления или, если требуется, дополнительного усиления сигнала, при этом первичные антитела могут быть выявлены по вторичным антителам, которые также могут быть включены в набор.
[0123] Также предусматриваются наборы для применения в исследованиях. Например, такие наборы могут иметь сходство с наборами, предназначенными для диагностического или терапевтического применений, однако дополнительно включают маркировку, уточняющую, что данный набор и его применение ограничиваются только исследовательскими целями.
Метки, конъюгаты и фрагменты
[0124] Настоящее раскрытие относится к способам, композициям и наборам, предусматривающим реагенты, которые могут быть конъюгированы с метками для диагностических и других анализов, где одна или несколько целевых молекул могут быть связаны и выявлены с помощью этого меченого реагента(-ов). Метки включают без ограничения хромофор, флуорофор, флуоресцентный белок, фосфоресцентный краситель, тандемный краситель, частицу, гаптен, фермент и радиоактивный изотоп.
[0125] В определенных аспектах реагенты конъюгированы с флуорофором. Выбор флуорофора, присоединяемого к реагенту(-ам), будет определять свойства поглощения и испускания флуоресценции конъюгированной молекулой. Физические свойства флуорофорной метки, которую можно применять, включают без ограничения спектральные характеристики (поглощение, испускание и стоксов сдвиг), интенсивность, длительность, поляризацию флуоресценции и скорость обесцвечивания или их комбинацию. Все эти физические свойства можно использовать для того, чтобы отличить один флуорофор от другого, и в результате этого обеспечить возможность мультиплексного анализа. Другие подходящие свойства флуоресцентной метки могут включать клеточную проницаемость и низкую токсичность, например, если мечение мишени(-ей) необходимо проводить в клетке или организме (например, живом животном).
[0126] В определенных аспектах фермент представляет собой метку и конъюгирован с реагентом. Ферменты могут представлять собой подходящие метки, поскольку можно получить усиление выявляемого сигнала, приводящее к повышению чувствительности анализов. Сам фермент не вызывает выявляемой ответной реакции, а действует путем разрушения субстрата, в случае если он вступает в контакт с соответствующим субстратом, так что превращаемый субстрат испускает флуоресцентный, колориметрический или люминесцентный сигналы. Ферменты усиливают выявляемый сигнал, поскольку один фермент в реактиве для мечения может приводить к превращению нескольких субстратов в поддающийся выявлению сигнал. Субстрат для фермента выбирают так, чтобы получить предпочтительный поддающийся измерению продукт, например, колориметрический, флуоресцентный или хемилюминесцентный. Такие субстраты широко используются в данной области техники и хорошо известны специалисту в данной области техники, и предусматривают например оксидоредуктазы, такие как пероксидаза хрена, и субстрат, такой как 3,3'-диаминобензидин (DAB); ферменты фосфатазы, такие как кислая фосфатаза, щелочная, и субстрат, такой как 5-бром-6-хлор-3-индолилфосфат (BCIP); гликозидазы, такие как бета-галактозидаза, бета-глюкуронидаза или бета-гликозидаза, и субстрат, такой как 5-бром-4-хлор-3-индолил-бета-D-галактопиранозид (X-gal); дополнительные ферменты предусматривают гидролазы, такие как холинэстеразы и пептидазы, оксидазы, такие как глюкозооксидаза и цитохромоксидазы, и редуктазы, для которых известны подходящие субстраты.
[0127] Ферменты и их соответствующие субстраты, которые инициируют хемилюминесценцию, являются подходящими для некоторых анализов. Они включают без ограничения природные и рекомбинантные формы люцифераз и экворинов. Также применимы инициирующие хемилюминесценцию субстраты для фосфатаз, гликозидаз и оксидаз, такие как те, которые содержат стабильные диоксетаны, люминол, изолюминол и сложные эфиры акридиния.
[0128] В другом аспекте в качестве меток также используются гаптены, такие как биотин. Биотин является подходящим, поскольку он может функционировать в ферментной системе с дополнительным усилением выявляемого сигнала, и он может функционировать в качестве маркера для использования в аффинной хроматографии в целях выделения. В целях выявления используют конъюгат фермента, который характеризуется аффинностью к биотину, такому как авидин-HRP. Затем добавляют субстрат для пероксидазы с целью получения выявляемого сигнала.
[0129] Гаптены также предусматривают гормоны, встречающиеся в природе, и синтетические лекарственные средства, загрязнители, аллергены, эффекторные молекулы, факторы роста, хемокины, цитокины, лимфокины, аминокислоты, пептиды, промежуточные химические соединения, нуклеотиды и т. п.
[0130] В определенных аспектах флуоресцентные белки могут быть конъюгированы с реагентом(-ами) в качестве метки. Примеры флуоресцентных белков включают зеленый флуоресцентный белок (GFP) и фикобилипротеины и их производные. Флуоресцентные белки, в частности фикобилипротеин, особенно применимы в получении реагентов для мечения на основе тандемных красителей. Эти тандемные красители содержат флуоресцентный белок и флуорофор для целей получения большего стоксового сдвига, при котором спектр испускания смещен дальше от длины волны спектра поглощения флуоресцентного белка.
[0131] В определенных аспектах метка представляет собой радиоактивный изотоп. Примеры подходящих радиоактивных материалов включают без ограничения йод (121I, 123I, 125I, 131I), углерод (14C), серу (35S), тритий (3H), индий (111In, 112In, 113mIn, 115mIn,), технеций (99Tc, 99mTc), таллий (201Ti), галлий (68Ga, 67Ga), палладий (103Pd), молибден (99Mo), ксенон (135Xe), фтор (18F), 153SM, 177Lu, 159Gd, 149Pm, 140La, 175Yb, 166Ho, 90Y, 47Sc, 186Re, 188Re, 142Pr, 105Rh и 97Ru.
[0132] В некоторых аспектах лекарственные средства или токсины могут быть конъюгированы с реагентом(-ами). Например, реагент может быть конъюгирован с цитотаксическим препаратом. В данном примере реагент может связываться с целевым антигеном на клеточной поверхности, например таким как CCR6, или образовывать комплекс между CCR6 и CCL20, а затем цитотоксический препарат доставляется в клетку. В некоторых вариантах осуществления комплекс реагент-конъюгат может быть интернализирован в клетке, которая высвобождает цитотоксический препарат в клетку. Можно конъюгировать любой цитотоксический препарат, известный из уровня техники. Некоторые конъюгаты антител уже одобрены FDA и в настоящее время проходят клинические испытания.
[0133] Примеры, которые следуют далее, представлены с целью обеспечения дополнительной иллюстрации некоторых из аспектов и вариантов осуществления, раскрытых выше. Примеры не следует подразумевать как каким-либо образом ограничивающие широту трактовки объема настоящего раскрытия или прилагаемой формулы изобретения.
Примеры
[0134] МАТЕРИАЛЫ И СПОСОБЫ
[0135] Монослойная и сферическая культуры. Для экспериментов с клеточными культурами панель из восьми клеточных линий рака молочной железы, охватывающих различные подтипы рака молочной железы, MDAMB468, HCC1937, SUM159PT, MCF7, BT549, BT474, T47D и Hs578T, панель из четырех клеточных линий рака поджелудочной железы, Aspc1, Bxpc3, HPAC и Panc1, и панель из семи клеточных линий колоректального рака, LS411N, SW1417, NCI-H508, Colo205, HT29, HCT116, Lovo, поддерживали в увлажненных инкубаторах при 37°C, 5% CO2, в рекомендованных поставщиками средах. Все клеточные линии изначально получали от ATCC (Манассас, Виргиния), за исключением SUM159PT, которую получали от Asterand (Детройт, Мичиган).
[0136] В случае стандартной монослойной культуры ткани клетки отбирали с помощью 0,25% трипсин-EDTA (Life Technologies, Гранд-Айленд, Нью-Йорк), промывали три раза в сбалансированном солевом растворе Хенкса (HBSS, Life Technologies) и помещали в полные сывороточные среды на планшеты, обработанные для культивирования тканей. В случае сферической культуры клетки отбирали с помощью 0,25% трипсин-EDTA, промывали три раза в сбалансированном солевом растворе Хенкса и помещали в бессывороточную среду определенного состава, обогащенную эпидермальным фактором роста (EGF), основным фибробластическим фактором роста (bFGF), инсулином, альбумином бычьей сыворотки (BSA) и сывороткой для нокаута (Life Technologies), в планшеты для культивирования тканей с ультранизким связыванием (Corning).
[0137] Клеточный рост в анализах монослоя определяли после 4-дневного периода инкубации с помощью люминесцентного анализа жизнеспособности клеток CellTiter glo® (CTG) (Promega, Мэдисон, Висконсин) согласно рекомендациям поставщиков. Анализы сферического роста выполняли после 4-дневного периода инкубации путем прямого подсчета сферических колоний с помощью визуализации с высоким содержанием (Arrayscan VTI, Thermo Scientific, Уолтем, Массачусетс), а также с помощью анализа CTG.
[0138] Выделение клеток на основе CCR6. CCR6-положительные (CCR6+) клетки отделяли от CCR6-отрицательных (CCR6-) клеток в клеточных линиях с помощью разделения магнитными гранулами. Систему положительного отбора тетрамерного комплекса антитела (TAC) разрабатывали с помощью образования комплекса моноклонального антитела мыши к CCR6 человека (BD Biosciences, Сан-Хосе, Калифорния) с помощью системы отбора "Do-It-Yourself" EasySep (Stem Cell Technologies, Ванкувер, Британская Колумбия, Канада). Применение данного набора для положительного отбора согласно рекомендованному поставщиками протоколу приводило к захвату клеток CCR6+ с помощью выделения с применением магнитных гранул, в то время как клетки CCR6- оставались в несвязанном супернатанте. Выделенные клетки CCR6+ и CCR6- затем помещали на монослойную культуру и стимулировали рекомбинантным CCL20 человека (rhCCL20), как описано в других разделах.
[0139] Иммуноферментный твердофазный анализ (ELISA). Уровни CCL20, секретируемые в кондиционированную среду культивируемых клеток, измеряли на 4-й день культивирования с помощью коммерчески полученного сэндвич-ELISA (R&D systems, Миннеаполис, Миннесота) согласно протоколу поставщика. Уровни CCL20 непосредственно измеряли в пикограммах/миллилитр (пг/мл), интерполированных из стандартной кривой. Секретируемые уровни CCL20 нормализовали и описывали в виде X-кратного изменения по сравнению с клетками из той же линии, культивируемыми в монослое.
[0140] Стимуляция и ингибирование CCL20. Коммерчески полученный рекомбинантный CCL20 человека (rhCCL20 или CCL20), поставляемого R&D systems, использовали для всех исследований, за исключением данных, обозначенных на ФИГ. 5D, где рекомбинантный CCL20 человека также получали из Life Technologies, для сравнения. Моноклональные тела изотипического контроля и моноклональные антитела к CCL20 также поставляли из коммерческих источников (R&D systems). Все материалы разбавляли и хранили согласно рекомендации производителя.
[0141] Для исследований по стимуляции и ингибированию клетки культивировали для анализа в монослойной и сферической культуре, как описано выше. Во время посева клетки обрабатывали rhCCL20 или антителами в дозах, описанных в экспериментах и результатах. В случае ФИГ. 8A клетки трансфицировали 20 нМ siRNA CCR6 или нецелевой контрольной siRNA (объединенные конструкции, полученные из Santa Cruz Biotechnology, Санта-Круз, Калифорния) в течение 48 часов перед добавлением rhCCL20, в то время как в случае ФИГ. 8C, 8D клетки трансфицировали 20 нМ CCL20, CCR6 или нецелевой контрольной siRNA (объединенные конструкции, Santa Cruz Biotechnology) во время посева, совместно с обработкой клеток антителами. Трансфекцию siRNA выполняли с помощью липида (Lipofectamine RNAimax (Life Technologies)) в качестве носителя, и получали комплекс с siRNA в соотношении 1:2,5 siRNA: липид. Все обработки проходили в течение 4 дней без нарушения порядка, после чего клетки переносили и готовили для анализа в монослойной/сферической культуре, проточно-цитометрического анализа или экстракции РНК, как описано в предыдущих или последующих разделах.
[0142] Наблюдение и применение в моделях ксенотрансплантатов пациентов на животных. Всех животных содержали в условиях 12/12-часового цикла свет-темнота, при доступе ad libitum к воде и корму, и акклиматизировали в течение по меньшей мере одной недели до начала исследований. Все исследования на животных были одобрены Институциональным комитетом по уходу за животными и их использованию компании MedImmune.
[0143] Модели BR_PDX_1 и PA_PDX_1 получали из Jackson Laboratories с использованием самок мышей NSG, несущих подкожные первичные ксенотрансплантаты опухоли поджелудочной железы человека, при пассировании P1 (PA_PDX_1) или пассировании P2 (BR_PDX_1). Модель PA_PDX_2 получали из Asterand в виде первичных резекций аденокарциномы поджелудочной железы человека. Все образцы получали после осознанного согласия пациента, согласно их соответствующих IRB, которые были изучены и одобрены в соответствии с политикой получения биологических образцов человека компании MedImmune.
[0144] Весь опухолевый материал размножали с помощью подкожной имплантации опухолевых фрагментов в заднем паху самок мышей NSG в возрасте от шести до восьми недель (NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ, Jackson Laboratories) или самок мышей Beige Nude XID (LystbgFoxn1nuBtkxid, Envigo) в стерильных условиях. Опухоли пассировали с помощью данной методики вплоть до 6-го пассирования (P6), при этом 0-е пассирование (P0) считали первым сформированным ксенотрансплантатом из биоптата пациента.
[0145] Когда опухоли достигали примерно 750 мм3, их собирали, промывали в сбалансированном солевом растворе Хенкса (HBSS), измельчали стерильным лезвием бритвы и диссоциировали до суспензии отдельных клеток в 20 ед/мл коллагеназы III (Worthington Biochemical). Диссоциированные опухолевые клетки использовали при сортировке клеток с активацией флуоресценции, как описано ниже.
[0146] Для in vivo исследования онкогенности клетки Panc1 культивировали в условиях образования сфер с обработкой 10 мкг/мл IgG к CCL20 или изотипического IgG в качестве контроля, начиная с времени посева. Через 4 дня культивирования сферы диссоциировали в аккутазе StemPro до суспензии отдельных клеток. Диссоциированные сферические клетки смешивали 1:1 с Matrigel GFR (Corning) и вводили подкожно в задний пах 6-8-недельных самок мышей nu/nu (Hsd:Athymic Nude-Foxn1nu, Envigo) в количестве 30000 клеток на мышь. Объем опухоли контролировали и измеряли с течением времени, при этом время приживания опухоли отмечали в виде первого наблюдения пальпируемой опухоли.
[0147] Проточная цитометрия и сортировка клеток с активацией флуоресценции (FACS). Образцы для проточно-цитометрических экспериментов получали с помощью инкубации живых клеток с Golgistop (BD Biosciences) в течение 1 часа при 37°C с целью приостановки секреции CCL20. После этого клетки собирали с помощью раствора аккутазы для диссоциации клеток (Life Technologies), промывали и ресуспендировали в концентрации, составляющей примерно 2,5×106 клеток на мл, в сбалансированном солевом растворе Хенкса (HBSS). Клетки окрашивали с помощью многоцветной панели, состоящей из всех или нескольких из следующих антител: антитела к CCL20-APC человека (R&D systems), антитела к CCR6-BV605 человека, антитела к CD24-FITC человека, антитела к CD44-PE-Cy7 человека и антитела к Epcam-PerCP-Cy5.5 или Epcam-BV421 человека (все из BD Biosciences). Первичные опухолевые ксенотрансплантаты дополнительно окрашивали антителом к H2Kd-PE мыши (BD Biosciences), чтобы обеспечить исключение из дальнейших анализов всех ассоциированных с опухолью эндотелиальных и стромальных клеток мыши. В экспериментах, включающих окрашивание CCL20, клетки окрашивали на наличие всех поверхностных рецепторов перед фиксацией и пермеабилизацией их для окрашивания антителом к CCL20. Контроль с одним окрашиванием использовали для определения компенсаторных матриц, а контроль с полным окрашиванием за исключением одной метки использовали для определения гейтов. В случае цитометрических экспериментов на живых клетках, DAPI (Invitrogen) добавляли к каждому образцу при 30 мкM для гейтирования мертвых клеток. Стандартные проточно-цитометрические эксперименты проводили на LSRII с 4-лазерной конфигурацией, в то время как эксперименты по сортировке клеток проводили на FACSAriaII (BD Biosciences). Гейтирование с помощью FACS определяли по флуоресцентному окрашиванию без одной метки (FMO), как показано на ФИГ. 13, ФИГ. 14 и ФИГ. 15.
[0148] Количественная RT-PCR. Все образцы обрабатывали для экстрагирования РНК с помощью набора Ambion RNAaqueous (Applied Biosystems). Выход и количество РНК определяли с помощью УФ-спектрофотометрии при 260/280 нм. Подвергали 10-100 нанограмм mRNA каждого образца ПЦР с обратной транскрипцией (RT-PCR) при 42°C в присутствии случайных праймерных олигодезоксирибонуклеотидов (Life Techologies) и обратной транскриптази Superscript III (Life Technologies). После RT-PCR 20 нг продукта cDNA предварительно амплифицировали в течение 14 циклов с применением объединенных анализов экспрессии генов Taqman (Life Technologies), каждый при 0,2x концентрации, для следующих генов.
Таблица 1.
|
[0149] Предварительно амплифицированный материал для каждого образца разбавляли 20-кратно в деионизированной воде (DI-H2O) и подвергали анализу на основе количественной PCR (qPCR) с использованием вышеуказанных праймеров в технических повторностях на термоциклере 7900HT (Life Technologies) согласно рекомендованному поставщиком протоколу.
[0150] Значения Ct получали, исходя из цикла qPCR с помощью программного обеспечения SDS 2.4 (Life Technologies), и переводили в значения относительной экспрессии (RE) с помощью сравнительного Ct-метода с использованием формулы RE=2-ΔΔCt, где:
[0151] ΔCt=нормализованный Ct=Ct гена - Ct 18S;
[0152] ΔΔCt=Ct нормализованного образца - Ct нормализованного контроля.
[0153] Среднее значение ± стандартную ошибку среднего определяли для значений RE среди технических повторностей, и затем откладывали на графике в виде конечного представления данных.
[0154] Культивирование TR1 и проточно-цитометрический анализ. T-клетки CD4+ человека, не подвергавшиеся воздействию, выделяли в свежем виде из крови здоровых доноров-людей с помощью набора II для выделения не подвергавшихся воздействию CD4 T-клеток согласно протоколу поставщика (Miltenyi Biotech) и смещали в культуре в направлении клеток TR1 согласно протоколу, описанному у Voo, et al. Всю кровь от доноров-людей получали после осознанного согласия и использовали/утилизировали в соответствии с политикой обращения с биологическими образцами человека компании Astrazeneca.
[0155] На 8-й день клетки TR1 собирали из культуры, промывали в PBS и окрашивали для проточно-цитометрического анализа с целью подтверждения фенотипа маркера Treg. Клетки ресуспендировали в PBS+2% FBS (Life Technologies) до концентрации, составляющей 0,5×106 клеток/0,1 мл, и окрашивали с помощью многоцветной панели антител, состоящей из CD3-APC-Cy7, CD25-BV711 (оба получены из Biolegend), CD4-FITC, FOXP3-PE и CCR6-DL647 (все получены из BD Biosciences), в рекомендуемых поставщиками концентрациях. Перед окрашиванием клеточной поверхности клетки обрабатывали Zombie-UV (Biolegend) согласно протоколу поставщика для гейтирования мертвых клеток из анализа. После этого живые клетки окрашивали на наличие всех маркеров поверхности клетки в течение 15 мин. на льду. Затем окрашенные клетки промывали дважды PBS+2% FBS и фиксировали с помощью набора BD cytofix/cytoperm (BD Biosciences) согласно рекомендуемому протоколу. После стадии фиксации клетки окрашивали на наличие внутриклеточного FOXP3 в течение 15 мин. на льду, после чего выполняли 2 дополнительных промывания в PBS+2% FBS. Проточно-цитометрический анализ выполняли на BD Fortessa и анализировали с помощью программного обеспечения FlowJo. Многоцветную компенсацию выполняли с помощью компенсаторных гранул (eBiosciences), окрашенных и анализируемых параллельно с клетками, и контроль за исключением одной метки (FMO) выполняли для каждого цвета с определением положительного/отрицательного гейтирования.
[0156] Анализ хемотаксиса ТR1. Раковые клетки толстой кишки NCIH508 культивировали в планшетах с ультранизким связыванием (Corning) в бессывороточных средах определенного состава, как описано выше, с целью активации CSC-управляемого сферического роста. Через 4 дня культивирования без нарушения установленного порядка кондиционированную среду (CM) из клеток собирали, фильтровали через поры размером 0,2 мкМ и хранили при 4°C до дальнейшего применения. Концентрацию CCL20 в средах определяли с помощью ELISA, как описано выше. Эту CM с CSC использовали в течение недели после сбора для хетотаксических анализов.
[0157] Клетки TR1, собранные на 8-й день культивирования, промывали в PBS и ресуспендировали либо в PBS+2% FBS, либо в бессывороточных средах (SCM) в концентрации, составляющей 0,4×106 клеток/мл. Выделенный CCL20 (R&D systems) готовили в 100 нм концентрации в PBS+2% FBS. Моноклональное антитело к CCL20 или антитело изотипического контроля (оба от R&D Systems) добавляли либо к CCL20, либо к CM с CSC в конечной концентрации, составляющей 667 нМ, и инкубировали в течение 30 мин. при комнатной температуре. Полученные после обработки комплексы переносили в принимающие лунки планшета для миграции Transwell с 8 мкМ порами (Neuroprobe) при n=4 лунки/обработка. Клетки TR1 помещали на верх фильтровального планшета согласно протоколу поставщиков по 50000 клеток/лунка в соответствующей среде (PBS+2% FBS для обработок с выделенным CCL20, и SCM для обработок CM с CSC). Планшеты инкубировали в течение 60 мин. при 37°C, после чего немигрировавшие клетки удаляли из фильтровального планшета и фильтр осторожно промывали PBS. Планшеты центрифугировали при 200 об/мин в течение 2 мин. с целью сбора мигрировавших клеток в принимающих лунках. Содержание мигрировавших клеток определяли с помощью анализа CellTiter glo (Promega) согласно протоколу поставщиков, при этом стандартную кривую содержания клеток в зависимости от относительной люминесценции (RLU) использовали для перевода RLU в % мигрировавших клеток TR1. Статистическую значимость определяли с помощью 2-стороннего t-критерия Стьюдента между обработкой и контролем, при этом n=4 повторности/обработка.
[0158] Анализы бета-аррестина и пути cAMP. Рекрутинг бета-аррестина измеряли с помощью репортера для активации пути CCL20-CCR6 как у человека, так и у мыши, с помощью анализа GPCR β-аррестина в CHO-K1 CCR6 PathHunter® eXpress (DiscoverX), при этом клетки стабильно экспрессировали CCR6 мыши в случае анализа пути мыши и CCR6 человека - в случае анализа пути человека. Анализы проводили согласно протоколу поставщика с поправкой на то, что клетки стимулировали 6 нМ рекомбинантным CCL20 человека (R&D Systems) или 1,2 нМ рекомбинантным CCL20 мыши (R&D Systems) в течение 90 мин. при 37°C. Изменения в уровнях cAMP дополнительно измеряли с помощью отдельного анализа репортера в случае активации пути CCL20-CCR6 человека с помощью набора для анализа cAMP LANCE (Perkin Elmer) согласно протоколу поставщика, с использованием клеток Ad293, стабильно трансфицированных CCR6 человека. В этом анализе клетки стимулировали 4 мкM форсколином (Sigma Aldrich) в комбинации с 1 нМ рекомбинантным CCL20 в течение 60 мин. при комнатной температуре. В обоих анализах нейтрализацию пути измеряли после обработки IgG к CCL20 или IgG изотипического контроля (оба от R&D systems).
[0159] Сингенные мышиные in-vivo модели. Карциному молочной железы мыши 4T1 ксенотрансплантировали подкожно в задний пах 4-6-недельных самок мышей Balb/c (BALB/cAnNHsd, Envigo). в случае если опухоли достигали примерно 50-100 мм3, мышей начинали обрабатывать либо моноклональным антителом к CCL20 (клон 114908), либо антителом изотипического контроля (оба от R&D systems), в дозе 10 мг на кг i.p. дважды в неделю в количестве 4 последовательных доз. Мышей выводили из эксперимента с соблюдением правил этики через 24 часа после последней дозы, и при этом селезенки и опухоли собирали для анализа. Как ткань селезенки, так и опухолевую ткань переваривали до суспензии отдельных клеток, и полученные клетки криоконсервировали в Cryostor CS5 (Sigma-Aldrich) перед проточно-цитометрическим анализом иммунных клеток.
[0160] Проточно-цитометрический анализ иммунных клеток мыши. Криоконсервированные клетки селезенки и опухоли от мышей, обработанные либо моноклональным антителом изотипического контроля, либо моноклональным антителом к CCL20 мыши, размораживали при 37°C, промывали и окрашивали для анализа иммунных клеток мыши с помощью следующей панели антител: антитела к cd45-BV21, антитела к cd4-BV711, антитела к cd11b-BV510 (все получены от BD Biosciences), антитела к cd3-FITC, антитела к cd8a-APC-Cy7, антитела к foxp3-PerCP-Cy5.5, антитела к rorγt-PE (все получены от eBiosciences), антитела к cd11c-BV605, антитела к cd83-PE-Cy7, антитела к ly6g-BV785 (все получены от Biolegend). Живые клетки сначала блокировали 4% мышиной сывороткой (Jackson Immunoresearch), затем окрашивали на наличие живых/мертвых клеток с помощью Zombie-UV (Biolegend), затем окрашивали на наличие внеклеточных антигенов (все мишени, за исключением foxp3 и rorγt). После этого клетки промывали и фиксировали, а затем пермеабилизировали с помощью набора Cytofix/Cytoperm (BD Biosciences) перед окрашиванием клеток антителами к внутриклеточным антигенам foxp3 и rorγt. Проточную цитометрию выполняли на BD Fortessa с лазерным возбуждением при 355 нм, 405 нм, 488 нм, 532 нм и 640 нм, и анализировали с помощью программного обеспечения flowjo V10. Статистическую значимость определяли с помощью 2-стороннего t-критерия Стьюдента между обработкой и контролем, при этом n=5 мышей/обработка/тип ткани. Точки данных, которые выходили за пределы 3x стандартной ошибки среднего, определяли как выпадающие значения и удаляли из анализа.
[0161] Анализ хемотаксиса T-клеток CD4+ человека. Выделяли T-клетки CD4+ из крови здоровых доноров-людей с помощью отрицательного отбора с применением набора для обогащения T-клеток CD4+ Rosettesep (Stemcell Technologies). Клетки промывали в PBS и ресуспендировали в PBS+2% FBS. Выделенный CCL20 (R&D systems) получали при 10 нм концентрации в PBS+2% FBS. Моноклональное антитело к CCL20 или антитело изотипического контроля (оба от R&D Systems) добавляли к выделенному CCL20 в конечной концентрации 30 нМ и инкубировали в течение 30 мин. при комнатной температуре. Полученные после обработки комплексы переносили в принимающие лунки планшета для миграции Transwell с 5 мкМ порами (Corning) при n=3 лунки/обработка, T-клетки CD4+ загружали во вставку на поликарбонатный фильтр по 50000 клеток/лунка в соответствующей среде (PBS+2% FBS), и планшеты инкубировали в течение 3 часов при 37°C. Содержание мигрировавших клеток определяли с помощью анализа CellTiter glo (Promega) согласно протоколу поставщиков, при этом стандартную кривую содержания клеток в зависимости от относительной люминесценции (RLU) использовали для перевода RLU в % мигрировавших T-клеток CD4+. Статистическую значимость определяли с помощью 2-стороннего t-критерия Стьюдента между обработкой и контролем, при этом n=3 повторности/обработка/донор.
ПРИМЕР 1. Экспрессия CCL20 в стволовых раковых клетках в культуре
[0162] Как описано выше, несмотря на то, что CCL20 известен в качестве хемоаттрактанта для рекрутинга иммунных клеток, результаты, описанные в данном документе, показывают, что CCL20 представляет собой фактор, продуцируемый CSC в клеточных линиях рака, некоторые из которых приводят в качестве примера в данном документе, в том числе формы рака молочной железы, поджелудочной железы и колоректальные формы рака. При культивировании тканей было обнаружено, что в большинстве клеточных линий значительно повышалась секреция CCL20 при сферическом культивировании в условиях высокого содержания CSC, по сравнению с условиями монослойного культивирования (ФИГ. 1A-1C). Как показано на фигуре 1, условия в случае сферической культуры приводили к значимому повышению секреции CCL20 по сравнению с монослойной культурой во многих исследованных линиях рака молочной железы (ФИГ. 1A), линиях рака поджелудочной железы (ФИГ. 1B) и линиях колоректального рака (ФИГ. 1C). Типичные уровни CCL20, которые секретировали клетки в условиях сферической культуры, находились в диапазоне от приблизительно 1 до приблизительно 1000 пг/мл, при этом клеточные линии, у которых отсутствовало повышение CCL20 в случае сферической культуры, как правило, характеризовались низкими или не выявляемыми уровнями белка, составляющими 1 пг/мл или ниже (ФИГ. 2).
[0163] Для подтверждения того, что ассоциированное со сферами повышение уровней CCL20 было связано с CSC, применяли сортировку клеток с активацией флуоресценции (FACS) для выделения CSC и клеток, не являющихся CSC, из линий рака молочной железы и поджелудочной железы, с целью измерения уровней mRNA CCL20 в каждой клеточной популяции. Выделенные CD44high/+ CD24low/- CSC из двух клеточных линий молочной железы (MDAMB468 и HCC1937) характеризовались значительно повышенными уровнями mRNA CCL20 по сравнению с клетками CD44low/- CD24low/-, не относящимися к CSC, выделенным из тех же линий (ФИГ. 1D). CSC из клеток MDAMB468 и HCC1937 приводили к 23-кратно и 10-кратно повышенному содержанию транскрипта CCL20 по сравнению с клетками, соответственно не являющимися CSC (RE в случае CSC по сравнению с клетками, не являющимися CSC,=23,3±16 по сравнению с 1,0±0,2 в MDAMB468 и 9,3±4,6 по сравнению с 0,9±0,3 в HCC1937). С целью подтверждения клинической релевантности данного наблюдения уровни транскриптов CCL20 также измеряли в CSC, выделенных с помощью FACS, по сравнению с клетками, не являющимися CSC, из ксенотрансплантатов первичных опухолей пациентов (PDX). Опухоли в моделях PDX из двух форм рака поджелудочной железы (PA_PDX_1 и PA_PDX_2) и одной формы рака молочной железы (BR_PDX_1) аналогичным образом сортировали с помощью FACS с целью выделения Epcam+ CD44+ CD24+ CSC совместно с Epcam- CD44- CD24- клетками, не являющимися CSC, и Epcam+ CD44+ CD24- CSC совместно с Epcam+ CD44- CD24- клетками, не являющимися CSC, в случае рака молочной железы. Как показано на ФИГ. 1E, все три модели ксенотрансплантатов пациентов характеризовались значимым повышением уровней mRNA CCL20 в выделенных CSC по сравнению с клетками, не являющимися CSC, при этом относительная экспрессия составляла в случае CSC по сравнению с клетками, не являющимися CSC,=71,8±41,6 по сравнению с 1,2±0,6 (в случае BR_PDX_1), 48,8±8,6 по сравнению с 1,0±0,0 (в случае PA_PDX_1) и 8,6±1,3 по сравнению с 1,0±0,0 (в случае PA_PDX_2).
[0164] Затем с помощью проточной цитометрии подтверждали, что CSC действительно характеризовались повышенными уровнями CCL20 по сравнению с оставшейся частью популяции опухолевых клеток. Несмотря на то, что CSC часто выявляли как Epcam+CD44+CD24+ в случае рака поджелудочной железы, а CD44+CD24- - в случае рака молочной железы, обнаружили, что фенотип стволовой клетки, определяемый онкогенностью, образованием сфер и экспрессией генов стволовости, часто прослеживался лучше в моделях монослойных клеточных линий с высокой экспрессией CD44 и/или CD24 (таким образом, Epcam+CD44highCD24high в случае рака поджелудочной железы при монослойном культивировании и CD44highCD24- в случае рака молочной железы при монослойном культивировании). С помощью такого определения обнаружили, что CSC из модели рака поджелудочной железы Bxpc3 (ФИГ. 3A) и из модели рака молочной железы HCC1937 (ФИГ. 3D) характеризовались 1,5-кратным повышением уровня средней интенсивности флуоресценции CCL20 (MFI) по сравнению со всей популяцией опухолевых клеток. CSC Bxpc3 (FIG. 3B) характеризовались сдвигом MFI, составляющим 189, в то время как во всей популяции опухолевых клеток MFI CCL20 в среднем составляла 124. Аналогично, CSC HCC1937 (ФИГ. 3E) также характеризовались сдвигом MFI CCL20 от значения 243 во всех опухолевых клетках по сравнению со значением 361, специфическом для CD44highCD24- CSC. Эти данные подтверждают факты и результаты, отображенные на ФИГ. 1, где показано, что повышенные уровни CCL20 ассоциированы преимущественно со сферами с высоким содержанием CSC и выделенными CSC. Гейтирование CSC определяли с помощью полного окрашивания за исключением одной метки, как отображено на ФИГ. 13.
ПРИМЕР 2. Ассоциация CCR6 и колокализация с CCL20 в стволовых раковых клетках
[0165] Интересно отметить, что при наложении популяций CSC с окрашиванием CCL20/CCR6 в случае опухолевых клеток обнаружили, что большинство из CSC как из линий Bxpc3, так и из линий HCC1937, по-видимому, совместно локализовались с клетками, которые были двойными положительными как в отношении лиганда, так и в отношении рецептора, т. е. CCL20+CCR6+ (ФИГ. 3C и 3E). Удивительным образом было обнаружено, что в сферической культуре резко увеличивалась двойная положительная популяция CCL20+CCR6+ по сравнению с монослойной культурой. На фигуре 4 показан данный эффект в моделях рака поджелудочной железы Bxpc3 и Panc1. При культивировании в стандартном монослое небольшую долю клеток в обеих моделях определяли как CCL20+CCR6+ (ФИГ. 4A и 4C, а также ФИГ. 13 в случае контроля гейтирования). Однако при культивирования в виде сфер большая часть клеток в обеих моделях окрашивались положительно как на наличие CCL20, так и на наличие CCR6 (ФИГ. 4B и 4D). В модели Bxpc3 эта популяция CCL20+CCR6+ увеличивалась от 3,76% (ФИГ. 4A) в случае монослоя до 71,2% (ФИГ. 4B) в сферах. Аналогично, клетки Panc1, культивированные в виде монослоя, характеризовались 5,87% клеток CCL20+CCR6+ (ФИГ. 4C), в случае сферической культуры популяция возрастала до 83,5% (ФИГ. 4D). Интересно отметить, что при гейтировании в отношении клеток Epcam+CD44+CD24+ в этих сферах они снова почти полностью перекрывались с популяцией CCL20+CCR6+ в сферах Bxpc3 (ФИГ. 4E) и Panc1 (ФИГ. 4F). Эти наблюдения подтверждали, что CSC могли аутокринно зависеть от оси CCL20-CCR6.
ПРИМЕР 3. Связь уровней CCL20 и активности раковых стволовых клеток
[0166] После подтверждения того, что CCL20 действительно сверхэкспрессировался популяцией CSC и был ассоциирован с таковой, авторы искали подтверждение фенотипической релевантности этой молекулы с активностью CSC. На ФИГ. 5 показано, что экзогенное добавление очищенного CCL20 активировало сферический рост, который выступал в качестве модели CSC-управляемой онкогенности. Добавление рекомбинантного CCL20 человека (rhCCL20) к культуре CSC значимо стимулировало сферический рост на 4-й день дозозависимым образом в трех моделях рака, Aspc1 (ФИГ. 5A), Bxpc3 (ФИГ. 5B) и SUM159 (ФИГ. 5C). Несмотря на то, что добавление CCL20 вызывало дозозависимое повышение сферического роста, лиганд характеризовался отсутствием эффекта в отношении стимулирования роста клеток в стандартной монослойной культуре (ФИГ. 5A-5C). Как правило, данное наблюдение указывало на то, что эффект CCL20 был направлен специфически в отношении CSC. Специфичность данного эффекта подтверждали на ФИГ. 5D, где показано, что доза 50 пг/мл CCL20, полученного из двух отдельных коммерческих источников (CCL20 A и CCL20 B), стимулировала сферический рост раковых клеток молочной железы BT549 в одинаковой степени. Например, CCL20 A стимулировал рост на 333,3±64,9% по сравнению с 100,0±16,7% в случае исходных клеток, в то время как CCL20 B стимулировал рост на 300,0±54,6% по отношению к исходному уровню (соответственно p<0,01 и p<0,05 при сравнении с исходным сферическим ростом). Кроме того, этот стимулирующий эффект можно было нейтрализовать или свести к нулю при добавлении моноклонального антитела к CCL20 (15 мкг/мл), причем несмотря на присутствие тех же 50 пг/мл CCL20 A или CCL20 B, при этом сферический рост составлял максимально 154±16,9% в случае CCL20 A+антитело к CCL20 и 125,0±16,1% в случае CCL20 B+антитело к CCL20 (см. ФИГ. 5D; p<0,05 по сравнению с обработанными CCL20 сферами без антитела к CCL20).
[0167] В целом, специфичность данного ответа подтверждала, что CCL20 действительно опосредовал фенотипическую активность CSC. Однако, поскольку сферический рост является непрямым показателем активности CSC, то авторы искали подтверждение того, что CCL20, как отдельный фактор, непосредственно увеличивал число CSC. Вкратце, сферы, обработанные и не обработанные 200 пг/мл CCL20 в течение 4 дней, подвергали проточно-цитометрическому анализу с целью непосредственного измерения увеличения популяции CSC, управляемого CCL20. На ФИГ. 6 показано, что обработка CCL20 значимо повышала процент CD44+CD24- CSC молочной железы от 0,9±0,1% (без CCL20) до 1,3±0,1% (с CCL20) в клетках MDAMB468 (p<0,05) (ФИГ. 6A). Аналогично, раковые клетки поджелудочной железы Bxpc3 (ФИГ. 6B) и Aspc1 (ФИГ. 6C) характеризовались значимым повышением частот своих Epcam+CD44highCD24high CSC после стимуляции CCL20, от 0,9±0,1% до 1,2±0,1% в Bxpc3 и от 2,7±0,1% до 3,6±0,4% в Aspc1 (p<0,05 в обоих типах клеток). В дополнение к сферическому росту и проточной цитометрии, наряду с другими учеными, авторы обнаружили, что панель из пяти связанных со стволовостью генов также приводила к фенотипу CSC. Экспрессия факторов транскрипции NANOG, SOX2 и OCT3/4, которые, как известно, были связаны с плюрипотентностью, увеличивалась и уменьшалась по мере соответствующего увеличения и уменьшения популяции CSC. Экспрессия транскриптов белков группы polycomb EZH2 и BMI1 аналогично была связана с изменениями популяции CSC. На ФИГ. 6D показано, что добавление 200 пг/мл CCL20 к сферам Bxpc3 действительно повышало экспрессию всех 5 генов, связанных со стволовостью, после 4 дней обработки. Аналогичные результаты обнаружили в клеточных линиях Hs578T, SUM159 и Panc1 (ФИГ.7). Совместно с эффектами, наблюдаемыми при сферическом росте, и измеряемым повышением процента клеток, несущих поверхностные маркеры CSC, данные действительно указывали на то, что лиганд CCL20 может непосредственно способствовать активности CSC в исследованных клеточных линиях.
ПРИМЕР 4. Эффект CCL20 в стволовых раковых клетках опосредован его рецептором CCR6
[0168] В то время как результаты экспериментов, описанных в примерах 1-3, подтвердили, что CCL20 непосредственно влияли на активность CSC, оставалось определить, действительно ли CCL20 передавал сигнал через свой известный рецептор CCR6, с тем, чтобы вызывать такую активность. Данные, показанные на ФИГ. 5, показали, что добавление очищенного CCL20 стимулировало сферический рост. Исходя из этого, разработали эксперимент для определения того, был ли эффект CCL20 опосредован посредством передачи сигнала через рецептор CCR6, полагая, что если CCL20 оказывал влияние на его функцию посредством передачи сигнала через CCR6, то нокдаун CCR6 предотвратил бы CCL20-стимулированный сферический рост.
[0169] На ФИГ. 8A показано, что рекомбинантный CCL20 человека (rhCCL20) утрачивал способность стимулировать сферический рост в клетках колоректального рака Lovo после нокдауна CCR6 с помощью 20 нМ siRNA, в то время как клетки, трансфицированные нецелевой контрольной siRNA (20 нМ) сохраняли свою ростовую ответную реакцию на CCL20. Для подтверждения того, что CCR6 был необходимым компонентом для этой оси CCL20 в отношении CSC, авторы отделяли клетки CCR6+ от клеток CCR6- в клеточной линии NCIH508, и стимулировали обе фракции 100 пг/мл CCL20 в течение 48 часов, а затем оценивали экспрессию генов, связанных со стволовостью. На ФИГ. 8B показано, что клетки CCR6+ отвечали приблизительно 2-кратно повышенной экспрессией NANOG, BMI1, OCT3/4 и SOX2 через 48 часов после стимуляции 100 пг/мл по сравнению с клетками CCR6-. Эти результаты показали, что активность, связанная с CSC, в ответе на стимуляцию CCL20 зависела от присутствия CCR6 в качестве рецептора. Для дополнительного подтверждения данного результата наблюдали, что подавление этой оси CCL20-CCR6 в отношении опухолевых клеток, либо в результате утраты CCL20, либо в результате утраты CCR6, приводила к аналогичному результату в отношении сферического роста (ФИГ. 8C и 8D). Опосредованный RNAi нокдаун либо CCL20, либо CCR6 ослаблял сферический рост до аналогичной степени в клетках NCIH508, а именно, 59,6±2,9% или 70,3±2,2% по сравнению с нецелевой контрольной siRNA (100,0±2,0%, p<0,001) (ФИГ. 8C). Аналогичное наблюдение проводили в клетках Hs578T, где опосредованный RNAi нокдаун ослаблял сферический рост до 55,4±3,9% в случае siRNA к CCL20 и 21,8±1,8% в случае siRNA к CCR6 по сравнению с 100,0±7,0% ростом в случае контрольной siRNA (p<0,001) (ФИГ. 8D). Совместно эти результаты подтверждают, что ось CCL20-CCR6 отвечает за активацию эффектов CCL20 в отношении CSC.
ПРИМЕР 5. Нейтрализация CCL20 ингибирует активность раковых стволовых клеток
[0170] Как подтверждено вышеуказанными примерами, CCL20 представлял собой выраженный медиатор активности CSC. В данном примере определяли, могла ли нейтрализация этой мишени впоследствии, в свою очередь, ингибировать CSC. Для исследования этого, коммерчески доступное моноклональное антитело IgG к CCL20, которое характеризовалось подтвержденной нейтрализующей способностью, использовали в серии экспериментов. Введение однократной дозы, составляющей 10 мкг/мл IgG к CCL20, значимо ослабляло образование сфер через 4 дня после обработки в моделях всех трех исследованных показаний, по сравнению с той же дозой, составляющей 10 мкг/мл IgG изотипического контроля (ФИГ. 9). Рост сфер рака молочной железы Hs578T ослаблялся только до 11,1±11,1% по сравнению с 100,0±27,2% сферическим ростом в случае контрольного IgG (p<0,05, ФИГ. 9A). Аналогично, рост сфер колоректального рака NCIH508 ослаблялся до 62,8±5,8% по сравнению с 100,0±4,8% в случае контрольного IgG (p<0,001, ФИГ. 9B), в то время как рост сфер при раке поджелудочной железы Panc1 ослаблялся до 18,1±2,1% по сравнению с 100,0±13,0% в случае обработки контрольным IgG (p<0,001, ФИГ. 9C). Контроль гейтирования в случае обнаружения CSC представлен на ФИГ. 15.
[0171] Эффект ингибирования CCL20 в отношении уменьшения CSC подтверждали с помощью проточной цитометрии, где аналогичная 4-дневная обработка сфер Bxpc3 с помощью введения однократной дозы 10 мкг/мл IgG к CCL20 приводила к снижению процента Epcam+CD44+CD24+ CSC до 4,5±0,4% по сравнению с 5,6±0,1% в случае обработки 10 мкг/мл контрольного IgG (p<0,05, ФИГ. 9D). Частоту CSC поджелудочной железы Panc1 снижали в сферах от 9,3±0,9 в случае обработки контрольным IgG до 6,6±0,7% после обработки IgG к CCL20 (p<0,05, ФИГ. 9E). Совместно эти результаты подтверждают, что нейтрализацию CCL20 моноклональным антителом можно применять в качестве потенциальной терапии для уменьшения популяции CSC, обеспечивая перспективную возможность для CCL20 функционировать в качестве мишени для видов терапии CSC.
ПРИМЕР 6. Мобильность Treg опосредована CCL20, продуцируемым CSC.
[0172] Как известно, CCL20 направляет хемотаксическую миграцию иммунных клеток CCR6+ главным образом в подгруппах B-клеток, T-клеток и дендритных клеток. В качестве положительного контроля подтверждали способность IgG к CCL20 блокировать хемотаксическую миграцию известного типа клеток, а именно T-клеток CD4+. На ФИГ. 10 подтверждено, что IgG к CCL20 в дозе, составляющей 30 нМ, мог значимо ингибировать хемотаксическую миграцию T-клеток CD4+, выделенных из периферической крови от 2 здоровых доноров-людей.
[0173] Для исследования того, мог ли CCL20, продуцируемый CSC, влиять на миграцию Treg, не подвергавшиеся воздействию T-клетки CD4+ человека смещали в направлении регуляторных T-клеток 1-го типа (TR1) в культуре, как описано в выше в материалах и способах. Проточно-цитометрический анализ клеток подтверждал, что клетки TR1 напоминали Treg по поверхностному фенотипу, поскольку они представляли собой преимущественно T-клетки CD3+/CD4+/CD25+/FOXP3+, и что эти TR1-клетки экспрессировали CCR6 (ФИГ. 11). При анализе миграции Transwell обнаружили, что эти клетки TR1 могли селективно мигрировать в направлении выделенного CCL20, при этом 14,7±0,9% клеток мигрировали в направлении CCL20 по сравнению с 10,2±0,6% клеток, которые мигрировали неспецифически (p<0,01, ФИГ. 12A). Добавление антитела к CCL20 в 6-кратном молярном избытке было способно блокировать эту миграцию, наблюдаемую по снижению клеточной миграции до 7,9±0,6% (p<0,01 по сравнению с обработкой 100 нМ CCL20, ФИГ. 12A).
[0174] Затем авторы интересовались тем, могли ли клетки TR1 мигрировать в направлении CCL20, продуцируемого CSC. При этом авторы получали кондиционированную среду из CSC раковых клеток толстой кишки NCIH508, культивируемых в условиях CSC-управляемого образования сфер в течение 4 дней, которые, как было обнаружено, содержали CCL20 в средней концентрации, составляющей 211 пг/мл (=26,4 пМ), как определено с помощью ELISA (ФИГ. 12B). Клетки TR1 (19,3±0,9%) были способны мигрировать в направлении CM с CSC по сравнению с 10,3±0,6% клеток, которые мигрировали неспецифически (p<0,01, ФИГ. 12C). Фактически миграция была направлена в направлении CCL20 в кондиционированной среде, поскольку добавление нейтрализующего антитела к CCL20 значимо ослабляло миграцию до 13,8±0,7% (p<0,01 по сравнению с CM с CSC или CM с CSC+IgG изотипического контроля, ФИГ. 12C). Добавление IgG изотипического контроля не оказывало какого-либо эффекта в отношении ослабления миграции TR1 в направлении CM с CSC (17,9±1,7% миграция в случае IgG изотипического контроля). Эти результаты подтверждали гипотезу о том, что регуляторные Т-клетки 1-го типа могли мигрировать в направлении CCL20, продуцируемого CSC, и в результате этого указывали на то, что нейтрализующие антитела к CCL20 могли ослаблять инфильтрацию Treg в опухолевом окружении.
ПРИМЕР 7. Нейтрализующие антитела к CCL20 ослаблялся онкогенез и иммуносупрессию in vivo
[0175] Непосредственно после установления того, что CCL20 представлял собой выраженный медиатор активности CSC, авторы исследовали, могла ли нейтрализация этой мишени, в свою очередь, ингибировать CSC. Для исследования этого, авторы использовали коммерчески доступные нейтрализующие моноклональные антитела человека к CCL20 (клон 67310; R&D Systems). Способность этого антитела ингибировать CCL20-стимулированную активность пути CCR6 как в анализе cAMP, так и в анализе транслокации бета-аррестина (ФИГ. 16A и 16B соответственно), подтверждала нейтрализующую способность. Измеряли IC50 при 0,8 нМ в анализе cAMP, в случае если клетки стимулировали 1 нМ CCL20, в то время как IC50 измеряли при 2,7 нМ, в случае если клетки стимулировали 6 нМ CCL20.
[0176] Уменьшение содержания CSC в результате нейтрализации CCL20 in vitro приводило к задержке скорости приживания опухоли и скорости роста опухоли. Медианное время приживания опухоли в случае опухолей Panc1 (% опухоль-несущих животных) задерживали на 56,5 дней, в случае если опухоли Panc1 предварительно обрабатывали 10 мкг/мл IgG к CCL20 по сравнению с опухолями Panc1, которые предварительно обрабатывали 10 мкг/мл IgG изотипического контроля в течение 4 дней in-vitro перед введением опухоли (ФИГ. 17A). Приживание опухоли в данном случае измеряли с момента первого случая пальпируемого опухолевого образования. Средний объем опухоли в течение исследования в случае обработанных IgG к CCL20 опухолей также был значимо меньше, чем в случае опухолей, обработанных IgG изотипического контроля (ФИГ. 17B).
[0177] Для оценки роли нейтрализации CCL20 в моделях с иммуннокомпетентными сингенными мышами, авторы обнаружили коммерчески доступное моноклональное антитело к CCL20 мыши (клон 114908; R&D Systems) с достаточной блокирующей/нейтрализующей способностью для выполнения роли заменителя моноклонального антитела к CCL20 человека. Антитело IgG к CCL20 мыши было способно ингибировать пути CCL20 мыши - CCR6 мыши с помощью анализа транслокации бета-аррестина с IC50, составляющей 14,0 нМ, в случае если клетки стимулировали 1,2 нМ CCL20 мыши (ФИГ. 18). Однако активность IgG к CCL20 мыши заметно ослаблялась по сравнению с IgG к CCL20 человека (описано в 0174), в случае если отношение содержания CCL20 к значению IC50 антитела сравнивали между человеком и мышью.
[0178] Сингенные опухолевые модели применяли для оценки эффекта нейтрализации CCL20 in vivo в отношении периферических и опухоль-инфильтрующих иммунных клеток. Известно, что клеточная линия карциномы молочной железы 4T1 мыши естественны образом экспрессирует CCL20, и поэтому ее выбрали для данного исследования. Иммунокомпетентным мышам ксенотрансплантировали подкожно HLA-сопоставимые 4T1-клетки, и вводили IgG к CCL20 мыши или соответствующий IgG изотипического контроля в дозе, составляющей 10 мг на кг дважды в неделю, в количестве 4 последовательных доз до тех пор, пока опухоли не достигали примерно 50-100 мм3. Иммунофенотипирование после вскрытия проводили на ткани селезенки и опухолевой ткани, собранных через 24 часа после 4-ой дозы.
[0179] Частоту подгрупп лимфоидных и миелоидных иммунных клеток определяли с помощью многоцветной проточной цитометрии согласно гейтированию, схематически представленному на ФИГ. 19 в случае ткани селезенки и на ФИГ. 20 в случае опухолевой ткани. Контроль полного окрашивания без одной метки (FMO) использовали для гейтирования с целью обнаружения клеток, которые были положительными и отрицательными в отношении любого конкретно взятого маркера в панели.
[0180] Данные указывали на то, что обработка in-vivo IgG к CCL20 значимо влияла на частоту периферических и опухоль-инфильтрующих иммунных клеток. В селезенке ингибирование CCL20 вызывало значимое уменьшение клеток foxp3+ Treg (ФИГ. 21A) и rorγt+ Th17 (ФИГ. 21B), при этом частота обеих популяций снижалась примерно 2-кратно по сравнению с обработанными изотипическим контролем животными (11,5±0,4% по сравнению с 6,5±1,2% Treg и 4,7±0,4% по сравнению с 2,2±0,5% Th17 в случае обработанных IgG изотипическим контролем животных и обработанных IgG к CCL20 животных, соответственно). Такой же эффект также наблюдали в опухоли, где частота Treg снижалась от 1,5±0,05% после обработки IgG изотипического контроля до 1,0±0,1% в ответ на обработку IgG к CCL20 (ФИГ. 22A), и частота клеток Th17 также снижалась от 0,4±0,05% в обработанных IgG изотипического контроля до 0,3±0,02% после обработки IgG к CCL20 (ФИГ. 22B). Этот результат указывал на то, что блокирование CCL20 in vivo приводило как к периферическому, так и к опухоль-специфическому снижению содержания 2 типов клеток, которые, как известно, активируют иммуносупрессию в опухолевом окружении, а именно, Treg и Th17, что указывало на то, что препараты, ингибирующие CCL20, способны облегчать иммуносупрессию как часть противораковой терапевтической стратегии.
[0181] В дополнение к эффекту, который CCL20 оказывали в отношении популяции Treg и Th17, нейтрализация CCL20 также значимо влияла на дендритные клетки. В опухолевом окружении частота дендритных клеток снижалась от 18,2±2,2% у мышей, обработанных IgG изотипического контроля, до 11,9±2,3% после обработки IgG к CCL20 (ФИГ. 22C, незначимо). Это снижение было связано главным образом со значимым снижением зрелых дендритных клеток cd83+ (ФИГ. 22E), а не незрелых дендритных клеток cd83- (ФИГ. 22D). В противоположность этому, в селезенке нейтрализация CCL20 вызывала значимое увеличение дендритных клеток, -от 6,9±0,5% у обработанных IgG изотипического контроля мышей до 9,8±0,6% у обработанных IgG к CCL20 мышей (ФИГ. 21C). Повышение содержания дендритных клеток было главным образом связано с повышением содержания незрелых дендритных клеток cd83- (ФИГ. 21D), а не зрелых дендритных клеток cd83+ (ФИГ. 21E). Этот результат указывает на то, что нейтрализация CCL20 in vivo ингибирует созревание дендритных клеток и, следовательно, инфильтрацию данного типа клеток в опухоль.
[0182] Изменений в оставшихся профилированных популяциях иммунных клеток, а именно, T-клетках cd8+ и супрессорных клетках нейтрофильного/гранулоцитарного происхождения (gMDSC), в селезенке либо в опухолях мышей, обработанных антителом к CCL20, по сравнению с мышами, обработанными изотипическим контролем, не обнаружили (данные не показаны).
ОБСУЖДЕНИЕ
[0183] Данные в вышеуказанных примерах демонстрируют ранее не обнаруженную и неожиданную функцию оси CCL20-CCR6 помимо ее известной роли в рекрутинге иммунных клеток. В частности, исследования, представленные в данном документе, демонстрируют, что в отношении рака CCL20 выполняет специфическую роль в функции CSC, представляя результат, о котором ранее не сообщалось. В нескольких из иллюстративных примеров результаты показывают, что в моделях рака молочной железы, колоректального рака и рака поджелудочной железы CCL20 специфически сверхэкспрессируется CSC по сравнению с опухолевыми клетками, не являющимися CSC, как на уровне транскриптов, так и на уровне белков. Примеры также подтвердили функциональную роль белка CCL20 в активности CSC, при этом экзогенное введение CCL20 в клеточные культуры приводило к непосредственному повышению процента CSC, как определено с помощью анализа поверхностных маркеров. CCL20 также повышал самообновление и пролиферативную функцию CSC, как наблюдали по его эффекту в отношении непосредственного повышения активации генов стволовости и сферического роста, соответственно. In vitro, CCL20 проявлял активность в отношении CSC при физиологически релевантных концентрациях, которые были не только аналогичны уровням, секретируемым в среду для культивирования в этих исследованиях, но также аналогичны циркулирующим уровням, выявляемым у пациентов с колоректальным раком с неблагоприятным прогнозом (Iwataetal., 2013).
[0184] Хотя такая активность CCL20 в отношении CSC представляла собой неожиданный результат, было показано, что другие хемокины/цитокины также оказывали непосредственный эффект в отношении активности CSC. Было показано, что интерлейкин-6 (IL6) и интерлейкин-8 (IL8) оказывали непосредственные эффекты в отношении CSC молочной железы (Ginestieretal., 2010; Iliopoulosetal., 2011). Аналогично, было показано, что модулирование лиганда 12 с CXC-мотивом (CXCL12) модулировало CSC глиобластомы (Wurthetal., 2014), в то время как активность CCL3 рассматривали в контексте клеток CML, инициирующих лейкоз (Babaetal., 2013). Таким образом, совместно с данным результатом, все больше доказательств указывали на роль медиаторов за пределами традиционных путей самообновления, таких как передача сигнала с помощью Notch, Wnt и Hedgehog, с целью регулирования функции CSC. Учитывая уникальную связь между CCL20 и рецептором CCR6, была выдвинута гипотеза о том, что CCL20 должен проявлять свою активность в отношении CSC в результате передачи сигнала на свой рецептор CCR6. С помощью нокаутирования CCR6 подтверждали, что рецептор действительно требовался для активности CCL20, обеспечивая функциональную активность CSC. Однако, кроме того, при разделении клеточных линий рака на фракции, которые были либо положительными, либо отрицательными в отношении рецептора, обнаружили, что лишь положительные в отношении рецептора клетки характеризовались активацией генов стволовости после стимуляции CCL20. Наконец, наблюдение того, что CSC, по-видимому, главным образом совместно локализованы с фенотипом клеточной поверхности CCL20+/CCR6+, указывало на то, что активность CCL20 в отношении CSC могла быть результатом аутокринной петли, несмотря на то, что для подтверждения данной гипотезы требуются дальнейшие исследования. Совместно эти факты подтверждают вывод о том, что CCL20 проявляет свою активность в отношении CSC в результате передачи сигнала через своей рецептор CCR6 на опухолевые клетки, и что таким образом ось CCL20-CCR6 в целом может быть задействована в активности CSC в случае рака молочной железы, поджелудочной железы и колоректального рака.
[0185] В недавней публикации было продемонстрировано, что мыши с APCmin характеризовались сниженным онкогенезом кишечника при нокаутировании CCR6 (Nandietal., 2014). Этот результат связывал ось CCL20-CCR6 с инициацией опухоли в кишечнике, повторно усиливая роль этой оси в событиях, лежащих в основе развития и прогрессирования опухолей. Учитывая тот результат, что ось CCL20-CCR6 является релевантной по отношению к фенотипу CSC, ожидалось, что терапевтическое вмешательство в эту ось могло способствовать устранению CSC. Действительно, авторы обнаружили, что обработка нейтрализующим моноклональным антителом к CCL20 значимо уменьшает частоту и активность CSC в моделях всех трех исследованных типов опухолей. Несмотря на то, что авторами отмечалось, что нейтрализация CCL20 непосредственно снижает процент CSC с положительным поверхностным фенотипом в моделях рака поджелудочной железы, авторы также обнаружили, что нейтрализация CCL20 значимо ингибирует сферический рост в моделях рака молочной железы, поджелудочной железы и колоректального рака. Эти результаты подтверждают, что можно ингибировать не только количество CSC, но, что более важно, функцию CSC.
[0186] In vivo функцию CSC можно измерить с помощью ее способности к онкогенезу. Авторами обнаружено, что обработка сфер в случае рака поджелудочной железы с высоким содержанием CSC нейтрализующим моноклональным антителом к CCL20 существенно задерживает наступление образования опухоли в мышиных моделях. Кроме того, опухоли, которые образовались из CSC, обработанных IgG к CCL20, характеризовались значимым снижением роста опухоли по сравнению с опухолями, обработанными изотипическим контролем. Этот результат подтверждает, что роль CCL20 в управлении функции CSC, обнаруженная в вышеуказанных примерах, преобразуется in vivo в эффект в отношении онкогенеза и скорости роста опухоли.
[0187] Поскольку ось CCL20-CCR6 обеспечивает исходную функцию рекрутинга иммунных клеток, то авторами выдвинута гипотеза о том, что CSC, секретируемые CCL20, могли потенциально влиять на рекрутинг опухоль-инфильтрующих лимфоцитов, в дополнение к своему непосредственному эффекту в отношении опухолевых клеток. Chen et al. продемонстрировали доказательства того, что уровни CCL20 непосредственно коррелировали с уровнями регуляторных T-клеток в биоптатах опухолей пациентов с гепатоцеллюлярной карциномой, и что CCL20 значимо активировал миграцию регуляторных T-клеток при данном признаке (Chen et al., 2011). Учитывая ассоциацию регуляторных T-клеток с неблагоприятным прогнозом во многих типах опухолей (Want et al. 2012), можно было предусмотреть механизм, посредством которого CCL20 активирует онкогенность посредством одной-двух сильных атак, либо в результате регулирования фракции CSC, либо в результате стимулирования рекрутинга иммуносупрессорных регуляторных T-клеток к опухолевому окружению.
[0188] При исследовании in vivo с помощью иммуннокомпетентных опухоль-несущих мышей авторы действительно подтвердили, что нейтрализация CCL20 ингибирует инфильтрацию Treg в опухоль. Однако нейтрализация CCL20 также ингибировали инфильтрацию Th17 в опухоль, результат, которого авторы ожидали, поскольку клетки Th17 характеризовались как CCR6+. Интересно отметить, что авторами обнаружено то, что ингибирование CCL20 не только влияет на частоту этих двух типов иммунных клеток в опухоли, но также снижает частоту клеток Treg и Th17 в селезенке, что указывает на периферический ответ на подавление этих двух типов клеток помимо только инфильтрации опухоли. В противоположность этому, авторами также обнаружено то, что нейтрализация CCL20 снижала частоту зрелых дендритных клеток в опухоли, однако данному результату противоречило присутствие незрелых дендритных клеток в селезенке. Этот результат указывает на то, что CCL20 также выполняет роль в созревании и дальнейшей инвазии дендритных клеток в опухолевое окружение.
[0189] Учитывая ассоциацию клеток Treg и Th17 с неблагоприятным прогнозом и иммуносупрессией во многих типах опухолей, а также тот результат, что CCL20 значимо снижает частоту этих двух типов клеток в опухоли и селезенке, в целом результаты предполагают, CCL20 выполняет двойственную роль в опухолевом окружении: 1) с помощью управления активностью и онкогенной способностью CSC, и 2) с помощью активации иммуносупрессорного фенотипа.
[0190] На определяющую функцию CSC в лечении рака указывает множество доклинических и клинических доказательств, таким образом, виды лечения, целенаправленно воздействующие на эту популяцию опухолевых клеток, могут иметь высокую ценность. Исследование, описанное в данном документе, указывает не только на новую и важную роль оси CCL20-CCR6 в поддержании CSC, но также на определяющую роль CCL20 в поддержании иммуносупрессорного фенотипа. Данный результат поддерживает гипотезу о том, что CCL20 действует активирующим образом в отношении опухоли по двум направлениям - с помощью активации функции CSC и в результате препятствования противоопухолевому иммунному ответу. Данные указывают на то, что нейтрализация CCL20 может быть полезной стратегией для одновременного ингибирования функции CSC и ослабления иммуносупрессорного фенотипа. В целом авторы выдвигают гипотезу, что в результате этого двойственного механизма ингибирование CSC в результате блокирования CCL20 могло обеспечивать уникальные и эффективные виды терапии рака и улучшать жизнь пациентов.
Включение с помощью ссылки
[0191] Все публикации и патенты, упомянутые в данном документе, настоящим включены в данное описание с помощью ссылки в полном их объеме, как если бы каждая отдельная публикация или патент были конкретно и индивидуально указаны как включенные с помощью ссылки.
[0192] Хотя обсуждались конкретные аспекты настоящего раскрытия, вышеуказанное описание носит иллюстративный, а не ограничительный характер. Многие варианты настоящего раскрытия будут очевидны специалистам в данной области техники после рассмотрения настоящего описания и нижеприведенной формулы изобретения. Полный объем настоящего раскрытия должен определяться со ссылкой на пункты формулы изобретения вместе с полным объемом их эквивалентов и описанием вместе с такими вариантами.
Список литературы
Al-Hajj, M., Wicha, M.S., Benito-Hernandez, A., Morrison, S.J., and Clarke, M.F. (2003). Prospective identification of tumorigenic breast cancer cells. Proceedings of the National Academy of Sciences of the United States of America 100, 3983-3988.
Baba, M., Imai, T., Nishimura, M., Kakizaki, M., Takagi, S., Hieshima, K., Nomiyama, H., and Yoshie, O. (1997). Identification of CCR6, the specific receptor for a novel lymphocyte-directed CC chemokine LARC. The Journal of biological chemistry 272, 14893-14898.
Baba, T., Naka, K., Morishita, S., Komatsu, N., Hirao, A., and Mukaida, N. (2013). MIP-1alpha/CCL3-mediated maintenance of leukemia-initiating cells in the initiation process of chronic myeloid leukemia. The Journal of experimental medicine 210, 2661-2673.
Barker, N., Ridgway, R.A., van Es, J.H., van de Wetering, M., Begthel, H., van den Born, M., Danenberg, E., Clarke, A.R., Sansom, O.J., and Clevers, H. (2009). Crypt stem cells as the cells-of-origin of intestinal cancer. Nature 457, 608-611.
Chen, K.-J., Lin, S.-Z., Zhou, L., Xie, H.-Y., Zhou, W.-H., Taki-Eldin, A., and Zheng, S.-S. (2011). Selective recruitment of regulatory T cell through CCR6-CCL20 in hepatocellular carcinoma fosters tumor progression and predicts poor prognosis. PloS one 6, e24671.
Creighton, C.J., Li, X., Landis, M., Dixon, J.M., Neumeister, V.M., Sjolund, A., Rimm, D.L., Wong, H., Rodriguez, A., Herschkowitz, J.I., et al. (2009). Residual breast cancers after conventional therapy display mesenchymal as well as tumor-initiating features. Proceedings of the National Academy of Sciences 106, 13820-13825.
Gemei, M., Mirabelli, P., Di Noto, R., Corbo, C., Iaccarino, A., Zamboli, A., Troncone, G., Galizia, G., Lieto, E., Del Vecchio, L., et al. (2013). CD66c is a novel marker for colorectal cancer stem cell isolation, and its silencing halts tumor growth in vivo. Cancer 119, 729-738.
Ghadjar, P., Rubie, C., Aebersold, D.M., and Keilholz, U. (2009). The chemokine CCL20 and its receptor CCR6 in human malignancy with focus on colorectal cancer. International journal of cancer Journal international du cancer 125, 741-745.
Ginestier, C., Liu, S., Diebel, M.E., Korkaya, H., Luo, M., Brown, M., Wicinski, J., Cabaud, O., Charafe-Jauffret, E., Birnbaum, D., et al. (2010). CXCR1 blockade selectively targets human breast cancer stem cells in vitro and in xenografts. The Journal of clinical investigation 120, 485-497.
Hermann, P.C., Huber, S.L., Herrler, T., Aicher, A., Ellwart, J.W., Guba, M., Bruns, C.J., and Heeschen, C. (2007). Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer. Cell stem cell 1, 313-323.
Hirsch, D., Barker, N., McNeil, N., Hu, Y., Camps, J., McKinnon, K., Clevers, H., Ried, T., and Gaiser, T. (2014). LGR5 positivity defines stem-like cells in colorectal cancer. Carcinogenesis 35, 849-858.
Iliopoulos, D., Hirsch, H.A., Wang, G., and Struhl, K. (2011). Inducible formation of breast cancer stem cells and their dynamic equilibrium with non-stem cancer cells via IL6 secretion. Proceedings of the National Academy of Sciences of the United States of America 108, 1397-1402.
Iwata, T., Tanaka, K., Inoue, Y., Toiyama, Y., Hiro, J., Fujikawa, H., Okugawa, Y., Uchida, K., Mohri, Y., and Kusunoki, M. (2013). Macrophage inflammatory protein-3 alpha (MIP-3a) is a novel serum prognostic marker in patients with colorectal cancer. Journal of surgical oncology 107, 160-166.
Kleeff, J., Kusama, T., Rossi, D.L., Ishiwata, T., Maruyama, H., Friess, H., Buchler, M.W., Zlotnik, A., and Korc, M. (1999). Detection and localization of Mip-3alpha/LARC/Exodus, a macrophage proinflammatory chemokine, and its CCR6 receptor in human pancreatic cancer. International journal of cancer Journal international du cancer 81, 650-657.
Lapidot, T., Sirard, C., Vormoor, J., Murdoch, B., Hoang, T., Caceres-Cortes, J., Minden, M., Paterson, B., Caligiuri, M.A., and Dick, J.E. (1994). A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature 367, 645-648.
Li, C., Heidt, D.G., Dalerba, P., Burant, C.F., Zhang, L., Adsay, V., Wicha, M., Clarke, M.F., and Simeone, D.M. (2007). Identification of pancreatic cancer stem cells. Cancer research 67, 1030-1037.
Liu, J., Zhang, N., Li, Q., Zhang, W., Ke, F., Leng, Q., Wang, H., Chen, J., and Wang, H. Tumor-associated macrophages recruit CCR6+ regulatory T cells and promote the development of colorectal cancer via enhancing CCL20 production in mice. PLoS One 2011 Apr 29;6(4):e19495.
Marsigliante, S., Vetrugno, C., and Muscella, A. (2013). CCL20 induces migration and proliferation on breast epithelial cells. Journal of cellular physiology 228, 1873-1883.
Nandi, B., Pai, C., Huang, Q., Prabhala, R.H., Munshi, N.C., and Gold, J.S. (2014). CCR6, the sole receptor for the chemokine CCL20, promotes spontaneous intestinal tumorigenesis. PloS one 9, e97566.
Schutyser, E., Struyf, S., and Van Damme, J. (2003). The CC chemokine CCL20 and its receptor CCR6. Cytokine & growth factor reviews 14, 409-426.
Tehranchi, R., Woll, P.S., Anderson, K., Buza-Vidas, N., Mizukami, T., Mead, A.J., Åstrand-Grundström, I., Strömbeck, B., Horvat, A., Ferry, H., et al. (2010). Persistent Malignant Stem Cells in del(5q) Myelodysplasia in Remission. New England Journal of Medicine 363, 1025-1037.
van Vlerken, L.E., Kiefer, C.M., Morehouse, C., Li, Y., Groves, C., Wilson, S.D., Yao, Y., Hollingsworth, R.E., and Hurt, E.M. (2013). EZH2 is required for breast and pancreatic cancer stem cell maintenance and can be used as a functional cancer stem cell reporter. Stem cells translational medicine 2, 43-52.
Voo, KS, Bover, L, Harline, ML, Vien, LT, Facchinetti V, Arima, K, Kwak, LW, and Liu, YJ. Antibodies targeting human OX40 expand effector T cells and block inducible and natural regulatory T cell function. J. Immunol. 2013 Oct 1; 191(7): 3641-3650.
Wang, C., Xie, J., Guo, J., Manning, H.C., Gore, J.C., and Guo, N. (2012). Evaluation of CD44 and CD133 as cancer stem cell markers for colorectal cancer. Oncology reports 28, 1301-1308.
Wang, Y., Ma, Y., Fang, Y., Wu, S., Liu, L., Fu, D., and Shen, X. (2012). Regulatory T cell: a protection for tumour cells. Journal of Cellular and Molecular Medicine 16, 425-436.
Wurth, R., Bajetto, A., Harrison, J.K., Barbieri, F., and Florio, T. (2014). CXCL12 modulation of CXCR4 and CXCR7 activity in human glioblastoma stem-like cells and regulation of the tumor microenvironment. Frontiers in cellular neuroscience 8, 144.
Yu, Q., Lou, X.M., and He, Y. Preferential Recruitment of Th17 Cells to Cervical Cancer via CCR6-CCL20 Pathway. PLoS One 2015 Mar 13;10(3):e0120855.
Zhang, C.Y., Qi, Y., Li, X.N., Yang, Y., Liu, D.L., Zhao, J., Zhu, D.Y., Wu, K., Zhou, X.D., and Zhao, S. The role of CCL20/CCR6 axis in recruiting Treg cells to tumor sites of NSCLC patients. Biomed Pharmacother 2015 Feb;69:242-8.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> van Vlerken-Ysla, Lilian Emilia
Hurt, Elaine Marie
<120> КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ РАКА
<130> CCL20-100-WO
<160> 8
<170> PatentIn версия 3.5
<210> 1
<211> 3156
<212> ДНК
<213> Homo sapiens
<400> 1
gaaggtcccc aggactctgt ggtcatcagt aagagagggc ccacgtgtat atgctggtga 60
acagaaatgt caaccttttc aaagtctgac atttaagaga aaaaactgtg gctgttggtt 120
tgtggaacag acagctcctt ctttattgag tcacctctac tttcctgcta ccgctgcctg 180
tgagctgaag gggctgaacc atacactcct ttttctacaa ccagcttgca ttttttctgc 240
ccacaatgag cggggaatca atgaatttca gcgatgtttt cgactccagt gaagattatt 300
ttgtgtcagt caatacttca tattactcag ttgattctga gatgttactg tgctccttgc 360
aggaggtcag gcagttctcc aggctatttg taccgattgc ctactccttg atctgtgtct 420
ttggcctcct ggggaatatt ctggtggtga tcacctttgc tttttataag aaggccaggt 480
ctatgacaga cgtctatctc ttgaacatgg ccattgcaga catcctcttt gttcttactc 540
tcccattctg ggcagtgagt catgccaccg gtgcgtgggt tttcagcaat gccacgtgca 600
agttgctaaa aggcatctat gccatcaact ttaactgcgg gatgctgctc ctgacttgca 660
ttagcatgga ccggtacatc gccattgtac aggcgactaa gtcattccgg ctccgatcca 720
gaacactacc gcgcagcaaa atcatctgcc ttgttgtgtg ggggctgtca gtcatcatct 780
ccagctcaac ttttgtcttc aaccaaaaat acaacaccca aggcagcgat gtctgtgaac 840
ccaagtacca gactgtctcg gagcccatca ggtggaagct gctgatgttg gggcttgagc 900
tactctttgg tttctttatc cctttgatgt tcatgatatt ttgttacacg ttcattgtca 960
aaaccttggt gcaagctcag aattctaaaa ggcacaaagc catccgtgta atcatagctg 1020
tggtgcttgt gtttctggct tgtcagattc ctcataacat ggtcctgctt gtgacggctg 1080
caaatttggg taaaatgaac cgatcctgcc agagcgaaaa gctaattggc tatacgaaaa 1140
ctgtcacaga agtcctggct ttcctgcact gctgcctgaa ccctgtgctc tacgctttta 1200
ttgggcagaa gttcagaaac tactttctga agatcttgaa ggacctgtgg tgtgtgagaa 1260
ggaagtacaa gtcctcaggc ttctcctgtg ccgggaggta ctcagaaaac atttctcggc 1320
agaccagtga gaccgcagat aacgacaatg cgtcgtcctt cactatgtga tagaaagctg 1380
agtctcccta aggcatgtgt gaaacatact catagatgtt atgcaaaaaa aagtctatgg 1440
ccaggtatgc atggaaaatg tgggaattaa gcaaaatcaa gcaagcctct ctcctgcggg 1500
acttaacgtg ctcatgggct gtgtgatctc ttcagggtgg ggtggtctct gataggtagc 1560
attttccagc actttgcaag gaatgttttg tagctctagg gtatatatcc gcctggcatt 1620
tcacaaaaca gcctttggga aatgctgaat taaagtgaat tgttgacaaa tgtaaacatt 1680
ttcagaaata ttcatgaagc ggtcacagat cacagtgtct tttggttaca gcacaaaatg 1740
atggcagtgg tttgaaaaac taaaacagaa aaaaaaatgg aagccaacac atcactcatt 1800
ttaggcaaat gtttaaacat ttttatctat cagaatgttt attgttgctg gttataagca 1860
gcaggattgg ccggctagtg tttcctctca tttccctttg atacagtcaa caagcctgac 1920
cctgtaaaat ggaggtggaa agacaagctc aagtgttcac aacctggaag tgcttcggga 1980
agaaggggac aatggcagaa caggtgttgg tgacaattgt caccaattgg ataaagcagc 2040
tcaggttgta gtgggccatt aggaaactgt cggtttgctt tgatttccct gggagctgtt 2100
ctctgtcgtg agtgtctctt gtctaaacgt ccattaagct gagagtgcta tgaagacagg 2160
atctagaata atcttgctca cagctgtgct ctgagtgcct agcggagttc cagcaaacaa 2220
aatggactca agagagattt gattaatgaa tcgtaatgaa gttggggttt attgtacagt 2280
ttaaaatgtt agatgttttt aattttttaa ataaatggaa tacttttttt ttttttttaa 2340
agaaagcaac tttactgaga caatgtagaa agaagttttg ttccgtttct ttaatgtggt 2400
tgaagagcaa tgtgtggctg aagacttttg ttatgaggag ctgcagatta gctaggggac 2460
agctggaatt atgctggctt ctgataatta ttttaaaggg gtctgaaatt tgtgatggaa 2520
tcagatttta acagctctct tcaatgacat agaaagttca tggaactcat gtttttaaag 2580
ggctatgtaa atatatgaac attagaaaaa tagcaacttg tgttacaaaa atacaaacac 2640
atgttaggaa ggtactgtca tgggctaggc atggtggctc acacctgtaa tcccagcatt 2700
ttgggaagct aagatgggtg gatcacttga ggtcaggagt ttgagaccag cctggccaac 2760
atggcgaaac ccctctctac taaaaataca aaaatttgcc aggcgtggtg gcgggtgcct 2820
gtaatcccag ctacttggga ggctgaggca agagaatcgc ttgaacccag gaggcagagg 2880
ttgcagtgag ccgagatcgt gccattgcac tccagcctgg gtgacaaagc gagactccat 2940
ctcaaaaaaa aaaaaaaaaa aaaaggaaag aactgtcatg taaacatacc aacatgttta 3000
aacctgacaa tggtgttatt tgaaacttta tattgttctt gtaagcttta actatatctc 3060
tctttaaaat gcaaaataat gtcttaagat tcaaagtctg tatttttaaa gcatggcttt 3120
ggctttgcaa aataaaaaat gtgttttgta catgaa 3156
<210> 2
<211> 374
<212> БЕЛОК
<213> Homo sapiens
<400> 2
Met Ser Gly Glu Ser Met Asn Phe Ser Asp Val Phe Asp Ser Ser Glu
1 5 10 15
Asp Tyr Phe Val Ser Val Asn Thr Ser Tyr Tyr Ser Val Asp Ser Glu
20 25 30
Met Leu Leu Cys Ser Leu Gln Glu Val Arg Gln Phe Ser Arg Leu Phe
35 40 45
Val Pro Ile Ala Tyr Ser Leu Ile Cys Val Phe Gly Leu Leu Gly Asn
50 55 60
Ile Leu Val Val Ile Thr Phe Ala Phe Tyr Lys Lys Ala Arg Ser Met
65 70 75 80
Thr Asp Val Tyr Leu Leu Asn Met Ala Ile Ala Asp Ile Leu Phe Val
85 90 95
Leu Thr Leu Pro Phe Trp Ala Val Ser His Ala Thr Gly Ala Trp Val
100 105 110
Phe Ser Asn Ala Thr Cys Lys Leu Leu Lys Gly Ile Tyr Ala Ile Asn
115 120 125
Phe Asn Cys Gly Met Leu Leu Leu Thr Cys Ile Ser Met Asp Arg Tyr
130 135 140
Ile Ala Ile Val Gln Ala Thr Lys Ser Phe Arg Leu Arg Ser Arg Thr
145 150 155 160
Leu Pro Arg Ser Lys Ile Ile Cys Leu Val Val Trp Gly Leu Ser Val
165 170 175
Ile Ile Ser Ser Ser Thr Phe Val Phe Asn Gln Lys Tyr Asn Thr Gln
180 185 190
Gly Ser Asp Val Cys Glu Pro Lys Tyr Gln Thr Val Ser Glu Pro Ile
195 200 205
Arg Trp Lys Leu Leu Met Leu Gly Leu Glu Leu Leu Phe Gly Phe Phe
210 215 220
Ile Pro Leu Met Phe Met Ile Phe Cys Tyr Thr Phe Ile Val Lys Thr
225 230 235 240
Leu Val Gln Ala Gln Asn Ser Lys Arg His Lys Ala Ile Arg Val Ile
245 250 255
Ile Ala Val Val Leu Val Phe Leu Ala Cys Gln Ile Pro His Asn Met
260 265 270
Val Leu Leu Val Thr Ala Ala Asn Leu Gly Lys Met Asn Arg Ser Cys
275 280 285
Gln Ser Glu Lys Leu Ile Gly Tyr Thr Lys Thr Val Thr Glu Val Leu
290 295 300
Ala Phe Leu His Cys Cys Leu Asn Pro Val Leu Tyr Ala Phe Ile Gly
305 310 315 320
Gln Lys Phe Arg Asn Tyr Phe Leu Lys Ile Leu Lys Asp Leu Trp Cys
325 330 335
Val Arg Arg Lys Tyr Lys Ser Ser Gly Phe Ser Cys Ala Gly Arg Tyr
340 345 350
Ser Glu Asn Ile Ser Arg Gln Thr Ser Glu Thr Ala Asp Asn Asp Asn
355 360 365
Ala Ser Ser Phe Thr Met
370
<210> 3
<211> 3419
<212> ДНК
<213> Homo sapiens
<400> 3
tgctcccagg agataaccag gtaaaggagt atgaaagttt gggtacaaac tcattgctgc 60
aaattgaaaa ccatgcaaag gctgtcttcc tctggggagt tcaatgcctc tctttttctt 120
atcactttac cattggttgg actttgattc cagggatcct acgattactc aataccctac 180
aggatataca tggttaacca tttgcatttg ggcaaatagg cgttactttt caataggaag 240
tggcaatcca gaacttgctt ttgggcaatt ctagtagctc accgcttttt tcttaatgac 300
tgctagaagc tgcatcttat tgacagatgg tcatcacatt ggtgagctgg agtcatcaga 360
ttgtggggcc cggagtgagg ctgaagggag tggatcagag cactgcctga gagtcacctc 420
tactttcctg ctaccgctgc ctgtgagctg aaggggctga accatacact cctttttcta 480
caaccagctt gcattttttc tgcccacaat gagcggggaa tcaatgaatt tcagcgatgt 540
tttcgactcc agtgaagatt attttgtgtc agtcaatact tcatattact cagttgattc 600
tgagatgtta ctgtgctcct tgcaggaggt caggcagttc tccaggctat ttgtaccgat 660
tgcctactcc ttgatctgtg tctttggcct cctggggaat attctggtgg tgatcacctt 720
tgctttttat aagaaggcca ggtctatgac agacgtctat ctcttgaaca tggccattgc 780
agacatcctc tttgttctta ctctcccatt ctgggcagtg agtcatgcca ccggtgcgtg 840
ggttttcagc aatgccacgt gcaagttgct aaaaggcatc tatgccatca actttaactg 900
cgggatgctg ctcctgactt gcattagcat ggaccggtac atcgccattg tacaggcgac 960
taagtcattc cggctccgat ccagaacact accgcgcagc aaaatcatct gccttgttgt 1020
gtgggggctg tcagtcatca tctccagctc aacttttgtc ttcaaccaaa aatacaacac 1080
ccaaggcagc gatgtctgtg aacccaagta ccagactgtc tcggagccca tcaggtggaa 1140
gctgctgatg ttggggcttg agctactctt tggtttcttt atccctttga tgttcatgat 1200
attttgttac acgttcattg tcaaaacctt ggtgcaagct cagaattcta aaaggcacaa 1260
agccatccgt gtaatcatag ctgtggtgct tgtgtttctg gcttgtcaga ttcctcataa 1320
catggtcctg cttgtgacgg ctgcaaattt gggtaaaatg aaccgatcct gccagagcga 1380
aaagctaatt ggctatacga aaactgtcac agaagtcctg gctttcctgc actgctgcct 1440
gaaccctgtg ctctacgctt ttattgggca gaagttcaga aactactttc tgaagatctt 1500
gaaggacctg tggtgtgtga gaaggaagta caagtcctca ggcttctcct gtgccgggag 1560
gtactcagaa aacatttctc ggcagaccag tgagaccgca gataacgaca atgcgtcgtc 1620
cttcactatg tgatagaaag ctgagtctcc ctaaggcatg tgtgaaacat actcatagat 1680
gttatgcaaa aaaaagtcta tggccaggta tgcatggaaa atgtgggaat taagcaaaat 1740
caagcaagcc tctctcctgc gggacttaac gtgctcatgg gctgtgtgat ctcttcaggg 1800
tggggtggtc tctgataggt agcattttcc agcactttgc aaggaatgtt ttgtagctct 1860
agggtatata tccgcctggc atttcacaaa acagcctttg ggaaatgctg aattaaagtg 1920
aattgttgac aaatgtaaac attttcagaa atattcatga agcggtcaca gatcacagtg 1980
tcttttggtt acagcacaaa atgatggcag tggtttgaaa aactaaaaca gaaaaaaaaa 2040
tggaagccaa cacatcactc attttaggca aatgtttaaa catttttatc tatcagaatg 2100
tttattgttg ctggttataa gcagcaggat tggccggcta gtgtttcctc tcatttccct 2160
ttgatacagt caacaagcct gaccctgtaa aatggaggtg gaaagacaag ctcaagtgtt 2220
cacaacctgg aagtgcttcg ggaagaaggg gacaatggca gaacaggtgt tggtgacaat 2280
tgtcaccaat tggataaagc agctcaggtt gtagtgggcc attaggaaac tgtcggtttg 2340
ctttgatttc cctgggagct gttctctgtc gtgagtgtct cttgtctaaa cgtccattaa 2400
gctgagagtg ctatgaagac aggatctaga ataatcttgc tcacagctgt gctctgagtg 2460
cctagcggag ttccagcaaa caaaatggac tcaagagaga tttgattaat gaatcgtaat 2520
gaagttgggg tttattgtac agtttaaaat gttagatgtt tttaattttt taaataaatg 2580
gaatactttt tttttttttt taaagaaagc aactttactg agacaatgta gaaagaagtt 2640
ttgttccgtt tctttaatgt ggttgaagag caatgtgtgg ctgaagactt ttgttatgag 2700
gagctgcaga ttagctaggg gacagctgga attatgctgg cttctgataa ttattttaaa 2760
ggggtctgaa atttgtgatg gaatcagatt ttaacagctc tcttcaatga catagaaagt 2820
tcatggaact catgttttta aagggctatg taaatatatg aacattagaa aaatagcaac 2880
ttgtgttaca aaaatacaaa cacatgttag gaaggtactg tcatgggcta ggcatggtgg 2940
ctcacacctg taatcccagc attttgggaa gctaagatgg gtggatcact tgaggtcagg 3000
agtttgagac cagcctggcc aacatggcga aacccctctc tactaaaaat acaaaaattt 3060
gccaggcgtg gtggcgggtg cctgtaatcc cagctacttg ggaggctgag gcaagagaat 3120
cgcttgaacc caggaggcag aggttgcagt gagccgagat cgtgccattg cactccagcc 3180
tgggtgacaa agcgagactc catctcaaaa aaaaaaaaaa aaaaaaagga aagaactgtc 3240
atgtaaacat accaacatgt ttaaacctga caatggtgtt atttgaaact ttatattgtt 3300
cttgtaagct ttaactatat ctctctttaa aatgcaaaat aatgtcttaa gattcaaagt 3360
ctgtattttt aaagcatggc tttggctttg caaaataaaa aatgtgtttt gtacatgaa 3419
<210> 4
<211> 374
<212> БЕЛОК
<213> Homo sapiens
<400> 4
Met Ser Gly Glu Ser Met Asn Phe Ser Asp Val Phe Asp Ser Ser Glu
1 5 10 15
Asp Tyr Phe Val Ser Val Asn Thr Ser Tyr Tyr Ser Val Asp Ser Glu
20 25 30
Met Leu Leu Cys Ser Leu Gln Glu Val Arg Gln Phe Ser Arg Leu Phe
35 40 45
Val Pro Ile Ala Tyr Ser Leu Ile Cys Val Phe Gly Leu Leu Gly Asn
50 55 60
Ile Leu Val Val Ile Thr Phe Ala Phe Tyr Lys Lys Ala Arg Ser Met
65 70 75 80
Thr Asp Val Tyr Leu Leu Asn Met Ala Ile Ala Asp Ile Leu Phe Val
85 90 95
Leu Thr Leu Pro Phe Trp Ala Val Ser His Ala Thr Gly Ala Trp Val
100 105 110
Phe Ser Asn Ala Thr Cys Lys Leu Leu Lys Gly Ile Tyr Ala Ile Asn
115 120 125
Phe Asn Cys Gly Met Leu Leu Leu Thr Cys Ile Ser Met Asp Arg Tyr
130 135 140
Ile Ala Ile Val Gln Ala Thr Lys Ser Phe Arg Leu Arg Ser Arg Thr
145 150 155 160
Leu Pro Arg Ser Lys Ile Ile Cys Leu Val Val Trp Gly Leu Ser Val
165 170 175
Ile Ile Ser Ser Ser Thr Phe Val Phe Asn Gln Lys Tyr Asn Thr Gln
180 185 190
Gly Ser Asp Val Cys Glu Pro Lys Tyr Gln Thr Val Ser Glu Pro Ile
195 200 205
Arg Trp Lys Leu Leu Met Leu Gly Leu Glu Leu Leu Phe Gly Phe Phe
210 215 220
Ile Pro Leu Met Phe Met Ile Phe Cys Tyr Thr Phe Ile Val Lys Thr
225 230 235 240
Leu Val Gln Ala Gln Asn Ser Lys Arg His Lys Ala Ile Arg Val Ile
245 250 255
Ile Ala Val Val Leu Val Phe Leu Ala Cys Gln Ile Pro His Asn Met
260 265 270
Val Leu Leu Val Thr Ala Ala Asn Leu Gly Lys Met Asn Arg Ser Cys
275 280 285
Gln Ser Glu Lys Leu Ile Gly Tyr Thr Lys Thr Val Thr Glu Val Leu
290 295 300
Ala Phe Leu His Cys Cys Leu Asn Pro Val Leu Tyr Ala Phe Ile Gly
305 310 315 320
Gln Lys Phe Arg Asn Tyr Phe Leu Lys Ile Leu Lys Asp Leu Trp Cys
325 330 335
Val Arg Arg Lys Tyr Lys Ser Ser Gly Phe Ser Cys Ala Gly Arg Tyr
340 345 350
Ser Glu Asn Ile Ser Arg Gln Thr Ser Glu Thr Ala Asp Asn Asp Asn
355 360 365
Ala Ser Ser Phe Thr Met
370
<210> 5
<211> 851
<212> ДНК
<213> Homo sapiens
<400> 5
agaatataac agcactccca aagaactggg tactcaacac tgagcagatc tgttctttga 60
gctaaaaacc atgtgctgta ccaagagttt gctcctggct gctttgatgt cagtgctgct 120
actccacctc tgcggcgaat cagaagcagc aagcaacttt gactgctgtc ttggatacac 180
agaccgtatt cttcatccta aatttattgt gggcttcaca cggcagctgg ccaatgaagg 240
ctgtgacatc aatgctatca tctttcacac aaagaaaaag ttgtctgtgt gcgcaaatcc 300
aaaacagact tgggtgaaat atattgtgcg tctcctcagt aaaaaagtca agaacatgta 360
aaaactgtgg cttttctgga atggaattgg acatagccca agaacagaaa gaaccttgct 420
ggggttggag gtttcacttg cacatcatgg agggtttagt gcttatctaa tttgtgcctc 480
actggacttg tccaattaat gaagttgatt catattgcat catagtttgc tttgtttaag 540
catcacatta aagttaaact gtattttatg ttatttatag ctgtaggttt tctgtgttta 600
gctatttaat actaattttc cataagctat tttggtttag tgcaaagtat aaaattatat 660
ttggggggga ataagattat atggactttc ttgcaagcaa caagctattt tttaaaaaaa 720
actatttaac attcttttgt ttatattgtt ttgtctccta aattgttgta attgcattat 780
aaaataagaa aaatattaat aagacaaata ttgaaaataa agaaacaaaa agttcttctg 840
ttaaaaaaaa a 851
<210> 6
<211> 96
<212> БЕЛОК
<213> Homo sapiens
<400> 6
Met Cys Cys Thr Lys Ser Leu Leu Leu Ala Ala Leu Met Ser Val Leu
1 5 10 15
Leu Leu His Leu Cys Gly Glu Ser Glu Ala Ala Ser Asn Phe Asp Cys
20 25 30
Cys Leu Gly Tyr Thr Asp Arg Ile Leu His Pro Lys Phe Ile Val Gly
35 40 45
Phe Thr Arg Gln Leu Ala Asn Glu Gly Cys Asp Ile Asn Ala Ile Ile
50 55 60
Phe His Thr Lys Lys Lys Leu Ser Val Cys Ala Asn Pro Lys Gln Thr
65 70 75 80
Trp Val Lys Tyr Ile Val Arg Leu Leu Ser Lys Lys Val Lys Asn Met
85 90 95
<210> 7
<211> 848
<212> ДНК
<213> Homo sapiens
<400> 7
agaatataac agcactccca aagaactggg tactcaacac tgagcagatc tgttctttga 60
gctaaaaacc atgtgctgta ccaagagttt gctcctggct gctttgatgt cagtgctgct 120
actccacctc tgcggcgaat cagaagcaag caactttgac tgctgtcttg gatacacaga 180
ccgtattctt catcctaaat ttattgtggg cttcacacgg cagctggcca atgaaggctg 240
tgacatcaat gctatcatct ttcacacaaa gaaaaagttg tctgtgtgcg caaatccaaa 300
acagacttgg gtgaaatata ttgtgcgtct cctcagtaaa aaagtcaaga acatgtaaaa 360
actgtggctt ttctggaatg gaattggaca tagcccaaga acagaaagaa ccttgctggg 420
gttggaggtt tcacttgcac atcatggagg gtttagtgct tatctaattt gtgcctcact 480
ggacttgtcc aattaatgaa gttgattcat attgcatcat agtttgcttt gtttaagcat 540
cacattaaag ttaaactgta ttttatgtta tttatagctg taggttttct gtgtttagct 600
atttaatact aattttccat aagctatttt ggtttagtgc aaagtataaa attatatttg 660
ggggggaata agattatatg gactttcttg caagcaacaa gctatttttt aaaaaaaact 720
atttaacatt cttttgttta tattgttttg tctcctaaat tgttgtaatt gcattataaa 780
ataagaaaaa tattaataag acaaatattg aaaataaaga aacaaaaagt tcttctgtta 840
aaaaaaaa 848
<210> 8
<211> 95
<212> БЕЛОК
<213> Homo sapiens
<400> 8
Met Cys Cys Thr Lys Ser Leu Leu Leu Ala Ala Leu Met Ser Val Leu
1 5 10 15
Leu Leu His Leu Cys Gly Glu Ser Glu Ala Ser Asn Phe Asp Cys Cys
20 25 30
Leu Gly Tyr Thr Asp Arg Ile Leu His Pro Lys Phe Ile Val Gly Phe
35 40 45
Thr Arg Gln Leu Ala Asn Glu Gly Cys Asp Ile Asn Ala Ile Ile Phe
50 55 60
His Thr Lys Lys Lys Leu Ser Val Cys Ala Asn Pro Lys Gln Thr Trp
65 70 75 80
Val Lys Tyr Ile Val Arg Leu Leu Ser Lys Lys Val Lys Asn Met
85 90 95
<---