Результат интеллектуальной деятельности: ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ВАРИАНТЫ ПЕПТИДОВ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По данной заявке испрашивается приоритет на основании патентной заявки США с серийным № 62/067824, поданной 23 октября 2014 г., полное содержание которой включено в настоящий документ посредством ссылки.
1. ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к фармацевтическим композициям, препаратам и лекарственным формам, содержащим варианты белковых и пептидных последовательностей (и пептидомиметиков) фактора роста фибробластов 19 (FGF19), а также продукты слияния FGF19, и/или варианты белковых и пептидных последовательностей (и пептидомиметиков) фактора роста фибробластов 21 (FGF21), а также варианты продуктов слияния белковых и пептидных последовательностей (и пептидомиметиков) FGF19 и/или FGF21. Настоящее изобретение также относится к способам применения фармацевтических композиций, препаратов и лекарственных форм.
2. ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Лекарственные субстанции, как правило, вводят в составе препарата в сочетании с одним или более другими средствами, которые выполняют различные и специализированные фармацевтические функции. Лекарственные формы разных видов могут быть получены за счет избирательного использования фармацевтических эксципиентов. Поскольку фармацевтические эксципиенты имеют разные функции, они вносят свой вклад в фармацевтические препараты множеством различных способов, например, в качестве солюбилизирующих средств, растворителей, загустителей, стабилизаторов, консервантов, красителей, ароматизаторов и так далее. Свойства, обычно учитываемые при формулировании активной лекарственной субстанции, включают биодоступность, простоту изготовления, легкость введения и стабильность лекарственной формы. Вследствие различных свойств формулируемых активных лекарственных субстанций, для достижения предпочтительных физических и фармацевтических свойств лекарственным формам, как правило, требуются фармацевтические эксципиенты, которые специально подобраны для конкретной лекарственной субстанции.
В настоящем документе предложены препараты и лекарственные формы, содержащие варианты белковых и пептидных последовательностей (и пептидомиметиков) фактора роста фибробластов 19 (FGF19), а также продуктов слияния FGF19, и/или варианты белковых и пептидных последовательностей (и пептидомиметиков) фактора роста фибробластов 21 (FGF21), а также варианты продуктов слияния белковых и пептидных последовательностей (и пептидомиметиков) FGF19 и/или FGF21. Такие белковые и пептидные последовательности полезны для лечения, предотвращения и/или контроля различных заболеваний или нарушений, включая, но не ограничиваясь ими, связанные с гомеостазом желчных кислот или сопутствующие заболевания, гипергликемические состояния, устойчивость к инсулину, гиперинсулинемию, непереносимость глюкозы, метаболический синдром и метаболические заболевания, а также некоторые формы рака. Таким образом, существует потребность в фармацевтических композициях и лекарственных формах таких белковых и пептидных последовательностей, имеющих благоприятные физические и фармацевтические свойства. Настоящее изобретение удовлетворяет эту потребность и предоставляет соответствующие преимущества.
3. СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей пептид или пептидную последовательность и фармацевтически приемлемый носитель. В конкретных вариантах осуществления фармацевтически приемлемый носитель включает Tris, трегалозу или полисорбат-20 (TWEEN-20), или любое их сочетание.
В некоторых вариантах осуществления фармацевтическая композиция содержит пептид, выбранный из группы, состоящей из вариантов пептидных последовательностей FGF19, продуктов слияния пептидных последовательностей FGF19 и/или FGF21, а также вариантов продуктов слияния (химер) пептидных последовательностей FGF19 и/или FGF21, имеющий одну или более активностей, например, модулирующую гомеостаз желчных кислот активность. Такие варианты и продукты слияния (химеры) пептидных последовательностей FGF19 и/или FGF21 включают последовательности, которые используют для лечения связанного с гомеостазом желчных кислот или сопутствующего заболевания. Такие варианты и продукты слияния (химеры) пептидных последовательностей FGF19 и/или FGF21 также включают последовательности, которые существенно или значительно не увеличивают или не индуцируют образование печеночно-клеточной карциномы (HCC) или онкогенез HCC. Такие варианты и продукты слияния (химеры) пептидных последовательностей FGF19 и/или FGF21 также включают последовательности, которые не вызывают существенного повышения или возрастания липидного профиля.
В одном варианте осуществления пептид представляет собой химерный пептид, включающий: a) N-концевую область, содержащую по меньшей мере семь аминокислотных остатков, N-концевую область, имеющую первое аминокислотное положение и последнее аминокислотное положение, при этом N-концевая область содержит последовательность DSSPL (SEQ ID NO: 121) или DASPH (SEQ ID NO: 122); и b) C-концевую область, содержащую часть SEQ ID NO: 99 (FGF19), C-концевую область, имеющую первое аминокислотное положение и последнее аминокислотное положение, при этом C-концевая область содержит аминокислотные остатки 16-29 из SEQ ID NO: 99 (FGF19) (WGDPIRLRHLYTSG; SEQ ID NO: 169), причем остаток W соответствует первому аминокислотному положению в C-концевой области, для модулирования гомеостаза желчных кислот или лечения связанного с гомеостазом желчных кислот или сопутствующего заболевания.
В другом варианте осуществления пептид представляет собой химерный пептид, включающий: a) N-концевую область, содержащую часть SEQ ID NO: 100 (FGF21), N-концевую область, имеющую первое аминокислотное положение и последнее аминокислотное положение, при этом N-концевая область содержит аминокислотные остатки GQV, причем остаток V соответствует последнему аминокислотному положению в N-концевой области; и b) C-концевую область, содержащую часть SEQ ID NO: 99 (FGF19), C-концевую область, имеющую первое аминокислотное положение и последнее аминокислотное положение, при этом C-концевая область содержит аминокислотные остатки 21-29 из SEQ ID NO: 99 (FGF19), RLRHLYTSG (SEQ ID NO: 185), причем остаток R соответствует первому положению в C-концевой области, для модулирования гомеостаза желчных кислот или лечения связанного с гомеостазом желчных кислот или сопутствующего заболевания.
В следующем варианте осуществления пептид представляет собой химерный пептид, включающий: a) N-концевую область, содержащую часть SEQ ID NO: 100 (FGF21), N-концевую область, имеющую первое аминокислотное положение и последнее аминокислотное положение, при этом N-концевая область содержит по меньшей мере 5 смежных аминокислот из SEQ ID NO: 100 (FGF21), включая аминокислотные остатки GQV, причем остаток V соответствует последнему аминокислотному положению в N-концевой области; и b) C-концевую область, содержащую часть SEQ ID NO: 99 (FGF19), C-концевую область, имеющую первое аминокислотное положение и последнее аминокислотное положение, при этом C-концевая область содержит аминокислотные остатки 21-29 из SEQ ID NO: 99 (FGF19), RLRHLYTSG (SEQ ID NO: 185), причем остаток R соответствует первому положению в C-концевой области, для модулирования гомеостаза желчных кислот или лечения связанного с гомеостазом желчных кислот или сопутствующего заболевания.
В дополнительном варианте осуществления пептид содержит или состоит из любого из: a) варианта последовательности FGF19, имеющего одну или более аминокислотных замен, вставок или делеций в сравнении с эталонным, или дикого типа, FGF19; b) варианта последовательности FGF21, имеющего одну или более аминокислотных замен, вставок или делеций в сравнении с эталонным, или дикого типа, FGF21; c) части последовательности FGF19, слитой с частью последовательности FGF21; или d) части последовательности FGF19, слитой с частью последовательности FGF21, причем часть(и) последовательностей FGF19 и/или FGF21 имеют одну или более аминокислотных замен, вставок или делеций в сравнении с эталонными, или дикого типа, FGF19 и/или FGF21, для модулирования гомеостаза желчных кислот или лечения связанного с гомеостазом желчных кислот или сопутствующего заболевания.
В различных конкретных вариантах осуществления химерная пептидная последовательность имеет N-концевую область с по меньшей мере 6 смежными аминокислотами из SEQ ID NO: 100 (FGF21), включая аминокислотные остатки GQ; или имеет N-концевую область с по меньшей мере 7 смежными аминокислотами из SEQ ID NO: 100 (FGF21), включая аминокислотные остатки GQV.
В некоторых вариантах осуществления пептид включает i) вариант последовательности FGF19, имеющий одну или более аминокислотных замен, вставок или делеций в сравнении с эталонным, или дикого типа, FGF19; ii) вариант последовательности FGF21, имеющий одну или более аминокислотных замен, вставок или делеций в сравнении с эталонным, или дикого типа, FGF21; iii) часть последовательности FGF19, слитую с частью последовательности FGF21; или iv) часть последовательности FGF19, слитую с частью последовательности FGF21, причем часть(и) последовательностей FGF19 и/или FGF21 имеют одну или более аминокислотных замен, вставок или делеций в сравнении с эталонными, или дикого типа, FGF19 и/или FGF21.
В различных дополнительных вариантах осуществления пептидная последовательность имеет амино-концевые аминокислоты 1-16 из SEQ ID NO: 100 (FGF21), слитые с карбокси-концевыми аминокислотами 21-194 из SEQ ID NO: 99 (FGF19), или пептидная последовательность имеет амино-концевые аминокислоты 1-147 из SEQ ID NO: 99 (FGF19), слитые с карбокси-концевыми аминокислотами 147-181 из SEQ ID NO: 100 (FGF21) (M41), или пептидная последовательность имеет амино-концевые аминокислоты 1-20 из SEQ ID NO: 99 (FGF19), слитые с карбокси-концевыми аминокислотами 17-181 из SEQ ID NO: 100 (FGF21) (M44), или пептидная последовательность имеет амино-концевые аминокислоты 1-146 из SEQ ID NO: 100 (FGF21), слитые с карбокси-концевыми аминокислотами 148-194 из SEQ ID NO: 99 (FGF19) (M45), или пептидная последовательность имеет амино-концевые аминокислоты 1-20 из SEQ ID NO: 99 (FGF19), слитые с внутренними аминокислотами 17-146 из SEQ ID NO: 100 (FGF21) или слитые с карбокси-концевыми аминокислотами 148-194 из SEQ ID NO: 99 (FGF19) (M46).
В различных дополнительных вариантах осуществления пептидная последовательность имеет по меньшей мере одну аминокислотную замену в аминокислотных остатках 125-129 из SEQ ID NO: 99 (FGF19), EIRPD; по меньшей мере одну аминокислотную замену в аминокислотных остатках 126-128 из SEQ ID NO: 99 (FGF19), IRP; или по меньшей мере одну аминокислотную замену в аминокислотных остатках 127-128 из SEQ ID NO: 99 (FGF19), RP, или по меньшей мере одну аминокислотную замену в аминокислотных остатках 1-124 из SEQ ID NO: 99 (FGF19) и/или в аминокислотных остатках 130-194 из SEQ ID NO: 99 (FGF19). Более конкретно, например, пептидная последовательность, имеющая замену в одном из аминокислотных остатков 127-128 из SEQ ID NO: 99 (FGF19), IRP, при этом по меньшей мере одна аминокислотная замена представляет собой R127L или P128E.
Способы и варианты применения, предложенные в настоящем документе, можно осуществлять на практике с использованием любой фармацевтической композиции, содержащей пептидную или химерную последовательность, приведенную в настоящем документе. Например, последовательность, которая содержит или состоит из любой пептидной последовательности, приведенной в настоящем документе в виде M1-M98, M101-M160 или M200-M207, или SEQ ID NOs: 1-98 или 101-135, или 138-212. В других вариантах осуществления пептидная последовательность содержит или состоит из любой последовательности, приведенной в таблице 1. В других вариантах осуществления пептидная последовательность содержит или состоит из любой последовательности, приведенной в списке последовательностей настоящего документа. В конкретных вариантах осуществления аминокислотная последовательность пептида имеет по меньшей мере одну аминокислотную замену в области петли-8 из FGF19, или соответствующей ей последовательности FGF19 в варианте пептида, предложенном в настоящем документе. В конкретных вариантах осуществления аминокислотная последовательность пептида имеет одну аминокислотную замену в аминокислотной последовательности EIRPD (аминокислоты 2-6 в SEQ ID NO: 190) в области петли-8 из FGF19. В некоторых вариантах осуществления аминокислотная последовательность пептида имеет две аминокислотные замены в аминокислотной последовательности EIRPD (аминокислоты 2-6 в SEQ ID NO: 190) в области петли-8 из FGF19. В других вариантах осуществления аминокислотная последовательность пептида имеет три аминокислотные замены в аминокислотной последовательности EIRPD (аминокислоты 2-6 в SEQ ID NO: 190) в области петли-8 из FGF19. В конкретных вариантах осуществления аминокислотная последовательность пептида имеет четыре аминокислотные замены в аминокислотной последовательности EIRPD (аминокислоты 2-6 в SEQ ID NO: 190) в области петли-8 из FGF19. В некоторых вариантах осуществления аминокислотная последовательность пептида имеет пять аминокислотных замен в аминокислотной последовательности EIRPD (аминокислоты 2-6 в SEQ ID NO: 190) в области петли-8 из FGF19. В конкретных вариантах осуществления аминокислотная последовательность пептида имеет одну аминокислотную замену в аминокислотной последовательности IRP (аминокислоты 3-5 в SEQ ID NO: 190) в области петли-8 из FGF19. В некоторых вариантах осуществления аминокислотная последовательность пептида имеет две аминокислотные замены в аминокислотной последовательности IRP (аминокислоты 3-5 в SEQ ID NO: 190) в области петли-8 из FGF19. В других вариантах осуществления аминокислотная последовательность пептида имеет три аминокислотные замены в аминокислотной последовательности IRP (аминокислоты 3-5 в SEQ ID NO: 190) в области петли-8 из FGF19. В конкретных вариантах осуществления аминокислотная последовательность пептида имеет одну аминокислотную замену в аминокислотной последовательности RP (аминокислоты 4-5 в SEQ ID NO: 190) в области петли-8 из FGF19. В некоторых вариантах осуществления аминокислотная последовательность пептида имеет две аминокислотные замены в аминокислотной последовательности RP (аминокислоты 4-5 в SEQ ID NO: 190) в области петли-8 из FGF19. В конкретных вариантах осуществления аминокислотная замена в аминокислотной последовательности RP (аминокислоты 4-5 в SEQ ID NO: 190) в области петли-8 из FGF19 представляет собой замену Arg (R) на Leu (L). В других вариантах осуществления замена в аминокислотной последовательности RP (аминокислоты 4-5 в SEQ ID NO: 190) в области петли-8 из FGF19 представляет собой замену Pro (P) на Glu (E). В некоторых вариантах осуществления замена в аминокислотной последовательности RP (аминокислоты 4-5 в SEQ ID NO: 190) в области петли-8 из FGF19 представляет собой замену Arg (R) на Leu (L) и замену Pro (P) на Glu (E). В конкретных вариантах осуществления вышеуказанная замена(ы) в области петли-8 из FGF19 находится в соответствующей ей последовательности FGF19 в варианте пептиде, предложенном в настоящем документе. То есть, указанные замены в составе соответствующей последовательности FGF19 (например, EIRPD, IRP или RP) вариантного пептида, предложенного в настоящем документе, также подразумеваются.
Способы и варианты применения, предложенные в настоящем документе, можно осуществлять на практике с использованием фармацевтической композиции, содержащей пептидную или химерную последовательность любой подходящей длины. В конкретных вариантах осуществления N-концевая или C-концевая область пептидной или химерной последовательности имеет длину от примерно 20 до примерно 200 аминокислотных остатков. В других конкретных аспектах пептидная или химерная последовательность имеет 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более аминокислотных делеций с амино-конца, карбокси-конца или внутри последовательности. В других конкретных вариантах осуществления пептидная или химерная последовательность имеет N-концевую область или C-концевую область, которая содержит или состоит из аминокислотной последовательности из примерно 5-10, 10-20, 20-30, 30-40, 40-50, 50-60, 60-70, 70-80, 80-90, 90-100 или более аминокислот. В дополнительных более конкретных вариантах осуществления пептидная или химерная последовательность имеет часть последовательности FGF19 или часть последовательности FGF21, которая содержит или состоит из аминокислотной последовательности из примерно 5-10, 10-20, 20-30, 30-40, 40-50, 50-60, 60-70, 70-80, 80-90, 90-100 или более аминокислот из FGF19 или FGF21.
В других дополнительных вариантах осуществления пептидная последовательность или химерная пептидная последовательность имеет фрагмент последовательности WGDPI (SEQ ID NO: 170), соответствующий последовательности WGDPI (SEQ ID NO: 170) из аминокислот 16-20 в SEQ ID NO: 99 (FGF19); имеет содержащий замены, мутантный или отсутствующий фрагмент последовательности WGDPI (SEQ ID NO: 170), соответствующий последовательности WGDPI (SEQ ID NO: 170) в FGF19 из аминокислот 16-20 в FGF19; имеет последовательность WGDPI (SEQ ID NO: 170) с одной или более аминокислотными заменами, мутантную или отсутствующую. В различных других аспектах пептидная последовательность отличается от вариантной последовательности FGF19, имеющей любую из последовательностей GQV, GDI, WGPI (SEQ ID NO: 171), WGDPV (SEQ ID NO: 172), WGDI (SEQ ID NO: 173), GDPI (SEQ ID NO: 174), GPI, WGQPI (SEQ ID NO: 175), WGAPI (SEQ ID NO: 176), AGDPI (SEQ ID NO: 177), WADPI (SEQ ID NO: 178), WGDAI (SEQ ID NO: 179), WGDPA (SEQ ID NO: 180), WDPI (SEQ ID NO: 181), WGDI (SEQ ID NO: 182), WGDP (SEQ ID NO: 183) или FGDPI (SEQ ID NO: 184) вместо последовательности WGDPI (SEQ ID NO: 170) из FGF19 на участке аминокислот 16-20.
В других вариантах осуществления пептидная последовательность или химерная пептидная последовательность имеет N-концевую область, содержащую аминокислотные остатки VHYG (SEQ ID NO: 101), при этом N-концевая область содержит аминокислотные остатки DASPHVHYG (SEQ ID NO: 102) или N-концевая область содержит аминокислотные остатки DSSPLVHYG (SEQ ID NO: 103). Более конкретно, в одном аспекте G соответствует последнему положению в N-концевой области.
В различных дополнительных аспектах N-концевая область содержит аминокислотные остатки DSSPLLQ (SEQ ID NO: 104), где остаток Q соответствует последнему аминокислотному положению в N-концевой области, или содержит аминокислотные остатки DSSPLLQFGGQV (SEQ ID NO: 105), где остаток V соответствует последнему положению в N-концевой области.
В конкретных вариантах осуществления N-концевая область содержит или состоит из (или дополнительно содержит или состоит из): RHPIP (SEQ ID NO: 106), где R соответствует первому аминокислотному положению в N-концевой области; или HPIP (SEQ ID NO: 107), где H соответствует первому аминокислотному положению в N-концевой области; или RPLAF (SEQ ID NO: 108), где R соответствует первому аминокислотному положению в N-концевой области; или PLAF (SEQ ID NO: 109), где P соответствует первому аминокислотному положению в N-концевой области; или R, где R соответствует первому аминокислотному положению в N-концевой области.
В различных других аспектах пептидная или химерная последовательность имеет: аминокислотные остатки HPIP (SEQ ID NO: 107), которые представляют собой первые 4 аминокислотных остатка в N-концевой области. В различных других аспектах пептидная или химерная последовательность имеет: остаток R, занимающий первое положение в N-концевой области, или первое положение в N-концевой области занимает остаток M, или первое и второе положения в N-концевой области занимает последовательность MR, или первое и второе положения в N-концевой области занимает последовательность RM, или первое и второе положения в N-концевой области занимает последовательность RD, или первое и второе положения в N-концевой области занимает последовательность DS, или первое и второе положения в N-концевой области занимает последовательность MD, или первое и второе положения в N-концевой области занимает последовательность MS, или с первого по третье положения в N-концевой области занимает последовательность MDS, или с первого по третье положения в N-концевой области занимает последовательность RDS, или с первого по третье положения в N-концевой области занимает последовательность MSD, или с первого по третье положения в N-концевой области занимает последовательность MSS, или с первого по третье положения в N-концевой области занимает последовательность DSS, или с первого по четвертое положения в N-концевой области занимает последовательность RDSS (SEQ ID NO: 115), или с первого по четвертое положения в N-концевой области занимает последовательность MDSS (SEQ ID NO: 116), или с первого по пятое положения в N-концевой области занимает последовательность MRDSS (SEQ ID NO: 117), или с первого по пятое положения в N-концевой области занимает последовательность MSSPL (SEQ ID NO: 113), или с первого по шестое положения в N-концевой области занимает последовательность MDSSPL (SEQ ID NO: 110), или с первого по седьмое положение в N-концевой области занимает последовательность MSDSSPL (SEQ ID NO: 111).
В различных других конкретных аспектах пептидная или химерная последовательность имеет в первом аминокислотном положении N-концевой области остаток «M», остаток «R», остаток «S», остаток «H», остаток «P», остаток «L» или остаток «D». В различных альтернативных конкретных аспектах пептидная или химерная последовательность не имеет остатка «M» или остатка «R» в первом аминокислотном положении N-концевой области.
В различных других вариантах осуществления пептидная или химерная последовательность имеет N-концевую область с любой из следующих последовательностей: MDSSPL (SEQ ID NO: 110), MSDSSPL (SEQ ID NO: 111), SDSSPL (SEQ ID NO: 112), MSSPL (SEQ ID NO: 113) или SSPL (SEQ ID NO: 114).
В различных дополнительных аспектах пептидная или химерная последовательность имеет остаток в последнем положении C-концевой области, который соответствует примерно остатку 194 в SEQ ID NO: 99 (FGF19). В других вариантах осуществления пептидная последовательность или химерная пептидная последовательность имеет добавленные аминокислотные остатки 30-194 из SEQ ID NO: 99 (FGF19) на C-конце, образуя химерный полипептид, имеющий последнее положение C-концевой области, соответствующее примерно остатку 194 в SEQ ID NO: 99 (FGF19). В других вариантах осуществления химерная пептидная последовательность или пептидная последовательность содержит всю или часть последовательности FGF19 (например, SEQ ID NO: 99), расположенную на C-конце пептида, или где амино-концевой остаток «R» делетирован из пептида.
В более конкретных вариантах осуществления химерная пептидная последовательность или пептидная последовательность содержит или состоит из любой из вариантных пептидных последовательностей M1-M98, либо подпоследовательности или фрагмента любой из вариантных пептидных последовательностей M1-M98. Способы и варианты применения, предложенные в настоящем документе, также можно осуществлять на практике, используя пептидную или химерную последовательность, приведенную в настоящем документе. Например, последовательность, которая содержит или состоит из любой пептидной последовательности, приведенной в настоящем документе в виде M1-M98, M101-M160 или M200-M207, или SEQ ID NOs:1-98, 101-135, 138-212, или пептидную последовательность, которая содержит или состоит из любой последовательности, приведенной в таблице 1, или пептидную последовательность, которая содержит или состоит из любой последовательности, приведенной в списке последовательностей настоящего документа.
В различных более конкретных вариантах осуществления пептидная последовательность содержит или состоит из любой из следующих последовательностей:
RPLAFSDAGPHVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEILEDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M3) (SEQ ID NO: 3);
RPLAFSDAGPHVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIREDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M140) (SEQ ID NO: 194);
RPLAFSDAGPHVHYGWGDPIRQRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEILEDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M160) (SEQ ID NO: 196);
RDSSPLVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M69) (SEQ ID NO: 69);
RDSSPLLQWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M52) (SEQ ID NO: 52);
RHPIPDSSPLLQFGGQVRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M5) (SEQ ID NO: 5);
HPIPDSSPLLQFGGQVRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M5-R) (SEQ ID NO: 160);
HPIPDSSPLLQFGGQVRQRYLYTDDAQQTEAHLEIREDGTVGGAADQSPESLLQLKALKPGVIQILGVKTSRFLCQRPDGALYGSLHFDPEACSFRELLLEDGYNVYQSEAHSLPLHLPGNKSPHRDPAPRGPARFLPLPGLPPALPEPPGILAPQPPDVGSSDPLSMVGPSQGRSPSYAS (M71) (SEQ ID NO: 71);
HPIPDSSPLLQFGGQVRQRYLYTDDAQQTEAHLEIREDGTVGGAADQSPESLLQLKALKPGVIQILGVKTSRFLCQRPDGALYGSLHFDPEACSFRELLLEDGYNVYQSEAHGLPLHLPGNKSPHRDPAPRGPARFLPLPGLPPAPPEPPGILAPQPPDVGSSDPLSMVGPSQGRSPSYAS (M72) (SEQ ID NO: 72);
HPIPDSSPLLQFGGQVRQRYLYTDDAQQTEAHLEIREDGTVGGAADQSPESLLQLKALKPGVIQILGVKTSRFLCQRPDGALYGSLHFDPEACSFRELLLEDGYNVYQSEAHGLPLHLPGNKSPHRDPAPRGPARFLPLPGLPPALPEPPGILAPQPPDVGSSDPLSMVVQDELQGVGGEGCHMHPENCKTLLTDIDRTHTEKPVWDGITGE (M73) (SEQ ID NO: 73);
RPLAFSDASPHVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M1) (SEQ ID NO: 1 или 139);
RPLAFSDSSPLVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M2) (SEQ ID NO: 2 или 140);
RDSSPLLQFGGQVRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M48) (SEQ ID NO: 48 или 6, или 148);
RPLAFSDSSPLLQFGGQVRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M49) (SEQ ID NO: 49 или 7, или 149);
RHPIPDSSPLLQFGDQVRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEILEDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M50) (SEQ ID NO: 50);
RHPIPDSSPLLQFGGNVRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M51) (SEQ ID NO: 51 или 36, или 155);
MDSSPLLQWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M53) (SEQ ID NO: 192);
MRDSSPLVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M70) (SEQ ID NO: 70);
RPLAFSDAGPHVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEILPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M139) (SEQ ID NO: 193); или
RPLAFSDAGPHVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEILCDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M141) (SEQ ID NO: 195);
RPLAFSDAGPHVHYGWGDPIRQRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEILEDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M160) (SEQ ID NO: 196);
либо подпоследовательности или фрагмента любой из вышеприведенных пептидных последовательностей. В конкретных вариантах осуществления любой из вышеприведенных пептидных последовательностей концевой остаток R (остаток R на N-конце) делетирован.
В других вариантах осуществления пептид содержит или состоит из:
RDSSPLVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEILEDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M200) (SEQ ID NO: 197); либо ее подпоследовательности или фрагмента. В одном варианте осуществления N-концевой остаток R делетирован.
В некоторых вариантах осуществления пептид содержит или состоит из:
RPLAFSDSSPLVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEILEDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M201) (SEQ ID NO: 198); либо ее подпоследовательности или фрагмента. В одном варианте осуществления N-концевой остаток R делетирован.
В конкретных вариантах осуществления пептид содержит или состоит из:
RPLAFSDASPHVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEILEDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M202) (SEQ ID NO: 199); либо ее подпоследовательности или фрагмента. В одном варианте осуществления N-концевой остаток R делетирован.
В других вариантах осуществления пептид содержит или состоит из:
RDSSPLLQWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEILEDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M203) (SEQ ID NO: 200); либо ее подпоследовательности или фрагмента. В одном варианте осуществления N-концевой остаток R делетирован.
В некоторых вариантах осуществления пептид содержит или состоит из:
RHPIPDSSPLLQFGDQVRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEILEDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M204) (SEQ ID NO: 201); либо ее подпоследовательности или фрагмента. В одном варианте осуществления N-концевой остаток R делетирован.
В конкретных вариантах осуществления пептид содержит или состоит из:
RDSSPLLQFGGQVRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEILEDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M205) (SEQ ID NO: 202); либо ее подпоследовательности или фрагмента. В одном варианте осуществления N-концевой остаток R делетирован.
В некоторых вариантах осуществления пептид содержит или состоит из:
RHPIPDSSPLLQFGGQVRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEILEDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M206) (SEQ ID NO: 203); либо ее подпоследовательности или фрагмента. В одном варианте осуществления N-концевой остаток R делетирован.
В других вариантах осуществления пептид содержит или состоит из:
MRDSSPLVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEILEDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M207) (SEQ ID NO: 204); либо ее подпоследовательности или фрагмента.
В некоторых вариантах осуществления пептид представляет собой вариантный пептид, обозначенный M139. В одном варианте осуществления пептид содержит аминокислотную последовательность, приведенную в SEQ ID NO: 193. В других вариантах осуществления пептид состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 193. В некоторых вариантах осуществления пептид представляет собой вариантный пептид, обозначенный M140. В одном варианте осуществления пептид содержит аминокислотную последовательность, приведенную в SEQ ID NO: 194. В других вариантах осуществления пептид состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 194. В некоторых вариантах осуществления пептид представляет собой вариантный пептид, обозначенный M141. В одном варианте осуществления пептид содержит аминокислотную последовательность, приведенную в SEQ ID NO: 195. В других вариантах осуществления пептид состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 195. В некоторых вариантах осуществления пептид представляет собой вариантный пептид, обозначенный M160. В одном варианте осуществления пептид содержит аминокислотную последовательность, приведенную в SEQ ID NO: 196. В других вариантах осуществления пептид состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 196. В некоторых вариантах осуществления пептид представляет собой вариантный пептид, обозначенный M200. В одном варианте осуществления пептид содержит аминокислотную последовательность, приведенную в SEQ ID NO: 197. В других вариантах осуществления пептид состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 197. В некоторых вариантах осуществления пептид представляет собой вариантный пептид, обозначенный M201. В одном варианте осуществления пептид содержит аминокислотную последовательность, приведенную в SEQ ID NO: 198. В других вариантах осуществления пептид состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 198. В других вариантах осуществления пептид представляет собой вариантный пептид, обозначенный M202. В некоторых вариантах осуществления пептид содержит аминокислотную последовательность, приведенную в SEQ ID NO: 199. В других вариантах осуществления пептид состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 199. В конкретных вариантах осуществления пептид представляет собой вариантный пептид, обозначенный M203. В одном варианте осуществления пептид содержит аминокислотную последовательность, приведенную в SEQ ID NO: 200. В других вариантах осуществления пептид состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 200. В некоторых вариантах осуществления пептид представляет собой вариантный пептид, обозначенный M204. В одном варианте осуществления пептид содержит аминокислотную последовательность, приведенную в SEQ ID NO: 201. В других вариантах осуществления пептид состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 201. В другом варианте осуществления пептид представляет собой вариантный пептид, обозначенный M205. В некоторых вариантах осуществления пептид содержит аминокислотную последовательность, приведенную в SEQ ID NO: 202. В других вариантах осуществления пептид состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 202. В других вариантах осуществления пептид представляет собой вариантный пептид, обозначенный M206. В некоторых вариантах осуществления пептид содержит аминокислотную последовательность, приведенную в SEQ ID NO: 203. В других вариантах осуществления пептид состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 203. В других вариантах осуществления пептид представляет собой вариантный пептид, обозначенный M207. В некоторых вариантах осуществления пептид содержит аминокислотную последовательность, приведенную в SEQ ID NO: 204. В других вариантах осуществления пептид состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 204.
В различных дополнительных конкретных аспектах N-конец пептидной последовательности содержит или состоит из любой из последовательностей:
HPIPDSSPLLQFGGQVRLRHLYTSG (M5-R) (аминокислоты 1-25 в SEQ ID NO: 160);
DSSPLLQFGGQVRLRHLYTSG (M6-R) (аминокислоты 2-22 в SEQ ID NO: 6);
RPLAFSDSSPLLQFGGQVRLRHLYTSG (M7) (аминокислоты 1-27 в SEQ ID NO: 7);
HPIPDSSPLLQWGDPIRLRHLYTSG (M8-R) (аминокислоты 2-26 в SEQ ID NO: 8);
HPIPDSSPLLQFGWGDPIRLRHLYTSG (M9-R) (аминокислоты 2-28 в SEQ ID NO: 9);
HPIPDSSPHVHYGWGDPIRLRHLYTSG (M10-R) (аминокислоты 2-28 в SEQ ID NO: 10);
RPLAFSDAGPLLQWGDPIRLRHLYTSG (M11) (аминокислоты 1-27 в SEQ ID NO: 11);
RPLAFSDAGPLLQFGWGDPIRLRHLYTSG (M12) (аминокислоты 1-29 в SEQ ID NO: 12);
RPLAFSDAGPLLQFGGQVRLRHLYTSG (M13) (аминокислоты 1-27 в SEQ ID NO: 13);
HPIPDSSPHVHYGGQVRLRHLYTSG (M14-R) (аминокислоты 2-26 в SEQ ID NO: 14);
RPLAFSDAGPHVHYGGQVRLRHLYTSG (M15) (аминокислоты 1-27 в SEQ ID NO: 15);
RPLAFSDAGPHVHWGDPIRLRHLYTSG (M16) (аминокислоты 1-27 в SEQ ID NO: 16);
RPLAFSDAGPHVGWGDPIRLRHLYTSG (M17) (аминокислоты 1-27 в SEQ ID NO: 17);
RPLAFSDAGPHYGWGDPIRLRHLYTSG (M18) (аминокислоты 1-27 в SEQ ID NO: 18);
RPLAFSDAGPVYGWGDPIRLRHLYTSG (M19) (аминокислоты 1-27 в SEQ ID NO: 19);
RPLAFSDAGPVHGWGDPIRLRHLYTSG (M20) (аминокислоты 1-27 в SEQ ID NO: 20);
RPLAFSDAGPVHYWGDPIRLRHLYTSG (M21) (аминокислоты 1-27 в SEQ ID NO: 21);
RPLAFSDAGPHVHGWGDPIRLRHLYTSG (M22) (аминокислоты 1-27 в SEQ ID NO: 22);
RPLAFSDAGPHHGWGDPIRLRHLYTSG (M23) (аминокислоты 1-27 в SEQ ID NO: 23);
RPLAFSDAGPHHYWGDPIRLRHLYTSG (M24) (аминокислоты 1-27 в SEQ ID NO: 24);
RPLAFSDAGPHVYWGDPIRLRHLYTSG (M25) (аминокислоты 1-27 в SEQ ID NO: 25);
RPLAFSDSSPLVHWGDPIRLRHLYTSG (M26) (аминокислоты 1-27 в SEQ ID NO: 26);
RPLAFSDSSPHVHWGDPIRLRHLYTSG (M27) (аминокислоты 1-27 в SEQ ID NO: 27);
RPLAFSDAGPHVWGDPIRLRHLYTSG (M28) (аминокислоты 1-26 в SEQ ID NO: 28);
RPLAFSDAGPHVHYWGDPIRLRHLYTSG (M29) (аминокислоты 1-28 в SEQ ID NO: 29);
RPLAFSDAGPHVHYAWGDPIRLRHLYTSG (M30) (аминокислоты 1-29 в SEQ ID NO: 30);
RHPIPDSSPLLQFGAQVRLRHLYTSG (M31) (аминокислоты 1-26 в SEQ ID NO: 31);
RHPIPDSSPLLQFGDQVRLRHLYTSG (M32) (аминокислоты 1-26 в SEQ ID NO: 32);
RHPIPDSSPLLQFGPQVRLRHLYTSG (M33) (аминокислоты 1-26 в SEQ ID NO: 33);
RHPIPDSSPLLQFGGAVRLRHLYTSG (M34) (аминокислоты 1-26 в SEQ ID NO: 34);
RHPIPDSSPLLQFGGEVRLRHLYTSG (M35) (аминокислоты 1-26 в SEQ ID NO: 35);
RHPIPDSSPLLQFGGNVRLRHLYTSG (M36) (аминокислоты 1-26 в SEQ ID NO: 36);
RHPIPDSSPLLQFGGQARLRHLYTSG (M37) (аминокислоты 1-26 в SEQ ID NO: 37);
RHPIPDSSPLLQFGGQIRLRHLYTSG (M38) (аминокислоты 1-26 в SEQ ID NO: 38);
RHPIPDSSPLLQFGGQTRLRHLYTSG (M39) (аминокислоты 1-26 в SEQ ID NO: 39);
RHPIPDSSPLLQFGWGQPVRLRHLYTSG (M40) (аминокислоты 1-28 в SEQ ID NO: 40);
DAGPHVHYGWGDPIRLRHLYTSG (M74-R) (аминокислоты 2-24 в SEQ ID NO: 74);
VHYGWGDPIRLRHLYTSG (M75-R) (аминокислоты 2-19 в SEQ ID NO: 75);
RLRHLYTSG (M77-R) (аминокислоты 2-10 в SEQ ID NO: 77);
RHPIPDSSPLLQFGWGDPIRLRHLYTSG (M9) (аминокислоты 1-28 в SEQ ID NO: 9);
RHPIPDSSPLLQWGDPIRLRHLYTSG (M8) (аминокислоты 1-26 в SEQ ID NO: 8);
RPLAFSDAGPLLQFGWGDPIRLRHLYTSG (M12) (аминокислоты 1-29 в SEQ ID NO: 12);
RHPIPDSSPHVHYGWGDPIRLRHLYTSG (M10) (аминокислоты 1-28 в SEQ ID NO: 10);
RPLAFSDAGPLLQFGGQVRLRHLYTSG (M13) (аминокислоты 1-27 в SEQ ID NO: 13);
RHPIPDSSPHVHYGGQVRLRHLYTSG (M14) (аминокислоты 1-26 в SEQ ID NO: 14);
RPLAFSDAGPHVHYGGDIRLRHLYTSG (M43) аминокислоты 1-27 в SEQ ID NO: 43); или
RDSSPLLQFGGQVRLRHLYTSG (M6) (аминокислоты 1-22 в SEQ ID NO: 6);
или любой из вышеприведенных пептидных последовательностей, в которой амино-концевой остаток R делетирован.
В конкретных вариантах осуществления пептид содержит или состоит из любой из последовательностей:
HPIPDSSPLLQFGGQVRLRHLYTSG (M5-R) (аминокислоты 1-25 в SEQ ID NO: 160);
DSSPLLQFGGQVRLRHLYTSG (M6-R) (аминокислоты 2-22 в SEQ ID NO: 6);
RPLAFSDSSPLLQFGGQVRLRHLYTSG (M7) (аминокислоты 1-27 в SEQ ID NO: 7);
HPIPDSSPLLQWGDPIRLRHLYTSG (M8-R) (аминокислоты 2-26 в SEQ ID NO: 8);
HPIPDSSPLLQFGWGDPIRLRHLYTSG (M9-R) (аминокислоты 2-28 в SEQ ID NO: 9);
HPIPDSSPHVHYGWGDPIRLRHLYTSG (M10-R) (аминокислоты 2-28 в SEQ ID NO: 10);
RPLAFSDAGPLLQWGDPIRLRHLYTSG (M11) (аминокислоты 1-27 в SEQ ID NO: 11);
RPLAFSDAGPLLQFGWGDPIRLRHLYTSG (M12) (аминокислоты 1-29 в SEQ ID NO: 12);
RPLAFSDAGPLLQFGGQVRLRHLYTSG (M13) (аминокислоты 1-27 в SEQ ID NO: 13);
HPIPDSSPHVHYGGQVRLRHLYTSG (M14-R) (аминокислоты 2-26 в SEQ ID NO: 14);
RPLAFSDAGPHVHYGGQVRLRHLYTSG (M15) (аминокислоты 1-27 в SEQ ID NO: 15);
RPLAFSDAGPHVHWGDPIRLRHLYTSG (M16) (аминокислоты 1-27 в SEQ ID NO: 16);
RPLAFSDAGPHVGWGDPIRLRHLYTSG (M17) (аминокислоты 1-27 в SEQ ID NO: 17);
RPLAFSDAGPHYGWGDPIRLRHLYTSG (M18) (аминокислоты 1-27 в SEQ ID NO: 18);
RPLAFSDAGPVYGWGDPIRLRHLYTSG (M19) (аминокислоты 1-27 в SEQ ID NO: 19);
RPLAFSDAGPVHGWGDPIRLRHLYTSG (M20) (аминокислоты 1-27 в SEQ ID NO: 20);
RPLAFSDAGPVHYWGDPIRLRHLYTSG (M21) (аминокислоты 1-27 в SEQ ID NO: 21);
RPLAFSDAGPHVHGWGDPIRLRHLYTSG (M22) (аминокислоты 1-27 в SEQ ID NO: 22);
RPLAFSDAGPHHGWGDPIRLRHLYTSG (M23) (аминокислоты 1-27 в SEQ ID NO: 23);
RPLAFSDAGPHHYWGDPIRLRHLYTSG (M24) (аминокислоты 1-27 в SEQ ID NO: 24);
RPLAFSDAGPHVYWGDPIRLRHLYTSG (M25) (аминокислоты 1-27 в SEQ ID NO: 25);
RPLAFSDSSPLVHWGDPIRLRHLYTSG (M26) (аминокислоты 1-27 в SEQ ID NO: 26);
RPLAFSDSSPHVHWGDPIRLRHLYTSG (M27) (аминокислоты 1-27 в SEQ ID NO: 27);
RPLAFSDAGPHVWGDPIRLRHLYTSG (M28) (аминокислоты 1-26 в SEQ ID NO: 28);
RPLAFSDAGPHVHYWGDPIRLRHLYTSG (M29) (аминокислоты 1-28 в SEQ ID NO: 29);
RPLAFSDAGPHVHYAWGDPIRLRHLYTSG (M30) (аминокислоты 1-29 в SEQ ID NO: 30);
RHPIPDSSPLLQFGAQVRLRHLYTSG (M31) (аминокислоты 1-26 в SEQ ID NO: 31);
RHPIPDSSPLLQFGDQVRLRHLYTSG (M32) (аминокислоты 1-26 в SEQ ID NO: 32);
RHPIPDSSPLLQFGPQVRLRHLYTSG (M33) (аминокислоты 1-26 в SEQ ID NO: 33);
RHPIPDSSPLLQFGGAVRLRHLYTSG (M34) (аминокислоты 1-26 в SEQ ID NO: 34);
RHPIPDSSPLLQFGGEVRLRHLYTSG (M35) (аминокислоты 1-26 в SEQ ID NO: 35);
RHPIPDSSPLLQFGGNVRLRHLYTSG (M36) (аминокислоты 1-26 в SEQ ID NO: 36);
RHPIPDSSPLLQFGGQARLRHLYTSG (M37) (аминокислоты 1-26 в SEQ ID NO: 37);
RHPIPDSSPLLQFGGQIRLRHLYTSG (M38) (аминокислоты 1-26 в SEQ ID NO: 38);
RHPIPDSSPLLQFGGQTRLRHLYTSG (M39) (аминокислоты 1-26 в SEQ ID NO: 39);
RHPIPDSSPLLQFGWGQPVRLRHLYTSG (M40) (аминокислоты 1-28 в SEQ ID NO: 40);
DAGPHVHYGWGDPIRLRHLYTSG (M74-R) (аминокислоты 2-24 в SEQ ID NO: 74);
VHYGWGDPIRLRHLYTSG (M75-R) (аминокислоты 2-19 в SEQ ID NO: 75);
RLRHLYTSG (M77-R) (аминокислоты 2-10 в SEQ ID NO: 77);
RHPIPDSSPLLQFGWGDPIRLRHLYTSG (M9) (аминокислоты 1-28 в SEQ ID NO: 9);
RHPIPDSSPLLQWGDPIRLRHLYTSG (M8) (аминокислоты 1-26 в SEQ ID NO: 8);
RPLAFSDAGPLLQFGWGDPIRLRHLYTSG (M12) (аминокислоты 1-29 в SEQ ID NO: 12);
RHPIPDSSPHVHYGWGDPIRLRHLYTSG (M10) (аминокислоты 1-28 в SEQ ID NO: 10);
RPLAFSDAGPLLQFGGQVRLRHLYTSG (M13) (аминокислоты 1-27 в SEQ ID NO: 13);
RHPIPDSSPHVHYGGQVRLRHLYTSG (M14) (аминокислоты 1-26 в SEQ ID NO: 14);
RPLAFSDAGPHVHYGGDIRLRHLYTSG (M43) аминокислоты 1-27 в SEQ ID NO: 43); или
RDSSPLLQFGGQVRLRHLYTSG (M6) (аминокислоты 1-22 в SEQ ID NO: 6). В некоторых вариантах осуществления пептид содержит одну из вышеприведенных последовательностей. В другом варианте осуществления пептид состоит из одной из вышеприведенных последовательностей. В некоторых вариантах осуществления пептид содержит C-концевую область, содержащую часть SEQ ID NO: 99 (FGF19), C-концевую область, имеющую первое аминокислотное положение и последнее аминокислотное положение,
при этом C-концевая область содержит аминокислотные остатки 16-29 из SEQ ID NO: 99 (FGF19), WGDPIRLRHLYTSG (SEQ ID NO: 169), причем остаток W соответствует первому аминокислотному положению в C-концевой области.
В различных других конкретных аспектах пептидная последовательность содержит или состоит из:
HPIPDSSPLLQFGGQVRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (SEQ ID NO: 160);
DSSPLLQFGGQVRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (SEQ ID NO: 138 или 161);
RPLAFSDASPHVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (SEQ ID NO: 1 или 139);
RPLAFSDSSPLVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (SEQ ID NO: 2 или 140); или
DSSPLVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (SEQ ID NO: 141);
либо подпоследовательности или фрагмента любой из вышеприведенных пептидных последовательностей. В конкретных вариантах осуществления любой из вышеприведенных пептидных последовательностей концевой остаток R делетирован.
В следующих вариантах осуществления пептидная последовательность содержит или состоит из:
MRDSSPLVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M70) (SEQ ID NO: 70), либо ее подпоследовательности или фрагмента.
В следующих вариантах осуществления пептидная последовательность содержит или состоит из:
RDSSPLVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M69) (SEQ ID NO: 69), либо ее подпоследовательности или фрагмента.
В конкретных вариантах осуществления пептидная последовательность имеет добавленные аминокислотные остатки 30-194 из SEQ ID NO: 99 (FGF19) на C-конце, образуя химерный полипептид. В некоторых вариантах осуществления пептидная последовательность имеет по меньшей мере одну аминокислотную замену в аминокислотных остатках 125-129 из SEQ ID NO: 99 (FGF19), EIRPD. В других вариантах осуществления пептидная последовательность имеет по меньшей мере одну аминокислотную замену в аминокислотных остатках 126-128 из SEQ ID NO: 99 (FGF19), IRP. В других вариантах осуществления пептидная последовательность имеет по меньшей мере одну аминокислотную замену в аминокислотных остатках 127-128 из SEQ ID NO: 99 (FGF19), RP. В других вариантах осуществления пептидная последовательность имеет по меньшей мере одну аминокислотную замену в аминокислотных остатках 1-124 из SEQ ID NO: 99 (FGF19) и/или в аминокислотных остатках 130-194 из SEQ ID NO: 99 (FGF19). Например, в конкретных вариантах осуществления пептидная последовательность имеет замену в одном из аминокислотных остатков 127-128 из SEQ ID NO: 99 (FGF19), RP, причем по меньшей мере одна аминокислотная замена представляет собой R127L или P128E. Указанные замены в составе соответствующей последовательности FGF19 (например, EIRPD, IRP или RP) вариантного пептида, предложенного в настоящем документе, также подразумеваются. В конкретных вариантах осуществления пептид имеет как R127L, так и P128E замену в аминокислотных остатках 127-128 из SEQ ID NO: 99 (FGF19), RP, или соответствующей им последовательности FGF19 в вариантном пептиде, предложенном в настоящем документе. В конкретных вариантах осуществления аминокислотная последовательность пептида имеет по меньшей мере одну аминокислотную замену в области петли-8 из FGF19 или соответствующей ей последовательности FGF19 в вариантном пептиде, предложенном в настоящем документе. В конкретных вариантах осуществления аминокислотная последовательность пептида имеет одну аминокислотную замену в аминокислотной последовательности EIRPD (аминокислоты 2-6 в SEQ ID NO: 190) в области петли-8 из FGF19. В некоторых вариантах осуществления аминокислотная последовательность пептида имеет две аминокислотные замены в аминокислотной последовательности EIRPD (аминокислоты 2-6 в SEQ ID NO: 190) в области петли-8 из FGF19. В других вариантах осуществления аминокислотная последовательность пептида имеет три аминокислотные замены в аминокислотной последовательности EIRPD (аминокислоты 2-6 в SEQ ID NO: 190) в области петли-8 из FGF19. В конкретных вариантах осуществления аминокислотная последовательность пептида имеет четыре аминокислотные замены в аминокислотной последовательности EIRPD (аминокислоты 2-6 в SEQ ID NO: 190) в области петли-8 из FGF19. В некоторых вариантах осуществления аминокислотная последовательность пептида имеет пять аминокислотных замен в аминокислотной последовательности EIRPD (аминокислоты 2-6 в SEQ ID NO: 190) в области петли-8 из FGF19. В конкретных вариантах осуществления аминокислотная последовательность пептида имеет одну аминокислотную замену в аминокислотной последовательности IRP (аминокислоты 3-5 в SEQ ID NO: 190) в области петли-8 из FGF19. В некоторых вариантах осуществления аминокислотная последовательность пептида имеет две аминокислотные замены в аминокислотной последовательности IRP (аминокислоты 3-5 в SEQ ID NO: 190) в области петли-8 из FGF19. В других вариантах осуществления аминокислотная последовательность пептида имеет три аминокислотные замены в аминокислотной последовательности IRP (аминокислоты 3-5 в SEQ ID NO: 190) в области петли-8 из FGF19. В конкретных вариантах осуществления аминокислотная последовательность пептида имеет одну аминокислотную замену в аминокислотной последовательности RP (аминокислоты 4-5 в SEQ ID NO: 190) в области петли-8 из FGF19. В некоторых вариантах осуществления аминокислотная последовательность пептида имеет две аминокислотные замены в аминокислотной последовательности RP (аминокислоты 4-5 в SEQ ID NO: 190) в области петли-8 из FGF19. В конкретных вариантах осуществления аминокислотная замена в аминокислотной последовательности RP (аминокислоты 4-5 в SEQ ID NO: 190) в области петли-8 из FGF19 представляет собой замену Arg (R) на Leu (L). В других вариантах осуществления замена в аминокислотной последовательности RP (аминокислоты 4-5 в SEQ ID NO: 190) в области петли-8 из FGF19 представляет собой замену Pro (P) на Glu (E). В некоторых вариантах осуществления замена в аминокислотной последовательности RP (аминокислоты 4-5 в SEQ ID NO: 190) в области петли-8 из FGF19 представляет собой замену Arg (R) на Leu (L) и замену Pro (P) на Glu (E). В конкретных вариантах осуществления вышеуказанная замена(ы) в области петли-8 из FGF19 находится в соответствующей ей последовательности FGF19 в вариантном пептиде, предложенном в настоящем документе. То есть, указанные замены в составе соответствующей последовательности FGF19 (например, EIRPD, IRP или RP) вариантного пептида, предложенного в настоящем документе, также подразумеваются.
Пептидные или химерные последовательности, предложенные в настоящем документе, могут быть любой подходящей длины. В конкретных вариантах осуществления N-концевая или C-концевая область пептидной или химерной последовательности имеет длину от примерно 20 до примерно 200 аминокислотных остатков. В других конкретных вариантах осуществления химерная пептидная последовательность или пептидная последовательность имеет по меньшей мере одну аминокислотную делецию. В других конкретных аспектах пептидная или химерная последовательность имеет 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более аминокислотных делеций с амино-конца, карбокси-конца или внутри последовательности. В одном варианте осуществления аминокислотная замена или делеция имеет место в любом из аминокислотных положений 8-20 в FGF19 (AGPHVHYGWGDPI) (SEQ ID NO: 187). В других конкретных вариантах осуществления пептидная или химерная последовательность имеет N-концевую область или C-концевую область, которая содержит или состоит из аминокислотной последовательности из примерно 5-10, 10-20, 20-30, 30-40, 40-50, 50-60, 60-70, 70-80, 80-90, 90-100 или более аминокислот. В дополнительных более конкретных вариантах осуществления пептидная или химерная последовательность имеет часть последовательности FGF19 или часть последовательности FGF21, которая содержит или состоит из аминокислотной последовательности из примерно 5-10, 10-20, 20-30, 30-40, 40-50, 50-60, 60-70, 70-80, 80-90, 90-100 или более аминокислот из FGF19 или FGF21.
В различных других вариантах осуществления пептидная или химерная последовательность имеет аминокислотную замену, добавление, вставку, или представляет собой подпоследовательность, в которой по меньшей мере одна аминокислота делетирована. Такие аминокислотные замены, добавления, вставки и делеции в пептидной последовательности могут составлять 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более аминокислотных остатков (10-20, 20-30, 30-40, 40-50 и так далее), например, на N- или C-конце, или внутри последовательности. Например, подпоследовательность, которая имеет 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более аминокислотных делеций с амино-конца, карбокси-конца или внутри последовательности. В конкретном аспекте аминокислотная замена или делеция имеет место в любом из аминокислотных положений 8-20 в FGF19 (AGPHVHYGWGDPI) (SEQ ID NO: 187).
В различных более конкретных вариантах осуществления пептидная или химерная последовательность содержит всю или часть последовательности FGF19, приведенную далее:
PHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (SEQ ID NO: 188), расположенную на C-конце пептида, или амино-концевой остаток «R» делетирован из последовательности.
В различных вариантах осуществления пептидная или химерная последовательность имеет функцию или активность, которая больше или меньше, чем у последовательности сравнения. В других конкретных вариантах осуществления химерные пептидные последовательности и пептидные последовательности имеют конкретные функции или активности. В одном аспекте химерная пептидная последовательность или пептидная последовательность имеет сохраненную или повышенную активность, опосредованную рецептором 4 фактора роста фибробластов (FGFR4). В дополнительных аспектах химерная пептидная последовательность или пептидная последовательность связывается с FGFR4 или активирует FGFR4, или заметно не связывается с FGFR4 или не активирует FGFR4, или связывается с FGFR4 с аффинностью, меньшей, сопоставимой или большей, чем аффинность связывания FGF19 для FGFR4, или активирует FGFR4 до степени или величины, меньшей, сопоставимой или большей, чем в случае, когда FGF19 активирует FGFR4. В некоторых вариантах осуществления химерная пептидная последовательность или пептидная последовательность, предложенная в настоящем документе, активирует FGFR4 до степени или величины, меньшей, чем степень или величина в случае, когда FGF19 активирует FGFR4. В одном варианте осуществления химерная пептидная последовательность или пептидная последовательность, предложенная в настоящем документе, активирует FGFR4 до степени или величины, сопоставимой со степенью или величиной в случае, когда FGF19 активирует FGFR4. В одном варианте осуществления химерная пептидная последовательность или пептидная последовательность, предложенная в настоящем документе, активирует FGFR4 до степени или величины, большей, чем степень или величина в случае, когда FGF19 активирует FGFR4.
В одном варианте осуществления химерная пептидная последовательность или пептидная последовательность, предложенная в настоящем документе, имеет сохраненную опосредованную FGFR4 активность. В одном варианте осуществления химерная пептидная последовательность или пептидная последовательность, предложенная в настоящем документе, имеет повышенную опосредованную FGFR4 активность. В некоторых вариантах осуществления химерная пептидная последовательность или пептидная последовательность, предложенная в настоящем документе, связывается с FGFR4 с аффинностью, меньшей, чем аффинность связывания FGF19 для FGFR4. В одном варианте осуществления химерная пептидная последовательность или пептидная последовательность, предложенная в настоящем документе, связывается с FGFR4 с аффинностью, сопоставимой с аффинностью связывания FGF19 для FGFR4. В некоторых вариантах осуществления химерная пептидная последовательность или пептидная последовательность, предложенная в настоящем документе, связывается с FGFR4 с аффинностью, большей, чем аффинность связывания FGF19 для FGFR4. В одном варианте осуществления химерная пептидная последовательность или пептидная последовательность, предложенная в настоящем документе, заметно не связывается с FGFR4.
В следующих аспектах химерная пептидная последовательность или пептидная последовательность обладает пониженной способностью вызывать образование HCC по сравнению с FGF19 или вариантной последовательностью FGF19, имеющей любую из последовательностей GQV, GDI, WGPI (SEQ ID NO: 171), WGDPV (SEQ ID NO: 172), WGDI (SEQ ID NO: 173), GDPI (SEQ ID NO: 174), GPI, WGQPI (SEQ ID NO: 175), WGAPI (SEQ ID NO: 176), AGDPI (SEQ ID NO: 177), WADPI (SEQ ID NO: 178), WGDAI (SEQ ID NO: 179), WGDPA (SEQ ID NO: 180), WDPI (SEQ ID NO: 181), WGDI (SEQ ID NO: 182), WGDP (SEQ ID NO: 183) или FGDPI (SEQ ID NO: 184) вместо последовательности WGDPI (SEQ ID NO: 170) в аминокислотах 16-20 из FGF19; или обладает повышенной снижающей уровень глюкозы активностью по сравнению с FGF19 или вариантной последовательностью FGF19, имеющей любую из последовательностей GQV, GDI, WGPI (SEQ ID NO: 171), WGDPV (SEQ ID NO: 172), WGDI (SEQ ID NO: 173), GDPI (SEQ ID NO: 174), GPI, WGQPI (SEQ ID NO: 175), WGAPI (SEQ ID NO: 176), AGDPI (SEQ ID NO: 177), WADPI (SEQ ID NO: 178), WGDAI (SEQ ID NO: 179), WGDPA (SEQ ID NO: 180), WDPI (SEQ ID NO: 181), WGDI (SEQ ID NO: 182), WGDP (SEQ ID NO: 183) или FGDPI (SEQ ID NO: 184) вместо последовательности WGDPI (SEQ ID NO: 170) в аминокислотах 16-20 из FGF19; обладает меньшей повышающей уровень липидов активностью по сравнению с FGF19 или вариантной последовательностью FGF19, имеющей любую из последовательностей GQV, GDI, WGPI (SEQ ID NO: 171), WGDPV (SEQ ID NO: 172), WGDI (SEQ ID NO: 173), GDPI (SEQ ID NO: 174), GPI, WGQPI (SEQ ID NO: 175), WGAPI (SEQ ID NO: 176), AGDPI (SEQ ID NO: 177), WADPI (SEQ ID NO: 178), WGDAI (SEQ ID NO: 179), WGDPA (SEQ ID NO: 180), WDPI (SEQ ID NO: 181), WGDI (SEQ ID NO: 182), WGDP (SEQ ID NO: 183) или FGDPI (SEQ ID NO: 184) вместо последовательности WGDPI (SEQ ID NO: 170) в аминокислотах 16-20 из FGF19; или обладает меньшей повышающей уровень триглицеридов, холестерина, не-ЛВП, или большей повышающей уровень ЛВП активностью по сравнению с FGF19 или вариантной последовательностью FGF19, имеющей любую из последовательностей GQV, GDI, WGPI (SEQ ID NO: 171), WGDPV (SEQ ID NO: 172), WGDI (SEQ ID NO: 173), GDPI (SEQ ID NO: 174), GPI, WGQPI (SEQ ID NO: 175), WGAPI (SEQ ID NO: 176), AGDPI (SEQ ID NO: 177), WADPI (SEQ ID NO: 178), WGDAI (SEQ ID NO: 179), WGDPA (SEQ ID NO: 180), WDPI (SEQ ID NO: 181), WGDI (SEQ ID NO: 182), WGDP (SEQ ID NO: 183) или FGDPI (SEQ ID NO: 184) вместо последовательности WGDPI (SEQ ID NO: 170) в аминокислотах 16-20 из FGF19; или пептидная последовательность обладает меньшей снижающей безжировую массу тела активностью по сравнению с FGF21. Такие функции и активности можно определять in vitro или in vivo, например, на мышах db/db.
В одном варианте осуществления пептидная или химерная последовательность обладает функцией или активностью, большей или меньшей, чем у последовательности сравнения. В некоторых вариантах осуществления последовательность сравнения представляет собой FGF19. В другом варианте осуществления последовательность сравнения представляет собой вариантную последовательность FGF19, имеющую любую из замен GQV, GDI, WGPI (SEQ ID NO: 171), WGDPV (SEQ ID NO: 172), WGDI (SEQ ID NO: 173), GDPI (SEQ ID NO: 174), GPI, WGQPI (SEQ ID NO: 175), WGAPI (SEQ ID NO: 176), AGDPI (SEQ ID NO: 177), WADPI (SEQ ID NO: 178), WGDAI (SEQ ID NO: 179), WGDPA (SEQ ID NO: 180), WDPI (SEQ ID NO: 181), WGDI (SEQ ID NO: 182), WGDP (SEQ ID NO: 183) или FGDPI (SEQ ID NO: 184) вместо последовательности WGDPI (SEQ ID NO: 170) в аминокислотах 16-20 из FGF19. В одном варианте осуществления пептидная или химерная пептидная последовательность, предложенная в настоящем документе, обладает большей снижающей уровень глюкозы активностью по сравнению с последовательностью сравнения. В другом варианте осуществления пептидная или химерная пептидная последовательность, предложенная в настоящем документе, обладает меньшей повышающей уровень липидов активностью по сравнению с последовательностью сравнения. В другом варианте осуществления пептидная или химерная пептидная последовательность, предложенная в настоящем документе, обладает меньшей повышающей уровень липидов (например, триглицеридов, холестерина, не-ЛВП) активностью по сравнению с последовательностью сравнения. В других вариантах осуществления пептидная или химерная пептидная последовательность, предложенная в настоящем документе, обладает большей повышающей уровень ЛВП активностью по сравнению с последовательностью сравнения. В другом варианте осуществления пептидная или химерная пептидная последовательность, предложенная в настоящем документе, обладает меньшей снижающей безжировую массу тела активностью по сравнению с последовательностью сравнения или FGF21.
В различных других дополнительных вариантах осуществления пептидная или химерная последовательность содержит одну или более L-аминокислот, D-аминокислот, неприродных аминокислот, либо миметиков, производных или аналогов аминокислот. В различных других вариантах осуществления пептидная или химерная последовательность имеет N-концевую область или C-концевую область, или часть последовательности FGF19, или часть последовательности FGF21, связанные через линкер или спейсер.
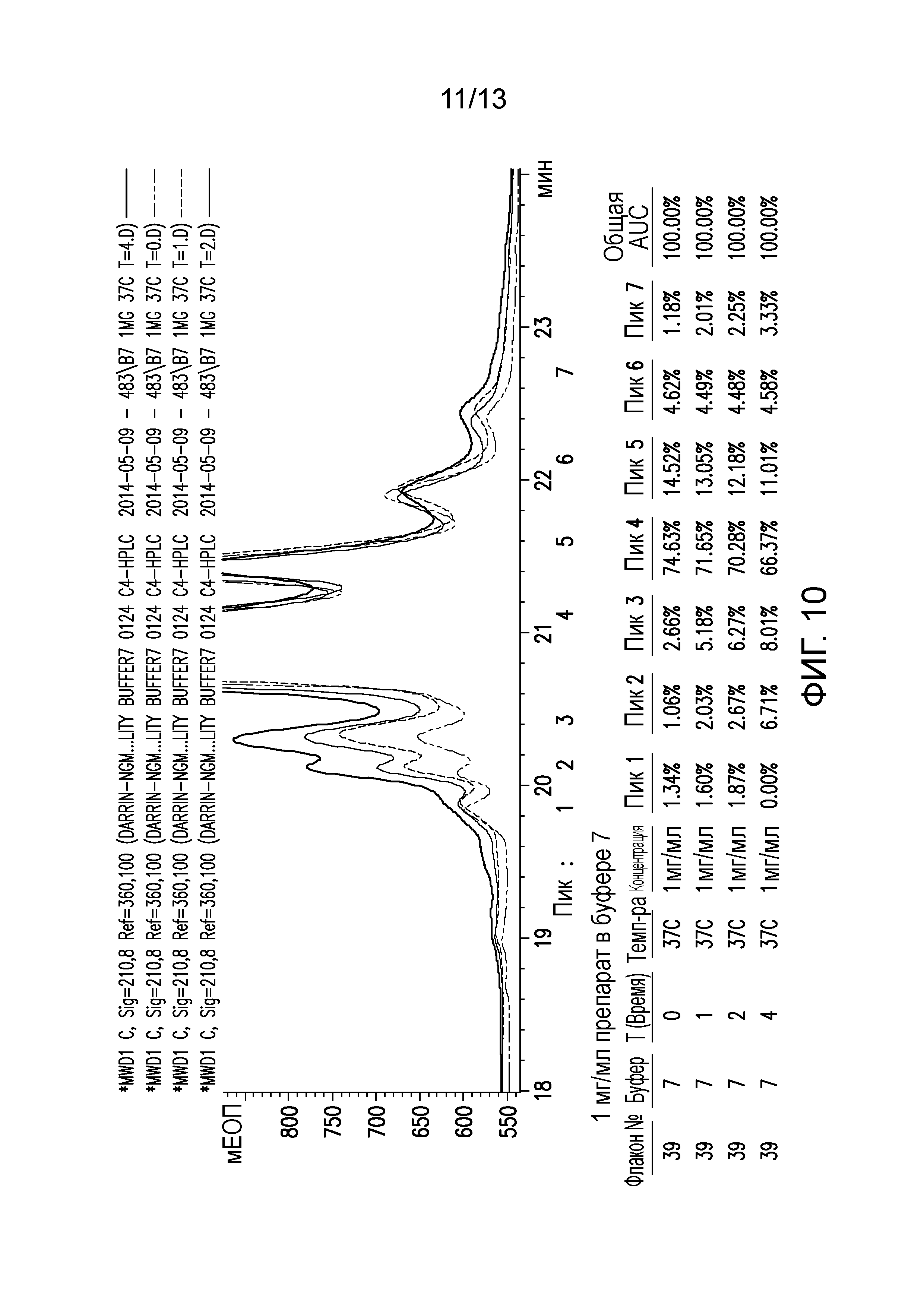
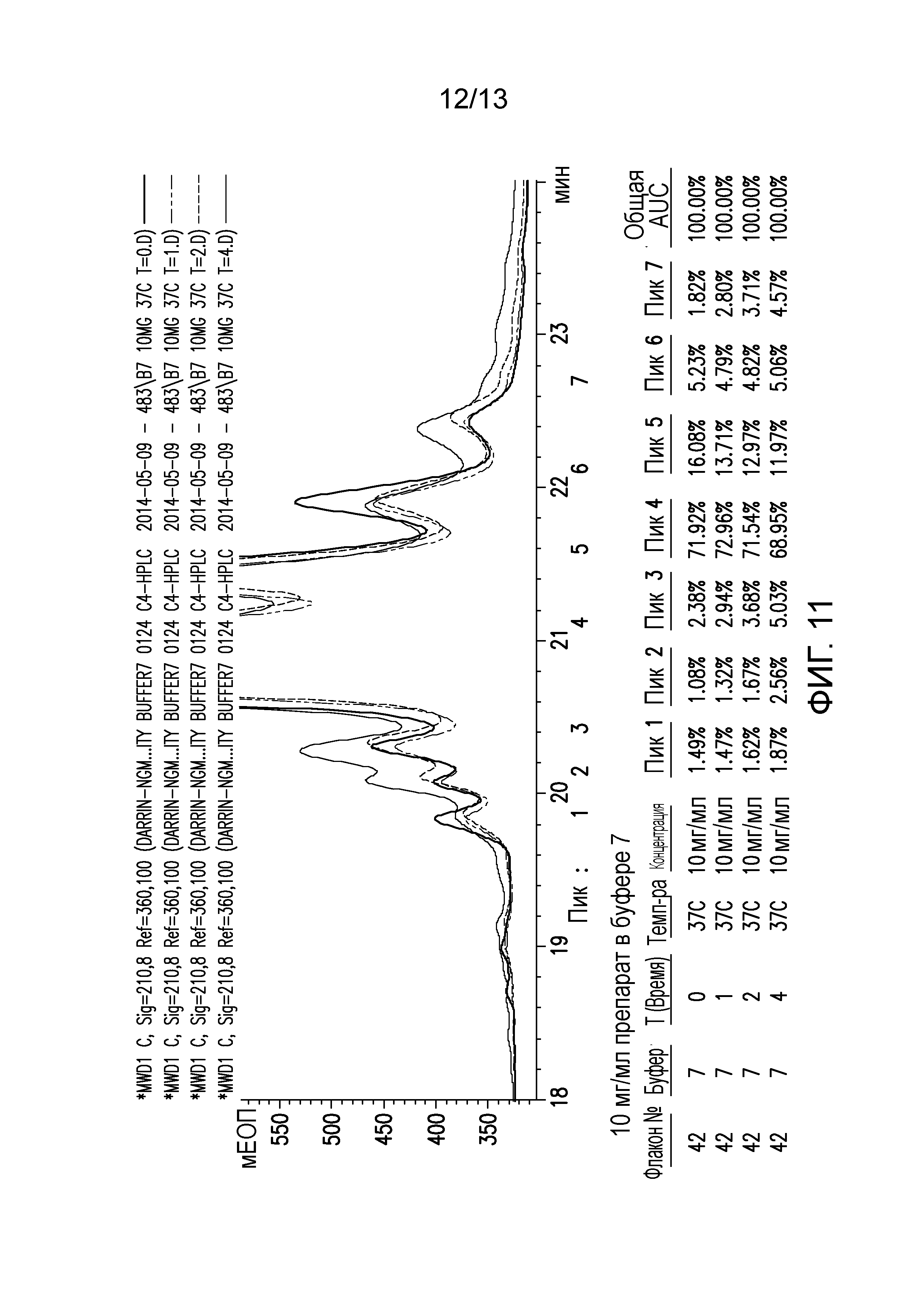
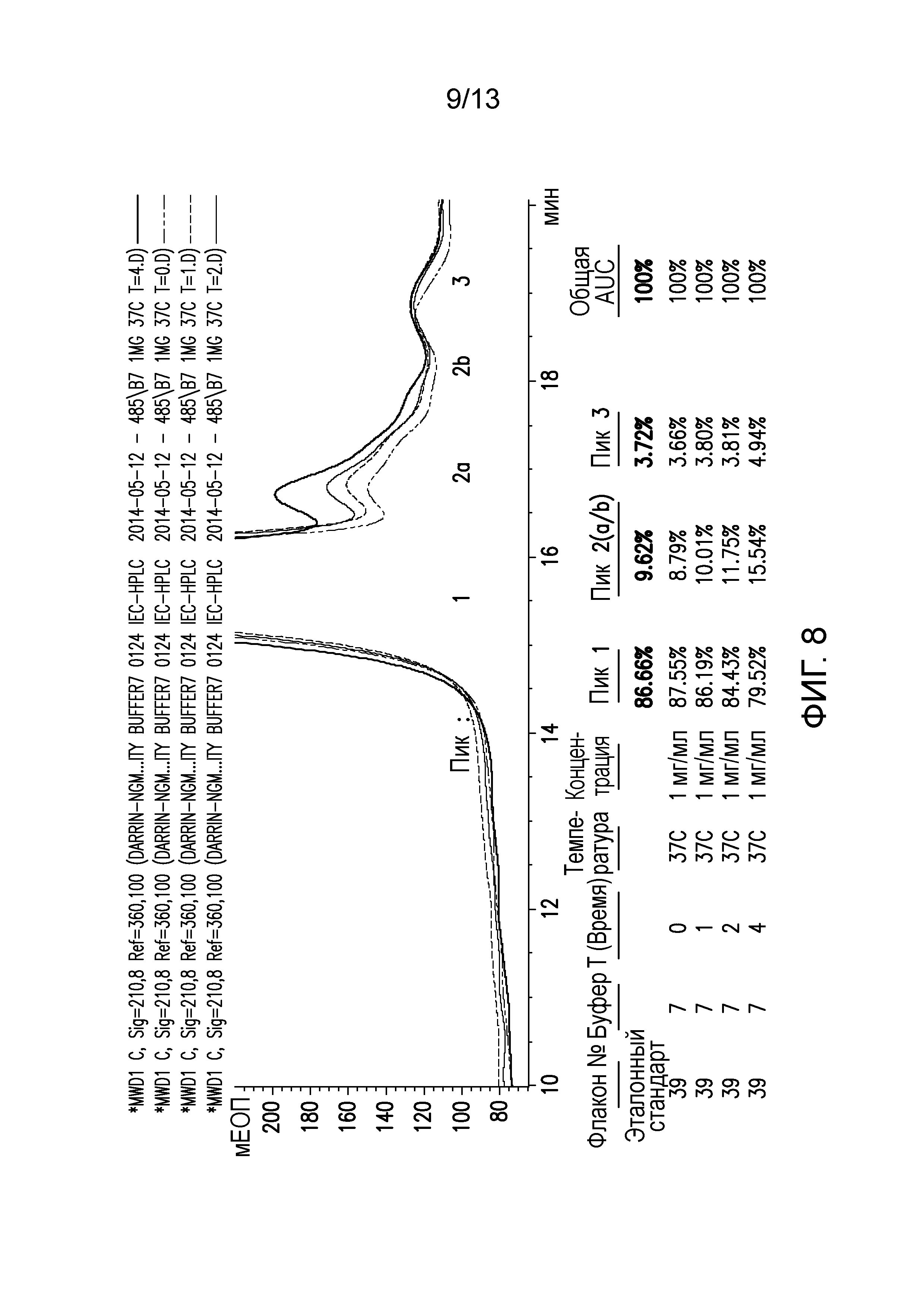
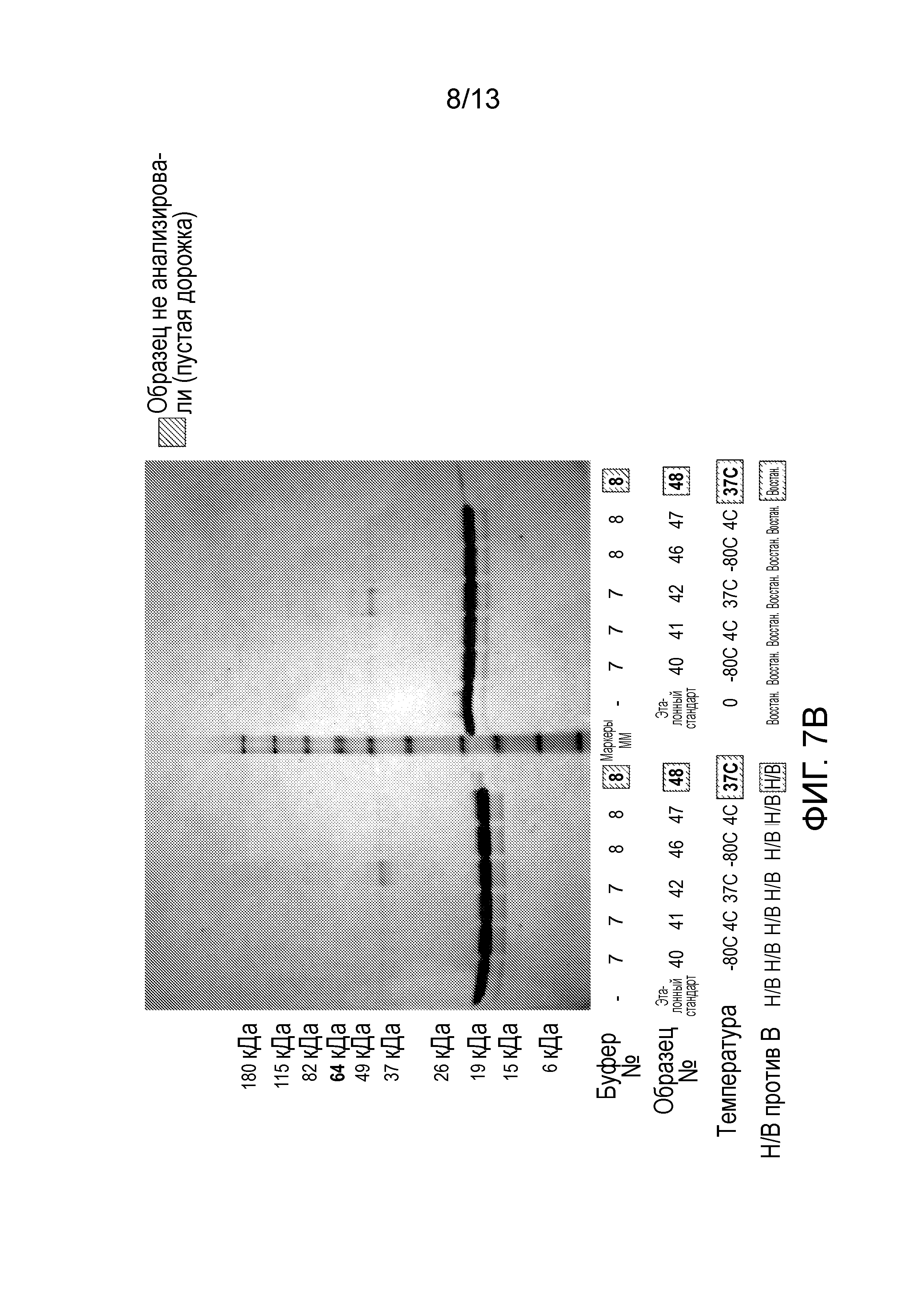
В конкретных вариантах осуществления фармацевтическая композиция, предложенная в настоящем документе, находится в жидкой лекарственной форме. В некоторых вариантах осуществления пептид присутствует в концентрации от 1 до 10 мг/мл. В одном варианте осуществления пептид присутствует в концентрации 1 мг/мл. В другом варианте осуществления пептид присутствует в концентрации 5 мг/мл. В некоторых вариантах осуществления пептид присутствует в концентрации 10 мг/мл. В одном варианте осуществления пептид содержит аминокислотную последовательность SEQ ID NO: 70. В некоторых вариантах осуществления пептид состоит из аминокислотной последовательности SEQ ID NO: 70. В одном варианте осуществления пептид содержит или состоит из аминокислотной последовательности SEQ ID NO: 204.
В некоторых вариантах осуществления фармацевтических композиций, предложенных в настоящем документе, Tris присутствует в диапазоне концентраций 5-50 мМ, 15-40 мМ, 20-35 мМ, 20-30 мМ или 20-25 мМ. В одном варианте осуществления Tris присутствует в концентрации 20 мМ. В некоторых вариантах осуществления препарат объемом 1000 мл содержит 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9 или 3,0 г Tris, или любое значение в этом диапазоне. В одном варианте осуществления препарат объемом 1000 мл содержит 2,4-2,5 г Tris.
В некоторых вариантах осуществления различных фармацевтических композиций, предложенных в настоящем документе, трегалоза присутствует в диапазоне концентраций 1-20%, 2-15%, 3-10%, 4-9,5%, 5-9,25%, 6-9%, 7-8,5%, 8-8,4% или 8,1-8,3%. В одном варианте осуществления трегалоза присутствует в концентрации 8,2%, 8,3% или 8,4%. В некоторых вариантах осуществления препарат объемом 1000 мл содержит 92,0, 92,1, 92,2, 92,3, 92,4, 92,5, 92,6, 92,7, 92,8, 92,9 или 93,0 г трегалозы дигидрата. В одном варианте осуществления препарат объемом 1000 мл содержит 92,4-92,5 г трегалозы дигидрата. В некоторых вариантах осуществления молярность трегалозы дигидрата составляет 240-300 мМ, 240-290 мМ, 250-290 мМ, 260-290 мМ, 270-290 мМ или 244-245 мМ. В одном варианте осуществления молярность трегалозы дигидрата составляет примерно 280 мМ.
В некоторых вариантах осуществления различных фармацевтических композиций, предложенных в настоящем документе, концентрация TWEEN-20 находится в диапазоне 0,001-0,1% (по объему), 0,0025-0,075% (по объему), 0,005-0,05% (по объему) или 0,0075-0,025% (по объему). В одном варианте осуществления концентрация TWEEN-20 составляет 0,01% (по объему).
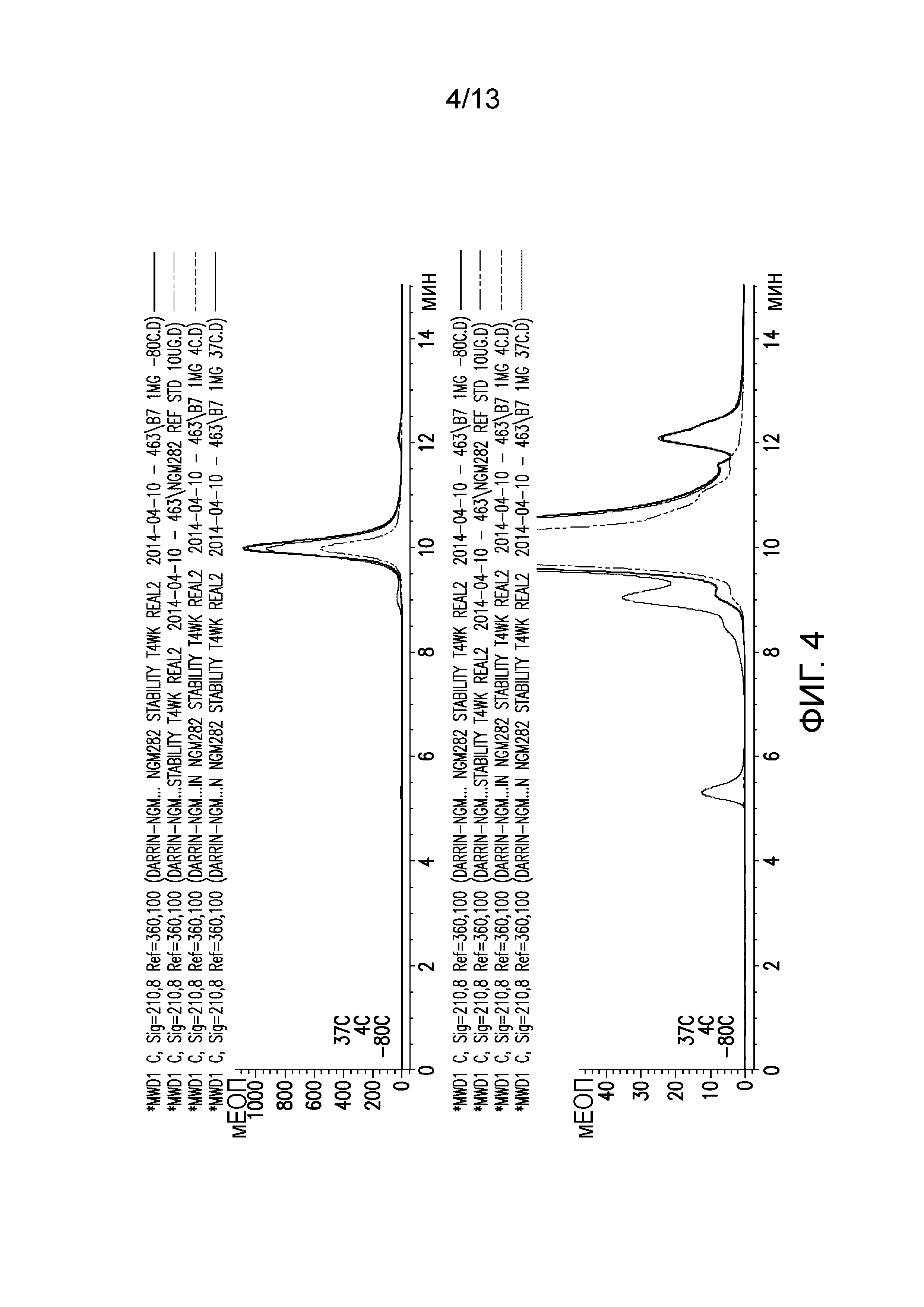
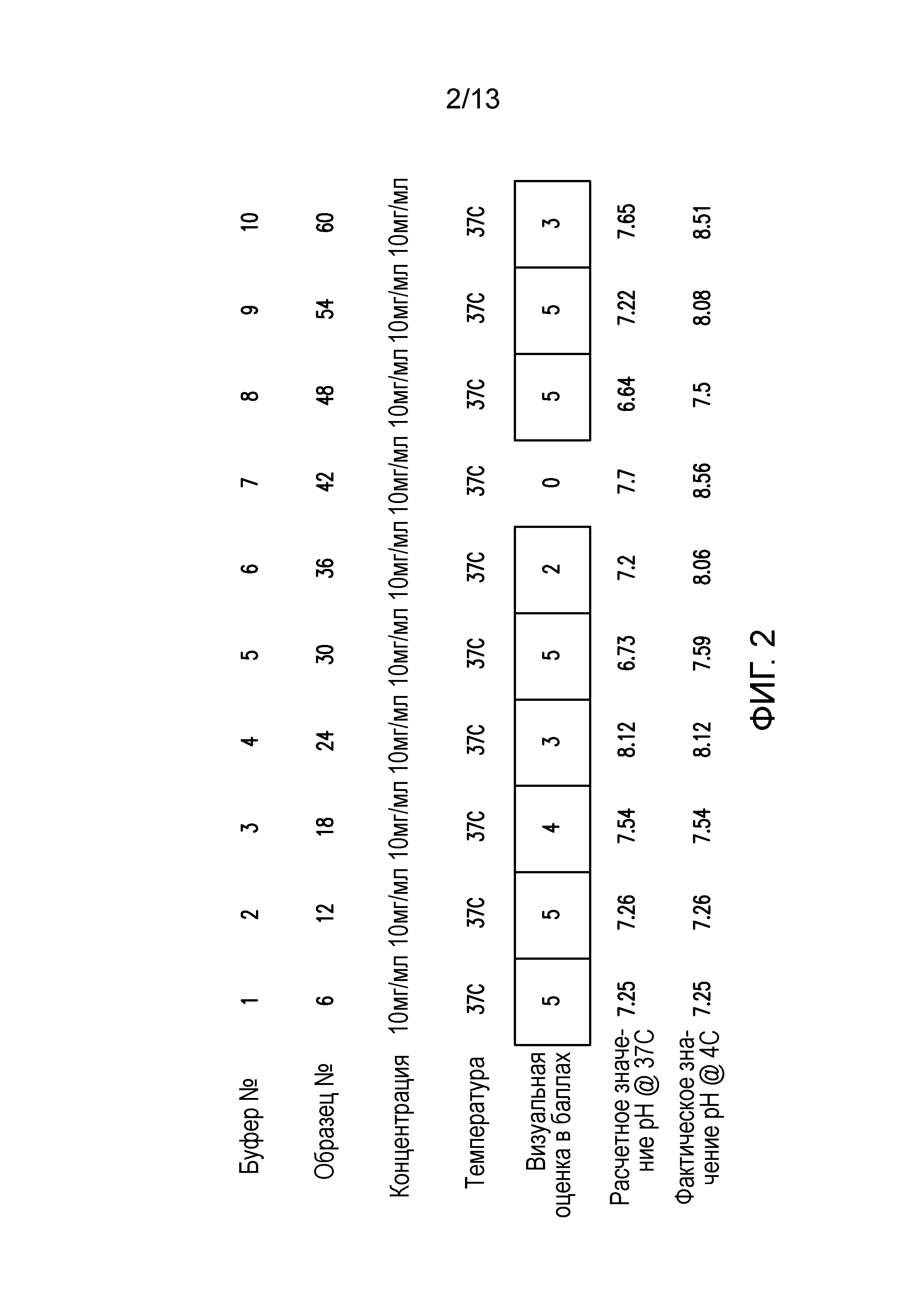
В некоторых вариантах осуществления различных фармацевтических композиций, предложенных в настоящем документе, фармацевтическая композиция имеет значение pH в диапазоне 6,5-9,5, 6,8-9,3, 7,0-9,0, 7,3-8,7, 7,5-8,5 или 7,7-8,2. В одном варианте осуществления фармацевтическая композиция имеет значение pH 7,3, 7,5, 8,0 или 8,5. В некоторых вариантах осуществления значение pH измеряют при температуре 4°C. В одном варианте осуществления значение pH измеряют при температуре 25°C.
В некоторых вариантах осуществления различных фармацевтических композиций, предложенных в настоящем документе, композиции содержат 20 мМ Tris, 8,37% (масс/об) трегалозы и 0,01% TWEEN-20. В одном варианте осуществления различных фармацевтических композиций, предложенных в настоящем документе, композиции содержат 20 мМ Tris, 8,3% (масс/об) трегалозы и 0,01% TWEEN-20. В одном варианте осуществления различных фармацевтических композиций, предложенных в настоящем документе, композиции содержат 20 мМ Tris, 8,2% (масс/об) трегалозы и 0,01% TWEEN-20. В некоторых вариантах осуществления различных фармацевтических композиций, предложенных в настоящем документе, композиции содержат 20 мМ Tris, 280 мМ трегалозы и 0,01% TWEEN-20. В одном варианте осуществления значение pH составляет 8,0 при температуре 25°C. В некоторых вариантах осуществления полипептид содержит SEQ ID NO: 70. В других вариантах осуществления полипептид состоит из SEQ ID NO: 70. В некоторых вариантах осуществления полипептид содержит SEQ ID NO: 69. В других вариантах осуществления полипептид состоит из SEQ ID NO: 69. В некоторых вариантах осуществления полипептид слит с Fc-фрагментом антитела человека.
В настоящем документе также предложена фармацевтическая композиция, содержащая: (A) пептид, содержащий или состоящий из SEQ ID NO: 70, и (B) фармацевтически приемлемый носитель, содержащий: (i) 20 мМ Tris, (ii) от 8,2% до 8,4% (масс/об) трегалозы и (iii) 0,01% TWEEN-20. В настоящем документе также предложена фармацевтическая композиция, содержащая: (A) пептид, содержащий или состоящий из SEQ ID NO: 69, и (B) фармацевтически приемлемый носитель, содержащий: (i) 20 мМ Tris, (ii) от 8,2% до 8,4% (масс/об) трегалозы и (iii) 0,01% TWEEN-20. В настоящем документе также предложена фармацевтическая композиция, содержащая: (A) пептид, содержащий или состоящий из SEQ ID NO: 70, и (B) фармацевтически приемлемый носитель, содержащий: (i) 20 мМ Tris, (ii) от 8,37% (масс/об) трегалозы и (iii) 0,01% TWEEN-20. В настоящем документе также предложена фармацевтическая композиция, содержащая: (A) пептид, содержащий или состоящий из SEQ ID NO: 69, и (B) фармацевтически приемлемый носитель, содержащий: (i) 20 мМ Tris, (ii) от 8,37% (масс/об) трегалозы и (iii) 0,01% TWEEN-20. В настоящем документе также предложена фармацевтическая композиция, содержащая: (A) пептид, содержащий или состоящий из SEQ ID NO: 70, и (B) фармацевтически приемлемый носитель, содержащий: (i) 20 мМ Tris, (ii) от 8,3% (масс/об) трегалозы и (iii) 0,01% TWEEN-20. В настоящем документе также предложена фармацевтическая композиция, содержащая: (A) пептид, содержащий или состоящий из SEQ ID NO: 69, и (B) фармацевтически приемлемый носитель, содержащий: (i) 20 мМ Tris, (ii) от 8,3% (масс/об) трегалозы и (iii) 0,01% TWEEN-20. В настоящем документе также предложена фармацевтическая композиция, содержащая: (A) пептид, содержащий или состоящий из SEQ ID NO: 70, и (B) фармацевтически приемлемый носитель, содержащий: (i) 20 мМ Tris, (ii) от 8,2% (масс/об) трегалозы и (iii) 0,01% TWEEN-20. В настоящем документе также предложена фармацевтическая композиция, содержащая: (A) пептид, содержащий или состоящий из SEQ ID NO: 69, и (B) фармацевтически приемлемый носитель, содержащий: (i) 20 мМ Tris, (ii) от 8,2% (масс/об) трегалозы и (iii) 0,01% TWEEN-20. В некоторых вариантах осуществления полипептид содержит SEQ ID NO: 70. В других вариантах осуществления полипептид состоит из SEQ ID NO: 70. В некоторых вариантах осуществления полипептид содержит SEQ ID NO: 69. В других вариантах осуществления полипептид состоит из SEQ ID NO: 69. В некоторых вариантах осуществления полипептид слит с Fc-фрагментом антитела человека.
В настоящем документе также предложена фармацевтическая композиция, содержащая: (A) пептид, содержащий или состоящий из SEQ ID NO: 70, и (B) фармацевтически приемлемый носитель, содержащий: (i) 20 мМ Tris, (ii) от 8,2% до 8,4% (масс/об) трегалозы и (iii) 0,01% TWEEN-20; при этом значение pH составляет 8,0 при температуре 25°C. В настоящем документе также предложена фармацевтическая композиция, содержащая: (A) пептид, содержащий или состоящий из SEQ ID NO: 69, и (B) фармацевтически приемлемый носитель, содержащий: (i) 20 мМ Tris, (ii) от 8,2% до 8,4% (масс/об) трегалозы и (iii) 0,01% TWEEN-20; при этом значение pH составляет 8,0 при температуре 25°C. В настоящем документе также предложена фармацевтическая композиция, содержащая: (A) пептид, содержащий или состоящий из SEQ ID NO: 70, и (B) фармацевтически приемлемый носитель, содержащий: (i) 20 мМ Tris, (ii) от 8,37% (масс/об) трегалозы и (iii) 0,01% TWEEN-20; при этом значение pH составляет 8,0 при температуре 25°C. В настоящем документе также предложена фармацевтическая композиция, содержащая: (A) пептид, содержащий или состоящий из SEQ ID NO: 69, и (B) фармацевтически приемлемый носитель, содержащий: (i) 20 мМ Tris, (ii) от 8,37% (масс/об) трегалозы и (iii) 0,01% TWEEN-20; при этом значение pH составляет 8,0 при температуре 25°C. В настоящем документе также предложена фармацевтическая композиция, содержащая: (A) пептид, содержащий или состоящий из SEQ ID NO: 70, и (B) фармацевтически приемлемый носитель, содержащий: (i) 20 мМ Tris, (ii) от 8,3% (масс/об) трегалозы и (iii) 0,01% TWEEN-20; при этом значение pH составляет 8,0 при температуре 25°C. В настоящем документе также предложена фармацевтическая композиция, содержащая: (A) пептид, содержащий или состоящий из SEQ ID NO: 69, и (B) фармацевтически приемлемый носитель, содержащий: (i) 20 мМ Tris, (ii) от 8,3% (масс/об) трегалозы и (iii) 0,01% TWEEN-20; при этом значение pH составляет 8,0 при температуре 25°C. В настоящем документе также предложена фармацевтическая композиция, содержащая: (A) пептид, содержащий или состоящий из SEQ ID NO: 70, и (B) фармацевтически приемлемый носитель, содержащий: (i) 20 мМ Tris, (ii) от 8,2% (масс/об) трегалозы и (iii) 0,01% TWEEN-20; при этом значение pH составляет 8,0 при температуре 25°C. В настоящем документе также предложена фармацевтическая композиция, содержащая: (A) пептид, содержащий или состоящий из SEQ ID NO: 69, и (B) фармацевтически приемлемый носитель, содержащий: (i) 20 мМ Tris, (ii) от 8,2% (масс/об) трегалозы и (iii) 0,01% TWEEN-20; при этом значение pH составляет 8,0 при температуре 25°C.
В некоторых вариантах осуществления полипептид содержит SEQ ID NO: 70. В других вариантах осуществления полипептид состоит из SEQ ID NO: 70. В некоторых вариантах осуществления полипептид содержит SEQ ID NO: 69. В других вариантах осуществления полипептид состоит из SEQ ID NO: 69. В некоторых вариантах осуществления полипептид слит с Fc-фрагментом антитела человека.
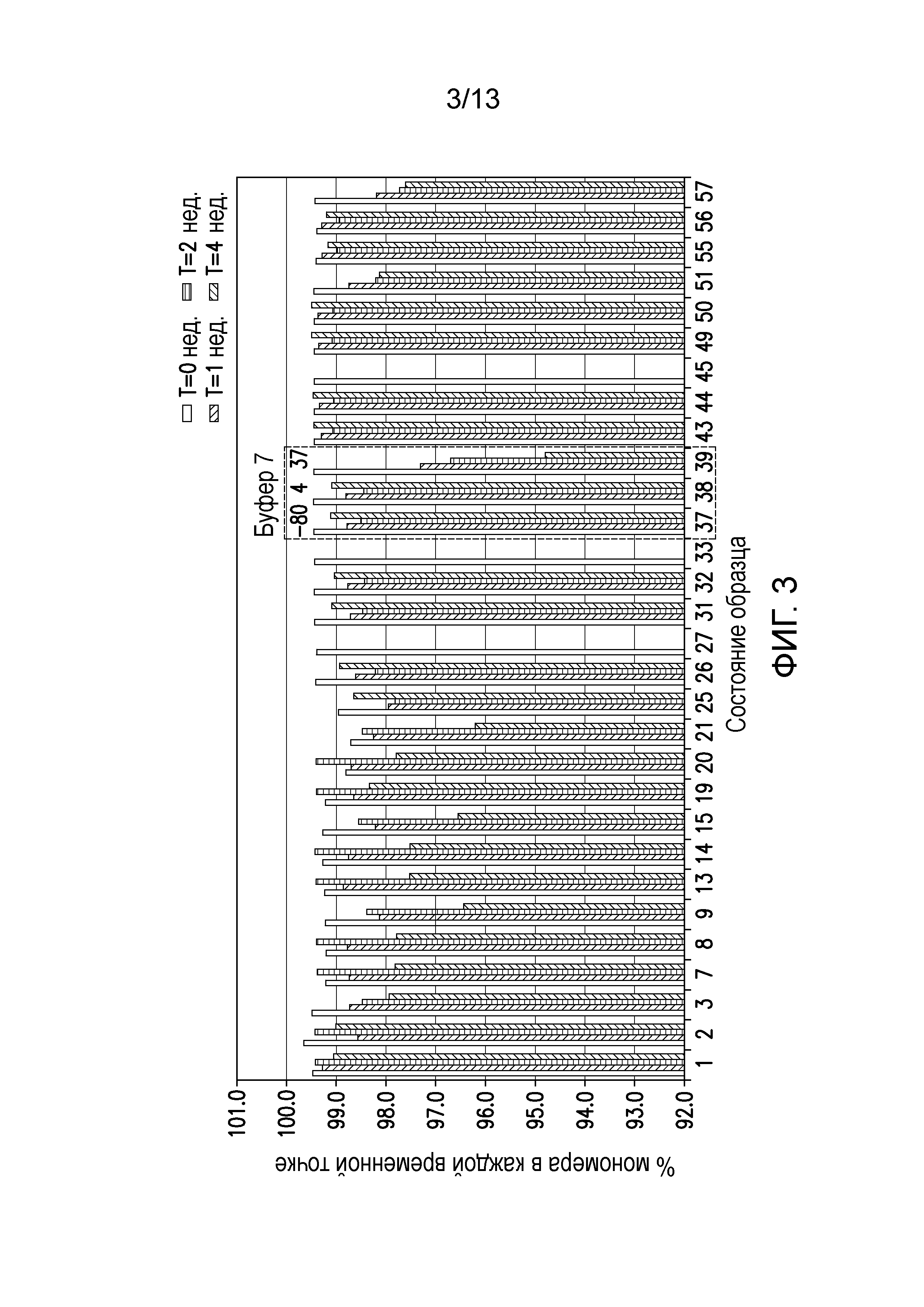
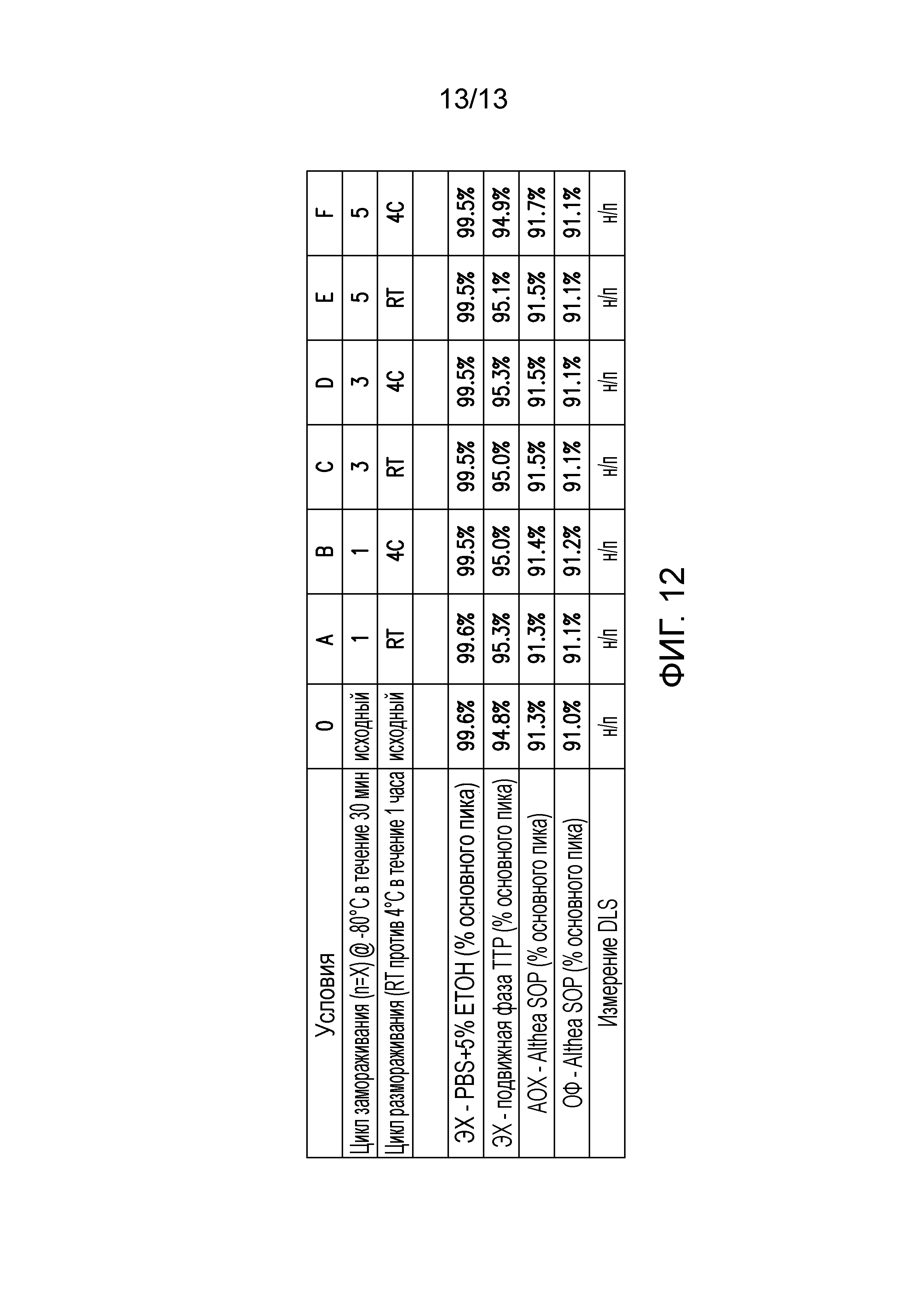
В некоторых вариантах осуществления различных фармацевтических композиций, предложенных в настоящем документе, фармацевтическая композиция не содержит соль. В одном варианте осуществления фармацевтическая композиция не содержит NaCl.
В некоторых вариантах осуществления различных фармацевтических композиций, предложенных в настоящем документе, фармацевтическая композиция находится в жидкой форме. В конкретных вариантах осуществления фармацевтическая композиция является лиофилизированной.
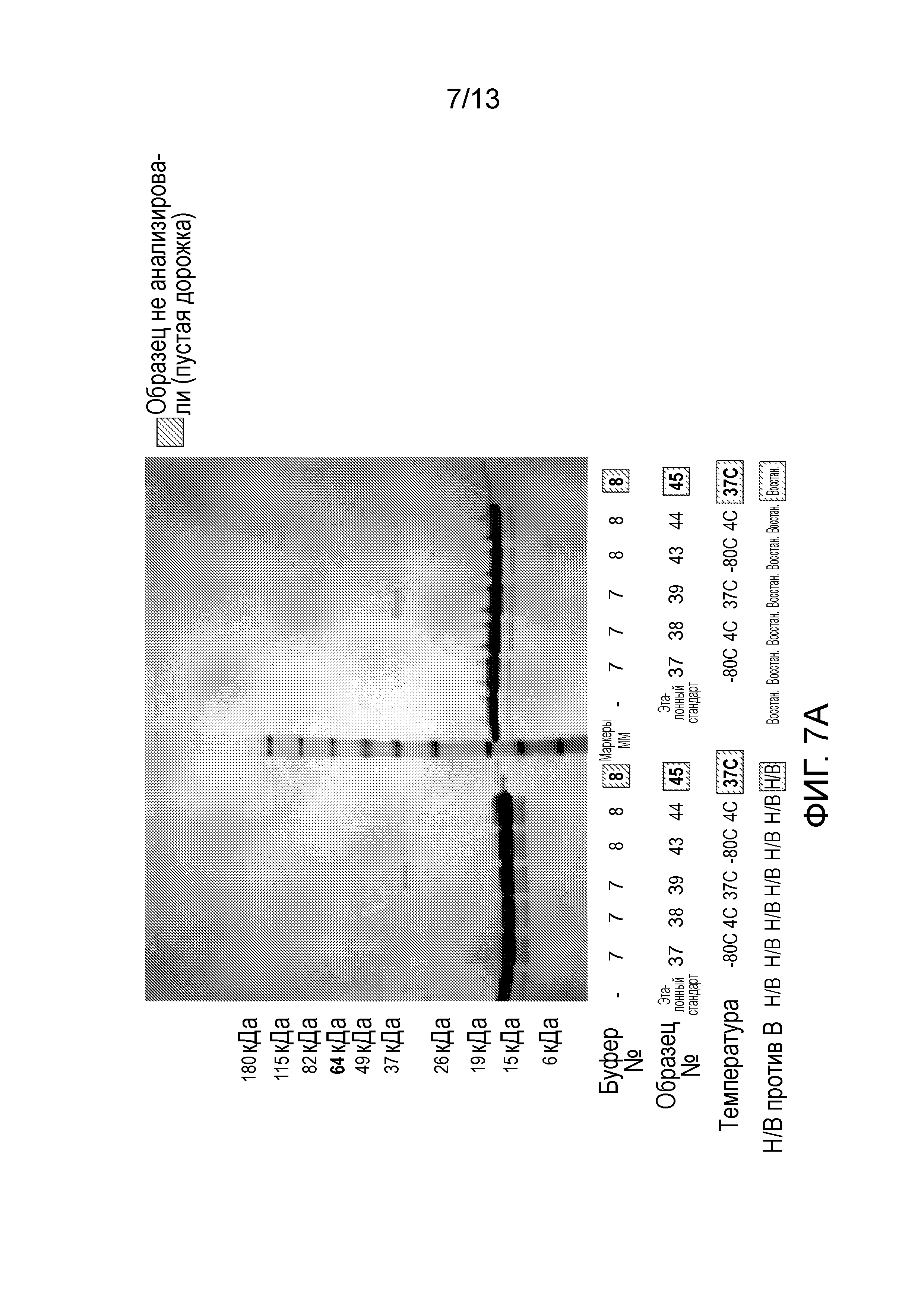
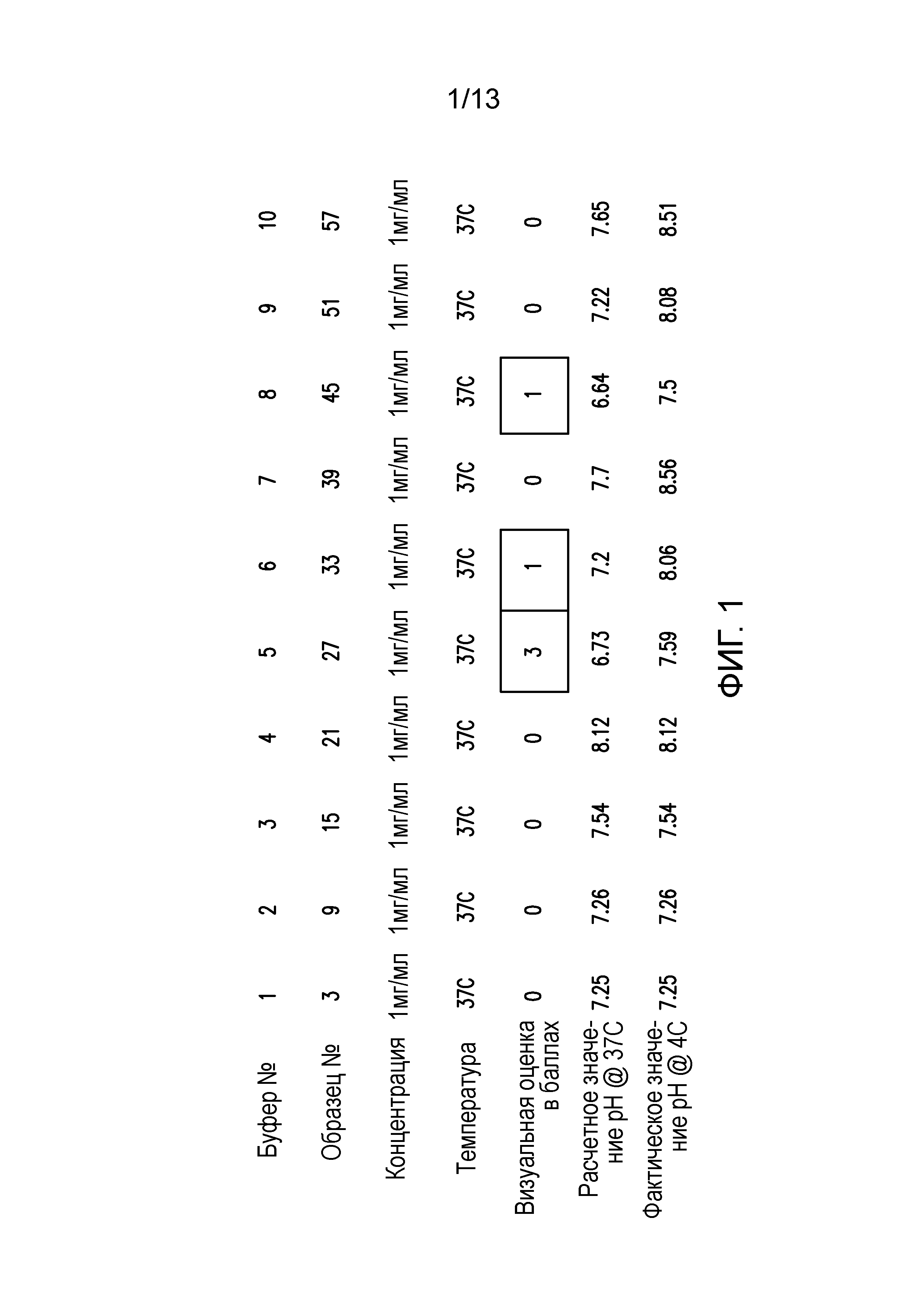
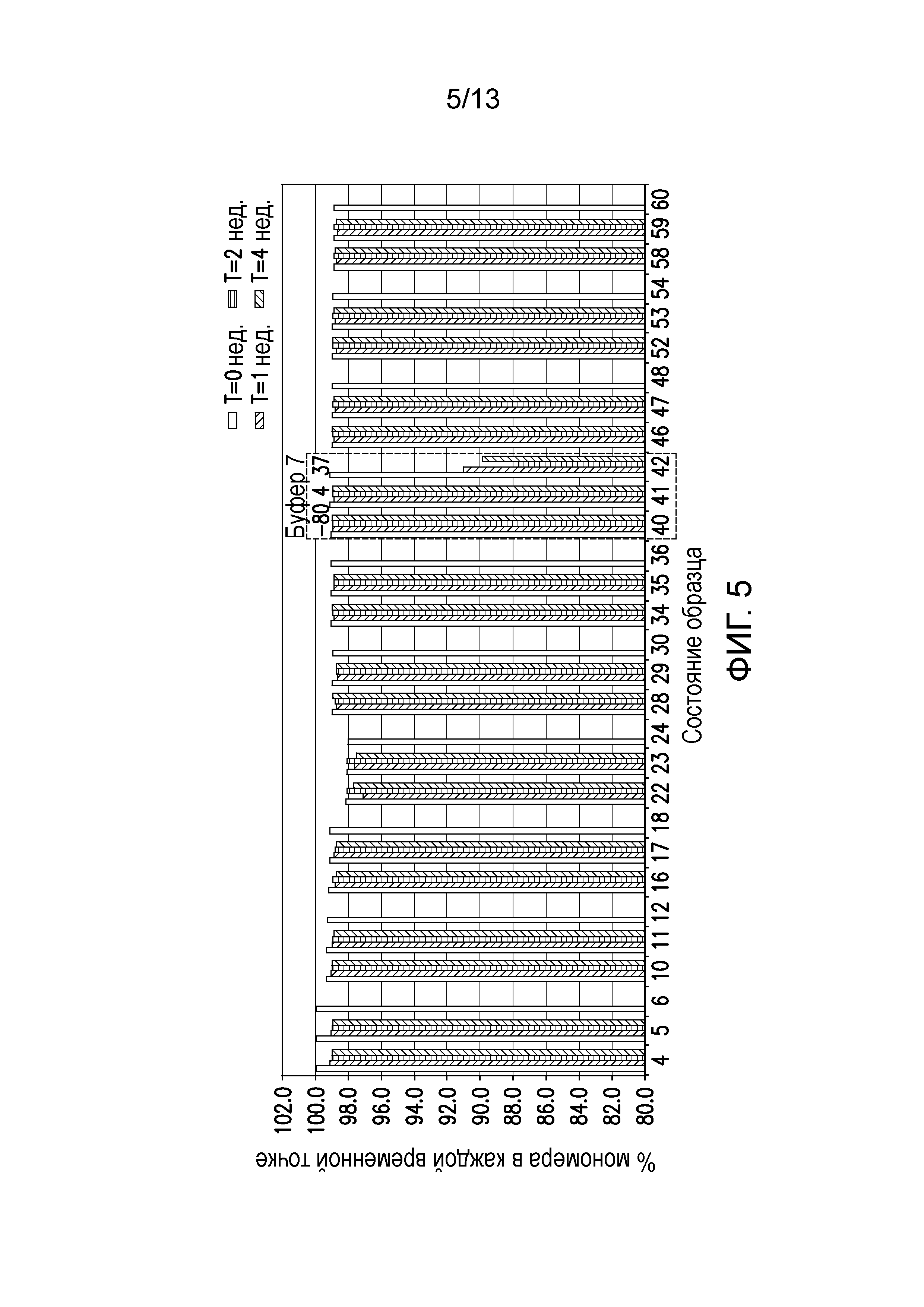
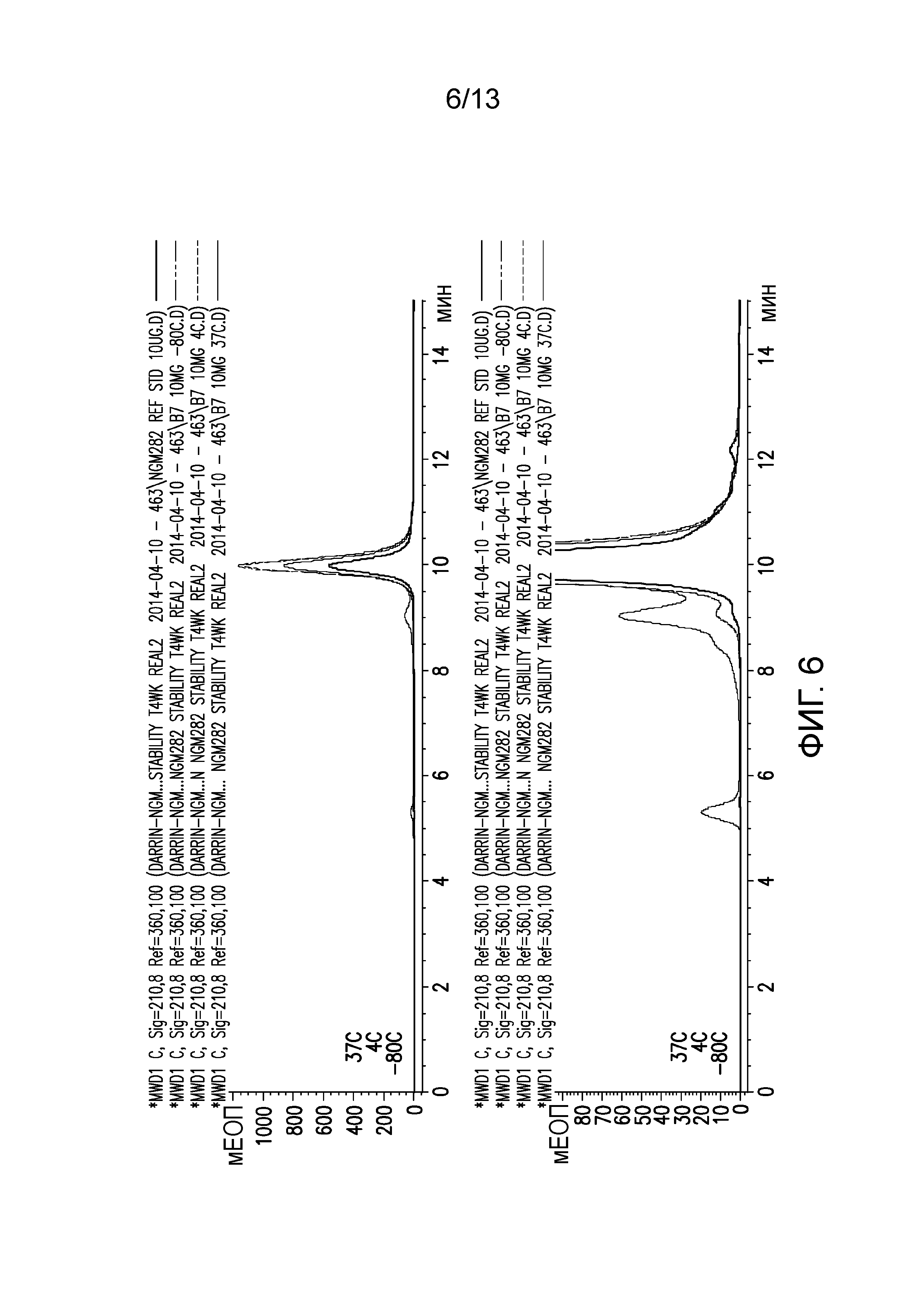
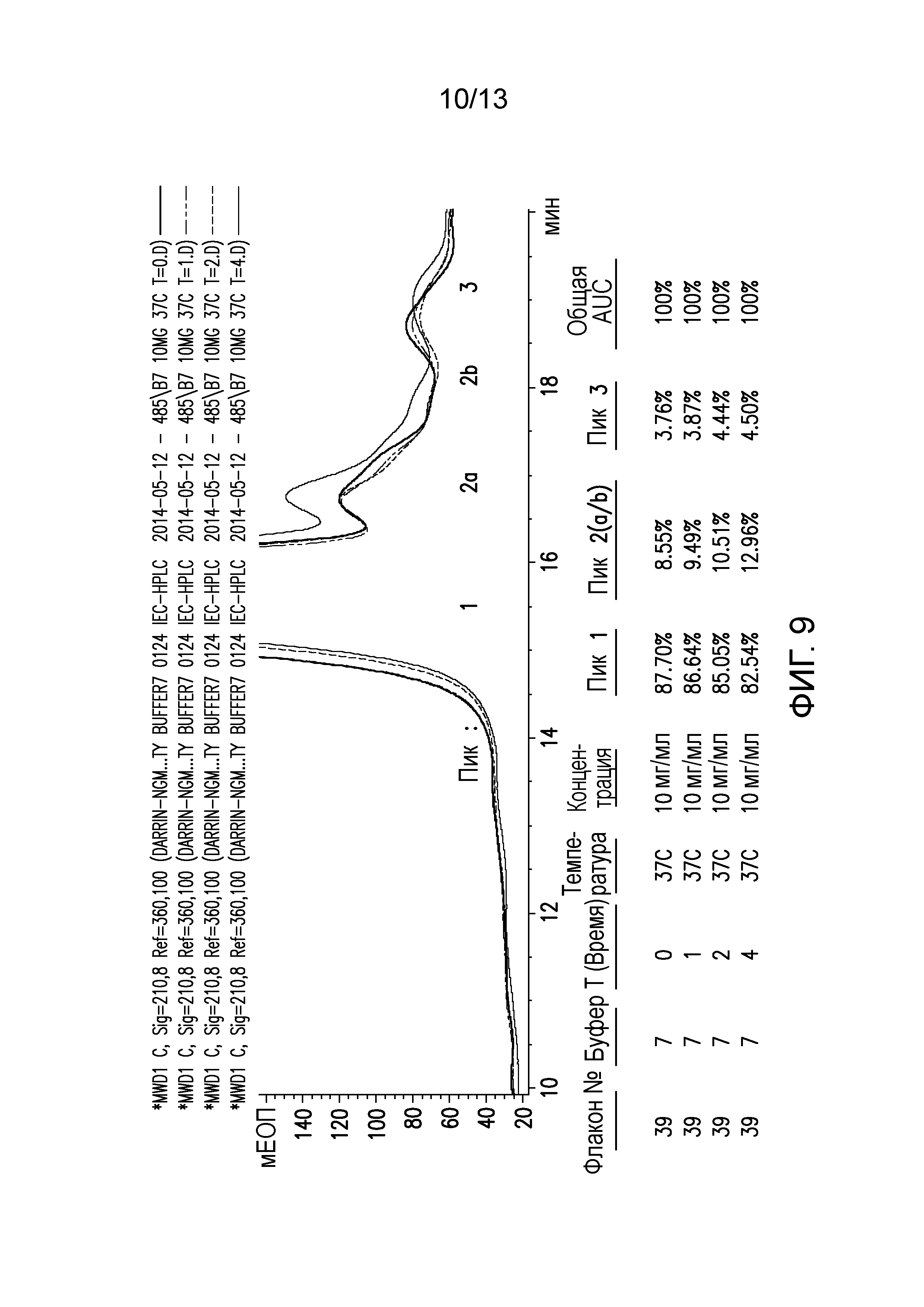
В одном варианте осуществления различных фармацевтических композиций, предложенных в настоящем документе, композиции содержат менее 20%, менее 15%, менее 10%, менее 5% или менее 2% пептидных агрегатов после некоторого периода времени. В некоторых вариантах осуществления агрегаты количественно определяют с использованием анализа, предложенного в настоящем документе (например, в «Экспериментальном разделе»). В одном варианте осуществления композиция содержит менее 20% пептидных агрегатов после некоторого периода времени. В одном варианте осуществления композиция содержит менее 15% пептидных агрегатов после некоторого периода времени. В одном варианте осуществления композиция содержит менее 10% пептидных агрегатов после некоторого периода времени. В одном варианте осуществления композиция содержит менее 5% пептидных агрегатов после некоторого периода времени. В одном варианте осуществления композиция содержит менее 2% пептидных агрегатов после некоторого периода времени. В одном варианте осуществления различных фармацевтических композиций, предложенных в настоящем документе, композиции содержат менее 20%, менее 15%, менее 10%, менее 5% или менее 2% пептидных преципитатов после некоторого периода времени. В некоторых вариантах осуществления преципитаты количественно определяют с использованием анализа, предложенного в настоящем документе (например, в «Экспериментальном разделе»). В одном варианте осуществления композиция содержит менее 20% пептидных преципитатов после некоторого периода времени. В одном варианте осуществления композиция содержит менее 15% пептидных преципитатов после некоторого периода времени. В одном варианте осуществления композиция содержит менее 10% пептидных преципитатов после некоторого периода времени. В одном варианте осуществления композиция содержит менее 5% пептидных преципитатов после некоторого периода времени. В одном варианте осуществления композиция содержит менее 2% пептидных преципитатов после некоторого периода времени. В конкретных вариантах осуществления период времени составляет 1 день, 7 дней, 14 дней, 28 дней, 2 месяца, 3 месяца, 4 месяца, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев, 12 месяцев, 18 месяцев, 24 месяца или более. В одном варианте осуществления период времени составляет 1 день. В одном варианте осуществления период времени составляет 7 дней. В одном варианте осуществления период времени составляет 14 дней. В одном варианте осуществления период времени составляет 21 день. В одном варианте осуществления период времени составляет 1 месяц. В одном варианте осуществления период времени составляет 2 месяца. В одном варианте осуществления период времени составляет 3 месяца. В одном варианте осуществления период времени составляет 4 месяца. В одном варианте осуществления период времени составляет 5 месяцев. В одном варианте осуществления период времени составляет 6 месяцев. В одном варианте осуществления период времени составляет 7 месяцев. В одном варианте осуществления период времени составляет 8 месяцев. В одном варианте осуществления период времени составляет 9 месяцев. В одном варианте осуществления период времени составляет 10 месяцев. В одном варианте осуществления период времени составляет 11 месяцев. В одном варианте осуществления период времени составляет 12 месяцев. В одном варианте осуществления период времени составляет 18 месяцев. В одном варианте осуществления период времени составляет 24 месяца. В некоторых вариантах осуществления фармацевтическую композицию хранят при температуре -80°C. В одном варианте осуществления фармацевтическую композицию хранят при температуре 4°C. В некоторых вариантах осуществления фармацевтическую композицию хранят при температуре 25°C. В одном варианте осуществления фармацевтическую композицию хранят при температуре 37°C.
В конкретных вариантах осуществления фармацевтическая композиция, предложенная в настоящем документе, имеет срок хранения по меньшей мере примерно 12 месяцев, по меньшей мере примерно 24 месяца или по меньшей мере примерно 36 месяцев. В конкретных вариантах осуществления фармацевтическая композиция, предложенная в настоящем документе, имеет срок хранения по меньшей мере примерно 12 месяцев. В конкретных вариантах осуществления фармацевтическая композиция, предложенная в настоящем документе, имеет срок хранения по меньшей мере примерно 24 месяца. В конкретных вариантах осуществления фармацевтическая композиция, предложенная в настоящем документе, имеет срок хранения по меньшей мере примерно 36 месяцев. В некоторых вариантах осуществления фармацевтическую композицию хранят при температуре -80°C. В одном варианте осуществления фармацевтическую композицию хранят при температуре 4°C. В некоторых вариантах осуществления фармацевтическую композицию хранят при температуре 25°C. В одном варианте осуществления фармацевтическую композицию хранят при температуре 37°C.
В дополнительных вариантах осуществления химерная пептидная или пептидная последовательность включена в фармацевтическую композицию, которая, в свою очередь, может быть использована для осуществления на практике способов и вариантом применения, предложенных в настоящем документе. Такие композиции включают сочетания неактивных или других активных ингредиентов. В одном варианте осуществления композиция, такая как фармацевтическая композиция, содержит химерную пептидную последовательность или пептидную последовательность и средство, например, которое способствует улучшению гомеостаза желчных кислот.
В одном варианте осуществления настоящее изобретение относится к способу предотвращения заболевания или нарушения у субъекта, который имеет, или рискует иметь, заболевание или нарушение, предотвращаемое с помощью пептидной последовательности, предложенной в настоящем документе, включающему введение субъекту фармацевтической композиции, содержащей пептид, предложенный в настоящем документе, в количестве, эффективном для предотвращения заболевания или нарушения. В другом варианте осуществления настоящее изобретение относится к способу лечения заболевания или нарушения у субъекта, который имеет, или рискует иметь, заболевание или нарушение, поддающееся лечению с помощью пептидной последовательности, предложенной в настоящем документе, включающему введение субъекту фармацевтической композиции, содержащей пептид, предложенный в настоящем документе, в количестве, эффективном для лечения заболевания или нарушения. В другом варианте осуществления настоящее изобретение относится к способу контроля заболевания или нарушения у субъекта, который имеет, или рискует иметь, заболевание или нарушение, поддающееся контролю с помощью пептидной последовательности, предложенной в настоящем документе, включающему введение субъекту фармацевтической композиции, содержащей пептид, предложенный в настоящем документе, в количестве, эффективном для контроля заболевания или нарушения. В одном варианте осуществления заболевание или нарушение представляет собой связанное с гомеостазом желчных кислот или сопутствующее заболевание. В другом варианте осуществления заболевание или нарушение представляет собой метаболическое заболевание или нарушение. В других вариантах осуществления заболевание или нарушение представляет собой рак или опухоль.
Неограничивающие иллюстративные связанные с гомеостазом желчных кислот или сопутствующие заболевания, предотвращаемые, поддающиеся лечению или поддающиеся контролю в соответствии со способами и вариантами применения, предложенными в настоящем документе, включают: холестаз, включая, например, заболевания внутрипеченочного холестаза (например, первичный билиарный цирроз (PBC), первичный семейный внутрипеченочный холестаз (PFIC) (например, прогрессирующий PFIC), первичный склерозирующий холангит (PSC), внутрипеченочный холестаз беременных (PIC), неонатальный холестаз и медикаментозный холестаз (вызванный, например, эстрогеном)), а также заболевания внепеченочного холестаза (например, сжатие желчных протоков из-за опухоли, блокирование желчных протоков желчными камнями); синдром недостаточности всасывания желчных кислот и другие заболевания с вовлечением дистального отдела тонкого кишечника, включая резекцию подвздошной кишки, воспалительные заболевания кишечника (например, болезнь Крона и язвенный колит), синдром короткой кишки, нарушения, приводящие к уменьшению всасывания желчных кислот, иначе не характеризуемые (идиопатические), ведущие к диарее (например, хологенной диарее (BAD)) и ЖК симптомам, а также формы рака ЖК тракта, печени и/или желчных протоков (например, рак толстого кишечника и печеночно-клеточный рак); и/или аномалии синтеза желчных кислот, такие как те, которые вносят вклад в развитие неалкогольного стеатогепатита (NASH), цирроза и портальной гипертензии; например, у млекопитающих, таких как люди. Дополнительные связанные с гомеостазом желчных кислот или сопутствующие заболевания включают метаболический синдром; нарушения метаболизма липидов или глюкозы; нарушения метаболизма холестерина или триглицеридов; диабет 2 типа. В одном конкретном варианте осуществления связанное с гомеостазом желчных кислот или сопутствующее заболевание представляет собой синдром недостаточности всасывания желчных кислот. В другом конкретном варианте осуществления связанное с гомеостазом желчных кислот или сопутствующее заболевание представляет собой диарею. В другом конкретном варианте осуществления связанное с гомеостазом желчных кислот или сопутствующее заболевание представляет собой холестаз (например, внутрипеченочный или внепеченочный холестаз). В другом конкретном варианте осуществления связанное с гомеостазом желчных кислот или сопутствующее заболевание представляет собой первичный билиарный цирроз (PBC). В других конкретных вариантах осуществления связанное с гомеостазом желчных кислот или сопутствующее заболевание представляет собой первичный склерозирующий холангит. В другом варианте осуществления связанное с гомеостазом желчных кислот или сопутствующее заболевание представляет собой PFIC (например, прогрессирующий PFIC). В другом варианте осуществления связанное с гомеостазом желчных кислот или сопутствующее заболевание представляет собой NASH. В другом варианте осуществления связанное с гомеостазом желчных кислот или сопутствующее заболевание представляет собой гипергликемическое состояние. В конкретном варианте осуществления связанное с гомеостазом желчных кислот или сопутствующее заболевание представляет собой диабет 2 типа.
В некоторых вариантах осуществления фармацевтическая композиция также содержит по меньшей мере одно дополнительное средство, эффективное для модулирования гомеостаза желчных кислот или лечения связанного с гомеостазом желчных кислот или сопутствующего заболевания, при этом дополнительное средство представляет собой: глюкокортикоид; CDCA; UDCA; инсулин, секретагоги инсулина, миметик инсулина, сульфонилмочевину и меглитинид; бигуанид; ингибиторы альфа-глюкозидазы; ингибитор DPP-IV, GLP-1, агонисты GLP-1 и аналог GLP-1; DPP-IV-устойчивый аналог; агонист PPAR-гамма, агонист PPAR двойного действия, агонист PPAR общего действия; ингибитор PTP1B; ингибитор SGLT; агонист RXR; ингибитор гликоген синтазы киназы-3; иммуномодулятор; агонист бета-3 адренергических рецепторов; ингибитор 11бета-HSD1; амилин и аналог амилина; секвестрант желчных кислот или ингибитор SGLT-2. В конкретных вариантах осуществления по меньшей мере одно дополнительное средство, эффективное для модулирования PBC, представляет собой UDCA, агонист FXR, OCA, ингибитор ASBT, средство против аутоиммунного заболевания, анти-IL-12 средство, анти-CD80 средство, анти-CD20 средство, CXCL10-нейтрализующее антитело, лиганд для CXCR3, фибрат, рыбий жир, колхицин, метотрексат, азатиоприн, циклоспорин или антиретровирусное терапевтическое средство. В конкретных вариантах осуществления по меньшей мере одно дополнительное средство, эффективное для модулирования PBC, представляет собой UDCA, OCA, ингибитор ASBT, анти-IL-12 средство, анти-CD20 средство или фибрат.
Неограничивающие иллюстративные заболевания или состояния, предотвращаемые, поддающиеся лечению или поддающиеся контролю с помощью пептидных препаратов, способов и вариантов их применения, предложенных в настоящем документе, включают метаболические заболевания и нарушения. Неограничивающие примеры заболеваний и нарушений включают: метаболический синдром; нарушение метаболизма липидов или глюкозы; нарушение метаболизма холестерина или триглицеридов; диабет 2 типа; холестаз, включая, например, заболевания внутрипеченочного холестаза (например, PBC, PFIC, PSC, PIC, неонатальный холестаз и медикаментозный холестаз (вызванный, например, эстрогеном)) и заболевания внепеченочного холестаза (например, сжатие желчных протоков из-за опухоли, блокирование желчных протоков желчными камнями); синдром недостаточности всасывания желчных кислот и другие заболевания с вовлечением дистального отдела тонкого кишечника, включая резекцию подвздошной кишки, воспалительные заболевания кишечника (например, болезнь Крона и язвенный колит), нарушения, приводящие к уменьшению всасывания желчных кислот, иначе не характеризуемые (идиопатические), ведущие к диарее (например, BAD) и ЖК симптомам, а также формы рака ЖК тракта, печени и/или желчных протоков (например, рак толстого кишечника и печеночно-клеточный рак); и/или аномалии синтеза желчных кислот, такие как те, которые вносят вклад в развитие NASH, цирроза и портальной гипертензии. Для лечения, пептид, предложенный в настоящем документе, можно вводить субъектам, которые нуждаются в модулировании гомеостаза желчных кислот или имеют связанное с гомеостазом желчных кислот или сопутствующее заболевание. Пептиды, предложенные в настоящем документе, также могут быть полезны в случае других заболеваний, связанных с гипергликемией, включая поражение почек (например, поражение почечных канальцев или нефропатию), дегенерацию печени, поражение глаз (например, диабетическую ретинопатию или катаракту), а также состояние «диабетической стопы»; дислипидемии и их последствия, например, атеросклероз, болезнь коронарных артерий, цереброваскулярные нарушения и тому подобное.
Другие состояния, которые могут быть ассоциированы с метаболическим синдромом, включают ожирение и избыточную массу тела (включая их сопутствующие патологические состояния, такие как, но без ограничения, болезнь неалкогольной жировой инфильтрации печени (NAFLD), неалкогольный стеатогепатит (NASH) и синдром поликистоза яичников (PCOS)), и также включают тромбозы, гиперкоагуляционные и протромботические состояния (артериальные и венозные), гипертензию (включая портальную гипертензию (когда градиент печеночного венозного давления (HVPG) превышает 5 мм ртутного столба), сердечно-сосудистое заболевание, инсульт и сердечную недостаточность; заболевания или состояния, в которые вовлечены воспалительные реакции, включая атеросклероз, хронические воспалительные заболевания кишечника (например, болезнь Крона и язвенный колит), астму, системную красную волчанку, артрит или другие воспалительные ревматические заболевания; нарушения клеточного цикла или процессов клеточной дифференцировки, такие как опухоли из жировых клеток, липоматозные карциномы, включая, например, липосаркомы, солидные опухоли и новообразования; нейродегенеративные заболевания и/или демиелинизирующие заболевания центральной и периферической нервных систем и/или неврологические заболевания с вовлечением нейровоспалительных процессов, и/или другие периферические невропатии, включая болезнь Альцгеймера, рассеянный склероз, болезнь Паркинсона, прогрессирующую мультифокальную лейкоэнцефалопатию и синдром Гийена-Барре; кожные и дерматологические заболевания и/или нарушения процессов заживления ран, включая эритемато-сквамозный дерматоз; а также другие заболевания, такие как синдром X, остеоартрит и острый респираторный дистресс-синдром.
В некоторых вариантах осуществления заболевание или нарушение представляет собой рак или опухоль. В конкретных вариантах осуществления рак или опухоль представляет собой FGF19-зависимый рак или опухоль. В одном варианте осуществления FGF19-зависимый рак или опухоль представляет собой печеночно-клеточную карциному. В некоторых вариантах осуществления FGF19-зависимый рак или опухоль представляет собой не печеночно-клеточную карциному. В одном варианте осуществления рак или опухоль представляет собой рак или опухоль толстого кишечника. В некоторых вариантах осуществления рак или опухоль представляет собой рак или опухоль предстательной железы. В одном варианте осуществления рак или опухоль представляет собой рак или опухоль легкого. В некоторых вариантах осуществления способ приводит к уменьшению числа опухолей, размера опухолей или массы опухолей.
В одном варианте осуществления различных способов, предложенных в настоящем документе, субъект является человеком. В конкретных вариантах осуществления субъект является субъектом, который нуждается в лечении.
В некоторых вариантах осуществления химерная пептидная последовательность или пептидная последовательность, описанная в настоящем документе, либо отдельно, либо в сочетании с по меньшей мере одним дополнительным лекарственным средством или методом лечения, проходит оценку для гарантии того, что она не вызывает неблагоприятные эффекты у субъекта. В конкретном аспекте сочетание химерной пептидной последовательности или пептидной последовательности, описанной в настоящем документе, и по меньшей мере одного дополнительного лекарственного средства или метода лечения проходит оценку для гарантии того, что оно не вызывает образование HCC у субъекта. Такие оценки можно проводить до начала терапии (например, в исследовании с эскалацией дозы), во время терапии (например, оценивая маркеры, коррелирующие с активностью HCC) или после завершения терапии (например, проводя биопсию печени). В некоторых аспектах оценку проводят в соответствующей тест-системе (например, с использованием валидированной животной модели). Специалисты в данной области знакомы с дополнительными способами, позволяющими убедиться в том, что комбинированная терапия, описанная в настоящем документе, подходит для конкретного субъекта, или популяции субъектов, репрезентативной для конкретного субъекта, с учетом всех релевантных факторов, включая, например, степень тяжести связанного с гомеостазом желчных кислот или сопутствующего заболевания (например, PBC) у субъекта, а также другие лекарственные средства, принимаемые субъектом.
4. ОПИСАНИЕ ЧЕРТЕЖЕЙ
На ФИГ. 1 представлены результаты визуальной оценки десяти различных буферов препарата в следующих условиях: концентрация активного ингредиента 1 мг/мл; температура 37°C; через 4 недели. Образцы ресуспендировали перед проведением визуальной оценки в баллах и фотографированием. Система оценки в баллах: 0 - прозрачный; 1 - слегка помутневший; 2 - слегка мутный; 3 - мутный; 4 - очень мутный; 5 - чрезвычайно мутный.
На ФИГ. 2 представлены результаты визуальной оценки десяти различных буферов препарата в следующих условиях: концентрация активного ингредиента 10 мг/мл; температура 37°C; через 4 недели. Образцы ресуспендировали перед проведением визуальной оценки в баллах и фотографированием. Система оценки в баллах: 0 - прозрачный; 1 - слегка помутневший; 2 - слегка мутный; 3 - мутный; 4 - очень мутный; 5 - чрезвычайно мутный.
На ФИГ. 3 представлены результаты ВЭЖХ анализа, основанного на определении методом ЭХ AUC поглощения при A210 образцов с концентрацией 1 мг/мл, показывающие процентную долю (%) мономера в каждый момент времени.
На ФИГ. 4 представлены результаты ВЭЖХ анализа, основанного на определении методом ЭХ AUC поглощения при A210 образцов с концентрацией 1 мг/мл в буфере 7.
На ФИГ. 5 представлены результаты ВЭЖХ анализа, основанного на определении методом ЭХ AUC поглощения при A210 образцов с концентрацией 10 мг/мл, показывающие процентную долю (%) мономера в каждый момент времени.
На ФИГ. 6 представлены результаты ВЭЖХ анализа, основанного на определении методом ЭХ AUC поглощения при A210 образцов с концентрацией 10 мг/мл в буфере 7 препарата.
На ФИГ. 7A-7B представлены результаты SDS-ПААГ электрофореза препарата (A) в буфере 7 через 4 недели в случае концентрации (A) 1 мг/мл и (B) 10 мг/мл.
На ФИГ. 8 представлены результаты ИО-ВЭЖХ для препарата с концентрацией 1 мг/мл в буфере 7 при 37°C, в момент времени t=0 недель, 1 неделя, 2 недели и 4 недели.
На ФИГ. 9 представлены результаты ИО-ВЭЖХ для препарата с концентрацией 10 мг/мл в буфере 7 при 37°C, в момент времени t=0 недель, 1 неделя, 2 недели и 4 недели.
На ФИГ. 10 представлены результаты ОФ-ВЭЖХ для препарата с концентрацией 1 мг/мл в буфере 7 при 37°C, в момент времени t=0 недель, 1 неделя, 2 недели и 4 недели.
На ФИГ. 11 представлены результаты ОФ-ВЭЖХ для препарата с концентрацией 10 мг/мл в буфере 7 при 37°C, в момент времени t=0 недель, 1 неделя, 2 недели и 4 недели.
На ФИГ. 12 представлены данные по стабильности после циклов замораживания/размораживания препарата M70, содержащего 20 мМ Tris, pH 8,0 (25°C), 8,3% (масс/об) трегалозы, 0,01% полисорбата-20 (TWEEN-20) («буфер TTP»).
5. ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Перед тем, как настоящее изобретение будет описано более подробно, следует отметить, что данное изобретение не ограничено конкретными вариантами осуществления, изложенными в настоящем документе, и также следует понимать, что терминология, используемая в настоящем документе, служит исключительно для целей описания конкретных вариантов осуществления и не должна быть ограничивающей.
5.1 Определения
Термины «пациент» или «субъект» используют взаимозаменяемо для обозначения человека или животного, отличного от человека (например, млекопитающего).
Термины «лечить», «лечение», «терапия», и тому подобное, означают последовательность действий (таких как введение полипептида или фармацевтической композиции, содержащей полипептид), инициированную после того, как заболевание, нарушение или состояние, либо его симптом, было диагностировано, обнаружено, и тому подобное, с целью устранения, уменьшения, подавления, ослабления или облегчения, либо временно, либо постоянно, по меньшей мере одной из основополагающих причин заболевания, нарушения или состояния, поражающего субъекта, или по меньшей мере одного из симптомов, ассоциированных с заболеванием, нарушением, состоянием, поражающим субъекта. Таким образом, лечение включает ингибирование активного заболевания (то есть, задержку развития или дальнейшего развития заболевания, нарушения или состояния, либо клинических симптомов, ассоциированных с ним).
Используемый в настоящем документе термин «нуждающийся в лечении» означает, что врач или другой медицинский работник принял решение о том, что субъект нуждается в лечении или получит пользу от лечения.
Термины «предотвращать», «профилактика», «предотвращение», и тому подобное, означают последовательность действий (таких как введение полипептида или фармацевтической композиции, содержащей полипептид), инициированную заранее (например, до начала заболевания, нарушения, состояния или его симптома) с целью предотвращения, подавления, ингибирования или уменьшения, либо временно, либо постоянно, для субъекта риска развития заболевания, нарушения, состояния, или тому подобного (что определяют, например, по отсутствию клинических симптомов), или для задержки начала его развития, как правило, в контексте субъекта, предрасположенного к развитию конкретного заболевания, нарушения или состояния. В некоторых случаях термины также означают замедление прогрессирования заболевания, нарушения или состояния, либо ингибирование его прогрессирования до опасного или иным образом нежелательного состояния.
Используемый в настоящем документе термин «нуждающийся в предотвращении» означает, что врач или другой медицинский работник принял решение о том, что субъект нуждается или получит пользу от превентивных мер.
Выражение «терапевтически эффективное количество» относится к введению субъекту средства, либо отдельно, либо в виде части фармацевтической композиции, и либо одной дозой, либо в виде части серии доз, в количестве, которое при введении пациенту способно оказывать какой-либо поддающийся обнаружению положительный эффект на какой-либо симптом, аспект или характеристику заболевания, нарушения или состояния. Терапевтически эффективное количество можно определять путем измерения релевантных физиологических эффектов. Например, в случае гипергликемического состояния снижение или уменьшение уровня глюкозы в крови, или улучшение результатов теста на толерантность к глюкозе можно использовать для определения того, является ли количество средства эффективным для лечения гипергликемического состояния. Например, терапевтически эффективное количество представляет собой количество, достаточное для уменьшения или снижения какого-либо уровня (например, исходного уровня) глюкозы в плазме крови натощак (FPG), при этом, например, количество является достаточным для снижения уровня FPG, превышающего 200 мг/дл, до уровня менее 200 мг/дл, при этом количество является достаточным для снижения уровня FPG, составляющего от 175 мг/дл до 200 мг/дл, до уровня ниже начального уровня, при этом количество является достаточным для снижения уровня FPG, составляющего от 150 мг/дл до 175 мг/дл, до уровня ниже начального уровня, при этом количество является достаточным для снижения уровня FPG, составляющего от 125 мг/дл до 150 мг/дл, до уровня ниже начального уровня, и так далее (например, для снижения уровней FPG до уровней ниже 125 мг/дл, ниже 120 мг/дл, ниже 115 мг/дл, ниже 110 мг/дл и так далее). Кроме того, в случае уровней HbAIc эффективное количество представляет собой количество, достаточное для уменьшения или снижения уровней на более чем примерно с 10% до 9%, на более чем примерно с 9% до 8%, на более чем примерно с 8% до 7%, на более чем примерно с 7% до 6%, на более чем примерно с 6% до 5%, и так далее. Более конкретно, по настоящему изобретению предусмотрено уменьшение или снижение уровней HbAIc на примерно 0,1%, 0,25%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1%, 1,5%, 2%, 3%, 4%, 5%, 10%, 20%, 30%, 33%, 35%, 40%, 45%, 50% или более. Терапевтически эффективное количество можно корректировать в зависимости от режима дозирования, диагностического анализа состояния здоровья субъекта, и тому подобного.
Выражение «в количестве, достаточном, чтобы вызвать изменение» означает, что существует поддающаяся обнаружению разница между уровнем индикатора, измеренным до (например, исходным уровнем) и после введения конкретного терапевтического средства. Индикаторы включают любой объективный параметр (например, уровень глюкозы или инсулина) или субъективный параметр (например, самочувствие субъекта).
Используемый в настоящем документе термин «толерантность к глюкозе» означает способность организма субъекта контролировать уровень глюкозы в плазме и/или инсулина в плазме при изменении потребления глюкозы. Например, термин «толерантность к глюкозе» означает способность организма субъекта снижать, в пределах примерно 120 минут, уровень глюкозы в плазме вновь до уровня, определяемого перед потреблением глюкозы.
В широком смысле термины «диабет» и «диабетический» означают прогрессирующее заболевание углеводного метаболизма, при котором имеет место недостаточное продуцирование или утилизация инсулина, и которое часто характеризуется гипергликемией и глюкозурией. Термины «предиабет» и «предиабетический» означают состояние, когда у субъекта отсутствуют характеристики, симптомы и тому подобное, как правило, наблюдаемые при диабете, однако присутствуют характеристики, симптомы и тому подобное, которые в отсутствие лечения могут прогрессировать до диабета. Наличие таких состояний можно определять с использованием, например, либо теста на уровень глюкозы в плазме натощак (FPG), либо перорального теста на толерантность к глюкозе (OGTT). В обоих случаях, как правило, необходимо, чтобы субъект голодал по меньшей мере 8 часов до начала теста. В тесте FPG уровень глюкозы в крови у субъекта измеряют после завершения периода голодания; как правило, субъект голодает в течение ночи и уровень глюкозы в крови измеряют утром до приема пищи субъектом. У здорового субъекта, как правило, концентрация FPG составляет от примерно 90 до примерно 100 мг/дл, у субъекта с «предиабетом» концентрация FPG, как правило, составляет от примерно 100 до примерно 125 мг/дл, и у субъекта с «диабетом», как правило, уровень FPG превышает примерно 126 мг/дл. В тесте OGTT уровень глюкозы в крови у субъекта измеряют после голодания и вновь через два часа после употребления напитка с высоким содержанием глюкозы. Через два часа после употребления напитка с высоким содержанием глюкозы у здорового субъекта концентрация глюкозы в крови, как правило, составляет менее примерно 140 мг/дл, у субъекта с предиабетом концентрация глюкозы в крови, как правило, составляет от примерно 140 до примерно 199 мг/дл, и у субъекта с диабетом концентрация глюкозы в крови, как правило, составляет примерно 200 мг/дл или выше. Хотя вышеуказанные гликемические показатели характерны для субъектов-людей, нормогликемия, умеренная гипергликемия и явная гипергликемия имеют другую шкалу оценки в случае субъектов-мышей. У здоровой мыши после четырехчасового голодания концентрация FPG как правило, будет составлять от примерно 100 до примерно 150 мг/дл, у мыши с «предиабетом» концентрация FPG как правило, будет составлять от примерно 175 до примерно 250 мг/дл, и у мыши с «диабетом» концентрация FPG как правило, будет превышать примерно 250 мг/дл.
Используемый в настоящем документе термин «устойчивость к инсулину» означает состояние, при котором нормальное количество инсулина неспособно вызывать нормальный физиологический или молекулярный ответ. В некоторых случаях гиперфизиологическое количество инсулина, либо продуцируемое эндогенно, либо введенное экзогенно, способно преодолевать устойчивость к инсулину, полностью или частично, и вызывать биологический ответ.
Термин «метаболический синдром» относится к связанному кластеру признаков, который включает, но не ограничивается ими, гиперинсулинемию, аномальную толерантность к глюкозе, ожирение, перераспределение жира в брюшной или верхний отдел тела, гипертензию, дисфибринолиз и дислипидемию, характеризующуюся высоким уровнем триглицеридов, низким уровнем холестерина липопротеинов высокой плотности (ЛВП) и высоким уровнем небольших плотных частиц липопротеинов низкой плотности (ЛНП). Субъекты с метаболическим синдромом имеют риск развития диабета 2 типа и/или других заболеваний (например, атеросклероза).
Термин «нарушение метаболизма глюкозы» охватывает любое нарушение, характеризующееся клиническим симптомом или сочетанием клинических симптомов, которые ассоциированы с повышенным уровнем глюкозы и/или повышенным уровнем инсулина у субъекта по сравнению со здоровым человеком. Повышенные уровни глюкозы и/или инсулина могут проявляться в заболеваниях, нарушениях и состояниях, перечисленных далее: гипергликемия, диабет II типа, гестационный диабет, диабет I типа, устойчивость к инсулину, нарушенная толерантность к глюкозе, гиперинсулинемия, нарушенный метаболизм глюкозы, предиабет, другие метаболические нарушения (такие как метаболический синдром, который также называют синдромом X), а также ожирение, в числе прочих. Полипептиды по настоящему изобретению и их композиции могут быть использованы, например, для достижения и/или поддержания нормального гомеостаза глюкозы, например, для снижения уровня глюкозы в крови и/или для снижения уровня инсулина до диапазона значений, характерных для здорового субъекта.
Используемый в настоящем документе термин «гипергликемия» означает состояние, при котором в плазме крови субъекта циркулирует повышенное, по сравнению со здоровым человеком, количество глюкозы. Гипергликемию можно диагностировать способами, известными в данной области, включая измерение уровней глюкозы в крови натощак, как описано в настоящем документе.
Используемый в настоящем документе термин «гиперинсулинемия» означает состояние, при котором имеют место повышенные уровни циркулирующего инсулина, причем в то же время уровни глюкозы в крови являются либо повышенными, либо нормальными. Гиперинсулинемия может быть вызвана устойчивостью к инсулину, которая связана с дислипидемией, например, высоким уровнем триглицеридов, высоким уровнем холестерина, высоким уровнем липопротеинов низкой плотности (ЛНП) и низким уровнем липопротеинов высокой плотности (ЛВП); высокими уровнями мочевых кислот; синдромом поликистоза яичников; диабетом II типа и ожирением. Гиперинсулинемию можно диагностировать по наличию уровня инсулина в плазме, превышающего примерно 2 мкЕд/мл.
Используемый в настоящем документе термин «заболевание избыточной массы тела» и аналогичные термины относятся к состояниям, ассоциированным с избыточной массой тела и/или повышенным аппетитом. Различные параметры используют для определения того, имеет ли субъект избыточную массу тела по сравнению с эталонным здоровым человеком, с учетом возраста, роста, пола и состояния здоровья субъекта. Например, можно определять, имеет ли субъект избыточную массу тела или ожирение, путем оценки индекса массы тела (ИМТ) субъекта, который рассчитывают путем деления величины массы тела субъекта в килограммах на возведенную в квадрат величину роста субъекта в метрах. Взрослый человек, имеющий ИМТ в диапазоне от ~18,5 до ~24,9 кг/м2, считается имеющим нормальную массу тела; взрослый человек, имеющий ИМТ в диапазоне от ~25 до ~29,9 кг/м2, может считаться имеющим избыточную массу тела (предожирение); и взрослый человек, имеющий ИМТ ~30 кг/м2 или выше, может считаться тучным. Повышенный аппетит часто способствует набиранию избыточной массы тела. Существует несколько состояний, ассоциированных с повышенным аппетитом, включая, например, синдром ночного питания, который характеризуется утренней анорексией и вечерней полифагией, часто сопровождающейся бессонницей, что может быть связано с травмой гипоталамуса.
Термины «полипептид», «пептид» и «белок», используемые в настоящем документе взаимозаменяемо, означают полимерную форму аминокислот любой длины, которая может включать генетически кодируемые и не кодируемые генетически аминокислоты, химически или биохимически модифицированные, или дериватизированные аминокислоты, а также полипептиды, имеющие модифицированные полипептидные каркасы. Термины охватывают слитые белки, в том числе, но без ограничения, слитые белки с гетерологичной аминокислотной последовательностью, слитые белки с гетерологичными и гомологичными лидерными последовательностями, имеющие или не имеющие N-концевые остатки метионина, иммунологически маркированные белки, и тому подобное. Следует понимать, что в тексте данного описания делаются ссылки на аминокислоты в соответствии с однобуквенным и трехбуквенным кодами.
Используемый в настоящем документе термин «вариант» охватывает природные варианты (например, гомологи и аллельные варианты) и неприродные варианты (например, мутеины). Природные варианты включают гомологи, то есть, нуклеиновые кислоты и полипептиды, которые отличаются по нуклеотидной или аминокислотной последовательности, соответственно, у разных видов. Природные варианты включают аллельные варианты, то есть, нуклеиновые кислоты и полипептиды, которые отличаются по нуклеотидной или аминокислотной последовательности, соответственно, у разных индивидуумов, относящихся к одному виду. Неприродные варианты включают нуклеиновые кислоты и полипептиды, которые имеют изменения в нуклеотидной или аминокислотной последовательности, соответственно, при этом изменение в последовательность введено искусственно, например, изменение создано в лаборатории или другой организации в результате вмешательства человека («рукой человека»).
Термин «нативный» применительно к FGF19 означает биологически активный природный FGF19, включая биологически активные природные варианты FGF19. Термин включает зрелую 194-аминокислотную последовательность FGF19 человека.
Термины «метка», «мечение», и тому подобное, при использовании в контексте полипептида или нуклеиновой кислоты (или антитела, в зависимости от ситуации) по настоящему изобретению должны означать, в широком смысле, любые средства, полезные, например, для очистки, идентификации, выделения и синтеза полипептида. Метки, как правило, ковалентно связаны с интересующим полипептидом и могут быть введены любым методом, известным в данной области, включая присоединение к зрелому полипептиду (обычно на N- или C-конце), включение в процессе твердофазного пептидного синтеза или рекомбинантными методами. Примеры включают, но не ограничиваются ими, введение флуоресцентных меток, биотинилирование и включение радиоактивных изотопов. Молекулы полипептидов и нуклеиновых кислот можно метить как in vitro, так и in vivo методами. Реагенты и наборы для мечения можно приобретать из различных коммерческих источников (например, Thermo Fischer Scientific, Rockford, IL; и Molecular Probes/Life Technologies; Grand Island, NY).
Используемый в настоящем документе термин «мутеины» означает, в широком смысле, мутантные рекомбинантные белки, то есть, полипептиды, имеющие искусственно внесенное изменение в аминокислотной последовательности, например, изменение в аминокислотной последовательности, созданное в лаборатории или другой организации в результате вмешательства человека («рукой человека»). Эти белки, как правило, имеют одну или несколько аминокислотных замен и часто бывают получены из клонированных генов, которые были подвергнуты сайт-направленному или случайному мутагенезу, или из полностью синтетических генов.
При использовании в настоящем документе применительно к нативному FGF19 человека или мутеину FGF19 термины «модифицированный», «модификация», и тому подобное, означают внесение одного или более изменений, которые приводят к усилению желательного свойства человеческого FGF19, природного варианта FGF19 или мутеина FGF19, при этом изменение(я) не затрагивает первичную аминокислотную последовательность FGF19. Такие желательные свойства включают, например, повышенную растворимость, более длительный период полувыведения в системе циркуляции, повышенную стабильность, уменьшенный клиренс, измененную иммуногенность или аллергенность, улучшенные технологические аспекты (например, затраты и эффективность), а также способность вызывать продуцирование конкретных антител (например, за счет введения особых эпитопов) для использования в анализах обнаружения. Изменения в человеческом FGF19, природном варианте FGF19 или мутеине FGF19, которые можно осуществлять, включают, но не ограничиваются ими, пегилирование (ковалентное присоединение одной или более молекул полиэтиленгликоля (ПЭГ), или его производных); гликозилирование (например, N-гликозилирование), полисиалирование и гесилирование (HESylation); слияние с альбумином; связывание с альбумином, например, через конъюгированную цепь жирной кислоты (ацилирование); слияние с Fc-областью; а также слияние с миметиком ПЭГ. Некоторые конкретные варианты осуществления включают модификации с использованием полиэтиленгликоля, другие конкретные варианты осуществления включают модификации с использованием альбумина и другие конкретные варианты осуществления включают модификации с использованием гликозилирования.
Термины «ДНК», «нуклеиновая кислота», «молекула нуклеиновой кислоты», «полинуклеотид», и тому подобное, в настоящем документе используют взаимозаменяемо для обозначения полимерной формы нуклеотидов любой длины, либо дезоксирибонуклеотидов, либо рибонуклеотидов, либо их аналогов. Неограничивающие примеры полинуклеотидов включают линейные и кольцевые нуклеиновые кислоты, матричные РНК (мРНК), комплементарные ДНК (кДНК), рекомбинантные полинуклеотиды, векторы, зонды, праймеры и тому подобное.
Термин «зонд» означает фрагмент ДНК или РНК, соответствующий интересующему гену или последовательности, при этом фрагмент является меченым радиоактивным изотопом (например, за счет введения 32P или 35S) или какой-либо другой поддающейся обнаружению молекулой, такой как биотин, дигоксигенин или флуоресцеин. Поскольку участки ДНК или РНК будут гибридизоваться с комплементарными последовательностями, зонд можно использовать, например, для мечения вирусных бляшек, бактериальных колоний или полос в геле, которые содержат интересующий ген. Зонд может представлять собой клонированную ДНК или он может представлять собой синтетическую нить ДНК; последнюю можно использовать для получения кДНК или геномного клона из выделенного белка, например, путем микросеквенирования части белка, выведения нуклеотидной последовательности, кодирующей белок, синтезирования олигонуклеотида, несущего эту последовательность, радиоактивного мечения этой последовательности и использования ее в качестве зонда для скрининга кДНК библиотеки или геномной библиотеки.
Термин «гетерологичные» относится к двум компонентам, которые содержат структуры, полученные из других источников. Например, в контексте полипептида «гетерологичный» полипептид может содержать функционально связанные аминокислотные последовательности, которые происходят из других полипептидов. Аналогично, в контексте полинуклеотида, кодирующего химерный полипептид, «гетерологичный» полинуклеотид может содержать функционально связанные нуклеотидные последовательности, которые могут быть получены из других генов. Иллюстративные «гетерологичные» нуклеиновые кислоты включают экспрессионные конструкты, в которых нуклеиновая кислота, содержащая кодирующую последовательность, функционально связана с регуляторным элементом (например, промотором), который имеет генетическое происхождение, отличное от такового у кодирующей последовательности (например, для обеспечения экспрессии в интересующей клетке-хозяине, которая может иметь иное генетическое происхождение, чем промотор, кодирующая последовательность, или и то, и другое). В контексте рекомбинантных клеток «гетерологичные» может означать присутствие нуклеиновой кислоты (или продукта гена, такого как полипептид), которая имеет иное генетическое происхождение, чем клетка-хозяин, в которой она присутствует.
Термин «функционально связанные» означает наличие связи между молекулами, обеспечивающей нужную функцию. Например, «функционально связанные» в контексте нуклеиновых кислот означает наличие функциональной связи между нуклеотидными последовательностями. В качестве примера, последовательность контроля экспрессии нуклеиновой кислоты (такая как промотор, сигнальная последовательность или группа сайтов связывания факторов транскрипции) может быть функционально связана со вторым полинуклеотидом, при этом последовательность контроля экспрессии влияет на транскрипцию и/или трансляцию второго полинуклеотида. В контексте полипептида «функционально связанные» означает наличие функциональной связи между аминокислотными последовательностями (например, разными доменами) для обеспечения описанной активности полипептида.
При использовании в настоящем документе в контексте структуры полипептида термины «N-конец» (или «амино-конец») и «C-конец» (или «карбокси-конец») относятся к крайним амино- и карбоксильному концам полипептида, соответственно, в то время как термины «N-концевой» и «C-концевой» относятся к относительным положениям в аминокислотной последовательности полипептида около N-конца и C-конца, соответственно, и могут включать остатки на N-конце и C-конце, соответственно. Термины «непосредственно N-концевой» или «непосредственно C-концевой» относятся к положению первого аминокислотного остатка относительно второго аминокислотного остатка, когда первый и второй аминокислотные остатки ковалентно связаны для обеспечения непрерывной аминокислотной последовательности.
Выражение «полученная из» в контексте аминокислотной последовательности или полинуклеотидной последовательности (например, аминокислотная последовательность, «полученная из» полипептида FGF19), должно означать, что полипептид или нуклеиновая кислота имеет последовательность, основанную на последовательности эталонного полипептида или нуклеиновой кислоты (например, природного полипептида FGF19 или кодирующей FGF19 нуклеиновой кислоты), и не должно быть ограничивающим в отношении источника или способа, которые были использованы для получения белка или нуклеиновой кислоты. В качестве примера, термин «полученная из» охватывает гомологи или варианты эталонных аминокислотных или ДНК последовательностей.
В контексте полипептида термин «выделенный» относится к интересующему полипептиду, который, если является природным, находится в окружении, отличном от того, в котором он находится в природе. Термин «выделенный» должен включать полипептиды, находящиеся в образцах, которые в значительной степени обогащены интересующим полипептидом, и/или в которых интересующий полипептид является частично или по существу очищенным. Если полипептид не является природным, термин «выделенный» указывает на то, что полипептид был выделен из окружения, в котором он был получен либо синтетическим, либо рекомбинантным способом.
Термин «обогащенный» означает, что образец был искусственно подвергнут манипуляциям (например, ученым или клиницистом) таким образом, что интересующий полипептид стал присутствовать a) в большей концентрации (например, по меньшей мере в 3 раза большей, по меньшей мере в 4 раза большей, по меньшей мере в 8 раз большей, по меньшей мере в 64 раза большей, или более), чем концентрация полипептида в исходном образце, например, биологическом образце (например, образце, в котором полипептид присутствует естественным образом или в котором он присутствует после введения), или b) в большей концентрации, чем концентрация в среде, в которой полипептид был получен (например, в бактериальной клетке).
Выражение «по существу чистый» указывает на то, что компонент (например, полипептид) составляет более чем примерно 50% от общего состава композиции и, как правило, более чем примерно 60% от общего содержания полипептидов. Более конкретно, выражение «по существу чистый» используют в случае композиций, в которых интересующий компонент составляет по меньшей мере 75%, по меньшей мере 85%, по меньшей мере 90% или более от общего состава композиции. В некоторых случаях полипептид будет составлять более чем примерно 90% или более чем примерно 95% от общего состава композиции.
Термины «измерение» или «тестирование» и их грамматические варианты в настоящем документе используются взаимозаменяемо и означают либо качественные, либо количественные определения, или и качественные, и количественные определения. Если термины используют применительно к обнаружению, предусмотрены любые способы оценки относительного количества, включая различные способы, изложенные в настоящем документе и известные в данной области. Например, экспрессию гена можно тестировать или измерять методом нозерн-блоттинга, вестерн-блоттинга, в анализе иммунопреципитации или путем измерения активности, функции или количества экспрессированного белка.
Термины «антитела» (Ат) и «иммуноглобулины» (Ig) относятся к гликопротеинам, имеющим одинаковые структурные характеристики. В то время как антитела обладают специфичностью связывания в отношении конкретного антигена, иммуноглобулины включают как антитела, так и другие антитело-подобные молекулы, у которых отсутствует антигенная специфичность.
Термин «моноклональное антитело» означает антитело, полученное из популяции по существу однородных антител, то есть, отдельные антитела, составляющие популяцию, являются идентичными, за исключением возможных естественных мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высокоспецифичными, будучи направленными против одного антигенного сайта. В отличие от препаратов поликлональных антител, которые содержат разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене.
В контексте антитела термин «выделенное» означает антитело, которое было выделено и/или извлечено из примесных компонентов его природного окружения; такие примесные компоненты включают материалы, которые могут препятствовать диагностическому или терапевтическому применению антитела, и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества.
В настоящем документе термин «FGF19-зависимое» и аналогичные термины, используемые в контексте заболевания, нарушения или состояния, означают заболевание, нарушение или иное состояние, которое полностью или частично вызвано экспрессией FGF19. В конкретных вариантах осуществления экспрессия FGF19 повышена по сравнению с контролем. В некоторых вариантах осуществления экспрессия FGF19 повышена на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или более, или на любое численное значение в этом диапазоне. В некоторых вариантах осуществления повышенная экспрессия FGF19 непосредственно приводит к заболеванию, нарушению или состоянию, либо его симптому. В других вариантах осуществления повышенная экспрессия FGF19 опосредованно приводит к заболеванию, нарушению или состоянию, либо его симптому.
5.2 Фармацевтические композиции
В одном аспекте настоящее изобретение относится к «фармацевтическим композициям», которые содержат пептидную последовательность (или последовательности), предложенные в настоящем документе, включая подпоследовательности, варианты и модифицированные формы иллюстративных пептидных последовательностей (например, последовательностей, приведенных в списке последовательностей или таблице 1), и один или более фармацевтически приемлемых или физиологически приемлемых разбавителей, носителей или эксципиентов. В конкретных вариантах осуществления пептидные последовательности предоставлены в сочетании с одним или более дополнительными средствами, либо отдельно. Также предложена композиция, содержащая такие одно или более дополнительных средств и один или более фармацевтически приемлемых или физиологически приемлемых разбавителей, носителей или эксципиентов. В конкретных вариантах осуществления пептидная последовательность или последовательности и дополнительное средство(а) присутствуют в терапевтически приемлемом количестве. Фармацевтические композиции могут быть использованы в соответствии со способами и вариантами применения, предложенными в настоящем документе. Так, например, фармацевтические композиции могут быть введены ex vivo или in vivo субъекту с целью осуществления на практике способов лечения и вариантов применения, предложенных в настоящем документе. Фармацевтические композиции, предложенные в настоящем документе, могут быть сформулированы для совместимости с запланированным способом или путем введения; иллюстративные пути введения описаны в настоящем документе.
В одном варианте осуществления предложены фармацевтические композиции и лекарственные формы химерной и пептидной последовательностей, которые модулируют гомеостаз желчных кислот и способны лечить связанное с гомеостазом желчных кислот или сопутствующее заболевание. В другом варианте осуществления предложены фармацевтические композиции и лекарственные формы химерной и пептидной последовательностей, которые модулируют гипергликемическое состояние, устойчивость к инсулину, гиперинсулинемию, непереносимость глюкозы, метаболический синдром или сопутствующие заболевания. В другом варианте осуществления предложены фармацевтические композиции и лекарственные формы химерной и пептидной последовательностей, которые модулируют рак или опухоль.
В некоторых аспектах фармацевтические композиции могут дополнительно содержать другие терапевтически активные средства или соединения, раскрытые в настоящем документе или известные квалифицированному специалисту, которые могут быть использованы для лечения или предотвращения различных заболеваний и нарушений, описанных в настоящем документе. Как указано выше, дополнительные терапевтически активные средства или соединения могут присутствовать в отдельной фармацевтической композиции(ях). Иллюстративные параметры и режимы дозирования описаны в настоящем документе.
Фармацевтические композиции, как правило, содержат терапевтически эффективное количество по меньшей мере одной из пептидных последовательностей, предложенных в настоящем документе, включая подпоследовательности, варианты и модифицированные формы иллюстративных пептидных последовательностей (например, последовательностей, приведенных в списке последовательностей или таблице 1), и один или более фармацевтически и физиологически приемлемых вспомогательных компонентов препарата. В конкретных вариантах осуществления фармацевтическая композиция дополнительно содержит одно или более дополнительных средств, описанных в настоящем документе.
В одном варианте осуществления фармацевтическая композиция содержит пептид, предложенный в настоящем документе. В некоторых вариантах осуществления фармацевтическая композиция содержит терапевтически эффективное количество пептида, предложенного в настоящем документе. В конкретных вариантах осуществления фармацевтическая композиция содержит фармацевтически приемлемый или физиологически приемлемый разбавитель, носитель или эксципиент. В конкретном варианте осуществления пептид содержит аминокислотную последовательность SEQ ID NO: 70. В другом варианте осуществления пептид состоит из аминокислотной последовательности SEQ ID NO: 70. В конкретном варианте осуществления пептид содержит аминокислотную последовательность SEQ ID NO: 204. В другом варианте осуществления пептид состоит из аминокислотной последовательности SEQ ID NO: 204. В конкретных вариантах осуществления фармацевтическая композиция дополнительно содержит одно или более дополнительных средств, описанных в настоящем документе.
В конкретных вариантах осуществления фармацевтическая композиция содержит пептид в концентрации 0,1-100 мг/мл. В некоторых вариантах осуществления фармацевтическая композиция содержит пептид в концентрации 1-10 мг/мл. В конкретных вариантах осуществления фармацевтическая композиция содержит пептид в концентрации 1 мг/мл. В другом варианте осуществления пептид присутствует в концентрации 5 мг/мл. В конкретных вариантах осуществления фармацевтическая композиция содержит пептид в концентрации 10 мг/мл.
Соответствующие фармацевтически приемлемые или физиологически приемлемые разбавители, носители или эксципиенты включают, но не ограничиваются ими, антиоксиданты (например, аскорбиновую кислоту и натрия бисульфат), консерванты (например, бензиловый спирт, метилпарабены, этил- или н-пропил-п-гидроксибензоат), эмульгаторы, суспендирующие средства, диспергирующие средства, растворители, наполнители, объемообразующие средства, буферы, среды, разбавители и/или адъюванты. Например, подходящей средой может быть физиологический солевой раствор или цитратно-буферный солевой раствор, возможно, с добавлением других материалов, обычно используемых в фармацевтических композициях, предназначенных для парентерального введения. Нейтральный буферный солевой раствор или солевой раствор, смешанный с сывороточным альбумином, являются дополнительными иллюстративными средами. Специалисты в данной области знают множество буферов, которые можно использовать в фармацевтических композициях и лекарственных формах, описанных в настоящем документе. Типичные буферы включают, но не ограничиваются ими, фармацевтически приемлемые слабые кислоты, слабые основания или их смеси. Компоненты буфера также включают водорастворимые материалы, такие как фосфорная кислота, виннокаменная кислота, молочная кислота, янтарная кислота, лимонная кислота, уксусная кислота, аскорбиновая кислота, аспарагиновая кислота, глутаминовая кислота, а также их соли.
В конкретном варианте осуществления фармацевтическая композиция содержит фосфат калия. В одном варианте осуществления фармацевтическая композиция содержит хлорид натрия. В другом варианте осуществления фармацевтическая композиция содержит трометамин (Tris). В других вариантах осуществления фармацевтическая композиция содержит трегалозы дигидрат. В другом варианте осуществления фармацевтическая композиция содержит TWEEN-20 (полисорбат 20). В другом варианте осуществления фармацевтическая композиция содержит соляную кислоту. В конкретном варианте осуществления фармацевтическая композиция содержит воду. Также предусмотрено использование любого сочетания из двух, трех, четырех, пяти, шести или всех семи вышеперечисленных компонентов.
Таким образом, в одном варианте осуществления фармацевтическая композиция содержит фосфат калия, хлорид натрия, трометамин (Tris), трегалозы дигидрат, TWEEN-20, соляную кислоту, воду или любое их сочетание. В конкретном варианте осуществления фармацевтическая композиция содержит фосфат калия, хлорид натрия, трометамин (Tris), трегалозы дигидрат, TWEEN-20, соляную кислоту и воду.
В одном варианте осуществления молярность Tris, используемая в фармацевтических композициях, предложенных в настоящем документе, находится в диапазоне 5-50 мМ. В другом варианте осуществления молярность Tris находится в диапазоне 10-45 мМ. В другом варианте осуществления молярность Tris находится в диапазоне 15-40 мМ. В другом варианте осуществления молярность Tris находится в диапазоне 20-35 мМ. В другом варианте осуществления молярность Tris находится в диапазоне 20-30 мМ. В другом варианте осуществления молярность Tris находится в диапазоне 20-25 мМ. В одном конкретном варианте осуществления молярность Tris составляет 20 мМ. В конкретных вариантах осуществления препарат объемом 1000 мл содержит от 2 до 3 г Tris. В некоторых вариантах осуществления препарат объемом 1000 мл содержит 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9 или 3,0 г Tris. В некоторых вариантах осуществления препарат объемом 1000 мл содержит 2,1 г Tris. В некоторых вариантах осуществления препарат объемом 1000 мл содержит 2,2 г Tris. В некоторых вариантах осуществления препарат объемом 1000 мл содержит 2,3 г Tris. В некоторых вариантах осуществления препарат объемом 1000 мл содержит 2,4 г Tris. В некоторых вариантах осуществления препарат объемом 1000 мл содержит 2,5 г Tris. В некоторых вариантах осуществления препарат объемом 1000 мл содержит 2,6 г Tris. В некоторых вариантах осуществления препарат объемом 1000 мл содержит 2,7 г Tris. В некоторых вариантах осуществления препарат объемом 1000 мл содержит 2,8 г Tris. В некоторых вариантах осуществления препарат объемом 1000 мл содержит 2,9 г Tris. В некоторых вариантах осуществления препарат объемом 1000 мл содержит 3,0 г Tris. В некоторых вариантах осуществления препарат объемом 1000 мл содержит 2,4-2,5 г Tris.
В одном варианте осуществления концентрация трегалозы дигидрата, используемая в фармацевтических композициях, предложенных в настоящем документе, находится в диапазоне от 1% до 20% (масс/об). В другом варианте осуществления концентрация трегалозы дигидрата находится в диапазоне от 2% до 15% (масс/об). В одном варианте осуществления концентрация трегалозы дигидрата находится в диапазоне от 3% до 10% (масс/об). В другом варианте осуществления концентрация трегалозы дигидрата находится в диапазоне от 4% до 9,5% (масс/об). В одном варианте осуществления концентрация трегалозы дигидрата находится в диапазоне от 5% до 9,25% (масс/об). В другом варианте осуществления концентрация трегалозы дигидрата находится в диапазоне от 6% до 9% (масс/об). В одном варианте осуществления концентрация трегалозы дигидрата находится в диапазоне от 7% до 8,5% (масс/об). В другом варианте осуществления концентрация трегалозы дигидрата находится в диапазоне от 8% до 8,4% (масс/об). В одном варианте осуществления концентрация трегалозы дигидрата находится в диапазоне 8,1-8,3% (масс/об). В одном конкретном варианте осуществления концентрация трегалозы дигидрата составляет 8,2%. В одном конкретном варианте осуществления концентрация трегалозы дигидрата составляет 8,3% (масс/об). В конкретных вариантах осуществления препарат объемом 1000 мл содержит 92-93 г трегалозы дигидрата. В некоторых вариантах осуществления препарат объемом 1000 мл содержит 92,0, 92,1, 92,2, 92,3, 92,4, 92,5, 92,6, 92,7, 92,8, 92,9 или 93,0 г трегалозы дигидрата. В некоторых вариантах осуществления препарат объемом 1000 мл содержит 92,0 г трегалозы дигидрата. В некоторых вариантах осуществления препарат объемом 1000 мл содержит 92,1 г трегалозы дигидрата. В некоторых вариантах осуществления препарат объемом 1000 мл содержит 92,2 г трегалозы дигидрата. В некоторых вариантах осуществления препарат объемом 1000 мл содержит 92,3 г трегалозы дигидрата. В некоторых вариантах осуществления препарат объемом 1000 мл содержит 92,4 г трегалозы дигидрата. В некоторых вариантах осуществления препарат объемом 1000 мл содержит 92,5 г трегалозы дигидрата. В некоторых вариантах осуществления препарат объемом 1000 мл содержит 92,6 г трегалозы дигидрата. В некоторых вариантах осуществления препарат объемом 1000 мл содержит 92,7 г трегалозы дигидрата. В некоторых вариантах осуществления препарат объемом 1000 мл содержит 92,8 г трегалозы дигидрата. В некоторых вариантах осуществления препарат объемом 1000 мл содержит 92,9 г трегалозы дигидрата. В некоторых вариантах осуществления препарат объемом 1000 мл содержит 93,0 г трегалозы дигидрата. В некоторых вариантах осуществления препарат объемом 1000 мл содержит 92,4-92,5 г трегалозы дигидрата. В конкретных вариантах осуществления молярность трегалозы дигидрата составляет 240-300 мМ. В других вариантах осуществления молярность трегалозы дигидрата составляет 240-290 мМ. В некоторых вариантах осуществления молярность трегалозы дигидрата составляет 250-290 мМ. В других вариантах осуществления молярность трегалозы дигидрата составляет 260-290 мМ. В некоторых вариантах осуществления молярность трегалозы дигидрата составляет 270-290 мМ. В конкретных вариантах осуществления молярность трегалозы дигидрата составляет 244-245 мМ. В других вариантах осуществления молярность трегалозы дигидрата составляет примерно 280 мМ.
В одном варианте осуществления концентрация соляной кислоты, используемая в фармацевтических композициях, предложенных в настоящем документе, находится в диапазоне 0,01-1% (по объему). В другом варианте осуществления концентрация соляной кислоты находится в диапазоне 0,025-0,75% (по объему). В другом варианте осуществления концентрация соляной кислоты находится в диапазоне 0,05-0,5% (по объему). В другом варианте осуществления концентрация соляной кислоты находится в диапазоне 0,075-0,25% (по объему). В одном конкретном варианте осуществления концентрация соляной кислоты составляет 0,1% (по объему). В конкретных вариантах осуществления препарат объемом 1000 мл содержит 0,8-1,1 мл соляной кислоты. В конкретном варианте осуществления препарат объемом 1000 мл содержит 0,9-1,0 мл соляной кислоты. В конкретных вариантах осуществления препарат объемом 1000 мл содержит 0,90, 0,91, 0,92, 0,93, 0,94, 0,95, 0,96, 0,97, 0,98, 0,99 или 1,00 мл соляной кислоты. В конкретных вариантах осуществления препарат объемом 1000 мл содержит 0,90 мл соляной кислоты. В конкретных вариантах осуществления препарат объемом 1000 мл содержит 0,91 мл соляной кислоты. В конкретных вариантах осуществления препарат объемом 1000 мл содержит 0,92 мл соляной кислоты. В конкретных вариантах осуществления препарат объемом 1000 мл содержит 0,93 мл соляной кислоты. В конкретных вариантах осуществления препарат объемом 1000 мл содержит 0,94 мл соляной кислоты. В конкретных вариантах осуществления препарат объемом 1000 мл содержит 0,95 мл соляной кислоты. В конкретных вариантах осуществления препарат объемом 1000 мл содержит 0,96 мл соляной кислоты. В конкретных вариантах осуществления препарат объемом 1000 мл содержит 0,97 мл соляной кислоты. В конкретных вариантах осуществления препарат объемом 1000 мл содержит 0,98 мл соляной кислоты. В конкретных вариантах осуществления препарат объемом 1000 мл содержит 0,99 мл соляной кислоты. В конкретных вариантах осуществления препарат объемом 1000 мл содержит 1,00 мл соляной кислоты.
В одном варианте осуществления концентрация TWEEN-20, используемая в фармацевтических композициях, предложенных в настоящем документе, находится в диапазоне 0,001-0,1% (по объему). В другом варианте осуществления концентрация TWEEN-20 находится в диапазоне 0,0025-0,075% (по объему). В одном варианте осуществления концентрация TWEEN-20 находится в диапазоне 0,005-0,05% (по объему). В другом варианте осуществления концентрация TWEEN-20 находится в диапазоне 0,0075-0,025% (по объему). В одном конкретном варианте осуществления концентрация TWEEN-20 составляет 0,01% (по объему). В конкретных вариантах осуществления, препарат объемом 1000 мл содержит 0,1 мл TWEEN-20.
В одном варианте осуществления молярность фосфата калия, используемая в фармацевтических композициях, предложенных в настоящем документе, находится в диапазоне 5-50 мМ. В одном варианте осуществления молярность фосфата калия находится в диапазоне 10-40 мМ. В другом варианте осуществления молярность фосфата калия находится в диапазоне 10-35 мМ. В одном варианте осуществления молярность фосфата калия находится в диапазоне 10-30 мМ. В другом варианте осуществления молярность фосфата калия находится в диапазоне 10-25 мМ. В одном варианте осуществления молярность фосфата калия находится в диапазоне 10-20 мМ. В одном конкретном варианте осуществления молярность фосфата калия составляет 10 мМ. В одном конкретном варианте осуществления молярность фосфата калия составляет 20 мМ.
В конкретных вариантах осуществления фармацевтическая композиция не содержит фосфат калия.
В одном варианте осуществления молярность хлорида натрия, используемая в фармацевтических композициях, предложенных в настоящем документе, находится в диапазоне 50-250 мМ. В другом варианте осуществления молярность хлорида натрия находится в диапазоне 75-225 мМ. В одном варианте осуществления молярность хлорида натрия находится в диапазоне 100-200 мМ. В другом варианте осуществления молярность хлорида натрия находится в диапазоне 125-175 мМ. В одном варианте осуществления молярность хлорида натрия находится в диапазоне 130-160 мМ. В другом варианте осуществления молярность хлорида натрия находится в диапазоне 140-150 мМ. В одном конкретном варианте осуществления молярность хлорида натрия составляет 125 мМ. В одном конкретном варианте осуществления молярность хлорида натрия составляет 140 мМ. В одном конкретном варианте осуществления молярность хлорида натрия составляет 150 мМ.
В конкретных вариантах осуществления фармацевтическая композиция не содержит соль. В других конкретных вариантах осуществления фармацевтическая композиция не содержит хлорид натрия.
В одном варианте осуществления фармацевтическая композиция имеет значение pH в диапазоне 6,5-9,5. В другом варианте осуществления фармацевтическая композиция имеет значение pH в диапазоне 6,8-9,3. В одном варианте осуществления фармацевтическая композиция имеет значение pH в диапазоне 7,0-9,0. В другом варианте осуществления фармацевтическая композиция имеет значение pH в диапазоне 7,3-8,7. В одном варианте осуществления фармацевтическая композиция имеет значение pH в диапазоне 7,5-8,5. В другом варианте осуществления фармацевтическая композиция имеет значение pH в диапазоне 7,7-8,2. В одном конкретном варианте осуществления значение pH фармацевтической композиции составляет 7,3. В одном конкретном варианте осуществления значение pH фармацевтической композиции составляет 7,5. В одном конкретном варианте осуществления значение pH фармацевтической композиции составляет 8,0. В одном конкретном варианте осуществления значение pH фармацевтической композиции составляет 8,5. Измерение pH можно выполнять при температуре 4°C.
В одном варианте осуществления фармацевтическая композиция, предложенная в настоящем документе, содержит 20 мМ Tris (например, 2,423 г в 1000 мл раствора). В другом варианте осуществления фармацевтическая композиция, предложенная в настоящем документе, содержит 8,2% (масс/об) трегалозы дигидрата (например, 92,55 г в 1000 мл раствора). В другом варианте осуществления фармацевтическая композиция, предложенная в настоящем документе, содержит 0,01% (по объему) TWEEN-20 (например, 0,1 мл в 1000 мл раствора). В другом варианте осуществления фармацевтическая композиция, предложенная в настоящем документе, содержит соляную кислоту, N.F. (например, 0,94 мл в 1000 мл раствора) и, в конкретных вариантах осуществления, дополнительно содержит воду категории «для инъекций» (добавленную до 999 мл). Также предусмотрено любое сочетание из двух, трех, четырех, пяти или всех шести из вышеперечисленных компонентов. В некоторых вариантах осуществления фармацевтическая композиция, предложенная в настоящем документе, имеет значение pH 7,7-8,2, например, выше 7,7, выше 7,8, выше 7,9, выше 8,0 или выше 8,1, измеренное при температуре 25°C. В некоторых вариантах осуществления фармацевтическая композиция, предложенная в настоящем документе, имеет значение pH выше 7,7, измеренное при температуре 25°C. В некоторых вариантах осуществления фармацевтическая композиция, предложенная в настоящем документе, имеет значение pH выше 7,8, измеренное при температуре 25°C. В некоторых вариантах осуществления фармацевтическая композиция, предложенная в настоящем документе, имеет значение pH выше 7,9, измеренное при температуре 25°C. В некоторых вариантах осуществления фармацевтическая композиция, предложенная в настоящем документе, имеет значение pH выше 8,0, измеренное при температуре 25°C. В некоторых вариантах осуществления фармацевтическая композиция, предложенная в настоящем документе, имеет значение pH выше 8,1, измеренное при температуре 25°C. В одном варианте осуществления фармацевтическая композиция, предложенная в настоящем документе, имеет значение pH 7,9-8,1, например, измеренное при температуре 25°C. В конкретных вариантах осуществления фармацевтическая композиция, предложенная в настоящем документе, имеет значение pH 8,0, например, измеренное при температуре 25°C. В некоторых вариантах осуществления фармацевтическая композиция, предложенная в настоящем документе, имеет значение pH 8,5, например, измеренное при температуре 4°C.
Таким образом, в одном варианте осуществления фармацевтическая композиция содержит фосфат калия, хлорид натрия, трометамин (Tris), трегалозы дигидрат, TWEEN-20, соляную кислоту, воду или любое их сочетание. В конкретном варианте осуществления фармацевтическая композиция содержит фосфат калия, хлорид натрия, трометамин (Tris), трегалозы дигидрат, TWEEN-20, соляную кислоту и воду.
В конкретном варианте осуществления фармацевтическая композиция, предложенная в настоящем документе, содержит 20 мМ Tris (2,423 г в 1000 мл раствора), 8,2% (масс/об) трегалозы дигидрата (92,55 г в 1000 мл раствора), 0,01% (по объему) TWEEN-20 (0,1 мл в 1000 мл раствора), соляную кислоту, N.F. (0,94 мл в 1000 мл раствора) и воду категории «для инъекций» (добавленную до 999 мл), и имеет значение pH 8,5 (измеренное при температуре 4°C).
В конкретных вариантах осуществления фармацевтическая композиция, предложенная в настоящем документе, не содержит соль. В конкретных вариантах осуществления фармацевтическая композиция, предложенная в настоящем документе, содержит сахар, такой как трегалоза. В конкретных вариантах осуществления фармацевтическая композиция, предложенная в настоящем документе, содержит сахар, но не содержит соль. В некоторых вариантах осуществления фармацевтическая композиция, предложенная в настоящем документе, имеет значение pH 7,7-8,2, измеренное при температуре 25°C.
В некоторых вариантах осуществления фармацевтическая композиция имеет осмоляльность 250-350 осмоль/л. В некоторых вариантах осуществления фармацевтическая композиция имеет осмоляльность 275-325 осмоль/л. В некоторых вариантах осуществления фармацевтическая композиция имеет осмоляльность 295-305 осмоль/л. В некоторых вариантах осуществления фармацевтическая композиция имеет осмоляльность 295 осмоль/л. В некоторых вариантах осуществления фармацевтическая композиция имеет осмоляльность 296 осмоль/л. В некоторых вариантах осуществления фармацевтическая композиция имеет осмоляльность 297 осмоль/л. В некоторых вариантах осуществления фармацевтическая композиция имеет осмоляльность 298 осмоль/л. В некоторых вариантах осуществления фармацевтическая композиция имеет осмоляльность 299 осмоль/л. В некоторых вариантах осуществления фармацевтическая композиция имеет осмоляльность 300 осмоль/л. В некоторых вариантах осуществления фармацевтическая композиция имеет осмоляльность 301 осмоль/л. В некоторых вариантах осуществления фармацевтическая композиция имеет осмоляльность 302 осмоль/л. В некоторых вариантах осуществления фармацевтическая композиция имеет осмоляльность 303 осмоль/л. В некоторых вариантах осуществления фармацевтическая композиция имеет осмоляльность 304 осмоль/л. В некоторых вариантах осуществления фармацевтическая композиция имеет осмоляльность 305 осмоль/л.
Хотя приведены конкретные числа (и диапазоны чисел), понятно, что в конкретных вариантах осуществления численные значения в пределах, например, 2%, 5%, 10%, 15% или 20%, от указанных чисел (или диапазонов чисел) также предусмотрены. Другие иллюстративные фармацевтические композиции приведены в «Экспериментальном разделе», ниже.
Основной растворитель в среде может быть либо водным, либо неводным по своей природе. Кроме того, среда может содержать другие фармацевтически приемлемые эксципиенты для модификации или поддержания значения pH, осмолярности, вязкости, стерильности или стабильности фармацевтической композиции. В конкретных вариантах осуществления фармацевтически приемлемая среда представляет собой водный буфер. В других вариантах осуществления среда содержит, например, хлорид натрия и/или цитрат натрия.
Фармацевтические композиции, предложенные в настоящем документе, могут дополнительно содержать другие фармацевтически приемлемые компоненты препарата для модификации или поддержания скорости высвобождения пептида и/или дополнительного средства, описанного в настоящем документе. Такие компоненты препарата включают вещества, которые специалисты в данной области используют для получения препаратов с замедленным высвобождением. Для получения дополнительной информации относительно фармацевтически и физиологически приемлемых компонентов препарата, смотри, например, сборники Remington's Pharmaceutical Sciences, 18е издание (1990, Mack Publishing Co., Easton, Pa. 18042) страницы 1435-1712, The Merck Index, 12е издание (1996, Merck Publishing Group, Whitehouse, NJ); и Pharmaceutical Principles of Solid Dosage Forms (1993, Technonic Publishing Co., Inc., Lancaster, Pa). Дополнительные фармацевтические композиции, подходящие для введения, известны в данной области и могут быть использованы в способах и композициях, предложенных в настоящем документе.
Фармацевтическую композицию можно хранить в стерильном флаконе в виде раствора, суспензии, геля, эмульсии, твердого вещества, либо высушенного или лиофилизированного порошка. Такие композиции можно хранить либо в готовой к употреблению форме, лиофилизированной форме, нуждающейся в восстановлении перед использованием, жидкой форме, нуждающейся в разбавлении перед использованием, либо в другой приемлемой форме. В некоторых вариантах осуществления фармацевтическую композицию предоставляют в одноразовом контейнере (например, одноразовом флаконе, ампуле, шприце или автоинъекторе (аналогичном, например, устройству EpiPen®)), в то время как в других вариантах осуществления предоставляют многоразовый контейнер (например, многоразовый флакон). Любое устройство для доставки лекарственных средств можно использовать для доставки пептидов и других средств, описанных в настоящем документе, включая имплантаты (например, имплантируемые насосы) и системы катетеров; оба вида устройств известны специалистам в данной области. Инъекцию веществ замедленной абсорбции, которую обычно вводят подкожно или внутримышечно, также можно использовать с целью высвобождения пептидов и/или других средств, описанных в настоящем документе, на протяжении определенного периода времени. Инъекции веществ замедленной абсорбции, как правило, имеют твердую или масляную основу и обычно содержат по меньшей мере один из компонентов препарата, описанных в настоящем документе. Специалисту в данной области знакомы возможные препараты и способы применения инъекций веществ замедленной абсорбции. В конкретных вариантах осуществления предусмотрено использование технологии доставки инъекции веществ замедленной абсорбции от компании Nano Precision Medical (Nano Precision Medical; Emeryville, CA). По данной технологии используют мембрану из титановых нанотрубок, которая обеспечивает скорости высвобождения нулевого порядка для макромолекул, таких как белковые и пептидные терапевтические препараты. Биосовместимую мембрану помещают в небольшой подкожный имплантат, который обеспечивает долгосрочную (например, до одного года) доставку терапевтических макромолекул с постоянной скоростью. В настоящее время данная технология проходит оценку, например, для доставки агонистов GLP-1 для лечения диабета II типа.
Фармацевтическая композиция может быть сформулирована для совместимости с запланированным для нее путем введения. Следовательно, фармацевтические композиции содержат носители, разбавители или эксципиенты, подходящие для введения различными путями введения, включая парентеральный (например, подкожный (п/к), внутривенный, внутримышечный или внутрибрюшинный), внутрикожный, пероральный (например, прием внутрь), ингаляцию, введение в полости тела, интракраниальный и чрескожный (топический) пути введения. Другие иллюстративные пути введения описаны в настоящем документе.
Фармацевтические композиции могут находиться в форме стерильной инъекционной водной или масляной суспензии. Такая суспензия может быть сформулирована с использованием соответствующих диспергирующих или увлажняющих средств, а также суспендирующих средств, раскрытых в настоящем документе или известных квалифицированному специалисту. Стерильный инъекционный препарат также может представлять собой стерильный инъекционный раствор или суспензию в нетоксичном, приемлемом для парентерального введения разбавителе или растворителе, например, раствор в 1,3-бутандиоле. Приемлемые разбавители, растворители и дисперсионные среды, которые можно использовать, включают воду, раствор Рингера, изотонический раствор хлорида натрия, кремофор EL™ (BASF, Parsippany, NJ) или фосфатно-солевой буфер (PBS), этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), а также соответствующие их смеси. Кроме того, в качестве растворителя или суспензионной среды обычно используют стерильные нелетучие масла. Для этой цели можно использовать любое легкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, для получения инъекционных препаратов используют жирные кислоты, такие как олеиновая кислота. Пролонгированной абсорбции конкретных инъекционных препаратов можно добиваться за счет включения средства, замедляющего абсорбцию (например, алюминия моностеарата или желатина).
В одном варианте осуществления фармацевтические композиции, предложенные в настоящем документе, можно вводить парентерально путем инъекции, инфузии или имплантации, для локального или системного введения. Используемый в настоящем документе термин «парентеральное введение» включает внутривенное, внутриартериальное, внутрибрюшинное, интратекальное, интравентрикулярное, интрауретральное, интрастернальное, интракраниальное, внутримышечное, внутрисуставное и подкожное введение.
В одном варианте осуществления фармацевтические композиции, предложенные в настоящем документе, могут быть сформулированы в любые лекарственные формы, которые подходят для парентерального введения, включая растворы, суспензии, эмульсии, мицеллы, липосомы, микросферы, наносистемы и твердые формы, подходящие для растворения или суспендирования в жидкости перед инъекцией. Такие лекарственные формы могут быть получены общепринятыми методами, известными специалистам в области фармацевтической науки (смотри, например, Remington, The Science и Practice of Pharmacy, выше).
В одном варианте осуществления фармацевтические композиции, предназначенные для парентерального введения, могут содержать один или более фармацевтически приемлемых носителей и эксципиентов, включая, но без ограничения, водные среды, смешивающиеся с водой среды, неводные среды, противомикробные средства или консерванты, препятствующие росту микроорганизмов, стабилизаторы, средства, повышающие растворимость, изотонические средства, буферные средства, антиоксиданты, местные анестетики, суспендирующие и диспергирующие средства, увлажнители или эмульгаторы, комплексообразователи, секвестрирующие или хелатирующие средства, криопротекторы, лиопротекторы, загустители, регуляторы pH и инертные газы.
В одном варианте осуществления соответствующие водные среды включают, но не ограничиваются ими, воду, солевой раствор, физиологический солевой раствор или фосфатно-солевой буфер (PBS), инъекционный хлорид натрия, инъекционный раствор Рингера, изотонический инъекционный раствор декстрозы, стерильную воду для инъекций, инъекционный раствор Рингера с декстрозой и инъекционный раствор Рингера лактат. Неводные среды включают, но не ограничиваются ими, нелетучие растительные масла, касторовое масло, кукурузное масло, хлопковое масло, оливковое масло, арахисовое масло, масло мяты перечной, сафлоровое масло, кунжутное масло, соевое масло, гидрогенизированные растительные масла, гидрогенизированное соевое масло и триглицериды средней цепи из кокосового масла, а также пальмовое масло. Смешивающиеся с водой среды включают, но не ограничиваются ими, этанол, 1,3-бутандиол, жидкий полиэтиленгликоль (например, полиэтиленгликоль 300 и полиэтиленгликоль 400), пропиленгликоль, глицерин, N-метил-2-пирролидон, N,N-диметилацетамид и диметилсульфоксид.
В одном варианте осуществления соответствующие противомикробные средства или консерванты включают, но не ограничиваются ими, фенолы, крезолы, ртутные препараты, бензиловый спирт, хлорбутанол, метил- и пропил-п-гидроксибензоаты, тимеросал, бензалконий хлорид (например, бензэтоний хлорид), метил- и пропилпарабены, а также сорбиновую кислоту. Соответствующие изотонические средства включают, но не ограничиваются ими, хлорид натрия, глицерин и декстрозу. Соответствующие буферные средства включают, но не ограничиваются ими, фосфат и цитрат. Соответствующие антиоксиданты являются такими, как описано в настоящем документе, включая бисульфит и метaбисульфит натрия. Соответствующие местные анестетики включают, но не ограничиваются им, прокаин гидрохлорид. Соответствующие суспендирующие и диспергирующие средства являются такими, как описано в настоящем документе, включая натрий-карбоксиметилцеллюлозу, гидроксипропилметилцеллюлозу и поливинилпирролидон. Соответствующие эмульгаторы включают те, которые описаны в настоящем документе, включая полиоксиэтилен сорбитан монолаурат, моноолеат полиоксиэтиленсорбитана 80 и триэтаноламин олеат. Соответствующие секвестрирующие или хелатирующие средства включают, но не ограничиваются ими, ЭДТА. Соответствующие регуляторы pH включают, но не ограничиваются ими, гидроксид натрия, соляную кислоту, лимонную кислоту и молочную кислоту. Соответствующие комплексообразователи включают, но не ограничиваются ими, циклодекстрины, в том числе a-циклодекстрин, b-циклодекстрин, гидроксипропил-b-циклодекстрин, сульфобутилэфир-b-циклодекстрин и сульфобутилэфир-7-b-циклодекстрин (CAPTISOL®, CyDex, Lenexa, KS).
В одном варианте осуществления фармацевтические композиции, предложенные в настоящем документе, могут быть сформулированы для введения одной дозой или несколькими дозами. Препараты для введения одной дозой помещают в ампулу, флакон или шприц. Парентеральные препараты для введения несколькими дозами могут содержать противомикробные средства в бактериостатических или фунгистатических концентрациях. Все парентеральные препараты должны быть стерильными, как известно и принято в данной области.
В одном варианте осуществления фармацевтические композиции предоставляют в виде готовых для использования стерильных растворов. В другом варианте осуществления фармацевтические композиции предоставляют в виде стерильных сухих растворимых препаратов, включая лиофилизированные порошки и гиподермальные таблетки, которые восстанавливают в среде перед использованием. В другом варианте осуществления фармацевтические композиции предоставляют в виде готовых для использования стерильных суспензий. В другом варианте осуществления фармацевтические композиции предоставляют в виде стерильных сухих нерастворимых препаратов, которые восстанавливают в среде перед использованием. В другом варианте осуществления фармацевтические композиции предоставляют в виде готовых для использования стерильных эмульсий.
В одном варианте осуществления фармацевтические композиции, предложенные в настоящем документе, могут быть сформулированы в виде лекарственных форм с немедленным или модифицированным высвобождением, включая формы с отсроченным, замедленным, импульсным, контролируемым, направленным и программируемым высвобождением.
В одном варианте осуществления фармацевтические композиции могут быть сформулированы в виде суспензии, твердого, полутвердого препарата или тиксотропной жидкости для введения в виде имплантированного депо. В одном варианте осуществления фармацевтические композиции, предложенные в настоящем документе, диспергированы в твердой внутренней матрице, окруженной наружной полимерной мембраной, которая нерастворима в жидкостях тела, но позволяет активному ингредиенту в фармацевтических композициях диффундировать через нее.
В одном варианте осуществления материалы соответствующих внутренних матриц включают полиметилметакрилат, полибутилметакрилат, пластифицированный или непластифицированный поливинилхлорид, пластифицированный нейлон, пластифицированный полиэтилентерефталат, природный каучук, полиизопрен, полиизобутилен, полибутадиен, полиэтилен, этиленвинилацетатные сополимеры, силиконовые каучуки, полидиметилсилоксаны, сополимеры с кремний-углеродной связью, гидрофильные полимеры, такие как гидрогели сложных эфиров акриловой и метакриловой кислот, коллаген, сшитый поливиниловый спирт и сшитый частично гидролизованный поливинилацетат.
В одном варианте осуществления материалы соответствующих наружных полимерных мембран включают полиэтилен, полипропилен, сополимеры этилена/пропилена, сополимеры этилена/этилакрилата, сополимеры этилена/винилацетата, силиконовые каучуки, полидиметилсилоксаны, неопреновый каучук, хлорированный полиэтилен, поливинилхлорид, сополимеры винилхлорида с винилацетатом, винилиденхлоридом, этиленом и пропиленом, ионосодержащий полиэтилентерефталат, бутиловые каучуки, эпихлорогидриновые каучуки, сополимер этилена/винилового спирта, сополимер этилена/винилоксиэтанола и терполимер этилена/винилацетата/винилового спирта.
Фармацевтические композиции могут находиться в форме, подходящей для перорального применения, например, в виде таблеток, капсул, лепешек, пастилок, водных или масляных суспензий, диспергируемых порошков или гранул, эмульсий, твердых или мягких капсул, либо сиропов, растворов, микрогранул или эликсиров. Фармацевтические композиции, предназначенные для перорального применения, могут быть изготовлены любым из способов, известных в области производства фармацевтических композиций. Такие композиции могут содержать одно или более таких средств, как подсластители, ароматизаторы, красители и консерванты, для создания фармацевтических препаратов изящной формы и с приятным вкусом. Содержащийся в таблетках пептид, предложенный в настоящем документе, может находиться в смеси с нетоксичными фармацевтически приемлемыми эксципиентами, подходящими для производства таблеток. Эти эксципиенты включают, например, разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие и дезинтегрирующие средства, например, кукурузный крахмал или альгиновую кислоту; связывающие вещества, например, крахмал, желатин или гуммиарабик, и смазывающие вещества, например, стеарат магния, стеариновую кислоту или тальк.
Таблетки, капсулы, и тому подобное, которые подходят для перорального введения, могут не иметь покрытия или они могут иметь нанесенное известными методами покрытие для задержки распада и абсорбции в желудочно-кишечном тракте, и, тем самым, обеспечения замедленного высвобождения на протяжении более длительного периода времени. Например, можно использовать материал, замедляющий высвобождение, такой как глицерил моностеарат или глицерил дистеарат. На них также может быть нанесено покрытие с использованием методов, известных в данной области, для создания осмотических терапевтических таблеток с контролируемым высвобождением. Дополнительные средства включают биоразлагаемые или биосовместимые частицы, или полимерное вещество, такое как полиэфиры, полиаминокислоты, гидрогель, поливинилпирролидон, полиангидриды, полигликолевая кислота, этиленвинилацетат, метилцеллюлоза, карбоксиметилцеллюлоза, протамина сульфат, либо сополимеры лактида/гликолида, сополимеры полилактида/гликолида или этиленвинилацетатные сополимеры, для обеспечения контролируемой доставки введенной композиции. Например, пероральное средство может быть заключено в микрокапсулы, полученные методом коацервации или межповерхностной полимеризации, с использованием микрокапсул из гидроксиметилцеллюлозы или желатина, или поли(метилметакрилатных) микрокапсул, соответственно, или может находиться в коллоидной системе доставки лекарственного средства. Коллоидные дисперсные системы включают макромолекулярные комплексы, нанокапсулы, микросферы, микрогранулы и системы на основе липидов, включая эмульсии типа масло-в-воде, мицеллы, смешанные мицеллы и липосомы. Способы получения липосом описаны, например, в патентах США №№ 4235871, 4501728 и 4837028. Способы получения вышеуказанных препаратов будут очевидны для специалистов в данной области.
Препараты для перорального применения также могут быть предоставлены в виде твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем, например, карбонатом кальция, фосфатом кальция, каолином или микрокристаллической целлюлозой, или в виде мягких желатиновых капсул, в которых активный ингредиент смешан с водной или масляной средой, например, арахисовым маслом, вазелиновым маслом или оливковым маслом.
Водные суспензии содержат активные материалы в смеси с эксципиентами, подходящими для их производства. Такие эксципиенты представляют собой суспендирующие средства, например, натрий-карбоксиметилцеллюлозу, метилцеллюлозу, гидроксипропилметилцеллюлозу, натрия альгинат, поливинилпирролидон, трагакантовую камедь и гуммиарабик; диспергирующие или увлажняющее средства могут представлять собой природный фосфатид, например, лецитин, или продукты конденсации алкиленоксида с жирными кислотами, например, полиоксиэтилен стеарат, или продукты конденсации этиленоксида с длинноцепочечными алифатическими спиртами, например, гептадекаэтиленоксицетанол, или продукты конденсации этиленоксида с частичными сложными эфирами, полученными из жирных кислот и гексита, например, полиоксиэтилен сорбит моноолеат, или продукты конденсации этиленоксида с частичными сложными эфирами, полученными из жирных кислот и ангидридов гексита, например, моноолеат полиэтиленсорбитана. Водные суспензии также могут содержать один или более консервантов.
Масляные суспензии можно формулировать путем суспендирования активного ингредиента в растительном масле, например, арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, либо в минеральном масле, таком как вазелиновое масло. Масляные суспензии могут содержать загуститель, например, пчелиный воск, твердый парафин или цетиловый спирт. Для создания приятного на вкус перорального препарата можно добавлять подсластители, такие как те, которые указаны выше, и ароматизаторы.
Диспергируемые порошки и гранулы, подходящие для получения водной суспензии путем добавления воды, содержат активный ингредиент в смеси с диспергирующим или увлажняющим средством, суспендирующим средством и одним или более консервантами. Соответствующие диспергирующие или увлажняющие средства и суспендирующие средства описаны в настоящем документе.
Фармацевтические композиции, предложенные в настоящем документе, также могут находиться в форме эмульсии типа масло-в-воде. Масляная фаза может представлять собой растительное масло, например, оливковое масло или арахисовое масло, или минеральное масло, например, вазелиновое масло, либо их смеси. Соответствующие эмульгаторы могут представлять собой природные камеди, например, гуммиарабик или трагакантовую камедь; природные фосфатиды, например, лецитин сои, а также сложные эфиры или частичные сложные эфиры, полученные из жирных кислот и ангидридов гексита, например, сорбитан моноолеат; и продукты конденсации частичных сложных эфиров с этиленоксидом, например, моноолеат полиоксиэтиленсорбитана.
Фармацевтические композиции также могут содержать носители для защиты композиции от быстрого распада или выведения из организма, например, препараты с контролируемым высвобождением, включая имплантаты, липосомы, гидрогели, пролекарства и микроинкапсулированные системы доставки. Например, можно использовать замедляющий высвобождение материал, такой как глицерил моностеарат или глицерил стеарат, отдельно или в сочетании с воском. Пролонгированной абсорбции инъекционных фармацевтических композиций можно добиваться путем включения средства, которое замедляет абсорбцию, например, алюминия моностеарата или желатина. Защиту от микроорганизмов можно обеспечивать за счет использования различных антибактериальных и противогрибковых средств, например, парабенов, хлорбутанола, фенола, аскорбиновой кислоты, тимеросала и тому подобного.
В настоящем документе также предложены пептиды и/или одно или более дополнительных средств, описанных в настоящем документе, в форме суппозиториев для ректального введения. Суппозитории можно изготавливать путем смешивания пептида и/или одного или более дополнительных средств, описанных в настоящем документе, с соответствующим нераздражающим эксципиентом, который является твердым при обычных температурах, но жидким при ректальной температуре и, следовательно, будет плавиться в прямой кишке, высвобождая лекарственное средство. Такие материалы включают, но не ограничиваются ими, масло какао и полиэтиленгликоли.
5.3 Пептиды
В конкретных вариантах осуществления фармацевтические композиции, препараты и лекарственные формы, предложенные в настоящем документе, содержат один или более пептидов, или пептидных последовательностей, предложенных в настоящем документе. В конкретных вариантах осуществления фармацевтические композиции, препараты и лекарственные формы, предложенные в настоящем документе, содержат один или более вариантов пептидных последовательностей FGF19, продуктов слияния пептидных последовательностей FGF19 и/или FGF21, а также вариантов продуктов слияния (химер) пептидных последовательностей FGF19 и/или FGF21, которые имеют одну или более активностей, имеющих отношение к лечению и/или предотвращению связанного с гомеостазом желчных кислот или сопутствующего заболевания (например, PBC), метаболического нарушения, либо рака или опухоли. В конкретных вариантах осуществления активность представляет собой снижающую уровень глюкозы активность. Такие варианты и продукты слияния (химеры) пептидных последовательностей FGF19 и/или FGF21 включают последовательности, которые существенно не увеличивают или не индуцируют образование HCC или онкогенез HCC, и/или не вызывают существенного повышения или возрастания липидного профиля.
В одном варианте осуществления химерная пептидная последовательность включает или состоит из N-концевой области, содержащей по меньшей мере семь аминокислотных остатков, N-концевой области, имеющей первое аминокислотное положение и последнее аминокислотное положение, при этом N-концевая область содержит последовательность DSSPL (SEQ ID NO: 121) или DASPH (SEQ ID NO: 122); и C-концевой области, содержащей часть FGF19, C-концевой области, имеющей первое аминокислотное положение и последнее аминокислотное положение, при этом C-концевая область содержит аминокислотные остатки 16-29 из FGF19 (WGDPIRLRHLYTSG; SEQ ID NO: 169) и остаток W соответствует первому аминокислотному положению в C-концевой области. В конкретных вариантах осуществления, вариант представляет собой M70:
MRDSSPLVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDS16MDPFGLVTGLEAVRSPSFEK (SEQ ID NO: 70).
В конкретных вариантах осуществления вариант представляет собой M69:
DSSPLVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M69) (SEQ ID NO: 69).
В другом варианте осуществления химерная пептидная последовательность включает или состоит из N-концевой области, содержащей часть FGF21, N-концевой области, имеющей первое аминокислотное положение и последнее аминокислотное положение, при этом N-концевая область содержит последовательность GQV и остаток V соответствует последнему аминокислотному положению в N-концевой области; и C-концевой области, содержащей часть FGF19, C-концевой области, имеющей первое аминокислотное положение и последнее аминокислотное положение, при этом C-концевая область содержит аминокислотные остатки 21-29 из FGF19 (RLRHLYTSG; SEQ ID NO: 185) и остаток R соответствует первому аминокислотному положению в C-концевой области.
В конкретных аспектах настоящего изобретения раскрыты модификации области петли-8 в FGF19, которые приводят к обладанию благоприятными метаболическими параметрами без существенного проявления онкогенности. В настоящем документе остатки 127-129 в FGF19 определяют, как составляющие область петли-8, хотя в литературе область петли-8 иногда определяют, как включающую или состоящую из других остатков (например, остатков 125-129). Определенные сочетания замен R127L и P128E в каркасе FGF19 неожиданно оказали положительный эффект на образование HCC. Даже более удивительно, сочетание замен R127L и P128E и замены Gln (Q) на Leu (L) в центральной области FGF19 привело к еще более существенному эффекту на предотвращение образования HCC.
Соответственно, варианты области петли-8 в FGF19 включены в изобретение, поскольку они способны приводить к уменьшению или устранению существенного, поддающегося измерению или обнаружению образования HCC. Более того, эффект уменьшения образования HCC может быть усилен за счет модификаций аминокислотных остатков за пределами области петли-8 (например, замен аминокислотных остатков в центральной области, такой как область, соответствующая аминокислотам 21-29 в SEQ ID NO: 99). В некоторых вариантах осуществления вариант с модифицированной петлей-8 имеет замену в области петли-8 из FGF19, соответствующей аминокислотам 127-129 в SEQ ID NO: 99. В конкретных вариантах осуществления вариант с модифицированной петлей-8 имеет замену в области петли-8 из FGF19, соответствующую (i) замене R127L, (ii) замене P128E или (iii) замене R127L и замене P128E. В некоторых вариантах осуществления вариант FGF19 имеет или дополнительно имеет замену в центральной области, соответствующей аминокислотам 21-29 в SEQ ID NO: 99. В конкретных вариантах осуществления вариант FGF19 имеет или дополнительно имеет замену в центральной области, соответствующую замене L22Q. В конкретных вариантах осуществления аминокислотная последовательность пептида имеет одну аминокислотную замену в аминокислотной последовательности EIRPD (аминокислоты 2-6 в SEQ ID NO: 190) в области петли-8 из FGF19. В некоторых вариантах осуществления аминокислотная последовательность пептида имеет две аминокислотные замены в аминокислотной последовательности EIRPD (аминокислоты 2-6 в SEQ ID NO: 190) в области петли-8 из FGF19. В других вариантах осуществления аминокислотная последовательность пептида имеет три аминокислотные замены в аминокислотной последовательности EIRPD (аминокислоты 2-6 в SEQ ID NO: 190) в области петли-8 из FGF19. В конкретных вариантах осуществления аминокислотная последовательность пептида имеет четыре аминокислотные замены в аминокислотной последовательности EIRPD (аминокислоты 2-6 в SEQ ID NO: 190) в области петли-8 из FGF19. В некоторых вариантах осуществления аминокислотная последовательность пептида имеет пять аминокислотных замен в аминокислотной последовательности EIRPD (аминокислоты 2-6 в SEQ ID NO: 190) в области петли-8 из FGF19. В конкретных вариантах осуществления аминокислотная последовательность пептида имеет одну аминокислотную замену в аминокислотной последовательности IRP (аминокислоты 3-5 в SEQ ID NO: 190) в области петли-8 из FGF19. В некоторых вариантах осуществления аминокислотная последовательность пептида имеет две аминокислотные замены в аминокислотной последовательности IRP (аминокислоты 3-5 в SEQ ID NO: 190) в области петли-8 из FGF19. В других вариантах осуществления аминокислотная последовательность пептида имеет три аминокислотные замены в аминокислотной последовательности IRP (аминокислоты 3-5 в SEQ ID NO: 190) в области петли-8 из FGF19. В конкретных вариантах осуществления аминокислотная последовательность пептида имеет одну аминокислотную замену в аминокислотной последовательности RP (аминокислоты 4-5 в SEQ ID NO: 190) в области петли-8 из FGF19. В некоторых вариантах осуществления аминокислотная последовательность пептида имеет две аминокислотные замены в аминокислотной последовательности RP (аминокислоты 4-5 в SEQ ID NO: 190) в области петли-8 из FGF19. В конкретных вариантах осуществления аминокислотная замена в аминокислотной последовательности RP (аминокислоты 4-5 в SEQ ID NO: 190) в области петли-8 из FGF19 представляет собой замену Arg (R) на Leu (L). В других вариантах осуществления замена в аминокислотной последовательности RP (аминокислоты 4-5 в SEQ ID NO: 190) в области петли-8 из FGF19 представляет собой замену Pro (P) на Glu (E). В некоторых вариантах осуществления замена в аминокислотной последовательности RP (аминокислоты 4-5 в SEQ ID NO: 190) в области петли-8 из FGF19 представляет собой замену Arg (R) на Leu (L) и замену Pro (P) на Glu (E). В конкретных вариантах осуществления вышеуказанная замена(ы) в области петли-8 из FGF19 находится в соответствующей ей последовательности FGF19 в вариантном пептиде, предложенном в настоящем документе. То есть, указанные замены в составе соответствующей последовательности FGF19 (например, EIRPD, IRP или RP) вариантного пептида, предложенного в настоящем документе, также подразумеваются.
В некоторых вариантах осуществления вариант с модифицированной петлей-8 представляет собой M70:
MRDSSPLVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDS16MDPFGLVTGLEAVRSPSFEK (SEQ ID NO: 70) с заменой в области петли-8 из FGF19 (подчеркнуто). В конкретных вариантах осуществления вариант M70 с модифицированной петлей-8 имеет замену в области петли-8 из FGF19 (подчеркнуто), соответствующую (i) замене R127L, (ii) замене P128E или (iii) замене R127L и замене P128E (SEQ ID NO: 204). В конкретных вариантах осуществления вариант M70 с модифицированной петлей-8 имеет или дополнительно имеет замену в центральной области FGF19. В некоторых вариантах осуществления вариант M70 с модифицированной петлей-8 имеет замену L18Q.
В некоторых вариантах осуществления, вариант с модифицированной петлей-8 представляет собой M69:
RDSSPLVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M69) (SEQ ID NO: 69) с заменой в области петли-8 из FGF19 (подчеркнуто). В конкретных вариантах осуществления вариант M69 с модифицированной петлей-8 имеет замену в области петли-8 из FGF19 (подчеркнуто), соответствующую (i) замене R100L, (ii) замене P101E или (iii) замене R100L и замене P101E. В конкретных вариантах осуществления вариант M69 с модифицированной петлей-8 имеет или дополнительно имеет замену в центральной области FGF19. В некоторых вариантах осуществления вариант M69 с модифицированной петлей-8 имеет замену L17Q.
В некоторых вариантах осуществления вариант с модифицированной петлей-8 имеет замену в области петли-8 из FGF19, соответствующей аминокислотам 127-129 в SEQ ID NO: 3. В конкретных вариантах осуществления вариант с модифицированной петлей-8 имеет замену в области петли-8 из FGF19, соответствующую (i) замене R127L, (ii) замене P128E или (iii) замене R127L и замене P128E. В некоторых вариантах осуществления вариант FGF19 имеет или дополнительно имеет замену в центральной области, соответствующей аминокислотам 21-29 в SEQ ID NO: 3. В конкретных вариантах осуществления вариант FGF19 имеет или дополнительно имеет замену в центральной области, соответствующую замене L22Q.
В следующих вариантах осуществления пептидная последовательность включает или состоит из варианта FGF19, имеющего одну или более аминокислотных замен, вставок или делеций в сравнении с эталонным, или дикого типа, FGF19. В дополнительных вариантах осуществления пептидная последовательность включает или состоит из вариантной последовательности FGF21, имеющей одну или более аминокислотных замен, вставок или делеций в сравнении с эталонным, или дикого типа, FGF21. В дополнительных вариантах осуществления пептидная последовательность включает или состоит из части последовательности FGF19, слитой с частью последовательности FGF21. В дополнительных вариантах осуществления пептидная последовательность включает или состоит из части последовательности FGF19, слитой с частью последовательности FGF21, при этом часть(и) последовательности FGF19 и/или FGF21 имеет одну или более аминокислотных замен, вставок или делеций в сравнении с эталонным, или дикого типа, FGF19 и/или FGF21. Примеры таких последовательностей раскрыты в PCT публикации № WO 2013/006486 и публикации патентной заявки США № 2013/0023474, а также в PCT публикации № WO 2014/085365, опубликованной 5 июня 2014 г. В таблице 1 и списке последовательностей также приведены репрезентативные последовательности, которые могут быть использованы в способах, предложенных в настоящем документе.
В некоторых вариантах осуществления терапевтические пептиды, предложенные в настоящем документе, включают варианты и продукты слияния пептидных последовательностей FGF19 и/или FGF21. В одном варианте осуществления терапевтические пептиды включают один или более вариантов, либо продуктов слияния пептида FGF19 и/или FGF21. В других вариантах осуществления способы, предложенные в настоящем документе, включают создание контакта с, или введение субъекту одной или более молекул нуклеиновой кислоты, кодирующих вариант или продукт слияния пептидной последовательности FGF19 и/или FGF21 (например, элемент контроля экспрессии, функционально связанный с нуклеиновой кислотой, кодирующей пептидную последовательность, необязательно, включая вектор), в количестве, эффективном для лечения связанного с гомеостазом желчных кислот или сопутствующего заболевания.
Репрезентативная эталонная, или дикого типа, последовательность FGF19 приведена далее:
RPLAFSDAGPHVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (SEQ ID NO: 99).
Репрезентативная эталонная, или дикого типа, последовательность FGF21 приведена далее:
HPIPDSSPLLQFGGQVRQRYLYTDDAQQTEAHLEIREDGTVGGAADQSPESLLQLKALKPGVIQILGVKTSRFLCQRPDGALYGSLHFDPEACSFRELLLEDGYNVYQSEAHGLPLHLPGNKSPHRDPAPRGPARFLPLPGLPPALPEPPGILAPQPPDVGSSDPLSMVGPSQGRSPSYAS (SEQ ID NO: 100). Аллельные варианты FGF21 включают, например, M70, M71 и M72.
Термины «пептидная» «белковая» и «полипептидная» последовательность используют в настоящем документе взаимозаменяемо для обозначения двух или более аминокислот, или «остатков», включая химические модификации и производные аминокислот, ковалентно связанных амидной, или эквивалентной, связью. Аминокислоты, образующие весь или часть пептида, могут быть из числа известных 21 природных аминокислот, которые обозначают как однобуквенным сокращением, так и обычным трехбуквенным сокращением. В пептидных последовательностях, предложенных в настоящем документе, обычные аминокислотные остатки имеют их обычное обозначение. Таким образом, «Leu» означает лейцин, «Ile» означает изолейцин, «Nle» означает норлейцин, и так далее.
В различных конкретных аспектах пептидная или химерная последовательность, предложенная в настоящем документе, имеет в первом аминокислотном положении N-концевой области остаток «M», остаток «R», остаток «S», остаток «H», остаток «P», остаток «L» или остаток «D». В различных альтернативных конкретных аспектах пептидная или химерная пептидная последовательность не имеет остатка «M» или остатка «R» в первом аминокислотном положении N-концевой области.
В настоящем документе также предложены подпоследовательности, варианты и модифицированные формы иллюстративных пептидных последовательностей (включая варианты и подпоследовательности FGF19 и FGF21, приведенные в списке последовательностей или таблице 1), при условии, что вышеуказанные последовательности сохраняют по меньшей мере поддающуюся обнаружению или измерению активность, либо функцию. Кроме того, некоторые иллюстративные вариантные пептиды, например, те, которые содержат всю или часть последовательности FGF21 на амино-конце, имеют остаток «R», расположенный на N-конце, который может отсутствовать. Аналогично, некоторые иллюстративные вариантные пептиды содержат остаток «M», расположенный на N-конце, который может быть добавлен или заменять отсутствующий остаток, такой как остаток «R». Более конкретно, в различных вариантах осуществления пептидные последовательности на N-конце содержат любую из последовательностей: RDSS (SEQ ID NO: 115), DSS, MDSS (SEQ ID NO: 116) или MRDSS (SEQ ID NO: 117). Кроме того, если остаток «M» находится рядом с остатком «S», остаток «M» может быть отщеплен так, что остаток «M» делетируется из пептидной последовательности, в то время как если остаток «M» находится рядом с остатком «D», остаток «M» не может быть отщеплен. Таким образом, в качестве примера, в различных вариантах осуществления пептидные последовательности включают последовательности со следующими остатками на N-конце: MDSSPL (SEQ ID NO: 119), MSDSSPL (SEQ ID NO: 120) (расщеплен до SDSSPL (SEQ ID NO: 112)) и MSSPL (SEQ ID NO: 113) (расщеплен до SSPL (SEQ ID NO: 114)).
В настоящем документе приведены иллюстративные пептидные последовательности, отличные от эталонных полипептидов FGF19 и FGF21, приведенных в настоящем документе, которые модулируют гомеостаз желчных кислот, гипергликемические состояния, устойчивость к инсулину, гиперинсулинемию, непереносимость глюкозы, метаболический синдром или сопутствующие заболевания in vivo (например, таблица 1 и список последовательностей). Неограничивающими конкретными примерами являются пептидная последовательность с амино-концевыми аминокислотами 1-16 из FGF21, слитыми с карбокси-концевыми аминокислотами 21-194 из FGF19; пептидная последовательность с амино-концевыми аминокислотами 1-147 из FGF19, слитыми с карбокси-концевыми аминокислотами 147-181 из FGF21; пептидная последовательность с амино-концевыми аминокислотами 1-20 из FGF19, слитыми с карбокси-концевыми аминокислотами 17-181 из FGF21; пептидная последовательность с амино-концевыми аминокислотами 1-146 из FGF21, слитыми с карбокси-концевыми аминокислотами 148-194 из FGF19, и пептидная последовательность с амино-концевыми аминокислотами 1-20 из FGF19, слитыми с внутренними аминокислотами 17-146 из FGF21, слитыми с карбокси-концевыми аминокислотами 148-194 из FGF19.
Дополнительные конкретные пептидные последовательности содержат фрагмент последовательности WGDPI (SEQ ID NO: 170), соответствующий последовательности WGDPI аминокислот 16-20 в FGF19 (SEQ ID NO: 99); лишены фрагмента последовательности WGDPI (SEQ ID NO: 170), соответствующего последовательности WGDPI аминокислот 16-20 в FGF19 (SEQ ID NO: 99), или содержат имеющий замены (то есть, мутантный) фрагмент последовательности WGDPI (SEQ ID NO: 170), соответствующий последовательности WGDPI аминокислот 16-20 в FGF19 (SEQ ID NO: 99).
Конкретные пептидные последовательности, предложенные в настоящем документе, также включают последовательности, отличающиеся от FGF19 и FGF21 (например, приведенных в настоящем документе), и вариантных последовательностей FGF19, имеющих любую из последовательностей GQV, GDI, WGPI (SEQ ID NO: 171), WGDPV (SEQ ID NO: 172), WGDI (SEQ ID NO: 173), GDPI (SEQ ID NO: 174), GPI, WGQPI (SEQ ID NO: 175), WGAPI (SEQ ID NO: 176), AGDPI (SEQ ID NO: 177), WADPI (SEQ ID NO: 178), WGDAI (SEQ ID NO: 179), WGDPA (SEQ ID NO: 180), WDPI (SEQ ID NO: 181), WGDI (SEQ ID NO: 182), WGDP (SEQ ID NO: 183) или FGDPI (SEQ ID NO: 184) вместо последовательности WGDPI (SEQ ID NO: 170) из FGF19 на участке аминокислот 16-20. Соответственно, последовательности дикого типа FGF19 и FGF21 (например, приведенные в настоящем документе в виде SEQ ID NOS: 99 и 100, соответственно) могут быть исключенными последовательностями, и последовательность FGF19, имеющая любую из последовательностей GQV, GDI, WGPI (SEQ ID NO: 171), WGDPV (SEQ ID NO: 172), WGDI (SEQ ID NO: 173), GDPI (SEQ ID NO: 174), GPI, WGQPI (SEQ ID NO: 175), WGAPI (SEQ ID NO: 176), AGDPI (SEQ ID NO: 177), WADPI (SEQ ID NO: 178), WGDAI (SEQ ID NO: 179), WGDPA (SEQ ID NO: 180), WDPI (SEQ ID NO: 181), WGDI (SEQ ID NO: 182), WGDP (SEQ ID NO: 183) или FGDPI (SEQ ID NO: 184) вместо последовательности WGDPI (SEQ ID NO: 170) на участке аминокислот 16-20 в FGF19, также может быть исключена. Такое исключение, однако, не применимо, когда последовательность имеет, например, 3 остатка FGF21, слитые с последовательностью FGF19, имеющей, например, любую из последовательностей GQV, GQV, GDI, или GPI, либо 2 остатка FGF21, слитые с любой из последовательностей WGPI (SEQ ID NO: 171), WGDI (SEQ ID NO: 173), GDPI (SEQ ID NO: 174), WDPI (SEQ ID NO: 181), WGDI (SEQ ID NO: 182) или WGDP (SEQ ID NO: 183).
Конкретные неограничивающие примеры пептидных последовательностей содержат или состоят из всех или части вариантных последовательностей, обозначенных в настоящем документе M1-M98 (SEQ ID NOs: 1-52, 192 и 54-98, соответственно). Более конкретные неограничивающие примеры пептидных последовательностей содержат или состоят из всех или части последовательностей, приведенных далее:
HPIPDSSPLLQFGGQVRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M5-R) (SEQ ID NO: 160) (последовательности FGF21 также могут иметь остаток «R» на амино-конце);
DSSPLLQFGGQVRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (SEQ ID NO: 138 и 161);
RPLAFSDASPHVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M1) (SEQ ID NO: 1 или 139);
RPLAFSDSSPLVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M2) (SEQ ID NO: 2 или 140);
DSSPLVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (SEQ ID NO: 141);
RDSSPLVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M69) (SEQ ID NO: 69);
RDSSPLLQWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M52) (SEQ ID NO: 52);
HPIPDSSPLLQFGGQVRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M5-R) (SEQ ID NO: 160);
HPIPDSSPLLQFGGQVRQRYLYTDDAQQTEAHLEIREDGTVGGAADQSPESLLQLKALKPGVIQILGVKTSRFLCQRPDGALYGSLHFDPEACSFRELLLEDGYNVYQSEAHSLPLHLPGNKSPHRDPAPRGPARFLPLPGLPPALPEPPGILAPQPPDVGSSDPLSMVGPSQGRSPSYAS (M71) (SEQ ID NO: 71);
HPIPDSSPLLQFGGQVRQRYLYTDDAQQTEAHLEIREDGTVGGAADQSPESLLQLKALKPGVIQILGVKTSRFLCQRPDGALYGSLHFDPEACSFRELLLEDGYNVYQSEAHGLPLHLPGNKSPHRDPAPRGPARFLPLPGLPPAPPEPPGILAPQPPDVGSSDPLSMVGPSQGRSPSYAS (M72) (SEQ ID NO: 72);
HPIPDSSPLLQFGGQVRQRYLYTDDAQQTEAHLEIREDGTVGGAADQSPESLLQLKALKPGVIQILGVKTSRFLCQRPDGALYGSLHFDPEACSFRELLLEDGYNVYQSEAHGLPLHLPGNKSPHRDPAPRGPARFLPLPGLPPALPEPPGILAPQPPDVGSSDPLSMVVQDELQGVGGEGCHMHPENCKTLLTDIDRTHTEKPVWDGITGE (M73) (SEQ ID NO: 73);
RPLAFSDAGPHVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEILEDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M3) (SEQ ID NO: 3);
RDSSPLLQFGGQVRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M48) (SEQ ID NO: 48, 6 или 148);
RPLAFSDSSPLLQFGGQVRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M49) (SEQ ID NO: 49, 7 или 149);
RHPIPDSSPLLQFGDQVRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEILEDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M50) (SEQ ID NO: 50);
RHPIPDSSPLLQFGGNVRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M51) (SEQ ID NO: 51, 36 или 155);
MDSSPLLQWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M53) (SEQ ID NO: 192);
MRDSSPLVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M70) (SEQ ID NO: 70);
RPLAFSDAGPHVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEILPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M139) (SEQ ID NO: 193);
RPLAFSDAGPHVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIREDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M140) (SEQ ID NO: 194);
RPLAFSDAGPHVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEILCDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M141) (SEQ ID NO: 195); или
RPLAFSDAGPHVHYGWGDPIRQRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEILEDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M160) (SEQ ID NO: 196);
либо подпоследовательности или фрагмента любой из вышеприведенных пептидных последовательностей. В конкретных вариантах осуществления любой из вышеприведенных пептидных последовательностей концевой остаток R делетирован.
Дополнительные конкретные неограничивающие примеры пептидных последовательностей, имеющих на N-конце пептидную последовательность, содержащую или состоящую из всех или части любой из последовательностей:
HPIPDSSPLLQFGGQVRLRHLYTSG (M5-R) (аминокислоты 1-25 в SEQ ID NO: 160);
DSSPLLQFGGQVRLRHLYTSG (M6) (M6-R) (аминокислоты 2-22 в SEQ ID NO: 6);
RPLAFSDSSPLLQFGGQVRLRHLYTSG (M7) (аминокислоты 1-27 в SEQ ID NO: 7);
HPIPDSSPLLQWGDPIRLRHLYTSG (M8-R) (аминокислоты 2-26 в SEQ ID NO: 8);
HPIPDSSPLLQFGWGDPIRLRHLYTSG (M9-R) (аминокислоты 2-28 в SEQ ID NO: 9);
HPIPDSSPHVHYGWGDPIRLRHLYTSG (M10-R) (аминокислоты 2-28 в SEQ ID NO: 10);
RPLAFSDAGPLLQWGDPIRLRHLYTSG (M11) (аминокислоты 1-27 в SEQ ID NO: 11);
RPLAFSDAGPLLQFGWGDPIRLRHLYTSG (M12) (аминокислоты 1-29 в SEQ ID NO: 12);
RPLAFSDAGPLLQFGGQVRLRHLYTSG (M13) (аминокислоты 1-27 в SEQ ID NO: 13);
HPIPDSSPHVHYGGQVRLRHLYTSG (M14-R) (аминокислоты 2-26 в SEQ ID NO: 14);
RPLAFSDAGPHVHYGGQVRLRHLYTSG (M15) (аминокислоты 1-27 в SEQ ID NO: 15);
RPLAFSDAGPHVHWGDPIRLRHLYTSG (M16) (аминокислоты 1-27 в SEQ ID NO: 16);
RPLAFSDAGPHVGWGDPIRLRHLYTSG (M17) (аминокислоты 1-27 в SEQ ID NO: 17);
RPLAFSDAGPHYGWGDPIRLRHLYTSG (M18) (аминокислоты 1-27 в SEQ ID NO: 18);
RPLAFSDAGPVYGWGDPIRLRHLYTSG (M19) (аминокислоты 1-27 в SEQ ID NO: 19);
RPLAFSDAGPVHGWGDPIRLRHLYTSG (M20) (аминокислоты 1-27 в SEQ ID NO: 20);
RPLAFSDAGPVHYWGDPIRLRHLYTSG (M21) (аминокислоты 1-27 в SEQ ID NO: 21);
RPLAFSDAGPHVHGWGDPIRLRHLYTSG (M22) (аминокислоты 1-27 в SEQ ID NO: 22);
RPLAFSDAGPHHGWGDPIRLRHLYTSG (M23) (аминокислоты 1-27 в SEQ ID NO: 23);
RPLAFSDAGPHHYWGDPIRLRHLYTSG (M24) (аминокислоты 1-27 в SEQ ID NO: 24);
RPLAFSDAGPHVYWGDPIRLRHLYTSG (M25) (аминокислоты 1-27 в SEQ ID NO: 25);
RPLAFSDSSPLVHWGDPIRLRHLYTSG (M26) (аминокислоты 1-27 в SEQ ID NO: 26);
RPLAFSDSSPHVHWGDPIRLRHLYTSG (M27) (аминокислоты 1-27 в SEQ ID NO: 27);
RPLAFSDAGPHVWGDPIRLRHLYTSG (M28) (аминокислоты 1-26 в SEQ ID NO: 28);
RPLAFSDAGPHVHYWGDPIRLRHLYTSG (M29) (аминокислоты 1-28 в SEQ ID NO: 29);
RPLAFSDAGPHVHYAWGDPIRLRHLYTSG (M30) (аминокислоты 1-29 в SEQ ID NO: 30);
RHPIPDSSPLLQFGAQVRLRHLYTSG (M31) (аминокислоты 1-26 в SEQ ID NO: 31);
RHPIPDSSPLLQFGDQVRLRHLYTSG (M32) (аминокислоты 1-26 в SEQ ID NO: 32);
RHPIPDSSPLLQFGPQVRLRHLYTSG (M33) (аминокислоты 1-26 в SEQ ID NO: 33);
RHPIPDSSPLLQFGGAVRLRHLYTSG (M34) (аминокислоты 1-26 в SEQ ID NO: 34);
RHPIPDSSPLLQFGGEVRLRHLYTSG (M35) (аминокислоты 1-26 в SEQ ID NO: 35);
RHPIPDSSPLLQFGGNVRLRHLYTSG (M36) (аминокислоты 1-26 в SEQ ID NO: 36);
RHPIPDSSPLLQFGGQARLRHLYTSG (M37) (аминокислоты 1-26 в SEQ ID NO: 37);
RHPIPDSSPLLQFGGQIRLRHLYTSG (M38) (аминокислоты 1-26 в SEQ ID NO: 38);
RHPIPDSSPLLQFGGQTRLRHLYTSG (M39) (аминокислоты 1-26 в SEQ ID NO: 39);
RHPIPDSSPLLQFGWGQPVRLRHLYTSG (M40) (аминокислоты 1-28 в SEQ ID NO: 40);
DAGPHVHYGWGDPIRLRHLYTSG (M74-R) (аминокислоты 2-24 в SEQ ID NO: 74);
VHYGWGDPIRLRHLYTSG (M75-R) (аминокислоты 2-19 в SEQ ID NO: 75);
RLRHLYTSG (M77-R) (аминокислоты 2-10 в SEQ ID NO: 77);
RHPIPDSSPLLQFGWGDPIRLRHLYTSG (M9) (аминокислоты 1-28 в SEQ ID NO: 9);
RHPIPDSSPLLQWGDPIRLRHLYTSG (M8) (аминокислоты 1-26 в SEQ ID NO: 8);
RPLAFSDAGPLLQFGWGDPIRLRHLYTSG (M12) (аминокислоты 1-29 в SEQ ID NO: 12);
RHPIPDSSPHVHYGWGDPIRLRHLYTSG (M10) (аминокислоты 1-28 в SEQ ID NO: 10);
RPLAFSDAGPLLQFGGQVRLRHLYTSG (M13) (аминокислоты 1-27 в SEQ ID NO: 13);
RHPIPDSSPHVHYGGQVRLRHLYTSG (M14) (аминокислоты 1-26 в SEQ ID NO: 14);
RPLAFSDAGPHVHYGGDIRLRHLYTSG (M43) аминокислоты 1-27 в SEQ ID NO: 43); или
RDSSPLLQFGGQVRLRHLYTSG (M6) (аминокислоты 1-22 в SEQ ID NO: 6);
и в любой из вышеперечисленных пептидных последовательностей амино-концевой остаток R может быть делетирован.
Пептидные последовательности, предложенные в настоящем документе, дополнительно включают последовательности с пониженной или отсутствующей способностью к индукции образования HCC по сравнению с последовательностью FGF19 или вариантной последовательностью FGF19, имеющей любую из последовательностей GQV, GDI, WGPI (SEQ ID NO: 171), WGDPV (SEQ ID NO: 172), WGDI (SEQ ID NO: 173), GDPI (SEQ ID NO: 174), GPI, WGQPI (SEQ ID NO: 175), WGAPI (SEQ ID NO: 176), AGDPI (SEQ ID NO: 177), WADPI (SEQ ID NO: 178), WGDAI (SEQ ID NO: 179), WGDPA (SEQ ID NO: 180), WDPI (SEQ ID NO: 181), WGDI (SEQ ID NO: 182), WGDP (SEQ ID NO: 183) или FGDPI (SEQ ID NO: 184) вместо последовательности WGDPI (SEQ ID NO: 170) на участке аминокислот 16-20 в FGF19. Пептидные последовательности, предложенные в настоящем документе, также включают последовательности с большей снижающей уровень глюкозы активностью по сравнению с последовательностью FGF19 или вариантной последовательностью FGF19, имеющей любую из последовательностей GQV, GDI, WGPI (SEQ ID NO: 171), WGDPV (SEQ ID NO: 172), WGDI (SEQ ID NO: 173), GDPI (SEQ ID NO: 174), GPI, WGQPI (SEQ ID NO: 175), WGAPI (SEQ ID NO: 176), AGDPI (SEQ ID NO: 177), WADPI (SEQ ID NO: 178), WGDAI (SEQ ID NO: 179), WGDPA (SEQ ID NO: 180), WDPI (SEQ ID NO: 181), WGDI (SEQ ID NO: 182), WGDP (SEQ ID NO: 183) или FGDPI (SEQ ID NO: 184) вместо последовательности WGDPI (SEQ ID NO: 170) на участке аминокислот 16-20 в FGF19. Пептидные последовательности, предложенные в настоящем документе, также включают последовательности с меньшей повышающей уровень липидов (например, триглицеридов, холестерина, не-ЛВП) или большей повышающей уровень ЛВП активностью по сравнению с последовательностью FGF19 или вариантной последовательностью FGF19, имеющей любую из последовательностей GQV, GDI, WGPI (SEQ ID NO: 171), WGDPV (SEQ ID NO: 172), WGDI (SEQ ID NO: 173), GDPI (SEQ ID NO: 174), GPI, WGQPI (SEQ ID NO: 175), WGAPI (SEQ ID NO: 176), AGDPI (SEQ ID NO: 177), WADPI (SEQ ID NO: 178), WGDAI (SEQ ID NO: 179), WGDPA (SEQ ID NO: 180), WDPI (SEQ ID NO: 181), WGDI (SEQ ID NO: 182), WGDP (SEQ ID NO: 183) или FGDPI (SEQ ID NO: 184) вместо последовательности WGDPI (SEQ ID NO: 170) на участке аминокислот 16-20 в FGF19.
Как правило, число аминокислот или остатков в пептидной последовательности, предложенной в настоящем документе, в совокупности будет составлять менее примерно 250 (например, аминокислот или их миметиков). В различных конкретных вариантах осуществления число остатков составляет от примерно 20 до примерно 200 остатков (например, аминокислот или их миметиков). В дополнительных вариантах осуществления число остатков составляет от примерно 50 до примерно 200 остатков (например, аминокислот или их миметиков). В следующих вариантах осуществления число остатков составляет от примерно 100 до примерно 195 остатков (например, аминокислот или их миметиков) в длину.
Аминокислоты или остатки могут быть связаны амидной, либо неприродными и не амидными химическими связями, включая, например, те, которые образованы с глутаральдегидом, N-гидроксисукцинимидными сложными эфирами, бифункциональными малеинимидами или N,N'-дициклогексилкарбодиимидом (DCC). Не амидные связи включают, например, кетометиленовую, аминометиленовую, олефиновую, эфирную, тиоэфирную связи, и тому подобное (смотри, например, Spatola в «Chemistry and Biochemistry of Amino Acids, Peptides and Proteins», Vol. 7, pp. 267-357 (1983), «Peptide and Backbone Modifications», Marcel Decker, NY). Таким образом, когда пептид, предложенный в настоящем документе, содержит часть последовательности FGF19 и часть последовательности FGF21, две части необязательно должны быть связаны друг с другом амидной связью, но могут быть связаны с помощью любого другого химического фрагмента или конъюгированы через фрагмент линкера.
В некоторых вариантах осуществления терапевтические пептиды, предложенные в настоящем документе, также включают подпоследовательности, варианты и модифицированные формы иллюстративных пептидных последовательностей (включая варианты и подпоследовательности FGF19 и FGF21, приведенные в таблице 1 и списке последовательностей), при условии, что вышеуказанные последовательности сохраняют по меньшей мере поддающуюся обнаружению или измерению активность, либо функцию. Например, некоторые иллюстративные вариантные пептиды содержат C-концевую последовательность FGF19,
PHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (SEQ ID NO: 188) в C-концевой части, например, после аминокислотных остатков «TSG» варианта.
Кроме того, некоторые иллюстративные вариантные пептиды, например, те, которые содержат всю или часть последовательности FGF21 на амино-конце, имеют остаток «R», расположенный на N-конце, который может отсутствовать. Аналогично, некоторые иллюстративные вариантные пептиды содержат остаток «M» на N-конце, который может быть добавлен или заменять отсутствующий остаток, такой как остаток «R». Более конкретно, в различных вариантах осуществления пептидные последовательности на N-конце содержат любую из последовательностей: RDSS (SEQ ID NO: 115), DSS, MDSS (SEQ ID NO: 116) или MRDSS (SEQ ID NO: 117). Кроме того, если остаток «M» находится рядом с остатком «S», остаток «M» может быть отщеплен так, что остаток «M» делетируется из пептидной последовательности, в то время как если остаток «M» находится рядом с остатком «D», остаток «M» не может быть отщеплен. Таким образом, в качестве примера, в различных вариантах осуществления пептидные последовательности включают последовательности со следующими остатками на N-конце: MDSSPL (SEQ ID NO: 119), MSDSSPL (SEQ ID NO: 120) (расщеплен до SDSSPL (SEQ ID NO: 112)) и MSSPL (SEQ ID NO: 113) (расщеплен до SSPL (SEQ ID NO: 114)).
Соответственно, в некоторых вариантах осуществления «пептидные», «полипептидные» и «белковые» последовательности, предложенные в настоящем документе, включают подпоследовательности, варианты и модифицированные формы вариантов и подпоследовательностей FGF19 и FGF21, приведенных в таблице 1 и списке последовательностей, а также продуктов слияния и химер FGF19/FGF21, приведенных в таблице 1 и списке последовательностей, при условии, что подпоследовательность, вариант или модифицированная форма (например, продукт слияния или химера) сохраняет по меньшей мере поддающуюся обнаружению активность или функцию, например, снижающую уровень глюкозы активность и/или модулирующую гомеостаз желчных кислот активность.
Используемый в настоящем документе термин «модифицировать», а также его грамматические варианты, означает, что композиция имеет отличия от эталонной композиции, например, пептидной последовательности. Такие модифицированные пептидные последовательности, нуклеиновые кислоты и другие композиции могут иметь большую или меньшую активность, либо функцию, или имеют отличающуюся функцию или активность по сравнению с эталонной не модифицированной пептидной последовательностью, нуклеиновой кислотой или другой композицией, или могут иметь свойство, желательное для белка, созданного для терапии (например, период полувыведения в сыворотке), для инициирования выработки антитела, используемого в анализе обнаружения, и/или для очистки белка. Например, пептидная последовательность, предложенная в настоящем документе, может быть модифицирована для увеличения периода полувыведения в сыворотке, для повышения стабильности белка in vitro и/или in vivo, и так далее.
Конкретные примеры таких подпоследовательностей, вариантов и модифицированных форм пептидных последовательностей, приведенных в настоящем документе (например, пептидных последовательностей, приведенных в списке последовательностей или таблице 1), имеют замены, делеции и/или вставки/добавления одной или более аминокислот, имеющие место на амино-конце, карбокси-конце или внутри последовательности. Одним примером является замена аминокислотного остатка на другой аминокислотный остаток в пептидной последовательности. Другим примером является делеция одного или более аминокислотных остатков из пептидной последовательности, либо вставка или добавление одного или более аминокислотных остатков в пептидную последовательность.
Число остатков, замененных, делетированных или вставленных/добавленных, составляет одну или более аминокислот (например, 1-3, 3-5, 5-10, 10-20, 20-30, 30-40, 40-50, 50-60, 60-70, 70-80, 80-90, 90-100, 100-110, 110-120, 120-130, 130-140, 140-150, 150-160, 160-170, 170-180, 180-190, 190-200, 200-225, 225-250 или более) пептидной последовательности. Таким образом, последовательность FGF19 или FGF21 может иметь несколько или множество аминокислот, которые заменены, делетированы или вставлены/добавлены (например, 1-3, 3-5, 5-10, 10-20, 20-30, 30-40, 40-50, 50-60, 60-70, 70-80, 80-90, 90-100, 100-110, 110-120, 120-130, 130-140, 140-150, 150-160, 160-170, 170-180, 180-190, 190-200, 200-225, 225-250 или более). Кроме того, аминокислотная последовательность FGF19 может содержать или состоять из аминокислотной последовательности длиной примерно 1-3, 3-5, 5-10, 10-20, 20-30, 30-40, 40-50, 50-60, 60-70, 70-80, 80-90, 90-100, 100-110, 110-120, 120-130, 130-140, 140-150, 150-160, 160-170, 170-180, 180-190, 190-200, 200-225, 225-250 или более аминокислот из FGF21; или аминокислотная последовательность FGF21 может содержать или состоять из аминокислотной последовательности длиной примерно 1-3, 3-5, 5-10, 10-20, 20-30, 30-40, 40-50, 50-60, 60-70, 70-80, 80-90, 90-100, 100-110, 110-120, 120-130, 130-140, 140-150, 150-160, 160-170, 170-180, 180-190, 190-200, 200-225, 225-250 или более аминокислот из FGF19.
Конкретные примеры замен включают замену D-остатка на L-остаток. Соответственно, хотя остатки приведены в L-изомерной конфигурации, D-аминокислоты в любом конкретном или во всех положениях пептидных последовательностей, предложенных в настоящем документе, также включены в изобретение, если только D-изомер не приводит к образованию последовательности, которая не имеет поддающуюся обнаружению или измерению функцию.
Дополнительными конкретными примерами являются не консервативные и консервативные замены. «Консервативная замена» представляет собой замену одной аминокислоты биологически, химически или структурно сходным остатком. «Биологическое сходство» означает, что замена совместима с биологической активностью, например, активностью, которая приводит к облегчению PBC и/или его проявлений. «Структурное сходство» означает, что аминокислоты имеют боковые цепи сходной длины, например, аланин, глицин и серин, или имеют сходный размер, или структура первой, второй или дополнительной пептидной последовательности сохраняется. «Химическое сходство» означает, что остатки имеют одинаковый заряд или оба являются гидрофильными и гидрофобными. Конкретные примеры включают замену одного гидрофобного остатка, такого как изолейцин, валин, лейцин или метионин, на другой, или замену одного полярного остатка на другой, например, замену аргинина на лизин, глутаминовой кислоты на аспарагиновую кислоту или глутамина на аспарагин, серина на треонин, и так далее. Можно использовать рутинные анализы для определения того, имеет ли подпоследовательность, вариант или модифицированная форма активность, например, активность, которая приводит к облегчению PBC и/или его проявлений.
Конкретные примеры подпоследовательностей, вариантов и модифицированных форм пептидных последовательностей, приведенных в настоящем документе, имеют 50%-60%, 60%-70%, 70%-75%, 75%-80%, 80%-85%, 85%-90%, 90%-95%, или 96%, 97%, 98% или 99% идентичности с эталонной пептидной последовательностью. Термины «идентичность» и «гомология», а также их грамматические варианты, означают, что две или более упоминаемые единицы являются одинаковыми. Таким образом, если две аминокислотные последовательности идентичны, они имеют идентичные аминокислотные последовательности. «Области, участки или домены идентичности» означает, что части в двух или более упоминаемых единицах являются одинаковыми. Таким образом, если две аминокислотные последовательности идентичны или гомологичны на протяжении одной или более областей последовательности, они идентичны в этих областях.
Степень идентичности между двумя последовательностями можно устанавливать с использованием компьютерных программ и математических алгоритмов, известных в данной области. Такие алгоритмы, которые рассчитывают процент идентичности (гомологии) последовательностей, как правило, учитывают делеции и несовпадения в последовательностях на протяжении сравниваемых областей. Например, алгоритм поиска BLAST (например, BLAST 2.0) (смотри, например, Altschul et al., J. Mol. Biol. 215: 403 (1990), общедоступный через NCBI) имеет следующие иллюстративные параметры поиска: несовпадение -2; штраф за открытие делеции 5; штраф за продолжение делеции 2. При сравнении пептидных последовательностей алгоритм BLASTP, как правило, используют в сочетании с матрицей замен, такой как PAM100, PAM 250, BLOSUM 62 или BLOSUM 50. Программы сравнения последовательностей FASTA (например, FASTA2 и FASTA3) и SSEARCH также используют для количественной оценки степени идентичности (Pearson et al., Proc. Natl. Acad. Sci. USA 85: 2444 (1988); Pearson, Methods Mol Biol. 132: 185 (2000); и Smith et al., J. Mol. Biol. 147: 195 (1981)). Также разработаны программы для количественной оценки структурного сходства белков с использованием топологического картирования Делоне (Bostick et al., Biochem Biophys Res Commun. 304: 320 (2003)).
В пептидных последовательностях, включая подпоследовательности, варианты и модифицированные формы пептидных последовательностей, приведенных в настоящем документе, термин «аминокислота» или «остаток» включает обычные альфа-аминокислоты, а также бета-аминокислоты, альфа,альфа двузамещенные аминокислоты и N-замещенные аминокислоты, в которых по меньшей мере одна боковая цепь представляет собой фрагмент аминокислотной боковой цепи, как определено в настоящем документе. Термин «аминокислота» также включает N-алкил-альфа-аминокислоты, в которых N-концевая аминогруппа имеет C1-C6 линейный или разветвленный алкильный заместитель. Таким образом, термин «аминокислота» включает стереоизомеры и модификации природных белковых аминокислот, небелковые аминокислоты, посттрансляционно модифицированные аминокислоты (например, путем гликозилирования, фосфорилирования, расщепления сложноэфирной или амидной связи и так далее), ферментативно модифицированные или синтезированные аминокислоты, дериватизированные аминокислоты, конструкции или структуры, разработанные для имитации аминокислот, аминокислоты с фрагментом боковой цепи, модифицированным, дериватизированным относительно природных фрагментов, или синтетические, или не существующие в природе, и так далее. Модифицированные и необычные аминокислоты включены в пептидные последовательности, предложенные в настоящем документе (смотри, например, в «Synthetic Peptides: A User's Guide»; Hruby et al., Biochem. J. 268: 249 (1990); и Toniolo C., Int. J. Peptide Protein Res. 35: 287 (1990)).
Кроме того, включены также защитные и модифицирующие группы аминокислот. Используемый в настоящем документе термин «фрагмент боковой цепи аминокислоты» включает любую боковую цепь любой аминокислоты, определение термину «аминокислота» дано в настоящем документе. Таким образом, он включает фрагмент боковой цепи в природных аминокислотах. Он также включает фрагменты боковой цепи в модифицированных природных аминокислотах, описанных в настоящем документе и известных специалистам в данной области, например, фрагменты боковой цепи в стереоизомерах и модификациях природных белковых аминокислот, небелковых аминокислотах, посттрансляционно модифицированных аминокислотах, ферментативно модифицированных или синтезированных аминокислотах, дериватизированных аминокислотах, конструкциях и структурах, разработанных для имитации аминокислот, и так далее. Например, фрагмент боковой цепи любой аминокислоты, раскрытой в настоящем документе или известной специалисту в данной области, охвачен данным определением.
Термин «производное фрагмента боковой цепи аминокислоты» входит в определение фрагмента боковой цепи аминокислоты. Неограничивающие примеры дериватизированных фрагментов боковой цепи аминокислоты включают, например: (a) добавление одного или более насыщенных или ненасыщенных атомов углерода к существующей алкильной, арильной или аралкильной цепи; (b) замену атома углерода в боковой цепи другим атомом, таким как атом кислорода или азота; (c) добавление концевой группы к атому углерода боковой цепи, включая метил (--CH3), метокси (--OCH3), нитро (--NO2), гидроксил (--OH) или циано (--C=N); (d) в случае фрагментов боковой цепи, содержащих гидрокси, тиоловые или аминогруппы, добавление соответствующей защитной группы для гидрокси, тиоловой или аминогруппы; или (e) в случае фрагментов боковой цепи, содержащих кольцевую структуру, добавление одного или более кольцевых заместителей, включая гидроксильные, галогеновые, алкильные или арильные группы, присоединенные напрямую или через, например, эфирную связь. Соответствующие защитные группы для аминогрупп известны квалифицированному специалисту. Условием является то, чтобы дериватизация обеспечивала желательную активность в конечной пептидной последовательности (например, активность, которая способствует ослаблению PBC и/или его проявлений).
Термин «фрагмент боковой цепи аминокислоты» охватывает все такие дериватизации, и конкретные неограничивающие примеры включают: гамма-аминомасляную кислоту, 12-аминододекановую кислоту, альфа-аминоизомасляную кислоту, 6-аминогексановую кислоту, 4-(аминометил)циклогексанкарбоновую кислоту, 8-аминооктановую кислоту, бифенилаланин, Boc--трет-бутоксикарбонил, бензил, бензоил, цитруллин, диаминомасляную кислоту, пирролизин, диаминопропионовую кислоту, 3,3-дифенилаланин, ортонин, цитруллин, 1,3-дигидро-2H-изоиндолкарбоновую кислоту, этил, Fmoc-флуоренилметоксикарбонил, гептаноил (CH3--(CH2)5--C(=O)--), гексаноил (CH3--(CH2)4--C(=O)--), гомоаргинин, гомоцистеин, гомолизин, гомофенилаланин, гомосерин, метил, метионин сульфоксид, метионин сульфон, норвалин (NVA), фенилглицин, пропил, изопропил, саркозин (SAR), трет-бутилаланин и бензилоксикарбонил.
Отдельная аминокислота, включая стереоизомеры и модификации природных белковых аминокислот, небелковые аминокислоты, посттрансляционно модифицированные аминокислоты, ферментативно синтезированные аминокислоты, неприродные аминокислоты, включая дериватизированные аминокислоты, альфа,альфа двузамещенную аминокислоту, полученную из любой из перечисленных выше (то есть, альфа,альфа двузамещенную аминокислоту, в которой по меньшей мере одна боковая цепь является такой же, как боковая цепь остатка, из которого она была получена), бета-аминокислоту, полученную из любой из перечисленных выше (то есть, бета-аминокислоту, которая, не считая наличия бета-углеродного атома, является такой же, как остаток, из которого она была получена), и так далее, включая все из перечисленных выше, в настоящем документе могут быть названы «остатком». Соответствующие заместители, в дополнение к фрагменту боковой цепи альфа-аминокислоты, включают C1-C6 линейный или разветвленный алкил. Aib является примером альфа,альфа двузамещенной аминокислоты. При том, что альфа,альфа двузамещенные аминокислоты можно называть с использованием общепринятый терминологии для L- и D-изомеров, следует понимать, что такая терминология предназначена для удобства, и что если заместители в альфа-положении являются разными, такая аминокислота взаимозаменяемо может быть названа альфа,альфа двузамещенной аминокислотой, полученной из L- или D-изомера, в зависимости от ситуации, остатка с указанным фрагментом боковой цепи аминокислоты. Таким образом, (S)-2-амино-2-метилгексановая кислота может быть названа либо альфа,альфа двузамещенной аминокислотой, полученной из L-Nle (норлейцина), либо альфа,альфа двузамещенной аминокислотой, полученной из D-Ala. Аналогично, Aib можно называть альфа,альфа двузамещенной аминокислотой, полученной из Ala. Каждый раз при упоминании альфа,альфа двузамещенной аминокислоты следует понимать, что она включает все ее (R) и (S) конфигурации.
«N-замещенная аминокислота» включает любую аминокислоту, в которой фрагмент боковой цепи аминокислоты ковалентно связан с каркасной аминогруппой, необязательно, при этом нет других заместителей, кроме H, в альфа-углеродном положении. Саркозин является примером N-замещенный аминокислоты. В качестве примера, саркозин может быть назван N-замещенным аминокислотным производным Ala, за счет того, что фрагмент боковой цепи аминокислоты саркозина и Ala является одним и тем же, то есть, метилом.
В конкретных вариантах осуществления предложены ковалентные модификации пептидных последовательностей, включая подпоследовательности, варианты и модифицированные формы пептидных последовательностей, приведенных в настоящем документе. Иллюстративный вид ковалентной модификации включает реакцию целевых аминокислотных остатков с органическим дериватизирующим реагентом, который способен к реакции с избранными боковыми цепями, либо N- или C-концевыми остатками пептида. Дериватизацию бифункциональными реагентами можно использовать, например, для перекрестной сшивки пептида с нерастворимой в воде матрицей-подложкой или поверхностью, используемой в методе очистки антител против пептида, и наоборот. Обычно используемые перекрестно сшивающие реагенты включают, например, 1,1-бис(диазоацетил)-2-фенилэтан, глутаральдегид, N-гидроксисукцинимидные сложные эфиры, например, эфиры с 4-азидосалициловой кислотой, гомобифункциональные имидоэфиры, включая дисукцинимидиловые сложные эфиры, такие как 3,3'-дитиобис(сукцинимидилпропионат), бифункциональные малеинимиды, такие как бис-N-малеимидо-1,8-октан, и такие реагенты, как метил-3-[(п-азидофенил)дитио]пропиоимидат.
Другие модификации включают дезамидирование остатков глутаминила и аспарагинила до соответствующих остатков глутамила и аспартила, соответственно, гидроксилирование остатков пролина и лизина, фосфорилирование гидроксильных групп остатков серила или треонила, метилирование альфа-аминогрупп боковых цепей лизина, аргинина и гистидина (T.E. Creighton, Proteins: Structure and Molecular Properties, W.H. Freeman & Co., San Francisco, pp. 79-86 (1983)), ацетилирование N-концевых аминогрупп, амидирование любых C-концевых карбоксильных групп, и так далее.
Иллюстративные пептидные последовательности, а также подпоследовательности, варианты и модифицированные формы пептидных последовательностей, приведенных в настоящем документе, также могут включать последовательности с изменениями в каркасе для придания стабильности, производные и пептидомиметики. Термин «пептидомиметик» означает молекулу, которая имитирует остаток (называемую «миметиком»), включая, но без ограничения, молекулы пиперазинового ядра, молекулы кето-пиперазинового ядра и молекулы диазепинового ядра. Если не указано иначе, аминокислотный миметик пептидной последовательности, предложенной в настоящем документе, включает как карбоксильную группу, так и аминогруппу, а также группу, соответствующую боковой цепи аминокислоты, или, в случае миметика глицина, никакую боковую цепь, кроме атома водорода.
В качестве примера, сюда будут относиться соединения, имитирующие пространственные свойства, поверхностное распределение заряда, полярность, и так далее, природных аминокислот, но не обязательно являющиеся аминокислотами, которые будут придавать стабильность биологической системе. Например, пролин может быть заменен другими лактамами или лактонами соответствующего размера и подходящими для замены; лейцин может быть заменен алкилкетоном, N-замещенным амидом, а также путем изменения длины боковой цепи аминокислоты с использованием алкила, алкенила или других заместителей, другие варианты будут очевидны для квалифицированного специалиста. Существенным элементом выполнения таких замен является использование молекулы примерно такого же размера, с таким же зарядом и конфигурацией, что и остаток, используемый для конструирования молекулы. Усовершенствование таких модификаций будет проведено путем тестирования соединений в функциональном (например, на снижение уровня глюкозы) или другом анализе и сравнения соотношения структуры-активности. Такие способы находятся в пределах компетенции квалифицированного специалиста, работающего в области медицинской химии и разработки лекарственных средств.
Термин «связывать» или «связывание» при использовании применительно к пептидной последовательности означает, что пептидная последовательность взаимодействует на молекулярном уровне. Специфическое и избирательное связывание можно отличать от неспецифического связывания с помощью анализов, известных в данной области (например, конкурентного связывания, иммунопреципитации, ELISA, проточной цитометрии, вестерн-блоттинга).
Пептиды и пептидомиметики можно получать и выделять с использованием методов, известных в данной области. Пептиды можно синтезировать, полностью или частично, химическими методами (смотри, например, Caruthers (1980), Nucleic Acids Res. Symp. Ser. 215; Horn (1980); и Banga, A.K., Therapeutic Peptides and Proteins, Formulation, Processing and Delivery Systems (1995) Technomic Publishing Co., Lancaster, PA). Пептидный синтез можно выполнять с использованием различных методик твердофазного синтеза (смотри, например, Roberge Science 269: 202 (1995); Merrifield, Methods Enzymol. 289: 3 (1997)), и автоматизированный синтез можно выполнять, например, с использованием пептидного синтезатора ABI 431A (Perkin Elmer) в соответствии с инструкциями производителя. Пептиды и пептидомиметики также можно синтезировать с использованием методологий комбинаторной химии. Синтетические остатки и полипептиды, содержащие миметики, можно синтезировать с использованием различных методов и технологий, известных в данной области (смотри, например, Organic Syntheses Collective Volumes, Gilman, et al. (Eds) John Wiley & Sons, Inc., NY). Модифицированные пептиды можно получать методами химической модификации (смотри, например, Belousov, Nucleic Acids Res. 25: 3440 (1997); Frenkel, Free Radic. Biol. Med. 19: 373 (1995); и Blommers, Biochemistry 33: 7886 (1994)). Вариации, производные, замены и модификации пептидных последовательностей также можно осуществлять такими методами, как олигонуклеотид-опосредованный (сайт-направленный) мутагенез, сканирование аланином и ПЦР-опосредованный мутагенез. Сайт-направленный мутагенез (Carter et al., Nucl. Acids Res., 13: 4331 (1986); Zoller et al., Nucl. Acids Res. 10: 6487 (1987)), кассетный мутагенез (Wells et al., Gene 34: 315 (1985)), мутагенез с выбором сайтов рестрикции (Wells et al., Philos. Trans. R. Soc. London SerA 317: 415 (1986)) и другие методы можно использовать применительно к клонированной ДНК для получения пептидных последовательностей, вариантов, продуктов слияния и химер, предложенных в настоящем документе, а также их вариаций, производных, замен и модификаций.
«Синтезированная» или «изготовленная» пептидная последовательность представляет собой пептид, полученный любым методом, включающим манипуляции, произведенные рукой человека. Такие методы включают, но не ограничиваются ими, вышеупомянутые методы, такие как химический синтез, технология рекомбинантной ДНК, биохимическая или ферментативная фрагментация более крупных молекул, а также сочетания вышеперечисленных методов.
Пептидные последовательности, предложенные в настоящем документе, включая подпоследовательности, варианты последовательностей и модифицированные формы приведенных пептидных последовательностей (например, последовательностей, приведенных в списке последовательностей или таблице 1), также можно модифицировать для получения химерной молекулы. В конкретных вариантах осуществления настоящего изобретения предложены пептидные последовательности, содержащие гетерологичный домен. Такие домены могут быть добавлены на амино-конце или на карбоксильном конце пептидной последовательности. Гетерологичные домены также могут быть помещены внутри пептидной последовательности и/или, альтернативно, быть фланкированы аминокислотными последовательностями, полученными из FGF19 и/или FGF21.
Термин «пептид» также охватывает димеры или мультимеры (олигомеры) пептидов. В конкретных вариантах осуществления настоящего изобретения предложены димеры или мультимеры (олигомеры) приведенных пептидных последовательностей, а также подпоследовательностей, вариантов и модифицированных форм приведенных пептидных последовательностей, включая последовательности, приведенные в списке последовательностей или таблице 1.
В конкретных вариантах осуществления пептидная последовательность, предложенная в настоящем документе, содержит аминокислотную последовательность, приведенную в таблице 1. В других вариантах осуществления последовательность, предложенная в настоящем документе, состоит из аминокислотной последовательности, приведенной в таблице 1.
Таблица 1
|
В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 1. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 2. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 3. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 4. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 5. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 6. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 7. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 8. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 9. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 10. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 11. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 12. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 13. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 14. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 15. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 16. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 17. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 18. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 19. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 20. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 21. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 22. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 23. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 24. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 25. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 26. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 27. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 28. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 29. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 30. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 31. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 32. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 33. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 34. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 35. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 36. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 37. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 38. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 39. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 40. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 41. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 42. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 43. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 44. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 45. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 46. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 47. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 48. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 49. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 50. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 51. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 52. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 53. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 54. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 55. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 56. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 57. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 58. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 59. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 60. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 61. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 62. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 63. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 64. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 65. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 66. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 67. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 68. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 69. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 70. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 71. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 72. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 73. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 74. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 75. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 76. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 77. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 78. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 79. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 80. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 81. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 82. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 83. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 84. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 85. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 86. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 87. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 88. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 89. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 90. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 91. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 92. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 93. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 94. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 95. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 96. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 97. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 98. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 138. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 139. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 140. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 141. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 142. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 143. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 144. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 145. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 146. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 147. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 148. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 149. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 150. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 151. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 152. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 153. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 154. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 155. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 156. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 157. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 158. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 159. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 160. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 161. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 162. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 163. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 164. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 165. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 166. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 167. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 168. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 192. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 193. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 194. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 195. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 196. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 197. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 198. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 199. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 200. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 201. В других вариантах осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 202. В одном варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 203. В другом варианте осуществления пептидная последовательность содержит аминокислотную последовательность, приведенную в SEQ ID NO: 204. В конкретных вариантах осуществления различных пептидных последовательностей, предложенных в настоящем документе, остаток R на N-конце делетирован.
В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 1. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 2. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 3. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 4. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 5. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 6. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 7. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 8. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 9. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 10. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 11. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 12. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 13. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 14. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 15. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 16. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 17. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 18. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 19. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 20. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 21. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 22. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 23. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 24. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 25. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 26. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 27. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 28. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 29. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 30. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 31. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 32. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 33. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 34. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 35. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 36. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 37. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 38. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 39. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 40. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 41. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 42. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 43. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 44. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 45. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 46. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 47. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 48. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 49. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 50. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 51. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 52. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 53. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 54. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 55. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 56. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 57. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 58. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 59. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 60. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 61. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 62. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 63. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 64. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 65. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 66. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 67. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 68. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 69. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 70. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 71. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 72. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 73. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 74. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 75. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 76. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 77. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 78. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 79. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 80. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 81. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 82. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 83. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 84. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 85. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 86. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 87. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 88. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 89. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 90. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 91. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 92. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 93. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 94. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 95. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 96. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 97. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 98. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 138. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 139. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 140. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 141. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 142. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 143. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 144. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 145. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 146. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 147. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 148. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 149. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 150. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 151. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 152. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 153. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 154. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 155. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 156. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 157. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 158. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 159. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 160. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 161. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 162. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 163. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 164. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 165. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 166. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 167. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 168. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 192. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 193. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 194. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 195. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 196. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 197. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 198. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 199. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 200. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 201. В других вариантах осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 202. В одном варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 203. В другом варианте осуществления пептидная последовательность состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 204. В конкретных вариантах осуществления различных пептидных последовательностей, предложенных в настоящем документе, остаток R на N-конце делетирован.
5.4 Конкретные модификации для усиления функции пептидов
Часто бывает полезно, а иногда необходимо, усовершенствовать одно или более физических свойств терапевтических средств, раскрытых в настоящем документе, и/или способ, которым их вводят. Усовершенствования физических свойств включают, например, модулирование иммуногенности; увеличение растворимости, биодоступности, периода полувыведения в сыворотке и/или терапевтического периода полувыведения; и/или модулирование биологической активности. Определенные модификации также могут быть полезны, например, для стимуляции продуцирования антител, используемых в анализах обнаружения (например, эпитопных маркеров), и для облегчения очистки белка. Такие усовершенствования, как правило, должны быть осуществлены без отрицательного влияния на биологическую активность терапевтического средства и/или без повышения его иммуногенности.
Пегилирование представляет собой одну конкретную модификацию, предусмотренную в настоящем документе, в то время как другие модификации включают, но не ограничиваются ими, гликозилирование (N- и O-связанное); полисиалирование; слитые с альбумином молекулы, содержащие сывороточный альбумин (например, человеческий сывороточный альбумин (ЧСА), сывороточный альбумин макаки или бычий сывороточный альбумин (БСА)); при этом альбумин связан, например, через конъюгированную цепь жирных кислот (ацилирование); а также Fc-слитые белки.
5.4.1 Пегилирование
Клиническая эффективность белковых терапевтических препаратов часто ограничена из-за короткого периода полувыведения в плазме крови и подверженности расщеплению протеазами. Исследования различных терапевтических белков (например, филграстима) показали, что такие сложности можно преодолевать, например, за счет конъюгации или связывания белка с любым из множества небелковых полимеров, например, полиэтиленгликолем (ПЭГ), полипропиленгликолем или полиоксиалкиленами. Это часто осуществляют с помощью связывающего фрагмента, ковалентно связанного как с белком, так и с небелковым полимером, например, ПЭГ. Показано, что такие конъюгированные с ПЭГ биологические молекулы обладают клинически полезными свойствами, включая повышенную физическую и температурную стабильность, защиту от подверженности ферментативному расщеплению, повышенную растворимость, более продолжительный период полувыведения в системе циркуляции in vivo, а также более низкий клиренс, меньшую иммуногенность и антигенность, и пониженную токсичность. В дополнение к благоприятным эффектам пегилирования на фармакокинетические параметры, пегилирование само по себе способно повышать активность.
ПЭГ, подходящие для конъюгации с полипептидной последовательностью, как правило, растворимы в воде при комнатной температуре и имеют общую формулу R(O-CH2-CH2)nO-R, где R представляет собой атом водорода или защитную группу, такую как алкильная или алканоловая группа, и где n равно целому числу от 1 до 1000. Если R представляет собой защитную группу, она, как правило, содержит от 1 до 8 атомов углерода. ПЭГ, конъюгированный с полипептидной последовательностью, может быть линейным или разветвленным. Разветвленные производные ПЭГ, «звездчатые ПЭГ» и многолучевые ПЭГ предусмотрены для использования по настоящему изобретению. Молекулярная масса ПЭГ, используемого в вариантах осуществления, предложенных в настоящем документе, не ограничена каким-либо конкретным диапазоном, и примеры приведены в других разделах настоящего документа; в качестве примера, в конкретных вариантах осуществления молекулярная масса составляет от 5 кДа до 20 кДа, в то время как в других вариантах осуществления молекулярная масса составляет от 4 кДа до 10 кДа.
В других вариантах осуществления настоящего изобретения предложены композиции из конъюгатов, в которых молекулы ПЭГ имеют другие значения n и, таким образом, различные ПЭГ присутствуют в определенных соотношениях. Например, некоторые композиции содержат смесь конъюгатов, где n=1, 2, 3 и 4. В некоторых композициях процентная доля конъюгатов, где n=1, составляет 18-25%, процентная доля конъюгатов, где n=2, составляет 50-66%, процентная доля конъюгатов, где n=3, составляет 12-16% и процентная доля конъюгатов, где n=4, составляет до 5%. Такие композиции можно получать с использованием условий реакции и методов очистки, известных в данной области. Для разделения конъюгатов можно использовать катионообменную хроматографию, с последующим определением фракции, которая содержит конъюгат, имеющий, например, нужное число присоединенных молекул ПЭГ, и очисткой ее от не модифицированных белковых последовательностей и от конъюгатов, содержащих другое количество присоединенных молекул ПЭГ.
Пегилирование наиболее часто происходит на альфа-аминогруппе в N-конце полипептида, эпсилон-аминогруппе на боковой цепи остатков лизина и имидазольной группе на боковой цепи остатков гистидина. Поскольку большинство рекомбинантных полипептидов имеют одну альфа и ряд эписилон-аминогрупп и имидазольных групп, можно создавать различные позиционные изомеры в зависимости от химии линкера.
В настоящем изобретении могут быть использованы общие стратегии пегилирования, известные в данной области. ПЭГ может быть связан с полипептидом, предложенным в настоящем документе, через концевую реакционноспособную группу («спейсер» или «линкер»), которая опосредует связывание между свободной амино или карбоксильной группой одной или более из полипептидных последовательностей и полиэтиленгликолем. ПЭГ, имеющий спейсер, который может быть связан со свободной аминогруппой, включает N-гидроксисукцинимид полиэтиленгликоль, который может быть получен путем активации сложного эфира янтарной кислоты и полиэтиленгликоля N-гидроксисукцинимидом. Другим активированным полиэтиленгликолем, который может быть связан со свободной аминогруппой, является 2,4-бис(O-метоксиполиэтиленгликоль)-6-хлор-втор-триазин, который может быть получен путем реакции монометилового эфира полиэтиленгликоля с цианурхлоридом. Активированный полиэтиленгликоль, который связывается со свободной карбоксильной группой, включает полиоксиэтилендиамин.
Одну или более из полипептидных последовательностей, предложенных в настоящем документе, можно конъюгировать с ПЭГ, имеющим спейсер, различными общепринятыми методами. Например, реакцию конъюгации можно проводить в растворе при значении pH 5-10, при температуре от 4°C до комнатной температуры, в течение периода времени от 30 минут до 20 часов, используя молярное соотношение реагента и белка, составляющее от 4:1 до 30:1. Условия реакции можно выбирать так, чтобы направлять реакцию в сторону преимущественного получения желательной степени замещения. Как правило, низкая температура, низкое значение pH (например, pH=5) и короткое время реакции приводят к уменьшению числа присоединенных молекул ПЭГ, в то время как высокая температура, нейтральное или высокое значение pH (например, pH≥7) и более продолжительное время реакции приводят к увеличению числа присоединенных молекул ПЭГ. Для остановки реакции можно использовать различные способы, известные в данной области. В некоторых вариантах осуществления реакцию останавливают, подкисляя реакционную смесь и замораживая, например, при температуре -20°C. Пегилирование различных молекул описано, например, в патентах США №№ 5252714, 5643575, 5919455, 5932462 и 5985263.
В некоторых вариантах осуществления настоящего изобретения также предложено использование миметиков ПЭГ. Разработаны рекомбинантные миметики ПЭГ, которые сохраняют свойства ПЭГ (например, продлевают период полувыведения в сыворотке), и в то же время придают некоторые дополнительные полезные свойства. В качестве примера, простые полипептидные цепи (содержащие, например, Ala, Glu, Gly, Pro, Ser и Thr), способные образовывать вытянутую конформацию аналогично ПЭГ, можно получать рекомбинантными методами уже слитыми с интересующим пептидным или белковым лекарственным средством (например, технология XTEN; Amunix; Mountain View, CA). Это устраняет необходимость в дополнительной стадии конъюгации в производственном процессе. Кроме того, разработанные методы молекулярной биологии позволяют контролировать состав боковых цепей полипептидных цепей, делая возможной оптимизацию иммуногенности и технологических свойств.
5.4.2. Гликозилирование
Используемый в настоящем документе термин «гликозилирование» в широком смысле означает ферментативный процесс присоединения гликанов к белкам, липидам или другим органическим молекулам. В настоящем документе термин «гликозилирование» должен означать присоединение, или удаление, одного или более углеводных фрагментов (либо путем удаления основного сайта гликозилирования, либо путем устранения гликозилирования химическими и/или ферментативными методами), и/или добавление одного или более сайтов гликозилирования, которые могут присутствовать или не присутствовать в нативной последовательности. Кроме того, термин охватывает качественные изменения в гликозилировании нативных белков, включающие изменение в природе и пропорциях различных присутствующих углеводных фрагментов.
Гликозилирование может существенно влиять на физические свойства (например, растворимость) полипептидов и также может быть важным для стабильности, секреции и субклеточной локализации белков. Гликозилированные полипептиды также могут обладать повышенной стабильностью или могут иметь усовершенствованные одно или более фармакокинетических свойств, таких как период полувыведения. Кроме того, повышение растворимости может, например, позволять создавать препараты, более подходящие для фармацевтического введения, чем препараты, содержащие не гликозилированный полипептид.
Добавление сайтов гликозилирования можно осуществлять путем изменения аминокислотной последовательности. Изменения в полипептид можно вносить, например, путем добавления, или замены на один или более остатков серина или треонина (для O-связанных сайтов гликозилирования) или остатков аспарагина (для N-связанных сайтов гликозилирования). Структуры N-связанных и O-связанных олигосахаридов и сахарных остатков, встречающихся в каждом виде, могут быть разными. Один вид сахара, который обычно встречается в обоих случаях, представляет собой N-ацетилнейраминовую кислоту (далее в настоящем документе называемую сиаловой кислотой). Сиаловая кислота, как правило, является концевым остатком как в N-связанных, так и в O-связанных олигосахаридах и, в силу своего отрицательного заряда, может придавать кислотные свойства гликопротеину. Конкретный вариант осуществления включает получение и использование N-гликозилированных вариантов.
Полипептидные последовательности, предложенные в настоящем документе, необязательно, могут быть изменены путем изменений на уровне нуклеиновой кислоты, в частности, за счет мутаций нуклеиновой кислоты, кодирующей полипептид, в заранее выбранных основаниях таким образом, что получаются кодоны, которые будут транслироваться в нужные аминокислоты.
Можно использовать различные линии клеток для продуцирования гликозилированных белков. Одним неограничивающим примером являются клетки яичника китайского хомячка (CHO), дефицитные по дигидрофолатредуктазе (DHFR), которые представляют собой обычно используемую клетку-хозяина для продуцирования рекомбинантных гликопротеинов. В этих клетках не экспрессируется фермент бета-галактозид-альфа-2,6-сиалилтрансфераза и, следовательно, не происходит добавления сиаловой кислоты в альфа-2,6 связь N-связанных олигосахаридов гликопротеинов, продуцируемых в этих клетках.
5.4.3 Полисиалилирование
В конкретных вариантах осуществления настоящего изобретения также предложено использование полисиалилирования, конъюгации полипептидов с природной, биоразлагаемой α-(2→8)-связанной полисиаловой кислотой («ПСК») с целью улучшения стабильности и in vivo фармакокинетики полипептидов.
Слияние с альбумином: дополнительные подходящие компоненты и молекулы для конъюгации включают альбумины, такие как человеческий сывороточный альбумин (ЧСА), сывороточный альбумин макаки и бычий сывороточный альбумин (БСА).
В некоторых вариантах осуществления альбумин конъюгирован с молекулой лекарственного средства (например, полипептидом, описанным в настоящем документе) на карбоксильном конце, амино-конце, как карбоксильном, так и амино-конце, а также внутри последовательности (смотри, например, патенты США №№ 5876969 и 7056701).
В вариантах осуществления конъюгатов ЧСА-лекарственное средство, предложенных в настоящем документе, можно использовать различные формы альбумина, такие как секретируемые предпоследовательности альбумина и их варианты, фрагменты альбумина и их варианты, а также варианты ЧСА. Такие формы, как правило, обладают одной или более желательными активностями альбумина. В дополнительных вариантах осуществления настоящего изобретения предложены слитые белки, содержащие молекулу полипептидного лекарственного средства, слитого напрямую или опосредованно с альбумином, фрагментом альбумина, вариантом альбумина, и так далее, при этом слитый белок имеет более высокую стабильность в плазме крови, чем не слитая молекула лекарственного средства, и/или слитый белок сохраняет терапевтическую активность не слитой молекулы лекарственного средства. В некоторых вариантах осуществления непрямое слияние опосредовано линкером, таким как пептидный линкер или его модифицированный вариант.
Как упоминалось выше, слияние альбумина с одним или более полипептидами, предложенными в настоящем документе, можно, например, осуществлять путем генетической манипуляции так, что нуклеиновая кислота, кодирующая ЧСА или его фрагмент, соединяется с нуклеиновой кислотой, кодирующей одну или более полипептидных последовательностей.
5.4.4 Альтернативные стратегии связывания альбумина
Несколько стратегий связывания альбумина были разработаны в качестве альтернативы прямому слиянию и могут быть использованы со средствами, описанными в настоящем документе. В качестве примера, в конкретных вариантах осуществления настоящего изобретения предложено связывание альбумина через конъюгированную цепь жирной кислоты (ацилирование), а также слитые белки, которые содержат полипептидную последовательность альбумин-связывающего домена (АСД) и последовательность одного или более из полипептидов, описанных в настоящем документе.
Продукт слияния альбумина с пептидной последовательностью можно, например, получать путем генетической манипуляции так, что ДНК, кодирующая ЧСА (человеческий сывороточный альбумин) или его фрагмент, соединяется с ДНК, кодирующей пептидную последовательность. Затем в соответствующего хозяина можно вводить трансформацией или трансфекцией слитую нуклеотидную последовательность в форме, например, соответствующей плазмиды, для экспрессии слитого полипептида. Экспрессию можно осуществлять in vitro, например, в прокариотических или эукариотических клетках, или in vivo, например, в трансгенном организме. В некоторых вариантах осуществления экспрессию слитого белка осуществляют в линии клеток млекопитающих, например, линии клеток CHO.
Дополнительные способы генетического слияния целевых белков или пептидов с альбумином включают технологию, известную как Albufuse® (Novozymes Biopharma A/S; Denmark), и конъюгированные терапевтические пептидные последовательности часто становятся гораздо более эффективными с лучшим усвоением в организме. Данная технология была коммерчески использована для производства альбуферона® (Human Genome Sciences), сочетания альбумина и интерферона α-2B, используемого для лечения инфекции гепатита C.
Другой вариант осуществления включает использование одного или более человеческих однодоменных антител (дАт). дАт представляют собой наименьшие функциональные связывающие единицы человеческих антител (IgG) и обладают благоприятными характеристиками стабильности и растворимости. Технология предполагает использование дАт, конъюгированных с ЧСА (таким образом, образующих «альбудАт»; смотри, например, EP1517921B, WO 2005/118642 и WO 2006/051288) и интересующей молекулой (например, пептидной последовательностью, предложенной в настоящем документе). АльбудАт часто имеют меньший размер и их легче производить в микробных экспрессионных системах, таких как бактерии или дрожжи, по сравнению с современными технологиями, используемыми для продления периода полувыведения пептидов в сыворотке. Поскольку ЧСА имеет период полувыведения примерно три недели, полученная конъюгированная молекула имеет более продолжительный период полувыведения. Использование технологии дАт также может приводить к повышению эффективности интересующей молекулы.
5.4.5 Конъюгация с другими молекулами
Дополнительные подходящие компоненты и молекулы для конъюгации включают, например, тиреоглобулин; токсоид столбняка; дифтерийный токсоид; полиаминокислоты, такие как поли(D-лизин:D-глутаминовая кислота); VP6 полипептиды ротавирусов; гемагглютинин вируса гриппа, нуклеопротеин вируса гриппа; гемоцианин лимфы улитки (KLH), а также коровый белок и поверхностный антиген вируса гепатита B; или любое сочетание перечисленных выше.
Таким образом, в конкретных вариантах осуществления также предусмотрена конъюгация на N- и/или C-конце полипептидной последовательности одного или более дополнительных компонентов или молекул, таких как другой полипептид (например, полипептид, имеющий аминокислотную последовательность, гетерологичную указанному полипептиду) или молекула носителя. Таким образом, иллюстративная полипептидная последовательность может быть предоставлена в виде конъюгата с другим компонентом или молекулой.
Полипептид также может быть конъюгирован с крупными, медленно метаболизируемыми молекулами, такими как белки; полисахаридами, например, сефарозой, агарозой, целлюлозой или целлюлозными гранулами; полимерными аминокислотами, например, полиглутаминовой кислотой или полилизином; аминокислотными сополимерами; инактивированными вирусными частицами; инактивированными бактериальными токсинами, такими как молекулы токсоида дифтерии, столбняка, холеры или лейкотоксины; инактивированными бактериями и дендритными клетками. Такие конъюгированные формы при необходимости можно использовать для получения антител против полипептида, предложенного в настоящем документе.
5.4.6 Fc-слитые молекулы
В конкретных вариантах осуществления амино- или карбоксильный конец полипептидной последовательности, предложенной в настоящем документе, слит с Fc-областью иммуноглобулина, образуя слитый конъюгат (или слитую молекулу). В конкретном варианте осуществления Fc-область иммуноглобулина представляет собой Fc-область иммуноглобулина человека. Показано, что слитые конъюгаты увеличивают системный период полувыведения биофармацевтических препаратов, и, таким образом, необходимая частота введения биофармацевтического препарата может быть уменьшена. В конкретных вариантах осуществления период полувыведения продлен по сравнению с тем же самым полипептидом, не слитым с Fc-областью иммуноглобулина.
Fc-область связывается с неонатальным Fc-рецептором (FcRn) в эндотелиальных клетках, которые выстилают кровеносные сосуды, и после связывания слитая с Fc-областью молекула становится защищенной от расщепления и вновь высвобождается в кровоток, что приводит к более продолжительному нахождению молекулы в кровотоке. Считают, что это связывание Fc-области является механизмом, за счет которого эндогенные IgG имеют длительный период полувыведения в плазме крови. Более современная технология слияния с Fc-областью позволяет связывать одну копию биофармацевтического препарата с Fc-областью антитела для оптимизации фармакокинетических и фармакодинамических свойств биофармацевтического препарата по сравнению с традиционными Fc-слитыми конъюгатами.
В некоторых вариантах осуществления настоящего изобретения предложено слияние M70 с Fc-фрагментом человеческого антитела. В некоторых вариантах осуществления настоящего изобретения предложено слияние M69 с Fc-фрагментом человеческого антитела. Такие продукты слияния могут быть полезны для лечения заболеваний, связанных с гомеостазом желчных кислот, и других метаболических заболеваний, описанных в настоящем документе. В некоторых вариантах осуществления Fc-слитый M70 имеет более продолжительный период полувыведения. В конкретных вариантах осуществления Fc-слитый M70 имеет более продолжительный период полувыведения по сравнению с M70, который не слит с Fc-областью. В некоторых вариантах осуществления Fc-слитый M69 имеет более продолжительный период полувыведения. В конкретных вариантах осуществления Fc-слитый M69 имеет более продолжительный период полувыведения по сравнению с M69, который не слит с Fc-областью. Такой продолжительный период полувыведения делает возможным дозирование этих слитых продуктов один раз в неделю или реже.
В некоторых вариантах осуществления Fc-слитый продукт содержит линкер. Иллюстративные гибкие линкеры включают глициновые полимеры (G)n, глицин-сериновые полимеры, глицин-аланиновые полимеры, аланин-сериновые полимеры и другие гибкие линкеры. В конкретных вариантах осуществления линкер представляет собой (G)4S. В некоторых вариантах осуществления линкер представляет собой ((G)4S)n, где n представляет собой целое число, равное по меньшей мере единице. В некоторых вариантах осуществления линкер представляет собой ((G)4S)2. Глициновые и глицин-сериновые полимеры являются относительно неструктурированными и, вследствие этого, могут служить в качестве нейтрального связующего звена между компонентами. В некоторых вариантах осуществления глицин-сериновый полимер представляет собой (GS)n, где n представляет собой целое число, равное по меньшей мере единице. В некоторых вариантах осуществления глицин-сериновый полимер представляет собой GSGGSn (SEQ ID NO: 129), где n представляет собой целое число, равное по меньшей мере единице. В некоторых вариантах осуществления глицин-сериновый полимер представляет собой GGGSn (SEQ ID NO: 130), где n представляет собой целое число, равное по меньшей мере единице. В конкретных вариантах осуществления линкер содержит дополнительный остаток G на N'-конце SEQ ID NO: 130. В одном варианте осуществления линкер представляет собой GGSG (SEQ ID NO: 131). В одном варианте осуществления линкер представляет собой GGSGG (SEQ ID NO: 132). В одном варианте осуществления линкер представляет собой GSGSG (SEQ ID NO: 133). В одном варианте осуществления линкер представляет собой GSGGG (SEQ ID NO: 134). В одном варианте осуществления линкер представляет собой GGGSG (SEQ ID NO: 189). В одном варианте осуществления линкер представляет собой GSSSG (SEQ ID NO: 135).
5.4.7 Очистка
Дополнительные подходящие компоненты и молекулы для конъюгации включают те, которые подходят для выделения или очистки. Конкретные неограничивающие примеры включают связывающие молекулы, такие как биотин (специфически связывающаяся пара биотин-авидин), антитело, рецептор, лиганд, лектин, либо молекулы, образующие твердую подложку, включая, например, пластиковые или полистирольные гранулы, планшеты или гранулы, магнитные гранулы, тест-полоски и мембраны.
Такие методы очистки, как катионообменная хроматография, можно использовать для разделения конъюгатов на основании различия в зарядах, что позволяет эффективно разделять конъюгаты по молекулярной массе. Например, катионообменную колонку можно нагружать, затем промывать ~20 мМ раствором ацетата натрия, pH ~4, и затем элюировать линейным (0 M - 0,5 M) градиентом NaCl, забуференным при pH 3-5,5, например, при pH ~4,5. Содержание фракций, полученных при катионообменной хроматографии, можно определять по молекулярной массе с использованием общепринятых методов, например, масс-спектроскопии, SDS-ПААГ или других известных способов разделения видов молекул по их молекулярной массе. Затем определяют фракцию, которая содержит конъюгат, имеющий нужное число присоединенных молекул ПЭГ, очищают его от не модифицированных белковых последовательностей и от конъюгатов, имеющих другое число присоединенных молекул ПЭГ.
5.4.8 Другие модификации
В конкретных вариантах осуществления настоящего изобретения также предложено использование других модификаций, известных в настоящее время или разработанных в будущем, для усовершенствования одного или более свойств. Примеры включают гесилирование, различные аспекты которого описаны, например, в патентных заявках США №№ 2007/0134197 и 2006/0258607, а также слитые молекулы, содержащие SUMO в качестве слитого маркера (LifeSensors, Inc.; Malvern, PA).
В других вариантах осуществления пептидная последовательность, предложенная в настоящем документе, связана с химическим средством (например, иммунотоксином или химиотерапевтическим средством), включая, но не ограничиваясь ими, цитотоксическое средство, в том числе таксол, цитохалазин B, грамицидин D, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, а также их аналоги или гомологи. Другие химические средства включают, например, антиметаболиты (например, метотрексат, 6-меркаптопурин, 6-тиогуанин, цитарабин, 5-фторурацил декарбазин); алкилирующие средства (например, мехлорэтамин, кармустин и ломустин, циклофосфамид, бусульфан, дибромманнит, стрептозотоцин, митомицин C и цисплатин); антибиотики (например, блеомицин) и антимитотические средства (например, винкристин и винбластин). Цитотоксины можно конъюгировать с пептидом, предложенным в настоящем документе, с использованием технологии линкеров, известной в данной области и описанной в настоящем документе.
Другие подходящие для конъюгации компоненты и молекулы включают те, которые подходят для обнаружения в анализах. Конкретные неограничивающие примеры включают детектируемые метки, такие как радиоактивный изотоп (например, 125I, 35S, 32P, 33P), фермент, который катализирует образование поддающегося обнаружению продукта (например, люцифераза, β-галактозидаза, пероксидаза хрена и щелочная фосфатаза), флуоресцентный белок, хромогенный белок, краситель (например, флуоресцеин изотиоцианат), флуоресцирующие металлы (например, 152Eu), хемилюминесцентные соединения (например, люминол и соли акридиния), биолюминесцентные соединения (например, люциферин) и флуоресцентные белки. Непрямые метки включают меченые или детектируемые антитела, которые связываются с пептидной последовательностью, при этом антитело может быть обнаружено.
В конкретных вариантах осуществления пептидная последовательность, предложенная в настоящем документе, конъюгирована с радиоактивным изотопом для получения цитотоксического радиофармацевтического средства (радиоиммуноконъюгата), полезного в качестве диагностического или терапевтического средства. Примеры таких радиоактивных изотопов включают, но не ограничиваются ими, йод131, индий111, иттрий90 и лютеций177. Методы получения радиоиммуноконъюгатов известны квалифицированному специалисту. Примеры коммерчески доступных радиоиммуноконъюгатов включают ибритумомаб тиуксетан и тозитумомаб.
5.4.9 Линкеры
Линкеры и их применение описаны выше. Любой из вышеперечисленных компонентов и молекул, используемых для модифицирования полипептидных последовательностей, предложенных в настоящем документе, может, необязательно, быть связан через линкер. Подходящие линкеры включают «гибкие линкеры», которые, как правило, имеют достаточную длину, чтобы допускать некоторое движение между модифицированными полипептидными последовательностями и связанными компонентами или молекулами. Молекулы линкера, как правило, имеют длину примерно 6-50 атомов. Молекулы линкера также могут представлять собой, например, арилацетилен, олигомеры этиленгликоля, содержащие 2-10 мономерных единиц, диамины, дикислоты, аминокислоты или их сочетания. Подходящие линкеры могут быть с легкостью выбраны и могут иметь любую подходящую длину, такую как 1 аминокислота (например, Gly), 2, 3, 4, 5, 6, 7, 8, 9, 10, 10-20, 20-30, 30-50 или более 50 аминокислот.
Иллюстративные гибкие линкеры включают глициновые полимеры (G)n, глицин-сериновые полимеры (например, (GS)n, GSGGSn (SEQ ID NO: 129) и GGGSn (SEQ ID NO: 130), где n представляет собой целое число, равное по меньшей мере единице), глицин-аланиновые полимеры, аланин-сериновые полимеры и другие гибкие линкеры. Глициновые и глицин-сериновые полимеры являются относительно неструктурированными и, вследствие этого, могут служить в качестве нейтрального связующего звена между компонентами. Иллюстративные гибкие линкеры включают, но не ограничиваются ими, GGSG (SEQ ID NO: 131), GGSGG (SEQ ID NO: 132), GSGSG (SEQ ID NO: 133), GSGGG (SEQ ID NO: 134), GGGSG (SEQ ID NO: 189) и GSSSG (SEQ ID NO: 135). В конкретных вариантах осуществления линкер представляет собой (G)4S. В некоторых вариантах осуществления линкер представляет собой ((G)4S)n), где n представляет собой целое число, равное по меньшей мере единице. В некоторых вариантах осуществления линкер представляет собой ((G)4S)2). В некоторых вариантах осуществления глицин-сериновый полимер представляет собой (GS)n, где n представляет собой целое число, равное по меньшей мере единице. В некоторых вариантах осуществления глицин-сериновый полимер представляет собой GSGGSn (SEQ ID NO: 129), где n представляет собой целое число, равное по меньшей мере единице. В некоторых вариантах осуществления глицин-сериновый полимер представляет собой GGGSn (SEQ ID NO: 130), где n представляет собой целое число, равное по меньшей мере единице. В конкретных вариантах осуществления линкер содержит дополнительный остаток G на N'-конце SEQ ID NO: 130. В одном варианте осуществления линкер представляет собой GGSG (SEQ ID NO: 131). В одном варианте осуществления линкер представляет собой GGSGG (SEQ ID NO: 132). В одном варианте осуществления линкер представляет собой GSGSG (SEQ ID NO: 133). В одном варианте осуществления линкер представляет собой GSGGG (SEQ ID NO: 134). В одном варианте осуществления линкер представляет собой GGGSG (SEQ ID NO: 189). В одном варианте осуществления линкер представляет собой GSSSG (SEQ ID NO: 135).
Пептидные последовательности, предложенные в настоящем документе, включая варианты и подпоследовательности FGF19 и FGF21, а также продукты слияния и химеры FGF19/FGF21, приведенные в таблице 1 и списке последовательностей, а также подпоследовательности, варианты последовательностей и модифицированные формы последовательностей, приведенных в таблице 1 и списке последовательностей, имеют одну или более активностей, описанных в настоящем документе. Одним примером активности является модулирование гомеостаза желчных кислот. Другим примером активности является пониженная стимуляция образования HCC, например, по сравнению с FGF19. Дополнительным примером активности является более низкая или уменьшенная повышающая уровень липидов (например, триглицеридов, холестерина, не-ЛВП) активность или более высокая повышающая уровень ЛВП активность, например, по сравнению с FGF21. Другим примером активности является более низкая или уменьшенная снижающая безжировую массу тела активность, например, по сравнению с FGF21. Другим примером активности является связывание с FGFR4 или активация FGFR4, например, пептидные последовательности, которые связываются с FGFR4 с аффинностью, сопоставимой или большей, чем аффинность связывания FGF19 для FGFR4; и пептидные последовательности, которые активируют FGFR4 до степени или величины, сопоставимой или большей, чем в случае, когда FGF19 активирует FGFR4. Дополнительные примеры активностей включают лечение связанного с гомеостазом желчных кислот или сопутствующего заболевания. Определение таких активностей, как, например, модуляция гомеостаза желчных кислот, снижающая уровень глюкозы активность; анализ связанного с гомеостазом желчных кислот или сопутствующего заболевания, образования или онкогенеза HCC, повышающей уровень липидов активности или уменьшающей безжировую массу тела активности можно проводить в экспериментах на животных, таких как мыши db/db. Связывание с FGFR4 или активацию FGFR4 можно количественно определять анализами, описанными в настоящем документе или известными квалифицированному специалисту.
Для скрининга или диагностики HCC можно использовать различные методологии, хорошо известные квалифицированному специалисту. Индикаторы HCC включают обнаружение опухолевого маркера, такого как повышенные уровни альфа-фетопротеина (AFP) или дез-гамма-карбоксипротромбина (DCP). Также полезны различные методы сканирования и визуализации, включая ультразвуковое сканирование, КТ сканирование и МРТ. В конкретных вариантах осуществления оценку того, проявляет ли пептид (например, пептид-кандидат) признаки индукции HCC, можно проводить in vivo, например, подсчитывая количество образовавшихся узлов HCC в животной модели, такой как мыши db/db, которым был введен пептид, по сравнению с количеством образовавшихся узлов HCC в случае FGF19 дикого типа. Макроскопически рак печени может иметь форму узлов, при этом опухолевые узлы (которые являются округлыми или овальными, серого или зеленого цвета, четко очерченными, но не инкапсулированными) представлены либо одной большой массой, либо несколькими массами меньшего размера. Альтернативно, HCC может присутствовать в виде инфильтративной опухоли, которая является диффузной и плохо очерченной, и часто инфильтрирует воротную вену. Патологоанатомическую оценку образцов печеночной ткани, как правило, проводят после того, как результаты одного или более из вышеуказанных методов указывают на вероятное наличие HCC. Таким образом, способы, предложенные в настоящем документе, могут дополнительно включать оценку образца печеночной ткани от животного в in vivo модели (например, мыши db/db), используемой в исследованиях HCC, с целью определения того, проявляет ли пептидная последовательность признаки индукции HCC. При микроскопической оценке патологоанатом может определять, имеет ли место HCC одного из четырех общих архитектурных и цитологических типов (паттернов) (то есть, фиброламеллярная, псевдогландулярная (аденоидная), плеоморфная (гигантоклеточная) и прозрачноклеточная).
Более конкретно, пептидные последовательности, предложенные в настоящем документе, включая варианты и подпоследовательности FGF19 и FGF21, продукты слияния и химеры FGF19/FGF21, приведенные в таблице 1 и списке последовательностей, а также подпоследовательности, варианты и модифицированные формы последовательностей, приведенных в таблице 1 и списке последовательностей, включают те, которые обладают следующими активностями: пептидные последовательности, модулирующие гомеостаз желчных кислот или способные лечить связанное с гомеостазом желчных кислот или сопутствующее заболевание, и в то же время имеющие пониженную способность стимулировать образование HCC по сравнению с FGF19 или вариантной последовательностью FGF19, имеющей любую из замен GQV, GDI, WGPI (SEQ ID NO: 171), WGDPV (SEQ ID NO: 172), WGDI (SEQ ID NO: 173), GDPI (SEQ ID NO: 174), GPI, WGQPI (SEQ ID NO: 175), WGAPI (SEQ ID NO: 176), AGDPI (SEQ ID NO: 177), WADPI (SEQ ID NO: 178), WGDAI (SEQ ID NO: 179), WGDPA (SEQ ID NO: 180), WDPI (SEQ ID NO: 181), WGDI (SEQ ID NO: 182), WGDP (SEQ ID NO: 183) или FGDPI (SEQ ID NO: 184) вместо последовательности WGDPI (SEQ ID NO: 170) в аминокислотах 16-20 из FGF19; пептидные последовательности, обладающие большей модулирующей гомеостаз желчных кислот активностью по сравнению с FGF19 или вариантной последовательностью FGF19, имеющей любую из замен GQV, GDI, WGPI (SEQ ID NO: 171), WGDPV (SEQ ID NO: 172), WGDI (SEQ ID NO: 173), GDPI (SEQ ID NO: 174), GPI, WGQPI (SEQ ID NO: 175), WGAPI (SEQ ID NO: 176), AGDPI (SEQ ID NO: 177), WADPI (SEQ ID NO: 178), WGDAI (SEQ ID NO: 179), WGDPA (SEQ ID NO: 180), WDPI (SEQ ID NO: 181), WGDI (SEQ ID NO: 182), WGDP (SEQ ID NO: 183) или FGDPI (SEQ ID NO: 184) вместо последовательности WGDPI (SEQ ID NO: 170) в аминокислотах 16-20 из FGF19; пептидные последовательности, обладающие меньшей повышающей уровень липидов (например, меньшей повышающей уровень триглицеридов, холестерина, не-ЛВП) активностью или большей повышающей уровень ЛВП активностью по сравнению с FGF19 или вариантной последовательностью FGF19, имеющей любую из последовательностей GQV, GDI, WGPI (SEQ ID NO: 171), WGDPV (SEQ ID NO: 172), WGDI (SEQ ID NO: 173), GDPI (SEQ ID NO: 174), GPI, WGQPI (SEQ ID NO: 175), WGAPI (SEQ ID NO: 176), AGDPI (SEQ ID NO: 177), WADPI (SEQ ID NO: 178), WGDAI (SEQ ID NO: 179), WGDPA (SEQ ID NO: 180), WDPI (SEQ ID NO: 181), WGDI (SEQ ID NO: 182), WGDP (SEQ ID NO: 183) или FGDPI (SEQ ID NO: 184) вместо последовательности WGDPI (SEQ ID NO: 170) в аминокислотах 16-20 из FGF19; и пептидные последовательности, обладающие меньшей снижающей безжировую массу тела активностью по сравнению с FGF21.
Более конкретно, пептидные последовательности, предложенные в настоящем документе, включая варианты и подпоследовательности FGF19 и FGF21, продукты слияния и химеры FGF19/FGF21, приведенные в таблице 1 и списке последовательностей, а также подпоследовательности, варианты и модифицированные формы последовательностей, приведенных в таблице 1 и списке последовательностей, включают те, которые обладают следующими активностями: пептидные последовательности, которые модулируют гомеостаз желчных кислот; пептидные последовательности, которые лечат связанное с гомеостазом желчных кислот или сопутствующее заболевание; пептидные последовательности, которые связываются с FGFR4 или активируют FGFR4, например, пептидные последовательности, которые связываются с FGFR4 с аффинностью, сопоставимой или большей, чем аффинность связывания FGF19 для FGFR4; пептидные последовательности, которые активируют FGFR4 до степени или величины, которая сопоставима или больше, чем в случае, когда FGF19 активирует FGFR4; пептидные последовательности, которые понижающе регулируют или уменьшают экспрессию гена альдо-кето-редуктазы, например, по сравнению с FGF19; и пептидные последовательности, которые повышающе регулируют или увеличивают экспрессию гена члена 2 семейства переносчиков растворенных веществ 1 (Slc1a2) по сравнению с FGF21.
Как описано в настоящем документе, варианты включают различные имеющие N-концевые модификации и/или укороченные варианты FGF19, включая варианты, в которых имеется замена одной или нескольких N-концевых аминокислот FGF19 аминокислотами из FGF21. Такие варианты включают варианты, обладающие снижающей уровень глюкозы активностью, а также благоприятно влияющие на липидный профиль, и при этом не имеющие измеримой или заметной онкогенной активности.
5.5 Дозирование и введение
Пептидные последовательности, предложенные в настоящем документе, включая подпоследовательности, варианты последовательностей и модифицированные формы приведенных пептидных последовательностей (например, последовательностей, приведенных в списке последовательностей или таблице 1), могут быть сформулированы в единичной дозе или стандартной лекарственной форме. В конкретном варианте осуществления пептидная последовательность присутствует в количестве, эффективном для лечения субъекта, который нуждается в лечении, например, вследствие аномального или аберрантного гомеостаза желчных кислот, такого как метаболический синдром; заболевания, связанного с метаболизмом липидов или глюкозы; нарушения метаболизма холестерина или триглицеридов; диабета 2 типа; холестаза, включая, например, заболевания внутрипеченочного холестаза (например, PBC, PFIC, PSC, PIC, неонатальный холестаз и медикаментозный холестаз (вызванный, например, эстрогеном)), и заболевания внепеченочного холестаза (например, сжатие желчных протоков из-за опухоли, блокирование желчных протоков желчными камнями); синдрома недостаточности всасывания желчных кислот и других заболеваний с вовлечением дистального отдела тонкого кишечника, включая резекцию подвздошной кишки, воспалительные заболевания кишечника (например, болезнь Крона и язвенный колит), нарушений, приводящих к уменьшению всасывания желчных кислот, иначе не характеризуемых (идиопатических), ведущих к диарее (например, BAD) и ЖК симптомам, а также форм рака ЖК тракта, печени и/или желчных протоков (например, рака толстого кишечника и печеночно-клеточного рака); и/или аномалий синтеза желчных кислот, таких как те, которые вносят вклад в развитие NASH, цирроза и портальной гипертензии. Иллюстративный диапазон единичных доз составляет примерно 25-250, 250-500, 500-1000, 1000-2500 или 2500-5000, 5000-25000, 25000-50000 нг; примерно 25-250, 250-500, 500-1000, 1000-2500 или 2500-5000, 5000-25000, 25000-50000 мкг; и примерно 25-250, 250-500, 500-1000, 1000-2500 или 2500-5000, 5000-25000, 25000-50000 мг.
Пептидные последовательности, предложенные в настоящем документе, включая подпоследовательности, варианты последовательностей и модифицированные формы приведенных пептидных последовательностей (например, последовательностей, приведенных в списке последовательностей или таблице 1), для обеспечения намеченного эффекта можно вводить одной дозой или несколькими дозами, например, в эффективном или достаточном количестве. Иллюстративные дозы находятся в диапазоне примерно 25-250, 250-500, 500-1000, 1000-2500 или 2500-5000, 5000-25000, 25000-50000 пг/кг; примерно 50-500, 500-5000, 5000-25000 или 25000-50000 нг/кг и примерно 25-250, 250-500, 500-1000, 1000-2500 или 2500-5000, 5000-25000, 25000-50000 мкг/кг. Можно вводить одну или несколько доз, например, несколько раз в сутки, ежедневно, через день, еженедельно или периодически (например, два раза в неделю, один раз каждые 1, 2, 3, 4, 5, 6, 7 или 8 недель, или один раз каждые 2, 3, 4, 5 или 6 месяцев).
Пептидные последовательности, предложенные в настоящем документе, включая подпоследовательности, варианты и модифицированные формы приведенных пептидных последовательностей (например, последовательностей, приведенных в списке последовательностей или таблице 1), можно вводить, и способы можно практиковать, системно, регионально или локально, любыми путями введения. Например, пептидную последовательность можно вводить парентерально (например, подкожно, внутривенно, внутримышечно или внутрибрюшинно), перорально (например, приемом внутрь, трансбуккальным или подъязычным введением), ингаляцией, внутрикожно, в полость тела, интракраниально, чрескожно (топически), трансмукозально или ректально. Пептидные последовательности, предложенные в настоящем документе, включая подпоследовательности, варианты и модифицированные формы приведенных пептидных последовательностей (например, последовательностей, приведенных в списке последовательностей или таблице 1), в том числе предложенные в настоящем документе фармацевтические композиции, можно вводить с помощью (микро)инкапсулированной системы доставки или помещенными в имплантат для введения.
Конкретные неограничивающие примеры парентерального (например, подкожного) введения включают использование системы подкожной доставки от компании Intarcia (Intarcia Therapeutics, Inc.; Hayward, CA). Система включает миниатюрный осмотический насос, который доставляет унифицированное количество лекарственного средства на протяжении нужного количества времени. Помимо поддержания уровней лекарственного средства в соответствующем терапевтическом диапазоне, систему можно использовать с препаратами, которые поддерживают стабильность белковых терапевтических средств при температуре тела человека в течение продолжительных периодов времени.
Другой неограничивающий пример парентерального введения включает использование имплантируемых осмотических насосов DUROS®-типа (например, от компании DURECT Corp.). Систему DUROS® можно использовать для методов лечения, требующих системного или сайт-специфического введения лекарственного средства. Для системной доставки лекарственных средств систему DUROS® помещают непосредственно под кожу, например, в плечо, амбулаторной процедурой, которая длится всего несколько минут, и с использованием местного анестетика. Для доставки лекарственного средства в определенную зону можно использовать технологию миниатюрных катетеров. Катетер можно присоединять к системе DUROS® для прямой доставки лекарственного средства в целевой орган, ткань или синтетическую медицинскую структуру, такую как имплантат. Сайт-специфическая доставка позволяет вводить лекарственное средство в терапевтической концентрации в целевую зону, не подвергая весь организм воздействию аналогичной концентрации. Точность, размер и технологические характеристики системы DUROS® позволяют производить непрерывную сайт-специфическую доставку в различные точно определенные участки тела.
Другой неограничивающий пример парентерального введения включает использование нательных систем доставки (например, набор для доставки Neulasta® от компании Amgen). Эта нательная система доставки включает нательный инъектор, который имеет небольшие размеры, малый вес, инъекционную систему устанавливают непосредственно в день посещения врача (например, в день проведения химиотерапии). Она разработана для доставки дозы терапевтического средства на следующий день или в ближайшие дни после посещения врача, так что для пациента нет необходимости возвращаться в кабинет врача для получения инъекции.
5.6 Способы предотвращения, лечения и контроля заболеваний и нарушений
В одном варианте осуществления настоящего изобретения предложен способ предотвращения заболевания или нарушения у субъекта, который имеет или рискует иметь заболевание или нарушение, предотвращаемое с помощью пептидной последовательности, предложенной в настоящем документе, включающий введение субъекту фармацевтической композиции, содержащей пептид, предложенный в настоящем документе, в количестве, эффективном для предотвращения заболевания или нарушения. В другом варианте осуществления настоящего изобретения предложен способ лечения заболевания или нарушения у субъекта, который имеет или рискует иметь заболевание или нарушение, поддающееся лечению с помощью пептидной последовательности, предложенной в настоящем документе, включающий введение субъекту фармацевтической композиции, содержащей пептид, предложенный в настоящем документе, в количестве, эффективном для лечения заболевания или нарушения. В другом варианте осуществления настоящего изобретения предложен способ контроля заболевания или нарушения у субъекта, который имеет или рискует иметь заболевание или нарушение, поддающееся контролю с помощью пептидной последовательности, предложенной в настоящем документе, включающий введение субъекту фармацевтической композиции, содержащей пептид, предложенный в настоящем документе, в количестве, эффективном для контроля заболевания или нарушения. В одном варианте осуществления заболевание или нарушение представляет собой связанное с гомеостазом желчных кислот или сопутствующее заболевание. В другом варианте осуществления заболевание или нарушение представляет собой метаболическое заболевание или нарушение. В других вариантах осуществления заболевание или нарушение представляет собой рак или опухоль.
Введение различных вариантных и слитых пептидных последовательностей FGF19 и/или FGF21 мышам приводит к успешной модуляции гомеостаза желчных кислот и гипергликемии (данные не представлены). Кроме того, в отличие от FGF19, конкретные пептидные последовательности не стимулируют и не индуцируют образование или онкогенез HCC у мышей (данные не представлены). Таким образом, введение пептидов, предложенных в настоящем документе, включая подпоследовательности, варианты и модифицированные формы приведенных пептидных последовательностей (в то числе варианты и подпоследовательности FGF19 и FGF21, приведенные в таблице 1 и списке последовательностей, а также продукты слияния и химеры FGF19/FGF21, приведенные в таблице 1 и списке последовательностей), животному, либо непосредственно, либо опосредованно in vivo или ex vivo способами (например, введением вариантного или слитого пептида, нуклеиновой кислоты, кодирующей вариантный или слитый пептид, либо трансформированной клетки или генно-терапевтического вектора, экспрессирующего вариантный или слитый пептид) можно использовать для лечения различных заболеваний, например, связанных с гомеостазом желчных кислот или сопутствующих заболеваний, а также метаболических заболеваний, таких как заболевания, связанные с высокими уровнями сахара в крови, гипергликемические состояния, устойчивость к инсулину, гиперинсулинемия, непереносимость глюкозы, метаболический синдром, либо родственных заболеваний, указанных в настоящем документе.
5.6.1 Способы предотвращения, лечения и контроля связанных с гомеостазом желчных кислот или сопутствующих заболеваний
В настоящем документе выражения «связанное с гомеостазом желчных кислот заболевание», «связанное с гомеостазом желчных кислот или сопутствующее заболевание», и тому подобное, при использовании применительно к состоянию субъекта означают нарушение гомеостаза желчных кислот, которое может проявляться, например, в виде острого, временного или хронического аномального уровня одной или более желчных кислот. Данное состояние может быть вызвано подавлением, уменьшением или задержкой синтеза, метаболизма или всасывания желчных кислот, так что у субъекта наблюдается уровень желчных кислот, которого как правило, не бывает у здоровых субъектов.
Кроме того, в настоящем документе предложены in vitro, ex vivo и in vivo (например, на теле или в теле субъекта) способы и варианты применения. Такие способы и варианты применения можно осуществлять на практике с любой из пептидных последовательностей, приведенных в настоящем документе. В различных вариантах осуществления способы включают введение пептидной последовательности, такой как вариант, продукт слияния или химера FGF19 или FGF21, раскрытые в настоящем документе (например, в списке последовательностей или таблице 1), либо подпоследовательность, вариант или модифицированная форма варианта, продукта слияния или химеры FGF19 или FGF21, раскрытых в настоящем документе (например, в списке последовательностей или таблице 1), субъекту в количестве, эффективном для лечения связанного с гомеостазом желчных кислот или сопутствующего заболевания.
В конкретных вариантах осуществления пептид вводят в сочетании с дополнительным терапевтическим средством(ами) и/или методами лечения (например, средством, полезным для лечения и/или предотвращения PBC). Дополнительное терапевтическое средство(а) можно вводить до, совместно или после введения пептидов, описанных в настоящем документе.
Кроме того, в настоящем документе предложены способы предотвращения (например, у субъектов, предрасположенных к развитию конкретного заболевания(й) в сравнении с субъектами сопоставимого возраста, пола, расы и так далее), задержки, замедления или ингибирования прогрессирования, начала развития, либо лечения (например, ослабления) связанного с гомеостазом желчных кислот или сопутствующего заболевания. Таким образом, в различных вариантах осуществления настоящего изобретения предложен способ, например, модуляции гомеостаза желчных кислот или лечения связанного с гомеостазом желчных кислот или сопутствующего заболевания, включающий создание контакта с, или введение одного или более пептидов, предложенных в настоящем документе (например, варианта или продукта слияния FGF19 и/или FGF21, приведенных в списке последовательностей или таблице 1), в количестве, эффективном для модуляции гомеостаза желчных кислот или лечения связанного с гомеостазом желчных кислот или сопутствующего заболевания. В конкретных вариантах осуществления способ дополнительно включает создание контакта с, или введение по меньшей мере одного дополнительного терапевтического средства или применение метода лечения, полезного для лечения или предотвращения связанного с гомеостазом желчных кислот или сопутствующего заболевания (например, PBC).
Термин «субъект» относится к животному. Как правило, животное является млекопитающим, которое получило бы пользу от лечения пептидной последовательностью, предложенной в настоящем документе. Конкретные примеры включают приматов (например, людей), собак, кошек, лошадей, коров, свиней и овец.
Субъекты включают тех, которые имеют заболевание, например, связанное с гомеостазом желчных кислот или сопутствующее заболевание, такое как холестаз, включая, например, заболевания внутрипеченочного холестаза (например, PBC, PFIC, PSC, PIC, неонатальный холестаз и медикаментозный холестаз (вызванный, например, эстрогеном)) и заболевания внепеченочного холестаза (например, сжатие желчных протоков из-за опухоли, блокирование желчных протоков желчными камнями); синдром недостаточности всасывания желчных кислот и другие заболевания с вовлечением дистального отдела тонкого кишечника, включая резекцию подвздошной кишки, воспалительные заболевания кишечника (например, болезнь Крона и язвенный колит), синдром короткой кишки, нарушения, приводящие к уменьшению всасывания желчных кислот, иначе не характеризуемые (идиопатические), ведущие к диарее (например, BAD) и ЖК симптомам, а также формы рака ЖК тракта, печени и/или желчных протоков (например, рак толстого кишечника и печеночно-клеточный рак); и/или аномалии синтеза желчных кислот, такие как те, которые вносят вклад в развитие NASH, цирроза и портальной гипертензии; или субъектов, которые не имеют заболевания, но могут иметь риск развития заболевания.
Неограничивающие иллюстративные связанные с гомеостазом желчных кислот или сопутствующие заболевания, предотвращаемые, поддающиеся лечению или поддающиеся контролю в соответствии со способами и вариантами применения, предложенными в настоящем документе, включают: холестаз, включая, например, заболевания внутрипеченочного холестаза (например, первичный билиарный цирроз (PBC), первичный семейный внутрипеченочный холестаз (PFIC) (например, прогрессирующий PFIC), первичный склерозирующий холангит (PSC), внутрипеченочный холестаз беременных (PIC), неонатальный холестаз и медикаментозный холестаз (вызванный, например, эстрогеном)), а также заболевания внепеченочного холестаза (например, сжатие желчных протоков из-за опухоли, блокирование желчных протоков желчными камнями); синдром недостаточности всасывания желчных кислот и другие заболевания с вовлечением дистального отдела тонкого кишечника, включая резекцию подвздошной кишки, воспалительные заболевания кишечника (например, болезнь Крона и язвенный колит), синдром короткой кишки, нарушения, приводящие к уменьшению всасывания желчных кислот, иначе не характеризуемые (идиопатические), ведущие к диарее (например, хологенной диарее (BAD)) и ЖК симптомам, а также формы рака ЖК тракта, печени и/или желчных протоков (например, рак толстого кишечника и печеночно-клеточный рак); и/или аномалии синтеза желчных кислот, такие как те, которые вносят вклад в развитие неалкогольного стеатогепатита (NASH), цирроза и портальной гипертензии; например, у млекопитающих, таких как люди. Дополнительные связанные с гомеостазом желчных кислот или сопутствующие заболевания включают метаболический синдром; нарушения метаболизма липидов или глюкозы; нарушения метаболизма холестерина или триглицеридов; диабет 2 типа. В одном конкретном варианте осуществления связанное с гомеостазом желчных кислот или сопутствующее заболевание представляет собой синдром недостаточности всасывания желчных кислот. В другом конкретном варианте осуществления связанное с гомеостазом желчных кислот или сопутствующее заболевание представляет собой диарею. В другом конкретном варианте осуществления связанное с гомеостазом желчных кислот или сопутствующее заболевание представляет собой холестаз (например, внутрипеченочный или внепеченочный холестаз). В другом конкретном варианте осуществления связанное с гомеостазом желчных кислот или сопутствующее заболевание представляет собой первичный билиарный цирроз (PBC). В других конкретных вариантах осуществления связанное с гомеостазом желчных кислот или сопутствующее заболевание представляет собой первичный склерозирующий холангит. В другом варианте осуществления связанное с гомеостазом желчных кислот или сопутствующее заболевание представляет собой PFIC (например, прогрессирующий PFIC). В другом варианте осуществления связанное с гомеостазом желчных кислот или сопутствующее заболевание представляет собой NASH. В другом варианте осуществления связанное с гомеостазом желчных кислот или сопутствующее заболевание представляет собой гипергликемическое состояние. В конкретном варианте осуществления связанное с гомеостазом желчных кислот или сопутствующее заболевание представляет собой диабет 2 типа.
В некоторых вариантах осуществления фармацевтическая композиция также содержит по меньшей мере одно дополнительное средство, эффективное для модулирования гомеостаза желчных кислот или лечения связанного с гомеостазом желчных кислот или сопутствующего заболевания, при этом дополнительное средство представляет собой: глюкокортикоид; CDCA; UDCA; инсулин, секретагоги инсулина, миметик инсулина, сульфонилмочевину и меглитинид; бигуанид; ингибиторы альфа-глюкозидазы; ингибитор DPP-IV, GLP-1, агонисты GLP-1 и аналог GLP-1; DPP-IV-устойчивый аналог; агонист PPAR-гамма, агонист PPAR двойного действия, агонист PPAR общего действия; ингибитор PTP1B; ингибитор SGLT; агонист RXR; ингибитор гликоген синтазы киназы-3; иммуномодулятор; агонист бета-3 адренергических рецепторов; ингибитор 11бета-HSD1; амилин и аналог амилина; секвестрант желчных кислот или ингибитор SGLT-2. В конкретных вариантах осуществления по меньшей мере одно дополнительное средство, эффективное для модулирования PBC, представляет собой UDCA, агонист FXR, OCA, ингибитор ASBT, средство против аутоиммунного заболевания, анти-IL-12 средство, анти-CD80 средство, анти-CD20 средство, CXCL10-нейтрализующее антитело, лиганд для CXCR3, фибрат, рыбий жир, колхицин, метотрексат, азатиоприн, циклоспорин или антиретровирусное терапевтическое средство. В конкретных вариантах осуществления по меньшей мере одно дополнительное средство, эффективное для модулирования PBC, представляет собой UDCA, OCA, ингибитор ASBT, анти-IL-12 средство, анти-CD20 средство или фибрат.
Дополнительные связанные с гомеостазом желчных кислот или сопутствующие заболевания, которые можно лечить или предотвращать с помощью пептидных последовательностей, предложенных в настоящем документе, включают метаболический синдром; нарушения метаболизма липидов или глюкозы; нарушения метаболизма холестерина или триглицеридов; диабет (например, диабет 2 типа), другие заболевания, связанные с гипергликемией, включая поражение почек (например, поражение почечных канальцев или нефропатию), дегенерацию печени, поражение глаз (например, диабетическую ретинопатию или катаракту), а также состояние «диабетической стопы»; дислипидемии и их последствия, например, атеросклероз, болезнь коронарных артерий, цереброваскулярные нарушения и тому подобное.
Другие состояния, которые могут быть ассоциированы с метаболическим синдромом, включают ожирение и избыточную массу тела (включая их сопутствующие патологические состояния, такие как, но без ограничения, болезнь неалкогольной жировой инфильтрации печени (NAFLD), неалкогольный стеатогепатит (NASH), и синдром поликистоза яичников (PCOS)), также включают тромбозы, гиперкоагуляционные и протромботические состояния (артериальные и венозные), гипертензию (включая портальную гипертензию (когда градиент печеночного венозного давления (HVPG) превышает 5 мм ртутного столба)), сердечно-сосудистое заболевание, инсульт и сердечную недостаточность; заболевания или состояния, в которые вовлечены воспалительные реакции, включая атеросклероз, хронические воспалительные заболевания кишечника (например, болезнь Крона и язвенный колит), астму, системную красную волчанку, артрит или другие воспалительные ревматические заболевания; нарушения клеточного цикла или процессов клеточной дифференцировки, такие как опухоли из жировых клеток, липоматозные карциномы, включая, например, липосаркомы, солидные опухоли и новообразования; нейродегенеративные заболевания и/или демиелинизирующие заболевания центральной и периферической нервных систем, и/или неврологические заболевания с вовлечением нейровоспалительных процессов, и/или другие периферические невропатии, включая болезнь Альцгеймера, рассеянный склероз, болезнь Паркинсона, прогрессирующую мультифокальную лейкоэнцефалопатию и синдром Гийена-Барре; кожные и дерматологические заболевания и/или нарушение процессов заживления ран, включая эритемато-сквамозный дерматоз; а также другие заболевания, такие как синдром X, остеоартрит и острый респираторный дистресс-синдром.
Лечение связанного с гомеостазом желчных кислот или сопутствующего заболевания (например, NASH) может быть полезным для облегчения или устранения заболевания, которое является по отношению к нему вторичным. В качестве примера, субъект, страдающий NASH, также может иметь депрессию или тревожность вследствие NASH; таким образом, лечение NASH у субъекта также может опосредованно лечить депрессию или тревожность. В конкретных вариантах осуществления также подразумевается применение терапевтических средств, раскрытых в настоящем документе, для лечения вторичных заболеваний.
В конкретных вариантах осуществления субъект имеет, или имеет риск развития, PBC. В других конкретных вариантах осуществления субъект имеет, или имеет риск развития, NASH.
Субъекты, имеющие риск развития связанного с гомеостазом желчных кислот или сопутствующего заболевания (такого, как заболевания, описанные выше), включают, например, тех, которые могут иметь заболевание в семейном анамнезе или генетическую предрасположенность к развитию такого заболевания, а также тех, диета которых может вносить вклад в развитие таких заболеваний.
Как описано в настоящем документе, способы лечения включают создание контакта с, или введение пептида, приведенного в настоящем документе (например, варианта или продукта слияния FGF19 и/или FGF21, приведенного в списке последовательностей или таблице 1) в количестве, эффективном для достижения желательного исхода или результата у субъекта. Желательный исход или результат лечения включает уменьшение, снижение или предотвращение тяжести, либо частоты одного или более симптомов состояния у субъекта, например, улучшение состояния здоровья субъекта, либо «благоприятный эффект» или «терапевтический эффект». Таким образом, лечение может приводить к уменьшению или снижению, либо предотвращению тяжести или частоты одного или более симптомов заболевания, стабилизации, либо ингибированию прогрессирования или усугубления заболевания, и в некоторых случаях обращению вспять заболевания, на короткое время (например, на 1-6, 6-12 или 12-24 часов), на период времени средней продолжительности (например, 1-6, 6-12, 12-24 или 24-48 дней) или продолжительный период времени (например, на 1-6, 6-12, 12-24, 24-48 недель или более чем 24-48 недель). Таким образом, в случае связанного с гомеостазом желчных кислот или сопутствующего заболевания лечение может приводить к ослаблению или уменьшению проявления одного или более симптомов, либо эффектов связанного с гомеостазом желчных кислот или сопутствующего заболевания, описанного выше.
В конкретных вариантах осуществления различные способы, предложенные в настоящем документе, дополнительно включают создание контакта с, или введение одного или более дополнительных средств, либо применение методов лечения, полезных для лечения или предотвращения связанного с гомеостазом желчных кислот или сопутствующего заболевания, например, средств или методов лечения, описанных в настоящем документе, в количестве, эффективном для достижения желательного исхода или результата у субъекта.
Используемый в настоящем документе термин «эффективное количество» или «достаточное количество» для использования и/или для лечения субъекта означает количество, которое обеспечивает, в одной или нескольких дозах, отдельно, либо в сочетании с одним или более другими средствами, терапевтическими препаратами, протоколами или режимами лечения, поддающийся обнаружению ответ, сохраняющийся в течение разного периода времени (кратковременный, средней продолжительности или долговременный), желательный результат, приносящий либо объективную, либо субъективную пользу субъекту в любой поддающейся измерению или обнаружению степени, или на любой период времени (например, несколько часов, дней, месяцев, лет) приводящий к ремиссии или исцелению. Такие количества, как правило, эффективны для облегчения заболевания, либо одного, нескольких или всех неблагоприятных симптомов, последствий или осложнений заболевания, в измеримой степени, хотя уменьшение, либо ингибирование прогрессирования или усугубления заболевания считают удовлетворительным исходом.
Используемый в настоящем документе термин «облегчать» означает улучшение состояния здоровья субъекта, уменьшение степени тяжести заболевания, либо ингибирование прогрессирования или усугубления заболевания (например, стабилизацию заболевания). В случае связанного с гомеостазом желчных кислот или сопутствующего заболевания, такого как те, которые описаны выше, включая холестаз (например, PBC), нарушения, приводящие к уменьшению всасывания желчных кислот, ведущие к диарее (например, BAD), и аномалии синтеза желчных кислот (например, NASH), улучшение состояния здоровья может представлять собой ослабление или уменьшение проявления одного или более симптомов, либо эффектов заболевания.
Вследствие этого, терапевтическая польза или улучшение состояния здоровья не обязательно должно представлять собой полное устранение любого одного, большинства или всех симптомов, осложнений, последствий или основополагающих причин, связанных с нарушением или заболеванием. Таким образом, удовлетворительный конечный результат достигается, когда имеет место временное, средней продолжительности или долговременное постепенное улучшение состояния здоровья субъекта, либо частичное уменьшение проявления, частоты, степени тяжести, прогрессирования или длительности, либо ингибирование или обращение вспять одного или более ассоциированных неблагоприятных симптомов или осложнений, или последствий, или основополагающих причин, ухудшения или прогрессирования (например, стабилизация одного или более симптомов или осложнений состояния, нарушения или заболевания) нарушения или заболевания в течение некоторого периода времени (часов, дней, недель, месяцев и так далее).
Таким образом, в случае заболевания, поддающегося лечению пептидной последовательностью, предложенной в настоящем документе, либо отдельно, либо в сочетании с дополнительным средством, количество пептида (и, необязательно, дополнительного средства), достаточное для облегчения заболевания, будет зависеть от вида, тяжести или стадии, или продолжительности заболевания, желаемого терапевтического эффекта или исхода, и может быть легко определено специалистом в данной области. Соответствующие количества также будут зависеть от конкретного субъекта (например, биодоступности в организме, пола, возраста субъекта и так далее). Например, в случае временного или частичного восстановления нормального гомеостаза желчных кислот у субъекта можно уменьшать количество или частоту дозирования пептидов и средств, описанных в настоящем документе, для лечения связанных с гомеостазом желчных кислот или сопутствующих заболеваний, описанных ранее, хотя полностью лечение не будет прекращено. Эффективное количество можно определять, например, путем измерения одного или более релевантных физиологических эффектов.
Способы и варианты применения, предложенные в настоящем документе для лечения субъекта, применимы для профилактики с целью предотвращения или снижения вероятности развития у субъекта заболевания, такого как связанное с гомеостазом желчных кислот или сопутствующее заболевание. Соответственно, способы и варианты применения, предложенные в настоящем документе для лечения субъекта, имеющего, или имеющего риск развития связанного с гомеостазом желчных кислот или сопутствующего заболевания, можно применять на практике до, практически одновременно, или после введения или применения другого средства, полезного для лечения или предотвращения связанного с гомеостазом желчных кислот или сопутствующего заболевания, и/или их можно сопровождать другими видами терапии. Дополнительные виды терапии включают использование других средств, снижающих уровень глюкозы в крови, таких как инсулин, усилитель чувствительности к инсулину и другие терапевтические препараты, изменение диеты (употребление меньше сахара, жиров и так далее), хирургическую операцию для снижения массы тела (уменьшение объема желудка за счет желудочного шунтирования, гастрэктомии), желудочный бандаж, внутрижелудочный баллон, желудочный рукав и так далее. Например, способ или вариант применения, предложенный в настоящем документе для лечения гипергликемического заболевания или устойчивости к инсулину, можно использовать в сочетании с лекарственными средствами или другими фармацевтическими композициями, снижающими уровень глюкозы в крови или повышающими чувствительность к инсулину у субъекта.
В одном варианте осуществления способ или вариант применения включает создание контакта с, или введение субъекту одного или более вариантов, или продуктов слияния пептидных последовательностей FGF19 и/или FGF21 в количестве, эффективном для предотвращения связанного с гомеостазом желчных кислот или сопутствующего заболевания. В одном варианте осуществления способ или вариант применения включает создание контакта с, или введение субъекту одного или более вариантов, или продуктов слияния пептидных последовательностей FGF19 и/или FGF21 в количестве, эффективном для лечения связанного с гомеостазом желчных кислот или сопутствующего заболевания. В одном варианте осуществления способ или вариант применения включает создание контакта с, или введение субъекту одного или более вариантов, или продуктов слияния пептидных последовательностей FGF19 и/или FGF21 в количестве, эффективном для контроля связанного с гомеостазом желчных кислот или сопутствующего заболевания.
5.6.1.1 PBC и лечение средствами, эффективными для его лечения и предотвращения
Первичный билиарный цирроз (PBC), наиболее распространенное холестатическое заболевание печени, представляет собой прогрессирующее заболевание печени, которое в основном возникает в результате аутоиммунного разрушения желчных протоков, выводящих желчные кислоты из печени. По мере прогрессирования заболевания постоянное токсическое накопление желчных кислот вызывает прогрессирующее поражение печени, характеризующееся хроническим воспалением и фиброзом. В связи с тем, что пациенты с PBC имеют повышенный риск развития HCC, терапия с использованием вариантов пептидных последовательностей FGF19, продуктов слияния пептидных последовательностей FGF19 и/или FGF21 и вариантов продуктов слияния (химер) пептидных последовательностей FGF19 и/или FGF21, описанных в настоящем документе, имеет особую важность, поскольку такие последовательности не индуцируют, или по существу не приводят к увеличению образования HCC или онкогенеза HCC.
Хотя пациенты с PBC часто не имеют симптомов во время первоначальной постановки диагноза, у большинства из них наблюдаются или впоследствии развиваются, одно или более из перечисленного далее: зуд, утомляемость; желтуха; ксантома; заболевания, ассоциированные с внепеченочным аутоиммунным заболеванием (например, синдром Шегрена и ревматоидный артрит); а также осложнения, являющиеся результатом цирроза или портальной гипертензии (например, асциты, варикозное расширение вен пищевода и печеночная энцефалопатия).
Хотя точная причина развития PBC не известна, результаты большинства исследований указывают на то, что это аутоиммунное заболевание. По-видимому, существует генетическая предрасположенность, и генетические исследования показали, что часть сигнального каскада IL-12, включая полиморфизмы IL-12A и I-12RB2, играет важную роль в этиологии заболевания.
Не существует исчерпывающего метода диагностирования PBC; как правило, требуется оценка ряда факторов. Кроме того, для диагностирования PBC необходимо исключить другие состояния с аналогичными симптомами (например, аутоиммунный гепатит и первичный склерозирующий холангит); в качестве примера, обычно проводят ультразвуковое или КТ сканирование брюшной полости, чтобы исключить блокаду желчных протоков.
Диагностические анализы крови включают тесты на аномалию печеночной функции (гамма-глутамилтрансфераза и щелочная фосфатаза) и на присутствие определенных антител (антимитохондриальное антитело (AMA), антиядерное антитело (ANA)). Считают, что антиядерные антитела являются прогностическими индикаторами PBC. Когда другие результаты тестов и методов указывают на PBC, часто проводят биопсию печени для подтверждения диагноза заболевания. Для подтверждения диагноза заболевания также можно использовать эндоскопическую ретроградную холангиопанкреатографию (ЭРХПГ), эндоскопическую оценку желчных протоков.
В зависимости от прогрессирования заболевания различают четыре стадии PBC. Стадия 1 (портальная стадия) характеризуется портальным воспалением и умеренным поражением желчных протоков; стадия 2 (перипортальная стадия) характеризуется увеличением триад, перипортальным фиброзом или воспалением; стадия 3 (септальная стадия) характеризуется наличием активных и/или пассивных фиброзных септ и стадия 4 (билиарный цирроз) характеризуется наличием печеночных узлов. Для определения стадии заболевания требуется проведение биопсии печени.
Сывороточный билирубин является индикатором прогрессирования и прогноза PBC. Для пациентов с сывороточным уровнем билирубина 2-6 мг/дл среднее время выживания составляет 4,1 года, для пациентов с сывороточным уровнем билирубина 6-10 мг/дл среднее время выживания составляет 2,1 года и для пациентов с сывороточным уровнем билирубина выше 10 мг/дл среднее время выживания составляет 1,4 года. Трансплантация печения является одним из вариантов лечения на поздних стадиях PBC, хотя частота рецидивов может достигать 18% через 5 лет, и до 30% через 10 лет.
Хотя прогрессирование заболевания может быть замедлено, фармацевтическое вмешательство с применением современных методов лечения не является ни целебным, ни эффективным для всех групп пациентов. С целью улучшения результатов лечения фармакологическими препаратами, один аспект изобретения относится к применению одного или более современных терапевтических препаратов в сочетании с вариантами пептидных последовательностей FGF19, продуктами слияния пептидных последовательностей FGF19 и/или FGF21 и вариантами продуктов слияния (химер) пептидных последовательностей FGF19 и/или FGF21, имеющими одну или более активностей, связанных с лечением и/или предотвращением PBC, а также сопутствующих заболеваний, нарушений и состояний. Наиболее часто используемые и/или подающие надежды средства для комбинированной терапии приведены далее в настоящем документе, хотя следует понимать, что эти средства являются иллюстративными, а не исключительными.
Лечение PBC наиболее часто включает использование желчной кислоты, урсодезоксихолевой кислоты (урсодиол, UDCA). Терапию UDCA используют для уменьшения холестаза и улучшения печеночной функции у пациентов с PBC; однако она явно не улучшает симптомы и ее влияние на прогноз вызывает сомнения. Показано, что UDCA приводит к снижению смертности, частоты неблагоприятных явлений и необходимости в трансплантации печени при PBC. Хотя лечение UDCA считается терапией первой линии, примерно одна треть пациентов могут быть невосприимчивыми, по-прежнему иметь риск прогрессирования заболевания печени и являться кандидатами на получение альтернативной или дополнительной терапии.
Существует несколько альтернативных и вспомогательных видов терапии, в настоящее время находящихся на стадии клинической разработки, которые могут быть использованы в сочетании с вариантами пептидных последовательностей FGF19, продуктами слияния пептидных последовательностей FGF19 и/или FGF21 и вариантами продуктов слияния (химер) пептидных последовательностей FGF19 и/или FGF21, предложенными в настоящем документе и имеющими одну или более активностей, связанных с лечением и/или предотвращением PBC, а также сопутствующих заболеваний, нарушений и состояний.
Агонисты фарнезоид-X рецептора (FXR) представляют собой многообещающий класс средств, которые могут быть использованы в комбинированной терапии. Одной из основных функций агонистов FXR, ядерного рецептора, экспрессируемого на высоком уровне в печени и кишечнике, является подавление холестерин-7α гидроксилазы-1 (CYP7A1), скорость-лимитирующего фермента в синтезе желчных кислот из холестерина. Обетихолевая кислота (OCA; Intercept Pharmaceuticals, NY) является аналогом желчной кислоты и агонистом FXR, ее получают из первичной желчной кислоты человека, хенодезоксихолевой кислоты, или CDCA. OCA в настоящее время проходит оценку для лечения пациентов, которые проявляют недостаточный терапевтический ответ на урсодиол или которые неспособны переносить урсодиол.
Ингибиторы апикального натрий-зависимого переносчика желчных кислот (ASBT) являются представителями другого класса средств, которые могут быть использованы в сочетании с вариантами пептидных последовательностей FGF19, продуктами слияния пептидных последовательностей FGF19 и/или FGF21 и вариантами продуктов слияния (химер) пептидных последовательностей FGF19 и/или FGF21, описанными в настоящем документе, для лечения и/или предотвращения PBC и сопутствующих заболеваний. ASBT, член семейства совместных переносчиков натрия/солей желчных кислот, кодируемый геном SLC10A2, в настоящее время считается основным участником механизма повторного всасывания желчных кислот в кишечнике. Примеры ингибиторов ABST включают LUM001 и SC-435, оба из которых были разработаны компанией Lumena Pharmaceuticals (San Diego, CA).
Секвестранты желчных кислот также находят применение в лечении PBC. Холестирамин и колестипол являются наиболее известными секвестрантами желчных кислот. Однако их использование иногда бывает ограничено, поскольку они доступны только в порошковой форме и часто не переносятся многими пациентами из-за плохой текстуры и вкуса порошкообразной смолы. Секвестрант желчных кислот колесевилам доступен в форме таблеток и часто лучше переносится пациентами. Все секвестранты желчных кислот способны связывать другие соединения, включая жирорастворимые витамины A, D, E и K, и при недостаточности этих витаминов может требоваться их дополнительный прием. Важно отметить, что пациенты с PBC от природы имеют плохую зависимую от жиров абсорбцию витаминов A, D, E и K, следовательно, пациенты, принимающие секвестранты желчных кислот, имеют особый риск развития недостаточности этих витаминов.
Средства, связанные с иммунной и воспалительной функцией, являются кандидатами для использования в комбинированной терапии с вариантами пептидных последовательностей FGF19, продуктами слияния пептидных последовательностей FGF19 и/или FGF21 и вариантами продуктов слияния (химер) пептидных последовательностей FGF19 и/или FGF21, имеющими одну или более активностей, связанных с лечением и/или предотвращением PBC, а также сопутствующих заболеваний, нарушений и состояний.
Интерлейкин IL-12 связан с аутоиммунными реакциями. Данные указывают на то, что сигнальный путь IL-12 играет ключевую роль в эффекторных механизмах, приводящих к поражениям желчных путей. Показано, что таргетирование p40 субъединицы IL-12 приводит к облегчению экспериментальной иммуноопосредованной холангиопатии. Таким образом, средства против IL-12 (например, ингибирующие моноклональные Ат) являются перспективным терапевтическим средством. Кроме того, поскольку показано, что полиморфизмы CD80 придают повышенную предрасположенность к PBC, блокирование костимуляции между T-клетками и антигенпредставляющими клетками через CD80 за счет использования анти-CD80 средства может являться важным терапевтическим подходом к лечению PBC. Кроме того, улучшение титра IgM и увеличение числа внутрипеченочных регуляторных T-клеток с помощью анти-CD20 антитела ритуксимаба (ритуксана) также является многообещающим.
Опосредованное иммунной системой разрушение мелких желчных протоков при PBC преимущественно является клеточно-опосредованным, с вовлечением Th1-клеток, CD8+ T-клеток, NK-клеток и NKT-клеток, которые экспрессируют CXCR3. Таким образом, использование нейтрализующих антител к CXCL10, лиганду для CXCR3, может создавать возможность для препятствования одному из ключевых воспалительных процессов, вносящему вклад в опосредованное иммунной системой разрушение желчных путей при PBC. Аналогично, блокирование костимулирующих сигналов между T-клетками, экспрессирующими CD28, и антигенпредставляющими клетками, экспрессирующими CD80 (например, холангиоцитами, антитело-секретирующими B-клетками), может являться важным подходом к лечению аутоиммунных заболеваний.
Варианты пептидных последовательностей FGF19, продукты слияния пептидных последовательностей FGF19 и/или FGF21 и варианты продуктов слияния (химер) пептидных последовательностей FGF19 и/или FGF21, описанные в настоящем документе, можно использовать отдельно или в сочетании с другими средствами для лечения и/или предотвращения тех связанных с гомеостазом желчных кислот или сопутствующих заболеваний, описанных в настоящем документе, которые имеют иммунный и/или воспалительный компонент, включая, но без ограничения, PBC и сопутствующие заболевания, нарушения и состояния. Примеры таких других средств включают, например, нестероидные противовоспалительные лекарственные средства (NSAID); стероиды; цитокин-подавляющие противовоспалительные лекарственные средства (CSAID); антитела к, или антагонисты других человеческих цитокинов или факторов роста (например, IL-2, IL-6 или PDGF); антагонисты TNF (например, такие средства, как ремикейд, p75TNFRIgG (энбрел) или p55TNFR1gG (ленерцепт)); интерферон-β1a (авонекс); интерферон-β1b (бетасерон) и ингибиторы иммунных контрольных точек, включая PD1 (сопутствующие средства включают антитела ниволумаб и ламбролизумаб), PDL1, BTLA, CTLA4 (сопутствующие средства включают полностью гуманизированное моноклональное антитело к CTLA4 ипилимумаб (ервой), TIM3, LAG3 и A2aR.
Показано, что фибраты улучшают многие показатели при PBC, включая результаты тестов на функцию печени, как в виде монотерапии, так и в сочетании, у невосприимчивых к UDCA пациентов. В конкретных вариантах осуществления фибрат выбирают из группы, включающей безафибрат (безалип), ципрофибрат (модалим), гемфиброзил (лопид), клофибрат и фенофибрат (трикор). Рыбий жир имеет аналогичные полезные свойства.
У пациентов с PBC, имеющих определенные признаки гепатита при биопсии, кортикостероиды, такие как будезонид, могут приводить к улучшению гистологических и биохимических показателей печени, особенно при использовании в сочетании с UDCA. Колхицин, как показано, способствует улучшению результатов тестов на функцию печени (например, AST и ALP) и представляет собой другой альтернативный метод лечения PBC.
Другие перспективные лекарственные средства включают метотрексат в качестве иммуномодулирующего средства, азатиоприн, циклоспорин и некоторые средства, используемые в антиретровирусной терапии (например, комбивир), хотя список ими не исчерпывается.
Различные методы лечения существуют для осложнений, связанных с PBC. Например, зуд можно облегчать при помощи секвестранта желчных кислот холестирамина или, альтернативно, налтрексона и рифампицина. Утомляемость вследствие PBC можно эффективно лечить модафинилом (провигил; Teva (бывший цефалон)), не повреждая печень. Поскольку пациенты с PBC имеют повышенный риск развития остеопороза и варикозного расширения вен пищевода по сравнению с общей популяцией (и другими людьми с заболеваниями печени), скрининг и лечение этих осложнений является важной частью контроля PBC. Варианты пептидных последовательностей FGF19, продукты слияния пептидных последовательностей FGF19 и/или FGF21 и варианты продуктов слияния (химер) пептидных последовательностей FGF19 и/или FGF21, имеющие одну или более активностей, связанных с лечением и/или предотвращением PBC, а также сопутствующих заболеваний, нарушений и состояний, предложенные в настоящем документе, либо отдельно, либо в сочетании с другими средствами, представляют собой новые многообещающие альтернативы для контроля таких осложнений.
5.6.1.2 NASH и NAFLD, и лечение средствами, эффективными для их лечения и предотвращения
Неалкогольный стеатогепатит (NASH), считающийся частью спектра заболеваний неалкогольной жировой инфильтрации печени (NAFLD), вызывает воспаление и скопление жира и фиброзной ткани в печени. Хотя точная причина развития NASH неизвестна, факторы риска включают центральное ожирение, сахарный диабет 2 типа, устойчивость к инсулину (IR) и дислипидемию; сочетание вышеперечисленных нарушений часто называют метаболическим синдромом. Кроме того, показано, что употребление некоторых лекарственных средств имеет связь с NASH, в том числе тамоксифена, амиодарона и стероидов (например, преднизона и гидрокортизона). Заболевание неалкогольной жировой инфильтрации печени является наиболее распространенной причиной хронического заболевания печени в США, и по оценкам, распространенность NAFLD составляет 20-30%, а для NASH распространенность оценивают в 3,5-5%. (Смотри, например, Abrams, G.A., et al., Hepatology, 2004. 40(2): 475-83; Moreira, R.K., Arch Pathol Lab Med, 2007, 131(11): 1728-34).
NASH часто не имеет явных симптомов, что осложняет его диагностирование. Процесс диагностирования, как правило, начинают с тестов на функцию печени, при этом уровни AST (аспартат аминотрансферазы) и ALT (аланин аминотрансферазы) бывают повышены примерно у 90% индивидуумов с NASH. Часто используют другие анализы крови, чтобы исключить другие причины заболевания печени, например, гепатит. Анализы визуализации (например, ультразвуковое, КТ сканирование или МРТ) могут выявлять скопление жира в печени, но часто не позволяют отличать NASH от других причин заболевания печени, которые проявляются похожим образом. Для подтверждения диагноза NASH необходима биопсия печени.
Исход для индивидуумов, страдающих NASH, трудно прогнозировать, хотя результаты биопсии печени могут быть полезны. Наиболее серьезным осложнением NASH является цирроз, который случается, когда печень в значительной степени покрывается рубцами. Сообщалось, что у 8-26 процентов индивидуумов с NASH развивается цирроз, и прогнозируют, что NASH станет лидирующим показанием для трансплантации печени к 2020 году.
В настоящее время лечение NASH направлено главным образом на фармакологический и не фармакологический контроль тех медицинских состояний, которые ассоциированы с этим заболеванием, включая гиперлипидемию, диабет и ожирение. Фармакологическое вмешательство в случае NASH, хотя само по себе и не является исцеляющим, включает лечение витамином E, пиоглитазоном, метформином, статинами, омега-3 жирными кислотами и урсодезоксихолевой кислотой (UDCA (урсодиол)). Другие средства, проходящие оценку, которые в настоящее время одобрены для лечения других состояний, включают лозартан и телисартан, эксенатид, агонисты GLP-1, ингибиторы DPP-IV и карбамазепин.
Ввиду недостатков вышеуказанных современных методов лечения, терапия средствами, имеющими четкие механизмы действия, является многообещающим новым подходом к лечению и предотвращению NASH и NAFLD. Устранение указанных недостатков подразумевается, например, за счет использования вариантов пептидных последовательностей FGF19, продуктов слияния пептидных последовательностей FGF19 и/или FGF21 и вариантов продуктов слияния (химер) пептидных последовательностей FGF19 и/или FGF21, описанных в настоящем документе. В конкретных вариантах осуществления пептиды используют в сочетании с другими терапевтическими средствами и/или методами лечения. В настоящем документе также предложено профилактическое и/или терапевтическое применение этих вариантов пептидных последовательностей FGF19, продуктов слияния пептидных последовательностей FGF19 и/или FGF21 и вариантов продуктов слияния (химер) пептидных последовательностей FGF19 и/или FGF21, либо отдельно, либо в сочетании с методами лечения, которые будут разработаны в будущем, для лечения или предотвращения NASH и NAFLD.
5.6.1.3 Терапевтические методы для лечения или предотвращения других заболеваний, связанных с гомеостазом желчных кислот, а также сопутствующих заболеваний, нарушений и состояний
В настоящем документе также предложено применение вариантов пептидных последовательностей FGF19, продуктов слияния пептидных последовательностей FGF19 и/или FGF21 и вариантов продуктов слияния (химер) пептидных последовательностей FGF19 и/или FGF21, имеющих одну или более активностей, связанных с лечением и/или предотвращением других заболеваний, связанных с гомеостазом желчных кислот, а также сопутствующих заболеваний, нарушений и состояний, помимо PBC. В конкретных вариантах осуществления пептиды используют в сочетании с другими терапевтическими средствами и/или методами лечения.
В качестве примера, пациентам с хологенной диареей, вторичной по отношению к илеиту Крона, будет помогать лечение глюкокортикоидами. В случае микроскопического колита также будет помогать прием стероидов. Показано, что у пациентов с синдромом короткой кишки (в проксимальном отделе кишечника имеет место недостаток желчных кислот, что приводит к нарушению солюбилизации мицелл) холилсаркозин (холил-N-метилглицин), синтетический аналог желчной кислоты, способствует повышению всасывания липидов.
Показано, что введение первичной желчной кислоты, хенодезоксихолевой кислоты (CDCA), приводит к уменьшению секреции холестерина желчи и постепенному растворению камней в желчном пузыре. Поскольку CDCA обладает небольшой гепатотоксичностью, ее постепенно заменяют на UDCA. Несмотря на эффективность и безопасность введения UDCA с целью растворения холестериновых желчных камней, ее нечасто используют в настоящее время из-за успехов, достигнутых в лапароскопической холецистэктомии, которая обеспечивает быстрое избавление от симптоматического заболевания. Медикаментозная терапия, напротив, требует лечения в течение нескольких месяцев, не всегда обеспечивает растворение камней и у некоторых пациентов со временем случаются рецидивы.
Замену желчных кислот используют при врожденных нарушениях биосинтеза желчных кислот, как правило, в виде смеси CDCA или UDCA и холевой кислоты, для подавления синтеза цитотоксических предшественников желчных кислот и восстановления поступления первичных желчных кислот в энтерогепатическую циркуляцию.
В дополнение к средствам и методам лечения, описанным выше, предусмотрена также комбинированная терапия многочисленными дополнительными средствами (и классами средств), включая, но без ограничения, 1) инсулин, например, болюсные и базальные аналоги, миметики инсулина и средства, стимулирующие секрецию инсулина, включая сульфонилмочевины (например, хлорпропамид, толазамид, ацетогексамид, толбутамид, глибурид, глимепирид, глипизид) и меглитиниды (например, репаглинид (прандин) и натеглинид (старликс)); 2) бигуаниды (например, метформин (глюкофаж)) и другие средства, действие которых заключается в стимуляции утилизации глюкозы, уменьшении производства глюкозы в печени и/или уменьшении выхода глюкозы из кишечника; 3) ингибиторы альфа-глюкозидазы (например, акарбоза и миглитол) и другие средства, замедляющие расщепление и последующее всасывание из кишечника углеводов и уменьшающие постпрандиальную гипергликемию; 4) тиазолидиндионы (например, росиглитазон (авандиа), троглитазон (резулин), пиоглитазон (актос), глипизид, балаглитазон, ривоглитазон, нетоглитазон, троглитазон, энглитазон, циглитазон, адаглитазон, дарглитазон), усиливающие действие инсулина (например, за счет сенсибилизации к инсулину), тем самым стимулирующие утилизацию глюкозы в периферических тканях; 5) глюкагон-подобные пептиды, включая ингибиторы DPP-IV (например, вилдаглиптин (галвус) и ситаглиптин (янувия)) и глюкагон-подобный пептид-1 (GLP-1), а также агонисты и аналоги GLP-1 (например, эксенатид (баетта) и ITCA 650 (осмотический насос, вводимый подкожно, который доставляет аналог эксенатида в течение 12-месячного периода; Intarcia, Boston, MA)) и 6) DPP-IV-устойчивые аналоги (миметики инкретина), агонисты PPAR-гамма, агонисты PPAR двойного действия, агонисты PPAR общего действия; ингибиторы PTP1B; ингибиторы SGLT; секретагоги инсулина, агонисты RXR, ингибиторы гликоген синтазы киназы-3, иммуномодуляторы, агонисты бета-3 адренергических рецепторов, ингибиторы 11бета-HSD1 и аналоги амилина.
Другие иллюстративные средства, которые в конкретных вариантах осуществления могут быть использованы в сочетании с пептидами и способами, предложенными в настоящем документе, включают ингибиторы дипептидил пептидазы-4 (DPP-4), препараты бромкриптина, секвестранты желчных кислот (например, колесевилам) и ингибиторы SGLT-2. Лекарственные средства, снижающие аппетит, также хорошо известны и могут быть использованы в сочетании с композициями и способами, предложенными в настоящем документе. Дополнительные терапевтические средства можно вводить до, одновременно или после использования способов и вариантов применения, предложенных в настоящем документе.
5.6.2 Способы предотвращения, лечения и контроля метаболических заболеваний
В настоящем документе также предложены in vitro, ex vivo и in vivo (например, на теле или в теле субъекта) способы и варианты применения. Такие способы и варианты применения можно осуществлять на практике с любой из пептидных последовательностей, приведенных в настоящем документе. В различных вариантах осуществления способы включают введение пептидной последовательности, такой как вариант, продукт слияния или химера FGF19 или FGF21, раскрытые в настоящем документе (например, в списке последовательностей или таблице 1), или подпоследовательность, вариант или модифицированная форма варианта, продукта слияния или химеры FGF19 или FGF21, раскрытых в настоящем документе (например, в списке последовательностей или таблице 1), субъекту в количестве, эффективном для лечения метаболического или сопутствующего заболевания.
В конкретных вариантах осуществления пептид вводят в сочетании с дополнительным терапевтическим средством(ами) и/или методами лечения (например, средством, полезным для лечения и/или предотвращения PBC). Дополнительное терапевтическое средство(а) можно вводить до, совместно или после введения пептидов, описанных в настоящем документе.
Кроме того, в настоящем документе предложены способы предотвращения (например, у субъектов, предрасположенных к развитию конкретного заболевания(й) в сравнении с субъектами сопоставимого возраста, пола, расы и так далее), задержки, замедления или ингибирования прогрессирования, начала развития, либо лечения (например, ослабления) метаболического или сопутствующего заболевания. Таким образом, в различных вариантах осуществления способ, предложенный в настоящем документе, например, для модуляции гомеостаза желчных кислот, либо лечения метаболического или сопутствующего заболевания, включает создание контакта с, или введение одного или более пептидов, предложенных в настоящем документе (например, варианта или продукта слияния FGF19 и/или FGF21, приведенного в списке последовательностей или таблице 1) в количестве, эффективном для модуляции гомеостаза желчных кислот, либо лечения метаболического или сопутствующего заболевания. В конкретных вариантах осуществления способ дополнительно включает создание контакта с, или введение по меньшей мере одного дополнительного терапевтического средства или применение метода лечения, полезного для лечения, либо предотвращения метаболического или сопутствующего заболевания (например, PBC).
Термин «субъект» относится к животному. Как правило, животное является млекопитающим, которое получило бы пользу от лечения пептидной последовательностью, предложенной в настоящем документе. Конкретные примеры включают приматов (например, людей), собак, кошек, лошадей, коров, свиней и овец.
Субъекты включают тех, которые имеют заболевание, например, метаболическое или сопутствующее заболевание, или субъектов, которые не имеют заболевания, но могут иметь риск развития заболевания.
Неограничивающие иллюстративные заболевания или состояния, предотвращаемые, поддающиеся лечению или поддающиеся контролю с помощью пептидных препаратов, способов и вариантов применения, предложенных в настоящем документе, включают метаболические заболевания и нарушения. Неограничивающие примеры заболеваний и нарушения включают: метаболический синдром; нарушение метаболизма липидов или глюкозы; нарушение метаболизма холестерина или триглицеридов; диабет 2 типа; холестаз, включая, например, заболевания внутрипеченочного холестаза (например, PBC, PFIC, PSC, PIC, неонатальный холестаз и медикаментозный холестаз (вызванный, например, эстрогеном)) и заболевания внепеченочного холестаза (например, сжатие желчных протоков из-за опухоли, блокирование желчных протоков желчными камнями); синдром недостаточности всасывания желчных кислот и другие заболевания с вовлечением дистального отдела тонкого кишечника, включая резекцию подвздошной кишки, воспалительные заболевания кишечника (например, болезнь Крона и язвенный колит), нарушения, приводящие к уменьшению всасывания желчных кислот, иначе не характеризуемые (идиопатические), ведущие к диарее (например, BAD) и ЖК симптомам, а также формы рака ЖК тракта, печени и/или желчных протоков (например, рак толстого кишечника и печеночно-клеточный рак); и/или аномалии синтеза желчных кислот, такие как те, которые вносят вклад в развитие NASH, цирроза и портальной гипертензии. Для лечения, пептидные последовательности, предложенные в настоящем документе, можно вводить субъектам, которые нуждаются в модулировании гомеостаза желчных кислот или имеют связанное с гомеостазом желчных кислот или сопутствующее заболевание. Пептидные последовательности, предложенные в настоящем документе, также могут быть полезны в случае других заболеваний, связанных с гипергликемией, включая поражение почек (например, поражение почечных канальцев или нефропатию), дегенерацию печени, поражение глаз (например, диабетическую ретинопатию или катаракту), а также состояние «диабетической стопы»; дислипидемии и их последствия, например, атеросклероз, болезнь коронарных артерий, цереброваскулярные нарушения и тому подобное.
Другие состояния, которые могут быть ассоциированы с метаболическим синдромом, включают ожирение и избыточную массу тела (включая их сопутствующие патологические состояния, такие как, но без ограничения, болезнь неалкогольной жировой инфильтрации печени (NAFLD), неалкогольный стеатогепатит (NASH), и синдром поликистоза яичников (PCOS)), также включают тромбозы, гиперкоагуляционные и протромботические состояния (артериальные и венозные), гипертензию (включая портальную гипертензию (когда градиент печеночного венозного давления (HVPG) превышает 5 мм ртутного столба)), сердечно-сосудистое заболевание, инсульт и сердечную недостаточность; заболевания или состояния, в которые вовлечены воспалительные реакции, включая атеросклероз, хронические воспалительные заболевания кишечника (например, болезнь Крона и язвенный колит), астму, системную красную волчанку, артрит или другие воспалительные ревматические заболевания; нарушения клеточного цикла или процессов клеточной дифференцировки, такие как опухоли из жировых клеток, липоматозные карциномы, включая, например, липосаркомы, солидные опухоли и новообразования; нейродегенеративные заболевания и/или демиелинизирующие заболевания центральной и периферической нервных систем, и/или неврологические заболевания с вовлечением нейровоспалительных процессов, и/или другие периферические невропатии, включая болезнь Альцгеймера, рассеянный склероз, болезнь Паркинсона, прогрессирующую мультифокальную лейкоэнцефалопатию и синдром Гийена-Барре; кожные и дерматологические заболевания и/или нарушение процессов заживления ран, включая эритемато-сквамозный дерматоз; а также другие заболевания, такие как синдром X, остеоартрит и острый респираторный дистресс-синдром.
В одном варианте осуществления субъект имеет гипергликемическое состояние (например, диабет, такой как инсулинозависимый диабет (I типа), диабет II типа или гестационный диабет), устойчивость к инсулину, гиперинсулинемию, непереносимость глюкозы или метаболический синдром, является тучным и/или имеет избыточную массу тела.
В конкретных аспектах способов и вариантов применения пептидную последовательность или химерную пептидную последовательность, предложенную в настоящем документе, вводят субъекту в количестве, эффективном для улучшения метаболизма глюкозы у субъекта. В более конкретных аспектах субъект до введения имеет уровень глюкозы в плазме крови натощак, превышающий 100 мг/дл, или имеет уровень гемоглобина A1c (HbA1c) выше 6%.
В следующих вариантах осуществления вариант применения или способ лечения субъекта имеет целью или приводит к снижению уровней глюкозы, повышению чувствительности к инсулину, уменьшению устойчивости к инсулину, снижению уровней глюкагона, улучшению переносимости глюкозы, либо метаболизма или гомеостаза глюкозы, улучшению функции поджелудочной железы, либо снижению уровней триглицеридов, холестерина, ЛПП, ЛНП или ЛОНП, либо снижению кровяного давления, уменьшению утолщения интимы кровеносных сосудов, либо снижению массы тела или уменьшению прибавления массы тела.
Лечение метаболического или сопутствующего заболевания (например, гипергликемии) может быть полезным для облегчения или устранения заболевания, которое является по отношению к нему вторичным. В качестве примера, субъект, страдающий гипергликемией, также может иметь депрессию или тревожность вследствие гипергликемии; таким образом, лечение гипергликемии у субъекта также может опосредованно лечить депрессию или тревожность. В конкретных вариантах осуществления также подразумевается применение терапевтических средств, раскрытых в настоящем документе, для лечения вторичных заболеваний.
В конкретных вариантах осуществления субъект имеет, или имеет риск развития гипергликемии. В других конкретных вариантах осуществления субъект имеет, или имеет риск развития диабета, например, диабета 2 типа.
Субъекты, имеющие риск развития метаболического или сопутствующего заболевания (такого, как заболевания, описанные выше), включают, например, тех, которые могут иметь заболевание в семейном анамнезе или генетическую предрасположенность к развитию такого заболевания, а также тех, диета которых может вносить вклад в развитие таких заболеваний.
Как описано в настоящем документе, способы лечения включают создание контакта с, или введение пептида, приведенного в настоящем документе (например, варианта или продукта слияния FGF19 и/или FGF21, приведенного в списке последовательностей или таблице 1) в количестве, эффективном для достижения желательного исхода или результата у субъекта. Желательный исход или результат лечения включает уменьшение, снижение или предотвращение тяжести, либо частоты одного или более симптомов состояния у субъекта, например, улучшение состояния здоровья субъекта, либо «благоприятный эффект» или «терапевтический эффект». Таким образом, лечение может приводить к уменьшению или снижению, или предотвращению тяжести, либо частоты одного или более симптомов заболевания, стабилизации, либо ингибированию прогрессирования или усугубления заболевания, и в некоторых случаях, обращению вспять заболевания, на короткое время (например, на 1-6, 6-12 или 12-24 часов), на период времени средней продолжительности (например, 1-6, 6-12, 12-24 или 24-48 дней) или продолжительный период времени (например, на 1-6, 6-12, 12-24, 24-48 недель или более чем 24-48 недель). Таким образом, в случае метаболического или сопутствующего заболевания лечение может приводить к ослаблению или уменьшению проявления одного или более симптомов, либо эффектов метаболических или сопутствующих заболеваний, описанных выше.
В конкретных вариантах осуществления различные способы, предложенные в настоящем документе, дополнительно включают создание контакта с, или введение одного или более дополнительных средств, либо применение методов лечения, полезных для лечения, либо предотвращения метаболического или сопутствующего заболевания, например, средств или методов лечения, описанных в настоящем документе, в количестве, эффективном для достижения желательного исхода или результата у субъекта.
Используемый в настоящем документе термин «эффективное количество» или «достаточное количество» для использования и/или для лечения субъекта означает количество, которое обеспечивает, в одной или нескольких дозах, отдельно, либо в сочетании с одним или более другими средствами, терапевтическими препаратами, протоколами или режимами лечения, поддающийся обнаружению ответ, сохраняющийся в течение разного периода времени (кратковременный, средней продолжительности или долговременный), желательный результат, приносящий либо объективную, либо субъективную пользу субъекту в любой поддающейся измерению или обнаружению степени, или на любой период времени (например, несколько часов, дней, месяцев, лет) приводящий к ремиссии или исцелению. Такие количества, как правило, эффективны для облегчения заболевания, либо одного, нескольких или всех неблагоприятных симптомов, последствий или осложнений заболевания, в измеримой степени, хотя уменьшение, либо ингибирование прогрессирования или усугубления заболевания считают удовлетворительным исходом.
Используемый в настоящем документе термин «облегчать» означает улучшение состояния здоровья субъекта, уменьшение степени тяжести заболевания, либо ингибирование прогрессирования или усугубления заболевания (например, стабилизацию заболевания). В случае метаболического или сопутствующего заболевания, такого как те, которые описаны выше, улучшение состояния здоровья может представлять собой ослабление или уменьшение проявления одного или более симптомов, либо эффектов заболевания.
Вследствие этого, терапевтическая польза или улучшение состояния здоровья не обязательно должно представлять собой полное устранение любого одного, большинства или всех симптомов, осложнений, последствий или основополагающих причин, связанных с нарушением или заболеванием. Таким образом, удовлетворительный конечный результат достигается, когда имеет место временное, средней продолжительности или долговременное постепенное улучшение состояния здоровья субъекта, либо частичное уменьшение проявления, частоты, степени тяжести, прогрессирования или длительности, либо ингибирование или обращение вспять одного или более ассоциированных неблагоприятных симптомов или осложнений, или последствий, или основополагающих причин, ухудшения или прогрессирования (например, стабилизация одного или более симптомов или осложнений состояния, нарушения или заболевания) нарушения или заболевания в течение некоторого периода времени (часов, дней, недель, месяцев и так далее).
Таким образом, в случае заболевания, поддающегося лечению пептидной последовательностью, предложенной в настоящем документе, либо отдельно, либо в сочетании с дополнительным средством, количество пептида (и, необязательно, дополнительного средства), достаточное для облегчения заболевания, будет зависеть от вида, тяжести или стадии, или продолжительности заболевания, желаемого терапевтического эффекта или исхода, и может быть легко определено специалистом в данной области. Соответствующие количества также будут зависеть от конкретного субъекта (например, биодоступности в организме, пола, возраста субъекта и так далее). Например, в случае временного или частичного восстановления нормального гомеостаза желчных кислот у субъекта можно уменьшать количество или частоту дозирования пептидов и средств, описанных в настоящем документе, для лечения метаболических или сопутствующих заболеваний, описанных выше, хотя полностью лечение не будет прекращено. Эффективное количество можно определять, например, путем измерения одного или более релевантных физиологических эффектов.
Способы и варианты применения, предложенные в настоящем документе для лечения субъекта, применимы для профилактики с целью предотвращения или снижения вероятности развития у субъекта заболевания, такого как метаболическое или сопутствующее заболевание. Соответственно, способы и варианты применения, предложенные в настоящем документе для лечения субъекта, имеющего, или имеющего риск развития метаболического или сопутствующего заболевания, можно применять на практике до, практически одновременно, или после введения или применения другого средства, полезного для лечения, либо предотвращения метаболического или сопутствующего заболевания, и/или их можно сопровождать другими видами терапии. Дополнительные виды терапии включают использование других средств, снижающих уровень глюкозы в крови, таких как инсулин, усилитель чувствительности к инсулину и другие терапевтические препараты, изменение диеты (употребление меньше сахара, жиров и так далее), хирургическую операцию для снижения массы тела (уменьшение объема желудка за счет желудочного шунтирования, гастрэктомии), желудочный бандаж, внутрижелудочный баллон, желудочный рукав и так далее. Например, способ или вариант применения, предложенный в настоящем документе для лечения гипергликемии или устойчивости к инсулину, можно использовать в сочетании с лекарственными средствами или другими фармацевтическими композициями, которые приводят к снижению уровня глюкозы в крови или повышению чувствительности к инсулину у субъекта.
В одном варианте осуществления способ или вариант применения включает создание контакта с, или введение субъекту одного или более вариантов, или продуктов слияния пептидных последовательностей FGF19 и/или FGF21 в количестве, эффективном для предотвращения метаболического или сопутствующего заболевания. В одном варианте осуществления способ или вариант применения включает создание контакта с, или введение субъекту одного или более вариантов, или продуктов слияния пептидных последовательностей FGF19 и/или FGF21 в количестве, эффективном для лечения метаболического или сопутствующего заболевания. В одном варианте осуществления способ или вариант применения включает создание контакта с, или введение субъекту одного или более вариантов, или продуктов слияния пептидных последовательностей FGF19 и/или FGF21 в количестве, эффективном для контроля метаболического или сопутствующего заболевания.
5.6.3 Способы предотвращения, лечения или контроля рака
В настоящем документе также предложены in vitro, ex vivo и in vivo (например, на теле или в теле субъекта) способы и варианты применения. Такие способы и варианты применения можно осуществлять на практике с любой из пептидных последовательностей, приведенных в настоящем документе. В различных вариантах осуществления способы включают введение пептидной последовательности, такой как вариант, продукт слияния или химера FGF19 или FGF21, раскрытые в настоящем документе (например, в списке последовательностей или таблице 1), или подпоследовательность, вариант или модифицированная форма варианта, продукта слияния или химеры FGF19 или FGF21, раскрытых в настоящем документе (например, в списке последовательностей или таблице 1), субъекту в количестве, эффективном для лечения рака, опухоли или сопутствующего заболевания.
В конкретных вариантах осуществления пептид вводят в сочетании с дополнительным терапевтическим средством(ами) и/или методами лечения (например, средством, полезным для лечения и/или предотвращения PBC). Дополнительное терапевтическое средство(а) можно вводить до, совместно или после введения пептидов, описанных в настоящем документе.
Кроме того, в настоящем документе также предложены способы предотвращения (например, у субъектов, предрасположенных к развитию конкретного заболевания(й) в сравнении с субъектами сопоставимого возраста, пола, расы и так далее), задержки, замедления или ингибирования прогрессирования, начала развития, либо лечения (например, ослабления) рака, опухоли или сопутствующего заболевания. Таким образом, в различных вариантах осуществления способ, предложенный в настоящем документе, например, для предотвращения или лечения рака, опухоли или сопутствующего заболевания, включает создание контакта с, или введение одного или более пептидов, предложенных в настоящем документе (например, варианта или продукта слияния FGF19 и/или FGF21, приведенного в списке последовательностей или таблице 1) в количестве, эффективном для предотвращения или лечения рака, опухоли или сопутствующего заболевания. В конкретных вариантах осуществления способ дополнительно включает создание контакта с, или введение по меньшей мере одного дополнительного терапевтического средства или применение метода лечения, полезного для лечения, либо предотвращения рака, опухоли или сопутствующего заболевания (например, PBC).
Термин «субъект» относится к животному. Как правило, животное является млекопитающим, которое получило бы пользу от лечения пептидной последовательностью, предложенной в настоящем документе. Конкретные примеры включают приматов (например, людей), собак, кошек, лошадей, коров, свиней и овец.
Субъекты включают тех, которые имеют заболевание, например, рак, опухоль или сопутствующее заболевание; или субъектов, которые не имеют заболевания, но могут иметь риск развития заболевания.
Неограничивающие иллюстративные заболевания или состояния, предотвращаемые, поддающиеся лечению или поддающиеся контролю с помощью пептидных препаратов, способов и вариантов применения, предложенных в настоящем документе, включают рак, опухоли и сопутствующие заболевания и нарушения.
В конкретных вариантах осуществления рак или опухоль представляет собой опухоль толстого кишечника или опухоль печени.
Лечение рака, опухоли или сопутствующего заболевания может быть полезным для облегчения или устранения заболевания, которое является по отношению к нему вторичным. В качестве примера, субъект, имеющий рак или опухоль, также может иметь депрессию или тревожность вследствие рака или опухоли; таким образом, лечение рака или опухоли у субъекта также может опосредованно лечить депрессию или тревожность. В конкретных вариантах осуществления также подразумевается применение терапевтических средств, раскрытых в настоящем документе, для лечения вторичных заболеваний.
Субъекты, имеющие риск развития рака, опухоли или сопутствующего заболевания (такого как заболевания, описанные выше), включают, например, тех, которые могут иметь заболевание в семейном анамнезе или генетическую предрасположенность к развитию такого заболевания, а также тех, диета которых может вносить вклад в развитие таких заболеваний.
В некоторых вариантах осуществления рак или опухоль представляет собой рак или опухоль печени, толстого кишечника, предстательной железы или легкого. В некоторых вариантах осуществления опухоль является доброкачественной. В других вариантах осуществления опухоль является злокачественной.
В конкретных вариантах осуществления субъект имеет, или имеет риск развития FGF19-зависимого заболевания, нарушения или состояния. В некоторых вариантах осуществления FGF19-зависимое заболевание, нарушение или состояние представляет собой печеночное (печеночно-клеточное) заболевание, нарушение или состояние, такое как цирроз или холестаз. В некоторых вариантах осуществления печеночное заболевание или нарушение представляет собой хроническое печеночное заболевание или нарушение. В некоторых вариантах осуществления FGF19-зависимое заболевание, нарушение или состояние представляет собой рак или опухоль, например, HCC. В других вариантах осуществления FGF19-зависимое заболевание, нарушение или состояние не является печеночным заболеванием, нарушением или состоянием, таким как цирроз или холестаз. В некоторых вариантах осуществления FGF19-зависимое заболевание, нарушение или состояние не является раком или опухолью, например, HCC. В некоторых вариантах осуществления FGF19-зависимое заболевание, нарушение или состояние представляет собой рак или опухоль толстого кишечника. В конкретных вариантах осуществления рак или опухоль толстого кишечника представляет собой аденокарциному толстого кишечника. В некоторых вариантах осуществления FGF19-зависимое заболевание, нарушение или состояние представляет собой рак или опухоль предстательной железы. В других вариантах осуществления FGF19-зависимое заболевание, нарушение или состояние представляет собой рак или опухоль легкого. В конкретных вариантах осуществления рак или опухоль легкого представляет собой плоскоклеточную карциному легкого. В некоторых вариантах осуществления FGF19 экспрессируется в первичных или метастатических клетках рака или опухоли. В конкретных вариантах осуществления FGF19-зависимое заболевание, нарушение или состояние представляет собой предраковое состояние. Например, цирроз и холестаз иногда приводят к раку печени, такому как HCC, и способы лечения или предотвращения таких печеночных заболеваний и нарушений подразумеваются. В конкретных вариантах осуществления субъект является субъектом, который нуждается в их предотвращении или лечении. В некоторых вариантах осуществления введение варианта FGF19 поддерживает гомеостаз желчных кислот у субъекта.
В настоящем документе также предложен способ лечения рака или опухоли, например, FGF19-зависимых рака или опухоли, либо их симптома, у субъекта, включающий введение субъекту терапевтически эффективного количества варианта FGF19. В конкретных вариантах осуществления введение приводит к уменьшению рака или опухоли, либо их симптома, у субъекта. В некоторых вариантах осуществления способ приводит к уменьшению числа опухолей, размера опухолей или массы опухолей. В настоящем документе также предложен способ предотвращения рака или опухоли, например, FGF19-зависимых рака или опухоли, либо их симптома, у субъекта, включающий введение субъекту терапевтически эффективного количества варианта FGF19. В некоторых вариантах осуществления введение приводит к предотвращению рака или опухоли, либо их симптома, у субъекта. В некоторых вариантах осуществления способ приводит к уменьшению числа опухолей, размера опухолей или массы опухолей. В конкретном варианте осуществления рак или опухоль представляет собой FGF19-зависимый рак или опухоль. В конкретных вариантах осуществления рак или опухоль представляет собой печеночно-клеточную карциному. В некоторых вариантах осуществления рак или опухоль представляет собой не печеночно-клеточную карциному. В одном варианте осуществления рак или опухоль представляет собой рак или опухоль толстого кишечника. В некоторых вариантах осуществления рак или опухоль представляет собой рак или опухоль предстательной железы. В конкретных вариантах осуществления рак или опухоль представляет собой рак или опухоль легкого. В конкретных вариантах осуществления вариант FGF19 представляет собой полипептид, содержащий аминокислотную последовательность, приведенную в ID NO: 70. В некоторых вариантах осуществления вариант FGF19 представляет собой полипептид, состоящий из аминокислотной последовательности, приведенной в SEQ ID NO: 70. В конкретных вариантах осуществления субъект является субъектом, который нуждается в лечении.
Как описано в настоящем документе, способы лечения включают создание контакта с, или введение пептида, приведенного в настоящем документе (например, варианта или продукта слияния FGF19 и/или FGF21, приведенного в списке последовательностей или таблице 1) в количестве, эффективном для достижения желательного исхода или результата у субъекта. Желательный исход или результат лечения включает уменьшение, снижение или предотвращение тяжести, либо частоты одного или более симптомов состояния у субъекта, например, улучшение состояния здоровья субъекта, либо «благоприятный эффект» или «терапевтический эффект». Таким образом, лечение может приводить к уменьшению или снижению, или предотвращению тяжести, либо частоты одного или более симптомов заболевания, стабилизации, либо ингибированию прогрессирования или усугубления заболевания, и в некоторых случаях, обращению вспять заболевания, на короткое время (например, на 1-6, 6-12 или 12-24 часов), на период времени средней продолжительности (например, 1-6, 6-12, 12-24 или 24-48 дней) или продолжительный период времени (например, на 1-6, 6-12, 12-24, 24-48 недель или более чем 24-48 недель). Таким образом, в случае рака, опухоли или сопутствующего заболевания лечение может приводить к ослаблению, либо уменьшению одного или более симптомов, или эффектов рака, опухоли или сопутствующих заболеваний, описанных выше.
В конкретных вариантах осуществления различные способы, предложенные в настоящем документе, дополнительно включают создание контакта с, или введение одного или более дополнительных средств, либо применение методов лечения, полезных для лечения, либо предотвращения рака, опухоли или сопутствующего заболевания, например, средств или методов лечения, описанных в настоящем документе, в количестве, эффективном для достижения желательного исхода или результата у субъекта.
Используемый в настоящем документе термин «эффективное количество» или «достаточное количество» для использования и/или для лечения субъекта означает количество, которое обеспечивает, в одной или нескольких дозах, отдельно, либо в сочетании с одним или более другими средствами, терапевтическими препаратами, протоколами или режимами лечения, поддающийся обнаружению ответ, сохраняющийся в течение разного периода времени (кратковременный, средней продолжительности или долговременный), желательный результат, приносящий либо объективную, либо субъективную пользу субъекту в любой поддающейся измерению или обнаружению степени, или на любой период времени (например, несколько часов, дней, месяцев, лет) приводящий к ремиссии или исцелению. Такие количества, как правило, эффективны для облегчения заболевания, либо одного, нескольких или всех неблагоприятных симптомов, последствий или осложнений заболевания, в измеримой степени, хотя уменьшение, либо ингибирование прогрессирования или усугубления заболевания считают удовлетворительным исходом.
Используемый в настоящем документе термин «облегчать» означает улучшение состояния здоровья субъекта, уменьшение степени тяжести заболевания, либо ингибирование прогрессирования или усугубления заболевания (например, стабилизацию заболевания). В случае рака, опухоли или сопутствующего заболевания, такого как те, которые описаны выше, улучшение состояния здоровья может представлять собой ослабление или уменьшение проявления одного или более симптомов, либо эффектов заболевания.
Вследствие этого, терапевтическая польза или улучшение состояния здоровья не обязательно должно представлять собой полное устранение любого одного, большинства или всех симптомов, осложнений, последствий или основополагающих причин, связанных с нарушением или заболеванием. Таким образом, удовлетворительный конечный результат достигается, когда имеет место временное, средней продолжительности или долговременное постепенное улучшение состояния здоровья субъекта, либо частичное уменьшение проявления, частоты, степени тяжести, прогрессирования или длительности, либо ингибирование или обращение вспять одного или более ассоциированных неблагоприятных симптомов или осложнений, или последствий, или основополагающих причин, ухудшения или прогрессирования (например, стабилизация одного или более симптомов или осложнений состояния, нарушения или заболевания) нарушения или заболевания в течение некоторого периода времени (часов, дней, недель, месяцев и так далее).
Таким образом, в случае заболевания, поддающегося лечению пептидной последовательностью, предложенной в настоящем документе, либо отдельно, либо в сочетании с дополнительным средством, количество пептида (и, необязательно, дополнительного средства), достаточное для облегчения заболевания, будет зависеть от вида, тяжести или стадии, или продолжительности заболевания, желаемого терапевтического эффекта или исхода, и может быть легко определено специалистом в данной области. Соответствующие количества также будут зависеть от конкретного субъекта (например, биодоступности в организме, пола, возраста субъекта и так далее). Например, в случае временного или частичного восстановления нормального гомеостаза желчных кислот у субъекта можно уменьшать количество или частоту дозирования пептидов и средств, описанных в настоящем документе, для лечения рака, опухоли или сопутствующих заболеваний, описанных выше, хотя полностью лечение не будет прекращено. Эффективное количество можно определять, например, путем измерения одного или более релевантных физиологических эффектов.
Способы и варианты применения, предложенные в настоящем документе для лечения субъекта, применимы для профилактики с целью предотвращения или снижения вероятности развития у субъекта заболевания, такого как рак, опухоль или сопутствующее заболевание. Соответственно, способы и варианты применения, предложенные в настоящем документе для лечения субъекта, имеющего, или имеющего риск развития рака, опухоли или сопутствующего заболевания, можно применять на практике до, практически одновременно, или после введения или применения другого средства, полезного для лечения, либо предотвращения рака, опухоли или сопутствующего заболевания, и/или их можно сопровождать другими видами терапии. Дополнительные виды терапии включают использование других средств, снижающих уровень глюкозы в крови, таких как инсулин, усилитель чувствительности к инсулину и другие терапевтические препараты, изменение диеты (употребление меньше сахара, жиров и так далее), хирургическую операцию для снижения массы тела (уменьшение объема желудка за счет желудочного шунтирования, гастрэктомии), желудочный бандаж, внутрижелудочный баллон, желудочный рукав и так далее. Например, способ или вариант применения, предложенный в настоящем документе для лечения гипергликемии или устойчивости к инсулину, можно использовать в сочетании с лекарственными средствами или другими фармацевтическими композициями, которые приводят к снижению уровня глюкозы в крови или повышению чувствительности к инсулину у субъекта.
В одном варианте осуществления способ или вариант применения включает создание контакта с, или введение субъекту одного или более вариантов, или продуктов слияния пептидных последовательностей FGF19 и/или FGF21 в количестве, эффективном для предотвращения рака, опухоли или сопутствующего заболевания. В одном варианте осуществления способ или вариант применения включает создание контакта с, или введение субъекту одного или более вариантов, или продуктов слияния пептидных последовательностей FGF19 и/или FGF21 в количестве, эффективном для лечения рака, опухоли или сопутствующего заболевания. В одном варианте осуществления способ или вариант применения включает создание контакта с, или введение субъекту одного или более вариантов, или продуктов слияния пептидных последовательностей FGF19 и/или FGF21 в количестве, эффективном для контроля рака, опухоли или сопутствующего заболевания.
5.7 Молекулы нуклеиновой кислоты
Также предложены молекулы нуклеиновой кислоты, кодирующие пептидные последовательности, предложенные в настоящем документе, включая подпоследовательности, варианты последовательностей и модифицированные формы последовательностей, приведенных в списке последовательностей (и в PCT публикации № WO 2013/006486, и патентной публикации США № 2013/0023474, а также PCT публикации № WO 2014/085365) или таблице 1, и векторы, содержащие нуклеиновую кислоту, кодирующую пептиды, используемые в способах, описанных в настоящем документе. Соответственно, термин «нуклеиновые кислоты» включает те, которые кодируют иллюстративные пептидные последовательности, раскрытые в настоящей документе, а также те, которые кодируют функциональные подпоследовательности, варианты последовательностей и модифицированные формы иллюстративных пептидных последовательностей, при условии, что вышеперечисленные последовательности сохраняют по меньшей мере поддающуюся обнаружению или измерению активность, либо функцию, полезную для лечения или предотвращения связанного с гомеостазом желчных кислот или сопутствующего заболевания (например, PBC).
«Нуклеиновая кислота», которая в настоящем документе также может быть названа геном, полинуклеотидом, нуклеотидной последовательностью, праймером, олигонуклеотидом или зондом, означает природные или модифицированные пурин- и пиримидин-содержащие полимеры любой длины, либо полирибонуклеотиды, либо полидезоксирибонуклеотиды, или смешанные полирибо-полидезоксирибонуклеотиды и их α-аномерные формы. Два или более пурин- и пиримидин-содержащих полимеров, как правило, связаны фосфоэфирной или аналогичной связью. Термины можно использовать взаимозаменяемо для обозначения всех форм нуклеиновой кислоты, включая дезоксирибонуклеиновую кислоту (ДНК) и рибонуклеиновую кислоту (РНК). Нуклеиновые кислоты могут быть одноцепочечными, дуплексными или триплексными, линейными или кольцевыми. Нуклеиновые кислоты включают геномную ДНК и кДНК. РНК может быть сплайсированной или не сплайсированной мРНК, рРНК, тРНК или антисмысловой РНК. Нуклеиновые кислоты включают природные, синтетические нуклеотиды, а также нуклеотидные аналоги и производные.
В результате вырожденности генетического кода молекулы нуклеиновой кислоты, предложенные в настоящем документе, включают последовательности, вырожденные относительно молекул нуклеиновой кислоты, кодирующих пептидные последовательности, используемые в способах, предложенных в настоящем документе. Таким образом, предложены также вырожденные нуклеотидные последовательности, кодирующие пептидные последовательности, включая подпоследовательности, варианты и модифицированные формы пептидных последовательностей, приведенных в настоящем документе (например, в списке последовательностей или таблице 1). Термин «комплементарные» при использовании применительно к нуклеотидным последовательностям означает, что указанные области являются на 100% комплементарными, то есть, характеризуются 100% спариванием оснований, без несовпадений.
Нуклеиновая кислота может быть получена с использованием любого из множества стандартных методов клонирования и химического синтеза, и может быть намеренно изменена путем сайт-направленного мутагенеза или других рекомбинантных методов, известных специалисту в данной области. Чистоту полинуклеотидов можно определять, например, методами секвенирования, электрофореза в геле и УФ-спектрометрии.
Нуклеиновые кислоты можно вставлять в нуклеотидный конструкт, называемый в настоящем документе «экспрессионной кассетой», в котором экспрессия нуклеиновой кислоты находится под влиянием или регулируется «элементом контроля экспрессии». Термин «элемент контроля экспрессии» означает один или более элементов нуклеотидной последовательности, которые регулируют или влияют на экспрессию нуклеотидной последовательности, с которой они функционально связаны. Элемент контроля экспрессии может включать, в соответствующих случаях, промоторы, энхансеры, терминаторы транскрипции, сайленсеры генов, инициирующий кодон (например, ATG) перед кодирующим белок геном, и так далее.
Элемент контроля экспрессии, функционально связанный с нуклеотидной последовательностью, контролирует транскрипцию и, в соответствующих случаях, трансляцию нуклеотидной последовательности. Термин «функционально связанные» означает смежное расположение, при котором указанные компоненты находятся во взаимосвязи, позволяющей им функционировать предназначенным для них образом. Как правило, элементы контроля экспрессии располагаются рядом с 5' или 3'-концами генов, но также могут быть интронными.
Элементы контроля экспрессии включают элементы, которые активируют транскрипцию конститутивно, которые являются индуцируемыми (то есть, нуждаются во внешнем сигнале или стимулах для активации), либо подавляемыми (то есть, нуждаются в сигнале для выключения транскрипции; когда сигнал больше не присутствует, транскрипция активируется или «дерепрессируется»). В экспрессионные кассеты, предложенные в настоящем документе, также включены элементы контроля, достаточные для придания экспрессии гена контролируемости в клетках или тканях определенных типов (то есть, тканеспецифические элементы контроля). Как правило, такие элементы расположены выше или ниже по ходу транскрипции (то есть, в 5' или 3' направлении) от кодирующей последовательности. Промоторы, как правило, расположены в 5'-положении относительно кодирующей последовательности. Для обеспечения транскрипции полинуклеотидов, предложенных в настоящем документе, можно использовать промоторы, полученные методами рекомбинантной ДНК или методами синтеза. «Промотор», как правило, означает минимальный элемент последовательности, достаточный для управления транскрипцией.
Нуклеиновые кислоты можно вставлять в плазмиду для введения трансформацией в клетку-хозяина и для последующей экспрессии и/или генетической манипуляции. Плазмида представляет собой нуклеиновую кислоту, которая может быть стабильно размножена в клетке-хозяине; плазмиды могут, необязательно, содержать элементы контроля экспрессии для управления экспрессией нуклеиновой кислоты. Используемый в настоящем документе термин «вектор» является синонимом термину «плазмида». Плазмиды и векторы, как правило, содержат по меньшей мере точку начала репликации для размножения в клетке и промотор. Плазмиды и векторы также могут содержать элемент контроля экспрессии для экспрессии в клетке-хозяине и, вследствие этого, являются полезными для экспрессии и/или генетической манипуляции нуклеиновых кислот, кодирующих пептидные последовательности, экспрессирующих пептидные последовательности в клетках-хозяевах и организмах, или продуцирующих пептидные последовательности, например.
Используемый в настоящем документе термин «трансген» означает полинуклеотид, который был введен в клетку или организм искусственным образом. Например, в клетку, содержащую трансген, трансген был введен генетической манипуляцией или «трансформацией» клетки. Клетку, в которую был введен трансген, или ее потомство, называют «трансформированной клеткой» или «трансформантом». Как правило, трансген включается в потомство трансформанта или становится частью организма, который развивается из клетки. Трансгены могут встраиваться в хромосомную ДНК или сохраняться в виде самореплицирующейся плазмиды, YAC, минихромосомы или тому подобного.
Промоторы для бактериальной системы включают промоторы T7 и индуцируемые промоторы, такие как pL из бактериофага λ, plac, ptrp, ptac (гибридный промотор ptrp-lac), а также тетрациклин-чувствительные промоторы. Промоторы для систем клеток насекомых включают конститутивные или индуцируемые промоторы (например, экдизон). Конститутивные промоторы для клеток млекопитающих включают промоторы вирусов SV40, RSV, бычьего папилломавируса (BPV) и другие вирусные промоторы или индуцируемые промоторы, получаемые из генома клеток млекопитающих (например, промотор металлотионеина IIA; промотор генов белков теплового шока) или из вирусов млекопитающих (например, поздний промотор аденовируса; индуцируемый длинный концевой повтор вируса опухоли молочной железы мыши). Альтернативно, ретровирусный геном может быть генетически модифицирован для введения и управления экспрессией пептидной последовательности в соответствующих клетках-хозяевах.
Поскольку способы и варианты применения, предложенные в настоящем документе, включают in vivo доставку, экспрессионные системы дополнительно включают векторы, разработанные для in vivo применения. Конкретные неограничивающие примеры включают аденовирусные векторы (патенты США № 5700470 и 5731172), аденоассоциированные вирусные векторы (патент США № 5604090), векторы на основе вируса простого герпеса (патент США № 5501979), ретровирусные векторы (патенты США №№ 5624820, 5693508 и 5674703), BPV векторы (патент США № 5719054), CMV векторы (патент США № 5561063), а также векторы на основе парвовируса, ротавируса, вируса Норуолк и лентивируса (смотри, например, патент США № 6013516). Векторы включают векторы, которые доставляют гены в клетки кишечного тракта, в том числе стволовые клетки (Croyle et al., Gene Ther. 5: 645 (1998); S.J. Henning, Adv. Drug Deliv. Rev. 17: 341 (1997), патенты США №№ 5821235 и 6110456). Многие из этих векторов были одобрены для исследований с участием людей.
Дрожжевые векторы содержат конститутивные и индуцируемые промоторы (смотри, например, Ausubel et al., в: Current Protocols in Molecular Biology, Vol. 2, Ch. 13, ed., Greene Publish. Assoc. & Wiley Interscience, 1988; Grant et al. Methods in Enzymology, 153: 516 (1987), eds. Wu & Grossman; Bitter Methods in Enzymology, 152: 673 (1987), eds. Berger & Kimmel, Acad. Press, N.Y.; и Strathern et al., The Molecular Biology of the Yeast Saccharomyces (1982) eds. Cold Spring Harbor Press, Vols. I и II). Можно использовать конститутивный дрожжевой промотор, такой как ADH или LEU2, или индуцируемый промотор, такой как GAL (R. Rothstein, в: DNA Cloning, A Practical Approach, Vol. 11, Ch. 3, ed. D.M. Glover, IRL Press, Wash., D.C., 1986). Векторы, которые способствуют интеграции чужеродных нуклеотидных последовательностей в дрожжевую хромосому, например, за счет гомологичной рекомбинации, известны в данной области. Искусственные хромосомы дрожжей (YAC), как правило, используют, когда вставляемые полинуклеотиды слишком велики для обычных векторов (например, более примерно 12 т.н.).
Экспрессионные векторы также могут содержать селективный маркер, придающий устойчивость к давлению селекции, или идентифицируемый маркер (например, бета-галактозидазу), что позволяет клеткам, содержащим вектор, быть отобранными, расти и размножаться. Альтернативно, селективный маркер может находиться на втором векторе, который трансфицирован в клетку-хозяина совместно с первым вектором, содержащим нуклеиновую кислоту, кодирующую пептидную последовательность. Селекционные системы включают, но не ограничиваются ими, ген тимидинкиназы вируса простого герпеса (Wigler et al., Cell 11: 223 (1977)), ген гипоксантин-гуанин фосфорибозилтрансферазы (Szybalska et al., Proc. Natl. Acad. Sci. USA 48: 2026 (1962)) и ген аденин фосфорибозилтрансферазы (Lowy et al., Cell 22: 817 (1980)), которые могут быть использованы в tk-, hgprt- или aprt- клетках, соответственно. Кроме того, устойчивость к антиметаболитам может быть использована в качестве основы селекции на ген dhfr, который придает устойчивость к метотрексату (O'Hare et al., Proc. Natl. Acad. Sci. USA 78: 1527 (1981)); ген gpt, который придает устойчивость к микофеноловой кислоте (Mulligan et al., Proc. Natl. Acad. Sci. USA 78: 2072 (1981)); ген неомицина, который придает устойчивость к аминогликозиду G-418 (Colberre-Garapin et al., J. Mol. Biol. 150: 1(1981)), пуромицину; и ген, который придает устойчивость к гигромицину (Santerre et al., Gene 30: 147 (1984)). Дополнительные гены селективных маркеров включают trpB, который позволяет клеткам использовать индол вместо триптофана, hisD, который позволяет клеткам использовать гистинол вместо гистидина (Hartman et al., Proc. Natl. Acad. Sci. USA 85: 8047 (1988)), и ген ODC (орнитин-декарбоксилазы), который придает устойчивость к ингибитору орнитин-декарбоксилазы, 2-(дифторметил)-DL-орнитину, DFMO (McConlogue (1987), в: Current Communications in Molecular Biology, Cold Spring Harbor Laboratory).
Линии клеток и животные модели
В конкретных вариантах осуществления также предложена трансформированная клетка(и) (in vitro, ex vivo и in vivo) и клетки-хозяева, которые продуцируют вариант или продукт слияния FGF19 и/или FGF21, приведенный в настоящем документе, в случае, когда экспрессия варианта или продукта слияния FGF19 и/или FGF21 обусловлена введенной нуклеиновой кислотой, кодирующей вариант или продукт слияния FGF19 и/или FGF21. Используемый в настоящем документе термин «трансформированная» клетка или клетка-«хозяин» означает клетку, в которую введена нуклеиновая кислота, способная размножаться и/или транскрибироваться для экспрессии закодированной пептидной последовательности. Термин также относится к любому потомству или субклонам клетки-хозяина. Трансформированные клетки и клетки-хозяева, экспрессирующие пептидные последовательности, предложенные в настоящем документе, как правило, содержат нуклеиновую кислоту, которая кодирует пептидную последовательность. В одном варианте осуществления трансформированная клетка или клетка-хозяин представляет собой прокариотическую клетку. В другом варианте осуществления трансформированная клетка или клетка-хозяин представляет собой эукариотическую клетку. В различных аспектах эукариотическая клетка представляет собой клетку дрожжей или млекопитающих (например, человека, примата и так далее).
Трансформированные клетки и клетки-хозяева включают, но не ограничиваются ими, микроорганизмы, такие как бактерии и дрожжи; а также клетки растений, насекомых и млекопитающих. Например, бактерии, трансформированные экспрессионными векторами на основе нуклеиновой кислоты рекомбинантного бактериофага, нуклеиновой кислоты плазмиды или нуклеиновой кислоты космиды; дрожжи, трансформированные рекомбинантными дрожжевыми экспрессионными векторами; системы растительных клеток, инфицированных рекомбинантными вирусными экспрессионными векторами (например, вирусом мозаики цветной капусты, CaMV; вирусом табачной мозаики, TMV) или трансформированных рекомбинантными плазмидными экспрессионными векторами (например, Ti плазмидой); системы клеток насекомых, инфицированных рекомбинантными вирусными экспрессионными векторами (например, бакуловирусом), и системы животных клеток, инфицированных рекомбинантными вирусными экспрессионными векторами (например, ретровирусами, аденовирусами, вирусом осповакцины), либо системы трансформированных животных клеток, сконструированных для временного или стабильного размножения или экспрессии.
Для генно-терапевтических вариантов применения и способов трансформированная клетка может находиться в организме субъекта. Клетку в организме субъекта можно трансформировать нуклеиновой кислотой, кодирующей пептидную последовательность, приведенную в настоящем документе, in vivo. Альтернативно, клетку можно трансформировать in vitro трансгеном или полинуклеотидом, а затем трансплантировать в ткань субъекта с целью лечения. Альтернативно, изолят первичных клеток или стабильную линию клеток можно трансформировать трансгеном или полинуклеотидом, кодирующим вариант FGF19 и/или FGF21, либо их продукт слияния/химерную последовательность (или вариант), например, химерную пептидную последовательность, содержащую весь или часть FGF19, либо содержащую весь или часть FGF21, а затем, необязательно, трансплантировать в ткань субъекта.
Неограничивающие примеры целевых клеток для экспрессии пептидных последовательностей, в частности, для экспрессии in vivo, включают клетки поджелудочной железы (островковые клетки), мышечные клетки, клетки слизистых оболочек и эндокринные клетки. Такие эндокринные клетки могут обеспечивать индуцируемое продуцирование (секрецию) варианта FGF19 и/или FGF21, либо их продукта слияния/химерной последовательности (или варианта), например, химерной пептидной последовательности, содержащей весь или часть FGF19, либо содержащей весь или часть FGF21. Дополнительные клетки, которые можно трансформировать, включают стволовые клетки или другие мультипотентные или плюрипотентные клетки, например, клетки-предшественники, которые дифференцируются в различные клетки поджелудочной железы (островковые клетки), мышечные клетки, клетки слизистых оболочек и эндокринные клетки. Использование стволовых клеток в качестве целевых клеток обеспечивает долгосрочную экспрессию пептидных последовательностей, предложенных в настоящем документе.
Используемый в настоящем документе термин «культивированная» применительно к клетке означает, что клетка выращена in vitro. Конкретным примером такой клетки является клетка, выделенная из организма субъекта и растущая или адаптированная для роста в тканевой культуре. Другим примером является клетка, подвергнутая генетической манипуляции in vitro и трансплантированная обратно в организм того же самого или другого субъекта.
Термин «выделенная» при использовании применительно к клетке означает клетку, которая отделена от ее естественного окружения in vivo. «Культивированные» и «выделенные» клетки могут быть изменены рукой человека, например, генетически трансформированы. Эти термины относятся к любому потомству клеток, включая клетки-потомки, которые могут не быть идентичными исходной клетке вследствие мутаций, имеющих место в процессе деления клетки. Термины не включают целый человеческий организм.
Нуклеиновые кислоты, кодирующие пептидные последовательности, предложенные в настоящем документе, можно вводить для стабильной экспрессии в клетки целого организма. Такие организмы, включая отличных от человека трансгенных животных, полезны для изучения эффекта экспрессии пептидов в целом организме животного и терапевтической пользы. Например, как описанное в настоящем документе продуцирование в организме мышей варианта FGF19 и/или FGF21, либо их продукта слияния/химерной последовательности (или варианта), например, химерной пептидной последовательности, содержащей весь или часть FGF19, либо содержащей весь или часть FGF21, приведенной в настоящем документе.
Мыши определенных линий, у которых развивается, или которые подвержены развитию конкретного заболевания (например, диабета, дегенеративных заболеваний, рака и так далее) также полезны для введения терапевтических белков, описанных в настоящем документе, с целью изучения эффекта экспрессии терапевтического белка у предрасположенных к заболеванию мышей. Трансгенные и генетические мышиные модели, отличающиеся предрасположенностью к конкретному заболеванию или физиологическим состояниям, например, мыши с индуцированным стрептозотоцином (STZ) диабетом, (STZ) мыши, являются подходящим объектом для экспрессии вариантов FGF19 и/или FGF21, их продуктов слияния/химерных последовательностей (или вариантов), например, химерной пептидной последовательности, содержащей весь или часть FGF19, либо содержащей весь или часть FGF21, приведенной в настоящем документе. Таким образом, в конкретных вариантах осуществления предложены отличные от человека трансгенные животные, продуцирующие вариант FGF19 и/или FGF21, либо их продукт слияния/химерную последовательность (или вариант), например, химерную пептидную последовательность, содержащую весь или часть FGF19, либо содержащую весь или часть FGF21, для которых такое продуцирование не является естественным, но обусловлено трансгеном, присутствующим в соматических или половых клетках животного.
Термин «трансгенное животное» означает животное, чьи соматические клетки или клетки зародышевой линии содержат генетическую информацию, полученную, прямо или косвенно, за счет преднамеренной генетической манипуляции на субклеточном уровне, такой как микроинъекция или инфицирование рекомбинантным вирусом. Термин «трансгенные» дополнительно охватывает клетки или ткани (то есть, «трансгенная клетка», «трансгенная ткань»), полученные от трансгенного животного, подвергнутого генетической манипуляции, как описано в настоящем документе. В контексте настоящего изобретения термин «трансгенное животное» не охватывает животных, получаемых классическими методами скрещивания или in vitro оплодотворения, но означает животных, одна или более клеток которого получили молекулу нуклеиновой кислоты. Трансгенные животные, предложенные в настоящем документе, могут быть либо гетерозиготными, либо гомозиготными в отношении трансгена. Способы получения трансгенных животных, включая мышей, овец, свиней и лягушек, хорошо известны в данной области (смотри, например, патенты США №№ 5721367, 5695977, 5650298 и 5614396), содержание которых включено в настоящий документ.
Пептидные последовательности, нуклеиновые кислоты, кодирующие пептидные последовательности, векторы и трансформированные клетки-хозяева, экспрессирующие пептидные последовательности, включают выделенные и очищенные формы. Термин «выделенная» при использовании применительно к композиции, предложенной в настоящем документе, означает, что композиция отделена, в значительной степени, полностью или по меньшей мере частично, от одного или более компонентов ее окружения. В целом, композиции, существующие в природе, которые являются выделенными, по существу свободны от одного или более материалов, с которыми они обычно связаны в природе, например, одного или более белков, нуклеиновых кислот, липидов, углеводов или клеточных мембран. Термин «выделенная» не исключает альтернативные физические формы композиции, такие как варианты, модификации или дериватизированные формы, продукты слияния и химеры, мультимеры/олигомеры и так далее, или формы, экспрессируемые в клетках-хозяевах. Термин «выделенная» также не исключает формы (например, фармацевтические композиции, комбинированные композиции и так далее), в которых имеют место сочетания, любое из которых создано рукой человека. «Выделенная» композиция также может быть «очищенной», когда она свободна от некоторых, значительного числа, либо большинства или всех из одного или более материалов, таких как примесь, либо нежелательное вещество или материал.
В настоящем документе термин «рекомбинантные» при использовании применительно к пептидным последовательностям, нуклеиновым кислотам, кодирующим пептидные последовательности, и так далее, означает, что композиции были подвергнуты манипуляции (то есть, генетически изменены) таким образом, который не существует в природе (например, in vitro). Конкретным примером рекомбинантного пептида была бы пептидная последовательность, предложенная в настоящем документе, которая экспрессируется клеткой, трансфицированной нуклеиновой кислотой, кодирующей пептидную последовательность. Конкретным примером рекомбинантной нуклеиновой кислоты была бы нуклеиновая кислота (например, геномная или кДНК), кодирующая пептидную последовательность, клонированная в плазмиду, с наличием или отсутствием 5', 3'-концов или областей интронов, так что ген, как правило, находится в составе генома организма. Другим примером рекомбинантного пептида или нуклеиновой кислоты является гибридная или слитая последовательность, такая как химерная пептидная последовательность, содержащая часть FGF19 и часть FGF21.
В соответствии со способами, предложенными в настоящем документе, предложены композиции и смеси пептидных последовательностей, предложенных в настоящем документе, включая подпоследовательности, варианты и модифицированные формы иллюстративных пептидных последовательностей (включая варианты и подпоследовательности FGF19 и FGF21, приведенные в таблице 1 и списке последовательностей, а также продукты слияния и химеры FGF19/FGF21, приведенные в таблице 1 и списке последовательностей). В одном варианте осуществления смесь содержит одну или более пептидных последовательностей и фармацевтически приемлемый носитель или эксципиент. В другом варианте осуществления смесь содержит одну или более пептидных последовательностей и дополнительное лекарственное средство или терапевтический препарат, например, модулирующее гомеостаз желчных кислот или антидиабетическое, или снижающее уровень глюкозы лекарственное средство или терапевтический препарат. Сочетания, например, одной или более пептидных последовательностей в фармацевтически приемлемом носителе или эксципиенте с одним или более модулирующим гомеостаз желчных кислот средством, либо терапевтическим препаратом для лечения связанного с гомеостазом желчных кислот или сопутствующего заболевания, либо антидиабетическим или снижающим уровень глюкозы лекарственным средством или терапевтическим препаратом, также предложены в настоящем документе. Такие сочетания пептидной последовательности, предложенной в настоящем документе, с другим лекарственным средством или веществом, например, модулирующим гомеостаз желчных кислот или лечащим заболевание, связанное с гомеостазом желчных кислот, или снижающим уровень глюкозы лекарственным средством или терапевтическим препаратом, например, могут быть использованы со способами и вариантами применения, предложенными в настоящем документе, например, для лечения субъекта.
Сочетания также включают заключение пептидных последовательностей или нуклеиновых кислот, предложенных в настоящем документе, в частицы или полимерные вещества, такие как полиэфиры, углеводы, полиаминокислоты, гидрогель, поливинилпирролидон, этиленвинилацетат, метилцеллюлоза, карбоксиметилцеллюлоза, протамина сульфат, либо сополимеры лактида/гликолида, сополимеры полилактида/гликолида или этиленвинилацетатные сополимеры; заключение в микрокапсулы, полученные методом коацервации или межповерхностной полимеризации, например, с использованием микрокапсул из гидроксиметилцеллюлозы или желатина, или поли(метилметакрилатных) микрокапсул, соответственно, включение в коллоидные и дисперсионные системы доставки лекарственного средства, такие как макромолекулярные комплексы, нанокапсулы, микросферы, гранулы и системы на основе липидов (например, жирных N-ацильных групп, таких как N-лауроил, N-олеоил, жирных аминов, таких как додециламин, олеоиламин и так далее, смотри патент США № 6638513), включая эмульсии типа масло-в-воде, мицеллы, смешанные мицеллы и липосомы, например.
Пептиды, предложенные в настоящем документе, включая подпоследовательности, варианты и модифицированные формы иллюстративных пептидных последовательностей (включая варианты и подпоследовательности FGF19 и FGF21, приведенные в таблице 1 и списке последовательностей, а также продукты слияния и химеры FGF19/FGF21, приведенные в таблице 1 и списке последовательностей), приведенные в настоящем документе, могут быть использованы для модуляции метаболизма глюкозы и облегчения транспорта глюкозы из крови в ключевые для метаболизма органы, такие как мышцы, печень и жир. Такие пептидные последовательности могут быть получены в количествах, достаточных или эффективных для восстановления толерантности к глюкозе и/или для улучшения или поддержания нормального гомеостаза глюкозы.
5.9 Наборы
В настоящем документе также предложены наборы, включающие, но без ограничения, пептидные последовательности, предложенные в настоящем документе, и/или одно или более дополнительных средств для лечения заболевания, нарушения или состояния, либо композицию, содержащую вышеперечисленные компоненты и один или более фармацевтически приемлемых или физиологически приемлемых разбавителей, носителей или эксципиентов, необязательно, в дополнительном сочетании с одним или более лекарственными средствами, отличными от тех, которые описаны выше, их композициями и фармацевтическими композициями, упакованные в соответствующий упаковочный материал. Набор может дополнительно включать этикетку или вкладыш в упаковку, содержащие описание компонентов или инструкции по применению in vitro, in vivo или ex vivo компонентов набора. Иллюстративные инструкции включают инструкции для лечения и/или предотвращения заболевания или нарушения. В одном варианте осуществления заболевание или нарушение представляет собой связанное с гомеостазом желчных кислот или сопутствующее заболевание, описанное в настоящем документе. В другом варианте осуществления заболевание или нарушение представляет собой метаболическое заболевание или сопутствующее состояние. В другом варианте осуществления заболевание или нарушение представляет собой рак или опухоль.
Термин «упаковочный материал» относится к физической конструкции, заключающей в себе компоненты набора. Упаковочный материал может сохранять компоненты стерильными и может быть выполнен из материала, обычно используемого для таких целей (примерами являются бумага, гофрированное волокно, стекло, пластик, фольга, ампулы, флаконы, пробирки и так далее).
Наборы, предложенные в настоящем документе, могут включать этикетки или вкладыши. Этикетки или вкладыши включают «печатные материалы», например, бумагу или картон, находящиеся отдельно или закрепленные на компоненте, наборе или упаковочном материале (например, коробке), либо наклеенные, например, на ампулу, пробирку или флакон, содержащие компонент набора. Этикетки или вкладыши могут дополнительно включать машиночитаемый носитель, такой как диск (например, жесткий диск, карта, внешний жесткий диск), оптический диск, такой как CD- или DVD-ROM/RAM, DVD, MP3, магнитная пленка, или электрическое запоминающее устройство, такое как RAM и ROM, или гибриды вышеперечисленных, например, магнитный/оптический носитель, FLASH-карта или карты памяти. В некоторых вариантах осуществления в инструкции описан способ, предложенный в настоящем документе.
Этикетки или вкладыши могут содержать, в числе прочего, идентификационную информацию для одного или более компонентов набора, параметры дозирования и/или информацию по клинической фармакологии активного ингредиента(ов), включая механизм действия, фармакокинетику и фармакодинамику. Этикетки или вкладыши могут содержать информацию о производителе, номера лотов, адрес производителя и дату производства.
Этикетки или вкладыши могут содержать информацию о состоянии, нарушении, заболевании или симптоме, для лечения которого может быть использован компонент набора. Этикетки или вкладыши могут содержать инструкции для клинициста или для субъекта по использованию одного или более компонентов набора в способе, протоколе лечения или режиме лечения. Инструкции могут содержать информацию о количестве доз, частоте или продолжительности дозирования, а также инструкции для осуществления на практике способов, протоколов лечения или режимов лечения, описанных в настоящем документе. Иллюстративные инструкции включают инструкции для лечения или применения пептидной последовательности, приведенной в настоящем документе, и/или применения дополнительного средства или терапевтического метода, полезного для лечения связанного с гомеостазом желчных кислот или сопутствующего заболевания, либо нарушения гомеостаза желчных кислот. Таким образом, наборы, предложенные в настоящем документе, могут дополнительно включать этикетки или инструкции для осуществления на практике любого из способов и вариантов применения, предложенных в настоящем документе, включая способы и варианты лечения.
Этикетки или вкладыши могут содержать информацию о какой-либо пользе, которую может приносить компонент, например, профилактической или терапевтической пользе. Этикетки или вкладыши могут содержать информацию о потенциальных неблагоприятных побочных эффектах, например, предостережение для субъекта или клинициста в отношении ситуаций, в которых не следует применять конкретную композицию. Неблагоприятные эффекты также могут иметь место, если субъект принимал, будет принимать или в настоящее время принимает один или более других препаратов, которые могут быть несовместимыми с композицией, или субъект применял, будет применять или в настоящее время применяет другой протокол лечения или режим лечения, который был бы несовместим с композицией, и, таким образом, инструкции могут содержать информацию о такой несовместимости.
Наборы, предложенные в настоящем документе, могут дополнительно содержать другие компоненты. Каждый компонент набора может быть заключен в отдельный контейнер, и все эти разные контейнеры могут находиться в одной упаковке. В конкретных вариантах осуществления наборы предназначены для хранения при низкой температуре. Наборы, предложенные в настоящем документе, дополнительно могут быть сконструированы для содержания пептидных последовательностей, предложенных в настоящем документе, или для содержания нуклеиновых кислот, кодирующих пептидные последовательности. Наборы, предложенные в настоящем документе, также могут быть сконструированы для содержания, либо отдельно, либо в сочетании с пептидными последовательностями, предложенными в настоящем документе, одного или более дополнительных средств, полезных для лечения, либо предотвращения заболевания или нарушения, описанного в настоящем документе. Любые клетки в наборе могут сохраняться в соответствующих условиях хранения до их использования.
Если не указано иначе, все технические и научные термины, используемые в настоящем документе, имеют то же значение, которое им обычно придают специалисты в области, к которой относится изобретение. Хотя способы и материалы, аналогичные или эквивалентные тем, которые описаны в настоящем документе, могут быть использованы на практике или при тестировании изобретения, подходящие способы и материалы описаны в настоящем документе.
В случае конфликта спецификация, включая определения, будет иметь преимущественную силу. При использовании в настоящем документе и в прилагаемой формуле изобретения форма единственного числа существительных включает соответствующую форму множественного числа, если из контекста явно не следует иное. Таким образом, например, при упоминании «пептидной последовательности» или «варианта лечения»» подразумевают множество таких последовательностей, вариантов лечения, и так далее. Следует также отметить, что формула изобретения может быть составлена таким образом, чтобы исключить любой необязательный элемент. Как таковое, данное заявление предназначено для использования в качестве упомянутого ранее основания для использования исключительной терминологии, такой как «исключительно», «только» и тому подобной, в связи с перечислением элементов формулы изобретения или использования «отрицательного» ограничения.
Если использован диапазон значений, понятно, что каждое промежуточное значение, до десятой доли единицы нижнего предела, если из контекста явно не следует иное, между верхним и нижним пределом этого диапазона, а также любое заявленное или промежуточное значение в этом указанном диапазоне, входит в объем изобретения. Верхние и нижние пределы этих меньших диапазонов могут быть независимо включены в меньшие диапазоны, и также входят в объем изобретения, с учетом любого специально исключенного предела в указанном диапазоне. Если указанный диапазон включает один или оба предела, диапазоны, исключающие любой или оба из этих включенных пределов, также входят в объем изобретения.
При использовании в настоящем документе числовые значения часто представлены в формате диапазона во всем тексте данного документа. Использование формата диапазона служит исключительно для удобства и краткости и не должно быть истолковано, как негибкое ограничение объема изобретения, если из контекста явно не следует иное. Соответственно, используемый диапазон специально включает все возможные поддиапазоны, все отдельные числовые значения в пределах этого диапазона, а также все числовые значения или числовые диапазоны, включая целые числа в таких диапазонах, а также доли значений или целых чисел в пределах диапазонов, если из контекста явно не следует иное. Это утверждение применимо независимо от широты диапазона, и во всех контекстах данного патентного документа. Таким образом, например, упоминание диапазона 90-100% включает 91-99%, 92-98%, 93-95%, 91-98%, 91-97%, 91-96%, 91-95%, 91-94%, 91-93% и так далее. Упоминание диапазона 90-100% также включает 91%, 92%, 93%, 94%, 95%, 96%, 97% и так далее, а также 91,1%, 91,2%, 91,3%, 91,4%, 91,5% и так далее, 92,1%, 92,2%, 92,3%, 92,4%, 92,5% и так далее, и так далее. Кроме того, упоминание диапазона 1-3, 3-5, 5-10, 10-20, 20-30, 30-40, 40-50, 50-60, 60-70, 70-80, 80-90, 90-100, 100-110, 110-120, 120-130, 130-140, 140-150, 150-160, 160-170, 170-180, 180-190, 190-200, 200-225, 225-250 включает 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 и так далее. В следующем примере упоминание диапазона 25-250, 250-500, 500-1000, 1000-2500, 2500-5000, 5000-25000 или 5000-50000 включает любое числовое значение или диапазон в пределах или включая такие значения, например, 25, 26, 27, 28, 29…250, 251, 252, 253, 254…500, 501, 502, 503, 504… и так далее. Использование ряда диапазонов включает комбинации верхнего и нижнего диапазонов для создания другого диапазона. Это утверждение применимо независимо от широты диапазона, и во всех контекстах данного патентного документа. Таким образом, например, упоминание ряда диапазонов, например, 5-10, 10-20, 20-30, 30-40, 40-50, 50-75, 75-100, 100-150, подразумевает такие диапазоны, как 5-20, 5-30, 5-40, 5-50, 5-75, 5-100, 5-150 и 10-30, 10-40, 10-50, 10-75, 10-100, 10-150, и 20-40, 20-50, 20-75, 20-100, 20-150, и так далее.
В настоящем документе для краткости использованы определенные сокращения. Одним примером является однобуквенное сокращение для обозначения аминокислотных остатков. Аминокислоты и соответствующие им трехбуквенные и однобуквенные сокращения приведены далее:
|
Изобретение в общих чертах раскрыто в настоящем документе с использованием аффирмативной речи для описания многочисленных вариантов осуществления. В изобретение также специально включены варианты осуществления, в которых конкретный объект исключен, полностью или частично, например, вещества или материалы, этапы и условия способа, протоколы, методы, тесты или анализы. Таким образом, даже если изобретение, в целом, не описано в настоящем документе с точки зрения того, что не входит в данное изобретение, аспекты, которые прямо не включены в изобретение, тем не менее раскрыты в настоящем документе.
В настоящем документе описаны конкретные варианты осуществления данного изобретения, включая наилучший известный авторам изобретения способ осуществления данного изобретения. После прочтения описания, приведенного выше, вариации раскрытых вариантов осуществления могут стать очевидными для специалистов в данной области, и ожидается, что эти квалифицированные специалисты смогут использовать такие вариации в зависимости от обстоятельств. Соответственно, предусмотрено, что изобретение будет осуществляться на практике иначе, чем это конкретно описано в настоящем документе, и что изобретение включает все модификации и эквиваленты объекта, изложенного в прилагаемой формуле изобретения, в соответствии с действующим законодательством. Более того, любое сочетание вышеописанных элементов во всех возможных его вариациях входит в объем изобретения, если нет иных указаний в настоящем документе или это иным образом явно не противоречит контексту.
Все публикации, патентные заявки, регистрационные номера и другие литературные источники, упомянутые в данной спецификации, включены в настоящий документ посредством ссылки в полном объеме, как если бы было специально и индивидуально указано, что каждая отдельная публикация или патентная заявка включена посредством ссылки. Публикации, обсуждаемые в настоящем документе, приведены исключительно с целью их раскрытия до даты подачи настоящей заявки. Ничто в настоящем документе не должно быть истолковано, как признание того, что настоящее изобретение неправомочно датировать такую публикацию задним числом в силу более раннего изобретения. Кроме того, приведенные даты публикации могут отличаться от фактических дат публикации, которые должны быть подтверждены независимо.
Описан целый ряд вариантов осуществления изобретения. Тем не менее, следует понимать, что различные модификации могут быть использованы без отклонения от сущности и объема изобретения. Соответственно, описания в «Экспериментальном разделе» предназначены для иллюстрации, но не для ограничения объема изобретения, определяемого формулой изобретения.
6. Экспериментальный раздел
Далее следует описание различных методов и материалов, использованных в исследовании, приведенное с целью предоставить специалистам в данной области полное раскрытие и описание того, как настоящее изобретение может быть осуществлено на практике и использовано, и оно не предназначено для ограничения объема того, что авторы настоящего документа считают своим изобретением, и также не должно восприниматься как указание на то, что проведенные эксперименты, описанные ниже, представляют собой все эксперименты, которые могут быть проведены. Следует понимать, что иллюстративные эксперименты, описанные в настоящем времени, не обязательно были проведены, но скорее, что они могут быть проведены для получения данных, и тому подобного, связанных с идеями настоящего изобретения. Были предприняты усилия для обеспечения точности в отношении используемых числовых значений (например, количеств, температур и так далее), но следует учитывать некоторые экспериментальные ошибки и отклонения.
Если нет иных указаний, части представляют собой части по массе, молекулярная масса представляет собой средневесовую молекулярную массу, температура указана в градусах Цельсия (°C) и давление соответствует атмосферному или примерно атмосферному давлению. Использованы стандартные сокращения, включая следующие: п.н.=пара(ы) нуклеотидов; т.н.=тысяча(и) нуклеотидов; с или сек=секунда(ы); мин=минута(ы); ч или час=час(ы); ак=аминокислота(ы); т.н.=тысяча(и) нуклеотидов; нт=нуклеотид(ы); пг=пикограмм; нг=нанограмм; мкг=микрограмм; мг=миллиграмм; г=грамм; кг=килограмм; пл или пЛ=пиколитр(ы); дл или дЛ=децилитр; мкл или мкЛ=микролитр; мл или мЛ=миллилитр; л или Л=литр; мкМ=микромолярный; мМ=миллимолярный; M=молярный; кДа=килодальтон; в/м=внутримышечное(но); в/б=внутрибрюшинное(но); п/к=подкожное(но); QD=ежедневно; BID=два раза в сутки; QW=еженедельно; TIW=три раза в неделю; QM=ежемесячно; ВЭЖХ=высокоэффективная жидкостная хроматография; МТ=масса тела; Ед=единица; н/з=не является статистически значимым; PBS=фосфатно-солевой буфер; ПЦР=полимеразная цепная реакция; NHS=N-гидроксисукцинимид; ЧСА=человеческий сывороточный альбумин; БСА=бычий сывороточный альбумин; DMEM=модифицированная по способу Дульбекко среда Игла; гк=геномная копия; ЭДТА=этилендиаминтетрауксусная кислота.
6.1 Пример 1 - Жидкий препарат M70
Ниже приведен состав жидкого препарата.
|
6.2 Пример 2 - Дизайн исследования стабильности препарата
Все исследования стабильности выполняли, используя концентрации белка 1 мг/мл и 10 мг/мл с осмоляльностью 300 осмоль/л, на протяжении 0-24 недель.
Объем содержимого флаконов составлял 0,5-1 мл/флакон при температуре -80°C; 2-8°C и 37°C в моменты времени 0 недель, 1 неделя, 2 недели, 4 недели, 3 месяца и 6 месяцев.
M70 концентрировали до 10+ мг/мл на основании значений A280 (ММ=21320, E=16180). Концентрированный маточный раствор разбавляли до концентрации 1 мг/мл или 10 мг/мл 1x раствором PBS и добавляли TWEEN-20 (0,01% по объему) перед этапом диализа.
|
В данных исследованиях использовали трегалозу с каталожным № BP26871 (Fisher).
Также отмечали зависимость значения pH от температуры для Tris:
|
Образцы диализовали в течение ночи в каждом буфере с использованием кассеты Slide-A-Lyzer® с 10K НОММ. Все флаконы продували воздухом для удаления пыли, а затем автоклавировали в сухом цикле в течение 2 часов при температуре 121°C для обеспечения стерильности. Образцы стерильно фильтровали через 0,22-мкм фильтр в вытяжном шкафу. Заполнение флаконов выполняли в ламинарном шкафу для обеспечения стабильности.
В общей сложности тестировали 60 вариантов на каждую временную точку. Нумерацию флаконов использовали во всех примерах, приведенных в настоящем документе.
|
Также определяли осмометрические значения для буферов в присутствии и в отсутствие M70 на приборе Advanced Instruments 3300, с номинальным объемом впрыска 20 мкл:
|
Визуальную оценку мутности проводили для всех образцов через 0, 1, 2, 4 недель. Образцы перемешивали на вихревой мешалке для ресуспендирования любых осадков на дне пробирки. Использовали следующую систему оценки в баллах: 0 - прозрачный; 1 - слегка помутневший; 2 - слегка мутный; 3 - мутный; 4 - очень мутный; 5 - чрезвычайно мутный.
Измерения показателей A340/A280 выполняли через 4 недели (Nanodrop; длина пути 1 мм), и для каждого образца использовали пустую пробу из соответствующего буфера препарата.
Анализ визуальной мутности выполняли для образцов через 4 недели при температуре 37°C. Результаты визуальной оценки образцов с концентрацией белка 1 мг/мл приведены на ФИГ. 1. Результаты визуальной оценки образцов с концентрацией белка 10 мг/мл приведены на ФИГ. 2.
Исследования показали полное отсутствие визуальных осадков или агрегатов для любого варианта образцов, хранящихся при температуре -80°C и 4°C, и в любой временной точке. В образцах, хранящихся при температуре 37°C, была зарегистрирована различная степень агрегации (данные не представлены), которая зависела от величины pH и концентрации белка.
Было отмечено, что трегалоза была лучшим модификатором тоничности, чем NaCl, в Tris-содержащих буферах. Действительно, наблюдали значительные различия в степени агрегации при температуре 37°C между 20 мМ Tris (pH 8,5), содержащим 8,2% трегалозы (буфер 7), и содержащим 140 мМ NaCl (буфер 10).
Буфер 7 (20 мМ Tris, 8,2% трегалозы, 0,01% TWEEN-20) был единственным буфером препарата без каких-либо признаков визуальных осадков при любых условиях, концентрациях или временных точках и, таким образом, был выбран для дальнейших исследований.
6.3 Пример 3. ЭХ-ВЭЖХ анализ
ВЭЖХ анализ проводили для образов без признаков наличия осадка на основании показателей A280/A340 (отношение ≤0,07) и визуального осмотра (без видимых осадков) в следующих условиях:
Прибор - ВЭЖХ серии 1200
Подвижная фаза - 1x раствор PBS с 5% этанола (по объему)
Скорость потока - 1 мл/мин
Время прогона образца - 15 мин/прогон
Колонка - Tosoh TSKgel3000
Температура - 25°C
Объем(ы) впрыска - 20 мкл для образца с концентрацией 1 мг/мл (нагрузка 20 мкг); или 2 мкл для образца с концентрацией 10 мг/мл (нагрузка 20 мкг).
Прогон пустой пробы (PBS) выполняли перед каждым впрыском для обеспечения минимального переноса образцов в последующие впрыски. Также определяли процент (%) выхода, исходя из общей AUC в момент времени=0 для каждой временной точки (t=1, 2 и 4 недели).
Результаты ВЭЖХ анализа, основанного на определении методом ЭХ AUC поглощения при A210 для образцов с концентрацией 1 мг/мл в разных буферах приведены на ФИГ. 3; и на ФИГ. 4 представлены результаты ВЭЖХ анализа, основанного на определении методом ЭХ AUC поглощения при A210 для образца с концентрацией 1 мг/мл в буфере 7. Аналогичные данные для образцов с концентрацией 10 мг/мл приведены на ФИГ. 5 и ФИГ. 6, соответственно.
Результаты показали, что процент (%) выхода, исходя из общей AUC, был выше 92% для все проанализированных образцов, что впоследствии было подтверждено ортогональным методом (AUCSV) (данные не представлены). В случае буфера 7 также наблюдали зависимое от времени возрастание, в процентах, образования димеров/агрегатов при температуре 37°C. Общие тенденции свидетельствуют о том, что чем выше значение pH, тем выше склонность к образованию димеров и высокомолекулярных агрегатов с течением времени в жидком препарате. Кроме того, увеличение концентрации M70 имело лишь минимальный эффект на склонность к образованию димеров и высокомолекулярных агрегатов с течением времени при температуре 4°C в жидком препарате.
6.4 Пример 4. Анализ методом электрофореза в SDS-ПААГ
Анализ методом электрофореза в SDS-ПААГ выполняли для образцов без признаков наличия осадка на основании показателей A280/A340 и визуального осмотра (буферы 1-10) в следующих условиях:
Прибор - Novex 4-20% гель в Tris-глициновом буфере
Буфер для обработки образцов - Lamelli 3x электродный буфер ± 100 мМ ДТТ.
Образцы разбавляли до концентрации 0,1 мкг/мкл в 1x электродном буфере Lamelli. Образцы центрифугировали при температуре 95°C в течение 5 мин, а затем наносили по 10 мкл/дорожку (всего 1 мкг) в геле. Также использовали эталонный стандарт для времени t=0. После завершения гель фиксировали в 1% растворе уксусной кислоты (по объему) в течение 30 мин, промывали водой Milli-Q™ в течение 15 минут, окрашивали кумасси Bio-Safe™ в течение 1 часа, а затем краситель удаляли в течение ночи в воде Milli-Q™.
Фотографии SDS-ПАА гелей в случае буфера 7 (слева) и буфера 8 (справа) с белком в концентрации как 1 мг/мл, так и 10 мг/мл, приведены на ФИГ. 7A и ФИГ. 7B, соответственно (другие буферы; данные не представлены). Результаты показали, что минимальное уменьшение интенсивности основного пика M70 имело место во всех протестированных образцах. В буфере 7 присутствовала полоса димера, связанного не дисульфидными связями, которая не исчезала в восстанавливающих условиях и соответствовала примерно 5% от интенсивности полосы всего белка через 4 недели при температуре 37°C и концентрации 10 мг/мл. В случае образца с концентрацией 10 мг/мл через 4 недели при температуре 4°C не наблюдали значительного увеличения полосы димера по сравнению с эталонным стандартом для t=0. Кроме того, во всех протестированных образцах отсутствовали признаки высокомолекулярных агрегатов в лунках геля.
На основании данных, полученных в этом и предыдущих экспериментах, были выбраны лучшие 3 буфера для дальнейшего анализа. Ранжирование буферов было основано на следующих анализах в моменты времени t=0, 1, 2 и 4 недели:
- визуальный осмотр (Пример 2)
- мутность при A340/A280 (Пример 2)
- ЭХ-ВЭЖХ (Пример 3)
- электрофорез в SDS-ПААГ (Пример 4).
Что касается критериев выбора, основное внимание было уделено анализу образца с концентрацией 10 мг/мл, чтобы снизить риск для препаратов с высокой концентрацией (до 10 мг/мл), предназначенных для клинического применения. Исследования также были сфокусированы на образцах, хранящихся при температуре 4°C, что могло послужить основой для условий хранения жидкого препарата.
С учетом вышеуказанных критериев для дальнейшего анализа были выбраны буферы 1, 7 и 10. Буфер 1 в случае образца с концентрацией белка 10 мг/мл отличался 100% выходом (4 недели при температуре 4°C) и содержанием мономера 98,9% при анализе в запланированных временных точках. Более того, другими методами анализа было показано минимальное содержание связанного не дисульфидными ковалентными связями димера в момент времени t=4 недели, и была отмечена долгосрочная стабильность при температуре 4°C (данные не представлены). В буфере 7 с белком в концентрации 10 мг/мл отсутствовал осадок при температуре 37°C в момент времени t=4 недели; и для белка в концентрации 10 мг/мл наблюдали минимальную деградацию за 4 недели при температуре 4°C (98,9% мономера). Буфер 10 был по существу эквивалентным буферу 7; но содержал NaCl для тоничности (данные не представлены) и добавлял разнообразие в диапазон эксципиентов.
6.5 Пример 5. Анализ методом ионообменной-высокоэффективной жидкостной хроматографии (ИО-ВЭЖХ)
ИО-ВЭЖХ анализ буфера 7 выполняли в следующих условиях:
Прибор: ВЭЖХ серии 1200
Подвижная фаза: (A) 20 мМ Tris-HCl; pH 8,5; 20% ацетонитрила
(B) 20 мМ Tris-HCl; pH 8,5; 20% ацетонитрила; 500 мМ NaCl
Скорость потока: 0,5 мл/мин с возрастающим линейным градиентом %B
Колонка: анионообменная колонка Tosoh TSKgel Q-5PW, 7,5 мм x 75 мм (PN 18257)
Объем впрыска: 20 мкл для образца с концентрацией 1 мг/мл
2 мкл для образца с концентрацией 10 мг/мл.
Анализ временных точек для образцов: буфер 7 с белком в концентрациях 1 мг/мл и 10 мг/мл в моменты времени t=0, 1, 2 и 4 недели; Эталонный стандарт против подвергнутых тепловому стрессу при температуре 37°C образцов в моменты времени t=0, 1, 2 и 4 недели.
На ФИГ. 8 представлены результаты ИО-ВЭЖХ для буфера 7 с белком в концентрации 1 мг/мл при температуре 37°C в моменты времени t=0 недель, 1 неделя, 2 недели и 4 недели. На ФИГ. 9 представлены результаты ИО-ВЭЖХ для буфера 7 с белком в концентрации 10 мг/мл при температуре 37°C в моменты времени t=0 недель, 1 неделя, 2 недели и 4 недели.
6.6 Пример 6. Анализ методом обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ)
ОФ-ВЭЖХ анализ выполняли для образцов без признаков наличия осадка на основании показателей A280/A340 и визуального осмотра в следующих условиях:
Прибор: ВЭЖХ серии 1200
Подвижная фаза: (A) 0,1 ТФУ
(B) 0,1 ТФУ, 90% CAN
Скорость потока: 0,4 мл/мин
Колонка: Phenomenox™ C4-Jupiter
Объем впрыска: 20 мкл для образца с концентрацией 1 мг/мл
2 мкл для образца с концентрацией 10 мг/мл.
Анализ временных точек для образцов: буфер 7 с белком в концентрациях 1 мг/мл и 10 мг/мл в моменты времени t=0, 1, 2 и 4 недели; Эталонный стандарт против подвергнутых тепловому стрессу при температуре 37°C образцов в моменты времени t=0, 1, 2 и 4 недели.
На ФИГ. 10 представлены результаты ОФ-ВЭЖХ для буфера 7 с белком в концентрации 1 мг/мл при температуре 37°C в моменты времени t=0 недель, 1 неделя, 2 недели и 4 недели. На ФИГ. 11 представлены результаты ОФ-ВЭЖХ для буфера 7 с белком в концентрации 10 мг/мл при температуре 37°C в моменты времени t=0 недель, 1 неделя, 2 недели и 4 недели.
6.7 Пример 7 - Анализ методом замораживания-размораживания
Данный анализ проводили для изучения эффекта нескольких циклов замораживания/размораживания на препараты M70.
M70 использовали в концентрации 10 мг/мл, и целевой показатель осмоль/л составлял 300 осмоль/л. Использовали буфер следующего состава (аналогичный буферу 7): 20 мМ Tris pH 8,0 (25°C), 8,3% (масс/об) трегалозы, 0,01% TWEEN-20. Объем заполнения во флаконах составлял 1,0 мл/флакон, и 6 аликвот разливали в стеклянные флаконы, которые были использованы в экспериментах по изучению стабильности, описанных выше.
Использовали следующие условия замораживания/размораживания:
Число циклов замораживания/размораживания: 1, 3, 5
Условия замораживания: нахождение при температуре -80°C в течение 30 мин.
Условия размораживания: (A) комнатная температура до оттаивания (1 час)
(B) 4°C до оттаивания (1 час)
Затем проводили оценку стабильности с использованием одного или более из методов ОФ-ВЭЖХ, ЭХ-ВЭЖХ или АО-ВЭЖХ.
На ФИГ. 12 представлены данные по стабильности препарата M70 после нескольких циклов замораживания/размораживания. Циклы замораживания/размораживания не влияли на стабильность препарата в буфере. Препарат M70 в 20 мМ Tris pH 8,0 (25°C), 8,3% трегалозы (масс/об), 0,01% полисорбата-20 (буфер «TTP») является стабильным при циклическом замораживании/размораживании от температуры -80°C до комнатной температуры. Отсутствовали заметные различия по сравнению с исходным препаратом (эталонным стандартом) при любых условиях образцов или методах анализа. Более того, отсутствовали признаки обратимого образования олигомеров при анализе методом ЭХ-ВЭЖХ с использованием TTP в качестве подвижной фазы.
Список последовательностей
Настоящая спецификация подана совместно с копией списка последовательностей в машиночитаемой форме (CRF). CRF под названием 13370-018-228_SEQLIST.txt, которая была создана 14 октября 2015 г. и имеет размер 255604 байтов, идентична бумажной копии списка последовательностей и включена в настоящий документ посредством ссылки в полном объеме.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> NGM Biopharmaceuticals, Inc.
LINDHOUT, Darrin Anthony
OLSON, Charles
<120> Фармацевтические композиции, содержащие варианты пептидов, и способы их применения
<130> 13370-018-228
<140>
<141>
<150> 62/067,824
<151> 2014-10-23
<160> 205
<170> PatentIn version 3.5
<210> 1
<211> 194
<212> БЕЛОК
<213> Homo sapiens
<400> 1
Arg Pro Leu Ala Phe Ser Asp Ala Ser Pro His Val His Tyr Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln
115 120 125
Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 2
<211> 194
<212> БЕЛОК
<213> Homo sapiens
<400> 2
Arg Pro Leu Ala Phe Ser Asp Ser Ser Pro Leu Val His Tyr Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln
115 120 125
Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 3
<211> 194
<212> БЕЛОК
<213> Homo sapiens
<400> 3
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Tyr Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Leu Glu Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln
115 120 125
Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 4
<211> 194
<212> БЕЛОК
<213> Homo sapiens
<400> 4
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Tyr Ala Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln
115 120 125
Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 5
<211> 191
<212> БЕЛОК
<213> Homo sapiens
<400> 5
Arg His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln
1 5 10 15
Val Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
20 25 30
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
35 40 45
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
50 55 60
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
65 70 75 80
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
85 90 95
Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu
100 105 110
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
115 120 125
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
130 135 140
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
145 150 155 160
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
165 170 175
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 6
<211> 187
<212> БЕЛОК
<213> Homo sapiens
<400> 6
Arg Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val Arg Leu Arg
1 5 10 15
His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser Cys Phe Leu Arg
20 25 30
Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly Gln Ser Ala His
35 40 45
Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr Val Ala Ile Lys
50 55 60
Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala Asp Gly Lys Met
65 70 75 80
Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe Glu Glu Glu
85 90 95
Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys His Arg Leu
100 105 110
Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr Lys Asn Arg
115 120 125
Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu Pro Met Val Pro
130 135 140
Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser Asp Met Phe Ser
145 150 155 160
Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly Leu Val Thr Gly
165 170 175
Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185
<210> 7
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 7
Arg Pro Leu Ala Phe Ser Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly
1 5 10 15
Gln Val Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 8
<211> 191
<212> БЕЛОК
<213> Homo sapiens
<400> 8
Arg His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Trp Gly Asp Pro
1 5 10 15
Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
20 25 30
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
35 40 45
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
50 55 60
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
65 70 75 80
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
85 90 95
Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu
100 105 110
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
115 120 125
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
130 135 140
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
145 150 155 160
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
165 170 175
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 9
<211> 193
<212> БЕЛОК
<213> Homo sapiens
<400> 9
Arg His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Trp Gly
1 5 10 15
Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu
20 25 30
Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala
35 40 45
Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu
50 55 60
Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met
65 70 75 80
Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp
85 90 95
Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg
100 105 110
Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg
115 120 125
Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro
130 135 140
Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu
145 150 155 160
Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro
165 170 175
Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu
180 185 190
Lys
<210> 10
<211> 193
<212> БЕЛОК
<213> Homo sapiens
<400> 10
Arg His Pro Ile Pro Asp Ser Ser Pro His Val His Tyr Gly Trp Gly
1 5 10 15
Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu
20 25 30
Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala
35 40 45
Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu
50 55 60
Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met
65 70 75 80
Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp
85 90 95
Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg
100 105 110
Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg
115 120 125
Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro
130 135 140
Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu
145 150 155 160
Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro
165 170 175
Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu
180 185 190
Lys
<210> 11
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 11
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro Leu Leu Gln Trp Gly Asp
1 5 10 15
Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 12
<211> 194
<212> БЕЛОК
<213> Homo sapiens
<400> 12
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro Leu Leu Gln Phe Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln
115 120 125
Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 13
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 13
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro Leu Leu Gln Phe Gly Gly
1 5 10 15
Gln Val Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 14
<211> 191
<212> БЕЛОК
<213> Homo sapiens
<400> 14
Arg His Pro Ile Pro Asp Ser Ser Pro His Val His Tyr Gly Gly Gln
1 5 10 15
Val Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
20 25 30
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
35 40 45
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
50 55 60
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
65 70 75 80
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
85 90 95
Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu
100 105 110
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
115 120 125
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
130 135 140
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
145 150 155 160
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
165 170 175
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 15
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 15
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Tyr Gly Gly
1 5 10 15
Gln Val Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 16
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 16
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Trp Gly Asp
1 5 10 15
Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 17
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 17
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val Gly Trp Gly Asp
1 5 10 15
Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 18
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 18
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Tyr Gly Trp Gly Asp
1 5 10 15
Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 19
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 19
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro Val Tyr Gly Trp Gly Asp
1 5 10 15
Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 20
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 20
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro Val His Gly Trp Gly Asp
1 5 10 15
Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 21
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 21
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro Val His Tyr Trp Gly Asp
1 5 10 15
Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 22
<211> 193
<212> БЕЛОК
<213> Homo sapiens
<400> 22
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Gly Trp Gly
1 5 10 15
Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu
20 25 30
Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala
35 40 45
Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu
50 55 60
Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met
65 70 75 80
Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp
85 90 95
Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg
100 105 110
Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg
115 120 125
Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro
130 135 140
Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu
145 150 155 160
Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro
165 170 175
Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu
180 185 190
Lys
<210> 23
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 23
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His His Gly Trp Gly Asp
1 5 10 15
Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 24
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 24
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His His Tyr Trp Gly Asp
1 5 10 15
Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 25
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 25
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val Tyr Trp Gly Asp
1 5 10 15
Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 26
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 26
Arg Pro Leu Ala Phe Ser Asp Ser Ser Pro Leu Val His Trp Gly Asp
1 5 10 15
Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 27
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 27
Arg Pro Leu Ala Phe Ser Asp Ser Ser Pro His Val His Trp Gly Asp
1 5 10 15
Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 28
<211> 191
<212> БЕЛОК
<213> Homo sapiens
<400> 28
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val Trp Gly Asp Pro
1 5 10 15
Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
20 25 30
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
35 40 45
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
50 55 60
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
65 70 75 80
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
85 90 95
Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu
100 105 110
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
115 120 125
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
130 135 140
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
145 150 155 160
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
165 170 175
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 29
<211> 193
<212> БЕЛОК
<213> Homo sapiens
<400> 29
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Tyr Trp Gly
1 5 10 15
Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu
20 25 30
Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala
35 40 45
Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu
50 55 60
Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met
65 70 75 80
Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp
85 90 95
Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg
100 105 110
Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg
115 120 125
Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro
130 135 140
Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu
145 150 155 160
Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro
165 170 175
Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu
180 185 190
Lys
<210> 30
<211> 194
<212> БЕЛОК
<213> Homo sapiens
<400> 30
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Tyr Ala Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln
115 120 125
Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 31
<211> 191
<212> БЕЛОК
<213> Homo sapiens
<400> 31
Arg His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Ala Gln
1 5 10 15
Val Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
20 25 30
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
35 40 45
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
50 55 60
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
65 70 75 80
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
85 90 95
Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu
100 105 110
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
115 120 125
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
130 135 140
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
145 150 155 160
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
165 170 175
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 32
<211> 191
<212> БЕЛОК
<213> Homo sapiens
<400> 32
Arg His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Asp Gln
1 5 10 15
Val Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
20 25 30
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
35 40 45
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
50 55 60
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
65 70 75 80
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
85 90 95
Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu
100 105 110
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
115 120 125
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
130 135 140
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
145 150 155 160
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
165 170 175
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 33
<211> 191
<212> БЕЛОК
<213> Homo sapiens
<400> 33
Arg His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Pro Gln
1 5 10 15
Val Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
20 25 30
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
35 40 45
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
50 55 60
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
65 70 75 80
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
85 90 95
Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu
100 105 110
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
115 120 125
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
130 135 140
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
145 150 155 160
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
165 170 175
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 34
<211> 191
<212> БЕЛОК
<213> Homo sapiens
<400> 34
Arg His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Ala
1 5 10 15
Val Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
20 25 30
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
35 40 45
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
50 55 60
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
65 70 75 80
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
85 90 95
Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu
100 105 110
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
115 120 125
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
130 135 140
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
145 150 155 160
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
165 170 175
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 35
<211> 191
<212> БЕЛОК
<213> Homo sapiens
<400> 35
Arg His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Glu
1 5 10 15
Val Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
20 25 30
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
35 40 45
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
50 55 60
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
65 70 75 80
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
85 90 95
Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu
100 105 110
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
115 120 125
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
130 135 140
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
145 150 155 160
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
165 170 175
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 36
<211> 191
<212> БЕЛОК
<213> Homo sapiens
<400> 36
Arg His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Asn
1 5 10 15
Val Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
20 25 30
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
35 40 45
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
50 55 60
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
65 70 75 80
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
85 90 95
Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu
100 105 110
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
115 120 125
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
130 135 140
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
145 150 155 160
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
165 170 175
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 37
<211> 191
<212> БЕЛОК
<213> Homo sapiens
<400> 37
Arg His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln
1 5 10 15
Ala Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
20 25 30
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
35 40 45
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
50 55 60
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
65 70 75 80
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
85 90 95
Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu
100 105 110
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
115 120 125
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
130 135 140
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
145 150 155 160
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
165 170 175
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 38
<211> 191
<212> БЕЛОК
<213> Homo sapiens
<400> 38
Arg His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln
1 5 10 15
Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
20 25 30
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
35 40 45
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
50 55 60
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
65 70 75 80
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
85 90 95
Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu
100 105 110
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
115 120 125
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
130 135 140
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
145 150 155 160
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
165 170 175
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 39
<211> 191
<212> БЕЛОК
<213> Homo sapiens
<400> 39
Arg His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln
1 5 10 15
Thr Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
20 25 30
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
35 40 45
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
50 55 60
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
65 70 75 80
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
85 90 95
Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu
100 105 110
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
115 120 125
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
130 135 140
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
145 150 155 160
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
165 170 175
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 40
<211> 193
<212> БЕЛОК
<213> Homo sapiens
<400> 40
Arg His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Trp Gly
1 5 10 15
Gln Pro Val Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu
20 25 30
Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala
35 40 45
Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu
50 55 60
Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met
65 70 75 80
Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp
85 90 95
Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg
100 105 110
Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg
115 120 125
Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro
130 135 140
Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu
145 150 155 160
Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro
165 170 175
Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu
180 185 190
Lys
<210> 41
<211> 182
<212> БЕЛОК
<213> Homo sapiens
<400> 41
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Tyr Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln
115 120 125
Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu
130 135 140
Pro Met Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp
145 150 155 160
Val Gly Ser Ser Asp Pro Leu Ser Met Val Gly Pro Ser Gln Gly Arg
165 170 175
Ser Pro Ser Tyr Ala Ser
180
<210> 42
<211> 178
<212> БЕЛОК
<213> Homo sapiens
<400> 42
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
1 5 10 15
Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser Cys
20 25 30
Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly Gln
35 40 45
Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr Val
50 55 60
Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala Asp
65 70 75 80
Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe
85 90 95
Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys
100 105 110
His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr
115 120 125
Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu Pro
130 135 140
Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val Gly Ser Ser
145 150 155 160
Asp Pro Leu Ser Met Val Gly Pro Ser Gln Gly Arg Ser Pro Ser Tyr
165 170 175
Ala Ser
<210> 43
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 43
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Tyr Gly Gly
1 5 10 15
Asp Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 44
<211> 185
<212> БЕЛОК
<213> Homo sapiens
<400> 44
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Tyr Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln
20 25 30
Thr Glu Ala His Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala
35 40 45
Ala Asp Gln Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro
50 55 60
Gly Val Ile Gln Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln
65 70 75 80
Arg Pro Asp Gly Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala
85 90 95
Cys Ser Phe Arg Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln
100 105 110
Ser Glu Ala His Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro
115 120 125
His Arg Asp Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro
130 135 140
Gly Leu Pro Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln
145 150 155 160
Pro Pro Asp Val Gly Ser Ser Asp Pro Leu Ser Met Val Gly Pro Ser
165 170 175
Gln Gly Arg Ser Pro Ser Tyr Ala Ser
180 185
<210> 45
<211> 193
<212> БЕЛОК
<213> Homo sapiens
<400> 45
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
1 5 10 15
Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His
20 25 30
Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser
35 40 45
Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln
50 55 60
Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly
65 70 75 80
Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg
85 90 95
Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His
100 105 110
Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro
115 120 125
Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro
130 135 140
Ala Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu
145 150 155 160
Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro
165 170 175
Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu
180 185 190
Lys
<210> 46
<211> 232
<212> БЕЛОК
<213> Homo sapiens
<400> 46
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Tyr Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln
20 25 30
Thr Glu Ala His Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala
35 40 45
Ala Asp Gln Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro
50 55 60
Gly Val Ile Gln Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln
65 70 75 80
Arg Pro Asp Gly Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala
85 90 95
Cys Ser Phe Arg Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln
100 105 110
Ser Glu Ala His Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro
115 120 125
His Arg Asp Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro
130 135 140
Gly Leu Pro Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln
145 150 155 160
Pro Pro Asp Val Gly Ser Ser Asp Pro Leu Ser Met Val Gly Pro Ser
165 170 175
Gln Gly Arg Ser Pro Ser Tyr Ala Ser Pro Met Val Pro Glu Glu Pro
180 185 190
Glu Asp Leu Arg Gly His Leu Glu Ser Asp Met Phe Ser Ser Pro Leu
195 200 205
Glu Thr Asp Ser Met Asp Pro Phe Gly Leu Val Thr Gly Leu Glu Ala
210 215 220
Val Arg Ser Pro Ser Phe Glu Lys
225 230
<210> 47
<211> 190
<212> БЕЛОК
<213> Homo sapiens
<400> 47
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Trp Gly Asp Pro Ile
1 5 10 15
Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser Cys
20 25 30
Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly Gln
35 40 45
Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr Val
50 55 60
Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala Asp
65 70 75 80
Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe
85 90 95
Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys
100 105 110
His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr
115 120 125
Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu Pro
130 135 140
Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser Asp
145 150 155 160
Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly Leu
165 170 175
Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 48
<211> 187
<212> БЕЛОК
<213> Homo sapiens
<400> 48
Arg Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val Arg Leu Arg
1 5 10 15
His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser Cys Phe Leu Arg
20 25 30
Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly Gln Ser Ala His
35 40 45
Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr Val Ala Ile Lys
50 55 60
Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala Asp Gly Lys Met
65 70 75 80
Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe Glu Glu Glu
85 90 95
Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys His Arg Leu
100 105 110
Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr Lys Asn Arg
115 120 125
Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu Pro Met Val Pro
130 135 140
Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser Asp Met Phe Ser
145 150 155 160
Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly Leu Val Thr Gly
165 170 175
Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185
<210> 49
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 49
Arg Pro Leu Ala Phe Ser Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly
1 5 10 15
Gln Val Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 50
<211> 191
<212> БЕЛОК
<213> Homo sapiens
<400> 50
Arg His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Asp Gln
1 5 10 15
Val Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
20 25 30
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
35 40 45
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
50 55 60
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
65 70 75 80
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
85 90 95
Phe Glu Glu Glu Ile Leu Glu Asp Gly Tyr Asn Val Tyr Arg Ser Glu
100 105 110
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
115 120 125
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
130 135 140
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
145 150 155 160
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
165 170 175
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 51
<211> 191
<212> БЕЛОК
<213> Homo sapiens
<400> 51
Arg His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Asn
1 5 10 15
Val Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
20 25 30
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
35 40 45
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
50 55 60
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
65 70 75 80
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
85 90 95
Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu
100 105 110
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
115 120 125
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
130 135 140
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
145 150 155 160
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
165 170 175
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 52
<211> 187
<212> БЕЛОК
<213> Homo sapiens
<400> 52
Arg Asp Ser Ser Pro Leu Leu Gln Trp Gly Asp Pro Ile Arg Leu Arg
1 5 10 15
His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser Cys Phe Leu Arg
20 25 30
Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly Gln Ser Ala His
35 40 45
Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr Val Ala Ile Lys
50 55 60
Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala Asp Gly Lys Met
65 70 75 80
Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe Glu Glu Glu
85 90 95
Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys His Arg Leu
100 105 110
Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr Lys Asn Arg
115 120 125
Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu Pro Met Val Pro
130 135 140
Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser Asp Met Phe Ser
145 150 155 160
Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly Leu Val Thr Gly
165 170 175
Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185
<210> 53
<211> 189
<212> БЕЛОК
<213> Homo sapiens
<400> 53
Met Asp Ser Ser Pro Leu Val His Tyr Gly Trp Gly Asp Pro Ile Arg
1 5 10 15
Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser Cys Phe
20 25 30
Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly Gln Ser
35 40 45
Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr Val Ala
50 55 60
Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala Asp Gly
65 70 75 80
Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe Glu
85 90 95
Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys His
100 105 110
Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr Lys
115 120 125
Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu Pro Met
130 135 140
Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser Asp Met
145 150 155 160
Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly Leu Val
165 170 175
Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185
<210> 54
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 54
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro Leu Leu Gln Trp Gly Asp
1 5 10 15
Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 55
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 55
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Tyr Gly Trp Gly Asp
1 5 10 15
Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 56
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 56
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro Val Tyr Gly Trp Gly Asp
1 5 10 15
Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 57
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 57
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro Val His Gly Trp Gly Asp
1 5 10 15
Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 58
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 58
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro Val His Tyr Trp Gly Asp
1 5 10 15
Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 59
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 59
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His His Gly Trp Gly Asp
1 5 10 15
Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 60
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 60
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His His Tyr Trp Gly Asp
1 5 10 15
Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 61
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 61
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val Gly Trp Gly Asp
1 5 10 15
Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 62
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 62
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val Tyr Trp Gly Asp
1 5 10 15
Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 63
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 63
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Trp Gly Asp
1 5 10 15
Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 64
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 64
Arg Pro Leu Ala Phe Ser Asp Ser Ser Pro Leu Val His Trp Gly Asp
1 5 10 15
Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 65
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 65
Arg Pro Leu Ala Phe Ser Asp Ser Ser Pro His Val His Trp Gly Asp
1 5 10 15
Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 66
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 66
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Leu Gln Trp Gly Asp
1 5 10 15
Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 67
<211> 191
<212> БЕЛОК
<213> Homo sapiens
<400> 67
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val Trp Gly Asp Pro
1 5 10 15
Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
20 25 30
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
35 40 45
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
50 55 60
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
65 70 75 80
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
85 90 95
Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu
100 105 110
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
115 120 125
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
130 135 140
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
145 150 155 160
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
165 170 175
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 68
<211> 193
<212> БЕЛОК
<213> Homo sapiens
<400> 68
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Tyr Trp Gly
1 5 10 15
Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu
20 25 30
Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala
35 40 45
Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu
50 55 60
Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met
65 70 75 80
Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp
85 90 95
Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg
100 105 110
Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg
115 120 125
Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro
130 135 140
Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu
145 150 155 160
Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro
165 170 175
Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu
180 185 190
Lys
<210> 69
<211> 189
<212> БЕЛОК
<213> Homo sapiens
<400> 69
Arg Asp Ser Ser Pro Leu Val His Tyr Gly Trp Gly Asp Pro Ile Arg
1 5 10 15
Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser Cys Phe
20 25 30
Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly Gln Ser
35 40 45
Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr Val Ala
50 55 60
Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala Asp Gly
65 70 75 80
Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe Glu
85 90 95
Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys His
100 105 110
Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr Lys
115 120 125
Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu Pro Met
130 135 140
Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser Asp Met
145 150 155 160
Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly Leu Val
165 170 175
Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185
<210> 70
<211> 190
<212> БЕЛОК
<213> Homo sapiens
<400> 70
Met Arg Asp Ser Ser Pro Leu Val His Tyr Gly Trp Gly Asp Pro Ile
1 5 10 15
Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser Cys
20 25 30
Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly Gln
35 40 45
Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr Val
50 55 60
Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala Asp
65 70 75 80
Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe
85 90 95
Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys
100 105 110
His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr
115 120 125
Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu Pro
130 135 140
Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser Asp
145 150 155 160
Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly Leu
165 170 175
Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 71
<211> 181
<212> БЕЛОК
<213> Homo sapiens
<400> 71
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
1 5 10 15
Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His
20 25 30
Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser
35 40 45
Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln
50 55 60
Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly
65 70 75 80
Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg
85 90 95
Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His
100 105 110
Ser Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro
115 120 125
Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro
130 135 140
Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val
145 150 155 160
Gly Ser Ser Asp Pro Leu Ser Met Val Gly Pro Ser Gln Gly Arg Ser
165 170 175
Pro Ser Tyr Ala Ser
180
<210> 72
<211> 181
<212> БЕЛОК
<213> Homo sapiens
<400> 72
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
1 5 10 15
Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His
20 25 30
Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser
35 40 45
Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln
50 55 60
Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly
65 70 75 80
Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg
85 90 95
Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His
100 105 110
Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro
115 120 125
Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro
130 135 140
Ala Pro Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val
145 150 155 160
Gly Ser Ser Asp Pro Leu Ser Met Val Gly Pro Ser Gln Gly Arg Ser
165 170 175
Pro Ser Tyr Ala Ser
180
<210> 73
<211> 212
<212> БЕЛОК
<213> Homo sapiens
<400> 73
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
1 5 10 15
Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His
20 25 30
Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser
35 40 45
Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln
50 55 60
Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly
65 70 75 80
Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg
85 90 95
Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His
100 105 110
Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro
115 120 125
Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro
130 135 140
Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val
145 150 155 160
Gly Ser Ser Asp Pro Leu Ser Met Val Val Gln Asp Glu Leu Gln Gly
165 170 175
Val Gly Gly Glu Gly Cys His Met His Pro Glu Asn Cys Lys Thr Leu
180 185 190
Leu Thr Asp Ile Asp Arg Thr His Thr Glu Lys Pro Val Trp Asp Gly
195 200 205
Ile Thr Gly Glu
210
<210> 74
<211> 189
<212> БЕЛОК
<213> Homo sapiens
<400> 74
Arg Asp Ala Gly Pro His Val His Tyr Gly Trp Gly Asp Pro Ile Arg
1 5 10 15
Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser Cys Phe
20 25 30
Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly Gln Ser
35 40 45
Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr Val Ala
50 55 60
Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala Asp Gly
65 70 75 80
Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe Glu
85 90 95
Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys His
100 105 110
Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr Lys
115 120 125
Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu Pro Met
130 135 140
Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser Asp Met
145 150 155 160
Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly Leu Val
165 170 175
Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185
<210> 75
<211> 184
<212> БЕЛОК
<213> Homo sapiens
<400> 75
Arg Val His Tyr Gly Trp Gly Asp Pro Ile Arg Leu Arg His Leu Tyr
1 5 10 15
Thr Ser Gly Pro His Gly Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala
20 25 30
Asp Gly Val Val Asp Cys Ala Arg Gly Gln Ser Ala His Ser Leu Leu
35 40 45
Glu Ile Lys Ala Val Ala Leu Arg Thr Val Ala Ile Lys Gly Val His
50 55 60
Ser Val Arg Tyr Leu Cys Met Gly Ala Asp Gly Lys Met Gln Gly Leu
65 70 75 80
Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro
85 90 95
Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys His Arg Leu Pro Val Ser
100 105 110
Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu
115 120 125
Pro Leu Ser His Phe Leu Pro Met Leu Pro Met Val Pro Glu Glu Pro
130 135 140
Glu Asp Leu Arg Gly His Leu Glu Ser Asp Met Phe Ser Ser Pro Leu
145 150 155 160
Glu Thr Asp Ser Met Asp Pro Phe Gly Leu Val Thr Gly Leu Glu Ala
165 170 175
Val Arg Ser Pro Ser Phe Glu Lys
180
<210> 76
<211> 179
<212> БЕЛОК
<213> Homo sapiens
<400> 76
Arg Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His
1 5 10 15
Gly Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp
20 25 30
Cys Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val
35 40 45
Ala Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu
50 55 60
Cys Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu
65 70 75 80
Glu Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val
85 90 95
Tyr Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys
100 105 110
Gln Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe
115 120 125
Leu Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly
130 135 140
His Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met
145 150 155 160
Asp Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser
165 170 175
Phe Glu Lys
<210> 77
<211> 175
<212> БЕЛОК
<213> Homo sapiens
<400> 77
Arg Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
1 5 10 15
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
20 25 30
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
35 40 45
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
50 55 60
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
65 70 75 80
Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu
85 90 95
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
100 105 110
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
115 120 125
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
130 135 140
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
145 150 155 160
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
165 170 175
<210> 78
<211> 188
<212> БЕЛОК
<213> Homo sapiens
<400> 78
Arg Ala Gly Pro His Val His Tyr Gly Trp Gly Asp Pro Ile Arg Leu
1 5 10 15
Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser Cys Phe Leu
20 25 30
Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly Gln Ser Ala
35 40 45
His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr Val Ala Ile
50 55 60
Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala Asp Gly Lys
65 70 75 80
Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe Glu Glu
85 90 95
Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys His Arg
100 105 110
Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr Lys Asn
115 120 125
Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu Pro Met Val
130 135 140
Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser Asp Met Phe
145 150 155 160
Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly Leu Val Thr
165 170 175
Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185
<210> 79
<211> 187
<212> БЕЛОК
<213> Homo sapiens
<400> 79
Arg Gly Pro His Val His Tyr Gly Trp Gly Asp Pro Ile Arg Leu Arg
1 5 10 15
His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser Cys Phe Leu Arg
20 25 30
Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly Gln Ser Ala His
35 40 45
Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr Val Ala Ile Lys
50 55 60
Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala Asp Gly Lys Met
65 70 75 80
Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe Glu Glu Glu
85 90 95
Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys His Arg Leu
100 105 110
Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr Lys Asn Arg
115 120 125
Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu Pro Met Val Pro
130 135 140
Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser Asp Met Phe Ser
145 150 155 160
Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly Leu Val Thr Gly
165 170 175
Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185
<210> 80
<211> 186
<212> БЕЛОК
<213> Homo sapiens
<400> 80
Arg Pro His Val His Tyr Gly Trp Gly Asp Pro Ile Arg Leu Arg His
1 5 10 15
Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser Cys Phe Leu Arg Ile
20 25 30
Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly Gln Ser Ala His Ser
35 40 45
Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr Val Ala Ile Lys Gly
50 55 60
Val His Ser Val Arg Tyr Leu Cys Met Gly Ala Asp Gly Lys Met Gln
65 70 75 80
Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe Glu Glu Glu Ile
85 90 95
Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys His Arg Leu Pro
100 105 110
Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr Lys Asn Arg Gly
115 120 125
Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu Pro Met Val Pro Glu
130 135 140
Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser Asp Met Phe Ser Ser
145 150 155 160
Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly Leu Val Thr Gly Leu
165 170 175
Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185
<210> 81
<211> 185
<212> БЕЛОК
<213> Homo sapiens
<400> 81
Arg His Val His Tyr Gly Trp Gly Asp Pro Ile Arg Leu Arg His Leu
1 5 10 15
Tyr Thr Ser Gly Pro His Gly Leu Ser Ser Cys Phe Leu Arg Ile Arg
20 25 30
Ala Asp Gly Val Val Asp Cys Ala Arg Gly Gln Ser Ala His Ser Leu
35 40 45
Leu Glu Ile Lys Ala Val Ala Leu Arg Thr Val Ala Ile Lys Gly Val
50 55 60
His Ser Val Arg Tyr Leu Cys Met Gly Ala Asp Gly Lys Met Gln Gly
65 70 75 80
Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe Glu Glu Glu Ile Arg
85 90 95
Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys His Arg Leu Pro Val
100 105 110
Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr Lys Asn Arg Gly Phe
115 120 125
Leu Pro Leu Ser His Phe Leu Pro Met Leu Pro Met Val Pro Glu Glu
130 135 140
Pro Glu Asp Leu Arg Gly His Leu Glu Ser Asp Met Phe Ser Ser Pro
145 150 155 160
Leu Glu Thr Asp Ser Met Asp Pro Phe Gly Leu Val Thr Gly Leu Glu
165 170 175
Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185
<210> 82
<211> 194
<212> БЕЛОК
<213> Homo sapiens
<400> 82
Arg Pro Leu Ala Phe Ser Ala Ala Gly Pro His Val His Tyr Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln
115 120 125
Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 83
<211> 194
<212> БЕЛОК
<213> Homo sapiens
<400> 83
Arg Pro Leu Ala Phe Ser Asp Ala Ala Pro His Val His Tyr Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln
115 120 125
Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 84
<211> 194
<212> БЕЛОК
<213> Homo sapiens
<400> 84
Arg Pro Leu Ala Phe Ser Asp Ala Gly Ala His Val His Tyr Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln
115 120 125
Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 85
<211> 194
<212> БЕЛОК
<213> Homo sapiens
<400> 85
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Tyr Gly Ala
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln
115 120 125
Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 86
<211> 194
<212> БЕЛОК
<213> Homo sapiens
<400> 86
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Tyr Gly Trp
1 5 10 15
Gly Ala Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln
115 120 125
Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 87
<211> 167
<212> БЕЛОК
<213> Homo sapiens
<400> 87
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Tyr Gly Trp
1 5 10 15
Gly Asp Ala Ile Cys Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu
20 25 30
Ile Lys Ala Val Ala Leu Arg Thr Val Ala Ile Lys Gly Val His Ser
35 40 45
Val Arg Tyr Leu Cys Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu
50 55 60
Gln Tyr Ser Glu Glu Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp
65 70 75 80
Gly Tyr Asn Val Tyr Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu
85 90 95
Ser Ser Ala Lys Gln Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro
100 105 110
Leu Ser His Phe Leu Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu
115 120 125
Asp Leu Arg Gly His Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu
130 135 140
Thr Asp Ser Met Asp Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val
145 150 155 160
Arg Ser Pro Ser Phe Glu Lys
165
<210> 88
<211> 194
<212> БЕЛОК
<213> Homo sapiens
<400> 88
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Tyr Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro Ala Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln
115 120 125
Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ala His Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 89
<211> 194
<212> БЕЛОК
<213> Homo sapiens
<400> 89
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Tyr Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro Ala Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln
115 120 125
Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser Ala Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 90
<211> 194
<212> БЕЛОК
<213> Homo sapiens
<400> 90
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Tyr Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Ala Gln
115 120 125
Ala Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 91
<211> 194
<212> БЕЛОК
<213> Homo sapiens
<400> 91
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Tyr Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Ala Gln
115 120 125
Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ala His Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 92
<211> 194
<212> БЕЛОК
<213> Homo sapiens
<400> 92
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Tyr Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Ala Gln
115 120 125
Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser Ala Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 93
<211> 194
<212> БЕЛОК
<213> Homo sapiens
<400> 93
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Tyr Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln
115 120 125
Ala Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ala His Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 94
<211> 194
<212> БЕЛОК
<213> Homo sapiens
<400> 94
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Tyr Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln
115 120 125
Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ala Ala Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 95
<211> 194
<212> БЕЛОК
<213> Homo sapiens
<400> 95
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Tyr Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Ala Gln
115 120 125
Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser Ala Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 96
<211> 194
<212> БЕЛОК
<213> Homo sapiens
<400> 96
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Tyr Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Ala Gln
115 120 125
Ala Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ala His Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 97
<211> 194
<212> БЕЛОК
<213> Homo sapiens
<400> 97
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Tyr Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Ala Gln
115 120 125
Ala Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser Ala Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 98
<211> 194
<212> БЕЛОК
<213> Homo sapiens
<400> 98
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Tyr Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Ala Gln
115 120 125
Ala Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ala Ala Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 99
<211> 194
<212> БЕЛОК
<213> Homo sapiens
<400> 99
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Tyr Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln
115 120 125
Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 100
<211> 181
<212> БЕЛОК
<213> Homo sapiens
<400> 100
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
1 5 10 15
Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His
20 25 30
Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser
35 40 45
Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln
50 55 60
Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly
65 70 75 80
Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg
85 90 95
Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His
100 105 110
Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro
115 120 125
Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro
130 135 140
Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val
145 150 155 160
Gly Ser Ser Asp Pro Leu Ser Met Val Gly Pro Ser Gln Gly Arg Ser
165 170 175
Pro Ser Tyr Ala Ser
180
<210> 101
<211> 4
<212> БЕЛОК
<213> Homo sapiens
<400> 101
Val His Tyr Gly
1
<210> 102
<211> 9
<212> БЕЛОК
<213> Homo sapiens
<400> 102
Asp Ala Ser Pro His Val His Tyr Gly
1 5
<210> 103
<211> 9
<212> БЕЛОК
<213> Homo sapiens
<400> 103
Asp Ser Ser Pro Leu Val His Tyr Gly
1 5
<210> 104
<211> 7
<212> БЕЛОК
<213> Homo sapiens
<400> 104
Asp Ser Ser Pro Leu Leu Gln
1 5
<210> 105
<211> 12
<212> БЕЛОК
<213> Homo sapiens
<400> 105
Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
1 5 10
<210> 106
<211> 5
<212> БЕЛОК
<213> Homo sapiens
<400> 106
Arg His Pro Ile Pro
1 5
<210> 107
<211> 4
<212> БЕЛОК
<213> Homo sapiens
<400> 107
His Pro Ile Pro
1
<210> 108
<211> 5
<212> БЕЛОК
<213> Homo sapiens
<400> 108
Arg Pro Leu Ala Phe
1 5
<210> 109
<211> 4
<212> БЕЛОК
<213> Homo sapiens
<400> 109
Pro Leu Ala Phe
1
<210> 110
<211> 6
<212> БЕЛОК
<213> Homo sapiens
<400> 110
Met Asp Ser Ser Pro Leu
1 5
<210> 111
<211> 7
<212> БЕЛОК
<213> Homo sapiens
<400> 111
Met Ser Asp Ser Ser Pro Leu
1 5
<210> 112
<211> 6
<212> БЕЛОК
<213> Homo sapiens
<400> 112
Ser Asp Ser Ser Pro Leu
1 5
<210> 113
<211> 5
<212> БЕЛОК
<213> Homo sapiens
<400> 113
Met Ser Ser Pro Leu
1 5
<210> 114
<211> 4
<212> БЕЛОК
<213> Homo sapiens
<400> 114
Ser Ser Pro Leu
1
<210> 115
<211> 4
<212> БЕЛОК
<213> Homo sapiens
<400> 115
Arg Asp Ser Ser
1
<210> 116
<211> 4
<212> БЕЛОК
<213> Homo sapiens
<400> 116
Met Asp Ser Ser
1
<210> 117
<211> 5
<212> БЕЛОК
<213> Homo sapiens
<400> 117
Met Arg Asp Ser Ser
1 5
<210> 118
<211> 5
<212> БЕЛОК
<213> Homo sapiens
<400> 118
Met Ser Ser Pro Leu
1 5
<210> 119
<211> 6
<212> БЕЛОК
<213> Homo sapiens
<400> 119
Met Asp Ser Ser Pro Leu
1 5
<210> 120
<211> 7
<212> БЕЛОК
<213> Homo sapiens
<400> 120
Met Ser Asp Ser Ser Pro Leu
1 5
<210> 121
<211> 5
<212> БЕЛОК
<213> Homo sapiens
<400> 121
Asp Ser Ser Pro Leu
1 5
<210> 122
<211> 5
<212> БЕЛОК
<213> Homo sapiens
<400> 122
Asp Ala Ser Pro His
1 5
<210> 123
<211> 4
<212> БЕЛОК
<213> Homo sapiens
<400> 123
Arg Asp Ser Ser
1
<210> 124
<211> 4
<212> БЕЛОК
<213> Homo sapiens
<400> 124
Met Asp Ser Ser
1
<210> 125
<211> 5
<212> БЕЛОК
<213> Homo sapiens
<400> 125
Met Arg Asp Ser Ser
1 5
<210> 126
<211> 6
<212> БЕЛОК
<213> Homo sapiens
<400> 126
Met Asp Ser Ser Pro Leu
1 5
<210> 127
<211> 7
<212> БЕЛОК
<213> Homo sapiens
<400> 127
Met Ser Asp Ser Ser Pro Leu
1 5
<210> 128
<211> 5
<212> БЕЛОК
<213> Homo sapiens
<400> 128
Met Ser Ser Pro Leu
1 5
<210> 129
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: последовательность линкера
<400> 129
Gly Ser Gly Gly Ser
1 5
<210> 130
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: последовательность линкера
<400> 130
Gly Gly Gly Ser
1
<210> 131
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: последовательность линкера
<400> 131
Gly Gly Ser Gly
1
<210> 132
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: последовательность линкера
<400> 132
Gly Gly Ser Gly Gly
1 5
<210> 133
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: последовательность линкера
<400> 133
Gly Ser Gly Ser Gly
1 5
<210> 134
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: последовательность линкера
<400> 134
Gly Ser Gly Gly Gly
1 5
<210> 135
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: последовательность линкера
<400> 135
Gly Ser Ser Ser Gly
1 5
<210> 136
<211> 32
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: прямой праймер
<400> 136
ccgactagtc accatgcgga gcgggtgtgt gg 32
<210> 137
<211> 41
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: обратный праймер
<400> 137
ataagaatgc ggccgcttac ttctcaaagc tgggactcct c 41
<210> 138
<211> 186
<212> БЕЛОК
<213> Homo sapiens
<400> 138
Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val Arg Leu Arg His
1 5 10 15
Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser Cys Phe Leu Arg Ile
20 25 30
Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly Gln Ser Ala His Ser
35 40 45
Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr Val Ala Ile Lys Gly
50 55 60
Val His Ser Val Arg Tyr Leu Cys Met Gly Ala Asp Gly Lys Met Gln
65 70 75 80
Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe Glu Glu Glu Ile
85 90 95
Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys His Arg Leu Pro
100 105 110
Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr Lys Asn Arg Gly
115 120 125
Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu Pro Met Val Pro Glu
130 135 140
Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser Asp Met Phe Ser Ser
145 150 155 160
Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly Leu Val Thr Gly Leu
165 170 175
Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185
<210> 139
<211> 194
<212> БЕЛОК
<213> Homo sapiens
<400> 139
Arg Pro Leu Ala Phe Ser Asp Ala Ser Pro His Val His Tyr Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln
115 120 125
Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 140
<211> 194
<212> БЕЛОК
<213> Homo sapiens
<400> 140
Arg Pro Leu Ala Phe Ser Asp Ser Ser Pro Leu Val His Tyr Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln
115 120 125
Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 141
<211> 188
<212> БЕЛОК
<213> Homo sapiens
<400> 141
Asp Ser Ser Pro Leu Val His Tyr Gly Trp Gly Asp Pro Ile Arg Leu
1 5 10 15
Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser Cys Phe Leu
20 25 30
Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly Gln Ser Ala
35 40 45
His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr Val Ala Ile
50 55 60
Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala Asp Gly Lys
65 70 75 80
Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe Glu Glu
85 90 95
Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys His Arg
100 105 110
Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr Lys Asn
115 120 125
Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu Pro Met Val
130 135 140
Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser Asp Met Phe
145 150 155 160
Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly Leu Val Thr
165 170 175
Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185
<210> 142
<211> 193
<212> БЕЛОК
<213> Homo sapiens
<400> 142
Arg His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Trp Gly
1 5 10 15
Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu
20 25 30
Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala
35 40 45
Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu
50 55 60
Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met
65 70 75 80
Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp
85 90 95
Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg
100 105 110
Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg
115 120 125
Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro
130 135 140
Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu
145 150 155 160
Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro
165 170 175
Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu
180 185 190
Lys
<210> 143
<211> 191
<212> БЕЛОК
<213> Homo sapiens
<400> 143
Arg His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Trp Gly Asp Pro
1 5 10 15
Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
20 25 30
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
35 40 45
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
50 55 60
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
65 70 75 80
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
85 90 95
Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu
100 105 110
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
115 120 125
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
130 135 140
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
145 150 155 160
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
165 170 175
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 144
<211> 194
<212> БЕЛОК
<213> Homo sapiens
<400> 144
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro Leu Leu Gln Phe Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln
115 120 125
Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 145
<211> 193
<212> БЕЛОК
<213> Homo sapiens
<400> 145
Arg His Pro Ile Pro Asp Ser Ser Pro His Val His Tyr Gly Trp Gly
1 5 10 15
Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu
20 25 30
Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala
35 40 45
Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu
50 55 60
Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met
65 70 75 80
Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp
85 90 95
Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg
100 105 110
Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg
115 120 125
Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro
130 135 140
Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu
145 150 155 160
Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro
165 170 175
Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu
180 185 190
Lys
<210> 146
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 146
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro Leu Leu Gln Phe Gly Gly
1 5 10 15
Gln Val Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 147
<211> 191
<212> БЕЛОК
<213> Homo sapiens
<400> 147
Arg His Pro Ile Pro Asp Ser Ser Pro His Val His Tyr Gly Gly Gln
1 5 10 15
Val Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
20 25 30
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
35 40 45
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
50 55 60
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
65 70 75 80
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
85 90 95
Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu
100 105 110
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
115 120 125
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
130 135 140
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
145 150 155 160
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
165 170 175
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 148
<211> 187
<212> БЕЛОК
<213> Homo sapiens
<400> 148
Arg Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val Arg Leu Arg
1 5 10 15
His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser Cys Phe Leu Arg
20 25 30
Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly Gln Ser Ala His
35 40 45
Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr Val Ala Ile Lys
50 55 60
Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala Asp Gly Lys Met
65 70 75 80
Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe Glu Glu Glu
85 90 95
Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys His Arg Leu
100 105 110
Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr Lys Asn Arg
115 120 125
Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu Pro Met Val Pro
130 135 140
Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser Asp Met Phe Ser
145 150 155 160
Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly Leu Val Thr Gly
165 170 175
Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185
<210> 149
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 149
Arg Pro Leu Ala Phe Ser Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly
1 5 10 15
Gln Val Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 150
<211> 191
<212> БЕЛОК
<213> Homo sapiens
<400> 150
Arg His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Ala Gln
1 5 10 15
Val Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
20 25 30
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
35 40 45
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
50 55 60
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
65 70 75 80
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
85 90 95
Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu
100 105 110
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
115 120 125
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
130 135 140
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
145 150 155 160
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
165 170 175
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 151
<211> 191
<212> БЕЛОК
<213> Homo sapiens
<400> 151
Arg His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Asp Gln
1 5 10 15
Val Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
20 25 30
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
35 40 45
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
50 55 60
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
65 70 75 80
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
85 90 95
Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu
100 105 110
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
115 120 125
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
130 135 140
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
145 150 155 160
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
165 170 175
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 152
<211> 191
<212> БЕЛОК
<213> Homo sapiens
<400> 152
Arg His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Pro Gln
1 5 10 15
Val Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
20 25 30
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
35 40 45
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
50 55 60
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
65 70 75 80
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
85 90 95
Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu
100 105 110
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
115 120 125
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
130 135 140
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
145 150 155 160
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
165 170 175
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 153
<211> 191
<212> БЕЛОК
<213> Homo sapiens
<400> 153
Arg His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Ala
1 5 10 15
Val Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
20 25 30
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
35 40 45
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
50 55 60
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
65 70 75 80
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
85 90 95
Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu
100 105 110
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
115 120 125
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
130 135 140
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
145 150 155 160
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
165 170 175
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 154
<211> 191
<212> БЕЛОК
<213> Homo sapiens
<400> 154
Arg His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Glu
1 5 10 15
Val Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
20 25 30
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
35 40 45
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
50 55 60
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
65 70 75 80
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
85 90 95
Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu
100 105 110
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
115 120 125
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
130 135 140
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
145 150 155 160
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
165 170 175
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 155
<211> 191
<212> БЕЛОК
<213> Homo sapiens
<400> 155
Arg His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Asn
1 5 10 15
Val Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
20 25 30
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
35 40 45
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
50 55 60
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
65 70 75 80
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
85 90 95
Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu
100 105 110
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
115 120 125
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
130 135 140
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
145 150 155 160
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
165 170 175
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 156
<211> 191
<212> БЕЛОК
<213> Homo sapiens
<400> 156
Arg His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln
1 5 10 15
Ala Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
20 25 30
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
35 40 45
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
50 55 60
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
65 70 75 80
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
85 90 95
Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu
100 105 110
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
115 120 125
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
130 135 140
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
145 150 155 160
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
165 170 175
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 157
<211> 191
<212> БЕЛОК
<213> Homo sapiens
<400> 157
Arg His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln
1 5 10 15
Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
20 25 30
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
35 40 45
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
50 55 60
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
65 70 75 80
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
85 90 95
Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu
100 105 110
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
115 120 125
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
130 135 140
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
145 150 155 160
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
165 170 175
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 158
<211> 191
<212> БЕЛОК
<213> Homo sapiens
<400> 158
Arg His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln
1 5 10 15
Thr Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
20 25 30
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
35 40 45
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
50 55 60
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
65 70 75 80
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
85 90 95
Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu
100 105 110
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
115 120 125
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
130 135 140
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
145 150 155 160
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
165 170 175
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 159
<211> 193
<212> БЕЛОК
<213> Homo sapiens
<400> 159
Arg His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Trp Gly
1 5 10 15
Gln Pro Val Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu
20 25 30
Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala
35 40 45
Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu
50 55 60
Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met
65 70 75 80
Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp
85 90 95
Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg
100 105 110
Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg
115 120 125
Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro
130 135 140
Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu
145 150 155 160
Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro
165 170 175
Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu
180 185 190
Lys
<210> 160
<211> 190
<212> БЕЛОК
<213> Homo sapiens
<400> 160
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
1 5 10 15
Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser Cys
20 25 30
Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly Gln
35 40 45
Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr Val
50 55 60
Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala Asp
65 70 75 80
Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe
85 90 95
Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys
100 105 110
His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr
115 120 125
Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu Pro
130 135 140
Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser Asp
145 150 155 160
Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly Leu
165 170 175
Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 161
<211> 186
<212> БЕЛОК
<213> Homo sapiens
<400> 161
Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val Arg Leu Arg His
1 5 10 15
Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser Cys Phe Leu Arg Ile
20 25 30
Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly Gln Ser Ala His Ser
35 40 45
Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr Val Ala Ile Lys Gly
50 55 60
Val His Ser Val Arg Tyr Leu Cys Met Gly Ala Asp Gly Lys Met Gln
65 70 75 80
Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe Glu Glu Glu Ile
85 90 95
Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys His Arg Leu Pro
100 105 110
Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr Lys Asn Arg Gly
115 120 125
Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu Pro Met Val Pro Glu
130 135 140
Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser Asp Met Phe Ser Ser
145 150 155 160
Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly Leu Val Thr Gly Leu
165 170 175
Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185
<210> 162
<211> 190
<212> БЕЛОК
<213> Homo sapiens
<400> 162
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Trp Gly Asp Pro Ile
1 5 10 15
Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser Cys
20 25 30
Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly Gln
35 40 45
Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr Val
50 55 60
Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala Asp
65 70 75 80
Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe
85 90 95
Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys
100 105 110
His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr
115 120 125
Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu Pro
130 135 140
Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser Asp
145 150 155 160
Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly Leu
165 170 175
Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 163
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 163
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Trp Gly Asp
1 5 10 15
Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 164
<211> 192
<212> БЕЛОК
<213> Homo sapiens
<400> 164
His Pro Ile Pro Asp Ser Ser Pro His Val His Tyr Gly Trp Gly Asp
1 5 10 15
Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser
20 25 30
Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg
35 40 45
Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg
50 55 60
Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly
65 70 75 80
Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys
85 90 95
Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser
100 105 110
Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln
115 120 125
Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met
130 135 140
Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu
145 150 155 160
Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe
165 170 175
Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 165
<211> 190
<212> БЕЛОК
<213> Homo sapiens
<400> 165
His Pro Ile Pro Asp Ser Ser Pro His Val His Tyr Gly Gly Gln Val
1 5 10 15
Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser Cys
20 25 30
Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly Gln
35 40 45
Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr Val
50 55 60
Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala Asp
65 70 75 80
Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe
85 90 95
Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys
100 105 110
His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr
115 120 125
Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu Pro
130 135 140
Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser Asp
145 150 155 160
Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly Leu
165 170 175
Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 166
<211> 188
<212> БЕЛОК
<213> Homo sapiens
<400> 166
Asp Ala Gly Pro His Val His Tyr Gly Trp Gly Asp Pro Ile Arg Leu
1 5 10 15
Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser Cys Phe Leu
20 25 30
Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly Gln Ser Ala
35 40 45
His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr Val Ala Ile
50 55 60
Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala Asp Gly Lys
65 70 75 80
Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe Glu Glu
85 90 95
Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys His Arg
100 105 110
Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr Lys Asn
115 120 125
Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu Pro Met Val
130 135 140
Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser Asp Met Phe
145 150 155 160
Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly Leu Val Thr
165 170 175
Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185
<210> 167
<211> 183
<212> БЕЛОК
<213> Homo sapiens
<400> 167
Val His Tyr Gly Trp Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr
1 5 10 15
Ser Gly Pro His Gly Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp
20 25 30
Gly Val Val Asp Cys Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu
35 40 45
Ile Lys Ala Val Ala Leu Arg Thr Val Ala Ile Lys Gly Val His Ser
50 55 60
Val Arg Tyr Leu Cys Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu
65 70 75 80
Gln Tyr Ser Glu Glu Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp
85 90 95
Gly Tyr Asn Val Tyr Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu
100 105 110
Ser Ser Ala Lys Gln Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro
115 120 125
Leu Ser His Phe Leu Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu
130 135 140
Asp Leu Arg Gly His Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu
145 150 155 160
Thr Asp Ser Met Asp Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val
165 170 175
Arg Ser Pro Ser Phe Glu Lys
180
<210> 168
<211> 174
<212> БЕЛОК
<213> Homo sapiens
<400> 168
Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser Cys
1 5 10 15
Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly Gln
20 25 30
Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr Val
35 40 45
Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala Asp
50 55 60
Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe
65 70 75 80
Glu Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys
85 90 95
His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr
100 105 110
Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu Pro
115 120 125
Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser Asp
130 135 140
Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly Leu
145 150 155 160
Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
165 170
<210> 169
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<400> 169
Trp Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly
1 5 10
<210> 170
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<400> 170
Trp Gly Asp Pro Ile
1 5
<210> 171
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<400> 171
Trp Gly Pro Ile
1
<210> 172
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<400> 172
Trp Gly Asp Pro Val
1 5
<210> 173
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<400> 173
Trp Gly Asp Ile
1
<210> 174
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<400> 174
Gly Asp Pro Ile
1
<210> 175
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<400> 175
Trp Gly Gln Pro Ile
1 5
<210> 176
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<400> 176
Trp Gly Ala Pro Ile
1 5
<210> 177
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<400> 177
Ala Gly Asp Pro Ile
1 5
<210> 178
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<400> 178
Trp Ala Asp Pro Ile
1 5
<210> 179
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<400> 179
Trp Gly Asp Ala Ile
1 5
<210> 180
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<400> 180
Trp Gly Asp Pro Ala
1 5
<210> 181
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<400> 181
Trp Asp Pro Ile
1
<210> 182
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<400> 182
Trp Gly Asp Ile
1
<210> 183
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<400> 183
Trp Gly Asp Pro
1
<210> 184
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<400> 184
Phe Gly Asp Pro Ile
1 5
<210> 185
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<400> 185
Arg Leu Arg His Leu Tyr Thr Ser Gly
1 5
<210> 186
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> коровая последовательность
<400> 186
Arg Gln Arg Tyr Leu Tyr Thr Asp Asp
1 5
<210> 187
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<400> 187
Ala Gly Pro His Val His Tyr Gly Trp Gly Asp Pro Ile
1 5 10
<210> 188
<211> 165
<212> БЕЛОК
<213> Homo sapiens
<220>
<223> C-концевая последовательность FGF19
<400> 188
Pro His Gly Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val
1 5 10 15
Val Asp Cys Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys
20 25 30
Ala Val Ala Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg
35 40 45
Tyr Leu Cys Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr
50 55 60
Ser Glu Glu Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro Asp Gly Tyr
65 70 75 80
Asn Val Tyr Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser
85 90 95
Ala Lys Gln Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser
100 105 110
His Phe Leu Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu
115 120 125
Arg Gly His Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp
130 135 140
Ser Met Asp Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser
145 150 155 160
Pro Ser Phe Glu Lys
165
<210> 189
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность линкера
<400> 189
Gly Gly Gly Ser Gly
1 5
<210> 190
<211> 11
<212> БЕЛОК
<213> Homo sapiens
<220>
<223> Область лист-8/петля-8/лист-9 в FGF19
<400> 190
Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr
1 5 10
<210> 191
<211> 11
<212> БЕЛОК
<213> Homo sapiens
<220>
<223> Область лист-8/петля-8/лист-9 в FGF21
<400> 191
Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr
1 5 10
<210> 192
<211> 187
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность M53
<400> 192
Met Asp Ser Ser Pro Leu Leu Gln Trp Gly Asp Pro Ile Arg Leu Arg
1 5 10 15
His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser Cys Phe Leu Arg
20 25 30
Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly Gln Ser Ala His
35 40 45
Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr Val Ala Ile Lys
50 55 60
Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala Asp Gly Lys Met
65 70 75 80
Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe Glu Glu Glu
85 90 95
Ile Arg Pro Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys His Arg Leu
100 105 110
Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr Lys Asn Arg
115 120 125
Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu Pro Met Val Pro
130 135 140
Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser Asp Met Phe Ser
145 150 155 160
Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly Leu Val Thr Gly
165 170 175
Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185
<210> 193
<211> 194
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность M139
<400> 193
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Tyr Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Leu Pro Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln
115 120 125
Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 194
<211> 194
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность M140
<400> 194
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Tyr Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Arg Glu Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln
115 120 125
Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 195
<211> 194
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность M141
<400> 195
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Tyr Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Leu Cys Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln
115 120 125
Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 196
<211> 194
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность M160
<400> 196
Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro His Val His Tyr Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Gln Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Leu Glu Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln
115 120 125
Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 197
<211> 189
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность M200
<400> 197
Arg Asp Ser Ser Pro Leu Val His Tyr Gly Trp Gly Asp Pro Ile Arg
1 5 10 15
Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser Cys Phe
20 25 30
Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly Gln Ser
35 40 45
Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr Val Ala
50 55 60
Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala Asp Gly
65 70 75 80
Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe Glu
85 90 95
Glu Glu Ile Leu Glu Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys His
100 105 110
Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr Lys
115 120 125
Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu Pro Met
130 135 140
Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser Asp Met
145 150 155 160
Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly Leu Val
165 170 175
Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185
<210> 198
<211> 194
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность M201
<400> 198
Arg Pro Leu Ala Phe Ser Asp Ser Ser Pro Leu Val His Tyr Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Leu Glu Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln
115 120 125
Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 199
<211> 194
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность M202
<400> 199
Arg Pro Leu Ala Phe Ser Asp Ala Ser Pro His Val His Tyr Gly Trp
1 5 10 15
Gly Asp Pro Ile Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly
20 25 30
Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys
35 40 45
Ala Arg Gly Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala
50 55 60
Leu Arg Thr Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys
65 70 75 80
Met Gly Ala Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu
85 90 95
Asp Cys Ala Phe Glu Glu Glu Ile Leu Glu Asp Gly Tyr Asn Val Tyr
100 105 110
Arg Ser Glu Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln
115 120 125
Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu
130 135 140
Pro Met Leu Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His
145 150 155 160
Leu Glu Ser Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp
165 170 175
Pro Phe Gly Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe
180 185 190
Glu Lys
<210> 200
<211> 187
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность M203
<400> 200
Arg Asp Ser Ser Pro Leu Leu Gln Trp Gly Asp Pro Ile Arg Leu Arg
1 5 10 15
His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser Cys Phe Leu Arg
20 25 30
Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly Gln Ser Ala His
35 40 45
Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr Val Ala Ile Lys
50 55 60
Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala Asp Gly Lys Met
65 70 75 80
Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe Glu Glu Glu
85 90 95
Ile Leu Glu Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys His Arg Leu
100 105 110
Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr Lys Asn Arg
115 120 125
Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu Pro Met Val Pro
130 135 140
Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser Asp Met Phe Ser
145 150 155 160
Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly Leu Val Thr Gly
165 170 175
Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185
<210> 201
<211> 191
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность M204
<400> 201
Arg His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Asp Gln
1 5 10 15
Val Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
20 25 30
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
35 40 45
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
50 55 60
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
65 70 75 80
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
85 90 95
Phe Glu Glu Glu Ile Leu Glu Asp Gly Tyr Asn Val Tyr Arg Ser Glu
100 105 110
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
115 120 125
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
130 135 140
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
145 150 155 160
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
165 170 175
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 202
<211> 187
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность M205
<400> 202
Arg Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val Arg Leu Arg
1 5 10 15
His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser Cys Phe Leu Arg
20 25 30
Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly Gln Ser Ala His
35 40 45
Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr Val Ala Ile Lys
50 55 60
Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala Asp Gly Lys Met
65 70 75 80
Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe Glu Glu Glu
85 90 95
Ile Leu Glu Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys His Arg Leu
100 105 110
Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr Lys Asn Arg
115 120 125
Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu Pro Met Val Pro
130 135 140
Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser Asp Met Phe Ser
145 150 155 160
Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly Leu Val Thr Gly
165 170 175
Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185
<210> 203
<211> 191
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность M206
<400> 203
Arg His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln
1 5 10 15
Val Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser
20 25 30
Cys Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly
35 40 45
Gln Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr
50 55 60
Val Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala
65 70 75 80
Asp Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala
85 90 95
Phe Glu Glu Glu Ile Leu Glu Asp Gly Tyr Asn Val Tyr Arg Ser Glu
100 105 110
Lys His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu
115 120 125
Tyr Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu
130 135 140
Pro Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser
145 150 155 160
Asp Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly
165 170 175
Leu Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 204
<211> 190
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность M207
<400> 204
Met Arg Asp Ser Ser Pro Leu Val His Tyr Gly Trp Gly Asp Pro Ile
1 5 10 15
Arg Leu Arg His Leu Tyr Thr Ser Gly Pro His Gly Leu Ser Ser Cys
20 25 30
Phe Leu Arg Ile Arg Ala Asp Gly Val Val Asp Cys Ala Arg Gly Gln
35 40 45
Ser Ala His Ser Leu Leu Glu Ile Lys Ala Val Ala Leu Arg Thr Val
50 55 60
Ala Ile Lys Gly Val His Ser Val Arg Tyr Leu Cys Met Gly Ala Asp
65 70 75 80
Gly Lys Met Gln Gly Leu Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe
85 90 95
Glu Glu Glu Ile Leu Glu Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys
100 105 110
His Arg Leu Pro Val Ser Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr
115 120 125
Lys Asn Arg Gly Phe Leu Pro Leu Ser His Phe Leu Pro Met Leu Pro
130 135 140
Met Val Pro Glu Glu Pro Glu Asp Leu Arg Gly His Leu Glu Ser Asp
145 150 155 160
Met Phe Ser Ser Pro Leu Glu Thr Asp Ser Met Asp Pro Phe Gly Leu
165 170 175
Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Phe Glu Lys
180 185 190
<210> 205
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Модифицированная область лист-8/петля-8/лист-9 в FGF19
<400> 205
Glu Glu Ile Leu Glu Asp Gly Tyr Asn Val Tyr
1 5 10
<---