Результат интеллектуальной деятельности: СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ СПИНОЦЕРЕБЕЛЛЯРНОЙ АТАКСИИ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
[0001]
Настоящее изобретение относится к средству для профилактики или лечения спиноцеребеллярной атаксии, включающему 1–(3–(2–(1–бензотиофен–5–ил)этокси)пропил)азетидин–3–ол или его соль в качестве активного ингредиента.
Предпосылки создания изобретения
[0002]
Спиноцеребеллярная атаксия представляет собой нейродегенеративное заболевание, основными симптомами которого являются атаксия мозжечка или заднего столба спинного мозга и спастическая параплегия. Спиноцеребеллярную атаксию можно условно подразделить на два типа: наследственную спиноцеребеллярную атаксию и ненаследственную спиноцеребеллярную атаксию. Примеры наследственной спиноцеребеллярной атаксии включают наследственную оливопонтоцеребеллярную атрофию, наследственную кортикальную мозжечковую атрофию, спиноцеребеллярную атаксию 1 типа, спиноцеребеллярную атаксию 2 типа, спиноцеребеллярную атаксию 3 типа (болезнь Мачадо–Джозефа), спиноцеребеллярную атаксию 6 типа, спиноцеребеллярную атаксию 31 типа, наследственную дентато–рубро–паллидо–льюисову атрофию, атаксию–телеангиэктазию, атаксию Фридрейха, атаксию с дефицитом витамина Е, дефицитом апратаксина, дефицитом сенатаксина, спастическую атаксию Шарлевуа–Сагенэ и наследственную спастическую параплегию. Примеры ненаследственной спиноцеребеллярной атаксии включают оливопонтоцеребеллярную атрофию, синдром Шая–Дрейджера, стрионигральную дегенерацию и кортикальную мозжечковую атрофию. Хотя спиноцеребеллярная атаксия с начальным симптомом мозжечковой атаксии была названа оливопонтоцеребеллярной атрофией, она же с начальным симптомом паркинсонизма была названа стрионигральной дегенерацией, и она же со значительной вегетативной невропатией, такой как ортостатическая гипотензия, была названа синдромом Шая–Дрейджера, исходя из того, что во всех случаях симптомы пересекаются по мере прогрессирования заболевания, обнаруживаются атрофия ствола мозга и мозжечка и стриарные аномалии, и из того, что имеются общие гистопатологические данные, эти заболевания в совокупности можно назвать множественной системной атрофией.
Для лекарственной терапии при всех симптомах атаксии используются тиреотропин–рилизинг–гормон (ТРГ) или производные ТРГ. Лекарственные средства, симптоматически используемые для каждого заболевания, включают мексилетин гидрохлорид при болезненных мышечных спазмах и ацетазоламид при эпизодической дистонии и симптомах головокружения.
[0003]
Известно, что 1–(3–(2–(1–бензотиофен–5–ил)этокси)пропил)азетидин–3–ол (именуемый далее "Соединение A") или его соль обладает нейропротекторным, стимулирующим регенерацию нервов и рост нейритов действием и является полезным в качестве терапевтического средства при заболеваниях центральной и периферической нервной системы (Патентная литература 1). Кроме того, публикация раскрывает, что обычно лекарственное средство можно вводить взрослому человеку в дозе или раздельными дозами от 0,01 до 500 мг в день (Патентная литература 2).
Литература предшествующего уровня техники
Патентная литература
[0004]
Патентная литература 1: Международная публикация WO 2003/035647
Патентная литература 2: Международная публикация WO 2003/105830
Сущность изобретения
Задача, решаемая настоящим изобретением
[0005]
Целью настоящего изобретения является обеспечение превосходного лекарственного средства для профилактики или лечения спиноцеребеллярной атаксии.
Средства решения задачи
[0006]
При таких обстоятельствах авторы настоящего изобретения обнаружили, что Соединение A или его соль обладает эффектом подавления атрофии мозжечка и завершили настоящее изобретение.
[0007]
Настоящее изобретение обеспечивает следующее.
(1) Средство для профилактики или лечения спиноцеребеллярной атаксии, включающее Соединение A или его соль в качестве активного ингредиента.
(2) Средство для профилактики или лечения спиноцеребеллярной атаксии по пункту (1), где спиноцеребеллярная атаксия представляет собой наследственную оливопонтоцеребеллярную атрофию, наследственную кортикальную мозжечковую атрофию, спиноцеребеллярную атаксию 3 типа (болезнь Мачадо–Джозефа), спиноцеребеллярную атаксию 6 типа, спиноцеребеллярную атаксию 31 типа или кортикальную мозжечковую атрофию.
(3) Средство для профилактики или лечения спиноцеребеллярной атаксии по пункту (1) или (2), где средство предназначено для подавления атрофии мозжечка у пациента со спиноцеребеллярной атаксией.
(4) Средство для профилактики или лечения спиноцеребеллярной атаксии по пункту (1) или (2), где средство предназначено для облегчения атаксии у пациента со спиноцеребеллярной атаксией.
(5) Средство для профилактики или лечения спиноцеребеллярной атаксии по пункту (1) или (2), где средство предназначено для регрессии нарушения равновесия у пациента со спиноцеребеллярной атаксией.
(6) Средство для профилактики или лечения спиноцеребеллярной атаксии по любому одному из пунктов (1) – (5), где средство вводят перорально в дозе от 100 мг до 400 мг в пересчете на Соединение A один раз в день.
(7) Средство для профилактики или лечения спиноцеребеллярной атаксии по любому одному из пунктов (1) – (5), где средство вводят перорально в дозе от 160 мг или 320 мг в пересчете на Соединение A один раз в день.
[0008]
Настоящее изобретение также обеспечивает следующее.
(a) Фармацевтическая композиция для профилактики или лечения спиноцеребеллярной атаксии, включающая Соединение A или его соль в качестве активного ингредиента.
(b) Соединение A или его соль для применения в профилактике или лечении спиноцеребеллярной атаксии.
(c) Способ профилактики или лечения спиноцеребеллярной атаксии, включающий введение пациенту Соединения A или его соли.
(d) Применение Соединения А или его соли для получения средства для профилактики или лечения спиноцеребеллярной атаксии.
(e) Средство для подавления атрофии мозжечка, включающее Соединение A или его соль в качестве активного ингредиента.
(f) Соединение A или его соль для применения для подавления атрофии мозжечка.
(g) Способ подавления атрофии мозжечка, включающий введение пациенту Соединения A или его соли.
(h) Применение Соединения А или его соли для получения средства для подавления атрофии мозжечка.
Полезные эффекты изобретения
[0009]
Атрофию головного мозга, в частности атрофию мозжечка, можно подавить, а спиноцеребеллярную атаксию можно предотвратить или лечить путем введения Соединения A или его соли.
Краткое описание чертежей
[0010]
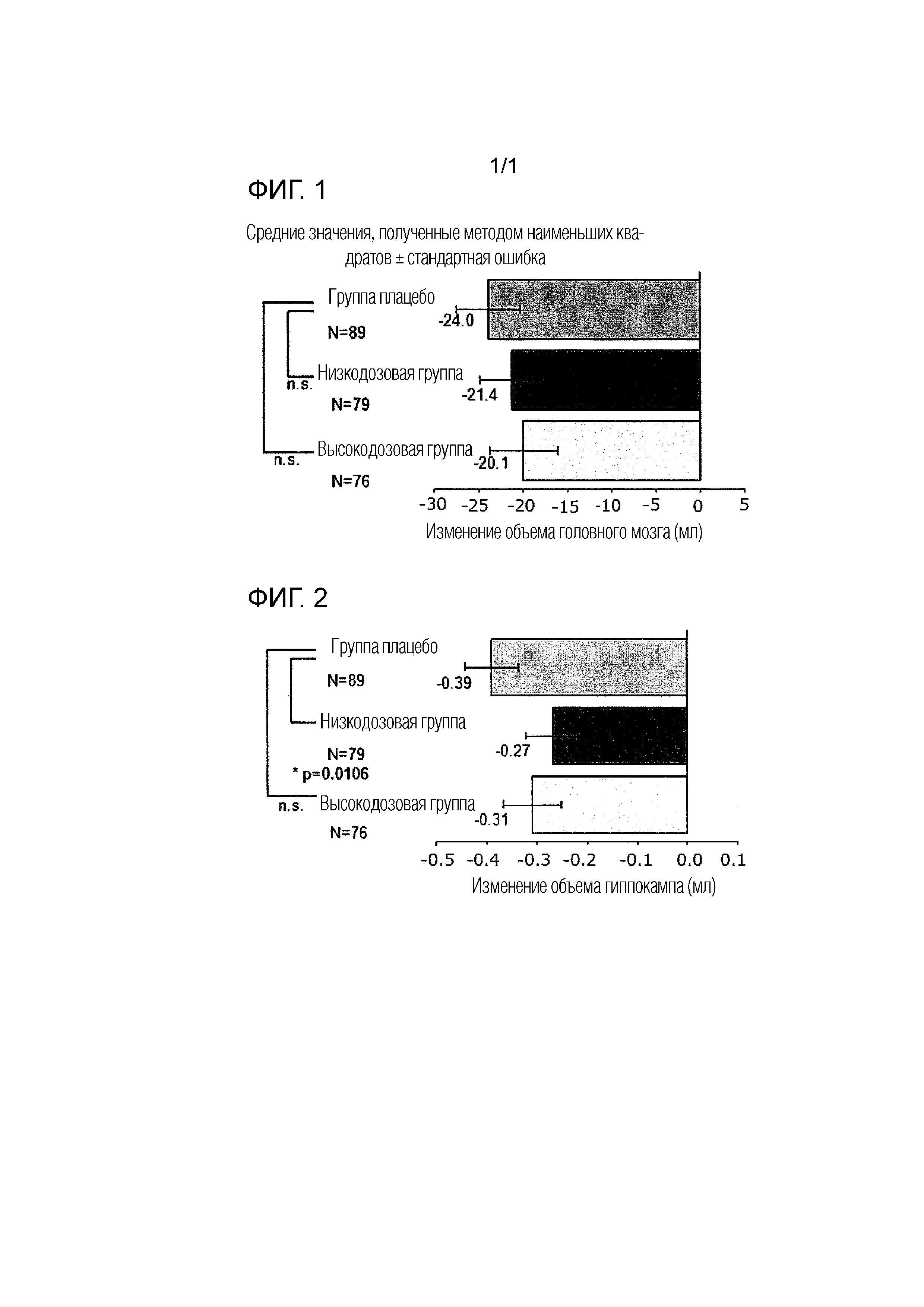
[Фиг. 1] Фиг. 1 представляет график, показывающий изменение объема головного мозга (мозга в целом) на неделе 52 по сравнению с объемом при скрининге в Примере испытания 1. "n.s." означает, что не было статистически значимой разницы.
[Фиг. 2] Фиг. 2 представляет график, показывающий изменение объема головного мозга (гиппокампа) на неделе 52 по сравнению с объемом при скрининге в Примере испытания 1. "n.s." означает, что не было статистически значимой разницы.
Варианты осуществления изобретения
[0011]
Далее настоящее изобретение будет описано подробно.
В настоящем описании соответствующие термины имеют следующее значение, если не указано иное.
[0012]
В настоящем описании числовой диапазон, показанный с помощью "до", представляет диапазон, включающий значение перед и после "до" в качестве минимального и максимального значения, соответственно.
[0013]
Соединение A представляет собой 1–(3–(2–(1–бензотиофен–5–ил)этокси)пропил)азетидин–3–ол.
[0014]
Примеры солей Соединения А включают известные соли основной группы, такой как аминогруппа, или кислотной группы, такой как гидроксильная группа или карбоксильная группа.
Примеры солей основной группы включают соли с минеральной кислотой, такой как хлористоводородная кислота, бромистоводородная кислота, азотная кислота и серная кислота; соли с органической карбоновой кислотой, такой как муравьиная кислота, уксусная кислота, лимонная кислота, щавелевая кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, яблочная кислота, винная кислота, аспарагиновая кислота, трихлоруксусная кислота и трифторуксусная кислота; и соли с сульфоновой кислотой, такой как метансульфоновая кислота, бензолсульфоновая кислота, п–толуолсульфоновая кислота, мезитиленсульфоновая кислота и нафталинсульфоновая кислота.
[0015]
Примеры солей кислотной группы включают соли со щелочным металлом, таким как натрий и калий; соли с щелочноземельным металлом, таким как кальций и магний; соли аммония; и соли с азот–содержащим органическим основанием, таким как триметиламин, триэтиламин, трибутиламин, пиридин, N, N–диметиланилин, N–метилпиперидин, N–метилморфолин, диэтиламин, дициклогексиламин, прокаин, дибензиламин, N–бензил–β–фенетиламин, 1–эфенамин и N, N’–дибензилэтилендиамин.
[0016]
Из вышеуказанных солей предпочтительными являются фармакологически приемлемые соли, а соли с малеиновой кислотой являются более предпочтительными.
[0017]
В случае, когда соединение A или его соль имеет изомеры (например, оптические изомеры, геометрические изомеры и таутомеры), настоящее изобретение включает все эти изомеры, а также включает гидраты, сольваты и их любые кристаллические формы.
[0018]
Профилактика означает предотвращение возникновения конкретного заболевания или по меньшей мере одного симптома, вызываемого заболеванием.
Лечение означает уменьшение или улучшение по меньшей мере одного симптома, вызванного конкретным заболеванием, которым страдает субъект, и замедление развития заболевания.
В одном варианте осуществления настоящего изобретения профилактика означает ингибирование или задержку начала или прогрессирования спиноцеребеллярной атаксии. Лечение означает подавление или задержку прогрессирования спиноцеребеллярной атаксии.
В другом варианте осуществления настоящего изобретения профилактика означает ингибирование или задержку начала или прогрессирования атрофии мозжечка. Лечение означает подавление или задержку прогрессирования атрофии мозжечка.
[0019]
Болезнь Альцгеймера от легкой до средней степени тяжести может быть клинически диагностирована как "вероятная AD" в соответствии с критериями диагностики, установленными the National Institute of Neurological and Communicative Disorders and Stroke/the Alzheimer's Disease and Related Disorders Associations (Национальным институтом неврологических и коммуникативных расстройств и инсульта/Ассоциацией болезни Альцгеймера и родственных нарушений) (NINCDS–ADRDA).
Обычный врач может обоснованно поставить клинический диагноз "болезнь Альцгеймера от легкой до средней степени тяжести", используя стандартные критерии. Например, на основании оценки в баллах по стандартизированной Краткой шкале оценки психического статуса (MMSE, баллы от 0 до 30) ставится клинический диагноз от легкой до средней степени, средней степени или от средней до тяжелой степени AD. MMSE (Folstein, Folstein and McHugh, 1975) представляет собой простой метод оценки когнитивной функции, включающий интервью с пациентами. Оценивают ориентацию, память, счет и внимание, языковые навыки и другие функции. Суммарный балл составляет 30. Чем ниже балл, тем выше уровень нарушения когнитивной функции.
В Примерах испытаний настоящего изобретения пациентов с оценкой по MMSE от 12 до 22 в начале испытания (скрининг) определяли как страдающих от легкой до средней степени AD. Следует отметить, что MMSE не единственный, хотя и удобный, способ клинического определения степени AD.
[0020]
Аполипопротеин E (ApoE), один из аполипопротеинов, входит в состав липопротеина и участвует в распознавании метаболизма липопротеинов и липидов. ApoE имеет 3 изоформы ApoE2, ApoE3 и ApoE4. В докладе показано, что ApoE4 генотип, кодирующий ApoE4, коррелирует с количеством отложения амилоидного β–белка в головном мозге, и генотип ApoE4 является геном риска болезни Альцгеймера.
[0021]
Структурные изменения в головном мозге также наблюдаются при нормальном старении, в то время как атрофия мозжечка является структурной аномалией, характерной для спиноцеребеллярной атаксии, которая вызывает, например, атаксию.
В одном варианте осуществления настоящего изобретения спиноцеребеллярная атаксия включает, например, наследственную оливопонтоцеребеллярную атрофию, наследственную кортикальную мозжечковую атрофию, спиноцеребеллярную атаксию 1 типа, спиноцеребеллярную атаксию 2 типа, спиноцеребеллярную атаксию 3 типа (болезнь Мачадо–Джозефа), спиноцеребеллярную атаксию 6 типа, спиноцеребеллярную атаксию 31 типа, наследственную дентато–рубро–паллидо–льюисову атрофию, атаксию–телеангиэктазию, атаксию Фридрейха, атаксию с дефицитом витамина Е, дефицитом апратаксина, дефицитом сенатаксина, спастическую атаксию Шарлевуа–Сагенэ, наследственную спастическую параплегию, мультисистемную атрофию (оливопонтоцеребеллярную атрофию, синдром Шая–Дрейджера, стрионигральную дегенерацию) и кортикальную мозжечковую атрофию. Предпочтительными являются наследственная оливопонтоцеребеллярная атрофия, наследственная кортикальная мозжечковая атрофия, спиноцеребеллярная атаксия 3 типа (болезнь Мачадо–Джозефа), спиноцеребеллярная атаксия 6 типа, спиноцеребеллярная атаксия 31 типа и кортикальная мозжечковая атрофия.
Волюметрическая МРТ (вМРТ) позволяет оценить объем структуры мозга in vivo, предлагая шкалы оценки атрофии.
[0022]
Соединение А или его соль, используемое в настоящем изобретении, может быть получено способом, известным per se, или объединением таких способов, или способом, раскрытым в Патентной литературе 1.
[0023]
Соединение А или его соль, используемое в настоящем изобретении, можно смешивать с различными фармацевтическими добавками, такими как эксципиент, связующее, разрыхлитель, ингибитор дезинтеграции, агент для предотвращения уплотнения/адгезии, смазывающее вещество, абсорбирующий/адсорбирующий носитель, растворитель, наполнитель, изотонический агент, солюбилизатор, эмульгатор, суспендирующий агент, загуститель, агент покрытия, усилитель абсорбции, гелеобразующий/прокоагулянтный агент, светостабилизатор, консервант, осушитель, стабилизатор эмульсии/суспензии/дисперсии, цветозащитный агент, деоксидант/антиоксидант, ароматизатор, краситель, пенообразователь, противовспенивающее вещество, смягчающий агент, антистатик, буфер и/или регулятор рН, для получения фармацевтического препарата, такого как пероральный препарат (например, таблетки, капсулы, порошки, гранулы, мелкие гранулы, пилюли, суспензии, эмульсии, жидкости и сиропы), инъекции, глазные капли, назальные спреи и трансдермальные средства. Таблетки являются предпочтительными в качестве пероральной лекарственной формы для пациентов с AD.
Вышеуказанные вещества формулируют в композицию обычным способом.
[0024]
Способ введения Соединения А, который конкретно не ограничивается, определяют соответственно на основании формы препарата, возраста, пола и других параметров пациента и уровня симптомов у пациента.
Дозу Соединения А, соответственно, выбирают на основании введения, возраста, пола, типа заболевания и других параметров пациента.
Средство можно вводить взрослому человеку в дозе или раздельными дозами обычно от 40 до 500 мг в пересчете на Соединение A в день. Средство вводят в дозе или раздельными дозами предпочтительно от 100 до 400 мг в пересчете на Соединение A в день, и наиболее предпочтительно вводят в дозе 160 мг или 320 мг в пересчете на Соединение A в день.
[0025]
Введение Соединения А или его соли в настоящем изобретении также может включать профилактику или лечение путем введения ингибиторов ацетилхолинэстеразы (AChEI). Примеры AchEI включают донепезила гидрохлорид, галантамина гидрохлорид, ривастигмина тартрат и такрина гидрохлорид.
В настоящем изобретении субъект может принимать AChEI для профилактики или лечения в течение по меньшей мере 6 месяцев перед введением Соединения A или его соли.
[0026]
Далее настоящее изобретение будет описано со ссылкой на Примеры испытаний и Примеры получения, но настоящее изобретение не ограничивается ими.
В качестве испытываемого соединения использовали малеат Соединения А.
[0027]
Пример испытания 1 Многоцентровое рандомизированное двойное слепое плацебо–контролируемое исследование фазы II для оценки эффективности и безопасности Соединения A у пациентов с легкой до средней степени AD
Субъект (критерии выбора): Осуществляли скрининг пациентов в период от 42 дней до распределения в группы лечения до момента распределения на основании следующих критериев выбора.
Пациенты с вероятной AD и возраста 55 лет или старше и 85 лет или младше на момент получения согласия на скрининг.
Пациенты с оценкой по MMSE от 12 до 22 на дату скрининга
Пациенты с оценкой 4 или менее по модифицированной ишемической шкале Хачинского
Пациенты, которых лечили донепезил гидрохлоридом или ривастигмином с использованием трансдермальной системы введения в течение по меньшей мере 4 месяцев до момента включения в исследование и путем введения стабильной дозы такого средства в течение 3 месяцев до момента включения в исследование.
В случае пациентов, которые получали мемантин в дополнение к лечению донепезил гидрохлоридом или ривастигмином, вводимым при помощи трансдермальной системы, пациенты, которые получали мемантин в течение по меньшей мере 4 месяцев до момента включения в исследование и его стабильную дозу в течение 3 месяцев до момента включения в исследование.
Пациенты, у которых результаты МРТ или КТ головного мозга соответствуют AD на момент скрининга
Организация групп: Отобранных пациентов (484 пациента) случайным образом разделяли на следующие 3 группы и начинали исследование.
(1) Высокодозовая группа: 224 мг испытываемого соединения (160 мг в пересчете на Соединение A) вводили перорально один раз в день в течение 4 недель, а затем 448 мг испытываемого соединения (320 мг в пересчете на Соединение A) вводили перорально один раз в день в течение 48 недель (158 пациентов)
(2) Низкодозовая группа: 224 мг испытываемого соединения (160 мг в пересчете на Соединение A) вводили перорально один раз в день в течение 52 недель (166 пациентов)
(3) Группа плацебо: плацебо вводили перорально один раз в день в течение 52 недель (158 пациентов)
Метод оценки:
Волюметрическая МРТ
Объем мозга субъектов измеряли при помощи вМРТ–сканирования во время скрининга и через 52 недели и осуществляли количественное определение изменения объема мозга в целом и гиппокампа у субъектов для оценки атрофии головного мозга на основании изменения с момента скрининга.
Кроме того, изменение объема мозга в целом и 101 области (полученной путем разделения областей, существующих как в левом, так и в правом полушариях мозга полей Бродмана (от 1 до 52) на 101 область) у каждого субъекта определяли количественно для оценки атрофии головного мозга на основании изменения с момента скрининга.
Статистический анализ:
Изменения объема мозга в целом и гиппокампа через 52 недели от исходного уровня сравнивали между высокодозовой группой и группой плацебо, а также между низкодозовой группой и группой плацебо на основании моделей со смешанными эффектами. Для моделей группы лечения были включены в качестве фиксированного эффекта, возраст, базовый уровень соответствующих объемов мозга (мозг в целом или гиппокамп), базовый уровень MMSE и генотип ApoE4 (положительный/отрицательный) были включены в качестве ковариат, а исследовательские центры были включены в качестве случайного эффекта.
Кроме того, изменения соответствующих объемов мозга в целом и 101 области через 52 недели от исходного уровня сравнивали между высокодозовой группой и группой плацебо, а также между низкодозовой группой и группой плацебо.
Результаты: показаны ниже
[0028]
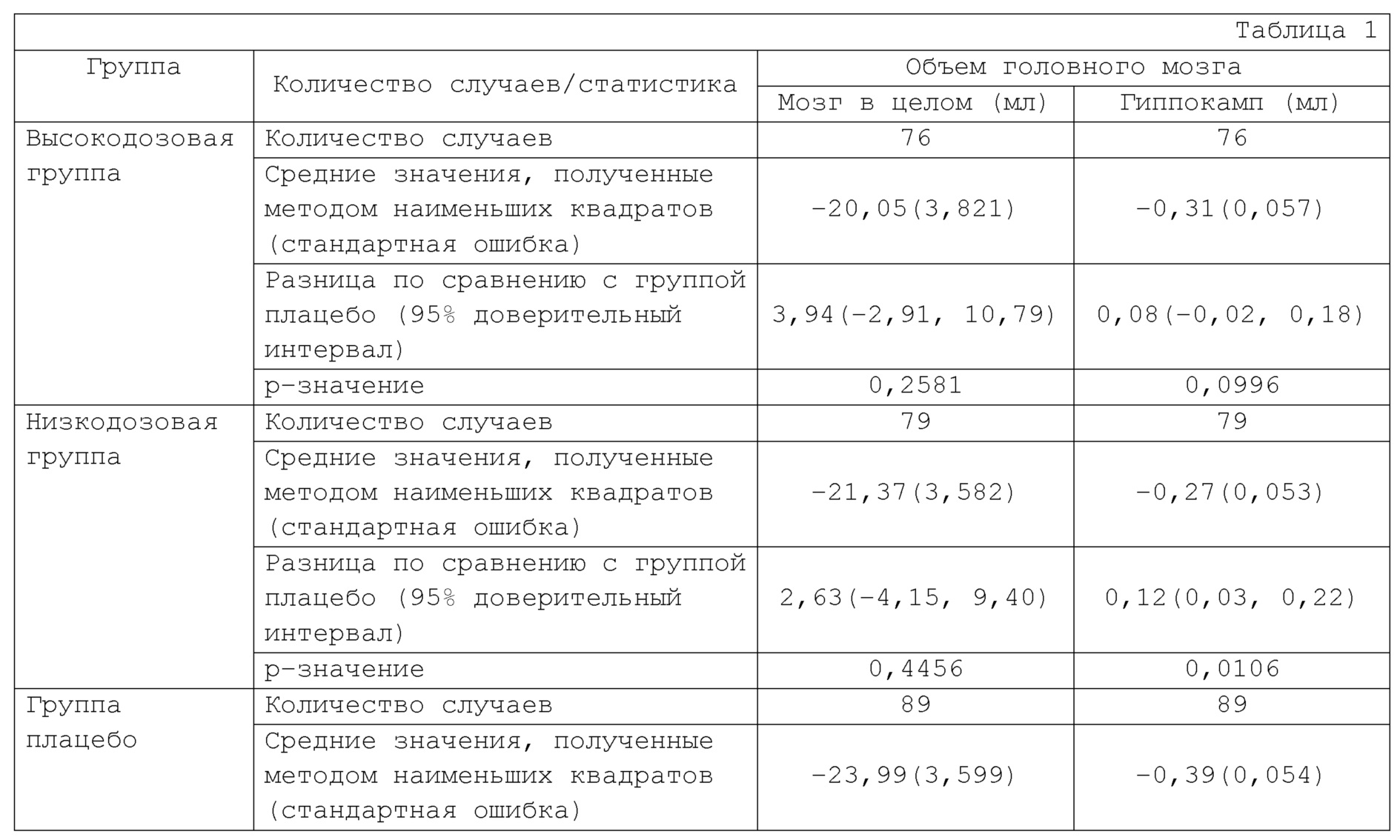
Изменение объема головного мозга, определенное при помощи вМРТ–сканирования на неделе 52, от исходного уровня показано в Таблице 1, Фиг. 1 и Фиг. 2.
[0029]
[0030]
Что касается изменения объема мозга в целом и гиппокампа на неделе 52 по сравнению с исходным уровнем, уменьшение объема, как правило, меньше в группе введения Соединения А, чем в группе плацебо. Разница в эффектах на изменение объема гиппокампа между группой введения низкой дозы Соединения А и группой плацебо была статистически значимой.
[0031]
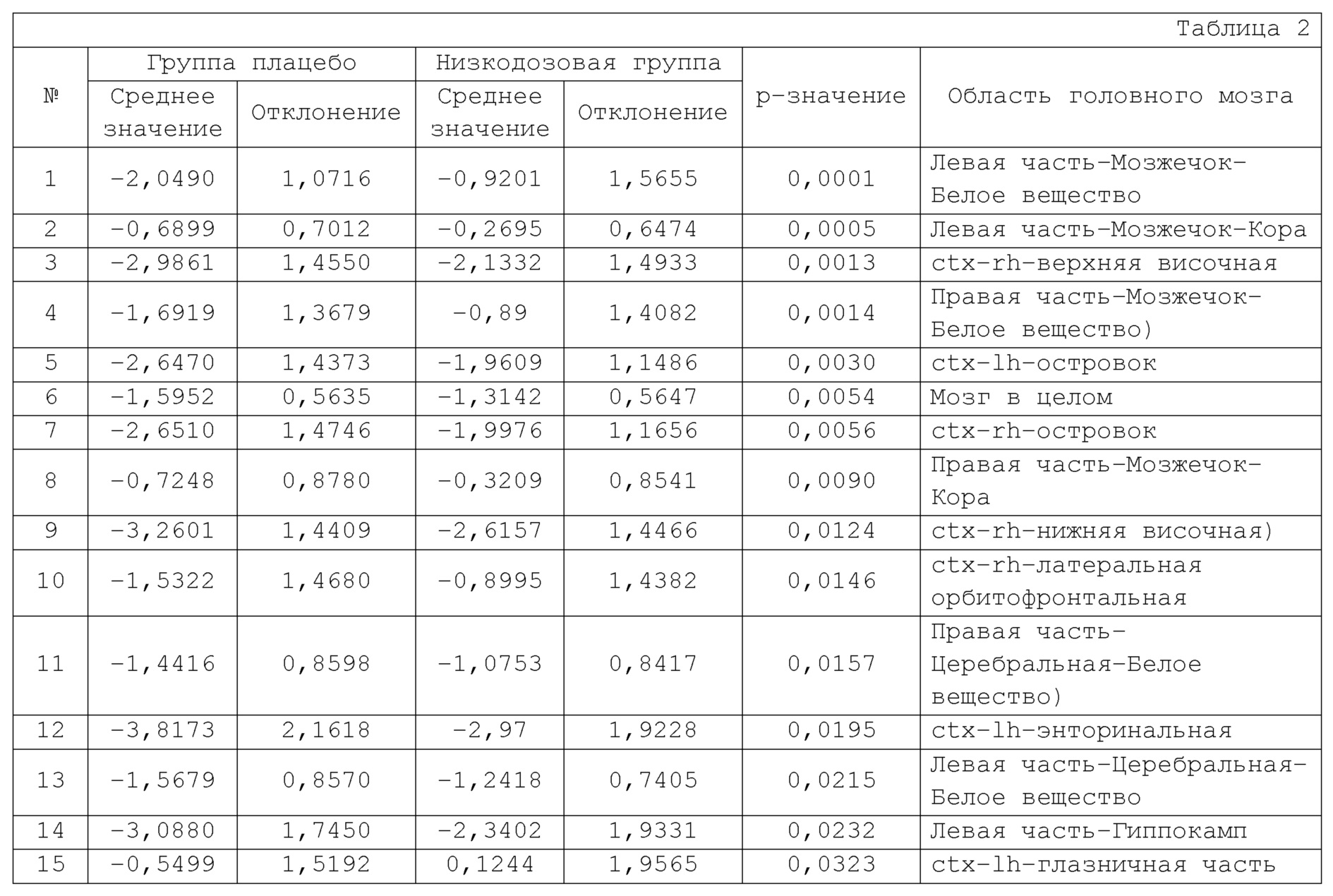
Что касается изменения объема головного мозга, определенного при помощи вМРТ–сканирования на неделе 52 от исходного уровня, в Таблице 2 показаны результаты для областей, в которых была обнаружена статистически значимая разница (p–значение ˂ 0,05) при сравнении между группой введения низкой дозы испытываемого соединения и группой плацебо.
[0032]
[0033]
В группе с низкой дозой соединения А уменьшение объема мозжечка из объема мозга в целом и 101 области особенно подавлялось по сравнению с группой плацебо (№№ 1, 2, 4 и 8 в Таблице 2).
Ту же тенденцию, что и в группе с низкой дозой, наблюдали в группе с высокой дозой Соединения А.
[0034]
Пример получения 1
0,9726 г Стеарата магния (стеарат магния, Merck) добавляли к 174,03 г малеата Соединения A и смесь перемешивали в течение 30 минут. Смешанный порошок формовали под давлением при помощи роликового уплотнителя (TF–LABO (давление прокатки 3 МПа), Freund Corporation) и твердое вещество, полученное формованием, гранулировали. 49,51 г Лактозы (FlowLac 90, Meggle Japan), 16,50 г кристаллической целлюлозы (CEOLUS PH302, Asahi Kasei Chemicals) и 6,67 г натрий кроскармеллозы (Primellose, DMV Japan) просеивали через сито с отверстием 850 мкм и добавляли к 60,0 г полученного гранулированного порошка, и смесь перемешивали в течение 10 минут. К смешанному порошку добавляли 0,6667 г стеарата магния и смесь перемешивали в течение 30 минут. Смешанный порошок таблетировали при помощи таблеточной машины (HT–P18A, Hata Tekkosho) при давлении таблетирования около 12 кН, используя пестик с двойной закругленной поверхностью, с диаметром таблеток 8,5 мм с получением круглых таблеток без покрытия, каждая из которых имела массу 250 мг. На таблетки без покрытия наносили 8 мг покрывающего агента на таблетку с использованием устройства для нанесения пленочного покрытия DRC–200 (Powrex), а затем добавляли небольшое количество карнаубского воска (Polishing Wax–105, Nippon Wax) с получением таблеток с пленочным покрытием.
[0035]
Пример получения 2
60,90 г Маннита (Parteck M200, Merck) и 3,60 г натрий кроскармеллозы добавляли к 53,70 г малеата Соединения A и смесь перемешивали в течение 10 минут. К смешанному порошку добавляли 1,80 г стеарата магния и смесь перемешивали в течение 30 минут. Смешанный порошок таблетировали при давлении таблетирования около 10 кН, используя пестик с двойной закругленной поверхностью, с диаметром таблеток 8,5 мм с получением круглых таблеток без покрытия, каждая из которых имела массу 250 мг. На таблетки без покрытия наносили 8 мг покрывающего агента (Opadry 03F44057, 00F440000 (гипромеллоза 2910: 71,5%, Макрогол 6000: 14,166%, тальк: 7,167%, оксид титана: 7,067%, сесквиоксид железа: 0,1%), Colorcon Japan LLC) на таблетку, и затем добавляли небольшое количество карнаубского воска с получением таблеток с пленочным покрытием.
[0036]
Пример получения 3
11,11 г Стеарата магния добавляли к 1988,89 г малеата Соединения A и смесь перемешивали в течение 30 минут. Смешанный порошок формовали под давлением при помощи роликового уплотнителя, и твердое вещество, полученное формованием, гранулировали. К 107,13 г полученного гранулированного порошка добавляли 26,21 г маннита, 7,50 г этилцеллюлозы (ETHOCEL 100FP Premium, The Dow Chemical Compаny), 3,75 г кристаллической целлюлозы (CEOLUS KG–1000, Asahi Kasei Chemicals), 3,75 г кросповидона (Kollidon CL–SF, BASF) и 0,75 г натрий кроскармеллозы, и смесь перемешивали в течение 30 минут. К смешанному порошку добавляли 0,90 г стеарата магния и смесь перемешивали в течение 5 минут. Смешанный порошок таблетировали при давлении таблетирования около 7 кН, используя пестик с двойной закругленной поверхностью, с диаметром таблеток 8,5 мм с получением круглых таблеток без покрытия, каждая из которых имела массу 315 мг. На таблетки без покрытия наносили 9 мг покрывающего агента на таблетку, и затем добавляли небольшое количество карнаубского воска с получением таблеток с пленочным покрытием.