Результат интеллектуальной деятельности: Способ определения ДНК вируса нодулярного дерматита (LSDV) в биологическом материале животных методом ПЦР с электрофоретической детекцией продуктов амплификации в агарозном геле
Вид РИД
Изобретение
Изобретение относится к ветеринарной микробиологии, в частности к лабораторной диагностике возбудителей инфекционных заболеваний, а именно к средствам диагностики инфекции у животных с помощью полимеразной цепной реакции.
Известны способы, предусматривающие отбор биоматериала, выделение ДНК вируса инфекционных заболеваний, амплификацию фрагментов ДНК исследуемого биологического материала методом ПЦР с использованием уникального набора олигонуклеотидных праймеров, где продукты амплификации разделяют методом электрофореза в агарозном геле. Результаты ПЦР учитывают, визуализируя окрашиванием бромистым этидием. Наличие в исследуемом биоматериале генов патогенности инфекционных возбудителей определяют по размерам образовавшихся фрагментов ДНК (патенты RU №№2483114, 2542396, 2514663, 2445370).
Достоинством метода ПЦР с электрофорезом, используемого в известных технических решениях, в котором продукты амплификации разделяют методом электрофореза в агарозном геле - является качественный анализ, позволяющий определить наличие остаточных количеств искомых молекул ДНК в образце и кроме того значительно дешевым, чем ПЦР в реальном времени.
Известно использование ПЦР для определения ДНК вируса нодулярного дерматита КРС включающий отбор проб патологического материала из очага инфекционного заболевания от всех животных, находящихся в очаге инфекционного заболевания, и проведение экспресс-диагностики полученного патологического материала в течение суток методом ПЦР с флуоресцентным учетом результатов в режиме реального времени с применением термоциклера типа RotorGene для выявления животных-носителей вируса нодулярного дерматита на начальной стадии инфицирования, при этом учет результатов ПЦР проводят по наличию или отсутствию пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией, если наблюдают рост специфического сигнала, то образец считают положительным - вирус нодулярного дерматита КРС присутствует, при этом значения контрольных образцов находятся в пределах нормы, если не наблюдают рост специфического сигнала, то образец считают отрицательным - вирус нодулярного дерматита крупного рогата скота отсутствует, и значения контрольных образцов также находятся в пределах нормы (патент RU 2648773, кл. G01N 33/533, 2018 г.).
Недостатком известного технического решения является, то что - не достаточно раскрыт, чтобы можно было использовать для диагностики вируса нодулярного дерматита у животных, т.к. не представлены олигонуклеотидные праймеры и флуоресцентно-меченные зонды, используемые для ПЦР в качестве внутреннего и положительного контролей, кроме того является дорогостоящим.
Также известен способ для выявления генома полевых изолятов вируса заразного узелкового дерматита (нодулярного дерматита) КРС в реакции полимеразной цепной реакции в режиме реального времени с использованием олигонуклеотидных праймеров и флуоресцентно-меченого зонда для амплификации и детекции фрагмента гена наружного капсидного белка EEV вируса заразного узелкового дерматита (ЗУД) КРС (патент RU 2668398, кл. C12Q 1/68, 2018 г.).
Известный способ предназначен для выявления генетического материала полевого вируса ЗУД КРС в биологических и культуральных образцах для постановки и уточнения диагноза, для решения научно-исследовательских задач по мониторингу распространения вируса ЗУД КРС среди восприимчивых животных методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией в режиме реального времени (РВ) с использованием олигонуклеотидных праймеров и флуоресцентно-меченого зонда для амплификации и детекции фрагмента гена наружного капсидного белка EEV вируса заразного узелкового дерматита (ЗУД) КРС. Недостатками известного способа является ограниченный спектр биологического материала и недостаточная чувствительность, т.к. в качестве мишени используют образцы гетерологичных вирусов, депонированных в коллекции штаммов микроорганизмов, которые перед использованием необходимо разморозить. Известно, что в результате заморозки и разморозки происходит нарушение строения микроорганизма, что влияет на чувствительность выявления вируса нодулярного дерматита.
Наиболее близким по технической сущности является изобретение по патенту RU №2680094, кл. C12Q 1/68, 2019 г., которое включает: выделение ДНК возбудителя инфекционного заболевания из биологического материала инфицированного животного сорбционным методом, постановку полимеразной цепной реакции с флуоресцентной детекцией с проведением 40 циклов амплификации с использованием специфичных для участка генома ДНК возбудителя инфекционного заболевания животного олигонуклеотидных праймеров, зондов, флуоресцентного красителя, внутреннего контрольного образца в виде суспензии бактериофага Т4 с концентрацией 5×103 фаговых частиц на 1 мкл и положительного контрольного образца в виде смеси содержащую в одинаковом объемном соотношении фрагменты геномов возбудителя инфекционного заболевания животного и бактериофага Т4, измерение, учет и интерпретацию результатов ПЦР.
Недостатком известного технического решения является отсутствие возможности выявления ДНК вируса нодулярного дерматита (LSDV) в биологическом материале животных и использование дорогостоящего оборудования для определения остаточных количеств искомых молекул.
Техническим результатом является расширение функциональных возможностей и снижение стоимости метода при выявлении остаточного количества ДНК вируса нодулярного дерматита.
Технический результат достигается тем, что в способе определения ДНК вируса нодулярного дерматита (LSDV) в биологическом материале животных методом ПНР с электрофоретической детекцией продуктов амплификации в агарозном геле, включающем выделение ДНК возбудителя инфекционного заболевания из биологического материала инфицированного животного сорбционным методом, постановку полимеразной цепной реакции с флуоресцентной детекцией с проведением 40 циклов амплификации с использованием специфичных для участка генома ДНК возбудителя инфекционного заболевания животного олигонуклеотидных праймеров, флуоресцентного красителя, внутреннего контрольного образца в виде суспензии бактериофага Т4 с концентрацией 5×103 фаговых частиц на 1 мкл и положительного контрольного образца в виде смеси, содержащую в одинаковом объемном соотношении фрагменты геномов возбудителя инфекционного заболевания животного и бактериофага Т4, измерение, учет и интерпретацию результатов ПЦР, согласно изобретению выделяют ДНК вируса нодулярного дерматита (LSDV) в биологическом материале животных, проводят электрофоретическую детекцию продуктов амплификации в агарозном геле и получают электрофореграмму ДНК со специфическими полосами амплифицированной продукции, визуализируя их окрашиванием флуоресцентным красителем, по которой учет и проведение интерпретации результатов ПЦР проводят по наличию или отсутствию специфической полосы фрагмента ДНК вируса нодулярного дерматита, совпадающей по размеру с полосой фрагмента этого же ДНК, амплифицированным из положительного контрольного образца, при этом для него используют смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома ДНК вируса нодулярного дерматита и фрагмент генома бактериофага Т4 со следующими нуклеотидными последовательностями:
LSDV-for: 5'-CCCATTCTAACACGCCTAACTCC-3'
LSDV-rev: 5'-CCACTAGAACACGACACTGTAC-3'
T4-for: 5'-CTGTAATGAACTAACCATATTAGC-5'
T4-rev: 5'-CCTCGTCCTAAAGCTGCTACAGC-5'.
Новизна заявляемого способа состоит в идентификации ДНК вируса нодулярного дерматита с помощью полимеразной цепной реакции (ПЦР) с электрофоретической детекцией с использованием специфичных для участка генома олигонуклеотидных праймеров и разных видов контроля для которых используют различные формы материала бактериофага Т4: суспензия и фрагмент генома со специфическими к нему праймерами. Такая постановка ПЦР обеспечивает возможность определения остаточных (следовых) количеств искомых молекул ДНК вируса нодулярного дерматита (LSDV).
Признаки, отличающие заявляемое техническое решение от прототипа, направлены на достижение технического результата и не выявлены при изучении данной и смежной областей науки и техники и, следовательно, соответствуют критерию «изобретательский уровень».
Заявляемый способ рекомендовано использовать в специализированных ветеринарных, санитарно-эпидемиологических, животноводческих, сельскохозяйственных предприятиях, что соответствует критерию «промышленная применимость».
Способ определения ДНК вируса нодулярного дерматита (LSDV) в биологическом материале животных методом ПЦР с электрофоретической детекцией продуктов амплификации в агарозном геле осуществляют следующим образом.
Предварительно выделяют ДНК из биологического материала животного сорбционным методом. В качестве биологического материала может быть использованы: цельная кровь, фрагменты пораженных кожных покровов (высыпания, корки, узелковые поражения-нодулы), легких, бронхов, селезенки, лимфоузлы, мазки со слизистых конъюнктивы и ротоглотки, молоко и сперма, которые подвергают определенной обработке.
Проводят полимеразную цепную реакцию с электрофоретической детекцией продуктов амплификации в агарозном геле с проведением 40 циклов амплификации с использованием специфичных для участка генома ДНК вируса нодулярного дерматита олигонуклеотидных праймеров, флуоресцентного красителя, внутреннего контрольного образца в виде суспензии бактериофага Т4 с концентрацией 5×103 фаговых частиц на 1 мкл и положительного контрольного образца в виде смеси рекомбинантных плазмидных ДНК, содержащую в одинаковом объемном соотношении фрагмент генома ДНК вируса нодулярного дерматита и фрагмент генома бактериофага Т4 со следующими нуклеотидными последовательностями:
LSDV-for: 5'-CCCATTCTAACACGCCTAACTCC-3'
LSDV-rev: 5'-CCACTAGAACACGACACTGTAC-3'
T4-for: 5'-CTGTAATGAACTAACCATATTAGC-5'
T4-rev: 5'-CCTCGTCCTAAAGCTGCTACAGC-5'.
Для амплификации используют прибор типа Rotor Gene, получают электрофореграмму ДНК со специфическими полосами амплифицированной продукции, визуализированные путем окрашивания флуоресцентным красителем - бромид этидия. Учет и проведение интерпретации результатов ПЦР проводят по наличию или отсутствию на электрофореграмме ДНК специфической полосы фрагмента ДНК вируса нодулярного дерматита, совпадающей по размеру с полосой фрагмента этого же ДНК, амплифицированным из положительного контрольного образца.
Для обеспечения идентификации вируса нодулярного дерматита (LSDV) для положительного контрольного образца используют смесь, содержащую фрагменты геномов нативного бактериофага Т4 и ДНК вируса нодулярного дерматита (LSDV) взятых в соотношении 1:1, со следующими нуклеотидными последовательностями:
LSDV-for: 5'-CCCATTCTAACACGCCTAACTCC-3'
LSDV-rev: 5'-CCACTAGAACACGACACTGTAC-3'
T4-for: 5'-CTGTAATGAACTAACCATATTAGC-5'
T4-rev: 5'-CCTCGTCCTAAAGCTGCTACAGC-5'.
Заявляемый способ обеспечивает высокую специфичность, что позволяет достоверно и количественно определять наличие следовых количеств искомых молекул ДНК вируса нодулярного дерматита (LSDV) в исследуемых пробах и по сравнению с известными технологиями, значительно дешевый.
При конструировании праймеров основными требованиями были: степень гомологии (комплементарность) с выбранным участком гена; отсутствие самокоплементарных участков внутри олигонуклеотидов и комплементарности друг другу, чтобы не допускать возникновения устойчивых вторичных структур (димеров); близость значений температуры отжига праймеров.
Конструирование специфических праймеров осуществляли с помощью компьютерных программ на основании анализа нуклеотидных последовательностей референтных штаммов и изолятов, опубликованных на ресурсе GenBank и подбора условий для проведения ПЦР с электрофоретической детекцией продуктов амплификации в агарозном геле с применением разработанных праймеров, несущего флуорофора и тушителя, и комплементарного части амплифицируемого со специфическими праймерами фрагмента. Праймеры, специфичные для генома вируса нодулярного дерматита были отобраны на нуклеотидной последовательности участка генома, кодирующей гипотетический белок гликопротеин (Lumpy skin disease virus strain LSDV/Russia/Saratov/2017, complete genome 150606 bp DNA linear VRL 18-NOV-2018, код MH646674, участок между 19000 и 20000 парами оснований). Праймеры были разработаны с использованием Primer Express Software v3.0 (Applied Biosystems) и исследованы с использованием BLAST, чтобы подтвердить их специфичность. Используя программу "Oligo 6.0" описаны основные свойства рассчитанных олигонуклеотидов, определившие возможность их использования в ПЦР. Заявляемая нуклеотидная последовательность имеет следующий набор:
LSDV-for: 5'-CCCATTCTAACACGCCTAACTCC-3'
LSDV-rev: 5'-CCACTAGAACACGACACTGTAC-3'
В качестве внутреннего контроля использовался бактериофаг Т4, имеющий геномную ДНК порядка 170 тысяч пар нуклеотидов (Enterobacteria phage T4T, complete genome GenBank: HM137666.1). В результате анализа был выбран участок между 200 и 1000 нуклеотидами, содержащий уникальную нуклеотидную последовательность. Последовательности праймеров были выбраны с использованием Primer Express Software v3.0 (Applied Biosystems). Специфичность выбранных праймеров оценивали используя программу BLAST на сервере NCBI.
Заявляемая нуклеотидная последовательность имеет следующий набор:
T4-for: 5'-CTGTAATGAACTAACCATATTAGC-5'
T4-rev: 5'-CCTCGTCCTAAAGCTGCTACAGC-5'.
Пример конкретного осуществления способа выявления ДНК вируса нодулярного дерматита (LSDV) в биологическом материале животных с помощью полимеразной цепной реакции с электрофоретической детекцией продуктов амплификации в агарозном геле
Для исследований используют биологический материал, который может быть взят по выбору от КРС, а также овец и коз.
1. Цельная кровь (в ранний период заболевания, во время виремии). Кровь забирается в пробирку с 3-6% ЭДТА из расчета 50 мкл раствора ЭДТА на 1 мл крови, закрытую пробирку с кровью несколько раз переворачивают.
2. Фрагменты пораженных кожных покровов (высыпания, корки, узелковые поражения-нодулы), легких, бронхов, селезенки отбирают в стерильный контейнер.
3. Лимфоузлы берут на исследование целиком.
4. Мазки со слизистых конъюнктивы и ротоглотки снимают с помощью стерильного зонда, зонд помещают в пластиковую микропробирку объемом 1,5 мл с 0,5 мл стерильного физиологического раствора/фосфатного буфера/транспортной среды.
5. Молоко отбирают в объеме 10-30 мл в стерильную посуду;
6. Сперму (0,5-1 мл) отбирают в стерильный контейнер.
Полученные образцы можно транспортировать и хранить в следующих режимах:
- при комнатной температуре - в течение 48 часов;
- при температуре от 2 до 8°С - в течение двух недель;
- при температуре не выше минус 20°С - в течение месяца;
- при температуре не выше минус 68°С - длительно.
- оттаивание биологического материала.
Чтобы избежать ложноположительных результатов необходимо после вакцинации выдержать 3-4 недели перед сдачей анализа.
Далее исследуемые образцы обрабатывают следующим образом:
Мазки со слизистых конъюнктивы, ротоглотки, пробы цельной крови, молоко исследуют без предварительной подготовки.
Сперму разводят физиологическим раствором 1:3, тщательно перемешивают на вортексе. Для экстракции ДНК используют аликвоту 0,1 мл суспензии.
Из тканей и органов вырезают небольшие кусочки до 1 г весом. Растирают пробы в фарфоровых ступках или гомогенизируют на автоматических гомогенизаторах. Затем готовят 20% суспензию на стерильном физиологическом растворе или фосфатном буфере. Суспензию переносят в пробирку объемом 1,5 мл и центрифугируют при 600-1000 g (2000 об./мин на центрифуге «MiniSpin», Eppendorf, Германия) в течение 2 мин. Аликвоту надосадочной жидкости (0,1 мл) используют для экстракции ДНК.
Для подтверждения эффективности способа были использованы пробы по выбору, например мазки со слизистых конъюнктивы, ротоглотки, которые исследуют без предварительной подготовки.
Лабораторные пробы (20-40 мг) отбирают на исследование в одноразовые микропробирки вместимостью 1,5 мл в двух повторах. Отобранные лабораторные пробы направляют на выделения ДНК.
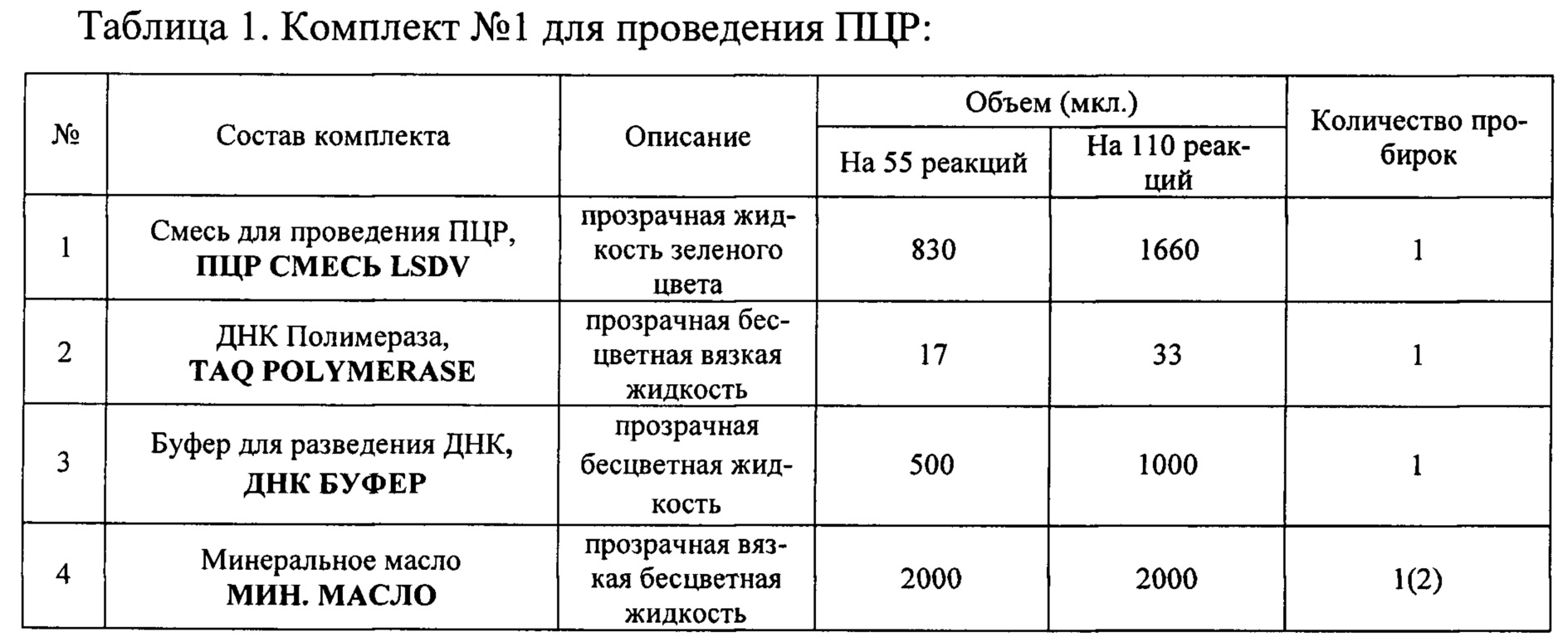
Исследование проводят с помощью набора реагентов «ПЦР-Ф-НОДУЛЯРНЫЙ-ДЕРМАТИТ-КРС-ФАКТОР». Набор состоит из комплекта реагентов для проведения мультиплексной ПЦР (комплект №1) и комплекта контрольных образцов (комплект №2). Набор выпускается в двух вариантах: 1) Для анализа 55 образцов (включая контрольные образцы) 2) Для анализа 110 образцов (включая контрольные образцы). Наборы используют в соответствии с инструкцией по применению набора реагентов "ПЦР-Ф-НОДУЛЯРНЫЙ-ДЕРМАТИТ-КРС-ФАКТОР" для выявления ДНК вируса нодулярного дерматита (Lumpy skin disease virus, LSDV) в биологическом материале методом полимеразной цепной реакции (ПЦР) с электрофоретической детекцией продуктов амплификации в агарозном геле, ТУ21.10.60-112-51062356-2016, для диагностики in vitro, http://www.vetfaktor.ru/. Состав набора приведен в Таблицах 1 и 2.

Исследование с помощью набора реагентов «ПЦР-Ф-НОДУЛЯРНЫЙ-ДЕРМАТИТ-КРС-ФАКТОР» состоит из трех этапов:
 экстракция НК (на этом этапе дополнительно используют реактивы для экстракции, например набор «ДНК/РНК-С-ФАКТОР»);
экстракция НК (на этом этапе дополнительно используют реактивы для экстракции, например набор «ДНК/РНК-С-ФАКТОР»);
 проведение ПЦР;
проведение ПЦР;
 анализ продуктов амплификации методом электрофореза (на этом этапе дополнительно используют набор реагентов для электрофоретического анализа, например набор «ПЦР-ЭФ-ФАКТОР»);
анализ продуктов амплификации методом электрофореза (на этом этапе дополнительно используют набор реагентов для электрофоретического анализа, например набор «ПЦР-ЭФ-ФАКТОР»);
 учет результатов анализа.
учет результатов анализа.
Для экстракции (выделение) НК из исследуемых проб, отбирают необходимое количество одноразовых пробирок объемом 1,5 мл, включая отрицательный контроль выделения. Вносят во все пробирки с исследуемыми образцами, включая пробирку для ОКО (отрицательный контрольный образец, по 10 мкл ВКО (внутренний контрольный образец) LSDV в виде суспензии бактериофага Т4.
Вносят исследуемые пробы в объеме согласно инструкции к набору для выделения НК, в пробирку отрицательного контроля выделения вместо исследуемой пробы вносят ОКО (пробирку обозначить как ВК-).
Выделяют ДНК из анализируемых и контрольных образцов согласно протоколу инструкции производителя набора для выделения НК.
Выделенную ДНК можно хранить в течение одной недели при температуре от 2°С до 8°С или в течение года при температуре не выше минус 16°С.
Далее готовят образцы к проведению ПЦР.
Общий объем реакционной смеси - 25 мкл, объем ДНК-пробы - 10 мкл. Успешное прохождение реакции контролируют использованием ПКО LSDV (положительный контрольный образец) в виде смеси, содержащей фрагменты геномов бактериофага Т4 и ДНК вируса нодулярного дерматита (LSDV) взятых в соотношении 1:1, со следующими нуклеотидными последовательностями:
LSDV-for: 5'-CCCATTCTAACACGCCTAACTCC-3'
LSDV-rev: 5'-CCACTAGAACACGACACTGTAC-3'
T4-for: 5'-CTGTAATGAACTAACCATATTAGC-5'
T4-rev: 5'-CCTCGTCCTAAAGCTGCTACAGC-5' и ДНК буфера.
В отдельной пробирке смешивают компоненты набора реагентов из расчета на каждую реакцию*2 (2 Объемы реагентов ПЦР СМЕСЬ LSDV и TAQ POLYMERASE на различное количество образцов приведены в Приложении 1):
15 мкл ПЦР СМЕСЬ LSDV;
0,3 мкл TAQ POLYMERASE
Перемешивают смесь на вортексе (без вспенивания) и сбрасывают капли кратковременным центрифугированием.
Отбирают необходимое количество пробирок для амплификации ДНК исследуемых и контрольных проб. Вносят по 15 мкл приготовленной реакционной смеси.
В случае использования амплификаторов без подогревающейся крышки (например, «Терцик», «ДНК технология») сверху в пробирки вносят по капле минерального масла для ПЦР (примерно 25 мкл).
Используют наконечники с фильтром в подготовленные пробирки (под масло или непосредственно на масло) вносят:
а) в пробирку отрицательного контроля ПЦР (К-) 10 мкл ДНК буфера;
б) в ряд пробирок для исследуемых проб - в каждую вносят по 10 мкл ДНК соответствующей пробы, (включая пробу ВК-);
в) в пробирку положительный контроль ПЦР (К+) - 10 мкл ПКО LSDV.
Рекомендуется перед постановкой в амплификатор осадить капли со стенок пробирок кратким центрифугированием на вортексе (1-2 секунды). Установить пробирки в амплификатор, для исследований был использован прибор «ДТ 96». Режим термоциклирования для разных приборов приведен в таблицах 3, 4 и 5.



После окончания реакции переставить пробирки в специальный штатив и отправить в помещение для детекции продуктов ПЦР.
Пробы после амплификации можно хранить в течение 16 ч при комнатной температуре. Для длительного хранения требуется заморозка.
Анализ продуктов амплификации проводится методом электрофореза в агарозном геле.
Затем проводят учет результатов ПЦР-анализа по наличию или отсутствию на электрофореграмме специфических полос амплифицированной НК.
Результат считается достоверным в случае корректного прохождения положительных и отрицательных контролен: амплификации и экстракции ДНК в соответствии с таблицей 6.

Появление специфической полосы ПЦР продукта 500 пн для отрицательного контроля этапа экстракции (ВК-) и полос 500 пн и/или 300 пн для отрицательного контроля этапа ПЦР (К-) свидетельствует о наличии контаминации реактивов или образцов. В этом случае результаты анализа для всех проб считаются недействительными. Требуется повторить анализ всех проб, а также предпринять меры по выявлению и ликвидации источника контаминации.
На дорожках с исследуемыми образцами должно наблюдаться одна или две полосы, совпадающими по подвижности с полосами от образца К+(ПКО LSDV).
Образец считается отрицательным (ДНК вируса LSDV отсутствует) если не наблюдается амплификации специфической полосы на уровне 300 пар нуклеотидов (пн) и при этом наблюдается специфическая полоса ВКО на уровне 500 пар нуклеотидов.
Образец считается положительным (ДНК вируса LSDV присутствует) если наблюдается полоса, подвижность которой совпадает с подвижностью нижней полосы (300 пар нуклеотидов) на дорожке К+(ПКО LSDV). Наличие полосы ВКО (500 пар нуклеотидов) при этом не обязательно.
Исследуемые образцы, для которых на дорожках отсутствуют обе полосы, требуют повторного проведения исследования. Отсутствие полосы ВКО (500 пар нуклеотидов) при отсутствии амплификации целевого ПЦР продукта вируса LSDV (300 пар нуклеотидов) указывает на наличие ингибиторов в пробе (ах) или на ошибки при постановке реакции. Необходимо провести исследование, начиная с этапа экстракции нк.
Для доказательства эффективности использования ПЦР с электрофоретической детекцией продуктов амплификации в агарозном геле для выявления ДНК вируса нодулярного дерматита в агарозном геле проводился сравнительный анализ заявляемого способа с известными техническими решениями (патенты №№2648773, 2668398), а также с прототипом (патент №2680094).
В заявляемом способе при обнаружении остаточных ДНК LSDV за счет повышения специфичности, точность определения остаточных (следовых) количеств искомых молекул ДНК вируса нодулярного дерматита (LSDV) больше на 3,4-4,5%, чем в известных способах и заявляемый способ в 8-10 раз дешевле, чем методы с использование ПЦР в реальном времени.



