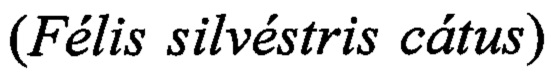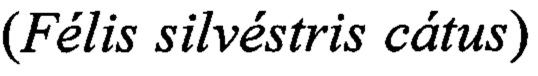Результат интеллектуальной деятельности: Способ идентификации ДНК ткани кошки домашней (Felis silvestris catus) в сухих кормах и мясных полуфабрикатах
Вид РИД
Изобретение
Изобретение относится к ветеринарной микробиологии, в частности к методам определения видовой принадлежности мяса с помощью полимеразной цепной реакции.
Известно использование ПЦР в реальном времени для определения ДНК следующих животных - лошади, коровы, свиньи, осла, курицы, индейки, кошки, собаки и кролика (https://stylab.ru/netcat_files/userfiles/Files/Articles/Meat/Meat_1_04_2013.pdf.).
Также известен метод выявления мяса кошки в говядине и баранине, в котором используют технологию LAMP и ген субъединицы цитохрома с оксидазы I (COXI) на митохондриальной ДНК кошек (https://ru.espacenet.com/publication_Details/biblio?_II=0&ND=3&adiacent=true&locale=ru_RU&FT=D&date=20151111&CC=CN&NR=105039540A&KC=A). Реакцию амплификации проводили на водяной бане при постоянной температуре в течение 40 минут, а результаты наблюдали непосредственно невооруженным глазом, добавляя краситель к конечному продукту.
Наиболее близким по технической сущности является способ идентификации видовой принадлежности тканей животного в продовольственном сырье, кормах и пищевых продуктах (патент РФ №2694713, кл. C12Q 1/68, 2019 г.), включающий выделение ДНК из ткани животного сорбционным методом, постановку полимеразной цепной реакции с флуоресцентной детекцией с проведением 45 циклов амплификации в реальном времени с использованием специфичных для участка генома ДНК животного олигонуклеотидных праймеров, зондов, флуоресцентных красителей: JOE/Yellow для специфического сигнала для животного и Cy5/Red - для внутреннего контрольного образца в виде суспензии бактериофага Т4 с концентрацией 5×103 фаговых частиц на 1 мкл, положительного контрольного образца в виде смеси, содержащую фрагменты геномов животного и бактериофага Т4 с нуклеотидной последовательностью:
T4F: 5'-TACATATAAATCACGCAAAGC-3' - прямой праймер
T4R: 5'-TAGTATGGCTAATCTTATTGG-3' - обратный праймер
Т4Р: НЕХ-5'-ACATTGGCACTGACCGAGTTC-3'-BHQ1 - зонд, взятых в соотношении 1:1 и измерение накопления флуоресцентных сигналов по каналам соответствующих флуоресцентных красителей, проведение интерпретации результатов на основании наличия или отсутствия пересечения кривой флуоресценции с пороговой линией, если кривые накопления флуоресцентного сигнала выходят до 35 цикла, то результат реакции считается положительным, а если кривые не пересекают пороговую линию или пересекают ее после 35 цикла, то результат реакции - отрицательный.
Недостатком известного технического решения является недостаточная точность из-за использования суспензии бактериофага, которая требует предварительную обработку, включая центрифугирование, концентрирование и перевод в определенный буферный раствор, что влечет за собой значительную трудоемкость и финансовые затраты.
Техническим результатом является повышение точности идентификации видовой принадлежности ткани кошки, упрощение процесса подготовки внутреннего контрольного образца и уменьшение его стоимости.
Технический результат достигается тем, что в способе идентификации ДНК ткани кошки домашней  в сухих кормах и мясных полуфабрикатах, включающем выделение ДНК из ткани животного сорбционным методом, постановку полимеразной цепной реакции с флуоресцентной детекцией с проведением 45 циклов амплификации в реальном времени с использованием специфичных для участка генома ДНК животного олигонуклеотидных праймеров, зондов, флуоресцентных красителей: для специфического сигнала для животного - JOE/Yellow и Cy5/Red - для внутреннего контрольного образца в виде суспензии бактериофага Т4 с концентрацией 5×103 частиц фага на 1 мкл, положительного контрольного образца в виде смеси, содержащую фрагменты геномов животного и бактериофага Т4 с нуклеотидной последовательностью:
в сухих кормах и мясных полуфабрикатах, включающем выделение ДНК из ткани животного сорбционным методом, постановку полимеразной цепной реакции с флуоресцентной детекцией с проведением 45 циклов амплификации в реальном времени с использованием специфичных для участка генома ДНК животного олигонуклеотидных праймеров, зондов, флуоресцентных красителей: для специфического сигнала для животного - JOE/Yellow и Cy5/Red - для внутреннего контрольного образца в виде суспензии бактериофага Т4 с концентрацией 5×103 частиц фага на 1 мкл, положительного контрольного образца в виде смеси, содержащую фрагменты геномов животного и бактериофага Т4 с нуклеотидной последовательностью:
T4F: 5'-TACATATAAATCACGCAAAGC-3' - прямой праймер
T4R: 5'-TAGTATGGCTAATCTTATTGG-3' - обратный праймер
Т4Р: НЕХ-5'-ACATTGGCACTGACCGAGTTC-3'-BHQ1 - зонд, взятых в соотношении 1:1 и измерение накопления флуоресцентных сигналов по каналам соответствующих флуоресцентных красителей, проведение интерпретации результатов на основании наличия или отсутствия пересечения кривой флуоресценции с пороговой линией, если кривые накопления флуоресцентного сигнала выходят до 35 цикла, то результат реакции считается положительным, а если кривые не пересекают пороговую линию или пересекают ее после 35 цикла, то результат реакции - отрицательный, согласно изобретению выделяют ДНК из ткани кошки домашней  и для внутреннего контрольного образца используют фаголизат бактериофага Т4, а для положительного контрольного образца - фрагменты геномов нативного бактериофага Т4 и ткани кошки домашней
и для внутреннего контрольного образца используют фаголизат бактериофага Т4, а для положительного контрольного образца - фрагменты геномов нативного бактериофага Т4 и ткани кошки домашней  со следующей нуклеотидной последовательностью:
со следующей нуклеотидной последовательностью:
 F ATTCggCCTACATCCgTgAC - прямой праймер
F ATTCggCCTACATCCgTgAC - прямой праймер
 R AgAAgACCCCTgCTACgACT - обратный праймер
R AgAAgACCCCTgCTACgACT - обратный праймер
 Р R6G-CTTgAgTggAgTAgggCgg-BHQ1 - зонд.
Р R6G-CTTgAgTggAgTAgggCgg-BHQ1 - зонд.
Новизна заявляемого способа состоит в идентификации видовой принадлежности ткани кошки с помощью полимеразной цепной реакции (ПЦР) с флуоресцентной детекцией в режиме реального времени с использованием в контрольных образцах разных видов бактериофага Т4, что позволяет с высокой точностью определить наличие ДНК ткани кошки в продовольственном сырье, кормах и пищевых продуктах.
Признаки, отличающие заявляемое техническое решение от прототипа, направлены на достижение технического результата и не выявлены при изучении данной и смежной областей науки и техники и, следовательно, соответствуют критерию «изобретательский уровень».
Заявляемый способ рекомендовано использовать в специализированных ветеринарных, санитарно-эпидемиологических, животноводческих, сельскохозяйственных предприятиях, что соответствует критерию «промышленная применимость».
Способ идентификации ДНК ткани кошки домашней  в сухих кормах и мясных полуфабрикатах осуществляется следующим образом.
в сухих кормах и мясных полуфабрикатах осуществляется следующим образом.
Для исследования сухих кормов и мясных полуфабрикатов на содержание ДНК ткани кошки проводят полимеразную цепную реакцию с флуоресцентной детекцией с применением термоциклера типа Rotor-Gene Q при соответствующих температурно-временных режимах амплификации и измеряют накопление флуоресцентных сигналов по каналам соответствующих флуоресцентных красителей: JOE/Yellow для специфического сигнала для ДНК ткани кошки домашней  и Cy5/Red - для внутреннего контрольного образца. Интерпретацию результатов проводят на основании наличия или отсутствия пересечения кривой флуоресценции с пороговой линией, если кривые накопления флуоресцентного сигнала выходят до 35 цикла, то результат реакции считается положительным, а если кривые не пересекают пороговую линию или пересекают ее после 35 цикла, то результат реакции - отрицательный.
и Cy5/Red - для внутреннего контрольного образца. Интерпретацию результатов проводят на основании наличия или отсутствия пересечения кривой флуоресценции с пороговой линией, если кривые накопления флуоресцентного сигнала выходят до 35 цикла, то результат реакции считается положительным, а если кривые не пересекают пороговую линию или пересекают ее после 35 цикла, то результат реакции - отрицательный.
Для повышения точности идентификации ткани кошки для внутреннего контрольного образца используют фаголизат бактериофага Т4 с концентрацией 5×103 фаговых частиц на 1 мкл, если концентрация фаговых частиц отклоняется в большую или меньшую сторону, то наблюдаются повторности сомнительных образцов. Для положительного контрольного образца используют смесь содержащую фрагменты геномов ДНК тканей кошки домашней  и нативный бактериофага Т4 взятых в соотношении 1:1, со следующими нуклеотидными последовательностями:
и нативный бактериофага Т4 взятых в соотношении 1:1, со следующими нуклеотидными последовательностями:
 F ATTCggCCTACATCCgTgAC прямой праймер
F ATTCggCCTACATCCgTgAC прямой праймер
 R AgAAgACCCCTgCTACgACT обратный праймер
R AgAAgACCCCTgCTACgACT обратный праймер
 P R6G-CTTgAgTggAgTAgggCgg-BHQ1 - зонд.
P R6G-CTTgAgTggAgTAgggCgg-BHQ1 - зонд.
T4F: 5'-TACATATAAATCACGCAAAGC-3' - прямой праймер
T4R: 5'-TAGTATGGCTAATCTTATTGG-3' - обратный праймер
Т4Р: НЕХ-5'-ACATTGGCACTGACCGAGTTC-3'-BHQ1 - зонд.
Использование для разных видов контроля различные формы материала бактериофага Т4: фаголизата и фрагмента генома нативного бактериофага со специфическими к нему праймерами и зондом обусловлено тем, что это позволяет контролировать корректное прохождение реакции в каждой пробирке, а также контролируется этап выделения ДНК из образцов. Кроме того, использование фаголизата бактериофага Т4, представляющего собой суспензию бактериофага, полученную после лизиса зараженных фагом клеток ткани, повышает воспроизводимость и упрощает процесс идентификации ткани кошки в продуктах. Использование нативного бактериофага, т.е. неповрежденного при исследовании, улучшает синтез ДНК, что также улучшает качество процесса идентификации.
При конструировании праймеров и зонда основными требованиями были: степень гомологии (комплементарность) с выбранным участком гена; отсутствие самокоплементарных участков внутри олигонуклеотидов и комплементарности друг другу, чтобы не допускать возникновения устойчивых вторичных структур (димеров); близость значений температуры отжига праймеров.
Конструирование специфических праймеров и зонда осуществляли с помощью компьютерных программ на основании анализа нуклеотидных последовательностей референтных штаммов и изолятов, опубликованных на ресурсе GenBank и подбора условий для проведения ПЦР в реальном времени с применением разработанных праймеров и зонда, несущего флуорофор и тушитель, и комплементарного части амплифицируемого со специфическими праймерами фрагмента.
Праймеры, специфичные для кошки домашней  были отобраны на основе митохондриальных последовательностей ДНК генома кошки домашней (Felis silvestris lybica isolate Pe4 NADH dehydrogenase subunit 5 (ND5) gene, partial cds; NADH dehydrogenase subunit 6 (ND6) gene, complete cds; tRNA-Glu gene, complete sequence; and cytochrome b (cyt b) gene, partial cds; mitochondrial, код доступа MG813967.1 complete genome, участок между 670 и 767). Праймеры были спроектированы с использованием Primer Express Software v3.0 (Applied Biosystems) и исследованы с использованием BLAST, чтобы подтвердить их специфичность. Для детекции продуктов амплификации были подобраны олигонуклеотидные флуоресцентно-меченные зонды Felis Р (комплементарный участку нуклеотидной последовательности, ограниченной позициями отжига праймеров Felis F и Felis R) Зонд был помечен красителем R6G. Используя программу "Oligo 6.0" описаны основные свойства рассчитанных олигонуклеотидов, определившие возможность их использования в ПЦР. Ни одна из выбранных последовательностей не обнаружена в геноме любых видов растений и животных, которые потенциально встречаются вблизи тех, которые определены в кормах и пищевых продуктах.
были отобраны на основе митохондриальных последовательностей ДНК генома кошки домашней (Felis silvestris lybica isolate Pe4 NADH dehydrogenase subunit 5 (ND5) gene, partial cds; NADH dehydrogenase subunit 6 (ND6) gene, complete cds; tRNA-Glu gene, complete sequence; and cytochrome b (cyt b) gene, partial cds; mitochondrial, код доступа MG813967.1 complete genome, участок между 670 и 767). Праймеры были спроектированы с использованием Primer Express Software v3.0 (Applied Biosystems) и исследованы с использованием BLAST, чтобы подтвердить их специфичность. Для детекции продуктов амплификации были подобраны олигонуклеотидные флуоресцентно-меченные зонды Felis Р (комплементарный участку нуклеотидной последовательности, ограниченной позициями отжига праймеров Felis F и Felis R) Зонд был помечен красителем R6G. Используя программу "Oligo 6.0" описаны основные свойства рассчитанных олигонуклеотидов, определившие возможность их использования в ПЦР. Ни одна из выбранных последовательностей не обнаружена в геноме любых видов растений и животных, которые потенциально встречаются вблизи тех, которые определены в кормах и пищевых продуктах.
 F ATTCggCCTACATCCgTgAC - прямой праймер
F ATTCggCCTACATCCgTgAC - прямой праймер
 R AgAAgACCCCTgCTACgACT - обратный праймер
R AgAAgACCCCTgCTACgACT - обратный праймер
 Р R6G-CTTgAgTggAgTAgggCgg-BHQ1 - зонд.
Р R6G-CTTgAgTggAgTAgggCgg-BHQ1 - зонд.
В качестве внутреннего контроля использовался фаголизат бактериофага Т4, имеющий геномную ДНК порядка 170 тысяч пар нуклеотидов (Enterobacteria phage Т4Т, complete genome GenBank: HM137666.1). В результате анализа был выбран участок между 400 и 600 нуклеотидами, содержащий уникальные нуклеотидные последовательности, рассчитаны первичные структуры олигонуклеотидных праймеров, фланкирующих выбранный участок генома. Праймеры были спроектированы с использованием Primer Express Software v3.0 (Applied Biosystems) и исследованы с использованием BLAST, чтобы подтвердить их специфичность.
Для детекции продуктов амплификации подобран олигонуклеотидный флуоресцентно-меченный зонд Т4Р, комплементарный участку нуклеотидной последовательности, ограниченной позициями отжига праймеров T4F и T4R. Зонд был помечен красителем Су5. Используя программу "Oligo 6.0" описаны основные свойства рассчитанных олигонуклеотидов, определившие возможность их использования в ПЦР.
T4F: 5'-TACATATAAATCACGCAAAGC-3' - прямой праймер
T4R: 5'-TAGTATGGCTAATCTTATTGG-3' - обратный праймер
Т4Р: НЕХ-5'-ACATTGGCACTGACCGAGTTC-3'-BHQ1 - зонд.
Пример конкретного осуществления способа идентификации идентификации ДНК ткани кошки домашней  в сухих кормах и мясных полуфабрикатах
в сухих кормах и мясных полуфабрикатах
Для подтверждения эффективности способа были использованы сухие корма в виде рыбной и мясной муки; сырые и термически обработанные мясные продукты, т.е. мясные полуфабрикаты.
От пробы плотной консистенции отбирают на исследование общую пробу весом 10-50 г. Гранулированную или консервированную продукцию перед исследованием (10-20 г) растирают в ступке до гомогенного состояния.
Лабораторные пробы (20-40 мг) отбирают на исследование в одноразовые микропробирки вместимостью 1,5 мл в двух повторах. Отобранные лабораторные пробы направляют на выделения ДНК.
Исследование проводят с помощью набора реагентов «ПЦР-КОШКА-ФАКТОР». Набор состоит из комплекта реагентов для проведения мультиплексной ПЦР (комплект №1) и комплекта контрольных образцов (комплект №2). Набор выпускается в двух вариантах: 1) Для анализа 55 образцов (включая контрольные образцы)
2) Для анализа 110 образцов (включая контрольные образцы).
Наборы используют в соответствии с инструкцией по применению набора реагентов «ПЦР-КОШКА-ФАКТОР» для определения ДНК тканей кошки домашней  методом полимеразной цепной реакции (ПЦР) с флуоресцентной детекцией в РВ ТУ 21.10.60-163-51062356-2018, для диагностики in vitro, http://www.vetfaktor.ru/.
методом полимеразной цепной реакции (ПЦР) с флуоресцентной детекцией в РВ ТУ 21.10.60-163-51062356-2018, для диагностики in vitro, http://www.vetfaktor.ru/.
Состав набора приведен в Таблицах 1 и 2.


Исследования состоит из трех этапов:
 экстракция нуклеиновая кислота (НК);
экстракция нуклеиновая кислота (НК);
 проведение реакции ПЦР РВ;
проведение реакции ПЦР РВ;
 учет результатов анализа.
учет результатов анализа.
* Возможна легкая опалесценция
Для экстракции (выделение) НК из исследуемых проб отбирают необходимое количество одноразовых пробирок объемом 1,5 мл, включая отрицательный контроль выделения. Во все пробирки с исследуемыми образцами, включая пробирку для отрицательного контрольного образца (ОКО), вносят по 10 мкл внутреннего контрольного образца (ВКО) для ткани кошки в качестве которого, используют фаголизат бактериофага Т4 с концентрацией 5×103 фаговых частиц на 1 мкл.
Следующий этап это подготовка образцов к проведению ПЦР.
Общий объем реакционной смеси - 25 мкл, объем ДНК-пробы - 10 мкл.
Успешное прохождение реакции контролируют использованием положительного контрольного образца (ПКО) КОШКА, ВКО КОШКА и ДНК буфера. В качестве ПКО используют смесь содержащую фрагменты геномов ткани кошки и нативного бактериофага Т4 взятых в соотношении 1:1, со следующими нуклеотидными последовательностями:
 F ATTCggCCTACATCCgTgAC прямой праймер
F ATTCggCCTACATCCgTgAC прямой праймер
 R AgAAgACCCCTgCTACgACT обратный праймер
R AgAAgACCCCTgCTACgACT обратный праймер
 Р R6G-CTTgAgTggAgTAgggCgg-ВНQ1 - зонд
Р R6G-CTTgAgTggAgTAgggCgg-ВНQ1 - зонд
T4F: 5'-TACATATAAATCACGCAAAGC-3' - прямой праймер
T4R: 5'-TAGTATGGCTAATCTTATTGG-3' - обратный праймер
Т4Р: НЕХ-5'-ACATTGGCACTGACCGAGTTC-3'-BHQ1 - зонд.
В отдельной пробирке смешивают компоненты набора из расчета на каждую реакцию:
5 мкл ПЦР СМЕСЬ КОШКА;
10 мкл ПЦР БУФЕР КОШКА;
0,5 мкл TAQ POLYMERASE
Перемешивают смесь на вортексе и сбрасывают капли кратковременным центрифугированием.
Отбирают необходимое количество пробирок для амплификации ДНК исследуемых и контрольных проб. Вносят по 15 мкл приготовленной реакционной смеси.
Помещают подготовленные для проведения ПЦР пробирки в ячейки амплификатора и используют программное обеспечение прибора. Далее проводят ПЦР РВ с флуоресцентной детекцией.
Параметры температурно-временного режима амплификации на приборе «Rotor-Gene Q» представлены в таблице 3.

Интерпретация результатов анализа.
Полученные данные - кривые накопления флуоресцентного сигнала анализируются с помощью программного обеспечения используемого прибора для проведения ПЦР в соответствии с инструкцией производителя к прибору.
Учет результатов ПЦР РВ проводится по наличию или отсутствию пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией (что соответствует наличию или отсутствию значения порогового цикла «Ct» для исследуемого образца).
Результат считается достоверным в случае корректного прохождения положительных и отрицательных контролей амплификации и экстракции ДНК в соответствии с таблицей 4.


Появление любого значения Ct в таблице 4 результатов для отрицательного контроля этапа экстракции ВК- на канале JOE/Yellow и для отрицательного контроля этапа ПЦР К- на любом из каналов свидетельствует о наличии контаминации реактивов или образцов. В этом случае результаты анализа для всех проб считаются недействительными. Требуется повторить анализ всех проб, а также предпринять меры по выявлению и ликвидации источника контаминации.
Образцы, для которых значение Ct по каналу Cy5/Red отсутствует или превышает 35 цикл (и при этом не получен положительный результат на канале JOE/Yellow) требуют повторного проведения исследования с этапа экстракции ДНК. Задержка в значениях пороговых циклов для исследуемых образцов указывает на присутствие ингибиторов в пробе(ах) или на ошибки при экстракции ДНК или при постановке реакции ПЦР РВ.
В образце обнаружена ДНК ткани кошки  если наблюдается экспоненциальный рост сигнала на канале JOE/Yellow, при этом значения Ct контрольных образцов находятся в пределах нормы (Табл. 4).
если наблюдается экспоненциальный рост сигнала на канале JOE/Yellow, при этом значения Ct контрольных образцов находятся в пределах нормы (Табл. 4).
Если для исследуемого образца по каналам JOE/Yellow значение Ct определяется позднее 37 цикла при корректном прохождении положительных и отрицательных контролей, образец исследуется повторно с этапа экстракция ДНК. Если при повторной постановке Ct более 37 результат считается отрицательным.
Образец считается отрицательным ДНК  не обнаружена), если не определяется значение Ct (не наблюдается рост специфического сигнала) на канале JOE/Yellow при этом значения Ct контрольных образцов находятся в пределах нормы (Табл. 4), а значение Ct по каналу Cy5/Red менее 35.
не обнаружена), если не определяется значение Ct (не наблюдается рост специфического сигнала) на канале JOE/Yellow при этом значения Ct контрольных образцов находятся в пределах нормы (Табл. 4), а значение Ct по каналу Cy5/Red менее 35.
Для исследуемых образцов (сухой корм и мясные полуфабрикаты) предел точности содержания тканей кошки представлен в таблице 5.

Для доказательства эффективности использования ПЦР с флуоресцентной детекцией в режиме реального времени проводился сравнительный анализ чувствительности заявляемого способа с прототипом, в котором использовался метод ПЦР с использованием внутреннего контроля в виде суспензии бактериофага, а в заявляемом - использовался фаголизат бактериофага и геном нативного бактериофага. Оказалось чувствительность ПЦР в заявляемом способе при обнаружении примеси ткани собаки в кормах и в мясных фаршах примерно выше в 1,3 раза. Трудоемкость и стоимость процесса определения ДНК ткани собаки в кормах и фаршах снизилась на 3,2-5%.