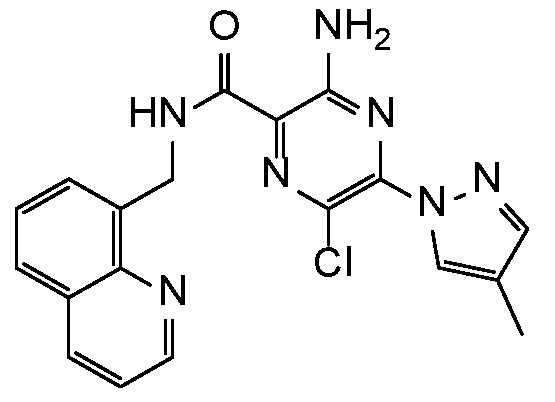
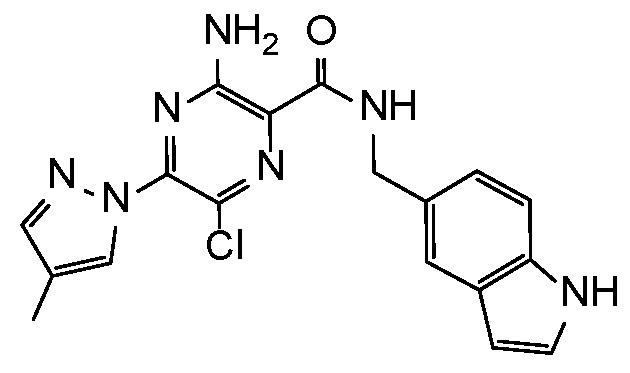
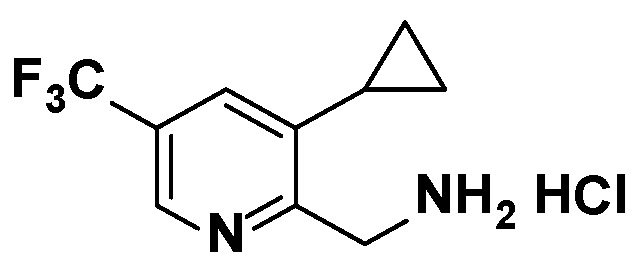
Результат интеллектуальной деятельности: АМИНОПИРАЗИНОВЫЕ СОЕДИНЕНИЯ СО СВОЙСТВАМИ АНТАГОНИСТА A2A
Вид РИД
Изобретение
Предпосылки создания изобретения
Аденозин известен как эндогенный модулятор ряда физиологических функций. На уровне сердечно-сосудистой системы аденозин является сильным сосудорасширяющим и сердечным депрессором. Аденозин индуцирует в центральной нервной системе седативные, анксиолитические и противоэпилептические эффекты. В дыхательной системе аденозин вызывает бронхоспазм. На уровне почек он оказывает двухфазное действие, вызывающее вазоконстрикцию в низких концентрациях и вазодилатацию при высоких дозах. Аденозин действует в качестве ингибитора липолиза в жировых клетках и в качестве антиагреганта тромбоцитов.
Действие аденозина опосредовано взаимодействием с различными специфическими мембранами рецепторов, которые принадлежат к семейству рецепторов, связанных с G-белками. Биохимические и фармакологические исследования, а также достижения в области молекулярной биологии, позволили идентифицировать по меньшей мере четыре подтипа аденозиновых рецепторов: A1, A2A, A2b и A3. A1 и A3 являются высокоаффинными, ингибирующими активность фермента аденилатциклазы, и A2A и A2b являются низкоаффинными, стимулирующими активность того же фермента.
Также были определены аналоги аденозина в качестве антагонистов рецепторов A1, A2A, A2b и A3. Селективные антагонисты рецепторов A2A представляют фармакологический интерес, поскольку у них снижен уровень побочных эффектов. В центральной нервной системе антагонисты A2A могут обладать антидепрессантными свойствами и стимулировать когнитивные функции. Кроме того, данные показали, что A2A рецепторы присутствуют в высокой плотности в базальных ядрах, известных как имеющие большое значение в управлении движением. Следовательно, антагонисты A2A могут улучшать двигательные нарушения, вызванные нейродегенеративными заболеваниями, например, болезнью Паркинсона, старческим слабоумием, как при болезни Альцгеймера, психозами органического происхождения.
В качестве селективных антагонистов рецепторов A1 были обнаружены некоторые связанные с ксантином соединения, и у ксантина и нексантиновых соединений обнаружена высокая аффинность в отношении A2A с различной степенью избирательности к A2A по сравнению с A1. Ранее были раскрыты триазоло-пиримидинаденозиновые антагонисты рецепторов A2A с различными замещениями в положении 7, например, в публикациях международной заявки PCT № WO 95/01356; США 5565460; WO 97/05138 и WO 98/52568.
Болезнь Паркинсона характеризуется прогрессивной дегенерацией нигростриарного дофаминэргического пути. Последующее сокращение уровня стриарного дофамина отвечает за двигательные симптомы, связанные с болезнью Паркинсона, например, потеря тонкой моторики или нарушения моторных функций, проявляется у тех, кто страдает этой болезнью. Существующие в настоящее время методики облегчения двигательных симптомов, связанных с болезнью Паркинсона, стремятся заменить дофамин либо в пресинаптическом терминале, например, введением L-Dopa, непосредственно через стимулирование постсинаптических рецепторов D2, или путем ингибирования метаболизма, например, путем введения моноаминоксидазы типа B (MAO-B) или катехол-О-метилтрансферазы (COMT). Длительное применение таких способов лечения часто связано с неблагоприятными событиями. Например, длительная терапия с L-Dopa (в настоящее время стандарт медицинской помощи) зачастую связана с неблагоприятными событиями (например, двигательными осложнениями), например, «исчезновением», «случайными включениями-выключениями» осцилляции или дискинезии. Эти двигательные осложнения, возникающие при проведении лечения болезни Паркинсона, зачастую становятся прогрессивно более тяжелыми при продолжительном лечении.
Как представлено выше, A2A рецепторы присутствуют в высокой плотности в базальных ядрах и известны, как имеющие большое значение при управлении тонкой двигательной моторикой. Высокоселективные антагонисты A2A продемонстрировали свою эффективность в снижении двигательных симптомов, связанных с нейродегенеративными заболеваниями. Таким образом, полагают, что, соединения, которые являются антагонистами рецепторов A2A, полезны в облегчении двигательных симптомов, связанных с болезнью Паркинсона. Например, в патенте США 6630475 на имя Neustadt et al. (патент '475) описано получение соединения Формулы PI:
 Формула PI.
Формула PI.
В примерах схем 1-5 патента '475, наряду с препаративными схемами 1-4, показаны общие способы получения соединений формулы PI. В патенте '475 описано также, что соединение формулы I может быть получено в виде фармацевтически приемлемой соли, которая может быть использована при лечении болезни Паркинсона.
Применение антагонистов рецептора A2A в отношении возможного лечения расстройств центральной нервной системы, в частности, болезни Паркинсона, и фармацевтических композиций, содержащих указанные соединения, имеет повышенную потребность в мощных, умеренно липофильных, проникающих в мозг ингибиторах рецептора A2A. Такие соединения могут обеспечить расширение арсенала соединений, которые, как считается, имеют значение в лечении расстройств центральной нервной системы, в частности, лечении или оказании помощи при прогрессировании заболеваний, таких как, например, но без ограничения, болезнь Паркинсона.
Сущность изобретения
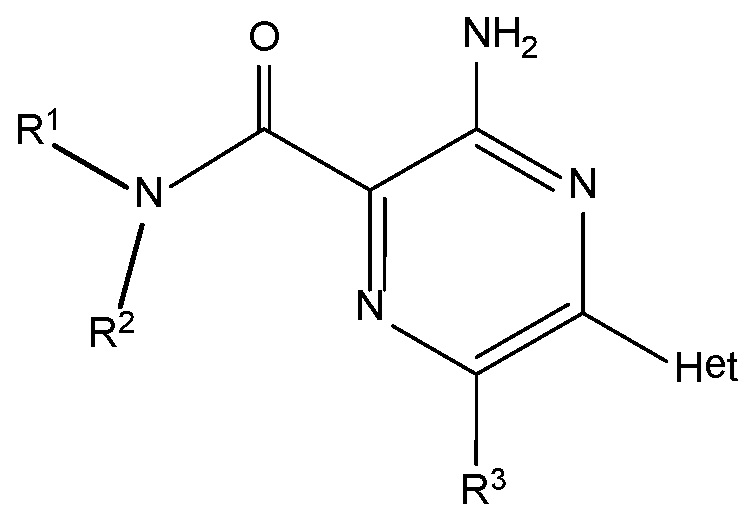
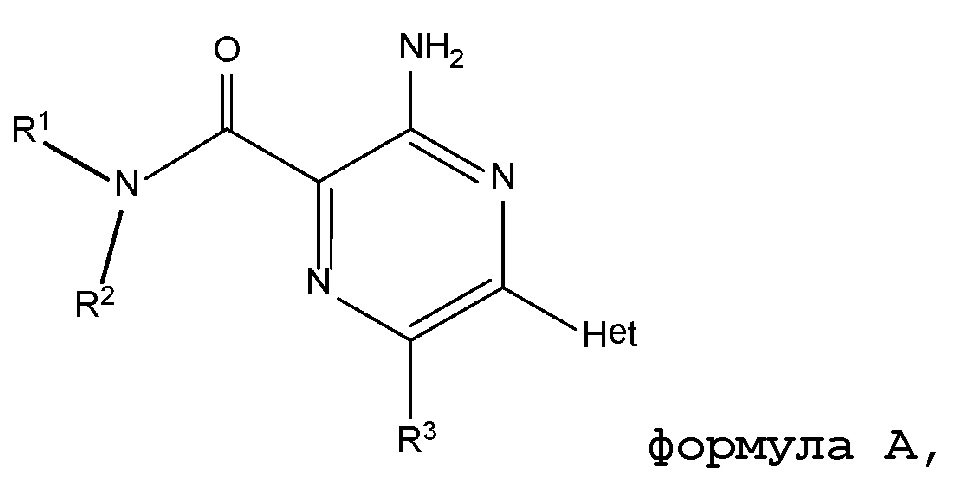
В одном из аспектов настоящее изобретение предоставляет одно или более соединений или их фармацевтически приемлемую соль, которые, как полагают, будут полезны в качестве антагониста рецептора A2A, имеющие структуру формулы A:
соединение формулы A:
 Формула A
Формула A
или его соль,
где:
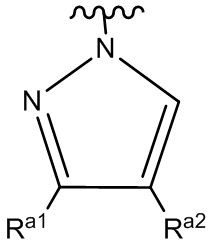
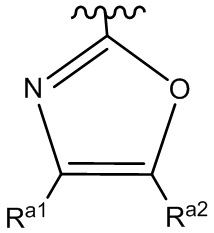
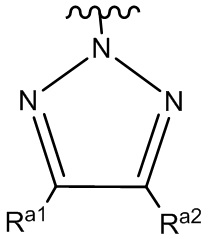
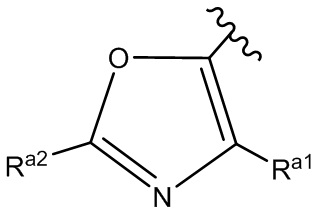
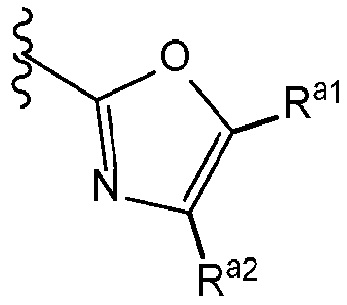
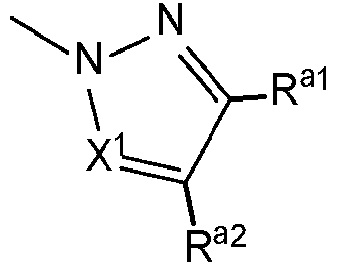
ʺHetʺ представляет собой группу формул:

 или
или

где ʺRa1ʺ и ʺRa2ʺ, каждый независимо, представляет собой: (a) -H или (b) низший алкил, который необязательно замещен одной или более группами, представляющими собой: (i) галоген, предпочтительно -F, или (ii) низший алкокси;
(А) один из R1 или R2 представляет собой низший алкил или -H, а другой представляет собой:
(а) линейную, разветвленную, моноциклическую или бициклическую алкильную группу с вплоть до 10 атомами углерода, которая необязательно замещена одним или более заместителями, которые независимо представляют собой:
(i) галоген, предпочтительно -F;
(ii) -NR1gR2g, где R1g и R2g независимо представляют собой: (aii) -H или (bii) низший алкил;
(iii) -CN;
(iv) -OH;
(v) моно- или полициклический гетероарил, содержащий по меньшей мере два атома углерода и вплоть до 3 гетероатомов, которые независимо представляют собой, N, O или S, и который необязательно замещен:
(ai) низшим алкилом, который необязательно замещен одной или более группами, независимо представляющими собой:
(aii) галоген, который в некоторых вариантах осуществления предпочтительно представляет собой -F,
(bii) низший алкокси,
(cii)-OH;
(bi) группой -NR1gR2g, где R1g и R2g независимо представляют собой: (aii) -H или (bii) низший алкил;
(ci) низшим алкокси, который необязательно замещен в его алкильной части галогеном, и когда является незамещенным, в некоторых вариантах осуществления указанный низший алкоксифрагмент предпочтительно представляет собой метокси; и когда является галоген-замещенным, в некоторых вариантах осуществления указанным галогеновым заместителем предпочтительно является -F;
(di) галогеном, который в некоторых вариантах осуществления предпочтительно представляет собой -F или -Cl;
(ei) -OH;
(fi) гетероарилом;
(gi) гетероциклоалкилом, который необязательно замещен одним или более атомами галогена, и когда является галоген-замещенным, галогеном предпочтительно является -F;
и где, если указанный гетероарил содержит единственный гетероатом азота в кольце, указанное азотсодержащее кольцо необязательно присутствует в окисленной форме в виде N-оксида;
(vi) гетероарилон, который необязательно замещен одной или более группами, независимо представляющими собой низший алкил, где низший алкильный заместитель необязательно замещен фтором;
(vii) гетероариларильный конденсированный фрагмент, который необязательно замещен одной или более низшими алкильными группами, где низшие алкильные группы необязательно замещены фтором;
(viii) арил, который необязательно замещен одной или более группами, независимо представляющими собой:
(ai) низший алкил, который необязательно замещен галогеном, и в некоторых вариантах осуществления, когда присутствует, указанным галогеновым заместителем предпочтительно является -F,
(bi) галоген, и в некоторых вариантах осуществления, когда присутствует, указанным галогеновым заместителем предпочтительно является -Cl или -F,
(ci) -OH,
(di) низший алкокси, который необязательно замещен галогеном, и в некоторых вариантах осуществления указанным низшим алкоксизаместителем предпочтительно является H3C-O- или F3C-O-, или
(ei) -N(Ra8)2, где ʺRa8ʺ независимо представляет собой -H или низший алкил;
(ix) арилгетероарильный конденсированный фрагмент, который необязательно замещен одной или более группами, представляющими собой низший алкил;
(x) циклоалкилгетероарильный конденсированный фрагмент;
(xi) линейный, разветвленный или циклический алкил с вплоть до 6 атомами углерода, который необязательно замещен одной или более группами, независимо представляющими собой: (ai) -CN; (bi) низший алкокси или (ci) галоген;
(xii) фрагмент формулы ʺ-C(O)-Ra12ʺ, где ʺRa12ʺ представляет собой группу, которой является: (ai) низший алкил; (bi) низший алкокси; (ci) гетероарил или (di) арил, и где указанная группа ʺRa12ʺ необязательно замещена одной или более галогеновыми группами, и когда одна или более галогеновых групп присутствуют на указанной группе ʺRa12ʺ, в некоторых вариантах осуществления указанным галогеном предпочтительно является -F;
(xiii) фрагмент формулы ʺ-O-Ra13ʺ, где ʺRa13ʺ представляет собой низший алкил или арил;
(xiv) -OH;
(xv) гетероарилгетероциклоалкильный конденсированный фрагмент;
(b) гетероарилциклоалкильный конденсированный фрагмент, который необязательно замещен:
(i) -OH или (ii) галогеном, и в некоторых вариантах осуществления, когда присутствует, указанным галогеновым заместителем предпочтительно является -F или -Cl;
(c) гетероциклоалкил, который необязательно замещен одной или более группами, независимо представляющими собой: (i) -F или (ii) гетероарил;
(d) соединение формулы:  , где ʺRd1ʺ представляет собой -H или низший алкил, и где один из ʺXd1ʺ или ʺXd2ʺ представляет собой -CH2-, а другой представляет собой -C(=O)-;
, где ʺRd1ʺ представляет собой -H или низший алкил, и где один из ʺXd1ʺ или ʺXd2ʺ представляет собой -CH2-, а другой представляет собой -C(=O)-;
(e) арилгетероциклоалкильный конденсированный фрагмент;
(f) гетероциклоалкиларильный конденсированный фрагмент, который необязательно замещен -OH или галогеном;
(g) гетероарилгетероциклоалкильный конденсированный фрагмент, который необязательно замещен -OH или галогеном;
(h) арилциклоалкильный конденсированный фрагмент, который необязательно замещен одной или более группами, независимо представляющими собой:
(i) -OH,
(ii) -CN,
(iii) галоген, и в некоторых вариантах осуществления, когда присутствует галогеновый заместитель, указанным галогеновым заместителем предпочтительно является -Cl или -F; или
(iv) низший алкокси;
и в некоторых вариантах осуществления, когда указанная группа ʺR1ʺ или ʺR2ʺ замещена линейной, разветвленной, моноциклической или бициклической группой, указанной алкильной группой предпочтительно является метилен или этилен;
(B) R1 и R2, взятые вместе, представляют собой группу формулы -[(CRB1RB2)2)n]-, где ʺnʺ равен целому числу от 3 до 6, и ʺRB1ʺ и ʺRB2ʺ, каждый независимо, представляет собой: (a) низший алкил; (b) водород; (c) арил или (d) галоген, образуя, таким образом, с атомом азота, с которым они связаны, гетероциклоалкильную группу; или
(C) R1 и R2, взятые вместе, образуют арилгетероциклоалкильный конденсированный фрагмент, который в некоторых вариантах осуществления предпочтительно представляет собой 6-N-связанный 6,7-дигидро-5H-пирроло[3,4-d]пиримидин; и
ʺR3ʺ представляет собой: (a) -CN; (b) галоген, предпочтительно -Cl; (c) низший алкил, который необязательно замещен одной или более группами, представляющими собой: (i) -OH или (ii) галоген, и когда является галоген-замещенным, галогеновым заместителем предпочтительно является -F, и когда является незамещенным, указанный низший алкил предпочтительно представляет собой -CH3.
В некоторых вариантах осуществления соединения настоящего изобретения предпочтительно имеют структуру формулы A-a:
 Формула A-a,
Формула A-a,
где R1, R2, R3, Ra1, и Ra2 являются такими, как определено выше.
В некоторых вариантах осуществления соединения настоящего изобретения предпочтительно имеют структуру формулы A-b:
 Формула A-b,
Формула A-b,
где R1, R2, R3, Ra1 и Ra2 являются такими, как определено выше; и ʺX1ʺ представляет собой [-CH=] или [-N=].
В некоторых вариантах осуществления соединением по настоящему изобретению является этил-3-амино-6-метил-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксилат.
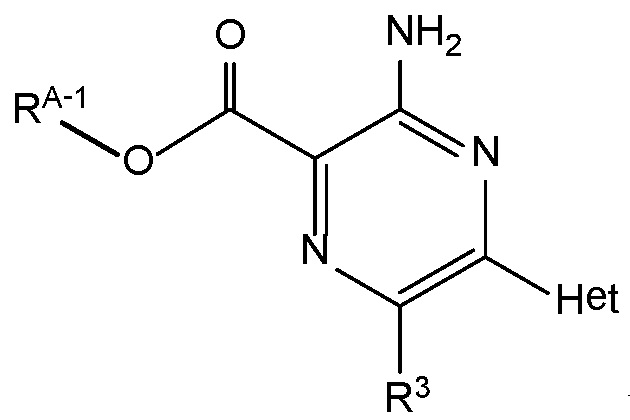
В некоторых вариантах осуществления соединения настоящего изобретения имеют структуру формулы A-1:
 Формула A-1,
Формула A-1,
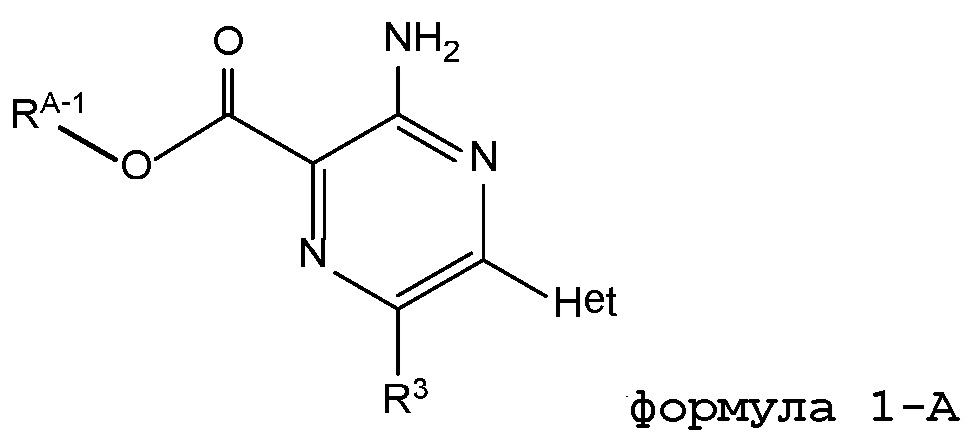
где ʺRA-1ʺ представляет собой низший алкил, и ʺR3ʺ и ʺHetʺ имеют определения, как указано выше.
В некоторых вариантах осуществления соединением по настоящему изобретению является этил-3-амино-6-метил-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксилат. В некоторых вариантах осуществления соединением по настоящему изобретению является метил-3-амино-6-хлор-5-(1H-пиразол-1-ил)пиразин-2-карбоксилат.
В другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей по меньшей мере одно соединение формулы GI или его фармацевтически приемлемую соль. В другом аспекте настоящее изобретение направлено на применение соединений и их фармацевтически приемлемой соли при лечении двигательных расстройств, в которые вовлечены рецепторы A2A.
В некоторых аспектах настоящее изобретение предоставляет способ лечения расстройств центральной нервной системы, путем введения субъекту, нуждающемуся в этом, терапевтического количества по меньшей мере одного соединения формулы GI или его фармацевтически приемлемой соли.
Подробное описание изобретения
Как приведено выше, настоящее изобретение предоставляет соединения, имеющие структуру формулы A и формулы A-1, или их соль:
 Формула A
Формула A
 Формула A-1
Формула A-1
где ʺR1ʺ, ʺRA-1ʺ, ʺR2ʺ, ʺR3ʺ и ʺHetʺ определены в данном описании выше, которые, как полагают, обладают активностью антагониста рецептора A2A.
В некоторых вариантах осуществления предпочтительными соединениями настоящего изобретения являются:
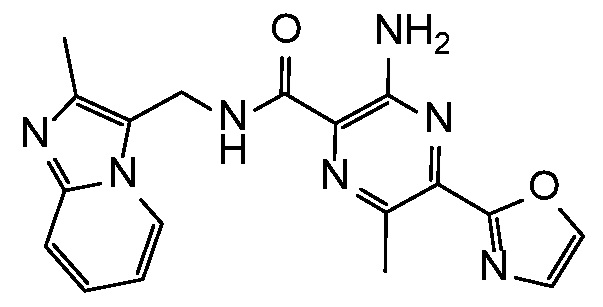
3-амино-6-метил-N-[(3-метилпиридин-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(3-циклопропилпиридин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-(хинолин-8-илметил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[(6-метилпиридин-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(2,6-дифторбензил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(изоксазол-5-илметил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-(1,3-оксазол-2-илметил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[(4-метил-1H-имидазол-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[(1-метил-1H-имидазол-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(1H-имидазол-2-илметил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-(1,3-тиазол-5-илметил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-{[3-(трифторметил)пиридин-2-ил]метил}пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-(пиримидин-2-илметил)пиразин-2-карбоксамид;
3-амино-N-[(3-фторпиридин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-{[6-(диметиламино)пиридин-2-ил]метил}-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(6-метоксипиридин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(изохинолин-8-илметил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-(3,4-дигидрохинолин-1(2H)-илкарбонил)-5-метил-6-(1,3-оксазол-2-ил)пиразин-2-амин;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-(2-пиридин-2-илэтил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[(1-метил-1H-пиразол-3-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-(пиридин-4-илметил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-(пиридин-3-илметил)пиразин-2-карбоксамид;
3-амино-N-(изохинолин-3-илметил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(2-фторбензил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(3-фторбензил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(4-фторбензил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-(хинолин-2-илметил)пиразин-2-карбоксамид;
3-[(3,3-дифторпиперидин-1-ил)карбонил]-5-метил-6-(1,3-оксазол-2-ил)пиразин-2-амин;
3-амино-N-[(4,6-диметилпиридин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-{[1-(2,2-дифторэтил)-1H-бензимидазол-4-ил]метил}-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-[(1,4,5-триметил-1H-имидазол-2-ил)метил]пиразин-2-карбоксамид;
3-амино-6-метил-N-{[5-метил-1-(1-метилэтил)-1H-имидазол-4-ил]метил}-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-(1,3-оксазол-5-илметил)пиразин-2-карбоксамид;
3-амино-N-(изотиазол-5-илметил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(3,6-диметилпиридин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-{[4-(трифторметил)пиридин-2-ил]метил}пиразин-2-карбоксамид;
3-амино-N-[(3-метоксипиридин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-{[1-(2,2-дифторэтил)-1H-имидазол-2-ил]метил}-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(4-хлорпиридин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(3-хлорпиридин-4-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(3-хлор-5-фторпиридин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[(4-метилпиридазин-3-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(5-хлорпиридин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[(1-метил-2-оксо-1,2-дигидропиридин-3-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-(пиридин-2-илметил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-[(1-оксидопиридин-2-ил)метил]пиразин-2-карбоксамид;
3-амино-N-[(6-фторпиридин-3-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-{[6-хлор-4-(трифторметил)пиридин-2-ил]метил}-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-{[5-метокси-6-(трифторметил)пиридин-2-ил]метил}-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[(5-метилпиридазин-3-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(5-фторпиридин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-{[3-метил-4-(2,2,2-трифторэтокси)пиридин-2-ил]метил}-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-{[5-(трифторметил)пиридин-2-ил]метил}пиразин-2-карбоксамид;
3-амино-6-метил-N-(2-метил-2-пиридин-4-илпропил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(4-фторпиридин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(3,5-дифторпиридин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-{[4,6-бис(дифторметил)пиридин-2-ил]метил}-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(2-гидроксипиридин-3-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(2-хлорпиридин-3-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-(1-пиримидин-2-илпиперидин-4-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[(3-метилпиридин-4-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(2-азетидин-1-ил-2-оксоэтил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-(пиримидин-5-илметил)пиразин-2-карбоксамид;
3-амино-N-[(2,6-диметилпиридин-3-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(2,4-диметил-1,3-тиазол-5-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(3-хлорпиридин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(2-фтор-5-метилпиридин-3-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(5-хлор-3-фторпиридин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-{[2,6-бис(дифторметил)пиридин-4-ил]метил}-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-(пиримидин-4-илметил)пиразин-2-карбоксамид;
3-амино-N-[(1,4-диметил-1H-пиразол-3-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(1,5-диметил-1H-пиразол-4-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(1-этил-1H-имидазол-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(6-метокси-3-метилпиридин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(4,6-диметилпиримидин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-(1-пиридин-2-илэтил)пиразин-2-карбоксамид;
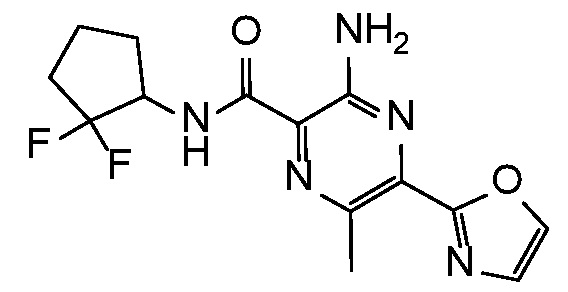
3-амино-N-(4,4-дифторциклогексил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-(5,6,7,8-тетрагидроизохинолин-5-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-{[6-(1-метилэтил)пиридин-2-ил]метил}-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-(1-пиридин-2-илэтил)пиразин-2-карбоксамид;
3-амино-6-метил-N-{[1-(1-метилэтил)-1H-имидазол-2-ил]метил}-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[(3-метил-2,2'-бипиридин-6-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-{[3-метил-6-(1-метилэтил)пиридин-2-ил]метил}-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-{[6-(2-этоксиэтил)-3-метилпиридин-2-ил]метил}-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-{[1-(2,2-дифторэтил)-2-оксо-1,2-дигидропиридин-3-ил]метил}-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-{[1-метил-4-(трифторметил)-1H-имидазол-2-ил]метил}-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(1-цианоциклобутил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-(1-пиридин-2-илпропил)пиразин-2-карбоксамид;
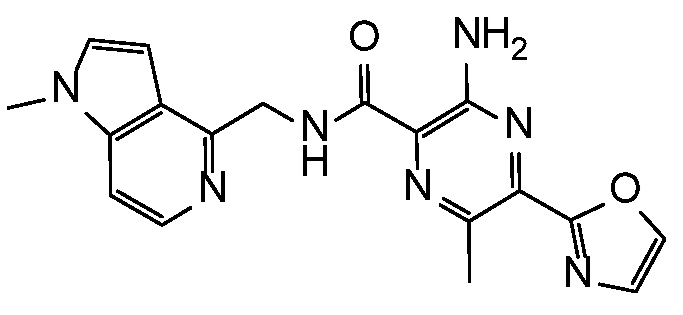
3-амино-N-(1H-индол-7-илметил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(имидазо-[1,2-a]пиридин-3-ил-метил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[(2-метилимидазо[1,2-a]пиридин-3-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-(5,6,7,8-тетрагидро-1,8-нафтиридин-2-илметил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-[(1-оксидопиридин-3-ил)метил]пиразин-2-карбоксамид;
3-амино-N-{[1-(циклопропилметил)-5-метил-1H-имидазол-4-ил]метил}-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-[цис-4-(трифторметил)циклогексил]пиразин-2-карбоксамид;
3-амино-6-метил-N-[(6-метилимидазо[1,2-a]пиридин-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-(1,4,5,6-тетрагидроциклопента[c]пиразол-3-илметил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-(5,6,7,8-тетрагидроизохинолин-5-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-(1-пиридин-2-илпропил)пиразин-2-карбоксамид;
3-амино-N,6-диметил-5-(1,3-оксазол-2-ил)-N-(1-пиридин-2-илэтил)пиразин-2-карбоксамид;
3-амино-N-[(5-фтор-3-метилпиридин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-{[4-(трифторметил)пиримидин-2-ил]метил}пиразин-2-карбоксамид;
3-амино-N-[(5-фторпиримидин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(4-метоксипиримидин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[(7-метилимидазо[1,2-a]пиридин-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[2-(4-фторфенил)-2-оксоэтил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[3-(3,3-дифторпирролидин-1-ил)пропил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-{[1-(циклопропилметил)-1H-имидазол-4-ил]метил}-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(3,3-дифторциклопентил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-[1-(2,2,2-трифторэтил)пиперидин-3-ил]пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-пиперидин-3-илпиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-[транс-4-(трифторметил)циклогексил]пиразин-2-карбоксамид;
3-амино-N-{[6-(1-гидрокси-1-метилэтил)пиридин-2-ил]метил}-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(1,4-диметил-1H-имидазол-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-{[6-(трифторметил)пиридин-2-ил]метил}пиразин-2-карбоксамид;
3-амино-N-{[6-(метоксиметил)пиридин-2-ил]метил}-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(2-метоксиэтил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(2-метоксипиридин-3-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-(5,8-дигидро-1,7-нафтиридин-7(6H)-илкарбонил)-5-метил-6-(1,3-оксазол-2-ил)пиразин-2-амин;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-{[5-(трифторметил)пиримидин-2-ил]метил}пиразин-2-карбоксамид;
3-амино-N-[(1-циклобутил-1H-имидазол-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(циклопропилметил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(5-фтор-2-гидроксибензил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(1S,2S)-2-гидрокси-2,3-дигидро-1H-инден-1-ил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
5-метил-6-(1,3-оксазол-2-ил)-3-[(2-фенилазетидин-1-ил)карбонил]пиразин-2-амин;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-(тиофен-2-илметил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[4-(1-метилэтил)бензил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(4-циклопропилбензил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(2-фтор-3-метилбензил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-(2,4,6-триметилбензил)пиразин-2-карбоксамид;
3-амино-N-(4-фтор-3-метилбензил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(1S)-2,3-дигидро-1H-инден-1-ил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(4-этилбензил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(1R)-2,3-дигидро-1H-инден-1-ил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[(1-метил-1H-пиррол-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(1,5-диметил-1H-пиррол-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(3-метоксибензил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(2-метоксибензил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(4R)-3,4-дигидро-2H-хромен-4-ил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(4S)-3,4-дигидро-2H-хромен-4-ил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(3R)-2,3-дигидро-1-бензофуран-3-ил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(4-метоксибензил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
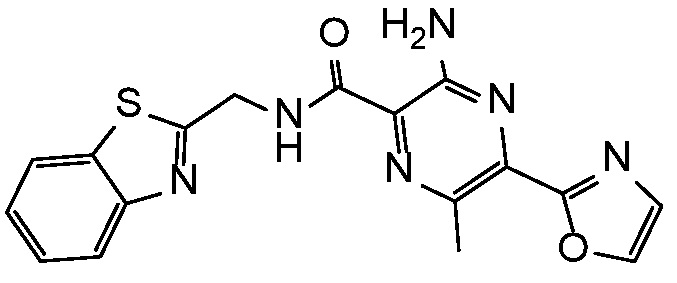
3-амино-N-(1,3-бензотиазол-2-илметил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-[(2-тиофен-2-ил-1,3-тиазол-4-ил)метил]пиразин-2-карбоксамид;
3-(5,7-дигидро-6H-пирроло[3,4-d]пиримидин-6-илкарбонил)-5-метил-6-(1,3-оксазол-2-ил)пиразин-2-амин;
3-(5,7-дигидро-6H-пирроло[3,4-d]пиримидин-6-илкарбонил)-5-метил-6-(1,3-оксазол-2-ил)пиразин-2-амин;
3-амино-N-(2-гидроксибензил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(2-гидрокси-5-метилбензил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(4-гидроксибензил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(1R,2S)-2-гидрокси-2,3-дигидро-1H-инден-1-ил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(3S)-2,3-дигидро-1-бензофуран-3-ил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(3-гидроксибензил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(1R,2R)-2-гидрокси-2,3-дигидро-1H-инден-1-ил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(6,7-дигидро-5H-пирроло[2,1-c][1,2,4]триазол-3-илметил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(1,4,5,6,7,8-гексагидроциклогепта[c]пиразол-3-илметил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(4-фтор-3-метилпиридин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
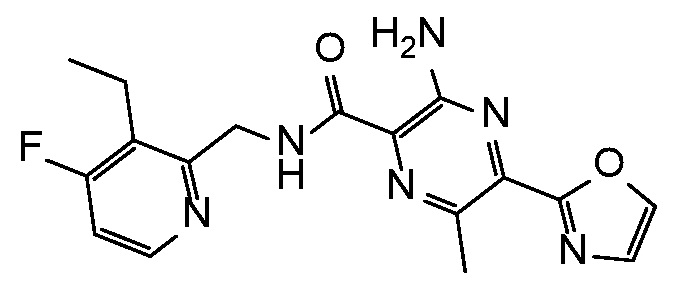
3-амино-N-[(3-этил-4-фторпиридин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(1H-бензимидазол-2-илметил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(4-гидроксициклогептил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(1-этил-1H-1,2,4-триазол-5-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(3-этоксипиридин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(4-гидроксициклогептил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(3-циклопропил-5-фторпиридин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(4-циклопропил-1-метил-1H-пиразол-3-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(1R,2S)-2-(метоксиметил)циклопентил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(3-фторпиразин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(2-этокси-6-фторбензил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[(1-метил-1,4,5,6-тетрагидроциклопента[c]пиразол-3-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[(5-метилпиримидин-4-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(4-гидроксициклогептил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(4-гидроксициклогептил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(изохинолин-1-илметил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(3-этилпиридин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(3-циклопропил-4-фторпиридин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-{[1-(2,2,2-трифторэтил)-1H-бензимидазол-4-ил]метил}пиразин-2-карбоксамид;
3-амино-N-{[3-циклопропил-5-(трифторметил)пиридин-2-ил]метил}-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-{[3-метил-5-(трифторметил)пиридин-2-ил]метил}-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(3-циклопропил-пиразин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[(5-метилпиримидин-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(2-фтор-6-метоксибензил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(3-этилпиразин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-{[1-(1-метилэтил)-1H-1,2,4-триазол-5-ил]метил}-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-{[1-(1-метилэтил)-1H-бензимидазол-4-ил]метил}-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[2-(2-метил-6,7-дигидро[1,3]оксазоло[5,4-c]пиридин-5(4H)-ил)этил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(2,2-дифторциклопентил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(2,2-дифторциклопентил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(1-этил-1H-бензимидазол-4-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-{[4-(дифторметил)-1-метил-1H-пиразол-3-ил]метил}-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[(3-метилпиразин-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-{[3-этил-5-(трифторметил)пиридин-2-ил]метил}-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(5-циклопропилпиримидин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[(3-метил-3H-имидазо[4,5-c]пиридин-4-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(5-этилпиримидин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(1S)-5-фтор-2,3-дигидро-1H-инден-1-ил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(1S)-6-фтор-2,3-дигидро-1H-инден-1-ил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(1R,2R)-2-гидроксициклопентил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(1S,2R)-2-фторциклопентил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(1R,2R)-2-(диметиламино)циклопентил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(1R,2R)-2-гидроксициклопентил]-N,6-диметил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(1R,2R)-2-фторциклопентил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(1S,2R,5R)-2-гидрокси-5-метилциклопентил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-[(1R,2R)-2-проп-2-ин-1-илциклопентил]пиразин-2-карбоксамид;
3-амино-N-[(1S,2R)-2-этинилциклопентил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(2-фторциклопентил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(1S,2S)-2-гидроксициклопентил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(1R,2S)-2-гидроксициклопентил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(1R,2R,4S)-бицикло[2,2,1]гепт-2-ил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[(1-метил-1H-пирроло[3,2-c]пиридин-4-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-{[3-(трифторметил)пиразин-2-ил]метил}пиразин-2-карбоксамид;
3-амино-N-[(2-этил-2H-индазол-7-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-{[1-(2,2-дифторэтил)-1H-индол-4-ил]метил}-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[(1-метил-1H-бензимидазол-4-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[(1-метил-1H-бензимидазол-7-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(5-циано-2,3-дигидро-1H-инден-1-ил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(5-циано-2,3-дигидро-1H-инден-1-ил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(1S)-5-хлор-2,3-дигидро-1H-инден-1-ил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
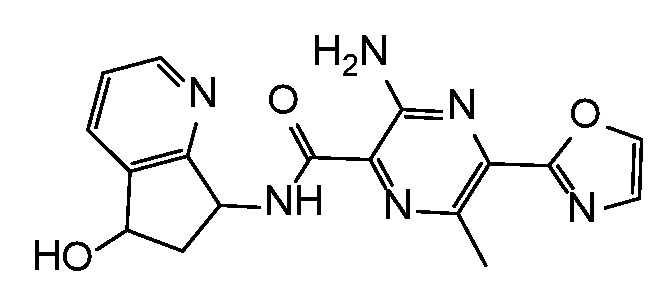
3-амино-N-(5-гидрокси-6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-{[3-(фторметил)пиридин-2-ил]метил}-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-{[3-(гидроксиметил)пиридин-2-ил]метил}-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[1-(3-метилпиридин-2-ил)этил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[1-(3-метилпиридин-2-ил)этил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-{[1-(2,2-дифторэтил)-1H-индазол-4-ил]метил}-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-{[1-(циклопропилметил)-1H-бензимидазол-4-ил]метил}-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-(5,6,7,8-тетрагидрохинолин-8-ил)пиразин-2-карбоксамид;
3-амино-N-(5-метокси-2,3-дигидро-1H-инден-1-ил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(5-метокси-2,3-дигидро-1H-инден-1-ил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-(1,2,3,4-тетрагидронафталин-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-(1,2,3,4-тетрагидронафталин-2-ил)пиразин-2-карбоксамид;
3-амино-N-(2,3-дигидро-1H-инден-2-ил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-{[6-(1-гидрокси-1-метилэтил)-3-метилпиридин-2-ил]метил}-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-{[6-(1-гидрокси-1-метилэтил)-3-метоксипиридин-2-ил]метил}-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(6-гидрокси-6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(6-гидрокси-6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(5-гидрокси-6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(5-гидрокси-6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(1-этил-1H-индазол-4-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(2-этил-2H-индазол-4-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(4-хлор-6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(2-хлор-6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-(5,6,7,8-тетрагидрохинолин-8-ил)пиразин-2-карбоксамид;
3-амино-N-(4-хлор-6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(2-хлор-6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-5-ил)-N-{[3-(трифторметил)-пиридин-2-ил]-метил}пиразин-2-карбоксамид;
3-амино-6-хлор-5-(1,3-оксазол-5-ил)-N-(хинолин-8-илметил)пиразин-2-карбоксамид;
3-амино-N-(2,6-дифторбензил)-6-метил-5-(1,3-оксазол-5-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[(3-метилпиридин-2-ил)метил]-5-(1,3-оксазол-5-ил)пиразин-2-карбоксамид;
3-амино-N-(2,4-дифторбензил)-6-метил-5-(1,3-оксазол-5-ил)пиразин-2-карбоксамид;
3-амино-N-(2-метоксибензил)-6-метил-5-(1,3-оксазол-5-ил)пиразин-2-карбоксамид;
3-амино-N-(2,6-дихлорбензил)-6-метил-5-(1,3-оксазол-5-ил)пиразин-2-карбоксамид;
3-амино-N-(2-хлор-6-метилбензил)-6-метил-5-(1,3-оксазол-5-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-5-ил)-N-{[3-(трифторметил)пиридин-2-ил]метил}пиразин-2-карбоксамид;
3-амино-N-(2,4-дихлор-6-метилбензил)-6-метил-5-(1,3-оксазол-5-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-(1-метил-1-пиридин-2-илэтил)-5-(1,3-оксазол-5-ил)пиразин-2-карбоксамид;
3-амино-N-[1-(3,4-дифторфенил)-1-метилэтил]-6-метил-5-(1,3-оксазол-5-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-(1-метил-1-пиридин-4-илэтил)-5-(1,3-оксазол-5-ил)пиразин-2-карбоксамид;
3-амино-N-(2,2-дифторпропил)-6-метил-5-(1,3-оксазол-5-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[(6-метилпиридин-2-ил)метил]-5-(1,3-оксазол-5-ил)пиразин-2-карбоксамид;
3-амино-N-(6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(1,3-оксазол-5-ил)пиразин-2-карбоксамид;
3-амино-N-(6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(1,3-оксазол-5-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-5-(1H-1,2,3-триазол-1-ил)-N-[2-(трифторметил)бензил]пиразин-2-карбоксамид;
3-амино-6-хлор-5-(2H-1,2,3-триазол-2-ил)-N-[2-(трифторметил)бензил]пиразин-2-карбоксамид;
3-амино-6-хлор-N-(2,4-дифторбензил)-5-(1H-1,2,3-триазол-1-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-(2,4-дифторбензил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-(хинолин-8-илметил)-5-(1H-1,2,3-триазол-1-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-(хинолин-8-илметил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(2,6-дифторбензил)-6-метил-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-(хинолин-8-илметил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
этил 3-амино-6-метил-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксилат;
3-амино-6-метил-N-[(3-метилпиридин-2-ил)метил]-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[(3-метилпиридин-2-ил)метил]-5-(1H-1,2,3-триазол-1-ил)пиразин-2-карбоксамид;
3-амино-N-(2,4-дихлорбензил)-6-метил-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
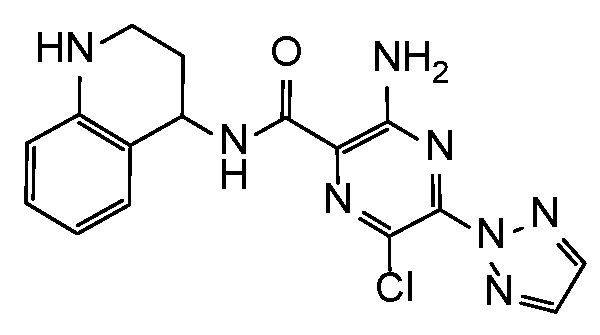
3-амино-6-метил-N-(1,2,3,4-тетрагидрохинолин-4-ил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-[(1R)-2,3-дигидро-1H-инден-1-ил]-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-[(3-метилпиридин-2-ил)метил]-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-(2-метоксибензил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-5-(2H-1,2,3-триазол-2-ил)-N-[2-(трифторметокси)бензил]пиразин-2-карбоксамид;
3-амино-6-хлор-5-(2H-1,2,3-триазол-2-ил)-N-[(1R)-2,2,2-трифтор-1-фенилэтил]пиразин-2-карбоксамид;
3-амино-6-хлор-5-(2H-1,2,3-триазол-2-ил)-N-[(1S)-2,2,2-трифтор-1-фенилэтил]пиразин-2-карбоксамид;
3-амино-6-хлор-N-[(1R)-1-хинолин-2-илэтил]-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(2-бромбензил)-6-хлор-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[2-(2-бромфенил)этил]-6-хлор-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-метил-N-(хинолин-8-илметил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-(1-пиридин-3-илциклопропил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-[(8-бром-3,4-дигидроизохинолин-2(1H)-ил)карбонил]-5-хлор-6-(2H-1,2,3-триазол-2-ил)пиразин-2-амин;
3-амино-6-хлор-N-(1,2,3,4-тетрагидрохинолин-4-ил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-[2-(3,4-диметоксифенил)этил]-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-(пиразолo[1,5-a]пиридин-3-илметил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-(изохинолин-5-илметил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-(изохинолин-8-илметил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(1,3-бензотиазол-2-илметил)-6-хлор-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(1,3-бензоксазол-2-илметил)-6-хлор-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-(хиноксалин-5-илметил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-(хинолин-4-илметил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(1H-бензимидазол-2-илметил)-6-хлор-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(2-аминобензил)-6-хлор-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(2-амино-6-фторбензил)-6-хлор-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-(имидазо[1,2-a]пиридин-3-илметил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-(хинолин-2-илметил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-(изохинолин-3-илметил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-(1H-индол-2-илметил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-(хинолин-5-илметил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-(имидазо[2,1-b][1,3]тиазол-6-илметил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-(2-пиразин-2-илэтил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-[(1R)-2-гидрокси-1-фенилэтил]-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-[(1S)-2-гидрокси-1-фенилэтил]-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-[(3-оксо-2,3-дигидро-1H-изоиндол-4-ил)метил]-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-(2-феноксиэтил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
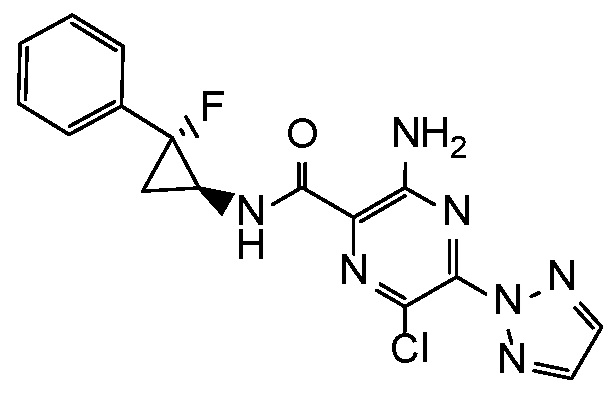
3-амино-6-хлор-N-[(1R,2R)-2-фтор-2-фенилциклопропил]-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-[(1S,2R)-2-фтор-2-фенилциклопропил]-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
метил N-{[3-амино-6-хлор-5-(2H-1,2,3-триазол-2-ил)пиразин-2-ил]карбонил}-D-серинат;
3-амино-6-хлор-N-(5,6,7,8-тетрагидрохинолин-8-илметил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(1S)-1-бензил-2-гидроксиэтил]-6-хлор-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-(1H-имидазол-2-илметил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-(1-метил-1,2,3,4-тетрагидрохинолин-4-ил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
метил (2S)-({[3-амино-6-хлор-5-(2H-1,2,3-триазол-2-ил)пиразин-2-ил]карбонил}амино)(фенил)этаноат;
3-амино-6-хлор-N-[(1S)-2-гидрокси-1-пиридин-2-илэтил]-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-[(1S)-2-гидрокси-1-(1H-индол-3-илметил)этил]-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-[(6-метилпиридин-2-ил)метил]-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-5-(1H-1,2,4-триазол-1-ил)-N-[2-(трифторметил)бензил]пиразин-2-карбоксамид;
3-амино-6-хлор-N-(2,4-дифторбензил)-5-(1H-1,2,4-триазол-1-ил)пиразин-2-карбоксамид;
метил 3-амино-6-хлор-5-(1H-пиразол-1-ил)пиразин-2-карбоксилат;
3-амино-6-хлор-5-(1H-пиразол-1-ил)-N-[2-(трифторметил)бензил]пиразин-2-карбоксамид;
3-амино-6-хлор-N-(4-фторбензил)-5-(1H-пиразол-1-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-(2,4-дифторбензил)-5-(1H-пиразол-1-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-5-(1H-пиразол-1-ил)-N-(хинолин-8-илметил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-[(1R)-2,3-дигидро-1H-инден-1-ил]-5-(1H-пиразол-1-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-[(3-метилпиридин-2-ил)метил]-5-(1H-пиразол-1-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-5-(4-метил-1H-пиразол-1-ил)-N-[2-(трифторметил)бензил]пиразин-2-карбоксамид;
3-амино-6-хлор-N-[(1R)-2,3-дигидро-1H-инден-1-ил]-5-(4-метил-1H-пиразол-1-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-5-(4-метил-1H-пиразол-1-ил)-N-[(3-метилпиридин-2-ил)метил]пиразин-2-карбоксамид;
3-амино-6-хлор-5-(3-метил-1H-пиразол-1-ил)-N-[2-(трифторметил)бензил]пиразин-2-карбоксамид;
3-амино-6-хлор-N-[(1R)-2,3-дигидро-1H-инден-1-ил]-5-(3-метил-1H-пиразол-1-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-5-(4-метил-1H-пиразол-1-ил)-N-(хинолин-8-илметил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(4-метил-1H-пиразол-1-ил)-N-[(3-метилпиридин-2-ил)метил]пиразин-2-карбоксамид;
3-амино-N-(изохинолин-1-илметил)-6-метил-5-(4-метил-1H-пиразол-1-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-5-(4-метил-1H-пиразол-1-ил)-N-{[3-(трифторметил)пиридин-2-ил]метил}пиразин-2-карбоксамид;
3-амино-6-хлор-N-(2,4-дифторбензил)-5-(4-метил-2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-[(3-метилпиридин-2-ил)метил]-5-(4-метил-2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-5-(4-метил-2H-1,2,3-триазол-2-ил)-N-(1,2,3,4-тетрагидрохинолин-4-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1H-пиразол-1-ил)-N-(хинолин-8-илметил)пиразин-2-карбоксамид;
3-амино-6-хлор-5-(4-метил-2H-1,2,3-триазол-2-ил)-N-(хинолин-8-илметил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-[(1S)-2-гидрокси-1-фенилэтил]-5-(4-метил-1H-пиразол-1-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-(1H-индол-5-илметил)-5-(4-метил-1H-пиразол-1-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-[(1-метил-1H-бензимидазол-2-ил)метил]-5-(4-метил-1H-пиразол-1-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-(1H-индол-7-илметил)-5-(4-метил-1H-пиразол-1-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-(1H-индол-4-илметил)-5-(4-метил-1H-пиразол-1-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-(1H-индол-6-илметил)-5-(4-метил-1H-пиразол-1-ил)пиразин-2-карбоксамид;
3-амино-N-(1,3-бензотиазол-2-илметил)-6-хлор-5-(4-метил-1H-пиразол-1-ил)пиразин-2-карбоксамид;
3-амино-N-(1,3-бензоксазол-2-илметил)-6-хлор-5-(4-метил-1H-пиразол-1-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-5-(4-метил-1H-пиразол-1-ил)-N-(хиноксалин-5-илметил)пиразин-2-карбоксамид;
3-амино-N-бензил-6-хлор-5-(4-метил-1H-пиразол-1-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-(имидазо[2,1-b][1,3]тиазол-6-илметил)-5-(4-метил-1H-пиразол-1-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-(имидазо[1,2-a]пиридин-3-илметил)-5-(4-метил-1H-пиразол-1-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-N-(изохинолин-4-илметил)-5-(4-метил-1H-пиразол-1-ил)пиразин-2-карбоксамид;
3-амино-6-хлор-5-(4-метил-1H-пиразол-1-ил)-N-(пиразолo[1,5-a]пиридин-3-илметил)пиразин-2-карбоксамид;
3-амино-6-хлор-5-(4-метил-1H-пиразол-1-ил)-N-[(3-оксо-2,3-дигидро-1H-изоиндол-4-ил)метил]пиразин-2-карбоксамид;
3-амино-6-метил-N-((3-метилпиридин-2-ил)метил)-5-(4-(трифторметил)оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-5-(4,5-диметилоксазол-2-ил)-6-метил-N-((3-метилпиридин-2-ил)метил)пиразин-2-карбоксамид;
3-амино-5-(4-метил-1H-пиразол-1-ил)-N-(хинолин-8-илметил)-6-винилпиразин-2-карбоксамид;
3-амино-6-(1,2-дигидроксиэтил)-5-(4-метил-1H-пиразол-1-ил)-N-(хинолин-8-илметил)пиразин-2-карбоксамид;
3-амино-6-формил-5-(4-метил-1H-пиразол-1-ил)-N-(хинолин-8-илметил)пиразин-2-карбоксамид;
3-амино-6-(дифторметил)-5-(4-метил-1H-пиразол-1-ил)-N-(хинолин-8-илметил)пиразин-2-карбоксамид;
3-амино-6-(гидроксиметил)-N-(хинолин-8-илметил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-циано-5-(1H-пиразол-1-ил)-N-(хинолин-8-илметил)пиразин-2-карбоксамид;
3-амино-6-циано-5-(оксазол-2-ил)-N-((3-(трифторметил)пиридин-2-ил)метил)пиразин-2-карбоксамид;
1-(3-амино-6-метил-5-(оксазол-2-ил)пиразин-2-ил)-3-(4,6-диметилпиридин-2-ил)пропан-1-он;
3-амино-6-метил-N-((5-метилпиримидин-4-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(5-метилоксазол-2-ил)-N-((3-метилпиридин-2-ил)метил)пиразин-2-карбоксамид;
3-амино-N-((5R,7S)-5-фтор-6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-((5R,7R)-5-фтор-6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-((5S,7S)-5-фтор-6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-((5S,7R)-5-фтор-6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(6-фтор-6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(7H-циклопента[b]пиридин-7-ил)-6-метил-5-(оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[(3-метилпиридин-2-ил)метил]-5-[4-(трифторметил)-1,3-оксазол-2-ил]пиразин-2-карбоксамид;
3-амино-6-метил-5-(4-метил-1,3-оксазол-2-ил)-N-[(3-метилпиридин-2-ил)метил]пиразин-2-карбоксамид;
3-амино-5-(4,5-диметил-1,3-оксазол-2-ил)-6-метил-N-[(3-метилпиридин-2-ил)метил]пиразин-2-карбоксамид;
3-амино-5-[4-(метоксиметил)-1,3-оксазол-2-ил]-6-метил-N-[(3-метилпиридин-2-ил)метил]пиразин-2-карбоксамид;
3-амино-6-метил-5-(5-метил-1,3-оксазол-2-ил)-N-[(3-метилпиридин-2-ил)метил]пиразин-2-карбоксамид;
3-амино-6-метил-N-[(3-метилпиридин-2-ил)метил]-5-[5-(трифторметил)-1,3-оксазол-2-ил]пиразин-2-карбоксамид;
3-амино-6-циано-5-(1H-пиразол-1-ил)-N-(хинолин-8-илметил)пиразин-2-карбоксамид;
3-амино-6-циано-5-(1,3-оксазол-2-ил)-N-{[3-(трифторметил)пиридин-2-ил]метил}пиразин-2-карбоксамид;
3-амино-6-(дифторметил)-5-(4-метил-1H-пиразол-1-ил)-N-(хинолин-8-илметил)пиразин-2-карбоксамид;
3-амино-6-(гидроксиметил)-N-(хинолин-8-илметил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(5-фтор-6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(5-фтор-6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(5-фтор-6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(5-фтор-6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид или
3-амино-N-(6-фтор-6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид,
или их фармацевтически приемлемая соль.
В некоторых вариантах осуществления предпочтительными соединениями настоящего изобретения являются:
3-амино-6-метил-N-[(3-метилпиридин-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-{[3-(трифторметил)пиридин-2-ил]метил}пиразин-2-карбоксамид;
3-амино-6-метил-5-(1,3-оксазол-2-ил)-N-(пиримидин-2-илметил)пиразин-2-карбоксамид;
3-амино-N-[(3-циклопропилпиридин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[(4-метилпиридазин-3-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-{[1-(1-метилэтил)-1H-имидазол-2-ил]метил}-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(3-этил-4-фторпиридин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(1-этил-1H-1,2,4-триазол-5-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(3-этилпиридин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(3-циклопропил-4-фторпиридин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(3-циклопропилпиразин-2-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-{[1-(1-метилэтил)-1H-1,2,4-триазол-5-ил]метил}-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-[(1-этил-1H-бензимидазол-4-ил)метил]-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[(3-метилпиразин-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-циано-5-(1,3-оксазол-2-ил)-N-{[3-(трифторметил)пиридин-2-ил]метил}пиразин-2-карбоксамид;
3-амино-N-{[3-(фторметил)пиридин-2-ил]метил}-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-{[3-(гидроксиметил)пиридин-2-ил]метил}-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-6-метил-N-[1-(3-метилпиридин-2-ил)этил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид;
3-амино-N-(6-гидрокси-6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид.
Как использовано в данном описании, если специально не указано иное, термин "антагонист рецептора A2aʺ (эквивалентно антагонисту A2a) означает соединение, проявляющее активность (IC50) менее чем примерно 1 мкМ, при испытании в соответствии с методикой, описанной в настоящем описании. Предпочтительные соединения проявляют по меньшей мере 10-кратную селективность в отношении антагонизма A2a рецептора по сравнению с любым другим анденозиновым рецептором (например, A1, A2b или A3).
Соединения настоящего изобретения и составы, содержащие соединения настоящего изобретения, считаются полезными в предоставлении возможного лечения, при оказании помощи, в облегчении или улучшении состояний или стадий заболевания, которые можно лечить, оказывать помощь, облегчать или смягчать антагонизмом конкретных A2a рецепторов. Состояния, для которых может быть предоставлена такая терапия, включают, например, заболевания или расстройства центральной нервной системы, включая, но, не ограничиваясь ими, лечение двигательных расстройств (например, дрожания, брадикинезии, походки, дистонии, дискинезии, поздней дискинезии, других экстрапирамидных синдромов, болезни Паркинсона и расстройств, связанных с болезнью Паркинсона). Соединения настоящего изобретения также имеют возможность, или считается, что имеют возможность для применения в предотвращении или уменьшении воздействия лекарственных средств, которые вызывают двигательные расстройства.
Как описано в данном описании, если специально не указано иное, применение соединения в лечении означает, что количество соединения, обычно присутствующего в качестве компонента препарата, который содержит другие эксципиенты, вводят в аликвотных количествах и во временных интервалах, которые обеспечивают и по меньшей мере поддерживают уровень лечебной среды по меньшей мере одной фармацевтически активной формы данного соединения в течение временного интервала между введениями дозы.
Абсолютная стереохимия проиллюстрирована путем использования пунктирных и цельных клиновидных связей, как показано на Illus-I и Illus-II. Соответственно, метильная группа на Illus-I направлена к наблюдателю из плоскости бумаги, и этильная группа на Illus-II направлена от наблюдателя к плоскости бумаги, на которой расположен остаток циклогексанового кольца. Предполагается, что водород на том же самом углероде, что и метильная группа Illus-I, направлен от наблюдателя к плоскости бумаги, и водород на том же самом углероде, что и этильная группа Illus-II, направлен к наблюдателю из плоскости бумаги. Конвенцией является то же самое, когда пунктирный и цельный клиновидный прямоугольник, оба присоединены к одному и тому же углероду, как на Illus-III, причем метильная группа направлена к наблюдателю из плоскости бумаги, и этильная группа направлена от наблюдателя к плоскости бумаги, на которой расположено циклогексановое кольцо.

Обычно, если в сопроводительном тексте не указано иное, обычные «линейные» связи или «волнистые» связи указывают, что представлена вся возможная стереохимия, включая чистые соединения, смеси изомеров и рацемические смеси.
Как использовано в данном описании, если специально не указано иное, следующие термины имеют соответствующие значения:
Фраза ʺпо меньшей мере одинʺ, при использовании в отношении числа компонентов, содержащихся в композиции, например, "по меньшей мере один фармацевтический эксципиент", означает, что один член конкретной группы присутствует в данной композиции, и может дополнительно присутствовать более чем один. Компоненты композиции обычно представляют собой аликвоты отдельного чистого вещества, добавленного в состав, где уровень чистоты отдельного вещества, добавленного в состав, является уровнем общепринятой чистоты реагента конкретного типа.
"По меньшей мере один", при использовании в отношении заместителей на соединении или фрагментах, присоединенных к основной структуре молекулы соединения, означает, что присутствует один заместитель из группы конкретных заместителей, и более чем один заместитель может быть связан в любой из точек химически доступного связывания ядра молекулы.
Фраза "один или более", при использовании в отношении заместителя на соединении или компоненте фармацевтической композиции, означает то же самое, что и "по меньшей мере один";
ʺодновременноʺ и "в одно время", обе включают в их смысл (1) одновременно во времени (например, в то же время); и (2) в разное время, но в течение общего графика лечения;
ʺпоследовательноʺ означает один, следующий за другим;
"последовательно" относительно серийного введения терапевтических средств при ожидании периода для выяснения эффективности между введением каждого дополнительного средства; это означает, что после введения одного компонента, следующий компонент вводят по истечении периода времени после введения первого компонента; эффективный период представляет собой количество времени, отведенное для реализации преимуществ от введения первого компонента;
ʺэффективное количествоʺ или ʺтерапевтически эффективное количествоʺ предназначено для описания обеспечения количеством по меньшей мере одного соединения по настоящему изобретению или композицией, содержащей по меньшей мере одно соединение по настоящему изобретению, которое эффективно для лечения или подавления заболевания или состояния, описанных в данном описании, и, таким образом, оказывают желаемый терапевтический, мелиоративный, тормозящий или профилактический эффект. Например, при лечении заболеваний или расстройств центральной нервной системы при помощи одного или более соединений, описанных в данном описании, ʺэффективное количествоʺ (или ʺтерапевтически эффективное количествоʺ) означает, например, обеспечение количества по меньшей мере одного соединения формулы A, которое вызывает в результате терапевтический ответ у пациента, страдающего заболеванием или расстройством центральной нервной системы ("состояние"), включая подходящий ответ на помощь, облегчение, улучшение или лечение состояния, или облегчение, улучшение, уменьшение или ликвидацию одного или более симптомов, относящихся к состоянию, и/или долговременную стабилизацию состояния, например, которые могут быть определены путем анализа фармакодинамическими маркерами или клинической оценки пациентов, страдающих данным состоянием;
ʺпациентʺ и "субъект" означает животное, такое как млекопитающее (например, человеческое существо), и предпочтительно представляет собой человека;
ʺпролекарствоʺ означает соединения, которые быстро трансформируются, например, путем гидролиза в крови in vivo, в родительское соединение, например, преобразованием пролекарства формулы A в соединение формулы A или в его соль; тщательное обсуждение которого приведено у T. Higuchi и V. Stella, в Pro-drugs as Novel Delivery Systems, Vol. 14 of the A.C.S. Symposium Series, и у Edward B. Roche, ed., Bioreversible Carriers in Drug Design, American Pharmaceutical Association and Pergamon Press, 1987, оба из которых включены в данное описание посредством ссылки; в объем настоящего изобретения включены пролекарства новых соединений настоящего изобретения.
Термин ʺзамещенныйʺ означает, что один или более из перечисленных заместителей (или из заместителей, конкретно не перечисленных, заданных по умолчанию заместителей, указанных в разделе «Определения» для конкретного типа основной молекулы, которая содержит переменные заместители) могут занимать одно или более положений связывания в основной молекуле, обычно занимаемых "-H", при условии, что такое замещение не превышает величины нормальной валентности у атома в связывающей конфигурации, присутствующей в основной молекуле, и такое замещение, в конечном счете, обеспечивает стабильное соединение, которое указывает на то, что такое замещение не приводит к соединению с взаимно реакционноспособными заместителями, расположенными гименально или вицинально относительно друг друга; и где замещение обеспечивает по существу прочное соединение, которое будет выдерживать выделение из реакционной смеси с достаточной степенью чистоты.
Необязательное замещение фрагмента описано (например, "необязательно замещенный") термином, означающим, что если заместители присутствуют, один или более из перечисленных (или заданных по умолчанию заместителей для конкретной основной молекулы, например, водород на алкильном или ароматическом фрагменте) могут присутствовать на основной молекуле в связывающем положении, обычно занимаемом заданным по умолчанию заместителем, например, атомом водорода, согласно определению "замещенный", представленному в данном описании.
Как использовано в данном описании, если специально не указано иное, следующие термины использованы для описания фрагментов, вне зависимости от содержания полного определения переменной части структуры представленного соединения по настоящему изобретению или заместителя, присоединенного к переменной части структуры представленной группы соединений настоящего изобретения, имеют следующие значения, и если специально не указано иное, определения каждого из терминов (т.е. фрагмента или заместителя) применяются, когда такой термин используется индивидуально или в качестве компонента другого термина (например, определение арила является таким же, как для арила и для арильной части арилалкильных, алкиларильных, арилалкинильных фрагментов, и тому подобное); фрагменты эквивалентно описаны в данном описании структурой, типографским обозначением или химической терминологией без какого-либо намерения дифференциации в значениях, например, химический термин "ацил", определенный ниже, эквивалентно описан в данном описании самим термином или типографскими обозначениями "R'-(C=O)-" или "R'-C(O)-", или структурным изображением:  ;
;
ʺалкоксиʺ обозначает фрагмент структуры: алкил-O- (т.е. связь с фрагментом основной молекулы через кислород), где алкильная часть данного фрагмента является такой, как определено ниже для алкила; неограничивающие примеры подходящих алкоксигрупп включают метокси, этокси, н-пропокси, изопропокси, н-бутокси и гептокси;
ʺалкоксикарбонилʺ обозначает фрагмент структуры алкил-O-C(O)-, эквивалентно представленный как [алкил-O-(C=O)-], а также как R-O(C=O)-, где "R" представляет собой определенный выше алкильный фрагмент, т.е. связанный с фрагментом основной молекулы через карбонильный углерод; неограничивающие примеры подходящих алкоксикарбонильных групп включают метоксикарбонил и этоксикарбонил;
ʺалкоксиарилʺ обозначает фрагмент структуры алкил-O-арил-, где данный заместитель связан с основной молекулой через арильную часть данного фрагмента, и термины ʺалкилʺ и ʺарилʺ имеют значения, представленные в данном описании;
ʺалкоксиарилʺ обозначает фрагмент структуры алкил-O-арил-, где данный заместитель связан с основной молекулой через арильную часть данного фрагмента, и термины ʺалкилʺ и ʺарилʺ имеют значения, представленные в данном описании;
ʺалкилʺ (включая алкильные части других фрагментов, таких как трифторметилалкил- и алкокси-) обозначает алифатический углеводородный фрагмент, содержащий вплоть до 20 атомов углерода (например, обозначение "C1-20алкил" указывает на алифатический углеводородный фрагмент с 1 до 20 атомами углерода). В некоторых вариантах осуществления алкилы предпочтительно содержат примерно до 10 атомов углерода, если термин изменен с указанием, что рассматриваются короткие цепи, например, алкильный фрагмент с 1 до 8 атомами углерода определен в данном описании как "C1-8алкил". Термин ʺалкилʺ дополнительно определяется как ʺлинейныʺ, ʺразветвленныйʺ или ʺциклический". Если термин "алкил" обозначен двумя дефисами (т.е. "-алкил-"), это указывает на то, что данный алкильный фрагмент связан таким образом, что данный алкильный фрагмент присоединяет заместители по обе стороны от него, например, "-алкил-OH" указывает на алкильный фрагмент, присоединяющий гидроксильную группу к основной части молекулы.
Термин "линейный алкилʺ включает алкильные фрагменты, которые содержат углеводородную цепь с присоединенными к ней алифатическими углеводородными "ветвями", хотя другие заместители могут заменять C-H связь на углеводородной цепи. Примеры линейного алкила включают, но, не ограничиваясь ими, метил-, этил-, н-пропил-, н-бутил-, н-пентил- или н-гексил-.
Термин ʺразветвленный алкилʺ представляет собой фрагмент, содержащий главную углеводородную цепь с вплоть до максимальным конкретным числом атомов углерода с низшей алкильной цепью, присоединенной к одному или более атомам углерода, составляющим, но не завершающим, главную углеводородную цепь. Разветвленный алькильный фрагмент, таким образом, содержит по меньшей мере 3 атома углерода в главной цепи. Примеры разветвленных алкильных фрагментов включают, но, не ограничиваясь ими, трет-бутил-, неопентил- или 2-метил-4-этилгексил-.
Термин ʺциклический алкилʺ (эквивалентно ʺциклоалкилуʺ) означает фрагмент, имеющий главную углеводородную цепь, образованную циклическим алифатическим фрагментом, содержащим по меньшей мере 3 атома углерода (минимальное число, необходимое для формирования циклического фрагмента) вплоть до максимального числа конкретных атомов углерода. Примеры циклоалкильных фрагментов включают, но, не ограничиваясь ими, циклопропил, циклобутил, циклопентил или циклогексил. Термин циклический алкил (эквивалентно ʺциклоалкилуʺ) также включает неароматическую, конденсированную мультициклическую кольцевую систему, содержащую вплоть до 20 атомов углерода, которая может быть необязательно замещена, в основном, как определено в данном описании для ʺалкилаʺ. Подходящими мультициклическими циклоалкилами являются, например, но, не ограничиваясь ими: 1-декалин; норбонил; адамантил и тому подобное;
любой из приведенных выше линейных, разветвленных или циклических алкильных фрагментов, которые определены как ʺнеобязательно замещенныйʺ, означает, что один или более атомов углерода в данной структуре может иметь одну или более C-H связей, соединенных с замещенным фрагментом, выбранным из перечисленных возможных заместителей, названных в определении данного фрагмента, и, таким же образом, где в определении данного фрагмента появляется фраза ʺзамещенныйʺ, означает, что по меньшей мере 1 атом водорода заменен там, где находится C-H связь, по меньшей мере одним из перечисленных заместителей в списке заместителей, названных в определении данного алкильного фрагмента;
"низший алкил" означает линейный, разветвленный или циклоалкильный фрагмент, содержащий вплоть до 6 атомов углерода; неограничивающие примеры подходящих низших алкильных групп включают метил, этил, н-пропил, изопропил, циклопропил, н-бутил, трет-бутил, циклобутил, н-пентил, изопентил, неопентил, циклопентил, н-гексил, циклогексил и тому подобное;
"низший алкокси" означает [R-O-], где ʺRʺ представляет собой линейный, разветвленный или циклоалкильный фрагмент, содержащий вплоть до 6 атомов углерода; примеры подходящих низших алкоксигрупп включают, но, не ограничиваясь ими, метокси, этокси, н-пропокси, изопропокси, циклопропокси, н-бутокси, трет-бутокси, циклобутокси, н-пентокси, изопентокси, неопентокси, циклопентокси, метоксициклопентан и тому подобное;
ʺалкиларил-ʺ (или алкарил) означает алкил-арильную- группу (т.е. связь с фрагментом основной молекулы через арильную группу), где алкильная группа является незамещенной или замещена, как определено выше, и арильная группа является незамещенной или замещена, как определено ниже; предпочтительные алкиларильные фрагменты содержат низшую алкильную группу; неограничивающие примеры подходящих алкиларильных групп включают о-толил, п-толил и ксилил;
как правило, на примере термина "алкил-арил", определенного выше, заместитель, который назван комбинацией терминов, используемых для определения двух других фрагментов заместителей, указывает на то, что с основной молекулой связан заместитель, названный последним термином, в то время как предыдущий названный термин, в свою очередь, связан с фрагментом заместителя, которому он предшествует, в направлении справа налево, чтобы понять порядок, в котором различные фрагменты связываются с основной молекулой;
ʺарилʺ (иногда сокращенно ʺарʺ) означает ароматическую моноциклическую или мультициклическую кольцевую систему, содержащую примерно от 6 до примерно 14 атомов углерода (обозначенную в данном описании также как "C6-14арил"), предпочтительно примерно от 6 до примерно 10 атомов углерода ("C6-10арил"); данная арильная группа может быть необязательно замещена одним или более независимо выбранными "кольцевыми заместителями" (определенными ниже). Неограничивающие примеры подходящих арильных групп включают фенил ( ) и нафтил (
) и нафтил ( ), где связывание может быть через любой из атомов углерода ароматического кольца, и где любой атом углерода кольца, не участвующий в связывании с основной молекулой, может иметь связь с ее заместителем, отличным от -H, независимо выбранным, в каждом конкретном случае, из списка заместителей, названных в списке перечисленных заместителей, присутствующих в определении данного фрагмента;
), где связывание может быть через любой из атомов углерода ароматического кольца, и где любой атом углерода кольца, не участвующий в связывании с основной молекулой, может иметь связь с ее заместителем, отличным от -H, независимо выбранным, в каждом конкретном случае, из списка заместителей, названных в списке перечисленных заместителей, присутствующих в определении данного фрагмента;
ʺарилциклоалкилʺ означает фрагмент, имеющий арильную часть, конденсированную с двумя атомами углерода циклоалкильной части, где любая часть может быть необязательно замещена одним или более заместителями, приведенными в списке перечисленных заместителей, присутствующих в определении данного фрагмента, и где арильная часть и циклоалкильная часть содержат до 10 атомов углерода в кольце, и в некоторых вариантах осуществления циклоалкильная часть предпочтительно содержит 6 атомов углерода. Примеры арилциклоалкильных фрагментов включают, но, не ограничиваясь ими, тетрагидроантрацен, тетрагидронафталин, дигидроинден и тому подобное. Если специально не указано иное, связывание арилциклоалкильного фрагмента с основной частью молекулы может быть через любой атом углерода арильного или циклоалкильного кольца. Когда термин используется со ʺспироʺ, например ʺарилспироциклоалкилʺ, это означает, что алкильная часть данного фрагмента включает один атом углерода, общий с основной молекулой, к которой он присоединен, с формированием спироциклоструктуры, например, структуры:  , где данная структура связана с основной частью молекулы через циклоалкильную часть, с которой арилциклоалкильный фрагмент формирует спироциклоалкильную структуру;
, где данная структура связана с основной частью молекулы через циклоалкильную часть, с которой арилциклоалкильный фрагмент формирует спироциклоалкильную структуру;
ʺгалогенʺ означает фтор, хлор, бром или йод; предпочтительными галогенами, если специально не указано иное, где термин используется, являются фтор, хлор и бром, заместитель, который представляет собой атом галогена, обозначен как -F, -Cl, -Br или -I, и ʺгалоʺ означает фтор, хлор, бром или йод, заместители, связанные с фрагментом, определенным, например, как "галоалкилʺ, означает алкил, определенный выше, где одно или более положений связывания на данном алкильном фрагменте, обычно заняты атомами водорода, заменены галогеновой группой, пергалоалкил (или ʺполностью галогенированныйʺ алкил) означает, что все положения связывания, не участвующие в связывании алкильного заместителя с основной частью молекулы, заняты атомами галогена, например, для алкила, выбранного из метила, термин перфторалкил означает -CF3;
"гетероарилʺ означает ароматическую моноциклическую или мультициклическую кольцевую систему, содержащую примерно от 5 до примерно 14 атомов кольца, предпочтительно примерно от 5 до примерно 10 атомов кольца, в котором один или более атомов кольца представляют собой элемент, отличный от углерода, например, азот, кислород или серу, один или в комбинации; данный "гетероарил" может быть необязательно замещен на химически доступных атомах кольца одним или более независимо выбранными "кольцевыми заместителями" (определенными ниже); префикс аза, азо, окса, оксо, тиа или тио перед корневым названием гетероарила, означает, что по меньшей мере атом азота, кислорода или серы, соответственно, присутствует в качестве атома кольца, и в некоторых вариантах осуществления 2 или более гетероатомов присутствуют в кольце, например, фрагмент пиразола или тиазола; атом азота гетероарила может быть необязательно окислен до соответствующего N-оксида; неограничивающие примеры гетероарильных фрагментов включают: пиридил-,  , тиопентил-,
, тиопентил-,  , фуранил-,
, фуранил-,  , пиразинил, тиенил, пиримидинил, изоксазолил, изотиазолил, оксазолил, тиазолил, пиразолил, фуразанил, пирролил, пиразолил, триазолил, 1,2,4-тиадиазолил, пиразинил, пиридазинил, хиноксалинил, фталазинил, имидазо[1,2-a]пиридинил, имидазо[2,1-b]тиазолил, бензофуразанил, индолил, азаиндолил, бензимидазолил, бензотиенил, хинолинил, имидазолил, тиенопиридил, хиназолинил, тиенопиримидил, пирролопиридил, имидазопиридил, изохинолинил, бензоазаиндолил, 1,2,4-триазинил, бензотиазолил, фуропиридин, и, например, гетероарильные фрагменты следующих структур:
, пиразинил, тиенил, пиримидинил, изоксазолил, изотиазолил, оксазолил, тиазолил, пиразолил, фуразанил, пирролил, пиразолил, триазолил, 1,2,4-тиадиазолил, пиразинил, пиридазинил, хиноксалинил, фталазинил, имидазо[1,2-a]пиридинил, имидазо[2,1-b]тиазолил, бензофуразанил, индолил, азаиндолил, бензимидазолил, бензотиенил, хинолинил, имидазолил, тиенопиридил, хиназолинил, тиенопиримидил, пирролопиридил, имидазопиридил, изохинолинил, бензоазаиндолил, 1,2,4-триазинил, бензотиазолил, фуропиридин, и, например, гетероарильные фрагменты следующих структур:  , где один из Xa или Xb представляет собой -CH= или -N=, а другой представляет собой -CH=;
, где один из Xa или Xb представляет собой -CH= или -N=, а другой представляет собой -CH=;  и тому подобное (где, если не указано иное, связывание с основной молекулой через любой доступный атом кольца приводит в результате к стабильному связыванию);
и тому подобное (где, если не указано иное, связывание с основной молекулой через любой доступный атом кольца приводит в результате к стабильному связыванию);
ʺгетероарилонʺ означает гетероарильный фрагмент, имеющий одно углеродное кольцо, связанное с ʺоксогруппойʺ, например, 1-метил-1,6-дигидропиридин-6-он формулы:
 ;
;
ʺгетероарилциклоалкилʺ означает фрагмент, имеющий гетероарильную часть, конденсированную с двумя атомами углерода циклоалкильной части, где атомы углерода кольца в любом положении могут быть необязательно замещены одним или более заместителями, приведенными в списке перечисленных заместителей, присутствующих в определении данного фрагмента, и где данная гетероарильная часть содержит до 8 атомов углерода и вплоть до трех гетероатомов, которые независимо представляют собой азот, кислород или серу, и циклоалкильная часть содержит до 10 атомов углерода. Таким же образом, ʺгетероарилгетероциклоалкилʺ означает фрагмент, в котором конденсированная циклоалкильная часть имеет в дополнение к насыщенному углероду, один или более гетероатомов, составляющих данное кольцо. В некоторых вариантах осуществления предпочтительным для циклоалкильной части является содержание вплоть до 6 атомов углерода. Примеры гетероарилциклоалкильных фрагментов включают, но, не ограничиваясь ими: 6,7-дигидро-5H-циклопента[b]пиразин и 5,6,7,8-тетрагидрохинолин. Когда термин используется со ʺспироʺ, например, ʺгетероарилспироциклоалкилʺ, это означает, что алкильная часть данного фрагмента включает один атом углерода общий с основной молекулой, к которой он присоединен, формируя спироциклоалкильную структуру, например, структуру:  , где данная структура связана с основной частью молекулы через циклоалкильную часть, с которой гетероарилциклоалкильный фрагмент формирует спироциклоалкильную структуру.
, где данная структура связана с основной частью молекулы через циклоалкильную часть, с которой гетероарилциклоалкильный фрагмент формирует спироциклоалкильную структуру.
ʺАрилгетероциклоалкилʺ или ʺгетероциклоалкиларилʺ означает фрагмент, имеющий арильную часть, которая определена в данном описании, где два соседних атома углерода в кольце конденсированы с гетероциклоалкильной частью, содержащей по меньшей мере один атом углерода и вплоть до 3 гетероатомов. Примеры арилгетероциклоалкильных фрагментов включают, но, не ограничиваясь ими, тетрагидрохиноксалин, тетрагидрохинолин, дигидроциклопентапиридин и тому подобное. Если специально не указано иное, связывание арилгетероциклоалкильного или гетероарилциклоалкильного фрагмента с основной частью молекулы может быть через любой арильный, гетероарильный, гетероциклоалкильный или циклоалкильный атом кольца, присутствующий в данном фрагменте.
"Гетероциклилʺ (или гетероциклоалкил) означает неароматическую насыщенную моноциклическую или мультициклическую кольцевую систему, содержащую примерно от 3 до примерно 10 атомов кольца, предпочтительно примерно от 5 до примерно 10 атомов кольца, в котором один или более атомов в кольцевой системе представляют собой элемент, отличный от углерода, например, азот (например, пиперидил- или пирролидинил), кислород (например, фуранил и тетрагидропиранил) или серу (например, тетрагидротиофенил и тетрагидротиопиранил); и где гетероатомы могут быть одни или в комбинации, при условии, что данный фрагмент не содержит соседних атомов кислорода и/или серы, присутствующих в кольцевой системе; предпочтительные гетероциклильные фрагменты содержат примерно от 5 до примерно 6 атомов кольца; префикс аза, окса или тиа перед корневым названием гетероциклила означает, что по меньшей мере один атом азота, кислорода или серы, соответственно, присутствует в качестве атома кольца; данный гетероциклил может быть необязательно замещен одним или более независимо выбранными "кольцевыми заместителями" (определенными ниже); атом азота или серы гетероциклила может быть необязательно окислен до соответствующего N-оксида, S-оксида или S,S-диоксида (SO2); неограничивающие примеры подходящих моноциклических гетероциклильных колец включают пиперидил, пирролидинил, пиперазинил, морфолинил -  (где, если не указано иное, данный фрагмент связан с основной молекулой через любые атомы углерода кольца C2, C3, C5 или C6), тиоморфолинил, тиазолидинил, 1,3-диоксоланил, 1,4-диоксанил, тетрагидрофуранил, тетрагидротиофенил, тетрагидротиопиранил и тому подобное; и полицикликгетероциклильные соединения, например, группы структур:
(где, если не указано иное, данный фрагмент связан с основной молекулой через любые атомы углерода кольца C2, C3, C5 или C6), тиоморфолинил, тиазолидинил, 1,3-диоксоланил, 1,4-диоксанил, тетрагидрофуранил, тетрагидротиофенил, тетрагидротиопиранил и тому подобное; и полицикликгетероциклильные соединения, например, группы структур:  и
и  , и тому подобное;
, и тому подобное;
"тетрагидропиранильный" фрагмент означает 6-членный простой циклический эфир формулы:  , где линия связи, имеющая открытый конец в центре данной структуры и на другом конце волнистой линии, указывает на то, что заместитель связан с основной молекулой, к которой он присоединен, через любые атомы углерода 1-5, и где любые положения связывания на атомах углерода 1-5 обычно заняты атомом водорода, то есть, положения связывания на атомах углерода 1-5, которые не заняты связью с основной молекулой, могут быть необязательно заняты конкретными или необязательными заместителями;
, где линия связи, имеющая открытый конец в центре данной структуры и на другом конце волнистой линии, указывает на то, что заместитель связан с основной молекулой, к которой он присоединен, через любые атомы углерода 1-5, и где любые положения связывания на атомах углерода 1-5 обычно заняты атомом водорода, то есть, положения связывания на атомах углерода 1-5, которые не заняты связью с основной молекулой, могут быть необязательно заняты конкретными или необязательными заместителями;
"пиперидинил" означает:  или
или  , где открытая линия связывания, заканчиваемая на одном конце волнистой линией, указывает на атом кольца, через который данный фрагмент связан с основной молекулой (т.е. любыми атомами углерода 2-6 (структура с левой стороны) или атомом азота кольца (структура с правой стороны), и где любые положения связывания на атоме азота или на атомах углерода 2-6, не участвующие в связывании с основной молекулой и обычно занятые атомом водорода, могут связываться с конкретным или необязательным заместителем, и где R', если присутствует, представляет собой или -H или другой конкретный заместитель;
, где открытая линия связывания, заканчиваемая на одном конце волнистой линией, указывает на атом кольца, через который данный фрагмент связан с основной молекулой (т.е. любыми атомами углерода 2-6 (структура с левой стороны) или атомом азота кольца (структура с правой стороны), и где любые положения связывания на атоме азота или на атомах углерода 2-6, не участвующие в связывании с основной молекулой и обычно занятые атомом водорода, могут связываться с конкретным или необязательным заместителем, и где R', если присутствует, представляет собой или -H или другой конкретный заместитель;
"пиридинил" означает:  , где связь, заканчиваемая на одном конце волнистой линией, указывает на то, что пиридинильный фрагмент связан с основной молекулой любыми атомами углерода 2-6, и где любое из положений связывания на атомах углерода 2-6 обычно заняты атомом водорода, то есть, любое положение на атоме углерода 2-6, который не связан с основной молекулой, может быть необязательно занято конкретным заместителем;
, где связь, заканчиваемая на одном конце волнистой линией, указывает на то, что пиридинильный фрагмент связан с основной молекулой любыми атомами углерода 2-6, и где любое из положений связывания на атомах углерода 2-6 обычно заняты атомом водорода, то есть, любое положение на атоме углерода 2-6, который не связан с основной молекулой, может быть необязательно занято конкретным заместителем;
"хинолин" означает:  , где связь, заканчиваемая на одном конце волнистой линией, указывает на то, что данный фрагмент связан с основной молекулой через любые атомы углерода 2-8, и где любые положения связывания на атомах углерода 2-8 обычно заняты атомом водорода, то есть, любые положения связывания на атомах углерода 2-8, которые не связаны с основной молекулой, могут быть необязательно заняты одним из списка перечисленных заместителей;
, где связь, заканчиваемая на одном конце волнистой линией, указывает на то, что данный фрагмент связан с основной молекулой через любые атомы углерода 2-8, и где любые положения связывания на атомах углерода 2-8 обычно заняты атомом водорода, то есть, любые положения связывания на атомах углерода 2-8, которые не связаны с основной молекулой, могут быть необязательно заняты одним из списка перечисленных заместителей;
"гидроксильная группа" и "гидрокси" обозначают HO-группу, ʺгидроксиалкилʺ обозначает заместитель формулы: "HO-алкил-", где алкильная группа связана с основной молекулой и может быть незамещенной или замещена, как определено выше; предпочтительные гидроксиалкильные группы содержат низший алкил; неограничивающие примеры подходящих гидроксиалкильных групп включают гидроксиметил и 2-гидроксиэтил; и
последовательность связывания указывается дефисами, где фрагменты представлены текстом, например, -алкил, указывает на простую связь между основной молекулой и алкильной группой, -алкил-X, указывает на то, что алкильная группа связывает "X" заместитель с основной частью молекулы, и в структурном представлении последовательность связывания указана волнистой линией, заканчивающей предоставленную связь, например:  , указывает на то, что метилфенильный фрагмент связан с основной частью молекулы через атом углерода орто к метильному заместителю, в то время как конечная связь, представленная волнистой линией и обращенная в структуру без конкретного указания атома, с которым она связывается, указывает на то, что данный фрагмент может быть связан с основной частью молекулы через любой из атомов в данном фрагменте, который доступен для связывания, как описано в примерах выше.
, указывает на то, что метилфенильный фрагмент связан с основной частью молекулы через атом углерода орто к метильному заместителю, в то время как конечная связь, представленная волнистой линией и обращенная в структуру без конкретного указания атома, с которым она связывается, указывает на то, что данный фрагмент может быть связан с основной частью молекулы через любой из атомов в данном фрагменте, который доступен для связывания, как описано в примерах выше.
Ненасыщенные валентности в тексте, схемах, примерах, структурных формулах и в любой из таблиц настоящего описания принимаются, как имеющие атом или атомы водорода в достаточном количестве для удовлетворения валентности в достаточном количестве.
Одно или более соединений настоящего изобретения также могут существовать в форме или необязательно преобразовываться в сольват. Получение сольватов в основном известно. Так, например, M. Caira et al, J. Pharmaceutical Sci., 93(3), 601-611 (2004) описывают получение сольватов противогрибкового флюконазола в этилацетате, а также из воды. Аналогичные получения сольватов и полусольватов, включая гидраты (где растворителем является вода или водная основа) и тому подобное, описаны E. C. van Tonder et al, AAPS PharmSciTech., 5(1), article 12 (2004); и A. L. Bingham et al, Chem. Commun., 603-604 (2001). Как правило, но без ограничения, способы включают растворение соединения изобретения в желаемых количествах требуемого растворителя (например, органического растворителя, водного растворителя, воды или смеси из двух или более из них) при более высокой температуре, чем температура окружающей среды, и охлаждение раствора, в присутствии антирастворителя или без, при скорости, достаточной для формирования кристаллов, которые затем выделяют стандартными методами. Аналитические методики, такие как, например, ИК спектроскопия, показывают присутствие растворителя (включая воду) в данных кристаллах в форме сольвата (или гидрата, в случае, когда в данную кристаллическую форму включена вода).
Термин ʺфармацевтическая композицияʺ, как использовано в данном описании, включает в себя как основную композицию, так и индивидуальные дозированные единицы, содержащие более чем одно (например, два) фармацевтически активное средство, такое как, например, соединение настоящего изобретения, и дополнительное средство, как описано в данном описании, наряду с любым из фармацевтически неактивных эксципиентов. Специалисту в данной области техники следует иметь в виду, что эксципиенты представляют собой любую составляющую, которая адаптирует композицию для конкретного пути введения или способствует переработке композиции в дозированную форму, не оказывая активного фармацевтического воздействия. Основная композиция и каждая индивидуальная дозированная единица может содержать фиксированное количество, обозначенное как ʺболее чем одно фармацевтически активное средствоʺ. Основная композиция представляет собой вещество, которое еще не сформулировано в индивидуальную дозированную единицу.
Настоящее изобретение также включает соединения настоящего изобретения в выделенной и очищенной форме, полученной по определенным методикам. Полиморфные формы соединений формулы A и их соли, сольваты и пролекарства соединений формулы A предназначены для включения в настоящее изобретение. Некоторые соединения настоящего изобретения могут существовать в различных изомерных формах (например, энантиомеров, диастереоизомеров, атропизомеров). Соединения по изобретению включают все их изомерные формы, как в чистой форме, так и в форме смеси двух или более, включая рацемические смеси.
Таким же образом, если не указано иное, структурное представление любой таутомерной формы соединения, которое проявляет таутомеризм, означает, что включены все такие таутомерные формы данного соединения. Таким образом, где соединения настоящего изобретения, их соли и их сольваты и пролекарства, могут существовать в различных таутомерных формах или в состоянии равновесия среди таких форм, все такие формы данного соединения охвачены и включены в объем настоящего изобретения. Примеры таких таутомеров включают, но, не ограничиваясь ими, кетон/энольные таутомерные формы, имин-енаминные таутомерные формы, и, в качестве примера, гетероароматические формы, такие как следующие фрагменты:
 и
и
 .
.
Все стереоизомеры соединений настоящего изобретения (включая соли и сольваты соединений по изобретению и их пролекарства), такие, которые могут существовать благодаря присутствию асимметрических атомов углерода в соединении по настоящему изобретению, и, включая энантиомерные формы (которые могут существовать даже в отсутствии асимметрических атомов углерода), ротамерные формы, атропизомерные и диастереомерные формы, включены в объем настоящего изобретения. Индивидуальные стереоизомеры соединений настоящего изобретения могут быть выделены в чистой форме, например, по существу свободными от других изомеров, или могут быть выделены в виде смеси двух или более стереоизомеров или в виде рацемата. Хиральные центры соединений настоящего изобретения могут иметь S или R конфигурацию, как определено рекомендациями IUPAC 1974. Использование терминов ʺсольʺ, ʺсольватʺ ʺпролекарствоʺ и тому подобное, предназначено в равной степени для применения к солям, сольватам и пролекарствам выделенных энантиомеров, пар стереоизомеров или групп, ротамеров, таутомеров или рацематов соединений по изобретению.
Когда диастереомерные смеси могут быть разделены на их индивидуальные диастереомеры на основе их физико-химических различий известными методами, например, хиральной хроматографией и/или фракционированной кристаллизацией, простое структурное представление данного соединения предусматривает все диастереомеры данного соединения. Как известно, энантиомеры также могут быть разделены преобразованием энантиомерной смеси в диастереомерную смесь путем взаимодействия с подходящим оптически активным соединением (например, хиральными вспомогательными веществами, такими как хиральный спирт или хлорангидрид кислоты Мошера), разделения диастереомеров и преобразования (например, гидролизом) индивидуально выделенных диастереомеров в соответствующие очищенные энантиомеры.
Как используется в данном описании, термин соли соединений по изобретению, являются ли они кислотными солями, сформированными с неорганическими и/или органическими кислотами, или основными солями, сформированными с неорганическими и/или органическими основаниями, или сформированными солями, которые обладают цвиттерионными свойствами, например, где соединение содержит как основной фрагмент, например, но, не ограничиваясь ими, атом азота, например, амин, пиридин или имидазол, так и кислотный фрагмент, например, но, не ограничиваясь ими, карбоновая кислота, включен в объем соединений по изобретению, описанных в данном описании. Формирование фармацевтически полезных солей из основных (или кислотных) фармацевтических соединений обсуждается, например, S. Berge et al., в Journal of Pharmaceutical Sciences (1977) 66(1) 1-19; P. Gould, International J. of Pharmaceutics (1986) 33 201-217; Anderson et al, The Practice of Medicinal Chemistry (1996), Academic Press, New York; в The Orange Book (Food & Drug Administration, Washington, D.C. on their website); и P. Heinrich Stahl, Camille G. Wermuth (Eds.), Handbook of Pharmaceutical Salts: Properties, Selection, and Use, (2002) Int'l. Union of Pure and Applied Chemistry, pp. 330-331. Указанные публикации включены в данное описание посредством ссылки.
Настоящее изобретение охватывает все доступные соли, включая соли, которые обычно признаются как безопасные для применения при получении фармацевтических препаратов, и такие, которые могут быть сформированы в настоящее время специалистом в данной области техники и затем классифицированы в качестве «обычно признанных как безопасные» для применения в получении фармацевтических препаратов, называются в данном описании ʺфармацевтически приемлемыми солямиʺ. Примеры фармацевтически приемлемых кислотно-аддитивных солей включают, но, не ограничиваясь ими, ацетаты, включая трифторацетатные соли, адипаты, альгинаты, аскобаты, аспартаты, бензоаты, бензолсульфонаты, бисульфаты, бораты, бутираты, цитраты, камфораты, камфорсульфонаты, циклопентанпропионаты, диглюконаты, додецилсульфаты, этансульфонаты, фумараты, глюкогептаноаты, глицерофосфаты, гемисульфаты, гептаноаты, гексаноаты, гидрохлориды, гидробромиды, гидройодиды, 2-гидроксиэтансульфонаты, лактаты, малеаты, метансульфонаты, метилсульфаты, 2-нафталинсульфонаты, никотинаты, нитраты, оксалаты, паиоаты, пектинаты, персульфаты, 3-фенилпропионаты, фосфаты, пикраты, пивaлаты, пропионаты, салицилаты, сукцинаты, сульфаты, сульфонаты (такие как приведено в данном описании), тартраты, тиоцианаты, толуолсульфонаты (также известные как тозилаты,) ундеканоаты и тому подобное.
Примеры фармацевтически приемлемых солей оснований включают, но, не ограничиваясь ими, аммониевые соли, соли щелочных металлов, такие как натриевые, литиевые и калиевые соли, соли щелочноземельных металлов, такие как кальциевые и магниевые соли, соли алюминия, соли цика, соли с органическими основаниями (например, органическими аминами), такими как бензатины, диэтиламин, дициклогексиламины, гидрабамины (образованные с N,N-бис(дегидроабиэтил)этилендиамином), N-метил-D-глюкамины, N-метил-D-глюкамиды, трет-бутиламины, пиперазин, фенилциклогексиламин, холин, трометамин, и соли с аминокислотами, такими как аргинин, лизин и тому подобное. Основные азотсодержащие группы могут быть преобразованы в аммониевый ион или кватернизированы при помощи агентов, таких как низший алкилгалогениды (например, метил, этил, пропил и бутилхлориды, бромиды и йодиды), диалкилсульфаты (например, диметил, диэтил, дибутил и диамилсульфаты), длинноцепочечные галогениды (например децил, лаурил, миристил и стеарилхлориды, бромиды и йодиды), аралкилгалогениды (например, бензил и фенетилбромиды) и другие.
Все такие кислотные и основные соли предназначены для включения в объем настоящего изобретения в качестве фармацевтически приемлемых солей, и все кислотные и основные соли считаются эквивалентами свободных форм соответствующих соединений для целей настоящего изобретения.
Термин ʺочищенноеʺ, ʺв очищенной формеʺ или ʺв выделенной и очищенной формеʺ для соединения относится к физическому состоянию указанного соединения после выделения из процесса синтеза или природного источника или их комбинации. Таким образом, термин ʺочищенноеʺ, ʺв очищенной формеʺ или ʺв выделенной и очищенной формеʺ для соединения относится к физическому состоянию указанного соединения после получения способом очистки или способами, описанными в данном описании или хорошо известными специалисту в данной области техники, и в достаточной чистоте для характеризации стандартными аналитическими методами, описанными в данном описании или хорошо известными специалисту в данной области техники.
Функциональная группа в соединении, названной ʺзащищеннойʺ, означает, что данная группа находится в модифицированной форме, чтобы предотвратить нежелательные побочные реакции на защищенном сайте, когда соединение подвергается взаимодействию. Подходящие защитные группы известны, например, как описано в стандартных пособиях, например, в T. W. Greene et al, Protective Groups in organic Synthesis (1991), Wiley, New York.
Когда переменная (например, арил, гетероцикл, RXY и т.д.) появляется более чем один раз в любом из фрагментов или в любом из соединений по настоящему изобретению, выбор определения этой переменной для фрагментов, в каждом случае, является независимым от его определения в каждом другом случае, если специально не указано иное, в определении локальной переменной.
Как использовано в данном описании, термин ʺкомпозицияʺ предназначен для охвата продукта, состоящего из конкретных ингредиентов в конкретном количестве, и любого продукта, который является результатом, прямо или косвенно, комбинации конкретных ингредиентов в конкретных количествах
Настоящее изобретение также охватывает изотопно-меченные соединения настоящего изобретения, которые структурно идентичны соединениям, описанным в данном описании, но по факту, в форме данного соединения статистически значимый процент одного или более атомов заменены атомами, имеющими атомную массу или массовое число, отличное от атомной массы или массового числа наиболее обогащенного изотопа, обычно встречающегося в природе, таким образом, изменяя существующее в природе обогащение такого изотопа, присутствующего в соединении по настоящему изобретению. Примеры изотопов, которые могут быть предпочтительно включены в соединения настоящего изобретения, включают изотопы водорода, углерода, азота, кислорода, фосфора, йода, фтора и хлора, например, но, не ограничиваясь ими: 2H, 3H, 11C, 13C, 14C, 13N, 15N, 15O, 17O, 18O, 31P, 32P, 35S, 18F и 36Cl, 123I и 125I. Следует отметить, что другие изотопы также могут быть включены известными способами.
Некоторые изотопно-меченные соединения настоящего изобретения (например, меченные 3H, 11C и 14C) признаны, как особенно полезные при анализе распределения соединений и/или тканевых субстратов с использованием целого ряда известных методов. Тритированные (т.е. 3H) и углеродные-14 (т.е. 14C) изотопы особенно предпочтительны из-за простоты их получения и детекции. Кроме того, замена природно обогащенного изотопа более тяжелым изотопом, например, замена протия дейтерием (т.е. 2H), может привести к некоторым терапевтическим преимуществам в результате повышенной метаболической стабильности (например, увеличению in vivo полужизни или снижению требуемого дозирования) и поэтому могут быть более предпочтительными в некоторых обстоятельствах. Изотопно-меченные соединения настоящего изобретения могут быть получены при помощи следующих методик по аналогии с представленными на реакционных схемах и/или в примерах, приведенных в данном описании ниже, заменяя немеченные изотопами реагенты подходящими изотопно-меченными реагентами, или путем хорошо известных взаимодействий предварительно полученных предшественников с соединением настоящего изобретения, которое специально получено для такой реакции ʺмеченияʺ. Такие соединения также включены в настоящее изобретение.
В одном из аспектов, как представлено выше, настоящее изобретение предоставляет фармацевтические препараты (фармацевтические композиции) для применения при антагонизме рецепторов A2A, считающиеся полезными при лечении расстройств центральной нервной системы (ЦНС), например, двигательных расстройств, связанных с болезнью Паркинсона, или при ее лечении, где композиции содержат по меньшей мере одно соединение формулы A или формулы A-1 или его фармацевтически приемлемую соль, как определено в данном описании.
Как представлено выше, в одном из аспектов настоящее изобретение предоставляет фармацевтические препараты (фармацевтические композиции), подходящие для применения при блокировании аденозиновых рецепторов A2a, обнаруженных в базальных ядрах, содержащие по меньшей мере одно соединение формулы A, представленной выше, или его фармацевтически приемлемую соль, и по меньшей мере один фармацевтически приемлемый носитель (описанный ниже). Следует отметить, что фармацевтические препараты по настоящему изобретению могут содержать более чем одно соединение по настоящему изобретению, например, комбинацию двух или трех соединений настоящего изобретения, каждое из которых предоставляется путем добавления в данную композицию желаемого количества данного соединения в фармацевтически приемлемой чистой форме. Следует отметить, что композиции по настоящему изобретению могут содержать, в дополнение к одному или более соединениям настоящего изобретения, одно или более других соединений, которые также обладают фармакологической активностью, например, как описано в данном описании ниже.
Как представлено выше, в одном из аспектов настоящее изобретение предоставляет фармацевтические препараты (фармацевтические композиции), подходящие для применения при селективном антагонизме рецепторов A2a, например, которые обнаружены в высокой плотности в базальных ядрах, содержащие по меньшей мере одно соединение формулы A, формулы A-1 или их соль:
 Формула A,
Формула A,
 Формула A-1
Формула A-1
где ʺR1ʺ, ʺRA-1ʺ, ʺR2ʺ, ʺR3ʺ и ʺHetʺ определены в данном описании выше, которые, как полагают, обладают активностью антагониста рецептора A2A. Такие соединения, как полагают, полезны при лечении или оказании помощи при нейродегенеративных заболеваниях, например, болезни Паркинсона.
В некоторых вариантах осуществления композиция предпочтительно содержит одно или более соединений формулы A или формулы A-1, как определено в данном описании, и по меньшей мере один фармацевтически приемлемый носитель (описанный ниже). Следует отметить, что фармацевтические препараты по настоящему изобретению могут содержать более чем одно соединение по настоящему изобретению, например, комбинацию двух или трех соединений формулы A или формулы A-1, каждое их которых предоставляется путем добавления в данную композицию желаемого количества данного соединения в фармацевтически приемлемой чистой форме. Следует отметить, что композиции по настоящему изобретению могут содержать, в дополнение к одному или более соединениям настоящего изобретения, одно или более дополнительных соединений, которые также обладают фармакологической активностью, например, как описано в данном описании ниже.
В то время как препараты по настоящему изобретению могут применяться в нерасфасованной форме, следует отметить, что большинство применяемых препаратов по изобретению будут включены в дозированную форму, подходящую для введения пациенту, причем каждая дозированная форма, содержащая количество выбранного состава, которое содержит эффективное количество указанного одного или более соединений формулы A. Примеры подходящих дозированных форм включают, но, не ограничиваясь ими, дозированные формы, адаптированные для: (i) перорального введения, например, жидкой, гелевой, порошковой, твердой или полутвердой фармацевтической композиции, которая заключена в капсулу или спрессована в таблетку и может содержать дополнительно одно или более покрытий, которые модифицируют их свойства высвобождения, например, покрытия, которые способствуют отсроченному высвобождению, или препараты, которые обладают свойствами замедленного высвобождения; (ii) дозированные формы, адаптированные для инъекций, например, инъецируемый раствор или суспензия, адаптированные для подкожных инъекций (Sub-Q) или внутримышечного введения (IM), например, где инъецируемый раствор или суспензия могут быть адаптированы для депо препарата, обладающего свойствами замедленного высвобождения; (iii) дозированные формы, адаптированные для внутривенного введения (IV), например, раствор или суспензия, например, в виде ВВ раствора или концентрата для инъекций в мешке с ВВ физиологическим раствором; (iv) дозированные формы, адаптированные для введения через ткани ротовой полости, например, быстрорастворимые таблетки, леденец, раствор, гель, саше или игольный чип, подходящий для проведения внутримышечного введения; (v) дозированные формы, адаптированные для введения через слизистую оболочку носа или верхних дыхательных полостей, например, раствор, суспензия или эмульсионный состав для диспергирования в нос или дыхательные пути; (vi) дозированные формы, адаптированные для трансдермального введения, например, пластырь, крем или гель; (vii) дозированные формы, адаптированные для внутрикожного введения, например, микроигольный чип; и (viii) дозированные формы, адаптированные для доставки через слизистую прямой кишки или влагалища, например, суппозиторий.
Для получения фармацевтических композиций, содержащих соединения настоящего изобретения, соединения настоящего изобретения, как правило, комбинируют с одним или более фармацевтически приемлемыми эксципиентами. Такие эксципиенты придают композиции свойства, которые упрощают ее обработку или процесс получения, например, лубриканты или способствующие прессованию добавки в порошковых медикаментах предназначены для таблетирования или адаптирования композиции для желаемого пути введения, например, эксципиенты, которые обеспечивают лекарственный препарат для перорального введения, например, через поглощение из желудочно-кишечного тракта, трансдермальное или чрезслизистое введение, например, через клейкий кожный "пластырь" или буккальное введение, или для инъекций, например, внутримышечного или внутривенного пути введения. Такие эксципиенты собирательно именуются в данном описании "носителем". Обычно препараты могут содержать примерно до 95 процентов активного ингредиента, хотя могут быть получены препараты с более большими количествами.
Фармацевтические композиции могут быть твердыми, полутвердыми или жидкими. Твердая форма препаратов может быть адаптирована для различных способов введения, примеры которых включают, но, не ограничиваясь ими, порошки, диспергируемые гранулы, минитаблетки, шарики, которые могут быть использованы, например, для таблетирования, инкапсулирования или прямого введения. Жидкая форма препаратов включают, но, не ограничиваясь ими, растворы, суспензии и эмульсии, которые, например, но не исключительно, могут применяться при получении препаратов, предназначенных для парентеральных инъекций, для интраназального введения или для введения в некоторые другие слизистые мембраны. Препараты, полученные для введения в различные слизистые мембраны, также могут включать дополнительные компоненты, адаптирующие их для такого введения, например, модификаторы вязкости.
Аэрозольные препараты, например, подходящие для введения ингаляцией или через слизистую оболочку носа, могут включать растворы и твердые вещества в порошковой форме, которые могут быть комбинированы с фармацевтически приемлемым пропеллентом, например, инертным сжатым газом, таким как азот. Также включенной является твердая форма препаратов, которая предназначена для преобразования, непосредственно перед использованием, в суспензию или раствор, например, для перорального или парентерального введения. Примеры таких твердых форм включают, но, не ограничиваясь ими, высушенные замораживанием препараты и жидкие препараты, адсорбированные в твердой абсорбирующей среде.
Соединения настоящего изобретения также могут быть доставлены трансдермально или чрезслизисто, например, из жидкой, суппозиторной, кремовой, пенной, гелевой или быстрорастворимой твердой формы. Следует отметить, что трансдермальные композиции также могут быть в форме кремов, лосьонов, аэрозолей и/или эмульсий и могут быть предоставлены в единичной дозированной форме, которая включает любой трансдермальный пластырь, известный в данной области техники, например, пластырь, который включает матрицу, содержащую фармацевтически активное соединение, или резервуар, который содержит твердую или жидкую форму фармацевтически активного соединения.
Примеры фармацевтически приемлемых носителей и способов изготовления различных композиций, приведенных выше, можно найти в A. Gennaro (ed.), Remington: The Science and Practice of Pharmacy, 20th Edition, (2000), Lippincott Williams & Wilkins, Baltimore, MD.
Предпочтительно, фармацевтический препарат находится в единичной дозированной форме. В такой форме препараты подразделяются по подходящему размеру дозированных единиц, приводя к содержанию подходящего количества активного компонента, например, эффективному количеству для достижения желаемой цели.
Фактическая применяемая доза может варьироваться в зависимости от потребностей пациента и тяжести подвергаемого лечению состояния. Определение надлежащего режима дозирования для конкретной ситуации находится в компетенции специалиста в данной области техники. Для удобства общая ежедневная доза может быть разделена и ведена порциями в течение дня при необходимости.
В другом варианте осуществления настоящее изобретение относится к применению соединений, описанных в данном описании, для возможного лечения, оказания помощи, сокращения или устранения заболеваний или болезненных состояний, которые можно или считается, что можно лечить, оказывать помощь, облегчать или способствовать улучшению специфическим антагонизмом рецепторов аденозина A2a, например, заболевания или расстройства центральной нервной системы, включая, но, не ограничиваясь ими, лечение двигательных расстройств (например, дрожания, брадикинезии, походки, дистонии, дискинезии, поздней дискинезии, других экстрапирамидных синдромов, болезни Паркинсона и расстройств, связанных с болезнью Паркинсона). Соединения настоящего изобретения имеют возможность для применения в предотвращении или уменьшении воздействия лекарственных средств, вызывающих двигательные расстройства.
В соответствии с настоящим изобретением, антагонизм рецепторов аденозина A2a устраняют путем введения пациенту, нуждающемуся в такой терапии, эффективного количества одного или более соединений настоящего изобретения или его фармацевтически приемлемой соли.
В некоторых вариантах осуществления данное соединение предпочтительно вводят в форме фармацевтической композиции, содержащей соединение настоящего изобретения, например, соединение формулы A или формулы A-1 или его соль и по меньшей мере один фармацевтически приемлемый носитель (описанный ниже). Следует отметить, что фармацевтические препараты по настоящему изобретению могут содержать более чем одно соединение по настоящему изобретению или его соль, например, комбинацию двух или трех соединений настоящего изобретения, каждое их которых добавлено в данную композицию в желаемом количестве данного соединения или его соли, которые выделены в фармацевтически приемлемой чистой форме.
Как представлено выше, введение соединения по настоящему изобретению для воздействия на антагонизм сайтов рецептора A2a, которое, как считается, полезно при лечении заболеваний центральной нервной системы, предпочтительно выполняют путем включения соединения в фармацевтическую композицию, заключенную в дозированную форму, например, одну из описанных выше дозированных форм, содержащих эффективное количество по меньшей мере одного соединения по настоящему изобретению (например, 1, 2 или 3, или 1 или 2, или 1, и обычно 1 соединение по настоящему изобретению) или его фармацевтически приемлемой соли. Методы определения безопасного и эффективного введения соединений, которые являются фармацевтически активными, например, соединения по настоящему изобретению, известны специалисту в данной области техники, например, как описано в стандартной литературе, например, в ʺPhysicians' Desk Referenceʺ (PDR), e.g., 1996 edition (Medical Economics Company, Montvale, NJ 07645-1742, USA), the Physician's Desk Reference, 56th Edition, 2002 (published by Medical Economics company, Inc. Montvale, NJ 07645-1742), или the Physician's Desk Reference, 57th Edition, 2003 (published by Thompson PDR, Montvale, NJ 07645-1742); содержания которых включены в настоящее описание посредством ссылки. Количество и частота введений соединений настоящего изобретения и/или их фармацевтически приемлемых солей будет регулироваться согласно решению лечащего врача, учитывая такие факторы как возраст, состояние и размер пациента, а также тяжесть симптомов, подвергаемых лечению. Соединения настоящего изобретения можно вводить в общей дневной дозе вплоть до 1000 мг, которую можно вводить одной дозой ежедневно или можно разделить на множественные дозы на 24-часовой период, например, две-четыре дозы в день.
Как представлено выше, введение соединения по настоящему изобретению предпочтительно выполняют включением данного соединения в фармацевтическую композицию, заключенную в дозированную форму, например, одну из описанных выше дозированных форм, содержащих эффективное количество по меньшей мере одного соединения по настоящему изобретению (например, 1, 2 или 3, или 1 или 2, или 1, и обычно 1 соединение по настоящему изобретению) или его фармацевтически приемлемой соли. Методы определения безопасного и эффективного введения соединений, которые являются фармацевтически активными, например, соединения формулы A или формулы A-1, или их фармацевтически приемлемой соли, известны специалисту в данной области техники, например, как описано в стандартной литературе, например, в ʺPhysicians' Desk Referenceʺ (PDR), e.g., 1996 edition (Medical Economics Company, Montvale, NJ 07645-1742, USA), the Physician's Desk Reference, 56th Edition, 2002 (published by Medical Economics company, Inc. Montvale, NJ 07645-1742), или the Physician's Desk Reference, 57th Edition, 2003 (published by Thompson PDR, Montvale, NJ 07645-1742); содержания которых включены в настоящее описание посредством ссылки. Количество и частота введения соединений настоящего изобретения и/или их фармацевтически приемлемых солей будет регулироваться согласно решению лечащего врача, учитывая такие факторы как возраст, состояние и размер пациента, а также тяжесть симптомов, подвергаемых лечению. Соединения настоящего изобретения можно вводить в общей дневной дозе вплоть до 1000 мг, которую можно вводить одной дозой ежедневно или можно разделить на множественные дозы на 24-часовой период, например, две-четыре дозы в день.
Как правило, в какой бы форме не осуществлялось введение, введенная дозированная форма будет содержать количество по меньшей мере одного соединения по настоящему изобретению или его соли, которое будет обеспечивать терапевтически эффективный уровень данного соединения в сыворотке крови в той или иной форме в течение периода по меньшей мере 2 часов, предпочтительно по меньшей мере четырех часов, и предпочтительно длительный. Обычно, как известно в данной области техники, дозирование фармацевтической композиции, обеспечивающее терапевтически эффективный уровень соединения по настоящему изобретению в сыворотке крови, может составлять промежуток времени для обеспечения уровня в сыворотке крови, удовлетворяющего или превышающего минимальный терапевтически эффективный уровень в сыворотке крови на постоянной основе на протяжении всего периода лечения, во время которого осуществляется введение. Следует отметить, что введенная дозированная форма также может быть в форме, обеспечивающей период замедленного высвобождения для фармацевтически активного соединения, которое будет обеспечивать терапевтический уровень в сыворотке крови в течение длительного периода времени, требующего менее частого дозирования. Как представлено выше, композиция по настоящему изобретению может содержать дополнительные фармацевтически активные компоненты или может быть введена совместно, одновременно или последовательно с другими фармацевтически активными композициями в качестве дополнительного необходимого курса лечения. Следует отметить, что введенная дозированная форма также может быть в форме, обеспечивающей период замедленного высвобождения для фармацевтически активного соединения, которое будет обеспечивать терапевтический уровень в сыворотке крови в течение длительного периода времени, требующего менее частого дозирования. Как представлено выше, композиция по настоящему изобретению может содержать дополнительные фармацевтически активные компоненты или может быть введена совместно, одновременно или последовательно с другими фармацевтически активными композициями в качестве дополнительного необходимого курса лечения. Такие дополнительные терапевтические средства могут включать соединения с дофаминэргической активностью, например, но, не ограничиваясь ими: i) L-DOPA; ii) ингибиторы DOPA декарбоксилазы и iii) ингибиторы COMT.
Специалисту в данной области техники будет очевидно, что протоколы лечения, использующие по меньшей мере одно соединение по настоящему изобретению, могут быть разнообразными, в соответствии с потребностями пациента. Таким образом, соединения настоящего изобретения, используемые в способах по настоящему изобретению, можно вводить по различным протоколам, описанным выше. Например, соединения настоящего изобретения можно вводить прерывисто, а не непрерывно, в ходе цикла лечения.
В примерах, которые следуют ниже, некоторые иллюстративные соединения получали в виде чистых энантиомеров, или получали из энантиомерночистых исходных, или выделяли после синтеза, используя методы хирального разделения, например, хиральную хроматографию. После выделения хиральных соединений, абсолютную стереохимию выделенных соединений определяли не в каждом примере. Таким образом, когда получали чистые изомеры, но абсолютную конфигурацию не проверяли, энантиомер, выделенный в чистой форме, определяли следующим порядком действий.
Если в тексте не указано иное, когда присутствуют, изомеры иллюстративных соединений не выделяли. Если в тексте не указано иное, когда изомеры выделяли во фракции, содержащие избыток особого изомера, например, фракцию, содержащую избыток оптического изомера, разделение которой можно провести, например, суперкритической жидкостной хроматографией, абсолютную стереохимию выделенных изомеров не определяли, если не указано иное.
В случае если реакционная схема представлена в примере использования соединения, имеющего один или более стереоцентров, такие стереоцентры отмечены звездочками, как показано ниже в иллюстративном соединении Def-1:

Таким образом, Def-1 состоит из следующих пар изомеров: (i) транс-изомеров ((2R,7aS)-2-метилгексагидро-1H-пирролизин-7a-ил)метанамина (соединение ABC-1) и ((2S,7aR)-2-метилгексагидро-1H-пирролизин-7a-ил)метанамина (соединение ABC-2); и (ii) цис-изомеров ((2R,7aR)-2-метилгексагидро-1H-пирролизин-7a-ил)метанамина (соединение ABC-3) и ((2S,7aS)-2-метилгексагидро-1H-пирролизин-7a-ил)метанамина (соединение ABC-4):

Когда соединение получают и разделяют на чистые энантиомеры, хотя и без определения абсолютной конфигурации каждого энантиомера данного соединения, продукт будет определен в указанном названии при использовании двух названий энантиомеров, например, когда ABC-1 и ABC-2 получают и разделяют на чистые энантиомеры, название будет читаться как ʺполучение ((2R,7aS)-2-метилгексагидро-1H-пирролизин-7a-ил)метанамина и ((2S,7aR)-2-метилгексагидро-1H-пирролизин-7a-ил)метанамина". В некоторых случаях, когда получают энантиомерные соединения, обозначение (цис) или (транс) могут добавляться к названию для уточнения взаимного расположения стереоцентров, присутствующих в двух стереоизомерах. Следует отметить, что идентификация каждого из продуктов в экспериментальном получении как ʺABC-энантиомер Aʺ или ʺABC-энантиомер Bʺ не связывает полученный и выделенный энантиомер с каким-любо стереоспецифическим названием, только с тем, что оба указанных энантиомера получали и выделяли с повышенной энантиомерной чистотой без определения абсолютной конфигурации полученного таким образом любого из соединений.
Когда изомерные соединения получают в виде рацемической смеси, звездочки будут вставлены в структурное представление для обозначения стереоцентров, но название будет относиться к получению обоих энантиомеров, например, когда получают ABC-3 и ABC-4 в виде рацемата, название будет читаться как ʺполучение ((2R,7aR и 2S7aS)-2-метилгексагидро-1H-пирролизин-7a-ил)метанаминаʺ.
Специалисту в данной области техники будет очевидно, что протоколы лечения, использующие по меньшей мере одно соединение по настоящему изобретению, как описано в данном описании, могут варьироваться в соответствии с потребностями пациента. Таким образом, соединения настоящего изобретения, используемые в способах настоящего изобретения, могут быть введены согласно различным протоколам, описанным выше. Например, соединения настоящего изобретения можно вводить прерывисто, а не непрерывно, во время цикла лечения.
Следующие примеры предоставлены для дополнительной иллюстрации соединений настоящего изобретения, со ссылкой на общие формулы, представленные выше, но не для ограничения настоящего изобретения этими конкретно проиллюстрированными соединениями.
ПРИМЕРЫ
Как правило, соединения настоящего изобретения (Пр-GP-1) могут быть получены аминным ацилированием при использовании подходящей кислоты и соответствующим образом замещенного амина в присутствии основания Хунига и HATU, как представлено на общей схеме GS-1 ниже:
Схема GS-1

Это также проиллюстрировано в примере получения соединений Пр-1A и Пр-1B, ниже.
Пример 1
Получение (S)-3-амино-N-(6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(оксазол-2-ил)пиразин-2-карбоксамида и (R)-3-амино-N-(6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(оксазол-2-ил)пиразин-2-карбоксамида (Пр-1A и Пр-1B)
Схема ES-1

3-Амино-6-метил-5-(оксазол-2-ил)пиразин-2-карбоновую кислоту (A-2, 200 мг, 0,91 ммоль) в ДМФА (4 мл) смешивали с 6,7-дигидро-5H-циклопента[b]пиридин-7-амином, 2HCl (245 мг, 1,2 ммоль), основанием Хунига (0,64 мл, 3,6 ммоль) и гексафторфосфатом 2-(3H-[1,2,3]триазолo[4,5-b]пиридин-3-ил)-1,1,3,3-тетраметилизоурония (V) (450 мг, 1,2 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов. Смесь выливали в 100 мл воды. Выпавшее в осадок вещество отделяли фильтрованием, водную часть экстрагировали EtOAc. Полученный раствор концентрировали, с получением небольшого количества неочищенного продукта. Объединенный неочищенный продукт очищали. Остаток очищали колоночной хроматографией на предварительно упакованной 50 г силикагеля колонке, элюируя градиентной смесью 20~100% EtOAc/гексан, с получением продукта в виде твердого вещества после концентрирования. Два энантиомера разделяли хиральным разделением, согласно следующим условиям: хиральная колонка OD-H (3×15 см), элюируя смесью 25% метанол (0,1% DEA)/CO2, 100 бар, 60 мл/мин.
Оба энантиомера характеризовали ЖХ/МС. Стереохимию определяли посредством VCD (спектроскопия колебательного кругового дихроизма). Быстро элюируемый изомер Пр-1A был определен как (R)-энантиомер: ЖХМС: 337 [M+1]), и медленно элюируемый энантиомер Пр-1B был определен как (S)-энантиомер: ЖХМС: 337 [M+1]).
Таким же образом, как проиллюстрировано выше, 3-амино-6-метил-N-((3-метилпиридин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединение Пр-3) получали из соответствующего амина и такого же предшественника A-2 карбоновой кислоты:

Соответственно, к смеси (3-метилпиридин-2-ил)метанамина (17 мг, 0,14 ммоль) и 3-амино-6-метил-5-(оксазол-2-ил)пиразин-2-карбоновой кислоты (30 мг, 0,14 ммоль) при комнатной температуре добавляли ДМФА (0,55 мл) с последующим добавлением основания Хунига (24 мкл, 0,14 ммоль) и HATU (52 мг, 0,14 ммоль). Полученной смеси давали возможность перемешиваться при комнатной температуре в течение ночи, и затем подвергали хроматографии методом препаративной ВЭЖХ, снабженной детектором Джильсона, элюируя градиентной смесью ацетонитрил/вода (содержащей 0,05% ТФУК), с получением ТФУК соли 3-амино-6-метил-N-((3-метилпиридин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида в виде твердого вещества (Пр-3). Соединение Пр-3 характеризовали ЖХ/МС. ЖХ/МС=325 [M+1].
По методике, аналогично получению соединений Пр-1A и Пр-1B, 3-амино-N-((3-циклопропилпиридин-2-ил)метил)-6-метил-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединение Пр-4) получали согласно схеме ES-2:
Схема ES-2

Соединение Пр-4 характеризовали со следующими результатами: ЖХ/МС=351 [M+1].
1H ЯМР (ДМСО-d6, 400 МГц) δ 9,42 (с, 1H), 7,49 (д, 1H), 7,88 (с, 1H), 7,42-7,37 (м, 2H), 7,22-7,17 (м, 1H), 4,94 (д, 2H), 2,92 (с, 3H).1,99 (т, 1H), 1,07 (м, 2H), 0,72 (м, 2H).
В таблице I представлены дополнительные соединения настоящего изобретения, полученные с использованием аналогичной методики из соответствующего амина и предшественника кислоты A2. Все соединения характеризовали с использованием данных ЖХ/МС (показаны в таблице). Там, где указано в таблице, присутствующие энантиомерные формы разделяли посредством хиральной ВЭЖХ. Абсолютную стереохимию определяли не во всех случаях. В примерах, отмеченных в таблице I, абсолютную стереохимию определяли при использовании сверхкритической CO2-хроматографии (SCF хроматография). Разделенные изомеры отмечены в таблице I как ʺпервыйʺ, ʺвторойʺ и т.д. в порядке их элюирования из колонки. В колонке применяли следующие условия (указанные в таблице I как ʺуслов. 1ʺ или ʺуслов. 2ʺ) определенного примера:
условия 1: SCF/CO2 с 25% метанолом (1% DEA), протекающим через OD-H колонку;
условия 2: SCF/CO2 со смесью н-гексан/этанол (1% DEA), протекающей через AY-H колонку;
условия 3: SCF/CO2 со смесью н-гексан/этанол (1% DEA), протекающей через OZ-H колонку;
условия 4: SCF/CO2 с 15% метанолом (2% DEA), протекающим через OD колонку;
условия 5: SCF/CO2 с 30% метанолом (1% DEA), протекающим через AD-H колонку;
условия 6: SCF/CO2 с 50% метанолом, протекающим через AD-H колонку;
условия 7: SCF/CO2 с 20% метанолом (1% DEA), протекающим через OJ-H колонку;
условия 8: SCF/CO2 с 35% изопропанолом, протекающим через OD-H колонку.
|
Получение 3-амино-6-метил-5-(оксазол-5-ил)-N-(2-(трифторметил)бензил)пиразин-2-карбоксамида (Пр-249)
Схема ES-3

Основание Хунига (0,052 мл, 0,30 ммоль) добавляли к перемешиваемой смеси 3-амино-6-метил-5-(оксазол-5-ил)пиразин-2-карбоновой кислоты (0,022 г, 0,10 ммоль), (2-(трифторметил)-фенил)метанамина (0,019 г, 0,110 ммоль) и HATU (0,042 г, 0,110 ммоль) в ДМФА, с последующим перемешиванием при КТ в течение 3 часов. Полученный раствор очищали ВЭЖХ с детектором Джильсона со смесью ацетонитрил/вода (каждый из которых с 0,01% ТФУК) в качестве элюентов, с получением соединения Пр-249 в виде твердого вещества. ЖХ/МС=379 [M+1].
При использовании описанных выше исходных химических веществ и соответствующим образом замещенных предшественников, получали соединения настоящего изобретения, перечисленные в таблице II.
|
Получение 3-амино-6-метил-5-(4-метил-1H-пиразол-1-ил)-N-((3-метилпиридин-2-ил)метил)пиразин-2-карбоксамида (Пр-267)
Соединение Пр-267 получали согласно схеме ES-4.
Схема ES-4

Основание Хунига (0,20 мл, 1,16 ммоль) добавляли к перемешиваемой смеси 3-амино-6-метил-5-(4-метил-1H-пиразол-1-ил)пиразин-2-карбоновой кислоты (0,090 г, 0,39 ммоль), 3-метил-2-аминометилпиридина (0,052 г, 0,42 ммоль) и HATU (0,161 г, 0,42 ммоль) в ДМФА (2 мл), и полученную смесь перемешивали при КТ в течение 3 часов. Полученный раствор очищали ВЭЖХ с детектором Джильсона со смесью ацетонитрил/вода с 0,01% ТФУК в качестве элюентов, с получением указанного в заголовке соединения в виде твердого вещества. ЖХ/МС=338 [M+1].
Пример получения соединений Пр-268 и Пр-269
3-Амино-6-хлор-5-(2H-1,2,3-триазол-2-ил)-N-(2-(трифторметил)бензил)пиразин-2-карбоксамид (Пр-269) и 3-амино-6-хлор-5-(1H-1,2,3-триазол-1-ил)-N-(2-(трифторметил)бензил)пиразин-2-карбоксамид (Пр-268) получали согласно реакционной схеме ES-5:
Схема ES-5

В реакционный сосуд помещали смесь 3-амино-6-хлор-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоновой кислоты и 3-амино-6-хлор-5-(1H-1,2,3-триазол-1-ил)пиразин-2-карбоновой кислоты (36 мг, 0,15 ммоль) в 1,5 мл ДМФА и смешивали с диизопропилэтиламином (0,07 мл, 0,39 ммоль), (2-(трифторметил)фенил)метанамином (39 мг, 0,22 ммоль) и HATU (95 мг, 0,25 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи, затем разбавляли ДМФА и очищали препаративной ВЭЖХ с детектором Джильсона, элюируя смесью ацетонитрил/вода, содержащей 0,1% ТФУК. Элюент собирали отдельно, концентрировали, и концентрат сушили в вакуумной печи в течение ночи, с получением 3-амино-6-хлор-5-(2H-1,2,3-триазол-2-ил)-N-(2-(трифторметил)бензил)пиразин-2-карбоксамида, ЖХ/МС=398 [M+1], и 3-амино-6-хлор-5-(1H-1,2,3-триазол-1-ил)-N-(2-(трифторметил)бензил)пиразин-2-карбоксамида, ЖХ/МС=398 [M+1].
При использовании описанных выше исходных химических веществ и соответствующим образом замещенных предшественников, получали соединения настоящего изобретения, перечисленные в таблице III.
|
Получение 3-амино-6-метил-N-((3-метилпиридин-2-ил)метил)-5-(4-(трифторметил)оксазол-2-ил)пиразин-2-карбоксамида (Пр-364)
Соединение Пр-364 получали согласно схеме ES-6.
Схема ES-6


Стадия A: Этил 3-амино-5-циано-6-метилпиразин-2-карбоксилат
20-мл запечатанную трубку заполняли этил 3-амино-5-хлор-6-метилпиразин-2-карбоксилатом (900 мг, 4,17 ммоль), цианидом цинка (1,47 г, 12,52 ммоль) и [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладием(II) (916 мг, 1,25 ммоль) в ДМФА (10,0 мл). Полученную в результате смесь нагревали в микроволновом реакторе при 140°C в течение 2 часов. Полученную смесь охлаждали до температуры окружающей среды. Добавляли воду (30 мл), и полученную смесь экстрагировали EtOAc (3×50 мл). Объединенные органические фракции промывали насыщенным раствором соли (70 мл), сушили (Na2SO4), фильтровали, и растворитель выпаривали при пониженном давлении. Остаток очищали препаративной ТСХ (гексан:EtOAc=1:1), с получением этил 3-амино-5-циано-6-метилпиразин-2-карбоксилата в виде твердого вещества. ЖХ/МС=207 [M+1].
Стадия B: 3-Амино-5-циано-6-метилпиразин-2-карбоновая кислота
К перемешиваемой смеси этил 3-амино-5-циано-6-метилпиразин-2-карбоксилата (330 мг, 1,55 ммоль) в воде (0,5 мл) и EtOH (5,0 мл) при комнатной температуре добавляли гидроксид лития (74 мг, 3,1 ммоль). Полученную смесь затем перемешивали в течение 30 минут, по истечении которых исходные вещества больше не присутствовали (ЖХМС). Полученную смесь подкисляли добавлением 1M раствора HCl для доведения pH до 5. Полученную смесь фильтровали и концентрировали при пониженном давлении. Остаток дополнительно сушили в вакуумной печи в течение ночи, с получением 3-амино-5-циано-6-метилпиразин-2-карбоновой кислоты в виде твердого вещества. ЖХ/МС=179 [M+1].
Стадия C: 3-Амино-6-метил-N2-((3-метилпиридин-2-ил)метил)пиразин-2,5-дикарбоксамид
Указанное в заголовке соединение получали, следуя методике, аналогично описанной в примере 1. ЖХ/МС=301 [M+1].
1H-ЯМР (CD3OD-d4, 400 МГц) δ 8,39 (д, 1H), 7,66-7,64 (м, 1H), 7,28-7,25 (м, 1H), 4,70 (с, 2H), 2,70 (с, 3H), 2,43 (с, 3H).
Стадия D: 3-Амино-6-метил-N-((3-метилпиридин-2-ил)метил)-5-(4-(трифторметил)оксазол-2-ил)пиразин-2-карбоксамид
Раствор 3-амино-6-метил-N2-((3-метилпиридин-2-ил)метил)пиразин-2,5-дикарбоксамида (15 мг, 0,05 ммоль) и бромтрифторацетона в трет-BuOH (5 мл нагревали при 100°C в течение 20 часов. Полученную смесь охлаждали, и растворитель выпаривали при пониженном давлении. Остаток очищали препаративной ВЭЖХ с использованием смеси MeCN/0,05% ТФУК в H2O=5%~95%, с получением 3-амино-6-метил-N-((3-метилпиридин-2-ил)метил)-5-(4-(трифторметил)оксазол-2-ил)пиразин-2-карбоксамида в виде твердого вещества. ЖХ/МС=393 [M+1].
1H-ЯМР (CD3OD-d4, 400 МГц) δ 8,56-8,54 (м, 2H), 8,21-8,19 (м, 1H), 7,72-7,69 (м, 1H), 5,01 (с, 2H), 2,73 (с, 3H), 2,62 (с, 3H).
Получение 3-амино-5-(4,5-диметилоксазол-2-ил)-6-метил-N-((3-метилпиридин-2-ил)метил)пиразин-2-карбоксамида (Пр-365)
Соединение Пр-365 получали согласно схеме ES-7.
Схема ES-7

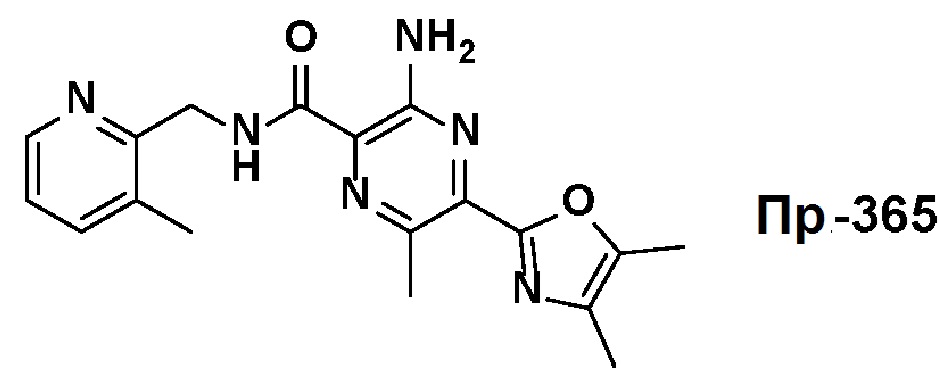
Стадия A: 4,5-Диметилоксазол
Смесь 3-хлорбутан-2-она (5 г, 46,9 ммоль), тетрабутиламмонийбромида (303 мг, 0,94 ммоль) и формамида (15 мл, 376 ммоль) нагревали при 100°C в течение 6 часов. Продукт отгоняли из полученной смеси при атмосферном давлении, с получением 4,5-диметилоксазола в виде масла.
1H-ЯМР (CDCl3, 400 МГц) δ 7,66 (с, 1H), 2,23 (с, 3H), 2,07 (с, 3H).
Стадия B: 3-Амино-5-(4,5-диметилоксазол-2-ил)-6-метилпиразин-2-карбоновая кислота
К перемешиваемому раствору 4,5-диметилоксазола (116 мг, 1,20 ммоль) в ТГФ (3,0 мл) при -78°C, по каплям добавляли бутиллитий (0,9 мл, 1,44 ммоль). Полученный раствор перемешивали при этой температуре в течение 10 минут с последующим добавлением по каплям раствора хлорида цинка (II) (380 мг, 2,79 ммоль) в ТГФ (5,0 мл). Полученную смесь перемешивали в течение 15 минут при -78°C. Охлаждающую баню удаляли, и реакционную смесь нагревали до комнатной температуры. К полученной смеси добавляли этил 3-амино-5-хлор-6-метилпиразин-2-карбоксилат (215 мг, 0,99 ммоль) и Pd(PPh3)4 (115 мг, 0,1 ммоль). Полученную смесь перемешивали при 80°C в течение 16 часов и добавляли воду (20 мл). Смесь экстрагировали EtOAc (20 мл ×3). Органические слои объединяли, промывали насыщенным раствором соли (20 мл), сушили (Na2SO4) и концентрировали. Остаток очищали на колонке с силикагелем, элюируя смесью гексан/EtOAc=3/1~1/1, с получением 3-амино-5-(4,5-диметилоксазол-2-ил)-6-метилпиразин-2-карбоновой кислоты в виде твердого вещества. ЖХ/МС=249 [M+1].
Стадия C: 3-Амино-5-(4,5-диметилоксазол-2-ил)-6-метил-N-((3-метилпиридин-2-ил)метил)пиразин-2-карбоксамид (Пр-365)
Соединение Пр-365 получали, следуя методике, аналогично описанной для примера получения соединений по схемам (ES-1)-(ES-7), и характеризовали с использованием ЖХ/МС=353 [M+1] и протонного ЯМР:
1H-ЯМР (CDCl3, 400 МГц) δ 9,50 (шир., 1H), 8,65-8,64 (м, 1H), 8,03 (д, 1H), 7,61-7,58 (м, 1H), 4,93-4,92 (м, 2H), 2,83 (с, 3H), 2,74 (с, 3H), 2,41 (с, 3H), 2,24 (с, 3H).
Пример получения соединений Пр-366, Пр-367, Пр-368 и Пр-369
Соединения примеров Пр-366, Пр-367, Пр-368 и Пр-369 получали из соединения Пр-340 согласно схеме ES-8.
Схема ES-8


Стадия A: 3-амино-5-(4-метил-1H-пиразол-1-ил)-N-(хинолин-8-илметил)-6-винилпиразин-2-карбоксамид (Пр-366)
Сосуд для микроволновой реакции заполняли 3-амино-6-хлор-5-(4-метил-1H-пиразол-1-ил)-N-(хинолин-8-илметил)пиразин-2-карбоксамидом (Пр-340, полученный выше, 0,520 г, 1,32 ммоль), винилтрифторборатом калия (0,212 г, 1,58 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладием(II) (0,145 г, 0,20 ммоль) и карбонатом калия (0,547 г, 3,96 ммоль) и закупоривали, заменяли воздух N2 3-х разовым циклом вакуумной заправки азотом. Добавляли дегазированную смесь MeCN/вода, с последующим нагреванием до 140°C в течение 30 минут в микроволновом реакторе. После охлаждения, неочищенную смесь концентрировали. Неочищенный концентрат поглощали EtOAc, промывали насыщенным раствором соли, сушили над безводным сульфатом натрия, концентрировали и очищали флэш-хроматографией на силикагелевой колонке с ISCO и смесью EtOAc/гексан (0-60%) в качестве элюента, с получением указанного в заголовке соединения в виде твердого вещества. ЖХ/МС=386 [M+1].
Стадия B: 3-амино-6-(1,2-дигидроксиэтил)-5-(4-метил-1H-пиразол-1-ил)-N-(хинолин-8-илметил)пиразин-2-карбоксамид (Пр-367)
4-Метилморфолин-N-оксид (0,137 г, 1,168 ммоль) и тетраоксид осмия (0,024 г, 0,093 ммоль) добавляли в раствор соединения Пр-366, полученного на предыдущей стадии (0,18 г, 0,467 ммоль), в смеси ацетон/ацетонитрил/вода, с последующим перемешиванием при КТ в течение 1,5 дней. Затем к реакционной смеси дополнительно добавляли 0,2 эквивалента тетраоксида осмия (0,024 г, 0,093 ммоль) и трет-бутанола (3,0 мл) и перемешивали при комнатной температуре (КТ) в течение 24 часов. Полученную смесь фильтровали, концентрировали и очищали ВЭЖХ с детектором Джильсона со смесью ацетонитрил/вода с 0,01% ТФУК в качестве элюента, с получением соединения Пр-367 в виде твердого вещества. ЖХ/МС=420 [M+1].
Стадия C: 3-амино-6-формил-5-(4-метил-1H-пиразол-1-ил)-N-(хинолин-8-илметил)пиразин-2-карбоксамид (Пр-368)
Периодат натрия (0,043 г, 0,200 ммоль) и воду (2,50 мл) добавляли к раствору соединения Пр-367, полученного на предыдущей стадии (0,070 г, 0,167 ммоль), в ацетоне (5,0 мл) при КТ, с последующим перемешиванием в течение 3 часов. Затем к реакционной смеси добавляли периодат натрия (0,043 г, 0,200 ммоль), с последующим перемешиванием в течение дополнительных 3 часов. Полученную смесь разбавляли водой и экстрагировали EtOAc/CH2Cl2. Органическую фазу сушили над MgSO4, фильтровали, концентрировали и очищали флэш-хроматографией на силикагелевой колонке с ISCO и со смесью 0-80% EtOAc/гексан в качестве элюента, с получением соединения Пр-368 в виде твердого вещества. ЖХ/МС=388 [M+1].
Стадия D: 3-амино-6-(дифторметил)-5-(4-метил-1H-пиразол-1-ил)-N-(хинолин-8-илметил)пиразин-2-карбоксамид (Пр-369)
Раствор DAST (0,041 мл, 0,310 ммоль) в CH2Cl2 (3,0 мл) по каплям добавляли к раствору соединения Пр-368, полученного на предыдущей стадии (0,048 г, 0,124 ммоль), в CH2Cl2 (5 мл) при -78°C, с последующим перемешиванием в течение 4 часов, после чего реакционной смеси давали возможность нагреться до комнатной температуры. Растворитель удаляли выпариванием, и остаток очищали препаративной ВЭЖХ с обращенной фазой (C-18), элюируя смесью ацетонитрил/вода+0,1% ТФУК, с получением соединения Пр-369 в виде твердого вещества. ЖХ/МС=410 [M+1].
Пример получения соединения Пр-370
Соединение Пр-370, 3-амино-6-(гидроксиметил)-N-(хинолин-8-илметил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид, получали согласно схеме ES-9:
Схема ES-9

Стадия A: Этил 3-амино-6-(гидроксиметил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксилат
В реакционный сосуд помещали смесь этил 3-амино-6-метил-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксилата (0,248 г, 1,00 ммоль), N-бромсукцинимида (0,214 г, 1,20 ммоль) и бензоилпероксида (0,290 г, 1,20 ммоль) в CCl4 (20 мл). Полученную смесь нагревали при 85°C в течение 3 часов. После охлаждения до температуры окружающей среды, полученную смесь концентрировали и поглощали CH3CN (10 мл), смешивали с ацетатом калия (0,15 г, 1,50 ммоль), и полученную смесь перемешивали при температуре окружающей среды в течение 24 часов. Растворитель удаляли, и остаток поглощали MeOH (10,0 мл) и смешивали с Na2CO3 (0,42 г, 4,0 ммоль) и H2O (0,25 мл), с последующим перемешиванием при КТ в течение 4 часов. Реакционную смесь концентрировали и очищали препаративной ВЭЖХ с обращенной фазой (C-18), элюируя смесью ацетонитрил/вода+0,1% ТФУК, с получением указанного в заголовке соединения в виде твердого вещества. ЖХ/МС=265 [M+1].
Стадия B: 3-амино-6-(гидроксиметил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоновая кислота
Смесь этил 3-амино-6-(гидроксиметил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксилата (0,15 г, 0,568 ммоль) и гидрата гидроксида лития (0,119 г, 2,84 ммоль) в ТГФ (5,0 мл) и воде (2,0 мл) перемешивали при КТ в течение 3 часов. Растворитель удаляли, остаток поглощали ДМФА и очищали препаративной ВЭЖХ с обращенной фазой (C-18), элюируя смесью ацетонитрил/вода+0,1% ТФУК, с получением указанного в заголовке соединения в виде твердого вещества. ЖХ/МС=237 [M+1].
Стадия C: 3-амино-6-(гидроксиметил)-N-(хинолин-8-илметил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамид
Основание Хунига (0,251 мл, 1,440 ммоль) добавляли к раствору 3-амино-6-(гидроксиметил)-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоновой кислоты (0,068 г, 0,288 ммоль), дигидрохлорида хинолин-8-илметанамина (0,073 г, 0,317 ммоль) и HATU (0,120 г, 0,317 ммоль) в ДМФА (2,0 мл) при 0°C на ледяной бане. Полученную смесь перемешивали при 0°C в течение 30 минут и при КТ в течение 30 минут. К полученной смеси добавляли насыщенный водный раствор NaHCO3 (50 мл) и экстрагировали CH2Cl2 (2×50 мл). Объединенную органическую фазу сушили над MgSO4, фильтровали, концентрировали, очищали флэш-хроматографией на силикагелевой колонке со смесью 0-60% EtOAc/гексан в качестве элюента, с получением указанного в заголовке соединения в виде твердого вещества. ЖХ/МС=377 [M+1].
Пример получения соединения Пр-371
Соединение Пр-371, 3-амино-6-циано-5-(1H-пиразол-1-ил)-N-(хинолин-8-илметил)пиразин-2-карбоксамид, получали согласно схеме ES-10:
Схема ES-10

Стадия A: 3-Амино-6-циано-5-(1H-пиразол-1-ил)пиразин-2-карбоновая кислота
Микроволновый сосуд заполняли этил 3-амино-6-хлор-5-(1H-пиразол-1-ил)пиразин-2-карбоксилатом (1,02 г, 4,00 ммоль), ферроцианидом калия (1,473 г, 4,00 ммоль) и йодидом меди (I) (0,762 г, 4,00 ммоль), закупоривали, дегазировали и заполняли азотом. К реакционной смеси добавляли NMP (8,0 мл), и полученную смесь перемешивали при 150°C в течение 8 часов. После охлаждения, полученную смесь разбавляли этилацетатом и обрабатывали 1Н водным раствором HCl. Органический слой отделяли, и водную часть экстрагировали этилацетатом (2×100 мл). Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали, очищали препаративной ВЭЖХ с обращенной фазой (C-18), элюируя смесью ацетонитрил/вода+0,1% ТФУК, с получением указанного в заголовке соединения в виде твердого вещества. ЖХ/МС=231 [M+1].
Стадия B: 3-амино-6-циано-5-(1H-пиразол-1-ил)-N-(хинолин-8-илметил)пиразин-2-карбоксамид
Основание Хунига (0,218 мл, 1,250 ммоль) добавляли в раствор 3-амино-6-циано-5-(1H-пиразол-1-ил)пиразин-2-карбоновой кислоты (0,058 г, 0,25 ммоль) и дигидрохлорида хинолин-8-илметанамина (0,064 г, 0,275 ммоль) и HATU (0,105 г, 0275 ммоль) в ДМФА (2 мл), с последующим перемешиванием при КТ в течение 3 часов. Полученную смесь очищали препаративной ВЭЖХ с обращенной фазой (C-18), элюируя смесью ацетонитрил/вода+0,1% ТФУК, с получением указанного в заголовке соединения в виде твердого вещества. ЖХ/МС=371 [M+1].
Пример получения соединения Пр-372
Соединение Пр-372, 3-амино-6-циано-5-(оксазол-2-ил)-N-((3-(трифторметил)пиридин-2-ил)метил)пиразин-2-карбоксамид, получали согласно схеме ES-11:
Схема ES-11
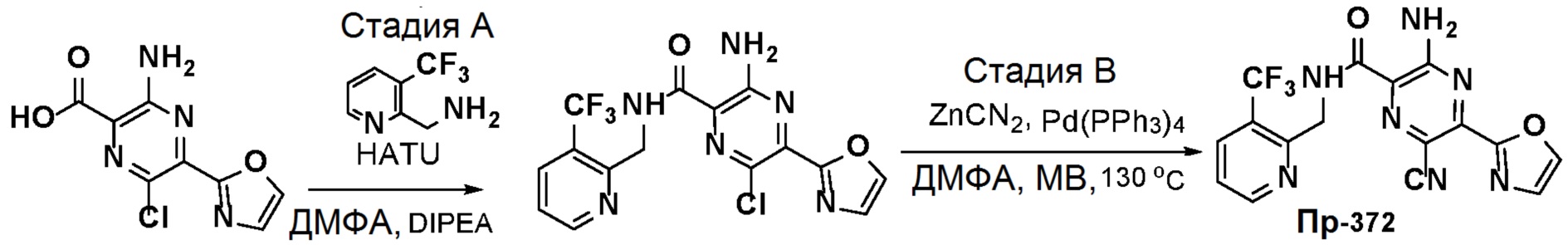
Стадия A: 3-Амино-6-хлор-5-(оксазол-2-ил)-N-((3-(трифторметил)пиридин-2-ил)метил)пиразин-2-карбоксамид
Раствор 3-амино-6-хлор-5-(оксазол-2-ил)пиразин-2-карбоновой кислоты (42 мг, 0,18 ммоль), HATU (74 мг, 0,26 ммоль) и DIPEA (67 мг, 0,53 ммоль) в ДМФА (5 мл) перемешивали при комнатной температуре в течение 0,5 часа. Спустя ½ часа, к полученной смеси добавляли (3-(трифторметил)пиридин-2-ил)метанамин (56 мг, 0,26 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение дополнительных 10 часов. По истечении 10 часов, реакционную смесь разбавляли этилацетатом (50 мл) и промывали водой (50 мл ×2). Органический слой отделяли и сушили над безводным Na2SO4, затем концентрировали, с получением неочищенного продукта, который очищали препаративной ТСХ (элюируя смесью 1:2 гексан/этилацетат), с получением 3-амино-6-хлор-5-(оксазол-2-ил)-N-((3-(трифторметил)пиридин-2-ил)метил)пиразин-2-карбоксамида в виде твердого вещества. ЖХ/МС=399 [M+1].
Стадия B: 3-Амино-6-циано-5-(оксазол-2-ил)-N-((3-(трифторметил)пиридин-2-ил)метил)пиразин-2-карбоксамид
Раствор цианида цинка (24 мг, 0,20 ммоль), амино-6-хлор-5-(оксазол-2-ил)-N-((3-(трифторметил)пиридин-2-ил)метил)пиразин-2-карбоксамида (27 мг, 0,068 ммоль) и Pd(PPh3)4 (24 мг, 0,02 ммоль) в ДМФА (2 мл) в закупоренной трубке нагревали в микроволновом реакторе при 130°C в течение 2 часов в атмосфере азота. После фильтрования, фильтрат очищали препаративной ВЭЖХ, с получением 3-амино-6-циано-5-(оксазол-2-ил)-N-((3-(трифторметил)пиридин-2-ил)метил)пиразин-2-карбоксамида (Пр-373) в виде твердого вещества. ЖХ/МС=390 [M+1].
1H ЯМР (ДМСО-d6, 400 МГц) δ 9,37 (т, 1H), 8,83 (д, 1H), 8,65 (с, 2H), 8,49 (с, 1H), 8,20 (д, 1H), 7,66 (с, 1H), 7,56 (дд, 1H), 4,78 (д, 2H).
Пример получения соединения Пр-373
Соединение Пр-373, 1-(3-амино-6-метил-5-(оксазол-2-ил)пиразин-2-ил)-3-(4,6-диметилпиридин-2-ил)пропан-1-он, получали согласно схеме ES-12:
Схема ES-12


Стадия A: 3-Амино-N-метокси-N,6-диметил-5-(оксазол-2-ил)пиразин-2-карбоксамид
Раствор 3-амино-6-хлор-5-(оксазол-2-ил)пиразин-2-карбоновой кислоты (440 мг, 2 ммоль), HATU (1,13 г, 3 ммоль) и DIPEA (774 мг, 6 ммоль) в ДМФА (5 мл) перемешивали при комнатной температуре в течение 0,5 часа, с последующим добавлением к реакционной смеси гидрохлорида N,O-диметилгидроксиламина (388 мг, 4 ммоль), и затем реакционную смесь перемешивали при комнатной температуре в течение дополнительных 12 часов. Реакционную смесь разбавляли этилацетатом (200 мл) и промывали водой (100 мл). Органический слой сушили над безводным Na2SO4, концентрировали, с получением неочищенного продукта, который очищали хроматографией на силикагеле, элюируя смесью (1:1 гексан/этилацетат), с получением 3-амино-N-метокси-N,6-диметил-5-(оксазол-2-ил)пиразин-2-карбоксамида. ЖХ/МС=264 [M+1].
Стадия B: 1-(3-Амино-6-метил-5-(оксазол-2-ил)пиразин-2-ил)этанон
В раствор 3-амино-N-метокси-N,6-диметил-5-(оксазол-2-ил)пиразин-2-карбоксамида (380 мг, 1,44 ммоль) в сухом ТГФ (5 мл) добавляли CH3MgBr (2,0 мл, 6 ммоль) при 0°C за 1 минуту. После завершения добавления, полученную смесь перемешивали при комнатной температуре в течение 1 часа, затем реакционную смесь гасили добавлением насыщенного раствора хлорида аммония (20 мл), разбавляли этилацетатом (100 мл) и промывали водой (100 мл ×1). Органический слой сушили над безводным Na2SO4 и концентрировали, с получением неочищенного продукта, который очищали хроматографией на силикагеле, элюируя смесью (гексан/этилацетат: 1:1), с получением 1-(3-амино-6-метил-5-(оксазол-2-ил)пиразин-2-ил)этанона. ЖХ/МС=219 [M+1].
Стадия C: 1-(3-Амино-6-метил-5-(оксазол-2-ил)пиразин-2-ил)-3-(4,6-диметилпиридин-2-ил)проп-2-ен-1-он
К раствору 4,6-диметилпиколинальдегида (130 мг, 0,97 ммоль) в MeOH 5 мл добавляли NaOH (78 мг, 1,94 ммоль) в H2O (0,5 мл) при 0°C, с последующим добавлением по каплям 1-(3-амино-6-метил-5-(оксазол-2-ил)пиразин-2-ил)этанона (106 мг, 0,48 ммоль) в MeOH (2 мл) при 0°C. После завершения добавления, полученную смесь перемешивали при комнатной температуре в течение 12 часов. ЖХ-МС показала, что реакция завершена. Реакционную смесь разбавляли этилацетатом (100 мл) и промывали водой (50 мл ×2). Органический слой сушили над безводным Na2SO4, концентрировали, с получением 1-(3-амино-6-метил-5-(оксазол-2-ил)пиразин-2-ил)-3-(4,6-диметилпиридин-2-ил)проп-2-ен-1-она в виде твердого вещества. ЖХ/МС=336 [M+1].
Стадия D: 1-(3-Амино-6-метил-5-(оксазол-2-ил)пиразин-2-ил)-3-(4,6-диметилпиридин-2-ил)пропан-1-он (Пр-373)
К раствору 1-(3-амино-6-метил-5-(оксазол-2-ил)пиразин-2-ил)-3-(4,6-диметилпиридин-2-ил)проп-2-ен-1-она (150 мг, 0,447 ммоль) в этилацетате (60 мл) добавляли Pd/C(10%, 100 мг), и затем полученную реакционную смесь перемешивали при комнатной температуре в атмосфере H2 в течение 1 часа, после чего реакционную смесь фильтровали, и фильтрат концентрировали, с получением неочищенного продукта. Неочищенный остаток очищали препаративной ВЭЖХ, с получением 1-(3-амино-6-метил-5-(оксазол-2-ил)пиразин-2-ил)-3-(4,6-диметилпиридин-2-ил)пропан-1-она в виде твердого вещества. ЖХ/МС=338 [M+1].
1H ЯМР (ДМСО-d6, 400 МГц) δ: 8,38 (с, 1H), 7,65 (с, 2H), 7,58 (с, 1H), 6,90 (д, 1H), 6,85 (д, 1H), 3,54 (т, 2H), 3,00 (т, 2H), 2,75 (с, 3H), 2,24 (с, 3H), 2,19 (с, 3H).
Пример получения соединения Пр-374
Соединение Пр-374, 3-амино-6-метил-N-((5-метилпиримидин-4-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамид, получали согласно схеме ES-13:
Схема ES-13


Стадия A: Оксазол-4-илметанол
Высушенную на пламени трехгорлую колбу (100 мл) заполняли метил оксазол-4-карбоксилатом (2,0 г, 14 ммоль) и этиловым эфиром (15 мл). По каплям добавляли DIBAL-H (30 мл, 30 ммоль) при -78°C в атмосфере азота. После завершения добавления, реакционной смеси давали нагреться до КТ и перемешивали в течение 1 часа. Реакционную смесь гасили добавлением Na2SO4-10H2O (5 г). После перемешивания в течение 10 часов, полученную суспензию фильтровали, фильтрат упаривали при пониженном давлении, остаток очищали препаративной ВЭЖХ, с получением оксазол-4-илметанола в виде масла. ЖХ/МС=100 [M+1].
Стадия B: 4-(Метоксиметил)оксазол
Разогретую на пламени трехгорлую колбу (100 мл) заполняли оксазол-4-илметанолом (1,0 ммоль) и этиловым эфиром (15 мл). Порциями добавляли NaH (50 мг, 1,2 ммоль) при 0°C в атмосфере азота. После перемешивания в течение 30 минут, добавляли метилтозилат (250 мг, 1,2 ммоль). Полученную суспензию перемешивали в течение ночи при комнатной температуре. Реакционную смесь фильтровали, и фильтрат концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ, с получением 4-(метоксиметил)оксазолa. ЖХ/МС=114 [M+1].
Стадия C: 3-Амино-5-(4-(метоксиметил)оксазол-2-ил)-6-метилпиразин-2-карбоновая кислота
Разогретую на пламени трехгорлую колбу (100 мл) заполняли 4-(метоксиметил)оксазолом (1,6 ммоль) и ТГФ (15 мл). Полученную смесь дегазировали и обратно заполняли азотом. Полученную смесь охлаждали до -78°C, и затем по каплям добавляли н-BuLi (1,2 мл, 1,8 ммоль). После перемешивания в течение 15 минут, добавляли сухой ZnCl2 (512 мг, 3,77 ммоль) в сухом ТГФ (5 мл) при -78°C. После перемешивания в течение 30 минут, полученную смесь нагревали до комнатной температуры. При комнатной температуре добавляли этил 3-амино-5-хлор-6-метилпиразин-2-карбоксилат (311 мг, 1,45 ммоль) и Pd(PPh3)4 (334 мг, 0,29 ммоль). Полученную в результате смесь нагревали до 70°C в течение ночи. Реакционную смесь фильтровали. Фильтрат концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ, с получением 3-амино-5-(4-(метоксиметил)оксазол-2-ил)-6-метилпиразин-2-карбоновой кислоты в виде масла. ЖХ/МС=265[M+1].
Стадия D: 3-Амино-5-(4-(метоксиметил)оксазол-2-ил)-6-метил-N-((3-метилпиридин-2-ил)метил)пиразин-2-карбоксамид (Пр-374)
Соединение Пр-374 получали из промежуточного соединения I-ES-12-A и 2-метиламино-3-метилпиперидина, используя методики схем ES-1 по ES-5. Соединение Пр-374 характеризовали ЖХ/МС и протонным ЯМР. ЖХ/МС=369[M+1].
1H ЯМР (MeOD-d4, 400 МГц) δ: 8,45-8,30 (д, 1H), 8,26-8,23 (д, 1H), 8,00 (с, 1H), 7,74-7,70 (м, 1H), 4,77 (с, 2H), 4,39 (с, 2H), 3,22-3,20 (м, 5H), 2,72 (с, 3H), 2,50 (с, 3H).
Пример получения соединения Пр-375A
Соединение (Пр-375), 3-амино-6-метил-5-(5-метилоксазол-2-ил)-N-((3-метилпиридин-2-ил)метил)пиразин-2-карбоксамид, получали согласно схеме ES-14:
Схема ES-14


Стадия A: Этил 2-амино-2-цианоацетат
Смесь метил 2-цианоэтанпероксоата (3,0 г, 26 ммоль) и 1,8-диазабицикло[5,4,0]ундек-7-ена (7,9 мл, 52 ммоль) в ДМФА (13 мл) перемешивали при комнатной температуре в течение 30 минут. Добавляли уксусный ангидрид (5,32 г, 52,1 ммоль), и полученную смесь перемешивали при комнатной температуре в течение дополнительных 18 часов. Органический растворитель выпаривали при пониженном давлении, и остаток выливали в 150 мл воды. Водный слой экстрагировали этилацетатом (150 мл ×3). Органические слои объединяли и сушили над Na2SO4, фильтровали, и из полученного в результате раствора органический растворитель выпаривали при пониженном давлении. Продукт отгоняли из остатка при 120°C при помощи масляного насоса, с получением этил 5-метилоксазол-4-карбоксилата в виде масла. ЖХ/МС=157 [M+1].
Стадия B: 5-метилоксазол-4-карбоксилат натрия
Смесь этил 5-метилоксазол-4-карбоксилата (2,3 г, 14,8 ммоль) и NaOH (0,59 г, 14,8 ммоль) в MeOH (10 мл) и воде (0,5 мл) перемешивали при комнатной температуре в течение 18 часов. Полученную смесь концентрировали при пониженном давлении, и полученный таким образом остаток промывали диэтиловым эфиром (30 мл) и сушили в вакууме, с получением 5-метилоксазол-4-карбоксилата натрия в виде твердого вещества. ЖХ/МС=128 [M+1].
Стадия C: 5-Метилоксазол
Смесь 5-метилоксазол-4-карбоксилата натрия (2,4 г, 16,1 ммоль), Cu2O (0,230 г, 1,6 ммоль) и хинолонсульфата (2,2 г, 9,7 ммоль) в хинолине (2 мл) перемешивали при 200°C в течение 1 часа. Продукт отгоняли при 150°C, с получением 5-метилоксазола в виде жидкости.
1HЯМР (CDCl3, 400 МГц) δ 7,75 (с, 1H), 6,75 (с, 1H).
Стадия D: 3-Амино-6-метил-5-(5-метилоксазол-2-ил)пиразин-2-карбоновая кислота
В предварительно высушенную 100-мл 3-горлую колбу добавляли смесь 5-метилоксазола (200 мг, 2,407 ммоль) в ТГФ (20 мл). Полученную смесь перемешивали при -78°C в течение 15 минут и затем по каплям добавляли н-BuLi (1,16 мл, 2,89 ммоль). Полученную смесь перемешивали при -78°C в течение 1 часов. Добавляли ZnCl2 (656 мг, 4,81 ммоль) в ТГФ (6 мл), и полученную смесь перемешивали при -78°C в течение 10 минут. Полученную смесь нагревали до комнатной температуры и перемешивали в течение 1 часа, с последующим добавлением дважды предварительно генерированного катализатора Xphos (23 мг, 0,29 ммоль) и этил 3-амино-5-хлор-6-метилпиразин-2-карбоксилата (42 мг, 1,9 ммоль). Полученную смесь перемешивали при 85°C в атмосфере N2 в течение 20 часов. Органический растворитель выпаривали при пониженном давлении. Добавляли 1M водную HCl (120 мл), и водный слой экстрагировали дихлорметаном (120 мл ×5). Органические слои объединяли, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали при помощи Biotage Isolera One (ацетонитрил/вода (0,05% ТФУК)), с получением 3-амино-6-метил-5-(5-метилоксазол-2-ил)пиразин-2-карбоновой кислоты в виде твердого вещества. ЖХ/МС=235 [M+1].
Стадия E: 3-Амино-6-метил-5-(5-метилоксазол-2-ил)-N-((3-метилпиридин-2-ил)метил)пиразин-2-карбоксамид (Пр-375)
Соединение Пр-375 получали из промежуточного соединения I-ES14-A и 2-метиламин-3-метилпиперидина, используя методику, аналогично использованной для примера получения соединения Пр-374. Соединение Пр-375 характеризовали ЖХ/МС и протонным ЯМР: ЖХ/МС=339 [M+1]. Продукт характеризовали протонным ЯМР:
1HЯМР (CDCl3, 400 МГц) δ 9,37 (с, 1H), 8,48 (д, 1H), 7,56 (д, 1H), 7,24-7,21 (м, 1H), 7,00 (с, 1H), 4,74 (д, 2H), 2,86 (с, 3H), 2,47 (с, 3H), 2,43 (с, 3H).
Пример получения соединений Пр-376A, Пр-376B, Пр-376C и Пр-376D
Соединения (Пр-376A)-(ПР-376D), различные изомеры 3-амино-N-(5-фтор-6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(оксазол-2-ил)пиразин-2-карбоксамида, получали согласно схеме ES-15:
Схема ES-15

Получение 3-амино-N-(5-фтор-6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(оксазол-2-ил)пиразин-2-карбоксамида
3-Амино-N-(5-гидрокси-6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(оксазол-2-ил)пиразин-2-карбоксамид получали из промежуточного соединения I-ES-14-A, полученного согласно схеме ES-14, и 7-амино-6,7-дигидро-5H-циклопента[b]пиридин-5-ола, следуя методике на стадии E, выше.
Полученный таким образом 3-амино-N-(5-гидрокси-6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(оксазол-2-ил)пиразин-2-карбоксамид (230 мг, 0,65 ммоль) растворяли в безводном ДХМ (15 мл), и полученный раствор охлаждали до -10°C. Добавляли DAST (0,11 мл, 0,85 ммоль). Смесь перемешивали при -10°C в течение 20 минут. Добавляли насыщенный раствор NH4Cl для гашения реакции. Продукт экстрагировали этилацетатом (3×50 мл). Органические слои объединяли и сушили над безводным сульфатом натрия. Полученный раствор фильтровали и концентрировали, и неочищенный остаток очищали колоночной хроматографией на предварительно упакованной 50 г силикагеля колонке, элюируя градиентной смесью 10-70% EtOAc/гексан, с получением двух пар диастереоизомеров.
Быстро элюируемую пару диастереоизомеров далее разделяли хиральной SFC (AS-H колонка, 15% метанол (0,1% DEA)/CO2), с получением изомера Пр-376A (быстро элюируемый): ЖХМС: 355 [M+1], и изомера Пр-376B (медленно элюируемый): ЖХМС: 355 [M+1].
Медленно элюируемую пару диастереоизомеров далее разделяли хиральной SFC (OJ-H колонка, 20% метанол/CO2), с получением изомера Пр-376C (быстро элюируемый): ЖХМС: 355 [M+1], и изомера Пр-376D (медленно элюируемый): ЖХМС: 355 [M+1].
Пример получения соединений Пр-377 и Пр-378
Соединения Пр-377, 3-амино-N-(6-фтор-6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(оксазол-2-ил)пиразин-2-карбоксамид, и Пр-378, 3-амино-N-(7H-циклопента[b]пиридин-7-ил)-6-метил-5-(оксазол-2-ил)пиразин-2-карбоксамид, получали согласно схеме ES-16:
Схема ES-16

Соответственно, 3-амино-N-(5-гидрокси-6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(оксазол-2-ил)пиразин-2-карбоксамид, получали согласно методике, описанной на схеме ES-15. DAST (0,030 мл, 0,227 ммоль) по каплям добавляли в раствор 3-амино-N-(6-гидрокси-6,7-дигидро-5H-циклопента[b]пиридин-7-ил)-6-метил-5-(оксазол-2-ил)пиразин-2-карбоксамида (0,040 г, 0,114 ммоль) в CH2Cl2 (4,0 мл) при -78°C, с последующим перемешиванием в течение 1 часа, затем нагревали до температуры окружающей среды, продолжая перемешивание в течение 2 дополнительных часов при температуре окружающей среды. Реакционную смесь обрабатывали насыщенным водным раствором NaHCO3 (2 мл). Органический слой отделяли, и водный слой экстрагировали CH2Cl2. Объединенную органическую фазу сушили над MgSO4, фильтровали, концентрировали и очищали на силикагелевой колонке с ISCO и 0-15% MeOH/CH2Cl2, с получением фторированного продукта, соединение Пр-377, в виде твердого вещества (ЖХ/МС=355 [M+1]), и элиминированного продукта, соединение Пр-378, в виде твердого вещества (ЖХ/МС=335 [M+1]).
При использовании методик по схемам ES-1 до ES-16 и соответствующего карбоксилата и предшественника аминных соединений, получали соединения таблицы IV. Где определено в данной таблице, присутствующие энантиомерные формы разделяли посредством хиральной ВЭЖХ. Абсолютную стереохимию определяли не во всех случаях. Где указано в таблице IV, абсолютную стереохимию определяли при использовании сверхкритической CO2-хроматографии (SCF хроматография). Разделенные изомеры отмечены в таблице I как ʺпервыйʺ, ʺвторойʺ и т.д. в порядке их элюирования из колонки. В колонке применяли следующие условия (обозначенные в таблице IV как ʺуслов. 9ʺ или ʺуслов. 10ʺ) указанного примера:
условия 9: SCF/CO2 с 15% метанолом (1% DEA), протекающим через AS-H колонку;
условия 10: SCF/CO2 с 20% метанолом, протекающим через OJ-H колонку.
|
В следующем разделе представленных примеров показано получение подходящих промежуточных соединений, которые полезны при получении соединений настоящего изобретения. Следует отметить, что следующее описание не является исчерпывающим списком или единственным, предназначенным для предоставления подходящих промежуточных соединений. Следует иметь в виду, что помимо способов, предоставленных в настоящем описании, подходящие промежуточные соединения также могут быть получены путем адаптации известных способов или могут быть коммерчески доступными.
3-Амино-6-метил-5-(оксазол-2-ил)пиразин-2-карбоновая кислота (промежуточное соединение A-1)
Схема 1

Стадия A: Этил 3-амино-6-метил-5-(оксазол-2-ил)пиразин-2-карбоксилат
Микроволновый сосуд заполняли этил 3-амино-5-хлор-6-метилпиразин-2-карбоксилатом (0,33 г, 1,5 ммоль), тетракисом (0,18 г, 0,15 ммоль), 2-(трибутилстаннил)оксазолом (0,49 мл, 2,2 ммоль), закупоривали, откачивали и заполняли азотом три раза. Во время перемешивания добавляли диоксан (8 мл) и дополнительно орошали три раза. Полученную смесь нагревали до 120°C в течение 18 часов. Концентрировали и очищали колоночной хроматографией на силикагеле (предварительно упакованные 40 г), элюируя градиентной смесью ДХМ/EtOAc, с получением этил 3-амино-6-метил-5-(оксазол-2-ил)пиразин-2-карбоксилата в виде твердого вещества. МС: 249 (M+1). Продукт характеризовали протонным ЯМР:
1H-ЯМР (ДМСО-d6, 400 МГц) δ 8,39 (с, 1H), 7,57 (с, 1H), 7,35 (с, 2H), 4,36 (т, 3H), 2,72 (с, 3H), 1,32 (т, 3H).
Стадия B: 3-Амино-6-метил-5-(оксазол-2-ил)пиразин-2-карбоновая кислота
Этил 3-амино-6-метил-5-(оксазол-2-ил)пиразин-2-карбоксилат (200 мг, 0,81 ммоль) суспендировали в смешанном растворителе из воды (2,7 мл), тетрагидрофурана (2,7 мл) и метанола (2,7 мл). Добавляли гидроксид лития (82 мг, 3,40 ммоль). Полученную смесь затем перемешивали в течение 30 минут, по истечении которых исходные вещества больше не присутствовали. Полученную смесь подкисляли добавлением 1M раствора HCl. Выпавшее в осадок вещество отделяли фильтрованием и сушили в вакуумной печи в течение ночи, с получением 3-амино-6-метил-5-(оксазол-2-ил)пиразин-2-карбоновой кислоты. ЖХ/МС=221 (M+1).
3-Амино-6-хлор-5-(оксазол-2-ил)пиразин-2-карбоновая кислота (промежуточное соединение A-2)
Используя методику, аналогичную для промежуточного соединения A-1, 3-амино-6-хлор-5-(оксазол-2-ил)пиразин-2-карбоновую кислоту (промежуточное соединение A-2) получали из метил 3-амино-5,6-дихлорпиразин-2-карбоксилата.
3-Амино-6-метил-5-(оксазол-5-ил)пиразин-2-карбоновая кислота (промежуточное соединение B-1)
Схема 2

Стадия A: Этил 3-амино-6-метил-5-(оксазол-5-ил)пиразин-2-карбоксилат
Этил 3-амино-5-хлор-6-метилпиразин-2-карбоксилат (0,40 г, 1,86 ммоль), 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)оксазол (0,40 г, 2,04 ммоль), бис(трифенилфосфин)палладий(II) дихлорид (0,14 г, 0,20 ммоль) и карбонат калия (0,77 г, 5,56 ммоль) помещали в колбу (100 мл) и заменяли воздух азотом путем переменного вакуумирования 3 раза. Затем в колбу добавляли ацетонитрил (20 мл) и воду (5 мл). Полученную смесь перемешивали при КТ в течение 4 часов, концентрировали, поглощали EtOAc, промывали водой (20 мл). Органическую фазу отделяли, и водную часть экстрагировали этилацетатом (2×50 мл). Объединенную органическую фазу промывали насыщенным раствором соли (50 мл), сушили над MgSO₄, фильтровали, концентрировали и очищали колоночной хроматографией на силикагелевой колонке с ISCO и смесью 0-65% этилацетат/гексан в качестве элюента, с получением указанного в заголовке соединения. ЖХ/МС=249 (M+1).
Стадия B: 3-амино-6-метил-5-(оксазол-5-ил)пиразин-2-карбоновая кислота
Смесь этил-3-амино-6-метил-5-(оксазол-5-ил)пиразин-2-карбоксилата (0,32 г, 1,29 ммоль) и гидроксида лития (0,15 г, 6,45 ммоль) в ТГФ (4 мл) и воде (1 мл) перемешивали при RT в течение 2 часов. Растворители удаляли на роторном испарителе. Остаток разбавляли водой (15 мл) и подкисляли 1,0M водным раствором HCl (6,5 мл) для осаждения продукта. Твердое вещество отделяли фильтрованием, промывали водой (5 мл), сушили в печи, с получением указанного в заголовке соединения. ЖХ/МС=221 (M+1).
3-Амино-6-метил-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоновая кислота (C-1) и 3-амино-6-метил-5-(1H-1,2,3-триазол-1-ил)пиразин-2-карбоновая кислота (D-1)
Схема 3


Стадия A: Этил 3-амино-6-метил-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксилат и этил 3-амино-6-метил-5-(1H-1,2,3-триазол-1-ил)пиразин-2-карбоксилат
Этил 3-амино-5-хлор-6-метилпиразин-2-карбоксилат (2,2 г, 10 ммоль) и 1,2,3-триазол (1,0 г, 15 ммоль) растворяли в сухом ДМФА (20 мл), и полученный раствор охлаждали на водяной бане со льдом. К полученному раствору добавляли порошок KOH, водяную баню со льдом удаляли. Полученную в результате смесь перемешивали при RT в течение ночи, затем выливали в 100 мл воды. Полученную смесь перемешивали при комнатной температуре в течение 30 минут. Выпавшее в осадок вещество отделяли фильтрованием и промывали водой. Водный слой экстрагировали EtOH/CH2Cl2 (3:1, 3×50 мл), затем сушили над MgSO4, фильтровали и концентрировали. Объединенный продукт сушили в вакуумной печи, с получением продуктов (смесь изомеров). ЖХМС: 249 (M+1).
Стадия B: 3-Амино-6-метил-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоновая кислота и 3-амино-6-метил-5-(1H-1,2,3-триазол-1-ил)пиразин-2-карбоновая кислота
Сложноэфирную смесь метил 3-амино-6-метил-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксилата и метил-3-амино-6-метил-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксилата (1,8 г, 3,6 ммоль) в смешанном растворителе из ТГФ (20 мл) и воды (5 мл) перемешивали с LiOH (170 мг, 7,3 ммоль) при комнатной температуре в течение 2 часов. Добавляли воду (25 мл). Для подкисления полученного раствора использовали раствор HCl (1Н, 7,3 мл). Выпавшее в осадок вещество отделяли фильтрованием и промывали водой, затем сушили в печи в течение ночи, с получением продуктов (смесь изомеров). ЖХМС: 221 (M+1).
3-Амино-6-хлор-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоновая кислота (C-2) и 3-амино-6-хлор-5-(1H-1,2,3-триазол-1-ил)пиразин-2-карбоновая кислота (D-2)
Используя методику, аналогичную для промежуточных соединений C-1 и D-1, 3-амино-6-хлор-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоновую кислоту (C-2) и 3-амино-6-хлор-5-(1H-1,2,3-триазол-1-ил)пиразин-2-карбоновую кислоту (D-2) получали из метил-3-амино-5,6-дихлорпиразин-2-карбоксилата.
Используя аналогичную методику, получали промежуточные соединения E-G с пиразолом, метилпиразолом или 1,2,4-триазолом.

Синтез промежуточных аминных соединений
Промежуточные аминные соединения (AI), которые не являются коммерчески доступными, синтезировали при использовании следующих методик.
AI-1. (4-Циклопропил-1-метил-1H-пиразол-3-ил)метанамин
Схема 4

Стадия A: (4-Циклопропил-1-метил-1H-пиразол-3-ил)метанол
(4-Бром-1-метил-1H-пиразол-3-ил)метанол (900 мг, 4,71 ммоль), циклопропилтрифторборат калия (1400 мг, 9,4 ммоль), K2CO3 (3900 мг, 28 ммоль) и предварительно дважды генерированный XPhos катализатор (370 мг, 0,47 ммоль) смешивали в сосуде для микроволновой реакции. Сосуд закупоривали, и вакуумом удаляли воздух, затем снова заполняли азотом (×3). Толуол (16 мл) и воду (4 мл) вводили шприцем. Удаляли воздух и снова заполняли азотом (×3). Смесь нагревали до 70°C в течение 15 часов. Полученную смесь разбавляли EtOAc и промывали водой и насыщенным раствором соли. После сушки над безводным сульфатом натрия, органический слой концентрировали, и неочищенный продукт очищали колоночной хроматографией на предварительно упакованной 50 г силикагеля колонке, элюируя градиентной смесью 0~100% EtOAc/гексан, с получением продукта в виде масла. МС: 153 [M+1]
Стадия B: 3-(Азидометил)-4-циклопропил-1-метил-1H-пиразол
Дифенилфосфорилазид (180 мг, 0,66 ммоль) и DBU (0,1 мл, 0,66 ммоль) добавляли к раствору (4-циклопропил-1-метил-1H-пиразол-3-ил)метанола (100 мг, 0,66 ммоль) в ДХМ (1 мл). Смесь перемешивали при 50°C в течение 5 часов, затем при комнатной температуре в течение ночи. Смесь разбавляли ДХМ, промывали насыщенным бикарбонатом натрия, затем 5% раствором HCl. Органический слой сушили над безводным сульфатом натрия. После фильтрования и концентрирования, неочищенный продукт очищали колоночной хроматографией на предварительно упакованной 20 г силикагеля колонке, элюируя градиентной смесью 0~40% EtOAc/гексан, с получением продукта в виде масла, после концентрирования.
Стадия C: (4-Циклопропил-1-метил-1H-пиразол-3-ил)метанамин
3-(Азидометил)-4-циклопропил-1-метил-1H-пиразол (95 мг, 0,54 ммоль) в ТГФ (1,5 мл) смешивали с Ph3P (170 мг, 0,64 ммоль). Спустя 30 минут, добавляли воду (0,3 мл, 16 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. Смесь концентрировали досуха. Неочищенную смесь использовали на следующей стадии без дополнительной обработки.
AI-2. гидрохлорид (3-циклопропил-5-фторпиридин-2-ил)метанамина
Схема 5

Стадия A: трет-Бутил((3-хлор-5-фторпиридин-2-ил)метил)карбамат
(3-Хлор-5-фторпиридин-2-ил)метанамин (1000 мг, 6,2 ммоль), (Boc)2C (1,7 мл, 7,5 ммоль) и основание Хунига (1,3 мл, 7,5 ммоль) смешивали в CH2Cl2 (15 мл) и перемешивали при комнатной температуре в течение 15 часов. Смесь разбавляли CH2Cl2 и промывали водой. Органический слой отделяли, сушили над безводным сульфатом натрия и концентрировали. Остаток очищали колоночной хроматографией на предварительно упакованной 50 г силикагеля колонке, элюируя градиентной смесью 0~50% EtOAc/гексан, с получением продукта в виде масла.
Стадия B: трет-Бутил((3-циклопропил-5-фторпиридин-2-ил)метил)карбамат
трет-Бутил((3-хлор-5-фторпиридин-2-ил)метил)карбамат (200 мг, 0,77 ммоль), циклопропилтрифторборат калия (180 мг, 1,2 ммоль), K2CO3 (530 мг, 3,8 ммоль) и предварительно дважды генерированный XPhos катализатор (60 мг, 0,077 ммоль) смешивали в сосуде для микроволновой реакции. Сосуд закупоривали, и вакуумом удаляли воздух, затем снова заполняли азотом (×3). Толуол (3,0 мл) и воду (0,7 мл) вводили шприцем. Удаляли воздух и снова заполняли азотом (×3). Смесь нагревали до 70°C в течение 15 часов. Смесь разбавляли этилацетатом и промывали водой и насыщенным раствором соли. После сушки над безводным сульфатом натрия, полученный раствор концентрировали, неочищенный продукт очищали колоночной хроматографией на предварительно упакованной 50 г силикагеля колонке, элюируя градиентной смесью 0~50% EtOAc/гексан, с получением продукта в виде масла. ЖХМС: 267 [M+1]
Стадия C: гидрохлорид (3-циклопропил-5-фторпиридин-2-ил)метанамина
трет-Бутил((3-циклопропил-5-фторпиридин-2-ил)метил)карбамат (170 мг, 0,64 ммоль) в 4M растворе HCl в диоксане (5 мл, 20,00 ммоль) перемешивали при 25°C в течение 5 часов. Смесь затем концентрировали досуха, с получением продукта в виде HCl соли. Продукт использовали на следующей стадии без дополнительной обработки.
AI-3. 6,7-Дигидро-5H-циклопента[b]пиридин-7-амин, 2HCl
Схема 6

Стадия A: 7-Азидо-6,7-дигидро-5H-циклопента[b]пиридин
Дифенилфосфорилазид (2400 мг, 8,9 ммоль) и DBU (1,3 мл, 8,9 ммоль) добавляли к раствору 6,7-дигидро-5H-циклопента[b]пиридин-7-ола (1000 мг, 7,4 ммоль) в толуоле (12 мл). Смесь перемешивали при комнатной температуре в течение 3 дней. Смесь разбавляли EtOAc и промывали водой и насыщенным раствором соли. Органический слой сушили над безводным сульфатом натрия и концентрировали. Неочищенный продукт очищали колоночной хроматографией на предварительно упакованной 50 г силикагеля колонке, элюируя смесью 0~30% EtOAc/гексан, с получением продукта в виде бесцветного масла.
Стадия B: 6,7-Дигидро-5H-циклопента[b]пиридин-7-амин, 2HCl
7-Aазидо-6,7-дигидро-5H-циклопента[b]пиридин (500 мг, 3,12 ммоль) в MeOH (30 мл) смешивали с HCl (4M в диоксане, 3 мл, 12 ммоль) и 10% Pd-C (170 мг). Смесь дегазировали, затем перемешивали в атмосфере баллонного водорода при комнатной температуре в течение ночи. Смесь фильтровали, и полученный раствор концентрировали досуха, с получением HCl соли продукта в виде твердого вещества.
AI-4. 6,7-Дигидро-5H-циклопента[b]пиридин-7-амин, 2HCl
Схема 7
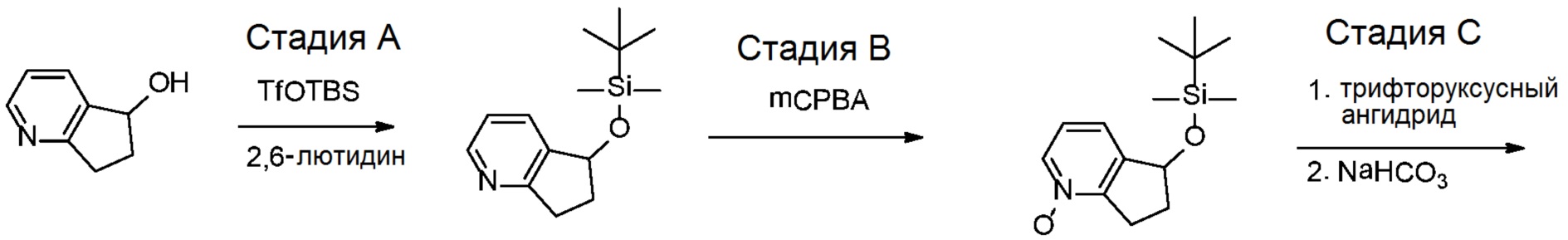

Стадия A: 5-((трет-Бутилдиметилсилил)окси)-6,7-дигидро-5H-циклопента[b]пиридин
6,7-Дигидро-5H-циклопента[b]пиридин-5-ол (2800 мг, 21 ммоль) в ТГФ (70 мл) охлаждали на водяной бане со льдом. Затем по каплям добавляли 2,6-лютидин (3,2 мл, 27,0 ммоль), затем трифторметансульфонат трет-бутилдиметилсилила (5,3 мл, 23 ммоль). Смесь перемешивали в течение ночи, при этом температура медленно поднималась до комнатной температуры. ТГФ удаляли на роторном испарителе. Остаток разбавляли этилацетатом и дважды промывали водой для удаления лютидина, затем промывали насыщенным раствором соли. После сушки над безводным сульфатом натрия и концентрирования, неочищенный продукт очищали флэш-хроматографией на предварительно упакованной 100 г силикагеля колонке, элюируя градиентной смесью 0~30% EtOAc/гексан, с получением продукта в виде бесцветного масла.
Стадия B: 5-((трет-бутилдиметилсилил)окси)-6,7-дигидро-5H-циклопента[b]пиридин 1-оксид
5-((трет-Бутилдиметилсилил)окси)-6,7-дигидро-5H-циклопента[b]пиридин (4400 мг, 18 ммоль) в ДХМ (50 мл) смешивали с mCPBA (75%, 4100 мг, 18 ммоль), затем перемешивали в течение ночи при комнатной температуре. Смесь разбавляли ДХМ, промывали насыщенным бикарбонатом натрия. После сушки над безводным сульфатом натрия и концентрирования, неочищенный продукт очищали колоночной хроматографией на предварительно упакованной 100 г силикагеля колонке, элюируя сначала смесью 10~65% EtOAc/изогексан, затем 0~8% MeOH/ДХМ, с получением продукта в виде твердого вещества после концентрирования и сушки в вакуумной печи в течение ночи. ЖХМС: 266 [M+1]
Стадия C: 5-((трет-Бутилдиметилсилил)окси)-6,7-дигидро-5H-циклопента[b]пиридин-7-ол
5-((трет-Бутилдиметилсилил)окси)-6,7-дигидро-5H-циклопента[b]пиридин 1-оксид (4,5 г, 17 ммоль) в ДХМ (80 мл) охлаждали на водяной бане со льдом. По каплям добавляли ангидрид ТФУК (7,2 мл, 51 ммоль) в ДХМ (15 мл), затем перемешивали в течение ночи, при этом температура медленно поднималась до комнатной температуры. Добавляли толуол, смесь затем концентрировали для удаления ангидрида ТФУК и ТФУК. Остаток разбавляли 5 мл MeOH и 5 мл воды. Добавляли насыщенный раствор бикарбоната натрия для доведения pH до 8. Продукт экстрагировали ДХМ (3×100 мл). Объединенный ДХМ раствор сушили над безводным сульфатом натрия. После фильтрования и концентрирования, неочищенный продукт очищали колоночной хроматографией на предварительно упакованной 50 г силикагеля колонке, элюируя смесью 0~5% MeOH/ДХМ, с получением продукта в виде твердого вещества после концентрирования и сушки в вакуумной печи в течение ночи. ЖХ/МС: 266 [M+1]
Стадия D: 7-Азидо-5-((трет-бутилдиметилсилил)окси)-6,7-дигидро-5H-циклопента[b]пиридин
5-((трет-Бутилдиметилсилил)окси)-6,7-дигидро-5H-циклопента[b]пиридин-7-ол (4,7 г, 18 ммоль) в толуоле (30 мл) охлаждали на водяной бане со льдом. Добавляли DBU (3,2 мл, 21 ммоль), затем дифенилфосфорилазид (5,8 г, 21 ммоль). Смесь перемешивали на водяной бане со льдом в течение 2 часов, затем нагревали при 50°C в течение 2 дней. Реакционную смесь разбавляли этилацетатом, промывали водой. После сушки над безводным сульфатом натрия, полученный раствор концентрировали, и неочищенный продукт очищали колоночной хроматографией на предварительно упакованной 100 г силикагеля колонке, элюируя градиентной смесью 0~20% EtOAc/гексан, с получением рацемической смеси продукта. ЖХМС: 291 [M+1]
Стадия E: гидрохлорид 7-амино-6,7-дигидро-5H-циклопента[b]пиридин-5-ола
7-Aазидо-5-((трет-бутилдиметилсилил)окси)-6,7-дигидро-5H-циклопента[b]пиридин (2,5 г, 8,6 ммоль) в MeOH (50 мл) смешивали с Pd-C, 10% (0,46 г, 0,43 ммоль). Смесь перемешивали при комнатной температуре в атмосфере баллонного водорода в течение 1 часа. Смесь фильтровали. Полученный раствор обрабатывали 4M HCl в диоксане (5,5 мл, 22 ммоль) в течение ночи. Смесь концентрировали и сушили в вакуумной печи при 50°C в течение 2 дней, с получением продукта в виде HCl соли. ЖХМС: 151 [M+1]
AI-5. гидрохлорид 7-Амино-6,7-дигидро-5H-циклопента[b]пиридин-6-ола
Схема 8

Стадия A: 6-бром-5H-циклопента[b]пиридин-7(6H)-он
Br2 (0,35 мл, 6,76 ммоль) по каплям добавляли к раствору 5H-циклопента[b]пиридин-7(6H)-она (1,00 г, 7,51 ммоль) в HBr (3,0 мл, 55,20 ммоль) и AcOH (7 мл) при 10°C, с последующим перемешиванием при КТ в течение 1 часа. Выпавший осадок отфильтровывали и промывали уксусной кислотой. Твердое вещество поглощали смесью EtOAc/CH2Cl2 (1:2), и полученный в результате раствор нейтрализовали насыщенным водным раствором NaHCO3. Органическую фазу отделяли, и водную часть экстрагировали смесью CH2Cl2/EtOAc (2:1). Объединенную органическую фазу промывали насыщенным раствором соли, отделяли, сушили над MgSO4, фильтровали, концентрировали и сушили в вакууме, с получением указанного в заголовке соединения в виде твердого вещества. ЖХ/МС=213 [M+1].
Стадия B: 7-оксо-6,7-дигидро-5H-циклопента[b]пиридин-6-илацетат
Смесь ацетата калия (0,42 г, 4,24 ммоль) и 6-бром-5H-циклопента[b]пиридин-7(6H)-она (0,45 г, 2,12 ммоль) в CH3CN (15 мл) перемешивали при КТ в течение 24 часов. Растворитель удаляли, и остаток поглощали CH2Cl2 и промывали водой. Органическую фазу отделяли, и водную часть экстрагировали CH2Cl2. Объединенную органическую фазу сушили над MgSO4, фильтровали, концентрировали и очищали на силикагелевой колонке со смесью 0-30% EtOAc/CH2Cl2, с получением указанного в заголовке соединения в виде масла. ЖХ/МС=192 [M+1].
Стадия C: O-метилоксим (E)/(Z)-6-гидрокси-5H-циклопента[b]пиридин-7(6H)-она
Смесь 7-оксо-6,7-дигидро-5H-циклопента[b]пиридин-6-илацетата (0,25 г, 1,31 ммоль), гидрохлорида O-метилоксима (0,22 г, 2,62 ммоль) и основания Хунига (0,46 мл, 2,62 ммоль) в EtOH (10 мл) перемешивали при КТ в течение 5 часов. Полученную смесь концентрировали, с получением неочищенного промежуточного соединения (Z)-7-(метоксиимино)-6,7-дигидро-5H-циклопента[b]пиридин-6-илацетата. Остаток поглощали MeOH (10,0 мл). Затем добавляли Na2CO3 (0,55 г, 5,23 ммоль) и H2O (0,25 мл), с последующим перемешиванием при КТ в течение 4 часов. Удаляли растворитель, и остаток поглощали CH2Cl2, промывали насыщенным раствором соли. Органическую фазу сушили над MgSO4, фильтровали, концентрировали и очищали на силикагелевой колонке со смесью 0-70% EtOAc/CH2Cl2, с получением указанного в заголовке соединения в виде твердого вещества. ЖХ/МС=179 [M+1].
Стадия D: гидрохлорид 7-амино-6,7-дигидро-5H-циклопента[b]пиридин-6-ола
BH3.ТГФ (2,19 мл, 2,19 ммоль) в ТГФ по каплям добавляли в раствор O-метилоксима (E)/(Z)-6-гидрокси-5H-циклопента[b]пиридин-7(6H)-она (0,13 г, 0,73 ммоль) в ТГФ (5 мл) при КТ, с последующим кипячением с обратным холодильником в течение 3 часов. После охлаждения, осторожно добавляли воду (0,5 мл), с последующим добавлением 20% водного KOH (2 мл) и нагреванием при 70°C в течение 4 часов. Затем реакционную смесь охлаждали до 0°C, туда добавляли BOC-ангидрид (0,34 мл, 1,46 ммоль), с последующим перемешиванием при КТ в течение 3 часов, разбавляли ДХМ, промывали насыщенным раствором соли. Органическую фазу отделяли, и водную часть экстрагировали ДХМ. Объединенную органическую фазу сушили над MgSO4, фильтровали, концентрировали и очищали на силикагелевой колонке со смесью 0-80% EtOAc/ДХМ, с получением трет-бутил(6-гидрокси-6,7-дигидро-5H-циклопента[b]пиридин-7-ил)карбамата. Полученное промежуточное соединение затем растворяли в ДХМ и обрабатывали 1 мл 4Н HCl в диоксане, с последующим перемешиванием при КТ в течение 3 часов. Удаляли растворитель и сушили в вакууме, с получением указанного в заголовке соединения в виде твердого вещества. ЖХ/МС=151 [M+1].
AI-9. Изохинолин-8-илметанамин
Схема 12

Стадия A: Изохинолин-8-карбонитрил
Смесь 8-бромизохинолина (440 мг, 2,14 ммоль), Zn(CN)2 (500 мг, 4,27 ммоль) и Pd(dppa)Cl2 (784 мг, 1,07 ммоль) и ДМФА (5 мл) в закупоренном сосуде для микроволновой реакции нагревали при 140°C в течение 5 часов. Реакционную смесь фильтровали через целит, промывали водой (20 мл) и экстрагировали EtOAc (3×20 мл). Объединенные органические слои промывали насыщенным раствором соли (10 мл), сушили над Na2SO4 и концентрировали, с получением остатка, который очищали колоночной хроматографией на силикагеле со смесью EtOAc/гексан (2/1), с получением изохинолин-8-карбонитрила в виде твердого вещества. ЖХ/МС=155 [M+1].
Стадия B: Изохинолин-8-илметанамин
Раствор изохинолин-8-карбонитрила (210 мг, 1,36 ммоль) в безводном ТГФ (10 мл) по каплям добавляли к суспензии LiAlH4 (103 мг, 2,72 ммоль) в безводном ТГФ (5 мл) при 0°C в атмосфере азота. По завершению добавления, охлаждающую баню удаляли, и полученную смесь перемешивали при температуре окружающей среды в течение 2 часов. Реакцию гасили добавлением Na2SO4.10H2O (0,5 г) и затем фильтровали. Фильтрат концентрировали, с получением изохинолин-8-илметанамина в виде масла, которое использовали на следующей стадии без дополнительной очистки. ЖХ/МС=159 [M+1].
AI-10. (4-(Трифторметил)пиридин-2-ил)метанамин

Стадия A: 4-(Трифторметил)пиридин 1-оксид
К раствору 4-(трифторметил)пиридина (1,0 г, 6,8 ммоль) в дихлорметане (50 мл) добавляли 3-хлорпероксобензойную кислоту (3,5 г, 20,4 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. Полученную смесь подщелачивали 2Н NaOH до pH 8. Полученную смесь промывали насыщенным водным раствором Na2CO3 (40 мл) с последующей экстракцией ДХМ (3×40 мл). Объединенные органические слои сушили над Na2SO4 и затем концентрировали, с получением 4-(трифторметил)пиридин 1-оксида в виде твердого вещества. ЖХ/МС=164 [M+1].
Стадия B: 4-(Трифторметил)пиколинонитрил
Раствор 4-(трифторметил)пиридин 1-оксида (970 мг, 5,91 ммоль), TMSCN (1,5 г, 14,78 ммоль) и TEA (3,3 мл, 23,64 ммоль) в ацетонеитриле (15 мл) перемешивали при 90°C в течение ночи. После охлаждения до комнатной температуры, реакционную смесь концентрировали, с получением неочищенного продукта, который очищали препаративной ВЭЖХ, элюируя градиентной смесью 5/95 до 95/5 ацетонитрил/вода (содержащей 0,05% NH4HCO3), с получением 4-(трифторметил)пиколинонитрила в виде твердого вещества. ЖХ/МС=173 [M+1].
Стадия C: (4-(Трифторметил)пиридин-2-ил)метанамин
Смесь 4-(трифторметил)пиколинонитрила (840 мг, 4,88 ммоль) и 10%Pd/C (168 мг, 0,16 ммоль) перемешивали в атмосфере водорода (баллон) в MeOH (10 мл) при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали через целит и концентрировали, с получением (4-(трифторметил)пиридин-2-ил)метанамина в виде масла. ЖХ/МС=177 [M+1].
AI-11. 3-Циклопропилпиразин-2-ил)метанамин

Стадия A: 3-циклопропилпиразин-2-карбонитрил
Смесь 3-хлорпиразин-2-карбонитрила (556 мг, 4 ммоль), циклопропилбороновой кислоты (688 мг, 8 ммоль), Pd2(dba)3 (732 мг, 0,8 ммоль), X-Phos (763 мг, 1,6 ммоль) и K3PO4.H2O (3,2 г, 12 ммоль) в толуоле (10 мл) нагревали в закупоренной трубке при 60°C в течение ночи. После охлаждения до комнатной температуры, реакционную смесь фильтровали и концентрировали, с получением неочищенного продукта, который очищали колоночной хроматографией на силикагеле со смесью EtOAc/гексан (1/1), с получением 3-циклопропилпиразин-2-карбонитрила в виде твердого вещества. ЖХ/МС=146 [M+1].
Стадия B: 3-Циклопропилпиразин-2-ил)метанамин
Смесь 3-циклопропилпиразин-2-карбонитрила (280 мг, 1,93 ммоль) и 10%Pd/C (84 мг, 0,08 ммоль) перемешивали в атмосфере водорода в смеси HCl/MeOH (0,1 мл/5 мл) при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали через слой целита и концентрировали, с получением HCl соли (3-циклопропилпиразин-2-ил)метанамина в виде масла. ЖХ/МС=150 [M+1].
AI-12. (5-Метилпиримидин-2-ил)метанамин

Стадия A: 5-Метилпиримидин-2-карбонитрил
Смесь 5-бромпиримидин-2-карбонитрила (800 мг, 4,37 ммоль), 2,4,6-триметил-1,3,5,2,4,6-триоксатриборинана (1,1 г, 8,74 ммоль), Pd(dppf)Cl2 (639 мг, 0,87 ммоль) и CsF (763 мг, 8,74 ммоль) и K3PO4.H2O (3,2 г, 12 ммоль) в толуоле (10 мл) нагревали в закупоренной трубке при 60°C в течение ночи. После охлаждения до комнатной температуры, реакционную смесь фильтровали и концентрировали, с получением неочищенного продукта, который очищали колоночной хроматографией на силикагеле со смесью этилацетат/гексан (1/1), с получением 3-циклопропилпиразин-2-карбонитрила в виде твердого вещества. ЖХ/МС=146 [M+1].
Стадия B: (5-Метилпиримидин-2-ил)метанамин
Смесь 5-метилпиримидин-2-карбонитрила (280 мг, 2,35 ммоль) и 10%Pd/C (84 мг, 0,08 ммоль) перемешивали в атмосфере водорода (баллон) в смеси HCl/MeOH (0,1 мл/5 мл) при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали через целит и концентрировали, с получением HCl соли (5-метилпиримидин-2-ил)метанамина в виде масла. ЖХ/МС=124 [M+1].
AI-13. (5-Циклопропилпиримидин-2-ил)метанамин

Стадия A: 5-Циклопропилпиримидин-2-карбонитрил
Смесь 5-бромпиримидин-2-карбонитрила (640 мг, 3,5 ммоль), циклопропилбороновой кислоты (601 мг, 7 ммоль), Pd2(dba)3 (640 мг, 0,7 ммоль), X-Phos (668 мг, 1,4 ммоль) и K3PO4.H2O (2,79 г, 10,5 ммоль) в толуоле (10 мл) нагревали в закупоренной трубке при 60°C в течение ночи. После охлаждения до комнатной температуры, реакционную смесь фильтровали и концентрировали, с получением неочищенного продукта, который очищали колоночной хроматографией на силикагеле со смесью этилацетат/гексан (1/1), с получением 5-циклопропилпиримидин-2-карбонитрила в виде твердого вещества. ЖХ/МС=146 [M+1].
Стадия B: (5-Циклопропилпиримидин-2-ил)метанамин
Смесь 5-циклопропилпиримидин-2-карбонитрила (240 мг, 1,66 ммоль) и 10%Pd/C (84 мг, 0,08 ммоль) перемешивали в атмосфере водорода (баллон) в смеси HCl/MeOH (0,1 мл/5 мл) при температуре окружающей среды в течение ночи. После охлаждения до комнатной температуры, реакционную смесь фильтровали через целит и концентрировали, с получением HCl соли (5-циклопропилпиримидин-2-ил)метанамина в виде масла. ЖХ/МС=150 [M+1].
(3,6-Диметилпиридин-2-ил)метанамин

Стадия A: 2-Хлор-3,6-диметилпиридин
К раствору 2-(диметиламино)этанола (2,15 г, 24 ммоль) в ТГФ (15 мл) при -5°C медленно добавляли н-BuLi (2,5M, 25 ммоль), и полученную в результате смесь перемешивали в течение 30 минут при -5°C, затем охлаждали до -75°C с последующим медленным добавлением раствора 2-хлор-3-метилпиридина (1,0 г, 8 ммоль) в ТГФ (5 мл). Реакционную смесь перемешивали в течение 1,5 часов, поддерживая температуру ниже чем -70°C. К указанной выше смеси медленно добавляли раствор MeI (2 мл, 32 ммоль) в ТГФ (60 мл). По завершению добавления, охлаждающую баню удаляли, и реакционную смесь нагревали до 0°C. Реакцию осторожно гасили добавлением воды (60 мл) и экстрагировали Et2O (3×50 мл). Органические слои объединяли, промывали водой (30 мл) и насыщенным раствором соли (30 мл), сушили над MgSO4 и концентрировали, с получением 1,0 г (88% выход) бесцветного масла, которое использовали на следующей стадии без дополнительной очистки. ЖХ/МС=142 [M+1]
Стадия B: 3,6-Диметилпиколинонитрил
Смесь 2-хлор-3,6-диметилпиридина (320 мг, 2,3 ммоль), Pd(PPh3)4 (810 мг, 6,80 ммоль) и Zn(CN)2 (820 мг, 6,80 ммоль) в ДМФА (2 мл) нагревали в микроволновом реакторе при 130°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли воду (5 мл). Полученную в результате смесь экстрагировали этилацетатом (3×10 мл). Органические фракции объединяли, промывали насыщенным раствором соли (5 мл), сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали препаративной ТСХ (гексан/EtOAc=30:1), с получением 3,6-диметилпиколинонитрила (200 мг, 66% выход) в виде бесцветного масла. ЖХ/МС=133 [M+1]
Стадия C: (3,6-Диметилпиридин-2-ил)метанамин
Смесь 3,6-диметилпиколинонитрила (120 мг, 0,91 ммоль), EtOH (8 мл), HCl (0,2 мл) и 10% Pd/C (12 мг, 0,011 ммоль) перемешивали при комнатной температуре в течение 2 часов в атмосфере H2 (при 1 атм). Полученную смесь фильтровали через тонкий слой силикагеля, и растворитель выпаривали при пониженном давлении, с получением 3,6-диметилпиридин-2-ил)метанамина (140 мг, 89% выход) в виде белого твердого вещества. ЖХ/МС=137 [M+1].
Следующие промежуточные аминные соединения (AI) получали, используя методики, аналогично описанным для соединений (AI-8)-(AI-14), из соответствующих арилнитрилов, гетероарилнитрилов или арил/гетероарил бромидов/хлоридов.
|
(6-(Метоксиметил)пиридин-2-ил)метанамин
Схема 13


Стадия A: 2-(Азидометил)-6-(хлорметил)пиридин
50-мл колбу заполняли 2,6-бис(хлорметил)пиридином (500 мг, 2,86 ммоль), азидом натрия (186 мг, 2,86 ммоль) и карбонатом натрия (606 мг, 5,71 ммоль) в ДМФА (5,0 мл). Полученную в результате смесь нагревали при 50°C в атмосфере N2 в течение ночи. Полученную смесь фильтровали, и фильтрат промывали насыщенным раствором соли (30 мл), сушили (MgSO4), фильтровали и концентрировали. Полученный в результате 2-(азидометил)-6-(хлорметил)пиридин в виде масла использовали на следующей стадии без дополнительной очистки. ЖХ/МС=183(M+1).
Стадия B: 2-(Азидометил)-6-(метоксиметил)пиридин
К раствору 2-(азидометил)-6-(хлорметил)пиридина (420 мг, 2,13 ммоль) в MeOH (5,0 мл) добавляли метанолят натрия (249 мг, 4,6 ммоль) и NaI (35 мг, 0,23 ммоль). Реакционную смесь нагревали при 50°C в атмосфере Ar в течение 2 часов. После охлаждения, полученную смесь гасили добавлением воды (10 мл). MeOH удаляли при пониженном давлении, и водную смесь экстрагировали EtOAc (3×10 мл). EtOAc фазы объединяли и промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали. Неочищенный продукт очищали препаративной ТСХ, с получением 2-(азидометил)-6-(метоксиметил)пиридина в виде твердого вещества. ЖХ/МС=179(M+1).
Стадия C: (6-(Метоксиметил)пиридин-2-ил)метанамин
К раствору 2-(азидометил)-6-(метоксиметил)пиридина (200 мг, 1,12 ммоль) в ТГФ (3 мл) и H2O (0,3 мл) добавляли трифенилфосфин (591 мг, 2,25 ммоль). Полученную реакционную смесь перемешивали при комнатной температуре в течение ночи. Полученную смесь концентрировали в вакууме, и остаток очищали препаративной ТСХ, с получением (6-(метоксиметил)пиридин-2-ил)метанамина в виде масла. ЖХ/МС=153(M+1).
4-Хлор-6,7-дигидро-5H-циклопента[b]пиридин-7-амин
Схема 14

Стадия A: 4-Хлор-5H-циклопента[b]пиридин-7(6H)-он
К раствору 4-хлор-6,7-дигидро-5H-циклопента[b]пиридин-7-ола (900 мг, 5,31 ммоль) в безводном CH2Cl2 (10 мл) добавляли периодинан Десса-Мартина (4501 мг, 10,61 ммоль). Полученную реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи. Смесь гасили добавлением NaHCO3 (водн.), экстрагировали ДХМ. ДХМ фазу промывали насыщенным раствором соли, сушили над Na2SO4, фильтровали и концентрировали, с получением неочищенного продукта. Неочищенный продукт очищали колоночной хроматографией на силикагеле, элюируя смесью гексан:этилацетат=3:1, с получением 4-хлор-5H-циклопента[b]пиридин-7(6H)-она в виде твердого вещества. ЖХ/МС=168 [M+1].
Стадия B: 4-Хлор-N-(2,4-диметоксибензил)-6,7-дигидро-5H-циклопента[b]пиридин-7-амин
К перемешиваемому раствору 4-хлор-5H-циклопента[b]пиридин-7(6H)-она (200 мг, 1,193 ммоль) и 2,4-диметоксибензиламина (399 мг, 2,387 ммоль) в ClCH2CH2Cl (10 мл) добавляли триацетоксиборогидрид натрия (1012 мг, 4,77 ммоль). Полученную реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь гасили добавлением водного NaHCO3 и экстрагировали ДХМ. ДХМ фазы промывали насыщенным раствором соли, сушили над Na2SO4, фильтровали и концентрировали. Неочищенный продукт очищали препаративной ТСХ, с получением 4-хлор-N-(2,4-диметоксибензил)-6,7-дигидро-5H-циклопента[b]пиридин-7-амина в виде твердого вещества. ЖХ/МС=319 [M+1].
Стадия C: 4-Хлор-6,7-дигидро-5H-циклопента[b]пиридин-7-амин
4-хлор-N-(2,4-диметоксибензил)-6,7-дигидро-5H-циклопента[b]пиридин-7-амин (150 мг, 0,471 ммоль) растворяли в ТФУК (3 мл), полученную реакционную смесь перемешивали на 50°C масляной бане в течение ночи. Полученную смесь концентрировали, и остаток растворяли в ДХМ (30 мл), промывали водным NaHCO3, сушили над Na2SO4, фильтровали и концентрировали, с получением 4-хлор-6,7-дигидро-5H-циклопента[b]пиридин-7-амина в виде твердого вещества. ЖХ/МС=169 [M+1].
(1-(2,2-Дифторэтил)-1H-имидазол-2-ил)метанамин
Схема 15

Стадия A: трет-Бутил(1H-имидазол-2-ил)метилкарбамат
Раствор (1H-имидазол-2-ил)метанамина (300 мг, 3,1 ммоль), (Boc)2O (2020 мг, 9,3 ммоль), Et3N (937 мг, 9,3 ммоль) и DMAP (76 мг, 0,62 ммоль) в ДХМ (20 мл) перемешивали при 60°C в течение ночи. Полученный раствор промывали водой (3×20 мл), и органический слой концентрировали, с получением трет-бутил(1H-имидазол-2-ил)метилкарбамата в виде твердого вещества. ЖХ/МС=198 [M+1].
Стадия B: трет-Бутил(1-(2,2-дифторэтил)-1H-имидазол-2-ил)метилкарбамат
Раствор трет-бутил(1H-имидазол-2-ил)метилкарбамата (220 мг, 1,12 ммоль), 2-бром-1,1-дифторэтана (487 мг, 3,36 ммоль), NaOH (134 мг, 3,36 ммоль) и NaI (84 мг, 0,56 ммоль) в ТГФ (20 мл) перемешивали при 60°C в течение ночи. Полученный раствор очищали препаративной ВЭЖХ со смесью MeCN/H2O, с получением трет-бутил(1-(2,2-дифторэтил)-1H-имидазол-2-ил)метилкарбамата в виде твердого вещества. ЖХ/МС=262 [M+1].
Стадия C: (1-(2,2-Дифторэтил)-1H-имидазол-2-ил)метанамин
Раствор трет-бутил(1-(2,2-дифторэтил)-1H-имидазол-2-ил)метилкарбамата (160 мг, 0,61 ммоль) в смеси ТФУК/ДХМ(2 мл/20 мл) перемешивали при 0°C в течение 4 часов. Полученный раствор промывали насыщенным водным NaHCO3 (3×20 мл), и органический слой концентрировали, с получением (1-(2,2-дифторэтил)-1H-имидазол-2-ил)метанамина в виде твердого вещества. ЖХ/МС=162 [M+1].
(1-изопропил-1H-1,2,4-триазол-5-ил)метанамин
Схема 16

Стадия A: 1-изопропил-1H-1,2,4-триазол
Смесь 1H-1,2,4-триазола (1 г, 14,48 ммоль), 2-йодопропана (3,69 г, 21,72 ммоль) и K2CO3 (3,00 г, 21,72 ммоль) в MeOH (15 мл) нагревали в микроволновой печи при 60°C в течение 2 часов. Полученную смесь фильтровали. Фильтрат упаривали при пониженном давлении и очищали колоночной хроматографией на силикагеле со смесью (ДХМ/MeOH: 50/1), с получением 1-изопропил-1H-1,2,4-триазола в виде бесцветного масла. ЖХ/МС=112 [M+1].
Стадия B: 1-изопропил-1H-1,2,4-триазол-5-карбальдегид
В 25-мл 3-горлую колбу добавляли смесь 1-изопропил-1H-1,2,4-триазола (600 мг, 5,40 ммоль) в сухом ТГФ (3 мл). Полученную смесь перемешивали при 0°C в течение 10 минут. Добавляли н-BuLi (2,59 мл, 6,48 ммоль). После добавления, полученную смесь перемешивали при 0°C в течение 45 минут. Добавляли безводный ДМФА (0,35 мл, 4,53 ммоль) при 0°C. Полученную смесь нагревали до комнатной температуры и перемешивали в течение 16 часов. Реакцию гасили добавлением насыщенного NH4Cl (20 мл). Водный слой экстрагировали этилацетатом (20 мл ×3). Органические слои объединяли и сушили над Na2SO4. После фильтрования, органический растворитель выпаривали при пониженном давлении, с получением 1-изопропил-1H-1,2,4-триазол-5-карбальдегида в виде масла без дополнительной очистки. ЖХ/МС=158 [M+H2O+H].
Стадия C: 1-изопропил-1H-1,2,4-триазол-5-карбальдегидоксим
В 50-мл круглодонную колбу добавляли смесь 1-изопропил-1H-1,2,4-триазол-5-карбальдегида (800 мг, 5,75 ммоль), гидрохлорида гидроксиламина (799 мг, 11,50 ммоль) и пиридина (1,4 г, 17,70 ммоль) в MeOH (15 мл). Полученную смесь перемешивали при 80°C в течение 6 часов. Полученную в результате смесь охлаждали до комнатной температуры. Органический растворитель выпаривали при пониженном давлении, и остаток очищали препаративной ТСХ (ДХМ/MeOH: 50/1), с получением 1-изопропил-1H-1,2,4-триазол-5-карбальдегидоксима в виде масла. ЖХ/МС=155 [M+1].
Стадия D:(1-изопропил-1H-1,2,4-триазол-5-ил)метанамин
В 25-мл круглодонную колбу добавляли смесь (E)-1-изопропил-1H-1,2,4-триазол-5-карбальдегидоксима (10 мг, 0,065 ммоль) и никеля Ренея (20 мг, 0,341 ммоль) в MeOH (10 мл). Полученную смесь перемешивали при комнатной температуре в течение 18 часов. После фильтрования, органический растворитель выпаривали при пониженном давлении, с получением (1-изопропил-1H-1,2,4-триазол-5-ил)метанамина в виде масла без дополнительной очистки. ЖХ/МС=141 [M+1].
2-Хлор-6,7-дигидро-5H-циклопента[b]пиридин-7-амин
Схема 17
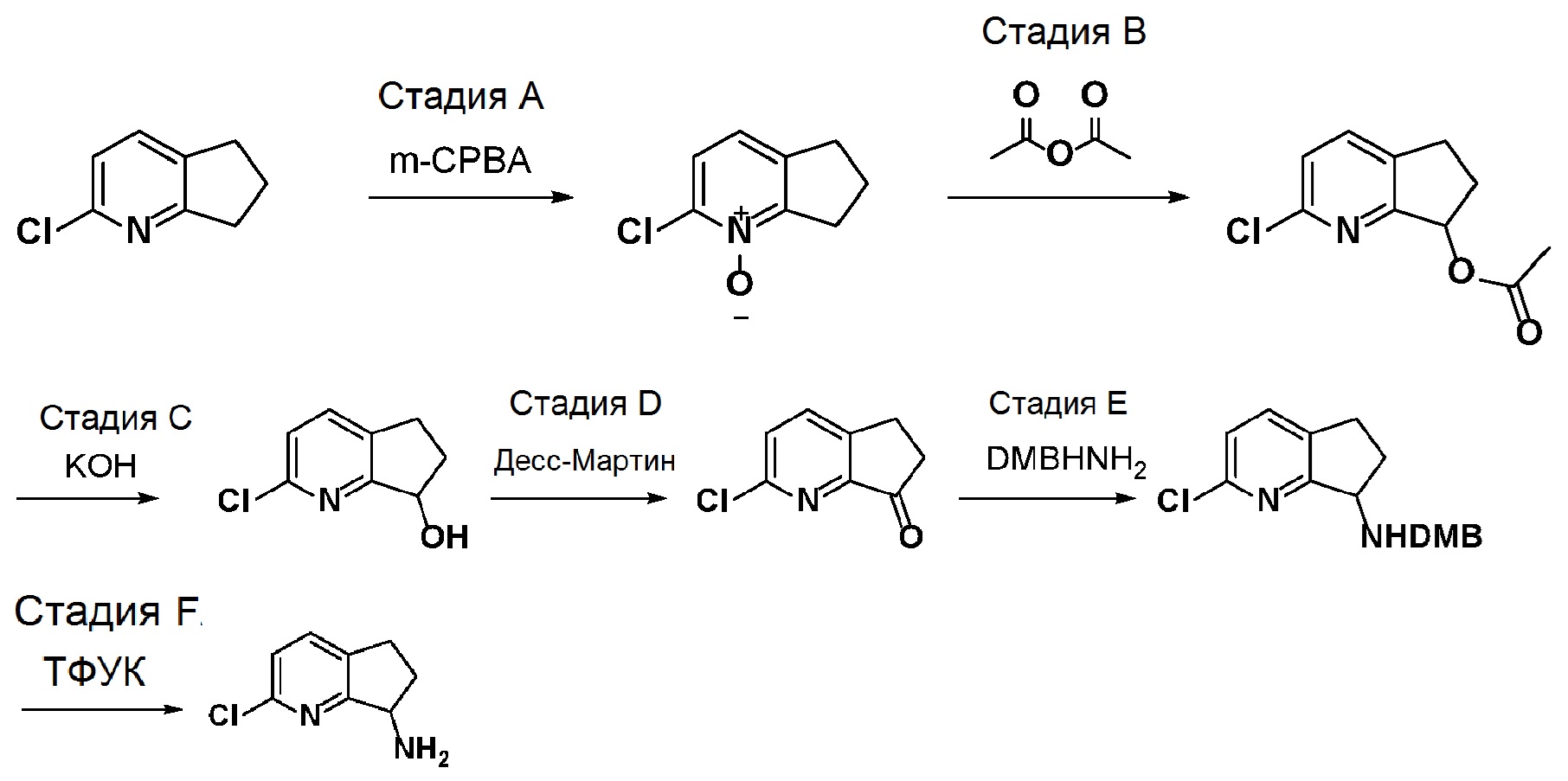
Стадия A: 2-Хлор-6,7-дигидро-5H-циклопента[b]пиридин 1-оксид
Раствор 70-процентной 3-хлорпероксибензойной кислоты (1,41 г, 5,73 ммоль) в CH2Cl2 (15 мл) по каплям добавляли к перемешиваемому раствору 2-хлор-6,7-дигидро-5H-циклопента[b]пиридина (800 мг, 5,21 ммоль) в CH2Cl2 (8 мл), и полученному в результате раствору давали возможность перемешиваться при комнатной температуре в течение ночи. Реакционную смесь гасили добавлением насыщенного раствора NaHCO3, и CH2Cl2 слой отделяли. Водную фазу затем экстрагировали CH2Cl2 (3×50 мл). Органические слои объединяли, промывали насыщенным раствором соли (20 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении, остаток очищали препаративной ТСХ (элюируя смесью гексан/этилацетат 1:1), с получением 2-хлор-6,7-дигидро-5H-циклопента[b]пиридин 1-оксида в виде твердого вещества. ЖХ/МС=170 [M+1].
Стадия B: 2-Хлор-6,7-дигидро-5H-циклопента[b]пиридин-7-илацетат
В круглодонной колбе, снабженной конденсатором, 2-хлор-6,7-дигидро-5H-циклопента[b]пиридин 1-оксид (200 мг, 1,18 ммоль) растворяли в уксусном ангидриде (5 мл) и нагревали при 110°C в течение ночи. ЖХМС показала, что исходные вещества израсходованы. Реакционной смеси давали охладиться, и растворитель отделяли при пониженном давлении. Полученный в результате остаток растворяли в CH2Cl2 (70 мл) и промывали последовательно насыщенным водным раствором NaHCO3 (2×60 мл) и насыщенным раствором соли (100 мл). После сушки над безводным Na2SO4, раствор отделяли при пониженном давлении и очищали препаративной ТСХ, элюируя смесью этилацетат/гексан (1:5), с получением 2-хлор-6,7-дигидро-5H-циклопента[b]пиридин-7-илацетата в виде масла. ЖХ/МС=212 [M+1].
Стадия C: 2-Хлор-6,7-дигидро-5H-циклопента[b]пиридин-7-ол
К перемешиваемому раствору 2-хлор-6,7-дигидро-5H-циклопента[b]пиридин-7-илацетата (190 мг, 0,90 ммоль) в EtOH (2 мл) добавляли раствор KOH (55 мг, 0,99 ммоль) в EtOH (5 мл). Полученную в результате смесь перемешивали при комнатной температуре в течение 3 часов, и затем растворитель удаляли при пониженном давлении, с получением темного твердого вещества, которое обрабатывали 30 мл воды и экстрагировали дихлорметаном (3×20 мл). Объединенные органические фракции промывали насыщенным раствором соли (насыщенный, 50 мл), сушили (Na₂SO₄), фильтровали, и растворитель выпаривали при пониженном давлении. Остаток очищали препаративной ТСХ, элюируя смесью гексан/этилацетат (5:1), с получением 2-хлор-6,7-дигидро-5H-циклопента[b]пиридин-7-ола в виде масла. ЖХ/МС=170 [M+1].
Стадия D: 2-Хлор-5,6-дигидро-7H-циклопента[b]пиридин-7-он
К раствору 2-хлор-6,7-дигидро-5H-циклопента[b]пиридин-7-ола (145 мг, 0,86 ммоль) в ДХМ (5 мл) добавляли периодинан Десса-Мартина (725 мг, 1,710 ммоль). Полученный раствор перемешивали при комнатной температуре в течение 2 часов, затем промывали 1Н NaOH, сушили над сульфатом натрия, декантировали и концентрировали, с получением 2-хлор-5H-циклопента[b]пиридин-7(6H)-она в виде твердого вещества. ЖХ/МС=168 [M+1].
Стадия E: 2-Хлор-N-(2,4-диметоксибензил)-6,7-дигидро-5H-циклопента[b]пиридин-7-амин
Раствор 2-хлор-5H-циклопента[b]пиридин-7(6H)-она (125 мг, 0,75 ммоль) и (2,4-диметоксифенил)метанамина (187 мг, 1,12 ммоль) в ДМФА (5 мл) перемешивали при комнатной температуре в течение 30 минут. Добавляли триацетоксиборогидрид натрия (632 мг, 2,98 ммоль), и полученную смесь перемешивали при комнатной температуре в течение ночи. Полученный раствор разбавляли этилацетатом (80 мл), промывали насыщенным раствором соли (насыщенный, 2×50 мл), сушили (Na₂SO₄), фильтровали и концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ, элюируя смесью гексан/этилацетат (1:2), с получением 2-хлор-N-(2,4-диметоксибензил)-6,7-дигидро-5H-циклопента[b]пиридин-7-амина в виде масла. ЖХ/МС=319 [M+1].
Стадия F: 2-Хлор-6,7-дигидро-5H-циклопента[b]пиридин-7-амин
Раствор 2-хлор-N-(2,4-диметоксибензил)-6,7-дигидро-5H-циклопента[b]пиридин-7-амина (160 мг, 0,50 ммоль) в ТФУК (5 мл) перемешивали при 50°C в течение 2 часов. Растворитель удаляли при пониженном давлении, и остаток нейтрализовали водным гидрокарбонатом натрия, экстрагировали дихлорметаном (3×30 мл), сушили над Na2SO4 и концентрировали, с получением 2-хлор-6,7-дигидро-5H-циклопента[b]пиридин-7-амина в виде масла. ЖХ/МС=169 [M+1].
(3-Этилпиразин-2-ил)метанамин
Схема 18

Стадия A: 3-Этилпиразин-2-карбальдегид
Смесь 2-метил-3-этилпиразина (1,0 г, 8,19 ммоль), диоксида селена (1,8 г, 16,38 ммоль) и диатомовой земли (1,8 г) в диоксане (20 мл) кипятили с обратным холодильником в течение ночи. Полученной смеси давали охладиться до комнатной температуры. Твердые вещества удаляли фильтрованием через диатомовую землю. Растворитель выпаривали при пониженном давлении. Неочищенный продукт промывали водой (3×10 мл), экстрагировали этилацетатом (3×20 мл), сушили над Na2SO4 и концентрировали. Неочищенный продукт непосредственно использовали на следующей стадии реакции без очистки. ЖХ/МС=137 [M+1].
Стадия B: 3-Этилпиразин-2-карбальдегидоксим
Смесь 3-этилпиразин-2-карбальдегида (111 мг, 0,816 ммоль), гидрохлорида гидроксиламина (2,5 мл, 50%) и воды (5 мл) перемешивали при комнатной температуре в течение 2 часов. Полученную в результате смесь промывали водой (3×10 мл), экстрагировали этилацетатом (3×20 мл), сушили над Na2SO4 и упаривали. Неочищенный продукт очищали препаративной ВЭЖХ, с получением 3-этилпиразин-2-карбальдегидоксима в виде твердого вещества. ЖХ/МС=152 [M+1].
Стадия C: (3-Этилпиразин-2-ил)метанамин
3-Этилпиразин-2-карбальдегидоксим (103 мг, 0,69 ммоль) и 10% палладий на сульфате бария (10 мг, 1 ммоль) смешивали с этанолом (10 мл) и подсоединяли к аппарату гидрирования. Полученную смесь заполняли водородом. Смесь перемешивали при комнатной температуре в течение 2 часов. Полученную в результате смесь фильтровали, и фильтрат концентрировали. Неочищенный продукт использовали непосредственно на следующей стадии без очистки. ЖХ/МС=138 [M+1].
(4-(Дифторметил)-1-метил-1H-пиразол-3-ил)метанамин
Схема 19

Стадия A: 4-(Дифторметил)-1,3-диметил-1H-пиразол
Бис(2-метоксиэтил)аминосератрифторид (3,71 мл, 20,14 ммоль) добавляли к перемешиваемому раствору 1,3-диметил-1H-пиразол-4-карбальдегида (500 мг, 4,03 ммоль) в ДХМ (6 мл) при 0°C. Затем полученную смесь перемешивали при комнатной температуре в течение ночи. Реакцию гасили добавлением раствора NaHCO3 (20 мл), экстрагировали дихлорметаном (3×10 мл). Объединенные органические фракции промывали насыщенным раствором соли (3×10 мл), сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали препаративной ВЭЖХ с обращенной фазой (C-8), элюируя смесью (MeCN/H2O=2/1), с получением 4-(дифторметил)-1,3-диметил-1H-пиразола в виде масла. ЖХ/МС=147 [M+1].
Стадия B: 3-(Бромметил)-4-(дифторметил)-1-метил-1H-пиразол
К раствору 4-(дифторметил)-1,3-диметил-1H-пиразола (300 мг, 2,053 ммоль) в CCl4 (3 мл) добавляли NBS (475 мг, 2,67 ммоль) и AIBN (34 мг, 0,207 ммоль). Полученную смесь кипятили с обратным холодильником в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры и фильтровали. Фильтрат концентрировали при пониженном давлении, с получением неочищенного продукта в виде твердого вещества. Неочищенный продукт непосредственно использовали на следующей стадии без очистки. ЖХ/МС=225 [M+1].
Стадия C: 2-((4-(Дифторметил)-1-метил-1H-пиразол-3-ил)метил)изоиндолин-1,3-дион
Смесь 3-(бромметил)-4-(дифторметил)-1-метил-1H-пиразола (290 мг, 1,289 ммоль) и 1,3-диоксоизоиндолин-2-ида калия (477 мг, 2,58 ммоль) в ДМФА (2 мл) перемешивали при 80°C в течение 1 часа. Полученную смесь охлаждали до комнатной температуры и добавляли воду (20 мл). Полученную смесь экстрагировали этилацетатом (3×10 мл). Объединенные органические фракции промывали насыщенным раствором соли (10 мл), сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле со смесью (гексан/этилацетат=2/1), с получением 2-((4-(дифторметил)-1-метил-1H-пиразол-3-ил)метил)изоиндолин-1,3-диона в виде твердого вещества. ЖХ/МС=292 [M+1].
Стадия D: (4-(Дифторметил)-1-метил-1H-пиразол-3-ил)метанамин
Смесь 2-((4-(дифторметил)-1-метил-1H-пиразол-3-ил)метил)изоиндолин-1,3-диона (89 мг, 0,30 ммоль) и гидразингидрата (42 мг, 0,82 ммоль) в метаноле (2 мл) перемешивали при комнатной температуре в течение ночи. Добавляли ДХМ (2 мл) и фильтровали. Фильтрат концентрировали и непосредственно использовали на следующей стадии без дополнительной очистки. ЖХ/МС=162 [M+1].
(1-Метил-4-(трифторметил)-1H-имидазол-2-ил)метанамин
Схема 20


Стадия A: 1-Метил-4-(трифторметил)-1H-имидазол
В раствор 5-(трифторметил)-1H-имидазола (1 г, 6,67 ммоль) в 5 мл сухого ТГФ добавляли 60% NaH (399 мг, 9,99 ммоль) в защитной атмосфере N2. Полученный раствор перемешивали при комнатной температуре в течение 1 часа. Затем добавляли метилйодид (1,42 г, 9,99 ммоль). Полученный раствор смеси перемешивали при комнатной температуре в течение 3 часов. Растворитель выпаривали, и к полученной смеси добавляли воду (20 мл). Полученную смесь экстрагировали ДХМ (3×20 мл). Органическую фазу сушили над Na2SO4 и упаривали. Неочищенный продукт очищали колоночной хроматографией со смесью гексан/этилацетат=1:1, с получением 1-метил-4-(трифторметил)-1H-имидазола. ЖХ/МС=165 [M+1].
Стадия B: 1-Метил-4-(трифторметил)-1H-имидазол-2-карбальдегид
н-Бутиллитий (1,6M в гексане, 2 мл, 3,2 ммоль) по каплям добавляли к раствору (10 мл) 1-метил-4-(трифторметил)-1H-имидазола (440 мг, 2,94 ммоль) в ТГФ при -78°C в атмосфере аргона. Полученную смесь перемешивали в течение 30 минут, и затем по каплям добавляли тетрагидрофурановый раствор (2 мл) диметилформамида (236 мг, 3,22). Полученную смесь перемешивали при 0°C в течение 2 часов, и затем реакционный раствор добавляли к ледяной воде (10 мл), с последующей экстракцией этилацетатом (3×10 мл). Органический слой промывали насыщенным солевым раствором (10 мл), затем сушили над безводным сульфатом магния и концентрировали, с получением неочищенного продукта при выпаривании растворителя. ЖХ/МС=179 [M+1].
Стадия C: 1-Метил-4-(трифторметил)-1H-имидазол-2-карбальдегидоксим
Смесь 1-метил-4-(трифторметил)-1H-имидазол-2-карбальдегида (400 мг, 2,25 ммоль), гидрохлорида гидроксиламина (232 мг, 3,37 ммоль), пиридина (266 мг, 3,37 ммоль) и этанола (20 мл) кипятили с обратным холодильником в течение ночи. Полученную смесь концентрировали в вакууме, и остаток промывали дихлорметаном (50 мл). Органический слой концентрировали, с получением продукта в виде белого твердого вещества без дополнительной очистки. ЖХ/МС=194 [M+1].
Стадия D: (1-Метил-4-(трифторметил)-1H-имидазол-2-ил)метанамин
Смесь (E)-1-метил-4-(трифторметил)-1H-имидазол-2-карбальдегидоксима (143 mg 0,74 ммоль), хлористоводородной кислоты (6M, 4 мл) и цинка (721 мг, 11,1 ммоль) в EtOH (50 мл) перемешивали при 80°C в течение 1 часа. Полученную смесь фильтровали, и фильтрат концентрировали в вакууме, с получением неочищенного продукта, который использовали на следующей стадии без дополнительной очистки. ЖХ/МС=180 [M+1].
(1-Этил-1H-1,2,4-триазол-5-ил)метанамин
Схема 21

Стадия A: 1-Метил-4-(трифторметил)-1H-имидазол-2-карбальдегид
н-Бутиллитий (0,8 мл, 2,5M в гексане, 2,0 ммоль) прикапывали в перемешиваемый раствор 1-этил-1H-1,2,4-триазола (200 мг, 2,06 ммоль), TMEDA (0,3 мл) и ТГФ (4 мл) при -78°C в атмосфере аргона. Полученную смесь перемешивали при -78°C в течение 2 часов. К полученной смеси добавляли ДМФА (0,3 мл) при -78°C. Смесь нагревали до комнатной температуры и перемешивали в течение ночи. Полученную смесь выливали в раствор NH4Cl (водн.) (10 мл) и экстрагировали ДХМ (15 мл ×2). Органический слой промывали насыщенным солевым раствором (10 мл) и сушили над MgSO4. Растворитель концентрировали, с получением неочищенного продукта 1-этил-1H-1,2,4-триазол-5-карбальдегида в виде масла. ЖХ/МС=144 [M+18+1].
Стадия B: (E)-1-Этил-1H-1,2,4-триазол-5-карбальдегидоксим
Смесь 1-метил-4-(трифторметил)-1H-имидазол-2-карбальдегида (160 мг, 1,28 ммоль), гидрохлорида гидроксиламина (177 мг, 2,56 ммоль) и NaHCO3 (188 мг, 2,56 ммоль) в этаноле (10 мл) нагревали при кипячении с обратным холодильником в течение ночи. Полученную смесь концентрировали в вакууме, и остаток промывали дихлорметаном (50 мл). Органический слой концентрировали, с получением продукта в виде твердого вещества. ЖХ/МС=141 [M+1].
Стадия C: (1-Этил-1H-1,2,4-триазол-5-ил)метанамин
Смесь (E)-1-этил-1H-1,2,4-триазол-5-карбальдегидоксима (140 mg 1 ммоль), хлористоводородной кислоты (6M, 4 мл) и Pd(OH)2/C (70 мг) в EtOH (30 мл) загружали в 50-мл круглодонную колбу. Систему откачивали и заполняли водородом 3 раза. Полученную смесь перемешивали при комнатной температуре в течение ночи. Полученную смесь фильтровали, и фильтрат концентрировали, с получением неочищенного продукта в виде масла. ЖХ/МС=127[M+1].
(5-Метилпиримидин-4-ил)метанамин
Схема 22


Стадия A: 4,5-Диметилпиримидин
Разогретую на пламени трехгорлую колбу (100 мл) заполняли метиллитием (1,78 мл, 5,3 ммоль) и этиловым эфиром (15 мл). Раствор 5-метилпиримидина (500 мг, 5,3 ммоль) в этиловом эфире (15 мл) по каплям добавляли при -30°C в атмосфере азота. После завершения добавления, реакционной смеси давали нагреться до КТ и перемешивали в течение 1 часа, затем по каплям добавляли раствор DDQ (1,2 г, 5,3 ммоль) в тетрагидроне (5 мл). Полученную смесь перемешивали при КТ в течение 1 часа. Реакционную смесь промывали водным гидроксидом натрия (10 мл). Органические фракции сушили над сульфатом натрия, фильтровали, и растворитель выпаривали при пониженном давлении, с получением 4,5-диметилпиримидина в виде масла. Продукт сразу использовали на следующей стадии. ЖХ/МС=109[M+1].
Стадия B: 4-(Бромметил)-5-метилпиримидин
Раствор 4,5-диметилпиримидина (572 мг, 5,3 ммоль) и брома (763 мг, 4,77 ммоль) в уксусной кислоте (10 мл) герметизировали в трубке, и реакционную смесь нагревали до 50°C в течение 2 часов. Реакционную смесь разбавляли этиловым эфиром (100 мл) и нейтрализовали насыщенным раствором карбоната натрия (200 мл). Органический слой сушили над сульфатом натрия, фильтровали, и растворитель выпаривали при пониженном давлении, с получением 4-(бромметил)-5-метилпиримидина в виде масла. Продукт сразу использовали на следующей стадии. ЖХ/МС=187[M+1].
Стадия C: 2-((5-Метилпиримидин-4-ил)метил)изоиндолин-1,3-дион
Раствор 4-(бромметил)-5-метилпиримидина (100 мг, 0,537 ммоль) и 1,3-диоксоизоиндолин-2-ида натрия (198 мг, 1,07 ммоль) в ДМФА(5 мл) нагревали до 80°C в течение 2 часов. Реакционную смесь фильтровали, и фильтрат очищали препаративной ВЭЖХ, с получением 2-((5-метилпиримидин-4-ил)метил)изоиндолин-1,3-диона в виде твердого вещества. ЖХ/МС=254[M+1].
Стадия D: (5-Метилпиримидин-4-ил)метанамин
2-((5-Метилпиримидин-4-ил)метил)изоиндолин-1,3-дион (150 мг, 0,592 ммоль) в метаноле (3 мл) перемешивали с гидразинмоногидратом (111 мг, 1,776 ммоль) при КТ в течение 12 часов. Реакционную смесь фильтровали, и фильтрат концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ, с получением (5-метилпиримидин-4-ил)метанамина. ЖХ/МС=124[M+1].
A2a Активность соединений настоящего изобретения
Аффинность связывания соединений настоящего изобретения в отношении рецептора A2a человека определяли в анализе конкурентного связывания при использовании сцинтилляционной бесконтактной технологии. Соответственно, 0,3 мкг мембран HEK293 клеток, экспрессирующих рецептор A2a человека, инкубировали с соединением по настоящему изобретению при концентрациях в интервале от 3000 нМ до 0,15 нМ в реакционной смеси, содержащей также 0,5 нМ тритированную форму 5-амино-7-[2-фенетил]-2-(фуран-2-ил)-7H-пиразолo[4,3-e][1,2,4]триазолo[1,5-c]пиримидина (тритированное соединение) и 100 мкг зародышей пшеницы с покрытыми агглютинином иттриевыми силикатными SPA бусинами, в течение одного часа при комнатной температуре при перемешивании. Бусинам затем давали возможность осесть в нижней части лунок в течение 1 часа, после чего определяли связанную мембранами радиоактивность путем сцинтилляционного подсчета импульсов на микропланшет-ридере. Значения Ki определяли с помощью уравнения Чэна-Прусоффа.
Краткое описание материалов и способов, использованных в определении активности A2a:
Материалы
HEK293 клетки, экспрессирующие рецептор аденозина 2a человека, крысы, собаки или обезьяны (куплены у фирмы Perkin-Elmer # RBHA2AM400UA);
тритированное соединение получали внутрилабораторно, согласно опубликованным способам, следуя МДУ (MRL) радиохимии;
зародыши пшеницы с покрытыми агглютинином иттриевыми силикатными SPA бусинами (GE Healthcare #RPNQ0023). Разведение до 25 мг/мл в аналитическом буфере;
аналитический буфер получали внутрилабораторно: свободный от кальция и магния физиологический раствор, забуференный фосфатом Дульбекко+10 мМ MgCl2;
аденозиндеминаза из кишки теленка, 10 мг/2 мл (Roche # 10 102 105 001);
ДМСО;
стандартный антагонист A2a (9-хлор-1-(2-фуранил)-[1,2,4]триазолo[1,5-c]хиназолин-5-амин от фирмы Tocris Bioscience).
Разведение соединений
Делают восемь 1:3 серийных разведений в 100% ДМСО из 3 мМ маточного раствора соединения.
Переносят 50 нл соединения в 384-луночный оптипланшет (Perkin Elmer).
Как правило, конечные концентрации соединений, использованных в данном анализе, составляют от 3000 нМ до 0,152 нМ.
Радиоизотоп
Разведение раствора тритированного соединения до 1,25 нМ в аналитическом буфере. Представляет собой 2,5Х раствор. Конечная концентрация в анализе составляет 0,5 нМ. Расчет концентрации путем подсчета двух 5-мкл аликвот.
Получение мембран
Используют 0,25 мкг мембран/лунка. Разведение мембран до 9,7 мкг/мл в аналитическом буфере. Обработка 20 мкг/мл аденозиндиаминазы (ADA) в течение 15 минут при комнатной температуре для разложения эндогенного аденозина.
Мембранно-шариковая смесь
Используют 100 мкг/лунка зародышей пшеницы с покрытыми агглютинином иттриевыми силикатными SPA бусинами.
Смешивание ADA-обработанных мембран и SPA бусин вместе в течение 30 минут перед анализом.
Аналитический комплекс
В планшет Perkin-Elmer Optiplate-384, содержащий тритированное соединение, добавляют 20 мкл 2,5X раствора тритированного соединения и 30 мкл мембранно-шариковой смеси. Инкубация в течение одного часа при комнатной температуре с перемешиванием.
Учет общего связывания (аналитический буфер+1% ДМСО) и неспецифического связывания (CGS15943, 1 мкМ) в лунках.
Подсчет
Дается возможность оседания бусин в течение одного часа.
Считывание на TopCount микропланшет-ридере.
Расчеты
Используют программу установки кривой (т.е. Prism, Activity Base, Chemcart) для определения EC50. Значение Ki вычисляют, используя уравнение Чэна-Прусоффа:
Ki=EC50/(1+(концентрация радиолиганда/Kd))
При помощи приведенного выше метода анализа, были получены следующие результаты при использовании различных соединений настоящего изобретения, описанных в данном описании. О каждом примере тестированного соединения сообщается в следующем формате: номер примера: A2a EC50, приведенное в нМ. Таким образом, например, соединение Пр-1, определенное, как имеющее значение EC50 при использовании описанного выше анализа, составляющее 4,0 нМ, представлено соответственно как "Пр-1: A2a=4,0":
Пр-1A: A2a=4,0; Пр-1B: A2a=2,9; Пр-3: A2a=3,4; Пр-4: A2a=4,6; Пр-5: A2a=4,7; Пр-6: A2a=5,9; Пр-7: A2a=1,4; Пр-8: A2a=2,2; Пр-9: A2a=2,1; Пр-10: A2a=1,2;
A2a Ki (нМ) для соединений таблицы I
Пр-5: A2a Ki=0,1994; Пр-6: A2a Ki=0,2244; Пр-7A: A2a Ki=5,183; Пр-7B: A2a Ki=0,3873; Пр-9: A2a Ki=0,6396; Пр-10: A2a Ki=0,5734; Пр-11: A2a Ki=0,1247; Пр-12: A2a Ki=9,825; Пр-13: A2a Ki=6,059; Пр-14: A2a Ki=2,119; Пр-15: A2a Ki=1,255; Пр-16: A2a Ki=5,143; Пр-17: A2a Ki=17,3; Пр-18: A2a Ki=0,1514; Пр-19: A2a Ki=2,763; Пр-20: A2a Ki=0,3655; Пр-21: A2a Ki=0,9344; Пр-22: A2a Ki=0,9189; Пр-23: A2a Ki=0,2927; Пр-24: A2a Ki=78,48; Пр-25: A2a Ki=16,15; Пр-26: A2a Ki=1,712; Пр-27: A2a Ki=119,5; Пр-28: A2a Ki=14,48; Пр-29: A2a Ki=0,3361; Пр-30: A2a Ki=0,3139; Пр-31: 2a Ki=0,7366; Пр-32: A2a Ki=1,505; Пр-33: A2a Ki=2,801; Пр-34: A2a Ki=846,6; Пр-35: A2a Ki=0,3959; Пр-36: A2a Ki=0,4639; Пр-37: A2a Ki=7,773; Пр-38: A2a Ki=2,268; Пр-39: A2a Ki=33,86; Пр-40: A2a Ki=14,59; Пр-41: A2a Ki=0,5931; Пр-42: A2a Ki=0,6718; Пр-43: A2a Ki=0,1155; Пр-44: A2a Ki=0,5328; Пр-45: A2a Ki=0,7352; Пр-46: A2a Ki=5,59; Пр-47: A2a Ki=1,802; Пр-48: A2a Ki=1,007; Пр-49: A2a Ki=1,265; Пр-50: A2a Ki=1,247; Пр-51: A2a Ki=0,7168; Пр-52: A2a Ki=4,876; Пр-53: A2a Ki=26,1; Пр-54: A2a Ki=1,77; Пр-55: A2a Ki=3,892; Пр-56: A2a Ki=21,52; Пр-57: A2a Ki=1,032; Пр-58: A2a Ki=4,559; Пр-59: A2a Ki=14,82; Пр-60: A2a Ki=9,202; Пр-61: A2a Ki=2,463; Пр-62: A2a Ki=0,6221; Пр-63: A2a Ki=2,517; Пр-64: A2a Ki=1,495; Пр-65: A2a Ki=4,192; Пр-66: A2a Ki=24,38; Пр-67: A2a Ki=64,09; Пр-68: A2a Ki=27,29; Пр-69: A2a Ki=56,46; Пр-70: A2a Ki=41,03; Пр-71: A2a Ki=23,84; Пр-72: A2a Ki=0,2868; Пр-73: A2a Ki=4,639; Пр-74: A2a Ki=2,271; Пр-75: A2a Ki=40,37; Пр-76: A2a Ki=50,14; Пр-77: A2a Ki=0,8283; Пр-78: A2a Ki=5,724; Пр-79: A2a Ki=0,3395; Пр-80: A2a Ki=1,588; Пр-81: A2a Ki=2,802; Пр-82A: A2a Ki=2,48; Пр-82B: A2a Ki=43,5; Пр-83: A2a Ki=3,178; Пр-84A: A2a Ki=279,9; Пр-84B: A2a Ki=245,4; Пр-85: A2a Ki=0,7; Пр-87: A2a Ki=0,4708; Пр-88: A2a Ki=6,155; Пр-89: A2a Ki=0,7461; Пр-90: A2a Ki=4,95; Пр-91: A2a Ki=2,931; Пр-92: A2a Ki=11,43; Пр-93: A2a Ki=3,996; Пр-94A: A2a Ki=8,7; Пр-94B: A2a Ki=137,6; Пр-95: A2a Ki=0,2765; Пр-96: A2a Ki=12,85; Пр-97: A2a Ki=35,23; Пр-98: A2a Ki=2,929; Пр-99: A2a Ki=208,2; Пр-100: A2a Ki=110,2; Пр-101: A2a Ki=12,88; Пр-102: A2a Ki=11,89; Пр-103: A2a Ki=0,3534; Пр-106: A2a Ki=251,6; Пр-107: A2a Ki=1,152; Пр-108: A2a Ki=6,581; Пр-109: A2a Ki=14,98; Пр-110: A2a Ki=1,324; Пр-111: A2a Ki=82,2; Пр-112: A2a Ki=14,54; Пр-113: A2a Ki=30,22; Пр-114: A2a Ki=5,76; Пр-115: A2a Ki=8,745; Пр-116: A2a Ki=21,35; Пр-117: A2a Ki=104,2; Пр-118: A2a Ki=31,68; Пр-119: A2a Ki=6,239; Пр-120: A2a Ki=5,808; Пр-121: A2a Ki=3,178; Пр-122: A2a Ki=2,913; Пр-123: A2a Ki=17,41; Пр-124: A2a Ki=1,77; Пр-125: A2a Ki=18,81; Пр-126: A2a Ki=83; Пр-127: A2a Ki=0,279; Пр-128: A2a Ki=12,49; Пр-129: A2a Ki=0,1983; Пр-130: A2a Ki=3,411; Пр-131: A2a Ki=10,33; Пр-132: A2a Ki=0,3574; Пр-133: A2a Ki=2,591; Пр-134: A2a Ki=3,394; Пр-135: A2a Ki=0,1686; Пр-136: A2a Ki=0,2665; Пр-137: A2a Ki=0,3068; Пр-138: A2a Ki=0,5878; Пр-139: A2a Ki=3,034; Пр-140: A2a Ki=0,2251; Пр-141: A2a Ki=0,3905; Пр-142: A2a Ki=0,7041; Пр-143: A2a Ki=1,72; Пр-144: A2a Ki=0,3817; Пр-145: A2a Ki=4,219; Пр-146: A2a Ki=5,573; Пр-147: A2a Ki=0,6007; Пр-148: A2a Ki=15,82; Пр-149: A2a Ki=0,8552; Пр-150: A2a Ki=3,589; Пр-151: A2a Ki=4,581; Пр-153: A2a Ki=0,1413; Пр-154: A2a Ki=0,1248; Пр-155: A2a Ki=13,92; Пр-156: A2a Ki=68,93; Пр-157: A2a Ki=0,6009; Пр-158: A2a Ki=1,967; Пр-159: A2a Ki=1,201; Пр-160: A2a Ki=264; Пр-161: A2a Ki=0,2934; Пр-162: A2a Ki=0,3331; Пр-163: A2a Ki=0,1966; Пр-164: A2a Ki=1,286; Пр-165A: A2a Ki=13,12; Пр-165B: A2a Ki=2,12; Пр-165C: A2a Ki=7,639; Пр-165D: A2a Ki=9,338; Пр-166: A2a Ki=0,5993; Пр-167: A2a Ki=0,1583; Пр-169: A2a Ki=0,3747; Пр-170: A2a Ki=0,4818; Пр-171: A2a Ki=1,034; Пр-172: A2a Ki=3,053; Пр-173: A2a Ki=0,1908; Пр-174: A2a Ki=2,964; Пр-175: A2a Ki=6,313; Пр-178: A2a Ki=0,2169; Пр-179: A2a Ki=0,1002; Пр-180: A2a Ki=0,1678; Пр-181: A2a Ki=1,303; Пр-182: A2a Ki=2,701; Пр-183: A2a Ki=6,721; Пр-184: A2a Ki=0,208; Пр-185: A2a Ki=4,254; Пр-186: A2a Ki=0,1809; Пр-187: A2a Ki=0,4489; Пр-188: A2a Ki=0,2902; Пр-189: A2a Ki=1,026; Пр-190: A2a Ki=12,27; Пр-191A: A2a Ki=1,329; Пр-191B: A2a Ki=2,563; Пр-193: A2a Ki=0,4352; Пр-194: A2a Ki=1,648; Пр-195: A2a Ki=1,714; Пр-196: A2a Ki=2,527; Пр-197: A2a Ki=6,372; Пр-198: A2a Ki=8,772; Пр-199: A2a Ki=9,424; Пр-200: A2a Ki=14,7; Пр-201: A2a Ki=0,6331; Пр-202: A2a Ki=2,22; Пр-203: A2a Ki=3,481; Пр-204: A2a Ki=1504; Пр-205: A2a Ki=385; Пр-206: A2a Ki=3,718; Пр-207: A2a Ki=2,922; Пр-208: A2a Ki=0,9819; Пр-209: A2a Ki=2,971; Пр-210: A2a Ki=1,419; Пр-211: A2a Ki=7,366; Пр-212: A2a Ki=98,95; Пр-213: A2a Ki=0,4199; Пр-214: A2a Ki=0,689; Пр-215: A2a Ki=1,444; Пр-216: A2a Ki=0,1228; Пр-217: A2a Ki=1,402; Пр-218: A2a Ki=0,3088; Пр-219: A2a Ki=36,48; Пр-222: A2a Ki=9,219; Пр-223: A2a Ki=2,977; Пр-224: A2a Ki=0,2012; Пр-225: A2a Ki=0,178; Пр-226A: A2a Ki=38,24; Пр-226B: A2a Ki=0,1741; Пр-228: A2a Ki=1,739; Пр-229: A2a Ki=0,3578; Пр-230A: A2a Ki=3,74; Пр-230B: A2a Ki=0,7618; Пр-231A: A2a Ki=29,18; Пр-231B: A2a Ki=10,47; Пр-233A: A2a Ki=1,154; Пр-233B: A2a Ki=0,5717; Пр-235: A2a Ki=0,2432; Пр-236: A2a Ki=1,609; Пр-237: A2a Ki=1,77; Пр-238A: A2a Ki=5,508; Пр-238B: A2a Ki=0,9399; Пр-240A: A2a Ki=40,45; Пр-240B: A2a Ki=1,725; Пр-242: A2a Ki=1,092; Пр-243: A2a Ki=15,09; Пр-244A: A2a Ki=0,2195; Пр-244B: A2a Ki=1,28; Пр-245A: A2a Ki=6,692; Пр-245B: A2a Ki=4,394;
Для соединений таблицы II
Пр-249: A2a Ki=3,451; Пр-250: A2a Ki=2,4; Пр-251: A2a Ki=1,104; Пр-252: A2a Ki=1,809; Пр-253: A2a Ki=8,569; Пр-254: A2a Ki=1,473; Пр-255: A2a Ki=0,1997; Пр-256: A2a Ki=0,1956; Пр-257: A2a Ki=1,944; Пр-258: A2a Ki=2,898; Пр-259: A2a Ki=403,1; Пр-260: A2a Ki=786,3; Пр-261: A2a Ki=1418; Пр-262: A2a Ki=339,7; Пр-263: A2a Ki=3,746; Пр-264A: A2a Ki=99; Пр-264B: A2a Ki=2,4;
Для соединений таблицы III
Пр-268: A2a Ki=359,1; Пр-269: A2a Ki=4,3; Пр-270: A2a Ki=6469,7; Пр-271: A2a Ki=6,19; Пр-272: A2a Ki=269,01; Пр-273: A2a Ki=2,23; Пр-274: A2a Ki=2; Пр-275: A2a Ki=2,1; Пр-276: A2a Ki=407,9; Пр-277: A2a Ki=3,3; Пр-278: A2a Ki=191,3; Пр-279: A2a Ki=59,3; Пр-280: A2a Ki=148,2; Пр-281: A2a Ki=5,7; Пр-282: A2a Ki=1,4; Пр-283: A2a Ki=2,4; Пр-284: A2a Ki=6,5; Пр-285: A2a Ki=10000; Пр-286: A2a Ki=123,7; Пр-287: A2a Ki=131; Пр-288: A2a Ki=1,9; Пр-289: A2a Ki=34,8; Пр-290: A2a Ki=317,6; Пр-291: A2a Ki=10000; Пр-292: A2a Ki=54,8; Пр-293: A2a Ki=106,8; Пр-294: A2a Ki=68,8; Пр-295: A2a Ki=13,6; Пр-296: A2a Ki=35,6; Пр-297: A2a Ki=1,65; Пр-298: A2a Ki=32,9; Пр-299: A2a Ki=33,6; Пр-300: A2a Ki=44,4; Пр-301: A2a Ki=182,5; Пр-302: A2a Ki=28,3; Пр-303: A2a Ki=14,4; Пр-304: A2a Ki=3,6; Пр-305: A2a Ki=49,5; Пр-306: A2a Ki=48,6; Пр-307: A2a Ki=21,6; Пр-308: A2a Ki=34,5; Пр-309: A2a Ki=179,6; Пр-310: A2a Ki=15,65; Пр-311: A2a Ki=1161,5; Пр-312: A2a Ki=606,9; Пр-313: A2a Ki=22,8; Пр-314: A2a Ki=3,7; Пр-315: A2a Ki=194,7; Пр-316: A2a Ki=66,9; Пр-317: A2a Ki=2196,9; Пр-318: A2a Ki=316,7; Пр-319: A2a Ki=77,9; Пр-320: A2a Ki=149,2; Пр-321: A2a Ki=70,2; Пр-322: A2a Ki=61,9; Пр-323: A2a Ki=65,3; Пр-324: A2a Ki=54; Пр-325: A2a Ki=337; Пр-326: A2a Ki=6,1; Пр-327: A2a Ki=55,7; Пр-328: A2a Ki=626,9; Пр-329: A2a Ki=8,6; Пр-330: A2a Ki=61,5; Пр-331: A2a Ki=75,4; Пр-332: A2a Ki=4,1; Пр-333: A2a Ki=57,9; Пр-334: A2a Ki=13,7; Пр-335: A2a Ki=114,4; Пр-336: A2a Ki=134,8; Пр-337: A2a Ki=11,2; Пр-338: A2a Ki=132,9; Пр-339: A2a Ki=117,4; Пр-340: A2a Ki=12,8; Пр-341: A2a Ki=104,6; Пр-342: A2a Ki=122,1; Пр-343: A2a Ki=35,9; Пр-344: A2a Ki=31; Пр-345: A2a Ki=6; Пр-346: A2a Ki=397,4; Пр-347: A2a Ki=46,39; Пр-348: A2a Ki=10,07; Пр-349: A2a Ki=179,67; Пр-350: A2a Ki=629,7; Пр-351: A2a Ki=314,9; Пр-352: A2a Ki=51,1; Пр-353: A2a Ki=49; Пр-354: A2a Ki=389,6; Пр-355: A2a Ki=543,4; Пр-356: A2a Ki=4,3; Пр-357: A2a Ki=69,4; Пр-358: A2a Ki=73,3; Пр-359: A2a Ki=90; Пр-360: A2a Ki=615,2; Пр-361: A2a Ki=63,2; Пр-362: A2a Ki=142,9; Пр-363: A2a Ki=0,5; Пр-394: A2a Ki=1911.
Для соединений таблицы IV
Пр-379: A2a Ki=1486; Пр-380: A2a Ki=0,3836; Пр-381: A2a Ki=80,5; Пр-382: A2a Ki=38,4; Пр-383: A2a Ki=6,4; Пр-384: A2a Ki=63,7; Пр-385: A2a Ki=0,6; Пр-386: A2a Ki=0,3; Пр-387: A2a Ki=2,8; Пр-388: A2a Ki=2,5; Пр-389A: A2a Ki=12,27; Пр-389B: A2a Ki=1,117; Пр-389C: A2a Ki=0,3169; Пр-389D: A2a Ki=2,209; Пр-393: A2a Ki=3,621.