Результат интеллектуальной деятельности: ПЕСТИЦИДНЫЕ ГЕНЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
[0001] По настоящей заявке испрашивается приоритет по предварительной патентной заявке США № 62/095524, зарегистрированной 22 декабря 2014 года, содержание которой включено в настоящее описание путем ссылки в полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0002] Настоящее изобретение относится к способам и композициям для контроля вредителей, в частности, вредителей растений.
ССЫЛКА НА СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ, ПОДАННЫЙ В ВИДЕ ТЕКСТОВОГО ФАЙЛА ПОСРЕДСТВОМ EFS-WEB
[0003] Официальная копия списка последовательностей подана в электронном виде посредством EFS-Web в виде списка последовательностей в формате ASCII с файлом под названием AgB006.PCT_SEQLIST.txt, созданном 14 декабря 2015 года, имеющим размер 956 KB и поданным одновременно с описанием. Список последовательностей, содержащийся в этом документе в формате ASCII, является частью описания и включен в настоящее описание путем ссылки в полном объеме.
УРОВЕНЬ ТЕХНИКИ
[0004] Вредители, заболевания растений и сорняки могут представлять собой серьезную угрозу сельскохозяйственным культурам. Потери по причине вредителей и заболеваний оценивают в 37% сельскохозяйственной продукции по всему миру, при этом 13% - по причине насекомых, бактерий и других организмов.
[0005] Токсины являются детерминантами вирулентности, играющими важную роль в патогенности микробов и/или уклонении от иммунного ответа хозяина. Токсины грамположительных бактерий Bacillus, в частности Bacillus thuringiensis, используют в качестве инсектицидных белков (в целом, обозначаемых как токсины Bt). В современных стратегиях используют гены, экспрессирующие эти токсины, для получения трансгенных сельскохозяйственных культур. Трансгенные сельскохозяйственные культуры, экспрессирующие инсектицидные белковые токсины, используют для борьбы с повреждением культур насекомыми.
[0006] Хотя использование токсинов Bacillus является успешным в контроле насекомых, у некоторых целевых вредителей во многих частях света, где такие токсины широко используют, развилась резистентность к токсинам Bt. Одним из способов решения этой проблемы является высевание сельскохозяйственных культур Bt в рядах, чередующихся с обычными не-Bt сельскохозяйственными культурами (заказник). Альтернативным способом избежания или замедления развития резистентности насекомых является пакетирование инсектицидных генов с разными механизмами действия против насекомых в трансгенных растениях. В современной стратегии использования трансгенных сельскохозяйственных культур, экспрессирующих инсектицидные белковые токсины, значительный упор сделан на открытие новых токсинов, помимо уже полученных из бактерий B. thuringiensis. Новые токсины могут оказаться применимыми в качестве альтернатив полученным из B. thuringiensis для размещения в резистентных к насекомым и вредителям трансгенных растениях. Таким образом, необходимы новые белки-токсины.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0007] На фигуре 1 представлено выравнивание аминокислот SEQ ID NO: 8, 9, 123 и 124. Подчеркнуты области, в которых аминокислоты различаются между четырьмя полипептидами.
[0008] На фигуре 2 представлено выравнивание аминокислот SEQ ID NO: 25, 26, 125 и 126. Подчеркнуты области, в которых аминокислоты различаются между четырьмя полипептидами.
[0009] На фигуре 3 представлено выравнивание аминокислот SEQ ID NO: 72, 94, 127 и 128. Подчеркнуты области, в которых аминокислоты различаются между четырьмя полипептидами.
[0010] На фигуре 4 представлено выравнивание аминокислот SEQ ID NO: 70, 71, 129, 130 и 131. Подчеркнуты области, в которых аминокислоты различаются между пятью полипептидами.
[0011] На фигурах 5A-5H представлено выравнивание аминокислот SEQ ID NO: 6, 7, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158 и 159. Подчеркнуты области, консервативные в каждом из полипептидов. Консервативные области, присутствующие в этом выравнивании, приведены в таблице 4.
[0012] На фигуре 6 представлена взаимосвязь процента идентичности последовательности каждой из SEQ ID NO: 6 и 132-159.
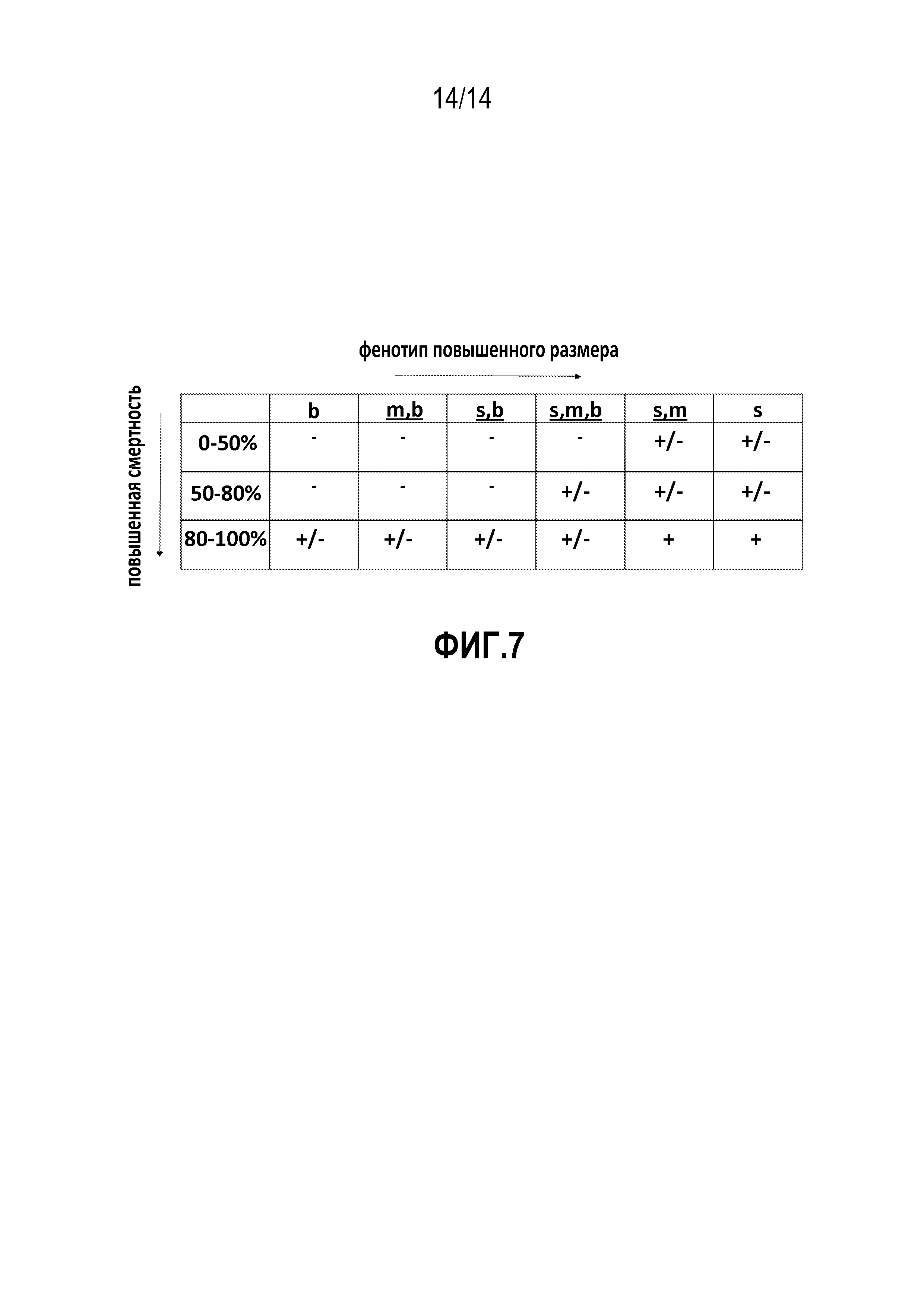
[0013] На фигуре 7 представлено руководство по анализу (матрица размер × смертность), используемому в биологическом анализе западного кукурузного жука.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0014] Настоящее изобретение относится к композициям, имеющим пестицидную активность, и способам их применения. Композиции включают выделенные и рекомбинантные полипептидные последовательности, имеющие пестицидную активность, рекомбинантные и синтетические молекулы нуклеиновой кислоты, кодирующие пестицидные полипептиды, конструкции ДНК, содержащие молекулы нуклеиновой кислоты, векторы, содержащие молекулы нуклеиновой кислоты, клетки-хозяева, содержащие векторы, и антитела против пестицидных полипептидов. Нуклеотидные последовательности, кодирующие полипептиды, представленные в настоящем описании, можно использовать в конструкциях ДНК или экспрессирующих кассетах для трансформации и экспрессии в интересующих организмах, включая микроорганизмы и растения.
[0015] Композиции и способы, представленные в настоящем описании, применимы для получения организмов с повышенной резистентностью или толерантностью к вредителям. Эти организмы и композиции, содержащие организмы, являются желательными для сельскохозяйственных целей. Настоящее изобретение также относится к трансгенным растениям и семенам, содержащим нуклеотидную последовательность, кодирующую пестицидный белок по изобретению. Такие растения резистентны к насекомым и другим вредителям.
[0016] Настоящее изобретение относится к способам получения различных полипептидов, представленных в настоящем описании, и применения этих полипептидов для контроля или уничтожения вредителя. Также включены способы и наборы для детекции полипептидов по изобретению в образце.
ПОДРОБНОЕ ОПИСАНИЕ
[0017] Настоящее изобретение далее в настоящем описании будет более подробно описано со ссылкой на сопутствующие чертежи, на которых представлены некоторые, но не все, варианты осуществления изобретения. Фактически, настоящее изобретение будут осуществлять во множестве разных форм, и их не следует истолковывать в качестве ограничения вариантов осуществления, приведенных в настоящем описании; наоборот, эти варианты осуществления представлены таким образом, что настоящее описание будет удовлетворять соответствующим юридическим требованиям. Подобные числа относятся к подобным элементам на всем протяжении описания.
[0018] Многие модификации и другие варианты осуществления изобретения, приведенного в настоящем описании, будут очевидны специалисту в области, к которой относится настоящее изобретение, пользуясь руководством, представленным в изложенном описании и прилагаемых чертежах. Таким образом, следует понимать, что изобретение не ограничено конкретными описываемыми вариантами осуществления, и что модификации и другие варианты осуществления должны быть включены в объем формулы изобретения. Хотя в настоящем описании используют конкретные термины, их используют исключительно в общем и описательном смысле, а не для ограничения.
I. Полинуклеотиды и полипептиды
[0019] Настоящее изобретение относится к композициям и способу придания пестицидной активности организму. Модифицированный организм проявляет резистентность или толерантность к вредителям. Настоящее изобретение относится к рекомбинантным пестицидным белкам или их полипептидам, фрагментам и вариантам, сохраняющим пестицидную активность, и они включают приведенные в SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158 и/или 159. Пестицидные белки являются биологически активными (например, являются пестицидными) в отношении вредителей, включая насекомых, грибов, нематод и т.п. Полинуклеотиды, кодирующие пестицидные полипептиды, включая, например, SEQ ID NO: 1-159 или их активные фрагменты или варианты, можно использовать для получения трансгенных организмов, таких как растения и микроорганизмы. Трансформированные организмы отличаются геномами, содержащими по меньшей мере одну стабильно встроенную конструкцию ДНК, содержащую кодирующую последовательность пестицидного белка, представленного в настоящем описании. В некоторых вариантах осуществления кодирующая последовательность функционально связана с промотором, регулирующим экспрессию кодируемого пестицидного полипептида. Таким образом, настоящее изобретение относится к трансформированным микроорганизмам, растительным клеткам, тканям растений, растениям, семенам и частям растений. Общие сведения о различных полипептидах, их активных вариантах и фрагментах и полинуклеотидах, кодирующих их, приведены ниже в таблице 1. Как указано в таблице 1, настоящее изобретение относится к различным формам полипептидов. Настоящее изобретение относится к полноразмерным пестицидным полипептидам, а также модифицированным версиям исходной полноразмерной последовательности (обозначаемым как варианты). В таблице 1 дополнительно приведены последовательности "CryBP1". Такие последовательности (SEQ ID NO: 24, 67 и 73) содержат акцессорные полипептиды, которые можно связывать с некоторыми из генов токсинов. В некоторых случаях последовательности CryBP1 можно использовать в отдельности или в комбинации с любым из пестицидных полипептидов, представленных в настоящем описании. В таблице 1 дополнительно приведены C'-концевые полипептиды Split-Cry (SEQ ID NO: 3, 74, 77, 80 и 91). Такие последовательности содержат последовательность нижележащего белка, имеющего гомологию с C'-концом класса Cry генов токсинов и, как правило, обнаруживаемого после гена Cry, не являющегося полноразмерным, и в котором отсутствует C'-концевая область.
Таблица 1. Общие сведения о SEQ ID NO, классе генов и их вариантах
|
i. Классы пестицидных белков
[0020] Пестицидные белки, представленные в настоящем описании, и нуклеотидные последовательности, кодирующие их, применимы в способах воздействия на вредителей. Т.е. композиции и способы по изобретению находят применение в сельском хозяйстве для контроля или уничтожения вредителей, включая вредителей многих сельскохозяйственных культур. Пестицидные белки, представленные в настоящем описании, являются белками-токсинами из бактерий и проявляются активность в отношении конкретных вредителей. Пестицидные белки относятся к нескольким классам токсинов, включая токсины Cry, Cyt, BIN, Mtx. См., например, таблицу 1 на предмет классификации конкретных белков различных SEQ ID NO, представленных в настоящем описании. Кроме того, на всем протяжении настоящего описания сделаны ссылки на записи в базе данных Pfam. База данных Pfam является базой данных семейств белков, каждое из которых представлено посредством множественного выравнивания последовательностей и профиля скрытой марковской модели. Finn et al. (2014) Nucl. Acid Res. Выпуск базы данных 42:D222-D230.
[0021] Bacillus thuringiensis (Bt) является грамположительной бактерией, продуцирующей инсектицидные белки в виде кристаллических включений в течение фазы споруляции. Белковоподобные включения Bt названы кристаллическими белками или δ-эндотоксинами (или белками Cry), токсичными для членов класса Insecta и других беспозвоночных. Аналогично, белки Cyt являются параспоральными белками включений из Bt, проявляющими гемолитическую (цитолитическую) активность или имеющими очевидное сходство последовательности с известным белком Cyt. Эти токсины высокоспецифичны для их целевого организма, безвредны для людей, позвоночных и растений.
[0022] В структуре токсинов Cry обнаружено пять консервативных блоков аминокислот, сконцентрированных, в основном, в центре домена или в соединении между доменами. Токсин Cry состоит из трех доменов, каждый из которых имеет специфическую функцию. Домен I является пучком из семи α-спиралей, в котором центральная спираль полностью окружена шестью внешними спиралями. Этот домен вовлечен в образование канала в мембране. Домен II выглядит как треугольная колонна из трех антипараллельных β-листов, схожих с антигенсвязывающими областями иммуноглобулинов. Домен III содержит антипараллельные β-тяжи в форме β-сэндвича. N-концевая часть белка-токсина отвечает за его токсичность и специфичность и содержит пять консервативных областей. C-концевая часть, как правило, высококонсервативна и, вероятно, отвечает за образование кристаллов. См., например, патент США № 8878007.
[0023] Штаммы B. thuringiensis демонстрируют широкий спектр специфичности в отношении различных отрядов насекомых (Lepidoptera, Diptera, Coleoptera, Hymenoptera, Homoptera, Phthiraptera или Mallophaga и Acari) и других беспозвоночных (Nemathelminthes, Platyhelminthes и Sarocomastebrates). Белки Cry классифицируют по группам с учетом токсичности для различных групп насекомых и беспозвоночных. Как правило, белки Cry I демонстрируют токсичность по отношению к чешуекрылым, белки Cry II - по отношению к чешуекрылым и двукрылым, белки CryIII - по отношению к жесткокрылым, белки Cry IV - по отношению к двукрылым, и белки Cry V и Cry VI - по отношению к нематодам. Новые белки Cry можно идентифицировать и приписывать группе Cry с учетом идентичности аминокислотной последовательности. См., например, Bravo, A. (1997) J. of Bacteriol. 179:2793-2801; Bravo et al. (2013) Microb. Biotechnol. 6:17-26, включенные в настоящее описание путем ссылок.
[0024] Более 750 различных последовательностей генов cry классифицируют на 73 группы (Cry1-Cry73), при этом продолжают обнаруживать новых членов этого семейства генов (Crickmore et al. (2014) www.btnomenclature.info/). Семейство генов cry состоит из нескольких филогенетически неродственных семейств белков, имеющих различные механизмы действия: семейство трехдоменных токсинов Cry, семейство москитоцидных токсинов Cry, семейство бинарно-подобных токсинов и семейство токсинов Cyt (Bravo et al., 2005). Некоторые штаммы Bt продуцируют дополнительные инсектицидные токсины, названные токсинами VIP. Также см. Cohen et al. (2011) J. Mol. Biol. 413:4-814; Crickmore et al. (2014) Bacillus thuringiensis toxin nomenclature, found on the World Wide Web at lifesci.sussex.ac.uk/home/Neil_Crickmore/Bt/; Crickmore et al. (1988) Microbiol. Mol. Biol. Rev. 62: 807-813; Gill et al. (1992) Ann. Rev. Entomol. 37: 807-636; Goldbert et al. (1997) Appl. Environ. Microbiol. 63:2716-2712; Knowles et al. (1992) Proc. R. Soc. Ser. B. 248: 1-7; Koni et al. (1994) Microbiology 140: 1869-1880; Lailak et al. (2013) Biochem. Biophys. Res. Commun. 435: 216-221; Lopez-Diaz et al. (2013) Environ. Microbiol. 15: 3030-3039; Perez et al. (2007) Cell. Microbiol. 9: 2931-2937; Promdonkoy et al. (2003) Biochem. J. 374: 255-259;Rigden (2009) FEBS Lett. 583: 1555-1560; Schnepf et al. (1998) Microbiol. Mol. Biol. Rev. 62: 775-806; Soberon et al. (2013) Peptides 41: 87-93; Thiery et al. (1998) J. Am. Mosq. Control Assoc. 14: 472-476; Thomas et al. (1983) FEBS Lett. 154: 362-368; Wirth et al. (1997) Proc. Natl. Acad. Sci. U.S.A. 94: 10536-10540; Wirth et al (2005) Appl. Environ. Microbiol. 71: 185-189; и Zhang et al. (2006) Biosci. Biotechnol. Biochem. 70: 2199-2204; каждая из которых включена в настоящее описание путем ссылки в полном объеме.
[0025] Cyt означает параспоральный кристаллический белок включения из Bacillus thuringiensis с цитолитической активностью или белок со сходством последовательности с известным белком Cyt. (Crickmore et al. (1998) Microbiol. Mol. Biol. Rev. 62: 807-813). Ген обозначают как cyt. Эти белки отличаются по структуре и активности от белков Cry (Gill et al. (1992) Annu. Rev. Entomol. 37: 615-636). Впервые токсины Cyt обнаружены в подвиде B. thuringiensis israelensis (Goldberg et al. (1977) Mosq. News. 37: 355-358). Существует 3 семейства токсинов Cyt, включая 11 голотипов токсинов в существующей номенклатуре (Crickmore et al. (2014) Bacillus thuringiensis toxin nomenclature, found on the World Wide Web at lifesci.sussex.ac.uk/home/Neil_Crickmore/Bt/). Большинство изолятов B. thuringiensis с генами cyt демонстрируют активность в отношении двукрылых насекомых (в частности, комаров и мошек), но также есть гены cyt, описанные в штаммах B. thuringiensis, воздействующие на чешуекрылых или жесткокрылых насекомых (Guerchicoff et al. (1997) Appl. Environ. Microbiol. 63: 2716-2721).
[0026] Структура Cyt2A, разрешенная посредством рентгеноструктурной кристаллографии, имеет один домен, в котором два внешних слоя α-спирали завернуты вокруг смешанного β-листа. Дополнительные доступные кристаллические структуры токсинов Cyt подтверждают консервативную α-β структурную модель с двумя α-спиральными шпильками, фланкирующими кор β-листа, содержащий от семи до восьми β-тяжей. (Cohen et al. (2011) J. Mol. Biol. 413: 80 4-814) В исследованиях с мутагенезом идентифицировали остатки в β-листах как критичные для токсичности, в то время как мутации в спиральных доменах не влияют на токсичность (Adang et al.; Diversity of Bacillus thuringiensis Crystal Toxins and Mechanism of Action. в T. S. Dhadialla and S. S. Gill, eds, Advances in Insect Physiology, Vol. 47, Oxford: Academic Press, 2014, pp. 39-87.) Типичным доменом токсина Cyt является δ-эндотоксин, Bac_thur_toxin (Pfam PF01338).
[0027] Предложено множество моделей механизма действия токсинов Cyt, и он все еще является предметом активных исследований. Показано, что в случае некоторых белков Cyt (Cyt1A) необходимо наличие акцессорных белков для кристаллизации. Протоксины Cyt1A и Cyt2A процессируются пищеварительными протеазами по одинаковым участкам на N- и C-концах в стабильный кор токсина. Затем токсины Cyt взаимодействуют с ненасыщенными липидами мембраны, такими как фосфатидилхолин, фосфатидилэтаноламин и сфингомиелин. В случае токсинов Cyt порообразование и разрушение мембраны, подобное действию детергентов, предложены в качестве неисключительных механизмов; и общепринято считают, что и то, и другое может происходить в зависимости от концентрации токсина, при этом более низкие концентрации способствуют образованию олигомерных пор, более высокие концентрации приводят к разрывам мембран. (Butko (2003) Appl. Environ. Microbiol. 69: 2415-2422) В модели порообразования токсин Cyt связывается с мембраной клетки, индуцируя образование катионселективных каналов в пузырьках мембраны, что приводит к коллоидно-осмотическому лизису клетки. (Knowles et al. (1989) FEBS Lett. 244: 259-262; Knowles et al. (1992) Proc. R. Soc. Ser. B. 248: 1-7 и Promdonkoy et al. (2003) Biochem. J. 374: 255-259). В детергентной модели происходит неспецифическая агрегация токсина на поверхности липидного бислоя, что приводит к разрушению мембраны и гибели клетки. (Butko (2003) выше; Manceva et al. (2005) Biochem. 44: 589-597).
[0028] Во множестве исследований показана синергическая активность между токсинами Cyt и другими токсинами B. thuringiensis, в частности, токсинами Cry, Bin и Mtx. Показано, что этот синергизм позволяет преодолевать резистентность насекомых к другому токсину. (Wirth 1997, Wirth 2005, Thiery 1998, Zhang 2006) Предполагают, что синергическое действие Cyt с токсинами Cry включает связывание Cyt1A с доменом II токсинов Cry в растворе или на мембране, способствующее образованию олигомера пре-поры токсина Cry. Образование этого олигомера не зависит от олигомеризации, связывания или инсерции Cyt. (Lailak 2013, Perez 2007, Lopez-Diaz 2013)
[0029] Ряд пестицидных белков, неродственных белкам Cry, продуцируется некоторыми штаммами B. thuringiensis и B. cereus в течение вегетативного роста (Estruch et al. (1996) Proc Natl Acad Sci USA 93:5389-5394; Warren et al. (1994) WO 94/21795). Эти вегетативные инсектицидные белки, или Vip, не образуют параспоральные кристаллические белки и, по-видимому, секретируются из клетки. Vip в настоящее время исключены из номенклатуры белков Cry, т.к. они не являются кристалло-образующими белками. Термин VIP является неправильным в том смысле, что некоторые белки Cry B. thuringiensis также продуцируются в течение вегетативного роста, а также в течение стационарной фазы и фазы споруляции, прежде всего Cry3Aa. Как сообщают, гены Vip в геноме B. thuringiensis расположены в крупных плазмидах, также кодирующих гены cry (Mesrati et al. (2005) FEMS Microbiol. Lett. 244(2):353-8). Веб-сайт с номенклатурой токсинов Bt можно найти в сети интернет по адресу lifesci.sussex.ac.uk с путем "/home/Neil_Crickmore/Bt/" и на "btnomenclature.info/". См. также, Schnepf et al. (1998) Microbiol. Mol. Biol. Rev. 62(3):775-806. Такие источники включены в настоящее описание путем ссылок.
[0030] К настоящему моменту идентифицировано четыре категории Vip. Некоторые гены Vip образуют бинарные двухкомпонентные белковые комплексы; компонент "A", как правило, является "активным", и компонент "B", как правило, является "связывающей" частью. (Pfam pfam.xfam.org/family/PF03495.) Белки Vip1 и Vip4, как правило, содержат белковые домены бинарного токсина B. Vip2, белки, как правило содержат белковые домены бинарного токсина A.
[0031] Белки Vip1 и Vip2 являются двумя компонентами бинарного токсина, проявляющими токсичность по отношению к жесткокрылым. Vip1Aa1 и Vip2Aa1 очень активны в отношении кукурузных жуков, в частности, Diabrotica virgifera и Diabrotica longicornis (Han et al. (1999) Nat. Struct. Biol. 6:932-936; Warren GW (1997) "Vegetative insecticidal proteins: novel proteins for control of corn pests" в Carozzi NB, Koziel M (eds) Advances in insect control, the role of transgenic plants; Taylor & Francis Ltd, London, pp 109-21). Мембраносвязанный мультимер Vip1 массой 95 кДа обеспечивает путь для АДФ-рибозилазы Vip2 массой 52 кДа для проникновения в цитоплазму клеток-мишеней западного кукурузного жука (Warren (1997) выше). НАД-зависимая АДФ-рибозилтрансфераза Vip2, вероятно, модифицирует мономерный актин по остатку Arg177 для блокирования полимеризации, что приводит к утрате актинового цитоскелета и, в конечном итоге, гибели клетки по причине быстрого обмена субъединиц в актиновых филаментах in vivo (Carlier M.F. (1990) Adv. Biophys. 26:51-73).
[0032] Подобно токсинам Cry, активированные токсины Vip3A являются порообразующими белками, способными создавать стабильные ионные каналы в мембране (Lee et al. (2003) Appl. Environ. Microbiol. 69:4648-4657). Белки Vip3 активны в отношении нескольких основных чешуекрылых вредителей (Rang et al. (2005) Appl. Environ. Microbiol. 71(10):6276-6281; Bhalla et al. (2005) FEMS Microbiol. Lett. 243:467-472; Estruch et al. (1998) WO 9844137; Estruch et al. (1996) Proc Natl Acad Sci USA 93:5389-5394; Selvapandiyan et al. (2001) Appl. Environ Microbiol. 67:5855-5858; Yu et al. (1997) Appl. Environ Microbiol. 63:532-536). Vip3A активен в отношении Agrotis ipsilon, Spodoptera frugiperda, Spodoptera exigua, Heliothis virescens и Helicoverpa zea (Warren et al. (1996) WO 96/10083; Estruch et al. (1996) Proc Natl Acad Sci USA 93:5389-5394). Подобно токсинам Cry, белки Vip3A должны активироваться протеазами перед распознаванием конкретных мембранных белков, отличающихся от распознаваемыми токсинами Cry, на поверхности эпителия средней кишки.
[0033] Семейство MTX белков-токсинов отличается наличием консервативного домена ETX_MTX2 (pfam 03318). Члены этого семейства обладают гомологией последовательности с москитоцидными токсинами Mtx2 и Mtx3 из Bacillus sphaericus, а также с эпсилон-токсином ETX из Clostridium perfringens (Cole et al. (2004) Nat. Struct. Mol. Biol. 11: 797-8; Thanabalu et al. (1996) Gene 170:85-9). MTX-подобные белки структурно отличаются от трехдоменных токсинов Cry, т.к. они имеют удлиненную и преимущественно основанную на β-листах структуру. Однако, считают, что, аналогично трехдоменным токсинам, MTX-подобные белки образуют поры в мембранах клеток-мишеней (Adang et al. (2014) выше). В отличие от трехдоменных белков Cry, MTX-подобные белки гораздо меньше в длину, в диапазоне от 267 аминокислот (Cry23) до 340 аминокислот (Cry15A).
[0034] К настоящему времени лишь 15 белкам, принадлежащим к семейству MTX-подобных токсинов, приписаны названия Cry, что делает его относительно небольшим классом по сравнению с семейством трехдоменных Cry (Crickmore et al. (2014) выше; Adang et al. (2014) выше). Члены семейства MTX-подобных токсинов включают Cry15, Cry23, Cry33, Cry38, Cry45, Cry46, Cry51, Cry60A, Cry60B и Cry64. Это семейство демонстрирует спектр инсектицидной активности, включая активность в отношении насекомых-вредителей отрядов Lepidoptera и Coleoptera. Некоторые члены этого семейства могут вступать в бинарное партнерство с другими белками, которые могут быть необходимыми для инсектицидной активности, или нет.
[0035] Cry15 является белком массой 34 кДа, идентифицированным в B. thuringiensis серовара thompsoni HD542. Cry15 в природе встречается в кристалле вместе с неродственным белком массой приблизительно 40 кДа. Ген, кодирующий Cry15 и его белок-партнер, организованы вместе в опероне. Показано, что Cry15 в отдельности имеет активность в отношении чешуекрылых насекомых-вредителей, включая Manduca sexta, Cydia pomonella и Pieris rapae, при этом показано, что наличие белка массой 40 кДа повышает активность Cry15 лишь в отношении C. pomonella (Brown K. и Whiteley H. (1992) J. Bacteriol. 174:549-557; Naimov et al. (2008) Appl. Environ. Microbiol. 74:7145-7151). Необходимы дальнейшие исследования для выяснения функции белка-партнера Cry15. Аналогично, Cry23 является белком массой 29 кДа, как показано, имеющим активность в отношении жесткокрылых вредителей Tribolium castaneum и Popillia japonica вместе со своим белком-партнером Cry37 (Donovan et al. (2000) патент США № 6063756).
[0036] Продолжают идентифицировать новых членов MTX-подобного семейства. Недавно в геноме Bacillus thuringiensis серовара tolworthi штамма Na205-3 идентифицирован ген токсина ETX_MTX. Обнаружено, что этот штамм является токсичным в отношении чешуекрылого вредителя Helicoverpa armigera, и он также содержал гомологи Cry1, Cry11, Vip1, Vip2 и Vip3 (Palma et al. (2014) Genome Announc. 2(2): e00187-14. опубликовано он-лайн Mar 13, 2014, doi: 10.1128/genomeA.00187-14; PMCID: PMC3953196). Т.к. MTX-подобные белки обладают уникальной доменной структурой относительно трехдоменных белков Cry, считают, что они обладают уникальным механизмом действия, что, таким образом, делает их важным инструментом в контроле насекомых и борьбе против резистентности насекомых.
[0037] Бактериальные клетки продуцируют большие количества токсинов с различной специфичностью в отношении организмов-хозяев и организмов-не-хозяев. Крупные семейства бинарных токсинов идентифицированы в многочисленных бактериальных семействах, включая токсины, имеющие активность в отношении насекомых-вредителей. (Poopathi and Abidha (2010) J. Physiol. Path. 1(3): 22-38). Lysinibacillus sphaericus (Ls), ранее известная как Bacillus sphaericus, (Ahmed et al. (2007) Int. J. Syst. Evol. Microbiol. 57:1117-1125) хорошо известна как штамм для биологического контроля насекомых. Ls продуцирует несколько инсектицидных белков, включая очень мощный бинарный комплекс BinA/BinB. Этот бинарный комплекс образует параспоральный кристалл в клетках Ls и обладает сильной и специфической активностью в отношении двукрылых насекомых, в частности, комаров. В некоторых областях сообщают о резистентности насекомых к существующим москитоцидным штаммам Ls. Открытие новых бинарных токсинов со специфичностью к другой мишени или способностью преодолевать резистентность насекомых представляет особенный интерес.
[0038] Бинарный инсектицидный белковый комплекс Ls содержит два основных полипептида, полипептид массой 42 кДа и полипептид массой 51 кДа, обозначенные как BinA и BinB, соответственно (Ahmed et al. (2007), выше). Два полипептида действуют синергически, придавая токсичность к своим мишеням. Механизм действия включает связывание белков с рецепторами в средней кишке личинки. В некоторых случаях белки модифицируются посредством расщепления протеазами в кишке личинки с образованием активированных форм. Считают, что компонент BinB участвует в связывании, в то время как компонент BinA придает токсичность (Nielsen-LeRoux et al. (2001) Appl. Environ. Microbiol. 67(11):5049-5054). При раздельном клонировании и экспрессии компонент BinA является токсичным для личинок комаров, в то время как компонент BinB - нет. Однако совместное введение белков заметно повышает токсичность (Nielsen-LeRoux et al. (2001) выше).
[0039] Описано небольшое количество гомологов белков Bin из бактериальных источников. В Priest et al. (1997) Appl. Environ. Microbiol. 63(4):1195-1198 описывают попытки гибридизации для идентификации новых штаммов Ls, хотя большинство идентифицированных ими генов кодируют белки, идентичные известным белкам BinA/BinB. Белок BinA содержит определенный консервативный домен, известный как домен суперсемейства токсинов 10. Этот домен токсина исходно определяли по его наличию в BinA и BinB. Оба белка содержат домен, хотя сходство последовательности между BinA и BinB ограничено в этой области (<40%). Белок Cry49Aa, также имеющий инсектицидную активность, также содержит этот домен (описано ниже).
[0040] Бинарный токсин Cry48Aa/Cry49Aa Ls обладает способностью уничтожать личинки комара Culex quinquefasciatus. Эти белки относятся к структурному классу белков, имеющих некоторое сходство с белковым комплексом Cry B. thuringiensis (Bt). Также известно, что бинарный токсин Cry34/Cry35 Bt убивает насекомых, включая западного кукурузного жука, значительного вредителя кукурузы. Cry34, несколько вариантов которого идентифицировано, является небольшим полипептидом (14 кДа), в то время как Cry35 (также кодируемый несколькими вариантами) является полипептидом массой 44 кДа. Эти белки имеют некоторую гомологию последовательности с группой белков BinA/BinB, и считают, что они являются эволюционно родственными (Ellis et al. (2002) Appl. Environ. Microbiol. 68(3):1137-1145).
[0041] В настоящем описании представлены пестицидные белки из этих классов токсинов. Пестицидные белки классифицируют по их структуре, гомологии с известными токсинами и/или их пестицидной специфичности.
ii. Варианты и фрагменты пестицидных белков и полинуклеотиды, кодирующие их
[0042] Пестицидные белки или полипептиды по изобретению включают приведенные в SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158 и/или 159 и их фрагменты и варианты. Термины "пестицидный токсин", "пестицидный белок" или "пестицидный полипептид" означают токсин, белок или полипептид, имеющий активность в отношении одного или нескольких вредителей, включая насекомых, грибов, нематод и т.п., таким образом, что вредителя убивают или контролируют.
[0043] "Выделенный" или "очищенный" полипептид или белок или его биологически активная часть, по существу, не содержат компоненты, как правило, сопутствующие или взаимодействующие с полипептидом или белком, как обнаруживают в его природной среде. Таким образом, выделенный или очищенный полипептид или белок, по существу, не содержит другой клеточный материал или среду для культивирования при получении рекомбинантными способами или, по существу, не содержит химических предшественников или других химических веществ при химическом синтезе. Белок, по существу, не содержащий клеточный материал включает препараты белка, имеющие менее приблизительно 30%, 20%, 10%, 5% или 1% (на сухую массу) белка-загрязнения. Если белок по изобретению или его биологически активную часть получают рекомбинантно, оптимально, чтобы среда для культивирования представляла менее чем приблизительно 30%, 20%, 10%, 5% или 1% (на сухую массу) химических предшественников или химических веществ, не являющихся интересующим белком.
[0044] Термин "фрагмент" относится к части последовательности полипептида по изобретению. "Фрагменты" или "биологически активные части" включают полипептиды, содержащие достаточное количество смежных аминокислотных остатков для сохранения биологической активности (имеют пестицидную активность). Фрагменты пестицидных белков включают фрагменты, являющиеся более короткими, чем полноразмерные последовательности, как по причине использования альтернативного нижележащего участка начала, так и по причине процессинга, при котором образуется более короткий белок, имеющий пестицидную активность. Процессинг может происходить в организме, в котором белок экспрессируется, или во вредителе после потребления белка. Примеры фрагментов белков можно найти в таблице 1. Биологически активная часть пестицидного белка может являться полипептидом, составляющим, например, 10, 25, 50, 100, 150, 200, 250 или более аминокислот в длину из любой из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158 и/или 159. Такие биологически активные части можно получать рекомбинантными способами и оценивать на пестицидную активность. В рамках изобретения фрагмент содержит по меньшей мере 8 смежных аминокислот из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158 и/или 159.
[0045] Бактериальные гены, включая кодирующие пестицидные белки, представленные в настоящем описании, достаточно часто содержат множество метиониновых инициаторных кодонов вблизи начала открытой рамки считывания. Зачастую инициация трансляции в одном или нескольких из этих инициаторных кодонов будет приводить к образованию функционального белка. Эти инициаторные кодоны могут включать ATG кодоны. Однако, бактерии, такие как Bacillus sp., также распознают кодон GTG в качестве инициаторного кодона, и белки, инициирующие трансляцию в кодонах GTG, содержат метионин в качестве первой аминокислоты. В редких случаях трансляция в бактериальных системах может начинаться с кодона TTG, хотя в этом случае TTG кодирует метионин. Кроме того, не часто определяется a priori, какой из этих кодонов в природе используется в бактерии. Таким образом, следует понимать, что использование одного из альтернативных метиониновых кодонов также может приводить к образованию пестицидных белков. Эти пестицидные белки включены в настоящее изобретение, и их можно использовать в способах, представленных в настоящем описании. Следует понимать, что при экспрессии в растениях необходимо будет заменять альтернативный инициаторный кодон на ATG для правильной трансляции.
[0046] В различных вариантах осуществления пестицидные белки, представленные в настоящем описании, включают аминокислотные последовательности, предсказанные из полноразмерных нуклеотидных последовательностей, и аминокислотные последовательности, являющиеся более короткими, чем полноразмерные последовательности, по причине использования альтернативного нижележащего инициаторного участка. Таким образом, нуклеотидная последовательность по изобретению и/или векторы, клетки-хозяева и растения, содержащие нуклеотидную последовательность по изобретению (и способы получения и применения нуклеотидной последовательности по изобретению) могут содержать нуклеотидную последовательность, кодирующую альтернативный инициаторный участок.
[0047] Установлено, что можно осуществлять модификации пестицидных полипептидов, представленных в настоящем описании, получая белки-варианты. Изменения, предусмотренные человеком, можно осуществлять способами сайт-специфического мутагенеза. Альтернативно, также можно идентифицировать нативные, еще неизвестные или еще неидентифицированные полинуклеотиды и/или полипептиды, структурно и/или функционально родственные последовательностям, представленным в настоящем описании, попадающие в объем настоящего изобретения. Можно осуществлять консервативные аминокислотные замены в неконсервативных областях, не изменяющие функцию пестицидных белков. Альтернативно, можно осуществлять модификации, улучшающие активность токсина. Например, предусмотрены различные варианты белков Cry. Модификация токсинов Cry посредством перестановки домена III в некоторых случаях приводит к получению гибридных токсинов с улучшенными токсичностями в отношении конкретных видов насекомых. Таким образом, перестановка домена III может представлять собой эффективную стратегию для улучшения токсичности токсинов Cry или для получения новых гибридных токсинов с токсичностью в отношении вредителей, у которых не наблюдают восприимчивость к родительским токсинам Cry. Сайт-специфический мутагенез последовательностей петли домена II может приводить к получению новых токсинов с повышенной инсектицидной активностью. Петлевые области домена II являются ключевыми связывающими областями исходных токсинов Cry, являющихся подходящими мишенями для мутагенеза и селекции токсинов Cry с улучшенными инсектицидными свойствами. Домен I токсина Cry можно модифицировать для встраивания участков расщепления протеаз для улучшения активности в отношении конкретных вредителей. С помощью стратегий перестановки трех разных доменов среди большого количества генов cry и способов высокопроизводительного скринингового биологического анализа можно получать новые Cry токсины с улучшенными или новыми токсичностями.
[0048] Как указано, фрагменты и варианты полипептидов, представленных в настоящем описании, будут сохранять пестицидную активность. Пестицидная активность включает способность композиции достигать наблюдаемого эффекта уменьшения распространенности или активности целевого вредителя, включая, например, гибель по меньшей мере одного вредителя или значительное снижение роста, питания или нормального физиологического развития вредителя. Такое снижение количества, роста, питания или нормального развития вредителя может включать любое статистически значимое снижение, включая, например, снижение на приблизительно 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 85%, 90%, 95% или более. Пестицидная активность в отношении одного или более различных вредителей, представленных в настоящем описании, включая, например, пестицидную активность в отношении Coleoptera, Diptera, Hymenoptera, Lepidoptera, Mallophaga, Homoptera, Hemiptera, Orthroptera, Nematodes, Thysanoptera, Dermaptera, Isoptera, Anoplura, Siphonaptera, Trichoptera и т.д. или любого другого вредителя, представленного в настоящем описании. Установлено, что пестицидная активность может являться другой или улучшенной относительно активности нативного белка, или она может являться неизменной, при условии, что пестицидная активность сохраняется. Способы измерения пестицидной активности представлены где-либо в настоящем описании. См. также, Czapla и Lang (1990) J. Econ. Entomol. 83:2480-2485; Andrews et al. (1988) Biochem. J. 252:199-206; Marrone et al. (1985) J. of Economic Entomology 78:290-293; и патент США № 5743477, каждый из которых включен в настоящее описание путем ссылки в полном объеме.
[0049] Варианты по настоящему изобретению включают полипептиды, имеющие аминокислотную последовательность, по меньшей мере на приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 86%, приблизительно 87%, приблизительно 88%, приблизительно 89%, приблизительно 90%, приблизительно 91%, приблизительно 92%, приблизительно 93%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98% или приблизительно 99% идентичную аминокислотной последовательности любой из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158 и/или 159, и сохраняющие пестицидную активность. В таблице 1 представлены неограничивающие примеры полипептидов-вариантов (и полинуклеотидов, кодирующих их) для каждой из SEQ ID NO: 1-159. Биологически активный вариант пестицидного полипептида, представленного в настоящем описании, может отличаться всего на приблизительно 1-15 аминокислотных остатков, всего на приблизительно 1-10, например, приблизительно 6-10, всего на 5, всего на 4, всего на 3, всего на 2 или всего на 1 аминокислотный остаток. В конкретных вариантах осуществления полипептиды могут содержать N'-концевое или C'-концевое укорачивание, которое может содержать по меньшей мере делецию 10, 15, 20, 25, 30, 35, 40, 45, 50 аминокислот или более с N'- или C'-конца полипептида.
[0050] В таблице 2 представлены белковые домены, обнаруживаемые в SEQ ID NO: 1-159 с учетом данных из PFAM. Описание доменов и положения в указанной SEQ ID NO представлены в таблице 2. В конкретных вариантах осуществления активный вариант, содержащий любую из SEQ ID NO: 1-159, может иметь по меньшей мере 70%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности последовательности по отношению к любой из SEQ ID NO: 1-159 и дополнительно содержит по меньшей мере один из консервативных доменов, приведенных в таблице 2. Например, в одном из вариантов осуществления активный вариант будет иметь по меньшей мере, 70%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности последовательности по отношению к SEQ ID NO: 15 и дополнительно содержит нативные аминокислоты в положениях 78-329, нативные аминокислоты в положениях 554-708 или нативные аминокислоты в положениях 78-329 и положениях 554-708.
Таблица 2. Общие сведения о доменах по PFAM в каждой из SEQ ID NO: 1-159
|
[0051] Варианты SEQ ID NO: 8 содержат SEQ ID NO: 9, 123 и 124. На фигуре 1 представлено выравнивание аминокислотной последовательности SEQ ID NO: 8, 9, 123 и 124, и в таблице 3 представлены общие сведения о типе модификации и проценте идентичности последовательности SEQ ID NO: 9, 123 и 124 по отношению к SEQ ID NO: 8.
[0052] Варианты SEQ ID NO: 25 содержат SEQ ID NO: 26, 125 и 126. На фигуре 2 представлено выравнивание аминокислотной последовательности SEQ ID NO: 25, 26, 125 и 126, и в таблице 3 представлены общие сведения о типе модификации и проценте идентичности последовательности SEQ ID NO: 26, 125 и 126 по отношению к SEQ ID NO: 25.
[0053] Варианты SEQ ID NO: 72 содержат SEQ ID NO: 94, 127 и 128. На фигуре 3 представлено выравнивание аминокислотной последовательности SEQ ID NO: 72, 94, 127 и 128, и в таблице 3 представлены общие сведения о типе модификации и проценте идентичности последовательности SEQ ID NO: 94, 127 и 128 по отношению к SEQ ID NO: 72.
[0054] Варианты SEQ ID NO: 70 содержат SEQ ID NO: 71, 129, 130 и 131. На фигуре 4 представлено выравнивание аминокислотной последовательности SEQ ID NO: 70, 71, 129, 130 и 131. В таблице 3 представлены общие сведения о типе модификации и проценте идентичности последовательности SEQ ID NO: 71, 129, 130 и 131 по отношению к SEQ ID NO: 70.
Таблица 3. Общие сведения о вариантах SEQ ID NO: 8, 25, 72 и 70
|
[0055] Как показано на фигурах 5A-5H, каждая из SEQ ID NO: 6, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158 и 159 имеет общие мотивы, как показано ниже в таблице 4. На фигурах 5A-5H показано, где каждую консервативную последовательность обнаруживают в каждой из SEQ ID NO: 6 и 132-159.
Таблица 4. Консервативные области в SEQ ID NO: 6 и 132-159
|
[0056] В конкретных вариантах осуществления активный вариант, содержащий SEQ ID NO: 6 или 132-159, может иметь по меньшей мере 70%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности последовательности по отношению к любой из SEQ ID NO: 6 и 132-159 и дополнительно содержит по меньшей мере один из консервативных доменов, приведенных в таблице 4. Например, в одном из вариантов осуществления активный вариант будет иметь по меньшей мере 70%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичности последовательности по отношению к SEQ ID NO: 6 или 132-159 и дополнительно содержат один или несколько аминокислотных доменов, приведенных в таблице 4 (т.е. по меньшей мере одну из SEQ ID NO: 161, 162, 163, 164, 165, 166 и/или 167). В неограничивающем варианте осуществления активный вариант имеет по меньшей мере 70%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности последовательности по отношению к SEQ ID NO: 6 или 132-159 и дополнительно содержит SEQ ID NO: 166. В другом варианте осуществления активный вариант SEQ ID NO: 6 или 132-159 содержит последовательность, имеющую по меньшей мере 70%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности последовательности по отношению к SEQ ID NO: 6 или 132-159, где активный вариант не является SEQ ID NO: 160.
[0057] На фигуре 6 представлена взаимосвязь процента идентичности последовательности между SEQ ID NO: 6, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158 и 159.
[0058] Настоящее изобретение также относится к рекомбинантным или синтетическим нуклеиновым кислотам, кодирующим пестицидные полипептиды, представленные в настоящем описании. Особый интерес представляют последовательности нуклеиновой кислоты, сконструированные для экспрессии в интересующем растении. Например, последовательность нуклеиновой кислоты можно оптимизировать для повышения экспрессии в растении-хозяине. Пестицидный белок, представленный в настоящем описании, можно подвергать обратной трансляции для получения нуклеиновой кислоты, содержащей кодоны, оптимизированные для экспрессии в конкретном хозяине, например, сельскохозяйственной культуре. В другом варианте осуществления полинуклеотиды, кодирующие полипептиды, представленные в настоящем описании, можно оптимизировать для повышения экспрессии в трансформированном хозяине. Например, полинуклеотиды можно синтезировать с использованием предпочтительных для растения кодонов для улучшенной экспрессии. См. обсуждение использования предпочтительных для хозяина кодонов, например, в Campbell and Gowri (1990) Plant Physiol. 92:1-11. В этой области доступны способы синтеза предпочтительных для растений генов. См., например, патенты США №№ 5380831 и 5436391, и Murray et al. (1989) Nucleic Acids Res. 17:477-498, каждый из которых включен в настоящее описание путем ссылки. Экспрессия такой кодирующей последовательности трансформированным растением (например, двудольных или однодольным) будет приводить к получению пестицидного полипептида и придавать растению повышенную резистентность к вредителю. Рекомбинантные и синтетические молекулы нуклеиновой кислоты, кодирующие пестицидные белки по изобретению, не включают природную бактериальную последовательность, кодирующую белок.
[0059] "Рекомбинантный полинуклеотид" или "рекомбинантная нуклеиновая кислота" содержат комбинацию двух или более химически соединенных сегментов нуклеиновой кислоты, не обнаруживаемых напрямую связанными в природе. Термин "напрямую связанный" означает, что два сегмента нуклеиновой кислоты являются непосредственно смежными и соединены друг с другом химической связью. В конкретных вариантах осуществления рекомбинантный полинуклеотид содержит интересующий полинуклеотид или его вариант или фрагмент таким образом, что дополнительный, химически соединенный сегмент нуклеиновой кислоты находится в 5'-, 3'-направлении или внутри интересующего полинуклеотида. Альтернативно, химически соединенный сегмент нуклеиновой кислоты рекомбинантного полинуклеотида можно получать посредством делеции последовательности. Дополнительный химически соединенный сегмент нуклеиновой кислоты или последовательность, делетированная для присоединения соединенных сегментов нуклеиновой кислоты, может иметь любую длину, включая например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20 нуклеотидов или более. Различные способы получения таких рекомбинантных полинуклеотидов включают химический синтез и воздействие на выделенные сегменты полинуклеотидов способами генетической инженерии. В конкретных вариантах осуществления рекомбинантный полинуклеотид может содержать рекомбинантную последовательность ДНК или рекомбинантную последовательность РНК. "Фрагмент рекомбинантного полинуклеотида или нуклеиновой кислоты" содержит по меньшей мере один из комбинации двух или более химически соединенных аминокислотных сегментов, не обнаруживаемых напрямую связанными в природе.
[0060] Фрагменты полинуклеотида (РНК или ДНК) могут кодировать фрагменты белка, сохраняющие активность. В конкретных вариантах осуществления фрагмент рекомбинантного полинуклеотида или конструкция рекомбинантного полинуклеотида содержит по меньшей мере одно соединение двух или более химически соединенных или функционально связанных сегментов нуклеиновой кислоты, не обнаруживаемых напрямую связанными в природе. Фрагмент полинуклеотида, кодирующего биологически активную часть полипептида, сохраняющего пестицидную активность, будет кодировать по меньшей мере 25, 30, 40, 50, 60, 70, 75, 80, 90, 100, 110, 120, 125, 130, 140, 150, 160, 170, 175 или 180 смежных аминокислот или вплоть до общего количества аминокислот, присутствующих в полноразмерном полипептиде, приведенном в SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158 и/или 159. В конкретных вариантах осуществления такие полипептидные фрагменты являются активными фрагментами. В некоторых вариантах осуществления полипептидный фрагмент содержит рекомбинантный полипептидный фрагмент. В рамках изобретения фрагмент рекомбинантного полипептида содержит по меньшей мере один из комбинации двух или более химически соединенных аминокислотных сегментов, не обнаруживаемых напрямую связанными в природе.
[0061] В рамках изобретения термин "варианты" должен означать, по существу, схожие последовательности. В случае полинуклеотидов вариант содержит делецию и/или инсерцию одного или нескольких нуклеотидов в одном или нескольких внутренних участках в нативном полинуклеотиде и/или замену одного или нескольких нуклеотидов в одном или нескольких участках в нативном полинуклеотиде. В рамках изобретения "нативный" полинуклеотид или полипептид содержит природную нуклеотидную последовательность или аминокислотную последовательность, соответственно.
[0062] Варианты конкретного полинуклеотида по изобретению (т.е. референсный полинуклеотид) также можно оценивать посредством сравнения полипептида, кодируемого вариантом полинуклеотида, и полипептида, кодируемого референсным полинуклеотидом, для определения процента идентичности последовательности между ними двумя. Таким образом, например, описывают выделенный полинуклеотид, кодирующий полипептид с указанным процентом идентичности последовательности по отношению к полипептиду SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158 и/или 159. Процент идентичности последовательности между любыми двумя полипептидами можно вычислять с использованием программ для выравнивания последовательностей и параметров, описываемых где-либо в настоящем описании. Если любую указанную пару полинуклеотидов по изобретению оценивают посредством сравнения процента идентичности последовательности между двумя полипептидами, которые они кодируют, процент идентичности последовательности между двумя кодируемыми полипептидами составляет по меньшей мере приблизительно 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичности последовательности по отношению к SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158 и/или 159. В других вариантах осуществления вариант полинуклеотида, представленный в настоящем описании, отличается от нативной последовательности по меньшей мере на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более нуклеотидов.
iii. Сравнение последовательностей
[0063] В рамках изобретения термин "идентичность" или "процент идентичности" при использовании в отношении конкретной пары выровненных аминокислотных последовательностей относится к проценту идентичности аминокислотных последовательностей, получаемому посредством подсчета количества идентичных совпадений при выравнивании и разделения этого количества идентичных совпадений на длину выровненных последовательности. В рамках изобретения термин "сходство" или "процент сходства" при использовании в отношении конкретной пары выровненных аминокислотных последовательностей относится к сумме баллов, получаемых из матрицы замен для каждой пары аминокислот при выравнивании, разделенной на длину выровненных последовательностей.
[0064] Если не указано иначе, идентичность и сходство вычисляют посредством алгоритмов глобального выравнивания и подсчета Needleman-Wunsch (Needleman and Wunsch (1970) J. Mol. Biol. 48(3):443-453), включенных в программу "needle", распространяемую как часть пакета программ EMBOSS (Rice, P. Longden, I. and Bleasby, A., EMBOSS: The European Molecular Biology Open Software Suite, 2000, Trends in Genetics 16, (6) pp. 276-277, версии 6.3.1, доступные, помимо прочих источников, в EMBnet embnet.org/resource/emboss и emboss.sourceforge.net) с использованием штрафа за пропуск по умолчанию и матриц замен (EBLOSUM62 для белка и EDNAFULL для ДНК). Также можно использовать эквивалентные программы. Термин "эквивалентная программа" означает любую программу для сравнения последовательности, с помощью которой для любых двух интересующих последовательностей получают выравнивание, имеющее совпадения идентичных нуклеотидных остатков и идентичный процент идентичности последовательности при сравнении с соответствующим выравниванием, генерируемым с помощью Needle из EMBOSS версии 6.3.1.
[0065] В этой области известны дополнительные математические алгоритмы, и их можно использовать для сравнения двух последовательностей. См., например, алгоритм Karlin and Altschul (1990) Proc. Natl. Acad. Sci. USA 87:2264, модифицированный в Karlin and Altschul (1993) Proc. Natl. Acad. Sci. USA 90:5873-5877. Такой алгоритм встроен в программы BLAST по Altschul et al. (1990) J. Mol. Biol. 215:403. Поиски BLAST nucleotide можно осуществлять с использованием программы BLASTN, для получения нуклеотидных последовательностей, гомологичных пестицид-подобным молекулам нуклеиновой кислоты по изобретению. Поиски BLAST protein можно осуществлять с использованием программы BLASTP для получения аминокислотных последовательностей, гомологичных молекулам пестицидного белка по изобретению. Для получения выравнивания с пропусками в целях сравнения можно использовать Gapped BLAST (в BLAST 2.0), как описано в Altschul et al. (1997) Nucleic Acids Res. 25:3389. Альтернативно, можно использовать Psi-Blast для осуществления итеративного поиска, с помощью которого определяют отдаленную взаимосвязь между молекулами. См. Altschul et al. (1997), выше. При использовании программ BLAST, Gapped BLAST и Psi-Blast можно использовать параметры по умолчанию соответствующих программ (например, BLASTX и BLASTN). Выравнивание также можно осуществлять вручную посредством осмотра.
[0066] Две последовательности являются "оптимально выровненными", когда их выравнивают по баллам сходства с использованием определенной матрицы замен аминокислот (например, BLOSUM62), штрафа за пропуск и штрафа за удлинение пропуска для получения наибольших баллов, возможных для этой пары последовательностей. Матрицы замен аминокислот и их применение в количественном анализе сходства между двумя последовательностями хорошо известны в этой области и описаны, например, в Dayhoff et al. (1978) "A model of evolutionary change in proteins." в "Atlas of Protein Sequence and Structure," Vol. 5, Suppl. 3 (ed. M. O. Dayhoff), pp. 345-352. Natl. Biomed. Res. Found., Washington, D.C. и Henikoff et al. (1992) Proc. Natl. Acad. Sci. USA 89:10915-10919. Матрицу BLOSUM62 часто используют в качестве матрицы замен по умолчанию при выравнивании последовательностей. Штраф за пропуск налагается за включение пропуска в одну аминокислоту в одну из выровненных последовательностей, и штраф за удлинение пропуска налагается за каждое дополнительное пустое положение аминокислоты, включаемое в уже открытый пропуск. Выравнивание определяют по положениям аминокислот каждой последовательности, на которых выравнивание начинают и заканчивают и, необязательно, по включению пропуска или множества пропусков в одной или нескольких последовательностях таким образом, чтобы достигать наиболее высоких возможных баллов. Хотя оптимальное выравнивание и балльную оценку можно осуществлять вручную, способ облегчают с помощью компьютеризованного алгоритма выравнивания, такого как, например, gapped BLAST 2.0, описываемый в Altschul et al. (1997) Nucleic Acids Res. 25:3389-3402, и общедоступный на веб-сайте National Center for Biotechnology Information (www.ncbi.nlm.nih.gov). Оптимальные выравнивания, включая множественные выравнивания, можно осуществлять с использованием, например, PSI-BLAST, доступного на www.ncbi.nlm.nih.gov и описываемого Altschul et al. (1997) Nucleic Acids Res. 25:3389-3402.
[0067] Что касается аминокислотной последовательности, оптимально выравниваемой с референсной последовательностью, аминокислотный остаток "соответствует" положению в референсной последовательности, с которым остаток спаривают при выравнивании. "Положение" обозначают номером, последовательно идентифицирующим каждую аминокислоту в референсной последовательности с учетом его положения относительно N-конца. Например, в SEQ ID NO: 1 положение 1 представляет собой M, положение 2 представляет собой A, положение 3 представляет собой N и т.д. Когда тестовую последовательность оптимально выравнивают с SEQ ID NO: 1, остаток в тестовой последовательности, выравниваемый с N в положении 3, указывают как "соответствующий положению 3" SEQ ID NO: 1. Вследствие делеций, инсерций, укорочений, слияний и т.д. при определении оптимального выравнивания, в основном, необходимо учитывать номер аминокислотного остатка в тестовой последовательности, т.к. определение путем простого подсчета с N-конца не обязательно будет таким же, как номер его соответствующего положения в референсной последовательности. Например, в случае делеции в выровненной тестовой последовательности, не будет аминокислоты, соответствующей положению в референсной последовательности в месте делеции. Если есть инсерция в выровненной референсной последовательности, эта инсерция не будет соответствовать какому-либо положению аминокислоты в референсной последовательности. В случае укорочений или слияний могут быть тяжи аминокислот в референсной или выровненной последовательности, не соответствующих какой-либо аминокислоте в соответствующей последовательности.
iv. Антитела
[0068] Также включены антитела против полипептидов по настоящему изобретению или против их вариантов или фрагментов. Способы получения антител хорошо известны в этой области (см., например, Harlow and Lane (1988) Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y; и патент США № 4196265). Эти антитела можно использовать в наборах для детекции и выделения полипептидов-токсинов. Таким образом, настоящее изобретение относится к наборам, содержащим антитела, специфически связывающиеся с полипептидами, представленными в настоящем описании, включая, например, полипептиды, имеющие последовательность SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158 и/или 159.
II. Вредители
[0069] Композиции и способы, представленные в настоящем описании, применимы против множества вредителей. "Вредители" включают, в качестве неограничивающих примеров, насекомых, грибы, бактерии, нематоды, акариды, простейшие-патогены, печеночные двуустки, паразитирующие на животных, и т.п. Особенно интересующими вредителями являются насекомые-вредители, в частности, насекомые-вредители, вызывающие значительное повреждение сельскохозяйственных растений. Насекомые-вредители включают насекомых, выбранных из отрядов Coleoptera, Diptera, Hymenoptera, Lepidoptera, Mallophaga, Homoptera, Hemiptera, Orthroptera, Thysanoptera, Dermaptera, Isoptera, Anoplura, Siphonaptera, Trichoptera или нематод. В неограничивающих вариантах осуществления насекомое-вредитель включает западного кукурузного жука, Diabrotica virgifera virgifera; совку травяную, Spodoptera frugiperda; колорадского жука, Leptinotarsa decemlineata; совку хлопковую, Helicoverpa zea (в Северной Америке некоторые виды атакуют хлопок и называются коробочным червем); мотылька кукурузного, Ostrinia nubilalis; совку-ипсилон, Agrotis ipsilon; моль капустную, Plutella xylostella; совку бархатных бобов, Anticarsia gemmatalis; огневку кукурузную юго-западную, Diatraea grandiosella; коробочного червя, Helicoverpa armigera (обнаруживаемые по всему миру за пределами США); зеленого овощного клопа, Nezara viridula; зеленого щитника, Chinavia halaris; коричневого мраморного щитника, Halyomorpha halys; и коричневого щитника, Euschistus servus. В других вариантах осуществления вредитель включает нематоду, включая, в качестве неограничивающих примеров, Meloidogyne hapla (северную галловую нематоду); Meloidogyne enterolobii, Meloidogyne arenaria (арахисовую галловую нематоду) и Meloidogyne javanica.
[0070] В рамках изобретения термин "насекомые-вредители" относится к насекомым и другим схожим вредителям, таким как, например, из отряда Acari, включая в качестве неограничивающих примеров, клещей и иксодовых клещей. Насекомые-вредители по настоящему изобретению включают, в качестве неограничивающих примеров, насекомых отряда Lepidoptera, например Achoroia grisella, Acleris gloverana, Acleris variana, Adoxophyes orana, Agrotis ipsilon, Alabama argillacea, Alsophila pometaria, Amyelois transitella, Anagasta kuehniella, Anarsia lineatella, Anisota senatoria, Antheraea pernyi, Anticarsia gemmatalis, Archips sp., Argyrotaenia sp., Athetis mindara, Bombyx mori, Bucculatrix thurberiella, Cadra cautella, Choristoneura sp., Cochylls hospes, Colias eurytheme, Corcyra cephalonica, Cydia latiferreanus, Cydia pomonella, Datana integerrima, Dendrolimus sibericus, Desmia funeralis, Diaphania hyalinata, Diaphania nitidalis, Diatraea grandiosella, Diatraea saccharalis, Ennomos subsignaria, Eoreuma loftini, Esphestia elutella, Erannis tilaria, Estigmene acrea, Eulia salubricola, Eupocoellia ambiguella, Eupoecilia ambiguella, Euproctis chrysorrhoea, Euxoa messoria, Galleria mellonella, Grapholita molesta, Harrisina americana, Helicoverpa subflexa, Helicoverpa zea, Heliothis virescens, Hemileuca oliviae, Homoeosoma electellum, Hyphantia cunea, Keiferia lycopersicella, Lambdina fiscellaria fiscellaria, Lambdina fiscellaria lugubrosa, Leucoma salicis, Lobesia botrana, Loxostege sticticalis, Lymantria dispar, Macalla thyrisalis, Malacosoma sp., Mamestra brassicae, Mamestra configurata, Manduca quinquemaculata, Manduca sexta, Maruca testulalis, Melanchra picta, Operophtera brumata, Orgyia sp., Ostrinia nubilalis, Paleacrita vernata, Papilio cresphontes, Pectinophora gossypiella, Phryganidia californica, Phyllonorycter blancardella, Pieris napi, Pieris rapae, Plathypena scabra, Platynota flouendana, Platynota stultana, Platyptilia carduidactyla, Plodia interpunctella, Plutella xylostella, Pontia protodice, Pseudaletia unipuncta, Pseudoplasia includens, Sabulodes aegrotata, Schizura concinna, Sitotroga cerealella, Spilonta ocellana, Spodoptera sp., Thaurnstopoea pityocampa, Tinsola bisselliella, Trichoplusia hi, Udea rubigalis, Xylomyges curiails и Yponomeuta padella.
[0071] Насекомые-вредители также включают насекомых, выбранных из отрядов Diptera, Hymenoptera, Lepidoptera, Mallophaga, Homoptera, Hemiptera, Orthroptera, Thysanoptera, Dermaptera, Isoptera, Anoplura, Siphonaptera, Trichoptera, Coleoptera.
[0072] Насекомые-вредители основных сельскохозяйственных культур включают, в качестве неограничивающих примеров: Кукуруза: Ostrinia nubilalis, мотылек кукурузный; Agrotis ipsilon, совка-ипсилон; Helicoverpa zeae, совка хлопковая; Spodoptera frugiperda, совка травяная; Diatraea grandiosella, огневка кукурузная юго-западная; Elasmopalpus lignosellus, малый мотылек кукурузный; Diatraea saccharalis, тростниковая огневка; западный кукурузный жук, например, Diabrotica virgifera virgifera; северный кукурузный жук, например, Diabrotica longicornis barberi; южный кукурузный жук, например, Diabrotica undecimpunctata howardi; Melanotus spp., проволочники; Cyclocephala borealis, северный масковый хрущ (личинка хруща); Cyclocephala immaculata, южный масковый хрущ (личинка хруща); Popillia japonica, хрущик японский; Chaetocnema pulicaria, земляная кукурузная блошка; Sphenophorus maidis, долгоносик кукурузный; Rhopalosiphum maidis, тля кукурузная листовая; Anuraphis maidiradicis, тля кукурузная корневая; Blissus leucopterus leucopterus, клоп-черепашка пшеничный североамериканский; Melanoplus femurrubrum, краснобедрая кобылка; Melanoplus sanguinipes, мигрирующий кузнечик; Hylemya platura, личинка мухи ростковой; Agromyza parvicornis, минирующая мушка; Anaphothrips obscrurus, трипс злаковый; Solenopsis milesta, муравей-вор; Tetranychus urticae, клещик паутинный двупятнистый; Сорго: Chilo partellus, огневка-травянка; Spodoptera frugiperda, совка травяная; Helicoverpa zea, совка хлопковая; Elasmopalpus lignosellus, малый мотылек кукурузный; Feltia subterranea, granulate cutworm; Phyllophaga crinita, личинка хруща; Eleodes, Conoderus и Aeolus spp., проволочники; Oulema melanopus, пьявица красногрудая; Chaetocnema pulicaria, земляная кукурузная блошка; Sphenophorus maidis, долгоносик кукурузный; Rhopalosiphum maidis; тля кукурузная листовая; Sipha flava, желтая тля сахарного тростника; клоп-черепашка пшеничный североамериканский, например, Blissus leucopterus leucopterus; Contarinia sorghicola, галлица сорговая; Tetranychus cinnabarinus, красный паутинный клещ; Tetranychus urticae, клещ двупятнистый паутинный; Пшеница: Pseudaletia unipunctata, походный червь; Spodoptera frugiperda, совка травяная; Elasmopalpus lignosellus, малый мотылек кукурузный; Agrotis orthogonia, совка прямоугольная; Elasmopalpus lignosellus, малый мотылек кукурузный; Oulema melanopus, пьявица красногрудая; Hypera punctata, слоник листовой бобовый; южный кукурузный жук, например, Diabrotica undecimpunctata howardi; русская пшеничная тля; Schizaphis graminum, тля злаковая обыкновенная; Macrosiphum avenae, тля листовая; Melanoplus femurrubrum, краснобедрая кобылка; Melanoplus differentialis, кобылка отличительная; Melanoplus sanguinipes, мигрирующий кузнечик; Mayetiola destructor, гессенская мушка; Sitodiplosis mosellana, wheat midge; Meromyza americana, личинка американской меромизы; Hylemya coarctata, муха озимая; Frankliniella fusca, американский табачный трипс; Cephus cinctus, пилильщик хлебный американский; Aceria tulipae, луковичный клещ тюльпанов; Подсолнечник: Cylindrocupturus adspersus, sunflower stem weevil; Smicronyx fulus, красный долгоносик подсолнечника; Smicronyx sordidus, серый долгоносик подсолнечника; Suleima helianthana, листовертка подсолнечника; Homoeosoma electellum, огневка подсолнечниковая; Zygogramma exclamationis, совка подсолнечниковая восклицательная; Bothyrus gibbosus, жук морковный; Neolasioptera murtfeldtiana, галлица подсолнечниковая; Хлопок: Heliothis virescens, табачная листовертка; Helicoverpa zea, коробочный червь; Spodoptera exigua, совка малая; Pectinophora gossypiella, розовый коробочный червь; долгоносик хлопковый, например, Anthonomus grandis; Aphis gossypii, тля хлопковая; Pseudatomoscelis seriatus, слепняк хлопковый; Trialeurodes abutilonea, белокрылка окаймленная; Lygus lineolaris, клоп луговой; Melanoplus femurrubrum, краснобедрая кобылка; Melanoplus differentialis, кобылка отличительная; Thrips tabaci, трипс луковый; Franklinkiella fusca, табачный трипс; Tetranychus cinnabarinus, красный паутинный клещ; Tetranychus urticae, клещик двупятнистый паутинный; Рис: Diatraea saccharalis, огневка сахарного тростника; Spodoptera frugiperda, совка травяная; Helicoverpa zea, совка хлопковая; Colaspis brunnea, grape colaspis; Lissorhoptrus oryzophilus, долгоносик рисовый водяной; Sitophilus oryzae, долгоносик рисовый; Nephotettix nigropictus, рисовая цикадка; клоп-черепашка пшеничный североамериканский, например, Blissus leucopterus leucopterus; Acrosternum hilare, зеленый овощной клоп; Соя: Pseudoplusia includens, соевая совка; Anticarsia gemmatalis, совка бархатных бобов; Plathypena scabra, совка клеверная; Ostrinia nubilalis, мотылек кукурузный; Agrotis ipsilon, совка-ипсилон; Spodoptera exigua, совка малая; Heliothis virescens, табачная листовертка; Helicoverpa zea, коробочный червь; Epilachna varivestis, зерновка бобовая мексиканская; Myzus persicae, тля персиковая зеленая; Empoasca fabae, цикадка картофельная; Acrosternum hilare, зеленый овощной клоп; Melanoplus femurrubrum, краснобедрая кобылка; Melanoplus differentialis, кобылка отличительная; Hylemya platura, личинка мухи ростковой; Sericothrips variabilis, соевый трипс; Thrips tabaci, трипс луковый; Tetranychus turkestani, клещик паутинный атлантический; Tetranychus urticae, клещик двупятнистый паутинный; Ячмень: Ostrinia nubilalis, мотылек кукурузный; Agrotis ipsilon, совка-ипсилон; Schizaphis graminum, тля злаковая обыкновенная; клоп-черепашка пшеничный североамериканский, например, Blissus leucopterus leucopterus; Acrosternum hilare, зеленый овощной клоп; Euschistus servus, коричневый щитник; Hylemya platura, личинка мухи ростковой; Mayetiola destructor, гессенская мушка; Petrobia latens, петробия многоядная; Рапс: Vrevicoryne brassicae, тля капустная; Phyllotreta cruciferae, блошка крестоцветная; Phyllotreta striolata, блошка полосатая; Phyllotreta nemorum, блошка земляная светлоногая; Meligethes aeneus, рапсовый цветоед; и рапсовые цветоеды Meligethes rufimanus, Meligethes nigrescens, Meligethes canadianus, и Meligethes viridescens; Картофель: Leptinotarsa decemlineata, колорадский жук.
[0073] Способы и композиции, представленные в настоящем описании, могут являться эффективными против Hemiptera, таких как Lygus hesperus, Lygus lineolaris, Lygus pratensis, Lygus rugulipennis Popp, Lygus pabulinus, Calocoris norvegicus, Orthops compestris, Plesiocoris rugicollis, Cyrtopeltis modestus, Cyrtopeltis notatus, Spanagonicus albofasciatus, Diaphnocoris chlorinonis, Labopidicola allii, Pseudatomoscelis seriatus, Adelphocoris rapidus, Poecilocapsus lineatus, Blissus leucopterus, Nysius ericae, Nysius raphanus, Euschistus servus, Nezara viridula, Eurygaster, Coreidae, Pyrrhocoridae, Tinidae, Blostomatidae, Reduviidae и Cimicidae. Интересующие вредители также включают Araecerus fasciculatus, ложнослоника кофейного; Acanthoscelides obtectus, зерновку фасолевую; Bruchus rufmanus, зерновку бобовую; Bruchus pisorum, зерновку гороховую; Zabrotes subfasciatus, зерновку бобовую мексиканскую; Diabrotica balteata, блошку окаймленную; Cerotoma trifurcata, жука-листоеда; Diabrotica virgifera, мексиканского кукурузного жука; Epitrix cucumeris, блошку картофельную; Chaetocnema confinis, блошка бататная; Hypera postica, долгоносика люцернового; Anthonomus quadrigibbus, цветоеда яблонного четырехбугорчатого; Sternechus paludatus, долгоносика стеблевого бобового; Hypera brunnipennis, долгоносика египетского люцернового; Sitophilus granaries, долгоносика амбарного; Craponius inaequalis, долгоносика виноградного; Sitophilus zeamais, кукурузного долгоносика; Conotrachelus nenuphar, долгоносика сливового; Euscepes postfaciatus, западно-индийской блошки бататной; Maladera castanea, хрущика азиатского садового; Rhizotrogus majalis, хруща европейского; Macrodactylus subspinosus, бронзовку золотистую; Tribolium confusum, хрущака малого мучного; Tenebrio obscurus, хрущака темного; Tribolium castaneum, хрущака каштанового; Tenebrio molitor, мучного хрущака большого.
[0074] Нематоды включают паразитарных нематод, таких как галловые, цистообразующие и ранящие нематоды, включая Heterodera spp., Meloidogyne spp. и Globodera spp.; в частности, членов цистообразующих нематод, включая, в качестве неограничивающих примеров, Heterodera glycines (соевую цистообразующую нематоду); Heterodera schachtii (свекловичную нематоду); Heterodera avenae (овсяную нематоду); и Globodera rostochiensis и Globodera pailida (картофельные нематоды). Ранящие нематоды включают Pratylenchus spp.
[0075] Насекомых-вредителей можно тестировать на пестицидную активность композиций по изобретению на ранних стадиях развития, например, личинки или другие незрелые формы. Насекомых можно держать в полной темноте при от приблизительно 20°C до приблизительно 30°C и при относительной влажности от приблизительно 30% до приблизительно 70%. Можно осуществлять биологические анализы, как описано в Czapla and Lang (1990) J. Econ. Entomol. 83 (6): 2480-2485. См., также раздел "Примеры" в настоящем описании.
III. Экспрессирующие кассеты
[0076] Полинуклеотиды, кодирующие пестицидные белки, представленные в настоящем описании, можно предоставлять в экспрессирующих кассетах для экспрессии в интересующем организме. Кассета будет включать 5'- и 3'-регуляторные последовательности, функционально связанные с полинуклеотидом, кодирующим пестицидный полипептид, представленный в настоящем описании, что делает возможной экспрессию полинуклеотида. Кассета дополнительно может содержать по меньшей мере один дополнительный ген или генетический элемент, подлежащий котрансформации в организм. При включении дополнительных генов или элементов компоненты являются функционально связанными. Альтернативно, дополнительные гены или элементы можно предоставлять на множестве экспрессирующих кассет. Такую экспрессирующую кассету получают с множеством участков рестрикции и/или участков рекомбинации для инсерции полинуклеотидов, подлежащих транскрипционной регуляции регуляторных областей. Экспрессирующая кассета дополнительно может содержать ген селективного маркера.
[0077] Экспрессирующая кассета будет включать в 5'-3'-направлении транскрипции область инициации транскрипции и трансляции (т.е. промотор), пестицидный полинуклеотид по изобретению и область терминации транскрипции и трансляции (т.е. область терминации), функциональные в интересующем организме, т.е. растении или бактериях. Промоторы по изобретению могут направлять или регулировать экспрессию кодирующей последовательности в клетке-хозяине. Регуляторные области (т.е. промоторы, области регуляции транскрипции и области терминации трансляции) могут являться эндогенными или гетерологичными клетке-хозяину или друг другу. В рамках изобретения "гетерологичной" по отношению к последовательности является последовательность, происходящая из другого биологического вида или, если она получена из того же вида, то, по существу, преднамеренно модифицированная человеком из своей нативной формы в композицию и/или геномный локус. В рамках изобретения химерный ген содержит кодирующую последовательность, функционально связанную с областью инициации транскрипции, гетерологичной кодирующей последовательности.
[0078] Подходящие области терминации доступны в Ti-плазмиде A. tumefaciens, такие как области терминации октопинсинтазы и нопалинсинтазы. См. также Guerineau et al. (1991) Mol. Gen. Genet. 262:141-144; Proudfoot (1991) Cell 64:671-674; Sanfacon et al. (1991) Genes Dev. 5:141-149; Mogen et al. (1990) Plant Cell 2:1261-1272; Munroe et al. (1990) Gene 91:151-158; Ballas et al. (1989) Nucleic Acids Res. 17:7891-7903; и Joshi et al. (1987) Nucleic Acids Res. 15:9627-9639.
[0079] Дополнительные регуляторные сигналы включают, в качестве неограничивающих примеров, участки инициации транскрипции, операторы, активаторы, энхансеры, другие регуляторные элементы, участки связывания рибосомы, инициаторный кодон, сигналы терминации и т.п. См., например, патенты США №№ 5039523 и 4853331; EPO 0480762A2; Sambrook et al. (1992) Molecular Cloning: A Laboratory Manual, ed. Maniatis et al. (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.) (далее в настоящем описании "Sambrook 11"); Davis et al., eds. (1980) Advanced Bacterial Genetics (Cold Spring Harbor Laboratory Press), Cold Spring Harbor, N.Y., и цитируемые в них ссылки.
[0080] При получении экспрессирующей кассеты различные фрагменты ДНК можно обрабатывать таким образом, чтобы получать последовательности ДНК в правильной ориентации и, при необходимости, в правильной рамке считывания. С этой целью можно использовать адаптеры или линкеры для соединения фрагментов ДНК или можно включать другие манипуляции для получения подходящих участков рестрикции, удаления лишней ДНК, удаления участков рестрикции или т.п. С этой целью можно включать мутагенез in vitro, репарацию с помощью праймеров, рестрикцию, отжиг, повторные замены, например, транзиции и трансверзии.
[0081] В практическом осуществлении изобретения можно использовать ряд промоторов. Промоторы можно выбирать с учетом желаемого результата. Нуклеиновые кислоты можно комбинировать с конститутивными, индуцибельными, ткане-предпочтительными или другими промоторами для экспрессии в интересующем организме. См., например, промоторы, приведенные в WO 99/43838 и в патентах США №№: 8575425; 7790846; 8147856; 8,586832; 7772369; 7534939; 6072050; 5659026; 5608149; 5608144; 5604121; 5569597; 5466785; 5399680; 5268463; 5608142 и 6177611; включенных в настоящее описание путем ссылки.
[0082] В случае экспрессии в растениях конститутивные промоторы также включают промотор CaMV 35S (Odell et al. (1985) Nature 313:810-812); актина риса (McElroy et al. (1990) Plant Cell 2:163-171); убиквитина (Christensen et al. (1989) Plant Mol. Biol. 12:619-632 и Christensen et al. (1992) Plant Mol. Biol. 18:675-689); pEMU (Last et al. (1991) Theor. Appl. Genet. 81:581-588); MAS (Velten et al. (1984) EMBO J. 3:2723-2730). Индуцибельные промоторы включают промоторы, регулирующие экспрессию связанных с патогенезом белков (белков PR), индуцируемых после инфицирования патогеном. См., например, Redolfi et al. (1983) Neth. J. Plant Pathol. 89:245-254; Uknes et al. (1992) Plant Cell 4:645-656; и Van Loon (1985) Plant Mol. Virol. 4:111-116; и WO 99/43819, каждый из которых включен в настоящее описание путем ссылки. Также можно использовать промоторы, экспрессируемые локально или вблизи участка патогенной инфекции (Marineau et al. (1987) Plant Mol. Biol. 9:335-342; Matton et al. (1989) Molecular Plant-Microbe Interactions 2:325-331; Somsisch et al. (1986) Proc. Natl. Acad. Sci. USA 83:2427-2430; Somsisch et al. (1988) Mol. Gen. Genet. 2:93-98; и Yang (1996) Proc. Natl. Acad. Sci. USA 93:14972-14977; Chen et al. (1996) Plant J. 10:955-966; Zhang et al. (1994) Proc. Natl. Acad. Sci. USA 91:2507-2511; Warner et al. (1993) Plant J. 3:191-201; Siebertz et al. (1989) Plant Cell 1:961-968; Cordero et al. (1992) Physiol. Mol. Plant Path. 41:189-200; патент США № 5750386 (нематодо-индуцибельные); и цитируемые в них ссылки).
[0083] В конструкциях по изобретению можно использовать повреждение-индуцибельные промоторы. Такие повреждение-индуцибельные промоторы включают промотор pin II (Ryan (1990) Ann. Rev. Phytopath. 28:425-449; Duan et al. (1996) Nature Biotechnology 14:494-498); wun1 и wun2 (патент США № 5428148); win1 и win2 (Stanford et al. (1989) Mol. Gen. Genet. 215:200-208); системина (McGurl et al. (1992) Science 225:1570-1573); WIP1 (Rohmeier et al. (1993) Plant Mol. Biol. 22:783-792; Eckelkamp et al. (1993) FEBS Letters 323:73-76); гена MPI (Corderok et al. (1994) Plant J. 6(2):141-150); и т.п., включенных в настоящее описание путем ссылок.
[0084] Ткане-предпочтительные промоторы для использования в изобретении включают приведенные в Yamamoto et al. (1997) Plant J. 12(2):255-265; Kawamata et al. (1997) Plant Cell Physiol. 38(7):792-803; Hansen et al. (1997) Mol. Gen Genet. 254(3):337-343; Russell et al. (1997) Transgenic Res. 6(2):157-168; Rinehart et al. (1996) Plant Physiol. 112(3):1331-1341; Van Camp et al. (1996) Plant Physiol. 112(2):525-535; Canevascini et al. (1996) Plant Physiol. 112(2):513-524; Yamamoto et al. (1994) Plant Cell Physiol. 35(5):773-778; Lam (1994) Results Probl. Cell Differ. 20:181-196; Orozco et al. (1993) Plant Mol Biol. 23(6):1129-1138; Matsuoka et al. (1993) Proc Natl. Acad. Sci. USA 90(20):9586-9590; и Guevara-Garcia et al. (1993) Plant J. 4(3):495-505.
[0085] Предпочтительные для листьев промоторы включают приведенные в Yamamoto et al. (1997) Plant J. 12(2):255-265; Kwon et al. (1994) Plant Physiol. 105:357-67; Yamamoto et al. (1994) Plant Cell Physiol. 35(5):773-778; Gotor et al. (1993) Plant J. 3:509-18; Orozco et al. (1993) Plant Mol. Biol. 23(6):1129-1138; и Matsuoka et al. (1993) Proc. Natl. Acad. Sci. USA 90(20):9586-9590.
[0086] Известны предпочтительные для корней промоторы, и они включают описываемые в Hire et al. (1992) Plant Mol. Biol. 20(2):207-218 (специфический для корня сои ген глутаминсинтетазы); Keller and Baumgartner (1991) Plant Cell 3(10):1051-1061 (корне-специфический контрольный элемент); Sanger et al. (1990) Plant Mol. Biol. 14(3):433-443 (ген маннопинсинтазы (MAS) Agrobacterium tumefaciens); и Miao et al. (1991) Plant Cell 3(1):11-22 (цитозольная глутаминсинтетаза (GS)); Bogusz et al. (1990) Plant Cell 2(7):633-641; Leach and Aoyagi (1991) Plant Science (Limerick) 79(1):69-76 (rolC и rolD); Teeri et al. (1989) EMBO J. 8(2):343-350; Kuster et al. (1995) Plant Mol. Biol. 29(4):759-772 (промотор гена VfENOD-GRP3); и Capana et al. (1994) Plant Mol. Biol. 25(4):681-691 (промотор rolB). См. также патенты США №№ 5837876; 5750386; 5633363; 5459252; 5401836; 5110732 и 5023179.
[0087] "Семя-предпочтительные" промоторы включают "семя-специфические" промоторы (промоторы, активные в течение развития семян, такие как промоторы запасных белков семян), а также промоторы "прорастания семян" (промоторы, активные в течение прорастания семян). См. Thompson et al. (1989) BioEssays 10:108. Семя-предпочтительные промоторы включают, в качестве неограничивающих примеров, Cim1 (цитокинин-индуцируемая передача сигнала); cZ19B1 (зеин кукурузы массой 19 кДа); milps (миоинозитол-1-фосфатсинтетаза) (см. WO 00/11177 и патент США № 6225529). Гамма-зеин имеет эндосперм-специфический промотор. Глобулин 1 (Glb-1) имеет типичный эмбрио-специфический промотор. В случае двудольных растений семя-специфические промоторы включают, в качестве неограничивающих примеров, промоторы β-фазеолина фасоли, напина, β-конглицина, лектина сои, круциферина и т.п. В случае однодольных растений семя-специфические промоторы включают, в качестве неограничивающих примеров, промоторы зеина кукурузы массой 15 кДа, зеина массой 22 кДа, зеина массой 27 кДа, гамма-зеина, waxy, shrunken 1, shrunken 2, глобулина 1, и т.д. См. также WO 00/12733, где описывают семя-предпочтительные промоторы генов end1 и end2.
[0088] Что касается экспрессии в бактериальном хозяине, промоторы, функционирующие в бактериях, хорошо известны в этой области. Такие промоторы включают любой из промоторов генов кристаллических белков, включая промоторы любого из пестицидных белков по изобретению, и промоторы, специфические для сигма-факторов B. thuringiensis. Альтернативно, промоторы подвергнутых мутагенезу или рекомбинантных генов, кодирующих кристаллические белки, можно рекомбинантно конструировать и использовать для стимуляции экспрессии новых сегментов генов, представленных в настоящем описании.
[0089] Экспрессирующая кассета также может содержать ген селективного маркера для селекции трансформированных клеток. Гены селективных маркеров используют для селекции трансформированных клеток или тканей. Маркерные гены включают гены, кодирующие резистентность к антибиотикам, такие как гены, кодирующие неомицинфосфотрансферазу II (NEO) и гигромицинфосфотрансферазу (HPT), а также гены, придающие резистентность к гербицидным соединениям, таким как глуфосинат аммония, бромоксинил, имидазолиноны и 2,4-дихлорфеноксиацетат (2,4-D). Известны дополнительные селективные маркеры, и можно использовать любой из них. См., например, предварительную патентную заявку США № 62/094697, зарегистрированную 19 декабря 2014 года, включенную в настоящее описание путем ссылки в полном объеме, в которой описывают последовательности резистентности к глуфосинату, которые можно использовать в качестве селективных маркеров.
IV. Способы, клетки-хозяева и растительные клетки
[0090] Как указано, конструкции ДНК, содержащие нуклеотидные последовательности, кодирующие пестицидные белки или их активные варианты или фрагменты, можно использовать для трансформации интересующих растений или других интересующих организмов. Способы трансформации включают встраивание нуклеотидной конструкции в растение. Термин "встраивание" означает встраивание нуклеотидной конструкции в растение или другую клетку-хозяина таким образом, что конструкция получает доступ внутрь клетки растения или клетки-хозяина. В способах по изобретению не требуется конкретный способ встраивания нуклеотидной конструкции в растение или клетку-хозяина, лишь то, что нуклеотидная конструкция получает доступ внутрь по меньшей мере одной клетки растения или организма-хозяина. В этой области известны способы встраивания нуклеотидных конструкций в растения и другие клетки-хозяева, включая, в качестве неограничивающих примеров, способы стабильной трансформации, способы транзиторной трансформации и вирус-опосредованные способы.
[0091] С помощью способов получают трансформированные организмы, такие как растение, включая целые растения, а также органы растений (например, листья, стебли, корни и т.д.), их семена, растительные клетки, ростки, эмбрионы и потомство. Растительные клетки могут являться дифференцированными или недифференцированными (например, каллюс, клетки суспензионной культуры, протопласты, клетки листьев, клетки корней, клетки флоэмы, пыльцу).
[0092] Термины "трансгенные растения", "трансформированные растения" или "стабильно трансформированные" растения, клетки или ткани относится к растениям, имеющим встроенный или интегрированный полинуклеотид, кодирующий по меньшей мере один пестицидный полипептид по изобретению. Установлено, что другие экзогенные или эндогенные последовательности нуклеиновой кислоты или фрагменты ДНК также можно встраивать в растительную клетку. Agrobacterium-опосредованная и биолистическая трансформация остаются двумя преимущественно используемыми подходами. Однако трансформацию можно осуществлять посредством инфицирования, трансфекции, микроинъекции, электропорации, микропроекции, биолистики или бомбардировки частицами, электропорации, с помощью волокон диоксида кремния/углерода, ультразвуковым способом, PEG-опосредованным способом, совместным осаждением фосфатом кальция, способом с использованием поликатиона DMSO, способом с использованием DEAE-декстрана, Agrobacterium-опосредованным и вирус-опосредованным способом (колимовирусы, геминивирусы, РНК-вирусы растений), липосомо-опосредованным способом и т.п.
[0093] Способы трансформации, а также способы встраивания полипептидов или полинуклеотидных последовательностей в растения могут варьироваться в зависимости от типа растения или растительной клетки, т.е. однодольного или двудольного, подлежащих трансформации. Способы трансформации известны в этой области и включают приведенные в патентах США №№: 8575425; 7692068; 8802934 и 7541517; каждый из которых включен в настоящее описание путем ссылки. См., также, Rakoczy-Trojanowska, M. (2002) Cell Mol Biol Lett. 7:849-858; Jones et al. (2005) Plant Methods 1:5; Rivera et al. (2012) Physics of Life Reviews 9:308-345; Bartlett et al. (2008) Plant Methods 4:1-12; Bates, G.W. (1999) Methods in Molecular biology 111:359-366; Binns and Thomashow (1988) Annual Reviews in Microbiology 42:575-606; Christou, P. (1992) The Plant Journal 2:275-281; Christou, P. (1995) Euphytica 85:13-27; Tzfira et al. (2004) TRENDS in Genetics 20:375-383; Yao et al. (2006) Journal of Experimental Botany 57:3737-3746; Zupan and Zambryski (1995) Plant Physiology 107:1041-1047; и Jones et al. (2005) Plant Methods 1:5.
[0094] Трансформация может приводить к стабильному или транзиторному встраиванию нуклеиновой кислоты в клетку. Термин "стабильная трансформация" означает, что нуклеотидная конструкция, встраиваемая в клетку-хозяина, интегрируется в геном клетки-хозяина и способна наследоваться его потомством. Термин "транзиторная трансформация" означает, что полинуклеотид встраивают в клетку-хозяина, но он не интегрируется в геном клетки-хозяина.
[0095] В этой области известны способы трансформации хлоропластов. См., например, Svab et al. (1990) Proc. Natl. Acad. Sci. USA 87:8526-8530; Svab and Maliga (1993) Proc. Natl. Acad. Sci. USA 90:913-917; Svab and Maliga (1993) EMBO J. 12:601-606. Способ основан на доставке ДНК, содержащей селективный маркер, с помощью генной пушки и направления ДНК в пластидный геном посредством гомологичной рекомбинации. Кроме того, трансформацию пластид можно осуществлять посредством трансактивации молчащего трансгена пластидного происхождения посредством ткане-предпочтительной экспрессии кодируемой в ядре и направляемой пластидами РНК-полимеразы. Такую систему описывают в McBride et al. (1994) Proc. Natl. Acad. Sci. USA 91:7301-7305.
[0096] Трансформированные клетки можно выращивать в растениях общепринятыми способами. См., например, McCormick et al. (1986) Plant Cell Reports 5:81-84. Эти растения затем можно выращивать и опылять той же трансформированной линией или другой линией и идентифицировать полученный гибрид, имеющий конститутивную экспрессию желаемых фенотипических характеристик. Можно выращивать два или более поколения для обеспечения стабильного поддержания и наследования экспрессии желаемой фенотипической характеристики, а затем собирать семена для подтверждения достижения экспрессии желаемой фенотипической характеристики. Таким образом, настоящее изобретение относится к трансформированным семенам (также обозначаемым как "трансгенные семена"), имеющим нуклеотидную конструкцию по изобретению, например, экспрессирующую кассету по изобретению, стабильно встроенную в их геном.
[0097] В конкретных вариантах осуществления последовательности, представленные в настоящем описании, можно направлять в конкретный участок в геноме клетки-хозяина или растительной клетки. Такие способы включают, в качестве неограничивающих примеров, мегануклеазы, сконструированные против интересующей растительной геномной последовательности (D'Halluin et al. 2013 Plant Biotechnol J); CRISPR-Cas9, TALEN и другие технологии для точного редактирования геномов (Feng, et al. Cell Research 23:1229-1232, 2013, Podevin, et al. Trends Biotechnology, публикация он-лайн, 2013, Wei et al., J Gen Genomics, 2013, Zhang et al (2013) WO 2013/026740); сайт-специфическую рекомбинацию Cre-lox (Dale et al. (1995) Plant J 7:649-659; Lyznik, et al. (2007) Transgenic Plant J 1:1-9; рекомбинацию FLP-FRT (Li et al. (2009) Plant Physiol 151:1087-1095); Bxb1-опосредованное встраивание (Yau et al. Plant J (2011) 701:147-166); встраивание, опосредованное цинковыми пальцами (Wright et al. (2005) Plant J 44:693-705); Cai et al. (2009) Plant Mol Biol 69:699-709) и гомологичную рекомбинацию (Lieberman-Lazarovich and Levy (2011) Methods Mol Biol 701: 51-65); Puchta (2002) Plant Mol Biol 48:173-182).
[0098] Последовательность, представленную в настоящем описании, можно использовать для трансформации любого вида растений, включая, в качестве неограничивающих примеров, однодольные и двудольные. Неограничивающие примеры интересующих растений включают кукурузу, сорго, пшеницу, подсолнечник, томат, крестоцветные растения, перцы, картофель, хлопок, рис, сою, сахарную свеклу, сахарный тростник, табак, ячмень и рапс, Brassica sp., люцерну, рожь, просо, сафлор, арахис, батат, маниок, кофе, кокос, ананас, цитрусовые, какао, чай, банан, авокадо, инжир, гуаву, манго, оливу, папайю, кешью, макадамию, миндаль, овес, овощи, декоративные растения и хвойные растения.
[0099] Овощи включают, в качестве неограничивающих примеров, томат, салат-латук, зеленую фасоль, лимскую фасоль, горох и членов рода Curcumis, таких как огурец, канталупа и мускусная дыня. Декоративные растения включают, в качестве неограничивающих примеров, азалию, гортензию, гибискус, розы, тюльпаны, нарциссы, петунии, гвоздики, пуансеттию и хризантему. Предпочтительно, растения по настоящему изобретению являются сельскохозяйственными культурами (например, кукурузой, сорго, пшеницей, подсолнечником, томатом, крестоцветными растениями, перцами, картофелем, хлопком, рисом, соей, сахарной свеклой, сахарным тростником, табаком, ячменем, рапсом и т.д.).
[0100] В рамках изобретения термин "растение" включает растительные клетки, протопласты растений, культуры клеток растительных тканей, из которых можно регенерировать растения, растительный каллюс, сгустки растительного материала и растительные клетки, интактные в растениях или частях растений, таких как эмбрионы, пыльца, семязачатки, семена, листья, цветы, ветви, плоды, зерна, початки, стержни початков, мякину, стебли, корни, кончики корней, пыльники и т.п. Термин "зерно" должен означать зрелое семя, произведенное сельхозпроизводителями в целях, иных, чем выращивание или воспроизведение видов. Потомство, варианты и мутанты регенерировавших растений также входят в объем изобретения, при условии, что эти части содержат встроенные полинуклеотиды. Кроме того, настоящее изобретение относится к обработанному растительному продукту или субпродукту, сохраняющему последовательности, представленные в настоящем описании, включая например, соевые продукты.
[0101] В другом варианте осуществления гены, кодирующие пестицидные белки, можно использовать для трансформации патогенных организмов насекомых. Такие организмы включают бакуловирусы, грибы, простейшие, бактерии и нематоды. Можно выбирать микроорганизмы-хозяева, как известно, занимающие "фитосферу" (филлоплан, филлосферу, ризосферу и/или ризоплан) одного или нескольких интересующих сельскохозяйственных культур. Эти микроорганизмы выбирают таким образом, чтобы они были способны успешно конкурировать в конкретной среде с микроорганизмами дикого типа, обеспечивать стабильное поддержание и экспрессию гена, экспрессирующего пестицидный белок, и, желательно, обеспечивать улучшенную защиту пестицида от деградации и инактивации в окружающей среде.
[0102] Такие микроорганизмы включают археи, бактерии, водоросли и грибы. Особенный интерес представляют микроорганизмы, такие как бактерии, например, Bacillus, Pseudomonas, Erwinia, Serratia, Klebsiella, Xanthomonas, Streptomyces, Rhizobium, Rhodopseudomonas, Methylius, Agrobacterium, Acetobacter, Lactobacillus, Arthrobacter, Azotobacter, Leuconostoc и Alcaligenes. Грибы включают дрожжей, например, Saccharomyces, Cryptococcus, Kluyveromyces, Sporobolomyces, Rhodotorula и Aureobasidium. Особый интерес представляют такие бактериальные виды фитосферы, как Pseudomonas syringae, Pseudomonas aeruginosa, Pseudomonas fluorescens, Serratia marcescens, Acetobacter xylinum, Agrobacteria, Rhodopseudomonas spheroides, Xanthomonas campestris, Rhizobium melioti, Alcaligenes entrophus, Clavibacter xyli и Azotobacter vinlandir, и виды дрожжей фитосферы, такие как Rhodotorula rubra, R. glutinis, R. marina, R. aurantiaca, Cryptococcus albidus, C. diffluens, C. laurentii, Saccharomyces rosei, S. pretoriensis, S. cerevisiae, Sporobolomyces rosues, S. odorus, Kluyveromyces veronae, Aureobasidium pollulans, Bacillus thuringiensis, Escherichia coli, Bacillus subtilis, и т.п.
[0103] Иллюстративные прокариоты, как грамотрицательные, так и грамположительные, включают Enterobacteriaceae, такие как Escherichia, Erwinia, Shigella, Salmonella и Proteus; Bacillaceae; Rhizobiceae, такие как Rhizobium; Spirillaceae, такие как Photobacterium, Zymomonas, Serratia, Aeromonas, Vibrio, Desulfovibrio, Spirillum; Lactobacillaceae; Pseudomonadaceae, такие как Pseudomonas и Acetobacter; Azotobacteraceae и Nitrobacteraceae. Грибы включают Phycomycetes и Ascomycetes, например, дрожжи, такие как Saccharomyces и Schizosaccharomyces; и дрожжи Basidiomycetes, такие как Rhodotorula, Aureobasidium, Sporobolomyces и т.п.
[0104] Гены, кодирующие пестицидные белки, можно встраивать посредством электротрансформации, PEG-индуцированной трансформации, теплового шока, трансдукции, конъюгации и т.п. В частности, гены, кодирующие пестицидные белки, можно клонировать в челночный вектор. Примером челночного вектора является pHT3101 (Lerecius et al. (1989) FEMS Microbiol. Letts. 60: 211-218). Челночный вектор pHT3101, содержащий кодирующую последовательность гена конкретного пестицидного белка, например, можно трансформировать в колонизирующие корень Bacillus посредством электропорации (Lerecius et al. (1989) FEMS Microbiol. Letts. 60: 211-218).
[0105] Системы экспрессии можно конструировать таким образом, что пестицидные белки секретируются вне цитоплазмы грамотрицательных бактерий, посредством слияния с подходящим сигнальным пептидом на амино-конце пестицидного белка. Сигнальные пептиды, распознаваемые E. coli, включают белок OmpA (Ghrayeb et al. (1984) EMBO J, 3: 2437-2442).
[0106] Пестицидные белки и их активные варианты можно ферментировать в бактериальном хозяине, и полученных бактерий, обработанных и используемых в качестве микробного спрея тем же образом, что и штаммы Bacillus thuringiensis, используют в качестве инсектицидных спреев. В случае пестицидных белков, секретируемых Bacillus, сигнал секреции удаляют или подвергают мутагенезу способами, известными в этой области. Такие мутации и/или делеции предотвращают секрецию пестицидных белков в среду для выращивания в течение ферментации. Пестицидные белки удерживаются внутри клетки, а затем клетки обрабатывают для получения инкапсулированных пестицидных белков.
[0107] Альтернативно, пестицидные белки получают посредством встраивания гетерологичных генов в клеточного хозяина. Экспрессия гетерологичного гена приводит, прямо или косвенно, к внутриклеточной продукции и поддержанию пестицида. Затем эти клетки обрабатывают в условиях, пролонгирующих активность токсина, продуцируемого в клетке, когда клетку наносят на окружающую среду целевых вредителей. Полученный продукт сохраняет токсичность токсина. Эти природно инкапсулированные пестицидные белки затем можно составлять общепринятыми способами для нанесения а окружающую среду целевого вредителя, например, почву, воду и листву растений. См., например патент США № 6468523, патентную публикацию США № 20050138685 и цитируемые в них ссылки. В настоящем изобретении трансформированный микроорганизм (включающий целые организмы, клетки, споры, пестицидные белки, пестицидные компоненты, влияющие на вредителя компоненты, мутанты, живые или мертвые клетки и компоненты клеток, включая смеси живых и мертвых клеток и компонентов клеток, и включая разрушенные клетки и компоненты клеток) или выделенный пестицидный белок можно составлять с приемлемым носителем в пестицидные или сельскохозяйственные композиции, представляющие собой, например, суспензию, раствор, эмульсию, опудривающее средство, диспергируемую гранулу, смачиваемый порошок и эмульгируемый концентрат, аэрозоль, пропитанную гранулу, вспомогательное средство, покрываемую пасту, а также инкапсуляции, например, в полимерных веществах.
[0108] Сельскохозяйственные композиции могут содержать полипептид, рекомбиногенный полипептид или его вариант или фрагмент, как представлено в настоящем описании. Сельскохозяйственную композицию, представленную в настоящем описании, можно наносить на окружающую среду растения или область культивирования или наносить на растение, часть растения, растительную клетку или семя.
[0109] Такие композиции, описываемые выше, можно получать посредством добавления поверхностно-активного средства, инертного носителя, консерванта, увлажнителя, пищевого стимулятора, аттрактанта, инкапсулирующего средства, связывающего средства, эмульгатора, красителя, УФ-протектора, буфера, добавки для повышения текучести или удобрений, доноров питательных микроэлементов или других препаратов, влияющих на рост растения. Один или несколько агрохимикатов, включая, в качестве неограничивающих примеров, гербициды, инсектициды, фунгициды, бактерициды, нематоциды, моллюскоциды, акарициды, регуляторы роста растений, средства для сбора урожая и удобрения, можно комбинировать с носителями, поверхностно-активными веществами или вспомогательными веществами, общепринято используемыми в этой области составления, или другими компонентами для облегчения обращения с продуктом и использования в отношении конкретных целевых вредителей. Подходящие носители и вспомогательные средства могут являться твердыми или жидкими веществами и соответствовать веществам, как правило, используемыми в составлении, например, природным или восстановленным минеральным веществам, растворителям, дисперсантам, увлажнителям, средствам, придающим липкость, связывающим средствам или удобрениям. Активные ингредиенты по настоящему изобретению, как правило, наносят в форме композиций, и их можно наносить на область сельскохозяйственной культуры, растение или семя, подлежащее обработке. Например, композиции по настоящему изобретению можно наносить на зерно в препарате для или в течение хранения в зернохранилище или силосной башне и т.д. Композиции по настоящему изобретению можно наносить одновременно или по очереди с другими соединениями. Способы нанесения активного ингредиента по настоящему изобретению или агрохимической композиции по настоящему изобретению, содержащей по меньшей мере один пестицидный белок, продуцируемый штаммами бактерий по настоящему изобретению, включают, в качестве неограничивающих примеров, некорневое внесение, дражирование семян и почвенное внесение. Количество нанесений и частота нанесений зависят от интенсивности заражения соответствующим вредителем.
[0110] Подходящие поверхностно-активные средства включают, в качестве неограничивающих примеров, анионные соединения, такие как карбоксилат, например, металла; карбоксилат длинноцепочечной жирной кислоты; N-ацилсаркозинат; сложные моно- или диэфиры фосфорной кислоты с этоксилатами жирных спиртов или соли таких сложных эфиров; сульфаты жирных спиртов, такие как додецилсульфат натрия, октадецилсульфат натрия или цетилсульфат натрия; этоксилированные сульфаты жирных спиртов; этоксилированные алкилфенолсульфаты; сульфонаты лигнина; нефтяные сульфонаты; алкиларилсульфонаты, такие как алкил-бензолсульфонаты или низший алкилнафталинсульфонаты, например, бутил-нафталинсульфонат; соли сульфонированных нафталин-формальдегидных конденсатов; соли сульфонированных фенол-формальдегидных конденсатов; более сложные сульфонаты, такие как амидсульфонаты, например, сульфонированный продукт конденсации олеиновой кислоты и N-метилтаурина; или диалкилсульфосукцинаты, например, сульфонат натрия диоктилсукцината. Неионные средства включают продукты конденсации сложных эфиров жирных кислот, жирных спиртов, амидов жирных кислот или жирные алкил- или алкенил-замещенные фенолы с этиленоксидом, жирные сложные эфиры простых эфиров многоатомных спиртов, например, сложные эфиры сорбитана и жирных кислот, продукты конденсации таких сложных эфиров с этиленоксидом, например, сложные эфиры полиоксиэтиленсорбитана и жирных кислот, блок-сополимеры этиленоксида и пропиленоксида, ацетиленовые гликоли, такие как 2,4,7,9-тетраэтил-5-децин-4,7-диол, или этоксилированные ацетиленовые гликоли. Примеры катионного поверхностно-активного средства включают, например, алифатический моно-, ди- или полиамин, такой как ацетат, нафтенат или олеат; или кислород-содержащий амин, такой как аминоксид полиоксиэтиленалкиламина; амид-соединенный амин, полученный посредством конденсации карбоновой кислоты с ди- или полиамином; или соль четвертичного аммония.
[0111] Неограничивающие примеры инертных материалов включают неорганические минералы, такие как каолин, филлосиликаты, карбонаты, сульфаты, фосфаты, или ботанические материалы, такие как пробка, измельченные стержни кукурузного початка, скорлупа арахиса, шелуха риса и скорлупа грецких орехов.
[0112] Композиции по настоящему изобретению могут находиться в подходящей форме для прямого нанесения или в виде концентрата первичной композиции, который необходимо разводить подходящим количеством воды или другого дилюента перед нанесением. Пестицидная концентрация будет варьироваться в зависимости от природы конкретного состава, в частности, является ли он концентратом или его используют напрямую. Композиция содержит от 1 до 98% твердого или жидкого инертного носителя, и от 0 до 50% или от 0,1 до 50% поверхностно-активного вещества (масс./масс., об./об., или масс./об., при необходимости или желании). Эти композиции будут вводить с отмеченной скоростью для коммерческого продукта, например, приблизительно 0,01-5,0 фунтов на акр в сухой форме и приблизительно 0,01-10 pts на акр в жидкой форме.
[0113] В дополнительном варианте осуществления композиции, а также трансформированные микроорганизмы и пестицидные белки, представленные в настоящем описании, можно обрабатывать перед составлением для продления пестицидной активности при нанесении на окружающую среду целевого вредителя при условии, что предварительная обработка не мешает пестицидной активности. Такую обработку можно осуществлять химическими способами, физическими способами или и теми, и другими, при условии, что обработка не влияет отрицательно на свойства композиций. Неограничивающие примеры химических реагентов включают галогенирующие средства; альдегиды, такие как формальдегид и глутаральдегид; противоинфекционные средства, такие как зефиран хлорид; спирты, такие как изопропанол и этанол; и гистологические фиксативы, такие как фиксатив Боуина и фиксатив Хелли (см., например, Humason (1967) Animal Tissue Techniques (W.H. Freeman and Co.).
[0114] В одном из аспектов вредителей можно уничтожать, или можно снижать их количество в указанной области посредством нанесения пестицидных белков, представленных в настоящем описании, на область. Альтернативно, пестицидные белки можно наносить профилактически на область окружающей среды для предотвращения заражения восприимчивым вредителем. Предпочтительно, вредитель потребляет или контактирует с пестицидно эффективным количеством полипептида. Термин "пестицидно эффективное количество" означает количество пестицида, способное вызывать гибель по меньшей мере одного вредителя или значительно снижать рост, питание или нормальное физиологическое развитие вредителя. Это количество будет варьироваться в зависимости от таких факторов как, например, конкретные целевые вредители, подлежащие контролю, конкретное окружение, местность, растение, сельскохозяйственная культура или сельскохозяйственная область, подлежащая обработке, условия окружающей среды и способ, частота, концентрация, стабильность и количество нанесений композиции пестицидно эффективного полипептида. Составы или композиции также могут варьироваться в отношении климатических условий, экологических факторов и/или частоты нанесения и/или тяжести заражения вредителем.
[0115] Активные ингредиенты, как правило, наносят в форме композиций, и их можно наносить на область сельскохозяйственной культуры, растение или семя, подлежащее обработке. Таким образом, настоящее изобретение относится к способам предоставления растению, растительной клетке, семени, части растения или области культивирования эффективного количества сельскохозяйственной композиции, содержащей полипептид, рекомбиногенный полипептид или его активный вариант или фрагмент. Термин "эффективное количество" означает количество белка или композиции, имеющей пестицидную активность, достаточную для уничтожения или контроля вредителя или приводящую к значительному снижению роста, питания или нормального физиологического развития вредителя. Такие снижения количества вредителей, роста вредителей, питания вредителей или нормального развития вредителей могут включать любое статистически значимое снижение, включая, например, снижение на приблизительно 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 85%, 90%, 95% или более. Например, композиции можно наносить на зерно в препарате для или в течение хранения в зернохранилище или силосной башне и т.д. Композиции можно наносить одновременно или по очереди с другими соединениями. Способы нанесения активного ингредиента или агрохимической композиции, содержащей по меньшей мере один из полипептидов, рекомбиногенных полипептидов или их вариантов или фрагментов, как представлено в настоящем описании, включают, в качестве неограничивающих примеров, некорневое внесение, дражирование семян и почвенное внесение.
[0116] Настоящее изобретение относится к способам повышения урожая растения. Способы включают получение растения или растительной клетки, экспрессирующей полинуклеотид, кодирующий последовательность пестицидного полипептида, представленного в настоящем описании, и выращивание растения или его семени в поле, зараженном (или восприимчивым к заражению) вредителем, против которого указанный полипептид имеет пестицидную активность. В некоторых вариантах осуществления полипептид имеет пестицидную активность в отношении чешуекрылых, жесткокрылых, двукрылых, полужесткокрылых вредителей или нематод, и указанное поле заражено чешуекрылыми, полужесткокрылыми, жесткокрылыми, двукрылыми вредителями или нематодами. Как определено в настоящем описании, термин "урожай" растения относится к качеству и/или количеству биомассы, продуцируемой растением. Термин "биомасса" означает любой измеримый растительный продукт. Повышение продукции биомассы является любым улучшением в полевых условиях измеримого растительного продукта. Повышение урожая растения имеет несколько коммерческих приложений. Например, повышение биомассы листьев растений может повышать урожай листовых овощей для потребления человеком или животным. Кроме того, повышение биомассы листьев можно использовать для повышения получения получаемых из растений фармацевтических или промышленных продуктов. Повышение урожая может включать любое статистически значимое повышение, включая, в качестве неограничивающих примеров, повышение по меньшей мере на 1%, повышение по меньшей мере на 3%, повышение по меньшей мере на 5%, повышение по меньшей мере на 10%, повышение по меньшей мере на 20%, повышение по меньшей мере на 30%, по меньшей мере на 50%, по меньшей мере на 70%, по меньшей мере на 100% или большее повышение урожая по сравнению с растением, не экспрессирующим пестицидную последовательность. В конкретных способах урожай растения повышают в результате улучшенной резистентности растения, экспрессирующего пестицидный белок, представленный в настоящем описании, к вредителю. Экспрессия пестицидного белка приводит к снижению способности вредителя заражать или питаться.
[0117] Растения также можно обрабатывать одной или несколькими химическими композициями, включая один или несколько гербицидов, инсектицидов или фунгицидов, или комбинацией двух или более из них.
[0118] Неограничивающие варианты осуществления включают:
[0119] 1. Выделенный полипептид, имеющий пестицидную активность, содержащий
(a) полипептид, содержащий аминокислотную последовательность, выбранную из группы, состоящей из последовательностей, приведенных в SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158 и/или 159; или
(b) полипептид, содержащий аминокислотную последовательность, имеющую, по меньшей мере, процент идентичности последовательности, приведенный в таблице 1, по отношению к аминокислотной последовательности, выбранной из группы, состоящей из последовательностей, приведенных в SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158 и/или 159.
[0120] 2. Полипептид по варианту осуществления 1, где указанный полипептид содержит аминокислотную последовательность, приведенную в SEQ ID NO. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158 и/или 159.
[0121] 3. Композиция, содержащая полипептид по вариантам осуществления 1 или 2.
[0122] 4. Полипептид по варианту осуществления 2, дополнительно содержащий гетерологичные аминокислотные последовательности.
[0123] 5. Рекомбинантная молекула нуклеиновой кислоты, кодирующая полипептид по варианту осуществления 1, где указанная рекомбинантная молекула нуклеиновой кислоты не является природной последовательностью, кодирующей указанный полипептид.
[0124] 6. Рекомбинантная нуклеиновая кислота по варианту осуществления 5, где указанная молекула нуклеиновой кислоты является синтетической последовательностью, сконструированной для экспрессии в растении.
[0125] 7. Рекомбинантная молекула нуклеиновой кислоты по варианту осуществления 6, где указанная молекула нуклеиновой кислоты функционально связана с промотором, способным направлять экспрессию в растительной клетке.
[0126] 8. Рекомбинантная молекула нуклеиновой кислоты по варианту осуществления 5, где указанная молекула нуклеиновой кислоты функционально связана с промотором, способным направлять экспрессию в бактериях.
[0127] 9. Клетка-хозяин, содержащая рекомбинантную молекулу нуклеиновой кислоты по варианту осуществления 8.
[0128] 10. Клетка-хозяин по варианту осуществления 9, где указанная клетка-хозяин является бактериальной клеткой-хозяином.
[0129] 11. Конструкция ДНК, содержащая промотор, регулирующий экспрессию в растительной клетке, функционально связанный с рекомбинантной молекулой нуклеиновой кислоты, содержащей
(a) нуклеотидную последовательность, кодирующую полипептид, содержащий аминокислотную последовательность любой из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158 и/или 159; или,
(b) нуклеотидную последовательность, кодирующую полипептид, содержащий аминокислотную последовательность, имеющую, по меньшей мере, процент идентичности последовательности, приведенный в таблице 1, по отношению к аминокислотной последовательности, выбранной из группы, состоящей из последовательностей, приведенных в SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158 и/или 159.
[0130] 12. Конструкция ДНК по варианту осуществления 11, где указанная нуклеотидная последовательность является синтетической последовательностью ДНК, сконструированной для экспрессии в растении.
[0131] 13. Вектор, содержащий конструкцию ДНК по варианту осуществления 11.
[0132] 14. Клетка-хозяин, содержащая конструкцию ДНК по любому из вариантов осуществления 11-13.
[0133] 15. Клетка-хозяин по варианту осуществления 14, где клетка-хозяин является растительной клеткой.
[0134] 16. Трансгенное растение, содержащее клетку-хозяина по варианту осуществления 15.
[0135] 17. Композиция, содержащая клетку-хозяина по варианту осуществления 10.
[0136] 18. Композиция по варианту осуществления 17, где указанная композиция выбрана из группы, состоящей из порошка, измельченного в пыль порошка, пеллета, гранулы, спрея, эмульсии, коллоидного раствора и раствора.
[0137] 19. Композиция по варианту осуществления 17, где указанная композиция содержит от приблизительно 1% до приблизительно 99% по массе указанного полипептида.
[0138] 20. Способ контроля популяции вредителей, включающий приведение указанной популяции в контакт с пестицидным эффективным количеством композиции по варианту осуществления 3 или 17.
[0139] 21. Способ уничтожения популяции вредителей, включающий приведение указанной популяции в контакт с пестицидным эффективным количеством композиции по варианту осуществления 3 или 17.
[0140] 22. Способ получения полипептида с пестицидной активностью, включающий культивирование клетки-хозяина по варианту осуществления 9 в условиях, в которых молекула нуклеиновой кислоты, кодирующая полипептид, экспрессируется.
[0141] 23. Растение, имеющее стабильно встроенную в его геном конструкцию ДНК, содержащую нуклеотидную последовательность, кодирующую белок, имеющий пестицидную активность, где указанная нуклеотидная последовательность содержит
(a) нуклеотидную последовательность, кодирующую полипептид, содержащий аминокислотную последовательность любой из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158 и/или 159; или,
(b) нуклеотидную последовательность, кодирующую полипептид, содержащий аминокислотную последовательность, имеющую, по меньшей мере, процент идентичности последовательности, приведенный в таблице 1, по отношению к аминокислотной последовательности, выбранной из группы, состоящей из последовательностей, приведенных в SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158 и/или 159.
[0142] 24. Трансгенное семя растения по варианту осуществления 23.
[0143] 25. Способ защиты растения от насекомого-вредителя, включающий экспрессию в растении или его клетке нуклеотидной последовательности, кодирующей пестицидный полипептид, где указанная нуклеотидная последовательность содержит
(a) нуклеотидную последовательность, кодирующую полипептид, содержащий аминокислотную последовательность любой из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158 и/или 159; или,
(b) нуклеотидную последовательность, кодирующую полипептид, содержащий аминокислотную последовательность, имеющую, по меньшей мере, процент идентичности последовательности, приведенный в таблице 1, по отношению к аминокислотной последовательности, выбранной из группы, состоящей из последовательностей, приведенных в SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158 и/или 159.
[0144] 26. Способ по варианту осуществления 25, где указанное растение продуцирует пестицидный полипептид, имеющий пестицидную активность против чешуекрылого или жесткокрылого вредителя или полужесткокрылого вредителя.
[0145] 27. Способ повышения урожая растения, включающий выращивание в поле растения или его семени, имеющих стабильно встроенную в их геном конструкцию ДНК, содержащую промотор, регулирующий экспрессию в растении, функционально связанный с нуклеотидной последовательностью, кодирующей пестицидный полипептид, где указанная нуклеотидная последовательность содержит
(a) нуклеотидную последовательность, кодирующую полипептид, содержащий аминокислотную последовательность любой из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158 и/или 159; или,
(b) нуклеотидную последовательность, кодирующую полипептид, содержащий аминокислотную последовательность, имеющую, по меньшей мере, процент идентичности последовательности, приведенный в таблице 1, по отношению к аминокислотной последовательности, выбранной из группы, состоящей из последовательностей, приведенных в SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158 и/или 159.
[0146] Следующие примеры представлены в иллюстративных целях, а не для ограничения.
ПРИМЕРЫ
Пример 1: Обнаружение новых генов посредством секвенирования и анализа ДНК
[0147] Культуры микроорганизмов выращивали в жидкой культуре в стандартных лабораторных средах. Культуры выращивали до насыщения (от 16 до 24 часов) до получения ДНК. ДНК выделяли из бактериальных клеток посредством лизиса детергентами с последующим связыванием с силикагелевой матрицей и промывкой этаноловым буфером. Очищенную ДНК элюировали из силикагелевой матрицы с помощью слабощелочного водного буфера.
[0148] ДНК для секвенирования тестировали на чистоту и концентрацию посредством спектрофотометрии. Библиотеки для секвенирования получали с использованием набора для получения библиотек Nextera XT по протоколу производителя. Данные секвенирования получали с помощью HiSeq 2000 по руководству пользователя к Illumina HiSeq 2000 System.
[0149] Риды секвенирования собирали в предварительные геномы с использованием пакета программ CLC Bio Assembly Cell. После сборки распознавание генов осуществляли несколькими способами и полученные последовательности исследовали для идентификации новых гомологов пестицидных генов. Новые гены идентифицировали посредством BLAST, по доменной композиции и посредством попарного выравнивания относительно целевого набора пестицидных генов. Общие сведения о таких последовательностях приведены в таблице 1.
[0150] Гены, идентифицированные при поиске гомологии, амплифицировали из бактериальной ДНК посредством ПЦР и клонировали в бактериальные экспрессирующие векторы, содержащие слитые метки для очистки, находящиеся в рамке считывания. Клонированные гены экспрессировали в E. coli и очищали посредством хроматографии на колонках. Очищенные белки оценивали в исследованиях с биологическими пищевыми анализами насекомых для идентификации активных белков.
[0151] Пищевые биологические анализы насекомых осуществляли с использованием зародышей пшеницы и агарового искусственного корма, на который очищенный белок наносили посредством поверхностной обработки. Личинок насекомых наносили на обработанный корм и подвергали мониторингу на смертность.
[0152] Пищевые биологические анализы насекомых осуществляли с использованием жидкого сахарозного корма, содержащегося в мембранном саше, в который добавляли очищенный белок. Нимфам насекомых позволяли питаться на саше с кормом, и их подвергали мониторингу на смертность. Насекомые, тестируемые в биологических анализах, включали коричневого щитника (BSB), Euschistus servus, и зеленого овощного клопа (SGSB), Nezara viridula. Данные представлены ниже в таблице 5.
Таблица 5. Результаты биологического анализа
|
BSB=Коричневый щитник, SGSB=Зеленый овощной клоп
Пример 2. Гетерологичная экспрессия в E. coli
[0153] Каждую открытую рамку считывания, приведенную в таблицах 6 и 7, клонировали в экспрессирующий вектор E. coli, содержащий мальтозо-связывающий белок (pMBP). Экспрессирующий вектор трансформировали в BL21*RIPL. Культуру LB, дополненную карбенициллином, инокулировали в одной колонии и выращивали в течение ночи при 37°C с использованием 0,5% ночной культуры, свежую культуру инокулировали и выращивали до логарифмической фазы при 37°C. Культуру индуцировали с использованием 250 мМ IPTG в течение 18 часов при 16°C. Клетки осаждали и ресуспендировали в 10 мМ Трис, pH 7,4, и 150 мМ NaCl, дополненных ингибиторами протеаз. Экспрессию белка оценивали посредством SDS-PAGE.
Пример 3. Пестицидная активность в отношении жесткокрылых и чешуекрылых
[0154] Экспрессия белка: Каждую последовательность, приведенную в таблице 6, экспрессировали в E. coli, как описано в примере 2. 400 мл LB инокулировали и выращивали до OD600 0,6. Культуру индуцировали 0,25 мМ IPTG в течение ночи при 16°C. Клетки центрифугировали и клеточный осадок ресуспендировали в 5 мл буфера. Ресуспендированный осадок обрабатывали ультразвуком в течение 2 мин на льду.
[0155] Биологический анализ: Яйца совки травяной (FAW), совки хлопковой (CEW), мотылька кукурузного (ECB), огневки кукурузной юго-западной (SWCB) и капустной моли (DBM) приобретали в коммерческом инсектарии (Benzon Research Inc., Carlisle, PA). Яйца FAW, CEW, ECB и BCW инкубировали до вылупления, происходящего в пределах 12 часов с начала анализа. SWCB и DBM включали в анализ в виде новорожденных личинок. Анализы осуществляли в 24-луночных лотках, содержащих корм для множества видов чешуекрылых (Southland Products Inc., Lake Village, AR). Образцы обработанного ультразвуком лизата наносили на поверхность корма (поверх корма) и позволяли испаряться и впитываться в корм. В случае CEW, FAW, BCW, ECB и SWCB 125 мкл обработанного ультразвуком лизата добавляли на поверхность корма и сушили. В случае DBM 50 мкл разведения 1:2 обработанного ультразвуком лизата добавляли на поверхность корма. Планшеты для биологического анализа закрывали пленкой, вентилируемой благодаря проколам булавкой. Планшеты инкубировали при 26°C при относительной влажности (RH) 65% с циклом день:ночь 16:8 в Percival в течение 5 дней. Анализы оценивали на уровень смертности, ингибирование роста и ингибирование питания.
[0156] Для биологического анализа западного кукурузного жука конструкцию/лизат белка оценивали в биологическом анализе насекомых посредством нанесения объема 60 мкл на поверхность корма в лунках 24-луночного планшета (Cellstar, 24-луночный, Greiner Bio One) и позволяли ему высушиваться. Каждая лунка содержала 500 мкл корма (Marrone et al., 1985). От пятнадцати до двадцати новорожденных личинок помещали в каждую лунку с использованием тонкой кисти и планшет покрывали мембраной (Viewseal, Greiner Bio One). Биологический анализ хранили при температуре окружающей среды и оценивали на смертность и/или ингибирование роста/питания в день 4. На фигуре 7 представлено руководство для биологического анализа кукурузного жука.
[0157] В случае колорадского жука (CPB) листовой диск, полученный с помощью сверла для пробки № 8, вырезали из листа картофеля и погружали в конструкцию/лизат белка до тщательного увлажнения и помещали поверх фильтровального диска (Millipore, фильтр из стекловолокна, 13 мм). 60 мкл dH2O добавляли на каждый фильтровальный диск и помещали в каждую лунку 24-луночного планшета (Cellstar, 24-луночный, Greiner Bio One). Диску листа позволяли сушиться и в каждую лунку с использованием тонкой помещали от пяти до семи личинок на первой личиночной стадии кисти. Планшет закрывали мембраной (Viewseal, Greiner Bio One) и протыкали небольшое отверстие в каждой мембране лунки. Конструкцию оценивали в четырех параллелях и анализировали на смертность и повреждение листьев в день 3.
[0158] В таблице 6 представлены общие сведения о пестицидной активности различных последовательностей в отношении жесткокрылых и чешуекрылых. Обозначения в таблице: "-" указано отсутствие наблюдаемой активности; "NT" - не тестировали; "S" - остановка роста; "SS" - незначительная остановка роста; "LF" - низкое питание.
Таблица 6. Общие сведения о пестицидной активности в отношении Coleoptera и Lepidoptera.
|
Пример 4. Пестицидная активность в отношении полужесткокрылых
[0159] Экспрессия белка: Каждую из последовательностей, приведенных в таблице 7, экспрессировали в E. coli, как описано в примере 2. 400 мл LB инокулировали и выращивали до OD600 0,6. Культуру индуцировали 0,25 мМ IPTG в течение ночи при 16°C. Клетки центрифугировали и клеточный осадок ресуспендировали в 5 мл буфера. Ресуспендированный осадок подвергали обработке ультразвуком в течение 2 мин на льду.
[0160] SGSB второй личиночной стадии получали из коммерческого инсектария (Benzon Research Inc., Carlisle, PA). В биологическом анализе использовали соотношение 50% об./об. образца обработанного ультразвуком лизата и 20% сахарозы. Натянутый парафильм использовали в качестве питательной мембраны для подвергания SGSB воздействию смеси корма/образца. Планшеты инкубировали при 25°C:21°C, цикле день:ночь 16:8 при 65% RH в течение 5 дней.
[0161] Смертность оценивали для каждого образца. Результаты приведены в таблице 7. Пунктирной линией указано отсутствие определенной смертности. Белок (APG00034) демонстрировал 25% смертности зеленого овощного клопа (1 клоп из 4 умер). В отрицательных контролях (пустой вектор, экспрессирующий связывающий домен, и только буфер) не наблюдали смертность (0 клопов из 4).
Таблица 7. Общие сведения о пестицидной активности в отношении Hemiptera
|
Пример 5. Трансформация сои
[0162] Конструкции ДНК, содержащие каждую из SEQ ID NO: 1-159 или их активные варианты или фрагменты, функционально связанные с промотором, активным в растении, клонировали в трансформационные векторы и встраивали в Agrobacterium, как описано в предварительной заявке США № 62/094782, зарегистрированной 19 декабря 2015 года, включенной в настоящее описание путем ссылки в полном объеме.
[0163] За четыре дня до инокуляции несколько петель Agrobacterium наносили на свежую чашку среды YEP*, дополненной соответствующими антибиотиками** (спектиномицином, хлорамфениколом и канамицином). Бактерии выращивали в течение двух дней в темноте при 28°C. Через два дня несколько петель бактерий переносили в 3 мл жидкой среды YEP с антибиотиками в колбу Эрленмейера емкостью 125 мл. Колбы помещали на ротационный шейкер при 250 об./мин. и 28°C на ночь. За день до инокуляции 2-3 мл ночной культуры переносили в 125 мл YEP с антибиотиками в колбу Эрленмейера емкостью 500 мл. Колбы помещают на ротационный шейкер при 250 об./мин. и 28°C на ночь.
[0164] Перед инокуляцией проверяют OD бактериальной культуры при OD 620. OD 0,8-1,0 свидетельствует о том, что культура находится в log-фазе. Культуру центрифугируют при 4000 об./мин. в течение 10 минут в пробирках Oak Ridge. Супернатант выбрасывают и осадок ресуспендируют в объеме среды для инфицирования сои (SI) для достижения желаемой OD. Культуры держали с периодическим перемешиванием до того, как они потребуются для инокуляции.
[0165] За два или три дня до инокуляции семена сои поверхностно стерилизовали газообразным хлором. В вытяжном шкафу чашку Петри с семенами помещают в стеклянный колпак с открытой крышкой. 1,75 мл 12 Н HCl медленно добавляют к 100 мл отбеливателя в колбе Эрленмейера емкостью 250 мл внутри стеклянного колпака. Крышку незамедлительно помещали поверх стеклянного колпака. Семенам позволяли стерилизоваться в течение 14-16 часов (в течение ночи). Снимают верх стеклянного колпака и снимают крышку чашки Петри. Затем чашку Петри с поверхностно стерилизованными семенами открывают в ламинарном шкафу в течение приблизительно 30 минут для удаления любого оставшегося газообразного хлора.
[0166] Семена пропитывали стерильной DI водой или средой для инфицирования сои (SI) в течение 1-2 дней. От двадцати до 30 семян покрывают жидкостью в чашке Петри 100×25 мм и инкубируют в темноте при 24°C. После пропитывания непроросшие семена выбрасывают.
[0167] Семядольные эксплантаты обрабатывают на стерильной бумажной печатной форме со стерильной фильтровальной бумагой, увлажненной с использованием среды SI способами по патенту США № 7473822, включенному в настоящее описание путем ссылки.
[0168] Как правило, инокулируют 16-20 семядолей на обработку. Среду SI, используемую для удержания эксплантатов, выбрасывают и заменяют 25 мл культуры Agrobacterium (OD 620=0,8-20). После погружения всех эксплантатов инокуляцию осуществляют в течение 30 минут с периодическим встряхиванием чашки. Через 30 минут культуру Agrobacterium удаляют.
[0169] Планшеты для совместного культивирования подготавливали, накладывая один кусок стерильной бумаги на среду для совместного культивирования сои (SCC). Без промокания инокулированные семядоли культивировали адаксиальной стороной вниз на фильтровальной бумаге. На каждом планшете можно культивировать приблизительно 20 эксплантатов. Планшеты закрывали парафильмом и культивировали при 24°C и приблизительно 120 мкмоль м-2с-1 (в инкубаторе Percival) в течение 4-5 дней.
[0170] После совместного культивирования семядоли 3 раза промывают в 25 мл промывочной среды для сои с 200 мг/л цефотаксима и тиментина. Семядоли промокают на стерильной фильтровальной бумаге, а затем переносят в среду для индукции побегов сои (SSI). Узловой конец эксплантата немного опускают в среду, при этом дистальный конец держат над поверхностью под углом приблизительно 45 градусов. На каждом планшете культивируют не более 10 эксплантатов. Планшеты заворачивают в ленту Micropore и культивируют в Percival при 24°C и приблизительно 120 мкмоль м-2с-1.
[0171] Эксплантаты переносят на свежую среду SSI через 14 дней. Появившиеся побеги с верхушки побега и семядольного узла выбрасывают. Индукцию побегов продолжают еще в течение 14 дней в тех же условиях.
[0172] Через 4 недель индукции побегов семядолю отделяют от нодального конца и делают параллельный разрез под областью индукции побега (подушечка побега). Площадь параллельного разреза помещают на среду для удлинения побегов сои (SSE) и эксплантаты культивируют в Percival при 24°C и приблизительно 120 мкмоль м-2м-1. Эту стадию повторяют каждые две недели в течение до 8 недель при условии, что побеги продолжают удлиняться.
[0173] Когда побеги достигают длины 2-3 см, их переносят на среду для укоренения сои (SR) в сосуд Plantcon и инкубируют в тех же условиях в течение 2 недель или до достижения корнями длины приблизительно 3-4 см. После этого растения переносят в почву.
[0174] Необходимо отметить, что все среды, упомянутые для трансформации сои, можно найти в Paz et al. (2010) Agrobacterium-mediated transformation of soybean and recovery of transgenic soybean plants; Plant Transformation Facility of Iowa State University, включенном в настоящее описание путем ссылки в полном объеме. (См. agron-www.agron.iastate.edu/ptf/protocol/Soybean.pdf.)
Пример 6. Трансформация кукурузы
[0175] Початки кукурузы лучше всего собирать через 8-12 дней после опыления. Эмбрионы выделяют из початков и эти эмбрионы размером 0,8-1,5 мм предпочтительны для использования в трансформация. Эмбрионы помещают щитком вверх на подходящие среды для инкубации, такие как среды DN62A5S (3,98 г/л солей N6; 1 мл/л (1000-кратного стока) витаминов N6; 800 мг/л L-аспарагина; 100 мг/л миоинозитола; 1,4 г/л L-пролина; 100 мг/л казаминовых кислот; 50 г/л сахарозы; 1 мл/L (из стока 1 мг/мл) 2,4-D). Однако среды и соли, иные, чем DN62A5S, подходят и известны в этой области. Эмбрионы инкубируют в течение ночи при 25°C в темноте. Однако, по существу, не обязательно инкубировать эмбрионы в течение ночи.
[0176] Полученные эксплантаты переносят на сито с квадратными отверстиями (30-40 на планшет), переносят на осмотические среды на приблизительно 30-45 минут, а затем переносят на планшет для инжекции (см., например, публикацию PCT № WO/0138514 и патент США № 5240842). Конструкции ДНК, сконструированные для экспрессии белков GRG по настоящему изобретению в растительных клетках, инъецировали в растительную ткань с использованием аэрозольного пучкового инжектора, с использованием условий, по существу, описанных в публикации PCT № WO/0138514. После инжекции эмбрионы инкубируют в течение приблизительно 30 мин на осмотических средах и помещают на инкубационные среды в течение ночи при 25°C в темноте. Для избежания чрезмерного повреждения подвергнутых инжекции эксплантатов, их инкубируют в течение по меньшей мере 24 часов перед переносом на среды для восстановления. Затем эмбрионы распределяют на среды для восстановления на приблизительно 5 дней при 25°C в темноте, а затем переносят на селективные среды. Эксплантаты инкубируют в селективных средах в течение до восьми недель, в зависимости от природы и характеристик конкретной используемой селекции. После периода селекции полученный каллюс переносят на среды для созревания эмбрионов до образования зрелых соматических эмбрионов. Затем полученные зрелые соматические эмбрионы переносят в область низкого освещения и инициируют регенерацию известными в этой области способами. Полученным побегам позволяют укореняться на средах для укоренения, и полученные растения переносят в горшки для рассады и выращивают как трансгенные растения.
Пример 7. Пестицидная активность в отношении нематоды
Анализ Heterodera glycine (цистообразующей нематоды сои) in vitro
[0177] Цистообразующие нематоды сои распределяют в 96-луночный планшет с общим объемом 100 мкл и 100 J2 на лунку. Интересующий белок, приведенный в любой из SEQ ID NO: 1-159, распределяют по лункам и держат при комнатной температуре для оценки. В конечном итоге, 96-луночный планшет, содержащий SCN J2, анализируют на подвижность. Данные представлены в виде % ингибирования по сравнению с контролями. Совпадения определены как превосходящие или равные 70% ингибированию.
Анализ Heterodera glycine (цистообразующей нематоды сои) на растении
[0178] Растения сои, экспрессирующие одну или несколько из SEQ ID NO: 1-159, получали как описано где-либо в настоящем описании. Саженцы сои возрастом 3 недели инокулируют 5000 яйцами SCN на растение. Это инфицирование поддерживают в течение 70 дней, а затем собирают для подсчета цист SCN, развившихся на растении. Данные представлены как % ингибирования по сравнению с контролями. Совпадения определены как превосходящие или равные 90% ингибированию.
Анализ Meloidogyne incognita (клубеньковой нематоды) in vitro
[0179] Клубеньковые нематоды распределяют в 96-луночный планшет с общим объемом 100 мкл и 100 J2 на лунку. Интересующий белок, содержащий любую из SEQ ID NO: 1-159, распределяют по лункам и держат при комнатной температуре для оценки. В конечном итоге, 96-луночный планшет, содержащий RKN J2, анализируют на подвижность. Данные представлены как % ингибирования по сравнению с контролями. Совпадения определены как превосходящие или равные 70% ингибированию.
Анализ Meloidogyne incognita (клубеньковой нематоды) на растении
[0180] Растения сои, экспрессирующие одну или несколько из SEQ ID NO: 1-159, получали как описано где-либо в настоящем описании. Сою возрастом 3 недели инокулируют 5000 яйцами RKN на растение. Это инфицирование поддерживают в течение 70 дней, а затем собирают для подсчета яиц RKN, развившихся на растении. Данные представлены как % ингибирования по сравнению с контролями. Совпадения определены как превосходящие или равные 90% ингибированию.
Пример 8. Дополнительные анализы на пестицидную активность
[0181] Различные полипептиды, приведенные в SEQ ID NO: 1-159, можно тестировать на пестицидную активность в отношении вредителя рядом способом. Одним из таких способов является осуществление пищевого анализа. В таком пищевом анализе вредителя подвергают воздействию образца, содержащего соединения, подлежащие тестированию, или контрольные образцы. Зачастую это осуществляют, помещая материал, подлежащий тестированию, или подходящее разведение такого материала, на материал, который вредитель будет потреблять, такой как искусственный корм. Материал, подлежащий тестированию, может состоять из жидкости, твердого вещества или суспензии. Материал, подлежащий тестированию, можно помещать на поверхность, а затем позволять ему высыхать. Альтернативно, материал, подлежащий тестированию, можно смешивать с расплавленным искусственным кормом, и затем помещать в камеру для анализа. Камера для анализа может являться, например, ванночкой, чашкой или лункой планшета для микротитрования.
[0182] Анализы сосущих вредителей (например, тли) могут включать отделение тестового материала от насекомого на отсеки, в идеале, частью, которая могут быть проколота сосательными частями сосущего насекомого, чтобы сделать возможным потребление тестового материала. Часто тестовый материал смешивают с пищевым стимулятором, таким как сахароза, чтобы способствовать потреблению тестируемого соединения.
[0183] Другие типы анализов могут включать микроинъекцию тестового материала в рот или кишечник вредителя, а также разработку трансгенных растений с последующим тестированием способности вредителя питаться на трансгенном растении. Тестирование растения может включать изоляцию частей растений, как правило, потребляемых, например, в небольших клетках, прикрепленных к листу, или изоляцию целых растениях в клетках, содержащих насекомых.
[0184] Другие способы и подходы анализа вредителей известны в этой области, и их можно найти, например, в Robertson and Preisler, eds. (1992) Pesticide bioassays with arthropods, CRC, Boca Raton, Fla. Альтернативно, анализы, как правило, описывают в журналах Arthropod Management Tests и Journal of Economic Entomology или при обсуждении с членами Entomological Society of America (ESA). Любую из SEQ ID NO: 1-159 можно экспрессировать и использовать в анализе, как приведено в примерах 3 и 4 в настоящем описании.
[0185] Все публикации и патентные заявки, упомянутые в описании, свидетельствуют об уровне знания специалистов в области, к которой относится изобретение. Все публикации и патентные заявки включены в настоящее описание путем ссылок в той же степени, как если бы каждая отдельная публикация или патентная заявка была конкретно и отдельно указана как включенная путем ссылки.
[0186] Хотя описанное выше изобретение описано в некоторых подробностях посредством иллюстрации и примеров в целях ясности понимания, очевидно, что можно осуществлять на практике конкретные изменения и модификации в объеме формулы изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Parks, Jessica
Roberts, Kira Bulazel
Thayer, Rebecca E
<120> ПЕСТИЦИДНЫЕ ГЕНЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ
<130> 098699-0965873
<150> US 60/095,524
<151> 2014-12-22
<160> 167
<170> PatentIn version 3.5
<210> 1
<211> 885
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученные из образца окружающей среды
<400> 1
Met Ala Asn Gly Thr Lys Lys His Val Ile Lys Lys Tyr Leu Glu Leu
1 5 10 15
Ile Lys Pro Ile Tyr Tyr Lys Gln Asn Ser Leu Leu Phe Ser Pro Phe
20 25 30
Ile Leu Ser Ile Pro Gly Cys Asp Ile Ser Gln His Gly Ser Ile Pro
35 40 45
Ala Met Lys Arg Asn Cys Phe Thr Leu Leu Leu Tyr Tyr Arg Arg Tyr
50 55 60
Val Met Ala Gln Leu Pro Glu Leu Gln Ala Gln Ser Phe Ile Pro Tyr
65 70 75 80
Asn Val Leu Ala Asn Pro Val Thr Gly Asn Ser Ala Gly Thr Asp Trp
85 90 95
Gly Glu Trp Leu Ser Ser Leu Lys Glu Ala Trp Thr Glu Phe Gln Lys
100 105 110
Thr Gly Ser Asp Lys Phe Leu Gln Ser Val Leu Ser Thr Gly Tyr Asp
115 120 125
Ala Ala Gln Gly Gly Ser Phe Asn Tyr Ile Ala Val Leu Gln Ala Gly
130 135 140
Val Ala Ile Leu Gly Thr Val Leu Gly Ala Glu Phe Pro Gly Ile Thr
145 150 155 160
Ala Ile Ala Val Pro Ala Leu Thr Phe Leu Ile Lys Trp Val Trp Pro
165 170 175
Lys Leu Thr Gly Gly Ser Ala Gly Glu Ser Asp Thr Gln Lys Met Leu
180 185 190
Asp Leu Ile Asp Lys Glu Ile Gln Gln Lys Leu Asp Gln Ala Leu Ser
195 200 205
Gln Gln Asp Ile Asn Asn Trp Arg Ala Tyr Leu Thr Ser Ile Phe Glu
210 215 220
Ala Ala Thr Asn Leu Ser Gln Ser Ile Ile Asp Ala Gln Phe Thr Gly
225 230 235 240
Thr Glu Arg Ser Ser Asp Arg Gln Pro Arg Val Pro Thr Ser Ser Asp
245 250 255
Tyr Glu Asp Val Tyr Thr Lys Leu Asn Ile Ala Asp Ala Val Leu Ser
260 265 270
Pro Ser Thr Asn Asn Ile Leu Thr Gly Asn Phe Asp Val Leu Ala Ile
275 280 285
Pro Tyr Tyr Thr Ile Gly Ala Thr Val Arg Ile Thr Ala Tyr Gln Ser
290 295 300
Phe Val Lys Phe Ala Asn Gln Trp Ile Asp Val Val Tyr Pro Asp Gln
305 310 315 320
Thr Ser Asn Thr Trp Leu Lys Ala His Gln Asn Leu Asp Asn Ala Lys
325 330 335
Asp Lys Met Ile Ala Met Ile Gln Gln Tyr Thr Ala Asn Val Leu Arg
340 345 350
Val Phe Thr Asp Pro Lys Asn Met Pro Pro Leu Gly Lys Asp Lys Lys
355 360 365
Ser Ile Asn Ala Tyr Asn Lys Phe Val Arg Gly Met Val Ile Ser Gly
370 375 380
Leu Asp Leu Val Ala Val Trp Pro Ser Leu Tyr Pro Asp Asp Tyr Gln
385 390 395 400
Val Gln Thr Asp Leu Glu Lys Thr Arg Val Ile Phe Ser Asp Leu Ile
405 410 415
Gly Lys Asp Gln Thr Ile Ser Asn Asp Val Thr Leu Ile Asn Met Ala
420 425 430
Asp Gly Lys Asp Gly Ser Gly Ala Phe Asn Gln His Ala Ala Ile Asp
435 440 445
Leu Asn Ser Ile Phe Tyr Tyr His Glu Glu Leu Ser Ser Met Gln Leu
450 455 460
Gly Ile His Asp Gly Ser Arg Gly Asn Thr Thr Asn Cys Tyr Asp Tyr
465 470 475 480
Gly Ile Ile Ala Asn Tyr Pro Asn His Ser Tyr Phe Tyr Gly Asp Leu
485 490 495
Tyr Ser Pro Ser Gly Asp Ala Thr Phe Ser Ala Pro Leu Asn Val Leu
500 505 510
Asn Ala Gln Thr Gln Tyr Ser Ser Gly Tyr Val Asp Ser Glu Phe Ile
515 520 525
Tyr Asn Ser Asp Pro Ser Ala Tyr Gly Leu Gly Cys His Ile Leu Gly
530 535 540
Gly Cys Thr Lys Gly Asp Cys Tyr Asn Gln Ser Ser Cys Ser Glu Gly
545 550 555 560
Phe Gly Tyr Ser Cys Asn Thr Ser Leu Pro Ser Gln Lys Ile Asn Ala
565 570 575
Phe Tyr Pro Phe Lys Met Asn Leu Asn Arg Ser Gly Thr Ser Asp Lys
580 585 590
Leu Gly Leu Met Tyr Ser Leu Val Pro Leu Asp Leu Ser Pro Asn Asn
595 600 605
Val Phe Gly Glu Leu Asp Ser Asp Thr Arg Asn Val Ile Gly Lys Gly
610 615 620
Phe Pro Ala Glu Lys Gly Thr Leu Ser Tyr Gly Arg Gln Pro Met Leu
625 630 635 640
Val Arg Glu Trp Val Asn Gly Ala Asn Ala Val Lys Leu Ser Asp Val
645 650 655
Pro Leu Thr Leu Gln Met Thr Asn Met Thr Ser Gly Lys Tyr Tyr Ile
660 665 670
Arg Val Arg Tyr Ala Asn Thr Ser Asn Ala Glu Ile Ser Ile Asn Gln
675 680 685
Gln Val Tyr Ala Gly Asn Gln Asn Val Gln Asn Gly Gly Trp Ser Leu
690 695 700
Pro Ser Thr Thr Ala Ser Asn Val Ala Thr Asn Phe Pro Asn Gln Leu
705 710 715 720
Tyr Ile Thr Gly Ile Asn Gly Asn Tyr Val Leu Glu Asp Ile Thr Trp
725 730 735
Gly Val Asp Gly Gln Gly Lys Pro Ile Thr Ile Pro Ser Gly Asp Val
740 745 750
Thr Val Thr Leu Ser Arg Thr Asn Met Ser Gln Ser Gly Asp Leu Phe
755 760 765
Ile Asp Arg Val Glu Leu Val Pro Ala Ala Pro Gln Ser Asp Tyr Ile
770 775 780
Asn Tyr Ser Ile Thr Ser Gln Ile Pro Asn Cys Asn Asn Phe Asp Thr
785 790 795 800
Ile Ile Trp Asp Gly Asn Gly Ala Gln Arg Ser Thr Ala Thr Val Thr
805 810 815
Val Ser Gly Leu Pro Asp Asn Asn Gly Ile Leu Ile Ser Gly Leu Ser
820 825 830
Ser Tyr Gly Trp Gln Pro Leu Gln Asp Val Asn Gly His Gly Asn Asn
835 840 845
Trp Val Thr Asn Gly Gly Pro Phe Thr Leu Ser Asn Asp His Thr Phe
850 855 860
Thr Ala Ile Ser Ile Cys Gly Phe Gln Asn Val Ser Ser Gly Lys Ile
865 870 875 880
Thr Gly Lys Leu Ser
885
<210> 2
<211> 777
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 2
Met Ala Asn Gly Thr Lys Lys His Val Ile Lys Lys Tyr Leu Glu Leu
1 5 10 15
Ile Lys Pro Ile Tyr Tyr Lys Gln Asn Ser Leu Leu Phe Ser Pro Phe
20 25 30
Ile Leu Ser Ile Pro Gly Cys Asp Ile Ser Gln His Gly Ser Ile Pro
35 40 45
Ala Met Lys Arg Asn Cys Phe Thr Leu Leu Leu Tyr Tyr Arg Arg Tyr
50 55 60
Val Met Ala Gln Leu Pro Glu Leu Gln Ala Gln Ser Phe Ile Pro Tyr
65 70 75 80
Asn Val Leu Ala Asn Pro Val Thr Gly Asn Ser Ala Gly Thr Asp Trp
85 90 95
Gly Glu Trp Leu Ser Ser Leu Lys Glu Ala Trp Thr Glu Phe Gln Lys
100 105 110
Thr Gly Ser Asp Lys Phe Leu Gln Ser Val Leu Ser Thr Gly Tyr Asp
115 120 125
Ala Ala Gln Gly Gly Ser Phe Asn Tyr Ile Ala Val Leu Gln Ala Gly
130 135 140
Val Ala Ile Leu Gly Thr Val Leu Gly Ala Glu Phe Pro Gly Ile Thr
145 150 155 160
Ala Ile Ala Val Pro Ala Leu Thr Phe Leu Ile Lys Trp Val Trp Pro
165 170 175
Lys Leu Thr Gly Gly Ser Ala Gly Glu Ser Asp Thr Gln Lys Met Leu
180 185 190
Asp Leu Ile Asp Lys Glu Ile Gln Gln Lys Leu Asp Gln Ala Leu Ser
195 200 205
Gln Gln Asp Ile Asn Asn Trp Arg Ala Tyr Leu Thr Ser Ile Phe Glu
210 215 220
Ala Ala Thr Asn Leu Ser Gln Ser Ile Ile Asp Ala Gln Phe Thr Gly
225 230 235 240
Thr Glu Arg Ser Ser Asp Arg Gln Pro Arg Val Pro Thr Ser Ser Asp
245 250 255
Tyr Glu Asp Val Tyr Thr Lys Leu Asn Ile Ala Asp Ala Val Leu Ser
260 265 270
Pro Ser Thr Asn Asn Ile Leu Thr Gly Asn Phe Asp Val Leu Ala Ile
275 280 285
Pro Tyr Tyr Thr Ile Gly Ala Thr Val Arg Ile Thr Ala Tyr Gln Ser
290 295 300
Phe Val Lys Phe Ala Asn Gln Trp Ile Asp Val Val Tyr Pro Asp Gln
305 310 315 320
Thr Ser Asn Thr Trp Leu Lys Ala His Gln Asn Leu Asp Asn Ala Lys
325 330 335
Asp Lys Met Ile Ala Met Ile Gln Gln Tyr Thr Ala Asn Val Leu Arg
340 345 350
Val Phe Thr Asp Pro Lys Asn Met Pro Pro Leu Gly Lys Asp Lys Lys
355 360 365
Ser Ile Asn Ala Tyr Asn Lys Phe Val Arg Gly Met Val Ile Ser Gly
370 375 380
Leu Asp Leu Val Ala Val Trp Pro Ser Leu Tyr Pro Asp Asp Tyr Gln
385 390 395 400
Val Gln Thr Asp Leu Glu Lys Thr Arg Val Ile Phe Ser Asp Leu Ile
405 410 415
Gly Lys Asp Gln Thr Ile Ser Asn Asp Val Thr Leu Ile Asn Met Ala
420 425 430
Asp Gly Lys Asp Gly Ser Gly Ala Phe Asn Gln His Ala Ala Ile Asp
435 440 445
Leu Asn Ser Ile Phe Tyr Tyr His Glu Glu Leu Ser Ser Met Gln Leu
450 455 460
Gly Ile His Asp Gly Ser Arg Gly Asn Thr Thr Asn Cys Tyr Asp Tyr
465 470 475 480
Gly Ile Ile Ala Asn Tyr Pro Asn His Ser Tyr Phe Tyr Gly Asp Leu
485 490 495
Tyr Ser Pro Ser Gly Asp Ala Thr Phe Ser Ala Pro Leu Asn Val Leu
500 505 510
Asn Ala Gln Thr Gln Tyr Ser Ser Gly Tyr Val Asp Ser Glu Phe Ile
515 520 525
Tyr Asn Ser Asp Pro Ser Ala Tyr Gly Leu Gly Cys His Ile Leu Gly
530 535 540
Gly Cys Thr Lys Gly Asp Cys Tyr Asn Gln Ser Ser Cys Ser Glu Gly
545 550 555 560
Phe Gly Tyr Ser Cys Asn Thr Ser Leu Pro Ser Gln Lys Ile Asn Ala
565 570 575
Phe Tyr Pro Phe Lys Met Asn Leu Asn Arg Ser Gly Thr Ser Asp Lys
580 585 590
Leu Gly Leu Met Tyr Ser Leu Val Pro Leu Asp Leu Ser Pro Asn Asn
595 600 605
Val Phe Gly Glu Leu Asp Ser Asp Thr Arg Asn Val Ile Gly Lys Gly
610 615 620
Phe Pro Ala Glu Lys Gly Thr Leu Ser Tyr Gly Arg Gln Pro Met Leu
625 630 635 640
Val Arg Glu Trp Val Asn Gly Ala Asn Ala Val Lys Leu Ser Asp Val
645 650 655
Pro Leu Thr Leu Gln Met Thr Asn Met Thr Ser Gly Lys Tyr Tyr Ile
660 665 670
Arg Val Arg Tyr Ala Asn Thr Ser Asn Ala Glu Ile Ser Ile Asn Gln
675 680 685
Gln Val Tyr Ala Gly Asn Gln Asn Val Gln Asn Gly Gly Trp Ser Leu
690 695 700
Pro Ser Thr Thr Ala Ser Asn Val Ala Thr Asn Phe Pro Asn Gln Leu
705 710 715 720
Tyr Ile Thr Gly Ile Asn Gly Asn Tyr Val Leu Glu Asp Ile Thr Trp
725 730 735
Gly Val Asp Gly Gln Gly Lys Pro Ile Thr Ile Pro Ser Gly Asp Val
740 745 750
Thr Val Thr Leu Ser Arg Thr Asn Met Ser Gln Ser Gly Asp Leu Phe
755 760 765
Ile Asp Arg Val Glu Leu Val Pro Ala
770 775
<210> 3
<211> 527
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp. из образца окружающей среды
<400> 3
Met Ala Val Asn Gly Thr Gln Leu Ala Ser Thr Val Thr Thr Val Ser
1 5 10 15
Asn Asp Ile Val Gln Thr Arg Thr Met Val Gln Gly Leu Phe Ser Ala
20 25 30
Asp Asn Pro Thr Gln Leu Ala Pro Gly Val Thr Asp Tyr Trp Ile Asp
35 40 45
Tyr Val His Gln Gln Val Gln Ser Leu Pro Asn Ala Leu Ala Ser Glu
50 55 60
Lys Arg Glu Leu Asn Thr Arg Val Asn Gln Ala Lys Arg Leu Ser Lys
65 70 75 80
Ser Gln Asn Val Leu Gln Ser Asp Ser Met Gly Gly Ala Gly Trp Lys
85 90 95
Leu Gly Arg Lys Val Phe Ile Ser Pro Gly Asp Leu Gln Tyr Lys Gly
100 105 110
Pro Gln Leu Val Leu Pro Pro Ser Ser Leu Val Tyr Pro Ser Tyr Ala
115 120 125
Tyr Gln Thr Val Pro Glu Ser Ala Leu Lys Pro Tyr Thr Arg Tyr Tyr
130 135 140
Leu Ser Val Phe Val Leu Gln Ala Asp Ser Leu His Ile Ile Ser Ser
145 150 155 160
Arg Tyr Gly Asn Ala Ile Ser His Val Val Asn Val Gly Tyr Ser Thr
165 170 175
Ser Met Pro Thr Ser Pro Asp Gly Val Leu Asn Ser Pro His Phe Phe
180 185 190
Gln Tyr Pro Ile Asp Val Gly Ala Val His Pro Asp Ala Asn Leu Gly
195 200 205
Ile Thr Val Gly Phe Thr Val Pro Thr Asn Gly Phe Ala Lys Ile Ser
210 215 220
Gln Val Ser Leu Thr Glu Ala Arg Pro Leu Thr Ala Ala Glu Val Arg
225 230 235 240
Arg Val Gln Asn Gln Asp Glu Gln Trp Phe Gln Pro Tyr Leu Arg Gln
245 250 255
Gln Ala Glu Ile Gln Thr Ser Leu Gln Val Ala Thr Asn Gln Leu Asn
260 265 270
Ala Ile Tyr Asn Ser Thr Asn Trp Ser Gly Ala Ile Gly Pro Asn Val
275 280 285
Thr Tyr Thr Asp Leu Ala Asn Val Thr Val Leu Glu Pro Thr Pro Ser
290 295 300
Gln Pro Arg Leu Ser Thr Asp Leu Pro Ile Gln Asp Pro Asp Ala Gln
305 310 315 320
Gln Lys Ala Ala Ile Phe Gln Ala Thr Gln Arg Ala Trp Met Gln Leu
325 330 335
Gln Ala Arg Asn Ile Val Pro Asn Ser Leu Phe Leu Gln Gly Gly Gln
340 345 350
Asn Trp Asn Val Glu Gly Thr Val Ser Phe Pro Gln Glu Asn Asn Lys
355 360 365
Pro Val Leu Thr Leu Ser Asp Trp Asp Ala Thr Val Ser Gln Met Ile
370 375 380
Ser Leu Pro Val His Asn Gly Tyr Thr Glu Tyr Arg Val Arg Val Arg
385 390 395 400
Ala Lys Gly Lys Gly Thr Ile Ser Ile Val Pro Pro Gly Asp Ala Lys
405 410 415
Arg Met Leu Phe Phe Asn Ser Pro Ser Phe Phe Ala Ile Gln Glu Phe
420 425 430
Tyr Phe Tyr Pro Asp Thr Ser Met Ser Gln Val Asn Leu Ile Ile Gln
435 440 445
Ser Glu Gly Ser Glu Phe Thr Val Asp Trp Val Glu Met Gln Glu Met
450 455 460
Lys Phe Thr Glu Glu Pro Leu Gly Val Asn Gly Gly Asn Ala Ala His
465 470 475 480
Thr Val Gly Ile Thr Lys Pro Val Gly His Leu Glu Ala Ser Asn Pro
485 490 495
Pro Met Glu Ser Gln Ser Thr Asn Ser Ser Ser Asn Cys Lys Cys Ser
500 505 510
Gln Ser Ser Ser Gln Ser Asn Ser Gly Cys Arg Cys Ser Gln Ser
515 520 525
<210> 4
<211> 660
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp. из образца окружающей среды
<400> 4
Met Asp Pro Asn Ala Lys Tyr Glu Ile Thr Asn Thr Lys Tyr Asn Leu
1 5 10 15
Ser His Thr Gly Asn Arg Tyr Ser Arg Phe Pro Leu Asp Asn Thr Gln
20 25 30
Tyr Lys Lys Leu Gln Asn Met Lys Tyr Glu Asn Met Ser Thr Ala Tyr
35 40 45
Gln Lys Asn Gly Asp Tyr Ala Lys Leu Pro Ile Ile Thr Ala Val Asp
50 55 60
Trp Ser Thr Ala Ser Ser Ala Leu Ile Leu Val Ala Gly Thr Leu Ile
65 70 75 80
Ser Ile Gly Ser Val Gly Val Gly Ala Ala Val Thr Thr Ile Gly Thr
85 90 95
Met Leu Pro Leu Phe Trp Ser Asp Leu Phe Gly Thr Pro Gly Glu Asn
100 105 110
Thr Trp Gln Asn Leu Ile Met Gln Gly Asn Ala Val Tyr Pro Val Gln
115 120 125
Asp Phe Thr Pro Tyr Phe Leu Gln Ser Leu Asn Asn Glu Ile Gly Arg
130 135 140
Ser Lys Ala Val Leu Glu Leu Phe Asp Asp Ile Phe Asn Tyr Trp Gln
145 150 155 160
Glu Tyr Asp Thr Pro Arg Ala Arg Glu Glu Val Ala Gln Gln Phe Arg
165 170 175
Asn Thr Asn Thr Thr Ile Val Gly Ser Leu Gly Val Ile Ser Asn Ala
180 185 190
Arg Glu Phe Asp Ile Ile Ser Leu Ala Thr Tyr Ala Ser Leu Ala Leu
195 200 205
Leu His Leu Thr Leu Leu Arg Gln Gly Val Lys Tyr Ala Asp Lys Trp
210 215 220
Gly Leu Ala Arg Glu Glu Gly Ala Tyr Tyr Lys Asn Leu Leu Lys Asp
225 230 235 240
Arg Ile Ala Thr Tyr Thr Asn Tyr Cys Gln Ser Arg Tyr Arg Ala Gly
245 250 255
Leu Asp Arg Leu Arg Thr Gly Thr Phe Tyr Gly Ala Trp Val Ser Phe
260 265 270
Asn Thr Tyr Arg Arg Glu Tyr Thr Ile Ser Val Leu Asn Ile Ile Ala
275 280 285
Met Phe Ser Thr Phe Asp Pro Asp Arg Tyr Pro Ser Asn Tyr Thr Thr
290 295 300
Asn Thr Gln Leu Thr Glu Lys Ile His Val Pro Thr Arg Asn Ser Ser
305 310 315 320
Glu Thr Phe Tyr Asn Gly Phe Pro Asp Leu Ser Asn Thr Glu Ala Lys
325 330 335
Leu Val Pro Thr Leu Ser Leu Phe Lys Ser Leu Ser Arg Leu Asp Phe
340 345 350
Tyr Ser Ser Tyr Thr Asn Gly Ile Tyr Phe Leu Asn Gly Ile Lys Asn
355 360 365
His Tyr Thr Tyr Ile Asp Gly Thr Asn Ala Gly Ser Leu Asn Ile Ile
370 375 380
Gly Asp Glu Arg His Ile Thr Tyr Leu Asp Gly Ser Ile Leu Ser Pro
385 390 395 400
Leu Val His Gln Cys Glu Tyr Asp Gln Ile Leu Thr Ala Val Ile Asn
405 410 415
Thr Pro Asn Tyr Gly Ile Ser Arg Leu Ala Phe Thr Ser Arg Asn Leu
420 425 430
Pro Pro Tyr Asp Val Tyr Ser Ala Asp Asn Gly Ile Gln Pro Val Arg
435 440 445
Thr Ala Lys Val Leu Pro Ile Gln Pro Ser Ser Leu Pro Pro Ser Ile
450 455 460
Pro Pro Ser Leu Arg Pro Tyr Met Val Pro Ile Asn Tyr Gln Leu Ser
465 470 475 480
Asp Ile Thr Ala Ile Asn Thr Gly Pro Phe Asn Pro Asp Ile Leu Tyr
485 490 495
Asn Phe Ser Trp Met Val Ala Ser Asp Asn Asn Val Ile Gln Gly Gly
500 505 510
Asn His Ile Thr Gln Ile Pro Ala Val Lys Gly Asn Ile Leu Gln Asn
515 520 525
Gly Ala Lys Val Arg Glu Gly Pro Gly His Thr Gly Gly Pro Ile Val
530 535 540
Glu Phe Gly Pro His Thr Pro Ala Asn Pro Pro Ala Leu Lys Ile Arg
545 550 555 560
Cys Gln Val Ser Pro Ala Ala Ala Asn Lys Tyr Leu Asn Met Arg Ile
565 570 575
Arg Tyr Ala Ser Asn Ser Thr Ile Ala Thr Asn Leu Asp Phe Ile Ile
580 585 590
Gly Gly Glu Val Arg Asn Ser Met Ala Phe Pro Gly Thr Asn Ala Asp
595 600 605
Ile Thr Lys Ile Asp Ile Pro Tyr Asn Asn Phe Asn Thr Val Glu Phe
610 615 620
Gln Ile Ile Asn Pro Lys Asn Val Gly Phe Met Asp Val Ser Ile Thr
625 630 635 640
Lys Ala Ser Asn Ile Asn Gly Thr Phe Leu Ile Asp Lys Ile Glu Phe
645 650 655
Tyr Val Arg Ser
660
<210> 5
<211> 659
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 5
Met Asp Pro Asn Ala Lys Tyr Glu Ile Thr Asn Thr Lys Tyr Asn Leu
1 5 10 15
Ser His Thr Gly Asn Arg Tyr Ser Arg Phe Pro Leu Asp Asn Thr Gln
20 25 30
Tyr Lys Lys Leu Gln Asn Met Lys Tyr Glu Asn Met Ser Thr Ala Tyr
35 40 45
Gln Lys Asn Gly Asp Tyr Ala Lys Leu Pro Ile Ile Thr Ala Val Asp
50 55 60
Trp Ser Thr Ala Ser Ser Ala Leu Ile Leu Val Ala Gly Thr Leu Ile
65 70 75 80
Ser Ile Gly Ser Val Gly Val Gly Ala Ala Val Thr Thr Ile Gly Thr
85 90 95
Met Leu Pro Leu Phe Trp Ser Asp Leu Phe Gly Thr Pro Gly Glu Asn
100 105 110
Thr Trp Gln Asn Leu Ile Met Gln Gly Asn Ala Val Tyr Pro Val Gln
115 120 125
Asp Phe Thr Pro Tyr Phe Leu Gln Ser Leu Asn Asn Glu Ile Gly Arg
130 135 140
Ser Lys Ala Val Leu Glu Leu Phe Asp Asp Ile Phe Asn Tyr Trp Gln
145 150 155 160
Glu Tyr Asp Thr Pro Arg Ala Arg Glu Glu Val Ala Gln Gln Phe Arg
165 170 175
Asn Thr Asn Thr Thr Ile Val Gly Ser Leu Gly Val Ile Ser Asn Ala
180 185 190
Arg Glu Phe Asp Ile Ile Ser Leu Ala Thr Tyr Ala Ser Leu Ala Leu
195 200 205
Leu His Leu Thr Leu Leu Arg Gln Gly Val Lys Tyr Ala Asp Lys Trp
210 215 220
Gly Leu Ala Arg Glu Glu Gly Ala Tyr Tyr Lys Asn Leu Leu Lys Asp
225 230 235 240
Arg Ile Ala Thr Tyr Thr Asn Tyr Cys Gln Ser Arg Tyr Arg Ala Gly
245 250 255
Leu Asp Arg Leu Arg Thr Gly Thr Phe Tyr Gly Ala Trp Val Ser Phe
260 265 270
Asn Thr Tyr Arg Arg Glu Tyr Thr Ile Ser Val Leu Asn Ile Ile Ala
275 280 285
Met Phe Ser Thr Phe Asp Pro Asp Arg Tyr Pro Ser Asn Tyr Thr Thr
290 295 300
Asn Thr Gln Leu Thr Glu Lys Ile His Val Pro Thr Arg Asn Ser Ser
305 310 315 320
Glu Thr Phe Tyr Asn Gly Phe Pro Asp Leu Ser Asn Thr Glu Ala Lys
325 330 335
Leu Val Pro Thr Leu Ser Leu Phe Lys Ser Leu Ser Arg Leu Asp Phe
340 345 350
Tyr Ser Ser Tyr Thr Asn Gly Ile Tyr Phe Leu Asn Gly Ile Lys Asn
355 360 365
His Tyr Thr Tyr Ile Asp Gly Thr Asn Ala Gly Ser Leu Asn Ile Ile
370 375 380
Gly Asp Glu Arg His Ile Thr Tyr Leu Asp Gly Ser Ile Leu Ser Pro
385 390 395 400
Leu Val His Gln Cys Glu Tyr Asp Gln Ile Leu Thr Ala Val Ile Asn
405 410 415
Thr Pro Asn Tyr Gly Ile Ser Arg Leu Ala Phe Thr Ser Arg Asn Leu
420 425 430
Pro Pro Tyr Asp Val Tyr Ser Ala Asp Asn Gly Ile Gln Pro Val Arg
435 440 445
Thr Ala Lys Val Leu Pro Ile Gln Pro Ser Ser Leu Pro Pro Ser Ile
450 455 460
Pro Pro Ser Leu Arg Pro Tyr Met Val Pro Ile Asn Tyr Gln Leu Ser
465 470 475 480
Asp Ile Thr Ala Ile Asn Thr Gly Pro Phe Asn Pro Asp Ile Leu Tyr
485 490 495
Asn Phe Ser Trp Met Val Ala Ser Asp Asn Asn Val Ile Gln Gly Gly
500 505 510
Asn His Ile Thr Gln Ile Pro Ala Val Lys Gly Asn Ile Leu Gln Asn
515 520 525
Gly Ala Lys Val Arg Glu Gly Pro Gly His Thr Gly Gly Pro Ile Val
530 535 540
Glu Phe Gly Pro His Thr Pro Ala Asn Pro Pro Ala Leu Lys Ile Arg
545 550 555 560
Cys Gln Val Ser Pro Ala Ala Ala Asn Lys Tyr Leu Asn Met Arg Ile
565 570 575
Arg Tyr Ala Ser Asn Ser Thr Ile Ala Thr Asn Leu Asp Phe Ile Ile
580 585 590
Gly Gly Glu Val Arg Asn Ser Met Ala Phe Pro Gly Thr Asn Ala Asp
595 600 605
Ile Thr Lys Ile Asp Ile Pro Tyr Asn Asn Phe Asn Thr Val Glu Phe
610 615 620
Gln Ile Ile Asn Pro Lys Asn Val Gly Phe Met Asp Val Ser Ile Thr
625 630 635 640
Lys Ala Ser Asn Ile Asn Gly Thr Phe Leu Ile Asp Lys Ile Glu Phe
645 650 655
Tyr Val Arg
<210> 6
<211> 632
<212> PRT
<213> Неизвестная
<220>
<223> Неизвестный организм из образца окружающей среды
<400> 6
Leu Asn Ser Lys Ser Ile Ile Glu Asn Glu Val Gln Glu Asn Gln Tyr
1 5 10 15
Ile Asp Ile Arg Asn Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp
20 25 30
Pro Asn Thr Asn Ile Thr Thr Leu Thr Glu Ala Ile Asn Ser Gln Ala
35 40 45
Gly Ala Ile Ala Gly Lys Thr Ala Leu Asp Met Arg Arg Asp Phe Thr
50 55 60
Leu Val Ala Asp Ile Tyr Leu Gly Ser Lys Ser Ser Gly Ala Asp Gly
65 70 75 80
Ile Ala Ile Ala Phe His Arg Gly Ser Ile Gly Phe Ile Gly Thr Met
85 90 95
Gly Gly Gly Leu Gly Ile Leu Gly Ala Pro Asn Gly Ile Gly Phe Glu
100 105 110
Ile Asp Thr Tyr Trp Lys Ala Ser Ser Asp Glu Thr Gly Asp Ser Phe
115 120 125
Gly His Gly Gln Met Asn Gly Pro His Ala Gly Phe Val Ser Thr Asn
130 135 140
Arg Asn Ala Ser Tyr Leu Thr Ala Leu Ala Pro Met Gln Arg Ile Pro
145 150 155 160
Ala Pro Asn Asp Lys Trp Arg Val Leu Thr Ile Asn Trp Asp Ala Arg
165 170 175
Asn Asn Lys Leu Thr Ala Ser Leu Gln Glu Lys Asn Asn Asp Ala Ser
180 185 190
Thr Arg Ser Ala Thr Pro Arg Tyr Gln Ala Trp Glu Leu Leu Asn Pro
195 200 205
Ala Phe Asp Leu Asn Gln Lys Tyr Thr Phe Val Ile Gly Ser Ala Thr
210 215 220
Gly Ala Ala Asn Asn Lys His Gln Ile Gly Val Thr Leu Phe Glu Ala
225 230 235 240
Tyr Phe Thr Lys Pro Thr Ile Val Ala Asn Pro Val Asp Ile Glu Ile
245 250 255
Gly Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
260 265 270
Thr Asp Glu Val Asp Gly Asp Ile Thr Lys Asp Ile Thr Val Glu Phe
275 280 285
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Arg Val Thr Tyr Lys
290 295 300
Val Val Asn Ser Tyr Gly Glu Ser Asp Glu Lys Thr Ile Glu Val Val
305 310 315 320
Val Tyr Thr Lys Pro Thr Ile Thr Ala His Asp Val Ala Ile Lys Lys
325 330 335
Gly Leu Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
340 345 350
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Lys Phe
355 360 365
Asn Asn Val Asp Thr Ser Lys Pro Gly Lys Tyr His Val Thr Tyr Lys
370 375 380
Val Ile Asn Ser Tyr Glu Lys Ile Asp Glu Lys Thr Ile Glu Ile Thr
385 390 395 400
Val Tyr Thr Lys Pro Thr Ile Val Ala Gln Asp Val Lys Ile Lys Lys
405 410 415
Asp Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
420 425 430
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Phe
435 440 445
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Ser Val Lys Tyr Lys
450 455 460
Val Val Asn Asn Tyr Glu Glu Ser Asp Glu Lys Thr Ile Ala Val Thr
465 470 475 480
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro Thr Gly Trp
485 490 495
Lys Phe Phe Ser Gly Glu Thr Ile Thr Leu Glu Glu Asp Glu Glu Asn
500 505 510
Ala Leu Asn Gly Lys Trp Val Phe Tyr Ala Asp Lys His Val Ala Ile
515 520 525
Tyr Lys Gln Val Glu Leu Lys Asn Asn Thr Pro Tyr Gln Ile Thr Val
530 535 540
Tyr Val Lys Pro Glu Asp Glu Glu Thr Val Ala His His Ile Val Lys
545 550 555 560
Val Ser Phe Lys Ser Asp Ser Ala Gly Gln Glu Ser Glu Glu Ile Ile
565 570 575
Asn Glu Arg Leu Ile Asp Ala Glu Gln Ile Gln Lys Gly Tyr Arg Lys
580 585 590
Leu Thr Ser Ile Pro Phe Thr Pro Thr Thr Ile Val Pro Asn Lys Lys
595 600 605
Pro Val Ile Ile Val Glu Asn Phe Leu Pro Gly Trp Ile Gly Gly Val
610 615 620
Arg Ile Ile Val Glu Pro Thr Lys
625 630
<210> 7
<211> 632
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 7
Met Asn Ser Lys Ser Ile Ile Glu Asn Glu Val Gln Glu Asn Gln Tyr
1 5 10 15
Ile Asp Ile Arg Asn Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp
20 25 30
Pro Asn Thr Asn Ile Thr Thr Leu Thr Glu Ala Ile Asn Ser Gln Ala
35 40 45
Gly Ala Ile Ala Gly Lys Thr Ala Leu Asp Met Arg Arg Asp Phe Thr
50 55 60
Leu Val Ala Asp Ile Tyr Leu Gly Ser Lys Ser Ser Gly Ala Asp Gly
65 70 75 80
Ile Ala Ile Ala Phe His Arg Gly Ser Ile Gly Phe Ile Gly Thr Met
85 90 95
Gly Gly Gly Leu Gly Ile Leu Gly Ala Pro Asn Gly Ile Gly Phe Glu
100 105 110
Ile Asp Thr Tyr Trp Lys Ala Ser Ser Asp Glu Thr Gly Asp Ser Phe
115 120 125
Gly His Gly Gln Met Asn Gly Pro His Ala Gly Phe Val Ser Thr Asn
130 135 140
Arg Asn Ala Ser Tyr Leu Thr Ala Leu Ala Pro Met Gln Arg Ile Pro
145 150 155 160
Ala Pro Asn Asp Lys Trp Arg Val Leu Thr Ile Asn Trp Asp Ala Arg
165 170 175
Asn Asn Lys Leu Thr Ala Ser Leu Gln Glu Lys Asn Asn Asp Ala Ser
180 185 190
Thr Arg Ser Ala Thr Pro Arg Tyr Gln Ala Trp Glu Leu Leu Asn Pro
195 200 205
Ala Phe Asp Leu Asn Gln Lys Tyr Thr Phe Val Ile Gly Ser Ala Thr
210 215 220
Gly Ala Ala Asn Asn Lys His Gln Ile Gly Val Thr Leu Phe Glu Ala
225 230 235 240
Tyr Phe Thr Lys Pro Thr Ile Val Ala Asn Pro Val Asp Ile Glu Ile
245 250 255
Gly Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
260 265 270
Thr Asp Glu Val Asp Gly Asp Ile Thr Lys Asp Ile Thr Val Glu Phe
275 280 285
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Arg Val Thr Tyr Lys
290 295 300
Val Val Asn Ser Tyr Gly Glu Ser Asp Glu Lys Thr Ile Glu Val Val
305 310 315 320
Val Tyr Thr Lys Pro Thr Ile Thr Ala His Asp Val Ala Ile Lys Lys
325 330 335
Gly Leu Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
340 345 350
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Lys Phe
355 360 365
Asn Asn Val Asp Thr Ser Lys Pro Gly Lys Tyr His Val Thr Tyr Lys
370 375 380
Val Ile Asn Ser Tyr Glu Lys Ile Asp Glu Lys Thr Ile Glu Ile Thr
385 390 395 400
Val Tyr Thr Lys Pro Thr Ile Val Ala Gln Asp Val Lys Ile Lys Lys
405 410 415
Asp Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
420 425 430
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Phe
435 440 445
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Ser Val Lys Tyr Lys
450 455 460
Val Val Asn Asn Tyr Glu Glu Ser Asp Glu Lys Thr Ile Ala Val Thr
465 470 475 480
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro Thr Gly Trp
485 490 495
Lys Phe Phe Ser Gly Glu Thr Ile Thr Leu Glu Glu Asp Glu Glu Asn
500 505 510
Ala Leu Asn Gly Lys Trp Val Phe Tyr Ala Asp Lys His Val Ala Ile
515 520 525
Tyr Lys Gln Val Glu Leu Lys Asn Asn Thr Pro Tyr Gln Ile Thr Val
530 535 540
Tyr Val Lys Pro Glu Asp Glu Glu Thr Val Ala His His Ile Val Lys
545 550 555 560
Val Ser Phe Lys Ser Asp Ser Ala Gly Gln Glu Ser Glu Glu Ile Ile
565 570 575
Asn Glu Arg Leu Ile Asp Ala Glu Gln Ile Gln Lys Gly Tyr Arg Lys
580 585 590
Leu Thr Ser Ile Pro Phe Thr Pro Thr Thr Ile Val Pro Asn Lys Lys
595 600 605
Pro Val Ile Ile Val Glu Asn Phe Leu Pro Gly Trp Ile Gly Gly Val
610 615 620
Arg Ile Ile Val Glu Pro Thr Lys
625 630
<210> 8
<211> 319
<212> PRT
<213> Неизвестная
<220>
<223> Lysinibacillus sp., полученный из образца окружающей среды
<400> 8
Met Lys Asn Lys Ile Ile Leu Tyr Gly Val Val Thr Ser Thr Leu Leu
1 5 10 15
Ala Gly Gly Pro Phe Ser Asn Asn Ala Ser Ala Ser Glu Asn Gln Gly
20 25 30
Leu Thr Gly Asn Asn Ile Gly Val Val Ser Ser Asn Ile Lys Ala Ala
35 40 45
Glu Gln Ser Gln Asn Lys Asn Ser Ala Tyr Gln Asp Ile Asp Glu Arg
50 55 60
Val Lys Lys Met Leu Ile Ser Ala Ala Phe Asp Gly Thr Glu Tyr Arg
65 70 75 80
Tyr His His Ile Lys Asp Thr Glu Leu Asn Gly Asn Ile Ile Glu Gly
85 90 95
Ser Met Ile Glu Asn Ala Gln Ile Leu Thr Ile Gly Glu Asn Ile Leu
100 105 110
Glu Asn Asn Leu Gly His Glu Val Thr Leu Phe Thr Ser Gly Tyr Glu
115 120 125
His Glu Phe Lys Glu Met Thr Ser Thr Thr Asn Thr Ser Gly Trp Thr
130 135 140
Phe Gly Tyr Asn Tyr Asn Ala Thr Leu Ser Val Met Met Val Ser Ala
145 150 155 160
Ser Gln Ser Phe Ser Val Asp Tyr Asn Met Ser Thr Ser Asn Thr Thr
165 170 175
Glu Lys Ser Gln Val Arg Lys Phe Thr Val Pro Pro Gln Gly Phe Pro
180 185 190
Val Pro Ala Gly Lys Lys Tyr Lys Val Glu Tyr Val Phe Glu Lys Ile
195 200 205
Thr Ile Ser Gly Arg Asn Arg Leu Asn Ala Asp Leu Tyr Gly Asp Ala
210 215 220
Thr Tyr Tyr Tyr Asn Asn Leu Pro Met Ser Pro Gln Leu Leu Tyr Ser
225 230 235 240
Ala Met Asn Phe Ala Ser Asp Thr Gln Gly Phe Glu Arg Val Ile Arg
245 250 255
Asp Asn Ala Glu Gly Asn Asp Arg Phe Gly Ile Arg Ala Thr Gly Glu
260 265 270
Gly Arg Phe Ser Thr Glu Phe Gly Thr Arg Leu Tyr Ala Lys Ile Thr
275 280 285
Asp Ile Thr Asp Ser Lys Lys Pro Val Thr Ile Glu Thr Lys Lys Ile
290 295 300
Pro Val Asn Phe Glu Thr Leu Ser Val Ala Thr Lys Ile Ile Glu
305 310 315
<210> 9
<211> 293
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 9
Met Ser Glu Asn Gln Gly Leu Thr Gly Asn Asn Ile Gly Val Val Ser
1 5 10 15
Ser Asn Ile Lys Ala Ala Glu Gln Ser Gln Asn Lys Asn Ser Ala Tyr
20 25 30
Gln Asp Ile Asp Glu Arg Val Lys Lys Met Leu Ile Ser Ala Ala Phe
35 40 45
Asp Gly Thr Glu Tyr Arg Tyr His His Ile Lys Asp Thr Glu Leu Asn
50 55 60
Gly Asn Ile Ile Glu Gly Ser Met Ile Glu Asn Ala Gln Ile Leu Thr
65 70 75 80
Ile Gly Glu Asn Ile Leu Glu Asn Asn Leu Gly His Glu Val Thr Leu
85 90 95
Phe Thr Ser Gly Tyr Glu His Glu Phe Lys Glu Met Thr Ser Thr Thr
100 105 110
Asn Thr Ser Gly Trp Thr Phe Gly Tyr Asn Tyr Asn Ala Thr Leu Ser
115 120 125
Val Met Met Val Ser Ala Ser Gln Ser Phe Ser Val Asp Tyr Asn Met
130 135 140
Ser Thr Ser Asn Thr Thr Glu Lys Ser Gln Val Arg Lys Phe Thr Val
145 150 155 160
Pro Pro Gln Gly Phe Pro Val Pro Ala Gly Lys Lys Tyr Lys Val Glu
165 170 175
Tyr Val Phe Glu Lys Ile Thr Ile Ser Gly Arg Asn Arg Leu Asn Ala
180 185 190
Asp Leu Tyr Gly Asp Ala Thr Tyr Tyr Tyr Asn Asn Leu Pro Met Ser
195 200 205
Pro Gln Leu Leu Tyr Ser Ala Met Asn Phe Ala Ser Asp Thr Gln Gly
210 215 220
Phe Glu Arg Val Ile Arg Asp Asn Ala Glu Gly Asn Asp Arg Phe Gly
225 230 235 240
Ile Arg Ala Thr Gly Glu Gly Arg Phe Ser Thr Glu Phe Gly Thr Arg
245 250 255
Leu Tyr Ala Lys Ile Thr Asp Ile Thr Asp Ser Lys Lys Pro Val Thr
260 265 270
Ile Glu Thr Lys Lys Ile Pro Val Asn Phe Glu Thr Leu Ser Val Ala
275 280 285
Thr Lys Ile Ile Glu
290
<210> 10
<211> 803
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp. из образца окружающей среды
<400> 10
Met Asp Lys Lys Gln Lys Lys Ile Leu Ser Met Thr Leu Ala Leu Gly
1 5 10 15
Val Leu Thr Gly Thr Tyr Ile Pro Ile Thr Ser Thr Ala Leu Ala Glu
20 25 30
Thr Glu Lys Glu Ser Ile Lys Lys Ser Ser Ala Lys Thr Ser Pro Gln
35 40 45
Met Asp Ser Arg Ala Trp Ile Asn Asn Pro Tyr Gln Gly Val Ser Met
50 55 60
Gly Gln Phe Leu Asn Ala Phe Asn Gly Asn Gln Trp Lys Pro Leu Leu
65 70 75 80
Glu Gln Ile His Asn Lys Gly Asp Ala Gly Ser Gly Thr Ile Ala Phe
85 90 95
Leu Lys Gly Met Met Thr Thr Gly Leu Ser Leu Leu Pro Pro Pro Gly
100 105 110
Ser Leu Leu Ala Ser Val Trp Asp Ile Phe Ile Pro Gly Thr Gly Val
115 120 125
Lys Asp Asp Met Trp Leu Gln Ile Glu Lys Tyr Val Asp Glu Lys Ile
130 135 140
Asp Ser Lys Ile Asn Asp Tyr His Lys Tyr Leu Met Gly Ala Gln Phe
145 150 155 160
Asn Gly Ala Met Glu Lys Val Lys Glu Tyr Gln Arg Val Leu Gln Ile
165 170 175
Tyr Asn Asn Ser Lys Val Ser Val Lys Val Glu Glu Pro Glu Ala Pro
180 185 190
Val Arg Asp Ala Val Arg Lys Ala Asp Ser Glu Leu Ala Ser Tyr Ile
195 200 205
Ala Val Ile Gln Thr Pro Glu Lys Glu Thr Asp Ser Val Tyr Gln Gln
210 215 220
Ile Thr Ala Pro Ile Phe Val Gln Ala Ala Asn Leu His Leu Leu Val
225 230 235 240
Leu Arg Asp Ile Ile Gln Phe Gly Glu Glu Trp Gly Ile Asp Lys Asp
245 250 255
Gln Leu Lys Gly Tyr Lys Asp Lys Gln Glu Lys Leu Ile Glu Asn Tyr
260 265 270
Thr Asp Tyr Ser Ile Lys Val Tyr Asn Asp Gly Leu Glu Lys Arg Ile
275 280 285
Asn Glu Ala Asp Lys Ile Phe Gly Pro Glu Asp Gly Tyr Gly Asn Pro
290 295 300
Ala Lys Pro Gly Pro Glu Glu Ala Tyr Thr Asn Thr His Arg Trp Asn
305 310 315 320
Tyr Ile Asn Glu Tyr Ile Arg Glu Tyr Thr Leu Ser Val Leu Asp Phe
325 330 335
Val Ala Leu Phe Pro Ser Thr Asn Pro Asn Ile Tyr Ser Arg Gly Ala
340 345 350
Met Gln Lys Asn Ser Arg Gln Ile Tyr Ser Ser Ile Ser Gly Thr Val
355 360 365
Thr Pro Asn Thr Gln Thr Trp Lys Asp Ile Asn Asn Arg Leu Ala Ser
370 375 380
Gln Glu Tyr Lys Gly Glu Leu Val Ala Ala Glu Val Gln Ser Tyr Ala
385 390 395 400
Arg Ile Asp Ala Leu Ala Pro Trp Phe Asp Arg Asn Ser Gly Thr Thr
405 410 415
Tyr Asn Thr Gly Trp Val Gly Asn Thr Ser Gly Gly Ile Leu Arg Lys
420 425 430
Ile Thr Ile Asp Tyr Ser Asn Pro Leu Thr Lys Val Asn Ile Gly Asp
435 440 445
Gln Arg Thr Pro Phe Tyr Phe Gln Leu Thr His Glu Asn Gly Ser Ala
450 455 460
Ile Pro Gln Phe Gly Gln Asp Asp Pro Arg Leu Lys Lys Arg Thr Phe
465 470 475 480
Glu Phe Pro Asn Gln Lys Ile Ser Asp Ile Gln Ala Phe Gly Lys Ser
485 490 495
Thr Ala Pro Gly Leu Asp Gly Ile Asp Ala Val Val Phe Gly Phe Thr
500 505 510
Asp Arg Asn Leu Asp Ser Lys His Asp Leu Met Arg Asn Met Ile Ser
515 520 525
Ser Ile Pro Ala Glu Met Tyr Gln Gly Lys Ser Asn Phe Lys Pro Gln
530 535 540
Met Glu Pro Ile Asn Ala Gln Gln Lys Ala Met Lys Thr Asp Thr Thr
545 550 555 560
Asn Ser Tyr Leu Thr Tyr Lys Val Asn Ser Tyr Lys Ala Gln Glu Tyr
565 570 575
Lys Ile Arg Tyr Arg Val Ala Ala Asn Glu Asn Ser Lys Ile Ser Ile
580 585 590
Ser Gln Lys Ser Gly Thr Asn Phe Glu Lys Ile Gly Asp Thr Asn Ile
595 600 605
Ser Lys Thr Val Asn Ala Glu Asp Thr Val Lys Gly Glu Tyr Gly Tyr
610 615 620
Tyr Lys Ile Ile Glu Gly Pro Thr Val Lys Leu Asn Tyr Gly Gln Asn
625 630 635 640
Glu Leu Lys Leu Glu Asn Thr Gln Gly Lys Phe Ala Ile Asp Arg Ile
645 650 655
Glu Leu Glu Pro Ile Gln Lys Asp Glu Ile Val Phe Glu Asp Asn Phe
660 665 670
Asp Gly Thr Asn Lys Gly Trp Ile Phe Tyr Ser Gly Gly Gly Ile Val
675 680 685
Gly Gly Gly Val Thr Gly Arg Ala Gly Met Ile Pro Ser Gly Thr Asn
690 695 700
Ser Ile Val Tyr Pro Ser Gly Ile Asp Tyr Tyr Ser Lys Tyr Thr Leu
705 710 715 720
Asn Met Lys Val Lys Leu Gln Ser Thr Asp Pro Asn Ile Lys Gln Lys
725 730 735
Val Lys Ile Tyr His Thr Thr Thr Lys Gly Gln Met Val Ser Lys Glu
740 745 750
Val Glu Leu Lys Gly Gly Glu Gly Tyr Lys Glu Leu Lys Leu Glu Phe
755 760 765
Ile Thr Gly Tyr Thr Pro Ser Glu Ser Asn Gln Ile Gly Ile Gln Ser
770 775 780
Ala Val Gly Gly Ser Asn Val Leu Phe Asp Asp Val Lys Leu Thr Gly
785 790 795 800
Ala Lys Arg
<210> 11
<211> 773
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 11
Met Glu Thr Glu Lys Glu Ser Ile Lys Lys Ser Ser Ala Lys Thr Ser
1 5 10 15
Pro Gln Met Asp Ser Arg Ala Trp Ile Asn Asn Pro Tyr Gln Gly Val
20 25 30
Ser Met Gly Gln Phe Leu Asn Ala Phe Asn Gly Asn Gln Trp Lys Pro
35 40 45
Leu Leu Glu Gln Ile His Asn Lys Gly Asp Ala Gly Ser Gly Thr Ile
50 55 60
Ala Phe Leu Lys Gly Met Met Thr Thr Gly Leu Ser Leu Leu Pro Pro
65 70 75 80
Pro Gly Ser Leu Leu Ala Ser Val Trp Asp Ile Phe Ile Pro Gly Thr
85 90 95
Gly Val Lys Asp Asp Met Trp Leu Gln Ile Glu Lys Tyr Val Asp Glu
100 105 110
Lys Ile Asp Ser Lys Ile Asn Asp Tyr His Lys Tyr Leu Met Gly Ala
115 120 125
Gln Phe Asn Gly Ala Met Glu Lys Val Lys Glu Tyr Gln Arg Val Leu
130 135 140
Gln Ile Tyr Asn Asn Ser Lys Val Ser Val Lys Val Glu Glu Pro Glu
145 150 155 160
Ala Pro Val Arg Asp Ala Val Arg Lys Ala Asp Ser Glu Leu Ala Ser
165 170 175
Tyr Ile Ala Val Ile Gln Thr Pro Glu Lys Glu Thr Asp Ser Val Tyr
180 185 190
Gln Gln Ile Thr Ala Pro Ile Phe Val Gln Ala Ala Asn Leu His Leu
195 200 205
Leu Val Leu Arg Asp Ile Ile Gln Phe Gly Glu Glu Trp Gly Ile Asp
210 215 220
Lys Asp Gln Leu Lys Gly Tyr Lys Asp Lys Gln Glu Lys Leu Ile Glu
225 230 235 240
Asn Tyr Thr Asp Tyr Ser Ile Lys Val Tyr Asn Asp Gly Leu Glu Lys
245 250 255
Arg Ile Asn Glu Ala Asp Lys Ile Phe Gly Pro Glu Asp Gly Tyr Gly
260 265 270
Asn Pro Ala Lys Pro Gly Pro Glu Glu Ala Tyr Thr Asn Thr His Arg
275 280 285
Trp Asn Tyr Ile Asn Glu Tyr Ile Arg Glu Tyr Thr Leu Ser Val Leu
290 295 300
Asp Phe Val Ala Leu Phe Pro Ser Thr Asn Pro Asn Ile Tyr Ser Arg
305 310 315 320
Gly Ala Met Gln Lys Asn Ser Arg Gln Ile Tyr Ser Ser Ile Ser Gly
325 330 335
Thr Val Thr Pro Asn Thr Gln Thr Trp Lys Asp Ile Asn Asn Arg Leu
340 345 350
Ala Ser Gln Glu Tyr Lys Gly Glu Leu Val Ala Ala Glu Val Gln Ser
355 360 365
Tyr Ala Arg Ile Asp Ala Leu Ala Pro Trp Phe Asp Arg Asn Ser Gly
370 375 380
Thr Thr Tyr Asn Thr Gly Trp Val Gly Asn Thr Ser Gly Gly Ile Leu
385 390 395 400
Arg Lys Ile Thr Ile Asp Tyr Ser Asn Pro Leu Thr Lys Val Asn Ile
405 410 415
Gly Asp Gln Arg Thr Pro Phe Tyr Phe Gln Leu Thr His Glu Asn Gly
420 425 430
Ser Ala Ile Pro Gln Phe Gly Gln Asp Asp Pro Arg Leu Lys Lys Arg
435 440 445
Thr Phe Glu Phe Pro Asn Gln Lys Ile Ser Asp Ile Gln Ala Phe Gly
450 455 460
Lys Ser Thr Ala Pro Gly Leu Asp Gly Ile Asp Ala Val Val Phe Gly
465 470 475 480
Phe Thr Asp Arg Asn Leu Asp Ser Lys His Asp Leu Met Arg Asn Met
485 490 495
Ile Ser Ser Ile Pro Ala Glu Met Tyr Gln Gly Lys Ser Asn Phe Lys
500 505 510
Pro Gln Met Glu Pro Ile Asn Ala Gln Gln Lys Ala Met Lys Thr Asp
515 520 525
Thr Thr Asn Ser Tyr Leu Thr Tyr Lys Val Asn Ser Tyr Lys Ala Gln
530 535 540
Glu Tyr Lys Ile Arg Tyr Arg Val Ala Ala Asn Glu Asn Ser Lys Ile
545 550 555 560
Ser Ile Ser Gln Lys Ser Gly Thr Asn Phe Glu Lys Ile Gly Asp Thr
565 570 575
Asn Ile Ser Lys Thr Val Asn Ala Glu Asp Thr Val Lys Gly Glu Tyr
580 585 590
Gly Tyr Tyr Lys Ile Ile Glu Gly Pro Thr Val Lys Leu Asn Tyr Gly
595 600 605
Gln Asn Glu Leu Lys Leu Glu Asn Thr Gln Gly Lys Phe Ala Ile Asp
610 615 620
Arg Ile Glu Leu Glu Pro Ile Gln Lys Asp Glu Ile Val Phe Glu Asp
625 630 635 640
Asn Phe Asp Gly Thr Asn Lys Gly Trp Ile Phe Tyr Ser Gly Gly Gly
645 650 655
Ile Val Gly Gly Gly Val Thr Gly Arg Ala Gly Met Ile Pro Ser Gly
660 665 670
Thr Asn Ser Ile Val Tyr Pro Ser Gly Ile Asp Tyr Tyr Ser Lys Tyr
675 680 685
Thr Leu Asn Met Lys Val Lys Leu Gln Ser Thr Asp Pro Asn Ile Lys
690 695 700
Gln Lys Val Lys Ile Tyr His Thr Thr Thr Lys Gly Gln Met Val Ser
705 710 715 720
Lys Glu Val Glu Leu Lys Gly Gly Glu Gly Tyr Lys Glu Leu Lys Leu
725 730 735
Glu Phe Ile Thr Gly Tyr Thr Pro Ser Glu Ser Asn Gln Ile Gly Ile
740 745 750
Gln Ser Ala Val Gly Gly Ser Asn Val Leu Phe Asp Asp Val Lys Leu
755 760 765
Thr Gly Ala Lys Arg
770
<210> 12
<211> 661
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 12
Met Asp Lys Lys Gln Lys Lys Ile Leu Ser Met Thr Leu Ala Leu Gly
1 5 10 15
Val Leu Thr Gly Thr Tyr Ile Pro Ile Thr Ser Thr Ala Leu Ala Glu
20 25 30
Thr Glu Lys Glu Ser Ile Lys Lys Ser Ser Ala Lys Thr Ser Pro Gln
35 40 45
Met Asp Ser Arg Ala Trp Ile Asn Asn Pro Tyr Gln Gly Val Ser Met
50 55 60
Gly Gln Phe Leu Asn Ala Phe Asn Gly Asn Gln Trp Lys Pro Leu Leu
65 70 75 80
Glu Gln Ile His Asn Lys Gly Asp Ala Gly Ser Gly Thr Ile Ala Phe
85 90 95
Leu Lys Gly Met Met Thr Thr Gly Leu Ser Leu Leu Pro Pro Pro Gly
100 105 110
Ser Leu Leu Ala Ser Val Trp Asp Ile Phe Ile Pro Gly Thr Gly Val
115 120 125
Lys Asp Asp Met Trp Leu Gln Ile Glu Lys Tyr Val Asp Glu Lys Ile
130 135 140
Asp Ser Lys Ile Asn Asp Tyr His Lys Tyr Leu Met Gly Ala Gln Phe
145 150 155 160
Asn Gly Ala Met Glu Lys Val Lys Glu Tyr Gln Arg Val Leu Gln Ile
165 170 175
Tyr Asn Asn Ser Lys Val Ser Val Lys Val Glu Glu Pro Glu Ala Pro
180 185 190
Val Arg Asp Ala Val Arg Lys Ala Asp Ser Glu Leu Ala Ser Tyr Ile
195 200 205
Ala Val Ile Gln Thr Pro Glu Lys Glu Thr Asp Ser Val Tyr Gln Gln
210 215 220
Ile Thr Ala Pro Ile Phe Val Gln Ala Ala Asn Leu His Leu Leu Val
225 230 235 240
Leu Arg Asp Ile Ile Gln Phe Gly Glu Glu Trp Gly Ile Asp Lys Asp
245 250 255
Gln Leu Lys Gly Tyr Lys Asp Lys Gln Glu Lys Leu Ile Glu Asn Tyr
260 265 270
Thr Asp Tyr Ser Ile Lys Val Tyr Asn Asp Gly Leu Glu Lys Arg Ile
275 280 285
Asn Glu Ala Asp Lys Ile Phe Gly Pro Glu Asp Gly Tyr Gly Asn Pro
290 295 300
Ala Lys Pro Gly Pro Glu Glu Ala Tyr Thr Asn Thr His Arg Trp Asn
305 310 315 320
Tyr Ile Asn Glu Tyr Ile Arg Glu Tyr Thr Leu Ser Val Leu Asp Phe
325 330 335
Val Ala Leu Phe Pro Ser Thr Asn Pro Asn Ile Tyr Ser Arg Gly Ala
340 345 350
Met Gln Lys Asn Ser Arg Gln Ile Tyr Ser Ser Ile Ser Gly Thr Val
355 360 365
Thr Pro Asn Thr Gln Thr Trp Lys Asp Ile Asn Asn Arg Leu Ala Ser
370 375 380
Gln Glu Tyr Lys Gly Glu Leu Val Ala Ala Glu Val Gln Ser Tyr Ala
385 390 395 400
Arg Ile Asp Ala Leu Ala Pro Trp Phe Asp Arg Asn Ser Gly Thr Thr
405 410 415
Tyr Asn Thr Gly Trp Val Gly Asn Thr Ser Gly Gly Ile Leu Arg Lys
420 425 430
Ile Thr Ile Asp Tyr Ser Asn Pro Leu Thr Lys Val Asn Ile Gly Asp
435 440 445
Gln Arg Thr Pro Phe Tyr Phe Gln Leu Thr His Glu Asn Gly Ser Ala
450 455 460
Ile Pro Gln Phe Gly Gln Asp Asp Pro Arg Leu Lys Lys Arg Thr Phe
465 470 475 480
Glu Phe Pro Asn Gln Lys Ile Ser Asp Ile Gln Ala Phe Gly Lys Ser
485 490 495
Thr Ala Pro Gly Leu Asp Gly Ile Asp Ala Val Val Phe Gly Phe Thr
500 505 510
Asp Arg Asn Leu Asp Ser Lys His Asp Leu Met Arg Asn Met Ile Ser
515 520 525
Ser Ile Pro Ala Glu Met Tyr Gln Gly Lys Ser Asn Phe Lys Pro Gln
530 535 540
Met Glu Pro Ile Asn Ala Gln Gln Lys Ala Met Lys Thr Asp Thr Thr
545 550 555 560
Asn Ser Tyr Leu Thr Tyr Lys Val Asn Ser Tyr Lys Ala Gln Glu Tyr
565 570 575
Lys Ile Arg Tyr Arg Val Ala Ala Asn Glu Asn Ser Lys Ile Ser Ile
580 585 590
Ser Gln Lys Ser Gly Thr Asn Phe Glu Lys Ile Gly Asp Thr Asn Ile
595 600 605
Ser Lys Thr Val Asn Ala Glu Asp Thr Val Lys Gly Glu Tyr Gly Tyr
610 615 620
Tyr Lys Ile Ile Glu Gly Pro Thr Val Lys Leu Asn Tyr Gly Gln Asn
625 630 635 640
Glu Leu Lys Leu Glu Asn Thr Gln Gly Lys Phe Ala Ile Asp Arg Ile
645 650 655
Glu Leu Glu Pro Ile
660
<210> 13
<211> 631
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 13
Met Glu Thr Glu Lys Glu Ser Ile Lys Lys Ser Ser Ala Lys Thr Ser
1 5 10 15
Pro Gln Met Asp Ser Arg Ala Trp Ile Asn Asn Pro Tyr Gln Gly Val
20 25 30
Ser Met Gly Gln Phe Leu Asn Ala Phe Asn Gly Asn Gln Trp Lys Pro
35 40 45
Leu Leu Glu Gln Ile His Asn Lys Gly Asp Ala Gly Ser Gly Thr Ile
50 55 60
Ala Phe Leu Lys Gly Met Met Thr Thr Gly Leu Ser Leu Leu Pro Pro
65 70 75 80
Pro Gly Ser Leu Leu Ala Ser Val Trp Asp Ile Phe Ile Pro Gly Thr
85 90 95
Gly Val Lys Asp Asp Met Trp Leu Gln Ile Glu Lys Tyr Val Asp Glu
100 105 110
Lys Ile Asp Ser Lys Ile Asn Asp Tyr His Lys Tyr Leu Met Gly Ala
115 120 125
Gln Phe Asn Gly Ala Met Glu Lys Val Lys Glu Tyr Gln Arg Val Leu
130 135 140
Gln Ile Tyr Asn Asn Ser Lys Val Ser Val Lys Val Glu Glu Pro Glu
145 150 155 160
Ala Pro Val Arg Asp Ala Val Arg Lys Ala Asp Ser Glu Leu Ala Ser
165 170 175
Tyr Ile Ala Val Ile Gln Thr Pro Glu Lys Glu Thr Asp Ser Val Tyr
180 185 190
Gln Gln Ile Thr Ala Pro Ile Phe Val Gln Ala Ala Asn Leu His Leu
195 200 205
Leu Val Leu Arg Asp Ile Ile Gln Phe Gly Glu Glu Trp Gly Ile Asp
210 215 220
Lys Asp Gln Leu Lys Gly Tyr Lys Asp Lys Gln Glu Lys Leu Ile Glu
225 230 235 240
Asn Tyr Thr Asp Tyr Ser Ile Lys Val Tyr Asn Asp Gly Leu Glu Lys
245 250 255
Arg Ile Asn Glu Ala Asp Lys Ile Phe Gly Pro Glu Asp Gly Tyr Gly
260 265 270
Asn Pro Ala Lys Pro Gly Pro Glu Glu Ala Tyr Thr Asn Thr His Arg
275 280 285
Trp Asn Tyr Ile Asn Glu Tyr Ile Arg Glu Tyr Thr Leu Ser Val Leu
290 295 300
Asp Phe Val Ala Leu Phe Pro Ser Thr Asn Pro Asn Ile Tyr Ser Arg
305 310 315 320
Gly Ala Met Gln Lys Asn Ser Arg Gln Ile Tyr Ser Ser Ile Ser Gly
325 330 335
Thr Val Thr Pro Asn Thr Gln Thr Trp Lys Asp Ile Asn Asn Arg Leu
340 345 350
Ala Ser Gln Glu Tyr Lys Gly Glu Leu Val Ala Ala Glu Val Gln Ser
355 360 365
Tyr Ala Arg Ile Asp Ala Leu Ala Pro Trp Phe Asp Arg Asn Ser Gly
370 375 380
Thr Thr Tyr Asn Thr Gly Trp Val Gly Asn Thr Ser Gly Gly Ile Leu
385 390 395 400
Arg Lys Ile Thr Ile Asp Tyr Ser Asn Pro Leu Thr Lys Val Asn Ile
405 410 415
Gly Asp Gln Arg Thr Pro Phe Tyr Phe Gln Leu Thr His Glu Asn Gly
420 425 430
Ser Ala Ile Pro Gln Phe Gly Gln Asp Asp Pro Arg Leu Lys Lys Arg
435 440 445
Thr Phe Glu Phe Pro Asn Gln Lys Ile Ser Asp Ile Gln Ala Phe Gly
450 455 460
Lys Ser Thr Ala Pro Gly Leu Asp Gly Ile Asp Ala Val Val Phe Gly
465 470 475 480
Phe Thr Asp Arg Asn Leu Asp Ser Lys His Asp Leu Met Arg Asn Met
485 490 495
Ile Ser Ser Ile Pro Ala Glu Met Tyr Gln Gly Lys Ser Asn Phe Lys
500 505 510
Pro Gln Met Glu Pro Ile Asn Ala Gln Gln Lys Ala Met Lys Thr Asp
515 520 525
Thr Thr Asn Ser Tyr Leu Thr Tyr Lys Val Asn Ser Tyr Lys Ala Gln
530 535 540
Glu Tyr Lys Ile Arg Tyr Arg Val Ala Ala Asn Glu Asn Ser Lys Ile
545 550 555 560
Ser Ile Ser Gln Lys Ser Gly Thr Asn Phe Glu Lys Ile Gly Asp Thr
565 570 575
Asn Ile Ser Lys Thr Val Asn Ala Glu Asp Thr Val Lys Gly Glu Tyr
580 585 590
Gly Tyr Tyr Lys Ile Ile Glu Gly Pro Thr Val Lys Leu Asn Tyr Gly
595 600 605
Gln Asn Glu Leu Lys Leu Glu Asn Thr Gln Gly Lys Phe Ala Ile Asp
610 615 620
Arg Ile Glu Leu Glu Pro Ile
625 630
<210> 14
<211> 831
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 14
Met Ala Gln Leu Arg Glu Leu Gln Thr Gln Ser Ile Ile Pro Tyr Asn
1 5 10 15
Ile Leu Ala Thr Pro Pro Ile Gly Asn Ala Asp Thr Gln Pro Ala Ser
20 25 30
Leu Asp Asp Leu Ile Glu Ser Leu Lys Glu Ala Trp Ile Glu Phe Gln
35 40 45
Lys Thr Gly Ser Asp Ala Leu Leu Gln Ser Val Leu Gln Asn Gly Phe
50 55 60
Ser Ala Ala Gly Gly Gly Ser Phe Asn Tyr Leu Ala Val Leu Gln Ala
65 70 75 80
Gly Ile Gly Ile Leu Gly Thr Met Leu Gly Ala Glu Ile Pro Gly Val
85 90 95
Ala Val Ala Ala Pro Ile Leu Ser Met Val Ile Gly Trp Leu Trp Pro
100 105 110
His Lys Thr Gln Asp Asp Thr Gln Gln Leu Ile Asn Leu Ile Asp Ala
115 120 125
Glu Ile Gln Lys Gln Leu Asn Lys Ala Leu Ser Glu Gln Asp Lys Asn
130 135 140
Asn Trp Thr Gly Tyr Leu Asn Ala Ile Phe Gln Ile Ser Asn Asp Ala
145 150 155 160
Ser Arg Ser Val Val Asp Ala Gln Phe Thr Gly Asn Glu Gly Asp Ala
165 170 175
Thr Arg Gln Pro Arg Thr Pro Gly Val Ser Asp Tyr Glu Asn Val Tyr
180 185 190
Asn His Leu Leu Ala Thr Gln Gly Ser Leu Ile Val Ala Leu Ser Gln
195 200 205
Met Ile Asn Gly Asn Phe Asp Thr Leu Ala Ile Pro Phe Phe Val Ile
210 215 220
Gly Ala Thr Val Gln Leu Ser Thr Tyr Gln Ser Phe Ile Gln Phe Ala
225 230 235 240
Asn Lys Trp Leu Pro Ile Val Tyr Pro Asp Tyr Gln Thr Gln Gly Thr
245 250 255
Ala Gly Tyr Thr Gln Gln Gln Asn Leu Ile Asn Ala Lys Ser Asp Met
260 265 270
Arg Ala Ala Ile Gln Asn His Thr Gln Lys Val Phe Asn Ala Phe Lys
275 280 285
Ala Gly Leu Pro Ser Leu Ser Ser Asp Lys Asn Ser Ile Ser Val Tyr
290 295 300
Asn Gln Tyr Val Arg Gly Leu Val Leu Asn Gly Leu Asp Thr Val Ala
305 310 315 320
Thr Trp Pro Ser Met Tyr Pro Asp Asp Tyr Arg Thr Gln Thr Glu Leu
325 330 335
Glu Gln Thr Arg Val Ile Phe Ser Asp Leu Ile Gly Lys Asp Gln Thr
340 345 350
Ile Ser Asn Asp Val Thr Leu Ile Asn Met Ala Asp Gly Lys Asn Gly
355 360 365
Ser Gly Ala Phe Asn Gln His Ala Thr Ile Asp Leu Asn Ser Ile Phe
370 375 380
Tyr Tyr His Glu Glu Leu Ser Ser Ile Gln Leu Gly Ile His Asp Gly
385 390 395 400
Asn Arg Gly Asn Thr Thr Asn Cys Tyr Asp Tyr Gly Ile Ile Thr Asn
405 410 415
Tyr Pro Asn Tyr Ser Tyr Phe Tyr Gly Asp Leu Tyr Ser Pro Ser Gly
420 425 430
Asp Ala Thr Phe Ser Ala Pro Leu Asn Val Leu Asn Ala Gln Thr Gln
435 440 445
Tyr Ser Ser Gly Tyr Val Asp Ser Glu Phe Ile Tyr Asn Ser Asp Pro
450 455 460
Ser Ala Tyr Gly Ala Gly Cys His Ile Leu Gly Gly Cys Thr Lys Gly
465 470 475 480
Asp Cys Tyr Asn Gln Ser Ser Cys Ser Glu Gly Phe Gly Tyr Ser Cys
485 490 495
Asn Pro Ser Leu Pro Ser Gln Lys Ile Asn Ala Phe Tyr Pro Phe Lys
500 505 510
Met Asn Leu Ser Arg Ser Gly Thr Ser Asp Lys Leu Gly Leu Met Tyr
515 520 525
Ser Leu Val Pro Leu Asp Leu Asn Pro Asn Asn Thr Phe Gly Glu Leu
530 535 540
Asp Ser Asn Thr Gly Asn Val Ile Gly Lys Gly Phe Pro Ala Glu Lys
545 550 555 560
Gly Thr Leu Ala Ser Gly Asn Val Pro Thr Val Val Arg Glu Trp Val
565 570 575
Asn Gly Ala Asn Ala Val Lys Leu Ser Asp Asp Ala Leu Thr Leu Lys
580 585 590
Met Thr Asn Met Thr Gly Gly Lys Tyr Tyr Ile Arg Val Arg Tyr Ala
595 600 605
Asn Thr Ser Asn Ala Glu Ile Ser Ile Asn Gln Ser Val Ser Ala Gly
610 615 620
Asn Gln Asn Ile Gln Asn Gly Pro Trp Gly Leu Pro Ser Thr Ile Thr
625 630 635 640
Ser Val Val Ser Asp Ala Ser Phe Lys Lys Leu Tyr Ile Ala Gly Gln
645 650 655
Thr Gly Asn Tyr Val Leu Glu Asp Ile Thr Trp Gly Val Asp Gly Gln
660 665 670
Gly Lys Pro Ile Thr Ile Pro Ser Gly Asp Val Thr Val Thr Leu Ser
675 680 685
Arg Thr Asn Met Ser Gln Ser Gly Asp Leu Phe Ile Asp Arg Val Glu
690 695 700
Leu Val Pro Met Ser Leu Gln Thr Tyr Thr Val Asn Tyr Thr Ile Thr
705 710 715 720
Ser Ser Leu Pro Ser Trp Asp Asp Phe Asn His Asp Ala Asn Asp Ile
725 730 735
Asn Ser Phe Pro Thr Val Trp Lys Ala Asp Ala Asn Gln Ser Val Ser
740 745 750
Lys Phe Ile Ala Ser Ala Gln Asp Leu Pro Gln Leu His Ser Val Val
755 760 765
Pro Ile Gly Leu Ser Thr Asn Gly Ser Trp Ser Glu Leu Arg Asp Ala
770 775 780
Asn Leu Asp Asp Leu Ile Ser Ser Gly Thr Gln Asn Val Ala Tyr Ser
785 790 795 800
Met Gln Asp Gly Ser Ser Phe Thr Glu Leu Lys Leu Gly Ser Ser Glu
805 810 815
Tyr Gln Met Ala Ala Ser Ser Gly Thr Ile Thr Gly Thr Leu Ile
820 825 830
<210> 15
<211> 708
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 15
Met Ala Gln Leu Arg Glu Leu Gln Thr Gln Ser Ile Ile Pro Tyr Asn
1 5 10 15
Ile Leu Ala Thr Pro Pro Ile Gly Asn Ala Asp Thr Gln Pro Ala Ser
20 25 30
Leu Asp Asp Leu Ile Glu Ser Leu Lys Glu Ala Trp Ile Glu Phe Gln
35 40 45
Lys Thr Gly Ser Asp Ala Leu Leu Gln Ser Val Leu Gln Asn Gly Phe
50 55 60
Ser Ala Ala Gly Gly Gly Ser Phe Asn Tyr Leu Ala Val Leu Gln Ala
65 70 75 80
Gly Ile Gly Ile Leu Gly Thr Met Leu Gly Ala Glu Ile Pro Gly Val
85 90 95
Ala Val Ala Ala Pro Ile Leu Ser Met Val Ile Gly Trp Leu Trp Pro
100 105 110
His Lys Thr Gln Asp Asp Thr Gln Gln Leu Ile Asn Leu Ile Asp Ala
115 120 125
Glu Ile Gln Lys Gln Leu Asn Lys Ala Leu Ser Glu Gln Asp Lys Asn
130 135 140
Asn Trp Thr Gly Tyr Leu Asn Ala Ile Phe Gln Ile Ser Asn Asp Ala
145 150 155 160
Ser Arg Ser Val Val Asp Ala Gln Phe Thr Gly Asn Glu Gly Asp Ala
165 170 175
Thr Arg Gln Pro Arg Thr Pro Gly Val Ser Asp Tyr Glu Asn Val Tyr
180 185 190
Asn His Leu Leu Ala Thr Gln Gly Ser Leu Ile Val Ala Leu Ser Gln
195 200 205
Met Ile Asn Gly Asn Phe Asp Thr Leu Ala Ile Pro Phe Phe Val Ile
210 215 220
Gly Ala Thr Val Gln Leu Ser Thr Tyr Gln Ser Phe Ile Gln Phe Ala
225 230 235 240
Asn Lys Trp Leu Pro Ile Val Tyr Pro Asp Tyr Gln Thr Gln Gly Thr
245 250 255
Ala Gly Tyr Thr Gln Gln Gln Asn Leu Ile Asn Ala Lys Ser Asp Met
260 265 270
Arg Ala Ala Ile Gln Asn His Thr Gln Lys Val Phe Asn Ala Phe Lys
275 280 285
Ala Gly Leu Pro Ser Leu Ser Ser Asp Lys Asn Ser Ile Ser Val Tyr
290 295 300
Asn Gln Tyr Val Arg Gly Leu Val Leu Asn Gly Leu Asp Thr Val Ala
305 310 315 320
Thr Trp Pro Ser Met Tyr Pro Asp Asp Tyr Arg Thr Gln Thr Glu Leu
325 330 335
Glu Gln Thr Arg Val Ile Phe Ser Asp Leu Ile Gly Lys Asp Gln Thr
340 345 350
Ile Ser Asn Asp Val Thr Leu Ile Asn Met Ala Asp Gly Lys Asn Gly
355 360 365
Ser Gly Ala Phe Asn Gln His Ala Thr Ile Asp Leu Asn Ser Ile Phe
370 375 380
Tyr Tyr His Glu Glu Leu Ser Ser Ile Gln Leu Gly Ile His Asp Gly
385 390 395 400
Asn Arg Gly Asn Thr Thr Asn Cys Tyr Asp Tyr Gly Ile Ile Thr Asn
405 410 415
Tyr Pro Asn Tyr Ser Tyr Phe Tyr Gly Asp Leu Tyr Ser Pro Ser Gly
420 425 430
Asp Ala Thr Phe Ser Ala Pro Leu Asn Val Leu Asn Ala Gln Thr Gln
435 440 445
Tyr Ser Ser Gly Tyr Val Asp Ser Glu Phe Ile Tyr Asn Ser Asp Pro
450 455 460
Ser Ala Tyr Gly Ala Gly Cys His Ile Leu Gly Gly Cys Thr Lys Gly
465 470 475 480
Asp Cys Tyr Asn Gln Ser Ser Cys Ser Glu Gly Phe Gly Tyr Ser Cys
485 490 495
Asn Pro Ser Leu Pro Ser Gln Lys Ile Asn Ala Phe Tyr Pro Phe Lys
500 505 510
Met Asn Leu Ser Arg Ser Gly Thr Ser Asp Lys Leu Gly Leu Met Tyr
515 520 525
Ser Leu Val Pro Leu Asp Leu Asn Pro Asn Asn Thr Phe Gly Glu Leu
530 535 540
Asp Ser Asn Thr Gly Asn Val Ile Gly Lys Gly Phe Pro Ala Glu Lys
545 550 555 560
Gly Thr Leu Ala Ser Gly Asn Val Pro Thr Val Val Arg Glu Trp Val
565 570 575
Asn Gly Ala Asn Ala Val Lys Leu Ser Asp Asp Ala Leu Thr Leu Lys
580 585 590
Met Thr Asn Met Thr Gly Gly Lys Tyr Tyr Ile Arg Val Arg Tyr Ala
595 600 605
Asn Thr Ser Asn Ala Glu Ile Ser Ile Asn Gln Ser Val Ser Ala Gly
610 615 620
Asn Gln Asn Ile Gln Asn Gly Pro Trp Gly Leu Pro Ser Thr Ile Thr
625 630 635 640
Ser Val Val Ser Asp Ala Ser Phe Lys Lys Leu Tyr Ile Ala Gly Gln
645 650 655
Thr Gly Asn Tyr Val Leu Glu Asp Ile Thr Trp Gly Val Asp Gly Gln
660 665 670
Gly Lys Pro Ile Thr Ile Pro Ser Gly Asp Val Thr Val Thr Leu Ser
675 680 685
Arg Thr Asn Met Ser Gln Ser Gly Asp Leu Phe Ile Asp Arg Val Glu
690 695 700
Leu Val Pro Met
705
<210> 16
<211> 796
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 16
Val Lys Lys Val Asn Ser Tyr Lys Asn Glu Asn Glu Tyr Glu Tyr Glu
1 5 10 15
Ile Leu Asp Thr Ser Gln Asn Asn Ser Asn Met Ser Asn Arg Tyr Pro
20 25 30
Arg Tyr Pro Leu Ala Asn Asn Pro Gln Thr Pro Met Arg Asn Val Asn
35 40 45
Tyr Lys Glu Trp Leu Asn Met Cys Asp Ser Asn Thr Lys Phe Val Gly
50 55 60
Asp Ile Asn Thr Tyr Ser Ser Pro Lys Ala Ala Leu Ser Val Gln Asn
65 70 75 80
Ala Ile Val Thr Gly Ile Ser Ile Ser Gly Thr Val Phe Leu Val Ile
85 90 95
Gly Ser Pro Val Leu Gly Gln Ser Leu Leu Leu Ile Ser Arg Leu Ile
100 105 110
Asn Leu Leu Trp Ser Val Phe Arg Pro Leu Glu Pro Trp Glu Glu Leu
115 120 125
Met Ala Leu Val Glu Glu Leu Ile Asn Gln Arg Ile Glu Val Val Ile
130 135 140
Lys Asn Asn Ala Leu Ala Ser Leu Asp Gly Leu Gln Gln Ile Met Glu
145 150 155 160
Leu Tyr Arg Ile Arg Leu Ser Ala Trp Val Asn Asn Lys Asn Asp Gln
165 170 175
Thr Lys Met Ala Val Arg Glu Gln His Arg Ile Val Asp Asn Phe Leu
180 185 190
Glu Val Asn Met Ala Arg Phe Arg Ile Ser Gly Ser Glu Val Leu Leu
195 200 205
Leu Pro Val Tyr Ala Gln Ala Ala Asn Leu His Leu Ile Leu Leu Arg
210 215 220
Asp Ile Asp Leu Phe Gly Ala Glu Trp Gly Ile Gly Pro Glu Gln Ile
225 230 235 240
Arg Asp Asp Tyr Ile Arg Leu Gln Arg Tyr Ile Arg Glu Tyr Lys Asp
245 250 255
His Cys Val Ile Phe Tyr Asn Gln Gly Leu Asn Gln Phe Asn Arg Ser
260 265 270
Thr Ala Gln Glu Trp Ile Arg Phe Asn Arg Phe Arg Arg Glu Met Thr
275 280 285
Leu Thr Val Leu Asp Leu Ala Ser Phe Phe Pro Asn Tyr Asp Pro Arg
290 295 300
Ile Tyr Pro Thr Ala Val Lys Thr Glu Leu Thr Arg Glu Ile Tyr Thr
305 310 315 320
Asp Leu Ile Gly Asn Ser Thr Phe Ser Pro Trp Trp Asn Gln Thr Val
325 330 335
Thr Ser Phe Ser Thr Ile Glu Ser Ser Val Ile Arg Arg Pro Ser Phe
340 345 350
Thr Thr Trp Leu Asn Arg Ile Arg Val Phe Thr Gly Ser Leu Asn Pro
355 360 365
Arg Ile Ser Pro Ala Tyr Val Trp Gly Gly His Glu Leu Val Glu Asn
370 375 380
Arg Ser Asn Gly Ser Glu Ile Thr His Val Phe Gly Asn Thr Ala Ser
385 390 395 400
Leu Thr Pro Ile Gln Phe Leu Ser Phe Ala Asn Val Ser Val Phe Arg
405 410 415
Ile Asn Ser Leu Ala Arg Ser Asp Thr Gln Ala His Thr Asn Tyr Gly
420 425 430
Val Ser Arg Ala Ile Phe His Thr Ser Asp Ile Asn Asn Ala Pro Gly
435 440 445
Ser Val Ala Tyr Glu Val Pro Asn Asn Asn Ser Ser Ser Pro Met Val
450 455 460
Ser Glu Leu Pro Arg Glu Asn Glu Gln Arg Pro Asn Glu Arg Glu Phe
465 470 475 480
Ser His Arg Leu Ser Tyr Ile Ser His Val Arg Ala Arg Arg Tyr Asn
485 490 495
Ser Gly Thr Asn Gly Asn Ile Asp Leu Leu Met Tyr Gly Trp Thr His
500 505 510
Thr Ser Met Asn Arg Asn Asn Arg Leu Glu Pro Asp Gly Ile Thr Gln
515 520 525
Ile Asp Ala Val Lys Gly Val Gly Gly Thr Val Ser Gly Val Val Ile
530 535 540
Pro Gly Pro Thr Gly Gly Asn Leu Val Asn Pro Gly Ala Ser Pro Ala
545 550 555 560
Ile Phe Ser Leu Arg Val Gln Ala Pro Gln Ile Pro Thr Ser Tyr Arg
565 570 575
Ile Arg Leu Arg Tyr Ala Cys Leu Ser Arg Ser Pro Ser Arg Ile Trp
580 585 590
Val His His Ser Gly Asn Phe His Phe Val Glu Leu Pro Cys Asn Asn
595 600 605
Val Ser Gly Arg Pro Ser Asn Thr Leu Leu Glu Ser Asp Phe His Tyr
610 615 620
Val Asp Val Pro Gly Val Phe Ser Pro Ser Ile Asn Pro Glu Ile Leu
625 630 635 640
Phe Gln Asp His Ser Phe Gly Thr Val Leu Asp Lys Ile Glu Phe Ile
645 650 655
Pro Ile Pro Leu Leu Pro Glu Gly Phe Arg Ile Val Thr Ala Leu Asn
660 665 670
Asn Asn Phe Val Ile Asp Leu Asn Pro Asn Asn Asn Val Thr Met Trp
675 680 685
Asn Asn Asn Gly Gly Asp Asn Gln Arg Trp Arg Phe Thr Tyr Asp Gln
690 695 700
Gln Arg Asn Ala Tyr Val Ile Arg Asn Leu Arg Asn Pro Asp Leu Ala
705 710 715 720
Leu Thr Trp Asp Thr Thr Ser Ser Ser Val Val Ala Ala Lys Ile Ser
725 730 735
Pro Glu Arg Arg Glu Gln Tyr Trp Val Leu Glu Asn Phe Gln Asn Gly
740 745 750
Tyr Val Leu Leu Asn Leu Arg Asp Thr Gly Arg Val Leu Asp Val Ala
755 760 765
Gly Gly Ser Val Gly Ser Gly Thr Asn Leu Ile Val Tyr Pro Arg His
770 775 780
Asn Gly Asn Gly Gln Ile Phe Phe Ile Arg Lys Pro
785 790 795
<210> 17
<211> 793
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 17
Met Asn Ser Tyr Lys Asn Glu Asn Glu Tyr Glu Tyr Glu Ile Leu Asp
1 5 10 15
Thr Ser Gln Asn Asn Ser Asn Met Ser Asn Arg Tyr Pro Arg Tyr Pro
20 25 30
Leu Ala Asn Asn Pro Gln Thr Pro Met Arg Asn Val Asn Tyr Lys Glu
35 40 45
Trp Leu Asn Met Cys Asp Ser Asn Thr Lys Phe Val Gly Asp Ile Asn
50 55 60
Thr Tyr Ser Ser Pro Lys Ala Ala Leu Ser Val Gln Asn Ala Ile Val
65 70 75 80
Thr Gly Ile Ser Ile Ser Gly Thr Val Phe Leu Val Ile Gly Ser Pro
85 90 95
Val Leu Gly Gln Ser Leu Leu Leu Ile Ser Arg Leu Ile Asn Leu Leu
100 105 110
Trp Ser Val Phe Arg Pro Leu Glu Pro Trp Glu Glu Leu Met Ala Leu
115 120 125
Val Glu Glu Leu Ile Asn Gln Arg Ile Glu Val Val Ile Lys Asn Asn
130 135 140
Ala Leu Ala Ser Leu Asp Gly Leu Gln Gln Ile Met Glu Leu Tyr Arg
145 150 155 160
Ile Arg Leu Ser Ala Trp Val Asn Asn Lys Asn Asp Gln Thr Lys Met
165 170 175
Ala Val Arg Glu Gln His Arg Ile Val Asp Asn Phe Leu Glu Val Asn
180 185 190
Met Ala Arg Phe Arg Ile Ser Gly Ser Glu Val Leu Leu Leu Pro Val
195 200 205
Tyr Ala Gln Ala Ala Asn Leu His Leu Ile Leu Leu Arg Asp Ile Asp
210 215 220
Leu Phe Gly Ala Glu Trp Gly Ile Gly Pro Glu Gln Ile Arg Asp Asp
225 230 235 240
Tyr Ile Arg Leu Gln Arg Tyr Ile Arg Glu Tyr Lys Asp His Cys Val
245 250 255
Ile Phe Tyr Asn Gln Gly Leu Asn Gln Phe Asn Arg Ser Thr Ala Gln
260 265 270
Glu Trp Ile Arg Phe Asn Arg Phe Arg Arg Glu Met Thr Leu Thr Val
275 280 285
Leu Asp Leu Ala Ser Phe Phe Pro Asn Tyr Asp Pro Arg Ile Tyr Pro
290 295 300
Thr Ala Val Lys Thr Glu Leu Thr Arg Glu Ile Tyr Thr Asp Leu Ile
305 310 315 320
Gly Asn Ser Thr Phe Ser Pro Trp Trp Asn Gln Thr Val Thr Ser Phe
325 330 335
Ser Thr Ile Glu Ser Ser Val Ile Arg Arg Pro Ser Phe Thr Thr Trp
340 345 350
Leu Asn Arg Ile Arg Val Phe Thr Gly Ser Leu Asn Pro Arg Ile Ser
355 360 365
Pro Ala Tyr Val Trp Gly Gly His Glu Leu Val Glu Asn Arg Ser Asn
370 375 380
Gly Ser Glu Ile Thr His Val Phe Gly Asn Thr Ala Ser Leu Thr Pro
385 390 395 400
Ile Gln Phe Leu Ser Phe Ala Asn Val Ser Val Phe Arg Ile Asn Ser
405 410 415
Leu Ala Arg Ser Asp Thr Gln Ala His Thr Asn Tyr Gly Val Ser Arg
420 425 430
Ala Ile Phe His Thr Ser Asp Ile Asn Asn Ala Pro Gly Ser Val Ala
435 440 445
Tyr Glu Val Pro Asn Asn Asn Ser Ser Ser Pro Met Val Ser Glu Leu
450 455 460
Pro Arg Glu Asn Glu Gln Arg Pro Asn Glu Arg Glu Phe Ser His Arg
465 470 475 480
Leu Ser Tyr Ile Ser His Val Arg Ala Arg Arg Tyr Asn Ser Gly Thr
485 490 495
Asn Gly Asn Ile Asp Leu Leu Met Tyr Gly Trp Thr His Thr Ser Met
500 505 510
Asn Arg Asn Asn Arg Leu Glu Pro Asp Gly Ile Thr Gln Ile Asp Ala
515 520 525
Val Lys Gly Val Gly Gly Thr Val Ser Gly Val Val Ile Pro Gly Pro
530 535 540
Thr Gly Gly Asn Leu Val Asn Pro Gly Ala Ser Pro Ala Ile Phe Ser
545 550 555 560
Leu Arg Val Gln Ala Pro Gln Ile Pro Thr Ser Tyr Arg Ile Arg Leu
565 570 575
Arg Tyr Ala Cys Leu Ser Arg Ser Pro Ser Arg Ile Trp Val His His
580 585 590
Ser Gly Asn Phe His Phe Val Glu Leu Pro Cys Asn Asn Val Ser Gly
595 600 605
Arg Pro Ser Asn Thr Leu Leu Glu Ser Asp Phe His Tyr Val Asp Val
610 615 620
Pro Gly Val Phe Ser Pro Ser Ile Asn Pro Glu Ile Leu Phe Gln Asp
625 630 635 640
His Ser Phe Gly Thr Val Leu Asp Lys Ile Glu Phe Ile Pro Ile Pro
645 650 655
Leu Leu Pro Glu Gly Phe Arg Ile Val Thr Ala Leu Asn Asn Asn Phe
660 665 670
Val Ile Asp Leu Asn Pro Asn Asn Asn Val Thr Met Trp Asn Asn Asn
675 680 685
Gly Gly Asp Asn Gln Arg Trp Arg Phe Thr Tyr Asp Gln Gln Arg Asn
690 695 700
Ala Tyr Val Ile Arg Asn Leu Arg Asn Pro Asp Leu Ala Leu Thr Trp
705 710 715 720
Asp Thr Thr Ser Ser Ser Val Val Ala Ala Lys Ile Ser Pro Glu Arg
725 730 735
Arg Glu Gln Tyr Trp Val Leu Glu Asn Phe Gln Asn Gly Tyr Val Leu
740 745 750
Leu Asn Leu Arg Asp Thr Gly Arg Val Leu Asp Val Ala Gly Gly Ser
755 760 765
Val Gly Ser Gly Thr Asn Leu Ile Val Tyr Pro Arg His Asn Gly Asn
770 775 780
Gly Gln Ile Phe Phe Ile Arg Lys Pro
785 790
<210> 18
<211> 658
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 18
Val Lys Lys Val Asn Ser Tyr Lys Asn Glu Asn Glu Tyr Glu Tyr Glu
1 5 10 15
Ile Leu Asp Thr Ser Gln Asn Asn Ser Asn Met Ser Asn Arg Tyr Pro
20 25 30
Arg Tyr Pro Leu Ala Asn Asn Pro Gln Thr Pro Met Arg Asn Val Asn
35 40 45
Tyr Lys Glu Trp Leu Asn Met Cys Asp Ser Asn Thr Lys Phe Val Gly
50 55 60
Asp Ile Asn Thr Tyr Ser Ser Pro Lys Ala Ala Leu Ser Val Gln Asn
65 70 75 80
Ala Ile Val Thr Gly Ile Ser Ile Ser Gly Thr Val Phe Leu Val Ile
85 90 95
Gly Ser Pro Val Leu Gly Gln Ser Leu Leu Leu Ile Ser Arg Leu Ile
100 105 110
Asn Leu Leu Trp Ser Val Phe Arg Pro Leu Glu Pro Trp Glu Glu Leu
115 120 125
Met Ala Leu Val Glu Glu Leu Ile Asn Gln Arg Ile Glu Val Val Ile
130 135 140
Lys Asn Asn Ala Leu Ala Ser Leu Asp Gly Leu Gln Gln Ile Met Glu
145 150 155 160
Leu Tyr Arg Ile Arg Leu Ser Ala Trp Val Asn Asn Lys Asn Asp Gln
165 170 175
Thr Lys Met Ala Val Arg Glu Gln His Arg Ile Val Asp Asn Phe Leu
180 185 190
Glu Val Asn Met Ala Arg Phe Arg Ile Ser Gly Ser Glu Val Leu Leu
195 200 205
Leu Pro Val Tyr Ala Gln Ala Ala Asn Leu His Leu Ile Leu Leu Arg
210 215 220
Asp Ile Asp Leu Phe Gly Ala Glu Trp Gly Ile Gly Pro Glu Gln Ile
225 230 235 240
Arg Asp Asp Tyr Ile Arg Leu Gln Arg Tyr Ile Arg Glu Tyr Lys Asp
245 250 255
His Cys Val Ile Phe Tyr Asn Gln Gly Leu Asn Gln Phe Asn Arg Ser
260 265 270
Thr Ala Gln Glu Trp Ile Arg Phe Asn Arg Phe Arg Arg Glu Met Thr
275 280 285
Leu Thr Val Leu Asp Leu Ala Ser Phe Phe Pro Asn Tyr Asp Pro Arg
290 295 300
Ile Tyr Pro Thr Ala Val Lys Thr Glu Leu Thr Arg Glu Ile Tyr Thr
305 310 315 320
Asp Leu Ile Gly Asn Ser Thr Phe Ser Pro Trp Trp Asn Gln Thr Val
325 330 335
Thr Ser Phe Ser Thr Ile Glu Ser Ser Val Ile Arg Arg Pro Ser Phe
340 345 350
Thr Thr Trp Leu Asn Arg Ile Arg Val Phe Thr Gly Ser Leu Asn Pro
355 360 365
Arg Ile Ser Pro Ala Tyr Val Trp Gly Gly His Glu Leu Val Glu Asn
370 375 380
Arg Ser Asn Gly Ser Glu Ile Thr His Val Phe Gly Asn Thr Ala Ser
385 390 395 400
Leu Thr Pro Ile Gln Phe Leu Ser Phe Ala Asn Val Ser Val Phe Arg
405 410 415
Ile Asn Ser Leu Ala Arg Ser Asp Thr Gln Ala His Thr Asn Tyr Gly
420 425 430
Val Ser Arg Ala Ile Phe His Thr Ser Asp Ile Asn Asn Ala Pro Gly
435 440 445
Ser Val Ala Tyr Glu Val Pro Asn Asn Asn Ser Ser Ser Pro Met Val
450 455 460
Ser Glu Leu Pro Arg Glu Asn Glu Gln Arg Pro Asn Glu Arg Glu Phe
465 470 475 480
Ser His Arg Leu Ser Tyr Ile Ser His Val Arg Ala Arg Arg Tyr Asn
485 490 495
Ser Gly Thr Asn Gly Asn Ile Asp Leu Leu Met Tyr Gly Trp Thr His
500 505 510
Thr Ser Met Asn Arg Asn Asn Arg Leu Glu Pro Asp Gly Ile Thr Gln
515 520 525
Ile Asp Ala Val Lys Gly Val Gly Gly Thr Val Ser Gly Val Val Ile
530 535 540
Pro Gly Pro Thr Gly Gly Asn Leu Val Asn Pro Gly Ala Ser Pro Ala
545 550 555 560
Ile Phe Ser Leu Arg Val Gln Ala Pro Gln Ile Pro Thr Ser Tyr Arg
565 570 575
Ile Arg Leu Arg Tyr Ala Cys Leu Ser Arg Ser Pro Ser Arg Ile Trp
580 585 590
Val His His Ser Gly Asn Phe His Phe Val Glu Leu Pro Cys Asn Asn
595 600 605
Val Ser Gly Arg Pro Ser Asn Thr Leu Leu Glu Ser Asp Phe His Tyr
610 615 620
Val Asp Val Pro Gly Val Phe Ser Pro Ser Ile Asn Pro Glu Ile Leu
625 630 635 640
Phe Gln Asp His Ser Phe Gly Thr Val Leu Asp Lys Ile Glu Phe Ile
645 650 655
Pro Ile
<210> 19
<211> 655
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 19
Met Asn Ser Tyr Lys Asn Glu Asn Glu Tyr Glu Tyr Glu Ile Leu Asp
1 5 10 15
Thr Ser Gln Asn Asn Ser Asn Met Ser Asn Arg Tyr Pro Arg Tyr Pro
20 25 30
Leu Ala Asn Asn Pro Gln Thr Pro Met Arg Asn Val Asn Tyr Lys Glu
35 40 45
Trp Leu Asn Met Cys Asp Ser Asn Thr Lys Phe Val Gly Asp Ile Asn
50 55 60
Thr Tyr Ser Ser Pro Lys Ala Ala Leu Ser Val Gln Asn Ala Ile Val
65 70 75 80
Thr Gly Ile Ser Ile Ser Gly Thr Val Phe Leu Val Ile Gly Ser Pro
85 90 95
Val Leu Gly Gln Ser Leu Leu Leu Ile Ser Arg Leu Ile Asn Leu Leu
100 105 110
Trp Ser Val Phe Arg Pro Leu Glu Pro Trp Glu Glu Leu Met Ala Leu
115 120 125
Val Glu Glu Leu Ile Asn Gln Arg Ile Glu Val Val Ile Lys Asn Asn
130 135 140
Ala Leu Ala Ser Leu Asp Gly Leu Gln Gln Ile Met Glu Leu Tyr Arg
145 150 155 160
Ile Arg Leu Ser Ala Trp Val Asn Asn Lys Asn Asp Gln Thr Lys Met
165 170 175
Ala Val Arg Glu Gln His Arg Ile Val Asp Asn Phe Leu Glu Val Asn
180 185 190
Met Ala Arg Phe Arg Ile Ser Gly Ser Glu Val Leu Leu Leu Pro Val
195 200 205
Tyr Ala Gln Ala Ala Asn Leu His Leu Ile Leu Leu Arg Asp Ile Asp
210 215 220
Leu Phe Gly Ala Glu Trp Gly Ile Gly Pro Glu Gln Ile Arg Asp Asp
225 230 235 240
Tyr Ile Arg Leu Gln Arg Tyr Ile Arg Glu Tyr Lys Asp His Cys Val
245 250 255
Ile Phe Tyr Asn Gln Gly Leu Asn Gln Phe Asn Arg Ser Thr Ala Gln
260 265 270
Glu Trp Ile Arg Phe Asn Arg Phe Arg Arg Glu Met Thr Leu Thr Val
275 280 285
Leu Asp Leu Ala Ser Phe Phe Pro Asn Tyr Asp Pro Arg Ile Tyr Pro
290 295 300
Thr Ala Val Lys Thr Glu Leu Thr Arg Glu Ile Tyr Thr Asp Leu Ile
305 310 315 320
Gly Asn Ser Thr Phe Ser Pro Trp Trp Asn Gln Thr Val Thr Ser Phe
325 330 335
Ser Thr Ile Glu Ser Ser Val Ile Arg Arg Pro Ser Phe Thr Thr Trp
340 345 350
Leu Asn Arg Ile Arg Val Phe Thr Gly Ser Leu Asn Pro Arg Ile Ser
355 360 365
Pro Ala Tyr Val Trp Gly Gly His Glu Leu Val Glu Asn Arg Ser Asn
370 375 380
Gly Ser Glu Ile Thr His Val Phe Gly Asn Thr Ala Ser Leu Thr Pro
385 390 395 400
Ile Gln Phe Leu Ser Phe Ala Asn Val Ser Val Phe Arg Ile Asn Ser
405 410 415
Leu Ala Arg Ser Asp Thr Gln Ala His Thr Asn Tyr Gly Val Ser Arg
420 425 430
Ala Ile Phe His Thr Ser Asp Ile Asn Asn Ala Pro Gly Ser Val Ala
435 440 445
Tyr Glu Val Pro Asn Asn Asn Ser Ser Ser Pro Met Val Ser Glu Leu
450 455 460
Pro Arg Glu Asn Glu Gln Arg Pro Asn Glu Arg Glu Phe Ser His Arg
465 470 475 480
Leu Ser Tyr Ile Ser His Val Arg Ala Arg Arg Tyr Asn Ser Gly Thr
485 490 495
Asn Gly Asn Ile Asp Leu Leu Met Tyr Gly Trp Thr His Thr Ser Met
500 505 510
Asn Arg Asn Asn Arg Leu Glu Pro Asp Gly Ile Thr Gln Ile Asp Ala
515 520 525
Val Lys Gly Val Gly Gly Thr Val Ser Gly Val Val Ile Pro Gly Pro
530 535 540
Thr Gly Gly Asn Leu Val Asn Pro Gly Ala Ser Pro Ala Ile Phe Ser
545 550 555 560
Leu Arg Val Gln Ala Pro Gln Ile Pro Thr Ser Tyr Arg Ile Arg Leu
565 570 575
Arg Tyr Ala Cys Leu Ser Arg Ser Pro Ser Arg Ile Trp Val His His
580 585 590
Ser Gly Asn Phe His Phe Val Glu Leu Pro Cys Asn Asn Val Ser Gly
595 600 605
Arg Pro Ser Asn Thr Leu Leu Glu Ser Asp Phe His Tyr Val Asp Val
610 615 620
Pro Gly Val Phe Ser Pro Ser Ile Asn Pro Glu Ile Leu Phe Gln Asp
625 630 635 640
His Ser Phe Gly Thr Val Leu Asp Lys Ile Glu Phe Ile Pro Ile
645 650 655
<210> 20
<211> 790
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 20
Val Lys Lys Met Asn Ser Tyr Gln Asn Lys Asn Glu Tyr Glu Ile Leu
1 5 10 15
Asp Ala Ser Glu Asn Thr Val Asn Ala Leu Asn Arg Tyr Pro Phe Ala
20 25 30
Asn Asn Pro Tyr Ser Ser Ile Phe Ser Ser Cys Pro Arg Ser Gly Pro
35 40 45
Gly Asn Trp Ile Asn Ile Leu Gly Asn Ala Val Ser Glu Ala Val Ser
50 55 60
Ile Ser Gln Asp Ile Ile Ser Leu Leu Thr Gln Pro Ser Ile Ser Gly
65 70 75 80
Ile Ile Ser Met Ala Phe Ser Leu Leu Ser Arg Met Ile Gly Ser Asn
85 90 95
Gly Arg Ser Ile Ser Glu Leu Ser Met Cys Asp Leu Leu Ala Ile Ile
100 105 110
Asp Leu Arg Val Asn Gln Ser Val Leu Asp Asp Gly Val Ala Asp Phe
115 120 125
Asn Gly Ser Leu Val Ile Tyr Arg Asn Tyr Leu Glu Ala Leu Gln Arg
130 135 140
Trp Asn Asn Asn Pro Asn Pro Ala Asn Ala Glu Glu Val Arg Thr Arg
145 150 155 160
Phe Arg Glu Ser Asp Thr Ile Phe Asp Leu Ile Leu Thr Gln Gly Ser
165 170 175
Leu Thr Asn Gly Gly Ser Leu Ala Arg Asn Asn Ala Gln Ile Leu Leu
180 185 190
Leu Pro Ser Phe Ala Asn Ala Ala Tyr Phe His Leu Leu Leu Leu Arg
195 200 205
Asp Ala Asn Val Tyr Gly Asn Asn Trp Gly Leu Phe Gly Val Thr Pro
210 215 220
Asn Ile Asn Tyr Glu Ser Lys Leu Leu Asn Leu Ile Arg Leu Tyr Thr
225 230 235 240
Asn Tyr Cys Thr His Trp Tyr Asn Gln Gly Leu Asn Glu Leu Arg Asn
245 250 255
Arg Gly Ser Asn Ala Thr Ala Trp Leu Glu Phe His Arg Phe Arg Arg
260 265 270
Asp Met Thr Leu Met Val Leu Asp Ile Val Ser Ser Phe Ser Ser Leu
275 280 285
Asp Ile Thr Arg Tyr Pro Arg Ala Thr Asp Phe Gln Leu Ser Arg Ile
290 295 300
Ile Tyr Thr Asp Pro Ile Gly Phe Val Asn Arg Ser Asp Pro Ser Ala
305 310 315 320
Pro Arg Thr Trp Phe Ser Phe His Asn Gln Ala Asn Phe Ser Ala Leu
325 330 335
Glu Ser Gly Ile Pro Ser Pro Ser Phe Ser Gln Phe Leu Asp Ser Met
340 345 350
Arg Ile Ser Thr Gly Pro Leu Ser Leu Pro Ala Ser Pro Asn Ile His
355 360 365
Arg Ala Arg Val Trp Tyr Gly Asn Gln Asn Asn Phe Asn Gly Ser Ser
370 375 380
Ser Gln Thr Phe Gly Glu Ile Thr Asn Asp Asn Gln Thr Ile Ser Gly
385 390 395 400
Leu Asn Ile Phe Arg Ile Asp Ser Gln Ala Val Asn Leu Asn Asn Thr
405 410 415
Thr Phe Gly Val Ser Arg Ala Glu Phe Tyr His Asp Ala Ser Gln Gly
420 425 430
Ser Gln Arg Ser Ile Tyr Gln Gly Phe Val Asp Thr Gly Gly Ala Ser
435 440 445
Thr Ala Val Ala Gln Asn Ile Gln Thr Phe Phe Pro Gly Glu Asn Ser
450 455 460
Ser Ile Pro Thr Pro Gln Asp Tyr Thr His Ile Leu Ser Arg Ser Thr
465 470 475 480
Asn Leu Thr Gly Gly Leu Arg Gln Val Ala Ser Gly Arg Arg Ser Ser
485 490 495
Leu Val Leu His Gly Trp Thr His Lys Ser Leu Ser Arg Gln Asn Arg
500 505 510
Val Glu Pro Asn Arg Ile Thr Gln Val Pro Ala Val Lys Ala Ser Ser
515 520 525
Pro Ser Asn Cys Thr Val Ile Ala Gly Pro Gly Phe Thr Gly Gly Asp
530 535 540
Leu Val Arg Met Ser Ser Asn Cys Ser Val Ser Tyr Asn Phe Thr Pro
545 550 555 560
Ala Asp Gln Gln Val Val Ile Arg Leu Arg Tyr Ala Cys Gln Gly Thr
565 570 575
Ala Ser Leu Arg Ile Thr Phe Gly Asn Gly Ser Ser Gln Ile Ile Pro
580 585 590
Leu Val Ser Thr Thr Ser Ser Ile Asn Asn Leu Gln Tyr Glu Asn Phe
595 600 605
Ser Phe Ala Ser Gly Pro Asn Ser Val Asn Phe Leu Ser Ala Gly Thr
610 615 620
Ser Ile Thr Ile Gln Asn Ile Ser Thr Asn Ser Asn Val Val Leu Asp
625 630 635 640
Arg Ile Glu Ile Val Pro Glu Gln Pro Ile Pro Ile Ile Pro Gly Asp
645 650 655
Tyr Gln Ile Val Thr Ala Leu Asn Asn Ser Ser Val Phe Asp Leu Asn
660 665 670
Ser Gly Thr Arg Val Thr Leu Trp Ser Asn Asn Arg Gly Ala His Gln
675 680 685
Ile Trp Asn Phe Met Tyr Asp Gln Gln Arg Asn Ala Tyr Val Ile Arg
690 695 700
Asn Val Ser Asn Pro Ser Leu Val Leu Thr Trp Asp Phe Thr Ser Pro
705 710 715 720
Asn Ser Ile Val Phe Ala Ala Pro Phe Ser Pro Gly Arg Gln Glu Gln
725 730 735
Tyr Trp Ile Ala Glu Ser Phe Gln Asn Ser Tyr Val Phe Glu Asn Leu
740 745 750
Arg Asn Thr Asn Met Val Leu Asp Val Ala Gly Gly Ser Thr Ala Ile
755 760 765
Gly Thr Asn Ile Ile Ala Phe Pro Arg His Asn Gly Asn Ala Gln Arg
770 775 780
Phe Phe Ile Arg Arg Pro
785 790
<210> 21
<211> 647
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 21
Val Lys Lys Met Asn Ser Tyr Gln Asn Lys Asn Glu Tyr Glu Ile Leu
1 5 10 15
Asp Ala Ser Glu Asn Thr Val Asn Ala Leu Asn Arg Tyr Pro Phe Ala
20 25 30
Asn Asn Pro Tyr Ser Ser Ile Phe Ser Ser Cys Pro Arg Ser Gly Pro
35 40 45
Gly Asn Trp Ile Asn Ile Leu Gly Asn Ala Val Ser Glu Ala Val Ser
50 55 60
Ile Ser Gln Asp Ile Ile Ser Leu Leu Thr Gln Pro Ser Ile Ser Gly
65 70 75 80
Ile Ile Ser Met Ala Phe Ser Leu Leu Ser Arg Met Ile Gly Ser Asn
85 90 95
Gly Arg Ser Ile Ser Glu Leu Ser Met Cys Asp Leu Leu Ala Ile Ile
100 105 110
Asp Leu Arg Val Asn Gln Ser Val Leu Asp Asp Gly Val Ala Asp Phe
115 120 125
Asn Gly Ser Leu Val Ile Tyr Arg Asn Tyr Leu Glu Ala Leu Gln Arg
130 135 140
Trp Asn Asn Asn Pro Asn Pro Ala Asn Ala Glu Glu Val Arg Thr Arg
145 150 155 160
Phe Arg Glu Ser Asp Thr Ile Phe Asp Leu Ile Leu Thr Gln Gly Ser
165 170 175
Leu Thr Asn Gly Gly Ser Leu Ala Arg Asn Asn Ala Gln Ile Leu Leu
180 185 190
Leu Pro Ser Phe Ala Asn Ala Ala Tyr Phe His Leu Leu Leu Leu Arg
195 200 205
Asp Ala Asn Val Tyr Gly Asn Asn Trp Gly Leu Phe Gly Val Thr Pro
210 215 220
Asn Ile Asn Tyr Glu Ser Lys Leu Leu Asn Leu Ile Arg Leu Tyr Thr
225 230 235 240
Asn Tyr Cys Thr His Trp Tyr Asn Gln Gly Leu Asn Glu Leu Arg Asn
245 250 255
Arg Gly Ser Asn Ala Thr Ala Trp Leu Glu Phe His Arg Phe Arg Arg
260 265 270
Asp Met Thr Leu Met Val Leu Asp Ile Val Ser Ser Phe Ser Ser Leu
275 280 285
Asp Ile Thr Arg Tyr Pro Arg Ala Thr Asp Phe Gln Leu Ser Arg Ile
290 295 300
Ile Tyr Thr Asp Pro Ile Gly Phe Val Asn Arg Ser Asp Pro Ser Ala
305 310 315 320
Pro Arg Thr Trp Phe Ser Phe His Asn Gln Ala Asn Phe Ser Ala Leu
325 330 335
Glu Ser Gly Ile Pro Ser Pro Ser Phe Ser Gln Phe Leu Asp Ser Met
340 345 350
Arg Ile Ser Thr Gly Pro Leu Ser Leu Pro Ala Ser Pro Asn Ile His
355 360 365
Arg Ala Arg Val Trp Tyr Gly Asn Gln Asn Asn Phe Asn Gly Ser Ser
370 375 380
Ser Gln Thr Phe Gly Glu Ile Thr Asn Asp Asn Gln Thr Ile Ser Gly
385 390 395 400
Leu Asn Ile Phe Arg Ile Asp Ser Gln Ala Val Asn Leu Asn Asn Thr
405 410 415
Thr Phe Gly Val Ser Arg Ala Glu Phe Tyr His Asp Ala Ser Gln Gly
420 425 430
Ser Gln Arg Ser Ile Tyr Gln Gly Phe Val Asp Thr Gly Gly Ala Ser
435 440 445
Thr Ala Val Ala Gln Asn Ile Gln Thr Phe Phe Pro Gly Glu Asn Ser
450 455 460
Ser Ile Pro Thr Pro Gln Asp Tyr Thr His Ile Leu Ser Arg Ser Thr
465 470 475 480
Asn Leu Thr Gly Gly Leu Arg Gln Val Ala Ser Gly Arg Arg Ser Ser
485 490 495
Leu Val Leu His Gly Trp Thr His Lys Ser Leu Ser Arg Gln Asn Arg
500 505 510
Val Glu Pro Asn Arg Ile Thr Gln Val Pro Ala Val Lys Ala Ser Ser
515 520 525
Pro Ser Asn Cys Thr Val Ile Ala Gly Pro Gly Phe Thr Gly Gly Asp
530 535 540
Leu Val Arg Met Ser Ser Asn Cys Ser Val Ser Tyr Asn Phe Thr Pro
545 550 555 560
Ala Asp Gln Gln Val Val Ile Arg Leu Arg Tyr Ala Cys Gln Gly Thr
565 570 575
Ala Ser Leu Arg Ile Thr Phe Gly Asn Gly Ser Ser Gln Ile Ile Pro
580 585 590
Leu Val Ser Thr Thr Ser Ser Ile Asn Asn Leu Gln Tyr Glu Asn Phe
595 600 605
Ser Phe Ala Ser Gly Pro Asn Ser Val Asn Phe Leu Ser Ala Gly Thr
610 615 620
Ser Ile Thr Ile Gln Asn Ile Ser Thr Asn Ser Asn Val Val Leu Asp
625 630 635 640
Arg Ile Glu Ile Val Pro Glu
645
<210> 22
<211> 861
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 22
Met Gly Phe Leu Pro Ile Ile Ile Cys Ser Ser Arg Arg Asn Phe Met
1 5 10 15
Ala Gln Leu Gln Glu Leu Gln Ile Gln Pro Val Ile Pro Tyr Asn Val
20 25 30
Leu Ala Ser Pro Gln Ile Gly Asn Leu Asp Thr Gln Pro Gly Ser Leu
35 40 45
Asp Asp Leu Ile Glu Ser Leu Lys Glu Ala Trp Thr Glu Phe Gln Lys
50 55 60
Thr Gly Ser Asp Lys Leu Leu Gln Thr Thr Leu Gln Asn Gly Phe Ser
65 70 75 80
Ala Ala Ser Gly Gly Ser Phe Asn Tyr Leu Ala Val Leu Gln Ala Gly
85 90 95
Ile Gly Leu Phe Gly Thr Leu Gly Ala Glu Ile Pro Gly Val Ala Val
100 105 110
Ala Ala Pro Ile Leu Ser Met Val Ile Gly Trp Leu Trp Pro His Lys
115 120 125
Ser Gly Asp Asp Gly Gln Gln Leu Val Asp Leu Ile Asp Ala Glu Ile
130 135 140
Gln Lys Gln Leu Asn Gln Ala Leu Ser Thr Gln Asp Lys His Asn Trp
145 150 155 160
Val Gly Tyr Leu Asp Glu Ser Phe Leu Asn Ala Ser His Asn Val Ala
165 170 175
Arg Ala Val Thr Asn Ala Gln Phe Val Gly Thr Glu Gly Asn Tyr Thr
180 185 190
Ala Pro Arg Thr Pro Thr Ala Ser Asp Tyr Thr Thr Val Glu Thr Thr
195 200 205
Leu Phe Ser Thr Glu Gly Ser Tyr His Thr Gly Leu Ser Gln Met Leu
210 215 220
Asn Gly Asn Phe Asp Thr Leu Ala Leu Pro Phe Tyr Val Ile Gly Val
225 230 235 240
Thr Met Gln Leu Ala Thr Tyr Gln Thr Phe Ile Gln Phe Gly Glu Lys
245 250 255
Trp Ile Asp Val Val Trp Pro Asp Asn Gln Thr Pro Gly Thr Thr Gly
260 265 270
Tyr Thr His Tyr Gln Thr Leu Gln Asp Lys Lys Thr Asp Met Arg Thr
275 280 285
Phe Ile Gln Gln His Thr Thr Thr Val Tyr Asn Ala Phe Lys Lys Gly
290 295 300
Met Pro Pro Leu Glu Ser Asn Lys Asn Ser Ile Asn Ala Tyr Asn Val
305 310 315 320
Tyr Val Arg Gly Met Val Leu Asn Gly Leu Asp Met Val Ala Thr Trp
325 330 335
Pro Ser Met Tyr Pro Asp Asp Tyr Pro Thr Gln Met Ala Leu Glu Gln
340 345 350
Thr Arg Val Ile Phe Ser Asp Met Val Gly Gln Asp Gln Thr Arg Asp
355 360 365
Gly Asn Thr Thr Ile Tyr Asn Ile Phe Asp Ser Thr Ser Asn Phe Gln
370 375 380
His Gly Thr Thr Asp Ile Asn Ser Ile His Tyr Phe Pro Asp Glu Leu
385 390 395 400
Gln Gln Ala Gln Ile Ala Glu Tyr Ser Pro Ser Arg Gly Asn His Cys
405 410 415
Tyr Pro Tyr Gly Ile Ile Leu Asn Tyr Gln His Asn Thr Tyr Arg Tyr
420 425 430
Gly Asp Asn Asp Pro Gly Thr Ser Gly Thr Val Phe Pro Ala Pro Met
435 440 445
Arg Ser Ile Asn Ala Lys Thr Gln Asn Thr Ser Tyr Leu Asn Ser Glu
450 455 460
Asn Leu Phe Thr Asp Leu Gly Ser Ser Thr Asn Cys Tyr Ile Pro Gly
465 470 475 480
Thr Cys Thr Asn Asn Cys Ser Pro Gly Ser Ser Cys Thr Asn Gly Ser
485 490 495
Gly Tyr Gly Glu Ser Cys Asn Val Pro Leu Pro Asn Gln Lys Ile Asn
500 505 510
Ala Leu Tyr Pro Phe Thr Gln Glu His Val Ser Gly Asp Ser Gly Lys
515 520 525
Leu Gly Leu Met Ala Ser Leu Val Pro Tyr Gly Leu Ser Pro Asn Asn
530 535 540
Val Phe Gly Glu Phe Asp Ser Asp Thr Gln Ala Ile Ile Gly Lys Gly
545 550 555 560
Phe Pro Ala Glu Lys Gly Tyr Ile Gly Asn Gly Ser Pro Val Ser Val
565 570 575
Val Arg Glu Trp Val Asn Gly Ala Asn Ala Val Gln Leu Pro Ala Trp
580 585 590
Asp Thr Phe Lys Ile Thr Ala Thr Asn Leu Ala Ala Asp Gln Tyr His
595 600 605
Ile Arg Val Arg Tyr Ala Ser Thr Ala Ala Tyr Pro Thr Asn Ala Lys
610 615 620
Tyr Pro Leu Ser Tyr Tyr Val Leu Ala Gly Asp Thr Ile Leu Gln Gln
625 630 635 640
Gly Lys Trp Glu Ala Ile Asp Thr Ser Gln Ala Asp Ile Thr Lys Gln
645 650 655
Val Tyr Val Thr Gly Gln Gln Gly Asn Tyr Ile Leu Thr Asp Ile Leu
660 665 670
Gly Glu Asn Pro Ile Thr Leu Pro Lys Asp Glu Ile Thr Val Gln Leu
675 680 685
Leu Gln Gly Asn Pro Ala Gly Gly Met Thr Lys Val Leu Ile Asp Arg
690 695 700
Ile Glu Phe Val Pro Ala Val Ile Asn Val Leu Asn Pro Gln Leu Asn
705 710 715 720
Tyr Gln Ile Ser Ser Gln Leu Pro Ala Trp Asn Asn Asn Gln Ser Met
725 730 735
Asp Pro Phe Pro Thr Ile Trp Arg Ala Asn Pro Gly Ile Val Gly Thr
740 745 750
Ser Ala Asn Ile Thr Val Ala Asp Leu Leu Asp Met Ser Gly Phe Lys
755 760 765
Tyr Thr Asn Ile Thr Ala Leu Asp Leu Gly Gly Gln Val Gly Leu Phe
770 775 780
Ala Lys Ile Gly Ile Gly Thr Asp Ser Asp Pro Asn Asn Trp Lys Trp
785 790 795 800
Met Cys Pro Asp Gly Gln Gly Glu Asn Pro Trp Ile Gly Asp Gly Thr
805 810 815
Tyr Asn Phe Asn Pro Lys Asn Ser Gly Ser Cys Phe Asp Lys Ser Phe
820 825 830
Thr Ala Ile Lys Leu Val Gly Gly Thr Ser Phe Asp Thr Phe Ile Ala
835 840 845
Ala Gly Ile Leu Thr Gly Thr Val Thr Thr Gln Lys Ser
850 855 860
<210> 23
<211> 710
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 23
Met Gly Phe Leu Pro Ile Ile Ile Cys Ser Ser Arg Arg Asn Phe Met
1 5 10 15
Ala Gln Leu Gln Glu Leu Gln Ile Gln Pro Val Ile Pro Tyr Asn Val
20 25 30
Leu Ala Ser Pro Gln Ile Gly Asn Leu Asp Thr Gln Pro Gly Ser Leu
35 40 45
Asp Asp Leu Ile Glu Ser Leu Lys Glu Ala Trp Thr Glu Phe Gln Lys
50 55 60
Thr Gly Ser Asp Lys Leu Leu Gln Thr Thr Leu Gln Asn Gly Phe Ser
65 70 75 80
Ala Ala Ser Gly Gly Ser Phe Asn Tyr Leu Ala Val Leu Gln Ala Gly
85 90 95
Ile Gly Leu Phe Gly Thr Leu Gly Ala Glu Ile Pro Gly Val Ala Val
100 105 110
Ala Ala Pro Ile Leu Ser Met Val Ile Gly Trp Leu Trp Pro His Lys
115 120 125
Ser Gly Asp Asp Gly Gln Gln Leu Val Asp Leu Ile Asp Ala Glu Ile
130 135 140
Gln Lys Gln Leu Asn Gln Ala Leu Ser Thr Gln Asp Lys His Asn Trp
145 150 155 160
Val Gly Tyr Leu Asp Glu Ser Phe Leu Asn Ala Ser His Asn Val Ala
165 170 175
Arg Ala Val Thr Asn Ala Gln Phe Val Gly Thr Glu Gly Asn Tyr Thr
180 185 190
Ala Pro Arg Thr Pro Thr Ala Ser Asp Tyr Thr Thr Val Glu Thr Thr
195 200 205
Leu Phe Ser Thr Glu Gly Ser Tyr His Thr Gly Leu Ser Gln Met Leu
210 215 220
Asn Gly Asn Phe Asp Thr Leu Ala Leu Pro Phe Tyr Val Ile Gly Val
225 230 235 240
Thr Met Gln Leu Ala Thr Tyr Gln Thr Phe Ile Gln Phe Gly Glu Lys
245 250 255
Trp Ile Asp Val Val Trp Pro Asp Asn Gln Thr Pro Gly Thr Thr Gly
260 265 270
Tyr Thr His Tyr Gln Thr Leu Gln Asp Lys Lys Thr Asp Met Arg Thr
275 280 285
Phe Ile Gln Gln His Thr Thr Thr Val Tyr Asn Ala Phe Lys Lys Gly
290 295 300
Met Pro Pro Leu Glu Ser Asn Lys Asn Ser Ile Asn Ala Tyr Asn Val
305 310 315 320
Tyr Val Arg Gly Met Val Leu Asn Gly Leu Asp Met Val Ala Thr Trp
325 330 335
Pro Ser Met Tyr Pro Asp Asp Tyr Pro Thr Gln Met Ala Leu Glu Gln
340 345 350
Thr Arg Val Ile Phe Ser Asp Met Val Gly Gln Asp Gln Thr Arg Asp
355 360 365
Gly Asn Thr Thr Ile Tyr Asn Ile Phe Asp Ser Thr Ser Asn Phe Gln
370 375 380
His Gly Thr Thr Asp Ile Asn Ser Ile His Tyr Phe Pro Asp Glu Leu
385 390 395 400
Gln Gln Ala Gln Ile Ala Glu Tyr Ser Pro Ser Arg Gly Asn His Cys
405 410 415
Tyr Pro Tyr Gly Ile Ile Leu Asn Tyr Gln His Asn Thr Tyr Arg Tyr
420 425 430
Gly Asp Asn Asp Pro Gly Thr Ser Gly Thr Val Phe Pro Ala Pro Met
435 440 445
Arg Ser Ile Asn Ala Lys Thr Gln Asn Thr Ser Tyr Leu Asn Ser Glu
450 455 460
Asn Leu Phe Thr Asp Leu Gly Ser Ser Thr Asn Cys Tyr Ile Pro Gly
465 470 475 480
Thr Cys Thr Asn Asn Cys Ser Pro Gly Ser Ser Cys Thr Asn Gly Ser
485 490 495
Gly Tyr Gly Glu Ser Cys Asn Val Pro Leu Pro Asn Gln Lys Ile Asn
500 505 510
Ala Leu Tyr Pro Phe Thr Gln Glu His Val Ser Gly Asp Ser Gly Lys
515 520 525
Leu Gly Leu Met Ala Ser Leu Val Pro Tyr Gly Leu Ser Pro Asn Asn
530 535 540
Val Phe Gly Glu Phe Asp Ser Asp Thr Gln Ala Ile Ile Gly Lys Gly
545 550 555 560
Phe Pro Ala Glu Lys Gly Tyr Ile Gly Asn Gly Ser Pro Val Ser Val
565 570 575
Val Arg Glu Trp Val Asn Gly Ala Asn Ala Val Gln Leu Pro Ala Trp
580 585 590
Asp Thr Phe Lys Ile Thr Ala Thr Asn Leu Ala Ala Asp Gln Tyr His
595 600 605
Ile Arg Val Arg Tyr Ala Ser Thr Ala Ala Tyr Pro Thr Asn Ala Lys
610 615 620
Tyr Pro Leu Ser Tyr Tyr Val Leu Ala Gly Asp Thr Ile Leu Gln Gln
625 630 635 640
Gly Lys Trp Glu Ala Ile Asp Thr Ser Gln Ala Asp Ile Thr Lys Gln
645 650 655
Val Tyr Val Thr Gly Gln Gln Gly Asn Tyr Ile Leu Thr Asp Ile Leu
660 665 670
Gly Glu Asn Pro Ile Thr Leu Pro Lys Asp Glu Ile Thr Val Gln Leu
675 680 685
Leu Gln Gly Asn Pro Ala Gly Gly Met Thr Lys Val Leu Ile Asp Arg
690 695 700
Ile Glu Phe Val Pro Ala
705 710
<210> 24
<211> 209
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 24
Leu Thr Ser Tyr Asn Ile Val Leu Ser Pro Lys Lys Asp Gly Met Arg
1 5 10 15
Leu Phe Trp Gln Lys Ser Asn Asp Phe Glu Arg Arg Met Ile Met Gln
20 25 30
Asp Phe Asp Tyr Phe Glu Gln Pro His Ser Asp Glu Ser Ile Pro Arg
35 40 45
Gln Pro Asp Pro Arg Pro Lys Gln Ala Pro Gln Pro Thr Val Ser Phe
50 55 60
Gln Cys Val Val Glu Ile Pro Arg Gly Tyr Arg Val Val Ser His Gly
65 70 75 80
Leu Thr Gln Phe Leu Tyr Asp Met Ser Gly Leu Ser Ile Ser Gln Glu
85 90 95
Thr Gly Lys Lys Thr Ile Asn Val Glu Glu Tyr Gly Gln Ile Glu Val
100 105 110
Asp Leu His Thr Leu Ser Leu Arg Gly Cys Ile Ser Ile Ser Thr Asn
115 120 125
Ile Asp Ile Gln Pro Glu Gln Gln Thr His Ile Gly Phe Val Gly His
130 135 140
Asn Thr Asn Thr Ile Gln Phe Tyr Phe Thr Asp Ile Ile Ser Ile Ser
145 150 155 160
Thr Val Leu Gln His Ser Val Thr Pro Leu Pro His Tyr Thr Val Asp
165 170 175
His Arg His Ile Lys Val Asp Asn Leu Gln Leu Glu Pro Phe Asp Thr
180 185 190
Ala Asn Pro Arg Leu Trp Lys Leu Thr Gly Leu Phe Ala Phe Leu Met
195 200 205
Lys
<210> 25
<211> 1177
<212> PRT
<213> Неизвестная
<220>
<223> Неизвестный организм из образца окружающей среды
<400> 25
Met Asp Cys Asn Leu Gln Ser Gln Gln Asn Ile Pro Tyr Asn Val Leu
1 5 10 15
Ala Ile Pro Val Ser Asn Val Asn Ser Leu Thr Asp Thr Ile Gly Asp
20 25 30
Leu Lys Lys Ala Trp Glu Glu Phe Gln Lys Thr Gly Ser Phe Ser Leu
35 40 45
Thr Ala Leu Gln Gln Gly Phe Asn Ala Ala Gln Gly Gly Thr Phe Asn
50 55 60
Tyr Leu Thr Leu Leu Gln Ser Gly Ile Ser Leu Ala Gly Ser Phe Val
65 70 75 80
Pro Gly Gly Thr Phe Val Ala Pro Ile Ile Asn Met Val Ile Gly Trp
85 90 95
Leu Trp Pro His Lys Asn Lys Asn Ala Asp Thr Glu Asn Leu Ile Asn
100 105 110
Leu Ile Asp Ser Glu Ile Gln Lys Gln Leu Asn Lys Ala Leu Leu Asp
115 120 125
Gln Asp Arg Gln Asp Trp Ile Ser Tyr Leu Glu Ser Ile Phe Asp Ser
130 135 140
Ser Asn Asn Leu Asn Gly Ala Ile Ile Asp Ala Gln Trp Ser Gly Thr
145 150 155 160
Val Asn Thr Thr Asn Arg Thr Leu Arg Asn Pro Thr Glu Ser Asp Tyr
165 170 175
Leu Asn Val Val Thr Asn Phe Ile Ala Ala Asp Gly Asp Ile Ser Ser
180 185 190
Asn Glu His His Ile Met Asn Gly Asn Phe Asp Val Ala Ala Ala Pro
195 200 205
Tyr Phe Val Ile Gly Ala Thr Ala Arg Phe Ala Thr Met Gln Ser Tyr
210 215 220
Ile Lys Phe Cys Asn Ala Trp Ile Asp Lys Val Gly Leu Ser Asp Ser
225 230 235 240
Gln Leu Thr Thr Gln Lys Ala Asn Leu Asp Arg Thr Lys Gln Thr Ile
245 250 255
Arg Asn Ala Ile Leu Ser Tyr Thr Gln Gln Val Met Lys Val Phe Lys
260 265 270
Asp Pro Lys Asn Met Pro Thr Ile Asp Thr Asn Lys Phe Ser Val Asp
275 280 285
Thr Tyr Asn Val Tyr Val Lys Gly Met Thr Leu Asn Val Leu Asp Ile
290 295 300
Val Ala Ile Trp Pro Ser Leu Tyr Pro Asp Asp Tyr Thr Ser Gln Thr
305 310 315 320
Ser Leu Glu Gln Thr Arg Val Thr Phe Ser Asn Met Val Gly Gln Glu
325 330 335
Glu Gly Thr Asp Gly Thr Val Thr Ile Tyr Asn Thr Phe Asp Ser Asp
340 345 350
Ser Tyr Arg His Lys Ala Ile Pro Asn Asn Asp Val Asn Leu Leu Ser
355 360 365
Tyr Phe Pro Asp Glu Leu Gln Asn Val Gln Leu Ala Leu Tyr Thr Pro
370 375 380
Ser Lys Lys Asp Ser Gly Tyr Thr Tyr Pro Tyr Ala Phe Ile Ser Asn
385 390 395 400
Tyr Gln Tyr Ser Arg Tyr Gln Tyr Gly Asp Asn Ala Pro Glu Gly Pro
405 410 415
Leu Ser Thr Leu Ser Ala Pro Ile Gln Ser Ile Asn Ala Ala Thr Gln
420 425 430
Asn Thr Lys Tyr Leu Asp Gly Glu Thr Ile Asn Gly Ile Gly Ala Asn
435 440 445
Leu Pro Gly Tyr Cys Thr Ser Asp Cys Ser Pro Thr Gln Gln Pro Phe
450 455 460
Ser Cys Thr Ser Thr Val Asn Gln Phe Lys Gln Ser Cys Asn Pro Thr
465 470 475 480
Asp Thr Asn Gln Lys Ile Asn Ala Leu Tyr Ala Phe Thr Gln Thr Asn
485 490 495
Val Lys Gly Asn Gln Gly Lys Leu Gly Leu Leu Ala Ser His Val Pro
500 505 510
Tyr Asp Leu Asn Pro Lys Asn Ile Phe Gly Glu Leu Asp Pro Asp Thr
515 520 525
Asn Asn Val Ile Leu Lys Gly Ile Pro Ala Glu Lys Gly Tyr Phe Ser
530 535 540
Asn Asn Thr Arg Pro Asn Ile Val Lys Glu Trp Ile Asn Gly Ala Asn
545 550 555 560
Ala Val Pro Leu Asp Ser Gly Asn Thr Leu Phe Met Thr Ala Thr Asn
565 570 575
Val Thr Ala Thr Gln Tyr Lys Ile Arg Ile Arg Tyr Ala Asn Pro Asn
580 585 590
Ser Asn Thr Gln Ile Gly Val Gln Ile Ser Gln Asn Gly Ser Ile Ile
595 600 605
Ser Asn Ser Asn Leu Thr Leu Tyr Ser Thr Thr Asp Met Asn Asn Thr
610 615 620
Leu Pro Leu Asn Val Tyr Val Thr Gly Glu Asn Gly Asn Tyr Thr Leu
625 630 635 640
Leu Asp Leu Tyr Ser Thr Thr Asn Val Leu Ser Thr Gly Asp Ile Thr
645 650 655
Leu Lys Leu Thr Gly Gly Asp Gln Lys Ile Phe Ile Asp Arg Ile Glu
660 665 670
Phe Val Pro Thr Met Pro Val Pro Gly Asn Thr Asn Asn Asn Asn Gly
675 680 685
Asp Asn Gly Asn Asn Asn Pro Val His His Val Cys Ala Ile Ala Gly
690 695 700
Thr Gln Gln Ser Cys Ser Gly Pro Pro Lys Phe Glu Gln Val Ser Asn
705 710 715 720
Leu Glu Lys Ile Thr Thr Gln Val Tyr Met Leu Phe Lys Ser Ser Pro
725 730 735
Tyr Glu Glu Leu Ala Pro Glu Val Ser Ser Tyr Gln Ile Ser Gln Val
740 745 750
Ala Leu Lys Val Met Ala Leu Ser Asp Glu Leu Phe Cys Lys Glu Lys
755 760 765
Ser Leu Leu Arg Lys Leu Val Asn Lys Ala Lys Gln Leu Leu Glu Ala
770 775 780
Ser Asn Leu Leu Val Gly Gly Asn Phe Glu Thr Thr Gln Asn Trp Val
785 790 795 800
Leu Gly Thr Asn Ala Tyr Ile Asn Tyr Asp Ser Phe Leu Phe Asn Gly
805 810 815
Asn Tyr Leu Ser Leu Gln Pro Ala Ser Gly Phe Phe Thr Ser Tyr Ala
820 825 830
Tyr Gln Lys Ile Asp Glu Ser Thr Leu Lys Pro Tyr Thr Arg Tyr Lys
835 840 845
Val Ser Gly Phe Ile Gly Gln Ser Asn Gln Val Glu Leu Ile Ile Ser
850 855 860
Arg Tyr Gly Lys Glu Ile Asp Lys Ile Leu Asn Val Pro Tyr Ala Gly
865 870 875 880
Pro Leu Pro Ile Thr Ala Asn Ala Leu Ile Thr Cys Cys Ala Pro Glu
885 890 895
Ile Gly Gln Cys Asp Gly Lys Gln Ser Asp Ser His Phe Phe Asn Tyr
900 905 910
Ser Ile Asp Val Gly Ala Leu His Leu Glu Leu Asn Pro Gly Ile Glu
915 920 925
Ile Gly Leu Lys Ile Val Gln Ser Asn Gly Tyr Ile Thr Ile Ser Asn
930 935 940
Leu Glu Ile Ile Glu Glu Arg Pro Leu Thr Glu Met Glu Ile Gln Ala
945 950 955 960
Val Asn Arg Lys Ser Gln Lys Trp Glu Arg Glu Lys Leu Leu Glu Cys
965 970 975
Ala Ser Ile Asn Glu Leu Leu Gln Pro Val Ile Asn Gln Ile Asp Ser
980 985 990
Leu Phe Lys Asp Gly Asn Trp Tyr Asn Asp Ile Leu Pro His Ile Thr
995 1000 1005
Tyr Gln Asp Leu Lys Asn Ile Ile Ile Pro Glu Leu Pro Lys Leu
1010 1015 1020
Lys His Trp Phe Ile Glu Asp Leu Pro Gly Glu Tyr His Glu Ile
1025 1030 1035
Glu Gln Lys Met Lys Glu Ala Leu Lys His Ala Phe Thr Gln Leu
1040 1045 1050
Asp Glu Arg Asn Leu Ile His Asn Gly His Phe Thr Ile Asn Leu
1055 1060 1065
Ile Asp Trp Gln Val Glu Gly Asp Ala Gln Met Lys Val Leu Glu
1070 1075 1080
Asn Asp Ala Leu Ala Leu Gln Leu Phe Asn Trp Asp Ser Ser Ala
1085 1090 1095
Ser Gln Ser Ile Lys Ile Leu Glu Phe Asp Glu Asp Lys Ala Tyr
1100 1105 1110
Lys Leu Arg Val Tyr Ala Gln Gly Asn Gly Thr Ile Gln Phe Gly
1115 1120 1125
Asn Cys Glu Asp Glu Ala Ile Gln Phe Asn Thr Asn Ser Phe Ile
1130 1135 1140
Tyr Gln Glu Lys Ile Val Tyr Phe Asp Thr Pro Ser Ile Asn Val
1145 1150 1155
Lys Ile Gln Ser Glu Gly Ala Glu Phe Val Val Ser Ser Val Glu
1160 1165 1170
Leu Ile Glu Leu
1175
<210> 26
<211> 676
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 26
Met Asp Cys Asn Leu Gln Ser Gln Gln Asn Ile Pro Tyr Asn Val Leu
1 5 10 15
Ala Ile Pro Val Ser Asn Val Asn Ser Leu Thr Asp Thr Ile Gly Asp
20 25 30
Leu Lys Lys Ala Trp Glu Glu Phe Gln Lys Thr Gly Ser Phe Ser Leu
35 40 45
Thr Ala Leu Gln Gln Gly Phe Asn Ala Ala Gln Gly Gly Thr Phe Asn
50 55 60
Tyr Leu Thr Leu Leu Gln Ser Gly Ile Ser Leu Ala Gly Ser Phe Val
65 70 75 80
Pro Gly Gly Thr Phe Val Ala Pro Ile Ile Asn Met Val Ile Gly Trp
85 90 95
Leu Trp Pro His Lys Asn Lys Asn Ala Asp Thr Glu Asn Leu Ile Asn
100 105 110
Leu Ile Asp Ser Glu Ile Gln Lys Gln Leu Asn Lys Ala Leu Leu Asp
115 120 125
Gln Asp Arg Gln Asp Trp Ile Ser Tyr Leu Glu Ser Ile Phe Asp Ser
130 135 140
Ser Asn Asn Leu Asn Gly Ala Ile Ile Asp Ala Gln Trp Ser Gly Thr
145 150 155 160
Val Asn Thr Thr Asn Arg Thr Leu Arg Asn Pro Thr Glu Ser Asp Tyr
165 170 175
Leu Asn Val Val Thr Asn Phe Ile Ala Ala Asp Gly Asp Ile Ser Ser
180 185 190
Asn Glu His His Ile Met Asn Gly Asn Phe Asp Val Ala Ala Ala Pro
195 200 205
Tyr Phe Val Ile Gly Ala Thr Ala Arg Phe Ala Thr Met Gln Ser Tyr
210 215 220
Ile Lys Phe Cys Asn Ala Trp Ile Asp Lys Val Gly Leu Ser Asp Ser
225 230 235 240
Gln Leu Thr Thr Gln Lys Ala Asn Leu Asp Arg Thr Lys Gln Thr Ile
245 250 255
Arg Asn Ala Ile Leu Ser Tyr Thr Gln Gln Val Met Lys Val Phe Lys
260 265 270
Asp Pro Lys Asn Met Pro Thr Ile Asp Thr Asn Lys Phe Ser Val Asp
275 280 285
Thr Tyr Asn Val Tyr Val Lys Gly Met Thr Leu Asn Val Leu Asp Ile
290 295 300
Val Ala Ile Trp Pro Ser Leu Tyr Pro Asp Asp Tyr Thr Ser Gln Thr
305 310 315 320
Ser Leu Glu Gln Thr Arg Val Thr Phe Ser Asn Met Val Gly Gln Glu
325 330 335
Glu Gly Thr Asp Gly Thr Val Thr Ile Tyr Asn Thr Phe Asp Ser Asp
340 345 350
Ser Tyr Arg His Lys Ala Ile Pro Asn Asn Asp Val Asn Leu Leu Ser
355 360 365
Tyr Phe Pro Asp Glu Leu Gln Asn Val Gln Leu Ala Leu Tyr Thr Pro
370 375 380
Ser Lys Lys Asp Ser Gly Tyr Thr Tyr Pro Tyr Ala Phe Ile Ser Asn
385 390 395 400
Tyr Gln Tyr Ser Arg Tyr Gln Tyr Gly Asp Asn Ala Pro Glu Gly Pro
405 410 415
Leu Ser Thr Leu Ser Ala Pro Ile Gln Ser Ile Asn Ala Ala Thr Gln
420 425 430
Asn Thr Lys Tyr Leu Asp Gly Glu Thr Ile Asn Gly Ile Gly Ala Asn
435 440 445
Leu Pro Gly Tyr Cys Thr Ser Asp Cys Ser Pro Thr Gln Gln Pro Phe
450 455 460
Ser Cys Thr Ser Thr Val Asn Gln Phe Lys Gln Ser Cys Asn Pro Thr
465 470 475 480
Asp Thr Asn Gln Lys Ile Asn Ala Leu Tyr Ala Phe Thr Gln Thr Asn
485 490 495
Val Lys Gly Asn Gln Gly Lys Leu Gly Leu Leu Ala Ser His Val Pro
500 505 510
Tyr Asp Leu Asn Pro Lys Asn Ile Phe Gly Glu Leu Asp Pro Asp Thr
515 520 525
Asn Asn Val Ile Leu Lys Gly Ile Pro Ala Glu Lys Gly Tyr Phe Ser
530 535 540
Asn Asn Thr Arg Pro Asn Ile Val Lys Glu Trp Ile Asn Gly Ala Asn
545 550 555 560
Ala Val Pro Leu Asp Ser Gly Asn Thr Leu Phe Met Thr Ala Thr Asn
565 570 575
Val Thr Ala Thr Gln Tyr Lys Ile Arg Ile Arg Tyr Ala Asn Pro Asn
580 585 590
Ser Asn Thr Gln Ile Gly Val Gln Ile Ser Gln Asn Gly Ser Ile Ile
595 600 605
Ser Asn Ser Asn Leu Thr Leu Tyr Ser Thr Thr Asp Met Asn Asn Thr
610 615 620
Leu Pro Leu Asn Val Tyr Val Thr Gly Glu Asn Gly Asn Tyr Thr Leu
625 630 635 640
Leu Asp Leu Tyr Ser Thr Thr Asn Val Leu Ser Thr Gly Asp Ile Thr
645 650 655
Leu Lys Leu Thr Gly Gly Asp Gln Lys Ile Phe Ile Asp Arg Ile Glu
660 665 670
Phe Val Pro Thr
675
<210> 27
<211> 1242
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 27
Met Asn Gly Gly Glu Asn Met Asn Gln Asn Asp Gln Asn Glu Ile Gln
1 5 10 15
Ile Ile Asp Ser Ser Ser Asn Asp Phe Asn Gln Ser Asn Arg Tyr Pro
20 25 30
Arg Tyr Pro Leu Ala Glu Glu Ser Asn Tyr Lys Asp Trp Leu Ala Asn
35 40 45
Cys Lys Glu Ser Asn Leu Asp Arg Leu Ser Thr Pro Ser Ser Val Gln
50 55 60
Asp Ala Val Val Thr Ser Leu Asn Ile Phe Ser Tyr Ile Phe Gly Phe
65 70 75 80
Leu Asp Phe Gly Ala Thr Ser Ala Gly Leu Gly Ile Leu Gly Ala Leu
85 90 95
Phe Gly Val Phe Trp Pro Ser Ser Asn Asn Gly Ile Ser Glu Asp Leu
100 105 110
Leu Arg Ser Ile Glu Ile Leu Ile Asp Arg Arg Ile Asn Glu Val Glu
115 120 125
Arg Asn Arg Ile Thr Val Gln Phe Glu Gly Leu Arg Ala Val Met Ser
130 135 140
Asn Tyr Asn Thr Ala Leu Arg Asn Trp Asn Ala Asn Arg Asn Asn Pro
145 150 155 160
Ala Leu Gln Ser Glu Val Arg Ser Arg Phe Asp Asn Ala Asp Asp Ala
165 170 175
Phe Ala Gly Arg Met Pro Glu Phe Arg Ile Pro Gly Phe Glu Ile Gln
180 185 190
Ser Leu Ser Val Tyr Ala Gln Ala Ala Thr Leu His Leu Leu Leu Leu
195 200 205
Arg Asp Ala Val Val Asn Gly Ser Leu Trp Gly Phe Asp Gly Glu Thr
210 215 220
Ile Glu Ser Tyr Tyr Thr Lys Leu Val Cys Leu Ile Asp Ala Tyr Ala
225 230 235 240
Asp His Cys Ala Ser Phe Tyr Arg Gln Gly Leu Gln Glu Leu Arg Asp
245 250 255
Arg Gly Asn Trp Asn Ala Phe Asn Asn Tyr Arg Arg Asp Met Thr Ile
260 265 270
Thr Val Leu Asp Ile Ile Ser Leu Phe Ser Asn Tyr Asp Pro Arg Arg
275 280 285
Tyr Thr Ile Asn Thr Asn Thr Gln Leu Thr Arg Glu Val Tyr Thr Glu
290 295 300
Pro Val Ala Thr Pro Gly Trp Leu Asn Leu Asn Ser Asn Pro Asp Gln
305 310 315 320
Phe Gln Gln Ile Glu Asn Asp Leu Ile Arg Pro Leu Arg Pro Ser Ser
325 330 335
Thr Leu Ala Ala Leu Ser Ala Glu Thr Ala Phe Ala Phe Phe Gln Ser
340 345 350
Gly Gln Thr Pro Leu Arg Ala Ile Leu Arg Thr Arg Thr Ser His Phe
355 360 365
Asn Ile Ser Gly Gly Phe Gly Thr Asp Pro Trp Gln Gly Ser Pro Asn
370 375 380
Pro Thr Gly Pro Ser Glu Ser Gln Leu Gln Phe Glu Asn Phe Asp Val
385 390 395 400
Tyr His Val Ser Ser Glu Val Thr Arg Glu Val Ser Ser Glu Asn Ser
405 410 415
Gly Leu Phe Gly Pro Gln Arg Ile Asn Phe Arg Met Val Ser Ile Ser
420 425 430
Gly Val Val Ala Ser Arg Glu Ile Ser Ser Pro Pro Phe Gly Arg Tyr
435 440 445
Ile Thr Asn Ile Ser Ser Ser Ile Pro Gly Ile Arg Ser Ala Asn Pro
450 455 460
Thr Ala Ser Asp Tyr Thr His Arg Leu Ser Ser Ile Arg Ser Thr Ser
465 470 475 480
Leu Arg Thr Met Tyr Arg Asp Arg Thr Asn Ile Ile Ala Tyr Gly Trp
485 490 495
Thr His Thr Ser Leu Glu Leu Thr Asn Arg Leu Leu Pro Asn Arg Ile
500 505 510
Thr Gln Ile Pro Ala Val Lys Ser Ser Ile Thr Pro Leu Pro Ile Val
515 520 525
Gly Gly Pro Gly His Thr Gly Gly Gly Leu Val Ser Leu Ala Gly Tyr
530 535 540
Gly Arg Tyr Met Leu Ile Asn Phe Ile Ser Pro Tyr Ser Pro Ser Arg
545 550 555 560
Gln Arg Tyr Arg Leu Arg Ile Arg Phe Val Lys Asp Phe Asp Asp Ala
565 570 575
His Leu Arg Val Ser Ile Ser Ala Ala Asn Phe Tyr Gln Asn Val Val
580 585 590
Leu Pro Gly Ser Arg Thr Ser Val Asn Pro Asn Leu Ser Phe Arg Asp
595 600 605
Phe Arg Tyr Val Asp Val Pro Gly Glu Phe Glu Leu Val Ala Asn Arg
610 615 620
Ser Tyr Ser Ile Asn Leu Gly Ala Pro Thr Ser Ser Ile Pro Gly Thr
625 630 635 640
Cys Leu Ile Asp Lys Ile Glu Phe Ile Pro Val Asn Ser Ala Ala Leu
645 650 655
Glu Tyr Glu Gly Glu Gln Ser Leu Lys Lys Ala Lys Lys Ala Val Asp
660 665 670
Asp Leu Phe Thr Asn Asp Leu Lys Asn Asp Leu Lys Ile Glu Thr Thr
675 680 685
Asp Tyr Asp Val Asp Gln Ala Ala Asn Leu Val Glu Cys Val Pro Glu
690 695 700
Glu Leu Tyr Ala Lys Glu Lys Met Ile Leu Leu Asp Glu Val Lys His
705 710 715 720
Ala Lys Gln Leu Ser Glu Ser Arg Asn Leu Ile Gln Asn Gly Asn Phe
725 730 735
Glu Phe Tyr Thr Asp Lys Trp Thr Thr Ser Asn Asn Ala Ser Ile Gln
740 745 750
Ala Asp Asn Pro Ile Phe Lys Gly Asn Tyr Leu Asn Met Pro Gly Ala
755 760 765
Arg Glu Thr Glu Ala Gly Ala Thr Thr Phe Pro Thr Tyr Val Phe Gln
770 775 780
Lys Ile Asp Glu Ser Lys Leu Lys Pro Tyr Thr Arg Tyr Lys Ala Arg
785 790 795 800
Gly Phe Val Gly Gly Ser Lys Glu Val Arg Leu Ile Val Ala Arg Tyr
805 810 815
Ala Glu Glu Val Asp Ala Ile Met Asn Val Arg Asn Asp Leu Thr Pro
820 825 830
Gly Val Pro Val Ala Ser Cys Gly Glu Phe Asp Arg Cys His Pro Gln
835 840 845
Ala Tyr Pro Ile Leu Gln Asp Arg Cys His Asp Asp Arg Ile Glu Gln
850 855 860
His Ala Asp Gly Gly Ser His Ser Cys His Gly Lys Ser Arg Glu Lys
865 870 875 880
His Ala Ile Cys His Asp Ser His Gln Phe Asp Phe His Ile Asp Thr
885 890 895
Gly Glu Val Tyr Leu Thr Glu Asn Pro Gly Ile Trp Val Leu Phe Lys
900 905 910
Ile Ser Ser Pro Glu Gly Tyr Ala Thr Leu Asp Asn Ile Glu Leu Ile
915 920 925
Glu Glu Gly Pro Leu Val Gly Glu Ser Leu Ala Leu Val Lys Lys Arg
930 935 940
Glu Lys Lys Trp Lys Asn Glu Met Glu Thr Lys Trp Ile His Thr Lys
945 950 955 960
Glu Ala Tyr Glu Lys Ala Lys Trp Ala Val Asp Ala Leu Phe Thr Thr
965 970 975
Pro Gln Asp Thr Ala Leu Lys Phe Glu Thr Ile Ile Ser Asn Ile Ile
980 985 990
Ser Ala Glu His Leu Val Gln Ser Ile Pro Tyr Val Tyr Asn Lys Trp
995 1000 1005
Leu Ala Asp Val Pro Gly Met Asn Tyr Asp Ile Tyr Thr Glu Leu
1010 1015 1020
Lys Arg Arg Ile Thr Gln Ala Tyr Ser Leu Tyr Glu Arg Arg Asn
1025 1030 1035
Ile Ile Lys Asn Gly Asp Phe His Gln Gly Leu Ala His Trp His
1040 1045 1050
Ala Thr Pro His Ala Arg Val Gln Gln Ile Asp Gly Thr Ala Val
1055 1060 1065
Leu Val Ile Pro Asn Trp Gly Ser Asn Val Ser Gln Asn Leu Cys
1070 1075 1080
Val Glu His Asn Arg Gly Tyr Val Leu Arg Val Thr Ala Lys Lys
1085 1090 1095
Glu Asp Met Gly Lys Gly Tyr Val Thr Ile Ser Asp Cys Ala Lys
1100 1105 1110
Asn Thr Glu Thr Leu Thr Phe Thr Ser Cys Asp Tyr Val Ser Asn
1115 1120 1125
Thr Ser Thr Ser Asp His Pro Arg Thr Cys Asn Ser Cys Asp Asp
1130 1135 1140
Tyr Val Ser Asn Glu Ser Ile Asn Asp Gln Pro Asp Tyr Leu Leu
1145 1150 1155
Asn Gln Glu Arg Asn Glu Ser Arg Cys Tyr Asn Arg Asn Ala Ser
1160 1165 1170
Thr Ser Glu Glu Ser Asp Tyr Leu Leu Asn Gln Lys Arg Asn Glu
1175 1180 1185
Gln Trp Ser Asn His Ser Asp Ala Thr Val Asn Glu Gln Met Asn
1190 1195 1200
Tyr Val Thr Arg Thr Ile Asp Phe Phe Pro Asp Thr Asp Arg Val
1205 1210 1215
Arg Ile Asp Ile Gly Glu Thr Glu Gly Ile Phe Lys Val Glu Ser
1220 1225 1230
Val Glu Leu Ile Cys Met Glu Gly Gln
1235 1240
<210> 28
<211> 651
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 28
Met Asn Gly Gly Glu Asn Met Asn Gln Asn Asp Gln Asn Glu Ile Gln
1 5 10 15
Ile Ile Asp Ser Ser Ser Asn Asp Phe Asn Gln Ser Asn Arg Tyr Pro
20 25 30
Arg Tyr Pro Leu Ala Glu Glu Ser Asn Tyr Lys Asp Trp Leu Ala Asn
35 40 45
Cys Lys Glu Ser Asn Leu Asp Arg Leu Ser Thr Pro Ser Ser Val Gln
50 55 60
Asp Ala Val Val Thr Ser Leu Asn Ile Phe Ser Tyr Ile Phe Gly Phe
65 70 75 80
Leu Asp Phe Gly Ala Thr Ser Ala Gly Leu Gly Ile Leu Gly Ala Leu
85 90 95
Phe Gly Val Phe Trp Pro Ser Ser Asn Asn Gly Ile Ser Glu Asp Leu
100 105 110
Leu Arg Ser Ile Glu Ile Leu Ile Asp Arg Arg Ile Asn Glu Val Glu
115 120 125
Arg Asn Arg Ile Thr Val Gln Phe Glu Gly Leu Arg Ala Val Met Ser
130 135 140
Asn Tyr Asn Thr Ala Leu Arg Asn Trp Asn Ala Asn Arg Asn Asn Pro
145 150 155 160
Ala Leu Gln Ser Glu Val Arg Ser Arg Phe Asp Asn Ala Asp Asp Ala
165 170 175
Phe Ala Gly Arg Met Pro Glu Phe Arg Ile Pro Gly Phe Glu Ile Gln
180 185 190
Ser Leu Ser Val Tyr Ala Gln Ala Ala Thr Leu His Leu Leu Leu Leu
195 200 205
Arg Asp Ala Val Val Asn Gly Ser Leu Trp Gly Phe Asp Gly Glu Thr
210 215 220
Ile Glu Ser Tyr Tyr Thr Lys Leu Val Cys Leu Ile Asp Ala Tyr Ala
225 230 235 240
Asp His Cys Ala Ser Phe Tyr Arg Gln Gly Leu Gln Glu Leu Arg Asp
245 250 255
Arg Gly Asn Trp Asn Ala Phe Asn Asn Tyr Arg Arg Asp Met Thr Ile
260 265 270
Thr Val Leu Asp Ile Ile Ser Leu Phe Ser Asn Tyr Asp Pro Arg Arg
275 280 285
Tyr Thr Ile Asn Thr Asn Thr Gln Leu Thr Arg Glu Val Tyr Thr Glu
290 295 300
Pro Val Ala Thr Pro Gly Trp Leu Asn Leu Asn Ser Asn Pro Asp Gln
305 310 315 320
Phe Gln Gln Ile Glu Asn Asp Leu Ile Arg Pro Leu Arg Pro Ser Ser
325 330 335
Thr Leu Ala Ala Leu Ser Ala Glu Thr Ala Phe Ala Phe Phe Gln Ser
340 345 350
Gly Gln Thr Pro Leu Arg Ala Ile Leu Arg Thr Arg Thr Ser His Phe
355 360 365
Asn Ile Ser Gly Gly Phe Gly Thr Asp Pro Trp Gln Gly Ser Pro Asn
370 375 380
Pro Thr Gly Pro Ser Glu Ser Gln Leu Gln Phe Glu Asn Phe Asp Val
385 390 395 400
Tyr His Val Ser Ser Glu Val Thr Arg Glu Val Ser Ser Glu Asn Ser
405 410 415
Gly Leu Phe Gly Pro Gln Arg Ile Asn Phe Arg Met Val Ser Ile Ser
420 425 430
Gly Val Val Ala Ser Arg Glu Ile Ser Ser Pro Pro Phe Gly Arg Tyr
435 440 445
Ile Thr Asn Ile Ser Ser Ser Ile Pro Gly Ile Arg Ser Ala Asn Pro
450 455 460
Thr Ala Ser Asp Tyr Thr His Arg Leu Ser Ser Ile Arg Ser Thr Ser
465 470 475 480
Leu Arg Thr Met Tyr Arg Asp Arg Thr Asn Ile Ile Ala Tyr Gly Trp
485 490 495
Thr His Thr Ser Leu Glu Leu Thr Asn Arg Leu Leu Pro Asn Arg Ile
500 505 510
Thr Gln Ile Pro Ala Val Lys Ser Ser Ile Thr Pro Leu Pro Ile Val
515 520 525
Gly Gly Pro Gly His Thr Gly Gly Gly Leu Val Ser Leu Ala Gly Tyr
530 535 540
Gly Arg Tyr Met Leu Ile Asn Phe Ile Ser Pro Tyr Ser Pro Ser Arg
545 550 555 560
Gln Arg Tyr Arg Leu Arg Ile Arg Phe Val Lys Asp Phe Asp Asp Ala
565 570 575
His Leu Arg Val Ser Ile Ser Ala Ala Asn Phe Tyr Gln Asn Val Val
580 585 590
Leu Pro Gly Ser Arg Thr Ser Val Asn Pro Asn Leu Ser Phe Arg Asp
595 600 605
Phe Arg Tyr Val Asp Val Pro Gly Glu Phe Glu Leu Val Ala Asn Arg
610 615 620
Ser Tyr Ser Ile Asn Leu Gly Ala Pro Thr Ser Ser Ile Pro Gly Thr
625 630 635 640
Cys Leu Ile Asp Lys Ile Glu Phe Ile Pro Val
645 650
<210> 29
<211> 661
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 29
Met Asn Lys Asn Asn Asn Ser Ser Glu Leu Asp Ile Asn Asp Thr Gly
1 5 10 15
Ala Ser His Pro Ser Asn Ser Ile Val Glu Val Pro Cys Ser Glu Cys
20 25 30
Gly Gly Ile Asp Tyr Arg Asp Val Met Asn Met Ser Thr Gln Asn Ala
35 40 45
Tyr Val Glu Gln Gln Ser Val Val Gly Ala Ala Thr Thr Thr Ser Phe
50 55 60
Gln Val Ile Arg Glu Leu Tyr Arg Ser Asn Lys Asp Ile Leu Ser Thr
65 70 75 80
Ala Gly Gly Ile Ile Lys Ser Ile Ser Val Phe Leu Trp Lys Lys Glu
85 90 95
His Ala Gln Thr Gln Trp Glu Glu Phe Met Lys Ser Val Glu Leu Met
100 105 110
Ile Asp Glu Lys Ile Asp Thr Ala Val Met Ala Ala Ala Ile Ser Arg
115 120 125
Val Ala Ser Leu Glu Ala Leu Leu Ala Val His Gln Asp Tyr Leu Asp
130 135 140
Ile Leu Ala Ala Asp Pro Ser Asn Pro Asp Leu Gln Glu Leu Val Ser
145 150 155 160
Asp His Val Val Asn Leu Gln Asp Phe Phe Val Tyr Thr Met Pro Gln
165 170 175
Leu Ser Gln Ser Pro Tyr Gln Val Gln Gln Leu Val Ala Tyr Ala Glu
180 185 190
Ala Ala Asn Leu His Leu Ala Phe Leu Arg Asp Val Val Met Phe Gly
195 200 205
Ser Gln Trp Gly Met Gln Gln Ala Thr Ile Asp Thr Tyr Tyr Lys Tyr
210 215 220
Leu Glu Asn Asn Ile Lys Val Tyr Thr Asn Tyr Cys Val Asn Thr Tyr
225 230 235 240
Asn Ile Gly Leu Glu Lys Thr Lys Asn Leu Met Gly Ser Ile Asn Pro
245 250 255
Lys Asn Tyr Asp Lys Tyr Pro Tyr Leu Asn Pro His Ala Asn Asn Ser
260 265 270
Thr Asn Asn Tyr Lys Lys Val Leu Gln Trp Asn Val Trp Asn Asp Phe
275 280 285
Arg Arg Asn Met Thr Ile Met Val Leu Asp Leu Val Val Val Phe Pro
290 295 300
Thr Tyr Asp Pro Lys Val Tyr Thr Asn Leu Glu Gly Ile Glu Ile Glu
305 310 315 320
Leu Ser Arg Glu Val Tyr Ser Thr Ser Tyr Asn Arg Tyr Gly Asp Ser
325 330 335
Thr His Gly Gly Asp Trp Lys Gly Trp Glu Ile Leu Glu Thr Ser Val
340 345 350
Val Arg Pro Pro His Leu Val Ser Phe Leu Ser Asn Leu Ala Phe Tyr
355 360 365
Met Ala Asn Tyr Ala Asn Ala Pro Thr Asn Thr Gly Leu Asp Gln Tyr
370 375 380
Asn Gly Val Ile Asn Thr Leu Arg Asn Ile Asp Ser Thr Ser Thr Trp
385 390 395 400
Glu Asp Gly Phe Ala Pro Ile Thr Lys Lys Glu Tyr Thr Thr Val Lys
405 410 415
Asp Ile Pro Gly Asp Phe Ile Lys Glu Ile Asn Met Asn Ser Gly Val
420 425 430
Asp Pro Cys Phe Leu Asn Phe Ile Thr Asn Ser Ser Gly Thr His Ser
435 440 445
Val Gly Thr Cys Tyr Arg Ser Pro Ile Gln Gly Pro Ile Tyr Asn Leu
450 455 460
Ser Ala Thr Ile Pro Tyr His Arg Leu Ser Tyr Val Asn Gly Met Asp
465 470 475 480
Asp Asn Phe Ser Glu Ser Phe Ser Gly Trp Gly Ile Ser Ala Trp Gly
485 490 495
Phe Gly Trp Leu His Glu Ser Leu Lys Thr Ser Asn Val Ile His Ala
500 505 510
Thr Arg Ser Ser Phe Ile Pro Ala Val Lys Ser Tyr Gly Leu Trp Gly
515 520 525
Gly Ala Thr Val Ile Lys Gly Pro Gly Ser Thr Gly Gly Asp Leu Val
530 535 540
Arg Leu Pro Ala Ala Pro Gly Val Ile Gln Val Arg Leu Pro Val Thr
545 550 555 560
Arg Gln Ala Val Lys Gln Tyr Lys Ile Arg Ile Arg Tyr Ala Ala Gln
565 570 575
Glu Asn Gly Glu Leu Phe Val Gly Lys Trp Ala Asn Arg Trp Trp Glu
580 585 590
Thr Ala Asn Leu Ser Leu Ile Lys Thr Thr Ser Ser Asn Thr Pro Ser
595 600 605
Tyr Ser Glu Phe Lys Leu Ile Asp Ala Phe Ile Met Thr Thr Asn Glu
610 615 620
Ser Ala Phe Gln Ile Glu Leu Arg Asn Asp Ser Gly Gly Pro Ile Leu
625 630 635 640
Ile Asp Arg Ile Glu Phe Ile Pro Ile Gln Gly Thr Leu Glu Gly Tyr
645 650 655
Glu Ala Thr Gln Asn
660
<210> 30
<211> 649
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 30
Met Asn Lys Asn Asn Asn Ser Ser Glu Leu Asp Ile Asn Asp Thr Gly
1 5 10 15
Ala Ser His Pro Ser Asn Ser Ile Val Glu Val Pro Cys Ser Glu Cys
20 25 30
Gly Gly Ile Asp Tyr Arg Asp Val Met Asn Met Ser Thr Gln Asn Ala
35 40 45
Tyr Val Glu Gln Gln Ser Val Val Gly Ala Ala Thr Thr Thr Ser Phe
50 55 60
Gln Val Ile Arg Glu Leu Tyr Arg Ser Asn Lys Asp Ile Leu Ser Thr
65 70 75 80
Ala Gly Gly Ile Ile Lys Ser Ile Ser Val Phe Leu Trp Lys Lys Glu
85 90 95
His Ala Gln Thr Gln Trp Glu Glu Phe Met Lys Ser Val Glu Leu Met
100 105 110
Ile Asp Glu Lys Ile Asp Thr Ala Val Met Ala Ala Ala Ile Ser Arg
115 120 125
Val Ala Ser Leu Glu Ala Leu Leu Ala Val His Gln Asp Tyr Leu Asp
130 135 140
Ile Leu Ala Ala Asp Pro Ser Asn Pro Asp Leu Gln Glu Leu Val Ser
145 150 155 160
Asp His Val Val Asn Leu Gln Asp Phe Phe Val Tyr Thr Met Pro Gln
165 170 175
Leu Ser Gln Ser Pro Tyr Gln Val Gln Gln Leu Val Ala Tyr Ala Glu
180 185 190
Ala Ala Asn Leu His Leu Ala Phe Leu Arg Asp Val Val Met Phe Gly
195 200 205
Ser Gln Trp Gly Met Gln Gln Ala Thr Ile Asp Thr Tyr Tyr Lys Tyr
210 215 220
Leu Glu Asn Asn Ile Lys Val Tyr Thr Asn Tyr Cys Val Asn Thr Tyr
225 230 235 240
Asn Ile Gly Leu Glu Lys Thr Lys Asn Leu Met Gly Ser Ile Asn Pro
245 250 255
Lys Asn Tyr Asp Lys Tyr Pro Tyr Leu Asn Pro His Ala Asn Asn Ser
260 265 270
Thr Asn Asn Tyr Lys Lys Val Leu Gln Trp Asn Val Trp Asn Asp Phe
275 280 285
Arg Arg Asn Met Thr Ile Met Val Leu Asp Leu Val Val Val Phe Pro
290 295 300
Thr Tyr Asp Pro Lys Val Tyr Thr Asn Leu Glu Gly Ile Glu Ile Glu
305 310 315 320
Leu Ser Arg Glu Val Tyr Ser Thr Ser Tyr Asn Arg Tyr Gly Asp Ser
325 330 335
Thr His Gly Gly Asp Trp Lys Gly Trp Glu Ile Leu Glu Thr Ser Val
340 345 350
Val Arg Pro Pro His Leu Val Ser Phe Leu Ser Asn Leu Ala Phe Tyr
355 360 365
Met Ala Asn Tyr Ala Asn Ala Pro Thr Asn Thr Gly Leu Asp Gln Tyr
370 375 380
Asn Gly Val Ile Asn Thr Leu Arg Asn Ile Asp Ser Thr Ser Thr Trp
385 390 395 400
Glu Asp Gly Phe Ala Pro Ile Thr Lys Lys Glu Tyr Thr Thr Val Lys
405 410 415
Asp Ile Pro Gly Asp Phe Ile Lys Glu Ile Asn Met Asn Ser Gly Val
420 425 430
Asp Pro Cys Phe Leu Asn Phe Ile Thr Asn Ser Ser Gly Thr His Ser
435 440 445
Val Gly Thr Cys Tyr Arg Ser Pro Ile Gln Gly Pro Ile Tyr Asn Leu
450 455 460
Ser Ala Thr Ile Pro Tyr His Arg Leu Ser Tyr Val Asn Gly Met Asp
465 470 475 480
Asp Asn Phe Ser Glu Ser Phe Ser Gly Trp Gly Ile Ser Ala Trp Gly
485 490 495
Phe Gly Trp Leu His Glu Ser Leu Lys Thr Ser Asn Val Ile His Ala
500 505 510
Thr Arg Ser Ser Phe Ile Pro Ala Val Lys Ser Tyr Gly Leu Trp Gly
515 520 525
Gly Ala Thr Val Ile Lys Gly Pro Gly Ser Thr Gly Gly Asp Leu Val
530 535 540
Arg Leu Pro Ala Ala Pro Gly Val Ile Gln Val Arg Leu Pro Val Thr
545 550 555 560
Arg Gln Ala Val Lys Gln Tyr Lys Ile Arg Ile Arg Tyr Ala Ala Gln
565 570 575
Glu Asn Gly Glu Leu Phe Val Gly Lys Trp Ala Asn Arg Trp Trp Glu
580 585 590
Thr Ala Asn Leu Ser Leu Ile Lys Thr Thr Ser Ser Asn Thr Pro Ser
595 600 605
Tyr Ser Glu Phe Lys Leu Ile Asp Ala Phe Ile Met Thr Thr Asn Glu
610 615 620
Ser Ala Phe Gln Ile Glu Leu Arg Asn Asp Ser Gly Gly Pro Ile Leu
625 630 635 640
Ile Asp Arg Ile Glu Phe Ile Pro Ile
645
<210> 31
<211> 404
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 31
Leu Gln Thr Lys Leu Glu Gly Asn Ile Met Lys Ser Ile Ser Lys Lys
1 5 10 15
Val Met Ala Gly Leu Leu Val Gly Ala Thr Ser Leu Ser Ile Trp Ala
20 25 30
Pro Ala Ser Gln Ala Ala Ala Pro Glu Asn Asn Arg Tyr Tyr Ser Val
35 40 45
His Leu Ala Ala Asp Thr Ala Leu Lys Trp Asp Val Tyr Gly Asn Gly
50 55 60
Thr Tyr Asp Asp Ala Gly Ile Leu Leu Tyr Asn Gly Ser Leu Gly Asp
65 70 75 80
Asn Glu Gln Phe Val Phe Phe Pro Leu Asp Gly Gly Leu Tyr Ala Ile
85 90 95
Val Asn Lys Asn Ser Gly Lys Ala Val Thr Ile Gly Gly Gly Trp Val
100 105 110
Gly Asp Asn Ala Phe Ser Tyr Asn Arg Glu Gly Leu Ile Gln Ser Lys
115 120 125
Trp Thr Gly Ala Ala Ala Asn Lys Trp Tyr Leu Arg Asp Lys Gly Asn
130 135 140
Thr Asn Tyr Glu Ile Val Asn Gln Gly Tyr Gly Lys Val Ala Ser Tyr
145 150 155 160
Ala Arg Leu Gly Ile Thr Gly Ala Lys Tyr Val Asp Leu Asp Asp Ser
165 170 175
Asn Pro Ser Asp Asn Asp Arg Leu Phe Arg Ile Asn Lys Ser Pro Leu
180 185 190
Gly Val Asp Ile Pro Gly Phe Asn Phe Asp Tyr Gly Thr Phe Ser Leu
195 200 205
Pro Gln Leu Pro Ala Thr Gly Asn Arg Pro Asp Ala Pro Asn Tyr Thr
210 215 220
Gly Gly Ile Asp Gln Gln Leu Pro Gln Thr Ser Asn Ser Val Ile Val
225 230 235 240
Gly Ala Ser Leu Val Pro Cys Ile Met Val Asn Asp Ser Gln Ala Ser
245 250 255
Asp Tyr Thr Lys Ile His Asn Ser Pro Tyr Tyr Thr Leu Val Lys Glu
260 265 270
Glu Tyr Trp Asp Lys Thr Phe Ser Ala Val Leu Pro Ala Gly Ile Thr
275 280 285
Arg Asn Tyr Ser Phe Lys Thr Gly Met Thr Ser Val Asp Gln Gln Lys
290 295 300
Met Thr Asp Thr Leu Ser Met Lys Ile Gly Ala Asp Phe Gly Leu Lys
305 310 315 320
Phe Gly Asp Ala Ser Ala Ser Leu Lys Thr Glu Ile Ser Arg Thr Ile
325 330 335
Gln Thr Glu Ile Thr Ser Thr Asn Thr Glu Ala Ser Glu Glu Thr Val
340 345 350
Thr Ser Thr Val Ala Ser Glu Ala Gly Lys Thr Thr Gly Phe Thr Glu
355 360 365
Tyr Gln Leu Ala Thr Lys Tyr Thr Leu Lys Arg Ala Asp Gly Ser Ile
370 375 380
Val Ser Asp Pro Trp Val Val Lys Asn Asn Lys Ile Thr Ile Ala Arg
385 390 395 400
Lys Asn Ala Gln
<210> 32
<211> 366
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 32
Met Pro Glu Asn Asn Arg Tyr Tyr Ser Val His Leu Ala Ala Asp Thr
1 5 10 15
Ala Leu Lys Trp Asp Val Tyr Gly Asn Gly Thr Tyr Asp Asp Ala Gly
20 25 30
Ile Leu Leu Tyr Asn Gly Ser Leu Gly Asp Asn Glu Gln Phe Val Phe
35 40 45
Phe Pro Leu Asp Gly Gly Leu Tyr Ala Ile Val Asn Lys Asn Ser Gly
50 55 60
Lys Ala Val Thr Ile Gly Gly Gly Trp Val Gly Asp Asn Ala Phe Ser
65 70 75 80
Tyr Asn Arg Glu Gly Leu Ile Gln Ser Lys Trp Thr Gly Ala Ala Ala
85 90 95
Asn Lys Trp Tyr Leu Arg Asp Lys Gly Asn Thr Asn Tyr Glu Ile Val
100 105 110
Asn Gln Gly Tyr Gly Lys Val Ala Ser Tyr Ala Arg Leu Gly Ile Thr
115 120 125
Gly Ala Lys Tyr Val Asp Leu Asp Asp Ser Asn Pro Ser Asp Asn Asp
130 135 140
Arg Leu Phe Arg Ile Asn Lys Ser Pro Leu Gly Val Asp Ile Pro Gly
145 150 155 160
Phe Asn Phe Asp Tyr Gly Thr Phe Ser Leu Pro Gln Leu Pro Ala Thr
165 170 175
Gly Asn Arg Pro Asp Ala Pro Asn Tyr Thr Gly Gly Ile Asp Gln Gln
180 185 190
Leu Pro Gln Thr Ser Asn Ser Val Ile Val Gly Ala Ser Leu Val Pro
195 200 205
Cys Ile Met Val Asn Asp Ser Gln Ala Ser Asp Tyr Thr Lys Ile His
210 215 220
Asn Ser Pro Tyr Tyr Thr Leu Val Lys Glu Glu Tyr Trp Asp Lys Thr
225 230 235 240
Phe Ser Ala Val Leu Pro Ala Gly Ile Thr Arg Asn Tyr Ser Phe Lys
245 250 255
Thr Gly Met Thr Ser Val Asp Gln Gln Lys Met Thr Asp Thr Leu Ser
260 265 270
Met Lys Ile Gly Ala Asp Phe Gly Leu Lys Phe Gly Asp Ala Ser Ala
275 280 285
Ser Leu Lys Thr Glu Ile Ser Arg Thr Ile Gln Thr Glu Ile Thr Ser
290 295 300
Thr Asn Thr Glu Ala Ser Glu Glu Thr Val Thr Ser Thr Val Ala Ser
305 310 315 320
Glu Ala Gly Lys Thr Thr Gly Phe Thr Glu Tyr Gln Leu Ala Thr Lys
325 330 335
Tyr Thr Leu Lys Arg Ala Asp Gly Ser Ile Val Ser Asp Pro Trp Val
340 345 350
Val Lys Asn Asn Lys Ile Thr Ile Ala Arg Lys Asn Ala Gln
355 360 365
<210> 33
<211> 717
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 33
Val Trp Ser Val Asp Leu Lys Glu Asn Ile Tyr Trp Lys Gly Val Ile
1 5 10 15
Lys Met Ser Ser Tyr Asn Lys Asn Pro Phe Glu Thr Ile Lys Glu Leu
20 25 30
Leu Ser Asn Ala Asn Val Ser Ile Thr Cys Pro Leu His Pro Leu Ala
35 40 45
Lys Glu Pro Thr Ala Val Leu Gln Gly Met Asn Tyr Lys Asp Trp Leu
50 55 60
Val Met Ser Glu Glu Glu Asn Ser Leu Gly Lys Pro Glu Asn Phe Asp
65 70 75 80
Ser Glu Thr Ile Gln Asn Ala Leu Ile Gly Thr Leu Ala Val Ile Gly
85 90 95
Phe Ile Ala Ser Val Leu Ile Thr Pro Ile Thr Gly Gly Ala Ser Val
100 105 110
Ala Ile Gly Ser Ala Leu Leu Leu Glu Thr Ile Pro Tyr Tyr Trp Gly
115 120 125
Leu Ala Glu Ser Glu Asp Pro Thr Ile Gln Glu Lys Ala Met Phe Asp
130 135 140
Asp Ile Met Lys Ala Thr Glu Lys Thr Ile Lys Ser Glu Ile Glu Lys
145 150 155 160
Val Val Lys Thr Lys Ala Glu Ser Glu Leu Thr Ser Leu Arg Asp Val
165 170 175
Phe Lys Tyr Tyr Thr Arg Ala Leu Asn Leu Trp Lys Glu Asn Lys Asp
180 185 190
Asn Gln Asp Ala Arg Lys Glu Val Ser Ser Arg Phe Arg Ala Ala His
195 200 205
Val Ala Phe Ile Gly Ala Met Ser Gln Phe Lys Met Pro Gly Tyr Glu
210 215 220
Leu Val Met Leu Pro Ile Tyr Ala Ala Ala Ala Asn Phe His Leu Met
225 230 235 240
Leu Leu Gln Asp Gly Met Ile Tyr Glu Lys Glu Trp Asn Glu Ser Asn
245 250 255
Asn Leu Thr Glu Asp Phe Tyr Tyr Lys Glu Tyr Gln Asn Trp Thr Ser
260 265 270
Gln Tyr Ile Asp His Cys Thr Ser Trp Tyr Gln Lys Gly Leu Lys Asp
275 280 285
Ile Lys Asp Asn Lys Glu Lys Asn Trp Val Asp Tyr Asn Ser Tyr Arg
290 295 300
Asn Asn Met Thr Ile Leu Val Leu Asp Leu Ile Ala Leu Phe Pro Ser
305 310 315 320
Tyr Asp Val Arg Gln Tyr Asn Asn Met Gly Val Lys Leu Glu Thr His
325 330 335
Thr Arg Thr Leu Tyr Ser Asn Pro Leu Lys Phe Ser Lys Gly Ser Arg
340 345 350
Ile Asp Asp Asp Glu Arg Val Tyr Thr Arg Glu Pro Asn Leu Phe Ser
355 360 365
Ser Leu Ser His Leu Glu Phe His Thr Arg Thr Thr Asn Leu Gly Ser
370 375 380
Asp Gly Ile Glu Phe Leu Ser Gly Ile Glu Lys Lys Tyr Gln Leu Thr
385 390 395 400
Glu Lys Glu Ser Tyr Arg Thr Lys Phe Glu Gly Lys Pro Thr Asp Ile
405 410 415
Gly Lys Lys His Glu Ile Pro Phe Lys Lys Asp Glu Ser Glu Phe Tyr
420 425 430
Ser Leu Tyr Glu Leu Ser Thr Glu Gly Lys Gly Phe Lys Asp Ser Thr
435 440 445
Lys Leu Pro Leu Ile Gln Lys Met Thr Phe Asn Asn Glu Glu Gly Lys
450 455 460
Lys Phe Glu Tyr Ser Val Asp Lys Phe Gly Asn Gly Ala Leu Glu Lys
465 470 475 480
Glu Ser Phe Ser Ile Thr Asn Pro Asp Asp Leu Leu Ala Asp Gln Lys
485 490 495
Ala Arg His Val Leu Ser Asp Ile Ile Phe Val Asp Asp Lys Asn Ile
500 505 510
Ser Pro Glu Gln Ile Gln Thr Arg Asp Tyr Ser Phe Ala Trp Thr Ser
515 520 525
Glu Gln Ile Ser Pro Tyr Asn Arg Ile Thr Asp Gly Thr Lys Asn Lys
530 535 540
Asp Gly Ser Ile Ser Tyr Gln Ile Thr Gln Val Pro Ala Val Lys Ala
545 550 555 560
Tyr Ser Leu Lys Ser Ser Lys Asp Thr Ser His Ile Asp Val Ile Ser
565 570 575
Gly Pro Gly Phe Thr Gly Gly Asp Leu Val Arg Cys Ala Ile Lys Lys
580 585 590
Thr Ala Ser Ser Thr Gly Val Thr Gln Leu Ser Ile Val Phe Pro Ile
595 600 605
Thr Phe Asn His Val Lys Thr Asp Lys Tyr Arg Val Arg Met Asn Tyr
610 615 620
Ala Ala Asp His Thr Lys Leu Ile Thr Leu Val Gly Gly Ser Asn Pro
625 630 635 640
Ile Ser Gly Thr Ile Glu Asn Thr Phe Asp Ala Lys Asp Thr Gly Lys
645 650 655
Ser Leu Lys Tyr Asn Asn Phe Lys Met Met Glu Phe Asn Ile Ala Thr
660 665 670
Asn Phe Lys Asp Glu Glu Lys Gln Lys Ile Ile Thr Leu Lys Leu Thr
675 680 685
Tyr Ala Asp Asp Asp Gln Ala Ile Ala Asp Gly Lys Val Ala Gln Leu
690 695 700
Trp Ile Asp Lys Leu Glu Phe Ile Pro Val Pro Thr Lys
705 710 715
<210> 34
<211> 714
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 34
Val Trp Ser Val Asp Leu Lys Glu Asn Ile Tyr Trp Lys Gly Val Ile
1 5 10 15
Lys Met Ser Ser Tyr Asn Lys Asn Pro Phe Glu Thr Ile Lys Glu Leu
20 25 30
Leu Ser Asn Ala Asn Val Ser Ile Thr Cys Pro Leu His Pro Leu Ala
35 40 45
Lys Glu Pro Thr Ala Val Leu Gln Gly Met Asn Tyr Lys Asp Trp Leu
50 55 60
Val Met Ser Glu Glu Glu Asn Ser Leu Gly Lys Pro Glu Asn Phe Asp
65 70 75 80
Ser Glu Thr Ile Gln Asn Ala Leu Ile Gly Thr Leu Ala Val Ile Gly
85 90 95
Phe Ile Ala Ser Val Leu Ile Thr Pro Ile Thr Gly Gly Ala Ser Val
100 105 110
Ala Ile Gly Ser Ala Leu Leu Leu Glu Thr Ile Pro Tyr Tyr Trp Gly
115 120 125
Leu Ala Glu Ser Glu Asp Pro Thr Ile Gln Glu Lys Ala Met Phe Asp
130 135 140
Asp Ile Met Lys Ala Thr Glu Lys Thr Ile Lys Ser Glu Ile Glu Lys
145 150 155 160
Val Val Lys Thr Lys Ala Glu Ser Glu Leu Thr Ser Leu Arg Asp Val
165 170 175
Phe Lys Tyr Tyr Thr Arg Ala Leu Asn Leu Trp Lys Glu Asn Lys Asp
180 185 190
Asn Gln Asp Ala Arg Lys Glu Val Ser Ser Arg Phe Arg Ala Ala His
195 200 205
Val Ala Phe Ile Gly Ala Met Ser Gln Phe Lys Met Pro Gly Tyr Glu
210 215 220
Leu Val Met Leu Pro Ile Tyr Ala Ala Ala Ala Asn Phe His Leu Met
225 230 235 240
Leu Leu Gln Asp Gly Met Ile Tyr Glu Lys Glu Trp Asn Glu Ser Asn
245 250 255
Asn Leu Thr Glu Asp Phe Tyr Tyr Lys Glu Tyr Gln Asn Trp Thr Ser
260 265 270
Gln Tyr Ile Asp His Cys Thr Ser Trp Tyr Gln Lys Gly Leu Lys Asp
275 280 285
Ile Lys Asp Asn Lys Glu Lys Asn Trp Val Asp Tyr Asn Ser Tyr Arg
290 295 300
Asn Asn Met Thr Ile Leu Val Leu Asp Leu Ile Ala Leu Phe Pro Ser
305 310 315 320
Tyr Asp Val Arg Gln Tyr Asn Asn Met Gly Val Lys Leu Glu Thr His
325 330 335
Thr Arg Thr Leu Tyr Ser Asn Pro Leu Lys Phe Ser Lys Gly Ser Arg
340 345 350
Ile Asp Asp Asp Glu Arg Val Tyr Thr Arg Glu Pro Asn Leu Phe Ser
355 360 365
Ser Leu Ser His Leu Glu Phe His Thr Arg Thr Thr Asn Leu Gly Ser
370 375 380
Asp Gly Ile Glu Phe Leu Ser Gly Ile Glu Lys Lys Tyr Gln Leu Thr
385 390 395 400
Glu Lys Glu Ser Tyr Arg Thr Lys Phe Glu Gly Lys Pro Thr Asp Ile
405 410 415
Gly Lys Lys His Glu Ile Pro Phe Lys Lys Asp Glu Ser Glu Phe Tyr
420 425 430
Ser Leu Tyr Glu Leu Ser Thr Glu Gly Lys Gly Phe Lys Asp Ser Thr
435 440 445
Lys Leu Pro Leu Ile Gln Lys Met Thr Phe Asn Asn Glu Glu Gly Lys
450 455 460
Lys Phe Glu Tyr Ser Val Asp Lys Phe Gly Asn Gly Ala Leu Glu Lys
465 470 475 480
Glu Ser Phe Ser Ile Thr Asn Pro Asp Asp Leu Leu Ala Asp Gln Lys
485 490 495
Ala Arg His Val Leu Ser Asp Ile Ile Phe Val Asp Asp Lys Asn Ile
500 505 510
Ser Pro Glu Gln Ile Gln Thr Arg Asp Tyr Ser Phe Ala Trp Thr Ser
515 520 525
Glu Gln Ile Ser Pro Tyr Asn Arg Ile Thr Asp Gly Thr Lys Asn Lys
530 535 540
Asp Gly Ser Ile Ser Tyr Gln Ile Thr Gln Val Pro Ala Val Lys Ala
545 550 555 560
Tyr Ser Leu Lys Ser Ser Lys Asp Thr Ser His Ile Asp Val Ile Ser
565 570 575
Gly Pro Gly Phe Thr Gly Gly Asp Leu Val Arg Cys Ala Ile Lys Lys
580 585 590
Thr Ala Ser Ser Thr Gly Val Thr Gln Leu Ser Ile Val Phe Pro Ile
595 600 605
Thr Phe Asn His Val Lys Thr Asp Lys Tyr Arg Val Arg Met Asn Tyr
610 615 620
Ala Ala Asp His Thr Lys Leu Ile Thr Leu Val Gly Gly Ser Asn Pro
625 630 635 640
Ile Ser Gly Thr Ile Glu Asn Thr Phe Asp Ala Lys Asp Thr Gly Lys
645 650 655
Ser Leu Lys Tyr Asn Asn Phe Lys Met Met Glu Phe Asn Ile Ala Thr
660 665 670
Asn Phe Lys Asp Glu Glu Lys Gln Lys Ile Ile Thr Leu Lys Leu Thr
675 680 685
Tyr Ala Asp Asp Asp Gln Ala Ile Ala Asp Gly Lys Val Ala Gln Leu
690 695 700
Trp Ile Asp Lys Leu Glu Phe Ile Pro Val
705 710
<210> 35
<211> 1261
<212> PRT
<213> Неизвестная
<220>
<223> Неизвестный организм из образца окружающей среды
<400> 35
Met Ser Gln Asn Tyr Asn Asp Glu Tyr Glu Val Ile Gly Thr Asp Glu
1 5 10 15
Arg Lys Asn His Pro Lys Tyr Pro Leu Ala Asn Thr Pro Gly Leu Glu
20 25 30
Leu Gln Gln Met Ser Tyr Lys Asp Trp Val Asp Ile Cys Thr Thr Glu
35 40 45
Glu Ser Glu Ser Leu Phe Thr Asp Ile Thr Val Lys Asp Ala Val Ser
50 55 60
Ile Ala Thr Ser Ile Thr Ala Ala Val Leu Gly Ile Ser Phe Pro Val
65 70 75 80
Ala Ser Ala Val Ser Ser Ile Ile Ser Val Leu Val Pro Tyr Trp Trp
85 90 95
Pro Ala Ser Ala Gly Thr Pro Gly Thr Pro Ser Ala Gln Ala Thr Trp
100 105 110
Glu Lys Phe Met Asn Ala Ala Glu Ala Leu Ser Asn Lys Thr Ile Ile
115 120 125
Ala Ser Lys Arg Ala Asp Ala Leu Ala Arg Trp Gln Gly Ile Gln Thr
130 135 140
Leu Gly Arg Asp Tyr Phe Gln Ala Gln Cys Asp Trp Leu Gln Asp Gln
145 150 155 160
Asn Asn Glu Leu Lys Lys Ser Asn Leu Arg Asp Ala Phe Asp Asp Val
165 170 175
Glu Asp Tyr Leu Lys Val Ser Met Pro Phe Phe Arg Ala Gln Gly Phe
180 185 190
Glu Ile Pro Met Leu Ala Met Tyr Ala Gln Ala Ala Asn Met His Leu
195 200 205
Leu Leu Leu Arg Glu Val Val Gln Asn Gly Val Ser Trp Gly Phe Gln
210 215 220
Gln Tyr Glu Ile Asp Arg Tyr Tyr Ser Asn Thr Asp Pro Phe Leu Gly
225 230 235 240
Asn Pro Gly Leu Ile Gln Leu Leu Glu Ser Tyr Thr Asp Tyr Cys Val
245 250 255
Gln Trp Tyr Asn Asn Gly Leu Gln Gln Gln Tyr Glu Asn Asn Ser Tyr
260 265 270
Asn Trp Asp Ala Phe Asn Asp Phe Arg Arg Asp Met Thr Ile Met Val
275 280 285
Leu Asp Val Val Ser Leu Trp Pro Thr Tyr Asp Gln Lys Arg Tyr Pro
290 295 300
Lys Pro Thr Lys Ser Gln Leu Thr Arg Thr Val Tyr Thr Asp Leu Val
305 310 315 320
Gly Phe Ser Gly Asp Phe Asp Tyr Thr Gln Ile Ala Ile Asp Arg Ala
325 330 335
Glu Arg Glu Leu Val Gln Thr Pro Asp Leu Phe Thr Trp Ile Arg Lys
340 345 350
Ile Val Phe Asn Leu Leu Pro Gly Gly Thr Asn Phe Val Arg Gly Arg
355 360 365
Ala Met Thr Phe Thr Tyr Thr Asp Ser Ile Asn Gly Tyr Glu Glu Asn
370 375 380
Ala Gly Asn Pro Gly Glu Ile Gln Lys Ile Val Asn Ile Pro Leu Pro
385 390 395 400
Asp Thr Gly Asp Asp Val Trp Arg Ile Thr Asn Gln Val Ser Pro Thr
405 410 415
Ser Gly Ala Leu Ser Gly Trp Ile Phe Ser Phe Ile Lys Ser Leu Asp
420 425 430
Gln Arg Ile Ser Trp Arg Glu Pro Ile Ser Ser Asp Ile Met Leu Met
435 440 445
Gln Gly Leu Ser Cys Asn Gly Pro Ser Val Asp Ser Cys Asp Leu Cys
450 455 460
Asp Arg Asn Ser Pro Cys Arg Asn Ile Thr Pro Asn Asp Ser Phe Pro
465 470 475 480
Cys Asn Asn Lys Ser Leu Tyr Ser His Arg Phe Ser Tyr Leu Gly Ala
485 490 495
Gly Leu Lys Ser Asp Leu Thr Thr Leu Thr Phe Phe Ser Tyr Gly Trp
500 505 510
Thr His Val Ser Ala Asp Ala Asn Asn Leu Ile Asp Thr Lys Lys Ile
515 520 525
Thr Gln Ile Pro Ala Val Lys Gly Ser His Leu Ile Gly Asn Ala His
530 535 540
Val Ile Lys Gly Thr Gly Ser Thr Gly Gly Asp Leu Val Val Leu Pro
545 550 555 560
Ile Asp Ser Gln Val Phe Val Asn Val Thr Thr Leu Glu Ser Asp Thr
565 570 575
Thr Ile Gly Tyr Glu Ile Arg Ile Arg Tyr Ala Ser Ala Thr Glu Val
580 585 590
Phe Leu Asn Val Arg Ile Glu Gln Pro Asp Ser Pro Pro Ile Tyr Arg
595 600 605
Asp Val Thr Leu Pro Ala Thr Thr Ser His Ser Asn Leu Thr Tyr Ala
610 615 620
Ala Phe Asn Tyr Tyr Thr Ile Ala Lys Ile Gly Thr Val Gly Ala Thr
625 630 635 640
Pro Gly Leu Thr Val Leu Arg Leu Ser Asn Ser Ile Asn Glu Leu Gly
645 650 655
Ala Ile Ile Asp Lys Ile Glu Phe Ile Pro Ser Glu Trp Ser Leu Glu
660 665 670
Glu Tyr Gln Thr Thr Gln Asp Leu Glu Glu Ala Arg Lys Ala Val Asn
675 680 685
Ala Leu Phe Met Asn Asp Ala Lys Asn Ala Leu Gln Leu Asp Val Thr
690 695 700
Asp Tyr Ala Val Asp Gln Ala Ala Asn Leu Val Glu Cys Val Ser Glu
705 710 715 720
Asp Phe His Ala Gln Glu Lys Met Ile Leu Leu Asp Gln Val Lys Phe
725 730 735
Ala Lys Arg Leu Ser Gln Thr Arg Asn Leu Leu Asn Tyr Gly Asp Phe
740 745 750
Glu Ser Ser Asp Trp Ser Gly Glu Asn Gly Trp Arg Thr Ser Asn His
755 760 765
Val His Val Ala Ser Asp Asn Pro Ile Phe Lys Gly Arg Tyr Leu His
770 775 780
Met Pro Gly Ala Met Ser Pro Gln Phe Ser Asn Asn Ile Tyr Pro Thr
785 790 795 800
Tyr Ala Tyr Gln Lys Val Asp Glu Ser Lys Leu Lys Ser Tyr Thr Arg
805 810 815
Tyr Leu Val Arg Gly Phe Val Gly Asn Ser Lys Asp Leu Glu Leu Leu
820 825 830
Val Glu Arg Tyr Gly Lys Glu Val His Val Glu Met Asp Val Pro Asn
835 840 845
Asp Ile Gln Tyr Ser Leu Pro Met Asn Glu Cys Gly Gly Phe Asn Arg
850 855 860
Cys Lys Pro Ala Ser Tyr Gln Thr Arg Pro Pro His Thr Cys Thr Cys
865 870 875 880
Lys Asp Thr Ala Val Ala His Thr Asp Cys Gln Cys Lys Asp Lys Val
885 890 895
Asn Arg Thr Ser Ala Asp Val Tyr Thr Asn Glu Ser Thr Ser Arg Gly
900 905 910
Met Tyr Ala Asp Glu Phe His Ser His Lys Ser Cys Gly Cys Gly Asp
915 920 925
Lys His Met Asp Lys Asn Gly Thr His Pro His Lys Ser Cys Gly Cys
930 935 940
Lys Asn Ser His Val Phe Thr Tyr His Ile Asp Thr Gly Cys Val Asp
945 950 955 960
Met Val Glu Asn Val Gly Leu Phe Phe Ala Leu Lys Ile Ala Ser Glu
965 970 975
Asn Gly Ile Ala Asn Ile Asp Asn Leu Glu Ile Ile Glu Ala Gln Pro
980 985 990
Leu Thr Gly Glu Ala Leu Ala Arg Val Lys Lys Arg Glu Gln Arg Trp
995 1000 1005
Lys Gln Glu Arg Asp Gln Lys Arg Val Glu Thr Glu Lys Ala Val
1010 1015 1020
Gln Ala Ala Gln Thr Ala Val Gln Asn Leu Phe Thr Asn Ala Gln
1025 1030 1035
Gln Asn Arg Leu Lys Phe Glu Thr Leu Phe Pro Gln Ile Val His
1040 1045 1050
Ala Glu Ala Leu Ile Gln Gln Ile Arg Tyr Val Tyr His Pro Phe
1055 1060 1065
Leu Gln Gly Ala Leu Pro Ala Ile Pro Gly Met Asn Phe Asp Leu
1070 1075 1080
Val Gln Glu Leu Ser Met Arg Ile Glu Asn Ala Arg Met Leu Phe
1085 1090 1095
Glu Thr Arg Asn Leu Ile Gln Asn Gly Ser Phe Ser Ala Gly Thr
1100 1105 1110
Gly Ser Trp His Val Thr Asp Gly Val Glu Val Gln Pro Leu Gln
1115 1120 1125
Asn Thr Ser Val Leu Val Leu Ser Glu Trp Ser His Glu Ala Ser
1130 1135 1140
Gln Gln Val Arg Ile Asp Ser Asp Arg Gly Tyr Val Leu Arg Val
1145 1150 1155
Thr Ala Arg Lys Glu Gly Ala Gly Lys Gly Thr Val Thr Leu Ser
1160 1165 1170
Asp Cys Ala Asp Tyr Met Glu Thr Leu Thr Phe Thr Ser Cys Asp
1175 1180 1185
Tyr Asn Lys Val Gly Ser Gln Thr Met Thr Glu Gly Thr Leu Thr
1190 1195 1200
Gly Phe Val Thr Lys Thr Leu Glu Ile Phe Pro Asp Thr Asp Gln
1205 1210 1215
Ile Arg Ile Asp Ile Gly Glu Thr Glu Gly Thr Phe Lys Val Glu
1220 1225 1230
Ser Val Glu Leu Ile Cys Met Glu Gln Met Glu Asp His Leu Tyr
1235 1240 1245
Asp Arg Ala Gly Ser Val Ala Lys Phe Ser Lys Arg Ser
1250 1255 1260
<210> 36
<211> 667
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 36
Met Ser Gln Asn Tyr Asn Asp Glu Tyr Glu Val Ile Gly Thr Asp Glu
1 5 10 15
Arg Lys Asn His Pro Lys Tyr Pro Leu Ala Asn Thr Pro Gly Leu Glu
20 25 30
Leu Gln Gln Met Ser Tyr Lys Asp Trp Val Asp Ile Cys Thr Thr Glu
35 40 45
Glu Ser Glu Ser Leu Phe Thr Asp Ile Thr Val Lys Asp Ala Val Ser
50 55 60
Ile Ala Thr Ser Ile Thr Ala Ala Val Leu Gly Ile Ser Phe Pro Val
65 70 75 80
Ala Ser Ala Val Ser Ser Ile Ile Ser Val Leu Val Pro Tyr Trp Trp
85 90 95
Pro Ala Ser Ala Gly Thr Pro Gly Thr Pro Ser Ala Gln Ala Thr Trp
100 105 110
Glu Lys Phe Met Asn Ala Ala Glu Ala Leu Ser Asn Lys Thr Ile Ile
115 120 125
Ala Ser Lys Arg Ala Asp Ala Leu Ala Arg Trp Gln Gly Ile Gln Thr
130 135 140
Leu Gly Arg Asp Tyr Phe Gln Ala Gln Cys Asp Trp Leu Gln Asp Gln
145 150 155 160
Asn Asn Glu Leu Lys Lys Ser Asn Leu Arg Asp Ala Phe Asp Asp Val
165 170 175
Glu Asp Tyr Leu Lys Val Ser Met Pro Phe Phe Arg Ala Gln Gly Phe
180 185 190
Glu Ile Pro Met Leu Ala Met Tyr Ala Gln Ala Ala Asn Met His Leu
195 200 205
Leu Leu Leu Arg Glu Val Val Gln Asn Gly Val Ser Trp Gly Phe Gln
210 215 220
Gln Tyr Glu Ile Asp Arg Tyr Tyr Ser Asn Thr Asp Pro Phe Leu Gly
225 230 235 240
Asn Pro Gly Leu Ile Gln Leu Leu Glu Ser Tyr Thr Asp Tyr Cys Val
245 250 255
Gln Trp Tyr Asn Asn Gly Leu Gln Gln Gln Tyr Glu Asn Asn Ser Tyr
260 265 270
Asn Trp Asp Ala Phe Asn Asp Phe Arg Arg Asp Met Thr Ile Met Val
275 280 285
Leu Asp Val Val Ser Leu Trp Pro Thr Tyr Asp Gln Lys Arg Tyr Pro
290 295 300
Lys Pro Thr Lys Ser Gln Leu Thr Arg Thr Val Tyr Thr Asp Leu Val
305 310 315 320
Gly Phe Ser Gly Asp Phe Asp Tyr Thr Gln Ile Ala Ile Asp Arg Ala
325 330 335
Glu Arg Glu Leu Val Gln Thr Pro Asp Leu Phe Thr Trp Ile Arg Lys
340 345 350
Ile Val Phe Asn Leu Leu Pro Gly Gly Thr Asn Phe Val Arg Gly Arg
355 360 365
Ala Met Thr Phe Thr Tyr Thr Asp Ser Ile Asn Gly Tyr Glu Glu Asn
370 375 380
Ala Gly Asn Pro Gly Glu Ile Gln Lys Ile Val Asn Ile Pro Leu Pro
385 390 395 400
Asp Thr Gly Asp Asp Val Trp Arg Ile Thr Asn Gln Val Ser Pro Thr
405 410 415
Ser Gly Ala Leu Ser Gly Trp Ile Phe Ser Phe Ile Lys Ser Leu Asp
420 425 430
Gln Arg Ile Ser Trp Arg Glu Pro Ile Ser Ser Asp Ile Met Leu Met
435 440 445
Gln Gly Leu Ser Cys Asn Gly Pro Ser Val Asp Ser Cys Asp Leu Cys
450 455 460
Asp Arg Asn Ser Pro Cys Arg Asn Ile Thr Pro Asn Asp Ser Phe Pro
465 470 475 480
Cys Asn Asn Lys Ser Leu Tyr Ser His Arg Phe Ser Tyr Leu Gly Ala
485 490 495
Gly Leu Lys Ser Asp Leu Thr Thr Leu Thr Phe Phe Ser Tyr Gly Trp
500 505 510
Thr His Val Ser Ala Asp Ala Asn Asn Leu Ile Asp Thr Lys Lys Ile
515 520 525
Thr Gln Ile Pro Ala Val Lys Gly Ser His Leu Ile Gly Asn Ala His
530 535 540
Val Ile Lys Gly Thr Gly Ser Thr Gly Gly Asp Leu Val Val Leu Pro
545 550 555 560
Ile Asp Ser Gln Val Phe Val Asn Val Thr Thr Leu Glu Ser Asp Thr
565 570 575
Thr Ile Gly Tyr Glu Ile Arg Ile Arg Tyr Ala Ser Ala Thr Glu Val
580 585 590
Phe Leu Asn Val Arg Ile Glu Gln Pro Asp Ser Pro Pro Ile Tyr Arg
595 600 605
Asp Val Thr Leu Pro Ala Thr Thr Ser His Ser Asn Leu Thr Tyr Ala
610 615 620
Ala Phe Asn Tyr Tyr Thr Ile Ala Lys Ile Gly Thr Val Gly Ala Thr
625 630 635 640
Pro Gly Leu Thr Val Leu Arg Leu Ser Asn Ser Ile Asn Glu Leu Gly
645 650 655
Ala Ile Ile Asp Lys Ile Glu Phe Ile Pro Ser
660 665
<210> 37
<211> 1164
<212> PRT
<213> Неизвестная
<220>
<223> Неизвестный организм из образца окружающей среды
<400> 37
Met Ser Glu Tyr Glu Leu Met Asp Val Ser Pro Asn Pro Tyr Asn Val
1 5 10 15
Leu Met Gln Arg Pro Asp Glu Ala Gly Gly Ile Asp Trp Asp Ala Glu
20 25 30
Ile Ser Lys Met Ile Lys Thr Tyr Tyr Gln Lys Gly Thr Phe Ala Ala
35 40 45
Asp Phe Ala Thr Ile Ile Leu Pro Leu Ile Leu Ala His Asn Val Gln
50 55 60
Trp Asn Val Val Leu Lys Ser Val Leu Ser Phe Ala Ser Ala Leu Pro
65 70 75 80
Gly Ile Gly Thr Ala Val Ser Ile Leu Ser Pro Phe Leu Gln Leu Leu
85 90 95
Phe Pro Thr Asp Pro Ala Ala His Asp Lys Gln Leu Met Lys Leu Ile
100 105 110
Leu Asp Gln Thr Lys Ile Leu Ile Asp Gln Ala Val Ser Gln Glu Val
115 120 125
Met Asn Arg Ile Ser Gln Gln Ile Thr Gly Leu Tyr Ala Asn Leu Ala
130 135 140
Arg Phe Asn Arg Thr Ile Ala Ala Tyr Glu Thr Leu Ala Pro Ser Thr
145 150 155 160
Ile Ile Ala Glu Ile Glu Ala Ile Glu Ala Val Phe Asp Asn Gln Val
165 170 175
Pro Gln Leu Val Asp Pro Gly Tyr Leu Ala Leu Thr Leu Pro Leu Tyr
180 185 190
Val Gln Gly Val Asn Leu Asn Leu Met Phe Tyr Lys Ser Val Leu Asp
195 200 205
His Ala Glu Gln Leu Lys Ile Pro Ala Gly Glu Gln Asn Phe Tyr Lys
210 215 220
Lys Ser Leu Ile Asp Lys Ile Lys Thr Ala Ser Ala Gln Val Tyr Thr
225 230 235 240
Tyr Phe Lys Gln Val Pro Trp Arg Pro Asn Glu Ile Thr Pro Ser Ser
245 250 255
Ala Ser Asn Gln Asp Ile Val Thr Arg Gln Thr Met Tyr Thr His Cys
260 265 270
Leu Asp Tyr Val Ala Met Trp Pro Thr Phe Asn Pro Asp Leu Tyr Pro
275 280 285
Leu Ser Ala Asp Ile Glu Gln Thr Arg Val Leu Ser Ser Pro Ile Ser
290 295 300
Gly Leu Leu Gly Lys Pro Gly Ala Tyr Gly Pro Phe Val Asp Phe Leu
305 310 315 320
Gly Phe Asp Asp Thr Leu Glu Leu Thr Ser Ile Thr Tyr Trp Gln Gly
325 330 335
Asp Arg Val Asp Arg Leu Asp Gln Asn Phe Thr His Gly Arg Val Ile
340 345 350
Arg Gly Gly Ser Gly Gly Gly Gly Ser Arg His Asp Ile Pro Ser Ser
355 360 365
Arg Glu Asn Pro Ile Ala Ser Leu Trp Met Asp Tyr Asn Ser Asn Asn
370 375 380
Tyr Gln Phe Val Ser Tyr Gln Met Tyr Asn Thr Leu Ile Asp Tyr Thr
385 390 395 400
Lys Pro Gln Thr Asn Leu Leu Leu Ala Pro Pro Asn His Lys Leu His
405 410 415
Arg Leu Tyr Thr Thr Asp Asp Pro Ser Phe Gly Gly Arg Val Gly Thr
420 425 430
Ile Gly Asn Gln Phe Ile Gln Asn Thr Ile Phe Pro Glu Asn Ile Met
435 440 445
Gly Thr Phe Asp Gln Asp Leu Gly Val Arg Arg Ile Lys Gly Ile Pro
450 455 460
Phe Glu Lys Ser Pro Ser Thr Thr Ala Phe Thr Tyr Ala Lys Glu Pro
465 470 475 480
Leu Asn Gly Ala Glu Ala Val Lys Leu Gly Ile Arg Gln Thr Leu Asp
485 490 495
Leu Pro Ile Thr Asn Val Thr Thr Gly Arg Tyr Glu Val Arg Ile Arg
500 505 510
Tyr Ala Ser Thr Asp Thr Ala Thr Ile Phe Val Asn Leu Asp Val Gly
515 520 525
Gly His Gln Pro Ile Tyr Lys Thr Val Val Leu Pro Ala Thr Thr Thr
530 535 540
Gly Asp Pro Thr Gly Ile Glu Gly Ala Asn Gly Thr Tyr Thr Leu Leu
545 550 555 560
Thr Ile Gln Glu Ile Ser Ile Pro Ala Gly Asn Phe His Val Tyr Val
565 570 575
Thr Asn Asn Thr Thr Asn Gly Ser Gln Leu Leu Leu Asp Arg Ile Glu
580 585 590
Phe Val Pro Ile Leu Val Pro Val Val Phe Ile Asp Glu Asp Phe Asn
595 600 605
Gly Glu Met Lys Thr Leu Trp Lys Ser Asp Thr Glu Gln Gly Ile His
610 615 620
Ile Asn Gly Met Ile Thr Ser Asn Glu Asn Phe Ala Leu Ala Thr Asp
625 630 635 640
Val Ser Leu Pro Thr Thr Thr Asp Thr Asp Lys Gly Gly Pro Ile Asn
645 650 655
Glu Asp Tyr Gln Pro Phe His Glu Leu Tyr Thr Trp Pro Leu Ser Pro
660 665 670
Asn Leu Arg Gly His Ile Thr Ala Ala Ile Ser Leu Val Ser Ser Gln
675 680 685
Asn Lys Phe Thr Thr Glu Glu Glu Leu Ser Ala Val Thr Gln Val Val
690 695 700
Asn Ala Leu Phe Ile Thr Asp Thr Gln Leu Ala Pro Thr Val Thr Asp
705 710 715 720
Tyr Trp Ile Asp Gln Val Tyr Leu Lys Val Lys Ala Leu Ser Asp Asp
725 730 735
Leu Phe Gly Glu Glu Lys Glu Arg Leu Arg Gln Arg Val Ala Arg Ala
740 745 750
Lys Gln Ile Asn Thr Met Lys Asn Lys Leu Ile Gly Ser Ser Phe Gln
755 760 765
Thr Leu Thr Asn Trp Gln Leu Ser Ser Asp Val Ala Leu Leu Ala Asp
770 775 780
Asn Pro Leu Phe Ala Gly Thr Tyr Val Leu Leu Pro Pro Ser Thr Tyr
785 790 795 800
Pro Asp Thr Arg Pro Ser Tyr Ala Tyr Gln Lys Val Asp Glu Ser Lys
805 810 815
Leu Lys Pro Tyr Thr Arg Tyr Ile Val Arg Gly Phe Ile Gly Gln Ala
820 825 830
Gln Asp Leu Ala Leu Leu Val Ser Arg Tyr Gly Lys Glu Val Asp Thr
835 840 845
Ala Leu Thr Val Pro Tyr Gln Glu Ala Leu Pro Leu Ser Pro Asp Ser
850 855 860
Thr Ser Asn Cys Cys Gly Pro Val Ala Cys Leu Pro Cys Glu Gly His
865 870 875 880
Glu Tyr Asp Thr His Leu Phe Ser Tyr Thr Ile Asp Val Gly Ala Leu
885 890 895
Gln Ser Glu Ile Asn Leu Gly Ile Glu Ile Gly Phe Lys Ile Thr Ser
900 905 910
Pro Thr Gly Phe Ala His Ile Ser Asn Leu Glu Ile Val Glu Asp Arg
915 920 925
Pro Leu Thr Glu Ala Glu Thr Ile Lys Val Lys Gln Arg Glu Lys Lys
930 935 940
Trp Met Arg Leu Ser Gln Lys Gln Gln Ser Gln Met Gln Ala Gln Tyr
945 950 955 960
Asp Gln Thr Met Gln Tyr Phe Ala Asn Leu Tyr Thr Thr Pro Asp Gln
965 970 975
Thr Glu Leu Lys Asn Thr Val Gln Tyr Thr Asp Ile Ala Lys Val Gln
980 985 990
Val Val Thr Phe Pro Ser Pro Met Gln Trp Phe Ile Pro Gln Leu Pro
995 1000 1005
Arg Ser Ser Ser Ala Met Val Gln Glu Leu Ile Asn Ala Lys Glu
1010 1015 1020
Lys Ala Leu Gln Leu Tyr Pro Thr Asn Leu Ile Gln Asn Gly Asn
1025 1030 1035
Phe Ala Ala Asp Leu Ser His Trp Asp Val Arg Gln Asp Thr Asn
1040 1045 1050
Val Ser Ile Asp Thr Val Asp Gly Thr Ser Val Leu His Val Pro
1055 1060 1065
Ser Trp Asp Glu Thr Val Ser Gln Thr Ile Thr Leu Pro Pro His
1070 1075 1080
Gln Glu Asn Ile Leu Tyr Gln Leu Arg Val Thr Ala Lys Gly Asn
1085 1090 1095
Gly Ser Val Ile Leu Gln His Asn Gly Glu Gln Glu Arg Leu Tyr
1100 1105 1110
Phe Asn Gln Asn Asn Pro Asn Gly Asn Thr Phe Val Thr Lys Thr
1115 1120 1125
Ile Ser Phe Tyr Pro Thr Ala Ser Asn Leu Ser Ile Gln Ile Gln
1130 1135 1140
Ser Glu Gly Thr Asp Phe Tyr Val Lys Thr Ile Glu Val Phe Val
1145 1150 1155
Gln Pro Val Pro Leu Thr
1160
<210> 38
<211> 596
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 38
Met Ser Glu Tyr Glu Leu Met Asp Val Ser Pro Asn Pro Tyr Asn Val
1 5 10 15
Leu Met Gln Arg Pro Asp Glu Ala Gly Gly Ile Asp Trp Asp Ala Glu
20 25 30
Ile Ser Lys Met Ile Lys Thr Tyr Tyr Gln Lys Gly Thr Phe Ala Ala
35 40 45
Asp Phe Ala Thr Ile Ile Leu Pro Leu Ile Leu Ala His Asn Val Gln
50 55 60
Trp Asn Val Val Leu Lys Ser Val Leu Ser Phe Ala Ser Ala Leu Pro
65 70 75 80
Gly Ile Gly Thr Ala Val Ser Ile Leu Ser Pro Phe Leu Gln Leu Leu
85 90 95
Phe Pro Thr Asp Pro Ala Ala His Asp Lys Gln Leu Met Lys Leu Ile
100 105 110
Leu Asp Gln Thr Lys Ile Leu Ile Asp Gln Ala Val Ser Gln Glu Val
115 120 125
Met Asn Arg Ile Ser Gln Gln Ile Thr Gly Leu Tyr Ala Asn Leu Ala
130 135 140
Arg Phe Asn Arg Thr Ile Ala Ala Tyr Glu Thr Leu Ala Pro Ser Thr
145 150 155 160
Ile Ile Ala Glu Ile Glu Ala Ile Glu Ala Val Phe Asp Asn Gln Val
165 170 175
Pro Gln Leu Val Asp Pro Gly Tyr Leu Ala Leu Thr Leu Pro Leu Tyr
180 185 190
Val Gln Gly Val Asn Leu Asn Leu Met Phe Tyr Lys Ser Val Leu Asp
195 200 205
His Ala Glu Gln Leu Lys Ile Pro Ala Gly Glu Gln Asn Phe Tyr Lys
210 215 220
Lys Ser Leu Ile Asp Lys Ile Lys Thr Ala Ser Ala Gln Val Tyr Thr
225 230 235 240
Tyr Phe Lys Gln Val Pro Trp Arg Pro Asn Glu Ile Thr Pro Ser Ser
245 250 255
Ala Ser Asn Gln Asp Ile Val Thr Arg Gln Thr Met Tyr Thr His Cys
260 265 270
Leu Asp Tyr Val Ala Met Trp Pro Thr Phe Asn Pro Asp Leu Tyr Pro
275 280 285
Leu Ser Ala Asp Ile Glu Gln Thr Arg Val Leu Ser Ser Pro Ile Ser
290 295 300
Gly Leu Leu Gly Lys Pro Gly Ala Tyr Gly Pro Phe Val Asp Phe Leu
305 310 315 320
Gly Phe Asp Asp Thr Leu Glu Leu Thr Ser Ile Thr Tyr Trp Gln Gly
325 330 335
Asp Arg Val Asp Arg Leu Asp Gln Asn Phe Thr His Gly Arg Val Ile
340 345 350
Arg Gly Gly Ser Gly Gly Gly Gly Ser Arg His Asp Ile Pro Ser Ser
355 360 365
Arg Glu Asn Pro Ile Ala Ser Leu Trp Met Asp Tyr Asn Ser Asn Asn
370 375 380
Tyr Gln Phe Val Ser Tyr Gln Met Tyr Asn Thr Leu Ile Asp Tyr Thr
385 390 395 400
Lys Pro Gln Thr Asn Leu Leu Leu Ala Pro Pro Asn His Lys Leu His
405 410 415
Arg Leu Tyr Thr Thr Asp Asp Pro Ser Phe Gly Gly Arg Val Gly Thr
420 425 430
Ile Gly Asn Gln Phe Ile Gln Asn Thr Ile Phe Pro Glu Asn Ile Met
435 440 445
Gly Thr Phe Asp Gln Asp Leu Gly Val Arg Arg Ile Lys Gly Ile Pro
450 455 460
Phe Glu Lys Ser Pro Ser Thr Thr Ala Phe Thr Tyr Ala Lys Glu Pro
465 470 475 480
Leu Asn Gly Ala Glu Ala Val Lys Leu Gly Ile Arg Gln Thr Leu Asp
485 490 495
Leu Pro Ile Thr Asn Val Thr Thr Gly Arg Tyr Glu Val Arg Ile Arg
500 505 510
Tyr Ala Ser Thr Asp Thr Ala Thr Ile Phe Val Asn Leu Asp Val Gly
515 520 525
Gly His Gln Pro Ile Tyr Lys Thr Val Val Leu Pro Ala Thr Thr Thr
530 535 540
Gly Asp Pro Thr Gly Ile Glu Gly Ala Asn Gly Thr Tyr Thr Leu Leu
545 550 555 560
Thr Ile Gln Glu Ile Ser Ile Pro Ala Gly Asn Phe His Val Tyr Val
565 570 575
Thr Asn Asn Thr Thr Asn Gly Ser Gln Leu Leu Leu Asp Arg Ile Glu
580 585 590
Phe Val Pro Ile
595
<210> 39
<211> 456
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 39
Met Thr Gln Arg Leu Pro Gln Phe Glu Ile Asp Gly Tyr Glu Glu Val
1 5 10 15
Ser Leu Pro Leu Phe Ala Glu Ile Cys Thr Leu His Leu Thr Leu Leu
20 25 30
Lys Asp Gly Val Leu Met Gly Pro Arg Trp Gly Leu Thr Thr Asp Asp
35 40 45
Val Lys Tyr Tyr Arg Asp Glu Phe Tyr Arg Leu Thr Ser Asn Tyr Asn
50 55 60
Ser Arg Ala Val Glu Leu Tyr Asn Arg Gly Phe Ser Asn Ala Ser Asn
65 70 75 80
Ser Leu Asp Phe Lys Lys Val Val Val Tyr Lys Thr Thr Met Asn Glu
85 90 95
Tyr Ala Leu Asp Leu Val Tyr Leu Trp Ser Leu Met Arg Tyr Glu Gly
100 105 110
Ile Thr Pro Ser Val Ser Arg Ser Leu Trp Asn Phe Val Gly Asn Arg
115 120 125
Thr Tyr Ile Pro Ile Ser Lys Ser Asp Trp Asn Ala Gln Tyr Lys Leu
130 135 140
Met Asn Gly Val Val Asn Ser Leu Leu Lys Ser Val Thr Phe Arg Ser
145 150 155 160
Ser His Ile Lys Phe Asn Gly Val Trp Pro Lys Tyr Arg Leu Gln Glu
165 170 175
Asn Ile Thr Gly Trp Met Gly Ala Thr Gln Leu Asp Thr Asp Tyr Ile
180 185 190
Tyr Gln Ala Pro Gln Ser Val Pro Lys Asp Ala Val Ile Ala Pro Gly
195 200 205
Gly Gly Val Lys Glu Lys Trp His Ile Lys Ile Gly Asp Thr Val Val
210 215 220
Ile Pro Gln Pro Trp Tyr Leu Pro Ile Lys Pro Ile Ala Tyr Asp Gly
225 230 235 240
Tyr Tyr Ile Arg Thr Ile Ser Ala Tyr Pro Thr Phe Ile Phe Pro Pro
245 250 255
Asn Leu Asp Phe Ser Leu Gly Ser Lys Leu Glu Leu Ser Val Pro Asn
260 265 270
His Thr Met Ala His Gly Gly Asn Ile Ile Leu Gly Phe Ala Pro Asp
275 280 285
Asn Thr Lys Glu Phe Phe Thr Thr Gly Gln His Thr Phe Pro Gln Lys
290 295 300
Gly Ser Tyr Thr Ile Pro Pro Leu Gln Tyr Thr Thr Ile Asn Asn Pro
305 310 315 320
Ser Gln Ala Phe Leu Asn Glu Thr Leu Asp Gln Gly Thr Asp Gly Val
325 330 335
Leu Ser Leu Thr Gly Ala Ala Asn Thr Asn Val Ile Gln Tyr Asn Ile
340 345 350
Asn Met Leu Asn Val Asp Gln Asn Lys Lys Tyr Val Leu Phe Leu Arg
355 360 365
Ile Gly Gly Pro Gly Asn Ile Asn Ala Ile Ile Lys Asn Ala Gly Gln
370 375 380
Gln Ser Asp Val Pro Ser Lys Arg Leu Gly Val Phe Asn Asn Pro Asn
385 390 395 400
Leu Tyr Gly Trp Lys Asp Phe Val Ser Thr Gly Phe Thr Phe Lys Leu
405 410 415
Asp Asp Met Gly Leu Pro Ile Pro Pro Val Gly Leu Val Leu Arg Lys
420 425 430
Thr Asn Asp Ala Gly Met Arg Ile Leu Gln Val Met Ile Ile Pro Glu
435 440 445
Ser Asp Phe Lys Ile Leu Ile Pro
450 455
<210> 40
<211> 505
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 40
Val Lys His Met Asn Ser Glu Gln Arg Lys His Gly Gln Asn Asn Glu
1 5 10 15
Tyr Lys His Gln Asn His Gly Val Ser Cys Asn Cys Gly Cys Gln Gln
20 25 30
Gly Lys Tyr Glu Tyr Glu Gln Lys Gln Asp Arg Glu Glu Tyr Asn Asn
35 40 45
Ser Tyr Met Ser Asn Glu Gln Thr Gln Asn His Glu Gly Met Gly Tyr
50 55 60
Leu Val Ala Lys Glu Gly Thr Arg Asn Asp Met Tyr Asn Ser Val Lys
65 70 75 80
Arg Glu Phe Arg Glu His Asp Met Tyr His Glu Asn Lys Asn Tyr Tyr
85 90 95
Ser Cys Ser Pro Arg Gln Phe Asn Thr Leu Asn Leu Pro Asp Glu Ser
100 105 110
Lys Arg Phe Gln Thr Ile Thr His Val Gln Asn Thr Asn Ser Asn Pro
115 120 125
Ser Leu Asn Ala Thr Ser Thr Thr Arg Gly Gln Asn Ile Asp Gly Ser
130 135 140
Asn Asn Phe Cys Arg Ser Ile Ser Leu Asp Phe Gln Leu Ile Asn Gln
145 150 155 160
Asp Leu Asn Thr Thr Gln Asp Thr Phe Tyr Tyr Leu Phe Tyr Leu Leu
165 170 175
Asp Ser Gly Asp Phe Ile Ile Ala Asn Tyr Gly Thr Gly Arg Val Leu
180 185 190
Glu Asn Arg Thr Val Glu Pro Asp Glu Arg Ala Ile Ile Ser Ser Leu
195 200 205
Tyr Thr Gly Ser Val Ser Gln Phe Phe Arg Lys Arg Ser Ser Val Asn
210 215 220
Asn Gln Phe Ile Leu Ser Pro Gln Gln Glu Leu Asn Arg Ala Val Asn
225 230 235 240
Val Cys Asn Asn Thr Ile Asn Leu Ala Thr Lys Ile Thr Ser Gly Phe
245 250 255
Asn Ile Pro Asp Asn Thr Ser Asn Val Phe Arg His Ile Val Ala Ser
260 265 270
Asn Arg Pro Ile Thr Ile Pro Ser Phe Ser Asn Glu Ser Thr Leu Gly
275 280 285
Pro Ala Pro Val Leu Thr Ser Leu Ser Asp Tyr Gly Pro Ser Pro Ala
290 295 300
Gln Ala Glu Arg Ala Val Ile Gly Ser Ala Leu Ile Pro Cys Ile Phe
305 310 315 320
Val Asn Asp Val Leu Pro Leu Glu Arg Arg Ile Lys Glu Ser Pro Tyr
325 330 335
Tyr Val Leu Glu Tyr Arg Gln Tyr Trp His Arg Leu Trp Thr Asp Glu
340 345 350
Ile Pro Ser Gly Asp Arg Arg Ser Phe Gly Glu Ile Thr Gly Ile Leu
355 360 365
Pro Asn Ala Gln Ala Ser Met Arg Asp Met Ile Asp Met Ser Ile Gly
370 375 380
Ala Asp Trp Gly Leu Arg Phe Gly Asp Ser Ser Thr Pro Phe Lys Arg
385 390 395 400
Gly Ile Leu Asn Ser Leu Asn Thr Gln Gly Ser Tyr Ala Asp Val Asp
405 410 415
Leu Gly Thr Gln Thr Gly Ser Asn Gln Leu Thr Asn Phe Asn Ser Phe
420 425 430
Ser Val Arg Tyr Ala Arg Phe Val Lys Ala His Glu Tyr Arg Leu Thr
435 440 445
Arg Ser Asn Gly Thr Val Val Thr Thr Pro Trp Val Ala Leu Asp Tyr
450 455 460
Arg Val Pro Gln Thr Ala Arg Phe Pro Leu Asn Ala Gln Leu Ser Gln
465 470 475 480
Asn Tyr Lys Ile Ile Ser Ser Tyr Asn Ser Tyr Asp Leu Pro Val Leu
485 490 495
Glu His Thr Asp Asn Lys Lys Lys Trp
500 505
<210> 41
<211> 720
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 41
Leu Leu Ile Glu Arg Gly Glu Ile Phe Met Asn Gln Asn Asn Asn Glu
1 5 10 15
Tyr Glu Ile Ala Asp Val Asn Pro Pro Ser Tyr Pro Ser Asn Arg Ile
20 25 30
Asn Asn Tyr Ser Arg Tyr Pro Phe Ala Asn Asp Pro Asn Gln Leu Leu
35 40 45
Gln Gln Thr Asn Tyr Lys Asp Trp Leu Asn Ile Cys Gln Gly Asn Asn
50 55 60
Gln Asn Ser Gly Asn Leu Ile Thr Asp Ala Gly Ala Ala Val Ser Ala
65 70 75 80
Gly Ile Ile Val Thr Gly Thr Met Ile Ala Ala Phe Ala Ala Leu Ala
85 90 95
Val Ala Pro Phe Pro Ile Val Gly Ala Ile Val Gly Gly Ile Val Ile
100 105 110
Ala Phe Gly Thr Leu Leu Pro Leu Val Trp Pro Gly Gly Lys Glu Asp
115 120 125
Arg Thr Val Trp Thr Gln Phe Phe Ala Leu Gly Glu Thr Leu Leu Gly
130 135 140
Lys Arg Leu Thr Asp Asp Ala Gln Lys Thr Ala Ala Glu Thr Val Asp
145 150 155 160
Gly Phe Gly Arg Val Leu Asp Asn Tyr Lys Val Ala Leu Asn Ser Trp
165 170 175
Met Asp Leu Lys Lys Lys Gln Ser Pro Gly Ser Pro Pro Thr Thr Glu
180 185 190
Leu Lys Glu Ala Ala Asp Asn Val Lys Gln Arg Phe Glu Ile Val His
195 200 205
Asn Glu Phe Asp Ala Asn Met Pro His Leu Gly Asn Pro Lys Ser Asn
210 215 220
Tyr Lys Glu Val Leu Leu Ser Ser Tyr Ala His Ala Ala Asn Leu His
225 230 235 240
Leu Asn Leu Leu Gln Gln Gly Val Arg Phe Ala Asp Gln Trp Asn Gln
245 250 255
Asp Ile Tyr Ser Ser Gln Ile Val Pro Ala Ala Gly Thr Ser Thr Glu
260 265 270
Tyr Leu Lys Phe Leu Gln Ala Arg Ile Gln Glu Tyr Val Asn Tyr Cys
275 280 285
Thr Ala Thr Tyr Arg Ser Gly Leu Asn Ile Leu Lys Asn Ser Asn Asp
290 295 300
Ile Thr Trp Asp Ile Tyr Asn Thr Tyr Arg Arg Asp Met Thr Leu Thr
305 310 315 320
Val Leu Asp Leu Val Ala Ala Phe Pro Asn Tyr Asp Pro Thr Tyr Tyr
325 330 335
Pro Ile Asp Thr Lys Ile Gln Leu Thr Arg Thr Ile Tyr Ser Asn Leu
340 345 350
Leu Gly Ile Thr Gln Ser Gly Arg Gln Tyr Phe Glu Ala Leu Glu Asn
355 360 365
Ala Leu Thr Met Arg Pro Asn Leu Tyr Arg Ile Leu Arg Gly Phe Asn
370 375 380
Phe Asn Thr Thr Phe Gly Ser Gly Val Asn Tyr Leu Ser Gly Ile Ala
385 390 395 400
Asn Arg Arg Gly Leu Ile Lys Thr Val Pro Ser Glu Glu Asp Glu Gln
405 410 415
Pro Phe Tyr Gly Gln Ser Asn Gly Arg His Asp Pro Met Ile Phe Ala
420 425 430
Asn Gly Leu Asn Ile Phe Arg Val Thr Leu Leu Arg Asn Lys His Tyr
435 440 445
Ile Ala Leu Pro Val Gly Pro Pro Leu Phe Ala Ala Asn Gln Ile Thr
450 455 460
Asp Leu Lys Leu Tyr Tyr Gly Asn Ala Thr Gln Tyr His His Tyr Gln
465 470 475 480
Pro Ser Asn Glu Gly Leu Thr Thr Glu Ser Thr Asp Leu Ser Phe Pro
485 490 495
Pro Lys Asn Glu Glu Tyr Leu Asn Ala Ile Leu Met Thr Ser Pro Arg
500 505 510
Thr Ile Tyr Glu Asn Pro Thr Asn Ile Tyr Ser Phe Ala Trp Thr Lys
515 520 525
Lys Asp Ile Asp Gln Gln Asn Asn Ile Ile Ile Asn Ala Ile Thr Gln
530 535 540
Ile Pro Ala Val Lys Gly Ile Ala Leu Gly Asn Gln Ser Arg Val Ile
545 550 555 560
Gln Gly Pro Gly His Thr Ser Gly Asp Leu Val Tyr Leu Lys Asp Ser
565 570 575
Leu Glu Leu Arg Cys Gln Tyr Thr Gly Pro Gln Gln Ser Tyr Asp Val
580 585 590
Arg Ile Arg Tyr Ala Ser Asn Gly Ile Leu Asn Asp Arg Ala Met Ile
595 600 605
Ala Ile Thr Ile Pro Gly Val Thr Gly Gln Ser Ile Ser Leu Ser Glu
610 615 620
Thr Phe Ser Gly Thr Asp Tyr Asn Val Leu Glu Phe Gln Asn Phe Lys
625 630 635 640
Ser Val Gln Phe Thr Ser Ala Ile Arg Leu Asn Pro Ser Gln Asn Ile
645 650 655
Phe Ile Tyr Leu Asn Arg Leu Asp Gln Asn Ala Asn Thr Thr Leu Leu
660 665 670
Ile Asp Lys Ile Glu Phe Ile Pro His Pro Leu Pro Arg Ile Leu Ser
675 680 685
Glu Gln Lys Leu Lys Lys Val Lys Gln Lys Val Asn Asp Leu Phe Ile
690 695 700
Asp Ala Glu Asn Gly Cys Phe Cys Pro Ser His Glu Lys Asp Leu Arg
705 710 715 720
<210> 42
<211> 681
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 42
Leu Leu Ile Glu Arg Gly Glu Ile Phe Met Asn Gln Asn Asn Asn Glu
1 5 10 15
Tyr Glu Ile Ala Asp Val Asn Pro Pro Ser Tyr Pro Ser Asn Arg Ile
20 25 30
Asn Asn Tyr Ser Arg Tyr Pro Phe Ala Asn Asp Pro Asn Gln Leu Leu
35 40 45
Gln Gln Thr Asn Tyr Lys Asp Trp Leu Asn Ile Cys Gln Gly Asn Asn
50 55 60
Gln Asn Ser Gly Asn Leu Ile Thr Asp Ala Gly Ala Ala Val Ser Ala
65 70 75 80
Gly Ile Ile Val Thr Gly Thr Met Ile Ala Ala Phe Ala Ala Leu Ala
85 90 95
Val Ala Pro Phe Pro Ile Val Gly Ala Ile Val Gly Gly Ile Val Ile
100 105 110
Ala Phe Gly Thr Leu Leu Pro Leu Val Trp Pro Gly Gly Lys Glu Asp
115 120 125
Arg Thr Val Trp Thr Gln Phe Phe Ala Leu Gly Glu Thr Leu Leu Gly
130 135 140
Lys Arg Leu Thr Asp Asp Ala Gln Lys Thr Ala Ala Glu Thr Val Asp
145 150 155 160
Gly Phe Gly Arg Val Leu Asp Asn Tyr Lys Val Ala Leu Asn Ser Trp
165 170 175
Met Asp Leu Lys Lys Lys Gln Ser Pro Gly Ser Pro Pro Thr Thr Glu
180 185 190
Leu Lys Glu Ala Ala Asp Asn Val Lys Gln Arg Phe Glu Ile Val His
195 200 205
Asn Glu Phe Asp Ala Asn Met Pro His Leu Gly Asn Pro Lys Ser Asn
210 215 220
Tyr Lys Glu Val Leu Leu Ser Ser Tyr Ala His Ala Ala Asn Leu His
225 230 235 240
Leu Asn Leu Leu Gln Gln Gly Val Arg Phe Ala Asp Gln Trp Asn Gln
245 250 255
Asp Ile Tyr Ser Ser Gln Ile Val Pro Ala Ala Gly Thr Ser Thr Glu
260 265 270
Tyr Leu Lys Phe Leu Gln Ala Arg Ile Gln Glu Tyr Val Asn Tyr Cys
275 280 285
Thr Ala Thr Tyr Arg Ser Gly Leu Asn Ile Leu Lys Asn Ser Asn Asp
290 295 300
Ile Thr Trp Asp Ile Tyr Asn Thr Tyr Arg Arg Asp Met Thr Leu Thr
305 310 315 320
Val Leu Asp Leu Val Ala Ala Phe Pro Asn Tyr Asp Pro Thr Tyr Tyr
325 330 335
Pro Ile Asp Thr Lys Ile Gln Leu Thr Arg Thr Ile Tyr Ser Asn Leu
340 345 350
Leu Gly Ile Thr Gln Ser Gly Arg Gln Tyr Phe Glu Ala Leu Glu Asn
355 360 365
Ala Leu Thr Met Arg Pro Asn Leu Tyr Arg Ile Leu Arg Gly Phe Asn
370 375 380
Phe Asn Thr Thr Phe Gly Ser Gly Val Asn Tyr Leu Ser Gly Ile Ala
385 390 395 400
Asn Arg Arg Gly Leu Ile Lys Thr Val Pro Ser Glu Glu Asp Glu Gln
405 410 415
Pro Phe Tyr Gly Gln Ser Asn Gly Arg His Asp Pro Met Ile Phe Ala
420 425 430
Asn Gly Leu Asn Ile Phe Arg Val Thr Leu Leu Arg Asn Lys His Tyr
435 440 445
Ile Ala Leu Pro Val Gly Pro Pro Leu Phe Ala Ala Asn Gln Ile Thr
450 455 460
Asp Leu Lys Leu Tyr Tyr Gly Asn Ala Thr Gln Tyr His His Tyr Gln
465 470 475 480
Pro Ser Asn Glu Gly Leu Thr Thr Glu Ser Thr Asp Leu Ser Phe Pro
485 490 495
Pro Lys Asn Glu Glu Tyr Leu Asn Ala Ile Leu Met Thr Ser Pro Arg
500 505 510
Thr Ile Tyr Glu Asn Pro Thr Asn Ile Tyr Ser Phe Ala Trp Thr Lys
515 520 525
Lys Asp Ile Asp Gln Gln Asn Asn Ile Ile Ile Asn Ala Ile Thr Gln
530 535 540
Ile Pro Ala Val Lys Gly Ile Ala Leu Gly Asn Gln Ser Arg Val Ile
545 550 555 560
Gln Gly Pro Gly His Thr Ser Gly Asp Leu Val Tyr Leu Lys Asp Ser
565 570 575
Leu Glu Leu Arg Cys Gln Tyr Thr Gly Pro Gln Gln Ser Tyr Asp Val
580 585 590
Arg Ile Arg Tyr Ala Ser Asn Gly Ile Leu Asn Asp Arg Ala Met Ile
595 600 605
Ala Ile Thr Ile Pro Gly Val Thr Gly Gln Ser Ile Ser Leu Ser Glu
610 615 620
Thr Phe Ser Gly Thr Asp Tyr Asn Val Leu Glu Phe Gln Asn Phe Lys
625 630 635 640
Ser Val Gln Phe Thr Ser Ala Ile Arg Leu Asn Pro Ser Gln Asn Ile
645 650 655
Phe Ile Tyr Leu Asn Arg Leu Asp Gln Asn Ala Asn Thr Thr Leu Leu
660 665 670
Ile Asp Lys Ile Glu Phe Ile Pro His
675 680
<210> 43
<211> 1229
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 43
Met Asn Gln Asn Asn Gln Lys Glu Ile Gln Ile Ile Gly Ser Ser Ser
1 5 10 15
Asn Asp Val Ser Gln Ser Asn Gly Tyr Pro Arg Tyr Pro Leu Ala Lys
20 25 30
Glu Ser Asn Tyr Lys Asn Trp Leu Thr Ser Cys Asp Glu Ser Asn Leu
35 40 45
Asp Arg Phe Ser Thr Pro Ser Ser Val Gln Asp Ala Ile Val Thr Ser
50 55 60
Leu Ser Val Thr Ser Tyr Ile Ile Ser Phe Leu Glu Gly Pro Ile Gly
65 70 75 80
Ala Gly Leu Gly Ile Leu Ser Val Leu Phe Gly Gln Phe Trp Pro Phe
85 90 95
Asn Thr Asn Thr Val Trp Asp Asn Leu Leu Arg Val Val Glu Glu Leu
100 105 110
Ile Asn Gln Arg Ile Asn Glu Val Glu Arg Glu Arg Ile Ile Arg Gln
115 120 125
Phe Asp Gly Ile Arg Ser Val Leu Ser Asn Tyr Asn Thr Ala Phe Arg
130 135 140
Asn Trp Asn Glu Asn Glu Thr Thr Arg Asn Asn Pro Arg Leu Gln Glu
145 150 155 160
Glu Leu Arg His Arg Phe Asn Asn Thr Asp Asp Ile Ile Ala Asp Arg
165 170 175
Met Pro Glu Phe Arg Ile Lys Gly Phe Glu Thr Gln Ser Leu Ala Val
180 185 190
Tyr Ala Lys Ala Ala Thr Leu His Leu Leu Leu Leu Arg Asp Ala Val
195 200 205
Val Tyr Gly Arg Ala Trp Gly Phe Asp Ser Gln Thr Ile Glu Ser Leu
210 215 220
Tyr Thr Lys Leu Val Cys Leu Ile Asn Ala Tyr Ala Asp His Cys Ile
225 230 235 240
Leu Val Tyr Ser Gln Gly Leu Gln Glu Leu Arg Asn Arg Gly Asn Trp
245 250 255
Arg Asn Phe Asn Asn Tyr Arg Arg Asp Met Thr Ile Thr Val Leu Asp
260 265 270
Ile Ile Ser Leu Phe Ser Asn Tyr Asp Pro Arg Ile Tyr Phe Tyr Asn
275 280 285
Thr Asn Thr Gln Leu Thr Arg Glu Val Tyr Thr Glu Pro Ile Ala Ser
290 295 300
Gly Asn Trp Leu Asn Ser Tyr Ser Asn Pro Asp Gln Phe Gln Gln Ile
305 310 315 320
Glu Asn Asp Leu Asn Pro Pro Pro Ser Leu Phe Ser Thr Leu Ser Thr
325 330 335
Leu Phe Ala Arg Ile Gly Phe Phe Tyr Tyr Asn Asp Ile Tyr Thr Pro
340 345 350
Arg Asp Ala Ile Leu Asn Thr Ser Met Arg Leu Thr Arg Thr Asp Gly
355 360 365
Thr Thr Ile Ile Thr Thr Pro Trp Gln Gly Ala Leu Ser Pro Glu Ile
370 375 380
Ser Gln Glu Arg Gln Leu Ile Phe Ser Gly Tyr Lys Val Tyr Lys Val
385 390 395 400
Asp Ser Ile Leu Ser Asn Thr Ala Val Gln Phe Thr Gly Val Gln Arg
405 410 415
Ala Asp Phe His Met Val Asn Glu Ala Gly Thr Gly Val Thr Ser Arg
420 425 430
Ser Ile Asp Leu Pro Leu Thr Thr Tyr Tyr Phe Ser Lys Ala Ser Asn
435 440 445
Ile Pro Gly Thr Arg Ser Glu Thr Pro Thr Ser Leu Asp Tyr Thr His
450 455 460
Ile Leu Ser Ser Val Arg Ser Thr Ser Ile Gly Thr Thr Tyr Arg Asn
465 470 475 480
Arg Ser Asn Ile Ile Ala Tyr Gly Trp Thr His Thr Ser Ala Glu Arg
485 490 495
Thr Asn Arg Ile Leu Pro Asn Arg Ile Thr Gln Ile Pro Ala Val Lys
500 505 510
Ala Phe Ala Leu Glu Ser Gly Ala Ser Val Arg Pro Gly Pro Gly His
515 520 525
Thr Gly Gly Asp Val Val Ser Leu Ala Leu Ser Gly Arg Leu Lys Ile
530 535 540
Arg Leu Thr Pro Ala Ser Thr Asn Thr Asn Tyr Arg Val Arg Ile Arg
545 550 555 560
Tyr Ala Thr Ser Tyr Gly Ala Ser Leu Met Val Gln Arg Trp Ser Pro
565 570 575
Ser Gly Ser Glu Ser Gly Tyr Phe Ser Ser Ser His Thr Gly Ala Tyr
580 585 590
Pro Lys Phe Gly Tyr Met Asp Thr Leu Val Thr Asn Phe Asn Gln Thr
595 600 605
Gly Val Glu Ile Ile Ile Glu Asn Arg His Tyr Ser Asn Ile Ile Ile
610 615 620
Asp Arg Ile Glu Leu Ile Pro Val Asn Ser Thr Ala Leu Glu Tyr Glu
625 630 635 640
Gly Lys Gln His Leu Glu Lys Ala Lys Lys Ala Val Gly Asn Leu Phe
645 650 655
Asn Asn Asn Gly Lys Glu Ala Leu Lys Ile Asp Thr Thr Asp Tyr Asp
660 665 670
Val Asp Gln Ala Val Asn Leu Val Glu Cys Val Pro Glu Glu Leu Tyr
675 680 685
Thr Lys Glu Lys Met Ile Leu Leu Asp Glu Val Lys His Ala Lys Gln
690 695 700
Leu Ser Ala Ser Arg Asn Leu Ile Gln Asn Gly Asn Phe Glu Phe Tyr
705 710 715 720
Thr Asp Glu Trp Thr Thr Ser Asn Asn Val Ser Ile Gln Ala Asp Asn
725 730 735
Pro Ile Phe Lys Gly Asn Tyr Leu Lys Met Pro Gly Ala Arg Glu Thr
740 745 750
Glu Gly Gly Thr Thr Arg Phe Pro Thr Tyr Val Leu Gln Lys Ile Asp
755 760 765
Glu Ser Lys Leu Lys Pro Tyr Thr Arg Tyr Lys Val Arg Gly Phe Val
770 775 780
Gly Gly Ser His Asp Val Lys Leu Ile Val Glu Arg Tyr Gly Asn Glu
785 790 795 800
Val Asp Ala Ile Leu Asn Val Arg Asn Asp Leu Ala Leu Asp Thr Ile
805 810 815
Ser Pro Ser Cys Val Glu Val Asn Gln Cys Gln Ser Gln Met Tyr Pro
820 825 830
Leu Met His Asp Gly Tyr Leu Ala Asn Val Ile Asn Thr Asn Ser Tyr
835 840 845
Glu Glu Ser Gln Leu Asp Arg Ala Asn Phe Lys Lys Glu Gln Gly Met
850 855 860
Cys His Gln Ser His Gln Phe Asp Phe His Ile Asp Thr Gly Glu Val
865 870 875 880
His Ile Asn Lys Asn Pro Gly Ile Trp Val Leu Phe Lys Ile Ser Ser
885 890 895
Pro Glu Gly His Ala Thr Leu Asp Asn Ile Glu Leu Ile Glu Glu Gly
900 905 910
Pro Leu Val Gly Glu Ser Leu Ala Leu Val Lys Lys Arg Glu Lys Lys
915 920 925
Trp Lys Asn Lys Met Glu Thr Arg Trp Phe Gln Thr Lys Glu Val Tyr
930 935 940
Glu Lys Ala Lys Gly Ala Ile Asp Ala Leu Phe Thr Asp Ala Gln Asp
945 950 955 960
Gln Ala Leu Lys Phe Asp Ile Asn Ile Ser His Ile Ile Ser Ala Glu
965 970 975
His Phe Val Gln Ser Met Pro Tyr Val Tyr Asn Arg Trp Ile Ser Asp
980 985 990
Val Pro Gly Met Asn Tyr Asp Ile Tyr Thr Glu Leu Asp Leu Arg Ile
995 1000 1005
Thr Gln Ala Tyr Ser Leu Tyr Glu His Arg Asn Ile Ile Lys Asn
1010 1015 1020
Gly Asp Phe Asn His Gly Leu Asn His Trp His Ala Thr Pro His
1025 1030 1035
Ala Lys Val Gln Arg Ile Asp Asp Thr Ala Val Leu Val Ile Pro
1040 1045 1050
Asn Trp Ser Ser Ser Val Ser Gln Asn Leu Cys Val Glu Tyr Asn
1055 1060 1065
Arg Gly Tyr Val Leu Arg Val Thr Ala Lys Lys Glu Asp Ile Gly
1070 1075 1080
Lys Gly Tyr Val Thr Ile Ser Asp Cys Asn Gly Asn Gln Glu Thr
1085 1090 1095
Leu Thr Phe Thr Ser Cys Asp Asn Tyr Val Ser Asn Glu Ile Thr
1100 1105 1110
Asn Asp Gln Ser Glu Tyr Pro Phe Ser Gln Glu Met Asn Glu Gln
1115 1120 1125
Arg Ser Tyr Asn Pro Asn Glu Ala Ile Asn Gly Gln Leu Gly Tyr
1130 1135 1140
Ser Leu Gly Gln Val Arg Asn Glu Gln Ser Cys Tyr Thr Arg Asn
1145 1150 1155
Ala Ile Thr Asn Asp Gln Ser Glu Tyr His Phe Ser Gln Glu Met
1160 1165 1170
Asn Glu Gln Arg Ser Tyr Asn Pro Asn Glu Thr Ile Asn Glu Gln
1175 1180 1185
Arg Asn Tyr Val Thr Arg Thr Ile Asp Phe Phe Pro Asp Thr Asp
1190 1195 1200
Lys Ile Arg Ile Asp Ile Gly Glu Thr Glu Gly Thr Phe Asn Ile
1205 1210 1215
Glu Ser Val Glu Leu Ile Cys Met Lys Ser Gln
1220 1225
<210> 44
<211> 632
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 44
Met Asn Gln Asn Asn Gln Lys Glu Ile Gln Ile Ile Gly Ser Ser Ser
1 5 10 15
Asn Asp Val Ser Gln Ser Asn Gly Tyr Pro Arg Tyr Pro Leu Ala Lys
20 25 30
Glu Ser Asn Tyr Lys Asn Trp Leu Thr Ser Cys Asp Glu Ser Asn Leu
35 40 45
Asp Arg Phe Ser Thr Pro Ser Ser Val Gln Asp Ala Ile Val Thr Ser
50 55 60
Leu Ser Val Thr Ser Tyr Ile Ile Ser Phe Leu Glu Gly Pro Ile Gly
65 70 75 80
Ala Gly Leu Gly Ile Leu Ser Val Leu Phe Gly Gln Phe Trp Pro Phe
85 90 95
Asn Thr Asn Thr Val Trp Asp Asn Leu Leu Arg Val Val Glu Glu Leu
100 105 110
Ile Asn Gln Arg Ile Asn Glu Val Glu Arg Glu Arg Ile Ile Arg Gln
115 120 125
Phe Asp Gly Ile Arg Ser Val Leu Ser Asn Tyr Asn Thr Ala Phe Arg
130 135 140
Asn Trp Asn Glu Asn Glu Thr Thr Arg Asn Asn Pro Arg Leu Gln Glu
145 150 155 160
Glu Leu Arg His Arg Phe Asn Asn Thr Asp Asp Ile Ile Ala Asp Arg
165 170 175
Met Pro Glu Phe Arg Ile Lys Gly Phe Glu Thr Gln Ser Leu Ala Val
180 185 190
Tyr Ala Lys Ala Ala Thr Leu His Leu Leu Leu Leu Arg Asp Ala Val
195 200 205
Val Tyr Gly Arg Ala Trp Gly Phe Asp Ser Gln Thr Ile Glu Ser Leu
210 215 220
Tyr Thr Lys Leu Val Cys Leu Ile Asn Ala Tyr Ala Asp His Cys Ile
225 230 235 240
Leu Val Tyr Ser Gln Gly Leu Gln Glu Leu Arg Asn Arg Gly Asn Trp
245 250 255
Arg Asn Phe Asn Asn Tyr Arg Arg Asp Met Thr Ile Thr Val Leu Asp
260 265 270
Ile Ile Ser Leu Phe Ser Asn Tyr Asp Pro Arg Ile Tyr Phe Tyr Asn
275 280 285
Thr Asn Thr Gln Leu Thr Arg Glu Val Tyr Thr Glu Pro Ile Ala Ser
290 295 300
Gly Asn Trp Leu Asn Ser Tyr Ser Asn Pro Asp Gln Phe Gln Gln Ile
305 310 315 320
Glu Asn Asp Leu Asn Pro Pro Pro Ser Leu Phe Ser Thr Leu Ser Thr
325 330 335
Leu Phe Ala Arg Ile Gly Phe Phe Tyr Tyr Asn Asp Ile Tyr Thr Pro
340 345 350
Arg Asp Ala Ile Leu Asn Thr Ser Met Arg Leu Thr Arg Thr Asp Gly
355 360 365
Thr Thr Ile Ile Thr Thr Pro Trp Gln Gly Ala Leu Ser Pro Glu Ile
370 375 380
Ser Gln Glu Arg Gln Leu Ile Phe Ser Gly Tyr Lys Val Tyr Lys Val
385 390 395 400
Asp Ser Ile Leu Ser Asn Thr Ala Val Gln Phe Thr Gly Val Gln Arg
405 410 415
Ala Asp Phe His Met Val Asn Glu Ala Gly Thr Gly Val Thr Ser Arg
420 425 430
Ser Ile Asp Leu Pro Leu Thr Thr Tyr Tyr Phe Ser Lys Ala Ser Asn
435 440 445
Ile Pro Gly Thr Arg Ser Glu Thr Pro Thr Ser Leu Asp Tyr Thr His
450 455 460
Ile Leu Ser Ser Val Arg Ser Thr Ser Ile Gly Thr Thr Tyr Arg Asn
465 470 475 480
Arg Ser Asn Ile Ile Ala Tyr Gly Trp Thr His Thr Ser Ala Glu Arg
485 490 495
Thr Asn Arg Ile Leu Pro Asn Arg Ile Thr Gln Ile Pro Ala Val Lys
500 505 510
Ala Phe Ala Leu Glu Ser Gly Ala Ser Val Arg Pro Gly Pro Gly His
515 520 525
Thr Gly Gly Asp Val Val Ser Leu Ala Leu Ser Gly Arg Leu Lys Ile
530 535 540
Arg Leu Thr Pro Ala Ser Thr Asn Thr Asn Tyr Arg Val Arg Ile Arg
545 550 555 560
Tyr Ala Thr Ser Tyr Gly Ala Ser Leu Met Val Gln Arg Trp Ser Pro
565 570 575
Ser Gly Ser Glu Ser Gly Tyr Phe Ser Ser Ser His Thr Gly Ala Tyr
580 585 590
Pro Lys Phe Gly Tyr Met Asp Thr Leu Val Thr Asn Phe Asn Gln Thr
595 600 605
Gly Val Glu Ile Ile Ile Glu Asn Arg His Tyr Ser Asn Ile Ile Ile
610 615 620
Asp Arg Ile Glu Leu Ile Pro Val
625 630
<210> 45
<211> 825
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 45
Leu Phe Ser Ile Phe Gly Ile Gln Met Leu Ser Tyr Ile Lys Ile Gly
1 5 10 15
Gly Glu Asn Met His Gln Thr Asn Thr Ser Lys Asp Lys Asn Arg Met
20 25 30
Ala Ser Phe Glu Lys Thr Asn Met Ser Asn Glu Gly Pro Ile Tyr Pro
35 40 45
Leu Ala Asn Ser Ser Asn Thr Gly Leu Gln Gly Met Asn Tyr Asn Asp
50 55 60
Ser Val Asn Met His Ala Thr Lys Asn Glu Asp Cys Leu Leu Ser Ser
65 70 75 80
Arg Val Ser Val Asp Pro Lys Thr Ala Val Ala Thr Gly Ile Lys Ile
85 90 95
Ser Thr Phe Ile Met Ser Ala Leu Gly Ile Pro Leu Ala Ser Gln Ile
100 105 110
Gly Gln Leu Trp Asn Phe Val Leu Asp Gln Leu Trp Pro Asn Gly Asp
115 120 125
Asn Gln Trp Glu Glu Phe Met Lys His Val Glu Glu Leu Ile Asn Gln
130 135 140
Lys Ile Thr Glu Tyr Ala Arg Asp Lys Ala Leu Ala Glu Leu Glu Gly
145 150 155 160
Leu Gly Asn Val Leu Glu Leu Tyr Gln Glu Ala Ile Glu Asp Trp Lys
165 170 175
Lys Asp Pro Thr Asn Val Ala Ser Gln Glu Arg Val Arg Thr Arg Phe
180 185 190
Arg Asn Ala Asp Ala Phe Phe Glu Asn Gly Met Pro Ser Phe Arg Ile
195 200 205
Lys Asn Tyr Glu Val Pro Leu Leu Ser Val Tyr Ala Ser Ala Ala Asn
210 215 220
Leu His Leu Leu Leu Leu Arg Asp Ala Ser Ile Tyr Gly Lys Asp Trp
225 230 235 240
Gly Leu Asn Glu Thr Asn Val Lys Asp Asn Tyr Asn Arg Gln Leu Lys
245 250 255
Arg Thr Glu Ser Tyr Ser Asn His Cys Val Thr Trp Tyr Gln Lys Gly
260 265 270
Leu Gln Arg Leu Lys Gly Ser Asp Ala Asp Ser Trp Leu Lys Phe Asn
275 280 285
Ala Phe Arg Arg Asp Met Thr Phe Thr Val Leu Asp Ile Val Val Leu
290 295 300
Phe Pro Cys Tyr Asp Ile Gln Lys Tyr Pro Met Gly Val Lys Thr Glu
305 310 315 320
Ile Thr Arg Glu Ile Tyr Thr Asp Pro Ile Gly Asn Leu Pro Arg Arg
325 330 335
Pro Gly Phe Gln Val Leu Asp Trp Val Asn His Ala Pro Ser Phe Glu
340 345 350
Glu Ile Glu Lys Glu Thr Thr Gly Asp Pro Ser Met Val Thr Trp Ile
355 360 365
Asn Tyr Leu Glu Ile Ser Arg Asn Lys Leu Gly Gly Trp Asn Ser Ser
370 375 380
Asn Asp Tyr Trp Glu Gly His Ser Val His Tyr Lys Tyr Ser Asn Asp
385 390 395 400
Gly Ile Val Ile Asp Ser Lys Ala Tyr Ala His Gly Asp Phe Ser Gly
405 410 415
Lys Phe Pro Thr Glu Ala Ile His Leu Glu Asn Cys Asp Val Tyr Ala
420 425 430
Ser Ser Ser Leu Pro Val Ala Ala Ser Asn Pro Tyr Gly Asp Lys Ala
435 440 445
Ser Phe Gly Val Thr Lys Val Tyr Phe Asp Met Leu Asn Leu Asn Asp
450 455 460
Asn Thr Leu Gln Arg Gly Ser Trp Asp His Pro Lys Asn Trp Gly Gly
465 470 475 480
Ser Trp Val Asp Leu Lys Phe Leu Asn Glu Thr Pro Asn Ile Lys Glu
485 490 495
Ile Gln Lys Tyr Ser His Lys Leu Thr Tyr Val Ser Ser Phe Ser Val
500 505 510
Asp Tyr Gly Ser Val Leu Cys Tyr Arg Trp Arg His Ser Ser Val Asp
515 520 525
Arg Asn Asn Thr Leu Asp Pro Gln Lys Ile Thr Gln Ile Ser Ala Val
530 535 540
Lys Gly His Thr Pro Ile Asn Cys Glu Val Val Arg Gly Asn Gly Leu
545 550 555 560
Thr Asp Gly Asp Trp Leu Gln Leu Lys Gly Gly Gly Ser Phe Thr Leu
565 570 575
Asn Val Ser Ser Val Ile Pro Lys Thr Tyr Arg Ile Arg Leu Arg Tyr
580 585 590
Ala Cys Gly Pro Lys Asp Val Asn Leu Thr Val Ser Cys Pro Asp Asn
595 600 605
Gly Ile Asp Lys Thr Ile Thr Ile Pro Ser Thr Ser Thr Ala Ser Leu
610 615 620
Ala Asn Asn Leu Met Tyr Lys Asp Phe Lys Tyr Ile Asp Leu Pro Ile
625 630 635 640
Glu Phe Ile Thr Ser Ala Ala Pro Lys Arg Cys Arg Ile Asn Leu Arg
645 650 655
Leu Glu Gly Val Gln Asn Thr Ser Phe Phe Met Asp Lys Phe Glu Phe
660 665 670
Ile Pro Glu Asn Glu Thr Glu Thr Arg Pro Trp Lys Ile Val Thr Ala
675 680 685
Leu Asn Asn Ser Ser Val Leu Ala Phe Ala Lys Asn Ser Leu Tyr Lys
690 695 700
Glu Ala Ile Leu Ser Asn Asp Thr Gly Glu Glu Ser Gln Lys Trp Arg
705 710 715 720
Phe Ile Tyr Asp Glu Glu Lys Lys Ala Tyr Gln Ile Glu Asp Val Lys
725 730 735
Ser Pro Arg Leu Ile Leu Ala Trp Ile Ile Asp Gly Pro Glu Ser Arg
740 745 750
Lys Val Trp Ala Thr Arg Ser Gln Asn Ile Asp Glu His Tyr Trp Ile
755 760 765
Leu Glu Glu Gln Glu Asp Ser Tyr Phe Ile Ile Lys Asn Lys Lys Asn
770 775 780
Pro Ser Leu Val Leu Asp Val Asp Gly Ala Gln Thr Asn Gln Gly Thr
785 790 795 800
Lys Ile Lys Val Asn Glu Arg His Pro Leu Tyr Ser Ser Arg Thr Asn
805 810 815
Ala Gln Lys Phe Lys Leu Glu Arg Val
820 825
<210> 46
<211> 675
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 46
Leu Phe Ser Ile Phe Gly Ile Gln Met Leu Ser Tyr Ile Lys Ile Gly
1 5 10 15
Gly Glu Asn Met His Gln Thr Asn Thr Ser Lys Asp Lys Asn Arg Met
20 25 30
Ala Ser Phe Glu Lys Thr Asn Met Ser Asn Glu Gly Pro Ile Tyr Pro
35 40 45
Leu Ala Asn Ser Ser Asn Thr Gly Leu Gln Gly Met Asn Tyr Asn Asp
50 55 60
Ser Val Asn Met His Ala Thr Lys Asn Glu Asp Cys Leu Leu Ser Ser
65 70 75 80
Arg Val Ser Val Asp Pro Lys Thr Ala Val Ala Thr Gly Ile Lys Ile
85 90 95
Ser Thr Phe Ile Met Ser Ala Leu Gly Ile Pro Leu Ala Ser Gln Ile
100 105 110
Gly Gln Leu Trp Asn Phe Val Leu Asp Gln Leu Trp Pro Asn Gly Asp
115 120 125
Asn Gln Trp Glu Glu Phe Met Lys His Val Glu Glu Leu Ile Asn Gln
130 135 140
Lys Ile Thr Glu Tyr Ala Arg Asp Lys Ala Leu Ala Glu Leu Glu Gly
145 150 155 160
Leu Gly Asn Val Leu Glu Leu Tyr Gln Glu Ala Ile Glu Asp Trp Lys
165 170 175
Lys Asp Pro Thr Asn Val Ala Ser Gln Glu Arg Val Arg Thr Arg Phe
180 185 190
Arg Asn Ala Asp Ala Phe Phe Glu Asn Gly Met Pro Ser Phe Arg Ile
195 200 205
Lys Asn Tyr Glu Val Pro Leu Leu Ser Val Tyr Ala Ser Ala Ala Asn
210 215 220
Leu His Leu Leu Leu Leu Arg Asp Ala Ser Ile Tyr Gly Lys Asp Trp
225 230 235 240
Gly Leu Asn Glu Thr Asn Val Lys Asp Asn Tyr Asn Arg Gln Leu Lys
245 250 255
Arg Thr Glu Ser Tyr Ser Asn His Cys Val Thr Trp Tyr Gln Lys Gly
260 265 270
Leu Gln Arg Leu Lys Gly Ser Asp Ala Asp Ser Trp Leu Lys Phe Asn
275 280 285
Ala Phe Arg Arg Asp Met Thr Phe Thr Val Leu Asp Ile Val Val Leu
290 295 300
Phe Pro Cys Tyr Asp Ile Gln Lys Tyr Pro Met Gly Val Lys Thr Glu
305 310 315 320
Ile Thr Arg Glu Ile Tyr Thr Asp Pro Ile Gly Asn Leu Pro Arg Arg
325 330 335
Pro Gly Phe Gln Val Leu Asp Trp Val Asn His Ala Pro Ser Phe Glu
340 345 350
Glu Ile Glu Lys Glu Thr Thr Gly Asp Pro Ser Met Val Thr Trp Ile
355 360 365
Asn Tyr Leu Glu Ile Ser Arg Asn Lys Leu Gly Gly Trp Asn Ser Ser
370 375 380
Asn Asp Tyr Trp Glu Gly His Ser Val His Tyr Lys Tyr Ser Asn Asp
385 390 395 400
Gly Ile Val Ile Asp Ser Lys Ala Tyr Ala His Gly Asp Phe Ser Gly
405 410 415
Lys Phe Pro Thr Glu Ala Ile His Leu Glu Asn Cys Asp Val Tyr Ala
420 425 430
Ser Ser Ser Leu Pro Val Ala Ala Ser Asn Pro Tyr Gly Asp Lys Ala
435 440 445
Ser Phe Gly Val Thr Lys Val Tyr Phe Asp Met Leu Asn Leu Asn Asp
450 455 460
Asn Thr Leu Gln Arg Gly Ser Trp Asp His Pro Lys Asn Trp Gly Gly
465 470 475 480
Ser Trp Val Asp Leu Lys Phe Leu Asn Glu Thr Pro Asn Ile Lys Glu
485 490 495
Ile Gln Lys Tyr Ser His Lys Leu Thr Tyr Val Ser Ser Phe Ser Val
500 505 510
Asp Tyr Gly Ser Val Leu Cys Tyr Arg Trp Arg His Ser Ser Val Asp
515 520 525
Arg Asn Asn Thr Leu Asp Pro Gln Lys Ile Thr Gln Ile Ser Ala Val
530 535 540
Lys Gly His Thr Pro Ile Asn Cys Glu Val Val Arg Gly Asn Gly Leu
545 550 555 560
Thr Asp Gly Asp Trp Leu Gln Leu Lys Gly Gly Gly Ser Phe Thr Leu
565 570 575
Asn Val Ser Ser Val Ile Pro Lys Thr Tyr Arg Ile Arg Leu Arg Tyr
580 585 590
Ala Cys Gly Pro Lys Asp Val Asn Leu Thr Val Ser Cys Pro Asp Asn
595 600 605
Gly Ile Asp Lys Thr Ile Thr Ile Pro Ser Thr Ser Thr Ala Ser Leu
610 615 620
Ala Asn Asn Leu Met Tyr Lys Asp Phe Lys Tyr Ile Asp Leu Pro Ile
625 630 635 640
Glu Phe Ile Thr Ser Ala Ala Pro Lys Arg Cys Arg Ile Asn Leu Arg
645 650 655
Leu Glu Gly Val Gln Asn Thr Ser Phe Phe Met Asp Lys Phe Glu Phe
660 665 670
Ile Pro Glu
675
<210> 47
<211> 624
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 47
Leu Tyr Ile Gly Lys Thr Ser Gly Glu Val Lys Met Leu Arg Thr Ile
1 5 10 15
Gln Tyr Lys Asn Ala Ser Glu Ile Val Tyr Asp Gln Pro Leu Pro Tyr
20 25 30
Gly Gly Val Val Lys Ile Ala Gly Lys Ile Gly Leu Gly Val Val Lys
35 40 45
Thr Val Ile Thr Ser Ile Ile Arg Arg Gly Arg Asp Asn Glu Ile Ala
50 55 60
Gly Arg Ile Leu Ser Asp Val Tyr Ser Val Leu Trp Ser Asn Arg Lys
65 70 75 80
Gly Tyr Trp Asn Glu Met Ile Glu Ala Val Glu Thr Leu Ile Gln Gln
85 90 95
Asp Ile Ser Glu Asn Ile Lys Asn Asn Ala Leu Ala Ala Leu Thr Asp
100 105 110
Ile Arg Asn Ala Leu Leu Leu Tyr Gln Gln Ala Val Glu Asp Trp Glu
115 120 125
Ser Asn Arg Thr Asp Ser Gln Leu Gln Glu Arg Val Arg Asn Gln Leu
130 135 140
Ile Ser Thr Ile Thr Phe Ile Glu Phe Ala Met Pro Ser Phe Thr Val
145 150 155 160
Gln His Tyr Glu Val Ile Leu Leu Pro Ile Phe Thr Gln Val Ala Asn
165 170 175
Leu His Leu Leu Leu Leu Arg Asp Ala Glu Ile Phe Gly Leu Lys Trp
180 185 190
Arg Met Ser Lys Ala Glu Ile Asp Asp Tyr Tyr Phe Ala Lys Ser Gly
195 200 205
Leu Thr Arg Leu Thr Gln Lys Tyr Thr Asn His Ser Val Lys Trp Tyr
210 215 220
Arg Glu Gly Leu Cys Ile Ala Thr Asn Ile Asp Leu Asp Gln Cys Pro
225 230 235 240
Glu Phe Tyr Gln Leu Asp Lys Trp Asn Ala Met Asn Asp Phe Arg Arg
245 250 255
Glu Met Thr Phe Met Val Leu Asp Ile Ile Ala Leu Trp Pro Thr Tyr
260 265 270
Asp Pro Ile Arg Tyr Pro Leu Gly Ile Lys Thr Glu Leu Thr Arg Glu
275 280 285
Val Phe Thr Pro Leu Leu Gly Ile Asn Pro Asn Ser Ser Trp Leu Ile
290 295 300
Arg Thr Met Glu Glu Ile Glu Ala Lys Leu Thr Val Leu Ser Pro Phe
305 310 315 320
Leu Ser Trp Ile Ser Phe Glu Gln Leu Val Lys Gln Gly Asp Gly Ile
325 330 335
Ser Thr Phe Thr Asp Trp Gly Asn Phe Thr Leu Ser Asn Thr Met Leu
340 345 350
Pro Leu Ser Tyr Ile Leu Gly Gly Ala Gly Pro Gly Thr Gly Asp Ser
355 360 365
Thr Asn Ile Pro Met Gln Ser Glu Asn Tyr Asp Val Tyr Lys Val Leu
370 375 380
Val Gly Thr Asp Tyr Ser His Pro Ser Asn Val Pro Ile Arg Lys Leu
385 390 395 400
Glu Tyr Tyr Cys Thr Asn Gly Met Met Glu Asn Val Ile Thr Val Gly
405 410 415
Thr Gly Thr Thr Asn Ala Leu Phe Glu Leu Pro Asn Asn Gly Cys Val
420 425 430
Asp Tyr Ser His Arg Val Ser Arg Leu Ser Cys Ser Asn Val Glu Val
435 440 445
Tyr Glu Trp Glu Gly Gly Pro Lys Tyr Ala Leu Lys Asn Ile Ala Tyr
450 455 460
Gly Trp Thr His Ile Ser Val Asp Ser Lys Asn Thr Leu Ser His Asn
465 470 475 480
Ala Ile Thr Gln Ile Pro Ala Arg Lys Gly Tyr Ser Ser Ser Glu Ser
485 490 495
Asn Leu Ser Ile Glu Gly Pro Tyr Phe Thr Gly Gly Asp Leu Ile Ala
500 505 510
Leu Pro Pro Asn Gly Ala Gln Leu Gln Met Arg Val Ser Pro Pro Val
515 520 525
Ser Ser Ser Ser Ile Asn Tyr Cys Val Arg Leu Arg Tyr Ala Ser Ser
530 535 540
Gly Asn Thr Asn Ile Tyr Val Glu Arg Val Leu Ser Ser Gly Asp Thr
545 550 555 560
Tyr Gly Glu Thr His Asp Val Pro Ala Thr Tyr Ser Gly Gly Ser Leu
565 570 575
Ser Tyr Ser Ser Phe Ala Tyr Val Val Asn Leu Thr Ala Ile Phe Glu
580 585 590
Gly Phe Asn Val Glu Ile Lys Ile Lys Asn Ile Gly Ser Ser Gln Ile
595 600 605
Ile Leu Asp Lys Ile Glu Phe Leu Pro Ile Lys Glu Ser Leu Lys Glu
610 615 620
<210> 48
<211> 618
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 48
Leu Tyr Ile Gly Lys Thr Ser Gly Glu Val Lys Met Leu Arg Thr Ile
1 5 10 15
Gln Tyr Lys Asn Ala Ser Glu Ile Val Tyr Asp Gln Pro Leu Pro Tyr
20 25 30
Gly Gly Val Val Lys Ile Ala Gly Lys Ile Gly Leu Gly Val Val Lys
35 40 45
Thr Val Ile Thr Ser Ile Ile Arg Arg Gly Arg Asp Asn Glu Ile Ala
50 55 60
Gly Arg Ile Leu Ser Asp Val Tyr Ser Val Leu Trp Ser Asn Arg Lys
65 70 75 80
Gly Tyr Trp Asn Glu Met Ile Glu Ala Val Glu Thr Leu Ile Gln Gln
85 90 95
Asp Ile Ser Glu Asn Ile Lys Asn Asn Ala Leu Ala Ala Leu Thr Asp
100 105 110
Ile Arg Asn Ala Leu Leu Leu Tyr Gln Gln Ala Val Glu Asp Trp Glu
115 120 125
Ser Asn Arg Thr Asp Ser Gln Leu Gln Glu Arg Val Arg Asn Gln Leu
130 135 140
Ile Ser Thr Ile Thr Phe Ile Glu Phe Ala Met Pro Ser Phe Thr Val
145 150 155 160
Gln His Tyr Glu Val Ile Leu Leu Pro Ile Phe Thr Gln Val Ala Asn
165 170 175
Leu His Leu Leu Leu Leu Arg Asp Ala Glu Ile Phe Gly Leu Lys Trp
180 185 190
Arg Met Ser Lys Ala Glu Ile Asp Asp Tyr Tyr Phe Ala Lys Ser Gly
195 200 205
Leu Thr Arg Leu Thr Gln Lys Tyr Thr Asn His Ser Val Lys Trp Tyr
210 215 220
Arg Glu Gly Leu Cys Ile Ala Thr Asn Ile Asp Leu Asp Gln Cys Pro
225 230 235 240
Glu Phe Tyr Gln Leu Asp Lys Trp Asn Ala Met Asn Asp Phe Arg Arg
245 250 255
Glu Met Thr Phe Met Val Leu Asp Ile Ile Ala Leu Trp Pro Thr Tyr
260 265 270
Asp Pro Ile Arg Tyr Pro Leu Gly Ile Lys Thr Glu Leu Thr Arg Glu
275 280 285
Val Phe Thr Pro Leu Leu Gly Ile Asn Pro Asn Ser Ser Trp Leu Ile
290 295 300
Arg Thr Met Glu Glu Ile Glu Ala Lys Leu Thr Val Leu Ser Pro Phe
305 310 315 320
Leu Ser Trp Ile Ser Phe Glu Gln Leu Val Lys Gln Gly Asp Gly Ile
325 330 335
Ser Thr Phe Thr Asp Trp Gly Asn Phe Thr Leu Ser Asn Thr Met Leu
340 345 350
Pro Leu Ser Tyr Ile Leu Gly Gly Ala Gly Pro Gly Thr Gly Asp Ser
355 360 365
Thr Asn Ile Pro Met Gln Ser Glu Asn Tyr Asp Val Tyr Lys Val Leu
370 375 380
Val Gly Thr Asp Tyr Ser His Pro Ser Asn Val Pro Ile Arg Lys Leu
385 390 395 400
Glu Tyr Tyr Cys Thr Asn Gly Met Met Glu Asn Val Ile Thr Val Gly
405 410 415
Thr Gly Thr Thr Asn Ala Leu Phe Glu Leu Pro Asn Asn Gly Cys Val
420 425 430
Asp Tyr Ser His Arg Val Ser Arg Leu Ser Cys Ser Asn Val Glu Val
435 440 445
Tyr Glu Trp Glu Gly Gly Pro Lys Tyr Ala Leu Lys Asn Ile Ala Tyr
450 455 460
Gly Trp Thr His Ile Ser Val Asp Ser Lys Asn Thr Leu Ser His Asn
465 470 475 480
Ala Ile Thr Gln Ile Pro Ala Arg Lys Gly Tyr Ser Ser Ser Glu Ser
485 490 495
Asn Leu Ser Ile Glu Gly Pro Tyr Phe Thr Gly Gly Asp Leu Ile Ala
500 505 510
Leu Pro Pro Asn Gly Ala Gln Leu Gln Met Arg Val Ser Pro Pro Val
515 520 525
Ser Ser Ser Ser Ile Asn Tyr Cys Val Arg Leu Arg Tyr Ala Ser Ser
530 535 540
Gly Asn Thr Asn Ile Tyr Val Glu Arg Val Leu Ser Ser Gly Asp Thr
545 550 555 560
Tyr Gly Glu Thr His Asp Val Pro Ala Thr Tyr Ser Gly Gly Ser Leu
565 570 575
Ser Tyr Ser Ser Phe Ala Tyr Val Val Asn Leu Thr Ala Ile Phe Glu
580 585 590
Gly Phe Asn Val Glu Ile Lys Ile Lys Asn Ile Gly Ser Ser Gln Ile
595 600 605
Ile Leu Asp Lys Ile Glu Phe Leu Pro Ile
610 615
<210> 49
<211> 376
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 49
Met Met Ser Asn Glu Ser Lys Asn Asn Glu Asn Met Asn Leu Pro Ile
1 5 10 15
Ile Asn Asp Glu Asp Ser Ile Pro Ser Glu Ile Arg Asp Ser Arg Ser
20 25 30
Lys Ile Thr Phe Pro Asp Phe Asn Ile Tyr Lys Ile Gly Thr Phe Cys
35 40 45
Gly Lys Tyr Val Asp Ile Pro Gly Gly Ala Asn Glu Asp Ser Ser Ala
50 55 60
Ile Gln Phe Gln Thr Gln Asp Gly Asp Asn Gln Lys Phe Leu Ile Phe
65 70 75 80
Thr Leu Asp Asp Ser Tyr Ser Ile Ile Ala Ala Arg His Ser Gly Lys
85 90 95
Val Met Asp Ala Tyr Tyr Asn Ser Ser Gln Asn Arg Ile Ile Gln Phe
100 105 110
Asp Phe His Asn Thr Asn Asn Gln Lys Phe Phe Leu Ser Asp Asn Gly
115 120 125
Thr Ile Ala Ser Lys Gln Asp Arg Gln Val Trp Asp Val Gln Gly Glu
130 135 140
Ser Thr Gln Asn Gly Ala Arg Ile Val Val Phe Lys Phe Ile Asp Val
145 150 155 160
Arg Asn Gln Lys Phe Thr Leu Asn Lys Leu Gly Ser Val Pro Val His
165 170 175
Gln Pro Thr Leu Ser Pro Leu Pro Ser Ala Pro Asp Phe Arg Thr Asn
180 185 190
Asp Ile Asn Glu Gln Leu Pro Asp Gln Thr Asn Pro Val Asn Thr His
195 200 205
Phe Thr Tyr Leu Pro Tyr Phe Met Val Lys Asp Pro Leu Tyr Asn Ala
210 215 220
Gln Gln Gln Ile Lys Asn Ser Pro Tyr Tyr Thr Leu Val Arg Arg Gln
225 230 235 240
Tyr Trp Glu Lys Lys Thr Gln Arg Ile Leu Ala Pro Ser Asp Thr Tyr
245 250 255
Glu Tyr Ser Glu Thr Ile Gly Val Ser Arg Thr Asp Gln Ser Ser Met
260 265 270
Thr Asp Ile Thr Glu Ile Ser Ile Gly Val Asp Leu Gly Phe Val Phe
275 280 285
Lys Gly Phe Ser Ala Gly Leu Ser Thr Asn Val Thr Arg Thr Leu Ser
290 295 300
Val Thr Lys Ser Thr Ser Asn Thr Glu Ser Ser Glu Ser Thr Arg Lys
305 310 315 320
Leu Ser Tyr Lys Asn Glu Phe Arg His Thr Ile Ala Tyr Ala Lys Tyr
325 330 335
Met Leu Ile Asn Glu Tyr Tyr Val Thr Arg Ala Asn Gly Glu Lys Ile
340 345 350
Thr Thr Gly Asp Ala Thr Tyr Trp Arg Val Pro Asn Pro Glu Gln Thr
355 360 365
Val Ala Arg Ile Ile Pro Arg Ser
370 375
<210> 50
<211> 665
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 50
Val Glu Ala Thr Arg Arg Lys Tyr Gln Ile Cys Cys His Gln Thr Tyr
1 5 10 15
Thr Ile Tyr Lys Gly Gly Leu Cys Met Asn Lys Asn Asn Asn Glu Ile
20 25 30
Thr Glu Val Pro Cys Ser Glu Cys Gly Asp Ile Asp Tyr Arg Asp Ile
35 40 45
Met Asn Met Ser Thr Gln Gly Glu Tyr Val Ala Gln Gln Ser Val Val
50 55 60
Leu Thr Ala Met Asn Thr Ser Phe Gln Val Ile Arg Thr Leu Tyr Gln
65 70 75 80
Ala Asn Lys Gly Thr Leu Ser Lys Ala Gly Gly Val Ile Lys Ser Ile
85 90 95
Phe Thr Tyr Leu Trp Arg Gln Lys Asn Ser Gln Glu Glu Trp Asp Asn
100 105 110
Phe Met Lys Ala Val Glu Ile Leu Ile Ala Glu Glu Leu Ser Thr Tyr
115 120 125
Ala Arg Asn Asp Ala Ile Ala Ser Val Arg Gly Leu Glu Asn Val Leu
130 135 140
Asn Glu Tyr Gln Glu Ala Leu Asp Asp Leu Ala Leu Asp Pro Thr Asn
145 150 155 160
Ser Ala Leu Lys Asp Glu Val Lys Arg Trp Val Thr Thr Val His Gly
165 170 175
Gln Phe Glu Ala Thr Met Pro Thr Leu Ala Val Gly Gly Tyr Glu Val
180 185 190
Gln Gln Leu Val Ala Tyr Ala Glu Ala Ala Asn Leu His Leu Ala Phe
195 200 205
Leu Arg Asp Val Ala Lys Phe Gly Tyr Gln Trp Asp Leu Asp Lys Thr
210 215 220
Thr Val Ala Asn Tyr Tyr Lys Asp Leu Lys Glu Asn Thr Gln Ile Tyr
225 230 235 240
Thr Asp His Cys Val Arg Thr Tyr Asn Thr Gly Leu Glu Lys Thr Lys
245 250 255
Ser Leu Met Gly Ala Ile Asn Pro Lys Asp Tyr Asn Lys Tyr Pro Tyr
260 265 270
Leu Asn Pro Tyr Ala Asn Gly Ser Thr Asn Phe Tyr Lys Lys Val Leu
275 280 285
Gln Trp Asn Val Trp Asn Asp Phe Arg Arg Asp Met Thr Ile Met Val
290 295 300
Leu Asp Leu Val Ala Leu Trp Pro Thr Phe Asp Pro Glu Val Tyr Thr
305 310 315 320
Asn Pro Glu Gly Val Asp Leu Glu Leu Ser Arg Glu Val Tyr Ser Thr
325 330 335
Ala Tyr Gly Arg Tyr Gly Ser Ser Thr His Gly Gly Asp Trp Lys Ser
340 345 350
Trp Glu Val Met Glu Thr Ala Val Asp Arg Ser Pro His Leu Val Ser
355 360 365
Phe Leu Thr Asn Leu Ala Ile Tyr Gln Lys Thr Tyr Ser Ser Ser Ser
370 375 380
Thr Asn Thr Lys Leu Asp Gln Tyr Asp Gly Val Ile Asn Thr Leu Lys
385 390 395 400
Thr Val Gly Ser Thr Ser Thr Phe Glu Asp Gly Phe Ala Pro Ile Ser
405 410 415
Lys Glu Ala Tyr Arg Ser Val Lys Asn Ile Pro Gly Glu Tyr Ile Asn
420 425 430
Gly Val Asp Leu Arg Leu Gly Met Val Pro Cys Ser Leu Thr Phe Lys
435 440 445
Thr Tyr Ser Ser Gly Thr Phe Phe Ala Gly Gln Cys Tyr Ser His Leu
450 455 460
Ala Gln Ser Thr Phe Tyr Asn Leu Ser Ala Thr Ile Ala Tyr His Arg
465 470 475 480
Leu Ser Tyr Val Asn Ala Ile Asp Asp Asn Phe Ser Gly Tyr Tyr Ser
485 490 495
Gly Trp Gly Ile Gly Thr Trp Gly Met Gly Trp Leu His Glu Asn Leu
500 505 510
Lys Thr Leu Asn Ile Ile His Ala Thr Lys Ser Ser Cys Ile Pro Ala
515 520 525
Val Lys Ala Arg Ile Leu Thr Asn Ser Ala Thr Val Ile Lys Gly Pro
530 535 540
Gly Ser Thr Gly Gly Asp Leu Val Lys Leu Pro Gly Val Pro Ser Thr
545 550 555 560
Ser Asp Ile Gln Val Arg Met Asn Met Thr Arg Glu Val Trp Lys Asn
565 570 575
Tyr Arg Ile Arg Ile Arg Tyr Ala Thr Ser Ser Ser Ala Gln Leu Phe
580 585 590
Val Gly Lys Trp Thr Gly Arg Trp Ala Ala Thr Ala Asn Ile Asn Leu
595 600 605
Ala Ala Thr Tyr Ser Gly Glu Leu Thr Tyr Ser Ala Phe Lys Leu Ala
610 615 620
Asp Val Pro Phe Asn Ile Thr Thr Gly Glu Pro Glu Phe Ser Phe Glu
625 630 635 640
Leu Arg Asn Asn Ser Gly Gly Pro Ile Leu Ile Asp Arg Ile Glu Phe
645 650 655
Ile Pro Leu Glu Gly Thr Phe Ala Glu
660 665
<210> 51
<211> 659
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 51
Val Glu Ala Thr Arg Arg Lys Tyr Gln Ile Cys Cys His Gln Thr Tyr
1 5 10 15
Thr Ile Tyr Lys Gly Gly Leu Cys Met Asn Lys Asn Asn Asn Glu Ile
20 25 30
Thr Glu Val Pro Cys Ser Glu Cys Gly Asp Ile Asp Tyr Arg Asp Ile
35 40 45
Met Asn Met Ser Thr Gln Gly Glu Tyr Val Ala Gln Gln Ser Val Val
50 55 60
Leu Thr Ala Met Asn Thr Ser Phe Gln Val Ile Arg Thr Leu Tyr Gln
65 70 75 80
Ala Asn Lys Gly Thr Leu Ser Lys Ala Gly Gly Val Ile Lys Ser Ile
85 90 95
Phe Thr Tyr Leu Trp Arg Gln Lys Asn Ser Gln Glu Glu Trp Asp Asn
100 105 110
Phe Met Lys Ala Val Glu Ile Leu Ile Ala Glu Glu Leu Ser Thr Tyr
115 120 125
Ala Arg Asn Asp Ala Ile Ala Ser Val Arg Gly Leu Glu Asn Val Leu
130 135 140
Asn Glu Tyr Gln Glu Ala Leu Asp Asp Leu Ala Leu Asp Pro Thr Asn
145 150 155 160
Ser Ala Leu Lys Asp Glu Val Lys Arg Trp Val Thr Thr Val His Gly
165 170 175
Gln Phe Glu Ala Thr Met Pro Thr Leu Ala Val Gly Gly Tyr Glu Val
180 185 190
Gln Gln Leu Val Ala Tyr Ala Glu Ala Ala Asn Leu His Leu Ala Phe
195 200 205
Leu Arg Asp Val Ala Lys Phe Gly Tyr Gln Trp Asp Leu Asp Lys Thr
210 215 220
Thr Val Ala Asn Tyr Tyr Lys Asp Leu Lys Glu Asn Thr Gln Ile Tyr
225 230 235 240
Thr Asp His Cys Val Arg Thr Tyr Asn Thr Gly Leu Glu Lys Thr Lys
245 250 255
Ser Leu Met Gly Ala Ile Asn Pro Lys Asp Tyr Asn Lys Tyr Pro Tyr
260 265 270
Leu Asn Pro Tyr Ala Asn Gly Ser Thr Asn Phe Tyr Lys Lys Val Leu
275 280 285
Gln Trp Asn Val Trp Asn Asp Phe Arg Arg Asp Met Thr Ile Met Val
290 295 300
Leu Asp Leu Val Ala Leu Trp Pro Thr Phe Asp Pro Glu Val Tyr Thr
305 310 315 320
Asn Pro Glu Gly Val Asp Leu Glu Leu Ser Arg Glu Val Tyr Ser Thr
325 330 335
Ala Tyr Gly Arg Tyr Gly Ser Ser Thr His Gly Gly Asp Trp Lys Ser
340 345 350
Trp Glu Val Met Glu Thr Ala Val Asp Arg Ser Pro His Leu Val Ser
355 360 365
Phe Leu Thr Asn Leu Ala Ile Tyr Gln Lys Thr Tyr Ser Ser Ser Ser
370 375 380
Thr Asn Thr Lys Leu Asp Gln Tyr Asp Gly Val Ile Asn Thr Leu Lys
385 390 395 400
Thr Val Gly Ser Thr Ser Thr Phe Glu Asp Gly Phe Ala Pro Ile Ser
405 410 415
Lys Glu Ala Tyr Arg Ser Val Lys Asn Ile Pro Gly Glu Tyr Ile Asn
420 425 430
Gly Val Asp Leu Arg Leu Gly Met Val Pro Cys Ser Leu Thr Phe Lys
435 440 445
Thr Tyr Ser Ser Gly Thr Phe Phe Ala Gly Gln Cys Tyr Ser His Leu
450 455 460
Ala Gln Ser Thr Phe Tyr Asn Leu Ser Ala Thr Ile Ala Tyr His Arg
465 470 475 480
Leu Ser Tyr Val Asn Ala Ile Asp Asp Asn Phe Ser Gly Tyr Tyr Ser
485 490 495
Gly Trp Gly Ile Gly Thr Trp Gly Met Gly Trp Leu His Glu Asn Leu
500 505 510
Lys Thr Leu Asn Ile Ile His Ala Thr Lys Ser Ser Cys Ile Pro Ala
515 520 525
Val Lys Ala Arg Ile Leu Thr Asn Ser Ala Thr Val Ile Lys Gly Pro
530 535 540
Gly Ser Thr Gly Gly Asp Leu Val Lys Leu Pro Gly Val Pro Ser Thr
545 550 555 560
Ser Asp Ile Gln Val Arg Met Asn Met Thr Arg Glu Val Trp Lys Asn
565 570 575
Tyr Arg Ile Arg Ile Arg Tyr Ala Thr Ser Ser Ser Ala Gln Leu Phe
580 585 590
Val Gly Lys Trp Thr Gly Arg Trp Ala Ala Thr Ala Asn Ile Asn Leu
595 600 605
Ala Ala Thr Tyr Ser Gly Glu Leu Thr Tyr Ser Ala Phe Lys Leu Ala
610 615 620
Asp Val Pro Phe Asn Ile Thr Thr Gly Glu Pro Glu Phe Ser Phe Glu
625 630 635 640
Leu Arg Asn Asn Ser Gly Gly Pro Ile Leu Ile Asp Arg Ile Glu Phe
645 650 655
Ile Pro Leu
<210> 52
<211> 383
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 52
Met Met Gln Phe Asn Lys Arg Asn Gly Asn Asn Ala Glu Phe Tyr Lys
1 5 10 15
Gly Glu Lys Val Thr Pro Phe Glu Tyr Asp Leu Pro Glu Glu Gly Lys
20 25 30
Ala Phe Gln Thr Ile Gly Ser Ile Leu Ser Thr Asn Asn Arg Ile Leu
35 40 45
Val Ala Thr Arg Thr Arg Ser Gly Gln Glu Leu Gly Gln Asp Val Gly
50 55 60
Asp Phe Cys Arg Arg Val Thr Leu Asn Asn Gln Val Val Asn Asp Thr
65 70 75 80
Ala Ala Ala Thr Asn Tyr Glu Ala Gln Phe Ile Phe Phe Lys Lys Asp
85 90 95
Phe Ser Gly Tyr Ile Ile Ala Asn Arg Gln His Gly Glu Val Leu Glu
100 105 110
Ser Val Phe Ala Asn Asn Asp Ser Leu Ile Thr Ala Pro Tyr Ala Asn
115 120 125
Lys Thr Gln Gln Val Phe Gly Lys Ser Ser Tyr Ser Asp Lys Ser Phe
130 135 140
Arg Leu Tyr Gly Asp His Gly Ala Ile Thr Thr Cys Gly Asp Lys Trp
145 150 155 160
Asn Ser Trp Thr Arg Ile Thr Met Ser Gly Ser Asn Glu Asn Gln Ala
165 170 175
Arg Tyr Val Phe Lys His Gly Asp Thr Ser Phe Pro Ile Thr Ile Pro
180 185 190
Thr Lys Leu Glu Pro Thr Thr Leu Gly Pro Ile Pro Glu Leu Thr Asn
195 200 205
Leu Asp Asp Val Gly Thr Pro Pro Ala Pro Ala Val Val Gly Thr Ala
210 215 220
Leu Leu Pro Cys Ile Phe Val Asn Asp Arg Thr Pro Ser Gln Arg Ile
225 230 235 240
Gln Asp Ser Pro Tyr Tyr Val Leu Glu Cys Tyr Asp Tyr Trp Lys Leu
245 250 255
Ile Lys Ser Ser Ile Ile Gln Pro Gly Gly Phe Asp Asn Trp Trp Glu
260 265 270
Glu Thr Gly Ile His Ser Asn Val Gln Ala Ala Met Lys Asn Met Ile
275 280 285
Asn Ile Ser Ile Gly Asp Asp Lys Arg Leu Arg Phe Phe Asn Leu Ser
290 295 300
Asp Pro Phe His Gln Ser Ile Val Glu Asp Ile Asn Ile Pro Ala Ser
305 310 315 320
Thr Ser Asn Ser Asp Leu Ser Phe Ile Thr Ala Ile Arg Glu His Thr
325 330 335
Asn Pro Tyr Ser Thr Arg Leu Arg Phe Ala Lys Tyr Phe Val Ala Arg
340 345 350
Lys Phe Glu Leu Lys Arg Leu Asp Gly Ser Thr Pro Ile Tyr Thr Trp
355 360 365
Glu Tyr Ile Asp Asp Thr Lys Tyr Val Met Lys Glu Phe Arg Ser
370 375 380
<210> 53
<211> 862
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 53
Met Val Phe Leu Pro Thr Ile Thr Cys Ile Ser Arg Arg Tyr Phe Met
1 5 10 15
Ala Gln Leu Gln Glu Leu Gln Ile Gln Pro Val Ile Pro Tyr Asn Val
20 25 30
Leu Ala Ser Pro Pro Met Gly Asn Val Asp Asp Leu Pro Thr Leu Ala
35 40 45
Glu Glu Leu Lys Gln Ala Trp Glu Ser Phe Gln Lys Thr Gly Asn Leu
50 55 60
Asn Phe Thr Ala Phe Gln Gln Gly Leu Ala Ala Ala Gly Gly Gly Ser
65 70 75 80
Phe Asn Tyr Leu Ala Leu Leu Gln Ala Ala Ile Gly Leu Ala Gly Thr
85 90 95
Val Gly Ala Glu Ile Pro Gly Val Ala Ile Ala Ala Pro Leu Val Ser
100 105 110
Ile Leu Leu Gly Phe Leu Trp Pro Asn Lys Gln Lys Ser Asp Ile Lys
115 120 125
Gln Leu Ile Thr Val Ile Asp Ala Glu Val Lys Arg Ile Leu Asn Gln
130 135 140
Glu Leu Thr Asp Tyr His Ser Gln Glu Val Gln Gly Tyr Leu Glu Gly
145 150 155 160
Phe Phe Asp Thr Met Thr Asn Pro Ala Thr Ser Pro Asp Ile Lys Ile
165 170 175
Asn Glu Ser Ile Phe Thr Gly Met Pro Gly Asp Pro Asn Arg Thr Pro
180 185 190
Lys Asp Val Asp Ala Thr Ala Tyr Asp Ala Val Val Asp Arg Phe Leu
195 200 205
Thr Ala Asn Val Ser Phe Ile Ile Asp Leu Asp Gln Phe Leu Thr Gly
210 215 220
Lys Phe Gly Thr Asn Asn Asp Val Asn Phe Asp Val Ala Ser Leu Pro
225 230 235 240
Tyr Tyr Val Ile Gly Ala Thr Leu Gln Leu Met Ser Tyr His Ser Val
245 250 255
Ile Asn Phe Met Thr Ala Trp Phe Pro Lys Ile Trp Pro Gln Tyr Thr
260 265 270
Thr Glu Asp Ser Arg Tyr Lys Asp Ile Leu Asn Ala Lys Gln Ala Met
275 280 285
Arg Met Ala Ile Arg Asp Asn Thr Asn Lys Val Leu Thr Ile Val Gln
290 295 300
Ala Asn Leu Pro Ser Leu Gly Ser Thr Arg Asn Ser Leu Asn Asp Tyr
305 310 315 320
Asn Arg Tyr Ala Arg Thr Met Gln Leu Thr Cys Leu Asp Thr Val Ala
325 330 335
Gln Trp Pro Thr Leu Tyr Pro Asp Asp Tyr Pro Val Ser Thr Thr Leu
340 345 350
Glu Gln Thr Arg Arg Ile Phe Leu Asp Thr Ala Gly Ile Asp Glu Arg
355 360 365
Lys Asp Ser Asn Gly Lys Tyr Thr Asn Asp Ser Thr Ile Thr Ala Leu
370 375 380
Tyr Asn Ile Leu Asp Gly Asn Ser Tyr Asn Ser His Asn Asn Val Gly
385 390 395 400
Ile Asn Gly Ile Asn Ser Leu Leu Tyr Ser Gln Asp Glu Leu Lys Ser
405 410 415
Ile Thr Tyr Arg Met Thr Tyr Thr Asn Asn Asn Asp Tyr Gly Gln Tyr
420 425 430
Pro Cys Phe Pro Tyr Gly Val Val Leu Gly Tyr Thr Asn Asn Gln Tyr
435 440 445
Pro Ser Asn Pro Ala Tyr Gly Asn Gly Gly Asp Pro Asn Asn Gly Ser
450 455 460
Tyr Ile Asp Ser Pro Asn Thr Ser Ala Pro Phe His Thr Val Asp Ala
465 470 475 480
Ala Thr Gln Asn Thr Met Tyr Ile Asp Ala Gln Asn Met Phe Thr Asp
485 490 495
Ser Asn Pro Thr Gly Cys Asn Ile Leu Asn Tyr Gly Gly Pro Asn Gly
500 505 510
Gly Lys Ser Asn Asn Pro Thr Leu Ala Thr Gln Lys Ile Asp Thr Leu
515 520 525
Phe Pro Phe Thr Ile Asn Asn Pro Pro Gly Ser Thr Lys Asn Gly Leu
530 535 540
Gly Arg Leu Gly Val Met Ala Ser Leu Val Pro Tyr Asn Leu Ser Pro
545 550 555 560
Asn Asn Val Phe Gly Glu Phe Asp Ser Asp Thr Gln Ala Ile Ile Ala
565 570 575
Lys Gly Phe Pro Ala Glu Lys Gly Tyr Ile Asp Asn Gly Ser Pro Val
580 585 590
Ser Val Val Lys Glu Trp Val Asn Gly Ala Asn Ala Val Gln Leu Pro
595 600 605
Ala Trp Asn Thr Phe Lys Ile Thr Ala Thr Asn Leu Ala Ala Gly Gln
610 615 620
Tyr Arg Ile Arg Val Arg Tyr Ala Asn Pro Gly Pro Asp Leu Leu Leu
625 630 635 640
His Gln Tyr Val Tyr Ala Gly Asp Asn Glu Val Gln Gly Gly Ala Trp
645 650 655
Thr Phe Lys Ser Thr Thr Asp Ser Asn Val Asn Thr Asn Phe Pro Asn
660 665 670
Gln Val Tyr Val Thr Gly Gln Gln Gly Asn Tyr Val Leu Glu Asp Ile
675 680 685
Thr Trp Pro Met Gly Gly Gly Pro Ser Asp Pro Leu Thr Leu Pro Ala
690 695 700
Gly Asp Val Thr Val Gln Leu Phe Leu Gly Asp Phe Ser Gln Gln Gly
705 710 715 720
Gln Met Thr Gln Val Phe Ile Asp Arg Ile Glu Phe Val Pro Val Gly
725 730 735
Ala Thr Phe Pro Ser Thr Ile Pro Ile Ser Val Asn Ala Gln Tyr Asn
740 745 750
Gln Gly Ser Val Leu Leu Trp Gln Ala Pro Ser Ser Ser Tyr Phe Ile
755 760 765
Tyr Asn Phe Asp Ile Thr Gly Thr Leu Tyr Gly Ser Gln Phe Thr Ser
770 775 780
Val Phe Phe Asp Leu Glu Asn Pro Gln Gly Ser Ser Gly Ile Val Pro
785 790 795 800
Gly Ile Asn Gln Ser Ile Thr Leu Asn Pro Asn Gly Thr Asp Ile Ser
805 810 815
Tyr Lys Asn Leu Thr Ala Asn Leu Asn Ser His Gly Gly Phe Asn Leu
820 825 830
Met Arg Met Glu Gly Ala Gly Ser Glu Asp Phe Gly Ser Asn Ile Thr
835 840 845
Gly Asn Leu Thr Ile Thr Ile His Lys Asp Ser Thr Asn Ser
850 855 860
<210> 54
<211> 735
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 54
Met Val Phe Leu Pro Thr Ile Thr Cys Ile Ser Arg Arg Tyr Phe Met
1 5 10 15
Ala Gln Leu Gln Glu Leu Gln Ile Gln Pro Val Ile Pro Tyr Asn Val
20 25 30
Leu Ala Ser Pro Pro Met Gly Asn Val Asp Asp Leu Pro Thr Leu Ala
35 40 45
Glu Glu Leu Lys Gln Ala Trp Glu Ser Phe Gln Lys Thr Gly Asn Leu
50 55 60
Asn Phe Thr Ala Phe Gln Gln Gly Leu Ala Ala Ala Gly Gly Gly Ser
65 70 75 80
Phe Asn Tyr Leu Ala Leu Leu Gln Ala Ala Ile Gly Leu Ala Gly Thr
85 90 95
Val Gly Ala Glu Ile Pro Gly Val Ala Ile Ala Ala Pro Leu Val Ser
100 105 110
Ile Leu Leu Gly Phe Leu Trp Pro Asn Lys Gln Lys Ser Asp Ile Lys
115 120 125
Gln Leu Ile Thr Val Ile Asp Ala Glu Val Lys Arg Ile Leu Asn Gln
130 135 140
Glu Leu Thr Asp Tyr His Ser Gln Glu Val Gln Gly Tyr Leu Glu Gly
145 150 155 160
Phe Phe Asp Thr Met Thr Asn Pro Ala Thr Ser Pro Asp Ile Lys Ile
165 170 175
Asn Glu Ser Ile Phe Thr Gly Met Pro Gly Asp Pro Asn Arg Thr Pro
180 185 190
Lys Asp Val Asp Ala Thr Ala Tyr Asp Ala Val Val Asp Arg Phe Leu
195 200 205
Thr Ala Asn Val Ser Phe Ile Ile Asp Leu Asp Gln Phe Leu Thr Gly
210 215 220
Lys Phe Gly Thr Asn Asn Asp Val Asn Phe Asp Val Ala Ser Leu Pro
225 230 235 240
Tyr Tyr Val Ile Gly Ala Thr Leu Gln Leu Met Ser Tyr His Ser Val
245 250 255
Ile Asn Phe Met Thr Ala Trp Phe Pro Lys Ile Trp Pro Gln Tyr Thr
260 265 270
Thr Glu Asp Ser Arg Tyr Lys Asp Ile Leu Asn Ala Lys Gln Ala Met
275 280 285
Arg Met Ala Ile Arg Asp Asn Thr Asn Lys Val Leu Thr Ile Val Gln
290 295 300
Ala Asn Leu Pro Ser Leu Gly Ser Thr Arg Asn Ser Leu Asn Asp Tyr
305 310 315 320
Asn Arg Tyr Ala Arg Thr Met Gln Leu Thr Cys Leu Asp Thr Val Ala
325 330 335
Gln Trp Pro Thr Leu Tyr Pro Asp Asp Tyr Pro Val Ser Thr Thr Leu
340 345 350
Glu Gln Thr Arg Arg Ile Phe Leu Asp Thr Ala Gly Ile Asp Glu Arg
355 360 365
Lys Asp Ser Asn Gly Lys Tyr Thr Asn Asp Ser Thr Ile Thr Ala Leu
370 375 380
Tyr Asn Ile Leu Asp Gly Asn Ser Tyr Asn Ser His Asn Asn Val Gly
385 390 395 400
Ile Asn Gly Ile Asn Ser Leu Leu Tyr Ser Gln Asp Glu Leu Lys Ser
405 410 415
Ile Thr Tyr Arg Met Thr Tyr Thr Asn Asn Asn Asp Tyr Gly Gln Tyr
420 425 430
Pro Cys Phe Pro Tyr Gly Val Val Leu Gly Tyr Thr Asn Asn Gln Tyr
435 440 445
Pro Ser Asn Pro Ala Tyr Gly Asn Gly Gly Asp Pro Asn Asn Gly Ser
450 455 460
Tyr Ile Asp Ser Pro Asn Thr Ser Ala Pro Phe His Thr Val Asp Ala
465 470 475 480
Ala Thr Gln Asn Thr Met Tyr Ile Asp Ala Gln Asn Met Phe Thr Asp
485 490 495
Ser Asn Pro Thr Gly Cys Asn Ile Leu Asn Tyr Gly Gly Pro Asn Gly
500 505 510
Gly Lys Ser Asn Asn Pro Thr Leu Ala Thr Gln Lys Ile Asp Thr Leu
515 520 525
Phe Pro Phe Thr Ile Asn Asn Pro Pro Gly Ser Thr Lys Asn Gly Leu
530 535 540
Gly Arg Leu Gly Val Met Ala Ser Leu Val Pro Tyr Asn Leu Ser Pro
545 550 555 560
Asn Asn Val Phe Gly Glu Phe Asp Ser Asp Thr Gln Ala Ile Ile Ala
565 570 575
Lys Gly Phe Pro Ala Glu Lys Gly Tyr Ile Asp Asn Gly Ser Pro Val
580 585 590
Ser Val Val Lys Glu Trp Val Asn Gly Ala Asn Ala Val Gln Leu Pro
595 600 605
Ala Trp Asn Thr Phe Lys Ile Thr Ala Thr Asn Leu Ala Ala Gly Gln
610 615 620
Tyr Arg Ile Arg Val Arg Tyr Ala Asn Pro Gly Pro Asp Leu Leu Leu
625 630 635 640
His Gln Tyr Val Tyr Ala Gly Asp Asn Glu Val Gln Gly Gly Ala Trp
645 650 655
Thr Phe Lys Ser Thr Thr Asp Ser Asn Val Asn Thr Asn Phe Pro Asn
660 665 670
Gln Val Tyr Val Thr Gly Gln Gln Gly Asn Tyr Val Leu Glu Asp Ile
675 680 685
Thr Trp Pro Met Gly Gly Gly Pro Ser Asp Pro Leu Thr Leu Pro Ala
690 695 700
Gly Asp Val Thr Val Gln Leu Phe Leu Gly Asp Phe Ser Gln Gln Gly
705 710 715 720
Gln Met Thr Gln Val Phe Ile Asp Arg Ile Glu Phe Val Pro Val
725 730 735
<210> 55
<211> 888
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 55
Met Ala Thr Val Ser Glu Leu Tyr Pro Val Pro Tyr Asn Val Leu Ala
1 5 10 15
Ile Ser Pro Ser Arg Leu Ser Ser Asn Trp Asp Glu Phe Gln Asp Ile
20 25 30
Phe Asn Gly Val Lys Glu Ala Phe Gly Glu Phe Gln Lys Thr Gly Gln
35 40 45
Leu Gln Lys Glu Ala Ile Gln Gln Gly Trp Asn Ala Tyr Arg Glu Gly
50 55 60
Lys Ile Asp Tyr Leu Ala Leu Val Lys Ala Ser Leu Ser Ile Val Gly
65 70 75 80
Leu Ile Val Pro Gly Gly Glu Ala Ala Val Pro Phe Ile Gly Met Phe
85 90 95
Leu Asp Phe Val Trp Pro Lys Leu Phe Gly Gly Ala Ser Asn Asp Glu
100 105 110
Thr Thr Leu Leu Asn Val Ile Asn Asp Val Val Asn Gln Ile Leu Asp
115 120 125
Lys Arg Leu Ser Glu Gln Gln Leu Gln Thr Val Asn Asn Val Leu Asn
130 135 140
Gly Phe Gln Thr Gln Met Leu Asp Leu Asn Arg Lys Ile Leu Ser Ala
145 150 155 160
Thr Phe Asp Ala Thr Thr Gln Lys Pro Arg Thr Pro Ser Ala Ser Asp
165 170 175
Met Ile Asn Val Tyr Asp Glu Phe Asn Leu Glu Gln Gly Leu Ile His
180 185 190
Asn Asp Leu Tyr Glu Phe Ile Leu Lys Asp Tyr Glu Asp Ile Thr Leu
195 200 205
Pro Met Tyr Val Ile Ala Ile Thr Tyr Ile Gly Lys Val Met Ser Tyr
210 215 220
Gln Ala Phe Ile Gln Phe Ala Asn Gln Trp Ile Asp Thr Val Tyr Pro
225 230 235 240
Asp Thr Thr Ser Gly Glu Gly Tyr Thr Phe Lys Thr Asn Leu Asp Ala
245 250 255
Ala Lys Thr Lys Met Gln Asp Asp Ile Asp Thr Ala Ser Gln His Val
260 265 270
Leu Thr Val Phe Gln Asp His Met Val Pro Ala Gly Val Asn Lys Leu
275 280 285
Gln His Asn Leu His Asn Gln Tyr Val Asn Thr Met Val Leu Gln Cys
290 295 300
Phe Asp Phe Val Ala Met Trp Pro Thr Leu Tyr Pro Asp Val Tyr Pro
305 310 315 320
Ala Asn Thr Ser Leu Asp Leu Thr Arg Val Leu Phe Ser Asp Ile Val
325 330 335
Gly Pro Asp Glu Val His Asp Gly Asn Val Thr Leu Tyr Asn Ile Phe
340 345 350
Asp Asn Pro Gln Gly Tyr Thr His Gly Ser Ile Asn Met Glu Asp Ile
355 360 365
Leu Tyr Leu Arg Lys Glu Leu Glu Gln Val Arg Ile Phe Gln His Glu
370 375 380
Ser Gly Thr Asn Cys Trp Ala Tyr Gly Ile Gly Leu Lys Tyr Ala Gly
385 390 395 400
Asp Pro Asn Ile Tyr Met Tyr Ser Pro Ser Ser Phe Asp Pro Ser Leu
405 410 415
Thr Val Pro Ser Thr Val Gln Ala Pro Ile Ile Val Val Asn Ala Ser
420 425 430
Thr Gln Tyr Thr Lys Gly Leu Leu Asp Lys Glu Ser Ile Gly Ile Leu
435 440 445
Ala Asp Asn Gly Asp Asn Ala Gly Thr Tyr Cys Pro Leu Pro Gly His
450 455 460
Asp Gly Val Glu Gly Tyr Gly Arg Ser His Asn Ser Pro Leu Ala Asn
465 470 475 480
Gln Lys Ile Asn Ala Leu Tyr Pro Val Thr Ala Glu His Val Ala Gly
485 490 495
Asp Gln Arg Lys Leu Gly Leu Ile Ala Thr His Val Pro Phe Asp Leu
500 505 510
Val Pro Gln Asn Ile Ile Gly Gln Thr Asp Thr Asp Glu Thr Ile Ser
515 520 525
Val Arg Gly Phe Pro Ala Glu Lys Gly Thr Ile Asp Asn Ile Gly Ser
530 535 540
Leu Gln Leu Val Pro Glu His Ile Asn Gly Ala Asn Ala Val Lys Leu
545 550 555 560
Asn Phe Gln Gln Ile Leu Ala Ile Pro Ile Thr Ser Val Thr Ser Gly
565 570 575
Tyr Tyr Phe Ile Arg Ile Arg Tyr Ala Ser Ser Ser Asp Ile Thr Gly
580 585 590
Tyr Phe His Val Gln Thr Pro Ala Gly Asp Ser Asn Arg Gly Ala Ile
595 600 605
Thr Phe Pro Asn Thr Gln Asn Met Glu Asn Thr Ile Asp Lys Met Tyr
610 615 620
Val Thr Gly Ala Asn Gly Lys Tyr Thr Leu Leu Thr Val Thr Gln Ala
625 630 635 640
Ile Lys Ile Pro Ser Gly Asn Ser Thr Ile Tyr Ile Gln Asn Asn Ser
645 650 655
Asn Ala Asp Phe Phe Leu Asp Arg Ile Glu Val Ile Pro Ile Thr Ala
660 665 670
Ser Gln Leu Pro Ala Pro Ser Ser Ala Asn Gln Phe Thr Leu Val Gly
675 680 685
Pro Tyr Thr Val Leu Pro Glu Pro Val Gly Lys Asp Phe Val Ile Trp
690 695 700
Gln Thr Ser Gln Thr Cys Ala Tyr Thr Pro Asn Ser Thr Leu Ser Phe
705 710 715 720
Thr Ile Leu Gly Ser Gly Glu Phe Gln Ala Leu Asp Lys Asn Asn Asn
725 730 735
Ile Ile Ala Arg Arg Val Glu Asn Gln Asn Asn Gln Thr Thr Glu Thr
740 745 750
Trp Asn Leu Pro Gln Asn Val Glu Lys Ile Arg Phe Val Ala Asn Asp
755 760 765
Tyr Val Val Leu Arg Asn Ile Met Gly Lys Ile Asn Cys Gln Glu Pro
770 775 780
Ile Lys Pro Cys Thr Leu Gly Gly Gln Thr Leu Val Asp Ile Asp Tyr
785 790 795 800
Asn Ala Asn Gly Glu Gln Val Leu Trp Ser Ser Thr Glu Pro Met Gly
805 810 815
Asn Cys Thr Val Asp Ile Val Leu Asp Ser Asp Phe Ile Ser Ser Ile
820 825 830
Ala Thr Leu Gln Phe Gln Asp Asn Thr Gly Thr Val Val Arg Ser Ile
835 840 845
Asp Phe Gly Pro Gly Glu Gln Asn Gln Thr Val Ser Val Ala Ser Thr
850 855 860
Thr Lys Ile Val Leu Lys Pro Thr Thr Phe Gly Pro Ile Ser Gly His
865 870 875 880
Leu Lys Ile Gln Val Val Thr Asn
885
<210> 56
<211> 670
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 56
Met Ala Thr Val Ser Glu Leu Tyr Pro Val Pro Tyr Asn Val Leu Ala
1 5 10 15
Ile Ser Pro Ser Arg Leu Ser Ser Asn Trp Asp Glu Phe Gln Asp Ile
20 25 30
Phe Asn Gly Val Lys Glu Ala Phe Gly Glu Phe Gln Lys Thr Gly Gln
35 40 45
Leu Gln Lys Glu Ala Ile Gln Gln Gly Trp Asn Ala Tyr Arg Glu Gly
50 55 60
Lys Ile Asp Tyr Leu Ala Leu Val Lys Ala Ser Leu Ser Ile Val Gly
65 70 75 80
Leu Ile Val Pro Gly Gly Glu Ala Ala Val Pro Phe Ile Gly Met Phe
85 90 95
Leu Asp Phe Val Trp Pro Lys Leu Phe Gly Gly Ala Ser Asn Asp Glu
100 105 110
Thr Thr Leu Leu Asn Val Ile Asn Asp Val Val Asn Gln Ile Leu Asp
115 120 125
Lys Arg Leu Ser Glu Gln Gln Leu Gln Thr Val Asn Asn Val Leu Asn
130 135 140
Gly Phe Gln Thr Gln Met Leu Asp Leu Asn Arg Lys Ile Leu Ser Ala
145 150 155 160
Thr Phe Asp Ala Thr Thr Gln Lys Pro Arg Thr Pro Ser Ala Ser Asp
165 170 175
Met Ile Asn Val Tyr Asp Glu Phe Asn Leu Glu Gln Gly Leu Ile His
180 185 190
Asn Asp Leu Tyr Glu Phe Ile Leu Lys Asp Tyr Glu Asp Ile Thr Leu
195 200 205
Pro Met Tyr Val Ile Ala Ile Thr Tyr Ile Gly Lys Val Met Ser Tyr
210 215 220
Gln Ala Phe Ile Gln Phe Ala Asn Gln Trp Ile Asp Thr Val Tyr Pro
225 230 235 240
Asp Thr Thr Ser Gly Glu Gly Tyr Thr Phe Lys Thr Asn Leu Asp Ala
245 250 255
Ala Lys Thr Lys Met Gln Asp Asp Ile Asp Thr Ala Ser Gln His Val
260 265 270
Leu Thr Val Phe Gln Asp His Met Val Pro Ala Gly Val Asn Lys Leu
275 280 285
Gln His Asn Leu His Asn Gln Tyr Val Asn Thr Met Val Leu Gln Cys
290 295 300
Phe Asp Phe Val Ala Met Trp Pro Thr Leu Tyr Pro Asp Val Tyr Pro
305 310 315 320
Ala Asn Thr Ser Leu Asp Leu Thr Arg Val Leu Phe Ser Asp Ile Val
325 330 335
Gly Pro Asp Glu Val His Asp Gly Asn Val Thr Leu Tyr Asn Ile Phe
340 345 350
Asp Asn Pro Gln Gly Tyr Thr His Gly Ser Ile Asn Met Glu Asp Ile
355 360 365
Leu Tyr Leu Arg Lys Glu Leu Glu Gln Val Arg Ile Phe Gln His Glu
370 375 380
Ser Gly Thr Asn Cys Trp Ala Tyr Gly Ile Gly Leu Lys Tyr Ala Gly
385 390 395 400
Asp Pro Asn Ile Tyr Met Tyr Ser Pro Ser Ser Phe Asp Pro Ser Leu
405 410 415
Thr Val Pro Ser Thr Val Gln Ala Pro Ile Ile Val Val Asn Ala Ser
420 425 430
Thr Gln Tyr Thr Lys Gly Leu Leu Asp Lys Glu Ser Ile Gly Ile Leu
435 440 445
Ala Asp Asn Gly Asp Asn Ala Gly Thr Tyr Cys Pro Leu Pro Gly His
450 455 460
Asp Gly Val Glu Gly Tyr Gly Arg Ser His Asn Ser Pro Leu Ala Asn
465 470 475 480
Gln Lys Ile Asn Ala Leu Tyr Pro Val Thr Ala Glu His Val Ala Gly
485 490 495
Asp Gln Arg Lys Leu Gly Leu Ile Ala Thr His Val Pro Phe Asp Leu
500 505 510
Val Pro Gln Asn Ile Ile Gly Gln Thr Asp Thr Asp Glu Thr Ile Ser
515 520 525
Val Arg Gly Phe Pro Ala Glu Lys Gly Thr Ile Asp Asn Ile Gly Ser
530 535 540
Leu Gln Leu Val Pro Glu His Ile Asn Gly Ala Asn Ala Val Lys Leu
545 550 555 560
Asn Phe Gln Gln Ile Leu Ala Ile Pro Ile Thr Ser Val Thr Ser Gly
565 570 575
Tyr Tyr Phe Ile Arg Ile Arg Tyr Ala Ser Ser Ser Asp Ile Thr Gly
580 585 590
Tyr Phe His Val Gln Thr Pro Ala Gly Asp Ser Asn Arg Gly Ala Ile
595 600 605
Thr Phe Pro Asn Thr Gln Asn Met Glu Asn Thr Ile Asp Lys Met Tyr
610 615 620
Val Thr Gly Ala Asn Gly Lys Tyr Thr Leu Leu Thr Val Thr Gln Ala
625 630 635 640
Ile Lys Ile Pro Ser Gly Asn Ser Thr Ile Tyr Ile Gln Asn Asn Ser
645 650 655
Asn Ala Asp Phe Phe Leu Asp Arg Ile Glu Val Ile Pro Ile
660 665 670
<210> 57
<211> 830
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 57
Met Asn Ser Leu Gln Thr Leu Gln Ala Gln Pro Ile Ile Pro Tyr Asn
1 5 10 15
Val Leu Ala Asn Pro Leu Ser Gly Asn Ala Asp Ala Gln Pro Gly Ser
20 25 30
Leu Gly Asp Leu Ile Ala Ser Leu Lys Glu Ala Trp Val Glu Phe Gln
35 40 45
Lys Thr Gly Ser Asp Lys Leu Leu Gln Ser Val Leu Gln Asn Gly Phe
50 55 60
Ser Ala Ala Ser Gly Gly Ser Phe Asn Tyr Leu Ala Val Leu Gln Ala
65 70 75 80
Val Ile Gly Val Leu Ser Thr Val Leu Gly Ala Glu Ile Pro Gly Val
85 90 95
Ala Val Ala Ala Pro Ile Leu Ser Met Val Ile Gly Trp Ile Trp Pro
100 105 110
Ser Lys Lys Lys Asp Glu Thr Gln Gln Leu Ile Asn Leu Ile Asp Ala
115 120 125
Glu Ile Gln Lys Gln Leu Asn Gln Ala Leu Ser Asn Gln Asp Lys Asn
130 135 140
Asp Trp Thr Gly Tyr Leu Asn Ala Ile Phe Gln Ile Ser His Asp Ala
145 150 155 160
Ala Arg Ala Val Val Asp Ala Gln Phe Thr Gly Ser Glu Gly Asp Thr
165 170 175
Asn Arg Gln Pro Arg Thr Pro Gly Val Ser Asp Tyr Glu Asn Val Tyr
180 185 190
Asn His Leu Leu Ala Thr Thr Gly Ser Leu Ile Val Ala Leu Ser Gln
195 200 205
Met Ile Asn Gly Asn Phe Asp Thr Leu Ala Ile Pro Phe Phe Val Ile
210 215 220
Gly Ala Thr Val Gln Leu Ser Thr Tyr Gln Thr Phe Ile Gln Phe Ala
225 230 235 240
Asn Lys Trp Leu Pro Ile Val Tyr Pro Asp Tyr Gln Thr Gln Gly Thr
245 250 255
Ala Gly Tyr Thr Gln Gln Gln Asn Leu Ile Asn Ala Lys Ser Asp Met
260 265 270
Arg Ala Ala Ile His Asp His Thr Gln Lys Val Phe Asn Ala Phe Lys
275 280 285
Thr Gly Met Pro Ser Leu Gly Ser Asp Lys Asn Ser Val Asn Ala Tyr
290 295 300
Asn Arg Tyr Val Arg Gly Met Val Leu Asn Gly Leu Asp Met Leu Ala
305 310 315 320
Thr Trp Pro Ser Met Tyr Pro Asp Asp Tyr Pro Ser Gln Thr Glu Leu
325 330 335
Glu Gln Thr Arg Val Ile Phe Ser Asp Leu Val Gly Lys Asp Gln Thr
340 345 350
Val Asn Asn Ala Val Thr Leu Ile Asn Met Val Asp Lys Ser Gly Pro
355 360 365
Asp Ala Trp Asn Gln His Ser Ser Ile Asp Ile Asn Ser Ile Ser Tyr
370 375 380
Thr Arg Arg Glu Leu Gln Gln Val Gln Phe Pro Ile His Asp Gly Asn
385 390 395 400
Arg Gly Asn Thr Thr Asn Cys Tyr Pro Tyr Ala Val Ile Leu Asn Tyr
405 410 415
Pro Asp Asn Ser Tyr Phe Tyr Gly Asp Leu Tyr Ala Pro Gln Phe Ser
420 425 430
Gly Asn Pro Thr Phe Gly Gly Asp Asn Asp Ile Leu Thr Ala Leu Asn
435 440 445
Ala Arg Thr Gln His Thr Arg Tyr Val Asp Ser Glu Ser Leu Gln Met
450 455 460
Asn Cys Tyr Pro Tyr Ala Ser Asn Asp Cys His Ile Leu Gly Tyr Cys
465 470 475 480
Thr Gly Gly Thr Cys Leu Ala Pro Ser Gly Cys Ser Asp Gly Tyr Gly
485 490 495
Lys Ser Cys Asn Glu Thr Leu Pro Asp Gln Lys Ile Asn Ala Leu Tyr
500 505 510
Pro Phe Arg Met Asp Leu Gly His Ser Gly Thr Pro Asp Lys Leu Gly
515 520 525
Val Met Ser Ser His Val Pro Phe Asn Leu Ile Pro Asn Asn Val Phe
530 535 540
Gly Ala Ile Asp Ser Asp Thr Asn Asn Ile Ile Gly Lys Gly Phe Pro
545 550 555 560
Ala Glu Lys Gly Tyr Trp Ser Asn Gly Gly Asp Arg Pro Ile Pro Ser
565 570 575
Ser Asn Ile Ala Lys Glu Trp Val Asn Gly Ala Asn Ala Val Lys Val
580 585 590
Glu Tyr Gly Ala Phe Leu Ala Met Lys Ala Thr Asn Met Lys Thr Gly
595 600 605
Lys Tyr Tyr Ile Arg Val Arg Tyr Ala Asn Pro Ser Asn Lys Asp Val
610 615 620
Asn Met Trp Gln Glu Val Trp Ala Gly Asn Gln Lys Leu Gln Gly Gly
625 630 635 640
Gly Trp Thr Phe Lys Ser Thr Ser Asp Asp Asn Val Ala Asp Asn Phe
645 650 655
Pro Lys Gln Val Tyr Val Thr Gly Gln Gln Gly Asp Pro Leu Asn Leu
660 665 670
Pro Ser Gly Glu Ile Met Val Lys Leu Ser Gly Gln Asn Ser Gly Asp
675 680 685
Ser Ile Tyr Val Asp Arg Ile Glu Phe Ile Pro Ile Ser Glu Thr Glu
690 695 700
Asn Ile Asn Tyr Met Ile Thr Ser Thr Val Pro Leu Leu Pro Ser Gly
705 710 715 720
Gln Tyr Val Pro Ser Leu Ser Asn Tyr Pro Thr Ile Trp Thr Ala Asp
725 730 735
Ser Gly Gln Gln Ala Ile Ser Ala Thr Leu Thr Phe Ser Gly Leu Asn
740 745 750
Ser Thr Leu Phe Leu Leu Ala Lys Thr Asn Pro Gly Asp Asp Asn Asp
755 760 765
Glu Asn Asn Trp Asp Trp Met Cys Pro Asp Gly Phe Leu Gly Ser Val
770 775 780
Leu Asn Gly Thr Tyr Thr Phe Pro Ile Asn Asn His Asp Ser Ala Cys
785 790 795 800
Ala Lys Lys Pro Phe Thr Ala Ile Lys Ile Gly Ala Glu Leu Ile Pro
805 810 815
Val Ser Ala Gly Thr Ile Thr Gly Ser Ile Thr His Gln Arg
820 825 830
<210> 58
<211> 700
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 58
Met Asn Ser Leu Gln Thr Leu Gln Ala Gln Pro Ile Ile Pro Tyr Asn
1 5 10 15
Val Leu Ala Asn Pro Leu Ser Gly Asn Ala Asp Ala Gln Pro Gly Ser
20 25 30
Leu Gly Asp Leu Ile Ala Ser Leu Lys Glu Ala Trp Val Glu Phe Gln
35 40 45
Lys Thr Gly Ser Asp Lys Leu Leu Gln Ser Val Leu Gln Asn Gly Phe
50 55 60
Ser Ala Ala Ser Gly Gly Ser Phe Asn Tyr Leu Ala Val Leu Gln Ala
65 70 75 80
Val Ile Gly Val Leu Ser Thr Val Leu Gly Ala Glu Ile Pro Gly Val
85 90 95
Ala Val Ala Ala Pro Ile Leu Ser Met Val Ile Gly Trp Ile Trp Pro
100 105 110
Ser Lys Lys Lys Asp Glu Thr Gln Gln Leu Ile Asn Leu Ile Asp Ala
115 120 125
Glu Ile Gln Lys Gln Leu Asn Gln Ala Leu Ser Asn Gln Asp Lys Asn
130 135 140
Asp Trp Thr Gly Tyr Leu Asn Ala Ile Phe Gln Ile Ser His Asp Ala
145 150 155 160
Ala Arg Ala Val Val Asp Ala Gln Phe Thr Gly Ser Glu Gly Asp Thr
165 170 175
Asn Arg Gln Pro Arg Thr Pro Gly Val Ser Asp Tyr Glu Asn Val Tyr
180 185 190
Asn His Leu Leu Ala Thr Thr Gly Ser Leu Ile Val Ala Leu Ser Gln
195 200 205
Met Ile Asn Gly Asn Phe Asp Thr Leu Ala Ile Pro Phe Phe Val Ile
210 215 220
Gly Ala Thr Val Gln Leu Ser Thr Tyr Gln Thr Phe Ile Gln Phe Ala
225 230 235 240
Asn Lys Trp Leu Pro Ile Val Tyr Pro Asp Tyr Gln Thr Gln Gly Thr
245 250 255
Ala Gly Tyr Thr Gln Gln Gln Asn Leu Ile Asn Ala Lys Ser Asp Met
260 265 270
Arg Ala Ala Ile His Asp His Thr Gln Lys Val Phe Asn Ala Phe Lys
275 280 285
Thr Gly Met Pro Ser Leu Gly Ser Asp Lys Asn Ser Val Asn Ala Tyr
290 295 300
Asn Arg Tyr Val Arg Gly Met Val Leu Asn Gly Leu Asp Met Leu Ala
305 310 315 320
Thr Trp Pro Ser Met Tyr Pro Asp Asp Tyr Pro Ser Gln Thr Glu Leu
325 330 335
Glu Gln Thr Arg Val Ile Phe Ser Asp Leu Val Gly Lys Asp Gln Thr
340 345 350
Val Asn Asn Ala Val Thr Leu Ile Asn Met Val Asp Lys Ser Gly Pro
355 360 365
Asp Ala Trp Asn Gln His Ser Ser Ile Asp Ile Asn Ser Ile Ser Tyr
370 375 380
Thr Arg Arg Glu Leu Gln Gln Val Gln Phe Pro Ile His Asp Gly Asn
385 390 395 400
Arg Gly Asn Thr Thr Asn Cys Tyr Pro Tyr Ala Val Ile Leu Asn Tyr
405 410 415
Pro Asp Asn Ser Tyr Phe Tyr Gly Asp Leu Tyr Ala Pro Gln Phe Ser
420 425 430
Gly Asn Pro Thr Phe Gly Gly Asp Asn Asp Ile Leu Thr Ala Leu Asn
435 440 445
Ala Arg Thr Gln His Thr Arg Tyr Val Asp Ser Glu Ser Leu Gln Met
450 455 460
Asn Cys Tyr Pro Tyr Ala Ser Asn Asp Cys His Ile Leu Gly Tyr Cys
465 470 475 480
Thr Gly Gly Thr Cys Leu Ala Pro Ser Gly Cys Ser Asp Gly Tyr Gly
485 490 495
Lys Ser Cys Asn Glu Thr Leu Pro Asp Gln Lys Ile Asn Ala Leu Tyr
500 505 510
Pro Phe Arg Met Asp Leu Gly His Ser Gly Thr Pro Asp Lys Leu Gly
515 520 525
Val Met Ser Ser His Val Pro Phe Asn Leu Ile Pro Asn Asn Val Phe
530 535 540
Gly Ala Ile Asp Ser Asp Thr Asn Asn Ile Ile Gly Lys Gly Phe Pro
545 550 555 560
Ala Glu Lys Gly Tyr Trp Ser Asn Gly Gly Asp Arg Pro Ile Pro Ser
565 570 575
Ser Asn Ile Ala Lys Glu Trp Val Asn Gly Ala Asn Ala Val Lys Val
580 585 590
Glu Tyr Gly Ala Phe Leu Ala Met Lys Ala Thr Asn Met Lys Thr Gly
595 600 605
Lys Tyr Tyr Ile Arg Val Arg Tyr Ala Asn Pro Ser Asn Lys Asp Val
610 615 620
Asn Met Trp Gln Glu Val Trp Ala Gly Asn Gln Lys Leu Gln Gly Gly
625 630 635 640
Gly Trp Thr Phe Lys Ser Thr Ser Asp Asp Asn Val Ala Asp Asn Phe
645 650 655
Pro Lys Gln Val Tyr Val Thr Gly Gln Gln Gly Asp Pro Leu Asn Leu
660 665 670
Pro Ser Gly Glu Ile Met Val Lys Leu Ser Gly Gln Asn Ser Gly Asp
675 680 685
Ser Ile Tyr Val Asp Arg Ile Glu Phe Ile Pro Ile
690 695 700
<210> 59
<211> 962
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 59
Met Ile Met Gln Met Val Thr Lys Ala Met Thr Pro Lys Leu Gly Ala
1 5 10 15
Leu Pro Asp Phe Ile Asp Asp Phe Asn Gly Ile Phe Gly Phe Met Gly
20 25 30
Asn Ile Thr Asp Val Met Ser Thr Ile Phe Gly Val Asp Thr Gly Asp
35 40 45
Ser Ser Ile Asp Asp Val Leu Asn Asn Gln Glu Leu Leu Gln Glu Met
50 55 60
Gln Ala Gln Met Gln Gln Ile Gln Glu Ser Ile Lys Asp Met Thr Asp
65 70 75 80
Lys Glu Ile Ile Thr Gln Ser Ile Glu Glu Gln Ile Leu Ala Leu Thr
85 90 95
Lys Asp Leu Ser Thr Ser Ile Thr Thr Glu Phe Glu Lys Ile Gly Asn
100 105 110
Ile Leu Thr Thr Tyr Leu Gln Ala Met Ser Gly Met Leu Lys Asp Ile
115 120 125
Tyr Ser Gln Thr Ser Val Ile Asp Gln Lys Val Asp Lys Leu Leu Ala
130 135 140
Met Met Thr Phe Ala Leu Lys Glu Leu Asp Tyr Ile Lys Asp Asn Val
145 150 155 160
Val Leu Asn Ser Ser Ile Val Glu Ile Thr Pro His Val Gln Lys Leu
165 170 175
Val Tyr Val Asn Lys Lys Phe Leu Ser Leu Thr Arg Gly Phe Leu Gln
180 185 190
Gly Glu Asp Leu Ser Ile Asp Ser Met Gln Glu Ile Gln Glu Trp Ala
195 200 205
Lys Ser Ile Leu Ala Thr Glu Met Asn Ser Phe Glu Phe Ser Val Asp
210 215 220
Thr Leu His Ser Ile Ile Ile Gly Asp Asn Leu Tyr Lys Arg Ser Ala
225 230 235 240
Leu Lys Thr Phe Ser Asp Val Leu Leu Asp Asp Ala Asp Gln Tyr Gly
245 250 255
Asn Phe Gly Thr Pro Leu Ala Lys Phe Tyr Thr Phe Phe Ser Ser Leu
260 265 270
Ala Thr Leu Gln Ile Asn Ala Tyr Leu Cys Leu Thr Phe Ala Arg Lys
275 280 285
Val Leu Gly Leu Ser Glu Ile Asp Tyr Gln Leu Ile Met Gln Asp Arg
290 295 300
Ile Glu Gln Gln Asn Gln Leu Phe Val Asn Leu Ile Gln Asp Lys Asn
305 310 315 320
Tyr Ser Asn Val Leu Glu Ile Lys Gly Val Tyr Pro Met Pro His Asn
325 330 335
Asn Glu Asp Gly Asn Ser Phe Ser Leu Gln Ala Lys Lys Gly Tyr Ala
340 345 350
Leu Ile Gly Leu Glu Phe Phe Met Asp Asn Gly Ile Tyr Lys Ala Lys
355 360 365
Ala Tyr Gln Gly Lys Ile Gly Lys Asn Phe Ser Val Tyr Ala Asp Thr
370 375 380
Val Glu Glu Ile Ile Ser Asp Asp Leu Ser Lys Val Phe Leu Asn Asn
385 390 395 400
Thr Lys Asp Phe Glu Gln Ser Tyr Lys Tyr Pro Leu Phe Gly Glu Leu
405 410 415
Lys Gly Glu Pro Asn Thr Leu Ile Thr Arg Ile Gly Phe Gly Thr Lys
420 425 430
Tyr Asp Glu Ser Lys Glu Arg Gln Ala Val Ala Tyr Ile Asp Ala Asp
435 440 445
Phe Ser Pro Tyr Glu Pro Lys Ser Gly Ser Ile Ser Thr Glu Gly Thr
450 455 460
Gln Thr Phe Gln Ile Glu Glu Thr Lys Asn Tyr Thr Tyr Cys Tyr Asp
465 470 475 480
Ala Trp Pro Ile Gly Ile Ile Gly Asp Leu Tyr Met Thr Pro Leu Lys
485 490 495
Ser Leu Ser Leu His Val Asp Gly Asp Ser Arg Lys Asn Leu Tyr Met
500 505 510
Ser Gly Glu Ser Tyr Phe Ser Thr Ile Leu Ser Arg Glu Tyr Asn Thr
515 520 525
Asn Phe Ile Leu Phe Pro Tyr Thr Asn Asn Ser Ser Pro Ile Val Glu
530 535 540
Asn Leu Ile Gln Asn Gly Asp Phe Glu Asp Gly Asp Lys Tyr Trp Glu
545 550 555 560
Val Ser Gly Asp Thr Ala Val Ile Ala Lys Gly Glu Gly Ile Tyr Gly
565 570 575
Ser Asn Ala Ile Ser Ile Lys Asn Thr Gly Asp Ala Phe Glu Pro Ala
580 585 590
Leu Lys Gln Glu Leu Asn Leu Lys Pro Tyr Thr Lys Tyr Lys Leu Thr
595 600 605
Ala Tyr Val Lys Ser Lys Thr Asn Asp Ser Gln Ala Gly Leu Ile Ala
610 615 620
Ile Lys Tyr Thr Asn Tyr Met Ile Ala Phe Ile Ser Lys Thr Phe Ser
625 630 635 640
Thr Ser Tyr Lys Gln Ile Glu Leu Lys Phe Arg Thr Gly Ala Asp Thr
645 650 655
Gln Asn Phe Tyr Val Thr Phe Glu Lys Ser Asn Thr Gly Tyr Leu Leu
660 665 670
Leu Asp Asn Ile Lys Leu His Glu Ile Pro Gln Thr Asp Asn Leu Ile
675 680 685
Asp Cys Gly Asp Phe Gly Gly Tyr Asp Tyr Thr Thr Lys Ile Asp Cys
690 695 700
Gln Tyr Tyr Glu Pro Tyr Leu Trp Glu Leu Asp Gly Gly Gly Ser Ile
705 710 715 720
Ser Asn Gly Phe Glu Glu Gly Leu Phe Gly Thr Asp Cys Leu Lys Ile
725 730 735
Ile Lys Ser Gly Gly Ala Asn Gln Lys Val Gln Leu Lys Ala Asn Thr
740 745 750
Asn Tyr Ile Leu Thr Ala Tyr Val Lys Val Asp Asp Pro Thr Thr Thr
755 760 765
Ala His Ile Gly Cys Gly Ser Asn Gln Val Thr Cys Asn Ser Thr Ser
770 775 780
Tyr Thr Leu Val Lys Val Lys Phe Lys Thr Gly Asp Asp Pro Ser Thr
785 790 795 800
Thr Glu Ser Ser Val Tyr Cys Ser Asn Pro Asn Asp Ser Gly Thr Ile
805 810 815
Trp Ala Asp Asn Phe Val Leu Cys Glu Val Pro Asn Leu Ile Val Asn
820 825 830
Gly Asp Phe Glu Gln Met Asp Leu Ser Ser Trp Ser Leu Ser Pro Ser
835 840 845
Glu Arg Gly Thr Ile Tyr Ile Gly Ile Gly Lys Gly Ile Ser Asn Ser
850 855 860
Asn Ala Ile Val Leu Gln Asp His Asn Gly Lys Ile Ser Gln Lys Leu
865 870 875 880
Pro Leu Lys Pro Ile Thr Lys Tyr Arg Leu Thr Ala Tyr Val Ser Val
885 890 895
Thr Gly Gly Gly Thr Ala Gln Ile Gly Tyr Gly Asp Asp Ser Ala Ser
900 905 910
Cys Thr Ser Asn Lys Phe Gln Gln Ile Ser Thr Asp Phe Thr Thr Gly
915 920 925
Ala Asp Pro Leu Gln Ser Asp Asp Val Ile Tyr Leu Ser Thr Asp Gly
930 935 940
Cys Thr Tyr Thr Ile Ala Asp Asn Phe Glu Leu Tyr Glu Leu Asp Gln
945 950 955 960
Ile Glu
<210> 60
<211> 860
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 60
Met Lys Asn Lys Lys Lys Tyr Met Lys Pro Leu Ala Val Gly Leu Leu
1 5 10 15
Ala Thr Asn Ile Ile Gly Phe Gly Thr Gln Thr Val Ala Phe Ala Ala
20 25 30
Thr Asp Lys Ala Pro Thr Lys Glu Gln Ala Gln Lys Gly Ser Phe Asn
35 40 45
Pro Thr Val Leu Ala Ser Met Pro Ser Asp Thr Ser Glu Leu Gln Glu
50 55 60
Ile Leu Glu Asp Ala Ile Thr Asn Pro Asn Thr Gln Ile Ser Pro Lys
65 70 75 80
Leu Val Lys Asp Leu Gln Asp Lys Gly Phe Asp Tyr Leu Ser Ile Val
85 90 95
Lys Ala Ala Thr Gly Gly Leu Val Lys Lys Ile Pro Tyr Ala Gly Ser
100 105 110
Phe Leu Ser Pro Leu Val Glu Phe Ile Phe Pro Gly Lys Lys Tyr Leu
115 120 125
Thr Lys Glu Thr Val Trp Gly Ala Ile Gln Asp Lys Val Ser Asn Leu
130 135 140
Ile Asp Glu Lys Leu Thr Glu Asn Gln Val Asn Glu Leu Ile Ala Ser
145 150 155 160
Leu Thr Gly Ile Gln Asp Asn Leu Lys Lys Tyr Gln Val Ala Val Gly
165 170 175
Leu Val Asn Gly Lys Glu Pro Pro Ile Asp Lys Ser Ile Gln Met Asn
180 185 190
Ala Glu Thr Asp Arg Thr Lys Glu Asp Leu Arg Gly Tyr Ile Asp His
195 200 205
Leu Asp Ser Asp Leu Gly Lys Glu Val Pro Lys Phe Ala Val Lys Asn
210 215 220
Tyr Glu Ala Ala Ser Ile Pro Tyr Tyr Val Gln Ile Ala Asn Ile His
225 230 235 240
Leu Phe Leu Leu Arg Asp Ala Val Thr His Ala Asp Glu Trp Gly Leu
245 250 255
Thr Ala Lys Glu Lys Asn Thr Tyr Leu Ser Arg Leu Gln Ser Lys Ile
260 265 270
Ile Glu Tyr Ser Asn Thr Val Tyr Asp Ser Phe Asn Lys Gly Val Ala
275 280 285
Ala Ala Lys Asn Lys Asp Gly Asn Trp Asp Asn Val Asn Lys Phe Val
290 295 300
Arg Thr Met Thr Val Tyr Gly Leu Asp Phe Val Ala Leu Trp Pro Thr
305 310 315 320
Phe Asp Pro Ser Arg Tyr Asp Glu Pro Thr Lys Leu Gln Gln Thr Arg
325 330 335
Gln Val Tyr Ser Asp Leu Ile Gly Asn Pro Glu Ala Gly Ser Asn Tyr
340 345 350
Asp Thr Leu Leu Pro Gln Ile His Ser Ser Ile Phe Ala Gly Tyr Pro
355 360 365
Gly Glu Leu Lys Gln Phe Asn Val Ser Gln Ala Asp Arg Ile Asp Ser
370 375 380
Ile Lys Glu Val Phe Asp Trp Thr Gly Asp Gly Ser Gln Asp Tyr Thr
385 390 395 400
Gln Gln Leu Gly Asn Pro Asn Pro Ser Gly Tyr Ser Val Arg Asn Val
405 410 415
Thr Arg Asp Ala Pro Val Ile Gly Leu Ser Ala Tyr Lys Ser Trp Asn
420 425 430
Asn Asn Trp Tyr Asn Met Phe Ser Leu Ser Tyr Pro Gly Lys Glu Val
435 440 445
Asp Phe Gln Ser Arg Phe Arg Gln Ala Leu Arg Asp Gly Tyr Val Thr
450 455 460
Lys Thr Ser Ala Pro Ser Gly Gln Lys Val Ser Asn Ile Lys Ala Ala
465 470 475 480
Glu Thr Gly Lys Gly Lys Gly Thr Ile Ser Ser Met Val Ala Ala Tyr
485 490 495
Ile Pro Glu Glu Val His Pro Glu Asn Ile Leu Ala Ala Arg Ser Ile
500 505 510
Thr Gly Ile Pro Ala Glu Lys Tyr Asn Ser Arg Ser Ala Val Asp Asn
515 520 525
Ala Ile Glu Tyr Thr Asn Gly Ser Asn Ala Met Val Phe Thr Gln Asn
530 535 540
Gly Ser Ser Ile Thr Tyr Asn Ile Gln Ser Pro Glu Lys Arg Lys Tyr
545 550 555 560
Lys Ile Arg Leu Arg Val Ala Thr Asn Ser Asp Thr Ser Val Gly Ile
565 570 575
Ser Val Asn Gly Asn Ala Gln Gln Met Asn Ile Glu Asn Thr Glu Ala
580 585 590
Lys Ala Thr Asp Arg Thr Gly Ile Lys Gly Val Asn Gly Thr Tyr Thr
595 600 605
Val Ile Glu Gly Pro Thr Val Glu Leu Gln Glu Gly Lys Asn Thr Ile
610 615 620
Thr Ile Asp His Lys Asp Ala Asn Lys Leu Val Leu Asp Arg Ile Glu
625 630 635 640
Phe Glu His Gln Pro Val Ala Pro Glu His Gly Asn Pro Gly Trp Gln
645 650 655
Thr Ile Asp Gly Lys Lys Tyr Leu Tyr Gly Lys Asp Gly Lys Leu Glu
660 665 670
Met Asn Ser Phe Gln Met Met Asp Gly Lys Gln Val Tyr Leu Asn Asp
675 680 685
Asp Gly Ala Met Val Lys Gly Trp Lys Thr Ile Asn Arg Glu Lys Tyr
690 695 700
Tyr Phe Asn Lys Thr Gly Asp Gly Ser Gly Met Glu Arg Glu Gly Glu
705 710 715 720
Val Ala Ile Gly Trp Lys Thr Ile Asn Gly Val Lys Tyr Tyr Phe Asn
725 730 735
Lys Thr Gly Asp Gly Ser Gly Met Glu Arg Glu Gly Ile Leu Ala Thr
740 745 750
Gly Trp Lys Thr Ile Asn Gly Val Lys Tyr Tyr Phe Asn Lys Thr Gly
755 760 765
Asp Gly Thr Gly Ser Asp His Glu Gly Glu Met Glu Ile Gly Trp Lys
770 775 780
Thr Ile Glu Gly Val Lys Tyr Tyr Leu Asp Pro Gln Asn Gly Lys Leu
785 790 795 800
Val Thr Gly Trp Lys Thr Ile Glu Gly Val Lys Tyr Tyr Phe Asn Arg
805 810 815
Ile Gly Asp Gly Ser Gly Met Thr His Glu Gly Glu Met Ala Ile Gly
820 825 830
Asn Met Thr Ile Asp Gly Val Lys His Tyr Phe Asn Lys Thr Gly Asp
835 840 845
Gly Thr Gly Tyr Asn Tyr Glu Gly Glu Leu Glu Trp
850 855 860
<210> 61
<211> 830
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 61
Met Ala Thr Asp Lys Ala Pro Thr Lys Glu Gln Ala Gln Lys Gly Ser
1 5 10 15
Phe Asn Pro Thr Val Leu Ala Ser Met Pro Ser Asp Thr Ser Glu Leu
20 25 30
Gln Glu Ile Leu Glu Asp Ala Ile Thr Asn Pro Asn Thr Gln Ile Ser
35 40 45
Pro Lys Leu Val Lys Asp Leu Gln Asp Lys Gly Phe Asp Tyr Leu Ser
50 55 60
Ile Val Lys Ala Ala Thr Gly Gly Leu Val Lys Lys Ile Pro Tyr Ala
65 70 75 80
Gly Ser Phe Leu Ser Pro Leu Val Glu Phe Ile Phe Pro Gly Lys Lys
85 90 95
Tyr Leu Thr Lys Glu Thr Val Trp Gly Ala Ile Gln Asp Lys Val Ser
100 105 110
Asn Leu Ile Asp Glu Lys Leu Thr Glu Asn Gln Val Asn Glu Leu Ile
115 120 125
Ala Ser Leu Thr Gly Ile Gln Asp Asn Leu Lys Lys Tyr Gln Val Ala
130 135 140
Val Gly Leu Val Asn Gly Lys Glu Pro Pro Ile Asp Lys Ser Ile Gln
145 150 155 160
Met Asn Ala Glu Thr Asp Arg Thr Lys Glu Asp Leu Arg Gly Tyr Ile
165 170 175
Asp His Leu Asp Ser Asp Leu Gly Lys Glu Val Pro Lys Phe Ala Val
180 185 190
Lys Asn Tyr Glu Ala Ala Ser Ile Pro Tyr Tyr Val Gln Ile Ala Asn
195 200 205
Ile His Leu Phe Leu Leu Arg Asp Ala Val Thr His Ala Asp Glu Trp
210 215 220
Gly Leu Thr Ala Lys Glu Lys Asn Thr Tyr Leu Ser Arg Leu Gln Ser
225 230 235 240
Lys Ile Ile Glu Tyr Ser Asn Thr Val Tyr Asp Ser Phe Asn Lys Gly
245 250 255
Val Ala Ala Ala Lys Asn Lys Asp Gly Asn Trp Asp Asn Val Asn Lys
260 265 270
Phe Val Arg Thr Met Thr Val Tyr Gly Leu Asp Phe Val Ala Leu Trp
275 280 285
Pro Thr Phe Asp Pro Ser Arg Tyr Asp Glu Pro Thr Lys Leu Gln Gln
290 295 300
Thr Arg Gln Val Tyr Ser Asp Leu Ile Gly Asn Pro Glu Ala Gly Ser
305 310 315 320
Asn Tyr Asp Thr Leu Leu Pro Gln Ile His Ser Ser Ile Phe Ala Gly
325 330 335
Tyr Pro Gly Glu Leu Lys Gln Phe Asn Val Ser Gln Ala Asp Arg Ile
340 345 350
Asp Ser Ile Lys Glu Val Phe Asp Trp Thr Gly Asp Gly Ser Gln Asp
355 360 365
Tyr Thr Gln Gln Leu Gly Asn Pro Asn Pro Ser Gly Tyr Ser Val Arg
370 375 380
Asn Val Thr Arg Asp Ala Pro Val Ile Gly Leu Ser Ala Tyr Lys Ser
385 390 395 400
Trp Asn Asn Asn Trp Tyr Asn Met Phe Ser Leu Ser Tyr Pro Gly Lys
405 410 415
Glu Val Asp Phe Gln Ser Arg Phe Arg Gln Ala Leu Arg Asp Gly Tyr
420 425 430
Val Thr Lys Thr Ser Ala Pro Ser Gly Gln Lys Val Ser Asn Ile Lys
435 440 445
Ala Ala Glu Thr Gly Lys Gly Lys Gly Thr Ile Ser Ser Met Val Ala
450 455 460
Ala Tyr Ile Pro Glu Glu Val His Pro Glu Asn Ile Leu Ala Ala Arg
465 470 475 480
Ser Ile Thr Gly Ile Pro Ala Glu Lys Tyr Asn Ser Arg Ser Ala Val
485 490 495
Asp Asn Ala Ile Glu Tyr Thr Asn Gly Ser Asn Ala Met Val Phe Thr
500 505 510
Gln Asn Gly Ser Ser Ile Thr Tyr Asn Ile Gln Ser Pro Glu Lys Arg
515 520 525
Lys Tyr Lys Ile Arg Leu Arg Val Ala Thr Asn Ser Asp Thr Ser Val
530 535 540
Gly Ile Ser Val Asn Gly Asn Ala Gln Gln Met Asn Ile Glu Asn Thr
545 550 555 560
Glu Ala Lys Ala Thr Asp Arg Thr Gly Ile Lys Gly Val Asn Gly Thr
565 570 575
Tyr Thr Val Ile Glu Gly Pro Thr Val Glu Leu Gln Glu Gly Lys Asn
580 585 590
Thr Ile Thr Ile Asp His Lys Asp Ala Asn Lys Leu Val Leu Asp Arg
595 600 605
Ile Glu Phe Glu His Gln Pro Val Ala Pro Glu His Gly Asn Pro Gly
610 615 620
Trp Gln Thr Ile Asp Gly Lys Lys Tyr Leu Tyr Gly Lys Asp Gly Lys
625 630 635 640
Leu Glu Met Asn Ser Phe Gln Met Met Asp Gly Lys Gln Val Tyr Leu
645 650 655
Asn Asp Asp Gly Ala Met Val Lys Gly Trp Lys Thr Ile Asn Arg Glu
660 665 670
Lys Tyr Tyr Phe Asn Lys Thr Gly Asp Gly Ser Gly Met Glu Arg Glu
675 680 685
Gly Glu Val Ala Ile Gly Trp Lys Thr Ile Asn Gly Val Lys Tyr Tyr
690 695 700
Phe Asn Lys Thr Gly Asp Gly Ser Gly Met Glu Arg Glu Gly Ile Leu
705 710 715 720
Ala Thr Gly Trp Lys Thr Ile Asn Gly Val Lys Tyr Tyr Phe Asn Lys
725 730 735
Thr Gly Asp Gly Thr Gly Ser Asp His Glu Gly Glu Met Glu Ile Gly
740 745 750
Trp Lys Thr Ile Glu Gly Val Lys Tyr Tyr Leu Asp Pro Gln Asn Gly
755 760 765
Lys Leu Val Thr Gly Trp Lys Thr Ile Glu Gly Val Lys Tyr Tyr Phe
770 775 780
Asn Arg Ile Gly Asp Gly Ser Gly Met Thr His Glu Gly Glu Met Ala
785 790 795 800
Ile Gly Asn Met Thr Ile Asp Gly Val Lys His Tyr Phe Asn Lys Thr
805 810 815
Gly Asp Gly Thr Gly Tyr Asn Tyr Glu Gly Glu Leu Glu Trp
820 825 830
<210> 62
<211> 644
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 62
Met Lys Asn Lys Lys Lys Tyr Met Lys Pro Leu Ala Val Gly Leu Leu
1 5 10 15
Ala Thr Asn Ile Ile Gly Phe Gly Thr Gln Thr Val Ala Phe Ala Ala
20 25 30
Thr Asp Lys Ala Pro Thr Lys Glu Gln Ala Gln Lys Gly Ser Phe Asn
35 40 45
Pro Thr Val Leu Ala Ser Met Pro Ser Asp Thr Ser Glu Leu Gln Glu
50 55 60
Ile Leu Glu Asp Ala Ile Thr Asn Pro Asn Thr Gln Ile Ser Pro Lys
65 70 75 80
Leu Val Lys Asp Leu Gln Asp Lys Gly Phe Asp Tyr Leu Ser Ile Val
85 90 95
Lys Ala Ala Thr Gly Gly Leu Val Lys Lys Ile Pro Tyr Ala Gly Ser
100 105 110
Phe Leu Ser Pro Leu Val Glu Phe Ile Phe Pro Gly Lys Lys Tyr Leu
115 120 125
Thr Lys Glu Thr Val Trp Gly Ala Ile Gln Asp Lys Val Ser Asn Leu
130 135 140
Ile Asp Glu Lys Leu Thr Glu Asn Gln Val Asn Glu Leu Ile Ala Ser
145 150 155 160
Leu Thr Gly Ile Gln Asp Asn Leu Lys Lys Tyr Gln Val Ala Val Gly
165 170 175
Leu Val Asn Gly Lys Glu Pro Pro Ile Asp Lys Ser Ile Gln Met Asn
180 185 190
Ala Glu Thr Asp Arg Thr Lys Glu Asp Leu Arg Gly Tyr Ile Asp His
195 200 205
Leu Asp Ser Asp Leu Gly Lys Glu Val Pro Lys Phe Ala Val Lys Asn
210 215 220
Tyr Glu Ala Ala Ser Ile Pro Tyr Tyr Val Gln Ile Ala Asn Ile His
225 230 235 240
Leu Phe Leu Leu Arg Asp Ala Val Thr His Ala Asp Glu Trp Gly Leu
245 250 255
Thr Ala Lys Glu Lys Asn Thr Tyr Leu Ser Arg Leu Gln Ser Lys Ile
260 265 270
Ile Glu Tyr Ser Asn Thr Val Tyr Asp Ser Phe Asn Lys Gly Val Ala
275 280 285
Ala Ala Lys Asn Lys Asp Gly Asn Trp Asp Asn Val Asn Lys Phe Val
290 295 300
Arg Thr Met Thr Val Tyr Gly Leu Asp Phe Val Ala Leu Trp Pro Thr
305 310 315 320
Phe Asp Pro Ser Arg Tyr Asp Glu Pro Thr Lys Leu Gln Gln Thr Arg
325 330 335
Gln Val Tyr Ser Asp Leu Ile Gly Asn Pro Glu Ala Gly Ser Asn Tyr
340 345 350
Asp Thr Leu Leu Pro Gln Ile His Ser Ser Ile Phe Ala Gly Tyr Pro
355 360 365
Gly Glu Leu Lys Gln Phe Asn Val Ser Gln Ala Asp Arg Ile Asp Ser
370 375 380
Ile Lys Glu Val Phe Asp Trp Thr Gly Asp Gly Ser Gln Asp Tyr Thr
385 390 395 400
Gln Gln Leu Gly Asn Pro Asn Pro Ser Gly Tyr Ser Val Arg Asn Val
405 410 415
Thr Arg Asp Ala Pro Val Ile Gly Leu Ser Ala Tyr Lys Ser Trp Asn
420 425 430
Asn Asn Trp Tyr Asn Met Phe Ser Leu Ser Tyr Pro Gly Lys Glu Val
435 440 445
Asp Phe Gln Ser Arg Phe Arg Gln Ala Leu Arg Asp Gly Tyr Val Thr
450 455 460
Lys Thr Ser Ala Pro Ser Gly Gln Lys Val Ser Asn Ile Lys Ala Ala
465 470 475 480
Glu Thr Gly Lys Gly Lys Gly Thr Ile Ser Ser Met Val Ala Ala Tyr
485 490 495
Ile Pro Glu Glu Val His Pro Glu Asn Ile Leu Ala Ala Arg Ser Ile
500 505 510
Thr Gly Ile Pro Ala Glu Lys Tyr Asn Ser Arg Ser Ala Val Asp Asn
515 520 525
Ala Ile Glu Tyr Thr Asn Gly Ser Asn Ala Met Val Phe Thr Gln Asn
530 535 540
Gly Ser Ser Ile Thr Tyr Asn Ile Gln Ser Pro Glu Lys Arg Lys Tyr
545 550 555 560
Lys Ile Arg Leu Arg Val Ala Thr Asn Ser Asp Thr Ser Val Gly Ile
565 570 575
Ser Val Asn Gly Asn Ala Gln Gln Met Asn Ile Glu Asn Thr Glu Ala
580 585 590
Lys Ala Thr Asp Arg Thr Gly Ile Lys Gly Val Asn Gly Thr Tyr Thr
595 600 605
Val Ile Glu Gly Pro Thr Val Glu Leu Gln Glu Gly Lys Asn Thr Ile
610 615 620
Thr Ile Asp His Lys Asp Ala Asn Lys Leu Val Leu Asp Arg Ile Glu
625 630 635 640
Phe Glu His Gln
<210> 63
<211> 614
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 63
Met Ala Thr Asp Lys Ala Pro Thr Lys Glu Gln Ala Gln Lys Gly Ser
1 5 10 15
Phe Asn Pro Thr Val Leu Ala Ser Met Pro Ser Asp Thr Ser Glu Leu
20 25 30
Gln Glu Ile Leu Glu Asp Ala Ile Thr Asn Pro Asn Thr Gln Ile Ser
35 40 45
Pro Lys Leu Val Lys Asp Leu Gln Asp Lys Gly Phe Asp Tyr Leu Ser
50 55 60
Ile Val Lys Ala Ala Thr Gly Gly Leu Val Lys Lys Ile Pro Tyr Ala
65 70 75 80
Gly Ser Phe Leu Ser Pro Leu Val Glu Phe Ile Phe Pro Gly Lys Lys
85 90 95
Tyr Leu Thr Lys Glu Thr Val Trp Gly Ala Ile Gln Asp Lys Val Ser
100 105 110
Asn Leu Ile Asp Glu Lys Leu Thr Glu Asn Gln Val Asn Glu Leu Ile
115 120 125
Ala Ser Leu Thr Gly Ile Gln Asp Asn Leu Lys Lys Tyr Gln Val Ala
130 135 140
Val Gly Leu Val Asn Gly Lys Glu Pro Pro Ile Asp Lys Ser Ile Gln
145 150 155 160
Met Asn Ala Glu Thr Asp Arg Thr Lys Glu Asp Leu Arg Gly Tyr Ile
165 170 175
Asp His Leu Asp Ser Asp Leu Gly Lys Glu Val Pro Lys Phe Ala Val
180 185 190
Lys Asn Tyr Glu Ala Ala Ser Ile Pro Tyr Tyr Val Gln Ile Ala Asn
195 200 205
Ile His Leu Phe Leu Leu Arg Asp Ala Val Thr His Ala Asp Glu Trp
210 215 220
Gly Leu Thr Ala Lys Glu Lys Asn Thr Tyr Leu Ser Arg Leu Gln Ser
225 230 235 240
Lys Ile Ile Glu Tyr Ser Asn Thr Val Tyr Asp Ser Phe Asn Lys Gly
245 250 255
Val Ala Ala Ala Lys Asn Lys Asp Gly Asn Trp Asp Asn Val Asn Lys
260 265 270
Phe Val Arg Thr Met Thr Val Tyr Gly Leu Asp Phe Val Ala Leu Trp
275 280 285
Pro Thr Phe Asp Pro Ser Arg Tyr Asp Glu Pro Thr Lys Leu Gln Gln
290 295 300
Thr Arg Gln Val Tyr Ser Asp Leu Ile Gly Asn Pro Glu Ala Gly Ser
305 310 315 320
Asn Tyr Asp Thr Leu Leu Pro Gln Ile His Ser Ser Ile Phe Ala Gly
325 330 335
Tyr Pro Gly Glu Leu Lys Gln Phe Asn Val Ser Gln Ala Asp Arg Ile
340 345 350
Asp Ser Ile Lys Glu Val Phe Asp Trp Thr Gly Asp Gly Ser Gln Asp
355 360 365
Tyr Thr Gln Gln Leu Gly Asn Pro Asn Pro Ser Gly Tyr Ser Val Arg
370 375 380
Asn Val Thr Arg Asp Ala Pro Val Ile Gly Leu Ser Ala Tyr Lys Ser
385 390 395 400
Trp Asn Asn Asn Trp Tyr Asn Met Phe Ser Leu Ser Tyr Pro Gly Lys
405 410 415
Glu Val Asp Phe Gln Ser Arg Phe Arg Gln Ala Leu Arg Asp Gly Tyr
420 425 430
Val Thr Lys Thr Ser Ala Pro Ser Gly Gln Lys Val Ser Asn Ile Lys
435 440 445
Ala Ala Glu Thr Gly Lys Gly Lys Gly Thr Ile Ser Ser Met Val Ala
450 455 460
Ala Tyr Ile Pro Glu Glu Val His Pro Glu Asn Ile Leu Ala Ala Arg
465 470 475 480
Ser Ile Thr Gly Ile Pro Ala Glu Lys Tyr Asn Ser Arg Ser Ala Val
485 490 495
Asp Asn Ala Ile Glu Tyr Thr Asn Gly Ser Asn Ala Met Val Phe Thr
500 505 510
Gln Asn Gly Ser Ser Ile Thr Tyr Asn Ile Gln Ser Pro Glu Lys Arg
515 520 525
Lys Tyr Lys Ile Arg Leu Arg Val Ala Thr Asn Ser Asp Thr Ser Val
530 535 540
Gly Ile Ser Val Asn Gly Asn Ala Gln Gln Met Asn Ile Glu Asn Thr
545 550 555 560
Glu Ala Lys Ala Thr Asp Arg Thr Gly Ile Lys Gly Val Asn Gly Thr
565 570 575
Tyr Thr Val Ile Glu Gly Pro Thr Val Glu Leu Gln Glu Gly Lys Asn
580 585 590
Thr Ile Thr Ile Asp His Lys Asp Ala Asn Lys Leu Val Leu Asp Arg
595 600 605
Ile Glu Phe Glu His Gln
610
<210> 64
<211> 962
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 64
Val Ile Lys Met Asn Asn Thr Ile Val Pro Tyr Asn Val Leu Arg Asp
1 5 10 15
Asn Asp Met Ser Asn Ile Ser Gly Thr Ser Trp Asp Lys Asp Gln Ile
20 25 30
Ser Lys Gly Met Glu Asn Ser Ser Ile Leu Leu Glu Leu Ile Glu Lys
35 40 45
Gly Leu Asn Asp Gly Asn Asp Ile Leu Ser Leu Leu Gly Phe Ile Gly
50 55 60
Met Lys Ala Ile Glu Ala Ile Pro Val Val Gly Gly Thr Ile Ser Ser
65 70 75 80
Leu Ile Ser Leu Ile Leu Phe Pro Leu Lys Ser Lys Val Asp Tyr Gln
85 90 95
Glu Ile Trp Asn Gln Leu Lys Lys Ser Ile Glu Lys Met Val Asp Gln
100 105 110
Lys Ile Glu Glu Ala Met Met Ser Gln Leu Met Gln Glu Ile Ala Gly
115 120 125
Leu Ala Ala Ile Leu Glu Gln Tyr Arg Ala Ala Tyr Asp Leu Tyr Asn
130 135 140
Gly Lys Lys Val Phe Asn Ile Pro Asp Gly Met Thr Pro Gly Asp His
145 150 155 160
Leu Asn Thr Val Phe Val Ser Ala Asn Met Gln Phe Ile Gln Arg Met
165 170 175
Lys Ile Phe Gln Asn Pro Lys Tyr Lys Val Asp Leu Leu Pro Phe Phe
180 185 190
Val His Ala Ala Glu Met His Ile Leu Leu Val Arg Asp Ala Ala Ile
195 200 205
Tyr Gly Leu Glu Trp Gly Met Asp Glu Ala Val Asn Gln Tyr Tyr Lys
210 215 220
Met Glu Leu Lys Arg Leu Ile Asn Glu Tyr Ser Lys Tyr Val Leu Asp
225 230 235 240
Thr Tyr Gln Lys Gly Leu Lys Glu Val Thr Glu Arg Glu Leu Glu Asp
245 250 255
Asn Asp Phe Pro Thr Thr Trp Gln Lys Asp Asn Tyr Lys Asn Thr Val
260 265 270
Arg Trp Asn Val Ile Asn Lys Tyr Lys Arg Gly Met Ser Leu Thr Val
275 280 285
Phe Asp Phe Ala Tyr Lys Trp Lys Tyr Tyr His Glu Ser Tyr Gln Lys
290 295 300
Asn Leu Met Leu Asn Pro Thr Arg Thr Ile Tyr Ser Asp Ile Glu Gly
305 310 315 320
Ser Val Tyr Pro Tyr Thr Lys Glu Thr Ser Glu Ile Asp Asn Asp Ile
325 330 335
Asn Phe Thr Asn Leu Glu Tyr Arg Gly Ile Leu Lys Glu Val Gln Val
340 345 350
Asn Asn Ala Asp Arg Ile Asp Ser Leu Gln Ser Ile Phe Ile Arg Glu
355 360 365
Asn Gln Lys Phe Glu Asn Arg Lys Thr Gly Gly Ser Gly Gly Arg Gly
370 375 380
Thr Phe Val Asn Ile Glu Ser Pro Lys Asn Asn Pro Leu Thr Arg Val
385 390 395 400
Glu Thr Trp Ser Glu Leu Val Pro Phe Ala Leu Lys Phe Gly Phe Tyr
405 410 415
Asn Gly Glu Glu Thr Arg Leu Met Gly Gln Lys Thr Tyr Gly Lys Lys
420 425 430
Tyr Thr Ile Tyr Gln Tyr Ser Gly Asn Lys Val Val Ser Ile Met Gly
435 440 445
Phe Gly Leu Asn Ala Thr Ser Gly Phe Asp Ser Leu Asp Ala Met Val
450 455 460
Val Gly Phe Lys Gln Asp Asp Tyr Ile Pro Glu Asn Lys Ile Val Pro
465 470 475 480
Ile Asn Thr Asn Gly Glu Pro Leu Ile Gln Val Val Glu Val Gly Asn
485 490 495
Phe Tyr Glu Gly Lys Phe Glu Ser Asn Leu Lys Met Ile Glu Glu Pro
500 505 510
Met Phe Gly Asp Gly Val Leu Gln Phe Glu Asn His Ser Asn Asn Leu
515 520 525
Asn Gln Asp Asn Tyr Val Thr Tyr Gln Ile His Ala Glu Ile Glu Gly
530 535 540
Thr Tyr Glu Leu Asn Ala Ile Ile Gly Ala Asn Lys Gln Lys Asp Arg
545 550 555 560
Ile Ala Phe Lys Met Ser Leu Asn Gly Glu Gln Pro Glu Asn Phe Ile
565 570 575
Thr Glu Ser Phe Asp Asp Gly Asp Ile Trp Glu Gly Met Ser Leu Asn
580 585 590
Glu Glu Leu Val Tyr Lys Lys Asn Ser Leu Gly Asn Phe Gln Leu Asn
595 600 605
Lys Gly Val Asn Asn Ile Thr Ile Tyr Asn Gly Ala Leu Gln Ala Ser
610 615 620
Ala Asn Ile Lys Ile Trp Asn Leu Ala Thr Ile Glu Leu Thr Ile Asn
625 630 635 640
Ala Asp Ser Leu Lys Asp Pro Asp Ile Thr Thr Leu Tyr Asp Gln Asp
645 650 655
Asn Tyr Thr Gly Thr Lys Lys Leu Ile Phe Glu Asp Thr Asn Arg Leu
660 665 670
Glu Asp Phe Asn Asp Lys Ala Ser Ser Ile Lys Ala Glu Ser His Ile
675 680 685
Ala Gly Ile Arg Phe Tyr Gln Asn Tyr Asp Tyr Thr Gly Asp Phe Ile
690 695 700
Asp Leu Val Gly Gly Glu Lys Ile Ser Leu Lys Asn His Leu Phe Asn
705 710 715 720
Asn Arg Ala Ser Ser Val Lys Phe Ala Asn Ile Val Leu Tyr Asn Lys
725 730 735
Asp Asn Tyr Glu Gly Ser Arg Lys Phe Val Phe Glu Asp Ile Pro Glu
740 745 750
Leu Thr Asp Phe Asn Asp Gln Thr Ser Ser Ile Val Ile Ser Ser Asn
755 760 765
Val Ser Gly Ala Arg Leu Tyr Glu His Ala Asn Tyr Glu Gly Asn Tyr
770 775 780
Val Asp Val Val Gly Gly Gln Arg Leu Ser Leu Lys Asn His Val Leu
785 790 795 800
Asn Lys Glu Ile Thr Ser Ile Lys Phe Phe Lys Gly Asp Asp Glu Ile
805 810 815
Leu Asn Gly Ile Tyr Gln Ile Val Pro Ala Ile Asn Asn Thr Ser Val
820 825 830
Ile Val Asn Leu Glu Ser Ser Ala Phe Val Trp Leu Trp Gly Lys Asp
835 840 845
Ser Glu Phe Ala His Gln Trp Arg Val Glu Tyr Asp Glu Ser Glu Leu
850 855 860
Ala Tyr Gln Ile Lys Asn Met Ser Asn Glu Asn Ile Val Leu Ala Ala
865 870 875 880
Met Ile Val Thr Glu Pro Ser Tyr Ala His Gly Ile Pro Asn Met Lys
885 890 895
Asn Ser Leu Gln Tyr Trp Ile Phe Glu Tyr Val Gly Asn Gly Tyr Tyr
900 905 910
Ile Ile Lys Leu Lys Ala Asn Pro Lys Leu Val Leu Asp Val Asn Gly
915 920 925
Gly Asn Pro Asn Asp Gly Thr Ile Ile Lys Val Asn Tyr Ser His Asp
930 935 940
Leu Asn Ser Pro Asn Ile Asn Ala Gln Lys Phe Arg Phe Asn Asn Met
945 950 955 960
Asn Asn
<210> 65
<211> 1396
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 65
Met Gly Gly Leu Leu Met Asn Gln Tyr Tyr Asn Asn Asn Glu Tyr Glu
1 5 10 15
Ile Leu Asp Asn Gly Gly Arg Gly Tyr Gln Pro Arg Tyr Pro Leu Ala
20 25 30
Gln Ala Pro Gly Ser Glu Phe Gln Gln Met Asn Tyr Lys Asp Trp Met
35 40 45
Asp Arg Tyr Thr Gly Glu Glu Gln Ala Gly Gly Leu Ile Arg Ala Glu
50 55 60
Ile Asp Ala Asn Thr Ala Leu Thr Ala Thr Phe Gly Val Ala Trp Ala
65 70 75 80
Val Leu Gly Val Ser Asn Pro Val Gly Ser Ala Ile Ala Gly Ile Leu
85 90 95
Asn Val Val Thr Pro Ile Ile Phe Asn Gln Val Asp Pro Asn Ser Pro
100 105 110
Leu Lys Val Trp Glu Ser Met Ile Gly Tyr Ala Gln Ala Leu Ile Lys
115 120 125
Lys Glu Leu Thr Glu Thr Val Arg Asn Leu Ala Leu Asp His Ile Asp
130 135 140
Arg Ile Asn Asp Tyr Gln Ile Asp Tyr Lys Asn Lys Ala Arg Ile Trp
145 150 155 160
Glu Gly Asn Pro Thr Pro Gly Asn Ala Ser Gln Leu Leu Asp Ala Phe
165 170 175
Lys Asn Leu Lys Lys Ser Cys Gln Asp Ala Met Pro His Leu Asp Thr
180 185 190
Arg Gly Tyr Glu Thr Ile Leu Leu Pro Leu Tyr Ala Gln Ala Ala Asn
195 200 205
Ile His Leu Ile Val Leu Arg Asp Gly Leu Met His Gly Arg Ser Trp
210 215 220
Gly Met Thr Asn Glu Glu Tyr Glu Asp Leu Tyr Ser Gly Phe Phe Gly
225 230 235 240
Phe Lys Asn Arg Ile Ala Thr Tyr Thr Asn Tyr Cys Thr Asn Thr Phe
245 250 255
Asn Gln Gly Ala Thr Thr Asn Tyr Thr Ala Asp Met Glu Asp Cys Ala
260 265 270
Lys Tyr Pro Trp Val Arg Tyr Asn Gln Asp Glu Phe Tyr Ser Gly Phe
275 280 285
Phe Gly Pro Glu Asn Ser Cys Arg Gln Ser Gln Thr Thr Asn Ala Tyr
290 295 300
Pro Gln Pro Lys Ser Gly Phe Asn Gln Pro Leu Asn Leu Arg Asn Ser
305 310 315 320
Arg Gln Ser Pro Gly Glu Tyr Arg Asp Val Glu Ala Trp Asn Leu Arg
325 330 335
Asn Glu Phe Ile Ser Ser Met Thr Ile Gln Val Leu Asp Thr Val Ala
340 345 350
Leu Trp Pro Thr Tyr Asp Pro Arg Val Tyr Thr Ser Ala Val Lys Thr
355 360 365
Glu Phe Thr Arg Glu Ile Tyr Thr Ser Ile Arg Gly Thr Thr Tyr Arg
370 375 380
Ser Asp Pro Ala Gln Asn Thr Met Ser Ala Ile Glu Ala Arg Met Ile
385 390 395 400
Arg Pro Pro His Leu Phe Glu Trp Pro Gln Thr Met Thr Phe Phe Phe
405 410 415
Glu Asp Val Asn Val Arg Tyr Thr Trp Val Gly Asn Ser Trp Thr Lys
420 425 430
Gly Gln Ala Leu Ile Gly Leu Lys Thr Glu Ser Ala Arg Thr Leu Asp
435 440 445
Thr Asn Met Ile Thr Ala Leu Gln Gly Leu Thr Asp Glu Tyr Glu Tyr
450 455 460
Tyr His Ile Pro Leu Asp Val Ser Thr Arg Gln Lys Asp Ile Thr Asn
465 470 475 480
Ile Arg Thr Lys Gln Trp Phe Glu Pro Arg Glu Phe Ile Phe Tyr Arg
485 490 495
Ser Gly Gly Gln Gln Val Leu Ala Leu Gly Thr Ile Glu Glu Asp Ile
500 505 510
Pro Gly Tyr Ser Val Tyr Leu Val Asn Asp Tyr Ile Tyr Thr Pro Ser
515 520 525
Ile Arg Gln Asn Thr Phe Pro Pro Ile Glu Val Pro Glu Gly Thr Pro
530 535 540
Pro Pro Ser His Arg Leu Ser Trp Val Lys Phe Glu Pro Val Arg Asp
545 550 555 560
Asn Ala Thr Thr Phe Val Asp Pro Lys Gln Ile Gly Ala Thr Ile Phe
565 570 575
Gly Trp Thr His Thr Ser Val Asp Pro Asn Asn Thr Ile Asp Ala Thr
580 585 590
Lys Ile Thr Gln Ile Pro Ala Val Lys Ala Ser Gly Gly Thr Asp Tyr
595 600 605
Gln Val Ile Lys Gly Pro Gly Ser Thr Gly Gly Asp Leu Val Ser Leu
610 615 620
Pro Thr Tyr Ala Lys Ile Glu Ile Pro Leu Thr Ser Ser Ala Asp Gln
625 630 635 640
Leu Tyr Glu Val Arg Ile Arg Tyr Ala Ala Ala Glu Gln Lys Arg Ile
645 650 655
Arg Ile Gly Lys Lys Ser Arg Asp Phe Gln Trp Arg Tyr Ile Asp Tyr
660 665 670
Asp Val Pro Ser Thr Pro Tyr Ser Gly Gly Asn Leu Thr Tyr Asn Ala
675 680 685
Phe Ser Tyr Lys Glu Leu Gly Thr Val Gln Gly Val Leu Glu Leu Ser
690 695 700
Ile Glu Arg Ile Asp Pro Phe Asp Glu Pro Ile Ile Ile Asp Lys Ile
705 710 715 720
Glu Phe Ile Pro Ile Gln Gly Ser Val Glu Thr Tyr Glu Ala Asp Gln
725 730 735
Asp Leu Glu Lys Ala Arg Lys Ala Val Asn Ala Leu Phe Thr Ser Asp
740 745 750
Ala Lys Asn Ala Leu Gln Leu Glu Val Thr Asp Tyr Leu Val Asp Gln
755 760 765
Ala Ala Lys Leu Val Glu Cys Met Ser Asp Glu Ile Tyr Pro Gln Glu
770 775 780
Lys Met Cys Leu Leu Asp Gln Val Lys Val Ala Lys Arg Leu Ser Gln
785 790 795 800
Ala Arg Asn Leu Leu His His Gly Asp Phe Glu Ser Pro Asp Trp Phe
805 810 815
Gly Glu Asn Gly Trp Lys Thr Ser Asn His Val Ser Val Thr Ser Gly
820 825 830
Asn Pro Ile Phe Lys Gly Arg Tyr Leu Asn Met Pro Gly Ala Asp Asn
835 840 845
Pro Gln Leu Ser Asp Thr Val Phe Pro Thr Tyr Ala Tyr Gln Lys Ile
850 855 860
Asp Glu Ser Lys Leu Lys Pro Tyr Thr Arg Tyr Met Ile Arg Gly Phe
865 870 875 880
Val Gly Asn Ser Lys Asp Leu Glu Val Phe Ile Thr Arg Tyr Asp Lys
885 890 895
Glu Val His Lys Asn Met Asn Val Pro His Asp Ile Leu Pro Thr Asp
900 905 910
Pro Cys Thr Gly Thr Tyr Pro Leu Gly Glu Gly Pro Met Leu Thr Asn
915 920 925
His Thr Ile Pro Gln Asp Met Ser Cys Asp Pro Cys Asp Ala Gly Thr
930 935 940
Val Met Lys Val Gln Gln Thr Leu Val Lys Cys Glu Ala Pro His Ala
945 950 955 960
Phe Thr Phe His Ile Asp Thr Gly Glu Leu Asn Arg Asp Gln Asn Leu
965 970 975
Gly Ile Trp Val Gly Phe Lys Ile Gly Thr Thr Asp Gly Arg Ala Thr
980 985 990
Phe Asp Asn Leu Glu Val Ile Glu Ala Asn Pro Leu Thr Gly Glu Ala
995 1000 1005
Leu Ala Arg Val Lys Lys Arg Glu His Lys Trp Lys Gln Lys Trp
1010 1015 1020
Met Glu Lys Arg Thr Lys Ile Asp Lys Ala Val Gln Ile Ala Gln
1025 1030 1035
Gly Ala Ile Gln Ala Leu Phe Thr Asp Ser Asn Gln Asn Arg Leu
1040 1045 1050
Lys Pro Asp Ile Thr Leu Asn His Ile Leu Gln Val Glu Thr Glu
1055 1060 1065
Val Gln Lys Ile Pro Tyr Val Tyr Asn Ala Phe Leu Gln Gly Ala
1070 1075 1080
Leu Pro Pro Val Pro Gly Glu Thr Tyr Asp Ile Phe Gln Gln Leu
1085 1090 1095
Ser Ser Ala Val Ala Ile Ala Arg Ser Leu Tyr Glu Gln Arg Asn
1100 1105 1110
Val Leu Arg Asn Gly Asp Phe Met Ala Gly Leu Ser Asn Trp Arg
1115 1120 1125
Gly Ala Lys Gly Ala Ile Val Gln Lys Ile Gly Asn Ala Ser Val
1130 1135 1140
Leu Val Ile Ser Asp Trp Ser Ala Asn Leu Ser Gln Asp Val Pro
1145 1150 1155
Val Asn Pro Gly His Gly Tyr Ile Leu Arg Val Thr Ala Lys Lys
1160 1165 1170
Glu Gly Ser Gly Glu Gly Tyr Val Thr Ile Ser Asp Gly Thr Glu
1175 1180 1185
Asp Asn Thr Glu Thr Leu Lys Phe Thr Val Gly Glu Val Ala Thr
1190 1195 1200
Arg Leu Ala Gln Ser Asp Met His Ser Pro Met Gln Gly Arg Tyr
1205 1210 1215
Gln Glu Arg Asn Met Thr Asn Ala Pro Ser Glu Ala Tyr Gly Thr
1220 1225 1230
Asn Gly Tyr Thr Ser His Thr Met Thr Asn Tyr Pro Ser Asp Asn
1235 1240 1245
Asp Gly Thr Asn Ala Tyr Pro Gly Asn His Asn Arg Asn Tyr Gln
1250 1255 1260
Ser Glu Ser Phe Gly Ile Thr Pro Tyr Gly Asp Glu Thr Ser Met
1265 1270 1275
Met Asn Gly Pro Ser Asn Lys Tyr Glu Met Asn Ala Tyr Ala Gly
1280 1285 1290
Ser Thr Tyr Met Thr Asn Asn Gly Val Gly Cys Ser Cys Gly Cys
1295 1300 1305
Ser Thr Asn Ala Tyr Ala Gly Glu Asn Met Met Arg Asn Asp Ser
1310 1315 1320
Ser Asn Glu Asn Gly Val Gly Tyr Gly Cys Gly Cys Arg Thr His
1325 1330 1335
Pro Asn Asn Arg Thr Asp Ser Tyr Pro Met Thr Ala His Gly Ser
1340 1345 1350
Ser Leu Ser Gly Tyr Val Thr Lys Thr Phe Glu Ile Phe Pro Glu
1355 1360 1365
Thr Asn Arg Val Cys Ile Glu Ile Gly Glu Thr Ser Gly Thr Phe
1370 1375 1380
Lys Val Glu Ser Ile Glu Leu Ile Arg Met Asp Cys Glu
1385 1390 1395
<210> 66
<211> 725
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 66
Met Gly Gly Leu Leu Met Asn Gln Tyr Tyr Asn Asn Asn Glu Tyr Glu
1 5 10 15
Ile Leu Asp Asn Gly Gly Arg Gly Tyr Gln Pro Arg Tyr Pro Leu Ala
20 25 30
Gln Ala Pro Gly Ser Glu Phe Gln Gln Met Asn Tyr Lys Asp Trp Met
35 40 45
Asp Arg Tyr Thr Gly Glu Glu Gln Ala Gly Gly Leu Ile Arg Ala Glu
50 55 60
Ile Asp Ala Asn Thr Ala Leu Thr Ala Thr Phe Gly Val Ala Trp Ala
65 70 75 80
Val Leu Gly Val Ser Asn Pro Val Gly Ser Ala Ile Ala Gly Ile Leu
85 90 95
Asn Val Val Thr Pro Ile Ile Phe Asn Gln Val Asp Pro Asn Ser Pro
100 105 110
Leu Lys Val Trp Glu Ser Met Ile Gly Tyr Ala Gln Ala Leu Ile Lys
115 120 125
Lys Glu Leu Thr Glu Thr Val Arg Asn Leu Ala Leu Asp His Ile Asp
130 135 140
Arg Ile Asn Asp Tyr Gln Ile Asp Tyr Lys Asn Lys Ala Arg Ile Trp
145 150 155 160
Glu Gly Asn Pro Thr Pro Gly Asn Ala Ser Gln Leu Leu Asp Ala Phe
165 170 175
Lys Asn Leu Lys Lys Ser Cys Gln Asp Ala Met Pro His Leu Asp Thr
180 185 190
Arg Gly Tyr Glu Thr Ile Leu Leu Pro Leu Tyr Ala Gln Ala Ala Asn
195 200 205
Ile His Leu Ile Val Leu Arg Asp Gly Leu Met His Gly Arg Ser Trp
210 215 220
Gly Met Thr Asn Glu Glu Tyr Glu Asp Leu Tyr Ser Gly Phe Phe Gly
225 230 235 240
Phe Lys Asn Arg Ile Ala Thr Tyr Thr Asn Tyr Cys Thr Asn Thr Phe
245 250 255
Asn Gln Gly Ala Thr Thr Asn Tyr Thr Ala Asp Met Glu Asp Cys Ala
260 265 270
Lys Tyr Pro Trp Val Arg Tyr Asn Gln Asp Glu Phe Tyr Ser Gly Phe
275 280 285
Phe Gly Pro Glu Asn Ser Cys Arg Gln Ser Gln Thr Thr Asn Ala Tyr
290 295 300
Pro Gln Pro Lys Ser Gly Phe Asn Gln Pro Leu Asn Leu Arg Asn Ser
305 310 315 320
Arg Gln Ser Pro Gly Glu Tyr Arg Asp Val Glu Ala Trp Asn Leu Arg
325 330 335
Asn Glu Phe Ile Ser Ser Met Thr Ile Gln Val Leu Asp Thr Val Ala
340 345 350
Leu Trp Pro Thr Tyr Asp Pro Arg Val Tyr Thr Ser Ala Val Lys Thr
355 360 365
Glu Phe Thr Arg Glu Ile Tyr Thr Ser Ile Arg Gly Thr Thr Tyr Arg
370 375 380
Ser Asp Pro Ala Gln Asn Thr Met Ser Ala Ile Glu Ala Arg Met Ile
385 390 395 400
Arg Pro Pro His Leu Phe Glu Trp Pro Gln Thr Met Thr Phe Phe Phe
405 410 415
Glu Asp Val Asn Val Arg Tyr Thr Trp Val Gly Asn Ser Trp Thr Lys
420 425 430
Gly Gln Ala Leu Ile Gly Leu Lys Thr Glu Ser Ala Arg Thr Leu Asp
435 440 445
Thr Asn Met Ile Thr Ala Leu Gln Gly Leu Thr Asp Glu Tyr Glu Tyr
450 455 460
Tyr His Ile Pro Leu Asp Val Ser Thr Arg Gln Lys Asp Ile Thr Asn
465 470 475 480
Ile Arg Thr Lys Gln Trp Phe Glu Pro Arg Glu Phe Ile Phe Tyr Arg
485 490 495
Ser Gly Gly Gln Gln Val Leu Ala Leu Gly Thr Ile Glu Glu Asp Ile
500 505 510
Pro Gly Tyr Ser Val Tyr Leu Val Asn Asp Tyr Ile Tyr Thr Pro Ser
515 520 525
Ile Arg Gln Asn Thr Phe Pro Pro Ile Glu Val Pro Glu Gly Thr Pro
530 535 540
Pro Pro Ser His Arg Leu Ser Trp Val Lys Phe Glu Pro Val Arg Asp
545 550 555 560
Asn Ala Thr Thr Phe Val Asp Pro Lys Gln Ile Gly Ala Thr Ile Phe
565 570 575
Gly Trp Thr His Thr Ser Val Asp Pro Asn Asn Thr Ile Asp Ala Thr
580 585 590
Lys Ile Thr Gln Ile Pro Ala Val Lys Ala Ser Gly Gly Thr Asp Tyr
595 600 605
Gln Val Ile Lys Gly Pro Gly Ser Thr Gly Gly Asp Leu Val Ser Leu
610 615 620
Pro Thr Tyr Ala Lys Ile Glu Ile Pro Leu Thr Ser Ser Ala Asp Gln
625 630 635 640
Leu Tyr Glu Val Arg Ile Arg Tyr Ala Ala Ala Glu Gln Lys Arg Ile
645 650 655
Arg Ile Gly Lys Lys Ser Arg Asp Phe Gln Trp Arg Tyr Ile Asp Tyr
660 665 670
Asp Val Pro Ser Thr Pro Tyr Ser Gly Gly Asn Leu Thr Tyr Asn Ala
675 680 685
Phe Ser Tyr Lys Glu Leu Gly Thr Val Gln Gly Val Leu Glu Leu Ser
690 695 700
Ile Glu Arg Ile Asp Pro Phe Asp Glu Pro Ile Ile Ile Asp Lys Ile
705 710 715 720
Glu Phe Ile Pro Ile
725
<210> 67
<211> 131
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 67
Met Ile Pro Thr Arg Ile His Asn Ser Met Leu Ser Ala Asn Asp Asp
1 5 10 15
Leu Ser Phe His Ser Phe Gln Thr Cys Phe Leu Val Arg Gly Ala Gln
20 25 30
Ala Glu Glu Val Lys Gly Leu Lys Pro Gly Gln Tyr Gly Lys Tyr Gly
35 40 45
Arg Glu Tyr Glu Met Val Gln Thr Gly Arg His His Pro Asp Leu Phe
50 55 60
Glu Gly Ala Met Gln Ser Ala Ala Thr Ile Asp Asp Pro Glu Gln Val
65 70 75 80
Gln Ser Ser Val Ser Phe Cys Ser Met Val His Val Pro Gln Gly Phe
85 90 95
Val Tyr Val Pro Lys Gly Thr Arg Lys Phe Ala Tyr Ser Leu Pro Asn
100 105 110
Leu Ser Val Val Lys Asp Thr Cys Gln Lys Thr Ile Ala Ala Gln Ser
115 120 125
Met Ser Arg
130
<210> 68
<211> 875
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 68
Met Ser Leu Leu Ile Lys Lys Glu Arg Asn Val Met Pro Asn Glu Met
1 5 10 15
Asn Ser Lys Asn Asn Met Asn Thr Thr Arg Ile Asp Asp Lys Asp Leu
20 25 30
Leu Asp Ser Lys Gly Arg Glu Cys Gln Pro Arg Tyr Pro Ser Ala Glu
35 40 45
Ala Pro Asp Val Met Asn Pro Ile Glu Lys Ile Tyr Thr Arg Gly Gln
50 55 60
Ser Ala Asn Ile Ser Asn Ala Thr Ser Thr Thr Ile Asp Val Thr Ser
65 70 75 80
Gln Ile Leu Arg Gly Ser Lys Lys Leu Ala Gly Leu Ile Ile Lys Val
85 90 95
Leu Ile Lys Ile Leu Trp Pro Lys Gly Thr Gln Gln Glu Trp Glu Asn
100 105 110
Phe Met Asp Ala Val Glu Gln Leu Ile His Glu Lys Leu Asp Thr Tyr
115 120 125
Ala Arg Asn Lys Ala Thr Ala Asp Leu Glu Gly Leu Gln Arg Val Leu
130 135 140
Ser Glu Tyr Ile Asp Lys Leu Thr Ile Tyr Thr Asp Asp Pro Asn Ala
145 150 155 160
Ala His Ala Gln Ser Leu Arg Thr Gln Val Ile Thr Thr Asp Asn Leu
165 170 175
Phe Glu Tyr Ser Met Pro Ser Phe Ala Ile Arg Asp Tyr Glu Met Gln
180 185 190
Leu Leu Thr Val Tyr Ala Gln Ala Ala Asn Leu His Leu Ala Phe Leu
195 200 205
Glu Asp Ile Val Arg Phe Gly Asp Glu Trp Gly Phe Thr Pro Ala Glu
210 215 220
Ile Ala Asp Phe His Lys Ser Met Lys Glu Arg Thr Asp Glu Tyr Thr
225 230 235 240
Asn His Cys Val Ser Thr Tyr Asn Lys Gly Leu Glu Lys Ala Lys Leu
245 250 255
Leu Thr Ala Asp Leu Cys Asn His Ser Thr Tyr Pro Trp Thr Arg Tyr
260 265 270
Asn Gln Gly Trp Arg Lys Glu Glu Thr Pro Asn Cys Ser Leu Gln Gln
275 280 285
Ile Asp Ser Cys Glu Gln Pro Leu Asn Glu Ser Asp Glu Gln Gly Thr
290 295 300
Pro Tyr Met Gly Pro Glu Arg Arg Ser Ile Asp Glu Tyr Gln Lys Leu
305 310 315 320
Glu Asn Trp Asn Leu Tyr Asn Ala Tyr Arg Arg Asp Met Thr Leu Met
325 330 335
Val Leu Asp Ile Val Ser Leu Trp Pro Thr Tyr Asp Pro Lys Leu Tyr
340 345 350
Pro Thr Ser Tyr Gly Val Thr Ser Glu Leu Thr Arg Glu Leu Tyr Thr
355 360 365
Asp Ile Arg Gly Thr Thr Tyr Arg Ser Asp Glu Ser Gln Asn Ser Leu
370 375 380
Asp Ala Ile Glu Gly Arg Met Ile Pro Gln Pro Ser Leu Phe Arg Trp
385 390 395 400
Leu Phe Gly Ile Ser Ile Lys Met Asn Gln Phe Ile Gly Thr Gly Gly
405 410 415
Ser Asp Asp Trp Thr Ser Gly Asn Leu Met Leu Gly Met Arg Ile Met
420 425 430
Trp Arg Lys Thr Leu Thr Glu Gln Trp Glu Gly Leu Tyr Phe Gly Gly
435 440 445
Gly Gly Asn Leu Tyr Ile Asn Leu Asn Pro Leu Asp Tyr Ala Glu Gly
450 455 460
Ile Thr His Val Asn Thr Arg Gln Trp Phe Glu Pro Arg Trp Phe Glu
465 470 475 480
Phe Tyr Ser Gly Gly Tyr Asp Thr Glu Leu Lys Phe Gln Asn Lys Cys
485 490 495
Gly Thr Ile Glu Glu Lys Ser Pro Phe Trp Ala Ala Gly Pro Tyr Asn
500 505 510
Tyr Ile Tyr Gln Pro Gly Val Arg Thr Ser Gln Ile Pro Glu His Arg
515 520 525
Leu Ser Trp Met Thr Tyr Glu Pro Val Arg Glu Asn Ala Pro Phe Val
530 535 540
Tyr Pro Gln Tyr Lys Gln Leu Gly Ala Val Ala Leu Gly Trp Thr Ser
545 550 555 560
Asn Ser Val Asp Gln Lys Asn Ala Ile Asp Leu Asp Lys Ile Thr Ser
565 570 575
Leu Pro Ala Val Lys Gly Asn Glu Ile Arg Gly Pro Gly Ser Val Val
580 585 590
Arg Gly Pro Gly Ser Thr Gly Gly Asn Leu Val Leu Leu Asn Pro Thr
595 600 605
Gly Glu Val Ser Ile Thr Val Ser Gln Pro Ile Leu Asn Lys Pro Gly
610 615 620
Ala Gly Tyr Tyr His Val Arg Ile Arg Tyr Ala Ala Ile Ala Asn Gly
625 630 635 640
Lys Leu Asn Val Lys Arg Ser Val Asn Ser Ser Thr Gln Glu Ser Val
645 650 655
Thr Tyr Asp Tyr Lys Gln Thr Thr Ala Arg Asp Leu Thr Tyr Ser Ser
660 665 670
Phe Gln Tyr Leu Glu Val Tyr Asp Phe Asn Pro Val Thr Thr Ala Ser
675 680 685
Gln Phe Glu Val Leu Leu Thr Asn Glu Ser Gly Gly Pro Ile Tyr Ile
690 695 700
Asp Lys Ile Glu Phe Ile Pro Phe Gln Gly Thr Thr Gly Pro Glu Ala
705 710 715 720
Pro Gly Ile Pro Ala Asp Ile Tyr Tyr Thr Ile Ser Pro Ala Ile Asp
725 730 735
Glu Asn Tyr Tyr Thr Ile Gly Gly Ser Thr Ile Trp Leu Ser Leu Lys
740 745 750
Glu Ser Phe Ser Asn Pro Pro Arg Asp Gly Gln Trp Arg Phe Val Tyr
755 760 765
Asp Thr Asn Lys Lys Ala Tyr Gln Ile Gly Thr Gln Leu Asn Glu Asp
770 775 780
Pro Ala Gly Gly Leu Phe Ala Val Leu Thr Ser Thr Glu Pro Asn Asn
785 790 795 800
Asn Leu Thr Met Tyr Pro Asn Leu Ser Leu Asp Gln Gln Tyr Trp Phe
805 810 815
Val Lys Asp Ala Gly Asp Gly Tyr Val Thr Leu Glu Asn Tyr Gly Tyr
820 825 830
Pro Gly Tyr Val Val Asn Val Pro Arg Val Tyr Gln Gly Ala Ile Leu
835 840 845
Thr Leu Ser Pro Phe Ile Gly Ser Met Asn His Lys Phe Lys Leu Thr
850 855 860
Lys Leu Ser Thr Asn Asp Glu Val Ile Leu Gly
865 870 875
<210> 69
<211> 712
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 69
Met Ser Leu Leu Ile Lys Lys Glu Arg Asn Val Met Pro Asn Glu Met
1 5 10 15
Asn Ser Lys Asn Asn Met Asn Thr Thr Arg Ile Asp Asp Lys Asp Leu
20 25 30
Leu Asp Ser Lys Gly Arg Glu Cys Gln Pro Arg Tyr Pro Ser Ala Glu
35 40 45
Ala Pro Asp Val Met Asn Pro Ile Glu Lys Ile Tyr Thr Arg Gly Gln
50 55 60
Ser Ala Asn Ile Ser Asn Ala Thr Ser Thr Thr Ile Asp Val Thr Ser
65 70 75 80
Gln Ile Leu Arg Gly Ser Lys Lys Leu Ala Gly Leu Ile Ile Lys Val
85 90 95
Leu Ile Lys Ile Leu Trp Pro Lys Gly Thr Gln Gln Glu Trp Glu Asn
100 105 110
Phe Met Asp Ala Val Glu Gln Leu Ile His Glu Lys Leu Asp Thr Tyr
115 120 125
Ala Arg Asn Lys Ala Thr Ala Asp Leu Glu Gly Leu Gln Arg Val Leu
130 135 140
Ser Glu Tyr Ile Asp Lys Leu Thr Ile Tyr Thr Asp Asp Pro Asn Ala
145 150 155 160
Ala His Ala Gln Ser Leu Arg Thr Gln Val Ile Thr Thr Asp Asn Leu
165 170 175
Phe Glu Tyr Ser Met Pro Ser Phe Ala Ile Arg Asp Tyr Glu Met Gln
180 185 190
Leu Leu Thr Val Tyr Ala Gln Ala Ala Asn Leu His Leu Ala Phe Leu
195 200 205
Glu Asp Ile Val Arg Phe Gly Asp Glu Trp Gly Phe Thr Pro Ala Glu
210 215 220
Ile Ala Asp Phe His Lys Ser Met Lys Glu Arg Thr Asp Glu Tyr Thr
225 230 235 240
Asn His Cys Val Ser Thr Tyr Asn Lys Gly Leu Glu Lys Ala Lys Leu
245 250 255
Leu Thr Ala Asp Leu Cys Asn His Ser Thr Tyr Pro Trp Thr Arg Tyr
260 265 270
Asn Gln Gly Trp Arg Lys Glu Glu Thr Pro Asn Cys Ser Leu Gln Gln
275 280 285
Ile Asp Ser Cys Glu Gln Pro Leu Asn Glu Ser Asp Glu Gln Gly Thr
290 295 300
Pro Tyr Met Gly Pro Glu Arg Arg Ser Ile Asp Glu Tyr Gln Lys Leu
305 310 315 320
Glu Asn Trp Asn Leu Tyr Asn Ala Tyr Arg Arg Asp Met Thr Leu Met
325 330 335
Val Leu Asp Ile Val Ser Leu Trp Pro Thr Tyr Asp Pro Lys Leu Tyr
340 345 350
Pro Thr Ser Tyr Gly Val Thr Ser Glu Leu Thr Arg Glu Leu Tyr Thr
355 360 365
Asp Ile Arg Gly Thr Thr Tyr Arg Ser Asp Glu Ser Gln Asn Ser Leu
370 375 380
Asp Ala Ile Glu Gly Arg Met Ile Pro Gln Pro Ser Leu Phe Arg Trp
385 390 395 400
Leu Phe Gly Ile Ser Ile Lys Met Asn Gln Phe Ile Gly Thr Gly Gly
405 410 415
Ser Asp Asp Trp Thr Ser Gly Asn Leu Met Leu Gly Met Arg Ile Met
420 425 430
Trp Arg Lys Thr Leu Thr Glu Gln Trp Glu Gly Leu Tyr Phe Gly Gly
435 440 445
Gly Gly Asn Leu Tyr Ile Asn Leu Asn Pro Leu Asp Tyr Ala Glu Gly
450 455 460
Ile Thr His Val Asn Thr Arg Gln Trp Phe Glu Pro Arg Trp Phe Glu
465 470 475 480
Phe Tyr Ser Gly Gly Tyr Asp Thr Glu Leu Lys Phe Gln Asn Lys Cys
485 490 495
Gly Thr Ile Glu Glu Lys Ser Pro Phe Trp Ala Ala Gly Pro Tyr Asn
500 505 510
Tyr Ile Tyr Gln Pro Gly Val Arg Thr Ser Gln Ile Pro Glu His Arg
515 520 525
Leu Ser Trp Met Thr Tyr Glu Pro Val Arg Glu Asn Ala Pro Phe Val
530 535 540
Tyr Pro Gln Tyr Lys Gln Leu Gly Ala Val Ala Leu Gly Trp Thr Ser
545 550 555 560
Asn Ser Val Asp Gln Lys Asn Ala Ile Asp Leu Asp Lys Ile Thr Ser
565 570 575
Leu Pro Ala Val Lys Gly Asn Glu Ile Arg Gly Pro Gly Ser Val Val
580 585 590
Arg Gly Pro Gly Ser Thr Gly Gly Asn Leu Val Leu Leu Asn Pro Thr
595 600 605
Gly Glu Val Ser Ile Thr Val Ser Gln Pro Ile Leu Asn Lys Pro Gly
610 615 620
Ala Gly Tyr Tyr His Val Arg Ile Arg Tyr Ala Ala Ile Ala Asn Gly
625 630 635 640
Lys Leu Asn Val Lys Arg Ser Val Asn Ser Ser Thr Gln Glu Ser Val
645 650 655
Thr Tyr Asp Tyr Lys Gln Thr Thr Ala Arg Asp Leu Thr Tyr Ser Ser
660 665 670
Phe Gln Tyr Leu Glu Val Tyr Asp Phe Asn Pro Val Thr Thr Ala Ser
675 680 685
Gln Phe Glu Val Leu Leu Thr Asn Glu Ser Gly Gly Pro Ile Tyr Ile
690 695 700
Asp Lys Ile Glu Phe Ile Pro Phe
705 710
<210> 70
<211> 1018
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 70
Met Asn Gln Asn Tyr Asn Asp Glu Tyr Glu Ile Met Asn Thr Gly Val
1 5 10 15
Met Gly Tyr Gln Ser Arg Tyr Pro Leu Ala Lys Thr Pro Gly Ser Glu
20 25 30
Ile Gln Gln Met Asn Tyr Lys Asp Trp Met Asp Met Tyr Thr His Gly
35 40 45
Glu Ser Gly Glu Thr Phe Ile Ser Ala Arg Asp Gly Val Ile Ile Gly
50 55 60
Thr Gly Ile Gly Trp Ala Ile Leu Gly Phe Val Pro Val Leu Gly Pro
65 70 75 80
Gly Leu Ser Ala Ile Ser Gly Ile Leu Asn Val Leu Leu Pro Ile Leu
85 90 95
Trp Pro Glu Asp Ala Val Thr Ala Glu Ser Gln Val Ser Trp Asp Lys
100 105 110
Leu Met Arg Thr Ala Glu Glu Ile Ala Asn Lys Ala Ile Asp Ala Gln
115 120 125
Val Arg Ala Glu Ala Ile Thr Glu Leu Gln Gly Ile Gln Glu Ala Ile
130 135 140
Gln Leu Tyr His Gly Ala Val Cys Asp Trp Lys Lys Ala Pro Thr Asn
145 150 155 160
Val Arg Leu Gln Glu Thr Val Arg Thr Gln Phe Ile Ala Thr Asn Thr
165 170 175
Val Ile Phe Asn Arg Met Pro Ser Phe Arg Val Gln Gly Phe Glu Thr
180 185 190
Ser Leu Leu Ser Thr Tyr Ala Gln Ala Ala Asn Leu His Leu Ala Phe
195 200 205
Leu Arg Asp Gly Val Gln Phe Gly Thr Glu Trp Gly Leu Asp Pro Thr
210 215 220
Thr Val Asp Arg Tyr Tyr Gly Tyr Leu Thr Ala Asn Thr Ala Ser Tyr
225 230 235 240
Thr Asn Tyr Cys Val Arg Trp Tyr Asp Lys Gly Leu Ser Asp Leu Arg
245 250 255
Thr Thr Asn Asn Trp Asn Lys Tyr Asn Asn Phe Arg Arg Asp Met Thr
260 265 270
Ile Met Ala Met Asp Leu Val Ser Leu Trp Pro Thr Tyr Asp Pro Lys
275 280 285
Arg Tyr Pro Thr Phe Thr Lys Ser Gln Leu Thr Arg Thr Val Tyr Thr
290 295 300
Pro Trp Ile Gly His Ile Lys Asn Arg Trp Met Gly His Pro Gln Glu
305 310 315 320
Val Pro Phe Ser Glu Ile Glu Ser Asn Leu Ile Asp Ile Pro Arg Leu
325 330 335
Phe Ala Trp Leu Arg Glu Leu Ile Val Tyr Ser Val Asp Pro Gln Arg
340 345 350
Arg Gly Tyr Ser Thr Leu Val Cys Gly Arg Lys Gln Arg Phe Gln Asn
355 360 365
Thr Leu Ser Asn Asn Leu Trp Asp Arg Gly Met Lys Gly Ser His Gly
370 375 380
Glu Glu Pro Pro Gln Thr Leu Thr Ile Pro Ser Pro Gln Ser Lys Asp
385 390 395 400
Asp Ile Trp Lys Ile Asn Thr Thr Ser Thr Leu Met Ala Gln Gly Pro
405 410 415
Glu Asn Thr Gln Ile Lys Gly Trp Asp Phe Ser Phe Thr Asn Ser Gln
420 425 430
Thr Gln Thr Ile Ser Thr Ile Tyr Gln Gly Gln Glu Ser Leu Val Tyr
435 440 445
Ala Val Ser Gly Leu Pro Cys Arg Ser Ser Tyr Asn Leu Cys Asp Pro
450 455 460
Cys Asp Pro Asp Cys Lys Val Asp Ile Leu Thr Pro Gly Asp Pro Cys
465 470 475 480
Asn Asp Lys Leu Leu Tyr Ser His Arg Phe Ala Tyr Leu Gly Ala Gly
485 490 495
Ile Asp Pro Tyr Met Gly Tyr Pro Gly Arg Ala Gly Gly Tyr Gly Tyr
500 505 510
Tyr Ser Tyr Gly Trp Thr His Ile Ser Ala Asp Ala Asn Asn Leu Ile
515 520 525
Asp Thr Glu Lys Ile Thr Gln Ile Pro Ala Val Lys Ala Ser Gly Gly
530 535 540
Thr Asp Tyr Gln Val Ile Arg Gly Pro Gly Ser Thr Gly Gly Asp Leu
545 550 555 560
Val Ser Leu Ala Thr Asp Ala Arg Ile Glu Leu Lys Leu Thr Ala Ser
565 570 575
Ile Ala Lys Tyr Tyr Gln Met Arg Ile Arg Tyr Ala Ser Pro Val Gln
580 585 590
Thr Arg Leu Arg Leu Glu Thr Tyr Gln Asp Asp Ile Ser Gly Gly Pro
595 600 605
Val Asn Tyr Asp Ile Pro Ser Thr Pro Tyr Ser Gly Asn Gln Asn Glu
610 615 620
Leu Ser Tyr Asn Ala Phe Gly Tyr Lys His Val Met Asn Val Tyr Ile
625 630 635 640
Ser Leu Thr Gly Thr Lys Ile Ser Ile Gln Arg Val Asp Pro Phe Asp
645 650 655
Tyr Pro Phe Ile Ile Asp Lys Ile Glu Phe Ile Pro Ile Glu Gly Ser
660 665 670
Leu Glu Ala Tyr Gln Ala Asp Gln Asp Leu Glu Lys Ala Arg Lys Lys
675 680 685
Val Asn Ala Leu Phe Met Ser Asp Ala Lys Asp Val Leu Lys Leu Asn
690 695 700
Val Thr Asp Tyr Ala Leu Asp Gln Ala Ala Asn Leu Val Glu Cys Leu
705 710 715 720
Ser Asp Glu Phe Cys Ala Gln Glu Lys Met Ile Leu Leu Asp Gln Val
725 730 735
Lys Phe Ala Lys Arg Leu Ser Gln Ser Arg Asn Leu Leu Asn Tyr Gly
740 745 750
Asp Phe Glu Ser Pro Tyr Trp Ser Gly Glu Asn Gly Trp Lys Thr Ser
755 760 765
Pro His Ile His Val Ala Ser Gly Asn Pro Ile Phe Lys Gly His Tyr
770 775 780
Leu His Met Pro Gly Ala Asn Gln Pro Gln Thr Ser Gly Thr Val Tyr
785 790 795 800
Pro Thr Tyr Ile Tyr Gln Lys Val Asp Glu Ser Lys Leu Lys Pro Tyr
805 810 815
Thr Arg Tyr His Val Arg Gly Phe Val Gly Asn Ser Lys Asp Leu Glu
820 825 830
Leu Leu Val Glu Arg Tyr Gly Lys Glu Ile His Val Glu Met Asp Val
835 840 845
Pro Asn Asp Ile Arg Tyr Thr Leu Pro Met Asn Glu Cys Gly Gly Phe
850 855 860
Glu Arg Cys Ser His Glu Pro His His Thr Cys Thr Cys Lys Asp Thr
865 870 875 880
Ala Arg Val Asp Thr Gly Cys Gln Cys Gln Asp Lys Met Asn Arg Met
885 890 895
Thr Thr Gly Val Tyr Thr Asn Ile Pro Thr Ala Ser Glu Met Tyr Pro
900 905 910
Asn Gly Tyr Leu Val His Lys Ser Cys Gly Cys Lys Asp Pro His Val
915 920 925
Phe Ser Phe His Ile Asp Thr Gly Cys Val Asp Leu Lys Glu Asn Leu
930 935 940
Gly Leu Leu Phe Ala Phe Lys Ile Ser Ser Thr Asp Gly Val Ala Asn
945 950 955 960
Val Asp Asn Leu Glu Ile Ile Glu Gly Gln Pro Leu Thr Gly Glu Ala
965 970 975
Leu Ala Arg Val Lys Lys Arg Glu His Lys Trp Lys Glu Thr Met Lys
980 985 990
Gln Lys Arg Cys Lys Thr Asp Glu Ala Val Gln Ala Val Gln Thr Ala
995 1000 1005
Ile Asn Ala Leu Phe Thr Asn Ala Gln Tyr
1010 1015
<210> 71
<211> 669
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 71
Met Asn Gln Asn Tyr Asn Asp Glu Tyr Glu Ile Met Asn Thr Gly Val
1 5 10 15
Met Gly Tyr Gln Ser Arg Tyr Pro Leu Ala Lys Thr Pro Gly Ser Glu
20 25 30
Ile Gln Gln Met Asn Tyr Lys Asp Trp Met Asp Met Tyr Thr His Gly
35 40 45
Glu Ser Gly Glu Thr Phe Ile Ser Ala Arg Asp Gly Val Ile Ile Gly
50 55 60
Thr Gly Ile Gly Trp Ala Ile Leu Gly Phe Val Pro Val Leu Gly Pro
65 70 75 80
Gly Leu Ser Ala Ile Ser Gly Ile Leu Asn Val Leu Leu Pro Ile Leu
85 90 95
Trp Pro Glu Asp Ala Val Thr Ala Glu Ser Gln Val Ser Trp Asp Lys
100 105 110
Leu Met Arg Thr Ala Glu Glu Ile Ala Asn Lys Ala Ile Asp Ala Gln
115 120 125
Val Arg Ala Glu Ala Ile Thr Glu Leu Gln Gly Ile Gln Glu Ala Ile
130 135 140
Gln Leu Tyr His Gly Ala Val Cys Asp Trp Lys Lys Ala Pro Thr Asn
145 150 155 160
Val Arg Leu Gln Glu Thr Val Arg Thr Gln Phe Ile Ala Thr Asn Thr
165 170 175
Val Ile Phe Asn Arg Met Pro Ser Phe Arg Val Gln Gly Phe Glu Thr
180 185 190
Ser Leu Leu Ser Thr Tyr Ala Gln Ala Ala Asn Leu His Leu Ala Phe
195 200 205
Leu Arg Asp Gly Val Gln Phe Gly Thr Glu Trp Gly Leu Asp Pro Thr
210 215 220
Thr Val Asp Arg Tyr Tyr Gly Tyr Leu Thr Ala Asn Thr Ala Ser Tyr
225 230 235 240
Thr Asn Tyr Cys Val Arg Trp Tyr Asp Lys Gly Leu Ser Asp Leu Arg
245 250 255
Thr Thr Asn Asn Trp Asn Lys Tyr Asn Asn Phe Arg Arg Asp Met Thr
260 265 270
Ile Met Ala Met Asp Leu Val Ser Leu Trp Pro Thr Tyr Asp Pro Lys
275 280 285
Arg Tyr Pro Thr Phe Thr Lys Ser Gln Leu Thr Arg Thr Val Tyr Thr
290 295 300
Pro Trp Ile Gly His Ile Lys Asn Arg Trp Met Gly His Pro Gln Glu
305 310 315 320
Val Pro Phe Ser Glu Ile Glu Ser Asn Leu Ile Asp Ile Pro Arg Leu
325 330 335
Phe Ala Trp Leu Arg Glu Leu Ile Val Tyr Ser Val Asp Pro Gln Arg
340 345 350
Arg Gly Tyr Ser Thr Leu Val Cys Gly Arg Lys Gln Arg Phe Gln Asn
355 360 365
Thr Leu Ser Asn Asn Leu Trp Asp Arg Gly Met Lys Gly Ser His Gly
370 375 380
Glu Glu Pro Pro Gln Thr Leu Thr Ile Pro Ser Pro Gln Ser Lys Asp
385 390 395 400
Asp Ile Trp Lys Ile Asn Thr Thr Ser Thr Leu Met Ala Gln Gly Pro
405 410 415
Glu Asn Thr Gln Ile Lys Gly Trp Asp Phe Ser Phe Thr Asn Ser Gln
420 425 430
Thr Gln Thr Ile Ser Thr Ile Tyr Gln Gly Gln Glu Ser Leu Val Tyr
435 440 445
Ala Val Ser Gly Leu Pro Cys Arg Ser Ser Tyr Asn Leu Cys Asp Pro
450 455 460
Cys Asp Pro Asp Cys Lys Val Asp Ile Leu Thr Pro Gly Asp Pro Cys
465 470 475 480
Asn Asp Lys Leu Leu Tyr Ser His Arg Phe Ala Tyr Leu Gly Ala Gly
485 490 495
Ile Asp Pro Tyr Met Gly Tyr Pro Gly Arg Ala Gly Gly Tyr Gly Tyr
500 505 510
Tyr Ser Tyr Gly Trp Thr His Ile Ser Ala Asp Ala Asn Asn Leu Ile
515 520 525
Asp Thr Glu Lys Ile Thr Gln Ile Pro Ala Val Lys Ala Ser Gly Gly
530 535 540
Thr Asp Tyr Gln Val Ile Arg Gly Pro Gly Ser Thr Gly Gly Asp Leu
545 550 555 560
Val Ser Leu Ala Thr Asp Ala Arg Ile Glu Leu Lys Leu Thr Ala Ser
565 570 575
Ile Ala Lys Tyr Tyr Gln Met Arg Ile Arg Tyr Ala Ser Pro Val Gln
580 585 590
Thr Arg Leu Arg Leu Glu Thr Tyr Gln Asp Asp Ile Ser Gly Gly Pro
595 600 605
Val Asn Tyr Asp Ile Pro Ser Thr Pro Tyr Ser Gly Asn Gln Asn Glu
610 615 620
Leu Ser Tyr Asn Ala Phe Gly Tyr Lys His Val Met Asn Val Tyr Ile
625 630 635 640
Ser Leu Thr Gly Thr Lys Ile Ser Ile Gln Arg Val Asp Pro Phe Asp
645 650 655
Tyr Pro Phe Ile Ile Asp Lys Ile Glu Phe Ile Pro Ile
660 665
<210> 72
<211> 662
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 72
Met Gly Gly Leu Leu Met Asn Gln Tyr Tyr Asn Asn Asn Glu Tyr Glu
1 5 10 15
Ile Leu Asp Asn Gly Val Gln Cys Cys Ser Pro Arg Tyr Pro Leu Ala
20 25 30
Gln Ala Pro Gly Ser Glu Trp Gln Asn Met Asn Tyr Gln Asp Val Met
35 40 45
Asn Thr Ser Val Gly Arg Glu Tyr Gln Ala Val Gln Gln Val Asn Val
50 55 60
Gly Glu Ala Val Gly Ala Ala Leu Gly Ile Leu Thr Thr Ile Leu Lys
65 70 75 80
Ala Val Asn Pro Thr Leu Gly Thr Ala Ala Gly Val Ile Ser Ser Ile
85 90 95
Phe Gly Phe Leu Trp Lys Arg Phe Gly Thr Asp Pro Gln Ala Gln Trp
100 105 110
Lys Gln Phe Met Glu Ala Val Glu Tyr Leu Val Ser Gln Lys Ile Thr
115 120 125
Asp Ala Val Arg Ser Lys Ala Val Ser Glu Leu Glu Gly Val Gln Arg
130 135 140
Ala Val Glu Leu Tyr Gln Glu Ala Ala Asn Ala Trp Asn Met Asn Pro
145 150 155 160
Asp Asn Ala Ala Ala Lys Glu Arg Ile Arg Arg Gln Tyr Thr Ser Thr
165 170 175
Asn Thr Val Ile Glu Tyr Ala Met Pro Ser Phe Arg Val Gly Ser Phe
180 185 190
Glu Val Pro Leu Leu Thr Val Tyr Ala Gln Ala Ala Asn Leu His Leu
195 200 205
Leu Leu Leu Arg Asp Ala Val Lys Phe Gly Ala Gly Trp Gly Phe Ser
210 215 220
Pro Thr Glu Val Glu Asp Asn Tyr Thr Arg Leu Gln Ala Arg Thr Ala
225 230 235 240
Glu Tyr Thr Asn His Cys Thr Asn Thr Tyr Asp Lys Gly Leu Lys Gln
245 250 255
Ala Tyr Asp Leu Ala Pro Asn Pro Thr Asp Tyr Asn Lys Tyr Pro Tyr
260 265 270
Leu Asn Pro Tyr Ser Lys Asp Pro Ile Tyr Gly Lys Tyr Tyr Thr Ala
275 280 285
Pro Val Asp Trp Asn Leu Phe Asn Asp Phe Arg Arg Asp Met Thr Leu
290 295 300
Met Val Leu Asp Ile Val Ala Val Trp Pro Thr Tyr Asn Pro Arg Leu
305 310 315 320
Tyr Asn Asn Pro Asn Gly Val Gln Ile Gln Leu Ser Arg Glu Val Tyr
325 330 335
Ser Thr Val Tyr Gly Arg Gly Trp Ser Asn Asn Ser Thr Val Asp Ala
340 345 350
Ile Glu Ser Thr Leu Val Arg Pro Pro His Leu Val Thr Glu Leu Thr
355 360 365
Lys Leu Thr Phe Asp Glu Arg Asn Leu Tyr Glu Ala Glu Thr Val Pro
370 375 380
Val Ala Phe Arg Lys Val Thr Asn Thr Leu His Tyr Val Gly Ser Ser
385 390 395 400
Thr Thr Trp Glu Gln Ser Phe Ser Ala Thr Pro Val Gly Ser Leu Lys
405 410 415
Ala Val His Asn Val Leu Ala Thr Asp Ile Gly Asn Leu Ala Leu Ser
420 425 430
Leu Gly Ala Val Pro Leu Gly Phe Ser Phe Tyr Asn Lys Asn Asp Gln
435 440 445
His Ile Thr Thr Val Gly Tyr Ser Gly Gly Trp Trp Asn Gly Ile Pro
450 455 460
Lys Asp Glu Gly Ser Asn Gln Asn Ser His His Leu Ser Tyr Val Ala
465 470 475 480
Ala Leu Glu Thr Gln Thr Thr Ala Gly Trp Phe Pro Thr Tyr Pro Val
485 490 495
Pro Leu Leu Gly Glu Trp Gly Phe Gly Trp Gln His Asn Ser Leu Lys
500 505 510
Tyr Thr Asn Arg Leu Val Thr Asn Gln Ile Asn Gln Leu Pro Ala Val
515 520 525
Lys Ala Ser Ala Leu Val Asn His Ala Arg Val Ser Lys Gly Thr Thr
530 535 540
Gly Thr Gly Gly Asn Ile Ile Glu Leu Val Asn Pro Asn Cys Gly Phe
545 550 555 560
Ile Phe Asn Phe Tyr Ala Glu Pro Glu Asn Pro Gln Gly Gln Ala Phe
565 570 575
Asn Ile Arg Ile Arg Tyr Ser Ala Thr Val Pro Gly Lys Leu Asn Ile
580 585 590
Arg His Leu Glu Ser Gly Lys Glu Phe Met Asn Thr Pro Arg Asp Phe
595 600 605
Lys Gly Thr Thr Thr Gly Thr Asn Trp Ile Pro Lys Phe Gln Glu Tyr
610 615 620
Gln Tyr Leu Asp Leu Gly Pro Ile Val Leu Arg Thr Gly Met Asn Tyr
625 630 635 640
Gly Phe Lys Ile Glu Leu Ala Ser Gly Gln Leu Val Ser Ile Asp Lys
645 650 655
Ile Glu Phe Leu Pro Phe
660
<210> 73
<211> 197
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 73
Val Lys Arg Leu Lys Pro Gly Gln Tyr Gly Lys Tyr Gly Arg Glu Tyr
1 5 10 15
Glu Met Val Gln Ala Gly Ser Gln His Pro Pro Leu Phe Glu Gly Ala
20 25 30
Met Gln Ser Ala Ala Thr Ile Asp Asp Arg Glu Gln Val Gln Ser Ser
35 40 45
Val Ser Phe Cys Ser Met Val His Val Pro Gln Gly Phe Val Tyr Val
50 55 60
Pro Lys Gly Thr Arg Lys Phe Ala Tyr Ser Leu Ser Gly Ile Ser Ile
65 70 75 80
Val Lys Glu Ala Ser Gln Lys Thr Ile Thr Val Asp Asn Cys Gly Pro
85 90 95
Val Asp Val Thr Leu Asn Leu Leu Lys Val Val Gly Ser Ile Pro Tyr
100 105 110
Leu Val Asn Ala Gln Val Gln Gly Glu Cys Gly Glu Lys Tyr Gly Ala
115 120 125
Ala Gln Gly Arg Asp Asn Gln Ile Glu Leu Ser His Thr Gly His Ile
130 135 140
Pro Val Asn Thr Val Leu Lys Phe Ser Val Ala Ser Leu Pro Asp Tyr
145 150 155 160
Gln Ile Glu Glu Lys Asn Ile Val Ile Ser Ala Phe Asp Val Thr Pro
165 170 175
Val Gln Glu Gln Asp Asn Gln Phe Leu Gln Phe Ile Gly Thr Leu Thr
180 185 190
Phe Gln Asn Ile Pro
195
<210> 74
<211> 731
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 74
Met Glu Ala Gly Tyr Ser Gln Glu Gly Arg Arg Phe Ala Phe His Asp
1 5 10 15
Ile Ser Leu Ile Gln Trp Lys His Ile Cys Tyr Lys Asn Gln Lys Pro
20 25 30
Lys Ser Pro Arg Arg Asn Glu Ile Leu Ala Ile Tyr Cys Val Cys Phe
35 40 45
Met Asp Val Thr Leu Met Gln Lys Gly Gly Phe Phe Met Asn Gln Tyr
50 55 60
Val Thr Arg Ala Arg Glu Ala Val Asn Ala Leu Phe Leu Asn Asn Thr
65 70 75 80
Leu Gln Ala Lys Val Thr Asp Tyr Gln Ile Asp Gln Ala Ala Lys Leu
85 90 95
Val Glu Cys Ile Pro Asp Glu Ile Tyr Pro Lys Glu Lys Met Cys Leu
100 105 110
Leu Asp Gln Val Lys Val Ala Lys Arg Leu Ser Gln Ala Arg Asn Leu
115 120 125
Leu Asn Tyr Gly Asp Phe Glu Ser Ser Asp Trp Ser Gly Val Asp Gly
130 135 140
Trp Asn Ile Ser Ala His Val Tyr Ala Val Ala Asp Asn Pro Thr Phe
145 150 155 160
Lys Gly Gln Tyr Leu Asn Leu Pro Ser Ala Asn Asn Pro Gln Phe Ser
165 170 175
Asp Lys Ile Phe Pro Ser Tyr Ala Tyr Gln Lys Ile Asp Glu Ser Lys
180 185 190
Leu Lys Pro Tyr Thr Arg Tyr Met Val Arg Gly Phe Val Gly Thr Ser
195 200 205
Lys Asp Leu Glu Leu Leu Val Ala Arg Tyr Asp Lys Glu Val His Lys
210 215 220
Lys Met Asn Val Pro Asn Asp Ile Ile Pro Thr Asp Pro Cys Thr Gly
225 230 235 240
Gly Tyr Leu Leu Glu Gln Gly Ser Tyr Pro Val Leu Thr Asn Gln Met
245 250 255
Met Pro Gln Asn Met Ser Cys Asp Pro Cys Asp Thr Gly Tyr Arg Asn
260 265 270
Glu Val Gly Met Met Val Pro Asn Thr Asn Met Met Cys Gln Asp Pro
275 280 285
His Ala Phe Gln Phe His Ile Asp Ile Gly Glu Leu Asp Met Asp Arg
290 295 300
Asn Leu Gly Ile Trp Val Gly Phe Lys Ile Gly Thr Thr Asp Gly Met
305 310 315 320
Ala Thr Leu Asp Asn Val Glu Val Val Glu Val Gly Pro Leu Thr Gly
325 330 335
Glu Ala Leu Val Arg Met Gln Lys Arg Glu Pro Lys Trp Lys Gln Lys
340 345 350
Trp Ala Glu Lys Arg Met Lys Ile Glu Lys Ala Val Gln Ala Ala Arg
355 360 365
Asp Ala Ile Gln Ala Leu Phe Thr Ser Pro Asp Gln Asn Arg Leu Gln
370 375 380
Ser Ala Ile Thr Leu His Thr Ile Leu His Ala Glu Lys Leu Val Gln
385 390 395 400
Lys Ile Pro Tyr Ile Tyr Asn Gln Phe Leu Leu Gly Ala Leu Pro Ser
405 410 415
Val Pro Gly Glu Gln Tyr Asp Ile Phe Arg Lys Leu Ser Asp Ala Val
420 425 430
Ala Ile Ala Gln Ser Leu Tyr Gly Gln Arg Asn Val Leu Asn Asn Gly
435 440 445
Asp Phe Ser Ala Gly Leu Ser Gly Trp Asn Ala Thr Asp Gly Ala Asp
450 455 460
Val Gln Gln Ile Gly Asn Thr Ser Val Leu Val Ile Ser Asp Trp Ser
465 470 475 480
Ala Ser Leu Ser Gln His Val Cys Val Lys Pro Glu His Ser Tyr Leu
485 490 495
Leu Arg Val Thr Ala Lys Lys Glu Gly Ser Gly Glu Gly Tyr Val Thr
500 505 510
Ile Ser Asp Gly Thr Glu Glu Asn Thr Glu Thr Leu Arg Phe Thr Val
515 520 525
Gly Glu Glu Ala Thr Ser Ser Pro Leu Ser Asp Ile Arg Ser Thr Leu
530 535 540
Arg Glu Arg Tyr Asn Glu Gln Asn Val Pro Asn Ala Ser Glu Glu Ala
545 550 555 560
Tyr Gly Ile Asn Gly Tyr Ala Ser Asn Asn Met Thr Asn Tyr Pro Ser
565 570 575
Asp Asn Tyr Gly Val Asn Ala Tyr Pro Gly Val Asn Asn Asn Met Thr
580 585 590
Asn Tyr Gln Ser Glu Ser Phe Gly Ile Thr Pro Tyr Gly Asp Glu Asn
595 600 605
Ser Met Met Asn Tyr Pro Ser Asn Asn Tyr Glu Met Asn Ala Tyr Pro
610 615 620
Gly Ser Thr Asn Met Thr Asn Pro Asn Gly Gly Cys Ser Cys Gly Cys
625 630 635 640
Ser Thr Asn Ala Tyr Ala Gly Glu Asn Met Arg Arg Asn Asp Ala Ser
645 650 655
Asn Glu Asn Gly Phe Gly Tyr Gly Cys Gly Cys Arg Thr His Thr Asn
660 665 670
Asn Arg Thr Asp Ser Tyr Ala Pro Pro Met Ile Ala Gln Asn Ser Ser
675 680 685
Ser Leu Ser Gly Tyr Val Thr Lys Thr Val Glu Ile Phe Pro Glu Thr
690 695 700
Asn Arg Val Cys Val Glu Ile Gly Glu Thr Ser Gly Thr Phe Met Val
705 710 715 720
Glu Ser Ile Glu Leu Ile Arg Met Asp Cys Glu
725 730
<210> 75
<211> 1060
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 75
Met Pro Ile Ser Lys Glu Pro Ile Leu Tyr Pro Leu Val Ser Ser Thr
1 5 10 15
Ser Asn Ile Pro Thr Ser Glu Ser Phe Thr Phe Asp Trp Asn Trp Gly
20 25 30
Leu His Gln Ala Leu Ser Ile Gly Thr Gly Leu Met Lys Phe Ile Pro
35 40 45
Gly Leu Gly Val Val Ala Gly Pro Tyr Gly Ala Leu Leu Asn Tyr Val
50 55 60
Tyr Gly Gly Val Ile Asp Glu Leu Phe Pro Lys Lys Asp Ala Gly Gly
65 70 75 80
Gln Asp Thr Val Asp Pro Thr Val Leu Phe Gln Thr Phe Met Ala Ala
85 90 95
Ala Glu Gln Met Ile Asp Glu Lys Leu Asn Asp Thr Val Lys Ser Thr
100 105 110
Ala Val Thr Lys Leu Ala Gly Leu Lys Asn Asn Leu Thr Asp Leu Lys
115 120 125
Thr Lys Leu Asp Thr Leu Lys Asp Asn Ser Asp Pro Lys Asp Thr Asp
130 135 140
Glu Leu Lys Lys Gln Val Arg Asp Lys Phe Glu Ala Val His Gly Leu
145 150 155 160
Phe Arg Ser Asp Met Pro Gln Phe Arg Val Ala Ser Tyr Glu Ser Ile
165 170 175
Leu Leu Pro Val Tyr Ala Gln Ala Ala Asn Leu His Leu Ile Phe Leu
180 185 190
Arg Glu Ala Ile Ile Lys Gly Val Ser Glu Trp Gly Phe Pro Gln Ala
195 200 205
Thr Ile Asp Lys Phe Tyr Asp Asn Pro Thr Asp Lys Asn Gly Phe Lys
210 215 220
Gln Leu Met Glu Glu Tyr Thr Thr Asn Cys Met Ser Ala Tyr Gln Gln
225 230 235 240
Gly Leu Asp Lys Leu Ala Thr Gln Ser Ile Asp Leu Cys Thr Ser Asp
245 250 255
Gln Ser Tyr Trp Asn Pro Ala Tyr Tyr Asn Gln Tyr Leu Phe Leu Asp
260 265 270
Asp Leu Phe Ser Tyr Ala Thr Cys Gln His Ser Leu Gly Asp Met Ser
275 280 285
Tyr Gly Cys Gly Gly Gly Glu Leu Lys Pro Ile Cys Lys Asn Tyr Asn
290 295 300
Ser Arg Ile Tyr Ser Lys Tyr Met Gln Ser Ile Thr Asn Trp Asn Gln
305 310 315 320
Tyr Asn Asp Tyr Val Met Ser Met Gln Val Thr Ala Leu Asp Leu Val
325 330 335
Ala Met Trp Pro Tyr Trp Asp Pro Lys Val Tyr Pro Asn Gly Ala Lys
340 345 350
Lys Glu Leu Thr Arg Glu Ile Tyr Thr Asp Ile Leu Gly Ser Pro Asp
355 360 365
Gly Gln Thr Lys Gly Val Thr Thr Ile Ser Gln Glu Leu Leu Pro Gln
370 375 380
Pro Arg Leu Phe Thr Gln Leu Thr Gln Leu Asp Leu Asn Thr Glu Pro
385 390 395 400
His Thr Ile Gln Gln Val Thr Arg Asn Pro Val Ser Gly Lys Val Asn
405 410 415
Ala Thr Tyr Lys Tyr Leu Asp Gly Asp Ile Ile Val Gly Ile Thr Gln
420 425 430
His Leu Gln Thr Thr Leu Gly Glu Ser Lys Leu His Ala Gln Gly Ser
435 440 445
Gly Gly Ser Lys Thr Gln Ser Tyr Asp Asn Ser Tyr Thr Asn Asp Phe
450 455 460
Thr Met Pro Leu Lys Val Ala Ser Trp Phe Glu Pro Arg Thr Ile Gly
465 470 475 480
Phe Ala Lys Ser Ser Gly Glu Ile Tyr Pro Val Gly Thr Ile Gly Asp
485 490 495
Glu Thr Pro Phe Val Glu Ile Ser Lys Ser Ile Gly His Asn Ser Gly
500 505 510
Thr Ile Thr Ala Ile Ala His His Ala Val Lys Ile Ser Glu Ser Thr
515 520 525
Gln Ser Gly Tyr Tyr Glu Glu Tyr Gln Gly Asp Thr Ala Tyr Ser Ile
530 535 540
Asp Glu His Arg Leu Ser Trp Met Asn Tyr Thr Pro Thr Ser Ala Ser
545 550 555 560
Ser Phe Val Val Thr Gly Lys Gln Ile Gly Ser Leu Ser Leu Gly Trp
565 570 575
Thr Ser Ser Thr Val Asp Pro Thr Asn Lys Val Gln Lys Asp Thr Ile
580 585 590
Thr Ser Ile Pro Ala Val Lys Ser His Ser Ile Thr Asp Trp Gly Thr
595 600 605
Gly Thr Val Val Lys Gly Pro Gly His Thr Gly Gly Asp Leu Val Lys
610 615 620
Leu Pro Ser Asn Thr Arg Ala Lys Met Ile Val Thr Ile Glu Asp Thr
625 630 635 640
Ser Thr Ser Tyr Asp Val Arg Ile Arg Tyr Ala Ala Pro Ser Gly Gly
645 650 655
His Ile Gln Phe Ser Tyr Trp Asn Gly Gly Ser Asp Val Lys Val Ala
660 665 670
Asp Thr Gln Leu Gln Asn Thr Gly Gly Asn Thr Asn Phe Glu His Phe
675 680 685
Gln Tyr Ala Met Leu Thr Thr Asp Asn Ala Lys Phe Lys Ala Pro Phe
690 695 700
Ser Pro Val Glu Ile Leu Ile Glu Asn Ile Gly Asp Ser Asp Val Tyr
705 710 715 720
Leu Asp Lys Val Glu Phe Leu Val Leu Ser Gln Pro Leu Ser Glu Gln
725 730 735
Leu Pro Pro Gly Ala Thr Pro Leu Thr Ser Gln Tyr Met Asn Pro Tyr
740 745 750
Gly Tyr Asn Ile Leu Trp Gln Ser Lys Asn Gly Glu Ala Ala Asn Gln
755 760 765
Gly Met Val Thr Phe Ser Gln Asn Asp Ser Ala Ile Lys Thr Phe Tyr
770 775 780
Leu Tyr Asn Thr Glu Val Val His Gln Thr Thr Gly Ser Pro Ser Ser
785 790 795 800
Trp Asn Gly Lys Phe Asp Thr Leu Tyr Val Gln Ser Pro Thr Ser Ile
805 810 815
Asn Leu Thr Gln Gly Phe Ile Val Ile Asp Thr Thr Lys Asn Asn Pro
820 825 830
Glu Pro Pro Ile Ala Leu Pro Asn Gln Asp Ile Leu Arg Pro Phe Thr
835 840 845
Asn Glu His Glu Ile Trp Asn Gly Arg Tyr Ser Thr Lys Ala Leu Asn
850 855 860
Leu Ser Leu Ser Thr Ser Ser Gly Ala Glu Gly Lys Ile Lys Phe Tyr
865 870 875 880
Asn Asn Thr Asn Leu Val His Glu Ser Pro Ala Leu Ser Gly Ser Pro
885 890 895
Ser Glu Pro Tyr Thr Trp Glu Gly Ser Phe Asn Arg Ile Thr Val Tyr
900 905 910
Gln Ser Asn Ser Ser Asp Ser Asn Tyr Phe Asn Leu Phe Gly Gly Phe
915 920 925
Leu Lys Leu Asp Pro Asn Ser Asn Asp Asn Gly Asn Asn Gly Gly Pro
930 935 940
His Asn Asp Cys Glu Asn Ile Ala His Pro Asp Gln Pro Leu Tyr Tyr
945 950 955 960
Glu Ser Asn Asn Leu Ile Trp Thr Ala Ala Pro Asn Lys Leu Ala Tyr
965 970 975
Ser Thr Thr Glu Met Gln Phe Val Leu Ser Gly Gly Leu Gly Phe Thr
980 985 990
Pro Gly Ala Ile Gly Ala Lys Ile Lys Leu Asn Phe Trp Lys Asn Asp
995 1000 1005
Ser Ile Gln Tyr Val Ala Tyr Gly Ala Val Ala Asn Leu Asp Phe
1010 1015 1020
Ile Ser Ala Pro Ala Gln Ser Ile Pro Gly Gly Phe Asp Lys Ile
1025 1030 1035
Thr Met Asp Asn Asp Glu Tyr Ser Phe Pro Thr Ser Leu Arg Met
1040 1045 1050
Thr Leu Gly Ser Val Cys Tyr
1055 1060
<210> 76
<211> 729
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 76
Met Pro Ile Ser Lys Glu Pro Ile Leu Tyr Pro Leu Val Ser Ser Thr
1 5 10 15
Ser Asn Ile Pro Thr Ser Glu Ser Phe Thr Phe Asp Trp Asn Trp Gly
20 25 30
Leu His Gln Ala Leu Ser Ile Gly Thr Gly Leu Met Lys Phe Ile Pro
35 40 45
Gly Leu Gly Val Val Ala Gly Pro Tyr Gly Ala Leu Leu Asn Tyr Val
50 55 60
Tyr Gly Gly Val Ile Asp Glu Leu Phe Pro Lys Lys Asp Ala Gly Gly
65 70 75 80
Gln Asp Thr Val Asp Pro Thr Val Leu Phe Gln Thr Phe Met Ala Ala
85 90 95
Ala Glu Gln Met Ile Asp Glu Lys Leu Asn Asp Thr Val Lys Ser Thr
100 105 110
Ala Val Thr Lys Leu Ala Gly Leu Lys Asn Asn Leu Thr Asp Leu Lys
115 120 125
Thr Lys Leu Asp Thr Leu Lys Asp Asn Ser Asp Pro Lys Asp Thr Asp
130 135 140
Glu Leu Lys Lys Gln Val Arg Asp Lys Phe Glu Ala Val His Gly Leu
145 150 155 160
Phe Arg Ser Asp Met Pro Gln Phe Arg Val Ala Ser Tyr Glu Ser Ile
165 170 175
Leu Leu Pro Val Tyr Ala Gln Ala Ala Asn Leu His Leu Ile Phe Leu
180 185 190
Arg Glu Ala Ile Ile Lys Gly Val Ser Glu Trp Gly Phe Pro Gln Ala
195 200 205
Thr Ile Asp Lys Phe Tyr Asp Asn Pro Thr Asp Lys Asn Gly Phe Lys
210 215 220
Gln Leu Met Glu Glu Tyr Thr Thr Asn Cys Met Ser Ala Tyr Gln Gln
225 230 235 240
Gly Leu Asp Lys Leu Ala Thr Gln Ser Ile Asp Leu Cys Thr Ser Asp
245 250 255
Gln Ser Tyr Trp Asn Pro Ala Tyr Tyr Asn Gln Tyr Leu Phe Leu Asp
260 265 270
Asp Leu Phe Ser Tyr Ala Thr Cys Gln His Ser Leu Gly Asp Met Ser
275 280 285
Tyr Gly Cys Gly Gly Gly Glu Leu Lys Pro Ile Cys Lys Asn Tyr Asn
290 295 300
Ser Arg Ile Tyr Ser Lys Tyr Met Gln Ser Ile Thr Asn Trp Asn Gln
305 310 315 320
Tyr Asn Asp Tyr Val Met Ser Met Gln Val Thr Ala Leu Asp Leu Val
325 330 335
Ala Met Trp Pro Tyr Trp Asp Pro Lys Val Tyr Pro Asn Gly Ala Lys
340 345 350
Lys Glu Leu Thr Arg Glu Ile Tyr Thr Asp Ile Leu Gly Ser Pro Asp
355 360 365
Gly Gln Thr Lys Gly Val Thr Thr Ile Ser Gln Glu Leu Leu Pro Gln
370 375 380
Pro Arg Leu Phe Thr Gln Leu Thr Gln Leu Asp Leu Asn Thr Glu Pro
385 390 395 400
His Thr Ile Gln Gln Val Thr Arg Asn Pro Val Ser Gly Lys Val Asn
405 410 415
Ala Thr Tyr Lys Tyr Leu Asp Gly Asp Ile Ile Val Gly Ile Thr Gln
420 425 430
His Leu Gln Thr Thr Leu Gly Glu Ser Lys Leu His Ala Gln Gly Ser
435 440 445
Gly Gly Ser Lys Thr Gln Ser Tyr Asp Asn Ser Tyr Thr Asn Asp Phe
450 455 460
Thr Met Pro Leu Lys Val Ala Ser Trp Phe Glu Pro Arg Thr Ile Gly
465 470 475 480
Phe Ala Lys Ser Ser Gly Glu Ile Tyr Pro Val Gly Thr Ile Gly Asp
485 490 495
Glu Thr Pro Phe Val Glu Ile Ser Lys Ser Ile Gly His Asn Ser Gly
500 505 510
Thr Ile Thr Ala Ile Ala His His Ala Val Lys Ile Ser Glu Ser Thr
515 520 525
Gln Ser Gly Tyr Tyr Glu Glu Tyr Gln Gly Asp Thr Ala Tyr Ser Ile
530 535 540
Asp Glu His Arg Leu Ser Trp Met Asn Tyr Thr Pro Thr Ser Ala Ser
545 550 555 560
Ser Phe Val Val Thr Gly Lys Gln Ile Gly Ser Leu Ser Leu Gly Trp
565 570 575
Thr Ser Ser Thr Val Asp Pro Thr Asn Lys Val Gln Lys Asp Thr Ile
580 585 590
Thr Ser Ile Pro Ala Val Lys Ser His Ser Ile Thr Asp Trp Gly Thr
595 600 605
Gly Thr Val Val Lys Gly Pro Gly His Thr Gly Gly Asp Leu Val Lys
610 615 620
Leu Pro Ser Asn Thr Arg Ala Lys Met Ile Val Thr Ile Glu Asp Thr
625 630 635 640
Ser Thr Ser Tyr Asp Val Arg Ile Arg Tyr Ala Ala Pro Ser Gly Gly
645 650 655
His Ile Gln Phe Ser Tyr Trp Asn Gly Gly Ser Asp Val Lys Val Ala
660 665 670
Asp Thr Gln Leu Gln Asn Thr Gly Gly Asn Thr Asn Phe Glu His Phe
675 680 685
Gln Tyr Ala Met Leu Thr Thr Asp Asn Ala Lys Phe Lys Ala Pro Phe
690 695 700
Ser Pro Val Glu Ile Leu Ile Glu Asn Ile Gly Asp Ser Asp Val Tyr
705 710 715 720
Leu Asp Lys Val Glu Phe Leu Val Leu
725
<210> 77
<211> 522
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 77
Met Leu Leu Thr Gln Lys Gly Gly His Val Met Ala Ile Ser Arg Ile
1 5 10 15
Ile Asn Pro Ile Phe Thr Lys Gln Glu His Leu Asp Gln Ile Thr Asn
20 25 30
Leu Val Asn Asn Leu Phe Ser Ser Gly Ser Ser Ser Leu Ser Gln Ser
35 40 45
Val Ser Asp Tyr Trp Ile Asp Gln Val Leu Leu Lys Val Asn Ala Leu
50 55 60
Ser Asp Thr Val Phe Pro Thr Gln Lys Glu Gln Leu Arg Gln Arg Leu
65 70 75 80
Ala Gln Ala Lys Gln Ile Ser Lys Ala Arg Asn Leu Leu Val Gly Gly
85 90 95
Asn Phe Glu Thr Leu Asn Lys Trp Lys Leu Ser Arg Asn Ala Val Leu
100 105 110
Val Ala Gly His Asp Leu Phe Gln Gly Tyr His Leu Glu Leu Pro Pro
115 120 125
Ala Ile Asp Ser Val Lys Tyr Pro Ser Tyr Ala Tyr Gln Lys Ile Asp
130 135 140
Glu Ser Lys Leu Lys Ala Asn Thr Arg Tyr Tyr Val Ser Ala Phe Ile
145 150 155 160
Ala Gln Gly Ser Gln Leu Glu Ile Met Val Ser Arg Tyr Gly Gln Glu
165 170 175
Tyr Ser Gln Ile Leu Tyr Val Pro Ala Glu Met Ala Lys Pro Ile Ser
180 185 190
Pro Asp Gly Gly Pro Asn Cys Cys Phe Pro His Pro Cys Asn Cys Thr
195 200 205
Ala Cys Asn Glu Glu Glu Val Asp Ser His Phe Phe Gln Val Pro Ile
210 215 220
Asp Val Gly Thr Leu Gln Ser Ser Gln Asn Leu Gly Ile Glu Ile Gly
225 230 235 240
Phe Lys Val Ala Ser Thr Asp Gly Phe Ala Lys Leu Ser Asn Ile Glu
245 250 255
Val Phe Glu Gly Arg Pro Leu Thr Ala Ala Glu Gln Arg Lys Val Ser
260 265 270
Arg Leu Glu Asn Glu Trp Lys Glu Glu Gln Gln Thr Lys Glu Thr Glu
275 280 285
Arg Thr Gln Leu Leu Gln Gln Ile Gln Gln Arg Phe Asn Met Leu Tyr
290 295 300
Thr Thr Pro Glu His His Thr Leu Arg Ala Glu Thr Gly Tyr Gln His
305 310 315 320
Leu Leu Glu Thr Met Leu Pro Ser Leu His His Val Tyr His Trp Phe
325 330 335
Met Pro Asp Val Pro Asp Ser Asp Tyr Ala Leu Tyr Tyr Glu Leu Gln
340 345 350
Gln Lys Leu Glu Arg Gly Trp Asp Gln Tyr Phe Ser Arg Asn Leu Leu
355 360 365
Glu Asn Gly Asp Phe Leu Glu Pro Leu Asp Asp Ser Trp Tyr Thr Gln
370 375 380
Gly Asn Val Ser Leu His Ile Ile Asn Asn Asn Thr Met Leu Arg Leu
385 390 395 400
His His Trp Asp Ser Leu Ile Arg Lys Asn Ala Ser Leu Pro Val Val
405 410 415
Asn Glu Asp Ala Glu Tyr Val Ile Arg Val Ile Gly Lys Gly Thr Gly
420 425 430
Ser Val Leu Ile Gln Asn Gly Thr Thr Thr Asn Lys Leu Val Phe Thr
435 440 445
Asn Ser Arg Gln Met Glu Thr Lys Glu Phe His Leu Gln Pro Glu Lys
450 455 460
Glu Gln Leu Ser Leu Thr Ile Arg Ser Asp Ala Asn Glu Phe Leu Val
465 470 475 480
Asp Ala Ile Glu Val Ile Leu Met Asn Asp Gly Ala Glu Glu Glu Glu
485 490 495
Gln Leu Pro Gly Met Phe Pro Pro Ile Asn Ser Asn Met Gly Ser Thr
500 505 510
Pro Asn Ser Asn Met Met Asn Asn Asn Gln
515 520
<210> 78
<211> 804
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 78
Met Asn Gln Asn Tyr Asn Asn Asn Glu Tyr Glu Ile Ile Asp Asn Gly
1 5 10 15
Asn Met Gly Tyr Gln Pro Arg Tyr Pro Leu Ala Arg Ala Pro Gly Ser
20 25 30
Glu Cys Pro Lys Pro Asn Ala Lys Asp Gly Leu Tyr Thr Pro Leu Gly
35 40 45
Arg Val Asp Thr Val Leu Gln Asn Leu Asp Ile Gly Leu Ser Ile Arg
50 55 60
Thr Ala Leu Gly Ile Leu Gln Met Ile Leu Ala Ala Arg Ser Pro Ala
65 70 75 80
Leu Gly Arg Ala Ala Gly Leu Ile Asn Leu Ile Phe Gly Phe Leu Trp
85 90 95
Gly Thr Leu Gly Gly Gln Lys Thr Trp Glu Ser Phe Met Lys Ala Val
100 105 110
Glu Ala Leu Val Asp Gln Lys Ile Thr Asp Ala Val Arg Ala Lys Ala
115 120 125
Leu Ser Glu Leu Glu Gly Val Gln Asn Ala Val Ile Leu Tyr Gln Glu
130 135 140
Ala Ala Asp Asp Trp Asn Glu Asn Pro Asn Asp Glu Ser Asn Lys Glu
145 150 155 160
Arg Val Arg Arg Gln Phe Thr Ser Thr Asn Thr Val Met Glu Phe Ala
165 170 175
Ile Pro Ser Phe Arg Ala Leu Gly Phe Glu Val Pro Leu Leu Thr Val
180 185 190
Tyr Ala Gln Ala Thr Asn Leu His Leu Gln Leu Leu Arg Asp Ala Val
195 200 205
Lys Phe Gly Thr Glu Trp Gly Met Pro Ser Ala Glu Val Glu Asp Leu
210 215 220
Tyr Thr Arg Leu Thr Arg Arg Thr Ala Glu Tyr Thr Asp His Cys Val
225 230 235 240
Thr Thr Tyr Asp Lys Gly Leu Lys Gln Ala Tyr Asp Leu Ala Pro Asn
245 250 255
Pro Thr Asp Tyr Asn Lys Tyr Pro Tyr Leu Asn Pro Tyr Ser Lys Asp
260 265 270
Pro Ile Tyr Gly Lys Tyr Tyr Thr Ala Pro Val Asp Trp Asn Leu Phe
275 280 285
Asn Asp Tyr Arg Arg Asn Met Thr Leu Met Val Leu Asp Ile Val Ala
290 295 300
Val Trp Pro Thr Tyr Asn Pro Arg Ile Tyr Thr Asn Pro Asn Gly Thr
305 310 315 320
Gln Ile Glu Leu Ser Arg Glu Val Tyr Ser Thr Val Tyr Gly Arg Gly
325 330 335
Gly Ser Asn Asn Ser Ser Val Asp Ala Ile Glu Ser Gln Ile Val Arg
340 345 350
Pro Pro His Leu Val Thr Glu Leu Thr Thr Leu Lys Ile Glu Gln Gly
355 360 365
Ser Thr Leu Asp Met Glu Gln Ile Gln Tyr Pro Lys Tyr Met Lys Val
370 375 380
Thr Asn Thr Leu His Tyr Ile Gly Ser Ser Ser Thr Trp Glu Gln Ser
385 390 395 400
Ser Ser Ala Pro Pro Ile Arg Pro Ile Thr Lys Ile His Thr Ile Pro
405 410 415
Ala Asn Asn Ile Gly Asn Leu Ser Leu Ser Gln Leu Asp Val Pro Tyr
420 425 430
Arg Phe Ser Phe Tyr Asn Lys Asp Asp Thr Leu Ile Ala Glu Val Gly
435 440 445
Ala Glu Phe Pro Pro Asn Thr Val Thr Trp Asn Gly Ile Glu Lys Ala
450 455 460
Glu Asp Ser Asn Gln Asn Ser His Arg Leu Ser Tyr Val Gly Ala Leu
465 470 475 480
Gly Thr Gln Ser Ser Ala Gly Phe Pro Trp Thr Tyr Pro Thr Glu Leu
485 490 495
Leu Gly Glu Trp Gly Phe Gly Trp Leu His Asn Ser Leu Thr Pro Glu
500 505 510
Asn Arg Val Gly Val Thr Thr Ile Thr Gln Ile Pro Ala Val Lys Ala
515 520 525
Tyr Trp Met Glu Gln Gly Ala Gln Val Val Lys Gly Pro Gly Ser Thr
530 535 540
Gly Gly Asp Val Ile Gln Leu Pro Val Asn Gly Ile Ile Arg Ile Asn
545 550 555 560
Leu Thr Ser Ile Asn Pro Gln Arg Asn Tyr Ser Val Arg Val Arg Tyr
565 570 575
Ala Ala Thr Ala Asn Gly Arg Leu Asn Phe Ser Arg Ile Asp Ser Phe
580 585 590
Gly Thr Ile Gln Ser Thr Ser Thr Glu Tyr Val Thr Thr Gly Ala Gly
595 600 605
Ala Asn Ala Ser Ser Phe Thr Tyr Asn Gln Phe Gln Tyr Val Asp Ile
610 615 620
Asp Pro Ser Asp Ser Thr Gln Val Tyr Thr Gly Ile Ile Leu Val Asn
625 630 635 640
Glu Met Gly Gly Pro Ile Tyr Ile Asp Lys Ile Glu Phe Ile Pro Leu
645 650 655
Ser Gln Ile Ile Glu Pro Pro Gln Leu Ile Pro Asp Gly Ser Tyr Gln
660 665 670
Ile Ile Thr Ala Leu Asn Asn Arg Ser Ala Val Gln Ala Ile Phe Lys
675 680 685
Asn Val Tyr Pro Arg Leu Asn Asn Leu Glu Leu Trp Glu Gly Ser Ser
690 695 700
Phe Lys Trp Asn Phe Val Tyr Asn Ala Gly Arg Asp Ala Tyr Gln Ile
705 710 715 720
Phe Thr Ala Asp Gly Gly Ala Leu Thr Arg Phe Asn Glu Ile Ser Thr
725 730 735
Asp Arg Asp Pro Val Phe Val Arg Gln Asn Leu Ser Thr Asp Asn Gln
740 745 750
Phe Trp Lys Ile Tyr Tyr Gln Asn Asp Gly Tyr Phe Val Ile Arg Asn
755 760 765
Leu Asp Ser Ala Leu Asp Val Trp Gly Tyr Ser Thr Ala Asn Gly Thr
770 775 780
Thr Val Asp Ala Tyr Arg Tyr His Gly Gly Ile Asn Gln Lys Phe Arg
785 790 795 800
Leu Leu Lys Val
<210> 79
<211> 656
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 79
Met Asn Gln Asn Tyr Asn Asn Asn Glu Tyr Glu Ile Ile Asp Asn Gly
1 5 10 15
Asn Met Gly Tyr Gln Pro Arg Tyr Pro Leu Ala Arg Ala Pro Gly Ser
20 25 30
Glu Cys Pro Lys Pro Asn Ala Lys Asp Gly Leu Tyr Thr Pro Leu Gly
35 40 45
Arg Val Asp Thr Val Leu Gln Asn Leu Asp Ile Gly Leu Ser Ile Arg
50 55 60
Thr Ala Leu Gly Ile Leu Gln Met Ile Leu Ala Ala Arg Ser Pro Ala
65 70 75 80
Leu Gly Arg Ala Ala Gly Leu Ile Asn Leu Ile Phe Gly Phe Leu Trp
85 90 95
Gly Thr Leu Gly Gly Gln Lys Thr Trp Glu Ser Phe Met Lys Ala Val
100 105 110
Glu Ala Leu Val Asp Gln Lys Ile Thr Asp Ala Val Arg Ala Lys Ala
115 120 125
Leu Ser Glu Leu Glu Gly Val Gln Asn Ala Val Ile Leu Tyr Gln Glu
130 135 140
Ala Ala Asp Asp Trp Asn Glu Asn Pro Asn Asp Glu Ser Asn Lys Glu
145 150 155 160
Arg Val Arg Arg Gln Phe Thr Ser Thr Asn Thr Val Met Glu Phe Ala
165 170 175
Ile Pro Ser Phe Arg Ala Leu Gly Phe Glu Val Pro Leu Leu Thr Val
180 185 190
Tyr Ala Gln Ala Thr Asn Leu His Leu Gln Leu Leu Arg Asp Ala Val
195 200 205
Lys Phe Gly Thr Glu Trp Gly Met Pro Ser Ala Glu Val Glu Asp Leu
210 215 220
Tyr Thr Arg Leu Thr Arg Arg Thr Ala Glu Tyr Thr Asp His Cys Val
225 230 235 240
Thr Thr Tyr Asp Lys Gly Leu Lys Gln Ala Tyr Asp Leu Ala Pro Asn
245 250 255
Pro Thr Asp Tyr Asn Lys Tyr Pro Tyr Leu Asn Pro Tyr Ser Lys Asp
260 265 270
Pro Ile Tyr Gly Lys Tyr Tyr Thr Ala Pro Val Asp Trp Asn Leu Phe
275 280 285
Asn Asp Tyr Arg Arg Asn Met Thr Leu Met Val Leu Asp Ile Val Ala
290 295 300
Val Trp Pro Thr Tyr Asn Pro Arg Ile Tyr Thr Asn Pro Asn Gly Thr
305 310 315 320
Gln Ile Glu Leu Ser Arg Glu Val Tyr Ser Thr Val Tyr Gly Arg Gly
325 330 335
Gly Ser Asn Asn Ser Ser Val Asp Ala Ile Glu Ser Gln Ile Val Arg
340 345 350
Pro Pro His Leu Val Thr Glu Leu Thr Thr Leu Lys Ile Glu Gln Gly
355 360 365
Ser Thr Leu Asp Met Glu Gln Ile Gln Tyr Pro Lys Tyr Met Lys Val
370 375 380
Thr Asn Thr Leu His Tyr Ile Gly Ser Ser Ser Thr Trp Glu Gln Ser
385 390 395 400
Ser Ser Ala Pro Pro Ile Arg Pro Ile Thr Lys Ile His Thr Ile Pro
405 410 415
Ala Asn Asn Ile Gly Asn Leu Ser Leu Ser Gln Leu Asp Val Pro Tyr
420 425 430
Arg Phe Ser Phe Tyr Asn Lys Asp Asp Thr Leu Ile Ala Glu Val Gly
435 440 445
Ala Glu Phe Pro Pro Asn Thr Val Thr Trp Asn Gly Ile Glu Lys Ala
450 455 460
Glu Asp Ser Asn Gln Asn Ser His Arg Leu Ser Tyr Val Gly Ala Leu
465 470 475 480
Gly Thr Gln Ser Ser Ala Gly Phe Pro Trp Thr Tyr Pro Thr Glu Leu
485 490 495
Leu Gly Glu Trp Gly Phe Gly Trp Leu His Asn Ser Leu Thr Pro Glu
500 505 510
Asn Arg Val Gly Val Thr Thr Ile Thr Gln Ile Pro Ala Val Lys Ala
515 520 525
Tyr Trp Met Glu Gln Gly Ala Gln Val Val Lys Gly Pro Gly Ser Thr
530 535 540
Gly Gly Asp Val Ile Gln Leu Pro Val Asn Gly Ile Ile Arg Ile Asn
545 550 555 560
Leu Thr Ser Ile Asn Pro Gln Arg Asn Tyr Ser Val Arg Val Arg Tyr
565 570 575
Ala Ala Thr Ala Asn Gly Arg Leu Asn Phe Ser Arg Ile Asp Ser Phe
580 585 590
Gly Thr Ile Gln Ser Thr Ser Thr Glu Tyr Val Thr Thr Gly Ala Gly
595 600 605
Ala Asn Ala Ser Ser Phe Thr Tyr Asn Gln Phe Gln Tyr Val Asp Ile
610 615 620
Asp Pro Ser Asp Ser Thr Gln Val Tyr Thr Gly Ile Ile Leu Val Asn
625 630 635 640
Glu Met Gly Gly Pro Ile Tyr Ile Asp Lys Ile Glu Phe Ile Pro Leu
645 650 655
<210> 80
<211> 614
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 80
Met Asn Lys Asp Ile Thr Arg Ala Arg Glu Thr Val Gln Ser Leu Phe
1 5 10 15
Ala Asn Asp Thr Arg Asn Ala Leu Lys Leu Ser Ile Thr Asp Tyr Ala
20 25 30
Val Asp Gln Ala Ala Asn Leu Val Glu Cys Val Ser Glu Asp Phe His
35 40 45
Ala Gln Glu Lys Met Ile Leu Leu Asp Gln Val Lys Phe Ala Lys Arg
50 55 60
Leu Ser Gln Ala Arg Asn Leu Leu Asn Tyr Gly Asp Phe Glu Ser Ser
65 70 75 80
Asp Trp Ser Gly Glu Asn Gly Trp Arg Thr Ser Pro His Val His Val
85 90 95
Lys Ser Asn Asn Pro Ile Phe Lys Gly His Tyr Leu His Ile Pro Gly
100 105 110
Ala Met Ser Pro Gln Phe Ser Asn Asn Thr Tyr Ser Thr Tyr Val Tyr
115 120 125
Gln Lys Val Asp Glu Ser Lys Leu Lys Ser Tyr Thr Arg Tyr Leu Val
130 135 140
Arg Gly Phe Val Gly Asn Ser Lys Asp Leu Gln Leu Leu Val Glu Arg
145 150 155 160
Tyr Gly Lys Glu Val His Val Glu Met Asp Val Pro Asp Asp Met Gln
165 170 175
Tyr Thr Leu Pro Met Asn Glu Cys Gly Gly Phe Asp Arg Cys Lys Pro
180 185 190
Thr Ser Tyr Gln Thr Arg Asn Pro His Thr Cys Thr Cys Lys Asp Thr
195 200 205
Ala Tyr Thr Asp Thr Asp Cys Gln Cys Lys Asp Lys Met Asn Arg Leu
210 215 220
Thr Thr Gly Val Tyr Thr Asn Met Pro Val Asp Ser Ser Met Tyr Ala
225 230 235 240
Asp Gly Tyr His Thr His Thr Ser Cys Gly Cys Gly Asn Lys Asn Met
245 250 255
Tyr Gln Asn Gly Lys His Thr His Thr Ser Cys Gly Cys Lys Asn Pro
260 265 270
His Val Phe Ser Phe His Ile Asp Thr Gly Tyr Val Asp Leu Glu Glu
275 280 285
Asn Val Gly Leu Leu Phe Ala Leu Lys Ile Val Ser Thr Asn Gly Val
290 295 300
Ala Asn Ile Asp Asn Leu Glu Ile Ile Glu Gly Lys Pro Leu Thr Gly
305 310 315 320
Glu Ala Leu Ala Arg Val Lys Lys Arg Glu His Lys Trp Lys Glu Lys
325 330 335
Met Lys Gln Lys Arg Cys Lys Thr Glu Glu Ala Val Gln Ala Ala Gln
340 345 350
Thr Ala Ile Gln Ala Leu Phe Thr Asn Ala Glu Tyr Asn Arg Leu Lys
355 360 365
Phe Glu Thr Leu Phe Pro His Ile Leu Tyr Ala Asp Glu Leu Val Gln
370 375 380
Gly Ile Pro Tyr Leu Tyr His Pro Phe Phe Lys Gly Ala Leu Pro Pro
385 390 395 400
Val Pro Gly Met Asn Asp Lys Leu Phe Gln Gln Leu Ser Asp Leu Val
405 410 415
Gly Arg Ala Arg Gly Phe Tyr Glu Met Arg Asn Leu Val Gln Asn Gly
420 425 430
Thr Phe Ser Ser Gly Thr Gly Asn Trp His Val Thr Asp Gly Val Thr
435 440 445
Thr Gln Pro Glu Gly Asn Thr Ser Val Leu Val Leu Arg Glu Trp Ser
450 455 460
Asp Gln Val Ile Gln His Leu Arg Ile Asp Ala Asp Arg Gly Tyr Val
465 470 475 480
Leu Arg Val Thr Ala Arg Lys Glu Gly Gly Gly Lys Gly Thr Val Thr
485 490 495
Met Ser Asp Cys Ala Ala Tyr Thr Glu Thr Leu Thr Phe Thr Ser Cys
500 505 510
Asp Tyr Asn Thr Leu Gly Ser Gln Thr Met Thr Ser Gly Thr Leu Ser
515 520 525
Gly Phe Val Thr Lys Thr Leu Glu Ile Phe Pro Asp Thr Asp Arg Ile
530 535 540
Arg Ile Asp Ile Gly Ala Thr Glu Gly Val Phe Lys Val Glu Ser Val
545 550 555 560
Glu Leu Ile Cys Met Glu Gln Met Glu Asp Arg Met Tyr Asp Met Ala
565 570 575
Gly Asn Val Glu Glu Glu Met Gln Tyr Leu Gln Glu Ser Gly Ser Val
580 585 590
Arg Asn Thr Ser Gly Pro Asp Cys Asn Thr Ile Pro Asp Phe Leu Gly
595 600 605
Gly Pro Cys Pro Ser Pro
610
<210> 81
<211> 382
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 81
Met Val Asn Ile Asp Lys Asp Lys Phe Tyr Lys Ile Glu Asn Ile Lys
1 5 10 15
Tyr Asn Lys Val Leu Ala Ile Ser Ala Gly Asn Thr Asp Asn Ala Phe
20 25 30
Ile Tyr Thr Asp Leu Gly Ser Asp Asp Gln Arg Trp Ala Phe Phe Lys
35 40 45
Leu Asp Asp Glu Ser Tyr Arg Ile Val Asn Lys Ser Asn Gly Lys Thr
50 55 60
Leu Ala Met Thr Asn Asp Asp Val Phe Val Tyr Pro His Leu Val Thr
65 70 75 80
Ala Asp Gln His Trp Thr Lys Tyr Asp Ile Ala Glu Asn Met Lys Phe
85 90 95
Arg Asn Leu Asn Asn Tyr Lys Val Leu Ala Ala Gly Pro Ser Ser Asp
100 105 110
Val Phe Val Trp Asp Asp Leu Pro Ser Asp Val Leu Asp Gln Gln Trp
115 120 125
Lys Ile Ser Pro Val Glu Asn Leu Val Met Pro Asn Leu Pro Thr Asn
130 135 140
Phe Lys Lys Leu Gly Pro Ser Pro Thr Tyr Ser Ser Pro Asn Asp Gln
145 150 155 160
Phe Gln Glu Asp Met Pro Arg Val Leu Val Gly Ala Val Leu Val Pro
165 170 175
Tyr Phe Ala Val Ala Asp Asn Asn Ile Asp Pro Gly Thr Gln Val Lys
180 185 190
Arg Asn Pro Tyr Tyr Val Met Glu His Tyr Gln Asn Trp His Leu Leu
195 200 205
Ser Glu Asn Ser Leu Pro Ala Gly Gly Glu Glu Thr Leu Thr Leu His
210 215 220
Thr Gly Ile Arg Thr Ile Asp Gln Gln Thr Ile Thr Gln Lys Ser Gly
225 230 235 240
Ile Ser Ile Ala Ser Asp Ala Gly Phe Thr Phe Pro Ile Val Pro Ala
245 250 255
Gly Arg Ala Asp Gly Pro Phe Pro Thr Val Thr Gly Asp Leu Lys Thr
260 265 270
Thr Ile Thr Glu Glu Leu Asp Val Ser Ile Ser His Thr Thr Glu Leu
275 280 285
Met Lys Glu Val Thr Gln Thr Gln Thr Val Arg Asn Pro Phe Asn Gln
290 295 300
Gln Leu Gln Tyr Ala Lys Phe Ala Val Lys Asp Thr Tyr Ile Leu Arg
305 310 315 320
Arg Ala Asp Asn Ser Val Val Tyr Glu Val Ser Ala Val Asp Thr Thr
325 330 335
Ser Ile Lys Gly Ala Ser Tyr Pro Glu Asp Lys Gln Pro Ile Thr Asp
340 345 350
Ala Ala Lys Ile Val Ala Ser Arg Tyr Asp Val Thr Asn Pro Asn Gln
355 360 365
Thr Asn Cys Gln Cys Gln Val Thr Cys Asn Cys Pro Ser Lys
370 375 380
<210> 82
<211> 1209
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 82
Met Tyr Asn Ile Glu Ile Gln Ile Arg Thr Gly Gly Thr Phe Met Asn
1 5 10 15
His Asn Asn Asn Asn Asn Glu Tyr Glu Ile Ile Asp Ser His Thr Ser
20 25 30
Ser Tyr Pro Ser Asn Arg Asn Ser Asn His Ser Arg Tyr Pro Tyr Thr
35 40 45
Asn Asn Pro Asn Gln Pro Leu Ser Asn Thr Asn Tyr Lys Asp Trp Leu
50 55 60
Thr Met Cys Gln Gly Asn Gln Pro Tyr Arg Asp Lys Pro Gln Thr Leu
65 70 75 80
Val Asp Thr Gly Val Ala Ile Ser Thr Gly Leu Ile Ile Ile Gly Thr
85 90 95
Ile Met Thr Gly Phe Pro Ala Leu Thr Pro Trp Gly Ile Gly Ile Val
100 105 110
Ser Phe Gly Thr Leu Leu Pro Val Leu Trp Pro Ser Gly Glu Thr Asp
115 120 125
Lys Lys Val Trp Ile Asp Phe Met Asn Tyr Gly Gly Thr Ile Phe Lys
130 135 140
Pro Leu Leu Asn Glu Gln Lys Asp Gln Ala Gln Arg Ile Leu Gln Gly
145 150 155 160
Phe His Leu Pro Ile Asn Ser Tyr Gln Asn Gly Ile Thr Thr Trp Gln
165 170 175
Asn Leu Arg Lys Ser His Ile Pro Gly Thr Pro Pro Ser Ser Ala Leu
180 185 190
Arg Glu Ala Ala Arg Val Ala Arg Thr Arg Ile Asp Ile Ala Asn Ser
195 200 205
Ala Leu Ser Arg Ile Ser Glu Ile Gln Ser Ala Gln Phe Gly Ala Ala
210 215 220
Ile Leu Pro Phe Tyr Ala Gln Ala Ala Thr Leu His Leu Asn Leu Leu
225 230 235 240
Ser Gln Ala Val Gln Phe Ala Asp Gln Leu Lys Ala Asp Ala Glu Asn
245 250 255
Gln Pro Thr Gln Asp Ala Gly Thr Ser Asp Glu Tyr His Arg Leu Leu
260 265 270
Lys Gln Tyr Thr Gln Gln Tyr Thr Asp Tyr Cys Val Lys Thr Tyr Gln
275 280 285
Glu Gly Leu Thr Thr Leu Lys Asn Ala Pro Asp Met Thr Trp Asn Ile
290 295 300
Tyr Asn Thr Tyr Arg Arg Asp Met Thr Leu Leu Val Leu Asp Tyr Ile
305 310 315 320
Ala Leu Phe Pro Asn Phe Asp Ile Arg Gln Tyr Pro Thr Gly Thr His
325 330 335
Ser Glu Leu Thr Arg Glu Ile Tyr Thr Asp Ala Leu Ile Lys Glu Gln
340 345 350
Pro Asn Pro Pro Ile Pro Ile Pro Val Ala Gln Arg Glu Thr Glu Leu
355 360 365
Thr Arg Pro Pro His Leu Phe Ser Arg Leu Asn Arg Leu Leu Leu Phe
370 375 380
Ser Asn Thr Asp Pro Ser Pro Pro Ala Leu Ser Ala Val Gln Asn Ser
385 390 395 400
Phe Thr Tyr Thr Asn Asn Asn Ile Val Gln Tyr Ser Gln Ile Tyr Arg
405 410 415
Leu Ile Asn Ser Pro Glu Pro Thr Gly Ser Thr Gln Gln Ile Ile Ile
420 425 430
Ser Asn Thr Asp Ile Tyr Arg Ile Glu Leu Thr Leu Arg Gln Asn Tyr
435 440 445
Phe Ile Thr His Asn Ile Asn Phe Tyr Thr Leu Asp Gly Ile Thr Arg
450 455 460
Arg Tyr Asn Ser Gly Ser Thr Pro Glu Thr Pro Ile Ile Ile Asn Phe
465 470 475 480
Gln Leu Pro Glu Phe Pro Ala Asp Lys Ile Pro Pro Tyr Gly Leu Gly
485 490 495
Thr Lys Tyr Ser His Ile Leu Ser Tyr Met Lys Ile Ser Pro Asn Arg
500 505 510
His Asn Ile Val Leu Pro Asn Glu Arg His Leu Ser Phe Ala Trp Thr
515 520 525
His Thr Ser Val Asn Phe Asp Asn Glu Ile Ser Asn Gln Ile Val Thr
530 535 540
Gln Ile Pro Ala Val Lys Ala Arg Ser Leu Asp Thr Ser Ser Ser Val
545 550 555 560
Ile Ser Gly Pro Gly His Thr Gly Gly Asp Leu Val Leu Phe Arg Ser
565 570 575
Arg Met Glu Phe Gln Cys Phe Val Pro Thr Gln Thr Lys Tyr Lys Ile
580 585 590
Arg Met Arg Tyr Val Ala Tyr Ser Pro Asn Asn Ser Ile Ser Leu Thr
595 600 605
Leu Asn Ile Met Gly Gln Val Asn Tyr Gly Leu Arg Ala Leu Asn Ile
610 615 620
Lys Ser Thr Val Ala Ser Glu Lys Asp Thr Val Asn Pro Lys Tyr Asn
625 630 635 640
Asp Phe Gln Tyr Leu Tyr Phe Tyr Thr Gln Asp Pro Asn Glu Ile Ala
645 650 655
Ile Val Asn Leu Tyr Ser Leu Thr Asn Met Thr Leu Gln Ser Asn Asn
660 665 670
Phe Ala Gly Asn Thr Leu Val Ile Asp Lys Ile Glu Phe Leu Pro Val
675 680 685
Thr Gln Thr Leu Glu Glu Asn Leu Glu Thr Gln Lys Leu Glu Glu Ile
690 695 700
Gln Gln Thr Val Asn Thr Phe Phe Thr Asn His Thr Lys Asn Ile Leu
705 710 715 720
Asn Ile Glu Thr Thr Asp Tyr Glu Ile Asp Gln Thr Ala Ile Leu Val
725 730 735
Glu Ser Leu Ser Glu Glu Gln Tyr Pro Gln Glu Lys Met Ile Leu Leu
740 745 750
Asp Thr Met Lys Gln Ala Lys Gln Phe Ser Gln Ser Arg Asn Leu Leu
755 760 765
Gln Asn Gly Asp Phe Ser Ser Phe Ile Gly Trp Thr Ile Asn Asn Asp
770 775 780
Leu Thr Leu Gln Thr Asn Asn Pro Ile Phe Lys Gly Gln Tyr Leu His
785 790 795 800
Ile Leu Gly Ala Arg Thr Thr Glu Ile Asp Asn Thr Ile Phe Pro Thr
805 810 815
Tyr Val Tyr Gln Lys Ile Asp Glu Ser Lys Leu Lys Pro Tyr Thr Arg
820 825 830
Tyr Val Val Arg Gly Cys Ile Ser Asn Ser Lys Asp Leu Glu Leu Phe
835 840 845
Val Thr Arg Tyr Asn Lys Glu Ile His Lys Ile Leu Asn Ile Pro Asn
850 855 860
Asp Ser Ser His Met Asn Ala Glu Ile Gln Thr Asn Ser Tyr Glu Ala
865 870 875 880
Gln Ser Tyr Ser Phe Arg Asn Glu Asn Asn Asn Leu Thr Asn Gln Gln
885 890 895
Ser Pro Tyr Pro Thr Thr Ser Asn His Ser Gly Tyr Ser Glu Ser Thr
900 905 910
Leu Ile Ser Ser Asn Phe Glu Asn Glu Asn Ala Phe Ser Phe Ser Ile
915 920 925
Asp Thr Gly Asn Leu Asp Phe Asn Glu Asn Leu Gly Ile Gly Ile Leu
930 935 940
Phe Lys Ile Ser Asn Pro Asp Gly Tyr Ala Ala Leu Gly Asn Leu Glu
945 950 955 960
Val Ile Glu Glu Gln Pro Leu Thr Glu Glu Glu Val Asn Arg Val Thr
965 970 975
Glu Lys Glu Asn Arg Trp Lys Gln Val Arg Asn Asn Gln Gln Lys Glu
980 985 990
Thr Glu Gln Ala Tyr Tyr Gln Ala Gln Gln Ala Ile Asp Ala Leu Phe
995 1000 1005
Ile Asn Ser Gln His Gln Met Leu Lys Ile Glu Thr Thr Ile Gln
1010 1015 1020
Asp Ile Val Val Ala Glu Thr Phe Ile Asp Lys Ile Pro Tyr Ile
1025 1030 1035
Tyr Asn Glu Trp Leu Pro Asn Glu Pro Gly Met Asn Tyr Thr Leu
1040 1045 1050
Tyr Gln Gly Leu Lys Gln Gln Ile Ser Gln Ala Tyr Met Leu Tyr
1055 1060 1065
Arg Asn Arg Asn Leu Ile Gln Asn Gly Asn Phe Ile Asn Ser Thr
1070 1075 1080
Thr Asn Trp Phe Thr Ser Pro Asp Ala Lys Ile Gln Gln Ile Asp
1085 1090 1095
Asn Thr Ser Ile Leu Val Ile Pro Asn Trp Ser Thr Gln Val Ser
1100 1105 1110
Gln Asn Ile Asn Leu Pro Gln Gln Asn His Gln Tyr Leu Leu Arg
1115 1120 1125
Val Ile Ala Lys Lys Glu Gly Ile Gly Asn Gly Tyr Val Lys Ile
1130 1135 1140
Ser Asp Cys Thr Lys His Val Glu Thr Leu Ile Phe Thr Ser Cys
1145 1150 1155
Asp Tyr Asn Asn Asn Ala Met Trp Asn Glu Pro Met Gly Tyr Val
1160 1165 1170
Thr Lys Thr Met His Ile Thr Pro His Thr Asn Gln Val Arg Ile
1175 1180 1185
Asp Ile Gly Glu Thr Glu Gly Thr Phe Lys Ile Asn Ser Val Glu
1190 1195 1200
Leu Ile Gly Ile Lys Asn
1205
<210> 83
<211> 688
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 83
Met Tyr Asn Ile Glu Ile Gln Ile Arg Thr Gly Gly Thr Phe Met Asn
1 5 10 15
His Asn Asn Asn Asn Asn Glu Tyr Glu Ile Ile Asp Ser His Thr Ser
20 25 30
Ser Tyr Pro Ser Asn Arg Asn Ser Asn His Ser Arg Tyr Pro Tyr Thr
35 40 45
Asn Asn Pro Asn Gln Pro Leu Ser Asn Thr Asn Tyr Lys Asp Trp Leu
50 55 60
Thr Met Cys Gln Gly Asn Gln Pro Tyr Arg Asp Lys Pro Gln Thr Leu
65 70 75 80
Val Asp Thr Gly Val Ala Ile Ser Thr Gly Leu Ile Ile Ile Gly Thr
85 90 95
Ile Met Thr Gly Phe Pro Ala Leu Thr Pro Trp Gly Ile Gly Ile Val
100 105 110
Ser Phe Gly Thr Leu Leu Pro Val Leu Trp Pro Ser Gly Glu Thr Asp
115 120 125
Lys Lys Val Trp Ile Asp Phe Met Asn Tyr Gly Gly Thr Ile Phe Lys
130 135 140
Pro Leu Leu Asn Glu Gln Lys Asp Gln Ala Gln Arg Ile Leu Gln Gly
145 150 155 160
Phe His Leu Pro Ile Asn Ser Tyr Gln Asn Gly Ile Thr Thr Trp Gln
165 170 175
Asn Leu Arg Lys Ser His Ile Pro Gly Thr Pro Pro Ser Ser Ala Leu
180 185 190
Arg Glu Ala Ala Arg Val Ala Arg Thr Arg Ile Asp Ile Ala Asn Ser
195 200 205
Ala Leu Ser Arg Ile Ser Glu Ile Gln Ser Ala Gln Phe Gly Ala Ala
210 215 220
Ile Leu Pro Phe Tyr Ala Gln Ala Ala Thr Leu His Leu Asn Leu Leu
225 230 235 240
Ser Gln Ala Val Gln Phe Ala Asp Gln Leu Lys Ala Asp Ala Glu Asn
245 250 255
Gln Pro Thr Gln Asp Ala Gly Thr Ser Asp Glu Tyr His Arg Leu Leu
260 265 270
Lys Gln Tyr Thr Gln Gln Tyr Thr Asp Tyr Cys Val Lys Thr Tyr Gln
275 280 285
Glu Gly Leu Thr Thr Leu Lys Asn Ala Pro Asp Met Thr Trp Asn Ile
290 295 300
Tyr Asn Thr Tyr Arg Arg Asp Met Thr Leu Leu Val Leu Asp Tyr Ile
305 310 315 320
Ala Leu Phe Pro Asn Phe Asp Ile Arg Gln Tyr Pro Thr Gly Thr His
325 330 335
Ser Glu Leu Thr Arg Glu Ile Tyr Thr Asp Ala Leu Ile Lys Glu Gln
340 345 350
Pro Asn Pro Pro Ile Pro Ile Pro Val Ala Gln Arg Glu Thr Glu Leu
355 360 365
Thr Arg Pro Pro His Leu Phe Ser Arg Leu Asn Arg Leu Leu Leu Phe
370 375 380
Ser Asn Thr Asp Pro Ser Pro Pro Ala Leu Ser Ala Val Gln Asn Ser
385 390 395 400
Phe Thr Tyr Thr Asn Asn Asn Ile Val Gln Tyr Ser Gln Ile Tyr Arg
405 410 415
Leu Ile Asn Ser Pro Glu Pro Thr Gly Ser Thr Gln Gln Ile Ile Ile
420 425 430
Ser Asn Thr Asp Ile Tyr Arg Ile Glu Leu Thr Leu Arg Gln Asn Tyr
435 440 445
Phe Ile Thr His Asn Ile Asn Phe Tyr Thr Leu Asp Gly Ile Thr Arg
450 455 460
Arg Tyr Asn Ser Gly Ser Thr Pro Glu Thr Pro Ile Ile Ile Asn Phe
465 470 475 480
Gln Leu Pro Glu Phe Pro Ala Asp Lys Ile Pro Pro Tyr Gly Leu Gly
485 490 495
Thr Lys Tyr Ser His Ile Leu Ser Tyr Met Lys Ile Ser Pro Asn Arg
500 505 510
His Asn Ile Val Leu Pro Asn Glu Arg His Leu Ser Phe Ala Trp Thr
515 520 525
His Thr Ser Val Asn Phe Asp Asn Glu Ile Ser Asn Gln Ile Val Thr
530 535 540
Gln Ile Pro Ala Val Lys Ala Arg Ser Leu Asp Thr Ser Ser Ser Val
545 550 555 560
Ile Ser Gly Pro Gly His Thr Gly Gly Asp Leu Val Leu Phe Arg Ser
565 570 575
Arg Met Glu Phe Gln Cys Phe Val Pro Thr Gln Thr Lys Tyr Lys Ile
580 585 590
Arg Met Arg Tyr Val Ala Tyr Ser Pro Asn Asn Ser Ile Ser Leu Thr
595 600 605
Leu Asn Ile Met Gly Gln Val Asn Tyr Gly Leu Arg Ala Leu Asn Ile
610 615 620
Lys Ser Thr Val Ala Ser Glu Lys Asp Thr Val Asn Pro Lys Tyr Asn
625 630 635 640
Asp Phe Gln Tyr Leu Tyr Phe Tyr Thr Gln Asp Pro Asn Glu Ile Ala
645 650 655
Ile Val Asn Leu Tyr Ser Leu Thr Asn Met Thr Leu Gln Ser Asn Asn
660 665 670
Phe Ala Gly Asn Thr Leu Val Ile Asp Lys Ile Glu Phe Leu Pro Val
675 680 685
<210> 84
<211> 387
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 84
Met Ala Asn Leu Lys Leu Asp Lys Phe Tyr Gln Ile Ser Pro Val Ile
1 5 10 15
Ser Pro Gly Lys Ile Val Gln Val Gly Trp Gly Ala Asp Ser Asp Gly
20 25 30
Asp Val Leu Glu Gln Phe Pro Pro Asp Arg Tyr Gln Asp Ala Trp His
35 40 45
Gln Phe Leu Phe Val Pro Leu Asp Tyr Gly Asn Tyr Ala Ile Val Cys
50 55 60
Lys Asn Ser Gly Lys Val Val Ser Val Ser His Arg Asp Asn Gly Asp
65 70 75 80
Gly Arg Trp Ile Glu Gln Trp Asp Trp Leu Ser Asp Val Asn Asp Gln
85 90 95
Glu Ala Gln His Ile Lys Leu Asn Asp Thr Pro Asn Ser Gly Thr Tyr
100 105 110
Tyr Phe Gln Phe Gln His Ser Gly Lys Tyr Met Ala Val Ser Trp Arg
115 120 125
Asn Ser Asn Asp Gly Asn Tyr Met Glu Gln Trp Gln Phe Glu Gly Lys
130 135 140
Asp Trp Gln Gln Phe Lys Val Glu Glu Leu Ser Asn Ser Ile Thr Leu
145 150 155 160
Pro Thr Ala Thr Ile Lys Pro Arg Pro Val Ala Pro Asp Tyr Thr Gly
165 170 175
Thr Asn Ile Asn Glu Thr Leu Pro Glu Ser Ser Glu Lys Ala Ile Thr
180 185 190
Ala Ala Ser Leu Val Pro Phe Phe Met Val Asp Asp Pro Phe Tyr Asn
195 200 205
Asp Ser Ala Thr Gln Phe Asn Ala Ser Pro Tyr Tyr Leu Leu Glu Lys
210 215 220
Thr Glu Gln Trp Ile Arg Ile Ser Thr Asn Ile Val Ser Pro Gly Asp
225 230 235 240
Lys Ile Val Tyr Thr Arg Lys Val Gly Ile Ser Glu Ala His Gln Thr
245 250 255
Thr Met Gln Ser Thr Val Asp Met Ser Leu Gly Val Asp Ile Gly Leu
260 265 270
Gln Phe Arg Ala Leu Ser Gly Ala Leu Ser Ala Asn Ile Ser Thr Gln
275 280 285
Leu Ser Met Thr Glu Ser Thr Thr Thr Thr Gln Met Lys Glu Glu Thr
290 295 300
Ile Thr Arg Glu Ile Leu Asn Asn Ala Asp Glu Ser Asp Ser Phe Thr
305 310 315 320
Ile Tyr Gln Leu Glu Thr Gln Phe His Leu Lys Arg Ser Asp Arg Ser
325 330 335
Tyr Val Ile Asp Pro Trp Ala Ala Arg Phe Glu Arg Asp Thr Val Thr
340 345 350
Arg Ser Tyr Leu Gln Ser Ile Gln Thr Thr Asp Asn Thr Leu Arg Ala
355 360 365
Glu Thr Ser Ala Glu Leu Gln Lys Arg Leu Ile Asn Lys Lys Ser Tyr
370 375 380
Leu Arg Ser
385
<210> 85
<211> 777
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 85
Met Gln Arg Asn Asn Lys Gln Phe Thr Asn Trp Lys Lys Gln Leu Met
1 5 10 15
Lys Ala Val Pro Val Cys Val Leu Ser Thr Gly Phe Leu Cys Gly Val
20 25 30
Ala Asn Thr Ala Leu Ala Ala Glu Lys Thr Asp Val Lys Thr Ala Val
35 40 45
Thr Ala Lys Gln Val His Thr Val Gln Asn Gly Asn Ile Lys Glu Ala
50 55 60
Thr Lys Ala Pro Ala Val Gly Ser Phe Ala Ser Asn Pro Glu Asp Asp
65 70 75 80
Leu Ser Val Leu Gly Lys Ala Ile Lys Asp Ala Ala Gln Ala Gly Ser
85 90 95
Ala Gly Ile Asp Pro Asn Ile Leu Gln Glu Ala Ala Asn Asn Asp Tyr
100 105 110
Thr Asp Ile Ala Lys Ser Ile Leu Lys Ile Thr Ala Met Ala Gly Ser
115 120 125
Ala Gly Phe Ala Pro Leu Gly Val Leu Val Pro Leu Ile Asp Ala Phe
130 135 140
Phe Pro Ser Gly Asp Lys Pro Thr Leu Ile Gln Gln Ile Thr Pro Ala
145 150 155 160
Val Gln Lys Met Ile Asp Ala Asn Asp Val Lys Asn Arg Ala Asn Thr
165 170 175
Leu Asp Gly Tyr Ile Asn Gly Leu Lys Ala Pro Leu Ala Asp Tyr Gly
180 185 190
Asn Tyr Val Arg Ala Val Gln Asn Gly Lys Phe Leu Asp Gly Arg Thr
195 200 205
Pro Thr Gln Lys Asp Arg Gln Glu Ala Met Glu Arg Met Ser Lys Asn
210 215 220
Ile Glu Asn Ile Lys Gln Thr Ile Asn Lys Asp Gln Lys Leu Lys Ser
225 230 235 240
Val Leu Lys Ser Glu Thr Leu Lys Gln Leu Asn Asp Asn Gln Asn Gln
245 250 255
Lys Asn Gly Ala Asn Ser Asp Val Asp Ile Leu Ala Gly Glu Ile Asn
260 265 270
Thr Val Asn Thr Ala Phe Glu Thr Ala Leu Ala Gln Phe Glu Gln Gly
275 280 285
Val Ser Asp Ser Ser Thr Arg Ile Ala Glu Thr Thr Val Pro Tyr Tyr
290 295 300
Ala Gln Phe Val Thr Met Tyr Thr Thr Phe Leu His Asp Val Val Thr
305 310 315 320
Asn Gly Ser Lys Trp Gly Ile Ser Asn Ala Val Ile Ser Thr Met His
325 330 335
Asp Asp Leu Gln Lys Leu Ile Pro His Ala Thr Gln Gln Ile His Asp
340 345 350
Met Tyr Leu Thr Ala Gln Lys Tyr Ala Glu Gln Ile Glu His Ser Glu
355 360 365
Pro Gly Ile Thr Thr His Lys Arg Glu Ala Asp Glu Ala Leu Ile Pro
370 375 380
Ser Leu Asn Leu Ala Ala Met Trp Thr Thr Met Ser Asp Asp Tyr Lys
385 390 395 400
Gly His Ala Val His Leu Asp Gln Ser Lys Thr Ile Thr Thr His Glu
405 410 415
Ile Gly Gln Ile Gln Asp Ser Trp Ser Pro Ser Phe Arg Asp Thr Ala
420 425 430
Thr Glu Phe Tyr Asp Gly Thr Leu Leu Met His Leu Asp Asp Glu Tyr
435 440 445
Phe Gln Thr Thr Thr Asn Ile Gly Glu Ser Phe Arg Asp Ser Thr Gly
450 455 460
Ala Arg His Gly Tyr Val Tyr Gly Glu Ala Thr Pro Ser Gly Tyr Ala
465 470 475 480
Val Lys Thr Glu Gly Gly Glu Ile Asp Pro Asn Asn Pro Ile Thr Ser
485 490 495
Val Trp Met Thr Gly Val Asn Asp Ala Thr Ser Arg Val His Phe Gly
500 505 510
Pro Ala Gly Val Gly Ser Asp Pro Gln Met Ala Gly Ser Val Asn Ile
515 520 525
Pro Gly Tyr Lys Leu Asn Trp Leu Asp Ala Asn Tyr Thr Thr Gly Val
530 535 540
Ser Gly Ser Glu Gly Arg Ser Val Ile Thr Asn Ala Phe Ala Arg Phe
545 550 555 560
Ile Pro Lys Asp Leu Val Pro Glu Asn Thr Val Arg Ser Glu Asn Val
565 570 575
Ile Thr Gly Ile Pro Phe Glu Lys Tyr Asp Arg Ser Lys Ala Phe Asn
580 585 590
Tyr Tyr Gly Arg Ala His Glu Ser Val Asn Gly Ala Asp Ala Val Thr
595 600 605
Thr Arg Pro Lys Gln Pro Gly Glu Asn Gly Pro Trp Met Ser Val Lys
610 615 620
Phe His Val Asp Lys Asp Gly Asp Tyr Asn Leu Arg Tyr Arg Ala Ala
625 630 635 640
Thr Thr Arg Asp Gly Asn Leu Phe Ile Ala Gln Asp Gly Ala Met Asn
645 650 655
Ala Asn Ser Val Lys Ile Gln Asn Thr Ser Ala Asp Ala Asn Ala Val
660 665 670
Gln Gly Asp Leu Gly Lys Tyr Gly Leu Ser Glu Asn Leu Pro Val His
675 680 685
Leu Thr Ala Gly Asp His Ser Val Glu Ile Met Val Pro Asp Glu Met
690 695 700
Leu Gly Asn Met Thr Leu Asp Arg Leu Glu Phe Val Pro Val Asp Thr
705 710 715 720
Ser Ala Gln Lys Ser Phe Lys Pro Ala Thr Pro Thr Val Lys Ile Ser
725 730 735
Lys Glu Leu Ala Ala Asn Phe Thr Lys Lys Val Asn Ser Glu Asp Lys
740 745 750
Thr Lys Lys Asp Asp Val Lys Ala Ser Ala Asp Thr Ser Lys Asn Pro
755 760 765
Glu Asp Ser Lys Asn Arg Glu Lys Gln
770 775
<210> 86
<211> 740
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 86
Met Ala Glu Lys Thr Asp Val Lys Thr Ala Val Thr Ala Lys Gln Val
1 5 10 15
His Thr Val Gln Asn Gly Asn Ile Lys Glu Ala Thr Lys Ala Pro Ala
20 25 30
Val Gly Ser Phe Ala Ser Asn Pro Glu Asp Asp Leu Ser Val Leu Gly
35 40 45
Lys Ala Ile Lys Asp Ala Ala Gln Ala Gly Ser Ala Gly Ile Asp Pro
50 55 60
Asn Ile Leu Gln Glu Ala Ala Asn Asn Asp Tyr Thr Asp Ile Ala Lys
65 70 75 80
Ser Ile Leu Lys Ile Thr Ala Met Ala Gly Ser Ala Gly Phe Ala Pro
85 90 95
Leu Gly Val Leu Val Pro Leu Ile Asp Ala Phe Phe Pro Ser Gly Asp
100 105 110
Lys Pro Thr Leu Ile Gln Gln Ile Thr Pro Ala Val Gln Lys Met Ile
115 120 125
Asp Ala Asn Asp Val Lys Asn Arg Ala Asn Thr Leu Asp Gly Tyr Ile
130 135 140
Asn Gly Leu Lys Ala Pro Leu Ala Asp Tyr Gly Asn Tyr Val Arg Ala
145 150 155 160
Val Gln Asn Gly Lys Phe Leu Asp Gly Arg Thr Pro Thr Gln Lys Asp
165 170 175
Arg Gln Glu Ala Met Glu Arg Met Ser Lys Asn Ile Glu Asn Ile Lys
180 185 190
Gln Thr Ile Asn Lys Asp Gln Lys Leu Lys Ser Val Leu Lys Ser Glu
195 200 205
Thr Leu Lys Gln Leu Asn Asp Asn Gln Asn Gln Lys Asn Gly Ala Asn
210 215 220
Ser Asp Val Asp Ile Leu Ala Gly Glu Ile Asn Thr Val Asn Thr Ala
225 230 235 240
Phe Glu Thr Ala Leu Ala Gln Phe Glu Gln Gly Val Ser Asp Ser Ser
245 250 255
Thr Arg Ile Ala Glu Thr Thr Val Pro Tyr Tyr Ala Gln Phe Val Thr
260 265 270
Met Tyr Thr Thr Phe Leu His Asp Val Val Thr Asn Gly Ser Lys Trp
275 280 285
Gly Ile Ser Asn Ala Val Ile Ser Thr Met His Asp Asp Leu Gln Lys
290 295 300
Leu Ile Pro His Ala Thr Gln Gln Ile His Asp Met Tyr Leu Thr Ala
305 310 315 320
Gln Lys Tyr Ala Glu Gln Ile Glu His Ser Glu Pro Gly Ile Thr Thr
325 330 335
His Lys Arg Glu Ala Asp Glu Ala Leu Ile Pro Ser Leu Asn Leu Ala
340 345 350
Ala Met Trp Thr Thr Met Ser Asp Asp Tyr Lys Gly His Ala Val His
355 360 365
Leu Asp Gln Ser Lys Thr Ile Thr Thr His Glu Ile Gly Gln Ile Gln
370 375 380
Asp Ser Trp Ser Pro Ser Phe Arg Asp Thr Ala Thr Glu Phe Tyr Asp
385 390 395 400
Gly Thr Leu Leu Met His Leu Asp Asp Glu Tyr Phe Gln Thr Thr Thr
405 410 415
Asn Ile Gly Glu Ser Phe Arg Asp Ser Thr Gly Ala Arg His Gly Tyr
420 425 430
Val Tyr Gly Glu Ala Thr Pro Ser Gly Tyr Ala Val Lys Thr Glu Gly
435 440 445
Gly Glu Ile Asp Pro Asn Asn Pro Ile Thr Ser Val Trp Met Thr Gly
450 455 460
Val Asn Asp Ala Thr Ser Arg Val His Phe Gly Pro Ala Gly Val Gly
465 470 475 480
Ser Asp Pro Gln Met Ala Gly Ser Val Asn Ile Pro Gly Tyr Lys Leu
485 490 495
Asn Trp Leu Asp Ala Asn Tyr Thr Thr Gly Val Ser Gly Ser Glu Gly
500 505 510
Arg Ser Val Ile Thr Asn Ala Phe Ala Arg Phe Ile Pro Lys Asp Leu
515 520 525
Val Pro Glu Asn Thr Val Arg Ser Glu Asn Val Ile Thr Gly Ile Pro
530 535 540
Phe Glu Lys Tyr Asp Arg Ser Lys Ala Phe Asn Tyr Tyr Gly Arg Ala
545 550 555 560
His Glu Ser Val Asn Gly Ala Asp Ala Val Thr Thr Arg Pro Lys Gln
565 570 575
Pro Gly Glu Asn Gly Pro Trp Met Ser Val Lys Phe His Val Asp Lys
580 585 590
Asp Gly Asp Tyr Asn Leu Arg Tyr Arg Ala Ala Thr Thr Arg Asp Gly
595 600 605
Asn Leu Phe Ile Ala Gln Asp Gly Ala Met Asn Ala Asn Ser Val Lys
610 615 620
Ile Gln Asn Thr Ser Ala Asp Ala Asn Ala Val Gln Gly Asp Leu Gly
625 630 635 640
Lys Tyr Gly Leu Ser Glu Asn Leu Pro Val His Leu Thr Ala Gly Asp
645 650 655
His Ser Val Glu Ile Met Val Pro Asp Glu Met Leu Gly Asn Met Thr
660 665 670
Leu Asp Arg Leu Glu Phe Val Pro Val Asp Thr Ser Ala Gln Lys Ser
675 680 685
Phe Lys Pro Ala Thr Pro Thr Val Lys Ile Ser Lys Glu Leu Ala Ala
690 695 700
Asn Phe Thr Lys Lys Val Asn Ser Glu Asp Lys Thr Lys Lys Asp Asp
705 710 715 720
Val Lys Ala Ser Ala Asp Thr Ser Lys Asn Pro Glu Asp Ser Lys Asn
725 730 735
Arg Glu Lys Gln
740
<210> 87
<211> 718
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 87
Met Gln Arg Asn Asn Lys Gln Phe Thr Asn Trp Lys Lys Gln Leu Met
1 5 10 15
Lys Ala Val Pro Val Cys Val Leu Ser Thr Gly Phe Leu Cys Gly Val
20 25 30
Ala Asn Thr Ala Leu Ala Ala Glu Lys Thr Asp Val Lys Thr Ala Val
35 40 45
Thr Ala Lys Gln Val His Thr Val Gln Asn Gly Asn Ile Lys Glu Ala
50 55 60
Thr Lys Ala Pro Ala Val Gly Ser Phe Ala Ser Asn Pro Glu Asp Asp
65 70 75 80
Leu Ser Val Leu Gly Lys Ala Ile Lys Asp Ala Ala Gln Ala Gly Ser
85 90 95
Ala Gly Ile Asp Pro Asn Ile Leu Gln Glu Ala Ala Asn Asn Asp Tyr
100 105 110
Thr Asp Ile Ala Lys Ser Ile Leu Lys Ile Thr Ala Met Ala Gly Ser
115 120 125
Ala Gly Phe Ala Pro Leu Gly Val Leu Val Pro Leu Ile Asp Ala Phe
130 135 140
Phe Pro Ser Gly Asp Lys Pro Thr Leu Ile Gln Gln Ile Thr Pro Ala
145 150 155 160
Val Gln Lys Met Ile Asp Ala Asn Asp Val Lys Asn Arg Ala Asn Thr
165 170 175
Leu Asp Gly Tyr Ile Asn Gly Leu Lys Ala Pro Leu Ala Asp Tyr Gly
180 185 190
Asn Tyr Val Arg Ala Val Gln Asn Gly Lys Phe Leu Asp Gly Arg Thr
195 200 205
Pro Thr Gln Lys Asp Arg Gln Glu Ala Met Glu Arg Met Ser Lys Asn
210 215 220
Ile Glu Asn Ile Lys Gln Thr Ile Asn Lys Asp Gln Lys Leu Lys Ser
225 230 235 240
Val Leu Lys Ser Glu Thr Leu Lys Gln Leu Asn Asp Asn Gln Asn Gln
245 250 255
Lys Asn Gly Ala Asn Ser Asp Val Asp Ile Leu Ala Gly Glu Ile Asn
260 265 270
Thr Val Asn Thr Ala Phe Glu Thr Ala Leu Ala Gln Phe Glu Gln Gly
275 280 285
Val Ser Asp Ser Ser Thr Arg Ile Ala Glu Thr Thr Val Pro Tyr Tyr
290 295 300
Ala Gln Phe Val Thr Met Tyr Thr Thr Phe Leu His Asp Val Val Thr
305 310 315 320
Asn Gly Ser Lys Trp Gly Ile Ser Asn Ala Val Ile Ser Thr Met His
325 330 335
Asp Asp Leu Gln Lys Leu Ile Pro His Ala Thr Gln Gln Ile His Asp
340 345 350
Met Tyr Leu Thr Ala Gln Lys Tyr Ala Glu Gln Ile Glu His Ser Glu
355 360 365
Pro Gly Ile Thr Thr His Lys Arg Glu Ala Asp Glu Ala Leu Ile Pro
370 375 380
Ser Leu Asn Leu Ala Ala Met Trp Thr Thr Met Ser Asp Asp Tyr Lys
385 390 395 400
Gly His Ala Val His Leu Asp Gln Ser Lys Thr Ile Thr Thr His Glu
405 410 415
Ile Gly Gln Ile Gln Asp Ser Trp Ser Pro Ser Phe Arg Asp Thr Ala
420 425 430
Thr Glu Phe Tyr Asp Gly Thr Leu Leu Met His Leu Asp Asp Glu Tyr
435 440 445
Phe Gln Thr Thr Thr Asn Ile Gly Glu Ser Phe Arg Asp Ser Thr Gly
450 455 460
Ala Arg His Gly Tyr Val Tyr Gly Glu Ala Thr Pro Ser Gly Tyr Ala
465 470 475 480
Val Lys Thr Glu Gly Gly Glu Ile Asp Pro Asn Asn Pro Ile Thr Ser
485 490 495
Val Trp Met Thr Gly Val Asn Asp Ala Thr Ser Arg Val His Phe Gly
500 505 510
Pro Ala Gly Val Gly Ser Asp Pro Gln Met Ala Gly Ser Val Asn Ile
515 520 525
Pro Gly Tyr Lys Leu Asn Trp Leu Asp Ala Asn Tyr Thr Thr Gly Val
530 535 540
Ser Gly Ser Glu Gly Arg Ser Val Ile Thr Asn Ala Phe Ala Arg Phe
545 550 555 560
Ile Pro Lys Asp Leu Val Pro Glu Asn Thr Val Arg Ser Glu Asn Val
565 570 575
Ile Thr Gly Ile Pro Phe Glu Lys Tyr Asp Arg Ser Lys Ala Phe Asn
580 585 590
Tyr Tyr Gly Arg Ala His Glu Ser Val Asn Gly Ala Asp Ala Val Thr
595 600 605
Thr Arg Pro Lys Gln Pro Gly Glu Asn Gly Pro Trp Met Ser Val Lys
610 615 620
Phe His Val Asp Lys Asp Gly Asp Tyr Asn Leu Arg Tyr Arg Ala Ala
625 630 635 640
Thr Thr Arg Asp Gly Asn Leu Phe Ile Ala Gln Asp Gly Ala Met Asn
645 650 655
Ala Asn Ser Val Lys Ile Gln Asn Thr Ser Ala Asp Ala Asn Ala Val
660 665 670
Gln Gly Asp Leu Gly Lys Tyr Gly Leu Ser Glu Asn Leu Pro Val His
675 680 685
Leu Thr Ala Gly Asp His Ser Val Glu Ile Met Val Pro Asp Glu Met
690 695 700
Leu Gly Asn Met Thr Leu Asp Arg Leu Glu Phe Val Pro Val
705 710 715
<210> 88
<211> 681
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 88
Met Ala Glu Lys Thr Asp Val Lys Thr Ala Val Thr Ala Lys Gln Val
1 5 10 15
His Thr Val Gln Asn Gly Asn Ile Lys Glu Ala Thr Lys Ala Pro Ala
20 25 30
Val Gly Ser Phe Ala Ser Asn Pro Glu Asp Asp Leu Ser Val Leu Gly
35 40 45
Lys Ala Ile Lys Asp Ala Ala Gln Ala Gly Ser Ala Gly Ile Asp Pro
50 55 60
Asn Ile Leu Gln Glu Ala Ala Asn Asn Asp Tyr Thr Asp Ile Ala Lys
65 70 75 80
Ser Ile Leu Lys Ile Thr Ala Met Ala Gly Ser Ala Gly Phe Ala Pro
85 90 95
Leu Gly Val Leu Val Pro Leu Ile Asp Ala Phe Phe Pro Ser Gly Asp
100 105 110
Lys Pro Thr Leu Ile Gln Gln Ile Thr Pro Ala Val Gln Lys Met Ile
115 120 125
Asp Ala Asn Asp Val Lys Asn Arg Ala Asn Thr Leu Asp Gly Tyr Ile
130 135 140
Asn Gly Leu Lys Ala Pro Leu Ala Asp Tyr Gly Asn Tyr Val Arg Ala
145 150 155 160
Val Gln Asn Gly Lys Phe Leu Asp Gly Arg Thr Pro Thr Gln Lys Asp
165 170 175
Arg Gln Glu Ala Met Glu Arg Met Ser Lys Asn Ile Glu Asn Ile Lys
180 185 190
Gln Thr Ile Asn Lys Asp Gln Lys Leu Lys Ser Val Leu Lys Ser Glu
195 200 205
Thr Leu Lys Gln Leu Asn Asp Asn Gln Asn Gln Lys Asn Gly Ala Asn
210 215 220
Ser Asp Val Asp Ile Leu Ala Gly Glu Ile Asn Thr Val Asn Thr Ala
225 230 235 240
Phe Glu Thr Ala Leu Ala Gln Phe Glu Gln Gly Val Ser Asp Ser Ser
245 250 255
Thr Arg Ile Ala Glu Thr Thr Val Pro Tyr Tyr Ala Gln Phe Val Thr
260 265 270
Met Tyr Thr Thr Phe Leu His Asp Val Val Thr Asn Gly Ser Lys Trp
275 280 285
Gly Ile Ser Asn Ala Val Ile Ser Thr Met His Asp Asp Leu Gln Lys
290 295 300
Leu Ile Pro His Ala Thr Gln Gln Ile His Asp Met Tyr Leu Thr Ala
305 310 315 320
Gln Lys Tyr Ala Glu Gln Ile Glu His Ser Glu Pro Gly Ile Thr Thr
325 330 335
His Lys Arg Glu Ala Asp Glu Ala Leu Ile Pro Ser Leu Asn Leu Ala
340 345 350
Ala Met Trp Thr Thr Met Ser Asp Asp Tyr Lys Gly His Ala Val His
355 360 365
Leu Asp Gln Ser Lys Thr Ile Thr Thr His Glu Ile Gly Gln Ile Gln
370 375 380
Asp Ser Trp Ser Pro Ser Phe Arg Asp Thr Ala Thr Glu Phe Tyr Asp
385 390 395 400
Gly Thr Leu Leu Met His Leu Asp Asp Glu Tyr Phe Gln Thr Thr Thr
405 410 415
Asn Ile Gly Glu Ser Phe Arg Asp Ser Thr Gly Ala Arg His Gly Tyr
420 425 430
Val Tyr Gly Glu Ala Thr Pro Ser Gly Tyr Ala Val Lys Thr Glu Gly
435 440 445
Gly Glu Ile Asp Pro Asn Asn Pro Ile Thr Ser Val Trp Met Thr Gly
450 455 460
Val Asn Asp Ala Thr Ser Arg Val His Phe Gly Pro Ala Gly Val Gly
465 470 475 480
Ser Asp Pro Gln Met Ala Gly Ser Val Asn Ile Pro Gly Tyr Lys Leu
485 490 495
Asn Trp Leu Asp Ala Asn Tyr Thr Thr Gly Val Ser Gly Ser Glu Gly
500 505 510
Arg Ser Val Ile Thr Asn Ala Phe Ala Arg Phe Ile Pro Lys Asp Leu
515 520 525
Val Pro Glu Asn Thr Val Arg Ser Glu Asn Val Ile Thr Gly Ile Pro
530 535 540
Phe Glu Lys Tyr Asp Arg Ser Lys Ala Phe Asn Tyr Tyr Gly Arg Ala
545 550 555 560
His Glu Ser Val Asn Gly Ala Asp Ala Val Thr Thr Arg Pro Lys Gln
565 570 575
Pro Gly Glu Asn Gly Pro Trp Met Ser Val Lys Phe His Val Asp Lys
580 585 590
Asp Gly Asp Tyr Asn Leu Arg Tyr Arg Ala Ala Thr Thr Arg Asp Gly
595 600 605
Asn Leu Phe Ile Ala Gln Asp Gly Ala Met Asn Ala Asn Ser Val Lys
610 615 620
Ile Gln Asn Thr Ser Ala Asp Ala Asn Ala Val Gln Gly Asp Leu Gly
625 630 635 640
Lys Tyr Gly Leu Ser Glu Asn Leu Pro Val His Leu Thr Ala Gly Asp
645 650 655
His Ser Val Glu Ile Met Val Pro Asp Glu Met Leu Gly Asn Met Thr
660 665 670
Leu Asp Arg Leu Glu Phe Val Pro Val
675 680
<210> 89
<211> 657
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 89
Val Lys Asn Met Asn Ser Tyr Gln Asn Thr Asn Glu Tyr Glu Ile Leu
1 5 10 15
Asp Gly Ser Pro Asn Asn Thr Asn Met Ser Asn Arg Tyr Pro Phe Ala
20 25 30
Lys Asp Pro Asn Ile Phe Pro Ile Asn Leu Asp Ala Cys Gln Gly Arg
35 40 45
Pro Trp Gln Asp Thr Trp Glu Ser Val Ser Asp Ile Val Thr Ile Gly
50 55 60
Thr Tyr Leu Ile Gln Phe Leu Leu Glu Pro Gly Ile Gly Gly Ile Pro
65 70 75 80
Val Ile Leu Ser Ile Ile Asn Lys Leu Ile Pro Ser Ser Gly Gln Ser
85 90 95
Val Ala Ala Leu Ser Ile Cys Asp Leu Leu Ser Ile Ile Arg Lys Glu
100 105 110
Val Asp Glu Ser Val Leu Ser Asp Gly Val Ala Asp Phe Lys Gly Glu
115 120 125
Met Thr Ala Tyr Arg Asp Tyr Tyr Leu Pro Tyr Leu Glu Asp Trp Leu
130 135 140
Thr Asp Lys Ser Asn Pro Glu Lys Leu Ala Asp Val Val Lys Gln Phe
145 150 155 160
Gln Ala Arg Glu Glu Asp Phe Thr Lys Leu Leu Ala Gly Ser Leu Ser
165 170 175
Arg Gln Lys Ala Glu Ile Leu Leu Leu Pro Thr Tyr Val Gln Ala Ala
180 185 190
Asn Val His Leu Leu Leu Leu Arg Asp Ala Val Lys Tyr Lys Lys Glu
195 200 205
Trp Gly Leu Val Cys Pro Pro Leu Tyr Pro Gly Ser Gly Arg Thr Asp
210 215 220
Cys Asn Glu Arg Leu Lys Ala Lys Ile Lys Glu Tyr Thr Asn Tyr Cys
225 230 235 240
Val Glu Trp Tyr Asn Lys Gly Leu Asp Gln Ile Lys Gln Ala Gly Thr
245 250 255
Ser Thr Glu Thr Trp Leu Lys Phe Asn Lys Phe Arg Arg Glu Met Thr
260 265 270
Leu Ala Val Leu Asp Val Ile Ala Ile Phe Pro Thr Tyr Asp Phe Glu
275 280 285
Lys Tyr Pro Leu Ala Thr Asn Val Glu Leu Thr Arg Glu Val Tyr Thr
290 295 300
Asp Pro Val Gly Tyr Ser Gly Ser Ser Ile Arg Trp Glu Arg Thr Phe
305 310 315 320
Pro Asn Ala Phe Asn Thr Leu Glu Ala Asn Gly Thr Arg Gly Pro Gly
325 330 335
Leu Val Thr Trp Leu Glu Val Leu Gly Ile Tyr Asn His Asp Phe Gln
340 345 350
Asp Ile Thr Val Tyr Phe Ser Gly Trp Val Gly Ser Arg His Ser Glu
355 360 365
Asp Tyr Thr Arg Gly Asn Gly Thr Phe Ser Arg Ile Ser Gly Thr Thr
370 375 380
Ser Asn Asp Ile Arg Asn Gln Thr Phe Tyr Ser Arg Asp Val Phe Lys
385 390 395 400
Ile Asp Ser Leu Gly Ile Tyr Glu Thr Arg Ala Glu Leu Gly Tyr Thr
405 410 415
Arg Gln Arg Phe Cys Val Ser Arg Ala Val Phe Ser Ser Thr Leu Tyr
420 425 430
Asn Tyr Val Tyr Asp Ala Arg Asn Asn Gly Gln Gly Arg Met Thr Ile
435 440 445
Glu Ser Met Leu Pro Gly Ile Lys Asn Pro Ile Pro Ser Ser Gln Asp
450 455 460
Tyr Ser His Arg Leu Ser Asn Ala Ala Cys Val Gln Phe Asn Asp Ser
465 470 475 480
Arg Ile Asn Val Tyr Gly Trp Thr His Thr Ser Met Thr Lys Asn Asn
485 490 495
Pro Ile Tyr Thr Asp Lys Ile Ser Gln Ile Pro Ala Val Lys Ala Phe
500 505 510
Ala Leu Glu Ser Gly Ala Tyr Val Ser Arg Gly Pro Gly His Thr Gly
515 520 525
Gly Asp Val Val Thr Leu Pro Asn Arg Gly Arg Leu Lys Ile Arg Leu
530 535 540
Thr Ser Ala Pro Thr Asn Lys Asn Tyr Arg Val Arg Val Arg Tyr Ala
545 550 555 560
Thr Ser Tyr Gly Ala Asp Leu Met Val Gln Arg Trp Ser Pro Ser Gly
565 570 575
Asn His Ala Ser Gly Tyr Phe Ser Gly Ser Pro Thr Gly Ser Tyr Pro
580 585 590
Thr Phe Gly Tyr Met Asn Thr Leu Val Thr Thr Phe Asn Gln Ser Gly
595 600 605
Val Glu Ile Ile Ile Glu Asn Arg His Tyr Ser Asn Ile Ile Ile Asp
610 615 620
Lys Ile Glu Phe Ile Pro Asp Asp Ile Thr Thr Leu Glu Tyr Glu Gly
625 630 635 640
Glu Arg Asp Leu Glu Lys Thr Lys Asn Ala Val Asn Asp Leu Phe Thr
645 650 655
Asn
<210> 90
<211> 631
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 90
Val Lys Asn Met Asn Ser Tyr Gln Asn Thr Asn Glu Tyr Glu Ile Leu
1 5 10 15
Asp Gly Ser Pro Asn Asn Thr Asn Met Ser Asn Arg Tyr Pro Phe Ala
20 25 30
Lys Asp Pro Asn Ile Phe Pro Ile Asn Leu Asp Ala Cys Gln Gly Arg
35 40 45
Pro Trp Gln Asp Thr Trp Glu Ser Val Ser Asp Ile Val Thr Ile Gly
50 55 60
Thr Tyr Leu Ile Gln Phe Leu Leu Glu Pro Gly Ile Gly Gly Ile Pro
65 70 75 80
Val Ile Leu Ser Ile Ile Asn Lys Leu Ile Pro Ser Ser Gly Gln Ser
85 90 95
Val Ala Ala Leu Ser Ile Cys Asp Leu Leu Ser Ile Ile Arg Lys Glu
100 105 110
Val Asp Glu Ser Val Leu Ser Asp Gly Val Ala Asp Phe Lys Gly Glu
115 120 125
Met Thr Ala Tyr Arg Asp Tyr Tyr Leu Pro Tyr Leu Glu Asp Trp Leu
130 135 140
Thr Asp Lys Ser Asn Pro Glu Lys Leu Ala Asp Val Val Lys Gln Phe
145 150 155 160
Gln Ala Arg Glu Glu Asp Phe Thr Lys Leu Leu Ala Gly Ser Leu Ser
165 170 175
Arg Gln Lys Ala Glu Ile Leu Leu Leu Pro Thr Tyr Val Gln Ala Ala
180 185 190
Asn Val His Leu Leu Leu Leu Arg Asp Ala Val Lys Tyr Lys Lys Glu
195 200 205
Trp Gly Leu Val Cys Pro Pro Leu Tyr Pro Gly Ser Gly Arg Thr Asp
210 215 220
Cys Asn Glu Arg Leu Lys Ala Lys Ile Lys Glu Tyr Thr Asn Tyr Cys
225 230 235 240
Val Glu Trp Tyr Asn Lys Gly Leu Asp Gln Ile Lys Gln Ala Gly Thr
245 250 255
Ser Thr Glu Thr Trp Leu Lys Phe Asn Lys Phe Arg Arg Glu Met Thr
260 265 270
Leu Ala Val Leu Asp Val Ile Ala Ile Phe Pro Thr Tyr Asp Phe Glu
275 280 285
Lys Tyr Pro Leu Ala Thr Asn Val Glu Leu Thr Arg Glu Val Tyr Thr
290 295 300
Asp Pro Val Gly Tyr Ser Gly Ser Ser Ile Arg Trp Glu Arg Thr Phe
305 310 315 320
Pro Asn Ala Phe Asn Thr Leu Glu Ala Asn Gly Thr Arg Gly Pro Gly
325 330 335
Leu Val Thr Trp Leu Glu Val Leu Gly Ile Tyr Asn His Asp Phe Gln
340 345 350
Asp Ile Thr Val Tyr Phe Ser Gly Trp Val Gly Ser Arg His Ser Glu
355 360 365
Asp Tyr Thr Arg Gly Asn Gly Thr Phe Ser Arg Ile Ser Gly Thr Thr
370 375 380
Ser Asn Asp Ile Arg Asn Gln Thr Phe Tyr Ser Arg Asp Val Phe Lys
385 390 395 400
Ile Asp Ser Leu Gly Ile Tyr Glu Thr Arg Ala Glu Leu Gly Tyr Thr
405 410 415
Arg Gln Arg Phe Cys Val Ser Arg Ala Val Phe Ser Ser Thr Leu Tyr
420 425 430
Asn Tyr Val Tyr Asp Ala Arg Asn Asn Gly Gln Gly Arg Met Thr Ile
435 440 445
Glu Ser Met Leu Pro Gly Ile Lys Asn Pro Ile Pro Ser Ser Gln Asp
450 455 460
Tyr Ser His Arg Leu Ser Asn Ala Ala Cys Val Gln Phe Asn Asp Ser
465 470 475 480
Arg Ile Asn Val Tyr Gly Trp Thr His Thr Ser Met Thr Lys Asn Asn
485 490 495
Pro Ile Tyr Thr Asp Lys Ile Ser Gln Ile Pro Ala Val Lys Ala Phe
500 505 510
Ala Leu Glu Ser Gly Ala Tyr Val Ser Arg Gly Pro Gly His Thr Gly
515 520 525
Gly Asp Val Val Thr Leu Pro Asn Arg Gly Arg Leu Lys Ile Arg Leu
530 535 540
Thr Ser Ala Pro Thr Asn Lys Asn Tyr Arg Val Arg Val Arg Tyr Ala
545 550 555 560
Thr Ser Tyr Gly Ala Asp Leu Met Val Gln Arg Trp Ser Pro Ser Gly
565 570 575
Asn His Ala Ser Gly Tyr Phe Ser Gly Ser Pro Thr Gly Ser Tyr Pro
580 585 590
Thr Phe Gly Tyr Met Asn Thr Leu Val Thr Thr Phe Asn Gln Ser Gly
595 600 605
Val Glu Ile Ile Ile Glu Asn Arg His Tyr Ser Asn Ile Ile Ile Asp
610 615 620
Lys Ile Glu Phe Ile Pro Asp
625 630
<210> 91
<211> 568
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 91
Leu Leu Phe Asn Lys Tyr Ala Lys Lys Val Val Ser Pro Met Phe Thr
1 5 10 15
Ser Gly Thr Lys Asn Thr Leu Lys Ile Glu Thr Thr Asp Tyr Glu Ile
20 25 30
Asp Gln Ala Ala Ile Ser Ile Glu Cys Met Ser Asp Glu His Ser Pro
35 40 45
Lys Glu Lys Met Met Leu Trp Asp Glu Val Lys Arg Ala Lys Gln Phe
50 55 60
Ser Gln Ser Arg Asn Leu Leu Gln Asn Gly Asp Phe Gly Asp Phe Pro
65 70 75 80
Arg Asn Asp Trp Thr Phe Gly Asn Asp Ile Ile Ile Gly Ser Asn Asn
85 90 95
Ser Ile Phe Lys Gly Asn Phe Leu Gln Met Ser Gly Ala Arg Asp Ile
100 105 110
Tyr Gly Thr Ile Phe Pro Thr Tyr Ile Tyr Gln Lys Ile Asp Glu Ser
115 120 125
Lys Leu Lys Thr Tyr Thr Arg Tyr Arg Val Arg Gly Val Val Gly Ser
130 135 140
Ser Lys Asp Leu Arg Leu Met Val Thr Arg Tyr Gly Lys Glu Ile Asp
145 150 155 160
Ala Ile Met Asn Val Pro Asn Asp Leu Val Tyr Thr Gln Pro Asn Pro
165 170 175
Ser Cys Gly Asp Tyr Arg Cys Glu Ser Ser Ser Gln Tyr Val Asn Gln
180 185 190
Gly Tyr Pro Thr Pro Tyr Thr Asp Gly Tyr Gly Val Gly Tyr Pro Ser
195 200 205
Asn Gln Gly Glu Lys Arg Val Lys Cys His Asp Arg His Ser Phe Asp
210 215 220
Phe His Ile Asp Thr Gly Glu Leu Asp Ile Asn Thr Asn Leu Gly Ile
225 230 235 240
Leu Val Leu Phe Lys Ile Ser Asn Pro Asp Gly Tyr Ala Thr Leu Gly
245 250 255
Asn Leu Glu Val Ile Glu Glu Gly Pro Leu Thr Asp Glu Ala Leu Ala
260 265 270
His Val Lys Gln Lys Glu Lys Lys Trp Asn Gln His Leu Glu Lys Ala
275 280 285
Arg Met Glu Thr Gln Gln Ala Asn Glu Pro Ala Lys Gln Ala Val Asp
290 295 300
Thr Leu Phe Thr Asn Glu Gln Glu Leu His Tyr His Ile Thr Leu Asp
305 310 315 320
His Ile Gln Asn Ala Asp Arg Leu Val Gln Leu Ile Pro Tyr Val His
325 330 335
His Ala Trp Leu Pro Asp Ala Pro Gly Met Asn Tyr Asp Val Tyr Gln
340 345 350
Gly Leu Asn Ala Arg Ile Met Gln Ala Tyr Asn Leu Tyr Asp Ala Arg
355 360 365
Asn Val Ile Thr Asn Gly Asp Phe Thr Gln Gly Leu Gln Gly Trp His
370 375 380
Ala Ala Gly Lys Ala Thr Val Gln Gln Met Asp Gly Ser Ser Val Leu
385 390 395 400
Val Leu Ser Asn Trp Ser Ala Gly Val Ser Gln Asn Leu His Ala Gln
405 410 415
Asp His His Gly Tyr Met Leu Arg Val Ile Ala Lys Lys Glu Gly Pro
420 425 430
Gly Lys Gly Tyr Val Thr Met Met Asp Cys Asn Gly Asn Gln Glu Thr
435 440 445
Leu Lys Phe Thr Ser Cys Glu Glu Gly Tyr Met Thr Lys Thr Val Glu
450 455 460
Val Phe Pro Asp Ser Asp Arg Val Arg Ile Glu Ile Gly Glu Thr Glu
465 470 475 480
Gly Thr Phe Tyr Ile Asp Ser Ile Glu Leu Ile Cys Met Gln Gly Tyr
485 490 495
Ala Ser Asn Asn Asn Pro His Thr Gly Asn Met Tyr Glu Gln Ser Tyr
500 505 510
Thr Arg Asn Phe Asn Gln Asn Thr Ser Asp Val Tyr His Gln Gly Tyr
515 520 525
Thr Asn Asn Tyr Asn Gln Asp Ser Ser Asn Met Tyr Asn Gln Asn Tyr
530 535 540
Thr Asn Asn Asp Asn Leu His Ser Gly Cys Thr Cys Asn Gln Gly His
545 550 555 560
Asn Ser Gly Cys Thr Cys Asn Arg
565
<210> 92
<211> 711
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 92
Met Asn Gln Asn Asn Asn Glu Tyr Glu Ile Ala Asp Val Asn Pro Pro
1 5 10 15
Ser Tyr Pro Ser Asn Arg Ile Asn Asn Tyr Ser Arg Tyr Pro Phe Ala
20 25 30
Asn Asp Pro Asn Gln Leu Leu Gln Gln Thr Asn Tyr Lys Asp Trp Leu
35 40 45
Asn Ile Cys Gln Gly Asn Asn Gln Asn Ser Gly Asn Leu Ile Thr Asp
50 55 60
Ala Gly Ala Ala Val Ser Ala Gly Ile Ile Val Thr Gly Thr Met Ile
65 70 75 80
Ala Ala Phe Ala Ala Leu Ala Val Ala Pro Phe Pro Ile Val Gly Ala
85 90 95
Ile Val Gly Gly Ile Val Ile Ala Phe Gly Thr Leu Leu Pro Leu Val
100 105 110
Trp Pro Gly Gly Lys Glu Asp Arg Thr Val Trp Thr Gln Phe Phe Ala
115 120 125
Leu Gly Glu Thr Leu Leu Gly Lys Arg Leu Thr Asp Asp Ala Gln Lys
130 135 140
Thr Ala Ala Glu Thr Val Asp Gly Phe Gly Arg Val Leu Asp Asn Tyr
145 150 155 160
Lys Val Ala Leu Asn Ser Trp Met Asp Leu Lys Lys Lys Gln Ser Pro
165 170 175
Gly Ser Pro Pro Thr Thr Glu Leu Lys Glu Ala Ala Asp Asn Val Lys
180 185 190
Gln Arg Phe Glu Ile Val His Asn Glu Phe Asp Ala Asn Met Pro His
195 200 205
Leu Gly Asn Pro Lys Ser Asn Tyr Lys Glu Val Leu Leu Ser Ser Tyr
210 215 220
Ala His Ala Ala Asn Leu His Leu Asn Leu Leu Gln Gln Gly Val Arg
225 230 235 240
Phe Ala Asp Gln Trp Asn Gln Asp Ile Tyr Ser Ser Gln Ile Val Pro
245 250 255
Ala Ala Gly Thr Ser Thr Glu Tyr Leu Lys Phe Leu Gln Ala Arg Ile
260 265 270
Gln Glu Tyr Val Asn Tyr Cys Thr Ala Thr Tyr Arg Ser Gly Leu Asn
275 280 285
Ile Leu Lys Asn Ser Asn Asp Ile Thr Trp Asp Ile Tyr Asn Thr Tyr
290 295 300
Arg Arg Asp Met Thr Leu Thr Val Leu Asp Leu Val Ala Ala Phe Pro
305 310 315 320
Asn Tyr Asp Pro Thr Tyr Tyr Pro Ile Asp Thr Lys Ile Gln Leu Thr
325 330 335
Arg Thr Ile Tyr Ser Asn Leu Leu Gly Ile Thr Gln Ser Gly Arg Gln
340 345 350
Tyr Phe Glu Ala Leu Glu Asn Ala Leu Thr Met Arg Pro Asn Leu Tyr
355 360 365
Arg Ile Leu Arg Gly Phe Asn Phe Asn Thr Thr Phe Gly Ser Gly Val
370 375 380
Asn Tyr Leu Ser Gly Ile Ala Asn Arg Arg Gly Leu Ile Lys Thr Val
385 390 395 400
Pro Ser Glu Glu Asp Glu Gln Pro Phe Tyr Gly Gln Ser Asn Gly Arg
405 410 415
His Asp Pro Met Ile Phe Ala Asn Gly Leu Asn Ile Phe Arg Val Thr
420 425 430
Leu Leu Arg Asn Lys His Tyr Ile Ala Leu Pro Val Gly Pro Pro Leu
435 440 445
Phe Ala Ala Asn Gln Ile Thr Asp Leu Lys Leu Tyr Tyr Gly Asn Ala
450 455 460
Thr Gln Tyr His His Tyr Gln Pro Ser Asn Glu Gly Leu Thr Thr Glu
465 470 475 480
Ser Thr Asp Leu Ser Phe Pro Pro Lys Asn Glu Glu Tyr Leu Asn Ala
485 490 495
Ile Leu Met Thr Ser Pro Arg Thr Ile Tyr Glu Asn Pro Thr Asn Ile
500 505 510
Tyr Ser Phe Ala Trp Thr Lys Lys Asp Ile Asp Gln Gln Asn Asn Ile
515 520 525
Ile Ile Asn Ala Ile Thr Gln Ile Pro Ala Val Lys Gly Ile Ala Leu
530 535 540
Gly Asn Gln Ser Arg Val Ile Gln Gly Pro Gly His Thr Ser Gly Asp
545 550 555 560
Leu Val Tyr Leu Lys Asp Ser Leu Glu Leu Arg Cys Gln Tyr Thr Gly
565 570 575
Pro Gln Gln Ser Tyr Asp Val Arg Ile Arg Tyr Ala Ser Asn Gly Ile
580 585 590
Leu Asn Asp Arg Ala Met Ile Ala Ile Thr Ile Pro Gly Val Thr Gly
595 600 605
Gln Ser Ile Ser Leu Ser Glu Thr Phe Ser Gly Thr Asp Tyr Asn Val
610 615 620
Leu Glu Phe Gln Asn Phe Lys Ser Val Gln Phe Thr Ser Ala Ile Arg
625 630 635 640
Leu Asn Pro Ser Gln Asn Ile Phe Ile Tyr Leu Asn Arg Leu Asp Gln
645 650 655
Asn Ala Asn Thr Thr Leu Leu Ile Asp Lys Ile Glu Phe Ile Pro His
660 665 670
Pro Leu Pro Arg Ile Leu Ser Glu Gln Lys Leu Lys Lys Val Lys Gln
675 680 685
Lys Val Asn Asp Leu Phe Ile Asp Ala Glu Asn Gly Cys Phe Cys Pro
690 695 700
Ser His Glu Lys Asp Leu Arg
705 710
<210> 93
<211> 672
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 93
Met Asn Gln Asn Asn Asn Glu Tyr Glu Ile Ala Asp Val Asn Pro Pro
1 5 10 15
Ser Tyr Pro Ser Asn Arg Ile Asn Asn Tyr Ser Arg Tyr Pro Phe Ala
20 25 30
Asn Asp Pro Asn Gln Leu Leu Gln Gln Thr Asn Tyr Lys Asp Trp Leu
35 40 45
Asn Ile Cys Gln Gly Asn Asn Gln Asn Ser Gly Asn Leu Ile Thr Asp
50 55 60
Ala Gly Ala Ala Val Ser Ala Gly Ile Ile Val Thr Gly Thr Met Ile
65 70 75 80
Ala Ala Phe Ala Ala Leu Ala Val Ala Pro Phe Pro Ile Val Gly Ala
85 90 95
Ile Val Gly Gly Ile Val Ile Ala Phe Gly Thr Leu Leu Pro Leu Val
100 105 110
Trp Pro Gly Gly Lys Glu Asp Arg Thr Val Trp Thr Gln Phe Phe Ala
115 120 125
Leu Gly Glu Thr Leu Leu Gly Lys Arg Leu Thr Asp Asp Ala Gln Lys
130 135 140
Thr Ala Ala Glu Thr Val Asp Gly Phe Gly Arg Val Leu Asp Asn Tyr
145 150 155 160
Lys Val Ala Leu Asn Ser Trp Met Asp Leu Lys Lys Lys Gln Ser Pro
165 170 175
Gly Ser Pro Pro Thr Thr Glu Leu Lys Glu Ala Ala Asp Asn Val Lys
180 185 190
Gln Arg Phe Glu Ile Val His Asn Glu Phe Asp Ala Asn Met Pro His
195 200 205
Leu Gly Asn Pro Lys Ser Asn Tyr Lys Glu Val Leu Leu Ser Ser Tyr
210 215 220
Ala His Ala Ala Asn Leu His Leu Asn Leu Leu Gln Gln Gly Val Arg
225 230 235 240
Phe Ala Asp Gln Trp Asn Gln Asp Ile Tyr Ser Ser Gln Ile Val Pro
245 250 255
Ala Ala Gly Thr Ser Thr Glu Tyr Leu Lys Phe Leu Gln Ala Arg Ile
260 265 270
Gln Glu Tyr Val Asn Tyr Cys Thr Ala Thr Tyr Arg Ser Gly Leu Asn
275 280 285
Ile Leu Lys Asn Ser Asn Asp Ile Thr Trp Asp Ile Tyr Asn Thr Tyr
290 295 300
Arg Arg Asp Met Thr Leu Thr Val Leu Asp Leu Val Ala Ala Phe Pro
305 310 315 320
Asn Tyr Asp Pro Thr Tyr Tyr Pro Ile Asp Thr Lys Ile Gln Leu Thr
325 330 335
Arg Thr Ile Tyr Ser Asn Leu Leu Gly Ile Thr Gln Ser Gly Arg Gln
340 345 350
Tyr Phe Glu Ala Leu Glu Asn Ala Leu Thr Met Arg Pro Asn Leu Tyr
355 360 365
Arg Ile Leu Arg Gly Phe Asn Phe Asn Thr Thr Phe Gly Ser Gly Val
370 375 380
Asn Tyr Leu Ser Gly Ile Ala Asn Arg Arg Gly Leu Ile Lys Thr Val
385 390 395 400
Pro Ser Glu Glu Asp Glu Gln Pro Phe Tyr Gly Gln Ser Asn Gly Arg
405 410 415
His Asp Pro Met Ile Phe Ala Asn Gly Leu Asn Ile Phe Arg Val Thr
420 425 430
Leu Leu Arg Asn Lys His Tyr Ile Ala Leu Pro Val Gly Pro Pro Leu
435 440 445
Phe Ala Ala Asn Gln Ile Thr Asp Leu Lys Leu Tyr Tyr Gly Asn Ala
450 455 460
Thr Gln Tyr His His Tyr Gln Pro Ser Asn Glu Gly Leu Thr Thr Glu
465 470 475 480
Ser Thr Asp Leu Ser Phe Pro Pro Lys Asn Glu Glu Tyr Leu Asn Ala
485 490 495
Ile Leu Met Thr Ser Pro Arg Thr Ile Tyr Glu Asn Pro Thr Asn Ile
500 505 510
Tyr Ser Phe Ala Trp Thr Lys Lys Asp Ile Asp Gln Gln Asn Asn Ile
515 520 525
Ile Ile Asn Ala Ile Thr Gln Ile Pro Ala Val Lys Gly Ile Ala Leu
530 535 540
Gly Asn Gln Ser Arg Val Ile Gln Gly Pro Gly His Thr Ser Gly Asp
545 550 555 560
Leu Val Tyr Leu Lys Asp Ser Leu Glu Leu Arg Cys Gln Tyr Thr Gly
565 570 575
Pro Gln Gln Ser Tyr Asp Val Arg Ile Arg Tyr Ala Ser Asn Gly Ile
580 585 590
Leu Asn Asp Arg Ala Met Ile Ala Ile Thr Ile Pro Gly Val Thr Gly
595 600 605
Gln Ser Ile Ser Leu Ser Glu Thr Phe Ser Gly Thr Asp Tyr Asn Val
610 615 620
Leu Glu Phe Gln Asn Phe Lys Ser Val Gln Phe Thr Ser Ala Ile Arg
625 630 635 640
Leu Asn Pro Ser Gln Asn Ile Phe Ile Tyr Leu Asn Arg Leu Asp Gln
645 650 655
Asn Ala Asn Thr Thr Leu Leu Ile Asp Lys Ile Glu Phe Ile Pro His
660 665 670
<210> 94
<211> 657
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 94
Met Asn Gln Tyr Tyr Asn Asn Asn Glu Tyr Glu Ile Leu Asp Asn Gly
1 5 10 15
Val Gln Cys Cys Ser Pro Arg Tyr Pro Leu Ala Gln Ala Pro Gly Ser
20 25 30
Glu Trp Gln Asn Met Asn Tyr Gln Asp Val Met Asn Thr Ser Val Gly
35 40 45
Arg Glu Tyr Gln Ala Val Gln Gln Val Asn Val Gly Glu Ala Val Gly
50 55 60
Ala Ala Leu Gly Ile Leu Thr Thr Ile Leu Lys Ala Val Asn Pro Thr
65 70 75 80
Leu Gly Thr Ala Ala Gly Val Ile Ser Ser Ile Phe Gly Phe Leu Trp
85 90 95
Lys Arg Phe Gly Thr Asp Pro Gln Ala Gln Trp Lys Gln Phe Met Glu
100 105 110
Ala Val Glu Tyr Leu Val Ser Gln Lys Ile Thr Asp Ala Val Arg Ser
115 120 125
Lys Ala Val Ser Glu Leu Glu Gly Val Gln Arg Ala Val Glu Leu Tyr
130 135 140
Gln Glu Ala Ala Asn Ala Trp Asn Met Asn Pro Asp Asn Ala Ala Ala
145 150 155 160
Lys Glu Arg Ile Arg Arg Gln Tyr Thr Ser Thr Asn Thr Val Ile Glu
165 170 175
Tyr Ala Met Pro Ser Phe Arg Val Gly Ser Phe Glu Val Pro Leu Leu
180 185 190
Thr Val Tyr Ala Gln Ala Ala Asn Leu His Leu Leu Leu Leu Arg Asp
195 200 205
Ala Val Lys Phe Gly Ala Gly Trp Gly Phe Ser Pro Thr Glu Val Glu
210 215 220
Asp Asn Tyr Thr Arg Leu Gln Ala Arg Thr Ala Glu Tyr Thr Asn His
225 230 235 240
Cys Thr Asn Thr Tyr Asp Lys Gly Leu Lys Gln Ala Tyr Asp Leu Ala
245 250 255
Pro Asn Pro Thr Asp Tyr Asn Lys Tyr Pro Tyr Leu Asn Pro Tyr Ser
260 265 270
Lys Asp Pro Ile Tyr Gly Lys Tyr Tyr Thr Ala Pro Val Asp Trp Asn
275 280 285
Leu Phe Asn Asp Phe Arg Arg Asp Met Thr Leu Met Val Leu Asp Ile
290 295 300
Val Ala Val Trp Pro Thr Tyr Asn Pro Arg Leu Tyr Asn Asn Pro Asn
305 310 315 320
Gly Val Gln Ile Gln Leu Ser Arg Glu Val Tyr Ser Thr Val Tyr Gly
325 330 335
Arg Gly Trp Ser Asn Asn Ser Thr Val Asp Ala Ile Glu Ser Thr Leu
340 345 350
Val Arg Pro Pro His Leu Val Thr Glu Leu Thr Lys Leu Thr Phe Asp
355 360 365
Glu Arg Asn Leu Tyr Glu Ala Glu Thr Val Pro Val Ala Phe Arg Lys
370 375 380
Val Thr Asn Thr Leu His Tyr Val Gly Ser Ser Thr Thr Trp Glu Gln
385 390 395 400
Ser Phe Ser Ala Thr Pro Val Gly Ser Leu Lys Ala Val His Asn Val
405 410 415
Leu Ala Thr Asp Ile Gly Asn Leu Ala Leu Ser Leu Gly Ala Val Pro
420 425 430
Leu Gly Phe Ser Phe Tyr Asn Lys Asn Asp Gln His Ile Thr Thr Val
435 440 445
Gly Tyr Ser Gly Gly Trp Trp Asn Gly Ile Pro Lys Asp Glu Gly Ser
450 455 460
Asn Gln Asn Ser His His Leu Ser Tyr Val Ala Ala Leu Glu Thr Gln
465 470 475 480
Thr Thr Ala Gly Trp Phe Pro Thr Tyr Pro Val Pro Leu Leu Gly Glu
485 490 495
Trp Gly Phe Gly Trp Gln His Asn Ser Leu Lys Tyr Thr Asn Arg Leu
500 505 510
Val Thr Asn Gln Ile Asn Gln Leu Pro Ala Val Lys Ala Ser Ala Leu
515 520 525
Val Asn His Ala Arg Val Ser Lys Gly Thr Thr Gly Thr Gly Gly Asn
530 535 540
Ile Ile Glu Leu Val Asn Pro Asn Cys Gly Phe Ile Phe Asn Phe Tyr
545 550 555 560
Ala Glu Pro Glu Asn Pro Gln Gly Gln Ala Phe Asn Ile Arg Ile Arg
565 570 575
Tyr Ser Ala Thr Val Pro Gly Lys Leu Asn Ile Arg His Leu Glu Ser
580 585 590
Gly Lys Glu Phe Met Asn Thr Pro Arg Asp Phe Lys Gly Thr Thr Thr
595 600 605
Gly Thr Asn Trp Ile Pro Lys Phe Gln Glu Tyr Gln Tyr Leu Asp Leu
610 615 620
Gly Pro Ile Val Leu Arg Thr Gly Met Asn Tyr Gly Phe Lys Ile Glu
625 630 635 640
Leu Ala Ser Gly Gln Leu Val Ser Ile Asp Lys Ile Glu Phe Leu Pro
645 650 655
Phe
<210> 95
<211> 820
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 95
Met Ala Gln Leu Pro Glu Leu Gln Ala Gln Ser Phe Ile Pro Tyr Asn
1 5 10 15
Val Leu Ala Asn Pro Val Thr Gly Asn Ser Ala Gly Thr Asp Trp Gly
20 25 30
Glu Trp Leu Ser Ser Leu Lys Glu Ala Trp Thr Glu Phe Gln Lys Thr
35 40 45
Gly Ser Asp Lys Phe Leu Gln Ser Val Leu Ser Thr Gly Tyr Asp Ala
50 55 60
Ala Gln Gly Gly Ser Phe Asn Tyr Ile Ala Val Leu Gln Ala Gly Val
65 70 75 80
Ala Ile Leu Gly Thr Val Leu Gly Ala Glu Phe Pro Gly Ile Thr Ala
85 90 95
Ile Ala Val Pro Ala Leu Thr Phe Leu Ile Lys Trp Val Trp Pro Lys
100 105 110
Leu Thr Gly Gly Ser Ala Gly Glu Ser Asp Thr Gln Lys Met Leu Asp
115 120 125
Leu Ile Asp Lys Glu Ile Gln Gln Lys Leu Asp Gln Ala Leu Ser Gln
130 135 140
Gln Asp Ile Asn Asn Trp Arg Ala Tyr Leu Thr Ser Ile Phe Glu Ala
145 150 155 160
Ala Thr Asn Leu Ser Gln Ser Ile Ile Asp Ala Gln Phe Thr Gly Thr
165 170 175
Glu Arg Ser Ser Asp Arg Gln Pro Arg Val Pro Thr Ser Ser Asp Tyr
180 185 190
Glu Asp Val Tyr Thr Lys Leu Asn Ile Ala Asp Ala Val Leu Ser Pro
195 200 205
Ser Thr Asn Asn Ile Leu Thr Gly Asn Phe Asp Val Leu Ala Ile Pro
210 215 220
Tyr Tyr Thr Ile Gly Ala Thr Val Arg Ile Thr Ala Tyr Gln Ser Phe
225 230 235 240
Val Lys Phe Ala Asn Gln Trp Ile Asp Val Val Tyr Pro Asp Gln Thr
245 250 255
Ser Asn Thr Trp Leu Lys Ala His Gln Asn Leu Asp Asn Ala Lys Asp
260 265 270
Lys Met Ile Ala Met Ile Gln Gln Tyr Thr Ala Asn Val Leu Arg Val
275 280 285
Phe Thr Asp Pro Lys Asn Met Pro Pro Leu Gly Lys Asp Lys Lys Ser
290 295 300
Ile Asn Ala Tyr Asn Lys Phe Val Arg Gly Met Val Ile Ser Gly Leu
305 310 315 320
Asp Leu Val Ala Val Trp Pro Ser Leu Tyr Pro Asp Asp Tyr Gln Val
325 330 335
Gln Thr Asp Leu Glu Lys Thr Arg Val Ile Phe Ser Asp Leu Ile Gly
340 345 350
Lys Asp Gln Thr Ile Ser Asn Asp Val Thr Leu Ile Asn Met Ala Asp
355 360 365
Gly Lys Asp Gly Ser Gly Ala Phe Asn Gln His Ala Ala Ile Asp Leu
370 375 380
Asn Ser Ile Phe Tyr Tyr His Glu Glu Leu Ser Ser Met Gln Leu Gly
385 390 395 400
Ile His Asp Gly Ser Arg Gly Asn Thr Thr Asn Cys Tyr Asp Tyr Gly
405 410 415
Ile Ile Ala Asn Tyr Pro Asn His Ser Tyr Phe Tyr Gly Asp Leu Tyr
420 425 430
Ser Pro Ser Gly Asp Ala Thr Phe Ser Ala Pro Leu Asn Val Leu Asn
435 440 445
Ala Gln Thr Gln Tyr Ser Ser Gly Tyr Val Asp Ser Glu Phe Ile Tyr
450 455 460
Asn Ser Asp Pro Ser Ala Tyr Gly Leu Gly Cys His Ile Leu Gly Gly
465 470 475 480
Cys Thr Lys Gly Asp Cys Tyr Asn Gln Ser Ser Cys Ser Glu Gly Phe
485 490 495
Gly Tyr Ser Cys Asn Thr Ser Leu Pro Ser Gln Lys Ile Asn Ala Phe
500 505 510
Tyr Pro Phe Lys Met Asn Leu Asn Arg Ser Gly Thr Ser Asp Lys Leu
515 520 525
Gly Leu Met Tyr Ser Leu Val Pro Leu Asp Leu Ser Pro Asn Asn Val
530 535 540
Phe Gly Glu Leu Asp Ser Asp Thr Arg Asn Val Ile Gly Lys Gly Phe
545 550 555 560
Pro Ala Glu Lys Gly Thr Leu Ser Tyr Gly Arg Gln Pro Met Leu Val
565 570 575
Arg Glu Trp Val Asn Gly Ala Asn Ala Val Lys Leu Ser Asp Val Pro
580 585 590
Leu Thr Leu Gln Met Thr Asn Met Thr Ser Gly Lys Tyr Tyr Ile Arg
595 600 605
Val Arg Tyr Ala Asn Thr Ser Asn Ala Glu Ile Ser Ile Asn Gln Gln
610 615 620
Val Tyr Ala Gly Asn Gln Asn Val Gln Asn Gly Gly Trp Ser Leu Pro
625 630 635 640
Ser Thr Thr Ala Ser Asn Val Ala Thr Asn Phe Pro Asn Gln Leu Tyr
645 650 655
Ile Thr Gly Ile Asn Gly Asn Tyr Val Leu Glu Asp Ile Thr Trp Gly
660 665 670
Val Asp Gly Gln Gly Lys Pro Ile Thr Ile Pro Ser Gly Asp Val Thr
675 680 685
Val Thr Leu Ser Arg Thr Asn Met Ser Gln Ser Gly Asp Leu Phe Ile
690 695 700
Asp Arg Val Glu Leu Val Pro Ala Ala Pro Gln Ser Asp Tyr Ile Asn
705 710 715 720
Tyr Ser Ile Thr Ser Gln Ile Pro Asn Cys Asn Asn Phe Asp Thr Ile
725 730 735
Ile Trp Asp Gly Asn Gly Ala Gln Arg Ser Thr Ala Thr Val Thr Val
740 745 750
Ser Gly Leu Pro Asp Asn Asn Gly Ile Leu Ile Ser Gly Leu Ser Ser
755 760 765
Tyr Gly Trp Gln Pro Leu Gln Asp Val Asn Gly His Gly Asn Asn Trp
770 775 780
Val Thr Asn Gly Gly Pro Phe Thr Leu Ser Asn Asp His Thr Phe Thr
785 790 795 800
Ala Ile Ser Ile Cys Gly Phe Gln Asn Val Ser Ser Gly Lys Ile Thr
805 810 815
Gly Lys Leu Ser
820
<210> 96
<211> 712
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 96
Met Ala Gln Leu Pro Glu Leu Gln Ala Gln Ser Phe Ile Pro Tyr Asn
1 5 10 15
Val Leu Ala Asn Pro Val Thr Gly Asn Ser Ala Gly Thr Asp Trp Gly
20 25 30
Glu Trp Leu Ser Ser Leu Lys Glu Ala Trp Thr Glu Phe Gln Lys Thr
35 40 45
Gly Ser Asp Lys Phe Leu Gln Ser Val Leu Ser Thr Gly Tyr Asp Ala
50 55 60
Ala Gln Gly Gly Ser Phe Asn Tyr Ile Ala Val Leu Gln Ala Gly Val
65 70 75 80
Ala Ile Leu Gly Thr Val Leu Gly Ala Glu Phe Pro Gly Ile Thr Ala
85 90 95
Ile Ala Val Pro Ala Leu Thr Phe Leu Ile Lys Trp Val Trp Pro Lys
100 105 110
Leu Thr Gly Gly Ser Ala Gly Glu Ser Asp Thr Gln Lys Met Leu Asp
115 120 125
Leu Ile Asp Lys Glu Ile Gln Gln Lys Leu Asp Gln Ala Leu Ser Gln
130 135 140
Gln Asp Ile Asn Asn Trp Arg Ala Tyr Leu Thr Ser Ile Phe Glu Ala
145 150 155 160
Ala Thr Asn Leu Ser Gln Ser Ile Ile Asp Ala Gln Phe Thr Gly Thr
165 170 175
Glu Arg Ser Ser Asp Arg Gln Pro Arg Val Pro Thr Ser Ser Asp Tyr
180 185 190
Glu Asp Val Tyr Thr Lys Leu Asn Ile Ala Asp Ala Val Leu Ser Pro
195 200 205
Ser Thr Asn Asn Ile Leu Thr Gly Asn Phe Asp Val Leu Ala Ile Pro
210 215 220
Tyr Tyr Thr Ile Gly Ala Thr Val Arg Ile Thr Ala Tyr Gln Ser Phe
225 230 235 240
Val Lys Phe Ala Asn Gln Trp Ile Asp Val Val Tyr Pro Asp Gln Thr
245 250 255
Ser Asn Thr Trp Leu Lys Ala His Gln Asn Leu Asp Asn Ala Lys Asp
260 265 270
Lys Met Ile Ala Met Ile Gln Gln Tyr Thr Ala Asn Val Leu Arg Val
275 280 285
Phe Thr Asp Pro Lys Asn Met Pro Pro Leu Gly Lys Asp Lys Lys Ser
290 295 300
Ile Asn Ala Tyr Asn Lys Phe Val Arg Gly Met Val Ile Ser Gly Leu
305 310 315 320
Asp Leu Val Ala Val Trp Pro Ser Leu Tyr Pro Asp Asp Tyr Gln Val
325 330 335
Gln Thr Asp Leu Glu Lys Thr Arg Val Ile Phe Ser Asp Leu Ile Gly
340 345 350
Lys Asp Gln Thr Ile Ser Asn Asp Val Thr Leu Ile Asn Met Ala Asp
355 360 365
Gly Lys Asp Gly Ser Gly Ala Phe Asn Gln His Ala Ala Ile Asp Leu
370 375 380
Asn Ser Ile Phe Tyr Tyr His Glu Glu Leu Ser Ser Met Gln Leu Gly
385 390 395 400
Ile His Asp Gly Ser Arg Gly Asn Thr Thr Asn Cys Tyr Asp Tyr Gly
405 410 415
Ile Ile Ala Asn Tyr Pro Asn His Ser Tyr Phe Tyr Gly Asp Leu Tyr
420 425 430
Ser Pro Ser Gly Asp Ala Thr Phe Ser Ala Pro Leu Asn Val Leu Asn
435 440 445
Ala Gln Thr Gln Tyr Ser Ser Gly Tyr Val Asp Ser Glu Phe Ile Tyr
450 455 460
Asn Ser Asp Pro Ser Ala Tyr Gly Leu Gly Cys His Ile Leu Gly Gly
465 470 475 480
Cys Thr Lys Gly Asp Cys Tyr Asn Gln Ser Ser Cys Ser Glu Gly Phe
485 490 495
Gly Tyr Ser Cys Asn Thr Ser Leu Pro Ser Gln Lys Ile Asn Ala Phe
500 505 510
Tyr Pro Phe Lys Met Asn Leu Asn Arg Ser Gly Thr Ser Asp Lys Leu
515 520 525
Gly Leu Met Tyr Ser Leu Val Pro Leu Asp Leu Ser Pro Asn Asn Val
530 535 540
Phe Gly Glu Leu Asp Ser Asp Thr Arg Asn Val Ile Gly Lys Gly Phe
545 550 555 560
Pro Ala Glu Lys Gly Thr Leu Ser Tyr Gly Arg Gln Pro Met Leu Val
565 570 575
Arg Glu Trp Val Asn Gly Ala Asn Ala Val Lys Leu Ser Asp Val Pro
580 585 590
Leu Thr Leu Gln Met Thr Asn Met Thr Ser Gly Lys Tyr Tyr Ile Arg
595 600 605
Val Arg Tyr Ala Asn Thr Ser Asn Ala Glu Ile Ser Ile Asn Gln Gln
610 615 620
Val Tyr Ala Gly Asn Gln Asn Val Gln Asn Gly Gly Trp Ser Leu Pro
625 630 635 640
Ser Thr Thr Ala Ser Asn Val Ala Thr Asn Phe Pro Asn Gln Leu Tyr
645 650 655
Ile Thr Gly Ile Asn Gly Asn Tyr Val Leu Glu Asp Ile Thr Trp Gly
660 665 670
Val Asp Gly Gln Gly Lys Pro Ile Thr Ile Pro Ser Gly Asp Val Thr
675 680 685
Val Thr Leu Ser Arg Thr Asn Met Ser Gln Ser Gly Asp Leu Phe Ile
690 695 700
Asp Arg Val Glu Leu Val Pro Ala
705 710
<210> 97
<211> 787
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 97
Met Asn Ser Tyr Gln Asn Lys Asn Glu Tyr Glu Ile Leu Asp Ala Ser
1 5 10 15
Glu Asn Thr Val Asn Ala Leu Asn Arg Tyr Pro Phe Ala Asn Asn Pro
20 25 30
Tyr Ser Ser Ile Phe Ser Ser Cys Pro Arg Ser Gly Pro Gly Asn Trp
35 40 45
Ile Asn Ile Leu Gly Asn Ala Val Ser Glu Ala Val Ser Ile Ser Gln
50 55 60
Asp Ile Ile Ser Leu Leu Thr Gln Pro Ser Ile Ser Gly Ile Ile Ser
65 70 75 80
Met Ala Phe Ser Leu Leu Ser Arg Met Ile Gly Ser Asn Gly Arg Ser
85 90 95
Ile Ser Glu Leu Ser Met Cys Asp Leu Leu Ala Ile Ile Asp Leu Arg
100 105 110
Val Asn Gln Ser Val Leu Asp Asp Gly Val Ala Asp Phe Asn Gly Ser
115 120 125
Leu Val Ile Tyr Arg Asn Tyr Leu Glu Ala Leu Gln Arg Trp Asn Asn
130 135 140
Asn Pro Asn Pro Ala Asn Ala Glu Glu Val Arg Thr Arg Phe Arg Glu
145 150 155 160
Ser Asp Thr Ile Phe Asp Leu Ile Leu Thr Gln Gly Ser Leu Thr Asn
165 170 175
Gly Gly Ser Leu Ala Arg Asn Asn Ala Gln Ile Leu Leu Leu Pro Ser
180 185 190
Phe Ala Asn Ala Ala Tyr Phe His Leu Leu Leu Leu Arg Asp Ala Asn
195 200 205
Val Tyr Gly Asn Asn Trp Gly Leu Phe Gly Val Thr Pro Asn Ile Asn
210 215 220
Tyr Glu Ser Lys Leu Leu Asn Leu Ile Arg Leu Tyr Thr Asn Tyr Cys
225 230 235 240
Thr His Trp Tyr Asn Gln Gly Leu Asn Glu Leu Arg Asn Arg Gly Ser
245 250 255
Asn Ala Thr Ala Trp Leu Glu Phe His Arg Phe Arg Arg Asp Met Thr
260 265 270
Leu Met Val Leu Asp Ile Val Ser Ser Phe Ser Ser Leu Asp Ile Thr
275 280 285
Arg Tyr Pro Arg Ala Thr Asp Phe Gln Leu Ser Arg Ile Ile Tyr Thr
290 295 300
Asp Pro Ile Gly Phe Val Asn Arg Ser Asp Pro Ser Ala Pro Arg Thr
305 310 315 320
Trp Phe Ser Phe His Asn Gln Ala Asn Phe Ser Ala Leu Glu Ser Gly
325 330 335
Ile Pro Ser Pro Ser Phe Ser Gln Phe Leu Asp Ser Met Arg Ile Ser
340 345 350
Thr Gly Pro Leu Ser Leu Pro Ala Ser Pro Asn Ile His Arg Ala Arg
355 360 365
Val Trp Tyr Gly Asn Gln Asn Asn Phe Asn Gly Ser Ser Ser Gln Thr
370 375 380
Phe Gly Glu Ile Thr Asn Asp Asn Gln Thr Ile Ser Gly Leu Asn Ile
385 390 395 400
Phe Arg Ile Asp Ser Gln Ala Val Asn Leu Asn Asn Thr Thr Phe Gly
405 410 415
Val Ser Arg Ala Glu Phe Tyr His Asp Ala Ser Gln Gly Ser Gln Arg
420 425 430
Ser Ile Tyr Gln Gly Phe Val Asp Thr Gly Gly Ala Ser Thr Ala Val
435 440 445
Ala Gln Asn Ile Gln Thr Phe Phe Pro Gly Glu Asn Ser Ser Ile Pro
450 455 460
Thr Pro Gln Asp Tyr Thr His Ile Leu Ser Arg Ser Thr Asn Leu Thr
465 470 475 480
Gly Gly Leu Arg Gln Val Ala Ser Gly Arg Arg Ser Ser Leu Val Leu
485 490 495
His Gly Trp Thr His Lys Ser Leu Ser Arg Gln Asn Arg Val Glu Pro
500 505 510
Asn Arg Ile Thr Gln Val Pro Ala Val Lys Ala Ser Ser Pro Ser Asn
515 520 525
Cys Thr Val Ile Ala Gly Pro Gly Phe Thr Gly Gly Asp Leu Val Arg
530 535 540
Met Ser Ser Asn Cys Ser Val Ser Tyr Asn Phe Thr Pro Ala Asp Gln
545 550 555 560
Gln Val Val Ile Arg Leu Arg Tyr Ala Cys Gln Gly Thr Ala Ser Leu
565 570 575
Arg Ile Thr Phe Gly Asn Gly Ser Ser Gln Ile Ile Pro Leu Val Ser
580 585 590
Thr Thr Ser Ser Ile Asn Asn Leu Gln Tyr Glu Asn Phe Ser Phe Ala
595 600 605
Ser Gly Pro Asn Ser Val Asn Phe Leu Ser Ala Gly Thr Ser Ile Thr
610 615 620
Ile Gln Asn Ile Ser Thr Asn Ser Asn Val Val Leu Asp Arg Ile Glu
625 630 635 640
Ile Val Pro Glu Gln Pro Ile Pro Ile Ile Pro Gly Asp Tyr Gln Ile
645 650 655
Val Thr Ala Leu Asn Asn Ser Ser Val Phe Asp Leu Asn Ser Gly Thr
660 665 670
Arg Val Thr Leu Trp Ser Asn Asn Arg Gly Ala His Gln Ile Trp Asn
675 680 685
Phe Met Tyr Asp Gln Gln Arg Asn Ala Tyr Val Ile Arg Asn Val Ser
690 695 700
Asn Pro Ser Leu Val Leu Thr Trp Asp Phe Thr Ser Pro Asn Ser Ile
705 710 715 720
Val Phe Ala Ala Pro Phe Ser Pro Gly Arg Gln Glu Gln Tyr Trp Ile
725 730 735
Ala Glu Ser Phe Gln Asn Ser Tyr Val Phe Glu Asn Leu Arg Asn Thr
740 745 750
Asn Met Val Leu Asp Val Ala Gly Gly Ser Thr Ala Ile Gly Thr Asn
755 760 765
Ile Ile Ala Phe Pro Arg His Asn Gly Asn Ala Gln Arg Phe Phe Ile
770 775 780
Arg Arg Pro
785
<210> 98
<211> 644
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 98
Met Asn Ser Tyr Gln Asn Lys Asn Glu Tyr Glu Ile Leu Asp Ala Ser
1 5 10 15
Glu Asn Thr Val Asn Ala Leu Asn Arg Tyr Pro Phe Ala Asn Asn Pro
20 25 30
Tyr Ser Ser Ile Phe Ser Ser Cys Pro Arg Ser Gly Pro Gly Asn Trp
35 40 45
Ile Asn Ile Leu Gly Asn Ala Val Ser Glu Ala Val Ser Ile Ser Gln
50 55 60
Asp Ile Ile Ser Leu Leu Thr Gln Pro Ser Ile Ser Gly Ile Ile Ser
65 70 75 80
Met Ala Phe Ser Leu Leu Ser Arg Met Ile Gly Ser Asn Gly Arg Ser
85 90 95
Ile Ser Glu Leu Ser Met Cys Asp Leu Leu Ala Ile Ile Asp Leu Arg
100 105 110
Val Asn Gln Ser Val Leu Asp Asp Gly Val Ala Asp Phe Asn Gly Ser
115 120 125
Leu Val Ile Tyr Arg Asn Tyr Leu Glu Ala Leu Gln Arg Trp Asn Asn
130 135 140
Asn Pro Asn Pro Ala Asn Ala Glu Glu Val Arg Thr Arg Phe Arg Glu
145 150 155 160
Ser Asp Thr Ile Phe Asp Leu Ile Leu Thr Gln Gly Ser Leu Thr Asn
165 170 175
Gly Gly Ser Leu Ala Arg Asn Asn Ala Gln Ile Leu Leu Leu Pro Ser
180 185 190
Phe Ala Asn Ala Ala Tyr Phe His Leu Leu Leu Leu Arg Asp Ala Asn
195 200 205
Val Tyr Gly Asn Asn Trp Gly Leu Phe Gly Val Thr Pro Asn Ile Asn
210 215 220
Tyr Glu Ser Lys Leu Leu Asn Leu Ile Arg Leu Tyr Thr Asn Tyr Cys
225 230 235 240
Thr His Trp Tyr Asn Gln Gly Leu Asn Glu Leu Arg Asn Arg Gly Ser
245 250 255
Asn Ala Thr Ala Trp Leu Glu Phe His Arg Phe Arg Arg Asp Met Thr
260 265 270
Leu Met Val Leu Asp Ile Val Ser Ser Phe Ser Ser Leu Asp Ile Thr
275 280 285
Arg Tyr Pro Arg Ala Thr Asp Phe Gln Leu Ser Arg Ile Ile Tyr Thr
290 295 300
Asp Pro Ile Gly Phe Val Asn Arg Ser Asp Pro Ser Ala Pro Arg Thr
305 310 315 320
Trp Phe Ser Phe His Asn Gln Ala Asn Phe Ser Ala Leu Glu Ser Gly
325 330 335
Ile Pro Ser Pro Ser Phe Ser Gln Phe Leu Asp Ser Met Arg Ile Ser
340 345 350
Thr Gly Pro Leu Ser Leu Pro Ala Ser Pro Asn Ile His Arg Ala Arg
355 360 365
Val Trp Tyr Gly Asn Gln Asn Asn Phe Asn Gly Ser Ser Ser Gln Thr
370 375 380
Phe Gly Glu Ile Thr Asn Asp Asn Gln Thr Ile Ser Gly Leu Asn Ile
385 390 395 400
Phe Arg Ile Asp Ser Gln Ala Val Asn Leu Asn Asn Thr Thr Phe Gly
405 410 415
Val Ser Arg Ala Glu Phe Tyr His Asp Ala Ser Gln Gly Ser Gln Arg
420 425 430
Ser Ile Tyr Gln Gly Phe Val Asp Thr Gly Gly Ala Ser Thr Ala Val
435 440 445
Ala Gln Asn Ile Gln Thr Phe Phe Pro Gly Glu Asn Ser Ser Ile Pro
450 455 460
Thr Pro Gln Asp Tyr Thr His Ile Leu Ser Arg Ser Thr Asn Leu Thr
465 470 475 480
Gly Gly Leu Arg Gln Val Ala Ser Gly Arg Arg Ser Ser Leu Val Leu
485 490 495
His Gly Trp Thr His Lys Ser Leu Ser Arg Gln Asn Arg Val Glu Pro
500 505 510
Asn Arg Ile Thr Gln Val Pro Ala Val Lys Ala Ser Ser Pro Ser Asn
515 520 525
Cys Thr Val Ile Ala Gly Pro Gly Phe Thr Gly Gly Asp Leu Val Arg
530 535 540
Met Ser Ser Asn Cys Ser Val Ser Tyr Asn Phe Thr Pro Ala Asp Gln
545 550 555 560
Gln Val Val Ile Arg Leu Arg Tyr Ala Cys Gln Gly Thr Ala Ser Leu
565 570 575
Arg Ile Thr Phe Gly Asn Gly Ser Ser Gln Ile Ile Pro Leu Val Ser
580 585 590
Thr Thr Ser Ser Ile Asn Asn Leu Gln Tyr Glu Asn Phe Ser Phe Ala
595 600 605
Ser Gly Pro Asn Ser Val Asn Phe Leu Ser Ala Gly Thr Ser Ile Thr
610 615 620
Ile Gln Asn Ile Ser Thr Asn Ser Asn Val Val Leu Asp Arg Ile Glu
625 630 635 640
Ile Val Pro Glu
<210> 99
<211> 846
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 99
Met Ala Gln Leu Gln Glu Leu Gln Ile Gln Pro Val Ile Pro Tyr Asn
1 5 10 15
Val Leu Ala Ser Pro Gln Ile Gly Asn Leu Asp Thr Gln Pro Gly Ser
20 25 30
Leu Asp Asp Leu Ile Glu Ser Leu Lys Glu Ala Trp Thr Glu Phe Gln
35 40 45
Lys Thr Gly Ser Asp Lys Leu Leu Gln Thr Thr Leu Gln Asn Gly Phe
50 55 60
Ser Ala Ala Ser Gly Gly Ser Phe Asn Tyr Leu Ala Val Leu Gln Ala
65 70 75 80
Gly Ile Gly Leu Phe Gly Thr Leu Gly Ala Glu Ile Pro Gly Val Ala
85 90 95
Val Ala Ala Pro Ile Leu Ser Met Val Ile Gly Trp Leu Trp Pro His
100 105 110
Lys Ser Gly Asp Asp Gly Gln Gln Leu Val Asp Leu Ile Asp Ala Glu
115 120 125
Ile Gln Lys Gln Leu Asn Gln Ala Leu Ser Thr Gln Asp Lys His Asn
130 135 140
Trp Val Gly Tyr Leu Asp Glu Ser Phe Leu Asn Ala Ser His Asn Val
145 150 155 160
Ala Arg Ala Val Thr Asn Ala Gln Phe Val Gly Thr Glu Gly Asn Tyr
165 170 175
Thr Ala Pro Arg Thr Pro Thr Ala Ser Asp Tyr Thr Thr Val Glu Thr
180 185 190
Thr Leu Phe Ser Thr Glu Gly Ser Tyr His Thr Gly Leu Ser Gln Met
195 200 205
Leu Asn Gly Asn Phe Asp Thr Leu Ala Leu Pro Phe Tyr Val Ile Gly
210 215 220
Val Thr Met Gln Leu Ala Thr Tyr Gln Thr Phe Ile Gln Phe Gly Glu
225 230 235 240
Lys Trp Ile Asp Val Val Trp Pro Asp Asn Gln Thr Pro Gly Thr Thr
245 250 255
Gly Tyr Thr His Tyr Gln Thr Leu Gln Asp Lys Lys Thr Asp Met Arg
260 265 270
Thr Phe Ile Gln Gln His Thr Thr Thr Val Tyr Asn Ala Phe Lys Lys
275 280 285
Gly Met Pro Pro Leu Glu Ser Asn Lys Asn Ser Ile Asn Ala Tyr Asn
290 295 300
Val Tyr Val Arg Gly Met Val Leu Asn Gly Leu Asp Met Val Ala Thr
305 310 315 320
Trp Pro Ser Met Tyr Pro Asp Asp Tyr Pro Thr Gln Met Ala Leu Glu
325 330 335
Gln Thr Arg Val Ile Phe Ser Asp Met Val Gly Gln Asp Gln Thr Arg
340 345 350
Asp Gly Asn Thr Thr Ile Tyr Asn Ile Phe Asp Ser Thr Ser Asn Phe
355 360 365
Gln His Gly Thr Thr Asp Ile Asn Ser Ile His Tyr Phe Pro Asp Glu
370 375 380
Leu Gln Gln Ala Gln Ile Ala Glu Tyr Ser Pro Ser Arg Gly Asn His
385 390 395 400
Cys Tyr Pro Tyr Gly Ile Ile Leu Asn Tyr Gln His Asn Thr Tyr Arg
405 410 415
Tyr Gly Asp Asn Asp Pro Gly Thr Ser Gly Thr Val Phe Pro Ala Pro
420 425 430
Met Arg Ser Ile Asn Ala Lys Thr Gln Asn Thr Ser Tyr Leu Asn Ser
435 440 445
Glu Asn Leu Phe Thr Asp Leu Gly Ser Ser Thr Asn Cys Tyr Ile Pro
450 455 460
Gly Thr Cys Thr Asn Asn Cys Ser Pro Gly Ser Ser Cys Thr Asn Gly
465 470 475 480
Ser Gly Tyr Gly Glu Ser Cys Asn Val Pro Leu Pro Asn Gln Lys Ile
485 490 495
Asn Ala Leu Tyr Pro Phe Thr Gln Glu His Val Ser Gly Asp Ser Gly
500 505 510
Lys Leu Gly Leu Met Ala Ser Leu Val Pro Tyr Gly Leu Ser Pro Asn
515 520 525
Asn Val Phe Gly Glu Phe Asp Ser Asp Thr Gln Ala Ile Ile Gly Lys
530 535 540
Gly Phe Pro Ala Glu Lys Gly Tyr Ile Gly Asn Gly Ser Pro Val Ser
545 550 555 560
Val Val Arg Glu Trp Val Asn Gly Ala Asn Ala Val Gln Leu Pro Ala
565 570 575
Trp Asp Thr Phe Lys Ile Thr Ala Thr Asn Leu Ala Ala Asp Gln Tyr
580 585 590
His Ile Arg Val Arg Tyr Ala Ser Thr Ala Ala Tyr Pro Thr Asn Ala
595 600 605
Lys Tyr Pro Leu Ser Tyr Tyr Val Leu Ala Gly Asp Thr Ile Leu Gln
610 615 620
Gln Gly Lys Trp Glu Ala Ile Asp Thr Ser Gln Ala Asp Ile Thr Lys
625 630 635 640
Gln Val Tyr Val Thr Gly Gln Gln Gly Asn Tyr Ile Leu Thr Asp Ile
645 650 655
Leu Gly Glu Asn Pro Ile Thr Leu Pro Lys Asp Glu Ile Thr Val Gln
660 665 670
Leu Leu Gln Gly Asn Pro Ala Gly Gly Met Thr Lys Val Leu Ile Asp
675 680 685
Arg Ile Glu Phe Val Pro Ala Val Ile Asn Val Leu Asn Pro Gln Leu
690 695 700
Asn Tyr Gln Ile Ser Ser Gln Leu Pro Ala Trp Asn Asn Asn Gln Ser
705 710 715 720
Met Asp Pro Phe Pro Thr Ile Trp Arg Ala Asn Pro Gly Ile Val Gly
725 730 735
Thr Ser Ala Asn Ile Thr Val Ala Asp Leu Leu Asp Met Ser Gly Phe
740 745 750
Lys Tyr Thr Asn Ile Thr Ala Leu Asp Leu Gly Gly Gln Val Gly Leu
755 760 765
Phe Ala Lys Ile Gly Ile Gly Thr Asp Ser Asp Pro Asn Asn Trp Lys
770 775 780
Trp Met Cys Pro Asp Gly Gln Gly Glu Asn Pro Trp Ile Gly Asp Gly
785 790 795 800
Thr Tyr Asn Phe Asn Pro Lys Asn Ser Gly Ser Cys Phe Asp Lys Ser
805 810 815
Phe Thr Ala Ile Lys Leu Val Gly Gly Thr Ser Phe Asp Thr Phe Ile
820 825 830
Ala Ala Gly Ile Leu Thr Gly Thr Val Thr Thr Gln Lys Ser
835 840 845
<210> 100
<211> 696
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 100
Met Ala Gln Leu Gln Glu Leu Gln Ile Gln Pro Val Ile Pro Tyr Asn
1 5 10 15
Val Leu Ala Ser Pro Gln Ile Gly Asn Leu Asp Thr Gln Pro Gly Ser
20 25 30
Leu Asp Asp Leu Ile Glu Ser Leu Lys Glu Ala Trp Thr Glu Phe Gln
35 40 45
Lys Thr Gly Ser Asp Lys Leu Leu Gln Thr Thr Leu Gln Asn Gly Phe
50 55 60
Ser Ala Ala Ser Gly Gly Ser Phe Asn Tyr Leu Ala Val Leu Gln Ala
65 70 75 80
Gly Ile Gly Leu Phe Gly Thr Leu Gly Ala Glu Ile Pro Gly Val Ala
85 90 95
Val Ala Ala Pro Ile Leu Ser Met Val Ile Gly Trp Leu Trp Pro His
100 105 110
Lys Ser Gly Asp Asp Gly Gln Gln Leu Val Asp Leu Ile Asp Ala Glu
115 120 125
Ile Gln Lys Gln Leu Asn Gln Ala Leu Ser Thr Gln Asp Lys His Asn
130 135 140
Trp Val Gly Tyr Leu Asp Glu Ser Phe Leu Asn Ala Ser His Asn Val
145 150 155 160
Ala Arg Ala Val Thr Asn Ala Gln Phe Val Gly Thr Glu Gly Asn Tyr
165 170 175
Thr Ala Pro Arg Thr Pro Thr Ala Ser Asp Tyr Thr Thr Val Glu Thr
180 185 190
Thr Leu Phe Ser Thr Glu Gly Ser Tyr His Thr Gly Leu Ser Gln Met
195 200 205
Leu Asn Gly Asn Phe Asp Thr Leu Ala Leu Pro Phe Tyr Val Ile Gly
210 215 220
Val Thr Met Gln Leu Ala Thr Tyr Gln Thr Phe Ile Gln Phe Gly Glu
225 230 235 240
Lys Trp Ile Asp Val Val Trp Pro Asp Asn Gln Thr Pro Gly Thr Thr
245 250 255
Gly Tyr Thr His Tyr Gln Thr Leu Gln Asp Lys Lys Thr Asp Met Arg
260 265 270
Thr Phe Ile Gln Gln His Thr Thr Thr Val Tyr Asn Ala Phe Lys Lys
275 280 285
Gly Met Pro Pro Leu Glu Ser Asn Lys Asn Ser Ile Asn Ala Tyr Asn
290 295 300
Val Tyr Val Arg Gly Met Val Leu Asn Gly Leu Asp Met Val Ala Thr
305 310 315 320
Trp Pro Ser Met Tyr Pro Asp Asp Tyr Pro Thr Gln Met Ala Leu Glu
325 330 335
Gln Thr Arg Val Ile Phe Ser Asp Met Val Gly Gln Asp Gln Thr Arg
340 345 350
Asp Gly Asn Thr Thr Ile Tyr Asn Ile Phe Asp Ser Thr Ser Asn Phe
355 360 365
Gln His Gly Thr Thr Asp Ile Asn Ser Ile His Tyr Phe Pro Asp Glu
370 375 380
Leu Gln Gln Ala Gln Ile Ala Glu Tyr Ser Pro Ser Arg Gly Asn His
385 390 395 400
Cys Tyr Pro Tyr Gly Ile Ile Leu Asn Tyr Gln His Asn Thr Tyr Arg
405 410 415
Tyr Gly Asp Asn Asp Pro Gly Thr Ser Gly Thr Val Phe Pro Ala Pro
420 425 430
Met Arg Ser Ile Asn Ala Lys Thr Gln Asn Thr Ser Tyr Leu Asn Ser
435 440 445
Glu Asn Leu Phe Thr Asp Leu Gly Ser Ser Thr Asn Cys Tyr Ile Pro
450 455 460
Gly Thr Cys Thr Asn Asn Cys Ser Pro Gly Ser Ser Cys Thr Asn Gly
465 470 475 480
Ser Gly Tyr Gly Glu Ser Cys Asn Val Pro Leu Pro Asn Gln Lys Ile
485 490 495
Asn Ala Leu Tyr Pro Phe Thr Gln Glu His Val Ser Gly Asp Ser Gly
500 505 510
Lys Leu Gly Leu Met Ala Ser Leu Val Pro Tyr Gly Leu Ser Pro Asn
515 520 525
Asn Val Phe Gly Glu Phe Asp Ser Asp Thr Gln Ala Ile Ile Gly Lys
530 535 540
Gly Phe Pro Ala Glu Lys Gly Tyr Ile Gly Asn Gly Ser Pro Val Ser
545 550 555 560
Val Val Arg Glu Trp Val Asn Gly Ala Asn Ala Val Gln Leu Pro Ala
565 570 575
Trp Asp Thr Phe Lys Ile Thr Ala Thr Asn Leu Ala Ala Asp Gln Tyr
580 585 590
His Ile Arg Val Arg Tyr Ala Ser Thr Ala Ala Tyr Pro Thr Asn Ala
595 600 605
Lys Tyr Pro Leu Ser Tyr Tyr Val Leu Ala Gly Asp Thr Ile Leu Gln
610 615 620
Gln Gly Lys Trp Glu Ala Ile Asp Thr Ser Gln Ala Asp Ile Thr Lys
625 630 635 640
Gln Val Tyr Val Thr Gly Gln Gln Gly Asn Tyr Ile Leu Thr Asp Ile
645 650 655
Leu Gly Glu Asn Pro Ile Thr Leu Pro Lys Asp Glu Ile Thr Val Gln
660 665 670
Leu Leu Gln Gly Asn Pro Ala Gly Gly Met Thr Lys Val Leu Ile Asp
675 680 685
Arg Ile Glu Phe Val Pro Ala Val
690 695
<210> 101
<211> 1236
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 101
Met Asn Gln Asn Asp Gln Asn Glu Ile Gln Ile Ile Asp Ser Ser Ser
1 5 10 15
Asn Asp Phe Asn Gln Ser Asn Arg Tyr Pro Arg Tyr Pro Leu Ala Glu
20 25 30
Glu Ser Asn Tyr Lys Asp Trp Leu Ala Asn Cys Lys Glu Ser Asn Leu
35 40 45
Asp Arg Leu Ser Thr Pro Ser Ser Val Gln Asp Ala Val Val Thr Ser
50 55 60
Leu Asn Ile Phe Ser Tyr Ile Phe Gly Phe Leu Asp Phe Gly Ala Thr
65 70 75 80
Ser Ala Gly Leu Gly Ile Leu Gly Ala Leu Phe Gly Val Phe Trp Pro
85 90 95
Ser Ser Asn Asn Gly Ile Ser Glu Asp Leu Leu Arg Ser Ile Glu Ile
100 105 110
Leu Ile Asp Arg Arg Ile Asn Glu Val Glu Arg Asn Arg Ile Thr Val
115 120 125
Gln Phe Glu Gly Leu Arg Ala Val Met Ser Asn Tyr Asn Thr Ala Leu
130 135 140
Arg Asn Trp Asn Ala Asn Arg Asn Asn Pro Ala Leu Gln Ser Glu Val
145 150 155 160
Arg Ser Arg Phe Asp Asn Ala Asp Asp Ala Phe Ala Gly Arg Met Pro
165 170 175
Glu Phe Arg Ile Pro Gly Phe Glu Ile Gln Ser Leu Ser Val Tyr Ala
180 185 190
Gln Ala Ala Thr Leu His Leu Leu Leu Leu Arg Asp Ala Val Val Asn
195 200 205
Gly Ser Leu Trp Gly Phe Asp Gly Glu Thr Ile Glu Ser Tyr Tyr Thr
210 215 220
Lys Leu Val Cys Leu Ile Asp Ala Tyr Ala Asp His Cys Ala Ser Phe
225 230 235 240
Tyr Arg Gln Gly Leu Gln Glu Leu Arg Asp Arg Gly Asn Trp Asn Ala
245 250 255
Phe Asn Asn Tyr Arg Arg Asp Met Thr Ile Thr Val Leu Asp Ile Ile
260 265 270
Ser Leu Phe Ser Asn Tyr Asp Pro Arg Arg Tyr Thr Ile Asn Thr Asn
275 280 285
Thr Gln Leu Thr Arg Glu Val Tyr Thr Glu Pro Val Ala Thr Pro Gly
290 295 300
Trp Leu Asn Leu Asn Ser Asn Pro Asp Gln Phe Gln Gln Ile Glu Asn
305 310 315 320
Asp Leu Ile Arg Pro Leu Arg Pro Ser Ser Thr Leu Ala Ala Leu Ser
325 330 335
Ala Glu Thr Ala Phe Ala Phe Phe Gln Ser Gly Gln Thr Pro Leu Arg
340 345 350
Ala Ile Leu Arg Thr Arg Thr Ser His Phe Asn Ile Ser Gly Gly Phe
355 360 365
Gly Thr Asp Pro Trp Gln Gly Ser Pro Asn Pro Thr Gly Pro Ser Glu
370 375 380
Ser Gln Leu Gln Phe Glu Asn Phe Asp Val Tyr His Val Ser Ser Glu
385 390 395 400
Val Thr Arg Glu Val Ser Ser Glu Asn Ser Gly Leu Phe Gly Pro Gln
405 410 415
Arg Ile Asn Phe Arg Met Val Ser Ile Ser Gly Val Val Ala Ser Arg
420 425 430
Glu Ile Ser Ser Pro Pro Phe Gly Arg Tyr Ile Thr Asn Ile Ser Ser
435 440 445
Ser Ile Pro Gly Ile Arg Ser Ala Asn Pro Thr Ala Ser Asp Tyr Thr
450 455 460
His Arg Leu Ser Ser Ile Arg Ser Thr Ser Leu Arg Thr Met Tyr Arg
465 470 475 480
Asp Arg Thr Asn Ile Ile Ala Tyr Gly Trp Thr His Thr Ser Leu Glu
485 490 495
Leu Thr Asn Arg Leu Leu Pro Asn Arg Ile Thr Gln Ile Pro Ala Val
500 505 510
Lys Ser Ser Ile Thr Pro Leu Pro Ile Val Gly Gly Pro Gly His Thr
515 520 525
Gly Gly Gly Leu Val Ser Leu Ala Gly Tyr Gly Arg Tyr Met Leu Ile
530 535 540
Asn Phe Ile Ser Pro Tyr Ser Pro Ser Arg Gln Arg Tyr Arg Leu Arg
545 550 555 560
Ile Arg Phe Val Lys Asp Phe Asp Asp Ala His Leu Arg Val Ser Ile
565 570 575
Ser Ala Ala Asn Phe Tyr Gln Asn Val Val Leu Pro Gly Ser Arg Thr
580 585 590
Ser Val Asn Pro Asn Leu Ser Phe Arg Asp Phe Arg Tyr Val Asp Val
595 600 605
Pro Gly Glu Phe Glu Leu Val Ala Asn Arg Ser Tyr Ser Ile Asn Leu
610 615 620
Gly Ala Pro Thr Ser Ser Ile Pro Gly Thr Cys Leu Ile Asp Lys Ile
625 630 635 640
Glu Phe Ile Pro Val Asn Ser Ala Ala Leu Glu Tyr Glu Gly Glu Gln
645 650 655
Ser Leu Lys Lys Ala Lys Lys Ala Val Asp Asp Leu Phe Thr Asn Asp
660 665 670
Leu Lys Asn Asp Leu Lys Ile Glu Thr Thr Asp Tyr Asp Val Asp Gln
675 680 685
Ala Ala Asn Leu Val Glu Cys Val Pro Glu Glu Leu Tyr Ala Lys Glu
690 695 700
Lys Met Ile Leu Leu Asp Glu Val Lys His Ala Lys Gln Leu Ser Glu
705 710 715 720
Ser Arg Asn Leu Ile Gln Asn Gly Asn Phe Glu Phe Tyr Thr Asp Lys
725 730 735
Trp Thr Thr Ser Asn Asn Ala Ser Ile Gln Ala Asp Asn Pro Ile Phe
740 745 750
Lys Gly Asn Tyr Leu Asn Met Pro Gly Ala Arg Glu Thr Glu Ala Gly
755 760 765
Ala Thr Thr Phe Pro Thr Tyr Val Phe Gln Lys Ile Asp Glu Ser Lys
770 775 780
Leu Lys Pro Tyr Thr Arg Tyr Lys Ala Arg Gly Phe Val Gly Gly Ser
785 790 795 800
Lys Glu Val Arg Leu Ile Val Ala Arg Tyr Ala Glu Glu Val Asp Ala
805 810 815
Ile Met Asn Val Arg Asn Asp Leu Thr Pro Gly Val Pro Val Ala Ser
820 825 830
Cys Gly Glu Phe Asp Arg Cys His Pro Gln Ala Tyr Pro Ile Leu Gln
835 840 845
Asp Arg Cys His Asp Asp Arg Ile Glu Gln His Ala Asp Gly Gly Ser
850 855 860
His Ser Cys His Gly Lys Ser Arg Glu Lys His Ala Ile Cys His Asp
865 870 875 880
Ser His Gln Phe Asp Phe His Ile Asp Thr Gly Glu Val Tyr Leu Thr
885 890 895
Glu Asn Pro Gly Ile Trp Val Leu Phe Lys Ile Ser Ser Pro Glu Gly
900 905 910
Tyr Ala Thr Leu Asp Asn Ile Glu Leu Ile Glu Glu Gly Pro Leu Val
915 920 925
Gly Glu Ser Leu Ala Leu Val Lys Lys Arg Glu Lys Lys Trp Lys Asn
930 935 940
Glu Met Glu Thr Lys Trp Ile His Thr Lys Glu Ala Tyr Glu Lys Ala
945 950 955 960
Lys Trp Ala Val Asp Ala Leu Phe Thr Thr Pro Gln Asp Thr Ala Leu
965 970 975
Lys Phe Glu Thr Ile Ile Ser Asn Ile Ile Ser Ala Glu His Leu Val
980 985 990
Gln Ser Ile Pro Tyr Val Tyr Asn Lys Trp Leu Ala Asp Val Pro Gly
995 1000 1005
Met Asn Tyr Asp Ile Tyr Thr Glu Leu Lys Arg Arg Ile Thr Gln
1010 1015 1020
Ala Tyr Ser Leu Tyr Glu Arg Arg Asn Ile Ile Lys Asn Gly Asp
1025 1030 1035
Phe His Gln Gly Leu Ala His Trp His Ala Thr Pro His Ala Arg
1040 1045 1050
Val Gln Gln Ile Asp Gly Thr Ala Val Leu Val Ile Pro Asn Trp
1055 1060 1065
Gly Ser Asn Val Ser Gln Asn Leu Cys Val Glu His Asn Arg Gly
1070 1075 1080
Tyr Val Leu Arg Val Thr Ala Lys Lys Glu Asp Met Gly Lys Gly
1085 1090 1095
Tyr Val Thr Ile Ser Asp Cys Ala Lys Asn Thr Glu Thr Leu Thr
1100 1105 1110
Phe Thr Ser Cys Asp Tyr Val Ser Asn Thr Ser Thr Ser Asp His
1115 1120 1125
Pro Arg Thr Cys Asn Ser Cys Asp Asp Tyr Val Ser Asn Glu Ser
1130 1135 1140
Ile Asn Asp Gln Pro Asp Tyr Leu Leu Asn Gln Glu Arg Asn Glu
1145 1150 1155
Ser Arg Cys Tyr Asn Arg Asn Ala Ser Thr Ser Glu Glu Ser Asp
1160 1165 1170
Tyr Leu Leu Asn Gln Lys Arg Asn Glu Gln Trp Ser Asn His Ser
1175 1180 1185
Asp Ala Thr Val Asn Glu Gln Met Asn Tyr Val Thr Arg Thr Ile
1190 1195 1200
Asp Phe Phe Pro Asp Thr Asp Arg Val Arg Ile Asp Ile Gly Glu
1205 1210 1215
Thr Glu Gly Ile Phe Lys Val Glu Ser Val Glu Leu Ile Cys Met
1220 1225 1230
Glu Gly Gln
1235
<210> 102
<211> 645
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 102
Met Asn Gln Asn Asp Gln Asn Glu Ile Gln Ile Ile Asp Ser Ser Ser
1 5 10 15
Asn Asp Phe Asn Gln Ser Asn Arg Tyr Pro Arg Tyr Pro Leu Ala Glu
20 25 30
Glu Ser Asn Tyr Lys Asp Trp Leu Ala Asn Cys Lys Glu Ser Asn Leu
35 40 45
Asp Arg Leu Ser Thr Pro Ser Ser Val Gln Asp Ala Val Val Thr Ser
50 55 60
Leu Asn Ile Phe Ser Tyr Ile Phe Gly Phe Leu Asp Phe Gly Ala Thr
65 70 75 80
Ser Ala Gly Leu Gly Ile Leu Gly Ala Leu Phe Gly Val Phe Trp Pro
85 90 95
Ser Ser Asn Asn Gly Ile Ser Glu Asp Leu Leu Arg Ser Ile Glu Ile
100 105 110
Leu Ile Asp Arg Arg Ile Asn Glu Val Glu Arg Asn Arg Ile Thr Val
115 120 125
Gln Phe Glu Gly Leu Arg Ala Val Met Ser Asn Tyr Asn Thr Ala Leu
130 135 140
Arg Asn Trp Asn Ala Asn Arg Asn Asn Pro Ala Leu Gln Ser Glu Val
145 150 155 160
Arg Ser Arg Phe Asp Asn Ala Asp Asp Ala Phe Ala Gly Arg Met Pro
165 170 175
Glu Phe Arg Ile Pro Gly Phe Glu Ile Gln Ser Leu Ser Val Tyr Ala
180 185 190
Gln Ala Ala Thr Leu His Leu Leu Leu Leu Arg Asp Ala Val Val Asn
195 200 205
Gly Ser Leu Trp Gly Phe Asp Gly Glu Thr Ile Glu Ser Tyr Tyr Thr
210 215 220
Lys Leu Val Cys Leu Ile Asp Ala Tyr Ala Asp His Cys Ala Ser Phe
225 230 235 240
Tyr Arg Gln Gly Leu Gln Glu Leu Arg Asp Arg Gly Asn Trp Asn Ala
245 250 255
Phe Asn Asn Tyr Arg Arg Asp Met Thr Ile Thr Val Leu Asp Ile Ile
260 265 270
Ser Leu Phe Ser Asn Tyr Asp Pro Arg Arg Tyr Thr Ile Asn Thr Asn
275 280 285
Thr Gln Leu Thr Arg Glu Val Tyr Thr Glu Pro Val Ala Thr Pro Gly
290 295 300
Trp Leu Asn Leu Asn Ser Asn Pro Asp Gln Phe Gln Gln Ile Glu Asn
305 310 315 320
Asp Leu Ile Arg Pro Leu Arg Pro Ser Ser Thr Leu Ala Ala Leu Ser
325 330 335
Ala Glu Thr Ala Phe Ala Phe Phe Gln Ser Gly Gln Thr Pro Leu Arg
340 345 350
Ala Ile Leu Arg Thr Arg Thr Ser His Phe Asn Ile Ser Gly Gly Phe
355 360 365
Gly Thr Asp Pro Trp Gln Gly Ser Pro Asn Pro Thr Gly Pro Ser Glu
370 375 380
Ser Gln Leu Gln Phe Glu Asn Phe Asp Val Tyr His Val Ser Ser Glu
385 390 395 400
Val Thr Arg Glu Val Ser Ser Glu Asn Ser Gly Leu Phe Gly Pro Gln
405 410 415
Arg Ile Asn Phe Arg Met Val Ser Ile Ser Gly Val Val Ala Ser Arg
420 425 430
Glu Ile Ser Ser Pro Pro Phe Gly Arg Tyr Ile Thr Asn Ile Ser Ser
435 440 445
Ser Ile Pro Gly Ile Arg Ser Ala Asn Pro Thr Ala Ser Asp Tyr Thr
450 455 460
His Arg Leu Ser Ser Ile Arg Ser Thr Ser Leu Arg Thr Met Tyr Arg
465 470 475 480
Asp Arg Thr Asn Ile Ile Ala Tyr Gly Trp Thr His Thr Ser Leu Glu
485 490 495
Leu Thr Asn Arg Leu Leu Pro Asn Arg Ile Thr Gln Ile Pro Ala Val
500 505 510
Lys Ser Ser Ile Thr Pro Leu Pro Ile Val Gly Gly Pro Gly His Thr
515 520 525
Gly Gly Gly Leu Val Ser Leu Ala Gly Tyr Gly Arg Tyr Met Leu Ile
530 535 540
Asn Phe Ile Ser Pro Tyr Ser Pro Ser Arg Gln Arg Tyr Arg Leu Arg
545 550 555 560
Ile Arg Phe Val Lys Asp Phe Asp Asp Ala His Leu Arg Val Ser Ile
565 570 575
Ser Ala Ala Asn Phe Tyr Gln Asn Val Val Leu Pro Gly Ser Arg Thr
580 585 590
Ser Val Asn Pro Asn Leu Ser Phe Arg Asp Phe Arg Tyr Val Asp Val
595 600 605
Pro Gly Glu Phe Glu Leu Val Ala Asn Arg Ser Tyr Ser Ile Asn Leu
610 615 620
Gly Ala Pro Thr Ser Ser Ile Pro Gly Thr Cys Leu Ile Asp Lys Ile
625 630 635 640
Glu Phe Ile Pro Val
645
<210> 103
<211> 700
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 103
Met Ser Ser Tyr Asn Lys Asn Pro Phe Glu Thr Ile Lys Glu Leu Leu
1 5 10 15
Ser Asn Ala Asn Val Ser Ile Thr Cys Pro Leu His Pro Leu Ala Lys
20 25 30
Glu Pro Thr Ala Val Leu Gln Gly Met Asn Tyr Lys Asp Trp Leu Val
35 40 45
Met Ser Glu Glu Glu Asn Ser Leu Gly Lys Pro Glu Asn Phe Asp Ser
50 55 60
Glu Thr Ile Gln Asn Ala Leu Ile Gly Thr Leu Ala Val Ile Gly Phe
65 70 75 80
Ile Ala Ser Val Leu Ile Thr Pro Ile Thr Gly Gly Ala Ser Val Ala
85 90 95
Ile Gly Ser Ala Leu Leu Leu Glu Thr Ile Pro Tyr Tyr Trp Gly Leu
100 105 110
Ala Glu Ser Glu Asp Pro Thr Ile Gln Glu Lys Ala Met Phe Asp Asp
115 120 125
Ile Met Lys Ala Thr Glu Lys Thr Ile Lys Ser Glu Ile Glu Lys Val
130 135 140
Val Lys Thr Lys Ala Glu Ser Glu Leu Thr Ser Leu Arg Asp Val Phe
145 150 155 160
Lys Tyr Tyr Thr Arg Ala Leu Asn Leu Trp Lys Glu Asn Lys Asp Asn
165 170 175
Gln Asp Ala Arg Lys Glu Val Ser Ser Arg Phe Arg Ala Ala His Val
180 185 190
Ala Phe Ile Gly Ala Met Ser Gln Phe Lys Met Pro Gly Tyr Glu Leu
195 200 205
Val Met Leu Pro Ile Tyr Ala Ala Ala Ala Asn Phe His Leu Met Leu
210 215 220
Leu Gln Asp Gly Met Ile Tyr Glu Lys Glu Trp Asn Glu Ser Asn Asn
225 230 235 240
Leu Thr Glu Asp Phe Tyr Tyr Lys Glu Tyr Gln Asn Trp Thr Ser Gln
245 250 255
Tyr Ile Asp His Cys Thr Ser Trp Tyr Gln Lys Gly Leu Lys Asp Ile
260 265 270
Lys Asp Asn Lys Glu Lys Asn Trp Val Asp Tyr Asn Ser Tyr Arg Asn
275 280 285
Asn Met Thr Ile Leu Val Leu Asp Leu Ile Ala Leu Phe Pro Ser Tyr
290 295 300
Asp Val Arg Gln Tyr Asn Asn Met Gly Val Lys Leu Glu Thr His Thr
305 310 315 320
Arg Thr Leu Tyr Ser Asn Pro Leu Lys Phe Ser Lys Gly Ser Arg Ile
325 330 335
Asp Asp Asp Glu Arg Val Tyr Thr Arg Glu Pro Asn Leu Phe Ser Ser
340 345 350
Leu Ser His Leu Glu Phe His Thr Arg Thr Thr Asn Leu Gly Ser Asp
355 360 365
Gly Ile Glu Phe Leu Ser Gly Ile Glu Lys Lys Tyr Gln Leu Thr Glu
370 375 380
Lys Glu Ser Tyr Arg Thr Lys Phe Glu Gly Lys Pro Thr Asp Ile Gly
385 390 395 400
Lys Lys His Glu Ile Pro Phe Lys Lys Asp Glu Ser Glu Phe Tyr Ser
405 410 415
Leu Tyr Glu Leu Ser Thr Glu Gly Lys Gly Phe Lys Asp Ser Thr Lys
420 425 430
Leu Pro Leu Ile Gln Lys Met Thr Phe Asn Asn Glu Glu Gly Lys Lys
435 440 445
Phe Glu Tyr Ser Val Asp Lys Phe Gly Asn Gly Ala Leu Glu Lys Glu
450 455 460
Ser Phe Ser Ile Thr Asn Pro Asp Asp Leu Leu Ala Asp Gln Lys Ala
465 470 475 480
Arg His Val Leu Ser Asp Ile Ile Phe Val Asp Asp Lys Asn Ile Ser
485 490 495
Pro Glu Gln Ile Gln Thr Arg Asp Tyr Ser Phe Ala Trp Thr Ser Glu
500 505 510
Gln Ile Ser Pro Tyr Asn Arg Ile Thr Asp Gly Thr Lys Asn Lys Asp
515 520 525
Gly Ser Ile Ser Tyr Gln Ile Thr Gln Val Pro Ala Val Lys Ala Tyr
530 535 540
Ser Leu Lys Ser Ser Lys Asp Thr Ser His Ile Asp Val Ile Ser Gly
545 550 555 560
Pro Gly Phe Thr Gly Gly Asp Leu Val Arg Cys Ala Ile Lys Lys Thr
565 570 575
Ala Ser Ser Thr Gly Val Thr Gln Leu Ser Ile Val Phe Pro Ile Thr
580 585 590
Phe Asn His Val Lys Thr Asp Lys Tyr Arg Val Arg Met Asn Tyr Ala
595 600 605
Ala Asp His Thr Lys Leu Ile Thr Leu Val Gly Gly Ser Asn Pro Ile
610 615 620
Ser Gly Thr Ile Glu Asn Thr Phe Asp Ala Lys Asp Thr Gly Lys Ser
625 630 635 640
Leu Lys Tyr Asn Asn Phe Lys Met Met Glu Phe Asn Ile Ala Thr Asn
645 650 655
Phe Lys Asp Glu Glu Lys Gln Lys Ile Ile Thr Leu Lys Leu Thr Tyr
660 665 670
Ala Asp Asp Asp Gln Ala Ile Ala Asp Gly Lys Val Ala Gln Leu Trp
675 680 685
Ile Asp Lys Leu Glu Phe Ile Pro Val Pro Thr Lys
690 695 700
<210> 104
<211> 502
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 104
Met Asn Ser Glu Gln Arg Lys His Gly Gln Asn Asn Glu Tyr Lys His
1 5 10 15
Gln Asn His Gly Val Ser Cys Asn Cys Gly Cys Gln Gln Gly Lys Tyr
20 25 30
Glu Tyr Glu Gln Lys Gln Asp Arg Glu Glu Tyr Asn Asn Ser Tyr Met
35 40 45
Ser Asn Glu Gln Thr Gln Asn His Glu Gly Met Gly Tyr Leu Val Ala
50 55 60
Lys Glu Gly Thr Arg Asn Asp Met Tyr Asn Ser Val Lys Arg Glu Phe
65 70 75 80
Arg Glu His Asp Met Tyr His Glu Asn Lys Asn Tyr Tyr Ser Cys Ser
85 90 95
Pro Arg Gln Phe Asn Thr Leu Asn Leu Pro Asp Glu Ser Lys Arg Phe
100 105 110
Gln Thr Ile Thr His Val Gln Asn Thr Asn Ser Asn Pro Ser Leu Asn
115 120 125
Ala Thr Ser Thr Thr Arg Gly Gln Asn Ile Asp Gly Ser Asn Asn Phe
130 135 140
Cys Arg Ser Ile Ser Leu Asp Phe Gln Leu Ile Asn Gln Asp Leu Asn
145 150 155 160
Thr Thr Gln Asp Thr Phe Tyr Tyr Leu Phe Tyr Leu Leu Asp Ser Gly
165 170 175
Asp Phe Ile Ile Ala Asn Tyr Gly Thr Gly Arg Val Leu Glu Asn Arg
180 185 190
Thr Val Glu Pro Asp Glu Arg Ala Ile Ile Ser Ser Leu Tyr Thr Gly
195 200 205
Ser Val Ser Gln Phe Phe Arg Lys Arg Ser Ser Val Asn Asn Gln Phe
210 215 220
Ile Leu Ser Pro Gln Gln Glu Leu Asn Arg Ala Val Asn Val Cys Asn
225 230 235 240
Asn Thr Ile Asn Leu Ala Thr Lys Ile Thr Ser Gly Phe Asn Ile Pro
245 250 255
Asp Asn Thr Ser Asn Val Phe Arg His Ile Val Ala Ser Asn Arg Pro
260 265 270
Ile Thr Ile Pro Ser Phe Ser Asn Glu Ser Thr Leu Gly Pro Ala Pro
275 280 285
Val Leu Thr Ser Leu Ser Asp Tyr Gly Pro Ser Pro Ala Gln Ala Glu
290 295 300
Arg Ala Val Ile Gly Ser Ala Leu Ile Pro Cys Ile Phe Val Asn Asp
305 310 315 320
Val Leu Pro Leu Glu Arg Arg Ile Lys Glu Ser Pro Tyr Tyr Val Leu
325 330 335
Glu Tyr Arg Gln Tyr Trp His Arg Leu Trp Thr Asp Glu Ile Pro Ser
340 345 350
Gly Asp Arg Arg Ser Phe Gly Glu Ile Thr Gly Ile Leu Pro Asn Ala
355 360 365
Gln Ala Ser Met Arg Asp Met Ile Asp Met Ser Ile Gly Ala Asp Trp
370 375 380
Gly Leu Arg Phe Gly Asp Ser Ser Thr Pro Phe Lys Arg Gly Ile Leu
385 390 395 400
Asn Ser Leu Asn Thr Gln Gly Ser Tyr Ala Asp Val Asp Leu Gly Thr
405 410 415
Gln Thr Gly Ser Asn Gln Leu Thr Asn Phe Asn Ser Phe Ser Val Arg
420 425 430
Tyr Ala Arg Phe Val Lys Ala His Glu Tyr Arg Leu Thr Arg Ser Asn
435 440 445
Gly Thr Val Val Thr Thr Pro Trp Val Ala Leu Asp Tyr Arg Val Pro
450 455 460
Gln Thr Ala Arg Phe Pro Leu Asn Ala Gln Leu Ser Gln Asn Tyr Lys
465 470 475 480
Ile Ile Ser Ser Tyr Asn Ser Tyr Asp Leu Pro Val Leu Glu His Thr
485 490 495
Asp Asn Lys Lys Lys Trp
500
<210> 105
<211> 806
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 105
Met His Gln Thr Asn Thr Ser Lys Asp Lys Asn Arg Met Ala Ser Phe
1 5 10 15
Glu Lys Thr Asn Met Ser Asn Glu Gly Pro Ile Tyr Pro Leu Ala Asn
20 25 30
Ser Ser Asn Thr Gly Leu Gln Gly Met Asn Tyr Asn Asp Ser Val Asn
35 40 45
Met His Ala Thr Lys Asn Glu Asp Cys Leu Leu Ser Ser Arg Val Ser
50 55 60
Val Asp Pro Lys Thr Ala Val Ala Thr Gly Ile Lys Ile Ser Thr Phe
65 70 75 80
Ile Met Ser Ala Leu Gly Ile Pro Leu Ala Ser Gln Ile Gly Gln Leu
85 90 95
Trp Asn Phe Val Leu Asp Gln Leu Trp Pro Asn Gly Asp Asn Gln Trp
100 105 110
Glu Glu Phe Met Lys His Val Glu Glu Leu Ile Asn Gln Lys Ile Thr
115 120 125
Glu Tyr Ala Arg Asp Lys Ala Leu Ala Glu Leu Glu Gly Leu Gly Asn
130 135 140
Val Leu Glu Leu Tyr Gln Glu Ala Ile Glu Asp Trp Lys Lys Asp Pro
145 150 155 160
Thr Asn Val Ala Ser Gln Glu Arg Val Arg Thr Arg Phe Arg Asn Ala
165 170 175
Asp Ala Phe Phe Glu Asn Gly Met Pro Ser Phe Arg Ile Lys Asn Tyr
180 185 190
Glu Val Pro Leu Leu Ser Val Tyr Ala Ser Ala Ala Asn Leu His Leu
195 200 205
Leu Leu Leu Arg Asp Ala Ser Ile Tyr Gly Lys Asp Trp Gly Leu Asn
210 215 220
Glu Thr Asn Val Lys Asp Asn Tyr Asn Arg Gln Leu Lys Arg Thr Glu
225 230 235 240
Ser Tyr Ser Asn His Cys Val Thr Trp Tyr Gln Lys Gly Leu Gln Arg
245 250 255
Leu Lys Gly Ser Asp Ala Asp Ser Trp Leu Lys Phe Asn Ala Phe Arg
260 265 270
Arg Asp Met Thr Phe Thr Val Leu Asp Ile Val Val Leu Phe Pro Cys
275 280 285
Tyr Asp Ile Gln Lys Tyr Pro Met Gly Val Lys Thr Glu Ile Thr Arg
290 295 300
Glu Ile Tyr Thr Asp Pro Ile Gly Asn Leu Pro Arg Arg Pro Gly Phe
305 310 315 320
Gln Val Leu Asp Trp Val Asn His Ala Pro Ser Phe Glu Glu Ile Glu
325 330 335
Lys Glu Thr Thr Gly Asp Pro Ser Met Val Thr Trp Ile Asn Tyr Leu
340 345 350
Glu Ile Ser Arg Asn Lys Leu Gly Gly Trp Asn Ser Ser Asn Asp Tyr
355 360 365
Trp Glu Gly His Ser Val His Tyr Lys Tyr Ser Asn Asp Gly Ile Val
370 375 380
Ile Asp Ser Lys Ala Tyr Ala His Gly Asp Phe Ser Gly Lys Phe Pro
385 390 395 400
Thr Glu Ala Ile His Leu Glu Asn Cys Asp Val Tyr Ala Ser Ser Ser
405 410 415
Leu Pro Val Ala Ala Ser Asn Pro Tyr Gly Asp Lys Ala Ser Phe Gly
420 425 430
Val Thr Lys Val Tyr Phe Asp Met Leu Asn Leu Asn Asp Asn Thr Leu
435 440 445
Gln Arg Gly Ser Trp Asp His Pro Lys Asn Trp Gly Gly Ser Trp Val
450 455 460
Asp Leu Lys Phe Leu Asn Glu Thr Pro Asn Ile Lys Glu Ile Gln Lys
465 470 475 480
Tyr Ser His Lys Leu Thr Tyr Val Ser Ser Phe Ser Val Asp Tyr Gly
485 490 495
Ser Val Leu Cys Tyr Arg Trp Arg His Ser Ser Val Asp Arg Asn Asn
500 505 510
Thr Leu Asp Pro Gln Lys Ile Thr Gln Ile Ser Ala Val Lys Gly His
515 520 525
Thr Pro Ile Asn Cys Glu Val Val Arg Gly Asn Gly Leu Thr Asp Gly
530 535 540
Asp Trp Leu Gln Leu Lys Gly Gly Gly Ser Phe Thr Leu Asn Val Ser
545 550 555 560
Ser Val Ile Pro Lys Thr Tyr Arg Ile Arg Leu Arg Tyr Ala Cys Gly
565 570 575
Pro Lys Asp Val Asn Leu Thr Val Ser Cys Pro Asp Asn Gly Ile Asp
580 585 590
Lys Thr Ile Thr Ile Pro Ser Thr Ser Thr Ala Ser Leu Ala Asn Asn
595 600 605
Leu Met Tyr Lys Asp Phe Lys Tyr Ile Asp Leu Pro Ile Glu Phe Ile
610 615 620
Thr Ser Ala Ala Pro Lys Arg Cys Arg Ile Asn Leu Arg Leu Glu Gly
625 630 635 640
Val Gln Asn Thr Ser Phe Phe Met Asp Lys Phe Glu Phe Ile Pro Glu
645 650 655
Asn Glu Thr Glu Thr Arg Pro Trp Lys Ile Val Thr Ala Leu Asn Asn
660 665 670
Ser Ser Val Leu Ala Phe Ala Lys Asn Ser Leu Tyr Lys Glu Ala Ile
675 680 685
Leu Ser Asn Asp Thr Gly Glu Glu Ser Gln Lys Trp Arg Phe Ile Tyr
690 695 700
Asp Glu Glu Lys Lys Ala Tyr Gln Ile Glu Asp Val Lys Ser Pro Arg
705 710 715 720
Leu Ile Leu Ala Trp Ile Ile Asp Gly Pro Glu Ser Arg Lys Val Trp
725 730 735
Ala Thr Arg Ser Gln Asn Ile Asp Glu His Tyr Trp Ile Leu Glu Glu
740 745 750
Gln Glu Asp Ser Tyr Phe Ile Ile Lys Asn Lys Lys Asn Pro Ser Leu
755 760 765
Val Leu Asp Val Asp Gly Ala Gln Thr Asn Gln Gly Thr Lys Ile Lys
770 775 780
Val Asn Glu Arg His Pro Leu Tyr Ser Ser Arg Thr Asn Ala Gln Lys
785 790 795 800
Phe Lys Leu Glu Arg Val
805
<210> 106
<211> 656
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 106
Met His Gln Thr Asn Thr Ser Lys Asp Lys Asn Arg Met Ala Ser Phe
1 5 10 15
Glu Lys Thr Asn Met Ser Asn Glu Gly Pro Ile Tyr Pro Leu Ala Asn
20 25 30
Ser Ser Asn Thr Gly Leu Gln Gly Met Asn Tyr Asn Asp Ser Val Asn
35 40 45
Met His Ala Thr Lys Asn Glu Asp Cys Leu Leu Ser Ser Arg Val Ser
50 55 60
Val Asp Pro Lys Thr Ala Val Ala Thr Gly Ile Lys Ile Ser Thr Phe
65 70 75 80
Ile Met Ser Ala Leu Gly Ile Pro Leu Ala Ser Gln Ile Gly Gln Leu
85 90 95
Trp Asn Phe Val Leu Asp Gln Leu Trp Pro Asn Gly Asp Asn Gln Trp
100 105 110
Glu Glu Phe Met Lys His Val Glu Glu Leu Ile Asn Gln Lys Ile Thr
115 120 125
Glu Tyr Ala Arg Asp Lys Ala Leu Ala Glu Leu Glu Gly Leu Gly Asn
130 135 140
Val Leu Glu Leu Tyr Gln Glu Ala Ile Glu Asp Trp Lys Lys Asp Pro
145 150 155 160
Thr Asn Val Ala Ser Gln Glu Arg Val Arg Thr Arg Phe Arg Asn Ala
165 170 175
Asp Ala Phe Phe Glu Asn Gly Met Pro Ser Phe Arg Ile Lys Asn Tyr
180 185 190
Glu Val Pro Leu Leu Ser Val Tyr Ala Ser Ala Ala Asn Leu His Leu
195 200 205
Leu Leu Leu Arg Asp Ala Ser Ile Tyr Gly Lys Asp Trp Gly Leu Asn
210 215 220
Glu Thr Asn Val Lys Asp Asn Tyr Asn Arg Gln Leu Lys Arg Thr Glu
225 230 235 240
Ser Tyr Ser Asn His Cys Val Thr Trp Tyr Gln Lys Gly Leu Gln Arg
245 250 255
Leu Lys Gly Ser Asp Ala Asp Ser Trp Leu Lys Phe Asn Ala Phe Arg
260 265 270
Arg Asp Met Thr Phe Thr Val Leu Asp Ile Val Val Leu Phe Pro Cys
275 280 285
Tyr Asp Ile Gln Lys Tyr Pro Met Gly Val Lys Thr Glu Ile Thr Arg
290 295 300
Glu Ile Tyr Thr Asp Pro Ile Gly Asn Leu Pro Arg Arg Pro Gly Phe
305 310 315 320
Gln Val Leu Asp Trp Val Asn His Ala Pro Ser Phe Glu Glu Ile Glu
325 330 335
Lys Glu Thr Thr Gly Asp Pro Ser Met Val Thr Trp Ile Asn Tyr Leu
340 345 350
Glu Ile Ser Arg Asn Lys Leu Gly Gly Trp Asn Ser Ser Asn Asp Tyr
355 360 365
Trp Glu Gly His Ser Val His Tyr Lys Tyr Ser Asn Asp Gly Ile Val
370 375 380
Ile Asp Ser Lys Ala Tyr Ala His Gly Asp Phe Ser Gly Lys Phe Pro
385 390 395 400
Thr Glu Ala Ile His Leu Glu Asn Cys Asp Val Tyr Ala Ser Ser Ser
405 410 415
Leu Pro Val Ala Ala Ser Asn Pro Tyr Gly Asp Lys Ala Ser Phe Gly
420 425 430
Val Thr Lys Val Tyr Phe Asp Met Leu Asn Leu Asn Asp Asn Thr Leu
435 440 445
Gln Arg Gly Ser Trp Asp His Pro Lys Asn Trp Gly Gly Ser Trp Val
450 455 460
Asp Leu Lys Phe Leu Asn Glu Thr Pro Asn Ile Lys Glu Ile Gln Lys
465 470 475 480
Tyr Ser His Lys Leu Thr Tyr Val Ser Ser Phe Ser Val Asp Tyr Gly
485 490 495
Ser Val Leu Cys Tyr Arg Trp Arg His Ser Ser Val Asp Arg Asn Asn
500 505 510
Thr Leu Asp Pro Gln Lys Ile Thr Gln Ile Ser Ala Val Lys Gly His
515 520 525
Thr Pro Ile Asn Cys Glu Val Val Arg Gly Asn Gly Leu Thr Asp Gly
530 535 540
Asp Trp Leu Gln Leu Lys Gly Gly Gly Ser Phe Thr Leu Asn Val Ser
545 550 555 560
Ser Val Ile Pro Lys Thr Tyr Arg Ile Arg Leu Arg Tyr Ala Cys Gly
565 570 575
Pro Lys Asp Val Asn Leu Thr Val Ser Cys Pro Asp Asn Gly Ile Asp
580 585 590
Lys Thr Ile Thr Ile Pro Ser Thr Ser Thr Ala Ser Leu Ala Asn Asn
595 600 605
Leu Met Tyr Lys Asp Phe Lys Tyr Ile Asp Leu Pro Ile Glu Phe Ile
610 615 620
Thr Ser Ala Ala Pro Lys Arg Cys Arg Ile Asn Leu Arg Leu Glu Gly
625 630 635 640
Val Gln Asn Thr Ser Phe Phe Met Asp Lys Phe Glu Phe Ile Pro Glu
645 650 655
<210> 107
<211> 613
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 107
Met Leu Arg Thr Ile Gln Tyr Lys Asn Ala Ser Glu Ile Val Tyr Asp
1 5 10 15
Gln Pro Leu Pro Tyr Gly Gly Val Val Lys Ile Ala Gly Lys Ile Gly
20 25 30
Leu Gly Val Val Lys Thr Val Ile Thr Ser Ile Ile Arg Arg Gly Arg
35 40 45
Asp Asn Glu Ile Ala Gly Arg Ile Leu Ser Asp Val Tyr Ser Val Leu
50 55 60
Trp Ser Asn Arg Lys Gly Tyr Trp Asn Glu Met Ile Glu Ala Val Glu
65 70 75 80
Thr Leu Ile Gln Gln Asp Ile Ser Glu Asn Ile Lys Asn Asn Ala Leu
85 90 95
Ala Ala Leu Thr Asp Ile Arg Asn Ala Leu Leu Leu Tyr Gln Gln Ala
100 105 110
Val Glu Asp Trp Glu Ser Asn Arg Thr Asp Ser Gln Leu Gln Glu Arg
115 120 125
Val Arg Asn Gln Leu Ile Ser Thr Ile Thr Phe Ile Glu Phe Ala Met
130 135 140
Pro Ser Phe Thr Val Gln His Tyr Glu Val Ile Leu Leu Pro Ile Phe
145 150 155 160
Thr Gln Val Ala Asn Leu His Leu Leu Leu Leu Arg Asp Ala Glu Ile
165 170 175
Phe Gly Leu Lys Trp Arg Met Ser Lys Ala Glu Ile Asp Asp Tyr Tyr
180 185 190
Phe Ala Lys Ser Gly Leu Thr Arg Leu Thr Gln Lys Tyr Thr Asn His
195 200 205
Ser Val Lys Trp Tyr Arg Glu Gly Leu Cys Ile Ala Thr Asn Ile Asp
210 215 220
Leu Asp Gln Cys Pro Glu Phe Tyr Gln Leu Asp Lys Trp Asn Ala Met
225 230 235 240
Asn Asp Phe Arg Arg Glu Met Thr Phe Met Val Leu Asp Ile Ile Ala
245 250 255
Leu Trp Pro Thr Tyr Asp Pro Ile Arg Tyr Pro Leu Gly Ile Lys Thr
260 265 270
Glu Leu Thr Arg Glu Val Phe Thr Pro Leu Leu Gly Ile Asn Pro Asn
275 280 285
Ser Ser Trp Leu Ile Arg Thr Met Glu Glu Ile Glu Ala Lys Leu Thr
290 295 300
Val Leu Ser Pro Phe Leu Ser Trp Ile Ser Phe Glu Gln Leu Val Lys
305 310 315 320
Gln Gly Asp Gly Ile Ser Thr Phe Thr Asp Trp Gly Asn Phe Thr Leu
325 330 335
Ser Asn Thr Met Leu Pro Leu Ser Tyr Ile Leu Gly Gly Ala Gly Pro
340 345 350
Gly Thr Gly Asp Ser Thr Asn Ile Pro Met Gln Ser Glu Asn Tyr Asp
355 360 365
Val Tyr Lys Val Leu Val Gly Thr Asp Tyr Ser His Pro Ser Asn Val
370 375 380
Pro Ile Arg Lys Leu Glu Tyr Tyr Cys Thr Asn Gly Met Met Glu Asn
385 390 395 400
Val Ile Thr Val Gly Thr Gly Thr Thr Asn Ala Leu Phe Glu Leu Pro
405 410 415
Asn Asn Gly Cys Val Asp Tyr Ser His Arg Val Ser Arg Leu Ser Cys
420 425 430
Ser Asn Val Glu Val Tyr Glu Trp Glu Gly Gly Pro Lys Tyr Ala Leu
435 440 445
Lys Asn Ile Ala Tyr Gly Trp Thr His Ile Ser Val Asp Ser Lys Asn
450 455 460
Thr Leu Ser His Asn Ala Ile Thr Gln Ile Pro Ala Arg Lys Gly Tyr
465 470 475 480
Ser Ser Ser Glu Ser Asn Leu Ser Ile Glu Gly Pro Tyr Phe Thr Gly
485 490 495
Gly Asp Leu Ile Ala Leu Pro Pro Asn Gly Ala Gln Leu Gln Met Arg
500 505 510
Val Ser Pro Pro Val Ser Ser Ser Ser Ile Asn Tyr Cys Val Arg Leu
515 520 525
Arg Tyr Ala Ser Ser Gly Asn Thr Asn Ile Tyr Val Glu Arg Val Leu
530 535 540
Ser Ser Gly Asp Thr Tyr Gly Glu Thr His Asp Val Pro Ala Thr Tyr
545 550 555 560
Ser Gly Gly Ser Leu Ser Tyr Ser Ser Phe Ala Tyr Val Val Asn Leu
565 570 575
Thr Ala Ile Phe Glu Gly Phe Asn Val Glu Ile Lys Ile Lys Asn Ile
580 585 590
Gly Ser Ser Gln Ile Ile Leu Asp Lys Ile Glu Phe Leu Pro Ile Lys
595 600 605
Glu Ser Leu Lys Glu
610
<210> 108
<211> 375
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 108
Met Ser Asn Glu Ser Lys Asn Asn Glu Asn Met Asn Leu Pro Ile Ile
1 5 10 15
Asn Asp Glu Asp Ser Ile Pro Ser Glu Ile Arg Asp Ser Arg Ser Lys
20 25 30
Ile Thr Phe Pro Asp Phe Asn Ile Tyr Lys Ile Gly Thr Phe Cys Gly
35 40 45
Lys Tyr Val Asp Ile Pro Gly Gly Ala Asn Glu Asp Ser Ser Ala Ile
50 55 60
Gln Phe Gln Thr Gln Asp Gly Asp Asn Gln Lys Phe Leu Ile Phe Thr
65 70 75 80
Leu Asp Asp Ser Tyr Ser Ile Ile Ala Ala Arg His Ser Gly Lys Val
85 90 95
Met Asp Ala Tyr Tyr Asn Ser Ser Gln Asn Arg Ile Ile Gln Phe Asp
100 105 110
Phe His Asn Thr Asn Asn Gln Lys Phe Phe Leu Ser Asp Asn Gly Thr
115 120 125
Ile Ala Ser Lys Gln Asp Arg Gln Val Trp Asp Val Gln Gly Glu Ser
130 135 140
Thr Gln Asn Gly Ala Arg Ile Val Val Phe Lys Phe Ile Asp Val Arg
145 150 155 160
Asn Gln Lys Phe Thr Leu Asn Lys Leu Gly Ser Val Pro Val His Gln
165 170 175
Pro Thr Leu Ser Pro Leu Pro Ser Ala Pro Asp Phe Arg Thr Asn Asp
180 185 190
Ile Asn Glu Gln Leu Pro Asp Gln Thr Asn Pro Val Asn Thr His Phe
195 200 205
Thr Tyr Leu Pro Tyr Phe Met Val Lys Asp Pro Leu Tyr Asn Ala Gln
210 215 220
Gln Gln Ile Lys Asn Ser Pro Tyr Tyr Thr Leu Val Arg Arg Gln Tyr
225 230 235 240
Trp Glu Lys Lys Thr Gln Arg Ile Leu Ala Pro Ser Asp Thr Tyr Glu
245 250 255
Tyr Ser Glu Thr Ile Gly Val Ser Arg Thr Asp Gln Ser Ser Met Thr
260 265 270
Asp Ile Thr Glu Ile Ser Ile Gly Val Asp Leu Gly Phe Val Phe Lys
275 280 285
Gly Phe Ser Ala Gly Leu Ser Thr Asn Val Thr Arg Thr Leu Ser Val
290 295 300
Thr Lys Ser Thr Ser Asn Thr Glu Ser Ser Glu Ser Thr Arg Lys Leu
305 310 315 320
Ser Tyr Lys Asn Glu Phe Arg His Thr Ile Ala Tyr Ala Lys Tyr Met
325 330 335
Leu Ile Asn Glu Tyr Tyr Val Thr Arg Ala Asn Gly Glu Lys Ile Thr
340 345 350
Thr Gly Asp Ala Thr Tyr Trp Arg Val Pro Asn Pro Glu Gln Thr Val
355 360 365
Ala Arg Ile Ile Pro Arg Ser
370 375
<210> 109
<211> 641
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 109
Met Asn Lys Asn Asn Asn Glu Ile Thr Glu Val Pro Cys Ser Glu Cys
1 5 10 15
Gly Asp Ile Asp Tyr Arg Asp Ile Met Asn Met Ser Thr Gln Gly Glu
20 25 30
Tyr Val Ala Gln Gln Ser Val Val Leu Thr Ala Met Asn Thr Ser Phe
35 40 45
Gln Val Ile Arg Thr Leu Tyr Gln Ala Asn Lys Gly Thr Leu Ser Lys
50 55 60
Ala Gly Gly Val Ile Lys Ser Ile Phe Thr Tyr Leu Trp Arg Gln Lys
65 70 75 80
Asn Ser Gln Glu Glu Trp Asp Asn Phe Met Lys Ala Val Glu Ile Leu
85 90 95
Ile Ala Glu Glu Leu Ser Thr Tyr Ala Arg Asn Asp Ala Ile Ala Ser
100 105 110
Val Arg Gly Leu Glu Asn Val Leu Asn Glu Tyr Gln Glu Ala Leu Asp
115 120 125
Asp Leu Ala Leu Asp Pro Thr Asn Ser Ala Leu Lys Asp Glu Val Lys
130 135 140
Arg Trp Val Thr Thr Val His Gly Gln Phe Glu Ala Thr Met Pro Thr
145 150 155 160
Leu Ala Val Gly Gly Tyr Glu Val Gln Gln Leu Val Ala Tyr Ala Glu
165 170 175
Ala Ala Asn Leu His Leu Ala Phe Leu Arg Asp Val Ala Lys Phe Gly
180 185 190
Tyr Gln Trp Asp Leu Asp Lys Thr Thr Val Ala Asn Tyr Tyr Lys Asp
195 200 205
Leu Lys Glu Asn Thr Gln Ile Tyr Thr Asp His Cys Val Arg Thr Tyr
210 215 220
Asn Thr Gly Leu Glu Lys Thr Lys Ser Leu Met Gly Ala Ile Asn Pro
225 230 235 240
Lys Asp Tyr Asn Lys Tyr Pro Tyr Leu Asn Pro Tyr Ala Asn Gly Ser
245 250 255
Thr Asn Phe Tyr Lys Lys Val Leu Gln Trp Asn Val Trp Asn Asp Phe
260 265 270
Arg Arg Asp Met Thr Ile Met Val Leu Asp Leu Val Ala Leu Trp Pro
275 280 285
Thr Phe Asp Pro Glu Val Tyr Thr Asn Pro Glu Gly Val Asp Leu Glu
290 295 300
Leu Ser Arg Glu Val Tyr Ser Thr Ala Tyr Gly Arg Tyr Gly Ser Ser
305 310 315 320
Thr His Gly Gly Asp Trp Lys Ser Trp Glu Val Met Glu Thr Ala Val
325 330 335
Asp Arg Ser Pro His Leu Val Ser Phe Leu Thr Asn Leu Ala Ile Tyr
340 345 350
Gln Lys Thr Tyr Ser Ser Ser Ser Thr Asn Thr Lys Leu Asp Gln Tyr
355 360 365
Asp Gly Val Ile Asn Thr Leu Lys Thr Val Gly Ser Thr Ser Thr Phe
370 375 380
Glu Asp Gly Phe Ala Pro Ile Ser Lys Glu Ala Tyr Arg Ser Val Lys
385 390 395 400
Asn Ile Pro Gly Glu Tyr Ile Asn Gly Val Asp Leu Arg Leu Gly Met
405 410 415
Val Pro Cys Ser Leu Thr Phe Lys Thr Tyr Ser Ser Gly Thr Phe Phe
420 425 430
Ala Gly Gln Cys Tyr Ser His Leu Ala Gln Ser Thr Phe Tyr Asn Leu
435 440 445
Ser Ala Thr Ile Ala Tyr His Arg Leu Ser Tyr Val Asn Ala Ile Asp
450 455 460
Asp Asn Phe Ser Gly Tyr Tyr Ser Gly Trp Gly Ile Gly Thr Trp Gly
465 470 475 480
Met Gly Trp Leu His Glu Asn Leu Lys Thr Leu Asn Ile Ile His Ala
485 490 495
Thr Lys Ser Ser Cys Ile Pro Ala Val Lys Ala Arg Ile Leu Thr Asn
500 505 510
Ser Ala Thr Val Ile Lys Gly Pro Gly Ser Thr Gly Gly Asp Leu Val
515 520 525
Lys Leu Pro Gly Val Pro Ser Thr Ser Asp Ile Gln Val Arg Met Asn
530 535 540
Met Thr Arg Glu Val Trp Lys Asn Tyr Arg Ile Arg Ile Arg Tyr Ala
545 550 555 560
Thr Ser Ser Ser Ala Gln Leu Phe Val Gly Lys Trp Thr Gly Arg Trp
565 570 575
Ala Ala Thr Ala Asn Ile Asn Leu Ala Ala Thr Tyr Ser Gly Glu Leu
580 585 590
Thr Tyr Ser Ala Phe Lys Leu Ala Asp Val Pro Phe Asn Ile Thr Thr
595 600 605
Gly Glu Pro Glu Phe Ser Phe Glu Leu Arg Asn Asn Ser Gly Gly Pro
610 615 620
Ile Leu Ile Asp Arg Ile Glu Phe Ile Pro Leu Glu Gly Thr Phe Ala
625 630 635 640
Glu
<210> 110
<211> 635
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 110
Met Asn Lys Asn Asn Asn Glu Ile Thr Glu Val Pro Cys Ser Glu Cys
1 5 10 15
Gly Asp Ile Asp Tyr Arg Asp Ile Met Asn Met Ser Thr Gln Gly Glu
20 25 30
Tyr Val Ala Gln Gln Ser Val Val Leu Thr Ala Met Asn Thr Ser Phe
35 40 45
Gln Val Ile Arg Thr Leu Tyr Gln Ala Asn Lys Gly Thr Leu Ser Lys
50 55 60
Ala Gly Gly Val Ile Lys Ser Ile Phe Thr Tyr Leu Trp Arg Gln Lys
65 70 75 80
Asn Ser Gln Glu Glu Trp Asp Asn Phe Met Lys Ala Val Glu Ile Leu
85 90 95
Ile Ala Glu Glu Leu Ser Thr Tyr Ala Arg Asn Asp Ala Ile Ala Ser
100 105 110
Val Arg Gly Leu Glu Asn Val Leu Asn Glu Tyr Gln Glu Ala Leu Asp
115 120 125
Asp Leu Ala Leu Asp Pro Thr Asn Ser Ala Leu Lys Asp Glu Val Lys
130 135 140
Arg Trp Val Thr Thr Val His Gly Gln Phe Glu Ala Thr Met Pro Thr
145 150 155 160
Leu Ala Val Gly Gly Tyr Glu Val Gln Gln Leu Val Ala Tyr Ala Glu
165 170 175
Ala Ala Asn Leu His Leu Ala Phe Leu Arg Asp Val Ala Lys Phe Gly
180 185 190
Tyr Gln Trp Asp Leu Asp Lys Thr Thr Val Ala Asn Tyr Tyr Lys Asp
195 200 205
Leu Lys Glu Asn Thr Gln Ile Tyr Thr Asp His Cys Val Arg Thr Tyr
210 215 220
Asn Thr Gly Leu Glu Lys Thr Lys Ser Leu Met Gly Ala Ile Asn Pro
225 230 235 240
Lys Asp Tyr Asn Lys Tyr Pro Tyr Leu Asn Pro Tyr Ala Asn Gly Ser
245 250 255
Thr Asn Phe Tyr Lys Lys Val Leu Gln Trp Asn Val Trp Asn Asp Phe
260 265 270
Arg Arg Asp Met Thr Ile Met Val Leu Asp Leu Val Ala Leu Trp Pro
275 280 285
Thr Phe Asp Pro Glu Val Tyr Thr Asn Pro Glu Gly Val Asp Leu Glu
290 295 300
Leu Ser Arg Glu Val Tyr Ser Thr Ala Tyr Gly Arg Tyr Gly Ser Ser
305 310 315 320
Thr His Gly Gly Asp Trp Lys Ser Trp Glu Val Met Glu Thr Ala Val
325 330 335
Asp Arg Ser Pro His Leu Val Ser Phe Leu Thr Asn Leu Ala Ile Tyr
340 345 350
Gln Lys Thr Tyr Ser Ser Ser Ser Thr Asn Thr Lys Leu Asp Gln Tyr
355 360 365
Asp Gly Val Ile Asn Thr Leu Lys Thr Val Gly Ser Thr Ser Thr Phe
370 375 380
Glu Asp Gly Phe Ala Pro Ile Ser Lys Glu Ala Tyr Arg Ser Val Lys
385 390 395 400
Asn Ile Pro Gly Glu Tyr Ile Asn Gly Val Asp Leu Arg Leu Gly Met
405 410 415
Val Pro Cys Ser Leu Thr Phe Lys Thr Tyr Ser Ser Gly Thr Phe Phe
420 425 430
Ala Gly Gln Cys Tyr Ser His Leu Ala Gln Ser Thr Phe Tyr Asn Leu
435 440 445
Ser Ala Thr Ile Ala Tyr His Arg Leu Ser Tyr Val Asn Ala Ile Asp
450 455 460
Asp Asn Phe Ser Gly Tyr Tyr Ser Gly Trp Gly Ile Gly Thr Trp Gly
465 470 475 480
Met Gly Trp Leu His Glu Asn Leu Lys Thr Leu Asn Ile Ile His Ala
485 490 495
Thr Lys Ser Ser Cys Ile Pro Ala Val Lys Ala Arg Ile Leu Thr Asn
500 505 510
Ser Ala Thr Val Ile Lys Gly Pro Gly Ser Thr Gly Gly Asp Leu Val
515 520 525
Lys Leu Pro Gly Val Pro Ser Thr Ser Asp Ile Gln Val Arg Met Asn
530 535 540
Met Thr Arg Glu Val Trp Lys Asn Tyr Arg Ile Arg Ile Arg Tyr Ala
545 550 555 560
Thr Ser Ser Ser Ala Gln Leu Phe Val Gly Lys Trp Thr Gly Arg Trp
565 570 575
Ala Ala Thr Ala Asn Ile Asn Leu Ala Ala Thr Tyr Ser Gly Glu Leu
580 585 590
Thr Tyr Ser Ala Phe Lys Leu Ala Asp Val Pro Phe Asn Ile Thr Thr
595 600 605
Gly Glu Pro Glu Phe Ser Phe Glu Leu Arg Asn Asn Ser Gly Gly Pro
610 615 620
Ile Leu Ile Asp Arg Ile Glu Phe Ile Pro Leu
625 630 635
<210> 111
<211> 847
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 111
Met Ala Gln Leu Gln Glu Leu Gln Ile Gln Pro Val Ile Pro Tyr Asn
1 5 10 15
Val Leu Ala Ser Pro Pro Met Gly Asn Val Asp Asp Leu Pro Thr Leu
20 25 30
Ala Glu Glu Leu Lys Gln Ala Trp Glu Ser Phe Gln Lys Thr Gly Asn
35 40 45
Leu Asn Phe Thr Ala Phe Gln Gln Gly Leu Ala Ala Ala Gly Gly Gly
50 55 60
Ser Phe Asn Tyr Leu Ala Leu Leu Gln Ala Ala Ile Gly Leu Ala Gly
65 70 75 80
Thr Val Gly Ala Glu Ile Pro Gly Val Ala Ile Ala Ala Pro Leu Val
85 90 95
Ser Ile Leu Leu Gly Phe Leu Trp Pro Asn Lys Gln Lys Ser Asp Ile
100 105 110
Lys Gln Leu Ile Thr Val Ile Asp Ala Glu Val Lys Arg Ile Leu Asn
115 120 125
Gln Glu Leu Thr Asp Tyr His Ser Gln Glu Val Gln Gly Tyr Leu Glu
130 135 140
Gly Phe Phe Asp Thr Met Thr Asn Pro Ala Thr Ser Pro Asp Ile Lys
145 150 155 160
Ile Asn Glu Ser Ile Phe Thr Gly Met Pro Gly Asp Pro Asn Arg Thr
165 170 175
Pro Lys Asp Val Asp Ala Thr Ala Tyr Asp Ala Val Val Asp Arg Phe
180 185 190
Leu Thr Ala Asn Val Ser Phe Ile Ile Asp Leu Asp Gln Phe Leu Thr
195 200 205
Gly Lys Phe Gly Thr Asn Asn Asp Val Asn Phe Asp Val Ala Ser Leu
210 215 220
Pro Tyr Tyr Val Ile Gly Ala Thr Leu Gln Leu Met Ser Tyr His Ser
225 230 235 240
Val Ile Asn Phe Met Thr Ala Trp Phe Pro Lys Ile Trp Pro Gln Tyr
245 250 255
Thr Thr Glu Asp Ser Arg Tyr Lys Asp Ile Leu Asn Ala Lys Gln Ala
260 265 270
Met Arg Met Ala Ile Arg Asp Asn Thr Asn Lys Val Leu Thr Ile Val
275 280 285
Gln Ala Asn Leu Pro Ser Leu Gly Ser Thr Arg Asn Ser Leu Asn Asp
290 295 300
Tyr Asn Arg Tyr Ala Arg Thr Met Gln Leu Thr Cys Leu Asp Thr Val
305 310 315 320
Ala Gln Trp Pro Thr Leu Tyr Pro Asp Asp Tyr Pro Val Ser Thr Thr
325 330 335
Leu Glu Gln Thr Arg Arg Ile Phe Leu Asp Thr Ala Gly Ile Asp Glu
340 345 350
Arg Lys Asp Ser Asn Gly Lys Tyr Thr Asn Asp Ser Thr Ile Thr Ala
355 360 365
Leu Tyr Asn Ile Leu Asp Gly Asn Ser Tyr Asn Ser His Asn Asn Val
370 375 380
Gly Ile Asn Gly Ile Asn Ser Leu Leu Tyr Ser Gln Asp Glu Leu Lys
385 390 395 400
Ser Ile Thr Tyr Arg Met Thr Tyr Thr Asn Asn Asn Asp Tyr Gly Gln
405 410 415
Tyr Pro Cys Phe Pro Tyr Gly Val Val Leu Gly Tyr Thr Asn Asn Gln
420 425 430
Tyr Pro Ser Asn Pro Ala Tyr Gly Asn Gly Gly Asp Pro Asn Asn Gly
435 440 445
Ser Tyr Ile Asp Ser Pro Asn Thr Ser Ala Pro Phe His Thr Val Asp
450 455 460
Ala Ala Thr Gln Asn Thr Met Tyr Ile Asp Ala Gln Asn Met Phe Thr
465 470 475 480
Asp Ser Asn Pro Thr Gly Cys Asn Ile Leu Asn Tyr Gly Gly Pro Asn
485 490 495
Gly Gly Lys Ser Asn Asn Pro Thr Leu Ala Thr Gln Lys Ile Asp Thr
500 505 510
Leu Phe Pro Phe Thr Ile Asn Asn Pro Pro Gly Ser Thr Lys Asn Gly
515 520 525
Leu Gly Arg Leu Gly Val Met Ala Ser Leu Val Pro Tyr Asn Leu Ser
530 535 540
Pro Asn Asn Val Phe Gly Glu Phe Asp Ser Asp Thr Gln Ala Ile Ile
545 550 555 560
Ala Lys Gly Phe Pro Ala Glu Lys Gly Tyr Ile Asp Asn Gly Ser Pro
565 570 575
Val Ser Val Val Lys Glu Trp Val Asn Gly Ala Asn Ala Val Gln Leu
580 585 590
Pro Ala Trp Asn Thr Phe Lys Ile Thr Ala Thr Asn Leu Ala Ala Gly
595 600 605
Gln Tyr Arg Ile Arg Val Arg Tyr Ala Asn Pro Gly Pro Asp Leu Leu
610 615 620
Leu His Gln Tyr Val Tyr Ala Gly Asp Asn Glu Val Gln Gly Gly Ala
625 630 635 640
Trp Thr Phe Lys Ser Thr Thr Asp Ser Asn Val Asn Thr Asn Phe Pro
645 650 655
Asn Gln Val Tyr Val Thr Gly Gln Gln Gly Asn Tyr Val Leu Glu Asp
660 665 670
Ile Thr Trp Pro Met Gly Gly Gly Pro Ser Asp Pro Leu Thr Leu Pro
675 680 685
Ala Gly Asp Val Thr Val Gln Leu Phe Leu Gly Asp Phe Ser Gln Gln
690 695 700
Gly Gln Met Thr Gln Val Phe Ile Asp Arg Ile Glu Phe Val Pro Val
705 710 715 720
Gly Ala Thr Phe Pro Ser Thr Ile Pro Ile Ser Val Asn Ala Gln Tyr
725 730 735
Asn Gln Gly Ser Val Leu Leu Trp Gln Ala Pro Ser Ser Ser Tyr Phe
740 745 750
Ile Tyr Asn Phe Asp Ile Thr Gly Thr Leu Tyr Gly Ser Gln Phe Thr
755 760 765
Ser Val Phe Phe Asp Leu Glu Asn Pro Gln Gly Ser Ser Gly Ile Val
770 775 780
Pro Gly Ile Asn Gln Ser Ile Thr Leu Asn Pro Asn Gly Thr Asp Ile
785 790 795 800
Ser Tyr Lys Asn Leu Thr Ala Asn Leu Asn Ser His Gly Gly Phe Asn
805 810 815
Leu Met Arg Met Glu Gly Ala Gly Ser Glu Asp Phe Gly Ser Asn Ile
820 825 830
Thr Gly Asn Leu Thr Ile Thr Ile His Lys Asp Ser Thr Asn Ser
835 840 845
<210> 112
<211> 720
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 112
Met Ala Gln Leu Gln Glu Leu Gln Ile Gln Pro Val Ile Pro Tyr Asn
1 5 10 15
Val Leu Ala Ser Pro Pro Met Gly Asn Val Asp Asp Leu Pro Thr Leu
20 25 30
Ala Glu Glu Leu Lys Gln Ala Trp Glu Ser Phe Gln Lys Thr Gly Asn
35 40 45
Leu Asn Phe Thr Ala Phe Gln Gln Gly Leu Ala Ala Ala Gly Gly Gly
50 55 60
Ser Phe Asn Tyr Leu Ala Leu Leu Gln Ala Ala Ile Gly Leu Ala Gly
65 70 75 80
Thr Val Gly Ala Glu Ile Pro Gly Val Ala Ile Ala Ala Pro Leu Val
85 90 95
Ser Ile Leu Leu Gly Phe Leu Trp Pro Asn Lys Gln Lys Ser Asp Ile
100 105 110
Lys Gln Leu Ile Thr Val Ile Asp Ala Glu Val Lys Arg Ile Leu Asn
115 120 125
Gln Glu Leu Thr Asp Tyr His Ser Gln Glu Val Gln Gly Tyr Leu Glu
130 135 140
Gly Phe Phe Asp Thr Met Thr Asn Pro Ala Thr Ser Pro Asp Ile Lys
145 150 155 160
Ile Asn Glu Ser Ile Phe Thr Gly Met Pro Gly Asp Pro Asn Arg Thr
165 170 175
Pro Lys Asp Val Asp Ala Thr Ala Tyr Asp Ala Val Val Asp Arg Phe
180 185 190
Leu Thr Ala Asn Val Ser Phe Ile Ile Asp Leu Asp Gln Phe Leu Thr
195 200 205
Gly Lys Phe Gly Thr Asn Asn Asp Val Asn Phe Asp Val Ala Ser Leu
210 215 220
Pro Tyr Tyr Val Ile Gly Ala Thr Leu Gln Leu Met Ser Tyr His Ser
225 230 235 240
Val Ile Asn Phe Met Thr Ala Trp Phe Pro Lys Ile Trp Pro Gln Tyr
245 250 255
Thr Thr Glu Asp Ser Arg Tyr Lys Asp Ile Leu Asn Ala Lys Gln Ala
260 265 270
Met Arg Met Ala Ile Arg Asp Asn Thr Asn Lys Val Leu Thr Ile Val
275 280 285
Gln Ala Asn Leu Pro Ser Leu Gly Ser Thr Arg Asn Ser Leu Asn Asp
290 295 300
Tyr Asn Arg Tyr Ala Arg Thr Met Gln Leu Thr Cys Leu Asp Thr Val
305 310 315 320
Ala Gln Trp Pro Thr Leu Tyr Pro Asp Asp Tyr Pro Val Ser Thr Thr
325 330 335
Leu Glu Gln Thr Arg Arg Ile Phe Leu Asp Thr Ala Gly Ile Asp Glu
340 345 350
Arg Lys Asp Ser Asn Gly Lys Tyr Thr Asn Asp Ser Thr Ile Thr Ala
355 360 365
Leu Tyr Asn Ile Leu Asp Gly Asn Ser Tyr Asn Ser His Asn Asn Val
370 375 380
Gly Ile Asn Gly Ile Asn Ser Leu Leu Tyr Ser Gln Asp Glu Leu Lys
385 390 395 400
Ser Ile Thr Tyr Arg Met Thr Tyr Thr Asn Asn Asn Asp Tyr Gly Gln
405 410 415
Tyr Pro Cys Phe Pro Tyr Gly Val Val Leu Gly Tyr Thr Asn Asn Gln
420 425 430
Tyr Pro Ser Asn Pro Ala Tyr Gly Asn Gly Gly Asp Pro Asn Asn Gly
435 440 445
Ser Tyr Ile Asp Ser Pro Asn Thr Ser Ala Pro Phe His Thr Val Asp
450 455 460
Ala Ala Thr Gln Asn Thr Met Tyr Ile Asp Ala Gln Asn Met Phe Thr
465 470 475 480
Asp Ser Asn Pro Thr Gly Cys Asn Ile Leu Asn Tyr Gly Gly Pro Asn
485 490 495
Gly Gly Lys Ser Asn Asn Pro Thr Leu Ala Thr Gln Lys Ile Asp Thr
500 505 510
Leu Phe Pro Phe Thr Ile Asn Asn Pro Pro Gly Ser Thr Lys Asn Gly
515 520 525
Leu Gly Arg Leu Gly Val Met Ala Ser Leu Val Pro Tyr Asn Leu Ser
530 535 540
Pro Asn Asn Val Phe Gly Glu Phe Asp Ser Asp Thr Gln Ala Ile Ile
545 550 555 560
Ala Lys Gly Phe Pro Ala Glu Lys Gly Tyr Ile Asp Asn Gly Ser Pro
565 570 575
Val Ser Val Val Lys Glu Trp Val Asn Gly Ala Asn Ala Val Gln Leu
580 585 590
Pro Ala Trp Asn Thr Phe Lys Ile Thr Ala Thr Asn Leu Ala Ala Gly
595 600 605
Gln Tyr Arg Ile Arg Val Arg Tyr Ala Asn Pro Gly Pro Asp Leu Leu
610 615 620
Leu His Gln Tyr Val Tyr Ala Gly Asp Asn Glu Val Gln Gly Gly Ala
625 630 635 640
Trp Thr Phe Lys Ser Thr Thr Asp Ser Asn Val Asn Thr Asn Phe Pro
645 650 655
Asn Gln Val Tyr Val Thr Gly Gln Gln Gly Asn Tyr Val Leu Glu Asp
660 665 670
Ile Thr Trp Pro Met Gly Gly Gly Pro Ser Asp Pro Leu Thr Leu Pro
675 680 685
Ala Gly Asp Val Thr Val Gln Leu Phe Leu Gly Asp Phe Ser Gln Gln
690 695 700
Gly Gln Met Thr Gln Val Phe Ile Asp Arg Ile Glu Phe Val Pro Val
705 710 715 720
<210> 113
<211> 960
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 113
Met Gln Met Val Thr Lys Ala Met Thr Pro Lys Leu Gly Ala Leu Pro
1 5 10 15
Asp Phe Ile Asp Asp Phe Asn Gly Ile Phe Gly Phe Met Gly Asn Ile
20 25 30
Thr Asp Val Met Ser Thr Ile Phe Gly Val Asp Thr Gly Asp Ser Ser
35 40 45
Ile Asp Asp Val Leu Asn Asn Gln Glu Leu Leu Gln Glu Met Gln Ala
50 55 60
Gln Met Gln Gln Ile Gln Glu Ser Ile Lys Asp Met Thr Asp Lys Glu
65 70 75 80
Ile Ile Thr Gln Ser Ile Glu Glu Gln Ile Leu Ala Leu Thr Lys Asp
85 90 95
Leu Ser Thr Ser Ile Thr Thr Glu Phe Glu Lys Ile Gly Asn Ile Leu
100 105 110
Thr Thr Tyr Leu Gln Ala Met Ser Gly Met Leu Lys Asp Ile Tyr Ser
115 120 125
Gln Thr Ser Val Ile Asp Gln Lys Val Asp Lys Leu Leu Ala Met Met
130 135 140
Thr Phe Ala Leu Lys Glu Leu Asp Tyr Ile Lys Asp Asn Val Val Leu
145 150 155 160
Asn Ser Ser Ile Val Glu Ile Thr Pro His Val Gln Lys Leu Val Tyr
165 170 175
Val Asn Lys Lys Phe Leu Ser Leu Thr Arg Gly Phe Leu Gln Gly Glu
180 185 190
Asp Leu Ser Ile Asp Ser Met Gln Glu Ile Gln Glu Trp Ala Lys Ser
195 200 205
Ile Leu Ala Thr Glu Met Asn Ser Phe Glu Phe Ser Val Asp Thr Leu
210 215 220
His Ser Ile Ile Ile Gly Asp Asn Leu Tyr Lys Arg Ser Ala Leu Lys
225 230 235 240
Thr Phe Ser Asp Val Leu Leu Asp Asp Ala Asp Gln Tyr Gly Asn Phe
245 250 255
Gly Thr Pro Leu Ala Lys Phe Tyr Thr Phe Phe Ser Ser Leu Ala Thr
260 265 270
Leu Gln Ile Asn Ala Tyr Leu Cys Leu Thr Phe Ala Arg Lys Val Leu
275 280 285
Gly Leu Ser Glu Ile Asp Tyr Gln Leu Ile Met Gln Asp Arg Ile Glu
290 295 300
Gln Gln Asn Gln Leu Phe Val Asn Leu Ile Gln Asp Lys Asn Tyr Ser
305 310 315 320
Asn Val Leu Glu Ile Lys Gly Val Tyr Pro Met Pro His Asn Asn Glu
325 330 335
Asp Gly Asn Ser Phe Ser Leu Gln Ala Lys Lys Gly Tyr Ala Leu Ile
340 345 350
Gly Leu Glu Phe Phe Met Asp Asn Gly Ile Tyr Lys Ala Lys Ala Tyr
355 360 365
Gln Gly Lys Ile Gly Lys Asn Phe Ser Val Tyr Ala Asp Thr Val Glu
370 375 380
Glu Ile Ile Ser Asp Asp Leu Ser Lys Val Phe Leu Asn Asn Thr Lys
385 390 395 400
Asp Phe Glu Gln Ser Tyr Lys Tyr Pro Leu Phe Gly Glu Leu Lys Gly
405 410 415
Glu Pro Asn Thr Leu Ile Thr Arg Ile Gly Phe Gly Thr Lys Tyr Asp
420 425 430
Glu Ser Lys Glu Arg Gln Ala Val Ala Tyr Ile Asp Ala Asp Phe Ser
435 440 445
Pro Tyr Glu Pro Lys Ser Gly Ser Ile Ser Thr Glu Gly Thr Gln Thr
450 455 460
Phe Gln Ile Glu Glu Thr Lys Asn Tyr Thr Tyr Cys Tyr Asp Ala Trp
465 470 475 480
Pro Ile Gly Ile Ile Gly Asp Leu Tyr Met Thr Pro Leu Lys Ser Leu
485 490 495
Ser Leu His Val Asp Gly Asp Ser Arg Lys Asn Leu Tyr Met Ser Gly
500 505 510
Glu Ser Tyr Phe Ser Thr Ile Leu Ser Arg Glu Tyr Asn Thr Asn Phe
515 520 525
Ile Leu Phe Pro Tyr Thr Asn Asn Ser Ser Pro Ile Val Glu Asn Leu
530 535 540
Ile Gln Asn Gly Asp Phe Glu Asp Gly Asp Lys Tyr Trp Glu Val Ser
545 550 555 560
Gly Asp Thr Ala Val Ile Ala Lys Gly Glu Gly Ile Tyr Gly Ser Asn
565 570 575
Ala Ile Ser Ile Lys Asn Thr Gly Asp Ala Phe Glu Pro Ala Leu Lys
580 585 590
Gln Glu Leu Asn Leu Lys Pro Tyr Thr Lys Tyr Lys Leu Thr Ala Tyr
595 600 605
Val Lys Ser Lys Thr Asn Asp Ser Gln Ala Gly Leu Ile Ala Ile Lys
610 615 620
Tyr Thr Asn Tyr Met Ile Ala Phe Ile Ser Lys Thr Phe Ser Thr Ser
625 630 635 640
Tyr Lys Gln Ile Glu Leu Lys Phe Arg Thr Gly Ala Asp Thr Gln Asn
645 650 655
Phe Tyr Val Thr Phe Glu Lys Ser Asn Thr Gly Tyr Leu Leu Leu Asp
660 665 670
Asn Ile Lys Leu His Glu Ile Pro Gln Thr Asp Asn Leu Ile Asp Cys
675 680 685
Gly Asp Phe Gly Gly Tyr Asp Tyr Thr Thr Lys Ile Asp Cys Gln Tyr
690 695 700
Tyr Glu Pro Tyr Leu Trp Glu Leu Asp Gly Gly Gly Ser Ile Ser Asn
705 710 715 720
Gly Phe Glu Glu Gly Leu Phe Gly Thr Asp Cys Leu Lys Ile Ile Lys
725 730 735
Ser Gly Gly Ala Asn Gln Lys Val Gln Leu Lys Ala Asn Thr Asn Tyr
740 745 750
Ile Leu Thr Ala Tyr Val Lys Val Asp Asp Pro Thr Thr Thr Ala His
755 760 765
Ile Gly Cys Gly Ser Asn Gln Val Thr Cys Asn Ser Thr Ser Tyr Thr
770 775 780
Leu Val Lys Val Lys Phe Lys Thr Gly Asp Asp Pro Ser Thr Thr Glu
785 790 795 800
Ser Ser Val Tyr Cys Ser Asn Pro Asn Asp Ser Gly Thr Ile Trp Ala
805 810 815
Asp Asn Phe Val Leu Cys Glu Val Pro Asn Leu Ile Val Asn Gly Asp
820 825 830
Phe Glu Gln Met Asp Leu Ser Ser Trp Ser Leu Ser Pro Ser Glu Arg
835 840 845
Gly Thr Ile Tyr Ile Gly Ile Gly Lys Gly Ile Ser Asn Ser Asn Ala
850 855 860
Ile Val Leu Gln Asp His Asn Gly Lys Ile Ser Gln Lys Leu Pro Leu
865 870 875 880
Lys Pro Ile Thr Lys Tyr Arg Leu Thr Ala Tyr Val Ser Val Thr Gly
885 890 895
Gly Gly Thr Ala Gln Ile Gly Tyr Gly Asp Asp Ser Ala Ser Cys Thr
900 905 910
Ser Asn Lys Phe Gln Gln Ile Ser Thr Asp Phe Thr Thr Gly Ala Asp
915 920 925
Pro Leu Gln Ser Asp Asp Val Ile Tyr Leu Ser Thr Asp Gly Cys Thr
930 935 940
Tyr Thr Ile Ala Asp Asn Phe Glu Leu Tyr Glu Leu Asp Gln Ile Glu
945 950 955 960
<210> 114
<211> 959
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 114
Met Asn Asn Thr Ile Val Pro Tyr Asn Val Leu Arg Asp Asn Asp Met
1 5 10 15
Ser Asn Ile Ser Gly Thr Ser Trp Asp Lys Asp Gln Ile Ser Lys Gly
20 25 30
Met Glu Asn Ser Ser Ile Leu Leu Glu Leu Ile Glu Lys Gly Leu Asn
35 40 45
Asp Gly Asn Asp Ile Leu Ser Leu Leu Gly Phe Ile Gly Met Lys Ala
50 55 60
Ile Glu Ala Ile Pro Val Val Gly Gly Thr Ile Ser Ser Leu Ile Ser
65 70 75 80
Leu Ile Leu Phe Pro Leu Lys Ser Lys Val Asp Tyr Gln Glu Ile Trp
85 90 95
Asn Gln Leu Lys Lys Ser Ile Glu Lys Met Val Asp Gln Lys Ile Glu
100 105 110
Glu Ala Met Met Ser Gln Leu Met Gln Glu Ile Ala Gly Leu Ala Ala
115 120 125
Ile Leu Glu Gln Tyr Arg Ala Ala Tyr Asp Leu Tyr Asn Gly Lys Lys
130 135 140
Val Phe Asn Ile Pro Asp Gly Met Thr Pro Gly Asp His Leu Asn Thr
145 150 155 160
Val Phe Val Ser Ala Asn Met Gln Phe Ile Gln Arg Met Lys Ile Phe
165 170 175
Gln Asn Pro Lys Tyr Lys Val Asp Leu Leu Pro Phe Phe Val His Ala
180 185 190
Ala Glu Met His Ile Leu Leu Val Arg Asp Ala Ala Ile Tyr Gly Leu
195 200 205
Glu Trp Gly Met Asp Glu Ala Val Asn Gln Tyr Tyr Lys Met Glu Leu
210 215 220
Lys Arg Leu Ile Asn Glu Tyr Ser Lys Tyr Val Leu Asp Thr Tyr Gln
225 230 235 240
Lys Gly Leu Lys Glu Val Thr Glu Arg Glu Leu Glu Asp Asn Asp Phe
245 250 255
Pro Thr Thr Trp Gln Lys Asp Asn Tyr Lys Asn Thr Val Arg Trp Asn
260 265 270
Val Ile Asn Lys Tyr Lys Arg Gly Met Ser Leu Thr Val Phe Asp Phe
275 280 285
Ala Tyr Lys Trp Lys Tyr Tyr His Glu Ser Tyr Gln Lys Asn Leu Met
290 295 300
Leu Asn Pro Thr Arg Thr Ile Tyr Ser Asp Ile Glu Gly Ser Val Tyr
305 310 315 320
Pro Tyr Thr Lys Glu Thr Ser Glu Ile Asp Asn Asp Ile Asn Phe Thr
325 330 335
Asn Leu Glu Tyr Arg Gly Ile Leu Lys Glu Val Gln Val Asn Asn Ala
340 345 350
Asp Arg Ile Asp Ser Leu Gln Ser Ile Phe Ile Arg Glu Asn Gln Lys
355 360 365
Phe Glu Asn Arg Lys Thr Gly Gly Ser Gly Gly Arg Gly Thr Phe Val
370 375 380
Asn Ile Glu Ser Pro Lys Asn Asn Pro Leu Thr Arg Val Glu Thr Trp
385 390 395 400
Ser Glu Leu Val Pro Phe Ala Leu Lys Phe Gly Phe Tyr Asn Gly Glu
405 410 415
Glu Thr Arg Leu Met Gly Gln Lys Thr Tyr Gly Lys Lys Tyr Thr Ile
420 425 430
Tyr Gln Tyr Ser Gly Asn Lys Val Val Ser Ile Met Gly Phe Gly Leu
435 440 445
Asn Ala Thr Ser Gly Phe Asp Ser Leu Asp Ala Met Val Val Gly Phe
450 455 460
Lys Gln Asp Asp Tyr Ile Pro Glu Asn Lys Ile Val Pro Ile Asn Thr
465 470 475 480
Asn Gly Glu Pro Leu Ile Gln Val Val Glu Val Gly Asn Phe Tyr Glu
485 490 495
Gly Lys Phe Glu Ser Asn Leu Lys Met Ile Glu Glu Pro Met Phe Gly
500 505 510
Asp Gly Val Leu Gln Phe Glu Asn His Ser Asn Asn Leu Asn Gln Asp
515 520 525
Asn Tyr Val Thr Tyr Gln Ile His Ala Glu Ile Glu Gly Thr Tyr Glu
530 535 540
Leu Asn Ala Ile Ile Gly Ala Asn Lys Gln Lys Asp Arg Ile Ala Phe
545 550 555 560
Lys Met Ser Leu Asn Gly Glu Gln Pro Glu Asn Phe Ile Thr Glu Ser
565 570 575
Phe Asp Asp Gly Asp Ile Trp Glu Gly Met Ser Leu Asn Glu Glu Leu
580 585 590
Val Tyr Lys Lys Asn Ser Leu Gly Asn Phe Gln Leu Asn Lys Gly Val
595 600 605
Asn Asn Ile Thr Ile Tyr Asn Gly Ala Leu Gln Ala Ser Ala Asn Ile
610 615 620
Lys Ile Trp Asn Leu Ala Thr Ile Glu Leu Thr Ile Asn Ala Asp Ser
625 630 635 640
Leu Lys Asp Pro Asp Ile Thr Thr Leu Tyr Asp Gln Asp Asn Tyr Thr
645 650 655
Gly Thr Lys Lys Leu Ile Phe Glu Asp Thr Asn Arg Leu Glu Asp Phe
660 665 670
Asn Asp Lys Ala Ser Ser Ile Lys Ala Glu Ser His Ile Ala Gly Ile
675 680 685
Arg Phe Tyr Gln Asn Tyr Asp Tyr Thr Gly Asp Phe Ile Asp Leu Val
690 695 700
Gly Gly Glu Lys Ile Ser Leu Lys Asn His Leu Phe Asn Asn Arg Ala
705 710 715 720
Ser Ser Val Lys Phe Ala Asn Ile Val Leu Tyr Asn Lys Asp Asn Tyr
725 730 735
Glu Gly Ser Arg Lys Phe Val Phe Glu Asp Ile Pro Glu Leu Thr Asp
740 745 750
Phe Asn Asp Gln Thr Ser Ser Ile Val Ile Ser Ser Asn Val Ser Gly
755 760 765
Ala Arg Leu Tyr Glu His Ala Asn Tyr Glu Gly Asn Tyr Val Asp Val
770 775 780
Val Gly Gly Gln Arg Leu Ser Leu Lys Asn His Val Leu Asn Lys Glu
785 790 795 800
Ile Thr Ser Ile Lys Phe Phe Lys Gly Asp Asp Glu Ile Leu Asn Gly
805 810 815
Ile Tyr Gln Ile Val Pro Ala Ile Asn Asn Thr Ser Val Ile Val Asn
820 825 830
Leu Glu Ser Ser Ala Phe Val Trp Leu Trp Gly Lys Asp Ser Glu Phe
835 840 845
Ala His Gln Trp Arg Val Glu Tyr Asp Glu Ser Glu Leu Ala Tyr Gln
850 855 860
Ile Lys Asn Met Ser Asn Glu Asn Ile Val Leu Ala Ala Met Ile Val
865 870 875 880
Thr Glu Pro Ser Tyr Ala His Gly Ile Pro Asn Met Lys Asn Ser Leu
885 890 895
Gln Tyr Trp Ile Phe Glu Tyr Val Gly Asn Gly Tyr Tyr Ile Ile Lys
900 905 910
Leu Lys Ala Asn Pro Lys Leu Val Leu Asp Val Asn Gly Gly Asn Pro
915 920 925
Asn Asp Gly Thr Ile Ile Lys Val Asn Tyr Ser His Asp Leu Asn Ser
930 935 940
Pro Asn Ile Asn Ala Gln Lys Phe Arg Phe Asn Asn Met Asn Asn
945 950 955
<210> 115
<211> 1391
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 115
Met Asn Gln Tyr Tyr Asn Asn Asn Glu Tyr Glu Ile Leu Asp Asn Gly
1 5 10 15
Gly Arg Gly Tyr Gln Pro Arg Tyr Pro Leu Ala Gln Ala Pro Gly Ser
20 25 30
Glu Phe Gln Gln Met Asn Tyr Lys Asp Trp Met Asp Arg Tyr Thr Gly
35 40 45
Glu Glu Gln Ala Gly Gly Leu Ile Arg Ala Glu Ile Asp Ala Asn Thr
50 55 60
Ala Leu Thr Ala Thr Phe Gly Val Ala Trp Ala Val Leu Gly Val Ser
65 70 75 80
Asn Pro Val Gly Ser Ala Ile Ala Gly Ile Leu Asn Val Val Thr Pro
85 90 95
Ile Ile Phe Asn Gln Val Asp Pro Asn Ser Pro Leu Lys Val Trp Glu
100 105 110
Ser Met Ile Gly Tyr Ala Gln Ala Leu Ile Lys Lys Glu Leu Thr Glu
115 120 125
Thr Val Arg Asn Leu Ala Leu Asp His Ile Asp Arg Ile Asn Asp Tyr
130 135 140
Gln Ile Asp Tyr Lys Asn Lys Ala Arg Ile Trp Glu Gly Asn Pro Thr
145 150 155 160
Pro Gly Asn Ala Ser Gln Leu Leu Asp Ala Phe Lys Asn Leu Lys Lys
165 170 175
Ser Cys Gln Asp Ala Met Pro His Leu Asp Thr Arg Gly Tyr Glu Thr
180 185 190
Ile Leu Leu Pro Leu Tyr Ala Gln Ala Ala Asn Ile His Leu Ile Val
195 200 205
Leu Arg Asp Gly Leu Met His Gly Arg Ser Trp Gly Met Thr Asn Glu
210 215 220
Glu Tyr Glu Asp Leu Tyr Ser Gly Phe Phe Gly Phe Lys Asn Arg Ile
225 230 235 240
Ala Thr Tyr Thr Asn Tyr Cys Thr Asn Thr Phe Asn Gln Gly Ala Thr
245 250 255
Thr Asn Tyr Thr Ala Asp Met Glu Asp Cys Ala Lys Tyr Pro Trp Val
260 265 270
Arg Tyr Asn Gln Asp Glu Phe Tyr Ser Gly Phe Phe Gly Pro Glu Asn
275 280 285
Ser Cys Arg Gln Ser Gln Thr Thr Asn Ala Tyr Pro Gln Pro Lys Ser
290 295 300
Gly Phe Asn Gln Pro Leu Asn Leu Arg Asn Ser Arg Gln Ser Pro Gly
305 310 315 320
Glu Tyr Arg Asp Val Glu Ala Trp Asn Leu Arg Asn Glu Phe Ile Ser
325 330 335
Ser Met Thr Ile Gln Val Leu Asp Thr Val Ala Leu Trp Pro Thr Tyr
340 345 350
Asp Pro Arg Val Tyr Thr Ser Ala Val Lys Thr Glu Phe Thr Arg Glu
355 360 365
Ile Tyr Thr Ser Ile Arg Gly Thr Thr Tyr Arg Ser Asp Pro Ala Gln
370 375 380
Asn Thr Met Ser Ala Ile Glu Ala Arg Met Ile Arg Pro Pro His Leu
385 390 395 400
Phe Glu Trp Pro Gln Thr Met Thr Phe Phe Phe Glu Asp Val Asn Val
405 410 415
Arg Tyr Thr Trp Val Gly Asn Ser Trp Thr Lys Gly Gln Ala Leu Ile
420 425 430
Gly Leu Lys Thr Glu Ser Ala Arg Thr Leu Asp Thr Asn Met Ile Thr
435 440 445
Ala Leu Gln Gly Leu Thr Asp Glu Tyr Glu Tyr Tyr His Ile Pro Leu
450 455 460
Asp Val Ser Thr Arg Gln Lys Asp Ile Thr Asn Ile Arg Thr Lys Gln
465 470 475 480
Trp Phe Glu Pro Arg Glu Phe Ile Phe Tyr Arg Ser Gly Gly Gln Gln
485 490 495
Val Leu Ala Leu Gly Thr Ile Glu Glu Asp Ile Pro Gly Tyr Ser Val
500 505 510
Tyr Leu Val Asn Asp Tyr Ile Tyr Thr Pro Ser Ile Arg Gln Asn Thr
515 520 525
Phe Pro Pro Ile Glu Val Pro Glu Gly Thr Pro Pro Pro Ser His Arg
530 535 540
Leu Ser Trp Val Lys Phe Glu Pro Val Arg Asp Asn Ala Thr Thr Phe
545 550 555 560
Val Asp Pro Lys Gln Ile Gly Ala Thr Ile Phe Gly Trp Thr His Thr
565 570 575
Ser Val Asp Pro Asn Asn Thr Ile Asp Ala Thr Lys Ile Thr Gln Ile
580 585 590
Pro Ala Val Lys Ala Ser Gly Gly Thr Asp Tyr Gln Val Ile Lys Gly
595 600 605
Pro Gly Ser Thr Gly Gly Asp Leu Val Ser Leu Pro Thr Tyr Ala Lys
610 615 620
Ile Glu Ile Pro Leu Thr Ser Ser Ala Asp Gln Leu Tyr Glu Val Arg
625 630 635 640
Ile Arg Tyr Ala Ala Ala Glu Gln Lys Arg Ile Arg Ile Gly Lys Lys
645 650 655
Ser Arg Asp Phe Gln Trp Arg Tyr Ile Asp Tyr Asp Val Pro Ser Thr
660 665 670
Pro Tyr Ser Gly Gly Asn Leu Thr Tyr Asn Ala Phe Ser Tyr Lys Glu
675 680 685
Leu Gly Thr Val Gln Gly Val Leu Glu Leu Ser Ile Glu Arg Ile Asp
690 695 700
Pro Phe Asp Glu Pro Ile Ile Ile Asp Lys Ile Glu Phe Ile Pro Ile
705 710 715 720
Gln Gly Ser Val Glu Thr Tyr Glu Ala Asp Gln Asp Leu Glu Lys Ala
725 730 735
Arg Lys Ala Val Asn Ala Leu Phe Thr Ser Asp Ala Lys Asn Ala Leu
740 745 750
Gln Leu Glu Val Thr Asp Tyr Leu Val Asp Gln Ala Ala Lys Leu Val
755 760 765
Glu Cys Met Ser Asp Glu Ile Tyr Pro Gln Glu Lys Met Cys Leu Leu
770 775 780
Asp Gln Val Lys Val Ala Lys Arg Leu Ser Gln Ala Arg Asn Leu Leu
785 790 795 800
His His Gly Asp Phe Glu Ser Pro Asp Trp Phe Gly Glu Asn Gly Trp
805 810 815
Lys Thr Ser Asn His Val Ser Val Thr Ser Gly Asn Pro Ile Phe Lys
820 825 830
Gly Arg Tyr Leu Asn Met Pro Gly Ala Asp Asn Pro Gln Leu Ser Asp
835 840 845
Thr Val Phe Pro Thr Tyr Ala Tyr Gln Lys Ile Asp Glu Ser Lys Leu
850 855 860
Lys Pro Tyr Thr Arg Tyr Met Ile Arg Gly Phe Val Gly Asn Ser Lys
865 870 875 880
Asp Leu Glu Val Phe Ile Thr Arg Tyr Asp Lys Glu Val His Lys Asn
885 890 895
Met Asn Val Pro His Asp Ile Leu Pro Thr Asp Pro Cys Thr Gly Thr
900 905 910
Tyr Pro Leu Gly Glu Gly Pro Met Leu Thr Asn His Thr Ile Pro Gln
915 920 925
Asp Met Ser Cys Asp Pro Cys Asp Ala Gly Thr Val Met Lys Val Gln
930 935 940
Gln Thr Leu Val Lys Cys Glu Ala Pro His Ala Phe Thr Phe His Ile
945 950 955 960
Asp Thr Gly Glu Leu Asn Arg Asp Gln Asn Leu Gly Ile Trp Val Gly
965 970 975
Phe Lys Ile Gly Thr Thr Asp Gly Arg Ala Thr Phe Asp Asn Leu Glu
980 985 990
Val Ile Glu Ala Asn Pro Leu Thr Gly Glu Ala Leu Ala Arg Val Lys
995 1000 1005
Lys Arg Glu His Lys Trp Lys Gln Lys Trp Met Glu Lys Arg Thr
1010 1015 1020
Lys Ile Asp Lys Ala Val Gln Ile Ala Gln Gly Ala Ile Gln Ala
1025 1030 1035
Leu Phe Thr Asp Ser Asn Gln Asn Arg Leu Lys Pro Asp Ile Thr
1040 1045 1050
Leu Asn His Ile Leu Gln Val Glu Thr Glu Val Gln Lys Ile Pro
1055 1060 1065
Tyr Val Tyr Asn Ala Phe Leu Gln Gly Ala Leu Pro Pro Val Pro
1070 1075 1080
Gly Glu Thr Tyr Asp Ile Phe Gln Gln Leu Ser Ser Ala Val Ala
1085 1090 1095
Ile Ala Arg Ser Leu Tyr Glu Gln Arg Asn Val Leu Arg Asn Gly
1100 1105 1110
Asp Phe Met Ala Gly Leu Ser Asn Trp Arg Gly Ala Lys Gly Ala
1115 1120 1125
Ile Val Gln Lys Ile Gly Asn Ala Ser Val Leu Val Ile Ser Asp
1130 1135 1140
Trp Ser Ala Asn Leu Ser Gln Asp Val Pro Val Asn Pro Gly His
1145 1150 1155
Gly Tyr Ile Leu Arg Val Thr Ala Lys Lys Glu Gly Ser Gly Glu
1160 1165 1170
Gly Tyr Val Thr Ile Ser Asp Gly Thr Glu Asp Asn Thr Glu Thr
1175 1180 1185
Leu Lys Phe Thr Val Gly Glu Val Ala Thr Arg Leu Ala Gln Ser
1190 1195 1200
Asp Met His Ser Pro Met Gln Gly Arg Tyr Gln Glu Arg Asn Met
1205 1210 1215
Thr Asn Ala Pro Ser Glu Ala Tyr Gly Thr Asn Gly Tyr Thr Ser
1220 1225 1230
His Thr Met Thr Asn Tyr Pro Ser Asp Asn Asp Gly Thr Asn Ala
1235 1240 1245
Tyr Pro Gly Asn His Asn Arg Asn Tyr Gln Ser Glu Ser Phe Gly
1250 1255 1260
Ile Thr Pro Tyr Gly Asp Glu Thr Ser Met Met Asn Gly Pro Ser
1265 1270 1275
Asn Lys Tyr Glu Met Asn Ala Tyr Ala Gly Ser Thr Tyr Met Thr
1280 1285 1290
Asn Asn Gly Val Gly Cys Ser Cys Gly Cys Ser Thr Asn Ala Tyr
1295 1300 1305
Ala Gly Glu Asn Met Met Arg Asn Asp Ser Ser Asn Glu Asn Gly
1310 1315 1320
Val Gly Tyr Gly Cys Gly Cys Arg Thr His Pro Asn Asn Arg Thr
1325 1330 1335
Asp Ser Tyr Pro Met Thr Ala His Gly Ser Ser Leu Ser Gly Tyr
1340 1345 1350
Val Thr Lys Thr Phe Glu Ile Phe Pro Glu Thr Asn Arg Val Cys
1355 1360 1365
Ile Glu Ile Gly Glu Thr Ser Gly Thr Phe Lys Val Glu Ser Ile
1370 1375 1380
Glu Leu Ile Arg Met Asp Cys Glu
1385 1390
<210> 116
<211> 720
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 116
Met Asn Gln Tyr Tyr Asn Asn Asn Glu Tyr Glu Ile Leu Asp Asn Gly
1 5 10 15
Gly Arg Gly Tyr Gln Pro Arg Tyr Pro Leu Ala Gln Ala Pro Gly Ser
20 25 30
Glu Phe Gln Gln Met Asn Tyr Lys Asp Trp Met Asp Arg Tyr Thr Gly
35 40 45
Glu Glu Gln Ala Gly Gly Leu Ile Arg Ala Glu Ile Asp Ala Asn Thr
50 55 60
Ala Leu Thr Ala Thr Phe Gly Val Ala Trp Ala Val Leu Gly Val Ser
65 70 75 80
Asn Pro Val Gly Ser Ala Ile Ala Gly Ile Leu Asn Val Val Thr Pro
85 90 95
Ile Ile Phe Asn Gln Val Asp Pro Asn Ser Pro Leu Lys Val Trp Glu
100 105 110
Ser Met Ile Gly Tyr Ala Gln Ala Leu Ile Lys Lys Glu Leu Thr Glu
115 120 125
Thr Val Arg Asn Leu Ala Leu Asp His Ile Asp Arg Ile Asn Asp Tyr
130 135 140
Gln Ile Asp Tyr Lys Asn Lys Ala Arg Ile Trp Glu Gly Asn Pro Thr
145 150 155 160
Pro Gly Asn Ala Ser Gln Leu Leu Asp Ala Phe Lys Asn Leu Lys Lys
165 170 175
Ser Cys Gln Asp Ala Met Pro His Leu Asp Thr Arg Gly Tyr Glu Thr
180 185 190
Ile Leu Leu Pro Leu Tyr Ala Gln Ala Ala Asn Ile His Leu Ile Val
195 200 205
Leu Arg Asp Gly Leu Met His Gly Arg Ser Trp Gly Met Thr Asn Glu
210 215 220
Glu Tyr Glu Asp Leu Tyr Ser Gly Phe Phe Gly Phe Lys Asn Arg Ile
225 230 235 240
Ala Thr Tyr Thr Asn Tyr Cys Thr Asn Thr Phe Asn Gln Gly Ala Thr
245 250 255
Thr Asn Tyr Thr Ala Asp Met Glu Asp Cys Ala Lys Tyr Pro Trp Val
260 265 270
Arg Tyr Asn Gln Asp Glu Phe Tyr Ser Gly Phe Phe Gly Pro Glu Asn
275 280 285
Ser Cys Arg Gln Ser Gln Thr Thr Asn Ala Tyr Pro Gln Pro Lys Ser
290 295 300
Gly Phe Asn Gln Pro Leu Asn Leu Arg Asn Ser Arg Gln Ser Pro Gly
305 310 315 320
Glu Tyr Arg Asp Val Glu Ala Trp Asn Leu Arg Asn Glu Phe Ile Ser
325 330 335
Ser Met Thr Ile Gln Val Leu Asp Thr Val Ala Leu Trp Pro Thr Tyr
340 345 350
Asp Pro Arg Val Tyr Thr Ser Ala Val Lys Thr Glu Phe Thr Arg Glu
355 360 365
Ile Tyr Thr Ser Ile Arg Gly Thr Thr Tyr Arg Ser Asp Pro Ala Gln
370 375 380
Asn Thr Met Ser Ala Ile Glu Ala Arg Met Ile Arg Pro Pro His Leu
385 390 395 400
Phe Glu Trp Pro Gln Thr Met Thr Phe Phe Phe Glu Asp Val Asn Val
405 410 415
Arg Tyr Thr Trp Val Gly Asn Ser Trp Thr Lys Gly Gln Ala Leu Ile
420 425 430
Gly Leu Lys Thr Glu Ser Ala Arg Thr Leu Asp Thr Asn Met Ile Thr
435 440 445
Ala Leu Gln Gly Leu Thr Asp Glu Tyr Glu Tyr Tyr His Ile Pro Leu
450 455 460
Asp Val Ser Thr Arg Gln Lys Asp Ile Thr Asn Ile Arg Thr Lys Gln
465 470 475 480
Trp Phe Glu Pro Arg Glu Phe Ile Phe Tyr Arg Ser Gly Gly Gln Gln
485 490 495
Val Leu Ala Leu Gly Thr Ile Glu Glu Asp Ile Pro Gly Tyr Ser Val
500 505 510
Tyr Leu Val Asn Asp Tyr Ile Tyr Thr Pro Ser Ile Arg Gln Asn Thr
515 520 525
Phe Pro Pro Ile Glu Val Pro Glu Gly Thr Pro Pro Pro Ser His Arg
530 535 540
Leu Ser Trp Val Lys Phe Glu Pro Val Arg Asp Asn Ala Thr Thr Phe
545 550 555 560
Val Asp Pro Lys Gln Ile Gly Ala Thr Ile Phe Gly Trp Thr His Thr
565 570 575
Ser Val Asp Pro Asn Asn Thr Ile Asp Ala Thr Lys Ile Thr Gln Ile
580 585 590
Pro Ala Val Lys Ala Ser Gly Gly Thr Asp Tyr Gln Val Ile Lys Gly
595 600 605
Pro Gly Ser Thr Gly Gly Asp Leu Val Ser Leu Pro Thr Tyr Ala Lys
610 615 620
Ile Glu Ile Pro Leu Thr Ser Ser Ala Asp Gln Leu Tyr Glu Val Arg
625 630 635 640
Ile Arg Tyr Ala Ala Ala Glu Gln Lys Arg Ile Arg Ile Gly Lys Lys
645 650 655
Ser Arg Asp Phe Gln Trp Arg Tyr Ile Asp Tyr Asp Val Pro Ser Thr
660 665 670
Pro Tyr Ser Gly Gly Asn Leu Thr Tyr Asn Ala Phe Ser Tyr Lys Glu
675 680 685
Leu Gly Thr Val Gln Gly Val Leu Glu Leu Ser Ile Glu Arg Ile Asp
690 695 700
Pro Phe Asp Glu Pro Ile Ile Ile Asp Lys Ile Glu Phe Ile Pro Ile
705 710 715 720
<210> 117
<211> 864
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 117
Met Pro Asn Glu Met Asn Ser Lys Asn Asn Met Asn Thr Thr Arg Ile
1 5 10 15
Asp Asp Lys Asp Leu Leu Asp Ser Lys Gly Arg Glu Cys Gln Pro Arg
20 25 30
Tyr Pro Ser Ala Glu Ala Pro Asp Val Met Asn Pro Ile Glu Lys Ile
35 40 45
Tyr Thr Arg Gly Gln Ser Ala Asn Ile Ser Asn Ala Thr Ser Thr Thr
50 55 60
Ile Asp Val Thr Ser Gln Ile Leu Arg Gly Ser Lys Lys Leu Ala Gly
65 70 75 80
Leu Ile Ile Lys Val Leu Ile Lys Ile Leu Trp Pro Lys Gly Thr Gln
85 90 95
Gln Glu Trp Glu Asn Phe Met Asp Ala Val Glu Gln Leu Ile His Glu
100 105 110
Lys Leu Asp Thr Tyr Ala Arg Asn Lys Ala Thr Ala Asp Leu Glu Gly
115 120 125
Leu Gln Arg Val Leu Ser Glu Tyr Ile Asp Lys Leu Thr Ile Tyr Thr
130 135 140
Asp Asp Pro Asn Ala Ala His Ala Gln Ser Leu Arg Thr Gln Val Ile
145 150 155 160
Thr Thr Asp Asn Leu Phe Glu Tyr Ser Met Pro Ser Phe Ala Ile Arg
165 170 175
Asp Tyr Glu Met Gln Leu Leu Thr Val Tyr Ala Gln Ala Ala Asn Leu
180 185 190
His Leu Ala Phe Leu Glu Asp Ile Val Arg Phe Gly Asp Glu Trp Gly
195 200 205
Phe Thr Pro Ala Glu Ile Ala Asp Phe His Lys Ser Met Lys Glu Arg
210 215 220
Thr Asp Glu Tyr Thr Asn His Cys Val Ser Thr Tyr Asn Lys Gly Leu
225 230 235 240
Glu Lys Ala Lys Leu Leu Thr Ala Asp Leu Cys Asn His Ser Thr Tyr
245 250 255
Pro Trp Thr Arg Tyr Asn Gln Gly Trp Arg Lys Glu Glu Thr Pro Asn
260 265 270
Cys Ser Leu Gln Gln Ile Asp Ser Cys Glu Gln Pro Leu Asn Glu Ser
275 280 285
Asp Glu Gln Gly Thr Pro Tyr Met Gly Pro Glu Arg Arg Ser Ile Asp
290 295 300
Glu Tyr Gln Lys Leu Glu Asn Trp Asn Leu Tyr Asn Ala Tyr Arg Arg
305 310 315 320
Asp Met Thr Leu Met Val Leu Asp Ile Val Ser Leu Trp Pro Thr Tyr
325 330 335
Asp Pro Lys Leu Tyr Pro Thr Ser Tyr Gly Val Thr Ser Glu Leu Thr
340 345 350
Arg Glu Leu Tyr Thr Asp Ile Arg Gly Thr Thr Tyr Arg Ser Asp Glu
355 360 365
Ser Gln Asn Ser Leu Asp Ala Ile Glu Gly Arg Met Ile Pro Gln Pro
370 375 380
Ser Leu Phe Arg Trp Leu Phe Gly Ile Ser Ile Lys Met Asn Gln Phe
385 390 395 400
Ile Gly Thr Gly Gly Ser Asp Asp Trp Thr Ser Gly Asn Leu Met Leu
405 410 415
Gly Met Arg Ile Met Trp Arg Lys Thr Leu Thr Glu Gln Trp Glu Gly
420 425 430
Leu Tyr Phe Gly Gly Gly Gly Asn Leu Tyr Ile Asn Leu Asn Pro Leu
435 440 445
Asp Tyr Ala Glu Gly Ile Thr His Val Asn Thr Arg Gln Trp Phe Glu
450 455 460
Pro Arg Trp Phe Glu Phe Tyr Ser Gly Gly Tyr Asp Thr Glu Leu Lys
465 470 475 480
Phe Gln Asn Lys Cys Gly Thr Ile Glu Glu Lys Ser Pro Phe Trp Ala
485 490 495
Ala Gly Pro Tyr Asn Tyr Ile Tyr Gln Pro Gly Val Arg Thr Ser Gln
500 505 510
Ile Pro Glu His Arg Leu Ser Trp Met Thr Tyr Glu Pro Val Arg Glu
515 520 525
Asn Ala Pro Phe Val Tyr Pro Gln Tyr Lys Gln Leu Gly Ala Val Ala
530 535 540
Leu Gly Trp Thr Ser Asn Ser Val Asp Gln Lys Asn Ala Ile Asp Leu
545 550 555 560
Asp Lys Ile Thr Ser Leu Pro Ala Val Lys Gly Asn Glu Ile Arg Gly
565 570 575
Pro Gly Ser Val Val Arg Gly Pro Gly Ser Thr Gly Gly Asn Leu Val
580 585 590
Leu Leu Asn Pro Thr Gly Glu Val Ser Ile Thr Val Ser Gln Pro Ile
595 600 605
Leu Asn Lys Pro Gly Ala Gly Tyr Tyr His Val Arg Ile Arg Tyr Ala
610 615 620
Ala Ile Ala Asn Gly Lys Leu Asn Val Lys Arg Ser Val Asn Ser Ser
625 630 635 640
Thr Gln Glu Ser Val Thr Tyr Asp Tyr Lys Gln Thr Thr Ala Arg Asp
645 650 655
Leu Thr Tyr Ser Ser Phe Gln Tyr Leu Glu Val Tyr Asp Phe Asn Pro
660 665 670
Val Thr Thr Ala Ser Gln Phe Glu Val Leu Leu Thr Asn Glu Ser Gly
675 680 685
Gly Pro Ile Tyr Ile Asp Lys Ile Glu Phe Ile Pro Phe Gln Gly Thr
690 695 700
Thr Gly Pro Glu Ala Pro Gly Ile Pro Ala Asp Ile Tyr Tyr Thr Ile
705 710 715 720
Ser Pro Ala Ile Asp Glu Asn Tyr Tyr Thr Ile Gly Gly Ser Thr Ile
725 730 735
Trp Leu Ser Leu Lys Glu Ser Phe Ser Asn Pro Pro Arg Asp Gly Gln
740 745 750
Trp Arg Phe Val Tyr Asp Thr Asn Lys Lys Ala Tyr Gln Ile Gly Thr
755 760 765
Gln Leu Asn Glu Asp Pro Ala Gly Gly Leu Phe Ala Val Leu Thr Ser
770 775 780
Thr Glu Pro Asn Asn Asn Leu Thr Met Tyr Pro Asn Leu Ser Leu Asp
785 790 795 800
Gln Gln Tyr Trp Phe Val Lys Asp Ala Gly Asp Gly Tyr Val Thr Leu
805 810 815
Glu Asn Tyr Gly Tyr Pro Gly Tyr Val Val Asn Val Pro Arg Val Tyr
820 825 830
Gln Gly Ala Ile Leu Thr Leu Ser Pro Phe Ile Gly Ser Met Asn His
835 840 845
Lys Phe Lys Leu Thr Lys Leu Ser Thr Asn Asp Glu Val Ile Leu Gly
850 855 860
<210> 118
<211> 701
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 118
Met Pro Asn Glu Met Asn Ser Lys Asn Asn Met Asn Thr Thr Arg Ile
1 5 10 15
Asp Asp Lys Asp Leu Leu Asp Ser Lys Gly Arg Glu Cys Gln Pro Arg
20 25 30
Tyr Pro Ser Ala Glu Ala Pro Asp Val Met Asn Pro Ile Glu Lys Ile
35 40 45
Tyr Thr Arg Gly Gln Ser Ala Asn Ile Ser Asn Ala Thr Ser Thr Thr
50 55 60
Ile Asp Val Thr Ser Gln Ile Leu Arg Gly Ser Lys Lys Leu Ala Gly
65 70 75 80
Leu Ile Ile Lys Val Leu Ile Lys Ile Leu Trp Pro Lys Gly Thr Gln
85 90 95
Gln Glu Trp Glu Asn Phe Met Asp Ala Val Glu Gln Leu Ile His Glu
100 105 110
Lys Leu Asp Thr Tyr Ala Arg Asn Lys Ala Thr Ala Asp Leu Glu Gly
115 120 125
Leu Gln Arg Val Leu Ser Glu Tyr Ile Asp Lys Leu Thr Ile Tyr Thr
130 135 140
Asp Asp Pro Asn Ala Ala His Ala Gln Ser Leu Arg Thr Gln Val Ile
145 150 155 160
Thr Thr Asp Asn Leu Phe Glu Tyr Ser Met Pro Ser Phe Ala Ile Arg
165 170 175
Asp Tyr Glu Met Gln Leu Leu Thr Val Tyr Ala Gln Ala Ala Asn Leu
180 185 190
His Leu Ala Phe Leu Glu Asp Ile Val Arg Phe Gly Asp Glu Trp Gly
195 200 205
Phe Thr Pro Ala Glu Ile Ala Asp Phe His Lys Ser Met Lys Glu Arg
210 215 220
Thr Asp Glu Tyr Thr Asn His Cys Val Ser Thr Tyr Asn Lys Gly Leu
225 230 235 240
Glu Lys Ala Lys Leu Leu Thr Ala Asp Leu Cys Asn His Ser Thr Tyr
245 250 255
Pro Trp Thr Arg Tyr Asn Gln Gly Trp Arg Lys Glu Glu Thr Pro Asn
260 265 270
Cys Ser Leu Gln Gln Ile Asp Ser Cys Glu Gln Pro Leu Asn Glu Ser
275 280 285
Asp Glu Gln Gly Thr Pro Tyr Met Gly Pro Glu Arg Arg Ser Ile Asp
290 295 300
Glu Tyr Gln Lys Leu Glu Asn Trp Asn Leu Tyr Asn Ala Tyr Arg Arg
305 310 315 320
Asp Met Thr Leu Met Val Leu Asp Ile Val Ser Leu Trp Pro Thr Tyr
325 330 335
Asp Pro Lys Leu Tyr Pro Thr Ser Tyr Gly Val Thr Ser Glu Leu Thr
340 345 350
Arg Glu Leu Tyr Thr Asp Ile Arg Gly Thr Thr Tyr Arg Ser Asp Glu
355 360 365
Ser Gln Asn Ser Leu Asp Ala Ile Glu Gly Arg Met Ile Pro Gln Pro
370 375 380
Ser Leu Phe Arg Trp Leu Phe Gly Ile Ser Ile Lys Met Asn Gln Phe
385 390 395 400
Ile Gly Thr Gly Gly Ser Asp Asp Trp Thr Ser Gly Asn Leu Met Leu
405 410 415
Gly Met Arg Ile Met Trp Arg Lys Thr Leu Thr Glu Gln Trp Glu Gly
420 425 430
Leu Tyr Phe Gly Gly Gly Gly Asn Leu Tyr Ile Asn Leu Asn Pro Leu
435 440 445
Asp Tyr Ala Glu Gly Ile Thr His Val Asn Thr Arg Gln Trp Phe Glu
450 455 460
Pro Arg Trp Phe Glu Phe Tyr Ser Gly Gly Tyr Asp Thr Glu Leu Lys
465 470 475 480
Phe Gln Asn Lys Cys Gly Thr Ile Glu Glu Lys Ser Pro Phe Trp Ala
485 490 495
Ala Gly Pro Tyr Asn Tyr Ile Tyr Gln Pro Gly Val Arg Thr Ser Gln
500 505 510
Ile Pro Glu His Arg Leu Ser Trp Met Thr Tyr Glu Pro Val Arg Glu
515 520 525
Asn Ala Pro Phe Val Tyr Pro Gln Tyr Lys Gln Leu Gly Ala Val Ala
530 535 540
Leu Gly Trp Thr Ser Asn Ser Val Asp Gln Lys Asn Ala Ile Asp Leu
545 550 555 560
Asp Lys Ile Thr Ser Leu Pro Ala Val Lys Gly Asn Glu Ile Arg Gly
565 570 575
Pro Gly Ser Val Val Arg Gly Pro Gly Ser Thr Gly Gly Asn Leu Val
580 585 590
Leu Leu Asn Pro Thr Gly Glu Val Ser Ile Thr Val Ser Gln Pro Ile
595 600 605
Leu Asn Lys Pro Gly Ala Gly Tyr Tyr His Val Arg Ile Arg Tyr Ala
610 615 620
Ala Ile Ala Asn Gly Lys Leu Asn Val Lys Arg Ser Val Asn Ser Ser
625 630 635 640
Thr Gln Glu Ser Val Thr Tyr Asp Tyr Lys Gln Thr Thr Ala Arg Asp
645 650 655
Leu Thr Tyr Ser Ser Phe Gln Tyr Leu Glu Val Tyr Asp Phe Asn Pro
660 665 670
Val Thr Thr Ala Ser Gln Phe Glu Val Leu Leu Thr Asn Glu Ser Gly
675 680 685
Gly Pro Ile Tyr Ile Asp Lys Ile Glu Phe Ile Pro Phe
690 695 700
<210> 119
<211> 1195
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 119
Met Asn His Asn Asn Asn Asn Asn Glu Tyr Glu Ile Ile Asp Ser His
1 5 10 15
Thr Ser Ser Tyr Pro Ser Asn Arg Asn Ser Asn His Ser Arg Tyr Pro
20 25 30
Tyr Thr Asn Asn Pro Asn Gln Pro Leu Ser Asn Thr Asn Tyr Lys Asp
35 40 45
Trp Leu Thr Met Cys Gln Gly Asn Gln Pro Tyr Arg Asp Lys Pro Gln
50 55 60
Thr Leu Val Asp Thr Gly Val Ala Ile Ser Thr Gly Leu Ile Ile Ile
65 70 75 80
Gly Thr Ile Met Thr Gly Phe Pro Ala Leu Thr Pro Trp Gly Ile Gly
85 90 95
Ile Val Ser Phe Gly Thr Leu Leu Pro Val Leu Trp Pro Ser Gly Glu
100 105 110
Thr Asp Lys Lys Val Trp Ile Asp Phe Met Asn Tyr Gly Gly Thr Ile
115 120 125
Phe Lys Pro Leu Leu Asn Glu Gln Lys Asp Gln Ala Gln Arg Ile Leu
130 135 140
Gln Gly Phe His Leu Pro Ile Asn Ser Tyr Gln Asn Gly Ile Thr Thr
145 150 155 160
Trp Gln Asn Leu Arg Lys Ser His Ile Pro Gly Thr Pro Pro Ser Ser
165 170 175
Ala Leu Arg Glu Ala Ala Arg Val Ala Arg Thr Arg Ile Asp Ile Ala
180 185 190
Asn Ser Ala Leu Ser Arg Ile Ser Glu Ile Gln Ser Ala Gln Phe Gly
195 200 205
Ala Ala Ile Leu Pro Phe Tyr Ala Gln Ala Ala Thr Leu His Leu Asn
210 215 220
Leu Leu Ser Gln Ala Val Gln Phe Ala Asp Gln Leu Lys Ala Asp Ala
225 230 235 240
Glu Asn Gln Pro Thr Gln Asp Ala Gly Thr Ser Asp Glu Tyr His Arg
245 250 255
Leu Leu Lys Gln Tyr Thr Gln Gln Tyr Thr Asp Tyr Cys Val Lys Thr
260 265 270
Tyr Gln Glu Gly Leu Thr Thr Leu Lys Asn Ala Pro Asp Met Thr Trp
275 280 285
Asn Ile Tyr Asn Thr Tyr Arg Arg Asp Met Thr Leu Leu Val Leu Asp
290 295 300
Tyr Ile Ala Leu Phe Pro Asn Phe Asp Ile Arg Gln Tyr Pro Thr Gly
305 310 315 320
Thr His Ser Glu Leu Thr Arg Glu Ile Tyr Thr Asp Ala Leu Ile Lys
325 330 335
Glu Gln Pro Asn Pro Pro Ile Pro Ile Pro Val Ala Gln Arg Glu Thr
340 345 350
Glu Leu Thr Arg Pro Pro His Leu Phe Ser Arg Leu Asn Arg Leu Leu
355 360 365
Leu Phe Ser Asn Thr Asp Pro Ser Pro Pro Ala Leu Ser Ala Val Gln
370 375 380
Asn Ser Phe Thr Tyr Thr Asn Asn Asn Ile Val Gln Tyr Ser Gln Ile
385 390 395 400
Tyr Arg Leu Ile Asn Ser Pro Glu Pro Thr Gly Ser Thr Gln Gln Ile
405 410 415
Ile Ile Ser Asn Thr Asp Ile Tyr Arg Ile Glu Leu Thr Leu Arg Gln
420 425 430
Asn Tyr Phe Ile Thr His Asn Ile Asn Phe Tyr Thr Leu Asp Gly Ile
435 440 445
Thr Arg Arg Tyr Asn Ser Gly Ser Thr Pro Glu Thr Pro Ile Ile Ile
450 455 460
Asn Phe Gln Leu Pro Glu Phe Pro Ala Asp Lys Ile Pro Pro Tyr Gly
465 470 475 480
Leu Gly Thr Lys Tyr Ser His Ile Leu Ser Tyr Met Lys Ile Ser Pro
485 490 495
Asn Arg His Asn Ile Val Leu Pro Asn Glu Arg His Leu Ser Phe Ala
500 505 510
Trp Thr His Thr Ser Val Asn Phe Asp Asn Glu Ile Ser Asn Gln Ile
515 520 525
Val Thr Gln Ile Pro Ala Val Lys Ala Arg Ser Leu Asp Thr Ser Ser
530 535 540
Ser Val Ile Ser Gly Pro Gly His Thr Gly Gly Asp Leu Val Leu Phe
545 550 555 560
Arg Ser Arg Met Glu Phe Gln Cys Phe Val Pro Thr Gln Thr Lys Tyr
565 570 575
Lys Ile Arg Met Arg Tyr Val Ala Tyr Ser Pro Asn Asn Ser Ile Ser
580 585 590
Leu Thr Leu Asn Ile Met Gly Gln Val Asn Tyr Gly Leu Arg Ala Leu
595 600 605
Asn Ile Lys Ser Thr Val Ala Ser Glu Lys Asp Thr Val Asn Pro Lys
610 615 620
Tyr Asn Asp Phe Gln Tyr Leu Tyr Phe Tyr Thr Gln Asp Pro Asn Glu
625 630 635 640
Ile Ala Ile Val Asn Leu Tyr Ser Leu Thr Asn Met Thr Leu Gln Ser
645 650 655
Asn Asn Phe Ala Gly Asn Thr Leu Val Ile Asp Lys Ile Glu Phe Leu
660 665 670
Pro Val Thr Gln Thr Leu Glu Glu Asn Leu Glu Thr Gln Lys Leu Glu
675 680 685
Glu Ile Gln Gln Thr Val Asn Thr Phe Phe Thr Asn His Thr Lys Asn
690 695 700
Ile Leu Asn Ile Glu Thr Thr Asp Tyr Glu Ile Asp Gln Thr Ala Ile
705 710 715 720
Leu Val Glu Ser Leu Ser Glu Glu Gln Tyr Pro Gln Glu Lys Met Ile
725 730 735
Leu Leu Asp Thr Met Lys Gln Ala Lys Gln Phe Ser Gln Ser Arg Asn
740 745 750
Leu Leu Gln Asn Gly Asp Phe Ser Ser Phe Ile Gly Trp Thr Ile Asn
755 760 765
Asn Asp Leu Thr Leu Gln Thr Asn Asn Pro Ile Phe Lys Gly Gln Tyr
770 775 780
Leu His Ile Leu Gly Ala Arg Thr Thr Glu Ile Asp Asn Thr Ile Phe
785 790 795 800
Pro Thr Tyr Val Tyr Gln Lys Ile Asp Glu Ser Lys Leu Lys Pro Tyr
805 810 815
Thr Arg Tyr Val Val Arg Gly Cys Ile Ser Asn Ser Lys Asp Leu Glu
820 825 830
Leu Phe Val Thr Arg Tyr Asn Lys Glu Ile His Lys Ile Leu Asn Ile
835 840 845
Pro Asn Asp Ser Ser His Met Asn Ala Glu Ile Gln Thr Asn Ser Tyr
850 855 860
Glu Ala Gln Ser Tyr Ser Phe Arg Asn Glu Asn Asn Asn Leu Thr Asn
865 870 875 880
Gln Gln Ser Pro Tyr Pro Thr Thr Ser Asn His Ser Gly Tyr Ser Glu
885 890 895
Ser Thr Leu Ile Ser Ser Asn Phe Glu Asn Glu Asn Ala Phe Ser Phe
900 905 910
Ser Ile Asp Thr Gly Asn Leu Asp Phe Asn Glu Asn Leu Gly Ile Gly
915 920 925
Ile Leu Phe Lys Ile Ser Asn Pro Asp Gly Tyr Ala Ala Leu Gly Asn
930 935 940
Leu Glu Val Ile Glu Glu Gln Pro Leu Thr Glu Glu Glu Val Asn Arg
945 950 955 960
Val Thr Glu Lys Glu Asn Arg Trp Lys Gln Val Arg Asn Asn Gln Gln
965 970 975
Lys Glu Thr Glu Gln Ala Tyr Tyr Gln Ala Gln Gln Ala Ile Asp Ala
980 985 990
Leu Phe Ile Asn Ser Gln His Gln Met Leu Lys Ile Glu Thr Thr Ile
995 1000 1005
Gln Asp Ile Val Val Ala Glu Thr Phe Ile Asp Lys Ile Pro Tyr
1010 1015 1020
Ile Tyr Asn Glu Trp Leu Pro Asn Glu Pro Gly Met Asn Tyr Thr
1025 1030 1035
Leu Tyr Gln Gly Leu Lys Gln Gln Ile Ser Gln Ala Tyr Met Leu
1040 1045 1050
Tyr Arg Asn Arg Asn Leu Ile Gln Asn Gly Asn Phe Ile Asn Ser
1055 1060 1065
Thr Thr Asn Trp Phe Thr Ser Pro Asp Ala Lys Ile Gln Gln Ile
1070 1075 1080
Asp Asn Thr Ser Ile Leu Val Ile Pro Asn Trp Ser Thr Gln Val
1085 1090 1095
Ser Gln Asn Ile Asn Leu Pro Gln Gln Asn His Gln Tyr Leu Leu
1100 1105 1110
Arg Val Ile Ala Lys Lys Glu Gly Ile Gly Asn Gly Tyr Val Lys
1115 1120 1125
Ile Ser Asp Cys Thr Lys His Val Glu Thr Leu Ile Phe Thr Ser
1130 1135 1140
Cys Asp Tyr Asn Asn Asn Ala Met Trp Asn Glu Pro Met Gly Tyr
1145 1150 1155
Val Thr Lys Thr Met His Ile Thr Pro His Thr Asn Gln Val Arg
1160 1165 1170
Ile Asp Ile Gly Glu Thr Glu Gly Thr Phe Lys Ile Asn Ser Val
1175 1180 1185
Glu Leu Ile Gly Ile Lys Asn
1190 1195
<210> 120
<211> 674
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 120
Met Asn His Asn Asn Asn Asn Asn Glu Tyr Glu Ile Ile Asp Ser His
1 5 10 15
Thr Ser Ser Tyr Pro Ser Asn Arg Asn Ser Asn His Ser Arg Tyr Pro
20 25 30
Tyr Thr Asn Asn Pro Asn Gln Pro Leu Ser Asn Thr Asn Tyr Lys Asp
35 40 45
Trp Leu Thr Met Cys Gln Gly Asn Gln Pro Tyr Arg Asp Lys Pro Gln
50 55 60
Thr Leu Val Asp Thr Gly Val Ala Ile Ser Thr Gly Leu Ile Ile Ile
65 70 75 80
Gly Thr Ile Met Thr Gly Phe Pro Ala Leu Thr Pro Trp Gly Ile Gly
85 90 95
Ile Val Ser Phe Gly Thr Leu Leu Pro Val Leu Trp Pro Ser Gly Glu
100 105 110
Thr Asp Lys Lys Val Trp Ile Asp Phe Met Asn Tyr Gly Gly Thr Ile
115 120 125
Phe Lys Pro Leu Leu Asn Glu Gln Lys Asp Gln Ala Gln Arg Ile Leu
130 135 140
Gln Gly Phe His Leu Pro Ile Asn Ser Tyr Gln Asn Gly Ile Thr Thr
145 150 155 160
Trp Gln Asn Leu Arg Lys Ser His Ile Pro Gly Thr Pro Pro Ser Ser
165 170 175
Ala Leu Arg Glu Ala Ala Arg Val Ala Arg Thr Arg Ile Asp Ile Ala
180 185 190
Asn Ser Ala Leu Ser Arg Ile Ser Glu Ile Gln Ser Ala Gln Phe Gly
195 200 205
Ala Ala Ile Leu Pro Phe Tyr Ala Gln Ala Ala Thr Leu His Leu Asn
210 215 220
Leu Leu Ser Gln Ala Val Gln Phe Ala Asp Gln Leu Lys Ala Asp Ala
225 230 235 240
Glu Asn Gln Pro Thr Gln Asp Ala Gly Thr Ser Asp Glu Tyr His Arg
245 250 255
Leu Leu Lys Gln Tyr Thr Gln Gln Tyr Thr Asp Tyr Cys Val Lys Thr
260 265 270
Tyr Gln Glu Gly Leu Thr Thr Leu Lys Asn Ala Pro Asp Met Thr Trp
275 280 285
Asn Ile Tyr Asn Thr Tyr Arg Arg Asp Met Thr Leu Leu Val Leu Asp
290 295 300
Tyr Ile Ala Leu Phe Pro Asn Phe Asp Ile Arg Gln Tyr Pro Thr Gly
305 310 315 320
Thr His Ser Glu Leu Thr Arg Glu Ile Tyr Thr Asp Ala Leu Ile Lys
325 330 335
Glu Gln Pro Asn Pro Pro Ile Pro Ile Pro Val Ala Gln Arg Glu Thr
340 345 350
Glu Leu Thr Arg Pro Pro His Leu Phe Ser Arg Leu Asn Arg Leu Leu
355 360 365
Leu Phe Ser Asn Thr Asp Pro Ser Pro Pro Ala Leu Ser Ala Val Gln
370 375 380
Asn Ser Phe Thr Tyr Thr Asn Asn Asn Ile Val Gln Tyr Ser Gln Ile
385 390 395 400
Tyr Arg Leu Ile Asn Ser Pro Glu Pro Thr Gly Ser Thr Gln Gln Ile
405 410 415
Ile Ile Ser Asn Thr Asp Ile Tyr Arg Ile Glu Leu Thr Leu Arg Gln
420 425 430
Asn Tyr Phe Ile Thr His Asn Ile Asn Phe Tyr Thr Leu Asp Gly Ile
435 440 445
Thr Arg Arg Tyr Asn Ser Gly Ser Thr Pro Glu Thr Pro Ile Ile Ile
450 455 460
Asn Phe Gln Leu Pro Glu Phe Pro Ala Asp Lys Ile Pro Pro Tyr Gly
465 470 475 480
Leu Gly Thr Lys Tyr Ser His Ile Leu Ser Tyr Met Lys Ile Ser Pro
485 490 495
Asn Arg His Asn Ile Val Leu Pro Asn Glu Arg His Leu Ser Phe Ala
500 505 510
Trp Thr His Thr Ser Val Asn Phe Asp Asn Glu Ile Ser Asn Gln Ile
515 520 525
Val Thr Gln Ile Pro Ala Val Lys Ala Arg Ser Leu Asp Thr Ser Ser
530 535 540
Ser Val Ile Ser Gly Pro Gly His Thr Gly Gly Asp Leu Val Leu Phe
545 550 555 560
Arg Ser Arg Met Glu Phe Gln Cys Phe Val Pro Thr Gln Thr Lys Tyr
565 570 575
Lys Ile Arg Met Arg Tyr Val Ala Tyr Ser Pro Asn Asn Ser Ile Ser
580 585 590
Leu Thr Leu Asn Ile Met Gly Gln Val Asn Tyr Gly Leu Arg Ala Leu
595 600 605
Asn Ile Lys Ser Thr Val Ala Ser Glu Lys Asp Thr Val Asn Pro Lys
610 615 620
Tyr Asn Asp Phe Gln Tyr Leu Tyr Phe Tyr Thr Gln Asp Pro Asn Glu
625 630 635 640
Ile Ala Ile Val Asn Leu Tyr Ser Leu Thr Asn Met Thr Leu Gln Ser
645 650 655
Asn Asn Phe Ala Gly Asn Thr Leu Val Ile Asp Lys Ile Glu Phe Leu
660 665 670
Pro Val
<210> 121
<211> 654
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 121
Met Asn Ser Tyr Gln Asn Thr Asn Glu Tyr Glu Ile Leu Asp Gly Ser
1 5 10 15
Pro Asn Asn Thr Asn Met Ser Asn Arg Tyr Pro Phe Ala Lys Asp Pro
20 25 30
Asn Ile Phe Pro Ile Asn Leu Asp Ala Cys Gln Gly Arg Pro Trp Gln
35 40 45
Asp Thr Trp Glu Ser Val Ser Asp Ile Val Thr Ile Gly Thr Tyr Leu
50 55 60
Ile Gln Phe Leu Leu Glu Pro Gly Ile Gly Gly Ile Pro Val Ile Leu
65 70 75 80
Ser Ile Ile Asn Lys Leu Ile Pro Ser Ser Gly Gln Ser Val Ala Ala
85 90 95
Leu Ser Ile Cys Asp Leu Leu Ser Ile Ile Arg Lys Glu Val Asp Glu
100 105 110
Ser Val Leu Ser Asp Gly Val Ala Asp Phe Lys Gly Glu Met Thr Ala
115 120 125
Tyr Arg Asp Tyr Tyr Leu Pro Tyr Leu Glu Asp Trp Leu Thr Asp Lys
130 135 140
Ser Asn Pro Glu Lys Leu Ala Asp Val Val Lys Gln Phe Gln Ala Arg
145 150 155 160
Glu Glu Asp Phe Thr Lys Leu Leu Ala Gly Ser Leu Ser Arg Gln Lys
165 170 175
Ala Glu Ile Leu Leu Leu Pro Thr Tyr Val Gln Ala Ala Asn Val His
180 185 190
Leu Leu Leu Leu Arg Asp Ala Val Lys Tyr Lys Lys Glu Trp Gly Leu
195 200 205
Val Cys Pro Pro Leu Tyr Pro Gly Ser Gly Arg Thr Asp Cys Asn Glu
210 215 220
Arg Leu Lys Ala Lys Ile Lys Glu Tyr Thr Asn Tyr Cys Val Glu Trp
225 230 235 240
Tyr Asn Lys Gly Leu Asp Gln Ile Lys Gln Ala Gly Thr Ser Thr Glu
245 250 255
Thr Trp Leu Lys Phe Asn Lys Phe Arg Arg Glu Met Thr Leu Ala Val
260 265 270
Leu Asp Val Ile Ala Ile Phe Pro Thr Tyr Asp Phe Glu Lys Tyr Pro
275 280 285
Leu Ala Thr Asn Val Glu Leu Thr Arg Glu Val Tyr Thr Asp Pro Val
290 295 300
Gly Tyr Ser Gly Ser Ser Ile Arg Trp Glu Arg Thr Phe Pro Asn Ala
305 310 315 320
Phe Asn Thr Leu Glu Ala Asn Gly Thr Arg Gly Pro Gly Leu Val Thr
325 330 335
Trp Leu Glu Val Leu Gly Ile Tyr Asn His Asp Phe Gln Asp Ile Thr
340 345 350
Val Tyr Phe Ser Gly Trp Val Gly Ser Arg His Ser Glu Asp Tyr Thr
355 360 365
Arg Gly Asn Gly Thr Phe Ser Arg Ile Ser Gly Thr Thr Ser Asn Asp
370 375 380
Ile Arg Asn Gln Thr Phe Tyr Ser Arg Asp Val Phe Lys Ile Asp Ser
385 390 395 400
Leu Gly Ile Tyr Glu Thr Arg Ala Glu Leu Gly Tyr Thr Arg Gln Arg
405 410 415
Phe Cys Val Ser Arg Ala Val Phe Ser Ser Thr Leu Tyr Asn Tyr Val
420 425 430
Tyr Asp Ala Arg Asn Asn Gly Gln Gly Arg Met Thr Ile Glu Ser Met
435 440 445
Leu Pro Gly Ile Lys Asn Pro Ile Pro Ser Ser Gln Asp Tyr Ser His
450 455 460
Arg Leu Ser Asn Ala Ala Cys Val Gln Phe Asn Asp Ser Arg Ile Asn
465 470 475 480
Val Tyr Gly Trp Thr His Thr Ser Met Thr Lys Asn Asn Pro Ile Tyr
485 490 495
Thr Asp Lys Ile Ser Gln Ile Pro Ala Val Lys Ala Phe Ala Leu Glu
500 505 510
Ser Gly Ala Tyr Val Ser Arg Gly Pro Gly His Thr Gly Gly Asp Val
515 520 525
Val Thr Leu Pro Asn Arg Gly Arg Leu Lys Ile Arg Leu Thr Ser Ala
530 535 540
Pro Thr Asn Lys Asn Tyr Arg Val Arg Val Arg Tyr Ala Thr Ser Tyr
545 550 555 560
Gly Ala Asp Leu Met Val Gln Arg Trp Ser Pro Ser Gly Asn His Ala
565 570 575
Ser Gly Tyr Phe Ser Gly Ser Pro Thr Gly Ser Tyr Pro Thr Phe Gly
580 585 590
Tyr Met Asn Thr Leu Val Thr Thr Phe Asn Gln Ser Gly Val Glu Ile
595 600 605
Ile Ile Glu Asn Arg His Tyr Ser Asn Ile Ile Ile Asp Lys Ile Glu
610 615 620
Phe Ile Pro Asp Asp Ile Thr Thr Leu Glu Tyr Glu Gly Glu Arg Asp
625 630 635 640
Leu Glu Lys Thr Lys Asn Ala Val Asn Asp Leu Phe Thr Asn
645 650
<210> 122
<211> 628
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 122
Met Asn Ser Tyr Gln Asn Thr Asn Glu Tyr Glu Ile Leu Asp Gly Ser
1 5 10 15
Pro Asn Asn Thr Asn Met Ser Asn Arg Tyr Pro Phe Ala Lys Asp Pro
20 25 30
Asn Ile Phe Pro Ile Asn Leu Asp Ala Cys Gln Gly Arg Pro Trp Gln
35 40 45
Asp Thr Trp Glu Ser Val Ser Asp Ile Val Thr Ile Gly Thr Tyr Leu
50 55 60
Ile Gln Phe Leu Leu Glu Pro Gly Ile Gly Gly Ile Pro Val Ile Leu
65 70 75 80
Ser Ile Ile Asn Lys Leu Ile Pro Ser Ser Gly Gln Ser Val Ala Ala
85 90 95
Leu Ser Ile Cys Asp Leu Leu Ser Ile Ile Arg Lys Glu Val Asp Glu
100 105 110
Ser Val Leu Ser Asp Gly Val Ala Asp Phe Lys Gly Glu Met Thr Ala
115 120 125
Tyr Arg Asp Tyr Tyr Leu Pro Tyr Leu Glu Asp Trp Leu Thr Asp Lys
130 135 140
Ser Asn Pro Glu Lys Leu Ala Asp Val Val Lys Gln Phe Gln Ala Arg
145 150 155 160
Glu Glu Asp Phe Thr Lys Leu Leu Ala Gly Ser Leu Ser Arg Gln Lys
165 170 175
Ala Glu Ile Leu Leu Leu Pro Thr Tyr Val Gln Ala Ala Asn Val His
180 185 190
Leu Leu Leu Leu Arg Asp Ala Val Lys Tyr Lys Lys Glu Trp Gly Leu
195 200 205
Val Cys Pro Pro Leu Tyr Pro Gly Ser Gly Arg Thr Asp Cys Asn Glu
210 215 220
Arg Leu Lys Ala Lys Ile Lys Glu Tyr Thr Asn Tyr Cys Val Glu Trp
225 230 235 240
Tyr Asn Lys Gly Leu Asp Gln Ile Lys Gln Ala Gly Thr Ser Thr Glu
245 250 255
Thr Trp Leu Lys Phe Asn Lys Phe Arg Arg Glu Met Thr Leu Ala Val
260 265 270
Leu Asp Val Ile Ala Ile Phe Pro Thr Tyr Asp Phe Glu Lys Tyr Pro
275 280 285
Leu Ala Thr Asn Val Glu Leu Thr Arg Glu Val Tyr Thr Asp Pro Val
290 295 300
Gly Tyr Ser Gly Ser Ser Ile Arg Trp Glu Arg Thr Phe Pro Asn Ala
305 310 315 320
Phe Asn Thr Leu Glu Ala Asn Gly Thr Arg Gly Pro Gly Leu Val Thr
325 330 335
Trp Leu Glu Val Leu Gly Ile Tyr Asn His Asp Phe Gln Asp Ile Thr
340 345 350
Val Tyr Phe Ser Gly Trp Val Gly Ser Arg His Ser Glu Asp Tyr Thr
355 360 365
Arg Gly Asn Gly Thr Phe Ser Arg Ile Ser Gly Thr Thr Ser Asn Asp
370 375 380
Ile Arg Asn Gln Thr Phe Tyr Ser Arg Asp Val Phe Lys Ile Asp Ser
385 390 395 400
Leu Gly Ile Tyr Glu Thr Arg Ala Glu Leu Gly Tyr Thr Arg Gln Arg
405 410 415
Phe Cys Val Ser Arg Ala Val Phe Ser Ser Thr Leu Tyr Asn Tyr Val
420 425 430
Tyr Asp Ala Arg Asn Asn Gly Gln Gly Arg Met Thr Ile Glu Ser Met
435 440 445
Leu Pro Gly Ile Lys Asn Pro Ile Pro Ser Ser Gln Asp Tyr Ser His
450 455 460
Arg Leu Ser Asn Ala Ala Cys Val Gln Phe Asn Asp Ser Arg Ile Asn
465 470 475 480
Val Tyr Gly Trp Thr His Thr Ser Met Thr Lys Asn Asn Pro Ile Tyr
485 490 495
Thr Asp Lys Ile Ser Gln Ile Pro Ala Val Lys Ala Phe Ala Leu Glu
500 505 510
Ser Gly Ala Tyr Val Ser Arg Gly Pro Gly His Thr Gly Gly Asp Val
515 520 525
Val Thr Leu Pro Asn Arg Gly Arg Leu Lys Ile Arg Leu Thr Ser Ala
530 535 540
Pro Thr Asn Lys Asn Tyr Arg Val Arg Val Arg Tyr Ala Thr Ser Tyr
545 550 555 560
Gly Ala Asp Leu Met Val Gln Arg Trp Ser Pro Ser Gly Asn His Ala
565 570 575
Ser Gly Tyr Phe Ser Gly Ser Pro Thr Gly Ser Tyr Pro Thr Phe Gly
580 585 590
Tyr Met Asn Thr Leu Val Thr Thr Phe Asn Gln Ser Gly Val Glu Ile
595 600 605
Ile Ile Glu Asn Arg His Tyr Ser Asn Ile Ile Ile Asp Lys Ile Glu
610 615 620
Phe Ile Pro Asp
625
<210> 123
<211> 317
<212> PRT
<213> Неизвестная
<220>
<223> Неизвестный организм из образца окружающей среды
<400> 123
Met Lys Asn Lys Ile Ile Leu Tyr Gly Val Val Thr Ser Thr Leu Leu
1 5 10 15
Ala Gly Gly Pro Phe Ser Asn Asn Ala Ser Ala Ser Glu Asn Gln Gly
20 25 30
Met Thr Gly Asn Asn Ile Gly Val Val Ser Ser Asn Ile Lys Ala Ala
35 40 45
Glu Gln Asn Lys Asn Ser Ala Tyr Gln Asp Ile Asp Glu Arg Val Lys
50 55 60
Lys Met Leu Ile Ser Ala Ala Phe Asp Gly Thr Glu Tyr Arg Tyr His
65 70 75 80
His Ile Lys Asp Thr Glu Leu Asn Gly Asn Ile Ile Glu Gly Ser Met
85 90 95
Ile Glu Asn Ala Gln Ile Leu Thr Ile Gly Glu Asn Ile Leu Glu Asn
100 105 110
Asn Leu Gly His Glu Val Thr Leu Phe Thr Ser Gly Tyr Glu His Glu
115 120 125
Phe Lys Glu Met Thr Ser Thr Thr Asn Thr Ser Gly Trp Thr Phe Gly
130 135 140
Tyr Asn Tyr Asn Ala Thr Leu Ser Val Met Met Val Ser Ala Ser Gln
145 150 155 160
Ser Phe Ser Val Asp Tyr Asn Met Ser Thr Ser Asn Thr Thr Glu Lys
165 170 175
Ser Gln Val Arg Lys Phe Thr Val Pro Pro Gln Gly Phe Pro Val Pro
180 185 190
Ala Gly Lys Lys Tyr Lys Val Glu Tyr Val Phe Glu Lys Ile Thr Ile
195 200 205
Ser Gly Arg Asn Arg Leu Asn Ala Asp Leu Tyr Gly Asp Ala Thr Tyr
210 215 220
Tyr Tyr Asn Asn Leu Pro Met Ser Pro Gln Leu Leu Tyr Ser Ala Met
225 230 235 240
Asn Phe Ala Ser Asp Thr Gln Gly Phe Glu Arg Val Ile Arg Asp Asn
245 250 255
Ala Glu Gly Asn Asp Arg Phe Gly Ile Arg Ala Thr Gly Glu Gly Arg
260 265 270
Phe Ser Thr Glu Phe Gly Thr Arg Leu Tyr Ala Lys Ile Thr Asp Ile
275 280 285
Thr Asp Ser Lys Lys Pro Val Thr Ile Glu Thr Lys Lys Ile Pro Val
290 295 300
Asn Phe Glu Thr Leu Ser Val Ala Thr Lys Ile Ile Glu
305 310 315
<210> 124
<211> 291
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 124
Met Ser Glu Asn Gln Gly Met Thr Gly Asn Asn Ile Gly Val Val Ser
1 5 10 15
Ser Asn Ile Lys Ala Ala Glu Gln Asn Lys Asn Ser Ala Tyr Gln Asp
20 25 30
Ile Asp Glu Arg Val Lys Lys Met Leu Ile Ser Ala Ala Phe Asp Gly
35 40 45
Thr Glu Tyr Arg Tyr His His Ile Lys Asp Thr Glu Leu Asn Gly Asn
50 55 60
Ile Ile Glu Gly Ser Met Ile Glu Asn Ala Gln Ile Leu Thr Ile Gly
65 70 75 80
Glu Asn Ile Leu Glu Asn Asn Leu Gly His Glu Val Thr Leu Phe Thr
85 90 95
Ser Gly Tyr Glu His Glu Phe Lys Glu Met Thr Ser Thr Thr Asn Thr
100 105 110
Ser Gly Trp Thr Phe Gly Tyr Asn Tyr Asn Ala Thr Leu Ser Val Met
115 120 125
Met Val Ser Ala Ser Gln Ser Phe Ser Val Asp Tyr Asn Met Ser Thr
130 135 140
Ser Asn Thr Thr Glu Lys Ser Gln Val Arg Lys Phe Thr Val Pro Pro
145 150 155 160
Gln Gly Phe Pro Val Pro Ala Gly Lys Lys Tyr Lys Val Glu Tyr Val
165 170 175
Phe Glu Lys Ile Thr Ile Ser Gly Arg Asn Arg Leu Asn Ala Asp Leu
180 185 190
Tyr Gly Asp Ala Thr Tyr Tyr Tyr Asn Asn Leu Pro Met Ser Pro Gln
195 200 205
Leu Leu Tyr Ser Ala Met Asn Phe Ala Ser Asp Thr Gln Gly Phe Glu
210 215 220
Arg Val Ile Arg Asp Asn Ala Glu Gly Asn Asp Arg Phe Gly Ile Arg
225 230 235 240
Ala Thr Gly Glu Gly Arg Phe Ser Thr Glu Phe Gly Thr Arg Leu Tyr
245 250 255
Ala Lys Ile Thr Asp Ile Thr Asp Ser Lys Lys Pro Val Thr Ile Glu
260 265 270
Thr Lys Lys Ile Pro Val Asn Phe Glu Thr Leu Ser Val Ala Thr Lys
275 280 285
Ile Ile Glu
290
<210> 125
<211> 900
<212> PRT
<213> Неизвестная
<220>
<223> Неизвестный организм из образца окружающей среды
<400> 125
Met Asp Cys Asn Leu Gln Ser Gln Gln Asn Ile Pro Tyr Asn Val Leu
1 5 10 15
Ala Ile Pro Val Ser Asn Val Asn Ser Leu Thr Asp Thr Ile Gly Asp
20 25 30
Leu Lys Lys Ala Trp Glu Glu Phe Gln Lys Thr Gly Ser Phe Ser Leu
35 40 45
Thr Ala Leu Gln Gln Gly Phe Asn Ala Ala Gln Gly Gly Thr Phe Asn
50 55 60
Tyr Leu Thr Leu Leu Gln Ser Gly Ile Ser Leu Ala Gly Ser Phe Val
65 70 75 80
Pro Gly Gly Thr Phe Val Ala Pro Ile Ile Asn Met Val Ile Gly Trp
85 90 95
Leu Trp Pro His Lys Asn Lys Asn Ala Asp Thr Glu Asn Leu Ile Asn
100 105 110
Leu Ile Asp Ser Glu Ile Gln Lys Gln Leu Asn Lys Ala Leu Leu Asp
115 120 125
Gln Asp Arg Gln Asp Trp Ile Ser Tyr Leu Glu Ser Ile Phe Asp Ser
130 135 140
Ser Asn Asn Leu Asn Gly Ala Ile Ile Asp Ala Gln Trp Ser Gly Thr
145 150 155 160
Val Asn Thr Thr Asn Arg Thr Leu Arg Asn Pro Thr Glu Ser Asp Tyr
165 170 175
Leu Asn Val Val Thr Asn Phe Ile Ala Ala Asp Gly Asp Ile Ser Ser
180 185 190
Asn Glu His His Ile Met Asn Gly Asn Phe Asp Val Ala Ala Ala Pro
195 200 205
Tyr Phe Val Ile Gly Ala Thr Ala Arg Phe Ala Thr Met Gln Ser Tyr
210 215 220
Ile Lys Phe Cys Asn Ala Trp Ile Asp Lys Val Gly Leu Ser Asp Ser
225 230 235 240
Gln Leu Thr Thr Gln Lys Ala Asn Leu Asp Arg Thr Lys Gln Thr Met
245 250 255
Arg Asn Ala Ile Leu Ser Tyr Thr Gln Gln Val Met Lys Val Phe Lys
260 265 270
Asp Pro Lys Asn Met Pro Thr Ile Asp Thr Asn Lys Phe Ser Val Asp
275 280 285
Thr Tyr Asn Val Tyr Val Lys Gly Met Thr Leu Asn Val Leu Asp Ile
290 295 300
Val Ala Ile Trp Pro Ser Leu Tyr Pro Asp Asp Tyr Thr Ser Gln Thr
305 310 315 320
Ser Leu Glu Gln Thr Arg Val Thr Phe Ser Asn Met Val Gly Gln Glu
325 330 335
Glu Gly Thr Asp Gly Thr Val Thr Ile Tyr Asn Thr Phe Asp Ser Asp
340 345 350
Ser Tyr Arg His Lys Ala Ile Pro Asn Asn Asp Val Asn Leu Leu Ser
355 360 365
Tyr Phe Pro Asp Glu Leu Gln Asn Val Gln Leu Ala Leu Tyr Thr Pro
370 375 380
Ser Lys Lys Asp Ser Gly Tyr Thr Tyr Pro Tyr Ala Phe Ile Ser Asn
385 390 395 400
Tyr Gln Tyr Ser Arg Tyr Gln Tyr Gly Asp Asn Ala Pro Glu Gly Pro
405 410 415
Leu Ser Thr Leu Ser Ala Pro Ile Gln Ser Ile Asn Ala Ala Thr Gln
420 425 430
Asn Thr Lys Tyr Leu Asp Gly Glu Thr Ile Asn Gly Ile Gly Ala Asn
435 440 445
Leu Pro Gly Tyr Cys Thr Ser Asp Cys Ser Pro Thr Gln Gln Pro Phe
450 455 460
Ser Cys Thr Ser Thr Val Asn Gln Phe Lys Gln Ser Cys Asn Pro Thr
465 470 475 480
Asp Thr Asn Gln Lys Ile Asn Ala Leu Tyr Ala Phe Thr Gln Thr Asn
485 490 495
Val Lys Gly Asn Gln Gly Lys Leu Gly Leu Leu Ala Ser His Val Pro
500 505 510
Tyr Asp Leu Asn Pro Lys Asn Ile Phe Gly Glu Leu Asp Pro Asp Thr
515 520 525
Asn Asn Val Ile Leu Lys Gly Ile Pro Ala Glu Lys Gly Tyr Phe Ser
530 535 540
Asn Asn Thr Arg Pro Asn Ile Val Lys Glu Trp Ile Asn Gly Ala Asn
545 550 555 560
Ala Val Pro Leu Asp Ser Gly Asn Thr Leu Phe Met Thr Ala Thr Asn
565 570 575
Val Thr Ala Thr Gln Tyr Lys Ile Arg Ile Arg Tyr Ala Asn Pro Asn
580 585 590
Ser Asn Thr Gln Ile Gly Val Gln Ile Ser Gln Asn Gly Ser Ile Ile
595 600 605
Ser Asn Ser Asn Leu Thr Leu Tyr Ser Thr Thr Asp Met Asn Asn Thr
610 615 620
Leu Pro Leu Asn Val Tyr Val Thr Gly Glu Asn Gly Asn Tyr Thr Leu
625 630 635 640
Leu Asp Leu Tyr Ser Thr Thr Asn Val Leu Ser Thr Gly Asp Ile Thr
645 650 655
Leu Lys Leu Thr Gly Gly Asp Gln Lys Ile Phe Ile Asp Arg Ile Glu
660 665 670
Phe Val Pro Thr Met Pro Val Pro Gly Asn Thr Asn Asn Asn Asn Gly
675 680 685
Asp Asn Gly Asn Asn Asn Pro Val His His Val Cys Ala Ile Ala Gly
690 695 700
Thr Gln Gln Ser Cys Ser Gly Pro Pro Lys Phe Glu Gln Val Ser Asp
705 710 715 720
Leu Glu Lys Ile Thr Thr Gln Val Tyr Met Leu Phe Lys Ser Ser Pro
725 730 735
Tyr Glu Glu Leu Ala Pro Glu Val Ser Ser Tyr Gln Ile Ser Gln Val
740 745 750
Ala Leu Lys Val Met Ala Leu Ser Asp Glu Leu Phe Cys Lys Glu Lys
755 760 765
Ser Leu Leu Arg Lys Leu Val Asn Lys Ala Lys Gln Leu Leu Glu Ala
770 775 780
Ser Asn Leu Leu Val Gly Gly Asn Phe Glu Thr Thr Gln Asn Trp Val
785 790 795 800
Leu Gly Thr Asn Ala Tyr Ile Asn Tyr Asp Ser Phe Leu Phe Asn Gly
805 810 815
Asn Tyr Leu Ser Leu Gln Pro Ala Ser Gly Phe Phe Thr Ser Tyr Ala
820 825 830
Tyr Gln Lys Ile Asp Glu Ser Thr Leu Lys Pro Tyr Thr Arg Tyr Lys
835 840 845
Val Ser Gly Phe Ile Gly Gln Ser Asn Gln Val Glu Leu Ile Ile Ser
850 855 860
Arg Tyr Gly Lys Glu Ile Asp Lys Ile Leu Asn Val Pro Tyr Ala Gly
865 870 875 880
Pro Leu Pro Ile Thr Ala Asn Ala Leu Ile Thr Cys Cys Ala Pro Glu
885 890 895
Asn Arg Pro Met
900
<210> 126
<211> 676
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 126
Met Asp Cys Asn Leu Gln Ser Gln Gln Asn Ile Pro Tyr Asn Val Leu
1 5 10 15
Ala Ile Pro Val Ser Asn Val Asn Ser Leu Thr Asp Thr Ile Gly Asp
20 25 30
Leu Lys Lys Ala Trp Glu Glu Phe Gln Lys Thr Gly Ser Phe Ser Leu
35 40 45
Thr Ala Leu Gln Gln Gly Phe Asn Ala Ala Gln Gly Gly Thr Phe Asn
50 55 60
Tyr Leu Thr Leu Leu Gln Ser Gly Ile Ser Leu Ala Gly Ser Phe Val
65 70 75 80
Pro Gly Gly Thr Phe Val Ala Pro Ile Ile Asn Met Val Ile Gly Trp
85 90 95
Leu Trp Pro His Lys Asn Lys Asn Ala Asp Thr Glu Asn Leu Ile Asn
100 105 110
Leu Ile Asp Ser Glu Ile Gln Lys Gln Leu Asn Lys Ala Leu Leu Asp
115 120 125
Gln Asp Arg Gln Asp Trp Ile Ser Tyr Leu Glu Ser Ile Phe Asp Ser
130 135 140
Ser Asn Asn Leu Asn Gly Ala Ile Ile Asp Ala Gln Trp Ser Gly Thr
145 150 155 160
Val Asn Thr Thr Asn Arg Thr Leu Arg Asn Pro Thr Glu Ser Asp Tyr
165 170 175
Leu Asn Val Val Thr Asn Phe Ile Ala Ala Asp Gly Asp Ile Ser Ser
180 185 190
Asn Glu His His Ile Met Asn Gly Asn Phe Asp Val Ala Ala Ala Pro
195 200 205
Tyr Phe Val Ile Gly Ala Thr Ala Arg Phe Ala Thr Met Gln Ser Tyr
210 215 220
Ile Lys Phe Cys Asn Ala Trp Ile Asp Lys Val Gly Leu Ser Asp Ser
225 230 235 240
Gln Leu Thr Thr Gln Lys Ala Asn Leu Asp Arg Thr Lys Gln Thr Met
245 250 255
Arg Asn Ala Ile Leu Ser Tyr Thr Gln Gln Val Met Lys Val Phe Lys
260 265 270
Asp Pro Lys Asn Met Pro Thr Ile Asp Thr Asn Lys Phe Ser Val Asp
275 280 285
Thr Tyr Asn Val Tyr Val Lys Gly Met Thr Leu Asn Val Leu Asp Ile
290 295 300
Val Ala Ile Trp Pro Ser Leu Tyr Pro Asp Asp Tyr Thr Ser Gln Thr
305 310 315 320
Ser Leu Glu Gln Thr Arg Val Thr Phe Ser Asn Met Val Gly Gln Glu
325 330 335
Glu Gly Thr Asp Gly Thr Val Thr Ile Tyr Asn Thr Phe Asp Ser Asp
340 345 350
Ser Tyr Arg His Lys Ala Ile Pro Asn Asn Asp Val Asn Leu Leu Ser
355 360 365
Tyr Phe Pro Asp Glu Leu Gln Asn Val Gln Leu Ala Leu Tyr Thr Pro
370 375 380
Ser Lys Lys Asp Ser Gly Tyr Thr Tyr Pro Tyr Ala Phe Ile Ser Asn
385 390 395 400
Tyr Gln Tyr Ser Arg Tyr Gln Tyr Gly Asp Asn Ala Pro Glu Gly Pro
405 410 415
Leu Ser Thr Leu Ser Ala Pro Ile Gln Ser Ile Asn Ala Ala Thr Gln
420 425 430
Asn Thr Lys Tyr Leu Asp Gly Glu Thr Ile Asn Gly Ile Gly Ala Asn
435 440 445
Leu Pro Gly Tyr Cys Thr Ser Asp Cys Ser Pro Thr Gln Gln Pro Phe
450 455 460
Ser Cys Thr Ser Thr Val Asn Gln Phe Lys Gln Ser Cys Asn Pro Thr
465 470 475 480
Asp Thr Asn Gln Lys Ile Asn Ala Leu Tyr Ala Phe Thr Gln Thr Asn
485 490 495
Val Lys Gly Asn Gln Gly Lys Leu Gly Leu Leu Ala Ser His Val Pro
500 505 510
Tyr Asp Leu Asn Pro Lys Asn Ile Phe Gly Glu Leu Asp Pro Asp Thr
515 520 525
Asn Asn Val Ile Leu Lys Gly Ile Pro Ala Glu Lys Gly Tyr Phe Ser
530 535 540
Asn Asn Thr Arg Pro Asn Ile Val Lys Glu Trp Ile Asn Gly Ala Asn
545 550 555 560
Ala Val Pro Leu Asp Ser Gly Asn Thr Leu Phe Met Thr Ala Thr Asn
565 570 575
Val Thr Ala Thr Gln Tyr Lys Ile Arg Ile Arg Tyr Ala Asn Pro Asn
580 585 590
Ser Asn Thr Gln Ile Gly Val Gln Ile Ser Gln Asn Gly Ser Ile Ile
595 600 605
Ser Asn Ser Asn Leu Thr Leu Tyr Ser Thr Thr Asp Met Asn Asn Thr
610 615 620
Leu Pro Leu Asn Val Tyr Val Thr Gly Glu Asn Gly Asn Tyr Thr Leu
625 630 635 640
Leu Asp Leu Tyr Ser Thr Thr Asn Val Leu Ser Thr Gly Asp Ile Thr
645 650 655
Leu Lys Leu Thr Gly Gly Asp Gln Lys Ile Phe Ile Asp Arg Ile Glu
660 665 670
Phe Val Pro Thr
675
<210> 127
<211> 662
<212> PRT
<213> Неизвестная
<220>
<223> Неизвестный организм из образца окружающей среды
<400> 127
Met Gly Gly Leu Leu Met Asn Gln Tyr Tyr Asn Asn Asn Glu Tyr Glu
1 5 10 15
Ile Leu Asp Asn Gly Val Gln Cys Cys Ser Pro Arg Tyr Pro Leu Ala
20 25 30
Gln Ala Pro Gly Ser Glu Trp Gln Asn Met Asn Tyr Gln Asp Val Met
35 40 45
Asn Thr Ser Val Gly Arg Glu Tyr Gln Ala Val Gln Gln Val Asn Val
50 55 60
Gly Glu Ala Val Gly Ala Ala Leu Gly Ile Leu Thr Thr Ile Leu Lys
65 70 75 80
Ala Val Asn Pro Thr Leu Gly Thr Ala Ala Gly Val Ile Ser Ser Ile
85 90 95
Phe Gly Phe Leu Trp Lys Arg Phe Gly Thr Asp Pro Gln Ala Gln Trp
100 105 110
Lys Gln Phe Met Glu Ala Val Glu Tyr Leu Val Ser Gln Lys Ile Thr
115 120 125
Asp Ala Val Arg Ser Lys Ala Val Ser Glu Leu Glu Gly Val Gln Arg
130 135 140
Ala Val Glu Leu Tyr Gln Glu Ala Ala Asn Ala Trp Asn Met Asn Pro
145 150 155 160
Asp Asp Ala Ala Ala Lys Glu Arg Ile Arg Arg Gln Tyr Thr Ser Thr
165 170 175
Asn Thr Val Ile Glu Tyr Ala Met Pro Ser Phe Arg Val Gly Ser Phe
180 185 190
Glu Val Pro Leu Leu Thr Val Tyr Ala Gln Ala Ala Asn Leu His Leu
195 200 205
Leu Leu Leu Arg Asp Ala Val Lys Phe Gly Ala Gly Trp Gly Phe Ser
210 215 220
Pro Thr Glu Val Glu Asp Asn Tyr Thr Arg Leu Gln Ala Arg Thr Ala
225 230 235 240
Glu Tyr Thr Asn His Cys Thr Asn Thr Tyr Asp Lys Gly Leu Lys Gln
245 250 255
Ala Tyr Asp Leu Ala Pro Asn Pro Thr Asp Tyr Asn Lys Tyr Pro Tyr
260 265 270
Leu Asn Pro Tyr Ser Lys Asn Pro Ile Tyr Gly Lys Tyr Tyr Thr Ala
275 280 285
Pro Val Asp Trp Asn Leu Phe Asn Asp Phe Arg Arg Asp Met Thr Leu
290 295 300
Met Val Leu Asp Ile Val Ala Val Trp Pro Thr Tyr Asn Pro Arg Leu
305 310 315 320
Tyr Asn Asn Pro Asn Gly Val Gln Ile Gln Leu Ser Arg Glu Val Tyr
325 330 335
Ser Thr Val Tyr Gly Arg Gly Trp Ser Asn Asn Ser Thr Val Asp Ala
340 345 350
Ile Glu Ser Thr Leu Val Arg Pro Pro His Leu Val Thr Glu Leu Thr
355 360 365
Lys Leu Thr Phe Asp Glu Arg Asn Leu Tyr Glu Ala Glu Thr Val Pro
370 375 380
Val Ala Phe Arg Lys Val Thr Asn Thr Leu His Tyr Val Gly Ser Ser
385 390 395 400
Thr Thr Trp Glu Gln Ser Phe Ser Ala Thr Pro Val Gly Ser Leu Lys
405 410 415
Ala Val His Asn Val Leu Ala Thr Asp Ile Gly Asn Leu Ala Leu Ser
420 425 430
Leu Gly Ala Val Pro Leu Gly Phe Ser Phe Tyr Asn Lys Asn Asp Gln
435 440 445
His Ile Thr Thr Val Gly Tyr Ser Gly Gly Trp Trp Asn Gly Ile Pro
450 455 460
Lys Asp Glu Gly Ser Asn Gln Asn Ser His His Leu Ser Tyr Val Ala
465 470 475 480
Ala Leu Glu Thr Gln Thr Thr Ala Gly Trp Phe Pro Thr Tyr Pro Val
485 490 495
Pro Leu Leu Gly Glu Trp Gly Phe Gly Trp Gln His Asn Ser Leu Lys
500 505 510
Tyr Thr Asn Arg Leu Val Thr Asn Gln Ile Asn Gln Leu Pro Ala Val
515 520 525
Lys Ala Ser Ala Leu Val Asn His Ala Arg Val Ser Lys Gly Thr Thr
530 535 540
Gly Thr Gly Gly Asn Ile Ile Glu Leu Val Asn Pro Asn Cys Gly Phe
545 550 555 560
Ile Phe Asn Phe Tyr Ala Glu Pro Glu Asn Pro Gln Gly Gln Ala Phe
565 570 575
Asn Ile Arg Ile Arg Tyr Ser Ala Thr Val Pro Gly Lys Leu Asn Ile
580 585 590
Arg His Leu Glu Ser Gly Lys Glu Phe Met Asn Thr Pro Arg Asp Phe
595 600 605
Lys Gly Thr Thr Thr Gly Thr Asn Trp Ile Pro Lys Phe Gln Glu Tyr
610 615 620
Gln Tyr Leu Asp Leu Gly Pro Ile Val Leu Arg Thr Gly Met Asn Tyr
625 630 635 640
Gly Phe Lys Ile Glu Leu Ala Ser Gly Gln Leu Val Ser Ile Asp Lys
645 650 655
Ile Glu Phe Leu Pro Phe
660
<210> 128
<211> 657
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 128
Met Asn Gln Tyr Tyr Asn Asn Asn Glu Tyr Glu Ile Leu Asp Asn Gly
1 5 10 15
Val Gln Cys Cys Ser Pro Arg Tyr Pro Leu Ala Gln Ala Pro Gly Ser
20 25 30
Glu Trp Gln Asn Met Asn Tyr Gln Asp Val Met Asn Thr Ser Val Gly
35 40 45
Arg Glu Tyr Gln Ala Val Gln Gln Val Asn Val Gly Glu Ala Val Gly
50 55 60
Ala Ala Leu Gly Ile Leu Thr Thr Ile Leu Lys Ala Val Asn Pro Thr
65 70 75 80
Leu Gly Thr Ala Ala Gly Val Ile Ser Ser Ile Phe Gly Phe Leu Trp
85 90 95
Lys Arg Phe Gly Thr Asp Pro Gln Ala Gln Trp Lys Gln Phe Met Glu
100 105 110
Ala Val Glu Tyr Leu Val Ser Gln Lys Ile Thr Asp Ala Val Arg Ser
115 120 125
Lys Ala Val Ser Glu Leu Glu Gly Val Gln Arg Ala Val Glu Leu Tyr
130 135 140
Gln Glu Ala Ala Asn Ala Trp Asn Met Asn Pro Asp Asp Ala Ala Ala
145 150 155 160
Lys Glu Arg Ile Arg Arg Gln Tyr Thr Ser Thr Asn Thr Val Ile Glu
165 170 175
Tyr Ala Met Pro Ser Phe Arg Val Gly Ser Phe Glu Val Pro Leu Leu
180 185 190
Thr Val Tyr Ala Gln Ala Ala Asn Leu His Leu Leu Leu Leu Arg Asp
195 200 205
Ala Val Lys Phe Gly Ala Gly Trp Gly Phe Ser Pro Thr Glu Val Glu
210 215 220
Asp Asn Tyr Thr Arg Leu Gln Ala Arg Thr Ala Glu Tyr Thr Asn His
225 230 235 240
Cys Thr Asn Thr Tyr Asp Lys Gly Leu Lys Gln Ala Tyr Asp Leu Ala
245 250 255
Pro Asn Pro Thr Asp Tyr Asn Lys Tyr Pro Tyr Leu Asn Pro Tyr Ser
260 265 270
Lys Asn Pro Ile Tyr Gly Lys Tyr Tyr Thr Ala Pro Val Asp Trp Asn
275 280 285
Leu Phe Asn Asp Phe Arg Arg Asp Met Thr Leu Met Val Leu Asp Ile
290 295 300
Val Ala Val Trp Pro Thr Tyr Asn Pro Arg Leu Tyr Asn Asn Pro Asn
305 310 315 320
Gly Val Gln Ile Gln Leu Ser Arg Glu Val Tyr Ser Thr Val Tyr Gly
325 330 335
Arg Gly Trp Ser Asn Asn Ser Thr Val Asp Ala Ile Glu Ser Thr Leu
340 345 350
Val Arg Pro Pro His Leu Val Thr Glu Leu Thr Lys Leu Thr Phe Asp
355 360 365
Glu Arg Asn Leu Tyr Glu Ala Glu Thr Val Pro Val Ala Phe Arg Lys
370 375 380
Val Thr Asn Thr Leu His Tyr Val Gly Ser Ser Thr Thr Trp Glu Gln
385 390 395 400
Ser Phe Ser Ala Thr Pro Val Gly Ser Leu Lys Ala Val His Asn Val
405 410 415
Leu Ala Thr Asp Ile Gly Asn Leu Ala Leu Ser Leu Gly Ala Val Pro
420 425 430
Leu Gly Phe Ser Phe Tyr Asn Lys Asn Asp Gln His Ile Thr Thr Val
435 440 445
Gly Tyr Ser Gly Gly Trp Trp Asn Gly Ile Pro Lys Asp Glu Gly Ser
450 455 460
Asn Gln Asn Ser His His Leu Ser Tyr Val Ala Ala Leu Glu Thr Gln
465 470 475 480
Thr Thr Ala Gly Trp Phe Pro Thr Tyr Pro Val Pro Leu Leu Gly Glu
485 490 495
Trp Gly Phe Gly Trp Gln His Asn Ser Leu Lys Tyr Thr Asn Arg Leu
500 505 510
Val Thr Asn Gln Ile Asn Gln Leu Pro Ala Val Lys Ala Ser Ala Leu
515 520 525
Val Asn His Ala Arg Val Ser Lys Gly Thr Thr Gly Thr Gly Gly Asn
530 535 540
Ile Ile Glu Leu Val Asn Pro Asn Cys Gly Phe Ile Phe Asn Phe Tyr
545 550 555 560
Ala Glu Pro Glu Asn Pro Gln Gly Gln Ala Phe Asn Ile Arg Ile Arg
565 570 575
Tyr Ser Ala Thr Val Pro Gly Lys Leu Asn Ile Arg His Leu Glu Ser
580 585 590
Gly Lys Glu Phe Met Asn Thr Pro Arg Asp Phe Lys Gly Thr Thr Thr
595 600 605
Gly Thr Asn Trp Ile Pro Lys Phe Gln Glu Tyr Gln Tyr Leu Asp Leu
610 615 620
Gly Pro Ile Val Leu Arg Thr Gly Met Asn Tyr Gly Phe Lys Ile Glu
625 630 635 640
Leu Ala Ser Gly Gln Leu Val Ser Ile Asp Lys Ile Glu Phe Leu Pro
645 650 655
Phe
<210> 129
<211> 1018
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 129
Met Asn Gln Asn Tyr Asn Asp Glu Tyr Glu Ile Met Asn Thr Gly Val
1 5 10 15
Met Gly Tyr Gln Ser Arg Tyr Pro Leu Ala Lys Thr Pro Gly Ser Glu
20 25 30
Ile Gln Gln Met Asn Tyr Lys Asp Trp Met Asp Met Tyr Thr His Gly
35 40 45
Glu Ser Gly Glu Thr Phe Ile Ser Ala Arg Asp Gly Val Ile Ile Gly
50 55 60
Thr Gly Ile Gly Trp Ala Ile Leu Gly Phe Val Pro Val Leu Gly Pro
65 70 75 80
Gly Leu Ser Ala Ile Ser Gly Ile Leu Asn Val Leu Leu Pro Ile Leu
85 90 95
Trp Pro Glu Asp Ala Val Thr Ala Glu Ser Gln Val Ser Trp Asp Lys
100 105 110
Leu Met Arg Thr Ala Glu Glu Ile Ala Asn Lys Ala Ile Asp Ala Gln
115 120 125
Val Arg Ala Glu Ala Ile Thr Glu Leu Gln Gly Ile Gln Glu Ala Ile
130 135 140
Gln Leu Tyr His Gly Ala Val Cys Asp Trp Lys Lys Ala Pro Thr Asn
145 150 155 160
Val Arg Leu Gln Glu Thr Val Arg Thr Gln Phe Ile Ala Thr Asn Thr
165 170 175
Val Ile Phe Asn Arg Met Pro Ser Phe Arg Val Gln Gly Phe Glu Thr
180 185 190
Ser Leu Leu Ser Thr Tyr Ala Gln Ala Ala Asn Leu His Leu Ala Phe
195 200 205
Leu Arg Asp Gly Val Gln Phe Gly Thr Glu Trp Gly Leu Asp Pro Thr
210 215 220
Thr Val Asp Arg Tyr Tyr Gly Tyr Leu Thr Ala Asn Thr Ala Ser Tyr
225 230 235 240
Thr Asn Tyr Cys Val Arg Trp Tyr Asp Lys Gly Leu Ser Asp Leu Arg
245 250 255
Thr Thr Asn Asn Trp Asn Lys Tyr Asn Asn Phe Arg Arg Asp Met Thr
260 265 270
Ile Met Ala Met Asp Leu Val Ser Leu Trp Pro Thr Tyr Asp Pro Lys
275 280 285
Arg Tyr Pro Thr Phe Thr Lys Ser Gln Leu Thr Arg Thr Val Tyr Thr
290 295 300
Pro Trp Ile Gly His Ile Lys Asn Arg Trp Met Gly His Pro Gln Glu
305 310 315 320
Val Pro Phe Ser Glu Ile Glu Ser Asn Leu Ile Asp Ile Pro Arg Leu
325 330 335
Phe Ala Trp Leu Arg Glu Leu Ile Val Tyr Ser Val Asp Pro Gln Arg
340 345 350
Arg Gly Tyr Ser Thr Leu Val Cys Gly Arg Lys Gln Arg Phe Gln Asn
355 360 365
Thr Leu Ser Asn Asn Leu Trp Asp Gly Gly Met Lys Gly Ser His Gly
370 375 380
Glu Glu Pro Pro Gln Thr Leu Thr Ile Pro Ser Pro Gln Ser Lys Asp
385 390 395 400
Asp Ile Trp Lys Ile Asn Thr Thr Ser Thr Leu Met Ala Gln Gly Pro
405 410 415
Glu Asn Thr Gln Ile Lys Gly Trp Asp Phe Ser Phe Thr Asn Ser Gln
420 425 430
Thr Gln Thr Ile Ser Thr Ile Tyr Gln Gly Gln Glu Ser Leu Val Tyr
435 440 445
Ala Val Ser Gly Leu Pro Cys Arg Ser Ser Tyr Asn Leu Cys Asp Pro
450 455 460
Cys Asp Pro Asp Cys Lys Val Asp Ile Leu Thr Pro Gly Asp Pro Cys
465 470 475 480
Asn Asp Lys Leu Leu Tyr Ser His Arg Phe Ala Tyr Leu Gly Ala Gly
485 490 495
Ile Asp Pro Tyr Met Gly Tyr Pro Gly Arg Ala Gly Gly Tyr Gly Tyr
500 505 510
Tyr Ser Tyr Gly Trp Thr His Ile Ser Ala Asp Ala Asn Asn Leu Ile
515 520 525
Asp Thr Glu Lys Ile Thr Gln Ile Pro Ala Val Lys Ala Ser Gly Gly
530 535 540
Thr Asp Tyr Gln Val Ile Arg Gly Pro Gly Ser Thr Gly Gly Asp Leu
545 550 555 560
Val Ser Leu Ala Thr Asp Ala Arg Ile Glu Leu Lys Leu Thr Ala Ser
565 570 575
Ile Ala Lys Tyr Tyr Gln Met Arg Ile Arg Tyr Ala Ser Pro Val Gln
580 585 590
Thr Arg Leu Arg Leu Glu Thr Tyr Gln Asp Asp Ile Ser Gly Gly Pro
595 600 605
Val Asn Tyr Asp Ile Pro Ser Thr Pro Tyr Ser Gly Asn Gln Asn Glu
610 615 620
Leu Ser Tyr Asn Ala Phe Gly Tyr Lys His Val Met Asn Val Tyr Ile
625 630 635 640
Ser Leu Thr Gly Thr Lys Ile Ser Ile Gln Arg Val Asp Pro Phe Asp
645 650 655
Tyr Pro Phe Ile Ile Asp Lys Ile Glu Phe Ile Pro Ile Glu Gly Ser
660 665 670
Leu Glu Ala Tyr Gln Ala Asp Gln Asp Leu Glu Lys Ala Arg Lys Lys
675 680 685
Val Asn Ala Leu Phe Met Ser Asp Ala Lys Asp Val Leu Lys Leu Asn
690 695 700
Val Thr Asp Tyr Ala Leu Asp Gln Ala Ala Asn Leu Val Glu Cys Leu
705 710 715 720
Ser Asp Glu Phe Cys Ala Gln Glu Lys Met Ile Leu Leu Asp Gln Val
725 730 735
Lys Phe Ala Lys Arg Leu Ser Gln Ser Arg Asn Leu Leu Asn Tyr Gly
740 745 750
Asp Phe Glu Ser Pro Tyr Trp Ser Gly Glu Asn Gly Trp Lys Thr Ser
755 760 765
Pro His Ile His Val Ala Ser Gly Asn Pro Ile Phe Lys Gly His Tyr
770 775 780
Leu His Met Pro Gly Ala Asn Gln Pro Gln Thr Ser Gly Thr Val Tyr
785 790 795 800
Pro Thr Tyr Ile Tyr Gln Lys Val Asp Glu Ser Lys Leu Lys Pro Tyr
805 810 815
Thr Arg Tyr His Val Arg Gly Phe Val Gly Asn Ser Lys Asp Leu Glu
820 825 830
Leu Leu Val Glu Arg Tyr Gly Lys Glu Ile His Val Glu Met Asp Val
835 840 845
Pro Asn Asp Ile Arg Tyr Thr Leu Pro Met Asn Glu Cys Gly Gly Phe
850 855 860
Glu Arg Cys Ser His Glu Pro His His Thr Cys Thr Cys Lys Asp Thr
865 870 875 880
Ala Arg Val Asp Thr Gly Cys Gln Cys Gln Asp Lys Met Asn Arg Met
885 890 895
Thr Thr Gly Val Tyr Thr Asn Ile Pro Thr Ala Ser Glu Met Tyr Pro
900 905 910
Asn Gly Tyr Leu Val His Lys Ser Cys Gly Cys Lys Asp Pro His Val
915 920 925
Phe Ser Phe His Ile Asp Thr Gly Cys Val Asp Leu Lys Glu Asn Leu
930 935 940
Gly Leu Leu Phe Ala Phe Lys Ile Ser Ser Thr Asp Gly Val Ala Asn
945 950 955 960
Val Asp Asn Leu Glu Ile Ile Glu Gly Gln Pro Leu Thr Gly Glu Ala
965 970 975
Leu Ala Arg Val Lys Lys Arg Glu His Lys Trp Lys Glu Thr Met Lys
980 985 990
Gln Lys Arg Cys Lys Thr Asp Glu Ala Val Gln Ala Val Gln Thr Ala
995 1000 1005
Ile Asn Ala Leu Phe Thr Asn Ala Gln Tyr
1010 1015
<210> 130
<211> 669
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 130
Met Asn Gln Asn Tyr Asn Asp Glu Tyr Glu Ile Met Asn Thr Gly Val
1 5 10 15
Met Gly Tyr Gln Ser Arg Tyr Pro Leu Ala Lys Thr Pro Gly Ser Glu
20 25 30
Ile Gln Gln Met Asn Tyr Lys Asp Trp Met Asp Met Tyr Thr His Gly
35 40 45
Glu Ser Gly Glu Thr Phe Ile Ser Ala Arg Asp Gly Val Ile Ile Gly
50 55 60
Thr Gly Ile Gly Trp Ala Ile Leu Gly Phe Val Pro Val Leu Gly Pro
65 70 75 80
Gly Leu Ser Ala Ile Ser Gly Ile Leu Asn Val Leu Leu Pro Ile Leu
85 90 95
Trp Pro Glu Asp Ala Val Thr Ala Glu Ser Gln Val Ser Trp Asp Lys
100 105 110
Leu Met Arg Thr Ala Glu Glu Ile Ala Asn Lys Ala Ile Asp Ala Gln
115 120 125
Val Arg Ala Glu Ala Ile Thr Glu Leu Gln Gly Ile Gln Glu Ala Ile
130 135 140
Gln Leu Tyr His Gly Ala Val Cys Asp Trp Lys Lys Ala Pro Thr Asn
145 150 155 160
Val Arg Leu Gln Glu Thr Val Arg Thr Gln Phe Ile Ala Thr Asn Thr
165 170 175
Val Ile Phe Asn Arg Met Pro Ser Phe Arg Val Gln Gly Phe Glu Thr
180 185 190
Ser Leu Leu Ser Thr Tyr Ala Gln Ala Ala Asn Leu His Leu Ala Phe
195 200 205
Leu Arg Asp Gly Val Gln Phe Gly Thr Glu Trp Gly Leu Asp Pro Thr
210 215 220
Thr Val Asp Arg Tyr Tyr Gly Tyr Leu Thr Ala Asn Thr Ala Ser Tyr
225 230 235 240
Thr Asn Tyr Cys Val Arg Trp Tyr Asp Lys Gly Leu Ser Asp Leu Arg
245 250 255
Thr Thr Asn Asn Trp Asn Lys Tyr Asn Asn Phe Arg Arg Asp Met Thr
260 265 270
Ile Met Ala Met Asp Leu Val Ser Leu Trp Pro Thr Tyr Asp Pro Lys
275 280 285
Arg Tyr Pro Thr Phe Thr Lys Ser Gln Leu Thr Arg Thr Val Tyr Thr
290 295 300
Pro Trp Ile Gly His Ile Lys Asn Arg Trp Met Gly His Pro Gln Glu
305 310 315 320
Val Pro Phe Ser Glu Ile Glu Ser Asn Leu Ile Asp Ile Pro Arg Leu
325 330 335
Phe Ala Trp Leu Arg Glu Leu Ile Val Tyr Ser Val Asp Pro Gln Arg
340 345 350
Arg Gly Tyr Ser Thr Leu Val Cys Gly Arg Lys Gln Arg Phe Gln Asn
355 360 365
Thr Leu Ser Asn Asn Leu Trp Asp Gly Gly Met Lys Gly Ser His Gly
370 375 380
Glu Glu Pro Pro Gln Thr Leu Thr Ile Pro Ser Pro Gln Ser Lys Asp
385 390 395 400
Asp Ile Trp Lys Ile Asn Thr Thr Ser Thr Leu Met Ala Gln Gly Pro
405 410 415
Glu Asn Thr Gln Ile Lys Gly Trp Asp Phe Ser Phe Thr Asn Ser Gln
420 425 430
Thr Gln Thr Ile Ser Thr Ile Tyr Gln Gly Gln Glu Ser Leu Val Tyr
435 440 445
Ala Val Ser Gly Leu Pro Cys Arg Ser Ser Tyr Asn Leu Cys Asp Pro
450 455 460
Cys Asp Pro Asp Cys Lys Val Asp Ile Leu Thr Pro Gly Asp Pro Cys
465 470 475 480
Asn Asp Lys Leu Leu Tyr Ser His Arg Phe Ala Tyr Leu Gly Ala Gly
485 490 495
Ile Asp Pro Tyr Met Gly Tyr Pro Gly Arg Ala Gly Gly Tyr Gly Tyr
500 505 510
Tyr Ser Tyr Gly Trp Thr His Ile Ser Ala Asp Ala Asn Asn Leu Ile
515 520 525
Asp Thr Glu Lys Ile Thr Gln Ile Pro Ala Val Lys Ala Ser Gly Gly
530 535 540
Thr Asp Tyr Gln Val Ile Arg Gly Pro Gly Ser Thr Gly Gly Asp Leu
545 550 555 560
Val Ser Leu Ala Thr Asp Ala Arg Ile Glu Leu Lys Leu Thr Ala Ser
565 570 575
Ile Ala Lys Tyr Tyr Gln Met Arg Ile Arg Tyr Ala Ser Pro Val Gln
580 585 590
Thr Arg Leu Arg Leu Glu Thr Tyr Gln Asp Asp Ile Ser Gly Gly Pro
595 600 605
Val Asn Tyr Asp Ile Pro Ser Thr Pro Tyr Ser Gly Asn Gln Asn Glu
610 615 620
Leu Ser Tyr Asn Ala Phe Gly Tyr Lys His Val Met Asn Val Tyr Ile
625 630 635 640
Ser Leu Thr Gly Thr Lys Ile Ser Ile Gln Arg Val Asp Pro Phe Asp
645 650 655
Tyr Pro Phe Ile Ile Asp Lys Ile Glu Phe Ile Pro Ile
660 665
<210> 131
<211> 1018
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 131
Met Asn Gln Asn Tyr Asn Asp Glu Tyr Glu Ile Met Asn Thr Gly Val
1 5 10 15
Met Gly Tyr Gln Ser Arg Tyr Pro Leu Ala Lys Thr Pro Gly Ser Glu
20 25 30
Ile Gln Gln Met Asn Tyr Lys Asp Trp Met Asp Met Tyr Thr His Gly
35 40 45
Glu Ser Gly Glu Thr Phe Ile Ser Ala Arg Asp Gly Val Ile Ile Gly
50 55 60
Thr Gly Ile Gly Trp Ala Ile Leu Gly Phe Val Pro Val Leu Gly Pro
65 70 75 80
Gly Leu Ser Ala Ile Ser Gly Ile Leu Asn Val Leu Leu Pro Ile Leu
85 90 95
Trp Pro Glu Asp Ala Val Thr Ala Glu Ser Gln Val Ser Trp Asp Lys
100 105 110
Leu Met Arg Thr Ala Glu Glu Ile Ala Asn Lys Ala Ile Asp Ala Gln
115 120 125
Val Arg Ala Glu Ala Ile Thr Glu Leu Gln Gly Ile Gln Glu Ala Ile
130 135 140
Gln Leu Tyr His Gly Ala Val Cys Asp Trp Lys Lys Ala Pro Thr Asn
145 150 155 160
Val Arg Leu Gln Glu Thr Val Arg Thr Gln Phe Ile Ala Thr Asn Thr
165 170 175
Val Ile Phe Asn Arg Met Pro Ser Phe Arg Val Gln Gly Phe Glu Thr
180 185 190
Ser Leu Leu Ser Thr Tyr Ala Gln Ala Ala Asn Leu His Leu Ala Phe
195 200 205
Leu Arg Asp Gly Val Gln Phe Gly Thr Glu Trp Gly Leu Asp Pro Thr
210 215 220
Thr Val Asp Arg Tyr Tyr Gly Tyr Leu Thr Ala Asn Thr Ala Ser Tyr
225 230 235 240
Thr Asn Tyr Cys Val Arg Trp Tyr Asp Lys Gly Leu Ser Asp Leu Arg
245 250 255
Thr Thr Asn Asn Trp Asn Lys Tyr Asn Asn Phe Arg Arg Asp Met Thr
260 265 270
Ile Met Ala Met Asp Leu Val Ser Leu Trp Pro Thr Tyr Asp Pro Lys
275 280 285
Arg Tyr Pro Thr Phe Thr Lys Ser Gln Leu Thr Arg Thr Val Tyr Thr
290 295 300
Pro Trp Ile Gly His Ile Lys Asn Arg Trp Met Gly His Pro Gln Glu
305 310 315 320
Val Pro Phe Ser Glu Ile Glu Ser Asn Leu Ile Asp Ile Pro Arg Leu
325 330 335
Phe Ala Trp Leu Arg Glu Leu Ile Val Tyr Ser Val Asp Pro Gln Arg
340 345 350
Arg Gly Tyr Ser Thr Leu Val Cys Gly Arg Lys Gln Arg Phe Gln Asn
355 360 365
Thr Leu Ser Asn Asn Leu Trp Asp Gly Gly Met Lys Gly Ser His Gly
370 375 380
Glu Glu Pro Pro Gln Thr Leu Thr Ile Pro Ser Pro Gln Ser Lys Asp
385 390 395 400
Asp Ile Trp Lys Ile Asn Thr Thr Ser Thr Leu Met Ala Gln Gly Pro
405 410 415
Glu Asn Thr Gln Ile Lys Gly Trp Asp Phe Ser Phe Thr Asn Ser Gln
420 425 430
Thr Gln Thr Ile Ser Thr Ile Tyr Gln Gly Gln Glu Ser Leu Val Tyr
435 440 445
Ala Val Ser Gly Leu Pro Cys Arg Ser Ser Tyr Asn Leu Cys Asp Pro
450 455 460
Cys Asp Pro Asp Cys Lys Val Asp Ile Leu Thr Pro Gly Asp Pro Cys
465 470 475 480
Asn Asp Lys Leu Leu Tyr Ser His Arg Phe Ala Tyr Leu Gly Ala Gly
485 490 495
Ile Asp Pro Tyr Met Gly Tyr Pro Gly Arg Ala Gly Gly Tyr Gly Tyr
500 505 510
Tyr Ser Tyr Gly Trp Thr His Ile Ser Ala Asp Ala Asn Asn Leu Ile
515 520 525
Asp Thr Glu Lys Ile Thr Gln Ile Pro Ala Val Lys Ala Ser Gly Gly
530 535 540
Thr Asp Tyr Gln Val Ile Arg Gly Pro Gly Ser Thr Gly Gly Asp Leu
545 550 555 560
Val Ser Leu Ala Thr Asp Ala Arg Ile Glu Leu Lys Leu Thr Ala Ser
565 570 575
Ile Ala Lys Tyr Tyr Gln Met Arg Ile Arg Tyr Ala Ser Pro Val Gln
580 585 590
Thr Arg Leu Arg Leu Glu Thr Tyr Gln Asp Asp Ile Ser Gly Gly Pro
595 600 605
Val Asn Tyr Asp Ile Pro Ser Thr Pro Tyr Ser Gly Asn Gln Asn Glu
610 615 620
Leu Ser Tyr Asn Ala Phe Gly Tyr Lys His Val Met Asn Val Tyr Ile
625 630 635 640
Ser Leu Thr Gly Thr Lys Ile Ser Ile Gln Arg Val Asp Pro Phe Asp
645 650 655
Tyr Pro Phe Ile Ile Asp Lys Ile Glu Phe Ile Pro Ile Glu Gly Ser
660 665 670
Leu Glu Ala Tyr Gln Ala Asp Gln Asp Leu Glu Lys Ala Arg Lys Lys
675 680 685
Val Asn Ala Leu Phe Met Ser Asp Ala Lys Asp Val Leu Lys Leu Asn
690 695 700
Val Thr Asp Tyr Ala Leu Asp Gln Ala Ala Asn Leu Val Glu Cys Leu
705 710 715 720
Ser Asp Glu Phe Cys Ala Gln Glu Lys Ile Ile Leu Leu Asp Gln Val
725 730 735
Lys Phe Ala Lys Arg Leu Ser Gln Ser Arg Asn Leu Leu Asn Tyr Gly
740 745 750
Asp Phe Glu Ser Pro Tyr Trp Ser Gly Glu Asn Gly Trp Lys Thr Ser
755 760 765
Pro His Ile His Val Ala Ser Gly Asn Pro Ile Phe Lys Gly His Tyr
770 775 780
Leu His Met Pro Gly Ala Asn Gln Pro Gln Thr Ser Gly Thr Val Tyr
785 790 795 800
Pro Thr Tyr Ile Tyr Gln Lys Val Asp Glu Ser Lys Leu Lys Pro Tyr
805 810 815
Thr Arg Tyr His Val Arg Gly Phe Val Gly Asn Ser Lys Asp Leu Glu
820 825 830
Leu Leu Val Glu Arg Tyr Gly Lys Glu Ile His Val Glu Met Asp Val
835 840 845
Pro Asn Asp Ile Arg Tyr Thr Leu Pro Met Asn Glu Cys Gly Gly Phe
850 855 860
Glu Arg Cys Ser His Glu Pro His His Thr Cys Thr Cys Lys Asp Thr
865 870 875 880
Ala Arg Val Asp Thr Gly Cys Gln Cys Gln Asp Lys Met Asn Arg Met
885 890 895
Thr Thr Gly Val Tyr Thr Asn Ile Pro Thr Ala Ser Glu Met Tyr Pro
900 905 910
Asn Gly Tyr Leu Val His Lys Ser Cys Gly Cys Lys Asp Pro His Val
915 920 925
Phe Ser Phe His Ile Asp Thr Gly Cys Val Asp Leu Lys Glu Asn Leu
930 935 940
Gly Leu Leu Phe Ala Phe Lys Ile Ser Ser Thr Asp Gly Val Ala Asn
945 950 955 960
Val Asp Asn Leu Glu Ile Ile Glu Gly Gln Pro Leu Thr Gly Glu Ala
965 970 975
Leu Ala Arg Val Lys Lys Arg Glu His Lys Trp Lys Glu Thr Met Lys
980 985 990
Gln Lys Arg Cys Lys Thr Asp Glu Ala Val Gln Ala Val Gln Thr Ala
995 1000 1005
Ile Asn Ala Leu Phe Thr Asn Ala Gln Tyr
1010 1015
<210> 132
<211> 641
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 132
Met Lys Gly Arg Arg Pro Met Gly Asn Met Asp Ser Lys Ser Val Met
1 5 10 15
Glu Lys Lys Glu Gln Lys Ser Gln Tyr Leu Asp Ile Arg Asp Ile Cys
20 25 30
Ser Ile Asn Gly Ser Ala Lys Phe Asp Pro Asn Thr Asn Ile Thr Thr
35 40 45
Leu Thr Glu Ala Ile Asn Ser Gln Ala Gly Ala Ile Ala Gly Lys Thr
50 55 60
Ala Phe Asp Met Arg His Asp Phe Thr Leu Val Ala Asp Ile Tyr Leu
65 70 75 80
Gly Ser Lys Ser Ser Gly Ala Asp Gly Ile Ala Ile Ala Phe His Arg
85 90 95
Gly Ser Ile Gly Phe Ile Gly Gln Met Gly Gly Gly Leu Gly Ile Leu
100 105 110
Gly Ala Pro Asn Gly Ile Gly Phe Glu Ile Asp Thr Tyr Trp Lys Ala
115 120 125
Ser Ser Asp Glu Thr Gly Asp Ser Phe Gly His Gly Gln Met Asn Gly
130 135 140
Pro His Ala Gly Phe Val Ser Thr Asn Arg Asn Thr Ser Tyr Leu Thr
145 150 155 160
Ala Leu Ala Pro Met Gln Arg Ile Pro Ala Pro Asn Ser Lys Trp Arg
165 170 175
Ile Leu Thr Ile Asn Trp Asp Ala Arg Asn Asn Lys Leu Thr Ala Arg
180 185 190
Leu Gln Glu Lys Asn Asn Asp Asp Thr Thr Arg Ser Ala Ser Pro Arg
195 200 205
Tyr Gln Thr Trp Glu Leu Leu Asn Pro Ala Phe Asp Leu Asn Gln Lys
210 215 220
Tyr Thr Phe Val Ile Gly Ser Ala Thr Gly Ala Ala Asn Asn Lys His
225 230 235 240
Gln Ile Gly Val Thr Leu Phe Glu Ala Tyr Phe Thr Lys Pro Thr Ile
245 250 255
Glu Ala Asn Pro Val Asp Ile Glu Ile Gly Thr Ala Phe Asp Pro Leu
260 265 270
Lys Tyr Glu Leu Ile Gly Leu Lys Ala Thr Asp Glu Ile Asp Gly Asp
275 280 285
Ile Thr Asp Lys Ile Thr Val Glu Phe Asn Asn Val Asp Thr Ser Lys
290 295 300
Pro Gly Ala Tyr Arg Val Thr Tyr Lys Val Leu Asn Ser Tyr Glu Glu
305 310 315 320
Ser Asp Glu Lys Ile Ile Glu Val Val Val Tyr Thr Lys Pro Thr Ile
325 330 335
Ala Ala His Asp Val Ala Ile Lys Lys Asp Leu Ala Phe Asp Pro Leu
340 345 350
Asp Tyr Glu Pro Ile Glu Leu Lys Ala Thr Asp Pro Ile Asp Gly Asp
355 360 365
Ile Thr Asp Lys Ile Thr Ile Glu Ser Asn Asn Ala Asp Thr Ser Lys
370 375 380
Pro Gly Lys Tyr His Val Thr Tyr Lys Val Leu Asn Ser Tyr Glu Lys
385 390 395 400
Ser Asp Glu Lys Thr Ile Glu Ile Thr Val Tyr Thr Lys Pro Thr Leu
405 410 415
Glu Ala Tyr Asp Val Glu Ile Lys Lys Asp Thr Val Phe Asp Pro Leu
420 425 430
Asn Tyr Glu Pro Ile Gly Leu Lys Ala Thr Asp Pro Ile Asp Gly Asp
435 440 445
Ile Thr Asp Lys Ile Thr Val Glu Ser Asn Asn Val Asp Thr Ser Lys
450 455 460
Pro Gly Glu Tyr His Val Thr Tyr Lys Val Leu Asn Ser Tyr Glu Glu
465 470 475 480
Ser Asp Glu Lys Thr Ile Thr Val Met Val Pro Val Ile Asp Asp Gly
485 490 495
Trp Glu Asn Gly Asp Pro Asn Gly Trp Lys Phe Phe Ser Gly Glu Ser
500 505 510
Ile Thr Leu Glu Glu Asp Glu Glu Asn Ala Leu Asn Gly Lys Trp Val
515 520 525
Phe Tyr Ser Asp Lys His Val Ala Ile Tyr Lys Gln Val Glu Leu Glu
530 535 540
Asn Asn Ile Ser Tyr Gln Ile Thr Val Tyr Val Lys Pro Glu Asp Glu
545 550 555 560
Gly Thr Val Ala Asn His Ile Val Lys Val Ser Leu Lys Pro Asp Pro
565 570 575
Ala Ser Gly Glu Ser Gln Glu Ile Leu Asn Thr Arg Leu Leu Gly Ala
580 585 590
Glu Gln Ile Gln Lys Gly Tyr Arg Lys Leu Thr Ser Asn Pro Phe Ile
595 600 605
Pro Thr Thr Ile Glu Pro Tyr Lys Lys Pro Ile Ile Val Ile Glu Asn
610 615 620
Phe Leu Val Gly Trp Ile Gly Gly Ile Lys Ile Ile Val Glu Pro Thr
625 630 635 640
Lys
<210> 133
<211> 632
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 133
Met Asp Ser Lys Ser Val Met Glu Lys Lys Glu Gln Lys Ser Gln Tyr
1 5 10 15
Leu Asp Ile Arg Asp Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp
20 25 30
Pro Asn Thr Asn Ile Thr Thr Leu Thr Glu Ala Ile Asn Ser Gln Ala
35 40 45
Gly Ala Ile Ala Gly Lys Thr Ala Phe Asp Met Arg His Asp Phe Thr
50 55 60
Leu Val Ala Asp Ile Tyr Leu Gly Ser Lys Ser Ser Gly Ala Asp Gly
65 70 75 80
Ile Ala Ile Ala Phe His Arg Gly Ser Ile Gly Phe Ile Gly Gln Met
85 90 95
Gly Gly Gly Leu Gly Ile Leu Gly Ala Pro Asn Gly Ile Gly Phe Glu
100 105 110
Ile Asp Thr Tyr Trp Lys Ala Ser Ser Asp Glu Thr Gly Asp Ser Phe
115 120 125
Gly His Gly Gln Met Asn Gly Pro His Ala Gly Phe Val Ser Thr Asn
130 135 140
Arg Asn Thr Ser Tyr Leu Thr Ala Leu Ala Pro Met Gln Arg Ile Pro
145 150 155 160
Ala Pro Asn Ser Lys Trp Arg Ile Leu Thr Ile Asn Trp Asp Ala Arg
165 170 175
Asn Asn Lys Leu Thr Ala Arg Leu Gln Glu Lys Asn Asn Asp Asp Thr
180 185 190
Thr Arg Ser Ala Ser Pro Arg Tyr Gln Thr Trp Glu Leu Leu Asn Pro
195 200 205
Ala Phe Asp Leu Asn Gln Lys Tyr Thr Phe Val Ile Gly Ser Ala Thr
210 215 220
Gly Ala Ala Asn Asn Lys His Gln Ile Gly Val Thr Leu Phe Glu Ala
225 230 235 240
Tyr Phe Thr Lys Pro Thr Ile Glu Ala Asn Pro Val Asp Ile Glu Ile
245 250 255
Gly Thr Ala Phe Asp Pro Leu Lys Tyr Glu Leu Ile Gly Leu Lys Ala
260 265 270
Thr Asp Glu Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Phe
275 280 285
Asn Asn Val Asp Thr Ser Lys Pro Gly Ala Tyr Arg Val Thr Tyr Lys
290 295 300
Val Leu Asn Ser Tyr Glu Glu Ser Asp Glu Lys Ile Ile Glu Val Val
305 310 315 320
Val Tyr Thr Lys Pro Thr Ile Ala Ala His Asp Val Ala Ile Lys Lys
325 330 335
Asp Leu Ala Phe Asp Pro Leu Asp Tyr Glu Pro Ile Glu Leu Lys Ala
340 345 350
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Ile Glu Ser
355 360 365
Asn Asn Ala Asp Thr Ser Lys Pro Gly Lys Tyr His Val Thr Tyr Lys
370 375 380
Val Leu Asn Ser Tyr Glu Lys Ser Asp Glu Lys Thr Ile Glu Ile Thr
385 390 395 400
Val Tyr Thr Lys Pro Thr Leu Glu Ala Tyr Asp Val Glu Ile Lys Lys
405 410 415
Asp Thr Val Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
420 425 430
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Ser
435 440 445
Asn Asn Val Asp Thr Ser Lys Pro Gly Glu Tyr His Val Thr Tyr Lys
450 455 460
Val Leu Asn Ser Tyr Glu Glu Ser Asp Glu Lys Thr Ile Thr Val Met
465 470 475 480
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro Asn Gly Trp
485 490 495
Lys Phe Phe Ser Gly Glu Ser Ile Thr Leu Glu Glu Asp Glu Glu Asn
500 505 510
Ala Leu Asn Gly Lys Trp Val Phe Tyr Ser Asp Lys His Val Ala Ile
515 520 525
Tyr Lys Gln Val Glu Leu Glu Asn Asn Ile Ser Tyr Gln Ile Thr Val
530 535 540
Tyr Val Lys Pro Glu Asp Glu Gly Thr Val Ala Asn His Ile Val Lys
545 550 555 560
Val Ser Leu Lys Pro Asp Pro Ala Ser Gly Glu Ser Gln Glu Ile Leu
565 570 575
Asn Thr Arg Leu Leu Gly Ala Glu Gln Ile Gln Lys Gly Tyr Arg Lys
580 585 590
Leu Thr Ser Asn Pro Phe Ile Pro Thr Thr Ile Glu Pro Tyr Lys Lys
595 600 605
Pro Ile Ile Val Ile Glu Asn Phe Leu Val Gly Trp Ile Gly Gly Ile
610 615 620
Lys Ile Ile Val Glu Pro Thr Lys
625 630
<210> 134
<211> 632
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 134
Leu Asn Ser Lys Ser Ile Ile Glu Asn Glu Val Gln Glu Asn Gln Tyr
1 5 10 15
Ile Asp Ile Arg Asn Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp
20 25 30
Pro Asn Thr Asn Ile Thr Thr Leu Thr Glu Ala Ile Asn Ser Gln Ala
35 40 45
Gly Ala Ile Ala Gly Lys Thr Ala Leu Asp Met Arg Arg Asp Phe Thr
50 55 60
Leu Val Ala Asp Ile Tyr Leu Gly Ser Lys Ser Ser Gly Ala Asp Gly
65 70 75 80
Ile Ala Ile Ala Phe His Arg Gly Ser Ile Gly Phe Ile Gly Thr Met
85 90 95
Gly Gly Gly Leu Gly Ile Leu Gly Ala Pro Asn Gly Ile Gly Phe Glu
100 105 110
Ile Asp Thr Tyr Trp Lys Ala Ser Ser Asp Glu Thr Gly Asp Ser Phe
115 120 125
Gly His Gly Gln Met Asn Gly Pro His Ala Gly Phe Val Ser Thr Asn
130 135 140
Arg Asn Ala Ser Tyr Leu Thr Ala Leu Ala Pro Met Gln Arg Ile Ala
145 150 155 160
Pro Pro Asn Gly Gln Trp Arg Val Leu Thr Ile Lys Trp Asp Ala Arg
165 170 175
Asp Asn Lys Leu Thr Ala Ser Leu Gln Glu Lys Asn Asn Asp Ala Ser
180 185 190
Thr Arg Ser Ala Thr Pro Arg Tyr Gln Thr Trp Glu Leu Leu Asn Pro
195 200 205
Ala Phe Asp Leu Asn Gln Lys Tyr Thr Phe Val Ile Gly Ser Ala Thr
210 215 220
Gly Ala Ala Asn Asn Lys His Gln Ile Gly Val Thr Leu Phe Glu Ala
225 230 235 240
Tyr Phe Thr Lys Pro Thr Ile Val Ala Asn Pro Val Asp Ile Glu Ile
245 250 255
Gly Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
260 265 270
Thr Asp Glu Val Asp Gly Asp Ile Thr Lys Asp Ile Thr Val Glu Phe
275 280 285
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Arg Val Thr Tyr Lys
290 295 300
Val Val Asn Ser Tyr Gly Glu Ser Asp Glu Lys Thr Ile Glu Val Val
305 310 315 320
Val Tyr Thr Lys Pro Thr Ile Thr Ala His Asp Val Ala Ile Lys Lys
325 330 335
Gly Leu Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
340 345 350
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Lys Phe
355 360 365
Asn Asn Val Asp Thr Ser Lys Pro Gly Lys Tyr His Val Thr Tyr Lys
370 375 380
Val Ile Asn Ser Tyr Glu Lys Ile Asp Glu Lys Thr Ile Glu Ile Thr
385 390 395 400
Val Tyr Thr Lys Pro Thr Ile Val Ala Gln Asp Val Lys Ile Lys Lys
405 410 415
Asp Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
420 425 430
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Phe
435 440 445
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Ser Val Arg Tyr Lys
450 455 460
Val Val Asn Asn Tyr Glu Glu Ser Asp Glu Lys Thr Ile Ala Val Thr
465 470 475 480
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro Thr Gly Trp
485 490 495
Lys Phe Phe Ser Gly Glu Thr Ile Thr Leu Glu Glu Asp Glu Glu Asn
500 505 510
Ala Leu Asn Gly Lys Trp Val Phe Tyr Ala Asp Lys His Val Ala Ile
515 520 525
Tyr Lys Gln Val Glu Leu Lys Asn Asn Thr Pro Tyr Gln Ile Thr Val
530 535 540
Tyr Val Lys Pro Glu Asp Glu Glu Thr Val Ala His His Ile Val Lys
545 550 555 560
Val Ser Phe Lys Ser Asp Ser Ala Gly Gln Glu Ser Glu Glu Ile Ile
565 570 575
Asn Glu Arg Leu Ile Asp Ala Glu Gln Ile Gln Lys Gly Tyr Arg Lys
580 585 590
Leu Thr Ser Ile Pro Phe Thr Pro Thr Thr Ile Val Pro Asn Lys Lys
595 600 605
Pro Val Ile Ile Val Glu Asn Phe Leu Pro Gly Trp Ile Gly Gly Val
610 615 620
Arg Ile Ile Val Glu Pro Thr Lys
625 630
<210> 135
<211> 632
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 135
Met Asn Ser Lys Ser Ile Ile Glu Asn Glu Val Gln Glu Asn Gln Tyr
1 5 10 15
Ile Asp Ile Arg Asn Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp
20 25 30
Pro Asn Thr Asn Ile Thr Thr Leu Thr Glu Ala Ile Asn Ser Gln Ala
35 40 45
Gly Ala Ile Ala Gly Lys Thr Ala Leu Asp Met Arg Arg Asp Phe Thr
50 55 60
Leu Val Ala Asp Ile Tyr Leu Gly Ser Lys Ser Ser Gly Ala Asp Gly
65 70 75 80
Ile Ala Ile Ala Phe His Arg Gly Ser Ile Gly Phe Ile Gly Thr Met
85 90 95
Gly Gly Gly Leu Gly Ile Leu Gly Ala Pro Asn Gly Ile Gly Phe Glu
100 105 110
Ile Asp Thr Tyr Trp Lys Ala Ser Ser Asp Glu Thr Gly Asp Ser Phe
115 120 125
Gly His Gly Gln Met Asn Gly Pro His Ala Gly Phe Val Ser Thr Asn
130 135 140
Arg Asn Ala Ser Tyr Leu Thr Ala Leu Ala Pro Met Gln Arg Ile Ala
145 150 155 160
Pro Pro Asn Gly Gln Trp Arg Val Leu Thr Ile Lys Trp Asp Ala Arg
165 170 175
Asp Asn Lys Leu Thr Ala Ser Leu Gln Glu Lys Asn Asn Asp Ala Ser
180 185 190
Thr Arg Ser Ala Thr Pro Arg Tyr Gln Thr Trp Glu Leu Leu Asn Pro
195 200 205
Ala Phe Asp Leu Asn Gln Lys Tyr Thr Phe Val Ile Gly Ser Ala Thr
210 215 220
Gly Ala Ala Asn Asn Lys His Gln Ile Gly Val Thr Leu Phe Glu Ala
225 230 235 240
Tyr Phe Thr Lys Pro Thr Ile Val Ala Asn Pro Val Asp Ile Glu Ile
245 250 255
Gly Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
260 265 270
Thr Asp Glu Val Asp Gly Asp Ile Thr Lys Asp Ile Thr Val Glu Phe
275 280 285
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Arg Val Thr Tyr Lys
290 295 300
Val Val Asn Ser Tyr Gly Glu Ser Asp Glu Lys Thr Ile Glu Val Val
305 310 315 320
Val Tyr Thr Lys Pro Thr Ile Thr Ala His Asp Val Ala Ile Lys Lys
325 330 335
Gly Leu Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
340 345 350
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Lys Phe
355 360 365
Asn Asn Val Asp Thr Ser Lys Pro Gly Lys Tyr His Val Thr Tyr Lys
370 375 380
Val Ile Asn Ser Tyr Glu Lys Ile Asp Glu Lys Thr Ile Glu Ile Thr
385 390 395 400
Val Tyr Thr Lys Pro Thr Ile Val Ala Gln Asp Val Lys Ile Lys Lys
405 410 415
Asp Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
420 425 430
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Phe
435 440 445
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Ser Val Arg Tyr Lys
450 455 460
Val Val Asn Asn Tyr Glu Glu Ser Asp Glu Lys Thr Ile Ala Val Thr
465 470 475 480
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro Thr Gly Trp
485 490 495
Lys Phe Phe Ser Gly Glu Thr Ile Thr Leu Glu Glu Asp Glu Glu Asn
500 505 510
Ala Leu Asn Gly Lys Trp Val Phe Tyr Ala Asp Lys His Val Ala Ile
515 520 525
Tyr Lys Gln Val Glu Leu Lys Asn Asn Thr Pro Tyr Gln Ile Thr Val
530 535 540
Tyr Val Lys Pro Glu Asp Glu Glu Thr Val Ala His His Ile Val Lys
545 550 555 560
Val Ser Phe Lys Ser Asp Ser Ala Gly Gln Glu Ser Glu Glu Ile Ile
565 570 575
Asn Glu Arg Leu Ile Asp Ala Glu Gln Ile Gln Lys Gly Tyr Arg Lys
580 585 590
Leu Thr Ser Ile Pro Phe Thr Pro Thr Thr Ile Val Pro Asn Lys Lys
595 600 605
Pro Val Ile Ile Val Glu Asn Phe Leu Pro Gly Trp Ile Gly Gly Val
610 615 620
Arg Ile Ile Val Glu Pro Thr Lys
625 630
<210> 136
<211> 632
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 136
Leu Asn Ser Lys Ser Ile Ile Glu Asn Glu Val Gln Glu Asn Gln Tyr
1 5 10 15
Ile Asp Ile Arg Asn Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp
20 25 30
Pro Asn Thr Asn Ile Thr Thr Leu Thr Glu Ala Ile Asn Ser Gln Ala
35 40 45
Gly Ala Ile Ala Gly Lys Thr Ala Leu Asp Met Arg Arg Asp Phe Thr
50 55 60
Leu Val Ala Asp Ile Tyr Leu Gly Ser Lys Ser Ser Gly Ala Asp Gly
65 70 75 80
Ile Ala Ile Ala Phe His Arg Gly Ser Ile Gly Phe Ile Gly Thr Met
85 90 95
Gly Gly Gly Leu Gly Ile Leu Gly Ala Pro Ser Gly Ile Gly Phe Glu
100 105 110
Ile Asp Thr Tyr Trp Lys Ala Ser Ser Asp Glu Thr Gly Asp Ser Phe
115 120 125
Gly His Gly Gln Met Asn Gly Pro His Ala Gly Phe Val Ser Thr Asn
130 135 140
Arg Asn Ala Ser Tyr Leu Thr Ala Leu Ala Pro Met Gln Arg Ile Ala
145 150 155 160
Pro Pro Asn Gly Gln Trp Arg Val Leu Thr Ile Lys Trp Asp Ala Arg
165 170 175
Asp Asn Lys Leu Thr Ala Ser Leu Gln Glu Lys Asn Asn Asp Ala Ser
180 185 190
Thr Arg Ser Ala Thr Pro Arg Tyr Gln Thr Trp Glu Leu Leu Asn Pro
195 200 205
Ala Phe Asp Leu Asn Gln Lys Tyr Thr Phe Val Ile Gly Ser Ala Thr
210 215 220
Gly Ala Ala Asn Asn Lys His Gln Ile Gly Val Thr Leu Phe Glu Ala
225 230 235 240
Tyr Phe Thr Lys Pro Thr Ile Val Ala Asn Pro Val Asp Ile Glu Ile
245 250 255
Gly Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
260 265 270
Thr Asp Glu Val Asp Gly Asp Ile Thr Lys Asp Ile Thr Val Glu Phe
275 280 285
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Arg Val Thr Tyr Lys
290 295 300
Val Val Asn Ser Tyr Gly Glu Ser Asp Glu Lys Thr Ile Glu Val Val
305 310 315 320
Val Tyr Thr Lys Pro Thr Ile Thr Ala His Asp Val Ala Ile Lys Lys
325 330 335
Gly Leu Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
340 345 350
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Lys Phe
355 360 365
Asn Asn Val Asp Thr Ser Lys Pro Gly Lys Tyr His Val Thr Tyr Lys
370 375 380
Val Ile Asn Ser Tyr Glu Lys Ile Asp Glu Lys Thr Ile Glu Ile Thr
385 390 395 400
Val Tyr Thr Lys Pro Thr Ile Val Ala Gln Asp Val Lys Ile Lys Lys
405 410 415
Asp Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
420 425 430
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Phe
435 440 445
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Ser Val Arg Tyr Lys
450 455 460
Val Val Asn Asn Tyr Glu Glu Ser Asp Glu Lys Thr Ile Ala Val Thr
465 470 475 480
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro Thr Gly Trp
485 490 495
Lys Phe Phe Ser Gly Glu Thr Ile Thr Leu Glu Glu Asp Glu Glu Asn
500 505 510
Ala Leu Asn Gly Lys Trp Val Phe Tyr Ala Asp Lys His Val Ala Ile
515 520 525
Tyr Lys Gln Val Glu Leu Lys Asn Asn Thr Pro Tyr Gln Ile Thr Val
530 535 540
Tyr Val Lys Pro Glu Asp Glu Glu Thr Val Ala His His Ile Val Lys
545 550 555 560
Val Ser Phe Lys Ser Asp Ser Ala Gly Gln Glu Ser Glu Glu Ile Ile
565 570 575
Asn Glu Arg Leu Ile Asp Ala Glu Gln Ile Gln Lys Gly Tyr Arg Lys
580 585 590
Leu Thr Ser Ile Pro Phe Thr Pro Thr Thr Ile Val Pro Asn Lys Lys
595 600 605
Pro Val Ile Ile Val Glu Asn Phe Leu Pro Gly Trp Ile Gly Gly Val
610 615 620
Arg Ile Ile Val Glu Pro Thr Lys
625 630
<210> 137
<211> 632
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 137
Met Asn Ser Lys Ser Ile Ile Glu Asn Glu Val Gln Glu Asn Gln Tyr
1 5 10 15
Ile Asp Ile Arg Asn Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp
20 25 30
Pro Asn Thr Asn Ile Thr Thr Leu Thr Glu Ala Ile Asn Ser Gln Ala
35 40 45
Gly Ala Ile Ala Gly Lys Thr Ala Leu Asp Met Arg Arg Asp Phe Thr
50 55 60
Leu Val Ala Asp Ile Tyr Leu Gly Ser Lys Ser Ser Gly Ala Asp Gly
65 70 75 80
Ile Ala Ile Ala Phe His Arg Gly Ser Ile Gly Phe Ile Gly Thr Met
85 90 95
Gly Gly Gly Leu Gly Ile Leu Gly Ala Pro Ser Gly Ile Gly Phe Glu
100 105 110
Ile Asp Thr Tyr Trp Lys Ala Ser Ser Asp Glu Thr Gly Asp Ser Phe
115 120 125
Gly His Gly Gln Met Asn Gly Pro His Ala Gly Phe Val Ser Thr Asn
130 135 140
Arg Asn Ala Ser Tyr Leu Thr Ala Leu Ala Pro Met Gln Arg Ile Ala
145 150 155 160
Pro Pro Asn Gly Gln Trp Arg Val Leu Thr Ile Lys Trp Asp Ala Arg
165 170 175
Asp Asn Lys Leu Thr Ala Ser Leu Gln Glu Lys Asn Asn Asp Ala Ser
180 185 190
Thr Arg Ser Ala Thr Pro Arg Tyr Gln Thr Trp Glu Leu Leu Asn Pro
195 200 205
Ala Phe Asp Leu Asn Gln Lys Tyr Thr Phe Val Ile Gly Ser Ala Thr
210 215 220
Gly Ala Ala Asn Asn Lys His Gln Ile Gly Val Thr Leu Phe Glu Ala
225 230 235 240
Tyr Phe Thr Lys Pro Thr Ile Val Ala Asn Pro Val Asp Ile Glu Ile
245 250 255
Gly Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
260 265 270
Thr Asp Glu Val Asp Gly Asp Ile Thr Lys Asp Ile Thr Val Glu Phe
275 280 285
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Arg Val Thr Tyr Lys
290 295 300
Val Val Asn Ser Tyr Gly Glu Ser Asp Glu Lys Thr Ile Glu Val Val
305 310 315 320
Val Tyr Thr Lys Pro Thr Ile Thr Ala His Asp Val Ala Ile Lys Lys
325 330 335
Gly Leu Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
340 345 350
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Lys Phe
355 360 365
Asn Asn Val Asp Thr Ser Lys Pro Gly Lys Tyr His Val Thr Tyr Lys
370 375 380
Val Ile Asn Ser Tyr Glu Lys Ile Asp Glu Lys Thr Ile Glu Ile Thr
385 390 395 400
Val Tyr Thr Lys Pro Thr Ile Val Ala Gln Asp Val Lys Ile Lys Lys
405 410 415
Asp Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
420 425 430
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Phe
435 440 445
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Ser Val Arg Tyr Lys
450 455 460
Val Val Asn Asn Tyr Glu Glu Ser Asp Glu Lys Thr Ile Ala Val Thr
465 470 475 480
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro Thr Gly Trp
485 490 495
Lys Phe Phe Ser Gly Glu Thr Ile Thr Leu Glu Glu Asp Glu Glu Asn
500 505 510
Ala Leu Asn Gly Lys Trp Val Phe Tyr Ala Asp Lys His Val Ala Ile
515 520 525
Tyr Lys Gln Val Glu Leu Lys Asn Asn Thr Pro Tyr Gln Ile Thr Val
530 535 540
Tyr Val Lys Pro Glu Asp Glu Glu Thr Val Ala His His Ile Val Lys
545 550 555 560
Val Ser Phe Lys Ser Asp Ser Ala Gly Gln Glu Ser Glu Glu Ile Ile
565 570 575
Asn Glu Arg Leu Ile Asp Ala Glu Gln Ile Gln Lys Gly Tyr Arg Lys
580 585 590
Leu Thr Ser Ile Pro Phe Thr Pro Thr Thr Ile Val Pro Asn Lys Lys
595 600 605
Pro Val Ile Ile Val Glu Asn Phe Leu Pro Gly Trp Ile Gly Gly Val
610 615 620
Arg Ile Ile Val Glu Pro Thr Lys
625 630
<210> 138
<211> 632
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 138
Met Asn Ser Lys Ser Thr Ile Glu Lys Glu Val Gln Lys Ser Gln Tyr
1 5 10 15
Leu Asp Ile Arg Asn Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp
20 25 30
Pro Asn Thr Asn Ile Thr Thr Leu Thr Glu Ala Ile Asn Ser Gln Ala
35 40 45
Gly Ala Ile Ala Gly Lys Thr Ala Leu Asp Met Arg His Asp Phe Thr
50 55 60
Leu Val Ala Asp Ile Tyr Leu Gly Ser Lys Ser Ser Gly Ala Asp Gly
65 70 75 80
Ile Ala Ile Ala Phe His Arg Gly Ser Ile Gly Phe Ile Gly Asn Met
85 90 95
Gly Gly Gly Leu Gly Ile Leu Gly Ala Pro Asn Gly Ile Gly Phe Glu
100 105 110
Ile Asp Thr Tyr Trp Lys Ala Ser Ser Asp Glu Thr Gly Asp Ser Phe
115 120 125
Gly His Gly Gln Met Asn Gly Pro His Ala Gly Phe Val Ser Thr Asn
130 135 140
Arg Asn Ala Ser Tyr Leu Thr Ala Leu Ala Pro Met Gln Arg Ile Ser
145 150 155 160
Thr Pro Asn Gly Lys Trp Arg Val Leu Thr Ile Asn Trp Asp Ala Arg
165 170 175
Asn Asn Lys Leu Thr Ala Arg Leu Gln Glu Lys Asn Asn Asp Ala Ser
180 185 190
Thr Ser Ser Ala Ser Pro Arg Tyr Gln Thr Trp Glu Leu Leu Asn Pro
195 200 205
Ala Phe Asp Leu Asn Gln Lys Tyr Thr Phe Val Ile Gly Ser Ala Thr
210 215 220
Gly Ala Ala Asn Asn Lys His Gln Ile Gly Val Thr Leu Phe Glu Ala
225 230 235 240
Tyr Phe Thr Lys Pro Thr Ile Glu Ala Asn Pro Val Asp Ile Glu Ala
245 250 255
Gly Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
260 265 270
Thr Asp Glu Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Phe
275 280 285
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Arg Val Thr Tyr Lys
290 295 300
Val Val Asn Ser Tyr Glu Glu Ser Asp Glu Lys Thr Ile Glu Val Ile
305 310 315 320
Val Tyr Thr Lys Pro Thr Ile Thr Ala His Asp Val Ile Ile Lys Lys
325 330 335
Asp Leu Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
340 345 350
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Val Thr Val Glu Ser
355 360 365
Asn Asn Val Asp Thr Ser Lys Pro Gly Lys Tyr His Val Ala Tyr Lys
370 375 380
Val Val Asn Ser Tyr Glu Lys Ser Asp Glu Lys Thr Ile Glu Val Val
385 390 395 400
Val Tyr Thr Lys Pro Thr Leu Glu Ala His Asp Val Glu Val Lys Lys
405 410 415
Asp Thr Val Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
420 425 430
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Ser
435 440 445
Asp Asn Val Asp Thr Ser Lys Pro Gly Glu Tyr His Val Thr Tyr Lys
450 455 460
Val Val Asn Ser Tyr Glu Glu Ser Asp Glu Lys Ser Ile Leu Val Thr
465 470 475 480
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro Lys Gly Trp
485 490 495
Lys Phe Phe Ser Gly Glu Ser Ile Thr Leu Asp Glu Asp Glu Glu Asn
500 505 510
Ala Leu Asn Gly Lys Trp Val Phe Tyr Ser Asp Lys His Val Ala Ile
515 520 525
Tyr Lys Gln Val Glu Leu Glu Asn Asn Thr Thr Tyr Gln Ile Thr Val
530 535 540
Tyr Val Lys Pro Glu Asp Glu Gly Thr Val Ala His His Ile Val Lys
545 550 555 560
Ala Ser Leu Lys Pro Asn Pro Ser Gly Pro Asp Ser Glu Glu Leu Leu
565 570 575
Asn Glu Arg Leu Ile Asn Gly Glu Gln Ile Gln Lys Gly Tyr Arg Lys
580 585 590
Leu Thr Ser Ile Pro Phe Thr Pro Thr Thr Ile Glu Pro Tyr Lys Lys
595 600 605
Pro Leu Ile Val Ile Glu Asn Tyr Leu Ala Gly Trp Ile Gly Gly Ile
610 615 620
Lys Ile Ile Val Glu Pro Thr Lys
625 630
<210> 139
<211> 632
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 139
Met Asn Ser Lys Ser Ile Ile Glu Asn Glu Val Gln Glu Asn Gln Tyr
1 5 10 15
Ile Asp Ile Arg Asn Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp
20 25 30
Pro Asn Thr Asn Ile Thr Thr Leu Thr Glu Ala Ile Asn Ser Gln Ala
35 40 45
Gly Ala Ile Ala Gly Lys Thr Ala Leu Asp Met Arg Arg Asp Phe Thr
50 55 60
Leu Val Ala Asp Ile Tyr Leu Gly Ser Lys Ser Ser Gly Ala Asp Gly
65 70 75 80
Ile Ala Ile Ala Phe His Arg Gly Ser Ile Gly Phe Ile Gly Thr Met
85 90 95
Gly Gly Gly Leu Gly Ile Leu Gly Ala Pro Asn Gly Ile Gly Phe Glu
100 105 110
Ile Asp Thr Tyr Trp Lys Ala Ser Ser Asp Glu Thr Gly Asp Ser Phe
115 120 125
Gly His Gly Gln Met Asn Gly Pro His Ala Gly Phe Val Ser Thr Asp
130 135 140
Arg Lys Ala Ser Tyr Leu Thr Ala Leu Ala Pro Met Gln Arg Ile Ala
145 150 155 160
Pro Pro Asn Gly Gln Trp Arg Val Leu Thr Ile Lys Trp Asp Ala Arg
165 170 175
Asp Asn Lys Leu Thr Ala Ser Leu Gln Glu Lys Asn Asn Asp Ala Ser
180 185 190
Thr Arg Ser Ala Thr Pro Arg Tyr Gln Thr Trp Glu Leu Leu Asn Pro
195 200 205
Ala Phe Asp Leu Asn Gln Lys Tyr Thr Phe Val Ile Gly Ser Ala Thr
210 215 220
Gly Ala Ala Asn Asn Lys His Gln Ile Gly Val Thr Leu Phe Glu Ala
225 230 235 240
Tyr Phe Thr Lys Pro Thr Ile Val Ala Asn Pro Val Asp Ile Glu Ile
245 250 255
Gly Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
260 265 270
Thr Asp Glu Val Asp Gly Asp Ile Thr Lys Asp Ile Thr Val Glu Phe
275 280 285
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Arg Val Thr Tyr Lys
290 295 300
Val Val Asn Ser Tyr Gly Glu Ser Asp Glu Lys Thr Ile Glu Val Val
305 310 315 320
Val Tyr Thr Lys Pro Thr Ile Thr Ala His Asp Val Ala Ile Lys Lys
325 330 335
Gly Leu Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
340 345 350
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Lys Phe
355 360 365
Asn Asn Val Asp Thr Ser Lys Pro Gly Lys Tyr His Val Thr Tyr Lys
370 375 380
Val Ile Asn Ser Tyr Glu Lys Ile Asp Glu Lys Thr Ile Glu Val Thr
385 390 395 400
Val Tyr Thr Lys Pro Thr Ile Val Ala Gln Asp Val Lys Ile Lys Lys
405 410 415
Asp Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
420 425 430
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Phe
435 440 445
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Ser Val Arg Tyr Lys
450 455 460
Val Val Asn Asn Tyr Glu Glu Ser Asp Glu Lys Thr Ile Ala Val Thr
465 470 475 480
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro Thr Gly Trp
485 490 495
Lys Phe Phe Ser Gly Glu Thr Ile Thr Leu Glu Glu Asp Glu Glu Asn
500 505 510
Ala Leu Asn Gly Lys Trp Val Phe Tyr Ala Asp Lys His Val Ala Ile
515 520 525
Tyr Lys Gln Val Glu Leu Lys Asn Asn Thr Pro Tyr Gln Ile Thr Val
530 535 540
Tyr Val Lys Pro Glu Asp Glu Glu Thr Val Ala His His Ile Val Lys
545 550 555 560
Val Ser Phe Lys Ser Asp Ser Ala Gly Gln Glu Ser Glu Glu Ile Ile
565 570 575
Asn Glu Arg Leu Ile Asp Ala Glu Gln Ile Gln Lys Gly Tyr Arg Lys
580 585 590
Leu Thr Ser Ile Pro Phe Thr Pro Thr Thr Ile Val Pro Asn Lys Lys
595 600 605
Pro Val Ile Ile Val Glu Asn Phe Leu Pro Gly Trp Ile Gly Gly Val
610 615 620
Arg Ile Ile Val Glu Pro Thr Lys
625 630
<210> 140
<211> 632
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 140
Met Asn Ser Lys Ser Ile Ile Glu Asn Glu Val Gln Glu Asn Gln Tyr
1 5 10 15
Ile Asp Ile Arg Asn Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp
20 25 30
Pro Asn Thr Asn Ile Thr Thr Leu Thr Glu Ala Ile Asn Ser Gln Ala
35 40 45
Gly Ala Ile Ala Gly Lys Thr Ala Leu Asp Met Arg Arg Asp Phe Thr
50 55 60
Leu Val Ala Asp Ile Tyr Leu Gly Ser Lys Ser Ser Gly Ala Asp Gly
65 70 75 80
Ile Ala Ile Ala Phe His Arg Gly Ser Ile Gly Phe Ile Gly Thr Met
85 90 95
Gly Gly Gly Leu Gly Ile Leu Gly Ala Pro Asn Gly Ile Gly Phe Glu
100 105 110
Ile Asp Thr Tyr Trp Lys Ala Ser Ser Asp Glu Thr Gly Asp Ser Phe
115 120 125
Gly His Gly Gln Met Asn Gly Pro His Ala Gly Phe Val Ser Thr Asp
130 135 140
Arg Lys Ala Ser Tyr Leu Thr Ala Leu Ala Pro Met Gln Arg Ile Ala
145 150 155 160
Pro Pro Asn Gly Gln Trp Arg Val Leu Thr Ile Lys Trp Asp Ala Arg
165 170 175
Asp Asn Lys Leu Thr Ala Ser Leu Gln Glu Lys Asn Asn Asp Ala Ser
180 185 190
Thr Arg Ser Ala Thr Pro Arg Tyr Gln Thr Trp Glu Leu Leu Asn Pro
195 200 205
Ala Phe Asp Leu Asn Gln Lys Tyr Thr Phe Val Ile Gly Ser Ala Thr
210 215 220
Gly Ala Ala Asn Asn Lys His Gln Ile Gly Val Thr Leu Phe Glu Ala
225 230 235 240
Tyr Phe Thr Lys Pro Thr Ile Val Ala Asn Pro Val Asp Ile Glu Ile
245 250 255
Gly Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
260 265 270
Thr Asp Glu Val Asp Gly Asp Ile Thr Lys Asp Ile Thr Val Glu Phe
275 280 285
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Arg Val Thr Tyr Lys
290 295 300
Val Val Asn Ser Tyr Gly Glu Ser Asp Glu Lys Thr Ile Glu Val Val
305 310 315 320
Val Tyr Thr Lys Pro Thr Ile Thr Ala His Asp Val Ala Ile Lys Lys
325 330 335
Gly Leu Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
340 345 350
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Lys Phe
355 360 365
Asn Asn Val Asp Thr Ser Lys Pro Gly Lys Tyr His Val Thr Tyr Lys
370 375 380
Val Ile Asn Ser Tyr Glu Lys Ile Asp Glu Lys Thr Ile Glu Val Thr
385 390 395 400
Val Tyr Thr Lys Pro Thr Ile Val Ala Gln Asp Val Lys Ile Lys Lys
405 410 415
Asp Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
420 425 430
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Phe
435 440 445
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Ser Val Arg Tyr Lys
450 455 460
Val Val Asn Asn Tyr Glu Glu Ser Asp Glu Lys Thr Ile Ala Val Thr
465 470 475 480
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro Thr Gly Trp
485 490 495
Lys Phe Phe Ser Gly Glu Thr Ile Thr Leu Glu Glu Asp Glu Glu Asn
500 505 510
Ala Leu Asn Gly Lys Trp Val Phe Tyr Ala Asp Lys His Val Ala Ile
515 520 525
Tyr Lys Gln Val Glu Leu Lys Asn Asn Thr Pro Tyr Gln Ile Thr Val
530 535 540
Tyr Val Lys Pro Glu Asp Glu Glu Thr Val Ala His His Ile Val Lys
545 550 555 560
Val Ser Phe Lys Ser Asp Ser Ala Gly Gln Glu Ser Glu Glu Ile Ile
565 570 575
Asn Glu Arg Leu Ile Asp Ala Glu Gln Ile Gln Lys Gly Tyr Arg Lys
580 585 590
Leu Thr Ser Ile Pro Phe Thr Pro Thr Thr Ile Val Pro Asn Lys Lys
595 600 605
Pro Val Ile Ile Val Glu Asn Phe Leu Pro Gly Trp Ile Gly Gly Val
610 615 620
Arg Ile Ile Val Glu Pro Thr Lys
625 630
<210> 141
<211> 632
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 141
Leu Asn Ser Lys Ser Ile Ile Glu Asn Glu Val Gln Glu Asn Gln Tyr
1 5 10 15
Ile Asp Ile Arg Asn Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp
20 25 30
Pro Asn Thr Asn Ile Thr Thr Leu Thr Glu Ala Ile Asn Ser Gln Ala
35 40 45
Gly Ala Ile Ala Gly Lys Thr Ala Leu Asp Met Arg Arg Asp Phe Thr
50 55 60
Leu Val Ala Asp Ile Tyr Leu Gly Ser Lys Ser Ser Gly Ala Asp Gly
65 70 75 80
Ile Ala Ile Ala Phe His Arg Gly Ser Ile Gly Phe Ile Gly Thr Met
85 90 95
Gly Gly Gly Leu Gly Ile Leu Gly Ala Pro Asn Gly Ile Gly Phe Glu
100 105 110
Ile Asp Thr Tyr Trp Lys Ala Ser Ser Asp Glu Thr Gly Asp Ser Phe
115 120 125
Gly His Gly Gln Met Asn Gly Pro His Ala Gly Phe Val Ser Thr Asn
130 135 140
Arg Asn Ala Ser Tyr Leu Thr Ala Leu Ala Pro Met Gln Arg Ile Pro
145 150 155 160
Ala Pro Asn Asp Lys Trp Arg Val Leu Thr Ile Asn Trp Asp Ala Arg
165 170 175
Asn Asn Lys Leu Thr Ala Ser Leu Gln Glu Lys Asn Asn Asp Ala Ser
180 185 190
Thr Arg Ser Ala Thr Pro Arg Tyr Gln Ala Trp Glu Leu Leu Asn Pro
195 200 205
Ala Phe Asp Leu Asn Gln Lys Tyr Thr Phe Val Ile Gly Ser Ala Thr
210 215 220
Gly Ala Ala Asn Asn Lys His Gln Ile Gly Val Thr Leu Phe Glu Ala
225 230 235 240
Tyr Phe Thr Lys Pro Thr Ile Val Ala Asn Pro Val Asp Ile Glu Ile
245 250 255
Gly Thr Ala Phe Asp Pro Leu Lys Tyr Glu Pro Ile Gly Leu Lys Ala
260 265 270
Thr Asp Glu Val Asp Gly Asp Ile Thr Lys Asp Ile Thr Val Glu Phe
275 280 285
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Arg Val Thr Tyr Lys
290 295 300
Val Val Asn Ser Tyr Gly Glu Ser Asp Glu Lys Thr Ile Glu Val Val
305 310 315 320
Val Tyr Thr Lys Pro Thr Ile Thr Ala His Asp Val Ala Ile Lys Lys
325 330 335
Gly Leu Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
340 345 350
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Lys Phe
355 360 365
Asn Asn Val Asp Thr Ser Lys Pro Gly Lys Tyr His Val Thr Tyr Lys
370 375 380
Val Ile Asn Ser Tyr Glu Lys Ile Asp Glu Lys Thr Ile Glu Ile Thr
385 390 395 400
Val Tyr Thr Lys Pro Thr Ile Val Ala Gln Asp Val Lys Ile Lys Lys
405 410 415
Asp Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
420 425 430
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Phe
435 440 445
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Ser Val Arg Tyr Lys
450 455 460
Val Val Asn Asn Tyr Glu Glu Ser Asp Glu Lys Thr Ile Ala Val Thr
465 470 475 480
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro Thr Gly Trp
485 490 495
Lys Phe Phe Ser Gly Glu Thr Ile Thr Leu Glu Glu Asp Glu Glu Asn
500 505 510
Ala Leu Asn Gly Lys Trp Val Phe Tyr Ala Asp Lys His Val Ala Ile
515 520 525
Tyr Lys Gln Val Glu Leu Lys Asn Asn Thr Pro Tyr Gln Ile Thr Val
530 535 540
Tyr Val Lys Pro Glu Asp Glu Glu Thr Val Ala His His Ile Val Lys
545 550 555 560
Val Ser Phe Lys Ser Asp Ser Ala Gly Gln Glu Ser Glu Glu Ile Ile
565 570 575
Asn Glu Arg Leu Ile Asp Ala Glu Gln Ile Gln Lys Gly Tyr Arg Lys
580 585 590
Leu Thr Ser Ile Pro Phe Thr Pro Thr Thr Ile Val Pro Asn Lys Lys
595 600 605
Pro Val Ile Ile Val Glu Asn Phe Leu Pro Gly Trp Ile Gly Gly Val
610 615 620
Arg Ile Ile Val Glu Pro Thr Lys
625 630
<210> 142
<211> 632
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 142
Met Asn Ser Lys Ser Ile Ile Glu Asn Glu Val Gln Glu Asn Gln Tyr
1 5 10 15
Ile Asp Ile Arg Asn Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp
20 25 30
Pro Asn Thr Asn Ile Thr Thr Leu Thr Glu Ala Ile Asn Ser Gln Ala
35 40 45
Gly Ala Ile Ala Gly Lys Thr Ala Leu Asp Met Arg Arg Asp Phe Thr
50 55 60
Leu Val Ala Asp Ile Tyr Leu Gly Ser Lys Ser Ser Gly Ala Asp Gly
65 70 75 80
Ile Ala Ile Ala Phe His Arg Gly Ser Ile Gly Phe Ile Gly Thr Met
85 90 95
Gly Gly Gly Leu Gly Ile Leu Gly Ala Pro Asn Gly Ile Gly Phe Glu
100 105 110
Ile Asp Thr Tyr Trp Lys Ala Ser Ser Asp Glu Thr Gly Asp Ser Phe
115 120 125
Gly His Gly Gln Met Asn Gly Pro His Ala Gly Phe Val Ser Thr Asn
130 135 140
Arg Asn Ala Ser Tyr Leu Thr Ala Leu Ala Pro Met Gln Arg Ile Pro
145 150 155 160
Ala Pro Asn Asp Lys Trp Arg Val Leu Thr Ile Asn Trp Asp Ala Arg
165 170 175
Asn Asn Lys Leu Thr Ala Ser Leu Gln Glu Lys Asn Asn Asp Ala Ser
180 185 190
Thr Arg Ser Ala Thr Pro Arg Tyr Gln Ala Trp Glu Leu Leu Asn Pro
195 200 205
Ala Phe Asp Leu Asn Gln Lys Tyr Thr Phe Val Ile Gly Ser Ala Thr
210 215 220
Gly Ala Ala Asn Asn Lys His Gln Ile Gly Val Thr Leu Phe Glu Ala
225 230 235 240
Tyr Phe Thr Lys Pro Thr Ile Val Ala Asn Pro Val Asp Ile Glu Ile
245 250 255
Gly Thr Ala Phe Asp Pro Leu Lys Tyr Glu Pro Ile Gly Leu Lys Ala
260 265 270
Thr Asp Glu Val Asp Gly Asp Ile Thr Lys Asp Ile Thr Val Glu Phe
275 280 285
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Arg Val Thr Tyr Lys
290 295 300
Val Val Asn Ser Tyr Gly Glu Ser Asp Glu Lys Thr Ile Glu Val Val
305 310 315 320
Val Tyr Thr Lys Pro Thr Ile Thr Ala His Asp Val Ala Ile Lys Lys
325 330 335
Gly Leu Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
340 345 350
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Lys Phe
355 360 365
Asn Asn Val Asp Thr Ser Lys Pro Gly Lys Tyr His Val Thr Tyr Lys
370 375 380
Val Ile Asn Ser Tyr Glu Lys Ile Asp Glu Lys Thr Ile Glu Ile Thr
385 390 395 400
Val Tyr Thr Lys Pro Thr Ile Val Ala Gln Asp Val Lys Ile Lys Lys
405 410 415
Asp Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
420 425 430
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Phe
435 440 445
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Ser Val Arg Tyr Lys
450 455 460
Val Val Asn Asn Tyr Glu Glu Ser Asp Glu Lys Thr Ile Ala Val Thr
465 470 475 480
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro Thr Gly Trp
485 490 495
Lys Phe Phe Ser Gly Glu Thr Ile Thr Leu Glu Glu Asp Glu Glu Asn
500 505 510
Ala Leu Asn Gly Lys Trp Val Phe Tyr Ala Asp Lys His Val Ala Ile
515 520 525
Tyr Lys Gln Val Glu Leu Lys Asn Asn Thr Pro Tyr Gln Ile Thr Val
530 535 540
Tyr Val Lys Pro Glu Asp Glu Glu Thr Val Ala His His Ile Val Lys
545 550 555 560
Val Ser Phe Lys Ser Asp Ser Ala Gly Gln Glu Ser Glu Glu Ile Ile
565 570 575
Asn Glu Arg Leu Ile Asp Ala Glu Gln Ile Gln Lys Gly Tyr Arg Lys
580 585 590
Leu Thr Ser Ile Pro Phe Thr Pro Thr Thr Ile Val Pro Asn Lys Lys
595 600 605
Pro Val Ile Ile Val Glu Asn Phe Leu Pro Gly Trp Ile Gly Gly Val
610 615 620
Arg Ile Ile Val Glu Pro Thr Lys
625 630
<210> 143
<211> 472
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 143
Leu Asn Ser Lys Ser Ile Thr Glu Lys Glu Ile Gln Glu Asn Gln Tyr
1 5 10 15
Ile Asp Ile Arg Asn Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp
20 25 30
Pro Asn Thr Asn Ile Thr Thr Leu Thr Glu Ala Ile Asn Ser Gln Ala
35 40 45
Gly Ala Ile Ala Gly Lys Thr Ala Leu Asp Met Lys Arg Asp Phe Thr
50 55 60
Leu Val Ala Asp Ile Tyr Leu Gly Ser Lys Ser Ser Gly Ala Asp Gly
65 70 75 80
Ile Ala Ile Ala Phe His Arg Gly Ser Ile Gly Phe Ile Gly Thr Met
85 90 95
Gly Gly Gly Leu Gly Ile Leu Gly Ala Pro Asn Gly Ile Gly Phe Glu
100 105 110
Ile Asp Thr Tyr Trp Lys Ala Thr Ser Asp Glu Thr Gly Asp Ser Phe
115 120 125
Gly His Gly Gln Met Asn Gly Ala His Ala Gly Phe Val Ser Thr Asn
130 135 140
Arg Asn Ala Ser Tyr Leu Thr Ala Leu Ala Pro Met Gln Lys Ile Pro
145 150 155 160
Glu Pro Asn Asn Lys Trp Arg Val Leu Thr Ile Asn Trp Asp Ala Arg
165 170 175
Asn Asn Lys Leu Thr Ala Arg Leu Gln Glu Lys Ser Asn Asp Ala Ser
180 185 190
Thr Ser Thr Pro Ser Pro Arg Tyr Gln Thr Trp Glu Leu Leu Asn Pro
195 200 205
Ala Phe Asp Leu Asn Gln Lys Tyr Thr Phe Ile Ile Gly Ser Ala Thr
210 215 220
Gly Ala Ala Asn Asn Glu His Gln Ile Gly Val Thr Leu Phe Glu Ala
225 230 235 240
Tyr Phe Thr Lys Pro Thr Ile Glu Ala Asn Pro Val Asp Ile Glu Leu
245 250 255
Gly Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
260 265 270
Thr Asp Ser Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Tyr
275 280 285
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Ser Val Lys Tyr Lys
290 295 300
Val Val Asn Asn Tyr Glu Glu Ser Asp Glu Lys Thr Ile Ala Val Thr
305 310 315 320
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro Thr Gly Trp
325 330 335
Lys Phe Phe Ser Gly Glu Thr Ile Thr Leu Glu Glu Asp Glu Glu Asn
340 345 350
Ala Leu Asn Gly Lys Trp Val Phe Tyr Ala Asp Lys His Val Ala Ile
355 360 365
Tyr Lys Gln Val Glu Leu Lys Asn Asn Ile Pro Tyr Gln Ile Thr Val
370 375 380
Tyr Val Lys Pro Glu Asp Glu Gly Thr Val Ala His His Ile Val Lys
385 390 395 400
Val Ser Phe Lys Ser Asp Ser Ala Gly Pro Glu Asn Glu Glu Val Ile
405 410 415
Asn Glu Arg Leu Ile Asp Ala Glu Gln Ile Gln Lys Gly Tyr Arg Lys
420 425 430
Leu Thr Ser Met Pro Phe Thr Pro Thr Thr Ile Val Pro Asn Lys Lys
435 440 445
Pro Val Ile Ile Val Glu Asn Phe Leu Pro Gly Trp Ile Gly Gly Val
450 455 460
Arg Ile Ile Val Glu Pro Thr Lys
465 470
<210> 144
<211> 472
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 144
Met Asn Ser Lys Ser Ile Thr Glu Lys Glu Ile Gln Glu Asn Gln Tyr
1 5 10 15
Ile Asp Ile Arg Asn Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp
20 25 30
Pro Asn Thr Asn Ile Thr Thr Leu Thr Glu Ala Ile Asn Ser Gln Ala
35 40 45
Gly Ala Ile Ala Gly Lys Thr Ala Leu Asp Met Lys Arg Asp Phe Thr
50 55 60
Leu Val Ala Asp Ile Tyr Leu Gly Ser Lys Ser Ser Gly Ala Asp Gly
65 70 75 80
Ile Ala Ile Ala Phe His Arg Gly Ser Ile Gly Phe Ile Gly Thr Met
85 90 95
Gly Gly Gly Leu Gly Ile Leu Gly Ala Pro Asn Gly Ile Gly Phe Glu
100 105 110
Ile Asp Thr Tyr Trp Lys Ala Thr Ser Asp Glu Thr Gly Asp Ser Phe
115 120 125
Gly His Gly Gln Met Asn Gly Ala His Ala Gly Phe Val Ser Thr Asn
130 135 140
Arg Asn Ala Ser Tyr Leu Thr Ala Leu Ala Pro Met Gln Lys Ile Pro
145 150 155 160
Glu Pro Asn Asn Lys Trp Arg Val Leu Thr Ile Asn Trp Asp Ala Arg
165 170 175
Asn Asn Lys Leu Thr Ala Arg Leu Gln Glu Lys Ser Asn Asp Ala Ser
180 185 190
Thr Ser Thr Pro Ser Pro Arg Tyr Gln Thr Trp Glu Leu Leu Asn Pro
195 200 205
Ala Phe Asp Leu Asn Gln Lys Tyr Thr Phe Ile Ile Gly Ser Ala Thr
210 215 220
Gly Ala Ala Asn Asn Glu His Gln Ile Gly Val Thr Leu Phe Glu Ala
225 230 235 240
Tyr Phe Thr Lys Pro Thr Ile Glu Ala Asn Pro Val Asp Ile Glu Leu
245 250 255
Gly Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
260 265 270
Thr Asp Ser Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Tyr
275 280 285
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Ser Val Lys Tyr Lys
290 295 300
Val Val Asn Asn Tyr Glu Glu Ser Asp Glu Lys Thr Ile Ala Val Thr
305 310 315 320
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro Thr Gly Trp
325 330 335
Lys Phe Phe Ser Gly Glu Thr Ile Thr Leu Glu Glu Asp Glu Glu Asn
340 345 350
Ala Leu Asn Gly Lys Trp Val Phe Tyr Ala Asp Lys His Val Ala Ile
355 360 365
Tyr Lys Gln Val Glu Leu Lys Asn Asn Ile Pro Tyr Gln Ile Thr Val
370 375 380
Tyr Val Lys Pro Glu Asp Glu Gly Thr Val Ala His His Ile Val Lys
385 390 395 400
Val Ser Phe Lys Ser Asp Ser Ala Gly Pro Glu Asn Glu Glu Val Ile
405 410 415
Asn Glu Arg Leu Ile Asp Ala Glu Gln Ile Gln Lys Gly Tyr Arg Lys
420 425 430
Leu Thr Ser Met Pro Phe Thr Pro Thr Thr Ile Val Pro Asn Lys Lys
435 440 445
Pro Val Ile Ile Val Glu Asn Phe Leu Pro Gly Trp Ile Gly Gly Val
450 455 460
Arg Ile Ile Val Glu Pro Thr Lys
465 470
<210> 145
<211> 632
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 145
Leu Asn Ser Lys Ser Ile Ile Glu Lys Gly Val Gln Glu Asn Gln Tyr
1 5 10 15
Ile Asp Ile Arg Asn Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp
20 25 30
Pro Asn Thr Asn Val Thr Thr Leu Thr Glu Ala Ile Asn Ser Gln Ala
35 40 45
Gly Ala Ile Ala Gly Lys Thr Ala Leu Asp Met Arg Arg Asp Phe Thr
50 55 60
Leu Val Ala Asp Ile Tyr Leu Gly Ser Asn Ser Ser Gly Ala Asp Gly
65 70 75 80
Ile Ala Ile Ala Phe His Arg Gly Ser Ile Gly Phe Ile Gly Thr Met
85 90 95
Gly Gly Gly Leu Gly Ile Leu Gly Ala Pro Asn Gly Ile Gly Phe Glu
100 105 110
Ile Asp Thr Tyr Trp Lys Ala Thr Ser Asp Glu Thr Gly Asp Ser Phe
115 120 125
Gly His Ser Gln Met Asn Gly Ala His Ala Gly Phe Val Ser Thr Asn
130 135 140
Arg Asn Ala Ser Tyr Leu Thr Ala Leu Ala Pro Met Gln Lys Ile Pro
145 150 155 160
Ala Pro Asn Asn Lys Trp Arg Val Leu Thr Ile Asn Trp Asp Ala Arg
165 170 175
Asn Asn Lys Leu Thr Ala Arg Leu Gln Glu Lys Ser Asn Asp Ala Ser
180 185 190
Thr Ser Thr Pro Ser Pro Arg Tyr Gln Thr Trp Glu Leu Leu Asn Pro
195 200 205
Ser Phe Asp Leu Asn Gln Lys Tyr Thr Phe Ile Ile Gly Ser Ala Thr
210 215 220
Gly Ala Ala Asn Asn Lys His Gln Ile Gly Val Thr Leu Phe Glu Ala
225 230 235 240
Tyr Phe Thr Lys Pro Thr Ile Glu Ala Asn Pro Val Asp Ile Glu Leu
245 250 255
Gly Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
260 265 270
Thr Asp Glu Val Asp Gly Asp Ile Thr Lys Asp Ile Thr Val Glu Phe
275 280 285
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Arg Val Thr Tyr Lys
290 295 300
Val Val Asn Ser Tyr Gly Glu Ser Asp Glu Lys Thr Ile Glu Val Val
305 310 315 320
Val Tyr Thr Lys Pro Thr Ile Thr Ala His Asp Ile Ala Ile Lys Lys
325 330 335
Asp Leu Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
340 345 350
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Ala Val Lys Phe
355 360 365
Asn Asn Val Asp Thr Ser Lys Pro Gly Lys Tyr His Val Thr Tyr Lys
370 375 380
Val Ile Asn Ser Tyr Glu Lys Ile Asp Glu Lys Thr Ile Glu Val Ile
385 390 395 400
Val Tyr Thr Lys Pro Ser Ile Val Ala His Asp Val Glu Ile Lys Lys
405 410 415
Asp Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
420 425 430
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Ser
435 440 445
Asn Asp Val Asp Thr Ser Ile Pro Gly Ala Tyr Ser Val Lys Tyr Lys
450 455 460
Val Val Asn Asn Tyr Glu Glu Ser Asp Glu Lys Thr Ile Ala Val Thr
465 470 475 480
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro Thr Gly Trp
485 490 495
Lys Phe Phe Ser Gly Glu Thr Ile Thr Leu Glu Glu Asp Glu Glu Asn
500 505 510
Ala Leu Asn Gly Lys Trp Val Phe Tyr Ala Asp Lys His Val Ala Ile
515 520 525
Tyr Lys Gln Val Glu Leu Lys Asn Asn Ile Pro Tyr Gln Ile Thr Val
530 535 540
Tyr Val Lys Pro Glu Asp Glu Gly Thr Val Ala His His Ile Val Lys
545 550 555 560
Val Ser Phe Lys Ser Asp Ser Ala Gly Pro Glu Asn Glu Glu Val Ile
565 570 575
Asn Glu Arg Leu Ile Asp Ala Glu Gln Ile Gln Lys Gly Tyr Arg Lys
580 585 590
Leu Thr Ser Met Pro Phe Thr Pro Thr Thr Ile Val Pro Asn Lys Lys
595 600 605
Pro Val Ile Ile Val Glu Asn Phe Leu Pro Gly Trp Ile Gly Gly Val
610 615 620
Arg Ile Ile Val Glu Pro Thr Lys
625 630
<210> 146
<211> 632
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 146
Met Asn Ser Lys Ser Ile Ile Glu Lys Gly Val Gln Glu Asn Gln Tyr
1 5 10 15
Ile Asp Ile Arg Asn Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp
20 25 30
Pro Asn Thr Asn Val Thr Thr Leu Thr Glu Ala Ile Asn Ser Gln Ala
35 40 45
Gly Ala Ile Ala Gly Lys Thr Ala Leu Asp Met Arg Arg Asp Phe Thr
50 55 60
Leu Val Ala Asp Ile Tyr Leu Gly Ser Asn Ser Ser Gly Ala Asp Gly
65 70 75 80
Ile Ala Ile Ala Phe His Arg Gly Ser Ile Gly Phe Ile Gly Thr Met
85 90 95
Gly Gly Gly Leu Gly Ile Leu Gly Ala Pro Asn Gly Ile Gly Phe Glu
100 105 110
Ile Asp Thr Tyr Trp Lys Ala Thr Ser Asp Glu Thr Gly Asp Ser Phe
115 120 125
Gly His Ser Gln Met Asn Gly Ala His Ala Gly Phe Val Ser Thr Asn
130 135 140
Arg Asn Ala Ser Tyr Leu Thr Ala Leu Ala Pro Met Gln Lys Ile Pro
145 150 155 160
Ala Pro Asn Asn Lys Trp Arg Val Leu Thr Ile Asn Trp Asp Ala Arg
165 170 175
Asn Asn Lys Leu Thr Ala Arg Leu Gln Glu Lys Ser Asn Asp Ala Ser
180 185 190
Thr Ser Thr Pro Ser Pro Arg Tyr Gln Thr Trp Glu Leu Leu Asn Pro
195 200 205
Ser Phe Asp Leu Asn Gln Lys Tyr Thr Phe Ile Ile Gly Ser Ala Thr
210 215 220
Gly Ala Ala Asn Asn Lys His Gln Ile Gly Val Thr Leu Phe Glu Ala
225 230 235 240
Tyr Phe Thr Lys Pro Thr Ile Glu Ala Asn Pro Val Asp Ile Glu Leu
245 250 255
Gly Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
260 265 270
Thr Asp Glu Val Asp Gly Asp Ile Thr Lys Asp Ile Thr Val Glu Phe
275 280 285
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Arg Val Thr Tyr Lys
290 295 300
Val Val Asn Ser Tyr Gly Glu Ser Asp Glu Lys Thr Ile Glu Val Val
305 310 315 320
Val Tyr Thr Lys Pro Thr Ile Thr Ala His Asp Ile Ala Ile Lys Lys
325 330 335
Asp Leu Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
340 345 350
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Ala Val Lys Phe
355 360 365
Asn Asn Val Asp Thr Ser Lys Pro Gly Lys Tyr His Val Thr Tyr Lys
370 375 380
Val Ile Asn Ser Tyr Glu Lys Ile Asp Glu Lys Thr Ile Glu Val Ile
385 390 395 400
Val Tyr Thr Lys Pro Ser Ile Val Ala His Asp Val Glu Ile Lys Lys
405 410 415
Asp Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
420 425 430
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Ser
435 440 445
Asn Asp Val Asp Thr Ser Ile Pro Gly Ala Tyr Ser Val Lys Tyr Lys
450 455 460
Val Val Asn Asn Tyr Glu Glu Ser Asp Glu Lys Thr Ile Ala Val Thr
465 470 475 480
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro Thr Gly Trp
485 490 495
Lys Phe Phe Ser Gly Glu Thr Ile Thr Leu Glu Glu Asp Glu Glu Asn
500 505 510
Ala Leu Asn Gly Lys Trp Val Phe Tyr Ala Asp Lys His Val Ala Ile
515 520 525
Tyr Lys Gln Val Glu Leu Lys Asn Asn Ile Pro Tyr Gln Ile Thr Val
530 535 540
Tyr Val Lys Pro Glu Asp Glu Gly Thr Val Ala His His Ile Val Lys
545 550 555 560
Val Ser Phe Lys Ser Asp Ser Ala Gly Pro Glu Asn Glu Glu Val Ile
565 570 575
Asn Glu Arg Leu Ile Asp Ala Glu Gln Ile Gln Lys Gly Tyr Arg Lys
580 585 590
Leu Thr Ser Met Pro Phe Thr Pro Thr Thr Ile Val Pro Asn Lys Lys
595 600 605
Pro Val Ile Ile Val Glu Asn Phe Leu Pro Gly Trp Ile Gly Gly Val
610 615 620
Arg Ile Ile Val Glu Pro Thr Lys
625 630
<210> 147
<211> 632
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 147
Leu Asn Ser Lys Ser Ile Ile Glu Asn Glu Val Gln Glu Asn Gln Tyr
1 5 10 15
Ile Asp Ile Arg Asn Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp
20 25 30
Pro Asn Thr Asn Ile Thr Thr Leu Thr Glu Ala Ile Asn Ser Gln Ala
35 40 45
Gly Ala Ile Ala Gly Lys Thr Ala Leu Asp Met Arg Arg Asp Phe Thr
50 55 60
Leu Val Ala Asp Ile Tyr Leu Gly Ser Lys Ser Ser Gly Ala Asp Gly
65 70 75 80
Ile Ala Ile Ala Phe His Arg Gly Ser Ile Gly Phe Ile Gly Thr Met
85 90 95
Gly Gly Gly Leu Gly Ile Leu Gly Ala Pro Asn Gly Ile Gly Phe Glu
100 105 110
Ile Asp Thr Tyr Trp Lys Ala Ser Ser Asp Glu Thr Gly Asp Ser Phe
115 120 125
Gly His Gly Gln Met Asn Gly Pro His Ala Gly Phe Val Ser Thr Asp
130 135 140
Arg Lys Ala Ser Tyr Leu Thr Ala Leu Ala Pro Met Gln Arg Ile Ala
145 150 155 160
Pro Pro Asn Gly Gln Trp Arg Val Leu Thr Ile Lys Trp Asp Ala Arg
165 170 175
Asp Asn Lys Leu Thr Ala Ser Leu Gln Glu Lys Asn Asn Asp Ala Ser
180 185 190
Thr Arg Ser Ala Thr Pro Arg Tyr Gln Thr Trp Glu Leu Leu Asn Pro
195 200 205
Ala Phe Asp Leu Asn Gln Lys Tyr Thr Phe Val Ile Gly Ser Ala Thr
210 215 220
Gly Ala Ala Asn Asn Lys His Gln Ile Gly Val Thr Leu Phe Glu Ala
225 230 235 240
Tyr Phe Thr Lys Pro Thr Ile Val Ala Asn Pro Val Asp Ile Glu Ile
245 250 255
Gly Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
260 265 270
Thr Asp Glu Val Asp Gly Asp Ile Thr Lys Asp Ile Thr Val Glu Phe
275 280 285
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Arg Val Thr Tyr Lys
290 295 300
Val Val Asn Ser Tyr Gly Glu Ser Asp Glu Lys Thr Ile Glu Val Val
305 310 315 320
Val Tyr Thr Lys Pro Thr Ile Thr Ala His Asp Val Ala Ile Lys Lys
325 330 335
Gly Leu Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
340 345 350
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Lys Phe
355 360 365
Asn Asn Val Asp Thr Ser Lys Pro Gly Lys Tyr His Val Thr Tyr Lys
370 375 380
Val Ile Asn Ser Tyr Glu Lys Ile Asp Glu Lys Thr Ile Glu Val Thr
385 390 395 400
Val Tyr Thr Lys Pro Thr Ile Val Ala Gln Asp Val Lys Ile Lys Lys
405 410 415
Asp Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
420 425 430
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Phe
435 440 445
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Ser Val Arg Tyr Lys
450 455 460
Val Val Asn Asn Tyr Glu Lys Ser Asp Glu Lys Thr Ile Ala Val Thr
465 470 475 480
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro Thr Gly Trp
485 490 495
Lys Phe Phe Ser Gly Glu Thr Ile Thr Leu Glu Glu Asp Glu Glu Asn
500 505 510
Ala Leu Asn Gly Lys Trp Val Phe Tyr Ala Asp Lys His Val Ala Ile
515 520 525
Tyr Lys Gln Val Glu Leu Lys Asn Asn Thr Pro Tyr Gln Ile Thr Val
530 535 540
Tyr Val Lys Pro Glu Asp Glu Glu Thr Val Ala His His Ile Val Lys
545 550 555 560
Val Ser Phe Lys Ser Asp Ser Ala Gly Gln Glu Ser Glu Glu Ile Ile
565 570 575
Asn Glu Arg Leu Ile Asp Ala Glu Gln Ile Gln Lys Gly Tyr Arg Lys
580 585 590
Leu Thr Ser Ile Pro Phe Thr Pro Thr Thr Ile Val Pro Asn Lys Lys
595 600 605
Pro Val Ile Ile Val Glu Asn Phe Leu Pro Gly Trp Ile Gly Gly Val
610 615 620
Arg Ile Ile Val Glu Pro Thr Lys
625 630
<210> 148
<211> 632
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 148
Met Asn Ser Lys Ser Ile Ile Glu Asn Glu Val Gln Glu Asn Gln Tyr
1 5 10 15
Ile Asp Ile Arg Asn Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp
20 25 30
Pro Asn Thr Asn Ile Thr Thr Leu Thr Glu Ala Ile Asn Ser Gln Ala
35 40 45
Gly Ala Ile Ala Gly Lys Thr Ala Leu Asp Met Arg Arg Asp Phe Thr
50 55 60
Leu Val Ala Asp Ile Tyr Leu Gly Ser Lys Ser Ser Gly Ala Asp Gly
65 70 75 80
Ile Ala Ile Ala Phe His Arg Gly Ser Ile Gly Phe Ile Gly Thr Met
85 90 95
Gly Gly Gly Leu Gly Ile Leu Gly Ala Pro Asn Gly Ile Gly Phe Glu
100 105 110
Ile Asp Thr Tyr Trp Lys Ala Ser Ser Asp Glu Thr Gly Asp Ser Phe
115 120 125
Gly His Gly Gln Met Asn Gly Pro His Ala Gly Phe Val Ser Thr Asp
130 135 140
Arg Lys Ala Ser Tyr Leu Thr Ala Leu Ala Pro Met Gln Arg Ile Ala
145 150 155 160
Pro Pro Asn Gly Gln Trp Arg Val Leu Thr Ile Lys Trp Asp Ala Arg
165 170 175
Asp Asn Lys Leu Thr Ala Ser Leu Gln Glu Lys Asn Asn Asp Ala Ser
180 185 190
Thr Arg Ser Ala Thr Pro Arg Tyr Gln Thr Trp Glu Leu Leu Asn Pro
195 200 205
Ala Phe Asp Leu Asn Gln Lys Tyr Thr Phe Val Ile Gly Ser Ala Thr
210 215 220
Gly Ala Ala Asn Asn Lys His Gln Ile Gly Val Thr Leu Phe Glu Ala
225 230 235 240
Tyr Phe Thr Lys Pro Thr Ile Val Ala Asn Pro Val Asp Ile Glu Ile
245 250 255
Gly Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
260 265 270
Thr Asp Glu Val Asp Gly Asp Ile Thr Lys Asp Ile Thr Val Glu Phe
275 280 285
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Arg Val Thr Tyr Lys
290 295 300
Val Val Asn Ser Tyr Gly Glu Ser Asp Glu Lys Thr Ile Glu Val Val
305 310 315 320
Val Tyr Thr Lys Pro Thr Ile Thr Ala His Asp Val Ala Ile Lys Lys
325 330 335
Gly Leu Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
340 345 350
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Lys Phe
355 360 365
Asn Asn Val Asp Thr Ser Lys Pro Gly Lys Tyr His Val Thr Tyr Lys
370 375 380
Val Ile Asn Ser Tyr Glu Lys Ile Asp Glu Lys Thr Ile Glu Val Thr
385 390 395 400
Val Tyr Thr Lys Pro Thr Ile Val Ala Gln Asp Val Lys Ile Lys Lys
405 410 415
Asp Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
420 425 430
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Phe
435 440 445
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Ser Val Arg Tyr Lys
450 455 460
Val Val Asn Asn Tyr Glu Lys Ser Asp Glu Lys Thr Ile Ala Val Thr
465 470 475 480
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro Thr Gly Trp
485 490 495
Lys Phe Phe Ser Gly Glu Thr Ile Thr Leu Glu Glu Asp Glu Glu Asn
500 505 510
Ala Leu Asn Gly Lys Trp Val Phe Tyr Ala Asp Lys His Val Ala Ile
515 520 525
Tyr Lys Gln Val Glu Leu Lys Asn Asn Thr Pro Tyr Gln Ile Thr Val
530 535 540
Tyr Val Lys Pro Glu Asp Glu Glu Thr Val Ala His His Ile Val Lys
545 550 555 560
Val Ser Phe Lys Ser Asp Ser Ala Gly Gln Glu Ser Glu Glu Ile Ile
565 570 575
Asn Glu Arg Leu Ile Asp Ala Glu Gln Ile Gln Lys Gly Tyr Arg Lys
580 585 590
Leu Thr Ser Ile Pro Phe Thr Pro Thr Thr Ile Val Pro Asn Lys Lys
595 600 605
Pro Val Ile Ile Val Glu Asn Phe Leu Pro Gly Trp Ile Gly Gly Val
610 615 620
Arg Ile Ile Val Glu Pro Thr Lys
625 630
<210> 149
<211> 641
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 149
Met Lys Gly Arg Arg Pro Met Gly Asn Met Asp Ser Lys Ser Val Met
1 5 10 15
Glu Lys Lys Glu Gln Lys Ser Gln Tyr Leu Asp Ile Arg Asp Ile Cys
20 25 30
Ser Ile Asn Gly Ser Ala Lys Phe Asp Pro Asn Thr Asn Ile Thr Thr
35 40 45
Leu Thr Glu Ala Ile Asn Ser Gln Ala Gly Ala Ile Ala Gly Lys Thr
50 55 60
Ala Phe Asp Met Arg His Asp Phe Thr Leu Val Ala Asp Ile Tyr Leu
65 70 75 80
Gly Ser Lys Ser Ser Gly Ala Asp Gly Ile Ala Ile Ala Phe His Arg
85 90 95
Gly Ser Ile Gly Phe Ile Gly Gln Met Gly Gly Gly Leu Gly Ile Leu
100 105 110
Gly Ala Pro Asn Gly Ile Gly Phe Glu Ile Asp Thr Tyr Trp Lys Ala
115 120 125
Ser Ser Asp Glu Thr Gly Asp Ser Phe Gly His Gly Gln Met Asn Gly
130 135 140
Pro His Ala Gly Phe Val Ser Thr Asn Arg Asn Thr Ser Tyr Leu Thr
145 150 155 160
Ala Leu Ala Pro Met Gln Arg Ile Pro Ala Pro Asn Ser Lys Trp Arg
165 170 175
Ile Leu Thr Ile Asn Trp Asp Ala Arg Asn Asn Lys Leu Thr Ala Arg
180 185 190
Leu Gln Glu Lys Asn Asn Asp Asp Thr Thr Arg Ser Ala Ser Pro Arg
195 200 205
Tyr Gln Thr Trp Glu Leu Leu Asn Pro Ala Phe Asp Leu Asn Gln Lys
210 215 220
Tyr Thr Phe Val Ile Gly Ser Ala Thr Gly Ala Ala Asn Asn Lys His
225 230 235 240
Gln Ile Gly Val Thr Leu Phe Glu Ala Tyr Phe Thr Lys Pro Thr Ile
245 250 255
Glu Ala Asn Pro Val Asp Ile Glu Ile Gly Thr Ala Phe Asp Pro Leu
260 265 270
Lys Tyr Glu Leu Ile Gly Leu Lys Ala Thr Asp Glu Ile Asp Gly Asp
275 280 285
Ile Thr Asp Lys Ile Thr Val Glu Phe Asn Asn Val Asp Thr Ser Lys
290 295 300
Pro Gly Ala Tyr Arg Val Thr Tyr Lys Val Leu Asn Ser Tyr Glu Glu
305 310 315 320
Ser Asp Glu Lys Thr Ile Glu Val Val Val Tyr Thr Lys Pro Thr Ile
325 330 335
Ala Ala His Asp Val Ala Ile Lys Lys Asp Leu Ala Phe Asp Pro Leu
340 345 350
Asp Tyr Glu Pro Ile Glu Leu Lys Ala Thr Asp Pro Ile Asp Gly Asp
355 360 365
Ile Thr Asp Lys Ile Thr Ile Glu Ser Asn Asn Ala Asp Thr Ser Lys
370 375 380
Pro Gly Lys Tyr His Val Thr Tyr Lys Val Leu Asn Ser Tyr Glu Lys
385 390 395 400
Ser Asp Glu Lys Thr Ile Glu Ile Thr Val Tyr Thr Lys Pro Thr Leu
405 410 415
Glu Ala Tyr Asp Val Glu Ile Lys Lys Asp Thr Val Phe Asp Pro Leu
420 425 430
Asn Tyr Glu Pro Ile Gly Leu Lys Ala Thr Asp Pro Ile Asp Gly Asp
435 440 445
Ile Thr Asp Lys Ile Thr Val Glu Ser Asn Asn Val Asp Thr Ser Lys
450 455 460
Pro Gly Glu Tyr His Val Thr Tyr Lys Val Leu Asn Ser Tyr Glu Glu
465 470 475 480
Ser Asp Glu Lys Thr Ile Thr Val Met Val Pro Val Ile Asp Asp Gly
485 490 495
Trp Glu Asn Gly Asp Pro Asn Gly Trp Lys Phe Phe Ser Gly Glu Ser
500 505 510
Ile Thr Leu Glu Glu Asp Glu Glu Asn Ala Leu Asn Gly Lys Trp Val
515 520 525
Phe Tyr Ser Asp Lys His Val Ala Ile Tyr Lys Gln Val Glu Leu Glu
530 535 540
Asn Asn Ile Ser Tyr Gln Ile Thr Val Tyr Val Lys Pro Glu Asp Glu
545 550 555 560
Gly Thr Val Ala Asn His Ile Val Lys Val Ser Leu Lys Pro Asp Pro
565 570 575
Ala Ser Gly Glu Ser Gln Glu Ile Leu Asn Thr Arg Leu Leu Gly Ala
580 585 590
Glu Gln Ile Gln Lys Gly Tyr Arg Lys Leu Thr Ser Asn Pro Phe Ile
595 600 605
Pro Thr Thr Ile Glu Pro Tyr Lys Lys Pro Ile Ile Val Ile Glu Asn
610 615 620
Phe Leu Ala Gly Trp Ile Gly Gly Ile Lys Ile Ile Val Glu Pro Thr
625 630 635 640
Lys
<210> 150
<211> 632
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 150
Met Asp Ser Lys Ser Val Met Glu Lys Lys Glu Gln Lys Ser Gln Tyr
1 5 10 15
Leu Asp Ile Arg Asp Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp
20 25 30
Pro Asn Thr Asn Ile Thr Thr Leu Thr Glu Ala Ile Asn Ser Gln Ala
35 40 45
Gly Ala Ile Ala Gly Lys Thr Ala Phe Asp Met Arg His Asp Phe Thr
50 55 60
Leu Val Ala Asp Ile Tyr Leu Gly Ser Lys Ser Ser Gly Ala Asp Gly
65 70 75 80
Ile Ala Ile Ala Phe His Arg Gly Ser Ile Gly Phe Ile Gly Gln Met
85 90 95
Gly Gly Gly Leu Gly Ile Leu Gly Ala Pro Asn Gly Ile Gly Phe Glu
100 105 110
Ile Asp Thr Tyr Trp Lys Ala Ser Ser Asp Glu Thr Gly Asp Ser Phe
115 120 125
Gly His Gly Gln Met Asn Gly Pro His Ala Gly Phe Val Ser Thr Asn
130 135 140
Arg Asn Thr Ser Tyr Leu Thr Ala Leu Ala Pro Met Gln Arg Ile Pro
145 150 155 160
Ala Pro Asn Ser Lys Trp Arg Ile Leu Thr Ile Asn Trp Asp Ala Arg
165 170 175
Asn Asn Lys Leu Thr Ala Arg Leu Gln Glu Lys Asn Asn Asp Asp Thr
180 185 190
Thr Arg Ser Ala Ser Pro Arg Tyr Gln Thr Trp Glu Leu Leu Asn Pro
195 200 205
Ala Phe Asp Leu Asn Gln Lys Tyr Thr Phe Val Ile Gly Ser Ala Thr
210 215 220
Gly Ala Ala Asn Asn Lys His Gln Ile Gly Val Thr Leu Phe Glu Ala
225 230 235 240
Tyr Phe Thr Lys Pro Thr Ile Glu Ala Asn Pro Val Asp Ile Glu Ile
245 250 255
Gly Thr Ala Phe Asp Pro Leu Lys Tyr Glu Leu Ile Gly Leu Lys Ala
260 265 270
Thr Asp Glu Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Phe
275 280 285
Asn Asn Val Asp Thr Ser Lys Pro Gly Ala Tyr Arg Val Thr Tyr Lys
290 295 300
Val Leu Asn Ser Tyr Glu Glu Ser Asp Glu Lys Thr Ile Glu Val Val
305 310 315 320
Val Tyr Thr Lys Pro Thr Ile Ala Ala His Asp Val Ala Ile Lys Lys
325 330 335
Asp Leu Ala Phe Asp Pro Leu Asp Tyr Glu Pro Ile Glu Leu Lys Ala
340 345 350
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Ile Glu Ser
355 360 365
Asn Asn Ala Asp Thr Ser Lys Pro Gly Lys Tyr His Val Thr Tyr Lys
370 375 380
Val Leu Asn Ser Tyr Glu Lys Ser Asp Glu Lys Thr Ile Glu Ile Thr
385 390 395 400
Val Tyr Thr Lys Pro Thr Leu Glu Ala Tyr Asp Val Glu Ile Lys Lys
405 410 415
Asp Thr Val Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
420 425 430
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Ser
435 440 445
Asn Asn Val Asp Thr Ser Lys Pro Gly Glu Tyr His Val Thr Tyr Lys
450 455 460
Val Leu Asn Ser Tyr Glu Glu Ser Asp Glu Lys Thr Ile Thr Val Met
465 470 475 480
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro Asn Gly Trp
485 490 495
Lys Phe Phe Ser Gly Glu Ser Ile Thr Leu Glu Glu Asp Glu Glu Asn
500 505 510
Ala Leu Asn Gly Lys Trp Val Phe Tyr Ser Asp Lys His Val Ala Ile
515 520 525
Tyr Lys Gln Val Glu Leu Glu Asn Asn Ile Ser Tyr Gln Ile Thr Val
530 535 540
Tyr Val Lys Pro Glu Asp Glu Gly Thr Val Ala Asn His Ile Val Lys
545 550 555 560
Val Ser Leu Lys Pro Asp Pro Ala Ser Gly Glu Ser Gln Glu Ile Leu
565 570 575
Asn Thr Arg Leu Leu Gly Ala Glu Gln Ile Gln Lys Gly Tyr Arg Lys
580 585 590
Leu Thr Ser Asn Pro Phe Ile Pro Thr Thr Ile Glu Pro Tyr Lys Lys
595 600 605
Pro Ile Ile Val Ile Glu Asn Phe Leu Ala Gly Trp Ile Gly Gly Ile
610 615 620
Lys Ile Ile Val Glu Pro Thr Lys
625 630
<210> 151
<211> 632
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 151
Leu Asn Ser Lys Ser Ile Ile Glu Lys Glu Val Gln Glu Ser Gln Tyr
1 5 10 15
Ile Asp Ile Arg Asn Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp
20 25 30
Pro Asn Thr Asn Ile Thr Thr Leu Thr Glu Ala Lys Asn Ser Gln Ala
35 40 45
Gly Ala Ile Ala Gly Lys Thr Ala Leu Asp Met Arg Arg Asp Phe Thr
50 55 60
Leu Val Ala Asp Ile Tyr Leu Gly Ser Asn Ser Ser Gly Ala Asp Gly
65 70 75 80
Ile Ala Ile Ala Phe His Arg Gly Ser Ile Gly Phe Ile Gly Thr Met
85 90 95
Gly Gly Gly Leu Gly Ile Leu Gly Ala Pro Asn Gly Ile Gly Phe Glu
100 105 110
Ile Asp Thr Tyr Trp Lys Ala Thr Ser Asp Glu Thr Gly Asp Ser Phe
115 120 125
Gly His Gly Gln Met Asn Gly Ala His Ala Gly Phe Val Ser Thr Asn
130 135 140
Arg Asn Ala Ser Tyr Leu Thr Ala Leu Ala Pro Met Gln Lys Ile Pro
145 150 155 160
Ala Pro Asn Asn Lys Trp Arg Val Leu Thr Ile Asn Trp Asp Ala Arg
165 170 175
Asn Asn Lys Leu Ile Ala Ser Leu Gln Glu Lys Asn Asn Asp Ala Ser
180 185 190
Thr Arg Ser Ala Thr Pro Arg Tyr Gln Thr Trp Glu Leu Leu Asn Pro
195 200 205
Ala Phe Asp Leu Lys Gln Lys Tyr Thr Phe Ile Ile Gly Ser Ala Thr
210 215 220
Gly Ala Ala Asn Asn Lys His Gln Ile Gly Val Thr Leu Phe Glu Ala
225 230 235 240
Tyr Phe Thr Lys Pro Thr Ile Val Ala Asn Pro Val Asp Ile Glu Leu
245 250 255
Gly Thr Ala Phe Asp Pro Leu Asn Tyr Gln Pro Ile Gly Leu Lys Ala
260 265 270
Thr Asp Glu Val Asp Gly Asp Ile Thr Lys Asp Ile Thr Val Glu Phe
275 280 285
Asn Asp Val Asp Thr Ser Lys Pro Gly Pro Tyr Arg Val Thr Tyr Lys
290 295 300
Val Val Asn Ser Tyr Gly Glu Ser Asp Glu Lys Thr Ile Glu Val Val
305 310 315 320
Val Tyr Thr Lys Pro Thr Ile Thr Ala His Asp Ile Ala Ile Lys Lys
325 330 335
Asp Leu Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
340 345 350
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Ala Val Lys Phe
355 360 365
Asn Asn Val Asp Thr Ser Lys Pro Gly Lys Tyr His Val Thr Tyr Lys
370 375 380
Val Ile Asn Ser Tyr Glu Lys Ile Asp Glu Lys Thr Ile Glu Val Thr
385 390 395 400
Val Tyr Thr Lys Pro Thr Ile Val Ala His Asp Val Ala Ile Lys Lys
405 410 415
Asp Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
420 425 430
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Ser Val Glu Ser
435 440 445
Asn Asn Val Asp Thr Ser Lys Pro Gly Glu Tyr Gln Val Thr Tyr Lys
450 455 460
Val Ile Asn Ser Tyr Gly Glu Phe Asp Asp Lys Thr Ile Thr Ile Thr
465 470 475 480
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro Gln Gly Trp
485 490 495
Lys Phe Phe Ser Gly Glu Thr Ile Thr Leu Glu Glu Asp Glu Glu Asn
500 505 510
Ala Leu Asn Gly Lys Trp Val Phe Tyr Ala Asp Lys His Val Ala Ile
515 520 525
Tyr Lys Gln Val Glu Phe Lys Asn Asn Thr Pro Tyr Gln Ile Thr Val
530 535 540
Tyr Ile Lys Pro Glu Asp Glu Glu Thr Val Ala His His Asn Val Lys
545 550 555 560
Val Ser Phe Lys Ser Asp Ser Ala Ser Gln Glu Ser Glu Glu Ile Leu
565 570 575
Asn Glu Arg Leu Ile Asp Ala Glu Gln Ile Gln Lys Gly Tyr Arg Lys
580 585 590
Leu Thr Ser Ile Pro Phe Thr Pro Thr Thr Ile Ala Pro Asn Lys Lys
595 600 605
Pro Val Ile Ile Val Glu Asn Phe Leu Pro Gly Trp Ile Gly Gly Val
610 615 620
Arg Ile Ile Val Glu Pro Thr Lys
625 630
<210> 152
<211> 632
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 152
Met Asn Ser Lys Ser Ile Ile Glu Lys Glu Val Gln Glu Ser Gln Tyr
1 5 10 15
Ile Asp Ile Arg Asn Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp
20 25 30
Pro Asn Thr Asn Ile Thr Thr Leu Thr Glu Ala Lys Asn Ser Gln Ala
35 40 45
Gly Ala Ile Ala Gly Lys Thr Ala Leu Asp Met Arg Arg Asp Phe Thr
50 55 60
Leu Val Ala Asp Ile Tyr Leu Gly Ser Asn Ser Ser Gly Ala Asp Gly
65 70 75 80
Ile Ala Ile Ala Phe His Arg Gly Ser Ile Gly Phe Ile Gly Thr Met
85 90 95
Gly Gly Gly Leu Gly Ile Leu Gly Ala Pro Asn Gly Ile Gly Phe Glu
100 105 110
Ile Asp Thr Tyr Trp Lys Ala Thr Ser Asp Glu Thr Gly Asp Ser Phe
115 120 125
Gly His Gly Gln Met Asn Gly Ala His Ala Gly Phe Val Ser Thr Asn
130 135 140
Arg Asn Ala Ser Tyr Leu Thr Ala Leu Ala Pro Met Gln Lys Ile Pro
145 150 155 160
Ala Pro Asn Asn Lys Trp Arg Val Leu Thr Ile Asn Trp Asp Ala Arg
165 170 175
Asn Asn Lys Leu Ile Ala Ser Leu Gln Glu Lys Asn Asn Asp Ala Ser
180 185 190
Thr Arg Ser Ala Thr Pro Arg Tyr Gln Thr Trp Glu Leu Leu Asn Pro
195 200 205
Ala Phe Asp Leu Lys Gln Lys Tyr Thr Phe Ile Ile Gly Ser Ala Thr
210 215 220
Gly Ala Ala Asn Asn Lys His Gln Ile Gly Val Thr Leu Phe Glu Ala
225 230 235 240
Tyr Phe Thr Lys Pro Thr Ile Val Ala Asn Pro Val Asp Ile Glu Leu
245 250 255
Gly Thr Ala Phe Asp Pro Leu Asn Tyr Gln Pro Ile Gly Leu Lys Ala
260 265 270
Thr Asp Glu Val Asp Gly Asp Ile Thr Lys Asp Ile Thr Val Glu Phe
275 280 285
Asn Asp Val Asp Thr Ser Lys Pro Gly Pro Tyr Arg Val Thr Tyr Lys
290 295 300
Val Val Asn Ser Tyr Gly Glu Ser Asp Glu Lys Thr Ile Glu Val Val
305 310 315 320
Val Tyr Thr Lys Pro Thr Ile Thr Ala His Asp Ile Ala Ile Lys Lys
325 330 335
Asp Leu Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
340 345 350
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Ala Val Lys Phe
355 360 365
Asn Asn Val Asp Thr Ser Lys Pro Gly Lys Tyr His Val Thr Tyr Lys
370 375 380
Val Ile Asn Ser Tyr Glu Lys Ile Asp Glu Lys Thr Ile Glu Val Thr
385 390 395 400
Val Tyr Thr Lys Pro Thr Ile Val Ala His Asp Val Ala Ile Lys Lys
405 410 415
Asp Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
420 425 430
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Ser Val Glu Ser
435 440 445
Asn Asn Val Asp Thr Ser Lys Pro Gly Glu Tyr Gln Val Thr Tyr Lys
450 455 460
Val Ile Asn Ser Tyr Gly Glu Phe Asp Asp Lys Thr Ile Thr Ile Thr
465 470 475 480
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro Gln Gly Trp
485 490 495
Lys Phe Phe Ser Gly Glu Thr Ile Thr Leu Glu Glu Asp Glu Glu Asn
500 505 510
Ala Leu Asn Gly Lys Trp Val Phe Tyr Ala Asp Lys His Val Ala Ile
515 520 525
Tyr Lys Gln Val Glu Phe Lys Asn Asn Thr Pro Tyr Gln Ile Thr Val
530 535 540
Tyr Ile Lys Pro Glu Asp Glu Glu Thr Val Ala His His Asn Val Lys
545 550 555 560
Val Ser Phe Lys Ser Asp Ser Ala Ser Gln Glu Ser Glu Glu Ile Leu
565 570 575
Asn Glu Arg Leu Ile Asp Ala Glu Gln Ile Gln Lys Gly Tyr Arg Lys
580 585 590
Leu Thr Ser Ile Pro Phe Thr Pro Thr Thr Ile Ala Pro Asn Lys Lys
595 600 605
Pro Val Ile Ile Val Glu Asn Phe Leu Pro Gly Trp Ile Gly Gly Val
610 615 620
Arg Ile Ile Val Glu Pro Thr Lys
625 630
<210> 153
<211> 632
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 153
Leu Asn Ser Lys Ser Ile Ile Glu Asn Glu Val Gln Glu Asn Gln Tyr
1 5 10 15
Ile Asp Ile Arg Asn Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp
20 25 30
Pro Asn Thr Asn Ile Thr Thr Leu Thr Glu Ala Ile Asn Ser Gln Ala
35 40 45
Gly Ala Ile Ala Gly Lys Thr Ala Leu Asp Met Arg Arg Asp Phe Thr
50 55 60
Leu Val Ala Asp Ile Tyr Leu Gly Ser Lys Ser Ser Gly Ala Asp Gly
65 70 75 80
Ile Ala Ile Ala Phe His Arg Gly Ser Ile Gly Phe Ile Gly Thr Met
85 90 95
Gly Gly Gly Leu Gly Ile Leu Gly Ala Pro Asn Gly Ile Gly Phe Glu
100 105 110
Ile Asp Thr Tyr Trp Lys Ala Ser Ser Asp Glu Thr Gly Asp Ser Phe
115 120 125
Gly His Gly Gln Met Asn Gly Pro His Ala Gly Phe Val Ser Thr Asn
130 135 140
Arg Asn Ala Ser Tyr Leu Thr Ala Leu Ala Pro Met Gln Arg Ile Pro
145 150 155 160
Ala Pro Asn Asp Lys Trp Arg Val Leu Thr Ile Asn Trp Asp Ala Arg
165 170 175
Asn Asn Lys Leu Thr Ala Ser Leu Gln Glu Lys Asn Asn Asp Ala Ser
180 185 190
Thr Arg Ser Ala Thr Pro Arg Tyr Gln Ala Trp Glu Leu Leu Asn Pro
195 200 205
Ala Phe Asp Leu Asn Gln Lys Tyr Thr Phe Val Ile Gly Ser Ala Thr
210 215 220
Gly Ala Ala Asn Asn Lys His Gln Ile Gly Val Thr Leu Phe Glu Ala
225 230 235 240
Tyr Phe Thr Lys Pro Thr Ile Val Ala Asn Pro Val Asp Ile Glu Ile
245 250 255
Gly Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
260 265 270
Thr Asp Glu Val Asp Gly Asp Ile Thr Lys Asp Ile Thr Val Glu Phe
275 280 285
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Arg Val Thr Tyr Lys
290 295 300
Val Val Asn Ser Tyr Gly Glu Ser Asp Glu Lys Thr Ile Glu Val Val
305 310 315 320
Val Tyr Thr Lys Pro Thr Ile Thr Ala His Asp Val Ala Ile Lys Lys
325 330 335
Gly Leu Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
340 345 350
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Lys Phe
355 360 365
Asn Asn Val Asp Thr Ser Lys Pro Gly Lys Tyr His Val Thr Tyr Lys
370 375 380
Val Ile Asn Ser Tyr Glu Lys Ile Asp Glu Lys Thr Ile Glu Ile Thr
385 390 395 400
Val Tyr Thr Lys Pro Thr Ile Val Ala Gln Asp Val Lys Ile Lys Lys
405 410 415
Asp Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
420 425 430
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Phe
435 440 445
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Ser Val Arg Tyr Lys
450 455 460
Val Val Asn Asn Tyr Glu Glu Ser Asp Glu Lys Thr Ile Ala Val Thr
465 470 475 480
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro Thr Gly Trp
485 490 495
Lys Phe Phe Ser Gly Glu Thr Ile Thr Leu Glu Glu Asp Glu Glu Asn
500 505 510
Ala Leu Asn Gly Lys Trp Val Phe Tyr Ala Asp Lys His Val Ala Ile
515 520 525
Tyr Lys Gln Val Glu Leu Lys Asn Asn Thr Pro Tyr Gln Ile Thr Val
530 535 540
Tyr Val Lys Pro Glu Asp Glu Glu Thr Val Ala His His Ile Val Lys
545 550 555 560
Val Ser Phe Lys Ser Asp Ser Ala Gly Gln Glu Ser Glu Glu Ile Ile
565 570 575
Asn Glu Arg Leu Ile Asp Ala Glu Gln Ile Gln Lys Gly Tyr Arg Lys
580 585 590
Leu Thr Ser Ile Pro Phe Thr Pro Thr Thr Ile Val Pro Asn Lys Lys
595 600 605
Pro Val Ile Ile Val Glu Asn Phe Leu Pro Gly Trp Ile Gly Gly Val
610 615 620
Arg Ile Ile Val Glu Pro Thr Lys
625 630
<210> 154
<211> 632
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 154
Met Asn Ser Lys Ser Ile Ile Glu Asn Glu Val Gln Glu Asn Gln Tyr
1 5 10 15
Ile Asp Ile Arg Asn Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp
20 25 30
Pro Asn Thr Asn Ile Thr Thr Leu Thr Glu Ala Ile Asn Ser Gln Ala
35 40 45
Gly Ala Ile Ala Gly Lys Thr Ala Leu Asp Met Arg Arg Asp Phe Thr
50 55 60
Leu Val Ala Asp Ile Tyr Leu Gly Ser Lys Ser Ser Gly Ala Asp Gly
65 70 75 80
Ile Ala Ile Ala Phe His Arg Gly Ser Ile Gly Phe Ile Gly Thr Met
85 90 95
Gly Gly Gly Leu Gly Ile Leu Gly Ala Pro Asn Gly Ile Gly Phe Glu
100 105 110
Ile Asp Thr Tyr Trp Lys Ala Ser Ser Asp Glu Thr Gly Asp Ser Phe
115 120 125
Gly His Gly Gln Met Asn Gly Pro His Ala Gly Phe Val Ser Thr Asn
130 135 140
Arg Asn Ala Ser Tyr Leu Thr Ala Leu Ala Pro Met Gln Arg Ile Pro
145 150 155 160
Ala Pro Asn Asp Lys Trp Arg Val Leu Thr Ile Asn Trp Asp Ala Arg
165 170 175
Asn Asn Lys Leu Thr Ala Ser Leu Gln Glu Lys Asn Asn Asp Ala Ser
180 185 190
Thr Arg Ser Ala Thr Pro Arg Tyr Gln Ala Trp Glu Leu Leu Asn Pro
195 200 205
Ala Phe Asp Leu Asn Gln Lys Tyr Thr Phe Val Ile Gly Ser Ala Thr
210 215 220
Gly Ala Ala Asn Asn Lys His Gln Ile Gly Val Thr Leu Phe Glu Ala
225 230 235 240
Tyr Phe Thr Lys Pro Thr Ile Val Ala Asn Pro Val Asp Ile Glu Ile
245 250 255
Gly Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
260 265 270
Thr Asp Glu Val Asp Gly Asp Ile Thr Lys Asp Ile Thr Val Glu Phe
275 280 285
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Arg Val Thr Tyr Lys
290 295 300
Val Val Asn Ser Tyr Gly Glu Ser Asp Glu Lys Thr Ile Glu Val Val
305 310 315 320
Val Tyr Thr Lys Pro Thr Ile Thr Ala His Asp Val Ala Ile Lys Lys
325 330 335
Gly Leu Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
340 345 350
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Lys Phe
355 360 365
Asn Asn Val Asp Thr Ser Lys Pro Gly Lys Tyr His Val Thr Tyr Lys
370 375 380
Val Ile Asn Ser Tyr Glu Lys Ile Asp Glu Lys Thr Ile Glu Ile Thr
385 390 395 400
Val Tyr Thr Lys Pro Thr Ile Val Ala Gln Asp Val Lys Ile Lys Lys
405 410 415
Asp Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
420 425 430
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Phe
435 440 445
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Ser Val Arg Tyr Lys
450 455 460
Val Val Asn Asn Tyr Glu Glu Ser Asp Glu Lys Thr Ile Ala Val Thr
465 470 475 480
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro Thr Gly Trp
485 490 495
Lys Phe Phe Ser Gly Glu Thr Ile Thr Leu Glu Glu Asp Glu Glu Asn
500 505 510
Ala Leu Asn Gly Lys Trp Val Phe Tyr Ala Asp Lys His Val Ala Ile
515 520 525
Tyr Lys Gln Val Glu Leu Lys Asn Asn Thr Pro Tyr Gln Ile Thr Val
530 535 540
Tyr Val Lys Pro Glu Asp Glu Glu Thr Val Ala His His Ile Val Lys
545 550 555 560
Val Ser Phe Lys Ser Asp Ser Ala Gly Gln Glu Ser Glu Glu Ile Ile
565 570 575
Asn Glu Arg Leu Ile Asp Ala Glu Gln Ile Gln Lys Gly Tyr Arg Lys
580 585 590
Leu Thr Ser Ile Pro Phe Thr Pro Thr Thr Ile Val Pro Asn Lys Lys
595 600 605
Pro Val Ile Ile Val Glu Asn Phe Leu Pro Gly Trp Ile Gly Gly Val
610 615 620
Arg Ile Ile Val Glu Pro Thr Lys
625 630
<210> 155
<211> 632
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 155
Met Asn Ser Lys Ser Thr Ile Glu Lys Glu Val Gln Lys Ser Gln Tyr
1 5 10 15
Leu Asp Ile Arg Asn Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp
20 25 30
Pro Asn Thr Asn Ile Thr Thr Leu Thr Glu Ala Ile Asn Ser Gln Ala
35 40 45
Gly Ala Ile Ala Gly Lys Thr Ala Leu Asp Met Arg His Asp Phe Thr
50 55 60
Leu Val Ala Asp Ile Phe Leu Gly Ser Lys Ser Ser Gly Ala Asp Gly
65 70 75 80
Ile Ala Ile Thr Phe His Arg Gly Ser Ile Gly Phe Ile Gly Asn Met
85 90 95
Gly Gly Gly Leu Gly Ile Leu Gly Ala Pro Asn Gly Ile Gly Phe Glu
100 105 110
Ile Asp Thr Tyr Trp Lys Ala Ser Ser Asp Glu Thr Gly Asp Ser Phe
115 120 125
Gly His Gly Gln Met Asn Gly Pro His Ala Gly Phe Val Ser Thr Asn
130 135 140
Arg Asn Ala Ser Tyr Leu Thr Ala Leu Ala Pro Met Gln Arg Ile Pro
145 150 155 160
Ala Pro Asn Gly Lys Trp Arg Val Leu Thr Ile Asn Trp Asp Ala Arg
165 170 175
Asn Asn Lys Leu Thr Ala Arg Leu Gln Glu Lys Ser Asn Asp Ala Ser
180 185 190
Thr Ser Ser Pro Ser Pro Arg Tyr Gln Thr Trp Glu Leu Leu Asn Pro
195 200 205
Ala Phe Asp Leu Asn Gln Lys Tyr Thr Phe Val Ile Gly Ser Ala Thr
210 215 220
Gly Ala Ala Asn Asn Lys His Gln Ile Gly Ile Thr Leu Phe Glu Ala
225 230 235 240
Tyr Phe Thr Lys Pro Thr Ile Glu Ala Asn Pro Val Asp Ile Glu Ile
245 250 255
Gly Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
260 265 270
Thr Asp Glu Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Gly Phe
275 280 285
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Arg Val Thr Tyr Lys
290 295 300
Val Val Asn Ser Tyr Glu Glu Ser Asp Glu Lys Thr Ile Glu Val Ile
305 310 315 320
Val Tyr Thr Lys Pro Thr Ile Thr Ala His Asp Val Val Ile Lys Lys
325 330 335
Asp Leu Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
340 345 350
Ile Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Val Thr Val Glu Ser
355 360 365
Asn Asn Val Asp Thr Ser Lys Pro Gly Lys Tyr His Val Ala Tyr Lys
370 375 380
Val Val Asn Ser Tyr Glu Lys Ser Asp Glu Lys Thr Ile Glu Val Val
385 390 395 400
Val Tyr Thr Lys Pro Thr Leu Glu Ala His Asp Val Glu Ile Lys Lys
405 410 415
Asp Thr Val Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
420 425 430
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Ser
435 440 445
Asp Asn Val Asp Thr Ser Lys Pro Gly Glu Tyr His Val Thr Tyr Lys
450 455 460
Val Val Asn Ser Tyr Glu Glu Ser Asp Glu Lys Ser Ile Leu Val Thr
465 470 475 480
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro Lys Gly Trp
485 490 495
Lys Phe Phe Ser Gly Glu Ser Ile Thr Leu Asp Glu Asp Glu Glu Asn
500 505 510
Ala Leu Asn Gly Lys Trp Val Phe Ser Ser Asp Lys His Val Ala Ile
515 520 525
Tyr Lys Gln Val Glu Leu Glu Asn Asn Thr Thr Tyr Gln Ile Thr Val
530 535 540
Tyr Val Lys Pro Glu Asp Glu Gly Thr Val Ala His His Ile Val Lys
545 550 555 560
Ala Ser Leu Lys Pro Asp Pro Ser Gly Pro Asp Ser Glu Glu Leu Leu
565 570 575
Asn Glu Arg Leu Ile Asn Gly Glu Gln Ile Gln Lys Gly Tyr Arg Lys
580 585 590
Leu Thr Ser Ile Pro Phe Thr Pro Thr Thr Ile Glu Pro Tyr Lys Lys
595 600 605
Pro Leu Ile Val Ile Glu Asn Tyr Leu Ala Gly Trp Ile Gly Gly Ile
610 615 620
Lys Ile Ile Val Glu Pro Thr Lys
625 630
<210> 156
<211> 632
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 156
Leu Asn Ser Lys Ser Ile Ile Glu Lys Gly Val Gln Glu Asn Gln Tyr
1 5 10 15
Ile Asp Ile Arg Asn Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp
20 25 30
Pro Asn Thr Asn Val Thr Thr Leu Thr Glu Ala Ile Asn Ser Gln Ala
35 40 45
Gly Ala Ile Ala Gly Lys Thr Ala Leu Asp Met Arg Arg Asp Phe Thr
50 55 60
Leu Val Ala Asp Ile Tyr Leu Gly Ser Asn Ser Ser Gly Ala Asp Gly
65 70 75 80
Ile Ala Ile Ala Phe His Arg Gly Ser Ile Gly Phe Ile Gly Thr Met
85 90 95
Gly Gly Gly Leu Gly Ile Leu Gly Ala Pro Asn Gly Ile Gly Phe Glu
100 105 110
Ile Asp Thr Tyr Trp Lys Ala Thr Ser Asp Glu Thr Gly Asp Ser Phe
115 120 125
Gly His Gly Gln Met Asn Gly Ala His Ala Gly Phe Val Ser Thr Asn
130 135 140
Arg Asn Ala Ser Tyr Leu Thr Ala Leu Ala Pro Met Gln Lys Ile Pro
145 150 155 160
Ala Pro Asn Asn Lys Trp Arg Val Leu Thr Ile Asn Trp Asp Ala Arg
165 170 175
Asn Asn Lys Leu Thr Ala Arg Leu Gln Glu Lys Ser Asn Asp Ala Ser
180 185 190
Thr Ser Thr Pro Ser Pro Ser Tyr Gln Thr Trp Glu Leu Leu Asn Pro
195 200 205
Ala Phe Asp Leu Asn Gln Lys Tyr Thr Phe Ile Ile Gly Ser Ala Thr
210 215 220
Gly Ala Ala Asn Asn Lys His Gln Ile Gly Val Thr Leu Phe Glu Ala
225 230 235 240
Tyr Phe Thr Lys Pro Thr Ile Glu Ala Asn Pro Val Asp Ile Glu Leu
245 250 255
Gly Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
260 265 270
Thr Asp Glu Val Asp Gly Asp Ile Thr Lys Asp Ile Thr Val Glu Phe
275 280 285
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Arg Val Ile Tyr Lys
290 295 300
Val Val Asn Ser Tyr Gly Glu Ser Asp Glu Lys Thr Ile Glu Val Val
305 310 315 320
Val Tyr Thr Lys Pro Thr Ile Thr Ala His Asp Ile Ala Ile Lys Lys
325 330 335
Asp Leu Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
340 345 350
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Ala Val Lys Phe
355 360 365
Asn Asn Val Asp Thr Ser Lys Pro Gly Lys Tyr His Val Thr Tyr Lys
370 375 380
Val Ile Asn Ser Tyr Glu Lys Ile Asp Glu Lys Thr Ile Glu Val Thr
385 390 395 400
Val Tyr Thr Lys Pro Ser Ile Val Ala His Asp Val Glu Ile Lys Lys
405 410 415
Asp Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
420 425 430
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Ser
435 440 445
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Ser Val Lys Tyr Lys
450 455 460
Val Val Asn Asn Tyr Glu Glu Cys Asp Glu Lys Thr Ile Ala Val Thr
465 470 475 480
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro Thr Gly Trp
485 490 495
Lys Phe Phe Ser Gly Glu Thr Ile Thr Leu Glu Glu Asp Glu Glu Asn
500 505 510
Ala Leu Asn Gly Lys Trp Val Phe Tyr Ala Asp Lys His Val Ala Ile
515 520 525
Tyr Lys Gln Val Glu Leu Lys Asn Asn Ile Pro Tyr Gln Ile Thr Val
530 535 540
Tyr Val Lys Pro Glu Asp Glu Gly Thr Val Ala His His Ile Val Lys
545 550 555 560
Val Ser Phe Lys Ser Asp Ser Ala Ser Pro Glu Ser Glu Glu Val Ile
565 570 575
Asn Glu Arg Leu Ile Asp Ala Glu Gln Ile Arg Lys Gly Tyr Arg Gln
580 585 590
Leu Thr Ser Ile Pro Phe Thr Pro Thr Thr Ile Val Pro Asn Lys Lys
595 600 605
Pro Val Ile Ile Val Glu Asn Phe Leu Pro Gly Trp Ile Gly Gly Val
610 615 620
Arg Ile Ile Ile Glu Pro Thr Lys
625 630
<210> 157
<211> 632
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 157
Met Asn Ser Lys Ser Ile Ile Glu Lys Gly Val Gln Glu Asn Gln Tyr
1 5 10 15
Ile Asp Ile Arg Asn Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp
20 25 30
Pro Asn Thr Asn Val Thr Thr Leu Thr Glu Ala Ile Asn Ser Gln Ala
35 40 45
Gly Ala Ile Ala Gly Lys Thr Ala Leu Asp Met Arg Arg Asp Phe Thr
50 55 60
Leu Val Ala Asp Ile Tyr Leu Gly Ser Asn Ser Ser Gly Ala Asp Gly
65 70 75 80
Ile Ala Ile Ala Phe His Arg Gly Ser Ile Gly Phe Ile Gly Thr Met
85 90 95
Gly Gly Gly Leu Gly Ile Leu Gly Ala Pro Asn Gly Ile Gly Phe Glu
100 105 110
Ile Asp Thr Tyr Trp Lys Ala Thr Ser Asp Glu Thr Gly Asp Ser Phe
115 120 125
Gly His Gly Gln Met Asn Gly Ala His Ala Gly Phe Val Ser Thr Asn
130 135 140
Arg Asn Ala Ser Tyr Leu Thr Ala Leu Ala Pro Met Gln Lys Ile Pro
145 150 155 160
Ala Pro Asn Asn Lys Trp Arg Val Leu Thr Ile Asn Trp Asp Ala Arg
165 170 175
Asn Asn Lys Leu Thr Ala Arg Leu Gln Glu Lys Ser Asn Asp Ala Ser
180 185 190
Thr Ser Thr Pro Ser Pro Ser Tyr Gln Thr Trp Glu Leu Leu Asn Pro
195 200 205
Ala Phe Asp Leu Asn Gln Lys Tyr Thr Phe Ile Ile Gly Ser Ala Thr
210 215 220
Gly Ala Ala Asn Asn Lys His Gln Ile Gly Val Thr Leu Phe Glu Ala
225 230 235 240
Tyr Phe Thr Lys Pro Thr Ile Glu Ala Asn Pro Val Asp Ile Glu Leu
245 250 255
Gly Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
260 265 270
Thr Asp Glu Val Asp Gly Asp Ile Thr Lys Asp Ile Thr Val Glu Phe
275 280 285
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Arg Val Ile Tyr Lys
290 295 300
Val Val Asn Ser Tyr Gly Glu Ser Asp Glu Lys Thr Ile Glu Val Val
305 310 315 320
Val Tyr Thr Lys Pro Thr Ile Thr Ala His Asp Ile Ala Ile Lys Lys
325 330 335
Asp Leu Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
340 345 350
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Ala Val Lys Phe
355 360 365
Asn Asn Val Asp Thr Ser Lys Pro Gly Lys Tyr His Val Thr Tyr Lys
370 375 380
Val Ile Asn Ser Tyr Glu Lys Ile Asp Glu Lys Thr Ile Glu Val Thr
385 390 395 400
Val Tyr Thr Lys Pro Ser Ile Val Ala His Asp Val Glu Ile Lys Lys
405 410 415
Asp Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
420 425 430
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Ser
435 440 445
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Ser Val Lys Tyr Lys
450 455 460
Val Val Asn Asn Tyr Glu Glu Cys Asp Glu Lys Thr Ile Ala Val Thr
465 470 475 480
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro Thr Gly Trp
485 490 495
Lys Phe Phe Ser Gly Glu Thr Ile Thr Leu Glu Glu Asp Glu Glu Asn
500 505 510
Ala Leu Asn Gly Lys Trp Val Phe Tyr Ala Asp Lys His Val Ala Ile
515 520 525
Tyr Lys Gln Val Glu Leu Lys Asn Asn Ile Pro Tyr Gln Ile Thr Val
530 535 540
Tyr Val Lys Pro Glu Asp Glu Gly Thr Val Ala His His Ile Val Lys
545 550 555 560
Val Ser Phe Lys Ser Asp Ser Ala Ser Pro Glu Ser Glu Glu Val Ile
565 570 575
Asn Glu Arg Leu Ile Asp Ala Glu Gln Ile Arg Lys Gly Tyr Arg Gln
580 585 590
Leu Thr Ser Ile Pro Phe Thr Pro Thr Thr Ile Val Pro Asn Lys Lys
595 600 605
Pro Val Ile Ile Val Glu Asn Phe Leu Pro Gly Trp Ile Gly Gly Val
610 615 620
Arg Ile Ile Ile Glu Pro Thr Lys
625 630
<210> 158
<211> 632
<212> PRT
<213> Неизвестная
<220>
<223> Bacillus sp., полученный из образца окружающей среды
<400> 158
Leu Asn Ser Lys Ser Ile Ile Glu Lys Gly Val Gln Glu Asn Gln Tyr
1 5 10 15
Ile Asp Ile Arg Asn Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp
20 25 30
Pro Asn Thr Asn Ile Thr Thr Leu Thr Glu Ala Ile Asn Ser Gln Ala
35 40 45
Gly Ala Ile Ala Gly Lys Thr Ala Leu Asp Met Arg Arg Asp Phe Thr
50 55 60
Leu Val Ala Asp Ile Tyr Leu Gly Ser Lys Ser Ser Gly Ala Asp Gly
65 70 75 80
Ile Ala Ile Ala Phe His Arg Gly Ser Ile Gly Phe Ile Gly Thr Met
85 90 95
Gly Gly Gly Leu Gly Ile Leu Gly Ala Pro Asn Gly Ile Gly Phe Glu
100 105 110
Ile Asp Thr Tyr Trp Lys Ala Thr Ser Asp Glu Thr Gly Asp Ser Phe
115 120 125
Gly His Gly Gln Met Asn Gly Ala His Ala Gly Phe Val Ser Thr Asn
130 135 140
Gln Asn Ala Ser Tyr Leu Thr Ala Leu Ala Pro Met Gln Lys Ile Pro
145 150 155 160
Ala Pro Asn Asn Lys Trp Arg Val Leu Thr Ile Asn Trp Asp Ala Arg
165 170 175
Asn Asn Lys Leu Thr Ala Arg Leu Gln Glu Lys Ser Asn Asp Ala Ser
180 185 190
Thr Arg Thr Pro Ser Pro Arg Tyr Gln Thr Trp Glu Leu Leu Asn Pro
195 200 205
Ala Phe Asp Leu Asn Gln Lys Tyr Thr Phe Ile Ile Gly Ser Ala Thr
210 215 220
Gly Ala Ala Asn Asn Lys His Gln Ile Gly Val Thr Leu Phe Glu Ala
225 230 235 240
Tyr Phe Thr Lys Pro Thr Ile Glu Ala Asn Pro Val Asp Ile Glu Leu
245 250 255
Gly Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
260 265 270
Thr Asp Glu Val Asp Gly Asp Ile Thr Lys Asp Ile Thr Val Glu Phe
275 280 285
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Arg Val Thr Tyr Lys
290 295 300
Val Val Asn Ser Tyr Gly Glu Ser Asp Glu Lys Thr Ile Glu Val Val
305 310 315 320
Val Tyr Thr Lys Pro Thr Ile Thr Ala His Asp Ile Ala Ile Lys Lys
325 330 335
Asp Leu Thr Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
340 345 350
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Lys Phe
355 360 365
Asn Asn Val Asp Thr Ser Lys Pro Gly Lys Tyr His Ile Thr Tyr Lys
370 375 380
Val Val Asn Ser Tyr Glu Lys Ile Glu Glu Lys Thr Ile Glu Ile Thr
385 390 395 400
Val Tyr Thr Lys Pro Ser Ile Glu Ala Tyr Asp Val Glu Ile Lys Lys
405 410 415
Asp Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
420 425 430
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Ser
435 440 445
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Ser Val Lys Tyr Lys
450 455 460
Val Val Asn Asn Tyr Glu Glu Ser Asp Glu Lys Thr Ile Ala Val Thr
465 470 475 480
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro Thr Gly Trp
485 490 495
Lys Phe Phe Ser Gly Glu Thr Ile Thr Leu Glu Glu Asp Glu Glu Asn
500 505 510
Ala Leu Asn Gly Lys Trp Val Phe Tyr Ala Asp Lys His Val Ala Ile
515 520 525
Tyr Lys Gln Val Glu Leu Lys Asn Asn Thr Pro Tyr Gln Ile Thr Val
530 535 540
Tyr Val Lys Pro Glu Asp Glu Gly Thr Val Ala His His Ile Val Lys
545 550 555 560
Val Ser Phe Lys Ser Asp Ser Ala Gly Gln Glu Ser Glu Glu Ile Ile
565 570 575
Asn Lys Arg Leu Ile Asp Ala Glu Gln Ile Gln Lys Gly Tyr Arg Lys
580 585 590
Leu Ala Ser Ile Pro Phe Thr Pro Thr Thr Ile Val Pro Asn Lys Lys
595 600 605
Pro Val Ile Ile Val Glu Asn Phe Leu Pro Gly Trp Ile Gly Gly Val
610 615 620
Arg Val Ile Val Glu Pro Thr Lys
625 630
<210> 159
<211> 632
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариант нативной последовательности
<400> 159
Met Asn Ser Lys Ser Ile Ile Glu Lys Gly Val Gln Glu Asn Gln Tyr
1 5 10 15
Ile Asp Ile Arg Asn Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp
20 25 30
Pro Asn Thr Asn Ile Thr Thr Leu Thr Glu Ala Ile Asn Ser Gln Ala
35 40 45
Gly Ala Ile Ala Gly Lys Thr Ala Leu Asp Met Arg Arg Asp Phe Thr
50 55 60
Leu Val Ala Asp Ile Tyr Leu Gly Ser Lys Ser Ser Gly Ala Asp Gly
65 70 75 80
Ile Ala Ile Ala Phe His Arg Gly Ser Ile Gly Phe Ile Gly Thr Met
85 90 95
Gly Gly Gly Leu Gly Ile Leu Gly Ala Pro Asn Gly Ile Gly Phe Glu
100 105 110
Ile Asp Thr Tyr Trp Lys Ala Thr Ser Asp Glu Thr Gly Asp Ser Phe
115 120 125
Gly His Gly Gln Met Asn Gly Ala His Ala Gly Phe Val Ser Thr Asn
130 135 140
Gln Asn Ala Ser Tyr Leu Thr Ala Leu Ala Pro Met Gln Lys Ile Pro
145 150 155 160
Ala Pro Asn Asn Lys Trp Arg Val Leu Thr Ile Asn Trp Asp Ala Arg
165 170 175
Asn Asn Lys Leu Thr Ala Arg Leu Gln Glu Lys Ser Asn Asp Ala Ser
180 185 190
Thr Arg Thr Pro Ser Pro Arg Tyr Gln Thr Trp Glu Leu Leu Asn Pro
195 200 205
Ala Phe Asp Leu Asn Gln Lys Tyr Thr Phe Ile Ile Gly Ser Ala Thr
210 215 220
Gly Ala Ala Asn Asn Lys His Gln Ile Gly Val Thr Leu Phe Glu Ala
225 230 235 240
Tyr Phe Thr Lys Pro Thr Ile Glu Ala Asn Pro Val Asp Ile Glu Leu
245 250 255
Gly Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
260 265 270
Thr Asp Glu Val Asp Gly Asp Ile Thr Lys Asp Ile Thr Val Glu Phe
275 280 285
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Arg Val Thr Tyr Lys
290 295 300
Val Val Asn Ser Tyr Gly Glu Ser Asp Glu Lys Thr Ile Glu Val Val
305 310 315 320
Val Tyr Thr Lys Pro Thr Ile Thr Ala His Asp Ile Ala Ile Lys Lys
325 330 335
Asp Leu Thr Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
340 345 350
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Lys Phe
355 360 365
Asn Asn Val Asp Thr Ser Lys Pro Gly Lys Tyr His Ile Thr Tyr Lys
370 375 380
Val Val Asn Ser Tyr Glu Lys Ile Glu Glu Lys Thr Ile Glu Ile Thr
385 390 395 400
Val Tyr Thr Lys Pro Ser Ile Glu Ala Tyr Asp Val Glu Ile Lys Lys
405 410 415
Asp Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
420 425 430
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Ser
435 440 445
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Ser Val Lys Tyr Lys
450 455 460
Val Val Asn Asn Tyr Glu Glu Ser Asp Glu Lys Thr Ile Ala Val Thr
465 470 475 480
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro Thr Gly Trp
485 490 495
Lys Phe Phe Ser Gly Glu Thr Ile Thr Leu Glu Glu Asp Glu Glu Asn
500 505 510
Ala Leu Asn Gly Lys Trp Val Phe Tyr Ala Asp Lys His Val Ala Ile
515 520 525
Tyr Lys Gln Val Glu Leu Lys Asn Asn Thr Pro Tyr Gln Ile Thr Val
530 535 540
Tyr Val Lys Pro Glu Asp Glu Gly Thr Val Ala His His Ile Val Lys
545 550 555 560
Val Ser Phe Lys Ser Asp Ser Ala Gly Gln Glu Ser Glu Glu Ile Ile
565 570 575
Asn Lys Arg Leu Ile Asp Ala Glu Gln Ile Gln Lys Gly Tyr Arg Lys
580 585 590
Leu Ala Ser Ile Pro Phe Thr Pro Thr Thr Ile Val Pro Asn Lys Lys
595 600 605
Pro Val Ile Ile Val Glu Asn Phe Leu Pro Gly Trp Ile Gly Gly Val
610 615 620
Arg Val Ile Val Glu Pro Thr Lys
625 630
<210> 160
<211> 632
<212> PRT
<213> Bacillus thuringiensis
<400> 160
Leu Asn Ser Lys Ser Ile Ile Glu Lys Gly Val Gln Glu Asn Gln Tyr
1 5 10 15
Ile Asp Ile Arg Asn Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp
20 25 30
Pro Asn Thr Asn Ile Thr Thr Leu Thr Glu Ala Ile Asn Ser Gln Ala
35 40 45
Gly Ala Ile Ala Gly Lys Thr Ala Leu Asp Met Arg Arg Asp Phe Thr
50 55 60
Leu Val Ala Asp Ile Tyr Leu Gly Ser Lys Ser Ser Gly Ala Asp Gly
65 70 75 80
Ile Ala Ile Ala Phe His Arg Gly Ser Ile Gly Phe Ile Gly Thr Met
85 90 95
Gly Gly Gly Leu Gly Ile Leu Gly Ala Pro Asn Gly Ile Gly Phe Glu
100 105 110
Ile Asp Thr Tyr Trp Lys Ala Thr Ser Asp Glu Thr Gly Asp Ser Phe
115 120 125
Gly His Gly Gln Met Asn Gly Ala His Ala Gly Phe Val Ser Thr Asn
130 135 140
Arg Asn Ala Ser Tyr Leu Thr Ala Leu Ala Pro Met Gln Lys Ile Pro
145 150 155 160
Ala Pro Asn Asn Lys Trp Arg Val Leu Thr Ile Asn Trp Asp Ala Arg
165 170 175
Asn Asn Lys Leu Thr Ala Arg Leu Gln Glu Lys Ser Asn Asp Ala Ser
180 185 190
Thr Ser Thr Pro Ser Pro Arg Tyr Gln Thr Trp Glu Leu Leu Asn Pro
195 200 205
Ala Phe Asp Leu Asn Gln Lys Tyr Thr Phe Ile Ile Gly Ser Ala Thr
210 215 220
Gly Ala Ala Asn Asn Lys His Gln Ile Gly Val Thr Leu Phe Glu Ala
225 230 235 240
Tyr Phe Thr Lys Pro Thr Ile Glu Ala Asn Pro Val Asp Ile Glu Leu
245 250 255
Gly Thr Ala Phe Asp Pro Leu Asn His Glu Pro Ile Gly Leu Lys Ala
260 265 270
Thr Asp Glu Val Asp Gly Asp Ile Thr Lys Asp Ile Thr Val Glu Phe
275 280 285
Asn Asp Ile Asp Thr Ser Lys Pro Gly Ala Tyr Arg Val Thr Tyr Lys
290 295 300
Val Val Asn Ser Tyr Gly Glu Ser Asp Glu Lys Thr Ile Glu Val Val
305 310 315 320
Val Tyr Thr Lys Pro Thr Ile Thr Ala His Asp Ile Thr Ile Lys Lys
325 330 335
Asp Leu Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
340 345 350
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Ala Val Lys Phe
355 360 365
Asn Asn Val Asp Thr Ser Lys Pro Gly Lys Tyr His Val Thr Tyr Lys
370 375 380
Val Ile Asn Ser Tyr Glu Lys Ile Asp Glu Lys Thr Ile Glu Val Thr
385 390 395 400
Val Tyr Thr Lys Pro Ser Ile Val Ala His Asp Val Glu Ile Lys Lys
405 410 415
Asp Thr Ala Phe Asp Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala
420 425 430
Thr Asp Pro Ile Asp Gly Asp Ile Thr Asp Lys Ile Thr Val Glu Ser
435 440 445
Asn Asp Val Asp Thr Ser Lys Pro Gly Ala Tyr Ser Val Lys Tyr Lys
450 455 460
Val Val Asn Asn Tyr Glu Glu Ser Asp Glu Lys Thr Ile Ala Val Thr
465 470 475 480
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro Thr Gly Trp
485 490 495
Lys Phe Phe Ser Gly Glu Thr Ile Thr Leu Glu Asp Asp Glu Glu His
500 505 510
Ala Leu Asn Gly Lys Trp Val Phe Tyr Ala Asp Lys His Val Ala Ile
515 520 525
Tyr Lys Gln Val Glu Leu Lys Asn Asn Ile Pro Tyr Gln Ile Thr Val
530 535 540
Tyr Val Lys Pro Glu Asp Glu Gly Thr Val Ala His His Ile Val Lys
545 550 555 560
Val Ser Phe Lys Ser Asp Ser Ala Gly Pro Glu Ser Glu Glu Val Ile
565 570 575
Asn Glu Arg Leu Ile Asp Ala Glu Gln Ile Gln Lys Gly Tyr Arg Lys
580 585 590
Leu Thr Ser Ile Pro Phe Thr Pro Thr Thr Ile Val Pro Asn Lys Lys
595 600 605
Pro Val Ile Ile Val Glu Asn Phe Leu Pro Gly Trp Ile Gly Gly Val
610 615 620
Arg Ile Ile Val Glu Pro Thr Lys
625 630
<210> 161
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> консенсусная последовательность
<400> 161
Ile Cys Ser Ile Asn Gly Ser Ala Lys Phe Asp Pro Asn Thr Asn
1 5 10 15
<210> 162
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> консенсусная последовательность
<400> 162
Asn Ser Gln Ala Gly Ala Ile Ala Gly Lys Thr Ala
1 5 10
<210> 163
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> консенсусная последовательность
<400> 163
Ile Gly Ser Ala Thr Gly Ala Ala Asn Asn
1 5 10
<210> 164
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> консенсусная последовательность
<400> 164
Pro Leu Asn Tyr Glu Pro Ile Gly Leu Lys Ala Thr Asp
1 5 10
<210> 165
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> консенсусная последовательность
<400> 165
Val Pro Val Ile Asp Asp Gly Trp Glu Asn Gly Asp Pro
1 5 10
<210> 166
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> консенсусная последовательность
<400> 166
Glu Asp Glu Glu Asn Ala Leu Asn Gly Lys Trp Val Phe
1 5 10
<210> 167
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> консенсусная последовательность
<400> 167
Asp Lys His Val Ala Ile Tyr Lys Gln Val Glu
1 5 10
<---