Результат интеллектуальной деятельности: Средство для терапии опухолей
Вид РИД
Изобретение
Изобретение относится к медицине, а именно к лекарственным средствам, обладающим противоопухолевым действием, и может найти применение при лечении злокачественных опухолей.
Создание новых отечественных противоопухолевых препаратов, избирательно разрушающих опухолевую ткань, является актуальной задачей современной российской науки [1]. Среди широкого спектра химических соединений особый интерес представляют препараты из группы производных индолокарбазола. N-Гликозиды замещенных индоло[2,3-а]карбазолов и родственных соединений - это быстро увеличивающаяся группа синтетических соединений, обладающих противоопухолевой, антибактериальной и иммуномодулирующей активностью [2, 3, 4].
Значительные успехи фундаментальной медицины в изучении механизма злокачественной трансформации клеток и процесса метастазирования новообразований позволили определить новые мишени воздействия потенциальных противоопухолевых средств. Способность взаимодействовать с несколькими мишенями и индуцировать различные пути гибели опухолевых клеток является отличительной особенностью механизма действия препаратов из группы производных индолокарбазола. Для этих соединений такими мишенями являются топоизомеразы, ДНК и протеинкиназы [5, 6].
Актуальность разработки определяется отсутствием в клинической практике отечественных ингибиторов топоизомеразы I и/или II, в то время как в онкологический портфель прочно вошла линейка химиотерапевтических препаратов данного действия, разработанных за границей: иринотекан, топотекан, этопозид и тенипозид [7].
Ингибиторы топоизомераз - одни из наиболее эффективных индукторов апоптозя. т.е. само программируемой гибели опухолевых клеток. Соединения этого класса обладают также активностью в отношении циклин-зависимых киназ. Эти особенности механизма действия определяют широкий спектр цитотоксической и противоопухолевой активности N-гликозидов индоло[2,3-а]карбазолов [8].
Первым противоопухолевым соединением из класса индолокарбазолов был антибиотик ребеккамицин - ингибитор топоизомеразы I, активный в отношении клеток меланомы В-16 и лимфоцитарной лейкемии Р-388 [9].
В связи с плохой растворимостью ребеккамицина синтезировано его водорастворимое производное бекатекарин. Бекатекарин прошел I-II фазу клинических исследований в монотерапии и при комбинированном лечении немелкоклеточного и мелкоклеточного рака легкого, рака молочной железы, рака почки, нейробластомы, колоректального рака, рака яичника, рака тонкой кишки, лейкозов, лимфом.
Бекатекарин вошел в Перечень редких («сиротских») медицинских технологий Евросоюза как препарат для лечения опухолей желчных протоков.
Синтетическим путем также получено другое производное ребеккамицина, также обладающее плохой растворимостью - препарат эдотекарин. Клинические исследования эдотекарина проводились при лечении глиобластомы (в комбинации с темозоломидом или ломустином), при распространенном раке желудка, рецидивирующем после ранее проведенной химиотерапии [10].
Известным ингибитором PDK-1 (фермента активации киназы Akt, иначе называемая протеинкиназа В) является индолокарбазол стауроспорин, растворимый в спирте 95% и нерастворимый в воде [11]. Его 7-гидроксипроизводное UCN-01 проходило II фазу клинических испытаний для лечения гемобластозов [12]. UCN-01 является неселективным ингибитором многих протеинкиназ, в частности - семейства протеинкиназ С и циклинзависимых киназ [13]. Все вышеперечисленные препараты при проведении клинических исследований пациентам вводили внутривенно.
За рубежом из этого класса исследуются следующие соединения производные индолокарбазола в традиционных лекарственных формах: аналоги стауроспорина - ингибитора протеинкиназы В:
- Мидостаурин (Rydapt), Novartis AG, Швейцария (перорально капсулы),
- Энзастаурин, Eli Lilly and Company, США (перорально капсулы, таблетки),
- Лестауртиниб, «Гилеад сайенсиз», США, (перорально раствор для приема внутрь), аналоги ребеккамицина - ингибитора топоизмеразы I:
- Бекатекарин, Швейцария (внутривенно болюсы),
- Эдотекарин, (внутривенно инфузия) препараты проходят различные фазы клинических исследований.
В клинической практике отсутствуют отечественные ингибиторы топоизомеразы I и II.
Известно средство «Производное класса n-гликозидов индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с] карбазол-6-ил}пиридин-2-карбоксамид, обладающее цитотоксической и противоопухолевой активностью», (патент РФ №2667906), обладающее уникальным механизмом воздействия на опухоль.
Концепция о том, что VEGF-индуцируемый ангиогенез действительно является фактором, лимитирующим рост опухоли, в настоящее время является общепринятой. По данным ряда клинических испытаний, антиангиогенная терапия достоверно увеличивает общую выживаемость онкологических больных. В то же время накапливаются факты, свидетельствующие о том, что большинство опухолей не отвечают на анти-VEGF терапию. Одной из причин выживаемости опухолевых клеток может быть гетерогенность кровеносных сосудов в опухоли. В кровоснабжении опухоли участвуют как сосуды, выстланные эндотелием, так и мозаичные сосуды, а также сосуды, выстланные опухолевыми клетками (так называемая васкулогенная мимикрия (ВМ)). Термин ВМ был введен для объяснения процесса кровоснабжения опухоли, имитирующего васкуляризацию эмбриона цитотрофобластами. Предполагается, что опухоль для выживания и прогрессии может индуцировать частичную транс дифференцировку опухолевых клеток в эндотелий-подобный фенотип, позволяющий формировать васкулярные каналы, необходимые для доставки питания и, возможно, метастазирования. Образование подобных структур - уникальная особенность клеток с высоко злокачественным фенотипом; менее агрессивные опухолевые клетки таких структур не формируют. Способность к трансдифференцировке в сочетании с высоким инвазивным, а, следовательно, метастатическим потенциалом ряда клеток позволяет им формировать сеть каналов внутри опухоли, которая может частично компенсировать недостаточно быстрое развитие в ней кровеносной микроциркуляторной сети и создать условия для выживания и пролиферации клеток, предотвращая некроз внутри опухоли. Высокая статистическая корреляция между способностью опухоли к ВМ и частотой метастазирования и плохим клиническим прогнозом подтверждает эту гипотезу [16].
Нами было показано, что ВМ представлена неодинаково в разных типах опухолей. В меланоме более 60% кровоснабжения осуществляется через каналы ВМ; при тройном негативном раке молочной железы - более 50%, при саркоме мягких тканей - 35-37%; при раке почки - 30-32%), при раке яичника, раке молочной железы - 15-18%; и меньше всего при раке толстой кишки - 10-12%. На фоне крайнего несовершенства циркуляции крови в опухоли 10-12% васкулярных каналов, выстланных опухолевыми клетками, вряд ли может серьезно повлиять на опухолевую прогрессию, однако 40-60%) должны иметь существенное значение, и с этим необходимо считаться [17].
Современная антиангиогенная терапия базируется на блокировании пролиферации эндотелиальных клеток. Для формирования функционально активных кровеносных сосудов эндотелиальные клетки должны остановить пролиферацию и пройти терминальную дифференцировку. Терминальную дифференцировку эндотелиальных клеток контролирует сигнальный путь Notch. В наших ранних работах на экспериментальной модели человеческой меланомы, растущей в бестимусных мышах, было показано, что ингибитор сигнального пути Notch (DAPT), незначительно снижал объем опухоли, при этом плотность каналов ВМ заметно возрастала [18]. Гистологический анализ опухоли выявил большие зоны некроза в DAPT-леченых опухолях - результат антиангиогенной терапии. В тех областях опухоли, где наблюдалась высокая плотность каналов ВМ, отсутствовал некроз, что, несомненно подтверждает функциональную активность васкулярных каналов, высланный опухолевыми клетками. Мы показали также, что в результате анти-Notch терапии опухоль переходила в более агрессивную фазу роста: наблюдалось значительное увеличение экспрессии ММР-2 и VEGFR1 - маркеров метастазирования [18]. Антиангиогенная терапия направлена на снижение плотности сосудов в опухоли, что приводит к увеличению локальной гипоксии. Адаптация к условиям гипоксии сопровождается селекцией клеток с более высоко злокачественным фенотипом, которые, скорее всего, и формируют васкулярные каналы. Таким образом, антиангиогенная терапия активирует альтернативную, более агрессивную систему кровоснабжения опухоли. Убивать такие клетки сегодня мы не можем. Мы предположили, что противоопухолевый эффект антиангиогенной терапии будет более ярко выражен, если ее сочетать с ингибиторами ВМ.
Среди протестированных нами четырех классов низкомолекулярных соединений [19-21], соединение индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамид обладало наибольшей активностью [22]. На пяти разных видах раках -меланоме, раке легкого Льюиса, раке шейки матки, раке толстой кишки, раке молочной железы - индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамид, снижал объем опухолевой массы на 65-80%. Подобное поведение ингибитора указывает на то, что мишень для ингибитора ВМ одна и та же в пяти исследованных опухолях. В этой серии экспериментов in vivo важным нам представляется также и другой аспект. После завершения лечения индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с] карбазол-6-ил}пиридин-2-карбоксамид, опухоли практически не росли в последующие 20-25 дней. 19 месяцев жизни мыши приравнивается к 63 годам человека, и эти 20-25 дней, когда опухоль не увеличивалась в размерах, приравнивается к 3 годам жизни человека [23].
Далее нами методом искусственной стимуляции апоптоза ДНК-алкилирующими агентами была получена стабильная клеточная линия меланомы, сохраняющая морфологические признаки родительской линии, но резистентная к индукции апоптоза. Не цитотоксические концентрации индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамид, снижали агрессивность резистентных клеток и восстанавливали чувствительность этих клеток к апоптозу, индуцированному ДНК-повреждающими агентами [24].
Нам удалось показать в экспериментах in vitro и подтвердить полученные результаты в экспериментальной модели опухоли, растущей в мышах C57/BL/6, что ВМ - это программа, которой можно обучить другие клетки [25].
Таким образом, полученные нами in vitro и подтвержденные in vivo результаты, позволяют поднять вопрос о возможности нового терапевтического подхода в лечении злокачественных заболеваний. Блокирование ВМ позволит повысить эффективность антиангиогенной терапии, преодолеть резистентность опухолевых клеток к цитотоксической терапии, будет препятствовать переходу опухоли в фазу более агрессивного роста, уменьшая ее пластичность, а также препятствовать рекруитированию опухолью нормальных клеток для построения дополнительных сосудов ВМ.
Исследована специфическая активность нового соединения - индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамид. Показано, что он проявляет активность в отношении ряда экспериментальных опухолей мышей [26].
Данное средство принято в качестве прототипа.
Недостатки прототипа:
1. Не растворим в растворителях для инъекций.
2. Невозможность автоматического дозирования.
3. Невозможно ввести в организм больного.
Задачей настоящего изобретения является создание нового отечественного противоопухолевого средства из группы производных индолокарбазолов для таргетной терапии опухолей, удобного в употреблении, обладающего хорошей растворимостью, стабильного в хранении при сохранении высокого цитостатического эффекта.
Технический результат:
1) хорошая растворимость;
2) точность дозирования;
3) создание отечественного противоопухолевого препарата - ингибитора топомеразы.
Поставленная задача достигается тем, что создано новое противоопухолевое средство, содержащее:
индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамид; диметилсульфоксид (ДМСО); Kollidon 17PF (поливинилпирролидон, ПВП) и спирт этиловый 95% при следующем соотношении компонентов: Состав на 1 мл (мг):
|
В процентном соотношении:
|
Способ получения заявляемого средства
Брали точную навеску субстанции индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) и добавляли ДМСО. Получали прозрачный раствор желтого цвета. Отдельно готовили раствор Колидона 17 PF в спирте этиловом. Затем в полученный раствор субстанции в ДМСО приливали по каплям, постоянно перемешивая, раствор солюбилизатора. Затем проводили стерилизующую фильтрацию - готовый раствор фильтровали через фильтр с размером пор 0,22 мкм. Стерильный раствор разливали во флаконы вместимостью 20 мл с дозировкой действующего вещества 25 мг на единицу упаковки. Хранили в холодильнике.
Биологическая активность. Животные.
Проведено изучение противоопухолевой активности соединения индоло [2,3-а]пирроло [3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил} пиридин-2-карбоксамида (прототип) на перевиваемых опухолях мышей.
Мышей получали из филиала «Столбовая» ФГБУН «Научного центра биомедицинских технологий Федерального медико-биологического агентства». В опытах использовали мышей-гибридов первого поколения F1(C57Bl/6xDBA/2) и Fl(CBAxC57Bl/6) обоего пола, самок CBA/Lac, Balb/ с и линейных мышей самцов и самок C57Bl6 и DBA/2 (доноры опухолевого материала) массой тела 20-25 г. Животных содержали в виварии с естественным освещением на брикетированном корме и постоянном доступе к воде [1, 2].
Перед лечением мышей распределяли по группам (n=7). Контрольные группы состояли из 10 животных (n=10).
Опухолевые модели.
Изучение противоопухолевой активности исследуемых соединений проводили на моделях перевиваемых опухолей мышей: лимфолейкозе Р-388, асцитном варианте опухоли Эрлиха, эпидермоидной карциноме легкого Lewis (LLC), аденокарциноме молочной железы Са-755, раке шейки матки РШМ-5 и раке толстого кишечника АКАТОЛ. Штаммы экспериментальных опухолей получены из Банка опухолевых штаммов ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России и поддерживались стандартными серийными перевивками каждые 7-8 дней внутрибрюшинно (в/бр) на самках линейных мышей DBA/2 (Р-388) и самках мышей-гибридов F1(CBAxC57Bl/6) (опухоль Эрлиха), подкожно каждые 11-13 дней на самках линейных мышей C57Bl/6 (для Са-755), каждые 19-20 дней на самках мышей CBA/Lac (для РШМ-5) и каждые 19 дней на самках мышей Balb/c (для АКАТОЛ). Штамм LLC поддерживали внутримышечно на самцах линии C57Bl/6 каждые 12-14 дней[3].
В опытах использованы 2-15-й пассажи in vivo. Трансплантацию опухолей выполняли по стандартной методике, принятой в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России [3, 4]. Р-388 и опухоль Эрлиха трансплантировали в/бр самкам гибридов F1(C57Bl/6хDBA/2) по 106 клеток в 0,3 мл питательной среды 199 при подсчете опухолевых клеток в камере Горяева. В эксперименте LLC перевивали самцам гибридам F1(C57Bl/6хDBA/2), Са-755 - мышам-самкам F1(C57Bl/6хDBA/2), РШМ-5 трансплантировали мышам-самкам линии CBA/Lac, АКАТОЛ трансплантировали мышам-самкам Balb/c. Солидные опухоли перевивали мышам подкожно в правую подмышечную область по 0,5 мл (50 мг) взвеси опухолевых клеток при разведении 1:10 в среде 199. Лечение начинали через 24 ч после трансплантации асцитных опухолей и через 48 ч - солидных опухолей [4]. Изучаемое соединение.
Соединение индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип).
Противоопухолевая активность соединения индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) изучалась при разных способах и режимах введения в свежеприготовленной разработанной для экспериментов инъекционной лекарственной форме с концентрацией действующего вещества 5 мг/мл, содержащей в составе комплексный растворитель диметилсульфоксид (ДМСО) (5%), спирт этиловый (20%) и солюбилизатор-комплексообразователь коллидон 17PF (20%).
Оценка противоопухолевого эффекта.
Критериями оценки противоопухолевой активности служили: торможение роста опухоли (ТРО %), увеличение продолжительности жизни подопытных животных по сравнению с контрольными животными (УПЖ %) [4].
Торможение роста опухоли вычисляли по формуле:
ТРО (%)=(Vк-Vo)/Vк×100, где
ТРО - торможение роста опухоли,
Vк - средний объем опухолей в контрольной группе (мм3),
Vo - средний объем опухолей в опытной группе (мм3).
Увеличение продолжительности жизни вычисляли по формуле:
УПЖ (%)=(СПЖо-СПЖк)/СПЖк×100, где
УПЖ - увеличение продолжительности жизни,
СПЖк - средняя продолжительность жизни животных в контрольной группе (дни),
СПЖо - средняя продолжительность жизни животных в опытной группе (дни).
Минимальные критерии активности - ТРО≥50%, УПЖ≥25%. Эффективными считали дозы препаратов, вызывающие ТРО≥70% продолжительностью не менее 7 дней после окончания лечения или УПЖ≥25% [4].
Статистическая обработка результатов.
Полученные данные обрабатывали статистически с использованием компьютерной программы STATISTICA 6.0. Различия между сравниваемыми группами считались статистически достоверными при р<0,05.
Изобретение иллюстрируется таблицами 1-7.
В табл. 1 представлена противоопухолевая активность индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) при внутрибрюшинном введении на лимфолейкозе Р-388.
В табл. 2 представлена противоопухолевая активность индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) при внутрибрюшинном введении на асцитной модели опухоли Эрлиха.
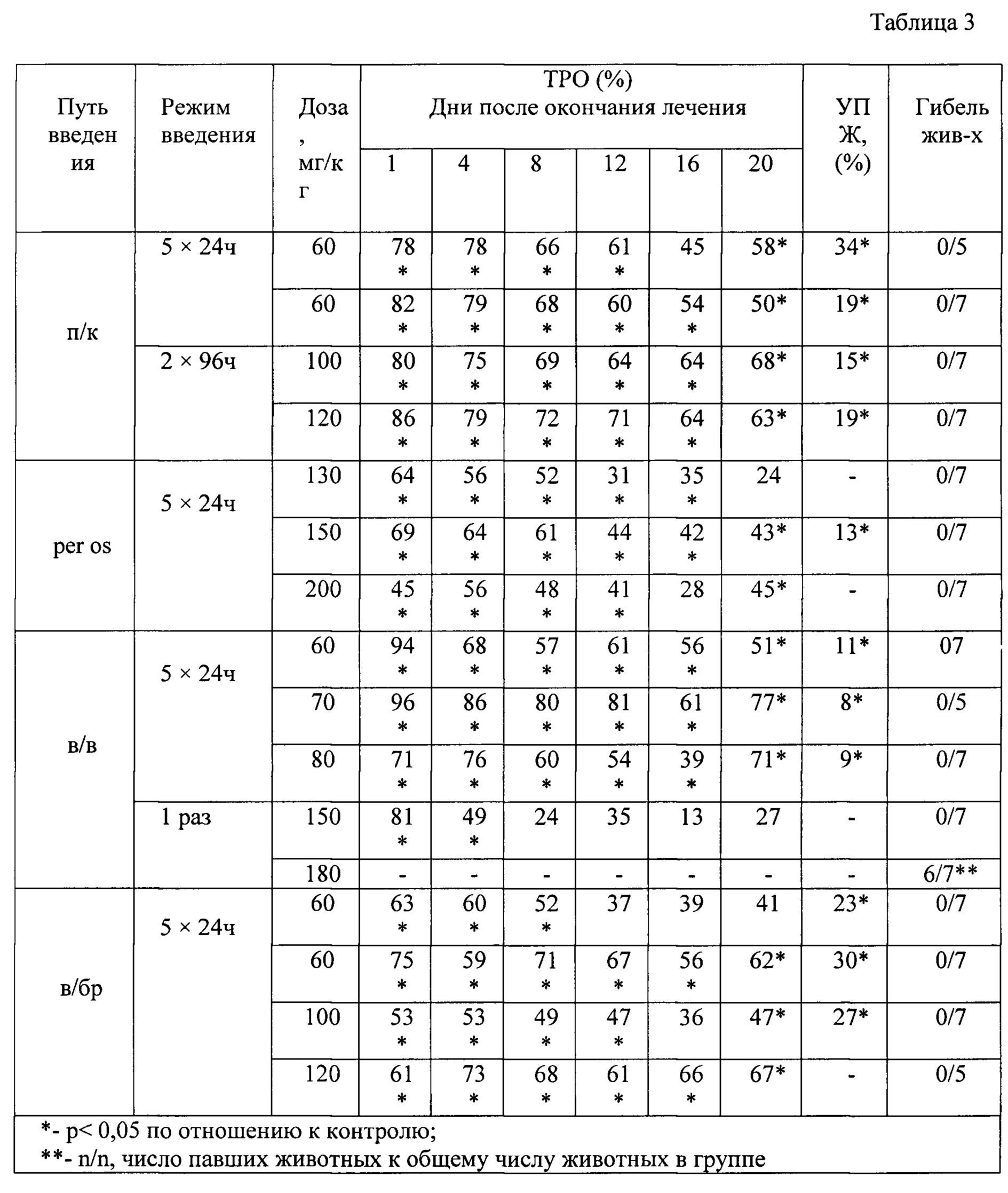
В табл. 3 представлена противоопухолевая активность индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) на эпидермоидной карциноме легкого Lewis (LLC).
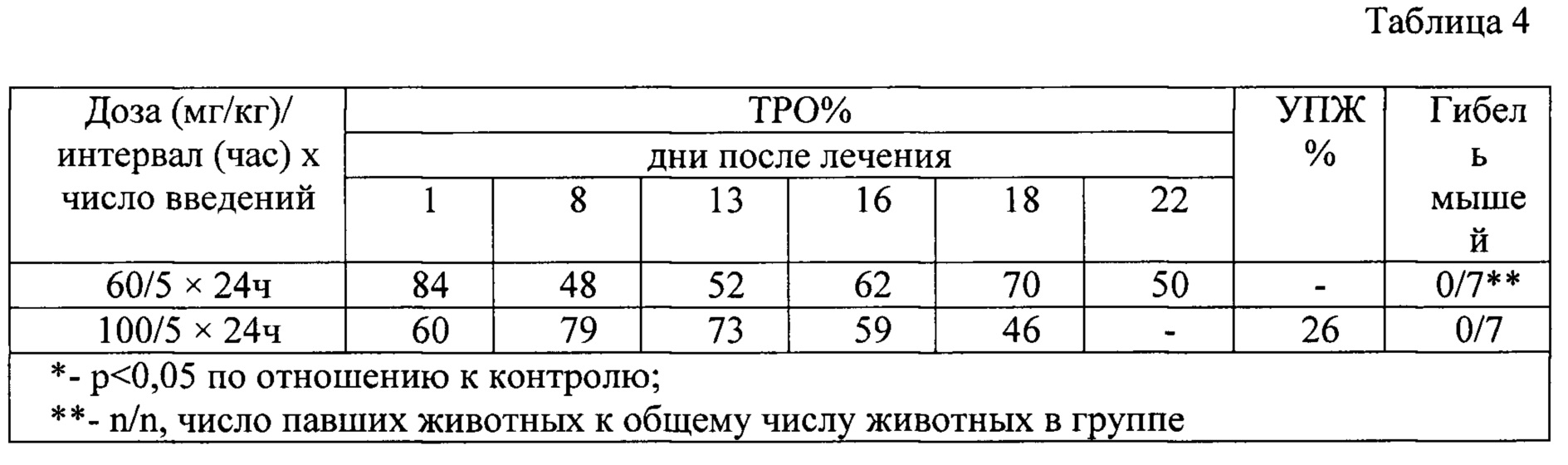
В табл. 4 - представлена противоопухолевая активность ЛХС 1269 при внутрибрюшинном введении на меланоме В-16.
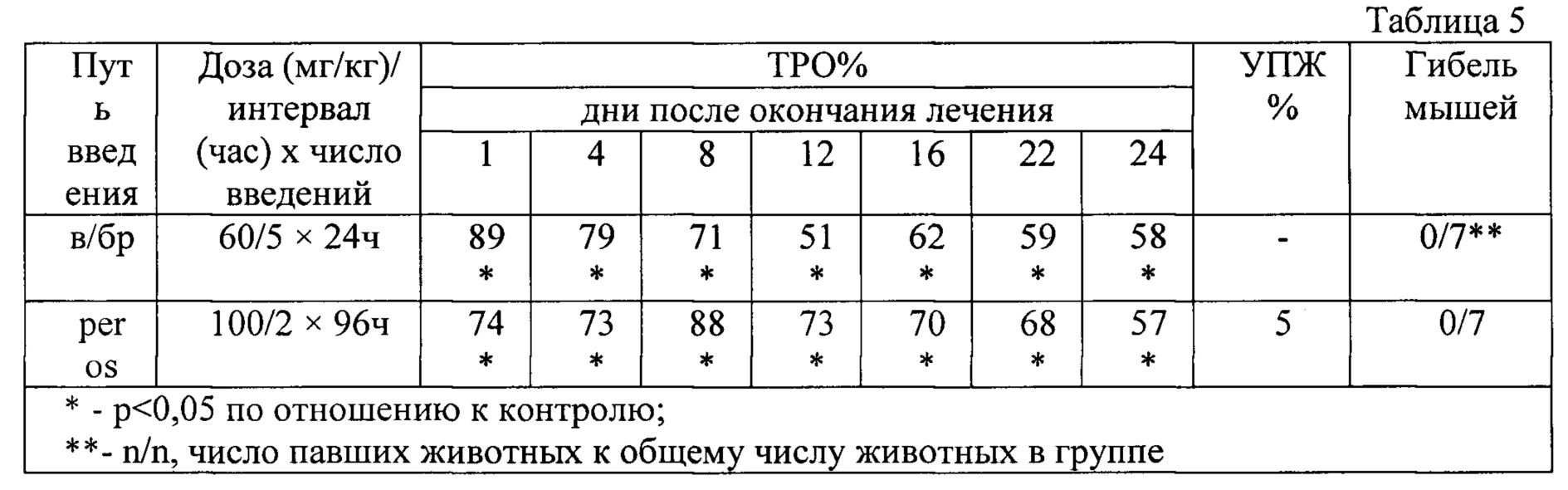
В табл. 5 - представлена противоопухолевая активность индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) при внутрибрюшинном введении на модели рака шейки матки РШМ-5.
В табл. 6 представлена противоопухолевая активность индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) при внутрибрюшинном введении на модели рака толстого кишечника АКАТОЛ.
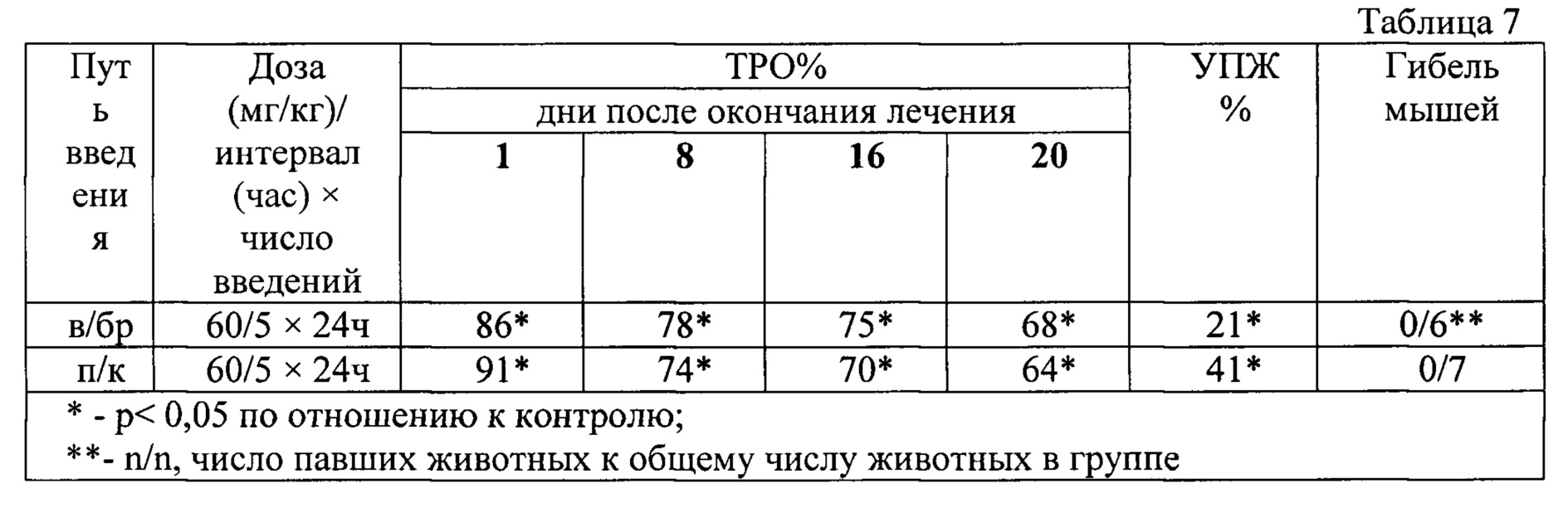
В табл. 7 представлена противоопухолевая активность индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) при внутрибрюшинном введении на аденокарциноме молочной железы Са 755.
На асцитных моделях опухолей мышей соединение индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) изучалось при внутрибрюшинном введении в ежедневном пятикратном режиме в широком диапазоне доз от 20 мг/кг до 100 мг/кг.
На лимфолейкозе Р-388 наилучший противоопухолевый эффект - увеличение продолжительности жизни животных 93% без гибели мышей отмечался в дозе 100 мг/кг (таблица 1).
Противоопухолевая активность индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) на асцитной модели опухоли Эрлиха в дозе 80 мг/кг в ежедневном пятикратном (через 24 ч) режиме при внутрибрюшинном введении составила 337% увеличения продолжительности жизни животных без гибели мышей (таблица 2).
Изучение противоопухолевой активности соединения индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) было продолжено на перевиваемых солидных опухолях мышей: эпидермоидной карциноме легкого Lewis (LLC), меланоме В-16, раке шейки матки РШМ-5, раке толстого кишечника АКАТОЛ, аденокарциноме молочной железы Са 755.
На LLC соединение индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) изучали в широком диапазоне доз от 40 мг/кг до 150 мг/кг при разных путях и режимах введения. Наиболее эффективные результаты исследования противоопухолевой активности соединения индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) на LLC представлены в таблице 3.
В дозе 60 мг/кг при пятикратном с интервалом 24 часа ежедневном подкожном введении соединение индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) вызывало 78%) торможения роста опухоли на LLC непосредственно после окончания лечения, которое сохранялось на уровне 58% до 20 дня наблюдения с увеличением продолжительности жизни животных 34%. После повторного исследования индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) в том же режиме, дозе и способе введения был подтвержден высокий уровень ТРО после окончания лечения (ТРО=82%, р<0,05), с сохранением терапевтического эффекта до 20 дня наблюдения (ТРО=50%). При подкожном способе применения в режиме введения 2 раза через 96 ч в дозах 100 и 120 мг/кг индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) также показал высокий противоопухолевый эффект (ТРО=80-86% до 68-63%) в течение 20 дней), как и в дозе 60 мг/кг при пятикратном ежедневном подкожном введении.
Изучение противоопухолевой активности индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) при введении per os в пятикратном режиме с интервалом 24 ч в диапазоне доз 130, 150 и 200 мг/кг на LLC показало эффект ТРО=64-52% и 69-61% (р<0,05)продолжительностью до 8 дня наблюдения после лечения в дозах 130 и 150 мг/кг, соответственно.
Сравнение внутривенного способа введения в двух режимах - пятикратном ежедневном с интервалом 24 ч и однократном - позволяет выделить лучший режим для данного способа введения из изученных. Анализируя результаты исследования противоопухолевого эффекта индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) в диапазоне доз 60, 70, 80 мг/кг (суммарные дозы 300, 350, 400 мг/кг, соответственно) при пятикратном ежедневном режиме и однократном - в дозах 150 и 180 мг/кг, выбран пятикратный ежедневный с интервалом 24 ч режим и доза 60 мг/кг, показавшая эффект ТРО=94% (р<0,05)с сохранением ТРО на уровне 51% до 20 дня наблюдения после окончания лечения при внутривенном пути введения (таблица 3). Следует отметить, что при однократном внутривенном введении индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) в дозе 180 мг/кг отмечалась гибель от токсичности 6 из 7 мышей в группе.
При сравнении внутрибрюшинного способа введения в двух режимах - при пятикратном с интервалом 24 ч и в режиме 2 раза через 96 ч противоопухолевая активность соединения оказалась наиболее высокой в дозе 120 мг/кг в режиме - 2 раза через 96 ч. ТРО составило 61% с сохранением активности на уровне 67% (р<0,05) до 20 дня наблюдения после окончания лечения.
Индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) на меланоме В-16 при ежедневном пятикратном внутрибрюшинном введении показал высокий противоопухолевый эффект в дозах 60 и 100 мг/кг: ТРО составило от 84-79% до 70-46%) (р<0,05), соответственно, в течение 18 дней после окончания лечения без гибели мышей (таблица 4).
На РШМ 5 соединение индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) при ежедневном пятикратном внутрибрюшинном введении показало высокий продолжительный противоопухолевый эффект в дозе 60 мг/кг: от 89% до 62% (р<0,05) ТРО в течение 16 дней с сохранением эффекта 58%) до 24 дня после окончания лечения без гибели мышей (таблица 5). индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) проявил высокий противоопухолевый эффект при пероральном применении в режиме введения 2 раза через 96 ч в дозе 100 мг/кг: ТРО составило от 74-68% (р<0,05) в течение 22 дней с сохранением эффекта до 57% на 24 день после окончания лечения. Гибели мышей не наблюдалось (таблица 5).
На раке толстого кишечника мышей АКАТОЛ соединение индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) при ежедневном в течение 5 дней внутрибрюшинном введении показало высокий продолжительный противоопухолевый эффект: ТРО=90-62% до 26 дня после окончания лечения. Гибели мышей не наблюдалось (таблица 6).
При изучении соединения индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) на аденокарциноме молочной железы Са 755 в дозе 60 мг/кг при пятикратном ежедневном внутрибрюшинном введении мышам наблюдался высокий противоопухолевый эффект: ТРО=86-78% (р<0,05)в течение 8 дней после окончания лечения, которое сохранялось на уровне 68% до 20 дня наблюдения. Увеличение продолжительности жизни животных составило 21% (таблица 7).
При пятикратном ежедневном подкожном введении мышам с Са 755 индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) в дозе 60 мг/кг вызывал высокое ТРО=91%) непосредственно после окончания лечения, которое сохранялосьна уровне 64% (р<0,05) до 20 дня наблюдения с увеличением продолжительности жизни животных на 41%. Гибели мышей не наблюдалось (таблица 7).
Соединение индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) в экспериментальной лекарственной форме для инъекций показал высокую противоопухолевую эффективность на моделях опухолей мышей различного гистогенеза при разных способах и режимах введения, которые можно использовать для дальнейших доклинических испытаний.
На лимфолейкозе Р-388 установлено, что соединение индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) в дозе 100 мг/кг при внутрибрюшинном введении в течение 5 дней увеличивает продолжительность жизни мышей на 93% (р<0,05). Гибели животных не наблюдается.
Показано, что соединение индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) на асцитном варианте опухоли Эрлиха в дозе 80 мг/кг при ежедневном пятикратном внутрибрюшинном введении вызывает увеличение продолжительности жизни мышей на 337%. Гибели животных не отмечается.
Установлено, что на эпидермоидной карциноме легкого Lewis (LLC) соединение индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) проявляет высокую противоопухолевую эффективность при внутривенном и подкожном способах введения и умеренную эффективность при пероральном применении. Так, при внутривенном способе применения наилучший противоопухолевый эффект установлен при ежедневном пятикратном (через 24 ч) введении в дозе 60 мг/кг (ТРО=94-51%, р<0,05 в течение 20 дней). При подкожном способе применения соединение эффективно в двух режимах: при введении ежедневно в течение 5 дней в дозе 60 мг/кг (ТРО=78-58%, р<0,05 в течение 20 дней, УПЖ=34%) и двукратном введении через 96 ч в дозе 100 мг/кг (ТРО=80-68%, р<0,05 в течение 20 дней). При применении индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) per os в режиме ежедневно пятикратно (через 24 ч) отмечается умеренный противоопухолевый эффект в дозе 150 мг/кг (ТРО=69-61%, р<0,05 до 8 дня наблюдения).
Обнаружено, что индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) на меланоме В-16 при ежедневном пятикратном введении показал высокий противоопухолевый эффект в дозах 60 и 100 мг/кг: ТРО составляет от 84-79%) до 70-46%) (р<0,05), соответственно, в течение18 дней после окончания лечения без гибели мышей.
Показано, что соединение индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) на РШМ-5 проявляет высокую противоопухолевую активность при внутрибрюшинном и пероральном способах введения. Так, при ежедневном пятикратном (через 24 ч) внутрибрюшинном введении в дозе 60 мг/кг наблюдается ТРО=89-62% (р<0,05)в течение 16 дней с сохранением эффекта до 58% до 24 дня после окончания лечения. При пероральном применении в режиме введения 2 раза через 96 ч в дозе 100 мг/кг отмечается ТРО=74-68% (р<0,05) в течение 22 дней с сохранением эффекта до 57% на 24 день после окончания лечения.
На раке толстого кишечника мышей АКАТОЛ показано, что соединение индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) вызывает высокий продолжительный противоопухолевый эффект при ежедневном в течение 5 дней внутрибрюшинном введении: ТРО=90-62% (р<0,05) до 26 дня после окончания лечения. Гибели мышей не наблюдается.
Установлено, что соединение индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов-n-{12-(β-d-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с]карбазол-6-ил}пиридин-2-карбоксамида (прототип) проявляет высокий противоопухолевый эффект на аденокарциноме молочной железы Са 755 мышей в дозе 60 мг/кг в режиме ежедневного в течение 5 дней введения при двух способах применения: внутрибрюшинном (ТРО=86-68%, р<0,05 до 20 дня наблюдения, УПЖ=21%) и подкожном (ТРО=91-64%, р<0,05 до 20 дня наблюдения, УПЖ=41%). Гибели мышей не наблюдается.



Литература
1. A.M. Гарин, И.С.Базин. - М.: ИНФОТЕХ; ЛЕКСРУС, 2015.-529 с.
2. Смирнова, З.С.Изучение связи структуры и противоопухолевой активности в ряду N-гликозидов, производных индоло[2,3-а]карбазола / З.С.Смирнова, И.Ю. Кубасова, Л.М. Борисова [и др.] // Российский биотерапевтический журнал. - 2006. - Т. 5. - №1. - C. 20.
3. Смирнова, З.С. Корреляция цитотоксической и противоопухолевой активности в отношении лейкозов в ряду N-гликозилированных производных индоло[2,3-а]карбазола / З.С.Смирнова, И.Ю. Кубасова, Л.М. Борисова [и др.] // Российский биотерапевтический журнал. - 2007. - Т. 6. - №1. - С. 50-51.
4. Голубева, И.С.Противоопухолевая активность гликозидов индолокарбазолов [Текст] / И.С. Голубева, Н.П. Яворская, В.А. Еремина, Н.И. Тихонова, Т.Д. Миникер, Л.В. Эктова, М.В. Дмитриева // Российский биотерапевтический журнал - 2016. - Т. 15, №1. - С. 23-24.
5. А.А. Вартанян, М.А. Барышникова, О.С. Бурова [и др.] // Вестник РОНЦ им. Н.Н. Блохина. - 2016. - Т. 27. - №2. - С. 165-17.], [Пат. №2548045 РФ, МКИ А61К 31/7008, А61Р 35/00, С07Н 19/04 N-гликозиды индоло[2,3-а]пирроло[3,4-с]карбазолов, обладающие противоопухолевой активностью.
6. А. А. Вартанян, М.А. Барышникова, О.С.Бурова, Л.В. Эктова, 3.С.Шпрах. Блокатор васкулагенной мимикрии восстанавливает чувствительность резистентных клеток меланомы к ДНК-повреждающим агентам. Российский биотерапевтический журнал - 2016. - Т. 15, №1. - С. 19-20.
7. Л.М. Борисова, И.С. Голубева, О.В. Горюнова [и др.] - №2014107507/04; заявл. 27.02.2014; опубл. 10.04.2015. - 6 с.], [Пат. №2557554 РФ, МКИ А61К 31/7056, А61Р 35/00, С07Н 19/23 Производные индолокарбазолов, блокирующие васкулогенную мимикрию в опухоли / А.А. Вартанян, М.А. Барышникова, В.А. Еремина [и др.] - №2014136547/04; заявл. 09.09.2014; опубл. 27.07.2015. - 6 с.
8. Смирнова З.С. Изучение связи структуры и противоопухолевой активности в ряду N-гликозидов, производных индоло[2,3-а]карбазола / З.С. Смирнова, И.Ю. Кубасова, Л.М. Борисова [и др.] // Российский биотерапевтический журнал. - 2006. - Т. 5. - №1. - С. 20.
9. Реагсе С.J., Doyle T.W., Forenza S., Lam K.S., Schroeder D.R. The biosynthetic origins of rebeccamycin. Journal of Natural Products. 1988. 51, P. 937-940.
10. Блохин, Д.Ю. Молекулярные мишени для противоопухолевой терапии: пути: пути передачи сигнала и эпигенетические модуляторы / Д.Ю. Блохин, Е.Ф. Чмутин, П.К. Иванов // Российский биотерапевтический журнал. - 2011. - Т. 10. - №4. - С. 81-88.
11. Pereira Rodrigues, Е. Structure - activity relationships in a series of substituted indolocarbazoles: topoisomerase I and protein kinase С ingibition and antitumoral and antimicrobial properties / E. Pereira Rodrigues, L. Belin, M. Sancelme [et al.] // J. Med.Chem. - 1996. - Vol. 39. - P. 4471-4477.
12. Schwandt, A. Phase-II trial of rebeccamycin analog, a dual topoisomerase-I and -II inhibitor, in relapsed "sensitive" small cell lung cancer / A. Schwandt, T. Mekhail, B. Halmos [et al.] // J Thorac Oncol. - 2012 - Vol. 7. - №4. - P. 751-754.
13. Nock, C.J. A phase I study of rebeccamycin analog in combination with oxaliplatin in patients with refractory solid tumors / C.J. Nock, J.M. Brell, J.A. Bokar [et al.] // Invest New Drugs.-2011.- Vol. 29. - P. 126-130.
14. Plas, D.R. Akt-dependent transformation: there is more to growth than just surviving / D.R. Plas, C.B. Thompson // Oncogene - 2005. - Vol. 24. - P. 7435-7442.
15. Senderowicz, A.M. Inhibitors of cyclin-dependent kinase modulators for cancer therapy / A.M. Senderowicz // Prog Drug Res. - 2005. - Vol. 63. - P. 183-206.
16. Блохин, Д.Ю. Молекулярные мишени для противоопухолевой терапии: пути: пути передачи сигнала и эпигенетические модуляторы / Д.Ю. Блохин, Е.Ф. Чмутин, П.К. Иванов // Российский биотерапевтический журнал. - 2011. - Т. 10. - №4. - С. 81-88.
17. Vartanian A. and Baryshnikov A. Molecular determinants of tumor vasculogenic mimicry. In "Cancer Etiology, Diagnosis and Treatments". NOVA Publisher, USA. Ed Jones A. 67-92.
18. Vartanian A., et al. The involvement of Notch signaling in melanoma vasculogenic mimicry. Clin. Exp.Med. 2013; 13(3):201-209.
19. Vartanian A., et al. VEGFR1 and PKCa signaling control melanoma vasculogenic mimicry in a VEGFR2 kinase-independent manner. Melanoma Res. 2011; 21(2): 91-98.
20. Vartanian A. et al. Melanoma vasculogenic mimicry is strongly related to reactive pxygen species level. Melanoma Res. 2007; 17(6): 370-379.
21. Vartanian A. et al. Melanoma vasculogenic mimicry depends on integrin and calcium signaling. Microcirculation 2011; 18(5), 390-399.
22. Вартанян A.A. и др. Производные индолокарбозолов, блокирующие васкулогенную мимикрию в опухоли. Патент №2557554, 2015.
23. Vartanian A. et al. Is vasculogenic mimicry a hallmark of cancer? Horizons in Cancer Res. 2017, 65:13-34.
24. Vartanian A. et al. Inhibitor of vasculogenic mimicry restores sensitivity of resistant melanoma cells to DNA-damaging agents. Melanoma Res. 2017; 27 (1):8-16.
25. Vartanian A. et al. Melanoma educates mesenchymal stromal cells towards vasculogenic mimicry. Oncol Lett. 2016;11(6):4264-4268.
26. Яворская, Н.П. Противоопухолевая активность индолокарбазола ЛХС-1269 [Текст]/ Н.П. Яворская, И.С.Голубева, Л.В. Эктова, В.А. Еремина, Н.И. Тихонова, Т.Д. Миникер, М.В. Дмитриева // Российский биотерапевтический журнал - 2016. - Т. 15, №1. - С. 125-126.

