Результат интеллектуальной деятельности: Способ диагностики хирургических заболеваний щитовидной железы с использованием динамической двухиндикаторной сцинтиграфии
Вид РИД
Изобретение
Изобретение относится к медицине, а именно к радионуклидной диагностике, и может быть использовано для дифференциальной диагностики доброкачественных и злокачественных заболеваний щитовидной железы (ЩЖ), в частности, фолликулярных неоплазий с целью уменьшения количества неоправданных оперативных вмешательств и выбора их рациональной методики и объема.
Хирургическое лечение пациентов с заболеваниями ЩЖ остается одной из сложных проблем эндокринной хирургии, что связано, в первую очередь, с количеством больных и трудностями предоперационной морфологической верификации узловых образований (УО), зачастую побуждающих к активной хирургической тактике. В связи с этим остается актуальным вопрос разработки новых и модификации уже известных методов обследования, которые позволят проводить дифференциальную диагностику УО, что особенно важно для группы фолликулярных неоплазий. На сегодняшний день радионуклидная диагностика является одним из самых используемых методов для выявления рака ЩЖ [1-3].
Методы радиоизотопной индикации впервые в клинической практике были использованы в 1927 году, когда Н. Blumgart и S. Weiss применили газ радон для оценки гемодинамики у больных с сердечной недостаточностью. В 1939 году J. Hamilton и соавт. впервые изучили закономерности распределения радиоактивного йода (131I) при различных заболеваниях ЩЖ, а за прошедшие 80 лет радионуклидная диагностика прочно вошла в арсенал диагностических средств учреждений здравоохранения, не уступая другим лучевым методам, таким как ультразвуковое исследование, компьютерная и магнитно-резонансная томография. На сегодняшний день созданы совершенные регистраторы излучения (радиометрические приборы - гамма-камеры, однофотонный эмиссионный компьютерный томограф и позитронно-эмиссионный томограф), используются современные радиофармпрепараты (РФП) и радионуклидные метки. Наиболее часто используемым радиоактивным изотопом в России является 99mTc, имеющий идеальный для сцинтиграфии моноэнергетический спектр гамма-излучения 140 кэВ и период полураспада 6 часов, а сам Технеций является радионуклидной меткой для различных РФП [1].
С целью диагностики заболеваний ЩЖ в настоящее время применяется двухиндикаторная сцинтиграфия с использованием двух РФП - тиреотропного 99mTc-пертехнетата и туморотропного 99mTc-технетрила (отечественного аналога 99mTc-метокси-изобутил-изонитрила (МИБИ) [4-7]. Использование двух РФП обусловлено необходимостью первичного применения 99mTc-пертехнетата с целью оценки равномерности распределения РФП, функциональной активности ткани ЩЖ, ее расположения, размеров, контуров, наличия аберрантной ткани, дифференциальной диагностики диффузного токсического и узлового токсического зоба, выяснения топографоанатомичеких особенностей расположения ЩЖ при ее загрудинном распространении, а также наличия и локализации патологического очага, его величины, контуров и формы. На основе поглощения 99mTc-пертехнетата УО ЩЖ могут быть классифицированы как гиперфункционирующие (горячие), гипофункционирующие (холодные) и функционирующие (теплые). «Горячие» узлы почти всегда являются доброкачественными, в то время как «холодные» обладают высоким риском злокачественности. УО ЩЖ размером менее 1,5 см лежат ниже порога разрешения данного метода исследования, что вносит свои ограничения в диагностику ранних форм рака ЩЖ [1]. Использование в качестве второго РФП 99mTc-технетрила позволяет проводить дифференциальную диагностику УО ЩЖ, оценивать локальную и отдаленную распространенность патологического процесса. Классическим результатом исследования, указывающим на злокачественный характер поражения ЩЖ, считается накопление 99mTc-технетрила в «холодных» при сканировании с 99mTc-пертехнетатом УО ЩЖ. По данным ряда авторов чувствительность данного метода диагностики варьирует от 67 до 85,2%, специфичность - от 69 до 77,2%, точность - от 70 до 80,9%. Все три показателя достигают 90-95% в диагностике папиллярного рака ЩЖ [4-5]. В ретроспективных и проспективных исследованиях зарубежных авторов, проведенных на больших группах пациентов, высокие показатели чувствительности и отрицательной прогностической ценности позволяли исключить рак ЩЖ почти со 100% вероятностью. Однако, положительные результаты сканирования отмечались как в доброкачественных, так и злокачественных УОЩЖ, что побудило авторов не только к совершенствованию визуальной методики оценки результатов исследования, но и к разработке более объективной полуколичественной [2,4, 6-12]. В основу модифицированных методик лег анализ накопления туморотропного РФП в раннюю и позднюю фазу сканирования, что позволило повысить диагностическую значимость сцинтиграфии в дифференциальной диагностике фолликулярных неоплазий. Исключение составляют лишь В-клеточные (Гюртле-клеточные) аденомы, характеристики которых в поглощении 99mTc-технетрила мало отличаются от рака ЩЖ, что может быть связано с отрицательным трансмембранным митохондриальным электрическим потенциалом, формирующих их онкоцитарных клеток [13]. Несмотря на все ограничения, данный метод исследования может позволить провести дифференциальную диагностику у большинства больных УО ЩЖ с неопределенным потенциалом злокачественности. Дополнительным преимуществом сцинтиграфии перед другими инструментальными и морфологическими методами исследования служит ее невысокая стоимость. Недостатком исследования можно считать относительную субъективность метода (зависимость интерпретации результата от опыта оператора и качества аппаратуры) и низкую доступность на территории Российской Федерации вследствие небольшого количества гамма-камер [1]. Очевидно, что этот метод не может быть ведущим при обследовании больных с УО ЩЖ. Все же, применение сцинтиграфии ЩЖ в международных рекомендация в настоящий момент носит ограниченный характер и рекомендовано только для дифференциальной диагностики токсических форм зоба, обнаружения «холодных» узлов в гиперфункционирующей ткани ЩЖ, подлежащих пункционной тонкоигольной аспирационной биопсии, выяснения топогрофоанатомических особенностей при загрудинном зобе, эктопии ЩЖ, для определения показаний к радиойодтерапии или оценки ее эффективности [14-16].
Учитывая отсутствие общепринятого стандарта выполнения исследования и оценки его результатов, нами предлагается способ диагностики хирургических заболеваний щитовидной железы с использованием динамической двухиндикаторной сцинтиграфии, основанный на визуальном и полуколичественном анализе данных и предназначенный для дифференциальной диагностики УО. Применение данной методики позволяет уточнить характер патологии ЩЖ, определить рациональную тактику лечения больных.
Решение поставленной задачи обеспечивается тем, что в способе диагностики хирургических заболеваний щитовидной железы с использованием динамической двухиндикаторной сцинтиграфии щитовидной железы, включающем выполнение исследования с помощью мультидетекторной гамма-камеры снабженной низкоэнергетическими высокоразрешающими коллиматорами, сцинтиграфию проводят в положении больного лежа на спине с запрокинутой назад головой; установку детектора осуществляют на минимальном расстоянии от передней поверхности шеи; анатомическими ориентирами выбирают перстневидный хрящ сверху и яремную вырезку грудины снизу; важным моментом считают сохранение стабильного положения пациента во время исследования с целью исключения ложноположительных и ложноотрицательных результатов; выделяют два этапа исследования: первым этапом осуществляют внутривенное ведение 99mTc-пертехнетата; в зависимости от возраста и массы тела пациенту вводят РФП удельной активностью 50-100 МБк, через 20 минут после инъекции которого получают плоскостные изображения передних отделов шеи (цифровой zoom: 3,2; матрица: 256×256; набор импульсов на каждый кадр: 500 Kcounts; время проведения исследования: 300 сек; энергия гамма-квантов: 140±20 КэВ); второй этап начинают после внутривенного введения 400-700 МБк 99mTc-технетрила, вводимого через 5 минут после окончания сканирования с 99mTc-пертехнетатом; в том же положении пациента проводят динамическое сканирование пациента в течение 35 минут и дополнительно статическое через 60 минут с последующим получением суммационных сцинтиграмм через 10 (ранняя фаза сканирования) и 60 (поздняя фаза) минут после инъекции туморотропного РФП (цифровой zoom: 3,2; матрица: 128×128; набор импульсов на каждый кадр: 50 Kcounts; энергия гамма-квантов: 140±20 КэВ); с целью улучшения качества снимков проводят стандартное сглаживание нативного изображения и вычитание она; первичную оценку полученных при сканировании с 99mTc-пертехнетатом сцинтиграмм проводят на основе их качественного (визуального) анализа: определяют расположение ЩЖ, ее размер, контуры, наличие аберрантной ткани, равномерность распределения РФП, наличие и локализацию патологического очага, его величину, контур, форму; при этом УО общепринято оценивают как гиперфункционирующие («горячие» - поглощение РФП в них выше чем в нормальной ткани ЩЖ), функционирующие («теплые» и «горячие») и нефункционирующие («холодные» - с отсутствием поглощения в них РФП); после выполнения субтракции (вычитания) изображений в проекции УО, выявленных на 1 этапе исследования, оценивают характер накопления в них туморотропного РФП; затем применяют модифицированную качественную (визуальную) методику оценки сцинтиграмм, отличающуюся тем, что используют систему, основанную на выделении 3-х моделей УО в зависимости от показателей поглощения ими 99mTc-пертехнетата и 99mTc-технетрила: Модель 1 - поглощение 99mTc-технетрила ниже поглощения 99mTc-пертехнетата; Модель 2 - поглощение 99mTc-технетрила выше поглощения 99mTc-пертехнетата в раннюю фазу сканирования; поглощение 99mTc-технетрила в раннюю фазу сканирования выше поглощения 99mTc-технетрила в позднюю фазу; Модель 3 - поглощение 99mTc-технетрила выше поглощения 99mTc-пертехнетата в раннюю фазу сканирования; поглощение 99mTc-технетрила в раннюю фазу сканирования ниже или равно поглощению 99mTc-технетрила в позднюю фазу; УО, расцененные первично как «горячие», а также соответствующие 1-ой и 2-ой моделям, расценивают как доброкачественные; Модель 3 характеризуют наличием признаков злокачественного роста; далее с целью повышения показателей информативности динамической двухиндикаторной сцинтиграфии ЩЖ применяют оригинальную методику полуколичественного анализа, основанную на оценке индекса вымывания (ИВ) 99mTc-технетрила в раннюю и позднюю фазы сканирования, для чего на ранних сцинтиграммах осуществляют построение области интересов (ОИ) вокруг УО и ее проекции за пределами ЩЖ (в надключичной области) с целью вычитания фонового поглощения РФП (область фонового поглощения (ОФП); указанные ОИ и ОФП копируют на отсроченные сцинтиграммы; для расчета ИВ используют средние показатели захвата 99mTc-технетрила в ОИ и в ОФП, указанные в числовом эквиваленте; таким образом, ИВ рассчитывают как отношению среднего захвата РФП (с учетом вычитания его фонового поглощения) в УО в позднюю (+60 мин) и раннюю (+10 мин) фазы сканирования выраженному в процентах; формула для расчета ИВ представляют следующим образом: среднее поглощение 99mTc-технетрила в ОИ в раннюю фазу сканирования - среднее поглощение 99mTc-технетрила в ОФП в раннюю фазу сканировании = ранний результат (РР); среднее поглощение 99mTc-технетрила в ОИ в позднюю фазу сканирования - среднее поглощение 99mTc-технетрила в ОФП в позднюю фазу сканировании = поздний результат (ПР); ИВ=100-ПР/РР×100; используя данную методику, предполагают, что УО с ИВ РФП более 20% соответствуют доброкачественной опухоли, а менее 20% - злокачественной; в первом случае больному обосновывают удаление доли ЩЖ, во втором - выполнение гемитиреоидэктомии или тиреоидэктомии.
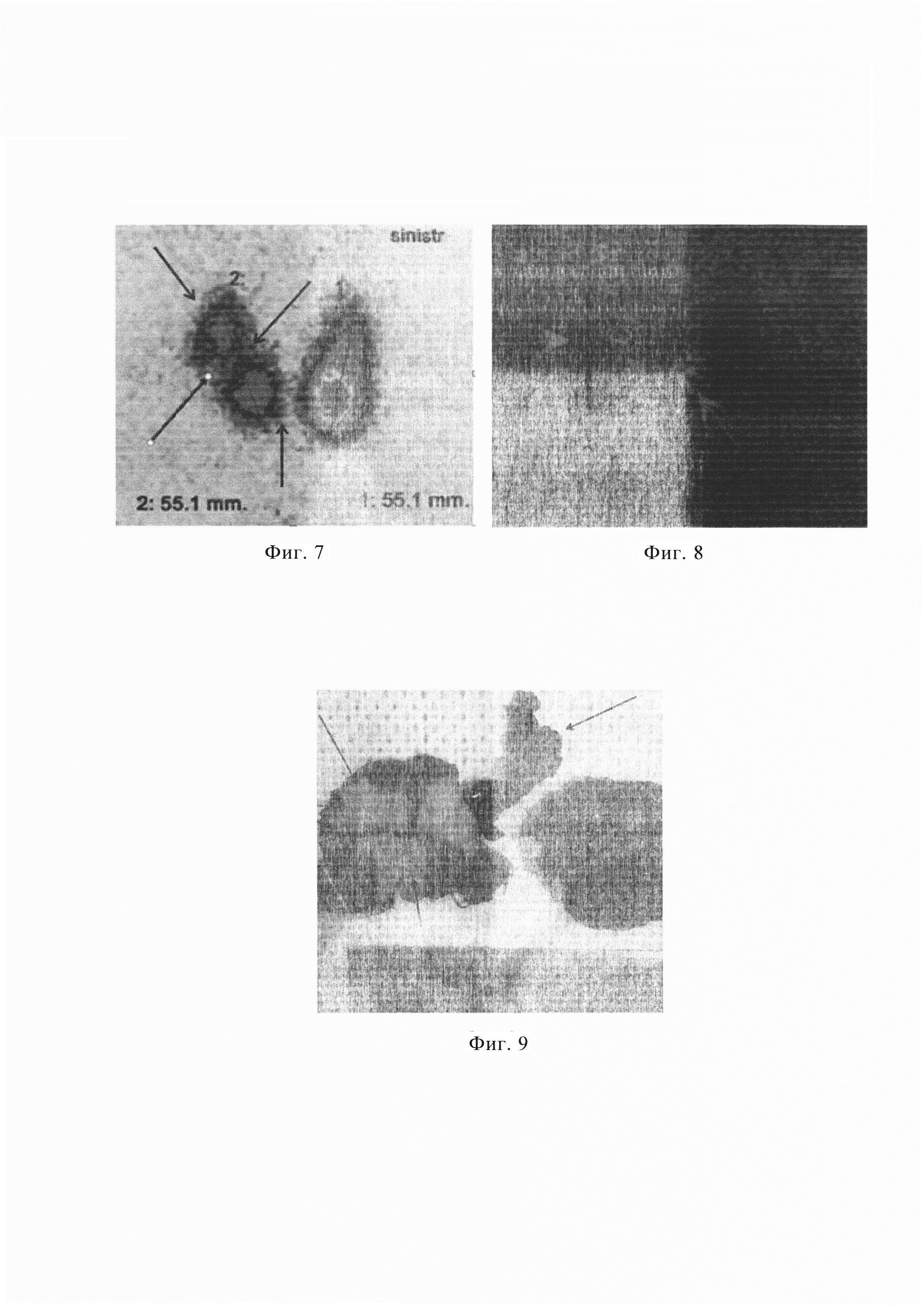
Изобретение поясняется фиг. 1, на которой представлена сцинтиграмма ЩЖ больного А. с нефункционирующим («холодным») узлом левой доли (указан стрелкой с кругом) при сканировании с 99mTc-пертехнетатом; фиг. 2, где изображена сцинтиграмма ЩЖ больного А. с образованием левой доли, в котором стрелкой и кругом указано поглощение 99mTc-технетрила в раннюю фазу сканирования (через 10 минут после введения РФП); фиг. 3-показана сцинтиграмма ЩЖ больного А. с образованием левой доли, в котором стрелкой и кругом указано поглощение 99mTc-технетрила в позднюю фазу сканирования (через 60 минут после введения РФП); фиг. 4, где на сцинтиграмме ЩЖ больного А. указано среднее поглощение 99mTc-технетрила в области интересов (88%) и среднее поглощение 99mTc-технетрила в области фонового поглощения (12%) в раннюю фазу сканировании; фиг. 5, на которой представлена сцинтиграмма ЩЖ больного А. с указанием среднего поглощения 99mTc-технетрила в области интересов (85%) и среднее поглощение 99mTc-технетрила в области фонового поглощения (15%) в позднюю фазу сканировании; фиг. 6 - показан макропрепарат левой доли ЩЖ больного А., где стрелкой указан фокус опухоли в месте инвазии в капсулу железы, а кругом - прилежащие лимфатические узлы; фиг. 7 с изображением сцинтиграммы ЩЖ больного Г. при исследовании с 99mTc-пертехнетатом, где стрелками указаны нефункционирующие («холодные») узлы правой доли ЩЖ; фиг. 8 - представлена сцинтиграмма ЩЖ больного Г. при исследовании с 99mTc-технетрилом, где стрелками указаны области повышенного накопления РФП в позднюю фазу сканирования (через 60 минут после введения РФП); фиг. 9, на которой представлен макропрепарат удаленной ЩЖ с фокусами роста опухоли и регионарными лимфатическими узлами (указаны стрелкой) больного Г.
Изобретение осуществляется следующим образом. Динамическая двухиндикаторная сцинтиграфия ЩЖ выполняется с помощью мультидетекторной гамма-камеры снабженной низкоэнергетическими высокоразрешающими коллиматорами. Исследование проводится в положении больного лежа на спине с запрокинутой назад головой. Установка детектора осуществляется на минимальном расстоянии от передней поверхности шеи. Анатомическими ориентирами являются перстневидный хрящ сверху и яремная вырезка грудины снизу. Важным моментом является сохранение стабильного положения пациента во время исследования с целью исключения ложноположительных и ложноотрицательных результатов. Целесообразно выделение двух этапов исследования. Первым этапом осуществляется внутривенное ведение 99mTc-пертехнетата. В зависимости от возраста и массы тела пациенту вводится РФП удельной активностью 50-100 МБк, через 20 минут после инъекции которого получают плоскостные изображения передних отделов шеи (цифровой zoom: 3,2; матрица: 256×256; набор импульсов на каждый кадр: 500 Kcounts; время проведения исследования: 300 сек; энергия гамма-квантов: 140±20 КэВ). Второй этап начинается после внутривенного введения 400-700 МБк 99mTc-технетрила (отечественный аналог Тс-99m-метоксиизобутилизонитрила), вводимого через 5 минут после окончания сканирования с 99mTc-пертехнетатом. В том же положении пациента проводится динамическое сканирование пациента в течение 35 минут и дополнительно статическое через 60 минут с последующим получением суммационных сцинтиграмм через 10 (ранняя фаза сканирования) и 60 (поздняя фаза) минут после инъекции туморотропного РФП (цифровой zoom: 3,2; матрица: 128×128; набор импульсов на каждый кадр: 50 Kcounts; энергия гамма-квантов: 140±20 КэВ). С целью улучшения качества снимков проводится стандартное сглаживание нативного изображения и вычитание тканевого фона. Первичная оценка полученных при сканировании с 99mTc-пертехнетатом сцинтиграмм основывается на их качественном (визуальном) анализе: определяется расположение ЩЖ, ее размер, контуры, наличие аберрантной ткани, равномерность распределения РФП, наличие и локализация патологического очага, его величина, контур, форма. При этом УО общепринято оцениваются как гиперфункционирующие («горячие» - поглощение РФП в них выше чем в нормальной ткани ЩЖ), функционирующие («теплые» и «горячие») и нефункционирующие (фиг. 1) («холодные» - с отсутствием поглощения в них РФП). После выполнения субтракции (вычитания) изображений в проекции УО, выявленных на 1 этапе исследования, мы оцениваем характер накопления в них туморотропного РФП. Визуальная оценка сцинтиграмм по предлагаемой модифицированной методике подразумевает использование системы, основанной на выделении 3-х моделей УО в зависимости от показателей поглощения ими 99mTc-пертехнетата и 99mTc-технетрила: Модель 1 - поглощение 99mTc-технетрила ниже поглощения 99mTc-пертехнетата; Модель 2 - поглощение 99mTc-технетрила выше поглощения 99mTc-пертехнетата в раннюю фазу сканирования; поглощение 99mTc-технетрила в раннюю фазу сканирования выше поглощения 99mTc-технетрила в позднюю фазу (фиг. 2). Модель 3 - поглощение 99mTc-технетрила выше поглощения 99mTc-пертехнетата в раннюю фазу сканирования; поглощение 99mTc-технетрила в раннюю фазу сканирования ниже или равно поглощению 99mTc-технетрила в позднюю фазу. УО, расцененные первично как «горячие», а также соответствующие 1-ой и 2-ой моделям, расцениваются как доброкачественные. Модель 3 характеризуется наличием признаков злокачественного роста (фиг. 3). С целью повышения показателей информативности динамической двухиндикаторной сцинтиграфии ЩЖ предлагается проведение полуколичественного анализа, основанного на оценке индекса вымывания (ИВ) 99mTc-технетрила в раннюю и позднюю фазы сканирования. Для этого на ранних сцинтиграммах осуществляется построение области интересов (ОИ) вокруг УО и ее проекция за пределами ЩЖ (в надключичной области) с целью вычитания фонового поглощения РФП (область фонового поглощения (ОФП). Указанные ОИ и ОФП копируются на отсроченные сцинтиграммы. Для расчета ИВ используются средние показатели захвата 99mTc-технетрила в ОИ и в ОФП, указанные в числовом эквиваленте. Таким образом, ИВ равен отношению среднего захвата РФП (с учетом вычитания его фонового поглощения) в УО в позднюю (+60 мин) и раннюю (+10 мин) фазы сканирования выраженному в процентах. Формула для расчета ИВ: Среднее поглощение 99mTc-технетрила в ОИ в раннюю фазу сканирования - среднее поглощение 99mTc-технетрила в ОФП в раннюю фазу сканировании = ранний результат (РР) (фиг. 4); Среднее поглощение 99mTc-технетрила в ОИ в позднюю фазу сканирования - среднее поглощение 99mTc-технетрила в ОФП в позднюю фазу сканировании = поздний результат (ПР) (фиг. 5); ИВ=100-ПР/РР×100. Используя данную методику, предполагается, что УО с ИВ РФП более 20% соответствуют доброкачественной опухоли, а менее 20% - злокачественной. В первом случае больным обосновано удаление доли ЩЖ, во втором - выполнение гемитиреоидэктомии или тиреоидэктомии.
С целью подтверждения эффективности предлагаемого нами способа диагностики хирургических заболеваний щитовидной железы с использованием динамической двухиндикаторной сцинтиграфии представляем клинические наблюдения.
Клиническое наблюдение №1. Пациент А., 38 лет, поступил в клинику для планового хирургического лечения фолликулярной опухоли левой доли щитовидной железы. Из анамнеза установлено, что впервые узел размером до 1 см в левой доле щитовидной железы был выявлен при плановом УЗИ около 10 лет назад. Был оценен гормональный фон щитовидной железы - эутиреоз без признаков аутоиммунного тиреоидита. На протяжении последующих лет пациент находился под наблюдением у эндокринолога по месту жительства с выполнением УЗИ и оценкой тиреоидного статуса ежегодно. При контрольном УЗИ в 2012 году отмечено увеличение узла до 1,5 см. Была выполнена его пункционная тонкоигольная аспирационная биопсия, получена цитологическая картина коллоидного узла. В 2017 году размер узла увеличился до 28 мм и при повторной тонкоигольной аспирационной биопсии получена цитологическая картина фолликулярной опухоли - Bethesda IV. В связи с онкологической настороженностью пациент поступил в клинику для выполнения планового оперативного вмешательства. В клиническом и биохимическом анализах крови, общем анализе мочи, показателях коагулограммы без патологических изменений. Оценен гормональный фон щитовидной железы - эутиреоз: уровень тиреотропного гормона составил 2,040 мкМЕ/мл, свободного тироксина - 19,90 пмоль/л, кальцитонин - менее 0,9 пг/мл. Уровень паратиреоидного гормона составил 50,98 пг/мл. При УЗИ щитовидной железы: перешеек размером 10×3 мм, однородный. Правая доля размером 12×14×45 мм, объемом 3,6 см3, однородная. Левая доля размером 23×27×46 мм, объемом 13,6 см3. Общий объем железы 17,5 см3. В области перехода средней в нижнюю треть левой доли определяется округлый гипоэхогенный узел с четкими, местами неровными контурами, центральными и периферическими микрокальцинатами, усиленной васкуляризацией, размером 26×22×20 мм. Местами образование интимно прилежит к окружающим мышцам, в связи с чем нельзя исключить их инвазию. Регионарные лимфатические узлы не изменены. Заключение: Образование левой доли щитовидной железы - TIRADS 4с. Нельзя исключить инвазию образования в окружающие железу ткани.
С учетом эхографических данных с целью более детального изучения местной распространенности опухолевого процесса с оценкой регионарных лимфатических узлов и исключения отдаленного метастазирования выполнена МСКТ шеи и груди, по данным которой структура левой доли неоднородная за счет образования размером 20×22×23 мм, деформирующего контур железы. Плотность образования при нативном сканировании 49-54 HU, накапливает контрастное вещество до 105-116 HU. Образование плотно прилежит к грудинно-щитовидной мышце (нельзя исключить инвазию). Регионарной лимфаденопатии нет. В S1, S2, S4, S8, S9 правого легкого и S1+2, S3, S4, S8 и S9 левого легкого определяются лимфатические узлы. Заключение: КТ-картина образования левой доли щитовидной железы с возможной инвазией в прилежащую мышцу. Локальные уплотнения легочной ткани с обеих сторон (вероятнее внутрилегочные лимфатический узлы).
С целью уточнения потенциала злокачественности образования левой доли, а также определения объема и методики оперативного вмешательства выполнена динамическая двухиндикаторная сцинтиграфия ЩЖ по разработанной методике. При сканировании с 99mTc-пертехнетатом в левой доле выявлен нефункционирующий («холодный») узел (фиг. 1), активно накапливающий 99mTc-технетрил в раннюю фазу сканирования (через 10 минут после введения РФП) (фиг. 2) и частично вымывающий его в позднюю фазу сканирования (через 60 минут после введения РФП) (фиг. 3). Было рассчитано среднее поглощение 99mTc-технетрила в области интересов (88%) и среднее поглощение 99mTc-технетрила в области фонового поглощения (12%) в раннюю (фиг. 4), а также позднюю (фиг. 5) фазы сканировании (85% и 15% соответственно). По результатам среднего поглощения РФП была применена оригинальная методика полуколичественного анализа данных, основанная на расчете индексе вымывания РФП из образования, который составил 8%. Учитывая низкое вымывание РФП, был установлен, с высокой вероятностью, злокачественный характер образования.
Учитывая результаты лабораторно-инструментального обследования, пациенту установлен предварительный диагноз: Злокачественное образование (фолликулярная опухоль) левой доли щитовидной железы. Данные УЗИ и динамической двухиндикаторной сцинтиграфии позволили с высокой вероятностью говорить о наличии у пациента папиллярной карциномы левой доли ЩЖ cT3NxM0. Несмотря на данные цитологического исследования, указывающие на неопределенный потенциал злокачественности образования и возможность выполнения минимально инвазивного органосберегающего (гемитиреоидэктомии) оперативного вмешательства, принято решение о выполнении радикальной операции в объеме тиреоидэктомии и центральной лимфаденэктомии по традиционной методике. При интраоперационной ревизии выявлена плотноэластическая опухоль, располагающаяся на границе нижней и средней трети левой доли ЩЖ, интимно спаянная с капсулой железы и прилежащими мышцами, при отсутствии признаков регионарной лимфаденопатии. Выполнена операция - тиреоидэктомия, центральная лимфаденэктомия (фиг. 6).
Гистологическое заключение: папиллярная карцинома (диаметром 2,2 см) левой доли щитовидной железы, классический вариант с участками солидно-фолликулярного строения с инвазией ткани и капсулы щитовидной железы, с признаками минимального распространения в окружающую жировую клетчатку (рТ3). В исследуемом материале выявлен один лимфатический узел с признаками роста папиллярного рака (pN1a).
Таким образом, установлен окончательный диагноз: рак (папиллярная карцинома) левой доли щитовидной железы pT3N1aM0, I стадия.
Послеоперационный период протекал без осложнений. Результат лечения - хороший. Учитывая результаты гистологического исследования, характеризующие экстартиреоидное распространение опухоли с наличием метастазов в регионарных лимфатических узлах, а также объем выполненного оперативного вмешательства, пациент согласно международной системе стратификации рисков для больных высокодифференцированным раком ЩЖ отнесен к группе промежуточного риска рецидивирования, и отправлен на следующий этап лечения - радиойодтерапию. В настоящее время срок наблюдения за пациентом составляет 17 месяцев - признаков рецидива или персистенции заболевания нет.
Клиническое наблюдение №2. Пациент Г., 59 лет, поступил в клинику с жалобами на дискомфорт в области передней поверхности шеи. Из анамнеза установлено, что узловые образования обеих долей ЩЖ впервые выявлены 2 месяца назад по данным УЗИ при обследовании и лечении в условиях терапевтического стационара по поводу гипертонической болезни. Оценен гормональный фон ЩЖ - эутиреоз с признаками аутоиммунного тиреоидита: уровень тиреотропного гормона составил 3,67 мкМЕд/мл, свободного тироксина - 17,5 пмоль/л, антител к тиреоидной пероксидазе - 151,2 МЕд/мл, кальцитонина - 1 пг/мл. При ультразвуковом исследовании: ЩЖ диффузно неоднородная. В правой доле выявлены множественные УО, образующие конгломерат размером до 33 мм без четких границ. В структуре узлов преобладает неоднородный тканевой компонент с множественными микрокальцинатами. В левой доле лоцирован единичный узелок диаметром 5 мм. Признаков инвазии образований в окружающие ткани получено не было. Выполнена пункционная тонкоигольная аспирационная биопсия узлов правой доли с цитологическим исследованием полученного материала, по результатам которого получена картина фолликулярной опухоли. По данным динамической двухиндикаторной сцинтиграфии при сканировании с 99mTc-пертехнетатом установлено, что в левой доле распределение РФП диффузно-неравномерное. В правой доле отмечается очаговая неравномерность - в области наружного края правой доли, нижнего полюса и средней трети доли лоцируются нефункционирующие («холодные») узлы размером 11×11 мм, 14×11 мм и 10×8 мм соответственно (фиг. 7), активно накапливающие РФП при сканировании с 99mTc-технетрилом через 10 минут (ранняя фаза сканирования). Через 60 минут от начала исследования (поздняя фаза) фиксация туморотропного РФП в указанных областях сохраняется на прежнем уровне (фиг. 8). Таким образом установлено, что выявленные образования правой доли соответствуют Модели 3 и характеризуются высоким риском злокачественности. Также был рассчитан индекс вымывания РФП - 7%, подтверждающий с высокой вероятностью злокачественный характер образований. Помимо этого, по данным УЗИ и сцинтиграфии ЩЖ нельзя было исключить накопление РФП в лимфатических узлах VI группы.
Учитывая результаты лабораторно-инструментального обследования, пациенту установлен предварительный диагноз: Фолликулярная опухоль правой доли щитовидной железы. Однако данные УЗИ и динамической двухиндикаторной сцинтиграфии, выполненной по разработанной методике, позволили с высокой вероятностью говорить о наличии у пациента папиллярной карциномы cT2Nx.M0. Несмотря на небольшой размер УО ЩЖ с неопределенным потенциалом злокачественности при небольшом объеме железы принято решение воздержаться от выполнения минимально инвазивного вмешательства в связи с возможной необходимостью выполнения оперативного вмешательства в объеме тиреоидэктомии и центральной лимфаденэктомии. Предположения были подтверждены при интраоперационной ревизии - каменистой плотности опухоль практически полностью замещала правую долю ЩЖ, определялись увеличенные до 5-7 мм плотноэластические околощитовидные, пре- и паратрахеальные, преларингеальные лимфатические узлы. Выполнена операция - тиреоидэктомия, центральная лимфаденэктомия (фиг. 9).
Гистологическое заключение: многофокусная (17 и 12 мм) папиллярная карцинома правой доли ЩЖ, классический вариант с очагами фолликулярного варианта, с выраженным фиброзным компонентом (рТ2), А-клеточная аденома левой доли ЩЖ диаметром 5 мм. Фрагменты фиброзно-мышечной и жировой ткани содержат 7 лимфатических узлов, в 4 из которых отмечается рост папиллярного рака, местами - с субтотальным замещением паренхимы узла (pN1a). Установлен окончательный диагноз: рак (папиллярная карцинома) правой доли щитовидной железы pT2N1aM0, II стадия.
Послеоперационный период протекал без особенностей и осложнений. Результат лечения - хороший. Учитывая результаты гистологического исследования, характеризующие многофокусную закладку и наличие регионарных метастазов, а также объем выполненного оперативного вмешательства, пациент согласно международной системе стратификации рисков для больных высокодифференцированным раком ЩЖ отнесен к группе промежуточного риска рецидивирования, и отправлен для проведения радиойодтерапии. В настоящее время срок наблюдения за пациентом составляет 39 месяцев - признаков рецидива или персистенции заболевания нет.
Представленные клинические наблюдения демонстрируют возможности динамической двухиндикаторной сцинтиграфии в дифференциальной диагностике фолликулярных неоплазий и обоснованность избранной хирургической тактики, позволившей избежать превышения показаний для выполнения минимально инвазивных оперативных вмешательств, развития осложнений операции и повторных оперативных вмешательств для обеспечения их радикального объема.
СПИСОК ЛИТЕРАТУРЫ
1. Лишманов Ю.Б., Чернов В.И. Национальное руководство по радионуклидной диагностике. - Томск.: STT, 2010.686 с.
2. Campenni A., Giovanella L., Siracusa М. et al. 99mTc-Methoxy-Isobutyl-Isonitrile Scintigraphy Is a Useful Tool for Assessing the Risk of Malignancy in Thyroid Nodules with Indeterminate Fine-Needle Cytology. Thyroid. 2016; 26(8):1-9.
3. Матвеенко Е.Г., Давыдов Г.А., Олейник H.A. и др. Двухиндикаторная сцинтиграфия в диагностике рака щитовидной железы. Медицинская радиология и радиационная безопасность. 2006; 4:52-57.
4. Кадочникова С.Ю., Шубина Ю.А., Мирхалеева Д.М. Роль сцинтиграфии в диагностике новообразований щитовидной железы. 2014; 16(4):24-25.
5. Тимофеева Л.А. Оценка эффективности метода двухиндикаторной сцинтиграфии в дифференциальной диагностике узловых образований щитовидной железы. Казанский медицинский журнал. 2012; 93(3):447-450.
6. Giovanella L., Campenni A., Treglia G. et al. Molecular imaging with 99mTc-MIBI and molecular testing for mutations in differentiating benign from malignant follicular neoplasm: a prospective comparison. Eur. J. Nucl. Med. Mol. Imaging. 2016; 43(6):10181026.
7. Piccardo A., Puntoni M., Treglia G. et al. Thyroid nodules with indeterminate cytology: prospective comparison 1 between 18F-FDG2 PET/CT, multiparametric neck ultrasonography, 99mTc-MIBI scintigraphy and histology. Eur. J. Endocrinol. 2016; 174(5):693-703.
8. Verburg F.A., Behrendt F.F., Mottaghy F.M. et al. Cost-effectiveness of 99mTc-MIBI in the evaluation of thyroid nodules for malignancy: a new lease of life for an old radiopharmaceutical? Eur. J. Nucl. Med. Imaging. 2014; 41:102-104.
9. Leidig-Bruckner G., Cichorowski G., Sattler P. et al. Evaluation of thyroid nodules - combined use of 99mTc-methylisobutylnitrile scintigraphy and aspiration cytology to assess risk of malignancy and stratify patients for surgical or nonsurgical therapy - a retrospective cohort study. Clin Endocrinol. 2012; 76:749-758.
10. Treglia G., Caldarella C., Saggiorato E. et al. Diagnostic performance of 99mTc-MIBI scan in predicting the malignancy of thyroid nodules: a meta-analysis. Endocrine. 2013; 44:70-78.
11. Wale A., Miles K.A., Young B. et al. Combined 99mTc-methoxyisobutylisonitrile scintigraphy and fine needle aspiration cytology offers an accurate and potentially cost-effective investigative strategy for the assessment of solitary or dominant thyroid nodules. Eur. J. Nucl. Med. Mol. Imaging. 2014; 41:105-115.
12. Heinzel A., Muller D., Behrendt F.F. et al. Thyroid nodules with indeterminate cytology: molecular imaging with 99mTc-methoxyisobutylisonitrile (MIBI) is more cost-effective than the Afirma gene expression classifier. Eur. J. Nucl. Med. Mol. Imaging. 2014; 41:1497-1500.
13. Moretti J.L., Hauet N., Caglar M. et al. To use MIBI or not to use MIBI? That is the question when assessing tumor cells. Eur. J. Nucl. Med. Mol. Imaging. 2005; 32:836-842.
14. Dralle H., Musholt J., Schabram J. et al. German Association of Endocrine Surgeons practice guideline for the surgical management of malignant thyroid tumors. Langenbeck's Archives of Surgery. 2013; 398(3):347-375.
15. Gharib H., Papini E., Garber J.R. et al. American association of clinical endocrinologists, American college of endocrinology, and Associazione medici endocrinologi medical guidelines for clinical practice for the diagnosis and management of thyroid nodules - 2016 update. Endocrine practice. 2016; 22(5):622-639.
16. Haugen B.R., Alexander E.K., Bible K.C. et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid. 2016; 26(1): 1-133.
Способ диагностики хирургических заболеваний щитовидной железы с использованием динамической двухиндикаторной сцинтиграфии щитовидной железы, включающий выполнение исследования с помощью мультидетекторной гамма-камеры снабженной низкоэнергетическими высокоразрешающими коллиматорами, отличающийся тем, что сцинтиграфию проводят в положении больного лежа на спине с запрокинутой назад головой; установку детектора осуществляют на минимальном расстоянии от передней поверхности шеи; анатомическими ориентирами выбирают перстневидный хрящ сверху и яремную вырезку грудины снизу; важным моментом считают сохранение стабильного положения пациента во время исследования с целью исключения ложноположительных и ложноотрицательных результатов; выделяют два этапа исследования: первым этапом осуществляют внутривенное ведение Tc-пертехнетата; в зависимости от возраста и массы тела пациенту вводят радиофармпрепарат удельной активностью 50-100 МБк, через 20 мин после инъекции которого получают плоскостные изображения передних отделов шеи при следующих параметрах исследования: цифровой zoom: 3,2; матрица: 256×256; набор импульсов на каждый кадр: 500 Kcounts; время проведения исследования: 300 сек; энергия гамма-квантов: 140±20 КэВ; второй этап начинают после внутривенного введения 400-700 МБк Tc-технетрила, вводимого через 5 мин после окончания сканирования с Tc-пертехнетатом; в том же положении пациента проводят динамическое сканирование пациента в течение 35 мин и дополнительно статическое через 60 мин с последующим получением суммационных сцинтиграмм через 10 при ранней фазе сканирования и 60 мин при поздней фазе сканирования после инъекции туморотропного радиофармпрепарата при следующих параметрах исследования: цифровой zoom: 3,2; матрица: 128×128; набор импульсов на каждый кадр: 50 Kcounts; энергия гамма-квантов: 140±20 КэВ; для улучшения качества снимков проводят стандартное сглаживание нативного изображения и вычитание тканевого фона; первичную оценку полученных при сканировании с Tc-пертехнетатом сцинтиграмм проводят на основе их качественного или визуального анализа: определяют расположение щитовидной железы, ее размер, контуры, наличие аберрантной ткани, равномерность распределения радиофармпрепарата, наличие и локализацию патологического очага, его величину, контур, форму; при этом узловые образования общепринято оценивают как гиперфункционирующие или «горячие» при поглощении радиофармпрепарата в них выше, чем в нормальной ткани щитовидной железы, функционирующие или «теплые» и нефункционирующие или «холодные» при отсутствии в них поглощения радиофармпрепарата; после выполнения вычитания изображений в проекции узловых образований, выявленных на 1 этапе исследования, оценивают характер накопления в них туморотропного радиофармпрепарата; затем применяют модифицированную качественную визуальную методику оценки сцинтиграмм, в которой используют систему, основанную на выделении 3-х моделей узловых образований в зависимости от показателей поглощения ими Tc-пертехнетата и Tc-технетрила: Модель 1 - поглощение Tc-технетрила ниже поглощения Tc-пертехнетата; Модель 2 - поглощение Tc-технетрила выше поглощения Tc-пертехнетата в раннюю фазу сканирования; поглощение Tc-технетрила в раннюю фазу сканирования выше поглощения Tc-технетрила в позднюю фазу; Модель 3 - поглощение Tc-технетрила выше поглощения Tc-пертехнетата в раннюю фазу сканирования; поглощение Tc-технетрила в раннюю фазу сканирования ниже или равно поглощению Tc-технетрила в позднюю фазу; узловые образования, расцененные первично как «горячие», а также соответствующие 1-ой и 2-ой моделям, расценивают как доброкачественные; Модель 3 характеризуют наличием признаков злокачественного роста; далее с целью повышения показателей информативности динамической двухиндикаторной сцинтиграфии щитовидной железы применяют оригинальную методику полуколичественного анализа, основанную на оценке индекса вымывания или «ИВ» Tc-технетрила в раннюю и позднюю фазы сканирования, для чего на ранних сцинтиграммах осуществляют построение области интересов или «ОИ» вокруг узловых образований и ее проекции за пределами щитовидной железы в надключичной области с целью вычитания области фонового поглощения или «ОФП» радиофармпрепарата; указанные ОИ и ОФП копируют на отсроченные сцинтиграммы; для расчета ИВ используют средние показатели захвата Tc-технетрила в ОИ и в ОФП, указанные в числовом эквиваленте; таким образом, ИВ рассчитывают как отношению среднего захвата РФП с учетом вычитания его фонового поглощения в узловых образованиях в позднюю и раннюю фазы сканирования, выраженному в процентах; формула для расчета ИВ представляют следующим образом: среднее поглощение Tc-технетрила в ОИ в раннюю фазу сканирования - среднее поглощение Tc-технетрила в ОФП в раннюю фазу сканировании = ранний результат или «РР»; среднее поглощение Tc-технетрила в ОИ в позднюю фазу сканирования - среднее поглощение Tc-технетрила в ОФП в позднюю фазу сканировании = поздний результат или «ПР»; ИВ=100-ПР/РР×100; используя данную методику, предполагают, что узловые образования с ИВ радиофармпрепарата более 20% соответствуют доброкачественной опухоли, а менее 20% - злокачественной; в первом случае больному обосновывают удаление доли щитовидной железы, во втором - выполнение гемитиреоидэктомии или тиреоидэктомии.