Результат интеллектуальной деятельности: Производные изоксазола, обладающие антиагрегационной активностью
Вид РИД
Изобретение
Изобретение относится к области биоорганической и медицинской химии и фармакологии и может быть использовано для разработки новых противоагрегационных лекарственных средств.
Наличие большого количества побочных эффектов у известных, применяемых в настоящее время антиагрегационных средств [M.N.D. Di Minno, A. Guida, М. Camera, et. al. Overcoming limitations of current antiplatelet drugs: A concerted effort for more profitable strategies of intervention. Annals of Medicine, 2011; v. 43, 531-544], а также недостаточная эффективность многих из них [Г.А. Березовская. Апоптоз тромбоцитов: причины недостаточной эффективности антитромбоцитарных препаратов. Бюллетень СО РАМН, т. 32, №4, 2012, 17-27; Bath P.M., May J., Heptinstall S. Clinical utility of remote platelet function measurement using P-selectin: assessment of aspirin, clopidogrel, and prasugrel and bleeding disorders. Platelets, 2018, v. 29, №5, 425-430] стимулируют поиск новых химических соединений, обладающих способностью предотвращать образование тромбоцитарных агрегатов, как основы для создания эффективных антиагрегационных лекарственных препаратов нового поколения.
Несмотря на использование известных лекарственных антиагрегационных препаратов, таких, как: аспирин, кетопрофен, дипиридамол, индометацин и др., предотвращающих образование тромбоксана А2 через ингибирование первого фермента каскада арахидоновой кислоты - циклооксигеназы, разработка новых антиагрегационных средств различной химической природы, среди которых более 70% составляют гетероциклические соединения, интенсивно ведется лабораториями ведущих зарубежных фармацевтических компаний и фирм [Michelson A.D. 2007. Platelets. 2nd Ed., Amsterdam-N.Y.-London: Academic Press, Elsevier. 1334 p.; Kontogiorgis C. et al. Cur. Med Chem., 2010, v. 17, 3162-3214; Fan H., Chem S. et al. Structural basis for ligand recognition of the human thromboxane A2 receptor. Nature Chem. Biol., 2019, v. 15, 27-33].
Производные 4,5-дигидроизоксазолов обладают широким спектром биологических активностей: 3,5-замещенные 4,5-дигидроизоксазолы обладают противоревматической активностью, могут использоваться для лечения заболеваний иммунной системы и пролиферативных нарушений [WO 0021959 А1, опубл. 20.04.2000] и онкологических заболеваний [Kaur K., Kumar V., Sharma А.K., Gupta G.K.. Isoxazoline containing natural products as anticancer agents: A review. Eur. J. Med. Chem., 2014, v. 77, 121-133]. 3,5-Замещенные изоксазолы и 4,5-дигидроизоксазолы, содержащие в положении 3 тетрагидропиридиновый фрагмент, являются агонистами M1 мускариновых ацетилхолиновых рецепторов [Huang М., Suk D.-H. et al. Synthesis and biological evaluation of isoxazoline derivatives as potent M1 muscarinic acetylcholine receptor agonists. Bioorg. Med. Chem. Letters, 2015, v. 25, 1546-1551], а также ингибиторами никотинамидофосфорибозилтрансферазы [WO 2016/012958 A1, опубл. 28.01.2016]. Однако эти вещества, как и промежуточные 3,5-замещенные 4,5-дигидроизоксазолы, содержащие пиридильный фрагмент в положении 3, не исследованы на наличие антиагрегационной активности.
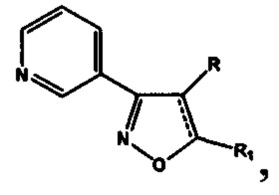
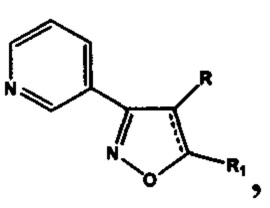
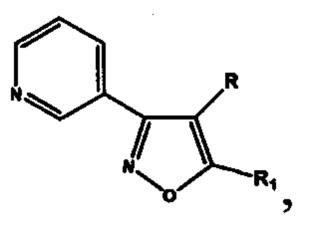
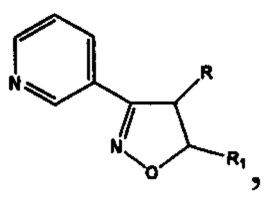
Анализ литературных данных, а также многолетние исследования авторов в этом направлении показывают, что фармакофорным фрагментом, ответственным за проявление антиагрегантной активности, является замещенный изоксазол, содержащий в положении 3 изоксазольного кольца 2-, 3- или 4-пиридиновые фрагменты. Авторами установлено, что ряд соединений этого класса, являющихся потенциальными антагонистами рецептора тромбоксана А2, обладают наибольшей антиагрегационной активностью при наличии 3-пиридильного фрагмента [Демина О.В. и др. Изв. АН. Сер. Химическая, 2014, №9, 2092-2113], а также показано, что 5-замещенные 3-(3-пиридил)изоксазолы и 3-(3-пиридил)-4,5-дигидроизоксазолы (структура I) обладают антиагрегационной активностью [RU №2565754 С2].
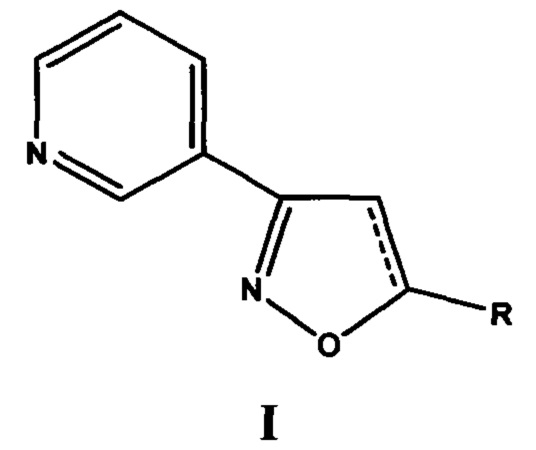
Анализ взаимосвязи структура - антиагрегационная активность показывает, что антиагрегационная активность зависит от химической природы заместителя R в положении 5 изоксазольного или 4,5-дигидроизоксазольного цикла [Демина О.В. и др. 3-Пиридилизоксазолы - прототипы антиагрегационных средств. Изв. АН. Сер. Химическая, 2018, №5, 866-877]. В статье [Gutierrez, М., Amigo, et al.. Synthetic isoxazole as antiplatelet agent. Platelets, 2014, 25(4), 234-238] приведена антиагрегационная активность серии производных изоксазола, включающая, в том числе, и соединения структуры I, однако, даже наиболее активное из соединений - 3-(3-пиридил)-5-(циклогекс-1-енил)изоксазол подавляет агрегацию тромбоцитов человека, инициированную аденозиндифосфатом или коллагеном, с IC50, составляющей 3×10-3 моль×л-1 или 3,7 10-3 моль×л-1 соответственно, что не укладывается в диапазон фармакологически допустимых концентраций, составляющий 1×10-6-1×10-3 моль×л-1 [P.V. Vrzheshch, О.V. Demina et al. Supercooperativity in platelet aggregation: substituted pyridyl-isoxazoles, a new class of supercooperative platelet aggregation inhibitors. FEBS Lett., 1994, v. 351, 168-170]. Приведенные в работе данные по антиагрегационной активности подтверждают экспериментальные данные авторов настоящего изобретения, что 3-(3-пиридил-5-фенилизоксазол и его 2- и 4-пиридильные аналоги не подавляют первую волну агрегации, вызванную аденозиндифосфатом, в концентрациях до 1×10-3 моль×л-1 [Демина О.В. и др. Изв. АН. Сер. Химическая, 2014, №9, 2092-2113].
В патенте на изобретение [RU 2088229 С1, опубл. 27.08.1997] и в публикации [О.В. Демина и др. Синтез новых 3,5-замещенных изоксазолов с потенциальной антиагрегационной активностью. Вестник МИТХТ, 2010, т. 5, №6, 47-51] описаны 3-(3-пиридил)-5-фенилизоксазол и 5-н-гексил-3-(3-пиридил)изоксазол, обладающие антиагрегационной активностью в концентрациях 5×10-6 - 2×10-4 моль×л-1, что сопоставимо с экспериментально определенной авторами активностью индометацина (5×10-6 - 2,5×10-5 моль×л-1).
Серия 5-н-алкил-3-(3-пиридил)изоксазолов и 4,5-дигидроизоксазолов структуры I с длиной алкильного радикала от 1 до 16 углеродных атомов, описанная в патенте на изобретение [RU 2565754 С2, опубл. 20.10.2015], принята за прототип. Все описанные соединения обладают антиагрегационной активностью в фармакологически допустимом диапазоне концентраций 1×10-6 - 1×10-3 моль×л-1. Наибольшей антиагрегационной активностью в этой серии обладают 5-н-пентил- и 5-н-гексил-3-(3-пиридил)изоксазолы [О.В. Демина, Н.Е. Беликов, С.Д. Варфоломеев, А.А. Ходонов. 3-Пиридилизоксазолы - прототипы антиагрегационных средств. Известия АН. Сер. Химическая, 2018, №5, 866-877]. Анализ взаимосвязи структура - антигрегационные свойства свидетельствует о наличии пространственных ограничений для заместителей в положении 5 изоксазольного кольца.
Проблема, решаемая настоящим изобретением, состоит в необходимости расширения арсенала химических соединений, обладающих антиагрегационной активностью.
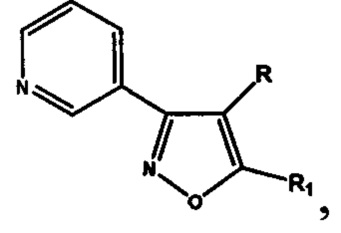
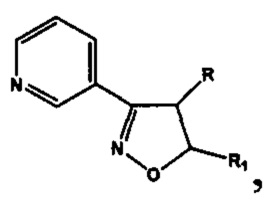
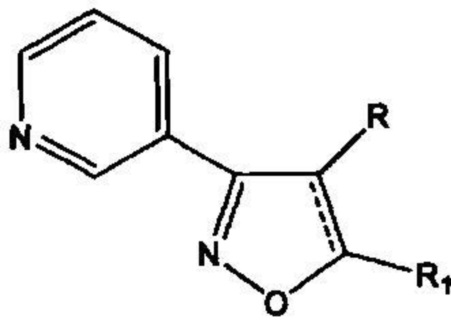
Проблема решена предлагаемой серией замещенных 4,5-дигидроизоксазолов и изоксазолов, обладающих антиагрегационной активностью, отвечающих общей формуле II
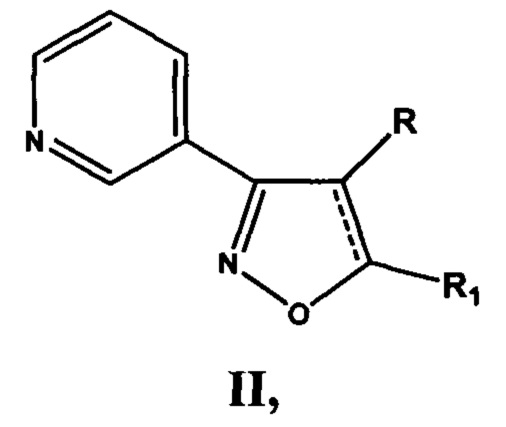
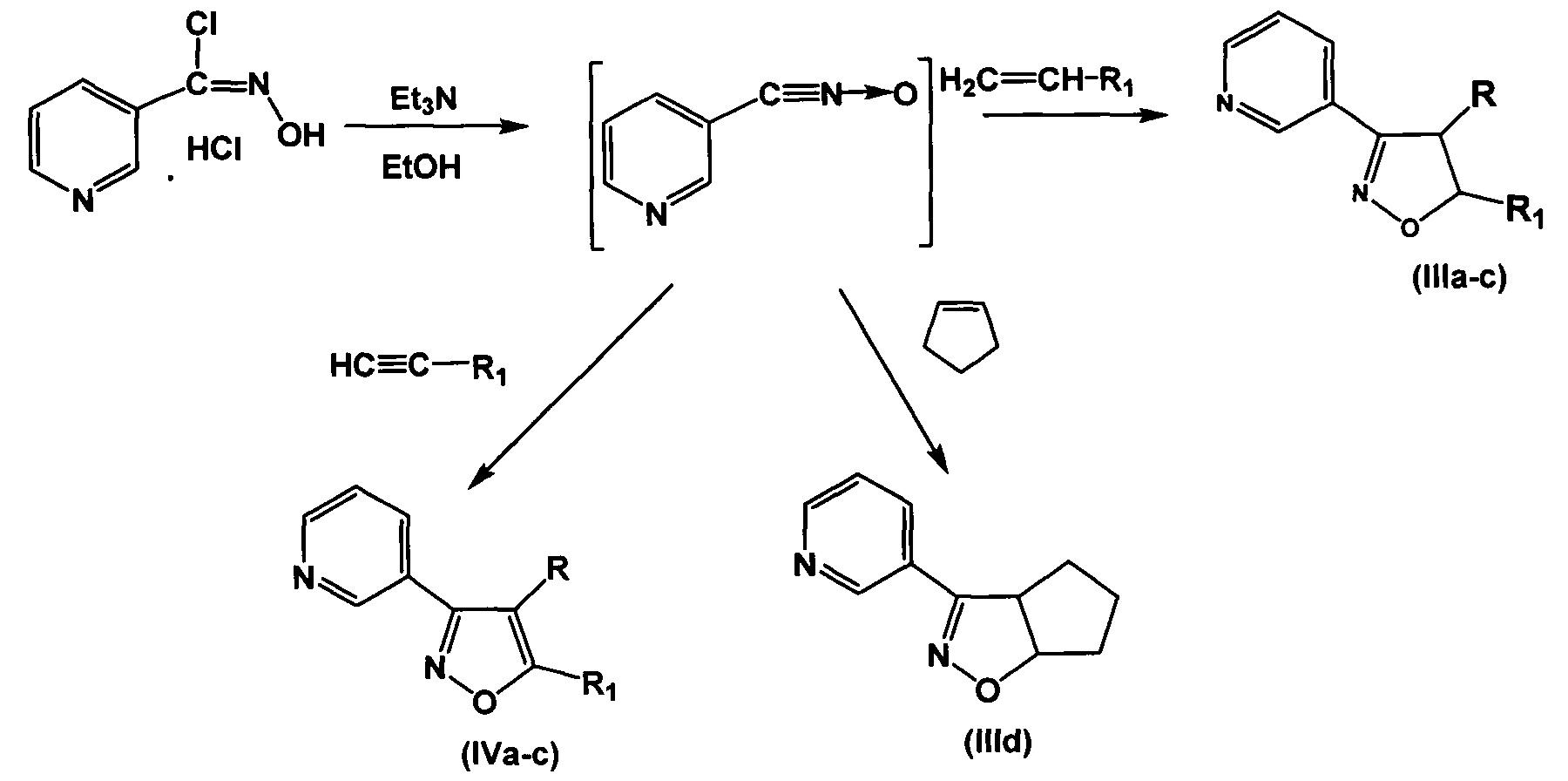
включающей производные 3-(3-пиридил)-4,5-дигидроизоксазола III
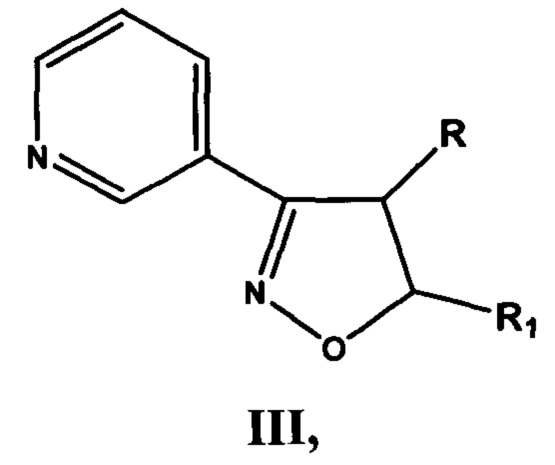
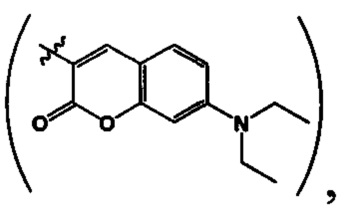
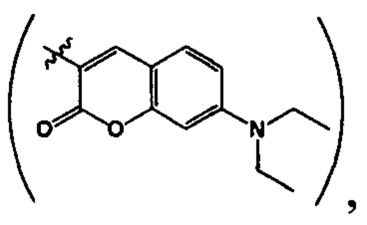
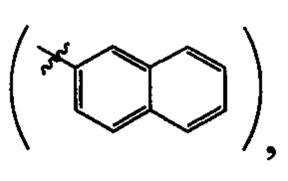
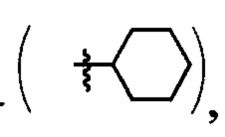
где R=Н, a R1=3-метилбутил- (-СН2СН2СН(СН3)СН3) (IIIa), или 2-нафтил-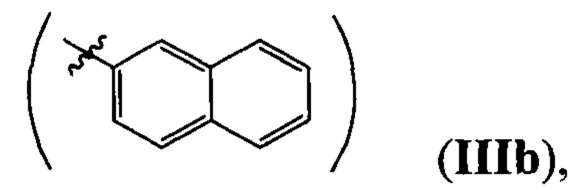 или 7-(N,N-диэтиламино)-2-оксо-2H-1-бензопиран-3-ил-
или 7-(N,N-диэтиламино)-2-оксо-2H-1-бензопиран-3-ил- или R+R1=4,5-триметилен (-СН2СН2СН2-) IIId);
или R+R1=4,5-триметилен (-СН2СН2СН2-) IIId);
и производные 3-(3-пиридил)изоксазола IV
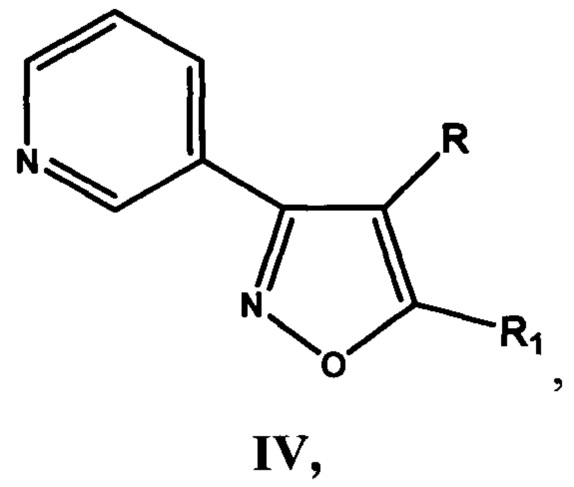
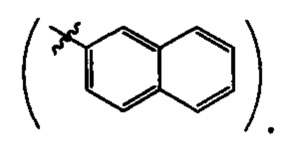
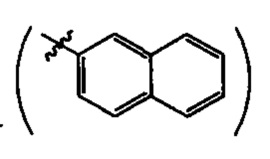
где R=Н, a R1 = циклопропил 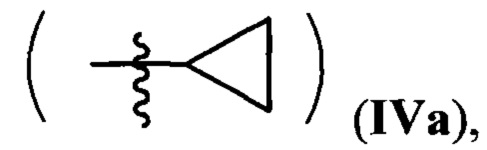 или циклогексил
или циклогексил  или 2-нафтил
или 2-нафтил 
Далее по тексту термины «вещества (соединения), обладающие антиагрегационной активностью» и «ингибиторы агрегации тромбоцитов» использованы как синонимы.
Соединения получают, как показано на схеме, с применением реакции [3+2]-циклоприсоединения нитрилоксидов к терминальным или циклическим алкенам или алкинам по Хьюзгену, модифицированной, как описано в работе [О.В. Демина, А.А. Ходонов, Е.И. Синауридзе, В.И. Швец, С.Д. Варфоломеев. Замещенные пиридилизоксазолы - эффективные ингибиторы агрегации тромбоцитов, Изв. АН. Сер. Химическая, 2014, №9, 2092-2113], позволяющей получать целевые соединения региоселективно.
Сущность изобретения поясняется рисунками на Фиг. 1-3:
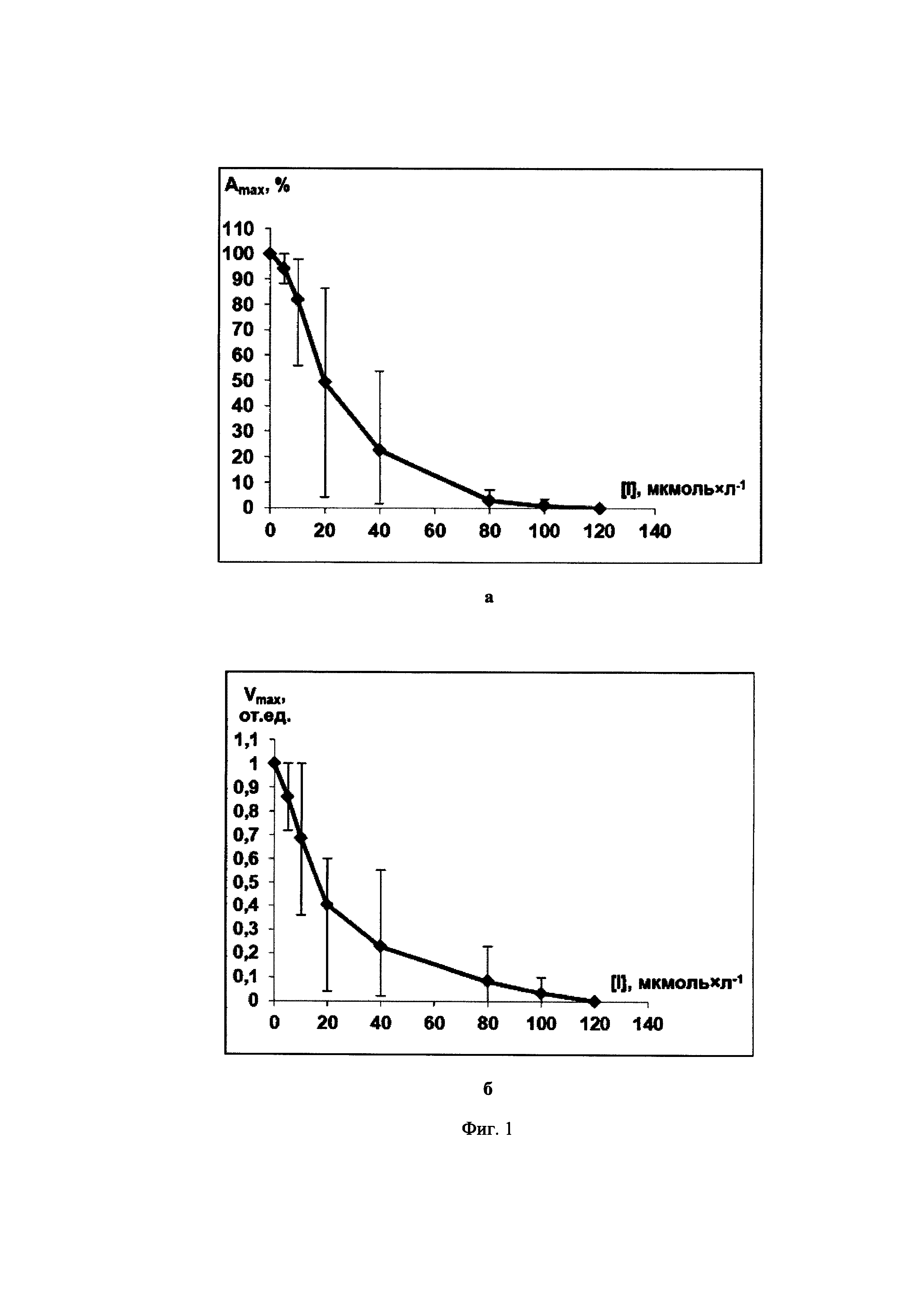
Фиг. 1. Зависимости максимальной степени агрегации Amax (Фиг. 1а) и максимальной скорости агрегации Vmax (Фиг. 1б) тромбоцитов от концентрации ингибитора 5-(2-нафтил)-3-(3-пиридил)-4,5-дигидроизоксазола (IIIb), полученные на основании экспериментальных данных с использованием трех образцов суспензий тромбоцитов человека от трех доноров при использовании арахидоновой кислоты (300 мкмоль×л-1) в качестве индуктора агрегации.
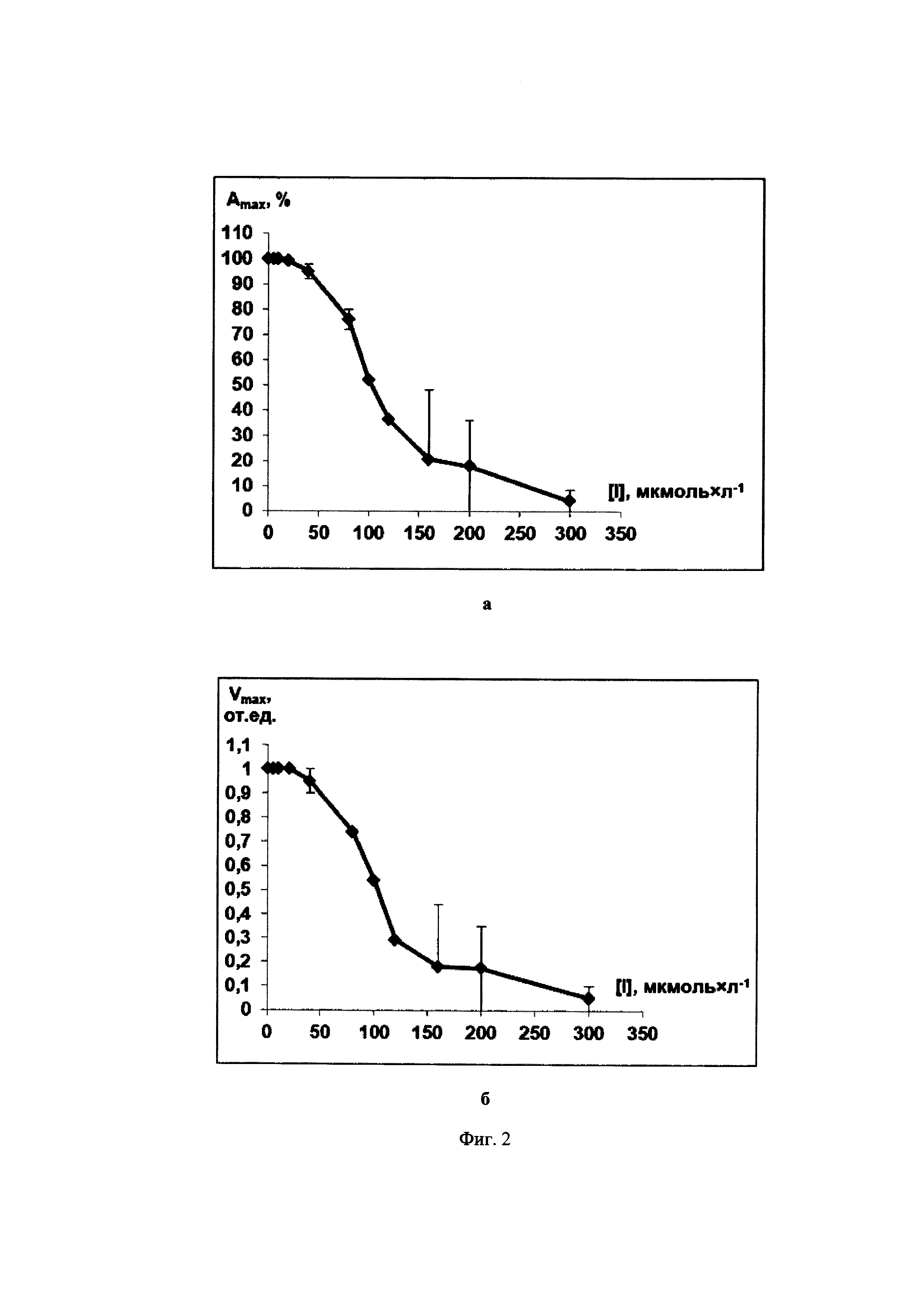
Фиг. 2. Зависимости максимальной степени агрегации Amax (Фиг. 2а) и максимальной скорости агрегации Vmax (Фиг. 2б) тромбоцитов от концентрации ингибитора 5-(2-нафтил)-3-(3-пиридил)изоксазола (IVc), полученные на основании экспериментальных данных с использованием двух образцов суспензий тромбоцитов человека от двух доноров, при использовании арахидоновой кислоты (300 мкмоль×л-1) как индуктора агрегации.
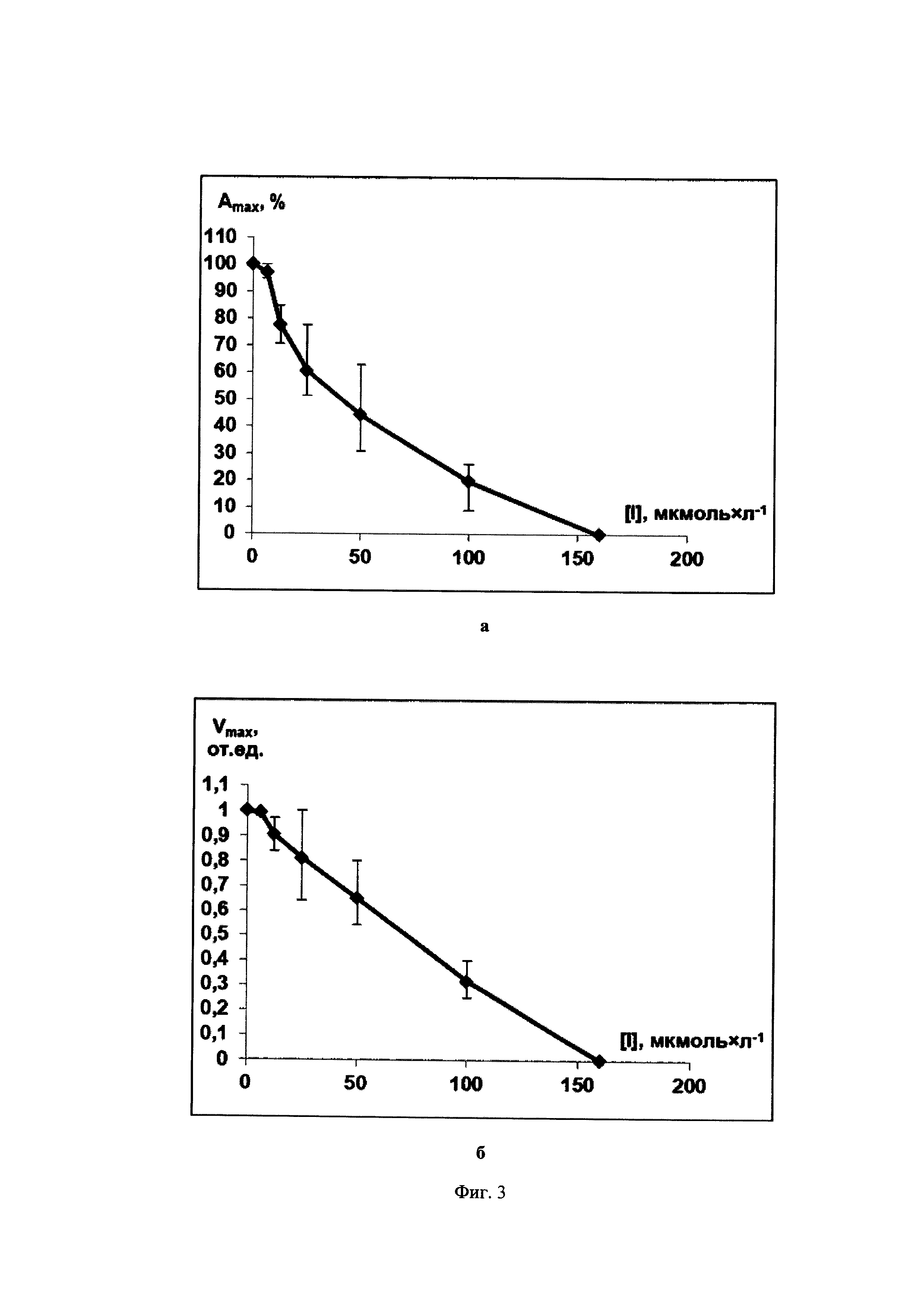
Фиг. 3. Зависимости максимальной степени агрегации Amax (Фиг. 3а) и максимальной скорости агрегации Vmax (Фиг. 3б) тромбоцитов от концентрации ингибитора 3-(3-пиридил)-4,5-триметилен-4,5-дигидроизоксазола (IIId), полученные на основании экспериментальных данных с использованием трех образцов суспензий тромбоцитов человека от трех доноров, при использовании арахидоновой кислоты (300 мкмоль×л-1) как индуктора агрегации.
Получение исходных веществ и целевых продуктов описано ниже. Структуры полученных веществ подтверждены 1Н-ЯМР спектроскопией и масс-спектрометрией, а также элементным анализом. Спектры 1Н-ЯМР регистрировали в дейтерохлороформе на спектрометре Avance III с рабочей частотой 500 Мгц (Bruker, Германия), в качестве внутреннего стандарта использовали тетраметилсилан. Масс-спектры регистрировали на масс-спектрометре Finnigan MAT INCOS-50 (Thermo Electron Inc., США) при прямом вводе образца, с энергией ионизации 70 эВ, токе эмиссии 1.5 мА и температурном диапазоне 70±25°С. Температуры плавления соединений определены на столике Коффлера с точностью 1-2°С.
Получение исходных соединений.
Получение гидрохлорида 3-пиридилгидроксимоилхлорида.
В раствор 6,32 г (0,052 моля) коммерчески доступного 3-пиридинальдоксима в 150 мл свежеперегнанного дихлорометана при перемешивании при температуре от -15°С до - 10°С пропускают сильный ток сухого хлора в течение 3 ч до появления устойчивой желто-зеленой окраски реакционной массы с выпадением осадка гидрохлорида 3-пиридилгидроксимоилхлорида. Затем реакционную массу разбавляют 250 мл сухого эфира, осадок отделяют на фильтре, промывают сухим диэтиловым эфиром 3 раза по 100 мл, сушат при 0,01 мм рт. ст.
Выход: 9,5 г (0,049 моля, 95%), т.пл. 192-193°С.
1Н-ЯМР спектр (δ, ДМСО-d6): 7,98 (1Н; дд; J 8,2, 5,0; 5-Н(Ру)); 8.70 (1Н; ддд; J 8,2, 2,0, 1,2; 4-Н(Ру)); 8,94 (1Н; дд; J 5,0, 1,2; 6-Н(Ру)); 9.10 (Ш; д; J 2,0; 2-Н(Ру)); 9,64 (1H; сш; N-H); 13,26 (1H; сш; =N-OH).
Найдено %: С 36,95; Н 2,98; N 13,72; Cl 35,87. C6H6N2Cl2O. Вычислено %: С 37,33; Н 3,13; N 14,51; Cl 36,73.
Получение 3-винил-(7-(N,N-диэтиламино)-2H-хромен-2-она.
3-Винил-(7-(N,N-диэтиламино)-2Н-хромен-2-он синтезируют согласно двухстадийной процедуре: ацилирование 2-гидрокси-4-(N,N-диэтиламино)бензальдегида винилуксусной кислотой в присутствии системы N,N-дициклогексилкарбодиимид / 4-(диметиламино)пиридин с последующей циклизацией „под действием карбоната цезия, как описано в работе [Gordo J., Avo J., Parola A.J., Lima J.C., Pereira A., Branco P.S. Convenient synthesis of 3-vinyl and 3-styryl coumarins. Org. Lett., 2011, v. 13, pp. 5112-5115]. Выход: 65%, т.пл. 99-100°C.
1H-ЯМР спектр (δ, CDCl3): 1,18 (6Н; т; J=7,1; -N(CH2CH3)2); 3,38 (4Н; кв; J=7,1, -N(CH2CH3)2); 5,27 (1Н; д; J=11,2; СН2-винил); 5,99 (1Н; дд; J=17,5, J=1,4; CH2-винил); 6,46 (1H; д; J=2,3; 8-Н); 6,55 (1H; д; J=8,9; 6-Н); 6,64 (1Н; дд; J=11,6, J=17,3; СН-винил); 7,23 (1H; м; 5-H); 7,55 (1Н; д; J=3,3; 4-Н).
Масс-спектр (m/z): 243 (М+).
Получение целевых соединений
Пример 1. Получение 5-(3-метилбутил)-3-(3-пиридил)-4,5-дигидроизоксазола (IIIa)
К перемешиваемому раствору 1,0 г (5,2 ммоля) гидрохлорида 3-пиридилгидроксимоилхлорида и 1,50 г (15,6 ммоля) коммерчески доступного 5-метил-1-гексена в 60 мл сухого этанола по каплям при 0°÷5°С прибавляют раствор 1,05 г (10,4 ммоля) триэтиламина в 20 мл сухого этанола. Мониторинг реакции проводят при помощи ТСХ. Реакционную массу выдерживают 48 ч при 20°С, затем растворитель удаляют в вакууме. Полученный остаток суспендируют в 40 мл сухого эфира, выпавший осадок гидрохлорида триэтиламина отделяют фильтрованием, промывают сухим эфиром (3 раза по 10 мл). Объединенный фильтрат упаривают, полученный остаток разделяют при помощи колоночной хроматографии с использованием в качестве элюента системы хлористый метилен - этанол с градиентом этанола от 0 до 4%, с получением нескольких фракций, содержащих продукт и примеси. Индивидуальный продукт получают очисткой на ВЭЖХ хроматографе Smart Line 1000 (Knauer, Германия) (колонка Eurospher 100-10Si 20×250 мм (Knauer), скорость потока 7 мл/мин при длине волны детектирования λ 254 нм, элюент 2% EtOH в CH2Cl2).
Выход 68%, масло.
Найдено %: С 70,89; Н 7,98; N 12,5. C13H18N2O. Вычислено %: С 71,53; Н 8,31; N 12,83.
Пример 2. Получение 5-(2-нафтил)-3-(3-пиридил)-4,5-дигидроизоксазола (IIIb)
Соединение получают аналогично примеру 1 из гидрохлорида 3-пиридилгидроксимоилхлорида, используя вместо 5-метил-1-гексена коммерчески доступный 2-винилнафталин. Выход 27%, белые кристаллы, т.пл. 118-120°С.
Найдено %: С 78,35; Н 4,97; N 10,01. C18H14N2O. Вычислено %: С 78,81; Н 5,14; N 10,21.
Пример 3. Получение 5-(7-(N,N-диэтиламино)-2-оксо-2Н-1-бензопиран-3-ил)-3-(3-пиридил)-4,5-дигидроизоксазола) (IIIc)
Соединение получают аналогично примеру 1 из гидрохлорида 3-пиридилгидроксимоилхлорида, используя вместо 5-метил-1-гексена 3-винил-7-(N,N-диэтиламино)-2Н-хромен-2-он.
Выход 70,3%, масло.
Найдено %: С 68,96; Н 5,31; N 10,97. C21H21N3O3. Вычислено %: С 69,41; Н 5,82; N 11,56.
Пример 4. Получение 3-(3-пиридил)-4,5-триметилен-4,5-дигидроизоксазола (IIId)
Соединение получают аналогично примеру 1 из гидрохлорида 3-пиридилгидроксимоилхлорида, используя вместо 5-метил-1-гексена коммерчески доступный циклопентен.
Выход 66,7%, масло.
Найдено %: С 69,95; Н 6,21; N 14,45. C11H12N2O. Вычислено %: С 70,19; Н 6,43; N 14,88.
Пример 5. Получение 3-(3-пиридил)-5-циклопропилизоксазола (IVa)
Соединение получают аналогично примеру 1 из гидрохлорида 3-пиридилгидроксимоилхлорида, используя вместо 5-метил-1-гексена коммерчески доступный циклопропилацетилен.
Выход 27%, масло.
Найдено %: С 70,41; Н 5,12; N 14,97. C11H10N2O. Вычислено %: С 70,95; Н 5,41; N 15,04.
Пример 6. Получение 3-(3-пиридил)-5-циклогексилизоксазола (IVb)
Соединение получают аналогично примеру 1 из гидрохлорида 3-пиридилгидроксимоилхлорида, используя вместо циклопропилацетилена коммерчески доступный циклогексилацетилен.
Выход 17%, масло.
Найдено %: С 73,11; Н 6,89; N 11,97. C14H16N2O. Вычислено %: С 73,66; Н 7,06; N 12,27.
Пример 7. Получение 5-(2-нафтил)-3-(3-пиридил)изоксазола (IVc)
Соединение получают из 5-(2-нафтил)-3-(3-пиридил)-4,5-дигидроизоксазола (IIIb), синтезированного по примеру 5, путем ароматизации 4,5-дигидроизоксазольного кольца под действием активного MnO2. В круглодонную колбу помещают 0,3 г (1,1 ммоля) 5-(2-нафтил)-3-(3-пиридил)-4,5-дигидроизоксазола, добавляют 30 мл CH2Cl2 и 0,5 г активного MnO2. Реакция протекает 48-72 ч с перемешиванием при комнатной температуре, затем реакционную смесь фильтруют для удаления MnO2, фильтрат упаривают, остаток разделяют на колонке с силикагелем. Индивидуальный продукт выделяют при помощи колоночной хроматографии на силикагеле.
Выход 77%, белые кристаллы, т.пл. 129-131°С.
Найдено %: С 78,95; Н 4,31; N 9,98. C18H12N2O. Вычислено %: С 79,39; Н 4,44; N 10,29.
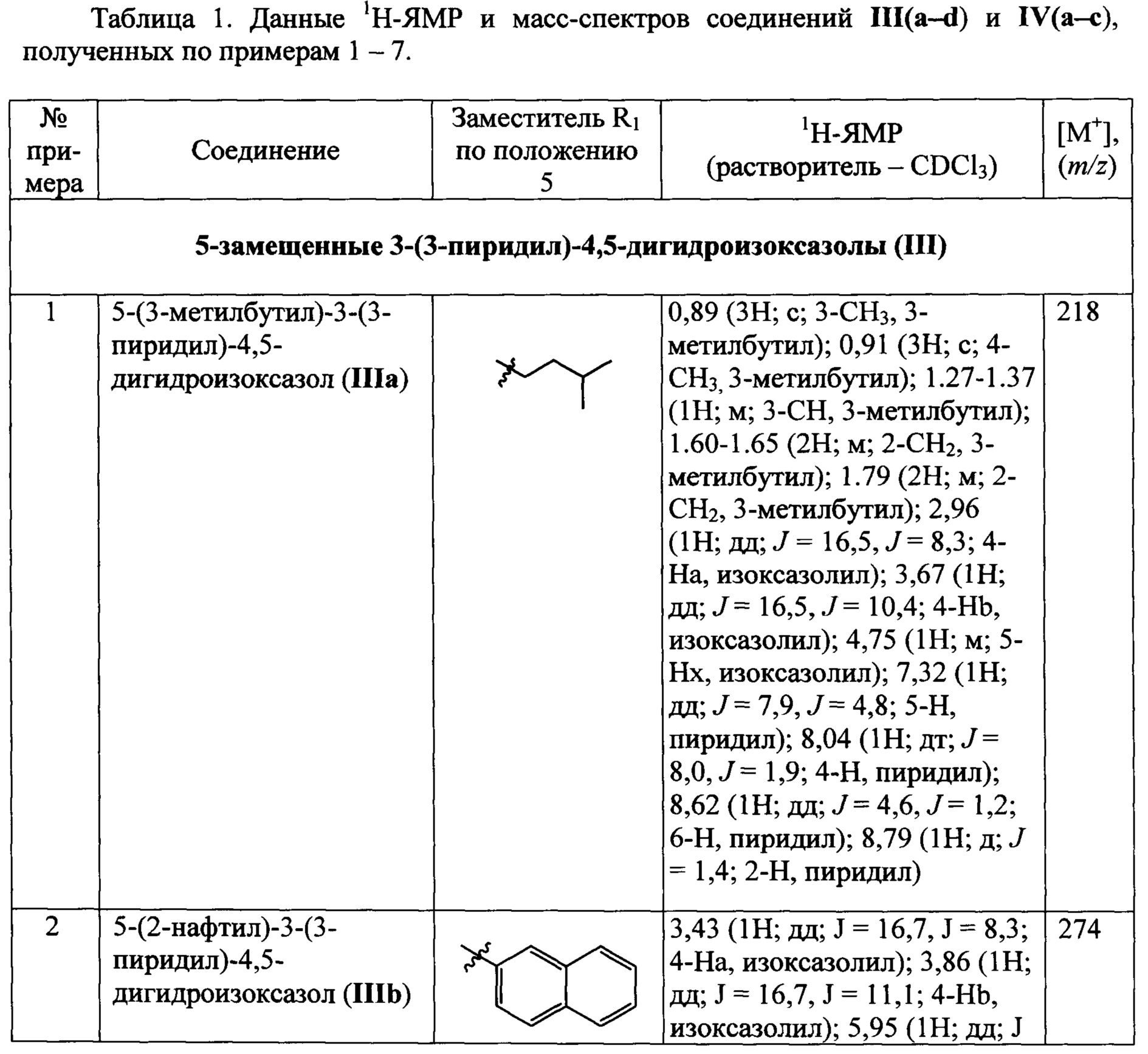
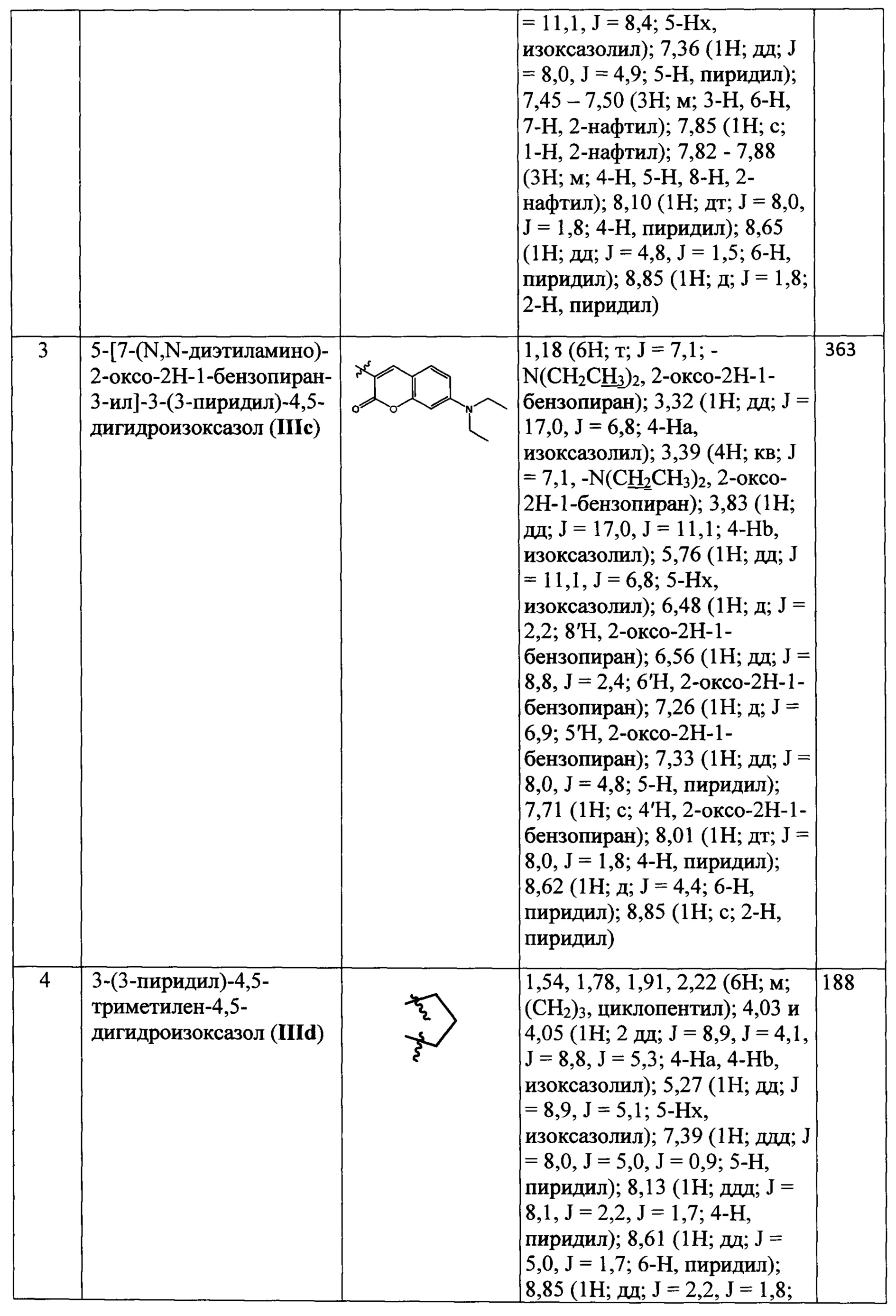
Данные 1Н-ЯМР и масс-спектров соединений III(a-d) и IV(a-c), полученных по примерам 1-7, приведены в Табл. 1

Определение антиагрегационной активности проводят турбодиметрическим методом по Борну [Flower R.J. Of platelets and aggregometers: personal reminiscences of Gus Born (1921-2018). Platelets, 2018, v. 29, №8, 749-755], непрерывно регистрируя изменение светопропускания в суспензиях отмытых тромбоцитов в течение 6 мин, при использовании арахидоновой кислоты в качестве индуктора агрегации, как описано в работе [Демина О.В. и др. 3-Пиридилизоксазолы - прототипы антиагрегационных средств. Изв. АН. Сер. Химическая, 2018, №5, 866-877]. Количественной характеристикой антиагрегационной активности соединений служит величина IC50 - концентрация соединения, вызывающая 50%-ное ингибирование агрегации тромбоцитов. Дополнительно соединения охарактеризованы величиной IC100 - концентрацией, вызывающей 100%-ное ингибирование агрегации тромбоцитов.
Пример 8. Определение антиагрегационной активности заявляемых соединений III(a-d) и IV(a-c)
Суспензию отмытых тромбоцитов получают, используя в качестве антикоагулянта 3,8%-ный цитрат натрия (рН 7,4) с добавлением простагландина E1 (1 мкмоль×мл-1) и апиразы (0,1 ед.×мл-1). Кровь доноров-добровольцев центрифугируют при комнатной температуре в течение 12 мин при 100g на центрифуге Hettich Universal 320R centrifuge (Andreas Hettich GmbH& Co. KG, Германия), затем, отобрав слой обогащенной тромбоцитами плазмы, добавляют к нему 3,8%-ный раствор цитрата натрия (рН 6,0) в соотношении плазма : цитрат 3:1. Тромбоциты осаждают в течение 5 мин при 400g и комнатной температуре на той же центрифуге, удаляют бедную тромбоцитами плазму, затем тромбоциты ресуспендируют в 1,4 мл 3,8%-ного цитрата натрия (рН 6,0), повторно осаждают при 400g в течение 5 мин и после удаления супернатанта ресуспендируют в буфере А, содержащем 20 мМ HEPES, 150 мМ NaCl, 2,7 мМ KCl, 1 мМ MgCl2, 0,4 мМ NaH2PO4, 5 мМ глюкозы, 0.5% бычьего сывороточного альбумина (рН 7,4). После измерения исходной концентрации тромбоцитов образец разбавляют буфером А до концентрации 200000 клеток×мкл-1.
Для тестирования каждого соединения на антиагрегационную активность используют 3 и более образцов суспензий отмытых тромбоцитов, полученных от разных доноров.
Калибровку лазерного агрегометра «Биола» LA-230 (Россия) перед тестированием проводят с использованием суспензии отмытых тромбоцитов и буфера А согласно инструкции по работе с прибором.
При тестировании в кювету прибора помещают суспензию отмытых тромбоцитов (242 мкл), инкубируют ее при 37°С в течение 2 мин без добавления тестируемого соединения ([I]=0), затем добавляют индуктор агрегации - арахидоновую кислоту (конечная концентрация в кювете составляет 300 мкмоль×л-1 для суспензий) и фибриноген (конечная концентрация в кювете составляет 0,46÷0,54 мг/мл). Агрегатограммы регистрируют в течение 6 мин при постоянном перемешивании (1000 об/мин) после добавления индуктора агрегации. Общий объем содержимого кюветы составляет 250 мкл для всех агрегатограмм. Затем, в следующей кювете тестируемое соединение (в диапазоне концентраций от 0 до 1000 мкмоль×мл-1) добавляют в кювету после внесения суспензии отмытых тромбоцитов, инкубируют в течение 2-3 мин, добавляют арахидоновую кислоту и фибриноген в концентрациях, указанных выше, и регистрируют агрегатограмму. Количество агрегатограмм в эксперименте варьируется от 7 до 16. По каждой агрегатограмме определяют два параметра - максимальную скорость агрегации Vmax и максимальную степень агрегации Amax, по которым строят зависимости Amax и Vmax от концентрации ингибитора [I], из которых определяют значения IC50 и IC100, характеризующие антиагрегационную активность соединений.
В качестве примера на Фиг. 1-3 показаны зависимости [Amax; [I]] и [Vmax; [I]] для соединений 5-(2-нафтил)-3-(3-пиридил)-4,5-дигидроизоксазол (IIIb), 3-(3-пиридил)-4,5-триметилен-4,5-дигидроизоксазол (IIId) и 5-(2-нафтил)-3-(3-пиридил)изоксазол (IVc). Аналогичные экспериментальные кривые получены для всех заявляемых соединений.
Результаты определения антиагрегационной активности заявляемых соединений приведены в Таблице 2 в виде средних значений IC50 и IC100, полученных по данным трех и более измерений.

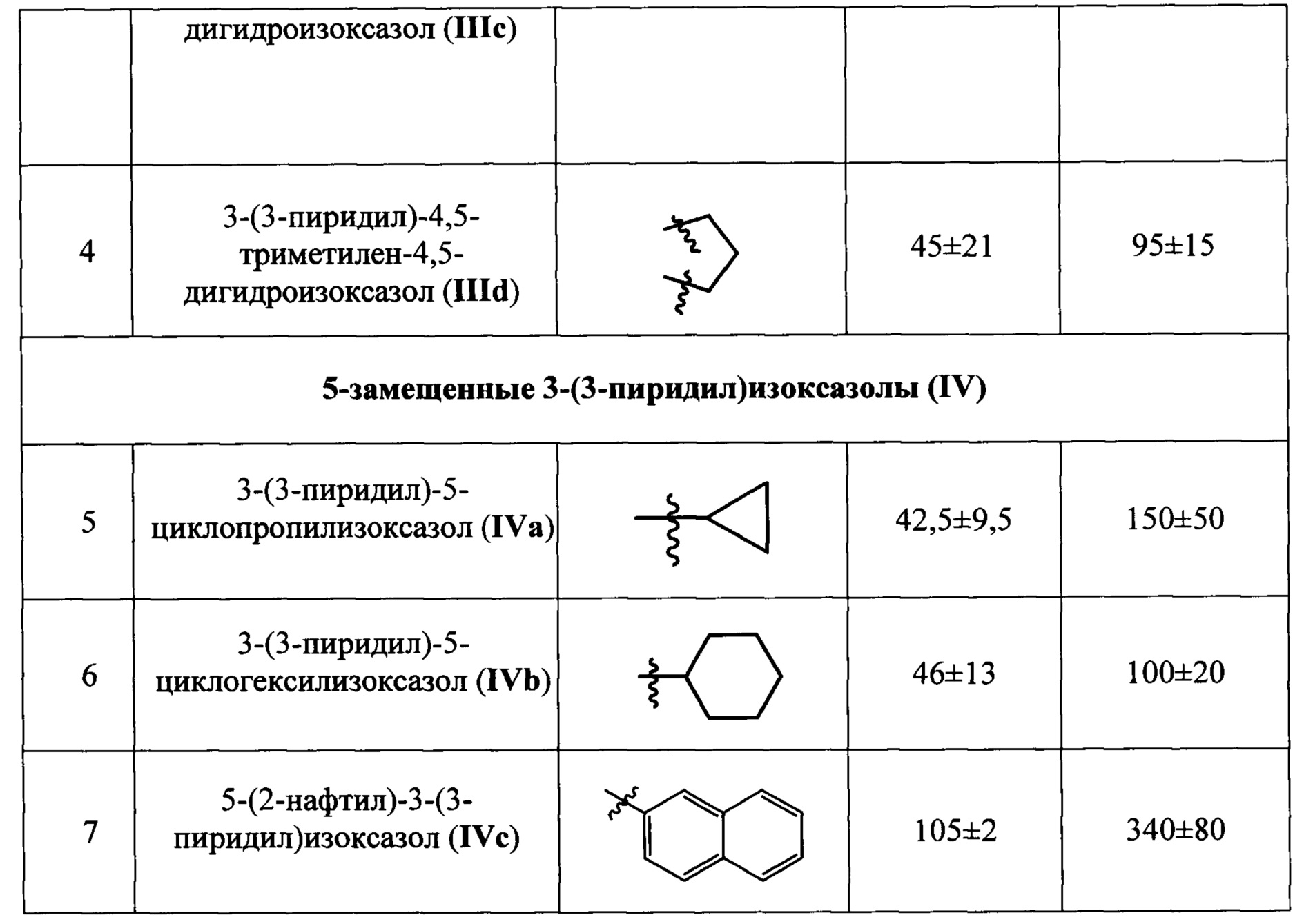
Данные Таблицы 2 показывают, что все заявленные соединения проявляют выраженную антиагрегационную активность. Наибольшую активность проявляет 5-(2-нафтил)-3-(3-пиридил)-4,5-дигидроизоксазол (IIIb), который в 6 раз активнее изоксазольного аналога (IVc) и практически равен по антиагрегационной активности прототипу - 5-н-гексил-3-(3-пиридил)изоксазолу (IC50=6,5-25 мкмоль×л-1).
С учетом разбросов, обусловленных индивидуальными особенностями образцов тромбоцитов, полученных от разных доноров, диапазоны значений IC50 и IC100 для заявленных 5-замещенных 4,5-дигидроизоксазолов и изоксазолов составляют 8×10-6 - 2,4×10-4 моль×л-1 и 4×10-5 - 4,2×10-4 моль×л-1 соответственно, то есть находятся в фармакологически допустимом диапазоне концентраций 1×10-6 - 1×10-3 моль×л-1, что позволяет рассматривать их в качестве перспективных действующих веществ для создания новых антиагрегационных лекарственных препаратов.
Таким образом, предложена серия производных изоксазола, расширяющих арсенал химических соединений, обладающих антиагрегационной активностью и расширяющих базу для отбора перспективных соединений в качестве действующих веществ для создания новых антиагрегационных лекарственных препаратов.