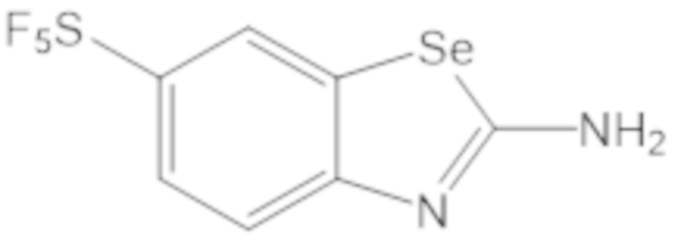
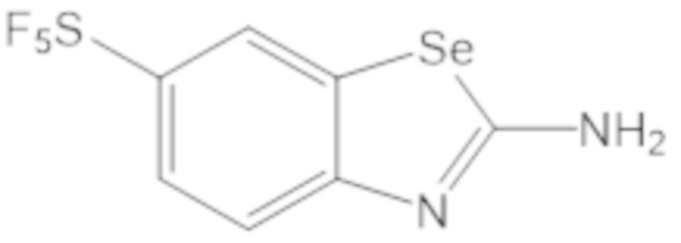
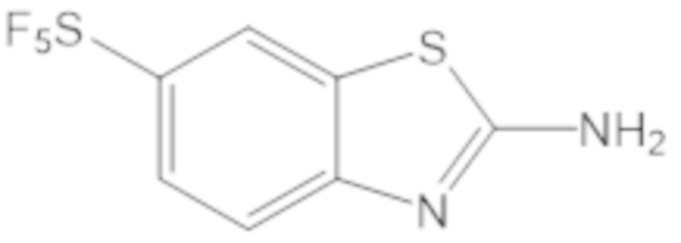
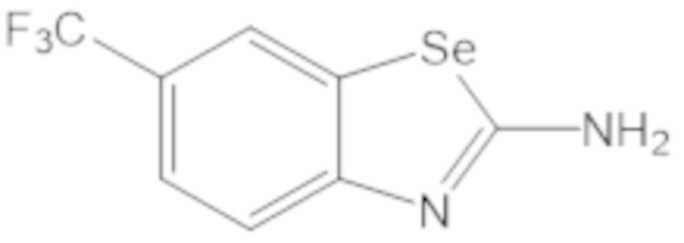
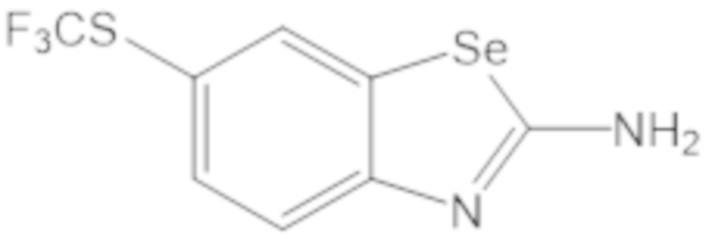
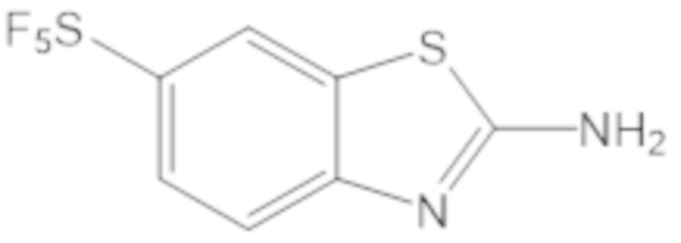
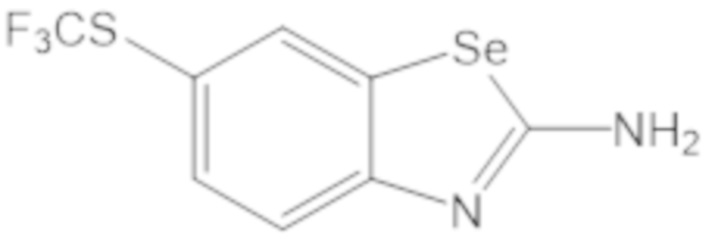
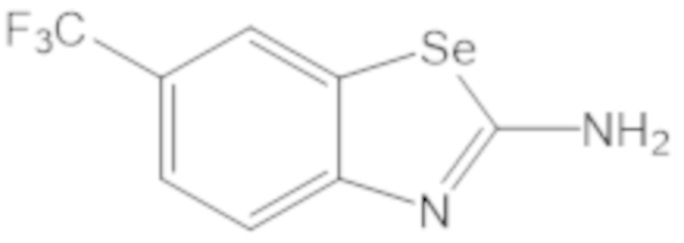
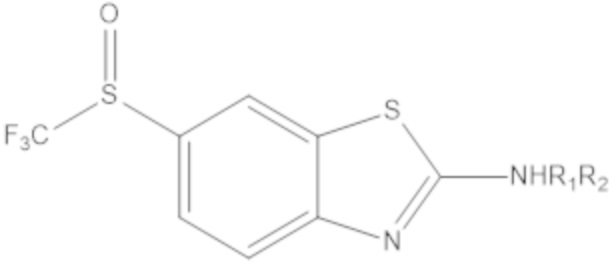
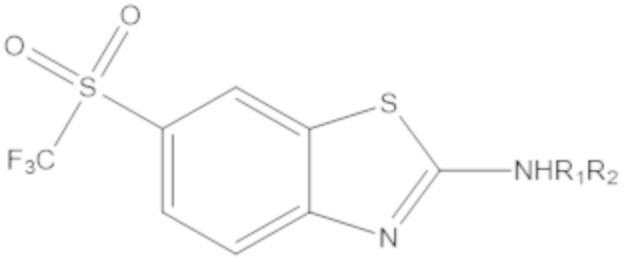
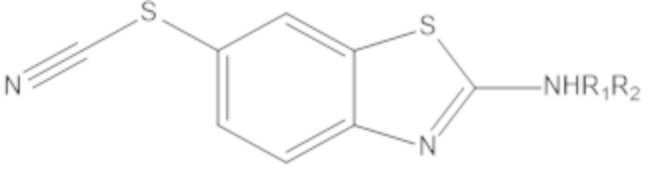
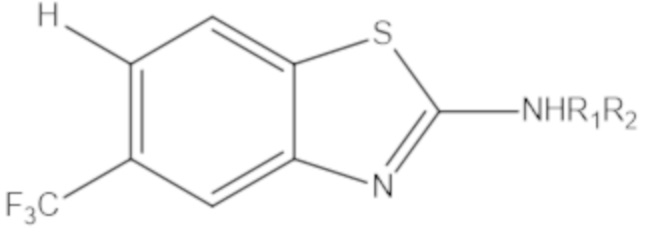
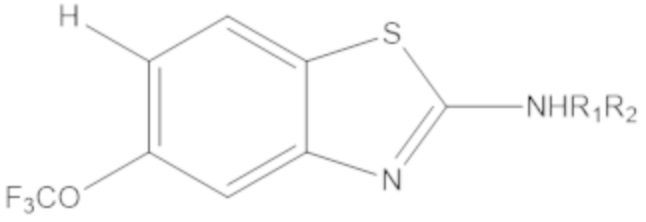
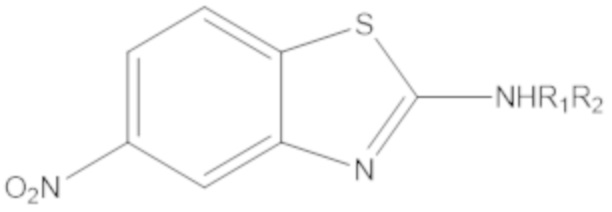
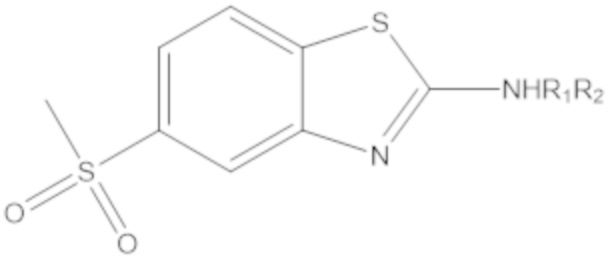
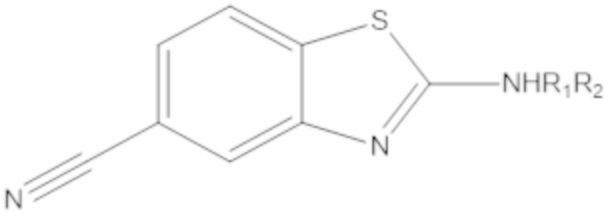
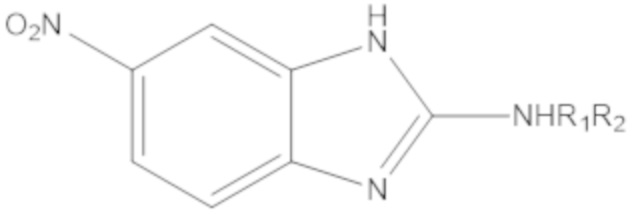
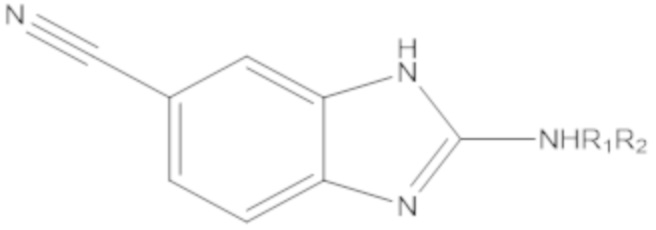
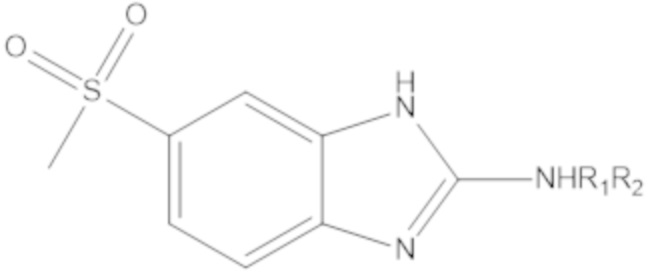
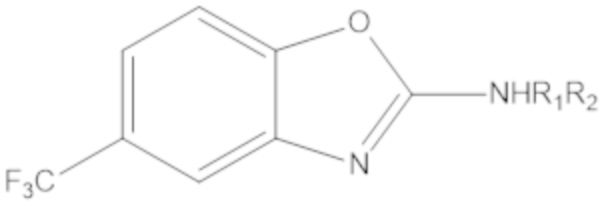
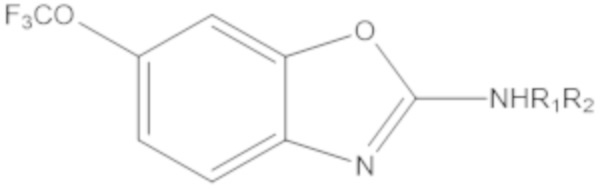
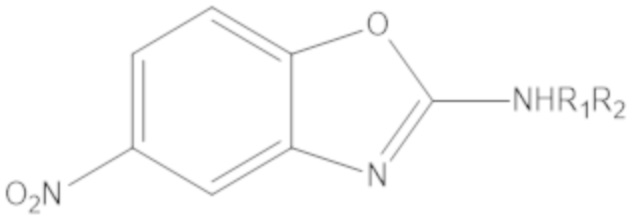
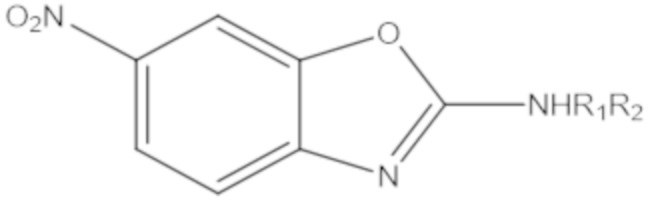
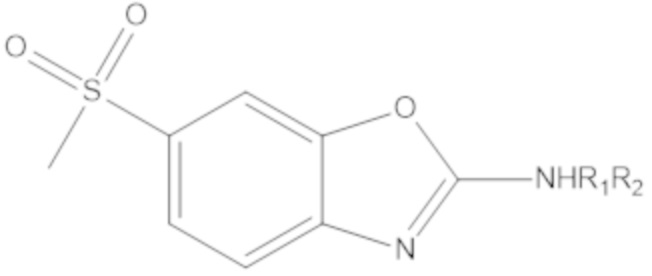
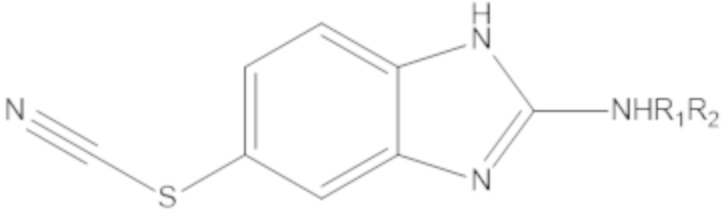
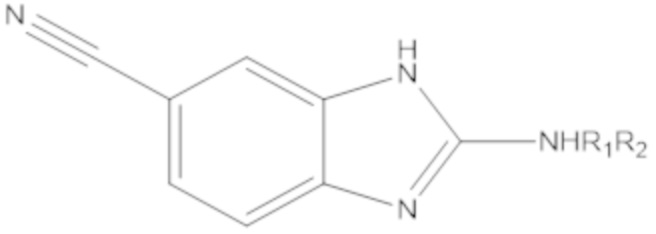
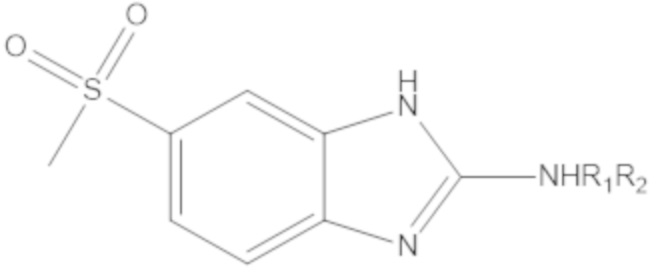
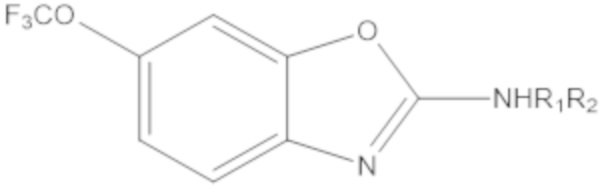
Результат интеллектуальной деятельности: БИЦИКЛИЧЕСКИЕ ГЕТЕРОАРИЛЬНЫЕ ПРОИЗВОДНЫЕ И ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ
Вид РИД
Изобретение
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области медицинской технологии, в частности, к определенным соединениям, их получению и применению, а также к фармацевтическим композициям, содержащим такие соединения. Как проиллюстрировано, настоящее изобретение относится к определенным бициклическом гетероарильным производным, их получению и к соответствующим фармацевтическим композициям. Соединения и/или фармацевтические композиции по настоящему изобретению потенциально можно использовать для производства лекарственного средства для предупреждения, лечения, смягчения определенного нарушения или заболевания у пациента, которое включает, среди прочего, неврологическое или психиатрическое нарушение или заболевание, а также злокачественную опухоль. Полагают, что соединения и/или фармацевтические композиции по настоящему изобретению демонстрируют их терапевтическую пользу посредством, среди прочего, модулирования (например, блокирования) дисфункциональной глутаматной передачи.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОМУ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Исходя из клинических данных и доказательств, полученных с использованием соответствующих доклинических моделей, дисфункциональная глутаматная передача имеет важную роль в патологии различных заболеваний (например, для краткой информации: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4693272/pdf/biomolecules–05–03112.pdf, по состоянию на 3/7/2017). При прогрессировании этих заболеваний основополагающие механизмы высвобождения и/или захвата глутамата в значительной степени вовлекают его внутриклеточную передачу, вызываемую аномальным внутриклеточным током ионов через соответствующие ионные каналы клеточных мембран. Как указано ниже, модулирование (например, блокада) этих каналов посредством опубликованных лекарственных средств (либо прямо, либо путем индукции каскада вовлеченных путей) может ослаблять прогрессирование таких заболеваний.
Многие неврологические и психиатрические заболевания вовлекают дисфункциональную глутаматную передачу, вызываемую аномальными активируемыми Na и/или Ca K–ионными каналами (также известными как KCa2, SK) (например, A. Doble, The Role of Excitotoxicity in Neurodegenerative Disease: Implications for Therapy, Pharmacol. Ther. Vol. 81 (3), pp. 163–221 и J. Lam, et. al. The Therapeutic Potential of Small–Conductance KCa2 Channels in Neurodegenerative and Psychiatric Diseases, Expert Opin Ther Targets Vol. 17(10), pp. 1203–1220). Такие нейродегенеративные заболевания включают боковой амиотрофический склероз (ALS), хроническую боль, такую как невропатия, рассеянный склероз (MS), атаксию, болезнь Паркинсона, болезнь Гентингтона, синдром Туретта, эпилепсию, дистонию, синдром ломкой Х–хромосомы и нарушения в результате травматических повреждений головного/спинного мозга и ишемии головного мозга. Психиатрические заболевания включают депрессию, тревожность, биполярное расстройство, шизофрению, обсессивно–компульсивное расстройство, аутизм, индуцированную глаукомой оптическую невропатию и пристрастие к алкоголю/наркотикам. Когнитивные дисфункции включают, но не ограничиваются ими, деменцию (сосудистая и обусловленная болезнью Альцгеймера) и синдром гиперактивности с дефицитом внимания (СДВГ). К сожалению, когда вышеупомянутые заболевания/нарушения являются прогрессирующими, они являются резистентными к одобренным в настоящее время медикаментозным способам терапии на поздних стадиях или становятся резистентными после начала медикаментозной терапии на ранних стадиях. Например, при большой депрессии (например, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2762009/pdf/nihms–113976.pdf, по состоянию на 3/7/2017), значительные выборки пациентов (10–55% в зависимости от оцениваемой базы данных) являются/становятся "резистентными к лечению" (см. например, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4609854/pdf/DRT2015–842817.pdf и реферат PMH14 http://www.valueinhealthjournal.com/article/S1098–3015(14)03177–5/pdf, по состоянию на 3/7/2017). При эпилепсии значительное меньшинство (20–30%) пациентов являются/становятся резистентными к одобренным в настоящее время лекарственным средствам (например, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5068473/pdf/ndt–12–2605.pdf, по состоянию на 3/7/2017). Эпилепсия, являющаяся комплексным неврологическим расстройством, которым, согласно оценкам, страдает свыше 50 миллионов человек по всему миру, характеризуется рецидивирующими спонтанными припадками вследствие нейрональной гипервозбудимости и гиперсинхронного нейронного разряда. Несмотря на доступность более чем 20 противоэпилептических лекарственных средств (AED), 30% пациентов с эпилепсией продолжают переносить припадки или страдать от нежелательных побочных эффектов лекарственных средств, таких как сонливость, изменения поведения, повреждение печени или тератогенность (См., например, различные ссылки. цитированные в https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5114206/pdf/40268_2016_Article_148.pdf, по состоянию на 3/7/2017).
Кроме того, полагают, что поглощение глутамата, вовлекающее Na–рецепторные каналы опухолевых клеток, усиливает метастазирование злокачественной опухоли (например, M. B.A. Djamgoz, Persistent Current Blockers of Voltage–Gated Sodium Channels: A Clinical Opportunity for Controlling Metastatic Disease, Recent Pat Anticancer Drug Discov. Vol. 8(1), pp. 66–84 and T. Koltai, Voltage–gated sodium channel as a target for metastatic risk reduction with re–purposed drugs, F1000 Research Vol. 4, p. 297). На 2 фазе клинических испытаний пациентов, имеющих метастазирующую меланому, лечили рилузолом (который в настоящее время одобрен для продажи только для лечения ALS, см. https://en.m.wikipedia.org/wiki/Riluzole (по состоянию на 3/7/2017; для перечня от января 2017 клинических испытаний фазы 2–4 в отношении эффективности лечения рилузолом заболеваний, включающих ALS: https://clinicaltrials.gov/ct2/results?term=riluzole&type=Intr&rslt=&recr=&age_v=&gndr=&cond=&intr=riluzole&titles=&outc=&spons=&lead=&id=&state1=&cntry1=&state2=&cntry2=&state3=&cntry3=&locn=&phase=1&phase=2&phase=3&rcv_s=&rcv_e=&lup_s=&lup_e=, по состоянию на 3/7/2017). В этом клиническом испытании метастазы первоначально стабилизировались у 42%, несмотря на отсутствие общего улучшения показателя RECIST. Для дальнейшего повышения эффективности рилузола для лечения метастазирующей меланомы была предложена комбинированная терапия с другими лекарственными средствами против злокачественной опухоли (http://meetinglibrary.asco.org/content/83734–102, по состоянию на 3/7/2017).
Таким образом, срочно необходимы новые лекарственные средства для лечения этих "резистентных" пациентов как в качестве монотерапии, так и для включения в комбинированные режимы (например, некоторые комбинации существующих лекарственных средств для лечения эпилепсии: N. Matsumura, Isobolographic analysis of the mechanisms of action of anticonvulsants from a combination effect, European Journal of Pharmacology, Vol. 741, pp. 237–246).
Полагают, что соединения и фармацевтические составы, описанные в настоящей заявке, будут эффективными для обеспечения требуемого решения для обеспечения модулирования дисфункциональной глутаматной передачи для вышеупомянутых терапевтических показаний.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Ниже приведен обзор только некоторых аспектов настоящего изобретения, однако оно не ограничивается ими. Все ссылки, приведенные в настоящем описании, включены в настоящее описание в качестве ссылок в полном объеме. Когда содержание настоящего описание отличается от содержания цитируемой литературы, преимущественным является содержание настоящей заявки. Настоящее изобретение относится к соединениям и фармацевтическим композициям, которые модулируют дисфункциональную глутаматную передачу через натриевые каналы и каналы KCa2, которые включают определенные бициклические гетероарильные производные, их получение и соответствующие фармацевтические композиции. Соединения и/или фармацевтические композиции по настоящему изобретению потенциально можно использовать для производства лекарственного средства для предупреждения, лечения, смягчения определенного нарушения или заболевания у пациента, которое включает, среди прочего, неврологическое или психиатрическое нарушение или заболевание, а также злокачественную опухоль.
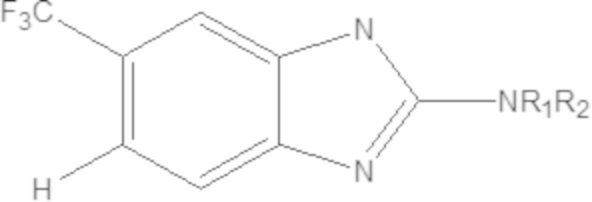
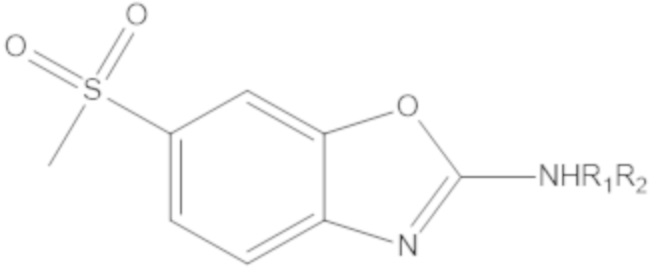
Одним аспектом настоящего изобретения является предоставление соединения формулы (A):
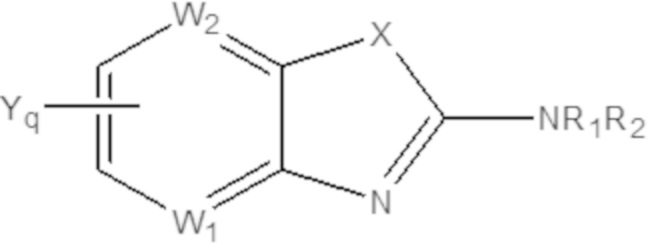 (A)
(A)
где
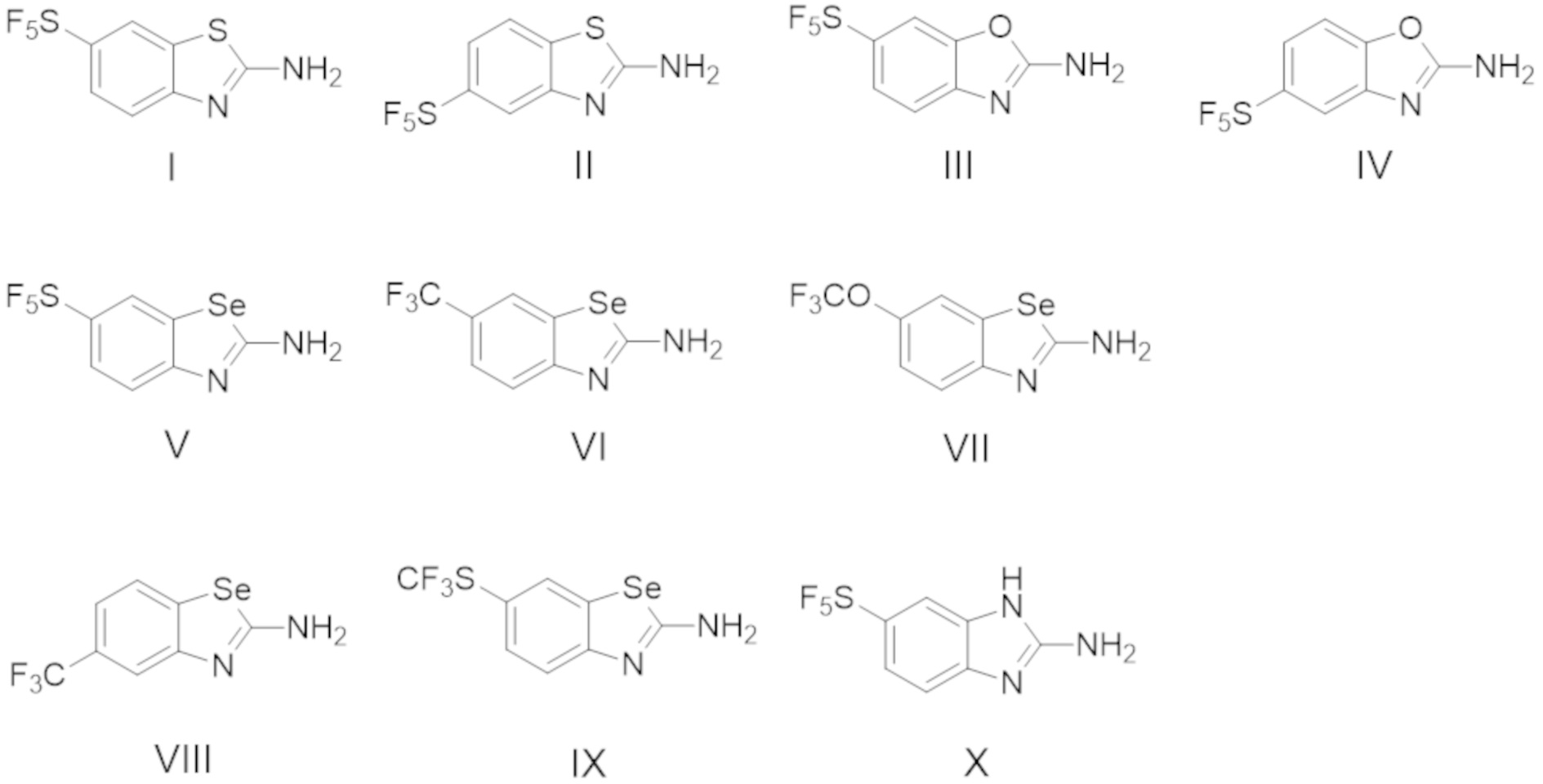
X представляет собой NH, O, S или Se;
W1 или W2 представляет собой CH или N, при условии, что W1 и W2 не оба являются N;
R1 и R2 являются одинаковыми или различаются, и независимо выбраны из группы, состоящей из:
водорода и
GRa, где G отсутствует, –C(O)– или –C(O)O–, и Ra представляет собой насыщенный прямой или разветвленный алкил из от одного до четырех атомов углерода, или насыщенный циклоалкил из от трех до шести атомов углерода, при условии, что R1 и R2 не оба являются GRa, в котором G отсутствует;
Yq выбран из группы, состоящей из водорода, дейтерия, SF5, CF3, OCF3, SCF3, S(O)CF3, S(O)2CF3, CN, SCN, S(O)CH3, S(O)2CH3, NO2, и где q равен 1 или 2; при условии, что, когда q равен 2, Y1 и Y2 могут быть одинаковыми или могут различаться, и они не оба являются водородом, или не оба являются дейтерием, или один не является водородом, а второй дейтерием одновременно;
или его фармацевтически приемлемой соли, и
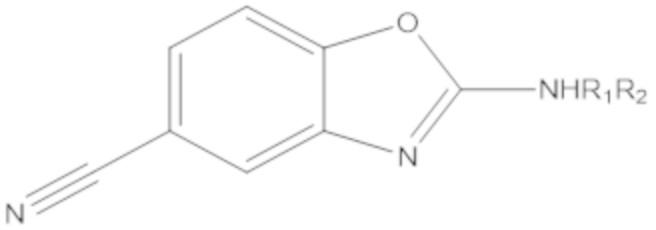
при условии, что, когда W1 и W2 представляют собой CH, соединение формулы (A) не является одним из следующих соединений:
|
где R1 или R2 являются такими, как определено выше; и
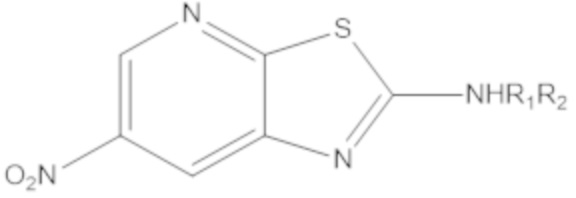
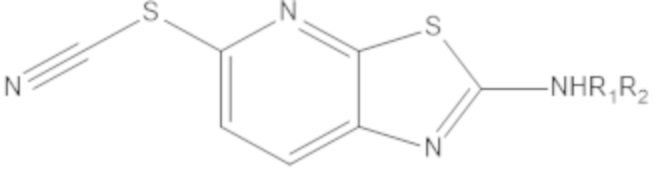
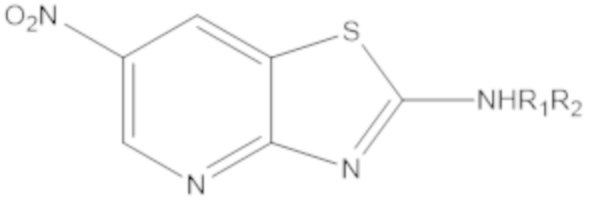
при условии, что, когда W1 или W2 представляет собой N, соединение формулы (A) не является одним из следующих соединений:
|
где R1 или R2 являются такими, как определено выше.
В следующем аспекте изобретение относится к фармацевтическим композициям, каждая из которых содержит эффективное количество по меньшей мере одного соединения формулы (A) или фармацевтически приемлемой соли соединения формулы (A). Фармацевтические композиции по изобретению, кроме того, могут содержать по меньшей мере один фармацевтически приемлемый эксципиент, носитель, адъювант, растворитель, подложку или их комбинацию.
В другом аспекте изобретение относится к способу лечения индивидуума, страдающего, среди прочего, от неврологического или психиатрического заболевания или нарушения или медицинского состояния, являющегося злокачественной опухолью, которые опосредуются дисфункциональной глутаматной передачей, включающему введение индивидууму, нуждающемуся в таком лечении, эффективного количества по меньшей мере одного соединения формулы (A) или фармацевтически приемлемой соли соединения формулы (A), или включающему введение индивидууму, нуждающемуся в таком лечении, эффективного количества фармацевтической композиции, содержащей эффективное количество по меньшей мере одного соединения формулы (A) или фармацевтически приемлемой соли соединения формулы (A).
Один аспект настоящего изобретения относится к применению соединения формулы (A) для получения лекарственного средства, используемого для лечения, предупреждения, ингибирования или устранения неврологического и психиатрического нарушения или заболевания, которое дополнительно содержит терапевтически эффективные количества одного или нескольких необязательных вспомогательных активных ингредиентов, которые включают антипсихотическое средство, атипичное антипсихотическое средство, противоэпилептическое средство, средство против болезни Паркинсона, лекарственное средство против бокового амиотрофического склероза, болеутоляющее лекарственное средство, лекарственное средство против рассеянного склероза, лекарственное средство против повреждения спинного мозга, или их комбинацию, выбранные из группы, состоящей из рилузола, амитриптилина, дезипрамина, миртазапина, бупропиона, ребоксетина, флуоксетина, тразодона, сертралина, дулоксетина, флувоксамина, милнаципрана, левомилнаципрана, десвенлафаксина, вилазодина, венлафаксина, дапоксетина, нефадозона, фемоксетина, клопирамина, циталопрама, эсциталопрама, пароксетина, карбоната лития, буспирона, оланзапина, кветиапина, рисперидона, зипразидона, арипипразола, пероспирона, клозапина, модафинила, мекамиламина, каберголина, адамантана, имипрамина, прамипексола, тироксина, декстрометорфана, квинидина, налтрексона, самидорфана, бупренорфина, мелатонина, альпразолама, пипамперона, вестипитанта, перфеназина, мидазолама, триазолама, эстазолама, диазепама, флуразепама, нитразепама, клонезепама, темазепама, флунитразепама, оксазепама, золпидема, залеплона, зопиклона, эсзопиклона, индиплона, тиагабина, габоксадола, клопирамина, доксепина, хлоралгидрата, галоперидола, хлорпромазина, карбамазепина, прометазина, лоразепама, гидроксизина, аспирина, дифенгидрамина, хлорфенирамина, лендормина, рамелтеона, тасимелтеона, агомелатина, миансерина, фемоксетина, набилона, доксепина, габапентина, хлордиазепоксида, суворексанта, Xuezang Guben или их комбинации.
Один аспект настоящего изобретения относится к применению соединения формулы (A) для получения лекарственного средства для применения для лечения, предупреждения, ингибирования или устранения злокачественной опухоли, которое дополнительно содержит терапевтически эффективные количества одного или нескольких необязательных вспомогательных активных ингредиентов, которые включают химиотерапевтическое средство, выбранное из группы, состоящей из: цитотоксического средства, цисплатина, доксорубицина, таксотера, таксола, этопозида, иринотекана, камптостара, топотекана, паклитаксела, доцетаксела, эпотилонов, тамоксифена, 5–фторурацила, метотрексата, темозоломида, циклофосфамида, SCH 66336, типифарниба (Zarnestra®), R115777, L778.123, BMS 214662, Iressa®, Tarceva®, C225, GLEEVEC®, Intron®, Peg–Intron®, антиароматазных комбинаций, ara–C, адриамицина, эрцепта, гемцитабина, урацил мустарда, хлорметина, ифосфамида, мелфалана, хлорамбуцила, пипобромана, триэтиленмеламина, триэтилентиофосфорамина, бусульфана, кармустина, ломустина, стрептозоцина, дакарбазина, флоксуридина, цитарабина, 6–меркаптопурина, 6–тиогуанина, флударабина фосфата, оксалиплатина, лейковирина, оксалиплатина (ELOXATIN®), пентостатина, винбластина, винкристина, виндезина, блеомицина, дактиномицина, даунорубицина, эпирубицина, идарубицина, митрамицинаTM, дезоксикоформицина, митомицина–C, L–аспарагиназы, тенипозида 17α–этинилэстрадиола, диэтилстилбестрола, тестостерона, преднизона, флуоксиместерона, дромостанолона пропионата, тестолактона, магестрола ацетата, метилпреднизолона, метилтестостерона, преднизолона, триамцинолона, хлортрианизена, гидроксипрогестерона, аминоглутетимида, эстрамустина, медроксипрогестеронацетата, леупролида, флутамида, торемифена, гозерелина, карбоплатина, гидроксимочевины, амсакрина, прокарбазина, митотана, митоксантрона, левамизола, навелбена, анастразола, летразола, капецитабина, релоксафина, дролоксафина, гексаметилмеламина, авастина, герцептина, бексара, велкейда, зевалина, Трисенокса, кселоды, винорелбина, порфимера, эрбитукса, липосомального, тиотепы, алтретамина, мелфалана, трастузумаба, фулвестранта, экземестана, ифосфамида, ритуксимаба, кампата, лейковорина и дексаметазона, бикалутамида, карбоплатина, хлорамбуцила, лектрозола, магестрола и валрубицина, или их комбинации.
Другой аспект настоящего изобретения относится к применению соединения формулы (A) для получения лекарственного средства, используемого для лечения, предупреждения, ингибирования или устранения нарушения, или заболевания, или медицинского состояния у пациента путем модулирования глутаматной передачи у указанного пациента, где указанное нарушение, или заболевание, или медицинское состояние выбрано из группы, состоящей из: глиомы, рака молочной железы, меланомы; бокового амиотрофического склероза (ALS), хронической невропатической боли, рассеянного склероза, атаксии, болезни Паркинсона, болезни Гентингтона, синдрома Туретта, эпилепсии, дистонии, синдрома ломкой Х–хромосомы, нарушений в результате травматического повреждения головного/спинного мозга, нарушений в результате ишемии головного мозга; депрессии, тревожности, биполярного нарушения, шизофрении, обсессивно–компульсивного расстройства, аутизма, пристрастия к алкоголю/наркотикам; сосудистой деменции и деменции в результате болезни Альцгеймера, индуцированной глаукомой оптической невропатии и синдрома гиперактивности с дефицитом внимания (СДВГ).
В другом аспекте настоящего изобретения соединения формулы (A) и их фармацевтически приемлемые соли являются пригодными в качестве модуляторов глутаматной передачи. Таким образом, изобретение относится к способу модулирования глутаматной передачи у индивидуума, включающему воздействие на индивидуума посредством эффективного количества по меньшей мере одного соединения формулы (A) или фармацевтически приемлемой соли соединения формулы (A).
В другом аспекте настоящее изобретение относится к способам получения соединений формулы (A) и их фармацевтически приемлемых солей.
В определенных вариантах осуществления соединений, фармацевтических композиций и способов по изобретению, соединение формулы (A) представляет собой соединение, выбранное из соединений, описанных или проиллюстрированных в подробном описании ниже, или представляет собой фармацевтически приемлемую соль такого соединения.
В другом предпочтительном варианте осуществления настоящее изобретение относится к способам получения фармацевтических композиций, каждая из которых содержит эффективное количество по меньшей мере одного соединения формулы (A) или фармацевтически приемлемой соли соединения формулы (A). Фармацевтические композиции по изобретению, кроме того, могут содержать по меньшей мере один фармацевтически приемлемый эксципиент, носитель, адъювант, растворитель, подложку или их комбинацию.
При составлении в фиксированной дозе в таких комбинированных продуктах используются соединения по настоящему изобретению в диапазоне дозирования, описанном в настоящем описании (или известном специалистам в данной области), и другие фармацевтически активные средства или терапевтические средства в их диапазонах дозирования. Например, было обнаружено, что ингибитор CDC2 оломуцин действует синергично с известными цитотоксическими средствами в отношении индукции апоптоза (J. Cell Sci., (1995) 108, 2897). Соединения по изобретению также можно вводить последовательно с известными средствами против злокачественной опухоли или цитотоксическими средствами, когда комбинированный состав является неприемлемым. При любом комбинированном лечении изобретение не ограничивается последовательностью введений; соединения формулы (A) можно вводить либо до, либо после введения известного средства против злокачественной опухоли или цитотоксического средства. Например, на цитотоксическую активность ингибитора циклин–зависимой киназы флавопиридола влияет последовательность введения средств против злокачественной опухоли (Cancer Research, (1997) 57, 3375). Такие способы входят в пределы квалификации специалистов в данной области, а также лечащих врачей.
Любые из вышеупомянутых способов могут быть усилены введением жидкостей (таких как вода), петлевых диуретиков, одного или нескольких химиотерапевтических или антинеопластических средств, таких как лейковорин и фторурацил, и вспомогательного химиотерапевтического средства (такого как филграстим и эритропоэтин), или любой комбинации вышеуказанных.
Другой вариант осуществления относится к способу введения соединения по настоящему изобретению индивидууму (например, человеку), нуждающемуся в этом, путем введения индивидууму фармацевтического состава по настоящему изобретению.
Другой вариант осуществления относится к способу получения фармацевтического состава по настоящему изобретению путем смешения по меньшей мере одного фармацевтически приемлемого соединения по настоящему изобретению и необязательно одной или нескольких фармацевтически приемлемых добавок или эксципиентов.
Для получения фармацевтических композиций из соединений, описанных в рамках настоящего изобретения, инертные фармацевтически приемлемые носители могут представлять собой либо твердое вещество, либо жидкость. Препараты в твердой форме включают порошки, таблетки, диспергируемые гранулы, капсулы, сферы, крахмальные капсулы и суппозитории. Порошки и таблетки могут содержать от приблизительно 5 до приблизительно 95 процентов активного ингредиента. Подходящие твердые носители известны в данной области, например, карбонат магния, стеарат магния, тальк, сахар или лактоза. Таблетки, порошки, крахмальные капсулы и капсулы можно использовать в качестве твердых дозированных форм, пригодных для перорального введения. Примеры фармацевтически приемлемых носителей и способов производства различных композиций могут быть найдены в A. Gennaro (ed.), Remington's Pharmaceutical Sciences, 18th Edition, (1990), Mack Publishing Co., Easton, Pa.
Препараты в жидкой форме включают растворы, суспензии и эмульсии. В качестве примера могут быть упомянуты вода или растворы вода–пропиленгликоль для парентеральной инъекции или добавление подсластителей и замутнителей для пероральных растворов, суспензий и эмульсий. Препараты в жидкой форме также могут включать растворы для интраназального введения.
Аэрозольные препараты, пригодные для ингаляции, могут включать растворы и твердые вещества в порошковой форме, которые могут присутствовать в комбинации с фармацевтически приемлемым носителем, таким как инертный сжатый газ, например, азот.
Также включены препараты в твердой форме, которые предназначены для преобразования непосредственно перед употреблением в препараты в жидкой форме либо для перорального, либо для парентерального введения. Такие жидкие формы включают растворы, суспензии и эмульсии.
Соединения по изобретению также можно доставлять трансдермальным путем. Трансдермальные композиции могут иметь форму кремов, лосьонов, аэрозолей и/или эмульсий, и могут быть включены в трансдермальный пластырь матриксного или резервуарного типа, как является общепринятым для его назначения.
Соединения по настоящему изобретению также можно доставлять подкожно.
Предпочтительно соединение вводят перорально или внутривенно.
Предпочтительно фармацевтический препарат находится в единичной дозированной форме. В такой форме препарат подразделен на единичные дозы подходящего размера, содержащие надлежащие количества активного компонента, например, эффективное количество для достижения желаемой цели.
Количество активного соединения в единичной дозе препарата может варьироваться или может быть доведено до от приблизительно 1 мг до приблизительно 1000 мг, предпочтительно от приблизительно 1 мг до приблизительно 500 мг, более предпочтительно от приблизительно 1 мг до приблизительно 250 мг, еще более предпочтительно от приблизительно 1 мг до приблизительно 50 мг, в зависимости от конкретного применения.
Фактическая используемая дозировка может варьироваться в зависимости от потребностей пациента и тяжести состояния, подвергаемого лечению. Определение надлежащего режима дозирования для конкретной ситуации входит в пределы квалификации в данной области. Для удобства общая суточная дозировка может быть подразделена и введена порционно в течение дня в соответствии с установленными требованиями. Количество и частота введения соединения по изобретению и/или его фармацевтически приемлемых солей регулируется в зависимости от мнения лечащего врача с учетом таких факторов, как возраст, состояние и размер пациента, а также тяжесть подвергаемых лечению симптомов. Типичный рекомендованный суточный режим дозирования для перорального введения может находиться в диапазоне от приблизительно 1 мг/сутки до приблизительно 200 мг/сутки, предпочтительно от 10 мг/сутки до 100 мг/сутки в одной или двух разделенных дозах.
Любой вариант осуществления, описанный в настоящем описании, можно комбинировать с другими вариантами осуществления при условии, что они не противоречат друг другу, даже если варианты осуществления описаны для различных аспектов изобретения. Кроме того, любой технический признак в одном варианте осуществления может быть применен к соответствующему техническому признаку в других вариантах осуществления при условии, что они не противоречат друг другу, даже несмотря на то, что варианты осуществления описаны для различных аспектов изобретения.
Вышеуказанное только обобщает определенные аспекты, описанные в настоящем описании, и по своей природе не предназначено для ограничения. Эти аспекты и другие аспекты и дополнительные варианты осуществления, признаки и преимущества изобретения станут очевидными из приведенного ниже подробного описания и путем применения настоящего изобретения на практике.
ПОДРОБНОЕ ОПИСАНИЕ И КОНКРЕТНЫЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
Для краткости, содержание публикаций, цитированных в настоящем описании, включая патенты и патентные заявки, включено в настоящее описание в качестве ссылки в полном объеме.
Большинство химических наименований в настоящем описании создано с использованием номенклатуры IUPAC. Некоторые химические наименования создавали с использованием других номенклатур или альтернативных или коммерческих наименований, известных в данной области. В случае противоречий между наименованиями и структурами, структуры имеют преимущество.
ОПРЕДЕЛЕНИЯ И ОБЩАЯ ТЕРМИНОЛОГИЯ
Ниже подробно приводятся определенные варианты осуществления изобретения, примеры которых проиллюстрированы прилагаемыми структурами и формулами. Изобретение предполагает охват всех альтернатив, модификаций и эквивалентов, которые могут входить в объем настоящего изобретения, как определено в формуле изобретения. Специалисту в данной области будут известны многие способы и материалы, сходные или эквивалентные способам и материалам, описанным в настоящем описании, которые можно использовать при применении настоящего изобретения на практике. Настоящее изобретение никоим образом не ограничивается способами и материалами, описанными в настоящем описании. В случае когда один или несколько из включенных источников литературы, патентов и сходных материалов отличается или противоречит заявке, включая, но не ограничиваясь ими, определенные термины, употребление терминов, описанные способы и т.п., настоящая заявка имеет преимущество.
Кроме того, будет понятно, что определенные признаки изобретения, которые для ясности описаны в контексте различных вариантов осуществления, также могут быть предоставлены в комбинации в одном варианте осуществления. Напротив, различные признаки изобретения, которые для краткости описаны в контексте одного варианта вариант осуществления также могут быть предоставлены по отдельности или в любой подходящей подкомбинации.
Если не определено иначе, все технические и научные термины, используемые в настоящем описании, имеют то же значение, которое обычно подразумевает специалист в области, к которой относится настоящее изобретение. Все патенты и публикации, упоминаемые в настоящем описании, включены в настоящее описание в качестве ссылки в полном объеме.
Как используют в рамках изобретения, если нет иных указаний, следует использовать следующие определения. Для целей настоящего изобретения химические элементы идентифицированы в соответствии с Периодической таблицей элементов, версия CAS, и Handbook of Chemistry and Physics, 75th Ed. 1994. Кроме того, общие принципы органической химии описаны в "Organic Chemistry", Thomas Sorrell, University Science Books, Sausalito: 1999, и "March's Advanced Organic Chemistry", Michael B. Smith and Jerry March, John Wiley & Sons, New York: 2007, полное содержание которых включено в настоящее описание в качестве ссылки.
Как используется выше и на протяжении настоящего описания нижеследующие термины, если нет иных указаний, следует понимать как имеющие приведенные значения. Если определение отсутствует, общепринятое определение, известное специалисту в данной области, имеет преимущество. Если определение, приведенное в настоящем описании, противоречит или отличается от определения, приведенного в какой–либо цитированной публикации, определение, приведенное в настоящем описании, имеет преимущество.
Как используют в рамках изобретения, термины "включающий", "охватывающий" и "содержащий" используют в их открытом не ограничивающем значении.
Как используют в рамках изобретения, форма единственного числа включает множественное число, если контекст явно не указывает на иное.
Для предоставления более точного писания некоторые из количественных выражений, приведенных в настоящем описании, не определены термином "приблизительно". Понятно, что, когда термин "приблизительно" используется явно или нет, то подразумевают, что каждое количество, приведенное в настоящем описании, относится к фактической данной величине, и также подразумевают, что оно относится к приближению к такой величине, которое обоснованно может быть выведено, исходя из средних специальных знаний, включая эквиваленты и приближения вследствие условий эксперимента и/или измерений для такой данной величины. Когда выход приведен в качестве процента, такой выход относится к массе структуры, для которой выход приведен относительно максимального количества той же структуры, которое могло бы быть получено в конкретных стехиометрических условиях. Концентрации, которые приведены в качестве процентов, относятся к соотношениям по массе, если не указано иное.
Химические определения
Как используют в рамках изобретения, "алкил" относится к насыщенной, прямой или разветвленной углеводородной группе, имеющей от 1 до 12 атомов углерода. Репрезентативные алкильные группы включают, но не ограничиваются ими, метил, этил, н–пропил, изопропил, 2–метил–1–пропил, 2–метил–2–пропил, 2–метил–1–бутил, 3–метил–1–бутил, 2–метил–3–бутил, 2,2–диметил–1–пропил, 2–метил–1–пентил, 3–метил–1–пентил, 4–метил–1–пентил, 2–метил–2–пентил, 3–метил–2–пентил, 4–метил–2–пентил, 2,2–диметил–1–бутил, 3,3–диметил–1–бутил, 2–этил–1–бутил, бутил, изобутил, трет–бутил, н–пентил, изопентил, неопентил, н–гексил и т.п., и более длинные алкильные группы, такие как гептил, октил и т.п. Как используют в рамках изобретения, "низший алкил" означает алкил, имеющий от 1 до 6 атомов углерода.
Термин "алкиламино", как используют в рамках изобретения, означает аминогруппу, как определено в настоящем описании, где один атом водорода аминогруппы заменен алкильной группой, как определено в настоящем описании. Аминоалкильные группы могут быть определены следующей общей формулой: –NH–алкил. Эта общая формула включает группы следующих общих формул: –NH–C1–C10 алкил и –NH–C1–C6 алкил. Примеры аминоалкильных групп включают, но не ограничиваются ими, аминометил, аминоэтил, аминопропил, аминобутил.
Термин "диалкиламино", как используют в рамках изобретения, обозначает аминогруппу, как определено в настоящем описании, где два атома водорода аминогруппы заменены алкильными группами, как определено в настоящем описании. Диаминоалкильные групы могут быть определены следующей общей формулой: –N(алкил)2, где алкильные группы могут быть одинаковыми или могут различаться и могут быть выбраны из алкилов, как определено в настоящем описании, например C1–C10 алкила или C1–C6 алкила.
Термин "алкокси", как используют в рамках изобретения, включает –O–(алкил), где алкил является таким, как определено выше.
Как используют в рамках изобретения, "алкоксиалкил" означает –(алкиленил)–O–(алкил), где каждый "алкил" независимо представляет собой алкильную группу, определенную выше.
Термин "амино", как используют в рамках изобретения, относится к группе –NH2.
"Арил" означает моно–, би– или трициклическую ароматическую группу, где все кольца группы являются ароматическими. Для би– или трициклических систем отдельные ароматические кольца слиты друг с другом. Иллюстративные арильные группы включают, но не ограничиваются ими, фенил, нафталин и антрацен.
"Арилокси", как используют в рамках изобретения, относится к группе –O–(арил), где арил является таким, как определено выше.
"Арилалкил", как используют в рамках изобретения, относится к группе –(алкиленил)–(арил), где алкиленил и арил являются такими, как определено выше. Неограничивающие примеры арилалкилов включают низшую алкильную группу. Неограничивающие примеры подходящих арилалкильных групп включают бензил, 2–фенэтил и нафталенилметил.
"Арилалкокси", как используют в рамках изобретения, относится к группе –O–(алкиленил)–арил, где алкиленил и арил являются такими, как определено выше.
Термин "циано", как используют в рамках изобретения, означает заместитель, имеющий атом углерода, связанный с атомом азота тройной связью.
Термин "цианоалкил" обозначает аклкильную группу, как определено выше, где атом водорода алкильной группы заменен цианогруппой (–CN). Алкильная часть цианоалкильной группы обеспечивает точку присоединения к остальной части молекулы.
Термин "дейтерий", как используют в рамках изобретения, означает стабильный изотоп водорода, имеющий один протон и один нейтрон.
Термин "галоген", как используют в рамках изобретения, относится к фтору, хлору, брому или йоду. Термин "галогено" обозначает хлоро, фторо, бромо или йодо.
Термин "галогеналкил" обозначает алкильную группу, как определено выше, где один или несколько, например, один, два или три атома водорода алкильной группы заменены атомом галогена, например, фтором, бромом или хлором, в частности, фтором. Примеры галогеналкила включают, но не ограничиваются ими, монофтор–, дифтор– или трифторметил, –этил или –пропил, например, 3,3,3–трифторпропил, 2–фторэтил, 2,2,2–трифторэтил, фторметил, дифторметил, или трифторметил, или бромэтил или хлорэтил. Аналогично, термин "фторалкил" относится к алкильной группе, как определено выше, замещенной одним или несколькими, например, одним, двумя или тремя атомами фтора.
Термин "галогеналкокси", как используют в рамках изобретения, относится к группе –O–(галогеналкил), где галогеналкил является таким, как определено выше. Иллюстративными группами галогеналкокси являются бромэтокси, хлорэтокси, трифторметокси и 2,2,2–трифторэтокси.
Термин "гидрокси" означает группу –OH.
Термин "гидроксиалкил" обозначает алкильную группу, которая замещена по меньшей мере одной гидроксигруппой, например, одной, двумя или тремя гидроксигруппой(ами). Алкильная часть гидроксиалкильной группы обеспечивает точку присоединения к остальной части молекулы. Примеры гидроксиалкильных групп включают, но не ограничиваются ими, гидроксиметил, гидроксиэтил, 1–гидроксипропил, 2–гидроксиизопропил, 1,4–дигидроксибутил и т.п.
Термин "оксо" означает группу =O, и она может быть присоединена к атому углерода или атому серы. Термин "N–оксид" относится к окисленной форме атома азота.
Как используют в рамках изобретения, термин "циклоалкил" относится к насыщенному или частично насыщенному моноциклическому, конденсированному полициклическому, мостиковому полициклическому или спирополициклическому карбоциклу, имеющему от 3 до 12 атомов углерода в кольце. Неограничивающей категорией циклоалкильных групп являются насыщенные или частично насыщенные моноциклические карбоциклы, имеющие от 3 до 6 атомов углерода. Иллюстративные примеры циклоалкильных групп включают, но не ограничиваются ими, следующие части:
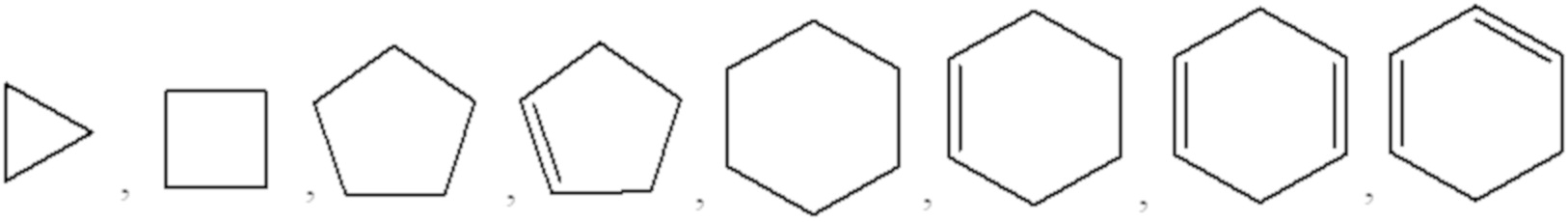 .
.
Термин "циклоалкокси" относится к –O–(циклоалкильной группе).
Как используют в рамках изобретения, термин "гетероарил" относится к моноциклическому или конденсированному полициклическому ароматическому гетероциклу, имеющему от трех до 15 атомов в кольце, которые выбраны из углерода, кислорода, азота, селена и серы. Подходящие гетероарильные группы не включают кольцевые системы, которые должны быть заряженными для того, чтобы быть ароматическими, такие как пирилий. Некоторые подходящие 5–членные гетероарильные кольца (в качестве моноциклического гетероарила или в качестве части полициклического гетероарила) имеют один атом кислорода, серы или азота, или один атом азота плюс один атом кислорода или серы, или 2, 3 или 4 атома азота. Некоторые подходящие 6–членные гетероарильные кольца (в качестве моноциклического гетероарила или в качестве части полициклического гетероарила) имеют 1, 2 или 3 атома азота. Примеры гетероарильных групп включают, но не ограничиваются ими, пиридинил, имидазолил, имидазопиридинил, пиримидинил, пиразолил, триазолил, пиразинил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксазолил, изотиазолил, пирролил, хинолинил, изохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, пиридазинил, триазинил, изоиндолил, птеридинил, пуринил, оксадиазолил, триазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофенил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил и фуропиридинил.
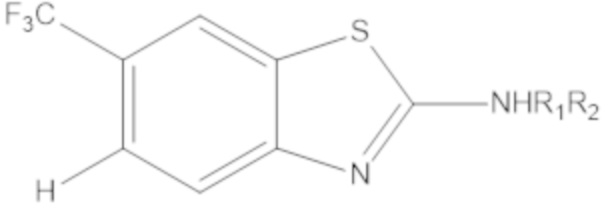
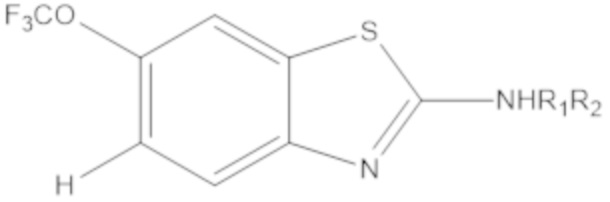
Термин "бициклический гетероарил" относится к гетероарилу, как определено выше, имеющему два составляющих ароматических кольца, где эти два кольца конденсированы друг с другом, и по меньшей мере одно из колец представляет собой гетероарил, как определено выше. Бициклические гетероарилы включают бициклические гетероарильные группы, содержащие 1, 2, 3 или 4 гетероатомных членов кольца, и они являются незамещенными или замещены одним или несколькими заместителями, выбранными из группы, состоящей из амино и галогена; и где один или несколько N–членов кольца указанного гетероарила необязательно представляет собой N–оксид. Бициклические гетероарилы также включают 8–, 9– или 10–членные бициклические гетероарильные группы. Бициклические гетероарилы также включают 8–, 9– или 10–членные бициклические гетероарильные группы, которые имеют 1, 2, 3 или 4 гетероатомных членов кольца и которые являются незамещенными или замещены одним или несколькими заместителями, выбранными из группы, состоящей из амино и галогена; и где один или несколько N–членов кольца указанного гетероарила необязательно представляют собой N–оксид. Иллюстративные примеры бициклических гетероарилов в отношении настоящего изобретения включают, но не ограничиваются ими:
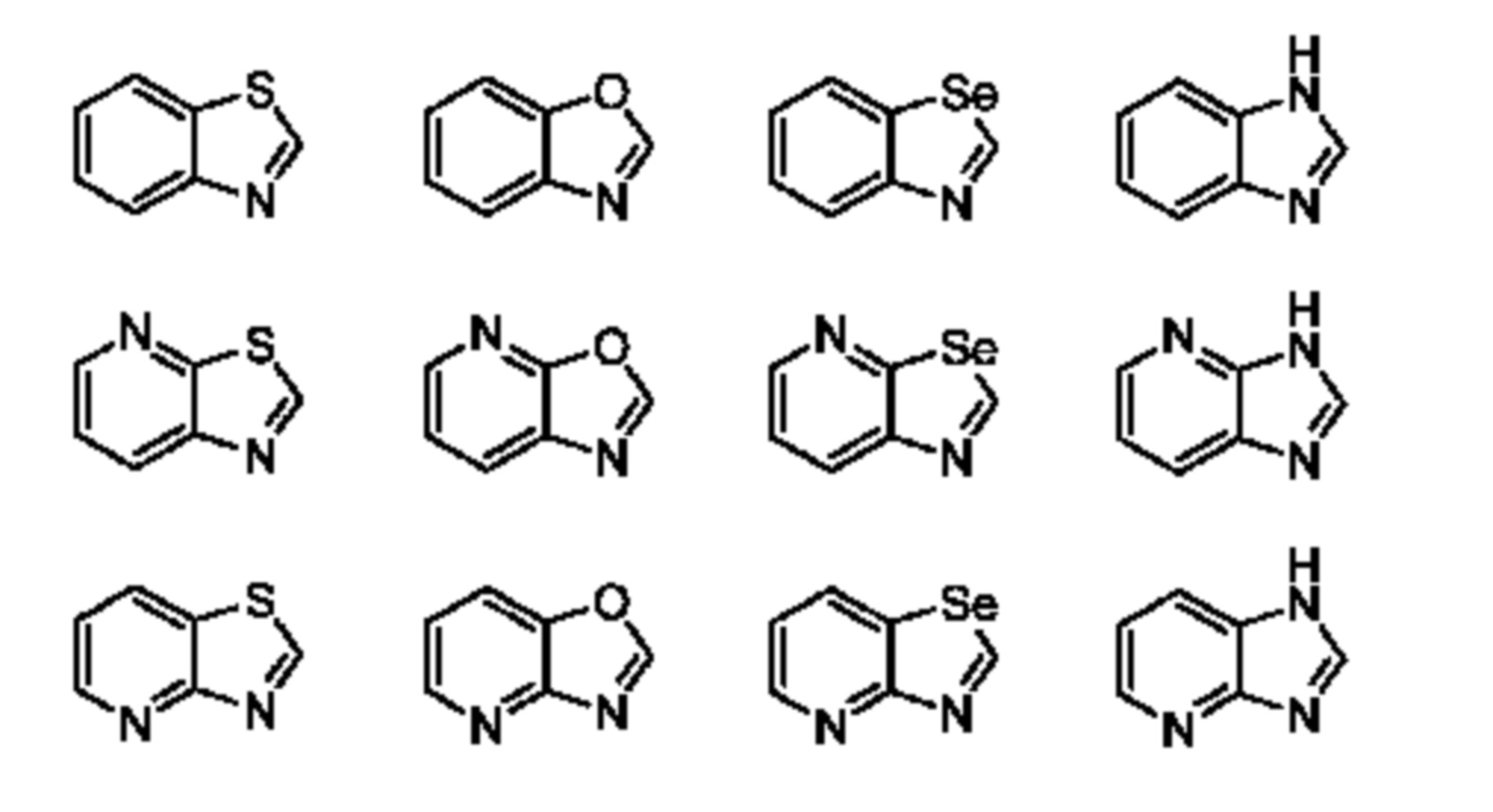
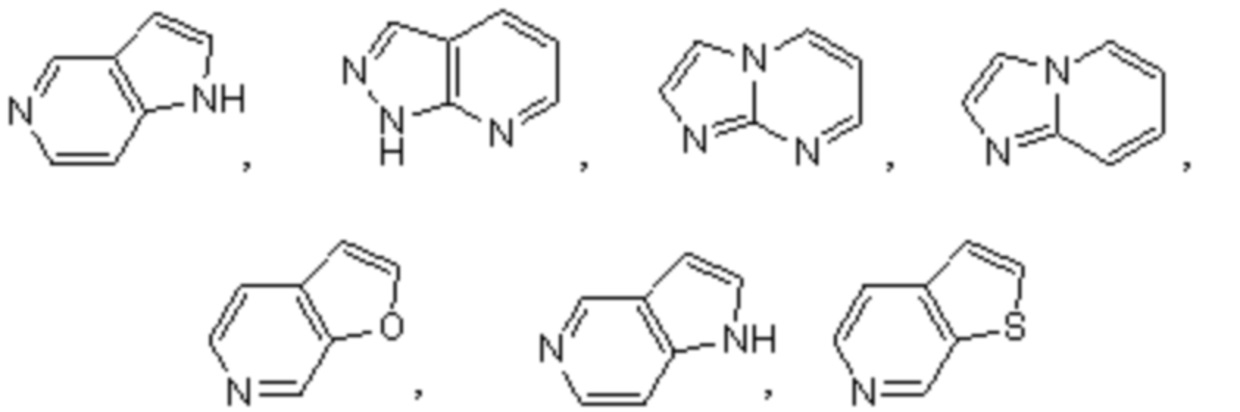
Специалистам в данной области будет понятно, что типы гетероарильных и циклоалкильных групп, приведенные или проиллюстрированные выше, не являются исчерпывающими и что также могут быть выбраны дополнительные типы, входящие в объем этих определенных терминов.
Как описано в настоящем описании, соединения, описанные в настоящем описании, необязательно могут быть замещены одним или несколькими заместителями, как проиллюстрировано конкретными классами, подклассами и типами по изобретению.
Как используют в рамках изобретения, термин "замещенный" означает, что указанная группа или часть содержит один или несколько подходящих заместителей. Как используют в рамках изобретения, термин "незамещенный" означает, что указанная группа не имеет заместителей. Как используют в рамках изобретения, термин "необязательно замещенный" означает, что указанная группа является незамещенной или замещена определенным количеством заместителей. Когда термин "замещенный" используют для описания структурной системы, подразумевается, что замещение может происходить в любой допускаемым валентностью положении на системе.
Как используют в рамках изобретения, выражение "один или несколько заместителей" обозначает от одного до максимального возможного количества замещения(й), которое может происходить в любом допускаемом валентностью положении на системе. В определенном варианте осуществления, один или несколько заместителей означает 1, 2, 3, 4 или 5 заместителей. В другом варианте осуществления один или несколько заместителей означают 1, 2 или 3 заместителя.
Подразумевается, что любой атом, указанный в настоящем описании с ненасыщенной валентностью, имеет достаточное количество атомов водорода для насыщения валентности атома.
Когда какая–либо переменная (например, алкил, алкиленил, гетероарил, R1, R2 или Ra) присутствует более чем в одном месте в какой–либо формуле или описании, приведенных в настоящем описании, определение этой переменной в каждом случае является независимым от ее определения в каждом другом случае.
Подразумевается, что числовые диапазоны, как используют в рамках изобретения, включают последовательные целые числа. Например, диапазон, выражаемый как "от 0 до 4" или "0–4", включает 0, 1, 2, 3 и 4, в то время как диапазон, выражаемый как "10–20%", включает 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19% и 20%. Аналогично, также подразумевается, что числовые диапазоны включают последовательные дробные числа. Например, диапазон, выражаемый как "1–2%", включает 1,0%, 1,1%, 1,2%, 1,3%, 1,4%, 1,5%, 1,6%, 1,7%, 1,8%, 1,9% и 2,0%.
Когда представлена мультифункциональная часть, точка присоединения к сердцевине указана линией или дефисом. Например, арилокси– относится к части, в которой атом кислорода является точкой присоединения к основной молекуле, в то время как как арил связан с атомом кислорода.
Дополнительные определения
Как используют в рамках изобретения, термин "индивидуум" охватывает млекопитающих и не млекопитающих. Примеры млекопитающих включают, но не ограничиваются ими, любого представителя класса млекопитающих: людей; не являющихся человеком приматов, таких как шимпанзе, и других приматов и видов обезьян; сельскохозяйственных животных, таких как крупный рогатый скот, лошади, овцы, козы, свиньи; домашних животных, таких как кролики, собаки и кошки; и лабораторных животных, включая грызунов, таких как крысы, мыши и морские свинки, и т.п. Примеры не млекопитающих включают, но не ограничиваются ими, птиц, рыб и т.п. В одном варианте осуществления настоящего изобретения млекопитающим является человек.
"Пациент" включает как человека, так и животных.
Термин "ингибитор" относится к молекуле, такой как соединение, лекарственное средство, активатор фермента или гормон, которая блокирует или иным образом препятствует конкретной биологической активности.
Термин "модулятор" относится к молекуле, такой как соединение по настоящему изобретению, которая увеличивает или снижает или иным образом влияет на активность данного белка, рецептора и/или ионных каналов.
Термины "эффективное количество" или "терапевтически эффективное количество" относятся к достаточному количеству средства для обеспечения требуемого биологического результата. Этот результат может представлять собой снижение и/или облегчение признаков, симптомов или причин заболевания или медицинского состояния, или другое желаемое изменение биологической системы. Например, "эффективное количество" для терапевтического применения представляет собой количество соединения или композиции, содержащей соединение, которое требуется для обеспечения клинически значимого изменения болезненного состояния, симптома или медицинского состояния. Подходящее "эффективное" количество в каком–либо индивидуальном случае может быть определено специалистом в данной области с использованием стандартного экспериментирования. Таким образом, выражение "эффективное количество", главным образом, относится к количеству, в котором активное вещество имеет терапевтически желаемый эффект.
Как используют в рамках изобретения, термины "лечить" или "лечение" охватывают как "превентивное" и "лечебное" лечение. "Превентивное" лечение означает отсрочивание развития заболевания, симптома заболевания или медицинского состояния, подавление симптомов, которые могут возникнуть, или уменьшение риска развития или рецидива заболевания или симптома. "Лечебное" лечение включает уменьшение тяжести или подавление ухудшения существующего заболевания, симптома или состояния. Таким образом, лечение включает смягчение или предупреждение ухудшения существующих симптомов заболевания, предупреждение возникновения дополнительных симптомов или предупреждение основополагающих метаболических причин симптомов, ингибирование нарушения или заболевания, например, остановку развития нарушения или заболевания, облегчение нарушения или заболевания, обеспечение регрессии нарушения или заболевания, облегчение состояния, вызываемого заболеванием или нарушением, или остановку симптомов заболевания или нарушения.
Как используют в рамках изобретения, термины "введение" и "проведение введения" соединения следует понимать как предоставление соединения по изобретению, фармацевтической композиции, содержащей соединение, или пролекарства соединения по изобретению, индивидууму, нуждающемуся в этом. Понятно, что специалист в данной области может лечить пациента, страдающего в данный момент неврологическими и психиатрическими нарушениями, или профилактически лечить пациента, страдающего нарушениями, эффективным количеством соединения по настоящему изобретению.
Термин "композиция", как используют в рамках изобретения, охватывает продукт, содержащий определенные ингредиенты в определенных количествах, а также любой другой продукт, который является результатом, прямо или непрямо, комбинаций определенных ингредиентов в определенных количествах. Такой термин применительно к фармацевтической композиции охватывает продукт, содержащий активный ингредиент(ы) и инертный ингредиент(ы), который составляет носитель, а также любой продукт, который является результатом, прямо или непрямо, комбинации, образования комплекса или агрегации любых двух или более ингредиентов, или других типов реакций или взаимодействий, вызывающих диссоциацию одного или нескольких ингредиентов. Таким образом, фармацевтические композиции по настоящему изобретению охватывают любую композицию, полученную путем смешения соединения по настоящему изобретению и фармацевтически приемлемого носителя.
Дополнительные химические описания
Любая формула, приведенная в настоящем описании, предназначена для обозначения соединений, имеющих структуры, обозначенные этой структурной формулой, а также определенных вариантов или форм. Например, соединения любой формулы, приведенной в настоящем описании, может иметь асимметричные или хиральные центры и, таким образом, существуют в различных стереоизомерных формах. Все стереоизомеры, включая оптические изомеры, энантиомеры и диастереомеры, соединений общей формулы, и их смеси считаются входящими в объем формулы. Более того, определенные структуры могут существовать в качестве геометрических изомеров (т.е. цис– и транс–изомеров), в качестве таутомеров или в качестве атропизомеров. Предусматривается, что все такие изомерные формы и их смеси являются частью настоящего изобретения. Таким образом, любая формула, приведенная в настоящем описании, предназначена для обозначения рацемата, одной или нескольких энантиомерных форм, одной или нескольких диастереомерных форм, одной или нескольких таутометрых или атропизомерных форм, и их смесей.
"Стереоизомер" относится к соединениям, которые имеют идентичное химическое строение, но различаются в отношении расположения атомов или групп в пространстве. Стереоизомеры включают энантиомер, диастереомеры, конформер (ротамер), геометрический (цис/транс) изомер, атропизомер и т.д.
"Хиральный" относится к молекулам, которые имеют свойство несовпадения при наложении с партнером–зеркальным отображением, в то время как термин "ахиральный" относится к молекулам, которые совпадают при наложении с их партнером–зеркальным отображением.
"Энантиомеры" относится к двум стереоизомерам соединениям, которые не являются совпадающими при наложении зеркальными отображениями друг друга.
"Диастереомер" относится к стереоизомеру с двумя или более центрами хиральности и чьи молекулы не являются совпадающими при наложении зеркальными отображениями друг друга. Диастереомеры имеют различные физические свойства, например, температуры плавления, температуры кипения, спектральные свойства или виды биологической активности. Смесь диастереомеров может быть разделена посредством аналитических методик высокого разрешения, таких как электрофорез и хроматография, такая как ВЭЖХ.
Стереохимические определения и условия, используемые в настоящем описании, обычно соответствуют S. P. Parker, Ed., McGraw–Hill Dictionary of Chemical Terms (1984) McGraw–Hill Book Company, New York; и Eliel, E. and Wilen, S., "Stereochemistry of Organic Compounds", John Wiley & Sons, Inc., New York, 1994.
Многие органические соединения существуют в оптически активных формах, т.е. они обладают способностью вращать плоскость поляризованного света. При описании оптически активного соединения приставки D и L, или R и S, используют для обозначения абсолютной конфигурации молекулы вокруг ее хирального центра(ов). Приставки d и l или (+) и (–) используют для обозначения знака вращения плоскополяризованного света соединением, причем (–) или l означает, что соединение является левовращающим. Соединение с приставкой (+) или d является правовращающим. Конкретный стереоизомер может быть обозначен как энантиомер, и смесь таких стереоизомеров называется энантиомерной смесью. Смесь энантиомеров 50:50 называется рацемической смесью или рацематом, которая может возникать, когда отсутствует стереоселективность или стереоспецифичность в химической реакции или процессе.
Любой асимметричный атом (например, углерод и т.п.) соединения(й), описанного в настоящем описании, может находиться в рацемической или энантиомерно обогащенной конфигурации, например, (R), (S) или (R, S). В определенных вариантах осуществления каждый асимметричный атом имеет по меньшей мере 50% энантиомерный избыток, по меньшей мере 60% энантиомерный избыток, по меньшей мере 70% энантиомерный избыток, по меньшей мере 80% энантиомерный избыток, по меньшей мере 90% энантиомерный избыток, по меньшей мере 95% энантиомерный избыток или по меньшей мере 99% энантиомерный избыток в отношении конфигурации (R) или (S).
В зависимости от выбора исходных материалов и методик, соединения могут присутствовать в форме одного из возможных стереоизомеров или в качестве их смесей, таких как рацематы и диастереомерные смеси, в зависимости от количества асимметричных атомов углерода. Оптические активные (R)– и (S)–изомеры можно получать с использованием хиральных синтонов или хиральных реагентов, или разделять с использованием общепринятых методик. Если соединение содержит двойную связь, заместитель может представлять собой конфигурацию E или Z. Если соединение содержит дизамещенный циклоалкил, циклоалкильный заместитель может иметь цис– или транс–конфигурацию относительно другого заместителя того же циклоалкильного каркаса.
Любые конечные смеси стереоизомеров можно разделять, исходя из физико–химических различий компонентов, на чистые или по существу чистые геометрические изомеры, энантиомеры, диастереомеры, например, посредством хроматографии и/или фракционной кристаллизации. Любые итоговые рацеметы конечных продуктов или промежуточных соединений можно разделять на оптические антиподы способами, известными специалистам в данной области, например, посредством разделения их диастереомерных солей. Рацемические продукты также можно разделять хиральной хроматографией, например, высокоэффективной жидкостной хроматографией (ВЭЖХ), с использованием хирального адсорбента. Предпочтительные энантиомеры также можно получать посредством асимметричного синтеза. См., например, Jacques, et al., Enantiomers, Racemates and Resolutions (Wiley Interscience, New York, 1981); Principles of Asymmetric Synthesis (2nd Ed. Robert E. Gawley, Jeffrey Aubé, Elsevier, Oxford, UK, 2012); Eliel, E.L. Stereochemistry of Carbon Compounds (McGraw–Hill, NY, 1962); Wilen, S.H. Tables of Resolving Agents and Optical Resolutions p. 268 (E.L. Eliel, Ed., Univ. of Notre Dame Press, Notre Dame, IN 1972); Chiral Separation Techniques: A Practical Approach (Subramanian, G. Ed., Wiley–VCH Verlag GmbH & Co. KGaA, Weinheim, Germany, 2007).
Диастереомерные смеси можно разделять на их индивидуальные диастереомеры, исходя из их физико–химических различий, способами, хорошо известными специалистам в данной области, например, такими как хроматография и/или фракционная кристаллизация. Энантиомеры можно разделять путем конвертирования энантиомерной смеси в диастереомерную смесь путем реакции с соответствующим оптически активным соединением (например, хиральное вспомогательное вещество, такое как хиральный спирт или хлорид кислоты Мошера, или образование смеси диастереомерных солей), разделения диастереомеров и преобразования (например, гидролиз или обессоливание) индивидуальных диастереомеров на соответствующие чистые энантиомеры. Энантиомеры также можно разделять с использованием хиральной колонки ВЭЖХ.
Соединения по изобретению могут образовывать фармацевтически приемлемые соли, которые также входят в объем настоящего изобретения. "Фармацевтически приемлемая соль" относится к соли свободной кислоты или основания соединения формулы I, которая является нетоксичной, является физиологически переносимой, совместима с фармацевтической композицией, в которой она составлена, и иным образом пригодна для составления и/или введения индивидууму. Подразумевается, что указание на соединение в настоящем описании включает указание на фармацевтически приемлемую соль указанного соединения, если нет иных указаний.
Соли соединений включают кислотные формы, образованные с неорганическими и/или органическими кислотами, а также основные формы, образованные с неорганическими и/или органическими основаниями. Кроме того, когда данное соединение содержит как основную часть, такую как, но не ограничиваясь ими, пиридин или имидазол, и кислотную часть, такую как, но не ограничиваясь ими, карбоновая кислота, специалисту в данной области будет понятно, что соединение может существовать в качестве цвиттериона ("внутренней соли"); такие соли включены в термин "соль", как используют в рамках изобретения. Соли соединений по изобретению можно получать, например, путем реакции соединения с количеством подходящей кислоты или основания, таким как эквивалентное количество, в среде, такой как среда, в которой соль преципитирует, или в водной среде с последующей лиофилизацией.
Иллюстративные соли включают, но не ограничиваются ими, сульфаты, цитраты, ацетаты, оксалаты, хлориды, бромиды, йодиды, нитраты, бисульфаты, фосфаты, кислые фосфаты, изоникотинаты, лактаты, салицилаты, кислые цитраты, тартраты, олеаты, таннаты, пантотенаты, битартраты, аскорбаты, сукцинаты, малеаты, гентизинаты, фумараты, глюконаты, глюкуронаты, сахараты, формиаты, бензоаты, глутаматы, метансульфонаты ("мезилат"), этансульфонаты, бензолсульфонаты, п–толуолсульфонаты и памоаты (т.е. 1,1’–метилен–бис(2–гидрокси–3–нафтоаты)). Фармацевтически приемлемая соль может вовлекать включение другой молекулы, такой как ацетатный ион, сукцинатный ион или другой противоион. Противоион может представлять собой любую органическую или неорганическую часть, которая стабилизирует заряд исходного соединения. Более того, фармацевтически приемлемая соль может иметь более одного заряженного атома в ее структуре. В случаях, когда множество заряженных атомов являются частью фармацевтически приемлемой соли, может существовать множество противоионов. Таким образом, фармацевтически приемлемая соль может иметь один или несколько заряженных атомов и/или один или несколько противоионов.
Иллюстративные кислотно–аддитивные соли включают ацетаты, аскорбаты, бензоаты, бензолсульфонаты, бисульфаты, бораты, бутираты, цитраты, камфораты, камфорсульфонаты, фумараты, гидрохлориды, гидробромиды, гидройодиды, лактаты, малеаты, метансульфонаты, нафталинсульфонаты, нитраты, оксалаты, фосфаты, пропионаты, салицилаты, сукцинаты, сульфаты, тартраты, тиоцианаты, толуолсульфонаты (также известные как тозилаты) и т.п.
Иллюстративные основные соли включают соли аммония, соли щелочных металлов, такие как соли натрия, лития и калия, соли щелочноземельных металлов, такие как соли кальция и магния, соли с органическими основаниями (например, органическими аминами), такие как дициклогексиламины, трет–бутиламины, и соли с аминокислотами, такие как аргинин, лизин и т.п. Основные азотсодержащие группы могут быть квартенизированными посредством агентов, таких как низшие алкилгалогениды (например, метил, этил и бутилхлориды, бромиды и йодиды), диалкилсульфаты (например, диметил, диэтил и дибутилсульфаты), галогениды длинных цепей (например, децил, лаурил и стеарилхлориды, бромиды и йодиды), аралкилгалогениды (например, бензил и фенэтилбромиды), и другие.
Кроме того, кислоты и основания, которые обычно считаются пригодными для образования фармацевтически полезных солей из фармацевтических соединений обсуждаются, например, P. Stahl et al, Camille G. (eds.) Handbook of Pharmaceutical Salts. Properties, Selection and Use. (2002) Zurich: Wiley–VCH; S. Berge et al, Journal of Pharmaceutical Sciences (1977) 66(1) 1–19; P. Gould, International J. of Pharmaceutics (1986) 33 201–217; Anderson et al, The Practice of Medicinal Chemistry (1996), Academic Press, New York; и в The Orange Book (Food & Drug Administration, MD, доступной от FDA). Эти источники литературы включены в настоящее описание в качестве ссылок.
Кроме того, также подразумевается, что любое соединение, описанное в настоящем описании, относится к любой несольватированной форме, или гидрату, сольвату, или полиморфу такого соединения, и к их смесям, даже если такие формы не перечислены явно. "Сольват" означает физическую ассоциацию соединения по изобретению с одной или несколькими молекулами растворителя. Эта физическая ассоциация вовлекает различные степени ионных и ковалентных связей, в том числе водородных связей. В определенных случаях сольват может быть выделен, например, когда одна или несколько молекул растворителя включены в кристаллическую решетку кристаллического твердого вещества. "Сольват" охватывает сольваты в фазе раствора и поддающиеся выделению сольваты. Подходящие сольваты включают сольваты, образованные с фармацевтически приемлемыми растворителями, такими как вода, этанол и т.п. В некоторых вариантах осуществления растворителем является вода и сольваты представляют собой гидраты.
Одно или несколько соединений по изобретению необязательно могут быть конвертированы в сольват. Способы получения сольватов являются общеизвестными. Таким образом, например, в M. Caira et al., J. Pharmaceutical Sci., 93(3), 601–611 (2004), описано получение сольватов противогрибкового средства флуконазола в этилацетате, а также из воды. Аналогичные способы получения сольватов, гемисольватов, гидратов и т.п. описаны E. C. van Tonder et al, AAPS PharmSciTech., 5(1), article 12 (2004); и A. L. Bingham et al, Chem. Commun., 603–604 (2001). Типичный неограничивающий способ вовлекает растворение соединения по изобретению в подходящем количестве растворителя (органический растворитель или вода, или их смесь) при температуре, превышающей температуру окружающей среды, и охлаждение раствора со скоростью, достаточной для образования кристаллов, которые затем выделяют стандартными способами. Аналитические способы, например, такие как инфракрасная спектроскопия, демонстрируют присутствие растворителя (или воды) в кристаллах в форме сольвата (или гидрата).
Настоящее изобретение также относится к фармацевтически активным метаболитам соединений формулы (A), и к применениям таких метаболитов в способах по изобретению. "Фармацевтически активный метаболит" означает фармакологически активный продукт метаболизма в организме соединения формулы (A) или его соли. Активные метаболиты соединения можно определять с использованием стандартных способов, известных или доступных в данной области. См., например, Bertolini et al., J. Med. Chem. 1997, 40, 2011–2016; Shan et al., J. Pharm. Sci. 1997, 86 (7), 765–767; Bagshawe, Drug Dev. Res. 1995, 34, 220–230; Bodor, Adv. Drug Res. 1984, 13, 255–331; Bundgaard, Design of Prodrugs (Elsevier Press, 1985); и Larsen, Design and Application of Prodrugs, Drug Design and Development (Krogsgaard–Larsen et al., eds., Harwood Academic Publishers, 1991).
Также подразумевается, что любая формула, приведенная в настоящем описании, обозначает немеченые формы, а также изотопно меченные формы соединений. Изотопно меченные соединения имеют структуры, изображенные посредством формул, приведенных в настоящем описании, за исключением того, что один или несколько атомов заменены атомом, имеющим определенную атомную массу или массовое число. Примеры изотопов, которые могут быть включены в соединения по изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора, хлора и йода, такие как 2H, 3H, 11C, 13C, 14C, 15N, 18O, 17O, 31P, 32P, 35S, 18F, 36Cl и 125I, соответственно. Такие изотопно меченные соединения являются пригодными в метаболических исследованиях (например, с 14C), исследованиях кинетики реакций (например, с 2H или 3H), способах детекции или визуализации [таких как позитронная эмиссионная томография (PET) или однофотонная эмиссионная компьютерная томография (SPECT), включающих анализы распределения лекарственного средства или субстрата в тканях, или в лучевой терапии пациентов. В частности, меченное 18F или 11C соединение может быть особенно пригодным для исследований PET или SPECT. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий (т.е. 2H) может обеспечить определенные терапевтические преимущества в результате большей метаболической стабильности, например, увеличенное время полужизни in vivo или снижение дозировок. Изотопно меченные соединения по настоящему изобретению обычно можно получать путем проведения методик, описанных на схемах или в примерах и способах получения, описанных ниже, путем замены легко доступным изотопно меченным реагентом изотопно немеченым реагентом.
Использование терминов "соль", "сольват", "полиморф" и т.п. в отношении соединений, описанных в настоящем описании, предназначено для применения в равной степени к формам солей, сольватов и полиморфов энантиомеров, стереоизомеров, ротамеров, таутомеров, атропизомеров и рацематов соединений по изобретению.
ОПИСАНИЕ СОЕДИНЕНИЙ ПО ИЗОБРЕТЕНИЮ
Настоящее изобретение относится к конкретным молекулам и их фармацевтически приемлемым солям или изомерам. Кроме того, изобретение относится к молекулам, которые являются пригодными для модулирования дисфункциональной глутаматной передачи, и к их фармацевтически приемлемым солям, сольватам, сложным эфиром или изомерам.
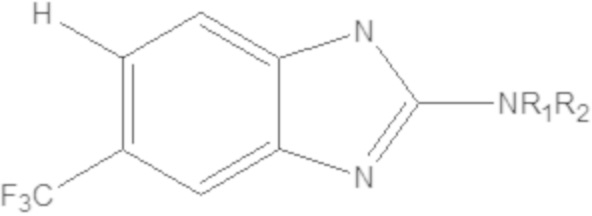
Изобретение относится к соединениям, как описано в настоящем описании, и к их фармацевтически приемлемым солям, сольватам, сложным эфирам или изомерам, и к фармацевтическим композициям, содержащим одно или несколько соединений, как описано в настоящем описании, и их фармацевтически приемлемых солей или изомеров. Один аспект настоящего изобретения относится к предоставлению соединений, композиций, наборов и антидотов для модулирования глутаматной передачи у млекопитающих, включающих соединение формулы (A):
 (A)
(A)
где
X представляет собой NH, O, S или Se;
W1 или W2 представляет собой CH или N, при условии, что W1 и W2 не оба являются N;
R1 и R2 являются одинаковыми или различаются, и независимо выбраны из группы, состоящей из:
водорода и
GRa, где G отсутствует, –C(O)– или –C(O)O–, и Ra представляет собой насыщенный прямой или разветвленный алкил из от одного до четырех атомов углерода, или насыщенный циклоалкил из от трех до шести атомов углерода, при условии, что R1 и R2 не оба являются GRa, в котором G отсутствует;
Yq выбран из группы, состоящей из водорода, дейтерия, SF5, CF3, OCF3, SCF3, S(O)CF3, S(O)2CF3, CN, SCN, S(O)CH3, S(O)2CH3, NO2, и где q равен 1 или 2; при условии, что, когда q равен 2, Y1 и Y2 могут быть одинаковыми или могут различаться, и они не оба являются водородом, или не оба являются дейтерием, или один не является водородом, а второй дейтерием одновременно;
или его фармацевтически приемлемой соли, и
при условии, что, когда W1 и W2 представляют собой CH, соединение формулы (A) не является одним из следующих соединений:
|
где R1 или R2 являются такими, как определено выше; и
при условии, что, когда W1 или W2 представляет собой N, соединение формулы (A) не является одним из следующих соединений:
|
где R1 или R2 являются такими, как определено выше.
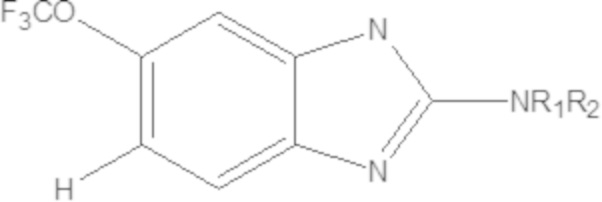
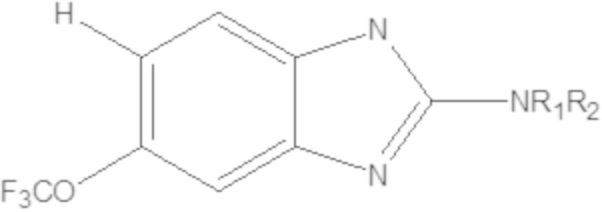
В некоторых вариантах осуществления, в которых соединения имеют общую формулу (A), X представляет собой NH или O или S или Se. В других вариантах осуществления W1 или W2 представляет собой N при условии, что W1 и W2 не оба являются N. В других вариантах осуществления, W1 или W2 представляет собой CH. В других вариантах осуществления основной бициклический гетероарил выбран из группы, состоящей из:
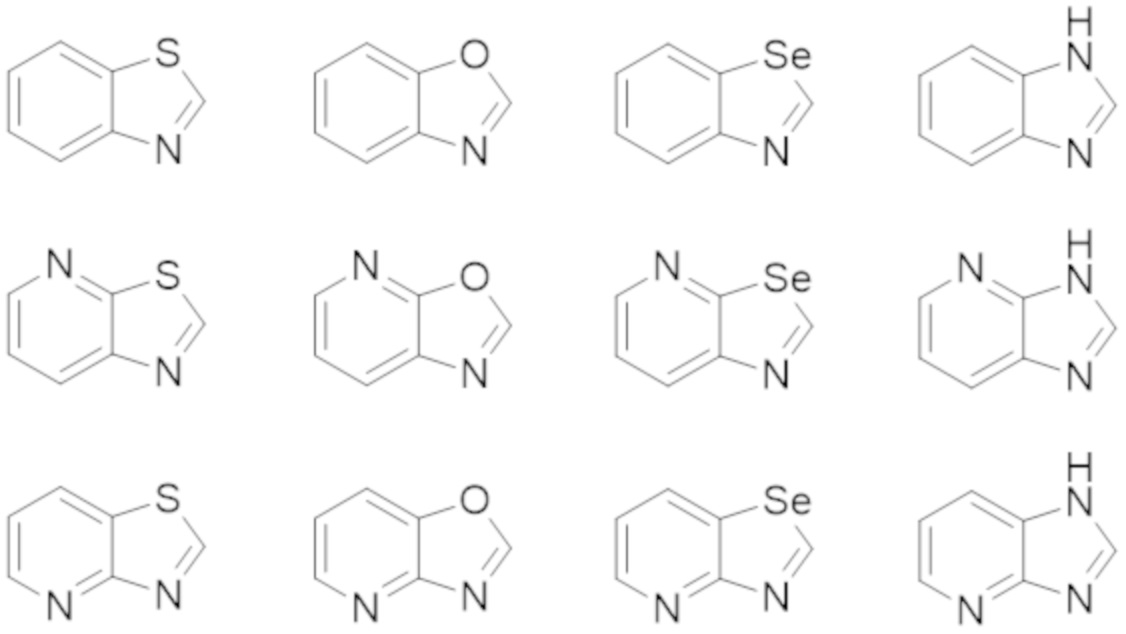
В других вариантах осуществления, в которых соединения имеют общую формулу (A), Yq выбран из группы, состоящей из водорода, дейтерия, SF5, CF3, OCF3, SCF3, S(O)CF3, S(O)2CF3, CN, SCN, S(O)CH3, S(O)2CH3, NO2, где q равен 1 или 2; но при условии, что, когда q равен 2, Y1 и Y2 могут быть одинаковыми или могут различаться, и они не оба являются водородом, или не оба являются дейтерием, или один не является водородом, а второй дейтерием одновременно;
В некоторых вариантах осуществления, в которых соединения имеют общую формулу (A), R1 и R2 являются одинаковыми или они различаются и независимо выбраны из группы, состоящей из: водорода и GRa, где G отсутствует, –C(O)– или –C(O)O– и Ra представляет собой насыщенный прямой или разветвленный алкил из от одного до четырех атомов углерода, или насыщенный циклоалкил из от трех до шести атомов углерода, при условии, что R1 и R2 не являются оба GRa, где G не отсутствует.
В некоторых вариантах осуществления, в которых соединения имеют общую формулу (A), R1 или R2 представляет собой GRa, где G отсутствует и Ra представляет собой прямой или разветвленный алкил из от одного до четырех атомов углерода и выбран из группы, состоящей из:
–CH3, –CH2CH3, –CH2CH2CH3, –CH(CH3)2, –CH2CH2CH2CH3, –CH2CH(CH3)2 и –C(CH3)3.
В некоторых вариантах осуществления, в которых соединения имеют общую формулу (A), R1 или R2 представляет собой GRa, где G отсутствует и Ra представляет собой циклоалкил из от трех до шести атомов углерода и выбран из группы, состоящей из,
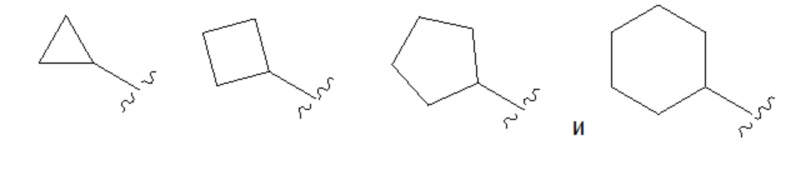 ,
,
необязательно, Ra замещен C1–C4 алкилом.
В некоторых вариантах осуществления, в которых соединения имеют общую формулу (A), один из R1 и R2 представляет собой GRa, где G представляет собой –C(O)– и Ra представляет собой насыщенный прямой или разветвленный алкил из от одного до четырех атомов углерода или насыщенный циклоалкил из от трех до шести атомов углерода и выбран из группы, состоящей из:
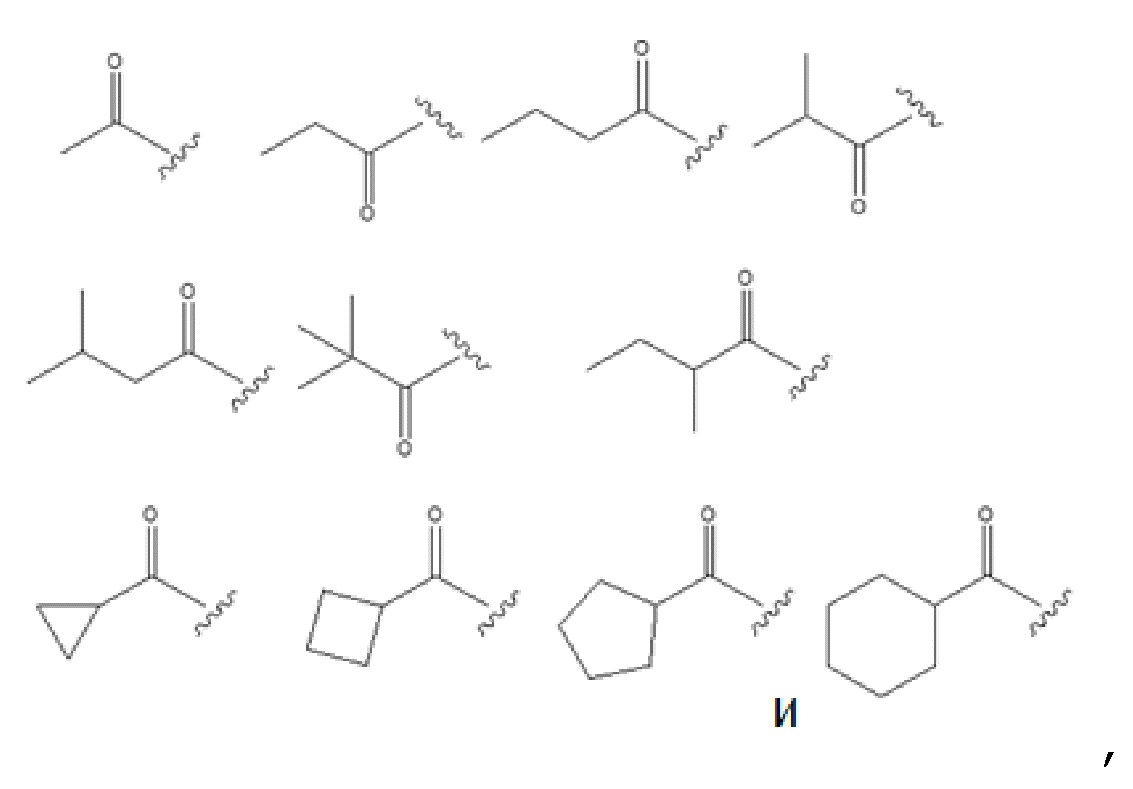
необязательно, Ra замещен C1–C4 алкилом.
В некоторых вариантах осуществления, в которых соединения имеют общую формулу (A), один из R1 и R2 представляет собой GRa, где G представляет собой –C(O)O– и Ra представляет собой насыщенный прямой или разветвленный алкил, имеющий от одного до четырех атомов углерода, или насыщенный циклический алкил, имеющий от трех до шести атомов углерода, и выбран из группы, состоящей из:
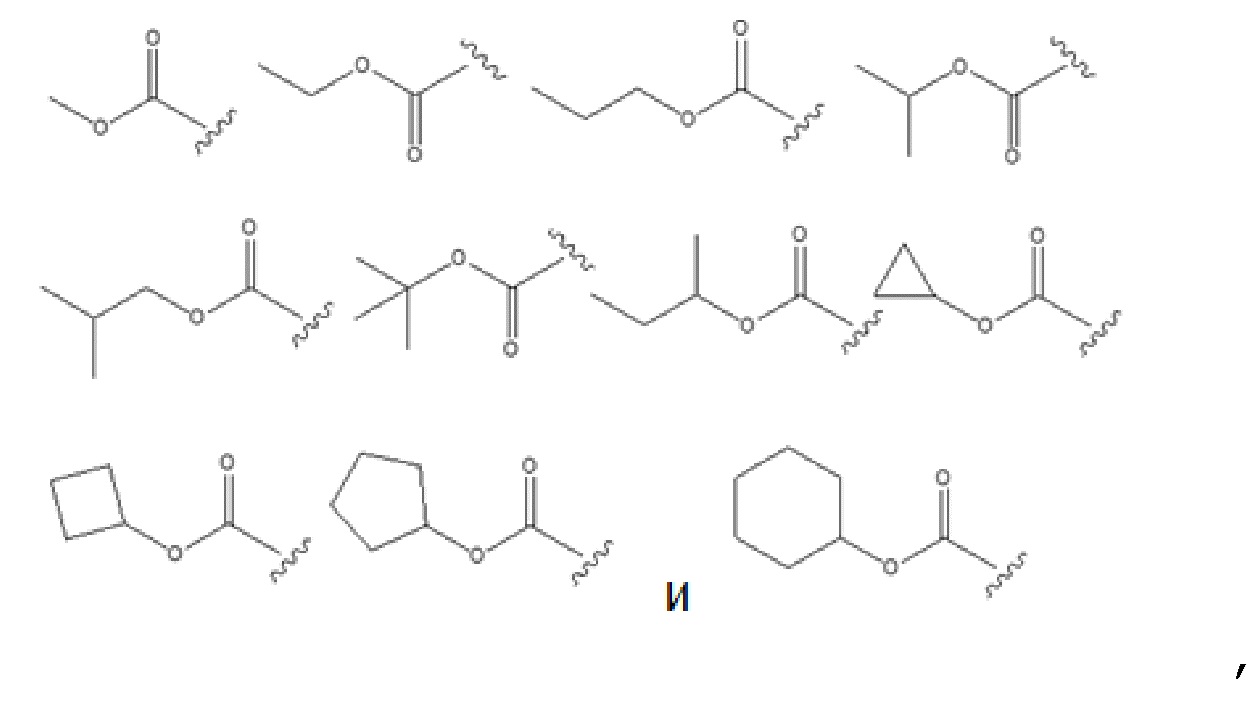
необязательно Ra замещен C1–C4 алкилом.
В других вариантах осуществления, в которых соединения имеют общую формулу (A), один из R1 и R2 представляет собой GRa, где Ra выбран из группы, состоящей из насыщенного прямого или разветвленного алкила из от одного до четырех атомов углерода и насыщенного циклоалкила из от трех до шести атомов углерода, где один или несколько из указанных атомов углерода необязательно представляют собой асимметричный атом.
Один вариант осуществления изобретения относится к предоставлению соединения, где различные части выбраны независимо, W1 и W2 представляют собой CH, X представляет собой N, Y1 представляет собой SF5, Y2 представляет собой H или D, и R1 и R2 являются такими, как определено выше.
Другой вариант осуществления изобретения относится к предоставлению соединения, где различные части выбраны независимо, W1 и W2 представляют собой CH, X представляет собой N, Y1 и Y2 представляют собой SF5, и R1 и R2 являются такими, как определено выше.
Другой вариант осуществления изобретения относится к предоставлению соединения, где различные части выбраны независимо, W1 и W2 представляют собой CH, X представляет собой O, Y1 представляет собой SF5, Y2 представляет собой H или D, и R1 и R2 являются такими, как определено выше.
Другой вариант осуществления изобретения относится к предоставлению соединения, где различные части выбраны независимо, W1 и W2 представляют собой CH, X представляет собой O, Y1 и Y2 представляют собой SF5, и R1 и R2 являются такими, как определено выше.
Другой вариант осуществления изобретения относится к предоставлению соединения, где различные части выбраны независимо, W1 и W2 представляют собой CH, X представляет собой S, Y1 представляет собой SF5, Y2 представляет собой H или D, и R1 и R2 являются такими, как определено выше.
Другой вариант осуществления изобретения относится к предоставлению соединения, где различные части выбраны независимо, W1 и W2 представляют собой CH, X представляет собой S, Y1 и Y2 представляют собой SF5, и R1 и R2 являются такими, как определено выше.
Другой вариант осуществления изобретения относится к предоставлению соединения, где различные части выбраны независимо, W1 и W2 представляют собой CH, X представляет собой Se, Y1 представляет собой SF5, Y2 представляет собой H или D, и R1 и R2 являются такими, как определено выше.
Другой вариант осуществления изобретения относится к предоставлению соединения, где различные части выбраны независимо, W1 и W2 представляют собой CH, X представляет собой Se, Y1 и Y2 представляют собой SF5, и R1 и R2 являются такими, как определено выше.
Другой вариант осуществления изобретения относится к предоставлению соединения, где различные части выбраны независимо, W1 и W2 представляют собой CH, X представляет собой Se, Y1 выбран из группы, состоящей из CF3, OCF3, SCF3, S(O)CF3, S(O)2CF3, CN, SCN, S(O)CH3, S(O)2CH3 и NO2, Y2 представляет собой H или D, и R1 и R2 являются такими, как определено выше.
Другой вариант осуществления изобретения относится к предоставлению соединения, где различные части выбраны независимо, W1 или W2 представляет собой N, X выбран из группы, состоящей из N, O, S и Se, Y1 представляет собой SF5, Y2 представляет собой H или D, и R1 и R2 являются такими, как определено выше.
Другой вариант осуществления изобретения относится к предоставлению соединения, где различные части выбраны независимо, W1 или W2 представляет собой N, X выбран из группы, состоящей из N, O, S и Se, Y1 представляет собой CF3, Y2 представляет собой H или D, и R1 и R2 являются такими, как определено выше.
Другой вариант осуществления изобретения относится к предоставлению соединения, где различные части выбраны независимо, W1 или W2 представляет собой N, X выбран из группы, состоящей из N, O, S и Se, Y1 представляет собой OCF3, Y2 представляет собой H или D, и R1 и R2 являются такими, как определено выше.
Другой вариант осуществления изобретения относится к предоставлению соединения, где различные части выбраны независимо, W1 или W2 представляет собой N, X выбран из группы, состоящей из N, O, S и Se, Y1 выбран из группы, состоящей из SCF3, S(O)CF3, S(O)2CF3, CN, SCN, S(O)CH3, S(O)2CH3, и NO2, Y2 представляет собой H или D, и R1 и R2 являются такими, как определено выше.
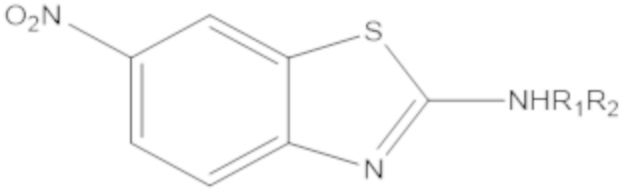
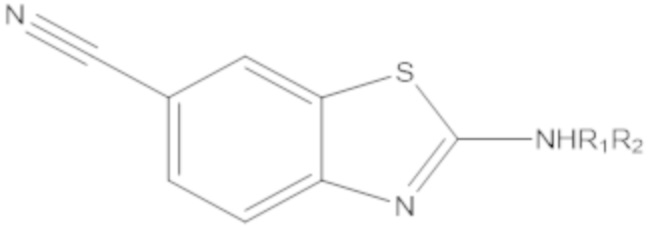
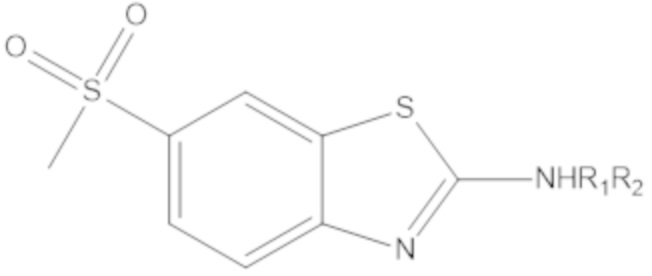
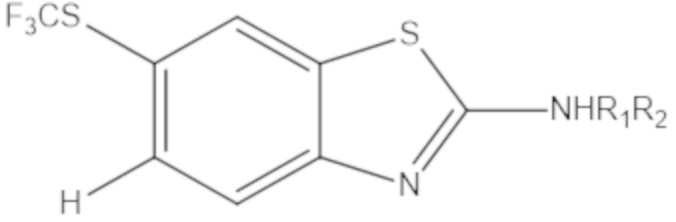
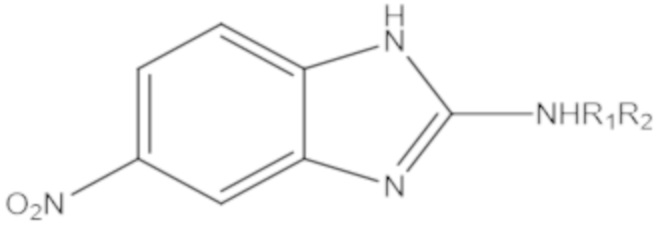
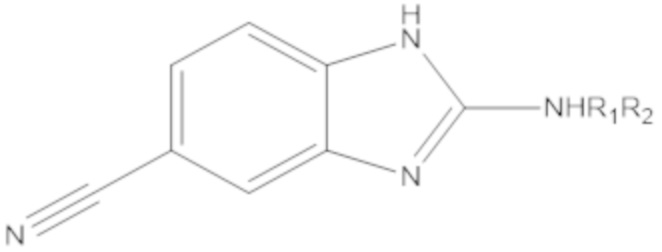
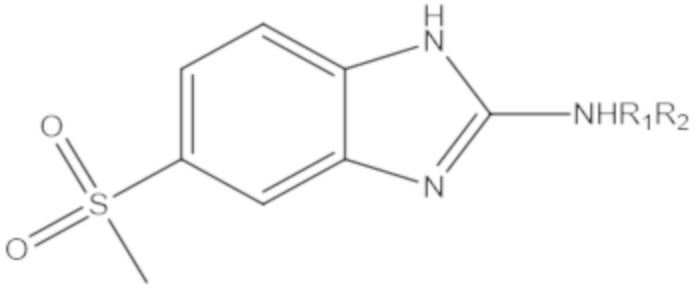
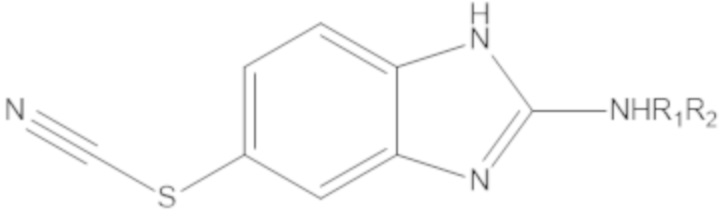
В определенных вариантах осуществления, соединение формулы (A) далее иллюстрируется следующей группой соединений, состоящей из:
и их фармацевтически приемлемыми солями.
Один аспект настоящего изобретения относится к соединениям, описанным в настоящем описании.
Один аспект настоящего изобретения относится к соединениям, которые представляют собой или могут представлять собой модуляторы дисфункциональной глутаматной передачи.
Один аспект настоящего изобретения относится к применению модулятора дисфункциональной глутаматной передачи для получения лекарственного средства, используемого для лечения, предупреждения, ингибирования или устранения злокачественных опухолей.
Один аспект настоящего изобретения относится к применению модулятора дисфункциональной глутаматной передачи для получения лекарственного средства, используемого для лечения, предупреждения, ингибирования или устранения нарушения, или заболевания, или медицинского состояния, у пациента путем модулирования дисфункциональной глутаматной передачи у указанного пациента, где указанное нарушение, или заболевание, или медицинское состояние выбрано из группы, состоящей из: глиомы, рака молочной железы, меланомы; бокового амиотрофического склероза (ALS), хронической невропатической боли, рассеянного склероза, атаксии, болезни Паркинсона, болезни Гентингтона, синдрома Туретта, эпилепсии, дистонии, синдрома ломкой Х–хромосомы, нарушений в результате травматических повреждений головного/спинного мозга, нарушений в результате церебральной ишемии; депрессии, тревожности, биполярного расстройства, шизофрении, обсессивно–компульсивного нарушения, аутизма, пристрастия к алкоголю/наркотикам; сосудистой деменции и деменции в результате болезни Альцгеймера, индуцированной глаукомой оптической невропатии и синдрома гиперактивности с дефицитом внимания (СДВГ).
Настоящее изобретение также относится к одному или нескольким способам синтеза соединений по настоящему изобретению.
Также изобретение относится к одному или нескольким применениям соединений по настоящему изобретению.
Также изобретение относится к одному или нескольким применениям соединений по настоящему изобретению с вспомогательным средством, такому как применение с фактором некроза опухоли (TNF), гранулоцитарным колониестимулирующим фактором (GCSF) или другими химиотерапевтическими средствами.
Также настоящее изобретение относится к одному или нескольким способам получения различных фармацевтических композиций, содержащих соединения по настоящему изобретению.
Также изобретение относится к одному или нескольким применениям различных фармацевтических композиций по настоящему изобретению для получения лекарственного средства, используемого для лечения, предупреждения, ингибирования или устранения нарушения, или заболевания, или медицинского состояния у пациента посредством модулирования дисфункциональной глутаматной передачи у указанного пациента.
ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ СОЕДИНЕНИЯ ПО ИЗОБРЕТЕНИЮ И ПРЕПАРАТЫ И ВВЕДЕНИЕ
Настоящее изобретение относится к фармацевтической композиции, содержащей соединения по настоящему изобретению, например, соединения примеров. В соответствии с конкретными примерами настоящего изобретения, фармацевтическая композиция может дополнительно содержать фармацевтически приемлемый эксципиент, носитель, адъювант, растворитель и их комбинацию.
Настоящее изобретение относится к способу лечения, предупреждения или смягчения заболевания или нарушения, включающему введение безопасного и эффективного количества комбинации лекарственных средств, содержащих соединения по изобретению, и одного или нескольких терапевтически активных средств. Среди них, комбинация лекарственных средств содержит одно или несколько дополнительных лекарственных средств для лечения неврологических и психиатрических нарушений и заболеваний центральной нервной системы.
Другие лекарственные средства для лечения неврологических и психиатрических нарушений и заболеваний центральной нервной системы включают, но не ограничиваются ими: антипсихотическое средство, атипичное антипсихотическое средство, противоэпилептическое средство, средство против болезни Паркинсона, лекарственное средство против бокового амиотрофического склероза, болеутоляющее лекарственное средство или их комбинацию.
Количество соединения фармацевтической композиции, описанной в настоящем описании, относится к количеству, для которого может быть эффективно обнаружено, что оно модулирует дисфункциональную глутаматную передачу в биологических образцах и у пациента. Активный ингредиент можно вводить индивидуумам, нуждающихся в таком лечении, в дозировке, которая обеспечит оптимальную фармацевтическую эффективность, которая представляет собой, но не ограничивается ими, желаемые терапевтические эффекты, посредством данного пути введения и длительности лечения. Дозировка будет варьироваться от пациента к пациенту в зависимости от природы и тяжести заболевания, массы тела пациента, особой диеты, которую соблюдает пациент, сопутствующего лечения и других факторов, которые понятны специалистам в данной области. Количество активного соединения в единичной дозе препарата может варьироваться или может быть доведено до от приблизительно 1 мг до приблизительно 1000 мг, предпочтительно от приблизительно 1 мг до приблизительно 500 мг, более предпочтительно от приблизительно 1 мг до приблизительно 250 мг, еще более предпочтительно от приблизительно 1 мг до приблизительно 50 мг, в зависимости от конкретного применения.
Фактическая используемая дозировка может варьироваться в зависимости от потребностей пациента и тяжести подвергаемого лечению состояния. Определение надлежащего режима дозирования для конкретной ситуации входит в пределы квалификации в данной области. Для удобства общая суточная дозировка может быть разделена и введена порционно в течение дня в соответствии с установленными требованиями. Количество и частота введения соединения по изобретению и/или его фармацевтически приемлемых солей регулируется в зависимости от мнения лечащего врача с учетом таких факторов, как возраст, состояние и размер пациента, а также тяжесть подвергаемых лечению симптомов. Типичный рекомендованный суточный режим дозирования для перорального введения может находиться в диапазоне от приблизительно 1 мг/сутки до приблизительно 200 мг/сутки, предпочтительно от 10 мг/сутки до 100 мг/сутки, которые можно вводить в однократной или многократных дозах. В другом варианте осуществления доза составляет приблизительно от 1 мг до 50 мг на пациента в сутки.
Также будет понятно, что определенные соединения по настоящему изобретению могут существовать в свободной форме для лечения, или, когда это целесообразно, в качестве его фармацевтически приемлемого производного или пролекарства. Фармацевтически приемлемое производное включает фармацевтически приемлемые соли, сложные эфиры, соли таких сложных эфиров или любой другой аддукт или производное, которые при введении пациенту, нуждающемуся в этом, обеспечивают, прямо или непрямо, соединение, как в остальном описано в настоящем описании, или его терапевтически эффективный метаболит или остаток.
Фармацевтические композиции по изобретению можно получать и упаковывать в нерасфасованной форме, где безопасное и эффективное количество соединения формулы (A), описанного в настоящем описании, может быть извлечено, а затем дано пациенту, как например, порошки или сиропы. Как правило, пациенту вводят дозировки на уровне от 0,0001 до 10 мг/кг массы тела для достижения эффективного модулирования дисфункциональной глутаматной передачи. Альтернативно фармацевтические композиции по изобретению можно получать и упаковывать в виде единичной дозированной формы, где каждая физически дискретная единица содержит безопасное и эффективное количество соединения формулы (A), описанного в настоящем описании. При получении в виде единичной дозированной формы, фармацевтические композиции по изобретению обычно содержат приблизительно от 0,5 мг до 1 г, или от 1 мг до 700 мг, или от 5 мг до 100 мг, или более предпочтительно, от 25 мг до 60 мг соединения по изобретению.
Когда фармацевтические композиции по настоящему изобретению также содержат один или несколько других активных ингредиентов, в дополнение к соединению по настоящему изобретению, соотношение масс соединения по настоящему изобретению и второго активного ингредиента может варьироваться и зависит от эффективной дозы каждого ингредиента. Таким образом, например, когда соединение по настоящему изобретению комбинируют с другим средством, соотношение масс соединения по настоящему изобретению и другого средства, как правило, находится в диапазоне от приблизительно 1000:1 до приблизительно 1:1000, таком как приблизительно от 200:1 до 1:200. Комбинации соединения по настоящему изобретению и других активных ингредиентов, как правило, также находятся в вышеупомянутом диапазоне, однако в каждом случае следует использовать эффективную дозу каждого активного ингредиента в комбинации.
"Фармацевтически приемлемый эксципиент", как используют в рамках изобретения, означает фармацевтически приемлемый материал, композицию или носитель, вовлеченный в сообщение формы и консистенции фармацевтической композиции. Каждый эксципиент должен быть совместимым с другими ингредиентами фармацевтической композиции при смешении, чтобы избегать взаимодействий, которые могут существенно снизить эффективность соединения по изобретению при введении пациенту и могут привести к фармацевтически неприемлемым композициям. Кроме того, каждый эксципиент, безусловно, должен иметь достаточно высокую чистоту, чтобы он был фармацевтически приемлемым.
Подходящие фармацевтически приемлемые эксципиенты могут варьироваться в зависимости от конкретной выбранной дозированной формы. Кроме того, подходящие фармацевтически приемлемые эксципиенты могут быть выбраны для конкретной функции, которую они могут выполнять в композиции. Например, определенные фармацевтически приемлемые эксципиенты могут быть выбраны вследствие их способности облегчать изготовление единообразных дозированных форм. Определенные фармацевтически приемлемые эксципиенты могут быть выбраны вследствие их способности облегчать изготовление стабильных дозированных форм. Определенные фармацевтически приемлемые эксципиенты могут быть выбраны вследствие их способности облегчать доставку или транспортировку соединения по настоящему изобретению после введения пациенту от одного органа или части тела к другому органу или части тела. Определенные фармацевтически приемлемые эксципиенты могут быть выбраны вследствие их способности улучшать соблюдение пациентом режима лечения.
Подходящие фармацевтически приемлемые эксципиенты включают следующие типы эксципиентов: разбавители, наполнители, связующие вещества, разрыхлители, смазывающие вещества, вещества, способствующие скольжению, гранулирующие вещества, покровные вещества, смачивающие вещества, растворители, сорастворители, суспендирующие вещества, эмульгаторы, подсластители, вкусовые добавки, маскирующие вкус средства, красители, средства против слеживания, увлажнители, хелатирующие агенты, пластификаторы, повышающие вязкость средства, антиоксиданты, консерванты, стабилизаторы, поверхностно–активные вещества и буферные средства. Специалисту в данной области будет понятно, что определенные фармацевтически приемлемые эксципиенты могут выполнять более одной функции и могут выполнять альтернативные функции в зависимости от того, в каком количестве эксципиент присутствует в составе и какие другие ингредиенты присутствуют в составе.
Квалифицированному специалисту известно и он способен выбрать подходящие фармацевтически приемлемые эксципиенты в надлежащих количествах для применения в рамках настоящего изобретения. Кроме того, существуют ресурсы, которые доступны квалифицированному специалисту, в которых описаны фармацевтически приемлемые эксципиенты и которые могут быть полезными для выбора подходящих фармацевтически приемлемых эксципиентов. Примеры включают Remington's Pharmaceutical Sciences (Mack Publishing Company), The Handbook of Pharmaceutical Additives (Gower Publishing Limited), и The Handbook of Pharmaceutical Excipients (the American Pharmaceutical Association and the Pharmaceutical Press).
В Remington: The Science and Practice of Pharmacy, 21st edition, 2005, ed. D.B. Troy, Lippincott Williams & Wilkins, Philadelphia, and Encyclopedia of Pharmaceutical Technology, eds. J. Swarbrick и J. C. Boylan, 1988–1999, Marcel Dekker, New York, содержание всех из которых включено в настоящее описание в качестве ссылки, описаны различные носители, используемые для составления фармацевтически приемлемых композиций, и известные способы их получения. За исключением случаев, когда какой–либо общепринятый носитель несовместим с соединениями по изобретению, например, вследствие обеспечения какого–либо нежелательного биологического эффекта или иного взаимодействия неблагоприятным образом с каким–либо другим компонентом(ами) фармацевтически приемлемой композиции, предусматривается, что его применение входит в объем настоящего изобретения.
Фармацевтические композиции по изобретению получают с использованием технологий и способов, известных специалистам в данной области. Некоторые из способов, часто используемых в данной области, описаны в Remington's Pharmaceutical Sciences (Mack Publishing Company).
Таким образом, другой аспект настоящего изобретения относится к способу получения фармацевтической композиции. Фармацевтическая композиция содержит соединение, описанное в настоящем описании, и фармацевтически приемлемый эксципиент, носитель, адъювант, наполнитель или их комбинацию, причем способ включает смешение различных ингредиентов. Фармацевтическую композицию, содержащую соединение, описанное в настоящем описании, можно получать, например, при нормальной температуре окружающей среды и давлении.
Соединение по изобретению обычно может быть составлено в дозированной форме, адаптированной для введения пациенту посредством требуемого пути введения. Например, дозированные формы включают формы, адаптированные для (1) перорального введения, такие как таблетки, капсулы, каплеты, пилюли, лепешки, порошки, сиропы, эликсиры, суспензии, растворы, эмульсии, саше и крахмальные капсулы; (2) парентерального введения, такие как стерильные растворы, суспензии и порошки для разбавления; (3) трансдермального введения, такие как трансдермальные пластыри; (4) ректального введения, такие как суппозитории; (5) ингаляции, такие как аэрозоли, растворы и сухие порошки; и (6) местного введения, такие как кремы, мази, лосьоны, растворы, пасты, спреи, пены и гели.
Фармацевтические композиции, описанные в настоящем описании, могут быть предоставлены в качестве прессованных таблеток, таблеток из порошков, жевательных пастилок, быстрорастворимых таблеток, многократно прессованных таблеток или кишечно–растворимых таблеток, покрытых сахаром или покрытых пленкой таблеток. Покрытые кишечнорастворимым покрытием таблетки представляют собой прессованные таблетки, покрытые веществами, которые являются устойчивыми к действию желудочной кислоты, но растворяются или дезинтегрируют в кишечнике, таким образом, защищая активные ингредиенты от кислой среды желудка. Кишечнорастворимые покрытия включают, но не ограничиваются ими, жирные кислоты, жиры, фенилсалицилат, воски, шеллак, аммиачный шелла и ацетаты фталаты целлюлозы. Покрытые сахаром таблетки представляют собой прессованные таблетки, окруженные сахарным покрытием, которые могут быть полезными для маскирования неприятных вкусов или запахов и для защиты таблеток от окисления. Покрытые пленкой таблетки представляют собой прессованные таблетки, которые покрыты тонким слоем или пленкой из растворимого в воде материала. Пленочные покрытия включают, но не ограничиваются ими, гидроксиэтилцеллюлозу, натрий карбоксиметилцеллюлозу, полиэтиленгликоль 4000 и целлюлозы ацетат фталат. Пленочное покрытие обеспечивает те же общие характеристики, что и сахарное покрытие. Многократно прессованные таблетки представляют собой прессованные таблетки, изготовленные в результате более чем одного цикла прессования, включающие многослойные таблетки, покрытые посредством прессования или таблетки, покрытые сухим способом нанесения покрытия.
Таблетированные дозированные формы можно получать из активного ингредиента в порошковой, кристаллической или гранулированной форме, отдельно или в комбинации с одним или несколькими носителями или эксципиентами, описанными в настоящем описании, включая связующие вещества, разрыхлители, полимеры контролируемого высвобождения, смазывающие вещества, разбавители и/или красители. Вкусовые добавки и подсластители являются особенно пригодными для получения желательных таблеток и пастилок.
Фармацевтические композиции, описанные в настоящем описании, могут быть предоставлены в качестве мягких или твердых капсул, которые могут быть изготовлены из желатина, метилцеллюлозы, крахмала или альгината кальция. Твердая желатиновая капсула, также известная как заполненная сухим материалом капсула (DFC), состоит из двух отделений, где одно насаживается на другое, таким образом, полностью заключая в себе активный ингредиент. Мягкая эластичная капсула (SEC) представляет собой мягкую шарообразную оболочку, такую как желатиновая оболочка, которая пластифицирована добавлением глицерина, сорбита или сходного полиола. Мягкие желатиновые оболочки могут содержать консервант для предотвращения роста микроорганизмов. Подходящие консерванты представляют собой консерванты, как описано в настоящем описании, включающие метил– и пропилпарабены и аскорбиновую кислоту. Жидкие, полутвердые и твердые дозированные формы, описанные в настоящем описании, могут быть инкапсулированы в капсулу. Подходящие жидкие и полутвердые дозированные формы включают растворы и суспензии в пропиленкарбонате, растительные масла или триглицериды. Капсулы, содержащие такие растворы, можно получать, как описано в патентах США № 4328245; 4409239 и 4410545. Капсулы также могут быть покрытыми, как известно специалистам в данной области, для модификации или замедления растворения активного ингредиента.
Фармацевтические композиции, описанные в настоящем описании, могут быть предоставлены в жидких и полутвердых дозированных формах, включая эмульсии, растворы, суспензии, эликсиры и сиропы. Эмульсия представляет собой двухфазную систему, в которой одна жидкость диспергирована в форме мелких сфер в другой жидкости и которая может представлять собой масло в воде или воду в масле. Эмульсии могут включать фармацевтически приемлемые неводные жидкости или растворитель, эмульгатор и консервант. Суспензии могут включать фармацевтически приемлемое суспендирующее вещество и консервант. Водные спиртовые растворы могут включать фармацевтически приемлемый ацеталь, такой как ди(низший алкил)ацеталь низшего алкилальдегида, например, ацетальдегид диэтилацеталь; и смешивающийся с водой растворитель, имеющий одну или несколько гидроксигрупп, такой как пропиленгликоль и этанол. Эликсиры представляют собой прозрачные, подслащенные и водно–спиртовые растворы. Сиропы представляют собой концентрированные водные растворы сахара, например сахарозы, и они также могут содержать консервант. Для жидкой дозированной формы, например, раствор в полиэтиленгликоле может быть разбавлен достаточным количеством фармацевтически приемлемого жидкого носителя, например воды, чтобы ее можно было удобно отмерить для введения.
Другие пригодные жидкие и полутвердые дозированные формы включают, но не ограничиваются ими, дозированные формы, содержащие активный ингредиент(ы), описанный в настоящем описании, и диалкилированный моно– или полиалкиленгликоль, включая 1,2–диметоксиметан, диглим, триглим, тетраглим, полиэтиленгликоль–350–диметиловый эфир, полиэтиленгликоль–550–диметиловый эфир, полиэтиленгликоль–750–диметиловый эфир, где 350, 550, и 750 относятся к приблизительной средней молекулярной массе полиэтиленгликоля. Эти составы, кроме того, могут содержать один или несколько антиоксидантов, таких как бутилированный гидрокситолуол (BHT), бутилированный гидроксианизол (BHA), пропилгаллат, витамин E, гидрохинон, гидроксикумарины, этаноламин, лецитин, цефалин, аскорбиновая кислота, яблочная кислота, сорбит, фосфорная кислота, бисульфит, метабисульфит натрия, тиодипропионовая кислота и ее сложные эфиры и дитиокарбаматы.
Когда это целесообразно, единичные дозированные составы для перорального введения могут быть микроинкапсулированными. Состав также можно получать для продления или замедления высвобождения, например, путем покрытия или заключения материала в форме частиц в полимеры, воск и т.п.
Фармацевтические композиции, описанные в настоящем описании для перорального введения, также могут быть предоставлены в формах липосом, мицелл, микросфер или наносистем. Мицеллярные дозированные формы можно получать, как описано в патенте США № 6350458.
Фармацевтические композиции, описанные в настоящем описании, могут быть предоставлены в качестве нешипучих или шипучих гранул и порошков для восстановления в жидкую дозированную форму. Фармацевтически приемлемые носители и эксципиенты, используемые в нешипучих гранулах или порошках, могут включать разбавители, подсластители и смачивающие вещества. Фармацевтически приемлемые носители и эксципиенты, используемые в шипучих гранулах или порошках, могут включать органические кислоты и источник диоксида углерода.
Во всех из описанных выше дозированных форм можно использовать красители и вкусовые добавки.
Соединения, описанные в настоящем описании, также могут быть связаны с растворимыми полимерами в качестве носителей направленных лекарственных средств. Такие полимеры могут охватывать поливинилпирролидон, пирановый сополимер, полигидроксипропилметакриламидофенол, полигидроксиэтиласпартамидофенол или полиэтиленоксид полилизин, замещенный пальмитоиловыми радикалами. Более того, соединения могут быть связаны с классом биодеградируемых полимеров, которые пригодны для обеспечения контролируемого высвобождения лекарственного средства, например, полимолочной кислотой, поли–эпсилон–капролактоном, полигидроксимасляной кислотой, сложными полиортоэфирами, полиацеталями, полидигидроксипиранами, полицианоакрилатами и сшитыми или амфипатическими блок–сополимерами гидрогелей.
Фармацевтические композиции, описанные в настоящем описании, могут быть составлены в качестве дозированных форм немедленного или модифицированного высвобождения, в том числе форм отсроченного, замедленного, импульсного, контролируемого, направленного и программируемого высвобождения.
Фармацевтические композиции, описанные в настоящем описании, могут быть составлены совместно с другими активными ингредиентами, которые не ухудшают требуемое терапевтическое действие, или с веществами, которые дополняют требуемое действие.
Фармацевтические композиции, описанные в настоящем описании, можно вводить парентерально посредством инъекции, инфузии или имплантации для местного или системного введения. Парентеральное введение, как используют в рамках изобретения, включает внутривенное, внутриартериальное, внутрибрюшинное, интратекальное, внутрижелудочковое, внутриуретральное, внутригрудинное, внутричерепное, внутримышечное, внутрисуставное и подкожное введение.
Фармацевтические композиции, описанные в настоящем описании, могут быть составлены в любых дозированных формах, которые пригодны для парентерального введения, включая растворы, суспензии, эмульсии, мицеллы, липосомы, микросферы, наносистемы и твердые формы, пригодные для растворения или суспендирования в жидкости перед инъекцией. Такие дозированные формы могут быть получены общепринятыми способами известными специалистам в области фармацевтики (см., Remington: The Science and Practice of Pharmacy, выше).
Фармацевтические композиции, предназначенные для парентерального введения, могут включать один или несколько фармацевтически приемлемых носителей и эксципиентов, включая, но не ограничиваясь ими, водные носители, смешивающиеся с водой носители, неводные носители, противомикробные средства или консерванты против роста микроорганизмов, стабилизаторы, вещества, повышающие растворимость, обеспечивающие изотоничность средства, буферные средства, антиоксиданты, местные анестетики, суспендирующе и диспергирующие средства, увлажнители или эмульгаторы, комплексообразующие средства, секвестрирующие или хелатирующие агенты, криопротекторы, лиопротекторы, загустители, pH–корректирующие средства и инертные газы.
Пригодные водные носители включают, но не ограничиваются ими, воду, солевой раствор, физиологический раствор или фосфатно–солевой буфер (PBS), хлорид натрия для инъекций, раствор Рингера для инъекций, изотонический раствор декстрозы для инъекций, стерильную воду для инъекций, декстрозу и лактатный раствор Рингера для инъекций. Неводные носители включают, но не ограничиваются ими, жирные масла растительного происхождения, касторовое масло, кукурузное масло, хлопковое масло, оливковое масло, арахисовое масло, масло мяты перечной, сафлоровое масло, кунжутное масло, соевое масло, гидрогенизированные растительные масла, гидрогенизированное соевое масло и триглицериды средней цепи кокосового масла, и пальмоядровое масло. Смешивающиеся с водой носители включают, но не ограничиваются ими, этанол, 1,3–бутандиол, жидкий полиэтиленгликоль (например, полиэтиленгликоль 300 и полиэтиленгликоль 400), пропиленгликоль, глицерин, N–метил–2–пирролидон, N, N–диметилацетамид и диметилсульфоксид.
Пригодные противомикробные средства или консерванты включают, но не ограничиваются ими, фенолы, крезолы, ртутьсодержащие соединения, бензиловый спирт, хлорбутанол, метил и пропил–п–гидроксибензоаты, тимеросал, хлорид бензалкония (например, хлорид бензэтония), метил– и пропилпарабены и сорбиновую кислоту. Подходящие обеспечивающие изотоничность средства включают, но не ограничиваются ими, хлорид натрия, глицерин и декстрозу. Подходящие буферные средства включают, но не ограничиваются ими, фосфат и цитрат. Подходящие антиоксиданты представляют собой антиоксиданты, как описано в настоящем описании, включая бисульфит и метабисульфит натрия. Подходящие местные анестетики включают, но не ограничиваются ими, прокаина гидрохлорид. Подходящие суспендирующие и диспергирующие средства представляют собой средства, как описано в настоящем описании, включая натрий карбоксиметилцеллюлозу, гидроксипропилметилцеллюлозу и поливинилпирролидон. Подходящие эмульгаторы включают эмульгаторы, описанные в настоящем описании, включая полиоксиэтилена сорбитана монолаурат, полиоксиэтилена сорбитана моноолеат 80 и триэтаноламина олеат. Подходящие секвестрирующие или хелатирующие агенты включают, но не ограничиваются ими, EDTA. Подходящие pH–корректирующие средства включают, но не ограничиваются ими, гидроксид натрия, хлористоводородную кислоту, лимонную кислоту и молочную кислоту. Подходящие комплексообразующие средства включают, но не ограничиваются ими, циклодекстрины, включая α–циклодекстрин, β–циклодекстрин, гидроксипропил–β–циклодекстрин, сульфобутиловый эфир–β–циклодекстрин и сульфобутиловый эфир 7–ββ–циклодекстрин (CAPTISOL®, CyDex, Lenexa, Kans.).
Фармацевтические композиции, описанные в настоящем описании, могут быть составлены для однократного или многократного введения дозировок. Составы однократных дозировок упакованы в ампулу, флакон или шприц. Парентеральные составы многократных дозировок должны содержать противомикробное средство в бактериостатических или фунгистатических концентрациях. Все парентеральные составы должны быть стерильными, как известно и применяется на практике в данной области.
В одном варианте осуществления фармацевтические композиции предоставлены в качестве готовых к употреблению стерильных составов. В другом варианте осуществления фармацевтические композиции предоставлены в качестве стерильных сухих растворимых продуктов, включая лиофилизированные порошки и гиподермальные таблетки, для восстановления стерильным носителем перед применением. В другом варианте осуществления фармацевтические композиции предоставляют в качестве готовых для употребления стерильных суспензий. В другом варианте осуществления фармацевтические композиции предоставляют в качестве стерильных сухих нерастворимых продуктов для восстановления носителем перед применением. В другом варианте осуществления фармацевтические композиции предоставляют в качестве готовых для употребления стерильных эмульсий.
Фармацевтические композиции могут быть составлены в качестве суспензии, твердого вещества, полутвердого вещества или тиксотропной жидкости для введения в качестве имплантируемого депо. В одном варианте осуществления фармацевтические композиции, описанные в настоящем описании, диспергированы в твердом внутреннем матриксе, который окружен наружной полимерной мембраной, которая является нерастворимой в жидкостях организма, но позволяет активному ингредиенту в фармацевтических композициях диффундировать через нее.
Подходящие внутренние матриксы включают полиметилметакрилат, полибутилметакрилат, пластифицированный или непластифицированный поливинилхлорид, пластифицированный нейлон, пластифицированный полиэтилентерефталат, натуральный каучук, полиизопрен, полиизобутилен, полибутадиен, полиэтилен, сополимеры этилен–винилацетат, кремнийорганические каучуки, полидиметилсилоксаны, силикон–карбонатные сополимеры, гидрофильные полимеры, такие как гидрогели сложных эфиров акриловой и метакриловой кислоты, коллаген, сшитый поливиниловый спирт и сшитый частично гидролизованный поливинилацетат.
Подходящие наружные полимерные мембраны включают полиэтилен, полипропилен, сополимеры этилен/пропилен, сополимеры этилен/этилакрилат, сополимеры этилен/винилацетат, кремнийорганические каучуки, полидиметилсилоксаны, неопреновый каучук, хлорированный полиэтилен, поливинилхлорид, сополимеры винилхлорида с винилацетатом, винилиденхлоридом, этиленом и пропиленом, иономерный полиэтилентерефталат, бутилкаучук–эпилхлоргидриновые каучуки, сополимер этилен/виниловый спирт, терполимер этилен/винилацетат/виниловый спирт и сополимер этилен/винилоксиэтанол.
В другом аспекте фармацевтическую композицию по изобретению получают в виде дозированной формы, адаптированной для введения пациенту посредством ингаляции, например, в качестве композиции сухого порошка, аэрозоля, суспензии или раствора. В одном варианте осуществления изобретение относится к дозированной форме, адаптированной для введения пациенту посредством ингаляции в качестве сухого порошка. В одном варианте осуществления изобретение относится к дозированной форме, адаптированной для введения пациенту посредством ингаляции в качестве сухого порошка. Композиции сухого порошка для доставки в легкое посредством ингаляции, как правило, содержат соединение, описанное в настоящем описании, или его фармацевтически приемлемую соль в качестве тонкоизмельчнного порошка вместе с одним или несколькими фармацевтически приемлемыми эксципиентами в виде тонкоизмельченных порошков. Фармацевтически приемлемые эксципиенты, особенно пригодные для применения в виде сухих порошков, известны специалистам в данной области и включают лактозу, крахмал, маннит и моно–, ди– и полисахариды. Тонкоизмельченный порошок можно получать, например, посредством микронизации и помола. Как правило, измельченное (например, микронизированное) соединение может определяться величиной D50 от приблизительно 1 до приблизительно 10 микрометров (например при определении с использованием лазерной дифракции).
Аэрозоли могут быть получены путем суспендирования или растворения соединения, описанного в настоящем описании, или его фармацевтически приемлемой соли в сжиженном пропелленте. Подходящие пропелленты включают галогенуглероды, углеводороды и другие сжиженные газы. Репрезентативные пропелленты включают: трихлорфторметан (пропеллент 11), дихлорфторметан (пропеллент 12), дихлортетрафторэтан (пропеллент 114), тетрафторэтан (HFA–134a), 1,1–дифторэтан (HFA–152a), дифторметан (HFA–32), пентаpфторэтан (HFA–12), гептафторпропан (HFA–227a), перфторпропан, перфторбутан, перфторпентан, бутан, изобутан и пентан. Аэрозоли, содержащие соединение формулы (A) или его фармацевтически приемлемую соль, в основном, можно вводить пациенту через ингалятор отмеренной дозы (MDI). Такие устройства известны специалистам в данной области.
Аэрозоль может содержать дополнительные фармацевтически приемлемые эксципиенты, как правило, используемые с MDI, такие как поверхностно–активные вещества, смазывающие вещества, coрастворители и другие эксципиенты, для повышения физической стабильности состава, для улучшения работы клапана, для повышения растворимости или для улучшения вкуса.
Фармацевтические композиции, адаптированные для трансдермального введения, могут быть предоставлены в качестве дискретных пластырей, предназначенных для того, чтобы оставаться в тесном контакте с эпидермисом пациента в течение длительного периода времени. Например, активный ингредиент может доставляться из пластыря посредством ионтофореза, в основном как описано в Pharmaceutical Research, 3(6), 318 (1986).
Фармацевтические композиции, адаптированные для местного введения, могут быть составлены в качестве мазей, кремов, суспензий, лосьонов, порошков, растворов, паст, гелей, спреев, аэрозолей или масел. Мази, кремы и гели могут быть составлены, например. с водной или масляной основой с добавлением подходящего загустителя, и/или гелеобразующего средства и/или растворителей. Таким образом, такие основы, могут включать, например, воду и/или масло, такое как вазелиновое масло или растительное масло, такое как арахисовое масло или касторовое масло, или растворитель, такой как полиэтиленгликоль. Загустители и гелеобразующие средства, которые можно использовать в соответствии с природой основы, включают мягкий парафин, стеарат алюминия, цетостеариловый спирт, полиэтиленгликоли, шерстяной жир, пчелиный воск, производные карбоксиполиметилена и целлюлозы, и/или глицерилмоностеарат и/или неионные эмульгаторы.
Лосьоны могут быть составлены с водной или масляной основой и, как правило, также содержат один или несколько эмульгаторов, стабилизаторов, диспергирующих веществ, суспендирующих веществ или загустителей.
Порошки для наружного применения могут быть получены с помощью любой подходящей основы порошка, например, талька, лактозы или крахмала. Капли могут быть составлены с водной или неводной основой, также содержащей одно или несколько диспергирующих веществ, солюбилизирующих веществ, суспендирующих веществ или консервантов.
Препараты для местного применения можно вводить посредством одного или нескольких нанесений в сутки на пораженную область; над областями кожи преимущественно можно использовать окклюзионную повязку. Непрерывной или пролонгированной доставки можно достигать с использованием адгезивной резервуарной системы.
ПРИМЕНЕНИЯ СОЕДИНЕНИЙ И КОМПОЗИЦИЙ ПО ИЗОБРЕТЕНИЮ
Соединения или фармацевтические композиции по изобретению, описанные в настоящем описании, можно использовать для изготовления лекарственного средства для лечения, предупреждения, смягчения или облегчения неврологического и психиатрического нарушения или заболевания, или злокачественной опухоли у индивидуума, а также других лекарственных средств для модулирования (например, блокирования) дисфункциональной глутаматной передачи, и соединения по настоящему изобретению обладают улучшенными фармакокинетическими и фармакодинамическими свойствами, меньшими токсическими побочными эффектами.
В частности, определенное количество соединения в композициях по настоящему изобретению может эффективно и на поддающемся обнаружению уровне модулировать дисфункциональную глутаматную передачу. Соединения или фармацевтические композиции по изобретению можно использовать для предупреждения, лечения или смягчения заболеваний, касающихся дисфункциональной глутаматной передачи, где такие заболевания включают глиому, рак молочной железы, меланому; боковой амиотрофический склероз (ALS), хроническую невропатическую боль, рассеянный склероз, атаксию, болезнь Паркинсона, болезнь Гентингтона, синдром Туретта, эпилепсию, дистонию, синдром ломкой Х–хромосомы, нарушения в результате травматического повреждения головного/спинного мозга, нарушения в результате церебральной ишемии; депрессию, тревожность, биполярное расстройство, шизофрению, обсессивно–компульсивное расстройство, аутизм, пристрастие к алкоголю/наркотикам; сосудистую деменцию и обусловленную болезнью Альцгеймера деменцию, индуцированную глаукомой оптическую невропатию и синдром гиперактивности с дефицитом внимания (СДВГ).
СПОСОБЫ ТЕРАПИИ
В одном варианте осуществления способы терапии, описанные в настоящем описании, включают введение безопасного и эффективного количества соединения по изобретению или фармацевтической композиции, содержащей соединение по изобретению, пациентам, нуждающимся в этом. Каждый пример, описанный в настоящем описании, включает способ лечения заболеваний, описанных выше, включающий введение безопасного и эффективного количества соединения по изобретению или фармацевтической композиции, содержащей соединение по изобретению, пациентам, нуждающимся в этом.
В одном варианте осуществления соединение по изобретению или его фармацевтическую композицию можно вводить любым подходящим путем введения, включая как системное введение, так и местное введение. Системное введение включает пероральное введение, парентеральное введение, трансдермальное введение и ректальное введение. Парентеральное введение относится к путям введения, отличным от энтерального или трансдермального и, как правило, осуществляется посредством инъекции или инфузии. Парентеральное введение включает внутривенную, внутримышечную и подкожную инъекцию или инфузию. Местное введение включает нанесение на кожу, а также внутриглазное, внутривагинальное, ингаляционное и интраназальное введение. В одном варианте осуществления соединение по изобретению или его фармацевтическую композицию можно вводить перорально. В другом варианте осуществления соединение по изобретению или его фармацевтическую композицию можно вводить путем ингаляции. В следующем варианте осуществления соединение по изобретению или его фармацевтическую композицию можно вводить интраназальным путем.
В одном варианте осуществления соединение по изобретению или его фармацевтическую композицию можно вводить один раз или по схеме дозирования, где множество доз вводят с различными интервалами в течение данного периода времени. Например, дозы можно вводить один, два, три или четыре раза в сутки. В одном варианте осуществления дозу вводят один раз в сутки. В следующем варианте осуществления дозу вводят два раза в сутки. Дозы можно вводить до тех пор, пока не будет достигнут желаемый терапевтический эффект или неопределенно долго для поддержания требуемого терапевтического эффекта. Подходящие режимы дозирования соединения по изобретению или его фармацевтической композиции зависят от фармакокинетических свойств этого соединения, таких как его всасывание, распределение и половинное время метаболизма и выведения, которые могут быть определены специалистом в данной области. Кроме того, подходящие режимы дозирования, включая длительность таких режимов, проводят для соединения по изобретению или его фармацевтической композиции в зависимости от подвергаемого лечению нарушения, тяжести подвергаемого лечению нарушения, возраста и физического состояния пациента, подвергаемого лечению, анамнеза пациента, подвергаемого лечению, характера сопутствующей терапии, требуемого терапевтического эффекта и сходных факторов, известных и являющихся частью профессиональных умений специалиста в данной области. Кроме того, специалистам в данной области будет понятно, что подходящие режимы дозирования могут требовать коррекции с учетом индивидуальной переносимости пациентом режима дозирования или с течением времени по мере необходимости изменения для пациента.
Соединения по настоящему изобретению можно вводить либо одновременно, либо до или после, одного или нескольких других терапевтических средств. Соединения по настоящему изобретению можно вводить по отдельности, посредством одного и того же или различных путей введения, или вместе в одной фармацевтической композиции с другими средствами.
Фармацевтическая композиция или комбинация по настоящему изобретению может находиться в однократной дозировке приблизительно 1–1000 мг активных ингредиентов для индивидуума массой приблизительно 50–70 кг, предпочтительно приблизительно 1–500 мг, или приблизительно 1–250 мг, или приблизительно 1–150 мг, или приблизительно 0,5–100 мг, или приблизительно 1–50 мг активных ингредиентов. Терапевтически эффективная дозировка соединения, фармацевтической композиции или их комбинаций зависит от вида индивидуума, массы тела, возраста и индивидуального состояния, нарушения или заболевания, подвергаемого лечению, или его тяжести. Врач, клиницист или ветеринар, являющийся средним специалистом в данной области, может без труда определить эффективное количество каждого из активных ингредиентов, необходимых для предупреждения, лечения или ингибирования прогрессирования нарушения или заболевания.
Цитированные выше свойства дозировок могут быть сопоставлены с помощью тестов in vitro и in vivo с использованием преимущественно млекопитающих, например, мышей, крыс, собак, не являющихся человеком приматов, таких как обезьяны, или их извлеченных органов, тканей и препаратов. Соединения по настоящему изобретению можно применять in vitro в форме растворов, например, предпочтительно водных растворов, и in vivo местным путем, ингаляционным путем, энтерально или парентерально, преимущественно внутривенно, например, в качестве суспензии или в водном растворе.
В одном варианте осуществления терапевтически эффективная дозировка соединения, описанного в настоящем описании, составляет от приблизительно 0,1 мг до приблизительно 1000 мг в сутки. Фармацевтические композиции должны обеспечивать дозировку от приблизительно 0,1 мг до приблизительно 1000 мг соединения. В особом варианте осуществления фармацевтические единичные дозированные формы получают для обеспечения от приблизительно 1 мг до приблизительно 1000 мг, от приблизительно 10 мг до приблизительно 500 мг, от приблизительно 20 мг до приблизительно 200 мг, от приблизительно 25 мг до приблизительно 100 мг, или от приблизительно 30 мг до приблизительно 60 мг активного ингредиента или комбинации необходимых ингредиентов на единичную дозированную форму. В особом варианте осуществления фармацевтические единичные дозированные формы получают для обеспечения приблизительно 1 мг, 5 мг, 10 мг, 20 мг, 25 мг, 50 мг, 100 мг, 250 мг, 500 мг, 1000 мг активного ингредиента.
ПРЕДПОЧТИТЕЛЬНЫЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
ОБЩИЕ МЕТОДИКИ СИНТЕЗА
Следующие примеры предоставлены для более полного понимания настоящего изобретения. Однако следует понимать, что эти варианты осуществления только обеспечивают способ применения настоящего на практике, и настоящее изобретение не ограничивается этими вариантами осуществления.
Главным образом, соединения, описанные в настоящем описании, можно получать способами, описанными в настоящем описании, где заместители являются такими, как определено для формулы (A) выше, за исключением случаев, когда дополнительно указано. Приведенные ниже неограничивающие схемы и примеры предоставлены для дополнительной иллюстрации изобретения.
Специалистам в данной области будет понятно, что описанные химические реакции можно без труда адаптировать для получения ряда других соединений, описанных в настоящем описании, и альтернативные способы получения соединений, описанных в настоящем описании, считаются входящими в объем, описанный в настоящем описании. Специалистам в данной области будет понятно, что исходные материалы могут варьироваться и дополнительные стадии могут использоваться для получения соединений, охватываемых настоящим изобретением, как демонстрируется с помощью следующих примеров. В некоторых случаях для обеспечения некоторых из описанных выше преобразований может быть необходима защита определенных реакционноспособных функциональных групп. Как правило, такая необходимость в защитных группах, а также условия, необходимые для присоединения и удаления таких групп, будут очевидными специалистам в области органического синтеза. Например, синтез не проиллюстрированных соединений по изобретению может быть успешно проведен посредством модификаций, известных специалистам в данной области, например, путем надлежащей защиты мешающих групп, посредством использования других подходящих реагентов, известных в данной области, отличных от описанных реагентов, и/или путем проведения стандартных модификаций условий реакций. Альтернативно, известные условия реакций или реакции, описанные в настоящем описании, могут считаться обладающими применимостью для получения других соединений, описанных в настоящем описании.
В примерах, описанных ниже, если нет иных указаний, все температуры приведены в градусах Цельсия. Реагенты приобретали от коммерческих поставщиков, таких как Aldrich Chemical Company, Arco Chemical Company и Alfa Chemical Company, и использовались без дальнейшей очистки, если нет иных указаний.
Получение соединений
Соединения по настоящему изобретению, включая их соли, сложные эфиры, гидраты или сольваты, можно получать с использованием любых известных методик органического синтеза, и они могут быть синтезированы любым из многочисленных возможных путей синтеза.
Реакции получения соединений по настоящему изобретению можно проводить в подходящих растворителях, которые могут быть без труда выбраны специалистом в области органического синтеза. Подходящие растворители могут быть по существу не реагирующими с исходными материалами (реактантами), промежуточными соединениями или продуктами при температурах, при которых реакции проводят, например, при температурах, которые могут находиться от температуры замерзания растворителя до температуры кипения растворителя. Данную реакцию можно проводить в одном растворителе или в смеси более чем одного растворителя. В зависимости от конкретной стадии реакции специалист в данной области может выбрать подходящие растворители для конкретной стадии реакции.
Мониторинг реакций можно проводить любым подходящим способом, известным в данной области. Например, мониторинг образования продукта можно проводить спектроскопическими способами, такими как ядерная магнитно–резонансная спектроскопия (например, 1H или 13C), инфракрасная спектроскопия, спектрофотометрия (например, в УФ–видимой области), масс–спектрометрия, или хроматографическими способами, такими как высокоэффективная жидкостная хроматография (ВЭЖХ), жидкостная хроматография–масс–спектроскопия (LCMS) или тонкослойная хроматография (TLC). Соединения могут быть очищенны специалистами в данной области различными способами, включая высокоэффективную жидкостную хроматографию (ВЭЖХ) ("Preparative LC–MS Purification: Improved Compound Specific Method Optimization" Karl F. Blom, Brian Glass, Richard Sparks, Andrew P. Combs J. Combi. Chem. 2004, 6(6), 874–883, которая включена в настоящее описание в качестве ссылки в полном объеме) и нормально–фазовую хроматографию на диоксиде кремния.
Соединения по настоящему изобретению можно синтезировать с использованием способов, описанных ниже, вместе со способами синтеза, известными в области синтетической органической химии, или их вариантов, как будет понятно специалистам в данной области. Предпочтительные способы включают, но не ограничиваются ими, способы, описанные ниже. В частности, соединения по настоящему изобретению формулы (A) можно синтезировать посредством следующих стадий, указанных на иллюстративных общих схемах синтеза, приведенных ниже, и сокращенные обозначения для реагентов или для химических групп реагентов, включенных в схемы синтеза, определены в примерах.
Основные схемы синтеза (1–13) представлены ниже:
Схема 1: Общий синтез Yq–замещенного бензо[d]тиазол–2–амина (XI)
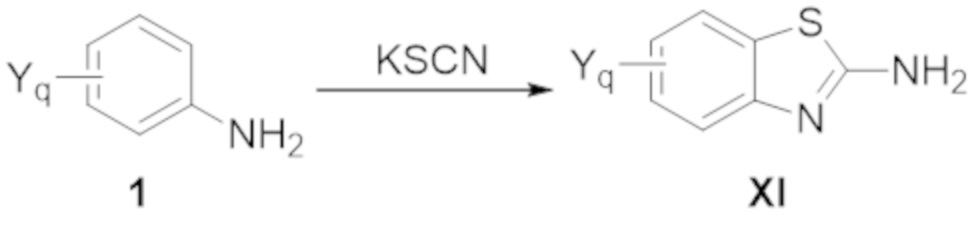
Синтез соединений формулы XI можно проводить согласно соответствующим методикам, описанным в ссылках (Synlett, 2012, 23, 15, 2219–2222; WO2013/163244 A1), но он не ограничивается этими описанными методиками. Таким образом, производное анилина 1 обрабатывают KSCN в подходящей системе растворителей с получением соединения XI.
Схема 2: Общий синтез Yq–замещенного бензо[d]оксазол–2–амина (XII)
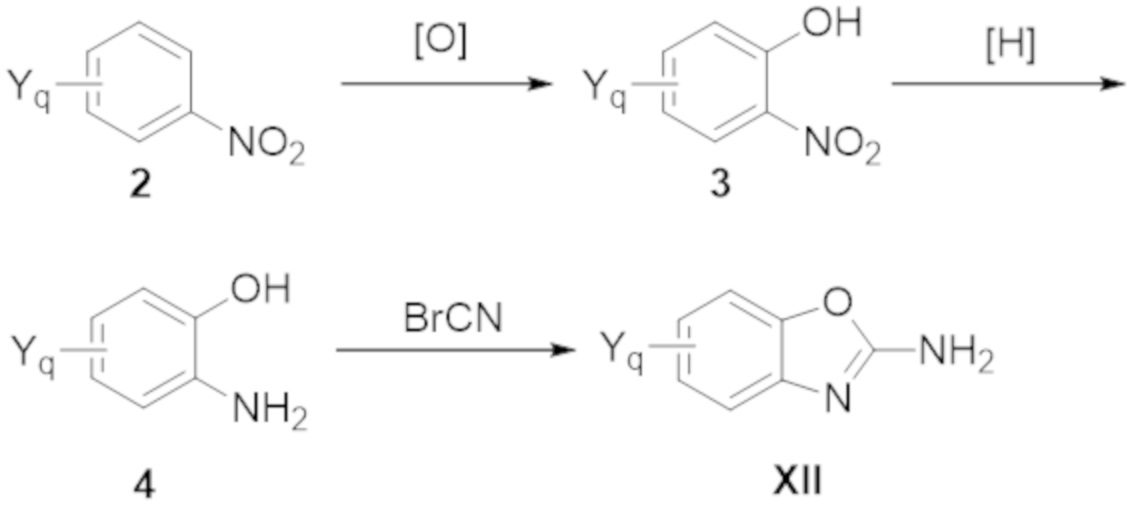
Синтез соединений формулы XII можно проводить согласно соответствующим методикам, описанным в ссылках (Journal of Organic Chemistry, 1990, 55, 17, 4979–4981; Tetrahedron Letters, 2011, 52, 34, 4392–4394; Bioorganic and Medicinal Chemistry Letters, 2014, 24, 15, 3521–3525), но он не ограничивается этими описанными методиками. Таким образом, производное нитробензола 2 окисляют с получением гидроксильного соединения 3 с последующей гидрогенизацией, полученное аминосоединение 4 обрабатывают BrCN в подходящей системе растворителей с получением соединения XII.
Схема 3: Общий синтез Yq–замещенного 1H–бензо[d]имидазол–2–амина (XIII)

Синтез соединений формулы XIII можно проводить согласно соответствующим методикам, описанным в ссылках (European Journal of Organic Chemistry, 2012, 11, 2123–2126; Journal of Medicinal Chemistry, 2014, 57, 17, 7325–7341; US2007/117818 A1), но он не ограничивается этими описанными методиками. Таким образом, производное нитробензола 5 преобразуют в соединение 6 с последующей гидрогенизацией, полученное диаминосоединение 7 обрабатывают BrCN в подходящей системе растворителей с получением соединения XIII.
Схема 4: Общий синтез Yq–замещенного бензо[d][1,3]селеназол–2–амина (XIV)
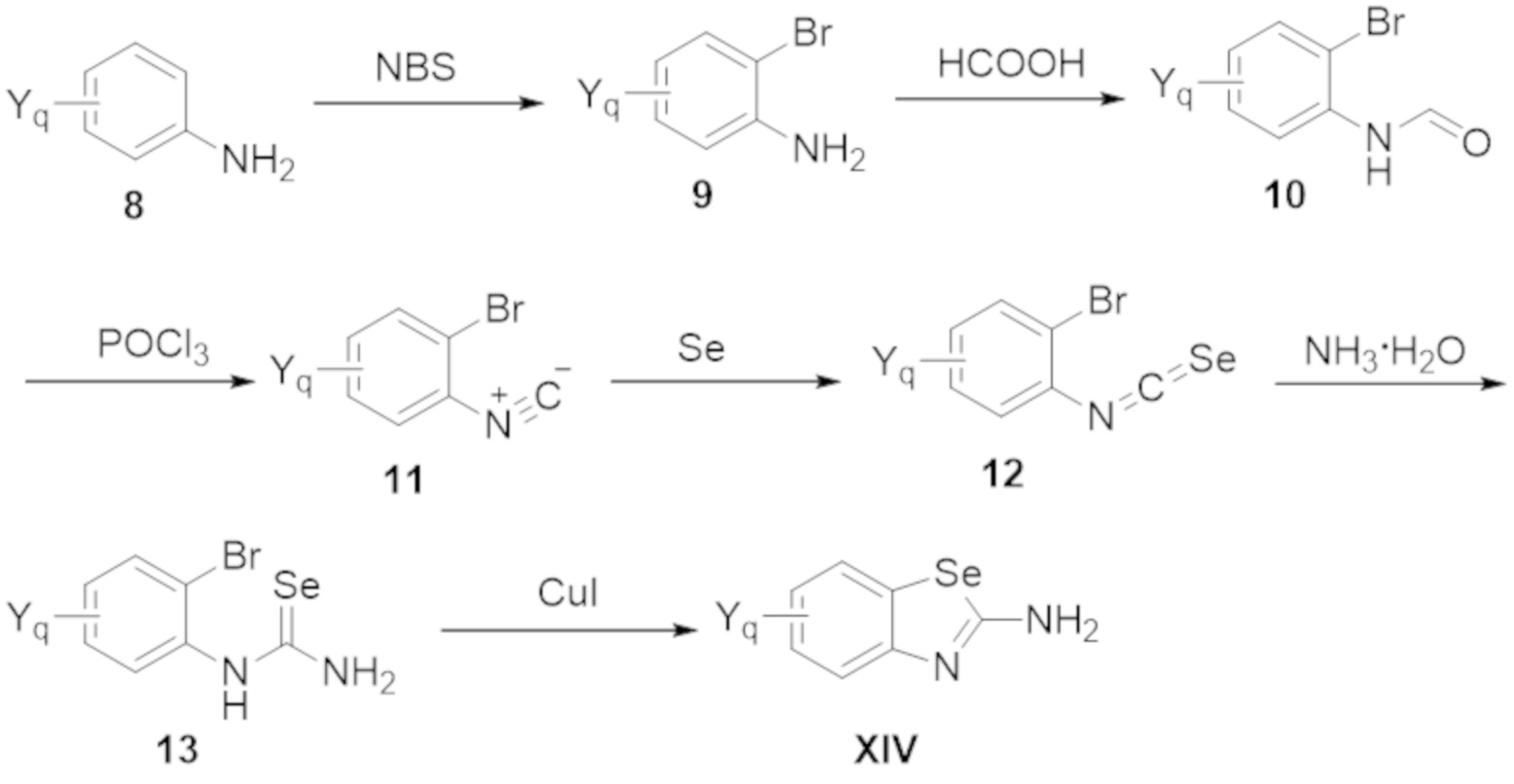
Синтез соединений формулы XIV можно проводить согласно соответствующим методикам, описанным в ссылках (European Journal of Medicinal Chemistry, 2015, 96, 92–97; Synthesis, 2016, 48, 01, 85–96; European Journal of Organic Chemistry, 2011, 25, 4756–4759), но он не ограничивается этими описанными методиками. Таким образом, производное анилина 8 бромируют с получением соединения 9, которое далее преобразуют в амидное соединение 10. Соединение 10 обрабатывают POCl3 с получением 11, после чего следует последовательная обработка Se и NH4OH, и полученное соединение 13 циклизуют в подходящей системе растворителей с получением соединения XIV.
Схема 5: Общий синтез Yq–замещенного тиазолo[5,4–b]пиридин–2–амина (XV)
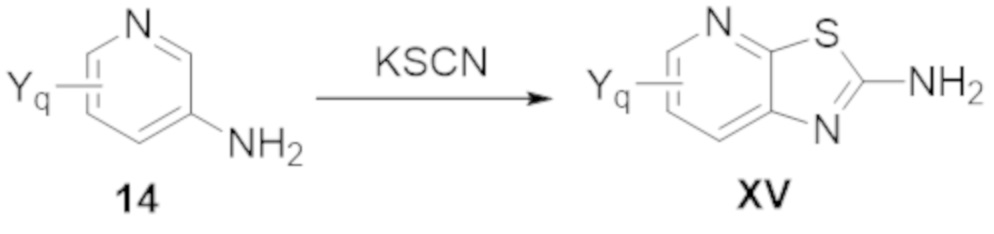
Синтез соединений формулы XV можно проводить согласно соответствующим методикам, описанным в ссылках (Journal of Medicinal Chemistry, 2009, 52, 19, 6142–6152; US2009/270405 A1), но он не ограничивается этими описанными методиками. Таким образом, производное аминопиридина 14 обрабатывают KSCN в подходящей системе растворителей с получением соединения XV.
Схема 6: Общий синтез Yq–замещенного оксазолo[5,4–b]пиридин–2–амина (XVI)
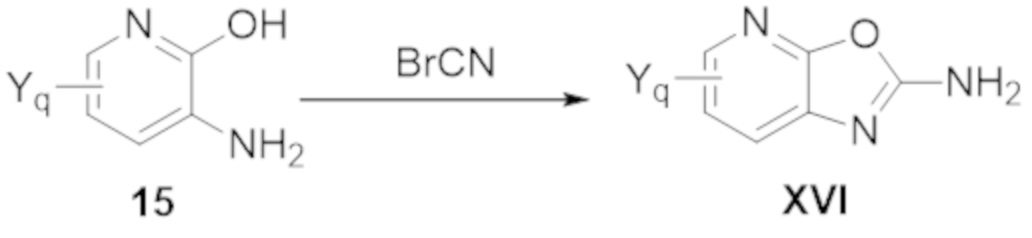
Синтез соединений формулы XVI можно проводить согласно соответствующим методикам, описанным в ссылках (WO2013/177024 A1; WO2009/147431 A1), но он не ограничивается этими описанными методиками. Таким образом, производное пиридина 15 обрабатывают BrCN в подходящей системе растворителей с получением соединения XVI.
Схема 7: Общий синтез Yq–замещенного 3H–имидазо[4,5–b]пиридин–2–амина (XVII)
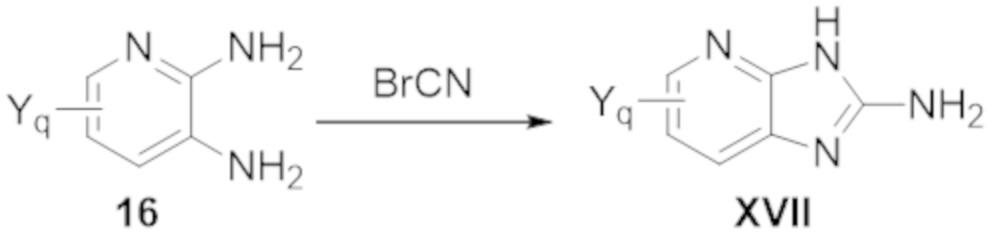
Синтез соединений формулы XVII можно проводить согласно соответствующим методикам, описанным в ссылках (Chemical Communications, 2014, 50, 85, 12911–12914; Journal of Medicinal Chemistry, 2014, 57, 13, 5702–5713), но он не ограничивается этими описанными методиками. Таким образом, производное диаминопиридина 16 обрабатывают BrCN в подходящей системе растворителей с получением соединения XVII.
Схема 8: Общий синтез Yq–замещенного [1,3]селеназоло[5,4–b]пиридин–2–амина (XVIII)
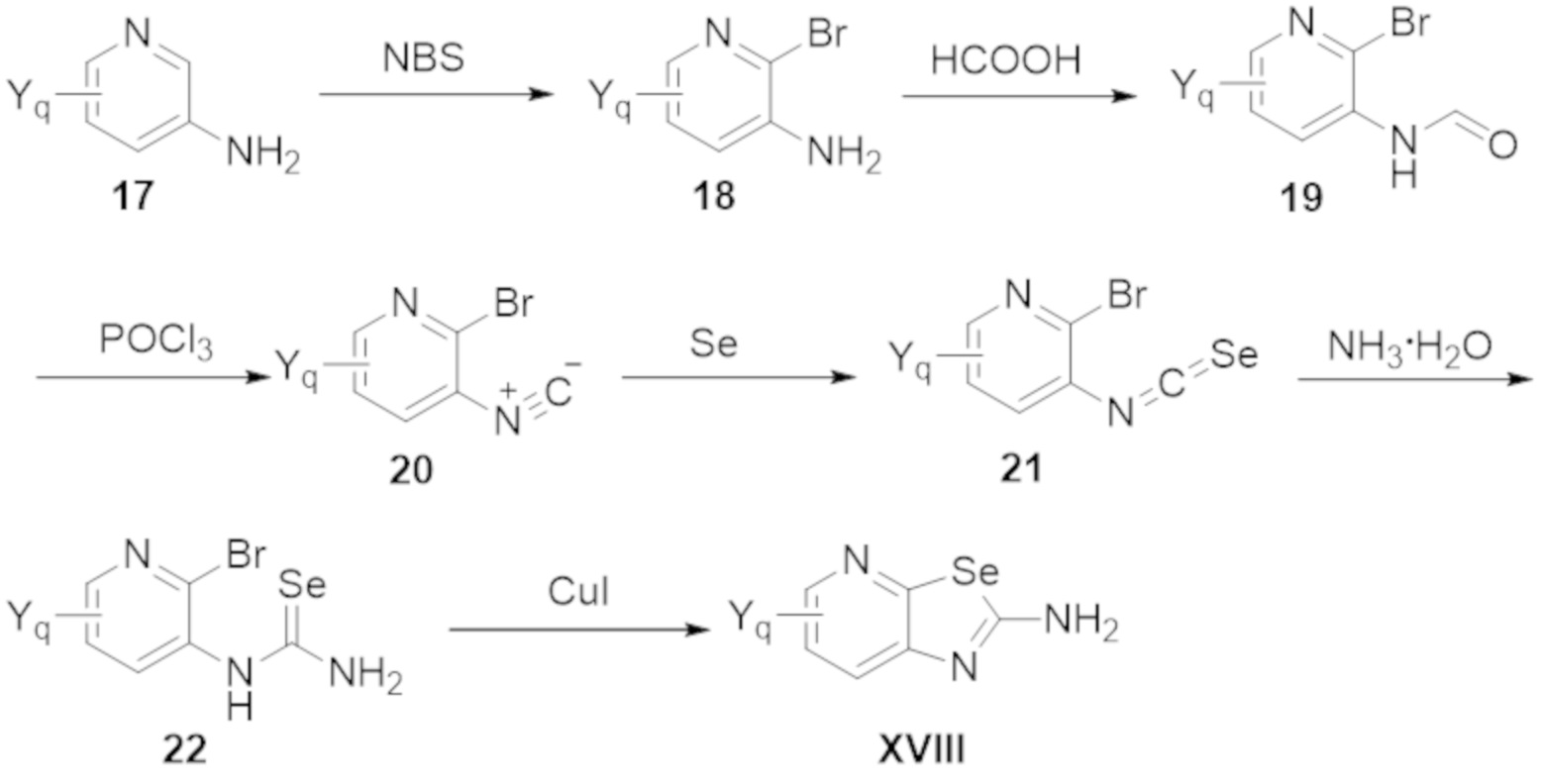
Синтез соединений формулы XVIII можно проводить согласно соответствующим методикам, описанным в ссылках (US2003/171395 A1; Synthesis, 2001, 14, 2175–2179; Synthesis, 2016, 48, 01, 85–96; European Journal of Organic Chemistry, 2011, 25, 4756–4759), но он не ограничивается этими описанными методиками. Таким образом, производное аминопиридина 17 бромируют с получением соединения 18, которое далее конвертируют в амидное соединение 19. Соединение 19 обрабатывают POCl3 с получением соединения 20, после чего следует последовательная обработка Se и NH4OH, и полученное соединение 22 циклизуют в подходящей системе растворителей с получением соединения XVIII.
Схема 9: Общий синтез Yq–замещенного тиазолo[4,5–b]пиридин–2–амина (XIX)
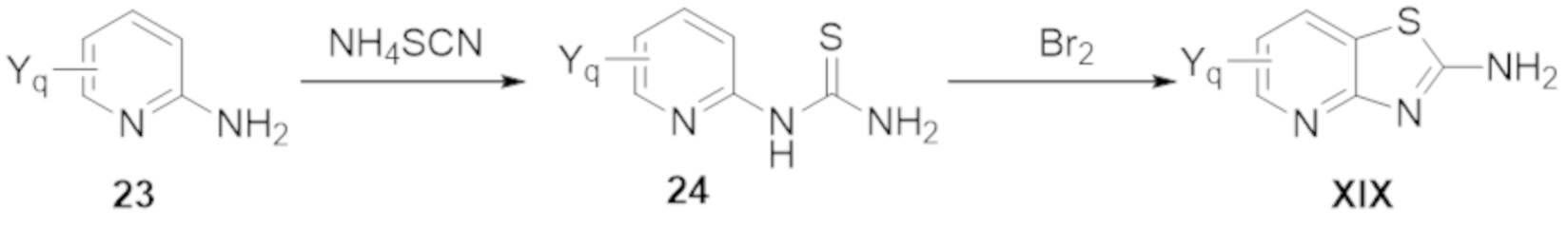
Синтез соединений формулы XIX можно проводить согласно соответствующим методикам, описанным в ссылках (Journal of Гетероcyclic Chemistry, 2003, 40, 2, 261–268; Phosphorus, Sulfur and Silicon and the Related Elements, 2006, 181, 7, 1665–1673), но он не ограничивается этими описанными методиками. Таким образом, производное аминопиридина 23 обрабатывают NH4SCN с получением соединения 24, которое далее циклизуют в подходящей системе растворителей с получением соединения XIX.
Схема 10: Общий синтез Yq–замещенного оксазолo[4,5–b]пиридин–2–амина (XX)
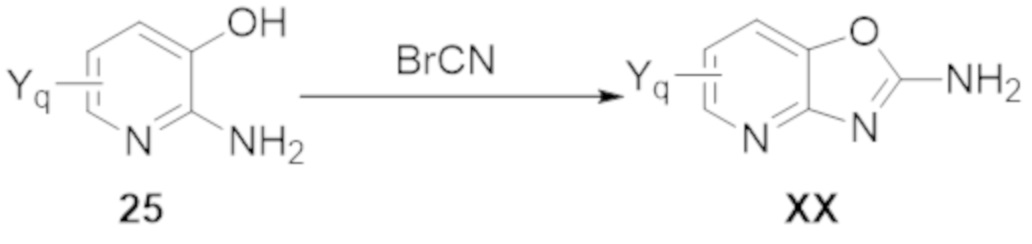
Синтез соединений формулы XX можно проводить согласно соответствующим методикам, описанным в ссылках (US2012/149718 A1; DE2239311), но он не ограничивается этими описанными методиками. Таким образом, производное пиридина 25 обрабатывают BrCN в подходящей системе растворителей с получением соединения XX.
Схема 11: Общий синтез Yq–замещенного 1H–имидазо[4,5–b]пиридин–2–амина (XXI)
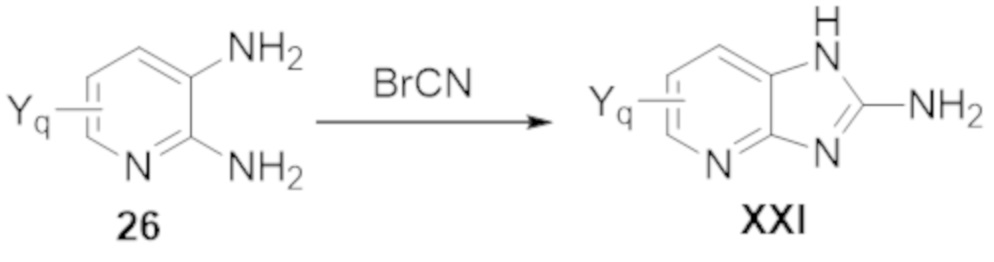
Синтез соединений формулы XXI можно проводить согласно соответствующим методикам, описанным в ссылках (Journal of Heterocyclic Chemistry, 1990, 27, 6, 1821–1824; Chemical Communications, 2014, 50, 85, 12911–12914), но он не ограничивается этими описанными методиками. Таким образом, производное диаминопиридина 26 обрабатывают BrCN в подходящей системе растворителей с получением соединения XXI.
Схема 12: Общий синтез Yq–замещенного [1,3]селеназоло[4,5–b]пиридин–2–амина (XXII)
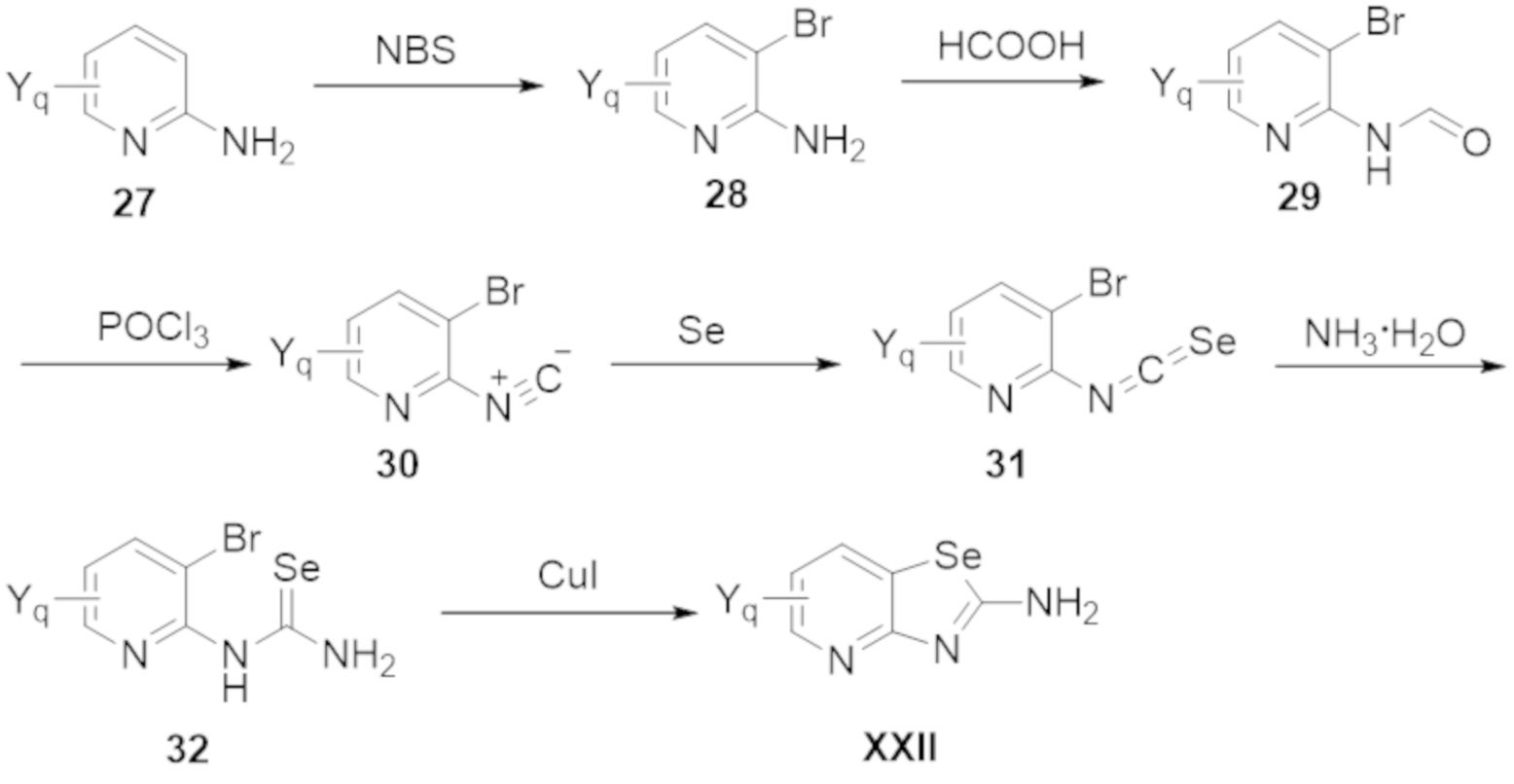
Синтез соединений формулы XXII можно проводить согласно соответствующим методикам, описанным в ссылках (Organic Letters, 2016, 18, 5, 984–987; European Journal of Medicinal Chemistry, 2015, 96, 92–97; European Journal of Organic Chemistry, 2011, 25, 4756–4759), но он не ограничивается этими описанными методиками. Таким образом, производное аминопиридина 27 бромируют с получением соединения 28, которое далее конвертируют в амидное соединение 29. Соединение 29 обрабатывают POCl3 с получением соединения 30, после чего следует последовательная обработка Se и NH4OH, и полученное соединение 32 циклизуют в подходящей системе растворителей с получением соединения XXII.
Схема 13: Общий синтез Yq–замещенного производного амина, имеющего формулу A
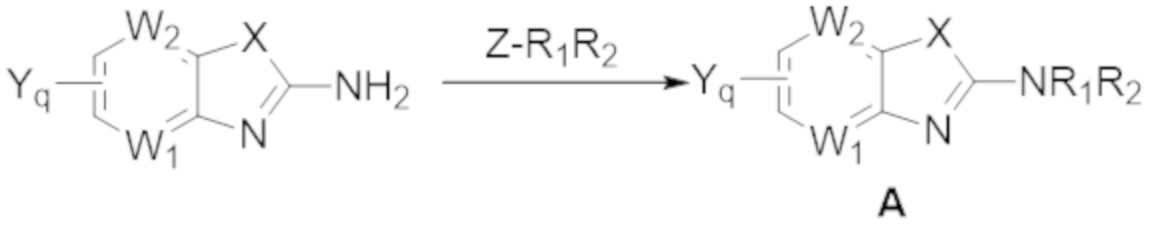
Синтез соединений формулы A можно проводить, начиная с аминосоединений, имеющих формулы I–XXII, согласно соответствующим методикам, описанным в источниках литературы, но он не ограничивается этими описанными методиками.
Где R1 и R2 не оба являются H, Z представляет собой уходящую группу, которая может быть выбрана из Cl, Br или I. Аминосоединения I–XXII можно конвертировать в соответствующие N–ацильные или N–ацилоксисоединения посредством типичных методик N–ацилирования (Journal of Medicinal Chemistry, 2012, 55, 11, 5554–5565; US2015/225407 A1, Bioorganic and Medicinal Chemistry, 2012, 20, 18, 5642–5648; WO2010/100144 A1).
Где R1 и R2 не оба являются H. Амино соединения I–XXII можно конвертировать в соответствующие N–алкильные соединения различными способами (Synlett, 2013, 24, 17, 2249–2254; Chemical Communications, 2012, 48, 4, 603–605; Journal of Medicinal Chemistry, 1999, 42, 15, 2828–2843; European Journal of Medicinal Chemistry, 2014, 74, 703–716; Angewandte Chemie–International Edition, 2015, 54, 31, 9042–9046; US2004/44258 A1).
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Эти и другие аспекты и преимущества вариантов осуществления настоящего изобретения станут очевидными и более понятными из приведенного ниже описания с отсылкой на прилагаемые схемы и чертежи, на которых:
на фиг.1A и 1B представлен ингибиторный эффект соединения I в отношении канала hNav1.2/1.7.
На фиг.2 представлены эффекты соединения I против аллодинии у крыс SNL.
На фиг.3 представлены фармакокинетические параметры соединения I у крыс.
Получение и охарактеризация иллюстративных соединений
Соединения, охватываемые настоящим изобретением, можно получать по различным схемам. Подробное описание способов получения 10 иллюстративных соединений по различным схемам представлено ниже, а также приводятся результаты охарактеризации.
Если нет иных указаний, все реагенты приобретали от коммерческих поставщиков без дальнейшей очистки. При необходимости использовали сушку растворителем. Пластины, использованные для тонкослойной хроматографии (TLC), представляли собой алюминивые пластины, предварительно покрытые силикагелем E. Merck 60F254 (толщина 0,24 нм), а затем визуализированные под УФ–излучением (365 нм и 254 нм) или посредством окрашивания 5% додекамолибдофосфорной кислотой в этаноле и последующего нагревания. Колоночную хроматографию проводили с использованием силикагеля (калибр 200–400) от коммерческих поставщиков. Спектры 1H–ЯМР регистрировали на спектрометре Agilent 400–MR NMR (400,00 МГц для 1H) при комнатной температуре. В качестве эталона для 1H NMR использовали сигнал растворителя (CDCl3, 7,26 м.д.; CD3OD, 3,31 м.д.; DMSO–d6, 2,50 м.д.; D2O, 4,79 м.д.). Для пояснения множественностей использовали следующие сокращения: с=синглет, д=дуплет, т=триплет, кв=квартет, ушир. с=уширенный синглет, дд=двойной дуплет, тд=тройной дуплет, дт=двойной триплет, дкв=двойной квартет, м=мультиплет. Другие сокращенные обозначения, используемые в детальном описании экспериментов, являются следующими: δ=химический сдвиг в миллионных долях относительно тетраметилсилана, Ar=арил, Ac=ацил, Boc=трет–бутилоксикарбонил, Bn=бензил, DCM=дихлорметан, DMF=N, N′–диметилформамид, DIPEA=диизопропилэтиламин, DMAP=4–(диметиламино)пиридин, DMSO=диметилсульфоксид, EA=этилацетат, Et=этил, Me=метил, Hz=Герц, ВЭЖХ=высокоэффективная жидкостная хроматография, J=константа взаимодействия (в ЯМР), мин=минута(ы), ч=час(ы), ЯМР=ядерный магнитный резонанс, преп=препаративный, t–Bu=трет–бутил, iPr=изопропил, TBAF=фторид тетрабутиламмония, трет=третичный, TFA=трифторуксусная кислота, THF=тетрагидрофуран, TLC=тонкослойная хроматография.
Примеры
Следует отметить, что варианты осуществления настоящего изобретения, подробно описанные ниже, являются иллюстративными только для пояснения настоящего изобретения, и их не следует считать ограничивающими настоящее изобретение. Примеры без конкретной технологии или условий могут быть выполнены в соответствии с технологией или условиями, приведенными в документах в данной области, или в соответствии с инструкциями к продукту. Реагенты или устройства без производителей доступны посредством общепринятой покупки. Специалистам в данной области будет понятно, что исходные материалы могут варьироваться и дополнительные стадии могут быть использованы для получения соединений, охватываемых настоящим изобретением, как демонстрируется с помощью следующих примеров.
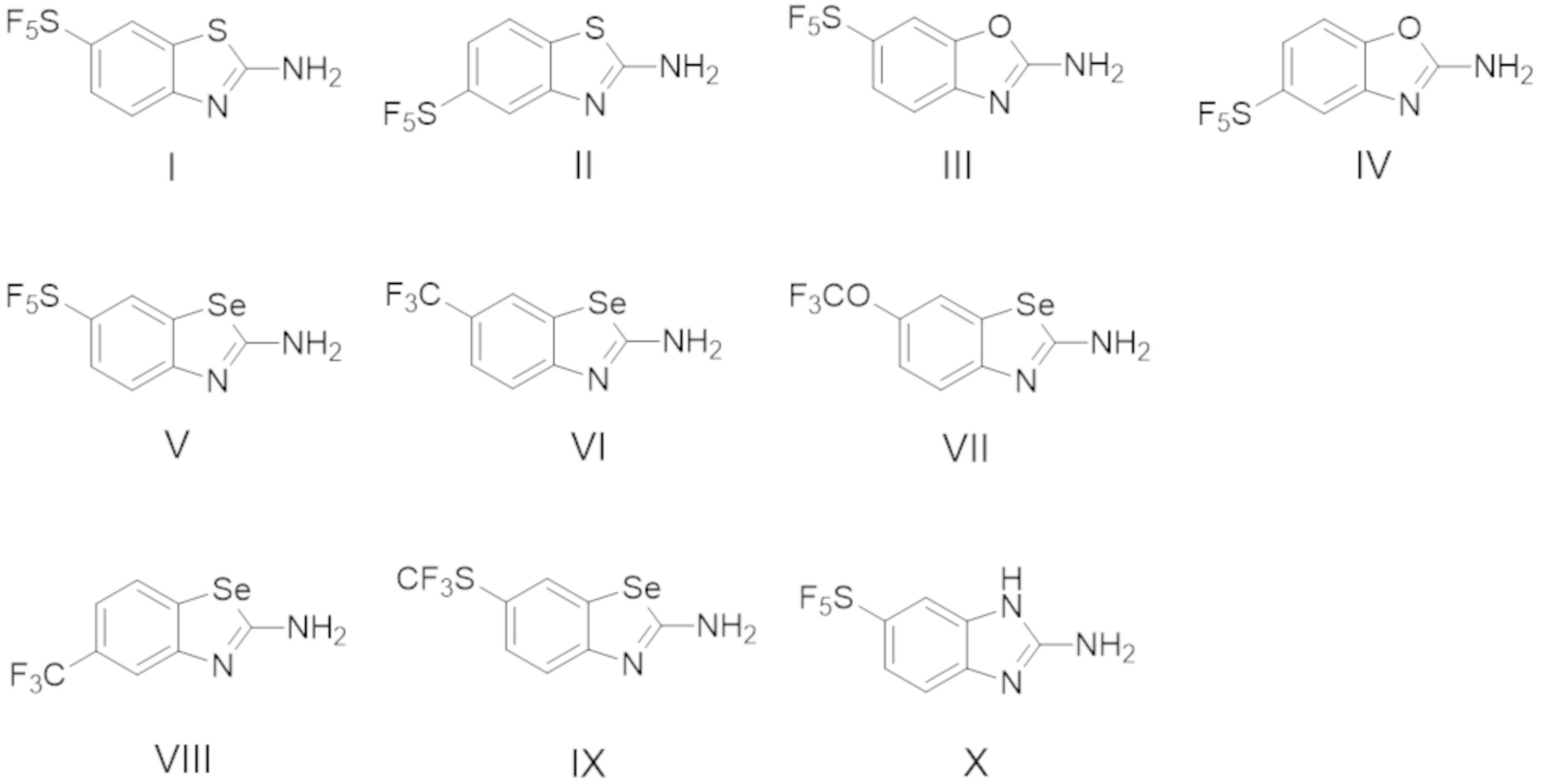
Пример 1: 6–(пентафторсульфанил)бензо[d]тиазол–2–амин (I)
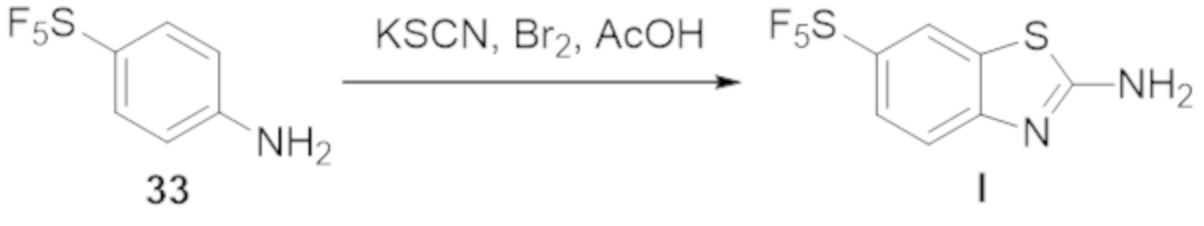
К перемешиваемому раствору 4–(пентафторсульфанил)анилина (33) (500 мг, 2,28 ммоль) в AcOH (10 мл) добавляли KSCN (265 мг, 2,73 ммоль) одной порцией при 20°C. После перемешивания в течение 30 мин реакционную смесь охлаждали до 0°C и капельно добавляли раствор Br2 (365 мг, 2,28 ммоль) в AcOH (1 мл). Затем ледяную баню удаляли и реакционную смесь перемешивали при 20°C в течение 16 ч. Смесь переливали в воду (100 мл) и экстрагировали CH2Cl2 (3×30 мл). Объединенную органическую фазу промывали насыщенным водным раствором NaHCO3 (15 мл), насыщенным водным раствором рассола (15 мл), сушили над безводным Na2SO4 и упаривали. Остаток очищали препаративной ВЭЖХ с получением указанного в заголовке соединения I (378 мг, 60%) в виде белого твердого вещества.
1H–ЯМР (400 МГц, DMSO–d6) δ=8,34 (д, J=2,0 Гц, 1 H), 7,97 (с, 2 H), 7,68 (дд, J=2,2 Гц, 9,0 Гц, 1 H), 7,40 (д, J=9,2 Гц, 1 H);
MS (ESI): [M+H+] = 276,9.
Пример 2: 5–(пентафторсульфанил)бензо[d]тиазол–2–амин (II)
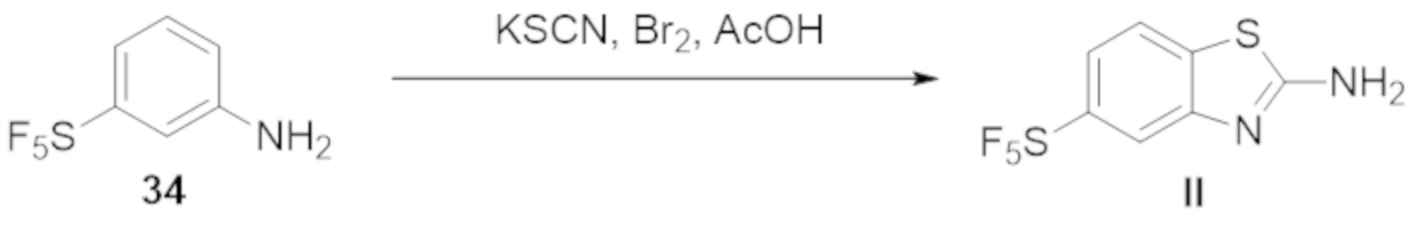
К перемешиваемому раствору 3–(пентафторсульфанил)анилина (34) (400 мг, 1,83 ммоль) в AcOH (8 мл) добавляли KSCN (355 мг, 3,65 ммоль) одной порцией при 20°C. После перемешивания в течение 30 мин реакционную смесь охлаждали до 0°C и капельно добавляли раствор Br2 (292 мг, 1,83 ммоль) в AcOH (1 мл). Затем ледяную баню удаляли, реакционную смесь перемешивали при 20°C в течение 16 ч. Смесь переливали в воду (100 мл) и экстрагировали CH2Cl2 (3×30 мл). Объединенную органическую фазу промывали насыщенным водным раствором NaHCO3 (15 мл), насыщенным водным раствором рассола (15 мл), сушили над безводным Na2SO4 и упаривали. Осадок очищали колоночной хроматографией (силикагель, петролейный эфир/EtOAc =10:1–2:1) с получением указанного в заголовке соединения II (135 мг, 27%) в виде белого твердого вещества.
1H ЯМР (400 МГц, DMSO–d6) δ=7,90 (br. s, 2 H), 7,87 (с, 1 H), 7,73 (д, J=2,4 Гц, 1 H), 7,50 (дд, J=2,0, 8,8 Гц, 1 H);
MS (ESI): [M+H+] = 276,8.
Пример 3: 6–(пентафторсульфанил)бензо[d]оксазол–2–амин (III)
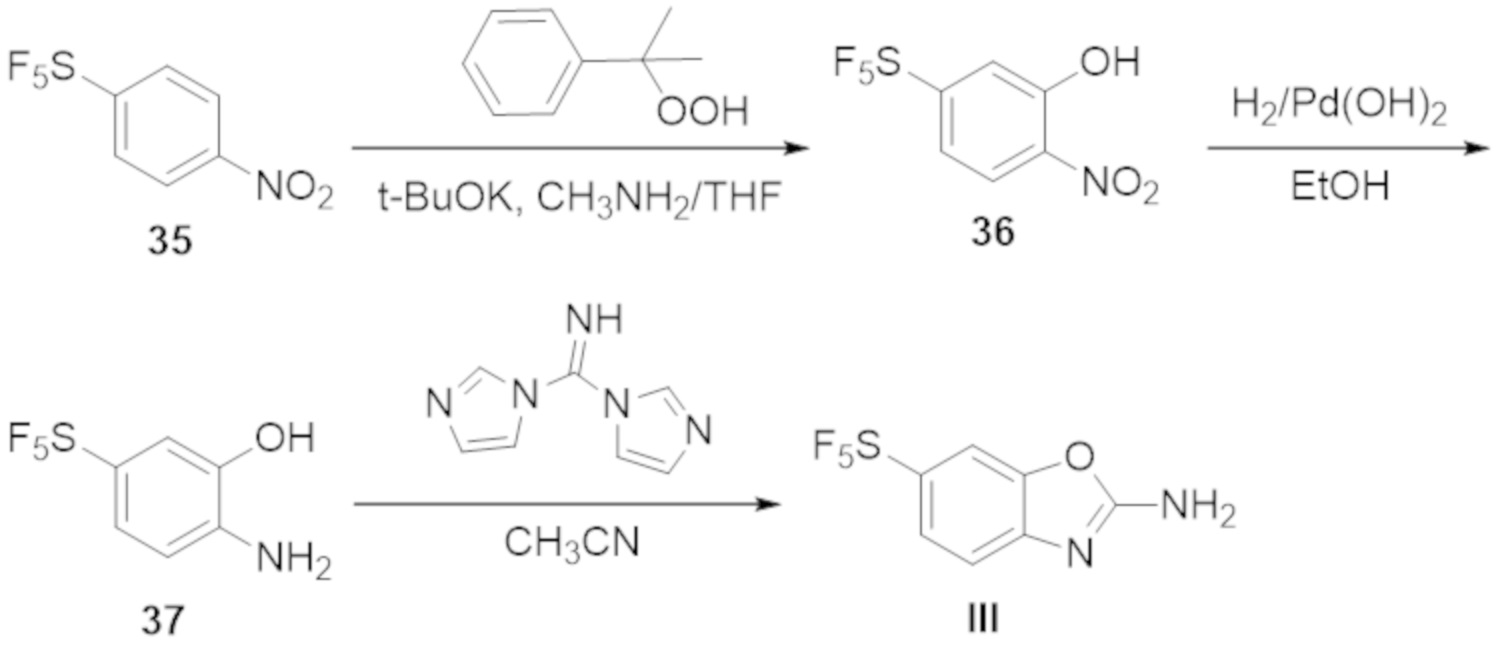
Стадия 1: 2–нитро–5–(пентафторсульфанил)фенол (36)
К перемешиваемому раствору t–BuOK (337 мг, 3 ммоль) в CH3NH2 (2 M в THF, 5 мл) при –50°C капельно добавляли раствор 1–нитро–4–(пентафторсульфанил)бензола (35) (249 мг, 1 ммоль) и гидропероксида кумена (80%, 0,2 мл, 1,1 ммоль) в сухом THF (1 мл). Полученную коричневую смесь перемешивали при –50°C в течение 15 мин, а затем добавляли твердый NH4Cl (1 г) и CH3NH2 выпаривали. Полученную смесь обрабатывали водным раствором HCl (1 M) до pH 1 и экстрагировали CH2Cl2 (3×20 мл). Объединенные органические экстракты промывали водным NaOH (0,5 M, 3×15 мл), щелочные экстракты собирали и подкисляли водным раствором HCl (6 M) до pH 1, а затем экстрагировали CH2Cl2 (3×20 мл). Объединенную органическую фазу сушили над безводным MgSO4 и упаривали. Остаток очищали колоночной хроматографией (силикагель, петролейный эфир/EtOAc =20:1) с получением указанного в заголовке соединения 36 (238 мг, 90%) в виде желтого масла.
1H–ЯМР (400 МГц, CDCl3) δ=10,56 (ушир. с, 1 H), 8,23 (д, J=9,2 Гц, 1 H), 7,62 (д, J=2,4 Гц, 1 H), 7,40 (дд, J=2,4, 9,6 Гц, 1 H).
Стадия 2: 2–амино–5–(пентафторсульфанил)фенол (37)
К раствору 2–нитро–5–(пентафторсульфанил)фенола (36) (616 мг, 2,32 ммоль) в этаноле (5 мл) добавляли Pd(OH)2 (200 мг, 10% на угле). Смесь перемешивали в атмосфере H2 в течение 3 ч. Смесь фильтровали и фильтрат концентрировали с получением указанного в заголовке соединения 37 (448 мг, 82%) в виде желтого масла.
1H–ЯМР (400 МГц, CDCl3) δ=7,21 (дд, J=2,0, 8,4 Гц, 1 H), 7,12 (д, J=2,0 Гц, 1 H), 6,67 (д, J=8,8 Гц, 1 H), 4,88 (ушир. с, 1 H), 4,08 (ушир. с, 2 H).
Стадия 3: 6–(пентафторсульфанил)бензо[d]оксазол–2–амин (III)
К перемешиваемому раствору 2–амино–5–(пентафторсульфанил)фенола (37) (410 мг, 1,74 ммоль) в CH3CN (10 мл) добавляли ди(1H–имидазол–1–ил)метанимин (562 мг, 3,49 ммоль) одной порцией при 20°C. Реакционную смесь перемешивали при 80°C в течение 6 ч. Растворитель выпаривали и остаток очищали колоночной хроматографией (силикагель, петролейный эфир/EtOAc =10:1–2:1) с получением указанного в заголовке соединения III (296 мг, 65%) в виде белого твердого вещества.
1H–ЯМР (400 МГц, DMSO–d6) δ=7,99 (д, J=2,0 Гц, 1 H), 7,96 (с, 2 H), 7,64 (дд, J=2,0, 8,4 Гц, 1 H), 7,30 (д, J=8,8 Гц, 1 H);
MS (ESI): [M+H+] = 260,7.
Пример 4: 5–(пентафторсульфанил)бензо[d]оксазол–2–амин (IV)
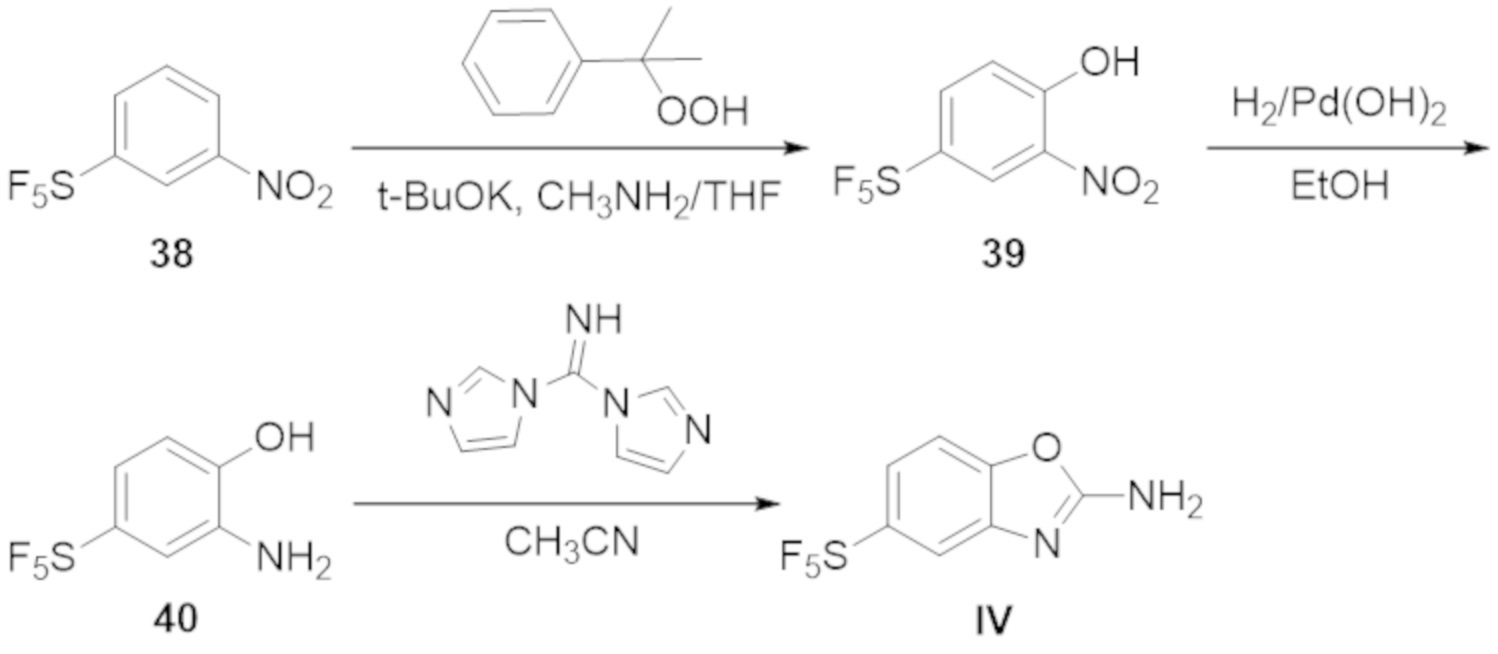
Стадия 1: 2–нитро–4–(пентафторсульфанил)фенол (39)
К перемешиваемому раствору t–BuOK (100 мг, 3 ммоль) в CH3NH2 (2 M в THF, 2 мл) при –50°C капельно добавляли раствор 1–нитро–4–(пентафторсульфанил)бензола (38) (249 мг,1 ммоль) и гидропероксида кумена (80%, 84 мг, 1,1 ммоль) в сухом THF (1 мл). Полученную коричневую смесь перемешивали при –50°C в течение 15 мин, а затем добавляли твердый NH4Cl (1 г) и CH3NH2 упаривали. Полученную смесь обрабатывали водным раствором HCl (1 M) до pH 1 и экстрагировали DCM (3×20 мл). Объединенные органические экстракты промывали водным раствором NaOH (0,5 M, 3×15 мл), щелочные растворы собирали и подкисляли водным раствором HCl (6 M) до pH 1, а затем экстрагировали CH2Cl2 (3×20 мл). Объединенную органическую фазу сушили над безводным MgSO4 и упаривали. Неочищенный продукт 39 получали в виде желтого масла (265 мг, 100%), которое использовали на следующей стадии без дальнейшей очистки.
1H–ЯМР (400 МГц, CDCl3) δ=10,78 (ушир. с, 1 H), 8,57 (с, 1 H), 7,96 (д, J=8,4 Гц, 1 H), 7,51 (с, 1 H).
Стадия 2: 2–амино–4–(пентафторсульфанил )фенол (40)
К раствору 2–нитро–4–(пентафторсульфанил)фенола (39) (150 мг, 0,40 ммоль) в этаноле (3 мл) добавляли Pd(OH)2 (80 мг, 10% на угле). Смесь перемешивали в атмосфере H2 в течение 3 ч. Смесь фильтровали и фильтрат концентрировали с получением неочищенного продукта, который очищали препаративной TLC (силикагель, петролейный эфир/EtOAc =3:1) с получением указанного в заголовке соединения 40 (70 мг, 74%) в виде желтого масла.
1H–ЯМР (400 МГц, CDCl3) δ=7,14 (д, J=2,4 Гц, 1 H), 7,07 (дд, J=2,0, 8,8 Гц, 1 H), 6,72 (д, J=8,8 Гц, 1 H), 5,40 (ушир. с, 1 H);
MS (ESI): [M+H+] = 235,8.
Стадия 3: 5–(пентафторсульфанил)бензо[d]оксазол–2–амин (IV)
К перемешиваемому раствору 2–амино–4–(пентафторсульфанил)фенола (40) (70 мг, 0,30 ммоль) в CH3CN (1 мл) добавляли ди(1H–имидазол–1–ил)метанимин (96 мг, 0,60 ммоль) одной порцией при 20°C. Реакционную смесь перемешивали при 80°C в течение 6 ч. Растворитель выпаривали и остаток очищали колоночной хроматографией (силикагель, петролейный эфир/EtOAc =10:1–2:1) с получением указанного в заголовке соединения IV (56 мг, 72%) в виде белого твердого вещества.
1H–ЯМР (400 МГц, DMSO–d6) δ=7,85 (с, 2 H), 7,68 (с, 1 H), 7,52 (с, 1 H);
MS (ESI): [M+H+] = 260,8.
Пример 5: 6-(пентафторсульфанил)бензо[d][1,3]селеназол–2–амин (V)
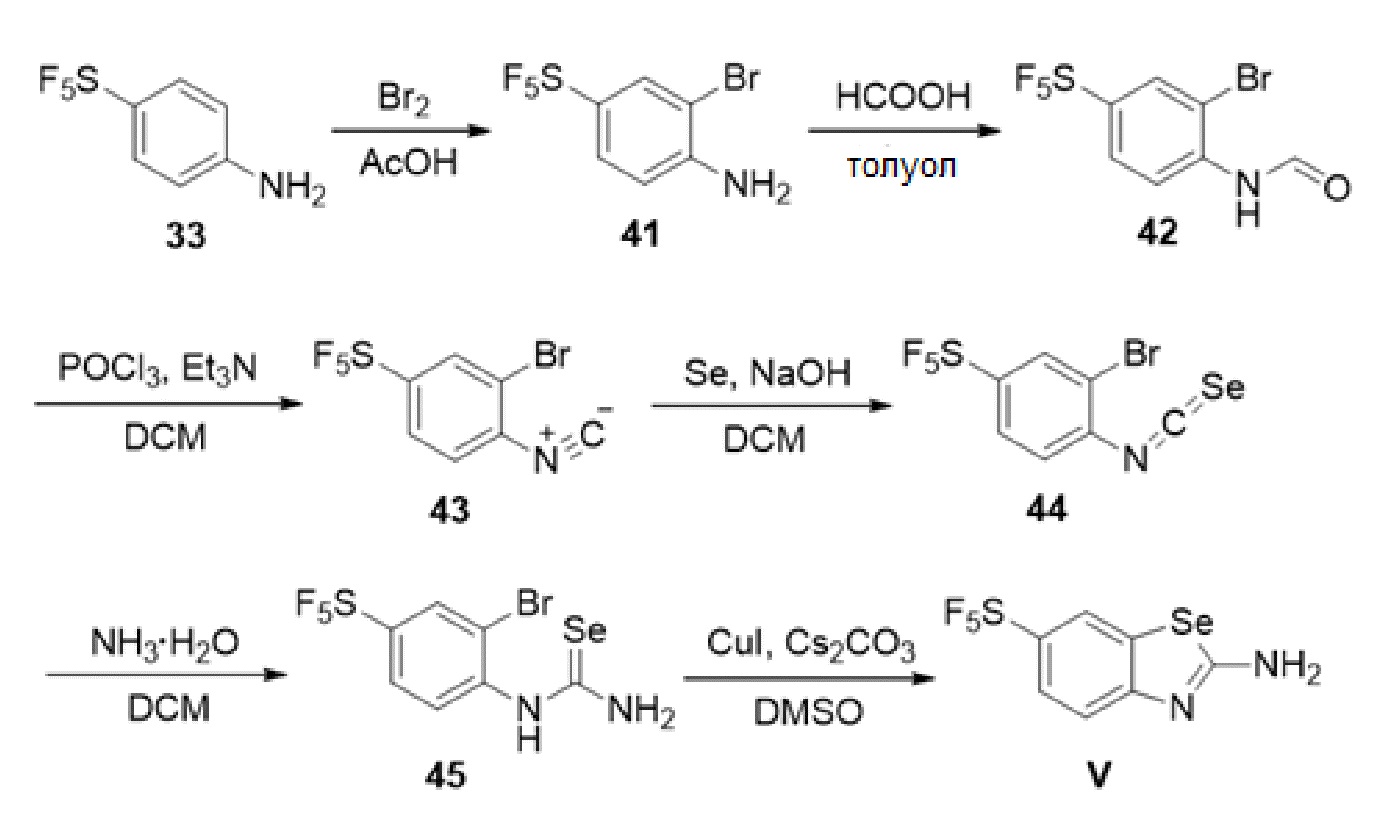
Стадия 1: 2–бром–4–(пентафторсульфанил)анилин (41)
К перемешиваемому раствору 4–(пентафторсульфанил)анилина (33) (500,0 мг, 2,28 ммоль) в AcOH (5,0 мл) добавляли раствор Br2 (364,6 мг, 2,28 ммоль) в AcOH (1,0 мл) медленно при 10°C. Смесь перемешивали при 10°C в течение 3 ч. Смесь гасили ледяной водой (60 мл), экстрагировали EtOAc (2×30 мл), объединенные экстракты сушили над безводным Na2SO4 и концентрировали. Остаток очищали колоночной хроматографией (силикагель, петролейный эфир/EtOAc =20:1–10:1) с получением указанного в заголовке соединения 41 (648 мг, 96%) в виде желтого твердого вещества.
1H–ЯМР (400 МГц, CDCl3) δ=7,81 (д, J=2,4 Гц, 1 H), 7,49 (дд, J=2,4, 9,2 Гц, 1 H), 6,71 (д, J=9,2 Гц, 1 H), 4,46 (с, 2 H).
Стадия 2: N–(2–бром–4–(пентафторсульфанил)фенил)формамид (42)
К перемешиваемому раствору 2–бром–4–(пентафторсульфанил)анилина (41) (1,54 г, 5,17 ммоль) в сухом толуоле (20 мл) капельно добавляли HCOOH (4,0 мл, 103,30 ммоль) при 20°C. Реакционную смесь перемешивали при 100°C в течение 16 ч. Реакционную смесь охлаждали до 30°C, а заем разбавляли EtOAc (60 мл), последовательно промывали водой (30 мл) и насыщенным водным раствором рассола (30 мл), сушили над безводным Na2SO4 и концентрировали. Остаток очищали колоночной хроматографией (силикагель, петролейный эфир/EtOAc =20:1–5:1) с получением указанного в заголовке соединения 42 (1,63 г, 97%) в виде желтого твердого вещества.
1H–ЯМР (400 МГц, DMSO–d6) δ=10,07 (с, 1 H), 8,44 (с, 1 H), 8,39 (д, J=8,8 Гц, 1 H), 8,22 (д, J=2,4 Гц, 1 H), 7,96 (дд, J=2,4, 8,8 Гц, 1 H).
Стадия 3: 2–бром–1–изоциано–4–(пентафторсульфанил)бензол (43)
К раствору N–(2–бром–4–(пентафторсульфанил)фенил)формамида (42) (400 мг, 1,23 ммоль) в сухом CH2Cl2 (10 мл) добавляли Et3N (0,5 мл, 3,68 ммоль) при 0°C, а затем POCl3 (282 мг, 1,84 ммоль). Реакционную смесь перемешивали при 0~20°C в течение 3 ч. После этого медленно добавляли насыщенный водный раствор Na2CO3. После перемешивания в течение 30 мин водную фазу экстрагировали CH2Cl2 (2×20 мл). Объединенные органические фазы сушили над безводным Na2SO4 и концентрировали. Остаток очищали колоночной хроматографией (силикагель, петролейный эфир/EtOAc =50:1–20:1) с получением указанного в заголовке соединения 43 (236 мг, 62%) в виде темного масла.
1H–ЯМР (400 МГц, CDCl3) δ=8,08 (д, J=2,0 Гц, 1 H), 7,78 (дд, J=2,0, 8,8 Гц, 1 H), 7,56 (д, J=8,8 Гц, 1 H).
Стадия 4: 2–бром–1–изоселеноцианат–4–(пентафторсульфанил)бензол (44)
К суспензии 2–бром–1–изоциано–4–(пентафторсульфанил)бензола (43) (517 мг, 1,68 ммоль) в CH2Cl2 (10 мл) добавляли порошковый Se (398 мг, 5,03 ммоль), хлорид бензилтриэтиламмония (19,10 мг, 0,084 ммоль), а затем добавляли водный раствор NaOH (50%, 0,5 мл). Реакционную смесь перемешивали при 40°C в течение 3 ч. После этого реакционную смесь разбавляли CH2Cl2 (20 мл), последовательно промывали водой (10 мл) и насыщенным водным раствором рассола (10 мл), сушили над безводным Na2SO4 и концентрировали. Остаток очищали колоночной хроматографией (силикагель, петролейный эфир/EtOAc =50:1–20:1) с получением указанного в заголовке соединения 44 (308 мг, 47%) в виде желтого масла.
1H–ЯМР (400 МГц, CDCl3) δ=8,00 (д, J=2,4 Гц, 1 H), 7,71 (дд, J=2,4, 9,2 Гц, 1 H), 7,39 (д, J=8,8 Гц, 1 H).
Стадия 5: 1–(2–бром–4–(пентафторсульфанил)фенил)селеномочевина (45)
К суспензии 2–бром–1–изоселеноцианат–4–(пентафторсульфанил)бензола (44) (308 мг, 0,80 ммоль) в CH2Cl2 (6 мл) добавляли NH4OH (134 мг, 25% в воде) при 20°C. Смесь перемешивали при 20°C в течение 15 мин. Растворители в смеси упаривали с получением указанного в заголовке соединения 45 (322 мг, 100%) в виде белого твердого вещества.
1H–ЯМР (400 МГц, DMSO–d6) δ=9,88 (с, 1 H), 8,64 (с, 1 H), 8,19 (д, J=2,0 Гц, 1 H), 7,96 (ушир. с, 1 H), 7,90 (дд, J=2,4, 8,8 Гц, 1 H), 7,78 (д, J=8,4 Гц, 1 H).
Стадия 6: 6–(пентафторсульфанил)бензо[d][1,3]селеназол–2–амин (V)
К перемешиваемому раствору 1–(2–бром–4–(пентафторсульфанил)фенил)селеномочевины (45) (322 мг, 0,80 ммоль) в DMSO (6 мл) добавляли CuI (15 мг, 0,08 ммоль), 1,10–фенанатролин (14 мг, 0,08 ммоль) при 20°C, а затем добавляли Cs2CO3 (130 мг, 0,40 ммоль). Реакционную смесь перемешивали при 80°C в атмосфере азота в течение 30 мин. После этого реакционную смесь гасили ледяной водой (60 мл), экстрагировали EtOAc (2×30 мл). Объединенную органическую фазу промывали насыщенным водным раствором рассола (30 мл), сушили над безводным Na2SO4 и концентрировали. Остаток очищали препаративной ВЭЖХ с получением указанного в заголовке соединения V (15 мг, 6%) в виде белого твердого вещества.
1H–ЯМР (400 МГц, DMSO–d6) δ=8,30 (д, J=2,4 Гц, 1 H), 8,00 (с, 2 H), 7,64 (дд, J=2,4, 8,8 Гц, 1 H), 7,33 (д, J=8,8 Гц, 1 H);
MS (ESI): [M+H+] = 324,7.
Пример 6: 6–(трифторметил)бензо[d][1,3]селеназол–2–амин (VI)
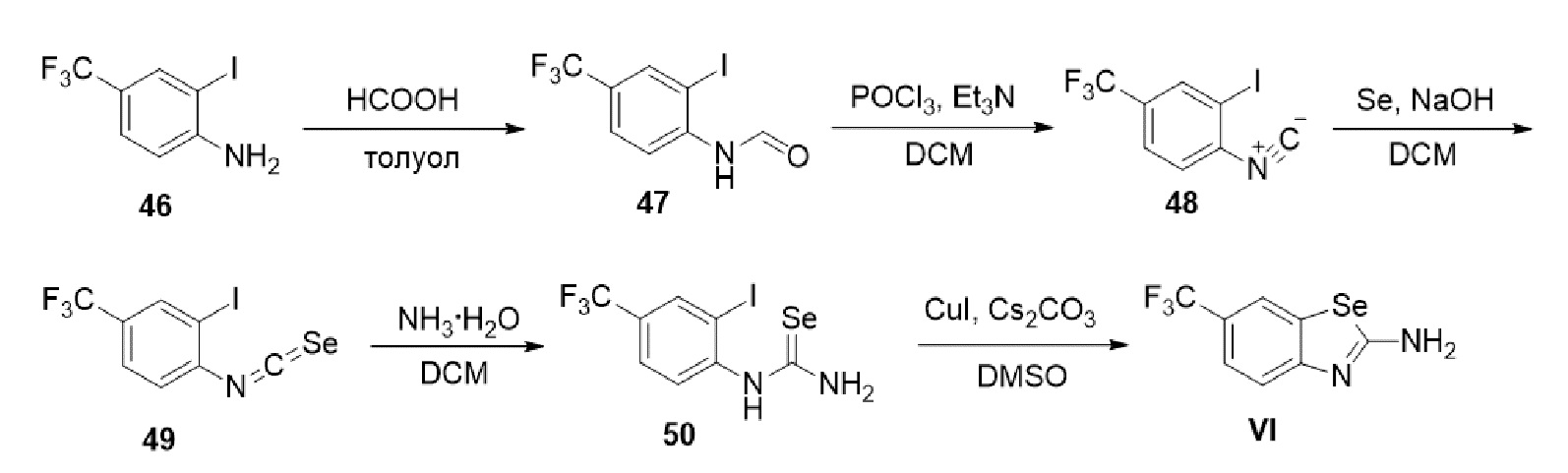
Стадия 1: N–(2–йод–4–(трифторметил)фенил)формамид (47)
К перемешиваемому раствору 2–йод–4–(трифторметил)анилина (46) (3,0 г, 10,5 ммоль) в сухом толуоле (30 мл) капельно добавляли HCOOH (4,0 мл, 114,5 ммоль) при 20°C. Реакционную смесь перемешивали при 100°C в течение 16 ч. Смесь охлаждали до 30°C, разбавляли EtOAc (80 мл), последовательно промывали водой (40 мл) и насыщенным водным раствором рассола (40 мл), сушили над безводным Na2SO4 и концентрировали. Остаток очищали колоночной хроматографией (силикагель, петролейный эфир/EtOAc =20:1–10:1) с получением указанного в заголовке соединения 47 (3,1 г, 94%) в виде белого твердого вещества.
MS (ESI): [M+H+] = 315,7
Стадия 2: 2–йод–1–изоциано–4–(трифторметил)бензол (48)
К раствору N–(2–йод–4–(трифторметил)фенил)формамида (47) (2,0 г, 6,35 ммоль) в сухом CH2Cl2 (30 мл) добавляли Et3N (2,6 мл, 19,05 ммоль) при 0°C, а затем добавляли POCl3 (1,5 г, 9,52 ммоль). Реакционную смесь перемешивали при 0~20°C в течение 3 ч, а затем капельно добавляли насыщенный водный раствор Na2CO3 (10 мл). После перемешивания в течение 30 мин водную фазу экстрагировали DCM (2×30 мл). Объединенную органическую фазу сушили над безводным Na2SO4 и концентрировали. Остаток очищали колоночной хроматографией (силикагель, петролейный эфир/EtOAc =50:1–20:1) с получением указанного в заголовке соединения 48 (1,32 г, 70%) в виде темного масла.
Стадия 3: 2–йод–1–изоселеноцианат–4–(трифторметил)бензол (49)
К суспензии 2–йод–1–изоциано–4–(трифторметил)бензола (48) (1,32 г, 4,44 ммоль) в CH2Cl2 (30 мл) добавляли порошковый Se (1,05 г, 13,33 ммоль), хлорид бензилтриэтиламмония (50,70 мг, 0,22 ммоль) и водный раствор NaOH (50%, 2,0 мл). Реакционную смесь перемешивали при 40°C в течение 3 ч. Смесь разбавляли CH2Cl2 (30 мл), последовательно промывали водой (20 мл) и насыщенным водным раствором рассола (20 мл), сушили над безводным Na2SO4 и концентрировали. Остаток очищали колоночной хроматографией (силикагель, PE/EA=50:1–20:1) с получением указанного в заголовке соединения 49 (0,90 г, 54%) в виде желтого масла.
1H–ЯМР (400 МГц, CDCl3) δ=8,08 (с, 1 H), 7,61 (д, J=8,0 Гц, 1 H), 7,40 (д, J=8,4 Гц, 1 H).
Стадия 4: 1–(2–йод–4–(трифторметил)фенил)селеномочевина (50)
К суспензии 2–йод–1–изоселеноцианат–4–(трифторметил)бензола (49) (300 мг, 0,80 ммоль) в CH2Cl2 (6 мл) добавляли NH4OH (134 мг, 25% в воде) при 20°C. Реакционную смесь перемешивали при 20°C в течение 15 мин. Растворители упаривали с получением указанного в заголовке соединения 50 (314 мг, 100%) в виде белого твердого вещества.
1H–ЯМР (400 МГц, DMSO–d6) δ=9,79 (с, 1 H), 8,48 (с, 1 H), 8,16 (с, 1 H), 7,76 (с, 1 H), 7,73 (д, J=8,0 Гц, 1 H), 7,57 (д, J=8,4 Гц, 1 H).
Стадия 5: 6–(трифторметил)бензо[d][1,3]селеназол–2–амин (VI)
К перемешиваемому раствору 1–(2–йод–4–(трифторметил)фенил)селеномочевины (50) (600,0 мг, 1,53 ммоль) в DMSO (10 мл) добавляли CuI (29,1 мг, 0,15 ммоль), 1,10–фенанатролин (27,5 мг, 0,15 ммоль) и Cs2CO3 (248,0 мг, 0,76 ммоль) при 20°C. Реакционную смесь перемешивали при 80°C в атмосфере азота в течение 30 мин. Смесь гасили ледяной водой (60 мл), экстрагировали EtOAc (2×30 мл). Объединенную органическую фазу промывали насыщенным водным раствором рассола (30 мл), сушили над безводным Na2SO4 и концентрировали. Остаток очищали колоночной хроматографией (силикагель, петролейный эфир/EtOAc =10:1–2:1) с получением указанного в заголовке соединения VI (226 мг, 56%) в виде светло–желтого твердого вещества.
1H–ЯМР (400 МГц, DMSO–d6) δ=8,12 (д, J=1,2 Гц, 1 H), 7,94 (с, 2 H), 7,48 (дд, J=1,2, 8,8 Гц, 1 H), 7,40 (д, J=8,8 Гц, 1 H);
MS (ESI): [M+H+] = 266,7.
Пример 7: 6–(трифторметокси)бензо[d][1,3]селеназол–2–амин (VII)
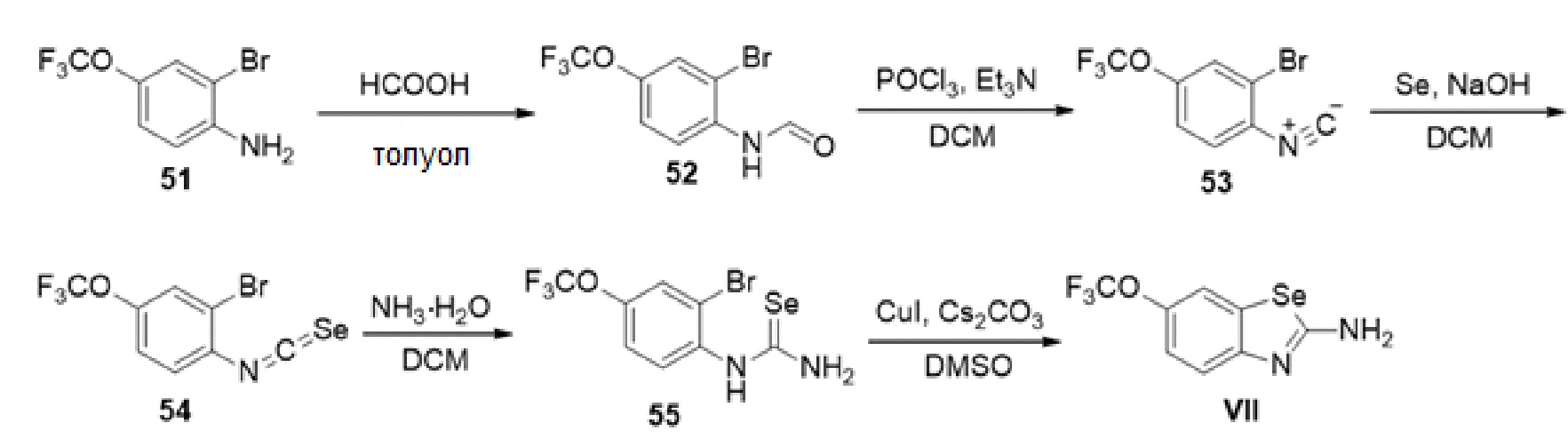
Стадия 1: N–(2–бром–4–(трифторметокси)фенил)формамид (52)
К перемешиваемому раствору 2–бром–4–(трифторметокси)анилина (51) (3,0 г, 11,7 ммоль) в сухом толуоле (30 мл) капельно добавляли HCOOH (4,3 мл, 113,7 ммоль) при 20°C. Реакционную смесь перемешивали при 100°C в течение 16 ч. Смесь охлаждали до 30°C, разбавляли EtOAc (60 мл), последовательно промывали водой (30 мл) и насыщенным водным раствором рассола (30 мл), сушили над безводным Na2SO4 и концентрировали. Остаток очищали колоночной хроматографией (силикагель, петролейный эфир/EtOAc =20:1–5:1) с получением указанного в заголовке соединения 52 (3,2 г, 96%) в виде белого твердого вещества.
1H–ЯМР (400 МГц, DMSO–d6) δ=9,90 (с, 1 H), 8,37 (с, 1 H), 8,14 (д, J=8,8 Гц, 1 H), 7,78 (д, J=2,0 Гц, 1 H), 7,45 (д, J=8,8 Гц, 1 H).
Стадия 2: 2–бром–1–изоциано–4–(трифторметокси)бензол (53)
К раствору N–(2–бром–4–(трифторметокси)фенил)формамида (52) (2,0 г, 7,04 ммоль) в сухом CH2Cl2 (30 мл) добавляли Et3N (2,1 г, 21,12 ммоль) при 0°C, а затем добавляли POCl3 (1,6 г, 10,56 ммоль). Реакционную смесь перемешивали при 0~20°C в течение 3 ч, а затем капельно добавляли насыщенный водный раствор Na2CO3 (10 мл). После перемешивания в течение 30 мин смесь экстрагировали CH2Cl2 (2×30 мл). Водную фазу сушили над безводным Na2SO4 и концентрировали. Остаток очищали колоночной хроматографией (силикагель, петролейный эфир/EtOAc =50:1–20:1) с получением указанного в заголовке соединения 53 (1,8 г, 96%) в виде темного масла.
1H–ЯМР (400 МГц, CDCl3) δ=7,55 (д, J=1,6 Гц, 1 H), 7,51 (д, J=9,2 Гц, 1 H), 7,24 (дд, J=1,6, 9,2 Гц, 1 H).
Стадия 3: 2–бром–1–изоселеноцианат–4–(трифторметокси)бензол (54)
К суспензии 2–бром–1–изоциано–4–(трифторметокси)бензола (53) (1,80 г, 6,77 ммоль) в CH2Cl2 (36 мл) добавляли порошковый Se (1,60 г, 20,30 ммоль), хлорид бензилтриэтиламмония (77,52 мг, 0,34 ммоль), а затем добавляли водный раствор NaOH (50%, 5 мл). Реакционную смесь перемешивали при 40°C в течение 3 ч. Смесь разбавляли CH2Cl2 (50 мл), последовательно промывали водой (30 мл) и насыщенным водным раствором рассола (30 мл), сушили над безводным Na2SO4 и концентрировали. Остаток очищали колоночной хроматографией (силикагель, петролейный эфир/EtOAc =50:1–20:1) с получением указанного в заголовке соединения 54 (0,95 г, 41%) в виде бесцветного твердого вещества.
1H–ЯМР (400 МГц, CDCl3) δ=7,49 (д, J=2,0 Гц, 1 H), 7,36 (д, J=8,8 Гц, 1 H), 7,18 (дд, J=1,2, 8,4 Гц, 1 H).
Стадия 4: 1–(2–бром–4–(трифторметокси)фенил)селеномочевина (55)
К суспензии 2–бром–1–изоселеноцианат–4–(трифторметокси)бензола (54) (820 мг, 2,38 ммоль) в CH2Cl2 (10 мл) добавляли NH4OH (400 мг, 25% в воде) при 20°C. Реакционную смесь перемешивали при 20°C в течение 15 мин. Растворители выпаривали с получением указанного в заголовке соединения у 55 (862 мг, 100%) в виде не совсем белого твердого вещества.
1H–ЯМР (400 МГц, DMSO–d6) δ=9,78 (с, 1 H), 8,45 (с, 1 H), 7,76 (д, J=2,0 Гц, 1 H), 7,74 (ушир. с, 1 H), 7,56 (д, J=9,2 Гц, 1 H), 7,42 (дд, J=1,2, 8,4 Гц, 1 H).
Стадия 5: 6–(трифторметокси)бензо[d][1,3]селеназол–2–амин (VII)
К перемешиваемому раствору 1–(2–бром–4–(трифторметокси)фенил)селеномочевины (55) (600,0 мг, 1,66 ммоль) в DMSO (10 мл) добавляли CuI (31,6 мг, 0,17 ммоль), 1,10–фенанатролин (30,0 мг, 0,17 ммоль) при 20°C, а затем добавляли Cs2CO3 (270,0 мг, 0,83 ммоль). Реакционную смесь перемешивали при 80°C в атмосфере азота в течение 30 мин. Смесь гасили ледяной водой (60 мл), экстрагировали EA (2×30 мл). Объединенную органическую фазу промывали насыщенным водным раствором рассола (30 мл), сушили над безводным Na2SO4 и концентрировали. Остаток очищали колоночной хроматографией (силикагель, петролейный эфир/EtOAc =10:1–2:1) с получением указанного в заголовке соединения VII (106 мг, 23%) в виде белого твердого вещества.
1H–ЯМР (400 МГц, DMSO–d6) δ=7,77 (д, J=1,2 Гц, 1 H), 7,71 (с, 2 H), 7,33 (д, J=8,8 Гц, 1 H), 7,16 (дд, J=1,2, 8,4 Гц, 1 H);
MS (ESI): [M+H+] = 282,8.
Пример 8: 5–(трифторметил)бензо[d][1,3]селеназол–2–амин (VIII)
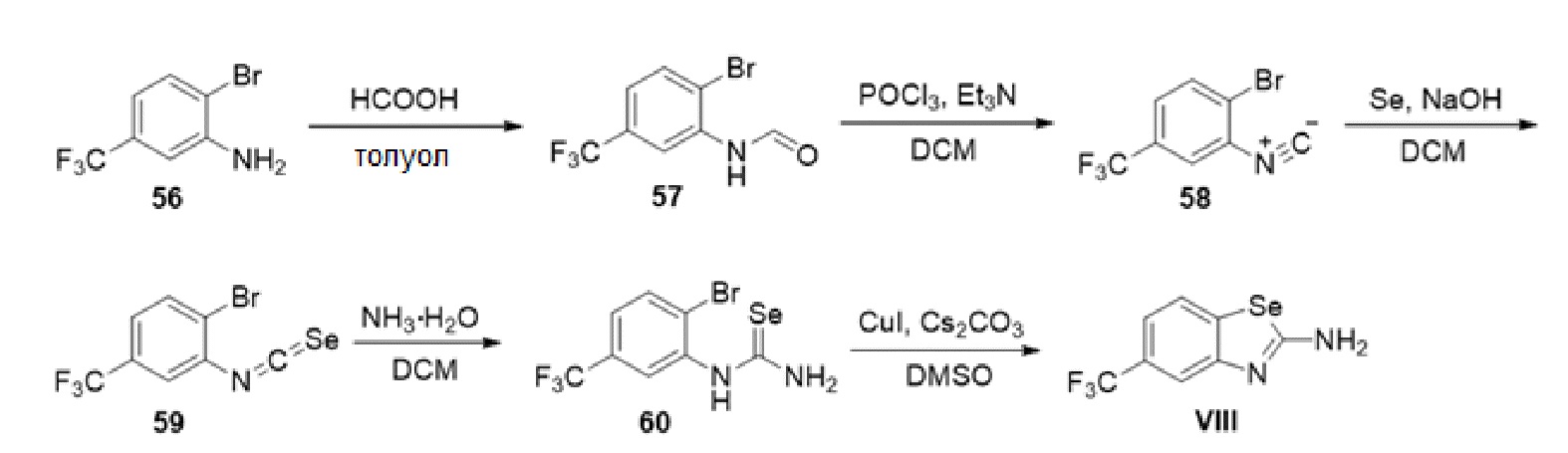
Стадия 1: N–(2–бром–5–(трифторметил)фенил)формамид (57)
К перемешиваемому раствору 2–бром–5–(трифторметил)анилина (56) (4,0 г, 16,67 ммоль) в сухом толуоле (40 мл) капельно добавляли HCOOH (6,4 мл, 166,70 ммоль) при 20°C. Реакционную смесь перемешивали при 100°C в течение 16 ч. Смесь охлаждали до 30°C, разбавляли EtOAc (120 мл), последовательно промывали (30 мл) и насыщенным водным раствором рассола (30 мл), сушили над безводным Na2SO4 и концентрировали. Остаток очищали колоночной хроматографией (силикагель, петролейный эфир/EtOAc =20:1–10:1) с получением указанного в заголовке соединения 57 (4,2 г, 93%) в виде белого твердого вещества.
1H–ЯМР (400 МГц, DMSO–d6) δ=10,05 (с, 1 H), 8,48 (с, 1 H), 8,42 (с, 1 H), 7,92 (д, J=8,4 Гц, 1 H), 7,43 (д, J=8,4 Гц, 1 H);
MS (ESI): [M+H++CH3CN] = 310,8.
Стадия 2: 2–бром–1–изоциано–5–(трифторметил)бензол (58)
К раствору N–(2–бром–5–(трифторметил)фенил)формамида (57) (3,0 г, 11,19 ммоль) в сухом CH2Cl2 (40 мл) добавляли Et3N (4,7 мл, 33,58 ммоль) при 0°C, а затем добавляли POCl3 (2,6 г, 16,79 ммоль). Реакционную смесь перемешивали при 0~20°C в течение 3 ч, а затем капельно добавляли насыщенный водный раствор Na2CO3. После перемешивания в течение 30 мин смесь экстрагировали CH2Cl2 (2×50 мл). Объединенную органическую фазу сушили над безводным Na2SO4 и концентрировали. Остаток очищали колоночной хроматографией (силикагель, петролейный эфир/EtOAc =50:1–20:1) с получением указанного в заголовке соединения 58 (2,02 г, 68%) в виде темного масла.
1H–ЯМР (400 МГц, CDCl3) δ=7,83 (д, J=8,0 Гц, 1 H), 7,71 (с, 1 H), 7,54 (д, J=8,4 Гц, 1 H).
Стадия 3: 2–бром–1–изоселеноцианат–5–(трифторметил)бензол (59)
К суспензии 2–бром–1–изоциано–5–(трифторметил)бензола (58) (2,0 г, 8,08 ммоль) в CH2Cl2 (40 мл) добавляли порошковый Se (1,92 г, 24,24 ммоль), хлорид бензилтриэтиламмония (92 мг, 0,40 ммоль), а затем добавляли водный раствор NaOH (50%, 4,0 мл). Смесь перемешивали при 40°C в течение 3 ч. Смесь разбавляли CH2Cl2 (100 мл), последовательно промывали водой (50 мл) и насыщенным водным раствором рассола (50 мл), сушили над безводным Na2SO4 и концентрировали. Остаток очищали колоночной хроматографией (силикагель, петролейный эфир/EtOAc =50:1–20:1) с получением указанного в заголовке соединения 59 (1,56 г, 54%) в виде желтого масла.
1H–ЯМР (400 МГц, CDCl3) δ=7,75 (д, J=8,4 Гц, 1 H), 7,56 (с, 1 H), 7,42 (д, J=8,4 Гц, 1 H).
Стадия 4: 1–(2–бром–5–(трифторметил)фенил)селеномочевина (60)
К суспензии 2–бром–1–изоселеноцианат–5–(трифторметил)бензола (59) (580 мг, 1,76 ммоль) в CH2Cl2 (10 мл) добавляли NH4OH (0,33 мл, 25% в воде) при 20°C. Реакционную смесь перемешивали при 20°C в течение 15 мин. Растворители выпаривали с получением указанного в заголовке соединения 60 (593 мг, 97%) в виде белого твердого вещества.
1H–ЯМР (400 МГц, DMSO–d6) δ=9,87 (с, 1 H), 8,53 (с, 1 H), 7,90 (д, J=8,4 Гц, 2 H), 7,86 (с, 1 H), 7,55 (дд, J=1,5, 8,0 Гц, 1 H);
MS (ESI): [M+H+] = 346,7.
Стадия 5: 5–(трифторметил)бензо[d][1,3]селеназол–2–амин (VIII)
К перемешиваемому раствору 1–(2–бром–5–(трифторметил)фенил)селеномочевины (60) (500,0 мг, 1,53 ммоль) в DMSO (10 мл) добавляли CuI (27,5 мг, 0,14 ммоль), 1,10–фенанатролин (26,0 мг, 0,14 ммоль) при 20°C, а затем добавляли Cs2CO3 (235,4 мг, 0,72 ммоль). Реакционную смесь перемешивали при 80°C в атмосфере азота в течение 30 мин. Смесь гасили ледяной водой (60 мл), экстрагировали EA (2×40 мл). Объединенную органическую фазу промывали насыщенным водным раствором рассола (50 мл), сушили над безводным Na2SO4 и концентрировали. Остаток очищали препаративной ВЭЖХ (0,5% TFA в элюентах) с получением указанного в заголовке соединения VIII (200 мг, 52%) в виде светло–желтого твердого вещества.
1H–ЯМР (400 МГц, DMSO–d6) δ=8,39 (ушир. с, 2 H), 7,98 (д, J=8,0 Гц, 1 H), 7,57 (с, 1 H), 7,31 (д, J=8,0 Гц, 1 H);
MS (ESI): [M+H+] = 266,7.
Пример 9: 6–((трифторметил)тио)бензо[d][1,3]селеназол–2–амин (IX)
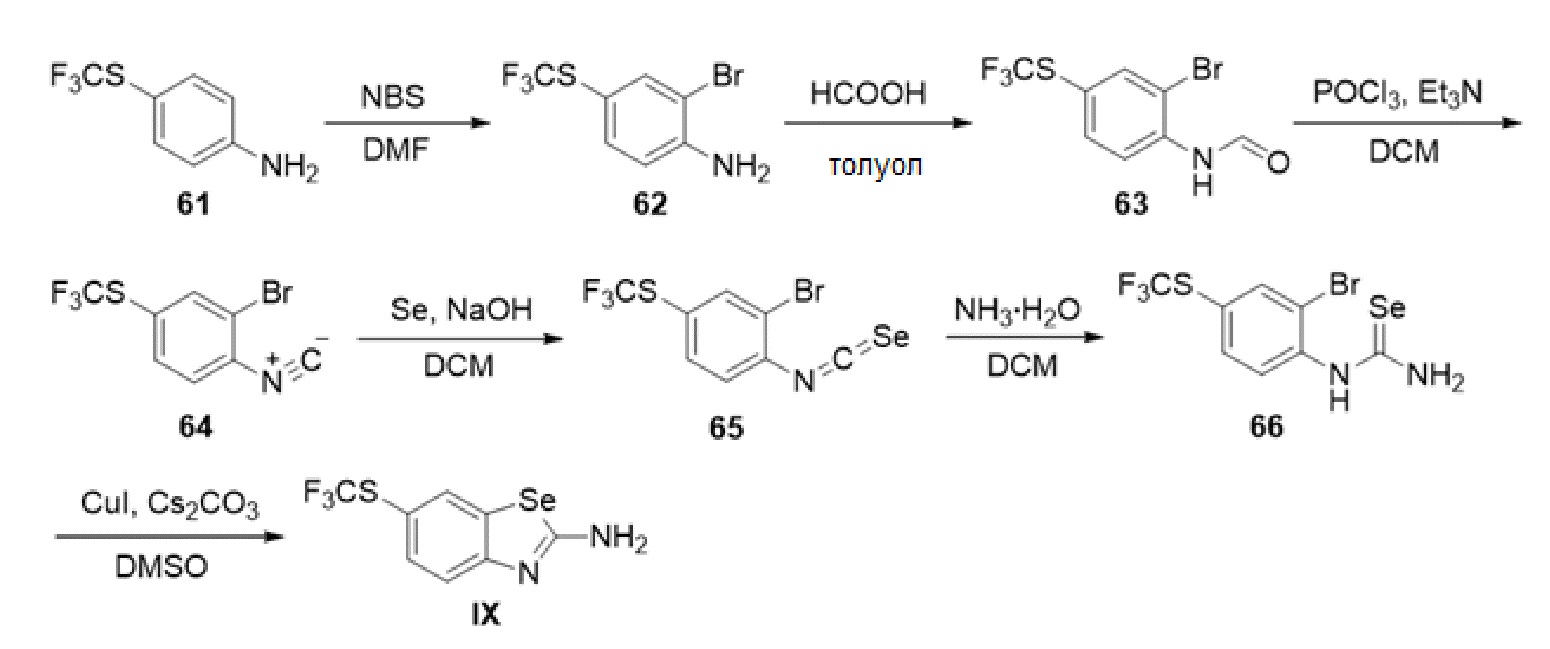
Стадия 1: 2–бром–4–((трифторметил)тио)анилин (62)
К перемешиваемому раствору 4–((трифторметил)тио)анилина (61) (4,0 г, 20,72 ммоль) в DMF (40 мл) добавляли N–бромсукцинамид (NBS) (3,87 г, 21,74 ммоль). Смесь перемешивали при 30°C в течение 2 ч. Смесь гасили ледяной водой (120 мл), экстрагировали EtOAc (2×50 мл). Объединенную органическую фазу последовательно промывали водой (50 мл) и насыщенным водным раствором рассола (50 мл), сушили над безводным Na2SO4 и концентрировали. Остаток очищали колоночной хроматографией (силикагель, петролейный эфир/EtOAc =20:1–10:1) с получением указанного в заголовке соединения 62 (3,60 г, 64%) в виде красного масла.
1H–ЯМР (400 МГц, CDCl3) δ=7,70 (д, J=1,6 Гц, 1 H), 7,37 (дд, J=1,6, 8,0 Гц, 1 H), 6,75 (д, J=8,4 Гц, 1 H), 4,41 (ушир. с, 2 H);
MS (ESI): [M+H+] = 273,8.
Стадия 2: N–(2–бром–4–((трифторметил)тио)фенил)формамид (63)
К перемешиваемому раствору 2–бром–4–((трифторметил)тио)анилина (62) (3,0 г, 11,03 ммоль) в сухом толуоле (30 мл) капельно добавляли HCOOH (4,3 мл, 113,70 ммоль) при 20°C. Реакционную смесь перемешивали при 100°C в течение 16 ч. Смесь охлаждали до 30°C, разбавляли EtOAc (60 мл), последовательно промывали водой (50 мл) и рассолом (50 мл). Органическую фазу сушили над безводным Na2SO4 и концентрировали. Остаток очищали колоночной хроматографией (силикагель, петролейный эфир/EtOAc =20:1–5:1) с получением указанного в заголовке соединения 63 (3,1 г, 94%) в виде белого твердого вещества.
1H–ЯМР (400 МГц, DMSO–d6) δ=10,00 (с, 1 H), 8,42 (с, 1 H), 8,29 (д, J=8,4 Гц, 1 H), 8,03 (д, J=1,6 Гц, 1 H), 7,74 (дд, J=1,2, 8,4 Гц, 1 H);
MS (ESI): [M+H++CH3CN] = 340,8.
Стадия 3: (3–бром–4–изоцианофенил)(трифторметил)сульфан (64)
К раствору N–(2–бром–4–((трифторметил)тио)фенил)формамида (63) (3,00 г, 10,0 ммоль) в сухом CH2Cl2 (30 мл) добавляли Et3N (4,17 мл, 30,0 ммоль) на ледяной бане, а затем добавляли POCl3 (1,40 мл, 15,0 ммоль). Реакционную смесь перемешивали при 0~20°C в течение 3 ч, а затем капельно добавляли насыщенный водный раствор Na2CO3 (10 мл). После перемешивания в течение 30 мин смесь экстрагировали CH2Cl2 (2×30 мл). Объединенную органическую фазу сушили над безводным Na2SO4 и концентрировали. Остаток очищали колоночной хроматографией (силикагель, петролейный эфир/EtOAc=50:1–20:1) с получением указанного в заголовке соединения 64 (2,4 г, 84%) в виде темного твердого вещества.
1H–ЯМР (400 МГц, CDCl3) δ=7,97 (д, J=1,6 Гц, 1 H), 7,65 (дд, J=1,6, 8,0 Гц, 1 H), 7,49 (д, J=8,8 Гц, 1 H).
Стадия 4: (3–бром–4–изоселеноцианатфенил)(трифторметил)сульфан (65)
К суспензии (3–бром–4–изоцианофенил)(трифторметил)сульфана (64) (800 мг, 2,84 ммоль) в CH2Cl2 (8 мл) добавляли порошковый Se (672 мг, 8,51 ммоль), хлорид бензилтриэтиламмония (33 мг, 0,14 ммоль), а затем добавляли водный раствор NaOH (50%, 1,2 мл). Реакционную смесь перемешивали при 40°C в течение 2 ч. После этого реакционную смесь разбавляли CH2Cl2 (50 мл). Органическую фазу последовательно промывали водой (50 мл) и рассолом (50 мл), сушили над безводным Na2SO4 и концентрировали. Остаток очищали колоночной хроматографией (силикагель, петролейный эфир/EtOAc =50:1–20:1) с получением указанного в заголовке соединения 65 (0,78 г, 78%) в виде коричневого твердого вещества.
1H–ЯМР (400 МГц, CDCl3) δ=7,90 (д, J=1,6 Гц, 1 H), 7,60 (дд, J=1,6, 8,0 Гц, 1 H), 7,36 (д, J=8,8 Гц, 1 H).
Стадия 5: 1–(2–бром–4–((трифторметил)тио)фенил)селеномочевина (66)
К раствору (3–бром–4–изоселеноцианатфенил)(трифторметил)сульфана (65) (558 мг, 1,55 ммоль) в CH2Cl2 (6 мл) добавляли NH4OH (0,3 мл, 25% в воде) при 20°C. Реакционную смесь перемешивали при 20°C в течение 30 мин. Растворители выпаривали с получением указанного в заголовке соединения 66 (486 мг, 83%) в виде желтого твердого вещества.
1H–ЯМР (400 МГц, DMSO–d6) δ=9,82 (с, 1 H), 8,61 (ушир. с, 1 H), 8,02 (д, J=1,6 Гц, 1 H), 7,94 (ушир. с, 1 H), 7,75 (д, J=8,0 Гц, 1 H), 7,71 (дд, J=1,6, 8,4 Гц, 1 H);
MS (ESI): [M+H+] = 378,7.
Стадия 6: 6–(трифторметокси)бензо[d][1,3]селеназол–2–амин (IX)
К перемешиваемому раствору 1–(2–бром–4–((трифторметил)тио)фенил)селеномочевины (66) (400,0 мг, 1,06 ммоль) в DMSO (6 мл) добавляли CuI (20,2 мг, 0,11 ммоль) и 1,10–фенанатролин (19,1 мг, 0,11 ммоль) при 20°C, а затем добавляли Cs2CO3 (172,4 мг, 0,53 ммоль). Реакционную смесь перемешивали при 80°C в атмосфере азота при 20 мин. Смесь гасили ледяной водой (60 мл), экстрагировали EtOAc (2×30 мл). Объединенную органическую фазу промывали насыщенным водным раствором рассола (50 мл), сушили над безводным Na2SO4 и концентрировали. Остаток очищали препаративной ВЭЖХ с получением указанного в заголовке соединения IX (40 мг, 13%) в виде белого твердого вещества.
1H–ЯМР (400 МГц, DMSO–d6) δ=8,21 (с, 1 H), 7,62 (д, J=8,4 Гц, 1 H), 7,48 (д, J=9,2 Гц, 1 H);
MS (ESI): [M+H+] = 298,8.
Пример 10: 6–(пентафторсульфанил)–1H–бензо[d]имидазол–2–амин (X)
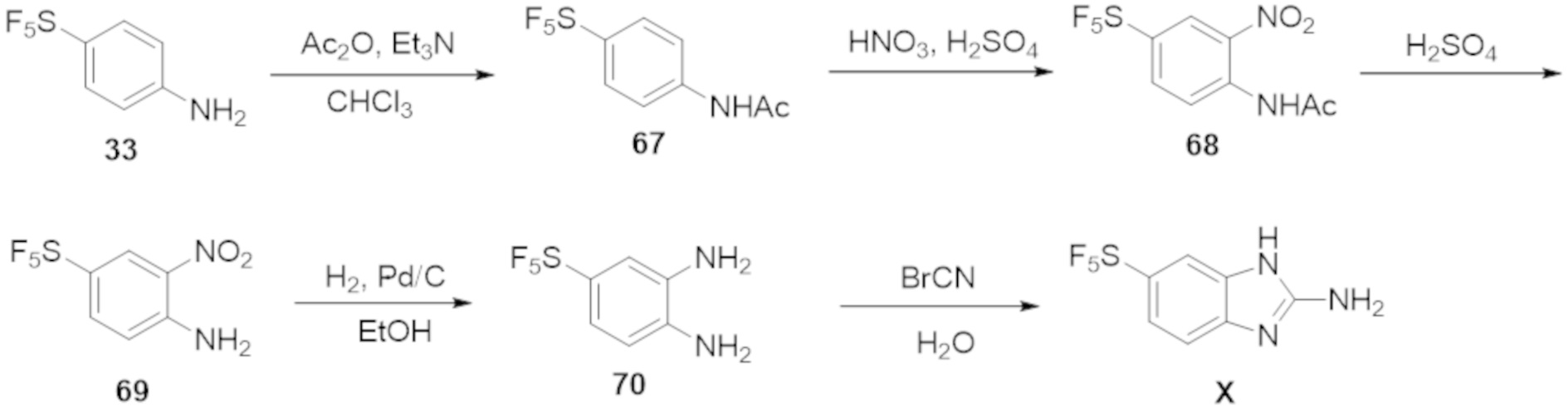
Стадия 1: N–(4–(пентафторсульфанил)фенил)ацетамид (67)
К перемешиваемому раствору 4–(пентафторсульфанил)анилина (33) (100 мг, 0,46 ммоль) в CHCl3 (1 мл) добавляли Et3N (92,3 мг, 0,92 ммоль), а затем добавляли Ac2O (61,2 мг, 0,46 ммоль). Реакционную смесь перемешивали при 20°C в течение 3 ч, и к ней добавляли H2O (20 мл). Смесь экстрагировали CH2Cl2 (2×10 мл). Объединенную органическую фазу сушили над безводным Na2SO4 и концентрировали с получением указанного в заголовке неочищенного соединения 67 (110 мг, 92%) в виде желтого твердого вещества, которое использовали для следующей стадии без дальнейшей очистки.
1H–ЯМР (400 МГц, CDCl3) δ=7,70 (д, J=9,2 Гц, 2 H), 7,62 (д, J=8,8 Гц, 2 H), 7,42 (ушир. с, 1 H), 2,22 (с, 3 H);
MS (ESI): [M+H+] = 261,8.
Стадия 2: N–(2–нитро–4–(пентафторсульфанил)фенил)ацетамид (68)
К раствору N–(4–(пентафторсульфанил)фенил)ацетамида (67) (110 мг, 0,42 ммоль) в конц. H2SO4 (1 мл) капельно добавляли HNO3 (0,3 мл, 65%) на ледяной бане. Реакционную смесь перемешивали при 0~20°C в течение 1 ч. После этого реакционную смесь переливали в ледяную воду (30 мл), экстрагировали CH2Cl2 (2×15 мл). Объединенную органическую фазу сушили над безводным Na2SO4 и концентрировали с получением указанного в заголовке соединения 68 (120 мг, 93%) в виде желтого твердого вещества, которое использовали для следующей стадии без дальнейшей очистки.
1H–ЯМР (400 МГц, CDCl3) δ=10,49 (ушир. с, 1 H), 8,99 (д, J=9,6 Гц, 1 H), 8,65 (д, J=2,4 Гц, 1 H), 8,00 (дд, J=2,4, 9,6 Гц, 1 H), 2,34 (с, 3 H).
Стадия 3: 2–нитро–4–(пентафторсульфанил)анилин (69)
N–(2–нитро–4–(пентафторсульфанил)фенил)ацетамид (68) (120 мг, 0,39 ммоль) растворяли в конц. H2SO4 (1 мл) и реакционную смесь перемешивали при 100°C в течение 15 мин. Смесь охлаждали до 30°C и переливали в раздробленный лед, перемешивали в течение 10 мин и экстрагировали CH2Cl2 (2×15 мл). Объединенную органическую фазу последовательно промывали водой (20 мл) и рассолом (20 мл), сушили над безводным Na2SO4 и концентрировали. Неочищенное указанное в заголовке соединение 69 (100 мг, 97%) получали в виде желтого твердого вещества, которое использовали для следующей стадии без дальнейшей очистки.
1H–ЯМР (400 МГц, CDCl3) δ=8,58 (д, J=2,4 Гц, 1 H), 7,70 (дд, J=2,4, 9,2 Гц, 1 H), 6,85 (д, J=9,6 Гц, 1 H), 6,40 (ушир. с, 2 H).
Стадия 4: 4–(пентафторсульфанил)бензол–1,2–диамин (70)
К раствору 2–нитро–4–(пентафторсульфанил)анилина (69) (100 мг, 0,39 ммоль) в EtOH (2 мл) добавляли Pd/C (100 мг, 10%). Реакционную смесь перемешивали при 20°C в атмосфере H2 в течение 16 ч. Реакционную смесь фильтровали, и фильтрат концентрировали с получением неочищенного указанного в заголовке соединения 70 (70 мг, 80%) в виде желтого твердого вещества.
MS (ESI): [M+H+] = 234,8.
Стадия 5: 6–(пентафторсульфанил)–1H–бензо[d]имидазол–2–амин (X)
К перемешиваемому раствору 4–(пентафторсульфанил)бензол–1,2–диамина (70) (70 мг, 0,30 ммоль) в H2O (1 мл) добавляли BrCN (32,3 мг, 0,31 ммоль). Реакционную смесь перемешивали при 100°C в атмосфере азота в течение 8 ч. Реакционную смесь разбавляли H2O (20 мл), обрабатывали NH4OH (25%) до pH 10–11, а затем экстрагировали EtOAc (2×10 мл). Объединенную органическую фазу промывали насыщенным водным раствором рассола (20 мл), сушили над безводным Na2SO4 и концентрировали. Остаток очищали препаративной TLC (силикагель, CH2Cl2/MeOH=8:1) с получением указанного в заголовке соединения X (30 мг, 38%) в виде светло–желтого твердого вещества.
1H–ЯМР (400 МГц, DMSO–d6) δ=11,14 (ушир. с, 1 H), 7,55 (с, 1 H), 7,37 (д, J=7,2 Гц, 1 H), 7,19 (д, J=8,4 Гц, 1 H), 6,71 (ушир. с, 2 H);
MS (ESI): [M+H+] = 259,8.
Пример 11: Фармакологические исследования
В этом примере подробно описаны фармакологические свойства соединений формул I–XXII.
A. Ингибиторный эффект соединений I–XXII на потенциалзависимые натриевые каналы человека
Потенциальный ингибиторный эффект соединения I–XXII на потенциалзависимые натриевые каналы человека (hNav1.2/1.7) оценивали с использованием ручной системы фиксации потенциала в соответствии с описанными методиками. В этом исследовании использовали клеточную линию HEK293, стабильно трансфицированную геном SCN2A/SCN9A, и в качестве положительного контроля в отношении хорошего качества анализа использовали тетродотоксин (TTX). Результаты представлены в таблице 1 ниже, в то время как аппроксимирующие кривые доза–ответ для соединения I представлены на фиг.1A и 1B.
Общая методика: клетки HEK 293 стабильно трансфицировали потенциалзависимыми натриевыми каналами Nav1.2 или Nav1.7 человека. Клетки стандартным образом поддерживали в культуральной среде, содержавшей 90% DMEM, 10% FBS, 100 Е/мл пенициллина–стрептомицина и 400 мг/мл G418. Перед анализом клетки ресуспендировали и высевали на покровные стекла в количестве 5×105 клеток /на культуральную чашку диаметром 6 см для применения. Ток в потенциалзависимых каналах Nav1.2 и Nav1.7 регистрировали при комнатной температуре (25°C) для случайным образом отобранных трансфицированных клеток на системах фиксации потенциала цельных клеток с усилителем EPC10 USB (HEKA) или Multiclamp 700B (Molecular Devices), в то время как электрические данные оцифровывали с использованием Digidata1440A с частотой взятия образцов более 10 kГц и извлекали с использованием Patchmaster или pClamp10, соответственно. Стеклянный электрод с сопротивлением от 2 до 3,5 МВт получали с использованием устройства для вытягивания микропипеток P–97 (Sutter Instrument) и заполняли внутренними растворами (в мМ): 140 KCl, 2 MgCl2, 10 EGTA, 10 HEPES и 5 MgATP (значение pH, доведенное до 7,35 с использованием KOH), в то время как клетки находились во внеклеточных растворах (в мМ) 132 NaCl, 4 KCl, 3 CaCl2, 0,5 MgCl2, 11,1 глюкозы и 10 HEPES (значение pH, доведенное до 7,35 с использованием NaOH). После пробоя последовательное сопротивление мембраны компенсировалось по меньшей мере на 50%, а также компенсировалась емкость. Все клетки подвергали фиксации потенциала для выдерживания потенциала –80 мВ, если нет иных указаний. Входящий ток натрия индуцировался 20–мс импульсом напряжения до 10 мВ от –80 мВ, применяемым каждые 15 c. Так натрия первоначально регистрировали в течение по меньшей мере 120 секунд для оценки стабильности тока, и для оценки ответа на дозу соединения I–XXII, добавляемого посредством локальной перфузии, использовали только клетки с параметрами регистрации, превышающими критерии допустимости. Сначала к подвергнутым фиксации потенциала клеткам применяли простой носитель, чтобы установить исходные показатели регистрации. Через по меньшей мере 5 мин, когда индуцированный ток натрия достигал стабилизации, в камеру регистрации перфузировали исследуемое соединение накопительным образом от низких до высоких концентраций. Также использовали положительное контрольное соединение тетродотоксин (TTX) для исследования той же партии клеток, чтобы убедиться в хороших характеристиках регистрирующей системы. Для определения IC50 все эксперименты проводили в трех экземплярах. При получении данных использовали программное обеспечение PatchMaster или pClamfit для извлечения максимального тока из исходных необработанных данных, в то время как ингибирование максимального тока определяли по уравнению, представленному ниже.
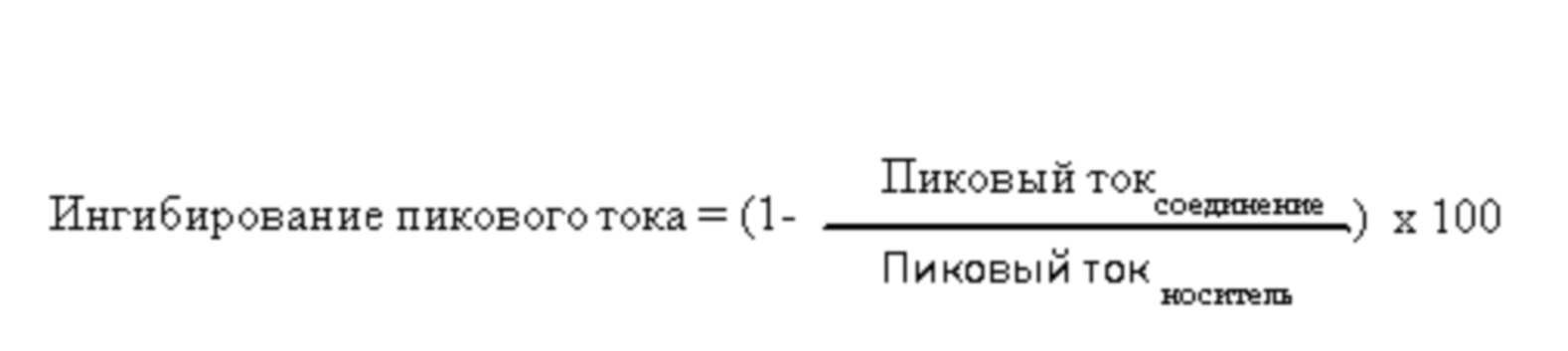
Кривую доза–эффект для исследуемого соединения наносили на график в виде % ингибирования против концентрации в исследуемого соединения в дозе с использованием программного обеспечения Graphpad Prism 5.0, а затем данные аппроксимировали к сигмовидной кривой доза–эффект с переменным наклоном для определения IC50.
Таблица 1 Ингибиторный эффект исследуемого соединения на каналы Nav1.2/1.7 человека
|
B. Тестирование соединения I в отношении механической аллодинии на крысах с SNL (лигирование спинномозгового нерва)
Модель SNL представляет собой часто используемую модель для определения хирургически индуцированной невропатической боли. Целью исследования была оценка эффективности соединения I в отношении ослабления механической аллодинии в модели SNL у крыс Sprague–Dawley.
В этом исследовании модель SNL получали согласно типичной методике и в качестве эталонного соединения использовали одобренное лекарственное средство тапентадол (XW–TAP). В качестве положительного контроля для подтверждения модели использовали габапентин.
Экспериментальные группы представлены в таблице 2.
Таблица 2:
|
Состав дозы:
1) 5 мг/кг соединения I: 17,13 мг соединения I, добавленные к 16,96 мл 0,5% метилцеллюлозы в нормальном солевом растворе и подвергнутые встряхиванию для полного перемешивания.
2) 10 мг/кг тапентадола: 39,39 мг тапентадола, добавленные к 16,81 мл нормального солевого раствора и подвергнутые встряхиванию для полного перемешивания.
Методики определения механической аллодинии:
1) Крыс помещали по отдельности в пластмассовый короб с ячеистым дном, позволяющим полный доступ к конечностям. Крыс подвергали акклиматизации в течение 15 мин перед тестированием.
2) После акклиматизации до средней подошвенной подушечки задней конечности касались одной из серии из восьми нитей фон Фрея с логарифмически возрастающей жесткостью следующим образом: 3,61 (0,4 г), 3,84 (0,6 г), 4,08 (1 г), 4,31 (2 г), 4,56 (4 г), 4,74 (6 г), 4,93 (8 г) и 5,18 (15 г). Нити фон Фрея подносились перпендикулярно подошвенной поверхности с достаточным усилием, чтобы вызвать небольшой прогиб под лапой, и удерживалась в течение приблизительно 6–8 с. Стимуляцию осуществляли с интервалами 5 секунд, обеспечивая видимое устранение каких–либо предшествующих поведенческих ответов на предшествующий стимул. Положительный ответ отмечали, если конечность быстро отдергивалась. Подергивание сразу после удаления нити также считалось положительным ответом. Ходьба считалась неоднозначным ответом и в таких случаях стимул повторялся.
3) Начиная с нити 4,31 (2 г), в зависимости от наличия или отсутствия ответа, исследователь использовал нить меньшего или большего усилия, соответственно, исходя из способа Диксона "вверх–вниз". Положительные ответы включали явное отдергивание задней конечности от нити или подергивание сразу после удаления нити. Максимальное примененное усилие осуществлялось посредством нити 5,18 (15 г).
Определение исходного уровня механической аллодинии при привыкании и до введения дозы:
Через десять суток после хирургической операции крыс приучали к условиям тестирования в течение 15 мин перед определением аллодинии в течение трех суток. Исходный уровень до дозирования определяли на 13 сутки. Крыс, которые не проявляли аллодинического ответа в этот момент времени исключали (крысы с пороговым значением отдергивания конечности >5 г).
На фиг.2 представлены эффекты соединений против аллодинии у крыс с SNL. (*p<0,05 против группы носителя) посредством одностороннего ANOVA, за которым следовал критерий множественных сравнений Даннетта.
Результаты показывают, что соединение I обращало вспять индуцируемую SNL механическую аллодинию в дозе 5 мг/кг в момент времени 0,5 ч после введения дозы.
C. Фармакокинетические исследования
Для фармакокинетических исследований на крысах самцов крыс Sprague–Dawley содержали по отдельности и подвергали голоданию в течение ночи перед использованием. Эксперименты по дозированию животным проводили в соответствии с National Institutes of Health Guide to the Care and Use of Laboratory Animals и Animal Welfare Act. Для соединения I вводили однократную дозу 5,8 мг/кг каждой крысы в двух группах (n=5/группа) посредством внутривенного (в/в) и перорального (п/о) введения, соответственно. Носитель, использованный для в/в введения, представлял собой 10% (об./об.) CremophorEL в 90% PBS. Носитель, использованный для п/о введения, представлял собой 0,5% (масс./об.) метилцеллюлозу в нормальном солевом растворе. Взятие образцов крови проводили в определенные моменты времени (до введения дозы, через 30 минут, 1 час, 2 часа, 4 часа, 7 часов, 8 часов, 12 часов, 24 часа) после введения отдельным крысам в группе в/в и п/о. Образцам крови сразу давали свернуться на льду, затем образцы плазмы выделяли центрифугированием и хранили замороженными (–80°C) до дальнейшего анализа. Концентрации соединения I определяли индивидуально посредством анализа LC/MS/MS. Различные фармакокинетические параметры вычисляли с использованием программного обеспечения PhoenixTM WinNonlin®. Для количественного определения эффективности биоконвертирования соединения I в кровеносной системе вычисляли биодоступность соединения I после п/о введения.
Результаты представлены в таблице 3 и на фиг.3.
Таблица 3: Фармакокинетические параметры соединения I у крыс
|
Наконец, следует отметить, что существуют другие способы применения настоящего изобретения на практике. Таким образом, варианты осуществления настоящего изобретения описаны в качестве примеры, однако настоящее изобретение не ограничивается описанным содержанием, в объем настоящего изобретения можно вносить дополнительные модификации или к формуле изобретения могут быть добавлены эквиваленты.
Все публикации или патенты, цитированные в настоящем описании, включены в настоящее описание в качестве ссылки.
Указание на протяжении настоящего описания на "вариант осуществления", "некоторые варианты осуществления", "один вариант осуществления", "другой пример", "пример", "конкретные примеры" или "некоторые примеры" означает, что конкретный признак, структура, материал или характеристика, описанные применительно к варианту осуществления или примеру, входит по меньшей мере в один вариант осуществления или пример настоящего изобретения. Таким образом, появление выражений, таких как "в некоторых вариантах осуществления", "в одном варианте осуществления", "в варианте осуществления", "в другом примере", "в примере", "в конкретном примере" или "в некоторых примерах" в различных местах настоящего описания не обязательно относятся к одному и тому же варианту осуществления или примеру настоящего изобретения. Более того, конкретные признаки, структуры, материалы или характеристики можно комбинировать любым подходящим образом в одном или нескольких вариантах осуществления или примерах.
Хотя иллюстративные варианты осуществления представлены и описаны, специалистам в данной области будет понятно, что описанные выше варианты осуществления не могут быть истолкованы как ограничивающие изобретение, и в варианты осуществления могут быть внесены изменения, альтернативы и модификации без отклонения от сущности, принципов и объема настоящего изобретения.