Результат интеллектуальной деятельности: СПОСОБ КОМБИНИРОВАННОЙ ЛУЧЕВОЙ И ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ
Вид РИД
Изобретение
Изобретение относится к медицине, а именно к экспериментальным исследованиям в онкологии и может быть использовано для увеличения эффективности лучевой терапии злокачественных новообразований.
Лучевая терапия наряду с хирургическим лечением и химиотерапией играет большую роль в лечении злокачественных новообразований. (Helen H.W. Chen, Macus Tien Kuo. Improving radiotherapy in cancer treatment: Promises and challenges. Oncotarget. 2017; Sep 5; 8(37): 62742-62758. doi: 10.18632/oncotarget. 18409). Несмотря на открытие и внедрение в практику видов излучения с высокой линейной передачей энергии (протонное, ионное излучение), значительные затраты на строительство и эксплуатацию ускорительных установок ограничивают доступ к широкому их применению. Фотонное и электронное излучение остаются одними из наиболее часто применяемых источников излучения в современной лучевой терапии (Каприн А.Д., Мардынский Ю.С., Смирнов В.П., Иванов С.А., Костин А.А., Полихов С.А., Решетов И.В., Фатьянова А.С., Денисенко М.В., Эпатова Т.В., Коренев СВ., Терещенко А.В., Филоненко Е.В., Гафаров М.М., Романко Ю.С. К истории развития лучевой терапии (часть I). Biomedical Photonics. 2019;8(1):52-62. https://doi.org/10.24931/2413-9432-2019-8-1-52-62 Kaprin A.D., Mardinskiy Y.S., Smirnov V.P., Ivanov S.A., Kostin A.A., Polikhov S.A., Reshetov I.V., Fatianova A.S., Denisenko M.V., Epatova T.V., Korenev S.V., Tereshchenko A.V., Filonenko E.V., Gafarov M.M., Romanko Y.S. The history of radiation therapy (part I). Biomedical Photonics. 2019; 8(1):52-62. (In Russ.) https://doi.org/10.24931/2413-9432-2019-8-1-52-62).
Основными механизмами противоопухолевого действия для всех видов лучевой терапии являются прямые цитотоксические эффекты за счет повреждения генетического аппарата клетки, а именно индукции двунитевых разрывов ДНК. Не следует забывать, что подобные изменения возникают и в окружающих нормальных тканях, попавших в зону воздействия. (Maria Rita Fabbrizi, Kacie E. Warshowsky, Cheri L. Zobel, Dennis E. Hallahan, Girdhar G. Molecular and epigenetic regulatory mechanisms of normal stem cell radiosensitivity. SharmaCell Death Discov. 2018; 4: 117.doi: 10.1038/s41420-018-0132-8)
Существуют прямая взаимосвязь между эффективностью лучевой терапии и степенью оксигенации ткани. В то же время гипоксия, возникающая из-за неравномерного распределения новообразованных сосудов, а также часто их функциональная незрелость, является общей чертой солидных опухолей. Этот факт определяет одну из наиболее важных причин неудачи лучевой терапии первичной опухоли и обуславливает возникновение радиорезистентных рецидивов (Kuwahara Y, Tomita K, Urushihara Y, Sato T, Kurimasa A, Fukumoto M. Association between radiation-induced cell death and clinically relevant radioresistance. Histochem Cell Biol. 2018 Dec; 150(6):649-659. doi: 10.1007/s00418-018-1728-z.)
Принимая во внимание тот факт, что рецидивные опухоли менее восприимчивы к лечению, было разработано множество стратегий для преодоления индуцированной гипоксией радиорезистентности. Наиболее распространенными из них являются добавление радиосенсибилизаторов, насыщение опухоли гипербарическим кислородом, использование селективных для гипоксии цитотоксинов (Hui Wang, Heng Jiang, Melissa Van De Gucht, Mark De Ridder. Hypoxic Radioresistance: Can ROS Be the Key to Overcome It? Cancers (Basel). 2019 Jan; 11(1): 112. doi: 10.3390/cancersl 1010112) (Higgins GS, O'Cathail SM, Muschel RJ, McKenna WG. Drug radiotherapy combinations: review of previous failures and reasons for future optimism. Cancer Treat Rev. 2015 Feb; 41(2):105-13. doi: 10.1016/j.ctrv.2014.12.012).
В последние годы гипоксия также была определена как основной фактор подавления иммунитета в микроокружении опухоли. В связи с чем особый интерес представляет сочетание лучевой терапии и иммунотаргетных агентов. (Eckert F, Zwirner К, Boeke S, Thorwarth D, Zips D, Huber SM. Rationale for Combining Radiotherapy and Immune Checkpoint Inhibition for Patients With Hypoxic Tumors. Front Immunol. 2019 Mar 12; 10:407. doi: 10.3389/fimmu.2019.00407).
Тем не менее, адекватное клиническое применение вышеописанных методов ограничено их недостаточной эффективностью, побочными эффектами, а зачастую и высокой стоимостью.
Фотодинамическая терапия - не инвазивный, эффективный метод лечения, зарекомендовавший себя в различных направлениях медицины, и в том числе в лечении злокачественных новообразований (Benov L. Photodynamic Therapy: Current Status and Future Directions. Med Princ Pract. 2015; 24(suppl 1):14-28.doi.org/10.1159/000362416).
Эффект достигается за счет одновременного присутствия трех компонентов: фотосенсибилизатора, молекулярного кислорода и лазерного света определенной длины волны, ни один из которых не является токсичным или сам по себе не повреждает клетки или ткани. Одним из значимых преимуществ метода считается его высокая селективность за счет таргетного накопления фотосенсибилизатора в клетках-мишенях. Это позволяет при облучении только нужной области избежать генерализованной токсичности. При поглощении энергии лазерного света препаратом запускается целый каскад событий, приводящий в конечном итоге к образованию свободных радикалов, которые убивают клетки-мишени, повреждают сосудистую сеть, связанную с опухолью, и активируют иммунный ответ ( Ferreira dos Santos, Daria Raquel Queiroz de Almeida, Leticia Ferreira Terra,
Ferreira dos Santos, Daria Raquel Queiroz de Almeida, Leticia Ferreira Terra, 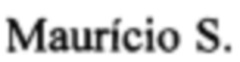 Baptista, Leticia Labriola. Photodynamic therapy in cancer treatment - an update review. J Cancer Metastasis Treat. 2019;5:25.10.20517/2394-4722.2018.83). Благодаря способности фотосенсибилизатора поглощать и испускать свет на определенных длинах волн возможен мониторинг фотодинамической терапии методом спектрометрии, условно позволяющей оценить разницу концентраций фотосенсибилизатора в опухоли до и после сеанса терапии и косвенно оценить эффективность проведенного лечения (Atif, М., Zellweger, М., Wagnieres, G.. Review of the role played by the photosensitizer's photobleaching during photodynamic therapy. Journal Of Optoelectronics And Advanced Materials. 2016; 18, 3-4,338-350).
Baptista, Leticia Labriola. Photodynamic therapy in cancer treatment - an update review. J Cancer Metastasis Treat. 2019;5:25.10.20517/2394-4722.2018.83). Благодаря способности фотосенсибилизатора поглощать и испускать свет на определенных длинах волн возможен мониторинг фотодинамической терапии методом спектрометрии, условно позволяющей оценить разницу концентраций фотосенсибилизатора в опухоли до и после сеанса терапии и косвенно оценить эффективность проведенного лечения (Atif, М., Zellweger, М., Wagnieres, G.. Review of the role played by the photosensitizer's photobleaching during photodynamic therapy. Journal Of Optoelectronics And Advanced Materials. 2016; 18, 3-4,338-350).
Значение параметров флюоресценции и их влияние на эффективность фотодинамической терапии подтверждено в клинических работах (Fluorescence imaging for photodynamic therapy of non-melanoma skin malignancies-a retrospective clinical study Gamayunov S., Turchin I., Fiks I., Kleshnin M., Shakhova N., Korchagina K. Photonics and Lasers in Medicine. 2016. T. 5. №2. C. 101-111).
Вклад тех или иных механизмов в противоопухолевый эффект зависит от химической структуры используемого фотосенсибилизатора и связанного с этим биораспределения препарата. Наиболее часто применяемые в клинической практике производные Хлорина Е6 - гидрофильны, что позволяет им аккумулироваться в сосудистом русле опухоли, вызывая повреждение базальной мембраны и эндотелия, высвобождение вазоактивных молекул, адгезию лейкоцитов, увеличение проницаемости сосудов и сужение их просвета. Это приводит к разрушению опухоли вследствие сосудистого коллапса, тромобоза и кровоизлияний в ткани (Krammer В. Vascular effects of photodynamic therapy. Anticancer Res. 2001 Nov-Dec;21(6B):4271-7).
Несмотря на довольно успешное применение метода одним из основных недостатков фотодинамической терапии является ограниченная глубина проникновения лазерного света, что делает данный метод возможным для лечения только поверхностно расположенных образований (Zheng Huang, Heping Xu, Arlen D. Meyers, Ali I. Musani, Luowei Wang, Randall Tagg, Al B. Barqawi, Yang K. Chen. Photodynamic therapy for treatment of solid tumors - potential and technical challenges. Technol Cancer Res Treat. 2008 Aug; 7(4): 309-320.doi: 10.1177/153303460800700405).
Теоретическим обоснованием для предложенного варианта комбинированного способа лучевой и фотодинамической терапии служит ряд статей.
Известен факт, что при прохождении заряженных частиц через среду с равномерной скоростью, превышающей фазовую скорость света в той же среде, возникает излучение, получившее название «Черенковского» (Xiaowei Ma, Jing Wang, Zhen Cheng. Cerenkov radiation: a multi-functional approach for biological sciences. Front. Phys., 2014(2), 1-14. doi.org/10.3389/fphy.2014.00004).
В последнее время применение «Черенковского» излучения в биологических исследованиях представляет большой интерес. К примеру, большое внимание уделяется использованию эффекта Черенкова в дозиметрии - для контроля глубины проникновения протонного пучка (Andy Lau, Salahuddin Ahmad and Yong Chen. A simulation study investigating a Cherenkov material for use with the prompt gamma range verification in proton therapy. Journal of X-Ray Science and Technology. 24 (2016), 565-582 DOI 10.3233/XST-160575) или суррогатного показателя поглощенной дозы ((Kyoung Won Jang, Sang Hun Shin, Seon Geun Kim, Jae Seok Kim, Wook Jae Yoo, Young Hoon Ji, Bongsoo Lee. Measurement of Cerenkov Radiation Induced by the Gamma-Rays of Co-60 Therapy Units Using Wavelength Shifting Fiber. Sensors (Basel). 2014 Apr; 14(4): 7013-7025. doi: 10.3390/s140407013.
Данные работы базируются на представлении, что графики распределения по глубине дозы гамма и электронного излучения и Черенковской эмиссии совпадают (Adam K Glaser1, Rongxiao Zhang2, David J Gladstone3 and Brian W Pogue. Optical dosimetry of radiotherapy beams using Cherenkov radiation: the relationship between light emission and dose. Phys. Med. Biol. 59 (2014) 3789-3811 doi: 10.1088/0031-9155/59/14/3789).
Черенковское излучение обладает уникальными спектральными и пространственными свойствами. Его спектр излучения непрерывен от инфракрасной до ультрафиолетовой области и пропорционален 1 / λ2. При этом максимум значений приходится на область 200-400 нм (Xu Cao, Shudong Jiang, Mengyu Jeremy Jia, Jason R. Gunn, Tianshun Miao, Scott C. Davis, Petr Bruza, Brian W. Pogue. Cherenkov excited short-wavelength infrared fluorescence imaging in vivo with external beam radiation. J. of Biomedical Optics.2018; 24(5). https://doi.Org/10.1117/1.JBO.24.5.051405).
Этот интервал перекрывается с уникальным, общим для всех типов фотосенсибилизаторов пиком поглощения равным 402 нм (Soret peak), причем квантовый выход синглетного кислорода при возбуждении ФС на этой длине волны является максимальным (Heidi Abrahamse, Michael R. Hamblin. New photosensitizers for photodynamic therapy. Biochem J. 2016 Feb 15; 473(4): 347-364. doi: 10.1042/BJ20150942).
Эти теоретические модели и их аналитическая интерпретация дают основания предполагать, что при соответствующих условиях возможна активация накопленного в опухоли фотосенсибилизатора при действии лучевого агента, способного генерировать Черенковское излучение.
Наиболее близким является способ лечения больных с узловыми и радиорезистентными злокачественными опухолями (RU 2570033 С1), включающий проведение 8-10 сеансов сочетанной дистанционной гамма-терапии и фотодинамической терапии с интервалом 24 часа.
Однако данный метод обладает следующими недостатками: длительный период полувыведения Фотосенса увеличивает время соблюдения светового режима. Последовательно применение методов фотодинамической и лучевой терапии удлиняет продолжительность процедуры. Использование для возбуждения фотосенсибилизатора источника дистанционного лазерного света не позволяет проводить лечение опухолей, расположенных на глубине более проникающей способности лазера (4-8 мм).
Техническим результатом заявляемого изобретения является возможность проведения комбинированной терапии, позволяющей одномоментно сочетать в себе эффекты лучевого и фотодинамического воздействия, которая привела бы к повышению противоопухолевого действия и, как следствие, к сокращению количества рецидивных опухолей, уменьшению общего времени терапевтической процедуры и позволила бы сочетать лучевую и фотодинамическую терапию глубоко расположенных опухолей за счет нивелирования ограничений по проникающей способности лазерного света, не увеличивая при этом повреждение окружающих здоровых тканей.
Технический результат достигается тем, что так же как и в известном способе проводят сочетанную дистанционную лучевой терапию и фотодинамическую терапию.
Особенность заявляемого способа заключается в том, что однократно внутривенно вводят фотосенсибилизатор Хлорин Е6 в дозе 10 мг/кг массы тела и через 3 часа после окончания введения препарата проводят спектрометрию для определения накопления препарата в опухоли относительно здоровых тканей, далее проводят сеанс дистанционной терапии электронами на опухоль в разовой очаговой дозе 32 Гр, при мощности дозы 3,3 Гр/мин, энергии 10 МэВ и повторно проводят спектральные измерения в тех же точках, после чего сравнивают значения флуоресценции до и после воздействия препарата и оценивают «фотовыгорание» фотосенсибилизатора для подтверждения фотодинамического компонента терапии, возникающего в следствии активации фотосенсебилизатора индуцированным Черенковским излучением.
Изобретение поясняется подробным описанием, лабораторными исследованиями и иллюстрациями, на которых изображено:
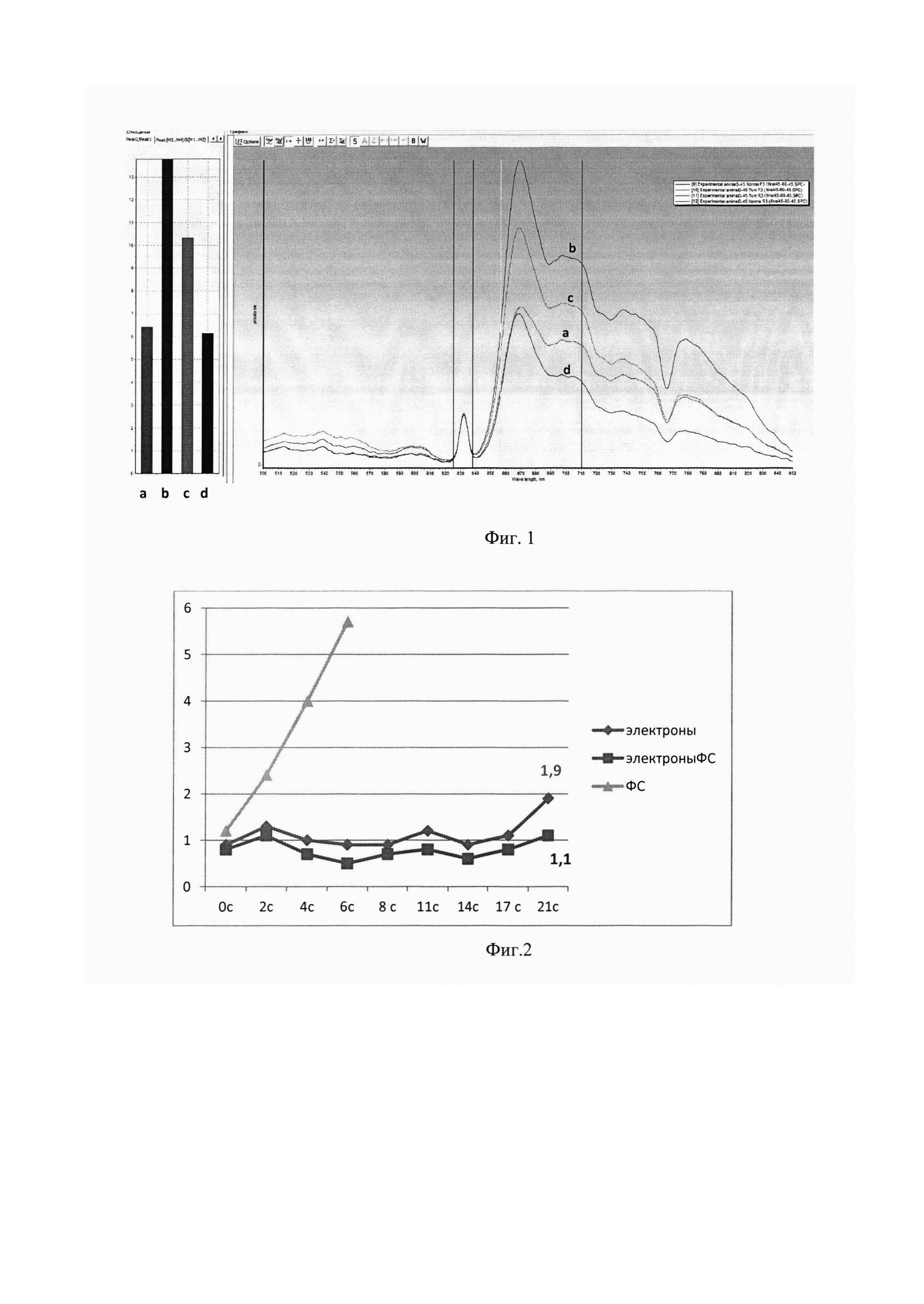
Фиг. 1 - Диаграмма и графическое изображение спектров флуоресценции в точках: а - нормальная кожа до лучевой терапии (6,4 о.е.), b - кожа над опухолью до лучевой терапии (13,6 о.е.), с - кожа над опухолью после лучевой терапии (10,2 о.е.), d - нормальная кожа после лучевой терапии (6,1 о.е.).
Фиг. 2 - Кривые роста опухоли Саркомы M1 в группах контроля, лучевого воздействия в самостоятельном режиме и лучевого воздействия с введением Фотодитазина (0 сутки - день лучевого воздействия, 2, 4, 6, 8, 11, 14, 17, 21 - сутки после воздействия). По шкале У - объем опухоли в см3.
Способ осуществляют следующим образом.
Животному однократно вводят внутривенно фотосенсибилизатор Хлорин Е6 (например, Фотодитазин, Радахлорин или аналог) в дозе 10 мг/кг, через 3 часа после введения препарата проводят спектрометрию для определения накопления препарата в опухоли относительно здоровых тканей. Далее проводится сеанс дистанционной терапии электронами на опухоль в разовой очаговой дозе 32 Гр, при мощности дозы 3,3 Гр/мин, энергии 10 МэВ. Незамедлительно после облучения повторно проводятся спектральные измерения в тех же точках. Сравнение значений флуоресценции до и после воздействия позволяет судить о «выгорании» препарата в процессе фотодинамической реакции.
Предложенный вариант комбинированной терапии выполнен у 8 крыс с имплантированной подкожно с внешней стороны левого бедра саркомой М-1.
Еще 8 животным с аналогичной опухолевой моделью включались в группу лучевой терапии в самостоятельном режиме. В качестве контрольных животных было 8 особей.
1-ой группе крыс «Фотодитазин» вводили внутривенно в хвостовую вену в дозе 10 мг/кг массы. Спектроскопия проводилась в 3-х рандомных точках нормальной кожи (область передней брюшной стенки) и 3-х точках кожи над опухолью с предварительным удаление шерстяного покрова. Полученные данные суммировались с вычислением среднего значения в каждой из групп. При анализе данных нормированной флуоресценции FN выявили, что опухоли накапливают препарат в значительно больших концентрациях - 14 отн. ед., чем здоровая ткань - 6 отн. ед. (Фиг. 1а,b). Далее животные обеих групп (с введением Фотодитазина и без него) подвергались облучению электронами на опухоль в разовой очаговой дозе 32 Гр, при мощности дозы 3,3 Гр/мин, энергии 10 МэВ. После чего крысы 1-ой группы отбирались для повторной спектрометрии в точках «норма/опухоль». При анализе полученных значений было показано «выгорание» препарата после сеанса лучевой терапии, тогда как показатели флуоресценции в нормальной ткани оставались на прежнем уровне (Фиг. 1a, d), что свидетельствует об активации ФС и его расходовании на реализацию фотодинамической реакции (фиксируется уменьшение флюоресценции над опухолью).
Далее животные всех групп наблюдались с целью изучения динамики роста Саркомы М-1. Измерения проводились 1 раз в 3 дня с регистрацией 3-х размеров опухоли. Полученные графики кривых роста (Фиг. 2) отражают большую противоопухолевую эффективность предложенного комбинированного способа в сравнении с облучением электронами в самостоятельном режиме, так как лучевая терапия воздействует на опухолевые клетки, оказывая на них прямые цитотоксические эффекты в виде повреждения молекулы ДНК. В то же время Черенковское излучение, возникающее при облучении электронами, активирует введенный и селективно накопленный в патологическом очаге фотосенсибилизатор. Это в свою очередь приводит к реализации эффектов фотодинамической терапии и к повреждению, в первую очередь, микроциркуляторного русла опухоли свободными радикалами, образующимися на выходе фото динамической реакции. Благодаря тому, что от момента воздействия повреждающего фактора до реализации сосудистых эффектов проходит срок равный 2-3 суткам, непосредственно в момент облучения не увеличивается доля более радиорезистентных гипоксических клеток за счет явлений стаза и тромбоза. В то же время, увеличение гипоксии в отдаленные сроки снижает способность опухоли к восстановлению разрывов цепи ДНК. Помимо этого значимым преимуществом данного способа является возможность фотодинамического воздействия на глубоко расположенные опухоли, учитывая, что возбуждающее излучение образуется непосредственно в эпицентре опухоли в зоне лучевого пучка. Время воздействия также сокращается за счет одномоментной реализации обеих терапевтических опций.
При проведении данного способа реализуется двойное воздействие на опухоль за счет энергии электронов и фотодинамической реакции, возникающей в результате возбуждения фотосенсибилизатора индуцированным «Черенковским» излучением.
Предлагаемый способ принципиально отличается от сочетания классической фотодинамической терапии с лучевой терапией отсутствием необходимости доставки световой энергии к патологическому очагу за счет использования индуцированного излучения, возникающего непосредственно в опухоли при ее облучении пучком электронов с указанными параметрами.
Использование разработанного способа в клинике приводит к повышению противоопухолевого действия и, как следствие, сокращению количества рецидивных опухолей, уменьшению общего времени терапевтической процедуры, увеличению глубины проникновения за счет нивелирования ограничений по проникающей способности лазерного света, не увеличивая при этом повреждение окружающих здоровых тканей. Изобретение промышленно применимо, так как при выполнении данного способа используют стандартное медицинское оборудование, применяемое при лечении онкологических больных в специализированных лечебных учреждениях.
Способ фотодинамической терапии, включающий однократное внутривенное введение фотосенсибилизатора Хлорин Е6 в дозе 10 мг/кг массы тела, проведение спектрометрии через 3 ч после окончания введения препарата, сеанс дистанционной терапии электронами в разовой очаговой дозе 32 Гр при мощности дозы 3,3 Гр/мин, энергии 10 МэВ, повторную спектрометрию, после чего сравнивают значения флуоресценции до и после воздействия препарата и оценивают «фотовыгорание» фотосенсибилизатора для подтверждения фотодинамического компонента терапии, возникающего вследствие активации фотосенсибилизатора индуцированным Черенковским излучением.