Результат интеллектуальной деятельности: ТАНДЕМНЫЙ ПРОМОТОР, ФУНКЦИОНИРУЮЩИЙ В БАКТЕРИИ РОДА Bacillus, ТРАНСФОРМИРОВАННАЯ БАКТЕРИЯ РОДА Bacillus - ПРОДУЦЕНТ ЦЕЛЕВОГО ПРОДУКТА, СОДЕРЖАЩАЯ УКАЗАННЫЙ ПРОМОТОР, И СПОСОБ ПОЛУЧЕНИЯ ЦЕЛЕВОГО ПРОДУКТА С ИСПОЛЬЗОВАНИЕМ УКАЗАННОЙ БАКТЕРИИ
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к биотехнологии, в частности к тандемному промотору, функционирующему в бактерии рода Bacillus и позволяющему осуществлять указанной бактерии экспрессию целевых генов, используемых для продукции целевых продуктов. Также настоящее изобретение относится к бактерии рода Bacillus - продуценту целевого продукта, содержащей указанный промотор, осуществляющий контроль экспрессии целевых генов, и к способу получения целевого продукта с использованием указанной бактерии.
Предшествующий уровень техники
Бактерии рода Bacillus хорошо известны в качестве клеток-хозяев для производства различных целевых продуктов.
Обычно обеспечение максимальной экспрессии целевых генов, содержащихся в клетке Bacillus и необходимых для получения целевых продуктов, осуществляют путем амплификации в хромосоме экспрессионной кассеты, содержащей один промотор, функционально связанный с представляющим интерес целевым геном и амплифицируемым селектируемым маркерным геном, например, маркером устойчивости к антибиотикам. Указанная амплификация приводит к получению нескольких копий экспрессионной кассеты и селективного маркерного гена в хромосоме.
Однако такие клетки-хозяева бактерий рода Bacillus не всегда обладают характеристиками, необходимыми для их коммерческого использования, и имеют некоторые недостатки, связанные с этим подходом. Например, не всегда возможно достичь насыщающих уровней мРНК путем амплификации генов, приводимых в действие одиночными промоторами. Кроме того удаление селектируемых маркерных генов без потери кассет экспрессии может оказаться технически невыполнимым.
Также обеспечение максимальной экспрессии целевых генов, необходимых для получения целевых продуктов, осуществляют путем использования сильных промоторов, индуцируемых промоторов, нескольких промоторов или тандемных промоторов, а также путем стабилизации мРНК.
В патенте US 5,955,310 описано использование в бактериях B. subtilis экспрессионной кассеты, содержащей тандемный промотор PamyQ-cryIIIA, функционально связанный с одной копией нуклеиновой кислоты, кодирующей целевой ген, и последовательность, расположенную после указанного промотора перед целевым геном и стабилизирующую мРНК. Однако указанный документ не содержит информации о профиле активности заявленного промотора в процессе культивирования бактерии.
В патентной заявке WO 201004625 А1 описано использование тандемного промотора PrpsB-subC в бактериях B. licheniformis и B. pumilus, и показано, что его использование позволяет увеличить продукцию протеаз 1 и 2 на 24% и 38%, соответственно, по сравнению с использованием одиночного промотора PsubC. Однако указанный документ не содержит информации о профиле активности заявленного промотора в процессе культивирования бактерии.
В патентной заявке CN 105779444 (A) описано использование тандемных промоторов P43-HpaII-SPO-I и P43-HpaII-SPO-I-cryIIIA в бактериях рода Bacillus. Показано, что использование первого промотора позволяет увеличить продукцию щелочной протеазы на 70% по сравнению с суммарной продукцией в бактериях, содержащих одиночные промоторы, а использование второго промотора позволяет увеличить продукцию щелочной протеазы на 50% по сравнению с суммарной продукцией в бактериях, содержащих одиночные промоторы. Однако указанный документ не содержит информации о профиле активности заявленных промоторов в процессе культивирования бактерии.
Раскрытие изобретения
Технической задачей настоящего изобретения являлась разработка более продуктивного способа микробиологического синтеза целевых продуктов с помощью бактерий рода Bacillus, а также расширение арсенала искусственных промоторов, функционирующих в бактериях рода Bacillus и обладающих улучшенными свойствами, необходимыми для продукции целевых продуктов.
Указанная задача была решена путем создания тандемного промотора PrpsF-gsiB, обладающего улучшенными свойствами, необходимыми для продукции целевых продуктов. Экспрессия целевого гена, находящегося под контролем указанного тандемного промотора PrpsF-gsi, в процессе культивирования бактерии рода Bacillus - продуцента целевого продукта нарастает и достигает максимума на поздних стадиях стационарного роста, что обеспечивает наиболее эффективный профиль экспрессии целевого гена и наиболее эффективную продукцию целевого продукта. Способ получения целевых продуктов с использованием указанной бактерии является более простым и технологичным, поскольку при использовании тандемного промотора PrpsF-gsiB не требуется добавления индуктора экспрессии в процессе культивирования бактерии, как, например, при использовании индуцируемого промотора.
Одним из аспектов настоящего изобретения является тандемный промотор, функционирующий в бактерии рода Bacillus, содержащий последовательности нуклеотидов промотора гена rpsF и промотора гена gsiB, причем промотор rpsF расположен выше по ходу транскрипции относительно промотора gsiB. Промотор PrpsF относится к наиболее сильным промоторам в геноме B. subtilis и обеспечивает максимально высокий уровень транскрипции на логарифмической стадии роста бактерий. Инициация транскрипции гена gsiB инициируется с участием альтернативной сигма-субъединицы ϭB и достигает максимума на стационарной фазе роста бактерий. Еще одним из аспектов настоящего изобретения является описанный выше тандемный промотор, который содержит последовательности нуклеотидов промотора гена rpsF и промотора гена gsiB из Bacillus subtilis.
Следующим аспектом настоящего изобретения является описанный выше тандемный промотор, содержащий последовательность нуклеотидов, представленную в Перечне последовательностей под номером SEQ ID NO: 1.
Еще одним из аспектов настоящего изобретения является бактерия рода Bacillus - продуцент целевого продукта, содержащая описанный выше тандемный промотор, функционально связанный с последовательностью нуклеиновой кислоты, кодирующей полипептид, являющийся целевым продуктом, или полипептид, необходимый для продукции целевого продукта.
Еще одним из аспектов настоящего изобретения является описанная выше бактерия, выбранная из группы, включающей Bacillus alkalophilus, Bacillus amyloliquefaciens, Bacillus brevis, Bacillus circulans, Bacillus clausii, Bacillus coagulans, Bacillus firmus, Bacillus lautus, Bacillus lentus, Bacillus licheniformis, Bacillus megaterium, Bacillus pumilus, Bacillus stearothermophilus, Bacillus subtilis и Bacillus thuringiensis.
Также одним из аспектов настоящего изобретения является описанная выше бактерия Bacillus subtilis.
Следующим аспектом настоящего изобретения является описанная выше бактерия, в которой последовательность нуклеиновой кислоты, кодирующей полипептид, являющийся целевым продуктом, или полипептид, необходимый для продукции целевого продукта, является гетерологичной.
Еще одним из аспектов настоящего изобретения является описанная выше бактерия, продуцирующая целевой продукт, выбранный из группы, включающей аминокислоты, полипептиды, углеводы, полисахариды, нуклеиновые кислоты и их производные.
Следующим аспектом настоящего изобретения является способ получения целевого продукта, включающий культивирование описанной выше бактерии рода Bacillus в питательной среде, пригодной для продукции целевого продукта, и выделение целевого продукта из культуральной жидкости.
Еще одним из аспектов настоящего изобретения является способ получения целевого продукта, в котором указанный целевой продукт выбран из группы, включающей аминокислоты, полипептиды, углеводы, полисахариды, нуклеиновые кислоты и их производные.
Краткое описание чертежей
На Фиг. 1 показана нуклеотидная последовательность промотора PrpsF. Заглавными буквами обозначены -35 и -10 участки промотора, подчеркнут сайт связывания рибосомы. Последовательность праймеров выделена жирным шрифтом.
На Фиг. 2 показана нуклеотидная последовательность промотора PgsiB. Заглавными буквами обозначены -35 и -10 участки промотора, подчеркнут сайт связывания рибосомы. Последовательность праймеров выделена жирным шрифтом.
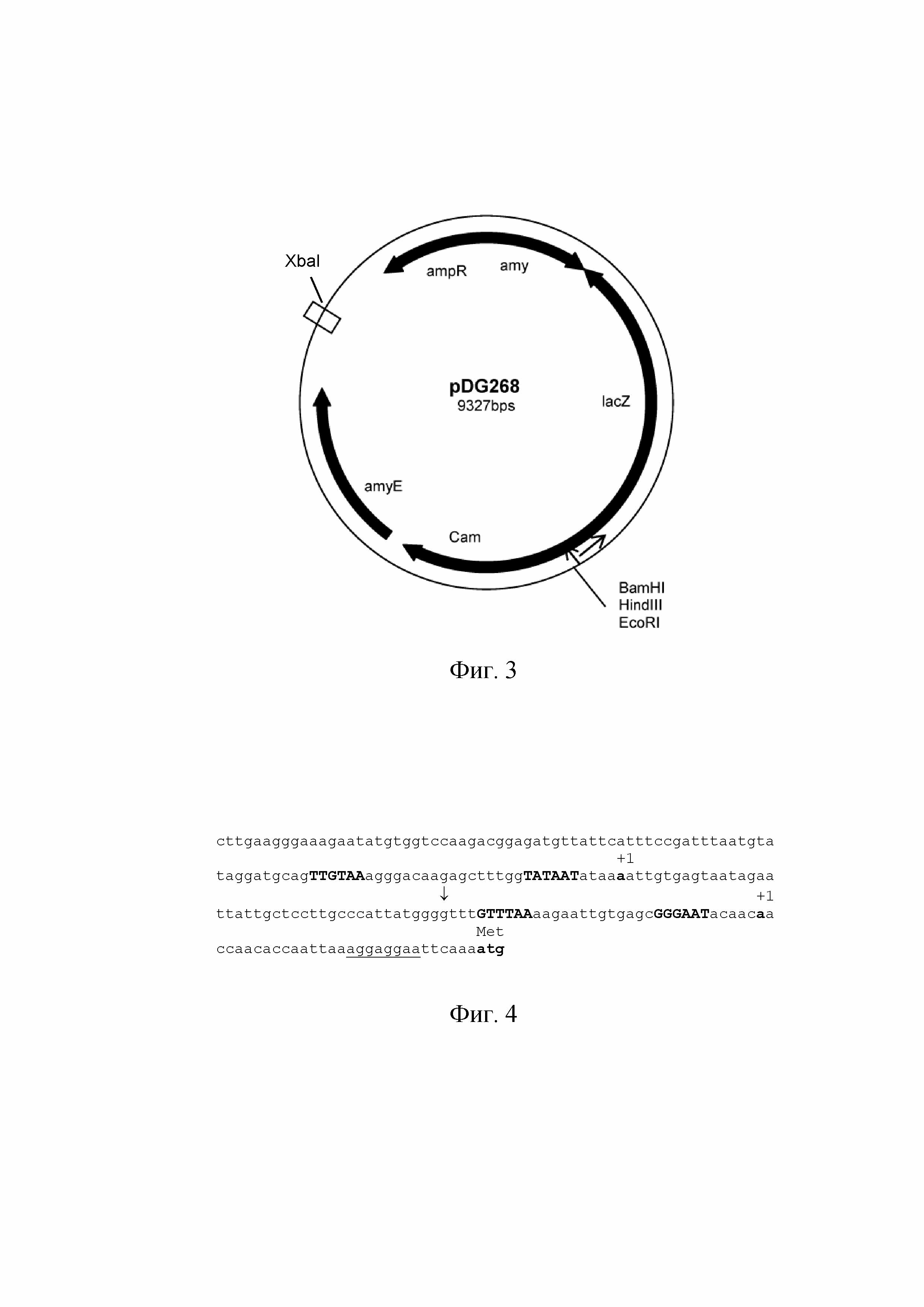
На Фиг. 3 показана структура плазмиды pDG268.
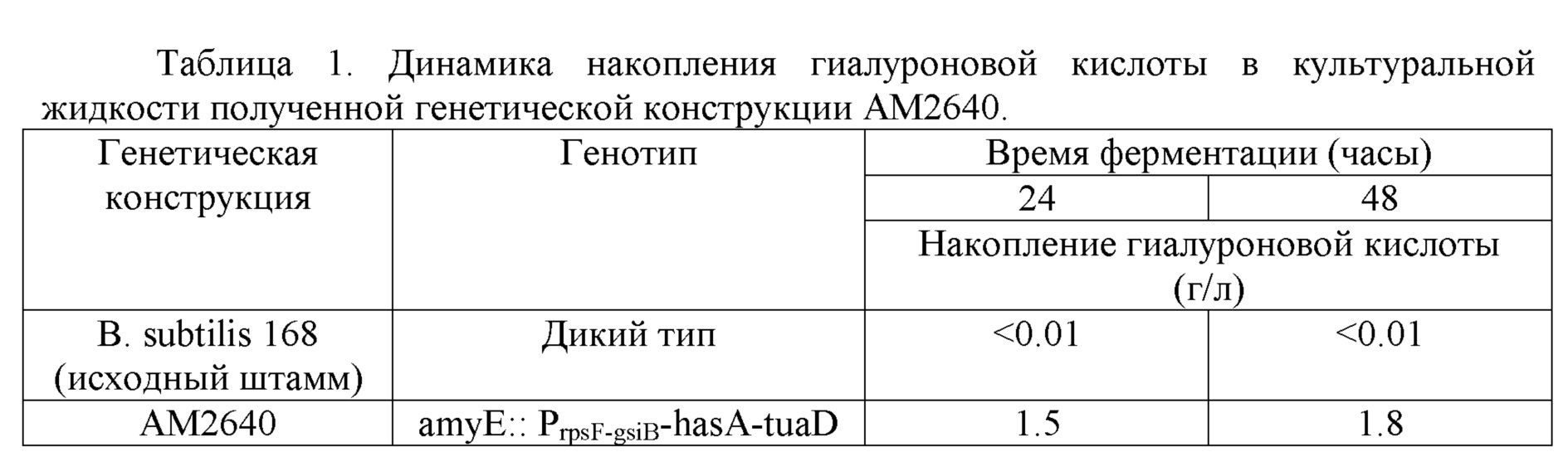
На Фиг. 4 показана нуклеотидная последовательность гибридного промотора PrpsF-gsiB. Заглавными жирными буквами обозначены -35 и -10 участки промоторов, подчеркнут сайт связывания рибосомы. Старты транскрипции обозначены как +1. Место стыка промоторов PrpsF и PgsiB обозначено стрелкой.
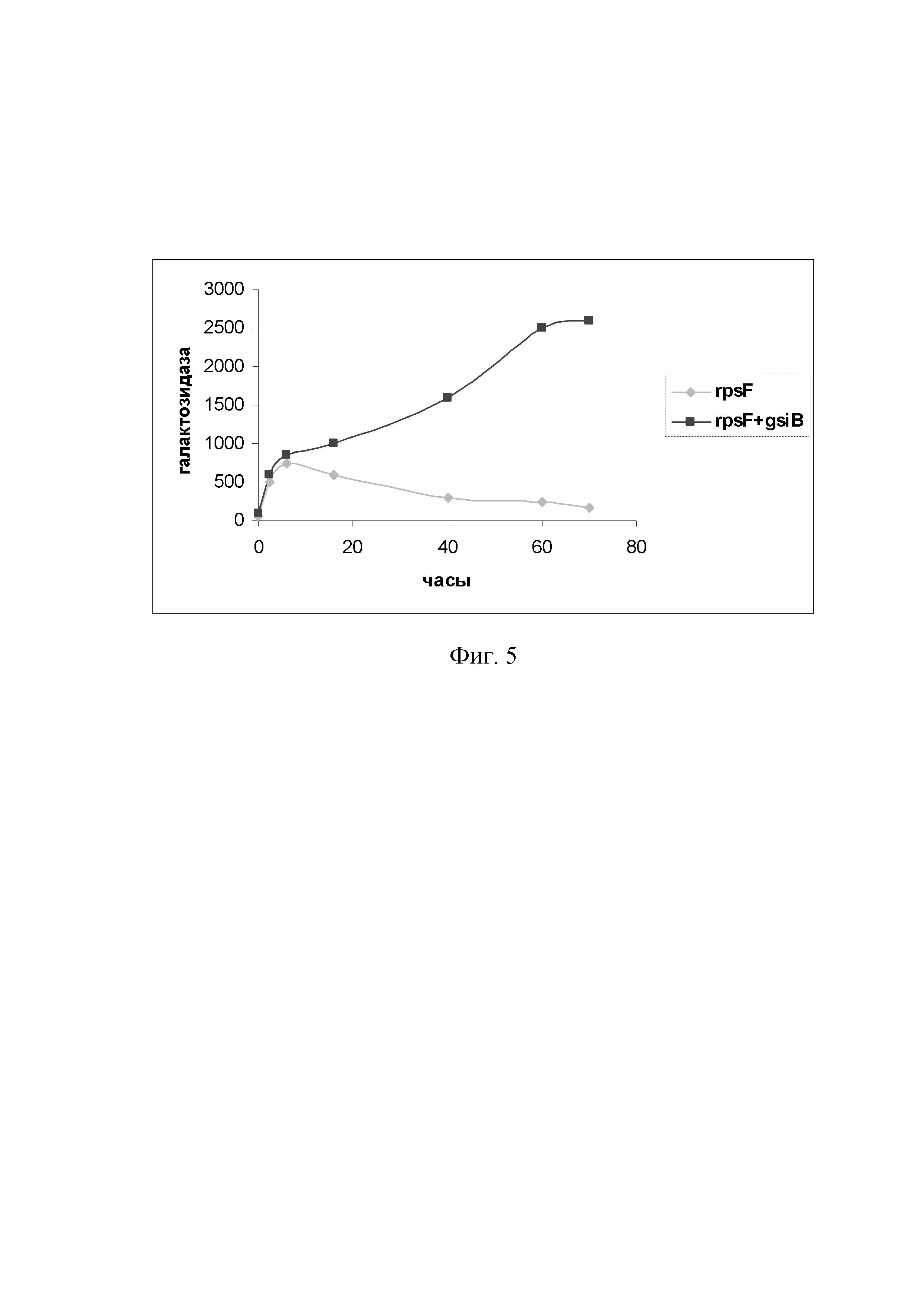
На Фиг. 5 приведены данные сравнения эффективности функционирования гибридного промотора PrpsF-gsiB и одиночного промотора PrpsF в процессе ферментации штаммов B. subtilis.
Осуществление изобретения
Тандемный промотор PrpsF-gsiB согласно настоящему изобретению представляет собой слияние промотора гена rpsF, кодирующего синтез рибосомного белка S6, и промотора гена gsiB, ответственного за белок общего клеточного стресса (РgsiB), причем промотор rpsF расположен выше по ходу транскрипции относительно промотора gsiB. Промотор PrpsF содержит близкую к консенсусной последовательности область -35 (TTGTAA) и консенсусную последовательность области -10 (TATAAT). Промотор PrpsF относится к наиболее сильным промоторам в геноме бактерий рода Bacillus, в частности B. subtilis и обеспечивает максимально высокий уровень транскрипции на логарифмической стадии роста бактерий. Инициация транскрипции этого промотора осуществляется с участием вегетативной сигма-субъединицы РНК-полимеразы (ϭA). Нуклеотидная последовательность гена rpsF В. subtilis представлена в базе данных «GenBank» под номером GeneID: 937919 (нуклеотиды с 4199445 по 4199732 в последовательности NC_000964.3). Нуклеотидная последовательность промотора PrpsF В. subtilis показана на Фиг. 1. Инициация транскрипции гена gsiB инициируется с участием альтернативной сигма-субъединицы ϭB и достигает максимума на стационарной фазе роста бактерий. Нуклеотидная последовательность гена gsiB В. subtilis представлена в базе данных «GenBank» под номером GeneID: 938235 (нуклеотиды с 494506 по 494877 в последовательности NC_000964.3). Нуклеотидная последовательность промотора PrpsF В. subtilis показана на Фиг. 2.
Нуклеотидная последовательность тандемного промотора PrpsF-gsiB согласно настоящему изобретению показана на Фиг. 4 и приведена в Перечне последовательностей под номером SEQ ID NO: 1.
Термины «тандемный промотор PrpsF-gsiB функционально связан» с целевым геном или «ген находится под контролем гибридного тандемного промотора PrpsF-gsiB» означают, что природные промоторы указанных генов заменены на промотор PrpsF-gsiB.
В настоящем описании в одном из воплощений заявленного изобретения для целей иллюстрации тандемный промотор PrpsF-gsiB функционально связан с репортерным геном lacZ, кодирующим β-галактозидазу. В другом иллюстративном воплощении заявленного изобретения, исключительно в качестве примера и для изучения профиля экспрессии генов, находящихся под контролем тандемного промотора PrpsF-gsiB, в процессе культивирования бактерии, содержащей тандемный промотор, функционально связан с последовательностью нуклеиновой кислоты, имеющей отношение к продукции целевого продукта. Однако специалисту в данной области техники понятно, что указанный тандемный промотор PrpsF-gsiB может быть функционально связан с любым геном, слиянием генов или опероном, имеющим отношение к продукции целевого продукта, и будет обеспечивать практически такой же профиль экспрессии указанного гена, слияния генов или оперона, как и профиль экспрессии репортерного гена lacZ, продемонстрированный в настоящем описании.
Термин «бактерия рода Bacillus» означает бактерию, которую относят к роду Bacillus в соответствии с классификацией, известной для специалиста в области микробиологии.
К бактериям рода Bacillus относятся, например, бактерии Bacillus alkalophilus, Bacillus amyloliquefaciens, Bacillus brevis, Bacillus circulans, Bacillus clausii, Bacillus coagulans, Bacillus firmus, Bacillus lautus, Bacillus lentus, Bacillus licheniformis, Bacillus megaterium, Bacillus pumilus, Bacillus stearothermophilus, Bacillus subtilis и Bacillus thuringiensis, но список видов рода Bacillus не ограничивается ими. Предпочтительными является использование бактерии Bacillus subtilis.
Известно, что род Bacillus включает в себя больше 200 видов бактерий, наиболее практически важные из которых, кроме общих морфологических, физиологических культуральных свойств, отличаются определенным сходством в организации генома и механизмах экспрессии генов. В прямых экспериментах показано, что, например,промотор гена внеклеточной протеиназы aprE B. subtilis способен инициировать синтез репортерного белка в клетках бацилл различного вида, иногда даже в большей степени, чем в клетках B. subtilis (Genome Biology, 5, 77, 2004).
Термин «гетерологичный ген» означает, что указанный ген выделен из хромосомы организма, отличного от используемой клетки-хозяина, например, бактерии рода Bacillus, в частности B. subtilis.
Термин «целевой продукт» означает любое представляющее интерес химическое соединение, продуцируемое бактерией и накапливающееся внутри клетки в растворимом или ином (например, в виде телец включения) виде, или питательной среде, в которой культивируют указанную бактерию. Целевой продукт представляет собой соединение, выбранное из группы, включающей аминокислоты, полипептиды, углеводы, полисахариды, нуклеиновые кислоты и их производные, но не ограничивается ими.
К способам согласно настоящему изобретению относится способ получения целевого продукта, включающий стадии выращивания бактерии согласно настоящему изобретению в питательной среде с целью продукции и накопления целевого продукта, и последующего выделения указанного целевого продукта.
Согласно настоящему изобретению выращивание, сбор и очистка полезного метаболита из культуральной или подобной ей жидкости может быть осуществлена способом, подобным традиционным способам культивирования, в которых целевой продукт продуцируется с использованием микроорганизма. Питательная среда, используемая для выращивания, может быть как синтетической, так и натуральной при условии, что указанная среда содержит источники углерода, азота, минеральные добавки и, если необходимо, соответствующее количество питательных добавок, которые требуются микроорганизму для роста. К источникам углерода относятся различные углеводы, такие как глюкоза и сахароза, и различные органические кислоты. В качестве источника азота могут использоваться различные соли аммония, такие как сульфат аммония, другие соединения азота, такие как аммиак, амины, природные источники азота, такие как пептон, гидролизат соевых бобов и ферментолизат микроорганизмов. В качестве минеральных добавок могут использоваться монофосфат калия, сульфат магния, хлорид натрия, сульфат железа, сульфат марганца, хлорид кальция и подобные соединения (Anagnostopoulos C., Spizizen J. Requirement for transformation in Bacillus subtilis // J. Bacteriol. 1961. V. 81.P. 7411. ln); C. R. Harwood and S. M. Cutting (ed.) Molecular biological methods for Bacillus// Wiley, Chichester, United Kingdom, 1990
Выращивание осуществляют предпочтительно в аэробных условиях, таких как перемешивание, ферментация с аэрацией, при температуре от 20 до 40°С, предпочтительно от 30 до 38°С. рН питательной среды находится в пределах от 5 до 9, предпочтительно от 6,5 до 7,2. рН среды может регулироваться аммиаком, карбонатом кальция, различными кислотами, основаниями и буферами. Обычно выращивание в течение от 1 до 5 дней приводит к накоплению целевого продукта в культуральной жидкости.
После выращивания твердые остатки, такие как клетки, могут быть удалены из культуральной жидкости методом центрифугирования или фильтрацией через мембрану, а затем целевой продукт может быть собран и очищен методами хроматографии, концентрирования и/или кристаллизации, фракционного осаждения солями, осаждения органическими растворителями и т.д., а также любыми сочетаниями указанных методов.
Настоящее изобретение более детально описано со ссылкой на примеры.
Примеры
Последующие примеры приведены для целей разъяснения сущности настоящего изобретения и не ограничивают каким-либо образом объем правовой охраны, определяемый формулой настоящего изобретения.
Пример 1. Конструирование гибридного промотора PrpsF-gsiB.
Конструирование гибридного промотора PrpsF-gsiB проводили в несколько этапов. Сначала c хромосомной ДНК B. subtilis провели ПЦР-амплификацию фрагмента промотора PrpsF размером 193 п.н. с использованием праймера 1 (SEQ ID NO: 2), содержащего сайт узнавания рестриктазы EcoRI, и праймера 2 (SEQ ID NO: 3), содержащего на 5'-конце последовательность, комплементарную участку промотора gsiB. Нуклеотидная последовательность промотора PrpsF с указанием расположения и последовательности праймеров приведена на Фиг. 1.
ПЦР-амплификацию проводили в 50 мкл инкубационной смеси, содержащей 5 нг хромосомной ДНК B. subtilis в качестве матрицы, по 20 пмоль праймеров 1 и 2, 1x буфер для ПЦР, смесь дезоксинуклеозидтрифосфатов (dNTP) (каждый в концентрации 0.5 мМ) и 2 ед. акт. термостабильной Taq-полимеразы. Реакции проводили в термоциклере My Cycler BioRad, запрограммированном на 1 цикл при 95оС в течение 5 мин; 30 циклов, каждый при 95°С в течение 30 сек, при 56оС в течение 30 сек, при 72°С в течение 30 сек, и 1 цикл при 72°С в течение 5 мин. Продукты анализировали гель-электрофорезом в 1.2% агарозе в 1х ТАE (Sambrook J., Fritsch E.F., Maniatis T. Molecular cloning: a laboratory manual. 2nd ed. N.Y.: Cold Spring Harbor Lab., 1989). Ожидаемый фрагмент составлял примерно 190 п.н.
На следующем этапе амплифицировали фрагмент промотора gsiB размером 184 п.н. с использованием праймера 3 (SEQ ID NO: 4), содержащего на 5'-конце последовательность, комплементарную участку промотора PrpsF и праймера 4 (SEQ ID NO: 5). Нуклеотидная последовательность промотора PgsiB с указанием расположения и последовательности праймеров приведена на Фиг. 2.
ПЦР-амплификацию проводили в 50 мкл инкубационной смеси, содержащей 5 нг хромосомной ДНК B. subtilis в качестве матрицы, по 20 пмоль праймеров 1 и 2, 1x буфер для ПЦР, смесь dNTP (каждый в концентрации 0.5 мМ) и 2 ед. акт. термостабильной Taq-полимеразы. Реакции проводили в термоциклере My Cycler BioRad, запрограммированном на 1 цикл при 95оС в течение 5 мин; 30 циклов, каждый при 95°С в течение 30 сек, при 56оС в течение 30 сек, при 72°С в течение 30 сек, и 1 цикл при 72°С в течение 5 мин. Продукты анализировали гель-электрофорезом в 1.2% агарозе в 1х ТАE. Ожидаемый фрагмент составлял примерно 200 п.н.
Затем с помощью ПЦР проводили состыковку двух полученных фрагментов путем их отжига друг на друга с использованием следующего режима ПЦР: ПЦР-амплификацию проводили в 50 мкл инкубационной смеси, содержащей по 5 нг ДНК каждого из фрагментов, 1x буфер для ПЦР, смесь dNTP (каждый в концентрации 0,5 мМ) и 2 ед. акт. термостабильной Taq-полимеразы. Реакции проводили в термоциклере My Cycler BioRad, запрограммированном на 1 цикл при 95оС в течение 5 мин; 10 циклов, каждый при 95°С в течение 30 сек, при 52оС в течение 30 сек, при 72°С в течение 2 мин, и 1 цикл при 72°С в течение 5 мин. После этого в реакционную смесь добавляли праймер 1 (SEQ ID NO: 2), содержащий сайт узнавания рестриктазы EcoRI, и праймер 5 (SEQ ID NO: 6), содержащий сайт узнавания рестриктазы BamHI, и проводили ПЦР в следующем режиме: 25 циклов, каждый при 95°С в течение 30 сек, при 56оС в течение 30 сек, при 72°С в течение 30 сек, и 1 цикл при 72°С в течение 5 мин. Продукты анализировали гель-электрофорезом в 1,2% агарозе в 1х ТАE. Ожидаемый фрагмент составлял примерно 255 п.н.
Полученный объединенный ПЦР фрагмент размером 255 п.н. обрабатывали рестриктазами EcoRI и BamHI и клонировали в соответствующие сайты плазмиды pDG268 (Cell 111: 747-756, 2002), которая содержит кассету, включающую полилинкер для клонирования, репортерный ген lacZ без собственного промотора и ген устойчивости к хлорамфениколу (CmR) (Фиг. 3). Кассета фланкирована фрагментами гена amyE, что позволяет проводить интеграцию вектора с клонированным фрагментом в локус amyE на хромосоме B. subtilis. Полученную плазмиду, получившую наименование pDG268-P, трансформировали в компетентные клетки штамма E. coli TG1. Трансформанты отбирали на LB-среде, cодержащей 100 мкг/мл ампициллина. Плазмидную ДНК очищали в агарозном геле и элюировали с помощью колонок (GFX PCR DNA and Gel Band Purification Kit фирмы Illustra) или шариков DNA Gel Extractionkit (компания «Fermentas»). Последовательность ДНК вставки подтверждали путем секвенирования ДНК с использованием праймера 6 (SEQ ID NO: 7) (прямой) и праймера 7 (SEQ ID NO: 8) (обратный).
На заключительном этапе проводили интеграцию полученной плазмиды, получившей наименование pDG268-P, содержащей гибридный промотор PrpsF-gsiB, в хромосомный локус amyE B. subtilis. С этой целью перед трансформацией в клетки B. subtilis плазмидную ДНК pDG268-P линеаризовали с помощью рестриктазы XbaI для обеспечения интеграции в хромосому путем двойного кроссинговера вместо простого кроссинговера. Компетентные клетки штамма B. subtilis 168 трансформировали обработанной рестриктазой XbaI ДНК плазмиды pDG268-P и проводили отбор трансформантов на среде LB, содержащей 10 мкг/мл хлорамфеникола. Для подтверждения интеграции плазмиды в хромосомный локус amyE использовали индикаторную среду, содержащую амилопектиназу в концентрации 0,2 %.
Таким образом, в результате проведенных манипуляций была сконструирована плазмида pDG268-Р, содержащая гибридный промотор PrpsF-gsiB и примыкающий к нему репортерный ген lacZ, что позволяет провести тестирование активности этого гибридного промотора в условиях ферментации. Нуклеотидная последовательность гибридного промотора PrpsF-gsiB представлена на Фиг. 4.
Как видно из Фиг. 4, гибридный промотор содержит по два -35 и -10 участка и два старта транскрипции, которые, как полагают изобретатели без намерения быть ограниченными какой-либо теорией, могут попеременно использоваться на различных стадиях роста культуры и обеспечивать оптимальную экспрессию генов, находящихся под контролем этого промотора.
Пример 2. Определение эффективности функционирования гибридного тандемного промотора PrpsF-gsiB
Для определения эффективности функционирования гибридного тандемного промотора PrpsF-gsiB полученную на предыдущем этапе плазмиду pDG268-P, содержащую транскрипционное слияние промотора PrpsF-gsiB с репортерным геном lacZ, трансформировали в клетки штамма B. subtilis 168, и у полученных тансформантов проводили измерение активности β-галактозидазы в условиях ферментации на полноценной среде LB. В качестве контроля использовали сконструированный параллельно вариант транскрипционного слияния гена lacZ с одиночным промотором PrpsF. Пробы для измерения активности β-галактозидазы отбирали через 2, 5, 6, 16, 40, 60 и 70 часов с начала ферментации. Результаты определения активности β-галактозидазы у исследуемых штаммов представлены на Фиг. 5.
Как следует из данных, представленных на Фиг. 5, эффективность функционирования исследуемых промоторов примерно одинакова до ранней стационарной стадии роста культуры, однако, начиная с 16 часов культивирования активность одиночного промотора PrpsF начинает снижаться, а к 60-ти часам ферментации падает почти на порядок. В то же время, активность гибридного промотора PrpsF-gsiB в процессе ферментации продолжает нарастать и достигает максимума на поздних стадиях стационарного роста. Таким образом, сконструированный нами гибридный промотор PrpsF-gsiB позволяет получать оптимальный профиль экспрессии целевого гена в ходе культивирования бактерии и представляется весьма перспективным для усиления экспрессии целевых генов, используемых для продукции полезных метаболитов.
Пример 3. Получение генетической конструкции АМ2640 путем введения в хромосому штамма-реципиента Bacillus subtilis 168 слияния гена hasA S. equisimilis с геном tuaD B. subtilis под контролем гибридного тандемного промотора PrpsF-gsiB.
Известно, что гены, участвующие в биосинтезе предшественников сахара для получения гиалуроновой кислоты, включают, в частности, ген tuaD B. subtilis, кодирующий UDP-глюкозо-6-дегидрогеназу (КФ1.1.1.22). В Streptococcus pyogenes оперон гиалуронансинтазы состоит из трех генов hasA, hasB и hasC, кодирующих гиалуронатсинтазу, UDP-глюкозодегидрогеназу и UDP-глюкозопирофосфорилазу, соответственно (Proc. Natl. Acad. Sci. USA. 98, 4658-4663,2001). В международной публикации WO 99/51265 описан сегмент нуклеиновой кислоты, содержащий кодирующую область гиалуронатсинтазы Streptococcus equisimilis.
Конструирование слияния гена hasA S. equisimilis с геном tuaD B. subtilis под контролем гибридного тандемного промотора PrpsF-gsiB проводили в несколько этапов. Сначала ген hasA синтезировали химически, взяв за основу нуклеотидную последовательность гена hasA S. equisimilis, и клонировали в вектор pUC57. С полученной плазмидной ДНК провели ПЦР-амплификацию гена hasA 1250 п.н. с использованием праймера 8 (SEQ ID NO: 9), содержащего сайт узнавания рестриктазы BamHI, и праймера 9 (SEQ ID NO: 10), содержащего на 5'-конце последовательность, комплементарную участку N-конца гена tuaD из B. subtilis.
ПЦР-амплификацию проводили в 50 мкл инкубационной смеси, содержащей 3 нг плазмидной ДНК pUC57 в качестве матрицы, по 20 пмоль праймеров 8 (SEQ ID NO: 9) и 9 (SEQ ID NO: 10), 1x буфер для ПЦР, смесь dNTP (каждый в концентрации 0.5 мМ) и 2 ед. акт. термостабильной Taq-полимеразы. Реакции проводили в термоциклере My Cycler BioRad, запрограммированном на 1 цикл при 95оС в течение 5 мин; 30 циклов, каждый при 95°С в течение 30 сек, при 58оС в течение 30 сек, при 72°С в течение 2 мин, и 1 цикл при 72°С в течение 5 мин. Продукты анализировали гель-электрофорезом в 1.2% агарозе в 1х ТАE. Ожидаемый фрагмент составлял примерно 1270 п.н.
На следующем этапе c хромосомной ДНК B. subtilis провели ПЦР-амплификацию гена tuaD с использованием праймера 10 (SEQ ID NO: 11), содержащего на 5'-конце последовательность, комплементарную С-концу гена hasA S. equisimilis, и праймера 11 (SEQ ID NO: 12), содержащего сайт узнавания рестриктазы NotI.
ПЦР-амплификацию проводили в 50 мкл инкубационной смеси, содержащей 5 нг хромосомной ДНК B. subtilis в качестве матрицы, по 20 пмоль праймеров 10 (SEQ ID NO: 11) и 11 (SEQ ID NO: 12), 1x буфер для ПЦР, смесь dNTP (каждый в концентрации 0.5 мМ) и 2 ед. акт. термостабильной Taq-полимеразы. Реакции проводили в термоциклере My Cycler BioRad, запрограммированном на 1 цикл при 95оС в течение 5 мин; 30 циклов, каждый при 95°С в течение 30 сек, при 58оС в течение 30 сек, при 72°С в течение 2 мин, и 1 цикл при 72°С в течение 5 мин. Продукты анализировали гель-электрофорезом в 1.2% агарозе в 1х ТАE. Ожидаемый фрагмент составлял примерно 1450 п.н.
Затем с помощью ПЦР проводили состыковку фрагментов, полученных с использованием пар праймеров 8-9 и 10-11, путем их отжига друг на друга с использованием следующего режима ПЦР: ПЦР-амплификацию проводили в 50 мкл инкубационной смеси, содержащей по 5 нг ДНК фрагментов, полученных с использованием пар праймеров 8-9 и 10-11, 1x буфер для ПЦР, смесь dNTP (каждый в концентрации 0.5 мМ) и 2 ед. акт. термостабильной Taq-полимеразы. Реакции проводили в термоциклере My Cycler BioRad, запрограммированном на 1 цикл при 95оС в течение 5 мин; 10 циклов, каждый при 95°С в течение 30 сек, при 52оС в течение 30 сек, при 72°С в течение 2 мин, и 1 цикл при 72°С в течение 5 мин. После этого в реакционную смесь добавляли праймер 8 (SEQ ID NO: 9), содержащий сайт узнавания рестриктазы BamHI, и праймер 11 (SEQ ID NO: 12), содержащий сайт узнавания рестриктазы NotI, и проводили ПЦР в режиме: 25 циклов, каждый при 95°С в течение 30 сек, при 56оС в течение 30 сек, при 72°С в течение 2.5 мин, и 1 цикл при 72°С в течение 5 мин. Продукты анализировали гель-электрофорезом в 1.2% агарозе в 1х ТАE. Ожидаемый фрагмент составлял примерно 2700 п.н.
Полученный ПЦР фрагмент размером 2700 п.н. обрабатывали рестриктазами BamHI и NotI, и клонировали в соответствующие сайты полученной ранее плазмиды pDG268-Р, содержащей гибридный тандемный промотор PrpsF-gsiB. Полученную плазмиду, получившую наименование pDG268-PHT, трансформировали в компетентные клетки штамма E. coli TG1. Трансформанты отбирали на LB-среде, cодержащей 100 мкг/мл ампициллина. Плазмидную ДНК очищали в агарозном геле и элюировали с помощью колонок (GFX PCR DNA and Gel Band Purification Kit фирмы Illustra) или шариков DNA Gel Extractionkit (компания «Fermentas»). Нуклеотидную последовательность ДНК вставки подтверждали путем секвенирования ДНК с использованием праймеров 12 (SEQ ID NO: 13) (прямой) и 13 (SEQ ID NO: 14) (обратный).
На заключительном этапе проводили интеграцию полученной плазмиды pDG268-PHT в хромосомный локус amyE B. subtilis. С этой целью перед трансформацией в клетки B. subtilis плазмидную ДНК pDG268-PHT линеаризовали с помощью рестриктазы XbaI для обеспечения интеграции в хромосому путем двойного кроссинговера вместо простого кроссинговера. Компетентные клетки штамма B. subtilis 168 трансформировали обработанной рестриктазой XbaI ДНК плазмиды pDG268-P и проводили отбор трансформантов на среде LB, содержащей 10 мкг/мл хлорамфеникола. Для подтверждения интеграции плазмиды в хромосомный локус amyE использовали индикаторную среду, содержащую амилопектин в концентрации 0,2 %.
Таким образом, в результате проведенных манипуляций была получена генетическая конструкция на основе B. subtilis, содержащей в хромосоме слияние гена hasA S. equisimilis с геном tuaD B. subtilis под контролем гибридного тандемного промотора PrpsF-gsiB.
Пример 4. Синтез гиалуроновой кислоты генетической конструкцией АМ2640 при культивировании.
Полученную, как описано в Примере 3, генетическую конструкцию АМ2640, содержащую в составе хромосомы слияние гетерологичного гена hasA S. equisimilis с геном tuaD B. subtilis под контролем гибридного тандемного промотора PrpsF-gsiB, проверяли на способность синтезировать гиалуроновую кислоту при культивировании в лабораторном ферментере объемом 3 л с использованием ферментационной среды. Результаты представлены в Таблице 1.
Как следует из данных Таблицы 1, полученная генетическая конструкция демонстрировала значительно более высокий уровень накопления гиалуроновой кислоты по сравнению с исходным штаммом B. subtilis 168.
Хотя настоящее изобретение подробно описано выше со ссылкой на предпочтительные варианты его осуществления, для специалиста в данной области техники ясно, что могут быть сделаны различные замены и применены эквиваленты, которые не выходят за рамки настоящего изобретения. Все процитированные здесь документы являются частью настоящей заявки и включены в нее посредством отсылки.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ООО "ЦЕНТР ТРАНСФЕРА БИОТЕХНОЛОГИЙ ОКА-БИОТЕХ"
<120> ТАНДЕМНЫЙ ПРОМОТОР, ФУНКЦИОНИРУЮЩИЙ В БАКТЕРИИ РОДА Bacillus,
ТРАНСФОРМИРОВАННАЯ БАКТЕРИЯ РОДА Bacillus - ПРОДУЦЕНТ ЦЕЛЕВОГО
ПРОДУКТА, СОДЕРЖАЩАЯ УКАЗАННЫЙ ПРОМОТОР, И СПОСОБ ПОЛУЧЕНИЯ
ЦЕЛЕВОГО ПРОДУКТА С ИСПОЛЬЗОВАНИЕМ УКАЗАННОЙ БАКТЕРИИ
<130> Промотор
<160> 14
<170> PatentIn version 3.5
<210> 1
<211> 210
<212> DNA
<213> Artificial Sequence
<220>
<223> Тандемный промотор PrpsF-gsiB
<400> 1
cttgaaggga aagaatatgt ggtccaagac ggagatgtta ttcatttccg atttaatgta 60
taggatgcag ttgtaaaggg acaagagctt tggtataata taaaattgtg agtaatagaa 120
ttattgctcc ttgcccatta tggggtttgt ttaaaagaat tgtgagcggg aatacaacaa 180
caacaccaat taaaggagga attcaaaatg 210
<210> 2
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер 1
<400> 2
cgcgaattct tgcgggcggc ggtat 25
<210> 3
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер 2
<400> 3
cacaattctt ttaaacccca taatgggcaa ggagcaata 39
<210> 4
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер 3
<400> 4
ttgcccatta tggggtttgt ttaaaagaat tgtgagcgg 39
<210> 5
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер 4
<400> 5
ttgctagtgg cttctccgcc t 21
<210> 6
<211> 31
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер 5
<400> 6
cgcggatcca ttttaaattc ctcctttaat t 31
<210> 7
<211> 18
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер 6
<400> 7
taagggtaac tattgccg 18
<210> 8
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер 7
<400> 8
taagttgggt aacgccaggg 20
<210> 9
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер 8
<400> 9
cgcggatcct aaatgagaac attaaaaaac ctcataa 37
<210> 10
<211> 46
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер 9
<400> 10
ttcattttga attcctcctt tttataataa ttttttacgt gttccc 46
<210> 11
<211> 46
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер 10
<400> 11
tataaaaagg aggaattcaa aatgaaaaaa atagctgtca ttggaa 46
<210> 12
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер 11
<400> 12
cccgcggccg ccgagcctag cagccgg 27
<210> 13
<211> 18
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер 12
<400> 13
taagggtaac tattgccg 18
<210> 14
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер 13
<400> 14
taagttgggt aacgccaggg 20
<---