НОВЫЕ ПОЛИПЕПТИДЫ СО СПЕЦИФИЧЕСКИМ СВЯЗЫВАНИЕМ И ПУТИ ИХ ПРИМЕНЕНИЯ
Вид РИД
Изобретение
I. Уровень техники
Мутеины разных липокалинов представляют собой быстро пополняющийся класс терапевтических средств. В самом деле, мутеины липокалинов могут быть сконструированы так, чтобы проявлять высокие аффинность и специфичность к мишени, которая отлична от естественного лиганда липокалинов дикого типа (например, WO 99/16873, WO 00/75308, WO 03/029463, WO 03/029471 и WO 05/19256), такого как интерлейкин-17A или интерлейкин-23.
A. Интерлейкин-17A
Интерлейкин-17A (IL-17A, синонимично IL-17) представляет собой цитокин, продуцируемый T-клетками линии дифференцировки Th17. IL-17 первоначально был обозначен как «CTL-ассоциированный антиген 8» (CTLA-8) (Rouvier et al., J. Immunol, 150 5445-5556 (1993); Yao et al., Immunity, 3: 811-821 (1995)). Эквивалент CTLA-8 человека позже был клонирован и обозначен как «IL-17» (Yao et al., J. Immunol, 155(12): 5483-5486 (1995); Fossiez et al., J. Exp. Med., 183(6): 2593-2603 (1996)).
IL-17A человека (CTLA-8, далее называемый IL-17, Swiss-Prot Q16552) представляет собой гликопротеин с молекулярной массой, составляющей 17000 дальтон (Spriggs et al., J. Clin. Immunol, 17: 366-369 (1997)). IL-17A может существовать или в виде гомодимера IL-17 A/A, или в виде гетеродимера, в комплексе с гомологом IL-17F с образованием гетеродимерного IL-17 A/F. IL-17F (IL-24, ML-1) характеризуется 55% аминокислотной идентичностью с IL-17A. IL-17A и IL-17F также совместно используют один и тот же рецептор (IL-17RA), который экспрессируется широким спектром клеток, в том числе клетками эндотелия сосудов, периферическими T-клетками, B-клетками, фибробластом, клетками легких, миеломоноцитарными клетками и стромальными клетками костного мозга (Kolls et al., Immunity, 21:467-476 (2004); Kawaguchi et al., J. Allergy Clin. Immunol, 114(6): 1267-1273 (2004); Moseley et al., Cytokine Growth Factor Rev., 14(2): 155-174 (2003)). Были идентифицированы дополнительные гомологи IL-17 (IL-17B, IL-17C, IL-17D и IL-17E). Эти другие представители семейства характеризуются аминокислотной идентичностью с IL-17A менее 30% (Kolls et al., 2004).
IL-17A в основном экспрессируется Th17-клетками и присутствует с повышенными уровнями в синовиальной жидкости пациентов с ревматоидным артритом (RA), и, как было показано, вовлечен в раннее развитие RA. IL-17A также экспрессируется на избыточном уровне в спинномозговой жидкости пациентов с рассеянным склерозом (MS). К тому же, IL-17 является индуцирующим фактором для TNF-α и IL-1, при этом последний в основном ответственен за эрозию костей и чрезвычайно болезненные последствия для пораженных пациентов (Lubberts E. (2008) Cytokine, 41, p. 84-91). Кроме того, неадекватное или чрезмерное продуцирование IL-17A связано с патологиями разных других заболеваний и нарушений, таких как остеоартрит, расшатывание костных имплантатов, острое отторжение трансплантата (Antonysamy et al., (1999) J. Immunol, 162, p. 577-584; van Kooten et al. (1998) J. Am. Soc. Nephrol., 9, p.1526-1534), септицемия, септический или эндотоксиновый шок, типы аллергии, астма (Molet et al., (2001) J. Allergy Clin. Immunol., 108, p. 430-438), разрежение кости, псориаз (Teunissen et al. (1998) J. Invest. Dermatol, 111, p. 645-649), ишемия, системный склероз (Kurasawa et al., (2000) Arthritis Rheum., 43, p. 2455-2463), инсульт и другие воспалительные нарушения.
Хотя, с тех пор как открыли этот крайне важный провоспалительный цитокин, было описано множество ингибиторов IL-17A, существующие в настоящее время подходы являются не наилучшими, как, например, существует необходимость в сложных системах клеток млекопитающих для продуцирования, зависимость от стабильности дисульфидных связей, склонность к агрегированию некоторых фрагментов антител, ограниченная растворимость и последнее, но не менее важное, они могут вызывать нежелательные иммунные реакции даже при гуманизации. Тем самым сохраняется необходимость в разработке белков, таких как мутеины липокалинов, с аффинностью связывания в отношении IL-17A.
B. Интерлейкин-23
Интерлейкин-23 (также известный как IL-23) представляет собой гетеродимерный цитокин, образованный двумя субъединицами, т.е. p19 и p40 (B. Oppmann et al., Immunity 13, 715 (2000)). Субъединица p19 (Swiss Prot Q9NPF7, в данном документе взаимозаменяемо называют «IL-23p19») по структуре родственна IL-6, колониестимулирующему фактору гранулоцитов (G-CSF) и субъединице p35 IL-12. IL-23 опосредует передачу сигнала путем связывания с гетеродимерным рецептором, образованным IL-23R и IL-12бета1. Субъединица IL-12бета1 является общей с рецептором IL-12, который образован IL-12бета1 и IL-12бета2. Как было недавно описано, у трансгенных по p19 мышей проявляется сильное системное воспаление и нейтрофилия (M. T. Wiekowski et al., J Immunol 166, 7563 (2001)).
Как сообщалось, IL-23 человека способствует пролиферации T-клеток, в частности T-клеток памяти, и может участвовать в дифференцировке и/или поддержании Th17-клеток (D.M. Frucht, Sci STKE 2002 Jan 8; 2002(114):PE1).
Хотя, с тех пор как открыли этот крайне важный гетеродимерный цитокин, было описано множество селективных ингибиторов IL-23 (путем связывания с субъединицей p19), эти существующие в настоящее время подходы все еще имеют ряд серьезных недостатков, как, например, необходимость в сложных системах клеток млекопитающих для продуцирования, зависимость от стабильности дисульфидных связей, склонность к агрегированию некоторых фрагментов антител, ограниченная растворимость и последнее, но не менее важное, они могут вызывать нежелательные иммунные реакции даже при гуманизации. Тем самым существует неудовлетворенная потребность в разработке белков, таких как мутеины липокалинов, с аффинностью связывания в отношении IL-23.
II. ОПРЕДЕЛЕНИЯ
В приведенном ниже списке определены термины, фразы и сокращения, используемые по всему данному описанию. Предполагается, что все термины, перечисленные и определенные в данном документе, охватывают все грамматические формы.
Используемый в данном документе «IL-17A» (в том числе IL-17 A/A, а также IL-17A в комплексе с IL-17F, также называемый IL-17 A/F) означает полноразмерный белок, обозначенный как Swiss Prot Q16552, его фрагмент или его вариант.
Используемый в данном документе «IL-23p19» означает полноразмерный белок, обозначенный как Swiss Prot Q9NPF7, его фрагмент или его вариант.
Используемая в данном документе «выявляемая аффинность» означает способность связываться с выбранной мишенью с аффинной константой, как правило, по меньшей мере приблизительно 10-5 M. Более низкие значения аффинности, как правило, уже невозможно измерить при помощи общепринятых способов, таких как ELISA, и следовательно являются второстепенными. Например, аффинности связывания мутеинов липокалинов согласно настоящему раскрытию могут в некоторых вариантах осуществления составлять KD меньше 800 нМ, в некоторых вариантах осуществления составлять KD меньше 30 нМ и в некоторых вариантах осуществления составлять приблизительно 50 пикомоль (пM) или меньше.
Используемую в данном документе «аффинность связывания» белка по настоящему раскрытию (например, мутеина липокалина) или его белка слияния с выбранной мишенью (в данном случае IL-17A или IL-23p19) можно измерять (и, таким образом, определять значения KD комплекса мутеин-лиганд) с помощью большого количества способов, известных специалисту в данной области. Такие способы включают без ограничения флуоресцентное титрование, конкурентный ELISA, калориметрические способы, такие как изотермическая титрационная калориметрия (ITC), и поверхностный плазмонный резонанс (BIAcore). Такие способы являются традиционными в уровне техники и их примеры также подробно описаны ниже.
Следует также отметить, что на образование комплекса между соответствующей связывающей молекулой и ее лигандом влияет много различных факторов, как, например, концентрации соответствующих партнеров по связыванию, присутствие конкурентов, pH и ионная сила используемой буферной системы и экспериментальный способ, используемый для определения константы диссоциации, KD, (например, флуоресцентное титрование, конкурентный ELISA или поверхностный плазмонный резонанс, к примеру) или даже математический алгоритм, который используют для оценки экспериментальных данных.
Следовательно, также очевидно специалисту в данной области, что значения KD (константа диссоциации комплекса, образованного между соответствующей связывающей молекулой и ее мишенью/лигандом) могут варьироваться в пределах определенного экспериментального диапазона в зависимости от способа и экспериментальной установки, которую используют для определения аффинности конкретного мутеина липокалина в отношении данного лиганда. Это значит, что может иметь место незначительное отклонение в измеренных значениях KD или диапазоне допусков, зависящее, например, от того было ли значение KD определено при помощи поверхностного плазмонного резонанса (Biacore), при помощи конкурентного ELISA или при помощи «прямого ELISA».
Как используется в данном документе, «мутеин», «подвергнутый мутации» целостный объект (или белок, или нуклеиновая кислота) или «мутант» относится к обмену, делеции или вставке одного или более из нуклеотидов или аминокислот по сравнению со встречающимся в природе (дикого типа) «эталонным» остовом нуклеиновой кислоты или белка.
Термин «фрагмент», используемый в данном документе применительно к мутеинам по настоящему раскрытию, относится к белкам или пептидам, полученным из полноразмерного зрелого липокалина слезы человека, который укорочен с N-конца и/или C-конца, т.е. у него отсутствует по меньшей мере одна из N-концевых и/или C-концевых аминокислот. Такие фрагменты могут включать по меньшей мере 10 или более, как, например, 20 или 30 или более последовательных аминокислот первичной последовательности зрелого липокалина, и обычно являются выявляемыми при иммуноанализе зрелого липокалина. Указанный термин также включает фрагменты мутеина и вариантов, описанных в данном документе. Мутеины липокалинов по настоящему изобретению, их фрагменты или варианты, предпочтительно, сохраняют функцию связывания с IL-17A и/или IL23p19, описанными в данном документе.
Как правило, термин «фрагмент», используемый в данном документе в отношении соответствующего белкового лиганда IL-17A (в том числе IL-17 A/A и IL-17 A/F) или IL-23p19 для мутеина липокалина по настоящему раскрытию, или для комбинации согласно настоящему раскрытию, или для белка слияния, описанного в данном документе, относится к укороченным с N-конца и/или C-конца белковым или пептидным лигандам, которые сохраняют способность полноразмерного лиганда быть узнанным и/или связанным мутеином согласно настоящему раскрытию.
Термин «мутагенез», используемый в данном документе, означает, что экспериментальные условия выбраны таким образом, что аминокислота, встречающаяся в природе в данном положении последовательности зрелого липокалина, может быть заменена по меньшей мере одной аминокислотой, которая не присутствует в этом конкретном положении в соответствующей природной последовательности полипептида. Термин «мутагенез» также включает (дополнительную) модификацию длины сегментов последовательности путем делеции или вставки одной или более аминокислот. Таким образом, в пределах объема настоящего раскрытия находится то, что, например, одну аминокислоту в выбранном положении последовательности заменяют отрезком из трех случайных мутаций, что приводит к вставке двух аминокислотных остатков по сравнению с длиной соответствующего сегмента белка дикого типа. Такая вставка или делеция может быть введена независимо друг от друга в любой из сегментов пептидов, которые могут быть подвергнуты мутагенезу в настоящем раскрытии. Согласно одному иллюстративному варианту осуществления настоящего раскрытия вставка нескольких мутаций может быть введена в петлю AB остова выбранного липокалина (см. международную заявку на патент WO 2005/019256, которая включена в данный документ в полном объеме при помощи ссылки).
Термин «случайный мутагенез» означает, что отсутствует предопределенная единичная аминокислота (мутация) в определенном положении последовательности, но что по меньшей мере две аминокислоты могут быть включены с определенной вероятностью в заранее определенное положение последовательности во время мутагенеза.
«Идентичность» является свойством последовательностей, при помощи которого определяют их сходство или родство. Термин «идентичность последовательностей» или «идентичность», используемый в настоящем раскрытии, означает процентную долю попарных идентичных остатков - последующее (гомологичное) выравнивание последовательности полипептида по настоящему раскрытию с последовательностью запроса - относительно количества остатков в более длинной из этих двух последовательностей. Идентичность определяют путем деления количества идентичных остатков на общее количество остатков и умножения полученного результата на 100.
Термин «гомология» используют в данном документе в его общепринятом значении, и он включает идентичные аминокислоты, а также аминокислоты, которые рассматриваются как консервативные замены (например, обмен остатка глутамата на остаток аспартата) в аналогичных положениях в линейной аминокислотной последовательности полипептида по настоящему раскрытию (например, любого мутеина липокалина по настоящему раскрытию).
Процентную долю гомологии последовательностей или идентичности последовательностей, например, можно определять в данном документе с использованием программы BLASTP, версии blastp 2.2.5 (16 ноября 2002 года; см. Altschul, S. F. et al. (1997) Nucl. Acids Res. 25, 3389-3402). Согласно данному варианту осуществления процентная доля гомологии основана на выравнивании целых последовательностей полипептидов (матрица: BLOSUM 62; штрафы за гэпы: 11,1; пороговое значение устанавливали как 10-3), в том числе последовательностей пропептидов, предпочтительно с использованием остова белка дикого типа в качестве эталона в сравнительном анализе пар. Ее рассчитывают как процентную долю количества «положительных» (гомологичных аминокислот), указанных в качестве итога в результате программы BLASTP, разделенных на общее количество аминокислот, выбранных программой для выравнивания.
В частности, для того, чтобы определить соответствует ли аминокислотный остаток аминокислотной последовательности липокалина (мутеина), отличного от липокалина дикого типа, определенному положению в аминокислотной последовательности липокалина дикого типа, специалист в данной области может применять средства и способы, хорошо известные из уровня техники, например выравнивания, либо вручную, либо с использованием компьютерных программ, таких как BLAST2.0, которая означает средство поиска основного локального выравнивания, или ClustalW, или любая другая подходящая программа, которая подходит для получения выравниваний последовательностей. Соответственно, липокалин дикого типа может служить в качестве «последовательности для сравнения» или «эталонной последовательности», тогда как аминокислотная последовательность липокалина, отличного от липокалина дикого типа, описанного в данном документе, служит в качестве «искомой последовательности». Термины «эталонная последовательность» и «последовательность дикого типа» используют в данном документе взаимозаменяемо.
«Гэпы» представляют собой пространства в выравнивании, которые являются результатом добавлений или делеций аминокислот. Таким образом, две копии точно такой же последовательности характеризуются 100% идентичностью, но последовательности, которые в меньшей степени высоко консервативны и имеют делеции, добавления или замещения, могут характеризоваться меньшей степенью идентичности. Специалисту в данной области будет понятно, что несколько компьютерных программ доступны для определения идентичности последовательностей с использованием общепринятых параметров, например Blast (Altschul, et al. (1997) Nucleic Acids Res. 25, 3389-3402), Blast2 (Altschul, et al. (1990) J. Mol. Biol. 215, 403-410) и Smith-Waterman (Smith, et al. (1981) J. Mol. Biol. 147, 195-197).
Термин «вариант», используемый в настоящем раскрытии, относится к производным белка или пептида, которые включают модификации аминокислотной последовательности, например при помощи замены, делеции, вставки или химической модификации. Согласно некоторым вариантам осуществления такие модификации не снижают функциональность белка или пептида. Такие варианты включают белки, где одна или более аминокислот были замещены их соответствующими D-стереоизомерами или аминокислотами, отличными от встречающихся в природе 20 аминокислот, такими как, например, орнитин, гидроксипролин, цитруллин, гомосерин, гидроксилизин, норвалин. Однако, такие замены также могут быть консервативными, т.е. аминокислотный остаток замещают подобным по химическим свойствам аминокислотным остатком. Примеры консервативных замен представляют собой замещения из числа представителей следующих групп: 1) аланин, серин и треонин; 2) аспарагиновая кислота и глутаминовая кислота; 3) аспарагин и глутамин; 4) аргинин и лизин; 5) изолейцин, лейцин, метионин и валин и 6) фенилаланин, тирозин и триптофан. Термин «вариант», используемый в данном документе в отношении соответствующего белкового лиганда IL-17A (в том числе IL-17 A/A и IL-17 A/F) или IL-23p19 для мутеина липокалина по настоящему раскрытию, или для комбинации согласно настоящему раскрытию, или для белка слияния, описанного в данном документе, относится к белку IL-17 или его фрагменту или белку IL-23 или его фрагменту соответственно, который имеет одну или более, как, например,1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 40, 50, 60, 70, 80 или более, аминокислотных замен, делеций и/или вставок по сравнению с белком IL-17A или IL-23p19 дикого типа соответственно, как, например, эталонным белком IL-17A или IL-23p19, депонированным с идентификатором SwissProt, описанным в данном документе. Вариант IL-17A или IL-23p19 соответственно, предпочтительно характеризуется аминокислотной идентичностью, составляющей по меньшей мере 50%, 60%, 70%, 80%, 85%, 90% или 95%, с белком IL-17A или IL-23p19 дикого типа соответственно, как, например, эталонным белком IL-17A или IL-23p19, депонированным с идентификатором SwissProt, описанным в данном документе.
Под «нативной последовательностью» липокалина подразумевают липокалин, который характеризуется такой же аминокислотной последовательностью, что и соответствующий полипептид, полученный из естественного окружения. Таким образом, нативная последовательность липокалина может характеризоваться аминокислотной последовательностью соответствующего встречающегося в природе липокалина из любого организма, в частности млекопитающего. Такая нативная последовательность полипептида может быть выделена из естественного окружения или может быть получена при помощи рекомбинантных способов или способов синтеза. Термин «нативная последовательность» полипептида, как правило, охватывает встречающиеся в природе усеченные или секретированные формы липокалина, встречающиеся в природе вариантные формы, такие как, альтернативно, сплайсированные формы, и встречающиеся в природе аллельные варианты липокалина. «Вариант» полипептида означает биологически активный полипептид, характеризующийся по меньшей мере приблизительно 50%, 60%, 70%, 80% или по меньшей мере приблизительно 85% аминокислотной идентичностью последовательности с нативной последовательностью полипептида. Такие варианты включают, к примеру, полипептиды, в которых один или более аминокислотных остатков добавлены или удалены на N- или C-конце полипептида. Как правило, вариант характеризуется по меньшей мере приблизительно 70%, в том числе по меньшей мере приблизительно 80%, как, например, по меньшей мере приблизительно 85% аминокислотной идентичностью последовательности, в том числе по меньшей мере приблизительно 90% аминокислотной идентичностью последовательности или по меньшей мере приблизительно 95%, аминокислотной идентичностью последовательности с нативной последовательностью полипептида. В качестве иллюстративного примера первые 4 N-концевых аминокислотных остатка (HHLA) и последние 2 C-концевых аминокислотных остатка (Ser, Asp) могут быть удалены, например в мутеине липокалина слезы (Tlc) по настоящему раскрытию, без воздействия на биологическую функцию белка, например SEQ ID NO: 1.
Термин «положение» при использовании в соответствии с настоящим раскрытием означает либо положение аминокислоты в аминокислотной последовательности, описанной в данном документе, либо положение нуклеотида в последовательности нуклеиновой кислоты, описанной в данном документе. Для понимания термина «соответствует» или «соответствующий», используемого в данном документе в случае положения аминокислотной последовательности одного или более мутеинов липокалинов, соответствующее положение определено не только номером предыдущих нуклеотидов/аминокислот. Следовательно, положение данной аминокислоты в соответствии с настоящим раскрытием, которое может быть замещено, может варьировать вследствие делеции или добавления аминокислот в любом месте в (мутантном или дикого типа) липокалине. Подобным образом, положение данного нуклеотида в соответствии с настоящим раскрытием, которое может быть замещено, может варьировать вследствие делеции или дополнительных нуклеотидов в любом месте в мутеине или 5'-нетранслируемом участке (UTR) липокалина дикого типа, в том числе промоторе и/или любых других регуляторных последовательностях или гене (в том числе экзонах и интронах).
Таким образом, в отношении соответствующего положения в соответствии с настоящим раскрытием предпочтительно понимать, что положения нуклеотидов/аминокислот могут отличаться по обозначенным номерам от подобных соседних нуклеотидов/аминокислот, но указанные соседние нуклеотиды/аминокислоты, которые могут быть обменены, удалены или добавлены, также заключены в одном или более соответствующих положениях.
К тому же в отношении соответствующего положения в мутеине липокалина на основе эталонного остова в соответствии с настоящим раскрытием предпочтительно понимать, что положения нуклеотидов/аминокислот являются структурно соответствующими положениям в любом месте в (мутантном или дикого типа) липокалине, даже если они могут отличаться по обозначенным номерам, что будет понятно специалисту в данной области с учетом высоко-консервативного общего паттерна фолдинга среди липокалинов.
Термин «альбумин» включает альбумины всех млекопитающих, как, например, сывороточный альбумин человека, или бычий сывороточный альбумин, или сывороточный альбумин крысы.
Термин «органическая молекула» или «малая органическая молекула», используемый в данном документе в отношении отличной от естественной мишени, означает органическую молекулу, содержащую по меньшей мере два атома углерода, но предпочтительно не более 7 или 12 вращающихся углеродных связей, с молекулярной массой в диапазоне от 100 до 2000 дальтон, предпочтительно от 100 до 1000 дальтон, и необязательно включающую один или два атома металла.
Слово «выявлять», «выявление», «выявляемый» или «выявляющий», используемое в данном документе, понимается как на количественном, так и качественном уровне, также как их комбинации. Таким образом, это включает количественные, полу-количественные и качественные измерения представляющей интерес молекулы.
«Субъект» представляет собой позвоночное, предпочтительно млекопитающее, более предпочтительно человека. Термин «млекопитающее» используется в данном документе в отношении любого животного, классифицированного как млекопитающее, в том числе без ограничения людей, домашних и сельскохозяйственных животных, а также животных в зоопарках, для занятий спортом или домашних животных, как, например, овец, собак, лошадей, кошек, коров, крыс, свиней, высших приматов, таких как яванские макаки, и т.д., для обозначения только некоторых иллюстративных примеров. Предпочтительно, млекопитающим в данном документе является человек.
«Эффективное количество» представляет собой количество, достаточное для обеспечения полезных или необходимых результатов. Эффективное количество можно вводить за одно или более введений.
«Образец» определяется как биологический образец, взятый у любого субъекта. Биологические образцы включают без ограничения кровь, сыворотку крови, мочу, экскременты, семенную жидкость или ткань.
«Полипептид слияния», описанный в данном документе, содержит по меньшей мере две субъединицы, при этом одна субъединица обладает специфичностью связывания в отношении IL-17A или обладает специфичностью связывания в отношении IL-23p19. В полипептиде слияния эти субъединицы могут быть связаны ковалентной или не ковалентной связью. Предпочтительно, полипептид слияния представляет собой трансляционный продукт слияния между двумя или более субъединицами. Трансляционный продукт слияния может быть получен при помощи генетически сконструированной кодирующей последовательности для одной субъединицы в рамке с кодирующей последовательностью дополнительной субъединицы. Между обеими субъединицами может быть вставлена нуклеотидная последовательность, кодирующая линкер. Однако, субъединицы полипептида слияния по настоящему раскрытию также могут быть связаны при помощи химического линкера.
«Линкер», который может содержать полипептид слияния по настоящему раскрытию, связывает две или более субъединицы полипептида слияния, описанного в данном документе. Связь может быть ковалентной или не ковалентной. Предпочтительная ковалентная связь осуществляется с использованием пептидной связи, такой как пептидная связь между аминокислотами. Соответственно, в предпочтительном варианте осуществления указанный линкер содержит одну или более аминокислот, как, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более аминокислот. Предпочтительные линкеры описаны в данном документе. Другие предпочтительный линкеры представляют собой химические линкеры.
III. Описание графических материалов
На фигуре 1 представлено характерное измерение скорости ассоциации и скорости диссоциации при помощи поверхностного плазмонного резонанса в отношении взаимодействия мутеина липокалина с SEQ ID NO: 1 с IL-17A человека. IL-17A иммобилизировали на сенсорном чипе с помощью общепринятой химии аминов и мутеин липокалина с SEQ ID NO: 1 использовали в качестве растворимого аналита, который стекал по поверхности чипа. Полученная в результате константа диссоциации (KD) составляет 0,8 нМ.
На фигуре 2 представлено характерное измерение скорости ассоциации и скорости диссоциации при помощи поверхностного плазмонного резонанса в отношении взаимодействия мутеина липокалина с SEQ ID NO: 1 IL-17 A/F человека. Биотинилированный SEQ ID NO: 1 фиксировали на сенсорном чипе с использованием специализированного экспериментального набора и IL-17 A/F человека использовали в качестве растворимого аналита, который стекал по поверхности чипа. Полученная в результате константа диссоциации (KD) составляет 100 пМ.
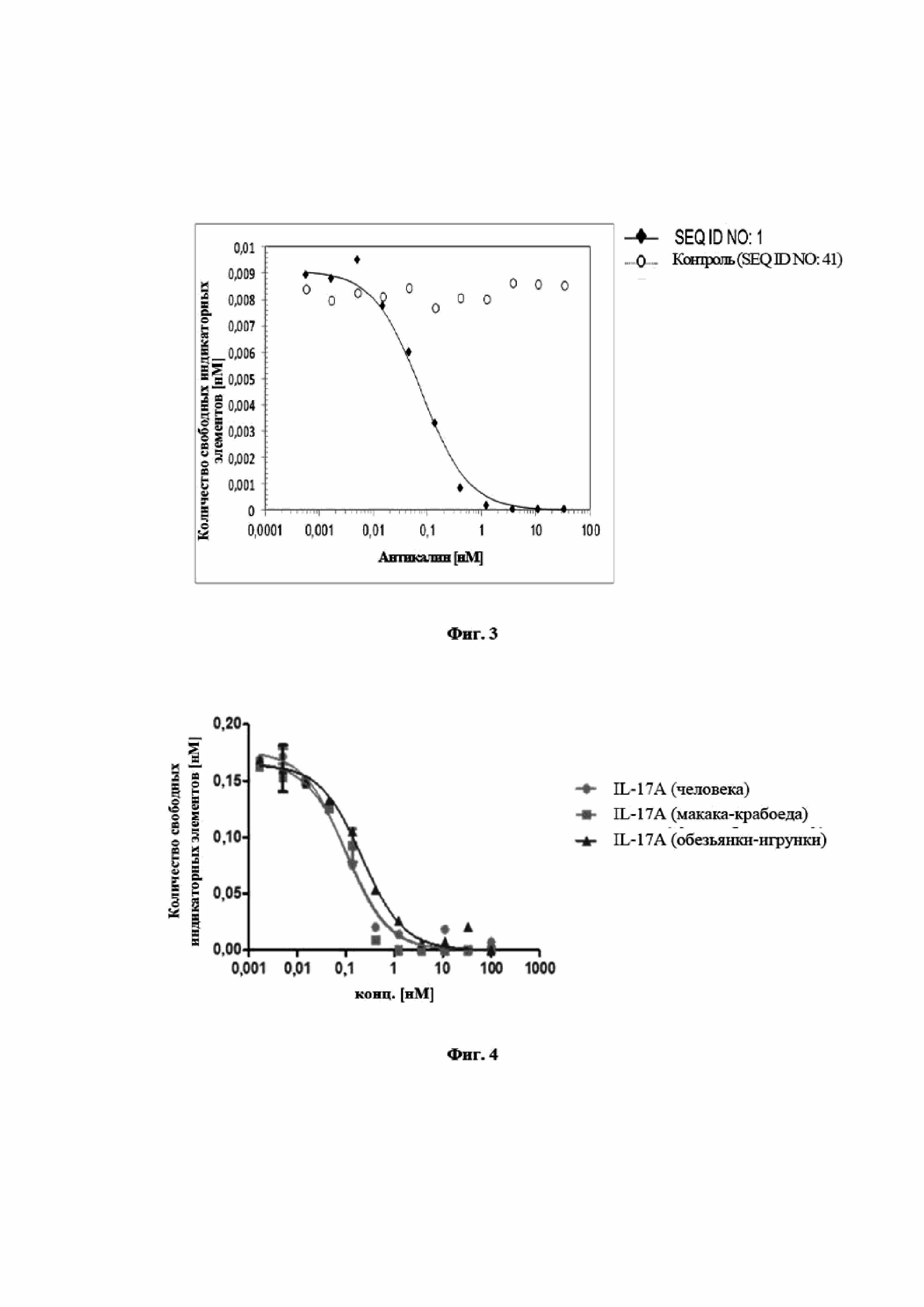
На фигуре 3 показано, что мутеин липокалина с SEQ ID NO: 1 способен блокировать взаимодействие между hIL-17A и его рецептором hIL-17RA с IC50, составляющей 75 пМ. Биотинилированный hIL-17A предварительно инкубировали с разными концентрациями мутеина липокалина с SEQ ID NO: 1 и не нейтрализованный hIL-17A количественно определяли на планшете для ELISA с иммобилизированным растворимым hIL-17RA. Отрицательный контроль, SEQ ID NO: 41, не оказывал конкурентного влияния. Данные приводили в соответствие с моделью связывания в одном участке.
На фигуре 4 показан профиль перекрестной реактивности мутеина липокалина с SEQ ID NO: 1, измеренного в формате конкурентного ELISA. Полная перекрестная реактивность с IL-17A макака-крабоеда и IL-17A игрунки видна из почти одинаковых значений IC50 по сравнению с hIL-17A. Данные приводили в соответствие с моделью связывания в одном участке.
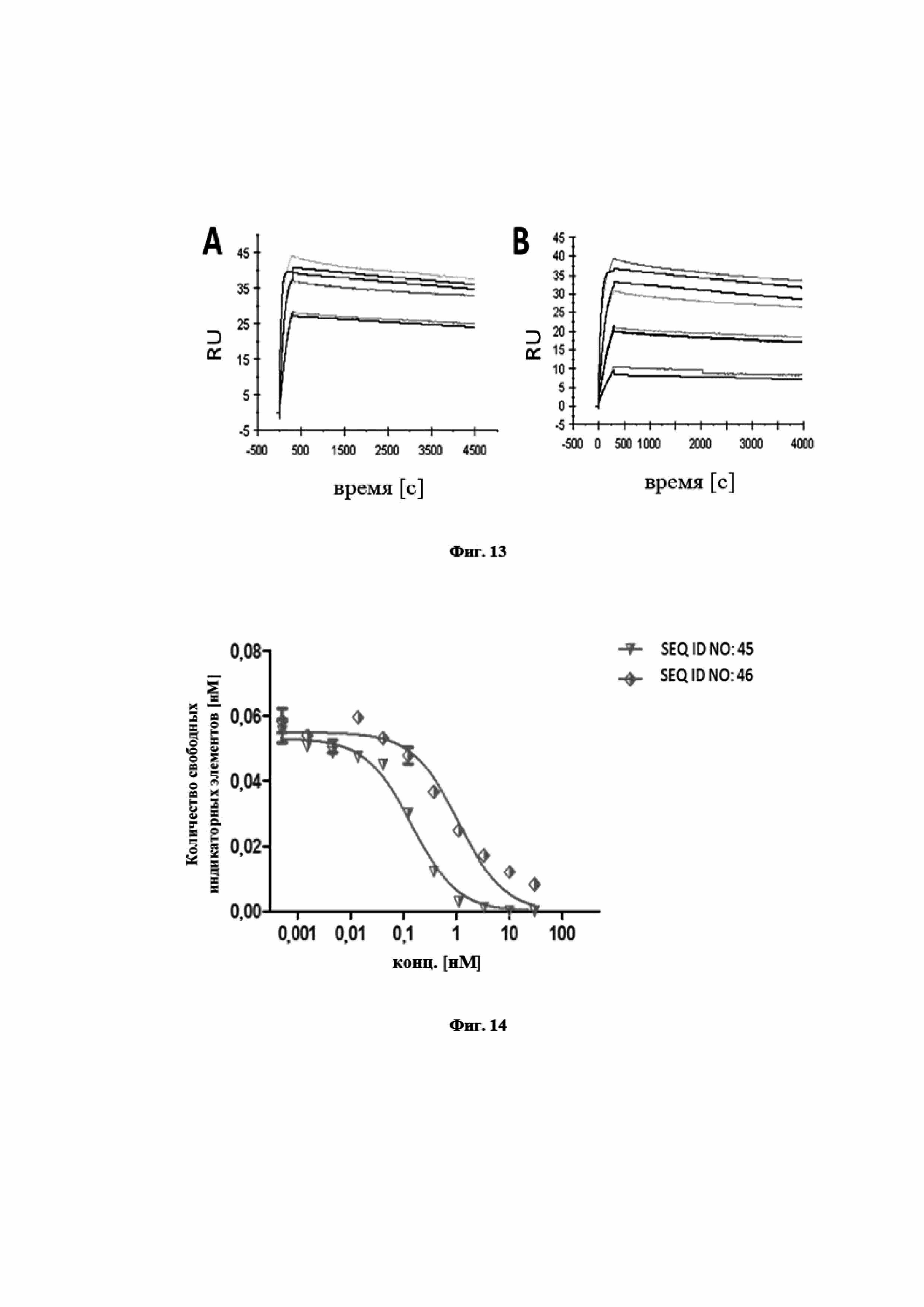
На фигуре 5 показано, что мутеин липокалина с SEQ ID NO: 1 является высоко эффективным в блокировании связывания hIL-17A с его рецептором hIL-17RA в клеточном анализе. Анализ основан на индуцированной hIL-17A секреции G-CSF в клетках U87-MG. Клетки инкубировали с установленной концентрацией hIL-17A и титровали с мутеином липокалина с SEQ ID NO: 1 или, для сравнения, сравнительным антителом 1 (тяжелая цепь SEQ ID NO: 53, легкая цепь SEQ ID NO: 54), сравнительным антителом 2 (тяжелая цепь SEQ ID NO: 55, легкая цепь SEQ ID NO: 56) и SEQ ID NO: 2 в качестве отрицательного контроля. Нанесенной на график является концентрация G-CSF во внесистемных единицах, измеренная при помощи MSD (Meso Scale Discovery®, далее в заявке «MSD») против концентрации мутеинов липокалинов или молекул антител. Полученное в результате среднее значение IC50 для мутеина липокалина с SEQ ID NO: 1 составило 0,13 нМ (0,17 нМ в первом эксперименте, 0,10 нМ в повторном эксперименте), которое было в значительной степени более эффективным, чем у эталона сравнения 1, который проявлял среднюю IC50=2,33 (2,65/2,01) нМ, и в равном диапазоне по сравнению с эталоном сравнения 2, со средней IC50=0,12 (0,14/0,10) нМ. Отрицательный контроль, SEQ ID NO: 2 не оказывал влияние на индуцированную IL-17A выработку G-CSF клетками. Связывание молекул SEQ ID NO: 1 или сравнительного антитела с IL-17A блокирует связывание IL-17A с клеточной поверхностью IL-17RA и таким образом предупреждает индукцию секреции G-CSF. Данные приводили в соответствие с моделью связывания в одном участке, полагая, что одинаковая концентрация G-CSF выравнивалась для всех молекул.
На фигуре 6 представлено характерное измерение скорости ассоциации и скорости диссоциации при помощи поверхностного плазмонного резонанса в отношении мутеина липокалина с SEQ ID NO: 2, взаимодействующего с IL-23 человека. Средняя константа диссоциации, определенная в трех повторных экспериментах, равнялась KD=0,35±0,20 нМ.
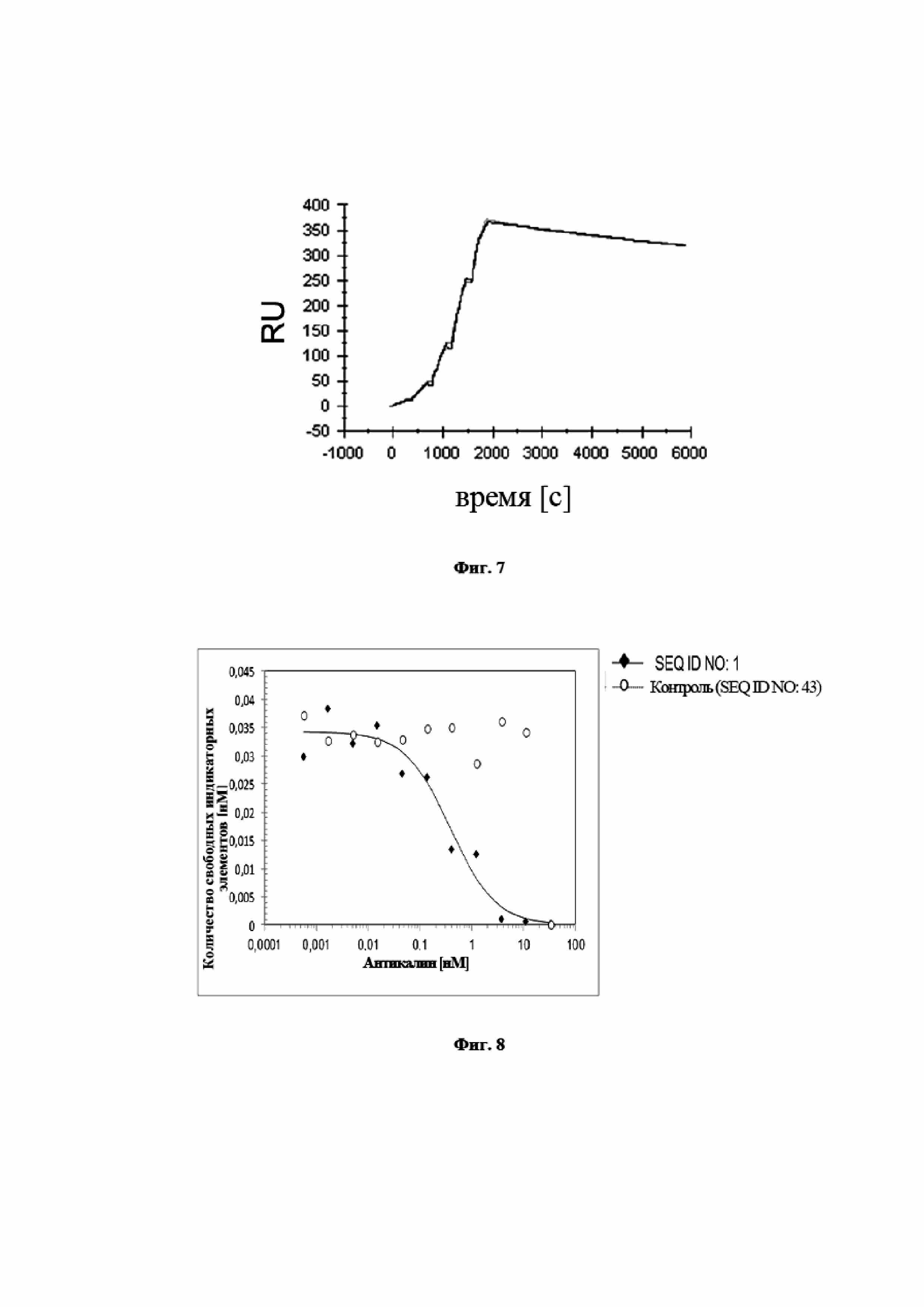
На фигуре 7 представлено характерное измерение скорости ассоциации и скорости диссоциации при помощи поверхностного плазмонного резонанса в отношении взаимодействия мутеина липокалина с SEQ ID NO: 2 с IL-23 человека. Биотинилированный SEQ ID NO: 2 фиксировали на сенсорном чипе с использованием специализированного экспериментального набора и IL-23 использовали в качестве растворимого аналита, который стекал по поверхности чипа. Полученная в результате константа диссоциации (KD) составляет 2,9 нМ. Необходимо отметить, что пришлось применять высокие не физиологичные концентрации NaCl для облегчения выполнения анализа. Вследствие этого, результаты аффинности SEQ ID NO: 2 к IL-23 в физиологических условиях не являются репрезентативными. Практичность анализа заключается в его способности делать возможными сравнения аффинности SEQ ID NO: 2 и белков слияния, содержащих такой мутеин (см. пример 11 и таблицу 1).
На фигуре 8 показано, что мутеин липокалина с SEQ ID NO: 2 способен блокировать взаимодействие между hIL-23 и его рецептором hIL-23R с IC50, составляющей 0,54 нМ. Биотинилированный hIL-23 предварительно инкубировали с разными концентрациями мутеина липокалина с SEQ ID NO: 2 и не нейтрализованный hIL-23 количественно определяли на планшете для ELISA с иммобилизированным растворимым hIL-23R. Отрицательный контроль, SEQ ID NO: 43, не оказывает конкурентного влияния. Данные приводили в соответствие с моделью связывания в одном участке.
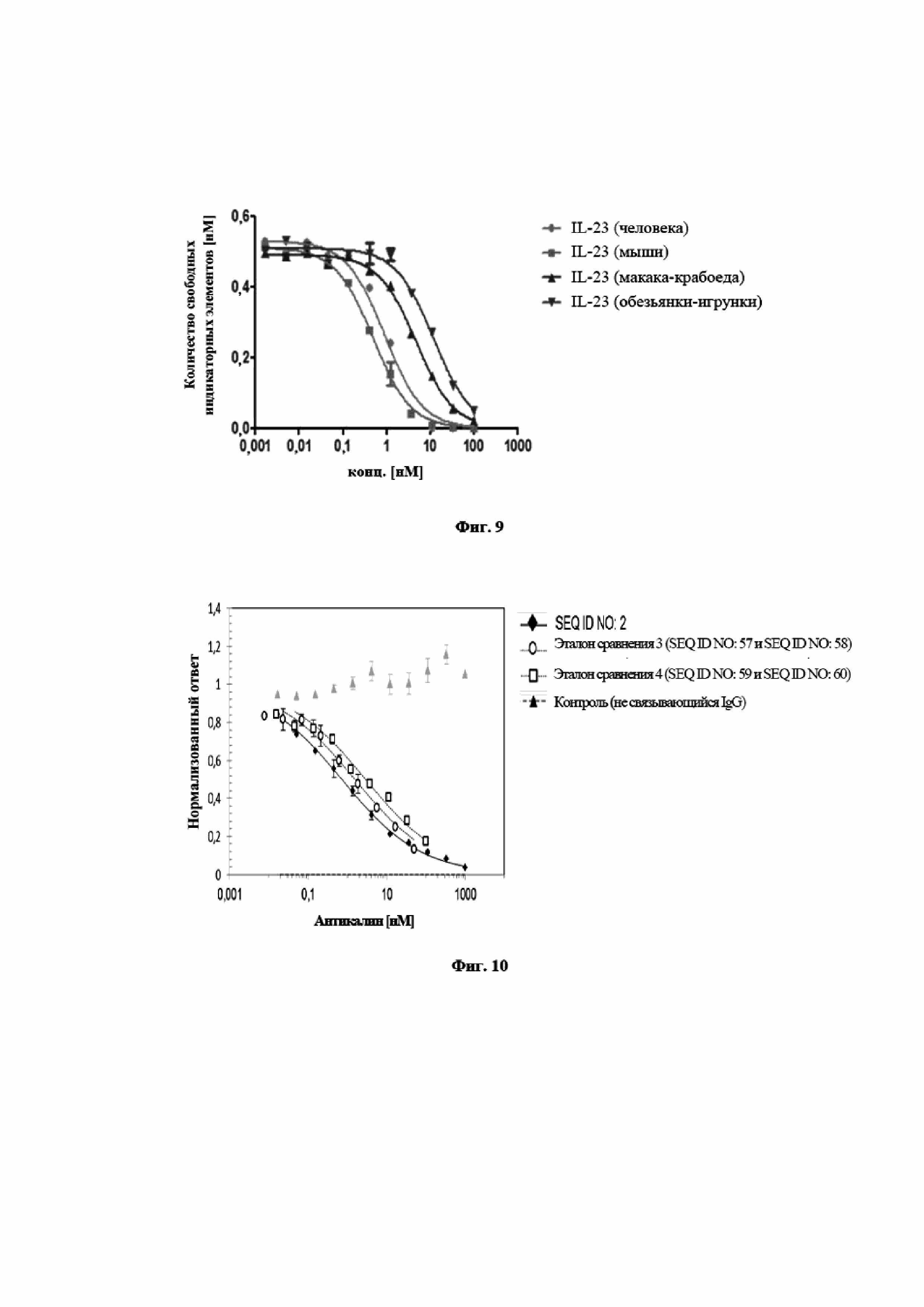
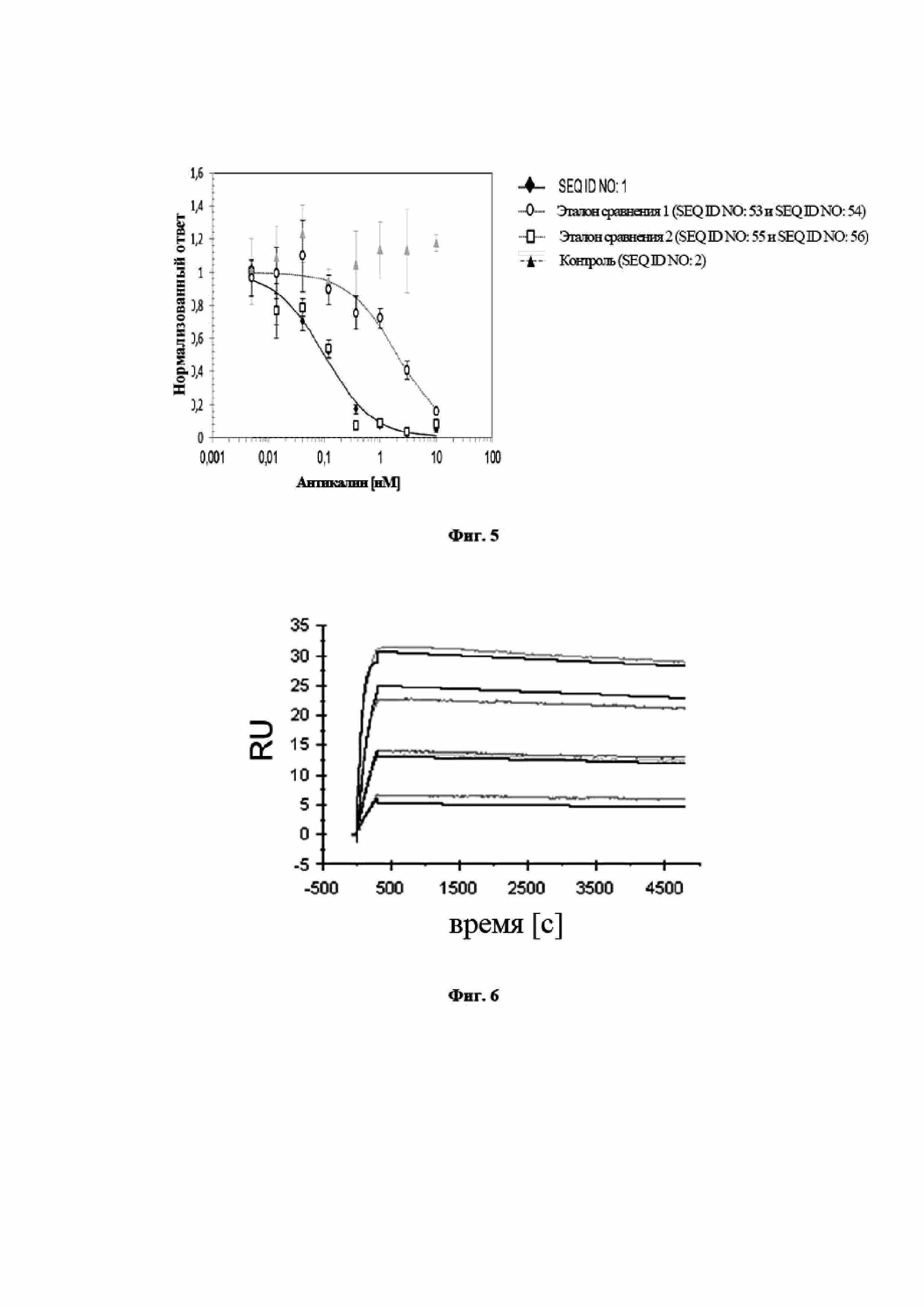
На фигуре 9 показан профиль перекрестной реактивности и специфичность мутеина липокалина с SEQ ID NO: 2, измеренного в формате конкурентного ELISA. Мутеин липокалина с SEQ ID NO: 2 является полностью перекрестнореагирующим с IL-23 человека и мыши и проявляет несколько меньшую аффинность относительно IL-23 макака-крабоеда и игрунки. Данные приводили в соответствие с моделью связывания в одном участке.
На фигуре 10 показано, что мутеин липокалина с SEQ ID NO: 2 способен блокировать биологическую активность hIL-23 в клеточном анализе пролиферации. В анализе SEQ ID NO: 2, отрицательный контроль, представляющий собой изотип IgG, и два сравнительных антитела (эталон сравнения 3: тяжелая цепь, SEQ ID NO: 57, и легкая цепь, SEQ ID NO: 58; эталон сравнения 4: тяжелая цепь, SEQ ID NO: 59, и легкая цепь, SEQ ID NO: 60) предварительно инкубировали с hIL-23 и впоследствии добавляли к клеткам Ba/F3, трансфицированным hIL-23R и hIL-12Rβ1. Трансфицированные клетки Ba/F3 пролиферировали в ответ на IL-23 человека. Из эксперимента видно, что данная биологическая активность блокируется при помощи SEQ ID NO: 2 и сравнительных антител 3 и 4 со значениями EC50, составляющими 1,2 нМ (1,7/0,7), 3,0 нМ (3,1/2,9), 1,2 нМ (0,8/1,5) соответственно. Отрицательный контроль не оказывал влияния на пролиферацию клеток. Данные приводили в соответствие с сигмоидальной моделью эффекта дозы.
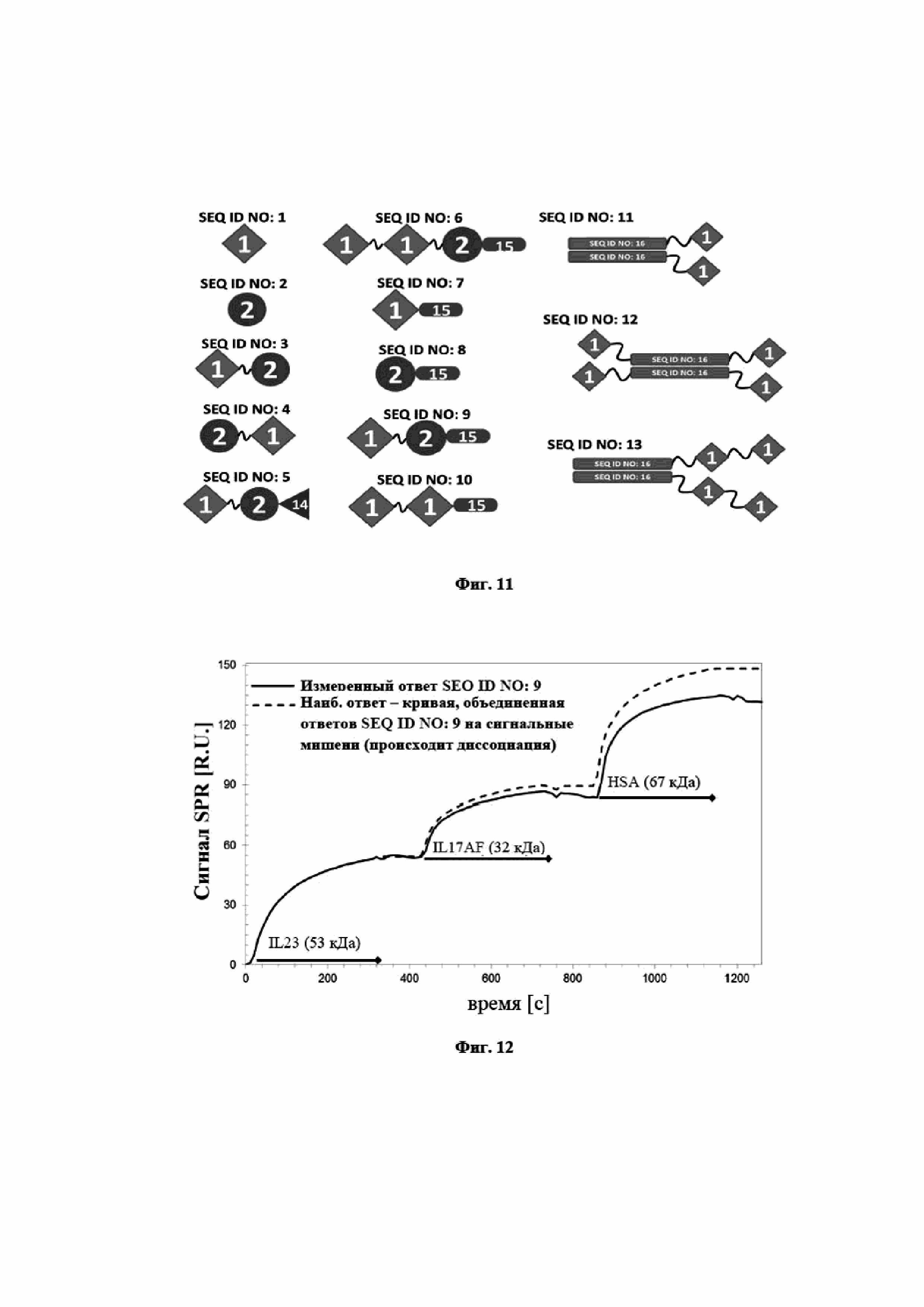
На фигуре 11 представлено графическое общее описание конструктов SEQ ID NO: 1-13, охарактеризованных в таблице 1. SEQ ID NO: 1 (сокращена на фигуре 11 как «1») соответствует связывающему IL-17A мутеину липокалина. SEQ ID NO: 2 (сокращена как «2») соответствует связывающему IL-23 мутеину липокалина. SEQ ID NO: 14 (сокращена как «14») соответствует альбумин-связывающему домену белка G стрептококка. SEQ ID NO: 15 (сокращена как «15») является сконструированным неиммуногенным вариантом SEQ ID NO: 14. SEQ ID NO: 16 (сокращена как «16») соответствует Fc-части антитела IgG1 человека.
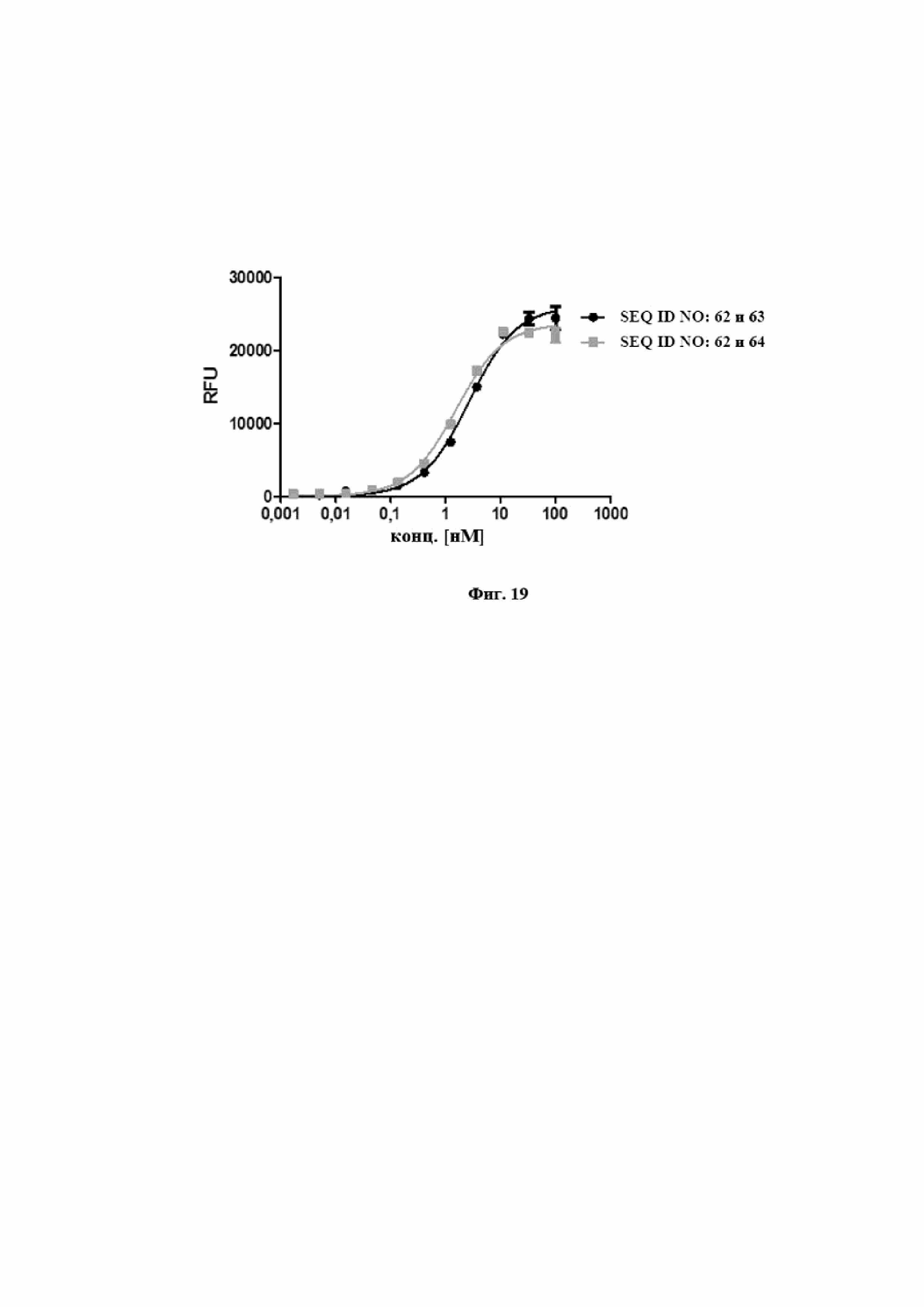
На фигуре 12 показано в иллюстративном эксперименте, что мультиспецифический белок слияния на основе мутеинов липокалинов, раскрытых в данном документе, способен к связыванию IL-17A, IL-23 и сывороточного альбумина человека (HSA) одновременно без взаимного влияния других соответствующих мишеней, с которыми он связывается. SEQ ID NO: 9 представляет собой гетеродимерный белок слияния из связывающего IL-17A мутеина липокалина, SEQ ID NO: 1, связывающего IL-23 мутеина липокалина, SEQ ID NO: 2, и связывающего сывороточный альбумин человека пептида, полученного из альбумин-связывающего домена белка G стрептококка. В эксперименте с поверхностным плазмонным резонансом, показанным на фигуре 12, биотинилированный SEQ ID NO: 9 фиксировали на сенсорном чипе. Для того, чтобы показать одновременное связывание титры hIL-17AF, hIL-23 и HSA в буфере последовательно применяли по отношению к полученной поверхности чипа. Применение hIL-17AF, hIL-23 и HSA по отношению к иммобилизированному SEQ ID NO: 9 также осуществляли, используя отдельную мишень, для получения наивысших уровней связывания, получаемых при помощи связывания отдельной мишени, для сравнения. На фигуре 12 показана измеренная кривая связывания и теоретическая кривая связывания, отражающая ответ, ожидаемый для полного связывания всех трех мишеней. Последнюю получали путем объединения экспериментальных ответов SEQ ID NO: 9 по отношению к отдельным мишеням. Измеренная и теоретическая кривые являются почти одинаковыми, с показанным различием, связанным с диссоциацией мишеней при построении экспериментальной кривой. Из данных видно, что SEQ ID NO: 9 способен одновременно связывать все мишени без потери интенсивности сигнала или изменения в кинетике по сравнению со связыванием только отдельной мишени.
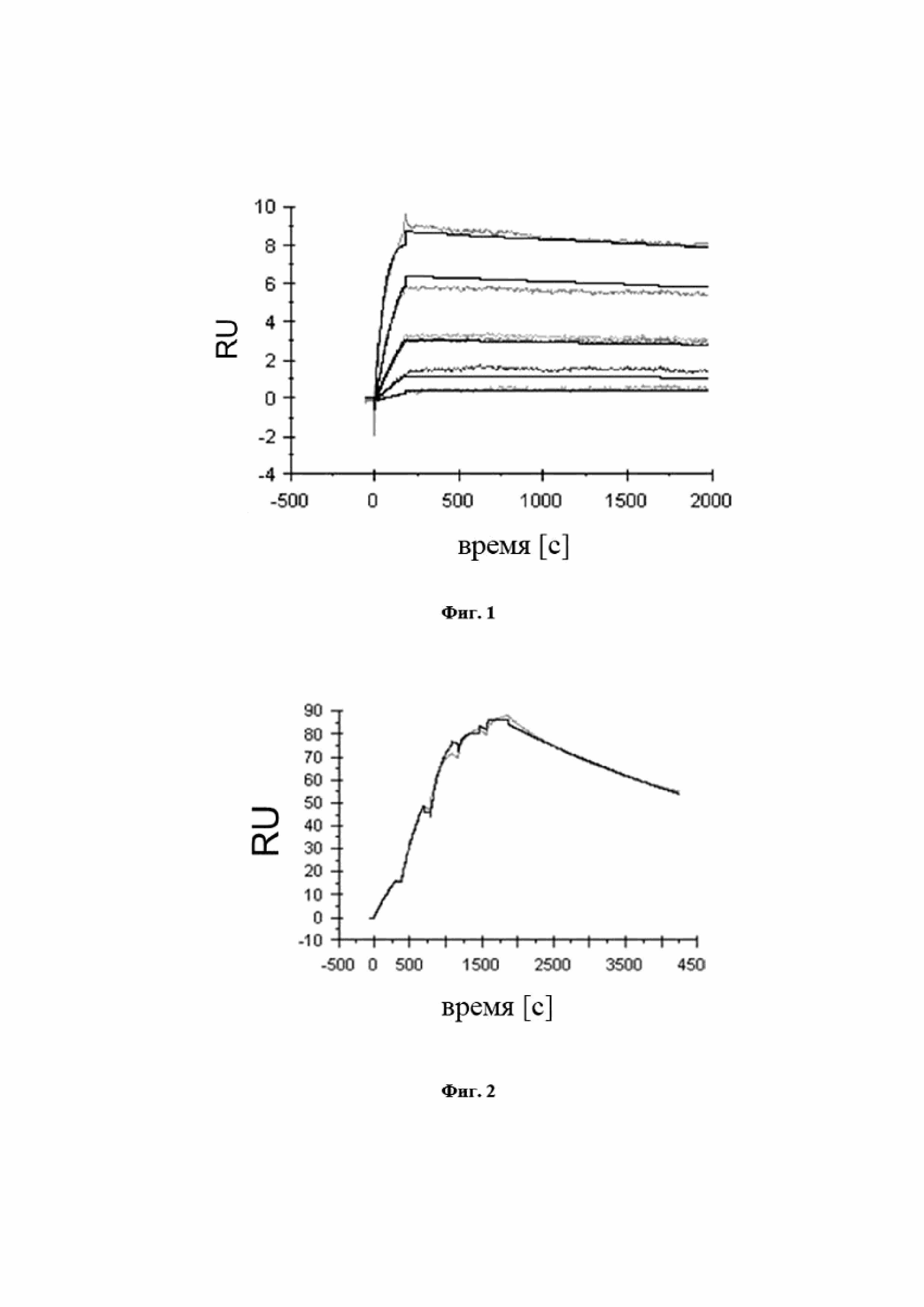
На фигуре 13 представлены характерные измерения скорости ассоциации и скорости диссоциации при помощи поверхностного плазмонного резонанса в отношении мутеинов липокалинов SEQ ID NO: 45 (фиг. 13A) и SEQ ID NO: 46 (фиг. 13B), связывающихся с IL-23 человека. Полученные в результате константы диссоциации (KD) составляют 0,1 нМ (SEQ ID NO: 45) и 0,6 нМ (SEQ ID NO: 46) соответственно.
На фигуре 14 показано, что мутеины липокалинов SEQ ID NO: 45 и SEQ ID NO: 46 способны блокировать взаимодействие между hIL-23 и его рецептором hIL-23R с IC50, составляющей 0,1 нМ (SEQ ID NO: 45) и 1,1 нМ (SEQ ID NO: 46) соответственно. Биотинилированный hIL-23 предварительно инкубировали с разными концентрациями указанных мутеинов липокалинов и не нейтрализованный hIL-23 количественно определяли на планшете для ELISA с иммобилизированным растворимым hIL-23R. Данные приводили в соответствие с моделью связывания в одном участке.
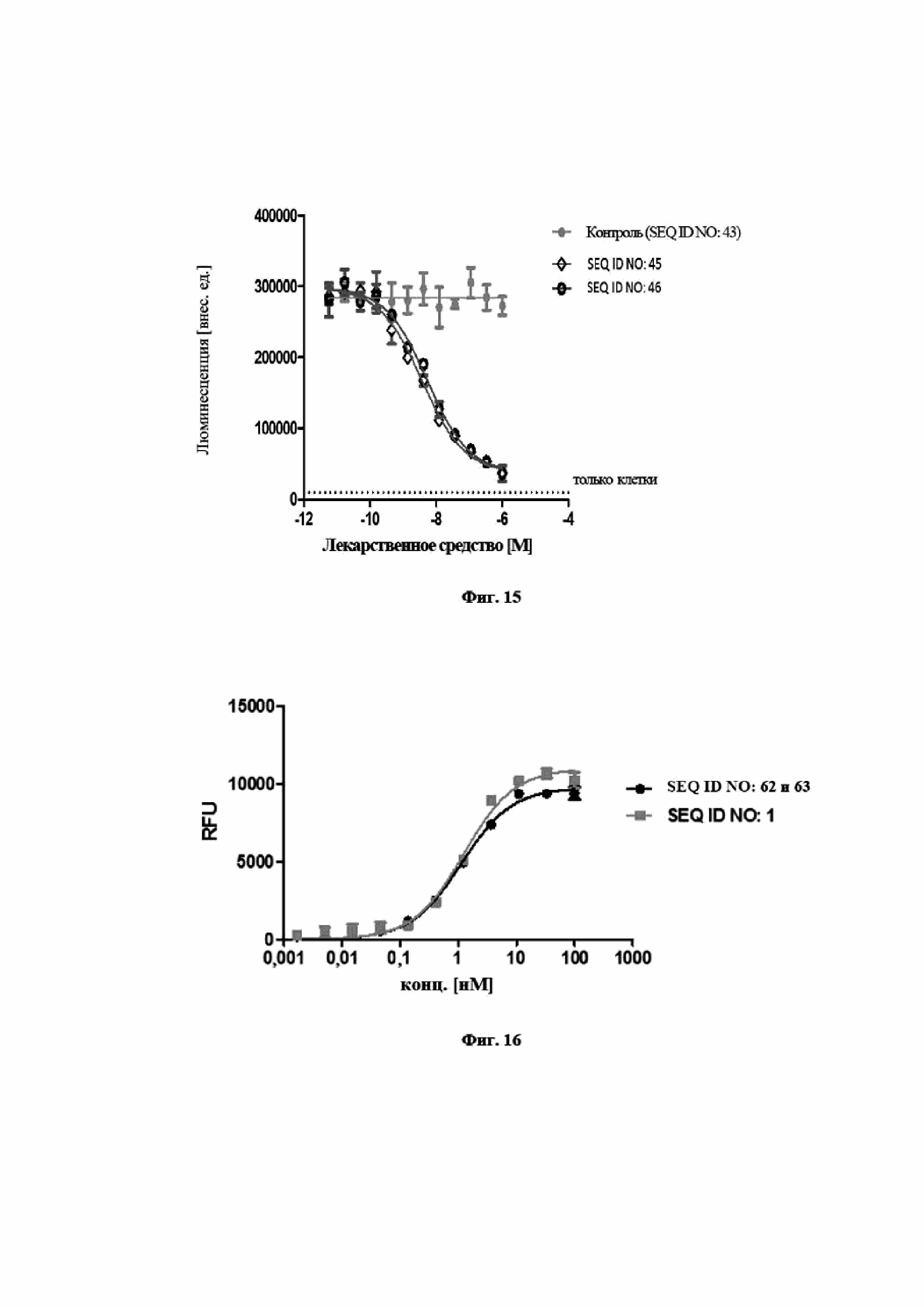
На фигуре 15 показано, что мутеины липокалинов с SEQ ID NO: 45 и SEQ ID NO: 46 способны блокировать биологическую активность hIL-23 в клеточном анализе пролиферации. В анализе SEQ ID NO: 45, SEQ ID NO: 46 и отрицательный контроль, SEQ ID NO: 43, предварительно инкубировали с hIL-23 и впоследствии добавляли к клеткам Ba/F3, трансфицированным hIL-23R и hIL-12Rβ1. Трансфицированные клетки Ba/F3 пролиферировали в ответ на IL-23 человека. Из эксперимента видно, что данная биологическая активность блокируется при помощи SEQ ID NO: 45, SEQ ID NO: 46 со значениями IC50, составляющими 3,7 нМ и 5,4 нМ соответственно. Отрицательный контроль, SEQ ID NO: 43, не оказывал влияния на пролиферацию клеток. Данные приводили в соответствие с сигмоидальной моделью эффекта дозы.
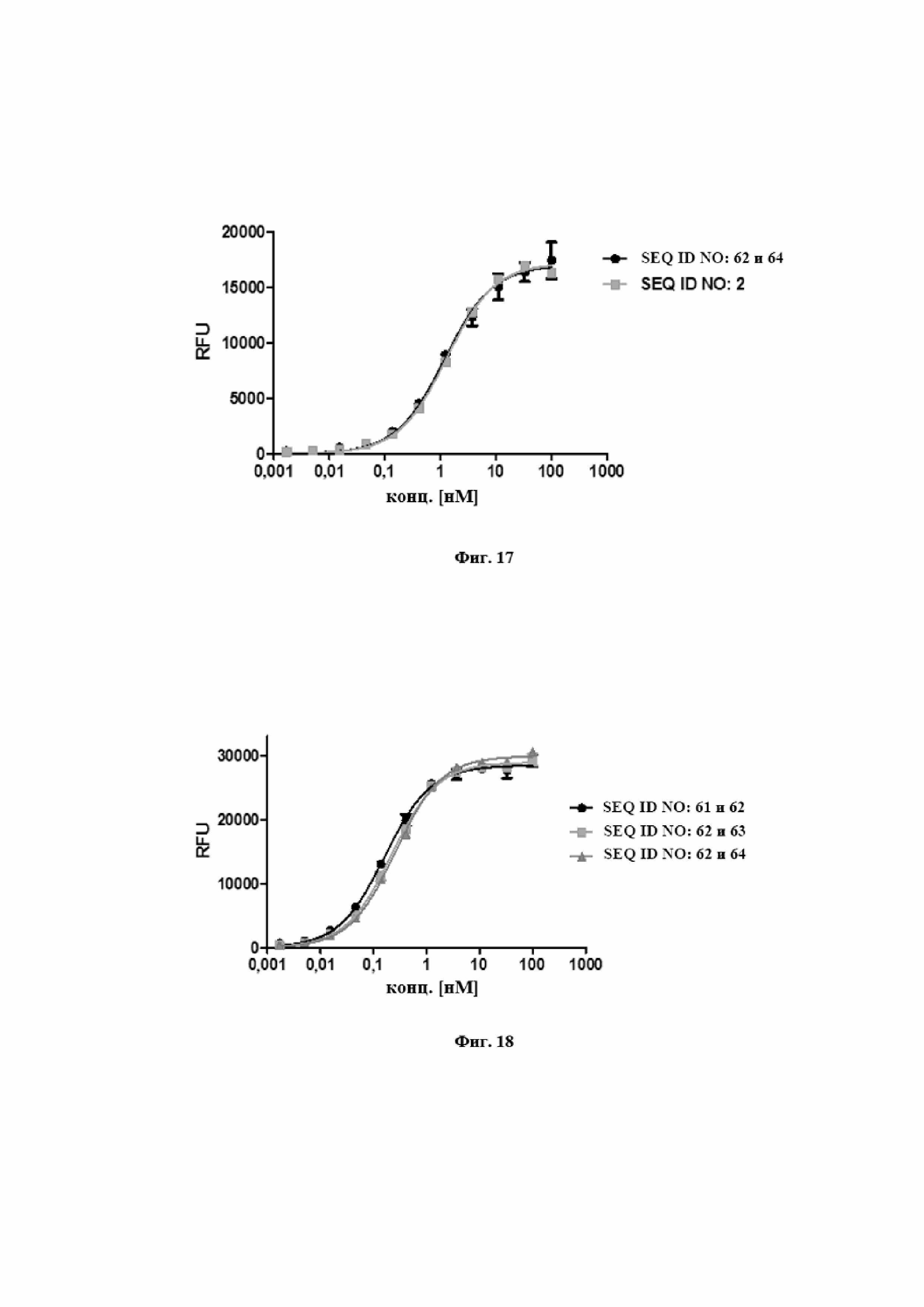
На фигуре 16 представлен иллюстративный эксперимент, в котором определяли специфичность SEQ ID NO: 63 и 62 и мутеина липокалина с SEQ ID NO: 1 относительно мишени IL-17A. Биотинилированный IL-17A фиксировали на титрационном микропланшете и титровали тестовые молекулы. Связанные тестовые молекулы обнаруживали с использованием меченного HRP специфического антитела к TLc человека, описанного в примере 16. Данные приводили в соответствие с моделью связывания 1:1 со значением EC50 и наибольшим сигналом в качестве незаданных параметров и наклоном, который фиксировали для единства.
На фигуре 17 представлен иллюстративный эксперимент, в котором определяли специфичность SEQ ID NO: 64 и 62 и мутеина липокалина с SEQ ID NO: 2 относительно мишени IL-23. Биотинилированный IL-23 фиксировали на титрационном микропланшете и титровали тестовые молекулы. Связанные тестовые молекулы обнаруживали с использованием меченного HRP специфического антитела к NGAL человека, описанного в примере 17. Данные приводили в соответствие с моделью связывания 1:1 со значением EC50 и наибольшим сигналом в качестве незаданных параметров и наклоном, который фиксировали для единства.
На фигуре 18 представлен иллюстративный эксперимент, в котором определяли специфичность полипептидного продукта слияния с SEQ ID NO: 63 и 62 и полипептидного продукта слияния с SEQ ID NO: 64 и 62, а также таковую антитела с SEQ ID NO: 61 и 62 относительно мишени TNF-α. TNF-α покрывали титрационный микропланшет и титровали тестовые молекулы. Связанные тестовые молекулы обнаруживали с использованием меченного HRP специфического антитела к Fc IgG человека, описанного в примере 18. Данные приводили в соответствие с моделью связывания 1:1 со значением EC50 и наибольшим сигналом в качестве незаданных параметров и наклоном, который фиксировали для единства.
На фигуре 19 представлен иллюстративный эксперимент, в котором определяли способность полипептидного продукта слияния с SEQ ID NO: 63 и 62 и полипептидного продукта слияния с SEQ ID NO: 64 и 62 к одновременному связыванию обоих мишеней - TNF-α и IL-17A, TNF-α и IL-23 соответственно. Рекомбинантным TNF-α покрывали титрационный микропланшет с последующим титрованием полипептидных продуктов слияния. Впоследствии добавляли неизменную концентрацию либо биотинилированного IL-17A, либо IL-23, который обнаруживали с использованием меченного HRP экстравидина, описанного в примере 19. Данные приводили в соответствие с моделью связывания 1:1 со значением EC50 и наибольшим сигналом в качестве незаданных параметров и наклоном, который фиксировали для единства.
IV. Подробное описание раскрытия
Настоящее раскрытие делает вклад в уровень техники области полипептидов или белков со специфичностью связывания в отношении IL-17A и/или IL-23p19, при этом полипептид включает мутеин липокалина, который связывается по меньшей мере с выявляемой аффинностью с IL-17A или IL-23p19.
Согласно некоторым вариантам осуществления полипептид представляет собой мутеин липокалина, который способен к связыванию IL-17A по меньшей мере с выявляемой аффинностью. Согласно некоторым вариантам осуществления полипептид представляет собой мутеин липокалина, который способен к связыванию IL-23p19 по меньшей мере с выявляемой аффинностью. Настоящее раскрытие также относится к применению обоих полипептидов для связывания IL-17A и IL-23p19 у субъекта.
Согласно некоторым аспектам полипептид представляет собой белок слияния, содержащий по меньшей мере две субъединицы, при этом одна субъединица обладает специфичностью связывания в отношении IL-17A, а другая субъединица обладает специфичностью связывания в отношении IL-23p19. Согласно некоторым дополнительным вариантам осуществления белок слияния может дополнительно содержать субъединицу, при этом субъединица обладает специфичностью связывания в отношении IL-23p19 или IL-17A. Согласно еще некоторым дополнительным вариантам осуществления белок слияния может содержать одну субъединицу, специфичную в отношении IL-17A, одну субъединицу, специфичную в отношении IL-23p19, и одну субъединицу, содержащую бактериальный альбумин-связывающий домен (ABD).
Согласно некоторым аспектам полипептид по настоящему раскрытию также может быть белком слияния, содержащим по меньшей мере две субъединицы, специфичные в отношении IL-17A, или белком слияния, содержащим по меньшей мере две субъединицы, специфичные в отношении IL-23p19.
Согласно некоторым вариантам осуществления субъединица белка слияния со специфичностью связывания в отношении IL-17A включает мутеин липокалина, специфичный в отношении IL-17A, по настоящему раскрытию. Согласно некоторым вариантам осуществления субъединица белка слияния со специфичностью связывания в отношении IL-23p19 содержит антитело, которое связывается с IL-23p19. Согласно некоторым вариантам осуществления субъединица белка слияния со специфичностью связывания в отношении IL-23p19 содержит мутеин липокалина, специфичный в отношении IL-23p19, по настоящему раскрытию. Согласно некоторым вариантам осуществления субъединица белка слияния со специфичностью связывания в отношении IL-17A содержит антитело, которое связывается с IL-17A.
Полипептидом или белком по настоящему раскрытию может быть мутеин липокалина, предпочтительно липокалина, выбранного из группы, включающей ретинол-связывающий белок (RBP), билин-связывающий белок (BBP), аполипопротеин D (APO D), липокалин, ассоциированный с желатиназой нейтрофилов (NGAL), липокалин слезы (TLPC или Tlc), родственный α2-микроглобулину белок (A2m), 24p3/утерокалин (24p3), белок 1 железы фон Эбнера (VEGP 1), белок 2 железы фон Эбнера (VEGP 2) и предшественник главного аллергена Can f1 (ALL-1).
Как используется в данном документе, «липокалин» определяется как мономерный белок весом примерно 18-20 кДа с участком с супервторичной структурой, представляющей собой цилиндрический β-складчатый лист, содержащий множество (предпочтительно восемь) β-нитей, соединенных попарно множеством (предпочтительно четырьмя) петлями на одном конце с образованием таким образом кармана связывания. Именно разнообразие петель в остальной части жесткого остова липокаина приводит к образованию разнообразия различных видов связывания среди представителей семейства липокалинов, при этом каждый способен приспосабливаться к мишеням различного размера, формы и с различными химическими особенностями (рассмотрены, например, в Flower, D.R. (1996), ранее; Flower, D.R. et al. (2000), ранее, или Skerra, A. (2000) Biochim. Biophys. Acta 1482, 337-350). Действительно, липокалиновое семейство белков естественным образом развивалось для связывания широкого спектра лигандов, при этом они характеризуются необычайно низкими уровнями общей консервативности последовательностей между собой (часто с идентичностями последовательностей менее 20%), но все же сохраняя высоко-консервативный общий паттерн фолдинга. Соответствие между положениями в разных липокалинах хорошо известно специалисту в данной области. См., например, патент США № 7250297.
Как отмечалось выше, липокалин представляет собой полипептид, определяемый его супервторичной структурой, а именно участком с супервторичной структурой, представляющей собой цилиндрический β-складчатый лист, содержащий восемь β-нитей, соединенных попарно четырьмя петлями на одном конце с образованием таким образом кармана связывания. Настоящее раскрытие не ограничено мутеинами липокалинов, конкретно раскрытыми в данном документе. В этой связи, настоящее раскрытие относится к мутеину липокалина с участком с супервторичной структурой, представляющей собой цилиндрический β-складчатый лист, содержащий восемь β-нитей, соединенных попарно четырьмя петлями на одном конце с образованием таким образом кармана связывания, где по меньшей мере одна аминокислота из каждой по меньшей мере из трех из указанных четырех петель была подвергнута мутации и где указанный липокалин эффективен для связывания IL-17A или IL-23p19 с выявляемой аффинностью.
Согласно одному конкретному варианту осуществления мутеин липокалина, раскрытый в данном документе, представляет собой мутеин липокалина слезы (TLPC или Tlc) человека, также называемый липокалином-1, преальбумином слезы или белком железы фон Эбнера. Термин «липокалин слезы человека», или «Tlc», или «липокалин-1», как используется в данном документе, относится к зрелому липокалину слезы человека с номером доступа базы данных SWISS-PROT/UniProt P31025 (изоформа 1). Аминокислотную последовательность, показанную под номером доступа базы данных SWISS-PROT/UniProt P31025, можно использовать в качестве предпочтительной «эталонной последовательности», более предпочтительно аминокислотную последовательность, показанную под SEQ ID NO: 41, используют в качестве эталонной последовательности.
Настоящее раскрытие также охватывает мутеины Tlc, определенные выше, в которых первых четыре N-концевых аминокислотных остатка последовательности зрелого липокалина слезы человека (His-His-Leu-Leu; положения 1-4) и/или последних два C-концевых аминокислотных остатка (Ser-Asp; положения 157-158) линейной полипептидной последовательности зрелого липокалина слезы человека (номер доступа базы данных SWISS-PROT P31025) были удалены (SEQ ID NO: 2-5). К тому же настоящее раскрытие охватывает мутеины Tlc, определенные выше, в которых один аминокислотный остаток GH-петли (Lys), соответствующий положению 108 последовательности линейной полипептидной последовательности зрелого липокалина слезы человека был удален (SEQ ID NO: 1 и SEQ ID NO: 43). Другой возможной мутацией последовательности полипептида дикого типа зрелого липокалина слезы человека является изменение аминокислотной последовательности в положениях 5-7 последовательности (Ala Ser Asp) на Gly Gly Asp, описанное в PCT-заявке WO 2005/019256, которая включена при помощи ссылки в данный документ в полном объеме.
Мутеин Tlc согласно настоящему раскрытию может дополнительно включать аминокислотную замену Arg 111 → Pro. Мутеин Tlc согласно настоящему раскрытию также может включать замену Lys 114 → Trp. Он также может содержать замену Cys 101 → Ser или Cys 101 → Thr. Согласно некоторым предпочтительным вариантам осуществления мутеин Tlc согласно настоящему раскрытию также может содержать замену Cys 153 → Ser.
Модификации аминокислотной последовательности включают направленный мутагенез отдельных аминокислотных положений для упрощения субклонирования подвергнутого мутации гена липокалина или его частей путем введения сайтов расщепления для определенных рестрикционных ферментов. К тому же такие мутации также можно вводить для дополнительного улучшения аффинности мутеина Tlc в отношении IL-17A или IL-23p19. Кроме того, мутации можно вводить для модулирования определенных характеристик мутеина, как, например, для улучшения стабильности фолдинга, стабильности в сыворотке крови, устойчивости белка или растворимости в воде или для снижения склонности к агрегированию, при необходимости. Например, встречающиеся в природе остатки цистеина можно мутировать в другие аминокислоты для предупреждения образования дисульфидного мостика. Иллюстративные варианты такой мутации для введения остатка цистеина в аминокислотную последовательность мутеина Tlc включают замены Thr 40→ Cys, Glu 73→ Cys, Arg 90→ Cys, Asp 95→ Cys и Glu 131→ Cys. Полученный тиоловый фрагмент сбоку любого из аминокислотных положений 40, 73, 90, 95 и/или 131 можно использовать для ПЭГилирования или ГЭКилирования мутеина, например, для увеличения времени полужизни соответствующего мутеина Tlc в сыворотке крови.
Согласно другому конкретному варианту осуществления мутеин липокалина, раскрытый в данном документе, представляет собой мутеин липокалина 2 человека. Термин «липокалин 2 человека», или «Lcn 2 человека», или «NGAL человека», используемый в данном документе, относится к зрелому человеческому липокалину, ассоциированному с желатиназой нейтрофилов (NGAL), с номером доступа базы данных SWISS-PROT/UniProt P80188. Мутеин липокалина 2 человека по настоящему раскрытию также можно назвать в данном документе «мутеином hNGAL». Аминокислотную последовательность, показанную под номером доступа базы данных SWISS-PROT/UniProt P80188, можно использовать в качестве предпочтительной «эталонной последовательности», более предпочтительно аминокислотную последовательность, показанную под SEQ ID NO: 43, используют в качестве эталонной последовательности.
Согласно некоторым вариантам осуществления мутеин липокалина, связывающий IL-17A или IL-23p19 с выявляемой аффинностью, может включать по меньшей мере одну аминокислотную замену природного остатка цистеина на другую аминокислоту, например остаток серина. Согласно некоторым вариантам осуществления мутеин липокалина, связывающий IL-17A или IL-23p19 с выявляемой аффинностью, может включать один или более не природных остатков цистеина, замещающих одну или более аминокислот липокалина дикого типа. Согласно дополнительному конкретному варианту осуществления мутеин липокалина согласно настоящему раскрытию включает по меньшей мере две аминокислотные замены природной аминокислоты остатком цистеина с образованием, тем самым, одного или более цистеиновых мостиков. Согласно некоторым вариантам осуществления указанный цистеиновый мостик может соединять по меньшей мере два участка, представляющих собой петли. Определение таких участков используют в данном документе в соответствии с Flower (Flower, 1996, ранее, Flower, et al., 2000, ранее) и Breustedt et al. (2005, ранее).
Белки по настоящему раскрытию, которые направлены против или специфичны в отношении IL-17A или IL-23p19, включают любое количество мутеинов-белков со специфическим связыванием, в которых за основу взят остов определенного белка. Предпочтительно, количество нуклеотидов или аминокислот, соответственно, которое обменивают, удаляют или вставляют, составляет 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более, как, например, 25, 30, 35, 40, 45 или 50, при этом предпочтительными являются 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11, и даже более предпочтительными являются 9, 10 или 11. Однако, предпочтительно, чтобы мутеин липокалина по настоящему раскрытию все еще был способен к связыванию IL-17A или IL-23p19, в частности IL-17A человека или IL-23p19 человека.
Согласно одному аспекту, настоящее раскрытие включает разные мутеины липокалинов, которые связывают IL-17A или IL-23p19 по меньшей мере с выявляемой аффинностью. В этом смысле, IL-17A или IL-23p19 может быть рассмотрен как не природный лиганд эталонного липокалина дикого типа, где «не природный лиганд» относится к соединению, которое не связывается с липокалинами дикого типа в физиологических условиях. При помощи внесения в липокалины дикого типа одной или более мутаций в определенные положения последовательности авторы данного изобретения показали, что высокая аффинность и высокая специфичность в отношении не природного лиганда, например, IL-17A или IL-23p19, возможны. Согласно некоторым вариантам осуществления в 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или даже большем количестве нуклеотидных триплетов, кодирующих определенные положения последовательности в липокалинах дикого типа, случайный мутагенез можно выполнять посредством замены в этих положениях подмножеством нуклеотидных триплетов.
К тому же мутеины липокалинов по настоящему раскрытию могут иметь подвергнутый мутации аминокислотный остаток в любом одном или более, в том числе по меньшей мере в любом одном, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати или двенадцати, из положений последовательности, соответствующих определенным положениям последовательности в линейной полипептидной последовательности эталонного липокалина.
Белок по настоящему раскрытию может включать дикого типа (природную) аминокислотную последовательность «исходного» остова белка (такого как липокалин) вне подвергнутых мутации положений аминокислотной последовательности. Согласно некоторым вариантам осуществления мутеин липокалина согласно настоящему раскрытию также может нести одну или более аминокислотных мутаций в положении/ положениях последовательности, если только такая мутация, по меньшей мере в значительной степени, не препятствует или не мешает связывающей активности и фолдингу мутеина. Такие мутации могут быть выполнены очень легко на уровне ДНК с использованием установленных общепринятых способов (Sambrook, J. et al. (2001) Molecular Cloning: A Laboratory Manual, 3rd Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY). Иллюстративные примеры перестроек аминокислотной последовательности представляют собой вставки или делеции, а также аминокислотные замены. Такие замены могут быть консервативными, т.е. аминокислотный остаток замещается аминокислотным остатком с химически подобными свойствами, в частности, в отношении полярности, а также размера. Примеры консервативных замен представляют собой замещения из числа представителей следующих групп: 1) аланин, серин и треонин; 2) аспарагиновая кислота и глутаминовая кислота; 3) аспарагин и глутамин; 4) аргинин и лизин; 5) изолейцин, лейцин, метионин и валин; и 6) фенилаланин, тирозин и триптофан. С другой стороны, также возможно вводить неконсервативные перестройки в аминокислотную последовательность. К тому же вместо замещения отдельных аминокислотных остатков, также возможно либо вставлять, либо удалять одну или более последовательных аминокислот первичной структуры липокалина слезы человека, если только эти делеции или вставка приводят в результате к стабильно свернутому/функциональному мутеину (например, мутеинам Tlc с усеченными N- и C-концами). В таком мутеине, к примеру, один или более аминокислотных остатков добавлены или удалены на N- или C-конце полипептида. Вообще такой мутеин может характеризоваться приблизительно по меньшей мере 70%, в том числе по меньшей мере приблизительно 80%, как, например, по меньшей мере приблизительно 85% идентичностью аминокислотной последовательности, с аминокислотной последовательностью зрелого липокалина слезы человека. В качестве иллюстративного примера, настоящее раскрытие также охватывает мутеины Tlc, определенные выше, в которых первых четыре N-концевых аминокислотных остатка последовательности зрелого липокалина слезы человека (His-His-Leu-Leu; положения 1-4) и/или последних два C-концевых аминокислотных остатка (Ser-Asp; положения 157-158) линейной полипептидной последовательности зрелого липокалина слезы человека были удалены (SEQ ID NO: 1 и SEQ ID NO: 43).
Аминокислотная последовательность мутеина липокалина, раскрытого в данном документе, характеризуется высокой идентичностью последовательности с эталонным липокалином по сравнению с идентичностями последовательностей в случае других липокалинов. В таком общем смысле аминокислотная последовательность мутеина липокалина по настоящему раскрытию по меньшей мере в значительной степени подобна аминокислотной последовательности эталонного липокалина, при условии, что в ней возможны гэпы (как определено ниже) при выравнивании, которые являются результатом добавлений или делеций аминокислот. Соответствующая последовательность мутеина липокалина по настоящему раскрытию, которая в значительной степени подобна последовательностям эталонного липокалина, согласно некоторым вариантам осуществления характеризуется по меньшей мере 70% идентичностью или гомологией последовательности, по меньшей мере 75% идентичностью или гомологией последовательности, по меньшей мере 80% идентичностью или гомологией последовательности, по меньшей мере 82% идентичностью или гомологией последовательности, по меньшей мере 85% идентичностью или гомологией последовательности, по меньшей мере 87% идентичностью или гомологией последовательности или по меньшей мере 90% идентичностью или гомологией последовательности, в том числе по меньшей мере 95% идентичностью или гомологией последовательности, с последовательностью эталонного липокалина, при условии, что сохраняются измененные положение или последовательность и что возможны один или более гэпов.
Как используется в данном документе, мутеин липокалина по настоящему раскрытию «специфически связывает» мишень (например, IL-17A или IL-23p19), если он способен отличать ту мишень от одной или более эталонных мишеней, поскольку специфичность связывания является не абсолютным, а относительным свойством. «Специфическое связывание» можно определять, например, в соответствии с вестерн-блоттингами, анализами ELISA, RIA, ECL, IRMA, FACS, IHC и пептидными сканированиями.
Согласно одному варианту осуществления мутеины липокалинов по настоящему раскрытию слиты на своем N-конце и/или своем C-конце с партнером по слиянию, который представляет собой белковый домен, что продлевает время полужизни мутеина в сыворотке крови. Согласно дополнительным конкретным вариантам осуществления белковый домен представляет собой Fc-часть иммуноглобулина, домен CH3 иммуноглобулина, домен CH4 иммуноглобулина, альбумин-связывающий домен, альбумин-связывающий пептид или альбумин-связывающий белок.
Согласно другому варианту осуществления мутеины липокалинов по настоящему раскрытию конъюгированы с соединением, которое продлевает время полужизни мутеина в сыворотке крови. Более предпочтительно, мутеин конъюгирован с соединением, выбранным из группы, включающей молекулы полиалкиленгликоля, гидроксиэтилкрахмал, Fc-часть иммуноглобулина, домен CH3 иммуноглобулина, домен CH4 иммуноглобулина, альбумин-связывающий домен, альбумин-связывающий пептид и альбумин-связывающий белок.
Согласно еще одному варианту осуществления настоящее раскрытие относится к молекуле нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую мутеин липокалина, раскрытый в данном документе. Настоящее раскрытие охватывает клетку-хозяина, содержащую указанную молекулу нуклеиновой кислоты.
Мутеин Tlc согласно настоящему раскрытию можно получать при помощи мутагенеза встречающейся в природе формы липокалина слезы человека. Мутеин hNGAL согласно настоящему раскрытию можно получать при помощи мутагенеза встречающейся в природе формы липокалина 2 человека. Согласно некоторым вариантам осуществления мутагенеза замена (или замещение) является консервативной заменой. Тем не менее, любая замена, в том числе неконсервативная замена или одна или более из приведенных ниже иллюстративных замен, предусматривается, если только мутеин липокалина сохраняет свою способность связываться с IL-17A или IL-23p19, и/или он характеризуется идентичностью с затем замещенной последовательностью в том смысле, что имеет место по меньшей мере 60%, как, например, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85% или более высокая идентичность с аминокислотной последовательностью зрелого липокалина слезы человека или зрелого липокалина 2 человека соответственно.
Мутеины липокалинов с аффинностью связывания в отношении интерлейкина-17A (IL-17A, синонимично IL-17)
Согласно одному аспекту настоящее раскрытие предусматривает мутеины липокалинов человека, которые связывают IL-17A (то же самое, что и «IL-17») человека, и их полезные применения. Связывающие белки, описанные в данном документе, могут связывать гомодимер IL-17A человека (то же самое, что и «IL-17 A/A») и/или гетеродимеры IL-17A человека и гомолога IL-17F человека (то же самое, что и «IL-17 A/F»). Настоящее раскрытие также предусматривает способы получения связывающих IL-17A белков, описанных в данном документе, а также композиций, содержащих такие белки. Связывающие IL-17A белки по настоящему раскрытию, а также их композиции можно применять в способах выявления IL-17A (в том числе IL-17 A/A и IL-17 A/F) в образцах или в способах связывания IL-17A (в том числе IL-17 A/A и IL-17 A/F) в субъекте. Ранее не были описаны такие мутеины липокалинов человека с такими качествами, сопутствующими путям применения, предусмотренным настоящим раскрытием.
Один вариант осуществления настоящего раскрытия относится к мутеину липокалина, который способен к связыванию интерлейкина-17A (IL-17A), с аффинностью, измеренной при помощи KD, составляющей приблизительно 1 нМ или меньше, как, например, 0,8 нМ, при измерении в анализе, по сути, описанном в примере 1.
Согласно некоторым другим вариантам осуществления мутеин липокалина способен ингибировать связывание IL-17A с его рецептором IL-17RA со значением IC50, составляющим приблизительно 100 пМ или меньше, как, например, 75 пМ, в формате конкурентного ELISA, по сути, описанном в примере 3.
Согласно некоторым конкретным вариантам осуществления связывающий IL-17A мутеин липокалина является перекрестнореагирующим с IL-17A человека, IL-17A макака-крабоеда и IL-17A игрунки.
Согласно еще некоторым дополнительным вариантам осуществления мутеин липокалина по настоящему раскрытию способен блокировать связывание IL-17A с его рецептором IL-17RA. Согласно некоторым дополнительным вариантам осуществления мутеин липокалина характеризуется средним значением EC50, по меньшей мере практически таким же (т.е. где разница составляет менее 0,1 нМ) или превосходящим значение EC50 сравнительного антитела, когда указанный мутеин липокалина и сравнительное антитело измерены в анализе, по сути, описанном в примере 5. Согласно некоторым вариантам осуществления сравнительное антитело представляет собой полипептид, содержащий (i) SEQ ID NO: 53 или 55 в качестве первой субъединицы и (ii) SEQ ID NO: 54 или 56 в качестве второй субъединицы. Мутеин липокалина может характеризоваться средним значением IC50, составляющим приблизительно 0,13 нМ или даже меньше, в анализе, при котором в то же время сравнительное антитело характеризуется значением EC50, составляющим приблизительно 2,33 нМ или меньше в анализе, как, например, приблизительно 0,12 нМ.
Согласно некоторым другим вариантам осуществления связывающий IL-17A мутеин липокалина по настоящему раскрытию способен к связыванию IL-17A с более высокой аффинностью, чем мутеин липокалина с SEQ ID NO: 42, измеренной при помощи KD первого указанного мутеина липокалина более низкой, чем KD мутеина липокалина с SEQ ID NO: 42, например, в анализе, по сути, описанном в примере 1. Согласно некоторым дополнительным вариантам осуществления связывающий IL-17A мутеин липокалина по настоящему раскрытию способен ингибировать связывание IL-17A с его рецептором IL-17RA с более низким значением EC50, чем таковое мутеина липокалина с SEQ ID NO: 42, например, при измерении в анализе, по сути, описанном в примере 5.
1. Иллюстративные мутеины липокалинов с аффинностью связывания в отношении интерлейкина-17A (IL-17A)
Согласно одному аспекту настоящее раскрытие относится к новым мутеинам липокалинов слезы человека со специфичностью связывания, направленным против или специфичным в отношении интерлейкина-17A (IL-17A). Мутеины липокалинов слезы человека, раскрытые в данном документе, можно применять для терапевтических и/или диагностических целей. Мутеин липокалина слезы человека по настоящему раскрытию также может быть обозначен в данном документе как «мутеин Tlc». Как используется в данном документе мутеин Tlc по настоящему раскрытию «специфически связывает» мишень (например, в данном случае IL-17A), если он способен отличать ту мишень от одной или более эталонных мишеней, поскольку специфичность связывания является не абсолютным, а относительным свойством. «Специфическое связывание» можно определять, например, в соответствии с вестерн-блоттингами, анализами ELISA, RIA, ECL, IRMA, FACS, IHC и пептидными сканированиями.
В связи с этим, настоящее раскрытие предусматривает один или более мутеинов Tlc, которые способны к связыванию интерлейкина-17A (IL-17A), с аффинностью, измеренной при помощи KD, составляющей приблизительно 10 нМ, приблизительно 1 нМ, приблизительно 0,1 нМ или меньше. Более предпочтительно, мутеины Tlc могут обладать аффинностью, измеренной при помощи KD, составляющей приблизительно 1 нМ, 0,8 нМ, 0,6 нМ, 100 пМ или меньше.
Согласно некоторым конкретным вариантам осуществления такой мутеин Tlc включает подвергнутый мутации аминокислотный остаток в одном или более положениях, соответствующих положениям 26-33, 56, 58, 60-61, 64, 92, 101, 104-106, 108, 111, 114 и 153 линейной полипептидной последовательности зрелого липокалина слезы человека (номер доступа базы данных SWISS-PROT P31025; SEQ ID NO: 41).
Согласно дополнительным конкретным вариантам осуществления такой мутеин Tlc может дополнительно включать подвергнутый мутации аминокислотный остаток в одном или более положениях, соответствующих положениям 101, 111, 114 и 153 линейной полипептидной последовательности зрелого липокалина слезы человека (SEQ ID NO: 41).
Согласно некоторым дополнительным вариантам осуществления мутеин Tlc может содержать по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21 или даже более подвергнутых мутации аминокислотных остатков в одном или более положениях последовательности, соответствующих положениям 26, 27, 28, 29, 30, 31, 32, 33, 56, 58, 60, 61, 64, 92, 101, 104, 105, 106, 108, 111, 114 и 153 линейной полипептидной последовательности зрелого липокалина слезы человека (SEQ ID NO: 41).
Согласно еще некоторым дополнительным вариантам осуществления настоящее раскрытие относится к полипептиду, при этом указанный полипептид представляет собой мутеин Tlc, содержащий по сравнению с линейной полипептидной последовательностью зрелого липокалина слезы человека по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или даже более подвергнутых мутации аминокислотных остатков в положениях 26-33, 56, 58, 60-61, 64, 92, 101, 104-106, 108, 111, 114 и 153 последовательности, и при этом указанный полипептид связывает IL-17A, в частности IL-17A человека.
Согласно некоторым вариантам осуществления мутеин липокалина согласно настоящему раскрытию может включать по меньшей мере одну аминокислотную замену природного остатка цистеина, например, остатком серина. Согласно некоторым вариантам осуществления мутеин Tlc согласно настоящему раскрытию включает аминокислотную замену природного остатка цистеина в положениях 61 и/или 153 остатком серина. В данном случае отмечено, что было обнаружено, что удаление дисульфидной связи в структуре (на уровне соответствующей библиотеки не подвергнутых мутации нуклеиновых кислот) липокалина дикого типа слезы, которая образована остатками цистеина 61 и 153 (см. Breustedt, et al., 2005, ранее), может обеспечить мутеины липокалинов слезы, которые не только стабильно сворачиваются, но также способны связывать данный не природный лиганд с высокой аффинностью. Не желая быть связанными теорией, также полагают, что устранение дисульфидной связи в структуре обеспечивает дополнительное преимущество предоставления возможности (самопроизвольного) образования или преднамеренного введения не природных искусственных дисульфидных связей в мутеинах по настоящему раскрытию, повышая, тем самым, стабильность мутеинов. Например, согласно некоторым вариантам осуществления мутеин Tlc согласно настоящему раскрытию включает аминокислотную замену природного остатка цистеина в положении 101 остатком серина. Дополнительно, согласно некоторым вариантам осуществления мутеин согласно настоящему раскрытию включает аминокислотную замену природного остатка аргинина в положении 111 остатком пролина. Согласно некоторым вариантам осуществления мутеин согласно настоящему раскрытию включает аминокислотную замену природного остатка лизина в положении 114 остатком триптофана.
Мутеин Tlc согласно настоящему раскрытию может дополнительно включать, в отношении аминокислотной последовательности зрелого липокалина слезы человека (номер доступа базы данных SWISS-PROT P31025), одну или более, в том числе по меньшей мере две, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять, по меньшей мере шесть, по меньшей мере семь, по меньшей мере восемь, по меньшей мере девять, по меньшей мере десять, по меньшей мере одиннадцать, по меньшей мере двенадцать, по меньшей мере тринадцать или по меньшей мере четырнадцать аминокислотных замен природных аминокислотных остатков остатками цистеина в любом из положений 26-33, 56, 58, 60-61, 64, 92, 101, 104-106, 108, 111, 114 и 153 зрелого липокалина слезы человека.
Согласно некоторым вариантам осуществления мутеин согласно настоящему раскрытию включает аминокислотную замену природной аминокислоты остатком цистеина в положениях 28 или 105 в отношении аминокислотной последовательности зрелого липокалина слезы человека. Согласно некоторым вариантам осуществления мутеин согласно настоящему раскрытию включает аминокислотную замену природной аминокислоты остатком цистеина в положениях 28 или 105 в отношении аминокислотной последовательности зрелого липокалина слезы человека. Согласно дополнительному конкретному варианту осуществления мутеин согласно настоящему раскрытию включает аминокислотную замену природной аминокислоты двумя остатками цистеина в положениях 28 и 105 в отношении аминокислотной последовательности зрелого липокалина слезы человека.
Согласно некоторым вариантам осуществления мутеин Tlc согласно настоящему раскрытию включает замещенную аминокислоту по меньшей мере одного или обоих остатков цистеина, встречающихся в каждом из положений 61 и 153 последовательности, другой аминокислотой и мутацию по меньшей мере трех аминокислотных остатков в любом из положений 26-33, 56, 58, 60-61, 64, 92, 101, 104-106, 108, 111, 114 и 153 линейной полипептидной последовательности зрелого липокалина слезы человека (номер доступа базы данных SWISS-PROT P31025). Положения 26-34 включены в петлю AB, положение 55 расположено на самом конце бета-листа, и последующие положения 56-58, а также 60-61 и 64 включены в петлю CD. Положения 104-108 включены в петлю GH в сайте связывания на открытом конце структуры с β-бочонками зрелого липокалина слезы человека. Определение таких участков используют в данном документе в соответствии с Flower (Flower, 1996, ранее, Flower, et al., 2000, ранее) и Breustedt et al. (2005, ранее). Согласно некоторым вариантам осуществления мутеин Tlc согласно настоящему раскрытию включает аминокислотные замены Cys 61 → Ala, Phe, Lys, Arg, Thr, Asn, Gly, Gln, Asp, Asn, Leu, Tyr, Met, Ser, Pro или Trp и Cys 153 → Ser или Ala. Как было доказано, такая замена удобна для предупреждения образования встречающегося в природе дисульфидного мостика, соединяющего Cys 61 и Cys 153, и, тем самым, облегчения манипуляции с мутеином. Однако мутеины липокалинов слезы, которые связывают IL-17A и которые имеют дисульфидный мостик, образованный между Cys 61 и Cys 153, также являются частью настоящего раскрытия.
Согласно некоторым вариантам осуществления связывающий IL-17A мутеин Tlc согласно настоящему раскрытию включает, в любом одном или более из положений 26-33, 56, 58, 60-61, 64, 92, 101, 104-106, 108, 111, 114 и 153 линейной полипептидной последовательности зрелого липокалина слезы человека (SEQ ID NO: 41), один или более из следующих подвергнутых мутации аминокислотных остатков: Arg 26 → Phe; Glu 27 → Trp; Phe 28 → Cys; Pro 29 → Ser; Glu 30 → Gly; Met 31 → Ile; Asn 32 → His; Leu 33 → Glu; Leu 56 → Asp; Ser 58 → Glu; Arg 60 → Phe; Cys 61 → Leu; Val 64 → Phe; His 92 → Arg; Cys101 → Ser; Glu 104 → Asp; Leu 105 → Cys; His 106 → Pro; делецию Lys 108; Arg 111 → Pro; Lys 114 → Trp и Cys 153 → Ser. Согласно некоторым вариантам осуществления мутеин Tlc по настоящему раскрытию включает два или более, как, например, 3, 4, 5, 6, 7, 8 или все, подвергнутых мутации аминокислотных остатков в этих положениях последовательности зрелого липокалина слезы человека.
Согласно дополнительным конкретным вариантам осуществления мутеин Tlc по настоящему раскрытию содержит аминокислотную последовательность, которая изложена под любым из SEQ ID NO: 1, или ее фрагмент или вариант.
Согласно дополнительным конкретным вариантам осуществления мутеин Tlc по настоящему раскрытию характеризуется по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85% или более высокой идентичностью с аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NO: 1.
Настоящее раскрытие также включает структурные гомологи мутеина Tlc с аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NO: 1, структурные гомологи которой характеризуются гомологией аминокислотной последовательности или идентичностью последовательностей более чем приблизительно 60%, предпочтительно более чем 65%, более чем 70%, более чем 75%, более чем 80%, более чем 85%, более чем 90%, более чем 92% и, наиболее предпочтительно, более чем 95% относительно указанного мутеина Tlc.
Согласно некоторым конкретным вариантам осуществления настоящее раскрытие предусматривает мутеин липокалина, который связывает IL-17A, с аффинностью, измеренной при помощи KD, составляющей 1 нМ или меньше, при этом мутеин липокалина характеризуется по меньшей мере 90% или более высокой, как, например, 95%, идентичностью с аминокислотной последовательностью с SEQ ID NO: 1.
2. Применения мутеинов липокалинов с аффинностью связывания в отношении интерлейкина-17A (IL-17A)
IL-17A является провоспалительным цитокином, продуцируемым подмножеством T-клеток памяти (называемых Th17), которые вовлечены в патогенез многих нарушений, например рассеянного склероза (MS) (Hellings, P. W. et al., Am. J. Resp. Cell Mol. Biol. 28 (2003) 42-50; Matusevicius, D. et al., Multiple Sclerosis 5 (1999) 101-104), ревматоидного артрита (RA) (Ziolkovvska, M. et al., J. Immunol. 164 (2000) 2832-38; Kotake, S. et al., J. Clin. Invest. 103 (1999) 1345-52; Hellings, P. W. et al., Am. J. Resp. Cell Mol. Biol. 28 (2003) 42-50). IL-17A играет роль в индукции других воспалительных цитокинов, хемокинов и адгезивных молекул (Komiyama, Y. et al., J. Immunol. 177 (2006) 566-573), псориазе, болезни Крона, хроническом обструктивном заболевании легких (COPD), астме и отторжении трансплантата.
IL-17A вовлечен в индукцию провоспалительных реакций и индуцирует или опосредует экспрессию множества других цитокинов, факторов и медиаторов, в том числе фактора альфа некроза ткани (TNF-α), IL-6, IL-8, IL-1β, колониестимулирующего фактора гранулоцитов (G-CSF), простагландина E2 (PGE2), IL-10, IL-12, антагониста IL-IR, фактора, ингибирующего лейкемию, и стромелизина (Yao et al., J. Immunol, 155(12): 5483-5486 (1995); Fossiez et al., J. Exp. Med., 183(6): 2593-2603 (1996); Jovanovic et al., J. Immunol, 160: 3513-3521 (1998); Teunissen et al., J. Investig. Dermatol, 111: 645-649 (1998); Chabaud et al., J. Immunol, 161: 409-414 (1998)). IL-17A также индуцирует образование оксида азота хондроцитами и в эксплантах человека с остеоартритом (Shalom-Barak et al., J. Biol Chem., 273: 27467-27473 (1998); Attur et al., Arthritis Rheum., 40: 1050- 1053 (1997)). По причине его участия в опосредованном T-клетками аутоиммунитете, IL-17A индуцирует высвобождение цитокинов, хемокинов и факторов роста (указанных выше), является важным локальным «организатором» накопления нейтрофилов и играет роль в разрушении хрящей и костей. Имеется растущее число доказательств, что целенаправленное воздействие на передачу сигнала IL-17A может оказаться полезным при множестве аутоиммунных заболеваний, включая ревматоидный артрит (RA), псориаз, болезнь Крона, рассеянный склероз (MS), псориатическое заболевание, астму и волчанку (SLE) (см., например, Aggarwal et al., J. Leukoc. Biol, 71(1): 1-8 (2002); Lubberts et al., «Treatment with a neutralizing anti-murine interleukin-17 Antibody after the onset of collagen-induced arthritis reduces joint inflammation, cartilage destruction, and bone erosion,» Arthritis Rheum., 50: 650-659 (2004)).
К тому же, в уровне техники известно, что воспалительные и иммунорегулирующие процессы вовлечены в патогенез разных форм сердечно-сосудистого заболевания (Biasucci, L., et al., Circulation 1999, 99:855-860; Albert, C, et al, Circulation 2002, 105:2595-9; Buffon, A., et al, NEJM 2002, 347:55-7; Nakajima, T., et al., Circulation 2002, 105:570-5). В недавних исследованиях установили основу для лечения сердечно-сосудистого заболевания путем снижения воспалительных и иммунорегулирующих реакций заболевания (Blankenberg, S., et al., Circulation 2002, 106:24-30; Mallat, Z., et al, Circulation 2001, 104:1598-603; Mallat, Z., et al, Circ Res. 2001, 89:E41-5). Сердечно-сосудистое заболевание охватывает ряд нарушений, которые влияют на мышцу и/или кровеносные сосуды сердца, периферические кровеносные сосуды, мышцы и разные органы.
Ввиду этого в медицине существует множество возможных применений мутеинов Tlc по настоящему раскрытию. Согласно одному дополнительному аспекту настоящее раскрытие относится к применению мутеина Tlc, раскрытого для выявления IL-17A (в том числе IL-17 A/A и IL-17 A/F) в образце, а также соответствующему способу диагностирования.
Настоящее раскрытие также включает применение одного или более мутеинов Tlc, которые описаны, для образования комплекса с IL-17A.
Ввиду этого, в другом аспекте настоящего раскрытия раскрытые мутеины применяют для выявления IL-17A. Такое применение может включать этапы приведения одного или более указанных мутеинов, при соответствующих условиях, в контакт с образцом, который, как подозревают, содержит IL-17A, с обеспечением таким образом возможности образования комплекса между мутеинами и IL-17A и выявления комплекса по соответствующему сигналу.
Выявляемый сигнал может быть обусловлен меткой, как разъяснено выше, или изменением физических свойств в результате связывания, т.е. образования комплекса, как такового. Одним примером является поверхностный плазмонный резонанс, значение которого изменяется в ходе связывания партнеров по связыванию, из которых один иммобилизирован на поверхности, такой как золотая фольга.
Мутеины, раскрытые в данном документе, также можно применять для отделения IL-17A. Такое применение может включать этапы приведения одного или более указанных мутеинов, при соответствующих условиях, в контакт с образцом, который, как полагают, содержит IL-17A, с обеспечением таким образом возможности образования комплекса между мутеинами и IL-17A и отделения комплекса от образца.
При применении раскрытых мутеинов для выявления IL-17A, а также отделения IL-17A, мутеины и/или IL-17A или их домен или фрагмент могут быть иммобилизированы на подходящей твердой фазе.
Согласно еще одному аспекту настоящее раскрытие описывает диагностический или аналитический набор, содержащий мутеин Tlc согласно настоящему раскрытию.
Вдобавок к их применению в диагностике согласно еще другому аспекту настоящее раскрытие охватывает применение мутеина по настоящему раскрытию или композиции, содержащей такой мутеин, для связывания IL-17A в субъекте и/или ингибирования связывания IL-17A с его рецептором в субъекте.
Согласно еще одному аспекту настоящее раскрытие описывает способ связывания IL-17A в субъекте, включающий введение указанному субъекту эффективного количества одного или более мутеинов липокалинов по настоящему раскрытию или одной или более композиций, содержащих такие мутеины.
Согласно еще одному аспекту настоящее раскрытие включает способ ингибирования связывания IL-17A с его рецептором в субъекте, включающий введение указанному субъекту эффективного количества одного или более мутеинов липокалинов по настоящему раскрытию или одной или более композиций, содержащих такие мутеины.
В случае настоящего раскрытия раскрытые мутеины липокалинов с аффинностью связывания в отношении IL-17A могут связываться с IL-17A, который существует в виде гомодимера, но такие мутеины также могут связываться с IL-17A, который существует в качестве гетеродимера, в комплексе с гомологом IL-17F с образованием гетеродимерного IL-17 A/F. Согласно одному предпочтительному варианту осуществления один мутеин липокалина по настоящему раскрытию может связывать с выявляемой аффинностью IL-17A в комплексе с IL-17F.
B. Мутеины липокалинов с аффинностью связывания в отношении интерлейкина-23p19 (IL-23p19)
К тому же, настоящее раскрытие удовлетворяет потребности в альтернативных ингибиторах IL-23p19 путем предоставления мутеинов липокалинов человека, которые связывают IL-23p19 человека, и их полезных применений. Соответственно, настоящее раскрытие также предусматривает способы получения и применения связывающих IL-23p19 белков, описанных в данном документе, а также композиций, которые можно применять в способах выявления IL-23p19 в образце или в способах связывания IL-23p19 в субъекте. Ранее не были описаны такие мутеины липокалинов человека с такими качествами, сопутствующими путям применения, предусмотренным настоящим раскрытием.
Один вариант осуществления настоящего раскрытия относится к мутеину липокалина, который способен к связыванию интерлейкина-23p19 (IL-23p19), с аффинностью, измеренной при помощи KD, составляющей приблизительно 1 нМ или меньше, как, например, приблизительно 0,6 нМ, при измерении в анализе, по сути, описанном в примере 6 или примере 13.
Согласно некоторым другим вариантам осуществления мутеин липокалина способен ингибировать связывание IL-23 с его рецептором IL-23R со значением IC50, составляющим приблизительно 0,55 нМ или меньше в формате конкурентного ELISA, по сути, описанном в примере 8 или примере 14.
Согласно некоторым конкретным вариантам осуществления мутеин липокалина является перекрестнореагирующим как с IL-23 человека, так и с IL-23 мыши.
Согласно еще некоторым дополнительным вариантам осуществления мутеин липокалина по настоящему раскрытию способен ингибировать связывание IL-23 с его рецептором IL-23R. Согласно некоторым дополнительным вариантам осуществления мутеин липокалина характеризуется средним значением EC50, по меньшей мере практически таким же (т.е. где разница составляет менее 1,0 нМ) или превосходящим среднее значение EC50 сравнительного антитела, когда указанный мутеин липокалина и сравнительное антитело измерены в анализе, который, по сути, описан в примере 10 или примере 15. Согласно некоторым вариантам осуществления сравнительное антитело представляет собой полипептид, содержащий (i) SEQ ID NO: 57 или 59 в качестве первой субъединицы и (ii) SEQ ID NO: 58 или 60 в качестве второй субъединицы. Мутеин липокалина может характеризоваться средним значением EC50, составляющим приблизительно 1,2 нМ или даже меньше, в анализе, при котором в то же время сравнительное антитело характеризуется значением EC50, составляющим приблизительно 3 нМ или меньше, в анализе, как, например, приблизительно 1,2 нМ.
Согласно некоторым другим вариантам осуществления связывающий IL-23p19 мутеин липокалина по настоящему раскрытию является более стабильным с точки зрения биофизики, чем мутеин липокалина с SEQ ID NO: 44.
1. Иллюстративные мутеины липокалинов с аффинностью связывания в отношении интерлейкина-23p19 (IL-23p19)
Согласно одному аспекту настоящее раскрытие относится к новым мутеинам липокалина 2 человека (Lcn2 или NGAL) со специфичностью связывания, направленным против или специфичным в отношении интерлейкина-23p19 (IL-23p19). Мутеины липокалина 2 человека, раскрытые в данном документе, можно применять для терапевтических и/или диагностических целей. Мутеин липокалина 2 человека по настоящему раскрытию также можно назвать в данном документе «мутеином NGAL». Как используется в данном документе мутеин Tlc по настоящему раскрытию «специфически связывает» мишень (в данном случае IL-23p19), если он способен отличать ту мишень от одной или более эталонных мишеней, поскольку специфичность связывания является не абсолютным, а относительным свойством. «Специфическое связывание» можно определять, например, в соответствии с вестерн-блоттингами, анализами ELISA, RIA, ECL, IRMA, FACS, IHC и пептидными сканированиями.
В связи с этим, настоящее раскрытие предусматривает один или более мутеинов NGAL, которые способны к связыванию интерлейкина-23p19 (IL-23p19), с аффинностью, измеренной при помощи KD, составляющей приблизительно 10 нМ или меньше. Более предпочтительно, мутеины NGAL могут обладать аффинностью, измеренной при помощи KD, составляющей приблизительно 1 нМ или меньше.
Согласно некоторым вариантам осуществления мутеин hNGAL по настоящему раскрытию включает в одном или более положениях, соответствующих положению 28, 36, 40-41, 49, 52, 65, 68, 70, 72-73, 75-77, 79, 81, 87, 96, 98, 100, 103, 106, 114, 120, 125, 127, 134 и 175 линейной полипептидной последовательности зрелого hNGAL (SEQ ID NO: 43), замену.
Согласно конкретным вариантам осуществления мутеин липокалина по настоящему раскрытию содержит по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21 или даже больше замен в положении последовательности, соответствующем положению 28, 36, 40-41, 49, 52, 65, 68, 70, 72-73, 75-77, 79, 81, 87, 96, 98, 100, 103, 106, 114, 120, 125, 127, 134 и 175 линейной полипептидной последовательности зрелого hNGAL (номер доступа базы данных SWISS-PROT P80188; SEQ ID NO: 43). Предпочтительно, предусматривают, что настоящее раскрытие относится к мутеину липокалина, который содержит, в дополнение к одной или более заменам в положениях, соответствующих положениям 36, 87 и/или 96 линейной полипептидной последовательности зрелого NGAL человека, в одном или более положениях, соответствующих положениям 28, 36, 40-41, 49, 52, 65, 68, 70, 72-73, 75-77, 79, 81, 87, 96, 98, 100, 103, 106, 114, 120, 125, 127, 134 и 175 линейной полипептидной последовательности зрелого hNGAL замену.
Согласно еще некоторым дополнительным вариантам осуществления настоящее раскрытие относится к полипептиду, при этом указанный полипептид представляет собой мутеин hNGAL, содержащий по сравнению с линейной полипептидной последовательностью зрелого hNGAL по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21 или даже больше подвергнутых мутации аминокислотных остатков в положениях 28, 36, 40-41, 49, 52, 65, 68, 70, 72-73, 75-77, 79, 81, 87, 96, 98, 100, 103, 106, 114, 120, 125, 127, 134 и 175 последовательности, и при этом указанный полипептид связывает IL-23p19, в частности IL-23p19 человека.
Согласно некоторым вариантам осуществления связывающий IL-23p19 мутеин hNGAL по настоящему раскрытию включает, в любом одном или более из положений 28, 36, 40-41, 49, 52, 65, 68, 70, 72-73, 75-77, 79, 81, 87, 96, 98, 100, 103, 106, 114, 120, 125, 127, 134 и 175 линейной полипептидной последовательности зрелого hNGAL (SEQ ID NO: 43), один или более из следующих подвергнутых мутации аминокислотных остатков: Gln 28 → His; Leu 36 → Glu; Ala 40 → Leu; Ile 41 → Leu; Gln 49 → Arg; Tyr 52 → Thr; Asn 65 → Asp; Ser 68 → Arg; Leu 70 → Glu; Arg 72 → Gly; Lys 73 → Ala или Val; Lys 75 → Thr; Asp 77 → Lys; Trp 79 → Gln или Arg; Arg 81 → Gly; Asn 96 → Gly; Lys 98 → Glu; Tyr 100 → Met; Leu 103 → Met; Tyr 106 → Phe; Asn 114 → Asp; Met 120 → Ile; Lys 125 → Tyr; Ser 127 → Tyr и Lys 134 → Glu. Согласно некоторым вариантам осуществления мутеин hNGAL по настоящему раскрытию включает два или более, как, например, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, даже больше или все подвергнутые мутации аминокислотные остатки в этих положениях последовательности зрелого hNGAL.
Дополнительно, связывающий IL-23p19 мутеин hNGAL согласно настоящему раскрытию также может содержать следующую замену: Cys 87 → Ser. Кроме того, связывающий IL-23p19 мутеин hNGAL согласно настоящему раскрытию также может содержать следующую замену: Cys 76 → Tyr или Arg. Кроме того, связывающий IL-23p19 мутеин hNGAL согласно настоящему раскрытию также может содержать следующую замену: Cys 175 → Ala.
Согласно некоторым дополнительным вариантам осуществления мутеин hNGAL по настоящему раскрытию, который связывается с IL-23p19, включает один из следующих комплектов аминокислотных замещений по сравнению с линейной полипептидной последовательностью зрелого hNGAL:
Gln 28 → His; Leu 36 → Glu; Ala 40 →Leu; Ile 41 → Leu; Gln 49 → Arg; Tyr 52 → Thr; Asn 65 → Asp; Ser 68 → Arg; Leu 70 → Glu; Arg 72 → Gly; Lys 73 → Ala; Lys 75 → Thr; Cys 76 → Tyr; Asp 77 → Lys; Trp 79 → Gln; Arg 81 → Gly; Asn 96 → Gly; Lys 98 → Glu; Tyr 100 → Met; Leu 103 → Met; Tyr 106 → Phe; Met 120 → Ile; Lys 125 → Tyr; Ser 127 → Tyr и Lys 134 → Glu;
Gln 28 → His; Leu 36 → Glu; Ala 40 →Leu; Gln 49 → Arg; Tyr 52 → Thr; Asn 65 → Asp; Ser 68 → Arg; Leu 70 → Glu; Arg 72 → Gly; Lys 73 → Val; Lys 75 → Thr; Cys 76 → Arg; Asp 77 → Lys; Trp 79 → Arg; Arg 81 → Gly; Asn 96 → Gly; Tyr 100 → Met; Leu 103 → Met; Tyr 106 → Phe; Lys 125 → Tyr; Ser 127 → Tyr и Lys 134 → Glu или
Gln 28 → His; Leu 36 → Glu; Ala 40 →Leu; Ile 41 → Leu; Gln 49 → Arg; Tyr 52 → Thr; Asn 65 → Asp; Ser 68 → Arg; Leu 70 → Glu; Arg 72 → Gly; Lys 73 → Val; Lys 75 → Thr; Cys 76 → Tyr; Asp 77 → Lys; Trp 79 → Gln; Arg 81 → Gly; Asn 96 → Gly; Tyr 100 → Met; Leu 103 → Met; Tyr 106 → Phe; Asn 114 → Asp; Lys 125 → Tyr; Ser 127 → Tyr и Lys 134 → Glu.
В остальной участок, т.е. участок, отличающийся от положений 28, 36, 40-41, 49, 52, 65, 68, 70, 72-73, 75-77, 79, 81, 87, 96, 98, 100, 103, 106, 114, 120, 125, 127, 134 и 175 последовательности мутеина hNGAL по настоящему раскрытию, можно включать дикого типа (природную) аминокислотную последовательность вне подвергнутых мутации положений аминокислотной последовательности.
Согласно дополнительным конкретным вариантам осуществления мутеин липокалина согласно настоящему раскрытию содержит аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO: 2 и 45-46, или ее фрагмент или вариант.
Аминокислотная последовательность связывающего IL-23p19 мутеина hNGAL по настоящему раскрытию может характеризоваться высокой идентичностью последовательности, как, например, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 82%, по меньшей мере 85%, по меньшей мере 87%, по меньшей мере 90% идентичностью, в том числе по меньшей мере 95% идентичностью, с последовательностью, выбранной из группы, включающей SEQ ID NO: 2 и 45-46.
Настоящее раскрытие также включает структурные гомологи мутеина hNGAL с аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NO: 2 и 45-46, структурные гомологи которой характеризуются гомологией аминокислотной последовательности или идентичностью последовательностей более чем приблизительно 60%, предпочтительно более чем 65%, более чем 70%, более чем 75%, более чем 80%, более чем 85%, более чем 90%, более чем 92% и, наиболее предпочтительно, более чем 95% относительно указанного мутеина hNGAL.
Согласно некоторым конкретным вариантам осуществления настоящее раскрытие предусматривает мутеин липокалина, который связывает IL-23p19, с аффинностью, измеренной при помощи KD, составляющей 1 нМ или меньше, при этом мутеин липокалина характеризуется по меньшей мере 90% или более высокой, как, например, 95%, идентичностью с аминокислотной последовательностью с SEQ ID NO: 2.
2. Применения мутеинов липокалинов с аффинностью связывания в отношении интерлейкина-23p19 (IL-23p19)
Интерлейкин-23 (IL-23) является гетеродимерным цитокином, образованным уникальной субъединицей, p19 (в данном документе взаимозаменяемо называемой «IL-23p19»), и субъединицей p40, которая является общей с интерлейкином-12 (IL-12) (Oppmann, Immunity 13:115 (2000)). Было обнаружено, что IL-23 способствует продуцированию и/или поддержанию IL-17A и IL-17F из активированных T-клеток CD4, которые в на сегодняшний день называют подмножеством «новых» T-хелперов (Th), обозначенным Th17. Обзор биологии цитокина IL-23 и рецептора рассмотрен в Holscher, Curr. Opin. Invest. Drugs 6:489 (2005) и Langrish et al. Immunol Rev. 202:96 (2004). Подобно линиям дифференцировки Th1 и Th2 Th17-клетки весьма вероятно формируются для обеспечения адаптивного иммунитета к специфическим классам патогенов, как, например, внеклеточным бактериям. Однако, неадекватные реакции Th 17 в значительной степени вовлечены в увеличивающийся список аутоиммунных нарушений, в том числе рассеянный склероз, ревматоидный артрит, воспалительное заболевание кишечника и псориаз.
В связи с этим, IL-23 содействует состоянию явной активации T-клеток CD4, характеризующемуся продуцированием интерлейкина-17 (J. Biol. Chem. 278:1910-191 (2003); см. также Langrish et al.). IL-23 управляет патогенной популяцией T-клеток, которая индуцирует аутоиммунное воспаление (J. Exp. Med. 201: 233-240 (2005); Starnes et al. «Cutting edge: IL-17F, a novel cytokine selectively expressed in activated T cells and monocytes, regulates angiogenesis and endothelial cell cytokine production» J. Immunol. 167:4137-4140 (2001)).
Ввиду этого, в медицине существует множество возможных применений мутеинов с аффинностью связывания в отношении IL-23p19 по настоящему раскрытию. Согласно одному дополнительному аспекту настоящее раскрытие относится к применению такого мутеина, раскрытого для выявления IL-23p19 в образце, а также соответствующему способу диагностирования.
Настоящее раскрытие также включает применение одного или более мутеинов с аффинностью связывания в отношении IL-23p19, которые описаны, для образования комплекса с IL-23p19.
Ввиду этого, в другом аспекте настоящего раскрытия раскрытые мутеины применяют для выявления IL-23p19. Такое применение может включать этапы приведения одного или более указанных мутеинов, при соответствующих условиях, в контакт с образцом, который, как подозревают, содержит IL-23p19, с обеспечением таким образом возможности образования комплекса между мутеинами и IL-23p19 и выявления комплекса по соответствующему сигналу.
Выявляемый сигнал может быть обусловлен меткой, как разъяснено выше, или изменением физических свойств в результате связывания, т.е. образования комплекса, как такового. Одним примером является поверхностный плазмонный резонанс, значение которого изменяется в ходе связывания партнеров по связыванию, из которых один иммобилизирован на поверхности, такой как золотая фольга.
Мутеины, раскрытые в данном документе, также можно применять для отделения IL-23p19. Такое применение может включать этапы приведения одного или более указанных мутеинов, при соответствующих условиях, в контакт с образцом, который, как полагают, содержит IL-23p19, с обеспечением таким образом возможности образования комплекса между мутеинами и IL-23p19 и отделения комплекса от образца.
При применении раскрытых мутеинов для выявления IL-23p19, а также отделения IL-23p19, мутеины и/или IL-23p19 или их домен или фрагмент могут быть иммобилизированы на подходящей твердой фазе.
Соответственно, могут быть определены присутствие или отсутствие молекулы, такой как IL-23p19, например, в образце, а также ее концентрация или уровень.
Согласно еще одному аспекту настоящее раскрытие описывает диагностический или аналитический набор, содержащий мутеин с аффинностью связывания в отношении IL-23p19 согласно настоящему раскрытию.
Вдобавок к их применению в диагностике согласно еще другому аспекту настоящее раскрытие охватывает применение такого мутеина по настоящему раскрытию или композиции, содержащей такой мутеин, для связывания IL-23p19 в субъекте и/или ингибирования связывания IL-23p19 с его рецептором в субъекте.
Согласно еще одному аспекту настоящее раскрытие описывает способ связывания IL-23p19 в субъекте, включающий введение указанному субъекту эффективного количества одного или более мутеинов липокалинов с аффинностью связывания в отношении IL-23p19 по настоящему раскрытию или одной или более композиций, содержащих такой мутеин.
Согласно еще одному аспекту настоящее раскрытие включает способ ингибирования связывания IL-23 с его рецептором в субъекте, включающий введение указанному субъекту эффективного количества одного или более мутеинов липокалинов с аффинностью связывания в отношении IL-23p19 по настоящему раскрытию или одной или более композиций, содержащих такой мутеин.
C. Композиции, содержащие связывающий IL-17A мутеин липокалина и/или связывающий IL-23p19 мутеин липокалина, и пути применения мутеинов липокалинов
IL-17A и IL-23 являются цитокинами, вовлеченными в воспалительный процесс. Интерлейкин-17A (также известный как «IL-17», в том числе IL-17 A/A и IL-17 A/F) человека является цитокином, который стимулирует экспрессию интерлейкина-6 (IL-6), внутриклеточной адгезивной молекулы 1 (ICAM-I), интерлейкина-8 (IL-8), гранулоцитарно-моноцитарного колониестимулирующего фактора (GM-CSF) и экспрессию простагландина E2 и играет роль в предпочтительном созревании кроветворных клеток-предшественников CD34+ в нейтрофилы (Yao et al., J. Immunol 755:5483 (1995); Fossiez et al., J. Exp. Med. 183:2593 (1996)). Интерлейкин-23 (также известный как «IL-23») человека является цитокином, который, как сообщалось, содействует пролиферации T-клеток, в частности T-клеток памяти.
Как сообщалось, как IL-17A (в том числе IL-17A в комплексе с IL-17F, также называемый IL-17 A/F), так и IL-23 играют важные роли во многих аутоиммунных заболеваниях, таких как рассеянный склероз, ревматоидный артрит, болезнь Крона и псориаз. Как IL-23, так и IL-17A экспрессируются на избыточном уровне в центральной нервной системе людей с рассеянным склерозом и у мышей, у которых воспроизводили животную модель рассеянного склероза, экспериментальный аутоиммунный энцефаломиелит (EAE). Экспрессию на избыточном уровне наблюдают у мышей при EAE, который вызывают либо при помощи пептида миелинового олигодендроцитарного гликопротеина (MOG) 35-55, либо при помощи пептида-протеолипида (PLP). Кроме того, нейтрализация либо IL-23p19, либо IL-17A приводит в результате к уменьшению интенсивности симптомов EAE у мышей (Park et al., Immunol 6:1133 (2005); Chen et al., J Clin Invest. 116:1317 (2006)).
Также было показано, что IL-17A и Th17-клетки могут продуцироваться из независимых от IL-23 источников, и было показано, что in vivo развитие эффекторной реакции IL-17 является независимым от IL-23 (Mangan et al., Nature 441:231 (2006)). Нейтрализация IL-23 теоретически будет устранять существующие продуцирующие IL-17A клетки, но не будет полностью предупреждать развитие новых Th17-клеток.
Ввиду этого, настоящее раскрытие касается связывания обоих из этих провоспалительных цитокинов, IL-17A и IL-23p19, поскольку связывание как IL-23 (через p19), так и IL-17A является более эффективным с терапевтической точки зрения, нежели нейтрализация только IL-23p19 или только IL-17A и, таким образом, целесообразно для эффективного лечения воспалительных заболеваний.
Хотя антитела к IL-17A и/или IL-23p19 были описаны, такие основанные на антителах подходы по-прежнему обладают рядом серьезных недостатков, как, например, существует необходимость в сложных системах клеток млекопитающих для продуцирования, зависимость от стабильности дисульфидных связей, склонность к агрегированию некоторых фрагментов антител, ограниченная растворимость и последнее, но не менее важное, они могут вызывать нежелательные иммунные реакции даже при гуманизации. В силу этого, существует неудовлетворенная потребность в разработке малых глобулярных белков, как, например, липокалинов, в качестве остовов для создания нового класса связывающих IL-17A или IL-23p19 белков, например мутеинов липокалинов с аффинностью связывания в отношении IL-17A или IL-23p19.
Соответственно, объектом настоящего раскрытия является обеспечение мутеинов липокалинов человека, которые связывают IL-17A (в том числе IL-17 A/A и IL-17 A/F) и/или IL-23p19 и которые можно применять в фармацевтических применениях. Настоящее раскрытие также предусматривает одну или более композиций, содержащих такие мутеины липокалинов и, необязательно, один или более фармацевтически или диагностически приемлемых наполнителей (например, вспомогательных средств, разбавителей или носителей). Мутеины липокалинов по настоящему раскрытию, а также их композиции можно применять в способах выявления IL-17A (в том числе IL-17 A/A и IL-17 A/F) и/или IL-23p19 в образце или в способах связывания IL-17A (в том числе IL-17 A/A и IL-17 A/F) и/или IL-23p19 в субъекте.
Как отмечалось выше, при помощи связывания IL-17A (в том числе IL-17 A/A и IL-17 A/F) и IL-23p19 одновременно мутеинами липокалинов, специфичными в отношении IL-17A (в том числе IL-17 A/A и IL-17 A/F) или IL-23p19 соответственно, можно устранить некоторые опосредованные гипоксией эффекты, которые может индуцировать связывание только IL-17A (в том числе IL-17 A/A и IL-17 A/F) или связывание только IL-23p19 соответственно. Ввиду этого, настоящее раскрытие охватывает применение (i) первого мутеина липокалина, специфичного в отношении IL-17A, и (ii) второго мутеина липокалина, специфичного в отношении IL-23p19, для связывания IL-17A и IL-23p19 в субъекте. Такое применение включает этап введения субъекту эффективного количества (i) первого мутеина липокалина, специфичного в отношении IL-17A, и (ii) второго мутеина липокалина, специфичного в отношении IL-23p19.
В случае настоящего раскрытия мутеин липокалина, специфичный в отношении IL-17A, может связываться с IL-17A, который существует в виде гомодимера (т.е. IL-17 A/A), но он также может связываться с IL-17A, который существует в виде гетеродимера, в комплексе с гомологом IL-17F с образованием гетеродимерного IL-17 A/F. Согласно одному предпочтительному варианту осуществления указанный мутеин липокалина связывается с комплексом IL-17A и IL-17F.
Первый мутеин липокалина и второй мутеин липокалина можно вводить в комбинации, в том числе параллельно, одновременно или последовательно. Согласно некоторым вариантам осуществления первый мутеин липокалина и второй мутеин липокалина могут быть включены в композицию, которую можно вводить. Композиция может включать эффективное количество первого и второго мутеинов липокалинов в качестве активных ингредиентов совместно по меньшей мере с одним фармацевтически приемлемым вспомогательным средством, разбавителем или носителем. Первый мутеин липокалина и второй мутеин липокалина также можно вводить независимо друг от друга, в том числе с индивидуальными временными интервалами в независимые моменты времени.
Согласно некоторым вариантам осуществления настоящее раскрытие также относится к композиции, содержащей первый мутеин липокалина, специфичный в отношении IL-17A, и (ii) второй мутеин липокалина, специфичный в отношении IL-23p19, причем композицию можно применять в способе связывания IL-17A и IL-23p19, например, в субъекте. К тому же, такую композицию можно применять в способе выявления IL-17A (в том числе IL-17 A/A и IL-17 A/F) и IL-23p19, например, в образце.
Согласно некоторым другим вариантам осуществления настоящее раскрытие относится к комбинации первого мутеина липокалина и второго мутеина липокалина. Один из этих мутеинов липокалинов может связываться с IL-17A в качестве заданной не природной мишени с выявляемой аффинностью. Другой мутеин липокалина может связываться с IL-23p19 в качестве заданной не природной мишени с выявляемой аффинностью. Соответствующий мутеин липокалина, таким образом, связывается с IL-17A или с IL-23p19 соответственно в качестве заданной не природной мишени. Термин «не природная мишень» относится к соединению, которое не связывается с соответствующим липокалином в физиологических условиях. Например, первый мутеин липокалина может связываться с IL-17A, и второй мутеин липокалина может связываться с IL-23p19 или наоборот. Комбинация первого мутеина липокалина и второго мутеина липокалина может быть предусмотрена в разных формах.
Согласно некоторым вариантам осуществления мутеин липокалина, специфичный в отношении IL-17A, который используют в настоящем раскрытии, способен связывать IL-17A с выявляемой аффинностью, т.е. с константой диссоциации, составляющей по меньшей мере 200 нМ, в том числе приблизительно 100 нМ, приблизительно 50 нМ, приблизительно 25 нМ или приблизительно 15 нМ. Согласно некоторым вариантам осуществления мутеин липокалина, специфичный в отношении IL-23p19, который используют в настоящем раскрытии, способен связывать IL-23p19 с выявляемой аффинностью, т.е. с константой диссоциации, составляющей по меньшей мере 200 нМ, в том числе приблизительно 100 нМ, приблизительно 50 нМ, приблизительно 25 нМ или приблизительно 15 нМ. Согласно некоторым дополнительным предпочтительным вариантам осуществления мутеин липокалина комбинации согласно настоящему раскрытию связывает IL-17A или IL-23p19 соответственно с константой диссоциации в отношении IL-17A или IL-23p19, составляющей по меньшей мере приблизительно 10 нМ, приблизительно 1 нМ, приблизительно 0,1 нМ, приблизительно 10 пМ или даже меньше. Таким образом, настоящее раскрытие предусматривает комбинацию (i) мутеина липокалина, который обладает чрезвычайно высокой аффинностью к IL-17A и (ii) мутеина липокалина, который обладает чрезвычайно высокой аффинностью к IL-23p19.
Согласно некоторым вариантам осуществления мутеины липокалинов с выявляемой аффинностью в отношении IL-17A представляют собой мутеины липокалина слезы человека. Эти и дополнительные подробности относительно мутеинов липокалинов с выявляемой аффинностью в отношении IL-17A могут быть найдены в разделе A настоящего раскрытия.
Согласно особенно предпочтительному варианту осуществления мутеин липокалина, который специфичен в отношении IL-17A, показан под SEQ ID NO: 1.
Согласно некоторым вариантам осуществления мутеины липокалинов с выявляемой аффинностью в отношении IL-23p19 представляют собой мутеины липокалина слезы человека или мутеины человеческого липокалина, ассоциированного с желатиназой нейтрофилов. Эти и дополнительные подробности о мутеинах липокалинов с выявляемой аффинностью в отношении IL-23p19 были раскрыты в разделе B настоящего раскрытия.
Согласно особенно предпочтительному варианту осуществления мутеин липокалина, который специфичен в отношении IL-23p19, показан под любым из SEQ ID NO: 2, 45 и 46.
Согласно еще одному аспекту настоящее раскрытие описывает способ связывания IL-17A и IL-23 в субъекте, включающий введение указанному субъекту эффективного количества (i) первого мутеина липокалина, специфичного в отношении IL-17A, и (ii) второго мутеина липокалина, специфичного в отношении IL-23p19.
Согласно еще другому аспекту настоящее раскрытие включает способ ингибирования связывания IL-17A и IL-23 с их соответствующим(-ими) рецептором(-ами) в субъекте, включающий введение указанному субъекту эффективного количества (i) первого мутеина липокалина, специфичного в отношении IL-17A, и (ii) второго мутеина липокалина, специфичного в отношении IL-23p19.
Настоящее раскрытие также включает применение (i) первого мутеина липокалина, специфичного в отношении IL-17A, и (ii) второго мутеина липокалина, специфичного в отношении IL-23p19, для образования комплекса с IL-17A и IL-23p19.
Ввиду этого, согласно другому аспекту настоящего раскрытия раскрытые мутеины можно применять для выявления IL-17A и IL-23p19. Такое применение может включать этапы приведения двух или более указанных мутеинов, при соответствующих условиях, в контакт с образцом, который, как подозревают, содержит IL-17A и IL-23p19, с обеспечением таким образом возможности образования комплекса между мутеинами и IL-17A или между мутеинами и IL-23p19 соответственно и выявления комплекса по соответствующему сигналу.
Выявляемый сигнал может быть обусловлен меткой, как разъяснено выше, или изменением физических свойств в результате связывания, т.е. образования комплекса, как такового. Одним примером является поверхностный плазмонный резонанс, значение которого изменяется в ходе связывания партнеров по связыванию, из которых один иммобилизирован на поверхности, такой как золотая фольга.
Мутеины, раскрытые в данном документе, также можно применять для отделения IL-17A и IL-23p19. Такое применение может включать этапы приведения одного или более указанных мутеинов, при соответствующих условиях, в контакт с образцом, который, как полагают, содержит IL-17A и IL-23p19, с обеспечением таким образом возможности образования комплекса между мутеинами и IL-17A или между мутеинами и IL-23 соответственно и отделения комплекса от образца.
При применении раскрытых мутеинов для выявления IL-17A и IL-23p19, а также отделения IL-17A и IL-23p19, мутеины и/или IL-17A и IL-23p19 или их домен или фрагмент могут быть иммобилизированы на подходящей твердой фазе.
Соответственно, могут быть определены присутствие или отсутствие IL-17A и/или IL-23p19, например, в образце, а также их концентрация или уровень.
Согласно другому аспекту настоящее раскрытие предусматривает набор составляющих. Набор содержитт первую и вторую емкости. Первая емкость включает первый мутеин липокалина, и вторая емкость включает второй мутеин липокалина. Согласно одному аспекту настоящее раскрытие относится к набору, который содержит, в одной или более емкостях, отдельно или в смеси, мутеин липокалина, специфичный в отношении IL-17A. Согласно еще одному аспекту настоящее раскрытие также относится к набору, который содержит, в одной или более емкостях, отдельно или в смеси, мутеин липокалина, специфичный в отношении IL-23p19. Согласно некоторым вариантам осуществления настоящее раскрытие относится к набору, который содержит, в одной или более емкостях, отдельно или в смеси, мутеин липокалина, специфичный в отношении IL-17A, и мутеин липокалина, специфичный в отношении IL-23p19. Согласно некоторым дополнительным предпочтительным вариантам осуществления набор содержит первую емкость, которая включает первый мутеин липокалина, специфичный в отношении IL-17A, и вторую емкость, которая включает второй мутеин липокалина, специфичный в отношении IL-23p19. Согласно некоторым вариантам осуществления набор дополнительно содержит прилагаемую к нему в едином виде или в виде одного или более отдельных документов информацию, касающуюся содержимого или набора и применения мутеинов липокалинов. Набор может содержать согласно некоторым вариантам осуществления одну или более композиций, которые составлены для растворения в разбавителе. Такой разбавитель, например стерильный разбавитель, также может быть включен в набор, например в емкости.
D. Белки слияния с аффинностью связывания в отношении IL-17A и/или IL-23p19 и пути их применения
Согласно одному аспекту настоящее раскрытие относится к белку слияния, содержащему по меньшей мере две субъединицы в любом порядке: одна субъединица обладает специфичностью связывания в отношении IL-17A, а другая субъединица обладает специфичностью связывания в отношении IL-23p19.
Например, настоящее раскрытие предусматривает белок слияния, который имеет фрагменты белков со специфичностью связывания в отношении IL-17A (в том числе IL-17 A/A и IL-17 A/F) и IL-23p19 соответственно. В связи с этим, одна субъединица указанного белка слияния может содержать мутеин липокалина по настоящему раскрытию, специфичный в отношении IL-17A (в том числе IL-17 A/A и IL-17 A/F), тогда как другая субъединица указанного белка слияния может содержать мутеин липокалина по настоящему раскрытию, специфичный в отношении IL-23p19.
Согласно другому аспекту настоящее раскрытие относится к белкам слияния, содержащим по меньшей мере две субъединицы, где каждая обладает специфичностью связывания в отношении IL-17A (в том числе IL-17 A/A и IL-17 A/F). Согласно некоторым вариантам осуществления по меньшей мере одна субъединица содержит мутеин липокалина, специфичный в отношении IL-17A. Согласно некоторым вариантам осуществления белок слияния обладает аффинностью связывания в отношении IL-17A, измеренной при помощи KD, составляющей приблизительно 1 нМ или меньше в анализе, по сути, описанном в примере 2. Согласно некоторым дополнительным вариантам осуществления белок слияния способен ингибировать связывание IL-17A с его рецептором в формате конкурентного ELISA, по сути, описанном в примере 3, или в анализе, по сути, описанном в примере 5.
Согласно некоторым дополнительным вариантам осуществления каждая из двух субъединиц содержит мутеин липокалина, специфичный в отношении IL-17 A/A. Согласно некоторым дополнительным вариантам осуществления каждая из двух субъединиц содержит мутеин липокалина, специфичный в отношении IL-17 A/F. Два мутеина липокалинов могут характеризоваться различными аминокислотными последовательностями. Следовательно, согласно некоторому варианту осуществления два мутеина липокалинов связываются с различными эпитопами IL-17A. Однако, согласно некоторым другим вариантам осуществления два мутеина липокалинов могут быть идентичны друг другу. Например, такой белок слияния может содержать две аминокислотные последовательности с SEQ ID NO: 1. В связи с этим, белок слияния может характеризоваться аминокислотной последовательностью, показанной под SEQ ID NO: 10, SEQ NO: 12 или SEQ ID NO: 13.
Согласно некоторым вариантам осуществления белок слияния по настоящему раскрытию с двумя субъединицами, которые обладают специфичностью связывания с IL-17A (в том числе IL-17 A/A и IL-17 A/F), может проявлять более высокую эффективность, чем одна субъединица, вследствие эффекта авидности двух субъединиц, который обусловлен димерной природой мишени (например, IL-17 A/A). В связи с этим, белок слияния может быть двухвалентным белком слияния. Согласно еще одному аспекту настоящее раскрытие также охватывает белок слияния, содержащий по меньшей мере две субъединицы, которые обладают специфичностью связывания в отношении IL-23p19. Согласно некоторым вариантам осуществления по меньшей мере одна субъединица содержит мутеин липокалина, специфичный в отношении IL-23p19. Согласно некоторым вариантам осуществления белок слияния обладает аффинностью связывания в отношении IL-23p19, измеренной при помощи KD, составляющей приблизительно 10 нМ или меньше в анализе, по сути, описанном в примере 7. Согласно некоторым дополнительным вариантам осуществления белок слияния способен ингибировать связывание IL-23 с его рецептором в формате конкурентного ELISA, по сути, описанном в примере 8 или примере 14, или в анализе, по сути, описанном в примере 10 или примере 15.
Согласно некоторым вариантам осуществления каждая из двух субъединиц содержит мутеин липокалина, специфичный в отношении IL-23p19. Два мутеина липокалинов могут характеризоваться различными аминокислотными последовательностями. Следовательно, согласно некоторым вариантам осуществления два мутеина липокалинов связываются с различными эпитопами IL-23p19. Однако согласно некоторым другим вариантам осуществления два мутеина липокалинов могут быть идентичны друг другу.
Согласно одному дополнительному аспекту в настоящей заявке раскрывается белок слияния, содержащий (i) Fc-часть иммуноглобулина, в том числе полноразмерного антитела человека, такого как антитело IgG, и (ii) мутеин липокалина, специфичный в отношении IL-17A.
Согласно другому аспекту в настоящей заявке раскрывается белок слияния, содержащий (i) Fc-часть иммуноглобулина, в том числе полноразмерного антитела человека, такого как антитело IgG, и (ii) мутеин липокалина, специфичный в отношении IL-23p19.
Иллюстративные мутеины липокалинов, специфичные в отношении IL-17A (в том числе IL-17 A/A и IL-17 A/F), включают такие, раскрытые в разделе A настоящего раскрытия. Согласно особенно предпочтительному варианту осуществления мутеин липокалина показан под SEQ ID NO: 1.
Иллюстративные мутеины липокалинов, специфичные в отношении IL-23p19, включают те, описанные в разделе B настоящего раскрытия. Согласно особенно предпочтительному варианту осуществления мутеин липокалина показан под любым из SEQ ID NO: 2, 45 и 46.
Согласно некоторым конкретным вариантам осуществления мутеин липокалина может быть связан, например, посредством пептидной связи с C-концом и/или N-концом Fc-части антитела человека (см. фигуру 11). Согласно конкретным вариантам осуществления белок слияния по настоящему раскрытию может содержать мутеин липокалина, присоединенный к Fc-части антитела IgG. В связи с этим, один из таких белков слияния содержит аминокислотные последовательности, показанные под SEQ ID NO: 16.
Согласно еще предпочтительному варианту осуществления белок слияния по настоящему раскрытию содержит аминокислоты, показанные под SEQ ID NO: 11, SEQ ID NO: 12 или SEQ ID NO: 13.
Согласно одному родственному варианту осуществления один или более белков слияния по настоящему раскрытию способны ингибировать связывание IL-17A и связывание IL-23 с их соответствующим(-ими) рецептором(-ами). Согласно некоторым дополнительным вариантам осуществления один или более белков слияния по настоящему раскрытию способны занимать IL-17A и IL-23p19 одновременно, и, следовательно, таким образом способны ингибировать связывание IL-17A и связывание IL-23 с их соответствующим(-ими) рецептором(-ами) в одно и то же время.
Согласно этому аспекту настоящее раскрытие относится к белку слияния, содержащему по меньшей мере две субъединицы в любом порядке, в том числе одна субъединица содержит мутеин липокалина, специфичный в отношении IL-17A (в том числе IL-17 A/A и IL-17 A/F), и одна субъединица содержит мутеин липокалина, специфичный в отношении IL-23p19. Согласно некоторым дополнительным вариантам осуществления белок слияния может содержать дополнительную субъединицу, при этом субъединица содержит мутеин липокалина, специфичный в отношении IL-17A (в том числе IL-17 A/A и IL-17 A/F) или IL-23p19. Согласно некоторым вариантам осуществления два специфичных к IL-17A мутеина липокалинов, которые включены в две различные субъединицы белка слияния, могут связываться с различными эпитопами мишени IL-17A; альтернативно, два специфичных к IL-17A мутеина липокалинов, которые включены в две различные субъединицы белка слияния, могут характеризоваться одинаковой аминокислотной последовательностью и, следовательно, обладают специфичностью в отношении одного и того же эпитопа мишени IL-17A. Белок слияния по настоящему раскрытию с двумя субъединицами связывания с IL-17A может проявлять более сильную степень связывания с IL-17A, чем белок слияния только с одной субъединицей связывания с IL-17A, вследствие эффекта авидности, обусловленного димерной природой мишени. Аналогично этому, два специфичных к IL-23p19 мутеина липокалинов, которые включены в две различные субъединицы белка слияния, могут связываться с различными эпитопами мишени IL-23p19; альтернативно, два специфичных к IL-23p19 мутеина липокалинов, которые включены в две различные субъединицы белка слияния, могут характеризоваться одинаковой аминокислотной последовательностью и, следовательно, специфичностью в отношении одного и того же эпитопа мишени IL-23p19. Белок слияния также может включать линкер, который соединяет одну субъединицу с другой субъединицей.
Согласно некоторым вариантам осуществления одна субъединица белка слияния по настоящему раскрытию содержит мутеин липокалина, раскрытый в разделе A настоящего раскрытия. Согласно конкретному предпочтительному варианту осуществления субъединица содержит мутеин липокалина, показанный под SEQ ID NO: 1.
Согласно некоторым вариантам осуществления одна субъединица белка слияния по настоящему раскрытию содержит мутеин липокалина, раскрытый в разделе B настоящего раскрытия. Согласно конкретному предпочтительному варианту осуществления субъединица содержит мутеин липокалина, показанный под любым из SEQ ID NO: 2, 45 и 46.
Согласно некоторым вариантам осуществления белок слияния по настоящему раскрытию содержит мутеин липокалина, раскрытый в разделе A, а также мутеин липокалина, раскрытый в разделе B.
Согласно конкретному варианту осуществления белок слияния по настоящему раскрытию содержит аминокислотную последовательность, показанную под SEQ ID NO: 3.
Согласно конкретному варианту осуществления белок слияния по настоящему раскрытию содержит аминокислотную последовательность, показанную под SEQ ID NO: 4.
Согласно еще предпочтительному варианту осуществления белок слияния по настоящему раскрытию содержит аминокислоты, показанные под SEQ ID NO: 12 или SEQ ID NO: 13.
Согласно другому аспекту в настоящей заявке раскрывается белок слияния, содержащий по меньшей мере две субъединицы, при этом одна субъединица обладает специфичностью связывания в отношении IL-17A или IL-23p19, а другая субъединица содержит альбумин-связывающий домен (ABD) или альбумин-связывающий пептид. Согласно некоторым вариантам осуществления субъединица обладает специфичностью связывания в отношении IL-17A или IL-23p19, содержит мутеин липокалина, специфичный в отношении IL-17A или IL-23p19, по настоящему раскрытию. Кроме того, белок слияния может содержать в любом порядке (i) одну субъединицу, специфичную в отношении IL-17A, (ii) одну субъединицу, специфичную в отношении IL-23p19, и (iii) одну субъединицу, которая содержит бактериальный альбумин-связывающий домен. Согласно некоторым вариантам осуществления субъединица обладает специфичностью связывания в отношении IL-17A, содержит мутеин липокалина, специфичный в отношении IL-17A, по настоящему раскрытию. Согласно некоторым другим вариантам осуществления субъединица обладает специфичностью связывания в отношении IL-23p19, содержит мутеин липокалина, специфичный в отношении IL-23p19, по настоящему раскрытию.
Согласно некоторым вариантам осуществления альбумин-связывающий домен (ABD) может быть белком G стрептококка (König, T., & Skerra, A. (1998) J. Immunol. Methods 218, 73-83) или его фрагментом, например, который показан под SEQ ID NO: 14. Согласно некоторым вариантам осуществления альбумин-связывающий пептид представляет собой связывающий сывороточный альбумин человека пептид, полученный из альбумин-связывающего домена белка G стрептококка, например, который раскрыт в PCT-заявке WO2012/004384, которая включена в данный документ при помощи ссылки в полном объеме. Согласно еще некоторым предпочтительным вариантам осуществления альбумин-связывающий пептид содержит аминокислотную последовательность, показанную под SEQ ID NO: 15.
В частности, настоящее раскрытие предусматривает белок слияния, который способен к связыванию как с сывороточным альбумином человека (HSA), так и с IL-23p19 одновременно, например, содержащий аминокислотную последовательность, показанную под SEQ ID NO: 7.
Настоящее раскрытие предусматривает белок слияния, который способен к связыванию как с HSA, так и с IL-17A одновременно, например, содержащий аминокислотную последовательность, показанную под SEQ ID NO: 8 или SEQ ID NO: 10. Согласно еще некоторому предпочтительному варианту осуществления такой белок слияния может включать два специфичных к IL-17A мутеина липокалинов, например, содержащих аминокислотную последовательность, показанную под SEQ ID NO: 10.
К тому же в настоящей заявке описывается белок слияния, который способен к связыванию со всеми из HSA, IL-17A и IL-23p19 одновременно, например, при измерении белка слияния в анализе, по сути, описанном в примере 12. Согласно некоторым дополнительным вариантам осуществления белок слияния содержит аминокислотную последовательность, показанную под SEQ ID NO: 5, SEQ ID NO: 6 или SEQ ID NO: 9. Согласно еще некоторому предпочтительному варианту осуществления такой белок слияния может включать два специфичных к IL-17A мутеина липокалинов, например, содержащих аминокислотную последовательность, показанную под SEQ ID NO: 6.
Согласно дополнительному аспекту настоящее раскрытие относится к белку слияния, содержащему по меньшей мере две субъединицы в любом порядке: одна субъединица обладает специфичностью связывания в отношении IL-17A или обладает специфичностью связывания в отношении IL-23p19, а другая субъединица обладает специфичностью связывания в отношении TNF, например содержащая ингибирующий TNF белок. Факторы некроза опухоли (или семейство TNF) относятся к группе цитокинов, которые могут вызывать клеточную смерть (апоптоз), таким как TNF-альфа (TNF-α и лимфотоксин-альфа. Иллюстративные ингибиторы TNF включают адалимумаб, инфликсимаб, этанерцепт, цертолизумаб пегол и голимумаб. Согласно некоторым дополнительным вариантам осуществления специфичная к TNF субъединица содержит антитело к TNF-α, как, например, антитело с SEQ ID NO: 61 и 62. Согласно некоторым дополнительным вариантам осуществления субъединица обладает специфичностью связывания в отношении IL-17A или обладает специфичностью связывания в отношении IL-23p19, содержит мутеин липокалина по настоящему раскрытию, как, например, липокалин с SEQ ID NO: 1 или липокалин с SEQ ID NO: 2. Согласно еще некоторым дополнительным вариантам осуществления белки слияния содержат аминокислотные последовательности с SEQ ID NO: 63 и 62 или аминокислотные последовательности с SEQ ID NO: 64 и 62.
Согласно некоторым вариантам осуществления белок слияния способен к связыванию 17A и согласно некоторым предпочтительным вариантам осуществления может характеризоваться средним значением EC50, по меньшей мере практически таким же или превосходящим среднее значение EC50 мутеина липокалина, который включен в белок слияния, например, при измерении белка слияния и мутеина липокалина в анализе, по сути, описанном в примере 16. Согласно некоторым вариантам осуществления, белок слияния способен к связыванию IL-23 и согласно некоторым предпочтительным вариантам осуществления может характеризоваться средним значением EC50, по меньшей мере практически таким же или превосходящим среднее значение EC50 мутеина липокалина, который включен в белок слияния, например, при измерении белка слияния и мутеина липокалина в анализе, по сути, описанном в примере 17. Согласно некоторым вариантам осуществления белок слияния способен к связыванию TNF-α и согласно некоторым предпочтительным вариантам осуществления может характеризоваться средним значением EC50, по меньшей мере практически таким же или превосходящим среднее значение EC50 антитела, которое включено в белок слияния, при измерении антитела и белка слияния в анализе, по сути, описанном в примере 18. Согласно некоторым дополнительным вариантам осуществления белок слияния может быть способен к связыванию со всеми из TNF-α, IL-17A и IL-23p19 одновременно, например, при измерении белка слияния в анализе, по сути, описанном в примере 19.
Согласно некоторым вариантам осуществления белок слияния по настоящему раскрытию обладает аффинностью связывания в отношении IL-17A (в том числе IL-17 A/A и IL-17 A/F), измеренной при помощи KD, составляющей приблизительно 1 нМ или меньше. Более предпочтительно, указанный белок слияния может обладать аффинностью, измеренной при помощи KD, составляющей 0,1 нМ или меньше. Согласно некоторым дополнительным вариантам осуществления связывающий IL-17A фрагмент (или связывающие IL-17A фрагменты) белка слияния по настоящему раскрытию могут обладать аффинностью связывания или способностью к ингибированию в отношении IL-17A (в том числе IL-17 A/A и IL-17 A/F), практически такой же и для такого фрагмента в качестве независимо-действующего полипептида (см. таблицу 1).
Согласно некоторым вариантам осуществления белок слияния по настоящему раскрытию обладает аффинностью связывания в отношении IL-23p19, измеренной при помощи KD, составляющей приблизительно 10 нМ или меньше. Более предпочтительно, указанный белок слияния может обладать аффинностью, измеренной при помощи KD, составляющей приблизительно 1 нМ или меньше. Согласно некоторым дополнительным вариантам осуществления связывающий IL-23p19 фрагмент (или связывающие IL-23p19 фрагменты) белка слияния по настоящему раскрытию могут обладать аффинностью связывания или способностью к ингибированию в отношении IL-23p19, такой же хорошей, как и для такого фрагмента в качестве независимо-действующего полипептида (см. таблицу 1, ниже).
В таблице 1 представлено общее описание активности отдельных мутеинов липокалинов SEQ ID NO: 1 и SEQ ID NO: 2 по сравнению с их белками слияния SEQ ID NO: 3-13 в анализах конкурентного ELISA, с поверхностным плазмонным резонансом (SPR) и функциональных клеточных анализах. Значения определяли в отношении взаимодействия с IL-17 и/или IL-23 в зависимости от того содержит ли соответствующий конструкт связывающий IL-17A мутеин липокалина SEQ ID NO: 1, связывающий IL-23 мутеин липокалина SEQ ID NO: 2 или оба. Для определения активности по отношению к IL-17 и IL-23 соответственно эксперименты с конкурентным ELISA выполняли, как описано в примере 3 и/или примере 8, эксперименты с SPR в обратном формате - т.е. с белковыми конструктами, иммобилизованными на сенсорном чипе - выполняли как описано в примере 2 и/или примере 6 и клеточные анализы были основаны либо на индуцированной IL-17A секреции G-CSF (пример 5) и/либо на индуцированной IL-23 пролиферации клеток Ba/F3 (пример 10). Следует отметить, что эксперимент с SPR в обратном формате, осуществленный для определения аффинности к IL-23, выполняли в присутствии нефизиологически высоких концентраций NaCl и что значения, вследствие этого, не отражают аффинность к IL-23 в физиологических условиях, но служат для определения является ли относительная аффинность к IL-23 отличной среди содержащих SEQ ID NO: 2 белков слияния с SEQ ID NO: 3-13 по сравнению с отдельным мутеином SEQ ID NO: 2. В таблице 1 показано, что связывающая IL-17A активность всех продуктов слияния, содержащих SEQ ID NO: 1, является по меньшей мере такой же хорошей как таковая SEQ ID NO: 1 самого по себе во всех форматах анализов. Таким образом, SEQ ID NO: 1 можно легко использовать в любом белке слияния без потери активности. Связывающая IL-23 активность всех продуктов слияния, содержащих SEQ ID NO: 2, очень близка к таковой SEQ ID NO: 2 самого по себе во всех форматах анализов. Таким образом, SEQ ID NO: 2 можно легко использовать в любом белке слияния без существенной потери активности.
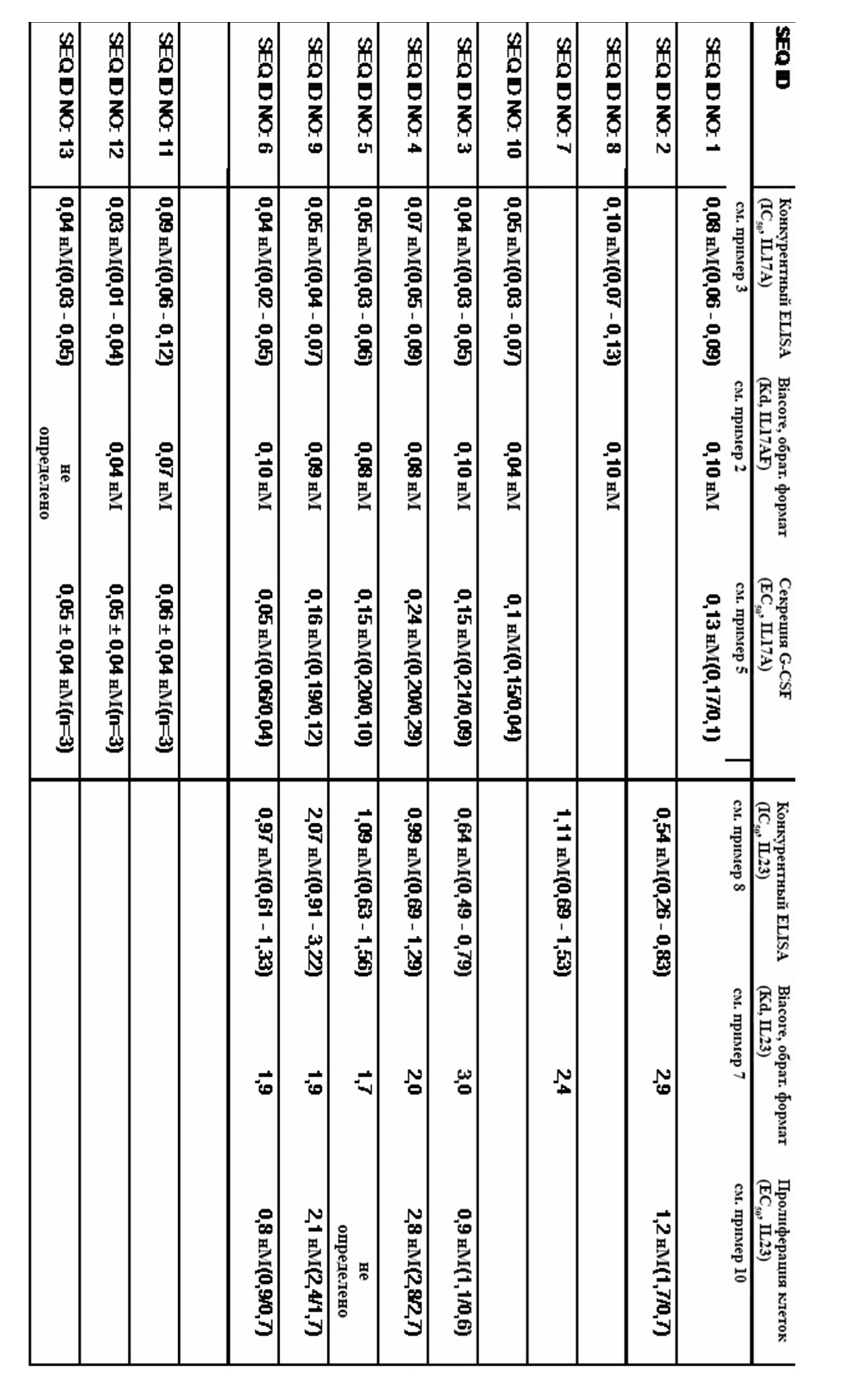
Согласно одному родственному варианту осуществления один или более белков слияния по настоящему раскрытию способны ингибировать связывание IL-17A с его рецептором.
Согласно одному родственному варианту осуществления белок слияния по настоящему раскрытию способен ингибировать связывание IL-23 с его рецептором.
Согласно некоторым вариантам осуществления белок слияния по настоящему раскрытию также может включать линкер (например, пептидную связь), который ковалентно соединяет мутеин липокалина по настоящему раскрытию и другой мутеин липокалина по настоящему раскрытию друг с другом. Этого можно достичь, например, путем экспрессии соединенных мутеинов липокалинов в виде единого полипептида, соединенного пептидным линкером. Подходящий пептидный линкер может быть образован отрезком из аминокислот произвольной длины, включающим любые аминокислоты, например которые описаны в данном документе. В конструкции предпочтительного линкера используют повторяющийся отрезок аминокислот из остатков глицина и серина следующей формулы (GxSy)n, где x является количеством повторов остатков глицина, и y является количеством повторов остатков серина в структурном элементе, который повторяется n раз. Значения каждой переменной x, y и n могут варьировать от 0 до 100, предпочтительно от 0 до 10. Неограничивающие примеры в настоящем документе представлены SEQ ID NO: 18-20.
Согласно некоторым другим вариантам осуществления химические способы ковалентного соединения можно применять для соединения мутеина липокалина по настоящему раскрытию с другим мутеином липокалина по настоящему раскрытию. Одним примером является применение бифункциональных линкеров, которые делают возможной реактивную химию между линкером и боковой цепью аминокислоты, например между малеимидом и свободным цистеином в мутеине липокалина или активированным сложным эфиром карбоновой кислоты и первичным амином в мутеине липокалина. Это включает реакцию с не природной боковой цепью аминокислоты, которая может включаться в ходе экспрессии белка и которая обеспечивает функциональные возможности, которые могут быть выборочно получены. Согласно еще некоторым дополнительным вариантам осуществления «клик»-химию, как, например, циклоприсоединение азида и алкина, можно использовать для соединения одной или более субъединиц белка слияния по настоящему раскрытию.
Согласно некоторым дополнительным предпочтительным вариантам осуществления белок слияния по настоящему раскрытию дополнительно содержит аминокислотную последовательность, показанную под любым из SEQ ID NO: 18-20.
Согласно некоторым дополнительным вариантам осуществления одна субъединица, содержащая мутеин липокалина по настоящему раскрытию, может быть непосредственно или посредством химического линкера присоединена к другой субъединице, содержащей мутеин липокалина по настоящему раскрытию, в белке слияния, который раскрыт в данном документе.
Согласно некоторым дополнительным вариантам осуществления мутеин липокалина по настоящему раскрытию может быть слит либо с N-, либо C-концом, либо с обоими N- и C-концами другого мутеина липокалина.
Согласно некоторым вариантам осуществления каждая из субъединиц, которые образуют белок слияния по настоящему раскрытию, остается термостойкой (например, может выдержать температуру плавления при Tm, составляющей по меньшей мере 40°C). Согласно некоторым вариантам осуществления каждая из указанных трех субъединиц, образующих белок слияния по настоящему раскрытию, является с высокой степенью кооперативности разворачивания в отношении одной или более других субъединиц (например, предотвращает частичное разворачивание и таким образом в значительной степени снижает их скорость разрушения). Такое предотвращение частичного разворачивания называют «кооперативным», поскольку разворачивание представляет собой процесс по типу «все или ни одного». Согласно некоторым дополнительным вариантам осуществления один или более мутеинов липокалинов, которые включены в белок слияния, могут выдержать температуру плавления при Tm, составляющей по меньшей мере 50°C, по меньшей мере 55°C, по меньшей мере 60°C или даже больше. Согласно еще некоторым дополнительным вариантам осуществления один или более компонентов HSA, которые включены в белок слияния, могут выдержать температуру плавления при Tm, составляющей по меньшей мере 30°C, по меньшей мере 35°C, по меньшей мере 40°C или даже больше.
Согласно некоторым вариантам осуществления один или более белков слияния по настоящему раскрытию содержат мультимеры, например тетрамеры, тримеры или димеры, мутеинов липокалинов по настоящему раскрытию, при этом по меньшей мере один мутеин липокалина слит по меньшей мере с одной стороной (например, с N-концом) другого мутеина липокалина. Согласно дополнительным вариантам осуществления мультимерные белки слияния могут быть предпочтительными по отношению к соответствующему мономерному белку слияния. Например, димерный белок слияния по настоящему раскрытию, связывающийся с IL-17A, может проявлять более сильную степень связывания с IL-17A вследствие эффекта авидности, обусловленного димерной природой мишени.
Согласно некоторому дополнительному варианту осуществления один или более белков слияния по настоящему раскрытию приводят в результате к образованию «дуокалинов», которые описаны в Schlehuber, S., and Skerra, A. (2001), Duocalins, engineered ligand-binding proteins with dual specificity derived from the lipocalin fold. Biol. Chem. 382, 1335-1342, раскрытие которой включено в данный документ при помощи ссылки в полном объеме.
Согласно еще одному аспекту настоящее раскрытие охватывает применение одного или более белков слияния по настоящему раскрытию или одной или более композиций, содержащих такие белки, для связывания IL-17A и/или IL-23p19 в субъекте и/или ингибирования связывания IL-17 и/или IL-23 с их соответствующим(-ими) рецептором(-ами) в субъекте.
Согласно еще другому аспекту настоящее раскрытие описывает способ связывания IL-17A и/или IL-23p19 в субъекте, включающий введение указанному субъекту эффективного количества одного или более белков слияния по настоящему раскрытию или одной или более композиций, содержащих такие белки.
Согласно еще одному аспекту настоящее раскрытие включает способ ингибирования связывания IL-17 и/или IL-23 с их соответствующим(-ими) рецептором(-ами) в субъекте, включающий введение указанному субъекту эффективного количества одного или более белков слияния по настоящему раскрытию или одной или более композиций, содержащих такие белки.
Белки слияния по настоящему раскрытию также могут включать сигнальную последовательность. Сигнальные последовательности на N-конце полипептида направляют этот полипептид к специфичному компартменту клетки, например периплазме E. coli или эндоплазматической сети эукариотических клеток. В уровне техники известно большое количество сигнальных последовательностей. Иллюстративная сигнальная последовательность для секреции полипептида в периплазму E. coli представляет собой сигнальную последовательность OmpA.
Настоящее раскрытие также включает применение одного или более белков слияния по настоящему раскрытию для образования комплекса с IL-17A и/или IL-23p19.
Ввиду этого, согласно другому аспекту настоящего раскрытия один или более белков слияния по настоящему раскрытию можно применять для выявления IL-17A и/или IL-23p19. Такое применение может включать этапы приведения одного или более белков слияния по настоящему раскрытию, при соответствующих условиях, в контакт с образцом, который, как подозревают, содержит IL-17A и/или IL-23p19, с обеспечением таким образом возможности образования комплекса между белками и IL-17A и/или между белками и IL-23p19 соответственно и выявления комплекса по соответствующему сигналу.
Выявляемый сигнал может быть обусловлен меткой, как разъяснено выше, или изменением физических свойств в результате связывания, т.е. образования комплекса, как такового. Одним примером является поверхностный плазмонный резонанс, значение которого изменяется в ходе связывания партнеров по связыванию, из которых один иммобилизирован на поверхности, такой как золотая фольга.
Один или более белков слияния, раскрытых в данном документе, также можно применять для отделения IL-17A и/или IL-23p19 от образца, который содержит другие вещества. Такое применение может включать этапы приведения одного или более указанных белков слияния, при соответствующих условиях, в контакт с образцом, который, как полагают, содержит IL-17A и/или IL-23p19, с обеспечением таким образом возможности образования комплекса между белками и IL-17A и/или между белками и IL-23 соответственно и отделения комплекса от образца.
При применении раскрытых белков слияния для выявления IL-17A и/или IL-23p19, а также отделения IL-17A и/или IL-23p19, белок слияния, IL-17A, IL-23p19 и/или их домен или фрагмент могут быть иммобилизированы на подходящей твердой фазе.
Соответственно, могут быть определены присутствие или отсутствие молекул, таких как IL-17A и/или IL-23p19, например, в образце, а также их концентрация или уровень.
Согласно другому аспекту настоящее раскрытие предусматривает набор, содержащий по меньшей мере один белок слияния по настоящему раскрытию и одну или более инструкций для применения набора.
Согласно некоторым вариантам осуществления набор дополнительно содержит прилагаемую к нему в едином виде или в виде одного или более отдельных документов информацию, касающуюся содержимого или набора и применения белков слияния. Согласно некоторым вариантам осуществления набор может содержать один или более белков слияния по настоящему раскрытию, которые составлены для растворения в разбавителе. Такой разбавитель, например стерильный разбавитель, также может быть включен в набор, например в емкости.
Согласно некоторым вариантам осуществления один или более белков слияния по настоящему раскрытию можно применять в лечении некоторого количества состояний, при которых желательно подавление иммунной реакции, как, например, ревматоидном артрите, псориатическом артрите, анкилозирующем спондилоартрите, болезни Крона, язвенном колите, бляшечном псориазе и ювенильном идиопатическом артрите.
E. Мутеины липокалинов и белки слияния по настоящему раскрытию
Липокалины являются белковоподобными связывающими молекулами, которые естественным образом развивались для связывания лигандов. Липокалины встречаются во многих организмах, в том числе позвоночных животных, насекомых, растений и бактерий. Представители семейства белков липокалинов (Pervaiz, S., & Brew, K. (1987) FASEB J. 1, 209-214), как правило, являются малыми секретируемыми белками и имеют одиночную полипептидную цепь. Они характеризуются целым рядом различных свойств молекулярного распознавания: их способностью связывать разные, в основном, гидрофобные молекулы (такие как ретиноиды, жирные кислоты, холестерины, простагландины, биливердины, феромоны, вкусовые добавки и отдушки), их связыванием со специфичными рецепторами клеточной поверхности и их образованием макромолекулярных комплексов. Хотя, в прошлом их классифицировали первоначально как транспортные белки, теперь ясно, что липокалины выполняют множество физиологических функций. Которые включают определенные роли в транспорте ретинола, обонянии, передаче сигнала с помощью феромонов и синтезе простагландинов. Липокалины также вовлечены в регуляцию иммунной реакции и опосредование гомеостаза клеток (рассмотрено, например, в Flower, D.R. (1996) Biochem. J. 318, 1-14 и Flower, D.R. et al. (2000) Biochim. Biophys. Acta 1482, 9-24).
Липокалины характеризуются необычайно низкими уровнями общей консервативности последовательностей, часто с идентичностями последовательностей менее 20%. В то же время, их общий паттерн фолдинга высококонсервативен. Центральная часть структуры липокалина образована отдельным встречно-параллельным β-листом с восемью нитями, замкнутым самом на себе, с образованием β-бочонка с непрерывной сеткой водородных связей. Такой β-бочонок образует центральную полость. Один конец бочонка стерически заблокирован N-концевым пептидным сегментом, который пересекает его дно, а также тремя пептидными петлями, соединяющими β-нити. Другой конец β-бочонка открыт для растворителя и содержит сайт связывания мишени, который образован четырьмя пластичными пептидными петлями. Именно это разнообразие петель в остальной части жесткого остова липокаина приводит к образованию разнообразия различных видов связывания, при этом каждый способен приспосабливаться к мишеням различного размера, формы и с различными химическими особенностями (рассмотрены, например, в Flower, D.R. (1996), ранее; Flower, D.R. et al. (2000), ранее, или Skerra, A. (2000) Biochim. Biophys. Acta 1482, 337-350).
Мутеин липокалина согласно настоящему раскрытию может быть мутеином любого выбранного липокалина. Примеры подходящих липокалинов (также иногда называемых «белковыми эталонными остовами» или просто «остовами»), мутеины которых можно использовать, включают без ограничения липокалин слезы (липокалин-1, белок железы фон Эбнера), ретинол-связывающий белок, нейтрофил, простагландин D-синтазу липокалинового типа, β-лактоглобулин, билин-связывающий белок (BBP), аполипопротеин D (APO D), липокалин, ассоциированный с желатиназой нейтрофилов (NGAL), липокалин слезы (Tlc), родственный α2-микроглобулину белок (A2m), 24p3/утерокалин (24p3), белок 1 железы фон Эбнера (VEGP 1), белок 2 железы фон Эбнера (VEGP 2) и предшественник главного аллергена Can f1 (ALL-1). Согласно родственным вариантам осуществления мутеин липокалина выбран из группы, включающей человеческий липокалин, ассоциированный с желатиназой нейтрофилов (NGAL), липокалин слезы (Tlc) человека, аполипопротеин D (APO D) человека и билин-связывающий белок Pieris brassicae.
При использовании в данном документе в контексте мутеинов липокалинов по настоящему раскрытию, которые связываются с IL-17A или IL-23p19, термин «специфичный в отношении» включает то, что мутеин липокалина направлен против, связывается с или вступает в реакцию с IL-17A или IL-23p19 соответственно. Таким образом, состояние «направленный на», «связывающийся с» или «вступающий в реакцию с» включает то, что мутеин липокалина специфически связывается с IL-17A или IL-23p19 соответственно. Термин «специфически» в данном случае означает, что мутеин липокалина вступает в реакцию с белком IL-17A или белком IL-23p19, который описан в данном документе, но, по преимуществу, не с другим белком. Термин «другой белок» включает любой отличный от IL-17A или отличный от IL-23p19 белок соответственно, в том числе белки близко-родственные или являющиеся гомологичными IL-17A или IL-23p19, против которых липокалины, раскрытые в данном документе, направлены. Однако, белки, фрагменты и/или варианты IL-17A или IL-23p19 из видов, отличных от человека, как, например, тех, которые описаны в контексте определения «субъект», не исключены при помощи термина «другой белок». Термин «по сути, не связывает» означает, что мутеин липокалина по настоящему раскрытию не связывает другой белок, т.е. демонстрирует перекрестную реактивность менее 30%, предпочтительно 20%, более предпочтительно 10%, в частности, предпочтительно менее 9, 8, 7, 6 или 5%. Вступает ли липокаин в реакцию специфически, как определено в данном документе выше, можно легко протестировать, в частности, путем сравнения реагирования мутеина липокалина по настоящему раскрытию с IL-17A или IL-23p19 и реагирования указанного липокалина с другим(-ими) белком(-ами). «Специфическое связывание» также можно определять, например, в соответствии с вестерн-блоттингами, анализами ELISA, RIA, ECL, IRMA, FACS, IHC и пептидными сканированиями.
Аминокислотная последовательность мутеина липокалина согласно настоящему раскрытию характеризуется высокой идентичностью последовательности с соответствующим липокалином по сравнению с идентичностями последовательностей в случае другого липокалина (также см. выше). В таком общем смысле аминокислотная последовательность мутеина липокалина комбинации согласно настоящему раскрытию по меньшей мере в значительной степени подобна аминокислотной последовательности соответствующего липокалина (липокалина дикого типа или эталонного липокалина). Соответствующая последовательность мутеина липокалина комбинации согласно настоящему раскрытию, будучи в значительной степени подобной последовательностям соответствующего липокалина, имеет в некоторой части относительно липокалина дикого типа (или эталонного липокалина) один или более аминокислотных вариантов по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 82%, по меньшей мере 85%, по меньшей мере 87%, по меньшей мере 90% идентичности, в том числе по меньшей мере 95% идентичности, с последовательностью соответствующего липокалина. В связи с этим, мутеин липокалина по настоящему раскрытию, разумеется, может содержать, в сравнении, замены, которые описаны в данном документе, которые делают мутеин липокалина способным к связыванию с IL-17A или IL-23p19 соответственно. Как правило, мутеин липокалина включает одну или более мутаций - по отношению к природной последовательности липокалина - аминокислот в четырех петлях на открытом конце сайта связывания лиганда липокалина (см. выше). Как разъяснено выше, эти участки являются важными в определении специфичности связывания мутеина липокалина в отношении необходимой мишени. В качестве иллюстративного примера, мутеин, полученный из полипептида липокалина слезы, липокалина NGAL или их гомологов, может иметь один, два, три, четыре или более подвергнутых мутации аминокислотных остатков в любом положении последовательности в N-концевом участке и/или в трех пептидных петлях BC, DE и FG, расположенных на конце структуры в виде β-бочонка, которая расположена напротив естественного кармана связывания липокалина. В качестве дополнительного иллюстративного примера, мутеин, полученный из полипептида липокалина слезы или его гомолога, может не иметь подвергнутых мутации аминокислотных остатков в пептидной петле DE, расположенной на конце структуры в виде β-бочонка, по сравнению с последовательностью дикого типа липокалина слезы.
Мутеин липокалина согласно настоящему раскрытию включает одну или более, как, например, две, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать, тринадцать, четырнадцать, пятнадцать, шестнадцать, семнадцать, восемнадцать, девятнадцать или даже двадцать, замен по сравнению с соответствующим природным липокалином при условии, что такой мутеин липокалина, должен быть способен к связыванию с IL-17A или IL-23p19 соответственно. Например, мутеин липокалина может иметь замену в положении, соответствующем отличному положению (т.е. в соответствующем положении) липокалина дикого типа с последовательностью дикого типа, например, липокалина слезы, липокалина NGAL или любого другого липокалина, описанного в данном документе. Согласно некоторым вариантам осуществления мутеин липокалина комбинации согласно настоящему раскрытию включает по меньшей мере две аминокислотные замены, в том числе 2, 3, 4 или 5, иногда даже больше аминокислотных замен природной аминокислоты остатком аргинина. Соответственно, нуклеиновую кислоту белкового ‘эталонного’ остова, который описан в данном документе, подвергают мутагенезу с целью создания мутеина липокалина, который способен к связыванию с IL-17A или IL-23p19 соответственно.
Также, мутеин липокалина по настоящему раскрытию может содержать гетерологичную аминокислотную последовательность на своем N- или C-конце, предпочтительно C-конце, как, например, Strep-метку, например Strep-метку II, без воздействия на биологическую активность (связывание со своей мишенью, например IL-17A или IL-23p19 соответственно) мутеина липокалина. Предпочтительный пример метки показан под SEQ ID NO: 17.
Аналогично этому, у мутеина липокалина по настоящему раскрытию может отсутствовать 1, 2, 3, 4 или более аминокислот на его N-конце и/или 1, 2 или более аминокислот на его C-конце по сравнению с соответствующим липокалином дикого типа; например SEQ ID NO: 2-7 и 12-14.
В частности, для того, чтобы определить соответствует ли аминокислотный остаток аминокислотной последовательности мутеина липокалина, отличного от липокалина дикого типа, определенному положению в аминокислотной последовательности липокалина дикого типа, специалист в данной области может применять средства и способы, хорошо известные из уровня техники, например выравнивания, либо вручную, либо с использованием компьютерных программ, таких как BLAST2.0, которая означает средство поиска основного локального выравнивания, или ClustalW, или любая другая подходящая программа, которая подходит для получения выравниваний последовательностей. Соответственно, липокалин дикого типа может служить в качестве «последовательности для сравнения» или «эталонной последовательности», тогда как аминокислотная последовательность липокалина, отличного от липокалина дикого типа, описанного в данном документе, служит в качестве «искомой последовательности». Термины «эталонная последовательность» и «последовательность дикого типа» используют в данном документе взаимозаменяемо.
Согласно некоторым вариантам осуществления замена (или замещение) представляет собой консервативную замену. Тем не менее, любая замена, в том числе неконсервативная замена или одна или более из перечисленных ниже иллюстративных замен, предусматривается, если только мутеин липокалина сохраняет свою способность связываться с IL-17A или IL-23p19 соответственно, и/или он характеризуется идентичностью с затем замещенной последовательностью в том смысле, что имеет место по меньшей мере 60%, как, например, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85% или более высокая идентичность с «исходной» последовательностью.
Консервативные замены, как правило, представляют собой следующие замены, перечисленные в зависимости от аминокислоты, подвергаемой мутации, за каждой следует одно или более замещений, которые могут быть взяты как консервативные: Ala → Gly, Ser, Val; Arg → Lys; Asn → Gln, His; Asp → Glu; Cys → Ser; Gln → Asn; Glu → Asp; Gly → Ala; His → Arg, Asn, Gln; Ile → Leu, Val; Leu → Ile, Val; Lys → Arg, Gln, Glu; Met → Leu, Tyr, Ile; Phe → Met, Leu, Tyr; Ser → Thr; Thr → Ser; Trp → Tyr; Tyr → Trp, Phe; Val → Ile, Leu. Другие замены также возможны и могут быть определены эмпирически или в соответствии с другими известными консервативными или неконсервативные заменами. В качестве дополнительной ориентировки, каждая из следующих восьми групп включает аминокислоты, которые, как правило, могут быть взяты для определения консервативных замен в отношении друг друга:
аланин (Ala), глицин (Gly);
аспарагиновая кислота (Asp), глутаминовая кислота (Glu);
аспарагин (Asn), глутамин (Gln);
аргинин (Arg), лизин (Lys);
изолейцин (Ile), лейцин (Leu), метионин (Met), валин (Val);
фенилаланин (Phe), тирозин (Tyr), триптофан (Trp);
серин (Ser), треонин (Thr) и
цистеин (Cys), метионин (Met).
Если такие замены приводят в результате к изменению биологической активности, тогда может быть введено больше существенных изменений, таких как следующие, или которые дополнительно описаны ниже относительно классов аминокислот и продукты отбирали в отношении необходимой характерной особенности. Примерами таких более существенных изменений являются Ala → Leu, Ile; Arg → Gln; Asn → Asp, Lys, Arg, His; Asp → Asn; Cys → Ala; Gln → Glu; Glu → Gln; His → Lys; Ile → Met, Ala, Phe; Leu → Ala, Met, норлейцин; Lys → Asn; Met → Phe; Phe → Val, Ile, Ala; Trp → Phe; Tyr → Thr, Ser; Val → Met, Phe, Ala.
Существенные модификации биологических свойств липокалина выполняют путем выбора замен, которые существенно отличаются по их действию на поддержание (a) структуры полипептидного скелета в области замены, например в виде листа или спиральной конформации, (b) заряда или гидрофобности молекулы в целевом сайте или (c) большей части боковой цепи. Встречающиеся в природе остатки разделены на группы на основе общих свойств боковых цепей: (1) гидрофобные: норлейцин, метионин, аланин, валин, лейцин, изо-лейцин; (2) нейтральные гидрофильные: цистеин, серин, треонин; (3) кислые: аспарагиновая кислота, глутаминовая кислота; (4) основные: аспарагин, глутамин, гистидин, лизин, аргинин; (5) остатки, которые влияют на ориентацию цепей: глицин, пролин и (6) ароматические: триптофан, тирозин, фенилаланин.
Неконсервативные замены будут включать в себя обмен представителя одного из этих классов на другой класс. Любой остаток цистеина, не вовлеченный в поддержание правильной конформации соответствующего липокалина, также может быть заменен, как правило, серином, для улучшения стойкости к окислению молекулы и предотвращения неправильного образования поперечных связей. В свою очередь, цистеиновая(-ые) связь(-и) может(могут) быть добавлена(-ы) к липокалину для улучшения его стабильности.
Любая мутация, в том числе вставка, которая рассматривалась выше, может быть выполнена очень просто на уровне нуклеиновой кислоты, например ДНК, с использованием установленных общепринятых способов. Иллюстративные примеры перестроек аминокислотной последовательности представляют собой вставки или делеции, а также аминокислотные замены. Такие замены могут быть консервативными, т.е. аминокислотный остаток замещается аминокислотным остатком с химически подобными свойствами, в частности, в отношении полярности, а также размера. Примеры консервативных замен представляют собой замещения из числа представителей следующих групп: 1) аланин, серин и треонин; 2) аспарагиновая кислота и глутаминовая кислота; 3) аспарагин и глутамин; 4) аргинин и лизин; 5) изо-лейцин, лейцин, метионин и валин и 6) фенилаланин, тирозин и триптофан. С другой стороны, также возможно вводить неконсервативные перестройки в аминокислотную последовательность. К тому же вместо замещения отдельных аминокислотных остатков также возможно либо вставлять, либо удалять одну или более последовательных аминокислот первичной структуры липокалина слезы, если только эти делеции или вставка приводят в результате к стабильно свернутому/функциональному мутеину.
Модификации аминокислотной последовательности включают направленный мутагенез отдельных аминокислотных положений для упрощения субклонирования подвергнутого мутации гена липокалина или его частей путем введения сайтов расщепления для определенных рестрикционных ферментов. К тому же такие мутации также можно вводить для дополнительного улучшения аффинности мутеина липокалина или белка слияния в отношении данной мишени. Кроме того, мутации можно вводить для модулирования определенных характеристик мутеина или белка слияния, как, например, для улучшения стабильности фолдинга, стабильности в сыворотке крови, устойчивости белка или растворимости в воде или для снижения склонности к агрегированию, при необходимости. Например, встречающиеся в природе остатки цистеина можно мутировать в другие аминокислоты для предупреждения образования дисульфидного мостика. Также возможно преднамеренно мутировать другие аминокислотные положения последовательности в цистеин для введения новых реакционно-способных групп, например для конъюгации с другими соединениями, такими как полиэтиленгликоль (ПЭГ), гидроксиэтилкрахмал (ГЭК), биотин, пептиды или белки, или для образования не встречающихся в природе дисульфидных связей. Полученный тиоловый фрагмент можно использовать для ПЭГилирования или ГЭКилирования мутеина или белка слияния, например, для увеличения времени полужизни соответствующего мутеина липокалина или белка слияния в сыворотке крови.
Согласно некоторым вариантам осуществления если один из приведенных выше фрагментов конъюгируется с мутеином липокалина или белком слияния по настоящему раскрытию, то конъюгация с боковой цепью аминокислоты может быть преимущественной. Подходящие боковые цепи аминокислот могут встречаться в природе в аминокислотной последовательности липокалина человека, или их можно вводить при помощи мутагенеза. В случае, если подходящий сайт связывания вводят посредством мутагенеза, то одна возможность представляет собой замещение аминокислоты в соответствующем положении остатком цистеина.
Например, такая мутация включает по меньшей мере одну из замен Thr 40 → Cys, Glu 73 → Cys, Arg 90 → Cys, Asp 95 → Cys или Glu 131 → Cys в последовательности дикого типа липокалина слезы человека. Новосозданный остаток цистеина в любом из этих положений в дальнейшем можно использовать для конъюгации мутеина или белка слияния с фрагментом, продлевающим время полужизни мутеина или его белка слияния в сыворотке крови, таким как ПЭГ или его активированное производное.
В отношении мутеина липокалина 2 человека иллюстративными возможностями такой мутации являются введение остатка цистеина в аминокислотную последовательность липокалина, в том числе мутеина липокалина 2 человека, включение введения остатка цистеина (Cys) по меньшей мере в одно из положений последовательности, которое соответствует положениям 14, 21, 60, 84, 88, 116, 141, 145, 143, 146 или 158 последовательности в последовательности дикого типа NGAL человека. Согласно некоторым вариантам осуществления, в которых мутеин липокалина 2 человека по настоящему раскрытию характеризуется последовательностью, в которой по сравнению с последовательностью с номером доступа базы данных SWISS-PROT/UniProt P80188 цистеин был замещен другим аминокислотным остатком, соответствующий цистеин может быть повторно введен в последовательность. В качестве иллюстративного примера, остаток цистеина в аминокислотном положении 87 может быть введен в таком случае путем возвращения цистеина, который первоначально присутствует в последовательности под номером доступа SWISS-PROT P80188. Полученный тиоловый фрагмент сбоку любого из аминокислотных положений 14, 21, 60, 84, 88, 116, 141, 145, 143, 146 и/или 158 можно использовать для ПЭГилирования или ГЭКилирования мутеина, например, для увеличения времени полужизни соответствующего мутеина липокалина 2 человека или его белка слияния.
Согласно другому варианту осуществления путем мутагенеза можно вводить искусственные аминокислоты для обеспечения подходящих боковых цепей аминокислот для конъюгирования одного из приведенных выше фрагментов с мутеином липокалина или белком слияния согласно настоящему раскрытию. Как правило, такие искусственные аминокислоты конструируют так, чтобы они были более реакционно-способными и, таким образом, облегчали конъюгацию с необходимым соединением. Одним примером такой искусственной аминокислоты, которую можно вводить посредством искусственной тРНК, является пара-ацетил-фенилаланин.
Для нескольких применений мутеинов или белков слияния, раскрытых в данном документе, может быть преимущественным применение их в форме конъюгатов, например таких, которые слиты с фрагментом, который представляет собой белок, или белковый домен, или пептид. Согласно некоторым вариантам осуществления мутеин липокалина или его белок слияния слиты на N-конце или C-конце мутеина липокалина (в том числе того, который входит в состав белка слияния по настоящему раскрытию) с белком, белковым доменом или пептидом, к примеру, сигнальной последовательностью и/или аффинной меткой.
Аффинные метки, как, например, Strep-метка® или Strep-метка® II (Schmidt, T.G.M. et al. (1996) J. Mol. Biol. 255, 753-766), myc-метка, FLAG-метка, His6-метка или HA-метка, или белки, как, например, глутатион-S-трансфераза, также обеспечивающие легкое выявление и/или очистку рекомбинантных белков, являются дополнительными примерами пригодных партнеров по слиянию. В конечном счете белки с хромогенными или флуоресцентными свойствами, как, например, зеленый флуоресцентный белок (GFP) или желтый флуоресцентный белок (YFP), также являются пригодными партнерами по слиянию для мутеинов липокалинов по настоящему раскрытию.
В целом, возможно метить мутеины липокалинов или белки слияния по настоящему раскрытию соединением, в том числе любым соответствующим химическим веществом или ферментом, которое непосредственно или опосредованно образует выявляемое соединение или сигнал при химической, физической, оптической или ферментативной реакции. Примером физической реакции и в то же время оптической реакции/маркера является испускание флуоресценции при облучении или испускание X-лучей при использовании радиоактивной метки. Щелочная фосфатаза, пероксидаза хрена и β-галактозидаза являются примерами ферментных меток (и в то же время оптических меток), которые катализируют образование продуктов хромогенной реакции. В целом, все метки, широко используемые для антител (за исключением тех, которые используют только с сахарными фрагментами в Fc-части иммуноглобулинов), также можно использовать для конъюгации с мутеинами липокалинов или белков слияния по настоящему раскрытию. Мутеины липокалинов или белки слияния по настоящему раскрытию также можно конъюгировать с любым пригодным терапевтически активным средством, например, для целенаправленной доставки таких средств к данной клетке, ткани или органу или для селективного целенаправленного воздействия на клетки, например клетки опухоли, без воздействия на близлежащие нормальные клетки. Примеры таких терапевтически активных средств включают радионуклиды, токсины, малые органические молекулы и терапевтические пептиды (как, например, пептиды, действующие в качестве агонистов/антагонистов рецептора клеточной поверхности, или пептиды, конкурирующие за сайт связывания белка на данной мишени, представляющей собой клетку). Однако, мутеины липокалинов или белки слияния по настоящему раскрытию также можно конъюгировать с терапевтически активными нуклеиновыми кислотами, как, например, молекулами антисмысловых нуклеиновых кислот, малыми интерферирующими РНК, микро-РНК или рибозимами. Такие конъюгаты можно получать способами, хорошо известными из уровня техники.
Как указано выше, мутеин липокалина или белок слияния по настоящему раскрытию, согласно некоторым вариантам осуществления, можно конъюгировать с фрагментом, который продлевает время полужизни мутеина или белка слияния в сыворотке крови (в связи с этим также см. PCT-заявку WO 2006/56464, в которой такие стратегии конъюгации описаны касательно мутеинов человеческого липокалина, ассоциированного с желатиназой нейтрофилов, с аффинностью связывания в отношении CTLA-4). Фрагментом, который продлевает время полужизни в сыворотке крови, может быть молекула полиалкиленгликоля, гидроксиэтилкрахмал, молекулы жирных кислот, как, например, пальмитиновой кислоты (Vajo & Duckworth 2000, Pharmacol. Rev. 52, 1-9), Fc-часть иммуноглобулина, домен CH3 иммуноглобулина, домен CH4 иммуноглобулина, альбумин-связывающий домен, альбумин-связывающий пептид или альбумин-связывающий белок, трансферрин, не говоря уже о других. Альбумин-связывающий белок может быть бактериальным альбумин-связывающим белком, антителом, фрагментом антитела, в том числе доменными антителами (см. патент США 6696245, например), или мутеином липокалина с активностью связывания в отношении альбумина. Соответственно, пригодный партнер по конъюгации для продления времени полужизни мутеина липокалина или белка слияния по настоящему раскрытию включает бактериальный альбумин-связывающий домен, как, например, таковой белка G стрептококка (König, T., & Skerra, A. (1998) J. Immunol. Methods 218, 73-83) или таковой, который показан под SEQ ID NO: 39. К тому же примерами альбумин-связывающих пептидов, которые можно использовать в качестве партнера по конъюгации, к примеру, являются таковые с консенсусной последовательностью Cys-Xaa1-Xaa2-Xaa3-Xaa4-Cys, где Xaa1 представляет собой Asp, Asn, Ser, Thr или Trp; Xaa2 представляет собой Asn, Gln, His, Ile, Leu или Lys; Xaa3 представляет собой Ala, Asp, Phe, Trp или Tyr; и Xaa4 представляет собой Asp, Gly, Leu, Phe, Ser или Thr, которая описана в заявке на выдачу патента США 2003/0069395 или в Dennis et al. (Dennis, M. S., Zhang, M., Meng, Y. G., Kadkhodayan, M., Kirchhofer, D., Combs, D. & Damico, L. A. (2002) J Biol Chem 277, 35035-35043).
Согласно другим вариантам осуществления альбумин сам по себе (Osborn, B.L. et al., 2002, J. Pharmacol. Exp. Ther. 303, 540-548) или биологический активный фрагмент альбумина можно использовать в качестве партнера по конъюгации мутеина липокалина или белка слияния по настоящему раскрытию. Термин «альбумин» включает альбумины всех млекопитающих, как, например, сывороточный альбумин человека, или бычий сывороточный альбумин, или альбумин крысы.
Если альбумин-связывающий белок представляет собой фрагмент антитела, то он может быть доменным антителом. Доменные антитела (dAbs) сконструированы для обеспечения точного контроля над биофизическими свойствами и временем полужизни in vivo с обеспечением оптимальной безопасности и эффективности профиля продукта. Доменные антитела, например, коммерчески доступны от Domantis Ltd. (Кембридж, Великобритания и Массачусетс, США).
При использовании трансферрина в качестве фрагмента для продления времени полужизни мутеинов липокалинов или белков слияния по настоящему раскрытию в сыворотке крови, мутеины или белки слияния могут быть генетически слиты с N- или C-концом, или обоими, негликозилированного трансферрина. Негликозилированный трансферрин характеризуется временем полужизни, составляющим 14-17 суток, и конъюгированный с трансферрином мутеин или белок слияния будет точно так же характеризоваться продленным временем полужизни. Носитель, представляющий собой трансферрин, также обеспечивает высокие биодоступность, биораспределение и стабильность при нахождении в кровотоке. Такая технология коммерчески доступна от BioRexis (BioRexis Pharmaceutical Corporation, Пенсильвания, США). Рекомбинантный трансферрин человека (DeltaFerrin™) для использования в качестве стабилизатора/партнера для продления времени полужизни белка также коммерчески доступен от Novozymes Delta Ltd. (Ноттингем, Великобритания).
Если Fc-часть иммуноглобулина используют для целей пролонгирования времени полужизни мутеинов липокалинов или белков слияния по настоящему раскрытию в сыворотке крови, то можно использовать технологию SynFusion™, коммерчески доступную от Syntonix Pharmaceuticals, Inc (Массачусетс, США). Применение такой технологии слияния с Fc предоставляет возможность создания длительно действующих биофармацевтических средств и, например, может быть образована двумя копиями мутеина, соединенного с Fc-участком антитела, для улучшения фармакокинетики, растворимости и эффективности продукта.
Еще одной альтернативой для пролонгирования времени полужизни мутеинов липокалинов или белков слияния по настоящему раскрытию является слияние с N- или C-концом мутеинов (в том числе тех, которые входят в состав белков слияния по настоящему раскрытию) длинных неструктурированных пластичных богатых глицином последовательностей (например, полиглицина с приблизительно 20-80 последовательными остатками глицина). Такой подход, раскрытый в WO2007/038619, например, также был назван «rPEG» (рекомбинантный ПЭГ).
Если используют полиалкиленгликоль в качестве партнера по конъюгации, то полиалкиленгликоль может быть замещенным, незамещенным, линейным или разветвленным. Он также может быть активированным производным полиалкилена. Примерами пригодных соединений являются молекулы полиэтиленгликоля (ПЭГ), которые описаны в WO 99/64016, в патенте США 6177074 или в патенте США 6403564 касательно интерферона или которые описаны в отношении других белков, как, например, модифицированная ПЭГ аспарагиназа, ПЭГ-аденозиндеаминаза (PEG-ADA) или ПЭГ-супероксиддисмутаза (см., например, Fuertges et al. (1990) The Clinical Efficacy of Poly(Ethylene Glycol)-Modified Proteins J. Control. Release 11, 139-148). Молекулярный вес такого полимера, как, например, полиэтиленгликоля, может варьировать от приблизительно 300 до приблизительно 70000 дальтон, в том числе, например, полиэтиленгликоль с молекулярным весом, составляющим приблизительно 10000, приблизительно 20000, приблизительно 30000 или приблизительно 40000 дальтон. Более того, например, как описано в патентах США 6500930 или 6620413, углеводные олиго- и полимеры, как, например, крахмал или гидроксиэтилкрахмал (ГЭК), могут быть конъюгированы с мутеином или белком слияния по настоящему раскрытию для целей продления времени полужизни в сыворотке крови.
К тому же мутеин липокалина или белок слияния, раскрытые в данном документе, можно конъюгировать с фрагментом, который может придавать новые характеристики мутеинам липокалинов или белкам слияния по настоящему раскрытию, как, например, ферментативную активность или аффинность связывания в отношении других молекул. Примеры пригодных фрагментов включают щелочную фосфатазу, пероксидазу хрена, глутатион-S-трансферазу, альбумин-связывающий домен белка G, белок A, фрагменты антител, домены олигомеризации или токсины.
К тому же может быть возможным слияние мутеина липокалина или белка слияния, раскрытого в данном документе, с активным сайтом отдельного фермента, как, например, оба «компонента» полученного в результате белка слияния действуют совместно на данную терапевтическую мишень. Например, связывающий домен мутеина липокалина (в том числе того, который входит в состав белка слияния по настоящему раскрытию) может прикрепляться к обуславливающей заболевание мишени, предоставляя возможность домену фермента разрушать биологическую функцию мишени.
Согласно некоторым вариантам осуществления мутеин липокалина или белок слияния по настоящему раскрытию можно конъюгировать с фрагментом посредством линкера (например, пептидной связи), который ковалентно соединяет мутеин липокалина по настоящему раскрытию и другой раскрытый фрагмент друг с другом. Этого можно достичь, например, путем экспрессии соединенных мутеинов липокалинов в виде единого полипептида, соединенного пептидным линкером. Подходящий пептидный линкер может быть образован отрезком из аминокислот произвольной длины, включающим любые аминокислоты. В конструкции предпочтительного линкера используют повторяющийся отрезок аминокислот из остатков глицина и серина следующей формулы (GxSy)n, где x является количеством повторов остатков глицина, и y является количеством повторов остатков серина в структурном элементе, который повторяется n раз. Значения каждой переменной x, y и n могут варьировать от 0 до 100, предпочтительно от 0 до 10. Неограничивающие примеры в настоящем документе представлены SEQ ID NO: 18 и SEQ ID NO: 36-38.
Согласно некоторым другим вариантам осуществления химические способы ковалентного соединения можно применять для соединения мутеина липокалина по настоящему раскрытию с другим раскрытым фрагментом. Одним примером является применение бифункциональных линкеров, которые делают возможной реактивную химию между линкером и боковой цепью аминокислоты, например между малеимидом и свободным цистеином в мутеине липокалина или активированным сложным эфиром карбоновой кислоты и первичным амином в мутеине липокалина. Это включает реакцию с не природной боковой цепью аминокислоты, которая может включаться в ходе экспрессии белка и которая обеспечивает функциональные возможности, которые могут быть выборочно получены. Согласно еще некоторым дополнительным вариантам осуществления «клик»-химию, как, например, циклоприсоединение азида и алкина, можно использовать для соединения одной или более субъединиц белка слияния по настоящему раскрытию.
Настоящее раскрытие также относится к молекулам нуклеиновых кислот (ДНК и РНК), которые включают нуклеотидные последовательности, кодирующие мутеины липокалинов и белки слияния по настоящему раскрытию. Поскольку вырожденность генетического кода допускает замены определенных кодонов на другие кодоны, определяющие ту же аминокислоту, настоящее раскрытие не ограничено конкретной молекулой нуклеиновой кислоты, кодирующей мутеин липокалина или белок слияния, который описан в данном документе, а охватывает все молекулы нуклеиновых кислот, которые включают нуклеотидные последовательности, кодирующие функциональный мутеин или функциональный белок слияния. В связи с этим, настоящее раскрытие предусматривает нуклеотидные последовательности, кодирующие некоторые иллюстративные мутеины липокалинов, некоторые иллюстративные типовые белки слияния, которые показаны под SEQ ID NO: 23-35, 45-49 и 54.
Согласно одному варианту осуществления настоящего раскрытия способ включает подвергание молекулы нуклеиновой кислоты мутагенезу в нуклеотидных триплетах, кодирующих по меньшей мере одно, иногда даже больше, положение последовательности, соответствующее положениям 28, 36, 40-41, 49, 52, 68, 70, 72-73, 75, 77, 79, 81, 87, 96, 100, 103, 106, 125, 127, 132 и 134 линейной полипептидной последовательности NGAL человека (SEQ ID NO: 8).
Согласно другому варианту осуществления способа согласно настоящему раскрытию молекулу нуклеиновой кислоты, кодирующую липокалин слезы человека, сперва подвергают мутагенезу в одном или более из положений 26-34, 55-58, 60-61, 64, 104-108 аминокислотной последовательности в линейной полипептидной последовательности липокалина слезы человека (SEQ ID NO: 1). После этого молекулу нуклеиновой кислоты, кодирующую липокалин слезы человека, также подвергают мутагенезу в одном или более из положений 101, 111, 114 и 153 аминокислотной последовательности в линейной полипептидной последовательности зрелого липокалина слезы человека.
Настоящее раскрытие также включает молекулы нуклеиновых кислот, кодирующие мутеины липокалинов и белки слияния по настоящему раскрытию, которые включают дополнительные мутации вне указанных положений последовательности экспериментального мутагенеза. Такие мутации часто допустимы или могут даже оказаться преимущественными, например, если они способствуют улучшенной эффективности сворачивания, стабильности в сыворотке крови, термостойкости или аффинности связывания с лигандом мутеинов и белков слияния.
Молекула нуклеиновой кислоты, раскрытая в данной заявке, может быть «функционально соединена» с регуляторной последовательностью (или регуляторными последовательностями) для обеспечения экспрессии этой молекулы нуклеиновой кислоты.
Молекулу нуклеиновой кислоты, как, например, ДНК, называют «способной к экспрессии молекулой нуклеиновой кислоты» или способной «обеспечивать экспрессию нуклеотидной последовательности», если она включает элементы последовательности, которые содержат информацию относительно транскрипционной и/или трансляционной регуляции, и такие последовательности «функционально соединены» с нуклеотидной последовательностью, кодирующей полипептид. Функциональная связь представляет собой связь, при которой элементы регуляторной последовательности и последовательность, подлежащая экспрессии, соединены таким образом, который обеспечивает экспрессию гена. Определенные особенности регуляторных участков, необходимых для экспрессии гена, могут варьировать между видами, но в общем эти участки включают промотор, который в прокариотах содержит как промотор per se, т.е. элементы ДНК, управляющие инициацией транскрипции, так и элементы ДНК, которые при транскрибировании в РНК будут подавать сигнал об инициации трансляции. Такие промоторные участки стандартно включают 5'-некодирующие последовательности, вовлеченные в инициацию транскрипции и трансляции, как, например, боксы -35/-10 и элемент Шайн-Дальгарно у прокариот или TATA-бокс, последовательности CAAT и 5'-кэппирующие элементы у эукариот. Такие участки также могут включать энхансерные или репрессорные элементы, а также сигнальные последовательности трансляции и лидерные последовательности для нацеливания природного полипептида на конкретный компартмент клетки-хозяина.
К тому же 3'-некодирующие последовательности могут содержать регуляторные элементы, вовлеченные в терминацию транскрипции, полиаденилирование или т.п. Однако, если такие последовательности терминации не удовлетворительны с точки зрения функциональности для конкретной клетки-хозяина, тогда их можно заменить сигналами, функциональными в такой клетке.
Ввиду этого, молекула нуклеиновой кислоты по настоящему раскрытию может включать регуляторные последовательности, как, например, промоторную последовательность. Согласно некоторым вариантам осуществления молекула нуклеиновой кислоты по настоящему раскрытию включает промоторную последовательность и последовательность терминации транскрипции. Подходящими промоторами прокариот являются, например, промотор tet, промотор lacUV5 или промотор T7. Примерами промоторов, пригодных для экспрессии в клетках эукариот, являются промотор SV40 или промотор CMV.
Молекулы нуклеиновых кислот по настоящему раскрытию также могут быть частью вектора или любого другого типа средства для клонирования, как, например, плазмиды, фагмиды, фага, бакуловируса, космиды или искусственной хромосомы.
Согласно одному варианту осуществления молекула нуклеиновой кислоты включена в фазмиду. Фазмидный вектор обозначает вектор, кодирующий межгенный участок умеренного фага, как, например, M13 или f1, или его функциональную часть, слитую с кДНК, представляющую интерес. После суперинфекции бактериальных клеток-хозяев таким фагмидным вектором и соответствующим хелперным фагом (например, M13K07, VCS-M13 или R408) продуцируются интактные фаговые частицы, таким образом, обеспечивая физическое сопряжение закодированной гетерологичной кДНК с ее соответствующим полипептидом, выведенным на поверхность фага (см., например, Lowman, H.B. (1997) Annu. Rev. Biophys. Biomol. Struct. 26, 401-424 или Rodi, D.J., and Makowski, L. (1999) Curr. Opin. Biotechnol. 10, 87-93).
Такие средства для клонирования могут включать, помимо регуляторных последовательностей, описанных выше, и последовательности нуклеиновой кислоты, кодирующей мутеин липокалина или белок слияния, который описан в данном документе, последовательности для репликации и контрольные последовательности, полученные из видов, совместимых с клеткой-хозяином, которую используют для экспрессии, а также маркеры отбора, придающие селектируемый фенотип трансформированным или трансфицированным клеткам. Из уровня техники известны большие количества пригодных векторов клонирования, и они коммерчески доступны.
Молекулой ДНК, кодирующей мутеин липокалина или белок слияния, который описан в данном документе, и, в частности, вектором клонирования, содержащим кодирующую последовательность такого мутеина, можно трансформировать клетку-хозяина, способную экспрессировать ген. Трансформацию можно осуществлять при помощи стандартных методик. Таким образом, настоящее раскрытие также направлено на клетку-хозяина, содержащую молекулу нуклеиновой кислоты, которая раскрыта в данном документе.
Трансформированные клетки-хозяева культивируют в условиях, пригодных для экспрессии нуклеотидной последовательности, кодирующей мутеин липокалина или белок слияния по настоящему раскрытию. Подходящие клетки-хозяева могут быть прокариотическими, как, например, Escherichia coli (E. coli) или Bacillus subtilis, или эукариотическими, как, например, Saccharomyces cerevisiae, Pichia pastoris, клетками насекомых SF9 или High5, иммортализованными клеточными линиями млекопитающих (например, клетками HeLa или клетками CHO) или первичными клетками млекопитающих.
Настоящее раскрытие также относится к способу получения полипептида, который описан в данном документе, где мутеин липокалина или белок слияния получают, исходя из нуклеиновой кислоты, кодирующей мутеин липокалина или белок слияния, при помощи способов генной инженерии. Способ можно выполнять in vivo, при этом мутеин липокалина или белок слияния, например, можно получать в организме-хозяине бактериального или эукариотического происхождения и затем выделять из этого организма-хозяина или его культуры. Также возможно получать белок in vitro, например путем использования системы трансляции in vitro.
При получении мутеина липокалина, белок слияния или in vivo фрагмент, нуклеиновую кислоту, кодирующую такой мутеин, вводят в подходящий организм-хозяина бактериального или эукариотического происхождения при помощи технологии рекомбинантной ДНК (как уже обозначалось выше). С этой целью клетку-хозяина сперва трансформируют вектором для клонирования, который включает молекулу нуклеиновой кислоты, кодирующую мутеин липокалина или белок слияния, который описан в данном документе, с применением установленных общепринятых способов. Клетку-хозяина затем культивируют в условиях, которые обеспечивают экспрессию гетерологичной ДНК и, таким образом, синтез соответствующего полипептида. Впоследствии, полипептид выделяют либо из клетки, либо из среды для культивирования.
Согласно некоторым вариантам осуществления молекула нуклеиновой кислоты, такая как ДНК, раскрытая в данной заявке, может быть «функционально соединена» с другой молекулой нуклеиновой кислоты по настоящему раскрытию для обеспечения экспрессии белка слияния по настоящему раскрытию. В связи с этим, функциональная связь представляет собой связь, при которой элементы последовательности первой молекулы нуклеиновой кислоты и элементы последовательности второй молекулы нуклеиновой кислоты соединены таким образом, который обеспечивает экспрессию белка слияния в виде единого полипептида.
К тому же согласно некоторым вариантам осуществления встречающаяся в природе дисульфидная связь между Cys 76 и Cys 175 может быть удалена в мутеинах NGAL по настоящему раскрытию (в том числе в тех, которые входят в состав белков слияния по настоящему раскрытию). Согласно некоторым вариантам осуществления для мутеинов Tlc по настоящему раскрытию (также в том числе тех, которые входят в состав белков слияния по настоящему раскрытию) встречающаяся в природе дисульфидная связь между Cys 61 и Cys 153 может быть удалена. Соответственно, такие мутеины или белки слияния можно получать в компартменте клетки со средой с восстанавливающим окислительно-восстановительным потенциалом, например, в цитоплазме грамотрицательных бактерий.
В случае, если мутеин липокалина или белок слияния по настоящему раскрытию включает внутримолекулярные дисульфидные связи, может быть предпочтительным направлять образующийся полипептид в компартмент клетки со средой с окисляющим окислительно-восстановительным потенциалом при помощи соответствующей сигнальной последовательности. Такая окисляющая среда может обеспечиваться периплазмой грамотрицательных бактерий, как, например, E. coli, во внеклеточной среде грамотрицательных бактерий или в просвете эндоплазматической сети эукариотических клеток и, как правило, она способствует образованию дисульфидных связей в структуре.
Однако, также возможно получение мутеина липокалина или белка слияния по настоящему раскрытию в цитозоле клетки-хозяина, предпочтительно E. coli. В данном случае, полипептид может быть либо непосредственно получен в растворимом и свернутом состоянии, либо выделен в форме телец включения с последующей ренатурацией in vitro. Дополнительной возможностью является применение конкретных штаммов-хозяев с окисляющей внутриклеточной средой, которая может, таким образом, обеспечивать образование дисульфидных связей в цитозоле (Venturi et al. (2002) J. Mol. Biol. 315, 1-8).
Однако, мутеин липокалина или белок слияния, который описан в данном документе, не обязательно можно создавать или получать только путем применения генной инженерии. Предпочтительнее, такой мутеин липокалина или белок слияния также можно получать путем химического синтеза, такого как твердофазный синтез полипептидов Меррифилда, или путем транскрипции и трансляции in vitro. Например, возможно, что представляющие интерес мутации определяют с помощью молекулярного моделирования и затем синтезируют необходимый (предусмотренный) полипептид in vitro и изучают активность связывания в отношении IL-17A. Способы твердофазного синтеза и/или синтеза в жидкой фазе белков хорошо известны из уровня техники (см., например, Bruckdorfer, T. et al. (2004) Curr. Pharm. Biotechnol. 5, 29-43).
Согласно другому варианту осуществления мутеины липокалинов или белки слияния по настоящему раскрытию можно получать путем транскрипции/трансляции in vitro, применяя общепринятые способы, известные специалистам в данной области.
Специалисту в данной области будут понятны способы, пригодные для получения мутеинов липокалинов, предполагаемые настоящим раскрытием, но чьи последовательности белков или нуклеиновых кислот явным образом не раскрыты в настоящем документе. В качестве обзора, такие модификации аминокислотной последовательности включают, например, направленный мутагенез отдельных аминокислотных положений для упрощения субклонирования подвергнутого мутации гена липокалина или его частей путем введения сайтов расщепления для определенных рестрикционных ферментов. К тому же такие мутации также можно вводить для дополнительного улучшения аффинности мутеина липокалина или белка слияния в отношении его мишени (например, IL-17A или IL-23p19 соответственно). Кроме того, мутации можно вводить для модулирования определенных характеристик мутеина или белка слияния, как, например, для улучшения стабильности фолдинга, стабильности в сыворотке крови, устойчивости белка или растворимости в воде или для снижения склонности к агрегированию, при необходимости. Например, встречающиеся в природе остатки цистеина можно мутировать в другие аминокислоты для предупреждения образования дисульфидного мостика.
Мутеины липокалинов и белки слияния, раскрытые в данном документе, а также их производные можно применять во многих областях, как и в случае их антител или фрагментов. Например, мутеины липокалинов и/или белки слияния, а также их соответствующие производные можно использовать для мечения ферментом, антителом, радиоактивным веществом или любой другой группой с биохимической активностью или определенными характеристиками связывания. При помощи такого подхода их соответствующие мишени можно выявлять или приводить в контакт с ними. К тому же, мутеины липокалинов и/или белки слияния по настоящему раскрытию могут служить для выявления химических структур при помощи установленных аналитических способов (например, ELISA или вестерн-блоттинга) или при помощи микроскопического исследования или иммуносенсорных анализов. В связи с этим, сигнал для выявления может быть получен либо непосредственно путем применения подходящего мутеина или подходящего белка слияния, либо опосредованно путем иммунохимического выявления связанного мутеина посредством антитела.
Другие белковые остовы, которые могут быть сконструированы в соответствии с настоящим изобретением для получения мутеинов белков, которые связывают IL-17 и/или IL-23 с выявляемой аффинностью, включают EGF-подобный домен, домен «двойная петля», домен фибронектинового типа I, домен фибронектинового типа II, домен фибронектинового типа III, домен PAN, домен G1a, домен SRCR, домен ингибитора семейства Kunitz/трипсина поджелудочной железы быка, тендамистат, домен ингибитора серин-протеазы по типу ингибиторов семейства Kazal, домен Trefoil (P-типа), домен фактора фон Виллебранда типа C, анафилатоксин-подобный домен, домен CUB, повтор I типа тиреоглобулина, домен LDL-рецептора класса A, домен Sushi, домен Link, домен I типа тромбоспондина, домен иммуноглобулина или подобный иммуноглобулиновому домен (например, доменные антитела или верблюжьи антитела только с тяжелой цепью), домен лектина C типа, домен MAM, домен фактора фон Виллебранда типа A, домен соматомедина B, коровый домен WAP-типа с четырьмя дисульфидными связями, домен F5/8 типа C, домен гемопексина, домен SH2, домен SH3, EGF-подобный домен ламининового типа, домен C2, «каппатела» (Ill. et al. «Design and construction of a hybrid immunoglobulin domain with properties of both heavy and light chain variable regions» Protein Eng 10:949-57 (1997)), «минитела» (Martin et al. «The affinity-selection of a minibody polypeptide inhibitor of human interleukin-6» EMBO J 13:5303-9 (1994)), «диатела» (Holliger et al. ««Diabodies»: small bivalent and bispecific antibody fragments» PNAS USA 90:6444-6448 (1993)), «Janusins» (Traunecker et al. «Bispecific single chain molecules (Janusins) target cytotoxic lymphocytes on HIV infected cells» EMBO J 10:3655-3659 (1991) и Traunecker et al. «Janusin: new molecular design for bispecific reagents» Int J Cancer Suppl 7:51-52 (1992), нанотело, аднектин, тетранектин, микротело, аффилин, аффитело, анкирин, кристаллин, ноттин, убиквитин, белки с «цинковыми пальцами», ауто-флуорисцентный белок, анкирин или белок с анкириновым повтором или белок с богатыми лейцином повторами, авимер (Silverman, Lu Q, Bakker A, To W, Duguay A, Alba BM, Smith R, Rivas A, Li P, Le H, Whitehorn E, Moore KW, Swimmer C, Perlroth V, Vogt M, Kolkman J, Stemmer WP 2005, Nat Biotech, Dec;23(12):1556-61, электронная публикация в Nat. Biotech., выпуск 20 ноября 2005 года); а также поливалентные белки-авимеры, образованные путем перестановки экзонов семейства доменов рецепторов человека, которые также описаны в Silverman J, Lu Q, Bakker A, To W, Duguay A, Alba BM, Smith R, Rivas A, Li P, Le H, Whitehorn E, Moore KW, Swimmer C, Perlroth V, Vogt M, Kolkman J, Stemmer WP, Nat Biotech, Dec;23(12):1556-61, электронная публикация в Nat. Biotechnology, выпуск 20 ноября 2005 года).
Дополнительные объекты, преимущества и особенности настоящего раскрытия станут очевидными специалисту в данной области при изучении следующих примеров и прилагаемых их фигур, которые не предназначены быть ограничивающими. Таким образом, следует понимать, что несмотря на то, что настоящее раскрытие в особенности раскрыто при помощи иллюстративных вариантов осуществления и необязательных особенностей, к модификации и вариации раскрываемой информации, воплощенной в них, раскрытой в данном документе, может прибегать специалист в данной области, и что такие модификации и вариации рассматриваются как часть объема настоящего раскрытия.
V. ПРИМЕРЫ
Пример 1. Аффинность мутеина липокалина к IL-17A, измеренная при помощи SPR.
Для измерения аффинности связывания мутеина липокалина с SEQ ID NO: 1 к IL-17A использовали анализ на основе поверхностного плазмонного резонанса (SPR) с использованием аппарата Biacore T200 (GE Healthcare). В анализе на аффинность с SPR (фигура 1) IL-17A иммобилизировали на сенсорном чипе с использование общепринятой химии аминов. Поверхность чипа активировали с помощью 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимида (NHS). Далее, 5 мкг/мл раствора IL-17A в 10 мМ ацетата, pH 5, наносили при скорости потока 10 мкл/мин. до тех пор, пока не достигали уровня иммобилизации, составляющего 279 резонансных единиц (RU). Остаточные активированные группы блокировали этаноламином. Эталонные каналы подвергали холостой иммобилизации путем обработки при помощи EDC/NHS с последующим этаноламином.
Для определения аффинности получали четыре разведения SEQ ID NO: 1 в буфере HBS-EP+ и их наносили на полученную поверхность чипа. Анализ связывания выполняли со временем контакта, составляющим 300 с, временем диссоциации, составляющим 1200 с, и применением скорости потока, составляющей 30 мкл/мин. Все измерения осуществляли при 25°C. Восстановление поверхности с иммобилизированным IL-17A выполняли при помощи последовательных введений 10 мМ водного раствора H3PO4 (30 с) и 10 мМ смеси глицин-HCl, pH 1,5 (15 с), с последующими дополнительной промывкой подвижным буфером и периодом стабилизации, составляющим 30 с. Перед измерениями белка осуществляли три цикла запуска для целей приведения к требуемым условиям. Данные оценивали при помощи программного обеспечения для оценивания при помощи Biacore T200 (V 1.0). Применяли двойное сравнение с образцом. Для приведения в соответствие первичных данных использовали модель связывания 1:1.
Полученные в результате подогнанные кривые показаны на фигуре 1. Из данных видно, что SEQ ID NO: 1 связывался с высокой степенью аффинности с IL-17A с константой скорости ассоциации, составляющей ka=7,0×104 M-1с-1, и константой скорости диссоциации, составляющей kd=5,3×10-5 с-1, что давало в результате константу диссоциации, составляющую KD=0,8 нМ.
Пример 2. Аффинность мутеина липокалина к IL-17 A/F, измеренная при помощи SPR в альтернативном формате.
Для измерения аффинности связывания мутеина липокалина с SEQ ID NO: 1 к IL-17AF в анализе на основе поверхностного плазмонного резонанса (SPR) в альтернативном формате анализа - фиксация SEQ ID NO: 1 в качестве лиганда и нанесение IL-17 A/F человека в качестве аналита - использовали аппарат Biacore T200 (GE Healthcare). В этом формате IL-17 A/F человека использовали (в отличие от гомодимерного IL-17A, который использовали в примере 1) для избежания возможных эффектов авидности в анализе. SEQ ID NO: 1 биотинилировали в течение 2 ч. при комнатной температуре, нанося необходимый избыток NHS-PEG4-биотина EZ-Link (EZ-Link NHS-PEG4-Biotin) (Thermo, номер по каталогу 21329) с последующим отделением непрореагировавшего биотина с использованием планшета для обессоливания Zeba с вращением (Zeba Spin Desalting Plate) (Thermo, номер по каталогу 21329) согласно инструкциям производителя.
В анализе на аффинность с SPR биотинилированный SEQ ID NO: 1 фиксировали на сенсорном чипе CAP при помощи набора для захвата биотина (Biotin CAPture Kit) (GE Healthcare). Сенсорный чип CAP предварительно иммобилизированный с использованием олигонуклеотида ssDNA. Неразведенный реагент набора для захвата биотина (Biotin CAPture Reagent) (стрептавидин, конъюгированный с комплементарным олигонуклеотидом ss-DNA) наносили при скорости потока 2 мкл/мин. в течение 300 с. Далее, 0,4-10 мкг/мл биотинилированного SEQ ID NO: 1 наносили в течение 300 с при скорости потока 5 мкл/мин. В эталонный канал загружали только реагент набора для захвата биотина.
Для определения аффинности связывания получали пять титров IL-17 A/F человека (0,2-20 нМ) в буфере HBS-EP+ и их наносили на полученную поверхность чипа. С нанесением со скоростью потока, составляющей 30 мкл/мин. использовали подход одноцикловой кинетики со временем контакта образца, составляющим 300 с, и временем диссоциации, составляющим 2400 с. После иммобилизации лиганда все 5 концентраций наносили последовательно в порядке возрастания перед отслеживанием диссоциации. Все измерения осуществляли при 25°C. Восстановление поверхности сенсорного чипа CAP выполняли при помощи введения 6 M смеси Gua-HCl с 0,25 M NaOH с последующими дополнительной промывкой подвижным буфером и периодом стабилизации, составляющим 120 с. Данные оценивали при помощи программного обеспечения для оценивания при помощи Biacore T200 (V 1.0). Применяли двойное сравнение с образцом. Для приведения в соответствие первичных данных использовали одноцикловую кинетическую модель связывания 1:1.
Полученные в результате подогнанные кривые показаны на фигуре 2. Из данных видно, что SEQ ID NO: 1 связывался с высокой степенью аффинности с IL-17 A/F человека с константой скорости ассоциации, составляющей ka=1,2×106 M-1с-1, и константой скорости диссоциации, составляющей kd=1,2×10-4 с-1, что давало в результате рассчитанную равновесную константу диссоциации, составляющую KD=100 пМ. При сравнении с примером 1 видно, что результат анализа с SPR до некоторой степени зависит от формата анализа. Однако, в обоих форматах аффинность SEQ ID NO: 1 соответственно к IL-17A человека и IL-17 A/F человека выше и находится в субнаномолярном диапазоне. Анализ важен для обеспечения возможности сравнения SEQ ID NO: 1 и продуктов слияния, содержащими этот мутеин (см. ниже пример 11).
Пример 3. Конкурентный механизм действия мутеина липокалина, связывающегося с IL-17A.
Связывается ли SEQ ID NO: 1 с IL-17A в конкурентном режиме исследовали in vitro с использованием формата конкурентного ELISA (фигура 3). В этом эксперименте неизменную концентрацию биотинилированного IL-17A человека инкубировали с разными концентрациями SEQ ID NO: 1 в течение 1 ч. После этой предварительной инкубации в растворе аликвоту смеси мутеин липокалина/ IL-17A переносили на планшеты для ELISA, покрытые IL-17RA человека для измерения концентрации hIL-17A, который не был блокирован для связывания с hIL-17RA (фигура 3).
Все этапы инкубации осуществляли со встряхиванием при 300 об./мин. и планшет промывали после каждого этапа инкубации 80 мкл буфера PBS-T (PBS, 0,05% Tween 20) пять раз при помощи устройства для избирательной промывки микропланшетов с глубокими лунками Biotek EL405 (Biotek EL405 select CW washer). На первом этапе 384-луночный планшет MSD непосредственно покрывали 20 мкл растворимого IL-17RA человека в концентрации, составляющей 1 мкг/мл в PBS, на ночь при 4°C. После промывки покрытые рецептором лунки блокировали при помощи 60 мкл PBS-T/BSA (2% BSA в PBS, содержащем 0,1% Tween 20) в течение 1 ч. при комнатной температуре.
Установленную концентрацию, составляющую 0,01 нМ, IL-17A человека инкубировали в растворе с различными концентрациями SEQ ID NO: 1 или с SEQ ID NO: 41 в качестве отрицательного контроля, используя подходящую начальную концентрацию SEQ ID NO: 1 и SEQ ID NO: 41, которую серийно разводили при отношении 1:4 до пикомолярного диапазона в буфере PBS-T/BSA. После 1 ч. инкубации при комнатной температуре 20 мкл реакционной смеси переносили на покрытый hIL-17RA планшет MSD для захвата несвязанного (свободного) или неконкурентно связанного hIL-17A на 20 мин. при RT. Для обеспечения возможности преобразования результатов считываний данных ELISA в концентрации абсолютно свободного hIL-17A (см. ниже), стандартную кривую, включающую различные концентрации hIL-17A, получали в PBS-T/BSA и инкубировали в течение 20 мин. также на том же самом планшете MSD.
Для обеспечения возможности выявления и количественного определения связанного биотинилированного hIL-17A, остаточные вещества, находящиеся на поверхности, отбрасывали, и добавляли 20 мкл метки стрептавидин-сульфо в концентрации, составляющей 1 мкг/мл в PBS-T/BSA, и инкубировали в течение 1 ч. при RT. После промывки в каждую лунку добавляли 60 мкл буфера для считывания T MSD (2x) и планшет подвергали считыванию в течение 15 мин.
Полученный электрохемилюминесцентный (ECL) сигнал измеряли при помощи устройства для визуализации SECTOR Imager 2400 (Meso Scale Discovery). Оценку осуществляли, как указано далее: высчитывали концентрацию свободного IL-17A, c(IL-17A)свободный, (из стандартной кривой, определенной в параллели) и наносили на график как функцию от концентрации SEQ ID NO: 1, c(SEQ ID NO: 1). Для получения концентрации SEQ ID NO: 1, при которой образование комплекса IL-17A/IL-17 RA блокировалось на 50% (IC50), кривые приводили в соответствие при помощи криволинейной регрессии с моделью связывания в отдельных участках согласно c(IL-17A)свободный=c(IL-17A)общая/(1+c(SEQ ID NO: 1)/IC50)), с общей концентрацией индикаторных элементов, c(IL-17A)общая, и значениями IC50 в качестве незаданных параметров. Подбор кривой осуществляли при помощи программного обеспечения GraphPad Prism 4.
На фигуре 3 показано, что отрицательный контроль SEQ ID NO: 41 не связывался с hIL-17A; в отличие от этого SEQ ID NO: 1 показывал сильное конкурентное связывание с hIL-17A с подобранным значением IC50, составляющим 75 пМ.
Пример 4. Специфичность и перекрестная реактивность между видами для мутеина липокалина к IL-17A.
Специфичность и перекрестную реактивность между видами (фигура 4) для мутеина липокалина с SEQ ID NO: 1 анализировали при помощи «конкурентного ELISA в растворе», принцип которого описан ниже. Неизменную концентрацию SEQ ID NO: 1 инкубировали с разными концентрациями лигандов, лигандов IL-17A человека, IL-17A макака-крабоеда (cIL-17A) и IL-17A игрунки в течение 1 ч. После этой предварительной инкубации в растворе аликвоту смеси мутеин/лиганд переносили на планшет для ELISA с биотинилированным hIL-17A, иммобилизированным посредством нейтравидина, для измерения остаточной концентрации свободного SEQ ID NO: 1. Концентрацию свободного (не связанного с лигандом) SEQ ID NO: 1 определяли посредством постановки количественного ELISA (фигура 4). Следует отметить, что этот анализ, опирался на то, что все лиганды целенаправленно воздействовали на один и тот же сайт связывания SEQ ID NO: 1, т.е. что лиганды связывались с SEQ ID NO: 1 в конкуренции друг с другом.
В дальнейшем подробном протоколе эксперимента этапы инкубации и промывки осуществляли, как описано выше в протоколе конкурентного ELISA. 384-луночный планшет, пригодный для флуоресцентных измерений (Greiner FLUOTRAC™ 600, черное плоское дно, высокая степень связывания) покрывали 20 мкл нейтравидина в концентрации, составляющей 5 мкг/мл в PBS, на ночь при 4°C. После промывки покрытые нейтравидином лунки блокировали при помощи 100 мкл блокирующего буфера (PBS-T/BSA) в течение 1 ч. при комнатной температуре. После еще промывки добавляли 20 мкл биотинилированного hIL-17A в концентрации, составляющей 1 мкг/мл в PBS, на 1 ч при комнатной температуре и избыточный реагент удаляли.
Установленную концентрацию, составляющую 0,25 нМ, SEQ ID NO: 1 инкубировали в растворе с различными концентрациями лигандов (hIL-17A, cIL-17A и IL-17A игрунки), используя подходящую начальную концентрацию, которую серийно разводили в отношении 1:3 до пикомолярного диапазона в PBS-T/BSA. После 1 ч инкубации при комнатной температуре 20 мкл реакционной смеси переносили в 384-луночный планшет, после чего биотинилированный hIL-17A иммобилизировали для захвата несвязанного (свободного) SEQ ID NO: 1 на 20 мин. при RT. Для обеспечения возможности преобразования результатов считываний данных ELISA в концентрации абсолютно свободного SEQ ID NO: 1 (см. ниже), стандартную кривую, включающую различные концентрации SEQ ID NO: 1, получали в PBS-T/BSA и инкубировали в течение 20 мин. также на том же самом планшете MSD.
Остаточные вещества, находящиеся на поверхности, отбрасывали, и добавляли 20 мкл меченного HRP антитела к липокалину в заранее определенной оптимальной концентрации в PBS-T/BSA, и инкубировали в течение 1 ч при RT. Антитело к липокалину получали путем иммунизации кроликов смесью мутеинов липокалинов и затем объединяли с HRP при помощи набора (EZ-link Plus Activated Peroxidase, Thermo Scientific) согласно инструкциям производителя с получением конъюгата антитело-HRP. После промывки в каждую лунку добавляли 20 мкл флуорогенного субстрата с HRP (Quantablue, Pierce) и обеспечивали протекание реакции в течение 60 минут. Интенсивность флуоресценции каждой лунки на планшете считывали при помощи считывающего устройства для микропланшетов Genios Plus (Tecan). Для оценки данных концентрацию свободного SEQ ID NO: 1, c(SEQ ID NO: 1)свободный, рассчитывали исходя из результатов, полученных со стандартной кривой, и наносили на график как функцию от концентрации лиганда, c(лиганда). Для получения концентрации лиганда, при которой образование комплекса IL-17A/SEQ ID NO: 1 блокировалось на 50% (IC50), кривые приводили в соответствие при помощи криволинейной регрессии с моделью связывания в отдельных участках согласно c(SEQ ID NO: 1)свободный=c(SEQ ID NO: 1)общая/(1+c(лиганд)/IC50)), с общей концентрацией индикаторных элементов, c(SEQ ID NO: 1)общая, и значением IC50 в качестве незаданных параметров. Подбор кривой осуществляли при помощи программного обеспечения GraphPad Prism 4.
В итоге, при подборе кривой получали следующие результаты: IC50hIL-17A=0,1 нМ, IC50cIL-17A=0,1 нМ, и IC50IL-17A игрунки=0,2 нМ. Как показано на фигуре 4 из данных видно, что SEQ ID NO: 1 проявляет высокую степень аффинности по отношению к IL-17A от человека, макака-крабоеда и игрунки и, таким образом, видно, что SEQ ID NO: 1 является полностью перекрестнореагирующим с IL-17A макака-крабоеда и игрунки.
Пример 5. Опосредованная мутеином липокалина блокада индуцированной IL-17A секреции G-CSF в клеточном анализе.
Авторы настоящего изобретения использовали клеточный анализ для того, чтобы показать способность SEQ ID NO: 1 блокировать биологическую активность IL-17A. Анализ основывался на индуцированной IL-17A секреции G-CSF в клетках U87-MG (ATCC, номер по каталогу HTB-14). Этот высокочувствительный функциональный анализ использовали для сравнения эффективности SEQ ID NO: 1 с двумя сравнительными антителами, которые разрабатывали с клинической точки зрения. В этом анализе рекомбинантный hIL-17A предварительно инкубировали с SEQ ID NO: 1, молекулами сравнительных антител или контролями и добавляли к клеткам. Помимо SEQ ID NO: 1, следующие эталоны сравнения и контроли включали в анализ: сравнительное антитело 1 (тяжелая цепь SEQ ID NO: 53; легкая цепь SEQ ID NO: 54), сравнительное антитело 2 (тяжелая цепь SEQ ID 55; легкая цепь SEQ ID NO: 56) и SEQ ID NO: 2 и антитело человека изотипа IgG (Dianova, номер по каталогу 009-000-002) в качестве отрицательных контролей. Концентрацию G-CSF в супернатанте затем измеряли при помощи ELISA.
Клетки U87-MG культивировали в колбах для клеточных культур в стандартных условиях (среда Игла, модифицированная по способу Дульбеко, DMEM (PAN Biotech GmbH), содержащая 10% фетальной телячьей сыворотки, FCS (PAA Laboratories), 37°C, атмосфера 5% CO2).
На 1 сутки эксперимента прилипающие клетки отделяли от их субстрата при помощи Accutase (PAA Laboratories) согласно инструкциям производителя. Далее, клетки центрифугировали в течение 5 минут при 1000 об/мин, ресуспендировали в среде и фильтровали через сито для клеток с размером пор 100 мкм (Falcon) для удаления агрегатов клеток. Клетки затем высевали в 96-луночные планшеты с плоским дном для культур тканей (Greiner) с плотностью 5000 клеток на лунку, используя конечный объем, составляющий 100 мкл. Их инкубировали в течение ночи в стандартных условиях.
SEQ ID NO: 1, SEQ ID NO: 2, антитело человека изотипа IgG (Dianova, номер по каталогу 009-000-002), сравнительное антитело 1 и сравнительное антитело 2 (которые описаны выше) были изучаемыми молекулами («MUS»). На 2 сутки среду клеток, растущих в 96-луночном планшете, замещали 80 мкл свежей среды и далее к клеткам добавляли установленную концентрацию, составляющую 0,1 нМ, рекомбинантного hIL-17A и серию разведений растворов MUS. Это выполняли в трех повторностях для каждых MUS или контроля. Клетки инкубировали в течение дополнительных 20-24 часов в стандартных условиях. Перед сбором супернатантов для измерений уровней G-CSF лунки визуально осматривали при помощи микроскопа. Лунки, в которых были видны существенная гибель клеток или присутствие клеточных агрегатов исключали из оценивания. Уровни G-CSF определяли при помощи сверхчувствительного набора для G-CSF от MSD. Для оценки данных концентрацию G-CSF во внесистемных единицах наносили на график как функцию от концентрации MUS, c(MUS). Для получения концентрации MUS, при которой индукция продуцирования G-CSF клетками U-87 MG снижалась на 50% (IC50), кривые приводили в соответствие при помощи криволинейной регрессии с моделью связывания в отдельных участках согласно c(G-CSF)=c(G-CSF)наим.+[c(G-CSF)наиб.-c(G-CSF)наим.]/[1+c(MUS)/IC50], с незаданными параметрами, являющимися IC50, индуцированной концентрацией G-CSF, c(G-CSF)наиб. и неиндуцированной концентрацией G-CSF, c(G-CSF)наим.. В данном случае, предположили, что c(G-CSF)наиб. и c(G-CSF)наим. были независимыми от изучаемой молекулы антагониста или контрольной молекулы и, таким образом, их приводили в соответствие с общими значениями для всех молекул.
На фигуре 5 показан характерный пример эксперимента, который осуществляли в двух повторностях. Полученное в результате среднее значение EC50 для SEQ ID NO: 1 составляло 0,13 нМ (0,17 нМ в первом эксперименте, 0,10 нМ в повторном эксперименте), которое было в значительной степени более эффективным, чем у эталона сравнения 1, который проявлял EC50=2,33 (2,65/2,01) нМ, и в равном диапазоне по сравнению с эталоном сравнения 2, с EC50=0,12 (0,14/0,10) нМ. Отрицательные контроли, включающие SEQ ID NO: 2 и антитело человека изотипа IgG (Dianova, номер по каталогу 009-000-002, не показано на фигуре 5), не оказывал влияния на индуцированное IL-17A продуцирование G-CSF клеток.
Пример 6. Аффинность мутеина липокалина к IL-23, измеренная при помощи SPR.
Для измерения аффинности связывания мутеинов липокалинов с SEQ ID NO: 2 к IL-23 человека использовали анализ на основе поверхностного плазмонного резонанса (SPR) с использованием аппарата Biacore T200 (GE Healthcare). В анализе на аффинность с SPR (фигура 6) hIL-23 иммобилизировали на сенсорном чипе с использование общепринятой химии аминов. Поверхность чипа активировали с использованием EDC и NHS. Далее, 5 мкг/мл раствора hIL-23 в 10 мМ ацетата, pH 4,5, наносили при скорости потока 10 мкл/мин до тех пор, пока не достигали достаточного уровня иммобилизации. Остаточные активированные группы блокировали этаноламином. Эталонные каналы обрабатывали при помощи EDC/NHS с последующим этаноламином (холостая иммобилизация).
Для определения аффинности связывания SEQ ID NO: 2 получали пять титров SEQ ID NO: 2 в буфере HBS-EP+ и их наносили на полученную поверхность чипа. Анализ связывания выполняли со временем контакта, составляющим 300 с, временем диссоциации, составляющим 1200 с, и применением скорости потока, составляющей 30 мкл/мин. Все измерения осуществляли при 25°C. Восстановление поверхности с иммобилизированным hIL-23 выполняли при помощи введения 10 мМ водного раствора H3PO4 (30 с) с последующими дополнительной промывкой подвижным буфером и периодом стабилизации, составляющим 30 с. Перед измерениями белка осуществляли три цикла запуска для целей приведения к требуемым условиям. Данные оценивали при помощи программного обеспечения для оценивания при помощи Biacore T200 (V 1.0). Применяли двойное сравнение с образцом. Для приведения в соответствие первичных данных использовали модель связывания 1:1.
На фигуре 6 показан характерный пример эксперимента, который осуществляли в трех повторностях. По полученным в результате подогнанным кривым видно, что SEQ ID NO: 2 связывался с высокой степенью аффинности с hIL-23 с константой скорости ассоциации, составляющей ka = 5,0×104 M-1с-1, и константой скорости диссоциации, составляющей kd = 1,9×10-5 с-1. По средней константе диссоциации, определенной в трех повторностях экспериментов, составляющей KD = 0,35±0,20 нМ, видно высоко-аффинное взаимодействие между SEQ ID NO: 2 и IL-23 человека.
Пример 7. Аффинность мутеина липокалина к IL-23, измеренная при помощи SPR в альтернативном формате.
Для измерения аффинности связывания SEQ ID NO: 2 к IL-23 человека с использованием поверхностного плазмонного резонанса (SPR) в альтернативном формате анализа - фиксация SEQ ID NO: 2 в качестве лиганда и нанесение hIL-23 в качестве аналита - использовали аппарат Biacore T200 (GE Healthcare). SEQ ID NO: 2 и контроли биотинилировали как описано в примере 2. В анализе на аффинность с SPR биотинилированный SEQ ID NO: 2 фиксировали на сенсорном чипе CAP при помощи набора для захвата биотина (GE Healthcare). Для этого неразведенный реагент набора для захвата биотина наносили при скорости потока 2 мкл/мин. в течение 300 с. Далее, от 0,4 до 10 мкг/мл биотинилированного SEQ ID NO: 2 или контролей наносили в течение 300 с при скорости потока 5 мкл/мин. В эталонный канал загружали только реагент набора для захвата биотина.
Для определения аффинности связывания получали пять титров hIL-23 (7 – 600 нМ) в буфере HBS-EP+, дополненном 350 мМ NaCl, и их наносили на полученную поверхность чипа. Добавление 350 мМ NaCl было необходимо для сведения к минимуму неспецифического взаимодействия hIL-23 с поверхностью чипа. С нанесением со скоростью потока, составляющей 30 мкл/мин. использовали подход одноцикловой кинетики со временем контакта образца, составляющим 300 с, и временем диссоциации, составляющим 4000 с или 7200 с. После иммобилизации лиганда все 5 концентраций наносили последовательно в порядке возрастания перед отслеживанием диссоциации. Все измерения осуществляли при 25°C. Восстановление поверхности сенсорного чипа CAP и оценку данных выполняли, как описано в примере 2.
Полученные в результате подогнанные кривые показаны на фигуре 7. Из данных видно, что SEQ ID NO: 2 связывался с довольно высокой степенью аффинности к hIL-23 с константой скорости ассоциации, составляющей ka = 1,23×104 M-1с-1, и константой скорости диссоциации, составляющей kd = 3,55×10-5 с-1, что давало в результате рассчитанную равновесную константу диссоциации, составляющую KD = 2,9 нМ. При сравнении с примером 6 видно сильное падение аффинности при использовании этого формата анализа с SPR, что связано с высокой и нефизиологической концентрацией NaCl (350 мМ), которую необходимо включать в буфер для сведения к минимуму неспецифических взаимодействий hIL-23 с поверхностью чипа и, таким образом, облегчения выполнения анализа в этом формате. Анализ важен для обеспечения возможности сравнения SEQ ID NO: 2 и продукта слияния, содержащего такой мутеин (см. ниже пример 11).
Пример 8. Конкурентный механизм действия мутеина липокалина, связывающегося с IL-23.
Связывается ли мутеин липокалина SEQ ID NO: 2 с hIL-23 в конкурентном режиме исследовали in vitro с использованием формата конкурентного ELISA (фигура 8), по аналогии с примером 3, но с использованием hIL-23 в качестве мишени.
Все этапы инкубации осуществляли со встряхиванием при 300 об/мин и планшет промывали после каждого этапа инкубации при помощи 80 мкл PBS/0,05% Tween 20 пять раз при помощи устройства для избирательной промывки микропланшетов с глубокими лунками Biotek EL405. 384-луночный планшет MSD непосредственно покрывали 20 мкл растворимого рецептора IL-23 человека в концентрации, составляющей 1 мкг/мл в PBS, на ночь при 4°C. После промывки покрытые рецептором лунки блокировали при помощи 60 мкл PBS-T/BSA в течение 1 ч при комнатной температуре.
Установленную концентрацию, составляющую 0,01 нМ, биотинилированного IL-23 человека инкубировали в растворе с различными концентрациями SEQ ID NO: 2 или с SEQ ID NO: 43 в качестве отрицательного контроля, используя подходящие начальные концентрации, которые серийно разводили в отношении 1:4 до пикомолярного диапазона в PBS-T/BSA. После 1 ч инкубации при комнатной температуре 20 мкл реакционной смеси переносили на покрытый рецептором IL-23 планшет MSD для захвата несвязанного (свободного) или неконкурентно связанного hIL-23 на 20 мин при RT. Для обеспечения возможности преобразования результатов считываний данных ELISA в концентрации абсолютно свободного hIL-23 (см. ниже), стандартную кривую, включающую различные концентрации hIL-23, начиная со 100 нМ (серийно разведенную 1:4 за 11 этапов), получали в PBS-T/BSA и инкубировали в течение 20 мин также на том же самом планшете MSD. Для обеспечения возможности выявления и количественного определения связанного биотинилированного hIL-23, остаточные вещества, находящиеся на поверхности, отбрасывали, и добавляли 20 мкл метки стрептавидин-сульфо в концентрации, составляющей 1 мкг/мл в PBS-T/BSA, и инкубировали в течение 1 ч при RT. После промывки в каждую лунку добавляли 60 мкл буфера для считывания T MSD (2x) и планшет подвергали считыванию в течение 15 мин.
Полученный ECL сигнал измеряли при помощи устройства для визуализации SECTOR Imager 2400 (Meso Scale Discovery). Оценивание выполняли по аналогии с примером 3. Как показано на фигуре 8, отрицательный контроль SEQ ID NO: 43 не связывался с hIL-23, в отличие от этого SEQ ID NO: 2 показывал сильное конкурентное связывание с hIL23 с подобранным значением IC50, составляющим 0,54 нМ.
Пример 9. Специфичность и перекрестная реактивность между видами для мутеина липокалина к IL-23.
Специфичность и перекрестную реактивность между видами для мутеина липокалина с SEQ ID NO: 2 (фигура 9) анализировали при помощи «конкурентного ELISA в растворе», по аналогии с примером 4, но с изучением отличных лигандов, а именно, IL-23 от человека, макака-крабоеда (cIL-23), игрунки и мыши.
В дальнейшем подробном протоколе эксперимента этапы инкубации и промывки осуществляли, как описано выше в протоколе конкурентного ELISA. 384-луночный планшет, пригодный для флуоресцентных измерений (Greiner FLUOTRAC™ 600, черное плоское дно, высокая степень связывания) покрывали 20 мкл нейтравидина в концентрации, составляющей 5 мкг/мл в PBS, на ночь при 4°C. После промывки покрытые нейтравидином лунки блокировали при помощи 100 мкл PBS-T/BSA в течение 1 ч при комнатной температуре. После еще промывки добавляли 20 мкл биотинилированного hIL-23-Bio в концентрации, составляющей 0,25 мкг/мл в PBS, на 1 ч при комнатной температуре и избыточный реагент удаляли.
Установленную концентрацию, составляющую 0,5 нМ, SEQ ID NO: 2 инкубировали в растворе с различными концентрациями лигандов (hIL-23, cIL-23, IL-23 игрунки и IL-23 мыши), используя подходящую начальную концентрацию, которую серийно разводили в отношении 1:3 до пикомолярного диапазона в PBS-T/BSA. После 20 минут инкубации при комнатной температуре 20 мкл реакционной смеси переносили на покрытый hIL-23 384-луночный планшет для захвата несвязанного (свободного) SEQ ID NO: 2 на 20 мин. при RT. Для обеспечения возможности преобразования результатов считываний данных ELISA в концентрации абсолютно свободного SEQ ID NO: 2 (см. ниже), стандартную кривую, включающую различные концентрации SEQ ID NO: 2, получали в PBS-T/BSA и инкубировали в течение 20 мин. также на том же самом планшете MSD.
Для количественного определения захваченного на планшете SEQ ID NO: 2 остаточные вещества, находящиеся на поверхности, отбрасывали, и добавляли 20 мкл меченного HRP антитела к липокалину в заранее определенной оптимальной концентрации в PBS-T/BSA, и инкубировали в течение 1 ч. при RT. Антитело к липокалину получали путем иммунизации кроликов смесью мутеинов липокалинов и затем объединяли с HRP при помощи набора (EZ-link Plus Activated Peroxidase, Thermo Scientific) согласно инструкциям производителя с получением конъюгата антитело-HRP. Дальнейшие манипуляция с планшетами, получение данных и оценивание осуществляли, как описано в примере 4.
Как показано на фигуре 9, из результатов видно, что SEQ ID NO: 2 является полностью перекрестнореагирующим с IL-23 человека и мыши и проявляет несколько меньшую аффинность относительно IL-23 макака-крабоеда и игрунки, при этом IC50hIL-23 = 0,9 нМ, IC50cIL-23 = 4,8 нМ, IC50IL-23 игрунки = 12 нМ и IC50mIL-23 = 0,5 нМ.
Пример 10. Опосредованная мутеином липокалина блокада IL-23 в анализах клеточной пролиферации.
Способность мутеина липокалина с SEQ ID NO: 2 нейтрализовать биологическую активность hIL-23 анализировали путем применения краткосрочных биоанализов пролиферации, в которых использовали клетки, которые рекомбинантно экспрессируют рецептор IL-23 человека. Линия трансфицированных клеток Ba/F3 экспрессирует обе субъединицы рецептора, hIL-23R и hIL-12Rβ1, и отвечает как на IL-23 человека, так и IL-23 макака-крабоеда. Клетки Ba/F3 пролиферируют, отвечая на hIL-23, в зависимости от дозы, и пролифеpацию можно ингибировать при помощи нейтрализующего hIL-23 средства. В анализе SEQ ID NO: 2 предварительно инкубировали в разных концентрациях с неизменным количеством hIL-23 и смеси впоследствии добавляли к клеткам Ba/F3 в культуре. Через трое суток в культуре степень пролиферации анализировали путем определения количества жизнеспособных клеток. Это осуществляли с применением люминесцентного анализа жизнеспособности клеток CellTiter-Glo (Promega, номер по каталогу G7571) для измерения уровней АТФ, которые коррелируют с количеством метаболически активных клеток. Способность SEQ ID NO: 2 нейтрализовать hIL-23 анализировали по его значению IC50, т.е. концентрации мутеина липокалина, которая приводит к половинному ингибированию индуцированной hIL-23 пролиферации.
Подробная процедура подготовки анализа таким образом описана ниже. Трансфектанты Ba/F3 поддерживали в среде RPMI-1640, 10% фетальной телячьей сыворотки, 0,05 мМ 2-меркаптоэтанола, 500 мкг/мл генетицина (G418), 1 нг/мл mIL-3, 2 мкг/мл пуромицина и 200 мкг/мл зеоцина. Анализы пролиферации Ba/F3 выполняли в среде RPMI-1640, 10% фетальной телячьей сыворотки и 0,05 мМ 2-меркаптоэтанола. Анализы выполняли в 384-луночных белых прозрачных планшетах с плоским дном (Greiner) с 25 мкл на лунку.
На 1 сутки клетки из суспензии культуры клеток Ba/F3 подсчитывали, осаждали центрифугированием, промывали дважды в среде для анализа и покрывали ими планшет с плотностью, составляющей 2500 клеток на лунку. В лунки добавляли 50 пМ hIL-23 (номер по каталогу HZ-1254, HumanZyme) - соответствующее заранее определенной EC50, необходимой для индукции пролиферации клеток Ba/F3 - и серию разведений SEQ ID NO: 2, отрицательный контроль (антитело человека изотипа IgG, номер по каталогу 009-000-003, Dianova) и сравнительные антитела (эталон сравнения 3: SEQ ID NO: 57 и SEQ ID NO: 58, эталон сравнения 4: SEQ ID NO: 59 и SEQ ID NO: 60). Все серии титрований осуществляли с серийным разведением 1:3 в среде для анализа и подходящей начальной концентрацией. Далее, клеткам предоставляли возможность пролиферировать в течение 72 часов при 37°C. Для того чтобы убедиться, что эффективность hIL-23 не подвергалась меж- и внутрисуточной изменчивости, дозозависимый ответ пролиферации клеток Ba/F3 на hIL-23 проверяли путем добавления серий разведений только hIL-23 к клеткам Ba/F3, используя этапы разведения 1:3 в среде для анализа, начиная с 50 нМ. Для количественного определения пролиферации клеток после 72 часов в каждую из лунок к клеткам добавляли 25 мкл реагентов CellTiter-Glo, и инкубировали в течение 2 минут на орбитальном встряхивателе для индукции лизиса клеток, и люминесценцию измеряли при помощи считывающего устройства PheraStar FS.
Значения EC50 определяли при помощи программного обеспечения GraphPad Prism (GraphPad Software Inc., Сан-Диего, Калифорния, США) путем построения графика для сигнала люминесценции как функции от концентрации образцов и нелинейной регрессии данных с сигмоидальной моделью эффекта дозы.
Результат эксперимента показан на фигуре 10. Анализ пролиферации, раскрытый выше, является репрезентативным для двух независимых экспериментов. SEQ ID NO: 2 показывало среднюю EC50, составляющую 1,2 нМ (1,7 нМ в первом эксперименте, 0,7 нМ в повторном эксперименте), эталон сравнения 3 проявлял EC50, составляющую 3,0 нМ (3,1/2,9), и эталон сравнения 4 проявлял EC50, составляющую 1,2 нМ (0,8/1,5). Отрицательный контроль не оказывал влияния на пролиферацию. Таким образом, из данных видно, что SEQ ID NO: 2 и молекулы эталонов сравнения проявляют сравнимую эффективность в этом функциональном анализе.
Пример 11. Конструирование и характеристика белков слияния.
Разные белки слияния, содержащие либо один, либо оба из связывающих IL-17A и IL-23 мутеинов липокалинов, получали, экспрессировали и характеризовали, как указано далее и как показано на фигуре 11.
SEQ ID NO: 8 представляет собой белок слияния с SEQ ID NO: 1 и неиммуногенный альбумин-связывающий пептид (dABD, SEQ ID NO: 15), который получен из альбумин-связывающего домена белка G стрептококка.
SEQ ID NO: 7 представляет собой белок слияния с SEQ ID NO: 2 и SEQ ID NO: 15.
SEQ ID NO: 10 представляет собой гомодимерный белок слияния из двух последовательностей SEQ ID NO: 1 подряд, соединенных посредством линкера SEQ ID NO: 18, и слитый с SEQ ID NO: 15.
SEQ ID NO: 3 представляет собой гетеродимерный белок слияния из SEQ ID NO: 1 и SEQ ID NO: 2, соединенных посредством линкера SEQ ID NO: 18; тогда как SEQ ID NO: 4 представляет собой гетеродимерный белок слияния с обратным порядком мутеинов липокалинов, SEQ ID NO: 2 и SEQ ID NO: 1, и соединенными несколько отличающимся линкером SEQ ID NO: 19.
Таким образом, SEQ ID NO: 5 представляет собой белок слияния, соответствующий SEQ ID NO: 3, но с дополнительным слиянием на C-конце с альбумин-связывающим доменом белка G стрептококка (SEQ ID NO: 14).
SEQ ID NO: 9 представляет собой белок слияния, соответствующий SEQ ID NO: 3, но с дополнительным слиянием на C-конце с dABD (SEQ ID NO: 15).
SEQ ID 6 представляет собой тримерный белок слияния, образованный двумя последовательностями SEQ ID NO: 1 подряд, слитый на C-конце с SEQ ID NO: 2 и dABD (SEQ ID NO: 15). Линкеры между липокалинами, образованы SEQ ID NO: 18.
Авторы настоящего изобретения также сконструировали белки слияния из одного или более фрагментов SEQ ID NO: 1 с Fc-частью IgG1, которая соответствует SEQ ID NO: 16.
SEQ ID NO: 11 представляет собой белок слияния, соответствующий C-концевому слиянию SEQ ID NO: 1 с SEQ ID NO: 16, соединенных посредством пептидного линкера SEQ ID NO: 19.
SEQ ID NO: 12 представляет собой белок слияния, соответствующий двойному слиянию на N- и C-концах SEQ ID NO: 1, вследствие чего Fc-молекула с SEQ ID NO: 16 имеет SEQ ID NO: 1 как на N-конце, так и на C-конце.
SEQ ID NO: 13 представляет собой белок слияния, соответствующий слиянию на C-конце гомодимерного белка слияния с SEQ ID NO: 10 с Fc-молекулой с SEQ ID NO: 16.
Все белки слияния - где применимо - полностью характеризовали при помощи анализов в точности как описанные выше для SEQ ID NO: 1 и SEQ ID NO: 2: анализы конкурентного ELISA для hIL-17A (пример 3) и hIL-23 (пример 8), анализы с SPR, где белок слияния иммобилизировали на чипе для SPR для hIL-17AF (пример 2) и hIL-23 (пример 6) и функциональные клеточные анализы, которые описаны для hIL-17A (пример 5) и hIL-23 (пример 10).
Результаты экспериментов подытожены в таблице 1. В таблице представлено общее описание активности отдельных мутеинов липокалинов SEQ ID NO: 1 и SEQ ID NO: 2 по сравнению с их белками слияния SEQ ID NO: 3-13 в анализах конкурентного ELISA, с поверхностным плазмонным резонансом (SPR) и функциональных клеточных анализах. Значения определяли в отношении взаимодействия с IL-17 и/или IL-23 в зависимости от того содержит ли соответствующий конструкт связывающий IL-17A мутеин липокалина SEQ ID NO: 1, связывающий IL-23 мутеин липокалина SEQ ID NO: 2 или оба. Для определения активности по отношению к IL-17 и IL-23 соответственно эксперименты с конкурентным ELISA выполняли, как описано в примере 3 и/или примере 8, эксперименты с SPR в обратном формате - т.е. с белковыми конструктами, иммобилизованными на сенсорном чипе – выполняли, как описано в примере 2 и/или примере 6 и клеточные анализы были основаны либо на индуцированной IL-17A секреции G-CSF (пример 5) и/либо на индуцированной IL-23 пролиферации клеток Ba/F3 (пример 10). Следует отметить, что эксперимент с SPR в обратном формате, осуществленный для определения аффинности к IL-23, выполняли в присутствии нефизиологически высоких концентраций NaCl и что значения, вследствие этого, не отражают аффинность к IL-23 в физиологических условиях, но служат для определения является ли относительная аффинность к IL-23 отличной в белках слияния SEQ ID NO: 3-13 по сравнению с отдельными мутеинами SEQ ID NO: 1 и SEQ ID NO: 2. В таблице 1 показано, что связывающая IL-17A активность всех продуктов слияния, содержащих SEQ ID NO: 1, является по меньшей мере такой же хорошей как таковая SEQ ID NO: 1 самого по себе во всех форматах анализов. SEQ ID NO: 1 можно легко использовать в любом белке слияния без потери активности. Связывающая IL-23 активность всех продуктов слияния, содержащих SEQ ID NO: 2, очень близка к таковой SEQ ID NO: 2 самого по себе во всех форматах анализов. SEQ ID NO: 2 можно легко использовать в любом белке слияния без существенной потери активности.
Пример 12. Эксперимент с SPR разрабатывали так, чтобы показать одновременное связывание всех мишеней белком слияния.
Для того чтобы продемонстрировать одновременное связывание белка слияния с SEQ ID NO: 9 для hIL-17A, hIL-23 и сывороточного альбумина человека (HSA), использовали анализ на основе поверхностного плазмонного резонанса (SPR) с использованием аппарата Biacore T200 (GE Healthcare). SEQ ID NO: 9 биотинилировали как описано в примере 2. В анализе на аффинность с SPR биотинилированный SEQ ID NO: 9 фиксировали на сенсорном чипе CAP при помощи набора для захвата биотина (GE Healthcare). Для этого неразведенный реагент набора для захвата биотина наносили при скорости потока 2 мкл/мин в течение 300 с. Далее, от 0,4 до 10 мкг/мл биотинилированного SEQ ID NO: 9 наносили в течение 300 с при скорости потока 5 мкл/мин. В эталонный канал загружали только реагент набора для захвата биотина.
Для того чтобы продемонстрировать одновременное связывание, получали титры hIL-17 A/F, hIL-23 и HSA (200 нМ, 1000 нМ и 2000 нМ) в буфере HBS-EP+, дополненном 350 мМ NaCl и их последовательно наносили на полученную поверхность чипа. С нанесением со скоростью 30 мкл/мин hIL-17 A/F, hIL-23 и HSA последовательно вводили со временем контакта с образцом, составляющим 300 с. Нанесение мишени на иммобилизированный SEQ ID NO: 9 также осуществляли, используя отдельные лиганды hIL-17 A/F, hIL-23 и HSA, для получения наивысших уровней связывания, получаемых при помощи связывания отдельной мишени, для сравнения.
На фигуре 12 показано сравнение измеренной кривой связывания с теоритической кривой связывания, отражающей полное связывание всех лигандов. Последнюю получали путем объединения экспериментальных ответов SEQ ID NO: 9 для отдельных лигандов. Измеренная и теоретическая кривые являются почти одинаковыми, с показанным различием, связанным с диссоциацией мишеней при построении экспериментальной кривой. Из данных видно, что SEQ ID NO: 9 способен одновременно связывать все мишени, hIL-17A, hIL-23 и HSA, без потери интенсивности сигнала или изменения в кинетике по сравнению со связыванием только отдельной мишени.
Пример 13. Аффинность альтернативных мутеинов липокалинов к IL-23.
Для измерения аффинности связывания мутеинов липокалинов SEQ ID NO: 45 и SEQ ID NO: 46 к IL-23 человека использовали анализ на основе поверхностного плазмонного резонанса (SPR) с использованием аппарата Biacore T200 (GE Healthcare). В анализе на аффинность с SPR (фигура 13) hIL-23 иммобилизировали на сенсорном чипе с использование общепринятой химии аминов. Активацию чипа, иммобилизацию hIL-23, измерения при помощи SPR и оценку данных осуществляли как описано в примере 6.
Как показано на фигуре 13, по полученным в результате подогнанным кривым видно, что SEQ ID NO: 45 связывался с высокой степенью аффинности с hIL-23 с константой скорости ассоциации, составляющей ka = 3,0×105 M-1с-1, и константой скорости диссоциации, составляющей kd = 3×10-5 с-1, что давало в результате константу диссоциации, составляющую KD = 100 пМ. Подобным образом, как показано на фигуре 13, SEQ ID NO: 46 связывался с высокой степенью аффинности с hIL-23 с константой скорости ассоциации, составляющей ka = 7,0×104 M-1с-1, и константой скорости диссоциации, составляющей kd = 4,0×10-5 с-1, что давало в результате константу диссоциации, составляющую KD = 0,6 нМ.
Пример 14. Конкурентный механизм действия мутеинов липокалинов относительно IL-23.
Связываются ли мутеины липокалинов SEQ ID NO: 45 и SEQ ID NO: 46 с IL-23 человека в конкурентном режиме исследовали in vitro с использованием формата конкурентного ELISA (фигура 14). Эксперимент и оценивание выполняли подобным примеру 8 образом.
Результат эксперимента показан на фигуре 14. SEQ ID NO: 45 проявляет конкурентное связывание с hIL23 с подобранным значением IC50, составляющим 0,1 нМ, и SEQ ID NO: 46 также проявляет конкурентное связывание с hIL23 с подобранным значением IC50, составляющим 1,1 нМ.
Пример 15. Опосредованная мутеином липокалина блокада IL-23 в анализах клеточной пролиферации.
Способность мутеинов липокалинов SEQ ID NO: 45 и SEQ ID NO: 46 нейтрализовать биологическую активность hIL-23 анализировали путем применения краткосрочных биоанализов пролиферации, в которых использовали клетки, которые рекомбинантно экспрессируют рецептор IL-23 человека. Эксперимент и оценивание выполняли аналогично примеру 10. SEQ ID NO: 43 служил в качестве отрицательного контроля.
Результат эксперимента показан на фигуре 15. SEQ ID NO: 45 проявляет среднюю EC50, составляющую 3,7 нМ, и SEQ ID NO: 46 проявляет EC50, составляющую 5,4 нМ. Отрицательный контроль не оказывал влияния на пролиферацию. Таким образом, из данных видно, что SEQ ID NO: 2 и мутеины липокалинов с SEQ ID NO: 45 и с SEQ ID NO: 46 проявляют сравнимую эффективность в этом функциональном анализе.
Пример 16. Специфичность белка слияния относительно IL-17A
Авторы настоящего изобретения использовали анализ ELISA для определения специфичности белка слияния с SEQ ID NO: 63 и 62 к IL-17A. Нейтравидин растворяли в PBS (5 мкг/мл) и им покрывали на ночь микротировальные планшеты при 4°C. Планшет промывали после каждого этапа инкубации при помощи 100 мкл PBS, дополненного 0,1% (объем/объем) Tween 20 (PBS-T), пять раз. Планшеты блокировали при помощи 2% BSA (вес/объем) в PBS-T (PBS-TB) в течение 1 ч. при комнатной температуре и затем промывали. IL-17A (Peprotech), который был биотинилирован, захватывали при помощи нейтравидина на протяжении 20 мин. в концентрации, составляющей 1 мкг/мл. Несвязанный белок вымывали. Далее, в лунки добавляли различные концентрации мутеина липокалина с SEQ ID NO: 1 или белка слияния и инкубировали в течение 1 ч при комнатной температуре с последующим этапом промывки. Связанный белок слияния или мутеин липокалина выявляли после инкубации с разведенным 1:2000 антителом к TLc человека, конъюгированным с HRP, в PBS-TB. После дополнительного этапа промывки в каждую лунку добавляли флуорогенный субстрат с HRP (QuantaBlu, Thermo) и интенсивность флуоресценции выявляли при помощи считывающего уровень флуоресценции устройства для микропланшетов.
Результат эксперимента изображен на фигуре 16 совместно с подогнанными кривыми, полученными из сигмоидальной функции связывания 1:1, где значение EC50 и наибольший сигнал были незаданными параметрами, и наклон фиксировали для единства. Полученные в результате значения EC50 представлены в таблице 2, в том числе ошибки сигмоидальной функции данных. Наблюдаемые значения EC50 являются, в пределах ошибок эксперимента, очень похожими для белка слияния антитело-мутеин липокалина и мутеина липокалина. Из эксперимента видно, что мутеин липокалина с SEQ ID NO: 1, который включен в белок слияния, может быть слит с антителом с SEQ ID NO: 61 и 62 без потери активности относительно IL-17A.
Таблица 2 - данные ELISA в отношении связывания IL-17A
|
Пример 17. Специфичность белка слияния относительно IL-23
Авторы настоящего изобретения использовали анализ ELISA для определения специфичности белка слияния с SEQ ID NO: 64 и 62 относительно IL-23. Нейтравидин растворяли в PBS (5 мкг/мл) и им покрывали на ночь микротировальные планшеты при 4°C. Планшет промывали после каждого этапа инкубации при помощи 100 мкл PBS, дополненного 0,1% (объем/объем) Tween 20 (PBS-T), пять раз. Планшеты блокировали при помощи 2% BSA (вес/объем) в PBS-T в течение 1 ч при комнатной температуре и затем промывали. Биотинилированный IL-23 захватывали при помощи нейтравидина на протяжении 20 мин. в концентрации, составляющей 1 мкг/мл. Несвязанный белок вымывали. Далее, в лунки добавляли различные концентрации мутеина липокалина с SEQ ID NO: 2 или белков слияния и инкубировали в течение 1 ч при комнатной температуре с последующим этапом промывки. Связанные белки слияния или мутеин липокалина выявляли после инкубации с разведенным 1:1000 антителом к NGAL человека, конъюгированным с HRP, в PBS-T, дополненном 2% (вес/объем) BSA (PBS-TB). После дополнительного этапа промывки в каждую лунку добавляли флуорогенный субстрат с HRP (QuantaBlu, Thermo) и интенсивность флуоресценции выявляли при помощи считывающего уровень флуоресценции устройства для микропланшетов.
Результат эксперимента изображен на фигуре 17 совместно с подогнанными кривыми, полученными из сигмоидальной функции связывания 1:1, где значение EC50 и наибольший сигнал были незаданными параметрами, и наклон фиксировали для единства. Полученные в результате значения EC50 представлены в таблице 3. Наблюдаемые значения EC50 для белка слияния антитело-мутеин липокалина и мутеина липокалина очень похожи в пределах ошибки эксперимента. Из этого видно, что мутеин липокалина с SEQ ID NO: 2, который включен в белок слияния, может быть слит с антителом с SEQ ID NO: 64 и 62 без потери активности относительно IL-23.
Таблица 3 – данные ELISA в отношении связывания IL-23
|
Пример 18. Специфичность белков слияния относительно TNF-α
Авторы настоящего изобретения использовали анализ ELISA для определения специфичности белка слияния с SEQ ID NO: 63 и 62 и белка слияния с SEQ ID NO: 64 и 62 к TNF-α. Антитело с SEQ ID NO: 61 и 62 служило в качестве положительного контроля. Рекомбинантный TNF-α (R&D Systems, 210-TA-100/CF) растворяли в PBS (1 мкг/мл) и им покрывали на ночь микротировальные планшеты при 4°C. Планшет промывали пять раз после каждого этапа инкубации при помощи 100 мкл PBS-T. Планшеты блокировали при помощи 2% BSA (вес/объем) в PBS-T в течение 1 ч. при комнатной температуре и затем промывали. В лунки добавляли различные концентрации специфичного к TNFα исходного антитела или белков слияния и инкубировали в течение 1 ч. при комнатной температуре с последующим этапом промывки. Связанные белки слияния или антитело выявляли после инкубации в течение 1 ч. при комнатной температуре с разведенным 1:5000 антителом козы к Fab IgG человека, конъюгированного с HRP (Jackson Laboratories), в PBS-TB. После дополнительного этапа промывки в каждую лунку добавляли флуорогенный субстрат с HRP (QuantaBlu, Thermo) и интенсивность флуоресценции выявляли при помощи считывающего уровень флуоресценции устройства для микропланшетов.
Результат эксперимента изображен на фигуре 18 совместно с подогнанными кривыми, полученными из сигмоидальной функции связывания 1:1, где значение EC50 и наибольший сигнал были незаданными параметрами, и наклон фиксировали для единства. Полученные в результате значения EC50 представлены в таблице 4. Наблюдаемые значения EC50 для всех протестированных белков очень похожи. Из этого видно, что антитело, которое включено в белки слияния, может быть слито с различными мутеинами липокалинов без нарушения его активности относительно TNFα.
Таблица 4 – данные ELISA в отношении связывания TNFα
|
Пример 19. Иллюстрация одновременного связывания мишени белков слияния в установке на основе ELISA
Для того чтобы продемонстрировать одновременное связывание белка слияния с SEQ ID NO: 63 и 62 и белка слияния с SEQ ID NO: 64 и 62 соответственно с TNFα и IL-17A или IL-23, использовали формат ELISA с двойным связыванием. Рекомбинантным TNF-α (R&D Systems, 210-TA-100/CF) в PBS (1 мкг/мл) покрывали на ночь микротитровальные планшеты при 4°C. Планшет промывали пять раз после каждого этапа инкубации при помощи 100 мкл PBS-T. Планшеты блокировали при помощи 2% BSA (вес/объем) в PBS-T в течение 1 ч при комнатной температуре и затем опять промывали. В лунки добавляли различные концентрации белков слияния и инкубировали в течение 1 ч при комнатной температуре с последующим этапом промывки. Далее, биотинилированный IL-17A (в случае с SEQ ID NO: 63 и 62) или биотинилированный IL-23 (в случае с SEQ ID NO: 64 и 62) добавляли в неизменной концентрации, составляющей 1 мкг/мл в PBS-TB, в течение 1 ч. После промывки в лунки на 1 ч добавляли экстравидин-HRP (Sigma-Adrich, 1:5000 в PBS-TB). После дополнительного этапа промывки в каждую лунку добавляли флуорогенный субстрат с HRP (QuantaBlu, Thermo) и интенсивность флуоресценции выявляли при помощи считывающего уровень флуоресценции устройства для микропланшетов.
Результат эксперимента изображен на фигуре 19 совместно с подогнанными кривыми, полученными из сигмоидальной функции связывания 1:1, где значение EC50 и наибольший сигнал были незаданными параметрами, и наклон фиксировали для единства. Полученные в результате значения EC50 представлены в таблице 5. Все белки слияния показывали чистые сигналы связывания со значениями EC50 в одноразрядном наномолярном диапазоне, что показывало, что белки слияния способны одновременно занимать TNFα и либо IL-17A, либо IL-23.
Таблица 5 – данные ELISA в отношении одновременного связывания мишени
|
Варианты осуществления, иллюстративно описанные в данном документе, надлежащим образом можно осуществлять на практике в отсутствие любых элемента или элементов, ограничения или ограничений, не раскрытых конкретно в данном документе. Таким образом, например, термины «содержащий», «включающий», «состоящий» и т.д. следует читать как открытые и без ограничений. Дополнительно, термины и выражения, используемые в данном документе, использовали в качестве терминов описания, а не ограничения, и в использовании таких терминов и выражений нет намерения исключить любые эквиваленты показанных и описанных особенностей или их частей, но следует понимать, что разные модификации возможны в пределах объема настоящего изобретения. Таким образом, следует понимать, что несмотря на то, что настоящие варианты осуществления были конкретно раскрыты при помощи предпочтительных вариантов осуществления и необязательных особенностей, к их модификации и вариациям может прибегать специалист в данной области, и что такие модификации и вариации рассматриваются как часть объема настоящего изобретения. Все патенты, патентные заявки, руководства и отрецензированные публикации, описанные в данном документе, в данный документ включены при помощи ссылки в полном объеме. Кроме того, в тех случаях, когда определение или использование термина в ссылочном материале, который включен при помощи ссылки в данный документ, не согласуется или противоречит определению такого термина, представленному в данном документе, тогда применяется определение термина, представленное в данном документе, а определение термина из ссылки не применяется. Каждое из более узких видов и субродовых группировок, находящихся в пределах родового раскрытия, также образует часть настоящего изобретения. Это включает родовое описание настоящего изобретения с оговоркой или отрицательными признаками, удаляющими любой объект из рода, независимо от того исключенный материал конкретно изложен в данном документе или нет. К тому же в тех случаях, когда особенности описаны в контексте группы Маркуша, тогда специалисту в данной области будет понятно, что настоящее раскрытие также таким образом раскрыто в контексте любого отдельного представителя или подгруппы представителей группы Маркуша. Дополнительные варианты осуществления будут очевидны из прилагаемой формулы изобретения.
Эквиваленты. Специалисту в данной области будут понятны, или он будет способен установить при помощи всего лишь проведения обычного эксперимента, много эквивалентов конкретных вариантов осуществления настоящего изобретения, описанного в данном документе. Как предполагается, такие эквиваленты охватываются прилагаемой формулой изобретения. Все публикации, патенты и патентные заявки, упомянутые в этом описании, таким образом включены при помощи ссылки в описание в такой же степени, как если бы каждая отдельная публикация, отдельный патент или отдельная патентная заявка были конкретно и отдельно указаны как включенные в данном документе при помощи ссылки.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ПИЕРИС АГ
<120> НОВЫЕ ПОЛИПЕПТИДЫ СО СПЕЦИФИЧЕСКИМ СВЯЗЫВАНИЕМ И ПУТИ ИХ ПРИМЕНЕНИЯ
<130> PIE15066PCT
<150> EP 14169488.5
<151> 2014-05-22
<160> 68
<170> PatentIn версия 3.5
<210> 1
<211> 151
<212> Белок
<213> искусственный
<220>
<223> мутеин липокалина
<400> 1
Ala Ser Asp Glu Glu Ile Gln Asp Val Ser Gly Thr Trp Tyr Leu Lys
1 5 10 15
Ala Met Thr Val Asp Phe Trp Cys Ser Gly Ile His Glu Glu Ser Val
20 25 30
Thr Pro Met Thr Leu Thr Thr Leu Glu Gly Gly Asn Leu Glu Ala Lys
35 40 45
Val Thr Met Asp Ile Glu Gly Phe Leu Gln Glu Phe Lys Ala Val Leu
50 55 60
Glu Lys Thr Asp Glu Pro Gly Lys Tyr Thr Ala Asp Gly Gly Lys His
65 70 75 80
Val Ala Tyr Ile Ile Arg Ser Arg Val Lys Asp His Tyr Ile Phe Tyr
85 90 95
Ser Glu Gly Asp Cys Pro Gly Pro Val Pro Gly Val Trp Leu Val Gly
100 105 110
Arg Asp Pro Lys Asn Asn Leu Glu Ala Leu Glu Asp Phe Glu Lys Ala
115 120 125
Ala Gly Ala Arg Gly Leu Ser Thr Glu Ser Ile Leu Ile Pro Arg Gln
130 135 140
Ser Glu Thr Ser Ser Pro Gly
145 150
<210> 2
<211> 178
<212> Белок
<213> искусственный
<220>
<223> мутеин липокалина
<400> 2
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe His Gly Lys Trp Tyr
20 25 30
Val Val Gly Glu Ala Gly Asn Leu Leu Leu Arg Glu Asp Lys Asp Pro
35 40 45
Arg Lys Met Thr Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr
50 55 60
Asp Val Thr Arg Val Glu Phe Gly Ala Lys Thr Tyr Lys Tyr Gln Ile
65 70 75 80
Gly Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Phe Thr Leu Gly Gly
85 90 95
Ile Glu Ser Met Pro Gly Met Thr Ser Phe Leu Val Arg Val Val Ser
100 105 110
Thr Asn Tyr Asn Gln His Ala Ile Val Phe Phe Lys Tyr Val Tyr Gln
115 120 125
Asn Arg Glu Tyr Phe Glu Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu
130 135 140
Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly
145 150 155 160
Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Ala Ile
165 170 175
Asp Gly
<210> 3
<211> 351
<212> Белок
<213> искусственный
<220>
<223> белок слияния
<400> 3
Ala Ser Asp Glu Glu Ile Gln Asp Val Ser Gly Thr Trp Tyr Leu Lys
1 5 10 15
Ala Met Thr Val Asp Phe Trp Cys Ser Gly Ile His Glu Glu Ser Val
20 25 30
Thr Pro Met Thr Leu Thr Thr Leu Glu Gly Gly Asn Leu Glu Ala Lys
35 40 45
Val Thr Met Asp Ile Glu Gly Phe Leu Gln Glu Phe Lys Ala Val Leu
50 55 60
Glu Lys Thr Asp Glu Pro Gly Lys Tyr Thr Ala Asp Gly Gly Lys His
65 70 75 80
Val Ala Tyr Ile Ile Arg Ser Arg Val Lys Asp His Tyr Ile Phe Tyr
85 90 95
Ser Glu Gly Asp Cys Pro Gly Pro Val Pro Gly Val Trp Leu Val Gly
100 105 110
Arg Asp Pro Lys Asn Asn Leu Glu Ala Leu Glu Asp Phe Glu Lys Ala
115 120 125
Ala Gly Ala Arg Gly Leu Ser Thr Glu Ser Ile Leu Ile Pro Arg Gln
130 135 140
Ser Glu Thr Ser Ser Pro Gly Ser Asp Gly Gly Gly Gly Ser Gly Gly
145 150 155 160
Gly Gly Ser Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu
165 170 175
Ser Lys Val Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe His Gly
180 185 190
Lys Trp Tyr Val Val Gly Glu Ala Gly Asn Leu Leu Leu Arg Glu Asp
195 200 205
Lys Asp Pro Arg Lys Met Thr Ala Thr Ile Tyr Glu Leu Lys Glu Asp
210 215 220
Lys Ser Tyr Asp Val Thr Arg Val Glu Phe Gly Ala Lys Thr Tyr Lys
225 230 235 240
Tyr Gln Ile Gly Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Phe Thr
245 250 255
Leu Gly Gly Ile Glu Ser Met Pro Gly Met Thr Ser Phe Leu Val Arg
260 265 270
Val Val Ser Thr Asn Tyr Asn Gln His Ala Ile Val Phe Phe Lys Tyr
275 280 285
Val Tyr Gln Asn Arg Glu Tyr Phe Glu Ile Thr Leu Tyr Gly Arg Thr
290 295 300
Lys Glu Leu Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys
305 310 315 320
Ser Leu Gly Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp
325 330 335
Gln Ala Ile Asp Gly Ser Ala Trp Ser His Pro Gln Phe Glu Lys
340 345 350
<210> 4
<211> 349
<212> Белок
<213> искусственный
<220>
<223> белок слияния
<400> 4
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe His Gly Lys Trp Tyr
20 25 30
Val Val Gly Glu Ala Gly Asn Leu Leu Leu Arg Glu Asp Lys Asp Pro
35 40 45
Arg Lys Met Thr Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr
50 55 60
Asp Val Thr Arg Val Glu Phe Gly Ala Lys Thr Tyr Lys Tyr Gln Ile
65 70 75 80
Gly Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Phe Thr Leu Gly Gly
85 90 95
Ile Glu Ser Met Pro Gly Met Thr Ser Phe Leu Val Arg Val Val Ser
100 105 110
Thr Asn Tyr Asn Gln His Ala Ile Val Phe Phe Lys Tyr Val Tyr Gln
115 120 125
Asn Arg Glu Tyr Phe Glu Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu
130 135 140
Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly
145 150 155 160
Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Ala Ile
165 170 175
Asp Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ala Ser Asp Glu
180 185 190
Glu Ile Gln Asp Val Ser Gly Thr Trp Tyr Leu Lys Ala Met Thr Val
195 200 205
Asp Phe Trp Cys Ser Gly Ile His Glu Glu Ser Val Thr Pro Met Thr
210 215 220
Leu Thr Thr Leu Glu Gly Gly Asn Leu Glu Ala Lys Val Thr Met Asp
225 230 235 240
Ile Glu Gly Phe Leu Gln Glu Phe Lys Ala Val Leu Glu Lys Thr Asp
245 250 255
Glu Pro Gly Lys Tyr Thr Ala Asp Gly Gly Lys His Val Ala Tyr Ile
260 265 270
Ile Arg Ser Arg Val Lys Asp His Tyr Ile Phe Tyr Ser Glu Gly Asp
275 280 285
Cys Pro Gly Pro Val Pro Gly Val Trp Leu Val Gly Arg Asp Pro Lys
290 295 300
Asn Asn Leu Glu Ala Leu Glu Asp Phe Glu Lys Ala Ala Gly Ala Arg
305 310 315 320
Gly Leu Ser Thr Glu Ser Ile Leu Ile Pro Arg Gln Ser Glu Thr Ser
325 330 335
Ser Pro Gly Ser Ala Trp Ser His Pro Gln Phe Glu Lys
340 345
<210> 5
<211> 406
<212> Белок
<213> искусственный
<220>
<223> белок слияния
<400> 5
Ala Ser Asp Glu Glu Ile Gln Asp Val Ser Gly Thr Trp Tyr Leu Lys
1 5 10 15
Ala Met Thr Val Asp Phe Trp Cys Ser Gly Ile His Glu Glu Ser Val
20 25 30
Thr Pro Met Thr Leu Thr Thr Leu Glu Gly Gly Asn Leu Glu Ala Lys
35 40 45
Val Thr Met Asp Ile Glu Gly Phe Leu Gln Glu Phe Lys Ala Val Leu
50 55 60
Glu Lys Thr Asp Glu Pro Gly Lys Tyr Thr Ala Asp Gly Gly Lys His
65 70 75 80
Val Ala Tyr Ile Ile Arg Ser Arg Val Lys Asp His Tyr Ile Phe Tyr
85 90 95
Ser Glu Gly Asp Cys Pro Gly Pro Val Pro Gly Val Trp Leu Val Gly
100 105 110
Arg Asp Pro Lys Asn Asn Leu Glu Ala Leu Glu Asp Phe Glu Lys Ala
115 120 125
Ala Gly Ala Arg Gly Leu Ser Thr Glu Ser Ile Leu Ile Pro Arg Gln
130 135 140
Ser Glu Thr Ser Ser Pro Gly Ser Asp Gly Gly Gly Gly Ser Gly Gly
145 150 155 160
Gly Gly Ser Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu
165 170 175
Ser Lys Val Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe His Gly
180 185 190
Lys Trp Tyr Val Val Gly Glu Ala Gly Asn Leu Leu Leu Arg Glu Asp
195 200 205
Lys Asp Pro Arg Lys Met Thr Ala Thr Ile Tyr Glu Leu Lys Glu Asp
210 215 220
Lys Ser Tyr Asp Val Thr Arg Val Glu Phe Gly Ala Lys Thr Tyr Lys
225 230 235 240
Tyr Gln Ile Gly Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Phe Thr
245 250 255
Leu Gly Gly Ile Glu Ser Met Pro Gly Met Thr Ser Phe Leu Val Arg
260 265 270
Val Val Ser Thr Asn Tyr Asn Gln His Ala Ile Val Phe Phe Lys Tyr
275 280 285
Val Tyr Gln Asn Arg Glu Tyr Phe Glu Ile Thr Leu Tyr Gly Arg Thr
290 295 300
Lys Glu Leu Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys
305 310 315 320
Ser Leu Gly Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp
325 330 335
Gln Ala Ile Asp Gly Ser Ala Gly Ala Val Asp Ala Asn Ser Leu Ala
340 345 350
Glu Ala Lys Val Leu Ala Asn Arg Glu Leu Asp Lys Tyr Gly Val Ser
355 360 365
Asp Tyr Tyr Lys Asn Leu Ile Asn Asn Ala Lys Thr Val Glu Gly Val
370 375 380
Lys Ala Leu Ile Asp Glu Ile Leu Ala Ala Leu Pro Ser Ala Trp Ser
385 390 395 400
His Pro Gln Phe Glu Lys
405
<210> 6
<211> 556
<212> Белок
<213> искусственный
<220>
<223> белок слияния
<400> 6
Ala Ser Asp Glu Glu Ile Gln Asp Val Ser Gly Thr Trp Tyr Leu Lys
1 5 10 15
Ala Met Thr Val Asp Phe Trp Cys Ser Gly Ile His Glu Glu Ser Val
20 25 30
Thr Pro Met Thr Leu Thr Thr Leu Glu Gly Gly Asn Leu Glu Ala Lys
35 40 45
Val Thr Met Asp Ile Glu Gly Phe Leu Gln Glu Phe Lys Ala Val Leu
50 55 60
Glu Lys Thr Asp Glu Pro Gly Lys Tyr Thr Ala Asp Gly Gly Lys His
65 70 75 80
Val Ala Tyr Ile Ile Arg Ser Arg Val Lys Asp His Tyr Ile Phe Tyr
85 90 95
Ser Glu Gly Asp Cys Pro Gly Pro Val Pro Gly Val Trp Leu Val Gly
100 105 110
Arg Asp Pro Lys Asn Asn Leu Glu Ala Leu Glu Asp Phe Glu Lys Ala
115 120 125
Ala Gly Ala Arg Gly Leu Ser Thr Glu Ser Ile Leu Ile Pro Arg Gln
130 135 140
Ser Glu Thr Ser Ser Pro Gly Ser Asp Gly Gly Gly Gly Ser Gly Gly
145 150 155 160
Gly Gly Ser Ala Ser Asp Glu Glu Ile Gln Asp Val Ser Gly Thr Trp
165 170 175
Tyr Leu Lys Ala Met Thr Val Asp Phe Trp Cys Ser Gly Ile His Glu
180 185 190
Glu Ser Val Thr Pro Met Thr Leu Thr Thr Leu Glu Gly Gly Asn Leu
195 200 205
Glu Ala Lys Val Thr Met Asp Ile Glu Gly Phe Leu Gln Glu Phe Lys
210 215 220
Ala Val Leu Glu Lys Thr Asp Glu Pro Gly Lys Tyr Thr Ala Asp Gly
225 230 235 240
Gly Lys His Val Ala Tyr Ile Ile Arg Ser Arg Val Lys Asp His Tyr
245 250 255
Ile Phe Tyr Ser Glu Gly Asp Cys Pro Gly Pro Val Pro Gly Val Trp
260 265 270
Leu Val Gly Arg Asp Pro Lys Asn Asn Leu Glu Ala Leu Glu Asp Phe
275 280 285
Glu Lys Ala Ala Gly Ala Arg Gly Leu Ser Thr Glu Ser Ile Leu Ile
290 295 300
Pro Arg Gln Ser Glu Thr Ser Ser Pro Gly Ser Asp Gly Gly Gly Gly
305 310 315 320
Ser Gly Gly Gly Gly Ser Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala
325 330 335
Pro Pro Leu Ser Lys Val Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln
340 345 350
Phe His Gly Lys Trp Tyr Val Val Gly Glu Ala Gly Asn Leu Leu Leu
355 360 365
Arg Glu Asp Lys Asp Pro Arg Lys Met Thr Ala Thr Ile Tyr Glu Leu
370 375 380
Lys Glu Asp Lys Ser Tyr Asp Val Thr Arg Val Glu Phe Gly Ala Lys
385 390 395 400
Thr Tyr Lys Tyr Gln Ile Gly Thr Phe Val Pro Gly Ser Gln Pro Gly
405 410 415
Glu Phe Thr Leu Gly Gly Ile Glu Ser Met Pro Gly Met Thr Ser Phe
420 425 430
Leu Val Arg Val Val Ser Thr Asn Tyr Asn Gln His Ala Ile Val Phe
435 440 445
Phe Lys Tyr Val Tyr Gln Asn Arg Glu Tyr Phe Glu Ile Thr Leu Tyr
450 455 460
Gly Arg Thr Lys Glu Leu Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg
465 470 475 480
Phe Ser Lys Ser Leu Gly Leu Pro Glu Asn His Ile Val Phe Pro Val
485 490 495
Pro Ile Asp Gln Ala Ile Asp Gly Ser Gly Gly Gly Gly Ser Leu Ala
500 505 510
Glu Ala Lys Glu Ala Ala Asn Ala Glu Leu Asp Ser Tyr Gly Val Ser
515 520 525
Asp Phe Tyr Lys Arg Leu Ile Asp Lys Ala Lys Thr Val Glu Gly Val
530 535 540
Glu Ala Leu Lys Asp Ala Ile Leu Ala Ala Leu Pro
545 550 555
<210> 7
<211> 240
<212> Белок
<213> искусственный
<220>
<223> белок слияния
<400> 7
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe His Gly Lys Trp Tyr
20 25 30
Val Val Gly Glu Ala Gly Asn Leu Leu Leu Arg Glu Asp Lys Asp Pro
35 40 45
Arg Lys Met Thr Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr
50 55 60
Asp Val Thr Arg Val Glu Phe Gly Ala Lys Thr Tyr Lys Tyr Gln Ile
65 70 75 80
Gly Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Phe Thr Leu Gly Gly
85 90 95
Ile Glu Ser Met Pro Gly Met Thr Ser Phe Leu Val Arg Val Val Ser
100 105 110
Thr Asn Tyr Asn Gln His Ala Ile Val Phe Phe Lys Tyr Val Tyr Gln
115 120 125
Asn Arg Glu Tyr Phe Glu Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu
130 135 140
Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly
145 150 155 160
Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Ala Ile
165 170 175
Asp Gly Ser Gly Gly Gly Gly Ser Leu Ala Glu Ala Lys Glu Ala Ala
180 185 190
Asn Ala Glu Leu Asp Ser Tyr Gly Val Ser Asp Phe Tyr Lys Arg Leu
195 200 205
Ile Asp Lys Ala Lys Thr Val Glu Gly Val Glu Ala Leu Lys Asp Ala
210 215 220
Ile Leu Ala Ala Leu Pro Ser Ala Trp Ser His Pro Gln Phe Glu Lys
225 230 235 240
<210> 8
<211> 215
<212> Белок
<213> искусственный
<220>
<223> белок слияния
<400> 8
Ala Ser Asp Glu Glu Ile Gln Asp Val Ser Gly Thr Trp Tyr Leu Lys
1 5 10 15
Ala Met Thr Val Asp Phe Trp Cys Ser Gly Ile His Glu Glu Ser Val
20 25 30
Thr Pro Met Thr Leu Thr Thr Leu Glu Gly Gly Asn Leu Glu Ala Lys
35 40 45
Val Thr Met Asp Ile Glu Gly Phe Leu Gln Glu Phe Lys Ala Val Leu
50 55 60
Glu Lys Thr Asp Glu Pro Gly Lys Tyr Thr Ala Asp Gly Gly Lys His
65 70 75 80
Val Ala Tyr Ile Ile Arg Ser Arg Val Lys Asp His Tyr Ile Phe Tyr
85 90 95
Ser Glu Gly Asp Cys Pro Gly Pro Val Pro Gly Val Trp Leu Val Gly
100 105 110
Arg Asp Pro Lys Asn Asn Leu Glu Ala Leu Glu Asp Phe Glu Lys Ala
115 120 125
Ala Gly Ala Arg Gly Leu Ser Thr Glu Ser Ile Leu Ile Pro Arg Gln
130 135 140
Ser Glu Thr Ser Ser Pro Gly Ser Asp Ser Gly Gly Gly Gly Ser Leu
145 150 155 160
Ala Glu Ala Lys Glu Ala Ala Asn Ala Glu Leu Asp Ser Tyr Gly Val
165 170 175
Ser Asp Phe Tyr Lys Arg Leu Ile Asp Lys Ala Lys Thr Val Glu Gly
180 185 190
Val Glu Ala Leu Lys Asp Ala Ile Leu Ala Ala Leu Pro Ser Ala Trp
195 200 205
Ser His Pro Gln Phe Glu Lys
210 215
<210> 9
<211> 403
<212> Белок
<213> искусственный
<220>
<223> белок слияния
<400> 9
Ala Ser Asp Glu Glu Ile Gln Asp Val Ser Gly Thr Trp Tyr Leu Lys
1 5 10 15
Ala Met Thr Val Asp Phe Trp Cys Ser Gly Ile His Glu Glu Ser Val
20 25 30
Thr Pro Met Thr Leu Thr Thr Leu Glu Gly Gly Asn Leu Glu Ala Lys
35 40 45
Val Thr Met Asp Ile Glu Gly Phe Leu Gln Glu Phe Lys Ala Val Leu
50 55 60
Glu Lys Thr Asp Glu Pro Gly Lys Tyr Thr Ala Asp Gly Gly Lys His
65 70 75 80
Val Ala Tyr Ile Ile Arg Ser Arg Val Lys Asp His Tyr Ile Phe Tyr
85 90 95
Ser Glu Gly Asp Cys Pro Gly Pro Val Pro Gly Val Trp Leu Val Gly
100 105 110
Arg Asp Pro Lys Asn Asn Leu Glu Ala Leu Glu Asp Phe Glu Lys Ala
115 120 125
Ala Gly Ala Arg Gly Leu Ser Thr Glu Ser Ile Leu Ile Pro Arg Gln
130 135 140
Ser Glu Thr Ser Ser Pro Gly Ser Asp Gly Gly Gly Gly Ser Gly Gly
145 150 155 160
Gly Gly Ser Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu
165 170 175
Ser Lys Val Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe His Gly
180 185 190
Lys Trp Tyr Val Val Gly Glu Ala Gly Asn Leu Leu Leu Arg Glu Asp
195 200 205
Lys Asp Pro Arg Lys Met Thr Ala Thr Ile Tyr Glu Leu Lys Glu Asp
210 215 220
Lys Ser Tyr Asp Val Thr Arg Val Glu Phe Gly Ala Lys Thr Tyr Lys
225 230 235 240
Tyr Gln Ile Gly Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Phe Thr
245 250 255
Leu Gly Gly Ile Glu Ser Met Pro Gly Met Thr Ser Phe Leu Val Arg
260 265 270
Val Val Ser Thr Asn Tyr Asn Gln His Ala Ile Val Phe Phe Lys Tyr
275 280 285
Val Tyr Gln Asn Arg Glu Tyr Phe Glu Ile Thr Leu Tyr Gly Arg Thr
290 295 300
Lys Glu Leu Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys
305 310 315 320
Ser Leu Gly Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp
325 330 335
Gln Ala Ile Asp Gly Ser Gly Gly Gly Gly Ser Leu Ala Glu Ala Lys
340 345 350
Glu Ala Ala Asn Ala Glu Leu Asp Ser Tyr Gly Val Ser Asp Phe Tyr
355 360 365
Lys Arg Leu Ile Asp Lys Ala Lys Thr Val Glu Gly Val Glu Ala Leu
370 375 380
Lys Asp Ala Ile Leu Ala Ala Leu Pro Ser Ala Trp Ser His Pro Gln
385 390 395 400
Phe Glu Lys
<210> 10
<211> 378
<212> Белок
<213> искусственный
<220>
<223> белок слияния
<400> 10
Ala Ser Asp Glu Glu Ile Gln Asp Val Ser Gly Thr Trp Tyr Leu Lys
1 5 10 15
Ala Met Thr Val Asp Phe Trp Cys Ser Gly Ile His Glu Glu Ser Val
20 25 30
Thr Pro Met Thr Leu Thr Thr Leu Glu Gly Gly Asn Leu Glu Ala Lys
35 40 45
Val Thr Met Asp Ile Glu Gly Phe Leu Gln Glu Phe Lys Ala Val Leu
50 55 60
Glu Lys Thr Asp Glu Pro Gly Lys Tyr Thr Ala Asp Gly Gly Lys His
65 70 75 80
Val Ala Tyr Ile Ile Arg Ser Arg Val Lys Asp His Tyr Ile Phe Tyr
85 90 95
Ser Glu Gly Asp Cys Pro Gly Pro Val Pro Gly Val Trp Leu Val Gly
100 105 110
Arg Asp Pro Lys Asn Asn Leu Glu Ala Leu Glu Asp Phe Glu Lys Ala
115 120 125
Ala Gly Ala Arg Gly Leu Ser Thr Glu Ser Ile Leu Ile Pro Arg Gln
130 135 140
Ser Glu Thr Ser Ser Pro Gly Ser Asp Gly Gly Gly Gly Ser Gly Gly
145 150 155 160
Gly Gly Ser Ala Ser Asp Glu Glu Ile Gln Asp Val Ser Gly Thr Trp
165 170 175
Tyr Leu Lys Ala Met Thr Val Asp Phe Trp Cys Ser Gly Ile His Glu
180 185 190
Glu Ser Val Thr Pro Met Thr Leu Thr Thr Leu Glu Gly Gly Asn Leu
195 200 205
Glu Ala Lys Val Thr Met Asp Ile Glu Gly Phe Leu Gln Glu Phe Lys
210 215 220
Ala Val Leu Glu Lys Thr Asp Glu Pro Gly Lys Tyr Thr Ala Asp Gly
225 230 235 240
Gly Lys His Val Ala Tyr Ile Ile Arg Ser Arg Val Lys Asp His Tyr
245 250 255
Ile Phe Tyr Ser Glu Gly Asp Cys Pro Gly Pro Val Pro Gly Val Trp
260 265 270
Leu Val Gly Arg Asp Pro Lys Asn Asn Leu Glu Ala Leu Glu Asp Phe
275 280 285
Glu Lys Ala Ala Gly Ala Arg Gly Leu Ser Thr Glu Ser Ile Leu Ile
290 295 300
Pro Arg Gln Ser Glu Thr Ser Ser Pro Gly Ser Asp Ser Gly Gly Gly
305 310 315 320
Gly Ser Leu Ala Glu Ala Lys Glu Ala Ala Asn Ala Glu Leu Asp Ser
325 330 335
Tyr Gly Val Ser Asp Phe Tyr Lys Arg Leu Ile Asp Lys Ala Lys Thr
340 345 350
Val Glu Gly Val Glu Ala Leu Lys Asp Ala Ile Leu Ala Ala Leu Pro
355 360 365
Ser Ala Trp Ser His Pro Gln Phe Glu Lys
370 375
<210> 11
<211> 390
<212> Белок
<213> искусственный
<220>
<223> белок слияния
<400> 11
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
130 135 140
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ala Ser Asp
225 230 235 240
Glu Glu Ile Gln Asp Val Ser Gly Thr Trp Tyr Leu Lys Ala Met Thr
245 250 255
Val Asp Phe Trp Cys Ser Gly Ile His Glu Glu Ser Val Thr Pro Met
260 265 270
Thr Leu Thr Thr Leu Glu Gly Gly Asn Leu Glu Ala Lys Val Thr Met
275 280 285
Asp Ile Glu Gly Phe Leu Gln Glu Phe Lys Ala Val Leu Glu Lys Thr
290 295 300
Asp Glu Pro Gly Lys Tyr Thr Ala Asp Gly Gly Lys His Val Ala Tyr
305 310 315 320
Ile Ile Arg Ser Arg Val Lys Asp His Tyr Ile Phe Tyr Ser Glu Gly
325 330 335
Asp Cys Pro Gly Pro Val Pro Gly Val Trp Leu Val Gly Arg Asp Pro
340 345 350
Lys Asn Asn Leu Glu Ala Leu Glu Asp Phe Glu Lys Ala Ala Gly Ala
355 360 365
Arg Gly Leu Ser Thr Glu Ser Ile Leu Ile Pro Arg Gln Ser Glu Thr
370 375 380
Ser Ser Pro Gly Ser Asp
385 390
<210> 12
<211> 553
<212> Белок
<213> искусственный
<220>
<223> белок слияния
<400> 12
Ala Ser Asp Glu Glu Ile Gln Asp Val Ser Gly Thr Trp Tyr Leu Lys
1 5 10 15
Ala Met Thr Val Asp Phe Trp Cys Ser Gly Ile His Glu Glu Ser Val
20 25 30
Thr Pro Met Thr Leu Thr Thr Leu Glu Gly Gly Asn Leu Glu Ala Lys
35 40 45
Val Thr Met Asp Ile Glu Gly Phe Leu Gln Glu Phe Lys Ala Val Leu
50 55 60
Glu Lys Thr Asp Glu Pro Gly Lys Tyr Thr Ala Asp Gly Gly Lys His
65 70 75 80
Val Ala Tyr Ile Ile Arg Ser Arg Val Lys Asp His Tyr Ile Phe Tyr
85 90 95
Ser Glu Gly Asp Cys Pro Gly Pro Val Pro Gly Val Trp Leu Val Gly
100 105 110
Arg Asp Pro Lys Asn Asn Leu Glu Ala Leu Glu Asp Phe Glu Lys Ala
115 120 125
Ala Gly Ala Arg Gly Leu Ser Thr Glu Ser Ile Leu Ile Pro Arg Gln
130 135 140
Ser Glu Thr Ser Ser Pro Gly Ser Asp Gly Gly Gly Gly Ser Gly Gly
145 150 155 160
Gly Gly Ser Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
165 170 175
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
180 185 190
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
195 200 205
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
210 215 220
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
225 230 235 240
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
245 250 255
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
260 265 270
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
275 280 285
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
290 295 300
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
305 310 315 320
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
325 330 335
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
340 345 350
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
355 360 365
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
370 375 380
Ser Leu Ser Pro Gly Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
385 390 395 400
Ala Ser Asp Glu Glu Ile Gln Asp Val Ser Gly Thr Trp Tyr Leu Lys
405 410 415
Ala Met Thr Val Asp Phe Trp Cys Ser Gly Ile His Glu Glu Ser Val
420 425 430
Thr Pro Met Thr Leu Thr Thr Leu Glu Gly Gly Asn Leu Glu Ala Lys
435 440 445
Val Thr Met Asp Ile Glu Gly Phe Leu Gln Glu Phe Lys Ala Val Leu
450 455 460
Glu Lys Thr Asp Glu Pro Gly Lys Tyr Thr Ala Asp Gly Gly Lys His
465 470 475 480
Val Ala Tyr Ile Ile Arg Ser Arg Val Lys Asp His Tyr Ile Phe Tyr
485 490 495
Ser Glu Gly Asp Cys Pro Gly Pro Val Pro Gly Val Trp Leu Val Gly
500 505 510
Arg Asp Pro Lys Asn Asn Leu Glu Ala Leu Glu Asp Phe Glu Lys Ala
515 520 525
Ala Gly Ala Arg Gly Leu Ser Thr Glu Ser Ile Leu Ile Pro Arg Gln
530 535 540
Ser Glu Thr Ser Ser Pro Gly Ser Asp
545 550
<210> 13
<211> 553
<212> Белок
<213> искусственный
<220>
<223> белок слияния
<400> 13
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
130 135 140
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ala Ser Asp
225 230 235 240
Glu Glu Ile Gln Asp Val Ser Gly Thr Trp Tyr Leu Lys Ala Met Thr
245 250 255
Val Asp Phe Trp Cys Ser Gly Ile His Glu Glu Ser Val Thr Pro Met
260 265 270
Thr Leu Thr Thr Leu Glu Gly Gly Asn Leu Glu Ala Lys Val Thr Met
275 280 285
Asp Ile Glu Gly Phe Leu Gln Glu Phe Lys Ala Val Leu Glu Lys Thr
290 295 300
Asp Glu Pro Gly Lys Tyr Thr Ala Asp Gly Gly Lys His Val Ala Tyr
305 310 315 320
Ile Ile Arg Ser Arg Val Lys Asp His Tyr Ile Phe Tyr Ser Glu Gly
325 330 335
Asp Cys Pro Gly Pro Val Pro Gly Val Trp Leu Val Gly Arg Asp Pro
340 345 350
Lys Asn Asn Leu Glu Ala Leu Glu Asp Phe Glu Lys Ala Ala Gly Ala
355 360 365
Arg Gly Leu Ser Thr Glu Ser Ile Leu Ile Pro Arg Gln Ser Glu Thr
370 375 380
Ser Ser Pro Gly Ser Asp Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
385 390 395 400
Ala Ser Asp Glu Glu Ile Gln Asp Val Ser Gly Thr Trp Tyr Leu Lys
405 410 415
Ala Met Thr Val Asp Phe Trp Cys Ser Gly Ile His Glu Glu Ser Val
420 425 430
Thr Pro Met Thr Leu Thr Thr Leu Glu Gly Gly Asn Leu Glu Ala Lys
435 440 445
Val Thr Met Asp Ile Glu Gly Phe Leu Gln Glu Phe Lys Ala Val Leu
450 455 460
Glu Lys Thr Asp Glu Pro Gly Lys Tyr Thr Ala Asp Gly Gly Lys His
465 470 475 480
Val Ala Tyr Ile Ile Arg Ser Arg Val Lys Asp His Tyr Ile Phe Tyr
485 490 495
Ser Glu Gly Asp Cys Pro Gly Pro Val Pro Gly Val Trp Leu Val Gly
500 505 510
Arg Asp Pro Lys Asn Asn Leu Glu Ala Leu Glu Asp Phe Glu Lys Ala
515 520 525
Ala Gly Ala Arg Gly Leu Ser Thr Glu Ser Ile Leu Ile Pro Arg Gln
530 535 540
Ser Glu Thr Ser Ser Pro Gly Ser Asp
545 550
<210> 14
<211> 55
<212> Белок
<213> искусственный
<220>
<223> альбумин-связывающий домен
<400> 14
Ser Ala Gly Ala Val Asp Ala Asn Ser Leu Ala Glu Ala Lys Val Leu
1 5 10 15
Ala Asn Arg Glu Leu Asp Lys Tyr Gly Val Ser Asp Tyr Tyr Lys Asn
20 25 30
Leu Ile Asn Asn Ala Lys Thr Val Glu Gly Val Lys Ala Leu Ile Asp
35 40 45
Glu Ile Leu Ala Ala Leu Pro
50 55
<210> 15
<211> 52
<212> Белок
<213> искусственный
<220>
<223> альбумин-связывающий домен
<400> 15
Ser Gly Gly Gly Gly Ser Leu Ala Glu Ala Lys Glu Ala Ala Asn Ala
1 5 10 15
Glu Leu Asp Ser Tyr Gly Val Ser Asp Phe Tyr Lys Arg Leu Ile Asp
20 25 30
Lys Ala Lys Thr Val Glu Gly Val Glu Ala Leu Lys Asp Ala Ile Leu
35 40 45
Ala Ala Leu Pro
50
<210> 16
<211> 227
<212> Белок
<213> искусственный
<220>
<223> Fc-часть
<400> 16
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
130 135 140
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys
225
<210> 17
<211> 10
<212> Белок
<213> искусственный
<220>
<223> белковая метка
<400> 17
Ser Ala Trp Ser His Pro Gln Phe Glu Lys
1 5 10
<210> 18
<211> 12
<212> Белок
<213> искусственный
<220>
<223> синтетический линкер
<400> 18
Ser Asp Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 19
<211> 10
<212> Белок
<213> искусственный
<220>
<223> синтетический линкер
<400> 19
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 20
<211> 2
<212> Белок
<213> искусственный
<220>
<223> синтетический линкер
<400> 20
Ser Asp
1
<210> 21
<211> 453
<212> ДНК
<213> искусственная
<220>
<223> мутеин липокалина
<400> 21
gcctcagacg aggagattca ggatgtgtca gggacgtggt atctgaaggc catgacggtg 60
gatttttggt gttctgggat tcatgaggag tctgttacgc caatgactct gactaccctt 120
gaaggcggca atctggaggc taaggtcacc atggatattg agggatttct tcaagagttt 180
aaggcagtgt tagagaagac agatgaaccg ggtaaatata cggccgatgg cggtaaacat 240
gttgcctata tcattcgcag ccgtgtgaaa gatcattaca tcttttatag cgagggagat 300
tgtcctggtc cggttccagg ggtgtggctc gtgggcagag accccaagaa caacctggaa 360
gccttggagg actttgagaa agccgcagga gcccgcggac tcagcacgga gagcatcctc 420
atccccaggc agagcgaaac cagctctcca ggg 453
<210> 22
<211> 534
<212> ДНК
<213> искусственная
<220>
<223> мутеин липокалина
<400> 22
caggactcca cctcagacct gatcccagcc ccacctctga gcaaggtccc tctgcagcag 60
aacttccagg acaaccaatt ccatgggaaa tggtatgtcg tgggcgaggc cggaaatctt 120
ttgctgcgtg aggataagga tccgaggaaa atgacggcga ccatttacga gttgaaagaa 180
gataaatcat atgacgtcac ccgggtggag tttggggcta agacatacaa gtaccagatt 240
gggacctttg tgccggggag ccagccgggc gagtttactt taggcggtat tgaaagtatg 300
ccgggcatga catcattttt ggtccgtgtc gtgagcacca actacaacca gcatgccata 360
gtgttcttca agtatgtgta tcagaaccgc gagtattttg agatcacact gtacgggcgc 420
acgaaagaac tgacaagcga gctgaaggaa aattttatcc gcttttccaa atctctgggc 480
ctccctgaaa accacatcgt cttccctgtc ccaatcgacc aggctatcga cggc 534
<210> 23
<211> 1053
<212> ДНК
<213> искусственная
<220>
<223> белок слияния
<400> 23
gcctcagacg aggagattca ggatgtgtca gggacgtggt atctgaaggc catgacggtg 60
gatttttggt gttctgggat tcatgaggag tctgttacgc caatgactct gactaccctt 120
gaaggcggca atctggaggc taaggtcacc atggatattg agggatttct tcaagagttt 180
aaggcagtgt tagagaagac agatgaaccg ggtaaatata cggccgatgg cggtaaacat 240
gttgcctata tcattcgcag ccgtgtgaaa gatcattaca tcttttatag cgagggagat 300
tgtcctggtc cggttccagg ggtgtggctc gtgggcagag accccaagaa caacctggaa 360
gccttggagg actttgagaa agccgcagga gcccgcggac tcagcacgga gagcatcctc 420
atccccaggc agagcgaaac cagctctcca gggagcgacg gtggtggtgg ttctggtggt 480
ggtggatcgc aggactccac ctcagacctg atcccagccc cacctctgag caaggtccct 540
ctgcagcaga acttccagga caaccaattc catgggaaat ggtatgtcgt gggcgaggcc 600
ggaaatcttt tgctgcgtga ggataaggat ccgaggaaaa tgacggcgac catttacgag 660
ttgaaagaag ataaatcata tgacgtcacc cgggtggagt ttggggctaa gacatacaag 720
taccagattg ggacctttgt gccggggagc cagccgggcg agtttacttt aggcggtatt 780
gaaagtatgc cgggcatgac atcatttttg gtccgtgtcg tgagcaccaa ctacaaccag 840
catgccatag tgttcttcaa gtatgtgtat cagaaccgcg agtattttga gatcacactg 900
tacgggcgca cgaaagaact gacaagcgag ctgaaggaaa attttatccg cttttccaaa 960
tctctgggcc tccctgaaaa ccacatcgtc ttccctgtcc caatcgacca ggctatcgac 1020
ggcagcgctt ggtctcaccc gcagttcgaa aaa 1053
<210> 24
<211> 1047
<212> ДНК
<213> искусственная
<220>
<223> белок слияния
<400> 24
caggactcca cctcagacct gatcccagcc ccacctctga gcaaggtccc tctgcagcag 60
aacttccagg acaaccaatt ccatgggaaa tggtatgtcg tgggcgaggc cggaaatctt 120
ttgctgcgtg aggataagga tccgaggaaa atgacggcga ccatttacga gttgaaagaa 180
gataaatcat atgacgtcac ccgggtggag tttggggcta agacatacaa gtaccagatt 240
gggacctttg tgccggggag ccagccgggc gagtttactt taggcggtat tgaaagtatg 300
ccgggcatga catcattttt ggtccgtgtc gtgagcacca actacaacca gcatgccata 360
gtgttcttca agtatgtgta tcagaaccgc gagtattttg agatcacact gtacgggcgc 420
acgaaagaac tgacaagcga gctgaaggaa aattttatcc gcttttccaa atctctgggc 480
ctccctgaaa accacatcgt cttccctgtc ccaatcgacc aggctatcga cggcggcggt 540
ggtggttctg gtggtggtgg atcggcctca gacgaggaga ttcaggatgt gtcagggacg 600
tggtatctga aggccatgac ggtggatttt tggtgttctg ggattcatga ggagtctgtt 660
acgccaatga ctctgactac ccttgaaggc ggcaatctgg aggctaaggt caccatggat 720
attgagggat ttcttcaaga gtttaaggca gtgttagaga agacagatga accgggtaaa 780
tatacggccg atggcggtaa acatgttgcc tatatcattc gcagccgtgt gaaagatcat 840
tacatctttt atagcgaggg agattgtcct ggtccggttc caggggtgtg gctcgtgggc 900
agagacccca agaacaacct ggaagccttg gaggactttg agaaagccgc aggagcccgc 960
ggactcagca cggagagcat cctcatcccc aggcagagcg aaaccagctc tccagggagc 1020
gcttggtctc acccgcagtt cgaaaaa 1047
<210> 25
<211> 1218
<212> ДНК
<213> искусственная
<220>
<223> белок слияния
<400> 25
gcctcagacg aggagattca ggatgtgtca gggacgtggt atctgaaggc catgacggtg 60
gatttttggt gttctgggat tcatgaggag tctgttacgc caatgactct gactaccctt 120
gaaggcggca atctggaggc taaggtcacc atggatattg agggatttct tcaagagttt 180
aaggcagtgt tagagaagac agatgaaccg ggtaaatata cggccgatgg cggtaaacat 240
gttgcctata tcattcgcag ccgtgtgaaa gatcattaca tcttttatag cgagggagat 300
tgtcctggtc cggttccagg ggtgtggctc gtgggcagag accccaagaa caacctggaa 360
gccttggagg actttgagaa agccgcagga gcccgcggac tcagcacgga gagcatcctc 420
atccccaggc agagcgaaac cagctctcca gggagcgacg gtggtggtgg ttctggtggt 480
ggtggatcgc aggactccac ctcagacctg atcccagccc cacctctgag caaggtccct 540
ctgcagcaga acttccagga caaccaattc catgggaaat ggtatgtcgt gggcgaggcc 600
ggaaatcttt tgctgcgtga ggataaggat ccgaggaaaa tgacggcgac catttacgag 660
ttgaaagaag ataaatcata tgacgtcacc cgggtggagt ttggggctaa gacatacaag 720
taccagattg ggacctttgt gccggggagc cagccgggcg agtttacttt aggcggtatt 780
gaaagtatgc cgggcatgac atcatttttg gtccgtgtcg tgagcaccaa ctacaaccag 840
catgccatag tgttcttcaa gtatgtgtat cagaaccgcg agtattttga gatcacactg 900
tacgggcgca cgaaagaact gacaagcgag ctgaaggaaa attttatccg cttttccaaa 960
tctctgggcc tccctgaaaa ccacatcgtc ttccctgtcc caatcgacca ggctatcgac 1020
ggcagcgctg gtgccgtcga cgctaactct ctggctgaag ctaaagttct ggctaaccgt 1080
gaactggaca aatacggtgt ttccgactac tacaaaaacc tcatcaacaa cgctaaaacc 1140
gttgaaggtg ttaaagctct gatcgacgaa attctcgcag cactgccgag cgcttggtct 1200
cacccgcagt tcgaaaaa 1218
<210> 26
<211> 1671
<212> ДНК
<213> искусственная
<220>
<223> белок слияния
<400> 26
gcaagtgatg aagaaattca ggatgttagc ggcacctggt atctgaaagc aatgaccgtt 60
gatttttggt gcagcggtat tcatgaagaa agcgttaccc cgatgaccct gaccaccctg 120
gaaggtggta atctggaagc aaaagttacc atggatattg agggttttct gcaagaattt 180
aaagccgtgc tggaaaaaac cgatgaaccg ggtaaatata ccgcagatgg tggtaaacat 240
gtggcctata ttatccgtag ccgtgtgaaa gatcactata tcttttatag cgaaggtgat 300
tgtccgggtc cggttccggg tgtttggctg gttggtcgtg atccgaaaaa taacctggaa 360
gcactggaag attttgaaaa agcagccggt gcacgtggtc tgagcaccga aagcattctg 420
attccgcgtc agagcgaaac cagcagtcct ggatccgacg gtggtggtgg ttctggtggt 480
ggtggatcgg cctcagacga ggagattcag gatgtgtcag ggacgtggta tctgaaggcc 540
atgacggtgg atttttggtg ttctgggatt catgaggagt ctgttacgcc aatgactctg 600
actacccttg aaggcggcaa tctggaggct aaggtcacca tggatattga gggatttctt 660
caagagttta aggcagtgtt agagaagaca gatgaaccgg gtaaatatac ggccgatggc 720
ggtaaacatg ttgcctatat cattcgcagc cgtgtgaaag atcattacat cttttatagc 780
gagggagatt gtcctggtcc ggttccaggg gtgtggctcg tgggcagaga ccccaagaac 840
aacctggaag ccttggagga ctttgagaaa gccgcaggag cccgcggact cagcacggag 900
agcatcctca tccccaggca gagcgaaacc agctctccag ggagcgacgg cggaggtggc 960
tcaggaggtg gcggatccca ggactccacc tcagacctga tcccagcccc acctctgagc 1020
aaggtccctc tgcagcagaa cttccaggac aaccaattcc atgggaaatg gtatgtcgtg 1080
ggcgaggccg gaaatctttt gctgcgtgag gataaggatc cgaggaaaat gacggcgacc 1140
atttacgagt tgaaagaaga taaatcatat gacgtcaccc gggtggagtt tggggctaag 1200
acatacaagt accagattgg gacctttgtg ccggggagcc agccgggcga gtttacttta 1260
ggcggtattg aaagtatgcc gggcatgaca tcatttttgg tccgtgtcgt gagcaccaac 1320
tacaaccagc atgccatagt gttcttcaag tatgtgtatc agaaccgcga gtattttgag 1380
atcacactgt acgggcgcac gaaagaactg acaagcgagc tgaaggaaaa ttttatccgc 1440
ttttccaaat ctctgggcct ccctgaaaac cacatcgtct tccctgtccc aatcgaccag 1500
gctatcgacg gcagcggcgg cggcggctct ctggctgaag ctaaagaagc ggctaacgcg 1560
gaactggact cttacggtgt ttccgacttt tacaaacgtc tcatcgataa agctaaaacc 1620
gttgaaggtg ttgaagctct gaaagacgcg attctcgcag cactgccgaa a 1671
<210> 27
<211> 720
<212> ДНК
<213> искусственная
<220>
<223> белок слияния
<400> 27
caggactcca cctcagacct gatcccagcc ccacctctga gcaaggtccc tctgcagcag 60
aacttccagg acaaccaatt ccatgggaaa tggtatgtcg tgggcgaggc cggaaatctt 120
ttgctgcgtg aggataagga tccgaggaaa atgacggcga ccatttacga gttgaaagaa 180
gataaatcat atgacgtcac ccgggtggag tttggggcta agacatacaa gtaccagatt 240
gggacctttg tgccggggag ccagccgggc gagtttactt taggcggtat tgaaagtatg 300
ccgggcatga catcattttt ggtccgtgtc gtgagcacca actacaacca gcatgccata 360
gtgttcttca agtatgtgta tcagaaccgc gagtattttg agatcacact gtacgggcgc 420
acgaaagaac tgacaagcga gctgaaggaa aattttatcc gcttttccaa atctctgggc 480
ctccctgaaa accacatcgt cttccctgtc ccaatcgacc aggctatcga cggcagcggc 540
ggcggcggct ctctggctga agctaaagaa gcggctaacg cggaactgga ctcttacggt 600
gtttccgact tttacaaacg tctcatcgat aaagctaaaa ccgttgaagg tgttgaagct 660
ctgaaagacg cgattctcgc agcactgccg agcgcttggt ctcacccgca gttcgaaaaa 720
<210> 28
<211> 645
<212> ДНК
<213> искусственная
<220>
<223> белок слияния
<400> 28
gcctcagacg aggagattca ggatgtgtca gggacgtggt atctgaaggc catgacggtg 60
gatttttggt gttctgggat tcatgaggag tctgttacgc caatgactct gactaccctt 120
gaaggcggca atctggaggc taaggtcacc atggatattg agggatttct tcaagagttt 180
aaggcagtgt tagagaagac agatgaaccg ggtaaatata cggccgatgg cggtaaacat 240
gttgcctata tcattcgcag ccgtgtgaaa gatcattaca tcttttatag cgagggagat 300
tgtcctggtc cggttccagg ggtgtggctc gtgggcagag accccaagaa caacctggaa 360
gccttggagg actttgagaa agccgcagga gcccgcggac tcagcacgga gagcatcctc 420
atccccaggc agagcgaaac cagctctcca gggagcgata gcggcggcgg cggctctctg 480
gctgaagcta aagaagcggc taacgcggaa ctggactctt acggtgtttc cgacttttac 540
aaacgtctca tcgataaagc taaaaccgtt gaaggtgttg aagctctgaa agacgcgatt 600
ctcgcagcac tgccgagcgc ttggtctcac ccgcagttcg aaaaa 645
<210> 29
<211> 1209
<212> ДНК
<213> искусственная
<220>
<223> белок слияния
<400> 29
gcctcagacg aggagattca ggatgtgtca gggacgtggt atctgaaggc catgacggtg 60
gatttttggt gttctgggat tcatgaggag tctgttacgc caatgactct gactaccctt 120
gaaggcggca atctggaggc taaggtcacc atggatattg agggatttct tcaagagttt 180
aaggcagtgt tagagaagac agatgaaccg ggtaaatata cggccgatgg cggtaaacat 240
gttgcctata tcattcgcag ccgtgtgaaa gatcattaca tcttttatag cgagggagat 300
tgtcctggtc cggttccagg ggtgtggctc gtgggcagag accccaagaa caacctggaa 360
gccttggagg actttgagaa agccgcagga gcccgcggac tcagcacgga gagcatcctc 420
atccccaggc agagcgaaac cagctctcca gggagcgacg gcggaggtgg ctcaggaggt 480
ggcggatccc aggactccac ctcagacctg atcccagccc cacctctgag caaggtccct 540
ctgcagcaga acttccagga caaccaattc catgggaaat ggtatgtcgt gggcgaggcc 600
ggaaatcttt tgctgcgtga ggataaggat ccgaggaaaa tgacggcgac catttacgag 660
ttgaaagaag ataaatcata tgacgtcacc cgggtggagt ttggggctaa gacatacaag 720
taccagattg ggacctttgt gccggggagc cagccgggcg agtttacttt aggcggtatt 780
gaaagtatgc cgggcatgac atcatttttg gtccgtgtcg tgagcaccaa ctacaaccag 840
catgccatag tgttcttcaa gtatgtgtat cagaaccgcg agtattttga gatcacactg 900
tacgggcgca cgaaagaact gacaagcgag ctgaaggaaa attttatccg cttttccaaa 960
tctctgggcc tccctgaaaa ccacatcgtc ttccctgtcc caatcgacca ggctatcgac 1020
ggcagcggcg gcggcggctc tctggctgaa gctaaagaag cggctaacgc ggaactggac 1080
tcttacggtg tttccgactt ttacaaacgt ctcatcgata aagctaaaac cgttgaaggt 1140
gttgaagctc tgaaagacgc gattctcgca gcactgccga gcgcttggtc tcacccgcag 1200
ttcgaaaaa 1209
<210> 30
<211> 1134
<212> ДНК
<213> искусственная
<220>
<223> белок слияния
<400> 30
gcaagtgatg aagaaattca ggatgttagc ggcacctggt atctgaaagc aatgaccgtt 60
gatttttggt gcagcggtat tcatgaagaa agcgttaccc cgatgaccct gaccaccctg 120
gaaggtggta atctggaagc aaaagttacc atggatattg agggttttct gcaagaattt 180
aaagccgtgc tggaaaaaac cgatgaaccg ggtaaatata ccgcagatgg tggtaaacat 240
gtggcctata ttatccgtag ccgtgtgaaa gatcactata tcttttatag cgaaggtgat 300
tgtccgggtc cggttccggg tgtttggctg gttggtcgtg atccgaaaaa taacctggaa 360
gcactggaag attttgaaaa agcagccggt gcacgtggtc tgagcaccga aagcattctg 420
attccgcgtc agagcgaaac cagcagtcct ggatccgacg gtggtggtgg ttctggtggt 480
ggtggatcgg cctcagacga ggagattcag gatgtgtcag ggacgtggta tctgaaggcc 540
atgacggtgg atttttggtg ttctgggatt catgaggagt ctgttacgcc aatgactctg 600
actacccttg aaggcggcaa tctggaggct aaggtcacca tggatattga gggatttctt 660
caagagttta aggcagtgtt agagaagaca gatgaaccgg gtaaatatac ggccgatggc 720
ggtaaacatg ttgcctatat cattcgcagc cgtgtgaaag atcattacat cttttatagc 780
gagggagatt gtcctggtcc ggttccaggg gtgtggctcg tgggcagaga ccccaagaac 840
aacctggaag ccttggagga ctttgagaaa gccgcaggag cccgcggact cagcacggag 900
agcatcctca tccccaggca gagcgaaacc agctctccag ggagcgatag cggcggcggc 960
ggctctctgg ctgaagctaa agaagcggct aacgcggaac tggactctta cggtgtttcc 1020
gacttttaca aacgtctcat cgataaagct aaaaccgttg aaggtgttga agctctgaaa 1080
gacgcgattc tcgcagcact gccgagcgct tggtctcacc cgcagttcga aaaa 1134
<210> 31
<211> 1173
<212> ДНК
<213> искусственная
<220>
<223> белок слияния
<400> 31
gacaaaaccc acacctgccc accttgtcct gcccctgaac tgctgggagg accttctgtg 60
tttctgttcc caccaaaacc aaaagatacc ctgatgatct ctagaacccc tgaggtgaca 120
tgtgtggtgg tggatgtgtc tcatgaggac cctgaggtca aattcaactg gtacgtggat 180
ggagtggaag tccacaatgc caaaaccaag cctagagagg aacagtacaa ttcaacctac 240
agagtggtca gtgtgctgac tgtgctgcat caggattggc tgaatggcaa ggaatacaag 300
tgtaaagtct caaacaaggc cctgcctgct ccaattgaga aaacaatctc aaaggccaag 360
ggacagccta gggaacccca ggtctacacc ctgccacctt caagagagga aatgaccaaa 420
aaccaggtgt ccctgacatg cctggtcaaa ggcttctacc cttctgacat tgctgtggag 480
tgggagtcaa atggacagcc tgagaacaac tacaaaacaa ccccccctgt gctggattct 540
gatggctctt tctttctgta ctccaaactg actgtggaca agtctagatg gcagcagggg 600
aatgtctttt cttgctctgt catgcatgag gctctgcata accactacac tcagaaatcc 660
ctgtctctgt ctcctggcaa aggcggcgga ggatccggcg gaggaggtag cgcatcagac 720
gaggaaatcc aggacgtgtc agggacctgg tacctgaaag ccatgaccgt ggatttttgg 780
tgctccggca tccatgagga gtcagtcact cccatgaccc tgacaaccct agaaggtggg 840
aatctggagg ccaaagtgac aatggatatt gagggctttc tccaggagtt caaagccgtc 900
ctcgagaaga cagacgagcc tggaaagtat actgctgatg ggggaaaaca cgtagcctat 960
atcattcgat ctcgggtgaa ggatcattat atcttctatt ccgagggcga ctgccccggc 1020
cctgtgccag gtgtctggct agttgggagg gaccccaaga acaatctcga ggctctggag 1080
gacttcgaga aggcagctgg tgccagggga ttgagcactg agtctatcct tatcccacgc 1140
cagagcgaga cctcaagccc agggtccgac tga 1173
<210> 32
<211> 1659
<212> ДНК
<213> искусственная
<220>
<223> белок слияния
<400> 32
gcatcagacg aggaaatcca ggacgtgtca gggacctggt acctgaaagc catgaccgtg 60
gatttttggt gctccggcat ccatgaggag tcagtcactc ccatgaccct gacaacccta 120
gaaggtggga atctggaggc caaagtgaca atggatattg agggctttct ccaggagttc 180
aaagccgtcc tcgagaagac agacgagcct ggaaagtata ctgctgatgg gggaaaacac 240
gtagcctata tcattcgatc tcgggtgaag gatcattata tcttctattc cgagggcgac 300
tgccccggcc ctgtgccagg tgtctggcta gttgggaggg accccaagaa caatctcgag 360
gctctggagg acttcgagaa ggcagctggt gccaggggat tgagcactga gtctatcctt 420
atcccacgcc agagcgagac ctcaagccca gggtccgacg gcggtggagg atccggtgga 480
ggcggttctg acaaaaccca cacctgccca ccttgtcctg cccctgaact gctgggagga 540
ccttctgtgt ttctgttccc accaaaacca aaagataccc tgatgatctc tagaacccct 600
gaggtgacat gtgtggtggt ggatgtgtct catgaggacc ctgaggtcaa attcaactgg 660
tacgtggatg gagtggaagt ccacaatgcc aaaaccaagc ctagagagga acagtacaat 720
tcaacctaca gagtggtcag tgtgctgact gtgctgcatc aggattggct gaatggcaag 780
gaatacaagt gtaaagtctc aaacaaggcc ctgcctgctc caattgagaa aacaatctca 840
aaggccaagg gacagcctag ggaaccccag gtctacaccc tgccaccttc aagagaggaa 900
atgaccaaaa accaggtgtc cctgacatgc ctggtcaaag gcttctaccc ttctgacatt 960
gctgtggagt gggagtcaaa tggacagcct gagaacaact acaaaacaac cccccctgtg 1020
ctggattctg atggctcttt ctttctgtac tccaaactga ctgtggacaa gtctagatgg 1080
cagcagggga atgtcttttc ttgctctgtc atgcatgagg ctctgcataa ccactacact 1140
cagaaatccc tgtctctgtc tcccgggaaa gggggtgggg gatccggcgg aggaggtagc 1200
gcatcagacg aggaaatcca ggacgtgtca gggacctggt acctgaaagc catgaccgtg 1260
gatttttggt gctccggcat ccatgaggag tcagtcactc ccatgaccct gacaacccta 1320
gaaggtggga atctggaggc caaagtgaca atggatattg agggctttct ccaggagttc 1380
aaagccgtcc tcgagaagac agacgagcct ggaaagtata ctgctgatgg gggaaaacac 1440
gtagcctata tcattcgatc tcgggtgaag gatcattata tcttctattc cgagggcgac 1500
tgccccggcc ctgtgccagg tgtctggcta gttgggaggg accccaagaa caatctcgag 1560
gctctggagg acttcgagaa ggcagctggt gccaggggat tgagcactga gtctatcctt 1620
atcccacgcc agagcgagac ctcaagccca gggtccgac 1659
<210> 33
<211> 1659
<212> ДНК
<213> искусственная
<220>
<223> белок слияния
<400> 33
gacaaaaccc acacctgccc accttgtcct gcccctgaac tgctgggagg accttctgtg 60
tttctgttcc caccaaaacc aaaagatacc ctgatgatct ctagaacccc tgaggtgaca 120
tgtgtggtgg tggatgtgtc tcatgaggac cctgaggtca aattcaactg gtacgtggat 180
ggagtggaag tccacaatgc caaaaccaag cctagagagg aacagtacaa ttcaacctac 240
agagtggtca gtgtgctgac tgtgctgcat caggattggc tgaatggcaa ggaatacaag 300
tgtaaagtct caaacaaggc cctgcctgct ccaattgaga aaacaatctc aaaggccaag 360
ggacagccta gggaacccca ggtctacacc ctgccacctt caagagagga aatgaccaaa 420
aaccaggtgt ccctgacatg cctggtcaaa ggcttctacc cttctgacat tgctgtggag 480
tgggagtcaa atggacagcc tgagaacaac tacaaaacaa ccccccctgt gctggattct 540
gatggctctt tctttctgta ctccaaactg actgtggaca agtctagatg gcagcagggg 600
aatgtctttt cttgctctgt catgcatgag gctctgcata accactacac tcagaaatcc 660
ctgtctctgt ctcctggcaa aggcggcgga ggatccggcg gaggaggtag cgcatcagac 720
gaggaaatcc aggacgtgtc agggacctgg tacctgaaag ccatgaccgt ggatttttgg 780
tgctccggca tccatgagga gtcagtcact cccatgaccc tgacaaccct agaaggtggg 840
aatctggagg ccaaagtgac aatggatatt gagggctttc tccaggagtt caaagccgtc 900
ctcgagaaga cagacgagcc tggaaagtat actgctgatg ggggaaaaca cgtagcctat 960
atcattcgat ctcgggtgaa ggatcattat atcttctatt ccgagggcga ctgccccggc 1020
cctgtgccag gtgtctggct agttgggagg gaccccaaga acaatctcga ggctctggag 1080
gacttcgaga aggcagctgg tgccagggga ttgagcactg agtctatcct tatcccacgc 1140
cagagcgaga cctcaagccc agggtccgac ggcggcggtg ggtccggcgg cggtggctcc 1200
gcgtccgatg aagaaatcca ggatgtgagc ggcacctggt atctgaaagc aatgaccgtt 1260
gacttctggt gctccggcat ccatgaagaa agcgtgaccc caatgacctt gaccacgctg 1320
gaaggcggta atttagaagc caaagtaact atggatatcg aaggcttcct gcaggaattt 1380
aaagcggtgc tggaaaaaac tgatgagcca ggtaaataca ccgccgacgg tggcaaacac 1440
gtggcctata ttatccgttc tcgtgtcaaa gaccattata tcttctactc tgaaggcgat 1500
tgccccggtc cggttccggg cgtctggctt gtcggtcgtg acccgaaaaa caacctggaa 1560
gcactcgaag acttcgaaaa agcggcaggc gcgcgtggtc tgtctaccga gagcatcctt 1620
atcccacgtc agagcgaaac ctccagccct ggttccgat 1659
<210> 34
<211> 165
<212> ДНК
<213> искусственная
<220>
<223> альбумин-связывающий домен
<400> 34
agcgctggtg ccgtcgacgc taactctctg gctgaagcta aagttctggc taaccgtgaa 60
ctggacaaat acggtgtttc cgactactac aaaaacctca tcaacaacgc taaaaccgtt 120
gaaggtgtta aagctctgat cgacgaaatt ctcgcagcac tgccg 165
<210> 35
<211> 156
<212> ДНК
<213> искусственная
<220>
<223> альбумин-связывающий домен
<400> 35
agcggcggcg gcggctctct ggctgaagct aaagaagcgg ctaacgcgga actggactct 60
tacggtgttt ccgactttta caaacgtctc atcgataaag ctaaaaccgt tgaaggtgtt 120
gaagctctga aagacgcgat tctcgcagca ctgccg 156
<210> 36
<211> 681
<212> ДНК
<213> искусственная
<220>
<223> Fc-часть
<400> 36
gacaaaaccc acacctgccc accttgtcct gcccctgaac tgctgggagg accttctgtg 60
tttctgttcc caccaaaacc aaaagatacc ctgatgatct ctagaacccc tgaggtgaca 120
tgtgtggtgg tggatgtgtc tcatgaggac cctgaggtca aattcaactg gtacgtggat 180
ggagtggaag tccacaatgc caaaaccaag cctagagagg aacagtacaa ttcaacctac 240
agagtggtca gtgtgctgac tgtgctgcat caggattggc tgaatggcaa ggaatacaag 300
tgtaaagtct caaacaaggc cctgcctgct ccaattgaga aaacaatctc aaaggccaag 360
ggacagccta gggaacccca ggtctacacc ctgccacctt caagagagga aatgaccaaa 420
aaccaggtgt ccctgacatg cctggtcaaa ggcttctacc cttctgacat tgctgtggag 480
tgggagtcaa atggacagcc tgagaacaac tacaaaacaa ccccccctgt gctggattct 540
gatggctctt tctttctgta ctccaaactg actgtggaca agtctagatg gcagcagggg 600
aatgtctttt cttgctctgt catgcatgag gctctgcata accactacac tcagaaatcc 660
ctgtctctgt ctcctggcaa g 681
<210> 37
<211> 30
<212> ДНК
<213> искусственная
<220>
<223> белковая метка
<400> 37
agcgcttggt ctcacccgca gttcgaaaaa 30
<210> 38
<211> 36
<212> ДНК
<213> искусственная
<220>
<223> синтетический линкер
<400> 38
agcgacggtg gtggtggttc tggtggtggt ggatcg 36
<210> 39
<211> 30
<212> ДНК
<213> искусственная
<220>
<223> синтетический линкер
<400> 39
ggtggtggtg gttctggtgg tggtggatcg 30
<210> 40
<211> 6
<212> ДНК
<213> искусственная
<220>
<223> синтетический линкер
<400> 40
agcgac 6
<210> 41
<211> 152
<212> Белок
<213> человек
<400> 41
Ala Ser Asp Glu Glu Ile Gln Asp Val Ser Gly Thr Trp Tyr Leu Lys
1 5 10 15
Ala Met Thr Val Asp Arg Glu Phe Pro Glu Met Asn Leu Glu Ser Val
20 25 30
Thr Pro Met Thr Leu Thr Thr Leu Glu Gly Gly Asn Leu Glu Ala Lys
35 40 45
Val Thr Met Leu Ile Ser Gly Arg Cys Gln Glu Val Lys Ala Val Leu
50 55 60
Glu Lys Thr Asp Glu Pro Gly Lys Tyr Thr Ala Asp Gly Gly Lys His
65 70 75 80
Val Ala Tyr Ile Ile Arg Ser His Val Lys Asp His Tyr Ile Phe Tyr
85 90 95
Cys Glu Gly Glu Leu His Gly Lys Pro Val Arg Gly Val Lys Leu Val
100 105 110
Gly Arg Asp Pro Lys Asn Asn Leu Glu Ala Leu Glu Asp Phe Glu Lys
115 120 125
Ala Ala Gly Ala Arg Gly Leu Ser Thr Glu Ser Ile Leu Ile Pro Arg
130 135 140
Gln Ser Glu Thr Cys Ser Pro Gly
145 150
<210> 42
<211> 151
<212> Белок
<213> искусственный
<220>
<223> мутеин липокалина
<400> 42
Ala Ser Asp Glu Glu Ile Gln Asp Val Ser Gly Thr Trp Tyr Leu Lys
1 5 10 15
Ala Met Thr Val Asp Phe Trp Cys Ser Gly Ile His Glu Glu Ser Val
20 25 30
Thr Pro Met Thr Leu Thr Thr Leu Glu Gly Gly Asn Leu Glu Ala Lys
35 40 45
Val Thr Met Asp Ile Glu Gly Phe Leu Gln Glu Phe Lys Ala Val Leu
50 55 60
Glu Lys Thr Asp Glu Pro Gly Lys Tyr Thr Ala Asp Gly Gly Lys His
65 70 75 80
Val Ala Tyr Ile Ile Arg Ser His Val Lys Asp His Tyr Ile Phe Tyr
85 90 95
Ser Glu Gly Asp Cys Pro Gly Pro Val Pro Gly Val Trp Leu Val Gly
100 105 110
Arg Asp Pro Lys Asn Asn Leu Glu Ala Leu Glu Asp Phe Glu Lys Ala
115 120 125
Ala Gly Ala Arg Gly Leu Ser Thr Glu Ser Ile Leu Ile Pro Arg Gln
130 135 140
Ser Glu Thr Ser Ser Pro Gly
145 150
<210> 43
<211> 178
<212> Белок
<213> человек
<400> 43
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe Gln Gly Lys Trp Tyr
20 25 30
Val Val Gly Leu Ala Gly Asn Ala Ile Leu Arg Glu Asp Lys Asp Pro
35 40 45
Gln Lys Met Tyr Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr
50 55 60
Asn Val Thr Ser Val Leu Phe Arg Lys Lys Lys Cys Asp Tyr Trp Ile
65 70 75 80
Arg Thr Phe Val Pro Gly Cys Gln Pro Gly Glu Phe Thr Leu Gly Asn
85 90 95
Ile Lys Ser Tyr Pro Gly Leu Thr Ser Tyr Leu Val Arg Val Val Ser
100 105 110
Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe Lys Lys Val Ser Gln
115 120 125
Asn Arg Glu Tyr Phe Lys Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu
130 135 140
Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly
145 150 155 160
Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Cys Ile
165 170 175
Asp Gly
<210> 44
<211> 178
<212> Белок
<213> искусственный
<220>
<223> мутеин липокалина
<400> 44
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe His Gly Lys Trp Tyr
20 25 30
Val Val Gly Glu Ala Gly Asn Leu Leu Leu Arg Glu Asp Lys Asp Pro
35 40 45
Arg Lys Met Thr Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr
50 55 60
Asn Val Thr Arg Val Glu Phe Gly Val Lys Thr Tyr Lys Tyr Gln Ile
65 70 75 80
Gly Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Phe Thr Leu Gly Gly
85 90 95
Ile Lys Ser Met Pro Gly Met Thr Ser Phe Leu Val Arg Val Val Ser
100 105 110
Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe Lys Tyr Val Tyr Gln
115 120 125
Asn Arg Glu Tyr Phe Glu Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu
130 135 140
Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly
145 150 155 160
Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Ala Ile
165 170 175
Asp Gly
<210> 45
<211> 178
<212> Белок
<213> искусственный
<220>
<223> мутеин липокалина
<400> 45
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe His Gly Lys Trp Tyr
20 25 30
Val Val Gly Glu Ala Gly Asn Leu Ile Leu Arg Glu Asp Lys Asp Pro
35 40 45
Arg Lys Met Thr Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr
50 55 60
Asp Val Thr Arg Val Glu Phe Gly Val Lys Thr Arg Lys Tyr Arg Ile
65 70 75 80
Gly Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Phe Thr Leu Gly Gly
85 90 95
Ile Lys Ser Met Pro Gly Met Thr Ser Phe Leu Val Arg Val Val Ser
100 105 110
Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe Lys Tyr Val Tyr Gln
115 120 125
Asn Arg Glu Tyr Phe Glu Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu
130 135 140
Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly
145 150 155 160
Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Ala Ile
165 170 175
Asp Gly
<210> 46
<211> 178
<212> Белок
<213> искусственный
<220>
<223> мутеин липокалина
<400> 46
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe His Gly Lys Trp Tyr
20 25 30
Val Val Gly Glu Ala Gly Asn Leu Leu Leu Arg Glu Asp Lys Asp Pro
35 40 45
Arg Lys Met Thr Ala Thr Ile Tyr Glu Leu Arg Glu Asp Lys Ser Tyr
50 55 60
Asp Val Thr Arg Val Glu Phe Gly Val Lys Thr Tyr Lys Tyr Gln Ile
65 70 75 80
Gly Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Phe Thr Leu Gly Gly
85 90 95
Ile Lys Ser Met Pro Gly Met Thr Ser Phe Leu Val Arg Val Val Ser
100 105 110
Thr Asp Tyr Asn Gln His Ala Met Val Phe Phe Lys Tyr Val Tyr Gln
115 120 125
Asn Arg Glu Tyr Phe Glu Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu
130 135 140
Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly
145 150 155 160
Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Ala Ile
165 170 175
Asp Gly
<210> 47
<211> 456
<212> ДНК
<213> человек
<400> 47
gcctcagacg aggagattca ggatgtgtca gggacgtggt atctgaaggc catgacggtg 60
gacagggagt tccctgagat gaatctggaa tcggtgacac ccatgaccct cacgaccctg 120
gaagggggca acctggaagc caaggtcacc atgctgataa gtggccggtg ccaggaggtg 180
aaggccgtcc tggagaaaac tgacgagccg ggaaaataca cggccgacgg gggcaagcac 240
gtggcataca tcatcaggtc gcacgtgaag gaccactaca tcttttactg tgagggcgag 300
ctgcacggga agccggtccg aggggtgaag ctcgtgggca gagaccccaa gaacaacctg 360
gaagccttgg aggactttga gaaagccgca ggagcccgcg gactcagcac ggagagcatc 420
ctcatcccca ggcagagcga aacctgctct ccaggg 456
<210> 48
<211> 453
<212> ДНК
<213> искусственная
<220>
<223> мутеин липокалина
<400> 48
gcctcagacg aggagattca ggatgtgtca gggacgtggt atctgaaggc catgacggtg 60
gatttttggt gttctgggat tcatgaggag tctgttacgc caatgactct gactaccctt 120
gaaggcggca atctggaggc taaggtcacc atggatattg agggatttct tcaagagttt 180
aaggcagtgt tagagaagac agatgaaccg ggtaaatata cggccgatgg cggtaaacat 240
gttgcctata tcattcgcag ccatgtgaaa gatcattaca tcttttatag cgagggagat 300
tgtcctggtc cggttccagg ggtgtggctc gtgggcagag accccaagaa caacctggaa 360
gccttggagg actttgagaa agccgcagga gcccgcggac tcagcacgga gagcatcctc 420
atccccaggc agagcgaaac cagctctcca ggg 453
<210> 49
<211> 534
<212> ДНК
<213> человек
<400> 49
caggactcca cctcagacct gatcccagcc ccacctctga gcaaggtccc tctgcagcag 60
aacttccagg acaaccaatt ccaggggaag tggtatgtgg taggcctggc agggaatgca 120
attctcagag aagacaaaga cccgcaaaag atgtatgcca ccatctatga gctgaaagaa 180
gacaagagct acaatgtcac ctccgtcctg tttaggaaaa agaagtgtga ctactggatc 240
aggacttttg ttccaggttg ccagcccggc gagttcacgc tgggcaacat taagagttac 300
cctggattaa cgagttacct cgtccgagtg gtgagcacca actacaacca gcatgctatg 360
gtgttcttta agaaagtttc tcaaaacagg gagtacttca agatcaccct ctacgggaga 420
accaaggagc tgacttcgga actaaaggag aacttcatcc gcttctccaa atctctgggc 480
ctccctgaaa accacatcgt cttccctgtc ccaatcgacc agtgtatcga cggc 534
<210> 50
<211> 534
<212> ДНК
<213> искусственная
<220>
<223> мутеин липокалина
<400> 50
caggactcca cctcagacct gatcccagcc ccacctctga gcaaggtccc tctgcagcag 60
aacttccagg acaaccaatt ccatgggaaa tggtatgtcg tgggcgaggc cggaaatctt 120
ttgctgcgtg aggataagga tccgaggaaa atgacggcga ccatttacga gttgaaagaa 180
gataaatcat ataacgtcac ccgggtggag tttggggtta agacatacaa gtaccagatt 240
gggacctttg tgccggggag ccagccgggc gagtttactt taggcggtat taaaagtatg 300
ccgggcatga catcattttt ggtccgcgtc gtgagcacca actacaacca gcatgccatg 360
gtgttcttca agtatgtgta tcagaaccgc gagtattttg agatcacact gtacgggcgc 420
acgaaagaac tgacaagcga gctgaaggaa aattttatcc gcttttccaa atctctgggc 480
ctccctgaaa accacatcgt cttccctgtc ccaatcgacc aggctatcga cggc 534
<210> 51
<211> 534
<212> ДНК
<213> искусственная
<220>
<223> мутеин липокалина
<400> 51
caggactcca cctcagacct gatcccagcc ccacctctga gcaaggtccc tctgcagcag 60
aacttccagg acaaccaatt ccatgggaaa tggtacgtag taggtgaggc cggaaatctg 120
attctgcgtg aggataagga tccgagaaaa atgactgcga ccatttacga gttgaaagaa 180
gataaatcat atgacgtcac cagggtggag tttggggtga agacgcgtaa gtaccggatt 240
gggacctttg tgccggggag ccagccgggc gagtttactt taggcggtat taaaagtatg 300
ccgggcatga catcattttt ggtccgcgtc gtgagcacca actacaacca gcatgccatg 360
gtgttcttca agtacgtgta tcagaaccgc gagtattttg agatcacact gtacgggcgc 420
acgaaagaac tgacaagcga gctgaaggaa aattttatcc gcttttccaa atctctgggc 480
ctccctgaaa accacatcgt cttccctgtc ccaatcgacc aggctatcga cggc 534
<210> 52
<211> 534
<212> ДНК
<213> искусственная
<220>
<223> мутеин липокалина
<400> 52
caggactcca cctcagacct gatcccagcc ccacctctga gcaaggtccc tctgcagcag 60
aacttccagg acaaccaatt ccatgggaaa tggtatgtcg tgggcgaggc cggaaatctt 120
ttgctgcgtg aggataagga tccgaggaaa atgacggcga ccatttacga gttgagagaa 180
gataaatcat atgacgtcac ccgggtggag tttggggtta agacatacaa gtaccagatt 240
gggacctttg tgccggggag ccagccgggc gagtttactt taggcggtat taaaagtatg 300
ccgggcatga catcattttt ggtccgcgtc gtgagcaccg actacaacca gcatgccatg 360
gtgttcttca agtatgtgta tcagaaccgc gagtattttg agatcacact gtacgggcgc 420
acgaaagaac tgacaagcga gttgaaggaa aattttatcc gcttttccaa atctctgggc 480
ctccctgaaa accacatcgt cttccctgtc ccaatcgacc aggctatcga cggc 534
<210> 53
<211> 457
<212> Белок
<213> искусственный
<220>
<223> тяжелая цепь эталонного антитела
<400> 53
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ala Ile Asn Gln Asp Gly Ser Glu Lys Tyr Tyr Val Gly Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Val Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Tyr Tyr Asp Ile Leu Thr Asp Tyr Tyr Ile His Tyr Trp
100 105 110
Tyr Phe Asp Leu Trp Gly Arg Gly Thr Leu Val Thr Val Ser Ser Ala
115 120 125
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser
130 135 140
Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
145 150 155 160
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
165 170 175
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
180 185 190
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr
195 200 205
Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys
210 215 220
Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
225 230 235 240
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
245 250 255
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
260 265 270
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
275 280 285
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
290 295 300
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
305 310 315 320
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
325 330 335
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
340 345 350
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
355 360 365
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
370 375 380
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
385 390 395 400
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
405 410 415
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
420 425 430
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
435 440 445
Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455
<210> 54
<211> 215
<212> Белок
<213> искусственный
<220>
<223> легкая цепь эталонного антитела
<400> 54
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Cys Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 55
<211> 446
<212> Белок
<213> искусственный
<220>
<223> тяжедая цепь эталонного антитела
<400> 55
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asp Tyr
20 25 30
His Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asn Pro Glu Tyr Gly Thr Thr Asp Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Asp Tyr Phe Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro
210 215 220
Cys Pro Ser Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val
260 265 270
Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 56
<211> 219
<212> Белок
<213> искусственный
<220>
<223> легкая цепь эталонного антитела
<400> 56
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Lys His Ser
20 25 30
Arg Gly Asn Thr Phe Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ile Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Ser
85 90 95
Thr His Tyr Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 57
<211> 449
<212> Белок
<213> искусственный
<220>
<223> тяжелая цепь эталонного антитела
<400> 57
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Val Ser Gly Lys Thr Phe Trp Ser Tyr
20 25 30
Gly Ile Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Tyr Ile Gly Thr Gly Tyr Thr Glu Pro Asn Pro Lys Tyr
50 55 60
Lys Gly Arg Val Thr Met Thr Glu Asp Thr Ser Thr Asp Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Ile Gly Gly Tyr Tyr Gly Asn Phe Asp Gln Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 58
<211> 219
<212> Белок
<213> искусственный
<220>
<223> легкая цепь эталонного антитела
<400> 58
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu Ile Ser
20 25 30
Gly Gly Lys Thr Tyr Leu Asn Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Gln Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr Tyr Phe Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 59
<211> 447
<212> Белок
<213> искусственный
<220>
<223> тяжелая цепь эталонного антитела
<400> 59
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Ser Asn Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asp Pro Ser Asn Ser Tyr Thr Arg Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Trp Tyr Tyr Lys Pro Phe Asp Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 60
<211> 217
<212> Белок
<213> искусственный
<220>
<223> легкая цепь эталонного антитела
<400> 60
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile Gly Ser Gly
20 25 30
Tyr Asp Val His Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu
35 40 45
Leu Ile Tyr Gly Asn Ser Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Leu
65 70 75 80
Gln Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ser Trp Thr Asp Gly
85 90 95
Leu Ser Leu Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105 110
Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu
115 120 125
Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe
130 135 140
Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val
145 150 155 160
Lys Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys
165 170 175
Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser
180 185 190
His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu
195 200 205
Lys Thr Val Ala Pro Thr Glu Cys Ser
210 215
<210> 61
<211> 451
<212> Белок
<213> искусственный
<220>
<223> тяжелая цепь сравнительного антитела
<400> 61
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Thr Trp Asn Ser Gly His Ile Asp Tyr Ala Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Ser Tyr Leu Ser Thr Ala Ser Ser Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 62
<211> 214
<212> Белок
<213> искусственный
<220>
<223> легкая цепь сравнительного антитела
<400> 62
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Gln Arg Tyr Asn Arg Ala Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 63
<211> 619
<212> Белок
<213> искусственный
<220>
<223> полипептид слияния
<400> 63
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Thr Trp Asn Ser Gly His Ile Asp Tyr Ala Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Ser Tyr Leu Ser Thr Ala Ser Ser Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
450 455 460
Gly Ser Ala Ser Asp Glu Glu Ile Gln Asp Val Ser Gly Thr Trp Tyr
465 470 475 480
Leu Lys Ala Met Thr Val Asp Phe Trp Cys Ser Gly Ile His Glu Glu
485 490 495
Ser Val Thr Pro Met Thr Leu Thr Thr Leu Glu Gly Gly Asn Leu Glu
500 505 510
Ala Lys Val Thr Met Asp Ile Glu Gly Phe Leu Gln Glu Phe Lys Ala
515 520 525
Val Leu Glu Lys Thr Asp Glu Pro Gly Lys Tyr Thr Ala Asp Gly Gly
530 535 540
Lys His Val Ala Tyr Ile Ile Arg Ser Arg Val Lys Asp His Tyr Ile
545 550 555 560
Phe Tyr Ser Glu Gly Asp Cys Pro Gly Pro Val Pro Gly Val Trp Leu
565 570 575
Val Gly Arg Asp Pro Lys Asn Asn Leu Glu Ala Leu Glu Asp Phe Glu
580 585 590
Lys Ala Ala Gly Ala Arg Gly Leu Ser Thr Glu Ser Ile Leu Ile Pro
595 600 605
Arg Gln Ser Glu Thr Ser Ser Pro Gly Ser Asp
610 615
<210> 64
<211> 644
<212> Белок
<213> искусственный
<220>
<223> полипептид слияния
<400> 64
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Thr Trp Asn Ser Gly His Ile Asp Tyr Ala Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Ser Tyr Leu Ser Thr Ala Ser Ser Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
450 455 460
Gly Ser Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser
465 470 475 480
Lys Val Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe His Gly Lys
485 490 495
Trp Tyr Val Val Gly Glu Ala Gly Asn Leu Leu Leu Arg Glu Asp Lys
500 505 510
Asp Pro Arg Lys Met Thr Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys
515 520 525
Ser Tyr Asp Val Thr Arg Val Glu Phe Gly Ala Lys Thr Tyr Lys Tyr
530 535 540
Gln Ile Gly Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Phe Thr Leu
545 550 555 560
Gly Gly Ile Glu Ser Met Pro Gly Met Thr Ser Phe Leu Val Arg Val
565 570 575
Val Ser Thr Asn Tyr Asn Gln His Ala Ile Val Phe Phe Lys Tyr Val
580 585 590
Tyr Gln Asn Arg Glu Tyr Phe Glu Ile Thr Leu Tyr Gly Arg Thr Lys
595 600 605
Glu Leu Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser
610 615 620
Leu Gly Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln
625 630 635 640
Ala Ile Asp Gly
<210> 65
<211> 1353
<212> ДНК
<213> искусственная
<220>
<223> тяжелая цепь сравнительного антитела
<400> 65
gaagtgcagc tggtcgaaag tggtggtggt ctggtgcagc ccggtagaag tctgcgtctg 60
tcttgtgccg catctggttt tacattcgac gattacgcaa tgcattgggt gagacaggcc 120
cccggcaagg gactggagtg ggtctccgct atcacctgga acagcgggca tattgactac 180
gcagattccg tggaaggcag gttcacaatc tctcgggaca acgccaagaa tagtctgtat 240
ctgcagatga attcactgag ggccgaggat accgccgtgt actattgcgc taaagtctct 300
tatctgtcta ccgcatcatc tctggattac tggggtcagg gaacactggt cactgtctcc 360
tctgctagca caaagggccc tagtgtgttt cctctggctc cctcttccaa atccacttct 420
ggtggcactg ctgctctggg atgcctggtg aaggattact ttcctgaacc tgtgactgtc 480
tcatggaact ctggtgctct gacttctggt gtccacactt tccctgctgt gctgcagtct 540
agtggactgt actctctgtc atctgtggtc actgtgccct cttcatctct gggaacccag 600
acctacattt gtaatgtgaa ccacaaacca tccaacacta aagtggacaa aaaagtggaa 660
cccaaatcct gtgacaaaac ccacacctgc ccaccttgtc ctgcccctga actgctggga 720
ggaccttctg tgtttctgtt cccaccaaaa ccaaaagata ccctgatgat ctctagaacc 780
cctgaggtga catgtgtggt ggtggatgtg tctcatgagg accctgaggt caaattcaac 840
tggtacgtgg atggagtgga agtccacaat gccaaaacca agcctagaga ggaacagtac 900
aattcaacct acagagtggt cagtgtgctg actgtgctgc atcaggattg gctgaatggc 960
aaggaataca agtgtaaagt ctcaaacaag gccctgcctg ctccaattga gaaaacaatc 1020
tcaaaggcca agggacagcc tagggaaccc caggtctaca ccctgccacc ttcaagagag 1080
gaaatgacca aaaaccaggt gtccctgaca tgcctggtca aaggcttcta cccttctgac 1140
attgctgtgg agtgggagtc aaatggacag cctgagaaca actacaaaac aaccccccct 1200
gtgctggatt ctgatggctc tttctttctg tactccaaac tgactgtgga caagtctaga 1260
tggcagcagg ggaatgtctt ttcttgctct gtcatgcatg aggctctgca taaccactac 1320
actcagaaat ccctgtctct gtctcctggc aaa 1353
<210> 66
<211> 642
<212> ДНК
<213> искусственная
<220>
<223> легкая цепь сравнительного антитела
<400> 66
gacatccaga tgacccagag cccaagttcc ctgagcgcaa gcgtcggaga tcgtgtgact 60
attacctgta gagcaagcca gggcatcaga aactacctgg catggtatca gcagaagccc 120
ggtaaagccc ctaagctgct gatctacgcc gcttccactc tgcagtctgg cgtgccaagc 180
aggttctctg gcagtggatc agggaccgac tttaccctga caatttccag cctgcagccc 240
gaggatgtcg ctacatacta ttgccagcgg tacaatcggg caccttatac attcggtcag 300
gggactaaag tggaaatcaa gagaactgtc gcggcgcctt ctgtgttcat tttcccccca 360
tctgatgaac agctgaaatc tggcactgct tctgtggtct gtctgctgaa caacttctac 420
cctagagagg ccaaagtcca gtggaaagtg gacaatgctc tgcagagtgg gaattcccag 480
gaatctgtca ctgagcagga ctctaaggat agcacatact ccctgtcctc tactctgaca 540
ctgagcaagg ctgattacga gaaacacaaa gtgtacgcct gtgaagtcac acatcagggg 600
ctgtctagtc ctgtgaccaa atccttcaat aggggagagt gc 642
<210> 67
<211> 1857
<212> ДНК
<213> искусственная
<220>
<223> полипептид слияния
<400> 67
gaagtgcagc tggtcgaaag tggtggtggt ctggtgcagc ccggtagaag tctgcgtctg 60
tcttgtgccg catctggttt tacattcgac gattacgcaa tgcattgggt gagacaggcc 120
cccggcaagg gactggagtg ggtctccgct atcacctgga acagcgggca tattgactac 180
gcagattccg tggaaggcag gttcacaatc tctcgggaca acgccaagaa tagtctgtat 240
ctgcagatga attcactgag ggccgaggat accgccgtgt actattgcgc taaagtctct 300
tatctgtcta ccgcatcatc tctggattac tggggtcagg gaacactggt cactgtctcc 360
tctgctagca caaagggccc tagtgtgttt cctctggctc cctcttccaa atccacttct 420
ggtggcactg ctgctctggg atgcctggtg aaggattact ttcctgaacc tgtgactgtc 480
tcatggaact ctggtgctct gacttctggt gtccacactt tccctgctgt gctgcagtct 540
agtggactgt actctctgtc atctgtggtc actgtgccct cttcatctct gggaacccag 600
acctacattt gtaatgtgaa ccacaaacca tccaacacta aagtggacaa aaaagtggaa 660
cccaaatcct gtgacaaaac ccacacctgc ccaccttgtc ctgcccctga actgctggga 720
ggaccttctg tgtttctgtt cccaccaaaa ccaaaagata ccctgatgat ctctagaacc 780
cctgaggtga catgtgtggt ggtggatgtg tctcatgagg accctgaggt caaattcaac 840
tggtacgtgg atggagtgga agtccacaat gccaaaacca agcctagaga ggaacagtac 900
aattcaacct acagagtggt cagtgtgctg actgtgctgc atcaggattg gctgaatggc 960
aaggaataca agtgtaaagt ctcaaacaag gccctgcctg ctccaattga gaaaacaatc 1020
tcaaaggcca agggacagcc tagggaaccc caggtctaca ccctgccacc ttcaagagag 1080
gaaatgacca aaaaccaggt gtccctgaca tgcctggtca aaggcttcta cccttctgac 1140
attgctgtgg agtgggagtc aaatggacag cctgagaaca actacaaaac aaccccccct 1200
gtgctggatt ctgatggctc tttctttctg tactccaaac tgactgtgga caagtctaga 1260
tggcagcagg ggaatgtctt ttcttgctct gtcatgcatg aggctctgca taaccactac 1320
actcagaaat ccctgtctct gtctcctggc aaaggcggcg gaggatccgg cggaggaggt 1380
agcggcggag gaggtagcgc atcagacgag gaaatccagg acgtgtcagg gacctggtac 1440
ctgaaagcca tgaccgtgga tttttggtgc tccggcatcc atgaggagtc agtcactccc 1500
atgaccctga caaccctaga aggtgggaat ctggaggcca aagtgacaat ggatattgag 1560
ggctttctcc aggagttcaa agccgtcctc gagaagacag acgagcctgg aaagtatact 1620
gctgatgggg gaaaacacgt agcctatatc attcgatctc gggtgaagga tcattatatc 1680
ttctattccg agggcgactg ccccggccct gtgccaggtg tctggctagt tgggagggac 1740
cccaagaaca atctcgaggc tctggaggac ttcgagaagg cagctggtgc caggggattg 1800
agcactgagt ctatccttat cccacgccag agcgagacct caagcccagg gtccgac 1857
<210> 68
<211> 1932
<212> ДНК
<213> искусственная
<220>
<223> полипептид слияния
<400> 68
gaagtgcagc tggtcgaaag tggtggtggt ctggtgcagc ccggtagaag tctgcgtctg 60
tcttgtgccg catctggttt tacattcgac gattacgcaa tgcattgggt gagacaggcc 120
cccggcaagg gactggagtg ggtctccgct atcacctgga acagcgggca tattgactac 180
gcagattccg tggaaggcag gttcacaatc tctcgggaca acgccaagaa tagtctgtat 240
ctgcagatga attcactgag ggccgaggat accgccgtgt actattgcgc taaagtctct 300
tatctgtcta ccgcatcatc tctggattac tggggtcagg gaacactggt cactgtctcc 360
tctgctagca caaagggccc tagtgtgttt cctctggctc cctcttccaa atccacttct 420
ggtggcactg ctgctctggg atgcctggtg aaggattact ttcctgaacc tgtgactgtc 480
tcatggaact ctggtgctct gacttctggt gtccacactt tccctgctgt gctgcagtct 540
agtggactgt actctctgtc atctgtggtc actgtgccct cttcatctct gggaacccag 600
acctacattt gtaatgtgaa ccacaaacca tccaacacta aagtggacaa aaaagtggaa 660
cccaaatcct gtgacaaaac ccacacctgc ccaccttgtc ctgcccctga actgctggga 720
ggaccttctg tgtttctgtt cccaccaaaa ccaaaagata ccctgatgat ctctagaacc 780
cctgaggtga catgtgtggt ggtggatgtg tctcatgagg accctgaggt caaattcaac 840
tggtacgtgg atggagtgga agtccacaat gccaaaacca agcctagaga ggaacagtac 900
aattcaacct acagagtggt cagtgtgctg actgtgctgc atcaggattg gctgaatggc 960
aaggaataca agtgtaaagt ctcaaacaag gccctgcctg ctccaattga gaaaacaatc 1020
tcaaaggcca agggacagcc tagggaaccc caggtctaca ccctgccacc ttcaagagag 1080
gaaatgacca aaaaccaggt gtccctgaca tgcctggtca aaggcttcta cccttctgac 1140
attgctgtgg agtgggagtc aaatggacag cctgagaaca actacaaaac aaccccccct 1200
gtgctggatt ctgatggctc tttctttctg tactccaaac tgactgtgga caagtctaga 1260
tggcagcagg ggaatgtctt ttcttgctct gtcatgcatg aggctctgca taaccactac 1320
actcagaaat ccctgtctct gtctcctggc aaaggcggcg gaggatccgg gggtggggga 1380
agcggcggag gaggtagcca ggattcaacc agcgatctga ttccagcacc gccactgtcg 1440
aaagtgccac tgcaacaaaa ctttcaagat aaccagtttc acggcaagtg gtatgtggtc 1500
ggggaggccg gtaacctgct gctgagggaa gacaaagatc cacggaaaat gaccgccacc 1560
atctacgagc tgaaagagga taagtcctac gacgtgactc gggtggagtt cggcgcaaaa 1620
acctacaagt accagatcgg caccttcgtg cccggctctc agcctggcga gtttaccctg 1680
ggcggcatcg aatctatgcc cggcatgacc agctttctcg tgcgggtggt gtccaccaac 1740
tacaaccagc acgccatcgt gttcttcaaa tacgtgtacc agaaccgcga gtacttcgag 1800
atcaccctgt acggccggac caaagagctg acctccgaac tgaaagagaa cttcatccgg 1860
ttctccaagt ccctgggcct gcccgagaac cacatcgtgt tccccgtgcc tatcgaccag 1920
gccatcgacg gc 1932
<---