Результат интеллектуальной деятельности: БИБЛИОТЕКИ TCR
Вид РИД
Изобретение
Краткое раскрытие настоящего изобретения
Настоящее изобретение относится к библиотеке частиц, при этом библиотека характеризуется дисплеем множества различных рецепторов Т-клеток (TCR), причем множество TCR по существу состоит из TCR, содержащих вариабельный домен альфа-цепи из естественного репертуара и вариабельный домен бета-цепи из естественного репертуара, причем вариабельный домен альфа-цепи включает генный продукт TRAV12-2 или TRAV21, а вариабельный домен бета-цепи включает генный продукт TRBV6.
Уровень техники
Рецепторы Т-клетки (TCR) опосредуют распознание специфичных, рестриктированных по главному комплексу гистосовместимости (МНС) пептидных антигенов Т-клетками и необходимы для функционирования клеточной ветки иммунной системы. TCR существуют только в связанной с мембраной форме, и по этой причине, как показывает опыт, TCR очень труднодоступны для выделения. Большинство TCR состоит из двух связанных дисульфидной связью полипептидных цепей: альфа- и бета-цепи.
В настоящем документе TCR описаны при помощи Международной иммунногенетической (IMGT) номенклатуры TCR и связаны с общедоступной базой данных IMGT последовательностей TCR. Природные альфа-бета-гетеродимерные TCR имеют альфа-цепь и бета-цепь. В целом, каждая цепь содержит вариабельные, J-сегмент и константные участки, а бета-цепь также обычно содержит короткий участок под названием D-сегмент между вариабельным участком и J-сегментом, но этот D-сегмент часто считают частью J-сегмента. Каждый вариабельный участок содержит три гипервариабельных CDR (определяющих комплементарность участков), окруженных каркасной последовательностью; полагают, что CDR3 является основным посредником распознавания антигена. Существует несколько типов вариабельных (Vα) участков альфа-цепи и несколько типов вариабельных (Vβ) участков бета-цепи, отличающихся своими каркасными, CDR1 и CDR2 последовательностями и частично определенной последовательностью CDR3. Типы Vα в номенклатуре IMGT обозначены под уникальным номером TRAV. Таким образом, «TRAV21» обозначает Vα участок TCR, имеющий уникальные каркасные и CDR1, и CDR2 последовательности и последовательность CDR3, которая частично определяется аминокислотной последовательностью, которая консервативна у различных TCR, но которая также включает аминокислотную последовательность, которая отличается у различных TCR. Таким же образом, «TRBV6-5» обозначает Vβ участок TCR, имеющий уникальные каркасные и CDR1, и CDR2 последовательности, но лишь с частично определяемой последовательностью CDR3. В контексте настоящей заявки, авторы используют общее предположение о том, что существует 54 функциональных гена вариабельных участков альфа-цепи и 67 функциональных генов вариабельных участков бета-цепи соответственно в альфа- и бета-локусах. Однако, это число может варьировать по мере развития исследования, и число генов вариабельных участков альфа- и бета-цепей можно рассматривать как отличающееся от известного в настоящее время в связи с определениями функциональности или дупликаций. Таким образом, для полной ясности, авторы постоянно ссылаются на Международную иммуногенетическую номенклатуру (IMGT) TCR, которую можно найти на веб-сайте IMGT www.imgt.org (согласно доступной на 10 марта 2013 года).
J-сегменты TCR обозначают аналогичным образом при помощи уникальной IMGT-номенклатуры TRAJ и TRBJ, а константные участки при помощи IMGT-номенклатуры TRAC и TRBC.
D-сегмент бета-цепи по IMGT-номенклатуре обозначают под аббревиатурой TRBD, и, как упоминалось, последовательно соединенные участки TRBD/TRBJ часто рассматривают одновременно как J-сегмент.
Генные пулы, которые кодируют альфа- и бета-цепи TCR, локализованы на различных хромосомах и содержат отдельные генные сегменты V, (D), J и С, которые сводятся вместе в результате перестройки в ходе развития Т-клеток. Это приводит к очень высокой изменчивости альфа- и бета-цепей Т-клеток в связи с большим числом потенциальных явлений рекомбинации, которые происходят между 54 генами вариабельных участков альфа-цепей TCR и 61 генами J-сегментов альфа-цепей или между 67 генами вариабельных участков бета-цепей, двумя генами D-сегмента бета-цепей и 13 генами J-сегмента бета-цепей. Процесс рекомбинации не является точным и вносит дополнительное разнообразие в участке CDR3. Каждый ген вариабельного участка альфа- и бета-цепей также может содержать аллельные варианты, соответственно обозначаемые в IMGT-номенклатуре TRAVxx*01 и *02 или TRBVx-х*01 и *02, таким образом дополнительно повышая количество вариантов. Аналогично, некоторые последовательности TRBJ имеют два известных варианта. (Следует отметить, что отсутствие сноски «*» означает, что известен лишь один аллель для соответствующей последовательности). Согласно оценке, естественный репертуар человеческих TCR, получаемый в результате рекомбинации и отбора в тимусе, содержит приблизительно 106 уникальных последовательностей бета-цепи, определенных, исходя из разнообразия CDR3 (Arstila, Т.P., et al (1999) Science, 286(5441), 958-61), и может быть даже более (Robins, H.S. et al. (2009) Blood, 114(9), 4099-4107). По оценке, каждая бета-цепь образует пару по меньшей мере с 25 различными альфа-цепями, таким образом формируя дополнительное разнообразие (Arstila, Т.P., et al (1999) Science, 286(5441), 958-61).
В соответствии с настоящим описанием и формулой изобретения, термин «вариабельный домен альфа (или α) цепи TCR», таким образом, относится к последовательному соединению участков TRAV и TRAJ; только участку TRAV; или участку TRAV и частичному участку TRAJ, а термин константный домен альфа (или α) цепи TCR относится к внеклеточному участку TRAC или к С-концевой укороченной последовательности TRAC. Аналогичным образом, термин «вариабельный домен бета (или β) цепи TCR» может относиться к последовательному соединению участков TRBV и TRBD/TRBJ; только к участкам TRBV и TRBD; только к участкам TRBV и TRBJ; или к участку TRBV и частичным участкам TRBD и/или TRBJ, термин константный домен бета (или β) цепи TCR относится к внеклеточному участку TRBC или к С-концевой укороченной последовательности TRBC.
Уникальные последовательности, обозначаемые при помощи номенклатуры IMGT, широко известны и доступны специалистам в области TCR. Например, их можно найти в общедоступной базе данных IMGT. В работе "Т cell Receptor Factsbook", (2001) LeFranc and LeFranc, Academic Press, ISBN 0-12-441352-8 также раскрыты последовательности, обозначаемые при помощи номенклатуры IMGT, но по причине даты ее публикации и последующего промежутка времени приведенная в ней информация иногда нуждается в подтверждении путем обращения к базе данных IMGT.
Уже долгое время пытались выявить TCR, фактически состоящие из естественных последовательностей альфа- и бета-цепей, которые специфично связываются с конкретными антигенами, так, например, можно разработать TCR или их растворимые аналоги для создания основы для потенциальных терапевтических средств. Антигены, распознаваемые выявленными TCR, могут быть ассоциированы с заболеванием, таким как злокачественная опухоль, вирусные инфекции, аутоиммунные заболевания, паразитарные инфекции и бактериальные инфекции. Следовательно, такие средства терапии можно применять для лечения указанных заболеваний.
Более того, после выявления естественных или природных TCR и определения их последовательностей при необходимости можно внести мутации, которые приводят в результате к повышению аффинности или периода полужизни, как, например, описано в WO 2012/013913.
До настоящего момента попытки выявления TCR, которые специфично связываются с антигенами, которые ассоциированы с заболеванием, такими как антигены злокачественной опухоли, антигены вируса, аутоиммунные или бактериальные антигены, обычно ограничивались применением образцов крови, взятых от добровольных доноров. Такие образцы применяют для выделения Т-клеток и их соответствующих TCR, которые связывают ассоциированные с заболеванием антигены. Для такого подхода обычно необходимо по меньшей мере 20 доноров. Такой способ является длительным и трудоемким, и нет гарантии выявления связывающихся с антигеном рецепторов Т-клеток. При выявлении функциональных рецепторов Т-клеток, они часто обладают слабой аффинностью к антигену, низкой специфичностью и/или не образуют правильную укладку in vitro. Разнообразие Т-клеток, которое доступно для скрининга, ограничено разнообразием Т-клеток доноров. Некоторые ассоциированные с заболеванием антигены, включая основные антигены злокачественных опухолей, являются аутоантигенами; поскольку отбор в тимусе служит для удаления TCR, которые распознают аутоантигены, TCR, специфичные к ассоциированным с заболеванием антигенам могут не присутствовать в естественном репертуаре доноров или же могут иметь слабую аффинность к антигену.
Попытки сконструировать библиотеку для выявления новых TCR со специфичностью связывания антигена уже продолжаются на протяжении нескольких лет. Библиотеки TCR являются гораздо более сложными для создания, чем аналогичные библиотеки антител, поскольку цепи TCR являются менее стабильными и часто неправильно подвергаются дисплею. Сложности, связанные с конструированием библиотеки TCR, огромны. Предпочтительной является сохраняющая изменчивость длины CDR3 (которая встречается в естественных репертуарах). Значительная часть любой библиотеки обычно лишена стоп-кодонов, сдвигов рамки считывания, проблем укладки и комбинаций цепей TCR, что в итоге просто никогда не сможет связаться в комплекс с HLA. Учитывая огромное число генов вариабельных доменов альфа- и бета-цепей, а также генов J и D сегментов, шанс получения и выявления альфа-цепи с функциональной укладкой и бета-цепи с функциональной укладкой, которые вместе формируют TCR, который связывается с антигенным пептидом с необходимой специфичностью, является чрезвычайно низкой.
Был предпринят ряд попыток по конструированию библиотек. Первые, которые описаны ниже в настоящем документе, основываются на синтетических библиотеках TCR; иными словами, TCR в такой библиотеке содержат мутации, обычно в CDR, которые были внесены in vitro при помощи неспецифического мутагенеза. Следовательно, последовательности любой отдельной цепи TCR, которая содержалась в таких библиотеках, могут не соответствовать любым встречающимся в естественном репертуаре. Вся библиотека не будет соответствовать естественному репертуару в связи с тем, что наличием в синтетических библиотеках лишь определенных мутаций. В раскрытых ранее синтетических библиотеках неспецифические мутации вносили в CDR участки альфа- и бета-цепей одного известного TCR, так что все TCR в библиотеке содержали одинаковую каркасную последовательность альфа- и бета-цепи, но со случайно полученными последовательностями CDR. Из результатов последующего анализа библиотеки было видно, что она не подходила для выявления специфичных к антигену TCR. В частности, было обнаружено, что большая доля цепей TCR не были функциональными по различным причинам: во многих случаях последовательности были укорочены или содержали сдвиги рамки считывания. В других случаях, несмотря на то, что были выявлены полноразмерные цепи TCR, они не могли правильно укладываться; наконец, TCR, выделенные из такой библиотеки, не были способны специфично связывать антиген при последующем тестировании. Полагают, что искусственное разнообразие в таких синтетических библиотеках могло быть одной из причин того, почему такие библиотеки не были эффективными. Внесение искусственных мутаций может препятствовать правильной функции TCR. Более того, внесенное в CDR3 разнообразие могло быть ограниченным по сравнению с естественным репертуаром TCR. Как проиллюстрировано на примере длины последовательности CDR3 в естественном репертуаре, значительное разнообразие в последовательностях CDR3 создается в ходе сборки TCR в Т-клетках. Если в основании библиотеки лежат на мутации в конкретных местоположениях, то разнообразие последовательностей CDR3 может быть очень сильно ограниченным, особенно в отношении длины последовательности CDR3. Наконец, синтетические последовательности TCR не будут подвергаться процессу отбора в тимусе, который происходит in vivo.
Такие причины в той или иной мере позволяют объяснить, без привязки к конкретной теории, почему попытки построить библиотеки, из которых надеялись выявить специфично связывающиеся TCR, описанные ниже, не были успешными.
В WO 2005/116646 описана библиотека на основе известного (естественного) TCR, в котором шесть CDR были подвергнуты отдельным мутациям или комбинации мутаций, т.е. все TCR в библиотеке были синтетическими, но основанными на естественном выявленном каркасном участке TCR. WO 2005/114215 дополнительно относится к продуктам, полученным из такой библиотеки. Библиотеку подвергали скринингу при помощи нескольких других антигенов (в дополнение к тем, с которым связывался исходный TCR). Тем не менее, это в результате привело к выделению только одной действующей полноразмерной последовательности TCR. В последующих экспериментах было обнаружено, что такой TCR был перекрестно реактивным.
Таким образом, были сконструированы библиотеки на основе in vitro-мутированных TCR, но из них нельзя было выделить новые TCR со специфичностью связывания с антигеном.
Была сконструирована библиотека, в основе которой лежал полностью естественный репертуар, причем естественные альфа- и бета-цепи перемешивали случайным образом (как описано ниже), но она не была эффективна в выявлении любых TCR, которые специфично связывают антиген.
В частности, в WO 2005/116074 описана библиотека нуклеопротеинов, каждый из которых характеризовался дисплеем на своей поверхности полипептида, содержащего последовательность вариабельного домена альфа-цепи природного TCR или последовательность вариабельного домена бета-цепи природного TCR. Описанную в этой публикации библиотеку конструировали из ряда альфа- и бета-цепей; 43 гена альфа-цепи V класса и 37 генов бета-цепи V класса были представлены в пуле мРНК, из которого амплифицировали кДНК, использованную для создания библиотеки. В этом документе утверждается, что три раунда фагового дисплея приводили к выделению клонов, которые связывались с тестируемым пептидом. Описано, что такие клоны были выявлены при ИФА-скрининге, которые определяли по сильным ИФА-сигналам. Однако, сильные ИФА-сигналы также наблюдали при тестировании таких клонов на связывание альтернативного пептидного HLA; с учетом вышесказанного, клоны TCR не были специфичными к пептиду. Дополнительный анализ такой библиотеки указал на проблемы, схожие с описанными выше проблемами для синтетических библиотек, в том, что они содержали большой процент недействующих цепей TCR, а также TCR, которые не были корректно укладываться. Таким образом, описанная в этом документе библиотека не пригодна для выявления новых связывающихся с антигеном TCR.
Следовательно, существует потребность в библиотеке TCR, которая обеспечивает более надежное выявление функциональных TCR, содержащих естественный вариабельный домен альфа-цепи и естественный вариабельный домен бета-цепи, при этом такую библиотеку можно подвергать скринингу при помощи ряда пептидных антигенов с целью выявления таких пригодных TCR. Выявленные TCR затем можно либо применять по их естественной аффинности, либо можно применять, например, при созревании фагового дисплея, для усиления аффинности.
Следовательно, настоящее изобретение в соответствии с первым аспектом относится к библиотеке частиц, при этом библиотека характеризуется дисплеем множества различных рецепторов Т-клеток (TCR), причем множество TCR по существу состоит из TCR, содержащих альфа-цепь, содержащую вариабельный домен альфа-цепи из естественного репертуара, и бета-цепь, содержащую вариабельный домен бета-цепи из естественного репертуара, причем вариабельный домен альфа-цепи включает генный продукт TRAV12-2 или TRAV21, а вариабельный домен бета-цепи включает генный продукт TRBV6. Вариабельные домены являются такими, как описано выше, т.е. они также соответственно могут содержать полные или частичные участки TRAJ или TRBD и/или TRBJ.
Настоящее изобретение в соответствии со вторым аспектом относится к библиотеке частиц, при этом библиотека характеризуется дисплеем множества различных TCR, причем множество TCR по существу состоит из TCR, содержащих альфа-цепь, содержащую вариабельный домен альфа-цепи из естественного репертуара, и бета-цепь, содержащую вариабельный домен бета-цепи из естественного репертуара, причем вариабельный домен альфа-цепи включает генный продукт TRAV12-2 и/или TRAV21, а вариабельный домен бета-цепи включает генный продукт TRBV6, и причем по меньшей мере часть TCR содержит вариабельный домен альфа-цепи и/или вариабельный домен бета-цепи, содержащий искусственную мутацию.
Генный продукт TRBV6 также может представлять собой любой из генного продукта TRBV6-1, TRBV6-2, TRBV6-3, TRBV6-5 или TRBV6-6. Вариабельный домен альфа-цепи TCR включает генный продукт TRAV12-2. В качестве альтернативы, вариабельный домен альфа-цепи TCR включает генный продукт TRAV21.
Вариабельный домен альфа-цепи и вариабельный домен бета-цепи может подвергаться дисплею в виде одной полипептидной цепи.
TCR подвергаются дисплею на частицах и могут содержать неестественную дисульфидную связь между константным участком альфа-цепи и константным участком бета-цепи. Такие неестественный дисульфидные связи описаны, например, в WO 03/020763. Если TCR, подвергаемый дисплею на частице библиотеки, содержит домен 1 константного участка, то TCR могут содержать естественную дисульфидную связь между константным участком альфа-цепи и константным участком бета-цепи.
Каждая альфа-цепь и каждая бета-цепь может содержать домен димеризации, который предпочтительно является гетерологичным. Такой гетерологичный домен может представлять собой лейциновую застежку, домен 5Н3 или гидрофобные богатые пролином противодомены, или их сходные формы, которые известны в настоящей области.
Образующие библиотеку частицы также могут представлять собой фаговые частицы.
В качестве альтернативы, библиотека может представлять собой библиотеку рибосом. В качестве альтернативы, библиотека может представлять собой библиотеку дрожжевого дисплея, поэтому частицы могут представлять собой дрожжевые клетки.
Настоящее изобретение в соответствии со следующим аспектом относится к выделенному рецептору Т-клеток (TCR), содержащему вариабельный домен альфа-цепи TCR, включающий генный продукт TRAV12-2 или генный продукт TRAV21, и вариабельный домен бета-цепи TCR, включающий генный продукт TRBV6, полученному из библиотеки согласно первому аспекту настоящего изобретения.
Генный продукт TRBV6 такого TCR может представлять собой любой из генного продукта TRBV6-1, TRBV6-2, TRBV6-3, TRBV6-5 или TRBV6-6. TCR предпочтительно является растворимым. Также настоящее изобретение охватывает нуклеиновую кислоту, кодирующую вариабельный домен альфа-цепи TCR и/или вариабельный домен бета-цепи TCR.
В качестве дополнительного аспекта настоящее изобретение относится к применению библиотеки по первому или второму аспекту для выявления TCR, который специфично связывается с пептидным антигеном. Пептидный антиген можно применять для скрининга библиотеки по настоящему изобретению в отношении TCR, с которым он связывается.
В соответствии с дополнительным аспектом настоящее изобретение относится к способу получения библиотеки частиц, при этом библиотека характеризуется дисплеем множества различных TCR, причем способ предусматривает: i) получение множества нуклеиновых кислот, которые кодируют различные вариабельные домены альфа-цепи TRAV12-2 или TRAV21; ii) получение множества нуклеиновых кислот, которые кодируют различные вариабельные домены бета-цепи TRBV6; iii) клонирование нуклеиновых кислот, кодирующих вариабельный домен альфа-цепи TRAV12-2 или TRAV21, в векторы экспрессии; iv) клонирование нуклеиновых кислот, кодирующих вариабельный домен бета-цепи TRBV6, в те же или в различные векторы; и v) экспрессирование векторов в частицах с получением, таким образом, библиотеки, по существу состоящей из TCR, содержащих вариабельный домен альфа-цепи и вариабельный домен бета-цепи, кодируемых такими нуклеиновыми кислотами.
Настоящее изобретение относится к дополнительному способу получения библиотеки частиц, при этом библиотека характеризуется дисплеем множества различных TCR, причем способ предусматривает: i) получение множества нуклеиновых кислот, которые кодируют различные вариабельные домены альфа-цепи TRAV12-2 или TRAV21, с помощью праймеров, которые гибридизируются с нуклеиновыми кислотами, кодирующими вариабельные домены альфа-цепи TRA12-2 или TRAV21; ii) получение множества нуклеиновых кислот, которые кодируют различные вариабельные домены бета-цепи TRBV6, с помощью праймеров, которые гибридизируются с нуклеиновыми кислотами, кодирующими вариабельные домены бета-цепи TRAV6; iii) клонирование нуклеиновых кислот, кодирующих вариабельный домен альфа-цепи TRAV12-2 или TRAV21, в векторы экспрессии; iv) клонирование нуклеиновых кислот, кодирующих вариабельный домен бета-цепи TRBV6, в те же или в различные векторы; и v) экспрессирование векторов в частицах с получением, таким образом, библиотеки, по существу состоящей из TCR, содержащих вариабельный домен альфа-цепи и вариабельный домен бета-цепи, кодируемых такими нуклеиновыми кислотами, с которыми гибридизируются указанные праймеры.
Прямой праймер может быть предназначен для гибридизации с локусом TRAV12-2, локусом TRAV21 или локусом TRBV6. Обратный праймер можно может быть предназначен для гибридизации, по меньшей мере частично, соответственно с константным участком альфа- или бета-цепи, так чтобы получаемый в результате ПЦР-продукт содержал вариабельные участки, вплоть до J-сегментов, и по меньшей мере часть константного участка. Транскрипция, трансляция или посттрансляционные события могут привести в результате к укорочению или делеции некоторых, или всех, из J-сегментов и/или константных участков, включая D-сегмент в случае последовательностей бета-цепи.
Предпочтительно, нуклеиновые кислоты стадии (i) и стадии (ii) получены из естественного репертуара.
В некоторых случаях в нуклеиновые кислоты можно вносить искусственные мутации до стадии iii). Мутации можно вносить после стадии i) и/или ii) или после стадий iii) и/или iv).
Вариабельные домены бета-цепи TRBV6 могут представлять собой вариабельные домены бета-цепи TRBV6-1, TRBV6-2, TRBV6-3, TRBV6-5 или TRBV6-6.
В любом способе получения библиотека по настоящему изобретению вариабельный домен альфа-цепи TCR и вариабельный домен бета-цепи TCR предпочтительно экспрессируется в виде одноцепочечного полипептида, т.е. нуклеиновые кислоты, которые кодируют каждый из вариабельных доменов альфа- и бета-цепи, клонируют в один вектор.
Настоящее изобретение в соответствии с дополнительным аспектом относится к способу получения рецептора Т-клетки, который специфично связывает пептидный антиген, предусматривающему скрининг библиотеки по первому или второму аспекту настоящего изобретения при помощи пептидного антигена.
Также в объем настоящего изобретения включена частица, характеризующаяся дисплеем на своей поверхности TCR в соответствии с настоящим изобретением.
Библиотека по настоящему изобретению является не встречающейся в природе, так как она включает TCR, которые не встречаются в природе или которые можно считать «выделенными» в том смысле, в котором этот термин применяют в настоящем документе; и соответственно TCR по настоящему изобретению аналогичным образом являются патентоспособным объектом изобретения, поскольку такие TCR не встречаются в природе или их можно считать «выделенными» в том смысле, в котором этот термин применяют в настоящем документе. Аналогичным образом, клетки и частицы по настоящему изобретению являются патентоспособным объектом изобретения, поскольку при дисплее на своей поверхности или экспрессии TCR по настоящему изобретению клетка или частица не является встречающейся в природе или ее можно считать «выделенной» в том смысле, в котором этот термин применяют в настоящем документе.
Также следует отметить, что в настоящем раскрытии, и особенно в формуле изобретения и/или абзацах настоящего описания, такие термины, как «содержит», «содержащийся», «содержащий» и т.п., могут иметь обычное приписываемое им значение; например, они могут означать «включает», «включенный», «включающий» и т.п.; и что такие термины, как «фактически состоящий из» и «по существу состоит из», имеют обычно приписываемое им значение, например, они предусматривают элементы, которая явно не перечислены, но исключают элементы, которые относятся к предшествующему уровню техники или которые влияют на основной или новый признак настоящего изобретения.
Эти и другие варианты осуществления раскрыты в последующем описании, или очевидны из него, или охватываются им.
Краткое описание чертежей
Последующее подробное описание, которое приведено лишь для примера, но не предназначено для ограничения настоящего изобретения исключительно до конкретных описанных вариантов осуществления, наилучшим образом можно понять в сочетании с прилагаемыми чертежами, где:
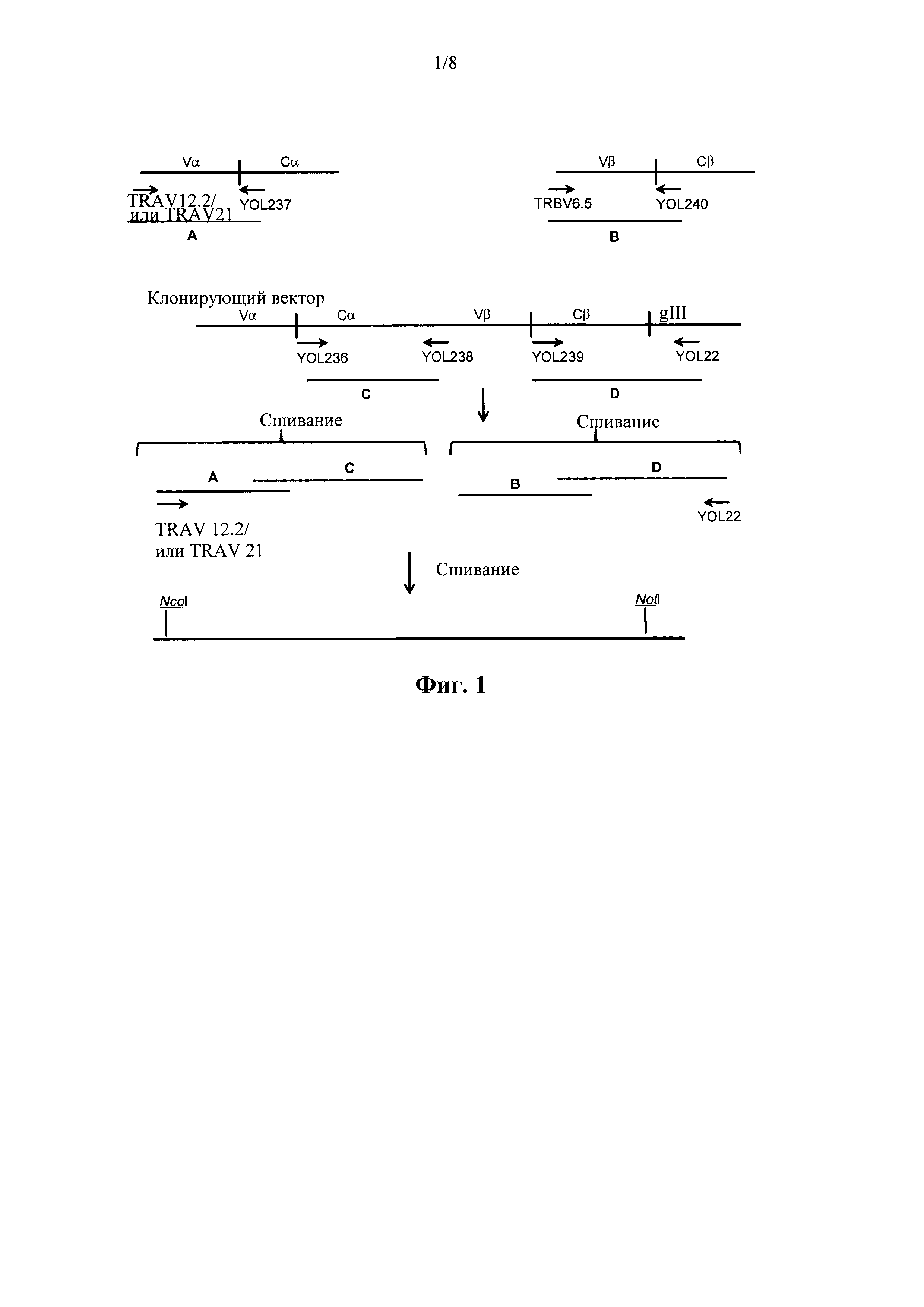
на фиг. 1 изображена стратегия клонирования, применяемая для создания библиотеки;
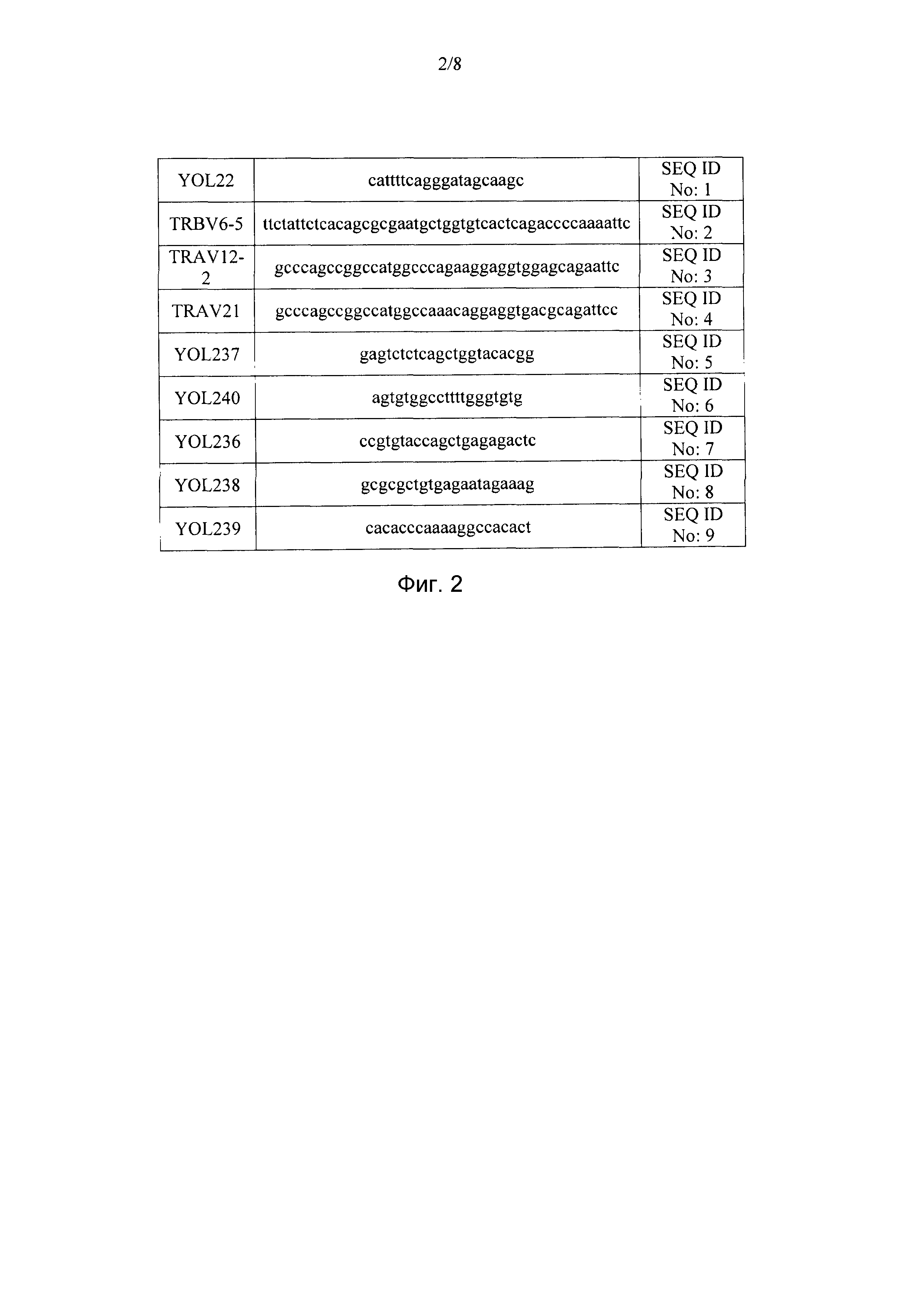
на фиг. 2 подробно описаны праймерные последовательности, применяемые при создании библиотеки;
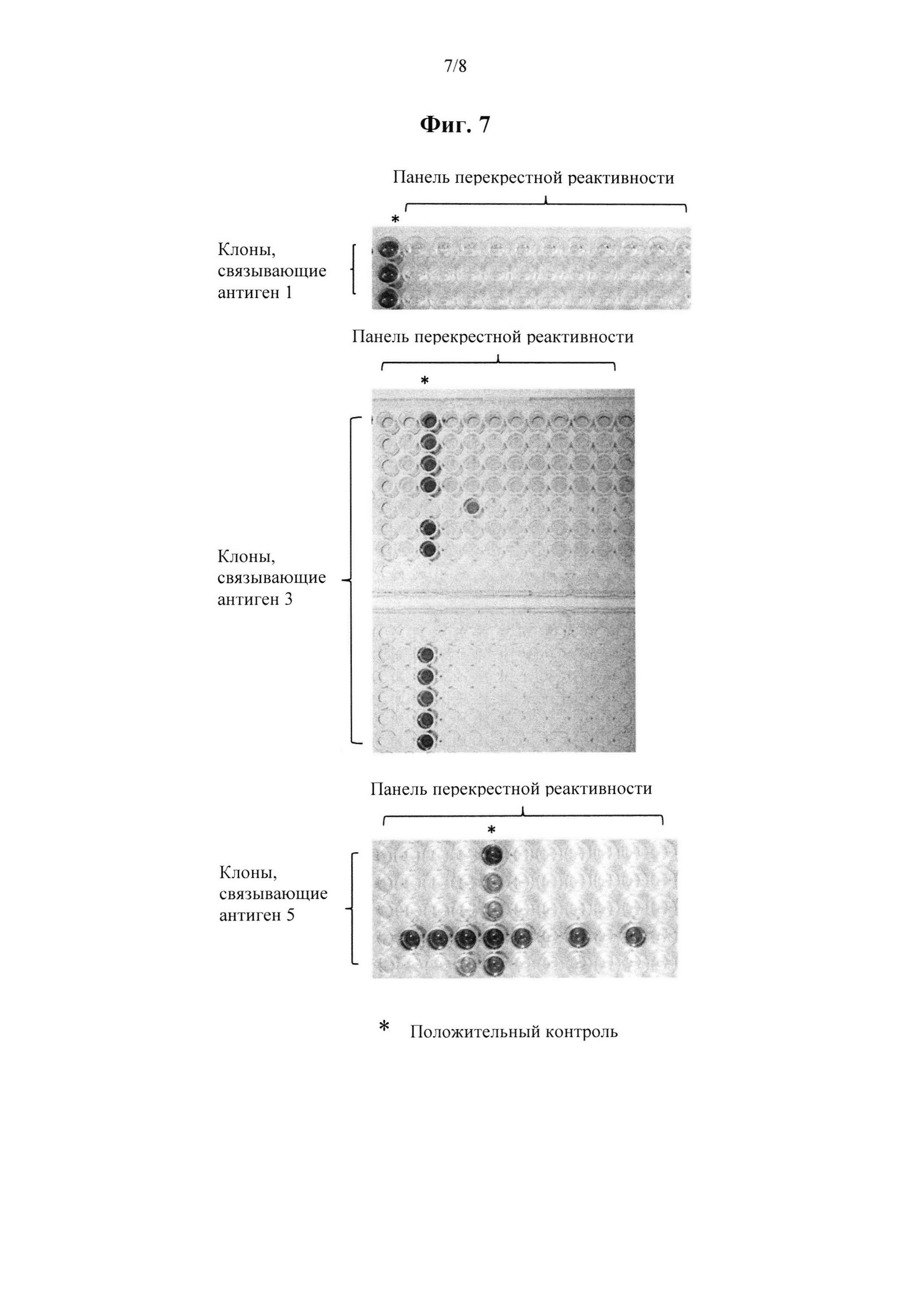
на фиг. 3 показаны результаты ИФА-скрининга объединенной библиотеки TRAV12.2/21 TRBV 6*, разделенной методом пэннинга при помощи 4 различных пептидных антигенов HLA. CMV служит отрицательным контрольным антигеном;
на фиг. 4 показаны результаты ИФА-скрининга объединенной библиотеки TRAV12.2/21 TRBV 6*, полученной от отдельного HLA-A2/A24 отрицательного донора и разделенной методом пэннинга при помощи 3 пептидных антигенов HLA. CMV служит отрицательным контрольным антигеном;
на фиг. 5 показаны результаты ИФА-скрининга отдельных библиотек TRAV 12.2 TRBV 6*/TRAV21 TRBV 6*, разделенных методом пэннинга при помощи 2 пептидных антигенов HLA. CMV служит отрицательным контрольным антигеном;
на фиг. 6 показаны результаты ИФА-скрининга отдельных библиотек TRAV12.2 TRBV 6*/TRAV21 TRBV 6*, полученных из коммерческого источника мРНК и разделенных методом пэннинга при помощи 2 пептидных антигенов HLA. CMV служит отрицательным контрольным антигеном;
на фиг. 7 показаны результаты дополнительных тестов специфичности TCR, выделенных из библиотеки по настоящему изобретению; и
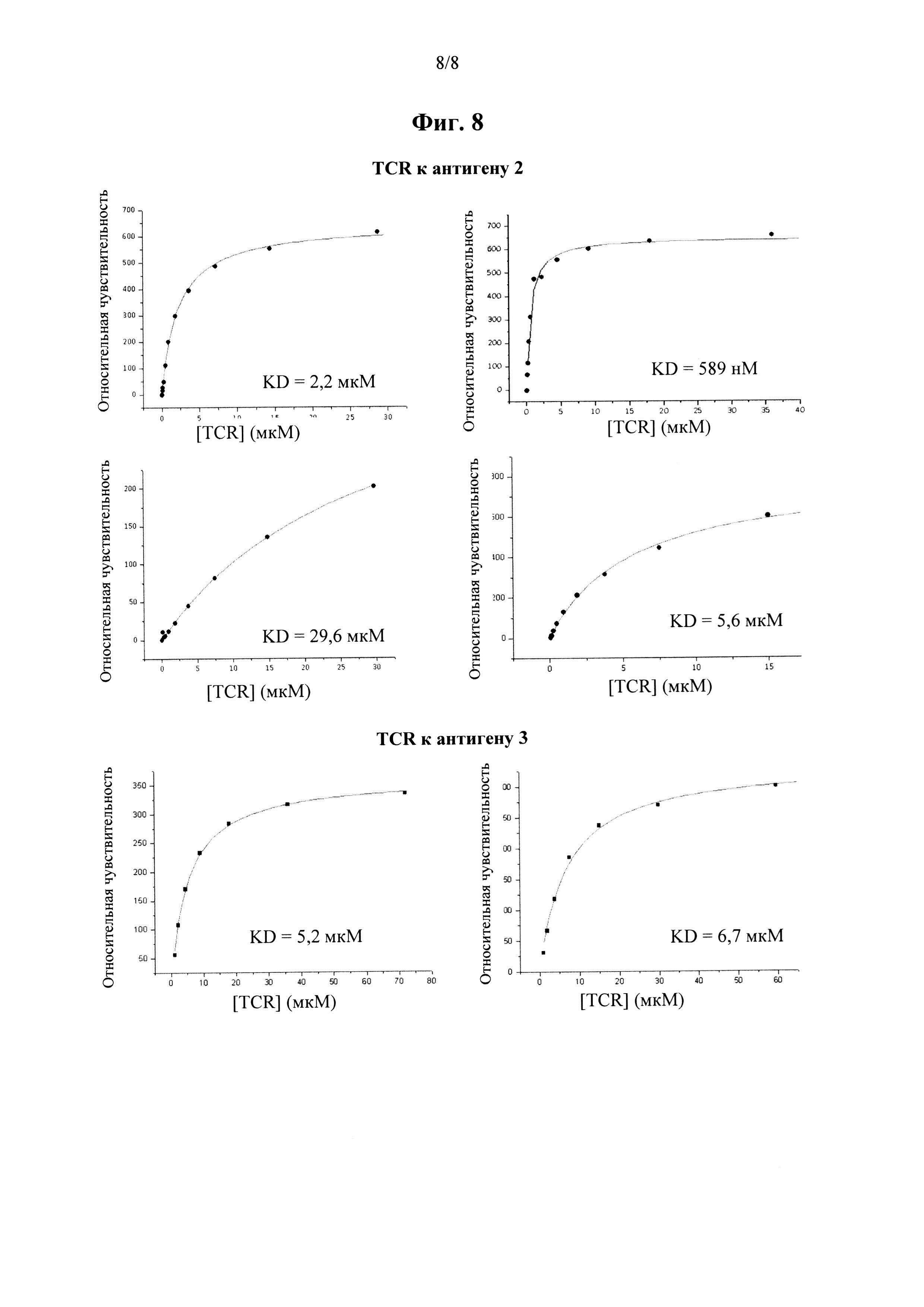
на фиг. 8 показаны кривые связывания Biacore для растворимых вариантов антиген-специфичных TCR, выделенных из библиотеки по настоящему изобретению.
Настоящее изобретение соответственно относится к библиотеке частиц, при этом библиотека характеризуется дисплеем множества различных рецепторов Т-клеток (TCR), причем множество TCR по существу состоит из TCR, содержащих альфа-цепь, содержащую вариабельный домен альфа-цепи из естественного репертуара, и бета-цепь, содержащую вариабельный домен бета-цепи из естественного репертуара, причем вариабельный домен альфа-цепи включает генный продукт TRAV12-2 или TRAV21, а вариабельный домен бета-цепи включает генный продукт TRBV6.
Под «фактически состоящий из» понимают, что основная часть TCR в библиотеке содержит TRAV12-2 или TRAV21 и TRBV6, но меньшая часть может содержать различные вариабельные домены альфа- или бета-цепей в связи с неспецифичной гибридизацией праймеров при получении библиотеки или участками высокой гомологии между генами в генах вариабельных локусов альфа- или бета-цепей. Величину основной части можно определить как указано ниже.
Множество TCR может состоять на 80% из TCR, содержащих вариабельный домен альфа-цепи, включающий генный продукт TRAV12-2 или TRAV21, и вариабельный домен бета-цепи, включающий генный продукт TRBV6. Множество TCR может состоять на 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 100% из TCR, содержащих вариабельный домен альфа-цепи, включающий генный продукт TRAV12-2 или TRAV21, и вариабельный домен бета-цепи, включающий генный продукт TRBV6.
Оставшиеся 20% или менее из множества TCR могут содержать иные генные продукты вариабельного домена альфа-цепи, спаренные с генными продуктами вариабельного домена бета-цепи TRBV6, иные генные продукты вариабельного домена бета-цепи, спаренные с генными продуктами вариабельного домена TRAV12-2 или TRAV21, или укороченные/недействующие цепи.
Таким образом, в соответствии с некоторыми вариантами осуществления вариабельный домен альфа-цепи TCR включает генный продукт TRAV12-2, а в соответствии с другими вариантами осуществления вариабельный домен альфа-цепи TCR включает генный продукт TRAV21. Библиотека может включать множество TCR, причем некоторая доля TCR включает генный продукт TRAV12-2 и некоторая доля TCR включает генный продукт TRAV21.
Таким образом, библиотека по настоящему изобретению может содержать множество TCR, каждый из которых имеет следующее применение гена V, J, (D) и С сегмента альфа-цепи и бета-цепи:
альфа-цепь - TRAV21/TRAJxx/TRAC; или
альфа-цепь - TRAV12-2/TRAJxx/TRAC; и
бета-цепь - TRBV6-y/TRBDx/TRBJxx/TRBC1, TRBC2 или химера из С1 и С2,
где xx соответственно является любым из 61 генов J сегмента альфа-цепи или 13 генов J сегмента бета-цепи, a Dx представляет собой любой из 2 генов D сегмента бета-цепи. TRBV6-y указывает на то, что применяемый аллель TRBV6 может изменяться.
Генный продукт TRBV также может представлять собой генный продукт TRBV6-1, TRBV6-2, TRBV6-3, TRBV6-5 или TRBV6-6.
Как обсуждалось ранее, каждый из J, D или С участков может полностью или частично присутствовать или отсутствовать.
Под выражением «из естественного репертуара» понимают, что вариабельные домены альфа- и бета-цепей TCR экспрессируется с последовательностей ДНК, которые были получены от доноров-людей. Иными словами, разнообразие вариабельных доменов альфа- и бета-цепей TCR библиотеки было естественным путем создано в ходе развития Т-клеток in vivo. Более того, это означает, что последовательности всех альфа- и бета-цепей в библиотеке будут подвергнуты отбору в ходе отбора в тимусе. Случайное комбинирование таких альфа- и бета-цепей, которое происходит в ходе создания библиотеки, может в результате дать альтернативный репертуар комбинаций альфа- и бета-цепей в сравнении с таким, который изначально присутствует in vivo (т.е. у донора (доноров)). Последовательности ДНК можно получить опосредованно, например, путем получения кДНК с донорской мРНК. Последовательности кДНК затем можно применять в качестве матриц для получения последовательностей ДНК, с которых получают множество различных TCR.
Под генным продуктом подразумевают полипептид, который может включать посттрансляционную модификацию, который кодируется последовательностью нуклеиновой кислоты указанного гена. Специалисту в настоящей области известно, что каждый ген вариабельного домена альфа- или бета-цепи TCR содержит вариацию в участках CDR3, которая обсуждалось выше, означая, что генные продукты также будут значительно варьировать.
Библиотека по настоящему изобретению предпочтительно содержит по меньшей мере 1×108 частиц, которые характеризуются дисплеем комбинацию αβ цепи TCR.
Библиотека может представлять собой библиотеку фаговых частиц. Фаговый дисплей описан в WO 2004/044004.
В качестве альтернативы, библиотека представляет собой библиотеку рибосом. Рибосомный дисплей известен из уровня техники. Частицы могут представлять собой полные рибосомальные комплексы или их части.
Можно применять системы дрожжевого дисплея, что означает, что библиотека может представлять собой библиотеку дрожжевых клеток.
Дополнительной методологией дисплея, подходящей для создания библиотек TCR, является дисплей клеток млекопитающих. В этой системе применяют ретровирусный вектор для внесения альфа- и бета-цепей TCR в TCR-отрицательную гибридому Т-клеток. Этот способ дополнительно описан в работе Chervin et al. (2008) J Immunol Methods, 339, 175-84; и в работе Kessels et al. (2000) Proc Natl Acad Sci USA, 97, 14578-83).
Настоящим изобретением охватывается любая библиотека частиц, которая может характеризоваться дисплеем гетеродимерных или одноцепочечных описываемых TCR.
Константный домен альфа- и/или бета-цепи может быть укороченным относительно природных/встречающихся в природе последовательностей TRAV/TRBV. Кроме того, при необходимости TRAC/TRBC может содержать модификации. Внеклеточная последовательность альфа-цепи может включать модификацию по отношению к природному/встречающемуся в природе TRAC, посредством которой аминокислота Т48 в TRAC, по нумерации IMGT, заменена на С48. Аналогичным образом, внеклеточная последовательность бета-цепи может включать модификацию по отношению к природному/встречающемуся в природе TRBC1 или TRBC2, посредством которой S57 в TRBC1 или TRBC2, по нумерации IMGT, заменена на С57, и С75 заменена на А75, и N89 заменена на D89. Такие цистеиновые замены относительно природных внеклеточных последовательностей альфа- и бета-цепей делают возможным формирование неестественной межцепочечной дисульфидной связи, которая стабилизирует повторно уложенный растворимый TCR, т.е. TCR, сформированный в результате рефолдинга внеклеточных альфа- и бета-цепей. Эта неестественная дисульфидная связь способствует дисплею правильно уложенных TCR на фаге. (Li, Y., et al. Nat Biotechnol 2005: 23(3), 349-54). В дополнение к этому, применение стабильного, связанного дисульфидными связями растворимого TCR обеспечивает более удобную оценку аффинности связывания и периода полужизни связывания. Альтернативные замены описаны в WO 03/020763. В качестве альтернативы, константные домены альфа- и бета-цепей могут быть соединены при помощи дисульфидной связи, которая соответствует встречающейся в природе.
Для дополнительной или альтернативной стабилизации гетеродимерных TCR каждая альфа-цепь и каждая бета-цепь может содержать домен димеризации, который может быть гетерологичным для природной последовательности цепи TCR.
В частности, домен димеризации может представлять собой лейциновую застежку. Этим термином описывают пары спиральных пептидов, которые особым образом взаимодействуют другим с другом с формированием гетеродимера. Такое взаимодействие происходит, поскольку есть комплементарные гидрофобные остатки вдоль одной стороны каждого пептида застежки. Природа пептидов является такой, что формирование гетеродимеров намного более выгодное, чем формирование гомодимеров спиралей. Лейциновые застежки могут быть синтетическими или встречающимися в природе, такими как описанные в WO 99/60120. Альтернативные домены димеризации включают элементы, формирующие дисульфидный мостик. В качестве альтернативы можно предложить домены SH3 и гидрофобные/богатые пролином противодомены, которые отвечают за белок-белковые взаимодействия, наблюдаемые среди белков, вовлекаемых в сигнальную трансдукцию (рассмотрено у Schlessinger, (Schlessinger, J., Curr Opin Genet Dev. 1994 Feb; 4(1):25-30). Другие естественные белок-белковые, встречающиеся среди белков, участвующих в каскадах сигнальной трансдукции, лежат в основе ассоциаций между посттрансляционно модифицируемыми аминокислотами и белковыми модулями, которые специфично распознают такие модифицированные остатки. Такие посттрансляционно модифицируемые аминокислоты и белковые модули могут формировать домен димеризации из цепей TCR библиотеки в соответствии с настоящим изобретением.
Без привязки к конкретной теории, полагают, что размер библиотеки по настоящему изобретению, т.е. уменьшенное число генов вариабельного домена альфа- и бета-цепи, которые в ней представлены, по отношению к полному (или почти полному) репертуару, является возможной причиной того, почему из библиотеки по настоящему изобретению можно выявить специфичные функциональные TCR. В более крупных ранее описанных «естественных» библиотеках, возможно, что некоторые альфа-цепи не образуют пару с некоторыми бета-цепями, и поэтому большая часть библиотеки является нефункциональной. Возможно, что некоторые типы цепей не образуют правильную укладку на поверхности фага. Возможно, что каждая альфа-цепь не экспрессируется или подвергается дисплею в достаточной степени часто для образования пары с «идеальной» бета-цепью, и наоборот, и таким образом уменьшая шансы выявления специфичного функционального TCR, содержащего альфа и бета-цепь. Вместе с тем, возможно, что некоторые последовательности альфа- или бета-цепи являются преобладающими и поэтому играют роль «яда» для библиотеки.
Настоящее изобретение также относится к библиотеке частиц, при этом библиотека характеризуется дисплеем множества различных TCR, причем множество TCR по существу состоит из TCR, содержащих вариабельный домен альфа-цепи из естественного репертуара и вариабельный домен бета-цепи из естественного репертуара, причем вариабельный домен альфа-цепи включает генный продукт TRAV12-2 или TRAV21, а вариабельный домен бета-цепи включает генный продукт TRBV6, и причем по меньшей мере часть TCR содержит вариабельный домен альфа-цепи и/или вариабельный домен бета-цепи, содержащий искусственную мутацию.
Искусственные мутации можно вносить любым известным в настоящей области способом. Искусственные мутации можно создать случайно, или задать специально, или и то, и другое. Например, случайно созданные мутации можно вносить в определенные положения при помощи сайт-насыщающего мутагенеза, в ходе которого природная аминокислотная кодирующая последовательность заменяется на кодирующую последовательность с любыми иными встречающимися в природе аминокислотами; таким образом создавая дополнительное разнообразие в библиотеке в определенном положении. Способ может предусматривать реплицирование представляющей интерес ДНК путем ПЦР-амплификации с вырожденными синтетическими олигонуклеотидами в качестве праймеров. В качестве альтернативы, или дополнительно, определенные мутации, включая вставки и делеции, можно вносить в конкретные положения при помощи, например, коммерчески доступных наборов, таких как набор для сайт-направленного мутагенеза Quik Change Site Directed Mutagensis Kit от Stratagene. Предпочтительно искусственные мутации вносят в CDR участки.
Библиотека может характеризоваться дисплеем TCR, при этом 10%, 15%, 20%, 25%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95% или 100% вариабельных доменов альфа-цепи или вариабельных доменов бета-цепи содержат искусственную мутацию.
Настоящее изобретение в соответствии с дополнительным аспектом относится к выделенному рецептору Т-клеток (TCR), содержащему вариабельный домен альфа-цепи TCR, включающий генный продукт TRAV12-2 или TRAV21, и вариабельный домен бета-цепи TCR, включающий генный продукт TRBV6, выделенному из библиотеки в соответствии с первым аспектом по настоящему изобретению.
Под выделенным понимают, что TCR удален из его естественной среды, т.е. не TCR, который естественным образом подвергается дисплею на Т-клетке in vivo.
TCR может специфично связываться с пептидным антигеном. Такой TCR, полученный из библиотеки по настоящему изобретению, с сильной аффинностью и высокой специфичностью может связываться с пептидным антигеном, что определяют при помощи, например, без ограничения ИФА или BiaCore. TCR можно подвергнуть дополнительной созреванию аффинности с тем, чтобы повысить аффинность связывания и/или период полужизни. TCR может быть растворимым, т.е. его можно отщепить от трансмембранного домена, например, как описано в WO 03/020763. TCR может содержать неестественную дисульфидную связь, как описано выше. TCR может быть гибридизирован с детектируемыми метками, включая без ограничения флуоресцентные метки, радиоактивные метки, ферменты, зонды нуклеиновых кислот и контрастные реактивы, или с терапевтическими средствами, включая без ограничения иммуномодуляторы, радиоактивные соединения, ферменты (например, перфорин) или химиотерапевтические средства (например, цисплатин) (WO 2010/133828). TCR можно искусственно экспрессировать на поверхности клеток, предпочтительно клеток млекопитающих, более предпочтительно иммуноцитов, еще более предпочтительно Т-клеток.
Аффинность связывания (обратно пропорциональная равновесной константе KD) и период полужизни связывания (выраженный как 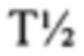 ) можно определить при помощи любого подходящего способа. Понятно, что удвоение аффинности TCR приводит в результате к уменьшению в два раза KD.
) можно определить при помощи любого подходящего способа. Понятно, что удвоение аффинности TCR приводит в результате к уменьшению в два раза KD. 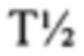 рассчитывают как ln2, деленный на скорость диссоциации (koff). Поэтому удвоение
рассчитывают как ln2, деленный на скорость диссоциации (koff). Поэтому удвоение 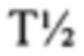 приводит в результате к уменьшению в два раза koff. Значения KD и koff для TCR обычно измеряют для растворимых форм TCR, т.е. таких форм, которые являются укороченными с удалением гидрофобных остатков трансмембранных доменов. С учетом вышесказанного, следует понимать, что данный TCR соответствует критерию в том, что он обладает аффинностью связывания к и/или периодом полужизни связывания с пептидным антигеном, если растворимая форма такого TCR соответствует такому критерию. Предпочтительно аффинность связывания или период полужизни связывания данного TCR измеряют несколько раз, при определенной температуре, при помощи одинакового протокола анализа и берут усредненный результат. Более предпочтительно аффинность связывания или период полужизни связывания измеряют при помощи поверхностного плазмонного резонанса при температуре 25°С. Предпочтительный способ приведен в Примере 10.
приводит в результате к уменьшению в два раза koff. Значения KD и koff для TCR обычно измеряют для растворимых форм TCR, т.е. таких форм, которые являются укороченными с удалением гидрофобных остатков трансмембранных доменов. С учетом вышесказанного, следует понимать, что данный TCR соответствует критерию в том, что он обладает аффинностью связывания к и/или периодом полужизни связывания с пептидным антигеном, если растворимая форма такого TCR соответствует такому критерию. Предпочтительно аффинность связывания или период полужизни связывания данного TCR измеряют несколько раз, при определенной температуре, при помощи одинакового протокола анализа и берут усредненный результат. Более предпочтительно аффинность связывания или период полужизни связывания измеряют при помощи поверхностного плазмонного резонанса при температуре 25°С. Предпочтительный способ приведен в Примере 10.
В контексте настоящего изобретения, как описано выше, TCR представляет собой молекулу, имеющую по меньшей мере один вариабельный домен альфа-цепи TCR и по меньшей мере один вариабельный домен бета-цепи TCR. Обычно он будет содержать как вариабельный домен альфа-цепи TCR, так и вариабельный домен бета-цепи TCR. Они могут представлять собой αβ гетеродимеры или могут иметь одноцепочечный формат, под которым понимают, что отдельный полипептид содержит как альфа-цепь, так и бета-цепь, например, как описано в WO 2004/033685. В качестве альтернативы, TCR может содержать внеклеточный домен α-цепи TCR, димеризованный с внеклеточным доменом β-цепи TCR путем образования пары С-концевых пептидов димеризации, таких как лейциновые застежки, такие TCR описаны в WO 99/60120. Для применения в адоптивной терапии αβ гетеродимерный TCR, например, можно трансфицировать в клетки, такие как Т-клетки, в виде полноразмерных цепей, имеющих как цитоплазматические, так и трансмембранные домены. При необходимости может присутствовать внесенная дисульфидная связь между остатками соответствующих константных доменов (см., например, WO 2006/000830). В качестве альтернативы, константные домены альфа- и бета-цепей могут быть соединены при помощи дисульфидной связи, которая соответствует встречающейся в природе.
Важно отметить, что, какой бы ни был формат, TCR библиотеки в соответствии с первым аспектом настоящего изобретения, поскольку имеют дело с вариабельными доменами альфа- и бета-цепи, происходят от встречающихся в природе последовательностей, которые не были модифицированы или подвергнуты мутации относительно мРНК донора, которая служит в качестве матрицы для создания кДНК, с которой амплифицируют цепи TCR.
Также настоящее изобретение относится к нуклеиновой кислоте, которая кодирует вариабельный домен альфа-цепи TCR и/или вариабельный домен бета-цепи TCR по настоящему изобретению. Альфа- и бета-цепи можно экспрессировать с отдельных нуклеиновых кислот или с одной молекулы нуклеиновой кислоты. В случае экспрессии с одной молекулы нуклеиновой кислоты, альфа- и бета-цепи можно экспрессировать в виде независимых полипептидов или в виде одной цепи.
Нуклеиновая кислота содержит последовательность TRAV12-2 или TRAV21 и/или последовательность нуклеиновой кислоты TRBV6. Нуклеиновая кислота также может содержать последовательность TRAJ и/или последовательность TRBD/TRBJ. Нуклеиновая кислота также может содержать последовательность нуклеиновой кислоты TRAC и/или TRBC1 или TRBC2 или частичные их последовательности.
В соответствии с дополнительным аспектом настоящее изобретение относится к применению библиотеки по первому и второму аспекту для выявления TCR, который специфично связывается с пептидным антигеном. Как упоминалось, TCR, которые специфично связываются с пептидным антигеном, необходимы по ряду причин.
В соответствии со следующим аспектом настоящее изобретение относится к способу получения библиотеки по первому аспектом настоящего изобретения. Способ предусматривает: i) получение множества нуклеиновых кислот, которые кодируют различные вариабельные домены альфа-цепи TRAV12-2 или TRAV21; ii) получение множества нуклеиновых кислот, которые кодируют различные вариабельные домены бета-цепи TRBV6; iii) клонирование нуклеиновых кислот, кодирующих вариабельный домен альфа-цепи TRAV12-2 или TRAV21, в векторы экспрессии; iv) клонирование нуклеиновых кислот, кодирующих вариабельный домен бета-цепи TRBV6, в те же или в различные векторы; и v) экспрессирование векторов в частицах с получением, таким образом, библиотеки, по существу состоящей из TCR, содержащих вариабельный домен альфа-цепи и вариабельный домен бета-цепи, кодируемых такими нуклеиновыми кислотами.
Нуклеиновые кислоты можно получить при помощи ПЦР или построить путем синтеза, например, при помощи твердофазного синтеза ДНК, например, осуществляемого на коммерческой основе компанией Life Technologies. Нуклеиновые кислоты из i) и ii) можно получить путем копирования/амплификации транс-кДНК нуклеотидной последовательности, которая была получена с мРНК и Т-клеточного репертуара донора. Получаемые нуклеиновые кислоты, которые кодируют различные вариабельные домены альфа-цепи TRAV12-2 или TRAV21 или бета-цепи TRBV6, могут быть единственными получаемыми нуклеиновыми кислотами, т.е. стадия i) может предусматривать получение только нуклеиновых кислот, которые кодируют различные вариабельные домены альфа-цепи TRAV12-2 или TRAV21, а стадия ii) может предусматривать получение только нуклеиновых кислот, которые кодируют различные вариабельные домены бета-цепи TRBV6. Созданная библиотека может представлять собой библиотеку, фактически состоящую из TCR, содержащих вариабельный домен альфа-цепи из естественного репертуара и вариабельный домен бета-цепи из естественного репертуара, причем вариабельный домен альфа-цепи включает генный продукт TRAV12-2 или TRAV21, а вариабельный домен бета-цепи включает генный продукт TRBV6.
Настоящее изобретение также относится к способу получения библиотеки частиц, при этом библиотека характеризуется дисплеем множества различных TCR, причем способ предусматривает: i) получение множества нуклеиновых кислот, которые кодируют различные вариабельные домены альфа-цепи TRAV12-2 или TRAV21, с помощью праймеров, которые гибридизируются с нуклеиновыми кислотами, кодирующими вариабельные домены альфа-цепи TRA12-2 или TRAV21; ii) получение множества нуклеиновых кислот, которые кодируют различные вариабельные домены бета-цепи TRBV6, с помощью праймеров, которые гибридизируются с нуклеиновыми кислотами, кодирующими вариабельные домены бета-цепи TRAV6; iii) клонирование нуклеиновых кислот, кодирующих вариабельный домен альфа-цепи TRAV12-2 или TRAV21, в векторы экспрессии; iv) клонирование нуклеиновых кислот, кодирующих вариабельный домен бета-цепи TRBV6, в те же или в различные векторы; и v) экспрессирование векторов в частицах с получением, таким образом, библиотеки, по существу состоящей из TCR, содержащих вариабельный домен альфа-цепи и вариабельный домен бета-цепи, кодируемых такими нуклеиновыми кислотами, с которыми гибридизируются указанные праймеры.
Две одноцепочечные последовательности будут гибридизироваться друг с другом, даже если нет 100% идентичности последовательности между двумя последовательностями, в зависимости от условий, рот которых происходит реакция гибридизации, и состава и длины гибридизирующихся последовательностей нуклеиновой кислоты.
Обычно температура гибридизации и ионная сила (как, например, концентрация Mg2+) буфера гибридизации будет определять жесткость условий гибридизации. Высокая жесткость, такая как высокая температура гибридизации и низкий уровень соли в буферах гибридизации, позволяет гибридизацию только между последовательностями нуклеиновой кислоты, которые имеют высокое сходство, тогда как низкая жесткость, такая как более низкая температура и высокое содержимое соли, обеспечивает гибридизацию при меньшем сходстве последовательностей. Расчеты, относящиеся к условиям гибридизации, для достижения определенной степени жесткости специалист в настоящей области сможет осуществить без труда, и они рассмотрены в работе Sambrook et al., (1989) Molecular Cloning, second edition, Cold Spring Harbor Laboratory, Plainview, NY (главы 9 и 11). Специалист в настоящей области сможет оптимизировать условия гибридизации в соответствии с результатами тестов на чувствительность и специфичность.
Далее представлен иллюстративный перечень условий гибридизации для применения по настоящему изобретению:
очень высокая жесткость (детектирует последовательности, которые имеют по меньшей мере 90% идентичности)
гибридизация: 5× SSC при 65°C в течение 16 часов
промыть два раза: 2× SSC при комнатной температуре (RT) в течение 15 минут каждый
промыть два раза: 0,5× SSC при 65°C в течение 20 минут каждый;
высокая жесткость (детектирует последовательности, которые имеют по меньшей мере 80% идентичности)
гибридизация: 5×-6× SSC при 65°C - 70°C в течение 16-20 часов
промыть два раза: 2× SSC при RT в течение 5-20 минут каждый
промыть два раза: 1× SSC при 55°C - 70°C в течение 30 минут каждый;
низкая жесткость (детектирует последовательности, которые имеют по меньшей мере 50% идентичности)
гибридизация: 6× SSC при температуре от RT до 55°C в течение 16-20 часов промыть по меньшей
мере два раза: 2×-3× SSC при температуре от RT до 55°C в течение 20-30 минут каждый.
Раскрываемые в настоящем документе праймеры могут гибридизироваться с нуклеиновыми кислотами, кодирующими вариабельные домены альфа-цепи Trav12 или TRAV21 или вариабельные домены бета-цепи TRBV6, в условиях низкой жесткости, высокой жесткости и очень высокой жесткости.
Праймер может связываться с высокой жесткостью с последовательностями, кодирующими вариабельные домены альфа- и бета-цепи. Тем не менее, праймеры могут связываться с некоторыми другими локусами, которые имеют высокую гомологию с TRAV12-2, TRAV21 и/или TRVB6.
Нуклеиновая кислота, кодирующая TRBV6, в обоих способах может давать генный продукт TRBV6-1, TRBV6-2, TRBV6-3, TRBV6-5 или TRBV6-6.
Нуклеиновые кислоты стадий i) и ii) могут происходить из естественного репертуара. Искусственные мутации можно вносить в вариабельные домены альфа- или бета-цепи до стадии iii) или после iii), т.е. последовательности нуклеиновой кислот могут иметь искусственные мутации, вносимые перед клонированием в векторы. В качестве альтернативы, искусственные мутации можно вносить после стадий клонирования iii) и/или iv).
Амплификация вариабельных доменов TRAV12-2 или TRAV21 может быть осуществлена из предварительно полученной библиотеки кДНК, которая сама по себе получена с мРНК донора, с прямым праймером, сконструированным для специфичного связывания с представляющим интерес локусом. Обратный праймер может быть сконструирован для специфичного связывания (по меньшей мере частично) с константным участком альфа-цепи TCR так, чтобы полученный в результате ПЦР-продукт содержал последовательность нуклеиновой кислоты TRAV 12-2 или TRAV21, j-сегмент и по меньшей мере часть константного участка. Такая конструкция праймера обеспечивает достижение изменчивости и разнообразия CDR3 участка вариабельного домена альфа-цепи, что в результате приводит к тому, что в библиотеке по настоящему изобретению представлено большое число уникальных последовательностей альфа-цепи TCR. Предпочтительно донором является человек.
Аналогичным образом, амплификация вариабельного домена TRAV6 может быть осуществлена с доступной библиотеки кДНК с прямым праймером, сконструированным для специфичного связывания с представляющим интерес локусом. Обратный праймер может быть сконструирован для специфичного связывания с константным участком бета-цепи TCR так, чтобы полученный в результате ПЦР-продукт содержал последовательность нуклеиновой кислоты TRBV6, j-сегмент (содержащий локусы D и J) и по меньшей мере часть константного участка. Такая конструкция праймера обеспечивает достижение изменчивости и разнообразия CDR3 участка вариабельного домена бета-цепи, что в результате приводит к тому, что в библиотеке по настоящему изобретению представлено большое число уникальных последовательностей бета-цепи TCR.
МРНК получают по меньшей мере от одного донора. Под «по меньшей мере от одного донора» понимают, что полипептидная последовательность вариабельного домена альфа- или бета-цепи является практически такой, как если бы она встречалась бы в природе в Т-клетке донора от которого получена мРНК.
Полученные в результате ПЦР-продукты можно лигировать непосредственно в фаговый вектор, если они содержат полные последовательности гена константного домена, при условии, что подлежащие лигированию или рекомбинации последовательности присутствуют в векторе и праймерных последовательностях. В качестве альтернативы, ПЦР-продукты альфа- и бета-цепей могут сшить вместе с последовательностями, содержащими соответственно последовательность гена константного домена альфа-цепи и последовательность гена константного домена бета-цепи, для того чтобы получить полные последовательности цепи TCR. Альфа-цепь и бета-цепь можно сшить вместе случайным образом для того, чтобы повысить разнообразие в фаговой библиотеке. Полные последовательности затем можно клонировать в фаговый вектор для экспрессии в виде одной открытой рамки считывания (как показано на фиг. 1).
В качестве альтернативы, также можно применять другие форматы дисплея на частице для получения библиотек по настоящему изобретению. Такие способы известны специалистам в настоящей области и могут включать без ограничения дисплей на рибосомных частицах или дрожжевых клетках.
Такие способы дисплея разделяются на две широкие категории: in-vitro и in-vivo дисплей.
Все способы in-vivo дисплея основываются на стадии, в ходе которой библиотеку, обычно закодированную в или при помощи генетической нуклеиновой кислоты реплицируемой частицы, такой как плазмидный или фаговый репликон, трансформируют в клетки для осуществления экспрессии белков или полипептидов. ( (2001) Adv Protein Chem 55 367-403). Существует ряд систем репликон/хозяин, которые были подтверждены как подходящие для in-vivo дисплея белка или полипептидов. Такие системы включают следующие:
(2001) Adv Protein Chem 55 367-403). Существует ряд систем репликон/хозяин, которые были подтверждены как подходящие для in-vivo дисплея белка или полипептидов. Такие системы включают следующие:
фаг / бактериальные клетки;
плазмида / клетки СНО;
векторы на основе дрожжевой 2 мкм плазмиды / дрожжевые клетки;
бакуловирус / клетки насекомого;
плазмида / бактериальные клетки;
ретровирусный вектор / клетки млекопитающего.
In vivo способы дисплея включают способы дисплея на клеточной поверхности, при которых плазмиду вносят в клетку-хозяина, кодирующую гибридный белок, состоящих из представляющего интерес белка или полипептида, гибридизированного с белком или полипептидом клеточной поверхности. Экспрессия такого гибридного белка приводит к дисплею на поверхности такой клетки представляющего интерес белка или полипептида. Клетки с дисплеем таких представляющие интерес белков или полипептидов затем можно подвергнуть способу отбора, такому как FACS, а плазмиды, полученные от отобранной клетки или отобранных клеток, можно выделить и секвенировать. Были разработаны системы дисплея на клеточной поверхности для клеток млекопитающих (Higuschi (1997) J Immunol. Methods 202 193-204), дрожжевых клеток (Shusta (1999) J Mol Biol 292 949-956) и бактериальных клеток (Sameulson (2002) J. Biotechnol 96 (2) 129-154). Дисплей одноцепочечных TCR на поверхности дрожжевых клеток известен из уровня техники (WO 01/48145)
Было опубликовано множество обзоров различных методик in-vivo дисплея. Например, (Hudson (2002) Expert Opin Biol Ther (2001) 1 (5) 845-55) и (Schmitz (2000) 21 (Supp A) S106-S112).
В основе способов in-vitro дисплея лежит применение рибосом для трансляции библиотек мРНК в разнообразный массив вариантов белка или полипептида. Сформированную связь между такими белками или полипептидами и мРНК, кодирующей такие молекулы, поддерживают с помощью одного из двух способов. В традиционном рибосомном дисплее используют последовательности мРНК, которые кодируют короткую (как правило из 40-100 аминокислот) линкерную последовательность и подлежащий дисплею белок или полипептид. Линкерные последовательности обеспечивают пространство для подвергаемого дисплею белка или полипептида, достаточное для рефолдинга без стерических затруднений, вызываемых рибосомой. У последовательности мРНК отсутствует стоп-кодон, это обеспечивает, чтобы экспрессируемый белок или полипептид и РНК оставались прикрепленными к рибосомной частице. В основе родственного способа мРНК-дисплея лежит получение последовательностей мРНК, кодирующих представляющий интерес белок или полипептид, и ДНК-линкеров, несущих пуромициновый фрагмент. Как только рибосома достигает точки соединения мРНК/ДНК, трансляция останавливается, и пуромицин формирует ковалентную связь с рибосомой. Обзор этим двух родственных способов in-vitro дисплея см. в работе (Amstutz (2001) Curr Opin Biotechnol 12 400-405).
Особенно предпочтительной является методика фагового дисплея, в основе которой лежит способность бактериофаговых частиц экспрессировать гетерологичный пептид или полипептид, гибридизированный с их поверхностными белками (Smith (1985) Science 217 1315-1317). Эта процедура является вполне привычной и хорошо известной в области техники для дисплея полипептидных мономеров. Дисплей димерных белков, таких как гетеродимерные TCR, также хорошо разработан в настоящей области техники (WO 04/044004)
Существуют две основные процедуры, которые применимы как для дисплея мономеров, так и для дисплея димеров.
Во-первых, (способ А) путем вставки в векторную (фагмидную) ДНК, кодирующую гетерологичный пептид или полипептид, гибридизированную с ДНК, кодирующей белок оболочки бактериофага (например, ДНК, кодирующей белки Р3 или Р8). Затем осуществляют экспрессию фаговых частиц с дисплеем гетерологичного пептида или полипептида путем трансфекции бактериальных клеток фагмидой, а затем инфицирования трансформированных клеток «фагом-помощником». Фаг-помощник играет роль источника фаговых белков, не кодируемых фагмидой, необходимых для получения функциональной фаговой частицы.
Во-вторых, (способ В) путем вставки ДНК, кодирующей гетерологичный пептид или полипептид, в полный фаговый геном, гибридизированной с ДНК, кодирующей белок оболочки бактериофага. Затем осуществляют экспрессию фаговых частиц с дисплеем гетерологичного пептида или полипептида путем инфицирования бактериальных клеток фаговым геномом. Этот способ обладает преимуществом относительно первого способа в том, что это «одностадийный» процесс. Однако, уменьшается размер последовательности гетерологичной ДНК, которую можно успешно упаковать в получаемые в результате фаговые частицы. Примерами подходящих для такого способа фагов являются М13, Т7 и лямбда.
Вариация (способа В) предусматривает добавление последовательности ДНК, кодирующий нуклеотид-связывающий домен, в ДНК фагового генома, кодирующей подлежащий дисплею гетерологичный пептид, а затем добавление в фаговый геном соответствующего нуклеотид-связывающего сайта. Это приводит к тому, что гетерологичный белок становится напрямую прикрепленным к фаговому геному. Такой комплекс пептид/геном затем упаковывают в фаговую частицу, которая характеризуется дисплеем гетерологичного пептида. Этот способ полностью описан в WO 99/11785.
Затем фаговые частицы можно выделить и применять для исследования характеристик связывания у гетерологичного пептида или полипептида. После выделения фагмидную или фаговую ДНК можно извлечь из фаговой частицы, характеризующейся дисплеем пептида или полипептида, и такую ДНК можно реплицировать с помощью ПЦР. ПЦР-продукт можно использовать для секвенирования гетерологичного пептида или полипептида, дисплей которого производится заданной фаговой частицей.
Фаговый дисплей одноцепочечных антител и его фрагментов стал стандартным средством исследования характеристик связывания таких полипептидов. Существует множество доступных книг, в которых рассмотрены методики фагового дисплея и биология бактериофага. (См., например, Phage Display - A Laboratory Manual, Barbas et al, (2001) Cold Spring Harbour Laboratory Press).
Третий способ фагового дисплея (способ С) основан на том факте, что гетерологичные полипептиды с цистеиновым остатком в необходимом положении могут экспрессироваться в растворимой форме фагмидным или фаговым геномом и вызывать ассоциацию с модифицированным фаговым поверхностным белком, у которого также есть цистеиновый остаток в находящемся на поверхности положении, путем образования дисульфидной связи между двумя цистеинами. В WO 01/05950 подробно раскрыто применение такого альтернативного способа связывания для экспрессии пептидов, производных от одноцепочечных антител.
Как указано выше, αβ-гетеродимерные TCR по настоящему изобретению могут иметь встроенную (неестественную) дисульфидную связь между своими константными доменами. Это можно осуществить в ходе способа получения библиотеки по настоящему изобретению путем сшивания амплифицированной последовательности нуклеиновой кислоты с модифицированной последовательностью гена константного домена. Такие последовательности могут включать последовательности, которые имеют последовательность константного домена TRAC и последовательность константного домена TRBC1 или TRBC2, за исключением того, что Thr 48 в TRAC и Ser 57 в TRBC1 или TRBC2, по нумерации IMGT, заменены цистеиновыми остатками, при этом указанные цистеины формируют дисульфидную связь между последовательностью константного домена TRAC и последовательностью константного домена TRBC1 или TRBC2 в TCR библиотеки.
С введенной межцепочечной связью, которая упомянута в предыдущем абзаце, или без нее, αβ-гетеродимерные TCR по настоящему изобретению могут иметь последовательность константного домена TRAC и последовательность константного домена TRBC1 или TRBC2, и такая последовательность константного домена TRAC и последовательность константного домена TRBC1 или TRBC2 в TCR могут быть соединены естественной дисульфидной связью между Cys4 экзона 2 у TRAC и Cys2 экзона 2 у TRBC1 или TRBC2.
В качестве альтернативы, вариабельный домен альфа-цепи TCR и вариабельный домен бета-цепи TCR могут быть экспрессированы в виде одноцепочечного полипептида. Такая конфигурация может включать неестественную дисульфидную связь между мутантными аминокислотными остатками.
Настоящее изобретение также относится к способу получения рецептора Т-клетки, который специфично связывает пептидный антиген, предусматривающему скрининг библиотеки по первому аспекту настоящего изобретения при помощи пептидного антигена.
Скрининг может включать одну или несколько изложенных ниже стадий:
a) пэннинг библиотеки с применением в качестве мишени пептидного антигена;
b) повторение стадии a) один или несколько раз;
c) скрининг фаговых клонов, выявленных на стадии a) или b);
d) выявление TCR, который специфично связывается с пептидным антигеном.
В соответствии со стадией (b) стадию (a) можно повторять один раз, два раза, 3 раза, 4 раза, 5 раз или 6 раз. Ее можно повторять до 10 раз. Стадию (a) можно повторять до 20 раз и более.
Под пэннинг понимают, что фаговым клонам позволяют войти во взаимодействие с антигеном и связавшиеся фаговые клоны отделяют от несвязавшихся фаговых клонов. Это может предусматривать иммобилизацию антигена на твердой подложке, такой как пробирки, магнитные микроносители, матрицы в колонках или сенсорные чипы BiaCore. Присоединение антигена может быть опосредовано неспецифической адсорбцией или с помощью метки специфического присоединения, такой как биотинилированный антиген или покрытая стрептавидином поверхность. Альтернативный способ может предусматривать пэннинг на интактных клетках. (Hoogenboom, Н.R., et al (1998) Immunotechnology, 4(1), 1-20.). Отмывают от фаговых клонов, которые не связываются (т.е. фаг без дисплея TCR, который связывается с антигеном). Связавшиеся фаговые клоны затем можно элюировать с помощью ферментативного расщепления по протеазному сайту, такому как трипсиновый, между бета-цепью TCR и геном III, с помощью крайне высоких значений pH или конкуренции с избыточным антигеном. Эти фаговые клоны можно получить посредством дополнительных циклов пэннинга или в ходе скрининговых экспериментов с целью выявления клонов с оптимальными характеристиками связывания.
Скрининг можно провести, например, с помощью ИФА-способов с помощью либо нанесенного покрытием антигена, либо интактных клеток и может быть представлен в 96-луночном формате, в котором используют цельные клетки, скрининг можно провести с помощью проточной цитометрии. Скрининг в отношении аффинности и кинетики можно осуществить с помощью поверхностного плазмонного резонанса, например, на приборе BiaCore, или с применением микровесов на кристалле кварца. Способы скрининга описаны в работе Pande, J., et al. (2010). Biotechnol Adv 28(6): 849-58. Как известно специалистам в настоящей области, доступны другие подходящие способы скрининга биомолекулярных взаимодействий такого типа, в том числе: система Octet от ForteBIO, в которой используется интерферометрия биослоя (BioLayer Interferometry - BLI), для измерения биомолекулярных взаимодействий в реальном времени и получения информации по аффинности и кинетике; гомогенный анализ усиленной за счет эффекта близости люминесценции (например, AlphaScreen™), в котором потенциально взаимодействующие молекулы прикрепляют к «донорным» и «акцепторным» микроносителям, которые проявляют определенные флуоресцентные свойства, находясь в непосредственной близости; сцинтилляционный анализ сближения, в котором взаимодействия оценивают по переносу бета-частиц между молекулами, находящихся в непосредственной близости; другие анализы поверхностных оптических свойств, которые описаны, например, в WO 2004/044004.
Специфичность можно определить путем тестирования выявленных TCR на связывание с другими пептидами, отличными от пептидного антигена, применяемого для скрининга библиотеки. Если происходит связывание с другими пептидами, то TCR можно считать неспецифичным. Специфичность можно оценить с помощью указанных выше способов.
Пептидный антиген может быть известным антигеном, таким как антигены, которые описаны в работе Bridgeman, J.S., et al. (2012) Immunology, 135(1), 9-18. Способ скрининга библиотеки по настоящему изобретению также можно применять с новыми пептидными антигенами для выявления специфично связывающихся TCR, которые могут оказаться пригодными в различных терапевтических областях.
В соответствии с последним аспектом настоящее изобретение относится к выделенной клетке с дисплеем на своей поверхности TCR по настоящему изобретению, т.е. выделенным рецептором Т-клеток (TCR), содержащим вариабельный домен альфа-цепи TCR, включающий генный продукт TRAV12-2 или генный продукт TRAV21, и вариабельный домен бета-цепи TCR, включающий генный продукт TRBV6, полученным из библиотеки согласно первому или второму аспекту настоящего изобретения, причем этот TCR специфично связывает пептидный антиген. Клетка может быть Т-клеткой. Клетка может быть человеческой, мышиной клеткой или клеткой другого млекопитающего.
Существует ряд способов, подходящих для трансфекции Т-клеток посредством ДНК или РНК, кодирующей TCR по настоящему изобретению. (См., например, работу Robbins et al., (2008,) J. Immunol. 180: 6116-6131). Т-клетки, экспрессирующие TCR по настоящему изобретению, будут пригодны для применения при лечении на основе адоптивной терапии таких заболеваний, как злокачественные опухоли, вирусные инфекции, аутоиммунные заболевания, паразитарные инфекции и бактериальные инфекции. Как будет известно специалистам в настоящей области, существует ряд подходящих способов, с помощью которых можно проводить адоптивную терапию. (См., например, работу Rosenberg et al., (2008) Nat Rev Cancer 8(4): 299-308).
Для применения в адоптивной терапии настоящее изобретение также относится к клеткам, несущим вектор экспрессии TCR, который содержит нуклеиновую кислоту, кодирующую TCR по настоящему изобретению в одной открытой рамке считывания или в двух раздельных открытых рамках считывания. Также в объем настоящего изобретения включены клетки, несущие первый вектор экспрессии, который содержит нуклеиновую кислоту, кодирующую альфа-цепь TCR по настоящему изобретению, и второй вектор экспрессии, который содержит нуклеиновую кислоту, кодирующую бета-цепь TCR по настоящему изобретению. В альтернативном варианте один вектор может экспрессировать как альфа-, так и бета-цепь TCR по настоящему изобретению.
TCR по настоящему изобретению, предназначенные для применения в адоптивной терапии, могут гликозилироваться при экспрессии трансфицированными Т-клетками. Как хорошо известно, паттерн гликозилирования трансфицированных TCR можно модифицировать с помощью мутаций трансфицируемого гена (Kuball J et al. (2009), J Exp Med 206(2):463-475).
Для введения пациентам Т-клетки, трансфицированные посредством TCR по настоящему изобретению, могут быть представлены в фармацевтической композиции вместе с фармацевтически приемлемым носителем. Клетки в соответствии с настоящим изобретением обычно будут поставлять как часть стерильной фармацевтической композиции, которая в норме будет включать фармацевтически приемлемый носитель. Такая фармацевтическая композиция может иметь любую подходящую форму (в зависимости от требуемого способа ее введения пациенту). Ее можно поставлять в стандартной лекарственной форме, обычно будут поставлять в герметично закрытой емкости и можно поставлять в качестве части набора. Такой набор в норме будет (хотя и не обязательно) включать инструкции по применению. Он может включать множество указанных стандартных лекарственных форм. Подходящие композиции и способы введения известны специалистам в настоящей области, например, см. работу Johnson et al. Blood (114):535-46 (2009), в связи с клиническими испытаниями под номерами NCI-07-С-0175 и NCI-07-C-0174.
Фармацевтическую композицию можно адаптировать для введения любым подходящим путем, таким как парентеральный (в том числе подкожный, внутримышечный, внутривенный или внутрибрюшинный), ингаляционный или пероральный путь. Такие композиции можно получить любым способом, известным в области фармации, например, путем смешивания активного ингредиента с носителем(носителями) или вспомогательным средством(средствами) в стерильных условиях.
Дозировки веществ по настоящему изобретению могут варьировать в широких пределах в зависимости от подлежащего лечению заболевания или нарушения, такого как злокачественная опухоль, вирусная инфекция, аутоиммунное заболевание, бактериальная инфекция или паразитарная инфекция, возраста и состояния подлежащего лечению индивидуума и т.д. Например, подходящим диапазоном доз для реагента ImmTAC (растворимый TCR, гибридизированный с доменом к CD3) может быть от 25 нг/кг до 50 мкг/кг. В конечном счете, лечащий врач определит подлежащие применению подходящие дозировки.
TCR по настоящему изобретению также можно пометить при помощи соединения для визуализации, например, метки, которая пригодна для диагностических целей. Такие меченные высокоаффинные TCR пригодны в способе детекции лиганда TCR, выбранного из комплексов CD1-антиген, бактериальных суперантигенов и комплексов МНС-пептид/суперантиген, причем способ предусматривает приведение в контакт лиганда TCR с высокоаффинным TCR (или мультимерным комплексом высокоаффинных TCR), который специфичен к лиганду TCR; и детектирование связывания с лигандом TCR. В тетрамерном комплексе высокоаффинных TCR (образованном, например, с помощью биотинилированных гетеродимеров) для создания детектируемой метки можно использовать флуоресцентный стрептавидин (коммерчески доступный). Флуоресцентно-меченный тетрамер подходит для применения в FACS-анализе, например, для детекции антиген-презентирующих клеток, несущих пептид, к которому специфичен высокоаффинный TCR.
Высокоаффинный TCR (или поливалентный комплекс на его основе) по настоящему изобретению альтернативно или дополнительно может быть ассоциирован (например, ковалентно или иным образом соединен) с терапевтическим средством, которое может представлять собой, например, токсичную частицу для применения в уничтожении клеток или иммуностимулирующее средство, такое как интерлейкин или цитокин. Поливалентный комплекс высокоаффинных TCR по настоящему изобретению может обладать повышенной способностью к связыванию с лигандом TCR по сравнению с неполивалентным гетеродимером высокоаффинного рецептора Т-клеток или рецептора Т-клеток дикого типа. Таким образом, поливалентные комплексы высокоаффинных TCR по настоящему изобретению особенно пригодны для отслеживания или нацеливания на клетки, презентирующие конкретные антигены in vitro или in vivo, а также пригодны в качестве промежуточных продуктов для создания последующих поливалентных комплексов высокоаффинных TCR с такими применениями. Следовательно, высокоаффинный TCR или поливалентный комплекс высокоаффинных TCR может быть представлен в фармацевтически приемлемом составе для применения in vivo.
Высокоаффинные TCR по настоящему изобретению можно применять при получении растворимых биспецифичных реагентов. В соответствии с предпочтительным вариантом осуществления таковыми являются реагенты ImmTAC. Реагенты ImmTAC содержат растворимый TCR, гибридизированный при помощи линкера с фрагментом специфичного к CD3 антитела. Дополнительные детали, в том числе как получить такие реагенты, описаны в WO 10/133828.
Предпочтительные или необязательные признаки каждого аспекта настоящего изобретения являются такими же, как и для каждого другого аспекта с учетом необходимых изменений. Соответственно, несмотря на то, что настоящее изобретение и его преимущества были подробно описаны, следует понимать, что в нем могут быть выполнены различные изменения, замены и правки без отступления от идеи и объема настоящего изобретения, который определяется прилагаемой формулой изобретения.
Далее настоящее изобретение будет проиллюстрировано в последующих примерах, которые приведены лишь с целью иллюстрации и не предназначены для какого-либо ограничения настоящего изобретения.
Примеры
Пример 1
Получение кДНК для конструирования библиотек фагового дисплея природного TCR TRAV12.2/TRBV6* и TRAV21/TRBV6*
Выделение мРНК из лимфоцитов периферической крови (PBL)
РНК экстрагировали из пула примерно 30 миллионов PBL, полученных от трех доноров с известным типом HLA. Экстракцию РНК осуществляли с применением реагента TRI (Sigma, кат. № Т9424) в соответствии с рекомендованным производителем протоколом. После этого мРНК выделяли с помощью наборов для выделения мРНК μMACS™ (Miltenyi, кат. №130-075-101) согласно инструкциям производителя.
Получение кДНК с мРНК
кДНК синтезировали с мРНК с применением обратной транскриптазы SMARTScribe™ (Clontech, 639536) в соответствии с рекомендованным производителем протоколом. кДНК дополнительно очищали с применением набора для очистки из геля S.N.A.P. (Invitrogen, 45-0078).
Пример 2
Конструирование фаговой библиотеки
Основные принципы конструирования библиотеки показаны на фиг. 1, а соответствующие праймерные последовательности изложены на фиг. 2. Цепи TCR амплифицировали с помощью ПЦР с очищенной кДНК с применением прямых праймеров TRAV12.2, TRAV21 или TRBV6* и обратных праймеров, которые гибридизировались либо в TRAC (праймер YOL237), либо в TRBC участках (праймер YOL 240). Наборы праймеров конструировали на основе известных последовательностей цепей TCR человека (Т Cell Receptor Facts Book, Lefranc and Lefranc, Publ. Academic Press 2001). Полученные ПЦР-продукты содержали полную последовательность вариабельного домена и укороченный константный домен (отмеченные А и В на фиг. 1). Оставшийся С-концевой отрезок доменов TRAC и TRBC2, содержавший неестественные цистеиновые остатки, амплифицировали с помощью ПЦР с отдельного вектора для клонирования с применением праймеров YOL236 и YOL238 для TRAC и YOL239 и YOL22 для TRBC2 (отмеченные С и D на фиг. 1). Очищенные фрагменты А/С и B/D затем сшивали друг с другом в раздельных реакциях с помощью перекрывающих их праймером участков (YOL237/YOL236 и YOL240/YOL239 соответственно). Полученные в результате фрагменты А-С и B-D очищали от геля и сшивали друг с другом с помощью ПЦР с перекрывающими праймерами с применением прямого праймера TRAV12.2/21 и обратного праймера YOL22, причем праймерные участки TRBV6* и YOL238 обеспечивали перекрывающую последовательность. Такая конечная реакция по сшиванию приводила в результате к случайной рекомбинации между альфа-цепями и бета-цепями. Сайты рестрикции Nco1/Not1 использовали для вставки случайно рекомбинированных цепей в подходящий фагмидный вектор, называемый pIM672 (pIM672 основан на ранее описанном векторе рЕХ922 (см. WO 2005116074)), который затем использовали для трансформации электрокомпетентных клеток TG1 Е. coli с высокой степенью эффективности трансформации. Культуры высевали на 2xTYag (EzMix, Sigma, кат. № Y2627 плюс 100 мкг/мл ампициллина и 2% глюкозы) агаровые пластины на ночь при 30°С, а полученные «газоны» клеток соскребали в небольшой объем 2xTYag среды, которая содержала 20% глицерина и 2% глюкозы. Глицериновые биомассы библиотек хранили при -80°С.
Пример 3
Размножение и пэннинг библиотек
Размножение фаговых частиц
Аликвоту глицериновой биомассы фаговой библиотеки, достаточную для охвата разнообразия библиотеки (TRAV12.2/TRBV6 и TRAV21/TRBV6), использовали для засевания среды 2xYTag до изначальной OD600, равной 0,05. Затем культуры инкубировали до OD600, равной приблизительно 0,5. Затем добавляли фаг-помощник в инфекционном соотношении ~20:1 фага к Е. coli. Затем культуры перемешивали путем вращения и инкубировали в течение 30 минут при 37°С. Культуры центрифугировали и осадки ресуспендировали в 2xYTak (аналогичной 2xYTag, но без глюкозы и с добавлением 50 мкг/мл канамицина), а затем инкубировали при 26°С в течение 16 часов с помешиванием.
Выделение фаговых частиц
Культуры объединяли, центрифугировали и надосадочную жидкость собирали и фильтровали через 0,45 мкм фильтр. Элюат смешивали с 7 мл PEG/NaCl (20% PEG-8000 (Sigma кат. №5413), 2,5 М NaCl) и инкубировали на льду в течение 30 минут. Затем осаждали центрифугированием образец и отбрасывали надосадочную жидкость. Осадок ресуспендировали в 10 мл PBS (Dulbeccos Sigma кат. № D8537 - без Mg, без Ca) и повторно центрифугировали. Собирали полученную в результате надосадочную жидкость, смешивали с 5 мл PEG/NaCl и выдерживали на льду в течение 30 минут. После центрифугирования осадок ресуспендировали в 3 мл PBS, повторно центрифугировали и собирали надосадочную жидкость. Производили оценку концентрации фагов с помощью спектрофотометра Nanodrop, где число фагов на мл = OD260×(22,14×1010). Рассчитывали, что полученная согласно такому протоколу библиотека содержала 6,8×1012/мл фаговых частиц.
Пэннинг
Очищенные фаговые частицы смешивали с 3% буфером MPBS (PBS (Dulbeccos Sigma кат. № D8537 - без Mg, без Ca) плюс 3% порошкового молока, предварительно инкубированным с покрытыми стрептавидином парамагнитными микроносителями, а затем обработанным посредством 15 мМ EDTA с последующим обширным диализом и в конце профильтрованным через 0,22 мкм фильтр) и инкубировали при комнатной температуре в течение 1 часа. Для ванночки 2 и ванночки 3 спустя первые 30 минут добавляли конструкцию несоответствующего небиотинилированного пептидного HLA для отрицательного отбора в конечной концентрации 2 мкМ и продолжали инкубацию в течение дополнительных 30 минут. Затем добавляли 10% (объем/объем) Tween-20 плюс 100 нМ или 1 мкМ биотинилированного пептидного HLA. Образцы перемешивали при комнатной температуре в течение 60 минут. Комплексы фаг-биотинилированный HLA спасали путем добавления покрытых стрептавидином парамагнитных микроносителей, предварительно блокированных в 3% буфере MPBS, и инкубировали при комнатной температуре в течение 7 минут. После спасения микроносители выделяли с помощью магнитного концентратора (Dynal) и три раза промывали 3% MPBS (без обработки EDTA) и два раза PBS - 0,1% Tween. Фаговые частицы элюировали в 0,5 мл TBSC (10 мМ Tris, pH 7,4, 137 мМ NaCl, 1 мМ CaCl2 и 0,1 мг/мл трипсина) в течение 25 минут при комнатной температуре и 5 минут при 37°C с легким вращением.
Элюированные фаговые частицы использовали для инфицирования клеток TGI Е. coli на ранней фазе логарифмического роста. Культуры инкубировали при 37°С в течение 30 минут, а затем высевали на YTEag (10 г триптона, 5 г дрожжевого экстракта, 8 г NaCl, 15 г агара Bacto-Agar в 1 л воды MQ плюс 100 мкг/мл ампициллина и 2% глюкозы) в серийных разведениях 1 мкл, 0,1 мкл и 0,01 мкл. Оставшуюся культуру концентрировали и также высевали на YTEag. Слои среды инкубировали при 30°С в течение 16 часов. Полученные на следующий день колонии со слоев среды добавляли в 2xTYag, замораживали на сухом льду и хранили при -80°С до следующего цикла пэннинга. Колонии от каждого цикла отбора анализировали с помощью ПЦР для проверки на наличие полноразмерных вставок.
После третьего раунда отбора колонии соскребали с агаровых слоев и использовали для инокуляции стерильной 2xTYag в 96-луночном планшете для культивирования клеток Cellstar в количестве одной колонии на лунку. Планшеты инкубировали при 26°С в течение 16 часов со встряхиванием. Эти культуры затем использовали для инокуляции свежей среды 2xTYag в 96-луночных планшетах и инкубировали в течение 30 минут при 37°С со встряхиванием до достижения OD600=0,5. Затем добавляли фаг-помощник в каждую лунку в инфекционном соотношении 20:1 фаг - Е. coli и планшеты инкубировали в течение 30 минут при 37°С без встряхивания. Собирали осадки путем центрифугирования и ресуспендировали их в 2xYTak. Планшеты инкубировали в течение 16 часов при 26°С со встряхиванием. Затем осаждали центрифугированием клетки и собирали надосадочную жидкость для ИФА-скрининга.
Пример 4
Детекция фага, несущего связывающийся с антигеном TCR, с помощью ИФА-скрининга
Способ
Фаговые клоны, которые связывались с комплексом пептидного HLA, выявляли с помощью ИФА-скрининга. Планшеты для ИФА готовили с помощью представляющего(ющих) интерес биотинилированного(ых) пептидного(ых) HLA и контрольного пептидного HLA. Фаговые частицы вносили в двух повторах в планшет для ИФА так, чтобы один образец был добавлен в лунку, которая содержала представляющий интерес пептидный HLA, а другой был добавлен в соседнюю контрольную лунку. Детекцию осуществляли с помощью антитела к Fd (Sigma, кат. № В7786) с последующим добавлением конъюгата моноклонального антитела к IgG кролика и пероксидазы (специфичного к гамма-цепи клона RG96) (Sigma, кат. № А1949). Связавшееся антитело детектировали с помощью субстратной системы для пероксидазы в микролунках ТМВ KPL labs (кат. №50-76-00). Проявление синего цвета в лунках указывало на то, что фаговый клон связывался с антигеном HLA. Отсутствие цвета в соответствующих контрольных лунках указывало на то, что связывание было специфичным.
Результаты
Библиотеку TRAV12.2/21 TRBV6* получали с помощью способов, описанных в Примерах 1, 2 и 3, за исключением того, что две культуры библиотек [TRAV12.2 TRBV6* и TRAV21 TRBV6*] объединяли перед стадиями выделения и пэннинга фаговых частиц, которые описаны в Примере 3. Из трех доноров, которые были использованы для получения библиотеки, один был HLA-A2 положительным, HLA-24 отрицательным, один был HLA-24 положительным, HLA-A2 отрицательным, и третий был отрицательным как по HLA-A2, так и по HLA-A24. ИФА-скрининг осуществляли как описано выше. Положительные результаты ИФА получали для 12 различных пептидов HLA-A2 и 1 пептида HLA-A24, за 2 кампании пэннинга, которые включали всего 16 различных комплексов с пептидным HLA. Из этих данных видно, что библиотеку по настоящему изобретению можно применять для выделения связывающихся с антигеном TCR.
Вторую библиотеку TRAV12.2/21 TRBV6* получали с помощью такого же способа, который описан в Примерах 1, 2 и 3, за исключением того, что две культуры библиотек [TRAV12.2 TRBV6* и TRAV21 TRBV6*] объединяли перед стадиями выделения и пэннинга фаговых частиц, которые описаны в Примере 3, и, кроме того, все три донора, которых использовали для получения библиотеки, были HLA-A2 HLA-A24 положительными. ИФА-скрининг осуществляли с помощью описанного выше способа. Положительные результаты ИФА получали для 16 различных пептидов HLA-A2 и 1 пептида HLA-A24, за одну кампанию пэннинга, которая включала 18 различных комплексов с пептидным HLA. Из этих данных видно, что библиотеку по настоящему изобретению можно применять для выделения связывающихся с антигеном TCR.
На фиг. 3 показаны результаты, полученные в результате ИФА-скрининга после пэннинга с четырьмя различными пептидами HLA-A2.
Пример 5
ИФА-скрининг в результате пэннинга библиотеки TRAV12.2/21 TRBV6*, полученной от HLA-A2/HLA-A24 отрицательного донора
Для подтверждения того, что связывающиеся с антигеном TCR можно было выделить из библиотеки, полученной от HLA-A2/HLA-A24 отрицательного донора, создавали третью библиотеку TRAV12-2/21/TRBV6* с помощью того же способа, который описан в Примерах 1, 2 и 3, за исключением того, что две культуры библиотек [TRAV12.2 TRBV6* и TRAV21 TRBV6*] объединяли перед стадиями выделения и пэннинга фаговых частиц, которые описаны в Примере 3, и, кроме того, кДНК получали от одного HLA-A2 и HLA-A24 отрицательного донора. ИФА-скрининг осуществляли с помощью способа из Примера 4. В результате одной кампании пэннинга (которая включала три цикла пэннинга), включавшей восемь антигенов, получали результаты ИФА для четырех различных пептидов HLA-A2 и четырех различных пептидов HLA-А24. На фиг. 4 показаны результаты, полученные в результате ИФА-скрининга после пэннинга с тремя различными антигенами.
Пример 6
ИФА-скрининг в результате пэннинга отдельных библиотек TRAV12.2 TRBV6* и TRAV21 TRBV6*
Отдельные библиотеки TRAV12.2 TRBV6* и TRAV21 TRBV6* получали с помощью способов, описанных в Примере 1, 2 и 3. Библиотеки объединяли перед выделением фагов и разделяли методом пэннинга. Положительные результаты ИФА получали как от библиотеки TRAV12.2 TRBV6*, так и от библиотеки TRAV21 TRBV6*. На фиг. 5 показаны результаты, полученные в результате ИФА-скрининга после пэннинга с двумя различными антигенами.
Пример 7
ИФА-скрининг в результате пэннинга отдельных TRAV12.2 TRBV6* и TRAV21 TRBV6*, созданных из коммерческого источника мРНК
Объединенную библиотеку TRAV12-2/21/TRBV6* создавали с помощью такого же способа, который описан в Примерах 1, 2 и 3, за исключением того, что кДНК получали с пула мРНК, полученного из коммерческого источника (Clontech кат. №636170; № партии: 1304103А. Донорами были 380 мужчин (возрастом 18-40) и 170 женщин (возрастом 18-40). Все доноры были протестированы на ВИЧ-1,11, гепатит В и сифилис). Для получения кДНК использовали 50 мкг мРНК. Библиотеки объединяли перед выделением фагов и разделяли методом пэннинга. ИФА-скрининг осуществляли с помощью способа из Примера 4. Положительные результаты ИФА получали как от библиотеки TRAV12.2 TRBV6*, так и от библиотеки TRAV21 TRBV6*. На фиг. 6 показаны результаты, полученные в результате ИФА-скрининга после пэннинга с одним антигеном.
Пример 8
Анализ последовательностей TCR
ДНК-последовательность TCR от положительных по результатам ИФА фаговых клонов можно получить путем секвенирования с помощью способов, известных специалистам в настоящей области техники. В некоторых случаях TCR конвергировали в одну последовательность, в других случаях выявляли более одной последовательности TCR. Например, от ИФА-планшетов, показанных на фиг. 3, три различных последовательности TCR были получены для антигена 1 и четыре различных последовательности TCR были получены для антигена 2. Из этих результатов видно, что из библиотеки по настоящему изобретению за одну кампанию пэннинга можно выделить множество TCR, специфичных к рестриктированным по HLA антигенам.
Пример 9
Специфичность библиотеки TCR
TCR можно дополнительно протестировать для определения их специфичности к комплексу пептидного HLA, в отношении которого их отбирали при пэннинге. Это можно осуществить с помощью ИФА-подхода, аналогичного описанному выше, и панели различных комплексов пептидных HLA. На фиг. 7 показаны результаты, полученные в дополнительных тестах по специфичности с TCR, выделенных в результате ИФА-скрининга, которые были отобраны по связыванию с антигеном 1, антигеном 3 или антигеном 5. Это свидетельствует о том, что из библиотеки могут быть выделены TCR с высокой специфичностью к антигену.
Пример 10
Анализ Biacore полученных из библиотеки TCR
Способ
Аффинность к антигену у выделенных из библиотеки TCR определяли с помощью поверхностного плазмонного резонанса с применением прибора BIAcore 3000 и регистрировали в виде равновесной константы диссоциации (KD). Последовательности TCR, полученные от фаговых клонов, использовали для получения растворимых версий TCR с помощью способа, описанного в работе Boulter, et al., Protein Eng, 2003. 16: 707-711. Биотинилированные специфичные и контрольные мономеры рМНС получали как описано в работе Garboczi, et al. Proc Natl Acad Sci USA 1992. 89: 3429-3433, и в работе O'Callaghan, et al., Anal Biochem 1999. 266: 9-15, и иммобилизировали на покрытых стрептавидином сенсорных чипах СМ-5. Все измерения проводили при 25°С в PBS-буфере (Sigma), дополненном 0,005% Tween (Sigma) с постоянной скоростью потока. Для измерения аффинности серийные разведения растворимых TCR пропускали потоком по иммобилизованным рМНС и определяли значения ответов в равновесии для каждой концентрации. Равновесные константы диссоциации (KD) определяли путем построения графика специфичного равновесного связывания относительно концентрации белка с последующим подбором методом наименьших квадратов к уравнению связывания Ленгмюра, исходя из взаимодействия 1:1.
Результаты
На фиг. 8 показаны кривые связывания и равновесная константа диссоциации (KD) для четырех TCR, полученных для антигена 2, и двух TCR, полученных для антигена 3. Отсюда видно, что выделенные из библиотеки TCR обладали пригодной аффинностью к соответствующему антигену.
Пример 11
Полученные из библиотеки TCR могут обладать повышенной аффинностью
Специфичный к пептидному HLA TCR, выделенный из библиотеки TRAV 12.2/21 TRBV6*, обладал аффинностью (Kd) 25 мкМ, по результатам определения способом поверхностного плазмонного резонанса, описанного в Примере 10. Для получения вариантов такого TCR с более высокой аффинностью последовательность вариабельного домена альфа- и бета-цепи подвергали мутации. Способы получения мутантных высокоаффинных вариантов TCR, такие как фаговый дисплей и сайт-направленный мутагенез, хорошо известны из уровня техники (например, см. WO 04044004 и работу Li et al, (2005) Nature Biotech 23 (3): 349-354). Аффинность и период полужизни вариантов TCR к антигену анализировали с помощью методики одноцикловой кинетики с применением BIAcore3000. Специфичные и контрольные pHLA иммобилизировали на различных проточных кюветах и вводили возрастающие концентрации TCR. Глобальный подбор проводили с помощью программного обеспечения BIAevaluation для одновременного извлечения kon, koff, KD и значений полужизни.
Результаты
Был выделен ряд вариантов с мутациями либо в альфа (А), либо в бета (В) цепи и имеющие более высокую аффинность к антигену.
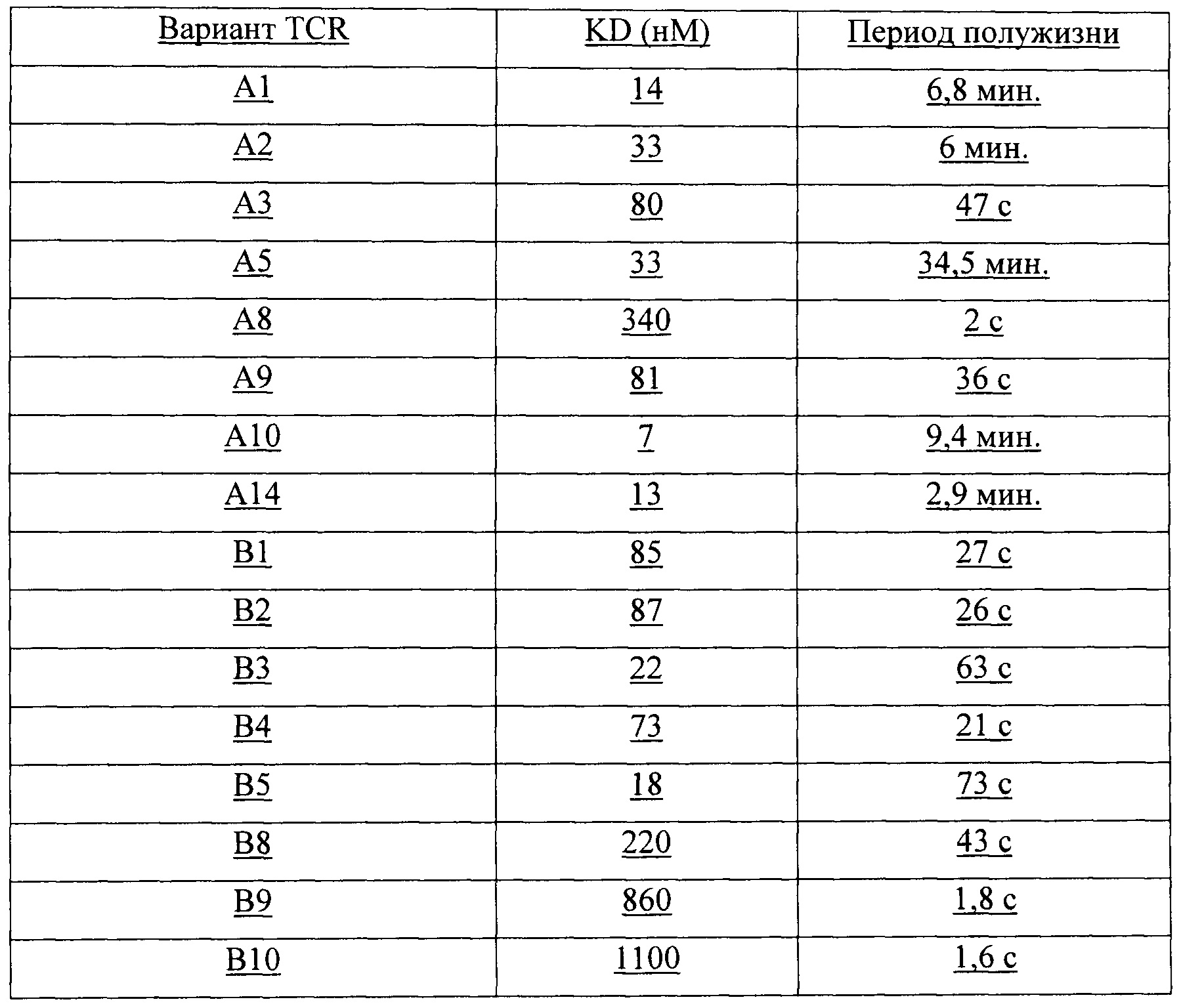
Несколько вариантов бета-цепи гибридизировали с антителом к CD3 и подвергали рефолдингу с отобранными вариантами альфа-цепи для получения растворимых гибридных белков с TCR, подходящих для применения в иммунотерапевтических целях. Дополнительные детали, описывающие получение таких гибридных белков с TCR, можно найти в WO 10133828. Измерения аффинности и периода полужизни проводили как описано выше.
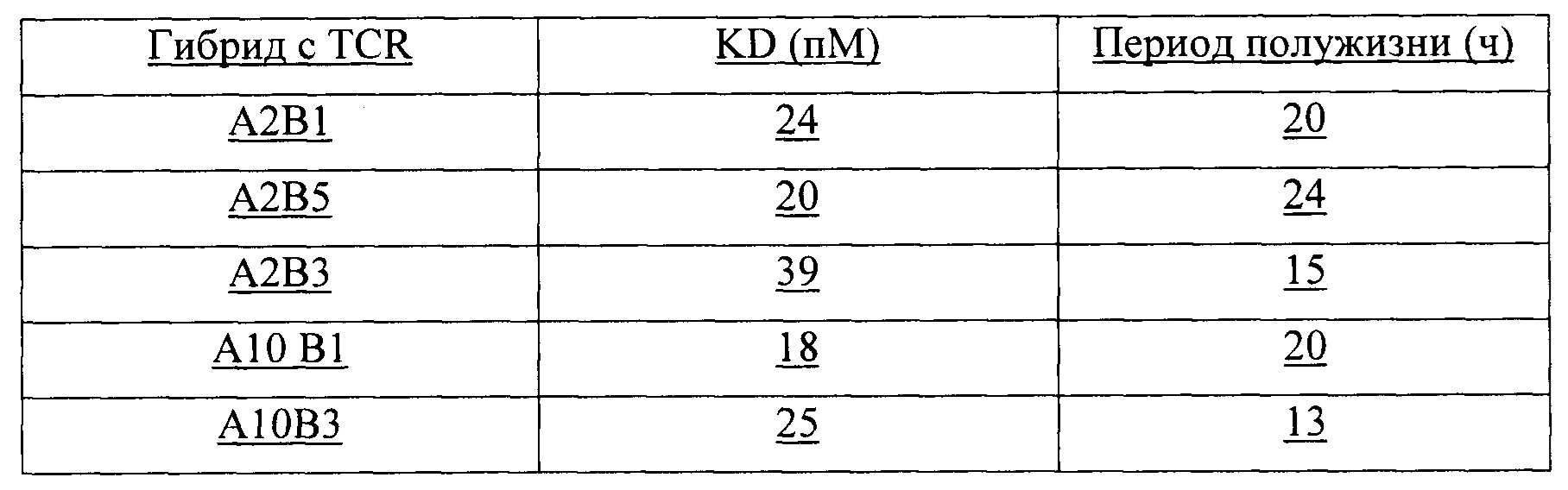

Сравнительный пример
Выделение связывающихся с антигеном TCR из свежей крови
Перед конструирование библиотеки по настоящему изобретению специфичные к антигену TCR получали из Т-клеток, выделенных из свежей донорской крови, после стимуляции представляющим интерес пептидным антигеном HLA. Эксперименты были разделены на кампании по клонированию, которые включали до 20 различных антигенов и свежую кровь, полученную от 12-20 отдельных доноров. Цепи TCR амплифицировали от дающих ответ Т-клеток и использовали для получения растворимых TCR. Связывание с антигеном наблюдали с помощью способа Biacore по Примеру 10.
Способ
Т-клетки, В-клетки и дендритные клетки получали из 200 мл свежей донорской крови. Проводили три раунда стимуляции: сначала с аутологическими DC, а затем с аутологическими В-клетками, обработанными панелью представляющих интерес антигенных пептидов. Активированные Т-клетки детектировали с помощью анализа ELISpot (BD Biosciences) и клеток Т2, обработанных либо представляющими интерес антигенными пептидами, либо несоответствующим контрольным антигеном. Дававшие ответ клетки окрашивали с помощью интерферона-гамма (IFNγ) и сортировали по экспрессии IFNγ или CD8. Связывавшиеся с антигеном линии клетки подтверждали с помощью анализа ELISpot и окрашивания тетрамером. Цепи TCR от подтвержденных клонов амплифицировали с помощью ПЦР с быстрой амплификацией концов кДНК (RACE) и клонировали в вектор экспрессии для Е. coli. TCR очищали от телец включения и подвергали рефолдингу. Связывание с антигеном подтверждали по связыванию на Biacore.
Результаты
В результате пяти кампаний по клонированию, проведенных за несколько лет, было выявлено менее 10 специфично связывающихся с антигеном TCR. Таким образом, библиотека по настоящему изобретению намного более эффективна для получения TCR, чем подход, который был использован в настоящем примере.
Что касается проиллюстрированных выше антигенов, антигены 1 и 2 были включены в две кампании (соответственно 4+5 и 3+4), а антигены 3 и 4 были включены в одну кампанию (соответственно 4 и 5). С помощью такого способа не были получены TCR, специфичные к антигенам 1, 2 и 3. Был получен один TCR, который связывал антиген 4. Это свидетельствовало о том, что даже для одинаковых антигенов библиотека по настоящему изобретению намного более эффективна для получения TCR, чем подход, который был использован в настоящем примере.
В некоторых кампаниях по клонированию были использованы три донора крови HLA-A2/HLA-A24, которых использовали для создания второй библиотеки в описанном выше Примере 4. Один из них использовали в кампаниях 1, 2, 4 и 5; второй использовали в кампании 4 и 5; а третий использовали в кампании 5. Это свидетельствовало о том, что даже при использовании одних и тех же доноров библиотека по настоящему изобретению намного более эффективна для получения TCR, чем подход, который был использован в настоящем примере.
Как было показано, было проведено множество кампаний по клонированию с целью попытки выделения специфично связывающихся с антигеном TCR, но с очень ограниченным успехом. На кампании было затрачено много усилий, результаты были ненадежными и включали коллекцию из множества сдач крови от многих доноров. Из представленных в настоящем документе результаты видно, что настоящее изобретение обеспечивает быстрое, эффективное и надежное выявление множества связывающихся с антигеном TCR, которые были недоступны для выявления или были труднодоступны для выявления при помощи ранее известных методик.

При прочтении описанных таким образом подробно предпочтительных вариантов осуществления настоящего изобретения следует понимать, что настоящее изобретение, которое описано выше, не ограничено конкретными деталями, изложенными в приведенном выше описании, поскольку возможно множество очевидных его вариантов без отступления от идеи или объема настоящего изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110>ИММУНОКОР ЛИМИТЕД
АДАПТИММУН ЛИМИТЕД
<120>БИБЛИОТЕКИ TCR
<130> P59903WO
<140> PCT/EP2015/055293
<141> 2015-03-13
<150> EP2015/055293
<151> 2014-03-14
<160> 9
<170> PatentIn version 3.5
<210> 1
<211> 20
<212> DNA
<213> Artificial sequence
<220>
<223> YOL22
<400>1
cattttcagg gatagcaagc 20
<210> 2
<211> 48
<212> DNA
<213> Artificial sequence
<220>
<223> TRBV6-5
<400> 2
ttctattctc acagcgcgaa tgctggtgtc actcagaccc caaaattc 48
<210> 3
<211> 41
<212> DNA
<213> Artificial sequence
<220>
<223> TRAV12-2
<400> 3
gcccagccgg ccatggccca gaaggaggtg gagcagaatt c 41
<210> 4
<211> 41
<212> DNA
<213> Artificial sequence
<220>
<223> TRAV21
<400> 4
gcccagccgg ccatggccaa acaggaggtg acgcagattc c 41
<210> 5
<211> 22
<212> DNA
<213> Artificial sequence
<220>
<223> YOL237
<400> 5
gagtctctca gctggtacac gg 22
<210> 6
<211> 20
<212> DNA
<213> Artificial sequence
<220>
<223> Artificial sequence
<400> 6
agtgtggcct tttgggtgtg 20
<210> 7
<211> 22
<212> DNA
<213> Artificial sequence
<220>
<223> YOL236
<400> 7
ccgtgtacca gctgagagac tc 22
<210> 8
<211> 21
<212> DNA
<213> Artificial sequence
<220>
<223> YOL238
<400> 8
gcgcgctgtg agaatagaaa g 21
<210> 9
<211> 20
<212> DNA
<213> Artificial sequence
<220>
<223> YOL239
<400> 9
cacacccaaa aggccacact 20
a
<---