КОМПОЗИЦИИ НА ОСНОВЕ ЦИКЛОДЕКСТРИНА И ПРОИЗВОДНОГО БУДЕСОНИДА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ
Вид РИД
Изобретение
Родственные заявки
Настоящая заявка на патент США относится и полностью включает посредством ссылки предварительную заявку на патент США №61/972209 под названием Compositions of Cyclodextrin with Budesonide Derivatives and Methods», поданную 28 марта 2014 г., и заявку на европейский патент № ЕР 14132158 BE под названием Composition of cyclodextrin with budesonide derivatives for treatment and prevention of pulmonary inflammatory disease», поданную 28 марта 2014 г., зарегистрированную Льежским университетом, и переданную публикацию № ЕР 14162158.1, как если бы указанные заявки и публикации были полностью изложены в настоящей заявке.
Область техники
Настоящее изобретение относится к новым и полезным фармацевтическим композициям, содержащим циклодекстриновое соединение и производное будесонида, для лечения и/или предотвращения воспалительного заболевания легких. Настоящее изобретение также относится к новому и полезному аналитическому способу для выявления и количественной оценки ГП-β-ЦД в растворе. Более конкретно, настоящее изобретение относится к применению валидированного 1Н ЯМР-анализа для выявления и количественной оценки циклодекстринов непосредственно в фармацевтических составах без каких-либо этапов экстрагирования или разделения для жидких лекарственных форм.
Уровень техники
Воспалительное заболевание легких (ВЗЛ) представляет собой заболевание, которое характеризуется не полностью обратимым ограничением поступления воздуха. Ограниченное поступление воздуха связано с аномальной воспалительной легочной реакцией, например, на вредные частицы (мелкие частицы, такие как частицы дыма и гари диаметром 2,5 микрометра или менее).
Воспалительные заболевания легких включают воспалительную астму, т.е. астму в острой стадии, хроническое обструктивное заболевание легких (ХНЗЛ), такое как хронический бронхит, обструктивный бронхиолит, эмфизема, легочный фиброз, муковисцедоз и т.д.
У пациентов, страдающих ВЗЛ, наблюдается значительное нейтрофильное воспаление в стенках бронхов, приводящее к прогрессирующему разрушению структур дыхательных путей в результате повторяющейся продукции протеаз и оксидантов (активных форм кислорода). Коммерчески доступные на сегодняшний день терапевтические препараты не способны адекватно снижать или предотвращать указанное нейтрофильное воспаление у пациентов, страдающих ВЗЛ. В частности, хорошо известно, что стероиды для ингаляции или перорального введения не обладают эффективностью в отношении нейтрофильного воспаления. Например, согласно исследованию, проведенному Калпиттом и соавторами (S. Culpitt et al: Am J Respir Crit Care Med. 160: 1635-1639 (1999)) на пациентах, страдающих ХНЗЛ, показано отсутствие эффективности высоких доз стероидов для ингаляции в отношении связанного с ХНЗЛ нейтрофильного воспаления и хемотаксических агентов для нейтрофилов (у людей в основном IL-8).
Учитывая неэффективность имеющихся на сегодняшний день стероидных лечебных препаратов у пациентов, страдающих ВЗЛ, существует необходимость в эффективном стероидном лечении для адекватного снижения или предотвращения нейтрофильного воспаления у пациентов, страдающих ВЗЛ.
Краткое описание изобретения
Вкратце, настоящее изобретение устраняет перечисленные выше недостатки и несовершенства, связанные с применением современного стероидного терапевтического лечения у пациентов, страдающих ВЗЛ, с помощью разработанных новых и полезных фармацевтических композиций для эффективного применения для терапевтического лечения и/или предотвращения легочных воспалительных заболеваний у хозяина, представляющего собой млекопитающее, нуждающегося в указанном лечении.
В целом, настоящее изобретение относится к новым и полезным фармацевтическим композициям, содержащим циклодекстриновое соединение и производное будесонида, для лечения и/или предотвращения воспалительного заболевания легких. Настоящее изобретение также относится к новому и полезному аналитическому способу выявления и количественной оценки ГП-β-ЦД в растворе. Более конкретно, настоящее изобретение относится к применению валидированного 1Н ЯМР-анализа для выявления и количественной оценки циклодекстринов непосредственно в фармацевтических составах без каких-либо этапов экстрагирования или разделения жидких лекарственных форм.
Новые композиции и способы согласно настоящему изобретению включают композиции, содержащие циклодекстриновое соединение и производное будесонида формулы (I):
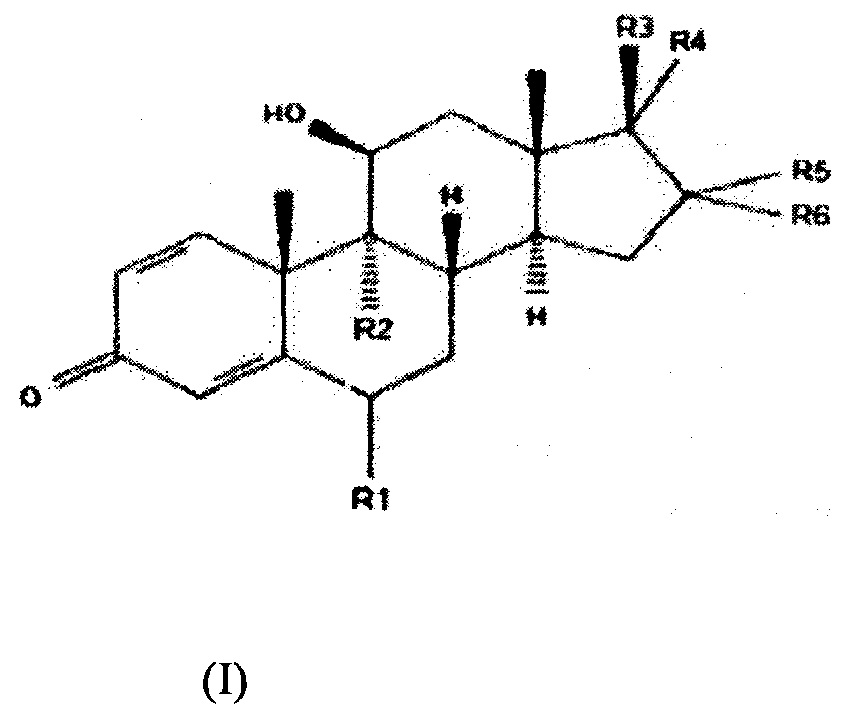
и способы их применения для лечения и/или предотвращения ВЗЛ у хозяина, представляющего собой млекопитающее, нуждающегося в указанном лечении, где каждый из «R1» и «R2» независимо представляет собой атом водорода, галоген, C1-5-алкил, С3-8-циклоалкил, гидрокси, C1-5-алкокси, C1-5-алкокси, С1-5-алкил, C1-5-алкил, необязательно содержащий в качестве заместителя один или несколько атомов галогена, С1-5-алкоксикарбонил или С1-5-алкоксикарбонил-С1-6-алкил;
Каждый из «R3», «R4», «R5» и «R6» независимо представляет собой атом водорода, гидроксильный фрагмент, C1-5-алкокси, C1-5-алкоксикарбонил, гидроксикарбонил, C1-5-алкилкарбонил, необязательно содержащий в качестве заместителя один или несколько атомов галогена, C1-5-алкилкарбонилокси, С3-8-циклоалкилкарбонилокси, С1-5-алкилтио, С1-5-алкилсульфонил, C1-5-алкилсульфинил, фуран, фуранкарбонилокси, C1-5-алкилтиокарбонил, необязательно содержащий в качестве заместителя один или несколько атомов галогена, или пропионилоксиметилкарбонил;
«R4» и «R5» необязательно образуют вместе углеводородное кольцо, содержащее от 3 до 5 атомов, где два атома углерода необязательно замещены на атом кислорода, и указанное кольцо необязательно содержит в качестве заместителя C1-5-алкильную группу, например, bis-окси-углеводородное кольцо, содержащее от 3 до 5 атомов, где два атома углерода замещены на атом кислорода, и указанное кольцо необязательно содержит в качестве заместителя алкильную группу, такую как пропильная группа; или его соль с фармацевтически приемлемой кислотой или основанием или любой оптический изомер или смесь оптических изомеров, включая рацемическую смесь или любую таутомерную форму, для применения для терапевтического и/или профилактического лечения воспалительного заболевания легких у хозяина, представляющего собой млекопитающее, нуждающегося в указанном лечении.
При использовании в настоящей заявке «C1-5-алкил» означает насыщенную или ненасыщенную углеводородную группу с прямой или разветвленной цепью, содержащую 1-5 атомов углерода, такую как метил, пропил, бутил, изопентил, 1-метилбутил, 1,2-диметилбутил, 2-этилбутил и т.д.
Термин «С3-8-циклоалкил» при использовании в настоящей заявке означает насыщенную или не полностью насыщенную гидрокарбильную группу, содержащую 3 или более атомов углерода в кольце, предпочтительно от 3 до 8 атомов углерода. Примерами циклоалкильной группы являются циклопропил, циклобутил, циклопентил, циклогексил и т.д.
«С1-5-алкокси», также обозначаемый как C1-5-алкилокси, при использовании в настоящей заявке относится к моновалентному заместителю с прямой или разветвленной углеводородной цепью, содержащему C1-5-алкильную группу, присоединенную через атом кислорода эфира, содержащему связь со свободной валентностью у атома кислорода эфира и от 1 до 5 атомов углерода, такому как метокси, этокси, пропилокси, изопропокси, бутилокси, втор-бутилокси, трет-бутилокси, 2-метилбутокси, пентилокси и т.д.
«С1-5-алкокси-С1-5-алкил» при использовании в настоящей заявке относится к группе, содержащей от 2 до 10 атомов углерода, которые прерываются атомом кислорода, такой как -СН2-О-СН3, -С Н2С Н2О-С Н3, -С Н2-О-С Н2С Н3, -С Н2-О-СН(С Н3)2, С Н2С Н2 -О- СН(С Н3)2 -СН(С Н3)С Н2-О-С Н3 и т.д.
«C1-5-алкилтио», отдельно или в комбинации, при использовании в настоящей заявке относится к моновалентному заместителю с прямой или разветвленной углеводородной цепью, содержащему С1-5-алкильную группу, присоединенную через дивалентый атом серы, содержащему связь со свободной валентностью у атома серы и от 1 до 5 атомов углерода, такому как метилтио, этилтио, пропилтио, изопропилтио, бутилтио, пентилтио, 3-метилпентилтио и т.д.
«C1-5-алкилсульфонил» при использовании в настоящей заявке относится к моновалентному заместителю, содержащему С1-5-алкильную группу, связанную через сульфонильную группу (- S(=0)), такому как метилсульфонил, этилсульфонил, пропилсульфонил, изопропилсульфонил, бутилсульфонил, пентилсульфонил, 2-метилпентилсульфонил и т.д.
«C1-5-алкилсульфинил» при использовании в настоящей заявке относится к моновалентному заместителю, содержащему C1-5-алкильную группу, связанную через сульфинильную группу (-S(=O)), такому как метилсульфинил, этилсульфинил, пропилсульфинил, изопропилсульфинил, трет-бутилсульфинил, пентилсульфинил, 2-этилбутилсульфинил и т.д.
«Фуран» при использовании в настоящей заявке означает:
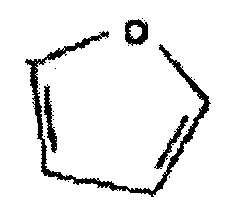
«Фуранкарбонилокси» при использовании в настоящей заявке означает:
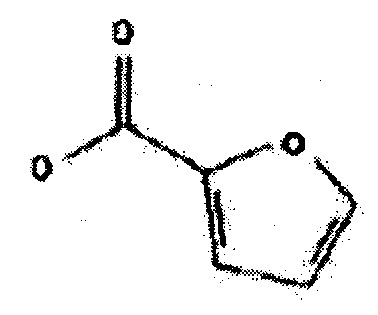
«Галоген» при использовании в настоящей заявке означает фтор, хлор, бром или йод.
«R4» и «R5» необязательно образуют вместе углеводородное кольцо, содержащее от 3 до 5 атомов, где два атома углерода могут быть необязательно замещены на атом кислорода, и указанное кольцо может необязательно содержать в качестве заместителя C1-5-алкильную группу, включая например, bis-окси-углеводородное кольцо, содержащее от 3 до 5 атомов, где два атома углерода могут быть замещены на атом кислорода, и указанное кольцо необязательно содержит в качестве заместителя алкильную группу, такую как 1,3-диоксолан-2-ил)пропил или
Предпочтительные производные будесонида согласно изобретению представляют собой мометазона фуроат или флутиказона фуроат, представленные общей формулой (I), содержащие фуранкарбонилокси группу в заместителе R3 или R4 соответственно, как показано дальше:
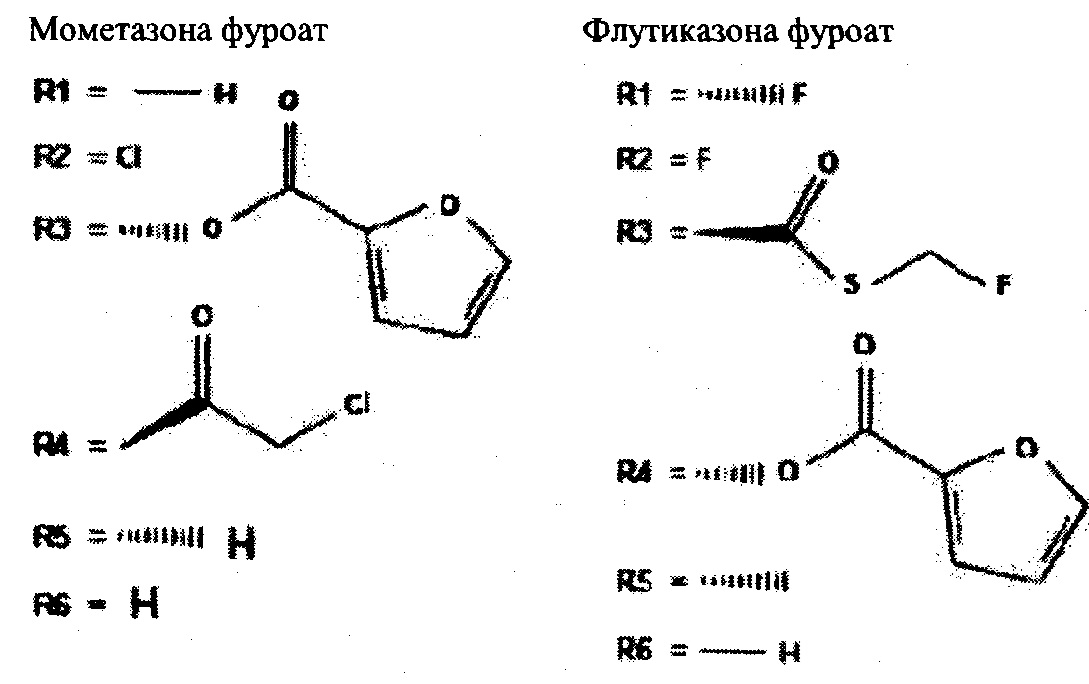
Мометазона фуроат является коммерчески доступным от компаний Pfizer и Merck, тогда как флутиказона фуроат является коммерчески доступным от компании GSK.
Другие предпочтительные производные будесонида согласно настоящему изобретению представляют собой флутиказона пропионат или беклометазона дипропионат, представленные общей формулой (I), содержащие по меньшей мере пропилкарбонилокси группу или пропионатную группу в заместителе R4, как показано далее:
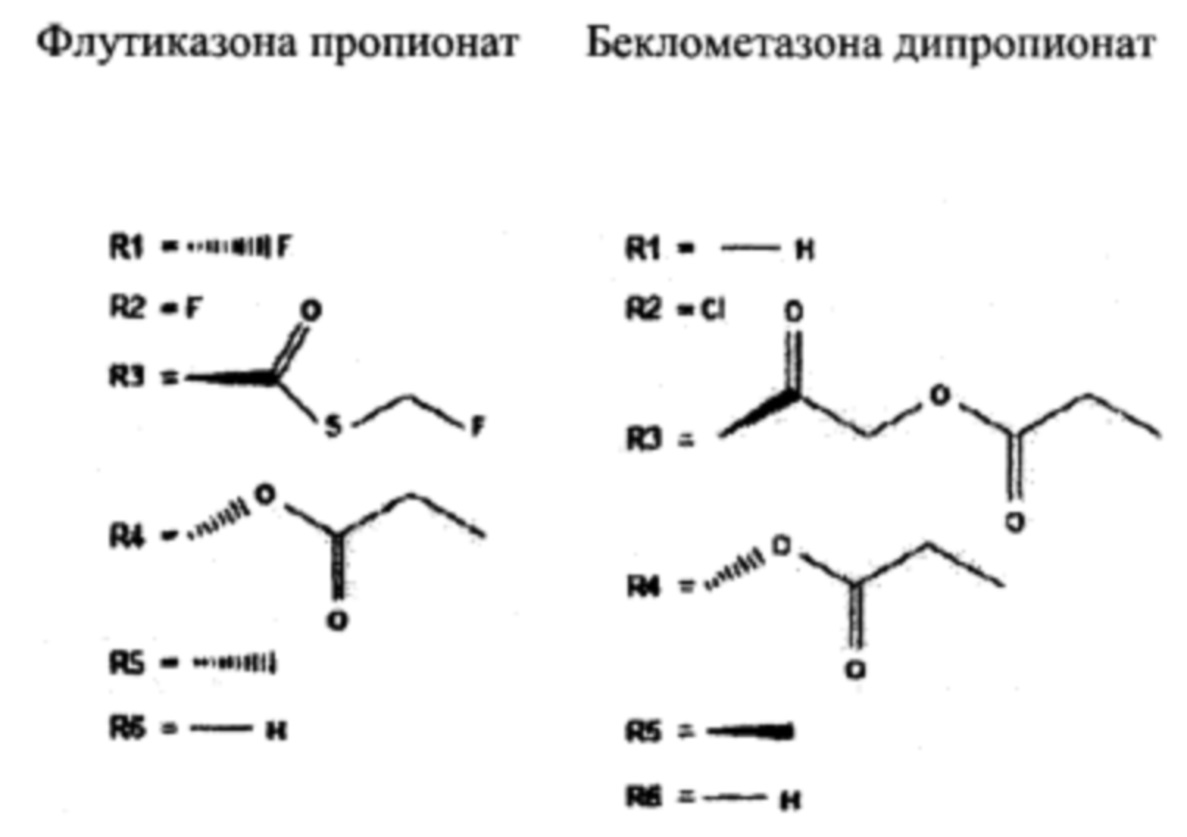
Флутиказона пропионат является коммерчески доступным из компании GSK под торговым названием Flixotide, и беклометазона дипропионат является коммерчески доступным из компаний UCB, SANDOZ, TEVA и CHIESI под торговыми названиями QVAR, Ecobec и Beclophar.
Согласно настоящему изобретению, наиболее предпочтительное производное будесонида представляет собой будесонид. Будесонид является кортикостероидом и представлен общей формулой (I), где:
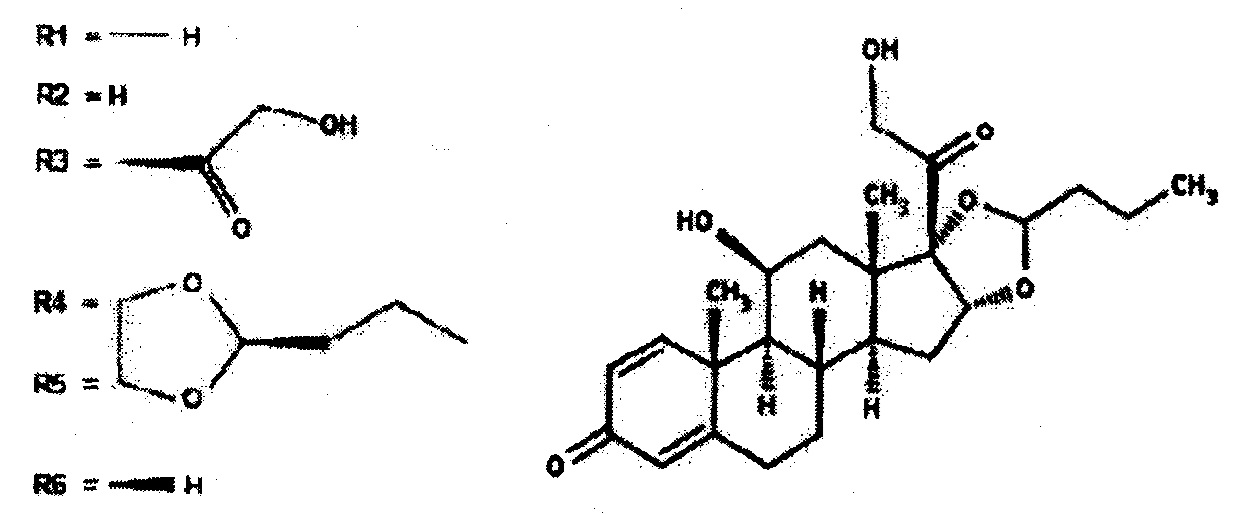
Будесонид также называется (R,S)-11(3,16а,17,21-тетрагидроксипрегна-1,4-диен-3,20-дион-циклический 16,17-ацеталь с бутиральдегидом или 16,17-(бутилиденбис(окси))-11,21-дигидрокси-(11-β3,16а)-прегна-1,4-диен-3,20-дион. Химическая формула, молекулярная масса и регистрационный номер CAS будесонида являются следующими: C25H3406MW: 430,5 и 51333-22-3 соответственно.
Будесонид представляет собой рацемат, состоящий из смеси двух диастереомеров 22R и 22S и является коммерчески доступным в виде смеси двух изомеров (22R и 22S).
Коммерчески доступные лекарственные формы будесонида предложены компанией AstraZeneca LP (Уилмингтон, Делавэр) в виде раствора под торговыми названиями Pulmicort Respules®, Rhinocort® Aqua, Rhinocort®, в также в виде порошка под торговыми названиями Nasal Inhaler и Pulmicort® Turbuhaler и под его международным непатентованным названием. Будесонид в форме порошка (неочищенный материал) предложен компанией Indis (Бельгия).
Бетаметазон также рассматривается согласно настоящему изобретению. Как и будесонид, бетаметазон представляет собой кортикостероид и представлен общей формулой, как показано далее:
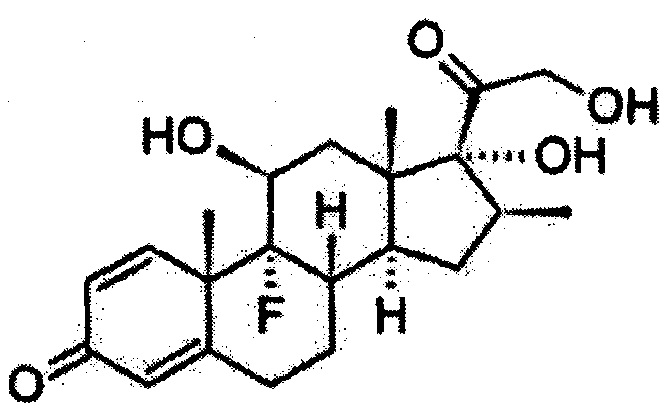
Бетаметазон имеет следующее название по системе ИЮПАК: (8S, 9R,10S,11S,13S,14S,16S,17R)-9-фтор-11,17-дигидрокси-17-(2-гидроксиацетил)-10,13,16-триметил-6,7,8,11,12,14,15,16-октагидроциклопента[а]фенантрен-3-он. Химическая формула, молекулярная масса и регистрационный номер CAS бетаметазона являются следующими: C22H29F05: 392,461063 г/моль и 378-44-9 соответственно.
Альтернативные химические названия бетаметазона включают целестон, риндерона бетадексаметазон и флубенизолон.
Флутиказон является другим кортикостероидом, рассматриваемым согласно настоящему изобретению, и представлен общей формулой, как показано далее:
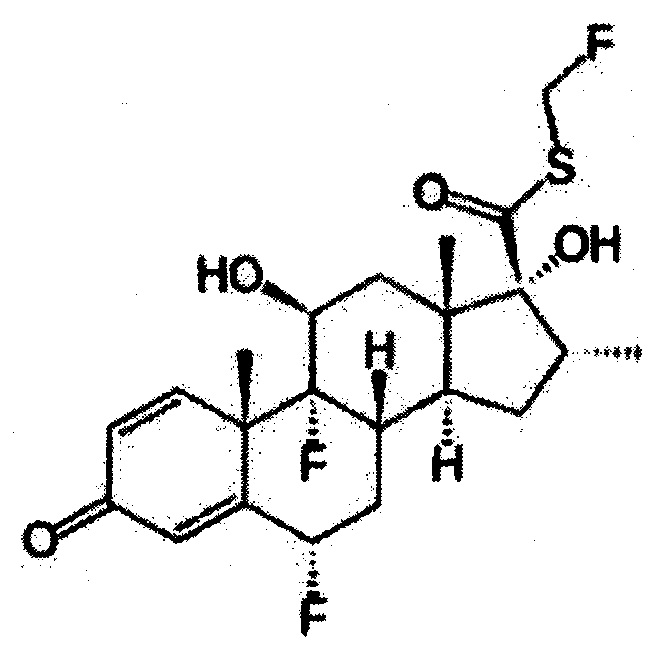
Флутиказон имеет следующее название по системе ИЮПАК: (6а,11(3,16а,17а)-6,9-дифтор-17-1{[(фторметил)тио]карбонил}-11-гидрокси-16-метил-3-оксоандроста-1,4-диен-17-ил-2-фуранкарбоксилат. Химическая формула, молекулярная масса и регистрационный номер CAS флутиказона являются следующими: C27H29F306S: 538,576 г/моль и 80474-14-2 соответственно.
Циклодекстрины, как известно, представляют собой циклические олигосахариды, образующиеся из крахмала в результате его бактериальной переработки. Циклодекстрины состоят из 6, 7 или 8 α-D-глюкопиранозидных единиц и называются соответственно α-, β- или γ-циклодекстрины.
Циклодекстриновые соединения согласно настоящему изобретению включают непосредственно циклодекстрин, алкил-циклодекстрин (R-ЦД), где «R» представляет собой метил, этил, пропил или бутил; карбоксиалкил-циклодекстрин (CR-ЦД), этерифицированный циклодекстрин (RO-ЦД), гидроксиалкил-циклодекстрин (HR-ЦД), гликозил-циклодекстрин, комплекс циклодекстрина с ди- и триглицеридами или их комбинации и фармацевтически приемлемые соли, растворимость которых в воде составляет по меньшей мере примерно 0,5 г/100 мл при температуре примерно 25°С.
Водорастворимые циклодекстриновые соединения, которые предпочтительно используются согласно настоящему изобретению, относятся к циклодекстриновым соединениям, обладающим по меньшей мере такой же растворимостью в воде, как β-циклодекстрин (примерно 1,85 г/100 мл). Примеры таких водорастворимых циклодекстриновых соединений включают гидроксипропилциклодекстрин, мальтозилциклодекстрин и их соли. В частности, предпочтительными являются гидроксипропил-β-циклодекстрин, мальтозил-β-циклодекстрин и их производные.
Другие предпочтительные циклодекстриновые соединения согласно настоящему изобретению включают метилциклодекстрины (продукты метилирования циклодекстринов), такие как 2-О-метил-β-циклодекстрин; диметилциклодекстрин (DIMEB) (предпочтительно замещенный в положениях 2 и 6), триметилциклодекстрин (предпочтительно замещенный в положениях 2, 3 и 6), «произвольно метилированные» циклодекстрины (RAMEB или РМ) (предпочтительно замещенные случайным образом в положениях 2, 3 и 6, но с количеством метильных групп, составляющим от 1,7 до 1,9 на единицу глюкоппираннозы), гидроксипропилциклодекстрины (ГПЦД), гидроксипропилированные циклодекстрины, предпочтительно замещенные случайным образом, в основном в положениях 2 и 3 (ГП-β-ЦД, ГП-γ-ЦД), гидроксиэтилциклодекстрины, карбоксиметилэтилциклодекстрины, этилциклодекстрины, амфифильные циклодекстрины, полученные в результате наращивания углеводородных цепей в гидроксильных группах и способные образовывать наночастицы, холестерин-циклодекстрины и триглицериды-циклодекстрины, полученные путем наращивания моноаминированных циклодекстринов (со спейсерной группой), как описано в обзоре Critical Review in Therapeutic drug Carrier Systems, Stephen D. Bruck Ed, Cyclodextrin-Enabling Excipient; their present and future use in Pharmaceuticals, D. Thomson, Volume 14, Issue 1 p1-114 (1997), который полностью включен в настоящую заявку посредством ссылки.
Наиболее предпочтительные циклодекстриновые соединения согласно настоящему изобретению включают β-циклодекстрин, необязательно содержащий химическую функциональную группу, присоединенную к глюкопираннозным единицам, такой как гидроксипропил-β-циклодекстрин (ГП-β-ЦД), сульфобутиловый эфир-β-циклодекстрин (СБЭ-β-ЦД), произвольно метилированный β-циклодекстрин (РМ-β-ЦД), диметил-β-циклодекстрин (DIME-β-ЦД), триметил-β-циклодекстрин (TRIME-β-ЦД), гидроксибутил-β-циклодекстрин (ГБ-β-ЦД), гликозил-β-циклодекстрин, мальтозил-β-циклодекстрин, 2-O-метил-β-циклодекстрин (Crysmeb) и их фармацевтически приемлемые соли и любую комбинацию.
Наиболее предпочтительный циклодекстрин согласно настоящему изобретению представляет собой гидроксипропил-β-циклодекстрин (также называемый выше и далее в настоящей заявке ГПβЦД или ГП-β-ЦД).
Циклодекстриновые соединения согласно настоящему изобретению получают с помощью хорошо известного метода ферментативной переработки крахмала, такого как метод, описанный в источнике «Cyclodextrin Technology, J Szejtli, Kluwer Academic Publishers 1998, pp 1-78», который полностью включен в настоящую заявку посредством ссылки, с последующим наращиванием подходящей химической группы. Указанные циклодекстриновые соединения являются коммерчески доступными из компании Roquette (Франция).
Наиболее предпочтительные фармацевтические композиции включают производное будесонида и циклодекстриновое соединение в молярном отношении, составляющем между примерно 1:1 и примерно 1:100, предпочтительно примерно 1:75 и наиболее предпочтительно примерно 1:50. Отношение концентраций будесонид/гидроксипропил-β-циклодекстрин предпочтительно находится в молярном отношении примерно 1:50.
Фармацевтические композиции согласно настоящему изобретению, содержащие циклодекстриновое соединение и производное будесонида, могут быть получены путем добавления избытка производного будесонида в форме порошка к подходящему количеству циклодекстрина в жидком растворе. Жидкий циклодекстрин в растворе представляет собой водный или водно-спиртовой или спиртовой раствор, такой как раствор этанола. Производное будесонида и циклодекстриновое соединение объединяют при непрерывном перемешивании при комнатной температуре. Избыточное количество производного будесонида удаляют посредством фильтрования.
Оба компонента взвешивают с получением смеси производного будесонида и циклодекстрина с отношением массовых концентраций, составляющим между примерно 1:1500 и примерно 1:2, предпочтительно примерно 1:60.
Жидкую смесь затем можно сушить в процессе атомизации с помощью подходящего хорошо известного в данной области техники метода получения микронизированного высушенного порошка. В данном случае фармацевтическая композиция также может содержать фармацевтически приемлемое вспомогательное вещество, такое как носитель, например, лактозу, стеарат магния, маннит, полиолы, производные лейцина и т.д.
Жидкую смесь также можно добавлять к циклодекстрину в изотоническом буфере на этапе смешивания в такой же концентрации, как концентрация циклодекстрина в жидком растворе, с получением фармацевтической композиции в жидком растворе.
Фармацевтическая композиция в жидком растворе также может содержать хорошо известные фармацевтически приемлемые добавки, такие как изотонические буферы, консерванты, растворители или агенты, модулирующие вязкость, и вспомогательные вещества. Подходящие изотонические буферные системы приставляют собой системы на основе фосфата натрия (ФСБ), ацетата натрия или бората натрия, такие как системы, описанные в источнике http://bio.lonza.com/uploads/tx_mwaxmarketingmaterial/Lonza_BenchGuides_Phosphate_Bufered_Saline_PBS.pdf.
Могут содержаться консерванты для предотвращения бактериальной контаминации фармацевтических композиций во время их применения. Подходящие консерванты представляют собой, например, бензалкония хлорид, хлорбутанол, метилпарабен, пропилпарабен, фенилэтиловый спирт, сорбиновую кислоту. Такие консерванты используются, как правило, в количестве, составляющем от примерно 0,01 до примерно 1% (по массе к объему).
Подходящие вспомогательные вещества и фармацевтически приемлемые соли описаны в источнике Remington's Pharmaceutical Sciences, 16th ed., 1980, Mack Publishing Co., edited by Oslo et al., который полностью включен в настоящую заявку посредством ссылки.
Как правило, в фармацевтической композиции согласно настоящему изобретению используется подходящее количество фармацевтически приемлемой соли для придания указанной композиции изотоничности. Примеры фармацевтически приемлемых веществ включают солевой раствор, раствор Рингера и раствор декстрозы. Согласно настоящему изобретению, рН раствора составляет предпочтительно от примерно 5 до примерно 8, более предпочтительно от примерно 7 до примерно 7,5.
Фармацевтические композиции согласно настоящему изобретению применимы для лечения и/или предотвращения воспалительного заболевания легких у хозяина, представляющего собой млекопитающее, нуждающегося в указанном лечении, предпочтительно хронического обструктивного заболевания легких, такого как хронический бронхит, обструктивный бронхиолит, эмфизема, легочный фиброз, муковисцедоз, и наиболее предпочтительно для вызванного табакокурением хронического обструктивного заболевания легких и муковисцедоза.
Фармацевтические композиции согласно настоящему изобретению могут быть представлены в виде форм дозирования для перорального, парентерального или местного введения, в частности, в формах дозирования для аэрозольного или ингаляционного введения через нос, в форме для местного введения. Фармацевтические композиции согласно настоящему изобретению можно доставлять в растворе, суспензии, в виде смеси тонкодисперсного порошка и т.д. Кроме того, фармацевтические композиции согласно настоящему изобретению можно вводить, например, с помощью небулайзера, ингалятора отмеренных доз или ингалятора сухого порошка или любого другого устройства, созданного для указанного местного введения.
Фармацевтические композиции согласно настоящему изобретению можно вводить в молекулярной дозе, составляющей в диапазоне от примерно 0,05 до примерно 1000 мкг, предпочтительно от примерно 0,1 до примерно 500 мкг, в частности, в диапазоне от примерно 50 до примерно 200 мкг в день.
Предпочтительная фармацевтическая композиция, рассматриваемая согласно настоящему изобретению, включает будесонид и циклодекстрин в жидком растворе, наиболее предпочтительно будесонид и ГП-β-циклодекстрин.
Наиболее предпочтительная фармацевтическая композиция, рассматриваемая согласно настоящему изобретению, содержит будесонид и циклодекстрин в жидком растворе в концентрации, составляющей примерно 100 мкг/мл будесонида примерно в 20 мМ растворе ГП-β-циклодекстрина в изотоническом буфере.
Комбинация циклодекстринового соединения с производным будесонида в фармацевтических композициях согласно настоящему изобретению предпочтительно представляет собой комплекс производного будесонида и циклодекстринового соединения в стехиометрическом отношении, составляющем примерно 1:1 или примерно 2:1. В частности, стехиометрическое отношение для комплекса будесонида с ГП-β-циклодекстрином составляет примерно 1:1.
Настоящее изобретение также относится к следующим пунктам:
(1) Фармацевтическая композиция, содержащая циклодекстриновое соединение и производное будесонида формулы I:
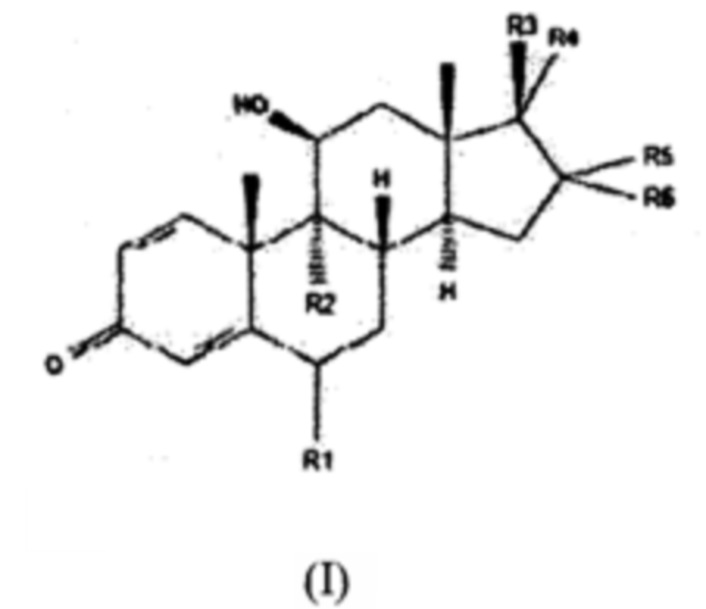
где каждый из R1 и R2 независимо представляет собой атом водорода, галоген, С1-5-алкил, С3-8-циклоалкил, гидрокси, C1-5-алкокси, С1-5-алкокси-С1-5-алкил, C1-5-алкил, необязательно содержащий в качестве заместителя один или несколько атомов галогена, С1-5-алкоксикарбонил, С1-5-алкоксикарбонил-С1-6-алкил;
каждый из R3, R4, R5 и R6 независимо представляет собой атом водорода, гидроксил, C1-5-алкокси, C1-5-алкоксикарбонил, гидроксикарбонил, C1-5-алкилкарбонил, необязательно содержащий в качестве заместителя один или несколько атомов галогена, С1-5-алкилкарбонилокси, С3-8-циклоалкилкарбонилокси, C1-5-алкилтио, С1-5-алкилсульфонил, С1-5-алкилсульфинил, фуран, фуранкарбонилокси, С1-5-алкилтиокарбонил, необязательно содержащий в качестве заместителя один или несколько атомов галогена; и
R4 и R5 необязательно образуют вместе углеводородное кольцо, содержащее от 3 до 5 атомов, где два атома углерода необязательно замещены на атом кислорода, и указанное кольцо необязательно содержит в качестве заместителя С1-5-алкильную группу, или его соль с фармацевтически приемлемой кислотой или основанием, или любой оптический изомер или смесь оптических изомеров, включая рацемическую смесь или любую таутомерную форму, для применения для терапевтического и/или профилактического лечения воспалительного заболевания легких у хозяина, представляющего собой млекопитающее, нуждающегося в указанном лечении.
(2) Фармацевтическая композиция по п. 1, отличающаяся тем, что отношение массовых концентраций производного будесонида и циклодекстринового соединения составляет между примерно 1:1500 и примерно 1:2.
(3) Фармацевтическая композиция по п. 1, отличающаяся тем, что отношение массовых концентраций производного будесонида и циклодекстринового соединения составляет примерно 1:60.
(4) Фармацевтическая композиция по пп. 1-3, отличающаяся тем, что производное будесонида выбрано из группы, состоящей из мометазона фуроата, флутиказона, флутиказона фуроата, флутиказона пропионата, бетаметазона, бетаметазона пропионата, беклометазона, будесонида или их комбинаций и фармацевтически приемлемых солей или сложных эфиров.
(5) Фармацевтическая композиция по любому из пп. 1-4, содержащая производное будесонида, отличающаяся тем, что R1, R2 и R6 представляют собой атомы водорода; R3 представляет собой гидроксиэтаноновую группу, и R4 вместе с R5 образует 1,3-диоксолан-2-ил)пропил или
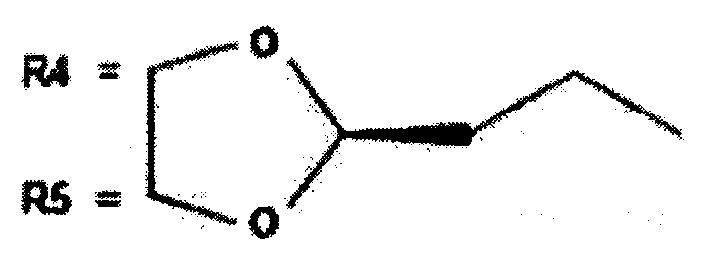
(будесонид).
(6) Фармацевтическая композиция по любому из пп. 1-4, содержащая производное будесонида, отличающаяся тем, что R1 представляет собой атом водорода, R2 представляет собой C1, R3 представляет собой фуранкарбоксил, R4 представляет собой хлорметилкарбонил, и R5 и R6 представляют собой атомы водорода (мометазона фуроат).
(7) Фармацевтическая композиция по любому из пп. 1-4, содержащая производное будесонида, отличающаяся тем, что R1 и R2 представляют собой фтор, R3 представляет собой фторметилтиокарбонил, R4 представляет собой фуранкарбоксил, и R5 и R6 представляют собой атомы водорода (флутиказона фуроат).
(8) Фармацевтическая композиция по любому из пп. 1-4, содержащая производное будесонида, отличающаяся тем, что R1 и R2 представляют собой фтор, R3 представляет собой фторметилтиокарбонил, R4 представляет собой пропилкарбоксил, и R5 и R6 представляют собой атомы водорода (флутиказона пропионат).
(9) Фармацевтическая композиция по любому из пп. 1-4, содержащая производное будесонида, где R2 представляет собой хлор, R1, R5 и R6 представляют собой атомы водорода, R3 представляет собой пропионилоксиметилкарбонил, и R4 представляет собой пропилкарбонилокси группу
(беклометазона дипропионат).
(10) Фармацевтическая композиция по любому из пп. 1-9, отличающаяся тем, что производное будесонида образует с циклодекстриновым соединением комплекс в стехиометрическом отношении, составляющем примерно 1:1.
(11) Композиция по любому из пп. 1-10, отличающаяся тем, что растворимость циклодекстринового соединения в воде составляет по меньшей мере примерно 1,85 г/100 мл.
(12) Композиция по любому из пп. 1-11, отличающаяся тем, что циклодекстриновое соединение выбрано из группы, состоящей из: β-циклодекстрина, гидроксипропил-β-циклодекстрина, произвольно метилированного β-циклодекстрина, диметил-β-циклодекстрина, триметил-β-циклодекстрина, гидроксипропил-β-циклодекстрина, гидроксибутил-β-циклодекстрина, гликозил-β-циклодекстрина, мальтозил-β-циклодекстрина, 2-О-метил-β-циклодекстрина или их комбинаций и фармацевтически приемлемых солей.
(13) Композиция по любому из пп. 1-12, отличающаяся тем, что циклодекстриновое соединение представляет собой гидроксипропил-β-циклодекстрин.
(14) Композиция по любому из пп. 1-13, отличающаяся тем, что воспалительное заболевание легких представляет собой хроническое обструктивное заболевание.
(15) Способ профилактического лечения воспалительного заболевания легких, включающий введение пациенту, нуждающемуся в указанном лечении, эффективной дозы композиции по любому из пп. 1-14.
(16) Способ терапевтического лечения воспалительного заболевания легких, включающий введение пациенту, нуждающемуся в указанном лечении, эффективной дозы композиции по любому из пп. 1-14.
(17) Способ лечения по п. 15 или 16, отличающийся тем, что циклодекстриновое соединение и производное будесонида вводят в номинальной дозе, составляющей примерно 0,1 мг/доза и примерно 25 мг/доза соответственно.
(18) Ингаляционная система для лечения воспалительного заболевания легких у пациента, нуждающегося в указанном лечении, содержащая фармацевтическую композицию по пп. 1-14.
(19) Фармацевтическая композиция, содержащая примерно 250 мкг/мл будесонида и примерно 20 мМ ГП-β-ЦД.
(20) Фармацевтическая композиция, содержащая примерно 100 мкг/мл будесонида и примерно 20 мМ ГП-β-ЦД.
(21) Фармацевтическая композиция, содержащая примерно 250 мкг/мл будесонида и примерно 10 мМ ГП-β-ЦД.
(22) Фармацевтическая композиция, содержащая примерно 100 мкг/мл будесонида и примерно 10 мМ ГП-β-ЦД.
(23) Фармацевтическая композиция, содержащая примерно 100 мкг/мл флутиказона и примерно 10 мМ ГП-β-ЦД.
(24) Фармацевтическая композиция, содержащая примерно 40 мкг/мл флутиказона и примерно 10 мМ ГП-β-ЦД.
(25) Фармацевтическая композиция, содержащая примерно 40 мкг/мл беклометазона и примерно 10 мМ ГП-β-ЦД.
(26) Фармацевтическая композиция по пп. 19-25, отличающаяся тем, что указанная фармацевтическая композиция представляет собой раствор.
(27) Фармацевтическая композиция по п. 26, отличающаяся тем, что значение рН раствора составляет от примерно 5 до примерно 8.
(28) Фармацевтическая композиция по п. 26, отличающаяся тем, что значение рН раствора составляет от примерно 7 до примерно 7,5.
(29) Фармацевтическая композиция по п. 26, отличающаяся тем, что указанная фармацевтическая композиция представляет собой раствор, и указанный раствор высушен распылением с получением порошка.
(30) Фармацевтическая композиция по п. 29, отличающаяся тем, что порошок содержит частицы размером примерно 3 микрона.
(31) Фармацевтическая композиция, содержащая производное будесонида и циклодекстрин, для доставки производного будесонида в молекулярной дозе, составляющей в диапазоне от примерно 0,05 до примерно 1000 мкг.
(32) Фармацевтическая композиция, содержащая производное будесонида и циклодекстрин, для доставки производного будесонида в молекулярной дозе, составляющей в диапазоне от примерно 0,1 до примерно 500 мкг.
(33) Фармацевтическая композиция, содержащая производное будесонида и циклодекстрин, для доставки производного будесонида в молекулярной дозе, составляющей в диапазоне от примерно 50 до примерно 200 мкг в день.
(34) Фармацевтическая композиция по пп. 31-33, отличающаяся тем, что производное будесонида представляет собой будесонид, и циклодекстриновое соединение представляет собой ГП-β-ЦД.
(35) Фармацевтическая композиция по пп. 31-33, отличающаяся тем, что производное будесонида представляет собой бетаметазон, и циклодекстриновое соединение представляет собой ГП-β-ЦД.
(36) Фармацевтическая композиция по пп. 31-33, отличающаяся тем, что производное будесонида представляет собой флутиказон, и циклодекстриновое соединение представляет собой ГП-β-ЦД.
(37) Фармацевтическая композиция по пп. 31-33, отличающаяся тем, что производное будесонида представляет собой беклометазон, и циклодекстриновое соединение представляет собой ГП-β-ЦД.
(38) Фармацевтическая композиция, содержащая комплекс производного будесонида и циклодекстринового соединения в стехиометрическом отношении, составляющем от примерно 1:1 до примерно 2:1.
(39) Фармацевтическая композиция, содержащая комплекс производного будесонида и циклодекстринового соединения в стехиометрическом отношении, составляющем примерно 1:1.
(40) Фармацевтическая композиция по пп. 38-39, отличающаяся тем, что производное будесонида представляет собой буденосид, и циклодекстриновое соединение представляет собой ГП-β-ЦД.
(41) Фармацевтическая композиция по пп. 38-39, отличающаяся тем, что производное будесонида представляет собой флутиказон, и циклодекстриновое соединение представляет собой ГП-β-ЦД.
(42) Фармацевтическая композиция по пп. 38-39, отличающаяся тем, что производное будесонида представляет собой беклометазон, и циклодекстриновое соединение представляет собой ГП-β-ЦД.
(43) Способ лечения воспалительного заболевания легких у хозяина, представляющего собой млекопитающее, нуждающегося в указанном лечении, где указанный способ включает
введение фармацевтической композиции по любому из пп. 1-14, 19-42 и 58 хозяину,
представляющему собой млекопитающее.
(44) Способ снижения количества воспалительных клеток в легочной ткани у хозяина, представляющего собой млекопитающее, нуждающегося в указанном лечении, где указанный способ включает введение фармацевтической композиции по любому из пп. 1-14, 19-42 и 58 хозяину, представляющему собой млекопитающее.
(45) Способ снижения вызванной озоном продукции КС в легочной ткани у хозяина, представляющего собой млекопитающее, нуждающегося в указанном лечении, где указанный способ включает
введение фармацевтической композиции по любому из пп. 1-14, 19-42 и 58 хозяину, представляющему собой млекопитающее.
(46) Способ снижения IL13 в легочной ткани у хозяина, представляющего собой млекопитающее, нуждающегося в указанном лечении, после стимуляции аллергеном, где указанный способ включает
введение фармацевтической композиции по любому из пп. 1-14, 19-42 и 58 хозяину, представляющему собой млекопитающее.
(47) Способ снижения гиперреактивности бронхов у хозяина, представляющего собой млекопитающее, нуждающегося в указанном лечении, где указанный способ включает
введение фармацевтической композиции по любому из пп. 1-14, 19-42 и 58 хозяину, представляющему собой млекопитающее.
(48) Способ снижения уровня IL17 у хозяина, представляющего собой млекопитающее, нуждающегося в указанном лечении, где указанный способ включает
введение фармацевтической композиции по любому из пп. 1-14, 19-42 и 58 хозяину, представляющему собой млекопитающее.
(49) Способ снижения уровня CXCL-1 у хозяина, представляющего собой млекопитающее, нуждающегося в указанном лечении, где указанный способ включает
введение фармацевтической композиции по любому из пп. 1-14, 19-42 и 58 хозяину, представляющему собой млекопитающее.
(50) Способ снижения нейтрофилов в легочной ткани у хозяина, представляющего собой млекопитающее, нуждающегося в указанном лечении, после подвергания воздействию сигаретного дыма, где указанный способ включает
введение фармацевтической композиции по любому из пп. 1-14, 19-42 и 58 хозяину, представляющему собой млекопитающее.
(51) Способ для выявления и количественной оценки ГП-β-ЦД в композиции, содержащей активный ингредиент и ГП-β-ЦД, без какого-либо этапа разделения или экстрагирования композиции, где ГП-β-ЦД содержит гидроксипропильную группу, где указанный способ включает:
применение 1H ЯМР-анализа гидроксипропильной группы на ГП-β-ЦД для выявления и количественной оценки ГП-β-ЦД в композиции.
(52) Способ по п. 51 отличающийся тем, что композиция представляет собой раствор.
(53) Способ по пп. 51 или 52, отличающийся тем, что активный ингредиент представляет собой производное будесонида.
(54) Способ по пп. 51 или 52, отличающийся тем, что производное будесонида представляет собой будесонид.
(55) Способ по пп. 51 или 52, отличающийся тем, что производное будесонида представляет собой флутиказон.
(56)Способ по пп. 51 или 52, отличающийся тем, что производное будесонида представляет собой беклометазон.
(57) Способ по пп. 51 или 52, отличающийся тем, что производное будесонида представляет собой бетаметазон.
(58) Фармацевтическая композиция по пп. 38-39, отличающаяся тем, что производное будесонида представляет собой бетаметазон, и циклодекстриновое соединение представляет собой ГП-β-ЦД.
Следующие далее примеры, ссылки и фигуры предложены для лучшего понимания настоящего изобретения. Следует понимать, что в пределах настоящего изобретения возможны модификации изложенных процедур.
Краткое описание чертежей
Вышеизложенные и другие объекты, преимущества и признаки настоящего изобретения, а также способы их реализации, будут более очевидны при рассмотрении следующих далее Фигур и Примеров, где:
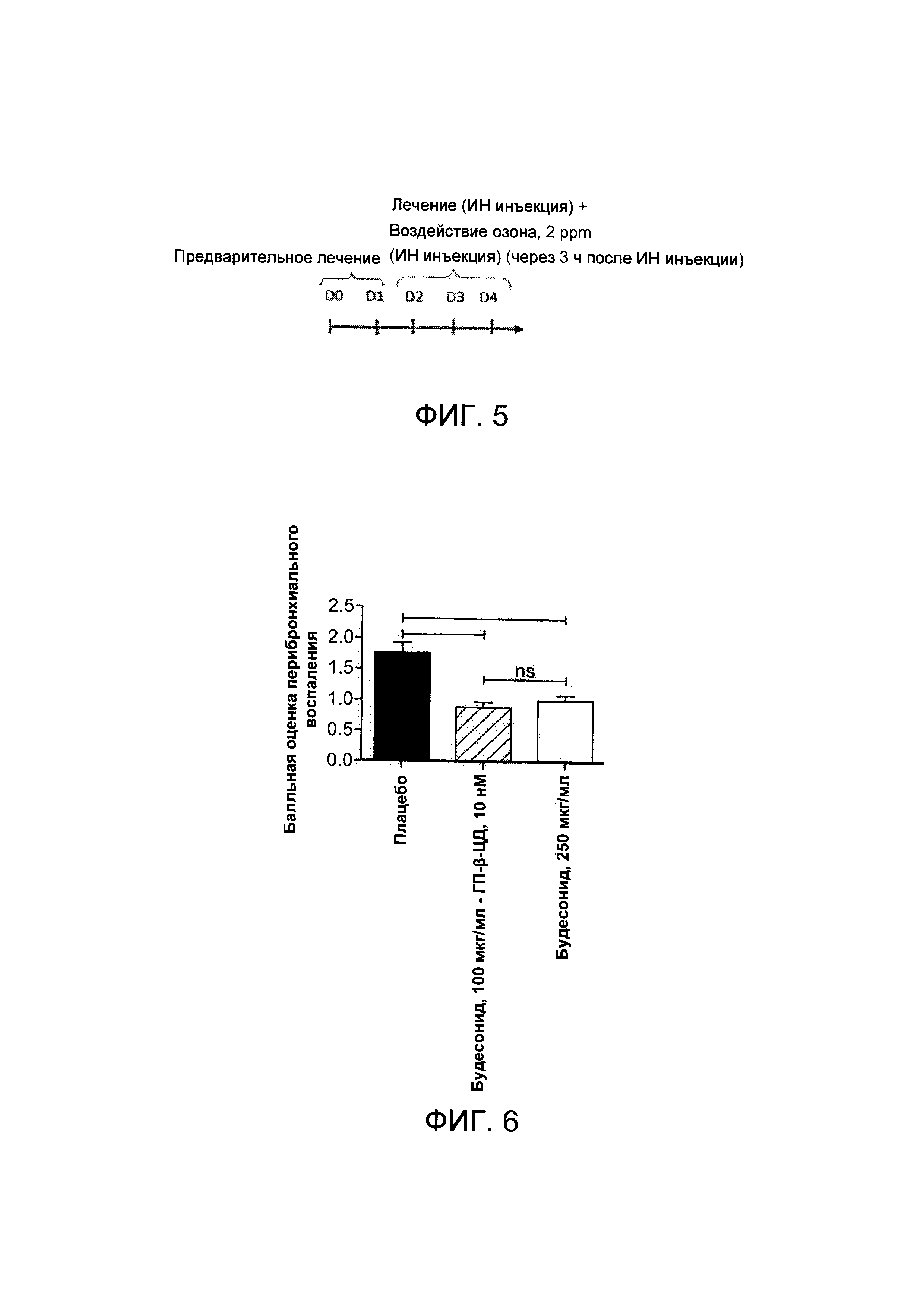
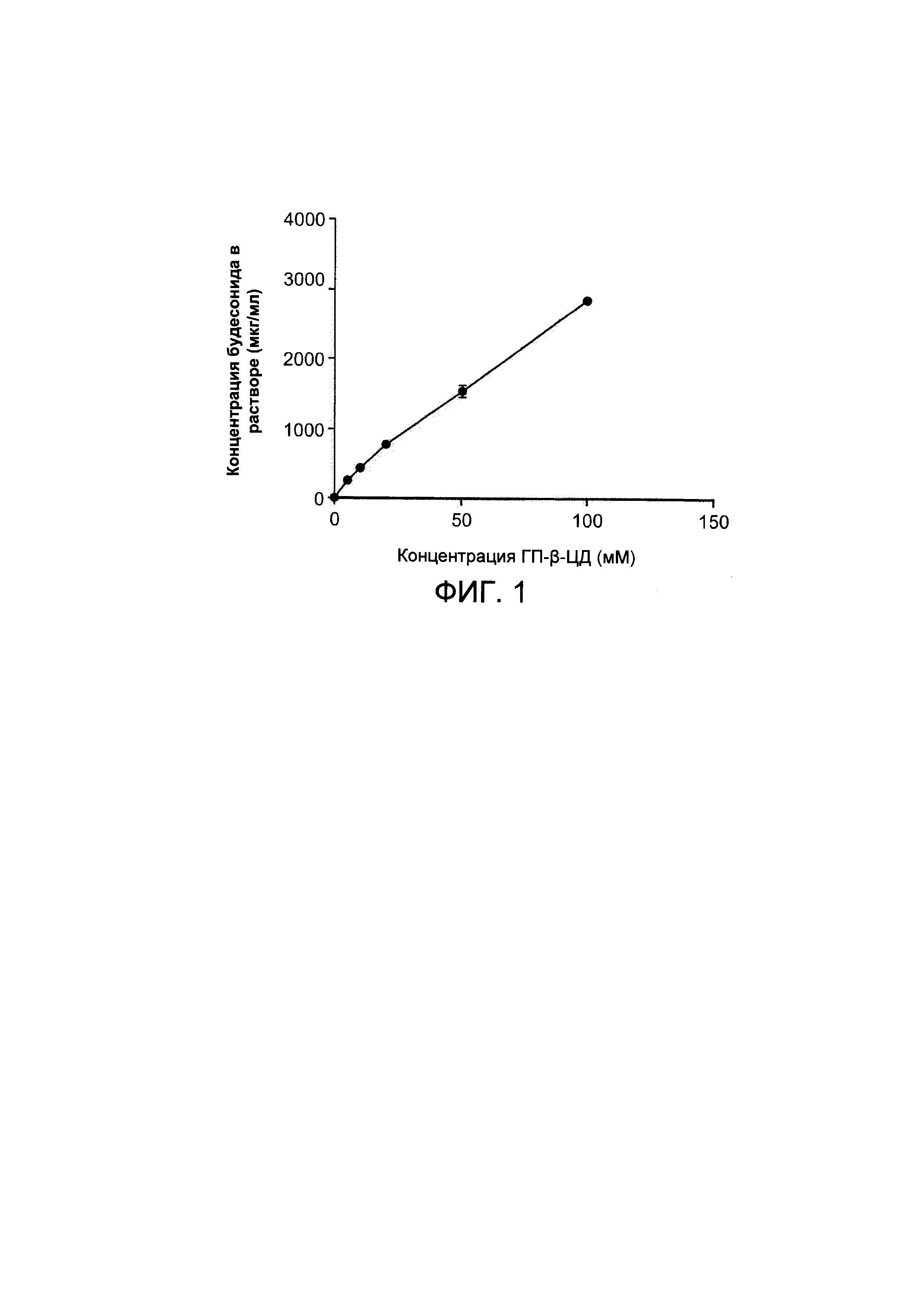
На Фигуре 1 показан график растворимости будесонида в водном растворе при повышающейся концентрации ГП-β-циклодекстрина (ГП-β-ЦД);
На Фигуре 2 представлено схематичное описание опыта с применением сенсибилизации и стимуляции аллергеном; ВБ означает внутрибрюшинную инъекцию, и ГРБ означает гиперреактивность бронхов;
На Фигуре 3 показана модель обструкции и воспаления дыхательных путей: балльная оценка перибронхиального воспаления, проведенная по результатам гистологического анализа;
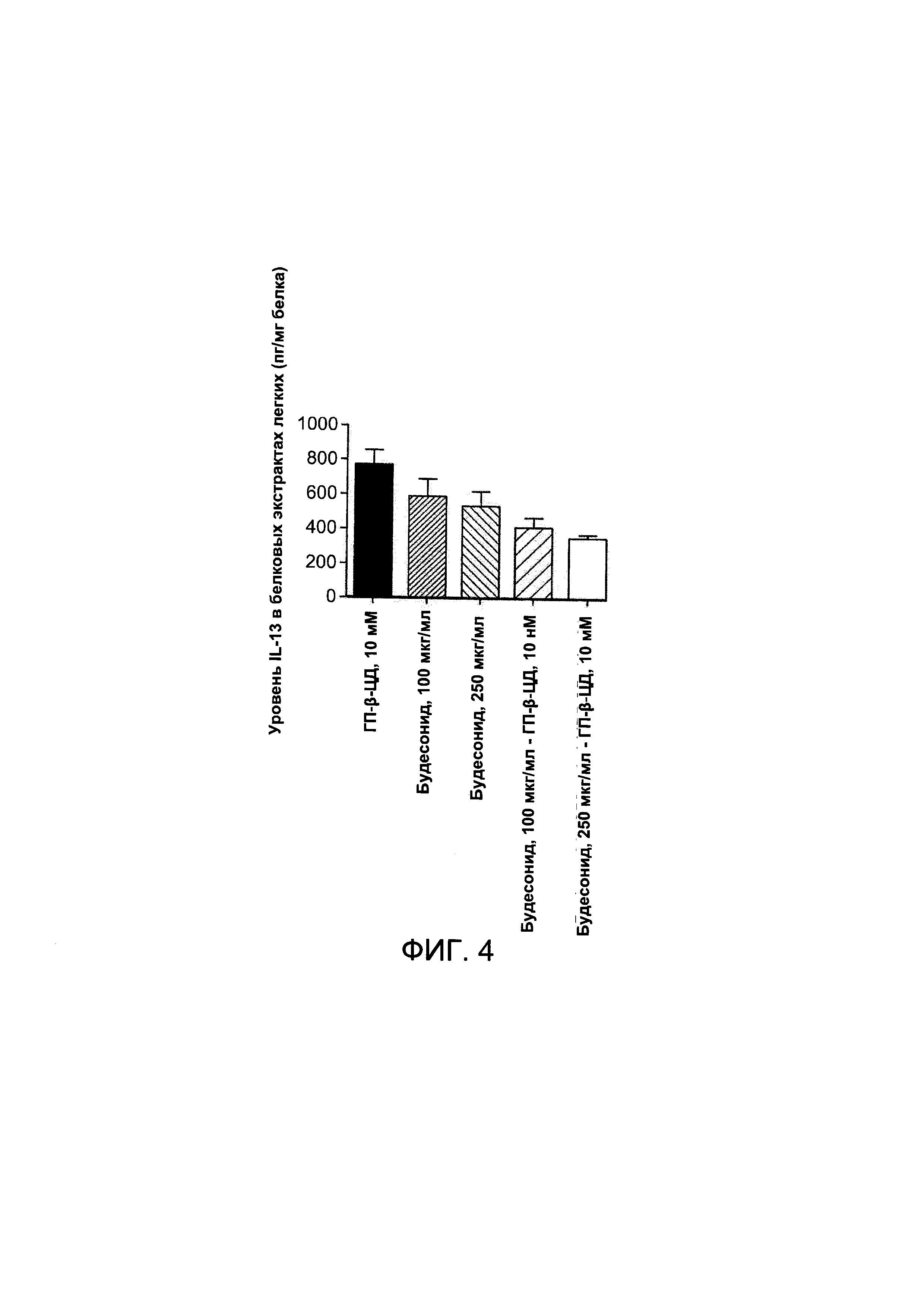
На Фигуре 4 показан уровень IL13, измеренный в легочных белковых экстрактах;
На Фигуре 5 представлено схематичное описание опыта с воздействием озона;
На Фигуре 6 показана модель ХНЗЛ: балльная оценка перибронхиального воспаления, проведенная по результатам гистологического анализа;
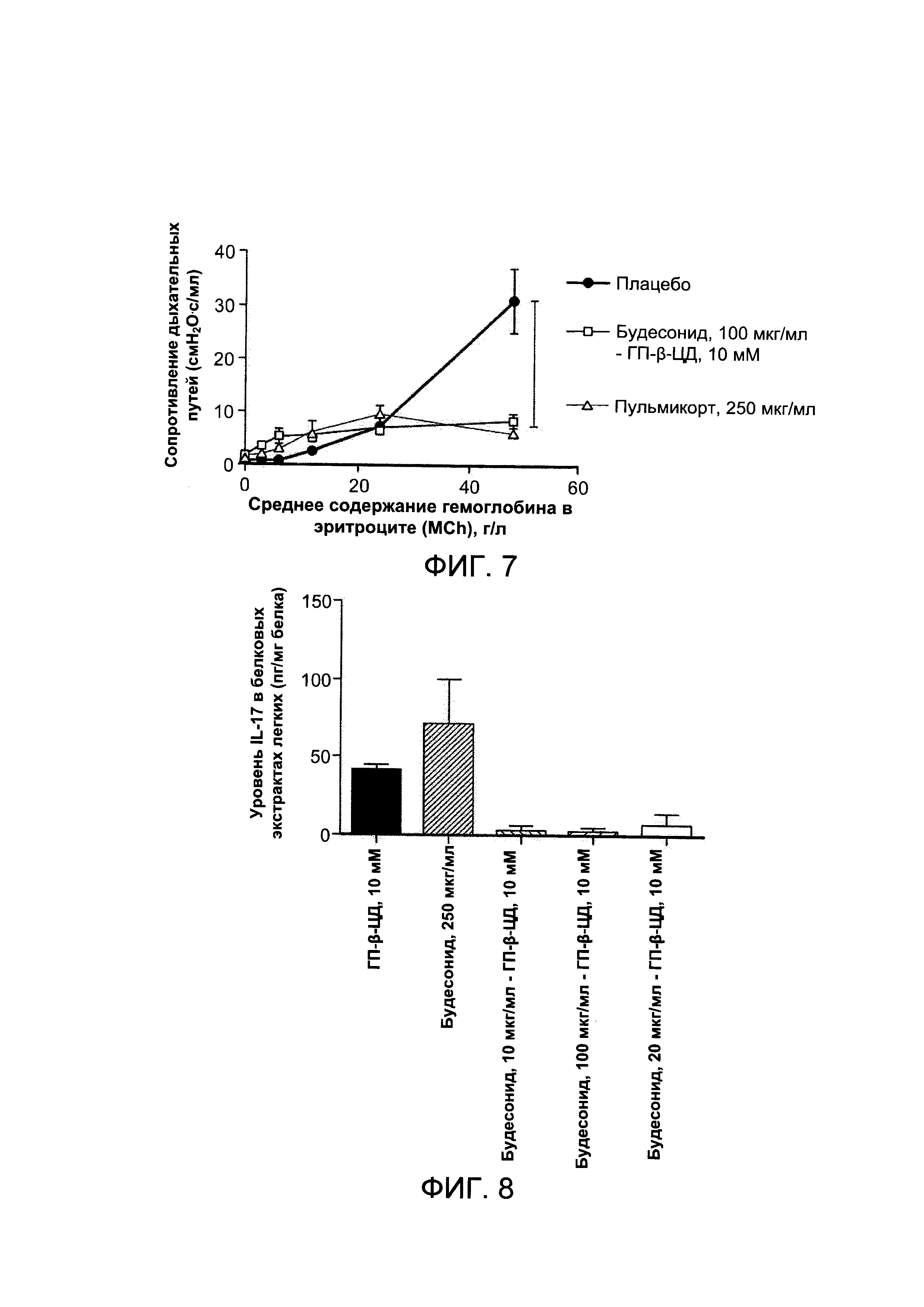
На Фигуре 7 показаны результаты измерения реактивности воздухоносных путей: произведение длительности паузы и отношения максимальных давлений на выдохе и вдохе (индекс Penh), измеренное у мышей после получения плацебо или лечебного препарата;
На Фигуре 8 показаны результаты измерения IL17 с помощью ИФА в легочных белковых экстрактах у мышей, подверженных воздействию озона;
На Фигуре 9 показаны результаты измерения IL13 с помощью ИФА в легочных
белковых экстрактах у мышей, подверженных воздействию озона.
На Фигуре 10 показаны результаты измерения КС (CXL1) с помощью ИФА в легочных белковых экстрактах у мышей, подверженных воздействию озона;
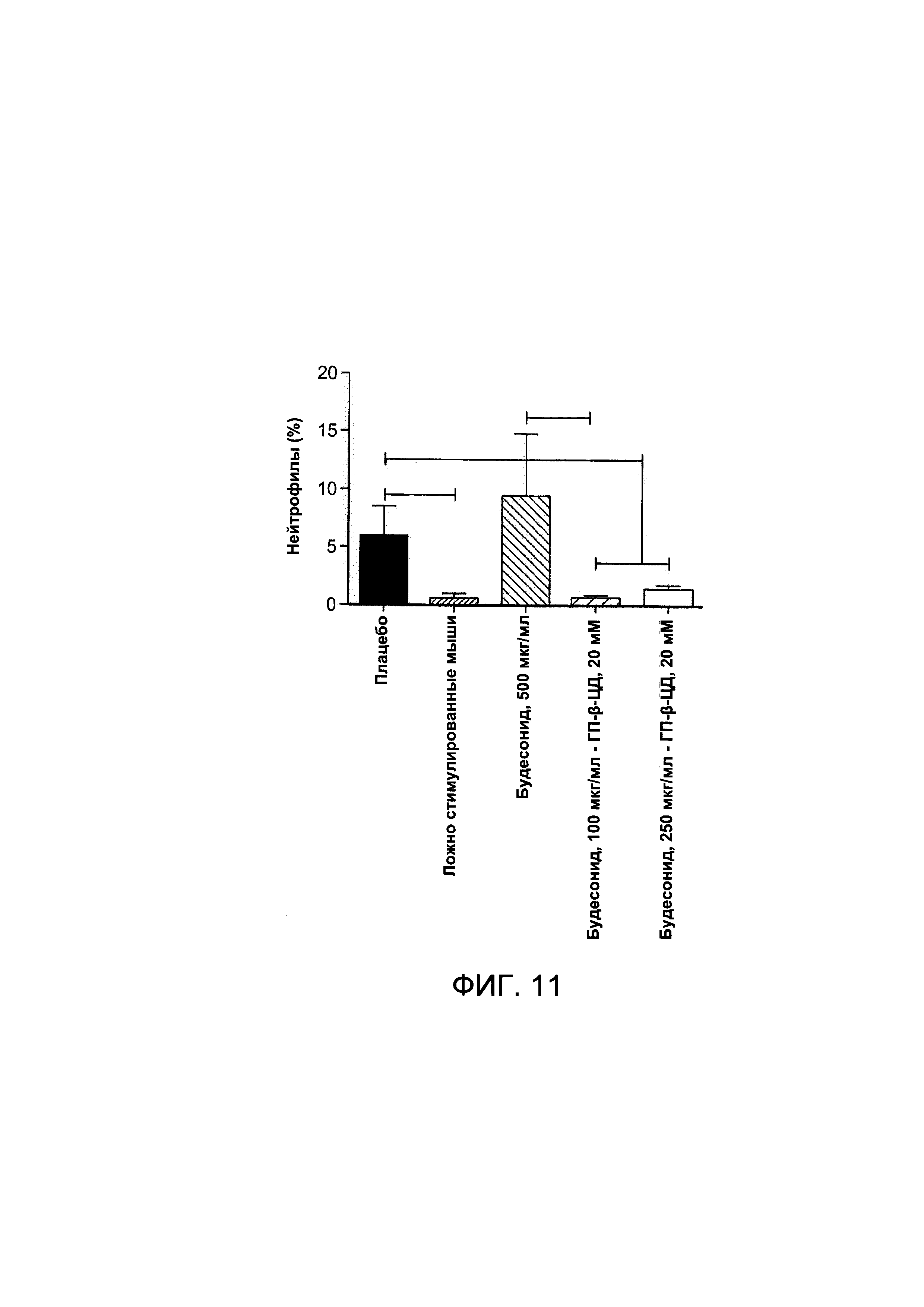
На Фигуре 11 показаны эффекты комплекса будесонида - циклодекстрин на процентное содержание нейтрофилов в жидкости БАЛ;
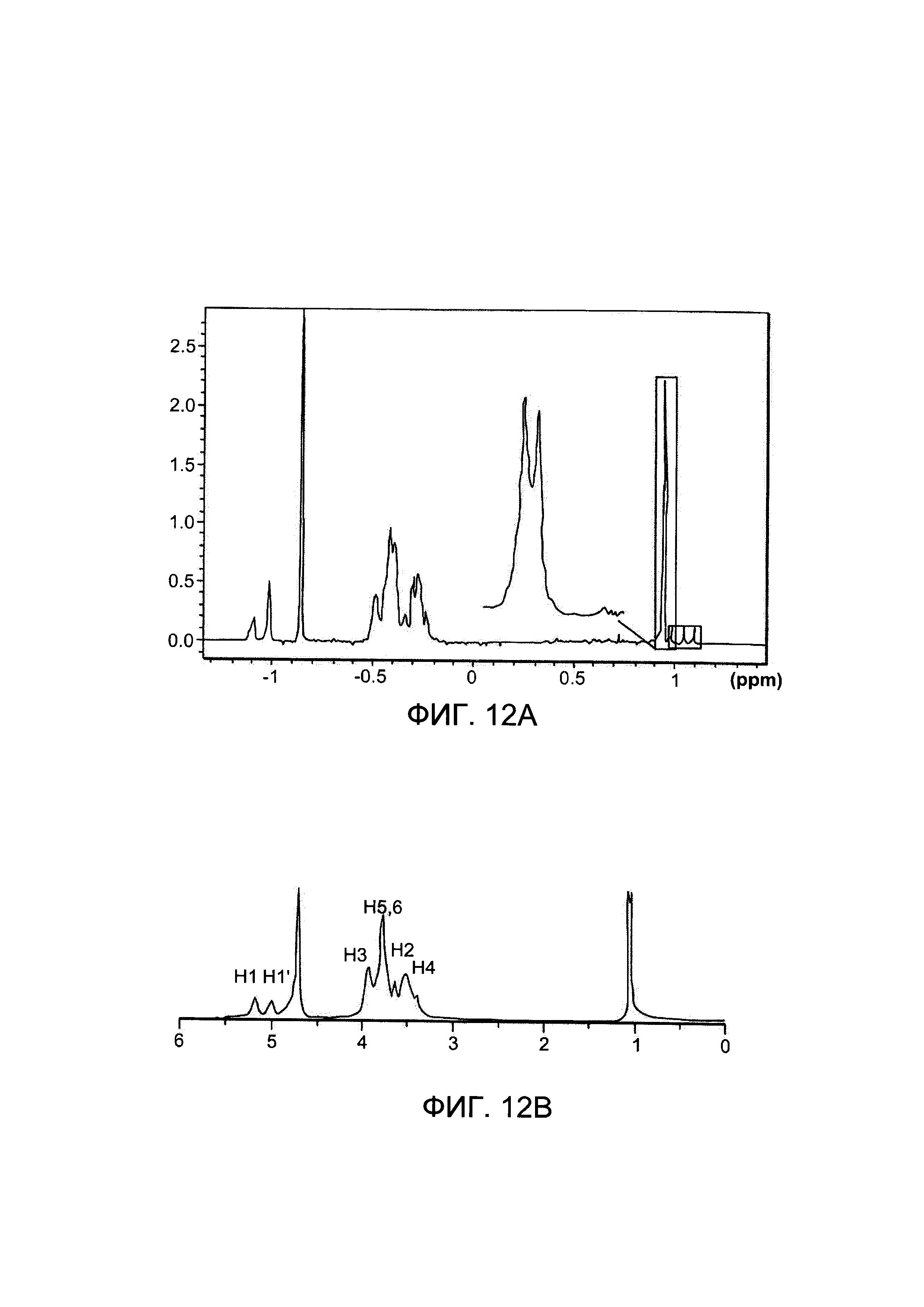
Фигура 12 представляет собой иллюстрацию комплекса включения, содержащего производное будесонида и циклодекстрин, по результатам 1Н-ЯМР спектров комплекса будесонид - гидроксипропил-β-циклодекстрин (Фигура 12а) по сравнению с референсным 1Н-ЯМР спектром гидроксипропил-β-циклодекстрина отдельно (Фигура 12b);
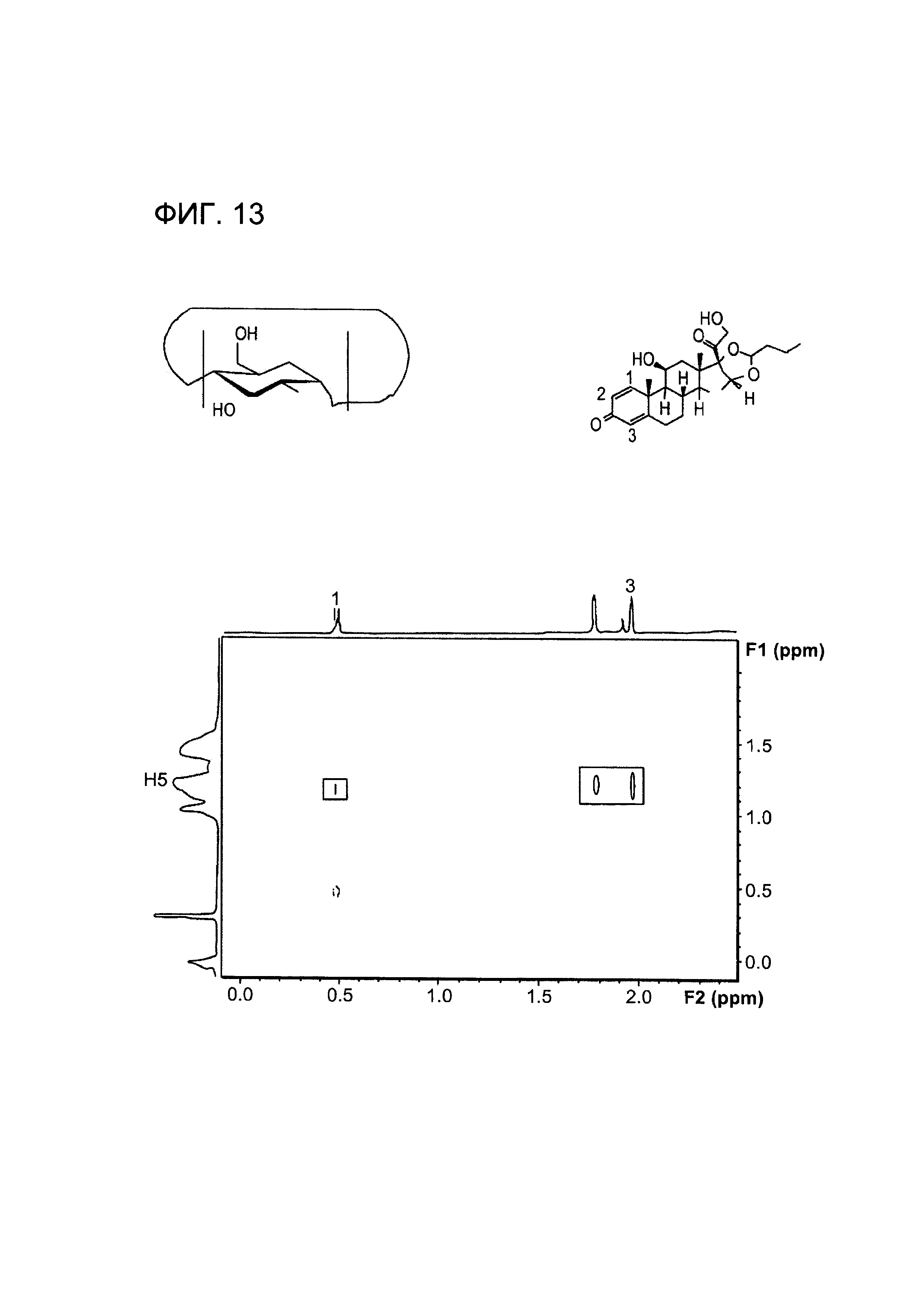
Фигура 13 представляет собой иллюстрацию комплекса включения, содержащего производное будесонида и циклодекстрин, по результатам 1D-COSY-ЯМР спектров комплекса будесонид - гидроксипропил-β-циклодекстрин;
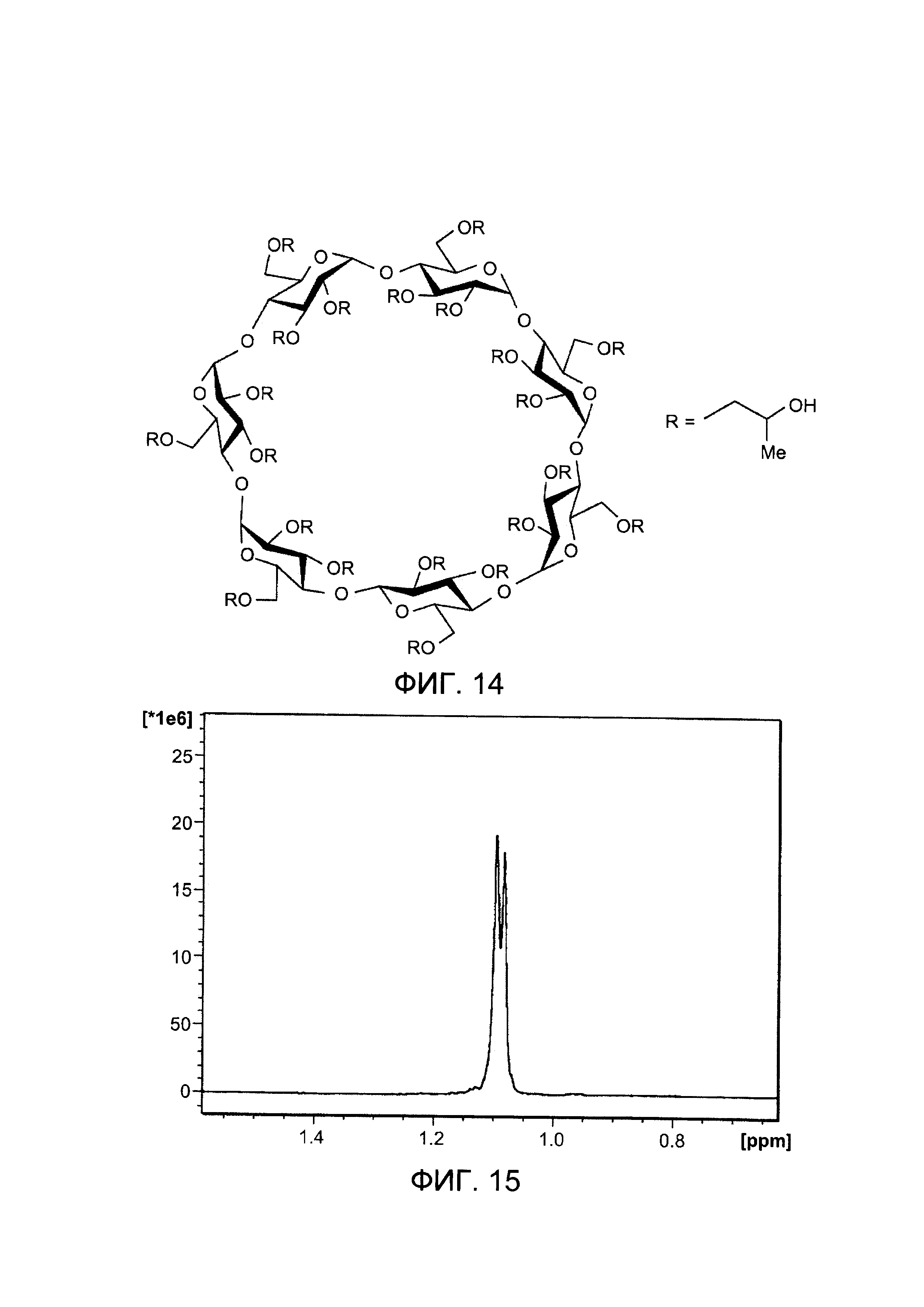
На Фигуре 14 показана химическая структура ГП-β-ЦД;
На Фигуре 15 показаны 1Н ЯМР-спектры ГП-β-ЦД (δ 0,6-1,5) в воде;
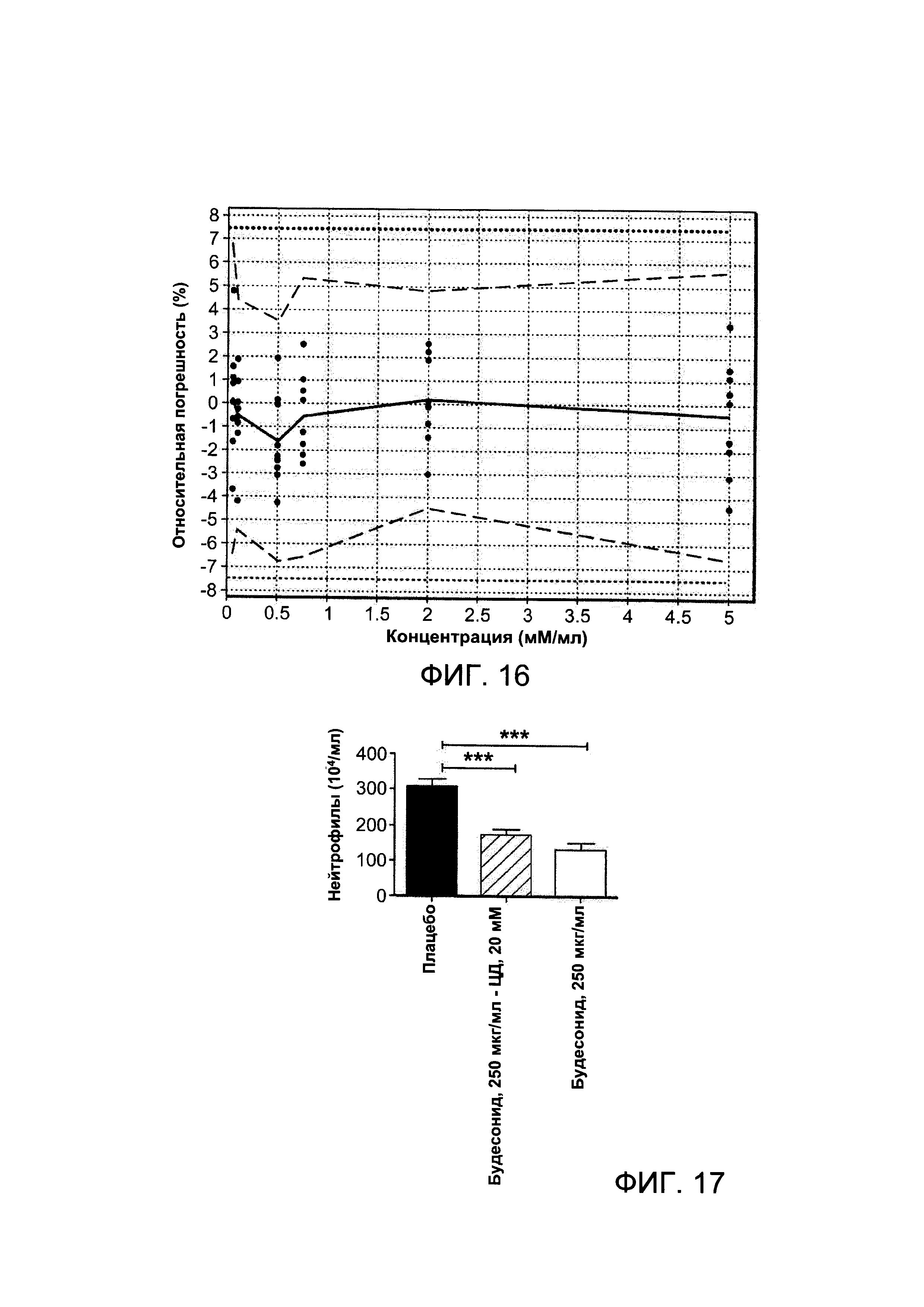
На Фигуре 16 показан профиль погрешности, полученный с учетом взвешенной (1/Х) квадратической регрессии.
На Фигуре 17 показаны результаты измерения числа нейтрофилов в жидкости БАЛ от животных, подверженных воздействию ЛПС, которым проводили лечение плацебо, суспензией будесонида и комплексом гидроксипропил-бета-циклодекстрин - будесонид;
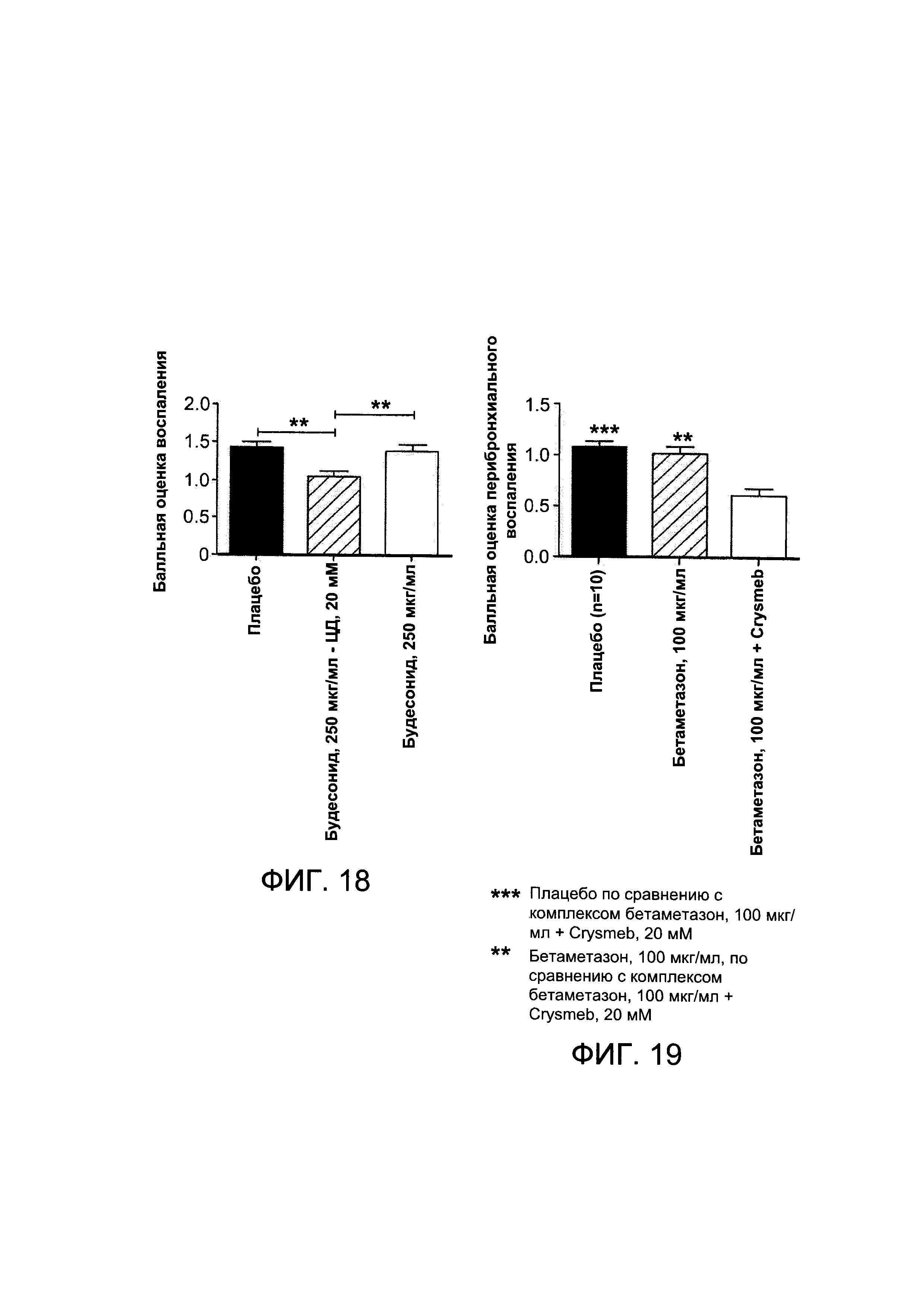
На Фигуре 18 показаны результаты балльной оценки воспаления у мышей, подверженных воздействию ЛПС;
На Фигуре 19 показаны результаты балльной оценки воспаления у мышей, подверженных воздействию ЛПС;
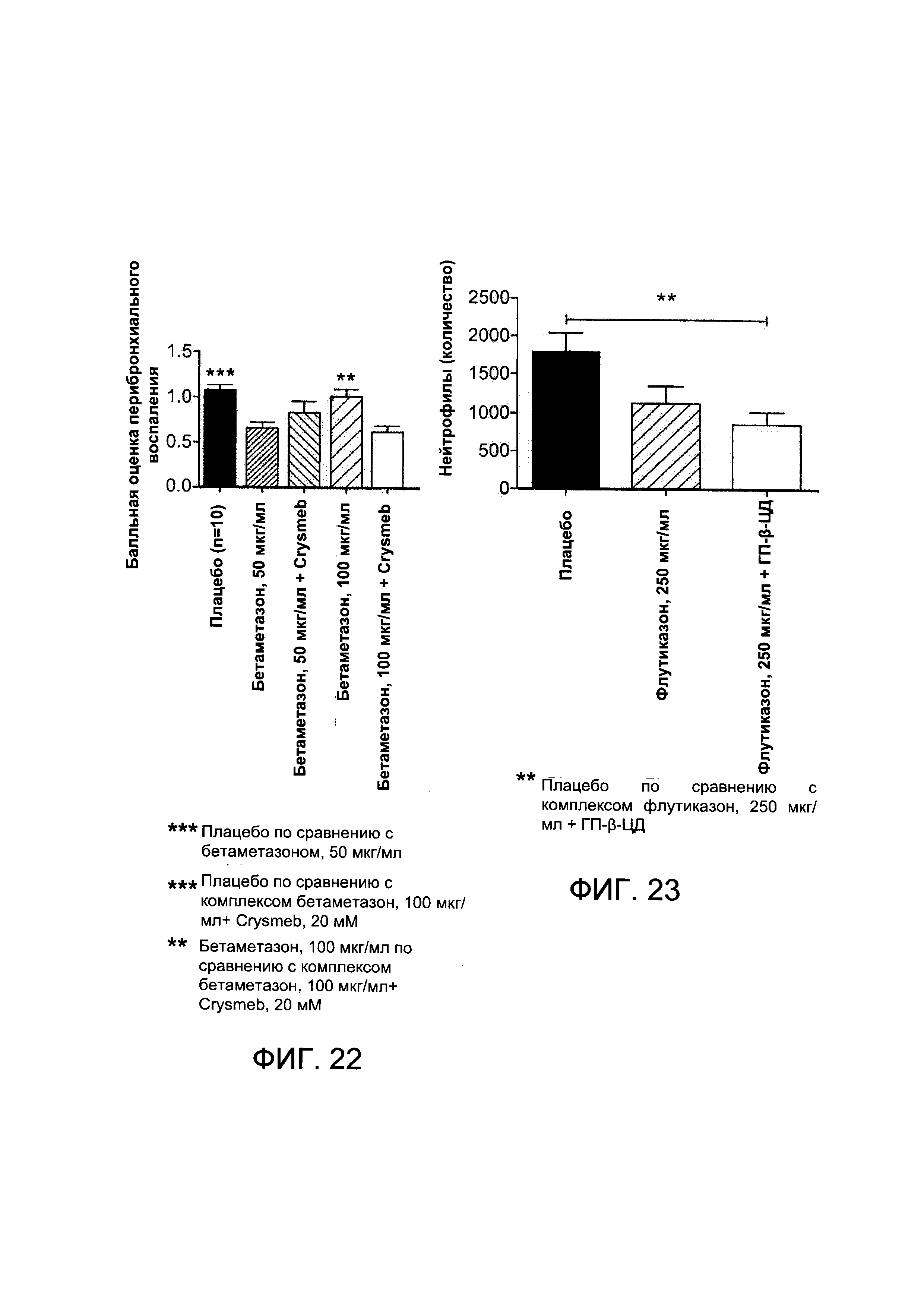
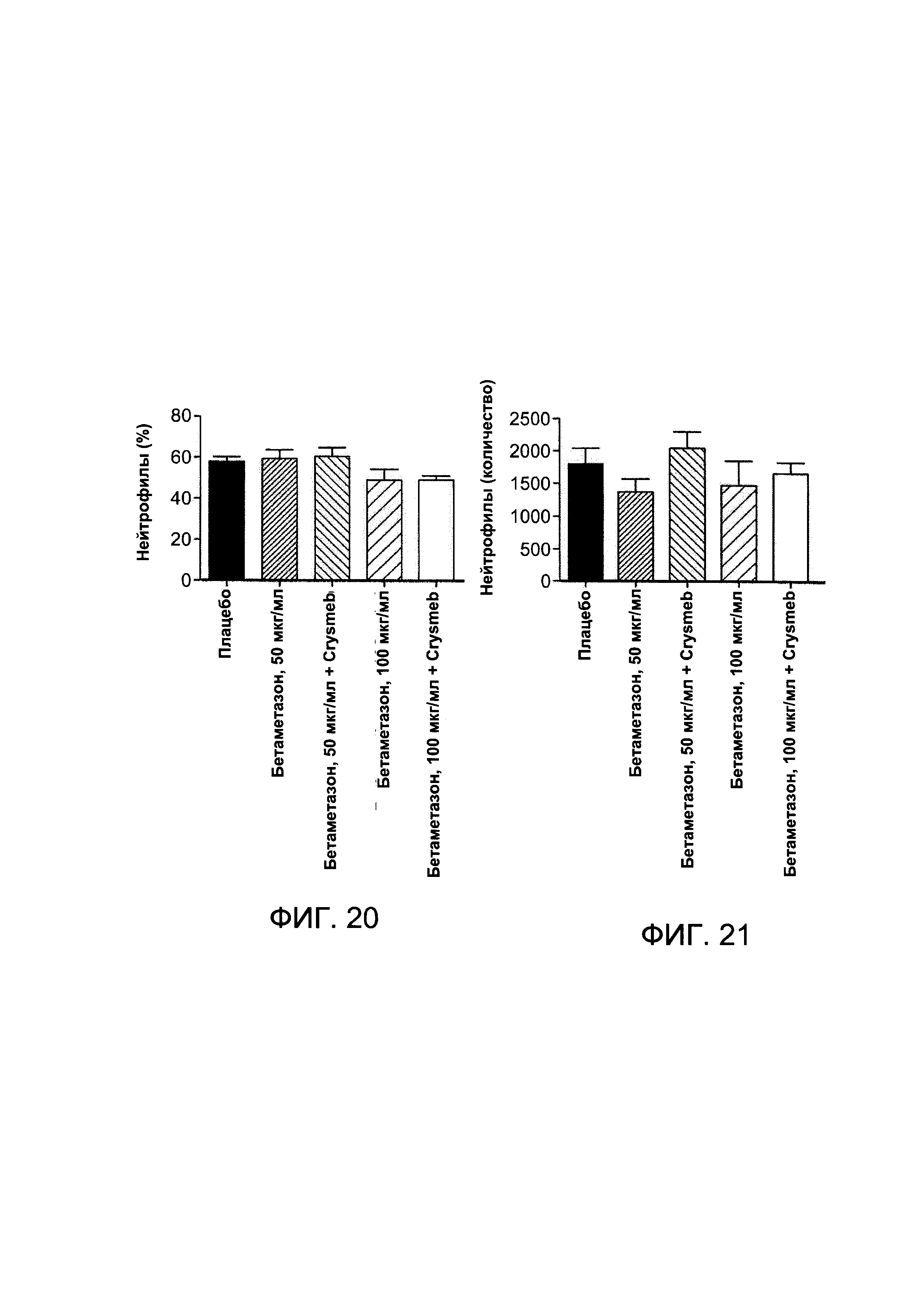
На Фигуре 20 показаны результаты измерения % числа нейтрофилов в жидкости БАЛ от животных, подверженных воздействию ЛПС, которым проводили лечение плацебо, комплексом Crysmeb - бетаметазона дипропионат и суспензией бетаметазона в концентрации 100 мкг/мл;
На Фигуре 21 показаны результаты измерения числа нейтрофилов в жидкости БАЛ от животных, подверженных воздействию ЛПС, которым проводили лечение плацебо, комплексом Crysmeb - бетаметазона дипропионат и суспензией бетаметазона;
На Фигуре 22 показаны результаты балльной оценки воспаления у мышей, подверженных воздействию ЛПС, которым проводили лечение плацебо, бетаметазона дипропионатом или комплексом бетаметазона дипропионат - Crysmeb в 2 концентрациях; и
На Фигуре 23 показаны результаты измерения числа нейтрофилов в жидкости БАЛ от животных, подверженных воздействию ЛПС, которым проводили лечение плацебо, суспензией флутиказона пропионата и комплексом гидроксипропил-бета-циклодекстрин - флутиказона пропионат.
Далее следуют примеры различных вариантов реализации настоящего изобретения, которые приведены для иллюстрации изобретения и не ограничивают настоящее изобретение. Части и проценты представляют собой части и проценты по массе, если иное специально не указано.
Пример 1
Фармацевтическая композиция будесонида и НРβ-циклодекстрина в растворе
Будесонид получали из компании Indis (Бельгия) и гидроксипропил-бета-циклодекстрин получали из компании Roquette (Франция). Коммерчески доступную суспензию будесонида (Pulmicort®) в концентрации, составляющей примерно 250 мкг/мл, получали из компании AstraZeneca (Швеция).
Фармацевтическую композицию в виде раствора (Фигура 1) получали путем добавления избытка будесонида в виде порошка к циклодекстрину в растворе с определенной концентрацией, составляющей примерно 5, примерно 10, примерно 25, примерно 50 и примерно 100 мМ в воде (рассчитанное и точно взвешенное количество циклодекстрина скорректировано с учетом содержания воды путем расчета молярности с использованием титратора по методу Карла-Фишера). Процесс смешивания занимает примерно 24 часа при комнатной температуре при непрерывном перемешивании со скоростью примерно 350 об./мин. Избыточное количество будесонида удаляли посредством фильтрования полученной смеси с помощью фильтрующего элемента с размером пор 0,22 мкм. Концентрацию будесонида в растворе проверяли с помощью валидированного метода ВЭЖХ и затем смесь разбавляли раствором ФСБ - циклодекстрин (при такой же определенной концентрации, что и ранее, составляющей примерно 5, примерно 10, примерно 25, примерно 50 и примерно 100 мМ) для достижения требуемой концентрации будесонида для исследования in vivo.
При таких концентрациях, как, например, примерно 100 мкг/мл или примерно 250 мкг/мл, будесонид растворим в воде/ФСБ, и полученные фармацевтические композиции представляют собой чистые прозрачные растворы для ингаляции.
Пример 1а: Примерно 100 мкг/мл будесонида и примерно 10 мМ ГП-β-ЦД
Предпочтительная фармацевтическая лекарственная форма в виде раствора для ингаляции содержит примерно 100 мкг/мл будесонида и примерно 10 мМ гидроксипропил-бета-циклодекстрин. Раствор готовили путем растворения примерно 0,6979 г ГП-β-ЦД с содержанием воды 5% (скорректировано с учетом содержания воды) в 50 мл очищенной апирогенной воды (или стерильного ФСБ), добавления избытка будесонида и перемешивания при комнатной температуре в течение примерно 24 часов со скоростью примерно 350 об./мин. Избыток будесонида удаляли посредством фильтрования через фильтрующий элемент с размером пор 0,22 мкм и полученный раствор дозировали с помощью валидированного метода ВЭЖХ. Полученный раствор затем разбавляли примерно 10 мМ раствором ГП-β-ЦД (в ФСБ или воде) для достижения концентрации будесонида примерно 100 мкг/мл. Изотоничность достигали путем добавления NaCl. Предпочтительно конечный раствор стерилизовали посредством фильтрования через полипропиленовую мембрану с размером пор 0,22 мкм или посредством жаропаровой стерилизации.
Пример 1b: Примерно 100 мкг/мл будесонида и примерно 20 мМ ГП-β-ЦД
Вторая предпочтительная фармацевтическая лекарственная форма в виде раствора для ингаляции содержит примерно 100 мкг/мл будесонида и примерно 20 мМ гидроксипропил-бета-циклодекстрин. Раствор готовили путем растворения примерно 1,3958 г ГП-β-ЦД с содержанием воды 5% (скорректировано с учетом содержания воды) примерно в 50 мл очищенной апирогенной воды (или стерильного ФСБ), добавления избытка будесонида и перемешивания в течение примерно 24 часов со скоростью примерно 350 об./мин. Избыток будесонида удаляли посредством фильтрования через фильтрующий элемент с размером пор 0,22 мкм и полученный раствор дозировали с помощью валидированного метода ВЭЖХ. Затем полученный раствор разбавляли примерно 20 мМ раствором ГП-β-ЦД (в ФСБ или воде) для достижения концентрацию будесонида примерно 100 мкг/мл. Изотоничность достигали путем добавления NaCl. Предпочтительно конечный раствор стерилизовали посредством фильтрования через полипропиленовую мембрану с размером пор 0,22 мкм или посредством жаропаровой стерилизации.
Пример 1с: Примерно 250 мкг/мл будесонида и примерно 20 мМ ГП-β-ЦД
Третья предпочтительная фармацевтическая лекарственная форма раствора для ингаляции содержала примерно 250 мкг/мл будесонида и примерно 20 мМ гидроксипропил-бета-циклодекстрин. Раствор готовили путем растворения примерно 1,3958 г ГП-β-ЦД с содержанием воды примерно 5% (скорректировано с учетом содержания воды) примерно в 50 мл очищенной апирогенной воды (или стерильного ФСБ), добавления избытка будесонида и перемешивания в течение примерно 24 часов со скоростью примерно 350 об./мин. Избыток будесонида удаляли посредством фильтрования через фильтрующий элемент с размером пор 0,22 мкм и полученный раствор дозировали с помощью валидированного метода ВЭЖХ. Полученный раствор затем разбавляли примерно 20 мМ раствором ГП-β-ЦД (в ФСБ или воде) для достижения концентрации будесонида примерно 250 мкг/мл. Изотоничность достигали путем добавления NaCl. Предпочтительно конечный раствор стерилизовали посредством фильтрования через полипропиленовую мембрану с диаметром пор 0,22 мкм или посредством жаропаровой стерилизации.
Пример 1d: Примерно 100 мкг/мл флутиказона и примерно 10 мМ ГП-β-ЦД
Четвертая предпочтительная фармацевтическая лекарственная форма в виде раствора для ингаляции содержала примерно 100 мкг/мл флутиказона и примерно 10 мМ гидроксипропил-бета-циклодекстрина. Раствор готовили путем растворения примерно 0,6979 г ГП-β-ЦД с содержанием воды примерно 5% (скорректировано с учетом содержания воды) примерно в 50 мл очищенной апирогенной воды (или стерильного ФСБ), добавления избытка флутиказона и перемешивания при комнатной температуре в течение примерно 24 часов со скоростью примерно 350 об./мин. Избыток флутиказона удаляли посредством фильтрования через фильтрующий элемент с размером пор 0,22 мкм и полученный раствор дозировали с помощью валидированного ВЭЖХ метода. Затем полученный раствор разбавляли примерно 10 мМ раствором ГП-β-ЦД (в ФСБ или воде) для достижения концентрации флутиказона примерно 100 мкг/мл. Изотоничность раствора достигали путем добавления NaCl. Предпочтительно конечный раствор стерилизовали посредством фильтрования через полипропиленовую мембрану с размером пор 0,22 мкм или путем жаропаровой стерилизации.
Пример 1е: Примерно 40 мкг/мл флутиказона и примерно 10 мМ ГП-β-ЦД
Пятая предпочтительная фармацевтическая лекарственная форма в виде раствора для ингаляции содержала примерно 40 мкг/мл флутиказона и примерно 10 мМ гидроксипропил-бета-циклодекстрин. Раствор готовили путем растворения примерно 0,6979 г ГП-β-ЦД с содержанием воды примерно 5% (скорректировано с учетом содержания воды) примерно в 50 мл очищенной апирогенной воды (или стерильного ФСБ), добавления избытка флутиказона и перемешивания при комнатной температуре в течение примерно 24 часов со скоростью примерно 350 об./мин. Флутиказон в избытке удаляли посредством фильтрования через фильтрующий элемент с размером пор 0,22 мкм и полученный раствор дозировали с помощью валидированного ВЭЖХ-метода. Полученный раствор затем разбавляли примерно 10 мМ раствором ГП-β-ЦД (в ФСБ или воде) для достижения концентрации флутиказона примерно 40 мкг/мл. Изотоничность раствора достигали путем добавления NaCl. Предпочтительно конечный раствор стерилизовали посредством фильтрования через полипропиленовую мембрану с размером пор 0,22 мкм или посредством жаропаровой стерилизации.
Пример 1f: Примерно 40 мкг/мл белкометазона и примерно 10 мМ ГП-β-ЦД
Седьмая предпочтительная фармацевтическая лекарственная форма в виде раствора для ингаляции содержала примерно 40 мкг/мл беклометазона и примерно 10 мМ гидроксипропил-бета-циклодекстрин. Раствор готовили путем растворения примерно 0,6979 г ГП-β-ЦД с содержанием воды примерно 5% (скорректировано с учетом содержание воды) примерно в 50 мл очищенной апирогенной воды (или стерильного ФСБ), добавления избытка беклометазона и перемешивания при комнатной температуре в течение примерно 24 часов со скоростью примерно 350 об./мин. Избыток беклометазона удаляли посредством фильтрования через фильтрующий элемент с размером пор 0,22 мкм и полученный раствор дозировали с помощью валидированного метода ВЭЖХ. Полученный раствор затем разбавляли примерно 10 мМ раствором ГП-β-ЦД (в ФСБ или воде) для достижения концентрации беклометазона примерно 40 мкг/мл. Изотоничность раствора достигали путем добавления NaCl. Предпочтительно конечный раствор стерилизовали посредством фильтрования через полипропиленовую мембрану с размером пор 0,22 мкм или посредством жаропаровой стерилизации.
Пример 2
Фармацевтическая композиция флутиказона с ГП-β-циклодекстрином в виде порошка
Предпочтительная фармацевтическая лекарственная форма в виде раствора для ингаляции содержала примерно 40 мкг/мл флутиказона от компании ECIC и примерно 10 мМ гидроксипропил-бета-циклодекстрин. Раствор готовили путем растворения примерно 0,6979 г ГП-β-ЦД с содержанием воды примерно 5% (скорректировано с учетом содержания воды) примерно в 50 мл очищенной апирогенной воды, добавления избытка флутиказона и перемешивания в течение примерно 24 часов со скоростью примерно 350 об./мин. Избыток флутиказона удаляли посредством фильтрования через ламинированный фильтрующий элемент с размером пор 0,22 мкм и полученный раствор дозировали с помощью валидированного метода ВЭЖХ. Полученный раствор затем разбавляли примерно 10 мМ раствором ГП-β-ЦД для достижения концентрации флутиказона примерно 40 мкг/мл. Конечный раствор сушили распылением с помощью распылительной сушилки-охладителя ProCept при оптимизированных условиях для достижения приемлемого выхода порошка (примерно >90%) с размером частиц примерно 3 микрона. Техника сушки распылением хорошо известна специалистам в данной области техники. Распылительная сушилка-охладитель и процесс сушки описан в информационном листе Procept или в сети Интернет по адресу http://www.procept.be/spray-dryer-chiller, который полностью включен в настоящую заявку посредством ссылки.
Пример 3
Оценка фармацевтической композиции из Примера 1 на модели обструкции дыхательных путей и воспаления
За: Сенсибилизация, стимуляция аллергеном и протокол терапевтического лечения (Фигура 2).
Для исследования изменения воспаления воздухоносных путей мышей линии BALB/c возрастом от примерно 6 до примерно 8 недель сенсибилизировали с помощью внутрибрюшинной инъекции примерно 10 мкг овальбумина (ОВА) (Sigma Aldrich, Шнелльдорф, Германия), эмульгированного в гидроксиде алюминия (Alumlnject; Perbio, Эрембодегем, Бельгия), на 0 (DO) и 7 (D7) сутки. Затем мышей подвергали воздействию аллергена путем ежедневной ингаляции примерно 1% аэрозолем ОВА (генерированным ультразвуковым небулайзером (Devilbiss 2000), в течение примерно 30 минут) с 21 до 25 сутки. Мышам проводили вливание примерно 50 мкл через нос с 18 по 24 сутки. Животных умерщвляли на 26 сутки, как описано ранее в источнике Cataldo et al: Am.J.Pathol. 161 (2):491-498 (2002), который полностью включен в настоящую заявку посредством ссылки. Мышам из группы плацебо вводили интраназально ФСБ.
Материалы и методы Самцов мышей линии С57В 1/6 возрастом от шести до восьми недель получали из компании Charles River (Кельн, Германия) и разводили в лаборатории, к которой относятся авторы настоящего изобретения. Все эксперименты и процедуры на животных одобрены этическим комитетом Льежского университета. Животным обеспечивали свободный доступ к пище и воде. Материалы
Фосфатный солевой буфер (ФСБ) получали из компании Lonza (Вервье, Бельгия), гидроксипропил-бета-циклодекстрин (степень замещения гидроксипропильной группой: 0,62) получали из компании Roquette (Франция), будесонид получали из компании Indis (Бельгия) и коммерческую суспензию будесонида в концентрации 250 мкг/мл (Pulmicort®) получали из компании AstraZeneca (Швеция). Метахолин получали из компании Sigma-Aldrich (Германия). Для введения мышам гидроксипропил-бета-примерно 20 мМ циклодекстрин смешивали с будесонидом (примерно 250 мкг/мл) и суспензией будесонида (примерно 250 мкг/мл) в соответствии с Примером 1а, выше. Все другие материалы имели аналитическую степень чистоты. Стерильные апирогенные и изотонические растворы комплекса производное циклодекстрина - кортикостероид получали в различных концентрациях. Растворы тестировали в соответствии с руководством 35 от 2012 г. по применению испытаний на бактериальные эндотоксины Управления по контролю за продуктами питания и лекарственными средствами с использованием лизата амебоцитов Limulus (LAL) для стерильной воды для ингаляции (< примерно 0,5 единиц эндотоксина согласно фармакопее США/мл).
Жидкость бронхоальвеолярного лаважа ГБАЛ)
Непосредственно после оценки реактивности воздухоносных путей и примерно через 24 часа после проведения последней стимуляции аллергеном мышей умерщвляли и проводили бронхоальвеолярный лаваж с использованием 4х примерно 1 мл ФСБ/примерно 0,05 мМ ЭДТА (Calbiochem, Дармштадт, Германия), как описано ранее в источнике Cataldo DD, Tournoy KG, Vermaelen K et al: Am J Pathol. 161(2):491-498 (2002), который полностью включен в настоящую заявку посредством ссылки.
Супернатант жидкости БАЛ собирали для анализа белка, тогда как клетки использовали для дифференциального подсчета. Дифференциальный подсчет клеток на основе морфологических критериев проводили на препаратах, полученных в результате цитоцентрифугирования, после их окрашивания гематоксилин-эозином (Diff-Quick, Dade, Бельгия). Клетки восстанавливали путем осторожной аспирации вручную. После центрифугирования бронхоальвеолярной жидкости (жидкости БАЛ) при скорости примерно 1200 об./мин в течение примерно 10 минут при температуре примерно 4°С супернатант замораживали при температуре примерно -80°С для анализа белка, а клеточный осадок ресуспендировали примерно в 1 мл ФСБ, содержащем примерно 0,05 мМ ЭДТА. Дифференциальный подсчет клеток осуществляли на препаратах, полученных в результате цитоцентрифугирования (Cytospin) после их окрашивания с помощью реагента Diff-Quick (Dade, Бельгия).
Гистологический анализ и процедура проводки легочной ткани
После проведения БАЛ вскрывали грудную клетку и пережимали левый главный бронх. Левое легкое отсекали и сразу замораживали при температуре примерно -80°С для дальнейшей белковой экстракции. Правое легкое заполняли 4 мл примерно 4% параформальдегида, заливали парафином и использовали для гистологического анализа. Делали парафиновые срезы толщиной примерно по 5 мкм и окрашивали гематоксилин-эозином. Степень перибронхиального воспаления оценивали с помощью баллов, рассчитанных на основе количественной оценки перибронхиальных воспалительных клеток, как описано ранее в источнике Cataldo DD, Tournoy KG, Vermaelen K et al: Am J Pathol. 161(2):491-498 (2002). Значение 0 соответствовало отсутствию выявляемого воспаления, значение 1 соответствовало случайным воспалительным клеткам, значение 2 соответствовало окружению большинства бронхов тонким слоем (от примерно 1 до примерно 5 клеток) воспалительных клеток, и значение 3 соответствовало окружению большинство бронхов толстым слоем (> примерно 5 клеток) воспалительных клеток. Так как балльную оценку проводили на 6-8 случайно выбранных тканевых срезах для каждой мыши, балльную оценку воспаления выражали как среднее значение, которое можно было сравнивать между группами.
Как указано выше, левое легкое отсекали и сразу замораживали при температуре примерно -80°С и затем измельчали в жидком N2 с использованием клеточного дезинтегратора Mikro-dismembrator (Braun Biotech International, Gmbh Melsungen, Германия) с получением гомогенизированного порошка. Измельченную легочную ткань инкубировали в течение ночи при температуре примерно 4°С в растворе, содержащем примерно 2 М мочевину, примерно 1 М NaCl и примерно 50 мМ Tris (рН примерно 7,5) и затем центрифугировали в течение примерно 15 мин при скорости примерно 16000 × g для экстракции белков.
Уровень IL13 измеряли в не объединенных образцах легочных белков с помощью ИФА (duoset kit, R&D Systems, Абингдон, Великобритания) в соответствии с инструкциями производителя.
Измерение реактивности бронхов
Мышам проводили анестезию путем внутрибрюшинной инъекции (примерно 200 мкл) смеси кетамина (примерно 10 мг/мл, Merial, Брюссель, Бельгия) и ксилазина (примерно 1 мг/мл, VMD, Арендонк, Бельгия). Трахеотомию осуществляли путем введения в трахею полиэтиленового катетера 20 калибра и ее лигирования вокруг катетера во избежание подтеков и отсоединения. Мышам проводили искусственную вентиляцию с помощью аппарата искусственного дыхания для мелких животных flexiVent® (SCIREQ, Монреаль, Канада) с частотой примерно 250 вдохов в минуту и объемом вдоха примерно 10 мл/кг. Положительное давление в конце выдоха устанавливали при значении примерно 2 гПа. Измерения начинали проводить примерно через 2 минуты механической вентиляции. Затем к трахеальной трубке прилагали синусоидальные колебания частотой примерно 1 Гц, что позволяло рассчитать динамическое сопротивление, эластичность и растяжимость дыхательных путей с помощью множественных линейных регрессий. Вторая операция заключалась в генерации форсированного колебательного сигнала с частотой, варьирующей между примерно 0,5 и примерно 19,6 Гц, в течение примерно 8 секунд и позволяла измерить сопротивление для оценки амортизации, эластичности и гистерезисности ткани. После измерения основной легочной функции мышей подвергали воздействию аэрозоля солевого раствора (ФСБ) с последующим введением аэрозолей, содержащих повышающиеся дозы (примерно 3, примерно 6, примерно 9, примерно 12 г/л) метахолина (ICN Biomedicals, Ассе, Релегем, Бельгия). Аэрозоли генерировали с помощью ультразвукового небулайзера (SYST'AM, LS 2000, Dupont Medical, Род-Сен-Женез, Бельгия) и доставляли во входной катетер системы flexiVent® с использованием отклоненного потока медицинского воздуха в соответствии с инструкциями производителя. Каждый аэрозоль доставляли в течение примерно 2 минут и измерения, как описано выше, проводили с интервалами в одну минуту после введения каждого аэрозоля. Среднее сопротивление дыхательных путей после воздействия метахолина представляло собой основной параметр, измеряемый во время стимуляции.
Статистический анализ
Результаты оценки уровней на гистологических препаратах легочной ткани выражены как среднее +/- SEM. Сравнение между группами осуществляли с использованием однофакторного дисперсионного анализа с последующим использованием посткритерия Тьюки. Анализ проводили с использованием программы GraphPad Prism 5. Уровень значимости: альфа = примерно 0,05 (95% доверительный интервал). Фармакологические результаты
На Фигуре 3 показана балльная оценка перибронхиального воспаления, полученная на основе гистологического анализа для групп, получающих плацебо, будесонид в концентрации примерно 100 мкг/мл, фармацевтическую композицию в соответствии с Примером 1а и будесонид в концентрации примерно 250 мкг/мл.
У мышей, подверженных воздействию овальбумина (плацебо), наблюдалось значительное повышение количества воспалительных клеток в легочной ткани. У животных, получавших комплекс будесонида в концентрации примерно 100 мкг/мл и примерно 10 мМ ГП-β-ЦД наблюдалось значительное снижение количества воспалительных клеток по сравнению с плацебо. Применение комплекса будесонид (примерно 100 мкг/мл) - ГП-β-ЦД (примерно 10 мМ) приводило к такому же снижению воспаления, как в случае отдельного использования будесонида в более высокой концентрации (примерно 250 мкг/мл), и являлось значительно более эффективным по сравнению с отдельным применением будесонида в той же концентрации (примерно 100 мкг/мл).
На Фигуре 4 показан уровень IL13, измеренный в легочных белковых экстрактах.
Легкие измельчали с использованием клеточного дезинтегратора Mikro-dismembrator (Braun Biotech International, Gmbh Melsungen, Германия). Измельченную ткань легкого инкубировали в течение ночи при температуре примерно 4°С в растворе, содержащем примерно 1М раствор мочевины для экстракции белков. Супернатант хранили при температуре примерно -80°С для дальнейшего иммуноферментного анализа (ИФА).
У мышей наблюдался более высокий уровень IL13 в легочной ткани после стимуляции аллергеном при лечении будесонидом в концентрации примерно 250 мкг/мл по сравнению с мышами, получавщими лечение комплексом будесонид в концентрации примерно 250 мкг/мл - примерно 10 мМ циклодекстрин. У мышей, получавших лечение будесонидом в концентрации примерно 100 мкг/мл, наблюдался высокий уровень IL13, сходный с уровнем у мышей, получавших лечение комплексом будесонид в концентрации примерно 100 мкг/мл - примерно 10 мМ циклодекстрин.
Пример 4
Оценка фармацевтических композиций из Примера 1а, Примера 1b и Примера 1с на моделях ХНЗЛ
Для имитации хронического обструктивного заболевания легких (ХНЗЛ) использовали две разные мышиные модели. Согласно первой модели, мышей линии C57BL/6 подвергали воздействию высокой концентрации озона (ОЗ), который является высоко активным оксидантным загрязнителем воздуха. Ингаляция ОЗ на животных моделях отвечает за воспаление дыхательных путей (по нейтрофилам) и гиперреактивность. Вторая модель представляла собой использование табачного дыма, так как табакокурение, как известно, являются главным возбудителем ХНЗЛ. Подвержение воздействию сигаретного дыма также приводит к воспалению дыхательных путей, опосредованному нейтрофилами. Озон и сигаретный дым являются активными индукторами окислительного стресса, который может приводить к хроническому воспалению, что наблюдается при долгосрочном исследовании.
4.А Озоновая модель
Подвержение воздействию озона и протокол терапевтического лечения
Согласно схематичному описанию (Фигура 5), мышам линии C57BL/6 сначала проводили лечение с помощью интраназальной инъекции, содержащей примерно 50 мкл, в качестве предварительного лечения (между 0 и 1 сутками). Затем примерно через 3 часа после введения терапевтической интраназальной инъекции, содержащей примерно 501 мкл, (между 2 и 4 сутками) мышей подвергали воздействию высокой концентрации озона (примерно 2 ppm) в течение примерно 3 часов. Мышей умерщвляли на 5 сутки. Мышам, получающим плацебо, инъецировали ФСБ.
Анализ жидкости бронхоальвеолярного лаважа (БАЛ), гистологический анализ легких, измерение бронхиальной реактивности и статистический анализ были такими же, как описано было ранее в Примере 1 (воспаление дыхательных путей и гиперреактивность). Уровень IL17 и KС (CXCL1) измеряли в не объединенных образцах легочных белков с помощью ИФА (duoset kit, R&D Systems, Абингдон, Великобритания) в соответствии с инструкциями производителя. Результаты фармакологического анализа
На Фигуре 6 показана балльная оценка перибронхиального воспаления, проведенная на основе гистологического анализа животных, получающих плацебо, композицию в соответствии с Примером 1а и будесонид в концентрации примерно 250 мкг/мл.
У мышей, подверженных воздействию озона (плацебо), наблюдалось значительное повышение количества воспалительных клеток в легочной ткани по сравнению с другими группами. Применение комплекса, содержащего будесонид в концентрации примерно 100 мкг/мл и 10 мМ ГП-β-ЦД вызывало значительное снижение количества воспалительных клеток по сравнению с плацебо. Применение комплекса будесонид (примерно 100 мкг/мл) - ГП-β-ЦД (примерно 10 мМ) вызывало такое же снижение воспаления, как отдельное применение будесонида в более высокой концентрации (примерно 250 мкг/мл).
На Фигуре 7 показаны результаты измерения реактивности воздухоносных путей: произведение длительности паузы и отношения максимальных давлений на выдохе и вдохе (индекс Penh) измеряли у мышей после получения плацебо или лечения фармацевтической композицией, полученной в соответствии с Примером 1а.
Подвержение воздействию озона вызвало ожидаемое повышение гиперреактивности бронхов у мышей, которых подвергали метахолиновой стимуляции, по сравнению с другими группами. По сравнению с группой плацебо комплекс, содержащий будесонид в концентрации примерно 100 мкг/мл и 10 мМ ГП-β-ЦД вызывает значительное снижение гиперреактивности бронхов при использовании примерно 48 г/л метахолина. Комплекс будесонид (примерно 100 мкг/мл) - ГП-β-ЦД (10 мМ) вызывал такое же снижение гиперреактивности бронхов, как будесонид при отдельном применении в более высокой концентрации (примерно 250 мкг/мл).
На Фигуре 8 показаны результаты измерения IL17 с помощью ИФА в легочных белковых экстрактах мышей, подверженных воздействию озона.
Проводили сравнение различных схем лечения ГП-β-ЦД и будесонидом по отдельности или в комбинации. Фармацевтические композиции получали в соответствии с Примером 1а либо в виде комбинированной смеси (будесонид - ГП-β-ЦД), либо в виде композиций, содержащих каждое активное соединение отдельно (будесонид в концентрации примерно 250 мкг/мл или примерно 10 мМ ГП-β-ЦД) в одном и том же буферном растворе ФСБ.
По сравнению с группой, получавшей лечение будесонидом (примерно 250 мкг/мл), комплекс, содержащий будесонид в концентрации примерно 250 мкг/мл или примерно 100 мкг/мл или примерно 10 мкг/мл и 10 мМ ГП-β-ЦД, вызывал значительное снижение уровня IL17.
Уровень IL17 повышается после подвержения воздействию озона и может участвовать в патогенезе вызванного озоном нейтрофильного воспаления. Согласно изобретению, впервые показано, что комплекс будесонид-циклодекстрин при его ингаляционном введении способен снижать вызванный озоном уровень IL17.
На Фигуре 9 показаны результаты измерения IL13 с помощью ИФА в легочных белковых экстрактах у мышей, подверженных воздействию озона.
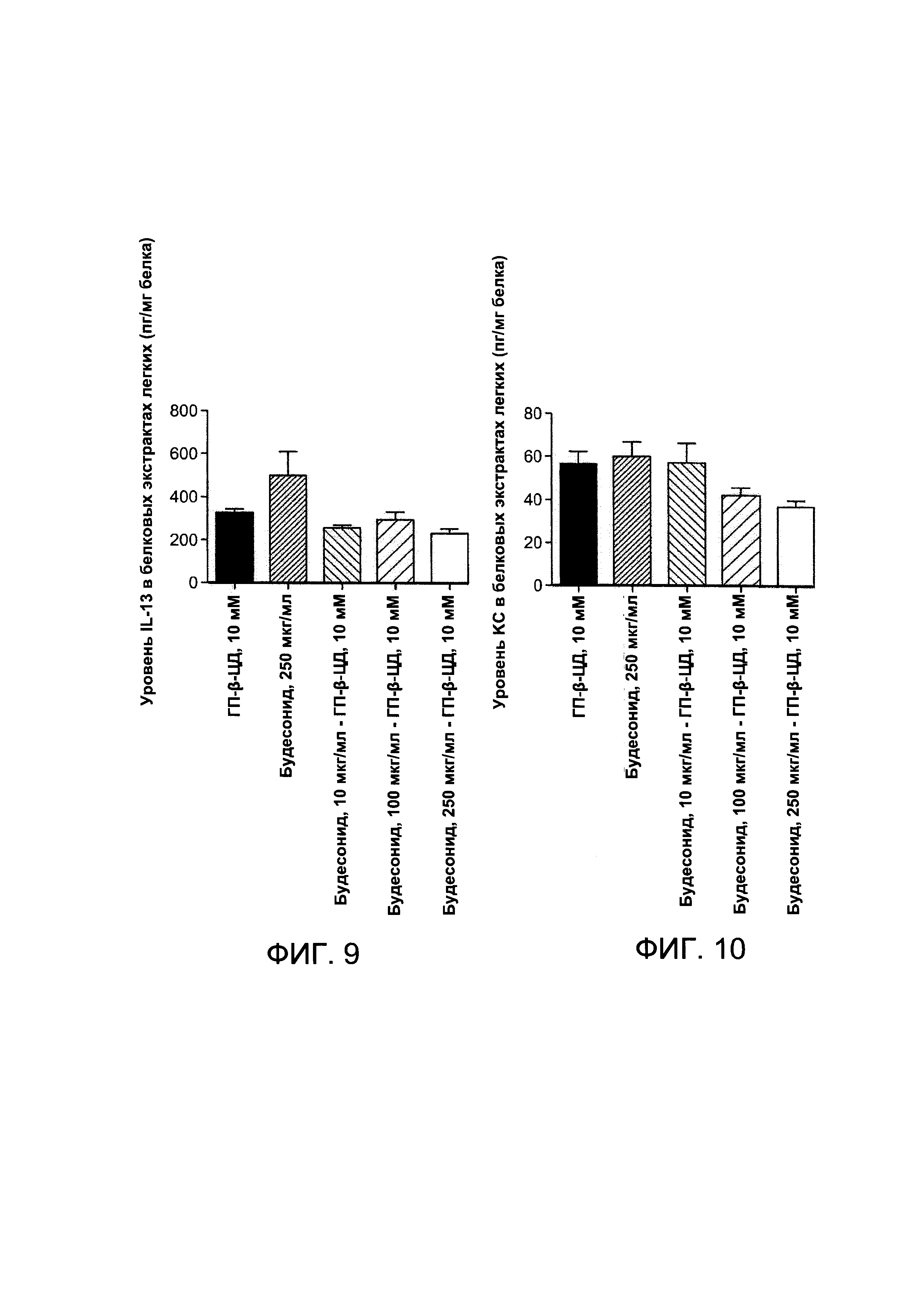
Сравнивали различные схемы лечения ГП-β-ЦД и будесонидом по отдельности или в комбинации. Фармацевтические композиции получали в соответствии с Примером 1а либо в виде комбинированной смеси (будесонида - ГП-β-ЦД), либо в виде композиций, содержащих каждое активное соединение по отдельности (будесонид в концентрации примерно 250 мкг/мл или примерно 10 мМ ГП-β-ЦД) в одинаковом буферном растворе ФСБ.
По сравнению с группой, получавшей лечение будесонидом (примерно 250 мкг/мл), комплекс, содержащий будесонид в концентрации примерно 250 мкг/мл или примерно 100 мкг/мл или примерно 10 мкг/мл и примерно 10 мМ ГП-β-ЦД, вызывал снижение уровня IL17.
Ранее было показано, что уровень IL13 изменяется после подвержения воздействию озона и участвует в нарушении функции дыхательных путей после озонового воздействия. См., например, Williams S., Nath Р, Leung S, et al: Eur Respir J. 32(3):571-8 (Sep. 2008), полностью включенный в настоящую заявку посредством ссылки. Согласно изобретению, впервые показано, что вызванный озоном уровень IL13 значительно снижается при ингаляционном введении соединения, содержащего будесонид. По сравнению с группой, получавшей лечение будесонидом (примерно 250 мкг/мл), комплекс, содержащий будесонид в концентрации примерно 250 мкг/мл или примерно 100 мкг/мл или примерно 10 мкг/мл и ГП-β-ЦД в концентрации примерно при 10 мМ, вызывал снижение уровня IL13. Таким образом, ингаляционное введение комплекса будесонид-циклодекстрин приводило к снижению уровня IL13 по сравнению с ингаляционным введением будесонида в концентрации примерно 250 мкг/мл.
На Фигуре 10 показаны результаты измерения КС (CXCL1) с помощью ИФА в легочных белковых экстрактах мышей, подверженных воздействию озона.
Сравнивали различные схемы ингаляционного лечения ГП-β-ЦД и будесонидом по отдельности или в комбинации. Фармацевтические композиции получали в соответствии с Примером 1а либо в виде комбинированной смеси (будесонида - ГП-β-ЦД), либо в виде композиций, содержащих каждое активное соединение по отдельности (будесонид в концентрации примерно 250 мкг/мл или примерно 10 мМ ГП-β-ЦД), в одинаковом буферном растворе ФСБ.
По сравнению с группой, получавшей лечение будесонидом (примерно 250 мкг/мл), комплекс, содержащий будесонид в концентрации примерно 250 мкг/мл или примерно 100 мкг/мл и ГП-β-ЦД в концентрации примерно при 10 мМ, вызвал снижение уровня КС.
Согласно изобретению, впервые показано, что уровень CXCL-1 - цитокина, который играет ключевую роль в месте действия нейтрофилов в стенках бронхов после подвержения воздействию раздражителей или оксидантов - может быть снижен путем ингаляции производных будесонида. Это единственный комплекс будесонид-циклодекстрин, который снижает вызванную озоном продукцию KС.
4. В Модель подвержения воздействию табачного дыма
Подвержение воздействию табачного дыма и протокол терапевтического лечения
Мышей линии C57B L/6 подвергали воздействию дыма от 10 сигарет 5 дней в неделю в течение 6 недель с использованием системы Inexpose® (Scireq, Монреаль, Канада). Мышам проводили лечение путем интраназальных инъекций примерно по 50 мкл 5 дней в неделю в течение 6 недель. Мышей умерщвляли на 43 сутки. Мышам из плацебо-группы, которую также называли ложно стимулированной группой, вводили ФСБ.
Анализ жидкости бронхоальвеолярного лаважа (БАЛ) проводили так же, как описано ранее в Примере 3 (модель обструкции дыхательных путей и воспаления).
Статистический анализ
Результаты количественной оценки воспалительных клеток в жидкости бронхоальвеолярного лаважа выражали как среднее +/- SEM. Сравнение между группами проводили с использованием критерия Манна-Уитни. Анализы проводили с использованием программы GraphPad Prism 5. Р значения <0,05 считали значимыми.
Результаты фармакологического исследования
В настоящем эксперименте фармацевтические композиции в соответствии с Примером 1b и 1с использовали в виде конкретных растворов для ингаляции, содержащих:
 примерно 100 мкг/мл будесонида и примерно 20 мМ гидроксипропил-бета-циклодекстрина (Пример 1b)
примерно 100 мкг/мл будесонида и примерно 20 мМ гидроксипропил-бета-циклодекстрина (Пример 1b)
 примерно 250 мкг/мл будесонида и примерно 20 мМ гидроксипропил-бета-циклодекстрина (Пример 1с)
примерно 250 мкг/мл будесонида и примерно 20 мМ гидроксипропил-бета-циклодекстрина (Пример 1с)
для их сравнения с раствором, содержащим отдельно будесонид в концентрации 500 мкг/мл.
На Фигуре 11 показаны эффекты смеси будесонид-циклодекстрин на процентное содержание нейтрофилов в жидкость БАЛ.

У мышей, подверженных воздействию табачного дыма, наблюдалось значительное повышение числа нейтрофилов в жидкости бронхоальвеолярного лаважа (БАЛ) по сравнению с ложно-стимулированными животными. Применение всех исследуемых концентраций комплекса будесонид - ГП-β-ЦД (примерно 20 мМ) вызывало значительное снижение числа нейтрофилов по сравнению с мышами, подверженными воздействию табачного дыма. Все комплексы будесонид - ГП-β-ЦД (примерно 20 мМ) приводили к более сильному снижению по сравнению с отдельным применением будесонида в более высокой концентрации (примерно 500 мкг/мл). Будесонид при отдельном применении был существенно не достаточно эффективным для снижения степени воспаления в жидкости БАЛ подверженных лечению мышей.
Пример 5
Комплекс производное будесонида-циклодекстрин
Поскольку углеводороды ГП-β-ЦД не содержат хромофоров, УФ-выявление не подходило для их определения. До сих пор не было описано методов для количественной оценки ГП-β-ЦД в фармацевтическом водном растворе. Поскольку ЯМР-спектроскопия широко применяется для оценки взаимодействия между ЦД и лекарственными средствами и для оценки количества замещенных глюкопиранозных единиц (молярное замещение), спектрометрию ядерного магнитного резонанса 1Н применяли для выявления и количественной оценки ГП-β-ЦД в воде.
Материалы
ГП-β-ЦД (молярное замещение = 0,64) был любезно предоставлен компанией Roquette (Франция). Триметилсилил-3-пропионовая кислота-d4 (TMSP) и оксид дейтерия (примерно 99,96% D) получали из компании Eurisotop (Жиф-Сюр-Иветт, Франция). Малеиновую кислоту получали из компании Sigma-Aldrich.
Получение образцов
Для валидации стандартные растворы ГП-β-ЦД разбавляли в воде Milli-Q® с получением калибровочных стандартов с шестью концентрациями в диапазоне между примерно 0,05 мг/мл и примерно 5 мг/мл. При объеме указанных растворов примерно 500 мкл для ЯМР-анализа добавляли примерно 100 мкл буфера D2O, примерно 100 мкл малеиновой кислоты (примерно 5 мМ) и примерно 10 мкл TMSP.
Предпочтительную фармацевтическую композицию комплекса будесонид - ГП-β-ЦД получали в соответствии с Примером 1а, за исключением того, что изотонический буфер был замещен на D2O.
Измерения с помощью ЯМР
Будесонид - ГП-β-ЦД в D2O анализировали при температуре примерно 298 K на спектрометре Bruker Avance, работающем примерно при частоте 500,13 МГц для обнаружения сигнала протона. Прибор снабжали криозондом (5 мМ TCI) с Z-градиентом. Последовательность 1D NOESY-presat (64 скана) использовали для минимизации сигнала от воды. Малеиновую кислоту использовали в качестве внутреннего стандарта для количественной оценки и TMSP использовали для калибровки нуля.
Для специфичного выявления ГП-β-ЦД анализировали гидроксипропильную группу. Таким образом, площадь дуплетов пиков метальной группы, которая является частью гидроксипропильной группы, соответствует примерно 1,1 ppm, (Фигура 12 В). Этот специфичный пик также можно количественно оценить для ГП-β-ЦД в присутствии будесонида. Пик примерно при 1,1 ppm остается измеримым и сохраняется в той же области, что и в отсутствии будесонида (Фигура 12А). Другие пики также можно было использовать для количественной оценки ГП-β-ЦД, включая пик, соответствующий примерно 5,2 ppm.
Валидация метода
Валидацию метода осуществляли в трех сериях экспериментов. Анализировали следующие критерии: селективность, специфичность (по сравнению с β-циклодекстрином), функция ответа (калибровочная кривая), линейность, совпадение (воспроизводимость и промежуточное совпадение), отсутствие погрешностей, предел выявления (LOD), предел количественной оценки (LOQ), матричный эффект и точность. Общую погрешность использовали в качестве критерия принятия решения для валидации. Допустимые пределы были установлены примерно при +/- 7,5%, и минимальная вероятность получения будущих результатов в пределах указанных лимитов была установлена при 0 = примерно 95% (β-пределы ожидания). Способ, таким образом, был валидирован в диапазоне, описанном выше.
На Фигуре 13 показан спектр 1D-COSY комплекса ГП-β-ЦД-будесонид.
В соответствии с источником K.А. Connors: Chem. Rev. 97:1325-1357 (1997), который полностью включен в настоящую заявку посредством ссылки, хорошо известно, что Н3 и Н5 протоны ГП-β-ЦД расположены внутри циклодекстриновой полости. Корреляция с указанными протонами дает основания полагать, что будесонид или часть будесонида включена внутрь ГП-β-ЦД.
В самом деле, два корреляционных пятна (соответствующих примерно 7,4-7,5 ppm и примерно 5,8-6,1 ppm) указывают на взаимодействие между ароматическими кольцами будесонида и Н-5 протоном ГП-β-ЦД, предполагая включение, приводящее к получению водорастворимого комплекса.
Пример 6
Выявление и количественная оценка 2-гидроксипропил-β-циклодекстрина в растворе с помощью 1Н ЯМР-спектроскопии в качестве инструмента для контроля качества
Циклодекстрины (ЦД) представляют собой циклические олигосахариды, образованные из связанных α-1,4-глюкопиранозных единиц, которые образуют структуру, подобную усеченному конусу, содержащую гидрофобную полость. Наиболее используемые природные циклодекстринов состоят из шести, семи или восьми глюкопиранозных единиц и обычно называются α-, β- и γ-циклодекстрины соответственно. Были разработаны некоторые производны для снижения токсичности и усиления растворимости в воде. Из них 2-гидроксипропил-β-циклодекстрин (ГП-β-ЦД) (Фигура 14) широко применяется в фармацевтических составах для повышения растворимости в воде, стабильности и биодоступности гидрофобных лекарственных средств путем образования растворимых в воде комплексов включения.
В соответствии с руководствами патента США и европейского патента, способы характеристики и количественной оценки фармацевтических вспомогательных веществ должны быть определены. Поскольку углеводороды ГП-β-ЦД не содержат хромофоров, методы УФ-выявления не подходят для их определения. Таким образом, существует несколько способов, описанных для количественной оценки ЦД, однако способы, разработанные для количественной оценки ГП-β-ЦД в фармацевтическом водном растворе, отсутствуют. Поскольку спектроскопия ЯМР широко применяется для исследования взаимодействия между ЦД и лекарственными средствами и для оценки количества замещенных глюкопиранозных единиц (молярное замещение), спектроскопия ядерного магнитного резонанса 1Н применялась в указанном исследовании для выявления и количественной оценки ГП-β-ЦД в воде.
Экспериментальные методы
Материалы
ГП-β-ЦД (молярное замещение = 0,64) был любезно предоставлен компанией Roquette (Франция). Триметилсилил-3-пропионовая кислота-d4 (TMSP) и оксид дейтерия (примерно 99,96% D) получали из компании Eurisotop (Жиф-Сюр-Иветт, Франция). Малеиновую кислоту получали из компании Sigma-Aldrich. Статистический анализ проводили с использованием программы e-noval (Arlenda, Льеж, Бельгия).
Получение образцов
Для валидации стандартные растворы ГП-β-ЦД разбавляли в воде Milli-Q® с получением калибровочных стандартов с шестью концентрациями в пределах диапазона между примерно 0,05 мг/мл и примерно 5 мг/мл. Примерно 500 мкл указанных растворов, примерно 100 мкл буфера D20, примерно 100 мкл малеиновой кислоты (примерно 5 мМ) и примерно 10 мкл TMSP добавляли для ЯМР-анализа.
Измерения с помощью ЯМР
Все образцы анализировали при температуре примерно 298 K на спектрометре Bruker Avance, работающем при частоте примерно 500,13 МГц для обнаружения сигнала протона. Прибор был снабжен криозондом (5 мМ TCI) с Z-градиентом. Последовательность ID NOESY-presat (64 скана) использовали для минимизации сигнала от воды. Малеиновую кислоту использовали в качестве внутреннего стандарта для количественной оценки, TMSP использовали для калибровки нуля.
Результаты и обсуждение
Выявление и количественная оценка ГП-β-ЦД в воде (1Н-ЯМР)
Для специфического выявления ГП-β-ЦД фокус на гидроксипропильной группе. Таким образом, измеряли область пика дуплета от метильной группы, которая является частью гидроксипропильной группы, соответствующую примерно 1,1, ppm (Фигура 15). Данный специфичный пик также можно количественно оценить при наличии других соединений в водном растворе ГП-β-ЦД. В самом деле, возможно получение раствора, содержащего ГП-β-ЦД и кортикостероид, включенный в циклодекстрин, при этом пик, соответствующий примерно 1,1 ppm все еще поддается измерению и сохраняется в той же области, что и в отсутствии кортикостероида.
Валидация способа
Валидацию способа осуществляли в трех сериях экспериментов. Оценивали следующие критерии: селективность, специфичность (по сравнению с β-циклодекстрином), функцию ответа (калибровочная кривая), линейность, совпадение (воспроизводимость и промежуточное совпадение), отсутствие погрешностей, предел выявление (LOD), предел количественной оценки (LOQ), матриксный эффект и точность (Фигура 4). Общую погрешность использовали в качестве критерия принятия решения для валидации. Допустимые пределы были установлены примерно при +/- 7,5%, и минимальная вероятность получения будущих результатов в указанных пределах была установлена при β = примерно 95% (β-ожидаемый предел).
Как показано на Фигуре 16, относительная погрешность концентраций, рассчитанных по результатам измерений, представленная зелеными точками, расположена вокруг относительной систематической ошибки (красная линия) и находится между бета-коэффициентами ожидания, представленными пунктирными линиями. Способ, таким образом, валидирован в диапазоне, описанном выше.
В настоящем исследовании впервые был разработан новый и полезный аналитический способ для выявления и количественной оценки ГП-β-ЦД в растворе. Указанный метод можно использовать для определения дозы в фармацевтических растворах, таких как растворы для парентерального введения. Указанный способ обладает по меньшей мере двумя основными преимуществами: скорость и удобство. В самом деле, измерение с помощью ЯМР отдельно занимает примерно 8 минут, тогда как отдельное приготовление образца требует простого добавления молекул для подавления сигнала от воды и для количественной оценки площади пика гидроксипропила. Измерения, таким образом, можно проводить непосредственно в фармацевтическом растворе (содержащем активный ингредиент) без какого-либо этапа разделения или экстрагирования.
Пример 7
Эффект будесонида на животной модели ЛПС/ХНЗЛ
Материалы и методы
Мыши
Самцов мышей С57 В1/6 возрастом от 6 до 8 недель получали из компании Charles River (Кельн, Германия) и разводили в лаборатории, к которой относятся авторы настоящего изобретатели. Все эксперименты и процедуры на животных одобрены этическим комитетом Льежского университета. Животным обеспечивали свободный доступ к пище и воде. Материалы
Фосфатный солевой буфер (ФСБ), как описано в источнике http://bio.lonza.comitiploads/tx rnwaxmarketingm ateri al/Lonza BenchGuides Phosphate Buffered Saline PBS.pdf, получали из компании Lonza (Вервье, Бельгия), гидроксипропил-бета-циклодекстрин получали из компании Roquette (Франция), будесонид получали из компании Indis (Бельгия) и коммерческую суспензию будесонида в концентрации примерно 250 мкг/мл (Pulmicort®) получали из компании AstraZeneca (Швеция). Для введения мышам гидроксипропил-бета-циклодекстрин (примерно 20 мМ) объединяли с будесонидом (примерно 250 мкг/мл) и суспензией будесонида в виде коммерческой лекарственной формы (примерно 250 мкг/мл).
Анализ воздействия липополисахарида (ЛПС) и лечения комплексом циклодекстрин - будесонид
Перед ежедневными вливаниями мышам (n=7/группа) проводили анестезию с помощью примерно 2,5% смеси изофлуран/кислород. Мышам вливали примерно 50 мкл фосфатного солевого буфера (ФСБ) (группа плацебо) или примерно 50 мкл комплекса гидроксипропил-бета-циклодекстрин - будесонид или примерно 50 мкл коммерчески доступной суспензии будесонида в концентрации примерно 250 мкг/мл (Pulmicort®) на 0, 1, 2 и 3 сутки. Мышей умерщвляли на 4 сутки. Через шесть часов после введения лечебного препарата мышам проводили интратрахеальное вливание ЛПС (примерно 1 мкг/100 мкл ФСБ, ультрачистый липополисахарид из E.Coli, InvivoGen, Сан-Диего, Калифорния, США) 2 раза на 1 и 3 сутки.
Цитологический и гистологический анализ легочной ткани
По завершении экспериментального протокола животных умерщвляли и получали жидкость бронхоальвеолярного лаважа (БАЛ) путем интратрахеального вливания раствора 4×1 мл смеси ФСБ - примерно 0,05 мМ ЭДТА (Calbiochem, Дармштадт, Германия). Супернатант жидкости БАЛ собирали для анализа белка, тогда как клетки использовали для дифференциального подсчета. Дифференциальный подсчет клеток на основе морфологических критериев проводили на препаратах, полученных в результате цитоцентрифугирования, после их окрашивания гематоксилин-эозином (Diff-Quick, Dade, Бельгия).
После проведения БАЛ пережимали левый главный бронх, отсекали левое легкое и хранили при температуре примерно -80°С. В правое легкое нагнетали примерно 4% параформальдегид под давлением примерно 25 см и заливали парафином. Отбирали случайным образом шесть фрагментов толщиной примерно 5 мкм, нарезали и окрашивали гематоксилином и эозином (Г-Э). Каждый последующий срез производился на расстоянии примерно 50 мкм от предыдущего. Стекла сканировали с помощью сканера NanoZoomer НТ 2,0, Hamamatsu, и проводили количественную оценку воспаления на оцифрованных препаратах с помощью описанной ранее системы балльной оценки воспаления. См., например, Cataldo et al: Am J Pathol (2002), полностью включенный в настоящую заявку посредством ссылки.
Результаты
Цитологический анализ бронхоальвеолярного лаважа
Количество нейтрофилов, измеренное в жидкости БАЛ от экспериментальных животных, значительно снижалось после лечения суспензией будесонида и комплексом гидроксипропил-бета-циклодекстрин - будесонид по сравнению с животными, получавшими плацебо. См. Фигуру 17.
Результаты измерения воспаления в паренхиме легкого
Как ни странно, у животных, которых подвергали воздействию ЛПС и лечению комплексом гидроксипропил-бета-циклодекстрин - будесонид, наблюдалось значительное снижение вызванного ЛПС воспаления по сравнению с животными, получавшими лечение плацебо и суспензией будесонида. См. Фигуру 18.
Пример 8
Бетаметазона дипропионат (микронизирвоанный исходный материал)
Растворы получали примерно в 20 мМ растворе Crysmeb в буфере ФСБ. Примерно 5,08 г Crysmeb растворяли в фосфатном солевом буфере (ФСБ). ФСБ, как описано в источнике http://bio.lonza.cominploads/tx mwaxmarketingrnaterial/Lonza BenchGuides Phosphate Buffered Saline PBS.pdf. полностью включенном в настоящую заявку посредством ссылки, получали из компании Lonza (Вервье, Бельгия),
Добавляли между примерно 25 и примерно 30 мг бетаметазона дипропионата (в избытке) для насыщения раствора и осторожно перемешивали в течение примерно 48 часов при температуре примерно 25°С.
Насыщенный раствор фильтровали через фильтр с размером пор 0,22 микрона и оценивали содержание бетаметазона дипропионата в фильтрате с помощью валидированного метода ВЭЖХ.
Раствор бетаметазона дипропионата получали в концентрации примерно 147 г/мл.
Пример 8а: Раствор бетаметазона дипропионата с концентрацией 100 мкг/мл
Примерно 34 мл раствора с концентрацией 147 мкг/мл, полученного выше, разводили до примерно 50 мл примерно 20 мМ раствором Crysmeb ФСБ (по результатам ВЭЖХ-анализа = примерно 99,00 мкг/мл).
Разбавленный раствор стерилизовали путем его пропускания через фильтр с размером пор 0,22 мкм под ламинарным воздушным потоком. Концентрация стерилизованного раствора бетаметазона дипропионата составляла примерно 100 мкг/мл.
Пример 8b: Раствор бетаметазона дипропионата с концентрацией 50 мкг/мл
Примерно 17 мл раствора с концентрацией 147 мкг/мл, полученного выше, разводили до примерно 50 мл примерно 20 мМ раствором Crysmeb ФСБ (по результатам ВЭЖХ-анализа = примерно 49,64 мкг/мл).
Раствор стерилизовали путем его пропускания через фильтр с размером пор 0,22 мкм под ламинарным воздушным потоком. Концентрация стерилизованного раствора бетаметазона дипропионата составляла примерно 50 мкг/мл.
Пример 8 с: Референсная суспензия
Не существует коммерчески доступного раствора бетаметазона дипропионата; в связи с этим референсный раствор бетаметазона дипропионата получали в соответствии со следующим рецептом:
Бетаметазона дипропионат 10,0 мг
Tween 80 (полисорбат 80) 00,1 мг
ФСБ, достаточное количество 100,0 мл
Суспензию получали под ламинарным воздушным потоком.
Замечание: Бетаметазона дипропионат разрушается при автоклавировании; в связи с этим препарат следует готовить перед его применением.
Пример 9
Флутиказона пропионата (исходный микронизирвоанный материал)
Как ГП-β-ЦД, так и Crysmeb способны солюбилизировать флутиказона пропионат (ФП) в соответствии со следующим способом получения.
Пример 9а: Промежуточный продукт совместного выпаривания
Растворяли примерно 1,5 г ГП-β-ЦД в 100 мл чистого этанола. Затем растворяли примерно 25 мг флутиказона пропионата в 50 мг чистого этанола. После растворения растворы объединяли растворы и выпаривали в вакууме до высыхания.
Пример 9b: Раствор флутиказона пропионата с концентрацией 250 пг/мл
Продукт совместного выпаривания диспергировали, как описано выше в Примере 8а, примерно в 100 мл ФСБ с получением суспензии. Указанную суспензию стерилизовали путем автоклавирования с получением раствора ФП с концентрацией примерно 250 мкг/мл ФП и примерно 10 мМ ГП-β-ЦД (по результатам ВЭЖХ-анализа примерно 238 мкг/мл ФП).
Пример 9с: Раствор флутиказона пропионата с концентрацией 100 мкг/мл
Раствор с концентрацией 250 мкг/мл, полученный выше в Примере 8b, разводили примерно 10 мМ раствором ГП-β-ЦД (примерно 8,4 мл раствора с концентрацией примерно 238 мкг/мл + примерно 11,6 мл ГП-β-ЦД в ФСБ). Суспензию стерилизовали путем автоклавирования для получения раствора ФП с концентрацией примерно 100 мкг/мл ФП и примерно 10 мМ ГП-β-ЦД.
Пример 9d: Раствор флутиказона пропионата с концентрацией 50 мкг/мл
Раствор с концентрацией 250 мкг/мл, полученный выше в Примере 8b, разводили примерно 10 мМ раствором ГП-β-ЦД (примерно 4,2 мл раствора с концентрацией примерно 238 мкг/мл+примерно 15,6 мл ГП-β-ЦД в ФСБ). Суспензию стерилизовали путем автоклавирования с получением раствора ФП с концентрацией примерно 50 мкг/мл ФП и примерно 10 мМ ГП-β-ЦД.
Референсный продукт, например, 9 представлял собой суспензию фликсотида.
Пример 10
Эффект бетаметазона дипропионата на животной модели ЛПС/ХНЗЛ
Материалы и методы
Мыши
Самцов мышей линии С57В 1/6 возрастом от 6 до 8 недель получали из компании Charles River (Кельн, Германия) и разводили в лаборатории, к которой относятся авторы настоящего изобретения. Все эксперименты и процедуры на животных одобрены этическим комитетом Льежского университета. Животным обеспечивали свободный доступ к пище и воде.
Материалы
Фосфатный солевой буфер (ФСБ), как описано в источнике http://bio.lonza.com/uploads/txmwaxmarketingrnatelial/LonzaBencl] Guides Phosphate Buffered Saline PBS, pdf, получали из компании Lonza (Вервье, Бельгия), Crysmeb получали из компании Roquette (Франция), бетаметазона дипропионат получали из компании ACIC (Канада) и Tween 80 получали из компании ICI через Sigma Aldrich. Для введения мышам продукты, полученные в Примере 8, тестировали.
Анализ воздействия липополисахарида (ЛПС) и лечения комплексом циклодекстрин -бетаметазона дипропионат
Перед ежедневными вливаниями мышам (n=10/группа) проводили анестезию примерно 2,5% смесью изофлуран/кислород. Мышам вливали примерно 50 мкл фосфатного солевого буфера (ФСБ) (группа плацебо) или примерно 50 мкл комплекса Crysmeb - бетаметазона дипропионат или примерно 50 мкл суспензии бетаметазона, приготовленной в соответствии с Примером 8, на 0, 1, 2, 3 сутки. Мышей умерщвляли на 4 сутки. Через шесть часов после введения лечебного препарат мышам проводили интратрахеальное вливание ЛПС (примерно 1 мкг/100 мкл ФСБ, ультрачистый липополисахарид из E.Coli, InvivoGen, Сан-Диего, Калифорния, США) 2 раза на 1 и 3 сутки.
Цитологический и гистологический анализ легких
По окончании экспериментального протекала животных умерщвляли и получали жидкость бронхоальвеолярного лаважа (БАЛ) путем интратрахеального вливания 4×1 мл раствора ФСБ - 0,05 мМ ЭДТА (Calbiochem, Дармштадт, Германия). Супернатант жидкости БАЛ собирали для оценки белка, тогда как клетки использовали для дифференциального подсчета. Дифференциальный подсчет клеток на основе морфологических критериев осуществляли на препаратах, полученных в результате цитоцентрифугирвоания, после их окрашивания гематоксилин-эозином (Diff-Quick, Dade, Бельгия).
После проведения БАЛ левый главный бронх пережимали и левое легкое отсекали и хранили при температуре -80°С. В правое легкое нагнетали примерно 4% параформальдегид под давлением примерно 25 см и заливали парафином. Отбирали случайным образом шесть срезов толщиной примерно 5 мкм, нарезали и окрашивали гематоксилином и эозином (Г-Э). Каждый последующий срез производили на расстоянии примерно 50 мкм от предыдущего. Стекла сканировали с помощью сканера NanoZoomer НТ 2,0, Hamamatsu, и проводили количественную оценку воспаления на оцифрованных препаратах с помощью описанной ранее системы балльной оценки воспаления. См., например, Cataldo et al.: Am J Pathol (2002), полностью включенный в настоящую заявку посредством ссылки.
Результаты
Цитологический анализ бронхоальвеолярного лаважа
Количество нейтрофилов, измеренное в жидкости БАЛ от экспериментальных животных после лечения суспензией бетаметазона дипропионата и комплексом Crysmeb - бетаметазона дипропионат, было снижено, но незначительно, по сравнению с животными, получающими плацебо. См. Фигуру 20 и Фигуру 21.
Результаты измерения воспаления в паренхиме легких
Как ни странно, у животных, подвергавшихся воздействию ЛПС и лечению комплексом Crysmeb - бетаметазона дипропионат в концентрации примерно 100 мкг/мл, наблюдалось значительное снижение вызванного ЛПС воспаления по сравнению с животными, получающими лечение плацебо и суспензией бетаметазона (в концентрации примерно 100 мкг/мл). См. Фигуру 19.
У животных, подвергавшихся воздействию ЛПС и лечению комплексом Crysmeb -бетаметазона дипропионат в концентрации примерно 50 и примерно 100 мкг/мл и суспензией бетаметазона в концентрации примерно 50 мкг/мл, наблюдалось значительное снижение вызванного ЛПС воспаления по сравнению с животными, получавшими лечение плацебо. Референсный флутиказон в концентрации примерно 100 мкг/мл также вызывал снижение по сравнению с плацебо, но незначительное. Кроме того, комплекс Crysmeb - бетаметазона дипропионат в концентрации примерно 100 мкг/мл приводил к значительному снижению воспаления по сравнению с балльным значением воспаления для референсного флутиказона в концентрации примерно 100 мкг/мл. См. Фигуру 22.
Пример 11
Эффект флутиказона пропионата на животной модели ЛПС/ХНЗЛ
Материалы и методы
Мыши
Самцов мышей С57В 1/6 возрастом от 6 до 8 недель получали из компании Charles River (Кельн, Германия) и разводили в лаборатории, к которой относятся авторы настоящего изобретения. Все эксперименты и процедуры на животных одобрены этическим комитетом Льежского университета. Животным обеспечивали свободный доступ к пище и воде.
Материалы
Фосфатно-солевой буфер (ФСБ), как описано в источнике http://biolonza.comluploads/tx mwaxmarketingmaterial/Lonza BenchGuides Phosphate Buffered Saline PBS.pdf, получали из компании Lonza (Вервье, Бельгия), гидроксипропил-бета-циклодекстрин получали из компании Roquette (Франция), флутиказона пропионат получали из компании ACIC (Канада) и коммерческую суспензию флутиказона пропионата в концентрации примерно 250 мкг/мл (Pulmicort®) получали из компании Glaxo SmithKline (Великобритания). Для введения мышам гидроксипропил-бета-циклодекстрин (примерно 10 мМ) объединяли с флутиказона пропионатом (примерно 250 мкг/мл) в соответствии с Примером 9 и суспензией флутиказона пропионата (примерно 250 мкг/мл) в виде коммерчески доступной лекарственной формы.
Анализ воздействия липополисахарида (ЛПС) и лечения комплексом циклодекстрин - флутиказона пропионат
Перед ежедневными вливаниями мышам (n=10/группа) проводили анестезию примерно 2,5% смесью изофлуран/кислород. Мышам вливали примерно 50 мкл фосфатного солевого буфера (ФСБ) (плацебо-группа) или примерно 50 мкл комплекса гидроксипропил-бета-циклодекстрин - флутиказона пропионат или примерно 50 мкл коммерчески доступной суспензии флутиказона пропионата в концентрации примерно 250 мкг/мл (Flixotide®) на 0, 1, 2, 3 сутки. Мышей умерщвляли на 4 сутки. Через шесть часов после лечебного введения мышам проводили интратрахеальное вливание ЛПС (примерно 1 мкг/100 мкл ФСБ, ультрачистый липополисахарид из E.Coli, InvivoGen, Сан-Диего, Калифорния, США) 2 раза на 1 и 3 сутки.
Цитологический и гистологический анализ легкого
По завершении экспериментального протокола животных умерщвляли и получали жидкость бронхоальвеолярного лаважа (БАЛ) путем интратрахеального вливания раствора 4×1 мл раствора ФСБ - 0,05 мМ ЭДТА (Calbiochem, Дармштадт, Германия). Супернатант жидкости БАЛ собирали для белкового анализа, тогда как клетки использовали для дифференциального подсчета. Дифференциальный подсчет клеток на основе морфологических критериев проводили на препаратах, полученных в результате цитоцентрифугирования, после их окрашивания гематоксилин-эозином (Diff-Quick, Dade, Бельгия).
После проведения БАЛ левый главный бронх пережимали и левое легкое отсекали и хранили при температуре -80°С. В правое легкое нагнетали примерно 4% параформальдегид под давлением примерно 25 см и заливали парафином. Отбирали случайным образом шесть срезов толщиной примерно 5 мкм, нарезали и окрашивали гематоксилином и эозином (ГЭ). Каждый последующий срез производили на расстоянии примерно 50 мкм от предыдущего. Стекла сканировали с помощью сканера NanoZoomer НТ 2,0, Hamamatsu, и проводили количественную оценку воспаления на оцифрованных препаратах с помощью описанной ранее системы балльной оценки воспаления. См., например, Cataldo et al: Am J Pathol (2002), полностью включенный в настоящую заявку посредством ссылки.
Результаты
Цитологический анализ бронхоальвеолярного лаважа
Неожиданно, количество нейтрофилов, измеренное в жидкости бронхоальвеолярного лаважа (БАЛ) от экспериментальных животных после лечения комплексом гидроксипропил-бета-циклодекстрин - флутиказона пропионат в концентрации примерно 250 мкг/мл, было значительно понижено по сравнению с животными, получавшими плацебо. В случае применения суспензии флутиказона пропионата с концентрацией примерно 250 мкг/мл число нейтрофилов было понижено по сравнению с плацебо, но незначительно. См. Фигуру 23.
Публикации
Frederick G. Vogt and Mark Strohmeier: "2D Solid-State NMR Analysis of Inclusion in Drug-Cyclodextrin Complexes", Molecular Pharmaceutics. 9:3357-3374 (2012).
Agiieros, M., Campanero, M.A., Irache, J.M.: "Simultaneous quantification of different cyclodextrins and Gantrez by HPLC with evaporative light scattering detection", J. Pharm. Biomed. Anal. 39:495-502 (2005).
Thorsteinn Loftsson and Marcus E. Brewster: "Pharmaceutical applications of cyclodextrins: basic science and product development", J. Pharm. Pharmacol. 62: 1607-1621 (2010).
Szeman, J., Gerloczy, A., Csabai, K., Szejtli, J., Kis, G.L., Su, P., Chau, R.Y., Jacober, A.: "High-performance liquid chromatographic determination of 2-hydroxypropyl-y-cyclodextrin in different biological fluids based on cyclodextrin enhanced fluorescence". J. Chromatogr. B. 774:157-164 (2002).
Полное описание всех публикаций, цитированных в настоящей заявке, полностью включено в настоящую заявку посредством ссылки, как если бы каждая отдельная публикация была полностью изложена и включена в настоящую заявку.
Различные модификации и вариации настоящего изобретения в пределах сущности и объема изобретения будут очевидны специалисту в данной области техники. Иллюстративные варианты реализации и примеры предложены исключительно в качестве примеров и не ограничивают объем настоящего изобретения. Объем изобретения ограничивается только следующей далее формулой изобретения.