Результат интеллектуальной деятельности: МОДИФИЦИРОВАННЫЕ ЦИТОТОКСИНЫ И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка претендует на приоритет предварительной заявки США US 62/222059, поданной 22 сентября 2015 года, которая включена в настоящее описание посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится в целом к соединениям, пригодным для лечения рака. В некоторых аспектах изобретение относится к низкомолекулярным цитотоксинам, которые являются химически модифицированными так, чтобы иметь один или несколько фрагментов, которые включают гидрофобные части. В некоторых аспектах изобретение относится к композициям, которые включают такие модифицированные низкомолекулярные цитотоксины и белок, такой как альбумин или миметики альбумина. Кроме того, изобретение обеспечивает различные применения этих соединений и композиций.
УРОВЕНЬ ТЕХНИКИ
Рак относится к группе заболеваний, характеризующихся образованием злокачественных опухолей или новообразований, которые включают аномальный рост клеток и способны внедряться в соседнюю ткань и распространяться на другие части тела. Ежегодно ставится более 14 миллионов новых диагнозов рака. Кроме того, рак вызывает более 8 миллионов смертей каждый год, что составляет приблизительно 15% всех смертей во всем мире. В развитых странах рак вызывает еще более высокий процент смертей.
Способы лечения рака значительно улучшились в течение последних нескольких лет. В частности, было обнаружено возрастающее количество цитотоксических агентов. Эти агенты обычно работают путем уничтожения раковых клеток. Но цитотоксические агенты также могут быть вредными для нормальных клеток. Поэтому субъекты, подвергающиеся лечению такими агентами, часто страдают от некоторых побочных эффектов лечения. В некоторых случаях побочные эффекты создают такой существенный риск, что может быть необходимо вводить очень ограниченные количества цитотоксических агентов. Таким образом, несмотря на то, что существует общее стремление обнаружить все более токсичные химиотерапевтические агенты, также желательно разработать новые средства для селективного направления этих соединений в раковые клетки и исключить их действие в отношении нормальных клеток.
Были использованы различные стратегии, способствующие направленной доставке химиотерапевтических агентов к раковым клеткам. Например, некоторые соединения основаны на пассивном нацеливании, где соединение селективно направляется к раковым клеткам (например, в солидные опухоли) в результате того, что злокачественные клетки имеют тенденцию к более быстрому делению, чем другие клетки, и, следовательно, имеют большую потребность в отношении некоторых биологических строительных блоков. Например, гемцитабин является обычно используемым цитотоксином, который содержит сахароподобную часть, и он также несет токсичную нагрузку (группу 5-фторурацила). Поскольку раковые клетки могут иметь более высокую потребность в сахаре, чем другие клетки, гемцитабин пассивно привлекается быстроделящимися раковыми клетками, поскольку он выглядит как сахарная молекула. Как только гемцитабин оказывается в раковой клетке, он может высвободить свою токсичную нагрузку. В некоторых других случаях нацеливание может быть активным, где цитотоксический агент включает в себя часть, которая селективно связывается с белком, который сверхэкспрессирован в некоторых раковых клетках. Например, пеметрексед включает в себя часть, которая имитирует фолиевую кислоту, и тем самым позволяет лекарственному средству активно нацеливаться на злокачественные клетки, которые сверхэкспрессируют рецепторы фолиевой кислоты.
Такое пассивное и активное нацеливание позволяет разрабатывать более токсичные цитотоксические агенты, которые имеют сниженные побочные эффекты по отношению к цитотоксинам более раннего поколения. Но даже и в этом случае прогресс был медленным, и часто было непрактичным включать в цитотоксические средства определенные группы, которые дают возможность избирательно нацеливать его на раковые клетки, и которые также могут быть сформулированы в виде, подходящим для доставки. Таким образом, существует постоянная потребность в обнаружении новых путей для селективного направления цитотоксических агентов в раковые клетки.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединениям и композициям, которые могут доставлять увеличенные токсичные количества цитотоксина в раковые клетки (например, в солидную опухоль) со сниженными побочными эффектами по отношению к другим нераковым клеткам. В некоторых вариантах осуществления изобретения, соединения представляют собой пролекарства низкомолекулярных цитотоксинов, так что пролекарство позволяет улучшить доставку цитотоксина в солидную опухоль млекопитающего. Изобретение также относится к способам и применениям этих соединений и композиций для лечения рака.
В первом аспекте изобретение относится к соединениям формулы (I):

где A1 представляет собой органическую группу, или A1 представляет собой гидрофильную группу или атом водорода; A2 представляет собой фрагмент цитотоксического лекарственного средства, который имеет молекулярную массу не более 1600 Да; X1 представляет собой гидрофобную группу; и X2 представляет собой простую связь, органическую группу или гетероатомную группу, выбранную из группы, состоящей из -O-, -S-, -S(=O)-, -S(=O)2-, -S-S-, -N=, =N-, -N(H)-, -N=N-N(H)-, -N(H)-N=N-, -N(OH)- и -N(=O)-. В некоторых вариантах осуществления изобретения A1 представляет собой гидрофильную группу, такую как группа карбоновой кислоты (-СООН,) или ее фармацевтически приемлемые соли. В некоторых вариантах осуществления изобретения, фрагмент цитотоксического лекарственного средства представляет собой фрагмент паклитаксела, фрагмент доксорубицина или фрагмент пеметрекседа. В некоторых вариантах осуществления гидрофобная группа представляет собой C12-22гидрокарбиленовую группу, которая необязательно замещена. В некоторых вариантах Осуществления X2 представляет собой органическую группу, такую как карбонильная группа, то есть -C(=O)-.
Во втором аспекте изобретение относится к соединению следующей формулы:
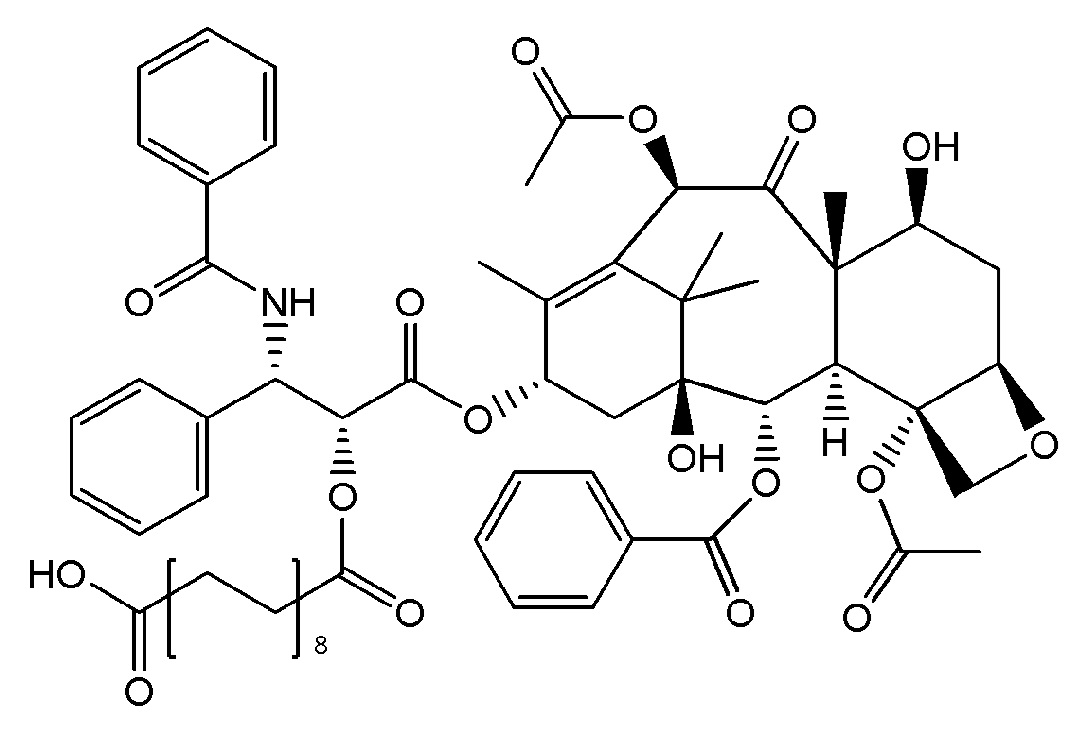
или его фармацевтически приемлемой соли.
В третьем аспекте изобретение относится к композициям (например, к фармацевтическим композициям), который содержат: соединение из любых вариантов вышеуказанных аспектов; и белок. В некоторых вариантах осуществления белком является альбумин или миметик альбумина.
В четвертом аспекте изобретение относится к композициям (например, к фармацевтическим композициям), которые содержат: соединение из любых вариантов осуществления первого или второго аспектов; белок, где белок представляет собой альбумин или миметик альбумина; и носитель, включбщий воду; где соединение и белок нековалентно связаны друг с другом; и где соединение и белок сольватированы носителем.
В пятом аспекте изобретение относится к способам лечения рака, которые включают введение субъекту соединения или композиции по любому варианту осуществления любого из вышеупомянутых аспектов.
В шестом аспекте изобретение относится к способам индукции апоптоза в раковой клетке, которые включают контактирование раковой клетки с соединением или композицией по любому варианту осуществления любого из первого - четвертого аспектов.
В седьмом аспекте изобретение относится к способам ингибирования роста злокачественной опухоли, который включает контактирование злокачественной опухоли с соединением по любому варианту осуществления первого или второго аспектов.
В восьмом аспекте изобретение предусматривает применение соединения или композиции по любому варианту осуществления любого из первого - четвертого аспектов в качестве лекарственного средства.
В девятом аспекте изобретение предусматривает применение соединения или композиции по любому варианту осуществления любого из первого - четвертого аспектов для лечения рака
В десятом аспекте изобретение предусматривает применение соединения или композиции по любому из вариантов осуществления любого из первого - четвертого аспектов для изготовления лекарственного средства.
В одиннадцатом аспекте изобретение предусматривает применение соединения или композиции по любому из вариантов осуществления любого из первого - четвертого аспектов для изготовления лекарственного средства для лечения рака
В двенадцатом аспекте изобретение относится к способам получения соединений по первому и второму аспектам и композиции по третьему и четвертому аспектам.
Дополнительные аспекты и варианты осуществления изобретения представлены на фигурах, в подробном описании, формуле изобретения и реферате.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Следующие фигуры предназначены для иллюстрации различных вариантов осуществления соединений, композиций, способов и применений, которые описанные в настоящей заявке. Фигуры представлены исключительно для иллюстративных целей, и они не предназначены для описания любых предпочтительных соединений или композиций или любых предпочтительных способов или применений, или для того, чтобы служить источником любых ограничений объема заявленных изобретений.
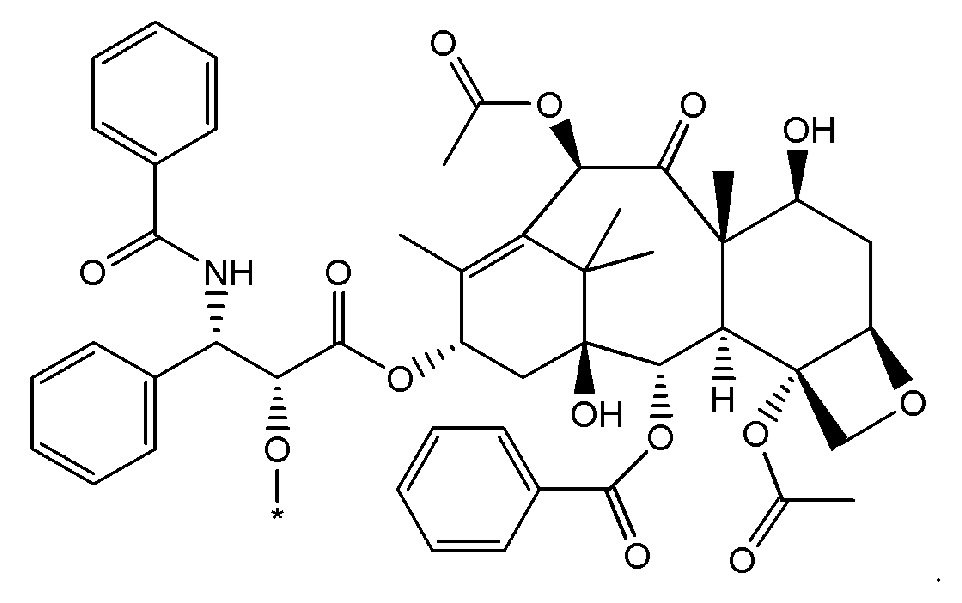
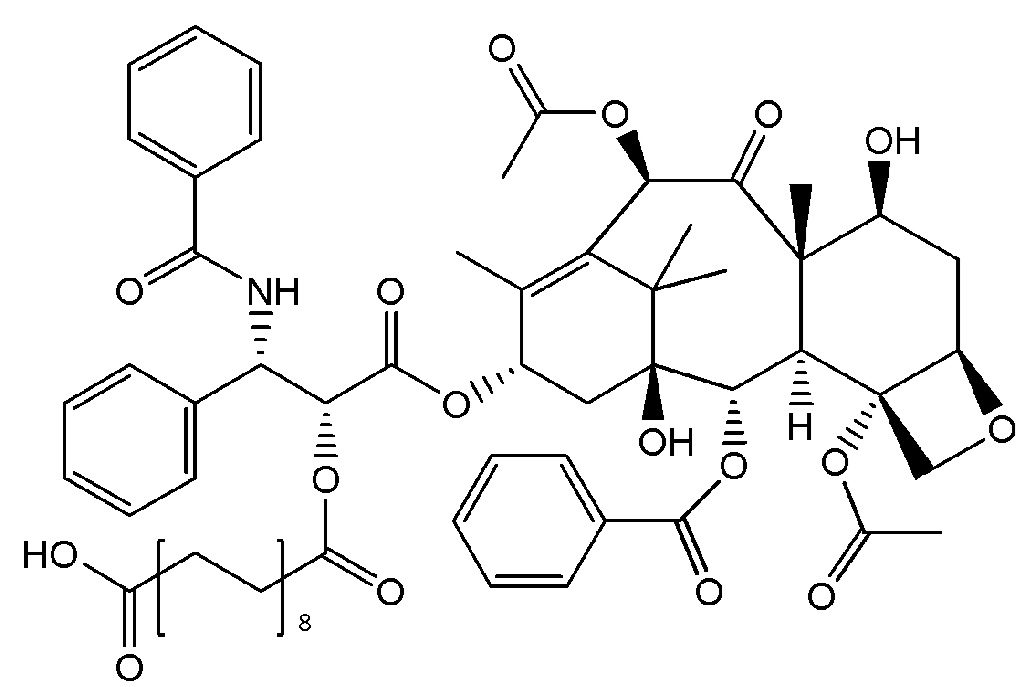
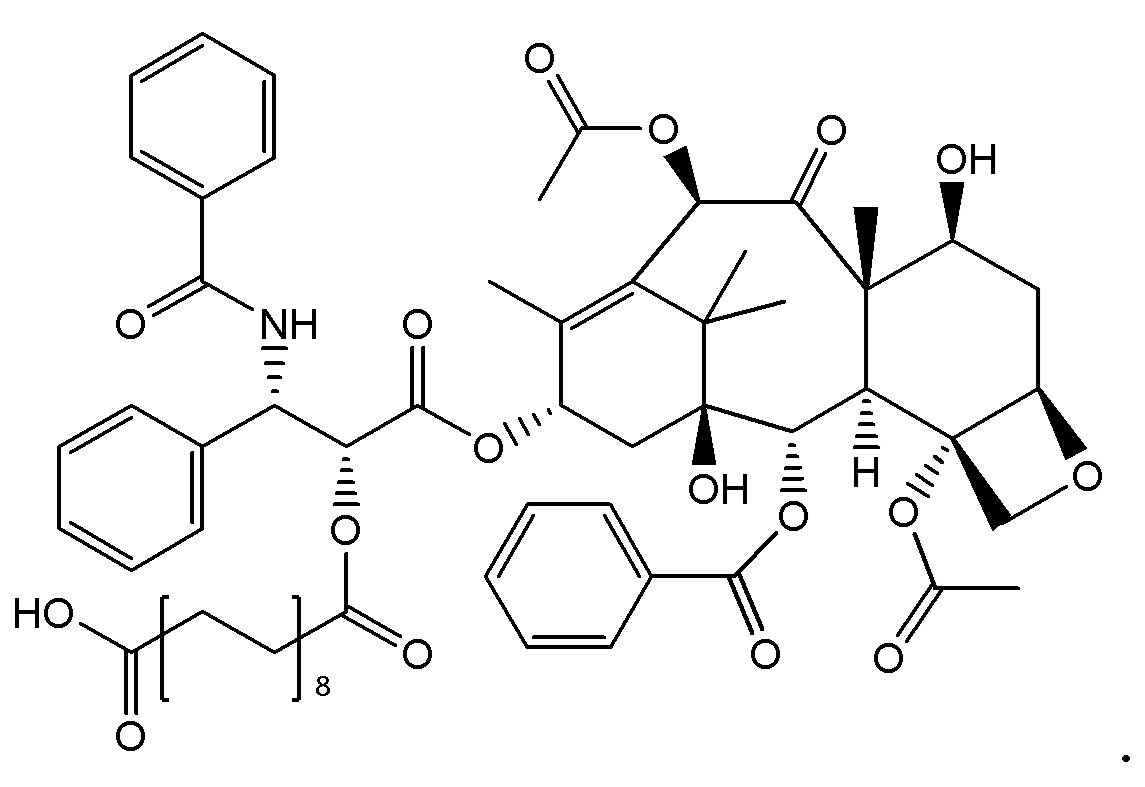
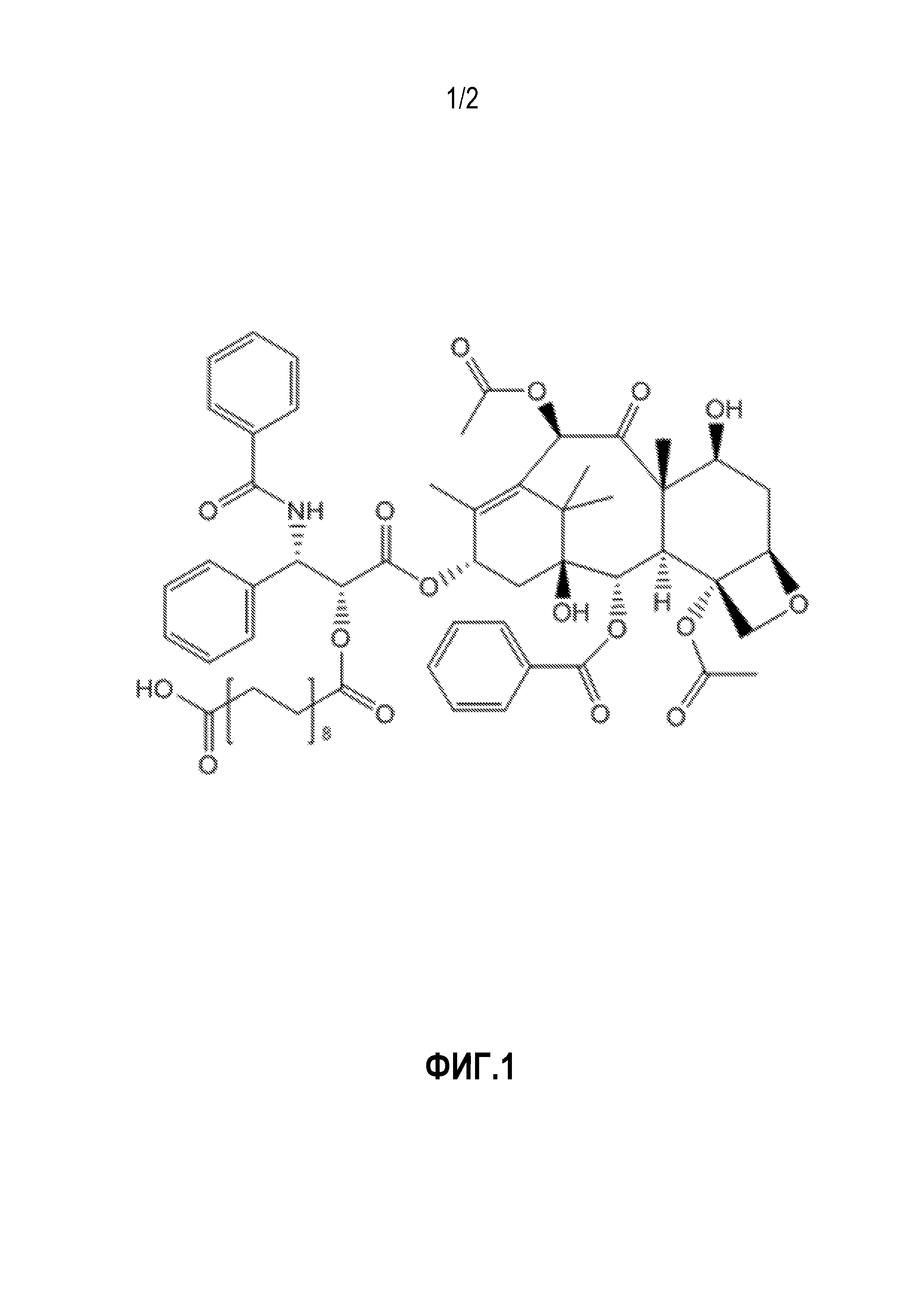
На Фигуре 1 представлен неограничивающий пример соединения формулы (I), где соединение представляет собой паклитаксел, который модифицирован таким образом, чтобы он включал сложный эфир октадекандикарбоновой кислоты.
На Фигуре 2 показана микрофотография крио-ТЕМ-анализа препарата PTX-FA/HSA.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В нижеследующем описании представлены различные аспекты и варианты осуществления изобретения, раскрытые в настоящей заявке. Ни один конкретный вариант осуществления не предназначен для ограничения объема изобретения. Скорее, варианты осуществления предоставляют неограничивающие примеры различных композиций и способов, которые включены в объем заявленных изобретений. Описание должно быть прочитано с точки зрения специалиста в данной области техники. Поэтому информация, хорошо известная специалистам в данной области техники, не включена как обязательная.
Определения
Следующие термины и выражения имеют смысловые значения, указанные ниже, если не указано иное. В данном описании могут использоваться другие термины и выражения, специально не определенные в данном документе. Такие другие термины и выражения должны иметь смысловые значения, которые они имеют в контексте данного описания, понятном обычному специалисту в данной области техники. В некоторых случаях термин или выражение могут быть представлены в единственном или множественном числе. В таких случаях следует понимать, что любой термин в единственном числе может включать формы во множественном числе, и наоборот, если явно не указано обратное.
В данном описании формы единственного числа подразумевают также формы во множественном числе, если из контекста явно не следует иное. Например, указание "заместитель" включает в себя один заместитель, а также два или более заместителей и т.п.
Используемые здесь термины "например", "в частности", "такой как" или "включает" подразумевают примеры, которые дополнительно поясняют общий объект изобретения. Если не указано иное, такие примеры представлены только для целей лучшего понимания вариантов осуществления изобретения, проиллюстрированные в настоящем раскрытии, и не предназначены для какого-либо ограничения. Эти выражения не указывают на какое-либо предпочтение при раскрытии варианта осуществления изобретения.
Используемый здесь термин "углеводород" относится к органической группе, состоящей из углерода и водорода, которые могут быть насыщенными или ненасыщенными, и которые могут включать ароматические группы. Термин "гидрокарбил" относится к одновалентному или многовалентному (например, двухвалентному или с большей валентностью) углеводородному остатку. В некоторых случаях двухвалентная гидрокарбильная группа обозначается как "гидрокарбиленовая" группа.
Термин "алкил", как он используется в настоящем документе, относится к неразветвленному или разветвленному насыщенному углеводороду, содержащему от 1 до 30 атомов углерода в цепи, который может быть необязательно замещен, как описано далее, при этом допустимы несколько степеней замещения. Примеры "алкила", как он используется здесь, включают, без ограничения, метил, этил, н-пропил, изопропил, изобутил, н-бутил, втор-бутил, трет-бутил, изопентил, н-пентил, неопентил, н-гексил и 2-этилгексил. В некоторых случаях "алкильная" группа может быть двухвалентной, и в этом случае, в качестве альтернативы, группа может быть названа "алкиленовой" группой. Кроме того, в некоторых случаях один или несколько атомов углерода в алкильной или алкиленовой группе может быть заменены гетероатомом (например, выбранных из азота, кислорода или серы, включая N-оксиды, оксиды серы, диоксиды серы и карбонильные группы, где это осуществимо), и такая группа соответственно называется "гетероалкильной" группой или "гетероалкиленовой" группой. Неограничивающие примеры включают "оксиалкильные" или "оксиалкиленовые" группы, где атом углерода в алкильной или алкиленовой группе замещен кислородом. Неограничивающие примеры оксиалкильных или оксиалкиленовых групп включают алкильные или алкиленовые цепи, которые содержат карбонильную группу, а также алкоксилаты, полиалкиленоксиды и т.п.
Число атомов углерода в любой группе или соединении может быть представлено численными индексами. Таким образом, "Cz" относится к группе соединений, имеющих "z" атомов углерода, и "Сх-y" относится к группе или соединению, содержащему от "х" до "y", включительно, атомов углерода. Например, "C1-6алкил" представляет собой алкильную группу, имеющую от 1 до 6 атомов углерода, и он включает, например, но без ограничений, метил, этил, н-пропил, изопропил, изобутил, н-бутил, втор-бутил, трет-бутил, изопентил, н-пентил, неопентил и н-гексил. Такая же логика относится к другим типам функциональных групп, определенным ниже.
Термин "алкенил", как он используется в настоящем документе, относится к неразветвленному или разветвленному неароматическому углеводороду, имеющему от 2 до 30 атомов углерода в цепи, и имеющему одну или несколько двойных углерод-углеродных связей, который может быть необязательно замещен, как описано далее, при этом допустимы несколько степеней замещения. Примеры "алкенила", как используется в данном описании, включают, без ограничения, этенил, 2-пропенил, 2-бутенил и 3-бутенил. В некоторых случаях "алкенильная" группа может быть двухвалентной, и в этом случае группа может альтернативно называться "алкениленовой" группой. Кроме того, в некоторых случаях один или более атомов углерода в алкенильной или алкениленовой группе может быть заменено гетероатомом (например, выбранного из азота, кислорода или серы, включая N-оксиды, оксиды серы, диоксиды серы и карбонильные группы, где это осуществимо), и такая группа соответственно называется "гетероалкенильная" группа или "гетероалкениленовая" группа.
Используемый в настоящем описании термин "циклоалкил" относится к алифатическому насыщенному или ненасыщенному углеводородному кольцу, содержащему от 3 до 20 атомов углерода, который может быть необязательно замещен, как описано далее, и при этом допустимы несколько степеней замещения. В некоторых вариантах осуществления изобретения этот термин относится только к системам с насыщенным углеводородным кольцом, замещенным, как дополнительно описано далее. Примеры "циклоалкила", используемого в данном описании, включают, без ограничения, циклопропил, циклобутил, циклопентил, циклогексил, циклогексенил, циклогептил, циклооктил, адамантил и тому подобное. В некоторых случаях "циклоалкильная" группа может быть двухвалентной, в этом случае группа может альтернативно называться "циклоалкиленовой" группой. Циклоалкильные и циклоалкиленовые группы также могут быть названы здесь как "карбоциклические кольца". Кроме того, в некоторых случаях, один или несколько атомов углерода в циклоалкильной или циклоалкиленовой группе могут быть заменены гетероатомом (например, независимо выбранным из азота, кислорода, кремния или серы, включая N-оксиды, оксиды серы и диоксиды серы, где это осуществимо) и соответственно обозначаются как "гетероциклильная" группа или "гетероциклиленовая" группа. Термин "гетероциклическое кольцо" также может быть использован взаимозаменяемо с любым из этих терминов. В некоторых вариантах осуществления циклоалкильные и гетероциклильные группы являются полностью насыщенными. В некоторых других вариантах осуществления изобретения, циклоалкильные и гетероциклические группы могут содержать одну или несколько двойных углерод-углеродных связей.
В данном описании термины "галоген", "атом галогена" или "гало" относятся к атому фтора, хлора, брома или йода. В некоторых вариантах осуществления термины относятся к атому фтора или хлора.
Термины "органическая группа", "органический фрагмент" или "органический остаток" относятся к одновалентной или поливалентной функциональной группе, имеющей по меньшей мере один атом углерода, которая необязательно содержит один или несколько дополнительных атомов, выбранных из группы, состоящей из атомов водорода, атомов галогена, атомов азота, атомов кислорода, атомов фосфора и атомов серы, и которая не содержит ковалентно связанных атомов металла или полуметалла. В некоторых вариантах осуществления изобретения эти термины могут включать соли металлов с органическими группами, такие как соли щелочных или щелочноземельных металлов с органическими анионами.
Используемый здесь термин "фармакофор" относится к типу органической функциональной группы. Стандартные фармакофоры представляют собой гидрофобные фармакофоры, фармакофоры, служащие донором водородной связи, поглощающие водородную связь фармакофоры, положительно ионизируемые фармакофоры и отрицательные ионизируемые фармакофоры. Классификация органических функциональных групп в соединении осуществляется в соответствии со стандартными системами классификации, известными в данной области.
Используемые здесь термины "гидрофобная группа", "гидрофобная часть" или "гидрофобный остаток" относятся к органической группе, которая состоит по существу из гидрофобных фармакофоров. В некоторых вариантах осуществления изобретения эти термины относятся к органической группе, состоящей из гидрофобных фармакофоров.
Термины "гидрофильная группа", "гидрофильная часть" или "гидрофильный остаток" относятся к органической группе, которая содержит один фармакофор, выбранный из группы, состоящей из доноров водородной связи, акцепторов водородной связи, отрицательных ионизируемых групп или положительно ионизируемых групп. В некоторых вариантах осуществления изобретения эти термины относятся к органической группе, состоящей по существу из фармакофоров, выбранных из группы, состоящей из доноров водородной связи, акцепторов водородной связи, отрицательных ионизируемых групп или положительно ионизируемых групп.
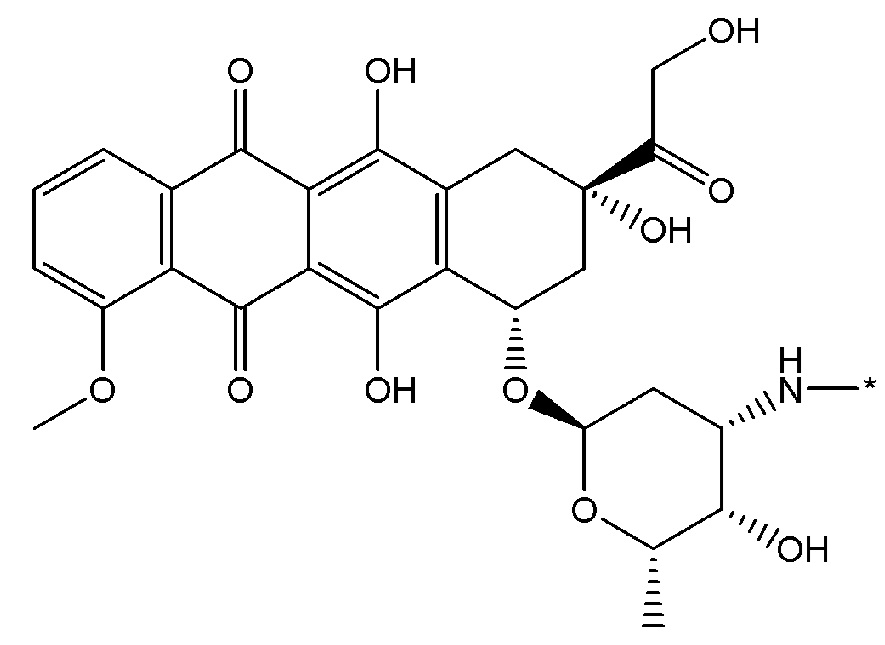
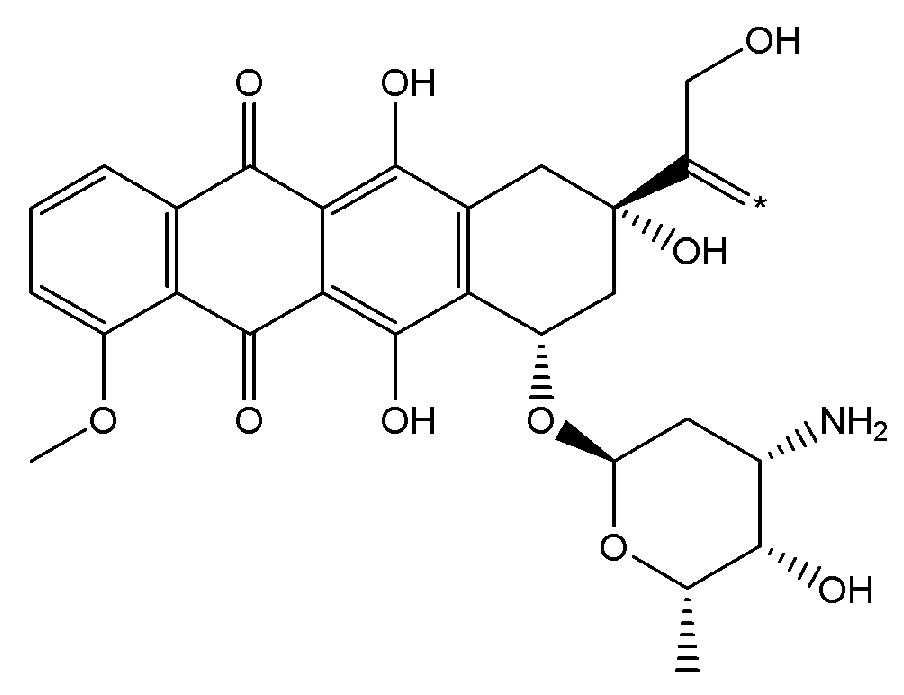
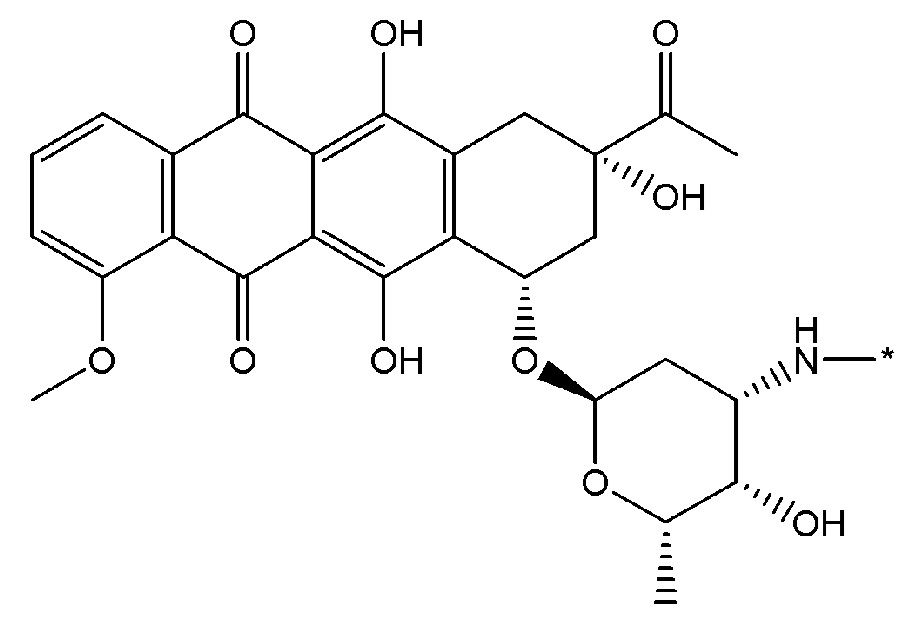
Как используется в данном описании, термин "лекарственный фрагмент" или "лекарственная группа" относится к лекарственному соединению или его фармацевтически приемлемой соли, где атом или группа атомов отсутствует, в результате чего образуется одновалентная или поливалентная группа. В некоторых вариантах осуществления изобретения, например, отсутствует атом водорода, в результате чего образуется одновалентная группа. В некоторых других вариантах осуществления функциональная группа, такая как группа -ОН, группа -NH2, или группа -СООН, отсутствует. В некоторых вариантах осуществления изобретения лекарственный фрагмент представляет собой "цитотоксическую лекарственную группу", которая относится к лекарственному фрагменту (как определено выше) цитотоксического лекарственного соединения. Один неограничивающий пример такого "лекарственного фрагмента" (в данном случае "фрагмента паклитаксела") представляет собой фрагмент следующей формулы:
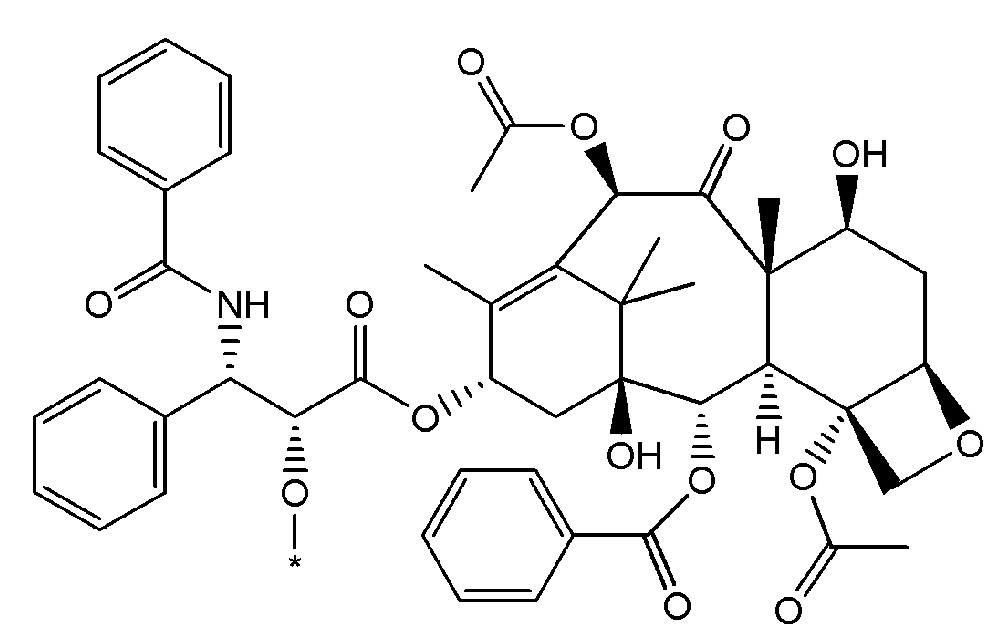
где атом водорода отсутствует для создания одновалентного фрагмента, который в соединении связан с остальной частью молекулы через оставшийся атом кислорода. Следует отметить, что термин "лекарственный фрагмент" не ограничивается какой-либо конкретной методикой получения таких соединений.
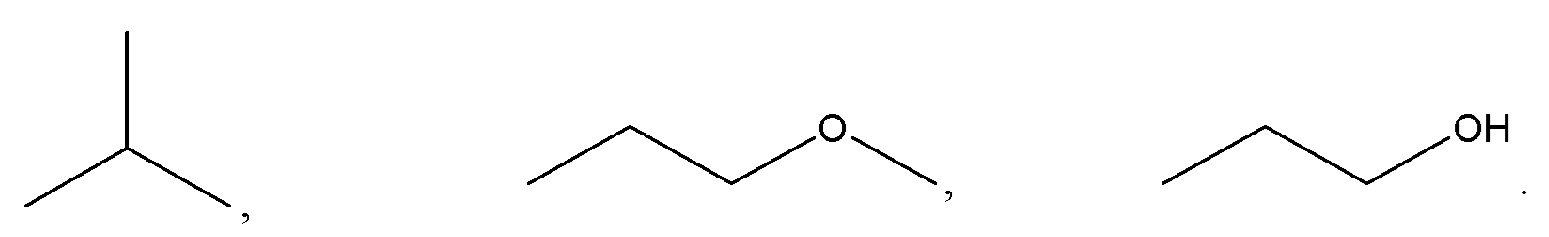
В данном описании используются различные способы описания химических структур. В некоторых случаях обозначения химических соединений или их фрагментов используется метод "линий связей и структуры". В способе обозначения "линий связи и структуры" линии представляют собой химические связи, и атомы углерода не показаны в явном виде (но подразумеваются в точках пересечения линий). Атомы водорода также не показаны в явном виде, где они присоединены к гетероатомам. Однако гетероатомы показаны в явном виде. Таким образом, используя эту методологию, структуры, показанные ниже, представляют собой 2-метилпропан, 1-метоксипропан и 1-пропанол:
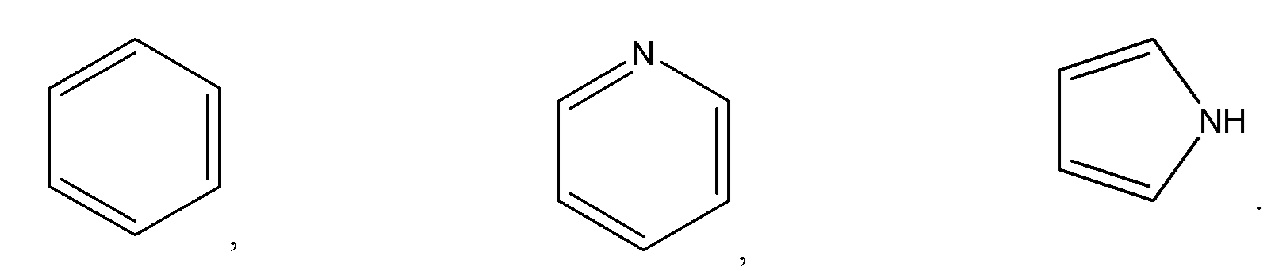
По этой методологии ароматические кольца, как правило, представлены только одной структурой, вносящих вклад в резонансную структуру. Таким образом, следующие структуры относятся к бензолу, пиридину и пирролу:
Используемый здесь термин "фрагмент, связывающийся с белком" представляет собой фрагмент, который нековалентно связывается с одним или несколькими сайтами белка с константой связывания (Kb) равной по меньшей мере 100 М-1 в воде при 25°С.
Используемый здесь термин "аминокислота" относится к соединению, имеющему структуру H2N-Rx-COOH, где Rx представляет собой органическую группу, и где NH2 может необязательно объединяться с Rx (например, как в случае пролина). Этот термин охватывает любые известные аминокислоты, включая, без ограничения, альфа-аминокислоты, бета-аминокислоты, гамма-аминокислоты, дельта-аминокислоты и т.п. В некоторых вариантах осуществления изобретения этот термин относится к альфа-аминокислотам.
Используемый здесь термин "гидроксикислота" относится к соединению, имеющему структуру HO-Ry-COOH, где Ry представляет собой органическую группу. Неограничивающие примеры включают в себя гликолевую кислоту, молочную кислоту и капролактон.
Используемый здесь термин "алканоламин" относится к соединению, имеющему структуру HO-Rz-NH2, где Rz представляет собой необязательно замещенную алкиленовую группу. Неограничивающие примеры включают в себя этаноламин.
Используемый здесь термин "введение" означает введение, субъекту соединения или композиции. Термин не ограничивается каким-либо конкретным способом доставки, и может включать, например, подкожное введение, внутривенное введение, внутримышечное введение, интрацистернальное введение, введение с помощью инфузионной техники, трансдермальное введение, пероральное введение, назальное введение и ректальное введение. Кроме того, в зависимости от путей и режима введения, введение может быть осуществлено различными лицами, включая, например, медицинского работника (например, врача, медсестру и т.п.), фармацевтом или субъектом (т.е. самовведение).
Используемый здесь термин "лечить" или "лечение" может относиться к одному или более из: замедления развития заболевания, расстройства или состояния; контроля заболевания, расстройства или состояние; облегчения одного или нескольких симптомов, характерных для заболевания, расстройства или состояния; или отсрочке рецидива заболевания, расстройства или состояния или его характерных симптомов, в зависимости от природы заболевания, расстройства или состояния и его характерных симптомов.
Используемый здесь термин "субъект" относится к любому млекопитающему, такому как, без ограничения, человек, лошадь, корова, овца, свинья, мышь, крыса, собака, кошка и приматы, таких как шимпанзе, горилла и макак-резус. В некоторых вариантах осуществления изобретения "субъект" является человеком. В некоторых таких вариантах осуществления изобретения "субъект" представляет собой человека, у которого проявляется один или несколько симптомов, характерных для заболевания, нарушения или состояния. Термин "субъект" не предусматривает, чтобы пациент или субъект имел какой-либо статус по отношению к больнице, клиники или исследовательского учреждения (например, в качестве лечащегося пациента, участника исследования и т.п.).
Используемый здесь термин "соединение" включает свободные кислоты, свободные основания и их соли.
В данном описании термин "фармацевтическая композиция" используется для обозначения композиция, которую можно вводить хозяину-млекопитающему, например, перорально, местно, парентерально, ингаляционно или ректально, в единичных дозированных лекарственных формах, содержащих обычные нетоксичные носители, разбавители, адъюванты, наполнители и тому подобное. Термин "парентеральный", как он используется здесь, включает подкожные инъекции, внутривенные инъекции, внутримышечные инъекции, интрацистернальные инъекции или введение с помощью инфузии.
В объем настоящего изобретения включены также индивидуальные энантиомеры соединений, представленных Формулой (I) или их фармацевтически приемлемые соли, а также любые их полностью или частично рацемические смеси. Изобретение также охватывает индивидуальные энантиомеры соединений, представленных Формулой (I) или их фармацевтически приемлемые соли, а также их смеси их диастереоизомеров, в которых один или несколько стереоцентров инвертированы. Если не указано иное, то подразумевается, что структуры, показанные в настоящем документе, также подразумевают включение соединений, которые отличаются только присутствием одного или нескольких изотопно обогащенных атомов. Например, соединения, имеющие настоящую структуру, включая замену атома водорода дейтерием или тритием, или замену атома углерода на 13C или обогащенный 14C, входят объем настоящего изобретения.
Используемый здесь термин "смесь" или "смешанный" относится в широком смысле к любому объединению двух или более композиций. Две или более композиций не обязательно должны иметь одно и то же физическое состояние; таким образом, твердые вещества могут быть "смешаны" с жидкостями, например, с образованием суспензии, взвеси или раствора. Кроме того, эти термины не предполагают наличия какой-либо степени гомогенности или однородности композиции. Такие "смеси" могут быть гомогенными или гетерогенными, или они могут быть однородным или неоднородным. Кроме того, эти термины не предусматривают обязательного использования какого-либо конкретного оборудования для выполнения смешивания, такого как промышленный смеситель.
Используемый здесь термин "необязательно" означает, что описанное далее событие или события могут происходить или не будут происходить. В некоторых вариантах осуществления изобретения необязательное событие не происходит. В некоторых других вариантах осуществления изобретения необязательное событие происходит один или несколько раз.
Используемый здесь термин "замещенный" относится к замещению одного или нескольких атомов водорода указанного фрагмента указанным заместителем или заместителями, при этом допустимы несколько степеней замещения, если не указано иное, при условии, что замещение приводит к устойчивому или химически возможному соединению. Стабильное соединение или химически возможное соединение представляет собой соединение, в котором химическая структура по существу не изменяется при температуре от приблизительно -80°С до приблизительно +40°С, в отсутствие влаги или других химически активных условий в течение, по меньшей мере, недели. В данном описании фразы "замещенный одним или более" или "замещенный один или несколько раз" относится к числу заместителей, которое равны от одного до максимального числа заместителей, возможных на основании числа доступных мест связывания, при условии, что удовлетворяются указанные выше требования по устойчивости и химической осуществимости.
Используемый здесь термин "содержит", "содержащий" или "включающий" относится к группам, которые являются открытыми, означая, что группа может включать дополнительные члены в дополнение к тем, которые специально указаны. Например, фраза "содержит А" означает, что должен присутствовать А, но также могут присутствовать и другие элементы. Термины "включает" и "имеет", а также их грамматические варианты, имеют одно и то же значение. В отличие от этого, термины "состоит", "состоящий" или "состоящий из" относятся к группам, которые закрыты. Например, фраза "состоит из А" означает, что присутствует А и присутствует только А. Используемые здесь выражения "состоит по существу из", "состоящий по существу из" и "по существу" относится к группам, которые открыты, но которые включает в себя только дополнительные неназванные элементы, которые не оказывают существенного влияния на основные характеристики заявляемого объекта.
Используемый здесь термин "или" следует толковать по его наиболее широкой интерпретации, и он не ограничивается толкованием "либо/либо". Таким образом, фраза "содержащий А или В" означает, что может присутствовать "А", а не "В", или что присутствует "В", а не "А", или что оба "А" и "В" присутствуют. Кроме того, если "А", например, определяет класс, в котором может быть несколько членов, например A1 и А2, то один или несколько членов этого класса могут присутствовать одновременно.
Как используется в настоящем документе, различные функциональные группы имеют точку присоединения, которые указаны на функциональной группе как черта или линия (-), или линия в сочетании со звездочкой (*). Другими словами, в случае -CH2CH2CH3 или *-CH2CH2CH3 следует иметь в виду, что точка присоединения представляет собой группу СН2 в крайнем левом положении. Если группа не отмечена звездочкой или штрихпунктирной линией, то точку присоединения определяют с помощью простого и обычного обозначения указанной группы.
Как используется здесь, многоатомные двухвалентные соединения и структуры должны читаться слева направо. Например, в описании или в формуле изобретения указана структура A-D-E, и D определено как -OC(O)-, то полученная группа после замены D читается как A-OC(O)-Е, а не А-С(O)O-E.
Другие термины определены в других частях описания, даже если они не включены в этот подраздел.
МОДИФИЦИРОВАННЫЕ ЦИТОТОКСИНЫ
По меньшей мере в одном аспекте настоящее изобретение относится к соединениям формулы (I):

где A1 представляет собой гидрофильную группу или атом водорода; A2 представляет собой фрагмент цитотоксического лекарственного средства; X1 представляет собой гидрофобную группу; и X2 представляет собой простую связь, органическую группу или группу, выбранную из группы, состоящей из -O-, -S-, -S(=O)-, -S(=O)2-, -S-S-, -N=, =N-, -N(H)-, -N=N-N(H)-, -N(H)-N=N-, -N(OH)- или -N(=O)-.
В некоторых вариантах осуществления A1 представляет собой органическую группу. А1 может содержать любое подходящее число атомов углерода. В некоторых вариантах осуществления, А1, например, содержит от 1 до 100 атомов углерода, или от 1 до 50 атомов углерода, или от 1 до 25 атомов углерода, или от 1 до 10 атомов углерода, или от 1 до 6 атомов углерода. А1 также может содержать один или несколько гетероатомов, таких как азот, кислород, сера или фосфор.
В некоторых вариантах осуществления изобретения в соответствии с любым из предшествующих вариантов, A1 представляет собой гидрофильную группу или остаток. Неограничивающие примеры гидрофильной группы включают, без ограничения, остаток карбоновой кислоты, сложноэфирный фрагмент, амидный фрагмент, фрагмент мочевины, фрагмент амина, простой эфирный остаток, спиртовую группу, тиоэфирную группу, тиольную группу, группу кетона, альдегидную группу, сульфатную группу, тиосульфатную группу, сульфитную группу, тиосульфитную группу, фосфатную группу, фосфонатную группу, фосфинатную группу, фосфитную группу, боратную или боронатную группу.
В некоторых вариантах осуществления изобретения в соответствии с любым из вышеуказанных вариантов, А1 выбирают из группы, состоящей из остатка карбоновой кислоты (-СООН), карбоксилатного аниона (-COO-) или карбоксилатного сложного эфира (-COORa, где Ra представляет собой органическую группу, такую как алкильная или алкоксилатная группа). В некоторых таких вариантах осуществления изобретения А1 представляет собой остаток карбоновой кислоты. В некоторых случаях А1 представляет собой сложноэфирную карбоксилатную группу.
В некоторых других вариантах осуществления изобретения в соответствии с любым из вышеуказанных вариантов, А1 представляет собой атом водорода. В некоторых других вариантах осуществления изобретения в соответствии с любым из вышеуказанных вариантов, А1 представляет собой гидроксильную группу (-ОН).
В любом из вышеупомянутых вариантов осуществления изобретения, X1 может представлять собой гидрофобную группу, имеющую любое подходящее число атомов углерода. В некоторых вариантах осуществления изобретения X1, например, содержит от 1 до 100 атомов углерода, или от 1 до 50 атомов углерода, или от 1 до 25 атомов углерода.
В некоторых вариантах осуществления изобретения в соответствии с любым из вышеуказанных вариантов, X1 представляет собой C8-30-гидрокарбилен, который необязательно может быть замещен. В некоторых дополнительных вариантах осуществления изобретения X1 представляет собой C12-22-гидрокарбилен, который необязательно может быть замещен. В некоторых дополнительных вариантах осуществления изобретения X1 представляет собой C12-22-алкилен. В некоторых дополнительных вариантах осуществления изобретения X1 представляет собой -(CH2)12-, -(CH2)14-, -(CH2)16-, -(CH2)18-, -(CH2)20- или -(CH2)22-. В других вариантах осуществления изобретения X1 представляет собой -(CH2)16-. В других дополнительных вариантах осуществления изобретения X1 представляет собой C12-22-алкилен. В некоторых дополнительных вариантах осуществления изобретения X1 представляет собой -(CH2)7-CH=CH-(CH2)7-.
В некоторых вариантах осуществления изобретения в соответствии с любым из вышеуказанных вариантов, Х2 представляет собой простую связь. В некоторых других вариантах осуществления изобретения X2 представляет собой органическую группу. В некоторых вариантах осуществления изобретения Х2 представляет собой гидрофильную группу. В некоторых вариантах осуществления изобретения Х2 представляет собой гетероалкиленовую группу.
В любом из вышеуказанных вариантов осуществления изобретения, где Х2 представляет собой органическую группу, X2 может содержать любое подходящее число атомов углерода. В некоторых вариантах осуществления изобретения, X2, например, содержит от 1 до 100 атомов углерода, или от 1 до 50 атомов углерода, или от 1 до 25 атомов углерода, или от 1 до 10 атомов углерода, или от 1 до 6 атомов углерода.
В любом из вышеуказанных вариантов осуществления изобретения, где Х2 представляет собой гетероалкиленовую группу, X2 может содержать любое подходящее число атомов углерода. В некоторых вариантах осуществления, X2, например, содержит от 1 до 100 атомов углерода, или от 1 до 50 атомов углерода, или от 1 до 25 атомов углерода, или от 1 до 10 атомов углерода, или от 1 до 6 атомов углерода.
В некоторых из вышеуказанных вариантов осуществления изобретения Х2 может содержать определенные группы. Некоторые неограничивающие примеры таких групп, которые могут входить в состав Х2, представляют собой полиалкиленоксидные группы, такие как полиэтиленгликоль (ПЭГ) и различные полипептидные цепи.
В некоторых вариантах осуществления изобретения Х2 представляет собой органическую группу, выбранную из группы, состоящей из -C(=O)-, -C≡C-, -C(H)=C(H)-, -C(=O)-O-, -O-C(=O)-, -C(=O)-NH-, -NH-C(=O)-, -NH-C(=O)-O-, -O-(C=O)-NH-, -O-C(=O)-O-, -C(=N-NH2)-, -C(=N-Rb)- (где Rb представляет собой атом водорода или алкильную группу), -C(=N-OH)-, -NH-C(=O)-NH-, -NH-C(=S)-NH-, -NH-C(=S)-O-, -O-C(=S)-NH-, -NH-C(=O)-S-, -S-C(=O)-NH-,-NH-C(=S)-S-, -S-C(=S)-NH- и циклических структур, показанных ниже:
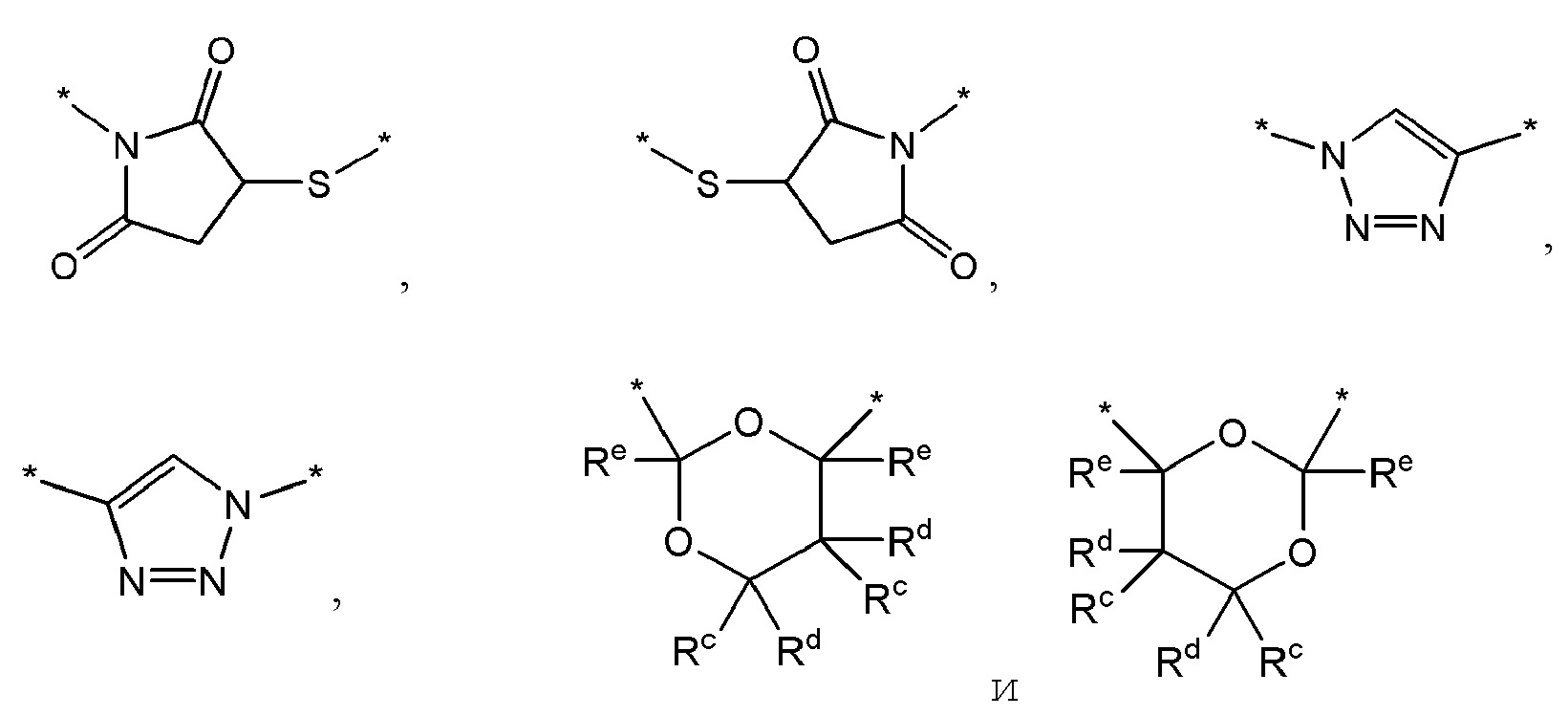
где Rc, Rd и Re независимо друг от друга представляют собой атом водорода или C1-10алкил. В некоторых дополнительных вариантах осуществления изобретения Х2 представляет собой -С(=O)-.
В некоторых вариантах осуществления изобретения Х2 представляет собой группу, выбранную из группы, состоящей из -O-, -S-, -S(=O)-, -S(=O)2-, -S-S-, -N=, =N-, -N(H)-, -N=N-N(H)-, -N(H)-N=N-, -N(OH)- и -N(O)-.
В некоторых вариантах осуществления изобретения Х2 содержит один или более фрагментов/групп, выбранных из группы, состоящей из групп: -C(=O)-, -O-C(=O)-, -NH-C(=O)-, одного или нескольких фрагментов, образованных из алкиленгликолей, одного или нескольких фрагментов, образованных из алканоламинов, одного или нескольких фрагментов, образованных из аминокислот, и одного или нескольких фрагментов, образованных из гидроксильных кислот. Таким образом, в некоторых вариантах осуществления изобретения Х2 содержит один или более фрагментов, образованных из алкиленгликолей, такой как короткий поли(этиленгликоль), цепь которого содержит от 1 до 25 звеньев этиленгликоля. В некоторых вариантах осуществления изобретения X2 содержит один или более фрагментов, образованных из аминокислот, таких как олигопептидная цепь из 1-25 аминокислотных звеньев. В некоторых вариантах осуществления изобретения Х2 содержит один или более фрагментов, образованных из гидроксикислот, таких как фрагменты, образованные из гликолевой кислоты, молочной кислоты или капролактона. В некоторых вариантах осуществления изобретения Х2 представляет собой комбинацию поли(этиленгликоля) с 1-25 звеньев этиленгликоля и олигопептида, имеющего от 1 до 25 аминокислотных звеньев, и, необязательно, одно или несколько фрагментов, образованных из гидроксикислот.
В любом из указанных выше вариантов осуществления изобретения выбор Х2 будет зависеть от типа функциональной группы, через которую он связан с цитотоксической лекарственной группой, чтобы избежать образования соединений, которые являются химически нестабильными или невозможными. Специалист в данной области может выбрать комбинации Х2 и A2, приводящие к получению химически стабильных соединений, которые представляют собой соединения, в которых химическая структура по существу не изменяется при температуре от приблизительно -80°С до приблизительно +40°С в отсутствие влаги или других химически активных условий, по меньшей мере в течение недели.
В указанных выше вариантах осуществления изобретения A2 может представлять собой любой подходящий фрагмент цитотоксического лекарственного средства. В некоторых вариантах осуществления изобретения часть цитотоксического лекарственного средства представляет собой часть низкомолекулярного лекарственного средства, такой как фрагмент цитотоксического лекарственного средства, имеющий молекулярную массу не более 1600 Да, или не более 1500 Да, или не более 1400 Да, или не более 1300 Да, или не более 1200 Да, или не более 1000 Да, или не более 1000 Да, или не более 900 Да. Такие лекарственные фрагменты могут представлять собой органические фрагменты, или они могут также представлять собой части, которые содержат неорганические атомы (например, платину). Однако в некоторых вариантах осуществления изобретения, фрагмент цитотоксического лекарственного средства представляет собой органический фрагмент.
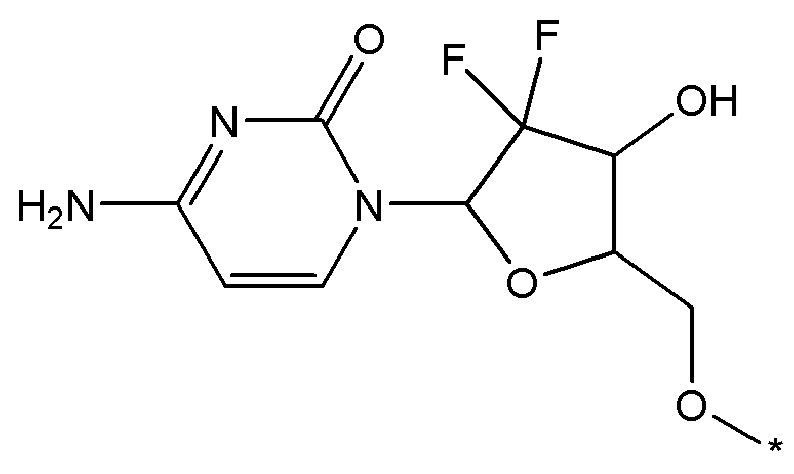
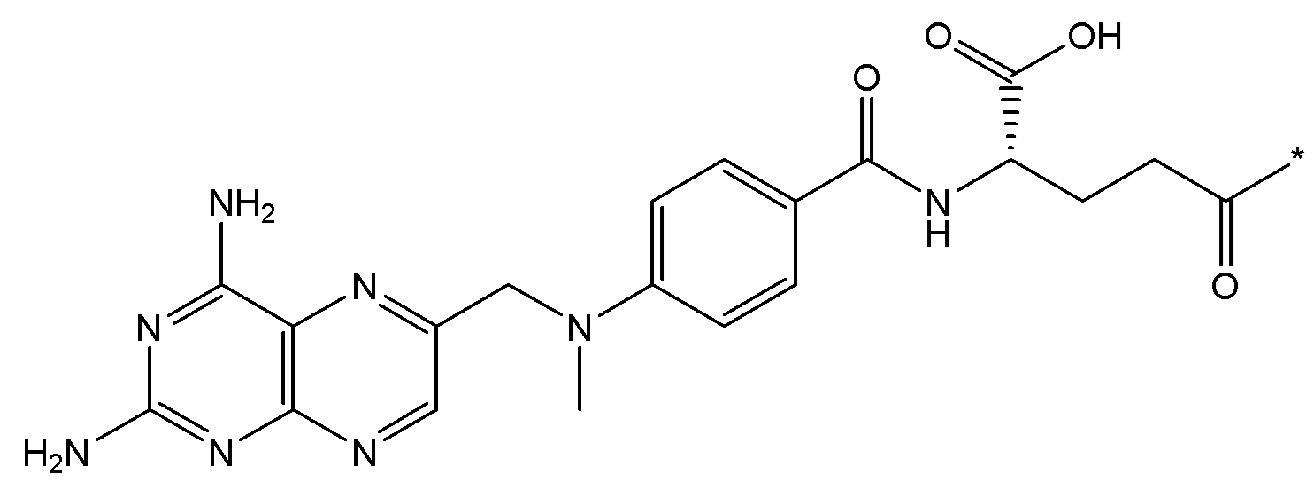
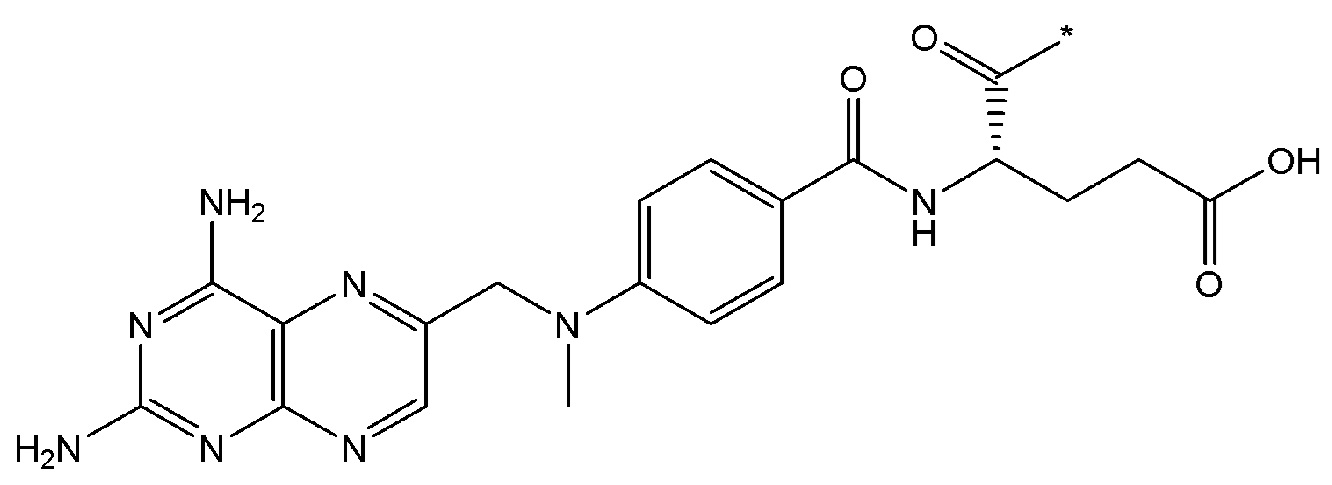
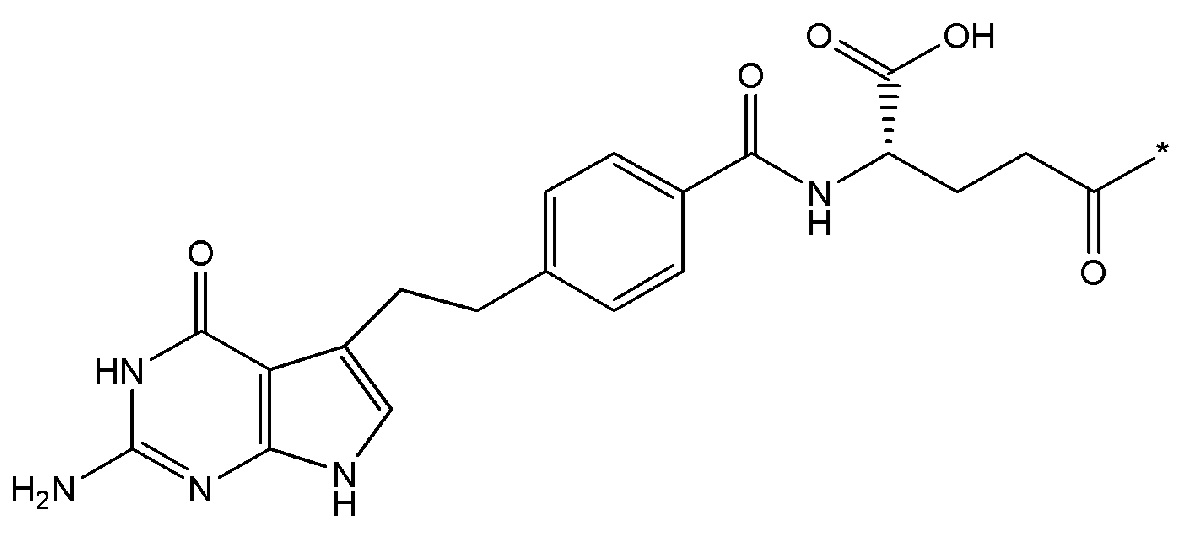
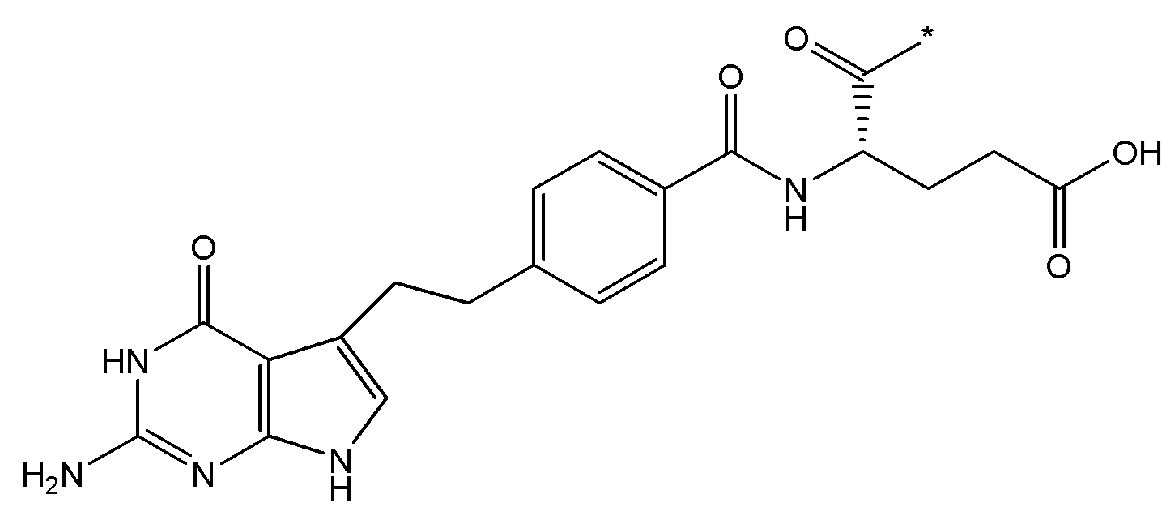
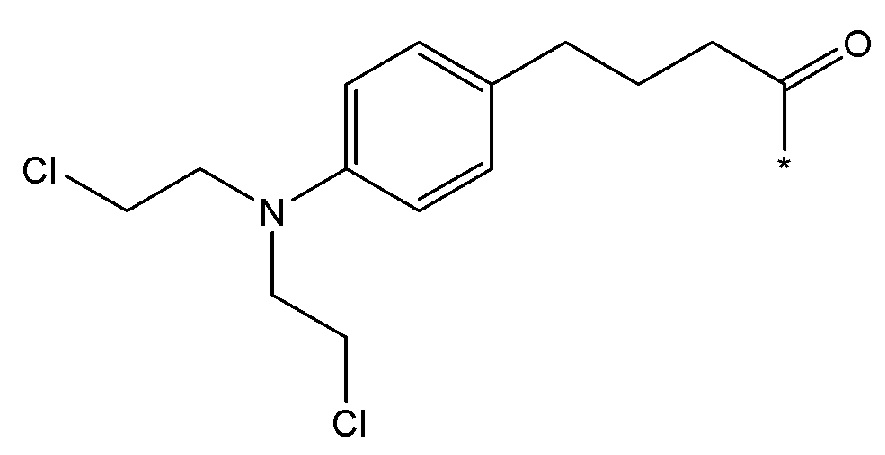
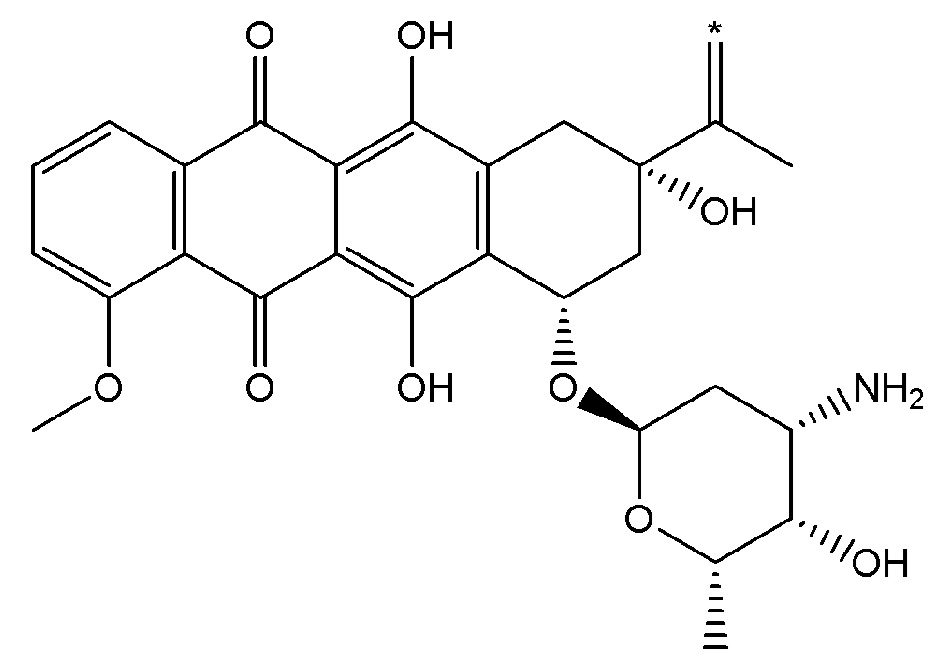
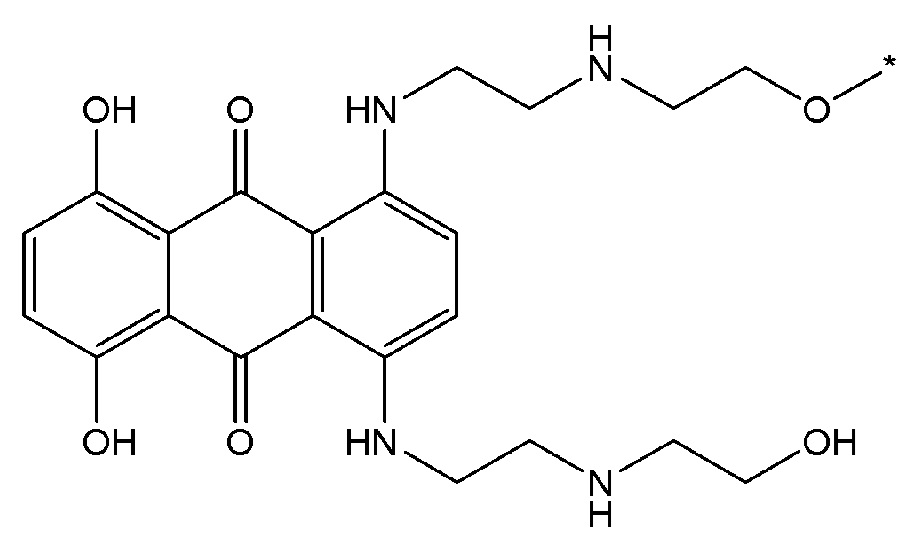
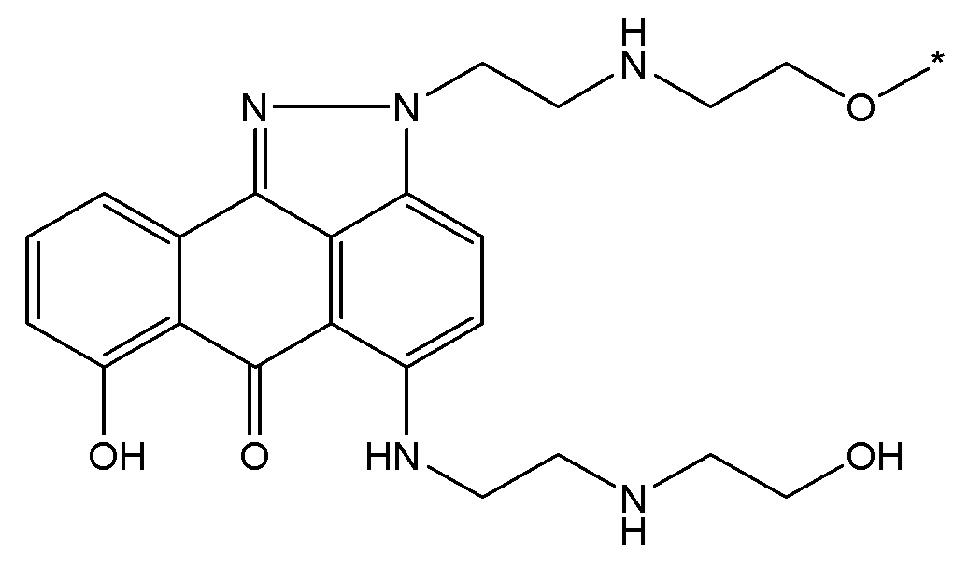
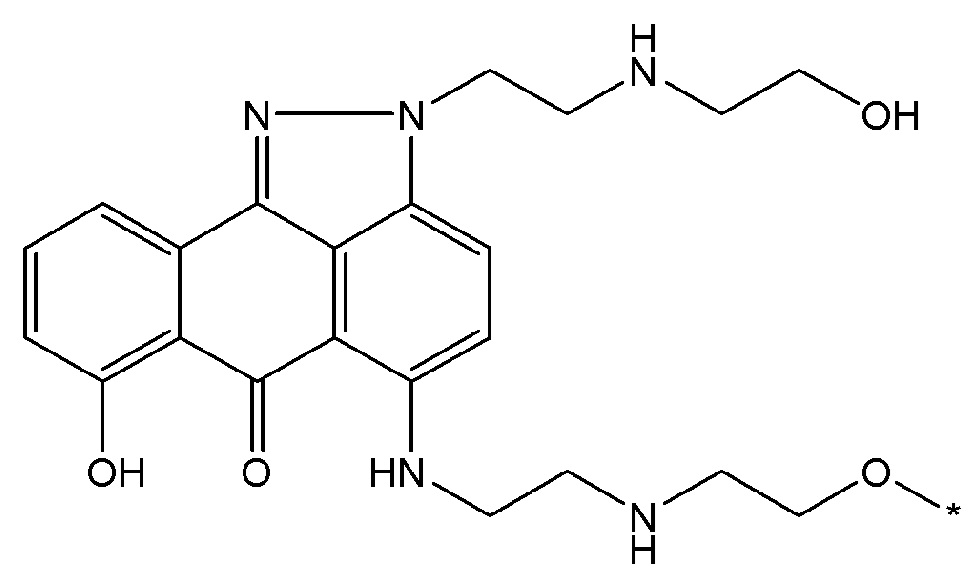
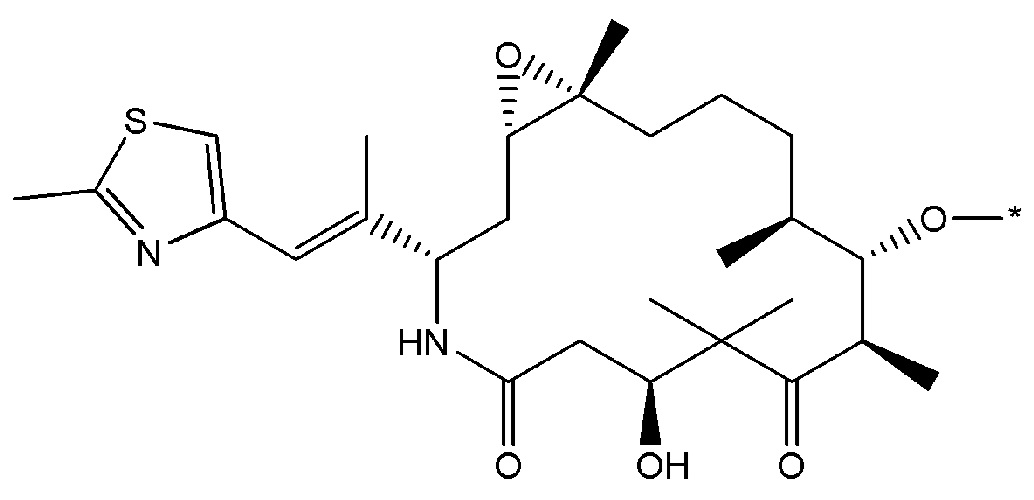
В некоторых вариантах осуществления любого из вышеупомянутых вариантов осуществления изобретения, фрагмент цитотоксического лекарственного средства представляет собой часть лекарственного средства, выбранного из группы, состоящей из: фрагмента паклитаксела, фрагмента этопозида, фрагмента гемцитабина, фрагмента циклофосфамида, фрагмента хлорамбуцила, фрагмента доксорубицина, фрагмента даунорубицина, фрагмента 5-фторурацила, фрагмента дактиномицина, фрагмента амифостина, фрагмента флударабина, фрагмента топотекана, фрагмента ифосфамида, фрагмента винкристина, фрагмента карбоплатина, фрагмента винбластина, фрагмента иматиниба, фрагмента леналидомида, фрагмента пеметрекседа, фрагмента абиратерона, фрагмента эрлотиниба, фрагмента бортезомиба, фрагмента оксалиплатина, фрагмента метотрексата, фрагмента карфилзомиба, фрагмента кризотиниба, фрагмента висмодегиба, фрагмента пoнатиниба, фрагмента тивозаниба, фрагмента карбозантиниба, фрагмента эпирубицина, фрагмента доцетаксела, фрагмента цисплатина, фрагмента эрибулуна, фрагмента иксабепилона, фрагмента винорелбина, фрагмента эверолимуса, фрагмента митомицина С, фрагмента сунитиниба, фрагмента иринотекана, фрагмента леиковорима, фрагмента третиноина, фрагмента аллопуринола, фрагмента аспарагиназы, фрагмента бендамустина, фрагмента блеомицина, фрагмента фолиновой кислоты, фрагмента капецитабина, фрагмента цитарабина, фрагмента дакарбазина, фрагмента филграстима, фрагмента гидроксикарбамида, фрагмента меркаптопурина, фрагмента месна, фрагмента прокарбазина, фрагмента тиогуанина и фармацевтически приемлемые соли любого из вышеперечисленных фрагментов. В некоторых таких дополнительных вариантах осуществления изобретения, фрагмент цитотоксического лекарственного средства представляет собой часть лекарственного средства, выбранного из группы, состоящей из: фрагмента паклитаксела, фрагмента этопозида, фрагмента гемцитабина, фрагмента циклофосфамида, фрагмента хлорамбуцила, фрагмента доксорубицина, фрагмента даунорубицина, фрагмента 5-фторурацила, фрагмента дактиномицина, фрагмента амифостина, фрагмента флударабина, фрагмента топотекана, фрагмента ифосфамида, фрагмента винкристина, фрагмента винбластина, фрагмента иматиниба, фрагмента леналидомида, фрагмента пеметрекседа, фрагмента абиратерона, фрагмента эрлотиниба, фрагмента бортезомиба, фрагмента метотрексата, фрагмента карфилзомиба, фрагмента кризотиниба, фрагмента висмодегиба, фрагмента понатиниба, фрагмента тивозаниба, фрагмента карбозантиниба, фрагмента эпирубицина, фрагмента доцетаксела, фрагмента эрибулуна, фрагмента иксабепилона, фрагмента винорелбина, фрагмента эверолимуса, фрагмента митомицина С, фрагмента сунитиниба, фрагмента иринотекана, фрагмента лейковорима и фармацевтически приемлемые соли любого из вышеперечисленных фрагментов. В некоторых дополнительных вариантах осуществления изобретения, фрагмент цитотоксического лекарственного средства выбирают из группы, состоящей из: фрагмента цитабина, фрагмента доксорубицина, фрагмента 5-фторурацила, фрагмента метотрексата и фрагмента пеметрекседа. В некоторых дополнительных вариантах осуществления изобретения фрагмент цитотоксического лекарственного средства представляет собой фрагмент паклитаксела. В некоторых дополнительных вариантах осуществления изобретения фрагмент цитотоксического лекарственного средства представляет собой фрагмент гемцитабина. В некоторых дополнительных вариантах осуществления изобретения фрагмент цитотоксического лекарственного средства представляет собой фрагмент 5-фторурацила. В некоторых дополнительных вариантах осуществления изобретения фрагмент цитотоксического лекарственного средства представляет собой фрагмент пеметрекседа.
В вышеуказанных вариантах осуществления изобретения перечисленные фрагменты могут иметь любую подходящую химическую форму. В некоторых вариантах осуществления изобретения по любому из вышеуказанных вариантов, фрагменты цитотоксического лекарственного средства представляют собой части, где атом водорода в указанном фрагменте лекарственного соединения отсутствует, или его фрагмент представляет собой фармацевтически приемлемую соль. В качестве неограничивающего примера можно назвать: такой "фрагмент паклитаксела", который может включать фрагмент следующей формулы:
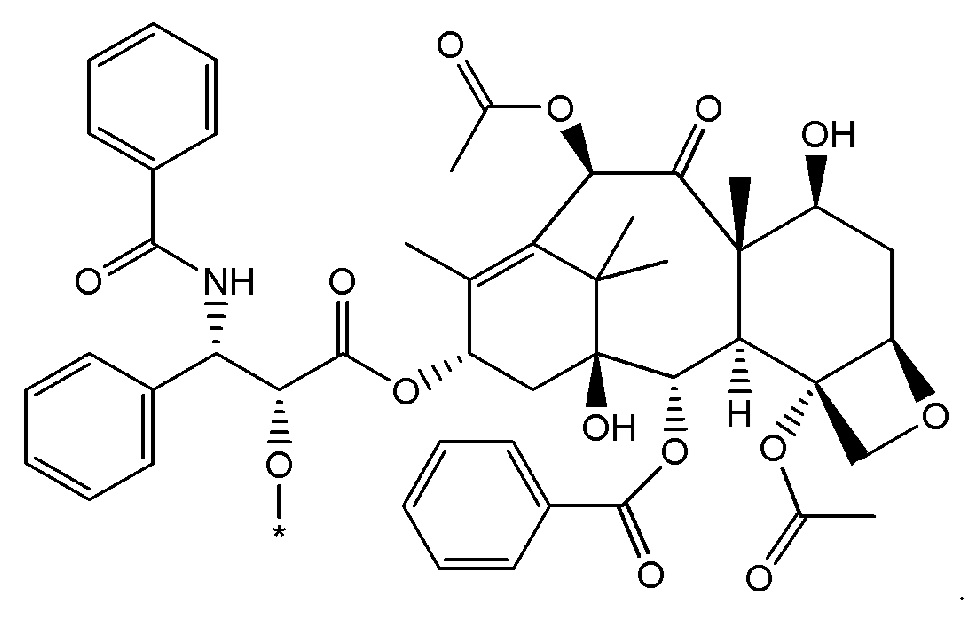
В некоторых случаях в точке присоединения фрагмента может происходить рацемизация. Таким образом, другой неограничивающий пример будет включать фрагмент следующей формулы:
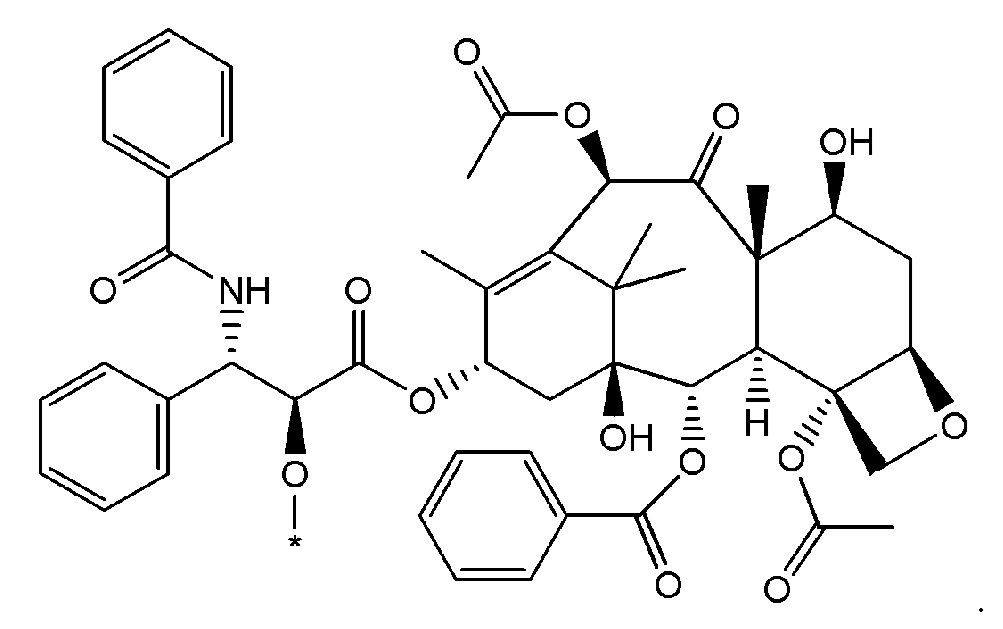
В приведенных ниже структурах показаны различные неограничивающие примеры соединений, которые включены в объем соединений формулы (I), как определено выше. Следует отметить, что в каждом случае G независимо представляет собой атом водорода или -X2-X1-А1 (согласно любому из вышеуказанных вариантов осуществления изобретения), где для каждого соединения по меньшей мере один G не является атомом водорода. В некоторых вариантах осуществления изобретения для каждого соединения, только один G представляет собой -X2-X1-А1 (согласно любому из вышеуказанных вариантов осуществления изобретения).
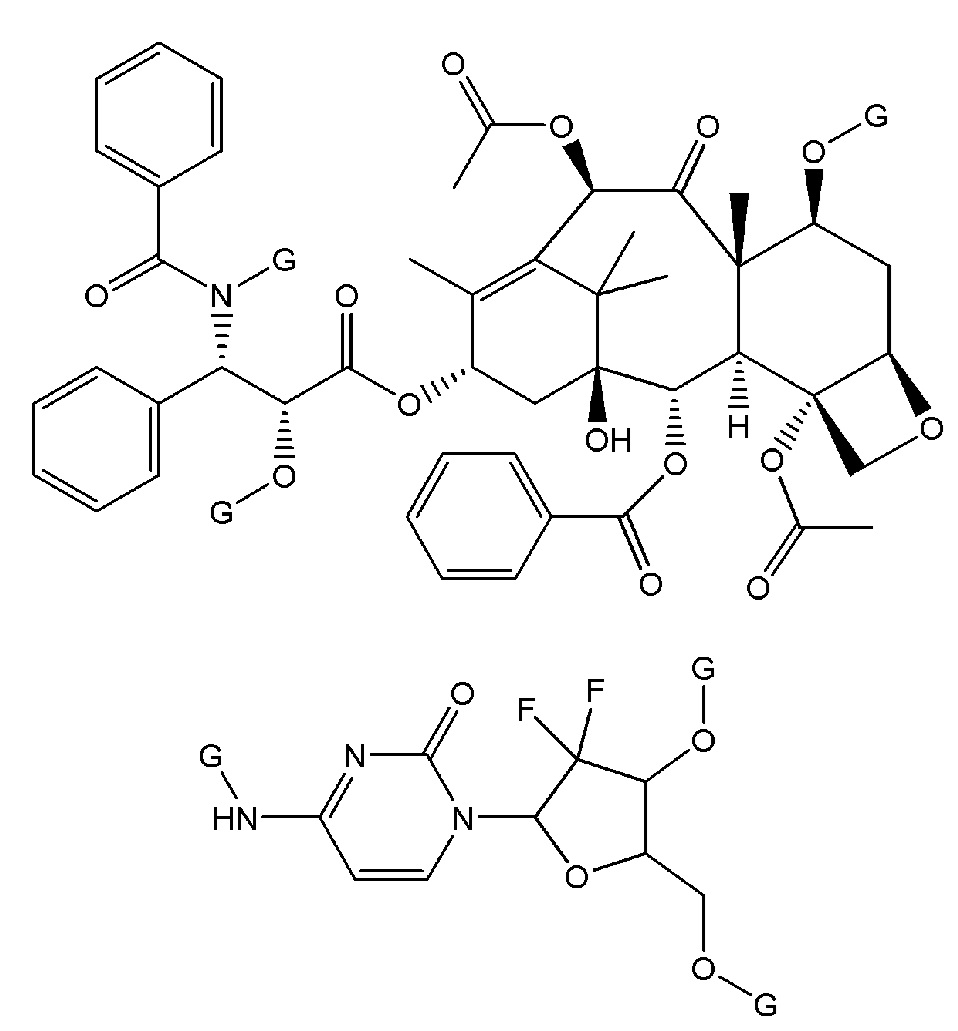
В указанных выше структурах, когда G представляет собой -X2-X1-А1, то X2-X1-А1 может быть таким, как указано в любом из вышеперечисленных вариантов осуществления, при условии, что эти комбинации приводят к стабильным химическим структурам, которые пригодны для фармацевтического использования. Однако, в некоторых таких вариантах осуществления изобретения -X2-X1-A1 представляет собой -C(=O)-(CH2)10-CH3, -C(=O)-(CH2)12-CH3, -C(=O)-(CH2)14-CH3 или -C(=O)-(CH2)16-CH3. В некоторых других вариантах осуществления -X2-X1-A1 представляет собой -C(=O)-(CH2)10-C(=O)-OH, -C(=O)-(CH2)12-C(=O)-OH, -C(=O)-(CH2)14-C(=O)-OH или -C(=O)-(CH2)16-C(=O)-OH.
Выбор X2-X1-A1 может зависеть от природы соединения связывающегося с фрагментом лекарственного средства.
Например, в вариантах осуществления, где X2-X1-A1 соединяется с атомом кислорода или с группой -NH на лекарственном фрагменте, как в случаях структур HA1, HA2, HA9, HA12, HA14, HA15, HA16, HA19, HA20, HA21, HA22, HA23 и HA24, указанных в Таблице 1, то группу X2-X1-A1 выбирают из группы, состоящей из следующего:
-C(=O)-(CH2)n1-C(=O)-OH;
-C(=O)-(CH2)n1-C(=O)-OCH3;
-C(=O)-(CH2)n1-CH3;
-C(=O)-(C1-6алкилен)-C(=O)-O-(CH2)n2-C(=O)-OH;
-C(=O)-(C1-6алкилен)-NH-C(=O)-(CH2)n1-C(=O)-OH;
-C(=O)-(C1-6алкилен)-C(=O)-O-[(CH2)2-O-]n3(CH2)n2-C(=O)-OH;
-C(=O)-O-(CH2)n2-C(=O)-OH; и
-C(=O)-NH-(CH2)n2-C(=O)-OH;
где n1 представляет собой целое число от 12 до 24, n2 представляет собой целое число от 13 до 25, и n 3 представляет собой целое число от 1 до 25.
В некоторых других вариантах выполнения изобретения, группу X2-X1-A1 выбирают из группы, состоящей из следующего:
-C(=O)-(CH2)n1-C(=O)-OH;
-C(=O)-(CH2)n1-C(=O)-OCH3;
-C(=O)-(C1-6алкилен)-C(=O)-O-(CH2)n2-C(=O)-OH;
-C(=O)-(C1-6алкилен)-NH-C(=O)-(CH2)n1-C(=O)-OH;
-C(=O)-(C1-6алкилен)-C(=O)-O-[(CH2)2-O-]n3(CH2)n2-C(=O)-OH;
-C(=O)-O-(CH2)n2-C(=O)-OH; и
-C(=O)-NH-(CH2)n2-C(=O)-OH.
В некоторых дополнительных вариантах выполнения изобретения, группу X2-X1-A1 выбирают из группы, состоящей из следующего:
-C(=O)-(CH2)n1-C(=O)-OH;
-C(=O)-O-(CH2)n2-C(=O)-OH; и
-C(=O)-NH-(CH2)n2-C(=O)-OH.
В некоторых других вариантах выполнения изобретения, группа X2-X1-A1 представляет собой
-C(=O)-(C1-6алкилен)-O-C(=O)-(CH2)n1-C(=O)-OH,
где n1 представляет собой целое число от 12 до 24.
В некоторых вариантах выполнения изобретения, из числа указанных выше, n1 представляет собой целое число от 14 до 22, или от 16 до 20. В некоторых вариантах осуществления изобретения по любому из вышеуказанных вариантов, n2 представляет собой целое число от 15 до 23, или от 17 до 21. В некоторых вариантах осуществления изобретения по любому из вышеуказанных вариантов, n3 представляет собой целое число от 1 до 15, или от 1 до 10, или от 1 до 6. В некоторых таких вариантах осуществления изобретения группа X2-X1-A1 представляет собой -C(=O)-(C1-6алкилен)-C(=O)-O-(CH2)n3-OH, где n3 представляет собой целое число от 14 до 26, или целое число от 16 до 24, или целое число от 18 до 22.
В вариантах осуществления изобретения, где группа X2-X1-A1 соединена с группой >N на лекарственном фрагменте, как в случае структур НА3 и НА4 в Таблице 1, то группу X2-X1-A1 выбирают из группы, состоящей из следующего:
-CH2-O-C(=O)-(CH2)n1-C(=O)-OH;
-CH2-O-C(=O)-(CH2)n1-C(=O)-OCH3;
-CH2-O-C(=O)-(CH2)n1-CH3;
-CH2-O-C(=O)-(C1-6алкилен)-C(=O)-O-(CH2)n2-C(=O)-OH;
-CH2-O-C(=O)-(C1-6алкилен)-NH-C(=O)-(CH2)n1-C(=O)-OH;
-CH2-O-C(=O)-(C1-6алкилен)-C(=O)-O-[(CH2)2-O-]n3(CH2)n2-C(=O)-OH;
-CH2-O-C(=O)-O-(CH2)n2-C(=O)-OH; и
-CH2-O-C(=O)-NH-(CH2)n2-C(=O)-OH;
где n1 представляет собой целое число от 12 до 24, n2 представляет собой целое число от 13 до 25, и n 3 представляет собой целое число от 1 до 25.
В некоторых других вариантах выполнения изобретения, группу X2-X1-A1 выбирают из группы, состоящей из следующего:
-CH2-O-C(=O)-(CH2)n1-C(=O)-OH;
-CH2-O-C(=O)-(CH2)n1-C(=O)-OCH3;
-CH2-O-C(=O)-(C1-6алкилен)-C(=O)-O-(CH2)n2-C(=O)-OH;
-CH2-O-C(=O)-(C1-6алкилен)-NH-C(=O)-(CH2)n1-C(=O)-OH;
-CH2-O-C(=O)-(C1-6алкилен)-C(=O)-O-[(CH2)2-O-]n3(CH2)n2-C(=O)-OH;
-CH2-O-C(=O)-O-(CH2)n2-C(=O)-OH; и
-C(=O)-NH-(CH2)n2-C(=O)-OH.
В других таких вариантах выполнения изобретения, группу X2-X1-A1 выбирают из группы, состоящей из следующего:
-CH2-O-C(=O)-(CH2)n1-C(=O)-OH;
-CH2-O-C(=O)-O-(CH2)n2-C(=O)-OH; и
-CH2-O-C(=O)-NH-(CH2)n2-C(=O)-OH.
В таких вариантах выполнения изобретения из числа вышеуказанных, n1 представляет собой целое число от 14 до 22, или от 16 до 20. В некоторых вариантах осуществления изобретения по любому из вышеуказанных вариантов, n2 представляет собой целое число от 15 до 23, или от 17 до 21. В некоторых вариантах осуществления изобретения по любому из вышеуказанных вариантов, n3 представляет собой целое число от 1 до 15, или от 1 до 10, или от 1 до 6. В некоторых таких вариантах осуществления изобретения из числа вышеуказанных, группа X2-X1-A1 представляет собой -CH2-O-C(=O)-(C1-6алкилен)-C(=O)-O-(CH2)n3-OH, где n3 представляет собой целое число от 14 до 26, или целое число от 16 до 24, или целое число от 18 до 22.
В вариантах осуществления изобретения, где группа X2-X1-A1 соединена с группой -C(=O) на лекарственном фрагменте, как в случае структур НА5, НА6, НА7, HA8, HA11 и HA17 в Таблице 1, то группу X2-X1-A1 выбирают из группы, состоящей из следующего:
O-(CH2)n2-C(=O)-OH;
-NH-(CH2)n2-C(=O)-OH;
-NH-(C1-6алкилен)-O-C(=O)-(CH2)n1-C(=O)-OH;
-O-(C1-6алкилен)-O-C(=O)-(CH2)n1-C(=O)-OH;
-NH-(C1-6алкилен)-O-C(=O)-(CH2)n1-C(=O)-OCH3;
-O-(C1-6алкилен)-O-C(=O)-(CH2)n1-C(=O)-OCH3;
-NH-(C1-6алкилен)-O-C(=O)-(CH2)n1-CH3;
-O-(C1-6алкилен)-O-C(=O)-(CH2)n1-CH3;
-NH-(C1-6алкилен)-C(=O)-O-[(CH2)2-O-]n3(CH2)n2-C(=O)-OH; и
-O-(C1-6алкилен)-C(=O)-O-[(CH2)2-O-]n3(CH2)n2-C(=O)-OH;
где n1 представляет собой целое число от 12 до 24, n2 представляет собой целое число от 13 до 25, и n3 представляет собой целое число от 1 до 25.
В других таких дополнительных выполнениях изобретения, группу X2-X1-A1 выбирают из группы, состоящей из следующего:
-O-(CH2)n2-C(=O)-OH;
-NH-(CH2)n2-C(=O)-OH;
-NH-(C1-6алкилен)-O-C(=O)-(CH2)n1-C(=O)-OH;
-O-(C1-6алкилен)-O-C(=O)-(CH2)n1-C(=O)-OH;
-NH-(C1-6алкилен)-O-C(=O)-(CH2)n1-C(=O)-OCH3; и
-O-(C1-6алкилен)-O-C(=O)-(CH2)n1-C(=O)-OCH3.
В других таких дополнительных выполнениях изобретения, группу X2-X1-A1 выбирают из группы, состоящей из следующего:
-O-(CH2)n2-C(=O)-OH;
-NH-(CH2)n2-C(=O)-OH;
-NH-(C1-6алкилен)-O-C(=O)-(CH2)n1-C(=O)-OH; и
-O-(C1-6алкилен)-O-C(=O)-(CH2)n1-C(=O)-OH.
В некоторых вариантах осуществления изобретения по любому из вышеуказанных вариантов, n1 представляет собой целое число от 14 до 22, или от 16 до 20. В некоторых вариантах осуществления изобретения по любому из вышеуказанных вариантов, n2 представляет собой целое число от 15 до 23, или от 17 до 21. В некоторых вариантах осуществления изобретения по любому из вышеуказанных вариантов, n3 представляет собой целое число от 1 до 15, или от 1 до 10, или от 1 до 6. В некоторых таких вариантах осуществления изобретения из числа вышеуказанных, группа X2-X1-A1 представляет собой -O-(CH2)n3-OH, где n3 представляет собой целое число от 14 до 26, или целое число от 16 до 24, или целое число от 18 до 22.
В вариантах осуществления изобретения, где группа X2-X1-A1 соединена с группой C=* на лекарственном фрагменте, как в случае структур HA10, HA13 и HA18, представленных в Таблице 1, то группу X2-X1-A1 выбирают из группы, состоящей из следующего:
=N-O-(CH2)n2-C(=O)-OH;
=N-NH-(CH2)n2-C(=O)-OH;
=N-O-(CH2)n2-C(=O)-OCH3;
=N-NH-(CH2)n2-C(=O)-OCH3;
=N-O-(CH2)n2-CH3;
=N-NH-(CH2)n2-CH3;
=N-O-[(CH2)2-O-]n3(CH2)n2-C(=O)-OH; и
=N-NH-[(CH2)2-O-]n3(CH2)n2-C(=O)-OH;
где n2 представляет собой целое число от 13 до 25; и n3 представляет собой целое число от 1 до 25.
В некоторых таких дополнительных выполнениях изобретения, группу X2-X1-A1 выбирают из группы, состоящей из следующего:
=N-O-(CH2)n2-C(=O)-OH;
=N-NH-(CH2)n2-C(=O)-OH;
=N-O-(CH2)n2-C(=O)-OCH3; и
=N-NH-(CH2)n2-C(=O)-OCH3.
В некоторых таких дополнительных выполнениях изобретения, группу X2-X1-A1 выбирают из группы, состоящей из следующего:
=N-O-(CH2)n2-C(=O)-OH; и
=N-NH-(CH2)n2-C(=O)-OH.
В некоторых вариантах осуществления изобретения согласно любому из вышеуказанных вариантов, n2 представляет собой целое число от 15 до 23, или от 17 до 21. В некоторых вариантах осуществления изобретения согласно любому из вышеуказанных вариантов, n3 представляет собой целое число от 1 до 15, или от 1 до 10, или от 1 до 6.
В некоторых таких вариантах осуществления изобретения группу X2-X1-A1 выбирают из группы, состоящей из следующего:
=N-O-(CH2)n3-OH; и
=N-NH-(CH2)n3-OH;
где n3 представляет собой целое число от 14 до 26, или целое число от 16 до 24, или целое число от 18 до 22.
Соединения, описанные в любом из вышеприведенных вариантов осуществления изобретения, также могут быть представлены в виде фармацевтически приемлемых солей. Термин "фармацевтически приемлемые соли" относится к солям соединений, которые не являются биологически или иначе нежелательными и обычно получают взаимодействием соединения в виде свободного основания с подходящей органической или неорганической кислотой или путем взаимодействия соединения в виде кислоты с подходящим органическим или неорганическим основанием. Типичные соли включают следующие соли: ацетат, бензолсульфонат, бензоат, бикарбонат, бисульфат, битартрат, борат, бромид, эдетат кальция, камсилат, карбонат, хлорид, клавуланат, цитрат, дигидрохлорид, эдетат, эдисилат, эстолат, эзилат, фумарат, глюцептат, глюконат, глутамат, гликолиларсанилат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, гидроксинафтоат, иодид, изетионат, лактат, лактобионат, лаурат, малат, малеат, манделат, мезилат, метилбромид, метилнитрат, метилсульфат, монокалиймалеат, мукат, напсилат, нитрат, N-метилглюкамин, оксалат, памоат (эмбонат), пальмитат, пантотенат, фосфат/дифосфат, полигалактуронат, калий, салицилат, натрий, стеарат, субацетат, сукцинат, таннат, тартрат, теоклат, тозилат, триэтиодид, триметиламмоний и валерат. Если присутствует кислотный заместитель, такой как -СООН, то может быть получена соль аммония, морфолиния, натрия, калия, бария, кальция и т.п., для использования в качестве лекарственной формы. Когда присутствует основная группа, такая как аминогруппа или основной гетероарильный радикал, такой как пиридил, то может быть получена кислая соль, такая как гидрохлорид, гидробромид, фосфат, сульфат, трифторацетат, трихлорацетат, ацетат, оксалат, малеат, пируват, малонат, сукцинат, цитрат, тартрат, фумарат, манделат, бензоат, циннамат, метансульфонат, этансульфонат, пикрат и т.п.
Указанные выше соединения могут быть получены стандартными методами органической химии, такими, например, которые описаны следующих справочниках: Wuts et al., Greene's Protective Groups in Organic Synthesis (4th ed., 2006); Larock, Comprehensive Organic Transformations (2nd ed., 1999); и Smith et al., March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed., 2007). Конкретные неограничивающие примеры синтеза и соединений приведены ниже в разделе Примеры.
Соединения вышеописанных вариантов осуществления изобретения, включая их фармацевтически приемлемые соли, являются полезными в качестве цитотоксических агентов или их пролекарств, и поэтому они пригодны в качестве соединений для лечения рака.
В Таблице 3 (ниже) показаны различные примеры соединений, которые охватываются настоящим изобретением. Таблица 3 относится к различным комбинациям группы А2 с группой -X2-X1-A1, которые вместе образуют соединения настоящего изобретения. В Таблице 1 показаны примеры групп А2, где группа А2 может представлять собой показанный фрагмент или может также представлять его фармацевтически приемлемую соль. В Таблице 2 показаны иллюстративные примеры групп -X2-X1-A1. В Таблице 3 показаны неограничивающие иллюстративные комбинации групп и фрагментов из Таблиц 1 и 2, которые могут быть объединены с образованием соединений настоящего изобретения. Соединения, представленные в Таблице 3, могут быть получены способами, аналогичными способам, проиллюстрированным в Примерах, а также обычными методами синтеза, известными специалистам в данной области. Подходящие способы получения таких соединений представлены в справочниках: Wuts et al., Greene's Protective Groups in Organic Synthesis (4th ed., 2006); Larock, Comprehensive Organic Transformations (2nd ed., 1999); и Smith et al., March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed., 2007).
Таблица 1
|
Таблица 2
|
Таблица 3
|
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ
В некоторых аспектах соединения по любому из описанных вариантов осуществления могут быть использованы для приготовления фармацевтических композиций любым подходящим способом. В целом, в качестве соединений для лечения рака, такие фармацевтические композиции представляют собой водные препараты, пригодные для парентерального введения, такого как внутривенное или внутриартериальное введение.
По меньшей мере в одном аспекте, изобретение относится к фармацевтическим композициям, которые включают одно или несколько соединений формулы (I) (согласно любому из вышеуказанных вариантов выполнения) и белок. В некоторых вариантах осуществления изобретения, белок представляет собой альбумин или миметик альбумина. В некоторых таких вариантах осуществления изобретения белок представляет собой сывороточный альбумин человека (HSA) или его миметик, то есть белок, последовательность которого по меньшей мере на 50% эквивалентна последовательности HSA, или по меньшей мере на 60% эквивалента HSA, или по меньшей мере на 70% эквивалента HSA, или по меньшей мере на 80% эквивалента HSA, или по меньшей мере на 90% эквивалента HSA, или по меньшей мере на 95% эквивалента HSA, или по меньшей мере на 97% эквивалента HSA, или по меньшей мере на 99% эквивалентна HSA. В некоторых вариантах осуществления изобретения белок представляет собой сывороточный альбумин человека.
В некоторых вариантах осуществления изобретения согласно любому из предшествующих вариантов, фармацевтическая композиция также включает носитель, такой как жидкий носитель. В некоторых вариантах осуществления изобретения носитель включает воду. Например, в некоторых таких вариантах осуществления изобретения вода составляет не менее 50 об. %, или по меньшей мере 60 об. %, или по меньшей мере 70 об. %, или по меньшей мере 80 об. %, или по меньшей мере 90 об. %, от общего объема жидких материалов в фармацевтической композиции Носитель может также включать другие жидкие ингредиенты, такие как жидкие ингредиенты, обычно включаемые в водные фармацевтические композиции для парентерального введения.
В некоторых вариантах осуществления изобретения, в фармацевтической композиции, содержащей водный носитель, соединения формулы (I) нековалентно связаны с белком. В некоторых вариантах осуществления изобретения, соединение формулы (I) и белок (например, сывороточный альбумин человека) нековалентно связаны друг с другом с константой связывания (Kb) равной по меньшей мере 102 М-1, или, по меньшей мере, 103 М-1, или по меньшей мере 104 М-1, или по меньшей мере 105 М-1 при 25°С в водной среде композиции.
В некоторых вариантах осуществления изобретения, в фармацевтической композиции, содержащей водный носитель, соединение формулы (I) и белок сольватированы носителем. В некоторых таких вариантах осуществления изобретения по меньшей мере 90 мас. %, или по меньшей мере 95 мас. %, или по меньшей мере 97 мас. %, или по меньшей мере 98 мас. %, или по меньшей мере 99 мас. % соединения формулы (I) в композиции нековалентно связаны с белком с константой связывания (Kb) равной по меньшей мере 102 М-1, или по меньшей мере 103 М-1, или по меньшей мере 104 М-1, или по меньшей мере 105 М-1 при 25°С в водной среде композиции. В некоторых дополнительных вариантах осуществления изобретения композиция по существу не содержит агломератов или наночастиц. Например, в некоторых вариантах осуществления изобретения согласно любому из вышеуказанных вариантов, не более 5 мас. %, или не более 4 мас. %, или не более 3 мас. %, или не более 2 мас. %, или не более 1 мас. % комплексов белок-соединение (т.е., нековалентно связанные конъюгаты между белком и одним или несколькими соединениями формулы (I)) в водной композиции имеют радиус более 7 нм, или радиус более 5 нм, или радиус более 4 нм, измеренный методом динамического рассеяния света.
Молярное соотношение соединения формулы (I) и белка в препарате может иметь любое подходящее значение. Например, в некоторых вариантах осуществления изобретения согласно любому из указанных вариантов, молярное соотношение соединения формулы (I) к белку находится в пределах от 1:10 до 20:1, или от 1:5 до 15:1, или от 1:2 до 10:1. В некоторых вариантах осуществления изобретения согласно любому из указанных вариантов, молярное соотношение соединения формулы (I) к белку составляет приблизительно 1:1, или приблизительно 2:1, или приблизительно 3:1, или приблизительно 4:1, или приблизительно 5:1, или приблизительно 6:1, или приблизительно 7:1, где термин "приблизительно" в данном случае означает ±0,5:1, так что "приблизительно 5:1" относится к диапазону от 4,5:1 до 5,5:1.
По меньшей мере в одном аспекте настоящее изобретение относится к фармацевтическим композициям, которые содержат: соединение, которое содержит фрагмент цитотоксического лекарственного средства и часть, связывающую белок; белок, где белок представляет собой альбумин или миметик альбумина; и носитель, который содержит воду.
В некоторых вариантах осуществления изобретения белок представляет собой сывороточный альбумин человека (HSA) или его миметик, то есть белок, последовательность которого по меньшей мере на 50% эквивалентна последовательности HSA, или по меньшей мере на 60% эквивалента HSA, или по меньшей мере на 70% эквивалента HSA, или по меньшей мере на 80% эквивалента HSA, или по меньшей мере на 90% эквивалента HSA, или по меньшей мере на 95% эквивалента HSA, или по меньшей мере на 97% эквивалента HSA, или по меньшей мере на 99% эквивалента HSA. В некоторых вариантах осуществления изобретения белок представляет собой человеческий сывороточный альбумин.
Как отмечено выше, в некоторых вариантах осуществления изобретения носитель включает воду. Например, в некоторых таких вариантах осуществления, вода составляет, по меньшей мере, 50 об. %, или, по меньшей мере, 60 об. %, или, по меньшей мере, 70 об. %, или, по меньшей мере, 80 об. %, или по меньшей мере 90 об. %, от общего объема жидких материалов в фармацевтической композиции Носитель может также включать другие жидкие ингредиенты, такие как жидкие ингредиенты, обычно включаемые в водные фармацевтические композиции для парентерального введения.
В некоторых вариантах осуществления изобретения в фармацевтической композиции соединения нековалентно связаны с белком. В некоторых вариантах осуществления изобретения соединение и белок (например, человеческий сывороточный альбумин) нековалентно связаны друг с другом с константой связывания (Kb) равной по меньшей мере 102 М-1, или, по меньшей мере, 103 М-1, или по меньшей мере 104 М-1, или по меньшей мере 105 М-1 при 25°С в водной среде композиции.
В некоторых вариантах осуществления изобретения, в фармацевтической композиции, содержащей водный носитель, соединение и белок сольватированы носителем. В некоторых таких вариантах осуществления изобретения по меньшей мере 90 мас. %, или по меньшей мере 95 мас. %, или по меньшей мере 97 мас. %, или по меньшей мере 98 мас. %, или по меньшей мере 99 мас. % соединения формулы (I) в композиции нековалентно связаны с белком с константой связывания (Kb) равной по меньшей мере 102 М-1, или, по меньшей мере, 103 М-1, или по меньшей мере 104 М-1, или по меньшей мере 105 М-1 при 25°С в водной среде композиции. В некоторых дополнительных вариантах осуществления изобретения композиция по существу не содержит агломератов или наночастиц. Например, в некоторых вариантах осуществления изобретения согласно любому из вышеуказанных вариантов, не более 5 мас. %, или не более 4 мас. %, или не более 3 мас. %, или не более 2 мас. %, или не более 1 мас. % комплексов белок-соединение (т.е., нековалентно связанные конъюгаты между белком и одним или несколькими соединениями формулы (I)) в водной композиции имеют радиус более 7 нм, или радиус более 5 нм, или радиус более 4 нм, измеренный методом динамического рассеяния света.
Молярное соотношение соединения формулы (I) и белка в композиции может иметь любое подходящее значение. Например, в некоторых вариантах осуществления изобретения согласно любому из указанных вариантов, молярное соотношение соединения формулы (I) к белку находится в пределах от 1:10 до 20:1, или от 1:5 до 15:1, или от 1:2 до 10:1. В некоторых вариантах осуществления изобретения согласно любому из указанных вариантов, молярное соотношение соединения формулы (I) к белку составляет приблизительно 1:1, или приблизительно 2:1, или приблизительно 3:1, или приблизительно 4:1, или приблизительно 5:1, или приблизительно 6:1, или приблизительно 7:1, где термин "приблизительно" в данном случае означает ±0,5:1, так что "приблизительно 5:1" относится к диапазону от 4,5:1 до 5,5:1.
Фармацевтические композиции по любому из вышеуказанных аспектов и вариантов осуществления изобретения могут также включать некоторые дополнительные ингредиенты, которые обычно используют в фармацевтических композициях для парентерального введения.
СПОСОБЫ И ПРИМЕНЕНИЯ
Соединения или композиции любого из указанных вариантов осуществления изобретения полезны при лечении рака и родственных нарушений. Поэтому эти соединения и композиции могут быть использованы для введения субъекту, который имеет или страдает от раковой опухоли.
Таким образом, в некоторых аспектах изобретение относится к способам лечения рака, включающим введение субъекту соединения или композиции по любому из указанных выше аспектов и вариантов осуществления изобретения. В некоторых вариантах осуществления изобретения субъектом является человек. В некоторых вариантах осуществления изобретения субъект является субъектом, нуждающимся в таком лечении, например, человеком, нуждающемся в таком лечении.
В некоторых аспектах изобретение относится к способам индуцирования апоптоза в раковой клетке, включающим контактирование раковой клетки с соединением или композицией по любому из вышеуказанных аспектов и вариантов осуществления изобретения.
В некоторых аспектах изобретение относится к способам ингибирования пролиферации злокачественной опухоли, включающим контактирование злокачественной опухоли с соединением или композицией по любого из вышеуказанных аспектов и вариантов осуществления изобретения.
В некоторых аспектах в настоящем изобретении предлагаются применения соединения или композиции по любому из вышеуказанных аспектов и вариантов осуществления изобретения в качестве лекарственного средства.
В некоторых аспектах в настоящем изобретении предлагаются применения соединения или композиции по любому из вышеуказанных аспектов и вариантов осуществления изобретения для лечения рака.
В некоторых аспектах в настоящем изобретении предлагаются применения соединения по любому из вышеуказанных аспектов и вариантов осуществления изобретения для изготовления лекарственного средства
В некоторых аспектах в настоящем изобретении предлагаются применения соединения по любому из вышеуказанных аспектов и вариантов осуществления изобретения для изготовления лекарственного средства для лечения рака.
ПРИМЕРЫ
Следующие примеры иллюстрируют некоторые иллюстративные варианты соединений, композиций и способов, раскрытых здесь. Эти примеры не должны рассматриваться как ограничивающие изобретение каким-либо образом. Ни примеры не следует рассматривать как отражающие какие-либо предпочтительные варианты осуществления изобретения, или как указывающее любое направление для дальнейших исследований.
В Примерах могут использоваться сокращенные наименования некоторых обычных химических веществ. Следующие сокращения связаны с указанными соединениями.
DMF=Диметилформамид
DCM=Дихлорметан
ЯМР=Ядерный магнитный резонанс
HPLS=Высокоэффективная жидкостная хроматография (ВЭЖХ)
RP-HPLS=Высокоэффективная жидкостная хроматография с обращенной фазой (ОФ-ВЭЖХ)
LRMS=Жидкостная хроматография/масс-спектрометрия низкого разрешения
HRMS=Жидкостная хроматография/масс-спектрометрия высокого разрешения
Tips=триизопропилсилил
DMAP=4-(диметиламино)пиридин
EDC=1-этил-3-(3-диметиламинопропил)карбодиимид
THF=Тетрагидрофуран
Dipea=N,N-диизопропилэтиламин
HATU=1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло-[4,5-b]пиридиний-3-оксид гексафторфосфата
DCC=N,N'-дициклогексилкарбодиимид
HSA=Cывороточный альбумин человека
Пример 1. Моно-Tips защищенная С18-двухосновная кислота
К раствору двухосновной кислоты (10 г) в cухом DMF (150 мл) при 60°С добавляли триизопропилсилилхлорид (6,68 мл)/ К перемешиваемому раствору добавляли по каплям свежеперегнанный триэтиламин (4,35 мл), реакционную смесь перемешивали в течение ночи в атмосфере азота, затем раствор охлаждали до комнатной температуры, фильтровали и концентрировали досуха. К твердому веществу добавляли дихлорметан (150 мл)) и круглое дно обрабатывали ультразвуком. Твердое вещество отфильтровывали и растворитель удаляли в вакууме. Остаток очищали колоночной хроматографией (2,5% THF в DCM), получая прозрачное масло (6,1 г, выход 41%).
LRMS - 471,32 [M+H]+, HRMS - теоретич.=471,3864, наблюд.=471,3861.
1H-ЯМР (CDCl3): δ (м.д.) 1,06-1,09 (м, 2Н), 1,2-1,4 (м, 24H), 1,55-1,70 (м, 4Н), 2,30-2,40 (м, 4Н).
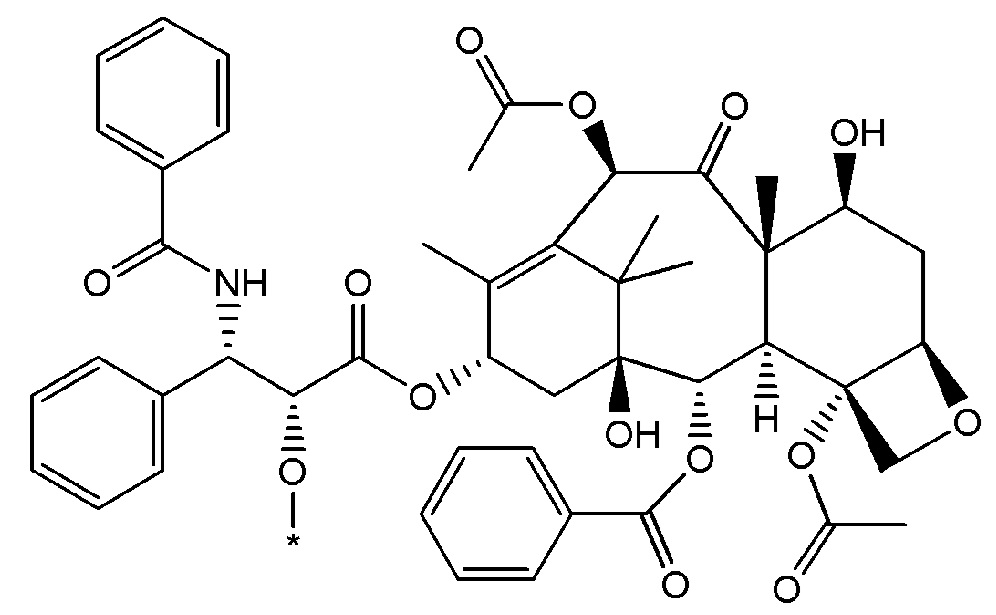
Пример 2. Конъюгат паклитаксел-С18-двухосновная кислота (PTX-FA18)
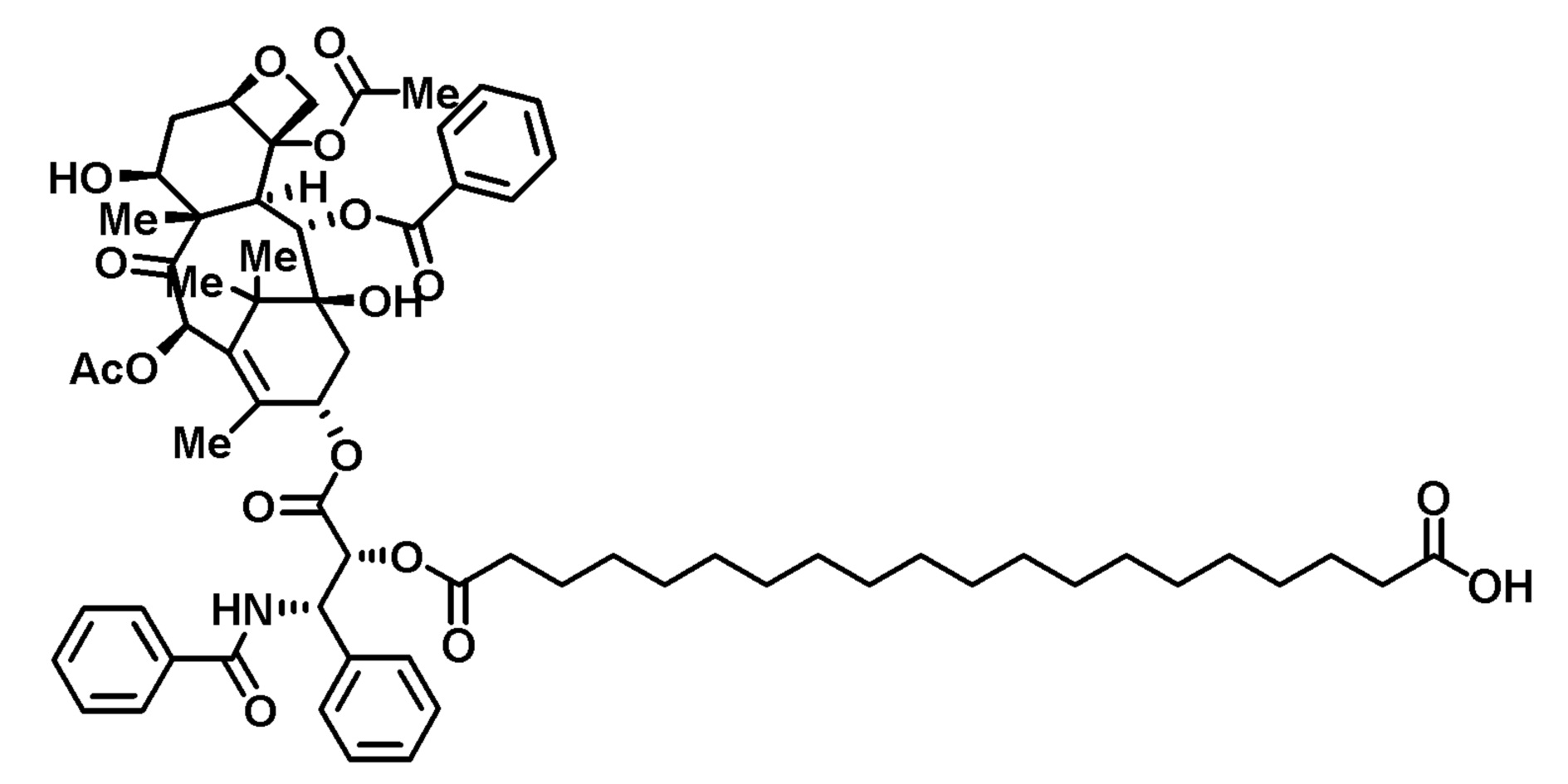
К перемешиваемому раствору паклитаксела (500 мг) в сухом DCM (50 мл) при 0°С добавляли DMAP (231 мг). Через 5 минут добавляли EDC (137 мг). После дополнительных 5 минут добавляли моно-Tips защищенную C18-двухосновную кислоту (791 мг) и полученный раствор перемешивали и нагревали до комнатной температуры в течение ночи. Неочищенную реакционную смесь переносили в делительную воронку и промывали водой (3×50 мл)), насыщенным раствором NaCl (3×50 мл)) и 0,1 М HCl (3×50 мл). Органическую фазу сушили над MgSO4 и на роторном испарителе, получая желтовато-белое твердое вещество. Для удаления защитной группы Tips твердое вещество растворяли в THF, добавляли Bu4NF (1,2 г, 0,0046 моль) и перемешивали. Через 18 часов к реакционной смеси добавляли избыток ионообменной смолы Amberlite® и избыток CaCO3. Через 1 час раствор фильтровали, и фильтрат концентрировали с получением свободнотекучего масла. Масло растворяли в 50 мл DCM, и после добавления воды наблюдали образование белого осадка. Реакционную смесь фильтровали и переносили в делительную воронку, где проводили экстракцию водой (3×50 мл). Органическую фазу сушили над MgSO4, фильтровали и концентрировали, с получением прозрачного/светлого стеклообразного твердого вещества (521 мг, выход 81%).
MS - теоретич.=1147,59 [M-H]-, наблюд.=1148,38.
1H-ЯМР (CDCl3): δ (м.д.) 0,08-1,10 (м, 21H), 1,2-1,4 (м, 24H), 1,55-1,64 (м, 4H), 1,65-1,7 (м, 2H), 1,8-1,95 (м, 4H), 1,95-1,05 (м, 2H), 2,1-2,15 (м, 4H), 2,25-2,40 (м, 6H), 2,4-2,5 (м, 2H), 2,5-2,55 (м, 1H), 3,7 (с, 1H), 3,75-3,95 (м, 3H), 4,1 (м, 1H), 4,2 (м, 1H), 4,3 (м, 1H), 4,4 (м, 1H), 4,7 (м, 1H), 4,95 (м, 1H), 5,5 (м, 1H), 5,7 (м, 1H), 5,8 (м, 1H), 6,2-6,3 (м, 2H), 6,8 (м, 1H), 6,97 (м, 1H), 7,05 (м, 1H), 7,3-7,45 (м, 5H), 7,45-7,55 (м, 4H), 7,6 (м, 1H), 7,75 (м, 2H), 8,1-8,2 (м, 2H).
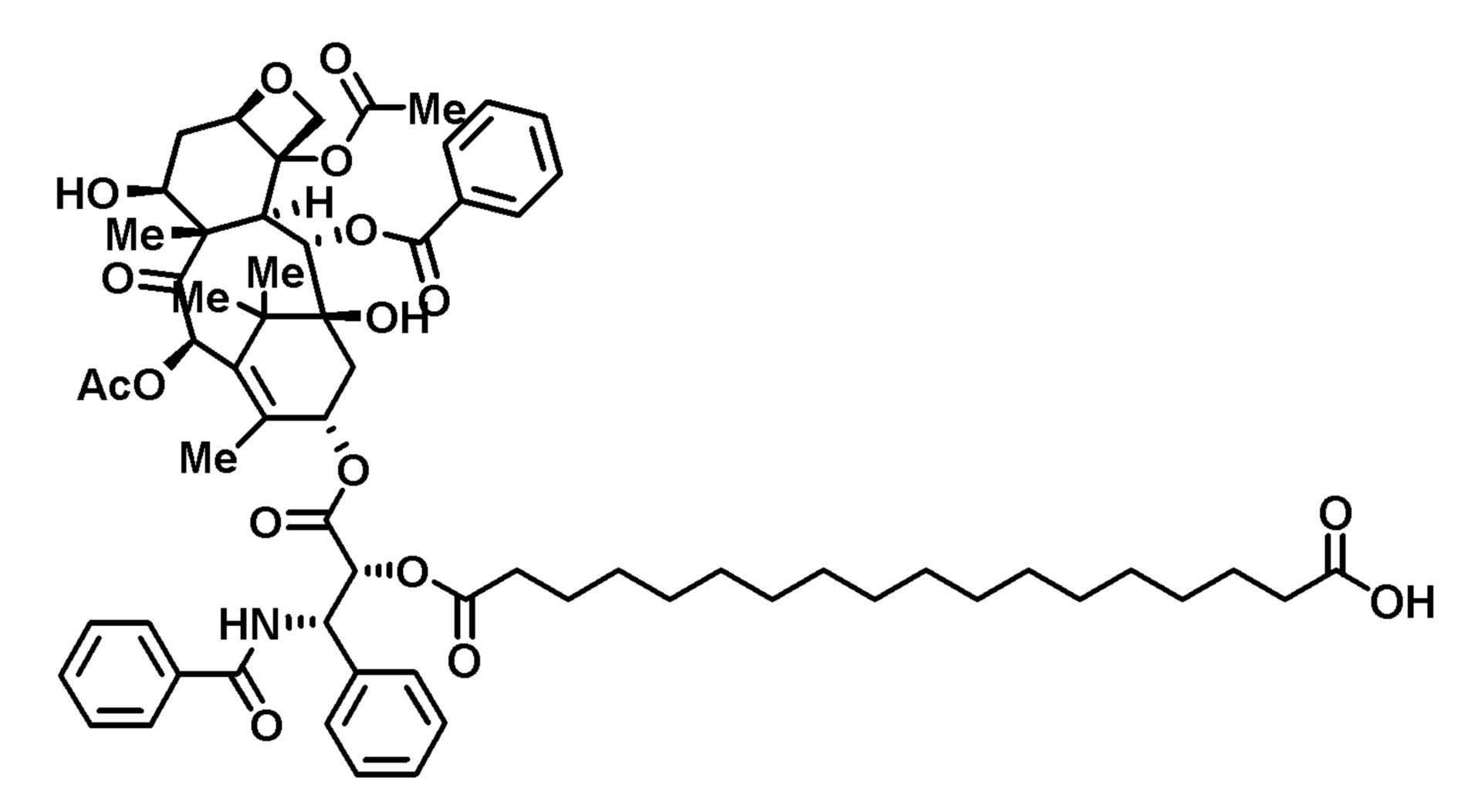
Пример 3. Конъюгат паклитаксел-С16-двухосновная кислота (PTX-FA16)
Гексадекандиоевую кислоту (250 мг), паклитаксел (372 мг), EDC (251 мг) и DMAP (160 мг) растворяли в DMF (5 мл)) и перемешивали в атмосфере азота в течение ночи. Реакционную смесь концентрировали досуха, остаток растворяли в хлороформе и промывали водой (3×20 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали досуха. Твердое вещество очищали препаративной ВЭЖХ с получением конъюгата в виде белого твердого вещества.
1H-ЯМР (CDCl3): δ (м.д.) 8,14 (2H, д), 7,74 (2H, д), 7,62 (1H, т), (7,55-7,30, 9H, м), 6,94 (1H, м), 6,31 (1H, с), 6,27 (1H, т), 5,95 (1H, м), 5,69 (1H, д), 5,51 (1H, м), 4,99 (1H, м) 4,45 (1H, м), 4,32 (1H, м), 4,21 (1H, м), 3,82 (1H, м), 2,60-1,00 (51H, м).
LRMS, ESI, 1121,03 [M-H]-.
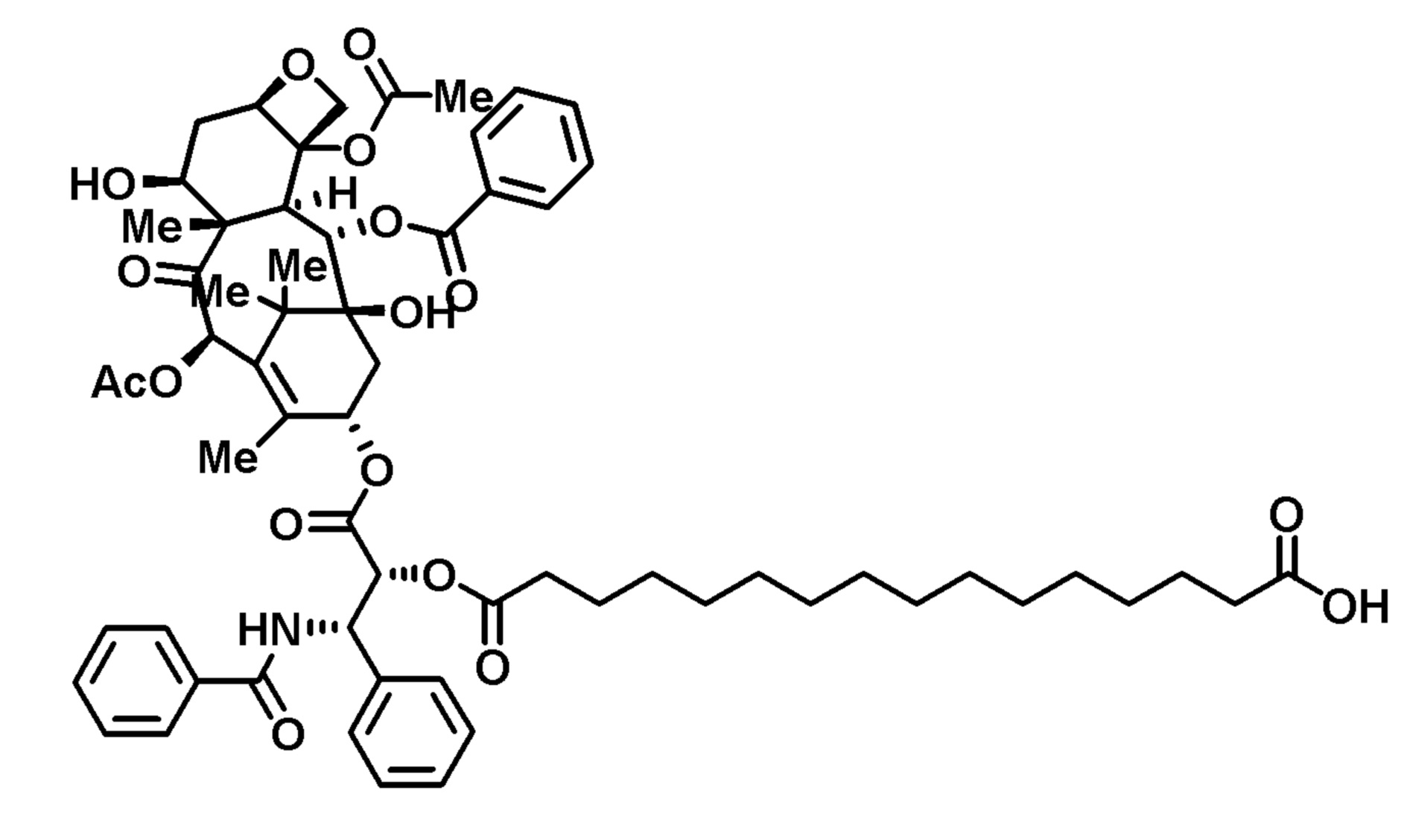
Пример 4. Конъюгат паклитаксел-С20-двухосновная кислота (PTX-FA20)
Эйкозандиоевую кислоту (160 мг), паклитаксел (200 мг), EDC (135 мг) и DMAP (86 мг) растворяли в DMF (2 мл)), перемешивали в атмосфере азота в течение ночи, затем концентрировали досуха. Твердое вещество очищали препаративной ВЭЖХ (65%-95% ACN), получая конъюгат в виде белого твердого вещества.
1H-ЯМР (CDCl3): δ (м.д.) 8,14 (2H, д), 7,74 (2H, д), 7,62 (1H, т), (7,56-7,30, 9H, м), 6,95 (1H, м), 6,31 (1H, с), 6,27 (1H, т), 5,96 (1H, м), 5,70 (1H, д), 5,51 (1H, м), 4,99 (1H, м) 4,45 (1H, м), 4,33 (1H, м), 4,22 (1H, м), 3,82 (1H, м), 2,60-1,00 (59H, м).
LRMS, ESI, 1290,67 [M-H+TFA]-.
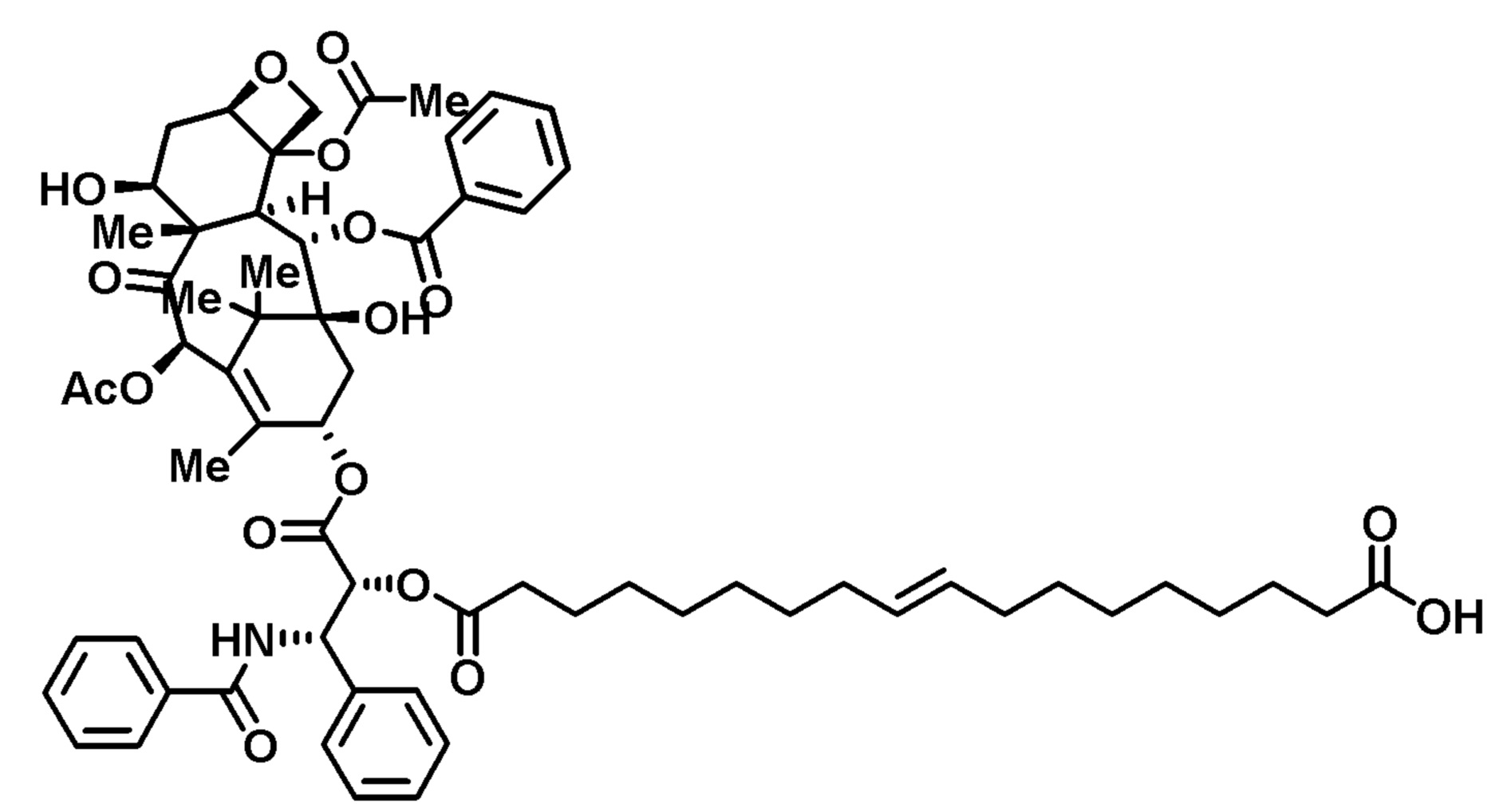
Пример 5. Конъюгат паклитаксел-uC18-двухосновная кислота (PTX-FAul8)
Октадец-9-ендиоевую кислоту (37 мг; 85% транс/15% цис), паклитаксел (200 мг), EDC (45 мг) и DMAP (29 мг) растворяли в DMF (2 мл), перемешивали в атмосфере азота в течение ночи, затем концентрировали досуха. Твердое вещество очищали препаративной ВЭЖХ (65%-95% ACN), получая конъюгат в виде белого твердого вещества.
1H-ЯМР (CDCl3): δ (м.д.) 8,14 (2H, д), 7,74 (2H, д), 7,62 (1H, т), (7,55-7,30, 9H, м), 7,03 (1H, м), 6,30 (1H, с), 6,27 (1H, т), 5,97 (1H, м), 5,69 (1H, д), 5,52 (1H, м), 5,37 (2H, м), 4,99 (1H, м) 4,45 (1H, м), 4,33 (1H, м), 4,21 (1H, м), 3,82 (1H, м), 2,60-1,00 (51H, м).
LRMS, ESI, 1146,72 [M-H]-.
Пример 6. Конъюгат метотрексат-С18-двухосновная кислота (МТХ-FA18)
К раствору метотрексата (66 мг) в DMF (1 мл)) добавляли Dipea (50 мкл), а затем HATU (55 мг), и после перемешивания в течение 3 мин добавляли 18-(2-аминоэтокси)-18-оксооктадекановую кислоту (57 мг) и реакционную смесь перемешивали в течение ночи в атмосфере азота. Раствор концентрировали досуха, и полученное твердое вещество очищали препаративной ВЭЖХ (40%-50% ACN), получая конъюгат в виде желтого твердого вещества.
1H-ЯМР (DMF-d7): δ (м.д.) 9,33 (1H, ш.с), 9,17 (1H, ш.с), 8,82 (1H, с), 8,13 (1H, м), 7,88 (2H, м), 6,91 (2H, м), 4,95 (2H, с), 4,10 (1H, м), 3,33 (3H, с), 2,45-2,0 (12H, м), 1,55 (4H, м), 1,27 (24H, м).
LRMS, ESI, 792,57 [M-H]-.
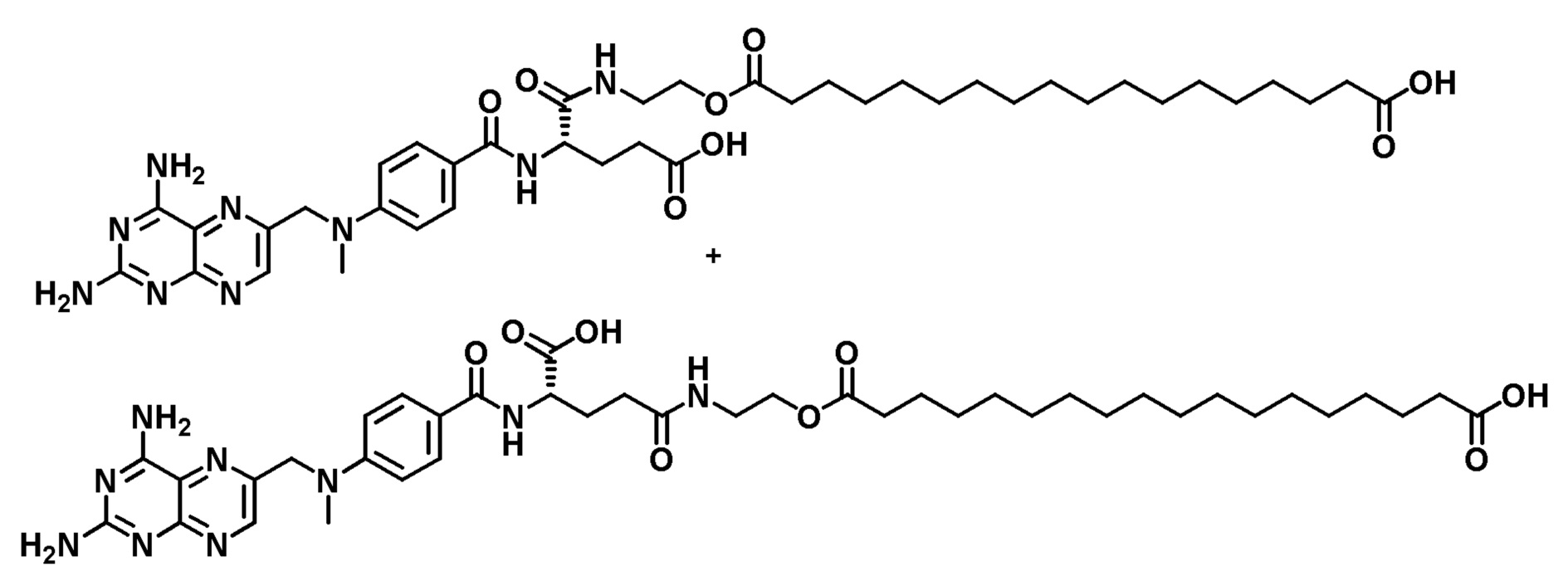
Пример 7. Модифицированный карбонатом промежуточный продукт
К раствору метил-18-гидроксиоктадеканоата (320 мг) и пиридина (222 мкг) в CHCl3/DMF (8:2) медленно добавляли п-нитрофенилхлорформиат (246 ммоль). Реакционную смесь перемешивали в атмосфере азота в течение ночи, затем переносили в делительную воронку и промывали водой (х 3). Органический слой сушили с помощью Na2SO4, фильтровали и концентрировали досуха. Твердое вещество очищали колоночной хроматографией (100% CHCl3), получая белое твердое вещество.
1H-ЯМР (CDCl3): δ (м.д.) 8,29 (2H, д), 7,39 (2H, д), 4,30 (2H, т), 3,67 (3H, с), 2,31 (2H, т), 1,76 (2H, м), 1,70-1,58 (2H, м), 1,42 (3H, т), 1,26 (27H, м).
LRMS, ESI, 480,47 [M+H]+.
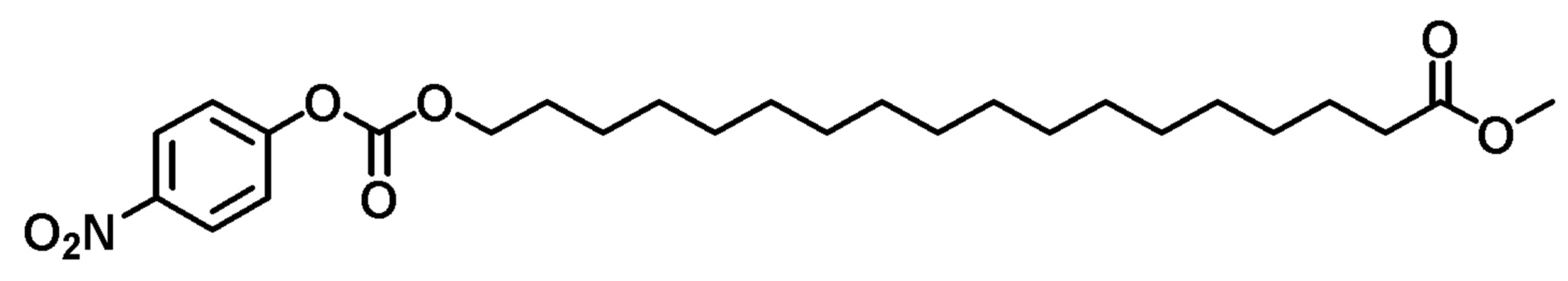
Пример 8. Конъюгат доксорубицин-карбамат сложного эфира C18-кислоты (DOX-FAE18-Cm)
К раствору гидрохлорида доксорубицина (50 мг) в сухом DMF (1 мл) добавляли триэтиламин (30 мл,) а затем метил-18-(((4-нитрофенокси)карбонил)окси)октадеканоат (50 мг), и реакционную смесь перемешивали в атмосфере азота в течение ночи, затем концентрировали досуха. Остаток растворяли в хлороформе, промывали водой (x 3) и органический слой сушили над Na2SO4, фильтровали и концентрировали досуха. Полученное красное твердое вещество очищали колоночной хроматографией (10% толуол в DCM), с получением красного твердого вещества.
1H-ЯМР (CDCl3): δ (м.д.) 8,02 (1H, м), 7,78 (1H, м), 7,39 (1H, м), 6,80 (1H, м), 5,50 (1H, м), 5,28 (1H, м), 5,06 (1H, м), 4,76 (2H, с), 4,56 (1H, м), 4,20-4,05 (4H, м), 3,98 (2H, м), 3,85 (1H, м), 3,67 (3H, с) 3,25 (1H, д), 3,04 (1H, м), 2,98 (1H, д), 2,36-1,20 (37H, м).
LRMS, ESI, 882,90 [M-H]-.
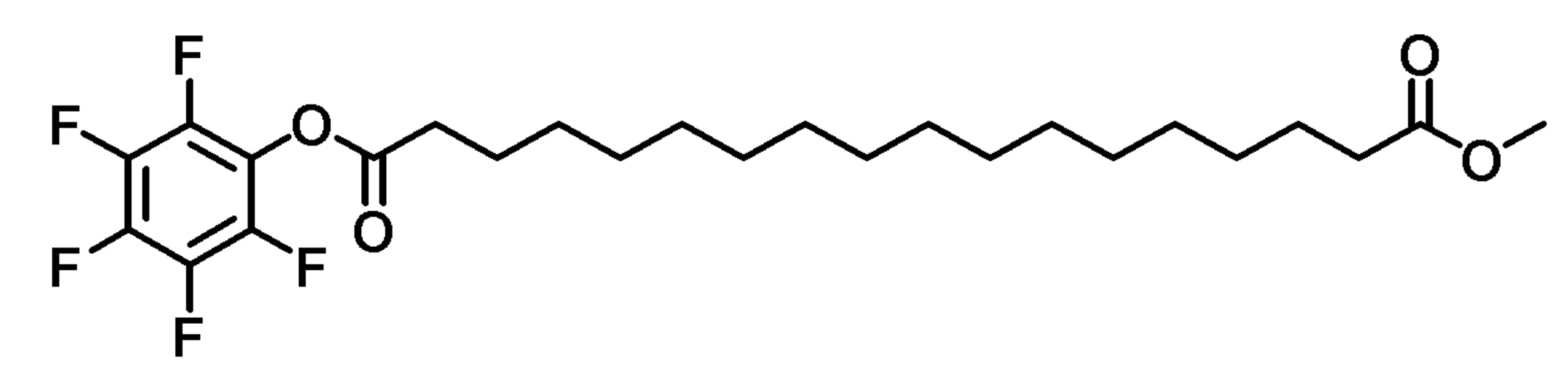
Пример 9. Промежуточное соединение пентафторфенола
К раствору 18-метокси-18-оксооктадекановой кислоты (250 мг), пентафторфенола (140 мг) и DMAP (23 мг) в этилацетате (10 мл) добавляли раствор DCC (157 мг) в этилацетате (2 мл). Реакционную смесь перемешивали в атмосфере азота в течение ночи. Полученный осадок удаляли фильтрацией и растворитель удаляли при пониженном давлении с получением белого твердого вещества.
1H-ЯМР (CDCl3): δ (м.д.) 3,67 (3H, с), 2,31 (2H, т), 1,78 (2H, м), 1,62 (2H, м), 1,42 (2H, м), 1,26 (22H, м).
LRMS, ESI, 517,40 [M+Na]+.
Пример 10. Модифицированный аминокислотный промежуточный продукт
Раствор 1-метил-18-(перфторфенил)октадекандиоата (250 мг), 6-аминогексановой кислоты (66 мг) и триэтиламина (141 мкмоль) в DMF (5 мл)) нагревали при 60°С при перемешивании в атмосфере азота в течение 48 часов. Реакционную смесь охлаждали и концентрировали при пониженном давлении. Остаток растворяли в хлороформе и промывали 10% HCl (x 3). Органический слой сушили с использованием Na2SO4, фильтровали и концентрировали досуха с получением коричневатого твердого вещества.
1H-ЯМР (CDCl3): δ (м.д.) 7,72 (1H, м), 3,64 (3H, с), 3,14 (2H, м), 2,40-2,20 (4H, м), 2,14 (2H, т), 1,60-1,40 (8H, м), 1,26 (26H, м).
LRMS, ESI, 442,56 [M+H]+.
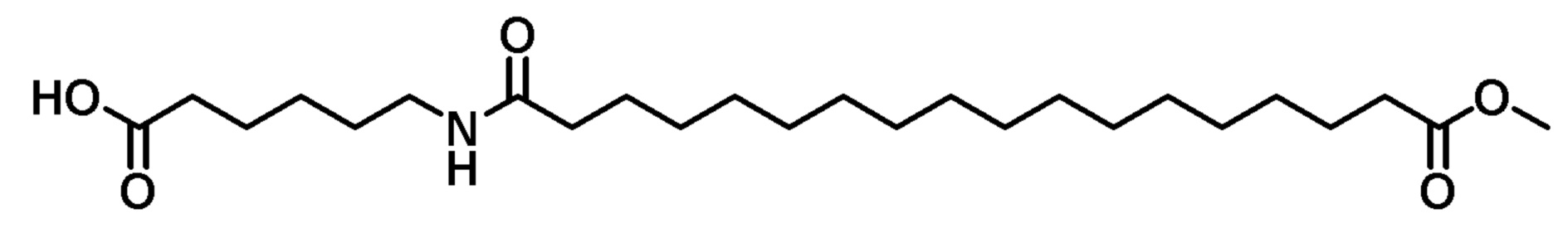
Пример 11. Конъюгат паклитаксел-C18-двухосновная кислота+аминокислотный спейсер (PTX-FAE18-Aa)
К раствору 6-(18-метокси-18-оксооктадеканоиламидо)гексановой кислоты (103 мг), паклитаксела (299 мг) и DMAP (43 мг) в DMF (2 мл) добавляли EDC (67 мг). Реакционную смесь перемешивали в атмосфере азота в течение ночи, затем концентрировали досуха. Остаток растворяли в хлороформе и промывали 0,1 М HCl (3 х). Органический слой сушили с использованием Na2SO4, фильтровали и концентрировали досуха. Твердое вещество очищали препаративной ВЭЖХ (65%-95% ACN), получая конъюгат в виде белого твердого вещества.
1H-ЯМР (CDCl3): δ (м.д.) 8,14 (2H, д), 7,75 (2H, д), 7,62 (1H, м), (7,55-7,30, 10H, м), 7,11 (1H, м), 6,30 (1H, с), 6,23 (1H, м), 5,95 (1H, м), 5,68 (1H, м), 5,50 (1H, м), 4,98 (1H, м) 4,45 (1H, м), 4,32 (1H, м), 4,21 (1H, м), 3,82 (1H, м), 3,67 (3H, с), 3,18 (2H, м), 2,60-1,00 (62H, м).
LRMS, ESI, 1312,52 [M-H+Cl]-.
Пример 12. Конъюгат камптотецин-С18-двухосновная кислота (СРТ-FA18)
Камптотецин перемешивали с октадекандикарбоновой кислотой в DMF вместе с избытком EDC и DMAP. После завершения реакции реакционный раствор концентрировали, переносили в DCM, затем промывали 2 М HCl и 1 x H2O. Органический слой сушили над MgSO4, фильтровали и концентрировали. Неочищенный FA-CPT очищали сначала флэш-хроматографией, используя градиентное элюирование (100% DCM - 10% метанол в DCM)); затем очищали с помощью препаративной ОФ-ВЭЖХ с использованием 70-90% ацетонитрила в воде+0,1% градиент TFA, с контролем при 260 нм. Очищенный продукт лиофилизировали для удаления растворителей ВЭЖХ, получая бледно-желтый порошок.
1H-ЯМР (CDCl3): δ (м.д.) 8,41 (с, 1H), 8,23 (д, 1H, J=8,4 Гц), 7,95 (д, 1H, J=8,1 Гц), 7,84 (т, 1H, J=8,5 Гц), 7,68 (т, 1H, 7,1 Гц), 7,26 (с, 1H), 5,68 (д, 1H, J=17,2 Гц), 5,42 (д, 1H, J=17,2 Гц), 5,31 (с, 2H), 2,49 (м, 2H), 2,35 (т, 2H, J=8,0 Гц), 2,29 (м, 1H), 2,17 (м, 1H), 1,70-1,59 (м, 4H), 1,39-1,11 (м, 24H), 0,98 (т, 3H, 7,4 Гц).
LRMS, ESI, 644,83 [M-H]-.
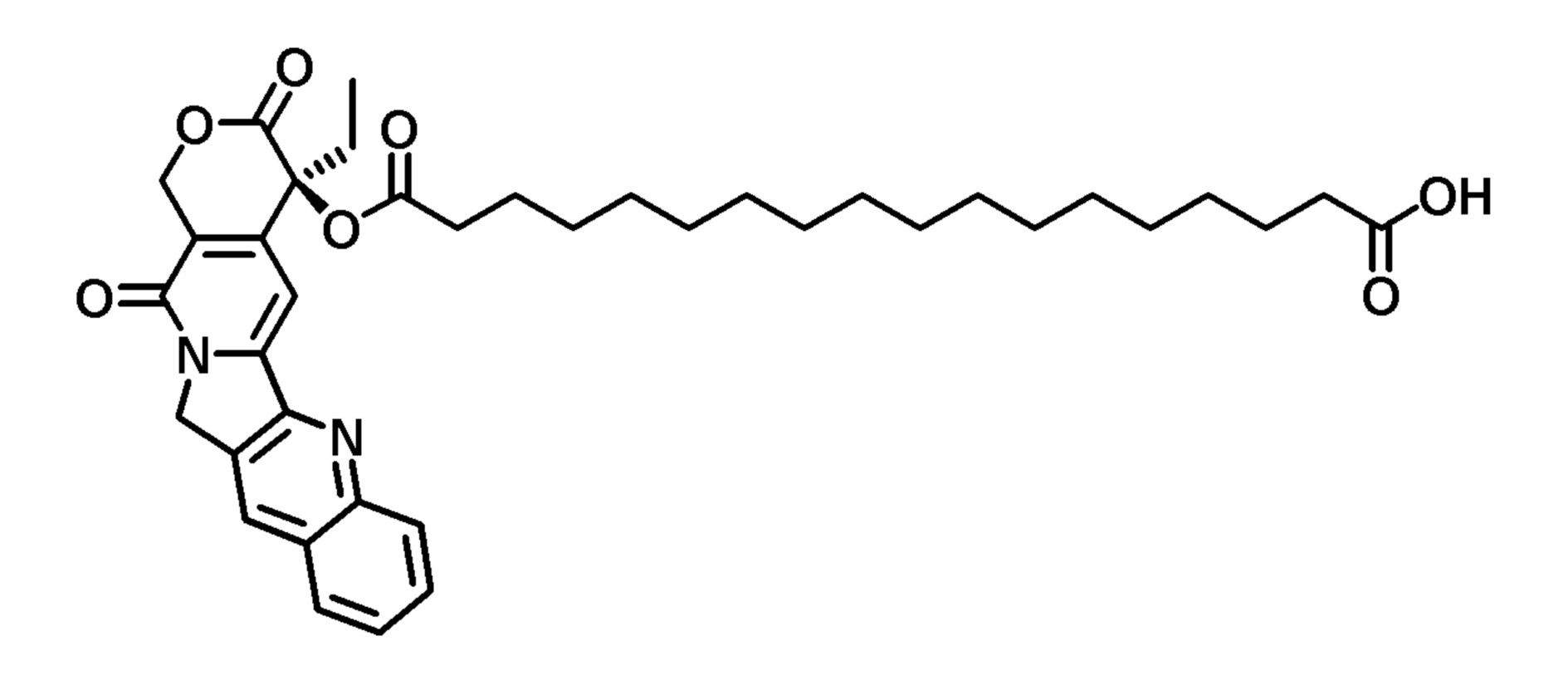
Пример 13. Конъюгат иксабепилон-С18-двухосновная кислота (IXB-FA18)
К перемешиваемому раствору иксабепилона (500 мг) в сухом DCM (50 мл,) при 0°С добавляли DMAP (231 мг). Через 5 минут добавляли EDC (137 мг). После дополнительных 5 минут, добавляли моно-Tips защищенную C18-диосновную кислоту (791 мг), полученный раствор перемешивали и нагревали до комнатной температуры в течение ночи. Затем неочищенную реакционную смесь переносили в делительную воронку и промывали водой (3×50 мл)), насыщенным раствором NaCl (3×50 мл) и 0,1 М HCl (3×50 мл). Органическую фазу сушили над MgSO4 и выпаривали на роторном испарителе с получением желтовато-белого твердого вещества. Для удаления защитной группы Tips твердое вещество растворяли в THF, добавляли Bu4NF (1,2 г) и перемешивали. Через 18 часов к реакционной смеси добавляли избыток ионообменной смолы AMBERLITE и избыток CaCl2. Через 1 час раствор фильтровали и фильтрат концентрировали с получением свободнотекучего масла. Масло растворяли в 50 мл DCM и после добавления воды наблюдали образование белого осадка. Реакционную смесь фильтровали и переносили в делительную воронку, где ее экстрагировали водой (3×50 мл). Органическую фазу сушили над MgSO4, фильтровали, и концентрировали с получением твердого вещества.
MS - теоретич.=803,16 [M-H]-.
Пример 14. Образование комплекса PTX-FA с сывороточным альбумином человека (PTX-FA-HSA)
Сывороточный альбумин человека (HSA) растворяли в дистиллированной воде с получением 4% (мас./об.) раствора (1000 мкл, 7,19×10-4 М). К этому раствору быстро добавляли маточный раствор PTX-FA (100 мкл, 0,0144 М). Полученный раствор обрабатывали ультразвуком в течение 10 секунд, замораживали и лиофилизировали. Лиофилизированный порошок ресуспендировали в 1,0 мл 1х DPBS.
Пример 15. Данные и результаты. Эффективность в условиях in vivo
Эквивалентные дозы (240 мг/кг по содержанию паклитаксела) PTX-FA-HSA вводили внутривенно (для PTX-FA-HSA) мышам nu/nu (n=3) с опухолевой нагрузкой (HT-1080), и контролировали в течение двух недель рост опухоли. Физиологический раствор (n=2) вводили в качестве отрицательного контроля. В Таблице 4 показаны средние относительные объемы опухолей (относительно дня 0).
Таблица 4
|
Кроме того для измерения соответствующих доз и выживания, проводили анализ связанного PTX-HA с белком in vivo в ксенотрансплантатах фибросаркомы НТ-1080. Результаты показаны в Таблице 5. Все дозы указаны по содержанию паклитаксела, используемого при лечении. Минимальная эффективная доза (MED) определена как самая низкая доза, необходимая для продления выживания свыше медианного выживание животных, не подвергавшихся лечению (получавших физиологический раствор). Максимальная эффективная доза (MTD) определена как самая высокая доза, приводящая к потере веса менее 10%. Терапевтический индекс (TI) определен как отношение MTD К MED. Медианное выживание определено как время для каждой группы для снижения выживаемости ниже 50%. N=6 для всех групп. Введение осуществляли внутривенно.
Таблица 5
|
Пример 16. Размер частиц определенный методом динамического рассеяния света
В соответствии со способом Примера 14 получали множество композиций PTX-FA и HSA с различными молярными соотношениями PTX-FA к HSA. Для каждого препарата проводили анализ размеров частиц с использованием метода динамического рассеяния света. В Таблице 6 показан средний радиус частиц и процентное содержание частиц (по массе) с соответствующим радиусом в препарате. На Фигуре 2 показана микрофотография, полученная с помощью метода крио-TEM (криогенная просвечивающая электронная микроскопия) при температуре жидкого азота для раствора с молярным соотношением PTX-FA и HSA, составляющего 1:1. Результаты крио-ТЕМ показывают, что раствор не содержит агрегатов.
Таблица 6
|
Пример 17. Связывание РТХ-FA18 с HSA
Использовали анализ связывания белков на основе диализа в соответствии со способом, описанным в документе Cohen, Plasma Protein-Binding Methods in Drug Discovery in OPTIMIZATION IN DRUG DISCOVERY: IN VITRO METHODS, Yan & Caldwell, eds., pp. 111-122 (Humana Press, Totowa, N.J., 2004), который включен во всей своей полноте в настоящее описание посредством ссылки. Измеряли процентное содержание PTX-FA18 и процентное содержание октадекандикарбоновой кислоты (C18-двухосновная кислота) связанных с белком при различных концентрациях. Результаты показаны в Таблице 7.
Таблица 7
|
Пример 18. Цитотоксичность в условиях in vitro
Общие методы культивирования клеток:
Клетки HeLa получали из АТСС И инкубировали при 37°C в атмосфере 5% СО2 с использованием среды DMEM с добавлением 10% FBS и 1х пирувата натрия, незаменимых аминокислот, L-глутамина и антибиотиков.
Эксперименты по оценке жизнеспособности клеток:
Цитотоксичность соединений оценивали с использованием метода CellTiter Blue (Promega)) клетки HeLa высевали в 96-луночные планшеты при плотности 3000 клеток/лунка за 1 день до обработки. Раствор для обработки готовили в виде 1000 х серийных разведений в DMSO, затем разбавляли в среду до 1X, получая растворы для обработки в 0,1% DMSO. Среду покрытия удаляли, затем в лунки добавляли растворы для обработки. Через 3 дня среду удаляли и заменяли на 100 мкл полной среды DMEM без фенолового красного. Затем добавляли 20 мкл реагента CellTiter Blue, и планшеты инкубировали в течение 2 часов при 37°С. Флуоресценцию измеряли при 590 нм с возбуждением при 560 нм. Для определения жизнеспособности клеток среднюю фоновую флуоресценцию вычитали из средних значений флуоресценции экспериментальных лунок (по три лунки на одну концентрацию при обработке). Жизнеспособность рассчитывали в виде среднего сигнала в лунке за вычетом фона и сравнивали со средним сигналом отрицательного контроля (обработка средой в 0,1% DMSO).
Определение IC50:
Показатели выживаемости определяли с помощью программного обеспечения GraphPad Prism, используя нелинейную дозо-зависимую кривую ингибирования. Значения IC50, приведенные в Таблице, отражают концентрацию, при которой гибель клеток составляет 50% от максимального ответа.
Результаты:
В Таблице 8 показаны значения IC50 (измеренные, как описано выше)) для различных конъюгатов HSA/лекарственное Средство-FA, которые были синтезированы в приведенных выше Примерах.
Таблица 8
|
Приведенные значения IC50 представляют собой средние значения, по меньшей мере для 3 повторов, за исключением случая, отмеченного знаком *, где был выполнен один эксперимент.