Результат интеллектуальной деятельности: АНТИТЕЛА ЧЕЛОВЕКА К PCSK9 ДЛЯ ПРИМЕНЕНИЯ В СПОСОБАХ ЛЕЧЕНИЯ КОНКРЕТНЫХ ГРУПП ИНДИВИДУУМОВ
Вид РИД
Изобретение
Настоящее изобретение относится к способам лечения заболеваний или состояний, в которые вовлечена экспрессия или активность конвертазы пробелков типа субтилизина/кексина 9 (PCSK9), путем введения специфичных к PCSK9 антител или их антигенсвязывающих фрагментов и, предпочтительно, путем дополнительного введения ингибитора 3-гидрокси-3-метил-глутарил-CoA-редуктазы (HMG-CoA-редуктаза). Кроме того, настоящее изобретение относится к специфичным к PCSK9 антителам или их антигенсвязывающим фрагментам (предпочтительно, в комбинации с ингибиторами HMG-CoA-редуктазы) для применения при лечении заболеваний или состояний, в которые вовлечена экспрессия или активность PCSK9.
Также настоящее изобретение относится к изделиям, содержащим упаковочный материал, специфичные к PCSK9 антитела или их антигенсвязывающие фрагменты, и ярлык или вкладыш в упаковку, на которых указано, какие группы пациентов можно лечить указанными антителами или фрагментами, какие группы пациентов нельзя лечить указанными антителами или фрагментами и какой режим дозирования следует использовать.
Кроме того, настоящее изобретение относится к способам исследования эффективности специфичных к PCSK9 антител или их антигенсвязывающих фрагментов для лечения определенных заболеваний или состояний и для лечения конкретных подгрупп пациентов.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОМУ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Конвертаза пробелков типа субтилизина/кексина 9 (PCSK9) представляет собой конвертазу пробелков, относящуюся к подсемейству протеазы K семейства секреторных субтилаз. Кодируемый белок синтезируется в качестве растворимого зимогена, который претерпевает аутокаталитический внутримолекулярный процессинг в эндоплазматической сети. Данные указывают на то, что PCSK9 увеличивает уровень холестерина LDL путем стимуляции деградации рецептора LDL, который опосредует эндоцитоз LDL в печени - основной путь выведения LDL из кровотока. Структура белка PCSK9 указывает на то, что он имеет сигнальную последовательность, за которой следует продомен, каталитический домен который содержит консервативную триаду остатков (D186, H226 и S386), и C-концевой домен. Он синтезируется в качестве растворимого предшественника размером 74 кДа, который претерпевает аутокаталитическое расщепление в ER с образованием продомена размером 14 кДа и каталитического фрагмента размером 60 кДа. Было показано, что аутокаталитическая активность требуется для секреции. После расщепления продомен остается прочно связанным с каталитическим доменом.
Антитела к PCSK9 описаны, например, в WO 2008/057457, WO 2008/057458, WO 2008/057459, WO 2008/063382, WO 2008/125623, и US 2008/0008697. Антитела против PCSK9, которые особенно пригодны для применения на практике настоящего изобретения, описаны в US 2010/0166768 A1, содержание которой включено в настоящее описание в качестве ссылки в полном объеме.
ТЕХНИЧЕСКИЕ ПРОБЛЕМЫ, ЛЕЖАЩИЕ В ОСНОВЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Статины относятся к наиболее широко используемым лекарственным средствам в мире. Хотя статины, как правило, проявляют превосходный профиль безопасности, желательно далее оптимизировать профиль безопасности путем снижения уже низкого уровня нежелательных побочных эффектов (таких как миопатия).
Несмотря на широкую доступность средств, снижающих уровень липидов, таких как статины, приблизительно 30% всех взрослых пациентов, которых лечили от гиперхолестеринемии в США между 1999 и 2006 годами, не достигали их рекомендованных целевых уровней LDL-С. Причины этого включают плохое соблюдение терапии, устойчивость/непереносимость лекарственных средств и положительную взаимосвязь между частотой неблагоприятных явлений и увеличением дозировки. Более того, поскольку наиболее эффективные средства, снижающие уровень липидов, могут снизить уровни LDL-С только на вплоть до 55%, частота достижения заданных уровней у пациентов, у которых требуется значительное снижение LDL-C, таких как пациенты с семейной гиперхолестеринемией, часто является значительно более низкой, чем можно ожидать. Таким образом, требуются более эффективные средства, снижающие уровень липидов, и режимы лечения для повышения частоты достижения заданных уровней у этих пациентов.
Совершенно неожиданно, авторы изобретения по настоящему изобретению открыли, что введение антител против PCSK9 или их фрагментов увеличивает активность статинов в отношении снижения уровней LDL-холестерина при введении в конкретных режимах дозирования и/или конкретным группам пациентов.
Таким образом, совместное введение антител против PCSK9 или их фрагментов увеличивает эффективность терапии статинами и позволяет снизить дозировку статинов, тем самым, снижая нежелательные побочные эффекты.
Более того, авторы настоящего изобретения открыли, что конкретные режимы дозирования антител против PCSK9 и/или статинов лучше подходят для снижения уровней LDL-холестерина, чем другие. Авторы изобретения также открыли, что для некоторых подгрупп пациентов более полезно, чем для других, лечение антителами против PCSK9 или их фрагментами и/или статинами. Кроме того, авторы изобретения открыли, что лечение антителами против PCSK9 или их фрагментами и/или статинами противопоказано некоторым подгруппам пациентов.
В представленном выше обзоре не обязательно описаны все проблемы, решаемые настоящим изобретением.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В первом аспекте настоящее изобретение относится к способу лечения заболевания или состояния, в которое вовлечена экспрессия или активность PCSK9, включающему:
введение терапевтического количества антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9), индивидууму, нуждающемуся в этом, где антитело или его антигенсвязывающий фрагмент вводят в дозировке в диапазоне от 5 мг до 500 мг, и
введение терапевтического количества ингибитора HMG-CoA-редуктазы указанному индивидууму, где ингибитор HMG-CoA-редуктазы вводят в дозировке в диапазоне от 0,05 мг до 100 мг.
Во втором аспекте настоящее изобретение относится к антителу или его антигенсвязывающему фрагменту, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9), для применения при лечении заболевания или состояния, в которые вовлечена экспрессия или активность PCSK9,
где антитело или его антигенсвязывающий фрагмент предназначены для введения в дозировке в диапазоне от 5 мг до 500 мг,
где антитело или его антигенсвязывающий фрагмент, кроме того, предназначены для введения в комбинации с ингибитором HMG-CoA-редуктазы в дозировке в диапазоне от 0,05 мг до 100 мг.
В третьем аспекте настоящее изобретение относится к изделию, содержащему: (a) упаковочный материал; (b) антитело или его антигенсвязывающий фрагмент, которые специфично связывают hPCSK9; и (c) ярлык или вкладыш в упаковку, находящиеся в упаковочном материале, на которых указано, что пациентов, которым проводят лечение указанным антителом или антигенсвязывающим фрагментом, можно лечить от заболевания или состояния, выбранного из группы, состоящей из гиперхолестеринемии, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний.
В четвертом аспекте настоящее изобретение относится к изделию, содержащему: (a) упаковочный материал; (b) антитело или его антигенсвязывающий фрагмент, которые специфично связывают hPCSK9; и (c) ярлык или вкладыш в упаковку, находящиеся в упаковочном материале, на которых указана информация о лечении антителом или его антигенсвязывающим фрагментом совместно с применением статина.
В пятом аспекте настоящее изобретение относится к изделию, содержащему (a) упаковочный материал; (b) антитело или его антигенсвязывающий фрагмент, которые специфично связывают hPCSK9; и (c) ярлык или вкладыш в упаковку, на которых указано, что лечение антителом или его антигенсвязывающим фрагментом вместе со статином противопоказано для пациентов, относящихся к одной или нескольким из следующих групп: (i) курильщики; (ii) лица в возрасте 70 лет и старше; (iii) лица, страдающие гипертензией; (iv) беременные женщины; (v) женщины, пытающиеся забеременеть; (vi) женщины, кормящие грудью; (vii) лица, которые имеют или когда-либо имели заболевание, поражающее печень; (viii) лица, которые имели какие-либо необъясненные аномальные показатели функции печени в тестах крови; (ix) лица, которые употребляют чрезмерные количества спиртных напитков; (x) лица, имеющие проблемы с почками; (xi) лица, страдающие гипотиреозом; (xii) лица, страдающие мышечными нарушениями; (xiii) лица, ранее сталкивавшиеся с мышечными проблемами в ходе лечения снижающей уровень липидов терапией; (xiv) лица, имеющие серьезные проблемы с дыханием; (xv) лица, принимающие одно или несколько из следующих лекарственных средств: лекарственные средства, изменяющие работу иммунной системы (например, циклоспорин или антигистамины), антибиотики или противогрибковые средства (например, эритромицин, кларитромицин, кетоконазол, итраконазол, рифампицин, фусидовая кислота), лекарственные средства, регулирующие уровень липидов (например, гемфиброзил, колестипол), блокаторы кальциевых каналов (например, верапамил, дилтиазем), лекарственные средства, регулирующие сердечный ритм (дигоксин, амиодарон), ингибиторы протеаз, используемые при лечении ВИЧ (например, нельфинавир), варфарин, пероральные контрацептивы, антациды или зверобой; или (xvi) лица, выпивающие более 0,1 л грейпфрутового сока в сутки; (xvii) лица, имеющие индекс массы тела (BMI) более 40; (xviii) лица, имеющие индекс массы тела (BMI) менее 18; (xix) лица, страдающие диабетом 1 типа или диабетом 2 типа; (xx) лица, положительные по гепатиту B или гепатиту C; или (xxi) лица, имеющие известную чувствительность к лекарственным средствам на основе моноклональных антител.
В шестом аспекте настоящее изобретение относится к способу исследования эффективности антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9, для лечения заболевания или состояния, выбранного из группы, состоящей из гиперхолестеринемии, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний, причем указанный способ включает:
лечение выбранной группы пациентов указанным антителом или его антигенсвязывающим фрагментом, где каждый пациент в указанной группе имеет уровень холестерина LDL (LDL-C) более 100 мг/дл; и
определение эффективности указанного антитела или его антигенсвязывающего фрагмента путем определения уровня LDL-C в группе пациентов до и после введения указанного антитела или его антигенсвязывающего фрагмента, где снижение уровня LDL-C по меньшей мере на 25% относительно уровня до введения дозы по меньшей мере у 75% группы пациентов указывает на то, что указанные антитело или его антигенсвязывающий фрагмент являются эффективными для лечения указанного заболевания или состояния в указанной группе пациентов.
В седьмом аспекте настоящее изобретение относится к способу исследования эффективности антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9, для лечения заболевания или состояния, выбранного из группы, состоящей из гиперхолестеринемии, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний, причем указанный способ включает:
определение эффективности антитела или его антигенсвязывающего фрагмента, которые используют для лечения выбранной группы пациентов указанным антителом или его антигенсвязывающим фрагментом, где каждый пациент в указанной группе имеет уровень холестерина LDL (LDL-C) более 100 мг/дл, путем определения уровня LDL-C в группе пациентов до и после введения указанного антитела или его антигенсвязывающего фрагмента, где снижение уровня LDL-C по меньшей мере на 25% относительно уровня до введения дозы по меньшей мере у 75% группы пациентов указывает на то, что указанные антитело или его антигенсвязывающий фрагмент являются эффективными для лечения указанного заболевания или состояния в указанной группе пациентов.
В восьмом аспекте настоящее изобретение относится к упаковке, содержащей антитело или его антигенсвязывающий фрагмент, которые специфично связывают hPCSK9 (см. раздел "Предпочтительные антитела для применения настоящего изобретения на практике") и ярлык, причем указанный ярлык содержит напечатанное сообщение, которое информирует пациента, что лечение антителом вместе со статином показано при одном или нескольких показаниях, выбранных из группы, состоящей из гиперхолестеринемии, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний.
В девятом аспекте настоящее изобретение относится к упаковке, содержащей антитело или его антигенсвязывающий фрагмент, которые специфично связывают hPCSK9 (см. раздел "Предпочтительные антитела для применения настоящего изобретения на практике") и ярлык, причем указанный ярлык содержит напечатанное сообщение, которое информирует пациента, что лечение антителом вместе со статином противопоказано для пациентов, относящихся к одной или нескольким из следующих групп: (i) курильщики; (ii) лица в возрасте 70 лет и старше; (iii) лица, страдающие гипертензией; (iv) беременные женщины; (v) женщины, пытающиеся забеременеть; (vi) женщины, кормящие грудью; (vii) лица, которые имеют или когда-либо имели заболевание, поражающее печень; (viii) лица, которые имели какие-либо необъясненные аномальные показатели функции печени в тестах крови; (ix) лица, которые употребляют чрезмерные количества спиртных напитков; (x) лица, имеющие проблемы с почками; (xi) лица, страдающие гипотиреозом; (xii) лица, страдающие мышечными нарушениями; (xiii) лица, ранее сталкивавшиеся с мышечными проблемами в ходе лечения снижающей уровень липидов терапией; (xiv) лица, имеющие серьезные проблемы с дыханием; (xv) лица, принимающие одно или несколько из следующих лекарственных средств: лекарственные средства, изменяющие работу иммунной системы (например, циклоспорин или антигистамины), антибиотики или противогрибковые средства (например, эритромицин, кларитромицин, кетоконазол, итраконазол, рифампицин, фусидовая кислота), лекарственные средства, регулирующие уровень липидов (например, гемфиброзил, колестипол), блокаторы кальциевых каналов (например, верапамил, дилтиазем), лекарственные средства, регулирующие сердечный ритм (дигоксин, амиодарон), ингибиторы протеаз, используемые при лечении ВИЧ (например, нельфинавир), варфарин, пероральные контрацептивы, антациды или зверобой; или (xvi) лица, выпивающие более 0,1 л грейпфрутового сока в сутки; (xvii) лица, имеющие индекс массы тела (BMI) более 40; (xviii) лица, имеющие индекс массы тела (BMI) менее 18; (xix) лица, страдающие диабетом 1 типа или диабетом 2 типа; (xx) лица, положительные по гепатиту B или гепатиту C; или (xxi) лица, имеющие известную чувствительность к лекарственным средствам на основе моноклональных антител.
В десятом аспекте настоящее изобретение относится к способу регуляции уровня LDL в крови, включающему:
введение терапевтического количества антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9) индивидууму, нуждающемуся в этом, где антитело или его антигенсвязывающий фрагмент вводят в дозировке в диапазоне от 5 мг до 500 мг, и
введение терапевтического количества ингибитора HMG-CoA-редуктазы указанному индивидууму, где ингибитор HMG-CoA-редуктазы вводят в дозировке в диапазоне от 0,05 мг до 100 мг.
В одиннадцатом аспекте настоящее изобретение относится к способу предупреждения эффектов (постоянно) увеличенного уровня LDL в крови, включающему:
введение терапевтического количества антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9), индивидууму, нуждающемуся в этом, где антитело или его антигенсвязывающий фрагмент вводят в дозировке в диапазоне от 5 мг до 500 мг, и
введение терапевтического количества ингибитора HMG-CoA-редуктазы указанному индивидууму, где ингибитор HMG-CoA-редуктазы вводят в дозировке в диапазоне от 0,05 мг до 100 мг.
В двенадцатом аспекте настоящее изобретение относится к способу определения того, пригодно ли фармацевтическое соединение для смягчения, улучшения, ингибирования или предупреждения заболевания или состояния, в которые вовлечена активность или экспрессия PCSK9, включающему: (a) введение индивидууму соединения, которое специфично связывается с PCSK9, предпочтительно, антитела или его антигенсвязывающего фрагмента, специфично связывающихся с PCSK9, и (b) определение того, какая часть PCSK9 в крови связана с соединением согласно (a).
В тринадцатом аспекте настоящее изобретение относится к способу лечения заболевания или состояния, в которые вовлечена экспрессия или активность PCSK9, включающему
введение терапевтического количества антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9) индивидууму, нуждающемуся в этом,
где индивидуум, нуждающийся в этом, относится к одной или нескольким из следующих групп индивидуумов: (i) индивидуумы с уровнем холестерина LDL (LDL-C) в сыворотке по меньшей мере 100 мг/дл; (ii) индивидуумы, имеющие уровень HDL-C в сыворотке менее 40 мг/дл; (iii) индивидуумы, имеющие уровень холестерина в сыворотке по меньшей мере 200 мг/дл; (iv) индивидуумы, имеющие уровень триацилглицерина в сыворотке по меньшей мере 150 мг/дл, где указанный уровень триацилглицерина определяют натощак после голодания в течение по меньшей мере 8 часов; (v) индивидуумы в возрасте по меньшей мере 35 лет; (vi) индивидуумы моложе 75 лет; (vii) индивидуумы, имеющие BMI 25 или более; (viii) мужчины; (ix) женщины; (x) индивидуумы, у которых введение указанного антитела или его антигенсвязывающего фрагмента приводит к снижению уровня LDL-C в сыворотке по меньшей мере на 30 мг/дл относительно уровня до введения дозы; или (xi) индивидуумы, у которых введение указанного антитела или его антигенсвязывающего фрагмента приводит к снижению уровня LDL-C в сыворотке по меньшей мере на 20% относительно уровня до введения дозы.
В четырнадцатом аспекте настоящее изобретение относится к способу лечения заболевания или состояния, в которые вовлечена экспрессия или активность PCSK9, включающему
введение терапевтического количества антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9), индивидууму, нуждающемуся в этом,
где индивидуум, нуждающийся в этом, не относится к одной или нескольким из следующих групп индивидуумов: (i) курильщики; (ii) лица в возрасте 70 лет и старше; (iii) лица, страдающие гипертензией; (iv) беременные женщины; (v) женщины, пытающиеся забеременеть; (vi) женщины, кормящие грудью; (vii) лица, которые имеют или когда-либо имели заболевание, поражающее печень; (viii) лица, которые имели какие-либо необъясненные аномальные показатели функции печени в тестах крови; (ix) лица, которые употребляют чрезмерные количества спиртных напитков; (x) лица, имеющие проблемы с почками; (xi) лица, страдающие гипотиреозом; (xii) лица, страдающие мышечными нарушениями; (xiii) лица, ранее сталкивавшиеся с мышечными проблемами в ходе лечения снижающей уровень липидов терапией; (xiv) лица, имеющие серьезные проблемы с дыханием; (xv) лица, принимающие одно или несколько из следующих лекарственных средств: лекарственные средства, изменяющие работу иммунной системы (например, циклоспорин или антигистамины), антибиотики или противогрибковые средства (например, эритромицин, кларитромицин, кетоконазол, итраконазол, рифампицин, фусидовая кислота), лекарственные средства, регулирующие уровень липидов (например, гемфиброзил, колестипол), блокаторы кальциевых каналов (например, верапамил, дилтиазем), лекарственные средства, регулирующие сердечный ритм (дигоксин, амиодарон), ингибиторы протеаз, используемые при лечении ВИЧ (например, нельфинавир), варфарин, пероральные контрацептивы, антациды или зверобой; или (xvi) лица, выпивающие более 0,1 л грейпфрутового сока в сутки; (xvii) лица, имеющие индекс массы тела (BMI) более 40; (xviii) лица, имеющие индекс массы тела (BMI) менее 18; (xix) лица, страдающие диабетом 1 типа или диабетом 2 типа; (xx) лица, положительные по гепатиту B или гепатиту C; или (xxi) лица, имеющие известную чувствительность к лекарственным средствам на основе моноклональных антител.
В пятнадцатом аспекте настоящее изобретение относится к антителу или его антигенсвязывающему фрагменту, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9), где антитело характеризуется одним или несколькими из следующих признаков при введении индивидууму, предпочтительно, человеку или не являющемуся человеком млекопитающему:
1. Снижение уровней липопротеинов низкой плотности (LDL-C) на по меньшей мере от приблизительно 25% до приблизительно 40% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 14 суток, где устойчивое снижение составляет, предпочтительно, по меньшей мере 25% и, более предпочтительно, по меньшей мере 30% относительно уровня до введения дозы, в частности, при введении в дозе от приблизительно 40 до приблизительно 60 мг, предпочтительно, от приблизительно 45 до приблизительно 55 мг и, более предпочтительно, от приблизительно 50 мг в режиме введения раз в две недели (через неделю, E2W).
2. Снижение уровня липопротеинов низкой плотности (LDL-C) на по меньшей мере от приблизительно 50% до приблизительно 65% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 14 суток, где устойчивое снижение составляет, предпочтительно, по меньшей мере 40% и, более предпочтительно, по меньшей мере 45% относительно уровня до введения дозы, в частности, при введении в дозе от приблизительно 100 мг E2W.
3. Снижение уровня липопротеинов низкой плотности (LDL-C) на по меньшей мере от приблизительно 60% до по меньшей мере приблизительно 75% [например, по меньшей мере приблизительно на 60%, по меньшей мере приблизительно на 65%, по меньшей мере приблизительно на 70% или по меньшей мере приблизительно на 75%] относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 14 суток, где устойчивое снижение составляет, предпочтительно, по меньшей мере 55% и, более предпочтительно, по меньшей мере 60% относительно уровня до введения дозы, в частности, при введении в дозе приблизительно 150 мг E2W.
4. Снижение уровня липопротеинов низкой плотности (LDL-C) на по меньшей мере от приблизительно 40% до приблизительно 75% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 28 суток, где устойчивое снижение составляет, предпочтительно, по меньшей мере 35% и, более предпочтительно, по меньшей мере 40% относительно уровня до введения дозы, в частности, при введении в дозе приблизительно 200 мг E4W.
5. Снижение уровня липопротеинов низкой плотности (LDL-C) на по меньшей мере от приблизительно 50% до приблизительно 75% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 28 суток, где устойчивое снижение составляет, предпочтительно, по меньшей мере 40% и, более предпочтительно, по меньшей мере 45% относительно уровня до введения дозы, в частности, при введении в дозе приблизительно 300 мг E4W.
6. Увеличение уровня холестерина HDL в сыворотке по меньшей мере на 2%, по меньшей мере на 2,5%, по меньшей мере на 3%, по меньшей мере на 3,5%, по меньшей мере на 4%, по меньшей мере на 4,5%, по меньшей мере на 5% или по меньшей мере на 5,5% относительно уровня до введения дозы, в частности, при введении в дозе приблизительно 150 мг E2W.
7. Снижение уровня общего холестерина в сыворотке на по меньшей мере от приблизительно 25% до приблизительно 35% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 24 суток.
8. Снижение уровня общего холестерина в сыворотке на по меньшей мере от приблизительно 65% до приблизительно 80% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 24 суток.
9. Снижение уровней триглицеридов в сыворотке на по меньшей мере от приблизительно 25% до приблизительно 40% относительно уровня до введения дозы.
10. Небольшой или отсутствие поддающегося измерению эффекта на функцию печени, при определении по результатам измерения ALT и AST.
11. Небольшой или отсутствие поддающегося измерению эффекта на уровни тропонина.
12. Увеличение одного или нескольких из: уровни общего холестерина, уровни ApoB, уровни С не HDL, соотношение Apo-B/ApoA-1.
В шестнадцатом аспекте настоящее изобретение относится к антителу или его антигенсвязывающему фрагменту, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9), для применения при лечении заболевания или состояния, в которые вовлечена экспрессия или активность PCSK9, где антитело или его антигенсвязывающий фрагмент предназначены для введения в дозе приблизительно от 50 до 500 мг.
В семнадцатом аспекте настоящее изобретение относится к антителу или его антигенсвязывающему фрагменту, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9).
для применения при лечении заболевания или состояния, в которые вовлечена экспрессия или активность PCSK9.
где антитело или его антигенсвязывающий фрагмент предназначены для введения индивидууму, относящемуся по меньшей мере к одной из следующих групп индивидуумов: (i) индивидуумы с уровнем холестерина LDL (LDL-C) в сыворотке по меньшей мере 100 мг/дл (т.е. по меньшей мере 2,6 ммоль/л) или по меньшей мере 115 мг/дл (т.е. по меньшей мере 3,0 ммоль/л); (ii) индивидуумы, имеющие уровень HDL-C в сыворотке менее 40 мг/дл; (iii) индивидуумы, имеющие уровень холестерина в сыворотке по меньшей мере 200 мг/дл; (iv) индивидуумы, имеющие уровень триацилглицерина в сыворотке по меньшей мере 150 мг/дл, где указанный уровень триацилглицеринов определяют натощак после голодания в течение по меньшей мере 8 часов; (v) индивидуумы в возрасте по меньшей мере 18, 24 или 35 лет; (vi) индивидуумы в возрасте 75 лет или моложе; (vii) индивидуумы, имеющие BMI 25 или более или 30 или более; (viii) мужчины; (ix) женщины; (x) индивидуумы, у которых введение указанного антитела или его антигенсвязывающего фрагмента приводит к снижению уровня LDL-C в сыворотке по меньшей мере на 30 мг/дл, по меньшей мере 40 мг/дл, по меньшей мере 45 мг/дл или по меньшей мере 50 мг/дл относительно уровня до введения дозы (особенно после лечения в течение 12 недель); или (xi) индивидуумы, у которых введение указанного антитела или его антигенсвязывающего фрагмента приводит к снижению уровня LDL-C в сыворотке по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65% или по меньшей мере на 70% относительно уровня до введения дозы, особенно после лечения в течение 12 недель).
В восемнадцатом аспекте настоящее изобретение относится к антителу или его антигенсвязывающему фрагменту, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9), для применения при лечении заболевания или состояния, в которые вовлечена экспрессия или активность PCSK9,
где антитело или его антигенсвязывающий фрагмент предназначены для введения индивидууму, который не относится к одной или нескольким из следующих групп индивидуумов: (i) курильщики; (ii) лица в возрасте 70 лет и старше; (iii) лица, страдающие гипертензией; (iv) беременные женщины; (v) женщины, пытающиеся забеременеть; (vi) женщины, кормящие грудью; (vii) лица, которые имеют или когда-либо имели заболевание, поражающее печень; (viii) лица, которые имели какие-либо необъясненные аномальные показатели функции печени в тестах крови; (ix) лица, которые употребляют чрезмерные количества спиртных напитков; (x) лица, имеющие проблемы с почками; (xi) лица, страдающие гипотиреозом; (xii) лица, страдающие мышечными нарушениями; (xiii) лица, ранее сталкивавшиеся с мышечными проблемами в ходе лечения снижающей уровень липидов терапией; (xiv) лица, имеющие серьезные проблемы с дыханием; (xv) лица, принимающие одно или несколько из следующих лекарственных средств: лекарственные средства, изменяющие работу иммунной системы (например, циклоспорин или антигистамины), антибиотики или противогрибковые средства (например, эритромицин, кларитромицин, кетоконазол, итраконазол, рифампицин, фусидовая кислота), лекарственные средства, регулирующие уровень липидов (например, гемфиброзил, колестипол), блокаторы кальциевых каналов (например, верапамил, дилтиазем), лекарственные средства, регулирующие сердечный ритм (дигоксин, амиодарон), ингибиторы протеаз, используемые при лечении ВИЧ (например, нельфинавир), варфарин, пероральные контрацептивы, антациды или зверобой; или (xvi) лица, выпивающие более 0,1 л грейпфрутового сока в сутки; (xvii) лица, имеющие индекс массы тела (BMI) более 40; (xviii) лица, имеющие индекс массы тела (BMI) менее 18; (xix) лица, страдающие диабетом 1 типа или диабетом 2 типа; (xx) лица, положительные по гепатиту B или гепатиту C; или (xxi) лица, имеющие известную чувствительность к лекарственным средствам на основе моноклональных антител.
В девятнадцатом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей антитело или его антигенсвязывающий фрагмент в соответствии с настоящим изобретением, вместе с фармацевтически приемлемым эксципиентом или носителем.
В двадцатом аспекте настоящее изобретение относится к раствору для инъекций, описанному в настоящем описании, содержащему антитело или его антигенсвязывающий фрагмент по настоящему изобретению, и, предпочтительно, содержащему от приблизительно 40 мг до приблизительно 200 мг или от приблизительно 50 до приблизительно 200 мг, например, приблизительно 40 мг, приблизительно 50 мг, приблизительно 75 мг, приблизительно 100 мг, приблизительно 150 мг или приблизительно 200 мг антитела или его антигенсвязывающего фрагмента на объем 1 мл.
В двадцать первом аспекте настоящее изобретение относится к сухому составу, как описано в настоящем описании, содержащему антитело или его антигенсвязывающий фрагмент по настоящему изобретению, и, предпочтительно, содержащему от приблизительно 40 мг до приблизительно 500 мг, от 50 до приблизительно 500 мг, от приблизительно 50 до приблизительно 400, от приблизительно 50 до приблизительно 300, например, приблизительно 40 мг, приблизительно 50 мг, приблизительно 75 мг, приблизительно 100 мг, приблизительно 150 мг, приблизительно 200 мг, приблизительно 250 мг, приблизительно 300 мг, приблизительно 350 мг, приблизительно 400 мг, приблизительно 450 мг или приблизительно 500 мг и, более предпочтительно, приблизительно 50 мг, приблизительно 100 мг, приблизительно 150 мг, приблизительно 200 мг, приблизительно 250 мг, приблизительно 300 мг и, еще более предпочтительно, приблизительно 150 мг, приблизительно 200 мг или приблизительно 300 мг антитела или его антигенсвязывающего фрагмента на дозу.
В двадцать втором аспекте настоящее изобретение относится к антителу или его антигенсвязывающему фрагменту, находящимся в одной из фармацевтических композиций согласно девятнадцатому аспекту.
В двадцать третьем аспекте настоящее изобретение относится к лекарственной форме, содержащей антитело, его антигенсвязывающий фрагмент или фармацевтическую композицию по настоящему изобретению.
В двадцать четвертом аспекте настоящее изобретение относится к изделию, содержащему фармацевтическую композицию по настоящему изобретению, жидкий состав по настоящему изобретению или сухой состав по настоящему изобретению, антитело или его антигенсвязывающий фрагмент по настоящему изобретению или одну или несколько лекарственной форм по настоящему изобретению и контейнер или упаковку.
В двадцать пятом аспекте настоящее изобретение относится к изделию, содержащему: (a) упаковочный материал; (b) антитело или его антигенсвязывающий фрагмент, которые специфично связывают hPCSK9; и (c) ярлык или вкладыш в упаковку, находящиеся в упаковочном материале, на которых указано, что пациентов, которым проводят лечение указанным антителом или антигенсвязывающим фрагментом, можно лечить от заболевания или состояния, выбранного из группы, состоящей из гиперхолестеринемии, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний, и, кроме того, указано, что можно лечить индивидуумов, относящихся к одной или нескольким группам индивидуумов, как указано в тринадцатом аспекте.
В двадцать шестом аспекте настоящее изобретение относится к изделию, содержащему: (a) упаковочный материал; (b) антитело или его антигенсвязывающий фрагмент, которые специфично связывают hPCSK9; и (c) ярлык или вкладыш в упаковку, находящиеся в упаковочном материале, на которых указано, что пациентов, которым проводят лечение указанным антителом или антигенсвязывающим фрагментом, можно лечить от заболевания или состояния, выбранного из группы, состоящей из гиперхолестеринемии, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний, и, кроме того, указано, что лечение пациентов указанным антителом или его антигенсвязывающим фрагментом противопоказано для пациентов, относящихся к одной или нескольким группам индивидуумов, как указано в четырнадцатом аспекте.
В двадцать седьмом аспекте настоящее изобретение относится к фармацевтической композиции или антителу или его антигенсвязывающего фрагмента по настоящему изобретению, таким как в соответствии с пятнадцатым или девятнадцатым аспектом настоящего изобретения, для применения при лечении заболевания или состояния, в которые вовлечена экспрессия или активность PCSK9.
В двадцать восьмом аспекте настоящее изобретение относится к способу получения фармацевтической композиции по настоящему изобретению, например, в соответствии с девятнадцатым аспектом, включающему смешение антитела или его антигенсвязывающего фрагмента и необязательно ингибитора HMG-CoA-редуктазы с одним или несколькими фармацевтическими эксципиентами или носителями.
В двадцать девятом аспекте настоящее изобретение относится к способу получения лекарственной формы по настоящему изобретению, включающему отмеривание количества фармацевтической композиции, антитела или его антигенсвязывающего фрагмента, жидкого состава или сухого состава в соответствии с настоящим изобретением, включающих одну или нескольких доз антитела или его антигенсвязывающего фрагмента, и необязательно ингибитора HMG-CoA-редуктазы, и преобразование их в физически дискретные единицы, пригодные в качестве единичных дозировок для введения человеку и/или животному.
В тридцатом аспекте настоящее изобретение относится к способу получению или сборки изделия по настоящему изобретению, включающему упаковывание фармацевтической композиции, антитела, жидкого состава, сухого состава или одной или нескольких лекарственных форм по настоящему изобретению в контейнер, необязательно вместе с одним или несколькими из следующих: ярлык, инструкции по применению, устройство для применения.
В тридцать первом аспекте настоящее изобретение относится к способу исследования эффективности антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9, для лечения заболевания или состояния, выбранного из группы, состоящей из гиперхолестеринемии, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний, причем указанный способ включает:
лечение выбранной группы пациентов указанным антителом или его антигенсвязывающим фрагментом, где каждый пациент в указанной группе имеет уровень холестерина LDL (LDL-C) более 100 мг/дл; и
определение эффективности указанного антитела или его антигенсвязывающего фрагмента путем определения уровня LDL-C в группе пациентов до и после введения указанного антитела или его антигенсвязывающего фрагмента, где снижение уровня LDL-C по меньшей мере на 25% относительно уровня до введения дозы по меньшей мере у 75% группы пациентов указывает на то, что указанные антитело или его антигенсвязывающий фрагмент являются эффективными для лечения указанного заболевания или состояния в указанной группе пациентов;
где каждый пациент относится к одной или нескольким группам индивидуумов, как указано в тринадцатом аспекте.
В тридцать втором аспекте настоящее изобретение относится к способу исследования эффективности антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9, для лечения заболевания или состояния, выбранного из группы, состоящей из гиперхолестеринемии, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний, причем указанный способ включает:
определение эффективности антитела или его антигенсвязывающего фрагмента, которые используют для лечения выбранной группы пациентов указанным антителом или его антигенсвязывающим фрагментом, где каждый пациент в указанной группе имеет уровень холестерина LDL (LDL-C) более 100 мг/дл, путем определения уровня LDL-C в группе пациентов до и после введения указанного антитела или его антигенсвязывающего фрагмента, где снижение уровня LDL-C по меньшей мере на 25% относительно уровня до введения дозы по меньшей мере у 75% группы пациентов указывает на то, что указанные антитело или его антигенсвязывающий фрагмент являются эффективными для лечения указанного заболевания или состояния в указанной группе пациентов;
где каждый пациент относится к одной или нескольким группам индивидуумов, как указано в тринадцатом аспекте.
В тридцать третьем аспекте настоящее изобретение относится к способу исследования эффективности соединения в отношении снижения уровней холестерина у индивидуума, включающему стадии: (a) предоставление животного отряда грызунов; (b) введение антитела или его антигенсвязывающего фрагмента, которые специфично связывают PCSK9, животному отряда грызунов; (c) введение исследуемого соединения указанному животному отряда грызунов; (d) определение эффекта исследуемого соединения у животного отряда грызунов, где снижение уровня холестерина у животного отряда грызунов по сравнению с уровнем холестерина у контрольного животного указывает на то, что исследуемое соединение является эффективным в отношении снижения уровней холестерина у индивидуума, где контрольное животное представляет собой животное того же вида, что и указанное животное отряда грызунов, и где контрольному животному не вводили исследуемое соединение.
В тридцать четвертом аспекте настоящее изобретение относится к способу усиления активности снижения уровней LDL-C у индивидуума, которому проводят терапию статином, причем способ включает введение индивидууму антитела или его антигенсвязывающего фрагмента, которые специфично связываются с конвертазой пробелков типа субтилизина/кексина человека 9 (hPCSK9), где антитело или его антигенсвязывающий фрагмент вводят в дозировке в диапазоне от приблизительно 5 мг до приблизительно 500 мг, тем самым, усиливая активность терапии статином в отношении снижения LCL-C у индивидуума.
В тридцать пятом аспекте настоящее изобретение относится набору для лечения увеличенных уровней холестерина липопротеинов низкой плотности (LDL-C) у индивидуума, причем набор содержит (a) фармацевтическую лекарственную форму, содержащую антитело или его антигенсвязывающей фрагмент, которые специфично связываются с hPCSK9; и фармацевтически приемлемый носитель, где антитело или его антигенсвязывающий фрагмент присутствуют в дозировке в диапазоне от приблизительно 5 мг до приблизительно 500 мг; и (b) ярлык или вкладыш в упаковку с инструкциями по применению.
В тридцать шестом аспекте настоящее изобретение относится к способу лечения индивидуума, страдающего заболеванием или нарушением, характеризующимся повышенными уровнями холестерина липопротеинов низкой плотности (LDL-C), причем способ включает:
(a) выбор индивидуума с уровнем LDL-C в крови более 100 мг/дл; и
(b) введение указанному индивидууму композиции, содержащей антитело или его антигенсвязывающий фрагмент, которые специфично связываются с конвертазой пробелков типа субтилизина/кексина человека 9 (hPCSK9); тем самым, снижая уровни холестерина у индивидуума, нуждающегося в этом.
В двадцать шестом аспекте настоящее изобретение относится к способу снижения уровней холестерина у индивидуума, нуждающегося в этом, включающему:
(a) выбор индивидуума с уровнем холестерина липопротеинов низкой плотности (LDL-C) более 100 мг/дл; и
(b) введение указанному индивидууму композиции, содержащей антитело или его антигенсвязывающий фрагмент, которые специфично связываются с конвертазой пробелков типа субтилизина/кексина человека 9 (hPCSK9); тем самым, снижая уровни холестерина у индивидуума, нуждающегося в этом.
В этом разделе "Сущность изобретения" не обязательно описаны все признаки настоящего изобретения. Другие варианты осуществления станут очевидными из обзора нижеследующего подробного описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
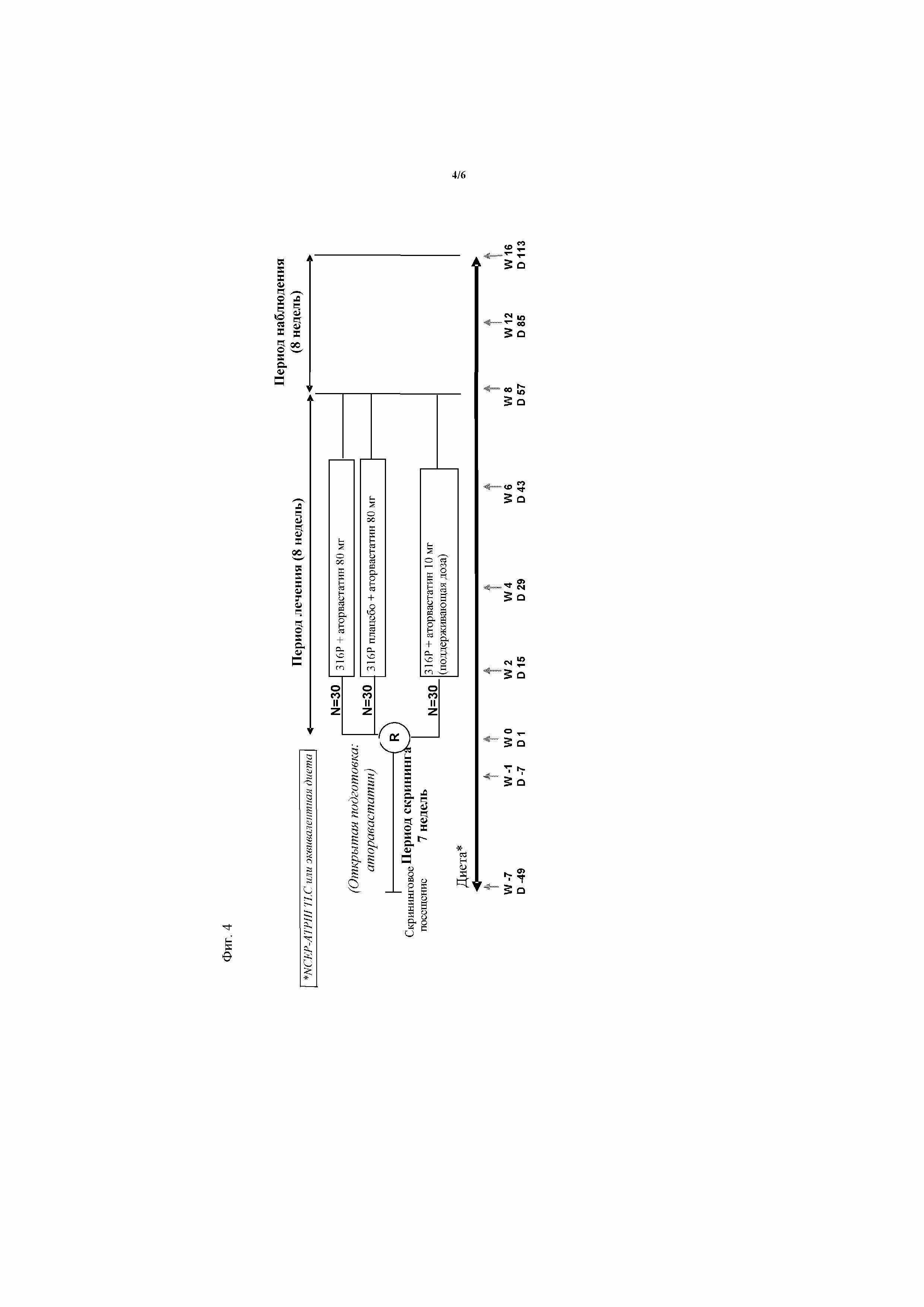
На фиг.1 представлено процентное снижение уровней холестерина LDL (LDL-C) относительно исходного уровня для трех групп пациентов при введении антитела против PCSK9 316P. Эти группы пациентов представляют собой: (1) пациенты с семейной гиперхолестеринемией (HeFH); (2) пациенты с другими формами первичной гиперхолестеринемии (не-FH) на диете или со стабильной терапией аторвастатином; и (3) пациенты с другими формами первичной гиперхолестеринемии (не-FH) только на диете. Дозу 50 мг антитела против PCSK9 вводили подкожно на 1, 29 и 43. Результаты для групп пациентов, которым вводили антитело (50-мг-FH-нет; 50-мг-FH-да; 50-мг-комбинация), представлены сплошными линиями, в то время как пациенты, которым вводили плацебо (PBO-FH-нет; PBO-FH-да; PBO-комбинация) представлены пунктирными линиями.
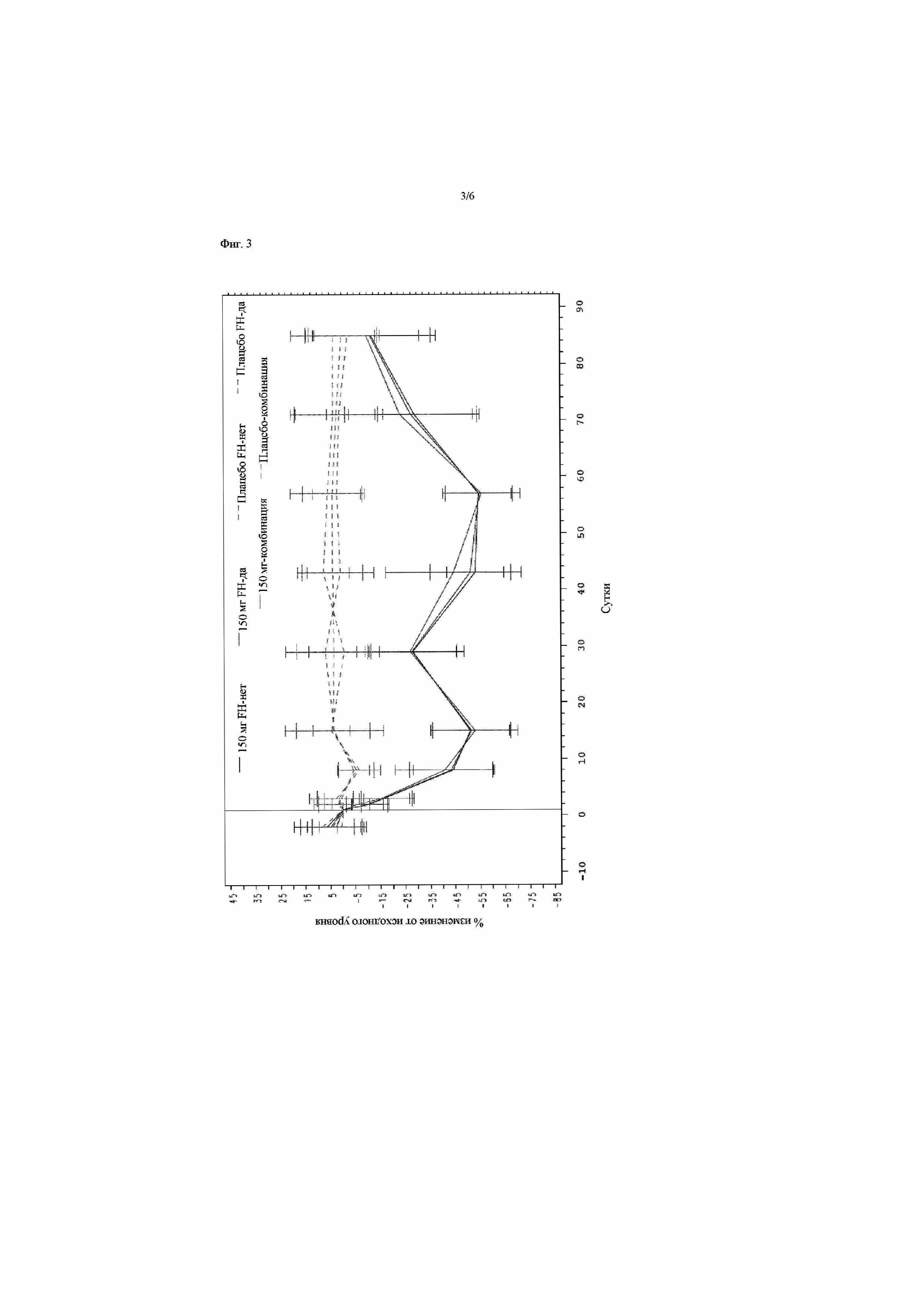
На фиг.2 представлено процентное снижение уровней холестерина LDL (LDL-C) относительно исходного уровня для трех групп пациентов при введении антитела против PCSK9 316P. Эти группы пациентов представляют собой: (1) пациенты с семейной гиперхолестеринемией (HeFH); (2) пациенты с другими формами первичной гиперхолестеринемии (не-FH) на диете или со стабильной терапией аторвастатином; и (3) пациенты с другими формами первичной гиперхолестеринемии (не-FH) только на диете. Дозу 100 мг антитела против PCSK9 вводили подкожно на сутки 1, 29 и 43. Результаты для групп пациентов, которым вводили антитело (100-мг-FH-нет; 100-мг-FH-да; 100-мг-комбинация) представлены сплошными линиями, в то время как пациенты, которым вводили плацебо (PBO-FH-нет; PBO-FH-да; PBO-комбинация) представлены пунктирными линиями.
На фиг.3 представлено процентное снижение уровней холестерина LDL (LDL-C) относительно исходного уровня для трех групп пациентов при введении антитела против PCSK9 316P. Эти группы пациентов представляют собой: (1) пациенты с семейной гиперхолестеринемией (HeFH); (2) пациенты с другими формами первичной гиперхолестеринемии (не-FH) на диете или со стабильной терапией аторвастатином; и (3) пациенты с другими формами первичной гиперхолестеринемии (не-FH) только на диете. Дозу 100 мг антитела против PCSK9 вводили подкожно на 1, 29 и 43 сутки. Результаты для групп пациентов, которым вводили антитело (150-мг-FH-нет; 150-мг-FH-да; 150-мг-комбинация) представлены сплошными линиями, в то время как пациенты, которым вводили плацебо (PBO-FH-нет; PBO-FH-да; PBO-комбинация) представлены пунктирными линиями.
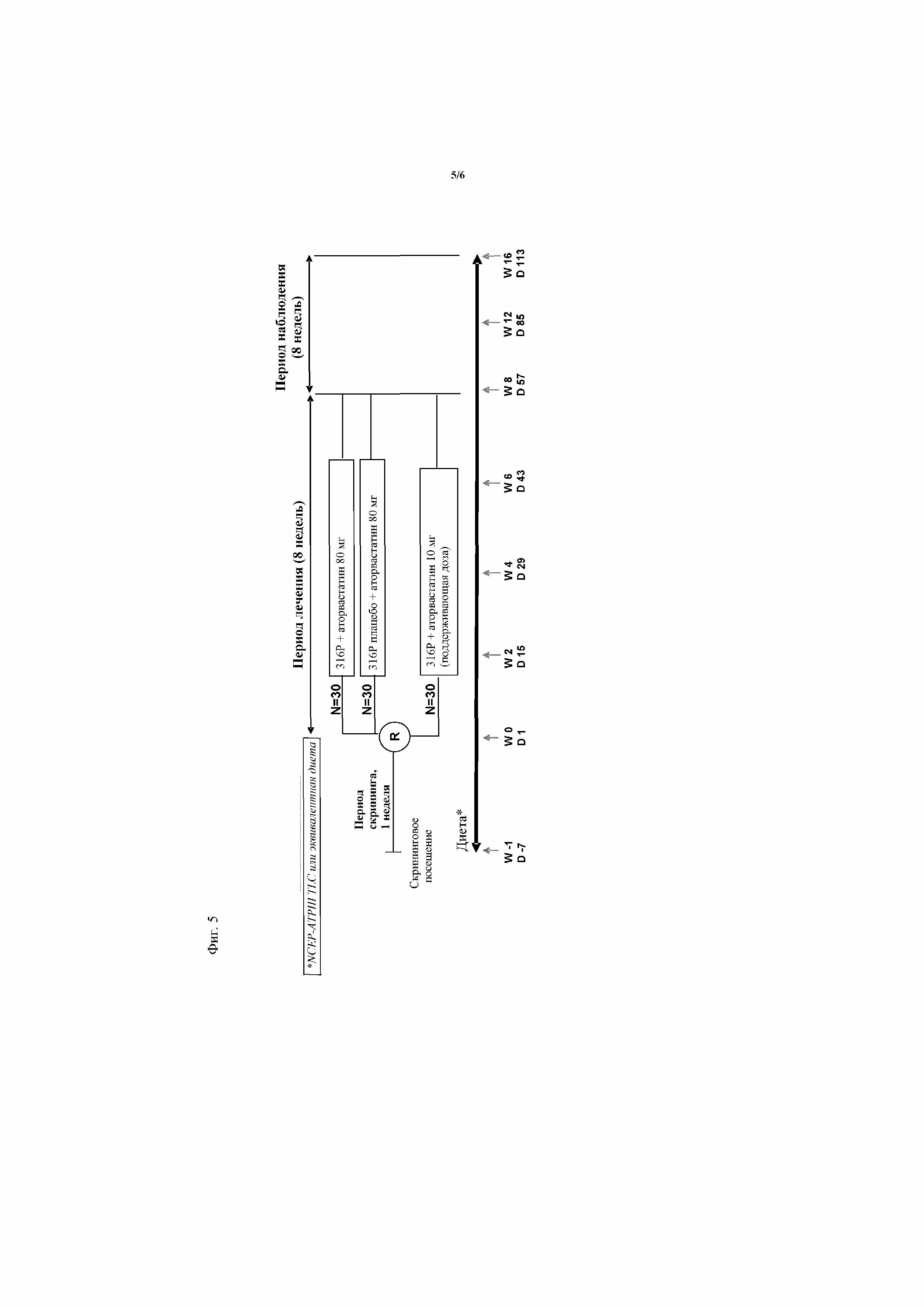
На фиг.4 представлена схема исследования для испытания 2 у группы пациентов, которым проводили снижающую уровень липидов терапию, отличную от аторвастатина, или которым не проводили терапию стабильной дозой аторвастатина 10 мг в течение по меньшей мере 6 недель перед скринингом, или пациентов, не подвергавшихся воздействию лекарственных средств.
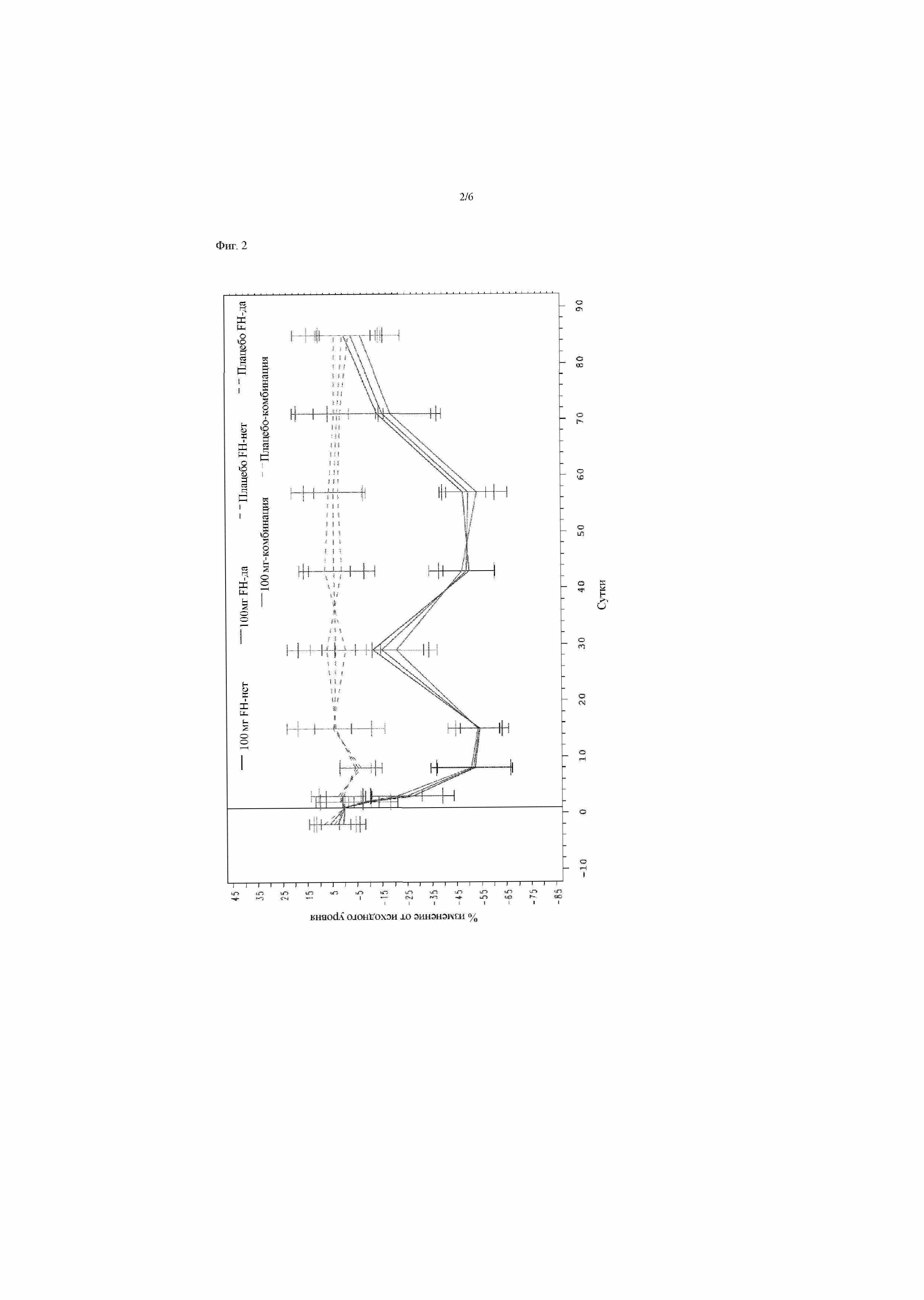
На фиг.5 представлена схема исследования для испытания 2 у группы пациентов, которых лечили 10 мг аторвастатина в стабильной дозе на протяжении по меньшей мере 6 недель перед скринингом.
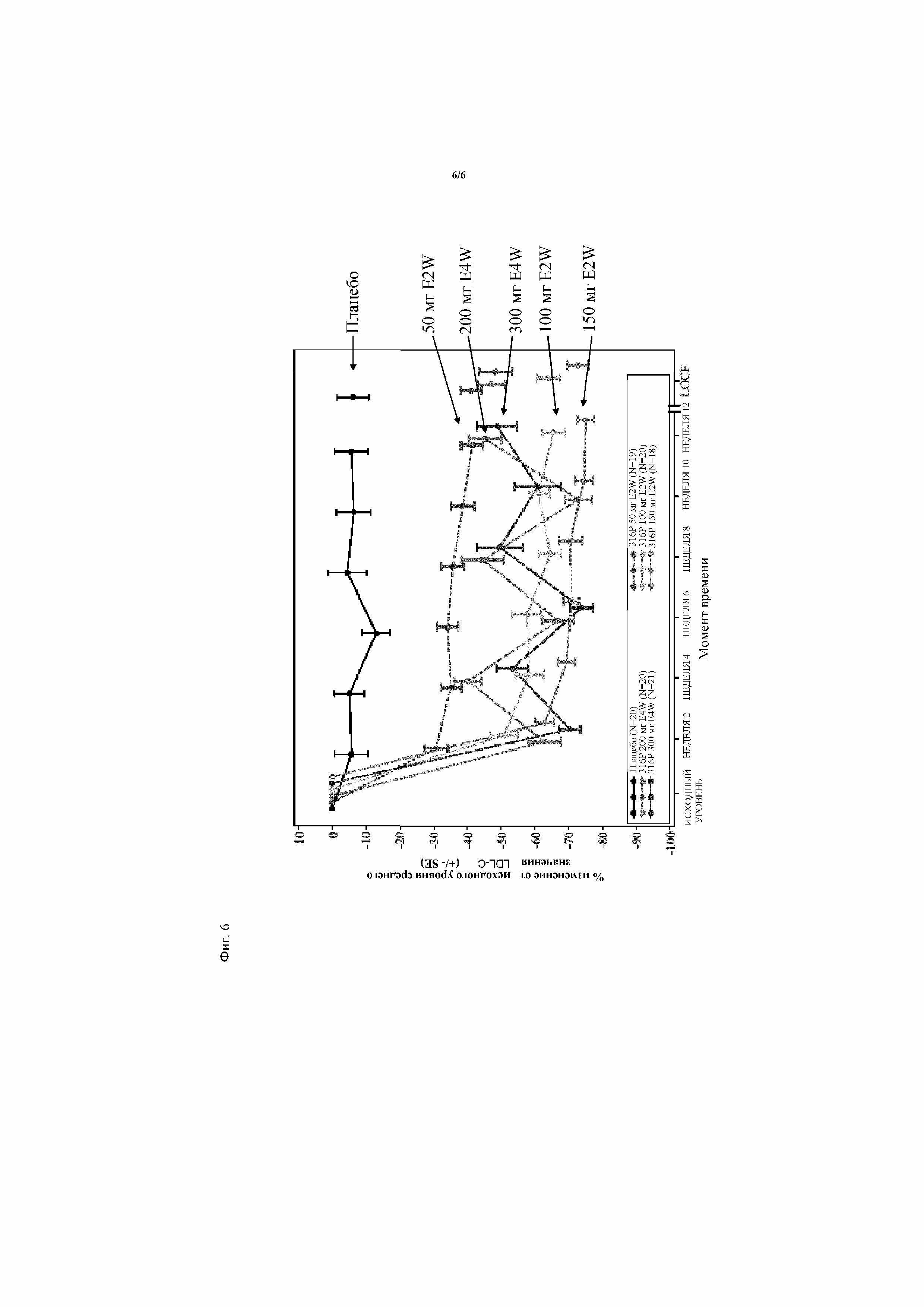
На фиг.6 представлено распределение средних величин LDL-C у пациентов испытания 1, которых лечили антителом 316P при стабильной дозе аторвастатина на протяжении 12 недель и LOCF (последнее проведенное наблюдение). Исследование было предназначено для оценки эффективности и безопасности антитела 316P у пациентов с гиперхолестеринемией с повышенным уровнем LDL-C (≥100 мг/дл или 2,59 ммоль/л), которым вводили стабильную дозу аторвастатина (10 мг, 20 мг или 40 мг). В ходе подготовительного периода пациентов стабилизировали в отношении лечения аторвастатином (10 мг, 20 мг или 40 мг), если они не были уже стабилизированы. После одной дополнительной недели пациентов централизованно случайным образом распределяли через IVRS/IWRS в соотношении 1:1:1:1:1:1 в одну из 6 групп лечения (плацебо, 316P 50 мг E2W, 316P 100 мг E2W, 316P 150 мг E2W, 316P 200 мг E4W, 316P 300 мг E4W) и проводили лечение двойным слепым способом в течение приблизительно 12 недель. Рандомизация Thr стратифицирована по дозе аторвастатина, вводимой перед введением. В ходе периода двойного слепого введения пациенты возвращались на их участок каждые 2 недели для проведения исследуемого введения (316P или плацебо). Затем после периода двойного слепого лечения следовал период наблюдения в течение 8 недель. Как может быть установлено из фиг.6, все группы лечения, за исключением группы пациентов, которым вводили плацебо, имели значительное и устойчивое снижение уровней LDL-C на протяжении всего периода испытания.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
Перед подробным описанием настоящего изобретения следует понимать, что это изобретение не ограничивается конкретной методологией, протоколами и реагентами, описанными в настоящем описании, поскольку они могут варьировать. Также следует понимать, что терминология, используемая в настоящем описании, предназначена только для описания конкретных вариантов осуществления, и не предназначена для ограничения объема настоящего изобретения, который ограничивается только прилагаемой формулой изобретения, если не определено иначе, все технические и научные термины, используемые в настоящем описании, имеют то же значение, которое обычно подразумевает специалист в области, к которой относится настоящее изобретение.
Предпочтительно, термины, используемые в рамках настоящего изобретения, определены, как описано в "A multilingual glossary of biotechnological terms: (IUPAC Recommendations)", Leuenberger, H.G.W, Nagel, B. и Kölbl, H. eds. (1995), Helvetica Chimica Acta, CH-4010 Basel, Switzerland).
На протяжении описания и формулы изобретения, которые следуют, если контекст не требует иного, слово "содержать" и его варианты, такие как "содержит" и "содержащий", следует понимать как подразумевающие включение числа или стадии или группы чисел или стадий, но не исключение какого-либо другого числа или группы чисел или стадии.
На протяжении текста настоящего описания цитировано несколько документов (например: патентов, патентных заявок, научных публикаций, описаний изготовителей, данных о последовательностях, представленных под номером доступа GenBank и т.д.). Ничто в настоящем документе не следует истолковывать как допущение того, что это изобретение дает право на противопоставление факта создания изобретения с более ранним приоритетом. Некоторые из документов, цитированных в настоящем описании, характеризуются как "включенные в качестве ссылки". В случае противоречия между определениями и идеями таких включенных ссылок и определений или указаний, цитированных в настоящем описании, текст настоящего описания имеет приоритет.
Последовательности: все последовательности, упоминаемые в настоящем описании, описаны в прилагаемом списке последовательностей, полное содержание и раскрытие которого являются частью настоящего описания.
Подразумевают, что термин "приблизительно", когда его используют применительно к числовой величине, охватывает числовые величины в диапазоне, имеющем нижний предел, который на 5% ниже, чем указанная числовая величина, и имеющем верхний предел, который на 5% превышает указанную числовую величину.
Термин "конвертаза пробелков типа субтилизина/кексина человека 9" или "hPCSK9", как используют в рамках изобретения, относится к hPCSK9, имеющей последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 754, и аминокислотную последовательность SEQ ID NO: 755, или ее биологически активному фрагменту.
Термины "специфично связывает", "специфичное связывание" и т.п., означают, что антитело или его антигенсвязывающий фрагмент образуют комплекс с антигеном, который относительно стабилен при физиологических условиях. Специфическое связывание может быть охарактеризовано с помощью равновесной константы диссоциации, составляющей по меньшей мере приблизительно 1×10-6 M или менее (например, меньшая KD обозначает более прочное связывание). Способы определения того, связываются ли две молекулы специфически, хорошо известны в данной области и включают, например, равновесный диализ, поверхностный плазмонный резонанс и т.п. Однако выделенное антитело, которое специфично связывает hPCSK9, может проявлять перекрестную реактивность в отношении других антигенов, таких как молекулы PCSK9 из других видов. Более того, полиспецифические антитела (например, биспецифические), которые связываются с hPCSK9 и одним или несколькими дополнительными антигенами, тем не менее, считаются антителами, которые "специфично связывают" hPCSK9, как используют в рамках изобретения.
Термин "KD", как используют в рамках изобретения, относится к равновесной константе диссоциации конкретного взаимодействия антитело-антиген. Равновесную константу диссоциации, как правило, измеряют в "моль/л" (сокращенно обозначается как "M").
Под термином "медленная константа диссоциации", "Koff" или "kd" подразумевают антитело, которое диссоциирует от hPCSK9 с константой скорости 1×10-3 c-1 или менее, предпочтительно, 1×10-4 c-1 или менее, при определении с использованием поверхностного плазмонного резонанса, например, BIACORE™.
Термин антитело с "высокой аффинностью" относится к mAb, имеющим аффинность связывания с hPCSK9 по меньшей мере 10-10 M; предпочтительно, 10-11 M; еще более предпочтительно, 10-12 M, при измерении с использованием поверхностного плазмонного резонанса, например, BIACORE™ или аффинной ELISA в растворе.
Термин "поверхностный плазмонный резонанс", как используют в рамках изобретения, относится к оптическому явлению, которое позволяет анализ биоспецифических взаимодействий в реальном времени путем детекции изменений концентраций белка в биосенсорной матрице, например, с использованием системы BIACORE™ (Pharmacia Biosensor AB, Uppsala, Sweden and Piscataway, N.J.).
"Эпитоп", также известный как антигенная детерминанта, представляет собой область антигена, которая распознается иммунной системой, в частности, антителами, B-клетками или T-клетками. Как используют в рамках изобретения, "эпитоп" является частью антигена, которая может связываться антителом или его антигенсвязывающим фрагментом, как описано в настоящем описании. В этом контексте термин "связывание", предпочтительно, относится к "специфическому связыванию", как определено в настоящем описании. Эпитопы обычно состоят из химически активных поверхностных групп молекул, таких как аминокислоты, боковые цепи сахаров, фосфорильные группы или сульфонильные группы, и могут иметь определенные трехмерные структурные характеристики и/или определенные зарядовые характеристики. Конформационные и неконформационные эпитопы могут отличаться тем, что связывание первых, но не последних из них утрачивается в присутствии денатурирующих растворителей.
"Паратоп" является частью антитела, которая специфично связывается с эпитопом.
Термин "антитело", как используют в рамках изобретения, относится к молекулам иммуноглобулинов, содержащим четыре полипептидных цепи: две тяжелых (H) цепи и две легких (L) цепи, связанных дисульфидными связями. Термин "антитело" также включает все рекомбинантные формы антител, в частности, антитела, описанные в настоящем описании, например, антитела, экспрессируемые у прокариот, негликозилированные антитела и любые антигенсвязывающие фрагменты и производные антител, как описано ниже. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи ("HCVR" или "VH") и константной области тяжелой цепи (состоящей из доменов CH1, CH2 и CH3). Каждая легкая цепь состоит из вариабельной области легкой цепи ("LCVR или "VL") и константной области легкой цепи (CL). Области VH и VL можно далее подразделять на области гипервариабельности, называемые определяющими комплементарность областями (CDR), между которыми распределены области, которые являются более консервативными, называемые каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных с N-конца к С-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат связывающий домен, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, включая различные клетки иммунной системы (например, эффекторные клетки) и первый компонент (C1q) классической системы комплемента.
Также возможна замена одного или нескольких остатков CDR или отсутствие одной или нескольких CDR. В научной литературе описаны антитела, в которых можно обходиться без одной или двух CDR. Padlan et al. (1995 FASEB J. 9:133-139) проанализировали контактные области между антителами и их антигенами, исходя из опубликованных кристаллических структур, и сделали заключение, что только приблизительно от одной пятой до одной трети остатков CDR в действительно контактируют с антигеном. Padlan также открыл множество антител, в которых одна или две CDR не имеют аминокислот, контактирующих с антигеном (также см. Vajdos et al. 2002 J Mol Biol 320:415-428).
Остатки CDR, не контактирующие с антигеном, можно идентифицировать, исходя из предшествующих исследований (например, часто не требуются остатки H60-H65 в CDRH2), в областях CDR по Kabat, находящихся вне CDR по Chothia, путем молекулярного моделирования и/или эмпирически. Если CDR или ее остаток(и) отсутствуют, они обычно заменены аминокислотой, занимающей соответствующее положение в другой последовательности антитела человека или консенсусным остатком таких последовательностей. Положения для замены в CDR и аминокислоты для замены также можно выбирать эмпирически. Эмпирические замены могут представлять собой консервативные или неконсервативные замены.
Термин "антигенсвязывающий фрагмент" антитела (или просто "связывающая часть"), как используют в рамках изобретения, относится к одному или нескольким фрагментам антитела, которые сохраняют способность специфично связываться с hPCSK9. Было показано, что антигенсвязывающую функцию антитела могут выполнять фрагменты полноразмерного антитела. Примеры связывающих фрагментов, охватываемых термином "антигенсвязывающий фрагмент" антитела, включают (i) Fab-фрагменты, одновалентные фрагменты, состоящие из доменов VL, VH, CL и CH; (ii) F(ab')2-фрагменты, двухвалентные фрагменты, содержащие два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагменты, состоящие из VH- и CH-доменов; (iv) Fv-фрагменты, состоящие из VL- и VH-доменов одного плеча антитела, (v) dAb-фрагменты (Ward et al., (1989) Nature 341: 544-546), которые состоят из VH-домена; (vi) выделенные определяющие комплементарность области (CDR), и (vii) комбинации двух или более выделенных CDR, которые необязательно могут быть связаны синтетическим линкером. Более того, хотя два домена Fv-фрагмента, VL и VH, кодируются отдельными генами, их можно связывать с использованием рекомбинантных способов через синтетический линкер, который обеспечивает образование ими единой белковой цепи, в которой области VL и VH образуют пару с формированием одновалентных молекул (известных как одноцепочечный Fv (scFv); см. например, Bird et al. (1988) Science 242: 423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85: 5879-5883). Такие одноцепочечные антитела также охватываются термином "антигенсвязывающий фрагмент" антитела. Следующим примером является слитый белок связывающий домен-иммуноглобулин, содержащий (i) полипептид связывающего домена, который является слитым с полипептидом шарнирной области иммуноглобулина, (ii) константную область CH2 тяжелой цепи иммуноглобулина, слитую с шарнирной областью, и (iii) константную область CH3 тяжелой цепи иммуноглобулина, слитую с константной областью CH2. Полипептид связывающего домена может представлять собой вариабельную область тяжелой цепи или вариабельную область легкой цепи. Слитые белки связывающий домен-иммуноглобулин дополнительно описаны в US 2003/0118592 и US 2003/0133939. Эти фрагменты антител получают с использованием общепринятых способов, известных специалистам в данной области, и фрагменты подвергают скринингу в отношении применимости аналогично тому, как и целые антитела. Следующими примерами "антигенсвязывающих фрагментов" являются так называемые микроантитела, которые происходят из единичных CDR. Например, Heap et al. описывают микроантитело из 17 аминокислотных остатков, происходящее из CDR3 тяжелой цепи антитела, направленного против гликопротеина оболочки gp120 ВИЧ-1 (Heap CJ et al. (2005) J. Gen. Virol. 86:1791-1800). Другие примеры включают небольшие миметики антител, содержащие две или более областей CDR, которые слиты друг с другом, предпочтительно, через собственные родственные им каркасные области. Такой небольшой миметик антитела, содержащий CDR1 VH и CDR3 VL, связанные через родственную FR2 VH, описан Qiu et al. (Qiu X-Q, et al. (2007) Nature biotechnology 25(8):921-929).
Таким образом, термин "антитело или его антигенсвязывающий фрагмент", как используют в рамках изобретения, относится к молекулам иммуноглобулинов и иммунологически активным частям молекул иммуноглобулинов, т.е. к молекулам, которые содержат антигенсвязывающий центр, который иммуноспецифически связывает антиген.
Антитела и их антигенсвязывающие фрагменты, пригодные в рамках изобретения, могут быть из любого животного, включая птиц и млекопитающих. Предпочтительно, антитела или фрагменты происходят из человека, шимпанзе, грызунов (например, мышь, крыса, морская свинка или кролика), курицы, индейки, свиньи, овцы, козы, верблюда, коровы, лошади, осла, кошки или собаки. Особенно предпочтительно, чтобы антитела происходили из человека или мыши. Антитела по изобретению также включают химерные молекулы, в которых константная область антитела, происходящая из одного вида, предпочтительно, человека, скомбинирована с антигенсвязывающим центром, происходящим из другого вида, например, мыши. Более того, антитела по изобретению включают гуманизированные молекулы, в которых антигенсвязывающие центры антитела, происходящие из не являющегося человеком вида (например, из мыши) скомбинированы с константными и каркасными областями, происходящими из человека.
Как проиллюстрировано в настоящем описании, антитела по изобретению можно получать непосредственно из гибридом, которые экспрессируют антитело, или можно клонировать и рекомбинантно экспрессировать в клетке-хозяине (например, клетке CHO или лимфоците). Примерами клеток-хозяев являются микроорганизмы, такие как E. coli, и грибы, такие как дрожжи. Альтернативно их можно получать рекомбинантными способами в трансгенном не являющемся человеком животном или растении.
Термин "химерное антитело" относится к антителам, где одна часть каждой из аминокислотных последовательностей тяжелой и легкой цепей гомологична соответствующим последовательностям в антителах, происходящих из конкретного вида или относящихся к конкретному классу, в то время как остальной сегмент цепи гомологичен соответствующим последовательностям в другом виде или классе. Как правило, вариабельная область как легкой, так и тяжелой цепей, имитирует вариабельные области антител, происходящих из одного вида млекопитающих, в то время как константные части гомологичны последовательностям антител, происходящим из другого вида. Одно явное преимущество таких химерных форм состоит в том, что вариабельная область может быть удобным образом получена из известных в настоящее время источников с использованием свободно доступных B-клеток или гибридом из не являющихся человеком организмов-хозяев в комбинации с константными областями, происходящими, например, из препаратов клеток человека. Хотя вариабельная область имеет преимущество простоты получения и на ее специфичность не влияет источник, константная область, являющаяся человеческой, с меньшей вероятностью вызовет иммунный ответ у человека при инъекции антител, чем константная область из не являющегося человеком источника. Однако это определение не ограничивается конкретным примером.
Термин "гуманизированное антитело" относится к молекуле, имеющей антигенсвязывающий центр, который по существу происходит из иммуноглобулина не являющегося человеком вида, где остальная структура иммуноглобулина в молекуле основана на структуре и/или последовательности иммуноглобулина человека. Антигенсвязывающий центр может содержать либо полные вариабельные домены, слитые с константными доменами, либо только определяющие комплементарность области (CDR), пересаженные в подходящие каркасные области в вариабельных доменах. Антигенсвязывающие центры могут быть дикого типа или могут быть модифицированы посредством одной или нескольких аминокислотных замен, например, они могут быть модифицированы так, чтобы в большей степени напоминать иммуноглобулины человека. Некоторые формы гуманизированных антител сохраняют все последовательности CDR (например, гуманизированное антитело мыши, которое содержит все шесть CDR их антитела мыши). Другие формы имеют одну или несколько CDR, которые изменены в отношении исходного антитела.
Специалисту в данной области известны различные способы гуманизации антител, как описано Almagro & Fransson, содержание которой включено в настоящее описание в качестве ссылки в полном объеме (Almagro JC и Fransson J (2008) Frontiers in Bioscience 13:1619-1633). Almagro & Fransson разделяют рациональные подходы и эмпирические подходы. Рациональные подходы характеризуются получением нескольких вариантов полученных способами инженерии антител и оценкой их связывания или любого другого представляющего интерес свойства. Если сконструированные варианты не дают ожидаемых результатов, начинают новый цикл конструирования и оценки связывания. Рациональные подходы включают пересадку CDR, изменение поверхности, супергуманизацию, и оптимизацию содержимого в цепях человека. Напротив, эмпирические подходы основаны на получении больших библиотек гуманизированных вариантов и выборе наилучших клонов с использованием технологий обогащения и высокопроизводительного скрининга. Таким образом, эмпирические подходы зависят от надежной системы отбора и/или скрининга, которая способна проводить поиск в широком множестве вариантов антител. Технологии дисплея in vitro, такие как фаговый дисплей и рибосомный дисплей, удовлетворяют этим требованиям и хорошо известны специалисту в данной области. Эмпирические подходы включают библиотеки FR, направленную селекцию, шаффлинг каркасных областей и инженерию антител человека.
Термин "антитело человека", как используют в рамках изобретения, включает антитела, имеющие вариабельные и константные области, происходящие из последовательностей иммуноглобулинов человека эмбрионального типа. mAb человека по изобретению могут включать аминокислотные остатки, не кодируемые последовательностями иммуноглобулинов человека эмбрионального типа (например, мутации, внесенные случайным или сайт-специфическим мутагенезом in vitro или путем соматической мутации in vivo), например, в CDR и, в частности, CDR3. Однако термин "антитело человека", как используют в рамках изобретения, не включает mAb, в которых последовательности CDR, происходящие из зародышевой линии другого вида млекопитающих (например, мыши), пересажены в последовательности FR человека. Антитела человека по изобретению включают антитела, выделенные из библиотек иммуноглобулинов человека или из животных, трансгенных по одному или нескольким иммуноглобулинам человека, и которые не экспрессируют эндогенные иммуноглобулины, как описано, например, в патенте США № 5939598, Kucherlapati & Jakobovits.
Термин "моноклональные антитело", как используют в рамках изобретения, относится к получению молекул антител с одной молекулярной композицией. Моноклональные антитело проявляет одну специфичность и аффинность связывания в отношении конкретного эпитопа. В одном из вариантов осуществления моноклональные антитела продуцируются гибридомой, которая включает B-клетку, полученную из не являющегося человеком животного, например, мыши, слитую с иммортализованной клеткой.
Термин "рекомбинантный антитело", как используют в рамках изобретения, включает все антитела, которые получают, экспрессируют, создают или выделяют рекомбинантными способами, такие как (a) антитела, выделенные из животного (например, мыши), которое является трансгенным или трансхромосомным в отношении генов иммуноглобулинов или гибридомы, полученной из этого животного, (b) антитела, выделенные из клетки-хозяина, трансформированной для экспрессии антитела, например, из трансфектомы, (c) антитела, выделенные из рекомбинантной комбинаторной библиотеки антител, и (d) антитела, полученные, экспрессированные, созданные или выделенные любыми другими способами, которые вовлекают сплайсинг последовательностей генов иммуноглобулинов с другими последовательностями ДНК.
Термин "трансфектома", как используют в рамках изобретения, включает рекомбинантные эукариотические клетки-хозяева, экспрессирующие антитело, такие как клетки CHO, клетки NS/0, клетки HEK293, клетки HEK293T, клетки растений или клетки грибов, в том числе клетки дрожжей.
Как используют в рамках изобретения, "гетерологичное антитело" определяют применительно к трансгенному организму, продуцирующему такое антитело. Этот термин относится к антителу, имеющему аминокислотную последовательность или кодирующему последовательность нуклеиновой кислоты, соответствующую последовательности, встречающейся в организме, не являющемся трансгенным организмом, и, как правило, происходящему из видов, отличных от трансгенного организма.
Как используют в рамках изобретения, "гетерогибридное антитело" относится к антителу, имеющему легкие и тяжелые цепи, происходящие из различных организмов. Например, антитело, имеющее тяжелую цепь человека, связанную с легкой цепью мыши, представляет собой гетерогибридное антитело.
Таким образом, "антитела и их антигенсвязывающие фрагменты", подходящие для применения в настоящем изобретении, включают, но не ограничиваются ими, поликлональные, моноклональные, одновалентные, биспецифические, гетероконъюгированные, полиспецифические, рекомбинантные, гетерологичные, гетерогибридные, химерные, гуманизированные (в частности, с пересаженными CDR), деиммунизированные антитела или антитела человека, Fab-фрагменты, Fab'-фрагменты, F(ab')2-фрагменты, фрагменты, продуцируемые экспрессирующей Fab библиотекой, Fd, Fv, связанные дисульфидной связью Fv (dsFv), одноцепочечные антитела (например, scFv), диатела или тетратела (Holliger P. et al. (1993) Proc. Natl. Acad. Sci. U.S.A. 90(14), 6444-6448), нанотела (также известные как однодоменные антитела), антиидиотипические (анти-Id) антитела (включая, например, анти-Id к антителам по изобретению), и связывающие эпитоп фрагменты любого из указанных выше.
Антитела, описанные в настоящем описании, предпочтительно, являются выделенными. "Выделенное антитело", как используют в рамках изобретения, относится к антителу, которое по существу свободно от других mAb, имеющих отличающуюся антигенную специфичность (например, выделенное антитело, которое специфично связывает hPCSK9, по существу свободно от mAb, которые специфично связывают антигены, отличные от hPCSK9). Однако выделенное антитело, которое специфично связывает hPCSK9, имеет перекрестную реактивность в отношении других антигенов, таких как молекулы PCSK9 из других видов.
Как используют в рамках изобретения, "антагонист PCSK9" обозначает соединение, которое ингибирует по меньшей мере один вид биологической активности PCSK9, предпочтительно, активность протеазы PCSK9. Предпочтительные антагонисты PCSK9 характеризуются тем, что они связывают от 10% до 100% (предпочтительно, 50%-100%) PCSK9, присутствующего в крови, при использовании в стехиометрических количествах. Предпочтительные антагонисты PCSK9 по настоящему изобретению представляют собой нейтрализующие антитела.
"Нейтрализующее антитело", как используют в рамках изобретения (или "антитело, которое нейтрализует активность PCSK9"), относится к антителу, связывание которого с hPCSK9 приводит к ингибированию по меньшей мере одного вида биологической активности PCSK9, предпочтительно, к ингибированию активности протеазы PCSK9. Это ингибирование биологической активности PCSK9 можно оценивать путем измерения одного или нескольких индикаторов биологической активности PCSK9 посредством одного или нескольких стандартных анализов in vitro или in vivo, известных в данной области. Такие анализы описаны, например, в US 2010/0166768 A1, содержание которой включено в настоящее описание в качестве ссылки в полном объеме.
Поскольку PCSK9 увеличивает уровень холестерина LDL в плазме путем обеспечения деградации рецептора LDL, активность PCSK9 имеет эффект при нескольких заболеваниях, связанных с увеличенными уровнями холестерина LDL в плазме. Таким образом, антагонисты PCSK9, такие как нейтрализующие антитела против hPCSK9 или их антигенсвязывающие фрагменты, пригодны для снижения увеличенного уровня общего холестерина, холестерина не-HDL, холестерина LDL и/или аполипопротеина B100 (ApoB100). Следовательно, антагонисты PCSK9 пригодны для смягчения, улучшения, ингибирования или предупреждения нескольких таких заболеваний, включая, но не ограничиваясь ими, гиперхолестеринемию, гиперлипидемию, дислипидемию, атеросклероз и сердечно-сосудистые заболевания.
В конкретных вариантах осуществления антитела против PCSK9 или их антигенсвязывающие фрагменты, описанные в настоящем описании, можно конъюгировать с терапевтической частью ("иммуноконъюгат"), такой как цитотоксин, химиотерапевтическое лекарственное средство, иммунодепрессант или радиоизотоп.
"Консервативная аминокислотная замена" представляет собой аминокислотную замену, в которой аминокислотный остаток замещен другим аминокислотным остатком, имеющим боковую цепь (R-группу) со сходными химическими свойствами (например, заряд или гидрофобность). Как правило, консервативная аминокислотная замена по существу не изменяет функциональные свойства белка. В случаях, где две или более аминокислотных последовательностей отличаются друг от друга консервативными заменами, процент или степень сходства можно повышать для поправки на консервативную природу замены. Способы внесения этой поправки хорошо известны специалистам в данной области. См., например, Pearson (1994) Methods Mol. Biol. 24: 307-331. Примеры групп аминокислот, которые имеют боковые цепи со сходными химическими свойствами, включают
1) алифатические боковые цепи: глицин, аланин, валин, лейцин и изолейцин;
2) алифатические гидроксилсодержащие боковые цепи: серин и треонин;
3) амидсодержащие боковые цепи: аспарагин и глутамин;
4) ароматические боковые цепи: фенилаланин, тирозин и триптофан;
5) основные боковые цепи: лизин, аргинин и гистидин;
6) кислотные боковые цепи: аспартат и глутамат, и
7) серосодержащие боковые цепи: цистеин и метионин.
Предпочтительные группы консервативных аминокислотных замен представляют собой: валин-лейцин-изолейцин, фенилаланин-тирозин, лизин-аргинин, аланин-валин, глутамат-аспартат и аспарагин-глутамин. Альтернативно консервативная замена представляет собой любую замену, имеющую положительную величину в логарифмической матрице вероятностей PAM250, описанной в Gonnet et al. (1992) Science 256: 1443-45. "Умеренно консервативная" замена представляет собой любую замену, имеющую неотрицательную величину в логарифмической матрице вероятностей PAM250. Учитывая известный генетический код и рекомбинантные и синтетические способы ДНК, квалифицированный ученый может легко сконструировать ДНК, кодирующую консервативные варианты аминокислот.
Как используют в рамках изобретения, "неконсервативные замены" или "неконсервативные аминокислотные замены" определяют как замену аминокислоты другой аминокислотой, приведенной в отличающейся группе из семи стандартных групп аминокислот 1)-7), представленных выше.
Термин "существенная идентичность" или "по существу идентичный" при указании на нуклеиновую кислоту или ее фрагмент указывает на то, что при оптимальным выравнивании с соответствующими нуклеотидными инсерциями или делециями с другой нуклеиновой кислотой (или комплементарной ей цепью), существует идентичность нуклеотидной последовательности по меньшей мере приблизительно в 90%, и более предпочтительно, по меньшей мере приблизительно в 95%, 96%, 97%, 98% или 99% нуклеотидных оснований при измерении с помощью любого хорошо известного алгоритма идентичности последовательностей, такого как FASTA, BLAST или GAP, как рассмотрено ниже.
Применительно к полипептидам, термин "существенное сходство" или "по существу сходный" означает, что две пептидных последовательности, при оптимальном выравнивании, например, с помощью программ GAP или BESTFIT с использованием веса пропусков по умолчанию, обладают по меньшей мере 90% идентичностью последовательностей, еще более предпочтительно, по меньшей мере 95%, 98% или 99% идентичностью последовательностей. Предпочтительно, положения остатков, которые не являются идентичными, отличаются консервативными аминокислотными заменами.
Сходство последовательностей для полипептидов, как правило, измеряют с использованием программного обеспечения для анализа последовательностей. Программное обеспечение для анализа белка сопоставляет сходные последовательности с использованием показателей сходства, приписываемых различным заменам, делециям и другим модификациям, включая консервативные аминокислотные замены. Например, программное обеспечение GCG содержит программы, такие как GAP и BESTFIT, которые можно использовать с параметрами по умолчанию для определения гомологии последовательностей или идентичности последовательностей между близкородственными полипептидами, такими как гомологичные полипептиды из различных видов организмов или между белком дикого типа и его мутеином. См., например, GCG Version 6.1. Полипептидные последовательности также можно сравнивать с использованием FASTA с параметрами по умолчанию или рекомендованными параметрами; программа в GCG Version 6.1. FASTA (например, FASTA2 и FASTA3) обеспечивает выравнивание и предоставляет процентную идентичность последовательностей в областях наилучшего перекрывания между последовательностью запроса и искомой последовательностью (Pearson (2000) выше). Другим предпочтительным алгоритмом при сравнении последовательности по изобретению с базой данных, содержащей большое количество последовательностей из различных организмов, является компьютерная программа BLAST, особенно BLASTP или TBLASTN, с использованием параметров по умолчанию. См., например, Altschul et al. (1990) J. Mol. Biol. 215: 403 410 и (1997) Nucleic Acids Res. 25:3389 402, все из которых включены в настоящее описание в качестве ссылок.
Когда процент идентичности последовательностей упоминается в настоящей заявке, эти проценты вычисляют относительно полной длины более длинной последовательности, если конкретно не указано иное. Это вычисление относительно полной длины более длинной последовательности применимо как к последовательностям нуклеиновых кислот, так и к полипептидным последовательностям.
Как используют в рамках изобретения, "лечить", "проведение лечения" или "лечение" заболевания или нарушения означает осуществление одного или нескольких из следующих: (a) снижение тяжести и/или длительности нарушения; (b) ограничение или предупреждение развития симптомов, характерных для нарушения(ий), подвергаемого лечению; (c) ингибирование ухудшения симптомов, характерных для нарушения(ий), подвергаемого лечению; (d) ограничение или предупреждение рецидива нарушения(ий) у пациентов, которые ранее имели нарушение(я); и (e) ограничение или предупреждение рецидива симптомов у пациентов, у которых ранее был симптомы нарушения(ий).
Как используют в рамках изобретения, "предупреждать", "проведение предупреждения", "предупреждение" или "профилактика" заболевания или нарушения означает предупреждение возникновения этого нарушения у индивидуума.
Как используют в рамках изобретения, выражения "предназначен для введения" и "намереваются вводить" имеет то же значение, что и "получен для введения". Иными словами, утверждение, что активное соединение "предназначено для введения", следует понимать так, что указанное активное соединение получено и преобразовано в дозы так, что указанное активное соединение находится в состоянии, способном осуществлять его терапевтическую активность.
Термины "терапевтически эффективное количество" или "терапевтическое количество" означают количество лекарственного средства или фармацевтического средства, которое индуцирует биологический или медицинский ответ в ткани, системе, животном или человеке, который является искомым для исследователя, ветеринара, врача или другого медицинского специалиста. Термин "профилактически эффективное количество" означает количество фармацевтического лекарственного средства, которое будет предупреждать или снижать риск возникновения биологического или медицинского события, которое исследователь, ветеринар, врач или другой медицинский специалист намеревается предупредить, в ткани, системе, у животного или человека. В частности, дозировка, которую вводят пациенту, может быть выбрана так, чтобы достигнуть желаемого снижения уровня холестирина LDL (липопротеин низкой плотности); дозировку, которую вводят пациенту, также можно титровать с течением времени для достижения заданного уровня LDL. Режим дозирования с использованием антитела или его антигенсвязывающего фрагмента, как описано в настоящем описании, выбирают в соответствии с различными факторами, включая тип, вид, возраст, массу тела, индекс массы тела, пол и медицинское состояние пациента; тяжесть состояния, подвергаемого лечению; эффективность соединения, выбранного для введения; путь введения; цель введения; и функцию почек и печени пациента.
Как используют в рамках изобретения, "пациент" означает любого человека или не являющееся человеком животное, такое как млекопитающее, пресмыкающееся или птица, для которого может быть полезным лечение антителами и их антигенсвязывающими фрагментами, описанными в настоящем описании. Предпочтительно, "пациент" выбран из группы, состоящей из лабораторных животных (например, мышь или крыса), домашних животных (включая, например, морскую свинку, кролика, курицу, индейку, свинью, овцу, козу, верблюда, корову, лошадь, осла, кошку или собаку), грызуна или приматов, включая шимпанзе, гориллу, бонобо и человека. Особенно предпочтительно, чтобы "пациентом" был человек.
Термины "индивидуум" или "субъект" используют в настоящем описании взаимозаменяемо. Как используют в рамках изобретения, "индивидуум" относится к человеку или не являющемуся человеком животному (например, млекопитающие, птицы, пресмыкающиеся, рыбы, земноводные или беспозвоночные); предпочтительно, индивиду, для которого либо будут полезны различные аспекты настоящего изобретения (например, способ лечения или лекарственное средство, идентифицированное способами по настоящему изобретению), либо которого можно использовать в качестве лабораторного животного для идентификации или охарактеризации лекарственного средства или способа лечения. Индивидуумом может быть, например, человек, дикое животное, домашнее животное или лабораторное животное; примеры включают: млекопитающих, например, человека, не являющегося человеком примата (шимпанзе, бонобо, горилла), собаку, кошку, грызуна (например, мышь, морская свинка, крыса, хомячок или кролик), лошадь, осла, корову, овцу, козу, свинью, верблюда; птицу, такую как утка, голубь, индейка, гусь или курица; пресмыкающееся, такое как: морская черепаха, сухопутная черепаха, змея, ящерица, земноводное, такое как лягушка (например, Xenopus laevis); рыбу, такую как кои или данио; беспозвоночных, таких как черви (например, c.elegans) или насекомые (такие как муха, например, drosophila melanogaster). Термин индивидуум также включает различные морфологические стадии развития птиц, рыб, пресмыкающихся или насекомых, такие как яйцо, куколка, личинка или имаго. Кроме того, предпочтительно, чтобы индивидуум являлся "пациентом".
Как используют в рамках изобретения, "лекарственная форма" относится к физически дискретным единицам, пригодным в качестве единичных дозировок для человека и/или животных, причем каждая единица содержит заданное количество активного материала (например, от приблизительно 50 до приблизительно 500 мг антитела PCSK5 и/или, например, от 0,05 мг до 100 мг ингибитора HMG-CoA-редуктазы), вычисленное для достижения желаемого терапевтического эффекта, вместе с требуемым фармацевтическим разбавителем, носителем или наполнителем. Характеристики новых лекарственных форм по настоящему изобретению определяются и прямо зависят от (a) уникальных характеристик активного материала и конкретного терапевтического эффекта, которого намереваются достигнуть, и (b) ограничения в данной области в отношении составления такого активного материала для терапевтического применения у животных или человека, как описано в настоящем описании, и они являются признаками настоящего изобретения. Примерами подходящих лекарственных форм по настоящему изобретению являются флаконы, таблетки, капсулы, лепешки, суппозитории, пакеты с порошком, вафли, крахмальные капсулы, ампулы, отдельные множества любых из вышесказанных, и другие формы, как описано в настоящем описании или общеизвестно в данной области. Одна или несколько таких лекарственных форм антитела могут содержаться в изделии по настоящему изобретению, необязательно дополнительно содержащем одну или несколько лекарственных форм ингибитора HMG-CoA-редуктазы (например, таблетки в блистерной упаковке, содержащие в качестве активного ингредиента ингибитор HMG-CoA-редуктазы).
Термин "активный материал" относится к любому материалу с терапевтической активностью, такому как один или несколько активных ингредиентов. Активные ингредиенты, используемые в качестве лекарственных средств, можно легко получать в такой лекарственной форме с использованием фармацевтических материалов, которые сами по себе доступны в данной области и могут быть получены общепринятыми способами.
Следующие препараты являются иллюстративными для получения лекарственных форм по настоящему изобретению, и не предназначены для их ограничения. Можно получать несколько дозированных форм, являющихся вариантами осуществления настоящего изобретения. Например, единичная доза на флакон может содержать 0,5 мл, 1 мл, 2 мл, 3 мл, 4 мл, 5 мл, 6 мл, 7 мл, 8 мл, 9 мл, 10 мл, 15 мл или 20 мл антитела PCSK5 или его фрагмента в диапазоне от приблизительно 40 до приблизительно 500 мг антитела PCSK5. Если необходимо, эти препараты можно доводить до желаемой концентрации путем добавления в каждый флакон стерильного разбавителя. В одном из вариантов осуществления ингредиенты состава по изобретению предоставляют либо по отдельности, либо смешанными вместе в лекарственную форму, например, в качестве сухого лиофилизированного порошка или не содержащего воды концентрата в герметично закрытом контейнере, таком как флакон, ампула или саше, на которых указано количество активного вещества. Когда композиция предназначена для введения путем инфузии, ее можно распространять с помощью бутылки для инфузий, содержащей стерильную воду фармацевтической категории или солевой раствор. Когда композицию вводят путем инъекции, может быть предоставлена ампула стерильной воды для инъекций или солевого раствора, так чтобы ингредиенты можно было смешивать перед введением.
Составы по изобретению включают композиции лекарственных средств в виде сыпучих смесей, пригодных для получения фармацевтических композиций (например, композиций, которые пригодны для введения индивидууму или пациенту), которые можно использовать для получения лекарственных форм. В предпочтительном варианте осуществления композиция по изобретению представляет собой фармацевтическую композицию. Такие композиции содержат профилактически или терапевтически эффективное количество одного или нескольких профилактических или терапевтических средств (например, антитело по изобретению или другое профилактическое или терапевтическое средство), и фармацевтически приемлемый носитель. Предпочтительно, фармацевтические композиции изготавливают так, чтобы они были пригодными для данного пути введения индивидууму.
Активные материалы или ингредиенты (например, антитела или их фрагменты и ингибитор HMG-CoA-редуктазы) можно получать в качестве различных дозированных форм, включая твердые дозированные формы для перорального введения, такие как капсулы, таблетки, пилюли, порошки и гранулы, жидкие дозированные формы для перорального введения, такие как фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры, инъецируемые препараты, например, стерильные инъецируемые водные или масляные суспензии, композиции для ректального или вагинального введения, предпочтительно, суппозитории, и дозированные формы для местного или чрескожного введения, такие как мази, пасты, кремы, лосьоны, гели, порошки, растворы, спреи, ингалируемые вещества или пластыри.
В конкретном варианте осуществления термин "фармацевтически приемлемый" означает одобренный регулирующим органом федерального правительства или правительства штата США или EMA (European Medicines Agency) или приведенный в фармакопее U.S. Pharmacopeia (United States Pharmacopeia-33/National Formulary-28 Reissue, опубликованная United States Pharmacopeial Convention, Inc., Rockville Md., дата публикации: April 2010) или другой общепризнанной фармакопеей для применения у животных, и, более конкретно, у человека. Термин "носитель" относится к разбавителю, адъюванту (например, адъювант Фрейнда (полный и неполный)), эксципиенту или наполнителю, с которым вводят лекарственное средство. Такие фармацевтические носители могут быть стерильными жидкостями, такими как вода и масла, включая масла из нефти, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.п. Вода является предпочтительным носителем, когда фармацевтическую композицию вводят внутривенно. Также в качестве жидких носителей можно использовать солевые растворы и водные растворы декстрозы и глицерина, в частности для инъецируемых растворов. Подходящие фармацевтические эксципиенты включают крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухое снятое молоко, глицерин, пропилен, гликоль, воду, этанол и т.п. Для (дополнительных) эксципиентов и их применения также см. "Handbook of Pharmaceutical Excipients", fifth edition, R.C.Rowe, P.J. Seskey and S.C. Owen, Pharmaceutical Press, London, Chicago. Композиция, если желательно, также может содержать небольшие количества смачивающих веществ или эмульгаторов, или pH-буферных веществ. Эти композиции могут иметь форму растворов, суспензий, эмульсий, таблеток, пилюль, капсул, порошков, составов с замедленным высвобождением и т.п. Пероральный состав может включать стандартные носители, такие как маннит, лактоза, крахмал, стеарат магния, сахарин натрия, целлюлоза, карбонат магния фармацевтической категории и т.д. Примеры подходящих фармацевтических носителей описаны в "Remington's Pharmaceutical Sciences", E. W. Martin. Такие композиции содержат профилактически или терапевтически эффективное количество антитела, предпочтительно, в очищенной форме, вместе с подходящим количеством носителя, так чтобы обеспечивалась форма для надлежащего введения пациенту. Состав должен соответствовать способу введения.
Как правило, ингредиенты композиций по изобретению предоставляют либо отдельно, либо смешанными вместе в лекарственную форму, например, в качестве сухого состава для растворения, такого как лиофилизированный порошок, высушенный сублиационной сушкой порошок или не содержащий воды концентрат, в герметично закрытом контейнере, таком как ампула или саше, на которых указано количество активного вещества. Ингредиенты композиций по изобретению также могут быть предоставлены в качестве смешанного жидкого состава (т.е. раствор для инъекций или инфузий) в герметично закрытом контейнере, таком как ампула, саше, предварительно заполненный шприц или шприц для самоинъекций, или кассета для многоразового шприца или аппликатора (например, шприца-ручки или шприца для самоинъекций). Когда композиция предназначена для введения путем инфузии, ее можно распространять в бутылке для инфузий, содержащей стерильную воду или солевой раствор фармацевтической категории. Когда композицию вводят путем инъекции, может быть предоставлена ампула стерильной воды или солевого раствора для инъекций, так чтобы ингредиенты можно было смешивать перед введением.
Изобретение также относится к составу, упакованному в герметично закрытый контейнер, такой как ампула или саше, на которых указано количество антитела. В одном из вариантов осуществления состав по изобретению, содержащий антитело, предоставляют в качестве сухого состава, такого как стерилизованный лиофилизированный порошок, высушенный сублиационной сушкой порошок, высушенный распылительной сушкой порошок или не содержащий воды концентрат, в герметично закрытом контейнере, и его можно разбавлять, например, водой или солевым раствором до соответствующей концентрации для введения индивидууму. В другом варианте осуществления антитело или его антигенсвязывающий фрагмент предоставляют в качестве жидкого состава, такого как раствор для инъекций или инфузий. В одном из вариантов осуществления состав по изобретению, содержащий антитело, предоставляют в качестве сухого состава или в качестве жидкого состава в герметично закрытом контейнере в единичной дозировке по меньшей мере 40 мг, по меньшей мере 50 мг, более предпочтительно, по меньшей мере 75 мг, по меньшей мере 100 мг, по меньшей мере 150 мг, по меньшей мере 200 мг, по меньшей мере 250 мг, по меньшей мере 300 мг, по меньшей мере 350 мг, по меньшей мере 400 мг, по меньшей мере 450 мг или по меньшей мере 500 мг, антитела или его антигенсвязывающего фрагмента. Лиофилизированный состав по изобретению, содержащий антитело, необходимо хранить при от 2 до 8°C в его исходном контейнере и антитело следует вводить в пределах 12 часов, предпочтительно, в пределах 6 часов, в пределах 5 часов, в пределах 3 часов, или в пределах 1 часа после восстановления. Состав по изобретению, содержащий антитела, можно составлять в качестве нейтральной или солевой форм. Фармацевтически приемлемые соли включают соли, образованные с анионами, такие как соли, происходящие из хлористоводородной, фосфорной, уксусной, щавелевой, виннокаменной кислот, и т.д., и соли, образованные с катионами, такие как соли, происходящие из гидроксида натрия, гидроксида калия, гидроксида аммония, гидроксида кальция, гидроксида железа, изопропиламина, триэтиламина, 2-этиламиноэтанола, гистидина, прокаина и т.д.
Взрослых индивидуумов характеризуют, как имеющих "гипертензию" или высокое кровяное давление, когда они имеют систолическое кровяное давление более 140 мм.рт.ст. и/или диастолическое кровяное давление более 90 мм.рт.ст.
Конкретные группы, которые можно лечить терапевтическими способами по изобретению, включают индивидуумов с одним или несколькими из следующих состояний: индивидуумы, для которых показан аферез LDL, индивидуумы с активирующими PCSK9 мутациями (мутации с приобретением функции, "GOF"), индивидуумы с повышенными уровням общего холестерина, индивидуумы с повышенными уровнями холестерина липопротеинов низкой плотности (LDL-C), индивидуумы с первичной гиперхолестеринемией, такие как индивидуумы с первичной семейной или несемейной гиперхолестеринемией, индивидуумы с гетерозиготной семейной гиперхолестеринемией (heFH); индивидуумы с гиперхолестеринемией, особенно с первичной гиперхолестеринемией с непереносимостью статинов или неконтролируемой статинами; и индивидуумы с риском развития гиперхолестеринемии, которых можно лечить профилактически. Другие показания включают гиперлипидемию и дислипидемию, особенно, если они связаны с вторичными причинами, такими как сахарный диабет 2 типа, холестатические заболевания печени (первичный билиарный цирроз), нефротический синдром, гипотиреоз, ожирение; и профилактика и лечение атеросклероза и сердечно-сосудистых заболеваний, таких как коронарная болезнь сердца (CHD). Состояния или нарушения, перечисленные для описанных выше групп или индивидуумов, представляют собой состояния или нарушения, при которых лечение антителом по изобретению является особенно пригодным.
Однако, в зависимости от тяжести вышеупомянутых заболеваний и состояний, лечение индивидуумов антителами и антигенсвязывающими фрагментами по изобретению может быть противопоказано при определенных заболеваниях и состояниях.
Термин "неблагоприятное явление" (или побочный эффект) относится к вредоносному и нежелательному эффекту вследствие медикаментозного лечения. Неблагоприятное явление может быть названо "побочным эффектом", когда считается, что оно является вторичным для главного или терапевтического эффекта. Некоторые неблагоприятные явления возникают только в начале, при увеличении или прекращении лечения. Неблагоприятные явления могут вызывать медицинские осложнения заболевания и отрицательно влиять на его прогноз. Примерами побочных эффектов являются аллергические реакции, рвота, головная боль или головокружение или любой другой эффект, описанный в настоящем описании.
Как используют в рамках изобретения, "лечить", "проведение лечения" или "лечение" заболевания или нарушения означает осуществление одного или нескольких из следующих: (a) снижение тяжести и/или длительности нарушения; (b) ограничение или предупреждение развития симптомов, характерных для нарушения(ий), подвергаемого лечению; (c) ингибирование ухудшения симптомов, характерных для нарушения(ий), подвергаемого лечению; (d) ограничение или предупреждение рецидива нарушения(ий) у пациентов, которые ранее имели нарушение(я); и (e) ограничение или предупреждение рецидива симптомов у пациентов, у которых ранее был симптомы нарушения(ий).
Как используют в рамках изобретения, "предупреждать", "проведение предупреждения", "предупреждение" или "профилактика" заболевания, состояния или нарушения означает предупреждение возникновения этого нарушения, заболевания или состояния у индивидуума.
Повышенные уровни общего холестерина понимают в контексте настоящего изобретения, как предпочтительно, уровни общего холестерина, составляющие 200 мг/дл или более, особенно 240 мг/дл или более. Международные руководства по лечению рекомендовали снижение LDL-C до <2,0-2,6 ммоль/л (<77-100 мг/дл) у пациентов с устоявшимися сердечно-сосудистыми заболеваниями (CVD) и до <1,8-2,0 ммоль/л (<70-77 мг/дл) в группах высокого риска, таких как группы с CVD вместе с диабетом, курением, плохо контролируемой гипертензией, метаболическим синдромом или предшествующим инфарктом миокарда. Таким образом, повышенные уровни LDL-C понимают в контексте настоящего изобретения как уровни LDL-C 77 мг/дл или более (особенно для пациентов с одной или несколькими из следующих характеристик: устоявшиеся CVD и одно или несколько из [диабета, курения, плохо контролируемой гипертензии, метаболического синдрома или предшествующего инфаркта миокарда]) и 100 мг/дл или более (особенно для пациентов с установившимися CVD), 130 мг/дл или более, или 160 мг/дл или 190 мг/дл или более. Низкие уровни липопротеинов высокой плотности (уровни HDL) в контексте настоящего изобретения понимают как предпочтительно составляющие менее чем приблизительно 40 мг/дл.
Термины "неконтролируемый статинами" или "устойчивый к статинам", особенно в контексте гиперлипидемии, гиперхолестеринемии и т.д., используют в настоящем описании синонимично и они относятся к состояниям, такими как гиперлипидемия, где лечение статином (т.е. регулярное введение статина, такого как аторвастатин, пациенту) не снижает в значительной степени уровень общего холестерина или LDL-C или не является достаточным для установления нормолипидемических уровней для пациента или для установления липидемического (например, общий холестерин или LDL-C) уровня, который не является существенным фактором риска для развития сердечно-сосудистых заболеваний. Этот означает, например, что лечение статинами не является достаточным для установления уровней менее 130 мг/дл, как правило, или менее 100 мг/дл (например, от приблизительно ≥77 мг/дл до приблизительно 100 мг/дл), особенно у пациентов с устоявшимися сердечно-сосудистыми заболеваниями, или для установления уровней приблизительно менее чем 77 мг/дл (например, приблизительно ≥70-77 мг/дл), особенно в группах высокого риска, таких как группы с CVD вместе с диабетом, курением, плохо контролируемой гипертензией, метаболическим синдромом или предшествующим инфарктом миокарда. В контексте настоящего изобретения, устойчивость к статинам предпочтительно, относится к устойчивости к аторвастатину.
Варианты осуществления изобретения
Настоящее изобретение далее описано дополнительно. В следующих абзацах различные аспекты изобретения определены более подробно. Каждый аспект, определенный таким путем, можно комбинировать с любым другим аспектом или аспектами, если явно не указано иное. В частности, любой признак, указанный как являющийся предпочтительным или преимущественным, можно комбинировать с любым другим признаком или признаками, указанными в качестве предпочтительных или преимущественных, если явно не указано иное.
В первом аспекте настоящее изобретение относится к способу лечения заболевания или состояния, которые вызваны экспрессией или активностью PCSK9, включающему:
введение терапевтического количества антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9) индивидууму, нуждающемуся в этом, где антитело или его антигенсвязывающий фрагмент вводят в дозировке в диапазоне от 5 мг до 500 мг, и
введение терапевтического количества ингибитора HMG-CoA-редуктазы указанному индивидууму, где ингибитор HMG-CoA-редуктазы предпочтительно, вводят в дозировке в диапазоне от 0,05 мг до 100 мг.
В контексте настоящей заявки термин "заболевание или состояние, в которые вовлечена экспрессия или активность PCSK9," понимают как включающий любое заболевание или состояние, при которых применение антитела против PCSK-9 оказывает влияние.
В предпочтительных вариантах осуществления первого и других аспектов настоящего изобретения заболевание или состояние, в которые вовлечена экспрессия или активность PCSK9, смягчаются, улучшаются, ингибируются или предупреждаются с помощью антагониста PCSK9.
В следующих предпочтительных вариантах осуществления первого и других аспектов настоящего изобретения заболевание или состояние выбраны из группы, состоящей из: повышенных уровней общего холестерина, повышенных уровней холестерина липопротеинов низкой плотности (LDL-C), гиперхолестеринемии, в частности гиперхолестеринемии, неконтролируемой статинами, гиперлипидемии, дислипидемии, атеросклероза, сердечно-сосудистых заболеваний, первичной гиперхолестеринемии, такой как первичная семейная гиперхолестеринемия или первичная несемейная гиперхолестеринемия, гиперхолестеринемия (особенно первичная гиперхолестеринемия), не контролируемая статинами (в частности, неконтролируемая аторвастатином).
В предпочтительных вариантах осуществления первого и других аспектов настоящего изобретения индивидуумом, нуждающемся в этом, является индивидуум, для которого показан аферез LDL, индивидуум с активирующими PCSK9 мутациями, индивидуум с гетерозиготной семейной гиперхолестеринемией, индивидуум с первичной гиперхолестеринемией, индивидуум с первичной гиперхолестеринемией, не контролируемой статинами, индивидуум с риском развития гиперхолестеринемии, индивидуум с гиперхолестеринемией, индивидуум с гиперлипидемией, индивидуум с дислипидемией, индивидуум с атеросклерозом или индивидуум с сердечно-сосудистыми заболеваниями. Наиболее предпочтительно, индивидуумом, нуждающимся в этом, является человек.
В некоторых вариантах осуществления первого и других аспектов изобретения ингибитор HMG-CoA-редуктазы вводят три раза в сутки, два раза в сутки или один раз в сутки. В некоторых вариантах осуществления первого и других аспектов настоящего изобретения ингибитор HMG-CoA-редуктазы вводят каждые сутки, раз в двое суток, раз в трое суток, раз в четверо суток, раз в пять суток или раз в шесть суток. В некоторых вариантах осуществления первого и других аспектов настоящего изобретения ингибитор HMG-CoA-редуктазы вводят раз в неделю, раз в две недели, раз в три недели или раз в четыре недели. В некоторых вариантах осуществления первого и других аспектов настоящего изобретения ингибитор HMG-CoA-редуктазы вводят утром, днем или вечером. В предпочтительных вариантах осуществления ингибитор HMG-CoA-редуктазы вводят один раз в сутки, предпочтительно, перорально, предпочтительно, вечером.
Предпочтительно, ингибитор HMG-CoA-редуктазы представляет собой статин. Более предпочтительно, статин выбран из группы, состоящей из церивастатина, аторвастатина, симвастатина, питавастатина, розувастатина, флувастатина, ловастатина и правастатина.
В более предпочтительных вариантах осуществления первого и других аспектов настоящего изобретения, статин представляет собой
- церивастатин, вводимый в суточной дозировке от 0,05 мг до 2 мг, предпочтительно, в суточной дозировке 0,2 мг, 0,4 мг или 0,8 мг;
- аторвастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 10 мг, 20 мг, 40 мг или 80 мг;
- симвастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 5 мг, 10 мг, 20 мг, 40 мг или 80 мг;
- питавастатин, вводимый в суточной дозировке от 0,2 мг до 100 мг, предпочтительно, в суточной дозировке 1 мг, 2 мг, 5 мг, 10 мг или 20 мг;
- розувастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 5 мг, 10 мг, 20 мг или 40 мг;
- флувастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 20 мг, 40 мг или 80 мг;
- ловастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 10 мг, 20 мг, 40 мг или 80 мг; или
- правастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 10 мг, 20 мг, 40 мг или 80 мг.
В предпочтительных вариантах осуществления первого и других аспектов настоящего изобретения антитело или его антигенсвязывающий фрагмент вводят индивидууму раз в две недели, раз в четыре недели или раз в месяц. Введение раз в четыре недели или введение раз в месяц (т.е. один раз в календарный месяц, например, каждый первый, второй и т.д. день месяца или каждый первый, второй, третий понедельник, вторник и т.д. каждого месяца, в противоположность введению раз в четыре недели) является предпочтительным ввиду соблюдения пациентом режима лечения. Введение раз в две неделю является предпочтительным ввиду низкого варьирования уровней холестерина в крови. Другие подходящие расписания для введения антитела или его антигенсвязывающего фрагмента включают, но не ограничиваются ими, введение один раз в сутки, раз в двое суток, раз в трое суток, раз в четверо суток, раз в пять суток, раз в шесть суток, раз в неделю, раз в три недели, раз в пять недель, раз в шесть недель, раз в восемь недель, раз в десять недель и раз в двенадцать недель.
В предпочтительных вариантах осуществления первого и других аспектов настоящего изобретения антитело или его антигенсвязывающий фрагмент вводят в дозировке в диапазоне, например, от приблизительно 40 мг до приблизительно 500 мг, от приблизительно 50 мг до приблизительно 500 мг, приблизительно от 50 мг до 300 мг или приблизительно от 100 мг до 200 мг. В более предпочтительных вариантах осуществления антитело или его антигенсвязывающий фрагмент вводят в дозировке приблизительно 50 мг, приблизительно 100 мг, приблизительно 150 мг, приблизительно 200 мг, приблизительно 250 мг, приблизительно 300 мг, приблизительно 350 мг, приблизительно 400 мг, приблизительно 450 мг или приблизительно 500 мг. Дозы от приблизительно 50 до приблизительно 200 мг, например, приблизительно 50 мг, приблизительно 100 мг, приблизительно 150 мг или приблизительно 200 мг особенно пригодны для режима дозирования раз в две недели (т.е. применение через неделю), дозы от приблизительно 150 мг до приблизительно 400 мг, например, приблизительно 150 мг, приблизительно 200 мг, приблизительно 250 мг, приблизительно 300 мг приблизительно 350 мг или приблизительно 400 мг особенно пригодны для режима введения с более длительными интервалами, например, введение раз в три или четыре недели или раз в месяц.
Антитела и их антигенсвязывающие фрагменты, которые можно использовать для применения на практике первого и других аспектов настоящего изобретения, описаны в разделе "Предпочтительные антитела для применения настоящего изобретения на практике".
Во втором аспекте настоящее изобретение относится к антителу или его антигенсвязывающему фрагменту, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9) для применения при лечении заболевания или состояния, в которые вовлечена экспрессия или активность PCSK9,
где антитело или его антигенсвязывающий фрагмент предназначены для введения в дозировке в диапазоне от 5 мг до 500 мг,
где антитело или его антигенсвязывающий фрагмент, кроме того, предназначены для введения в комбинации с ингибитором HMG-CoA-редуктазы в дозировке в диапазоне от 0,05 мг до 100 мг.
В предпочтительных вариантах осуществления второго и других аспектов настоящего изобретения заболевание или состояние, в которые вовлечена экспрессия или активность PCSK9, смягчаются, улучшаются, ингибируются или предупреждаются с помощью антагониста PCSK9.
В следующих предпочтительных вариантах осуществления второго и других аспектов настоящего изобретения заболевание или состояние выбраны из группы, состоящей из: повышенных уровней холестерина липопротеинов низкой плотности (LDL-C), гиперхолестеринемии, в частности, гиперхолестеринемии, не контролируемой статинами, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний, в частности, первичной гиперхолестеринемии, такой как первичная семейная гиперхолестеринемия или первичная несемейная гиперхолестеринемия.
В предпочтительных вариантах осуществления второго и других аспектов настоящего изобретения антитело или его антигенсвязывающий фрагмент предназначены для введения индивидууму, для которого показан аферез LDL, индивидууму с активирующими PCSK9 мутациями, индивидууму с гетерозиготной семейной гиперхолестеринемией, индивидууму с первичной гиперхолестеринемией, индивидууму с первичной гиперхолестеринемией, неконтролируемой статинами, индивидууму с риском развития гиперхолестеринемии, индивидууму с гиперхолестеринемией, индивидууму с гиперлипидемией, индивидууму с дислипидемией, индивидууму с атеросклерозом или индивидууму с сердечно-сосудистыми заболеваниями. Наиболее предпочтительно, индивидуумом является человек.
В некоторых вариантах осуществления второго и других аспектов настоящего изобретения антитело или его антигенсвязывающий фрагмент предназначены для введения в комбинации с ингибитором HMG-CoA-редуктазы, который вводят три раза в сутки, два раза в сутки или один раз в сутки. В некоторых вариантах осуществления второго и других аспектов настоящего изобретения ингибитор HMG-CoA-редуктазы вводят раз в сутки, раз в двое суток, раз в трое суток, раз в четверо суток, раз в пять суток или раз в шесть суток. В некоторых вариантах осуществления второго и других аспектов настоящего изобретения ингибитор HMG-CoA-редуктазы вводят раз в неделю, раз в две недели, раз в три недели или раз в четыре недели. В некоторых вариантах осуществления второго и других аспектов настоящего изобретения ингибитор HMG-CoA-редуктазы вводят утром, днем или вечером. В предпочтительных вариантах осуществления ингибитор HMG-CoA-редуктазы вводят один раз в сутки, предпочтительно, перорально, предпочтительно, вечером.
В предпочтительных вариантах осуществления второго и других аспектов настоящего изобретения ингибитор HMG-CoA-редуктазы представляет собой статин. Более предпочтительно, станин выбран из группы, состоящей из церивастатина, аторвастатина, симвастатина, питавастатина, розувастатина, флувастатина, ловастатина и правастатина.
В более предпочтительных вариантах осуществления второго и других аспектов настоящего изобретения статин представляет собой
- церивастатин, вводимый в суточной дозировке от 0,05 мг до 2 мг, предпочтительно, в суточной дозировке 0,2 мг, 0,4 мг или 0,8 мг;
- аторвастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 10 мг, 20 мг, 40 мг или 80 мг;
- симвастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 5 мг, 10 мг, 20 мг, 40 мг или 80 мг;
- питавастатин, вводимый в суточной дозировке от 0,2 мг до 100 мг, предпочтительно, в суточной дозировке 1 мг, 2 мг, 5 мг, 10 мг или 20 мг;
- розувастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 5 мг, 10 мг, 20 мг или 40 мг;
- флувастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 20 мг, 40 мг или 80 мг;
- ловастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 10 мг, 20 мг, 40 мг или 80 мг; или
- правастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 10 мг, 20 мг, 40 мг или 80 мг.
В предпочтительных вариантах осуществления второго и других аспектов настоящего изобретения антитело или его антигенсвязывающий фрагмент предназначены для введения индивидууму раз в две недели, раз в четыре недели или раз в месяц. Введение раз в четыре недели или введение раз в месяц является предпочтительным, ввиду соблюдения пациентом режима введения. Введение раз в две недели является предпочтительным ввиду очень низкого варьирования уровней холестерина в крови. Другие подходящие расписания для введения антитела или его антигенсвязывающего фрагмента включают, но не ограничиваются ими, введение один раз в сутки, раз в двое суток, раз в трое суток, раз в четверо суток, раз в пять суток, раз в шесть суток, раз в неделю, раз в три недели, раз в пять недель, раз в шесть недель, раз в восемь недель, раз в десять недель и раз в двенадцать недель.
В предпочтительных вариантах осуществления второго и других аспектов настоящего изобретения антитело или его антигенсвязывающий фрагмент предназначены для введения в дозировке в диапазоне от приблизительно 40 мг до приблизительно 500 мг или от приблизительно 50 мг до приблизительно 500 мг или от приблизительно 50 мг до приблизительно 400 мг или от приблизительно 50 мг до приблизительно 300 мг, или от приблизительно 100 мг до приблизительно 300 мг или от приблизительно 100 мг до приблизительно 200 мг. В более предпочтительных вариантах осуществления антитело или его антигенсвязывающий фрагмент вводят в дозировке приблизительно 50 мг, приблизительно 100 мг, приблизительно 150 мг, приблизительно 200 мг, приблизительно 250 мг, приблизительно 300 мг, приблизительно 350 или приблизительно 400 мг.
В предпочтительных вариантах осуществления второго и других аспектов настоящего изобретения антитело или его антигенсвязывающий фрагмент предназначены для введения в дозировке (т.е. в режиме дозирования) в диапазоне от приблизительно 50 мг до приблизительно 200 мг раз в две недели (E2W), предпочтительно, приблизительно 50 мг E2W, приблизительно 100 мг E2W, приблизительно 150 мг E2W, приблизительно 200 мг E2W, приблизительно 250 мг E2W или приблизительно 300 мг E2W, причем еще более предпочтительными являются приблизительно 50 мг E2W, приблизительно 100 мг E2W, приблизительно 150 мг E2W, приблизительно 200 мг E2W. В соответствии с особенно преимущественным вариантом осуществления второго и других аспектов настоящего изобретения антитело или его антигенсвязывающий фрагмент предназначены для введения в дозировке (т.е. в режиме дозирования) E2W от приблизительно 50 мг до приблизительно 200 мг, от приблизительно 100 мг до приблизительно 180 мг, от приблизительно 130 мг до приблизительно 170 мг, от приблизительно 140 до приблизительно 160 мг, или приблизительно 90, приблизительно 100, приблизительно 110, приблизительно 120, приблизительно 130, приблизительно 140, приблизительно 145, приблизительно 150, приблизительно 155, приблизительно 160, приблизительно 170, приблизительно 180, приблизительно 190 или приблизительно 200 мг E2W, причем режимы дозирования от приблизительно 145 мг до приблизительно 155 мг E2W и, в частности, приблизительно 150 мг E2W относятся к особенно предпочтительным вариантам осуществления.
В других предпочтительных вариантах осуществления второго и других аспектов настоящего изобретения антитело или его антигенсвязывающий фрагмент предназначены для введения в дозировке в диапазоне от приблизительно 100 мг до приблизительно 400 мг раз в четыре недели (E4W), предпочтительно, приблизительно 100 мг E4W, приблизительно 150 мг E4W, приблизительно 200 мг E4W, приблизительно 250 мг E4W, приблизительно 300 мг E4W, приблизительно 350 мг E4W или приблизительно 400 мг E4W, причем дозировки от приблизительно 190 до приблизительно 310 E4W, от приблизительно 200 до приблизительно 300 мг E4W, от приблизительно 190 до приблизительно 210 E4W, от приблизительно 195 до приблизительно 205 E4W, от приблизительно 290 до приблизительно 310 E4W, от приблизительно 295 до приблизительно 305 E4W, приблизительно 200 мг E4W или приблизительно 300 мг E4W относятся к особенно предпочтительным вариантам осуществления. Эти дозировки, показанные для введения E4W, также пригодны для введения раз в месяц.
Антитела и их антигенсвязывающие фрагменты, которые можно использовать для применения на практике второго и других аспектов настоящего изобретения, описаны в разделе "Предпочтительные антитела для применения настоящего изобретения на практике".
В третьем аспекте настоящее изобретение относится к изделию, содержащему: (a) упаковочный материал; (b) антитело или его антигенсвязывающий фрагмент, которые специфично связывают hPCSK9; и (c) ярлык или вкладыш в упаковку, находящиеся в упаковочном материале, на которых указано, что пациентов, которым проводят лечение указанным антителом или антигенсвязывающим фрагментом, можно лечить от заболевания или состояния, выбранного из группы, состоящей из гиперхолестеринемии, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний.
В четвертом аспекте настоящее изобретение относится к изделию, содержащему: (a) упаковочный материал; (b) антитело или его антигенсвязывающий фрагмент, которые специфично связывают hPCSK9; и (c) ярлык или вкладыш в упаковку, находящиеся в упаковочном материале, на которых указана информация о лечении пациентов указанным антителом или его антигенсвязывающим фрагментом вместе с применением ингибитора HMG Co A, такого как статин.
В пятом аспекте настоящее изобретение относится к изделию, содержащему (a) упаковочный материал; (b) антитело или его антигенсвязывающий фрагмент, которые специфично связывают hPCSK9; и (c) ярлык или вкладыш в упаковку, на которых указано, что лечение пациентов указанным антителом или его антигенсвязывающим фрагментом вместе с ингибитором HMG-Co A, таким как статин, противопоказано для пациентов, относящихся к одной или нескольким из следующих групп: (i) курильщики; (ii) лица в возрасте 70 лет и старше; (iii) лица, страдающие гипертензией; (iv) беременные женщины; (v) женщины, пытающиеся забеременеть; (vi) женщины, кормящие грудью; (vii) лица, которые имеют или когда-либо имели заболевание, поражающее печень; (viii) лица, которые имели какие-либо необъясненные аномальные показатели функции печени в тестах крови; (ix) лица, которые употребляют чрезмерные количества спиртных напитков; (x) лица, имеющие проблемы с почками; (xi) лица, страдающие гипотиреозом; (xii) лица, страдающие мышечными нарушениями; (xiii) лица, ранее сталкивавшиеся с мышечными проблемами в ходе лечения снижающей уровень липидов терапией; (xiv) лица, имеющие серьезные проблемы с дыханием; (xv) лица, принимающие одно или несколько из следующих лекарственных средств: лекарственные средства, изменяющие работу иммунной системы (например, циклоспорин или антигистамины), антибиотики или противогрибковые средства (например, эритромицин, кларитромицин, кетоконазол, итраконазол, рифампицин, фусидовая кислота), лекарственные средства, регулирующие уровень липидов (например, гемфиброзил, колестипол), блокаторы кальциевых каналов (например, верапамил, дилтиазем), лекарственные средства, регулирующие сердечный ритм (дигоксин, амиодарон), ингибиторы протеаз, используемые при лечении ВИЧ (например, нельфинавир), варфарин, пероральные контрацептивы, антациды или зверобой; или (xvi) лица, выпивающие более 0,1 л грейпфрутового сока в сутки или съедающие более половины грейпфрута в сутки; (xvii) лица, имеющие индекс массы тела (BMI) более 40; (xviii) лица, имеющие индекс массы тела (BMI) менее 18; (xix) лица, страдающие диабетом 1 типа или диабетом 2 типа; (xx) лица, положительные по гепатиту B или гепатиту C; (xxi) лица, имеющие известную чувствительность к лекарственным средствам на основе моноклональных антител; (xxii) лица, имеющие концентрацию нейтрофилов менее 1500/мм3; (xxiii) лица, имеющие концентрацию тромбоцитов менее 100000/мм3; (xxiv) мужчины, имеющие уровень креатинина в сыворотке более 1,5×ULN (верхняя граница нормы); (xxv) женщины, имеющие уровень креатинина в сыворотке более 1,4×ULN (верхняя граница нормы); (xxvi) лица, имеющие уровень аланинтрансаминазы (ALT) или уровень аспартаттрансаминазы (AST) более 2×ULN; или (xxvii) лица, имеющие уровень CPK более 3×ULN.
В предпочтительных вариантах осуществления третьего, четвертого и пятого аспекта антитело или антигенсвязывающий фрагмент представляют собой антитело или антигенсвязывающий фрагмент, как описано ниже в разделе "Предпочтительные антитела для применения настоящего изобретения на практике".
Ярлык или вкладыш в упаковку согласно различным аспектам и вариантам осуществления изобретения, в частности, в отношении различных изделий по изобретению, может представлять собой любой тип носителя данных, пригодный для того, чтобы быть помещенным в упаковку или контейнер, или снаружи упаковки или контейнера. Предпочтительно, носитель данных (т.е. ярлык или чип, штриховой код или листок или ярлык, содержащий штриховой код и т.д.) содержит информацию, такую как
(i) композиция, состав, концентрация и общее количество, тип активного ингредиента(ов), содержащегося в изделии, т.е. антитело или антигенсвязывающие фрагменты, ингибитор HMG-CoA-редуктазы, фармацевтическая композиция, лекарственная форма или состав по настоящему изобретению
(ii) количество и композиция лекарственной формы, содержащейся в изделии
(iii) показания, противопоказания для антитела или антигенсвязывающих фрагментов, фармацевтическая композиция, лекарственная форма или состав по настоящему изобретению
(iv) (ii) индивидуумы/пациенты или группы индивидуумов/пациентов, для которых показано или противопоказано лечение антителом или антигенсвязывающими фрагментами, фармацевтической композицией, лекарственной формой или составом по настоящему изобретению
(v) инструкции по применению, режимы дозирования и/или режимы введения
(vi) информация о качестве, такая как информации о номере партии/серии антитела или антигенсвязывающих фрагментов, фармацевтической композиции, лекарственной формы или состава по настоящему изобретению, место получения или сборки или срок хранения или срок реализации,
(vii) информация, касающаяся правильного хранения или обращения с изделием, устройством для аппликации, или антителом или антигенсвязывающими фрагментами, фармацевтической композицией, лекарственной формой или составом по настоящему изобретению,
(iv) информация, касающаяся композиции буфера(ов), разбавителя(ей), реагента(ов), эксципиентов, носителей, составов антитела или антигенсвязывающих фрагментов, фармацевтической композиции, лекарственной формы или состава по настоящему изобретению,
(vi) предупреждение, касающееся возможных последствий при применении неподходящей дозировки или режимов введения и/или при применении в группе пациентов с противопоказаниями.
В предпочтительных вариантах осуществления третьего, четвертого и пятого аспекта ярлык или вкладыш в упаковку содержат указание на способ лечения или медицинское применение в соответствии с первым или вторым аспектом и вариантами осуществления первого и второго аспекта, как описано в настоящем описании.
Следующий предпочтительный вариант осуществления сочетает в себе признаки третьего аспекта и четвертого аспекта, как описано в настоящем описании.
Следующий предпочтительный вариант осуществления сочетает в себе признаки третьего аспекта и пятого аспекта, как описано в настоящем описании.
Следующий предпочтительный вариант осуществления сочетает в себе признаки четвертого аспекта и пятого аспекта, как описано в настоящем описании.
Следующий предпочтительный вариант осуществления сочетает в себе признаки третьего аспекта, четвертого аспекта и пятого аспекта, как описано в настоящем описании.
В шестом аспекте настоящее изобретение относится к способу исследования эффективности антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9, для лечения заболевания или состояния, выбранного из группы, состоящей из гиперхолестеринемии, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний, или любого из других состояний заболеваний в соответствии с первым или вторым аспектом настоящего изобретения, причем указанный способ включает:
лечение выбранной группы пациентов указанным антителом или его антигенсвязывающим фрагментом, где каждый пациент в указанной группе имеет уровень холестерина LDL (LDL-C) более 100 мг/дл; и
определение эффективности указанного антитела или его антигенсвязывающего фрагмента путем определения уровня LDL-C в группе пациентов до и после введения указанного антитела или его антигенсвязывающего фрагмента, где снижение уровня LDL-C по меньшей мере на 25% относительно уровня до введения дозы по меньшей мере у 75% группы пациентов указывает на то, что указанные антитело или его антигенсвязывающий фрагмент являются эффективными для лечения указанного заболевания или состояния в указанной группе пациентов.
В седьмом аспекте настоящее изобретение относится к способу исследования эффективности антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9, для лечения заболевания или состояния, выбранного из группы, состоящей из гиперхолестеринемии, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний, или любых других состояний в соответствии с первым или вторым аспектом настоящего изобретения, причем указанный способ включает:
определение эффективности антитела или его антигенсвязывающего фрагмента, которые используют для лечения выбранной группы пациентов указанным антителом или его антигенсвязывающим фрагментом, где каждый пациент в указанной группе имеет уровень холестерина LDL (LDL-C) более 100 мг/дл, путем определения уровня LDL-C в группе пациентов до и после введения указанного антитела или его антигенсвязывающего фрагмента, где снижение уровня LDL-C по меньшей мере на 25% относительно уровня до введения дозы по меньшей мере у 75% группы пациентов указывает на то, что указанные антитело или его антигенсвязывающий фрагмент являются эффективными для лечения указанного заболевания или состояния в указанной группе пациентов.
В предпочтительных вариантах осуществления шестого и седьмого аспекта каждому пациенту в указанной популяции проводили снижающее уровень липидов лечение путем введения ингибитора HMG CoA, такого как статин, в течение по меньшей мере 6 недель перед лечением указанным антителом или его антигенсвязывающим фрагментом.
В предпочтительных вариантах осуществления шестого и седьмого аспекта антитело или антигенсвязывающий фрагмент представляет собой антитело или антигенсвязывающий фрагмент, как указано ниже в разделе "Предпочтительные антитела для применения настоящего изобретения на практике".
В предпочтительных вариантах осуществления шестого и седьмого аспекта выбранную группу пациентов лечат способом лечения в соответствии с первым аспектом и вариантами осуществления первого и второго аспекта, как описано в настоящем описании.
В восьмом аспекте настоящее изобретение относится к упаковке, содержащей антитело или его антигенсвязывающий фрагмент, которые специфично связывают hPCSK9, и ярлык, причем указанный ярлык содержит напечатанное сообщение, которое информирует пациента, что лечение антителом вместе с ингибитором HMG-CoA-редуктазы, таким как статин, показано при одном или нескольких показаниях, выбранных из группы, состоящей из гиперхолестеринемии, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний или любых других состояний или заболеваний в соответствии с первым или вторым аспектом настоящего изобретения. Антитела и их антигенсвязывающие фрагменты, которые можно использовать для применения на практике восьмого аспекта настоящего изобретения, описаны в разделе "Предпочтительные антитела для применения настоящего изобретения на практике".
В девятом аспекте настоящее изобретение относится к упаковке, содержащей антитело или его антигенсвязывающий фрагмент, которые специфично связывают hPCSK9, и ярлык, причем указанный ярлык содержит напечатанное сообщение, которое информирует пациента, что лечение антителом вместе со статином противопоказано для пациентов, относящихся к одной или нескольким из следующих групп: (i) курильщики; (ii) лица в возрасте 70 лет и старше; (iii) лица, страдающие гипертензией; (iv) беременные женщины; (v) женщины, пытающиеся забеременеть; (vi) женщины, кормящие грудью; (vii) лица, которые имеют или когда-либо имели заболевание, поражающее печень; (viii) лица, которые имели какие-либо необъясненные аномальные показатели функции печени в тестах крови; (ix) лица, которые употребляют чрезмерные количества спиртных напитков; (x) лица, имеющие проблемы с почками; (xi) лица, страдающие гипотиреозом; (xii) лица, страдающие мышечными нарушениями; (xiii) лица, ранее сталкивавшиеся с мышечными проблемами в ходе лечения снижающей уровень липидов терапией; (xiv) лица, имеющие серьезные проблемы с дыханием; (xv) лица, принимающие одно или несколько из следующих лекарственных средств: лекарственные средства, изменяющие работу иммунной системы (например, циклоспорин или антигистамины), антибиотики или противогрибковые средства (например, эритромицин, кларитромицин, кетоконазол, итраконазол, рифампицин, фусидовая кислота), лекарственные средства, регулирующие уровень липидов (например, гемфиброзил, колестипол), блокаторы кальциевых каналов (например, верапамил, дилтиазем), лекарственные средства, регулирующие сердечный ритм (дигоксин, амиодарон), ингибиторы протеаз, используемые при лечении ВИЧ (например, нельфинавир), варфарин, пероральные контрацептивы, антациды или зверобой; или (xvi) лица, выпивающие более 0,1 л грейпфрутового сока в сутки или съедающие более половины грейпфрута в сутки; (xvii) лица, имеющие индекс массы тела (BMI) более 40; (xviii) лица, имеющие индекс массы тела (BMI) менее 18; (xix) лица, страдающие диабетом 1 типа или диабетом 2 типа; (xx) лица, положительные по гепатиту B или гепатиту C; (xxi) лица, имеющие известную чувствительность к лекарственным средствам на основе моноклональных антител; (xxii) лица, имеющие концентрацию нейтрофилов менее 1500/мм3; (xxiii) лица, имеющие концентрацию тромбоцитов менее 100000/мм3; (xxiv) мужчины, имеющие уровень креатинина в сыворотке более 1,5×ULN (верхняя граница нормы); (xxv) женщины, имеющие уровень креатинина в сыворотке более 1,4×ULN (верхняя граница нормы); (xxvi) лица, имеющие уровень аланинтрансаминазы (ALT) или уровень аспартаттрансаминазы (AST) более 2×ULN; или (xxvii) лица, имеющие уровень CPK более 3×ULN. Антитела и их антигенсвязывающие фрагменты, которые можно использовать для применения на практике девятого аспекта настоящего изобретения, описаны в разделе "Предпочтительные антитела для применения настоящего изобретения на практике".
Следующий предпочтительный вариант осуществления сочетает в себе признаки восьмого аспекта и девятого аспекта, как описано в настоящем описании.
В десятом аспекте настоящее изобретение относится к способу регуляции уровня LDL в крови, включающему:
введение терапевтического количества антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9), индивидууму, нуждающемуся в этом, где антитело или его антигенсвязывающий фрагмент вводят в дозировке в диапазоне от 5 мг до 500 мг, и
введение терапевтического количества ингибитора HMG-CoA-редуктазы указанному индивидууму, где ингибитор HMG-CoA-редуктазы, предпочтительно, вводят в дозировке в диапазоне от 0,05 мг до 100 мг.
В одиннадцатом аспекте настоящее изобретение относится к способу предупреждения эффектов (постоянно) увеличенного уровня LDL в крови, включающему:
введение терапевтического количества антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9), индивидууму, нуждающемуся в этом, где антитело или его антигенсвязывающий фрагмент вводят в дозировке в диапазоне от 5 мг до 500 мг, и
введение терапевтического количества ингибитора HMG-CoA-редуктазы указанному индивидууму, где ингибитор HMG-CoA-редуктазы, предпочтительно, вводят в дозировке в диапазоне от 0,05 мг до 100 мг.
В предпочтительных вариантах осуществления десятого и одиннадцатого аспекта заболевание или состояние, в которые вовлечена экспрессия или активность PCSK9, смягчаются, улучшаются, ингибируются или предупреждаются с помощью антагониста PCSK9. В следующих предпочтительных вариантах осуществления десятого и одиннадцатого аспекта заболевание или состояние, в которые вовлечена экспрессия или активность PCSK9, выбраны из группы, состоящей из: повышенных уровней LDL-C, гиперхолестеринемии, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний или любых других состояний или заболеваний в соответствии с первым или вторым аспектом настоящего изобретения.
В предпочтительных вариантах осуществления десятого и одиннадцатого аспекта индивидуумом, нуждающимся в этом, является индивидуум, для которого показан аферез LDL, индивидуум с активирующими PCSK9 мутациями, индивидуум с гетерозиготной семейной гиперхолестеринемией, индивидуум с первичной гиперхолестеринемией, не контролируемой статинами, индивидуум с риском развития гиперхолестеринемии, индивидуум с гиперхолестеринемией, индивидуум с гиперлипидемией, индивидуум с дислипидемией, индивидуум с атеросклерозом или индивидуум с сердечно-сосудистыми заболеваниями или любой из индивидуумов, как описано для первого или второго аспекта настоящего изобретения. Наиболее предпочтительно, индивидуумом, нуждающимся в этом, является человек.
В некоторых вариантах осуществления десятого и одиннадцатого аспекта ингибитор HMG-CoA-редуктазы вводят три раза в сутки, два раза в сутки или один раз в сутки. В некоторых вариантах осуществления ингибитор HMG-CoA-редуктазы вводят раз в сутки, раз в двое суток, раз в трое суток, раз в четверо суток, раз в пять суток или раз в шесть суток. В некоторых вариантах осуществления ингибитор HMG-CoA-редуктазы вводят раз в неделю, раз в две недели, раз в три недели, раз в четыре недели или раз в месяц. В некоторых вариантах осуществления ингибитор HMG-CoA-редуктазы вводят утром, днем или вечером. В предпочтительных вариантах осуществления ингибитор HMG-CoA-редуктазы вводят один раз в сутки, предпочтительно, перорально, предпочтительно, вечером. Следующие подходящие режимы введения описаны в первом или втором аспекте.
Предпочтительно, ингибитором HMG-CoA-редуктазы является статин. Более предпочтительно, статин выбран из группы, состоящей из церивастатина, аторвастатина, симвастатина, питавастатина, розувастатина, флувастатина, ловастатина и правастатина.
В более предпочтительных вариантах осуществления десятого и одиннадцатого аспекта, статин представляет собой
- церивастатин, вводимый в суточной дозировке от 0,05 мг до 2 мг, предпочтительно, в суточной дозировке 0,2 мг, 0,4 мг или 0,8 мг;
- аторвастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 10 мг, 20 мг, 40 мг или 80 мг;
- симвастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 5 мг, 10 мг, 20 мг, 40 мг или 80 мг;
- питавастатин, вводимый в суточной дозировке от 0,2 мг до 100 мг, предпочтительно, в суточной дозировке 1 мг, 2 мг, 5 мг, 10 мг или 20 мг;
- розувастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 5 мг, 10 мг, 20 мг или 40 мг;
- флувастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 20 мг, 40 мг или 80 мг;
- ловастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 10 мг, 20 мг, 40 мг или 80 мг; или
- правастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 10 мг, 20 мг, 40 мг или 80 мг.
В предпочтительных вариантах осуществления десятого и одиннадцатого аспекта антитело или его антигенсвязывающий фрагмент вводят индивидууму раз в две недели, раз в четыре недели или раз в месяц. Введение раз в четыре недели или раз в месяц является предпочтительным ввиду соблюдения пациентом режима лечения. Введение через неделю является предпочтительным ввиду очень низкого варьирования уровней холестерина в крови. Другие подходящие расписания для введения антитела или его антигенсвязывающего фрагмента включают, но не ограничиваются ими, введение один раз в сутки, раз в двое суток, раз в трое суток, раз в четверо суток, раз в пять суток, раз в шесть суток, раз в неделю, раз в три недели, раз в пять недель, раз в шесть недель, раз в восемь недель, раз в десять недель и раз в двенадцать недель.
В предпочтительных вариантах осуществления десятого и одиннадцатого аспекта, антитело или его антигенсвязывающий фрагмент вводят в дозировке в диапазоне от 50 мг до 300 мг, например, от 100 мг до 200 мг. В более предпочтительных вариантах осуществления антитело или его антигенсвязывающий фрагмент вводят в дозировке приблизительно 50 мг, приблизительно 100 мг, приблизительно 150 мг, приблизительно 200 мг или приблизительно 300 мг. Кроме того, подходящие и предпочтительные режимы дозирования описаны для первого или второго аспектов.
Антитела и их антигенсвязывающие фрагменты, которые можно использовать для применения на практике десятого и одиннадцатого аспектов настоящего изобретения, описаны в разделе "Предпочтительные антитела для применения настоящего изобретения на практике".
В двенадцатом аспекте настоящее изобретение относится к способу определения того, пригодно ли фармацевтическое соединение для смягчения, улучшения, ингибирования или предупреждения заболевания или состояния, в которые вовлечена активность или экспрессия PCSK9, включающему: (a) введение индивидууму соединения, которое специфично связывается с PCSK9, предпочтительно, антитела или его антигенсвязывающего фрагмента, специфично связывающихся с PCSK9, и (b) определение того, какая часть PCSK9 в крови связана с соединением согласно (a).
Главным образом, соединения, которые специфично связывают от 10% до 100% (предпочтительно, 20%-100%, более предпочтительно, 30%-100%, более предпочтительно, 40%-100%, более предпочтительно, 50%-100%) PCSK9, присутствующей в крови при использовании в стехиометрических количествах, пригодны для смягчения, улучшения, ингибирования или предупреждения заболевания или состояния, в которые вовлечена активность или экспрессия PCSK9.
Предпочтительно, заболевание или состояние, в которые вовлечена экспрессия или активность PCSK9, выбраны из группы, состоящей из: повышенных уровней LDL-C, гиперхолестеринемии, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний или любых других заболеваний, описанных для первого или второго аспекта.
Антитела и их антигенсвязывающие фрагменты, которые можно использовать для применения на практике двенадцатого аспекта настоящего изобретения, описаны в разделе "Предпочтительные антитела для применения настоящего изобретения на практике".
В тринадцатом аспекте настоящее изобретение относится к способу лечения заболевания или состояния, в которые вовлечена экспрессия или активность PCSK9, включающему
введение терапевтического количества антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9), индивидууму, нуждающемуся в этом,
где индивидуум, нуждающийся в этом, относится к одной или нескольким из следующих групп индивидуумов: (i) индивидуумы с уровнем холестерина LDL (LDL-C) в сыворотке по меньшей мере 100 мг/дл, предпочтительно, по меньшей мере 130 мг/дл, более предпочтительно, по меньшей мере 160 мг/дл, еще более предпочтительно, по меньшей мере 200 мг/дл; (ii) индивидуумы, имеющие уровень HDL-C в сыворотке менее 40 мг/дл; (iii) индивидуумы, имеющие уровень холестерина в сыворотке по меньшей мере 200 мг/дл, предпочтительно, по меньшей мере 240 мг/дл; (iv) индивидуумы, имеющие уровень триацилглицерина в сыворотке по меньшей мере 150 мг/дл, например, по меньшей мере 200 мг/дл или по меньшей мере 500 мг/дл, где указанный уровень триацилглицеринов определяют после голодания в течение по меньшей мере 8 часов; (v) индивидуумы в возрасте по меньшей мере 35 лет, например, по меньшей мере 40 лет, по меньшей мере 45 лет, по меньшей мере 50 лет, по меньшей мере 55 лет, по меньшей мере 60 лет, по меньшей мере 65 лет, или по меньшей мере 75 лет; (vi) индивидуумы моложе 75 лет, например, моложе 70 лет, моложе 65 лет, моложе 60 лет, моложе 55 лет, моложе 50 лет, моложе 45 лет или моложе 40 лет; (vii) индивидуумы, имеющие BMI 25 или более (например, 26 или более, 27 или более, 28 или более, 29 или более, 30 или более, 31 или более, 32 или более, 33 или более, 34 или более, 35 или более, 36 или более, 37 или более, 38 или более, или 39 или более); (viii) мужчины; (ix) женщины; (x) индивидуумы, у которых введение указанного антитела или его антигенсвязывающего фрагмента приводит к снижению уровня LDL-C в сыворотке по меньшей мере на 30 мг/дл, предпочтительно, по меньшей мере на 40 мг/дл, более предпочтительно, по меньшей мере на 50 мг/дл, более предпочтительно, по меньшей мере на 60 мг/дл, более предпочтительно, по меньшей мере на 70 мг/дл, относительно уровня до введения дозы; или (xi) индивидуумы, у которых введение указанного антитела или его антигенсвязывающего фрагмента приводит к снижению уровня LDL-C в сыворотке по меньшей мере на 20%, предпочтительно, по меньшей мере на 30%, более предпочтительно, по меньшей мере на 40%, более предпочтительно, по меньшей мере на 50%, более предпочтительно, по меньшей мере на 60%, относительно уровня до введения дозы.
В четырнадцатом аспекте настоящее изобретение относится к способу лечения заболевания или состояния, в которые вовлечена экспрессия или активность PCSK9, включающему
введение терапевтического количества антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9), индивидууму, нуждающемуся в этом,
где индивидуум, нуждающийся в этом, не относится к одной или нескольким из следующих групп индивидуумов: (i) курильщики; (ii) лица в возрасте 70 лет и старше; (iii) лица, страдающие гипертензией; (iv) беременные женщины; (v) женщины, пытающиеся забеременеть; (vi) женщины, кормящие грудью; (vii) лица, которые имеют или когда-либо имели заболевание, поражающее печень; (viii) лица, которые имели какие-либо необъясненные аномальные показатели функции печени в тестах крови; (ix) лица, которые употребляют чрезмерные количества спиртных напитков; (x) лица, имеющие проблемы с почками; (xi) лица, страдающие гипотиреозом; (xii) лица, страдающие мышечными нарушениями; (xiii) лица, ранее сталкивавшиеся с мышечными проблемами в ходе лечения снижающей уровень липидов терапией; (xiv) лица, имеющие серьезные проблемы с дыханием; (xv) лица, принимающие одно или несколько из следующих лекарственных средств: лекарственные средства, изменяющие работу иммунной системы (например, циклоспорин или антигистамины), антибиотики или противогрибковые средства (например, эритромицин, кларитромицин, кетоконазол, итраконазол, рифампицин, фусидовая кислота), лекарственные средства, регулирующие уровень липидов (например, гемфиброзил, колестипол), блокаторы кальциевых каналов (например, верапамил, дилтиазем), лекарственные средства, регулирующие сердечный ритм (дигоксин, амиодарон), ингибиторы протеаз, используемые при лечении ВИЧ (например, нельфинавир), варфарин, пероральные контрацептивы, антациды или зверобой; или (xvi) лица, выпивающие более 0,1 л грейпфрутового сока в сутки или съедающие более половины грейпфрута в сутки; (xvii) лица, имеющие индекс массы тела (BMI) более 40; (xviii) лица, имеющие индекс массы тела (BMI) менее 18; (xix) лица, страдающие диабетом 1 типа или диабетом 2 типа; (xx) лица, положительные по гепатиту B или гепатиту C; (xxi) лица, имеющие известную чувствительность к лекарственным средствам на основе моноклональных антител; (xxii) лица, имеющие концентрацию нейтрофилов менее 1500/мм3; (xxiii) лица, имеющие концентрацию тромбоцитов менее 100000/мм3; (xxiv) мужчины, имеющие уровень креатинина в сыворотке более 1,5×ULN (верхняя граница нормы); (xxv) женщины, имеющие уровень креатинина в сыворотке более 1,4×ULN (верхняя граница нормы); (xxvi) лица, имеющие уровень аланинтрансаминазы (ALT) или уровень аспартаттрансаминазы (AST) более 2×ULN; или (xxvii) лица, имеющие уровень CPK более 3×ULN.
В предпочтительных вариантах осуществления тринадцатого и четырнадцатого аспекта заболевание или состояние, в которые вовлечена экспрессия или активность PCSK9, смягчаются, улучшаются, ингибируются или предупреждаются с помощью антагониста PCSK9.
В предпочтительных вариантах осуществления тринадцатого и четырнадцатого аспекта заболевание или состояние, в которые вовлечена экспрессия или активность PCSK9, выбраны из группы, состоящей из: повышенных уровней LDL-C, гиперхолестеринемии, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний или любых других заболеваний или состояний, описанных в других аспектах настоящего изобретения, таких как первый или второй аспект.
В предпочтительных вариантах осуществления тринадцатого и четырнадцатого аспекта индивидуумом, нуждающимся в этом, является индивидуум, для которого показан аферез LDL, индивидуум с активирующими PCSK9 мутациями, индивидуум с гетерозиготной семейной гиперхолестеринемией, индивидуум с первичной гиперхолестеринемией, например, индивидуум с первичной семейной или первичной несемейной гиперхолестеринемией, индивидуум с гиперхолестеринемией, такой как первичная гиперхолестеринемия, не контролируемая статинами, индивидуум с риском развития гиперхолестеринемии, индивидуум с гиперхолестеринемией, индивидуум с гиперлипидемией, индивидуум с дислипидемией, индивидуум с атеросклерозом или индивидуум с сердечно-сосудистыми заболеваниями, или любые другие индивидуумы, описанные для первого или второго аспектов. Наиболее предпочтительно, индивидуумом, нуждающимся в этом, является человек. Кроме того, предпочтительные или подходящие индивидуумы описаны для других аспектов настоящего изобретения.
Антитела и их антигенсвязывающие фрагменты, которые можно использовать для применения на практике тринадцатого и четырнадцатого аспекта и других аспектов настоящего изобретения, описаны в разделе "Предпочтительные антитела для применения настоящего изобретения на практике".
В предпочтительных вариантах осуществления тринадцатого и четырнадцатого аспекта способ дополнительно включает: введение терапевтического количества ингибитора HMG-CoA-редуктазы индивидууму в дозировке от 0,05 мг до 100 мг. В некоторых вариантах осуществления ингибитор HMG-CoA-редуктазы вводят три раза в сутки, два раза в сутки, или один раз в сутки. В некоторых вариантах осуществления ингибитор HMG-CoA-редуктазы вводят раз в сутки, раз в двое суток, раз в трое суток, раз в четверо суток, раз в пять суток или раз в шесть суток. В некоторых вариантах осуществления ингибитор HMG-CoA-редуктазы вводят раз в неделю, раз в две недели, раз в три недели или раз в четыре недели. В некоторых вариантах осуществления ингибитор HMG-CoA-редуктазы вводят утром, днем или вечером. В предпочтительных вариантах осуществления ингибитор HMG-CoA-редуктазы вводят один раз в сутки, предпочтительно, перорально, предпочтительно, вечером. Предпочтительно, ингибитором HMG-CoA-редуктазы является статин. Более предпочтительно, статин выбран из группы, состоящей из церивастатина, аторвастатина, симвастатина, питавастатина, розувастатина, флувастатина, ловастатина и правастатина. В следующем предпочтительном варианте осуществления тринадцатого и четырнадцатого аспекта способ включает введение терапевтического количества статина индивидууму, где статин представляет собой:
- церивастатин, вводимый в суточной дозировке от 0,05 мг до 2 мг, предпочтительно, в суточной дозировке 0,2 мг, 0,4 мг или 0,8 мг;
- аторвастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 10 мг, 20 мг, 40 мг или 80 мг;
- симвастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 5 мг, 10 мг, 20 мг, 40 мг или 80 мг;
- питавастатин, вводимый в суточной дозировке от 0,2 мг до 100 мг, предпочтительно, в суточной дозировке 1 мг, 2 мг, 5 мг, 10 мг или 20 мг;
- розувастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 5 мг, 10 мг, 20 мг или 40 мг;
- флувастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 20 мг, 40 мг или 80 мг;
- ловастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 10 мг, 20 мг, 40 мг или 80 мг; или
- правастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 10 мг, 20 мг, 40 мг или 80 мг.
Следующий предпочтительный вариант осуществления сочетает в себе признаки тринадцатого аспекта и четырнадцатого аспекта, как описано в настоящем описании.
В пятнадцатом аспекте настоящее изобретение относится к антителу или его антигенсвязывающему фрагменту, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9), где антитело характеризуется одним или несколькими из следующих признаков при введении индивидууму, предпочтительно, человеку или не являющемуся человеком млекопитающему:
13. Снижение уровней липопротеинов низкой плотности (LDL-C) на по меньшей мере от приблизительно 25% до приблизительно 40% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 14 суток, где устойчивое снижение составляет, предпочтительно, по меньшей мере 25% и, более предпочтительно, по меньшей мере 30% относительно уровня до введения дозы, в частности, при введении в дозе от приблизительно 40 до приблизительно 60 мг, предпочтительно, от приблизительно 45 до приблизительно 55 мг и, более предпочтительно, приблизительно 50 мг в режиме введения раз в две недели (через неделю, E2W).
14. Снижение уровня липопротеинов низкой плотности (LDL-C) на по меньшей мере от приблизительно 50% до приблизительно 65% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 14 суток, где устойчивое снижение составляет, предпочтительно, по меньшей мере 40% и более предпочтительно, по меньшей мере 45% относительно уровня до введения дозы, в частности, при введении в дозе от приблизительно 100 мг E2W.
15. Снижение уровня липопротеинов низкой плотности (LDL-C) на от по меньшей мере приблизительно 60% до по меньшей мере приблизительно 75% [например, по меньшей мере приблизительно на 60%, по меньшей мере приблизительно на 65%, по меньшей мере приблизительно на 70 или по меньшей мере приблизительно на 75%] относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 14 суток, где устойчивое снижение составляет, предпочтительно, по меньшей мере 55% и, более предпочтительно, по меньшей мере 60% относительно уровня до введения дозы, в частности, при введении в дозе приблизительно 150 мг E2W.
16. Снижение уровня липопротеинов низкой плотности (LDL-C) на по меньшей мере от приблизительно 40% до приблизительно 75% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 28 суток, где устойчивое снижение составляет, предпочтительно, по меньшей мере 35% и, более предпочтительно, по меньшей мере 40% относительно уровня до введения дозы, в частности, при введении в дозе приблизительно 200 мг E4W.
17. Снижение уровня липопротеинов низкой плотности (LDL-C) на по меньшей мере от приблизительно 50% до приблизительно 75% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 28 суток, где устойчивое снижение составляет, предпочтительно, по меньшей мере 40% и, более предпочтительно, по меньшей мере 45% относительно уровня до введения дозы, в частности, при введении в дозе приблизительно 300 мг E4W.
18. Увеличение уровня холестерина HDL в сыворотке по меньшей мере на 2%, по меньшей мере на 2,5%, по меньшей мере на 3%, по меньшей мере на 3,5%, по меньшей мере на 4%, по меньшей мере на 4,5%, по меньшей мере на 5% или по меньшей мере на 5,5% относительно уровня до введения дозы, в частности, при введении в дозе приблизительно 150 мг E2W.
19. Снижение уровня общего холестерина в сыворотке на по меньшей мере приблизительно от 25% до приблизительно 35% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 24 суток.
20. Снижение уровня общего холестерина в сыворотке на по меньшей мере от приблизительно 65% до приблизительно 80% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 24 суток.
21. Снижение уровней триглицеридов в сыворотке на по меньшей мере от приблизительно 25% до приблизительно 40% относительно уровня до введения дозы.
22. Небольшой или отсутствие поддающегося измерению эффекта на функцию печени, при определении по результатам измерения ALT и AST.
23. Небольшой или отсутствие поддающегося измерению эффекта на уровни тропонина.
24. Увеличение одного или нескольких из: уровни общего холестерина, уровни ApoB, уровни С не HDL, соотношение Apo-B/ApoA-1.
Антитело согласно пятнадцатому аспекту настоящего изобретения проявляет описанные выше свойства, предпочтительно, при введении в комбинации с лечением ингибитором HMG-CoA-редуктазы. Предпочтительные варианты осуществления ингибиторов HMG-CoA-редуктазы для применения вместе с антителом по изобретению и их дозировки и режимы введения могут быть найдены на протяжении описания, в частности, как описано в аспектах 1, 2 или 19.
В соответствии с предпочтительным вариантом осуществления антител и их антигенсвязывающих фрагментов по настоящему изобретению, в частности, антитела или антигенсвязывающего фрагмента в соответствии с пятнадцатым аспектом, антитело или его антигенсвязывающий фрагмент имеет одну или несколько из следующих характеристик:
(i) Антитело или антигенсвязывающий фрагмент содержат CDR тяжелой и легкой цепи из пары аминокислотных последовательностей HCVR/LCVR, как представлено в SEQ ID NO: 90/92.
(ii) Антитело или его антигенсвязывающий фрагмент содержат пару аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
(iii) Антитело или его антигенсвязывающий фрагмент конкурируют за связывание hPCSK9 с антителом или антигенсвязывающим фрагментом, содержащими пару аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
В соответствии с другим предпочтительным вариантом осуществления антител и их антигенсвязывающих фрагментов по настоящему изобретению, в частности, антитела или антигенсвязывающего фрагмента согласно пятнадцатому аспекту, антитело или его антигенсвязывающий фрагмент имеет одну или несколько из следующих характеристик:
(i) преодолевает устойчивость к статинам у млекопитающих, особенно у грызунов, таких как хомячок
(ii) увеличивает экспрессию LDLR у млекопитающих, в частности, у грызунов, таких как хомячок
(iii) снижает LDL-C в сыворотке у грызунов, таких как хомячок
(iv) синергически снижает LDL-C совместно с введением ингибитора HMG-CoA-редуктазы, в частности, у грызунов, таких как хомячок, где ингибитором HMG-CoA-редуктазы, предпочтительно, является аторвастатин.
Кроме того, подходящие характеристики и структурные признаки антитела по настоящему изобретению и, в частности, антитела согласно пятнадцатому аспекту, а также антител и их антигенсвязывающих фрагментов, которые можно использовать для применения на практике пятнадцатого аспекта и других аспектов настоящего изобретения, описаны в разделе "Предпочтительные антитела для применения настоящего изобретения на практике".
Антитело по настоящему изобретению, такое как антитело согласно пятнадцатому аспекту, предпочтительно, составляют в качестве фармацевтически приемлемого состава, как известно в данной области, и, в частности, как описано в настоящем описании, такого как сухой состав для растворения или жидкий состав, например, как описано в двадцать первом или двадцать втором аспекте.
В шестнадцатом аспекте настоящее изобретение относится к антителу или его антигенсвязывающему фрагменту, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9), для применения при лечении заболевания или состояния, в которые вовлечена экспрессия или активность PCSK9, где антитело или его антигенсвязывающий фрагмент предназначены для введения в дозе приблизительно от 50 до 500 мг.
Предпочтительные варианты осуществления шестнадцатого аспекта настоящего изобретения описаны в пятнадцатом аспекте. Антитела и их антигенсвязывающие фрагменты, которые можно использовать для применения на практике шестнадцатого аспекта настоящего изобретения, описаны в разделе "Предпочтительные антитела для применения настоящего изобретения на практике".
Согласно другому предпочтительному варианту осуществления шестнадцатого аспекта антитело или его антигенсвязывающий фрагмент предназначены для введения в дозе приблизительно 50, 100, 150, 200, 250, 300, 350, 400, 450 или 500 мг и, предпочтительно, приблизительно 150, 200 или 300 мг.
Согласно другому предпочтительному варианту осуществления шестнадцатого аспекта заболевание или состояние выбраны из группы, состоящей из: повышенных уровней общего холестерина, повышенных уровней липопротеинов низкого уровня (LDL-C), гиперхолестеринемии, гиперлипидемии, дислипидемии и атеросклероза, в частности, первичной гиперхолестеринемии, семейной гиперхолестеринемии или гиперхолестеринемии, которая не контролируется статинами.
В соответствии с другим предпочтительным вариантом осуществления шестнадцатого аспекта, антитело или его антигенсвязывающий фрагмент вводят индивидууму раз в две недели (E2W), раз в четыре недели (E4W) или раз в месяц.
В соответствии с другим предпочтительным вариантом осуществления шестнадцатого аспекта антитело или его антигенсвязывающий фрагмент имеют одну или несколько из следующих характеристик:
(i) предназначены для применения для снижения уровней липопротеинов низкой плотности (LDL-C) на по меньшей мере от приблизительно 25% до приблизительно 40% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 14 суток, где устойчивое снижение составляет, предпочтительно, по меньшей мере 25% и, более предпочтительно, по меньшей мере 30% относительно уровня до введения дозы, где антитело или его антигенсвязывающий фрагмент, предпочтительно, вводят в дозе от приблизительно 40 до приблизительно 60 мг, от приблизительно 45 до приблизительно 55 мг или приблизительно 50 мг E2W;
(ii) предназначены для применения для снижения уровня липопротеинов низкой плотности (LDL-C) на по меньшей мере от приблизительно 50% до приблизительно 65% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 14 суток, где устойчивое снижение составляет, предпочтительно, по меньшей мере 40% и, более предпочтительно, по меньшей мере 45% относительно уровня до введения дозы, где антитело или его фрагмент, предпочтительно, вводят в дозе приблизительно 100 мг E2W;
(iii) предназначены для применения для снижения уровня липопротеинов низкой плотности (LDL-C) на от по меньшей мере приблизительно 60% до по меньшей мере приблизительно 75% [например, по меньшей мере приблизительно на 60%, по меньшей мере приблизительно на 65%, по меньшей мере приблизительно на 70 или по меньшей мере приблизительно на 75%] относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 14 суток, где устойчивое снижение составляет, предпочтительно, по меньшей мере 55% и, более предпочтительно, по меньшей мере 60% относительно уровня до введения дозы, где антитело или его фрагмент, предпочтительно, вводят в дозе приблизительно 150 мг E2W;
(iv) предназначены для применения для снижения уровня липопротеинов низкой плотности (LDL-C) на по меньшей мере от приблизительно 40% до приблизительно 75% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 28 суток, где устойчивое снижение составляет, предпочтительно, по меньшей мере на 35% и более предпочтительно по меньшей мере на 40% относительно уровня до введения дозы, где антитело или его фрагмент, предпочтительно, вводят в дозе приблизительно 200 мг E4W;
(v) предназначены для применения для снижения уровня липопротеинов низкой плотности (LDL-C) на по меньшей мере от приблизительно 50% до приблизительно 75% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 28 суток, где устойчивое снижение составляет, предпочтительно, по меньшей мере 40% и более предпочтительно по меньшей мере 45% относительно уровня до введения дозы, где антитело или его фрагмент, предпочтительно, вводят в дозе приблизительно 300 мг E4W;
(vi) предназначены для применения для увеличения уровня холестерина HDL в сыворотке по меньшей мере на 2%, по меньшей мере на 2,5%, по меньшей мере на 3%, по меньшей мере на 3,5%, по меньшей мере на 4%, по меньшей мере на 4,5%, по меньшей мере на 5% или по меньшей мере на 5,5% относительно уровня до введения дозы;
(vii) предназначены для применения для снижения уровня общего холестерина в сыворотке на по меньшей мере от приблизительно 25% до приблизительно 35% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 24 суток;
(viii) предназначено для применения для снижения уровня общего холестерина в сыворотке на по меньшей мере от приблизительно 65% до приблизительно 80% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 24 суток;
25. предназначены для применения для снижения уровней триглицеридов в сыворотке на по меньшей мере от приблизительно 25% до приблизительно 40% относительно уровня до введения дозы;
26. имеют небольшой или отсутствие поддающегося измерению эффекта на функцию печени, при определении по результатам измерения ALT и AST, или на уровни тропонина.
27. предназначены для увеличения или нескольких из: уровни общего холестерина, уровни ApoB, уровни С не HDL, соотношение Apo-B/ApoA-1.
В соответствии с другим предпочтительным вариантом осуществления шестнадцатого аспекта антитело или его антигенсвязывающий фрагмент предназначены для применения вместе с ингибитором HMG-CoA-редуктазы, где ингибитор HMG-CoA-редуктазы, предпочтительно, вводят в дозировке в диапазоне от приблизительно 0,05 мг до приблизительно 100 мг и, предпочтительно, представляет собой статин, где статин, предпочтительно, выбран из группы, состоящей из: церивастатина, аторвастатина, симвастатина, питавастатина, розувастатина, флувастатина, ловастатина или правастатина.
В соответствии с другим предпочтительным вариантом осуществления шестнадцатого аспекта статин вводят в соответствии с одной из следующих режимов дозирования или введения:
(i) стадин вводят один раз в сутки,
(ii) статин вводят в дозировке от приблизительно 0,5 до приблизительно 100 мг, от приблизительно 5 до приблизительно 90 мг, приблизительно 10, 20, 40 или 80 мг, и предпочтительно, он представляет собой аторвастатин.
Кроме того, режимы дозирования и введения антитела, его антигенсвязывающего фрагмента или ингибитора HMG-CoA-редуктазы описаны для других аспектов настоящего изобретения и, предпочтительно, для первого, второго или девятнадцатого аспектов.
В семнадцатом аспекте настоящее изобретение относится к антителу или его антигенсвязывающему фрагменту, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9), для применения при лечении заболевания или состояния, в которые вовлечена экспрессия или активность PCSK9,
где антитело или его антигенсвязывающий фрагмент предназначены для введения индивидууму, относящемуся по меньшей мере к одной из следующих групп индивидуумов: (i) индивидуумы с уровнем холестерина LDL (LDL-C) в сыворотке по меньшей мере 100 мг/дл, предпочтительно, по меньшей мере 130 мг/дл, более предпочтительно, по меньшей мере 160 мг/дл, еще более предпочтительно, по меньшей мере 200 мг/дл; (ii) индивидуумы, имеющие уровень С HDL в сыворотке менее 40 мг/дл; (iii) индивидуумы, имеющие уровень холестерина в сыворотке по меньшей мере 200 мг/дл, предпочтительно, по меньшей мере 240 мг/дл; (iv) индивидуумы, имеющие уровень триацилглицерина в сыворотке по меньшей мере 150 мг/дл, например, по меньшей мере 200 мг/дл или по меньшей мере 500 мг/дл, где указанный уровень триацилглицеринов определяют после голодания в течение по меньшей мере 8 часов; (v) индивидуумы в возрасте по меньшей мере 35 лет, например, по меньшей мере 40 лет, по меньшей мере 45 лет, по меньшей мере 50 лет, по меньшей мере 55 лет, по меньшей мере 60 лет, по меньшей мере 65 лет или по меньшей мере 75 лет; (vi) индивидуумы моложе 75 лет, например, моложе 70 лет, моложе 65 лет, моложе 60 лет, моложе 55 лет, моложе 50 лет, моложе 45 лет или моложе 40 лет; (vii) индивидуумы, имеющие BMI 25 или более (например, 26 или более, 27 или более, 28 или более, 29 или более, 30 или более, 31 или более, 32 или более, 33 или более, 34 или более, 35 или более, 36 или более, 37 или более, 38 или более, или 39 или более); (viii) мужчины; (ix) женщины; (x) индивидуумы, у которых введение указанного антитела или его антигенсвязывающего фрагмента приводит к снижению уровня LDL-C в сыворотке по меньшей мере на 30 мг/дл, предпочтительно, по меньшей мере на 40 мг/дл, более предпочтительно, по меньшей мере на 50 мг/дл, более предпочтительно, по меньшей мере на 60 мг/дл, более предпочтительно, по меньшей мере на 70 мг/дл, относительно уровня до введения дозы; или (xi) индивидуумы, у которых введение указанного антитела или его антигенсвязывающего фрагмента приводит к снижению уровня LDL-C в сыворотке по меньшей мере на 20%, предпочтительно, по меньшей мере на 30%, более предпочтительно, по меньшей мере на 40%, более предпочтительно, по меньшей мере на 50%, более предпочтительно, по меньшей мере на 60%, относительно уровня до введения дозы.
В восемнадцатом аспекте настоящее изобретение относится к антителу или его антигенсвязывающему фрагменту, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9), для применения при лечении заболевания или состояния, в которые вовлечена экспрессия или активность PCSK9,
где антитело или его антигенсвязывающий фрагмент предназначены для введения индивидууму, который не относится к одной или нескольким из следующих групп индивидуумов: (i) курильщики; (ii) лица в возрасте 70 лет и старше; (iii) лица, страдающие гипертензией; (iv) беременные женщины; (v) женщины, пытающиеся забеременеть; (vi) женщины, кормящие грудью; (vii) лица, которые имеют или когда-либо имели заболевание, поражающее печень; (viii) лица, которые имели какие-либо необъясненные аномальные показатели функции печени в тестах крови; (ix) лица, которые употребляют чрезмерные количества спиртных напитков; (x) лица, имеющие проблемы с почками; (xi) лица, страдающие гипотиреозом; (xii) лица, страдающие мышечными нарушениями; (xiii) лица, ранее сталкивавшиеся с мышечными проблемами в ходе лечения снижающей уровень липидов терапией; (xiv) лица, имеющие серьезные проблемы с дыханием; (xv) лица, принимающие одно или несколько из следующих лекарственных средств: лекарственные средства, изменяющие работу иммунной системы (например, циклоспорин или антигистамины), антибиотики или противогрибковые средства (например, эритромицин, кларитромицин, кетоконазол, итраконазол, рифампицин, фусидовая кислота), лекарственные средства, регулирующие уровень липидов (например, гемфиброзил, колестипол), блокаторы кальциевых каналов (например, верапамил, дилтиазем), лекарственные средства, регулирующие сердечный ритм (дигоксин, амиодарон), ингибиторы протеаз, используемые при лечении ВИЧ (например, нельфинавир), варфарин, пероральные контрацептивы, антациды или зверобой; или (xvi) лица, выпивающие более 0,1 л грейпфрутового сока в сутки или съедающие более половины грейпфрута в сутки; (xvii) лица, имеющие индекс массы тела (BMI) более 40; (xviii) лица, имеющие индекс массы тела (BMI) менее 18; (xix) лица, страдающие диабетом 1 типа или диабетом 2 типа; (xx) лица, положительные по гепатиту B или гепатиту C; (xxi) лица, имеющие известную чувствительность к лекарственным средствам на основе моноклональных антител; (xxii) лица, имеющие концентрацию нейтрофилов менее 1500/мм3; (xxiii) лица, имеющие концентрацию тромбоцитов менее 100000/мм3; (xxiv) мужчины, имеющие уровень креатинина в сыворотке более 1,5×ULN (верхняя граница нормы); (xxv) женщины, имеющие уровень креатинина в сыворотке более 1,4×ULN (верхняя граница нормы); (xxvi) лица, имеющие уровень аланинтрансаминазы (ALT) или уровень аспартаттрансаминазы (AST) более 2×ULN; или (xxvii) лица, имеющие уровень CPK более 3×ULN.
В предпочтительных вариантах осуществления аспектов с пятнадцатого до восемнадцатого, заболевание или состояние, в которые вовлечена экспрессия или активность PCSK9, смягчаются, улучшаются, ингибируются или предупреждаются антагонистом PCSK9.
В предпочтительных вариантах осуществления аспектов с пятнадцатого по восемнадцатый, заболевание или состояние, в которые вовлечена экспрессия или активность PCSK9, выбраны из группы, состоящей из: повышенных уровней LDL-C, гиперхолестеринемии, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний или любых других заболеваний и состояний, описанных в первом или втором аспекте.
В предпочтительных вариантах осуществления аспектов с пятнадцатого по восемнадцатый, антитело или его антигенсвязывающий фрагмент предназначены для введения индивидууму, для которого показан аферез LDL, индивидууму с активирующими PCSK9 мутациями, индивидууму с гетерозиготной семейной гиперхолестеринемией, индивидууму с первичной гиперхолестеринемией, например, индивидууму с первичной семейной или первичной несемейной гиперхолестеринемией, индивидууму с гиперхолестеринемией, такой как первичная гиперхолестеринемия, не контролируемая статинами, индивидууму с риском развития гиперхолестеринемии, индивидууму с гиперхолестеринемией, индивидууму с гиперлипидемией, индивидууму с дислипидемией, индивидууму с атеросклерозом или индивидууму с сердечно-сосудистыми заболеваниями или любому другому из индивидуумов, как описано в первом или втором аспекте. Наиболее предпочтительно, индивидуумом является человек.
Антитела и их антигенсвязывающие фрагменты, которые можно использовать для применения на практике аспектов с пятнадцатого по восемнадцатый настоящего изобретения, описаны в разделе "Предпочтительные антитела для применения настоящего изобретения на практике".
В предпочтительных вариантах осуществления аспектов с шестнадцатого по восемнадцатый, антитело или его антигенсвязывающий фрагмент предназначены для введения в комбинации с дозировкой от 0,05 мг до 100 мг ингибитора HMG-CoA-редуктазы. В некоторых вариантах осуществления ингибитор HMG-CoA-редуктазы предназначен для введения три раза в сутки, два раза в сутки или один раз в сутки. В некоторых вариантах осуществления ингибитор HMG-CoA-редуктазы предназначен для введения раз в сутки, раз в двое суток, раз в трое суток, раз в четверо суток, раз в пять суток или раз в шесть суток. В некоторых вариантах осуществления ингибитор HMG-CoA-редуктазы предназначен для введения раз в неделю, раз в две недели, раз в три недели или раз в четыре недели. В некоторых вариантах осуществления ингибитор HMG-CoA-редуктазы предназначен для введения утром, днем или вечером. В предпочтительных вариантах осуществления ингибитор HMG-CoA-редуктазы предназначен для введения один раз в сутки, предпочтительно, перорально, предпочтительно, вечером. Предпочтительно, ингибитором HMG-CoA-редуктазы является статин. Более предпочтительно, статин выбран из группы, состоящей из церивастатина, аторвастатина, симвастатина, питавастатина, розувастатина, флувастатина, ловастатина и правастатина. В следующем предпочтительном варианте осуществления аспектов с шестнадцатого по восемнадцатый, антитело или его антигенсвязывающий фрагмент предназначены для введения в комбинации со статином, где статин представляет собой
- церивастатин, вводимый в суточной дозировке от 0,05 мг до 2 мг, предпочтительно, в суточной дозировке 0,2 мг, 0,4 мг или 0,8 мг;
- аторвастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 10 мг, 20 мг, 40 мг или 80 мг;
- симвастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 5 мг, 10 мг, 20 мг, 40 мг или 80 мг;
- питавастатин, вводимый в суточной дозировке от 0,2 мг до 100 мг, предпочтительно, в суточной дозировке 1 мг, 2 мг, 5 мг, 10 мг или 20 мг;
- розувастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 5 мг, 10 мг, 20 мг или 40 мг;
- флувастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 20 мг, 40 мг или 80 мг;
- ловастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 10 мг, 20 мг, 40 мг или 80 мг; или
- правастатин, вводимый в суточной дозировке от 2 мг до 100 мг, предпочтительно, в суточной дозировке 10 мг, 20 мг, 40 мг или 80 мг.
Следующий предпочтительный вариант осуществления сочетает в себе признаки шестнадцатого и семнадцатого или шестнадцатого и восемнадцатого или семнадцатого и восемнадцатого или шестнадцатого и семнадцатого и восемнадцатого аспектов, как описано в настоящем описании.
В девятнадцатом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей антитело или его антигенсвязывающий фрагмент в соответствии с настоящим изобретением, вместе с фармацевтически приемлемым эксципиентом или носителем.
В соответствии с предпочтительным вариантом осуществления девятнадцатого аспекта антитело или его фрагмент являются такими, как описано для пятнадцатого, первого или второго аспектов; кроме того, пригодные признаки антитела описаны в разделе "Предпочтительные антитела для применения настоящего изобретения на практике".
В соответствии с другим предпочтительным вариантом осуществления фармацевтическая композиция содержит от приблизительно 40 до приблизительно 500 мг антитела или антигенсвязывающего фрагмента на дозу.
В соответствии с другим предпочтительным вариантом осуществления фармацевтическая композиция содержит от приблизительно 50 мг до приблизительно 500 мг, от приблизительно 50 мг до приблизительно 300 мг, приблизительно 50 мг, приблизительно 100 мг, приблизительно 150 мг, приблизительно 200 мг, приблизительно 250 мг, приблизительно 300 мг, приблизительно 350 мг, приблизительно 400 мг, приблизительно 450 мг или приблизительно 500 мг антитела или его антигенсвязывающего фрагмента.
В соответствии с другим предпочтительным вариантом осуществления фармацевтическая композиция содержит приблизительно 150, 200 или 300 мг антитела или его антигенсвязывающего фрагмента.
В соответствии с другим предпочтительным вариантом осуществления фармацевтическая композиция содержит эффективную дозу антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9), где доза является достаточной для устойчивого снижения уровней липопротеинов низкой плотности (LDL-C) в течение периода по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19, по меньшей мере 20, по меньшей мере 21, по меньшей мере 22, по меньшей мере 23 или по меньшей мере 28 суток после введения, вместе с фармацевтически приемлемым эксципиентом или носителем. В соответствии с другим предпочтительным вариантом осуществления доза является достаточной для устойчивого снижения уровней LDL-C на протяжении периода по меньшей мере 14 суток, 28 суток или 1 месяца.
В соответствии с другим предпочтительным вариантом осуществления фармацевтическая композиция содержит эффективное количество ингибитора HMG-CoA-редуктазы.
В соответствии с другим предпочтительным вариантом осуществления фармацевтическая композиция предоставляется вместе с эффективным количеством ингибитора HMG-CoA-редуктазы.
В соответствии с другим предпочтительным вариантом осуществления ингибитором HMG-CoA-редуктазы является статин, предпочтительно, выбранный из списка, состоящего из: церивастатина, аторвастатина, симвастатина, питавастатина, розувастатина, флувастатина, ловастатина или правастатина и, предпочтительно, он представляет собой аторвастатин.
В соответствии с другим предпочтительным вариантом осуществления фармацевтическая композиция содержит от приблизительно 0,05 мг до приблизительно 100 мг, от приблизительно 0,5 мг до приблизительно 100 мг, от приблизительно 5 мг до приблизительно 90 мг, приблизительно 10 мг, приблизительно 20 мг, приблизительно 40 мг или приблизительно 80 мг ингибитора HMG-CoA-редуктазы и, предпочтительно, приблизительно 10, приблизительно 20, приблизительно 40 или приблизительно 80 мг.
В соответствии с другим предпочтительным вариантом осуществления фармацевтическая композиция содержит эффективную дозу ингибитора HMG-CoA-редуктазы для снижения уровней LDL-C при введении один раз в сутки.
Антитело или его антигенсвязывающий фрагмент для применения в фармацевтической композиции в соответствии с настоящим изобретением могут представлять собой любое антитело, как описано в настоящем описании, как например, в разделе "Предпочтительные антитела для применения настоящего изобретения на практике" или для пятнадцатого и других аспектов.
В соответствии с предпочтительным вариантом осуществления антитело или его антигенсвязывающий фрагмент имеют один или несколько из следующих признаков при введении индивидууму, такому как человек или не являющееся человеком млекопитающее:
a. снижение уровней липопротеинов низкой плотности (LDL-C) на по меньшей мере от приблизительно 25% до приблизительно 40% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 14 суток при введении индивидууму, где устойчивое снижение составляет, предпочтительно, по меньшей мере 25% и, более предпочтительно, по меньшей мере 30% относительно уровня до введения дозы, в частности, при введении в дозе от приблизительно 40 до приблизительно 60 мг, предпочтительно, от приблизительно 45 до приблизительно 55 мг и, более предпочтительно, приблизительно 50 мг в режиме введения раз в две недели (через неделю, E2W);
b. снижение уровня липопротеинов низкой плотности (LDL-C) на по меньшей мере от приблизительно 50% до приблизительно 65% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 14 суток при введении индивидууму, где устойчивое снижение составляет, предпочтительно, по меньшей мере 40% и, более предпочтительно, по меньшей мере 45% относительно уровня до введения дозы, в частности, при введении в дозе от приблизительно 100 мг E2W.
с. снижение уровня липопротеинов низкой плотности (LDL-C) на от по меньшей мере приблизительно 60% до по меньшей мере приблизительно 75% [например, по меньшей мере приблизительно на 60%, по меньшей мере приблизительно на 65%, по меньшей мере приблизительно на 70 или по меньшей мере приблизительно на 75%] относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 14 суток при введении индивидууму, где устойчивое снижение составляет, предпочтительно, по меньшей мере 55% и, более предпочтительно, по меньшей мере 60% относительно уровня до введения дозы, в частности, при введении в дозе приблизительно 150 мг E2W,
d. снижение уровня липопротеинов низкой плотности (LDL-C) на по меньшей мере от приблизительно 40% до приблизительно 75% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 28 суток, где устойчивое снижение составляет, предпочтительно, по меньшей мере 35% и более предпочтительно, по меньшей мере 40% относительно уровня до введения дозы, в частности, при введении в дозе приблизительно 200 мг E4W,
e. снижение уровня липопротеинов низкой плотности (LDL-C) на по меньшей мере от приблизительно 50% до приблизительно 75% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 28 суток при введении индивидууму, где устойчивое снижение составляет, предпочтительно, по меньшей мере 40% и, более предпочтительно, по меньшей мере 45% относительно уровня до введения дозы, в частности, при введении в дозе приблизительно 300 мг E4W,
f. увеличение уровня холестерина HDL в сыворотке по меньшей мере на 2%, по меньшей мере на 2,5%, по меньшей мере на 3%, по меньшей мере на 3,5%, по меньшей мере на 4%, по меньшей мере на 4,5%, по меньшей мере на 5% или по меньшей мере на 5,5% относительно уровня до введения дозы upon введение индивидууму, в частности, при введении в дозе приблизительно 150 мг E2W,
g. небольшой или отсутствие поддающегося измерению эффекта на уровни тропонина при введении индивидууму,
h. увеличение одного или нескольких из: уровни общего холестерина, уровни ApoB, уровни С не HDL, соотношение Apo-B/ApoA-1, при введении индивидууму.
В соответствии с другим предпочтительным вариантом осуществления антитело или его антигенсвязывающий фрагмент способны преодолевать устойчивость к статинам при введении индивидууму с резистентной к статинам гиперхолестеринемией.
В соответствии с другим предпочтительным вариантом осуществления антитело или его антигенсвязывающий фрагмент содержат CDR тяжелой и легкой цепей из пары аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92, по существу идентичных последовательностей, имеющих по меньшей мере 98% или 99% идентичность с ними.
В соответствии с другим предпочтительным вариантом осуществления антитело или его антигенсвязывающий фрагмент содержат пару аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92, или пару по существу идентичных последовательностей, имеющих по меньшей мере 98% или 99% идентичность с ними.
В соответствии с другим предпочтительным вариантом осуществления антитело или его антигенсвязывающий фрагмент конкурируют за связывание hPCSK9 с антителом или антигенсвязывающим фрагментом, содержащими пару аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
В соответствии с другим предпочтительным вариантом осуществления антитело или его антигенсвязывающий фрагмент связывают эпитоп, содержащий аминокислотный остаток 238 hPCSK9 (SEQ ID NO:755).
В соответствии с другим предпочтительным вариантом осуществления антитело или его антигенсвязывающий фрагмент связывают эпитоп, содержащую один или несколько аминокислотных остатков в положениях 238, 153, 159 и 343 hPCSK9 (SEQ ID NO: 755).
В соответствии с другим предпочтительным вариантом осуществления антитело или его антигенсвязывающий фрагмент связывают эпитоп, который не содержит аминокислотный остаток в положениях 192, 194, 197 и/или 237 hPCSK9 (SEQ ID NO: 755).
Фармацевтическая композиция может быть получена в соответствии с любым фармацевтически применимым составом, как известно в данной области, и, в частности, как описано в настоящем описании, таком как сухой состав для растворения или жидкий состав. Подходящие составы антител известны в данной области и включают сухие составы (например, высушенные сублимационной сушкой, высушенные распылительной сушкой или лиофилизированные, не содержащий воды концентрат), а также жидкие составы (например, растворы). Пригодные составы статинов хорошо известны в данной области и включают сухие составы, а также жидкие составы, например, суспензии, дисперсии и растворы (для обзора, см., например, "Statins therapy: a review on conventional and novel formulation approaches" R. Tiwari и K. Pathak, Journal of Pharmacy and Pharmacology, 2011, которая включена в настоящее описание в качестве ссылки).
В соответствии с предпочтительным вариантом осуществления фармацевтическая композиция содержит антитело или его антигенсвязывающий фрагмент в качестве сухого состава для растворения, такого как лиофилизированный порошок, высушенный сублимационной сушкой или высушенный распылительной сушкой порошок или не содержащий воды концентрат.
В соответствии с другим предпочтительным вариантом осуществления фармацевтическая композиция содержит антитело или его антигенсвязывающий фрагмент в качестве жидкого состава, например, раствора для инъекций или инфузий.
В соответствии с другим предпочтительным вариантом осуществления фармацевтическая композиция содержит ингибитор HMG-CoA-редуктазы в качестве орального или перорального состава, например, капсулы или таблетки, или в качестве жидкого состава, например, суспензии, дисперсии или раствора, например, для перорального введения, инъекции или инфузии.
В соответствии с другим предпочтительным вариантом осуществления фармацевтическая композиция предназначена для применения для лечения заболевания или нарушения для применения при лечении заболевания или состояния, в которые вовлечена экспрессия или активность PCSK9, или для снижения повышенных уровней общего холестерина или LDL-C. Кроме того, предпочтительные применения, режимы дозирования, режимы введения антитела или его фрагмента или ингибитора HMG-CoA-редуктазы, или группы, подлежащие лечению фармацевтической композицией, описаны в настоящей заявке, например, для других аспектов настоящего изобретения, таких как первый или второй аспект.
В двадцатом аспекте настоящее изобретение относится к раствору для инъекций, как описано в настоящем описании, содержащему антитело или его антигенсвязывающий фрагмент по настоящему изобретению, и предпочтительно, содержащему от приблизительно 40 мг до приблизительно 200 мг или от приблизительно 50 до приблизительно 200 мг, например, приблизительно 40 мг, приблизительно 50 мг, приблизительно 75 мг, приблизительно 100 мг, приблизительно 150 мг или приблизительно 200 мг антитела или его антигенсвязывающего фрагмента на объем 1 мл.
В двадцать первом аспекте настоящее изобретение относится к сухому составу, как описано в настоящем описании, содержащему антитело или его антигенсвязывающий фрагмент по настоящему изобретению, и предпочтительно, содержащему от приблизительно 40 мг до приблизительно 500 мг, от 50 до приблизительно 500 мг, от приблизительно 50 до приблизительно 400, от приблизительно 50 до приблизительно 300, например, приблизительно 40 мг, приблизительно 50 мг, приблизительно 75 мг, приблизительно 100 мг, приблизительно 150 мг, приблизительно 200 мг, приблизительно 250 мг, приблизительно 300 мг, приблизительно 350 мг, приблизительно 400 мг, приблизительно 450 мг или приблизительно 500 мг и, более предпочтительно, приблизительно 50 мг, приблизительно 100 мг, приблизительно 150 мг, приблизительно 200 мг, приблизительно 250 мг, приблизительно 300 мг и, еще более предпочтительно, приблизительно 150 мг, приблизительно 200 мг или приблизительно 300 мг антитела или его антигенсвязывающего фрагмента на дозу.
Составы по настоящему изобретению могут содержать дополнительные активные ингредиенты, такие как ингибитор HMG-CoA-редуктазы, как описано в настоящем описании. Предпочтительные варианты осуществления 20 или 21 аспекта описаны в других разделах настоящей заявки, например, для других аспектов настоящего изобретения, таких как пятнадцатый, девятнадцатый или двадцатый аспект.
Пригодные составы антител, как правило, известны в данной области и содержат сухие составы (например, высушенные сублимационной сушкой, высушенные распылительной сушкой или лиофилизированные, не содержащий воды концентрат), а также жидкие составы (например, растворы). Пригодные составы статинов хорошо известны в данной области и включают сухие составы, а также жидкие составы, например, суспензии, дисперсии и растворы (для обзора, см., например, "Statins therapy: a review on conventional and novel formulation approaches" R. Tiwari и K. Pathak, Journal of Pharmacy and Pharmacology, 2011, которая включена в настоящее описание в качестве ссылки).
В соответствии с двадцать вторым аспектом, настоящее изобретение относится к антителу или его антигенсвязывающему фрагменту, содержащимся в одной из фармацевтических композиций в соответствии с девятнадцатым аспектом.
В двадцать третьем аспекте настоящее изобретение относится к лекарственной форме, содержащей антитело, его антигенсвязывающий фрагмент или фармацевтическую композицию по настоящему изобретению. Пригодные варианты осуществления антитела, фармацевтической композиции или состава для применения на практике два двадцать третьего аспекта настоящего изобретения, могут быть установлены из соответствующих разделов настоящей заявки, таких как первый, второй, девятнадцатый, двадцатый, двадцать первый или двадцать второй аспекты, или из раздела "Предпочтительные антитела для применения настоящего изобретения на практике".
В соответствии с предпочтительным вариантом осуществления лекарственная форма содержит приблизительно 40 мг, приблизительно 50 мг, приблизительно 75 мг, приблизительно 100 мг, приблизительно 150 мг, приблизительно 200 мг, приблизительно 250 мг, приблизительно 300 мг, приблизительно 350 мг, приблизительно 400 мг, приблизительно 450 мг или приблизительно 500 мг антитела или его антигенсвязывающего фрагмента.
В соответствии с другим предпочтительным вариантом осуществления лекарственная форма содержит антитело или его фрагмент в качестве сухого состава для растворения в герметично закрытом контейнере, таком как флакон, ампула или саше.
В соответствии с другим предпочтительным вариантом осуществления лекарственная форма содержит антитело или его фрагмент в качестве жидкого состава в герметично закрытом контейнере, таком как флакон, саше, предварительно заполненный шприц, предварительно заполненный шприц для самоинъекций или кассета для повторно используемого шприца или аппликатора.
В соответствии с другим предпочтительным вариантом осуществления на герметично закрытом контейнере указано количество активного ингредиента.
Как используют в различных аспектах и вариантах осуществления настоящего изобретения, в частности, в двадцать третьем аспекте, термин "лекарственная форма" относится к физически дискретным единицам, пригодным в качестве единичных дозировок для человека и/или животных, причем каждая единица содержит заданное количество активного материала (например, приблизительно 40 мг или от приблизительно 50 до приблизительно 500 мг антитела PCSK5 и/или, например, от 0,05 мг до 100 мг ингибитора HMG-CoA-редуктазы), вычисленное для достижения желаемого терапевтического эффекта, вместе с требуемым фармацевтическим разбавителем, носителем или наполнителем. Характеристики новых лекарственных форм по настоящему изобретению определяются и прямо зависят от (a) уникальных характеристик активного материала и конкретного терапевтического эффекта, которого намереваются достигнуть, и (b) ограничения в данной области в отношении составления такого активного материала для терапевтического применения у животных или человека, как описано в настоящем описании, и они являются признаками настоящего изобретения. Примерами подходящих лекарственных форм по настоящему изобретению являются флаконы, таблетки, капсулы, лепешки, суппозитории, пакеты с порошком, вафли, крахмальные капсулы, ампулы, отдельные множества любых из вышесказанных, и другие формы, как описано в настоящем описании или общеизвестно в данной области.
Одна или несколько таких лекарственных форм антитела могут содержаться в изделии по настоящему изобретению, необязательно дополнительно содержащем одну или несколько лекарственных форм ингибитора HMG-CoA-редуктазы (например, таблетки в блистерной упаковке, содержащие в качестве активного ингредиента ингибитор HMG-CoA-редуктазы).
Термин "активный материал" относится к любому материалу с терапевтической активностью, такому как один или несколько активных ингредиентов. Активные ингредиенты, используемые в качестве лекарственных средств, можно легко получать в такой лекарственной форме с использованием фармацевтических материалов, которые сами по себе доступны в данной области и могут быть получены общепринятыми способами. Предпочтительными активными ингредиентами по настоящему изобретению являются антитело или его фрагмент или ингибитор HMG-CoA-редуктазы, такой как статин.
В предпочтительном варианте осуществления лекарственная форма содержит 40 - приблизительно 500 мг антитела или антигенсвязывающего фрагмента по настоящему изобретению. В соответствии с другим предпочтительным вариантом осуществления лекарственная форма содержит приблизительно 40 мг, приблизительно 50 мг, приблизительно 75 мг, приблизительно 100 мг, приблизительно 150 мг, приблизительно 200 мг, приблизительно 250 мг, приблизительно 300 мг, приблизительно 350 мг, приблизительно 400 мг, приблизительно 450 мг, или приблизительно 500 мг и, более предпочтительно, приблизительно 150 мг, приблизительно 200 мг или приблизительно 300 мг антитела или его антигенсвязывающего фрагмента. Кроме того, предпочтительные дозировки и режимы дозирования являются такими, как описано в настоящей заявке, как например, для первого, второго аспектов или аспектов с пятнадцатого до девятнадцатого.
В соответствии с другим предпочтительным аспектом лекарственная форма содержит антитело, его антигенсвязывающий фрагмент или фармацевтическую композицию в качестве сухого состава для растворения, такого как лиофилизированный порошок, высушенный сублимационной сушкой порошок или не содержащий воды концентрат. В соответствии с другим предпочтительным вариантом осуществления сухой состав содержится в герметично закрытом контейнере, таком как флакон, ампула или саше.
В соответствии с другим предпочтительным вариантом осуществления лекарственная форма содержит антитело, его антигенсвязывающий фрагмент или фармацевтическую композицию в качестве жидкого состава, например, раствора для инъекций или инфузий. В соответствии с другим предпочтительным вариантом осуществления жидкий состав содержится в герметично закрытом контейнере, таком как флакон, саше, предварительно заполненный шприц, предварительно заполненный шприц для самоинъекций или кассета для многоразового шприца или аппликатора.
Кроме того, предпочтительно, чтобы количество активного ингредиента (например, антитела) было указано на герметично закрытом контейнере лекарственной формы.
Следующие препараты являются иллюстративными для получения лекарственных форм по настоящему изобретению, а не для ограничения их. Можно получать несколько дозированных форм, являющихся вариантами осуществления настоящего изобретения. Например, единичная доза на флакон может содержать 0,5 мл, 1 мл, 2 мл, 3 мл, 4 мл, 5 мл, 6 мл, 7 мл, 8 мл, 9 мл, 10 мл, 15 мл, или 20 мл антитела против PCSK5 или его фрагмента в диапазоне от приблизительно 40 до приблизительно 500 мг антитела против PCSK5. Если необходимо, эти препараты можно доводить до желаемой концентрации добавлением стерильного разбавителя в каждый флакон.
В одном из вариантов осуществления ингредиенты состава по изобретению предоставляют по отдельности или смешанными вместе в лекарственную форму, например, в качестве сухого состава для растворения или жидкого состава. Препараты фармацевтически приемлемых составов белковых биомолекул, таких как антитела или их антигенсвязывающие фрагменты, или низкомолекулярных соединений, таких как статины, как правило, известны в данной области. В соответствии с предпочтительным вариантом осуществления активные ингредиенты, активный материал или фармацевтическая композиция в соответствии с настоящим изобретением представляют собой сухой состав для растворения жидкостью, такой как лиофилизированный порошок, высушенный сублимационной сушкой порошок или не содержащий воды концентрат, предпочтительно, содержащиеся в герметично закрытом контейнере, таком как флакон, ампула или саше, и предпочтительно, на которых указано количество активного вещества. Когда композиция предназначена для введения путем инфузии, ее можно распределять в бутылку для инфузий, содержащую стерильную воду или солевой раствор фармацевтической категории. Когда композицию вводят путем инъекции, может быть предоставлена ампула стерильной воды для инъекций или солевого раствора, чтобы ингредиенты можно было смешивать перед введением.
Составы по изобретению включают композиции лекарственных средств в виде сыпучих смесей, пригодных для получения фармацевтических композиций (например, композиций, которые пригодны для введения индивидууму или пациенту), которые можно использовать для получения лекарственных форм. В предпочтительном варианте осуществления композиция по изобретению представляет собой фармацевтическую композицию. Такие композиции содержат профилактически или терапевтически эффективное количество одного или нескольких профилактических или терапевтических средств (например, антитело по изобретению или другое профилактическое или терапевтическое средство), и фармацевтически приемлемый носитель. Предпочтительно, фармацевтические композиции изготавливают так, чтобы они были пригодными для данного пути введения индивидууму.
В конкретном варианте осуществления термин "фармацевтически приемлемый" означает одобренный регулирующим органом федерального правительства или правительства штата США или EMA (European Medicines Agency) или приведенный в фармакопее U.S. Pharmacopeia (United States Pharmacopeia-33/National Formulary-28 Reissue, опубликованная United States Pharmacopeial Convention, Inc., Rockville Md., дата публикации: April 2010) или другой общепризнанной фармакопеей для применения у животных, и более конкретно у человека.
Термин "носитель" относится к разбавителю, адъюванту (например, адъювант Фрейнда (полный и неполный)), эксципиенту или носителю, с которым вводят лекарственное средство. Такие фармацевтические носители могут быть стерильными жидкостями, такими как вода и масла, включая масла из нефти, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.п. Вода является предпочтительным носителем, когда фармацевтическую композицию вводят внутривенно. Также в качестве жидких носителей можно использовать солевые растворы и водные растворы декстрозы и глицерина, в частности, для инъецируемых растворов. Подходящие фармацевтические эксципиенты включают крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухое снятое молоко, глицерин, пропилен, гликоль, воду, этанол и т.п. Композиция, если желательно, также может содержать небольшие количества смачивающих веществ или эмульгаторов, или pH-буферных веществ. Эти композиции могут иметь форму растворов, суспензий, эмульсий, таблеток, пилюль, капсул, порошков, составов с замедленным высвобождением и т.п. Пероральный состав может включать стандартные носители, такие как маннит, лактоза, крахмал, стеарат магния, сахарин натрия, целлюлоза, карбонат магния фармацевтической категории и т.д. Примеры подходящих фармацевтических носителей описаны в "Remington's Pharmaceutical Sciences", E. W. Martin. Такие композиции содержат профилактически или терапевтически эффективное количество антитела, предпочтительно, в очищенной форме, вместе с подходящим количеством носителя с получением формы для надлежащего введения пациенту. Композиция, кроме того, может содержать один или несколько активных ингредиентов, таких как ингибитор HMG-CoA-редуктазы. Состав должен соответствовать способу введения.
Как правило, ингредиенты композиций по изобретению предоставляют либо отдельно, либо смешанными вместе в лекарственной форме, например, в качестве сухого состава для растворения, такого как лиофилизированный порошок, высушенный сублимационной сушкой порошок или не содержащий воды концентрат, в герметично закрытом контейнере, таком как ампула или саше, на которых указано количество активного вещества. Ингредиенты композиций по изобретению также могут быть представлены в качестве смешанного жидкого состава (т.е. раствор для инъекций или инфузий) в герметично закрытом контейнере, таком как ампула, саше, предварительно заполненный шприц или шприц для самоинъекций, или кассета для многоразового шприца или аппликатора (например, шприца-ручки или шприца для самоинъекций). Когда композиция предназначена для введения путем инфузии, ее можно распространять в бутылке для инфузий, содержащей стерильную воду или солевой раствор фармацевтической категории. Когда композицию вводят путем инъекции, может быть предоставлена ампула стерильной воды или солевого раствора для инъекций, так чтобы ингредиенты можно было смешивать перед введением. Композиция также может содержать два или более активных ингредиента, каждый из которых составлен по-разному или одинаковым образом, например, комбинацию антитела по настоящему изобретению с ингибитором HMG-CoA-редуктазы или настоящим изобретением.
Изобретение также относится к составу, упакованному в герметично закрытый контейнер, такой как ампула или саше, на котором указано количество антитела. В одном из вариантов осуществления состав по изобретению, содержащий антитело, предоставляют в качестве сухого стерилизованного лиофилизированного порошка, высушенного сублимационной сушкой порошка или не содержащего воды концентрата в герметично закрытом контейнере, и его можно восстанавливать, например, водой или солевым раствором, до соответствующей концентрации для введения индивидууму. В одном из вариантов осуществления состав по изобретению, содержащий антитело, предоставляют в качестве сухого стерильного лиофилизированного порошка в герметично закрытом контейнере в единичной дозировке по меньшей мере 40 мг, по меньшей мере 50 мг, более предпочтительно, по меньшей мере 75 мг, по меньшей мере 100 мг, по меньшей мере 150 мг, по меньшей мере 200 мг, по меньшей мере 250 мг, по меньшей мере 300 мг, по меньшей мере 350 мг, по меньшей мере 400 мг, по меньшей мере 450 мг, или по меньшей мере 500 мг антитела или его антигенсвязывающего фрагмента. Лиофилизированный состав по изобретению, содержащий антитело, должен храниться при от 2 до 8°C в его исходном контейнере и антитело должно быть введено в пределах 12 часов, предпочтительно, в пределах 6 часов, в пределах 5 часов, в пределах 3 часов, или в пределах 1 часа после восстановления. Состав по изобретению, содержащий антитело, может быть получен в качестве нейтральной или солевой форм. Фармацевтически приемлемые соли включают соли, образованные с анионами, такие как соли, происходящие из хлористоводородной, фосфорной, уксусной, щавелевой, виннокаменной кислот и т.д., и соли, образованные с катионами, такие как соли, происходящие из гидроксидов натрия, калия, аммония, кальция, железа, изопропиламина, триэтиламина, 2-этиламиноэтанола, гистидина, прокаина и т.д.
В двадцать четвертом аспекте настоящее изобретение относится к изделию, содержащему фармацевтическую композицию по настоящему изобретению, жидкий состав по настоящему изобретению или сухой состав по настоящему изобретению, антитело или его антигенсвязывающий фрагмент по настоящему изобретению или одну или несколько лекарственных форм по настоящему изобретению и контейнер или упаковку.
В соответствии с другим предпочтительным вариантом осуществления изделие содержит достаточное количество лекарственных форм антитела для периода две недели (14 сутки), четыре недели (28 суток) или один месяц с режимом введения E2W, E4W или один раз в месяц.
Изделие может содержать одну или несколько лекарственных форм, которые содержат(содержит) как антитело, так и ингибитор HMG CoA, например, лекарственную форму, содержащую жидкий состав для инъекции или инфузии, содержащий оба активных ингредиента. Изделие также может содержать антитело (или его антигенсвязывающий фрагмент) и ингибитор HMG-CoA-редуктазы в двух или нескольких отдельных лекарственных формах.
В соответствии с одним вариантом осуществления изделие содержит одну или несколько лекарственных форм ингибитора HMG-CoA-редуктазы в соответствии с настоящим изобретением.
В соответствии с предпочтительным вариантом осуществления каждая лекарственная форма ингибитора HMG-CoA-редуктазы содержит от приблизительно 0,05 мг до приблизительно 100 мг ингибитора HMG-CoA-редуктазы.
В соответствии с другим предпочтительным вариантом осуществления ингибитор HMG-CoA-редуктазы представляет собой статин, предпочтительно, выбранный из списка, содержащего: церивастатин, аторвастатин, симвастатин, питавастатин, розувастатин, флувастатин, ловастатин или правастатин и предпочтительно, аторвастатин.
В соответствии с другим предпочтительным вариантом осуществления ингибитор HMG-CoA-редуктазы, например, статин, находится в эффективной дозе для введения один раз в сутки.
В соответствии с другим предпочтительным вариантом осуществления лекарственная форма ингибитора HMG-CoA-редуктазы содержит от приблизительно 0,5 до приблизительно 100 мг, от приблизительно 5 до приблизительно 90 мг, приблизительно 10, 20, 40 или 80 мг ингибитора HMG-CoA-редуктазы.
В соответствии с другим предпочтительным вариантом осуществления изделие содержит достаточное количество лекарственных форм ингибитора HMG-CoA-редуктазы для режима введения каждые сутки.
В соответствии с другим предпочтительным вариантом осуществления лекарственная форма, содержащая антитело, представляет собой саше, предварительно заполненный шприц, предварительно заполненный шприц для самоинъекций или кассету для многоразового шприца или аппликатора, в частности, содержащие 1 мл или 2 мл раствора для инъекций.
В соответствии с другим вариантом осуществления изделие содержит один или несколько из следующих компонентов:
i. Одна или несколько лекарственных форм, содержащих антитело по настоящему изобретению
j. Одна или несколько лекарственных форм, содержащих ингибитор HMG-CoA-редуктазы по настоящему изобретению;
k. Инструкции по применению;
l. Устройство для применения антитела, такое как шприц.
В соответствии с другим предпочтительным вариантом осуществления изделие содержит достаточное количество лекарственных форм антитела и также, предпочтительно, ингибитор HMG-CoA-редуктазы…
(a) для одного единственного введения антитела и ингибитора HMG-CoA-редуктазы, например, включая ампулу, саше, флакон, кассету или предварительно заполненный шприц, содержащий приблизительно 50 мг, приблизительно 100 мг, приблизительно 150 мг, приблизительно 200 мг, приблизительно 250 мг, приблизительно 300 мг, приблизительно 350 мг, приблизительно 400 мг, приблизительно 450 мг или приблизительно 500 мг антитела и, предпочтительно, приблизительно 150 мг антитела, приблизительно 200 мг антитела или приблизительно 300 мг антитела, вместе с таблеткой или капсулой, например, для орального или перорального введения, содержащей HMG, ингибитор CoA, например, содержащей приблизительно 10 мг, приблизительно 20 мг, приблизительно 40 мг или приблизительно 80 мг ингибитора HMG CoA, такого как аторвастатин.
(b) для лечения в течение двух недель (т.е. 14 суток) антителом и ингибитором HMG-CoA-редуктазы, например, включая ампулу, саше, флакон, кассету или предварительно заполненный шприц, содержащие приблизительно 50 мг, приблизительно 100 мг, приблизительно 150 мг, приблизительно 200 мг, приблизительно 250 мг, приблизительно 300 мг, приблизительно 350 мг, приблизительно 400 мг, приблизительно 450 мг или приблизительно 500 мг антитела и, предпочтительно, приблизительно 150 мг антитела, приблизительно 200 мг антитела или приблизительно 300 мг антитела; вместе с достаточным количеством единиц, содержащих ингибитор HMG-CoA-редуктазы (например, таблетки или капсулы, например, для орального или перорального введения) для лечения в течение 14 суток, например, 14 единиц для режима введения ингибитора HMG-CoA-редуктазы один раз в сутки или 28 единиц для режима введения два раза в сутки и т.д., где единицы на сутки ингибитора HMG CoA, предпочтительно, содержат приблизительно 10 мг, приблизительно 20 мг, приблизительно 40 мг или приблизительно 80 мг ингибитора HMG CoA, такого как аторвастатин. В случае, когда антитело предназначено для введения в дозировке более 200 мг, могут быть предпочтительными две лекарственные формы антитела вместе с общей дозой, составляющие общую дозу (например, два предварительно заполненных шприца, содержащих приблизительно по 150 мг антитела в 1 мл жидкого состава для введения в целом (например, подкожной инъекции) приблизительно 300 мг антитела за две инъекции) (или две единицы по 100 мг каждая для введения в целом приблизительно 200 мг антитела, две единицы по приблизительно 175 мг для введения в целом приблизительно 350 мг антитела, и т.д…).
(с) для лечения в течение четырех недель (т.е. 28 суток) антителом и ингибитором HMG-CoA-редуктазы, например
1. для режима введения E2W антитела с от приблизительно 50 до приблизительно 200 мг антитела на две недели: включая две лекарственных формы (например, как проиллюстрировано выше) каждая по приблизительно 50 мг, приблизительно 100 мг, приблизительно 150 мг или приблизительно 200 мг антитела или его антигенсвязывающего фрагмента вместе с 28 лекарственными формами ингибитора HMG-CoA-редуктазы (как проиллюстрировано выше) для режима введения один раз в сутки или вместе с 56 лекарственными формами ингибитора HMG-CoA-редуктазы для режима введения два раза в сутки, предпочтительно, 28 лекарственные формы (например, капсулы или таблетки) приблизительно 10 мг, приблизительно 20 мг, приблизительно 40 мг или приблизительно 80 мг аторвастатина
2. для режима введения E4W антитела или его фрагмента с введением приблизительно 200 мг на четыре недели (28 суток): например, включая одну лекарственную форму антитела приблизительно с 200 мг антитела (например, как проиллюстрировано выше) вместе с 28 или 56, и предпочтительно, 28 лекарственными формами ингибитора HMG-CoA-редуктазы (например, как проиллюстрировано выше)
3. для режима введения E4W антитела с более чем 200 мг на четыре недели (28 сутки): включая две лекарственные формы, которые вместе содержат общую дозу антитела (например, два предварительно заполненных шприца, каждый из которых содержит 1 мл жидкого состава антитела по 150 мг антитела в каждом) или включая одну лекарственную форму, которая содержит общее количество антитела, подлежащее введению (например, флакон, содержащий приблизительно 300 мг антитела для растворения, или флакон, кассета или предварительно заполненный шприц, содержащий приблизительно 300 мг антитела в жидком составе (т.е. приблизительно 2 мл жидкого состава, где 1 мл жидкого состава содержит приблизительно 150 мг антитела); вместе с 28 или 56, и предпочтительно, 28 лекарственными формами ингибитора HMG-CoA-редуктазы (например, как проиллюстрировано выше)
(d) для лечения в течение одного месяца антителом и ингибитором HMG-CoA-редуктазы: включая те же количества лекарственных форм антитела, как проиллюстрировано в (c) для введения один или два раза в месяц, например, каждый первый день месяца или каждые первый понедельник и т.д. месяца для введения один раз в месяц, или, например, каждые первый и 14 или 15 день месяца для режима введения два раза в месяц; кроме того, изделие содержит 31 лекарственную форму ингибитора HMG-CoA-редуктазы, предпочтительно, таблетки или капсулы, находящиеся в блистерной упаковке, имеющей последовательную нумерацию от 1 до 31 для дней месяца (где лишние таблетки или капсулы для лишних дней выбрасываются).
В двадцать пятом аспекте настоящее изобретение относится к изделию, содержащему: (a) упаковочный материал; (b) антитело или его антигенсвязывающий фрагмент, которые специфично связывают hPCSK9; и (c) ярлык или вкладыш в упаковку, находящиеся в упаковочном материале, на которых указано, что пациентов, которым проводят лечение указанным антителом или антигенсвязывающим фрагментом, можно лечить от заболевания или состояния, выбранного из группы, состоящей из гиперхолестеринемии, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний и, кроме того, указано, что можно лечить индивидуумов, относящихся к одной или нескольким группам индивидуумов, как указано в тринадцатом аспекте.
В двадцать шестом аспекте настоящее изобретение относится к изделию, содержащему: (a) упаковочный материал; (b) антитело или его антигенсвязывающий фрагмент, которые специфично связывают hPCSK9; и (c) ярлык или вкладыш в упаковку, находящиеся в упаковочном материале, на которых указано, что пациентов, которым проводят лечение указанным антителом или антигенсвязывающим фрагментом, можно лечить от заболевания или состояния, выбранного из группы, состоящей из гиперхолестеринемии, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний, и, кроме того, указано, что лечение пациентов указанным антителом или его антигенсвязывающим фрагментом противопоказано для пациентов, относящихся к одной или нескольким группам индивидуумов, как указано в четырнадцатом аспекте.
Антитела и их антигенсвязывающие фрагменты, которые можно использовать для применения на практике различных изделий по настоящему изобретению, описаны в разделе "Предпочтительные антитела для применения настоящего изобретения на практике".
В предпочтительных вариантах осуществления двадцать четвертого, двадцать пятого или двадцать шестого аспекта ярлык или вкладыш в упаковку содержит указание способа лечения в соответствии с первым аспектом или медицинского применения в соответствии со вторым аспектом и вариантами осуществления первого и второго аспекта, как описано в настоящем описании.
Изделия, описанные в 24, 25 или 26 аспекте, кроме того, могут включать один или несколько из признаков или компонентов изделия, которые включены в 3, 4 или 5 аспект настоящего изобретения, и наоборот. Следующий предпочтительный вариант осуществления по настоящему изобретению сочетает в себе один или несколько признаков 24 и 25, 25 и 26 или 24 и 25 и 26 аспекта, как описано в настоящем описании.
В соответствии с 27 аспектом, настоящее изобретение относится к фармацевтической композиции или антителу или его антигенсвязывающего фрагмента по настоящему изобретению, как например, в соответствии с девятнадцатым аспектом настоящего изобретения, для применения при лечении заболевания или состояния, в которые вовлечена экспрессия или активность PCSK9, предпочтительно, для применения в снижении повышенных уровней LDL-C (ХС липопротеинов низкой плотности).
В соответствии с предпочтительным вариантом осуществления заболевание или состояние выбрано из группы, состоящей из: повышенных уровней общего холестерина, повышенных уровней липопротеинов низкой плотности (LDL-C), гиперхолестеринемии, гиперлипидемии, дислипидемии и атеросклероза, в частности, первичной гиперхолестеринемии, семейной гиперхолестеринемии или гиперхолестеринемии, не контролируемой статинами.
В соответствии с другим предпочтительным вариантом осуществления композицию, антитело или его антигенсвязывающий фрагмент вводят индивидууму раз в две недели (E2W), раз в четыре недели (E4W) или раз в месяц.
В соответствии с другим предпочтительным вариантом осуществления ингибитор HMG-CoA-редуктазы вводят совместно с фармацевтической композицией, антителом или его антигенсвязывающим фрагментом, предпочтительно, ингибитор HMG-CoA-редуктазы в соответствии с одним из различных аспектов настоящего изобретения, как например, в соответствии с первым или вторым аспектом.
В соответствии с другим предпочтительным вариантом осуществления ингибитор HMG-CoA-редуктазы вводят один раз в сутки и, предпочтительно, каждые сутки.
В двадцать восьмом аспекте настоящее изобретение относится к способу получения фармацевтической композиции по настоящему изобретению, например, в соответствии с девятнадцатым аспектом, включающему смешение антитела или его антигенсвязывающего фрагмента и необязательно ингибитора HMG-CoA-редуктазы с одним или несколькими фармацевтическими эксципиентами или носителями.
В двадцать девятом аспекте настоящее изобретение относится к способу получения лекарственной формы по настоящему изобретению, включающему отмеривание количества фармацевтической композиции, антитела или его антигенсвязывающего фрагмента, жидкого состава или сухого состава в соответствии с настоящим изобретением, включающих одну или нескольких доз антитела или его антигенсвязывающего фрагмента, и необязательно ингибитора HMG-CoA-редуктазы, и преобразование их в физически дискретные единицы, пригодные в качестве единичных дозировок для введения человеку и/или животному.
В тридцатом аспекте настоящее изобретение относится к способу получения или сборки изделия по настоящему изобретению, включающему упаковывание фармацевтической композиции, антитела, жидкого состава, сухого состава или одной или нескольких лекарственных форм по настоящему изобретению в контейнер, необязательно вместе с одним или несколькими из следующих: ярлык, инструкции по применению, устройство для применения.
В тридцать первом аспекте настоящее изобретение относится к способу исследования эффективности антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9, для лечения заболевания или состояния, выбранного из группы, состоящей из повышенных уровней LDL-C, гиперхолестеринемии, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний, или любого другого заболевания или состояния, описанных в первом или втором аспекте, причем указанный способ включает:
лечение выбранной группы пациентов указанным антителом или его антигенсвязывающим фрагментом, где каждый пациент в указанной группе имеет уровень холестерина LDL (LDL-C) более 100 мг/дл; и
определение эффективности указанного антитела или его антигенсвязывающего фрагмента путем определения уровня LDL-C в группе пациентов до и после введения указанного антитела или его антигенсвязывающего фрагмента, где снижение уровня LDL-C по меньшей мере на 25% относительно уровня до введения дозы по меньшей мере у 75% группы пациентов указывает на то, что указанные антитело или его антигенсвязывающий фрагмент являются эффективными для лечения указанного заболевания или состояния в указанной группе пациентов;
где каждый пациент относится к одной или нескольким группам индивидуумов, как указано в тринадцатом аспекте.
В тридцать втором аспекте настоящее изобретение относится к способу исследования эффективности антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9, для лечения заболевания или состояния, выбранного из группы, состоящей из повышенных уровней LDL-C, гиперхолестеринемии, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний (или любому другому способу, как описано в первом или втором аспекте), причем указанный способ включает:
определение эффективности антитела или его антигенсвязывающего фрагмента, которые используют для лечения выбранной группы пациентов указанным антителом или его антигенсвязывающим фрагментом, где каждый пациент в указанной группе имеет уровень холестерина LDL (LDL-C) более 100 мг/дл, путем определения уровня LDL-C в группе пациентов до и после введения указанного антитела или его антигенсвязывающего фрагмента, где снижение уровня LDL-C по меньшей мере на 25% относительно уровня до введения дозы по меньшей мере у 75% группы пациентов указывает на то, что указанные антитело или его антигенсвязывающий фрагмент являются эффективными для лечения указанного заболевания или состояния в указанной группе пациентов;
где каждый пациент относится к одной или нескольким группам индивидуумов, как указано в тринадцатом аспекте.
В предпочтительных вариантах осуществления 31 или 32 аспекта, каждому пациенту в указанной группе проводят снижающее уровень липидов лечение путем введения ингибитора HMG-CoA-редуктазы, такого как статин, в течение по меньшей мере 6 недель перед лечением указанным антителом или его антигенсвязывающим фрагментом.
Антитела и их антигенсвязывающие фрагменты, которые можно использовать для применения на практике девятнадцатого и двадцатого аспекта настоящего изобретения, описаны в разделе "Предпочтительные антитела для применения настоящего изобретения на практике" или другом разделе настоящей заявки, в котором описаны антитела по настоящему изобретению, например, таком как пятнадцатый аспект.
В предпочтительных вариантах осуществления 31 или 32 аспекта выбранную группу пациентов лечат или лечили способом лечения в соответствии с первым или вторым аспектом и вариантами осуществления первого или второго аспекта, как описано в настоящем описании.
В следующих предпочтительных вариантах осуществления 31 или 32 аспекта эффективность указанного антитела или его указанного антигенсвязывающего фрагмента определяют для подгрупп указанной выбранной группы пациентов, где указанные подгруппы стратифицированы по меньшей мере по одному стратификационному фактору, выбранному из группы, состоящей из: группа с гетерозиготной семейной гиперхолестеринемией (heFH); инфаркт миокарда (MI) в анамнезе; инсульт в анамнезе; проведение высокоинтенсивной терапии статинами; и географическая область пациента (например, Северная Америка, Западная Европа, Восточная Европа и остальная часть мира).
У хомячков и других грызунов статины не являются эффективными в отношении выведения LDL из крови. Более конкретно, введение статинов отдельно (например, аторвастатина) не имеет эффекта на экспрессию рецептора LDL (LDLR) у хомячков или других грызунов, предположительно, вследствие активности эндогенной PCSK9. Эксперименты, представленные в настоящей заявке (см. испытание 4) демонстрируют, что ингибирование PCSK9 путем введения антитела против PCSK9 придает грызунам (например, хомячкам) чувствительность к лечению статинами. Таким образом, в настоящей заявке предоставлена новая модель на животных для исследования эффективности статинов или других лекарственных средств, которые снижают уровни холестерина.
Таким образом, в тридцать третьем аспекте настоящее изобретение относится к способу исследования эффективности соединения в отношении снижения уровней холестерина у индивидуума, включающему стадии:
(a) предоставление животного отряда грызунов;
(b) введение антитела или его антигенсвязывающего фрагмента, которые специфично связывают PCSK9, грызуну;
(c) введение исследуемого соединения указанному животному отряда грызунов;
(d) определение эффекта исследуемого соединения у животного отряда грызунов, где снижение уровня холестерина у животного отряда грызунов по сравнению с уровнем холестерина у контрольного животного указывает на то, что исследуемое соединение является эффективным в отношении снижения уровней холестерина у индивидуума, где контрольное животное представляет собой животное того же вида, что и указанное животное отряда грызунов, и где контрольному животному не вводили исследуемое соединение.
В предпочтительных вариантах осуществления тридцать третьего аспекта грызун выбран из группы, состоящей из хомячка, мыши, крысы, морской свинки и кролика.
Антитела и их антигенсвязывающие фрагменты, которые можно использовать для применения на практике двадцать первого аспекта настоящего изобретения, описаны в других разделах настоящей заявки, таких как пятнадцатый аспект раздела "Предпочтительные антитела для применения настоящего изобретения на практике". Предпочтительно, антитело или его антигенсвязывающий фрагмент вводят грызуну в концентрации 1 мг/кг массы тела, 3 мг/кг массы тела или 10 мг/кг массы тела.
В предпочтительных вариантах осуществления 33 аспекта снижение уровня холестерина определяют путем измерения уровня общего холестерина в сыворотке. В более предпочтительных вариантах осуществления снижение уровня холестерина определяют путем измерения уровня холестерина LDL (LDL-C) в сыворотке.
В предпочтительных вариантах осуществления 33 аспекта контрольное животное представляет собой животное той же линии, что и грызун. Предпочтительно, одно и то же антитело или его антигенсвязывающий фрагмент вводят грызуну и контрольному животному. Предпочтительно, одну и ту же концентрацию (измеряемую в мг/кг массы тела) антитела или его антигенсвязывающего фрагмента вводят грызуну и контрольному животному.
В одном из вариантов осуществления 33 аспекта контрольное животное является отличающимся животным, т.е. отличающимся индивидуумом, от грызуна. Также можно определить уровень холестерина у двух или более контрольных животных и вычислить среднюю величину уровня холестерина у этих двух или более контрольных животных. Аналогично, можно нагрузить двух или более грызунов антителом или его антигенсвязывающим фрагментом для определения уровня холестерина у этих двух или более грызунов и вычисления средней величины уровня холестерина у этих двух или более грызунов.
В альтернативном варианте осуществления 33 аспекта контрольное животное является тем же самым животным, что и грызун, однако его исследуют в другой момент времени. Более конкретно, уровень холестерина у грызуна после введения исследуемого соединения можно сравнивать с уровнем холестерина до введения дозы у того же животного. Предпочтительно, указанный уровень холестерина до введения дозы определяют между стадиями (b) и (c), указанными выше.
Согласно тридцать четвертому аспекту, настоящее изобретение относится к способу усиления активности снижения LDL-C у индивидуума, которому проводят терапию статинами, причем способ включает введение индивидууму антитела или его антигенсвязывающего фрагмента, которые специфично связываются с конвертазой пробелков типа субтилизина/кексина человека 9 (hPCSK9), где антитело или его антигенсвязывающий фрагмент вводят в дозировке в диапазоне от приблизительно 5 мг до приблизительно 500 мг, тем самым усиливая активность терапии статинами в отношении снижения LDL-C у индивидуума.
В соответствии с предпочтительным вариантом осуществления 34 аспекта, индивидуум является устойчивым к терапии статинами перед введением антитела.
В соответствии с другим предпочтительным вариантом осуществления индивидуум страдает заболеванием или состоянием, выбранным из группы, состоящей из гиперхолестеринемии, гиперлипидемии, дислипидемии и атеросклероза.
В соответствии с другим предпочтительным вариантом осуществления заболевание или состояние представляет собой первичную гиперхолестеринемию или семейную гиперхолестеринемию.
В соответствии с другим предпочтительным вариантом осуществления антитело или антигенсвязывающий фрагмент вводят в дозировке в диапазоне от приблизительно 50 мг до приблизительно 300 мг.
В соответствии с другим предпочтительным вариантом осуществления антитело или антигенсвязывающий фрагмент вводят в дозировке приблизительно 150 мг.
В соответствии с другим предпочтительным вариантом осуществления антитело или его антигенсвязывающий фрагмент вводят индивидууму раз в две недели (E2W).
В соответствии с другим предпочтительным вариантом осуществления антитело или его антигенсвязывающий фрагмент вводят индивидууму раз в четыре недели (E4W).
В соответствии с другим предпочтительным вариантом осуществления лечение снижает общий холестерин в сыворотке на по меньшей мере от приблизительно 25% до приблизительно 35% относительно уровня до введения дозы и поддерживает снижение на протяжении периода по меньшей мере 24 суток.
В соответствии с другим предпочтительным вариантом осуществления лечение снижает общий холестерин в сыворотке на по меньшей мере от приблизительно 65% до приблизительно 80% относительно уровня до введения дозы и поддерживает снижение на протяжении периода по меньшей мере 24 суток.
В соответствии с другим предпочтительным вариантом осуществления лечение снижает уровни триглицеридов в сыворотке на по меньшей мере от приблизительно 25% до приблизительно 40% относительно уровня до введения дозы.
В соответствии с другим предпочтительным вариантом осуществления лечение снижает уровень холестерина HDL не более чем на 5% относительно уровня до введения дозы.
В соответствии с другим предпочтительным вариантом осуществления лечение имеет небольшой или отсутствие поддающегося измерению эффекта на функцию печени при определении по результатам измерения ALT и AST.
В соответствии с другим предпочтительным вариантом осуществления антитело или антигенсвязывающий фрагмент содержат CDR тяжелой и легкой цепи из пары аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
В соответствии с другим предпочтительным вариантом осуществления антитело или антигенсвязывающий фрагмент содержат пару аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
В соответствии с другим предпочтительным вариантом осуществления антитело или его антигенсвязывающий фрагмент конкурируют за связывание hPCSK9 с антителом или антигенсвязывающим фрагментом, содержащими пару аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
В соответствии с другим предпочтительным вариантом осуществления статин выбран из группы, состоящей из церивастатина, аторвастатина, симвастатина, питавастатина, розувастатина, флувастатина, ловастатина и правастатина.
В соответствии с другим предпочтительным вариантом осуществления статин представляет собой аторвастатин, вводимый в дозировке 10 мг, 20 мг, 40 мг или 80 мг.
В тридцать пятом аспекте настоящее изобретение относится к набору для лечения повышенных уровней холестерина липопротеинов низкой плотности (LDL-C) у индивидуума, причем набор содержит (a) фармацевтическую лекарственную форму, содержащую антитело или его антигенсвязывающий фрагмент, которые специфично связываются hPCSK9; и фармацевтически приемлемый носитель, где антитело или антигенсвязывающий фрагмент присутствуют в дозировке в диапазоне от приблизительно 5 мг до приблизительно 500 мг; и (b) ярлык или вкладыш в упаковку с инструкциями по применению.
В соответствии с предпочтительным вариантом осуществления 35 аспекта на ярлыке указано, что пациентов, которым проводят лечение указанным антителом или антигенсвязывающим фрагментом, можно лечить от заболевания или состояния, выбранного из группы, состоящей из гиперхолестеринемии, гиперлипидемии, дислипидемии и атеросклероза и сердечно-сосудистых заболеваний.
В соответствии с другим предпочтительным вариантом осуществления заболевание или состояние представляет собой первичную гиперхолестеринемию или семейную гиперхолестеринемию. В соответствии с другим предпочтительным вариантом осуществления заболевание или состояние представляет собой гиперхолестеринемию, не контролируемую статинами.
В соответствии с другим предпочтительным вариантом осуществления антитело или антигенсвязывающий фрагмент находятся в дозировке в диапазоне от приблизительно 50 мг до приблизительно 300 мг. В соответствии с другим предпочтительным вариантом осуществления антитело или антигенсвязывающий фрагмент находятся в дозировке приблизительно 150 мг.
В соответствии с другим предпочтительным вариантом осуществления на ярлыке или вкладыше в упаковку указано, что антитело или его антигенсвязывающий фрагмент вводят индивидууму раз в две недели (E2W).
В соответствии с другим предпочтительным вариантом осуществления на ярлыке или вкладыше в упаковку указано, что антитело или его антигенсвязывающий фрагмент вводят индивидууму раз в четыре недели (E4W).
В соответствии с другим предпочтительным вариантом осуществления антитело или антигенсвязывающий фрагмент содержат CDR тяжелой и легкой цепи из пары аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
В соответствии с другим предпочтительным вариантом осуществления антитело или антигенсвязывающий фрагмент содержат пару аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
В соответствии с другим предпочтительным вариантом осуществления антитело или его антигенсвязывающий фрагмент конкурируют за связывание hPCSK9 с антителом или антигенсвязывающим фрагментом, содержащими пару аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
В соответствии с другим предпочтительным вариантом осуществления набор дополнительно содержит ингибитор HMG-CoA-редуктазы. В соответствии с другим предпочтительным вариантом осуществления ингибитор находится в дозировке в диапазоне приблизительно от 0,05 мг до 100 мг. В соответствии с другим предпочтительным вариантом осуществления ингибитор HMG-CoA-редуктазы представляет собой статин. В соответствии с другим предпочтительным вариантом осуществления статин выбран из группы, состоящей из церивастатина, аторвастатина, симвастатина, питавастатина, розувастатина, флувастатина, ловастатина и правастатина.
В соответствии с другим предпочтительным вариантом осуществления в инструкциях указано, что статин представляет собой аторвастатин, вводимый в дозировке 10 мг, 20 мг, 40 мг или 80 мг.
В соответствии с другим предпочтительным вариантом осуществления на инструкциях указано, что лечение антителом противопоказано для пациентов, относящихся к одной или нескольким из следующих групп:
(i) курильщики;
(ii) лица в возрасте 70 лет и старше;
(iii) лица, страдающие гипертензией;
(iv) беременные женщины;
(v) женщины, пытающиеся забеременеть;
(vi) женщины, кормящие грудью;
(vii) лица, которые имеют или когда-либо имели заболевание, поражающее печень;
(viii) лица, которые имели какие-либо необъясненные аномальные показатели функции печени в тестах крови;
(ix) лица, которые употребляют чрезмерные количества спиртных напитков;
(x) лица, имеющие проблемы с почками;
(xi) лица, страдающие гипотиреозом;
(xii) лица, страдающие мышечными нарушениями;
(xiii) лица, ранее сталкивавшиеся с мышечными проблемами в ходе лечения снижающей уровень липидов терапией;
(xiv) лица, имеющие серьезные проблемы с дыханием;
(xv) лица, принимающие одно или несколько из следующих лекарственных средств: лекарственные средства, изменяющие работу иммунной системы (например, циклоспорин или антигистамины), антибиотики или противогрибковые средства (например, эритромицин, кларитромицин, кетоконазол, итраконазол, рифампицин, фусидовая кислота), лекарственные средства, регулирующие уровень липидов (например, гемфиброзил, колестипол), блокаторы кальциевых каналов (например, верапамил, дилтиазем), лекарственные средства, регулирующие сердечный ритм (дигоксин, амиодарон), ингибиторы протеаз, используемые при лечении ВИЧ (например, нельфинавир), варфарин, пероральные контрацептивы, антациды или Зверобой; или
(xvi) лица, выпивающие более 0,1 л грейпфрутового сока в сутки;
(xvii) лица, имеющие индекс массы тела (BMI) более 40;
(xviii) лица, имеющие индекс массы тела (BMI) менее 18;
(xix) лица, страдающие диабетом 1 типа или диабетом 2 типа;
(xx) лица, положительные по гепатиту B или гепатиту C; или
(xxi) лица, имеющие известную чувствительность к лекарственным средствам на основе моноклональных антител.
В тридцать шестом аспекте настоящее изобретение относится к способу лечения индивидуума, страдающего заболеванием или нарушением, характеризующимся повышенными уровнями холестерина липопротеинов низкой плотности (LDL-C), причем способ включает:
(a) выбор индивидуума с уровнем LDL-C в крови, превышающим 100 мг/дл; и
(b) введение указанному индивидууму композиции, содержащей антитело или его антигенсвязывающий фрагмент, которые специфично связываются с конвертазой пробелков типа субтилизина/кексина человека 9 (hPCSK9); тем самым, снижая уровни холестерина у индивидуума, нуждающегося в этом.
В соответствии с предпочтительным вариантом осуществления заболевание или состояние выбрано из группы, состоящей из: гиперхолестеринемии, гиперлипидемии, дислипидемии и атеросклероза.
В соответствии с другим предпочтительным вариантом осуществления заболевание или состояние представляет собой первичную гиперхолестеринемию или семейную гиперхолестеринемию.
В соответствии с другим предпочтительным вариантом осуществления заболевание или состояние представляет собой гиперхолестеринемию, не контролируемую статинами.
В соответствии с другим предпочтительным вариантом осуществления индивидуум имеет индекс массы тела (BMI) менее 18 кг/м2 или более 40 кг/м2.
В соответствии с другим предпочтительным вариантом осуществления индивидуума ранее не инструктировали в отношении диеты, снижающей уровень холестерина.
В соответствии с другим предпочтительным вариантом осуществления индивидуум ранее не принимал снижающее уровень холестерина лекарственное средство, за исключением аторвастатина.
В соответствии с другим предпочтительным вариантом осуществления аторвастатин вводили в дозе приблизительно 10 мг в сутки.
В соответствии с другим предпочтительным вариантом осуществления снижающее уровень холестерина лекарственное средство выбрано из группы, состоящей из фибратов, секвестрантов желчных кислот, ниацина, блокаторов всасывания холестерина в кишечнике (ICA) и омега-3-жирных кислот. В соответствии с другим предпочтительным вариантом осуществления ниацин вводят в дозе более 500 мг в сутки. В соответствии с другим предпочтительным вариантом осуществления омега-3 жирные кислоты вводят в дозе более 1000 мг в сутки.
В соответствии с другим предпочтительным вариантом осуществления индивидуум не страдает диабетом. В соответствии с другим предпочтительным вариантом осуществления диабет представляет собой диабет 1 типа. В соответствии с другим предпочтительным вариантом осуществления диабет представляет собой диабет 2 типа. В соответствии с другим предпочтительным вариантом осуществления диабет 2 типа лечат инсулином.
В соответствии с другим предпочтительным вариантом осуществления индивидуум имеет концентрацию гликированного гемоглобина в крови, превышающую или равную 8,5%.
В соответствии с другим предпочтительным вариантом осуществления индивидуум является отрицательным по поверхностному антигену гепатита B и C.
В соответствии с другим предпочтительным вариантом осуществления индивидуум имеет концентрацию триглицеридов в крови более 350 мг/дл.
В соответствии с другим предпочтительным вариантом осуществления индивидуум имеет менее 1500 нейтрофилов на кубический мм крови.
В соответствии с другим предпочтительным вариантом осуществления индивидуум имеет менее 100000 тромбоцитов на кубический мм крови.
В соответствии с другим предпочтительным вариантом осуществления индивидуумом является женщина.
В соответствии с другим предпочтительным вариантом осуществления индивидуум не является беременной женщиной.
В соответствии с другим предпочтительным вариантом осуществления индивидуум имеет концентрацию тиреостимулирующего гормона в крови, превышающую нижний предел нормы и находящуюся ниже верхней границы нормы.
В соответствии с другим предпочтительным вариантом осуществления индивидуум имеет уровень креатинина в сыворотке, менее чем в 1,4 раз превышающий верхнюю границу нормы.
В соответствии с другим предпочтительным вариантом осуществления индивидуумом является мужчина.
В соответствии с другим предпочтительным вариантом осуществления индивидуум имеет уровень креатинина в сыворотке, менее чем в 1,5 раз превышающий верхнюю границы нормы.
В соответствии с другим предпочтительным вариантом осуществления индивидуум имеет количество аспартаттрансаминазы, которое менее чем в два раза превышает верхнюю границу нормы.
В соответствии с другим предпочтительным вариантом осуществления индивидуум имеет количество аланинтрансаминазы, которое менее чем в два раза превышает верхнюю границу нормы.
В соответствии с другим предпочтительным вариантом осуществления антитело или антигенсвязывающий фрагмент вводят в дозировке в диапазоне от приблизительно 5 мг до приблизительно 500 мг.
В соответствии с другим предпочтительным вариантом осуществления антитело или антигенсвязывающий фрагмент вводят в дозировке в диапазоне от приблизительно 50 мг до приблизительно 300 мг.
В соответствии с другим предпочтительным вариантом осуществления антитело вводят в дозе от 200 до 300 мг раз в четыре недели.
В соответствии с другим предпочтительным вариантом осуществления антитело или антигенсвязывающий фрагмент вводят в дозировке приблизительно 150 мг.
В соответствии с другим предпочтительным вариантом осуществления антитело или его антигенсвязывающий фрагмент вводят индивидууму раз в две недели (E2W).
В соответствии с другим предпочтительным вариантом осуществления антитело или его антигенсвязывающий фрагмент вводят индивидууму раз в четыре недели (E4W).
В соответствии с другим предпочтительным вариантом осуществления антитело или антигенсвязывающий фрагмент содержат CDR тяжелой и легкой цепей из пары аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
В соответствии с другим предпочтительным вариантом осуществления антитело или антигенсвязывающий фрагмент содержат пару аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
В соответствии с другим предпочтительным вариантом осуществления антитело или его антигенсвязывающий фрагмент конкурируют за связывание hPCSK9 с антителом или антигенсвязывающим фрагментом, содержащими пару аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
В соответствии с другим предпочтительным вариантом осуществления антитело вводят подкожно.
В соответствии с другим предпочтительным вариантом осуществления антитело вводят в брюшную полость.
В соответствии с другим предпочтительным вариантом осуществления ингибитор HMG-CoA-редуктазы вводят индивидууму.
В соответствии с другим предпочтительным вариантом осуществления ингибитор HMG-CoA-редуктазы вводят в дозировке в диапазоне приблизительно от 0,05 мг до 100 мг.
В соответствии с другим предпочтительным вариантом осуществления ингибитором HMG-CoA-редуктазы является статин.
В соответствии с другим предпочтительным вариантом осуществления статин выбран из группы, состоящей из церивастатина, аторвастатина, симвастатина, питавастатина, розувастатина, флувастатина, ловастатина и правастатина.
В соответствии с другим предпочтительным вариантом осуществления статин представляет собой аторвастатин, вводимый в дозировке 10 мг или 80 мг.
В соответствии с другим предпочтительным вариантом осуществления аторвастатин вводят в дозировке приблизительно 10 мг в сутки и 80 мг один день в течение периода 8 недель.
В тридцать седьмом аспекте настоящее изобретение относится к способу снижения уровней холестерина у индивидуума, нуждающегося в этом, включающему:
(a) выбор индивидуума с уровнем липопротеина низкой плотности холестерина (LDL-C) в крови более 100 мг/дл; и
(b) введение указанному индивидууму композиции, содержащей антитело или его антигенсвязывающий фрагмент, которые специфично связываются с конвертазой пробелков типа субтилизина/кексина человека 9 (hPCSK9); тем самым, снижая уровни холестерина у индивидуума, нуждающегося в этом.
В соответствии с предпочтительным вариантом осуществления 37 аспекта заболевание или состояние выбраны из группы, состоящей из: гиперхолестеринемии, гиперлипидемии, дислипидемии и атеросклероза.
В соответствии с другим предпочтительным вариантом осуществления заболевание или состояние представляют собой первичную гиперхолестеринемию или семейную гиперхолестеринемию.
В соответствии с другим предпочтительным вариантом осуществления заболевание или состояние представляет собой гиперхолестеринемию, не контролируемую статинами.
В соответствии с другим предпочтительным вариантом осуществления индивидуум имеет индекс массы тела (BMI) менее 18 кг/м2 или более 40 кг/м2.
В соответствии с другим предпочтительным вариантом осуществления индивидуума ранее не инструктировали в отношении диеты, снижающей уровень холестерина.
В соответствии с другим предпочтительным вариантом осуществления индивидуум ранее не принимал снижающее уровень холестерина лекарственное средство, за исключением аторвастатина.
В соответствии с другим предпочтительным вариантом осуществления аторвастатин вводили в дозе приблизительно 10 мг в сутки.
В соответствии с другим предпочтительным вариантом осуществления снижающее уровень холестерина лекарственное средство выбрано из группы, состоящей из фибратов, секвестранта желчных кислот, ниацина, блокаторов всасывания холестерина в кишечнике (ICA) и омега-3 жирных кислот.
В соответствии с другим предпочтительным вариантом осуществления ниацин вводят в дозе более 500 мг в сутки.
В соответствии с другим предпочтительным вариантом осуществления омега-3 жирные кислоты вводят в дозе более 1000 мг в сутки.
В соответствии с другим предпочтительным вариантом осуществления индивидуум не страдает диабетом.
В соответствии с другим предпочтительным вариантом осуществления диабет представляет собой диабет 1 типа.
В соответствии с другим предпочтительным вариантом осуществления диабет представляет собой диабет 2 типа.
В соответствии с другим предпочтительным вариантом осуществления диабет 2 типа лечат инсулином.
В соответствии с другим предпочтительным вариантом осуществления индивидуум имеет концентрацию гликированного гемоглобина в крови, превышающую или равную 8,5%.
В соответствии с другим предпочтительным вариантом осуществления индивидуум является отрицательным по поверхностному антигену гепатита B и C.
В соответствии с другим предпочтительным вариантом осуществления индивидуум имеет концентрацию триглицеридов в крови более 350 мг/дл.
В соответствии с другим предпочтительным вариантом осуществления индивидуум имеет менее 1500 нейтрофилов на кубический мм крови.
В соответствии с другим предпочтительным вариантом осуществления индивидуум имеет менее 100000 тромбоцитов на кубический мм крови.
В соответствии с другим предпочтительным вариантом осуществления индивидуумом является женщина.
В соответствии с другим предпочтительным вариантом осуществления индивидуумом не является беременная женщина.
В соответствии с другим предпочтительным вариантом осуществления индивидуум имеет концентрацию тиреостимулирующего гормона в крови, превышающую нижнюю границу нормы и находящуюся ниже верхней границы нормы.
В соответствии с другим предпочтительным вариантом осуществления индивидуум имеет уровень креатинина в сыворотке, менее чем в 1,4 раз превышающий верхнюю границу нормы.
В соответствии с другим предпочтительным вариантом осуществления индивидуумом является мужчина.
В соответствии с другим предпочтительным вариантом осуществления индивидуум имеет уровень креатинина в сыворотке, менее чем в 1,5 превышающий верхнюю границу нормы.
В соответствии с другим предпочтительным вариантом осуществления индивидуум имеет уровень аспартаттрансаминазы, который менее чем в два раза превышает верхнюю границу нормы.
В соответствии с другим предпочтительным вариантом осуществления индивидуум имеет уровень аланинтрансаминазы, который менее чем в два раза превышает верхнюю границу нормы.
В соответствии с другим предпочтительным вариантом осуществления антитело или антигенсвязывающий фрагмент вводят в дозировке в диапазоне от приблизительно 5 мг до приблизительно 500 мг.
В соответствии с другим предпочтительным вариантом осуществления антитело или антигенсвязывающий фрагмент вводят в дозировке в диапазоне от 50 мг до приблизительно 300 мг.
В соответствии с другим предпочтительным вариантом осуществления антитело вводят в дозе от 200 до 300 мг раз в четыре недели.
В соответствии с другим предпочтительным вариантом осуществления антитело или антигенсвязывающий фрагмент вводят в дозировке приблизительно 150 мг.
В соответствии с другим предпочтительным вариантом осуществления антитело или его антигенсвязывающий фрагмент вводят индивидууму раз в две недели (E2W).
В соответствии с другим предпочтительным вариантом осуществления антитело или его антигенсвязывающий фрагмент вводят индивидууму раз в четыре недели (E4W).
В соответствии с другим предпочтительным вариантом осуществления антитело или антигенсвязывающий фрагмент содержат CDR тяжелой и легкой цепей пары аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92. В соответствии с другим предпочтительным вариантом осуществления антитело или антигенсвязывающий фрагмент содержит пару аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92. В соответствии с другим предпочтительным вариантом осуществления антитело или его антигенсвязывающий фрагмент конкурируют за связывание hPCSK9 с антителом или антигенсвязывающим фрагментом, содержащими пару аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92. В соответствии с другим предпочтительным вариантом осуществления антитело вводят подкожно. В соответствии с другим предпочтительным вариантом осуществления антитело вводят в брюшную полость.
В соответствии с другим предпочтительным вариантом осуществления способ дополнительно включает введение ингибитора HMG-CoA-редуктазы индивидууму. В соответствии с другим предпочтительным вариантом осуществления ингибитор HMG-CoA-редуктазы вводят в дозировке в диапазоне приблизительно от 0,05 мг до 100 мг. В соответствии с другим предпочтительным вариантом осуществления ингибитором HMG-CoA-редуктазы является статин. В соответствии с другим предпочтительным вариантом осуществления статин выбран из группы, состоящей из церивастатина, аторвастатина, симвастатина, питавастатина, розувастатина, флувастатина, ловастатина и правастатина. В соответствии с другим предпочтительным вариантом осуществления статин представляет собой аторвастатин, вводимый в дозировке 10 мг, 20 мг, 40 мг или 80 мг. В соответствии с другим предпочтительным вариантом осуществления аторвастатин вводят в дозе приблизительно 10 мг в сутки и 80 мг одни сутки в течение периода 8 недель.
Несколько аспектов изобретения можно комбинировать друг с другом. Например, можно комбинировать способ лечения заболевания или состояния в соответствии с первым аспектом и способ лечения заболевания или состояния в соответствии с тринадцатым аспектом. В результате этого комбинирования настоящее изобретение относится к способу лечения заболевания или состояния, который обеспечивает лечение определенных групп индивидуумов определенными режимами дозирования. Аналогичным путем, антитело или антигенсвязывающий фрагмент для применения при лечении заболевания или состояния в соответствии со вторым аспектом можно комбинировать с антителом или антигенсвязывающим фрагментом для применения при лечении заболевания или состояния в соответствии с пятнадцатым аспектом. В результате этого комбинирования настоящее изобретение относится к антителу или его антигенсвязывающего фрагмента для применения при лечении определенных групп индивидуумов определенными режимами дозирования.
В соответствии с другим примером, можно комбинировать способ лечения заболевания или состояния в соответствии с первым аспектом и способ лечения заболевания или состояния в соответствии с четырнадцатым аспектом. В результате этого комбинирования настоящее изобретение относится к способу лечения заболевания или состояния, который исключает определенные группы индивидуумов из лечения определенным режимом дозирования. Аналогичным путем, антитело или антигенсвязывающий фрагмент для применения при лечении заболевания или состояния в соответствии со вторым аспектом можно комбинировать с антителом или антигенсвязывающим фрагментом для применения при лечении заболевания или состояния в соответствии с шестнадцатым аспектом. В результате этого комбинирования настоящее изобретение относится к антителу или его антигенсвязывающего фрагмента для применения при лечении с помощью определенного режима дозирования, где определенные группы индивидуумов исключены из лечения.
Квалифицированному специалисту будут понятны другие предпочтительные варианты осуществления, являющиеся результатом подходящих комбинаций различных аспектов и вариантов осуществления настоящего изобретения.
Фармацевтические применения по настоящему изобретению, как описано в настоящем описании, также относятся к применениям данного антитела или его антигенсвязывающего фрагмента, данной фармацевтической композиции и т.д. для получения лекарственного средства для лечения одного или нескольких заболеваний или состояний, как описано в настоящем описании.
Предпочтительные антитела для применения настоящего изобретения на практике
В следующем разделе описаны функциональные и структурные признаки антител и их антигенсвязывающих фрагментов, которые можно использовать для применения на практике всех из двадцати одного аспекта настоящего изобретения. Таким образом, выражения, такие как "в предпочтительных вариантах осуществления", "в некоторых вариантах осуществления", "в другом предпочтительном варианте осуществления" и сходные выражения следует понимать как относящиеся к вариантам осуществления первого аспекта настоящего изобретения, второго аспекта настоящего изобретения, третьего аспекта настоящего изобретения, четвертого аспекта настоящего изобретения, пятого аспекта настоящего изобретения, шестого аспекта настоящего изобретения, седьмого аспекта настоящего изобретения, восьмого аспекта настоящего изобретения, девятого аспекта настоящего изобретения, десятого аспекта настоящего изобретения, одиннадцатого аспекта настоящего изобретения, двенадцатого аспекта настоящего изобретения, тринадцатого аспекта настоящего изобретения, четырнадцатого аспекта настоящего изобретения, пятнадцатого аспекта настоящего изобретения, шестнадцатого аспекта настоящего изобретения, семнадцатого аспекта настоящего изобретения, восемнадцатого аспекта настоящего изобретения, девятнадцатого аспекта настоящего изобретения, двадцатого аспекта и двадцать первого аспекта настоящего изобретения, двадцать второго аспекта настоящего изобретения, двадцать третьего аспекта настоящего изобретения, двадцать четвертого аспекта настоящего изобретения, двадцать пятого аспекта настоящего изобретения, двадцать шестого аспекта настоящего изобретения, двадцать седьмого аспекта настоящего изобретения, двадцать восьмого аспекта настоящего изобретения, двадцать девятого аспекта настоящего изобретения, тридцатого аспекта настоящего изобретения, тридцать первого аспекта настоящего изобретения, тридцать второго аспекта настоящего изобретения, тридцать третьего аспекта настоящего изобретения, тридцать четвертого аспекта настоящего изобретения, тридцать пятого аспекта настоящего изобретения, тридцать шестого аспекта настоящего изобретения, тридцать седьмого аспекта настоящего изобретения.
Все антитела или их антигенсвязывающие фрагменты, пригодные для применения на практике настоящего изобретения, специфично связывают hPCSK9. В предпочтительных вариантах осуществления любого аспекта настоящего изобретения антитело или его антигенсвязывающий фрагмент представляют собой рекомбинантное антитело человека или его фрагмент. В более конкретных вариантах осуществления антитело или его антигенсвязывающий фрагмент представляют собой полностью человеческое моноклональное антитело или его антигенсвязывающий фрагмент, которые специфично связывают hPCSK9 и нейтрализуют активность PCSK9.
mAb, пригодные в рамках настоящего изобретения, могут быть полноразмерными (например, IgG1- или IgG4-антитело) или могут содержать только антигенсвязывающий фрагмент (например, Fab-, F(ab')2- или scFv-фрагмент), и могут быть модифицированы для изменения функциональности, например, для устранения остаточных эффекторных функций (Reddy et al. (2000) J. Immunol. 164:1925-1933).
В предпочтительных вариантах осуществления антитела по настоящему изобретению характеризуются одним или несколькими из следующих признаков при введении индивидууму, предпочтительно, человеку или не являющемуся человеком млекопитающему и, более предпочтительно, человеку:
- снижение уровней С липопротеинов низкой плотности (LDL-C) на по меньшей мере от приблизительно 25% до приблизительно 40% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 14 суток, где устойчивое снижение составляет, предпочтительно, по меньшей мере 25% и, более предпочтительно, по меньшей мере 30% относительно уровня до введения дозы, в частности, при введении в дозе от приблизительно 40 до приблизительно 60 мг, предпочтительно, от приблизительно 45 до приблизительно 55 мг и более предпочтительно, приблизительно 50 мг в режиме введения раз в две недели (раз в две недели, E2W),
- снижение уровней С липопротеинов низкой плотности (LDL-C) на по меньшей мере от приблизительно -50% до приблизительно 65% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 14 суток, где устойчивое снижение составляет, предпочтительно, по меньшей мере 40% и более предпочтительно, по меньшей мере 45% относительно уровня до введения дозы, в частности, при введении в дозе от приблизительно 100 мг E2W,
- снижение уровней С липопротеинов низкой плотности (LDL-C) на от по меньшей мере приблизительно 60% до по меньшей мере приблизительно 75% [например, по меньшей мере приблизительно на 60%, по меньшей мере приблизительно на 65%, по меньшей мере приблизительно на 70 или по меньшей мере приблизительно на 75%] относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 14 суток, где устойчивое снижение составляет, предпочтительно, по меньшей мере 55% и, более предпочтительно, по меньшей мере 60% относительно уровня до введения дозы, в частности, при введении в дозе приблизительно 150 мг E2W,
- снижение уровней С липопротеинов низкой плотности (LDL-C) на по меньшей мере от приблизительно 40% до приблизительно 75% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 28 суток, где устойчивое снижение составляет, предпочтительно, по меньшей мере 35% и, более предпочтительно, по меньшей мере 40% относительно уровня до введения дозы, в частности, при введении в дозе приблизительно 200 мг E4W,
- снижение уровней С липопротеинов низкой плотности (LDL-C) на по меньшей мере от приблизительно 50% до приблизительно 75% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 28 суток, где устойчивое снижение составляет, предпочтительно, по меньшей мере 40% и, более предпочтительно, по меньшей мере 45% относительно уровня до введения дозы, в частности, при введении в дозе приблизительно 300 мг E4W,
- увеличение уровня холестерина HDL в сыворотке по меньшей мере на 2%, по меньшей мере на 2,5%, по меньшей мере на 3%, по меньшей мере на 3,5%, по меньшей мере на 4%, по меньшей мере на 4,5%, по меньшей мере на 5% или по меньшей мере на 5,5% относительно уровня до введения дозы, в частности, при введении в дозе приблизительно 150 мг E2W,
- небольшой или отсутствие поддающегося выявлению эффекта на уровни тропонина,
- увеличение одного или нескольких из: уровни общего холестерина, уровни ApoB, уровни С не HDL, соотношение Apo-B/ApoA-1,
Антитела в соответствии с настоящим изобретением проявляют описанные выше свойства, предпочтительно, если их вводят в комбинации с лечением ингибитором HMG-CoA-редуктазы. Предпочтительные варианты осуществления ингибиторов HMG-CoA-редуктазы, подлежащих применению совместно с антителом по изобретению и их режимами дозирования и введения могут быть найдены на протяжении описании, в частности, как описано в аспектах, касающихся медицинского применения и способов лечения.
В соответствии с другим предпочтительным вариантом осуществления антител и их антигенсвязывающих фрагментов по настоящему изобретению антитело или его антигенсвязывающий фрагмент имеют одну или несколько из следующих характеристик:
- Антитело или антигенсвязывающий фрагмент содержат CDR тяжелой и легкой цепей из пары аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
- Антитело или его антигенсвязывающий фрагмент содержат пару аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
- Антитело или его антигенсвязывающий фрагмент конкурируют за связывание hPCSK9 с антителом или антигенсвязывающим фрагментом, содержащими пару аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
В соответствии с другим предпочтительным вариантом осуществления антител и их антигенсвязывающих фрагментов по настоящему изобретению антитело или его антигенсвязывающий фрагмент имеют одну или несколько из следующих характеристик:
- преодолевают устойчивость к статинам у млекопитающих, особенно у грызунов, таких как хомячок
- увеличивают экспрессию LDLR у млекопитающих, в частности, у грызунов, таких как хомячок
- снижают LDL-C в сыворотке у грызунов, таких как хомячок
- синергически снижают LDL-C при введении совместно с ингибитором HMG-CoA-редуктазы, в частности, у грызунов, таких как хомячок, где ингибитором HMG-CoA-редуктазы, предпочтительно, является аторвастатин.
В предпочтительных вариантах осуществления антитело или его антигенсвязывающий фрагмент характеризуются одним или несколькими из следующих:
(i) способны снижать уровень общего холестерина в сыворотке на по меньшей мере от приблизительно 25 до приблизительно 35% и сохранять снижение на протяжении периода по меньшей мере 24 суток относительно уровня до введения дозы, предпочтительно, снижение уровней общего холестерина в сыворотке составляет по меньшей мере приблизительно 30-40%;
(ii) способны снижать холестерин LDL в сыворотке по меньшей мере приблизительно на 65-80% и сохранять снижение на протяжении периода по меньшей мере 24 суток относительно уровня до введения дозы;
(iii) способны снижать уровень триглицеридов в сыворотке по меньшей мере приблизительно на 25-40% относительно уровня до введения дозы;
(iv) достигают одного или нескольких из (i)-(iii) без снижения холестерина HDL в сыворотке или со снижением холестерина HDL в сыворотке не более чем на 5% относительно уровня до введения дозы;
(v) достигают одного или нескольких из (i)-(iii) с небольшим или отсутствием поддающегося измерению эффекта на функцию печени, при определении по результатам измерения ALT и AST.
В предпочтительных вариантах осуществления антитело или его антигенсвязывающий фрагмент характеризуются одним или несколькими из следующих:
(i) способны снижать уровень холестерина LDL с сыворотке по меньшей мере приблизительно на 40-70% и сохранять снижение на протяжении периода по меньшей мере 60 или 90 суток относительно уровня до введения дозы;
(ii) способны снижать уровень триглицеридов в сыворотке по меньшей мере приблизительно на 25-40% относительно уровня до введения дозы;
(iii) не снижают уровень холестерина HDL в сыворотке или снижают уровень холестерина HDL в сыворотке не более чем на 5% относительно уровня до введения дозы.
В одном из вариантов осуществления антитело или его антигенсвязывающий фрагмент характеризуются тем, что связывают эпитоп, содержащий аминокислотный остаток 238 hPCSK9 (SEQ ID NO:755). В более конкретном варианте осуществления антитело или его антигенсвязывающий фрагмент связывают эпитоп, содержащий один или несколько аминокислотных остатков в положениях 238, 153, 159 и 343 hPCSK9 (SEQ ID NO:755). В более конкретном варианте осуществления антитело или его фрагмент характеризуются тем, что они связывают эпитоп, который не содержит аминокислотный остаток в положениях 192, 194, 197 и/или 237 SEQ ID NO:755.
В одном из вариантов осуществления антитело или его антигенсвязывающий фрагмент характеризуются тем, что они связывают эпитоп, содержащий аминокислотный остаток 366 hPCSK9 (SEQ ID NO: 755). В более конкретном варианте осуществления антитело или антигенсвязывающий фрагмент связывают эпитоп, содержащий один или несколько из аминокислотных остатков в положениях 147, 366 и 380 hPCSK9 (SEQ ID NO: 755). В более конкретном варианте осуществления антитело или антигенсвязывающий фрагмент антитела характеризуются тем, что они связывают эпитоп, который не содержит аминокислотный остаток в положении 215 или 238 SEQ ID NO: 755.
В одном из вариантов осуществления антитело или его антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи (HCVR), выбранную из группы, состоящей из SEQ ID NO:2, 18, 22, 26, 42, 46, 50, 66, 70, 74, 90, 94, 98, 114, 118, 122, 138, 142, 146, 162, 166, 170, 186, 190, 194, 210, 214, 218, 234, 238, 242, 258, 262, 266, 282, 286, 290, 306, 310, 314, 330, 334, 338, 354, 358, 362, 378, 382, 386, 402, 406, 410, 426, 430, 434, 450, 454, 458, 474, 478, 482, 498, 502, 506, 522, 526, 530, 546, 550, 554, 570, 574, 578, 594, 598, 602, 618, 622, 626, 642, 646, 650, 666, 670, 674, 690, 694, 698, 714, 718, 722, 738 и 742, или по существу сходной с ними последовательности, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности. В одном из вариантов осуществления HCVR содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 50, 66, 70, 74, 90, 94, 122, 138, 142, 218, 234, 238, 242, 258, 262, 314, 330 и 334. В более конкретном варианте осуществления HCVR содержит SEQ ID NO: 90 или 218.
В одном из вариантов осуществления антитело или его антигенсвязывающий фрагмент, кроме того, содержат вариабельную область легкой цепи (LCVR), выбранную из группы, состоящей из SEQ ID NO: 10, 20, 24, 34, 44, 48, 58, 68, 72, 82, 92, 96, 106, 116, 120, 130, 140, 144, 154, 164, 168, 178, 188, 192, 202, 212, 216, 226, 236, 240, 250, 260, 264, 274, 284, 288, 298, 308, 312, 322, 332, 336, 346, 356, 360, 370, 380, 384, 394, 404, 408, 418, 428, 432, 442, 452, 456, 466, 476, 480, 490, 500, 504, 514, 524, 528, 538, 548, 552, 562, 572, 576, 586, 596, 600, 610, 620, 624, 634, 644, 648, 658, 668, 672, 682, 692, 696, 706, 716, 720, 730, 740 и 744, или по существу сходной с ними последовательности, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности. В одном из вариантов осуществления LCVR содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 58, 68, 72, 82, 92, 96, 130, 140, 144, 226, 236, 240, 250, 260, 264, 322, 332 и 336. В более конкретном варианте осуществления LCVR содержит SEQ ID NO: 92 или 226.
В конкретных вариантах осуществления антитело или его антигенсвязывающий фрагмент содержат пару последовательностей HCVR и LCVR (HCVR/LCVR), выбранную из группы, состоящей из SEQ ID NO: 2/10, 18/20, 22/24, 26/34, 42/44, 46/48, 50/58, 66/68, 70/72, 74/82, 90/92, 94/96, 98/106, 114/116, 118/120, 122/130, 138/140, 142/144, 146/154, 162/164, 166/168, 170/178, 186/188, 190/192, 194/202, 210/212, 214/216, 218/226, 234/236, 238/240, 242/250, 258/260, 262/264, 266/274, 282/284, 286/288, 290/298, 306/308, 310/312, 314/322, 330/332, 334/336, 338/346, 354/356, 358/360, 362/370, 378/380, 382/384, 386/394, 402/404, 406/408, 410/418, 426/428, 430/432, 434/442, 450/452, 454/456, 458/466, 474/476, 478/480, 482/490, 498/500, 502/504, 506/514, 522/524, 526/528, 530/538, 546/548, 550/552, 554/562, 570/572, 574/576, 578/586, 594/596, 598/600, 602/610, 618/620, 622/624, 626/634, 642/644, 646/648, 650/658, 666/668, 670/672, 674/682, 690/692, 694/696, 698/706, 714/716, 718/720, 722/730, 738/740 и 742/744. В одном из вариантов осуществления пара последовательностей HCVR и LCVR содержит одну из SEQ ID NO: 50/58, 66/68, 70/72, 74/82, 90/92, 94/96, 122/130, 138/140, 142/144, 218/226, 234/236, 238/240, 242/250, 258/260, 262/264, 314/322, 330/332 и 334/336. В предпочтительных вариантах осуществления антитело или его антигенсвязывающий фрагмент содержат аминокислотную последовательность HCVR, как показано в SEQ ID NO: 90, и аминокислотную последовательность LCVR, как показано в SEQ ID NO: 92. В другом предпочтительном варианте осуществления антитело или его антигенсвязывающий фрагмент содержат аминокислотную последовательность HCVR, как показано в SEQ ID NO: 218, и аминокислотную последовательность LCVR, как показано в SEQ ID NO: 226.
В предпочтительных вариантах осуществления антитело или его антигенсвязывающий фрагмент содержат домен CDR3 тяжелой цепи (HCDR3), выбранный из группы, состоящей из SEQ ID NO: 8, 32, 56, 80, 104, 128, 152, 176, 200, 224, 248, 272, 296, 320, 344, 368, 392, 416, 440, 464, 488, 512, 536, 560, 584, 608, 632, 656, 680, 704 и 728, или по существу сходной с ними последовательности, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; и домен CDR3 легкой цепи (LCDR3), выбранный из группы, состоящей из SEQ ID NO:16, 40, 64, 88, 112, 136, 160, 184, 208, 232, 256, 280, 304, 328, 352, 376, 400, 424, 448, 472, 496, 520, 544, 568, 592, 616, 640, 664, 688, 712 и 736, или их по существу сходных последовательностей, имеющих по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательностей. В одном из вариантов осуществления пара последовательностей HCDR3/LCDR3 выбрана из группы, состоящей из SEQ ID NO:56/64, 80/88, 128/136, 224/232, 248/256 и 320/328. В более предпочтительных вариантах осуществления антитело или его антигенсвязывающий фрагмент содержат домен HCDR3, как показано в SEQ ID NO: 80, и домен LCDR3, как показано в SEQ ID NO: 88. В другом предпочтительном варианте осуществления антитело или его антигенсвязывающий фрагмент содержат домен HCDR3, как показано в SEQ ID NO: 224, и домен LCDR3, как показано в SEQ ID NO: 232.
В следующем варианте осуществления антитело или его антигенсвязывающий фрагмент, кроме того, содержат домен CDR1 тяжелой цепи (HCDR1), выбранный из группы, состоящей из SEQ ID NO: 4, 28, 52, 76, 100, 124, 148, 172, 196, 220, 244, 268, 292, 316, 340, 364, 388, 412, 436, 460, 484, 508, 532, 556, 580, 604, 628, 652, 676, 700 и 724, или по существу сходной с ними последовательности, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; домен CDR2 тяжелой цепи (HCDR2), выбранный из группы, состоящей из SEQ ID NO: 6, 30, 54, 78, 102, 126, 150, 174, 198, 222, 246, 270, 294, 318, 342, 366, 390, 414, 438, 462, 486, 510, 534, 558, 582, 606, 630, 654, 678, 702 и 726, или по существу сходных с ними последовательностей, имеющих по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; домен CDR1 легкой цепи (LCDR1), выбранный из группы, состоящей из SEQ ID NO: 12, 36, 60, 84, 108, 132, 156, 180, 204, 228, 252, 276, 300, 324, 348, 372, 396, 420, 444, 468, 492, 516, 540, 564, 588, 612, 636, 660, 684, 708 и 732, или по существу сходных с ними последовательностей, имеющих по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; и домен CDR2 легкой цепи (LCDR2), выбранный из группы, состоящей из SEQ ID NO: 14, 38, 62, 86, 110, 134, 158, 182, 206, 230, 254, 278, 302, 326, 350, 374, 398, 422, 446, 470, 494, 518, 542, 566, 590, 614, 638, 662, 686, 710 и 734, или по существу сходных с ними последовательностей, имеющих по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности. В одном из вариантов осуществления последовательности CDR тяжелой и легкой цепей содержат последовательность, выбранную из группы, состоящей из SEQ ID NO: 52, 54, 56, 60, 62, 64; 76, 78, 80, 84, 86, 88; 124, 126, 128, 132, 134, 136; 220, 222, 224, 228, 230, 232; 244, 246, 248, 252, 254, 256; и 316, 318, 320, 324, 326, 328. В более конкретных вариантах осуществления последовательности CDR содержат SEQ ID NO: 76, 78, 80, 84, 86, 88; или 220, 222, 224, 228, 230, 232. В предпочтительных вариантах осуществления антитело или его антигенсвязывающий фрагмент содержат аминокислотные последовательности CDR тяжелой и легкой цепей, как показано в SEQ ID NO: 76, 78, 80, 84, 86 и 88. В другом предпочтительном варианте осуществления антитело или его антигенсвязывающий фрагмент содержат аминокислотные последовательности CDR тяжелой и легкой цепей, как показано в SEQ ID NO: 220, 222, 224, 228, 230 и 232.
В родственном варианте осуществления антитело или его антигенсвязывающий фрагмент содержат домены CDR тяжелой и легкой цепей, содержащиеся в парах последовательностей тяжелой и легкой цепей, выбранных из группы, состоящей из SEQ ID NO: 2/10, 18/20, 22/24, 26/34, 42/44, 46/48, 50/58, 66/68, 70/72, 74/82, 90/92, 94/96, 98/106, 114/116, 118/120, 122/130, 138/140, 142/144, 146/154, 162/164, 166/168, 170/178, 186/188, 190/192, 194/202, 210/212, 214/216, 218/226, 234/236, 238/240, 242/250, 258/260, 262/264, 266/274, 282/284, 286/288, 290/298, 306/308, 310/312, 314/322, 330/332, 334/336, 338/346, 354/356, 358/360, 362/370, 378/380, 382/384, 386/394, 402/404, 406/408, 410/418, 426/428, 430/432, 434/442, 450/452, 454/456, 458/466, 474/476, 478/480, 482/490, 498/500, 502/504, 506/514, 522/524, 526/528, 530/538, 546/548, 550/552, 554/562, 570/572, 574/576, 578/586, 594/596, 598/600, 602/610, 618/620, 622/624, 626/634, 642/644, 646/648, 650/658, 666/668, 670/672, 674/682, 690/692, 694/696, 698/706, 714/716, 718/720, 722/730, 738/740 и 742/744. В одном из вариантов осуществления последовательности CDR содержатся в HCVR и LCVR, выбранных из пар аминокислотных последовательностей SEQ ID NO: 50/58, 66/68, 70/72, 74/82, 90/92, 94/96, 122/130, 138/140, 142/144, 218/226, 234/236, 238/240, 242/250, 258/260, 262/264, 314/322, 330/332 и 334/336. В более конкретных вариантах осуществления последовательности CDR содержатся в последовательностях HCVR/LCVR, выбранных из SEQ ID NO: 90/92 или 218/226. В предпочтительных вариантах осуществления антитело или его антигенсвязывающий фрагмент содержат CDR тяжелой и легкой цепей пары аминокислотных последовательностей HCVR/LCVR, представленной в SEQ ID NO: 90/92. В другом предпочтительном варианте осуществления антитело или его антигенсвязывающий фрагмент содержат CDR тяжелой и легкой цепей пары аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 218/226.
В одном конкретном варианте осуществления антитело или его антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи (HCVR) SEQ ID NO: 90 или по существу сходную с ней последовательность, имеющую по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательностей.
В одном конкретном варианте осуществления антитело или его антигенсвязывающий фрагмент, кроме того, содержат вариабельную область легкой цепи (LCVR) SEQ ID NO: 92 или по существу сходную с ней последовательность, имеющую по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности.
В конкретных вариантах осуществления антитело или его антигенсвязывающий фрагмент содержат аминокислотную последовательность HCVR, как показано в SEQ ID NO: 90, и аминокислотную последовательность LCVR, как показано в SEQ ID NO: 92.
В конкретных вариантах осуществления антитело или его антигенсвязывающий фрагмент содержат домен CDR3 тяжелой цепи (HCDR3) SEQ ID NO: 80 или по существу сходную с ним последовательность, имеющую по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; и/или домен CDR3 легкой цепи (LCDR3) SEQ ID NO: 88 или по существу сходную с ней последовательность, имеющую по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности. В одном из вариантов осуществления пара последовательностей HCDR3/LCDR3 представляет собой SEQ ID NO: 80/88. В более предпочтительных вариантах осуществления антитело или его антигенсвязывающий фрагмент содержат домен HCDR3, как показано в SEQ ID NO: 80, и домен LCDR3, как показано в SEQ ID NO: 88.
В следующем конкретном варианте осуществления антитело или его антигенсвязывающий фрагмент, кроме того, содержат домен CDR1 тяжелой цепи (HCDR1) SEQ ID NO: 76, или по существу сходную с ним последовательность, имеющую по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; и/или домен CDR2 тяжелой цепи (HCDR2) SEQ ID NO: 78 или по существу сходную с ним последовательность, имеющую по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; и/или домен CDR1 легкой цепи (LCDR1) SEQ ID NO: 84 или по существу сходную с ним последовательность, имеющую по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности; и/или домен CDR2 легкой цепи (LCDR2) SEQ ID NO: 86, или по существу сходную с ним последовательность, имеющую по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности. В одном из вариантов осуществления последовательности CDR тяжелой и легкой цепей содержат последовательность, выбранную из группы, состоящей из SEQ ID NO: 76, 78, 80, 84, 86, 88. В предпочтительных вариантах осуществления антитело или его антигенсвязывающий фрагмент содержат аминокислотные последовательности CDR тяжелой и легкой цепей, как показано в SEQ ID NO: 76, 78, 80, 84, 86 и 88.
В другом конкретном варианте осуществления антитело или его антигенсвязывающий фрагмент содержат домены CDR тяжелой и легкой цепей, содержащиеся в паре последовательностей тяжелой и легкой цепей SEQ ID NO: 90/92.
Особенно предпочтительный вариант осуществления относится к антителу, содержащему последовательности HCVR/LCVR SEQ ID NO: 90/92 и/или последовательности CDR SEQ ID NO: 76, 78, 80 и/или последовательности CDR SEQ ID NO: 84, 86, 88. Другой особенно предпочтительный вариант осуществления относится к антителу, содержащему последовательности HCVR/LCVR SEQ ID NO: 90/92 и последовательности CDR SEQ ID NO: 76, 78, 80 и последовательности CDR SEQ ID NO: 84, 86, 88 ("316P").
В одном из вариантов осуществления антитело или его антигенсвязывающий фрагмент содержат HCVR, кодируемую последовательностью нуклеиновой кислоты, выбранной из группы, состоящей из SEQ ID NO: 1, 17, 21, 25, 41, 45, 49, 65, 69, 73, 89, 93, 97, 113, 117, 121, 137, 141, 145, 161, 165, 169, 185, 189, 193, 209, 213, 217, 233, 237, 241, 257, 261, 265, 281, 285, 289, 305, 309, 313, 329, 333, 337, 353, 357, 361, 377, 381, 385, 401, 405, 409, 425, 429, 433, 449, 453, 457, 473, 477, 481, 497, 501, 505, 521, 525, 529, 545, 549, 553, 569, 573, 577, 593, 597, 601, 617, 621, 625, 641, 645, 649, 665, 669, 673, 689, 693, 697, 713, 717, 721, 737 и 741, или по существу идентичной последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98%, или по меньшей мере 99% идентичность последовательности с ними. В одном из вариантов осуществления HCVR кодируется последовательностью нуклеиновой кислоты, выбранной из группы, состоящей из SEQ ID NO: 49, 65, 69, 73, 89, 93, 121, 137, 141, 217, 233, 237, 241, 257, 261, 313, 329 и 333. В более конкретных вариантах осуществления HCVR кодируется последовательностью нуклеиновой кислоты, выбранной из группы, состоящей из SEQ ID NO: 89 и 217.
В одном из вариантов осуществления антитело или его фрагмент, кроме того, содержат LCVR, кодируемую последовательностью нуклеиновой кислоты, выбранной из группы, состоящей из SEQ ID NO: 9, 19, 23, 33, 43, 47, 57, 67, 71, 81, 91, 95, 105, 115, 119, 129, 139, 143, 153, 163, 167, 177, 187, 191, 201, 211, 215, 225, 235, 239, 249, 259, 263, 273, 283, 287, 297, 307, 311, 321, 331, 335, 345, 355, 359, 369, 379, 383, 393, 403, 407, 417, 427, 431, 441, 451, 455, 465, 475, 479, 489, 499, 503, 513, 523, 527, 537, 547, 551, 561, 571, 575, 585, 595, 599, 609, 619, 623, 633, 643, 647, 657, 667, 671, 681, 691, 695, 705, 715, 719, 729, 739 и 743, или по существу идентичной последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98%, или по меньшей мере 99% идентичность последовательности с ними. В одном из вариантов осуществления LCVR кодируется последовательностью нуклеиновой кислоты, выбранной из группы, состоящей из SEQ ID NO: 57, 67, 71, 81, 91, 95, 129, 139, 143, 225, 235, 239, 249, 259, 263, 321, 331 и 335. В более конкретных вариантах осуществления LCVR кодируется последовательностью нуклеиновой кислоты, выбранной из группы, состоящей из SEQ ID NO: 91 и 225.
В одном из вариантов осуществления антитело или его антигенсвязывающий фрагмент содержат домен HCDR3, кодируемый нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO:7, 31, 55, 79, 103, 127, 151, 175, 199, 223, 247, 271, 295, 319, 343, 367, 391, 415, 439, 463, 487, 511, 535, 559, 583, 607, 631, 655, 679, 703 и 727, или по существу идентичной последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98%, или по меньшей мере 99% идентичность последовательности с ними; и домен LCDR3, кодируемый нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 15, 39, 63, 87, 111, 135, 159, 183, 207, 231, 255, 279, 303, 327, 351, 375, 399, 423, 447, 471, 495, 519, 543, 567, 591, 615, 639, 663, 687, 711 и 735, или по существу идентичной последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98%, или по меньшей мере 99% идентичность последовательности с ними. В одном из вариантов осуществления HCDR3 и LCDR3 содержат пару последовательностей, кодируемых последовательностью нуклеиновой кислоты SEQ ID NO: 55/63, 79/87, 127/135, 223/231, 247/255 и 319/327, соответственно. В более конкретных вариантах осуществления HCDR3 и LCDR3 содержат пару последовательностей, кодируемых последовательностью нуклеиновой кислоты SEQ ID NO: 79/87 и 223/231.
В следующем варианте осуществления антитело или его антигенсвязывающий фрагмент, кроме того, содержат: домен HCDR1, кодируемый нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 3, 27, 51, 75, 99, 123, 147, 171, 195, 219, 243, 267, 291, 315, 339, 363, 387, 411, 435, 459, 483, 507, 531, 555, 579, 603, 627, 651, 675, 699 и 723, или по существу идентичной последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98%, или по меньшей мере 99% идентичность последовательности с ними; домен HCDR2, кодируемый нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 5, 29, 53, 77, 101, 125, 149, 173, 197, 221, 245, 269, 293, 317, 341, 365, 389, 413, 437, 461, 485, 509, 533, 557, 581, 605, 629, 653, 677, 701 и 725, или по существу идентичной последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98%, или по меньшей мере 99% идентичность последовательности с ними; домен LCDR1, кодируемый нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 11, 35, 59, 83, 107, 131, 155, 179, 203, 227, 251, 275, 299, 323, 347, 371, 395, 419, 443, 467, 491, 515, 539, 563, 587, 611, 635, 659, 683, 707 и 731, или по существу идентичной последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98%, или по меньшей мере 99% идентичность последовательности с ними; и домен LCDR2, кодируемый нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 13, 37, 61, 85, 109, 133, 157, 181, 205, 229, 253, 277, 301, 325, 349, 373, 397, 421, 445, 469, 493, 517, 541, 565, 589, 613, 637, 661, 685, 709 и 733, или по существу идентичной последовательностью, имеющей по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98%, или по меньшей мере 99% идентичность последовательности с ними. В одном из вариантов осуществления последовательности CDR тяжелой и легкой цепей кодируются последовательностями нуклеиновых кислот SEQ ID NO: 51, 53, 55, 59, 61, 63; 75, 77, 79, 83, 85, 87; 123, 125, 127, 131, 133, 135; 219, 221, 223, 227, 229, 231; 243, 245, 247, 251, 253, 255; и 315, 317, 319, 323, 325, 327. В более конкретных вариантах осуществления последовательности CDR тяжелой и легкой цепей кодируются последовательностями нуклеиновых кислот SEQ ID NO: 75, 77, 79, 83, 85, 87; и 219, 221, 223, 227, 229, 231.
В следующем варианте осуществления антитело или его антигенсвязывающий фрагмент содержат HCDR3 и LCDR3, где HCDR3 содержит аминокислотную последовательность формулы X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-X20 (SEQ ID NO: 747), где X1 представляет собой Ala, X2 представляет собой Arg или Lys, X3 представляет собой Asp, X4 представляет собой Ser или Ile, X5 представляет собой Asn или Val, X6 представляет собой Leu или Trp, X7 представляет собой Gly или Met, X8 представляет собой Asn или Val, X9 представляет собой Phe или Tyr, X10 представляет собой Asp, X11 представляет собой Leu или Met, X12 представляет собой Asp или отсутствует, X13 представляет собой Tyr или отсутствует, X14 представляет собой Tyr или отсутствует, X15 представляет собой Tyr или отсутствует, X16 представляет собой Tyr или отсутствует, X17 представляет собой Gly или отсутствует, X18 представляет собой Met или отсутствует, X19 представляет собой Asp или отсутствует, и X20 представляет собой Val или отсутствует; и LCDR3 содержит аминокислотную последовательность формулы X1-X2-X3-X4-X5-X6-X7-X8-X9 (SEQ ID NO:750), где X1 представляет собой Gln или Met, X2 представляет собой Gln, X3 представляет собой Tyr или Thr, X4 представляет собой Tyr или Leu, X5 представляет собой Thr или Gln, X6 представляет собой Thr, X7 представляет собой Pro, X8 представляет собой Tyr или Leu, и X9 представляет собой Thr.
В следующем варианте осуществления антитело или его антигенсвязывающий фрагмент, кроме того, содержат последовательность HCDR1 формулы X1-X2-X3-X4-X5-X6-X7-X8 (SEQ ID NO: 745), где X1 представляет собой Gly, X2 представляет собой Phe, X3 представляет собой Thr, X4 представляет собой Phe, X5 представляет собой Ser или Asn, X6 представляет собой Ser или Asn, X7 представляет собой Tyr или His, и X8 представляет собой Ala или Trp; последовательность HCDR2 формулы X1-X2-X3-X4-X5-X6-X7-X8 (SEQ ID NO:746), где X1 представляет собой Ile, X2 представляет собой Ser или Asn, X3 представляет собой Gly или Gln, X4 представляет собой Asp или Ser, X5 представляет собой Gly, X6 представляет собой Ser или Gly, X7 представляет собой Thr или Glu, и X8 представляет собой Thr или Lys; последовательность LCDR1 формулы X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12 (SEQ ID NO:748), где X1 представляет собой Gln, X2 представляет собой Ser, X3 представляет собой Val или Leu, X4 представляет собой Leu, X5 представляет собой His или Tyr, X6 представляет собой Arg или Ser, X7 представляет собой Ser или Asn, X8 представляет собой Asn или Gly, X9 представляет собой Asn, X10 представляет собой Arg или Asn, X11 представляет собой Asn или Tyr, и X12 представляет собой Phe или отсутствует; последовательность LCDR2 формулы X1-X2-X3 (SEQ ID NO:749), где X1 представляет собой Trp или Leu, X2 представляет собой Ala или Gly, и X3 представляет собой Ser.
В следующем варианте осуществления антитело или его антигенсвязывающий фрагмент представляют собой антитело против PCSK9 человека или его антигенсвязывающий фрагмент, содержащие вариабельную область тяжелой цепи (HCVR), кодируемую сегментами нуклеотидной последовательности, происходящими из последовательностей VH, DH и JH эмбрионального типа, и вариабельную область легкой цепи (LCVR), кодируемую сегментами нуклеотидной последовательности, происходящими из последовательностей VK и JK эмбрионального типа, где последовательности эмбрионального типа представляют собой (a) сегмент гена VH 3-23, сегмент гена DH 7-27, сегмент гена JH 2, сегмент гена VK 4-1 и сегмент гена JK 2; или (b) сегмент гена VH 3-7, сегмент гена DH 2-8, сегмент гена JH 6, сегмент гена VK 2-28 и сегмент гена JK 4.
В предпочтительных вариантах осуществления антитело или его антигенсвязывающий фрагмент связываются с тем же эпитопом на hPCSK9, что и антитело, содержащее аминокислотные последовательности CDR тяжелой и легкой цепей, как показано в SEQ ID NO: 76, 78, 80, 84, 86, и 88, или как показано в SEQ ID NO: 220, 222, 224, 228, 230 и 232.
В предпочтительных вариантах осуществления антитело или его антигенсвязывающий фрагмент конкурируют за связывание hPCSK9 с антителом, содержащим аминокислотные последовательности CDR тяжелой и легкой цепей, как показано в SEQ ID NO: 76, 78, 80, 84, 86 и 88, или как показано в SEQ ID NO: 220, 222, 224, 228, 230 и 232.
Изобретение охватывает антитела против PCSK9, имеющие модифицированный профиль гликозилирования. В некоторых применениях может быть пригодна модификация для удаления нежелательных участков гликозилирования, или, например, для удаления части фукозы для усиления функции антителозависимой клеточной цитотоксичности (ADCC) (см. Shield et al. (2002) JBC 277:26733). В других применениях можно проводить модификацию галактозилирования для модификации комплементзависимой цитотоксичности (CDC).
Некоторые предпочтительные последовательности, относящиеся к предпочтительным антителам для применения на практике настоящего изобретения:
SEQ ID NO: 76: Gly Phe Thr Phe Asn Asn Tyr Ala
SEQ ID NO:78: Ile Ser Gly Ser Gly Gly Thr Thr
SEQ ID NO: 80: Ala Lys Asp Ser Asn Trp Gly Asn Phe Asp Leu
SEQ ID NO: 84: Gln Ser Val Leu Tyr Arg Ser Asn Asn Arg Asn Phe
SEQ ID NO: 86: Trp Ala Ser
SEQ ID NO: 88: Gln Gln Tyr Tyr Thr Thr Pro Tyr Thr


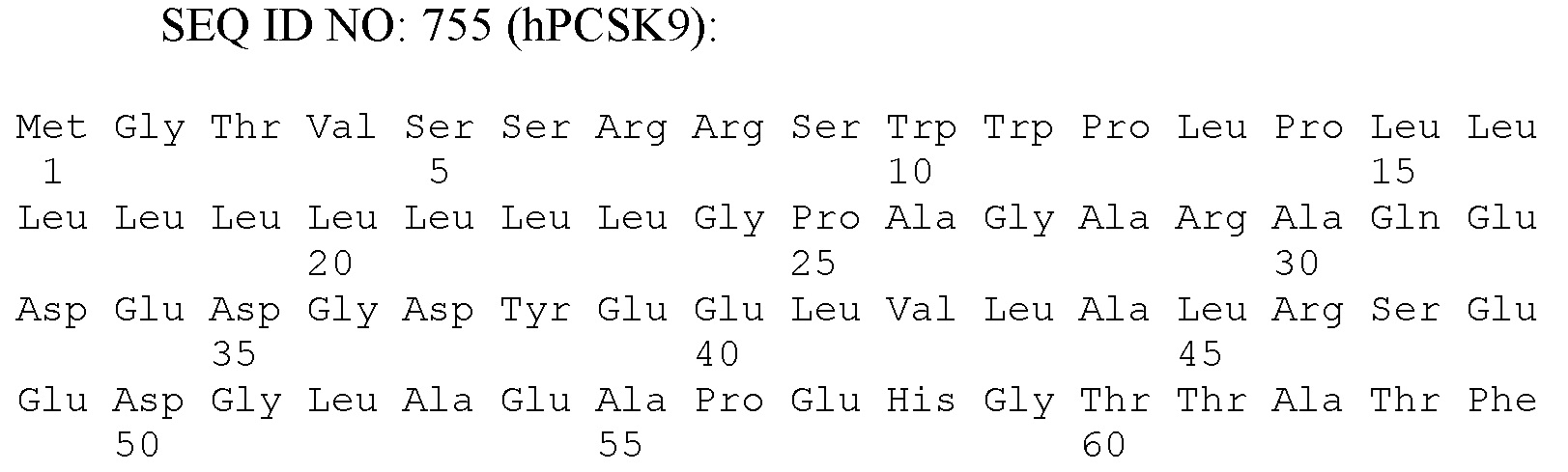



Получение антител человека
Способы получения антител человека из трансгенных мышей известны (см. например, US 6596541, Regeneron Pharmaceuticals, VELOCIMMUNE™). Технология VELOCIMMUNE™ вовлекает получение трансгенной мыши, имеющей геном, содержащий вариабельные области тяжелой и легкой цепей человека, функционально связанные с эндогенными локусами константных областей мыши, так что у мыши продуцируется антитело, содержащее вариабельную область человека и константную область мыши, в ответ на антигенную стимуляцию. ДНК, кодирующую вариабельные области тяжелой и легкой цепей антитела, выделяют и функционально связывают с ДНК, кодирующей константные области тяжелой и легкой цепей человека. Затем ДНК экспрессируют в клетке, способной экспрессировать полностью человеческое антитело. В конкретном варианте осуществления клетка представляет собой клетку CHO.
Антитела могут быть терапевтически пригодными, благодаря блокированию взаимодействия лиганд-рецептор или ингибированию взаимодействия рецептор-комплемент, а не уничтожению клеток через фиксацию комплемента и участию в комплементзависимой цитотоксичности (CDC), или уничтожению клеток через антителозависимую клеточно-опосредуемую цитотоксичность (ADCC). Таким образом, константная область антитела является важной для способности антитела фиксировать комплемент и опосредовать клеточно-опосредуемую цитотоксичность. Таким образом, изотип антитела можно выбирать, исходя того, желательно ли, чтобы антитело опосредовало цитотоксичность.
Антитела человека могут существовать в двух формах, которые связаны с гетерогенностью шарнирной области. В одной форме молекула антитела содержит стабильную конструкцию из четырех цепей размером приблизительно 150-160 кДа, в которой димеры удерживаются вместе межцепочечной дисульфидной связью тяжелых цепей. Во второй форме димеры не связаны через межцепочечные дисульфидные связи и образуется молекула размером приблизительно 75-80 кДа, состоящая из ковалентно связанной легкой и тяжелой цепей (половинное антитело). Эти формы крайне трудно разделять, даже после аффинной очистки.
Частота появления второй формы в различных неизмененных изотипах IgG является следствием, но не ограничиваясь ими, структурных различий, связаанных с изотипом шарнирной области антитела. Одна аминокислотная замена в шарнирной области IgG4 человека может значительно снизить появление второй формы (Angal et al. (1993) Molecular Immunology 30:105) до уровней, как правило, наблюдаемых с использованием шарнирной области IgG1 человека. Настоящее изобретение охватывает антитела, имеющие одну или несколько мутаций в шарнирной области, области CH2 или CH3, которые могут быть желательными, например, при продуцировании, для увеличения выхода желаемой формы антитела.
Как правило, мышь VELOCIMMUNE™ нагружают представляющим интерес антигеном и из мышей, которые экспрессируют антитела, выделяют лимфоциты (такие как B-клетки). Лимфоциты можно сливать с клеточной линией миеломы для получения бессмертных гибридомных клеточных линий и такие гибридомные клеточные линии подвергают скринингу и селекции для идентификации гибридомных клеточных линий, которые продуцируют антитела, специфичные к представляющему интерес антигену. ДНК, кодирующую вариабельные области тяжелой цепи и легкой цепей, можно выделять и связывать с желаемыми изотипическими константными областями тяжелой цепи и легкой цепи. Такой белок антитела можно продуцировать в клетке, такой как клетка CHO. Альтернативно ДНК, кодирующую антигенспецифические химерные антитела или вариабельные домены легкой и тяжелой цепей, можно выделять прямо из антигенспецифических лимфоцитов.
Первоначально, выделяют высокоаффинные химерные антитела, имеющие вариабельную область человека и константную область мыши. Как описано ниже, антитела охарактеризовывают и подвергают селекции в отношении желаемых характеристик, включая аффинность, селективность, эпитоп и т.д. Константные области мыши заменяют желаемой константной областью человека для получения полностью человеческого антитела по изобретению, например, IgG1 или IgG4 дикого типа или модифицированного IgG1 или IgG4 (например, SEQ ID NO:751, 752, 753). Хотя выбранная константная область может варьировать, в зависимости от конкретного применения, характеристики высокоаффинного связывания антигена и специфичности к мишени являются присущими вариабельной области.
Картирование эпитопов и сходные технологии
Для скрининга антител, которые связываются с конкретным эпитопом (например, антител, которые блокируют связывание IgE с его высокоаффинным рецептором), можно проводить общепринятый анализ перекрестного блокирования, такой как анализ, описанный в Antibodies, Harlow and Lane (Cold Spring Harbor Press, Cold Spring Harb., NY). Другие способы включают мутантов, полученных способом сканирования аланином, пептидные блоты (Reineke (2004) Methods Mol Biol 248:443-63) (включенная в настоящее описание в качестве ссылки в полном объеме) или анализ отщепления пептидов. Кроме того, можно использовать способы, такие как вырезание эпитопа, извлечение эпитопа и химическая модификация антигенов (Tomer (2000) Protein Science 9: 487-496) (включенные в настоящее описание в качестве ссылок в полном объеме).
Термин "эпитоп" относится к участку на антигене, на который отвечают B- и/или T-клетки. B-клеточные эпитопы могут быть образованы последовательно расположенными аминокислотами или не последовательно расположенными аминокислотами, находящимися рядом в третичной укладке белка. Эпитопы, образованные последовательно расположенными аминокислотами, как правило, сохраняются при воздействии денатурирующих растворителей, в то время как кая эпитопы, образованные третичной укладкой, как правило, утрачиваются при обработке денатурирующими растворителями. Эпитоп, как правило, включает по меньшей мере 3, и, более часто, по меньшей мере 5 или 8-10 аминокислот в уникальной пространственной конформации.
Определение профиля с помощью модификаций (MAP), также известное как определение профиля антитела на основе структуры антигена (ASAP) представляет собой способ, который распределяет большие количества моноклональных антител (mAb), направленных против одного и того же антигена, на категории в зависимости от сходств профилей связывания каждого антитела с химически или ферментативно модифицированными поверхностями антигенов (US 2004/0101920, включенный в настоящее описание в качестве ссылки в полном объеме). Каждая категория может отражать уникальный эпитоп, либо четко отличающийся, либо частично перекрывающийся с эпитопом, соответствующим другой категории. Эта технология позволяет быструю сортировку генетически идентичных mAb, так что охарактеризация может быть сфокусирована на генетически различающихся mAb. При применении для скрининга гибридом, MAP может способствовать идентификации редких клонов гибридом, которые продуцируют mAb, имеющие желаемые характеристики. MAP можно использовать для сортировки mAb против PCSK9 по изобретению на группы mAb, связывающих различные эпитопы.
В различных вариантах осуществления антитело против hPCSK9 или антигенсвязывающий фрагмент антитела связывает эпитоп в каталитическом домене, который представляет собой эпитоп приблизительно от 153 до 425 SEQ ID NO: 755; более конкретно, эпитоп от приблизительно 153 до приблизительно 250 или от приблизительно 250 до приблизительно 425; более конкретно, антитело или антитело фрагмент по изобретению связывают эпитоп во фрагменте от приблизительно 153 до приблизительно 208, от приблизительно 200 до приблизительно 260, от приблизительно 250 до приблизительно 300, от приблизительно 275 до приблизительно 325, от приблизительно 300 до приблизительно 360, от приблизительно 350 до приблизительно 400, и/или от приблизительно 375 до приблизительно 425.
В различных вариантах осуществления антитело против hPCSK9 или антигенсвязывающий фрагмент антитела связывают эпитоп в домене пропептида (остатки 31-152 SEQ ID NO:755); более конкретно, эпитоп от приблизительно остатка 31 до приблизительно остатка 90 или от приблизительно остатка 90 до приблизительно остатка 152; более конкретно, антитело или фрагмент антитела по изобретению связывают эпитоп во фрагменте от приблизительно остатка 31 до приблизительно остатка 60, от приблизительно остатка 60 до приблизительно остатка 90, от приблизительно остатка 85 до приблизительно остатка 110, от приблизительно остатка 100 до приблизительно остатка 130, от приблизительно остатка 125 до приблизительно остатка 150, от приблизительно остатка 135 до приблизительно остатка 152, и/или от приблизительно остатка 140 до приблизительно остатка 152.
В некоторых вариантах осуществления антитело против hPCSK9 или антигенсвязывающий фрагмент антитела связывают эпитоп в C-концевом домене (остатки 426-692 SEQ ID NO: 755); более конкретно, эпитоп от приблизительно остатка 426 до приблизительно остатка 570 или от приблизительно остатка 570 до приблизительно остатка 692; более конкретно, антитело или или антигенсвязывающий фрагмент по изобретению связывают эпитоп во фрагменте от приблизительно остатка 450 до приблизительно остатка 500, от приблизительно остатка 500 до приблизительно остатка 550, от приблизительно остатка 550 до приблизительно остатка 600, и/или от приблизительно остатка 600 до приблизительно остатка 692.
В некоторых вариантах осуществления антитело или фрагмент антитела связывают эпитоп, который включает более одного из перечисленных выше эпитопов в каталитическом, пропептидном или C-концевом домене, и/или в двух или трех различных доменах (например, эпитопы в каталитическом и C-концевом доменах, или в пропептидном и каталитическом доменах, или в пропептидном, каталитическом и C-концевом доменах).
В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент связывают эпитоп на hPCSK9, содержащий аминокислотный остаток 238 hPCSK9 (SEQ ID NO: 755). Экспериментальные результаты (см. US 2010/0166768) показали, что когда вносили мутацию в D238, KD mAb 316P проявляла >400-кратное снижение аффинности связывания (от ~1×10-9 M до ~410×10-9 M) и T1/2 снижалась >30 раз (от ~37 до ~1 мин). В конкретном варианте осуществления мутация представляла собой D238R. В конкретных вариантах осуществления антитело или антигенсвязывающий фрагмент по изобретению связывают эпитоп hPCSK9, содержащий два или более из аминокислотных остатков в положениях 153, 159, 238 и 343.
Как показано ранее (см. US 2010/0166768), мутация аминокислотного остатка 153, 159 или 343 приводила приблизительно к 5-10-кратному снижению аффинности или сходному укорочению T1/2. В конкретных вариантах осуществления мутация представляла собой S153R, E159R и/или D343R.
В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент связывают эпитоп на hPCSK9, содержащем аминокислотный остаток 366 hPCSK9 (SEQ ID NO:755). Экспериментальные результаты (см. US 2010/0166768) показали, что, когда E366 подвергали мутации, происходило приблизительно 50-кратное снижение аффинности mAb 300N (от ~0,7×10-9 M до ~36×10-9 M) и сходное укорочение T1/2 (от ~120 до ~2 мин). В конкретном варианте осуществления мутация представляет собой E366K.
Настоящее изобретение относится к антителам против PCSK9, которые связываются с тем же эпитопом, что и любое из конкретных иллюстративных антител, описанных в настоящем описании. Аналогично, настоящее изобретение также относится к антителам против PCSK9, которые конкурируют за связывание PCSK9 или фрагмента PCSK9 с любым из конкретных иллюстративных антител, описанных в настоящем описании.
Можно легко определить, связывает ли антитело тот же эпитоп, или конкурирует ли оно за связывание с, эталонным антителом против PCSK9, с использованием общепринятых способов, известных в данной области. Например, для определения того, связывается ли антитело с тем же эпитопом, что и эталонное антитело против PCSK9 по изобретению, эталонному антителу позволяют связываться с белком или пептидом PCSK9 в насыщающих условиях. Далее оценивают способность исследуемого антитела связываться с молекулой PCSK9. Если исследуемое антитело способно связываться с PCSK9 после насыщающего связывания с эталонным антителом против PCSK9, можно заключить, что исследуемое антитело связывается с отличающимся эпитопом от эталонного антитела против PCSK9. С другой стороны, если исследуемое антитело не способно связываться с молекулой PCSK9 после насыщающего связывания с эталонным антителом против PCSK9, тогда исследуемое антитело может связываться с тем же эпитопом, что и эпитоп, с которым связывается эталонное антитело против PCSK9 по изобретению.
Для определения того, конкурирует ли антитело за связывание с эталонным антителом против PCSK9, выполняют описанную выше методологию связывания в двух ориентациях: в первой ориентации эталонному антителу позволяют связываться с молекулой PCSK9 в насыщающих условиях с последующей оценкой связывания исследуемого антитела с молекулой PCSK9. Во второй ориентации исследуемому антителу позволяют связываться с молекулой PCSK9 в насыщающих условиях с последующей оценкой связывания эталонного антитела с молекулой PCSK9. Если в обеих ориентациях только первое (насыщающее) антитело способно связываться с молекулой PCSK9, тогда делают заключение, что исследуемое антитело и эталонное антитело конкурируют за связывание с PCSK9. Как будет понятно специалисту в данной области, антитело, которое конкурирует за связывание с эталонным антителом, не обязательно может связываться с тем же идентичным эпитопом, что и эталонное антитело, а может пространственным образом блокировать связывание эталонного антитела путем связывания перекрывающегося или соседнего эпитопа.
Два антитела связываются с тем же или перекрывающимся эпитопом, если каждое из них конкурентно ингибирует (блокирует) связывание другого с антигеном. Следовательно, 1-, 5-, 10-, 20- или 100-кратный избыток одного антитела ингибирует связывание другого по меньшей мере на 50%, и, предпочтительно, на 75%, 90% или даже 99% при измерении в конкурентном анализе связывания (см., например, Junghans et al., Cancer Res. 1990 50:1495-1502). Альтернативно два антитела имеют тот же эпитоп, если по существу все аминокислотные мутации в антигене, которые снижают или устраняют связывание одного антитела, снижают или устраняют связывание другого. Два антитела имеют перекрывающиеся эпитопы, если некоторые аминокислотные мутации, которые снижают или устраняют связывание одного антитела, снижают или устраняют связывание другого.
Затем можно проводить дополнительное общепринятое экспериментирование (например, мутация пептидов и анализы связывания) для подтверждения того, является ли в действительности наблюдаемое отсутствие связывания исследуемого антитела следствием связывания с тем же эпитопом, что и эталонное антитело, или является ли пространственное блокирование (или другое явление) ответственным за отсутствие наблюдаемого связывания. Эксперименты этого типа можно проводить с использованием ELISA, RIA, поверхностного плазмонного резонанса, проточной цитометрии или любого другого количественного или качественного анализа связывания антитела, доступного в данной области.
В конкретном варианте осуществления изобретение включает антитело против PCSK9 или антигенсвязывающий фрагмент антитела, который связывает белок PCSK9 SEQ ID NO: 755, где связывание между антителом или его фрагментом с PCSK9 и вариантом белка PCSK9 составляет менее 50% от связывания между антителом или фрагментом и белком PCSK9 SEQ ID NO: 755. В одном конкретном варианте осуществления вариант белка PCSK9 содержит по меньшей мере одну мутацию остатка в положении, выбранном из группы, состоящей из 153, 159, 238 и 343. В более конкретном варианте осуществления по меньшей мере одна мутация представляет собой S153R, E159R, D238R и/или D343R. В другом конкретном варианте осуществления вариант белка PCSK9 содержит по меньшей мере одну мутацию остатка в положении, выбранном из группы, состоящей из 366. В одном конкретном варианте осуществления вариант белка PCSK9 содержит по меньшей мере одну мутацию остатка в положении, выбранном из группы, состоящей из 147, 366 и 380. В более конкретном варианте осуществления мутация представляет собой S147F, E366K и V380M.
Иммуноконъюгаты
Изобретение относится к моноклональному антителу человека против PCSK9, конъюгированному с терапевтической частью ("иммуноконъюгат"), такой как цитотоксин, химиотерапевтическое средство, иммунодепрессант или радиоизотоп. Агенты на основе цитотоксинов включают любой агент, который является вредоносным для клеток. Примеры подходящих агентов на основе цитотоксинов и химиотерапевтических средств для образования иммуноконъюгатов известны в данной области, см. например, WO 05/103081.
Биспецифические антитела
Антитела по настоящему изобретению могут быть моноспецифическими, биспецифическими или полиспецифическими. Полиспецифические mAb могут быть специфичными к различным эпитопам одного полипептида-мишени или могут содержать антигенсвязывающие домены, специфичные более чем к одному полипептиду-мишени. См., например, Tutt et al. (1991) J. Immunol. 147:60-69. mAb человека против PCSK9 можно связывать или коэкспрессировать с другой функциональной молекулой, например, другим пептидом или белком. Например, антитело или его фрагмент можно функционально связывать (например, путем химического связывания, генетического слияния, нековалентного связывания или иным образом) с одной или несколькими другими молекулярными структурами, такими как другое антитело или его антитело, с получением биспецифического или полиспецифического антитела со второй специфичностью связывания.
Иллюстративный формат биспецифических антител, который можно использовать в контексте настоящего изобретения, вовлекает применение первого домена CH3 иммуноглобулина (Ig) и второго домена CH3 Ig, где первый и второй домены CH3 Ig отличаются друг от друга по меньшей мере на одну аминокислоту, и где различие по меньшей мере в одну аминокислоту снижает связывание биспецифического антитела с белком A по сравнению с биспецифическим антителом, лишенным аминокислотных отличий. В одном из вариантов осуществления первый домен CH3 Ig связывает белок A и второй домен CH3 Ig содержит мутацию, которая снижает или устраняет связывание белка A, такую как модификация H95R (согласно нумерации экзонов IMGT; H435R согласно нумерации EU). Второй CH3, кроме того, может содержать модификацию Y96F (по IMGT; Y436F по EU). Другие модификации, которые могут быть найдены во втором CH3, включают: D16E, L18M, N44S, K52N, V57M, и V82I (по IMGT; D356E, L358M, N384S, K392N, V397M, и V422I по EU) в случае антител IgG1; N44S, K52N, и V82I (IMGT; N384S, K392N, и V422I по EU) в случае антител IgG2; и Q15R, N44S, K52N, V57M, R69K, E79Q и V82I (по IMGT; Q355R, N384S, K392N, V397M, R409K, E419Q, и V422I по EU) в случае антител IgG4. Изменения формата биспецифических антител, описанных выше, предусматриваются объемом настоящего изобретения.
Биоэквиваленты
Антитела против PCSK9 и фрагменты антител по настоящему изобретению охватывают белки, имеющие аминокислотные последовательности, которые отличаются от аминокислотных последовательностей, описанных mAb, но которые сохраняют способность связывать PCSK9 человек. Такие варианты mAb и фрагменты антител содержат одну или несколько вставок, делеций или замен аминокислот по сравнению с исходной последовательностью, но проявляют биологическую активность, которая по существу эквивалентна активности описанных mAb. Аналогично, последовательности ДНК, кодирующие антитело против PCSK9 по настоящему изобретению, охватывают последовательности, которые содержат одну или несколько вставок, делеций или замен нуклеотидов по сравнению с описанной последовательностью, но которые кодируют антитело против PCSK9 или фрагмент антитела, который по существу биоэквивалентен антителу против PCSK9 или фрагменту антитела по изобретению. Примеры таких вариантов аминокислот и последовательностей ДНК рассмотрены выше.
Два антигенсвязывающих белка или антитела считаются биоэквивалентными, если, например, они являются фармацевтическими эквивалентами или фармацевтическими альтернативами, у которых скорость и степень всасывания не проявляют значительного отличия при введении в той же молярной дозе в сходных экспериментальных условиях, либо в однократной дозе, либо в многократных дозах. Некоторые антитела считаются эквивалентами или фармацевтическими альтернативами, если они эквиваленты по степени их всасывания, но не по их скорости всасывания, и, тем не менее, они могут считаться биоэквивалентными, поскольку такие отличия в скорости всасывания являются преднамеренными и отражаются в маркировке, не являются необходимыми для достижения эффективных концентраций лекарственного средства в организме, например, при хроническом применении, и считаются с медицинской точки зрения незначительными для конкретного исследуемого лекарственного продукта. В одном из вариантов осуществления два антигенсвязывающих белка являются биоэквивалентными, если отсутствуют клинически значимые отличия в их безопасности, чистоте и эффективности.
В одном из вариантов осуществления два антигенсвязывающих белка являются биоэквивалентными, если пациента можно переключать один или несколько раз между эталонным продуктом и биологическим продуктом без ожидаемого увеличения риска неблагоприятных явлений, включая клинически значимое изменение иммуногенности, или снижение эффективности по сравнению с продолжающейся терапией без такого переключения.
В одном из вариантов осуществления два антигенсвязывающих белка являются биоэквивалентными, если они действуют путем общего механизма или механизмов действия для данного условия или условий применения, в тех случаях, когда такие механизмы известны.
Биоэквивалентность можно продемонстрировать способами in vivo и in vitro. Показатели биоэквивалентности включают, например, (a) исследование in vivo у человека или других млекопитающих, у которых концентрацию антитела или его метаболитов измеряют в крови, плазме, сыворотке или другой или биологической жидкости в качестве функции времени; (b) исследование in vitro, которое коррелирует с и объективно предсказывает данные о биодоступности у человека in vivo; (c) исследование in vivo у человека или других млекопитающих, у которых измеряют соответствующий острый фармакологический эффект антитела (или его мишени) в качестве функции времени; и (d) строго контролируемое клиническое испытание, в котором устанавливается безопасность, эффективность или биодоступность или биоэквивалентность антитела.
Биоэквивалентные варианты антител против PCSK9 по изобретению можно конструировать, например, путем внесения различных замен остатков или последовательностей или делеции концевых или внутренних остатков или последовательностей, не требуемых для биологической активности. Например, остатки цистеина, не являющиеся необходимыми для биологической активности, можно удалять или заменять другими аминокислотами для предупреждения образования не являющихся необходимыми или неправильных внутримолекулярных дисульфидных мостиков при ренатурации.
Группа, подлежащая лечению
Изобретение относится к терапевтическим способам для лечения пациента-человека, нуждающегося в композиции по изобретению. Хотя модификации образа жизни и лечение общепринятыми лекарственными средствами часто являются успешными в отношении снижения уровней холестерина, не все пациенты способны достигать рекомендованных заданных уровней холестерина с помощью таких подходов. Различные состояния, такие как семейная гиперхолестеринемия (FH), по-видимому, являются устойчивыми к снижению уровней LDL-C, не смотря на интенсивное использование общепринятой терапии. Гомозиготная и гетерозиготная семейная гиперхолестеринемия (hoFH, heFH) представляет собой состояние, связанные с преждевременным атеросклеротическим сосудистым заболеванием. Однако пациенты, у которых диагностирована hoFH, по большей степени не отвечают на общепринятую медикаментозную терапию и имеют ограниченные варианты лечения. В частности, лечение статинами, которое снижает LDL-C путем ингибирования синтеза и активации рецептора LDL в печени, может иметь небольшой эффект у пациентов, у которых рецепторы LDL не существуют или являются дефектными. Недавно было описано среднее снижение LDL-C только менее чем приблизительно на 20% у пациентов с подтвержденной по генотипу hoFH, которых лечили максимальной дозой статинов. Добавление эзетимиба 10 мг/сутки к этому режиму приводило к общему снижению уровней LDL-C 27%, которое все еще далеко от оптимального. Аналогично, многие пациенты не отвечают на статины, плохо контролируются терапией статинами или не могут переносить терапию статинами; как правило, эти пациенты неспособны достигнуть контроля холестерина с помощью альтернативных способов лечения. Существует большая неудовлетворенная медицинская потребность в новых способах лечения, которые могут преодолеть недостатки современных вариантов лечения.
Конкретные группы, которые можно лечить терапевтическими способами по изобретению, включают индивидуумов, для которых показан аферез LDL, индивидуумов с активирующими PCSK9 мутациями (мутации с приобретением функции, "GOF"), индивидуумов с гетерозиготной семейной гиперхолестеринемией (heFH); индивидуумов с первичной гиперхолестеринемией, которые не переносят статины или не контролируются статинами; и индивидуумов, имеющих риск развития гиперхолестеринемии, которых можно лечить профилактически. Другие показания включают гиперлипидемию и дислипидемию, связанную с вторичными причинами, такими как сахарный диабет 2 типа, холестатические заболевания печени (первичный биллиарный цирроз), нефротический синдром, гипотиреоз, ожирение; и профилактику и лечение атеросклероза и сердечно-сосудистых заболеваний. Однако в зависимости от тяжести упомянутых выше заболеваний и состояний, лечение индивидуумов антителами и антигенсвязывающими фрагментами по изобретению может быть противопоказано для определенных заболеваний и состояний.
Терапевтическое введение и составы
Изобретение относится к терапевтическим композициям, содержащим антитела против PCSK9 или их антигенсвязывающие фрагменты по настоящему изобретению. Введение терапевтических композиций в соответствии с изобретением можно проводить с помощью подходящих носителей, эксципиентов и других средств, которые включены в составы, для обеспечения улучшенного транспорта, доставки, переносимости и т.п. Множество подходящих составов может быть найдено в справочнике, известном всем фармацевтическим химикам: Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, PA. Эти составы включают, например, порошки, пасты, мази, желе, воски, масла, липиды, содержащие липиды (катионные или анионные) везикулы (такие как LIPOFECTIN™), конъюгаты ДНК, безводные всасывающиеся пасты, эмульсии типа "масло-в-воде" и "вода-в-масле", эмульсии карбовакс (полиэтиленгликоли с различной молекулярной массой), полутвердые гели и полутвердые смеси, содержащие карбовакс. Также cм. Powell et al. "Compendium of excipients for parenteral formulations" PDA (1998) J Pharm Sci Technol 52:238-311.
Доза может варьировать, в зависимости от возраста и размера индивидуума, которому намереваются проводить введение, заданных заболеваний, состояний, пути введения и т.п. Когда антитело по настоящему изобретению используют для лечения различных состояний и заболеваний, связанных с PCSK9, включая гиперхолестеринемию, нарушения, связанные с LDL и аполипопротеином B, и нарушения метаболизма липидов и т.п., у взрослого пациента, обычно является преимущественным введение антитела по настоящему изобретению обычно в единичной дозе от приблизительно 0,01 до приблизительно 20 мг/кг массы тела, более предпочтительно, от приблизительно 0,02 до приблизительно 7, от приблизительно 0,03 до приблизительно 5, или от приблизительно 0,05 до приблизительно 3 мг/кг массы тела. В зависимости от тяжести состояния, частоты и длительности лечения, дозу можно корректировать.
Известны различные системы для доставки и их можно использовать для введения фармацевтических композиций по изобретению, например, инкапсулирование в липосомы, микрочастицы, микрокапсулы, рекомбинантные клетки, способные экспрессировать мутантные вирусы, опосредуемый рецептором эндоцитоз (см., например, Wu et al. (1987) J. Biol. Chem. 262:4429-4432). Способы введения включают, но не ограничиваются ими, внутрикожный, внутримышечный, внутрибрюшинный, внутривенный, подкожный, интраназальный, эпидуральный и оральный или пероральный пути. Если антитело по настоящему изобретению вводят путем инъекции, предпочтительной является подкожная инъекция. Оральное или пероральное введение является предпочтительным для ингибитора HMG-CoA, например, статина.
Композицию можно вводить любым удобным путем, например, путем инфузии или болюсной инъекции, путем всасывания через эпителиальные или кожно-слизистые выстилки (например, слизистая оболочка полости рта, слизистая оболочка прямой кишки и слизистая оболочка кишечника и т.д.) и ее можно вводить вместе с другими биологически активными средствами. Введение может быть системным или местным. Фармацевтическую композицию также можно доставлять в везикуле, в частности, в липосоме (см. Langer (1990) Science 249:1527-1533; Treat et al. (1989), Liposomes in the Therapy of Infectious Disease and Cancer, Lopez Berestein and Fidler (eds.), Liss, New York, pp. 353-365; Lopez-Berestein, там же., pp. 317-327; см., главным образом, там же).
В определенных ситуациях фармацевтическую композицию можно доставлять в системе с контролируемым высвобождением. В одном из вариантов осуществления можно использовать насос (см. Langer, supra; Sefton (1987) CRC Crit. Ref. Biomed. Eng. 14:201). В другом варианте осуществления можно использовать полимерные материалы; см., Medical Applications of Controlled Release, Langer and Wise (eds.), CRC Pres., Boca Raton, Florida (1974). В другом варианте осуществления систему с контролируемым высвобождением можно помещать рядом с мишенью композиции, что, таким образом, приводит к тому, что требуется только часть системной дозы (см., например, Goodson, in Medical Applications of Controlled Release, supra, vol. 2, pp. 115-138, 1984).
Инъецируемые препараты могут включать дозированные формы для внутривенных, подкожных, внутрикожных и внутримышечных инъекций, капельных инфузий и т.д. Эти инъецируемые препараты можно получать общеизвестными способами. Например, инъецируемые препараты можно получать, например, путем растворения, суспендирования или эмульгации антитела или его соли, описанных выше, в стерильной водной среде или в масляной среде, обычно используемой для инъекций. В качестве водной среды для инъекций существуют, например, физиологический раствор, изотонический раствор, содержащий глюкозу и другие вспомогательные средства, и т.д., которые можно использовать в комбинации с подходящим солюбилизирующим средством, таким как спирт (например, этанол), полиспирт (например, пропиленгликоль, полиэтиленгликоль), неионное поверхностно-активное вещество [например, полисорбат 80, HCO-50 (полиоксиэтилен (50 моль) аддукт гидрогенизированного касторового масла)] и т.д. В качестве масляной среды используют, например, кунжутное масло, соевое масло и т.д., которые можно использовать в комбинации с солюбилизирующим средством, таким как бензилбензоат, бензиловый спирт и т.д. Инъекционным раствором, полученным таким образом, заполняют соответствующую ампулу. Фармацевтическую композицию по настоящему изобретению можно доставлять подкожно или внутривенно с помощью стандартной иглы или шприца. Кроме того, что касается подкожной доставки, при доставке фармацевтической композиции по настоящему изобретению применимо устройство для доставки в виде шприца-ручки. Такое устройство для доставки в виде шприца-ручки может быть многоразовым или одноразовым. В многоразовом устройстве для доставки в виде шприца-ручки используемся заменяемая кассета, которая содержит фармацевтическую композицию. После введения всей фармацевтической композиции в кассете и опустошения кассеты, пустую кассету можно легко выбрасывать и заменять новой кассетой, которая содержит фармацевтическую композицию. Затем устройство для доставки в виде шприца-ручки можно использовать повторно. В многоразовом устройстве для доставки в виде шприца-ручки отсутствует одноразовая кассета. Вместо этого имеется одноразовое устройство в виде шприца-ручки, предварительно заполненное фармацевтической композицией, содержащейся в емкости в устройстве. После опустошения емкости с фармацевтической композицией, все устройство выбрасывают.
Многочисленные многоразовые устройства в виде шприца-ручки и шприца для самоинъекций применимы для подкожной доставки фармацевтической композиции по настоящему изобретению. Примеры включают, но, безусловно, не ограничиваются ими AUTOPEN™ (Owen Mumford, Inc., Woodstock, Великобритания), шприц-ручку DISETRONIC™ (Disetronic Medical Systems, Burghdorf, Швейцария), шприц-ручку HUMALOG MIX 75/25™, шприц-ручка HUMALOG™, шприц-ручку HUMALIN 70/30™ (Eli Lilly and Co., Indianapolis, IN), NOVOPEN™ I, II и III (Novo Nordisk, Copenhagen, Дания), NOVOPEN JUNIOR™ (Novo Nordisk, Copenhagen, Дания), шприц-ручку BD™ (Becton Dickinson, Franklin Lakes, NJ), OPTIPEN™, OPTIPEN PRO™, OPTIPEN STARLET™ и OPTICLIK™ (sanofi-aventis, Frankfurt, Germany), среди прочих. Примеры многоразовых устройств для доставки, применимых для подкожной доставки фармацевтической композиции по настоящему изобретению, включают, но, безусловно, не ограничиваются ими, шприц-ручку SOLOSTAR™ (sanofi-aventis), FLEXPEN™ (Novo Nordisk) и KWIKPEN™ (Eli Lilly).
Преимущественно, фармацевтические композиции для перорального или парентерального применения, описанные выше, получают в виде дозированных форм в единичной дозе, пригодных для подбора дозы активных ингредиентов. Такие дозированные формы в единичной дозе включают, например, таблетки, пилюли, капсулы, инъекции (ампулы), суппозитории и т.д. Содержащееся количество упомянутого выше антитела, как правило, составляет от приблизительно 4 до приблизительно 500 мг, или от приблизительно 5 до приблизительно 500 мг на дозированную форму в единичной дозе; в частности, в форме инъекции, предпочтительно, чтобы упомянутое выше антитело содержалось в дозе от приблизительно 5 до приблизительно 100 мг или приблизительно от 5 до 400 мг (как например, от приблизительно 50 до приблизительно 200 мг на 1 мл раствора для инъекций) и в дозе от приблизительно 10 до приблизительно 250 мг или до приблизительно 500 мг для других дозированных форм.
Изобретение относится к терапевтическим способам, в которых антитело или фрагмент антитела по изобретению пригодны для лечения гиперхолестеринемии, связанной с различными состояниями, вовлекающими hPCSK9. Антитела против PCSK9 или фрагменты антител по изобретению особенно пригодны для лечения гиперхолестеринемии и т.п. Комбинированная терапия может включать антитело против PCSK9 по изобретению, например, с одним или несколькими из любого средства, которое (1) индуцирует истощение в клетках синтеза холестерина путем ингибирования редуктазы 3-гидрокси-3-метилглутарил(HMG)-кофермента A (CoA), такого как церивастатин, аторвастатин, симвастатин, питавастатин, розувастатин, флувастатин, ловастатин, правастатин; (2) ингибирует захват холестерина и/или обратное всасывание желчных кислот; (3) увеличивает катаболизм липопротеинов (как например, ниацин); и активаторами фактора транскрипции LXR, который играет роль в выведении холестерина, такими как 22-гидроксихолестерин, или фиксированными комбинациями, такими как эзетимиб вместе с симвастатином; статин с секвестрантом желчных кислот (например, холестирамин, колестипол, колесевелам), фиксированной комбинацией ниацина вместе со статином (например, ниацин с ловастатином); или с другими средствами, снижающими уровень липидов, такими как этиловые эфиры омега-3-жирных кислот (например, омакор).
ПРЕДПОЧТИТЕЛЬНЫЕ АСПЕКТЫ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Ниже приведены некоторые предпочтительные аспекты и варианты осуществления настоящего изобретения:
АСПЕКТЫ, ОТНОСЯЩИЕСЯ К ГРУППАМ ПАЦИЕНТОВ - A)
1. Способ лечения заболевания или состояния, в которые вовлечена экспрессия или активность PCSK9, включающий
введение терапевтического количества антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9) индивидууму, нуждающемуся в этом,
где индивидуум, нуждающийся в этом, относится к одной или нескольким из следующих групп индивидуумов:
(i) индивидуумы с уровнем холестерина LDL (LDL-C) в сыворотке по меньшей мере 100 мг/дл, [по меньшей мере 130 мг/дл, по меньшей мере 160 мг/дл / по меньшей мере 200 мг/дл];
(ii) индивидуумы, имеющие уровень С HDL в сыворотке менее 40 мг/дл;
(iii) индивидуумы, имеющие уровень холестерина в сыворотке по меньшей мере 200 мг/дл [240 мг/дл];
(iv) индивидуумы, имеющие уровень триацилглицерина в сыворотке по меньшей мере 150 мг/дл [по меньшей мере 200 мг/дл; по меньшей мере 500 мг/дл], где указанный уровень триацилглицеринов определяют после голодания в течение по меньшей мере 8 часов;
(v) индивидуумы в возрасте по меньшей мере 35 лет [по меньшей мере 40/50/55/60/65/70 лет];
(vi) индивидуумы моложе 75 лет [65/60/55/50/45/40 лет];
(vii) индивидуумы, имеющие BMI 25 [26/27/28/29/30/31/32/33/34/35/36/37/38/39] или более;
(viii) мужчины;
(ix) женщины;
(x) индивидуумы, у которых введение указанного антитела или его антигенсвязывающего фрагмента приводит к снижению уровня LDL-C в сыворотке по меньшей мере на 30 мг/дл [40 мг/дл; 50 мг/дл; 60 мг/дл; 70 мг/дл] относительно уровня до введения дозы; или
(xi) индивидуумы, у которых введение указанного антитела или его антигенсвязывающего фрагмента приводит к снижению уровня LDL-C в сыворотке по меньшей мере на 20% [30%; 40%; 50%; 60%] относительно уровня до введения дозы.
2. Способ лечения заболевания или состояния, в которые вовлечена экспрессия или активность PCSK9, включающий
введение терапевтического количества антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9) индивидууму, нуждающемуся в этом,
где индивидуум, нуждающийся в этом, не относится к одной или нескольким из следующих групп индивидуумов:
(i) курильщики;
(ii) лица в возрасте 70 лет и старше;
(iii) лица, страдающие гипертензией;
(iv) беременные женщины;
(v) женщины, пытающиеся забеременеть;
(vi) женщины, кормящие грудью;
(vii) лица, которые имеют или когда-либо имели заболевание, поражающее печень;
(viii) лица, которые имели какие-либо необъясненные аномальные показатели функции печени в тестах крови;
(ix) лица, которые употребляют чрезмерные количества спиртных напитков;
(x) лица, имеющие проблемы с почками;
(xi) лица, страдающие гипотиреозом;
(xii) лица, страдающие мышечными нарушениями;
(xiii) лица, ранее сталкивавшиеся с мышечными проблемами в ходе лечения снижающей уровень липидов терапией;
(xiv) лица, имеющие серьезные проблемы с дыханием;
(xv) лица, принимающие одно или несколько из следующих лекарственных средств: лекарственные средства, изменяющие работу иммунной системы (например, циклоспорин или антигистамины), антибиотики или противогрибковые средства (например, эритромицин, кларитромицин, кетоконазол, итраконазол, рифампицин, фусидовая кислота), лекарственные средства, регулирующие уровень липидов (например, гемфиброзил, колестипол), блокаторы кальциевых каналов (например, верапамил, дилтиазем), лекарственные средства, регулирующие сердечный ритм (дигоксин, амиодарон), ингибиторы протеаз, используемые при лечении ВИЧ (например, нельфинавир), варфарин, пероральные контрацептивы, антациды или зверобой; или
(xvi) лица, выпивающие более 0,1 л грейпфрутового сока в сутки;
(xvii) лица, имеющие индекс массы тела (BMI) более 40;
(xviii) лица, имеющие индекс массы тела (BMI) менее 18;
(xix) лица, страдающие диабетом 1 типа или диабетом 2 типа;
(xx) лица, положительные по гепатиту B или гепатиту C; или
(xi) лица, имеющие известную чувствительность к лекарственным средствам на основе моноклональных антител.
3. Антитело или его антигенсвязывающий фрагмент, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9), для применения при лечении заболевания или состояния, в которые вовлечена экспрессия или активность PCSK9,
где антитело или его антигенсвязывающий фрагмент предназначены для введения индивидууму, относящемуся по меньшей мере к одной из следующих групп индивидуумов:
(i) индивидуумы, имеющие уровень LDL-C в сыворотке по меньшей мере 100 мг/дл [по меньшей мере 130 мг/дл / по меньшей мере 160 мг/дл / по меньшей мере 200 мг/дл];
(ii) индивидуумы, имеющие уровень С HDL в сыворотке менее 40 мг/дл;
(iii) индивидуумы, имеющие уровень холестерина в сыворотке по меньшей мере 200 мг/дл [240 мг/дл];
(iv) индивидуумы, имеющие уровень триацилглицерина в сыворотке по меньшей мере 150 мг/дл [по меньшей мере 200 мг/дл; по меньшей мере 500 мг/дл], где указанный уровень триацилглицеринов определяют после голодания в течение по меньшей мере 8 часов;
(v) индивидуумы в возрасте по меньшей мере 35 лет [по меньшей мере 40/50/55/60/65/70 лет];
(vi) индивидуумы моложе 75 лет [65/60/55/50/45/40 лет];
(vii) индивидуумы, имеющие BMI 25 [26/27/28/29/30/31/32/33/34/35/36/37/38/39] или более;
(vii) мужчины;
(viii) женщины;
(ix) индивидуумы, у которых введение указанного антитела или его антигенсвязывающего фрагмента приводит к снижению уровня LDL-C в сыворотке по меньшей мере на 20 мг/дл [30 мг/дл; 40 мг/дл; 50 мг/дл; 60 мг/дл; 70 мг/дл]; или
(x) индивидуумы, у которых введение указанного антитела или его антигенсвязывающего фрагмента приводит к снижению уровня LDL-C в сыворотке по меньшей мере на 10% [20%; 30%; 40%; 50%; 60%].
4. Антитело или его антигенсвязывающий фрагмент, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9) для применения при лечении заболевания или состояния, в которые вовлечена экспрессия или активность PCSK9, где антитело или его антигенсвязывающий фрагмент предназначены для введения индивидууму, который не относится к одной или нескольким из следующих групп индивидуумов:
(i) курильщики;
(ii) лица в возрасте 70 лет и старше;
(iii) лица, страдающие гипертензией;
(iv) беременные женщины;
(v) женщины, пытающиеся забеременеть;
(vi) женщины, кормящие грудью;
(vii) лица, которые имеют или когда-либо имели заболевание, поражающее печень;
(viii) лица, которые имели какие-либо необъясненные аномальные показатели функции печени в тестах крови;
(ix) лица, которые употребляют чрезмерные количества спиртных напитков;
(x) лица, имеющие проблемы с почками;
(xi) лица, страдающие гипотиреозом;
(xii) лица, страдающие мышечными нарушениями;
(xiii) лица, ранее сталкивавшиеся с мышечными проблемами в ходе лечения снижающей уровень липидов терапией;
(xiv) лица, имеющие серьезные проблемы с дыханием;
(xv) лица, принимающие одно или несколько из следующих лекарственных средств: лекарственные средства, изменяющие работу иммунной системы (например, циклоспорин или антигистамины), антибиотики или противогрибковые средства (например, эритромицин, кларитромицин, кетоконазол, итраконазол, рифампицин, фусидовая кислота), лекарственные средства, регулирующие уровень липидов (например, гемфиброзил, колестипол), блокаторы кальциевых каналов (например, верапамил, дилтиазем), лекарственные средства, регулирующие сердечный ритм (дигоксин, амиодарон), ингибиторы протеаз, используемые при лечении ВИЧ (например, нельфинавир), варфарин, пероральные контрацептивы, антациды или зверобой;
(xvi) лица, выпивающие более 0,1 л грейпфрутового сока в сутки;
(xvii) лица, имеющие индекс массы тела (BMI) более 40;
(xviii) лица, имеющие индекс массы тела (BMI) менее 18;
(xix) лица, страдающие диабетом 1 типа или диабетом 2 типа;
(xx) лица, положительные по гепатиту B или гепатиту C; или
(xxi) лица, имеющие известную чувствительность к лекарственным средствам на основе моноклональных антител.
5. Способ согласно аспекту 1 или 2 или антитело согласно аспекту 2 или 3, где заболевание или состояние, в которые вовлечена экспрессия или активность PCSK9, смягчаются, улучшаются, ингибируются или предупреждаются антагонистом PCSK9.
6. Способ или антитело согласно любому из аспектов 1-5, где заболевание или состояние, в которые вовлечена экспрессия или активность PCSK9, выбраны из группы, состоящей из:
гиперхолестеринемии, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний.
7. Способ или антитело согласно любому из аспектов 1-6, где индивидуумом, нуждающимся в этом, является индивидуум, для которого показан аферез LDL, индивидуум с активирующими PCSK9 мутациями, индивидуум с гетерозиготной семейной гиперхолестеринемией, индивидуум с первичной гиперхолестеринемией, не контролируемой статинами, индивидуум с риском развития гиперхолестеринемии, индивидуум с гиперхолестеринемией, гиперлипидемией, дислипидемией, атеросклерозом или сердечно-сосудистыми заболеваниями.
8. Способ или антитело согласно любому из аспектов 1-7, где антитело или его антигенсвязывающий фрагмент представляет собой рекомбинантное антитело человека или его фрагмент.
9. Способ или антитело согласно любому из аспектов 1-8, где антитело или его антигенсвязывающий фрагмент характеризуются одним или несколькими из следующих:
(i) способны снижать уровень общего холестерина в сыворотке на по меньшей мере от приблизительно 25 до приблизительно 35% и сохранять снижение на протяжении периода по меньшей мере 24 суток относительно уровня до введения дозы;
(ii) способны снижать холестерин LDL в сыворотке по меньшей мере приблизительно на 65-80% и сохранять снижение на протяжении периода по меньшей мере 24 суток относительно уровня до введения дозы;
(iii) способны снижать уровень триглицеридов в сыворотке по меньшей мере приблизительно на 25-40% относительно уровня до введения дозы;
(iv) достигают одного или нескольких из (i)-(iii) без снижения уровня холестерина HDL в сыворотке или со снижением холестерина HDL в сыворотке не более чем на 5% относительно уровня до введения дозы;
(v) достигают одного или нескольких из (i)-(iii) с небольшим или отсутствием поддающегося измерению эффекта на функцию печени, при определении по результатам измерения ALT и AST.
10. Способ или антитело согласно любому из аспектов 1-9, где антитело или его антигенсвязывающий фрагмент содержат
- домен CDR3 тяжелой цепи (HCDR3), выбранный из группы, состоящей из SEQ ID NO: 8, 32, 56, 80, 104, 128, 152, 176, 200, 224, 248, 272, 296, 320, 344, 368, 392, 416, 440, 464, 488, 512, 536, 560, 584, 608, 632, 656, 680, 704 и 728; и
- домен CDR3 легкой цепи (LCDR3), выбранный из группы, состоящей из SEQ ID NO: 16, 40, 64, 88, 112, 136, 160, 184, 208, 232, 256, 280, 304, 328, 352, 376, 400, 424, 448, 472, 496, 520, 544, 568, 592, 616, 639, 664, 688, 712 и 736.
11. Способ или антитело согласно любому из аспектов 1-9, где антитело или его антигенсвязывающий фрагмент содержат CDR тяжелой и легкой цепей пары аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
12. Способ или антитело согласно аспекту 11, где антитело или его антигенсвязывающий фрагмент содержат аминокислотные последовательности CDR тяжелой и легкой цепей, как показано в SEQ ID NO: 76, 78, 80, 84, 86 и 88.
13. Способ или антитело согласно аспекту 12, где антитело или его антигенсвязывающий фрагмент содержат аминокислотную последовательность HCVR, как показано в SEQ ID NO: 90, и аминокислотную последовательность LCVR, как показано в SEQ ID NO: 92.
14. Способ или антитело согласно любому из аспектов 1-9, где антитело или его антигенсвязывающий фрагмент связываются с тем же эпитопом на hPCSK9, что и антитело, содержащее аминокислотные последовательности CDR тяжелой и легкой цепей, представленные в SEQ ID NO: 76, 78, 80, 84, 86 и 88.
15. Способ или антитело согласно любому из аспектов 1-9, где антитело или его антигенсвязывающий фрагмент конкурируют за связывание hPCSK9 с антителом, содержащим аминокислотные последовательности CDR тяжелой и легкой цепей, как показано в SEQ ID NO: 76, 78, 80, 84, 86 и 88.
16. Способ или антитело согласно любому из аспектов 1-15, дополнительно включающие:
введение терапевтического количества ингибитора HMG-CoA-редуктазы индивидууму в дозировке от 0,05 мг до 100 мг.
17. Способ или антитело согласно аспекту 16, где ингибитор HMG-CoA-редуктазы представляет собой статин.
18. Способ или антитело согласно аспекту 17, где статин выбран из группы, состоящей из церивастатина, аторвастатина, симвастатина, питавастатина, розувастатина, флувастатина, ловастатина и правастатина.
19. Способ или антитело согласно аспекту 18, где статин представляет собой
- церивастатин, вводимый в суточной дозировке от 0,05 мг до 2 мг;
- аторвастатин, вводимый в суточной дозировке от 2 мг до 100 мг;
- симвастатин, вводимый в суточной дозировке от 2 мг до 100 мг;
- питавастатин, вводимый в суточной дозировке от 0,2 мг до 100 мг;
- розувастатин, вводимый в суточной дозировке от 2 мг до 100 мг;
- флувастатин, вводимый в суточной дозировке от 2 мг до 100 мг;
- ловастатин, вводимый в суточной дозировке от 2 мг до 100 мг; или
- правастатин, вводимый в суточной дозировке от 2 мг до 100 мг.
20. Изделие, содержащее
(a) упаковочный материал;
(b) антитело или его антигенсвязывающий фрагмент, которые специфично связывают hPCSK9; и
(c) ярлык или вкладыш в упаковку, находящиеся в упаковочном материале, на которых указано, что пациентов, которым проводят лечение указанным антителом или антигенсвязывающим фрагментом, можно лечить от заболевания или состояния, выбранного из группы, состоящей из гиперхолестеринемии, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний, и, кроме того, указано, что можно лечить индивидуумов, относящихся к одной или нескольким группам индивидуумов, как указано в аспекте 1.
21. Изделие, содержащее
(a) упаковочный материал;
(b) антитело или его антигенсвязывающий фрагмент, которые специфично связывают hPCSK9; и
(c) ярлык или вкладыш в упаковку, находящиеся в упаковочном материале, на которых указано, что пациентов, которым проводят лечение указанным антителом или антигенсвязывающим фрагментом, можно лечить от заболевания или состояния, выбранного из группы, состоящей из гиперхолестеринемии, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний, и, кроме того, указано, что лечение пациентов указанным антителом или его антигенсвязывающим фрагментом противопоказано для пациентов, относящихся к одной или нескольким группам индивидуумов, как указано в аспекте 2.
22. Изделие согласно аспекту 20 или 21, где антитело или антигенсвязывающий фрагмент представляет собой антитело или антигенсвязывающий фрагмент, как указано в любом из аспектов 3-19.
23. Изделие согласно любому из аспектов 20-22, где ярлык или вкладыш в упаковку содержат указание на способ лечения согласно любому из аспектов 1, 2 или 5-19.
24. Способ исследования эффективности антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9, для лечения заболевания или состояния, выбранного из группы, состоящей из гиперхолестеринемии, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний, причем указанный способ включает:
лечение выбранной группы пациентов указанным антителом или его антигенсвязывающим фрагментом, где каждый пациент в указанной группе имеет уровень холестерина LDL (LDL-C) более 100 мг/дл; и
определение эффективности указанного антитела или его антигенсвязывающего фрагмента путем определения уровня LDL-C в группе пациентов до и после введения указанного антитела или его антигенсвязывающего фрагмента, где снижение уровня LDL-C по меньшей мере на 25% относительно уровня до введения дозы по меньшей мере у 75% группы пациентов указывает на то, что указанные антитело или его антигенсвязывающий фрагмент являются эффективными для лечения указанного заболевания или состояния в указанной группе пациентов;
где каждый пациент относится к одной или нескольким группам индивидуумов, указанным в аспекте 1.
25. Способ исследования эффективности антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9, для лечения заболевания или состояния, выбранного из группы, состоящей из гиперхолестеринемии, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний, причем указанный способ включает:
определение эффективности антитела или его антигенсвязывающего фрагмента, которые используют для лечения выбранной группы пациентов указанным антителом или его антигенсвязывающим фрагментом, где каждый пациент в указанной группе имеет уровень холестерина LDL (LDL-C) более 100 мг/дл, путем определения уровня LDL-C в группе пациентов до и после введения указанного антитела или его антигенсвязывающего фрагмента, где снижение уровня LDL-C по меньшей мере на 25% относительно уровня до введения дозы по меньшей мере у 75% группы пациентов указывает на то, что указанные антитело или его антигенсвязывающий фрагмент являются эффективными для лечения указанного заболевания или состояния в указанной группе пациентов;
где каждый пациент относится к одной или нескольким группам индивидуумов, как указано в аспекте 1.
26. Способ согласно аспекту 25, где каждому пациенту в указанной группе проводили снижающее уровень липидов лечение путем введения статина в течение по меньшей мере 6 недель до лечения указанным антителом или его антигенсвязывающим фрагментом.
27. Способ согласно любому из аспектов 24-26, где антитело или антигенсвязывающий фрагмент представляют собой антитело или антигенсвязывающий фрагмент, как указано в любом из аспектов 3-19.
28. Способ согласно любом из аспектов 24-27, где выбранную группу пациентов лечат или лечили способом лечения согласно любому из аспектов 1, 2 или 5-19.
29. Способ исследования эффективности соединения в отношении снижения уровней холестерина у индивидуума, включающий стадии:
(a) предоставление животного отряда грызунов;
(b) введение антитела или его антигенсвязывающего фрагмента, которые специфично связывают PCSK9, животному отряда грызунов;
(c) введение исследуемого соединения указанному животному отряда грызунов;
(d) определение эффекта исследуемого соединения у животного отряда грызунов, где снижение уровня холестерина у животного отряда грызунов по сравнению с уровнем холестерина у контрольного животного указывает на то, что исследуемое соединение является эффективным в отношении снижения уровней холестерина у индивидуума, где контрольное животное представляет собой животное того же вида, что и указанное животное отряда грызунов, и где контрольному животному не вводили исследуемое соединение.
АСПЕКТЫ, ОТНОСЯЩИЕСЯ ГРУППАМ ПАЦИЕНТОВ - B)
1. Способ лечения индивидуума, страдающего заболеванием или нарушением, характеризующимся повышенными уровнями холестерина липопротеинов низкой плотности (LDL-C), причем способ включает:
(a) выбор индивидуума с уровнем LDL-C в крови более 100 мг/дл; и
(b) введение указанному индивидууму композиции, содержащей антитело или его антигенсвязывающий фрагмент, которые специфично связываются с конвертазой пробелков типа субтилизина/кексина человека 9 (hPCSK9); тем самым, снижая уровни холестерина у индивидуума, нуждающегося в этом.
2. Способ согласно аспекту 1, где заболевание или состояние выбраны из группы, состоящей из: гиперхолестеринемии, гиперлипидемии, дислипидемии и атеросклероза.
3. Способ согласно аспекту 1, где заболевание или состояние представляет собой первичную гиперхолестеринемию или семейную гиперхолестеринемию.
4. Способ согласно аспекту 1, где заболевание или состояние представляет собой гиперхолестеринемию, не контролируемую статинами.
5. Способ согласно аспекту 1, где индивидуум имеет индекс массы тела (BMI) менее 18 кг/м2 или более 40 кг/м2.
6. Способ согласно аспекту 1, где индивидуума ранее не инструктировали в отношении диеты, снижающей уровень холестерина.
7. Способ согласно аспекту 1, где индивидуум ранее принимал снижающее уровень холестерина лекарственное средство, за исключением аторвастатина.
8. Способ согласно аспекту 7, где аторвастатин вводили в дозе приблизительно 10 мг в сутки.
9. Способ согласно аспекту 7, где снижающее уровень холестерина лекарственное средство выбрано из группы, состоящей из фибратов, секвестрантов желчных кислот, ниацина, блокаторов всасывания холестерина в кишечнике (ICA) и омега-3 жирных кислот.
10. Способ согласно аспекту 9, где ниацин вводят в дозе более 500 мг в сутки.
11. Способ согласно аспекту 9, где омега-3 жирные кислоты вводят в дозе более 1000 мг в сутки.
12. Способ согласно аспекту 1, где индивидуум не страдает диабетом.
13. Способ согласно аспекту 12, где диабет представляет собой диабет 1 типа.
14. Способ согласно аспекту 12, где диабет представляет собой диабет 2 типа.
15. Способ согласно аспекту 12, где диабет 2 типа лечат инсулином.
16. Способ согласно аспекту 12, где индивидуум имеет концентрацию гликированного гемоглобина в крови, превышающую или равную 8,5%.
17. Способ согласно аспекту 1, где индивидуум является отрицательным по поверхностному антигену гепатита B и C.
18. Способ согласно аспекту 1, где индивидуум имеет концентрацию триглицеридов в крови более 350 мг/дл.
19. Способ согласно аспекту 1, где индивидуум имеет менее 1500 нейтрофилов на кубический мм крови.
20. Способ согласно аспекту 1, где индивидуум имеет менее 100000 тромбоцитов на кубический мм крови.
21. Способ согласно аспекту 1, где индивидуумом является женщина.
22. Способ согласно аспекту 21, где индивидуум не является беременной женщиной.
23. Способ согласно аспекту 1, где индивидуум имеет концентрацию тиреостимулирующего гормона в крови, которая находится выше нижней границы нормы и ниже верхней границы нормы.
24. Способ согласно аспекту 23, где индивидуум имеет креатинин в сыворотке, менее чем в 1,4 раза превышающий верхнюю границу нормы.
25. Способ согласно аспекту 1, где индивидуумом является мужчина.
26. Способ согласно аспекту 25, где индивидуум имеет креатинин в сыворотке, менее чем в 1,5 раза превышающий верхнюю границу нормы.
27. Способ согласно аспекту 1, где индивидуум имеет количество аспартаттрансаминазы, которое менее чем в два раза превышает верхнюю границу нормы.
28. Способ согласно аспекту 1, где индивидуум имеет количество аланинтрансаминазы, которое менее чем в два раза превышает верхнюю границу нормы.
29. Способ согласно аспекту 1, где антитело или антигенсвязывающий фрагмент вводят в дозировке в диапазоне от приблизительно 5 мг до приблизительно 500 мг.
30. Способ согласно аспекту 29, где антитело или антигенсвязывающий фрагмент вводят в дозировке в диапазоне от приблизительно 50 мг до приблизительно 300 мг.
31. Способ согласно аспекту 29, где антитело вводят в дозировке от 200 до 300 мг раз в четыре недели.
32. Способ согласно аспекту 29, где антитело или антигенсвязывающий фрагмент вводят в дозировке приблизительно 150 мг.
33. Способ согласно аспекту 1, где антитело или его антигенсвязывающий фрагмент вводят индивидууму раз в две недели (E2W).
34. Способ согласно аспекту 1, где антитело или его антигенсвязывающий фрагмент вводят индивидууму раз в четыре недели (E4W).
35. Способ согласно аспекту 1, где антитело или антигенсвязывающий фрагмент содержат CDR тяжелой и легкой цепей пары аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
36. Способ согласно аспекту 1, где антитело или антигенсвязывающий фрагмент содержат пару аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
37. Способ согласно аспекту 1, где антитело или его антигенсвязывающий фрагмент конкурируют за связывание hPCSK9 с антителом или антигенсвязывающим фрагментом, содержащими пару аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
38. Способ согласно аспекту 1, где антитело вводят подкожно.
39. Способ согласно аспекту 38, где антитело вводят в брюшную полость.
40. Способ согласно аспекту 1, кроме того, включающий введение индивидууму ингибитора HMG-CoA-редуктазы.
41. Способ согласно аспекту 40, где ингибитор HMG-CoA-редуктазы вводят в дозировке в диапазоне приблизительно от 0,05 мг до 100 мг.
42. Способ согласно аспекту 41, где ингибитором HMG-CoA-редуктазы является статин.
43. Способ согласно аспекту 42, где статин выбран из группы, состоящей из церивастатина, аторвастатина, симвастатина, питавастатина, розувастатина, флувастатина, ловастатина и правастатина.
44. Способ согласно аспекту 42, где статин представляет собой аторвастатин, вводимый в дозировке 10 мг или 80 мг.
45. Способ согласно аспекту 44, где аторвастатин вводят в количестве приблизительно 10 мг в сутки и 80 мг один день в период 8 недель.
46. Способ снижения уровней холестерина у индивидуума, нуждающегося в этом, включающий:
(a) выбор индивидуума с уровнем холестерина липопротеинов низкой плотности холестерина (LDL-C) в крови более 100 мг/дл; и
(b) введение указанному индивидууму композиции, содержащей антитело или его антигенсвязывающий фрагмент, которые специфично связываются с конвертазой пробелков типа субтилизина/кексина человека 9 (hPCSK9); тем самым, снижая уровни холестерина у индивидуума, нуждающегося в этом.
47. Способ согласно аспекту 46, где заболевание или состояние выбраны из группы, состоящей из: гиперхолестеринемии, гиперлипидемии, дислипидемии и атеросклероза.
48. Способ согласно аспекту 46, где заболевание или состояние представляют собой первичную гиперхолестеринемию или семейную гиперхолестеринемию.
49. Способ согласно аспекту 46, где заболевание или состояние представляют собой гиперхолестеринемию, не контролируемую статинами.
50. Способ согласно аспекту 46, где индивидуум имеет индекс массы тела (BMI) менее 18 кг/м2 или более 40 кг/м2.
51. Способ согласно аспекту 46, где индивидуума ранее не инструктировали в отношении диеты, снижающей уровень холестерина.
52. Способ согласно аспекту 46, где индивидуум ранее не принимал лекарственное средство, снижающее уровень холестерина, за исключением аторвастатина.
53. Способ согласно аспекту 52, где аторвастатин вводили в дозе приблизительно 10 мг в сутки.
54. Способ согласно аспекту 52, где снижающее уровень холестерина лекарственное средство выбрано из группы, состоящей из фибратов, секвестрантов желчных кислот, ниацина, блокаторов всасывания холестерина в кишечнике (ICA) и омега-3 жирных кислот.
55. Способ согласно аспекту 54, где ниацин вводят в дозе более 500 мг в сутки.
56. Способ согласно аспекту 54, где омега-3 жирные кислоты вводят в дозе более 1000 мг в сутки.
57. Способ согласно аспекту 46, где индивидуум не страдает диабетом.
58. Способ согласно аспекту 57, где диабет представляет собой диабет 1 типа.
59. Способ согласно аспекту 57, где диабет представляет собой диабет 2 типа.
60. Способ согласно аспекту 57, где диабет 2 типа лечат инсулином.
61. Способ согласно аспекту 57, где индивидуум имеет концентрацию гликированного гемоглобина в крови, превышающую или равную 8,5%.
62. Способ согласно аспекту 46, где индивидуум является отрицательным по поверхностному антигену гепатита B и C.
63. Способ согласно аспекту 46, где индивидуум имеет концентрацию триглицеридов в крови более 350 мг/дл.
64. Способ согласно аспекту 46, где индивидуум имеет менее 1500 нейтрофилов на кубический мм крови.
65. Способ согласно аспекту 46, где индивидуум имеет менее 100000 тромбоцитов на кубический мм крови.
66. Способ согласно аспекту 46, где индивидуумом является женщина.
67. Способ согласно аспекту 66, где индивидуумом не является беременная женщина.
68. Способ согласно аспекту 46, где индивидуум имеет концентрацию тиреостимулирующего гормона в крови, превышающую нижнюю границу нормы и находящуюся ниже верхней границы нормы.
69. Способ согласно аспекту 68, где индивидуум имеет креатинин в сыворотке, менее чем в 1,4 раза превышающий верхнюю границу нормы.
70. Способ согласно аспекту 46, где индивидуумом является мужчина.
71. Способ согласно аспекту 70, где индивидуум имеет уровень креатинина в сыворотке, менее чем в 1,5 раза превышающий верхнюю границу нормы.
72. Способ согласно аспекту 46, где индивидуум имеет количество аспартаттрансаминазы, которое менее чем в два раза превышает верхнюю границу нормы.
73. Способ согласно аспекту 46, где индивидуум имеет количество аланинтрансаминазы, которое менее чем в два раза превышает верхнюю границу нормы.
74. Способ согласно аспекту 46, где антитело или антигенсвязывающий фрагмент вводят в дозировке в диапазоне от приблизительно 5 мг до приблизительно 500 мг.
75. Способ согласно аспекту 74, где антитело или антигенсвязывающий фрагмент вводят в дозировке в диапазоне от приблизительно 50 мг до приблизительно 300 мг.
76. Способ согласно аспекту 74, где антитело вводят в дозировке 200 и 300 мг раз в четыре недели.
77. Способ согласно аспекту 74, где антитело или антигенсвязывающий фрагмент вводят в дозировке приблизительно 150 мг.
78. Способ согласно аспекту 46, где антитело или его антигенсвязывающий фрагмент вводят индивидууму раз в две недели (E2W).
79. Способ согласно аспекту 46, где антитело или его антигенсвязывающий фрагмент вводят индивидууму раз в четыре недели (E4W).
80. Способ согласно аспекту 46, где антитело или антигенсвязывающий фрагмент содержат CDR тяжелой и легкой цепей из пары аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
81. Способ согласно аспекту 46, где антитело или антигенсвязывающий фрагмент содержат пару аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
82. Способ согласно аспекту 46, где антитело или его антигенсвязывающий фрагмент конкурируют за связывание hPCSK9 с антителом или антигенсвязывающим фрагментом, содержащими пару аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
83. Способ согласно аспекту 46, где антитело вводят подкожно.
84. Способ согласно аспекту 38, где антитело вводят в брюшную полость.
85. Способ согласно аспекту 46, дополнительно включающий введение индивидууму ингибитора HMG-CoA-редуктазы.
86. Способ согласно аспекту 85, где ингибитор HMG-CoA-редуктазы вводят в дозировке в диапазоне приблизительно от 0,05 мг до 100 мг.
87. Способ согласно аспекту 86, где ингибитор HMG-CoA-редуктазы представляет собой статин.
88. Способ согласно аспекту 87, где статин выбран из группы, состоящей из церивастатина, аторвастатина, симвастатина, питавастатина, розувастатина, флувастатина, ловастатина и правастатина.
89. Способ согласно аспекту 88, где статин представляет собой аторвастатин, вводимый в дозировке 10 мг или 80 мг.
90. Способ согласно аспекту 89, где аторвастатин вводят в количестве приблизительно 10 мг в сутки и 80 мг одни сутки в период 8 недель.
АСПЕКТЫ, ОТНОСЯЩИЕСЯ К РЕЖИМАМ ДОЗИРОВАНИЯ- A)
1. Способ лечения заболевания или состояния, в которые вовлечена экспрессия или активность PCSK9, включающий:
- введение терапевтического количества антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9), индивидууму, нуждающемуся в этом, где антитело или его антигенсвязывающий фрагмент вводят в дозировке в диапазоне от 5 мг до 500 мг, и
- введение терапевтического количества ингибитора HMG-CoA-редуктазы указанному индивидууму, где ингибитор HMG-CoA-редуктазы вводят в дозировке в диапазоне от 0,05 мг до 100 мг.
2. Антитело или его антигенсвязывающий фрагмент, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9) для применения при лечении заболевания или состояния, в которые вовлечена экспрессия или активность PCSK9,
где антитело или его антигенсвязывающий фрагмент предназначены для введения в дозировке в диапазоне от 5 мг до 500 мг,
где антитело или его антигенсвязывающий фрагмент, кроме того, предназначены для введения в комбинации с ингибитором HMG-CoA-редуктазы в дозировке в диапазоне от 0,05 мг до 100 мг.
3. Способ согласно аспекту 1 или антитело согласно 2, где заболевание или состояние, в которые вовлечена экспрессия или активность PCSK9, смягчаются, улучшаются, ингибируются или предупреждаются с помощью антагониста PCSK9.
4. Способ или антитело согласно любому из аспектов 1-3, где заболевание или состояние, в которые вовлечена экспрессия или активность PCSK9, выбраны из группы, состоящей из:
гиперхолестеринемии, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний.
5. Способ или антитело согласно любому из аспектов 1-4, где индивидуумом, нуждающимся в этом, является индивидуум, для которого показан аферез LDL, индивидуум с активирующими PCSK9 мутациями, индивидуум с гетерозиготной семейной гиперхолестеринемией, индивидуум с первичной гиперхолестеринемией, не контролируемой статинами, индивидуум с риском развития гиперхолестеринемии, индивидуум с гиперхолестеринемией, гиперлипидемией, дислипидемией, атеросклерозом или сердечно-сосудистыми заболеваниями.
6. Способ или антитело согласно любому из аспектов 1-5, где ингибитор HMG-CoA-редуктазы вводят три раза в сутки, два раза в сутки или один раз в сутки.
7. Способ или антитело согласно любому из аспектов 1-6, где ингибитор HMG-CoA-редуктазы вводят раз в сутки, раз в двое суток, раз в трое суток, раз в четверо суток, раз в пять суток или раз в шесть суток.
8. Способ или антитело согласно любому из аспектов 1-6, где ингибитор HMG-CoA-редуктазы вводят раз в неделю, раз в две недели, раз в три недели или раз в четыре недели.
9. Способ или антитело согласно любому из аспектов 1-8, где ингибитор HMG-CoA-редуктазы вводят утром, днем или вечером.
10. Способ или антитело согласно любому из аспектов 1-9, где ингибитор HMG-CoA-редуктазы представляет собой статин.
11. Способ или антитело согласно аспекту 10, где статин выбран из группы, состоящей из церивастатина, аторвастатина, симвастатина, питавастатина, розувастатина, флувастатина, ловастатина и правастатина.
12. Способ или антитело согласно аспекту 11, где статин представляет собой
- церивастатин, вводимый в суточной дозировке от 0,05 мг до 2 мг;
- аторвастатин, вводимый в суточной дозировке от 2 мг до 100 мг;
- симвастатин, вводимый в суточной дозировке от 2 мг до 100 мг;
- питавастатин, вводимый в суточной дозировке от 0,2 мг до 100 мг;
- розувастатин, вводимый в суточной дозировке от 2 мг до 100 мг;
- флувастатин, вводимый в суточной дозировке от 2 мг до 100 мг;
- ловастатин, вводимый в суточной дозировке от 2 мг до 100 мг; или
- правастатин, вводимый в суточной дозировке от 2 мг до 100 мг;
13. Способ или антитело согласно любому из аспектов 1-12, где антитело или его антигенсвязывающий фрагмент вводят индивидууму раз в две недели.
14. Способ или антитело согласно любому из аспектов 1-13, где антитело или его антигенсвязывающий фрагмент вводят в дозировке в диапазоне от 50 мг до 300 мг.
15. Способ или антитело согласно любому из аспектов 1-14, где антитело или его антигенсвязывающий фрагмент представляют собой рекомбинантное антитело человека или его фрагмент.
16. Способ или антитело согласно любому из аспектов 1-15, где антитело или его антигенсвязывающий фрагмент характеризуются одним или несколькими из следующих:
(i) способны снижать уровень общего холестерина в сыворотке на по меньшей мере от приблизительно 25 до приблизительно 35% и сохранять снижение на протяжении периода по меньшей мере 24 суток относительно уровня до введения дозы;
(ii) способны снижать уровень холестерина LDL в сыворотке по меньшей мере приблизительно на 65-80% и сохранять снижение на протяжении периода по меньшей мере 24 суток относительно уровня до введения дозы;
(iii) способны снижать уровень триглицеридов в сыворотке по меньшей мере приблизительно на 25-40% относительно уровня до введения дозы;
(iv) достигают одного или нескольких из (i)-(iii) без снижения уровня холестерина HDL в сыворотке или со снижением уровня холестерина HDL не более чем на 5% относительно уровня до введения дозы;
(v) достигают одного или нескольких из (i)-(iii) с небольшим или отсутствием поддающегося измерению эффекта на функцию печени, при определении по результатам измерения ALT и AST.
17. Способ или антитело согласно любому из аспектов 1-16, где антитело или его антигенсвязывающий фрагмент содержат
- домен CDR3 тяжелой цепи (HCDR3), выбранный из группы, состоящей из SEQ ID NO: 8, 32, 56, 80, 104, 128, 152, 176, 200, 224, 248, 272, 296, 320, 344, 368, 392, 416, 440, 464, 488, 512, 536, 560, 584, 608, 632, 656, 680, 704 и 728; и
- домен CDR3 легкой цепи (LCDR3), выбранный из группы, состоящей из SEQ ID NO: 16, 40, 64, 88, 112, 136, 160, 184, 208, 232, 256, 280, 304, 328, 352, 376, 400, 424, 448, 472, 496, 520, 544, 568, 592, 616, 639, 664, 688, 712 и 736.
18. Способ или антитело согласно любому из аспектов 1-16, где антитело или его антигенсвязывающий фрагмент содержат CDR тяжелой и легкой цепей из пары аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
19. Способ или антитело согласно аспекту 18, где антитело или его антигенсвязывающий фрагмент содержат аминокислотные последовательности CDR тяжелой и легкой цепей, как показано в SEQ ID NO: 76, 78, 80, 84, 86 и 88.
20. Способ или антитело согласно аспекту 19, где антитело или его антигенсвязывающий фрагмент содержат аминокислотную последовательность HCVR, как показано в SEQ ID NO: 90, и аминокислотную последовательность LCVR, как показано в SEQ ID NO: 92.
21. Способ или антитело согласно любому из аспектов 1-16, где антитело или его антигенсвязывающий фрагмент связываются с тем же эпитопом на hPCSK9, что и антитело, содержащее аминокислотные последовательности CDR тяжелой и легкой цепей, как показано в SEQ ID NO: 76, 78, 80, 84, 86 и 88.
22. Способ или антитело согласно любому из аспектов 1-16, где антитело или его антигенсвязывающий фрагмент конкурируют за связывание hPCSK9 с антителом, содержащим аминокислотные последовательности CDR тяжелой и легкой цепей, как показано в SEQ ID NO: 76, 78, 80, 84, 86 и 88.
23. Изделие, содержащее
(a) упаковочный материал;
(b) антитело или его антигенсвязывающий фрагмент, которые специфично связывают hPCSK9; и
(c) ярлык или вкладыш в упаковку, находящиеся в упаковочном материале, на которых указано, что пациентов, которым проводят лечение указанным антителом или антигенсвязывающим фрагментом, можно лечить от заболевания или состояния, выбранного из группы, состоящей из гиперхолестеринемии, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний.
24. Изделие, содержащее
(a) упаковочный материал;
(b) антитело или его антигенсвязывающий фрагмент, которые специфично связывают hPCSK9; и
(c) ярлык или вкладыш в упаковку, находящиеся в упаковочном материале, на которых указана информация о лечении пациентов антителом или его антигенсвязывающим фрагментом совместно с применением статина.
25. Изделие, содержащее
(a) упаковочный материал;
(b) антитело или его антигенсвязывающий фрагмент, которые специфично связывают hPCSK9; и
(c) ярлык или вкладыш в упаковку, на которых указано, что лечение антителом или его антигенсвязывающим фрагментом вместе со статином противопоказано для пациентов, относящихся к одной или нескольким из следующих групп:
(i) курильщики;
(ii) лица в возрасте 70 лет и старше;
(iii) лица, страдающие гипертензией;
(iv) беременные женщины;
(v) женщины, пытающиеся забеременеть;
(vi) женщины, кормящие грудью;
(vii) лица, которые имеют или когда-либо имели заболевание, поражающее печень;
(viii) лица, которые имели какие-либо необъясненные аномальные показатели функции печени в тестах крови;
(ix) лица, которые употребляют чрезмерные количества спиртных напитков;
(x) лица, имеющие проблемы с почками;
(xi) лица, страдающие гипотиреозом;
(xii) лица, страдающие мышечными нарушениями;
(xiii) лица, ранее сталкивавшиеся с мышечными проблемами в ходе лечения снижающей уровень липидов терапией;
(xiv) лица, имеющие серьезные проблемы с дыханием;
(xv) лица, принимающие одно или несколько из следующих лекарственных средств: лекарственные средства, изменяющие работу иммунной системы (например, циклоспорин или антигистамины), антибиотики или противогрибковые средства (например, эритромицин, кларитромицин, кетоконазол, итраконазол, рифампицин, фусидовая кислота), лекарственные средства, регулирующие уровень липидов (например, гемфиброзил, колестипол), блокаторы кальциевых каналов (например, верапамил, дилтиазем), лекарственные средства, регулирующие сердечный ритм (дигоксин, амиодарон), ингибиторы протеаз, используемые при лечении ВИЧ (например, нельфинавир), варфарин, пероральные контрацептивы, антациды или зверобой; или
(xvi) лица, выпивающие более 0,1 л грейпфрутового сока в сутки;
(xvii) лица, имеющие индекс массы тела (BMI) более 40;
(xviii) лица, имеющие индекс массы тела (BMI) менее 18;
(xix) лица, страдающие диабетом 1 типа или диабетом 2 типа;
(xx) лица, положительные по гепатиту B или гепатиту C; или
(xxi) лица, имеющие известную чувствительность к лекарственным средствам на основе моноклональных антител.
26. Изделие согласно одному из аспектов 23-25, где антитело или антигенсвязывающий фрагмент представляют собой антитело или антигенсвязывающий фрагмент, как указано в любом из аспектов 2-22.
27. Изделие согласно одному из аспектов 23-26, где ярлык или вкладыш в упаковку содержат указание способа лечения в соответствии с любым из аспектов 1 или 3-22.
28. Способ исследования эффективности антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9, для лечения заболевания или состояния, выбранного из группы, состоящей из гиперхолестеринемии, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний, причем указанный способ включает:
лечение выбранной группы пациентов указанным антителом или его антигенсвязывающим фрагментом, где каждый пациент в указанной группе имеет уровень холестерина LDL (LDL-C) более 100 мг/дл; и
определение эффективности указанного антитела или его антигенсвязывающего фрагмента путем определения уровня LDL-C в группе пациентов до и после введения указанного антитела или его антигенсвязывающего фрагмента, где снижение уровня LDL-C по меньшей мере на 25% относительно уровня до введения дозы по меньшей мере у 75% группы пациентов указывает на то, что указанные антитело или его антигенсвязывающий фрагмент являются эффективными для лечения указанного заболевания или состояния в указанной группе пациентов.
29. Способ исследования эффективности антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9, для лечения заболевания или состояния, выбранного из группы, состоящей из гиперхолестеринемии, гиперлипидемии, дислипидемии, атеросклероза и сердечно-сосудистых заболеваний, причем указанный способ включает:
определение эффективности антитела или его антигенсвязывающего фрагмента, которые используют для лечения выбранной группы пациентов указанным антителом или его антигенсвязывающим фрагментом, где каждый пациент в указанной группе имеет уровень холестерина LDL (LDL-C) более 100 мг/дл, путем определения уровня LDL-C в группе пациентов до и после введения указанного антитела или его антигенсвязывающего фрагмента, где снижение уровня LDL-C по меньшей мере на 25% относительно уровня до введения дозы по меньшей мере у 75% группы пациентов указывает на то, что указанные антитело или его антигенсвязывающий фрагмент являются эффективными для лечения указанного заболевания или состояния в указанной группе пациентов.
30. Способ согласно аспекту 28 или 29, где каждому пациенту в указанной популяции проводили снижающее уровень липидов лечение путем введения статина в течение по меньшей мере 6 недель перед лечением указанным антителом или его антигенсвязывающим фрагментом.
31. Способ согласно любому из аспектов 28-30, где антитело или антигенсвязывающий фрагмент представляют собой антитело или антигенсвязывающий фрагмент, как указано в любом из аспектов 2-22.
32. Способ согласно любому из аспектов 28-31, где выбранную группу пациентов лечат способом лечения согласно любому из аспектов 1 или 3-22.
33. Упаковка, содержащая антитело или его антигенсвязывающий фрагмент согласно одному или нескольким из аспектов 2-22 и ярлык, причем указанный ярлык содержит напечатанное сообщение, которое информирует пациента, что лечение антителом вместе со статином показано при одном или нескольких показаниях аспекта 4.
34. Упаковка, содержащая антитело или его антигенсвязывающий фрагмент согласно одному или нескольким из аспектов 2-22 и ярлык, причем указанный ярлык содержит напечатанное сообщение, которое информирует пациента, что лечение антителом вместе со статином противопоказано для пациентов, относящихся к одной или нескольким из следующих групп:
(i) курильщики;
(ii) лица в возрасте 70 лет и старше;
(iii) лица, страдающие гипертензией;
(iv) беременные женщины;
(v) женщины, пытающиеся забеременеть;
(vi) женщины, кормящие грудью;
(vii) лица, которые имеют или когда-либо имели заболевание, поражающее печень;
(viii) лица, которые имели какие-либо необъясненные аномальные показатели функции печени в тестах крови;
(ix) лица, которые употребляют чрезмерные количества спиртных напитков;
(x) лица, имеющие проблемы с почками;
(xi) лица, страдающие гипотиреозом;
(xii) лица, страдающие мышечными нарушениями;
(xiii) лица, ранее сталкивавшиеся с мышечными проблемами в ходе лечения снижающей уровень липидов терапией;
(xiv) лица, имеющие серьезные проблемы с дыханием;
(xv) лица, принимающие одно или несколько из следующих лекарственных средств: лекарственные средства, изменяющие работу иммунной системы (например, циклоспорин или антигистамины), антибиотики или противогрибковые средства (например, эритромицин, кларитромицин, кетоконазол, итраконазол, рифампицин, фусидовая кислота), лекарственные средства, регулирующие уровень липидов (например, гемфиброзил, колестипол), блокаторы кальциевых каналов (например, верапамил, дилтиазем), лекарственные средства, регулирующие сердечный ритм (дигоксин, амиодарон), ингибиторы протеаз, используемые при лечении ВИЧ (например, нельфинавир), варфарин, пероральные контрацептивы, антациды или Зверобой; или
(xvi) лица, выпивающие более 0,1 л грейпфрутового сока в сутки;
(xvii) лица, имеющие индекс массы тела (BMI) более 40;
(xviii) лица, имеющие индекс массы тела (BMI) менее 18;
(xix) лица, страдающие диабетом 1 типа или диабетом 2 типа;
(xx) лица, положительные по гепатиту B или гепатиту C; или
(xxi) лица, имеющие известную чувствительность к лекарственным средствам на основе моноклональных антител.
35. Способ регуляции уровня LDL в крови, включающий:
- введение терапевтического количества антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9), индивидууму, нуждающемуся в этом, где антитело или его антигенсвязывающий фрагмент вводят в дозировке в диапазоне от 5 мг до 500 мг, и
- введение терапевтического количества ингибитора HMG-CoA-редуктазы указанному индивидууму, где ингибитор HMG-CoA-редуктазы вводят в дозировке в диапазоне от 0,05 мг до 100 мг.
36. Способ предупреждения эффектов (устойчиво) повышенного уровня LDL в крови, включающий:
- введение терапевтического количества антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9), индивидууму, нуждающемуся в этом, где антитело или его антигенсвязывающий фрагмент вводят в дозировке в диапазоне от 5 мг до 500 мг, и
- введение терапевтического количества ингибитора HMG-CoA-редуктазы указанному индивидууму, где ингибитор HMG-CoA-редуктазы вводят в дозировке в диапазоне от 0,05 мг до 100 мг.
37. Способ определения того, является ли фармацевтическое соединение пригодным для смягчения, улучшения, ингибирования или предупреждения заболевания или состояния, в которые вовлечена активность или экспрессия PCSK9, включающий
(a) введение индивидууму соединения, которое специфично связывается с PCSK9, предпочтительно, антитела или его антигенсвязывающего фрагмента, специфично связывающихся с PCSK9, и
(b) определение того, какая часть PCSK9 в крови связана с соединением согласно (a).
АСПЕКТЫ, ОТНОСЯЩИЕСЯ К РЕЖИМАМ ДОЗИРОВАНИЯ- B)
1. Способ лечения индивидуума, страдающего заболеванием или нарушением, характеризующимся повышенными уровнями холестерина липопротеинов низкой плотности (LDL-C), причем способ включает введение индивидууму: (1) антитела или его антигенсвязывающего фрагмента, которые специфично связываются с конвертазой пробелков типа субтилизина/кексина человека 9 (hPCSK9); и (2) ингибитора HMG-CoA-редуктазы, где антитело или его антигенсвязывающий фрагмент вводят в дозировке в диапазоне от приблизительно 5 мг до приблизительно 500 мг, тем самым, осуществляя лечение индивидуума.
2. Способ согласно аспекту 1, где заболевание или состояние выбраны из группы, состоящей из: гиперхолестеринемии, гиперлипидемии, дислипидемии и атеросклероза.
3. Способ согласно аспекту 1, где заболевание или состояние представляет собой первичную гиперхолестеринемию или семейную гиперхолестеринемию.
4. Способ согласно аспекту 1, где заболевание или состояние представляет собой гиперхолестеринемию, не контролируемую статинами.
5. Способ согласно аспекту 1, где антитело или антигенсвязывающий фрагмент вводят в дозировке в диапазоне от приблизительно 50 мг до приблизительно 300 мг.
6. Способ согласно аспекту 1, где антитело или антигенсвязывающий фрагмент вводят в дозировке приблизительно 150 мг.
7. Способ согласно аспекту 1, где антитело или его антигенсвязывающий фрагмент вводят индивидууму раз в две недели (E2W).
8. Способ согласно аспекту 1, где антитело или его антигенсвязывающий фрагмент вводят индивидууму раз в четыре недели (E4W).
9. Способ согласно аспекту 1, где лечение снижает уровень общего холестерина в сыворотке на по меньшей мере от приблизительно 25% до приблизительно 35% относительно уровня до введения дозы и сохраняет снижение на протяжении периода по меньшей мере 24 суток.
10. Способ согласно аспекту 1, где лечение снижает уровень общего холестерина в сыворотке на по меньшей мере от приблизительно 65% до приблизительно 80% относительно уровня до введения дозы и сохраняет снижение на протяжении периода по меньшей мере 24 суток.
11. Способ согласно аспекту 1, где лечение снижает уровни триглицеридов в сыворотке на по меньшей мере от приблизительно 25% до приблизительно 40% относительно уровня до введения дозы.
12. Способ согласно аспекту 1, где лечение снижает уровень холестерина HDL в сыворотке не более чем на 5% относительно уровня до введения дозы.
13. Способ согласно аспекту 1, где лечение имеет небольшой или отсутствие поддающегося измерению эффекта на функцию печени, при определении по результатам измерения ALT и AST.
14. Способ согласно аспекту 1, где антитело или антигенсвязывающий фрагмент содержат CDR тяжелой и легкой цепей из пары аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
15. Способ согласно аспекту 1, где антитело или антигенсвязывающий фрагмент содержат пару аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
16. Способ согласно аспекту 1, где антитело или его антигенсвязывающий фрагмент конкурируют за связывание hPCSK9 с антителом или антигенсвязывающим фрагментом, содержащими пару аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
17. Способ согласно аспекту 1, где ингибитор HMG-CoA-редуктазы вводят в дозировке в диапазоне приблизительно от 0,05 мг до 100 мг.
18. Способ согласно аспекту 1, где ингибитор HMG-CoA-редуктазы представляет собой статин.
19. Способ согласно аспекту 1, где статин выбран из группы, состоящей из церивастатина, аторвастатина, симвастатина, питавастатина, розувастатина, флувастатина, ловастатина и правастатина.
20. Способ согласно аспекту 1, где статин представляет собой аторвастатин, вводимый в дозировке 10 мг или 80 мг.
21. Способ усиления активности снижения LDL-C у индивидуума, подвергающегося терапии статинами, причем способ включает введение индивидууму антитела, или его антигенсвязывающего фрагмента, которые специфично связываются с конвертазой пробелков типа субтилизина/кексина человека 9 (hPCSK9), где антитело или его антигенсвязывающий фрагмент вводят в дозировке в диапазоне от приблизительно 5 мг до приблизительно 500 мг, тем самым, усиливая активность терапии статином в отношении снижения LCL-C у индивидуума.
22. Способ согласно аспекту 21, где индивидуум является устойчивым к терапии статинами перед введением антитела.
23. Способ согласно аспекту 21, где индивид страдает заболеванием или состоянием, выбранным из группы, состоящей из гиперхолестеринемии, гиперлипидемии, дислипидемии и атеросклероза.
24. Способ согласно аспекту 21, где заболевание или состояние представляет собой первичную гиперхолестеринемию или семейную гиперхолестеринемию.
25. Способ согласно аспекту 21, где антитело или антигенсвязывающий фрагмент вводят в дозировке в диапазоне от приблизительно 50 мг до приблизительно 300 мг.
26. Способ согласно аспекту 21, где антитело или антигенсвязывающий фрагмент вводят в дозировке приблизительно 150 мг.
27. Способ согласно аспекту 21, где антитело или его антигенсвязывающий фрагмент вводят индивидууму раз в две недели (E2W).
28. Способ согласно аспекту 21, где антитело или его антигенсвязывающий фрагмент вводят индивидууму раз в четыре недели (E4W).
29. Способ согласно аспекту 21, где лечение снижает уровень общего холестерина в сыворотке на по меньшей мере от приблизительно 25% до приблизительно 35% относительно уровня до введения дозы и сохраняет снижение на протяжении периода по меньшей мере 24 суток.
30. Способ согласно аспекту 21, где лечение снижает уровень общего холестерина в сыворотке на по меньшей мере от приблизительно 65% до приблизительно 80% относительно уровня до введения дозы и сохраняет снижение на протяжении периода по меньшей мере 24 суток.
31. Способ согласно аспекту 21, где лечение снижает уровни триглицеридов в сыворотке на по меньшей мере от приблизительно 25% до приблизительно 40% относительно уровня до введения дозы.
32. Способ согласно аспекту 21, где лечение снижает уровень холестерина HDL в сыворотке не более чем на 5% относительно уровня до введения дозы.
33. Способ согласно аспекту 21, где лечение имеет небольшой или отсутствие поддающегося измерению эффекта на функцию печени при определении по результатам измерения ALT и AST.
34. Способ согласно аспекту 21, где антитело или антигенсвязывающий фрагмент содержат CDR тяжелой и легкой цепей из пары аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
35. Способ согласно аспекту 21, где антитело или антигенсвязывающий фрагмент содержат пару аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
36. Способ согласно аспекту 21, где антитело или его антигенсвязывающий фрагмент конкурируют за связывание hPCSK9 с антителом или антигенсвязывающим фрагментом, содержащими пару аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
37. Способ согласно аспекту 21, где статин выбран из группы, состоящей из церивастатина, аторвастатина, симвастатина, питавастатина, розувастатина, флувастатина, ловастатина и правастатина.
38. Способ согласно аспекту 21, где статин представляет собой аторвастатин, вводимый в дозировке 10 мг или 80 мг.
39. Фармацевтическая лекарственная форма, содержащая антитело или его антигенсвязывающий фрагмент, которые специфично связываются с hPCSK9; и фармацевтически приемлемый носитель, где антитело или антигенсвязывающий фрагмент присутствуют в дозировке в диапазоне от приблизительно 5 мг до приблизительно 500 мг.
40. Дозированная форма согласно аспекту 39, где антитело или антигенсвязывающий фрагмент находятся в дозировке в диапазоне от приблизительно 50 мг до приблизительно 300 мг.
41. Дозированная форма согласно аспекту 39, где антитело или антигенсвязывающий фрагмент находятся в дозировке приблизительно 150 мг.
42. Дозированная форма согласно аспекту 39, где антитело или антигенсвязывающий фрагмент содержат CDR тяжелой и легкой цепей пары аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
43. Дозированная форма согласно аспекту 39, где антитело или антигенсвязывающий фрагмент содержат пару аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
44. Дозированная форма согласно аспекту 39, где антитело или его антигенсвязывающий фрагмент конкурируют за связывание hPCSK9 с антителом или антигенсвязывающим фрагментом, содержащими пару аминокислотных последовательностей, как показано в SEQ ID NO: 90/92.
45. Дозированная форма согласно аспекту 39, дополнительно содержащая иингибитор HMG-CoA-редуктазы.
46. Дозированная форма согласно аспекту 39, где ингибитор HMG-CoA-редуктазы находится в дозировке в диапазоне приблизительно от 0,05 мг до 100 мг.
47. Дозированная форма согласно аспекту 39, где ингибитор HMG-CoA-редуктазы представляет собой статин.
48. Дозированная форма согласно аспекту 39, где статин выбран из группы, состоящей из церивастатина, аторвастатина, симвастатина, питавастатина, розувастатина, флувастатина, ловастатина и правастатина.
49. Дозированная форма согласно аспекту 39, где статин представляет собой аторвастатин, находящийся в дозировке 10 мг или 80 мг.
50. Набор для лечения повышенных уровней холестерина липопротеинов низкой плотности (LDL-C) у индивидуума, причем набор содержит (a) фармацевтическую лекарственную форму, содержащую антитело или его антигенсвязывающий фрагмент, которые специфично связываются с hPCSK9; и фармацевтически приемлемый носитель, где антитело или антигенсвязывающий фрагмент находятся в дозировке в диапазоне от приблизительно 5 мг до приблизительно 500 мг; и (b) ярлык или вкладыш в упаковку с инструкциями по применению.
51. Набор согласно аспекту 50, где на ярлыке указано, что пациентов, которым проводят лечение указанным антителом или антигенсвязывающим фрагментом, можно лечить от заболевания или состояния, выбранного из группы, состоящей из гиперхолестеринемии, гиперлипидемии, дислипидемии и атеросклероза и сердечно-сосудистых заболеваний.
52. Набор согласно аспекту 51, где заболевание или состояние представляет собой первичную гиперхолестеринемию или семейную гиперхолестеринемию.
53. Набор согласно аспекту 51, где заболевание или состояние представляет собой гиперхолестеринемию, не контролируемую статинами.
54. Набор согласно аспекту 50, где антитело или антигенсвязывающий фрагмент находятся в дозировке в диапазоне от приблизительно 50 мг до приблизительно 300 мг.
55. Набор согласно аспекту 50, где антитело или антигенсвязывающий фрагмент находятся в дозировке приблизительно 150 мг.
56. Набор согласно аспекту 50, где на ярлыке или вкладыше в упаковку указано, что антитело или его антигенсвязывающий фрагмент вводят индивидууму раз в две недели (E2W).
57. Набор согласно аспекту 50, где на ярлыке или вкладыше в упаковку указано, что антитело или его антигенсвязывающий фрагмент вводят индивидууму раз в четыре недели (E4W).
58. Набор согласно аспекту 50, где антитело или антигенсвязывающий фрагмент содержат CDR тяжелой и легкой цепей из пары аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
59. Набор согласно аспекту 50, где антитело или антигенсвязывающий фрагмент содержат пару аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
60. Набор согласно аспекту 50, где антитело или его антигенсвязывающий фрагмент конкурируют за связывание hPCSK9 с антителом или антигенсвязывающим фрагментом, содержащими пару аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
61. Набор согласно аспекту 50, дополнительно содержащий ингибитор HMG-CoA-редуктазы.
62. Набор согласно аспекту 61, где ингибитор находится в дозировке в диапазоне приблизительно от 0,05 мг до 100 мг.
63. Набор согласно аспекту 50, где ингибитор HMG-CoA-редуктазы представляет собой статин.
64. Набор согласно аспекту 50, где статин выбран из группы, состоящей из церивастатина, аторвастатина, симвастатина, питавастатина, розувастатина, флувастатина, ловастатина и правастатина.
65. Набор согласно аспекту 50, где на инструкциях указано, что статин представляет собой аторвастатин, вводимый в дозировке 10 мг или 80 мг.
66. Набор согласно аспекту 50, где в инструкциях указано, что лечение антителом противопоказано для пациентов, относящихся к одной или нескольким из следующих групп:
(xxii) курильщики;
(xxiii) лица в возрасте 70 лет и старше;
(xxiv) лица, страдающие гипертензией;
(xxv) беременные женщины;
(xxvi) женщины, пытающиеся забеременеть;
(xxvii) женщины, кормящие грудью;
(xxviii) лица, которые имеют или когда-либо имели заболевание, поражающее печень;
(xxix) лица, которые имели какие-либо необъясненные аномальные показатели функции печени в тестах крови;
(xxx) лица, которые употребляют чрезмерные количества спиртных напитков;
(xxxi) лица, имеющие проблемы с почками;
(xxxii) лица, страдающие гипотиреозом;
(xxxiii) лица, страдающие мышечными нарушениями;
(xxxiv) лица, ранее сталкивавшиеся с мышечными проблемами в ходе лечения снижающей уровень липидов терапией;
(xxxv) лица, имеющие серьезные проблемы с дыханием;
(xxxvi) лица, принимающие одно или несколько из следующих лекарственных средств: лекарственные средства, изменяющие работу иммунной системы (например, циклоспорин или антигистамины), антибиотики или противогрибковые средства (например, эритромицин, кларитромицин, кетоконазол, итраконазол, рифампицин, фусидовая кислота), лекарственные средства, регулирующие уровень липидов (например, гемфиброзил, колестипол), блокаторы кальциевых каналов (например, верапамил, дилтиазем), лекарственные средства, регулирующие сердечный ритм (дигоксин, амиодарон), ингибиторы протеаз, используемые при лечении ВИЧ (например, нельфинавир), варфарин, пероральные контрацептивы, антациды или зверобой; или
(xxxvii) лица, выпивающие более 0,1 л грейпфрутового сока в сутки;
(xxxviii) лица, имеющие индекс массы тела (BMI) более 40;
(xxxix) лица, имеющие индекс массы тела (BMI) менее 18;
(xl) лица, страдающие диабетом 1 типа или диабетом 2 типа;
(xli) лица, положительные по гепатиту B или гепатиту C; или
(xlii) лица, имеющие известную чувствительность к лекарственным средствам на основе моноклональных антител.
АСПЕКТЫ, ОТНОСЯЩИЕСЯ К КОМПОЗИЦИЯМ
1. Фармацевтическая композиция, содержащая от приблизительно 40 до приблизительно 500 мг на дозу антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9), вместе с фармацевтически приемлемым эксципиентом или носителем.
2. Фармацевтическая композиция согласно аспекту 1, содержащая от приблизительно 50 мг до приблизительно 500 мг, от приблизительно 50 мг до приблизительно 300 мг, приблизительно 50 мг, приблизительно 100 мг, приблизительно 150 мг, приблизительно 200 мг, приблизительно 250 мг, приблизительно 300 мг, приблизительно 350 мг, приблизительно 400 мг, приблизительно 450 мг или приблизительно 500 мг антитела или его антигенсвязывающего фрагмента.
3. Фармацевтическая композиция согласно одному из аспектов 1 или 2, содержащая приблизительно 150, 200 или 300 мг антитела или его антигенсвязывающего фрагмента.
4. Фармацевтическая композиция согласно одному из аспектов 1-3, содержащая эффективную дозу антитела или его антигенсвязывающего фрагмента, которые специфично связывают hPCSK9 (конвертаза пробелков типа субтилизина/кексина человека 9), где доза является достаточной для непрерывного снижения уровней липопротеинов низкой плотности (LDL-C) в течение периода по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19, по меньшей мере 20, по меньшей мере 21, по меньшей мере 22, по меньшей мере 23 или по меньшей мере 28 суток после введения вместе с фармацевтически приемлемым эксципиентом или носителем.
5. Фармацевтическая композиция согласно одному из аспектов 1-4, где доза является достаточной для непрерывного снижения уровней LDL-C в течение периода по меньшей мере 14 суток, 28 суток или 1 месяца.
6. Фармацевтическая композиция согласно одному из аспектов 1-5, дополнительно содержащая эффективное количество ингибитора HMG-CoA-редуктазы.
7. Фармацевтическая композиция согласно аспекту 6, где ингибитор HMG-CoA-редуктазы представляет собой статин, предпочтительно, выбранный из списка, состоящего из: церивастатина, аторвастатина, симвастатина, питавастатина, розувастатина, флувастатина, ловастатина или правастатина, и предпочтительно, он представляет собой аторвастатин.
8. Фармацевтическая композиция согласно аспекту 6 или 7, содержащая от приблизительно 0,05 мг до приблизительно 100 мг, от приблизительно 0,5 мг до приблизительно 100 мг, от приблизительно 5 мг до приблизительно 90 мг, приблизительно 10 мг, приблизительно 20 мг, приблизительно 40 мг или приблизительно 80 мг ингибитора HMG-CoA-редуктазы и, предпочтительно, приблизительно 10, приблизительно 20, приблизительно 40 или приблизительно 80 мг.
9. Фармацевтическая композиция согласно одному из аспектов 6-8, содержащая эффективную дозу ингибитора HMG-CoA-редуктазы для снижения уровней LDL-C путем введения один раз в сутки.
10. Фармацевтическая композиция согласно одному из аспектов 1-9, где антитело или его антигенсвязывающий фрагмент имеют один или несколько из следующих признаков:
a. Снижение уровней липопротеинов низкой плотности (LDL-C) на по меньшей мере от приблизительно 25% до приблизительно 40% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 14 суток при введении индивидууму, где устойчивое снижение составляет, предпочтительно, по меньшей мере 25% и, более предпочтительно, по меньшей мере 30% относительно уровня до введения дозы, в частности, при введении в дозе от приблизительно 40 до приблизительно 60 мг, предпочтительно, от приблизительно 45 до приблизительно 55 мг и, более предпочтительно, приблизительно 50 мг в режиме введения раз в две недели (раз в две недели, E2W);
b. Снижение уровня липопротеинов низкой плотности (LDL-C) на по меньшей мере от приблизительно 50% до приблизительно 65% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 14 суток при введении индивидууму, где устойчивое снижение составляет, предпочтительно, по меньшей мере 40% и, более предпочтительно, по меньшей мере 45% относительно уровня до введения дозы, в частности, при введении в дозе от приблизительно 100 мг E2W.
c. Снижение уровня липопротеинов низкой плотности (LDL-C) на от по меньшей мере приблизительно 60% до по меньшей мере приблизительно 75% [например, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 65%, по меньшей мере приблизительно 70 или по меньшей мере приблизительно 75%] относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 14 суток при введении индивидууму, где устойчивое снижение составляет, предпочтительно, по меньшей мере 55% и, более предпочтительно, по меньшей мере 60% относительно уровня до введения дозы, в частности, при введении в дозе приблизительно 150 мг E2W,
d. Снижение уровня липопротеинов низкой плотности (LDL-C) на по меньшей мере от приблизительно 40% до приблизительно 75% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 28 суток, где устойчивое снижение составляет, предпочтительно, по меньшей мере 35% и, более предпочтительно, по меньшей мере 40% относительно уровня до введения дозы, в частности, при введении в дозе приблизительно 200 мг E4W,
e. Снижение уровня липопротеинов низкой плотности (LDL-C) на по меньшей мере от приблизительно 50% до приблизительно 75% относительно уровня до введения дозы с устойчивым снижением на протяжении периода по меньшей мере 28 суток при введении индивидууму, где устойчивое снижение составляет, предпочтительно, по меньшей мере 40% и, более предпочтительно, по меньшей мере 45% относительно уровня до введения дозы, в частности, при введении в дозе приблизительно 300 мг E4W,
f. Увеличение уровня холестерина HDL в сыворотке по меньшей мере на 2%, по меньшей мере на 2,5%, по меньшей мере на 3%, по меньшей мере на 3,5%, по меньшей мере на 4%, по меньшей мере на 4,5%, по меньшей мере на 5% или по меньшей мере на 5,5% относительно уровня до введения дозы при введении индивидууму, в частности, при введении в дозе приблизительно 150 мг E2W,
g. Небольшой или отсутствие поддающегося измерению эффекта на уровни тропонина при введении индивидууму,
h. Увеличение одного или нескольких из: уровни общего холестерина, уровни ApoB, уровни С не HDL, соотношение Apo-B/ApoA-1, при введении индивидууму.
11. Фармацевтическая композиция согласно одному из аспектов 1-9, где антитело или его антигенсвязывающий фрагмент способны преодолевать устойчивость к статинам при введении индивидууму с устойчивой к статинам гиперхолестеринемией.
12. Фармацевтическая композиция согласно одному из аспектов 1-10, где антитело или его антигенсвязывающий фрагмент содержат CDR тяжелой и легкой цепей из пары аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92, или по существу идентичные последовательности, имеющие по меньшей мере 98% или 99% идентичность с ними.
13. Фармацевтическая композиция согласно одному из аспектов 1-11, где антитело или его антигенсвязывающий фрагмент содержат пару аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92, или пару по существу идентичных последовательностей, имеющих по меньшей мере 98% или 99% идентичность с ними.
14. Фармацевтическая композиция согласно одному из аспектов 1-10, где антитело или его антигенсвязывающий фрагмент конкурируют за связывание hPCSK9 с антителом или антигенсвязывающим фрагментом, содержащими пару аминокислотных последовательностей HCVR/LCVR, как показано в SEQ ID NO: 90/92.
15. Фармацевтическая композиция согласно одному из аспектов 1-13, где антитело или его антигенсвязывающий фрагмент связывают эпитоп, содержащий аминокислотный остаток 238 hPCSK9 (SEQ ID NO:755).
16. Фармацевтическая композиция согласно одному из аспектов 1-14, где антитело или его антигенсвязывающий фрагмент связывают эпитоп, содержащий один или несколько из аминокислотных остатков в положениях 238, 153, 159 и 343 hPCSK9 (SEQ ID NO:755).
17. Фармацевтическая композиция согласно одному из аспектов 1-15, где антитело или его антигенсвязывающий фрагмент связывают эпитоп, который не содержит аминокислотный остаток в положениях 192, 194, 197 и/или 237 hPCSK9 (SEQ ID NO:755).
18. Фармацевтическая композиция согласно одному из аспектов 1-16, содержащая антитело или его антигенсвязывающий фрагмент в качестве сухого состава для растворения, такого как лиофилизированный порошок, высушенный сублимационной сушкой порошок или не содержащий воды концентрат.
19. Фармацевтическая композиция согласно одному из аспектов 1-17, содержащая антитело или его фрагмент в качестве жидкого состава, например, раствора для инъекций или инфузий.
20. Фармацевтическая композиция согласно одному из аспектов 4-18, содержащая ингибитор HMG-CoA-редуктазы в качестве перорального состава, например, капсулы или таблетки, или в качестве жидкого состава, например, суспензии, дисперсии или раствора, например, для перорального введения, инъекции или инфузии.
21. Раствор для инъекций в соответствии с аспектом 19, предпочтительно, содержащий от приблизительно 40 мг до приблизительно 200 мг или от приблизительно 40 до приблизительно 200 мг, например, приблизительно 40 мг, приблизительно 50 мг, приблизительно 75 мг, приблизительно 100 мг, приблизительно 150 мг или приблизительно 200 мг антитела или его антигенсвязывающего фрагмента на объем 1 мл.
22. Сухой состав в соответствии с аспектом 17, предпочтительно, содержащий от приблизительно 40 мг до приблизительно 500 мг, от 50 до приблизительно 500 мг, от приблизительно 50 до приблизительно 400, от приблизительно 50 до приблизительно 300, например, приблизительно 40 мг, приблизительно 50 мг, приблизительно 75 мг, приблизительно 100 мг, приблизительно 150 мг, приблизительно 200 мг, приблизительно 250 мг, приблизительно 300 мг, приблизительно 350 мг, приблизительно 400 мг, приблизительно 450 мг или приблизительно 500 мг и, предпочтительно, приблизительно 50 мг, приблизительно 100 мг, приблизительно 150 мг, приблизительно 200 мг, приблизительно 250 мг, приблизительно 300 мг и, еще более предпочтительно, приблизительно 150 мг, приблизительно 200 мг или приблизительно 300 мг антитела или его антигенсвязывающего фрагмента на дозу.
23. Антитело или его антигенсвязывающий фрагмент, содержащиеся в одной из фармацевтических композиций согласно одному из аспектов 1-17.
24. Лекарственная форма, содержащая фармацевтическую композицию согласно одному из аспектов 1-20, раствор для инъекций согласно аспекту 21, сухой состав согласно аспекту 22, или антитело согласно аспекту 23.
25. Лекарственная форма согласно аспекту 24, содержащая приблизительно 40 мг, приблизительно 50 мг, приблизительно 75 мг, приблизительно 100 мг, приблизительно 150 мг, приблизительно 200 мг, приблизительно 250 мг, приблизительно 300 мг, приблизительно 350 мг, приблизительно 400 мг, приблизительно 450 мг или приблизительно 500 мг антитела или его антигенсвязывающего фрагмента.
26. Лекарственная форма согласно одному из аспектов 24 или 25, содержащая антитело или его фрагмент в качестве сухого состава для растворения в герметично закрытом контейнере, таком ка флакон, ампула или саше.
27. Лекарственная форма согласно одному из аспектов 24 или 25, содержащая антитело или его фрагмент в качестве жидкого состава в герметично закрытом контейнере, таком как флакон, саше, предварительно заполненный шприц, предварительно заполненный шприц для самоинъекций или кассета для многоразового шприца или аппликатора.
28. Лекарственная форма согласно аспекту 26 или 27, где на герметично закрытом контейнере указано количество активного ингредиента.
29. Изделие, содержащее фармацевтическую композицию согласно одному из аспектов 1-20, жидкий состав согласно аспекту 21 или сухой состав согласно аспекту 22, антитело или его антигенсвязывающий фрагмент согласно аспекту 23 или одну или несколько лекарственных формы согласно одному из аспектов 24-28, и контейнер.
30. Изделие согласно аспекту 29, содержащее отдельные лекарственные формы антитела согласно аспекту 23 и ингибитора HMG-CoA-редуктазы согласно одному из аспектов 5-9 или 20.
31. Изделие согласно аспекту 30, содержащее один или несколько из следующих компонентов:
a. Одна или несколько лекарственных форм, содержащих антитело согласно аспекту 23;
b. Одна или несколько лекарственных форм, содержащих ингибитор HMG-CoA-редуктазы согласно одному из аспектов 6-9 или 20;
c. Инструкции по применению;
d. Устройство для применения антитела, такое как шприц.
32. Изделие согласно аспекту 31, содержащее достаточное количество лекарственных форм антитела и, предпочтительно, также ингибитора HMG-CoA-редуктазы, для однократного введения антитела и ингибитора HMG-CoA-редуктазы, в ходе лечения в течение двух недель (т.е. 14 суток) антителом и ингибитором HMG-CoA-редуктазы, в ходе лечение в течение четырех недель (т.е. 28 суток) антителом и ингибитором HMG-CoA-редуктазы или в ходе лечения в течение одного месяца антителом и ингибитором HMG-CoA-редуктазы.
33. Изделие согласно аспекту 32, содержащее достаточное количество лекарственных форм антитела для режима введения раз в две недели, или режима введения раз в четыре недели, или режима введения раз в месяц.
34. Изделие согласно аспекту 32 или 33, содержащее достаточное количество лекарственных форм ингибитора HMG-CoA-редуктазы для режима введения раз в сутки.
35. Фармацевтическая композиция согласно одному из аспектов 1-20 или антитело или его антигенсвязывающий фрагмент согласно аспекту 21 для применения при лечении заболевания или состояния, в которые вовлечена экспрессия или активность PCSK9, предпочтительно, для применения в снижении повышенных уровней LDL-C (ХС липопротеинов низкой плотности).
36. Фармацевтическая композиция или антитело или его антигенсвязывающий фрагмент согласно аспекту 35, где заболевание или состояние выбраны из группы, состоящей из: повышенных уровней общего холестерина, повышенных уровней липопротеинов низкой плотности (LDL-C), гиперхолестеринемии, гиперлипидемии, дислипидемии и атеросклероза, в частности, первичной гиперхолестеринемии, семейной гиперхолестеринемии или гиперхолестеринемии, не контролируемой статинами.
37. Фармацевтическая композиция или антитело или его антигенсвязывающий фрагмент согласно аспекту 35 или 36, где композицию, антитело или его антигенсвязывающий фрагмент вводят индивидууму раз в две недели (E2W), раз в четыре недели (E4W) или раз в месяц.
38. Фармацевтическая композиция или антитело или его антигенсвязывающий фрагмент согласно одному из аспектов 35-37, включающие совместное введение ингибитора HMG-CoA-редуктазы, предпочтительно, ингибитор HMG-CoA-редуктазы согласно одному из аспектов 7-9 или 20.
39. Фармацевтическая композиция или антитело согласно аспекту 38, где ингибитор HMG-CoA-редуктазы вводят один раз в сутки и, предпочтительно, каждые сутки.
40. Способ получения фармацевтической композиции согласно одному из аспектов 1-20, включающий смешение антитела или его антигенсвязывающего фрагмента и необязательно ингибитора HMG-CoA-редуктазы с одним или несколькими фармацевтическими эксципиентами или носителями.
41. Способ получения лекарственной формы согласно одному из аспектов 24-28, включающий отмеривание количества фармацевтической композиции согласно одному из аспектов 1-20, антитела согласно аспекту 21, жидкого состава согласно аспекту 22 или сухого состава согласно аспекту 23, содержащего одну или несколько доз антитела и необязательно ингибитора HMG-CoA-редуктазы, и преобразование их в физически дискретные единицы, пригодные в качестве единичных дозировок для человека и/или животных.
42. Способ получения изделия согласно одному из аспектов 29-34, включающий упаковывание фармацевтической композиции согласно одному из аспектов 1-20, антитела согласно аспекту 21, жидкого состава согласно аспекту 22, сухого состава согласно аспекту 23 или одной или нескольких из лекарственных форм согласно одному из аспектов 24-28, в контейнер.
ПРИМЕРЫ
Следующие ниже примеры представлены для предоставления специалистам в данной области полного раскрытия и описания того, как получать и применять способы и композиции по изобретению, и не предназначены для ограничения объема того, что авторы изобретения считают их изобретением. Были предприняты усилия для обеспечения точности в отношении использованных чисел, однако следует учитывать некоторые экспериментальные погрешности и отклонения. Если нет иных указаний, молекулярная масса представляет собой среднюю молекулярную массу, температура представлена в градусах Цельсия, и давление является атмосферным или практическим атмосферным.
Испытание 1
Это испытание представляло собой многоцентровое, рандомизированное, двойное слепое плацебо-контролируемое испытание с параллельными группами в течение 12 недель для оценки эффективности и безопасности антитела 316P у пациентов с повышенным уровнем холестерина липопротеинов низкой плотности (LDL-C) (≥100 мг/дл или 2,59 ммоль/л), при лечении аторвастатином (10 гм, 20 мг или 40 мг) в стабильной дозе в течение по меньшей мере 6 недель. Рандомизацию стратифицировали по дозе аторвастатина перед рандомизацией. После двойного слепого периода пациентов наблюдали в ходе периода наблюдения в течение 8 недель. Первичной задачей испытания была оценка эффекта антитела 316P на уровни LDL-C после лечения в течение 12 недель по сравнению с плацебо у пациентов LDL-C (≥ 100 мг/дл или 2,59 ммоль/л) на продолжающуюся стабильную терапию аторвастатином.
Оценивали следующие дозы/режимы дозирования: 50 мг, 100 мг и 150 мг раз в 2 недели (E2W), 200 мг и 300 мг раз в 4 недели (E4W) по сравнению с плацебо.
Настоящее испытание включало всего 122 пациента (20 в группе плацебо, 19 в группе 50 мг E2W, 20 в группе 100 мг E2W, 20 в группе 150 мг E2W, 22 в группе 200 мг E4W и 21 в группе 300 мг E4W). Сорок шесть (37,7%) из этих пациентов случайным образом распределяли в группу аторвастатина 10 мг, 43 (35,2%), в группу аторвастатина 20 мг и 33 (27,0%) в группу аторвастатина 40 мг.
Выбор пациентов
Критерии включения:
- Пациенты (пациенты, которым проводили лечение, снижающее уровень липидов, отличное от аторвастатина/ или не находившиеся на стабильной дозе аторвастатина 10 мг, 20 мг или 40 мг в течение по меньшей мере 6 недель перед периодом скрининга, или пациенты, не подвергавшиеся воздействию лекарственных средств) с первичной гиперхолестеринемией, которые вероятно будут иметь уровень холестерина липопротеинов низкой плотности (LDL-C)≥100 мг/дл (≥2,59 ммоль/л) в конце подготовительного периода на терапии аторвастатином (неделя-1).
ИЛИ
- Пациенты с первичной гиперхолестеринемией, которых лечили аторвастатином в стабильной дозе 10 мг, 20 мг или 40 мг в течение по меньшей мере 6 недель перед периодом скрининга, и которые, вероятно будут иметь LDL-C ≥ 100 мг/дл (≥2,59 ммоль/л) при скрининговом посещении на неделе 1.
Критерии исключения:
- LDL-C < 100 мг/дл (<2,59 ммоль/л) на неделе 1 (V1):
o После подготовительного периода на аторвастатине (10 мг, 20 мг или 40 мг) для пациентов, которым проводили терапию, снижающую уровень липидов, отличную от аторвастатина/ или не находящихся на стабильной дозе аторвастатина 10 мг, 20 мг или 40 мг в течение по меньшей мере 6 недель перед скрининговым периодом, или пациентов, не подвергавшихся воздействию лекарственных средств.
ИЛИ
o При первом посещении для пациентов, которых лечат стабильной дозой аторвастатина (10 мг, 20 мг или 40 мг) в течение по меньшей мере 6 недель перед скрининговым посещением на неделе 1.
- Применение статина, отличного от аторвастатина 10 мг, 20 мг или 40 мг, или применение других лекарственных средств, снижающих уровень липидов, включая, но не ограничиваясь ими, фибраты, секвестранты желчных кислот, ниацин > 500 мг, блокаторы всасывания холестерина в кишечнике (ICA) или омега-3 жирные кислоты в дозах > 1000 мг в ходе скринингового периода.
- Индекс массы тела (BMI)<18 или >40 кг/м2 на неделе 7 или неделе 1.
- Пациенты, которых ранее не инструктировали в отношении диеты, снижающей уровень холестерина.
- Пациенты с диабетом 1 типа.
- Пациенты с диабетом 2 типа, которых лечили инсулином.
- Пациенты с диабетом 2 типа и с HbA1c≥8,5% на неделе 7 или неделе 1 (которые считаются плохо контролируемыми).
- Лабораторные данные, измеренные перед рандомизацией:
o Положительный тест на антитело против поверхностного антигена гепатита B и/или гепатита C.
o Триглицериды (TG)>350 мг/дл (>3,95 ммоль/л) на неделе -7 или неделе -1.
o Нейтрофилы < 1500/мм3 и/или тромбоциты < 100000/мм3.
o Положительный тест на беременность в сыворотке или моче у женщин, способных к деторождению.
o Аномальный уровень в чувствительном тесте на TSH (> ULN или < LLN) в соответствии с величинами нормы центральной лаборатории
o Доказательство нарушения почек при определении по:
- Мужчины: уровень креатинина в сыворотке >1,5×ULN.
- Женщины: уровень креатинина в сыворотке >1,4×ULN.
o ALT или AST>2×ULN.
o CPK>3×ULN (допускается 1 повторный лабораторный тест).
- Все противопоказания для протокола, требуемого для фоновой терапии (т.е. аторвастатин), или предупреждения/предостережения по применению (когда это пригодно), как показано в соответствующем National Product Labeling, который использовали для определения этих критериев исключения.
- Известная чувствительность к лекарственным средствам на основе моноклональных антител.
- Беременные или кормящие грудью женщины.
- Женщины, способные к деторождению, без эффективного способа контрацепции.
Группы пациентов:
Демографические и исходные характеристики были, главным образом, сходными среди групп лечения. Средний возраст пациентов составлял 58,0 лет (28,7% пациентов были в возрасте ≥ 65 лет) с возрастом пациентов 24-75 лет. Средний диапазон для исходного уровня LDL-C и уровня общего С среди групп лечения был сходным и находился в диапазоне от 3214 ммоль/л до 3500 ммоль/л для LDL-C и от 5,284 ммоль/л до 5,521 ммоль/л для общего ХС. BMI (кг/м2) составлял от 19,7 до 40,5 со средней величиной 29,04 и срединной величиной 28,4 (63,6% пациентов имели BMI<30 и 36,4% пациентов имели BMI>30). 80 (65,6%) из 122 пациентов имели гиперлипопротеинемию типа IIa (семейная гиперхолестеринемия) в соответствии с классификацией Фредриксона, 41 (33,6%) имели тип IIb (комбинированная гиперлипидемия) и 1 (0,8%) имел тип IV (эндогенная гиперлипидемия). Всего 82% пациентов проводили предшествующее лечение средством, снижающим уровень липидов, в то время как 22% не проводили.
Длительность периода испытания для индивидуума:
Длительность участия в исследовании зависела от состояния пациента при скрининге:
• Для пациентов, которых лечили аторвастатином 10 мг, 20 мг или 40 мг в стабильной дозе в течение по меньшей мере 6 недель перед скринингом, участие в испытании составляло приблизительно 21 неделю, включая период скрининга в течение 1 недели, период двойного слепого лечения в течение 12 недель и период наблюдения в течение 8 недель.
• Для пациентов, которым проводили снижающее уровень липидов лечение, отличное от аторвастатина/ или не находившихся на дозе аторвастатина 10 мг, 20 мг или 40 мг в течение по меньшей мере 6 недель перед скринингом, или не подвергавшихся воздействию лекарственных средств пациентов, участие в испытании составляло приблизительно 27 недель, включая период скрининга 7 недель (включая подготовительный период 6 недель), период двойного слепого введения 12 недель, и период наблюдения 8 недель.
Активные соединения:
Антитело 316P:
Антитело 316P представляет собой полностью человеческое антитело, содержащее HCVR, как показано в SEQ ID NO: 90, и LCVR, как показано в SEQ ID NO: 92 списка последовательностей. Последовательности CDR представлены в SEQ ID NO: 76, 78 и 80 (CDR1, CDR2, CDR3 тяжелой цепи), а также в SEQ ID NO: 84, 86 и 88 (CDR1, CDR2, CDR3 легкой цепи).
Антитело 300N:
Антитело 300N представляет собой полностью человеческое антитело, содержащее HCVR, как показано в SEQ ID NO: 218, и LCVR, как показано в SEQ ID NO: 226 списка последовательностей. Последовательности CDR представлены в SEQ ID NO: 220, 222 и 224 (CDR1, CDR2, CDR3 тяжелой цепи), а также в SEQ ID NO: 228, 230 и 232 (CDR1, CDR2, CDR3 легкой цепи).
Ветви испытания:
Ветвь 1: В первой группе пациентов проводили две инъекции по 1 мл каждая антитела 316P, вводимые подкожно в брюшную полость с режимом дозирования 50 мг, раз в две недели, в течение периода введения 12 недель;
Аторвастатин вводили один раз в сутки в стабильной дозе 10 мг, 20 мг или 40 мг в качестве фоновой терапии.
Ветвь 2: Во второй группе пациентов проводили две инъекции по 1 мл каждая антитела 316P, вводимые подкожно в брюшную полость, с режимом дозирования 100 мг, раз в две недели, в течение периода введения 12 недель;
Аторвастатин вводили один раз в сутки в стабильной дозе 10 мг, 20 мг или 40 мг в качестве фоновой терапии.
Ветвь 3: В третьей группе пациентов проводили две инъекции по 1 мл каждая антитела 316P, вводимые подкожно в брюшную полость, с режимом дозирования 150 мг, раз в две недели, в течение периода лечения 12 недель;
Аторвастатин вводили один раз в сутки в стабильной дозе 10 мг, 20 мг или 40 мг в качестве фоновой терапии.
Ветвь 4: В четвертой группе пациентов проводили две инъекции по 1 мл каждая раствора плацебо, вводимые подкожно в брюшную полость раз в две недели в течение периода лечения 12 недель;
Аторвастатин вводили один раз в сутки в стабильной дозе 10 мг, 20 мг или 40 мг в качестве фоновой терапии.
Ветвь 5: В пятой группе пациентов проводили две инъекции по 1 мл каждая антитела 316P, вводимые подкожно в брюшную полость, с режимом дозирования 200 мг, раз в четыре недели, в течение периода лечения 12 недель;
раствор плацебо вводили, чередуя с введением антитела 316P так чтобы пациент имел ту же схему введения, что и пациенты в ветвях 1-4, т.е. пациенту проводили две инъекции по 1 мл каждая раствора плацебо на неделях 2, 6 и 10 и две инъекции по 1 мл каждая антитела 316P на неделях 0, 4, 8 и 12;
Аторвастатин вводили один раз в сутки в стабильной дозе 10 мг, 20 мг или 40 мг в качестве фоновой терапии.
Ветвь 6: В шестой группе пациентов проводили две инъекции по 1 мл каждая антитела 316P, вводимые подкожно в брюшную полость, с режимом дозирования 300 мг, раз в четыре недели, в течение периода лечения 12 недель;
раствор плацебо вводили, чередуя с введением антитела 316P, так чтобы пациент имел ту же схему инъекции, что и пациенты в ветвях 1-4, т.е. пациенту проводили две инъекции по 1 мл каждая раствора плацебо на неделях 2, 6 и 10 и две инъекции по 1 мл каждая антитела 316P на неделях 0, 4, 8 и 12;
Аторвастатин вводили один раз в сутки в стабильной дозе 10 мг, 20 мг или 40 мг в качестве фоновой терапии.
Первичные и ключевые вторичные результаты:
Первичной переменной величиной эффективности является процентное изменение вычисленного LDL-C от исходного уровня до недели 12, которое определяется как: 100x (вычисленная величина LDL-C на неделе 12 - вычисленная величина LDL-C на исходном уровне)/вычисленная величина LDL-C на исходном уровне.
В случае недоступной вычисленной величины LDL-C на неделе 12, как описано выше, используют последнюю вычисленную величину LDL-C, измеренную во временном окне периода исследования эффективности и до недели 12, для приписывания вместо отсутствующей величины LDL-C на неделе 12 (методика переноса данных последнего наблюдения [LOCF]).
Вторичные результаты эффективности представляют собой:
Абсолютное изменение (ммоль/л и мг/дл) от исходного уровня вычисленной величины LDL-C до недели 12, определяемое как: (вычисленная величина LDL-C на неделе 12-вычисленная величина LDL-C на исходном уровне), с использованием тех же определений и правил приписывания величин, что и для первичных результатов.
Процент пациентов с вычисленным LDL-C<70 мг/дл (1,81 ммоль/л) и <100 мг/дл (2,59 ммоль/л) на неделе 12.
Процентное изменение ApoB от исходного уровня до недели 12: те же определения и правила, что и для LDL-C, за исключением исходной величины, которая представляет собой величину ApoB, измеренную при посещении для рандомизации (посещение 2) и до первой в/б инъекции, или, при отсутствии, последнюю непредусмотренной графиком величину от посещения 1 (неделя 1) вплоть до момента до первой в/б инъекции.
Процентное и абсолютное (ммоль/л и мг/дл) изменение С не-HDL от исходного уровня до недели 12: те же определения и правила, что и для LDL-C.
Процентное и абсолютное (ммоль/л и мг/дл) изменение уровня триглицеридов натощак от исходного уровня до недели 12: те же определения и правила, что и для LDL-C, за исключением измерений у пациентов не натощак или измерений с отсутствующим статусом в отношении состояния натощак.
Процентное изменение ApoA-1 от исходного уровня до недели 12: те же определения и правила, что и для AboB.
Абсолютное изменение соотношения AboB/ApoA-1 от исходного уровня до недели 12: те же определения и правила, что и для AboB.
Процентное изменение Lp(a) от исходного уровня до недели 12: те же определения и правила, что и для ApoB. В случае величины Lp(a) ниже предела выявления, для вычисления используют величину от нуля до предела выявления.
Результаты:
Эффективность лечения 316P в отношении снижения уровня LDL-C
|
Во всех группах наблюдали статистически значимое снижение процентного изменения LDL-C от исходного уровня через 12 недель по сравнению с плацебо. Наибольшее снижение наблюдали в группах 100 мг E2W (-63,90%) и 150 мг E2W (-72,68%) по сравнению с небольшим снижением в группе плацебо (-6,08%) (среднеквадратичное отличие против плацебо -58,36% и -68,78%, соответственно); эти снижения, наблюдаемые после первой инъекции, сохранялись на протяжении испытания и, более конкретно, на протяжении промежуточного периода между инъекциями. Также наблюдали значительные снижения от исходного уровня в LDL-C через 12 недель в группах 200 мг и 300 мг E4W (-47,23% и 48,29%, соответственно со среднеквадратичным отличием против плацебо -42,53% и -42,26%) также со значительными снижениями по меньшей мере приблизительно на 40% в ходе промежуточных периодов. Среди 18 пациентов в группе 150 мг E2W, 17 имели снижение LDL-C от исходного уровня > 50% на неделе 12.
Эффекты введения 316P на другие ключевые результаты эффективности
|
Наблюдали единообразные результаты (снижение) для общего ХС, ApoB, не HDL-C. Для HDL-C существовала тенденция к увеличению во всех группах, сходный профиль наблюдали для ApoA-1. Антитело 316P хорошо переносилось в ходе введения в течение 12 недель при всех исследованных дозах/режимах дозирования. По существу, не было отмечено изменения в уровнях тропонина во всех группах введения.
Заключение:
Результаты этого исследования показали, что режимы дозирования со схемой применения E2W или E4W и различными дозировками антитела против PCSK 9 316P, использованные в этом исследовании, являются эффективными и безопасными способами лечения для снижения уровней LDL-C у пациентов с гиперлипопротеинемией и или гиперлипидемией и, таким образом, для лечения гиперлипопротеинемии и/или гиперлипидемии. Наилучшие результаты в целом были достигнуты с использованием режима дозирования 150 мг E2W. Однако, учитывая удобство пациентов с точки зрения введения антитела только раз в месяц, также оба режима дозирования E4W, исследованных в настоящем описании, показали очень хорошие результаты.
Испытание 2
Это испытание представляло собой рандомизированное, двойное слепое, плацебо-контролируемое, многоцентровое испытание с 3 параллельными группами, фиксированной дозой/режим дозирования в течение 8 недель у индивидуумов с первичной гиперхолестеринемией в возрасте 18-75 лет. Одной из целей этого испытания была оценка эффективности и безопасности 316P у пациентов с повышенными уровнями LDL-C (≥100 мг/дл или 2,59 ммоль/л), которым вводили стабильную дозу аторвастатина 10 мг.
В ходе периода скрининга пациенты должны были быть стабилизированы в отношении аторвастатина 10 мг в течение по меньшей мере 6 недель, если они не были уже стабилизированы. Затем после 1 дополнительной недели скрининга, пациентов центральным образом распределяли случайным образом на группы через IVRS/IWRS в соотношении 1:1:1 в одну из 3 групп введения (плацебо или 316P + аторвастатин 80 мг, 316P 150 мг E2W + аторвастатин 80 мг, 316P 150 мг E2W + аторвастатин 10 мг) и лечили двойным слепым образом в течение приблизительно 8 недель. 316P вводили раз в 2 недели в центре путем подкожной инъекции и аторвастатин вводили перорально один раз в сутки вечером дома. Затем после периода двойного слепого введения следовал период наблюдения в течение 8 недель.
В исследование было включено и случайным образом распределено приблизительно 90 пациентов (30 пациентов на группе введения) приблизительно из 20 центров.
Задачи
Первичная задача
Оценить эффект 316P на уровни холестерина липопротеинов низкой плотности (LDL-C) по сравнению с плацебо при совместном введении с 80 мг аторвастатина после лечения в течение 8 недель у пациентов с LDL-C ≥ 100 мг/дл (≥2,59 ммоль/л) на аторвастатине 10 мг.
Вторичная задача
Ключевые вторичные задачи, представленные в этом KRM, представляют собой:
- Оценить эффекты 316P на уровни других липидов по сравнению с плацебо при совместном введении с 80 мг аторвастатина после лечения в течение 8 недель
- Оценить эффективность 316P при совместном введении с высокой дозой аторвастатина (80 мг) против аторвастатина 10 мг
- Оценить безопасность и переносимость 316P при совместном введении с 2 различными дозами аторвастатина
- Оценить эффекты 316P на другие результаты исследования: уровень глюкозы в плазме натощак, уровень гликированного гемоглобина A1c (HbA1c), высокочувствительный C-реактивный белок (hs-CRP).
Выбор пациентов:
Критерии включения:
- Пациенты (пациенты, которым проводили лечение, снижающее уровень липидов, отличное от аторвастатина/ или не находившиеся на стабильной дозе аторвастатина 10 мг в течение по меньшей мере 6 недель перед периодом скрининга или пациенты, не подвергавшиеся воздействию лекарственных средств) с первичной гиперхолестеринемией, которые вероятно будут иметь уровень холестерина липопротеинов низкой плотности (LDL-C) ≥ 100 мг/дл (≥ 2,59 ммоль/л) в конце подготовительного периода на терапии аторвастатином (неделя-1).
ИЛИ
- Пациенты с первичной гиперхолестеринемией, которых лечили аторвастатином в стабильной дозе 10 мг в течение по меньшей мере 6 недель перед периодом скрининга, и которые, вероятно будут иметь LDL-C ≥ 100 мг/дл (≥ 2,59 ммоль/л) при скрининговом посещении (неделя 1).
Критерии исключения:
- LDL-C < 100 мг/дл (<2,59 ммоль/л) на неделе 1 (V1):
o После подготовительного периода на 10 мг аторвастатина для пациентов, которым проводили терапию, снижающую уровень липидов, отличную от аторвастатина/ или не находящихся на стабильной дозе аторвастатина 10 мг в течение по меньшей мере 6 недель перед скрининговым периодом, или пациентов, не подвергавшиеся воздействию лекарственных средств.
ИЛИ
o При первом посещении для пациентов, которых лечат стабильной дозой 10 мг аторвастатина в течение по меньшей мере 6 недель перед скрининговым посещением на неделе 1.
- Индекс массы тела (BMI)<18 или >40 кг/м2 на неделе 7 или неделе 1.
- Пациентов ранее не инструктировали в отношении диеты, снижающей уровень холестерина.
- Применение статина, отличного от аторвастатина 10 мг, или применение других лекарственных средств, снижающих уровень липидов, включая, но не ограничиваясь ими фибраты, секвестранты желчных кислот, ниацин > 500 мг, блокаторы всасывания холестерина в кишечнике (ICA) или омега-3 жирные кислоты в дозах > 1000 мг в ходе периода скрининга.
- Пациенты с диабетом 1 типа.
- Пациенты с диабетом 2 типа, которых лечили инсулином.
- Пациенты с диабетом 2 типа и с HbA1c ≥ 8,5% на неделе 7 или неделе 1 (которые считаются плохо контролируемыми).
- Лабораторные данные, измеренные перед рандомизацией:
o Положительный тест на антитело против поверхностного антигена гепатита B и/или гепатита C.
o Триглицериды (TG)>350 мг/дл (>3,95 ммоль/л) на неделе -7 или неделе -1.
o Нейтрофилы <1500/мм3 и/или тромбоциты <100000/мм3.
o Положительный тест на беременность в сыворотке или моче у женщин, способных к деторождению.
o Аномальный уровень в чувствительном тесте на TSH (> ULN или < LLN) в соответствии с величинами нормы Центральной лаборатории
o Доказательство нарушения почек при определении по:
- Мужчины: уровень креатинина в сыворотке >1,5×ULN.
- Женщины: уровень креатинина в сыворотке >1,4×ULN.
o ALT или AST>2×ULN (допускается 1 повторный лабораторный тест).
o CPK>3×ULN (допускается 1 повторный лабораторный тест).
- Все противопоказания для протокола, требуемого для фоновой терапии (т.е. аторвастатин), или предупреждения/предостережения по применению (когда это пригодно), как показано в соответствующем National Product Labeling, который использовали для определения этих критериев исключения.
- Известная чувствительность к лекарственным средствам на основе моноклональных антител.
- Беременные или кормящие грудью женщины.
- Женщины, способные к деторождению, без эффективного способа контрацепции.
Длительность периода испытания для индивидуумов:
Длительность участия в исследовании зависела от состояния пациента при скрининге:
• Для пациентов, которых лечили аторвастатином 10 мг в стабильной дозе в течение по меньшей мере 6 недель перед скринингом, участие в испытании составляло приблизительно 17 недель, включая период скрининга в течение 1 недели, период двойного слепого лечения в течение 8 недель и период наблюдения в течение 8 недель (см. фиг. 5).
• Для пациентов, которым проводили снижающее уровень липидов лечение, отличное от аторвастатина/ или не находившихся на дозе аторвастатина 10 мг в течение по меньшей мере 6 недель перед скринингом, или не подвергавшихся воздействию лекарственных средств пациентов, участие в испытании составляло приблизительно 23 недель с периодом скрининга 7 недель (включая подготовительный период 6 недель), период двойного слепого введения 8 недель, и период наблюдения 8 недель (см. фиг.4).
Активные соединения:
Антитело 316P:
Антитело 316P представляет собой полностью человеческое антитело, содержащее HCVR, как показано в SEQ ID NO: 90, и LCVR, как показано в SEQ ID NO: 92 списка последовательностей. Последовательности CDR представлены в SEQ ID NO: 76, 78 и 80 (CDR1, CDR2, CDR3 тяжелой цепи), а также в SEQ ID NO: 84, 86 и 88 (CDR1, CDR2, CDR3 легкой цепи).
Антитело 300N:
Антитело 300N представляет собой полностью человеческое антитело, содержащее HCVR, как показано в SEQ ID NO: 218, и LCVR, как показано в SEQ ID NO: 226 списка последовательностей. Последовательности CDR представлены в SEQ ID NO: 220, 222 и 224 (CDR1, CDR2, CDR3 тяжелой цепи), а также в SEQ ID NO: 228, 230 и 232 (CDR1, CDR2, CDR3 легкой цепи).
Ветви испытания:
Ветвь 1: В первой группе пациентов проводят одну подкожную инъекцию по 1 мл каждая антитела 316P, вводимую подкожно в брюшную полость с режимом дозирования 150 мг, раз в две недели, в течение периода введения 8 недель;
Аторвастатин вводят дозе 8 мг в течение двойного слепого лечения в период 8 недель.
Аторвастатин вводят один раз в сутки в стабильной дозе 10 мг в качестве фоновой терапии.
Ветвь 2: Во второй группе пациентов проводят одну подкожную инъекцию 1 мл раствора плацебо, вводимую в брюшную полость раз в две недели, с режимом дозирования 150 мг в течение периода двойного слепого введения 8 недель;
Аторвастатин вводят один раз в сутки в стабильной дозе 10 мг в качестве фоновой терапии.
Аторвастатин вводят в дозе 80 мг (2 инкапсулированных таблетки аторвастатина 40 мг таблетки) один раз в ходе периода двойного слепого введения 8 недель.
Ветвь 3: В третьей группе пациентов проводят одну подкожную инъекцию по 1 мл каждая антитела 316P, вводимую подкожно в брюшную полость раз в две недели с режимом дозирования 150 мг, в течение периода двойного слепого введения 8 недель;
Аторвастатин вводят один раз в сутки в стабильной дозе 10 мг в качестве фоновой терапии.
Аторвастатин вводят в дозе 10 мг (1 инкапсулированная таблетка аторвастатина 10 мг + 1 соответствующая таблетка плацебо) один раз в ходе периода двойного слепого лечения 8 недель.
Первичные и ключевые вторичные результаты:
Первичные результаты:
Первичной переменной величиной эффективности является процентное изменение вычисленного LDL-C от исходного уровня до недели 8, которое определяется как: 100× (вычисленная величина LDL-C на неделе 8 - вычисленная величина LDL-C на исходном уровне)/вычисленная величина LDL-C на исходном уровне.
В случае недоступной вычисленной величины LDL-C на неделе 8, как описано выше, используют последнюю вычисленную величину LDL-C, измеренную во временном окне периода исследования эффективности и до недели 8, для приписывания вместо отсутствующей величины LDL-C на неделе 8 (методика переноса данных последнего наблюдения [LOCF]).
Ключевые вторичные результаты
Вторичные результаты эффективности представляют собой:
- Абсолютное изменение (ммоль/л и мг/дл) от исходного уровня в вычисленной величине LDL-C до недели 8, определяемое как: (вычисленная величина LDL-C на неделе 8-вычисленная величина LDL-C на исходном уровне)
- Процент пациентов с вычисленным LDL-C<70 мг/дл (1,81 ммоль/л) и <100 мг/дл (2,59 ммоль/л) на неделе 8.
- Процентное изменение ApoB от исходного уровня до недели 8
- Процентное и абсолютное (ммоль/л и мг/дл) изменение не-HDL-С от исходного уровня до недели 8.
- Процентное и абсолютное (ммоль/л и мг/дл) изменение общего холестерина от исходного уровня до недели 8.
- Процентное и абсолютное (ммоль/л и мг/дл) изменение HDL-С от исходного уровня до недели 8.
- Процентное и абсолютное (ммоль/л и мг/дл) изменение уровня триглицеридов натощак от исходного уровня до недели 8.
- Процентное изменение ApoA-1 от исходного уровня до недели 8.
- Абсолютное изменение соотношения AboB/ApoA-1 от исходного уровня до недели 8.
- Процентное изменение в Lp(a) от исходного уровня до недели 8.
Допущения при вычислении размера выборки
Ожидалось, что в это исследование будет включено приблизительно 90 пациентов.
Для выявления различия 20% в процентном изменении LDL-C от исходного уровня до недели 8 между группой 316P 150 мг + аторвастатин 80 мг и группой плацебо или 316P + аторвастатин 80 мг, предполагая 5% уровень не поддающихся оценке конечных результатов, оценивали 30 пациентов на ветвь, чтобы получить мощность 95% со стандартным отклонением 20% и с использованием двухстороннего t-критерия при уровне значимости 0,05.
Вычисления проводили с использованием nQuery Advisor 6.01.
Статистические методы
Группы для анализа
Группы для анализа эффективности
Группа для первичного анализа эффективности представляет собой модифицированную группу с намерением лечиться (mITT).
Модифицированная группа с намерением лечиться
Модифицированная группа ITT (mITT): рандомизированная группа с поддающимся оценке первичным результатом.
Первичный результат поддавался оценке, когда удовлетворялись оба из следующих условий:
- Доступность по меньшей мере одной вычисленной величины LDL-C от посещения 1 (неделя -1) и вплоть до первой в/б инъекции.
- Доступность по меньшей мере одной вычисленной величины LDL-C в ходе периода эффективности и, в пределах или до временного окна 8 недель.
Пациентов в группе mITT анализировали в соответствии с группой введения, определенной путем рандомизации.
Группа согласно протоколу
Группа согласно протоколу (PP) представляет собой подгруппу группы mITT, исключающую пациентов:
- с важными отклонениями от протокола, влияющими на исходный уровень LDL-C или оценку LDL-C на неделе 8,
- получающих запрещенную терапию, потенциально влияющую на уровни липидов в ходе периода до лечения или в ходе периода исследования эффективности до оценки первичного конечного результата
- с плохим соблюдением режима в/б введения 316P.
- с плохим соблюдением режима аторвастатина не в/б в ходе периода до лечения или с не соблюдением режима аторвастатина в/б в ходе 3 суток, предшествующих оценке первичных результатов.
Группа безопасности
Группу безопасности определяют как рандомизированную группу, в которой в действительно получили по меньшей мере одну дозу или частичную дозу 316P в/б, проанализированную согласно фактически проведенному лечению. Пациенты, которых лечили без рандомизации, не рассматриваются как рандомизированные и не включаются ни в одну из групп. Опыт безопасности у пациентов, которых лечили и не рандомизировали, описывается отдельно.
Первичный анализ эффективности
Процентное изменение от исходного уровня в вычисленном LDL-C на неделе 8-LOCF, как определено выше, анализировали в группе mITT с использованием модели ковариационного анализа (ANCOVA) с группой лечения в качестве фиксированного эффекта и исходным LDL-C в качестве ковариаты. Фактор группы лечения имел три уровня: плацебо + аторвастатин 80 мг, 316P 150 мг E2W + аторвастатин 10 мг и 316P 150 мг E2W + аторвастатин 80 мг.
Во всей модели ANCOVA группу 316P 150 мг E2W + аторвастатин 80 мг сравнивали с группой плацебо + аторвастатин 80 мг с использованием соответствующей разницы и предоставляли 95% доверительный интервал (CI) для отличий.
Не проводили формального сравнения группы 316P 150 мг E2W + аторвастатин 10 мг: предоставлялись только 95% CI для отличий против других ветвей.
Ключевой вторичный анализ эффективности
Непрерывные вторичные переменные эффективности анализировали в группе mITT с использованием той же модели ANCOVA, что и для первичного результата. Для триглицеридов и LP(a), известных тем, что они имеют негауссовское распределение, использовали ранговый способ ANCOVA.
Двоичные вторичные переменные эффективности анализировали в группе mITT с использованием модели точной условной логистической регрессией с группой лечения и исходным уровнем LDL-C в качестве эффектов.
Анализ безопасности
Анализ безопасности был основан на сообщенных неблагоприятных явлениях (AE) (при их наличии) и другой информации о безопасности, такой как клинические лабораторные данные, основные показатели жизнедеятельности и ЭКГ.
Период TEAE определяли как время от первой в/б инъекции до последней в/б инъекции + 70 суток (10 недель).
Представляющие интерес AE включали следующие показатели:
- Возможная реакция области инъекции (HLT "Реакции области инъекции")
- Возможные аллергические явления (HLGT "Аллергические состояния")
- Пациенты с LDL-C <25 мг/дл (при их наличии) или LDL-C <15 мг/дл (при их наличии).
Анализ других оцениваемых показателей
Другими результатами оценки, определенными ниже, являются переменные исследования. Они включают метаболические и воспалительные параметры:
- Абсолютное изменение HbA1c (%) от исходного уровня до недели 8
- Абсолютное изменение от исходного уровня показателя глюкозы в плазме натощак (ммоль/л) до недели 8
- Процентное изменение от исходного уровня в hs-CRP до недели 8.
Эти результаты суммировали в группе m-ITT по моментам времени с использованием описательной статистики. Временной профиль (включая величину LOCF) каждого параметра также наносили на график по группе лечения с соответствующими стандартными ошибками.
Критерий PCSA для hs-CRP также суммировали по группе лечения с использованием описательной статистики.
Результаты
Испытание 2 представляло собой многоцентровое, рандомизированное, двойное слепое, плацебо-контролируемое испытание с параллельными группами в течение 8 недель, проводимое в США для оценки эффективности и безопасности 316P у пациентов с повышенным уровнем холестерина липопротеинов низкой плотности (LDL-C) (≥ 100 мг/дл или 2,59 ммоль/л), которым вводили стабильную дозу аторвастатина 10 мг в течение по меньшей мере 6 недель. После двойного слепого периода в течение 8 недель пациентов наблюдали в ходе 8-недельного периода наблюдения.
Первичной задачей испытания была оценка эффекта 316P на уровни LDL-C по сравнению с плацебо при совместном введении с 80 мг аторвастатина после лечения в течение 8 недель у пациентов с LDL-C ≥ 100 мг/дл (≥ 2,59 ммоль/л), которых ранее лечили аторвастатином 10 мг. Оценка эффективности совместного лечения 316P с этой высокой дозой аторвастатина (80 мг) по сравнению с эффективностью совместного лечения 316P с аторвастатином 10 мг была одной из вторичных задач. Оценивали режим дозирования 150 мг раз в 2 недели (E2W) по сравнению с плацебо.
Анализы эффективности проводили на 88 пациентах (29 в группе плацебо + аторвастатин 80 мг, 29 в группе 316P 150 мг + аторвастатин 10 мг, и 30 в группе 316P 150 мг + аторвастатин 80 мг).
Демографические данные и исходные характеристики были сходными среди групп введения. Средний возраст пациентов составил 58,0 лет (25,0% пациентов были в возрасте ≥ 65 лет). Средний исходный уровень LDL-C и общего С находился в диапазоне от 3,101 ммоль/л до 3,288 ммоль/л, и от 5,447 ммоль/л до 5,200 ммоль/л, соответственно.
Эффективность:
Статистически значимое снижение процентного изменения от исходного уровня LDL-C на 8 неделе наблюдали в группе 316P 150 мг + аторвастатин 80 мг по сравнению с группой плацебо + аторвастатин 80 мг (среднеквадратичное отличие -55,8%; p < 0,0001). Вследствие негауссовского распределения и неоднородности дисперсии для первичного результата эффективности, также проводили анализ чувствительности с использованием рангового ковариационного анализа, который показал сходные результаты: оценка величины эффекта 316P 150 мг + аторвастатин 80 мг против плацебо + аторвастатин 80 мг составила -54,5%, p < 0,0001. Значительные снижения от исходного уровня наблюдали в обеих группах введения, где 316P 150 мг вводили совместно с аторвастатином со средним снижением -70,4% для группы 316P 150 мг + аторвастатин 10 мг, и -70,6% для группы 316P 150 мг + аторвастатин 80 мг по сравнению со средним снижением -26,9% в группе плацебо + аторвастатин 80 мг.
Достоверные результаты наблюдали для общего холестерина, ApoB, не HDL-С и соотношения Apo-B/ApoA-1. Для HDL-С увеличение процентного изменения от исходного уровня наблюдали в обеих группах введения, где 316P 150 мг вводили совместно с аторвастатином 10 мг или 80 мг (среднеквадратичное значение + 2,6%, и + 5,8%, соответственно) по сравнению со снижением в группе плацебо + аторвастатин 80 мг (среднеквадратичное значение -3,6%).
Безопасность:
316P хорошо переносилось в ходе лечения в течение 8 недель во всех группах лечения. Существенно, что не было отмечено изменений в уровнях тропонина во всех группах лечения.
Заключение:
Происходило статистически значимое снижение процентного изменения от исходного уровня в LDL-C через 8 недель в группе 316P 150 мг + аторвастатин 80 мг по сравнению с группой плацебо + аторвастатин 80 мг (среднеквадратичное отличие -55,8%; p < 0,0001). Была отмечена сходная величина эффекта, наблюдаемого для 316P, независимо от дозы аторвастатина (10 мг или 80 мг) с существенным снижением LDL-C при совместном введении для этих двух доз 2 аторвастатина.
Достоверные результаты наблюдали для общего ХС, ApoB, С не HDL и соотношения Apo-B/ApoA-1. Для С HDL существовала тенденция к увеличению в обеих группах лечения, где 316P 150 мг вводили совместно с аторвастатином 10 мг или 80 мг.
316P 150 мг E2W хорошо переносилось в ходе лечения в течение 8 недель во всех группах лечения. Не было отмечено конкретных сигналов безопасности.
Эффективность 316P 150 мг E2W, а также хороший профиль безопасности был подтвержден в этом испытании, независимо от вводимой дозы аторвастатина (10 мг или 80 мг).
Испытание 3
Это испытание представляет собой рандомизированное, двойное слепое, плацебо-контролируемое многоцентровое клиническое испытание с возрастающей дозой у индивидуумов с первичной гиперхолестеринемией.
Задачей этого испытания было определения того, является ли полностью человеческое моноклональное антитело к PCSK9 (316P) эффективным и безопасным либо в качестве первичного, либо в качестве вспомогательного средства для снижения LDL-C у пациентов с гетерозиготной семейной гиперхолестеринемией (HeFH) или другими формами первичной гиперхолестеринемии (не-FH). В это клиническое испытание был включен 61 взрослый либо с документально подтвержденной HeFH (n=21), либо с не-FH (n=30) на диете вместе со стабильной терапией аторвастатином (atorvaRx), или не-FH (n=10) только на диете. Индивидуумы на стабильной терапии аторвастатином имели LDL-C ≥2,6 ммоль/л и индивидуумы только на диете имели LDL-C ≥3,4 ммоль/л. 316P в дозах 50, 100 и 150 мг вводили подкожно (п/к) на сутки 1, 29 и 43. Первичным результатом была встречаемость и тяжесть возникших неблагоприятных явлений (TEAE). Первичным результатом эффективности было процентное и абсолютное изменение LDL-C в сыворотке от исходного уровня до каждого посещения. Дополнительные результаты включали аполипопротеин (apo) B, общий холестерин, ХС-ХС HDL, ХС-ЛПОНП и соотношение apoB к apoA1. Проводили скрининг 109 пациентов и 61 пациента случайным образом распределяли (14 плацебо, 47 316P) со 100% завершением 148 +/-7 суток лечения и наблюдением. По сравнению с группой не-FH, группа FH была моложе (среднее значение 40 против 52 лет), имела больше мужчин (81% против 57%) и имела более высокие дозы аторвастатина (52% на 40 мг против 3%). Исходный уровень LDL-C составлял 3,45, 2,88 и 4,46 ммоль/л в группах FH, не-FH atorvaRx и не-FH только на диете, соответственно. Лечение 316P приводило к среднему% снижению LDL-C при наибольшей дозе статинов на 57 сутки, составляющему 35,6%, 50,2% и 57,5% в дозах 50, 100 и 150 мг, соответственно, в комбинированных группах FH и не-FH. Хотя статистический анализ не проводили, по-видимому, отсутствовали отличия в ответе между индивидуумами FH и не-FH или индивидуумами FH и не-FH на терапии статинами или не на терапии статинами. Ответ на 316P представлен на фиг.1, 2 и 3. Благоприятные изменения наблюдали в ХС-HDL и apoA1. Не наблюдали тяжелых неблагоприятных явлений и лечение, как правило, хорошо переносилось. Не наблюдали связанных с лекарственным средством неблагоприятных явлений при исследовании функции печени или других лабораторных параметров.
Это испытание с первой многократной дозой для проверки концепции ингибитора PCSK9 при FH и не-FH на стабильной терапии статинами, показывает, что лечение антителом против PCSK9, таким как 316P, является перспективным вариантом терапии для пациентов с или без HeFH с повышенным уровнем холестерина на терапии статинами.
Испытание 4
Это испытание представляет собой испытание на животных эффекта в отношении снижения уровня холестерина 316P полностью человеческого блокирующего PCSK9 моноклонального антитела у самцов сирийского хомячка.
Введение
Рецептор LDL печени (LDLR) является ключевым компонентом гомеостаза холестерина. PCSK9 регулирует уровни LDLR в печени путем усиления его деградация. Транскрипция как LDLR, так и PCSK9, активируется статинами через SREBP-2, тем самым, ограничивая степень, с которой статиным могут снижать уровень холестерина LDL (LDL-C) у человека и еще в большей степени у грызунов, где статины являются неэффективными в отношения снижения LDL-C.
Задача
Целью этого испытания было исследование эффекта 316P, моноклонального антитела человека к PCSK9 человека, отдельно и в комбинации со статинами, на экспрессию LDLR печени и достигнутые эффекты на LDL-C в сыворотке.
Результаты
У хомячков однократная подкожная инъекция 316P (1/3/10 мг/кг) приводила к дозозависимому снижению LDL-C, длящемуся более 2 недель. Максимальный эффект на LDL-C (-17/-27/-60%) наблюдали в пределах 7 суток. Данные PK для 316P согласуются с дозозависимым эффектом на LDL-C. Лечение аторвастатином вплоть до максимально переносимой дозы не оказывало эффекта на экспрессию LDLR в печени и не снижало LDL-C. 316P при верхней дозе аторвастатина могло преодолеть устойчивость к статином, увеличивало экспрессию LDLR и снижало LDL-C в сыворотке. Комбинированное лечение было более эффективным, чем однократное введение 316P отдельно, хотя аторвастатин отдельно не имел эффекта.
Заключение
Ингибирование PCSK9 приводило к дозозависимому снижению LDL-C у хомячков. Однако при введении в комбинации с обычно неэффективной дозой аторвастатина, наблюдали потенциированное снижение LDL-C. Эти данные указывают на то, что нейтрализация PCSK9 является эффективной в отношении преодоления устойчивости к статинам, наблюдаемой в модели на хомячках. Эти данные согласуются с результатами в испытании фазы I у человека, где снижение LDL-C превышало 60% и длилось в течение 30 суток после однократного в/в введения. Это подтвердило, что хомячок является пригодной моделью для исследования лекарственных средств, нацеленных на PCSK9.
Испытание 5
Это испытание представляет собой рандомизированное, двойное слепое, плацебо-контролируемое, несбалансированное (2:1, 316P:плацебо) испытание с параллельными группами с открытым продолжением.
Задача(и)
Первичной задачей этого испытания является оценка длительной безопасности и переносимости 316P на протяжении основного периода лечения у пациентов с гиперхолестеринемией, имеющих риск сердечно-сосудистого заболевания, не достаточно контролируемых их лечением, снижающим уровень липидов.
Вторичными задачами являются
- Оценка долговременной безопасности и переносимости 316P на протяжении всей продолжительности испытания.
- Оценка эффекта 316P на уровни холестерина липопротеинов низкой плотности (LDL-C) после лечения в течение 12 недель по сравнению с плацебо.
- Оценка долговременной эффективности 316P в отношении уровней холестерина липопротеинов низкой плотности (LDL-C).
- Оценка эффекта 316P на уровень общего холестерина (TC), холестерина не липопротеинов высокой плотности (ХС не HDL), аполипопротеина B (ApoB), ХС-HDL, триглицеридов (TG), аполипопротеина A-1 (ApoA-1), соотношения ApoB/ApoA-1 и липопротеина a (Lp (a)) после лечения в течение 12 недель по сравнению с плацебо и после долговременного лечения
- Оценка возникновения антител против 316P.
- Оценка фармакокинетики (PK) 316P.
- Изучение эффекта 316P на определенные сердечно-сосудистые явления на протяжении основного периода лечения по сравнению с плацебо и на протяжении всего испытания.
Схема испытания
Пациентов будут стратифицировать на группу гетерозиготной семейной гиперхолестеринемии (heFH), предшествующего инфаркта миокарда (MI) или инсульта в анамнезе, высокоинтенсивной терапии статинами (т.п., аторвастатин от 40 до 80 мг каждые сутки или розувастатин от 20 до 40 мг каждые сутки) и географической области. Пациентам, случайным образом распределенных в группу 316P, будут вводить 150 мг подкожно (п/к) раз в 2 недели. Эта доза/режим дозирования, оцененные в программе 1 фазы, также являются одними из доз/режимов дозирования, оцениваемых в программе фазы 2. Для настоящего испытания введение 150 мг подкожно раз в 2 недели было выбрано в качестве дозы/режима дозирования, обеспечивающих наиболее высокую системную экспозицию 316P в диапазоне доз/режимов, которые, вероятно, будут эффективными. Эту дозу и режим можно корректировать, при необходимости, до отличающейся дозы/частоты дозирования в ходе испытания, путем изменения протокола, когда полный набор данных о поиске дозы/режима станет доступным.
Испытание состоит из:
• Периода скрининга из вплоть до 2 недель, включающего промежуточное посещение, в ходе которого пациента или другое уполномоченное лицо (такое как супруг, родственник и т.д...) будут обучать самоинъекции/инъекции плацебо.
• Двойной слепой период исследуемого лечения, составляющий 18 месяцев, с 316P или плацебо для всех пациентов.
- Главный период лечения определяют для цели первичного анализа, и это период кончается через 12 месяцев после распределения случайным образом последнего пациента в (LPI), и он включает пациентов с переменной продолжительностью двойного слепого лечения между 12 месяцами и 18 месяцами.
• Открытый период (OLP), который состоит из исследуемого лечения 316P пациентов, которые завершили двойной слепой период в течение 18 месяцев. OLP будет иметь переменную продолжительность и закончится для всех пациентов через 24 месяца после LPI или через 39 месяцев после FPI, в зависимости от того, что произойдет раньше.
• Период наблюдения (без лечения) в течение 8 недель после завершения открытого периода.
Пациенты будут проинструктированы в отношении постоянной диеты (диета NCEP-ATPIII TLC или ее эквивалент) на протяжении всей длительности испытания после скрининга. Доза статина, а также доза другого снижающего уровень липидов способа(ов) лечения (если они применимы) должны быть стабильными на протяжении всей длительности испытания. В ходе двойного слепого периода в определенных условиях допускается модификация. В ходе открытого периода модификация основывается на мнении исследователя. Фибраты, отличные от фенофибрата, не допустимы в ходе испытания. Параметры липидов будут скрыты в ходе двойного слепого периода.
Исследуемая группа:
Критерии включения
Либо A, либо B, ниже, И не достаточно контролируемые с помощью максимально переносимой дозы статина в течение по меньшей мере 6 недель до скринингового посещения (неделя -2) с другой терапией, снижающей уровень липидов (LLT), или без нее.
A) Пациенты с гетерозиготной семейной гиперхолестеринемией (heFH)
ИЛИ
B) Пациенты с несемейной гиперхолестеринемией (не-FH) с развернутой коронарной болезнью сердца (CHD) или эквивалентами с риском CHD
Примечание:
- Все типы фоновой LLT, включая терапию, отличную от терапии статинами, должны быть в стабильной дозе в течение по меньшей мере 6 недель перед скрининговым посещением (неделя -2).
- Единственными статинами, которые допустимы при включении в испытании, являются симвастатин, аторвастатин и розувастатин, принимаемые каждые сутки.
- Пациенты пригодны для включения в испытание, если они находятся на максимально переносимой дозе статина, даже если она не является высокоинтенсивной. Максимально переносимую дозу статина определяют как любую суточную дозу симвастатина, аторвастатина и розувастатина, которая максимально переносится. Высокоинтенсивную дозу статина определяют как аторвастатин от 40 до 80 мг каждые сутки или розувастатин от 20 до 40 мг каждые сутки.
- Если пациент не находится на высокоинтенсисной дозе статина в ходе скрининга, тогда причина должна быть задокументирована (т.е. миалгии, аномалии ферментов печени и т.д.).
- Если при скрининге (посещение на неделе -2) LDL-C составляет ≥160 мг/дл (4,14 ммоль/л), пациентам в прошлом должна была быть предложена другая LLT в дополнение к их максималььно переносимой дозе статина. Кроме того, если пациенты находятся только на максимально переносимой терапии статинами, тогда должна быть задокументирована причина; такие пациенты, тем не менее, являются пригодными для включения в испытание и не исключаются.
- Суточные дозы выше симвастатина 80 мг, аторвастатина 80 мг или розувастатина 40 мг не допустимы для включения в испытание.
- Симвастатин 80 мг следует применять только у пациентов, которые принимали эту дозу в течение 12 месяцев или более без признаков повреждения мышц (миопатия) и его не следует начинать у новых пациентов, включая пациентов, уже принимающих более низкие дозы этого лекарственного средства.
- Назначение другого LLT должно согласовываться с National Product Label.
Ключевые критерии исключения
• LDL-C <70 мг/дл (<1,8 ммоль/л) при скрининговом посещении (неделя -2).
• TG >350 мг/дл (>3,95 ммоль/л) при скрининговом посещении (неделя -2)
• Применение фибратов, отличных от фенофибрата, в пределах 6 недель перед скрининговым посещением (неделя -2) или планирование применять их.
Общее ожидаемое количество пациентов:
Приблизительно 2100 случайным образом распределенных пациентов (1400:700, 316P:плацебо)
Исследуемое лечение(я)
Исследуемый медицинский продукт(ы): Антитело 316P и плацебо для 316P
Антитело 316P представляет собой полностью человеческое антитело, содержащее HCVR, как показано в SEQ ID NO: 90, и LCVR, как показано в SEQ ID NO: 92 списка последовательностей. Последовательности CDR представлены в SEQ ID NO: 76, 78 и 80 (CDR1, CDR2, CDR3 тяжелой цепи), а также в SEQ ID NO: 84, 86 и 88 (CDR1, CDR2, CDR3 легкой цепи).
Альтернативно испытание можно проводить с антителом 300N (соединение-дублер) вместо антитела 316P. Антитело 300N представляет собой полностью человеческое антитело, содержащее HCVR, как показано в SEQ ID NO: 218, и LCVR, как показано в SEQ ID NO: 226 списка последовательностей. Последовательности CDR показаны в SEQ ID NO: 220, 222 и 224 (CDR1, CDR2, CDR3 тяжелой цепи), а также в SEQ ID NO: 228, 230 и 232 (CDR1, CDR2, CDR3 легкой цепи).
Состав
Предварительно заполненные шприцы: 316P 150 мг/мл или плацебо для 316P.
Путь(и) введения:
- Подкожный (п/к)
- Объем инъекции: 1 мл в целом для дозы 150 мг
- Одна инъекция 1 мл подкожно в брюшную полость, бедро или наружную область верхнего отдела плеча (т.е., область дельтовидной мышцы).
Режим дозирования: Доза 150 мг раз в 2 недели
Первичный и вторичный результат(ы)
Первичный результат:
Параметры безопасности (неблагоприятные явления [включая определенные сердечно-сосудистые явления], лабораторные данные, основные показатели жизнедеятельности и ЭКГ), оцененные на протяжении основного периода лечения.
Основные вторичные результаты:
- Параметры безопасности (неблагоприятные явления [включая определенные сердечно-сосудистые явления], лабораторные данные, основные показатели жизнедеятельности и ЭКГ), оцениваемые на протяжении всего испытания
- Процентное изменение LDL-C от исходного уровня до недели 12 (в качестве основного момента времени).
- Антитела против 316P
- концентрации 316P в сыворотке
График проведения оценки
Оценка пациентов в период скрининга:
- Посещение участка: неделя -2 (скрининговое посещение), неделя -1 (посещение для обучения инъекции).
Оценка пациентов в двойной слепой период:
- Посещения участка: неделя 0 (посещение для рандомизации = исходный уровень), неделя 4, неделя 8, неделя 12, неделя 16, неделя 24, неделя 36, неделя 52/месяц 12, неделя 64/месяц 15, неделя 78/месяц 18 (конец двойного слепого периода).
- Телефонные звонки: неделя 2*, неделя 20, неделя 28, неделя 32, неделя 40, неделя 44, неделя 48, неделя 56, неделя 60, неделя 68, неделя 72 и неделя 76.
*Примечание: неделя 2 может стать посещением участка для дополнительного обучения инъекции с помощью предполагаемой графиком инъекции пациенту из набора для двойного слепого исследуемого лечения, выданного IVRS, при необходимости.
Оценка пациентов в открытом периоде:
- Посещения участка: каждые 12 недель после окончания посещения двойного слепого периода и до окончания посещения открытого периода.
- Телефонные звонки: каждые 4 недели между посещениями участка.
Примечание: в ходе испытания путем постоянных анализов безопасности, Data Monitoring Committee (DMC) будет оценивать достаточность частоты посещений и соответствующих процедур для открытого периода и делать соответствующие рекомендации.
Оценки пациентов в период наблюдения:
- Посещение участка: через 8 недель после окончания посещения открытого периода.
Статистическая оценка
Для оценки безопасности размер выборки 2100 пациентов (соотношение для рандомизации 2:1, т.е., 316P: 1400 и плацебо: 700) позволит иметь долговременные данные безопасности в широкой базе данных. При этом размере выборки ожидается, что 1050 и 364 пациентов будут подвергнуты воздействию 316P в течение минимум 12 месяцев и 18 месяцев, соответственно, во время первичного анализа (12 месяцев после включения последнего пациента). Более того, при наличии 1400 пациентов, которым вводят 316P, неблагоприятные явления с частотой ≥0,002 будут выявлены с 95% доверительным интервалом.
Факторы стратификации включают группу heFH, предшествующий MI или инсульт в анамнезе, высокоинтенсивную дозу статина и географическую область (Северная Америка, Западная Европа, Восточная Европа, остальные части мира).
Обобщение переменных безопасности будет проведено на основе группы безопасности. Группа безопасности состоит из рандомизированной группы, в которой в действительности вводили по меньшей мере одну дозу или частичную дозу Investigational Medicinal Product (IMP), проанализированной согласно фактически проведенному лечению.
Описательную статистку будут использовать для обобщения переменных безопасности из этого испытания. Для неблагоприятных явлений в дополнение к обобщающим таблицам, представленным с необработанными частотами, будет предоставлена таблица всех TEAE с использованием скорректированных уровней встречаемости пациент-год. При выявлении какого-либо клинически значимого сигнала и необходимости в дальнейшей охарактеризации, или для представляющего интерес неблагоприятного явления или потенциально клинически значимой аномалии (PCSA), будут проводить анализ времени до возникновения явления с использованием методологии Каплана-Мейера. Более того, будет предоставлена частота представляющего интерес неблагоприятного явления или PCSA с течением времени. Первичный анализ безопасности будут проводить на явлениях безопасности, которые могут приписаны проведению двойного слепого лечения в ходе основного периода лечения. Вторичный анализ безопасности будут проводить на явлениях безопасности, наблюдаемых в ходе двойного слепого периода и открытого периода.
Группа для анализа эффективности будет представлять собой модифицированную группу с намерением лечиться (mITT), определяемую как группа ITT (т.е. рандомизированная группа) с поддающимся оценке результатом LDL-C. Этот результат будет считаться поддающимся оценке, когда удовлетворяются оба из следующих условий:
• Доступна исходная величина LDL-C.
• Доступна по меньшей мере одна величина LDL-C, полученная в основной период исследования эффективности.
Основной период исследования эффективности будут определять как:
• Время от первой инъекции IMP (исключая обучающую инъекцию) вплоть до 21 суток после последней инъекции IMP для пациентов, которые бессрочно прекратят IMP до недели 12.
• Время от первой инъекции IMP (исключая обучающую инъекцию) вплоть до 12 недели для пациентов, которых лечили в течение по меньшей мере 12 недель.
Пациентов в группе mITT будут анализировать в соответствии с группой лечения, определяемой путем рандомизации.
Процентное изменение LDL-C от исходного уровня до недели 12 (главный вторичный результат) и в другие моменты времени на протяжении испытания (другие вторичные результаты) будут анализировать с использованием модели ковариационного анализа (ANCOVA) с группой лечения и каждым фактором стратификации (группа heFH, предшествующий MI или инсульт в анамнезе, высокоинтенсивная доза статина, область) в качестве фиксированного эффекта и исходного уровня LDL-C ковариаты. Фактор группы лечения будет иметь 2 уровня: плацебо и 316P. Во всей модели ANCOVA группу 316P будут сравнивать с плацебо с использованием соответствующей разницы, и будут предоставлять 95% CI отличий.
В случае отсутствия величины LDL-C при лечении на 12 неделе, будут использовать принцип переноса данных последнего наблюдения (LOCF).
Длительность периода испытания (на пациента)
Длительность испытания для каждого пациента является переменной. Максимальная длительность испытания включает вплоть до 2 недель периода скрининга, 18 месяцев исследуемого лечения в ходе двойного слепого периода, вплоть до 21 месяца лечения 316P в открытом периоде (в зависимости от того, когда пациента рандомизировали в испытание и длительности набора) и 8 недель периода наблюдения. Таким образом, максимальная длительность испытания составляет вплоть до ~42 месяцев для первого пациента, рандомизированного в испытание, и вплоть до ~27 месяцев для последнего пациента, рандомизированного в испытание.
Испытание 6
Рандомизированное, двойное слепое, многодозовое, плацебо-контролируемое испытание у 75-пациентов с гетерозиготной семейной гиперхолестеринемией (heFH). В этом испытании пациенты должны удовлетворять критериям Всемирной Организации Здравоохранения для heFH, быть на стабильном ежесуточном режиме статинов в течение по меньшей мере 6 недель до включения в испытание и иметь уровни LDL-C в сыворотке ≥100 мг/дл. Пациентам позволяли принимать эзетимиб в дополнение к статину каждые сутки. Первичным результатом испытания является изменение холестерина LDL от исходного уровня по сравнению с плацебо на протяжении периода испытания 12 недель.
Промежуточный анализ испытания 6 у пациентов с гетерозиготной семейной гиперхолестеринемией с повышенным уровнем холестерина (LDL-C ≥100 мг/дл) на стабильных дозах статинов с эзетимибом или без него продемонстрировал, что пациенты, которых лечили 316P каждые две или четыре недели, достигли значительно более высокого среднего снижения LDL-C через 12 недель по сравнению с пациентами, которых лечили плацебо. Пациенты, которых лечили различными дозами 316P, достигли среднего снижения LDL-C от приблизительно 30% до более чем 60% от исходного уровня через 12 недель по сравнению с 10% снижением в случае плацебо (p<0,01), что было первичным результатом испытания. Промежуточный анализ проводили, когда все пациенты достигли первичного результата через 12 недель.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> SANOFI
<120> АНТИТЕЛА ЧЕЛОВЕКА К PCSK9 ДЛЯ ПРИМЕНЕНИЯ В СПОСОБАХ ЛЕЧЕНИЯ
КОНКРЕТНЫХ ГРУПП ИНДИВИДУУМОВ
<130> DE2011-013
<160> 758
<170> FastSEQ для Windows Version 4.0
<210> 1
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 1
caggtccagc tggtgcagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt tactctaagt agttacgaca tgcactgggt ccgccaatct 120
acaggaaaag gtctggagtg ggtctcagct attggttcta ccggtgacac atactatcca 180
ggctccgtga agggccgatt caccatcacc agagaaaaag ccaagaactc cgtgtatctt 240
caaatgaaca gcctgagagc cggggacacg gctgtgtatt actgtgtaag agaggggtgg 300
gaggtaccct ttgactactg gggccaggga accctggtca ctgtctcctc a 351
<210> 2
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 2
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Leu Ser Ser Tyr
20 25 30
Asp Met His Trp Val Arg Gln Ser Thr Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Gly Ser Thr Gly Asp Thr Tyr Tyr Pro Gly Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Thr Arg Glu Lys Ala Lys Asn Ser Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Gly Asp Thr Ala Val Tyr Tyr Cys Val
85 90 95
Arg Glu Gly Trp Glu Val Pro Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 3
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 3
ggatttactc taagtagtta cgac 24
<210> 4
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 4
Gly Phe Thr Leu Ser Ser Tyr Asp
1 5
<210> 5
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 5
attggttcta ccggtgacac a 21
<210> 6
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 6
Ile Gly Ser Thr Gly Asp Thr
1 5
<210> 7
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 7
gtaagagagg ggtgggaggt accctttgac tac 33
<210> 8
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 8
Val Arg Glu Gly Trp Glu Val Pro Phe Asp Tyr
1 5 10
<210> 9
<211> 327
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 9
gacatccaga tgacccagtc tccagccacc ctgtctgtgt ctccagggga aagagccgcc 60
ctctcctgca gggccagtca gagtgttagc agcaacttag cctggtacca ccagaaacct 120
ggccaggctc ccaggctcct catctatggt gcatccacca gggccactgg tatcccagcc 180
aggttcagtg gcattgggtc tgggacagag ttcactctca ttatcagcag cctgcagtct 240
gaagattttg cattttattt ctgtcagcag tataataact ggcctccatt cactttcggc 300
cctgggacca aggtggagat caaacga 327
<210> 10
<211> 109
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 10
Asp Ile Gln Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Ala Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Leu Ala Trp Tyr His Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ile Gly Ser Gly Thr Glu Phe Thr Leu Ile Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Phe Tyr Phe Cys Gln Gln Tyr Asn Asn Trp Pro Pro
85 90 95
Phe Thr Phe Gly Pro Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 11
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 11
cagagtgtta gcagcaac 18
<210> 12
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 12
Gln Ser Val Ser Ser Asn
1 5
<210> 13
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 13
ggtgcatcc 9
<210> 14
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 14
Gly Ala Ser
1
<210> 15
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 15
cagcagtata ataactggcc tccattcact 30
<210> 16
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 16
Gln Gln Tyr Asn Asn Trp Pro Pro Phe Thr
1 5 10
<210> 17
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 17
gaggtgcagc tggtggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt tactctaagt agttacgaca tgcactgggt ccgccaatct 120
acaggaaaag gtctggagtg ggtctcagct attggttcta ccggtgacac atactatcca 180
ggctccgtga agggccgatt caccatcacc agagaaaaag ccaagaactc cgtgtatctt 240
caaatgaaca gcctgagagc cggggacacg gctgtgtatt actgtgtaag agaggggtgg 300
gaggtaccct ttgactactg gggccaggga accctggtca ccgtctcctc a 351
<210> 18
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 18
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Leu Ser Ser Tyr
20 25 30
Asp Met His Trp Val Arg Gln Ser Thr Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Gly Ser Thr Gly Asp Thr Tyr Tyr Pro Gly Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Thr Arg Glu Lys Ala Lys Asn Ser Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Gly Asp Thr Ala Val Tyr Tyr Cys Val
85 90 95
Arg Glu Gly Trp Glu Val Pro Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 19
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 19
gaaatagtga tgacgcagtc tccagccacc ctgtctgtgt ctccagggga aagagccgcc 60
ctctcctgca gggccagtca gagtgttagc agcaacttag cctggtacca ccagaaacct 120
ggccaggctc ccaggctcct catctatggt gcatccacca gggccactgg tatcccagcc 180
aggttcagtg gcattgggtc tgggacagag ttcactctca ttatcagcag cctgcagtct 240
gaagattttg cattttattt ctgtcagcag tataataact ggcctccatt cactttcggc 300
cctgggacca aagtggatat caaa 324
<210> 20
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 20
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Ala Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Leu Ala Trp Tyr His Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ile Gly Ser Gly Thr Glu Phe Thr Leu Ile Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Phe Tyr Phe Cys Gln Gln Tyr Asn Asn Trp Pro Pro
85 90 95
Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 21
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 21
gaggtgcagc tggtggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt tactctaagt agttacgaca tgcactgggt ccgccaagct 120
acaggaaaag gtctggagtg ggtctcagct attggttcta ccggtgacac atactatcca 180
ggctccgtga agggccgatt caccatctcc agagaaaatg ccaagaactc cttgtatctt 240
caaatgaaca gcctgagagc cggggacacg gctgtgtatt actgtgtaag agaggggtgg 300
gaggtaccct ttgactactg gggccaggga accctggtca ccgtctcctc a 351
<210> 22
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 22
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Leu Ser Ser Tyr
20 25 30
Asp Met His Trp Val Arg Gln Ala Thr Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Gly Ser Thr Gly Asp Thr Tyr Tyr Pro Gly Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Glu Asn Ala Lys Asn Ser Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Gly Asp Thr Ala Val Tyr Tyr Cys Val
85 90 95
Arg Glu Gly Trp Glu Val Pro Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 23
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 23
gaaatagtga tgacgcagtc tccagccacc ctgtctgtgt ctccagggga aagagccacc 60
ctctcctgca gggccagtca gagtgttagc agcaacttag cctggtacca gcagaaacct 120
ggccaggctc ccaggctcct catctatggt gcatccacca gggccactgg tatcccagcc 180
aggttcagtg gcagtgggtc tgggacagag ttcactctca ccatcagcag cctgcagtct 240
gaagattttg cagtttatta ctgtcagcag tataataact ggcctccatt cactttcggc 300
cctgggacca aagtggatat caaa 324
<210> 24
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 24
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Asn Trp Pro Pro
85 90 95
Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 25
<211> 342
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 25
caggtgcagc tggtgcagtc tgggggaggc gtggtccagc ctgggaggtc cctgagactc 60
tcctgtgcag cgtctggatt caccttcagt agctatggca tgcactgggt ccgccaggct 120
ccaggcaagg ggctggagtg ggtggcgttt ataggatttg atggaagtaa tatacattat 180
ggagactccg tgaggggccg aatcatcata tccagagaca attccgagaa cacgttgtat 240
ctggaaatga acagcctgag agccgaggac acggcaatgt actattgtgc gagagagaag 300
ggtttagact ggggccaggg aaccacggtc accgtctcct ca 342
<210> 26
<211> 114
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 26
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Gly Phe Asp Gly Ser Asn Ile His Tyr Gly Asp Ser Val
50 55 60
Arg Gly Arg Ile Ile Ile Ser Arg Asp Asn Ser Glu Asn Thr Leu Tyr
65 70 75 80
Leu Glu Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Glu Lys Gly Leu Asp Trp Gly Gln Gly Thr Thr Val Thr Val
100 105 110
Ser Ser
<210> 27
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 27
ggattcacct tcagtagcta tggc 24
<210> 28
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 28
Gly Phe Thr Phe Ser Ser Tyr Gly
1 5
<210> 29
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 29
ataggatttg atggaagtaa tata 24
<210> 30
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 30
Ile Gly Phe Asp Gly Ser Asn Ile
1 5
<210> 31
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 31
gcgagagaga agggtttaga c 21
<210> 32
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 32
Ala Arg Glu Lys Gly Leu Asp
1 5
<210> 33
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 33
gccatccaga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggccagtca gagtattagt agctggttgg cctggtatca gcagaaacca 120
gggaaagccc ctaagctcct gatctataag gcgtctagtt tagaaagtgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagaa ttcactctca ccatcagcag cctgcagcct 240
gatgattttg caacttatta ctgccaacag tataatagtt attacacttt tggccagggg 300
accaaggtgg aaatcaaacg a 321
<210> 34
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 34
Ala Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Tyr Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 35
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 35
cagagtatta gtagctgg 18
<210> 36
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 36
Gln Ser Ile Ser Ser Trp
1 5
<210> 37
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 37
aaggcgtct 9
<210> 38
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 38
Lys Ala Ser
1
<210> 39
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 39
caacagtata atagttatta cact 24
<210> 40
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 40
Gln Gln Tyr Asn Ser Tyr Tyr Thr
1 5
<210> 41
<211> 342
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 41
caggtgcagc tggtggagtc tgggggaggc gtggtccagc ctgggaggtc cctgagactc 60
tcctgtgcag cgtctggatt caccttcagt agctatggca tgcactgggt ccgccaggct 120
ccaggcaagg ggctggagtg ggtggcgttt ataggatttg atggaagtaa tatacattat 180
ggagactccg tgaggggccg aatcatcata tccagagaca attccgagaa cacgttgtat 240
ctggaaatga acagcctgag agccgaggac acggcaatgt actattgtgc gagagagaag 300
ggtttagact ggggccaggg aaccctggtc accgtctcct ca 342
<210> 42
<211> 114
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 42
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Gly Phe Asp Gly Ser Asn Ile His Tyr Gly Asp Ser Val
50 55 60
Arg Gly Arg Ile Ile Ile Ser Arg Asp Asn Ser Glu Asn Thr Leu Tyr
65 70 75 80
Leu Glu Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Glu Lys Gly Leu Asp Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 43
<211> 318
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 43
gacatccaga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggccagtca gagtattagt agctggttgg cctggtatca gcagaaacca 120
gggaaagccc ctaagctcct gatctataag gcgtctagtt tagaaagtgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagaa ttcactctca ccatcagcag cctgcagcct 240
gatgattttg caacttatta ctgccaacag tataatagtt attacacttt tggccagggg 300
accaagctgg agatcaaa 318
<210> 44
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 44
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Tyr Thr
85 90 95
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 45
<211> 342
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 45
caggtgcagc tggtggagtc tgggggaggc gtggtccagc ctgggaggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt agctatggca tgcactgggt ccgccaggct 120
ccaggcaagg ggctggagtg ggtggcagtt ataggatttg atggaagtaa tatatactat 180
gcagactccg tgaagggccg attcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agctgaggac acggctgtgt attactgtgc gagagagaag 300
ggtttagact ggggccaggg aaccctggtc accgtctcct ca 342
<210> 46
<211> 114
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 46
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Gly Phe Asp Gly Ser Asn Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Lys Gly Leu Asp Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 47
<211> 319
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 47
gacatccaga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggccagtca gagtattagt agctggttgg cctggtatca gcagaaacca 120
gggaaagccc ctaagctcct gatctataag gcgtctagtt tagaaagtgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagaa ttcactctca ccatcagcag cctgcagcct 240
gatgattttg caacttatta ctgccaacag tataatagtt attacacttt tggccagggg 300
accaagctgg agatcaaac 319
<210> 48
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 48
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Tyr Thr
85 90 95
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 49
<211> 342
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 49
caggtgcagc tgcaggagtc tgggggaggc gtggtccagc ctgggaggtc cctgagactc 60
tcctgtgcag cgtctggatt caccttcagt agctatggca tgcactgggt ccgccaggct 120
ccaggcaagg ggctggagtg ggtggcgttt ataggatttg atggaagtaa tatatattat 180
ggagactccg tgaggggccg aatcatcata tccagagaca attccgagaa cacgttgtat 240
ctggaaatga acagcctgag agccgaggac acggcagtgt attattgtgc gagagagaag 300
ggtttagact ggggccaggg aaccctggtc actgtctcct ca 342
<210> 50
<211> 114
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 50
Gln Val Gln Leu Gln Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Gly Phe Asp Gly Ser Asn Ile Tyr Tyr Gly Asp Ser Val
50 55 60
Arg Gly Arg Ile Ile Ile Ser Arg Asp Asn Ser Glu Asn Thr Leu Tyr
65 70 75 80
Leu Glu Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Lys Gly Leu Asp Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 51
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 51
ggattcacct tcagtagcta tggc 24
<210> 52
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 52
Gly Phe Thr Phe Ser Ser Tyr Gly
1 5
<210> 53
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 53
ataggatttg atggaagtaa tata 24
<210> 54
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 54
Ile Gly Phe Asp Gly Ser Asn Ile
1 5
<210> 55
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 55
gcgagagaga agggtttaga c 21
<210> 56
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 56
Ala Arg Glu Lys Gly Leu Asp
1 5
<210> 57
<211> 342
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 57
gccatccaga tgacccagtc tccagactcc ctggctgtgt ctctgggcga gagggccacc 60
atcaactgca agtccagcca gagtgttttt cacacctcca acaataagaa ctacttagtt 120
tggtatcagc agaaaccagg acagcctcct aagttgctcc tttactgggc ctctacccgg 180
gaatccgggg tccctgaccg attcagtggc agcgggtctg ggacagattt cactctcacc 240
atcagcagcc tgcaggctga agatgtggca aattattact gtcaccaata ttacagtatt 300
ccgtggacgt tcggccaagg gaccaaggtg gagatcaaac ga 342
<210> 58
<211> 114
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 58
Ala Ile Gln Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Phe His Thr
20 25 30
Ser Asn Asn Lys Asn Tyr Leu Val Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Leu Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Asn Tyr Tyr Cys His Gln
85 90 95
Tyr Tyr Ser Ile Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg
<210> 59
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 59
cagagtgttt ttcacacctc caacaataag aactac 36
<210> 60
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 60
Gln Ser Val Phe His Thr Ser Asn Asn Lys Asn Tyr
1 5 10
<210> 61
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 61
tgggcctct 9
<210> 62
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 62
Trp Ala Ser
1
<210> 63
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 63
caccaatatt acagtattcc gtggacg 27
<210> 64
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 64
His Gln Tyr Tyr Ser Ile Pro Trp Thr
1 5
<210> 65
<211> 342
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 65
caggtgcagc tggtggagtc tgggggaggc gtggtccagc ctgggaggtc cctgagactc 60
tcctgtgcag cgtctggatt caccttcagt agctatggca tgcactgggt ccgccaggct 120
ccaggcaagg ggctggagtg ggtggcgttt ataggatttg atggaagtaa tatatattat 180
ggagactccg tgaggggccg aatcatcata tccagagaca attccgagaa cacgttgtat 240
ctggaaatga acagcctgag agccgaggac acggcagtgt attattgtgc gagagagaag 300
ggtttagact ggggccaggg aaccctggtc accgtctcct ca 342
<210> 66
<211> 114
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 66
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Gly Phe Asp Gly Ser Asn Ile Tyr Tyr Gly Asp Ser Val
50 55 60
Arg Gly Arg Ile Ile Ile Ser Arg Asp Asn Ser Glu Asn Thr Leu Tyr
65 70 75 80
Leu Glu Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Lys Gly Leu Asp Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 67
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 67
gacatcgtga tgacccagtc tccagactcc ctggctgtgt ctctgggcga gagggccacc 60
atcaactgca agtccagcca gagtgttttt cacacctcca acaataagaa ctacttagtt 120
tggtatcagc agaaaccagg acagcctcct aagttgctcc tttactgggc ctctacccgg 180
gaatccgggg tccctgaccg attcagtggc agcgggtctg ggacagattt cactctcacc 240
atcagcagcc tgcaggctga agatgtggca aattattact gtcaccaata ttacagtatt 300
ccgtggacgt tcggccaagg gaccaaggtg gaaatcaaa 339
<210> 68
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 68
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Phe His Thr
20 25 30
Ser Asn Asn Lys Asn Tyr Leu Val Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Leu Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Asn Tyr Tyr Cys His Gln
85 90 95
Tyr Tyr Ser Ile Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
<210> 69
<211> 342
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 69
caggtgcagc tggtggagtc tgggggaggc gtggtccagc ctgggaggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt agctatggca tgcactgggt ccgccaggct 120
ccaggcaagg ggctggagtg ggtggcagtt ataggatttg atggaagtaa tatatactat 180
gcagactccg tgaagggccg attcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agctgaggac acggctgtgt attactgtgc gagagagaag 300
ggtttagact ggggccaggg aaccctggtc accgtctcct ca 342
<210> 70
<211> 114
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 70
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Gly Phe Asp Gly Ser Asn Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Lys Gly Leu Asp Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 71
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 71
gacatcgtga tgacccagtc tccagactcc ctggctgtgt ctctgggcga gagggccacc 60
atcaactgca agtccagcca gagtgttttt cacacctcca acaataagaa ctacttagct 120
tggtaccagc agaaaccagg acagcctcct aagctgctca tttactgggc ctctacccgg 180
gaatccgggg tccctgaccg attcagtggc agcgggtctg ggacagattt cactctcacc 240
atcagcagcc tgcaggctga agatgtggca gtttattact gtcaccaata ttacagtatt 300
ccgtggacgt tcggccaagg gaccaaggtg gaaatcaaa 339
<210> 72
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 72
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Phe His Thr
20 25 30
Ser Asn Asn Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys His Gln
85 90 95
Tyr Tyr Ser Ile Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
<210> 73
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 73
gaagtgcagc tggtgcagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttaac aactatgcca tgaactgggt ccgccaggct 120
ccaggaaagg gactggactg ggtctcaact attagtggta gcggtggtac tacaaactac 180
gcagactccg tgaagggccg tttcattatt tcccgagaca gttccaaaca cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtat attactgtgc gaaagattct 300
aactggggaa atttcgatct ctggggccgt ggcaccacgg tcactgtctc ctca 354
<210> 74
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 74
Glu Val Gln Leu Val Gln Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Asn Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Asp Trp Val
35 40 45
Ser Thr Ile Ser Gly Ser Gly Gly Thr Thr Asn Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Ile Ile Ser Arg Asp Ser Ser Lys His Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Ser Asn Trp Gly Asn Phe Asp Leu Trp Gly Arg Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 75
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 75
ggattcacct ttaacaacta tgcc 24
<210> 76
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 76
Gly Phe Thr Phe Asn Asn Tyr Ala
1 5
<210> 77
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 77
attagtggta gcggtggtac taca 24
<210> 78
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 78
Ile Ser Gly Ser Gly Gly Thr Thr
1 5
<210> 79
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 79
gcgaaagatt ctaactgggg aaatttcgat ctc 33
<210> 80
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 80
Ala Lys Asp Ser Asn Trp Gly Asn Phe Asp Leu
1 5 10
<210> 81
<211> 342
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 81
gacatccaga tgacccagtc tccagactcc ctggctgtgt ctctgggcga gagggccacc 60
atcaactgca agtccagcca gagtgtttta tacaggtcca acaataggaa cttcttaggt 120
tggtaccagc agaaaccagg gcagcctcct aatctactca tttactgggc atctacccgg 180
gaatccgggg tccctgaccg attcagtggc agcgggtctg ggacagattt cactctcacc 240
atcagcagcc tgcaggctga agatgtggca gtttattact gtcaacaata ttatactact 300
ccgtacactt ttggccaggg gaccaaggtg gaaatcaaac ga 342
<210> 82
<211> 114
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 82
Asp Ile Gln Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Arg
20 25 30
Ser Asn Asn Arg Asn Phe Leu Gly Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Asn Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Thr Thr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg
<210> 83
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 83
cagagtgttt tatacaggtc caacaatagg aacttc 36
<210> 84
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 84
Gln Ser Val Leu Tyr Arg Ser Asn Asn Arg Asn Phe
1 5 10
<210> 85
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 85
tgggcatct 9
<210> 86
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 86
Trp Ala Ser
1
<210> 87
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 87
caacaatatt atactactcc gtacact 27
<210> 88
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 88
Gln Gln Tyr Tyr Thr Thr Pro Tyr Thr
1 5
<210> 89
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 89
gaggtgcagc tggtggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttaac aactatgcca tgaactgggt ccgccaggct 120
ccaggaaagg gactggactg ggtctcaact attagtggta gcggtggtac tacaaactac 180
gcagactccg tgaagggccg tttcattatt tcccgagaca gttccaaaca cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtat attactgtgc gaaagattct 300
aactggggaa atttcgatct ctggggccgt ggcaccctgg tcactgtctc ctca 354
<210> 90
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 90
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Asn Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Asp Trp Val
35 40 45
Ser Thr Ile Ser Gly Ser Gly Gly Thr Thr Asn Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Ile Ile Ser Arg Asp Ser Ser Lys His Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Ser Asn Trp Gly Asn Phe Asp Leu Trp Gly Arg Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 91
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 91
gacatcgtga tgacccagtc tccagactcc ctggctgtgt ctctgggcga gagggccacc 60
atcaactgca agtccagcca gagtgtttta tacaggtcca acaataggaa cttcttaggt 120
tggtaccagc agaaaccagg gcagcctcct aatctactca tttactgggc atctacccgg 180
gaatccgggg tccctgaccg attcagtggc agcgggtctg ggacagattt cactctcacc 240
atcagcagcc tgcaggctga agatgtggca gtttattact gtcaacaata ttatactact 300
ccgtacactt ttggccaggg gaccaagctg gagatcaaa 339
<210> 92
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 92
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Arg
20 25 30
Ser Asn Asn Arg Asn Phe Leu Gly Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Asn Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Thr Thr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile
100 105 110
<210> 93
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 93
gaggtgcagc tggtggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttaac aactatgcca tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagct attagtggta gcggtggtac tacatactac 180
gcagactccg tgaagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtat attactgtgc gaaagattct 300
aactggggaa atttcgatct ctggggccgt ggcaccctgg tcactgtctc ctca 354
<210> 94
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 94
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Asn Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Thr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Ser Asn Trp Gly Asn Phe Asp Leu Trp Gly Arg Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 95
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 95
gacatcgtga tgacccagtc tccagactcc ctggctgtgt ctctgggcga gagggccacc 60
atcaactgca agtccagcca gagtgtttta tacaggtcca acaataggaa cttcttagct 120
tggtaccagc agaaaccagg acagcctcct aagctgctca tttactgggc atctacccgg 180
gaatccgggg tccctgaccg attcagtggc agcgggtctg ggacagattt cactctcacc 240
atcagcagcc tgcaggctga agatgtggca gtttattact gtcaacaata ttatactact 300
ccgtacactt ttggccaggg gaccaagctg gagatcaaa 339
<210> 96
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 96
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Arg
20 25 30
Ser Asn Asn Arg Asn Phe Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Thr Thr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile
100 105 110
<210> 97
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 97
caggtgcagc tggtgcagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag tctctggatt caccctcagt agctacgata tgcactgggt ccgccaacct 120
acaggaaaag gtctggagtg ggtctcagct attggttcta ctggtgacac atactatcca 180
ggctccgtga agggccgatt caccatctcc agagaaaatg ccaagaactc cttgtatctt 240
caaatgaaca gcctgagagc cggggacacg gctgtgtatt actgtgcaag agagggatgg 300
gacgtaccct ttgacttctg gggccaggga accctggtca ccgtctcctc a 351
<210> 98
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 98
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Thr Leu Ser Ser Tyr
20 25 30
Asp Met His Trp Val Arg Gln Pro Thr Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Gly Ser Thr Gly Asp Thr Tyr Tyr Pro Gly Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Glu Asn Ala Lys Asn Ser Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Gly Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Gly Trp Asp Val Pro Phe Asp Phe Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 99
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 99
ggattcaccc tcagtagcta cgat 24
<210> 100
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 100
Gly Phe Thr Leu Ser Ser Tyr Asp
1 5
<210> 101
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 101
attggttcta ctggtgacac a 21
<210> 102
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 102
Ile Gly Ser Thr Gly Asp Thr
1 5
<210> 103
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 103
gcaagagagg gatgggacgt accctttgac ttc 33
<210> 104
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 104
Ala Arg Glu Gly Trp Asp Val Pro Phe Asp Phe
1 5 10
<210> 105
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 105
gccatccagt tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggcaagtca ggacattaga aatgatttag gctggtatca gcagaaacca 120
gggaaagccc ctaagctcct gatctatgct gcatccagtt tacaaagtgg ggtcccatca 180
cggttcagcg gcagtggatc tggcacagat ttcactctca ccatcagcag cctgcagcct 240
gaagattttg caacttatta ctgtctacaa gattacaatt acccgtggac gttcggccaa 300
gggaccaagg tggagatcaa acga 324
<210> 106
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 106
Ala Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Arg Asn Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Asp Tyr Asn Tyr Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 107
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 107
caggacatta gaaatgat 18
<210> 108
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 108
Gln Asp Ile Arg Asn Asp
1 5
<210> 109
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 109
gctgcatcc 9
<210> 110
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 110
Ala Ala Ser
1
<210> 111
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 111
ctacaagatt acaattaccc gtggacg 27
<210> 112
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 112
Leu Gln Asp Tyr Asn Tyr Pro Trp Thr
1 5
<210> 113
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 113
gaggtgcagc tggtggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag tctctggatt caccctcagt agctacgata tgcactgggt ccgccaacct 120
acaggaaaag gtctggagtg ggtctcagct attggttcta ctggtgacac atactatcca 180
ggctccgtga agggccgatt caccatctcc agagaaaatg ccaagaactc cttgtatctt 240
caaatgaaca gcctgagagc cggggacacg gctgtgtatt actgtgcaag agagggatgg 300
gacgtaccct ttgacttctg gggccaggga accctggtca ccgtctcctc a 351
<210> 114
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 114
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Thr Leu Ser Ser Tyr
20 25 30
Asp Met His Trp Val Arg Gln Pro Thr Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Gly Ser Thr Gly Asp Thr Tyr Tyr Pro Gly Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Glu Asn Ala Lys Asn Ser Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Gly Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Gly Trp Asp Val Pro Phe Asp Phe Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 115
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 115
gccatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggcaagtca ggacattaga aatgatttag gctggtatca gcagaaacca 120
gggaaagccc ctaagctcct gatctatgct gcatccagtt tacaaagtgg ggtcccatca 180
cggttcagcg gcagtggatc tggcacagat ttcactctca ccatcagcag cctgcagcct 240
gaagattttg caacttatta ctgtctacaa gattacaatt acccgtggac gttcggccaa 300
gggaccaagg tggaaatcaa a 321
<210> 116
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 116
Ala Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Arg Asn Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Asp Tyr Asn Tyr Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 117
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 117
gaggtgcagc tggtggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt caccctcagt agctacgata tgcactgggt ccgccaagct 120
acaggaaaag gtctggagtg ggtctcagct attggttcta ctggtgacac atactatcca 180
ggctccgtga agggccgatt caccatctcc agagaaaatg ccaagaactc cttgtatctt 240
caaatgaaca gcctgagagc cggggacacg gctgtgtatt actgtgcaag agagggatgg 300
gacgtaccct ttgacttctg gggccaggga accctggtca ccgtctcctc a 351
<210> 118
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 118
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Leu Ser Ser Tyr
20 25 30
Asp Met His Trp Val Arg Gln Ala Thr Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Gly Ser Thr Gly Asp Thr Tyr Tyr Pro Gly Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Glu Asn Ala Lys Asn Ser Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Gly Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Gly Trp Asp Val Pro Phe Asp Phe Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 119
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 119
gccatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggcaagtca ggacattaga aatgatttag gctggtatca gcagaaacca 120
gggaaagccc ctaagctcct gatctatgct gcatccagtt tacaaagtgg ggtcccatca 180
aggttcagcg gcagtggatc tggcacagat ttcactctca ccatcagcag cctgcagcct 240
gaagattttg caacttatta ctgtctacaa gattacaatt acccgtggac gttcggccaa 300
gggaccaagg tggaaatcaa a 321
<210> 120
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 120
Ala Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Arg Asn Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Asp Tyr Asn Tyr Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 121
<211> 384
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 121
caggtgcagc tgcaggagtc ggggccagga ctggtgaagc cttcggagac cctgtccctc 60
acctgcactg tctctgggga ctccatcaat acttactact ggagctggtt ccggcagccc 120
ccagggaagg gactggagtg gattgggtat atctattata gtggaaccac caactacaac 180
ccctccctca agagtcgagt caccatatca atagacacgc ccaggaacca gttctccctg 240
aagctgatct ctgtgaccgc agcggacacg gccgtgtatt actgtgcgag agagaggatt 300
actatgattc ggggagttac cctctactat tactcctacg gtatggacgt ctggggccaa 360
gggaccacgg tcaccgtctc ctca 384
<210> 122
<211> 128
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 122
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Asp Ser Ile Asn Thr Tyr
20 25 30
Tyr Trp Ser Trp Phe Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Tyr Tyr Ser Gly Thr Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Ile Asp Thr Pro Arg Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ile Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Arg Ile Thr Met Ile Arg Gly Val Thr Leu Tyr Tyr Tyr Ser
100 105 110
Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 123
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 123
ggggactcca tcaatactta ctac 24
<210> 124
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 124
Gly Asp Ser Ile Asn Thr Tyr Tyr
1 5
<210> 125
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 125
atctattata gtggaaccac c 21
<210> 126
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 126
Ile Tyr Tyr Ser Gly Thr Thr
1 5
<210> 127
<211> 66
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 127
gcgagagaga ggattactat gattcgggga gttaccctct actattactc ctacggtatg 60
gacgtc 66
<210> 128
<211> 22
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 128
Ala Arg Glu Arg Ile Thr Met Ile Arg Gly Val Thr Leu Tyr Tyr Tyr
1 5 10 15
Ser Tyr Gly Met Asp Val
20
<210> 129
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 129
gacatccaga tgacccagtc tccatccttc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgct gggccagtca ggacattagc agttatttag cctggtatca gcaaaaacca 120
gggatagccc ctaagctcct gatctatgct gcatccactt tgcaaagtgg ggtcccatca 180
aggttcggcg gcagtggatc tgggacagaa ttcactctca caatcagcag cctgcagcct 240
gaagattttg caacttatta ctgtcaacag cttaatagtt accctcggac gttcggccaa 300
gggaccaagg tggaaatcaa acga 324
<210> 130
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 130
Asp Ile Gln Met Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Trp Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Ile Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Gly Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Leu Asn Ser Tyr Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 131
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 131
caggacatta gcagttat 18
<210> 132
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 132
Gln Asp Ile Ser Ser Tyr
1 5
<210> 133
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 133
gctgcatcc 9
<210> 134
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 134
Ala Ala Ser
1
<210> 135
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 135
caacagctta atagttaccc tcggacg 27
<210> 136
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 136
Gln Gln Leu Asn Ser Tyr Pro Arg Thr
1 5
<210> 137
<211> 384
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 137
caggtgcagc tgcaggagtc ggggccagga ctggtgaagc cttcggagac cctgtccctc 60
acctgcactg tctctgggga ctccatcaat acttactact ggagctggtt ccggcagccc 120
ccagggaagg gactggagtg gattgggtat atctattata gtggaaccac caactacaac 180
ccctccctca agagtcgagt caccatatca atagacacgc ccaggaacca gttctccctg 240
aagctgatct ctgtgaccgc agcggacacg gccgtgtatt actgtgcgag agagaggatt 300
actatgattc ggggagttac cctctactat tactcctacg gtatggacgt ctggggccaa 360
gggaccacgg tcaccgtctc ctca 384
<210> 138
<211> 128
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 138
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Asp Ser Ile Asn Thr Tyr
20 25 30
Tyr Trp Ser Trp Phe Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Tyr Tyr Ser Gly Thr Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Ile Asp Thr Pro Arg Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ile Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Arg Ile Thr Met Ile Arg Gly Val Thr Leu Tyr Tyr Tyr Ser
100 105 110
Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 139
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 139
gacatccaga tgacccagtc tccatccttc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgct gggccagtca ggacattagc agttatttag cctggtatca gcaaaaacca 120
gggatagccc ctaagctcct gatctatgct gcatccactt tgcaaagtgg ggtcccatca 180
aggttcggcg gcagtggatc tgggacagaa ttcactctca caatcagcag cctgcagcct 240
gaagattttg caacttatta ctgtcaacag cttaatagtt accctcggac gttcggccaa 300
gggaccaagg tggaaatcaa a 321
<210> 140
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 140
Asp Ile Gln Met Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Trp Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Ile Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Gly Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Leu Asn Ser Tyr Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 141
<211> 384
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 141
caggtgcagc tgcaggagtc gggcccagga ctggtgaagc cttcggagac cctgtccctc 60
acctgcactg tctctgggga ctccatcaat acttactact ggagctggat ccggcagccc 120
ccagggaagg gactggagtg gattgggtat atctattata gtggaaccac caactacaac 180
ccctccctca agagtcgagt caccatatca gtagacacgt ccaagaacca gttctccctg 240
aagctgagct ctgtgaccgc tgcggacacg gccgtgtatt actgtgcgag agagaggatt 300
actatgattc ggggagttac cctctactat tactcctacg gtatggacgt ctggggccaa 360
gggaccacgg tcaccgtctc ctca 384
<210> 142
<211> 128
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 142
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Asp Ser Ile Asn Thr Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Tyr Tyr Ser Gly Thr Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Arg Ile Thr Met Ile Arg Gly Val Thr Leu Tyr Tyr Tyr Ser
100 105 110
Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 143
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 143
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggcaagtca ggacattagc agttatttag gctggtatca gcagaaacca 120
gggaaagccc ctaagcgcct gatctatgct gcatccagtt tgcaaagtgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagaa ttcactctca caatcagcag cctgcagcct 240
gaagattttg caacttatta ctgtcaacag cttaatagtt accctcggac gttcggccaa 300
gggaccaagg tggaaatcaa a 321
<210> 144
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 144
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Arg Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Leu Asn Ser Tyr Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 145
<211> 378
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 145
caggtgcagc tggtgcagtc tggagctgag gtgaagaagc ctggggcctc agtgaaggtc 60
tcctgcaagg cttctggtta cacctttacc aactatggta tcagctgggt gcgacaggcc 120
cctggacaag gacttgagtt aatgggatgg attagtggtt acaatggtaa cacaaactat 180
gcacaagaac tccaggccag agtcaccatg accacagaca catccacgag cacagcctac 240
atggagctga ggaacctgag atctgacgac acggccgtat attactgtgc gagagataga 300
gtcgttgtag cagctgctaa ttactacttt tattctatgg acgtctgggg ccaagggacc 360
acggtcaccg tctcctca 378
<210> 146
<211> 126
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 146
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Leu Met
35 40 45
Gly Trp Ile Ser Gly Tyr Asn Gly Asn Thr Asn Tyr Ala Gln Glu Leu
50 55 60
Gln Ala Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Asn Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Val Val Val Ala Ala Ala Asn Tyr Tyr Phe Tyr Ser
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 147
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 147
ggttacacct ttaccaacta tggt 24
<210> 148
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 148
Gly Tyr Thr Phe Thr Asn Tyr Gly
1 5
<210> 149
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 149
attagtggtt acaatggtaa caca 24
<210> 150
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 150
Ile Ser Gly Tyr Asn Gly Asn Thr
1 5
<210> 151
<211> 57
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 151
gcgagagata gagtcgttgt agcagctgct aattactact tttattctat ggacgtc 57
<210> 152
<211> 19
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 152
Ala Arg Asp Arg Val Val Val Ala Ala Ala Asn Tyr Tyr Phe Tyr Ser
1 5 10 15
Met Asp Val
<210> 153
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 153
gccatccaga tgacccagtc tccactctcc ctgtccgtca cccttggaca gccggcctcc 60
atctcctgca ggtctagtca aagcctcgta tacagtgatg gagacaccta cttgaattgg 120
tttcagcaga ggccaggcca atctccaagg cgcctaattt ataaggtttc taaccgggac 180
tctggggtcc cagacagatt cagcggcagt gggtcaggca ctgctttcac actgaaaatc 240
agcggggtgg aggccgagga tgttggggtt tactactgca tgcaagctac acactggcct 300
cggacgttcg gccaagggac caaggtggaa atcaaacga 339
<210> 154
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 154
Ala Ile Gln Met Thr Gln Ser Pro Leu Ser Leu Ser Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Tyr Ser
20 25 30
Asp Gly Asp Thr Tyr Leu Asn Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Lys Val Ser Asn Arg Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Ala Phe Thr Leu Lys Ile
65 70 75 80
Ser Gly Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Thr His Trp Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg
<210> 155
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 155
caaagcctcg tatacagtga tggagacacc tac 33
<210> 156
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 156
Gln Ser Leu Val Tyr Ser Asp Gly Asp Thr Tyr
1 5 10
<210> 157
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 157
aaggtttct 9
<210> 158
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 158
Lys Val Ser
1
<210> 159
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 159
atgcaagcta cacactggcc tcggacg 27
<210> 160
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 160
Met Gln Ala Thr His Trp Pro Arg Thr
1 5
<210> 161
<211> 378
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 161
caggttcagc tggtgcagtc tggagctgag gtgaagaagc ctggggcctc agtgaaggtc 60
tcctgcaagg cttctggtta cacctttacc aactatggta tcagctgggt gcgacaggcc 120
cctggacaag gacttgagtt aatgggatgg attagtggtt acaatggtaa cacaaactat 180
gcacaagaac tccaggccag agtcaccatg accacagaca catccacgag cacagcctac 240
atggagctga ggaacctgag atctgacgac acggccgtat attactgtgc gagagataga 300
gtcgttgtag cagctgctaa ttactacttt tattctatgg acgtctgggg ccaagggacc 360
acggtcaccg tctcctca 378
<210> 162
<211> 126
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 162
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Leu Met
35 40 45
Gly Trp Ile Ser Gly Tyr Asn Gly Asn Thr Asn Tyr Ala Gln Glu Leu
50 55 60
Gln Ala Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Asn Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Val Val Val Ala Ala Ala Asn Tyr Tyr Phe Tyr Ser
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 163
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 163
gatgttgtga tgactcagtc tccactctcc ctgtccgtca cccttggaca gccggcctcc 60
atctcctgca ggtctagtca aagcctcgta tacagtgatg gagacaccta cttgaattgg 120
tttcagcaga ggccaggcca atctccaagg cgcctaattt ataaggtttc taaccgggac 180
tctggggtcc cagacagatt cagcggcagt gggtcaggca ctgctttcac actgaaaatc 240
agcggggtgg aggccgagga tgttggggtt tactactgca tgcaagctac acactggcct 300
cggacgttcg gccaagggac caaggtggaa atcaaa 336
<210> 164
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 164
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Ser Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Tyr Ser
20 25 30
Asp Gly Asp Thr Tyr Leu Asn Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Lys Val Ser Asn Arg Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Ala Phe Thr Leu Lys Ile
65 70 75 80
Ser Gly Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Thr His Trp Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 165
<211> 378
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 165
caggttcagc tggtgcagtc tggagctgag gtgaagaagc ctggggcctc agtgaaggtc 60
tcctgcaagg cttctggtta cacctttacc aactatggta tcagctgggt gcgacaggcc 120
cctggacaag ggcttgagtg gatgggatgg attagtggtt acaatggtaa cacaaactat 180
gcacagaagc tccagggcag agtcaccatg accacagaca catccacgag cacagcctac 240
atggagctga ggagcctgag atctgacgac acggccgtgt attactgtgc gagagataga 300
gtcgttgtag cagctgctaa ttactacttt tattctatgg acgtctgggg ccaagggacc 360
acggtcaccg tctcctca 378
<210> 166
<211> 126
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 166
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Ser Gly Tyr Asn Gly Asn Thr Asn Tyr Ala Gln Lys Leu
50 55 60
Gln Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Val Val Val Ala Ala Ala Asn Tyr Tyr Phe Tyr Ser
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 167
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 167
gatgttgtga tgactcagtc tccactctcc ctgcccgtca cccttggaca gccggcctcc 60
atctcctgca ggtctagtca aagcctcgta tacagtgatg gagacaccta cttgaattgg 120
tttcagcaga ggccaggcca atctccaagg cgcctaattt ataaggtttc taaccgggac 180
tctggggtcc cagacagatt cagcggcagt gggtcaggca ctgatttcac actgaaaatc 240
agcagggtgg aggctgagga tgttggggtt tattactgca tgcaagctac acactggcct 300
cggacgttcg gccaagggac caaggtggaa atcaaa 336
<210> 168
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 168
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Tyr Ser
20 25 30
Asp Gly Asp Thr Tyr Leu Asn Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Lys Val Ser Asn Arg Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Thr His Trp Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 169
<211> 375
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 169
caggtccact tgaaggagtc tggtcctacg ctggtgaaac ccacacagac cctcacgctg 60
acctgcacct tctctggatt ctcactcatc actagtggag tgggtgtggg ctggattcgt 120
cagccccccg gaaaggccct ggagtggctt gcactcattt attggaatgg tgataagcgc 180
tacagcccat ctctgaagag caggctcacc atcaccaagg acacctccaa aaaccaggtg 240
gtccttacaa tgaccaacat ggaccctgtg gacacagcca catattactg tgcacacagg 300
ataactgaaa ctagttacta cttctactac ggtatggacg tctggggcca agggaccacg 360
gtcaccgtct cctca 375
<210> 170
<211> 125
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 170
Gln Val His Leu Lys Glu Ser Gly Pro Thr Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ile Thr Ser
20 25 30
Gly Val Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala Leu Ile Tyr Trp Asn Gly Asp Lys Arg Tyr Ser Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Thr Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala His Arg Ile Thr Glu Thr Ser Tyr Tyr Phe Tyr Tyr Gly Met
100 105 110
Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 171
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 171
ggattctcac tcatcactag tggagtgggt 30
<210> 172
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 172
Gly Phe Ser Leu Ile Thr Ser Gly Val Gly
1 5 10
<210> 173
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 173
atttattgga atggtgataa g 21
<210> 174
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 174
Ile Tyr Trp Asn Gly Asp Lys
1 5
<210> 175
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 175
gcacacagga taactgaaac tagttactac ttctactacg gtatggacgt c 51
<210> 176
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 176
Ala His Arg Ile Thr Glu Thr Ser Tyr Tyr Phe Tyr Tyr Gly Met Asp
1 5 10 15
Val
<210> 177
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 177
gacatccaga tgacccagtc tccactctcc ctgcccgtca cccctggaga gccggcctcc 60
atctcctgca ggtctagtca gagcctcctg catagtcatg gatacgacta tttggattgg 120
tacctgcaga agccagggca gtctccacag ctcctgatct atttgggttc taatcgggcc 180
tccggggtcc ctgacaggtt cagtggcagt ggatcaggca cagattttac actgaaaatc 240
agcagagtgg aggctgagga tgttggggtt tattactgca tgcaagctct acaaactccg 300
ctcactttcg gcggagggac caaggtggaa atcaaacga 339
<210> 178
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 178
Asp Ile Gln Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
His Gly Tyr Asp Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg
<210> 179
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 179
cagagcctcc tgcatagtca tggatacgac tat 33
<210> 180
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 180
Gln Ser Leu Leu His Ser His Gly Tyr Asp Tyr
1 5 10
<210> 181
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 181
ttgggttct 9
<210> 182
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 182
Leu Gly Ser
1
<210> 183
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 183
atgcaagctc tacaaactcc gctcact 27
<210> 184
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 184
Met Gln Ala Leu Gln Thr Pro Leu Thr
1 5
<210> 185
<211> 375
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 185
cagatcacct tgaaggagtc tggtcctacg ctggtgaaac ccacacagac cctcacgctg 60
acctgcacct tctctggatt ctcactcatc actagtggag tgggtgtggg ctggattcgt 120
cagccccccg gaaaggccct ggagtggctt gcactcattt attggaatgg tgataagcgc 180
tacagcccat ctctgaagag caggctcacc atcaccaagg acacctccaa aaaccaggtg 240
gtccttacaa tgaccaacat ggaccctgtg gacacagcca catattactg tgcacacagg 300
ataactgaaa ctagttacta cttctactac ggtatggacg tctggggcca agggaccacg 360
gtcaccgtct cctca 375
<210> 186
<211> 125
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 186
Gln Ile Thr Leu Lys Glu Ser Gly Pro Thr Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ile Thr Ser
20 25 30
Gly Val Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala Leu Ile Tyr Trp Asn Gly Asp Lys Arg Tyr Ser Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Thr Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala His Arg Ile Thr Glu Thr Ser Tyr Tyr Phe Tyr Tyr Gly Met
100 105 110
Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 187
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 187
gatattgtga tgactcagtc tccactctcc ctgcccgtca cccctggaga gccggcctcc 60
atctcctgca ggtctagtca gagcctcctg catagtcatg gatacgacta tttggattgg 120
tacctgcaga agccagggca gtctccacag ctcctgatct atttgggttc taatcgggcc 180
tccggggtcc ctgacaggtt cagtggcagt ggatcaggca cagattttac actgaaaatc 240
agcagagtgg aggctgagga tgttggggtt tattactgca tgcaagctct acaaactccg 300
ctcactttcg gcggagggac caaggtggag atcaaa 336
<210> 188
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 188
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
His Gly Tyr Asp Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 189
<211> 375
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 189
cagatcacct tgaaggagtc tggtcctacg ctggtgaaac ccacacagac cctcacgctg 60
acctgcacct tctctggatt ctcactcatc actagtggag tgggtgtggg ctggatccgt 120
cagcccccag gaaaggccct ggagtggctt gcactcattt attggaatgg tgataagcgc 180
tacagcccat ctctgaagag caggctcacc atcaccaagg acacctccaa aaaccaggtg 240
gtccttacaa tgaccaacat ggaccctgtg gacacagcca catattactg tgcacacagg 300
ataactgaaa ctagttacta cttctactac ggtatggacg tctggggcca agggaccacg 360
gtcaccgtct cctca 375
<210> 190
<211> 125
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 190
Gln Ile Thr Leu Lys Glu Ser Gly Pro Thr Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ile Thr Ser
20 25 30
Gly Val Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala Leu Ile Tyr Trp Asn Gly Asp Lys Arg Tyr Ser Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Thr Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala His Arg Ile Thr Glu Thr Ser Tyr Tyr Phe Tyr Tyr Gly Met
100 105 110
Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 191
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 191
gatattgtga tgactcagtc tccactctcc ctgcccgtca cccctggaga gccggcctcc 60
atctcctgca ggtctagtca gagcctcctg catagtcatg gatacgacta tttggattgg 120
tacctgcaga agccagggca gtctccacag ctcctgatct atttgggttc taatcgggcc 180
tccggggtcc ctgacaggtt cagtggcagt ggatcaggca cagattttac actgaaaatc 240
agcagagtgg aggctgagga tgttggggtt tattactgca tgcaagctct acaaactccg 300
ctcactttcg gcggagggac caaggtggag atcaaa 336
<210> 192
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 192
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
His Gly Tyr Asp Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 193
<211> 375
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 193
cagatcacct tgaaggagtc tggtcctact ctggtgaaac cctcacagac cctcacgctg 60
acctgcacct tctctgggtt ctcactcagc actagtggag tgggtgtggg ctggatccgt 120
cagcccccag gaaaggccct ggagtggctt gcactcattt attggaattc tgataagcgc 180
tacagcccat ctctgaagag caggctcacc atcaccaagg acacctccaa aaaccaggta 240
gtccttacaa tgaccaacat ggaccctgtg gacacagcca catattactg tgcacacaga 300
catgacagct cgtcctacta cttctactac ggtatggacg tctggggcca agggatcacg 360
gtcaccgtct cctca 375
<210> 194
<211> 125
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 194
Gln Ile Thr Leu Lys Glu Ser Gly Pro Thr Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Val Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala Leu Ile Tyr Trp Asn Ser Asp Lys Arg Tyr Ser Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Thr Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala His Arg His Asp Ser Ser Ser Tyr Tyr Phe Tyr Tyr Gly Met
100 105 110
Asp Val Trp Gly Gln Gly Ile Thr Val Thr Val Ser Ser
115 120 125
<210> 195
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 195
gggttctcac tcagcactag tggagtgggt 30
<210> 196
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 196
Gly Phe Ser Leu Ser Thr Ser Gly Val Gly
1 5 10
<210> 197
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 197
atttattgga attctgataa g 21
<210> 198
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 198
Ile Tyr Trp Asn Ser Asp Lys
1 5
<210> 199
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 199
gcacacagac atgacagctc gtcctactac ttctactacg gtatggacgt c 51
<210> 200
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 200
Ala His Arg His Asp Ser Ser Ser Tyr Tyr Phe Tyr Tyr Gly Met Asp
1 5 10 15
Val
<210> 201
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 201
gacatccaga tgacccagtc tccgctctcc ctgcccgtca cccctggaga gccggcctcc 60
atctcctgca ggtctagtca gagcctcctc catagtcatg gatacaacta tttggattgg 120
tacctgcaga agccagggca gtctccacaa ctcctgatct atttgggttc taatcgggcc 180
tccggggtcc ctgacaggtt cagtggcggt ggatcaggca cagattttac actgaaaatc 240
agcagagtgg aggctgagga tgttgggatt tattactgca tgcaagctct acagactcct 300
ctcactttcg gcggagggac caaggtggag atcaaacga 339
<210> 202
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 202
Asp Ile Gln Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
His Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Gly Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Ile Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg
<210> 203
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 203
cagagcctcc tccatagtca tggatacaac tat 33
<210> 204
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 204
Gln Ser Leu Leu His Ser His Gly Tyr Asn Tyr
1 5 10
<210> 205
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 205
ttgggttct 9
<210> 206
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 206
Leu Gly Ser
1
<210> 207
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 207
atgcaagctc tacagactcc tctcact 27
<210> 208
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 208
Met Gln Ala Leu Gln Thr Pro Leu Thr
1 5
<210> 209
<211> 375
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 209
cagatcacct tgaaggagtc tggtcctact ctggtgaaac cctcacagac cctcacgctg 60
acctgcacct tctctgggtt ctcactcagc actagtggag tgggtgtggg ctggatccgt 120
cagcccccag gaaaggccct ggagtggctt gcactcattt attggaattc tgataagcgc 180
tacagcccat ctctgaagag caggctcacc atcaccaagg acacctccaa aaaccaggta 240
gtccttacaa tgaccaacat ggaccctgtg gacacagcca catattactg tgcacacaga 300
catgacagct cgtcctacta cttctactac ggtatggacg tctggggcca agggaccacg 360
gtcaccgtct cctca 375
<210> 210
<211> 125
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 210
Gln Ile Thr Leu Lys Glu Ser Gly Pro Thr Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Val Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala Leu Ile Tyr Trp Asn Ser Asp Lys Arg Tyr Ser Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Thr Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala His Arg His Asp Ser Ser Ser Tyr Tyr Phe Tyr Tyr Gly Met
100 105 110
Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 211
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 211
gatattgtga tgactcagtc tccgctctcc ctgcccgtca cccctggaga gccggcctcc 60
atctcctgca ggtctagtca gagcctcctc catagtcatg gatacaacta tttggattgg 120
tacctgcaga agccagggca gtctccacaa ctcctgatct atttgggttc taatcgggcc 180
tccggggtcc ctgacaggtt cagtggcggt ggatcaggca cagattttac actgaaaatc 240
agcagagtgg aggctgagga tgttgggatt tattactgca tgcaagctct acagactcct 300
ctcactttcg gcggagggac caaggtggag atcaaa 336
<210> 212
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 212
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
His Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Gly Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Ile Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 213
<211> 375
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 213
cagatcacct tgaaggagtc tggtcctacg ctggtgaaac ccacacagac cctcacgctg 60
acctgcacct tctctgggtt ctcactcagc actagtggag tgggtgtggg ctggatccgt 120
cagcccccag gaaaggccct ggagtggctt gcactcattt attggaattc tgataagcgc 180
tacagcccat ctctgaagag caggctcacc atcaccaagg acacctccaa aaaccaggtg 240
gtccttacaa tgaccaacat ggaccctgtg gacacagcca catattactg tgcacacaga 300
catgacagct cgtcctacta cttctactac ggtatggacg tctggggcca agggaccacg 360
gtcaccgtct cctca 375
<210> 214
<211> 125
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 214
Gln Ile Thr Leu Lys Glu Ser Gly Pro Thr Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Val Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala Leu Ile Tyr Trp Asn Ser Asp Lys Arg Tyr Ser Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Thr Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala His Arg His Asp Ser Ser Ser Tyr Tyr Phe Tyr Tyr Gly Met
100 105 110
Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 215
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 215
gatattgtga tgactcagtc tccactctcc ctgcccgtca cccctggaga gccggcctcc 60
atctcctgca ggtctagtca gagcctcctc catagtcatg gatacaacta tttggattgg 120
tacctgcaga agccagggca gtctccacag ctcctgatct atttgggttc taatcgggcc 180
tccggggtcc ctgacaggtt cagtggcagt ggatcaggca cagattttac actgaaaatc 240
agcagagtgg aggctgagga tgttggggtt tattactgca tgcaagctct acagactcct 300
ctcactttcg gcggagggac caaggtggag atcaaa 336
<210> 216
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 216
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
His Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 217
<211> 381
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 217
gagatgcaac tggtggagtc tgggggaggc ttggtccagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagt agtcactgga tgaagtgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtggccaac ataaaccaag atggaagtga gaaatactat 180
gtggactctg tgaagggccg attcaccatc tccagagaca acgccaagaa ctcactgttt 240
ctgcaaatga acagcctgag agccgaggac acggctgtgt attactgtgc gagagatatt 300
gtactaatgg tctatgatat ggactactac tactacggta tggacgtctg gggccaaggg 360
accacggtca ccgtctcctc a 381
<210> 218
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 218
Glu Met Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser His
20 25 30
Trp Met Lys Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asn Ile Asn Gln Asp Gly Ser Glu Lys Tyr Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Ile Val Leu Met Val Tyr Asp Met Asp Tyr Tyr Tyr Tyr
100 105 110
Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 219
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 219
ggattcacct ttagtagtca ctgg 24
<210> 220
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 220
Gly Phe Thr Phe Ser Ser His Trp
1 5
<210> 221
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 221
ataaaccaag atggaagtga gaaa 24
<210> 222
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 222
Ile Asn Gln Asp Gly Ser Glu Lys
1 5
<210> 223
<211> 60
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 223
gcgagagata ttgtactaat ggtctatgat atggactact actactacgg tatggacgtc 60
<210> 224
<211> 20
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 224
Ala Arg Asp Ile Val Leu Met Val Tyr Asp Met Asp Tyr Tyr Tyr Tyr
1 5 10 15
Gly Met Asp Val
20
<210> 225
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 225
gatattgtga tgactcagtc tccactctcc ctgcccgtca cccctggaga gccggcctcc 60
atctcctgca ggtctagtca gagcctcctg catagtaatg gaaacaacta tttggattgg 120
tacctgcaga agccagggca gtctccacag ctcctgatct atttgggttc taatcgggcc 180
tccggggtcc ctgacaggtt cagtggcagt ggatcaggca cagattttac actgaaaatc 240
agcagagtgg aggctgagga tgttggggtt tattactgca tgcaaactct acaaactccg 300
ctcactttcg gcggagggac caaggtggag atcaaa 336
<210> 226
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 226
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Asn Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Thr
85 90 95
Leu Gln Thr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 227
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 227
cagagcctcc tgcatagtaa tggaaacaac tat 33
<210> 228
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 228
Ser Ser Gln Ser Leu Leu His Ser Asn Gly Asn
1 5 10
<210> 229
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 229
ttgggttct 9
<210> 230
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 230
Leu Gly Ser
1
<210> 231
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 231
atgcaaactc tacaaactcc gctcact 27
<210> 232
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 232
Met Gln Thr Leu Gln Thr Pro Leu Thr
1 5
<210> 233
<211> 381
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 233
gaggtgcagc tggtggagtc tgggggaggc ttggtccagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagt agtcactgga tgaagtgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtggccaac ataaaccaag atggaagtga gaaatactat 180
gtggactctg tgaagggccg attcaccatc tccagagaca acgccaagaa ctcactgttt 240
ctgcaaatga acagcctgag agccgaggac acggctgtgt attactgtgc gagagatatt 300
gtactaatgg tctatgatat ggactactac tactacggta tggacgtctg gggccaaggg 360
accacggtca ccgtctcctc a 381
<210> 234
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 234
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser His
20 25 30
Trp Met Lys Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asn Ile Asn Gln Asp Gly Ser Glu Lys Tyr Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Ile Val Leu Met Val Tyr Asp Met Asp Tyr Tyr Tyr Tyr
100 105 110
Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 235
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 235
gatattgtga tgactcagtc tccactctcc ctgcccgtca cccctggaga gccggcctcc 60
atctcctgca ggtctagtca gagcctcctg catagtaatg gaaacaacta tttggattgg 120
tacctgcaga agccagggca gtctccacag ctcctgatct atttgggttc taatcgggcc 180
tccggggtcc ctgacaggtt cagtggcagt ggatcaggca cagattttac actgaaaatc 240
agcagagtgg aggctgagga tgttggggtt tattactgca tgcaaactct acaaactccg 300
ctcactttcg gcggagggac caaggtggag atcaaa 336
<210> 236
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 236
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Asn Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Thr
85 90 95
Leu Gln Thr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 237
<211> 381
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 237
gaggtgcagc tggtggagtc tgggggaggc ttggtccagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagt agtcactgga tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtggccaac ataaaccaag atggaagtga gaaatactat 180
gtggactctg tgaagggccg attcaccatc tccagagaca acgccaagaa ctcactgtat 240
ctgcaaatga acagcctgag agccgaggac acggctgtgt attactgtgc gagagatatt 300
gtactaatgg tctatgatat ggactactac tactacggta tggacgtctg ggggcaaggg 360
accacggtca ccgtctcctc a 381
<210> 238
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 238
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser His
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asn Ile Asn Gln Asp Gly Ser Glu Lys Tyr Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Ile Val Leu Met Val Tyr Asp Met Asp Tyr Tyr Tyr Tyr
100 105 110
Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 239
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 239
gatattgtga tgactcagtc tccactctcc ctgcccgtca cccctggaga gccggcctcc 60
atctcctgca ggtctagtca gagcctcctg catagtaatg gaaacaacta tttggattgg 120
tacctgcaga agccagggca gtctccacag ctcctgatct atttgggttc taatcgggcc 180
tccggggtcc ctgacaggtt cagtggcagt ggatcaggca cagattttac actgaaaatc 240
agcagagtgg aggctgagga tgttggggtt tattactgca tgcaaactct acaaactccg 300
ctcactttcg gcggagggac caaggtggag atcaaa 336
<210> 240
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 240
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Asn Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Thr
85 90 95
Leu Gln Thr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 241
<211> 381
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 241
caggtgcagc tggtggagtc tgggggaggc gtggtccagc ctgggaggtc cctgagactc 60
tcctgtgcag tctctggatt caccttcagt agctatggca tgcactgggt ccgccaggct 120
ccaggcaagg ggctggagtg ggtggcagct atatcatatg atggaagtaa taaatactat 180
gtagactccg tgaagggccg attcaccatc tccagagaca attccaagaa aacgctgtat 240
ctgcaaatga acagcctgag agctgaggac acggctgtgt ataattgtgc gaaaaatatt 300
gtactagtga tgtatgatat agactatcac tactatggga tggacgtctg gggccaaggg 360
accacggtca ccgtctcctc a 381
<210> 242
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 242
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ala Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Lys Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Asn Cys
85 90 95
Ala Lys Asn Ile Val Leu Val Met Tyr Asp Ile Asp Tyr His Tyr Tyr
100 105 110
Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 243
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 243
ggattcacct tcagtagcta tggc 24
<210> 244
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 244
Gly Phe Thr Phe Ser Ser Tyr Gly
1 5
<210> 245
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 245
atatcatatg atggaagtaa taaa 24
<210> 246
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 246
Ile Ser Tyr Asp Gly Ser Asn Lys
1 5
<210> 247
<211> 60
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 247
gcgaaaaata ttgtactagt gatgtatgat atagactatc actactatgg gatggacgtc 60
<210> 248
<211> 20
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 248
Ala Lys Asn Ile Val Leu Val Met Tyr Asp Ile Asp Tyr His Tyr Tyr
1 5 10 15
Gly Met Asp Val
20
<210> 249
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 249
gatattgtga tgactcagtc tccactctcc ctgcccgtca cccctggaga gccggcctcc 60
atctcctgca ggtctagtca gagcctcctg catagtaatg gatacaacta tttggattgg 120
tacctgcaga agccagggca gtctccacaa ctcctgatct atttgggttt taatcgggcc 180
tccggggtcc ctgacaggtt cagtggcagt ggatcaggca cagattttac actgaaaatc 240
agcagagtgg aggctgagga tgttggggtt tattactgca tgcaagctct acaaactcct 300
ctcactttcg gcggagggac caaggtggag atcaga 336
<210> 250
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 250
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Phe Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Arg
100 105 110
<210> 251
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 251
cagagcctcc tgcatagtaa tggatacaac tat 33
<210> 252
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 252
Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr
1 5 10
<210> 253
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 253
ttgggtttt 9
<210> 254
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 254
Leu Gly Phe
1
<210> 255
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 255
atgcaagctc tacaaactcc tctcact 27
<210> 256
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 256
Met Gln Ala Leu Gln Thr Pro Leu Thr
1 5
<210> 257
<211> 381
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 257
caggtgcagc tggtggagtc tgggggaggc gtggtccagc ctgggaggtc cctgagactc 60
tcctgtgcag tctctggatt caccttcagt agctatggca tgcactgggt ccgccaggct 120
ccaggcaagg ggctggagtg ggtggcagct atatcatatg atggaagtaa taaatactat 180
gtagactccg tgaagggccg attcaccatc tccagagaca attccaagaa aacgctgtat 240
ctgcaaatga acagcctgag agctgaggac acggctgtgt ataattgtgc gaaaaatatt 300
gtactagtga tgtatgatat agactatcac tactatggga tggacgtctg gggccaaggg 360
accacggtca ccgtctcctc a 381
<210> 258
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 258
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ala Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Lys Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Asn Cys
85 90 95
Ala Lys Asn Ile Val Leu Val Met Tyr Asp Ile Asp Tyr His Tyr Tyr
100 105 110
Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 259
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 259
gatattgtga tgactcagtc tccactctcc ctgcccgtca cccctggaga gccggcctcc 60
atctcctgca ggtctagtca gagcctcctg catagtaatg gatacaacta tttggattgg 120
tacctgcaga agccagggca gtctccacaa ctcctgatct atttgggttt taatcgggcc 180
tccggggtcc ctgacaggtt cagtggcagt ggatcaggca cagattttac actgaaaatc 240
agcagagtgg aggctgagga tgttggggtt tattactgca tgcaagctct acaaactcct 300
ctcactttcg gcggagggac caaggtggag atcaaa 336
<210> 260
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 260
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Phe Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 261
<211> 381
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 261
caggtgcagc tggtggagtc tgggggaggc gtggtccagc ctgggaggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt agctatggca tgcactgggt ccgccaggct 120
ccaggcaagg ggctggagtg ggtggcagtt atatcatatg atggaagtaa taaatactat 180
gcagactccg tgaagggccg attcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agctgaggac acggctgtgt attactgtgc gaaaaatatt 300
gtactagtga tgtatgatat agactatcac tactatggga tggacgtctg ggggcaaggg 360
accacggtca ccgtctcctc a 381
<210> 262
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 262
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asn Ile Val Leu Val Met Tyr Asp Ile Asp Tyr His Tyr Tyr
100 105 110
Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 263
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 263
gatattgtga tgactcagtc tccactctcc ctgcccgtca cccctggaga gccggcctcc 60
atctcctgca ggtctagtca gagcctcctg catagtaatg gatacaacta tttggattgg 120
tacctgcaga agccagggca gtctccacag ctcctgatct atttgggttt taatcgggcc 180
tccggggtcc ctgacaggtt cagtggcagt ggatcaggca cagattttac actgaaaatc 240
agcagagtgg aggctgagga tgttggggtt tattactgca tgcaagctct acaaactcct 300
ctcactttcg gcggagggac caaggtggag atcaaa 336
<210> 264
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 264
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Phe Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 265
<211> 381
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 265
caggtgcagc tggtggagtc tgggggaggc gtggtccagc ctgggaggtc cctgagactc 60
tcctgtgcag tctctggatt caccttcagt agctatggca tgcactgggt ccgccaggct 120
ccaggcaagg ggctggagtg ggtggcagct atatcatatg atggaagtaa taaatactat 180
gtagactccg tgaagggccg attcaccatc tccagagaca attccaagaa aacgctgtat 240
ctgcaaatga acagcctgag agctgaggac acggctgtgt ataattgtgc gaaaaatatt 300
gtactagtga tgtatgatat agactatcac tactatggga tggacgtctg gggccaaggg 360
accacggtca ccgtctcctc a 381
<210> 266
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 266
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ala Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Lys Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Asn Cys
85 90 95
Ala Lys Asn Ile Val Leu Val Met Tyr Asp Ile Asp Tyr His Tyr Tyr
100 105 110
Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 267
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 267
ggattcacct tcagtagcta tggc 24
<210> 268
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 268
Gly Phe Thr Phe Ser Ser Tyr Gly
1 5
<210> 269
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 269
atatcatatg atggaagtaa taaa 24
<210> 270
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 270
Ile Ser Tyr Asp Gly Ser Asn Lys
1 5
<210> 271
<211> 60
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 271
gcgaaaaata ttgtactagt gatgtatgat atagactatc actactatgg gatggacgtc 60
<210> 272
<211> 20
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 272
Ala Lys Asn Ile Val Leu Val Met Tyr Asp Ile Asp Tyr His Tyr Tyr
1 5 10 15
Gly Met Asp Val
20
<210> 273
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 273
gatattgtga tgactcagtc tccactctcc ctgcccgtca cccctggaga gccggcctcc 60
atctcctgca ggtctagtca gagcctcctg catagtaatg gatacaacta tttggattgg 120
tacctgcaga agccagggca gtctccacaa ctcctgatct atttgggttt taatcgggcc 180
tccggggtcc ctgacaggtt cagtggcagt ggatcaggca cagattttac actgaaaatc 240
agcagagtgg aggctgagga tgttggggtt tattactgca tgcaagctct acaaactcct 300
ctcactttcg gcggagggac caaggtggag atcaga 336
<210> 274
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 274
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Phe Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Arg
100 105 110
<210> 275
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 275
cagagcctcc tgcatagtaa tggatacaac tat 33
<210> 276
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 276
Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr
1 5 10
<210> 277
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 277
ttgggtttt 9
<210> 278
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 278
Leu Gly Phe
1
<210> 279
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 279
atgcaagctc tacaaactcc tctcact 27
<210> 280
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 280
Met Gln Ala Leu Gln Thr Pro Leu Thr
1 5
<210> 281
<211> 381
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 281
caggtgcagc tggtggagtc tgggggaggc gtggtccagc ctgggaggtc cctgagactc 60
tcctgtgcag tctctggatt caccttcagt agctatggca tgcactgggt ccgccaggct 120
ccaggcaagg ggctggagtg ggtggcagct atatcatatg atggaagtaa taaatactat 180
gtagactccg tgaagggccg attcaccatc tccagagaca attccaagaa aacgctgtat 240
ctgcaaatga acagcctgag agctgaggac acggctgtgt ataattgtgc gaaaaatatt 300
gtactagtga tgtatgatat agactatcac tactatggga tggacgtctg gggccaaggg 360
accacggtca ccgtctcctc a 381
<210> 282
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 282
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ala Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Lys Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Asn Cys
85 90 95
Ala Lys Asn Ile Val Leu Val Met Tyr Asp Ile Asp Tyr His Tyr Tyr
100 105 110
Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 283
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 283
gatattgtga tgactcagtc tccactctcc ctgcccgtca cccctggaga gccggcctcc 60
atctcctgca ggtctagtca gagcctcctg catagtaatg gatacaacta tttggattgg 120
tacctgcaga agccagggca gtctccacaa ctcctgatct atttgggttt taatcgggcc 180
tccggggtcc ctgacaggtt cagtggcagt ggatcaggca cagattttac actgaaaatc 240
agcagagtgg aggctgagga tgttggggtt tattactgca tgcaagctct acaaactcct 300
ctcactttcg gcggagggac caaggtggag atcaaa 336
<210> 284
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 284
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Phe Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 285
<211> 381
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 285
caggtgcagc tggtggagtc tgggggaggc gtggtccagc ctgggaggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt agctatggca tgcactgggt ccgccaggct 120
ccaggcaagg ggctggagtg ggtggcagtt atatcatatg atggaagtaa taaatactat 180
gcagactccg tgaagggccg attcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agctgaggac acggctgtgt attactgtgc gaaaaatatt 300
gtactagtga tgtatgatat agactatcac tactatggga tggacgtctg ggggcaaggg 360
accacggtca ccgtctcctc a 381
<210> 286
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 286
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asn Ile Val Leu Val Met Tyr Asp Ile Asp Tyr His Tyr Tyr
100 105 110
Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 287
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 287
gatattgtga tgactcagtc tccactctcc ctgcccgtca cccctggaga gccggcctcc 60
atctcctgca ggtctagtca gagcctcctg catagtaatg gatacaacta tttggattgg 120
tacctgcaga agccagggca gtctccacag ctcctgatct atttgggttt taatcgggcc 180
tccggggtcc ctgacaggtt cagtggcagt ggatcaggca cagattttac actgaaaatc 240
agcagagtgg aggctgagga tgttggggtt tattactgca tgcaagctct acaaactcct 300
ctcactttcg gcggagggac caaggtggag atcaaa 336
<210> 288
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 288
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Phe Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 289
<211> 372
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 289
cagatcacct tgaaggagtc tggtcctacg ctggtaaaac ccacacagac cctcacgctg 60
acctgcacct tctctgggtt ctcactcagc gctagtggag tgggtgtggg ctggttccgt 120
cagcccccag gaaaggccct ggagtggctt gcactcattt attggaatga tgataagcgt 180
tacagcccat ctctaaagaa cagcctcacc atcaccaagg acacctccaa aaaccaggtg 240
gtccttacaa tgaccaacat ggaccctgtg gacacagcca catattactg tgcacacaga 300
atacatctat ggtcctactt ctactacggt atggacgtct ggggccaagg gaccacggtc 360
accgtctcct ca 372
<210> 290
<211> 124
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 290
Gln Ile Thr Leu Lys Glu Ser Gly Pro Thr Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Ala Ser
20 25 30
Gly Val Gly Val Gly Trp Phe Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala Leu Ile Tyr Trp Asn Asp Asp Lys Arg Tyr Ser Pro Ser
50 55 60
Leu Lys Asn Ser Leu Thr Ile Thr Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala His Arg Ile His Leu Trp Ser Tyr Phe Tyr Tyr Gly Met Asp
100 105 110
Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 291
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 291
gggttctcac tcagcgctag tggagtgggt 30
<210> 292
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 292
Gly Phe Ser Leu Ser Ala Ser Gly Val Gly
1 5 10
<210> 293
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 293
atttattgga atgatgataa g 21
<210> 294
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 294
Ile Tyr Trp Asn Asp Asp Lys
1 5
<210> 295
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 295
gcacacagaa tacatctatg gtcctacttc tactacggta tggacgtc 48
<210> 296
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 296
Ala His Arg Ile His Leu Trp Ser Tyr Phe Tyr Tyr Gly Met Asp Val
1 5 10 15
<210> 297
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 297
gatattgtga tgactcagtc tccactctcc ctgcccgtca cccctggaga gccggcctcc 60
atctcctgca ggtctagtca gactctcctg catagtaatg gatacaacta tttcgattgg 120
tacctgcaga agccagggca gtctccacag ctcctgatct atttgggttc taatcgggcc 180
tccggggtcc ctgacagatt cagtggcagt ggatcaggca cagattttac actgaaaatc 240
agcagagtgg aggctgagga tgttggaatt tattactgca tgcaagctct acaaactcct 300
ctcactttcg gcggagggac caaggtggag atcaga 336
<210> 298
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 298
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Thr Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Phe Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Ile Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Arg
100 105 110
<210> 299
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 299
cagactctcc tgcatagtaa tggatacaac tat 33
<210> 300
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 300
Gln Thr Leu Leu His Ser Asn Gly Tyr Asn Tyr
1 5 10
<210> 301
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 301
ttgggttct 9
<210> 302
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 302
Leu Gly Ser
1
<210> 303
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 303
atgcaagctc tacaaactcc tctcact 27
<210> 304
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 304
Met Gln Ala Leu Gln Thr Pro Leu Thr
1 5
<210> 305
<211> 372
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 305
cagatcacct tgaaggagtc tggtcctacg ctggtaaaac ccacacagac cctcacgctg 60
acctgcacct tctctgggtt ctcactcagc gctagtggag tgggtgtggg ctggttccgt 120
cagcccccag gaaaggccct ggagtggctt gcactcattt attggaatga tgataagcgt 180
tacagcccat ctctaaagaa cagcctcacc atcaccaagg acacctccaa aaaccaggtg 240
gtccttacaa tgaccaacat ggaccctgtg gacacagcca catattactg tgcacacaga 300
atacatctat ggtcctactt ctactacggt atggacgtct ggggccaagg gaccacggtc 360
accgtctcct ca 372
<210> 306
<211> 124
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 306
Gln Ile Thr Leu Lys Glu Ser Gly Pro Thr Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Ala Ser
20 25 30
Gly Val Gly Val Gly Trp Phe Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala Leu Ile Tyr Trp Asn Asp Asp Lys Arg Tyr Ser Pro Ser
50 55 60
Leu Lys Asn Ser Leu Thr Ile Thr Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala His Arg Ile His Leu Trp Ser Tyr Phe Tyr Tyr Gly Met Asp
100 105 110
Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 307
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 307
gatattgtga tgactcagtc tccactctcc ctgcccgtca cccctggaga gccggcctcc 60
atctcctgca ggtctagtca gactctcctg catagtaatg gatacaacta tttcgattgg 120
tacctgcaga agccagggca gtctccacag ctcctgatct atttgggttc taatcgggcc 180
tccggggtcc ctgacagatt cagtggcagt ggatcaggca cagattttac actgaaaatc 240
agcagagtgg aggctgagga tgttggaatt tattactgca tgcaagctct acaaactcct 300
ctcactttcg gcggagggac caaggtggag atcaaa 336
<210> 308
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 308
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Thr Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Phe Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Ile Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 309
<211> 372
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 309
cagatcacct tgaaggagtc tggtcctacg ctggtgaaac ccacacagac cctcacgctg 60
acctgcacct tctctgggtt ctcactcagc gctagtggag tgggtgtggg ctggatccgt 120
cagcccccag gaaaggccct ggagtggctt gcactcattt attggaatga tgataagcgc 180
tacagcccat ctctgaagag caggctcacc atcaccaagg acacctccaa aaaccaggtg 240
gtccttacaa tgaccaacat ggaccctgtg gacacagcca catattactg tgcacacaga 300
atacatctat ggtcctactt ctactacggt atggacgtct gggggcaagg gaccacggtc 360
accgtctcct ca 372
<210> 310
<211> 124
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 310
Gln Ile Thr Leu Lys Glu Ser Gly Pro Thr Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Ala Ser
20 25 30
Gly Val Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala Leu Ile Tyr Trp Asn Asp Asp Lys Arg Tyr Ser Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Thr Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala His Arg Ile His Leu Trp Ser Tyr Phe Tyr Tyr Gly Met Asp
100 105 110
Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 311
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 311
gatattgtga tgactcagtc tccactctcc ctgcccgtca cccctggaga gccggcctcc 60
atctcctgca ggtctagtca gactctcctg catagtaatg gatacaacta tttggattgg 120
tacctgcaga agccagggca gtctccacag ctcctgatct atttgggttc taatcgggcc 180
tccggggtcc ctgacaggtt cagtggcagt ggatcaggca cagattttac actgaaaatc 240
agcagagtgg aggctgagga tgttggggtt tattactgca tgcaagctct acaaactcct 300
ctcactttcg gcggagggac caaggtggag atcaaa 336
<210> 312
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 312
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Thr Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 313
<211> 381
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 313
caggttcagc tggtgcagtc tggacctgag gtgaagaacc ctggggcctc agtgaaggtc 60
tcctgcaagg cttctggtta cacctttacc acctatggta tcagttgggt acgacaggcc 120
cctggacaag ggcttgagtg gatgggatgg atcagcggtt acaatggtaa aacaaacgat 180
gcacagaagt tccaggacag agtcgccatg accacagaca catccacgag cacagcctac 240
atggagctga ggagcctgag atctgacgac acggccattt attactgttc gagagatcgt 300
ttagtagtac cacctgccct taattattcc tactacgtta tggacgtctg gggccaaggg 360
accacggtca ccgtctcctc a 381
<210> 314
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 314
Gln Val Gln Leu Val Gln Ser Gly Pro Glu Val Lys Asn Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Gly Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Ser Gly Tyr Asn Gly Lys Thr Asn Asp Ala Gln Lys Phe
50 55 60
Gln Asp Arg Val Ala Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ser Arg Asp Arg Leu Val Val Pro Pro Ala Leu Asn Tyr Ser Tyr Tyr
100 105 110
Val Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 315
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 315
ggttacacct ttaccaccta tggt 24
<210> 316
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 316
Gly Tyr Thr Phe Thr Thr Tyr Gly
1 5
<210> 317
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 317
atcagcggtt acaatggtaa aaca 24
<210> 318
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 318
Ile Ser Gly Tyr Asn Gly Lys Thr
1 5
<210> 319
<211> 60
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 319
tcgagagatc gtttagtagt accacctgcc cttaattatt cctactacgt tatggacgtc 60
<210> 320
<211> 20
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 320
Ser Arg Asp Arg Leu Val Val Pro Pro Ala Leu Asn Tyr Ser Tyr Tyr
1 5 10 15
Val Met Asp Val
20
<210> 321
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 321
gatgttgtga tgactcagtc tccactctcc ctgcccgtca cccttggaca gccggcctcc 60
atctcctgca ggtctagtca aagcctcgta tacagtgatg gaaacaccta cttgaattgg 120
tctcagcaga ggccaggtca atctccaagg cgcctaattt ataaggtttc taaccgggac 180
tctggggtcc cagacagatt cagcggcagt gggtcaggca ctgatttcac actgaaaatc 240
agcagggtgg aggctgagga tgttggggtt tattactgca tgcaaggtac acactggccg 300
tacacttttg gccaggggac caagctggag atcaaa 336
<210> 322
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 322
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Tyr Ser
20 25 30
Asp Gly Asn Thr Tyr Leu Asn Trp Ser Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Lys Val Ser Asn Arg Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Gly
85 90 95
Thr His Trp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 323
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 323
caaagcctcg tatacagtga tggaaacacc tac 33
<210> 324
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 324
Gln Ser Leu Val Tyr Ser Asp Gly Asn Thr Tyr
1 5 10
<210> 325
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 325
aaggtttct 9
<210> 326
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 326
Lys Val Ser
1
<210> 327
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 327
atgcaaggta cacactggcc gtacact 27
<210> 328
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 328
Met Gln Gly Thr His Trp Pro Tyr Thr
1 5
<210> 329
<211> 381
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 329
caggttcagc tggtgcagtc tggacctgag gtgaagaacc ctggggcctc agtgaaggtc 60
tcctgcaagg cttctggtta cacctttacc acctatggta tcagttgggt acgacaggcc 120
cctggacaag ggcttgagtg gatgggatgg atcagcggtt acaatggtaa aacaaacgat 180
gcacagaagt tccaggacag agtcgccatg accacagaca catccacgag cacagcctac 240
atggagctga ggagcctgag atctgacgac acggccattt attactgttc gagagatcgt 300
ttagtagtac cacctgccct taattattcc tactacgtta tggacgtctg gggccaaggg 360
accacggtca ccgtctcctc a 381
<210> 330
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 330
Gln Val Gln Leu Val Gln Ser Gly Pro Glu Val Lys Asn Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Gly Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Ser Gly Tyr Asn Gly Lys Thr Asn Asp Ala Gln Lys Phe
50 55 60
Gln Asp Arg Val Ala Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ser Arg Asp Arg Leu Val Val Pro Pro Ala Leu Asn Tyr Ser Tyr Tyr
100 105 110
Val Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 331
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 331
gatgttgtga tgactcagtc tccactctcc ctgcccgtca cccttggaca gccggcctcc 60
atctcctgca ggtctagtca aagcctcgta tacagtgatg gaaacaccta cttgaattgg 120
tctcagcaga ggccaggtca atctccaagg cgcctaattt ataaggtttc taaccgggac 180
tctggggtcc cagacagatt cagcggcagt gggtcaggca ctgatttcac actgaaaatc 240
agcagggtgg aggctgagga tgttggggtt tattactgca tgcaaggtac acactggccg 300
tacacttttg gccaggggac caagctggag atcaaa 336
<210> 332
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 332
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Tyr Ser
20 25 30
Asp Gly Asn Thr Tyr Leu Asn Trp Ser Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Lys Val Ser Asn Arg Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Gly
85 90 95
Thr His Trp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 333
<211> 381
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 333
caggttcagc tggtgcagtc tggagctgag gtgaagaagc ctggggcctc agtgaaggtc 60
tcctgcaagg cttctggtta cacctttacc acctatggta tcagctgggt gcgacaggcc 120
cctggacaag ggcttgagtg gatgggatgg atcagcggtt acaatggtaa aacaaactat 180
gcacagaagc tccagggcag agtcaccatg accacagaca catccacgag cacagcctac 240
atggagctga ggagcctgag atctgacgac acggccgtgt attactgttc gagagatcgt 300
ttagtagtac cacctgccct taattattcc tactacgtta tggacgtctg ggggcaaggg 360
accacggtca ccgtctcctc a 381
<210> 334
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 334
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Gly Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Ser Gly Tyr Asn Gly Lys Thr Asn Tyr Ala Gln Lys Leu
50 55 60
Gln Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Asp Arg Leu Val Val Pro Pro Ala Leu Asn Tyr Ser Tyr Tyr
100 105 110
Val Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 335
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 335
gatgttgtga tgactcagtc tccactctcc ctgcccgtca cccttggaca gccggcctcc 60
atctcctgca ggtctagtca aagcctcgta tacagtgatg gaaacaccta cttgaattgg 120
tttcagcaga ggccaggcca atctccaagg cgcctaattt ataaggtttc taaccgggac 180
tctggggtcc cagacagatt cagcggcagt gggtcaggca ctgatttcac actgaaaatc 240
agcagggtgg aggctgagga tgttggggtt tattactgca tgcaaggtac acactggccg 300
tacacttttg gccaggggac caagctggag atcaaa 336
<210> 336
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 336
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Tyr Ser
20 25 30
Asp Gly Asn Thr Tyr Leu Asn Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Lys Val Ser Asn Arg Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Gly
85 90 95
Thr His Trp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 337
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 337
gaggtgcagc tggtggagtc tgggggaggc ctggtcaagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt agctatagca tggactgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcatcc attagtagta gtagtagtta catatactac 180
gcagactctg tgaagggccg attcaccatc tccagagaca ccgccaagaa ctcactgtat 240
ctgcaaatga acagcctgag agacgaggac acggctgttt attactgtgc gagagagggc 300
agtagcagac tttttgacta ctggggccag ggaaccctgg tcaccgtctc ctca 354
<210> 338
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 338
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ser Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Ser Ser Ser Ser Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Thr Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Asp Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Ser Ser Arg Leu Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 339
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 339
ggattcacct tcagtagcta tagc 24
<210> 340
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 340
Gly Phe Thr Phe Ser Ser Tyr Ser
1 5
<210> 341
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 341
attagtagta gtagtagtta cata 24
<210> 342
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 342
Ile Ser Ser Ser Ser Ser Tyr Ile
1 5
<210> 343
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 343
gcgagagagg gcagtagcag actttttgac tac 33
<210> 344
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 344
Ala Arg Glu Gly Ser Ser Arg Leu Phe Asp Tyr
1 5 10
<210> 345
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 345
gacatccaga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggccagtca gagtattagt agctggttgg cctggtatca gcagagacca 120
gggaaagccc ctaagctcct gatctataag gcgtctagtt tagaaggtgg agtcccatca 180
aggttcagcg gcagtggatc tgggacagaa ttcactctca ccatcagcag cctgcagcct 240
gaggattttg caacttatta ctgccaacag tataatagtt attggtacac ttttggccag 300
gggaccaagc tggagatcaa a 321
<210> 346
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 346
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Arg Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Gly Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Trp Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 347
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 347
cagagtatta gtagctgg 18
<210> 348
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 348
Gln Ser Ile Ser Ser Trp
1 5
<210> 349
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 349
aaggcgtct 9
<210> 350
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 350
Lys Ala Ser
1
<210> 351
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 351
caacagtata atagttattg gtacact 27
<210> 352
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 352
Gln Gln Tyr Asn Ser Tyr Trp Tyr Thr
1 5
<210> 353
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 353
gaggtgcagc tggtggagtc tgggggaggc ctggtcaagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt agctatagca tggactgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcatcc attagtagta gtagtagtta catatactac 180
gcagactctg tgaagggccg attcaccatc tccagagaca ccgccaagaa ctcactgtat 240
ctgcaaatga acagcctgag agacgaggac acggctgttt attactgtgc gagagagggc 300
agtagcagac tttttgacta ctggggccag ggaaccctgg tcaccgtctc ctca 354
<210> 354
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 354
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ser Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Ser Ser Ser Ser Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Thr Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Asp Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Ser Ser Arg Leu Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 355
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 355
gacatccaga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggccagtca gagtattagt agctggttgg cctggtatca gcagagacca 120
gggaaagccc ctaagctcct gatctataag gcgtctagtt tagaaggtgg agtcccatca 180
aggttcagcg gcagtggatc tgggacagaa ttcactctca ccatcagcag cctgcagcct 240
gaggattttg caacttatta ctgccaacag tataatagtt attggtacac ttttggccag 300
gggaccaagc tggagatcaa a 321
<210> 356
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 356
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Arg Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Gly Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Trp Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 357
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 357
gaggtgcagc tggtggagtc tgggggaggc ctggtcaagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt agctatagca tgaactgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcatcc attagtagta gtagtagtta catatactac 180
gcagactcag tgaagggccg attcaccatc tccagagaca acgccaagaa ctcactgtat 240
ctgcaaatga acagcctgag agccgaggac acggctgtgt attactgtgc gagagagggc 300
agtagcagac tttttgacta ctggggccaa ggaaccctgg tcaccgtctc ctca 354
<210> 358
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 358
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ser Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Ser Ser Ser Ser Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Ser Ser Arg Leu Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 359
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 359
gacatccaga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggccagtca gagtattagt agctggttgg cctggtatca gcagaaacca 120
gggaaagccc ctaagctcct gatctataag gcgtctagtt tagaaagtgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagaa ttcactctca ccatcagcag cctgcagcct 240
gatgattttg caacttatta ctgccaacag tataatagtt attggtacac ttttggccag 300
gggaccaagc tggagatcaa a 321
<210> 360
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 360
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Trp Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 361
<211> 384
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 361
caggtgcacc tggtggagtc tgggggaggc ttggtcaagc ctggagggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt gaccactaca tgagctggat ccgccaggct 120
ccagggaagg ggctggagtg gatttcatac attagtaatg atggtggtac caaatactat 180
gtggactctg tggagggccg attcatcatt tccagggaca acgccaagaa ctcattgtat 240
ctacatatga acagcctcag agccgacgac acggccgtgt attactgtgc gagagatcag 300
ggatatattg gctacgactc gtattattac tattcctacg gtatggacgt ctggggccaa 360
gggaccacgg tcaccgtcgc ctca 384
<210> 362
<211> 128
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 362
Gln Val His Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp His
20 25 30
Tyr Met Ser Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Ser Tyr Ile Ser Asn Asp Gly Gly Thr Lys Tyr Tyr Val Asp Ser Val
50 55 60
Glu Gly Arg Phe Ile Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu His Met Asn Ser Leu Arg Ala Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gln Gly Tyr Ile Gly Tyr Asp Ser Tyr Tyr Tyr Tyr Ser
100 105 110
Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ala Ser
115 120 125
<210> 363
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 363
ggattcacct tcagtgacca ctac 24
<210> 364
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 364
Gly Phe Thr Phe Ser Asp His Tyr
1 5
<210> 365
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 365
attagtaatg atggtggtac caaa 24
<210> 366
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 366
Ile Ser Asn Asp Gly Gly Thr Lys
1 5
<210> 367
<211> 63
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 367
gcgagagatc agggatatat tggctacgac tcgtattatt actattccta cggtatggac 60
gtc 63
<210> 368
<211> 21
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 368
Ala Arg Asp Gln Gly Tyr Ile Gly Tyr Asp Ser Tyr Tyr Tyr Tyr Ser
1 5 10 15
Tyr Gly Met Asp Val
20
<210> 369
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 369
aaaattgtgt tgacgcagtc tccaggcacc ctgcctttgt ttccagggga aagagccacc 60
ctctcctgta gggccagtca gagtgttaac aacaaattct tagcctggta ccagcagaaa 120
tctggccagg ctcccaggct cctcatctat ggtgcatcca gcagggccac tggcatccca 180
gacaggttca gtggcagtgg gtctgggacc gacttcactc tcaccatcag cggactggag 240
cctgaagatt ttgaagtgta ttattgtcaa gtatatggta actcactcac tctcggcgga 300
gggaccaagg tggagatcaa g 321
<210> 370
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 370
Lys Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Pro Leu Phe Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Asn Asn Lys
20 25 30
Phe Leu Ala Trp Tyr Gln Gln Lys Ser Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Gly Leu Glu
65 70 75 80
Pro Glu Asp Phe Glu Val Tyr Tyr Cys Gln Val Tyr Gly Asn Ser Leu
85 90 95
Thr Leu Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 371
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 371
cagagtgtta acaacaaatt c 21
<210> 372
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 372
Gln Ser Val Asn Asn Lys Phe
1 5
<210> 373
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 373
ggtgcatcc 9
<210> 374
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 374
Gly Ala Ser
1
<210> 375
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 375
caagtatatg gtaactcact cact 24
<210> 376
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 376
Gln Val Tyr Gly Asn Ser Leu Thr
1 5
<210> 377
<211> 384
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 377
caggtgcagc tggtggagtc tgggggaggc ttggtcaagc ctggagggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt gaccactaca tgagctggat ccgccaggct 120
ccagggaagg ggctggagtg gatttcatac attagtaatg atggtggtac caaatactat 180
gtggactctg tggagggccg attcatcatt tccagggaca acgccaagaa ctcattgtat 240
ctacatatga acagcctcag agccgacgac acggccgtgt attactgtgc gagagatcag 300
ggatatattg gctacgactc gtattattac tattcctacg gtatggacgt ctggggccaa 360
gggaccacgg tcaccgtctc ctca 384
<210> 378
<211> 128
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 378
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp His
20 25 30
Tyr Met Ser Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Ser Tyr Ile Ser Asn Asp Gly Gly Thr Lys Tyr Tyr Val Asp Ser Val
50 55 60
Glu Gly Arg Phe Ile Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu His Met Asn Ser Leu Arg Ala Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gln Gly Tyr Ile Gly Tyr Asp Ser Tyr Tyr Tyr Tyr Ser
100 105 110
Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 379
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 379
gaaattgtgt tgacgcagtc tccaggcacc ctgcctttgt ttccagggga aagagccacc 60
ctctcctgta gggccagtca gagtgttaac aacaaattct tagcctggta ccagcagaaa 120
tctggccagg ctcccaggct cctcatctat ggtgcatcca gcagggccac tggcatccca 180
gacaggttca gtggcagtgg gtctgggacc gacttcactc tcaccatcag cggactggag 240
cctgaagatt ttgaagtgta ttattgtcaa gtatatggta actcactcac tctcggcgga 300
gggaccaagg tggagatcaa a 321
<210> 380
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 380
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Pro Leu Phe Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Asn Asn Lys
20 25 30
Phe Leu Ala Trp Tyr Gln Gln Lys Ser Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Gly Leu Glu
65 70 75 80
Pro Glu Asp Phe Glu Val Tyr Tyr Cys Gln Val Tyr Gly Asn Ser Leu
85 90 95
Thr Leu Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 381
<211> 384
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 381
caggtgcagc tggtggagtc tgggggaggc ttggtcaagc ctggagggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt gaccactaca tgagctggat ccgccaggct 120
ccagggaagg ggctggagtg ggtttcatac attagtaatg atggtggtac caaatactac 180
gcagactctg tgaagggccg attcaccatc tccagggaca acgccaagaa ctcactgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactgtgc gagagatcag 300
ggatatattg gctacgactc gtattattac tattcctacg gtatggacgt ctgggggcaa 360
gggaccacgg tcaccgtctc ctca 384
<210> 382
<211> 128
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 382
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp His
20 25 30
Tyr Met Ser Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Asn Asp Gly Gly Thr Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gln Gly Tyr Ile Gly Tyr Asp Ser Tyr Tyr Tyr Tyr Ser
100 105 110
Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 383
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 383
gaaattgtgt tgacgcagtc tccaggcacc ctgtctttgt ctccagggga aagagccacc 60
ctctcctgca gggccagtca gagtgttaac aacaaattct tagcctggta ccagcagaaa 120
cctggccagg ctcccaggct cctcatctat ggtgcatcca gcagggccac tggcatccca 180
gacaggttca gtggcagtgg gtctgggaca gacttcactc tcaccatcag cagactggag 240
cctgaagatt ttgcagtgta ttactgtcaa gtatatggta actcactcac tttcggcgga 300
gggaccaagg tggagatcaa a 321
<210> 384
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 384
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Asn Asn Lys
20 25 30
Phe Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Val Tyr Gly Asn Ser Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 385
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 385
gaggtgcaga aggtggagtc tgggggaggc ctggtcaagc cgggggggtc cctgagactc 60
tcctgtacag cctctggatt caccttcagt acttataaca tgaattgggt ccgccaggct 120
ccagggaagg gactggagtg ggtctcatcc attaggagta gtagtaatta catatactac 180
gcagactcag tgaagggccg attcaccatc tccagagaca acgccaagaa ttcactgtat 240
ctgcaaatga acagcctgag agccgatgac acggctgtgt attactgtgc gagagatggc 300
agcagttggt acgactactc tgactactgg ggccagggaa ccctggtcac cgtctcctca 360
<210> 386
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 386
Glu Val Gln Lys Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Asn Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Ser Asn Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gly Ser Ser Trp Tyr Asp Tyr Ser Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 387
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 387
ggattcacct tcagtactta taac 24
<210> 388
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 388
Gly Phe Thr Phe Ser Thr Tyr Asn
1 5
<210> 389
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 389
attaggagta gtagtaatta cata 24
<210> 390
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 390
Ile Arg Ser Ser Ser Asn Tyr Ile
1 5
<210> 391
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 391
gcgagagatg gcagcagttg gtacgactac tctgactac 39
<210> 392
<211> 13
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 392
Ala Arg Asp Gly Ser Ser Trp Tyr Asp Tyr Ser Asp Tyr
1 5 10
<210> 393
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 393
gacatccaga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggccagtca gagtattagt agctggttgg cctggtatca acagatacca 120
gggaaagccc ctaaactcct gatctataag gcgtctagtt tagaaaatgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagaa ttcactctca tcatcagcag cctgcagcct 240
gatgattttg caacttatta ctgccaacag tatattagtt attctcggac gttcggccaa 300
gggaccaagg tggaaatcaa a 321
<210> 394
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 394
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Ile Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Asn Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Ile Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ile Ser Tyr Ser Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 395
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 395
cagagtatta gtagctgg 18
<210> 396
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 396
Gln Ser Ile Ser Ser Trp
1 5
<210> 397
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 397
aaggcgtct 9
<210> 398
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 398
Lys Ala Ser
1
<210> 399
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 399
caacagtata ttagttattc tcggacg 27
<210> 400
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 400
Gln Gln Tyr Ile Ser Tyr Ser Arg Thr
1 5
<210> 401
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 401
gaggtgcagc tggtggagtc tgggggaggc ctggtcaagc cgggggggtc cctgagactc 60
tcctgtacag cctctggatt caccttcagt acttataaca tgaattgggt ccgccaggct 120
ccagggaagg gactggagtg ggtctcatcc attaggagta gtagtaatta catatactac 180
gcagactcag tgaagggccg attcaccatc tccagagaca acgccaagaa ttcactgtat 240
ctgcaaatga acagcctgag agccgatgac acggctgtgt attactgtgc gagagatggc 300
agcagttggt acgactactc tgactactgg ggccagggaa ccctggtcac cgtctcctca 360
<210> 402
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 402
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Asn Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Ser Asn Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gly Ser Ser Trp Tyr Asp Tyr Ser Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 403
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 403
gacatccaga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggccagtca gagtattagt agctggttgg cctggtatca acagatacca 120
gggaaagccc ctaaactcct gatctataag gcgtctagtt tagaaaatgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagaa ttcactctca tcatcagcag cctgcagcct 240
gatgattttg caacttatta ctgccaacag tatattagtt attctcggac gttcggccaa 300
gggaccaagg tggaaatcaa a 321
<210> 404
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 404
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Ile Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Asn Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Ile Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ile Ser Tyr Ser Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 405
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 405
gaggtgcagc tggtggagtc tgggggaggc ctggtcaagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt acttataaca tgaactgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcatcc attaggagta gtagtaatta catatactac 180
gcagactcag tgaagggccg attcaccatc tccagagaca acgccaagaa ctcactgtat 240
ctgcaaatga acagcctgag agccgaggac acggctgtgt attactgtgc gagagatggc 300
agcagttggt acgactactc tgactactgg ggccaaggaa ccctggtcac cgtctcctca 360
<210> 406
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 406
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Asn Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Ser Asn Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gly Ser Ser Trp Tyr Asp Tyr Ser Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 407
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 407
gacatccaga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggccagtca gagtattagt agctggttgg cctggtatca gcagaaacca 120
gggaaagccc ctaagctcct gatctataag gcgtctagtt tagaaagtgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagaa ttcactctca ccatcagcag cctgcagcct 240
gatgattttg caacttatta ctgccaacag tatattagtt attctcggac gttcggccaa 300
gggaccaagg tggaaatcaa a 321
<210> 408
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 408
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ile Ser Tyr Ser Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 409
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 409
gaggtgcagc tggtggagtc tgggggaggc ctggtcaagc cgggggggtc cctgagactc 60
tcctgtacag cctctggatt caccttcagt acttataaca tgaattgggt ccgccaggct 120
ccagggaagg gactggagtg ggtctcatcc attaggagta gtagtaatta catatactac 180
gcagactcag tgaagggccg attcaccatc tccagagaca acgccaagaa ttcactgtat 240
ctgcaaatga acagcctgag agccgatgac acggctgtgt attactgtgc gagagatggc 300
agcagttggt acgactactc tgactactgg ggccagggaa ccctggtcac cgtctcctca 360
<210> 410
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 410
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Asn Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Ser Asn Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gly Ser Ser Trp Tyr Asp Tyr Ser Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 411
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 411
ggattcacct tcagtactta taac 24
<210> 412
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 412
Gly Phe Thr Phe Ser Thr Tyr Asn
1 5
<210> 413
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 413
attaggagta gtagtaatta cata 24
<210> 414
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 414
Ile Arg Ser Ser Ser Asn Tyr Ile
1 5
<210> 415
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 415
gcgagagatg gcagcagttg gtacgactac tctgactac 39
<210> 416
<211> 13
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 416
Ala Arg Asp Gly Ser Ser Trp Tyr Asp Tyr Ser Asp Tyr
1 5 10
<210> 417
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 417
gacatccaga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggccagtca gagtattagt agctggttgg cctggtatca acagatacca 120
gggaaagccc ctaaactcct gatctataag gcgtctagtt tagaaaatgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagaa ttcactctca tcatcagcag cctgcagcct 240
gatgattttg caacttatta ctgccaacag tatattagtt attctcggac gttcggccaa 300
gggaccaagg tggaaatcaa a 321
<210> 418
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 418
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Ile Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Asn Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Ile Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ile Ser Tyr Ser Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 419
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 419
cagagtatta gtagctgg 18
<210> 420
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 420
Gln Ser Ile Ser Ser Trp
1 5
<210> 421
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 421
aaggcgtct 9
<210> 422
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 422
Lys Ala Ser
1
<210> 423
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 423
caacagtata ttagttattc tcggacg 27
<210> 424
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 424
Gln Gln Tyr Ile Ser Tyr Ser Arg Thr
1 5
<210> 425
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 425
gaggtgcagc tggtggagtc tgggggaggc ctggtcaagc cgggggggtc cctgagactc 60
tcctgtacag cctctggatt caccttcagt acttataaca tgaattgggt ccgccaggct 120
ccagggaagg gactggagtg ggtctcatcc attaggagta gtagtaatta catatactac 180
gcagactcag tgaagggccg attcaccatc tccagagaca acgccaagaa ttcactgtat 240
ctgcaaatga acagcctgag agccgatgac acggctgtgt attactgtgc gagagatggc 300
agcagttggt acgactactc tgactactgg ggccagggaa ccctggtcac cgtctcctca 360
<210> 426
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 426
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Asn Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Ser Asn Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gly Ser Ser Trp Tyr Asp Tyr Ser Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 427
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 427
gacatccaga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggccagtca gagtattagt agctggttgg cctggtatca acagatacca 120
gggaaagccc ctaaactcct gatctataag gcgtctagtt tagaaaatgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagaa ttcactctca tcatcagcag cctgcagcct 240
gatgattttg caacttatta ctgccaacag tatattagtt attctcggac gttcggccaa 300
gggaccaagg tggaaatcaa a 321
<210> 428
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 428
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Ile Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Asn Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Ile Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ile Ser Tyr Ser Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 429
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 429
gaggtgcagc tggtggagtc tgggggaggc ctggtcaagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt acttataaca tgaactgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcatcc attaggagta gtagtaatta catatactac 180
gcagactcag tgaagggccg attcaccatc tccagagaca acgccaagaa ctcactgtat 240
ctgcaaatga acagcctgag agccgaggac acggctgtgt attactgtgc gagagatggc 300
agcagttggt acgactactc tgactactgg ggccaaggaa ccctggtcac cgtctcctca 360
<210> 430
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 430
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Asn Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Ser Asn Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gly Ser Ser Trp Tyr Asp Tyr Ser Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 431
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 431
gacatccaga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggccagtca gagtattagt agctggttgg cctggtatca gcagaaacca 120
gggaaagccc ctaagctcct gatctataag gcgtctagtt tagaaagtgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagaa ttcactctca ccatcagcag cctgcagcct 240
gatgattttg caacttatta ctgccaacag tatattagtt attctcggac gttcggccaa 300
gggaccaagg tggaaatcaa a 321
<210> 432
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 432
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ile Ser Tyr Ser Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 433
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 433
gaggtgcagc tggtggagtc tgggggaggc ctggtcaagc cgggggggtc cctgagactc 60
tcctgtacag cctctggatt caccttcagt acttataaca tgaattgggt ccgccaggct 120
ccagggaagg gactggagtg ggtctcatcc attaggagta gtagtaatta catatactac 180
gcagactcag tgaagggccg attcaccatc tccagagaca acgccaagag ttcactgtat 240
ctgcaaatga acagcctgag agccgaggac acggctgtgt attactgtgc gagagatggc 300
agcagttggt acgactactc tgactactgg ggccagggaa ccctggtcac cgtctcctca 360
<210> 434
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 434
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Asn Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Ser Asn Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Ser Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gly Ser Ser Trp Tyr Asp Tyr Ser Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 435
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 435
ggattcacct tcagtactta taac 24
<210> 436
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 436
Gly Phe Thr Phe Ser Thr Tyr Asn
1 5
<210> 437
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 437
attaggagta gtagtaatta cata 24
<210> 438
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 438
Ile Arg Ser Ser Ser Asn Tyr Ile
1 5
<210> 439
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 439
gcgagagatg gcagcagttg gtacgactac tctgactac 39
<210> 440
<211> 13
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 440
Ala Arg Asp Gly Ser Ser Trp Tyr Asp Tyr Ser Asp Tyr
1 5 10
<210> 441
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 441
gacatccaga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggccagtca gagtattagt agctggttgg cctggtatca acaggtacca 120
gggaaagccc ctaaactcct gatctataag gcgtctagtt tagaaaatgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagaa ttcactctca tcatcagcag cctgcagcct 240
gatgattttg caacttatta ctgccaacag tatattagtt attctcggac gttcggccaa 300
gggaccaagg tggaaatcaa a 321
<210> 442
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 442
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Val Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Asn Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Ile Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ile Ser Tyr Ser Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 443
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 443
cagagtatta gtagctgg 18
<210> 444
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 444
Gln Ser Ile Ser Ser Trp
1 5
<210> 445
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 445
aaggcgtct 9
<210> 446
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 446
Lys Ala Ser
1
<210> 447
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 447
caacagtata ttagttattc tcggacg 27
<210> 448
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 448
Gln Gln Tyr Ile Ser Tyr Ser Arg Thr
1 5
<210> 449
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 449
gaggtgcagc tggtggagtc tgggggaggc ctggtcaagc cgggggggtc cctgagactc 60
tcctgtacag cctctggatt caccttcagt acttataaca tgaattgggt ccgccaggct 120
ccagggaagg gactggagtg ggtctcatcc attaggagta gtagtaatta catatactac 180
gcagactcag tgaagggccg attcaccatc tccagagaca acgccaagag ttcactgtat 240
ctgcaaatga acagcctgag agccgaggac acggctgtgt attactgtgc gagagatggc 300
agcagttggt acgactactc tgactactgg ggccagggaa ccctggtcac cgtctcctca 360
<210> 450
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 450
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Asn Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Ser Asn Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Ser Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gly Ser Ser Trp Tyr Asp Tyr Ser Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 451
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 451
gacatccaga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggccagtca gagtattagt agctggttgg cctggtatca acaggtacca 120
gggaaagccc ctaaactcct gatctataag gcgtctagtt tagaaaatgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagaa ttcactctca tcatcagcag cctgcagcct 240
gatgattttg caacttatta ctgccaacag tatattagtt attctcggac gttcggccaa 300
gggaccaagg tggaaatcaa a 321
<210> 452
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 452
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Val Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Asn Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Ile Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ile Ser Tyr Ser Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 453
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 453
gaggtgcagc tggtggagtc tgggggaggc ctggtcaagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt acttataaca tgaactgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcatcc attaggagta gtagtaatta catatactac 180
gcagactcag tgaagggccg attcaccatc tccagagaca acgccaagaa ctcactgtat 240
ctgcaaatga acagcctgag agccgaggac acggctgtgt attactgtgc gagagatggc 300
agcagttggt acgactactc tgactactgg ggccagggaa ccctggtcac cgtctcctca 360
<210> 454
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 454
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Asn Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Ser Asn Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gly Ser Ser Trp Tyr Asp Tyr Ser Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 455
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 455
gacatccaga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggccagtca gagtattagt agctggttgg cctggtatca gcagaaacca 120
gggaaagccc ctaagctcct gatctataag gcgtctagtt tagaaagtgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagaa ttcactctca ccatcagcag cctgcagcct 240
gatgattttg caacttatta ctgccaacag tatattagtt attctcggac gttcggccaa 300
gggaccaagg tggaaatcaa a 321
<210> 456
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 456
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ile Ser Tyr Ser Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 457
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 457
gaggtgcagc tggtggagtc tgggggaggc ctggtcaagc cgggggggtc cctgagactc 60
tcctgtacag cctctggatt caccttcagt acttataaca tgaattgggt ccgccaggct 120
ccagggaagg gactggagtg ggtctcatcc attaggagta gtagtaatta catatactac 180
gcagactcag tgaagggccg attcaccatc tccagagaca acgccaagaa ttcactgtat 240
ctgcaaatga acagcctgag agccgatgac acggctgtgt attactgtgc gagagatggc 300
agcagttggt acgactactc tgactactgg ggccagggaa ccctggtcac cgtctcctca 360
<210> 458
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 458
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Asn Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Ser Asn Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gly Ser Ser Trp Tyr Asp Tyr Ser Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 459
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 459
ggattcacct tcagtactta taac 24
<210> 460
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 460
Gly Phe Thr Phe Ser Thr Tyr Asn
1 5
<210> 461
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 461
attaggagta gtagtaatta cata 24
<210> 462
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 462
Ile Arg Ser Ser Ser Asn Tyr Ile
1 5
<210> 463
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 463
gcgagagatg gcagcagttg gtacgactac tctgactac 39
<210> 464
<211> 13
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 464
Ala Arg Asp Gly Ser Ser Trp Tyr Asp Tyr Ser Asp Tyr
1 5 10
<210> 465
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 465
gacatccaga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggccagtca gagtattagt agctggttgg cctggtatca acagatacca 120
gggaaagccc ctaaactcct gatctataag gcgtctagtt tagaaaatgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagaa ttcactctca tcatcagcag cctgcagcct 240
gatgattttg caacttatta ctgccaacag tatattagtt attctcggac gttcggccaa 300
gggaccaagg tggaaatcaa a 321
<210> 466
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 466
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Ile Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Asn Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Ile Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ile Ser Tyr Ser Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 467
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 467
cagagtatta gtagctgg 18
<210> 468
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 468
Gln Ser Ile Ser Ser Trp
1 5
<210> 469
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 469
aaggcgtct 9
<210> 470
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 470
Lys Ala Ser
1
<210> 471
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 471
caacagtata ttagttattc tcggacg 27
<210> 472
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 472
Gln Gln Tyr Ile Ser Tyr Ser Arg Thr
1 5
<210> 473
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 473
gaggtgcagc tggtggagtc tgggggaggc ctggtcaagc cgggggggtc cctgagactc 60
tcctgtacag cctctggatt caccttcagt acttataaca tgaattgggt ccgccaggct 120
ccagggaagg gactggagtg ggtctcatcc attaggagta gtagtaatta catatactac 180
gcagactcag tgaagggccg attcaccatc tccagagaca acgccaagaa ttcactgtat 240
ctgcaaatga acagcctgag agccgatgac acggctgtgt attactgtgc gagagatggc 300
agcagttggt acgactactc tgactactgg ggccagggaa ccctggtcac cgtctcctca 360
<210> 474
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 474
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Asn Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Ser Asn Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gly Ser Ser Trp Tyr Asp Tyr Ser Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 475
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 475
gacatccaga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggccagtca gagtattagt agctggttgg cctggtatca acagatacca 120
gggaaagccc ctaaactcct gatctataag gcgtctagtt tagaaaatgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagaa ttcactctca tcatcagcag cctgcagcct 240
gatgattttg caacttatta ctgccaacag tatattagtt attctcggac gttcggccaa 300
gggaccaagg tggaaatcaa a 321
<210> 476
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 476
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Ile Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Asn Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Ile Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ile Ser Tyr Ser Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 477
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 477
gaggtgcagc tggtggagtc tgggggaggc ctggtcaagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt acttataaca tgaactgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcatcc attaggagta gtagtaatta catatactac 180
gcagactcag tgaagggccg attcaccatc tccagagaca acgccaagaa ctcactgtat 240
ctgcaaatga acagcctgag agccgaggac acggctgtgt attactgtgc gagagatggc 300
agcagttggt acgactactc tgactactgg ggccaaggaa ccctggtcac cgtctcctca 360
<210> 478
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 478
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Asn Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Arg Ser Ser Ser Asn Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gly Ser Ser Trp Tyr Asp Tyr Ser Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 479
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 479
gacatccaga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggccagtca gagtattagt agctggttgg cctggtatca gcagaaacca 120
gggaaagccc ctaagctcct gatctataag gcgtctagtt tagaaagtgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagaa ttcactctca ccatcagcag cctgcagcct 240
gatgattttg caacttatta ctgccaacag tatattagtt attctcggac gttcggccaa 300
gggaccaagg tggaaatcaa a 321
<210> 480
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 480
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ile Ser Tyr Ser Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 481
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 481
gaggtgcaac tagtggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgtag tctctggatt caccttcggt gactacgaca tgcactgggt ccgtcaagct 120
acaggaagag gtctggagtg ggtctcaggt attgctcctg ctggtgacac atcctataca 180
ggctccgtga agggccgatt caccatctcc agagagaatg ccaagaactc cttgcatctt 240
caaatgaaca gcctgacaac cggggacacg gctatatatt attgtgctag agaggatata 300
gcagtgcctg gttttgatta ctggggccag ggaaccctgg tcaccgtctc ctca 354
<210> 482
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 482
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Val Val Ser Gly Phe Thr Phe Gly Asp Tyr
20 25 30
Asp Met His Trp Val Arg Gln Ala Thr Gly Arg Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ala Pro Ala Gly Asp Thr Ser Tyr Thr Gly Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Glu Asn Ala Lys Asn Ser Leu His Leu
65 70 75 80
Gln Met Asn Ser Leu Thr Thr Gly Asp Thr Ala Ile Tyr Tyr Cys Ala
85 90 95
Arg Glu Asp Ile Ala Val Pro Gly Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 483
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 483
ggattcacct tcggtgacta cgac 24
<210> 484
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 484
Gly Phe Thr Phe Gly Asp Tyr Asp
1 5
<210> 485
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 485
attgctcctg ctggtgacac a 21
<210> 486
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 486
Ile Ala Pro Ala Gly Asp Thr
1 5
<210> 487
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 487
gctagagagg atatagcagt gcctggtttt gattac 36
<210> 488
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 488
Ala Arg Glu Asp Ile Ala Val Pro Gly Phe Asp Tyr
1 5 10
<210> 489
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 489
gaaatagtga tgacgcagtc tccagccacc ctgtctgtgt ctccagggga acgaggcacc 60
ctctcctgca gggccagtca gagtgttagc agcaacttag cctggtacca gcagaaacct 120
ggccaggctc ccagactcct catctatggt gcatccacga gggccactgg cttcccagcc 180
aggttcagtg gcagtgggtc tgggacagag ttcactctca ccatcagcag cctgcagtct 240
gaagattttg cagtttatta ctgtcagcag tataataagt ggcctccgtt cactttcggc 300
cctgggacca aagtggattt caaa 324
<210> 490
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 490
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Gly Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Phe Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Lys Trp Pro Pro
85 90 95
Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Phe Lys
100 105
<210> 491
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 491
cagagtgtta gcagcaac 18
<210> 492
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 492
Gln Ser Val Ser Ser Asn
1 5
<210> 493
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 493
ggtgcatcc 9
<210> 494
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 494
Gly Ala Ser
1
<210> 495
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 495
cagcagtata ataagtggcc tccgttcact 30
<210> 496
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 496
Gln Gln Tyr Asn Lys Trp Pro Pro Phe Thr
1 5 10
<210> 497
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 497
gaggtgcaac tagtggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgtag tctctggatt caccttcggt gactacgaca tgcactgggt ccgtcaagct 120
acaggaagag gtctggagtg ggtctcaggt attgctcctg ctggtgacac atcctataca 180
ggctccgtga agggccgatt caccatctcc agagagaatg ccaagaactc cttgcatctt 240
caaatgaaca gcctgacaac cggggacacg gctatatatt attgtgctag agaggatata 300
gcagtgcctg gttttgatta ctggggccag ggaaccctgg tcaccgtctc ctca 354
<210> 498
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 498
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Val Val Ser Gly Phe Thr Phe Gly Asp Tyr
20 25 30
Asp Met His Trp Val Arg Gln Ala Thr Gly Arg Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ala Pro Ala Gly Asp Thr Ser Tyr Thr Gly Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Glu Asn Ala Lys Asn Ser Leu His Leu
65 70 75 80
Gln Met Asn Ser Leu Thr Thr Gly Asp Thr Ala Ile Tyr Tyr Cys Ala
85 90 95
Arg Glu Asp Ile Ala Val Pro Gly Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 499
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 499
gaaatagtga tgacgcagtc tccagccacc ctgtctgtgt ctccagggga acgaggcacc 60
ctctcctgca gggccagtca gagtgttagc agcaacttag cctggtacca gcagaaacct 120
ggccaggctc ccagactcct catctatggt gcatccacga gggccactgg cttcccagcc 180
aggttcagtg gcagtgggtc tgggacagag ttcactctca ccatcagcag cctgcagtct 240
gaagattttg cagtttatta ctgtcagcag tataataagt ggcctccgtt cactttcggc 300
cctgggacca aagtggatat caaa 324
<210> 500
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 500
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Gly Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Phe Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Lys Trp Pro Pro
85 90 95
Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 501
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 501
gaggtgcagc tggtggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcggt gactacgaca tgcactgggt ccgccaagct 120
acaggaaaag gtctggagtg ggtctcagct attgctcctg ctggtgacac atactatcca 180
ggctccgtga agggccgatt caccatctcc agagaaaatg ccaagaactc cttgtatctt 240
caaatgaaca gcctgagagc cggggacacg gctgtgtatt actgtgctag agaggatata 300
gcagtgcctg gttttgatta ctggggccaa ggaaccctgg tcaccgtctc ctca 354
<210> 502
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 502
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gly Asp Tyr
20 25 30
Asp Met His Trp Val Arg Gln Ala Thr Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ala Pro Ala Gly Asp Thr Tyr Tyr Pro Gly Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Glu Asn Ala Lys Asn Ser Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Gly Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Asp Ile Ala Val Pro Gly Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 503
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 503
gaaatagtga tgacgcagtc tccagccacc ctgtctgtgt ctccagggga aagagccacc 60
ctctcctgca gggccagtca gagtgttagc agcaacttag cctggtacca gcagaaacct 120
ggccaggctc ccaggctcct catctatggt gcatccacca gggccactgg tatcccagcc 180
aggttcagtg gcagtgggtc tgggacagag ttcactctca ccatcagcag cctgcagtct 240
gaagattttg cagtttatta ctgtcagcag tataataagt ggcctccgtt cactttcggc 300
cctgggacca aagtggatat caaa 324
<210> 504
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 504
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Lys Trp Pro Pro
85 90 95
Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 505
<211> 378
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 505
caaattctgc tggtgcaatc tggacctgag gtgaaggagc ctggggcctc agtgaaggtc 60
tcctgcaagg cttctggtta cacctttacc aactacgcta tcagctgggt gcgacaggtc 120
cctggacaag ggcttgagtg gatgggatgg gtcagcgctt acaatggtca cacaaactat 180
gcacatgaag tccagggcag agtcaccatg accacagaca catccacgac cacagcctac 240
atggagctga ggagcctgag atctgacgac acggccatgt attactgtgc gagagggggt 300
gtagtcgtgc cagttgctcc ccacttctac aacggtatgg acgtctgggg ccaagggacc 360
acggtcaccg tctcctca 378
<210> 506
<211> 126
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 506
Gln Ile Leu Leu Val Gln Ser Gly Pro Glu Val Lys Glu Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Val Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Val Ser Ala Tyr Asn Gly His Thr Asn Tyr Ala His Glu Val
50 55 60
Gln Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Thr Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Val Val Val Pro Val Ala Pro His Phe Tyr Asn Gly
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 507
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 507
ggttacacct ttaccaacta cgct 24
<210> 508
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 508
Gly Tyr Thr Phe Thr Asn Tyr Ala
1 5
<210> 509
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 509
gtcagcgctt acaatggtca caca 24
<210> 510
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 510
Val Ser Ala Tyr Asn Gly His Thr
1 5
<210> 511
<211> 57
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 511
gcgagagggg gtgtagtcgt gccagttgct ccccacttct acaacggtat ggacgtc 57
<210> 512
<211> 19
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 512
Ala Arg Gly Gly Val Val Val Pro Val Ala Pro His Phe Tyr Asn Gly
1 5 10 15
Met Asp Val
<210> 513
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 513
gatattgtga tgactcagtt tccactctcc ctgcccgtca cccctggaga gccggcctcc 60
atctcctgca ggtctagtca gagcctcctg catattaatg aatacaacta tttggattgg 120
tacctaaaga agccagggca gtctccacag ctcctgatct atttgggttt taatcgggcc 180
tccggggtcc ctgacaggtt cagtggcagt ggatcaggca cagattttac actgaaaatc 240
agcagagtgg aggctgagga tgttggggtc tattactgca tgcaagctct tcaaactccg 300
tggacgttag gccaagggac caaggtggaa atcaaa 336
<210> 514
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 514
Asp Ile Val Met Thr Gln Phe Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ile
20 25 30
Asn Glu Tyr Asn Tyr Leu Asp Trp Tyr Leu Lys Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Phe Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Trp Thr Leu Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 515
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 515
cagagcctcc tgcatattaa tgaatacaac tat 33
<210> 516
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 516
Gln Ser Leu Leu His Ile Asn Glu Tyr Asn Tyr
1 5 10
<210> 517
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 517
ttgggtttt 9
<210> 518
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 518
Leu Gly Phe
1
<210> 519
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 519
atgcaagctc ttcaaactcc gtggacg 27
<210> 520
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 520
Met Gln Ala Leu Gln Thr Pro Trp Thr
1 5
<210> 521
<211> 378
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 521
caggttcagc tggtgcagtc tggacctgag gtgaaggagc ctggggcctc agtgaaggtc 60
tcctgcaagg cttctggtta cacctttacc aactacgcta tcagctgggt gcgacaggtc 120
cctggacaag ggcttgagtg gatgggatgg gtcagcgctt acaatggtca cacaaactat 180
gcacatgaag tccagggcag agtcaccatg accacagaca catccacgac cacagcctac 240
atggagctga ggagcctgag atctgacgac acggccatgt attactgtgc gagagggggt 300
gtagtcgtgc cagttgctcc ccacttctac aacggtatgg acgtctgggg ccaagggacc 360
acggtcaccg tctcctca 378
<210> 522
<211> 126
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 522
Gln Val Gln Leu Val Gln Ser Gly Pro Glu Val Lys Glu Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Val Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Val Ser Ala Tyr Asn Gly His Thr Asn Tyr Ala His Glu Val
50 55 60
Gln Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Thr Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Val Val Val Pro Val Ala Pro His Phe Tyr Asn Gly
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 523
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 523
gatattgtga tgactcagtc tccactctcc ctgcccgtca cccctggaga gccggcctcc 60
atctcctgca ggtctagtca gagcctcctg catattaatg aatacaacta tttggattgg 120
tacctaaaga agccagggca gtctccacag ctcctgatct atttgggttt taatcgggcc 180
tccggggtcc ctgacaggtt cagtggcagt ggatcaggca cagattttac actgaaaatc 240
agcagagtgg aggctgagga tgttggggtc tattactgca tgcaagctct tcaaactccg 300
tggacgttag gccaagggac caaggtggaa atcaaa 336
<210> 524
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 524
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ile
20 25 30
Asn Glu Tyr Asn Tyr Leu Asp Trp Tyr Leu Lys Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Phe Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Trp Thr Leu Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 525
<211> 378
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 525
caggttcagc tggtgcagtc tggagctgag gtgaagaagc ctggggcctc agtgaaggtc 60
tcctgcaagg cttctggtta cacctttacc aactacgcta tcagctgggt gcgacaggcc 120
cctggacaag ggcttgagtg gatgggatgg gtcagcgctt acaatggtca cacaaactat 180
gcacagaagc tccagggcag agtcaccatg accacagaca catccacgag cacagcctac 240
atggagctga ggagcctgag atctgacgac acggccgtgt attactgtgc gagagggggt 300
gtagtcgtgc cagttgctcc ccacttctac aacggtatgg acgtctgggg gcaagggacc 360
acggtcaccg tctcctca 378
<210> 526
<211> 126
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 526
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Val Ser Ala Tyr Asn Gly His Thr Asn Tyr Ala Gln Lys Leu
50 55 60
Gln Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Val Val Val Pro Val Ala Pro His Phe Tyr Asn Gly
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 527
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 527
gatattgtga tgactcagtc tccactctcc ctgcccgtca cccctggaga gccggcctcc 60
atctcctgca ggtctagtca gagcctcctg catattaatg aatacaacta tttggattgg 120
tacctgcaga agccagggca gtctccacag ctcctgatct atttgggttc taatcgggcc 180
tccggggtcc ctgacaggtt cagtggcagt ggatcaggca cagattttac actgaaaatc 240
agcagagtgg aggctgagga tgttggggtt tattactgca tgcaagctct tcaaactccg 300
tggacgttcg gccaagggac caaggtggaa atcaaa 336
<210> 528
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 528
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ile
20 25 30
Asn Glu Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 529
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 529
gaggtgcagc tggtggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt caccctaagt agctacgaca tgcactgggt ccgccaagca 120
acaggaaaag gtctggagtg ggtctcagct attggcagta ctggtgacac atactataca 180
ggctccgtga tgggccgatt caccatctcc agagacgctg ccaaaaactc cttctatctt 240
gaaatgaaca gcctgagagt cggggacacg gctgtatatt actgtgcaag agagggaata 300
agaacaccct atgattattg gggccaggga gcccgggtca ccgtctcctc a 351
<210> 530
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 530
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Leu Ser Ser Tyr
20 25 30
Asp Met His Trp Val Arg Gln Ala Thr Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Gly Ser Thr Gly Asp Thr Tyr Tyr Thr Gly Ser Val Met
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Ala Ala Lys Asn Ser Phe Tyr Leu
65 70 75 80
Glu Met Asn Ser Leu Arg Val Gly Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Gly Ile Arg Thr Pro Tyr Asp Tyr Trp Gly Gln Gly Ala Arg
100 105 110
Val Thr Val Ser Ser
115
<210> 531
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 531
ggattcaccc taagtagcta cgac 24
<210> 532
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 532
Gly Phe Thr Leu Ser Ser Tyr Asp
1 5
<210> 533
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 533
attggcagta ctggtgacac a 21
<210> 534
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 534
Ile Gly Ser Thr Gly Asp Thr
1 5
<210> 535
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 535
gcaagagagg gaataagaac accctatgat tat 33
<210> 536
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 536
Ala Arg Glu Gly Ile Arg Thr Pro Tyr Asp Tyr
1 5 10
<210> 537
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 537
gaaatagtga tgacgcagtc tccagccacc ctgtctgtgt ctccagggga aagagccacc 60
ctctcctgca gggccagtca gagtgttagc agcaatgtag cctggtacca gcagaaacct 120
ggccaggctc ccaggctcct catctatggt gcatccacca gggccactgg tatcccagcc 180
aggttcagtg gcagtgggtc tgggacagaa ttcactctca ccatcagcag cctgcagtct 240
gaagattttg cagtttatta ctgtcagcag tataataatt ggcctccatt cactttcggc 300
cctgggacca aagtggatat caaa 324
<210> 538
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 538
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Asn Trp Pro Pro
85 90 95
Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 539
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 539
cagagtgtta gcagcaat 18
<210> 540
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 540
Gln Ser Val Ser Ser Asn
1 5
<210> 541
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 541
ggtgcatcc 9
<210> 542
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 542
Gly Ala Ser
1
<210> 543
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 543
cagcagtata ataattggcc tccattcact 30
<210> 544
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 544
Gln Gln Tyr Asn Asn Trp Pro Pro Phe Thr
1 5 10
<210> 545
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 545
gaggtgcagc tggtggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt caccctaagt agctacgaca tgcactgggt ccgccaagca 120
acaggaaaag gtctggagtg ggtctcagct attggcagta ctggtgacac atactataca 180
ggctccgtga tgggccgatt caccatctcc agagacgctg ccaaaaactc cttctatctt 240
gaaatgaaca gcctgagagt cggggacacg gctgtatatt actgtgcaag agagggaata 300
agaacaccct atgattattg gggccaggga accctggtca ccgtctcctc a 351
<210> 546
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 546
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Leu Ser Ser Tyr
20 25 30
Asp Met His Trp Val Arg Gln Ala Thr Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Gly Ser Thr Gly Asp Thr Tyr Tyr Thr Gly Ser Val Met
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Ala Ala Lys Asn Ser Phe Tyr Leu
65 70 75 80
Glu Met Asn Ser Leu Arg Val Gly Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Gly Ile Arg Thr Pro Tyr Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 547
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 547
gaaatagtga tgacgcagtc tccagccacc ctgtctgtgt ctccagggga aagagccacc 60
ctctcctgca gggccagtca gagtgttagc agcaatgtag cctggtacca gcagaaacct 120
ggccaggctc ccaggctcct catctatggt gcatccacca gggccactgg tatcccagcc 180
aggttcagtg gcagtgggtc tgggacagaa ttcactctca ccatcagcag cctgcagtct 240
gaagattttg cagtttatta ctgtcagcag tataataatt ggcctccatt cactttcggc 300
cctgggacca aagtggatat caaa 324
<210> 548
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 548
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Asn Trp Pro Pro
85 90 95
Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 549
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 549
gaggtgcagc tggtggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt caccctaagt agctacgaca tgcactgggt ccgccaagct 120
acaggaaaag gtctggagtg ggtctcagct attggcagta ctggtgacac atactatcca 180
ggctccgtga agggccgatt caccatctcc agagaaaatg ccaagaactc cttgtatctt 240
caaatgaaca gcctgagagc cggggacacg gctgtgtatt actgtgcaag agagggaata 300
agaacaccct atgattattg gggccaagga accctggtca ccgtctcctc a 351
<210> 550
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 550
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Leu Ser Ser Tyr
20 25 30
Asp Met His Trp Val Arg Gln Ala Thr Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Gly Ser Thr Gly Asp Thr Tyr Tyr Pro Gly Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Glu Asn Ala Lys Asn Ser Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Gly Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Gly Ile Arg Thr Pro Tyr Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 551
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 551
gaaatagtga tgacgcagtc tccagccacc ctgtctgtgt ctccagggga aagagccacc 60
ctctcctgca gggccagtca gagtgttagc agcaatttag cctggtacca gcagaaacct 120
ggccaggctc ccaggctcct catctatggt gcatccacca gggccactgg tatcccagcc 180
aggttcagtg gcagtgggtc tgggacagag ttcactctca ccatcagcag cctgcagtct 240
gaagattttg cagtttatta ctgtcagcag tataataatt ggcctccatt cactttcggc 300
cctgggacca aagtggatat caaa 324
<210> 552
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 552
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Asn Trp Pro Pro
85 90 95
Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 553
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 553
gaggtgcagc tggtggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt caccctaagt agctacgaca tgcactgggt ccgccaagca 120
acaggaaaag gtctggagtg ggtctcagct attggcagta ctggtgacac atactataca 180
ggctccgtga tgggccgatt caccatctcc agagacgctg ccaaaaactc cttctatctt 240
gaaatgaaca gcctgagagt cggggacacg gctgtatatt actgtgcaag agagggaata 300
agaacaccct atgattattg gggccaggga gcccgggtca ccgtctcctc a 351
<210> 554
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 554
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Leu Ser Ser Tyr
20 25 30
Asp Met His Trp Val Arg Gln Ala Thr Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Gly Ser Thr Gly Asp Thr Tyr Tyr Thr Gly Ser Val Met
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Ala Ala Lys Asn Ser Phe Tyr Leu
65 70 75 80
Glu Met Asn Ser Leu Arg Val Gly Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Gly Ile Arg Thr Pro Tyr Asp Tyr Trp Gly Gln Gly Ala Arg
100 105 110
Val Thr Val Ser Ser
115
<210> 555
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 555
ggattcaccc taagtagcta cgac 24
<210> 556
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 556
Gly Phe Thr Leu Ser Ser Tyr Asp
1 5
<210> 557
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 557
attggcagta ctggtgacac a 21
<210> 558
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 558
Ile Gly Ser Thr Gly Asp Thr
1 5
<210> 559
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 559
gcaagagagg gaataagaac accctatgat tat 33
<210> 560
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 560
Ala Arg Glu Gly Ile Arg Thr Pro Tyr Asp Tyr
1 5 10
<210> 561
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 561
gaaatagtga tgacgcagtc tccagccacc ctgtctgtgt ctccagggga aagagccacc 60
ctctcctgca gggccagtca gagtgttagc agcaatgtag cctggtacca gcagaaacct 120
ggccaggctc ccaggctcct catctatggt gcatccacca gggccactgg tatcccagcc 180
aggttcagtg gcagtgggtc tgggacagaa ttcactctca ccatcagcag cctgcagtct 240
gaagattttg cagtttatta ctgtcagcag tataataatt ggcctccatt cactttcggc 300
cctgggacca aagtggatat caaa 324
<210> 562
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 562
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Asn Trp Pro Pro
85 90 95
Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 563
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 563
cagagtgtta gcagcaat 18
<210> 564
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 564
Gln Ser Val Ser Ser Asn
1 5
<210> 565
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 565
ggtgcatcc 9
<210> 566
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 566
Gly Ala Ser
1
<210> 567
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 567
cagcagtata ataattggcc tccattcact 30
<210> 568
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 568
Gln Gln Tyr Asn Asn Trp Pro Pro Phe Thr
1 5 10
<210> 569
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 569
gaggtgcagc tggtggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt caccctaagt agctacgaca tgcactgggt ccgccaagca 120
acaggaaaag gtctggagtg ggtctcagct attggcagta ctggtgacac atactataca 180
ggctccgtga tgggccgatt caccatctcc agagacgctg ccaaaaactc cttctatctt 240
gaaatgaaca gcctgagagt cggggacacg gctgtatatt actgtgcaag agagggaata 300
agaacaccct atgattattg gggccaggga accctggtca ccgtctcctc a 351
<210> 570
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 570
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Leu Ser Ser Tyr
20 25 30
Asp Met His Trp Val Arg Gln Ala Thr Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Gly Ser Thr Gly Asp Thr Tyr Tyr Thr Gly Ser Val Met
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Ala Ala Lys Asn Ser Phe Tyr Leu
65 70 75 80
Glu Met Asn Ser Leu Arg Val Gly Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Gly Ile Arg Thr Pro Tyr Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 571
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 571
gaaatagtga tgacgcagtc tccagccacc ctgtctgtgt ctccagggga aagagccacc 60
ctctcctgca gggccagtca gagtgttagc agcaatgtag cctggtacca gcagaaacct 120
ggccaggctc ccaggctcct catctatggt gcatccacca gggccactgg tatcccagcc 180
aggttcagtg gcagtgggtc tgggacagaa ttcactctca ccatcagcag cctgcagtct 240
gaagattttg cagtttatta ctgtcagcag tataataatt ggcctccatt cactttcggc 300
cctgggacca aagtggatat caaa 324
<210> 572
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 572
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Asn Trp Pro Pro
85 90 95
Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 573
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 573
gaggtgcagc tggtggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt caccctaagt agctacgaca tgcactgggt ccgccaagct 120
acaggaaaag gtctggagtg ggtctcagct attggcagta ctggtgacac atactatcca 180
ggctccgtga agggccgatt caccatctcc agagaaaatg ccaagaactc cttgtatctt 240
caaatgaaca gcctgagagc cggggacacg gctgtgtatt actgtgcaag agagggaata 300
agaacaccct atgattattg gggccaagga accctggtca ccgtctcctc a 351
<210> 574
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 574
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Leu Ser Ser Tyr
20 25 30
Asp Met His Trp Val Arg Gln Ala Thr Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Gly Ser Thr Gly Asp Thr Tyr Tyr Pro Gly Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Glu Asn Ala Lys Asn Ser Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Gly Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Gly Ile Arg Thr Pro Tyr Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 575
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 575
gaaatagtga tgacgcagtc tccagccacc ctgtctgtgt ctccagggga aagagccacc 60
ctctcctgca gggccagtca gagtgttagc agcaatttag cctggtacca gcagaaacct 120
ggccaggctc ccaggctcct catctatggt gcatccacca gggccactgg tatcccagcc 180
aggttcagtg gcagtgggtc tgggacagag ttcactctca ccatcagcag cctgcagtct 240
gaagattttg cagtttatta ctgtcagcag tataataatt ggcctccatt cactttcggc 300
cctgggacca aagtggatat caaa 324
<210> 576
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 576
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Asn Trp Pro Pro
85 90 95
Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 577
<211> 363
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 577
gaagtgcagc tggtggagtc tgggggaggc ttggtacagc ctggcaggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttgat gattatgcca tgcactgggt ccggcaagct 120
ccagggaagg gcctggagtg ggtctcaggt attaattgga acagtggtag cataggctat 180
gcggactctg tgaagggccg attcaccatc tccagagaca acgccaagca ctccctgtat 240
ctgcaaatga acagtctgag acctgaggac acggccttgt attactgtgt aaaagaggtg 300
actacgggat actactacgg tatggacgtc tggggccaag ggaccacggt caccgtctcc 360
tca 363
<210> 578
<211> 121
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 578
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Asn Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys His Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Lys Glu Val Thr Thr Gly Tyr Tyr Tyr Gly Met Asp Val Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 579
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 579
ggattcacct ttgatgatta tgcc 24
<210> 580
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 580
Gly Phe Thr Phe Asp Asp Tyr Ala
1 5
<210> 581
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 581
attaattgga acagtggtag cata 24
<210> 582
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 582
Ile Asn Trp Asn Ser Gly Ser Ile
1 5
<210> 583
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 583
gtaaaagagg tgactacggg atactactac ggtatggacg tc 42
<210> 584
<211> 14
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 584
Val Lys Glu Val Thr Thr Gly Tyr Tyr Tyr Gly Met Asp Val
1 5 10
<210> 585
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 585
gacatccagt tgacccagtc tccatccttc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgct gggccagtca gggcattagc agttatttag cctggtatca gaaaaaacca 120
gggaaagccc ctaacctcct gatctatgat gcatccactt tgcaaagtgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagaa ttcactctca cactcagcag cctgcagcct 240
gaagattttg caacttatta ctgtcaacag cttaatattt acccattcac tttcggccct 300
gggaccaaag tggatatcaa a 321
<210> 586
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 586
Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Trp Ala Ser Gln Gly Ile Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Lys Lys Pro Gly Lys Ala Pro Asn Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Leu Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Leu Asn Ile Tyr Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 587
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 587
cagggcatta gcagttat 18
<210> 588
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 588
Gln Gly Ile Ser Ser Tyr
1 5
<210> 589
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 589
gatgcatcc 9
<210> 590
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 590
Asp Ala Ser
1
<210> 591
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 591
caacagctta atatttaccc attcact 27
<210> 592
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 592
Gln Gln Leu Asn Ile Tyr Pro Phe Thr
1 5
<210> 593
<211> 363
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 593
gaagtgcagc tggtggagtc tgggggaggc ttggtacagc ctggcaggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttgat gattatgcca tgcactgggt ccggcaagct 120
ccagggaagg gcctggagtg ggtctcaggt attaattgga acagtggtag cataggctat 180
gcggactctg tgaagggccg attcaccatc tccagagaca acgccaagca ctccctgtat 240
ctgcaaatga acagtctgag acctgaggac acggccttgt attactgtgt aaaagaggtg 300
actacgggat actactacgg tatggacgtc tggggccaag ggaccacggt caccgtctcc 360
tca 363
<210> 594
<211> 121
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 594
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Asn Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys His Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Lys Glu Val Thr Thr Gly Tyr Tyr Tyr Gly Met Asp Val Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 595
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 595
gacatccagt tgacccagtc tccatccttc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgct gggccagtca gggcattagc agttatttag cctggtatca gaaaaaacca 120
gggaaagccc ctaacctcct gatctatgat gcatccactt tgcaaagtgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagaa ttcactctca cactcagcag cctgcagcct 240
gaagattttg caacttatta ctgtcaacag cttaatattt acccattcac tttcggccct 300
gggaccaaag tggatatcaa a 321
<210> 596
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 596
Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Trp Ala Ser Gln Gly Ile Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Lys Lys Pro Gly Lys Ala Pro Asn Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Leu Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Leu Asn Ile Tyr Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 597
<211> 363
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 597
gaagtgcagc tggtggagtc tgggggaggc ttggtacagc ctggcaggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttgat gattatgcca tgcactgggt ccggcaagct 120
ccagggaagg gcctggagtg ggtctcaggt attaattgga acagtggtag cataggctat 180
gcggactctg tgaagggccg attcaccatc tccagagaca acgccaagaa ctccctgtat 240
ctgcaaatga acagtctgag agctgaggac acggccttgt attactgtgt aaaagaggtg 300
actacgggat actactacgg tatggacgtc tgggggcaag ggaccacggt caccgtctcc 360
tca 363
<210> 598
<211> 121
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 598
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Asn Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Val Lys Glu Val Thr Thr Gly Tyr Tyr Tyr Gly Met Asp Val Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 599
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 599
gacatccagt tgacccagtc tccatccttc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggccagtca gggcattagc agttatttag cctggtatca gcaaaaacca 120
gggaaagccc ctaagctcct gatctatgat gcatccactt tgcaaagtgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagaa ttcactctca caatcagcag cctgcagcct 240
gaagattttg caacttatta ctgtcaacag cttaatattt acccattcac tttcggccct 300
gggaccaaag tggatatcaa a 321
<210> 600
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 600
Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Leu Asn Ile Tyr Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 601
<211> 366
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 601
gaggtgcagt tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacgtttagt agctatgcca tgaactgggt ccgccaggct 120
ccagggaagg ggctggattg ggtctcaggt atcagtggta atggtggtag cacctactac 180
gcagactccg tgaagggccg gttcaccatc tccagagaca tttccaagaa cacgctgtat 240
gtgcaaatgc acagcctgag agtcgaggac acggccgttt actactgtgc gaaagcccgt 300
tattacgatt tttggggggg gaatttcgat ctctggggcc gtggcaccca ggtcactgtc 360
tcctca 366
<210> 602
<211> 122
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 602
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Asp Trp Val
35 40 45
Ser Gly Ile Ser Gly Asn Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Ile Ser Lys Asn Thr Leu Tyr
65 70 75 80
Val Gln Met His Ser Leu Arg Val Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Ala Arg Tyr Tyr Asp Phe Trp Gly Gly Asn Phe Asp Leu Trp
100 105 110
Gly Arg Gly Thr Gln Val Thr Val Ser Ser
115 120
<210> 603
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 603
ggattcacgt ttagtagcta tgcc 24
<210> 604
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 604
Gly Phe Thr Phe Ser Ser Tyr Ala
1 5
<210> 605
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 605
atcagtggta atggtggtag cacc 24
<210> 606
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 606
Ile Ser Gly Asn Gly Gly Ser Thr
1 5
<210> 607
<211> 45
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 607
gcgaaagccc gttattacga tttttggggg gggaatttcg atctc 45
<210> 608
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 608
Ala Lys Ala Arg Tyr Tyr Asp Phe Trp Gly Gly Asn Phe Asp Leu
1 5 10 15
<210> 609
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 609
gaaattgtgt tgacgcagtc tccaggcacc ctgtctttgt ctccagggga aagagccacc 60
ctctcctgca gggccagtca gagtgttagc atcaggtact tagcctggta tcagcagaaa 120
cctggccagg ctcccaggct cctcatctat ggtgcatcca gcagggccac tggcatccca 180
gacaggttca gtgtcagtgt gtctgggaca gacttcactc tcaccatcac tagactggag 240
cctgaagatt ttgcagtcta ttactgtcag caatatggta gttcaccgct cactttcggc 300
ggagggacca aggtggagat caaa 324
<210> 610
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 610
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ile Arg
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Val Ser Val Ser Gly Thr Asp Phe Thr Leu Thr Ile Thr Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 611
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 611
cagagtgtta gcatcaggta c 21
<210> 612
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 612
Gln Ser Val Ser Ile Arg Tyr
1 5
<210> 613
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 613
ggtgcatcc 9
<210> 614
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 614
Gly Ala Ser
1
<210> 615
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 615
cagcaatatg gtagttcacc gctcact 27
<210> 616
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 616
Gln Gln Tyr Gly Ser Ser Pro Leu Thr
1 5
<210> 617
<211> 366
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 617
gaggtgcagt tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacgtttagt agctatgcca tgaactgggt ccgccaggct 120
ccagggaagg ggctggattg ggtctcaggt atcagtggta atggtggtag cacctactac 180
gcagactccg tgaagggccg gttcaccatc tccagagaca tttccaagaa cacgctgtat 240
gtgcaaatgc acagcctgag agtcgaggac acggccgttt actactgtgc gaaagcccgt 300
tattacgatt tttggggggg gaatttcgat ctctggggcc gtggcaccct ggtcactgtc 360
tcctca 366
<210> 618
<211> 122
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 618
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Asp Trp Val
35 40 45
Ser Gly Ile Ser Gly Asn Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Ile Ser Lys Asn Thr Leu Tyr
65 70 75 80
Val Gln Met His Ser Leu Arg Val Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Ala Arg Tyr Tyr Asp Phe Trp Gly Gly Asn Phe Asp Leu Trp
100 105 110
Gly Arg Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 619
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 619
gaaattgtgt tgacgcagtc tccaggcacc ctgtctttgt ctccagggga aagagccacc 60
ctctcctgca gggccagtca gagtgttagc atcaggtact tagcctggta tcagcagaaa 120
cctggccagg ctcccaggct cctcatctat ggtgcatcca gcagggccac tggcatccca 180
gacaggttca gtgtcagtgt gtctgggaca gacttcactc tcaccatcac tagactggag 240
cctgaagatt ttgcagtcta ttactgtcag caatatggta gttcaccgct cactttcggc 300
ggagggacca aggtggagat caaa 324
<210> 620
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 620
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ile Arg
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Val Ser Val Ser Gly Thr Asp Phe Thr Leu Thr Ile Thr Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 621
<211> 366
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 621
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacgtttagt agctatgcca tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagct atcagtggta atggtggtag cacctactac 180
gcagactccg tgaagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtat attactgtgc gaaagcccgt 300
tattacgatt tttggggggg gaatttcgat ctctggggcc gtggcaccct ggtcactgtc 360
tcctca 366
<210> 622
<211> 122
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 622
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Asn Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Ala Arg Tyr Tyr Asp Phe Trp Gly Gly Asn Phe Asp Leu Trp
100 105 110
Gly Arg Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 623
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 623
gaaattgtgt tgacgcagtc tccaggcacc ctgtctttgt ctccagggga aagagccacc 60
ctctcctgca gggccagtca gagtgttagc atcaggtact tagcctggta ccagcagaaa 120
cctggccagg ctcccaggct cctcatctat ggtgcatcca gcagggccac tggcatccca 180
gacaggttca gtggcagtgg gtctgggaca gacttcactc tcaccatcag cagactggag 240
cctgaagatt ttgcagtgta ttactgtcag caatatggta gttcaccgct cactttcggc 300
ggagggacca aggtggagat caaa 324
<210> 624
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 624
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ile Arg
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 625
<211> 381
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 625
caggttcagc tggtgcagtc tggacctgag gtgaagaacc ctggggcctc agtgaaggtc 60
tcctgcaagg cttctggtta cacctttacc acctatggta tcagttgggt acgacaggcc 120
cctggacaag ggcttgagtg gatgggatgg atcagcggtt acaatggtaa aacaaacgat 180
gcacagaagt tccaggacag agtcgccatg accacagaca catccacgag cacagcctac 240
atggagctga ggagcctgag atctgacgac acggccattt attactgttc gagagatcgt 300
ttagtagtac cacctgccct ttattattcc tactacgtta tggacgtctg gggccaaggg 360
accacggtca ccgtctcctc a 381
<210> 626
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 626
Gln Val Gln Leu Val Gln Ser Gly Pro Glu Val Lys Asn Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Gly Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Ser Gly Tyr Asn Gly Lys Thr Asn Asp Ala Gln Lys Phe
50 55 60
Gln Asp Arg Val Ala Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ser Arg Asp Arg Leu Val Val Pro Pro Ala Leu Tyr Tyr Ser Tyr Tyr
100 105 110
Val Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 627
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 627
ggttacacct ttaccaccta tggt 24
<210> 628
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 628
Gly Tyr Thr Phe Thr Thr Tyr Gly
1 5
<210> 629
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 629
atcagcggtt acaatggtaa aaca 24
<210> 630
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 630
Ile Ser Gly Tyr Asn Gly Lys Thr
1 5
<210> 631
<211> 60
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 631
tcgagagatc gtttagtagt accacctgcc ctttattatt cctactacgt tatggacgtc 60
<210> 632
<211> 20
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 632
Ser Arg Asp Arg Leu Val Val Pro Pro Ala Leu Tyr Tyr Ser Tyr Tyr
1 5 10 15
Val Met Asp Val
20
<210> 633
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 633
gatgttgtga tgactcagtc tccactctcc ctgcccgtca cccttggaca gccggcctcc 60
atctcctgca ggtctagtca aagcctcgta tacagtgatg gaaacaccta cttgaattgg 120
tttcagcaga ggccaggtca atctccaagg cgcctaattt ataaggtttc taaccgggac 180
tctggggtcc cagacagatt cagcggcagt gggtcaggca ctgatttcac actgaaaatc 240
agcagggtgg aggctgagga tgttggggtt tattactgca tgcaaggtac acactggccg 300
tacacttttg gccaggggac caagctggag atcaaa 336
<210> 634
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 634
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Tyr Ser
20 25 30
Asp Gly Asn Thr Tyr Leu Asn Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Lys Val Ser Asn Arg Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Gly
85 90 95
Thr His Trp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 635
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 635
caaagcctcg tatacagtga tggaaacacc tac 33
<210> 636
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 636
Gln Ser Leu Val Tyr Ser Asp Gly Asn Thr Tyr
1 5 10
<210> 637
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 637
aaggtttct 9
<210> 638
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 638
Lys Val Ser
1
<210> 639
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 639
atgcaaggta cacactggcc gtacact 27
<210> 640
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 640
Met Gln Gly Thr His Trp Pro Tyr Thr
1 5
<210> 641
<211> 381
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 641
caggttcagc tggtgcagtc tggacctgag gtgaagaacc ctggggcctc agtgaaggtc 60
tcctgcaagg cttctggtta cacctttacc acctatggta tcagttgggt acgacaggcc 120
cctggacaag ggcttgagtg gatgggatgg atcagcggtt acaatggtaa aacaaacgat 180
gcacagaagt tccaggacag agtcgccatg accacagaca catccacgag cacagcctac 240
atggagctga ggagcctgag atctgacgac acggccattt attactgttc gagagatcgt 300
ttagtagtac cacctgccct ttattattcc tactacgtta tggacgtctg gggccaaggg 360
accacggtca ccgtctcctc a 381
<210> 642
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 642
Gln Val Gln Leu Val Gln Ser Gly Pro Glu Val Lys Asn Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Gly Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Ser Gly Tyr Asn Gly Lys Thr Asn Asp Ala Gln Lys Phe
50 55 60
Gln Asp Arg Val Ala Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ser Arg Asp Arg Leu Val Val Pro Pro Ala Leu Tyr Tyr Ser Tyr Tyr
100 105 110
Val Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 643
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 643
gatgttgtga tgactcagtc tccactctcc ctgcccgtca cccttggaca gccggcctcc 60
atctcctgca ggtctagtca aagcctcgta tacagtgatg gaaacaccta cttgaattgg 120
tttcagcaga ggccaggtca atctccaagg cgcctaattt ataaggtttc taaccgggac 180
tctggggtcc cagacagatt cagcggcagt gggtcaggca ctgatttcac actgaaaatc 240
agcagggtgg aggctgagga tgttggggtt tattactgca tgcaaggtac acactggccg 300
tacacttttg gccaggggac caagctggag atcaaa 336
<210> 644
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 644
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Tyr Ser
20 25 30
Asp Gly Asn Thr Tyr Leu Asn Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Lys Val Ser Asn Arg Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Gly
85 90 95
Thr His Trp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 645
<211> 381
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 645
caggttcagc tggtgcagtc tggagctgag gtgaagaagc ctggggcctc agtgaaggtc 60
tcctgcaagg cttctggtta cacctttacc acctatggta tcagctgggt gcgacaggcc 120
cctggacaag ggcttgagtg gatgggatgg atcagcggtt acaatggtaa aacaaactat 180
gcacagaagc tccagggcag agtcaccatg accacagaca catccacgag cacagcctac 240
atggagctga ggagcctgag atctgacgac acggccgtgt attactgttc gagagatcgt 300
ttagtagtac cacctgccct ttattattcc tactacgtta tggacgtctg ggggcaaggg 360
accacggtca ccgtctcctc a 381
<210> 646
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 646
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Gly Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Ser Gly Tyr Asn Gly Lys Thr Asn Tyr Ala Gln Lys Leu
50 55 60
Gln Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Asp Arg Leu Val Val Pro Pro Ala Leu Tyr Tyr Ser Tyr Tyr
100 105 110
Val Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 647
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 647
gatgttgtga tgactcagtc tccactctcc ctgcccgtca cccttggaca gccggcctcc 60
atctcctgca ggtctagtca aagcctcgta tacagtgatg gaaacaccta cttgaattgg 120
tttcagcaga ggccaggcca atctccaagg cgcctaattt ataaggtttc taaccgggac 180
tctggggtcc cagacagatt cagcggcagt gggtcaggca ctgatttcac actgaaaatc 240
agcagggtgg aggctgagga tgttggggtt tattactgca tgcaaggtac acactggccg 300
tacacttttg gccaggggac caagctggag atcaaa 336
<210> 648
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 648
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Tyr Ser
20 25 30
Asp Gly Asn Thr Tyr Leu Asn Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Lys Val Ser Asn Arg Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Gly
85 90 95
Thr His Trp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 649
<211> 381
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 649
caggttcagc tggtgcagtc tggacctgag gtgaagaacc ctggggcctc agtgaaggtc 60
tcctgcaagg cttctggtta cacctttacc acctatggta tcagttgggt acgacaggcc 120
cctggacaag ggcttgagtg gatgggatgg atcagcggtt acaatggtaa aacaaacgat 180
gcacagaagt tccaggacag agtcgccatg accacagaca catccacgag cacagcctac 240
atggagctga ggagcctgag atctgacgac acggccattt attactgttc gagagatcgt 300
ttagtagtac cacctgccct taattattac tactacgtta tggacgtctg gggccaaggg 360
accacggtca ccgtctcctc a 381
<210> 650
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 650
Gln Val Gln Leu Val Gln Ser Gly Pro Glu Val Lys Asn Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Gly Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Ser Gly Tyr Asn Gly Lys Thr Asn Asp Ala Gln Lys Phe
50 55 60
Gln Asp Arg Val Ala Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ser Arg Asp Arg Leu Val Val Pro Pro Ala Leu Asn Tyr Tyr Tyr Tyr
100 105 110
Val Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 651
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 651
ggttacacct ttaccaccta tggt 24
<210> 652
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 652
Gly Tyr Thr Phe Thr Thr Tyr Gly
1 5
<210> 653
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 653
atcagcggtt acaatggtaa aaca 24
<210> 654
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 654
Ile Ser Gly Tyr Asn Gly Lys Thr
1 5
<210> 655
<211> 60
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 655
tcgagagatc gtttagtagt accacctgcc cttaattatt actactacgt tatggacgtc 60
<210> 656
<211> 20
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 656
Ser Arg Asp Arg Leu Val Val Pro Pro Ala Leu Asn Tyr Tyr Tyr Tyr
1 5 10 15
Val Met Asp Val
20
<210> 657
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 657
gatgttgtga tgactcagtc tccactctcc ctgcccgtca cccttggaca gccggcctcc 60
atctcctgca ggtctagtca aagcctcgta tacagtgatg gaaacaccta cttgaattgg 120
tttcagcaga ggccaggtca atctccaagg cgcctaattt ataaggtttc taaccgggac 180
tctggggtcc cagacagatt cagcggcagt gggtcaggca ctgatttcac actgaaaatc 240
agcagggtgg aggctgagga tgttggggtt tattactgca tgcaaggtac acactggccg 300
tacacttttg gccaggggac caagctggag atcaaa 336
<210> 658
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 658
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Tyr Ser
20 25 30
Asp Gly Asn Thr Tyr Leu Asn Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Lys Val Ser Asn Arg Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Gly
85 90 95
Thr His Trp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 659
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 659
caaagcctcg tatacagtga tggaaacacc tac 33
<210> 660
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 660
Gln Ser Leu Val Tyr Ser Asp Gly Asn Thr Tyr
1 5 10
<210> 661
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 661
aaggtttct 9
<210> 662
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 662
Lys Val Ser
1
<210> 663
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 663
atgcaaggta cacactggcc gtacact 27
<210> 664
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 664
Met Gln Gly Thr His Trp Pro Tyr Thr
1 5
<210> 665
<211> 381
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 665
caggttcagc tggtgcagtc tggacctgag gtgaagaacc ctggggcctc agtgaaggtc 60
tcctgcaagg cttctggtta cacctttacc acctatggta tcagttgggt acgacaggcc 120
cctggacaag ggcttgagtg gatgggatgg atcagcggtt acaatggtaa aacaaacgat 180
gcacagaagt tccaggacag agtcgccatg accacagaca catccacgag cacagcctac 240
atggagctga ggagcctgag atctgacgac acggccattt attactgttc gagagatcgt 300
ttagtagtac cacctgccct taattattac tactacgtta tggacgtctg gggccaaggg 360
accacggtca ccgtctcctc a 381
<210> 666
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 666
Gln Val Gln Leu Val Gln Ser Gly Pro Glu Val Lys Asn Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Gly Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Ser Gly Tyr Asn Gly Lys Thr Asn Asp Ala Gln Lys Phe
50 55 60
Gln Asp Arg Val Ala Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ser Arg Asp Arg Leu Val Val Pro Pro Ala Leu Asn Tyr Tyr Tyr Tyr
100 105 110
Val Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 667
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 667
gatgttgtga tgactcagtc tccactctcc ctgcccgtca cccttggaca gccggcctcc 60
atctcctgca ggtctagtca aagcctcgta tacagtgatg gaaacaccta cttgaattgg 120
tttcagcaga ggccaggtca atctccaagg cgcctaattt ataaggtttc taaccgggac 180
tctggggtcc cagacagatt cagcggcagt gggtcaggca ctgatttcac actgaaaatc 240
agcagggtgg aggctgagga tgttggggtt tattactgca tgcaaggtac acactggccg 300
tacacttttg gccaggggac caagctggag atcaaa 336
<210> 668
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 668
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Tyr Ser
20 25 30
Asp Gly Asn Thr Tyr Leu Asn Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Lys Val Ser Asn Arg Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Gly
85 90 95
Thr His Trp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 669
<211> 381
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 669
caggttcagc tggtgcagtc tggagctgag gtgaagaagc ctggggcctc agtgaaggtc 60
tcctgcaagg cttctggtta cacctttacc acctatggta tcagctgggt gcgacaggcc 120
cctggacaag ggcttgagtg gatgggatgg atcagcggtt acaatggtaa aacaaactat 180
gcacagaagc tccagggcag agtcaccatg accacagaca catccacgag cacagcctac 240
atggagctga ggagcctgag atctgacgac acggccgtgt attactgttc gagagatcgt 300
ttagtagtac cacctgccct taattattac tactacgtta tggacgtctg ggggcaaggg 360
accacggtca ccgtctcctc a 381
<210> 670
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 670
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Gly Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Ser Gly Tyr Asn Gly Lys Thr Asn Tyr Ala Gln Lys Leu
50 55 60
Gln Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Asp Arg Leu Val Val Pro Pro Ala Leu Asn Tyr Tyr Tyr Tyr
100 105 110
Val Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 671
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 671
gatgttgtga tgactcagtc tccactctcc ctgcccgtca cccttggaca gccggcctcc 60
atctcctgca ggtctagtca aagcctcgta tacagtgatg gaaacaccta cttgaattgg 120
tttcagcaga ggccaggcca atctccaagg cgcctaattt ataaggtttc taaccgggac 180
tctggggtcc cagacagatt cagcggcagt gggtcaggca ctgatttcac actgaaaatc 240
agcagggtgg aggctgagga tgttggggtt tattactgca tgcaaggtac acactggccg 300
tacacttttg gccaggggac caagctggag atcaaa 336
<210> 672
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 672
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Tyr Ser
20 25 30
Asp Gly Asn Thr Tyr Leu Asn Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Lys Val Ser Asn Arg Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Gly
85 90 95
Thr His Trp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 673
<211> 381
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 673
caggttcagc tggtgcagtc tggacctgag gtgaagaacc ctggggcctc agtgaaggtc 60
tcctgcaagg cttctggtta cacctttacc acctatggta tcagttgggt acgacaggcc 120
cctggacaag ggcttgagtg gatgggatgg atcagcggtt acaatggtaa aacaaacgat 180
gcacagaagt tccaggacag agtcgccatg accacagaca catccacgag cacagcctac 240
atggagctga ggagcctgag atctgacgac acggccattt attactgttc gagagatcgt 300
ttagtagtac cacctgccct ttattattac tactacgtta tggacgtctg gggccaaggg 360
accacggtca ccgtctcctc a 381
<210> 674
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 674
Gln Val Gln Leu Val Gln Ser Gly Pro Glu Val Lys Asn Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Gly Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Ser Gly Tyr Asn Gly Lys Thr Asn Asp Ala Gln Lys Phe
50 55 60
Gln Asp Arg Val Ala Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ser Arg Asp Arg Leu Val Val Pro Pro Ala Leu Tyr Tyr Tyr Tyr Tyr
100 105 110
Val Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 675
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 675
ggttacacct ttaccaccta tggt 24
<210> 676
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 676
Gly Tyr Thr Phe Thr Thr Tyr Gly
1 5
<210> 677
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 677
atcagcggtt acaatggtaa aaca 24
<210> 678
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 678
Ile Ser Gly Tyr Asn Gly Lys Thr
1 5
<210> 679
<211> 60
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 679
tcgagagatc gtttagtagt accacctgcc ctttattatt actactacgt tatggacgtc 60
<210> 680
<211> 20
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 680
Ser Arg Asp Arg Leu Val Val Pro Pro Ala Leu Tyr Tyr Tyr Tyr Tyr
1 5 10 15
Val Met Asp Val
20
<210> 681
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 681
gatgttgtga tgactcagtc tccactctcc ctgcccgtca cccttggaca gccggcctcc 60
atctcctgca ggtctagtca aagcctcgta tacagtgatg gaaacaccta cttgaattgg 120
tttcagcaga ggccaggtca atctccaagg cgcctaattt ataaggtttc taaccgggac 180
tctggggtcc cagacagatt cagcggcagt gggtcaggca ctgatttcac actgaaaatc 240
agcagggtgg aggctgagga tgttggggtt tattactgca tgcaaggtac acactggccg 300
tacacttttg gccaggggac caagctggag atcaaa 336
<210> 682
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 682
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Tyr Ser
20 25 30
Asp Gly Asn Thr Tyr Leu Asn Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Lys Val Ser Asn Arg Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Gly
85 90 95
Thr His Trp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 683
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 683
caaagcctcg tatacagtga tggaaacacc tac 33
<210> 684
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 684
Gln Ser Leu Val Tyr Ser Asp Gly Asn Thr Tyr
1 5 10
<210> 685
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 685
aaggtttct 9
<210> 686
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 686
Lys Val Ser
1
<210> 687
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 687
atgcaaggta cacactggcc gtacact 27
<210> 688
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 688
Met Gln Gly Thr His Trp Pro Tyr Thr
1 5
<210> 689
<211> 381
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 689
caggttcagc tggtgcagtc tggacctgag gtgaagaacc ctggggcctc agtgaaggtc 60
tcctgcaagg cttctggtta cacctttacc acctatggta tcagttgggt acgacaggcc 120
cctggacaag ggcttgagtg gatgggatgg atcagcggtt acaatggtaa aacaaacgat 180
gcacagaagt tccaggacag agtcgccatg accacagaca catccacgag cacagcctac 240
atggagctga ggagcctgag atctgacgac acggccattt attactgttc gagagatcgt 300
ttagtagtac cacctgccct ttattattac tactacgtta tggacgtctg gggccaaggg 360
accacggtca ccgtctcctc a 381
<210> 690
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 690
Gln Val Gln Leu Val Gln Ser Gly Pro Glu Val Lys Asn Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Gly Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Ser Gly Tyr Asn Gly Lys Thr Asn Asp Ala Gln Lys Phe
50 55 60
Gln Asp Arg Val Ala Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ser Arg Asp Arg Leu Val Val Pro Pro Ala Leu Tyr Tyr Tyr Tyr Tyr
100 105 110
Val Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 691
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 691
gatgttgtga tgactcagtc tccactctcc ctgcccgtca cccttggaca gccggcctcc 60
atctcctgca ggtctagtca aagcctcgta tacagtgatg gaaacaccta cttgaattgg 120
tttcagcaga ggccaggtca atctccaagg cgcctaattt ataaggtttc taaccgggac 180
tctggggtcc cagacagatt cagcggcagt gggtcaggca ctgatttcac actgaaaatc 240
agcagggtgg aggctgagga tgttggggtt tattactgca tgcaaggtac acactggccg 300
tacacttttg gccaggggac caagctggag atcaaa 336
<210> 692
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 692
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Tyr Ser
20 25 30
Asp Gly Asn Thr Tyr Leu Asn Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Lys Val Ser Asn Arg Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Gly
85 90 95
Thr His Trp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 693
<211> 381
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 693
caggttcagc tggtgcagtc tggagctgag gtgaagaagc ctggggcctc agtgaaggtc 60
tcctgcaagg cttctggtta cacctttacc acctatggta tcagctgggt gcgacaggcc 120
cctggacaag ggcttgagtg gatgggatgg atcagcggtt acaatggtaa aacaaactat 180
gcacagaagc tccagggcag agtcaccatg accacagaca catccacgag cacagcctac 240
atggagctga ggagcctgag atctgacgac acggccgtgt attactgttc gagagatcgt 300
ttagtagtac cacctgccct ttattattac tactacgtta tggacgtctg ggggcaaggg 360
accacggtca ccgtctcctc a 381
<210> 694
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 694
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Gly Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Ser Gly Tyr Asn Gly Lys Thr Asn Tyr Ala Gln Lys Leu
50 55 60
Gln Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Asp Arg Leu Val Val Pro Pro Ala Leu Tyr Tyr Tyr Tyr Tyr
100 105 110
Val Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 695
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 695
gatgttgtga tgactcagtc tccactctcc ctgcccgtca cccttggaca gccggcctcc 60
atctcctgca ggtctagtca aagcctcgta tacagtgatg gaaacaccta cttgaattgg 120
tttcagcaga ggccaggcca atctccaagg cgcctaattt ataaggtttc taaccgggac 180
tctggggtcc cagacagatt cagcggcagt gggtcaggca ctgatttcac actgaaaatc 240
agcagggtgg aggctgagga tgttggggtt tattactgca tgcaaggtac acactggccg 300
tacacttttg gccaggggac caagctggag atcaaa 336
<210> 696
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 696
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Tyr Ser
20 25 30
Asp Gly Asn Thr Tyr Leu Asn Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Lys Val Ser Asn Arg Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Gly
85 90 95
Thr His Trp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 697
<211> 384
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 697
caggtgcacc tggtggagtc tgggggaggc ttggtcaagc ctggagggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt gaccactaca tgagctggat ccgccaggct 120
ccagggaagg ggctggagtg gatttcatac attagtaatg atggtggtac caaatactat 180
gtggactctg tggagggccg attcatcatt tccagggaca acgccaagaa ctcattgtat 240
ctacatatga acagcctcag agccgacgac acggccgtgt attactgtgc gagagatcag 300
ggatatattg gctacgactc gtattattac tattcctacg gtatggacgt ctggggccaa 360
gggaccacgg tcaccgtcgc ctca 384
<210> 698
<211> 128
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 698
Gln Val His Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp His
20 25 30
Tyr Met Ser Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Ser Tyr Ile Ser Asn Asp Gly Gly Thr Lys Tyr Tyr Val Asp Ser Val
50 55 60
Glu Gly Arg Phe Ile Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu His Met Asn Ser Leu Arg Ala Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gln Gly Tyr Ile Gly Tyr Asp Ser Tyr Tyr Tyr Tyr Ser
100 105 110
Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ala Ser
115 120 125
<210> 699
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 699
ggattcacct tcagtgacca ctac 24
<210> 700
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 700
Gly Phe Thr Phe Ser Asp His Tyr
1 5
<210> 701
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 701
attagtaatg atggtggtac caaa 24
<210> 702
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 702
Ile Ser Asn Asp Gly Gly Thr Lys
1 5
<210> 703
<211> 63
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 703
gcgagagatc agggatatat tggctacgac tcgtattatt actattccta cggtatggac 60
gtc 63
<210> 704
<211> 21
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 704
Ala Arg Asp Gln Gly Tyr Ile Gly Tyr Asp Ser Tyr Tyr Tyr Tyr Ser
1 5 10 15
Tyr Gly Met Asp Val
20
<210> 705
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 705
aaaattgtgt tgacgcagtc tccaggcacc ctgcctttgt ttccagggga aagagccacc 60
ctctcctgta gggccagtca gagtgttaac aacaaattct tagcctggta ccagcagaaa 120
tctggccagg ctcccaggct cctcatctat ggtgcatcca gcagggccac tggcatccca 180
gacaggttca gtggcagtgg gtctgggacc gacttcactc tcaccatcag cggactggag 240
cctgaagatt ttgaagtgta ttattgtcaa gtatatggta actcactcac tttcggcgga 300
gggaccaagg tggagatcaa g 321
<210> 706
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 706
Lys Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Pro Leu Phe Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Asn Asn Lys
20 25 30
Phe Leu Ala Trp Tyr Gln Gln Lys Ser Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Gly Leu Glu
65 70 75 80
Pro Glu Asp Phe Glu Val Tyr Tyr Cys Gln Val Tyr Gly Asn Ser Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 707
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 707
cagagtgtta acaacaaatt c 21
<210> 708
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 708
Gln Ser Val Asn Asn Lys Phe
1 5
<210> 709
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 709
ggtgcatcc 9
<210> 710
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 710
Gly Ala Ser
1
<210> 711
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 711
caagtatatg gtaactcact cact 24
<210> 712
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 712
Gln Val Tyr Gly Asn Ser Leu Thr
1 5
<210> 713
<211> 384
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 713
caggtgcagc tggtggagtc tgggggaggc ttggtcaagc ctggagggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt gaccactaca tgagctggat ccgccaggct 120
ccagggaagg ggctggagtg gatttcatac attagtaatg atggtggtac caaatactat 180
gtggactctg tggagggccg attcatcatt tccagggaca acgccaagaa ctcattgtat 240
ctacatatga acagcctcag agccgacgac acggccgtgt attactgtgc gagagatcag 300
ggatatattg gctacgactc gtattattac tattcctacg gtatggacgt ctggggccaa 360
gggaccacgg tcaccgtctc ctca 384
<210> 714
<211> 128
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 714
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp His
20 25 30
Tyr Met Ser Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Ser Tyr Ile Ser Asn Asp Gly Gly Thr Lys Tyr Tyr Val Asp Ser Val
50 55 60
Glu Gly Arg Phe Ile Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu His Met Asn Ser Leu Arg Ala Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gln Gly Tyr Ile Gly Tyr Asp Ser Tyr Tyr Tyr Tyr Ser
100 105 110
Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 715
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 715
gaaattgtgt tgacgcagtc tccaggcacc ctgcctttgt ttccagggga aagagccacc 60
ctctcctgta gggccagtca gagtgttaac aacaaattct tagcctggta ccagcagaaa 120
tctggccagg ctcccaggct cctcatctat ggtgcatcca gcagggccac tggcatccca 180
gacaggttca gtggcagtgg gtctgggacc gacttcactc tcaccatcag cggactggag 240
cctgaagatt ttgaagtgta ttattgtcaa gtatatggta actcactcac tttcggcgga 300
gggaccaagg tggagatcaa a 321
<210> 716
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 716
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Pro Leu Phe Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Asn Asn Lys
20 25 30
Phe Leu Ala Trp Tyr Gln Gln Lys Ser Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Gly Leu Glu
65 70 75 80
Pro Glu Asp Phe Glu Val Tyr Tyr Cys Gln Val Tyr Gly Asn Ser Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 717
<211> 384
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 717
caggtgcagc tggtggagtc tgggggaggc ttggtcaagc ctggagggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt gaccactaca tgagctggat ccgccaggct 120
ccagggaagg ggctggagtg ggtttcatac attagtaatg atggtggtac caaatactac 180
gcagactctg tgaagggccg attcaccatc tccagggaca acgccaagaa ctcactgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtgt attactgtgc gagagatcag 300
ggatatattg gctacgactc gtattattac tattcctacg gtatggacgt ctgggggcaa 360
gggaccacgg tcaccgtctc ctca 384
<210> 718
<211> 128
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 718
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp His
20 25 30
Tyr Met Ser Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Asn Asp Gly Gly Thr Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gln Gly Tyr Ile Gly Tyr Asp Ser Tyr Tyr Tyr Tyr Ser
100 105 110
Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 719
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 719
gaaattgtgt tgacgcagtc tccaggcacc ctgtctttgt ctccagggga aagagccacc 60
ctctcctgca gggccagtca gagtgttaac aacaaattct tagcctggta ccagcagaaa 120
cctggccagg ctcccaggct cctcatctat ggtgcatcca gcagggccac tggcatccca 180
gacaggttca gtggcagtgg gtctgggaca gacttcactc tcaccatcag cagactggag 240
cctgaagatt ttgcagtgta ttactgtcaa gtatatggta actcactcac tttcggcgga 300
gggaccaagg tggagatcaa a 321
<210> 720
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 720
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Asn Asn Lys
20 25 30
Phe Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Val Tyr Gly Asn Ser Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 721
<211> 378
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 721
caaattctgc tggtgcaatc tggacctgag gtgaaggagc ctggggcctc agtgaaggtc 60
tcctgcaagg cttctggtta cacctttacc aactacgcta tcagctgggt gcgacaggtc 120
cctggacaag ggcttgagtg gatgggatgg gtcagcgctt acaatggtca cacaaactat 180
gcacatgaag tccagggcag agtcaccatg accacagaca catccacgac cacagcctac 240
atggagctga ggagcctgag atctgacgac acggccatgt attactgtgc gagagggggt 300
gtagtcgtgc cagttgctcc ccacttctac aacggtatgg acgtctgggg ccaagggacc 360
acggtcaccg tctcctca 378
<210> 722
<211> 126
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 722
Gln Ile Leu Leu Val Gln Ser Gly Pro Glu Val Lys Glu Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Val Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Val Ser Ala Tyr Asn Gly His Thr Asn Tyr Ala His Glu Val
50 55 60
Gln Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Thr Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Val Val Val Pro Val Ala Pro His Phe Tyr Asn Gly
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 723
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 723
ggttacacct ttaccaacta cgct 24
<210> 724
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 724
Gly Tyr Thr Phe Thr Asn Tyr Ala
1 5
<210> 725
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 725
gtcagcgctt acaatggtca caca 24
<210> 726
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 726
Val Ser Ala Tyr Asn Gly His Thr
1 5
<210> 727
<211> 57
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 727
gcgagagggg gtgtagtcgt gccagttgct ccccacttct acaacggtat ggacgtc 57
<210> 728
<211> 19
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 728
Ala Arg Gly Gly Val Val Val Pro Val Ala Pro His Phe Tyr Asn Gly
1 5 10 15
Met Asp Val
<210> 729
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 729
gatattgtga tgactcagtt tccactctcc ctgcccgtca cccctggaga gccggcctcc 60
atctcctgca ggtctagtca gagcctcctg catattaatg aatacaacta tttggattgg 120
tacctaaaga agccagggca gtctccacag ctcctgatct atttgggttt taatcgggcc 180
tccggggtcc ctgacaggtt cagtggcagt ggatcaggca cagattttac actgaaaatc 240
agcagagtgg aggctgagga tgttggggtc tattactgca tgcaagctct tcaaactccg 300
tggacgttcg gccaagggac caaggtggaa atcaaa 336
<210> 730
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 730
Asp Ile Val Met Thr Gln Phe Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ile
20 25 30
Asn Glu Tyr Asn Tyr Leu Asp Trp Tyr Leu Lys Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Phe Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 731
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 731
cagagcctcc tgcatattaa tgaatacaac tat 33
<210> 732
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 732
Gln Ser Leu Leu His Ile Asn Glu Tyr Asn Tyr
1 5 10
<210> 733
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 733
ttgggtttt 9
<210> 734
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 734
Leu Gly Phe
1
<210> 735
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 735
atgcaagctc ttcaaactcc gtggacg 27
<210> 736
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 736
Met Gln Ala Leu Gln Thr Pro Trp Thr
1 5
<210> 737
<211> 378
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 737
caggttcagc tggtgcagtc tggacctgag gtgaaggagc ctggggcctc agtgaaggtc 60
tcctgcaagg cttctggtta cacctttacc aactacgcta tcagctgggt gcgacaggtc 120
cctggacaag ggcttgagtg gatgggatgg gtcagcgctt acaatggtca cacaaactat 180
gcacatgaag tccagggcag agtcaccatg accacagaca catccacgac cacagcctac 240
atggagctga ggagcctgag atctgacgac acggccatgt attactgtgc gagagggggt 300
gtagtcgtgc cagttgctcc ccacttctac aacggtatgg acgtctgggg ccaagggacc 360
acggtcaccg tctcctca 378
<210> 738
<211> 126
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 738
Gln Val Gln Leu Val Gln Ser Gly Pro Glu Val Lys Glu Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Val Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Val Ser Ala Tyr Asn Gly His Thr Asn Tyr Ala His Glu Val
50 55 60
Gln Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Thr Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Val Val Val Pro Val Ala Pro His Phe Tyr Asn Gly
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 739
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 739
gatattgtga tgactcagtc tccactctcc ctgcccgtca cccctggaga gccggcctcc 60
atctcctgca ggtctagtca gagcctcctg catattaatg aatacaacta tttggattgg 120
tacctaaaga agccagggca gtctccacag ctcctgatct atttgggttt taatcgggcc 180
tccggggtcc ctgacaggtt cagtggcagt ggatcaggca cagattttac actgaaaatc 240
agcagagtgg aggctgagga tgttggggtc tattactgca tgcaagctct tcaaactccg 300
tggacgttcg gccaagggac caaggtggaa atcaaa 336
<210> 740
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 740
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ile
20 25 30
Asn Glu Tyr Asn Tyr Leu Asp Trp Tyr Leu Lys Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Phe Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 741
<211> 378
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 741
caggttcagc tggtgcagtc tggagctgag gtgaagaagc ctggggcctc agtgaaggtc 60
tcctgcaagg cttctggtta cacctttacc aactacgcta tcagctgggt gcgacaggcc 120
cctggacaag ggcttgagtg gatgggatgg gtcagcgctt acaatggtca cacaaactat 180
gcacagaagc tccagggcag agtcaccatg accacagaca catccacgag cacagcctac 240
atggagctga ggagcctgag atctgacgac acggccgtgt attactgtgc gagagggggt 300
gtagtcgtgc cagttgctcc ccacttctac aacggtatgg acgtctgggg gcaagggacc 360
acggtcaccg tctcctca 378
<210> 742
<211> 126
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 742
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Val Ser Ala Tyr Asn Gly His Thr Asn Tyr Ala Gln Lys Leu
50 55 60
Gln Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Val Val Val Pro Val Ala Pro His Phe Tyr Asn Gly
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 743
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 743
gatattgtga tgactcagtc tccactctcc ctgcccgtca cccctggaga gccggcctcc 60
atctcctgca ggtctagtca gagcctcctg catattaatg aatacaacta tttggattgg 120
tacctgcaga agccagggca gtctccacag ctcctgatct atttgggttc taatcgggcc 180
tccggggtcc ctgacaggtt cagtggcagt ggatcaggca cagattttac actgaaaatc 240
agcagagtgg aggctgagga tgttggggtt tattactgca tgcaagctct tcaaactccg 300
tggacgttcg gccaagggac caaggtggaa atcaaa 336
<210> 744
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 744
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ile
20 25 30
Asn Glu Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 745
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<221> ВАРИАНТ
<222> (1)...(8)
<223> Xaa = любая аминокислота
<400> 745
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5
<210> 746
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<221> ВАРИАНТ
<222> (1)...(8)
<223> Xaa - любая аминокислота
<400> 746
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5
<210> 747
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<221> ВАРИАНТ
<222> (1)...(16)
<223> Xaa = любая аминокислота
<400> 747
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5 10 15
<210> 748
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<221> ВАРИАНТ
<222> (1)...(12)
<223> Xaa = любая аминокислота
<400> 748
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5 10
<210> 749
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<221> ВАРИАНТ
<222> (1)...(3)
<223> Xaa = любая аминокислота
<400> 749
Xaa Xaa Xaa
1
<210> 750
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<221> ВАРИАНТ
<222> (1)...(9)
<223> Xaa = любая аминокислота
<400> 750
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5
<210> 751
<211> 330
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 751
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 752
<211> 327
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 752
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly Lys
325
<210> 753
<211> 327
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 753
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly Lys
325
<210> 754
<211> 2076
<212> ДНК
<213> Homo sapiens
<400> 754
atgggcaccg tcagctccag gcggtcctgg tggccgctgc cactgctgct gctgctgctg 60
ctgctcctgg gtcccgcggg cgcccgtgcg caggaggacg aggacggcga ctacgaggag 120
ctggtgctag ccttgcgttc cgaggaggac ggcctggccg aagcacccga gcacggaacc 180
acagccacct tccaccgctg cgccaaggat ccgtggaggt tgcctggcac ctacgtggtg 240
gtgctgaagg aggagaccca cctctcgcag tcagagcgca ctgcccgccg cctgcaggcc 300
caggctgccc gccggggata cctcaccaag atcctgcatg tcttccatgg ccttcttcct 360
ggcttcctgg tgaagatgag tggcgacctg ctggagctgg ccttgaagtt gccccatgtc 420
gactacatcg aggaggactc ctctgtcttt gcccagagca tcccgtggaa cctggagcgg 480
attacccctc cacggtaccg ggcggatgaa taccagcccc ccgacggagg cagcctggtg 540
gaggtgtatc tcctagacac cagcatacag agtgaccacc gggaaatcga gggcagggtc 600
atggtcaccg acttcgagaa tgtgcccgag gaggacggga cccgcttcca cagacaggcc 660
agcaagtgtg acagtcatgg cacccacctg gcaggggtgg tcagcggccg ggatgccggc 720
gtggccaagg gtgccagcat gcgcagcctg cgcgtgctca actgccaagg gaagggcacg 780
gttagcggca ccctcatagg cctggagttt attcggaaaa gccagctggt ccagcctgtg 840
gggccactgg tggtgctgct gcccctggcg ggtgggtaca gccgcgtcct caacgccgcc 900
tgccagcgcc tggcgagggc tggggtcgtg ctggtcaccg ctgccggcaa cttccgggac 960
gatgcctgcc tctactcccc agcctcagct cccgaggtca tcacagttgg ggccaccaat 1020
gcccaagacc agccggtgac cctggggact ttggggacca actttggccg ctgtgtggac 1080
ctctttgccc caggggagga catcattggt gcctccagcg actgcagcac ctgctttgtg 1140
tcacagagtg ggacatcaca ggctgctgcc cacgtggctg gcattgcagc catgatgctg 1200
tctgccgagc cggagctcac cctggccgag ttgaggcaga gactgatcca cttctctgcc 1260
aaagatgtca tcaatgaggc ctggttccct gaggaccagc gggtactgac ccccaacctg 1320
gtggccgccc tgccccccag cacccatggg gcaggttggc agctgttttg caggactgta 1380
tggtcagcac actcggggcc tacacggatg gccacagccg tcgcccgctg cgccccagat 1440
gaggagctgc tgagctgctc cagtttctcc aggagtggga agcggcgggg cgagcgcatg 1500
gaggcccaag ggggcaagct ggtctgccgg gcccacaacg cttttggggg tgagggtgtc 1560
tacgccattg ccaggtgctg cctgctaccc caggccaact gcagcgtcca cacagctcca 1620
ccagctgagg ccagcatggg gacccgtgtc cactgccacc aacagggcca cgtcctcaca 1680
ggctgcagct cccactggga ggtggaggac cttggcaccc acaagccgcc tgtgctgagg 1740
ccacgaggtc agcccaacca gtgcgtgggc cacagggagg ccagcatcca cgcttcctgc 1800
tgccatgccc caggtctgga atgcaaagtc aaggagcatg gaatcccggc ccctcaggag 1860
caggtgaccg tggcctgcga ggagggctgg accctgactg gctgcagtgc cctccctggg 1920
acctcccacg tcctgggggc ctacgccgta gacaacacgt gtgtagtcag gagccgggac 1980
gtcagcacta caggcagcac cagcgaaggg gccgtgacag ccgttgccat ctgctgccgg 2040
agccggcacc tggcgcaggc ctcccaggag ctccag 2076
<210> 755
<211> 692
<212> Белок
<213> Homo sapiens
<400> 755
Met Gly Thr Val Ser Ser Arg Arg Ser Trp Trp Pro Leu Pro Leu Leu
1 5 10 15
Leu Leu Leu Leu Leu Leu Leu Gly Pro Ala Gly Ala Arg Ala Gln Glu
20 25 30
Asp Glu Asp Gly Asp Tyr Glu Glu Leu Val Leu Ala Leu Arg Ser Glu
35 40 45
Glu Asp Gly Leu Ala Glu Ala Pro Glu His Gly Thr Thr Ala Thr Phe
50 55 60
His Arg Cys Ala Lys Asp Pro Trp Arg Leu Pro Gly Thr Tyr Val Val
65 70 75 80
Val Leu Lys Glu Glu Thr His Leu Ser Gln Ser Glu Arg Thr Ala Arg
85 90 95
Arg Leu Gln Ala Gln Ala Ala Arg Arg Gly Tyr Leu Thr Lys Ile Leu
100 105 110
His Val Phe His Gly Leu Leu Pro Gly Phe Leu Val Lys Met Ser Gly
115 120 125
Asp Leu Leu Glu Leu Ala Leu Lys Leu Pro His Val Asp Tyr Ile Glu
130 135 140
Glu Asp Ser Ser Val Phe Ala Gln Ser Ile Pro Trp Asn Leu Glu Arg
145 150 155 160
Ile Thr Pro Pro Arg Tyr Arg Ala Asp Glu Tyr Gln Pro Pro Asp Gly
165 170 175
Gly Ser Leu Val Glu Val Tyr Leu Leu Asp Thr Ser Ile Gln Ser Asp
180 185 190
His Arg Glu Ile Glu Gly Arg Val Met Val Thr Asp Phe Glu Asn Val
195 200 205
Pro Glu Glu Asp Gly Thr Arg Phe His Arg Gln Ala Ser Lys Cys Asp
210 215 220
Ser His Gly Thr His Leu Ala Gly Val Val Ser Gly Arg Asp Ala Gly
225 230 235 240
Val Ala Lys Gly Ala Ser Met Arg Ser Leu Arg Val Leu Asn Cys Gln
245 250 255
Gly Lys Gly Thr Val Ser Gly Thr Leu Ile Gly Leu Glu Phe Ile Arg
260 265 270
Lys Ser Gln Leu Val Gln Pro Val Gly Pro Leu Val Val Leu Leu Pro
275 280 285
Leu Ala Gly Gly Tyr Ser Arg Val Leu Asn Ala Ala Cys Gln Arg Leu
290 295 300
Ala Arg Ala Gly Val Val Leu Val Thr Ala Ala Gly Asn Phe Arg Asp
305 310 315 320
Asp Ala Cys Leu Tyr Ser Pro Ala Ser Ala Pro Glu Val Ile Thr Val
325 330 335
Gly Ala Thr Asn Ala Gln Asp Gln Pro Val Thr Leu Gly Thr Leu Gly
340 345 350
Thr Asn Phe Gly Arg Cys Val Asp Leu Phe Ala Pro Gly Glu Asp Ile
355 360 365
Ile Gly Ala Ser Ser Asp Cys Ser Thr Cys Phe Val Ser Gln Ser Gly
370 375 380
Thr Ser Gln Ala Ala Ala His Val Ala Gly Ile Ala Ala Met Met Leu
385 390 395 400
Ser Ala Glu Pro Glu Leu Thr Leu Ala Glu Leu Arg Gln Arg Leu Ile
405 410 415
His Phe Ser Ala Lys Asp Val Ile Asn Glu Ala Trp Phe Pro Glu Asp
420 425 430
Gln Arg Val Leu Thr Pro Asn Leu Val Ala Ala Leu Pro Pro Ser Thr
435 440 445
His Gly Ala Gly Trp Gln Leu Phe Cys Arg Thr Val Trp Ser Ala His
450 455 460
Ser Gly Pro Thr Arg Met Ala Thr Ala Val Ala Arg Cys Ala Pro Asp
465 470 475 480
Glu Glu Leu Leu Ser Cys Ser Ser Phe Ser Arg Ser Gly Lys Arg Arg
485 490 495
Gly Glu Arg Met Glu Ala Gln Gly Gly Lys Leu Val Cys Arg Ala His
500 505 510
Asn Ala Phe Gly Gly Glu Gly Val Tyr Ala Ile Ala Arg Cys Cys Leu
515 520 525
Leu Pro Gln Ala Asn Cys Ser Val His Thr Ala Pro Pro Ala Glu Ala
530 535 540
Ser Met Gly Thr Arg Val His Cys His Gln Gln Gly His Val Leu Thr
545 550 555 560
Gly Cys Ser Ser His Trp Glu Val Glu Asp Leu Gly Thr His Lys Pro
565 570 575
Pro Val Leu Arg Pro Arg Gly Gln Pro Asn Gln Cys Val Gly His Arg
580 585 590
Glu Ala Ser Ile His Ala Ser Cys Cys His Ala Pro Gly Leu Glu Cys
595 600 605
Lys Val Lys Glu His Gly Ile Pro Ala Pro Gln Glu Gln Val Thr Val
610 615 620
Ala Cys Glu Glu Gly Trp Thr Leu Thr Gly Cys Ser Ala Leu Pro Gly
625 630 635 640
Thr Ser His Val Leu Gly Ala Tyr Ala Val Asp Asn Thr Cys Val Val
645 650 655
Arg Ser Arg Asp Val Ser Thr Thr Gly Ser Thr Ser Glu Gly Ala Val
660 665 670
Thr Ala Val Ala Ile Cys Cys Arg Ser Arg His Leu Ala Gln Ala Ser
675 680 685
Gln Glu Leu Gln
690
<210> 756
<211> 692
<212> Белок
<213> Macaca mulata
<400> 756
Met Gly Thr Val Ser Ser Arg Arg Ser Trp Trp Pro Leu Pro Leu Pro
1 5 10 15
Leu Leu Leu Leu Leu Leu Leu Gly Pro Ala Gly Ala Arg Ala Gln Glu
20 25 30
Asp Glu Asp Gly Asp Tyr Glu Glu Leu Val Leu Ala Leu Arg Ser Glu
35 40 45
Glu Asp Gly Leu Ala Asp Ala Pro Glu His Gly Ala Thr Ala Thr Phe
50 55 60
His Arg Cys Ala Lys Asp Pro Trp Arg Leu Pro Gly Thr Tyr Val Val
65 70 75 80
Val Leu Lys Glu Glu Thr His Arg Ser Gln Ser Glu Arg Thr Ala Arg
85 90 95
Arg Leu Gln Ala Gln Ala Ala Arg Arg Gly Tyr Leu Thr Lys Ile Leu
100 105 110
His Val Phe His His Leu Leu Pro Gly Phe Leu Val Lys Met Ser Gly
115 120 125
Asp Leu Leu Glu Leu Ala Leu Lys Leu Pro His Val Asp Tyr Ile Glu
130 135 140
Glu Asp Ser Ser Val Phe Ala Gln Ser Ile Pro Trp Asn Leu Glu Arg
145 150 155 160
Ile Thr Pro Ala Arg Tyr Arg Ala Asp Glu Tyr Gln Pro Pro Lys Gly
165 170 175
Gly Ser Leu Val Glu Val Tyr Leu Leu Asp Thr Ser Ile Gln Ser Asp
180 185 190
His Arg Glu Ile Glu Gly Arg Val Met Val Thr Asp Phe Glu Ser Val
195 200 205
Pro Glu Glu Asp Gly Thr Arg Phe His Arg Gln Ala Ser Lys Cys Asp
210 215 220
Ser His Gly Thr His Leu Ala Gly Val Val Ser Gly Arg Asp Ala Gly
225 230 235 240
Val Ala Lys Gly Ala Gly Leu Arg Ser Leu Arg Val Leu Asn Cys Gln
245 250 255
Gly Lys Gly Thr Val Ser Gly Thr Leu Ile Gly Leu Glu Phe Ile Arg
260 265 270
Lys Ser Gln Leu Val Gln Pro Val Gly Pro Leu Val Val Leu Leu Pro
275 280 285
Leu Ala Gly Gly Tyr Ser Arg Val Phe Asn Ala Ala Cys Gln Arg Leu
290 295 300
Ala Arg Ala Gly Val Val Leu Val Thr Ala Ala Gly Asn Phe Arg Asp
305 310 315 320
Asp Ala Cys Leu Tyr Ser Pro Ala Ser Ala Pro Glu Val Ile Thr Val
325 330 335
Gly Ala Thr Asn Ala Gln Asp Gln Pro Val Thr Leu Gly Thr Leu Gly
340 345 350
Thr Asn Phe Gly Arg Cys Val Asp Leu Phe Ala Pro Gly Glu Asp Ile
355 360 365
Ile Gly Ala Ser Ser Asp Cys Ser Thr Cys Phe Val Ser Arg Ser Gly
370 375 380
Thr Ser Gln Ala Ala Ala His Val Ala Gly Ile Ala Ala Met Met Leu
385 390 395 400
Ser Ala Glu Pro Glu Leu Thr Leu Ala Glu Leu Arg Gln Arg Leu Ile
405 410 415
His Phe Ser Ala Lys Asp Val Ile Asn Glu Ala Trp Phe Pro Glu Asp
420 425 430
Gln Arg Val Leu Thr Pro Asn Leu Val Ala Ala Leu Pro Pro Ser Thr
435 440 445
His Arg Ala Gly Trp Gln Leu Phe Cys Arg Thr Val Trp Ser Ala His
450 455 460
Ser Gly Pro Thr Arg Met Ala Thr Ala Val Ala Arg Cys Ala Gln Asp
465 470 475 480
Glu Glu Leu Leu Ser Cys Ser Ser Phe Ser Arg Ser Gly Lys Arg Arg
485 490 495
Gly Glu Arg Ile Glu Ala Gln Gly Gly Lys Arg Val Cys Arg Ala His
500 505 510
Asn Ala Phe Gly Gly Glu Gly Val Tyr Ala Ile Ala Arg Cys Cys Leu
515 520 525
Leu Pro Gln Val Asn Cys Ser Val His Thr Ala Pro Pro Ala Gly Ala
530 535 540
Ser Met Gly Thr Arg Val His Cys His Gln Gln Gly His Val Leu Thr
545 550 555 560
Gly Cys Ser Ser His Trp Glu Val Glu Asp Leu Gly Thr His Lys Pro
565 570 575
Pro Val Leu Arg Pro Arg Gly Gln Pro Asn Gln Cys Val Gly His Arg
580 585 590
Glu Ala Ser Ile His Ala Ser Cys Cys His Ala Pro Gly Leu Glu Cys
595 600 605
Lys Val Lys Glu His Gly Ile Pro Ala Pro Gln Glu Gln Val Ile Val
610 615 620
Ala Cys Glu Asp Gly Trp Thr Leu Thr Gly Cys Ser Pro Leu Pro Gly
625 630 635 640
Thr Ser His Val Leu Gly Ala Tyr Ala Val Asp Asn Thr Cys Val Val
645 650 655
Arg Ser Arg Asp Val Ser Thr Thr Gly Ser Thr Ser Lys Glu Ala Val
660 665 670
Ala Ala Val Ala Ile Cys Cys Arg Ser Arg His Leu Val Gln Ala Ser
675 680 685
Gln Glu Leu Gln
690
<210> 757
<211> 694
<212> Белок
<213> Mus muscular
<400> 757
Met Gly Thr His Cys Ser Ala Trp Leu Arg Trp Pro Leu Leu Pro Leu
1 5 10 15
Leu Pro Pro Leu Leu Leu Leu Leu Leu Leu Leu Cys Pro Thr Gly Ala
20 25 30
Gly Ala Gln Asp Glu Asp Gly Asp Tyr Glu Glu Leu Met Leu Ala Leu
35 40 45
Pro Ser Gln Glu Asp Gly Leu Ala Asp Glu Ala Ala His Val Ala Thr
50 55 60
Ala Thr Phe Arg Arg Cys Ser Lys Glu Ala Trp Arg Leu Pro Gly Thr
65 70 75 80
Tyr Ile Val Val Leu Met Glu Glu Thr Gln Arg Leu Gln Ile Glu Gln
85 90 95
Thr Ala His Arg Leu Gln Thr Arg Ala Ala Arg Arg Gly Tyr Val Ile
100 105 110
Lys Val Leu His Ile Phe Tyr Asp Leu Phe Pro Gly Phe Leu Val Lys
115 120 125
Met Ser Ser Asp Leu Leu Gly Leu Ala Leu Lys Leu Pro His Val Glu
130 135 140
Tyr Ile Glu Glu Asp Ser Phe Val Phe Ala Gln Ser Ile Pro Trp Asn
145 150 155 160
Leu Glu Arg Ile Ile Pro Ala Trp His Gln Thr Glu Glu Asp Arg Ser
165 170 175
Pro Asp Gly Ser Ser Gln Val Glu Val Tyr Leu Leu Asp Thr Ser Ile
180 185 190
Gln Gly Ala His Arg Glu Ile Glu Gly Arg Val Thr Ile Thr Asp Phe
195 200 205
Asn Ser Val Pro Glu Glu Asp Gly Thr Arg Phe His Arg Gln Ala Ser
210 215 220
Lys Cys Asp Ser His Gly Thr His Leu Ala Gly Val Val Ser Gly Arg
225 230 235 240
Asp Ala Gly Val Ala Lys Gly Thr Ser Leu His Ser Leu Arg Val Leu
245 250 255
Asn Cys Gln Gly Lys Gly Thr Val Ser Gly Thr Leu Ile Gly Leu Glu
260 265 270
Phe Ile Arg Lys Ser Gln Leu Ile Gln Pro Ser Gly Pro Leu Val Val
275 280 285
Leu Leu Pro Leu Ala Gly Gly Tyr Ser Arg Ile Leu Asn Ala Ala Cys
290 295 300
Arg His Leu Ala Arg Thr Gly Val Val Leu Val Ala Ala Ala Gly Asn
305 310 315 320
Phe Arg Asp Asp Ala Cys Leu Tyr Ser Pro Ala Ser Ala Pro Glu Val
325 330 335
Ile Thr Val Gly Ala Thr Asn Ala Gln Asp Gln Pro Val Thr Leu Gly
340 345 350
Thr Leu Gly Thr Asn Phe Gly Arg Cys Val Asp Leu Phe Ala Pro Gly
355 360 365
Lys Asp Ile Ile Gly Ala Ser Ser Asp Cys Ser Thr Cys Phe Met Ser
370 375 380
Gln Ser Gly Thr Ser Gln Ala Ala Ala His Val Ala Gly Ile Val Ala
385 390 395 400
Arg Met Leu Ser Arg Glu Pro Thr Leu Thr Leu Ala Glu Leu Arg Gln
405 410 415
Arg Leu Ile His Phe Ser Thr Lys Asp Val Ile Asn Met Ala Trp Phe
420 425 430
Pro Glu Asp Gln Gln Val Leu Thr Pro Asn Leu Val Ala Thr Leu Pro
435 440 445
Pro Ser Thr His Glu Thr Gly Gly Gln Leu Leu Cys Arg Thr Val Trp
450 455 460
Ser Ala His Ser Gly Pro Thr Arg Thr Ala Thr Ala Thr Ala Arg Cys
465 470 475 480
Ala Pro Glu Glu Glu Leu Leu Ser Cys Ser Ser Phe Ser Arg Ser Gly
485 490 495
Arg Arg Arg Gly Asp Trp Ile Glu Ala Ile Gly Gly Gln Gln Val Cys
500 505 510
Lys Ala Leu Asn Ala Phe Gly Gly Glu Gly Val Tyr Ala Val Ala Arg
515 520 525
Cys Cys Leu Val Pro Arg Ala Asn Cys Ser Ile His Asn Thr Pro Ala
530 535 540
Ala Arg Ala Gly Leu Glu Thr His Val His Cys His Gln Lys Asp His
545 550 555 560
Val Leu Thr Gly Cys Ser Phe His Trp Glu Val Glu Asp Leu Ser Val
565 570 575
Arg Arg Gln Pro Ala Leu Arg Ser Arg Arg Gln Pro Gly Gln Cys Val
580 585 590
Gly His Gln Ala Ala Ser Val Tyr Ala Ser Cys Cys His Ala Pro Gly
595 600 605
Leu Glu Cys Lys Ile Lys Glu His Gly Ile Ser Gly Pro Ser Glu Gln
610 615 620
Val Thr Val Ala Cys Glu Ala Gly Trp Thr Leu Thr Gly Cys Asn Val
625 630 635 640
Leu Pro Gly Ala Ser Leu Thr Leu Gly Ala Tyr Ser Val Asp Asn Leu
645 650 655
Cys Val Ala Arg Val His Asp Thr Ala Arg Ala Asp Arg Thr Ser Gly
660 665 670
Glu Ala Thr Val Ala Ala Ala Ile Cys Cys Arg Ser Arg Pro Ser Ala
675 680 685
Lys Ala Ser Trp Val Gln
690
<210> 758
<211> 653
<212> Белок
<213> Homo sapiens
<400> 758
Glu Phe Arg Cys His Asp Gly Lys Cys Ile Ser Arg Gln Phe Val Cys
1 5 10 15
Asp Ser Asp Arg Asp Cys Leu Asp Gly Ser Asp Glu Ala Ser Cys Pro
20 25 30
Val Leu Thr Cys Gly Pro Ala Ser Phe Gln Cys Asn Ser Ser Thr Cys
35 40 45
Ile Pro Gln Leu Trp Ala Cys Asp Asn Asp Pro Asp Cys Glu Asp Gly
50 55 60
Ser Asp Glu Trp Pro Gln Arg Cys Arg Gly Leu Tyr Val Phe Gln Gly
65 70 75 80
Asp Ser Ser Pro Cys Ser Ala Phe Glu Phe His Cys Leu Ser Gly Glu
85 90 95
Cys Ile His Ser Ser Trp Arg Cys Asp Gly Gly Pro Asp Cys Lys Asp
100 105 110
Lys Ser Asp Glu Glu Asn Cys Ala Val Ala Thr Cys Arg Pro Asp Glu
115 120 125
Phe Gln Cys Ser Asp Gly Asn Cys Ile His Gly Ser Arg Gln Cys Asp
130 135 140
Arg Glu Tyr Asp Cys Lys Asp Met Ser Asp Glu Val Gly Cys Val Asn
145 150 155 160
Val Thr Leu Cys Glu Gly Pro Asn Lys Phe Lys Cys His Ser Gly Glu
165 170 175
Cys Ile Thr Leu Asp Lys Val Cys Asn Met Ala Arg Asp Cys Arg Asp
180 185 190
Trp Ser Asp Glu Pro Ile Lys Glu Cys Gly Thr Asn Glu Cys Leu Asp
195 200 205
Asn Asn Gly Gly Cys Ser His Val Cys Asn Asp Leu Lys Ile Gly Tyr
210 215 220
Glu Cys Leu Cys Pro Asp Gly Phe Gln Leu Val Ala Gln Arg Arg Cys
225 230 235 240
Glu Asp Ile Asp Glu Cys Gln Asp Pro Asp Thr Cys Ser Gln Leu Cys
245 250 255
Val Asn Leu Glu Gly Gly Tyr Lys Cys Gln Cys Glu Glu Gly Phe Gln
260 265 270
Leu Asp Pro His Thr Lys Ala Cys Lys Ala Val Gly Ser Ile Ala Tyr
275 280 285
Leu Phe Phe Thr Asn Arg His Glu Val Arg Lys Met Thr Leu Asp Arg
290 295 300
Ser Glu Tyr Thr Ser Leu Ile Pro Asn Leu Arg Asn Val Val Ala Leu
305 310 315 320
Asp Thr Glu Val Ala Ser Asn Arg Ile Tyr Trp Ser Asp Leu Ser Gln
325 330 335
Arg Met Ile Cys Ser Thr Gln Leu Asp Arg Ala His Gly Val Ser Ser
340 345 350
Tyr Asp Thr Val Ile Ser Arg Asp Ile Gln Ala Pro Asp Gly Leu Ala
355 360 365
Val Asp Trp Ile His Ser Asn Ile Tyr Trp Thr Asp Ser Val Leu Gly
370 375 380
Thr Val Ser Val Ala Asp Thr Lys Gly Val Lys Arg Lys Thr Leu Phe
385 390 395 400
Arg Glu Asn Gly Ser Lys Pro Arg Ala Ile Val Val Asp Pro Val His
405 410 415
Gly Phe Met Tyr Trp Thr Asp Trp Gly Thr Pro Ala Lys Ile Lys Lys
420 425 430
Gly Gly Leu Asn Gly Val Asp Ile Tyr Ser Leu Val Thr Glu Asn Ile
435 440 445
Gln Trp Pro Asn Gly Ile Thr Leu Asp Leu Leu Ser Gly Arg Leu Tyr
450 455 460
Trp Val Asp Ser Lys Leu His Ser Ile Ser Ser Ile Asp Val Asn Gly
465 470 475 480
Gly Asn Arg Lys Thr Ile Leu Glu Asp Glu Lys Arg Leu Ala His Pro
485 490 495
Phe Ser Leu Ala Val Phe Glu Asp Lys Val Phe Trp Thr Asp Ile Ile
500 505 510
Asn Glu Ala Ile Phe Ser Ala Asn Arg Leu Thr Gly Ser Asp Val Asn
515 520 525
Leu Leu Ala Glu Asn Leu Leu Ser Pro Glu Asp Met Val Leu Phe His
530 535 540
Asn Leu Thr Gln Pro Arg Gly Val Asn Trp Cys Glu Arg Thr Thr Leu
545 550 555 560
Ser Asn Gly Gly Cys Gln Tyr Leu Cys Leu Pro Ala Pro Gln Ile Asn
565 570 575
Pro His Ser Pro Lys Phe Thr Cys Ala Cys Pro Asp Gly Met Leu Leu
580 585 590
Ala Arg Asp Met Arg Ser Cys Leu Thr Glu Ala Glu Ala Ala Val Ala
595 600 605
Thr Gln Glu Thr Ser Thr Val Arg Leu Lys Val Ser Ser Thr Ala Val
610 615 620
Arg Thr Gln His Thr Thr Thr Arg Pro Val Pro Asp Thr Ser Arg Leu
625 630 635 640
Pro Gly Ala Thr Pro Gly Leu Thr Thr Val Glu Ile Val
645 650
<---