Результат интеллектуальной деятельности: Способ определения химического участия активатора хемилюминесценции в липопероксидазной реакции
Вид РИД
Изобретение
Изобретение относится к области биофизики и может найти применение в разработке алгоритмов изучения липопероксидазных реакций, имеющих основную роль в запуске апоптоза по внутреннему, митохондриальному пути. Представляемое изобретение нацелено на подбор оптимального активатора хемилюминесценции при изучении пероксидазных реакций, катализируемых различными ферментами или агентами неорганической природы.
Известен способ, в котором активность жизнеспособной клетки биообъекта определяют спектром хемилюминесценции по интенсивности вспышки и показателей свободного радикального окисления с последующим вычислением показателей жизнеспособности клеточных структур по соответствующей формуле (патент №2662997, опубликован 31.07.2018, МПК G01N 33/483, G01N 21/76, C12N 5/07).
Однако способ имеет следующий недостаток: в качестве активатора хемилюминесценции в нем используется люминол, вступающий в непосредственное химическое взаимодействие с компонентами изучаемой реакционной смеси. Это нарушает принцип наименьшего вмешательства в исследуемую систему, что чрезвычайно важно для фундаментальных исследований, для количественных прикладных исследований
Наиболее близким к предлагаемому объекту является способ, в которомметодом спектрофотометрии изучались производные кумаринана предмет участия в липопероксидазной реакции, катализируемой комплексом цитохрома с с кардиолипином, с применением источника света в диапазонедлин волн 300-600 нм. Для осуществления способа использовали фосфатный буфер и метанол с добавлением различных растворов производных кумарина в качестве изучаемых активаторов хемилюминесценции (Ромодин Л.А., Владимиров Ю.А., Лысенко Н.П., Зарудная Е.Н. Принципиальная возможность использования метанольных растворов кумаринов С-314, С-334 и С-525 при изучении свойств комплекса цитохрома С с кардиолипином //Известия Международной академии Аграрного Образования, №42, т. 1. 2018, с. 102-106).
Недостаток способа-прототипа заключается в том, что оценка участия в реакции изучаемых веществ (кумариновых производных) оценивалась по снижению значения суммарной оптической плотности реакционной смеси на длинах волн, соответствующих пикам поглощения кумаринов, без использования точных временных алгоритмов регистрации спектров и.без вычисления примерных концентраций веществ, что было недостаточно точным показателем, особенно при фундаментальных исследованиях Технический результат - увеличение точности результата. Техническое решение заявленного объекта заключается в том, что в отличие от известного способа-прототипа, производится регистрация спектров поглощения с четкими временными интервалами и выведением примерных значений концентраций изучаемого активатора и фермента-пероксидазы (или его неорганического аналог) на четко определенных моментах времени от начала реакции, причем определение участия/неучастия исследуемого активатора хемилюминесценции в липопероксидазной реакции определяют на основании анализа серии спектров поглощения реакционной смеси, зарегистрированных при следующих параметрах: продолжительность регистрации спектра - 1 минута, скорость регистрации - 5 нм/с, дискрета (шаг) - 0,5 или 1 нм, диапазон длин волн 300-600 нм с временными промежутками между измерениями спектра: с первого по шестое измерения - 10 секунд, с 6-го по 29-е - 60 секунд и с 29 по 55-е - 120 секунд и на основе полученных результатов концентрации изучаемого активатора хемилюминесценции и фермента-пероксидазы вычисляют по формуле:
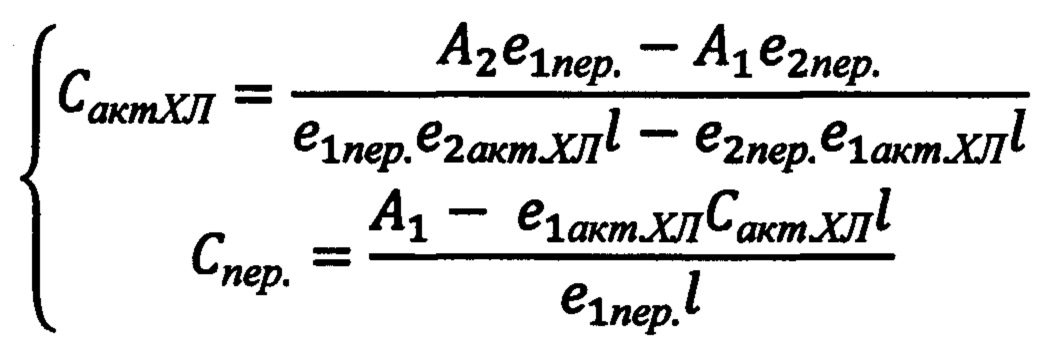
, где Сакт.ХЛ - концентрация изучаемого активатора хемилюминесценции, моль/л; A1 - значение оптической плотности (поглощения)на первой длине волны; А2 - значение оптической плотности (поглощения)на второй длине волны; е1пер. - коэффициент молярного поглощения пероксидазы на первой длине волны; е2пер. - коэффициент молярного поглощения пероксидазы на второй длине волны; е1актХЛ - коэффициент молярного поглощения исследуемого активатора хемилюминесценции на первой длине волны; е2актХЛ - коэффициент молярного поглощения исследуемого активатора хемилюминесценции на второй длине волны;1-толщина кюветы (длина оптического пути), см; Спер. - концентрация пероксидазы, моль/л.
Способ осуществляется следующим образом
Определение участия/неучастия исследуемого активатора хемилюминесценции в липопероксидазной реакции определяется на основании зарегистрированной по указанному ниже алгоритму серии спектров поглощения реакционной смеси. Если концентрация активатора будет снижаться в ходе реакции (о снижении концентрации говорит снижение значения поглощения на длине волны, соответствующей максимуму поглощения), то это указывает на то, что он расходуется в ходе реакции, то есть сам является ее субстратом, если же снижения концентрации не наблюдается, то исследуемой вещество в ходе реакции не расходуется, и если оно в этой концентрации вызывает улавливаемую хемилюминесценцию, то данный активатор увеличивает квантовый выход свечения исключительно за счет перехвата электронно-возбужденных состояний с молекул участников и продуктов липопероксидазной реакции без химического взаимодействия с ними.
Для осуществления способа необходимы следующие реактивы и оборудование: спектрофотометр с кварцевыми кюветами или кюветами из кварцевого стекла, хемилюминометр, раствор пероксидазы или ее неорганического аналога, разведенный в буферном растворе, раствор перекиси водорода, растворы исследуемых активаторов хемилюминесценции, при необходимости - растворы веществ-кофакторов пероксидазы.
Продолжительность регистрации спектра поглощения в предлагаемом нами способе составляет 1 минуту. Параметры регистрации спектра поглощения: скорость регистрации спектра 5 нм/с, дискрета (шаг) 0,5 нм или 1 нм, ширина оптической щели 5 нм, диапазон длин волн 300-600 нм, в случае, если спектральные характеристики изучаемых веществ неизвестны или пики их поглощения приходятся на длины волн меньше 300 нм или больше 600 нм, то тогда спектр следует регистрировать в диапазоне длин волн 220-810 нм при скорости регистрации спектра 10 нм/с, дискрете 0,5 нм или 1 нм, ширине оптической щели 5 нм. Спектр поглощения регистрируется 55 раз, временные промежутки между измерениями с первого по 6-е составляют 10 секунд, с 6-го по 29-е - 60 секунд, с 29-го по 55-е - 120 секунд.
Полученные данные об изменении концентраций изучаемых веществ позволят не только установить факт участия или неучастия изучаемого вещества в липопероксидазной реакции, но и определить кинетические особенности течения реакции с изучаемым веществом.
Оценка участия-неучастия вещества, используемого в качестве активатора хемилюминесценции, в липопероксидазной реакции проводится методом спектрофотометрии - регистрации серии спектров оптической плотности реакционной смеси с последующим анализом изменения значений оптической плотности на длинах волн, советующих пикам поглощения исследуемого активатора хемилюминесценции; по уменьшению значений оптической плотности на данных длинах волн можно судить об уменьшении концентрации оцениваемого вещества, что свидетельствует об его участии в липопероксидазной реакции.
Состав реакционной смеси следующий: 10 мкмоль/л фермент-пероксидаза (в его роли может выступать классическая пероксидаза или же белок, приобретший свойства пероксидазы в следствие воздействия какими-либо факторами, например, цитохром с в комплексе с кардиолипином, или же неорганический агент, например, ионы железа, образующиеся в растворе в результате диссоциации растворимых солей железа), перекись водорода концентрацией от 200 до 230 мкмоль/л (в наших измерениях концентрация Н2О2 составляла 215 мкмоль/л), вещество, изучаемое на предмет участия в липопероксидазной реакции следует брать в концентрации, при которой регистрируется достаточная интенсивность хемилюминесценции, по нашим данным, оптимальной является концентрация, равная 25 мкмоль/л. В качестве контроля регистрируется аналогичная серия спектров оптической плотности для такой же смеси, в которой вместо перекиси водорода добавлен соответствующий объем растворителя.
В кювету спектрофотометра добавить раствор пероксидазы или ее неорганического аналога, объемом, равным 1/10 от общего объема реакционной смеси и концентрацией, равной 100 мкмоль/л;
- В кювету спектрофотометра добавить раствор исследуемого активатора хемилюминесценции, концентрация которого на столько больше определенной для исследования, на сколько меньше добавленный объем общего объема исследуемой смеси;
-. В кювету спектрофотометра добавить фосфатный буфер (рН≈7,4) например, KH2PO4 концентрацией 20 ммоль/л, объемом, равным разности 8/10 общего объема пробы и объема добавленного в предыдущем пункте раствора исследуемого активатора;
-. Добавить в кювету спектрофотометра раствор перекиси водорода, концентрацией 2150 мкмоль/л (допускается диапазон концентраций от 2000 до 2300 мкмоль/л) объемом, равным 1/10 от общего объема реакционной смеси (в контрольной пробе вместо перекиси водорода добавляется аналогичный объем буферного раствора), перемешать раствором пипетированием в течение 5-10 секунд после чего - начать регистрацию первого спектра оптической плотности, продолжительность регистрации составляет 1 минуту, диапазон измерения: 300-600 нм при скорости измерения 5 нм/с, дискрете 0,5 нм или 1 нм, ширине оптической щели 5 нм, вместе с перекисью водорода допустимо добавление липидного субстрата (например, лецитина, отдельных жирных кислот и т.п.);
-. Через 10 секунд после завершения первой регистрации начать вторую;
- После завершения второй регистрации с интервалами, равными 10 секундам, провести еще 5 регистраций спектра оптической плотности;
- Далее с временным интервалом, равным 1 минуте, зарегистрировать спектр оптической плотности 23 раза;
-. Далее с временным интервалом, равным 2 минутам, зарегистрировать спектр оптической плотности 26 раз.
При проведении спектрофотометрического исследования рекомендуется параллельно регистрировать хемилюминесценцию изучаемой реакционной смеси по следующему алгоритму: повторить пункты 1-3, приготовив раствор в кювете для измерения хемилюминесценции, регистрировать фоновой хемилюминесцентный сигнал в течение 30-60 секунд, после чего добавить в кювету хемилюминометра раствор перекиси водорода, аналогичный описанному для спектрофотометрических измерений, после чего - продолжить регистрации хемилюминесцентного сигнала в течение 130-135 минут.
По серии спектров поглощения с использованием приведенной ниже формулы по концентрации исследуемого вещества производится оценка того, является ли изучаемое вещество субстратом липопероксидазной реакции (в этом случае значение оптической плотности на длине воны, соответствующей пику поглощения исследуемого вещества, будет явно уменьшаться, в обратном случае - уменьшения значения оптической плотности наблюдаться не будет наблюдаться или же оно будет незначительным). По интенсивности хемилюминесцентного сигнала в случае, если вещество будет расходоваться в процессе реакции, можно судить о взаимосвязи между интенсивностью хемилюминесценции и скоростью уменьшения концентрации активатора, что необходимо для вычисления поправочных коэффициентов в случае, если данный активатор хемилюминесценции все равно планируется использовать в исследовании липопероксидазных реакций несмотря на то, что он сам является субстратом данной реакции.
Вычисление концентрации исследуемого вещества производится по формуле из каждого спектра оптической плотностис использованием значений молярных коэффициентов поглощения, взятых из справочников или вычисленных по уравнению Бугера-Ламберта-Бера, используются значения длин волн, советующих желательно максимумам поглощения пероксидазы и исследуемого вещества, формулы для расчета концентраций выводятся из уравнения Бугера-Ламберта-Бера для смеси веществ:
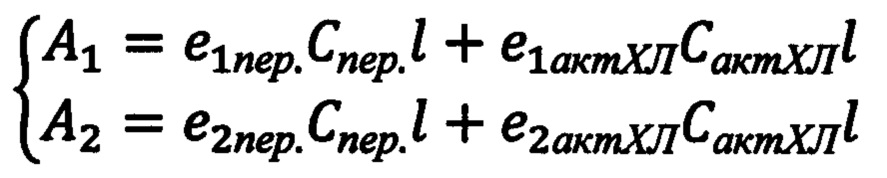
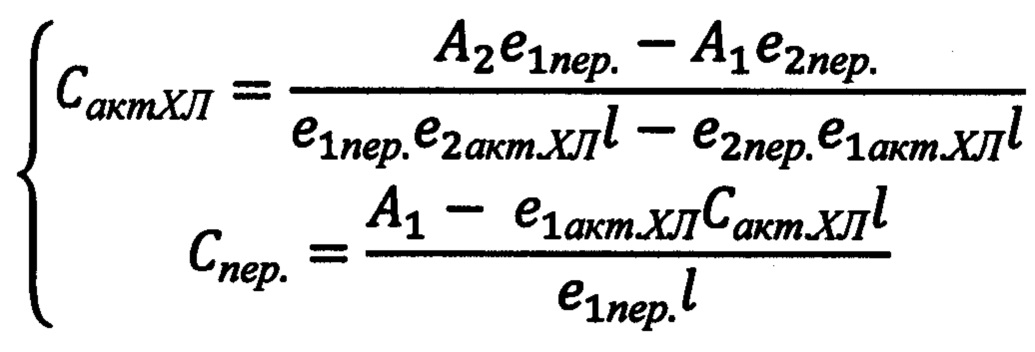
, где Сакт.ХЛ - концентрация изучаемого активатора хемилюминесценции, моль/л; А1 - значение оптической плотности (поглощения)на первой длине волны; А2 - значение оптической плотности (поглощения)на второй длине волны; е1пер. - коэффициент молярного поглощения пероксидазы на первой длине волны; е2пер. - коэффициент молярного поглощения пероксидазы на второй длине волны; е1актХЛ - коэффициент молярного поглощения исследуемого активатора хемилюминесценции на первой длине волны; е2актХЛ - коэффициент молярного поглощения исследуемого активатора хемилюминесценции на второй длине волны; 1-толщина кюветы (длина оптического пути), см; Спер. - концентрация пероксидазы, моль/л.
В случае уменьшения концентрации изучаемого активатора хемилюминесценции он является субстратом липопероксидазной реакции, если же уменьшения концентрации не наблюдается, то он не вступает в химическое взаимодействие с участниками и продуктами липопероксидазной реакции и если при регистрации хемилюминесценции изучаемой смеси наблюдаются относительно высокие ее значения, то исследуемый активатор может применяться при изучении липопероксидазной реакции без риска искажения результатов, а получаемые при его использовании хемилюминесцентные данные будут получаться легко интерпретируемыми.
Пример конкретного осуществления способа
Пример 1. Определение учасия кумарина С-334 в липопероксидазной реакции, катализируемой комплексом цитохрома с с кардиолипином (неклассической, факультативной, пероксидазой)
Допустим, необходимо определить, являются ли кумарин С-334, используемый в качестве активатора хемилюминесценции, субстратом липопероксидазной реакции, катализируемой комплексом цитохрома с с кардиолипином. Для этого зарегистрируем спектр поглощения реакционной смеси состава, предложенной описываемой методикой: 10 мкМ (10 мкмоль/л) цитохром с в комплексе с 300 мкМ кардиолипином, 25 мкМ кумарин С-334, 215 мкМ Н2О2. Допустим, объем кюветы спектрофотометра равен 3 мл, тогда выполняем следующий алгоритм:
1. В кювету спектрофотометра добавляем 300 мкл 100 мкМ раствора цитохрома с;
2. В кювету спектрофотометра добавляем 150 мкл 6000 мкМ раствора кардиолипина;
3. В кювету спектрофотометра добавляем 75 мкл 1000 мкМ раствора кумарина С-334;
4. В кювету спектрофотометра добавляем 2175 мкл фосфатного буфера (KH2PO4 концентрацией 20 ммоль/л);
5. Добавляем в кювету спектрофотометра 300 мл раствора перекиси водорода, концентрацией 2150 мкмоль/л (в контрольную пробу - 300 мкл буферного раствора), перемешиваем раствор пипетированием в течение 5-10 секунд после чего начинаем первую регистрацию спектра оптической плотности, продолжительность регистрации составляет 1 минуту, диапазон измерения: 300-600 нм при скорости измерения 5 нм/с, дискрета - 0,5 нм, ширина оптической щели - 5 нм;
6. Через 10 секунд после завершения первой регистрации проводим вторую;
7. После завершения второй регистрации с интервалами, равными 10 секундам, проводим еще 5 регистрации спектра оптической плотности;
8. Далее с временным интервалом, равным 1 минуте, проводим регистрацию спектра оптической плотности 23 раза;
9. Далее с временным интервалом, равным 2 минутам, проводим регистрацию спектра оптической плотности 26 раз.
Для каждого спектра поглощения вычисляются концентрации кумарина С-334 и цитохромас решением системы уравнений, составляемой для каждого полученного спектра, исходя из того, что пик поглощения цитохрома с находится на длине волны 409 нм, а кумарина С-334-460 нм:
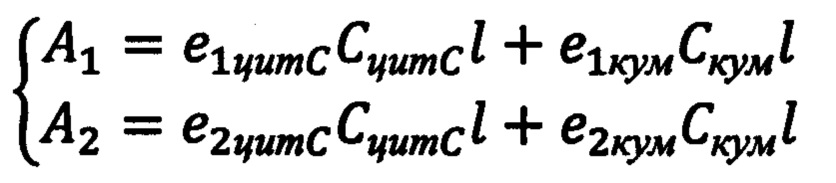
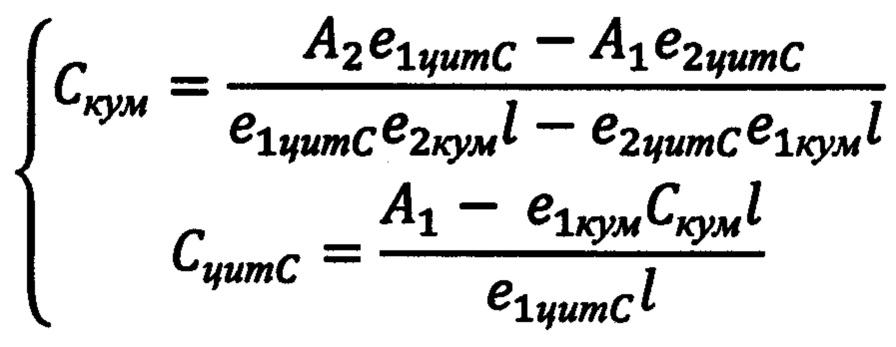
, где Скум - концентрация кумарина С-334, моль/л; A1 - значение оптической плотности (поглощения) на длине волны 409 нм; А2 - значение оптической плотности (поглощения) на длине волны 460 нм; е1цитС - коэффициент молярного поглощения цитохрома с на длине волны 409 нм; е2цитС - коэффициент молярного поглощения цитохрома с на длине волны 460 нм; е1кум - коэффициент молярного поглощения кумарина С-334 на длине волны 409 нм; е2кум - коэффициент молярного поглощения кумарина С-334 на длине волны 460 нм; 1-толщина кюветы (длина оптического пути), см; СцитС - концентрация пероксидазы, моль/л.
Параллельная регистрация хемилюминесценции:
1. В кювету хемилюминометра добавляем 300 мкл 100 мкМ раствора цитохрома с;
2. В кювету хемилюминометра добавляем 150 мкл 6000 мкМ раствора кардиолипина;
3. В кювету хемилюминометра добавляем 75 мкл 1000 мкМ раствора кумарина С-334;
4. В кювету хемилюминометра добавляем 2175 мкл фосфатного буфера (KH2PO4 концентрацией 20 ммоль/л);
5. Запускаем регистрацию хемилюминесценции и регистрируем сигнал в течение 30-60 секунд, полученную интенсивность хемилюминесценции считаем фоновым сигналом
6. Добавляем в кювету хемилюминометра 300 мл раствора перекиси водорода, концентрацией 2150 мкмоль/л (в контрольную пробу - 300 мкл буферного раствора), продолжаем регистрацию хемилюминесцентного сигнала;
7. Регистрируем хемилюминесцентный сигнал в течение 130 минут (регистрацию можно прекратить раньше, если значение интенсивности хемилюминесценции стабильно вернулось к фоновому значению).
Пример 2. Определение химического участия люминолав липопероксидазной реакции, катализируемой миелопероксидазой (классической пероксидазой)
Допустим, необходимо определить, являются ли люминол, используемый в качестве активатора хемилюминесценции, субстратом липопероксидазной реакции, катализируемой миелопероксидазой. Для этого зарегистрируем спектр поглощения реакционной смеси состава, предложенной описываемой методикой: 10 мкМ (10 мкмоль/л) миелопероксидаза, 25 мкМ люминол, 215 мкМ Н2О2. Допустим, объем кюветы спектрофотометра равен 3 мл, тогда выполняем следующий алгоритм:
1. В кювету спектрофотометра добавляем 300 мкл 100 мкМ раствора миелопероксидазы;
2. В кювету спектрофотометра добавляем 75 мкл 1000 мкМ раствора люминола;
3. В кювету спектрофотометра добавляем 2325 мкл фосфатного буфера (KH2PO4 концентрацией 20 ммоль/л);/
4. Добавляем в кювету спектрофотометра 300 мл. раствора перекиси водорода, концентрацией 2150 мкмоль/л (в контрольную пробу - 300 мкл буферного раствора), перемешиваем раствор пикетированием в течение 5-10 секунд после чего начинаем первую регистрацию спектра оптической плотности, продолжительность регистрации составляет 1 минуту, диапазон измерения: 230-810 нм при скорости измерения 10 нм/с, дискрета - 0,5 нм, ширина оптической щели - 5 нм;
5. Через 10 секунд после завершения первой регистрации проводим вторую;
6. После завершения второй регистрации с интервалами, равными 10 секундам, проводим еще 5 регистраций спектра оптической плотности;
7. Далее с временным интервалом, равным 1 минуте, проводим регистрацию спектра оптической плотности 23 раза;
8. Далее с временным интервалом, равным 2 минутам, проводим регистрацию спектра оптической плотности 26 раз.
Параллельная регистрация хемилюминесценции:
1. В кювету хемилюминометра добавляем 300 мкл 100 мкМ раствора миелопероксидазы;
2. В кювету хемилюминометра добавляем 75 мкл 1000 мкМ раствора люминола;
3. В кювету хемилюминометра добавляем 2325 мкл фосфатного буфера (KH2PO4 концентрацией 20 ммоль/л);
4. Запускаем регистрацию хемилюминесценции и регистрируем сигнал в течение 30-60 секунд, полученную интенсивность хемилюминесценции считаем фоновым сигналом;
5. Добавляем в кювету хемилюминометра 300 мл раствора перекиси водорода, концентрацией 2150 мкмоль/л (в контрольную пробу - 300 мкл буферного раствора), продолжаем регистрацию хемилюминесцентного сигнала;
6. Регистрируем хемилюминесцентный сигнал в течение 130 минут (регистрацию можно прекратить раньше, если значение интенсивности - хемилюминесценции стабильно вернулось к фоновому значению).
Полученные данные об изменении концентраций изучаемых веществ позволят не только установить факт участия или неучастия изучаемого вещества в липопероксидазной реакции, но и определить кинетические особенности течения реакции с изучаемым веществом, повысить точность результатов исследований
Способ определения химического участия активатора хемилюминесценции в липопероксидазной реакции, включающий изучение липопероксидазной реакции с применением источника света в диапазоне волн 300-600 нм с параллельной регистрацией хемилюминесценции, отличающийся тем, что производится регистрация нескольких спектров оптической плотности с соблюдением приведенных ниже временных интервалов и выведением значений концентраций изучаемого активатора и фермента-пероксидазы в моменты времени от начала реакции, на которых происходит регистрация спектров оптической плотности, причем определение участия/неучастия исследуемого активатора хемилюминесценции в липопероксидазной реакции определяют на основании анализа серии спектров оптической плотности реакционной смеси, зарегистрированных при следующих параметрах: время регистрации спектра - 1 минута, скорость регистрации - 5 нм/с, дискрета (шаг) - 0,5 или 1 нм, в зависимости от технических возможностей спектрофотометра, диапазон длин волн - 300-600 нм со следующими временными промежутками между измерениями: с первого по шестое измерения - 10 секунд, с 6-го по 29-е - 60 секунд и с 29 по 55-е - 120 секунд, и на основе полученных результатов вычисляют концентрации активатора хемилюминесценции и фермента-пероксидазы.
