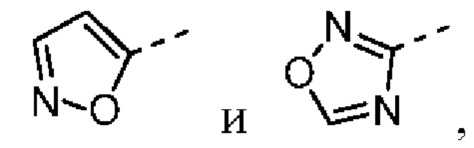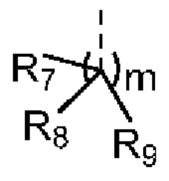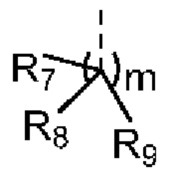Результат интеллектуальной деятельности: СОЕДИНЕНИЕ, ПРЕДСТАВЛЯЮЩЕЕ СОБОЙ ПРОЛЕКАРСТВО ЛАНОСТЕРИНА, А ТАКЖЕ СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ
Вид РИД
Изобретение
[1] Перекрестная ссылка на родственные заявки
[2] Настоящая заявка испрашивает приоритет согласно заявке на патент Китая № CN201710061039.8, поданной 25 января 2017 г., и заявке на патент Китая № CN201710868274.6, поданной 22 сентября 2017 г., содержание которых включено в данный документ посредством ссылки во всей своей полноте.
[3] Область техники
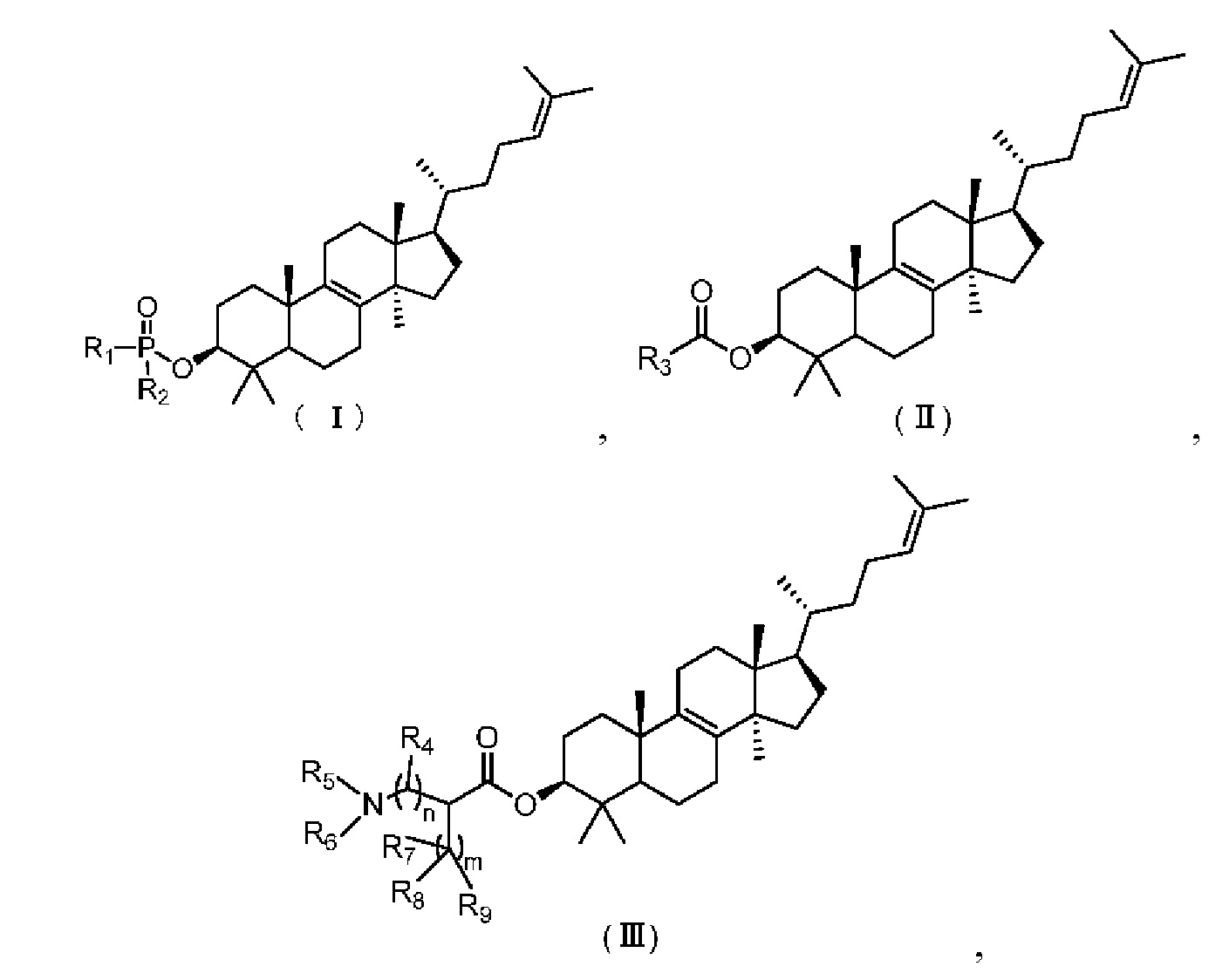
[4] Настоящее изобретение относится к соединению, представленному формулой (I), (II) или (III), его фармацевтически приемлемой соли и изомеру и его применению в изготовлении лекарственного препарата для лечения офтальмологических заболеваний.
[5] Уровень техники
[6] Катаракта представляет собой заболевание глаза, которое возникает в хрусталике в глазном яблоке, и помутнение хрусталика в совокупности называют катарактой. Старение, наследственность, метаболическое расстройство, травма, облучение, отравление и локальная недостаточность питательных веществ могут вызывать повреждение капсулы хрусталика, что приводит в результате к увеличению проницаемости и потере барьерной функции или вызывает метаболические нарушения в хрусталике, приводя к денатурации белка хрусталика и возникновению помутнения. Если прозрачный хрусталик глазного яблока становится замутненным, а это сказывается на количестве получаемого глазами солнечного света, то это повлияет на остроту зрения. При легкой степени помутнения в глазном яблоке эффект в отношении зрения является менее значительным, однако по мере постепенного усиления степени помутнения острота зрения будет снижаться, и в тяжелых случаях это приведет к слепоте. Катаракта является одним из наиболее распространенных глазных заболеваний, приводящих к слепоте, и она является основной причиной слепоты. Поскольку механизм развития катаракты все еще не установлен, прорыва в лекарственной терапии сделано не было. Поэтому в настоящее время единственным эффективным способом лечения является хирургическое лечение.
[7] Несмотря на постоянное совершенствование катарактальной хирургии, что оказало существенное содействие в лечении катаракты, уровень излечения в результате хирургического лечения все еще находится значительно ниже уровня заболеваемости, и присутствует вероятность серьезных осложнений. С другой стороны, стоимость хирургического лечения катаракты является крайне высокой, и даже в развитых странах катаракта тяжело обременяет систему медицинского страхования. Таким образом, предупреждение и лечение с применением лекарственных средств играет решающую роль. В настоящее время терапевтические лекарственные средства, доступные для клинического лечения катаракты, включают: 1) ингибиторы альдозоредуктазы, такие как каталин (Catalin, Kary Uni, прифеноксин натрия), факолизин, бендазак L-лизин и т. д.; 2) лекарственные средства против окислительного повреждения, такие как глутатион, таурин, аспирин и т. д.; 3) лекарственные средства на основе необходимых для метаболизма питательных элементов, такие как витамины, каротиноиды и т. д.; 4) композиции на основе растительного сырья, используемого в традиционной китайской медицине, в том числе таблетка Шиху Егуан, таблетка Ци Цзюй Ди Хуан, таблетка Шицзюэмин Сань и т. п. В ходе продолжительных клинических исследований было подтверждено, что эти лекарственные средства для лечения катаракты могут лишь замедлять развитие катаракты, но не могут способствовать регрессии состояния для осуществления лечения катаракты. В то же время по мере того, как общество Китая становится стареющим, число пациентов с катарактой возрастает, и потребность в лекарственных средствах против катаракты будет становиться все более острой. Таким образом, в клинической практике необходимы новые группы офтальмологических лекарственных средств местного применения против катаракты, характеризующиеся безопасностью, хорошим лечебным эффектом, высокой интраокулярной проникающей способностью и стабильностью.
[8] Ланостерин представляет собой амфифильную молекулу, которой богат хрусталик, синтез которой осуществляет ланостеринсинтаза (LSS) посредством ключевой реакции циклизации синтетического пути холестерина, и может обеспечивать уменьшение аномальной агрегации белков хрусталика и способствовать их реорганизации в регулярно упорядоченную структуру с восстановлением прозрачности хрусталика. Исследования показали, что ланостеринсинтазу можно обнаружить в хрусталике. Кроме того, в исследовании на крысах с катарактой Shumiya специфическая комбинация гомозиготных мутаций ланостеринсинтазы и фарнезилдифосфатфарнезилтрансферазы 1 (FDFT1) может снижать уровни холестерина в хрусталике и приводить к развитию форм катаракты. В то же время в ходе последних исследований, проведенных авторами настоящего изобретения, было обнаружено, что ланостерин может значительно снижать ранее сформированные агрегаты белков хрусталика на клеточном уровне in vitro. Было также подтверждено, что ланостерин может способствовать регрессии состояния, представляющего собой катаракту, и приводить к устранению помутнения и восстановлению прозрачности хрусталика in vivo. Данный результат был недавно опубликован в Nature и привлек внимание во всем мире, и ланостерин представляется новой молекулой для предупреждения и лечения катаракты.
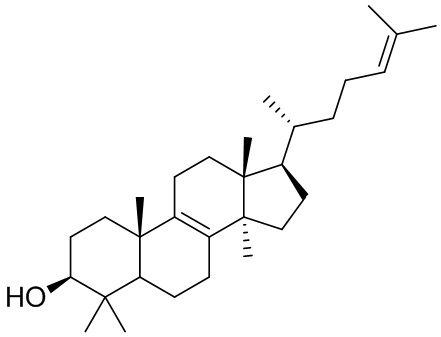
Ланостерин
[9] Глазные капли Kary Uni представляют собой лекарственный препарат, производимый Santen Pharmaceutical Co., Ltd в Японии для лечения ранних стадий возрастной катаракты, и структурная формула его активного ингредиента показана ниже:
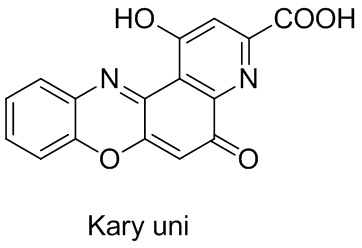 .
.
Краткое описание настоящего изобретения
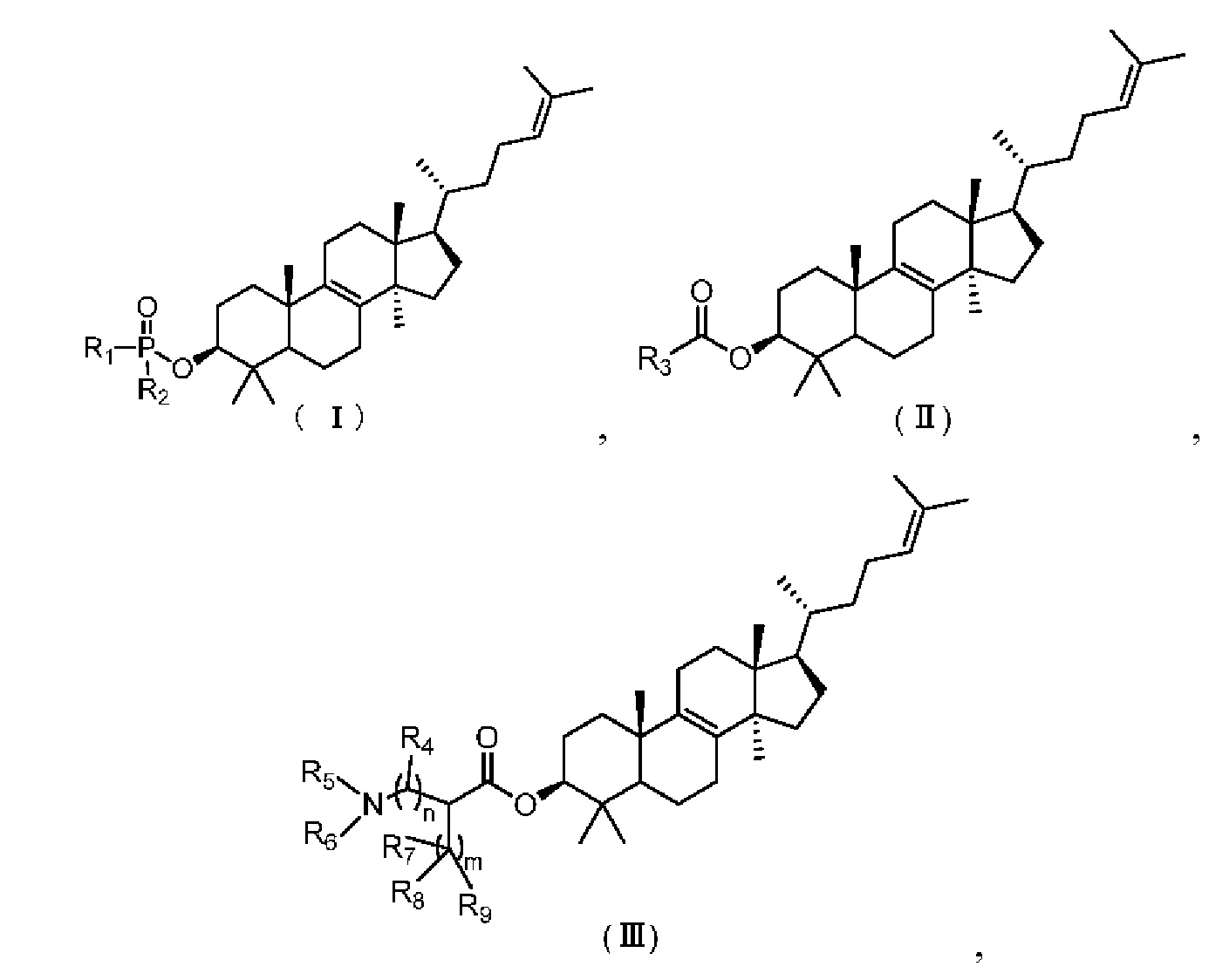
[10] Настоящее изобретение предусматривает соединение, представленное формулой (I), (II) или (III), его фармацевтически приемлемую соль или изомер,
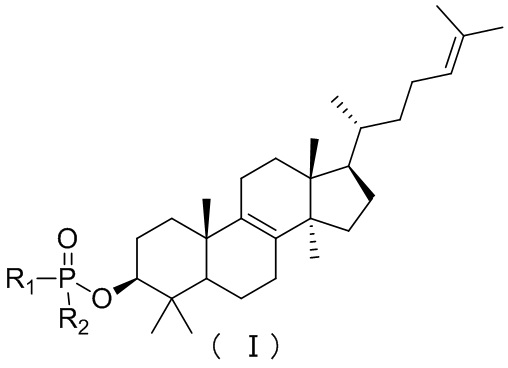 ,
, 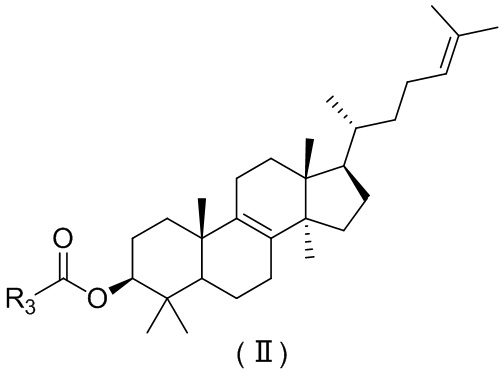 ,
, 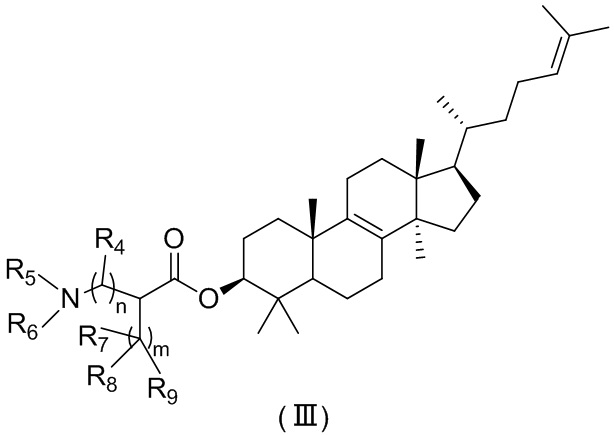 ,
,
[11] где
[12] m равняется 0 или 1, причем если m равняется 0, то фрагмент 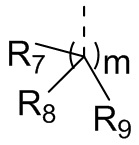 отсутствует;
отсутствует;
[13] n равняется 0 или 1;
[14] R1 представляет собой C1-3алкил-O-C(=O)-C1-3алкил-NH-, который необязательно замещен 1, 2 или 3 R;
[15] R2 выбран из группы, состоящей из фенил-O- и 5-10-членного гетероарила, каждый из которых необязательно замещен 1, 2 или 3 R;
[16] R3 выбран из группы, состоящей из 6-10-членного арила, 6-10-членного арил-C1-3алкил-, 5-10-членного гетероарила и 5-10-членного гетероарил-C1-3алкил-, каждый из которых необязательно замещен 1, 2 или 3 R, но при этом R3 не является фенилом и 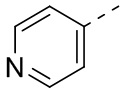 ;
;
[17] R4 представляет собой H, F, Cl, Br, I, OH или NH2, или R4 представляет собой C1-6алкил, который необязательно замещен 1, 2 или 3 R;
[18] R5 представляет собой H или C1-6алкил, который необязательно замещен 1, 2 или 3 R;
[19] R6 представляет собой H или C1-6алкил, который необязательно замещен 1, 2 или 3 R;
[20] R7 представляет собой H, F, Cl, Br, I, OH, COOH, CONH2, NH2, SH или NH2C(=NH)NH-, или R7 выбран из группы, состоящей из C1-6алкила, C1-6гетероалкила, фенила и 5-10-членного гетероарила, каждый из которых необязательно замещен 1, 2 или 3 R;
[1] или R7 и R6 соединены вместе с образованием 3-10-членного кольца, которое необязательно замещено 1, 2 или 3 R;
[2] или R7 и R4 соединены вместе с образованием 3-10-членного кольца, которое необязательно замещено 1, 2 или 3 R;
[3] или R4 и R6 соединены с R7 с образованием 3-10-членного кольца, которое необязательно замещено 1, 2 или 3 R;
[21] R8 представляет собой H или C1-3алкил;
[22] R9 представляет собой H или C1-3алкил;
[23] каждый из R независимо представляет собой F, Cl, Br, I, NH2, NO2, OH, CN, COOH или NH2C(=NH)NH- или выбран из группы, состоящей из C1-3алкила и -C(=O)O-C1-3алкила, каждый из которых необязательно замещен 1, 2 или 3 R’;
[24] R’ представляет собой F, Cl, Br, I, NH2, NO2, OH, CN или COOH;
[25] «гетеро» в 5-10-членном гетероариле или C1-6гетероалкиле независимо выбран из группы, состоящей из -NH-, N, -O- и -S-;
[26] причем в любом из вышеуказанных случаев число гетероатомов или содержащих гетероатом групп независимо представляет собой 1, 2 или 3.
[27] В некоторых вариантах осуществления настоящего изобретения каждый из R независимо представляет собой F, Cl, Br, I, NH2, NO2, OH, CN, COOH, CH3, NH2C(=NH)NH-, CH3CH2-, CF3 или -O-C(=O)-CH3, и другие переменные являются такими, как определено в настоящем изобретении.
[28] В некоторых вариантах осуществления настоящего изобретения R1 представляет собой  , который необязательно замещен 1, 2 или 3 R, и другие переменные являются такими, как определено в настоящем изобретении.
, который необязательно замещен 1, 2 или 3 R, и другие переменные являются такими, как определено в настоящем изобретении.
[29] В некоторых вариантах осуществления настоящего изобретения R1 представляет собой 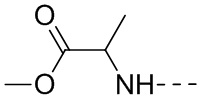 , и другие переменные являются такими, как определено в настоящем изобретении.
, и другие переменные являются такими, как определено в настоящем изобретении.
[30] В некоторых вариантах осуществления настоящего изобретения R2 представляет собой 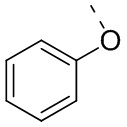 , и другие переменные являются такими, как определено в настоящем изобретении.
, и другие переменные являются такими, как определено в настоящем изобретении.
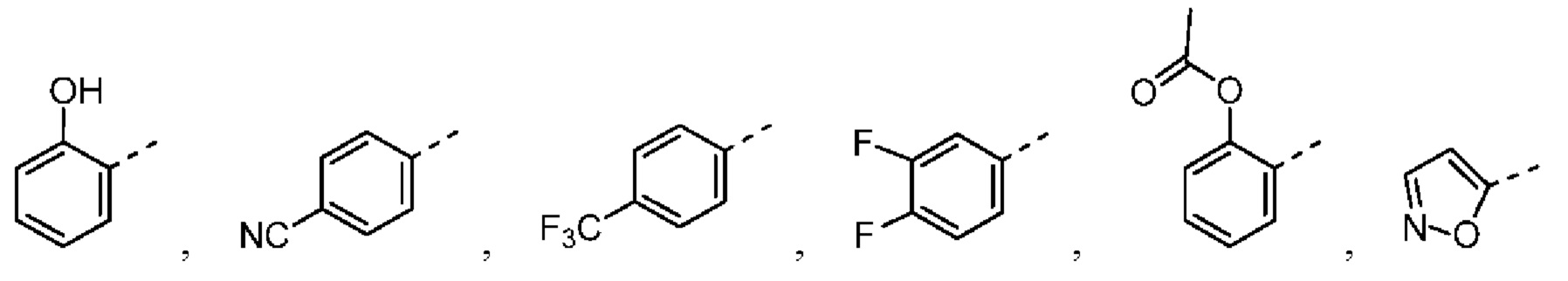
[31] В некоторых вариантах осуществления настоящего изобретения R3 выбран из группы, состоящей из фенила, тиенила, пиридила, хинолила, пиримидила, изоксазолила и 1,2,4-оксадиазолила, каждый из которых необязательно замещен 1, 2 или 3 R, но при этом R3 не является фенилом и  , и другие переменные являются такими, как определено в настоящем изобретении.
, и другие переменные являются такими, как определено в настоящем изобретении.
[32] В некоторых вариантах осуществления настоящего изобретения R3 выбран из группы, состоящей из 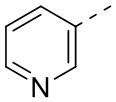 ,
, 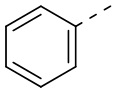 ,
, 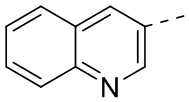 ,
, 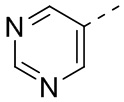 ,
, 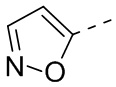 и
и 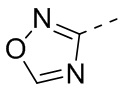 , каждый из которых необязательно замещен 1, 2 или 3 R, но при этом R3 не является фенилом, и другие переменные являются такими, как определено в настоящем изобретении.
, каждый из которых необязательно замещен 1, 2 или 3 R, но при этом R3 не является фенилом, и другие переменные являются такими, как определено в настоящем изобретении.
[33] В некоторых вариантах осуществления настоящего изобретения R3 представляет собой  ,
, 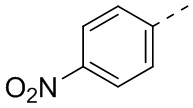 ,
,  ,
,  ,
, 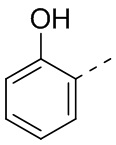 ,
, 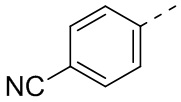 ,
, 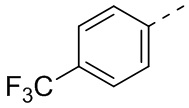 ,
, 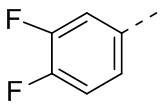 ,
, 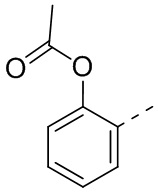 ,
,  или
или 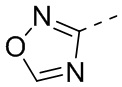 , и другие переменные являются такими, как определено в настоящем изобретении.
, и другие переменные являются такими, как определено в настоящем изобретении.
[34] В некоторых вариантах осуществления настоящего изобретения R4 представляет собой H, F, Cl, Br, I, OH, NH2, CH3 или -CH2-CH3, и другие переменные являются такими, как определено в настоящем изобретении.
[35] В некоторых вариантах осуществления настоящего изобретения R5 представляет собой H или CH3, и другие переменные являются такими, как определено в настоящем изобретении.
[36] В некоторых вариантах осуществления настоящего изобретения R6 представляет собой H или CH3, и другие переменные являются такими, как определено в настоящем изобретении.
[37] В некоторых вариантах осуществления настоящего изобретения R7 представляет собой H, OH, COOH, CONH2, NH2, SH, NH2C(=NH)NH-, или R7 выбран из группы, состоящей из C1-6алкила, C1-3алкил-S-C1-3алкил-, C1-6алкокси, C1-6алкилтио, фенила, 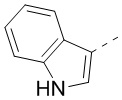 и
и 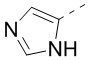 , каждый из которых необязательно замещен 1, 2 или 3 R, и другие переменные являются такими, как определено в настоящем изобретении.
, каждый из которых необязательно замещен 1, 2 или 3 R, и другие переменные являются такими, как определено в настоящем изобретении.
[38] В некоторых вариантах осуществления настоящего изобретения R7 представляет собой H, OH, COOH, CONH2, NH2, NH2C(=NH)NH-, SH, CH3S-,  ,
,  ,
, 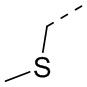 ,
, 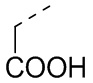 ,
, 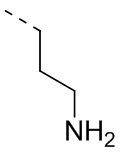 ,
, 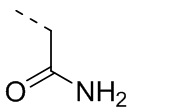 ,
, 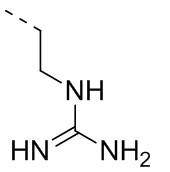 ,
,  ,
, 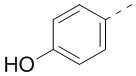 ,
,  или
или  , и другие переменные являются такими, как определено в настоящем изобретении.
, и другие переменные являются такими, как определено в настоящем изобретении.
[39] В некоторых вариантах осуществления настоящего изобретения R7 и R4 соединены вместе с образованием 3-10-членного кольца, причем 3-10-членное кольцо представляет собой 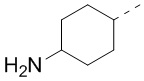 , и другие переменные являются такими, как определено в настоящем изобретении.
, и другие переменные являются такими, как определено в настоящем изобретении.
[40] В некоторых вариантах осуществления настоящего изобретения R7 и R6 соединены вместе с образованием 3-10-членного кольца, причем 3-10-членное кольцо представляет собой 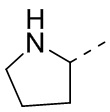 ,
, 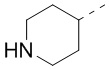 ,
, 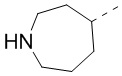 ,
, 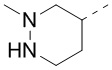 ,
, 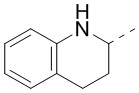 ,
, 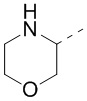 или
или 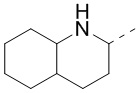 , и другие переменные являются такими, как определено в настоящем изобретении.
, и другие переменные являются такими, как определено в настоящем изобретении.
[41] В некоторых вариантах осуществления настоящего изобретения R4 и R6 соединены с R7 с образованием 3-10-членного кольца, причем 3-10-членное кольцо представляет собой 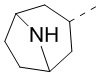 , и другие переменные являются такими, как определено в настоящем изобретении.
, и другие переменные являются такими, как определено в настоящем изобретении.
[42] В некоторых вариантах осуществления настоящего изобретения R8 представляет собой H или CH3, и другие переменные являются такими, как определено в настоящем изобретении.
[43] В некоторых вариантах осуществления настоящего изобретения R9 представляет собой H или CH3, и другие переменные являются такими, как определено в настоящем изобретении.
[44] Настоящее изобретение также предусматривает соединение, представленное формулой (I), (II) или (III), его фармацевтически приемлемую соль или изомер,
 ,
,  ,
, 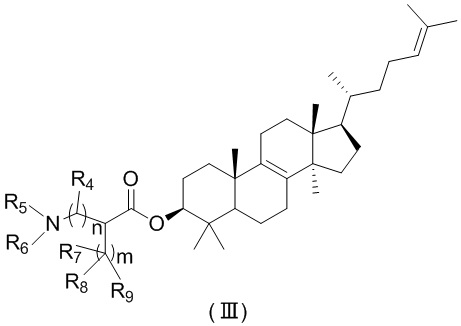 ,
,
[45] где
[46] m равняется 0, 1, 2, 3, 4, 5 или 6, причем если m равняется 0, то фрагмент  отсутствует;
отсутствует;
[47] n равняется 0, 1, 2 или 3;
[48] R1 представляет собой C1-3алкил-O-C(=O)-C1-3алкил-NH-, который необязательно замещен 1, 2 или 3 R;
[49] R2 выбран из группы, состоящей из фенил-O- и 5-10-членного гетероарила, каждый из которых необязательно замещен 1, 2 или 3 R;
[50] R3 выбран из группы, состоящей из 6-10-членного арила, 6-10-членного арил-C1-3алкил-, 5-10-членного гетероарила и 5-10-членного гетероарил-C1-3алкил-, каждый из которых необязательно замещен 1, 2 или 3 R;
[51] R4 представляет собой H, F, Cl, Br, I, OH, или NH2, или C1-6алкил, который необязательно замещен 1, 2 или 3 R;
[52] R5 представляет собой H или C1-6алкил, который необязательно замещен 1, 2 или 3 R;
[53] R6 представляет собой H или C1-6алкил, который необязательно замещен 1, 2 или 3 R;
[54] R7 представляет собой H, F, Cl, Br, I, OH, COOH, CONH2, NH2, SH или NH2C(=NH)NH-, или R7 выбран из группы, состоящей из C1-6алкокси, C1-6алкилтио, арила и 5-10-членного гетероарила, каждый из которых необязательно замещен 1, 2 или 3 R;
[55] или R7 и R6 соединены вместе с образованием 3-10-членного кольца;
[56] или R7 и R4 соединены вместе с образованием 3-10-членного кольца;
[57] или R4 и R6 соединены с R7 с образованием 3-10-членного кольца;
[58] R8 представляет собой H или C1-3алкил;
[59] R9 представляет собой H или C1-3алкил;
[60] R представляет собой F, Cl, Br, I, NH2, NO2, OH, или COOH, или C1-3алкил;
[61] «гетеро» в 5-10-членном гетероариле или C1-6гетероалкиле независимо выбран из группы, состоящей из -NH-, N, -O- и -S-;
[62] причем в любом из вышеуказанных случаев число гетероатомов или содержащих гетероатом групп независимо представляет собой 1, 2 или 3.
[63] В некоторых вариантах осуществления настоящего изобретения R представляет собой F, Cl, Br, I, NH2, NO2, OH, COOH, CH3 или CH3CH2-.
[64] В некоторых вариантах осуществления настоящего изобретения R1 представляет собой  , который необязательно замещен 1, 2 или 3 R.
, который необязательно замещен 1, 2 или 3 R.
[65] В некоторых вариантах осуществления настоящего изобретения R1 представляет собой  .
.
[66] В некоторых вариантах осуществления настоящего изобретения R2 представляет собой  .
.
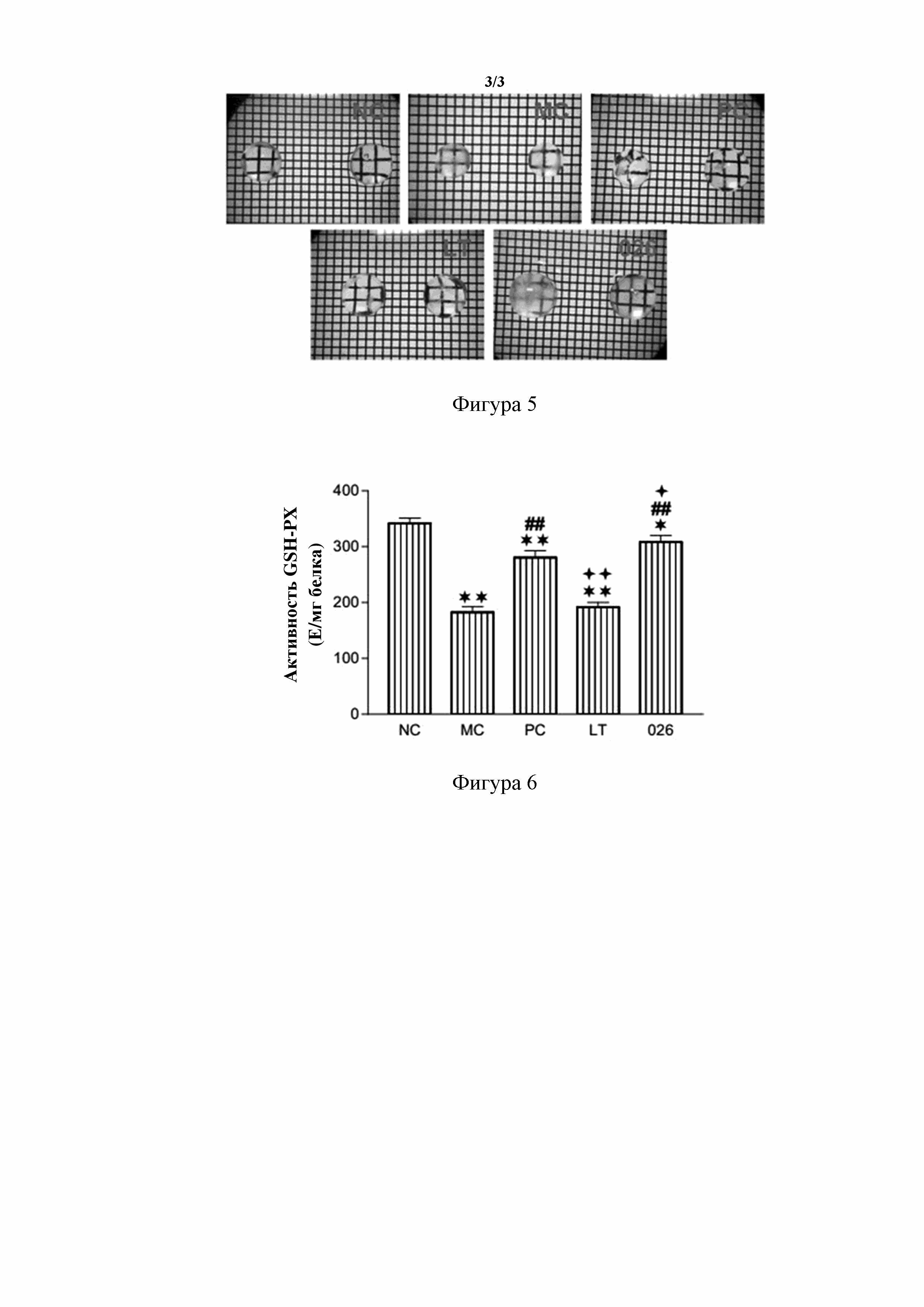
[67] В некоторых вариантах осуществления настоящего изобретения R3 выбран из группы, состоящей из фенила, тиенила, пиридила и хинолила, каждый из которых необязательно замещен 1, 2 или 3 R.
[68] В некоторых вариантах осуществления настоящего изобретения R3 выбран из группы, состоящей из  ,
,  и
и  , каждый из которых необязательно замещен 1, 2 или 3 R.
, каждый из которых необязательно замещен 1, 2 или 3 R.
[69] В некоторых вариантах осуществления настоящего изобретения R3 представляет собой  ,
,  или
или  .
.
[70] В некоторых вариантах осуществления настоящего изобретения R7 представляет собой H, OH, COOH, CONH2, NH2, SH или NH2C(=NH)NH-, или R7 выбран из группы, состоящей из C1-6алкокси, C1-6алкилтио, фенила,  и
и  , каждый из которых необязательно замещен 1, 2 или 3 R.
, каждый из которых необязательно замещен 1, 2 или 3 R.
[71] В некоторых вариантах осуществления настоящего изобретения R7 представляет собой H, OH, COOH, CONH2, NH2, NH2C(=NH)NH-, SH, CH3S-,  ,
,  ,
,  или
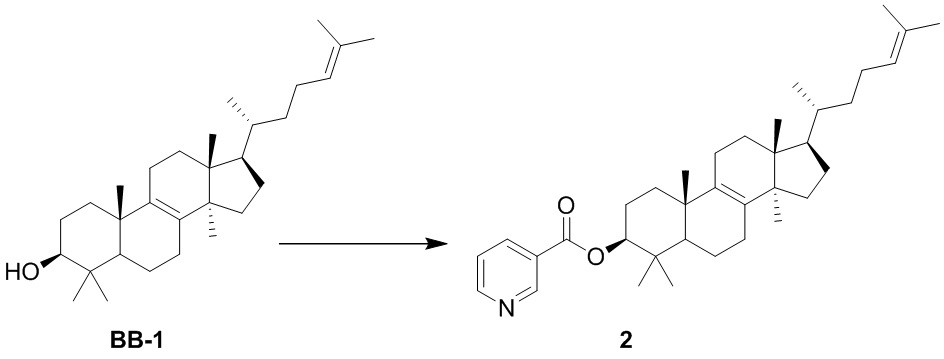
или  .
.
[72] В некоторых вариантах осуществления настоящего изобретения R7 и R4 соединены вместе с образованием 3-10-членного кольца, причем 3-10-членное кольцо представляет собой  .
.
[73] В некоторых вариантах осуществления настоящего изобретения R7 и R6 соединены вместе с образованием 3-10-членного кольца, причем 3-10-членное кольцо представляет собой  ,
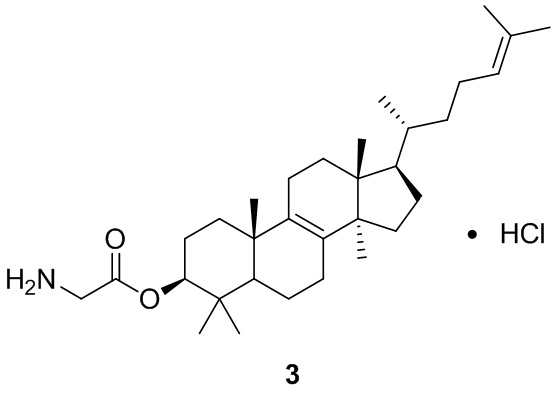
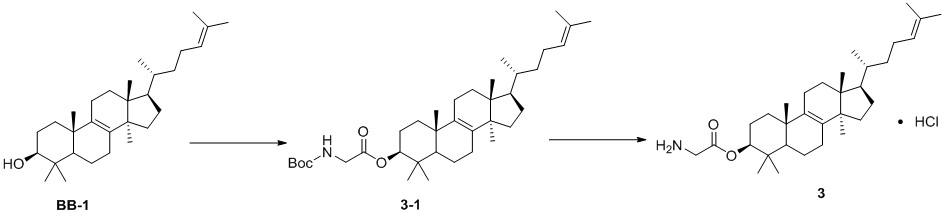
,  ,
,  ,
,  ,
,  ,
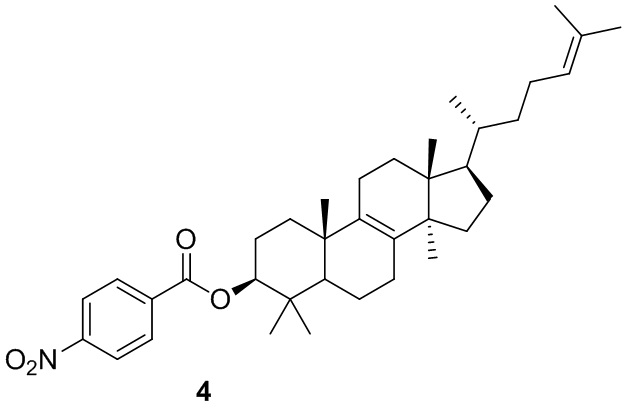
,  или
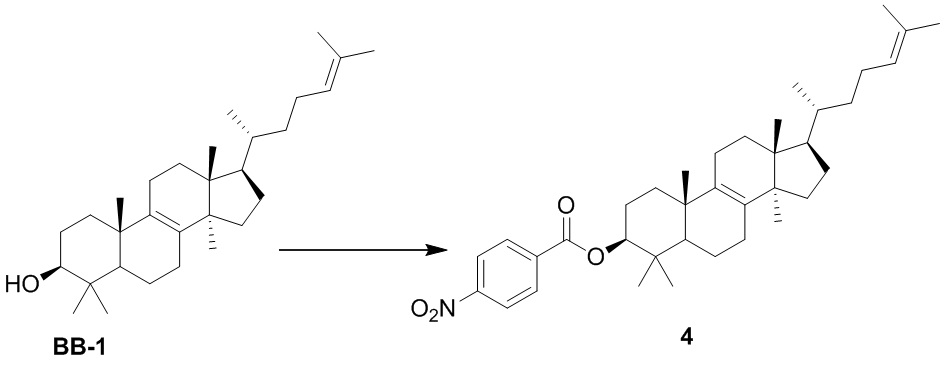
или  .
.
[74] В некоторых вариантах осуществления настоящего изобретения R4 и R6 соединены с R7 с образованием 3-10-членного кольца, причем 3-10-членное кольцо представляет собой  .
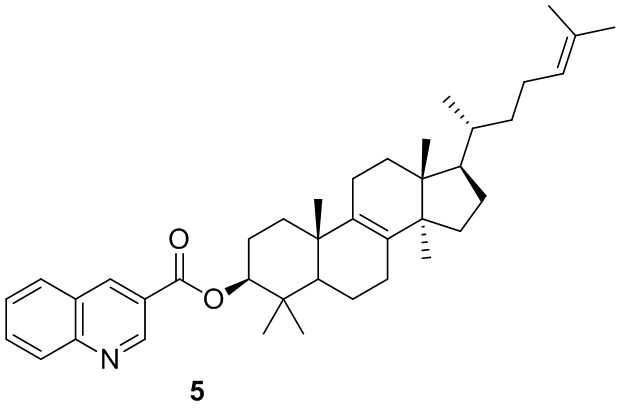
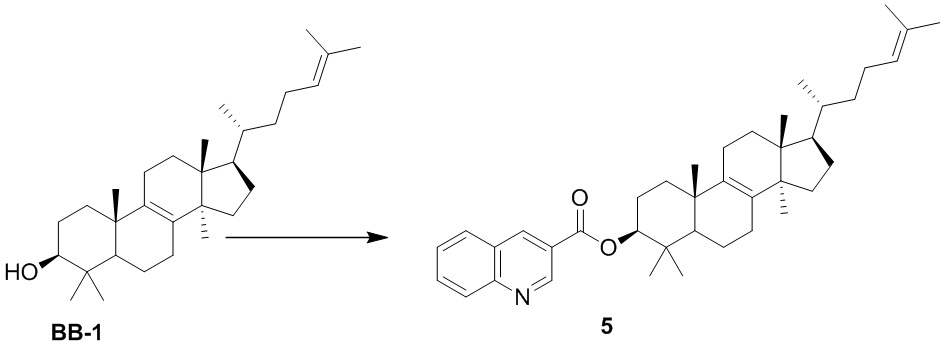
.
[75] Другие варианты осуществления настоящего изобретения можно получить путем произвольного комбинирования вышеуказанных переменных.
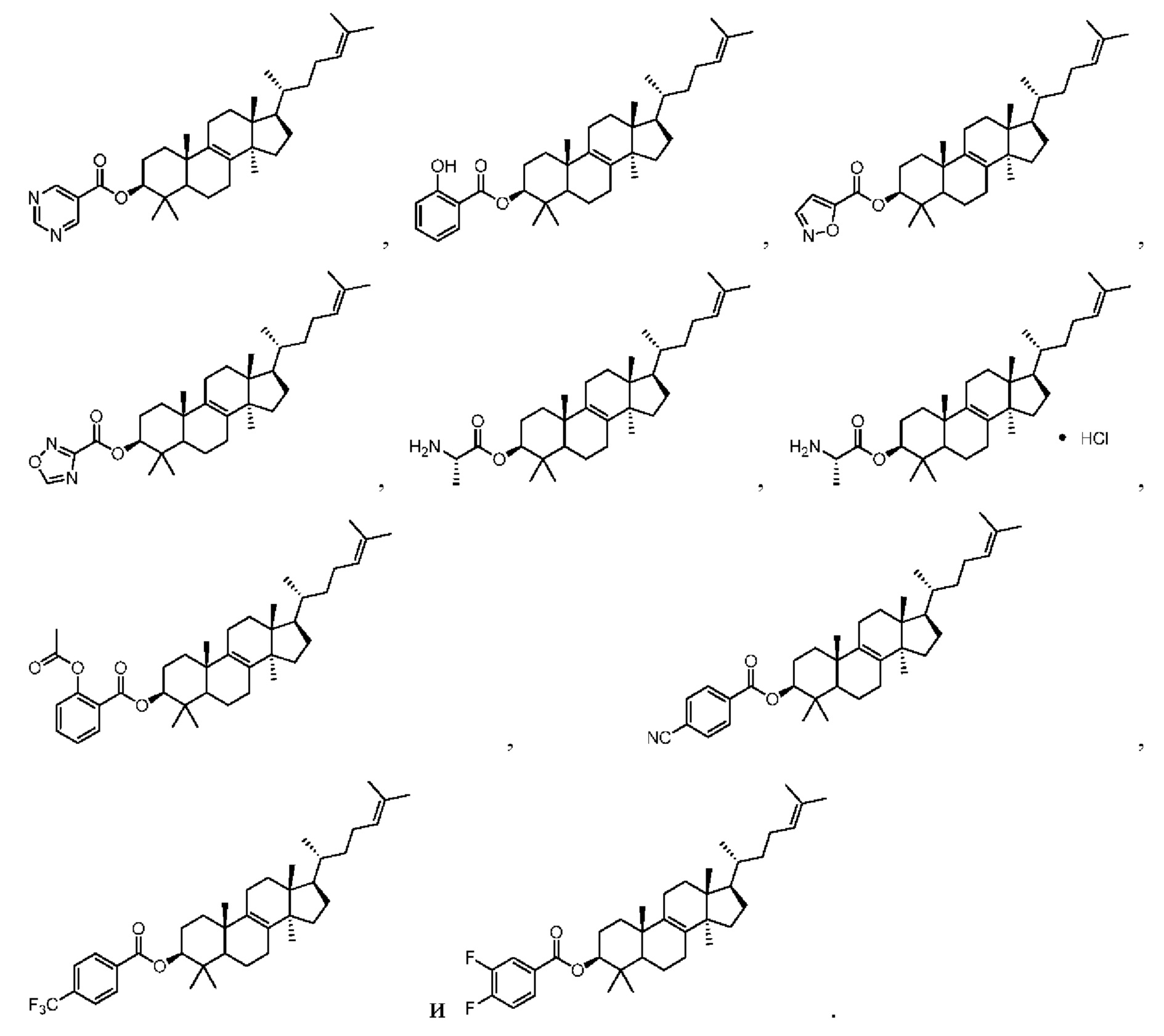
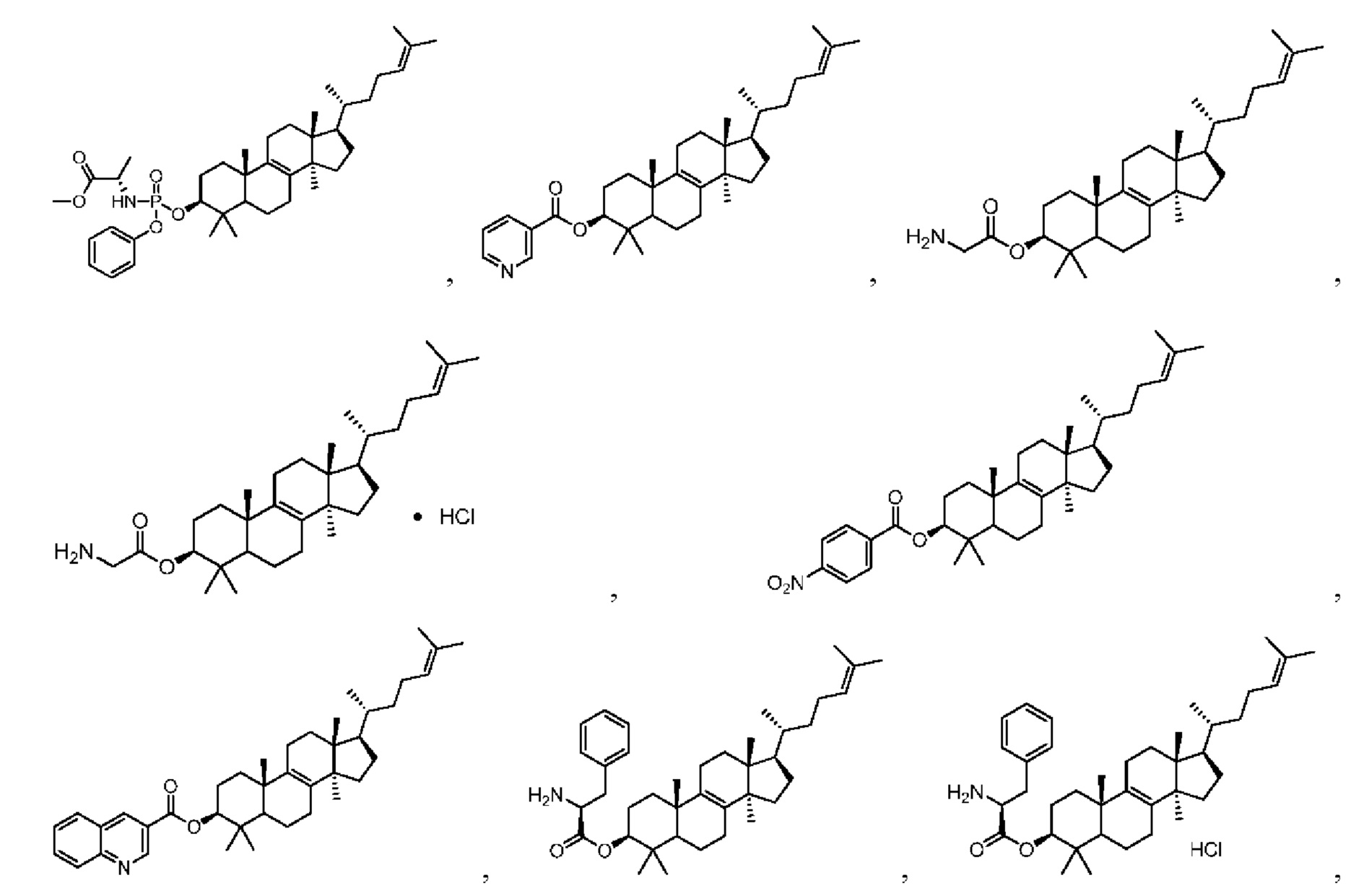
[76] Настоящее изобретение также предусматривает соединение, его фармацевтически приемлемую соль или изомер, которые выбраны из группы, состоящей из:
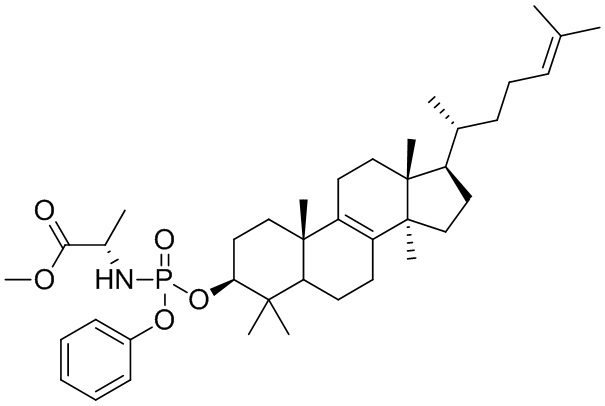 ,
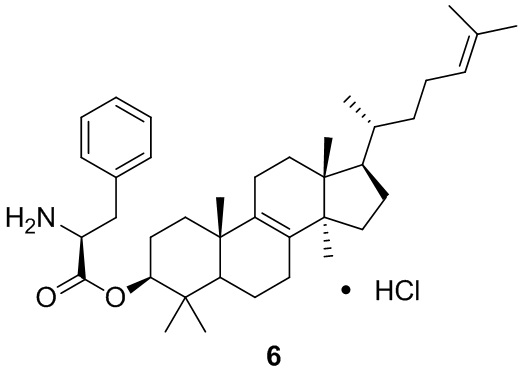
, 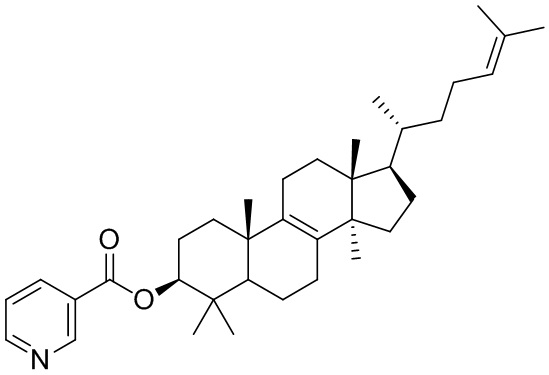 ,
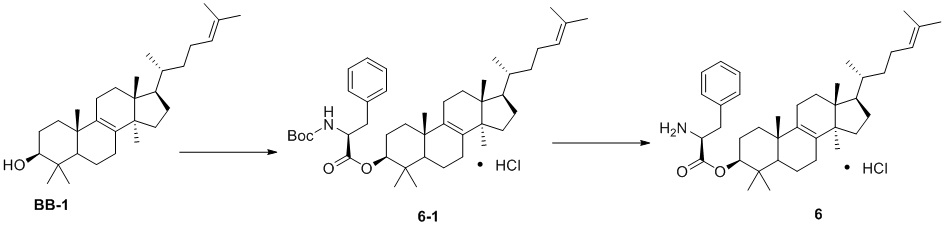
, 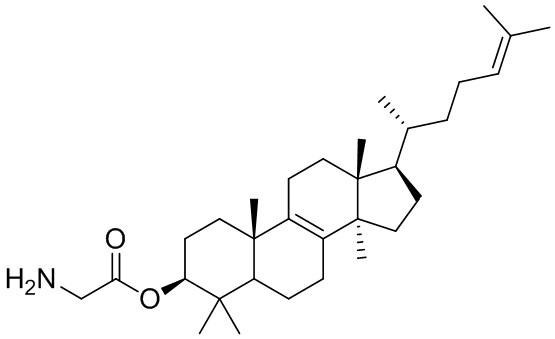 ,
, 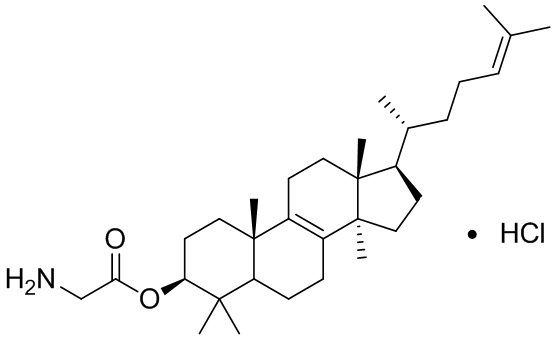 ,
, 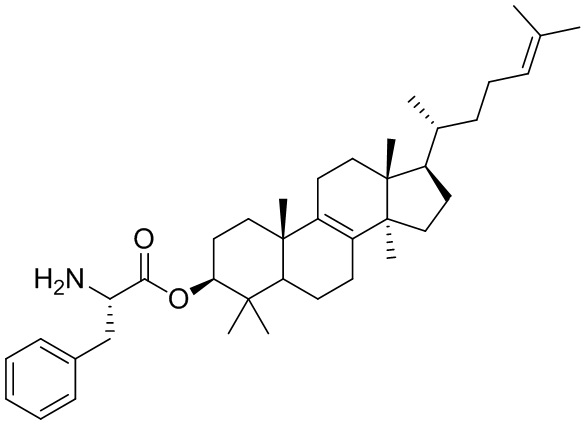 ,
, 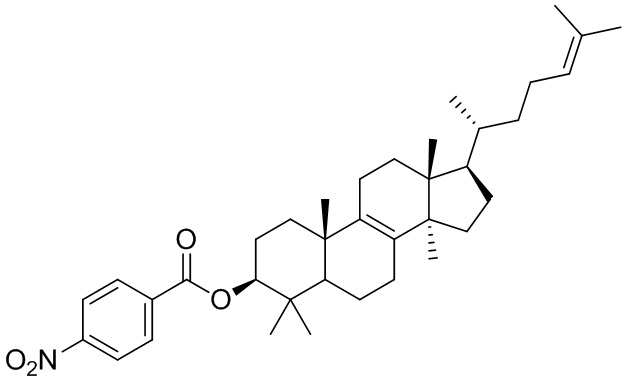 ,
, 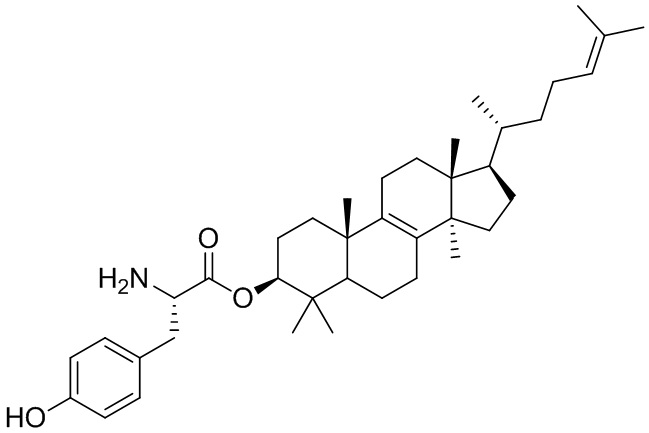 ,
, 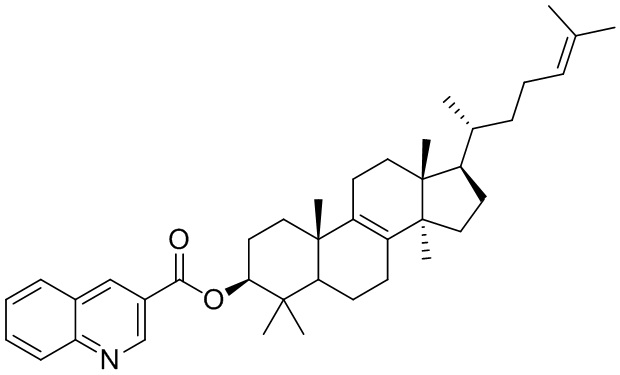 ,
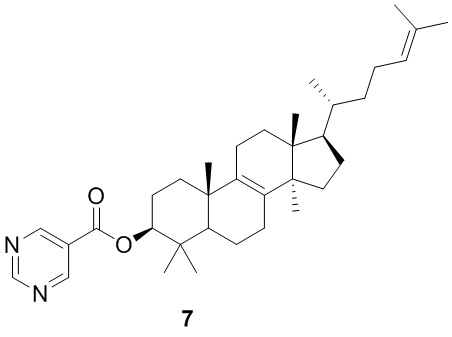
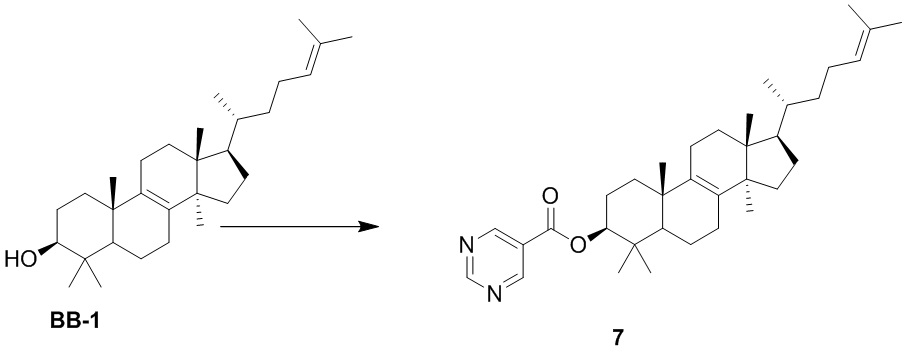
, 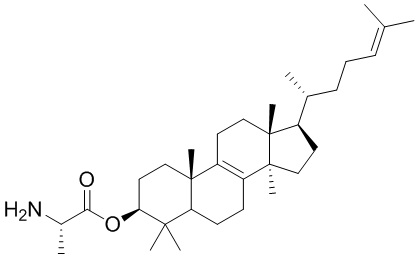 ,
, 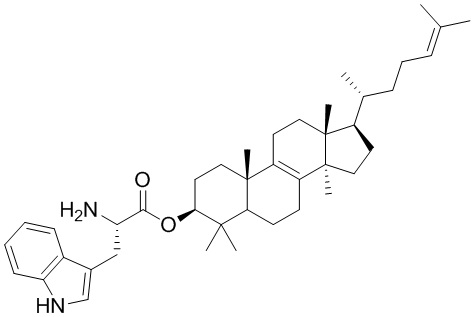 ,
, 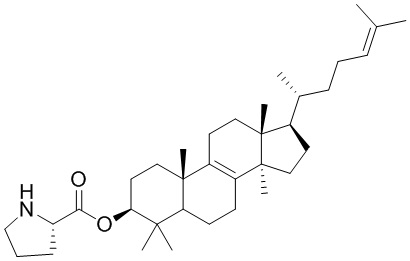 ,
, 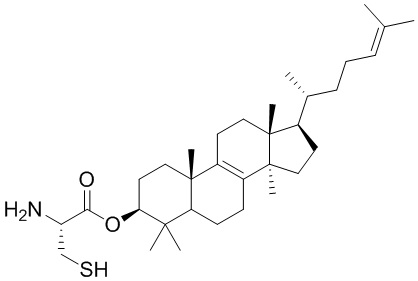 ,
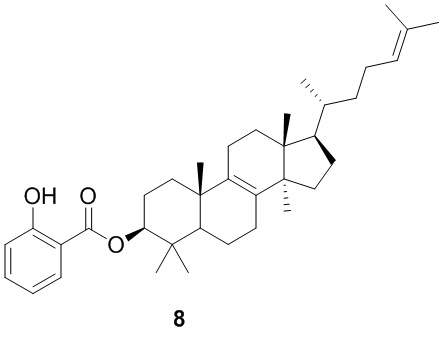
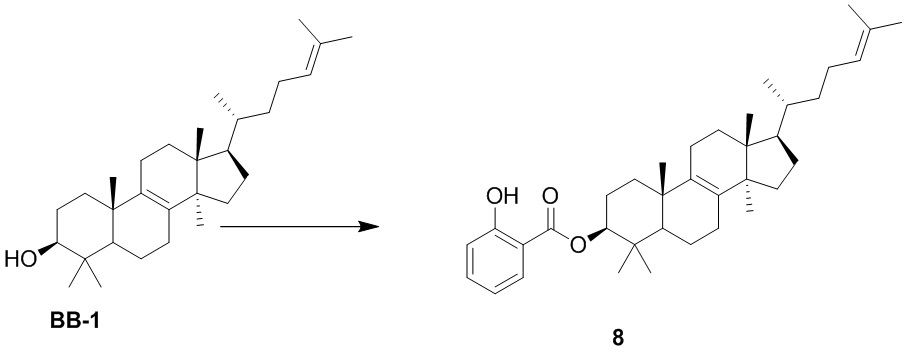
, 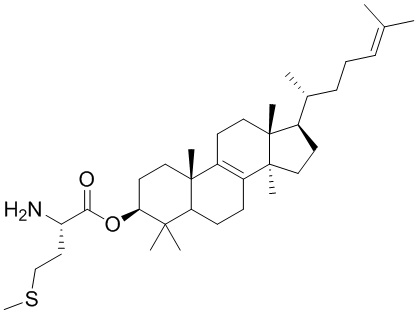 ,
, 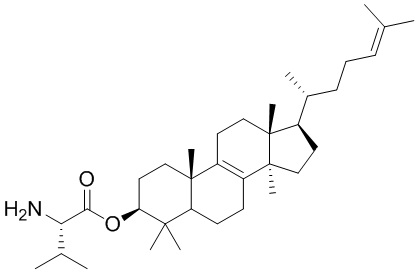 ,
, 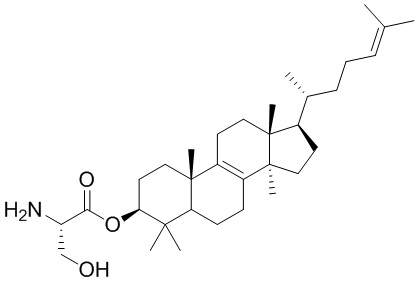 ,
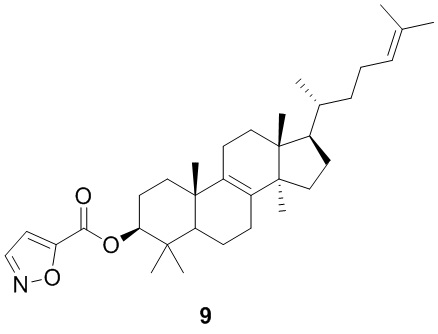
, 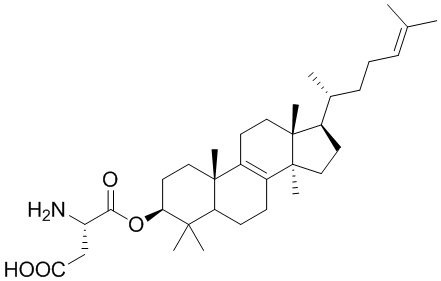 ,
, 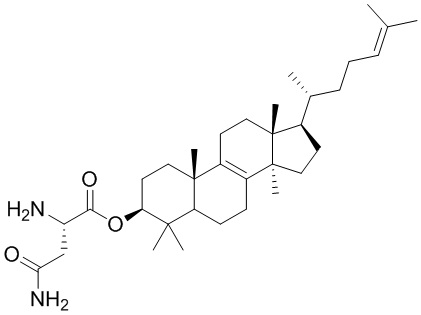 ,
, 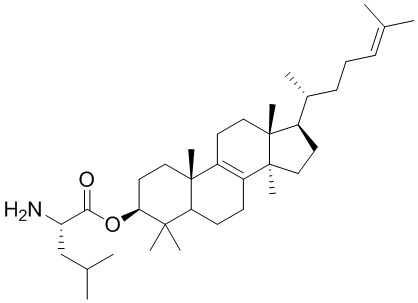 ,
, 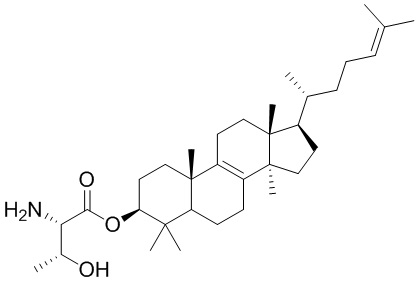 ,
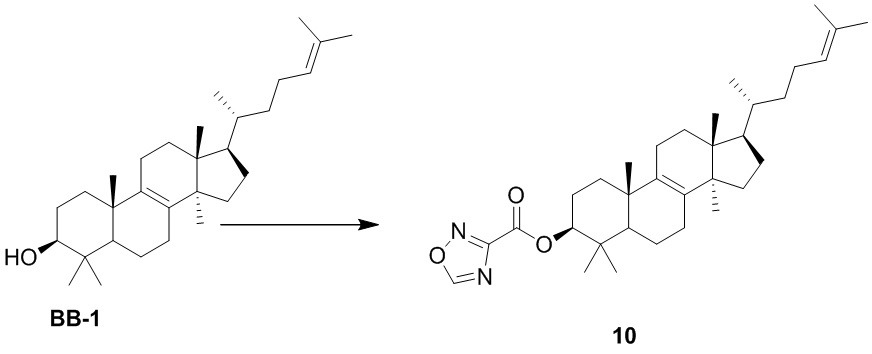
, 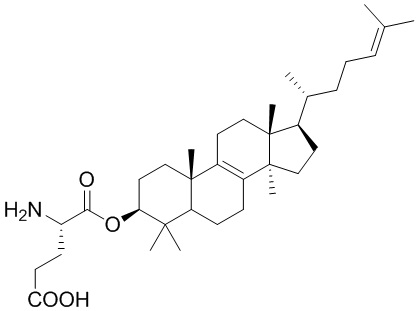 ,
, 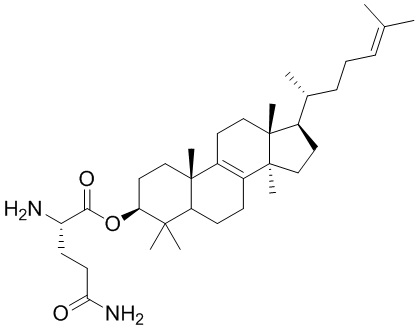 ,
, 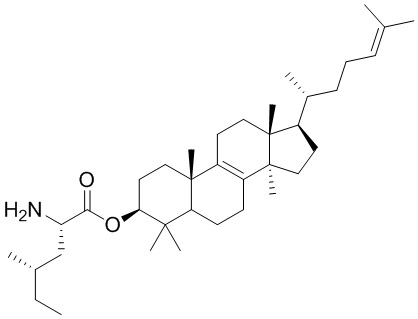 ,
, 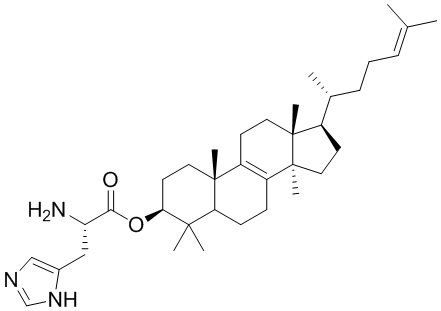 ,
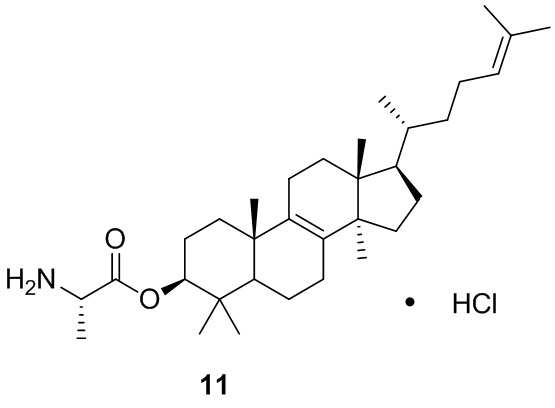
, 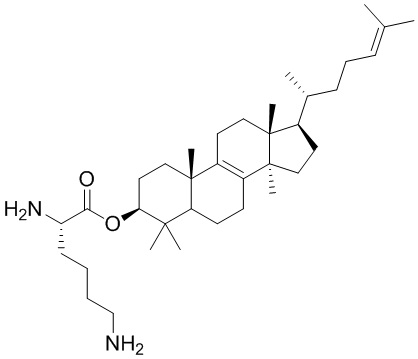 ,
, 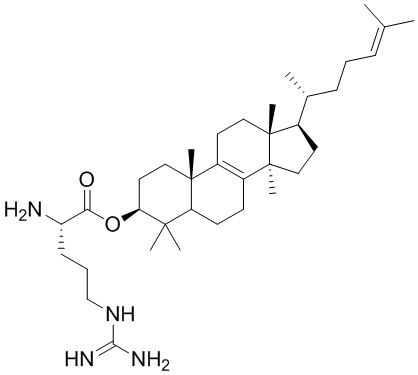 ,
, 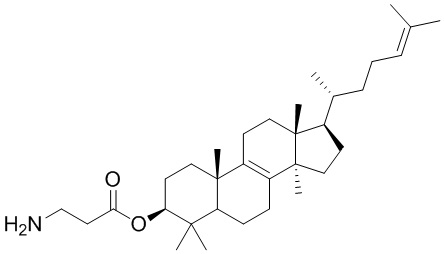 ,
, 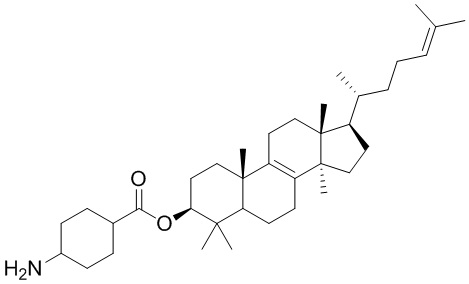 ,
, 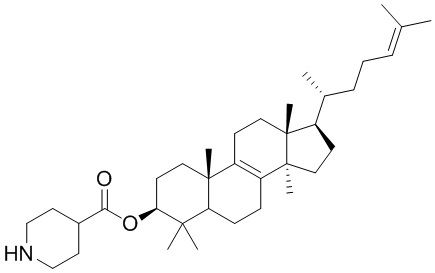 ,
, 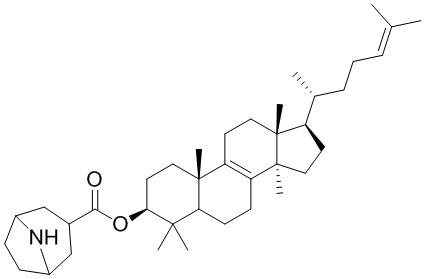 ,
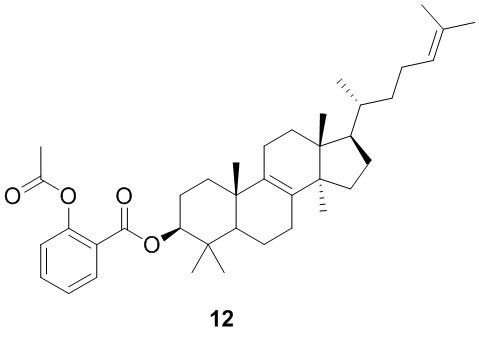
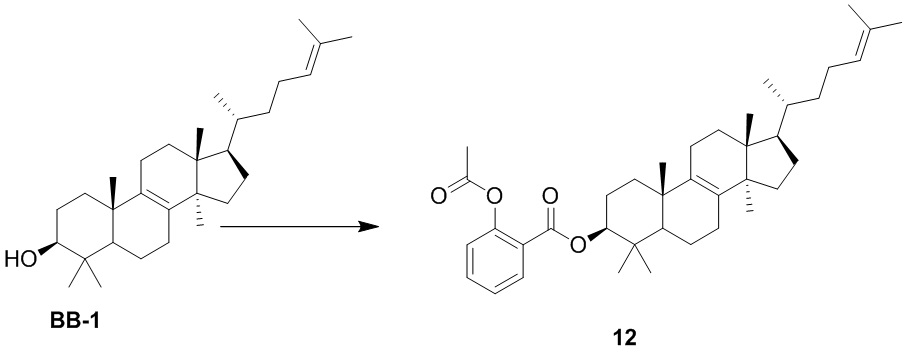
, 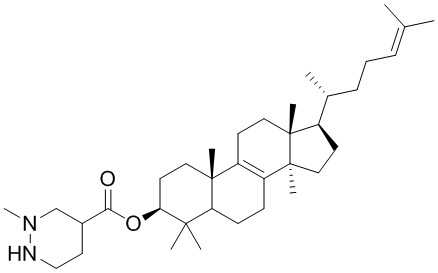 ,
, 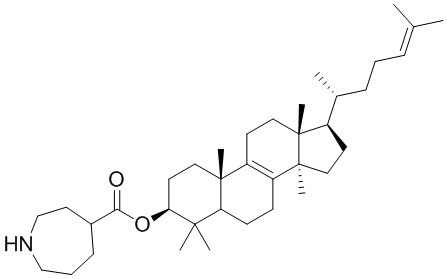 ,
, 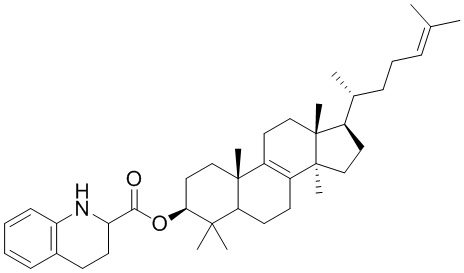 ,
, 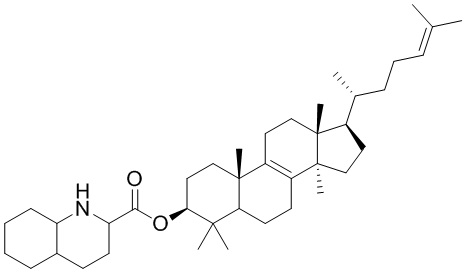 ,
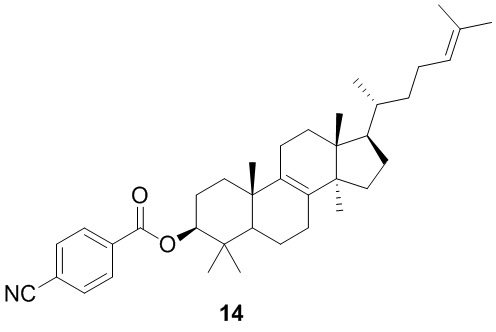
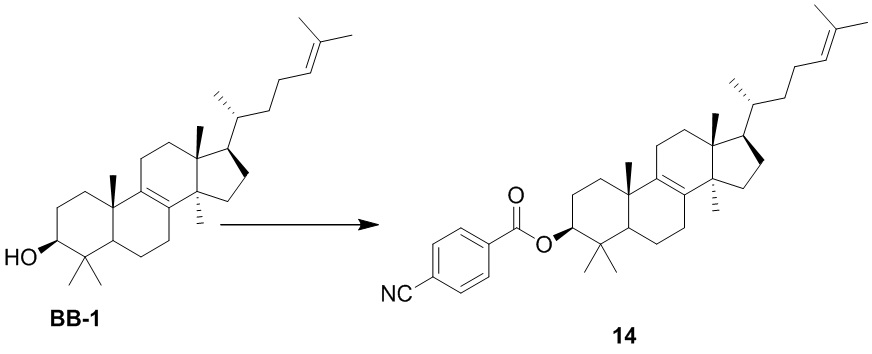
, 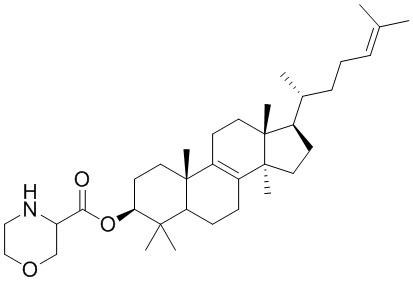 ,
, 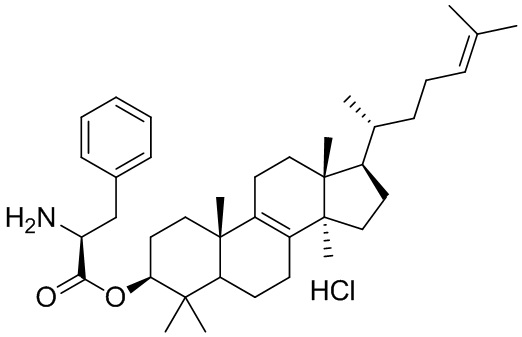 ,
, 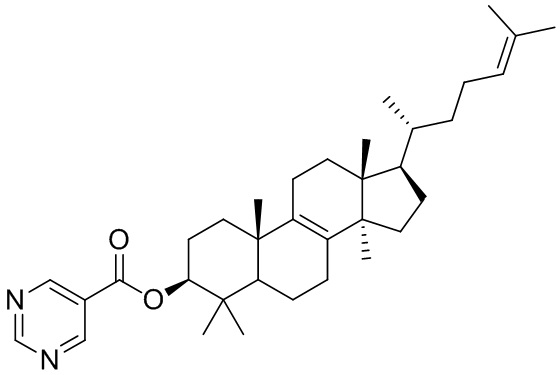 ,
, 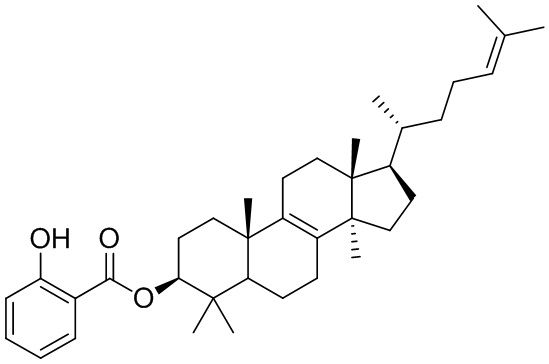 ,
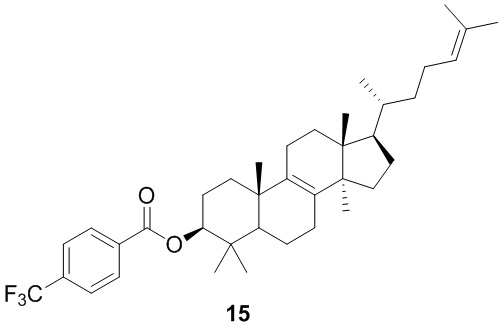
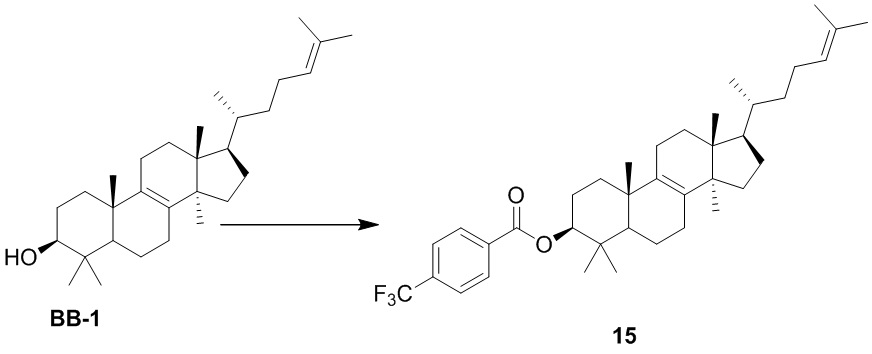
, 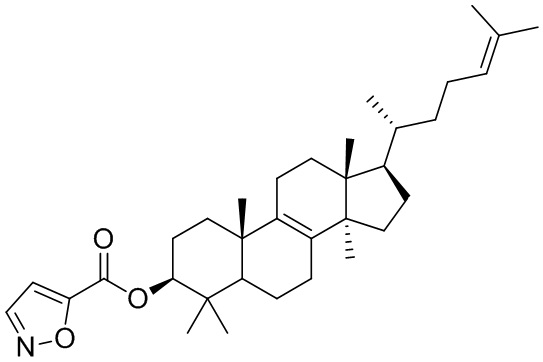 ,
, 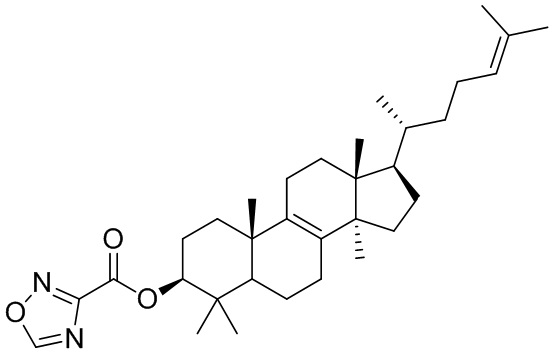 ,
, 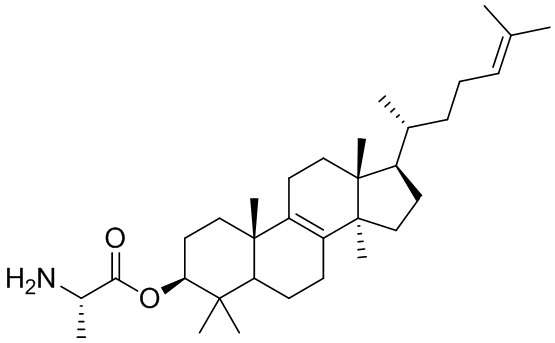 ,
, 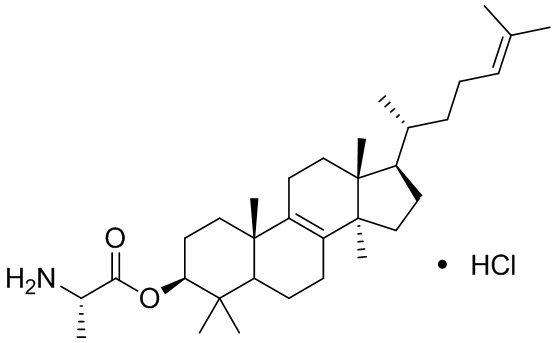 ,
, 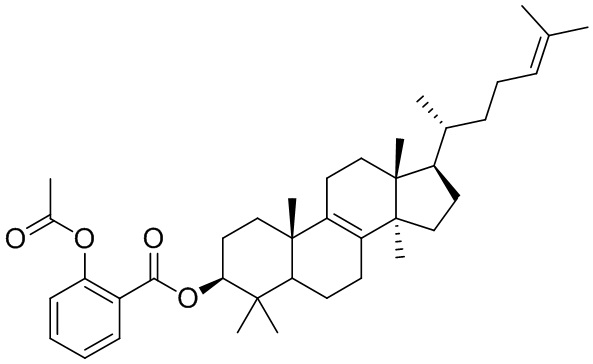 ,
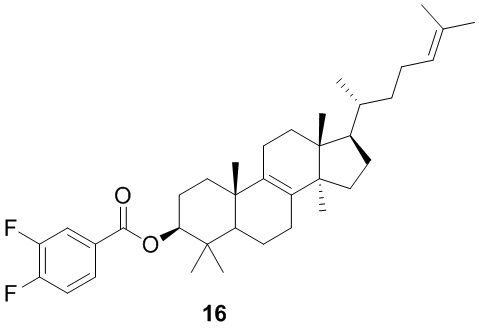
, 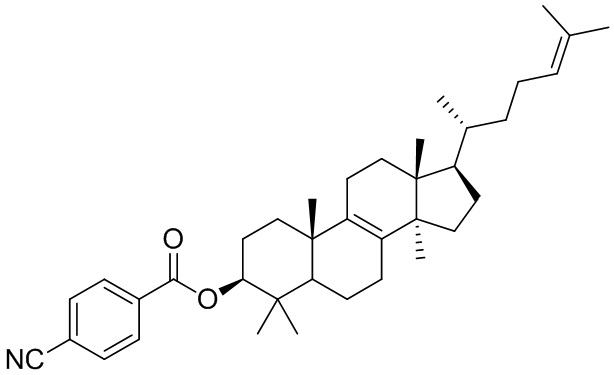 ,
, 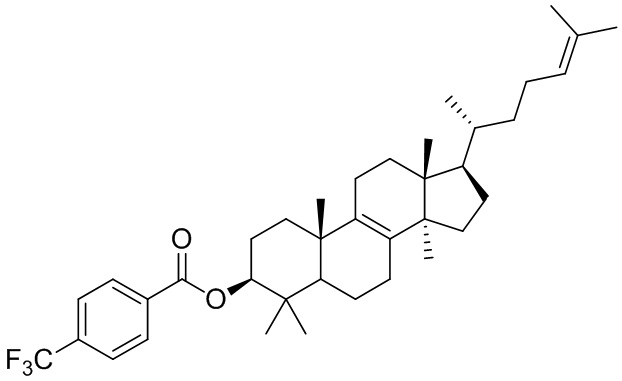 и
и 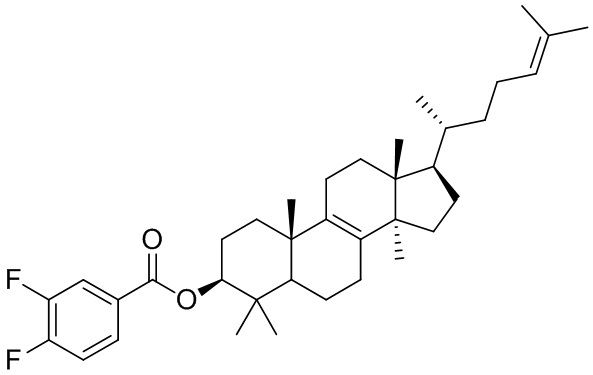 .
.
[77] Настоящее изобретение также предусматривает фармацевтическую композицию, содержащую терапевтически эффективное количество соединения или его фармацевтически приемлемой соли в качестве активного ингредиента и фармацевтически приемлемый носитель.
[78] Настоящее изобретение также предусматривает применение соединения, или фармацевтически приемлемой соли, или фармацевтической композиции в изготовлении лекарственного препарата для лечения офтальмологических заболеваний.
[79] В некоторых вариантах осуществления настоящего изобретения лекарственный препарат для лечения офтальмологических заболеваний представляет собой лекарственный препарат для лечения катаракты.
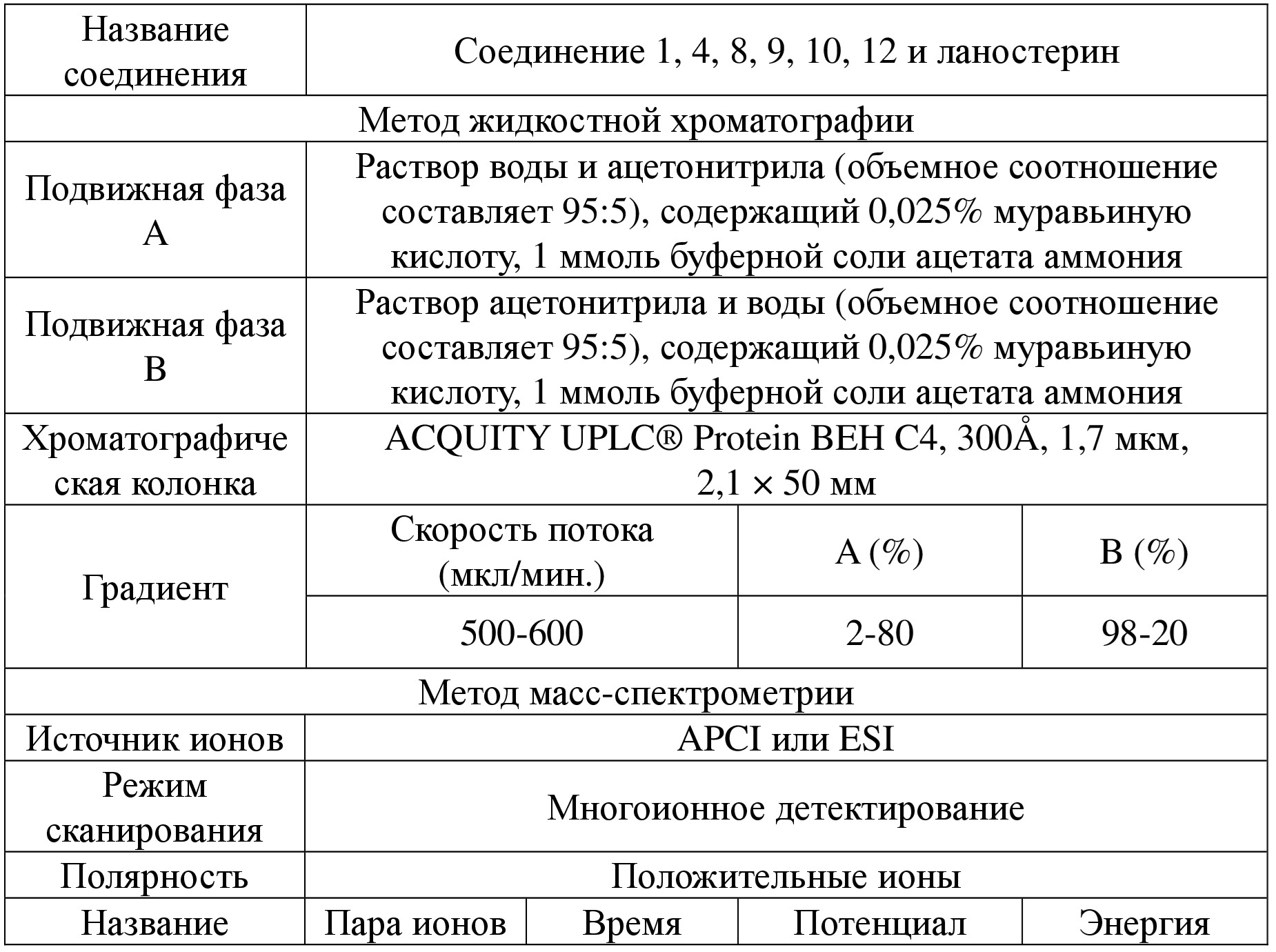
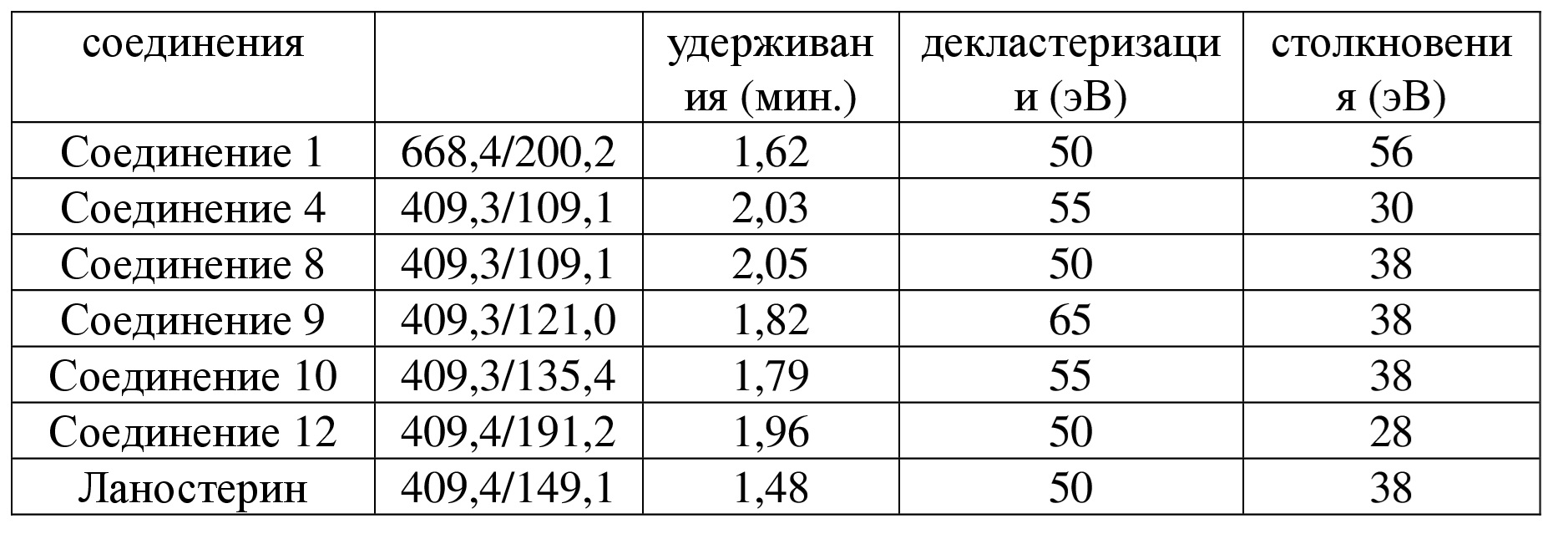
[80] В некоторых вариантах осуществления настоящего изобретения лекарственный препарат для лечения катаракты представляет собой глазные капли.
[81] Область техники
[82] Являясь новым пролекарством ланостерина, соединение по настоящему изобретению характеризуется хорошей проникающей способностью и может подвергаться эффективному превращению в ланостерин in vivo, что значительно улучшает биодоступность лекарственного средства, содержащего ланостерин.
[83] Определения терминов и их описание
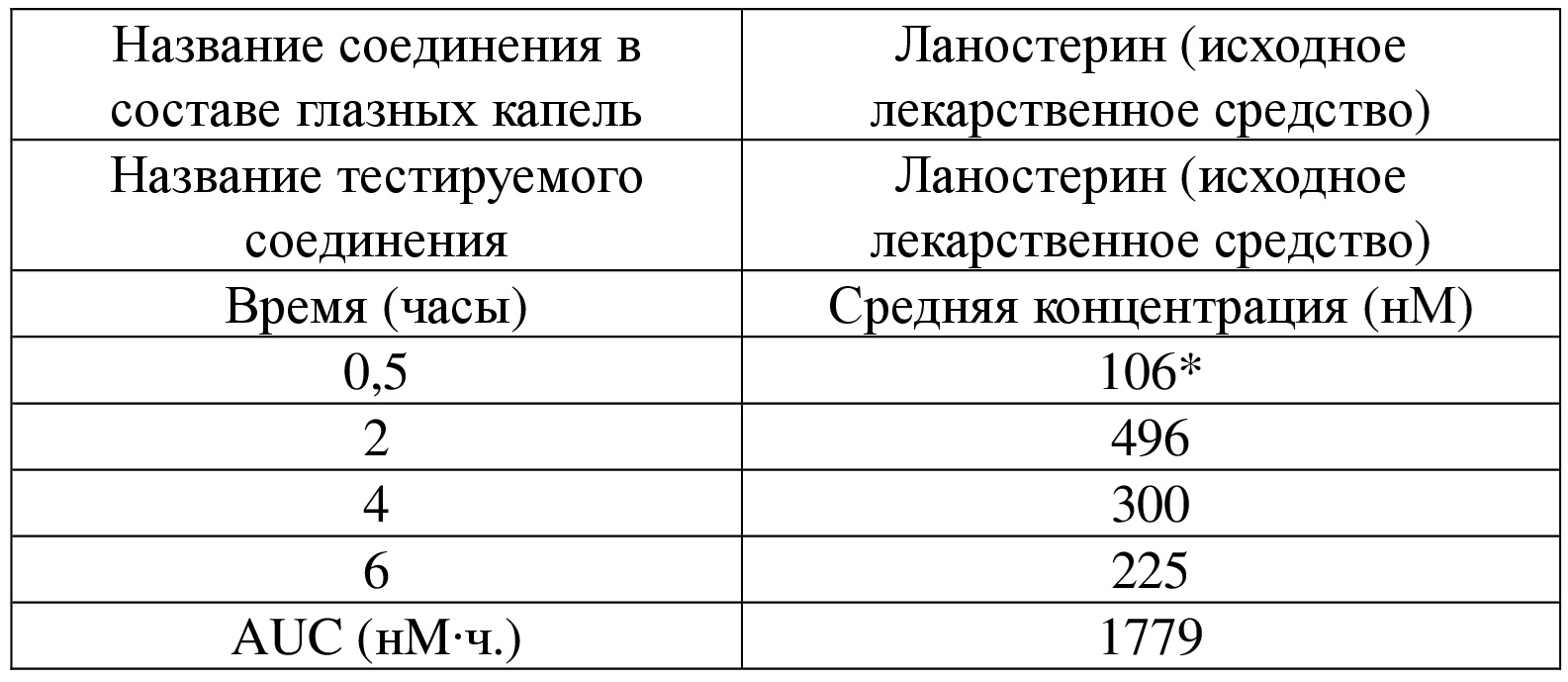
[84] Если не указано иное, предполагается, что следующие термины и выражения, используемые в настоящем документе, имеют следующие значения. Конкретный термин или выражение при отсутствии точного определения не стоит считать неопределенным или неясным, а следует понимать в соответствии с обычным значением. Если в данном документе встречается торговое название, то предполагается, что оно относится к соответствующему продукту или его активному ингредиенту. Термин «фармацевтически приемлемый» используют в данном документе применительно к тем соединениям, материалам, композициям и/или лекарственным формам, которые в рамках объективного врачебного мнения являются подходящими для применения в контакте с тканями людей и животных без избыточной токсичности, раздражения, аллергической реакции или других проблем или осложнений в соответствии с обоснованным соотношением польза/риск.
[85] Термин «фармацевтически приемлемая соль» относится к соли соединения по настоящему изобретению, которую получают путем осуществления реакции соединения, имеющего конкретный заместитель согласно настоящему изобретению, с относительно нетоксичной кислотой или основанием. Если соединение по настоящему изобретению содержит относительно кислотную функциональную группу, то соль присоединения основания может быть получена посредством приведения нейтральной формы соединения в контакт с достаточным количеством основания в чистом растворе или подходящем инертном растворителе. Фармацевтически приемлемая соль присоединения основания включает соль натрия, калия, кальция, аммония, органического амина или магния или подобные соли. Если соединение по настоящему изобретению содержит относительно основную функциональную группу, то соль присоединения кислоты может быть получена посредством приведения нейтральной формы соединения в контакт с достаточным количеством кислоты в чистом растворе или подходящем инертном растворителе. Примеры фармацевтически приемлемой соли присоединения кислоты включают соль неорганической кислоты, где неорганическая кислота включает, например, хлористоводородную кислоту, бромистоводородную кислоту, азотную кислоту, угольную кислоту, бикарбонат, фосфорную кислоту, моногидрофосфат, дигидрофосфат, серную кислоту, гидросульфат, йодистоводородную кислоту, фосфористую кислоту и т. п.; и соль органической кислоты, где органическая кислота включает, например, уксусную кислоту, пропионовую кислоту, изомасляную кислоту, малеиновую кислоту, малоновую кислоту, бензойную кислоту, янтарную кислоту, субериновую кислоту, фумаровую кислоту, молочную кислоту, миндальную кислоту, фталевую кислоту, бензолсульфоновую кислоту, п-толуолсульфоновую кислоту, лимонную кислоту, винную кислоту и метансульфоновую кислоту и т. п.; и соль аминокислоты (такой как аргинин и т. п.), и соль органической кислоты, такой как глюкуроновая кислота и т. п. Некоторые конкретные соединения по настоящему изобретению, которые содержат как основные, так и кислотные функциональные группы, могут быть превращены в любую соль присоединения основания или соль присоединения кислоты.
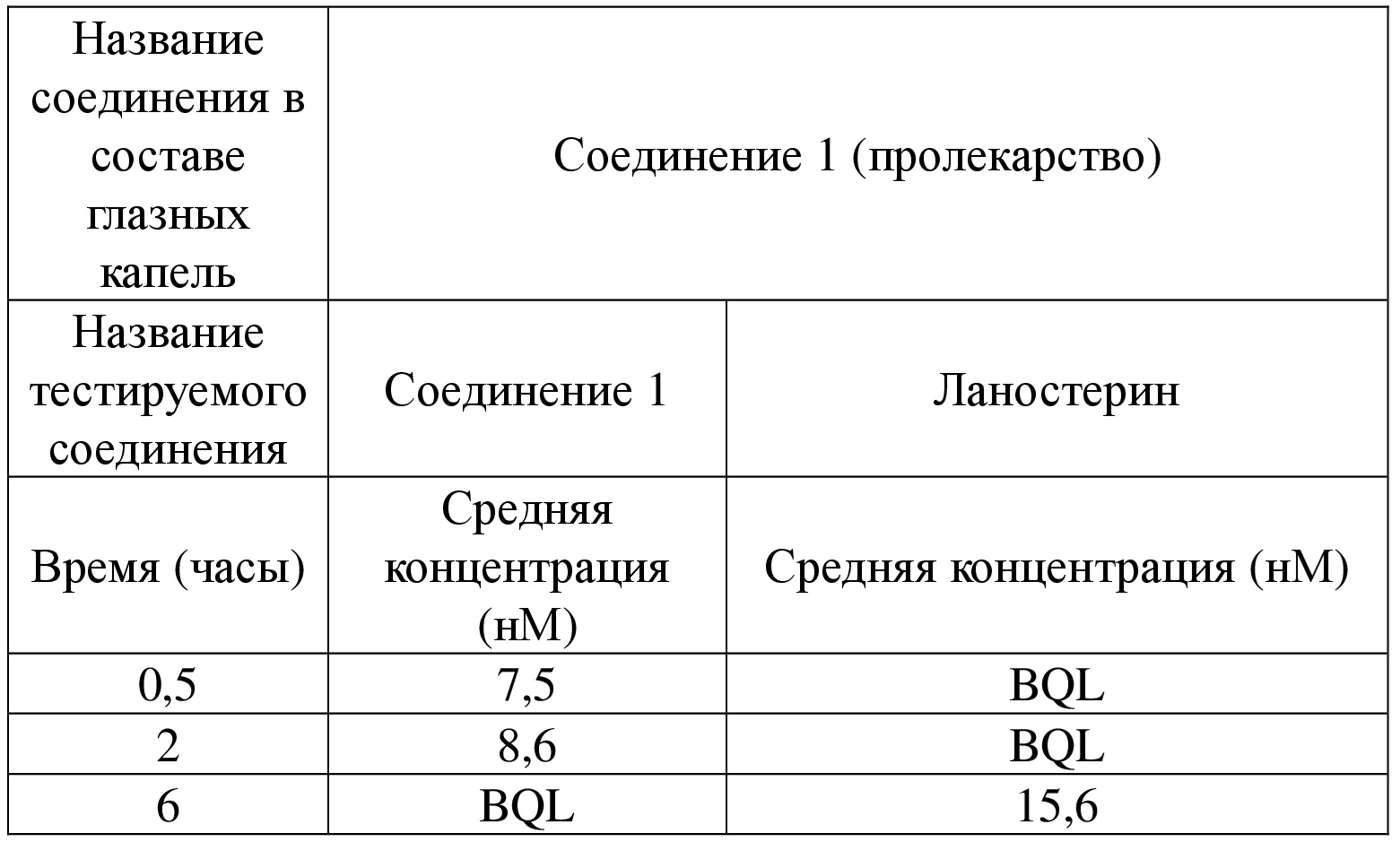
[86] Фармацевтически приемлемую соль по настоящему изобретению можно получать из исходного соединения, которое содержит кислотный или основный фрагмент, с помощью традиционного химического способа. Как правило, такая соль может быть получена путем осуществления реакции свободных кислотных или основных форм соединения со стехиометрическим количеством соответствующего основания или кислоты в воде, или в органическом растворителе, или в их смеси.
[87] В дополнение к солевой форме соединение, предусмотренное в настоящем изобретении, также находится в форме пролекарства. Пролекарственная форма соединения, описанного в данном документе, представляет собой соединение, которое легко подвергается химическим изменениям в физиологических условиях с превращением в соединение по настоящему изобретению. Кроме того, пролекарство можно превращать в соединение согласно настоящему изобретению посредством химического или биохимического способа в условиях in vivo.
[88] Некоторые соединения по настоящему изобретению могут находиться в несольватированной форме или сольватированной форме, в том числе в гидратированной форме. Как правило, сольватированная форма является эквивалентной несольватированной форме, и обе формы включены в объем настоящего изобретения.
[89] Соединение согласно настоящему изобретению может находиться в форме конкретного геометрического или стереоизомера. В настоящем изобретении подразумеваются все такие соединения, в том числе цис- и транс-изомер, (-)- и (+)-энантиомер, (R)- и (S)-энантиомер, диастереоизомер, (D)-изомер, (L)-изомер, и рацемическая смесь, и другие смеси, например, энантиомерно или диастереоизомерно обогащенная смесь, все из которых включены в объем настоящего изобретения. Заместитель, такой как алкил, может иметь дополнительный асимметрический атом углерода. Все эти изомеры и их смеси включены в объем настоящего изобретения.
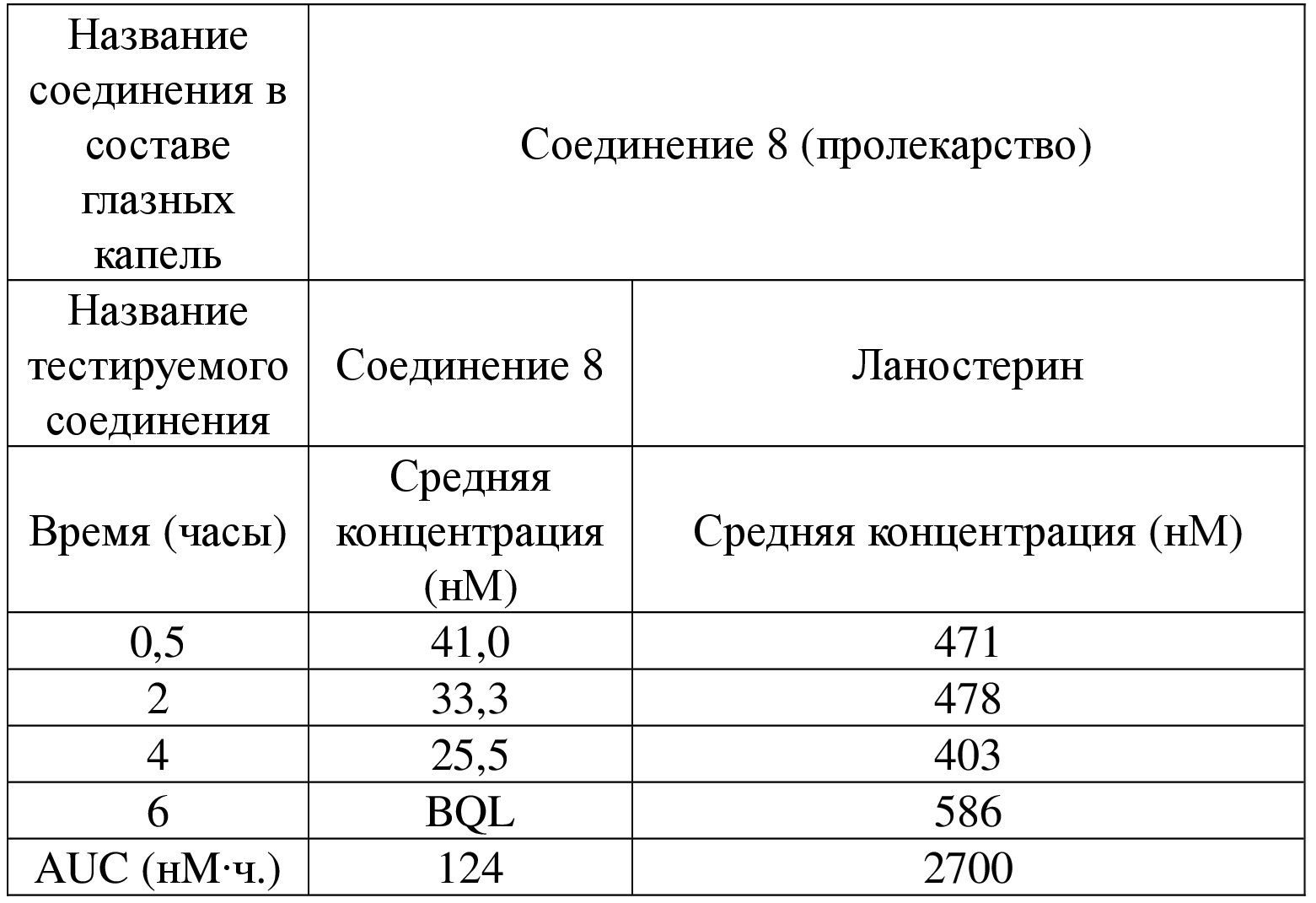
[90] Если не указано иное, термин «энантиомер» или «оптический изомер» относится к стереоизомерам, которые представляют собой зеркальные отражения друг друга.
[91] Если не указано иное, термин «цис-транс-изомер» или «геометрический изомер» обусловлен неспособностью двойной связи или одинарной связи между атомами углерода в кольце к свободному вращению.
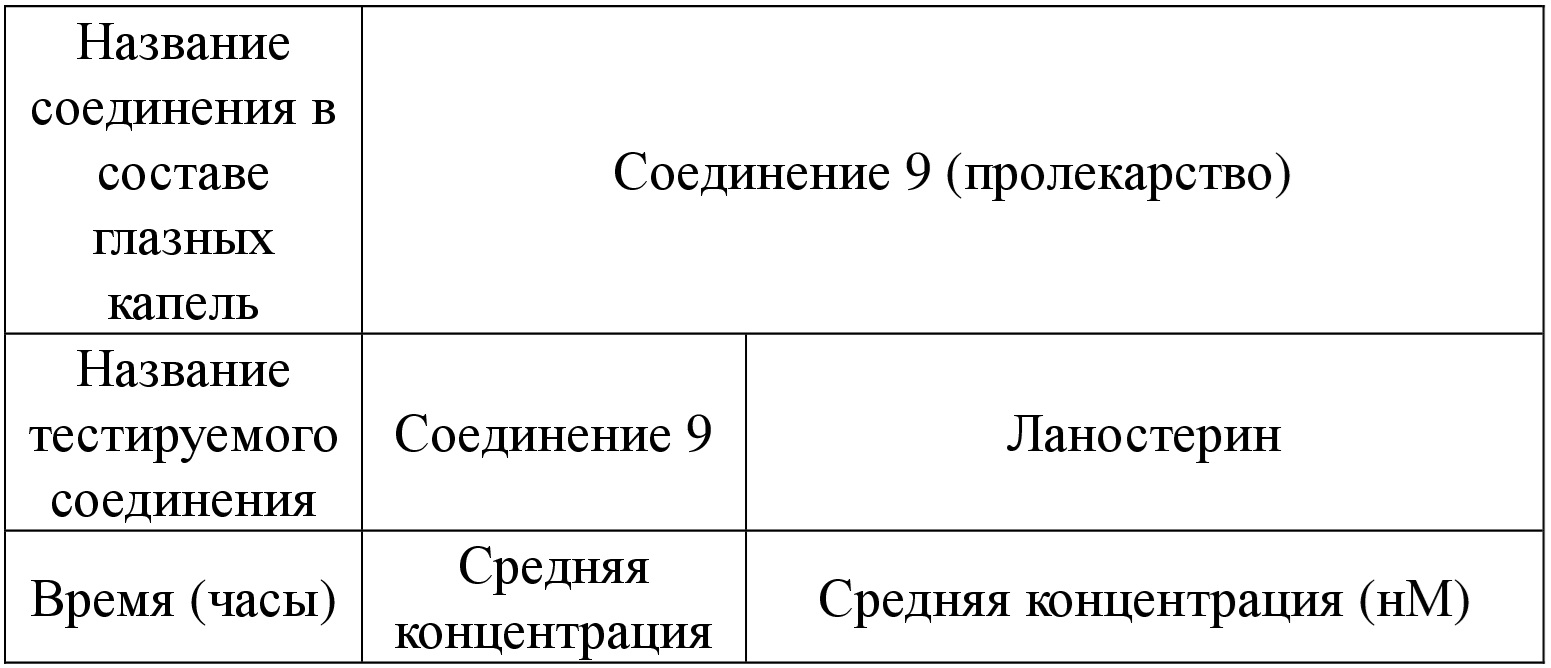
[92] Если не указано иное, термин «диастереомер» относится к стереоизомерам, молекулы которых имеют два или более хиральных центра и не являются зеркальными отражениями друг друга.
[93] Если не указано иное, «(D)» или «(+)» обозначает правостороннее вращение, «(L)» или «(-)» обозначает левостороннее вращение, «(DL)» или «(±)» обозначает рацемическую смесь.
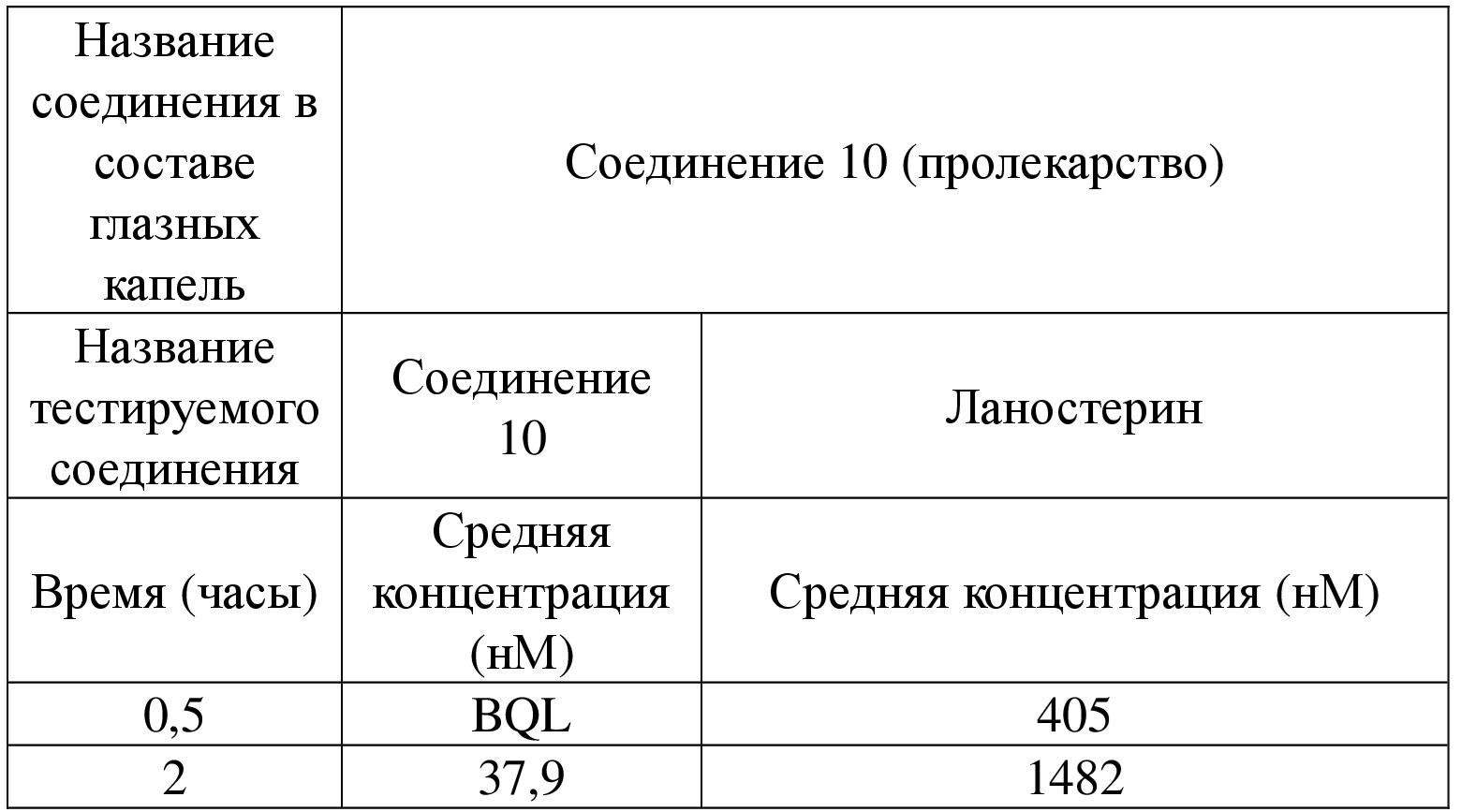
[94] Если не указано иное, абсолютная конфигурация стереогенного центра представлена клиновидной сплошной связью ( ) и клиновидной пунктирной связью (
) и клиновидной пунктирной связью (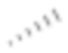 ), а относительная конфигурация стереогенного центра представлена прямой сплошной связью (
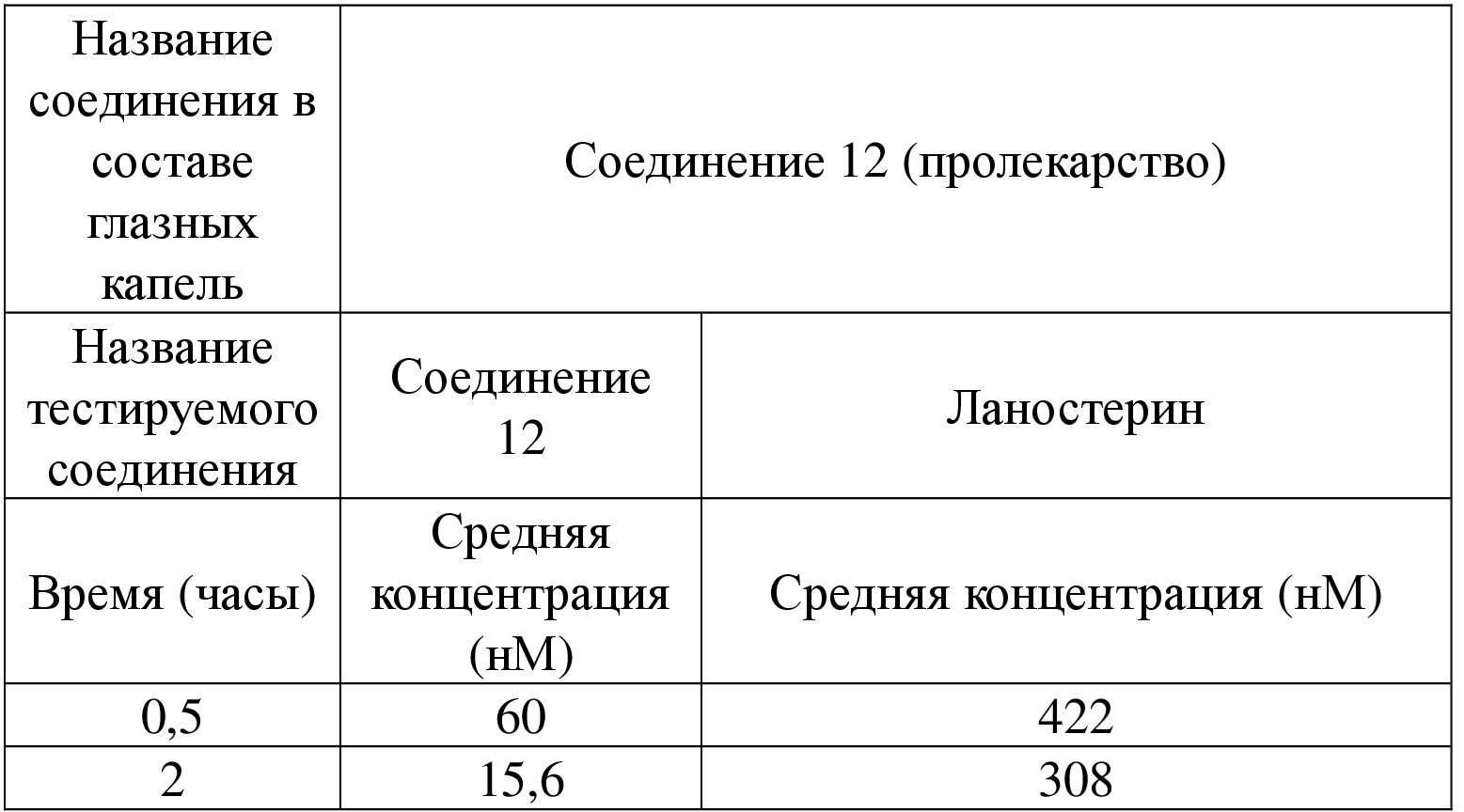
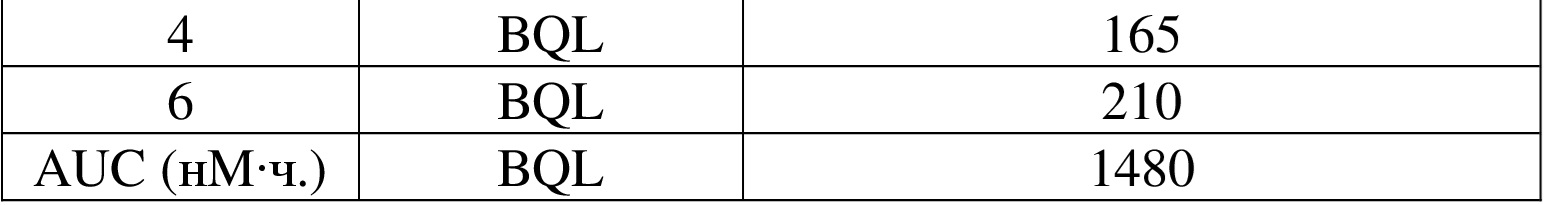
), а относительная конфигурация стереогенного центра представлена прямой сплошной связью ( ) и прямой пунктирной связью (
) и прямой пунктирной связью (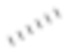 ), волнистая линия (
), волнистая линия ( ) представляет собой клиновидную сплошную связь (
) представляет собой клиновидную сплошную связь ( ) или клиновидную пунктирную связь (
) или клиновидную пунктирную связь ( ), или волнистая линия (
), или волнистая линия ( ) представляет собой прямую сплошную связь (
) представляет собой прямую сплошную связь ( ) и прямую пунктирную связь (
) и прямую пунктирную связь ( ).
).
[95] Соединения по настоящему изобретению могут находиться в конкретной форме. Если не указано иное, термины «таутомер» или «таутомерная форма» означают, что разные функциональные изомеры находятся в состоянии динамического равновесия при комнатной температуре и могут подвергаться быстрому превращению друг в друга. Если существует возможность образования таутомеров (как например в растворе), таутомеры могут достигать состояния химического равновесия. Например, протонные таутомеры (также известные как прототропные таутомеры) включают взаимопревращения посредством протонного переноса, такие как кето-енольная изомеризация и имино-енаминовая изомеризация. Валентный таутомер включает взаимопревращение некоторых связывающих электронов. Конкретным примером кето-енольной таутомеризации является взаимопревращение двух таутомеров пентан-2,4-диона и 4-гидроксипент-3-ен-2-она.
[96] Если не указано иное, термины «обогащенный одним изомером», «обогащенный изомером», «обогащенный одним энантиомером» или «энантиомерно обогащенный» относятся к содержанию одного из изомеров или энантиомеров, которое составляет менее 100%, и при этом содержание изомера или энантиомера составляет 60% или больше, или 70% или больше, или 80% или больше, или 90% или больше, или 95% или больше, или 96% или больше, или 97% или больше, или 98% или больше, или 99% или больше, или 99,5% или больше, или 99,6% или больше, или 99,7% или больше, или 99,8% или больше, или 99,9% или больше.
[97] Если не указано иное, термины «избыток изомера» или «избыток энантиомера» относятся к разнице между значениями относительного процентного содержания двух аксиально хиральных изомеров. Например, если содержание одного из изомеров или энантиомеров составляет 90%, а другого составляет 10%, то избыток изомера или энантиомера (ee-значение) составляет 80%.
[98] Оптически активные (R)- и (S)-изомеры или D- и L-изомеры могут быть получены с использованием хирального синтеза, или хиральных реагентов, или других традиционных методик. Если требуется получение одного типа энантиомера конкретного соединения по настоящему изобретению, чистый необходимый энантиомер может быть получен путем асимметрического синтеза или дериватизации с помощью хирального вспомогательного вещества с последующим разделением полученной диастереомерной смеси и отщеплением вспомогательной группы. В качестве альтернативы, если молекула содержит основную функциональную группу (такую как амино) или кислотную функциональную группу (такую как карбоксильная), соединение вступает в реакцию с подходящей оптически активной кислотой или основанием с образованием соли диастереомерного изомера, которую затем подвергают диастереомерному разделению посредством традиционных способов из уровня техники с получением чистого энантиомера. Кроме того, энантиомер и диастереоизомер обычно выделяют посредством хроматографии, которую проводят с использованием хиральной неподвижной фазы и необязательно объединяют с методом химической дериватизации (например, карбамат, образованный из амина). Соединение по настоящему изобретению может содержать неприродное соотношение атомных изотопов при одном или более атомах, которые составляют соединение. Например, соединение может быть мечено радиоактивным изотопом, таким как тритий (3H), йод-125 (125I) или C-14 (14C). В качестве другого примера, водород можно заменять на тяжелый водород с образованием дейтерированного лекарственного средства, и при этом связь между дейтерием и углеродом является более прочной, чем связь между обычным водородом и углеродом. По сравнению с недейтерированными лекарственными средствами дейтерированные лекарственные средства характеризуются менее выраженными побочными эффектами и более высокой стабильностью лекарственного средства с усилением эффективности и продлением биологического периода полувыведения лекарственного средства. Все изотопные варианты соединения по настоящему изобретению, вне зависимости от радиоактивности, включены в объем настоящего изобретения. Термин «фармацевтически приемлемый носитель» относится к любому средству или среде-носителю, которые способны доставлять эффективное количество активного вещества по настоящему изобретению, не оказывают отрицательного воздействия на биологическую активность активного вещества и не вызывают какого-либо токсичного побочного эффекта у хозяина или пациента. Иллюстративный носитель включает воду, растительное и минеральное масло, кремовую основу, лосьонную основу, мазевую основу и т. п. Основа включает суспендирующее средство, загуститель, вещество, способствующее проникновению, и т. п. Их составы хорошо известны специалисту в области косметических средств или в области фармацевтических препаратов для местного применения.
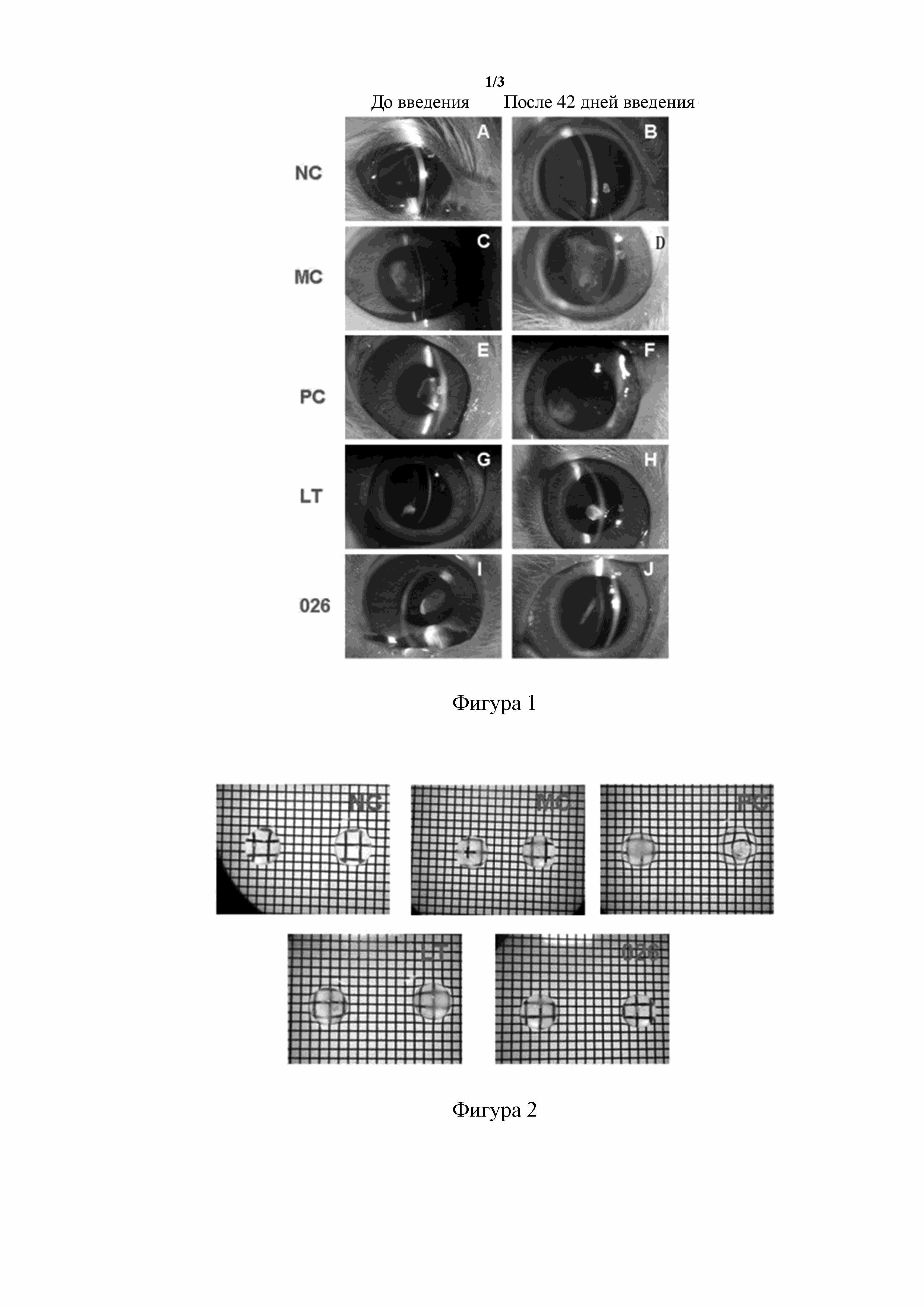
[99] «Необязательный» или «необязательно» означает, что последующее событие или условие может реализовываться, но не является необходимым, и что термин включает случаи, в которых событие или условие реализуется, и случаи, в которых событие или условие не реализуется.
[100] Термин «замещенный» означает, что один или более атомов водорода при конкретном атоме замещены заместителем, в том числе дейтерием и вариантами водорода, при условии, что валентность конкретного атома является нормальной и замещенное соединение является стабильным. Если заместитель представляет собой атом кислорода (т. е. =O), то это означает, что два атома водорода являются замещенными. Положения в ароматическом кольце не могут быть замещены атомом кислорода. Термин «необязательно замещенный» означает, что атом может быть замещенным или не быть замещенным заместителем, если не указано иное, причем тип и число заместителей могут быть произвольными при условии, что это химически достижимо.
[101] Если любая переменная (такая как R) встречается более одного раза в составе или структуре соединения, то определение переменной в каждом случае является независимым. Таким образом, например, если группа замещена 0-2 R, то данная группа необязательно может быть замещена не более чем двумя R, при этом определение R в каждом случае является независимым. Более того, комбинация заместителя и/или его варианта является допустимой, только если такая комбинация приводит к стабильному соединению.
[102] Если число линкерных групп равняется 0, как например -(CRR)0-, это означает, что линкерная группа представляет собой одинарную связь.
[103] Если одна из переменных выбрана из одинарной связи, это означает, что две группы, соединенные одинарной связью, соединены непосредственно. Например, если L в A-L-Z представляет собой одинарную связь, то структура A-L-Z фактически представляет собой A-Z.
[104] Если заместитель не указан, это означает, что заместитель отсутствует. Например, если X не указан в A-X, то структура A-X фактически представляет собой A. Если заместитель может быть присоединен к более чем одному атому в кольце, то такой заместитель может быть связан с любым атомом в кольце. Например, структурное звено 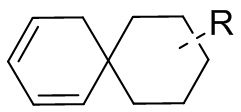 или
или 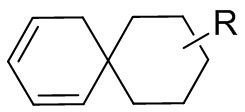 означает, что заместитель R может находиться в любом положении в циклогексиле или циклогексадиене. Если в перечисленном заместителе не указано посредством какого атома он связан с замещаемой группой, такой заместитель может быть связан посредством любого его атома. Например, если пиридил выполняет функцию заместителя, он может быть связан с замещаемой группой посредством любого атома углерода в пиридиновом кольце. Если в перечисленной линкерной группе не указано направление связывания, то направление связывания является произвольным, например линкерная группа L, содержащаяся в
означает, что заместитель R может находиться в любом положении в циклогексиле или циклогексадиене. Если в перечисленном заместителе не указано посредством какого атома он связан с замещаемой группой, такой заместитель может быть связан посредством любого его атома. Например, если пиридил выполняет функцию заместителя, он может быть связан с замещаемой группой посредством любого атома углерода в пиридиновом кольце. Если в перечисленной линкерной группе не указано направление связывания, то направление связывания является произвольным, например линкерная группа L, содержащаяся в 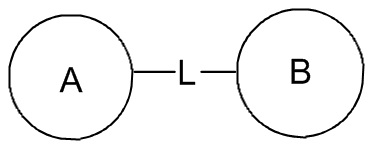 , представляет собой -MW-, причем -MW- может связывать кольцо A и кольцо B с образованием
, представляет собой -MW-, причем -MW- может связывать кольцо A и кольцо B с образованием 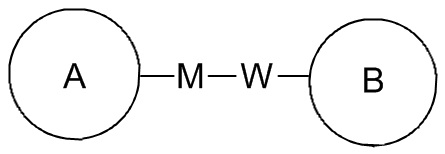 в таком направлении, как порядок чтения слева направо, и с образованием
в таком направлении, как порядок чтения слева направо, и с образованием 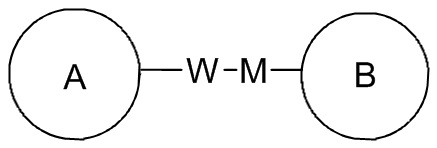 в направлении, противоположном порядку чтения слева направо. Комбинация линкерных групп, заместителей и/или их вариантов является допустимой, только если такая комбинация может приводить к стабильному соединению.
в направлении, противоположном порядку чтения слева направо. Комбинация линкерных групп, заместителей и/или их вариантов является допустимой, только если такая комбинация может приводить к стабильному соединению.
[105] Если не указано иное, термин «гетеро» представляет собой гетероатом или содержащую гетероатом группу (например, радикал, содержащий гетероатом), в том числе атом, отличный от углерода (C) и водорода (H), и радикал, содержащий вышеуказанный гетероатом, например, включая кислород (O), азот (N), серу (S), кремний (Si), германий (Ge), алюминий (Al), бор (B), -O-, -S-, =O, =S, -C(=O)O-, -C(=O)-, -C(=S)-, -S(=O), -S(=O)2- и группу, состоящую из -C(=O)N(H)-, -N(H)-, -C(=NH)-, -S(=O)2N(H)- и -S(=O)N(H)-, каждый из которых необязательно замещен.
[106] Если не указано иное, термин «кольцо» относится к замещенному или незамещенному циклоалкилу, гетероциклоалкилу, циклоалкенилу, гетероциклоалкенилу, циклоалкинилу, гетероциклоалкинилу, арилу или гетероарилу. Так называемое кольцо включает одно кольцо, систему колец, спирокольцо, конденсированное кольцо или кольцо с мостиковой связью. Число атомов в кольце обычно определено как число членов в кольце, например «5-7-членное кольцо» означает, что 5-7 атомов объединены в кольцо. Если не указано иное, кольцо необязательно содержит 1-3 гетероатома. Следовательно, «5-7-членное кольцо» включает, например, фенил, пиридинил и пиперидинил; с другой стороны, термин «5-7-членное гетероциклоалкильное кольцо» включает пиридил и пиперидинил, но не включает фенил. Термин «кольцо» также включает кольцевую систему, содержащую по меньшей мере одно кольцо, где каждое кольцо независимо соответствует вышеуказанному определению.
[107] Если не указано иное, термин «гетероцикл» или «гетероциклил» относится к стабильному моноциклическому, бициклическому или трициклическому кольцу, содержащему гетероатом или содержащую гетероатом группу, которое может быть насыщенным, частично ненасыщенным или ненасыщенным (ароматическим), и может содержать атомы углерода и 1, 2, 3 или 4 гетероатома в кольце, независимо выбранных из N, O и S, где любой из вышеуказанного гетероцикла может быть конденсирован с бензольным кольцом с образованием бициклического кольца. Гетероатомы, представляющие собой азот и серу, необязательно могут быть окислены (т. е. NO и S(O)p, причем p равняется 1 или 2). Атом азота может быть замещенным или незамещенным (т. е. N или NR, где R представляет собой H или другие заместители, уже определенные в данном документе). Гетероцикл может быть присоединен к боковой группе посредством любого гетероатома или атома углерода с образованием стабильной структуры. Если полученное соединение является устойчивым, гетероцикл, описанный в данном документе, может быть замещен в положениях, соответствующих атому углерода или азота. Атом азота в гетероцикле необязательно является кватернизированным. В предпочтительном варианте осуществления, если общее количество атомов S и O в гетероцикле превышает 1, то гетероатомы не являются смежными друг с другом. В другом предпочтительном варианте осуществления общее количество атомов S и O в гетероцикле не превышает 1. Как используется в данном документе, термин «ароматическая гетероциклическая группа» или «гетероарил» относится к стабильному 5-, 6-, 7-членному моноциклическому или бициклическому или 7-, 8-, 9- или 10-членному бициклическому гетероциклическому ароматическому кольцу, которое содержит атомы углерода и 1, 2, 3 или 4 гетероатома в кольце, независимо выбранных из N, O и S. Атом азота может быть замещенным или незамещенным (т. е. N или NR, где R представляет собой H или другие заместители, уже определенные в данном документе). Гетероатомы, представляющие собой азот и серу, необязательно могут быть окислены (т. е. NO и S(O)p, причем p равняется 1 или 2). Следует отметить, что общее количество атомов S и O в ароматическом гетероцикле не превышает одного. Кольцо с мостиковой связью также включено в определение гетероцикла. Кольцо с мостиковой связью образуется, если один или более атомов (т. е. C, O, N или S) соединяют два несмежных атома углерода или азота. Предпочтительное кольцо с мостиковой связью включает без ограничения один атом углерода, два атома углерода, один атом азота, два атома азота и одну группу углерод-азот. Следует отметить, что мостиковая связь всегда превращает моноциклическое кольцо в трициклическое кольцо. В кольце с мостиковой связью заместитель в кольце также может присутствовать при мостиковой связи.
[4] Примеры гетероциклического соединения включают без ограничения акридинил, азоцинил, бензимидазолил, бензофуранил, бензотиофуранил, бензотиофенил, бензоксазолил, бензоксазолинил, бензтиазолил, бензтриазолил, бензтетразолил, бензизоксазолил, бензизотиазолил, бензимидазолинил, карбазолил, 4aH-карбазолил, карболинил, дигидробензофуран, хроменил, циннолинил, декагидрохинолинил, 2H,6H-1,5-2-дитиазинил, дигидрофуро[2,3-b]тетрагидрофуран, фуранил, фуразанил, имидазолидинил, имидазолинил, имидазолил, 1H-индазолил, индоленил, индолинил, индолизинил, индолил, 3H-индолил, изобензофуранил, изоиндолинил, изоиндолил, изохинолинил, изотиазолил, изоксазолил, метилендиоксифенил, морфолинил, нафтиридинил, октагидроизохинолинил, оксадиазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, оксазолидинил, оксазолил, гидроксииндолил, пиримидинил, фенантридинил, фенантролинил, феназинил, фенотиазинил, бензодиазепинил, фенолоксазинил, фталазинил, пиперазинил, пиперидинил, пиперидонил, 4-пиперидонил, пиперонил, птеридинил, пуринил, пиранил, пиразинил, пиразолидинил, пиродазинил, пиразолил, пиридазинил, пиридооксазол, пиридоимидазол, пиридотиазол, пиридинил, пирролидинил, пирролинил, 2H-пирролил, пирролил, хиназолинил, хинолинил, 4H-хинолизинил, хиноксалинил, хинуклидинил, тетрагидрофуранил, тетрагидроизохинолинил, тетрагидрохинолинил, тетразолил, 6H-1,2,5-тиадиазинил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, тиантренил, тиазолил, изотиазолил, тиофенил, тиенооксазолил, тиенотиазолил, тиеноимидазол, тиенил, триазинил, 1H-1,2,3-триазолил, 2H-1,2,3-триазолил, 1H-1,2,4-триазолил, 4H-1,2,4-триазолил и ксантенил. Также включены конденсированные кольцевые и спиросоединения.
[108] Если не указано иное, термин «гидрокарбил» или его гипонимы (например, алкил, алкенил, алкинил и арил и т. д.), сами по себе или в качестве части другого заместителя, относятся к линейной, разветвленной цепи, или циклической углеводородной группе, или любой их комбинации. Они могут быть полностью насыщенными (например, алкил), моно- или полиненасыщенными (например, алкенил, алкинил и арил), могут быть моно-, ди- или полизамещенными, могут быть одновалентными (например, метил), двухвалентными (например, метилен) или многовалентными (например, метенил), могут также включать двухвалентную или многовалентную группу, имеют конкретное число атомов углерода (например, C1-C12 означает 1-12 атомов углерода, причем C1-12 выбран из группы, состоящей из C1, C2, C3, C4, C5, C6, C7, C8, C9, C10, C11 и C12; C3-12 выбран из группы, состоящей из C3, C4, C5, C6, C7, C8, C9, C10, C11 и C12). Термин «гидрокарбил» включает без ограничения алифатический гидрокарбил и ароматический гидрокарбил. Алифатический гидрокарбил включает линейный и циклический гидрокарбил, в частности, включает без ограничения алкил, алкенил и алкинил. Ароматический гидрокарбил включает без ограничения 6-12-членный ароматический гидрокарбил, такой как фенил, нафтил и т. п. В некоторых вариантах осуществления термин «гидрокарбил» относится к линейной или разветвленной атомной группе или их комбинации, которая может быть полностью насыщенной, моно- или полиненасыщенной и может включать двухвалентную или многовалентную группу. Примеры насыщенной гидрокарбильной группы включают без ограничения метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил, втор-бутил, изобутил, циклогексил, (циклогексил)метил, циклопропилметил и гомологи или изомеры н-амила, н-гексила, н-гептила, н-октила и других атомных групп. Ненасыщенный гидрокарбил содержит одну или более двойных или тройных связей. Примеры ненасыщенного алкила включают без ограничения винил, 2-пропенил, бутенил, кротил, 2-изопентенил, 2-(бутадиенил), 2,4-пентадиенил, 3-(1,4-пентадиенил), этинил, 1- и 3-пропинил, 3-бутинил и более высшие гомологи и изомеры.
[109] Если не указано иное, термин «гетерогидрокарбил» или его гипонимы (такие как гетероалкил, гетероалкенил, гетероалкинил и гетероарил и т. д.), сами по себе или в комбинации с другим термином, относятся к устойчивой линейной, разветвленной или циклической углеводородной группе или любой их комбинации, которая содержит конкретное число атомов углерода и по меньшей мере один гетероатом. В некоторых вариантах осуществления термин «гетероалкил», сам по себе или в комбинации с другим термином, относится к стабильной линейной цепи, разветвленной углеводородной группе или их комбинации, которая содержит конкретное число атомов углерода и по меньшей мере один гетероатом. В конкретном варианте осуществления гетероатом выбран из B, O, N и S, где атомы азота и серы необязательно окислены, и атом азота необязательно кватернизирован. Гетероатом или содержащая гетероатом группа могут находиться в любом внутреннем положении гетерогидрокарбила, включая положение, в котором гидрокарбил присоединяется к остальной части молекулы. Однако термины «алкокси», «алкиламино» и «алкилтио» (или тиоалкокси) применяются в их обычном значении и относятся к алкильной группе, соединенной с остальной частью молекулы посредством атома кислорода, аминогруппы или атома серы соответственно. Примеры включают без ограничения -CH2-CH2-O-CH3, -CH2-CH2-NH-CH3, -CH2-CH2-N(CH3)-CH3, -CH2-S-CH2-CH3, -CH2-CH2, -S(O)-CH3, -CH2-CH2-S(O)2-CH3, -CH=CH-O-CH3, -CH2-CH=N-OCH3 и –CH=CH-N(CH3)-CH3. Могут присутствовать не более двух смежных гетероатомов, как например -CH2-NH-OCH3.
[110] Если не указано иное, термины «циклогидрокарбил», «гетероциклогидрокарбил» или их гипонимы (такие как арил, гетероарил, циклоалкил, гетероциклоалкил, циклоалкенил, гетероциклоалкенил, циклоалкинил, гетероциклоалкинил и т. д.), применяемые сами по себе или в комбинации с другим термином, относятся к циклизированному «гидрокарбилу» или «гетерогидрокарбилу». Кроме того, в случае гетерогидрокарбила или гетероциклогидрокарбила (таких как гетероалкил и гетероциклоалкил) один гетероатом может занимать положение, в котором гетероцикл присоединяется к остальной части молекулы. Примеры циклоалкила включают без ограничения циклопентил, циклогексил, 1-циклогексенил, 3-циклогексенил, циклогептил и т. п. Неограничивающие примеры гетероциклоалкила включают 1-(1,2,5,6-тетрагидропиридил), 1-пиперидинил, 2-пиперидинил, 3-пиперидинил, 4-морфолинил, 3-морфолинил, тетрагидрофуран-2-ил, тетрагидрофуран-3-ил, тетрагидротиофен-2-ил, тетрагидротиофен-3-ил, 1-пиперазинил и 2-пиперазинил.
[111] Если не указано иное, термин «алкил» относится к линейной цепи или разветвленной насыщенной углеводородной группе, которая может быть монозамещенной (например -CH2F) или полизамещенной (например -CF3), может быть одновалентной (например метил), двухвалентной (например метилен) или многовалентной (например метенил). Примеры алкила включают метил (Me), этил (Et), пропил (такой как н-пропил и изопропил), бутил (такой как н-бутил, изобутил, втор-бутил, трет-бутил), пентил (такой как н-пентил, изопентил, неопентил) и т. п.
[112] Если не указано иное, термин «алкенил» относится к алкильной группе, содержащей одну или более углерод-углеродных двойных связей в любом положении в цепи, которая может быть монозамещенной или полизамещенной и может быть одновалентной, двухвалентной или многовалентной. Примеры алкенила включают этенил, пропенил, бутенил, пентенил, гексенил, бутадиенил, пентадиенил, гексадиенил и т. п.
[113] Если не указано иное, термин «алкинил» относится к алкильной группе, содержащей одну или более углерод-углеродных тройных связей в любом положении в цепи, которая может быть монозамещенной или полизамещенной и может быть одновалентной, двухвалентной или многовалентной. Примеры алкинила включают этинил, пропинил, бутинил, пентинил и т. п.
[114] Если не указано иное, циклоалкил включает любой устойчивый циклический или полициклический гидрокарбил, и при этом любой атом углерода является насыщенным, который может быть монозамещенным или полизамещенным и может быть одновалентным, двухвалентным или многовалентным. Примеры циклоалкила включают без ограничения циклопропил, норборнанил, [2.2.2]бициклооктан, [4.4.0]бициклодеканил и т. п.
[115] Если не указано иное, циклоалкенил включает любой устойчивый циклический или полициклический гидрокарбил, содержащий одну или более ненасыщенных углерод-углеродных двойных связей в любом положении в кольце, который может быть монозамещенным или полизамещенным и может быть одновалентным, двухвалентным или многовалентным. Примеры циклоалкенила включают без ограничения циклопентенил, циклогексенил и т. п.
[116] Если не указано иное, циклоалкинил включает любой устойчивый циклический или полициклический гидрокарбил, имеющий одну или более углерод-углеродных тройных связей в любом положении в кольце, который может быть монозамещенным или полизамещенным и может быть одновалентным, двухвалентным или многовалентным.
[117] Если не указано иное, «циклоалкенилалкил» или «циклоалкенилалкильная группа» относятся к алкилу, замещенному циклоалкенилом.
[118] Если не указано иное, «циклоалкинилалкил» или «циклоалкинилалкильная группа» относятся к алкилу, замещенному циклоалкинилом.
[119] Если не указано иное, термин «галогено» или «галоген», сам по себе или как часть другого заместителя, обозначает атом фтора, хлора, брома или йода. Кроме того, подразумевается, что термин «галогеналкил» включает моногалогеналкил и полигалогеналкил. Например, подразумевается, что термин «галоген(C1-C4)алкил» включает без ограничения трифторметил, 2,2,2-трифторэтил, 4-хлорбутил, 3-бромпропил и т. п. Если не указано иное, примеры галогеналкила включают без ограничения трифторметил, трихлорметил, пентафторэтил и пентахлорэтил.
[120] Термин «алкокси» представляет собой любой алкил, определенный выше, характеризующийся конкретным числом атомов углерода, присоединенный с помощью кислородного мостика. Если не указано иное, C1-6алкокси включает C1, C2, C3, C4, C5 и C6алкокси. Примеры алкокси включают без ограничения метокси, этокси, н-пропокси, изопропокси, н-бутокси, втор-бутокси, трет-бутокси, н-пентилокси и S-пентокси.
[121] Если не указано иное, термин «арил» относится к полиненасыщенному ароматическому заместителю, который может быть моно-, ди- или полизамещенным, может быть одновалентным, двухвалентным или многовалентным, может представлять собой одно кольцо или несколько колец (например, от одного до трех колец; где по меньшей мере одно кольцо является ароматическим), которые совместно конденсированы или соединены ковалентно. Термин «гетероарил» относится к арилу (или кольцу), содержащему от одного до четырех гетероатомов. В иллюстративном примере гетероатом выбран из B, O, N и S, где атомы азота и серы необязательно окислены, и атом азота необязательно кватернизирован. Гетероарил может присоединяться к остальной части молекулы посредством гетероатома. Неограничивающие примеры арила или гетероарила включают фенил, нафтил, бифенил, пирролил, пиразолил, имидазолил, пиразинил, оксазолил, фенилоксазолил, изоксазолил, тиазолил, фуранил, тиенил, пиридил, пиримидинил, бензотиазолил, пуринил, бензимидазолил, индолил, изохинолил, хиноксалинил, хинолил, 1-нафтил, 2-нафтил, 4-бифенил, 1-пирролил, 2-пирролил, 3-пирролил, 3-пиразолил, 2-имидазолил, 4-имидазолил, пиразинил, 2-оксазолил, 4-оксазолил, 2-фенил-4-оксазолил, 5-оксазолил, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 2-фурил, 3-фурил, 2-тиенил, 3-тиенил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидил, 4-пиримидил, 5-бензотиазолил, пуринил, 2-бензимидазолил, 5-индолил, 1-изохинолил, 5-изохинолил, 2-хиноксалинил, 5-хиноксалинил, 3-хинолил и 6-хинолил. Заместители любой описанной выше арильной и гетероарильной кольцевой системы выбраны из приемлемых заместителей, описанных ниже.
[122] Если не указано иное, в случае объединения с другими терминами (как например арилокси, арилтио, арилалкил), арил включает арильное и гетероарильное кольцо, как определено выше. Таким образом, подразумевается, что термин «арилалкил» включает группы (например, бензил, фенэтил, пиридилметил и т. д.), где арил присоединен к алкилу, в том числе алкилу, где атом углерода (например, метилен) был заменен на такой атом, как кислород, например, феноксиметил, 2-пиридилоксиметил-3-(1-нафтилокси)пропил и т. п.
[123] Термин «уходящая группа» относится к функциональной группе или атому, которые могут быть заменены на другую функциональную группу или атом посредством реакции замещения (такой как реакция замещения по аффинности). Например, иллюстративные уходящие группы включают трифлат; хлор, бром и йод; сульфонатную группу, как например мезилат, тозилат, п-бромбензолсульфонат, п-толуолсульфонаты и т. п.; ацилокси, как например ацетокси, трифторацетокси и т. п.
[124] Термин «защитная группа» включает без ограничения «защитную группу для аминогруппы», «защитную группу для гидроксигруппы» или «защитную группу для меркаптогруппы». Термин «защитная группа для аминогруппы» относится к защитной группе, подходящей для блокирования побочных реакций с участием азота аминогруппы. Иллюстративные защитные группы для аминогруппы включают без ограничения формил; ацил, как например алканоил (например ацетил, трихлорацетил или трифторацетил); алкоксикарбонил, как например трет-бутоксикарбонил (Boc); арилметоксикарбонил, как например бензилоксикарбонил (Cbz) и 9-флуоренилметоксикарбонил (Fmoc); арилметил, как например бензил (Bn), тритил (Tr), 1,1-бис-(4'-метоксифенил)метил; силил, как например триметилсилил (TMS) и трет-бутилдиметилсилил (TBS), и т. п. Термин «защитная группа для гидроксигруппы» относится к защитной группе, подходящей для блокирования побочных реакций с участием гидроксигруппы. Иллюстративные защитные группы для гидроксигруппы включают без ограничения алкил, такой как метил, этил и трет-бутил; ацил, такой как алканоил (например, ацетил); арилметил, такой как бензил (Bn), п-метоксибензил (PMB), 9-флуоренилметил (Fm) и дифенилметил (бензгидрил, DPM); силил, такой как триметилсилил (TMS) и трет-бутилдиметилсилил (TBS), и т. п.
[125] Соединение по настоящему изобретению можно получать посредством различных способов синтеза, хорошо известных специалистам в данной области техники, в том числе следующий перечисленный вариант осуществления, вариант осуществления, образованный следующим перечисленным вариантом осуществления в комбинации с другими способами химического синтеза и эквивалентными заменами, хорошо известными специалистам в данной области техники. Предпочтительный вариант осуществления включает без ограничения вариант осуществления настоящего изобретения.
[126] Все растворители, используемые в настоящем изобретении, являются коммерчески доступными. В настоящем изобретении используются следующие сокращения: водн. означает водный; HATU означает O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат; EDC означает N-(3-диметиламинопропил)-N’-этилкарбодиимида гидрохлорид; m-CPBA означает 3-хлорпероксибензойную кислоту; экв. означает эквивалент или равный; CDI означает карбонилдиимидазол; DCM означает дихлорметан; PE означает петролейный эфир; DIAD означает диизопропилазодиформиат; DMF означает N,N-диметилформамид; DMSO означает диметилсульфоксид; EtOAc означает этилацетат; EtOH означает этанол; MeOH означает метанол; CBz означает бензилоксикарбонил, который является защитной группой для аминогруппы; BOC означает трет-бутилкарбонил, который является защитной группой для аминогруппы; HOAc означает уксусную кислоту; NaCNBH3 означает натрия цианоборгидрид; к. т. означает комнатную температуру; O/N означает в течение ночи; THF означает тетрагидрофуран; Boc2O означает ди-трет-бутилдикарбонат; TFA означает трифторуксусную кислоту; DIPEA означает этилдиизопропиламин; SOCl2 означает тионилхлорид; CS2 означает сероуглерод; TsOH означает п-толуолсульфоновую кислоту; NFSI означает N-фторбензолсульфонимид; NCS означает 1-хлорпирролидин-2,5-дион; n-Bu4NF означает тетрабутиламмония фторид; iPrOH означает 2-пропанол; т. пл. означает температуру плавления; LDA означает лития диизопропиламид; пролекарство 026 ланостерина означает соединение 8 по настоящему изобретению, т. е. вариант осуществления 8.
[127] Соединения названы вручную или с помощью программного обеспечения ChemDraw®, а для коммерчески доступных соединений используются названия в соответствии с каталогом их поставщика.
[128] Краткое описание графических материалов
[129] На фигуре 1 показан эффект глазных капель, содержащих ланостерин и его пролекарство 026, в отношении модели индуцированной селенитом натрия катаракты у неонатального новозеландского кролика, наблюдаемый с помощью щелевой лампы. NC: нормальная контрольная группа; MC: модельная контрольная группа; PC: группа положительного контроля; LT: группа с обработкой глазными каплями, содержащими ланостерин; 026: группа с обработкой глазными каплями, содержащими пролекарство 026 ланостерина.
[130] На фигуре 2 показано сравнение прозрачности хрусталика модели индуцированной селенитом натрия катаракты у неонатального новозеландского кролика в каждой группе in vitro после 42 дней введения. NC: нормальная контрольная группа; MC: модельная контрольная группа; PC: группа положительного контроля; LT: группа с обработкой глазными каплями, содержащими ланостерин; 026: группа с обработкой глазными каплями, содержащими пролекарство 026 ланостерина. Размерность сетки составляет 2,12×2,12 мм.
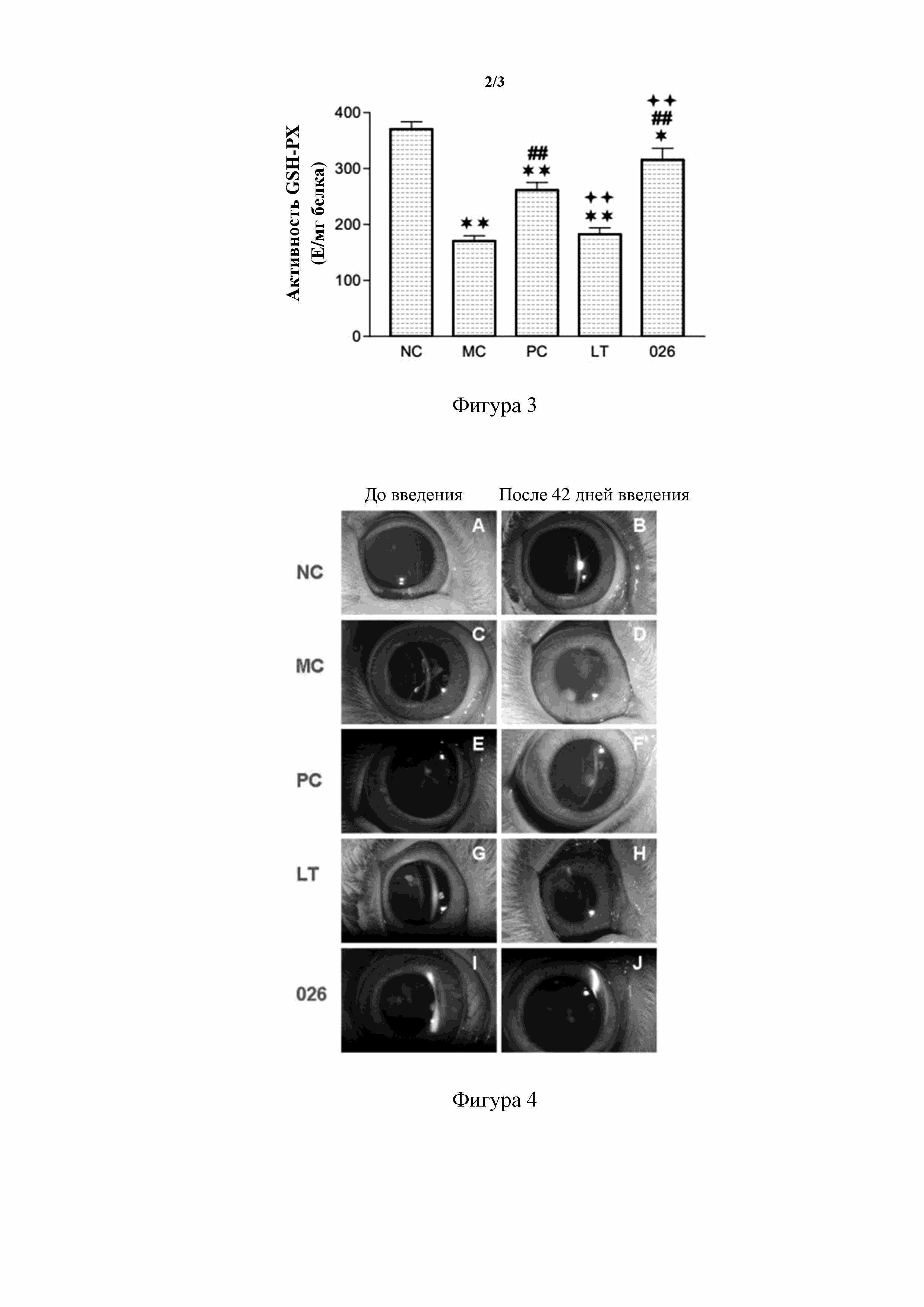
[131] На фигуре 3 показано сравнение активности глутатионпероксидазы (GSH-PX) хрусталика модели индуцированной селенитом натрия катаракты у неонатального новозеландского кролика после 42 дней введения. NC: нормальная контрольная группа; MC: модельная контрольная группа; PC: группа положительного контроля; LT: группа с обработкой глазными каплями, содержащими ланостерин; 026: группа с обработкой глазными каплями, содержащими пролекарство 026 ланостерина. По сравнению с NC: * * обозначает p < 0,01, * обозначает p < 0,05; по сравнению с MC: ## обозначает p < 0,01, # обозначает p < 0,05; по сравнению с PC: ++ обозначает p < 0,01, + обозначает p < 0,05.
[132] На фигуре 4 показан эффект глазных капель, содержащих ланостерин и его пролекарство 026, в отношении модели индуцированной ультрафиолетовым излучением катаракты у новозеландского кролика, наблюдаемый с помощью щелевой лампы. NC: нормальная контрольная группа; MC: модельная контрольная группа; PC: группа положительного контроля; LT: группа с обработкой глазными каплями, содержащими ланостерин; 026: группа с обработкой глазными каплями, содержащими пролекарство 026 ланостерина.
[133] На фигуре 5 показано сравнение прозрачности хрусталика модели индуцированной ультрафиолетовым излучением катаракты у новозеландского кролика в каждой группе in vitro после 42 дней введения. NC: нормальная контрольная группа; MC: модельная контрольная группа; PC: группа положительного контроля; LT: группа с обработкой глазными каплями, содержащими ланостерин; 026: группа с обработкой глазными каплями, содержащими пролекарство 026 ланостерина. Размерность сетки составляет 2,12×2,12 мм.
[134] На фигуре 6 показано сравнение активности глутатионпероксидазы (GSH-PX) хрусталика модели индуцированной ультрафиолетовым излучением катаракты у неонатального новозеландского кролика в каждой группе после 42 дней введения. NC: нормальная контрольная группа; MC: модельная контрольная группа; PC: группа положительного контроля; LT: группа с обработкой глазными каплями, содержащими ланостерин; 026: группа с обработкой глазными каплями, содержащими пролекарство 026 ланостерина. По сравнению с NC: ** обозначает p < 0,01, * обозначает p < 0,05; по сравнению с MC: ## обозначает p < 0,01, # обозначает p < 0,05; по сравнению с PC: ++ обозначает p<0,01, + обозначает p < 0,05.
[135] Подробное описание предпочтительного варианта осуществления
[136] Настоящее изобретение будет конкретно описано ниже с помощью вариантов осуществления, но объем настоящего изобретения не ограничивается ими. Хотя настоящее изобретение было описано подробно и со ссылкой на его конкретные варианты осуществления, специалисту в данной области техники будет понятно, что можно осуществлять различные изменения и модификации в отношении настоящего изобретения без отступления от его сущности и объема.
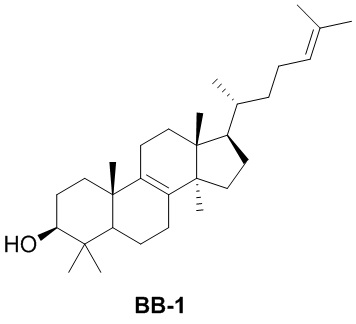
[137] Иллюстративный вариант осуществления 1. Фрагмент BB-1
[138] Путь синтеза:
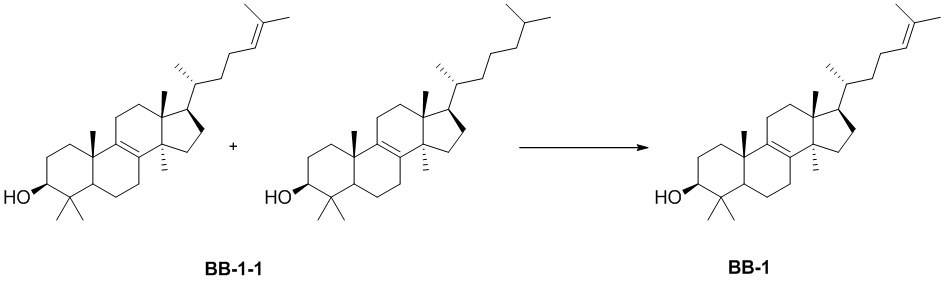
[139] Стадия 1. Синтез соединения BB-1
[140] Смесь BB-1-1 разделяли с помощью сверхкритической жидкостной хроматографии (условия разделения: колонка: Chiralpak AD-3 150 × 4,6 мм, внутренний диаметр 3 мкм; подвижная фаза: A: CO2 B: этанол (0,05% диэтаноламин); градиент: B составляет от 5% до 40% в течение 5 минут, затем B составляет 40% в течение 2,5 минут, и затем B составляет 5% в течение 2,5 минут; скорость потока: 25 мл/мин.; температура колонки: 35°C; длина волны: 220 нм) с получением соединения BB-1. 1H ЯМР 1H ЯМР (хлороформ-d, 400 МГц): δ = 5,06-5,15 (m, 1H), 5,10 (br t, J=7,2 Гц, 1H), 3,20-3,22 (m, 1H), 3,24 (dd, J=11,5, 4,5 Гц, 1H), 1,64-2,09 (m, 15H), 0,77-1,57 (m, 29H), 0,65-0,72 ppm (m, 3H).
[141] Вариант осуществления 1
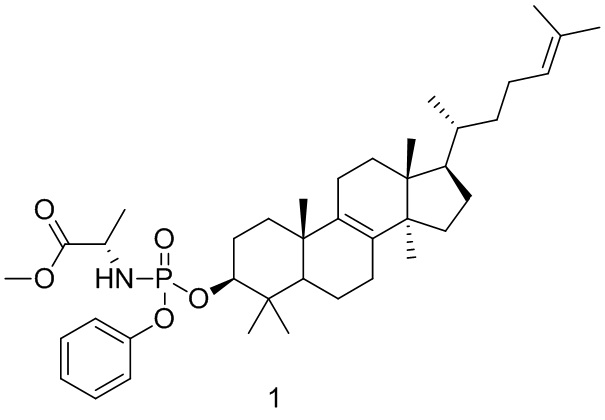
[142] Путь синтеза:
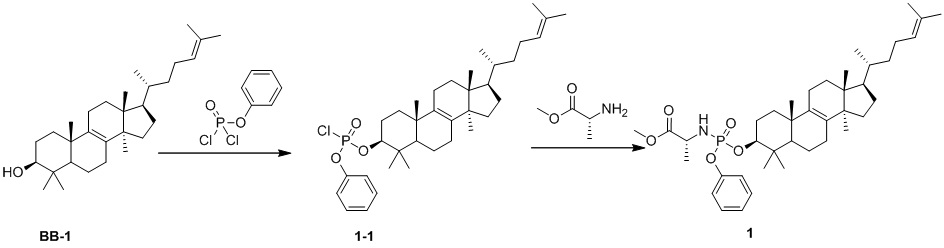
[143] Стадия 1. Синтез соединения 1-1
[144] Соединение BB-1 (1,00 г, 2,34 ммоль) растворяли в дихлорметане (10 мл), и смесь охлаждали до 0oC с последующим добавлением фенилдихлорфосфата (1,48 г, 7,02 ммоль) и 4-диметиламинопиридина (1,72 г, 14,04 ммоль). Смесь нагревали до комнатной температуры в атмосфере N2 и перемешивали в течение ночи. После завершения реакции реакционную смесь гасили с помощью ледяной воды, органическую фазу отделяли и выпаривали до сухого состояния при пониженном давлении и остаток очищали с помощью колоночной хроматографии, элюировали с помощью EA/PE (0-5%) с получением целевого соединения 1-1. 1H ЯМР (400 МГц, хлороформ-d) δ = 7,46-7,31 (m, 2H), 7,29-7,27 (m, 1H), 7,27-7,19 (m, 2H), 5,10 (br t, J=7,0 Гц, 1H), 4,52-4,20 (m, 1H), 2,15-1,96 (m, 6H), 1,92-1,66 (m, 9H), 1,56-1,46 (m, 2H), 1,43 (s, 2H), 1,38-1,11 (m, 7H), 1,08-0,99 (m, 7H), 0,93-0,85 (m, 11H), 0,68 (s, 3H).
[145] Стадия 2. Синтез соединения 1
[146] Соединение 1-1 (500 мг, 0,8316 ммоль) растворяли в дихлорметане (10 мл) и смесь охлаждали до 0oC с последующим добавлением гидрохлорида сложного метилового эфира L-аланина (348,23 мг, 2,49 ммоль) и 4-диметиламинопиридина (609,59 мг, 4,99 ммоль). Смесь нагревали до комнатной температуры и перемешивали в течение ночи. После завершения реакции смесь концентрировали с удалением растворителя и остаток очищали с помощью колоночной хроматографии, элюировали с помощью EA/PE (0-5%) с получением целевого соединения 1. 1H ЯМР (400 MГц, DMSO-d6) δ: 2,89-2,88 (m, 2H), 2,64-2,63 (m, 2H), 2,06-2,03 (m, 1H), 1,73-1,62 (m, 4H), 1,07-1,02 (m, 2H), 0,66-0,63 (m, 2H) 1H ЯМР (400 МГц, хлороформ-d) δ = 7,33-7,27 (m, 2H), 7,24-7,18 (m, 2H), 7,17-7,08 (m, 1H), 5,09 (br s, 1H), 4,19-3,93 (m, 2H), 3,77-3,64 (m, 3H), 3,52-3,36 (m, 1H), 2,02 (br d, J=9,5 Гц, 6H), 1,92-1,75 (m, 3H), 1,68 (s, 4H), 1,60 (s, 3H), 1,38 (br d, J=7,0 Гц, 4H), 1,42-1,35 (m, 1H), 1,33-1,08 (m, 7H), 0,99 (t, J=5,8 Гц, 4H), 1,03 (br s, 1H), 0,93-0,79 (m, 14H), 0,67 (s, 3H).
[147] Вариант осуществления 2
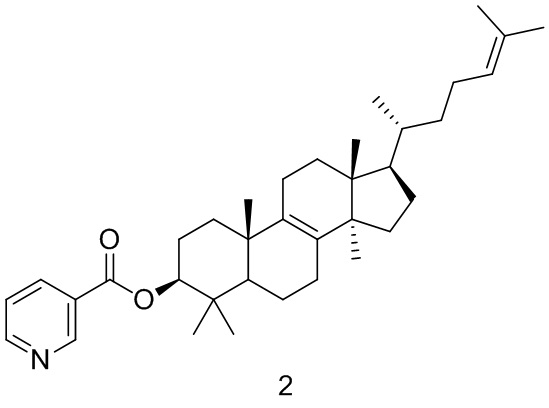
[148] Путь синтеза:
[149] Стадия 1. Синтез соединения 2
[150] Соединение BB-1 (500 мг, 1,17 ммоль) растворяли в дихлорметане (10,00 мл) с последующим добавлением пиридин-3-карбоновой кислоты (288,08 мг, 2,34 ммоль), дициклогексилкарбодиимида (555,23 мг, 2,69 ммоль) и 4-диметиламинопиридина (328,76 мг, 2,3 ммоль) при перемешивании при комнатной температуре. Смесь перемешивали в течение ночи при комнатной температуре. После завершения реакции смесь концентрировали с удалением растворителя при пониженном давлении и остаток очищали с помощью колоночной хроматографии, элюировали с помощью EA/PE (0-5%) с получением целевого соединения 2. 1H ЯМР (400 МГц, хлороформ-d) δ = 9,24 (d, J=1,3 Гц, 1H), 8,77 (dd, J=1,8, 4,8 Гц, 1H), 8,30 (td, J=1,9, 8,0 Гц, 1H), 7,48-7,32 (m, 1H), 5,10 (br t, J=7,0 Гц, 1H), 4,85-4,73 (m, 1H), 2,10-1,67 (m, 17H), 1,56-1,16 (m, 10H), 1,05 (d, J=5,0 Гц, 7H), 0,98-0,86 (m, 10H), 0,70 (s, 3H).
[151] Вариант осуществления 3
[152] Путь синтеза:
[153] Стадия 1. Синтез соединения 3-1
[154] Соединение 3-1 получали в соответствии со стадией 1 в варианте осуществления 2. 1H ЯМР (400 МГц, хлороформ-d) δ = 5,10 (br t, J=7,0 Гц, 1H), 5,00 (br s, 1H), 4,67-4,49 (m, 1H), 3,90 (br d, J=5,3 Гц, 2H), 2,04-1,61 (m, 15H), 1,58-1,29 (m, 18H), 1,20-0,80 (m, 20H), 0,74-0,63 (m, 3H).
[155] Стадия 2. Синтез соединения 3
[156] Соединение 3-1 (200,00 мг, 0,3425 ммоль) растворяли в дихлорметане (5,00 мл), и смесь охлаждали до 0oC с последующим медленным добавлением раствора хлороводорода в этилацетате (0,5 М, 10,00 мл). Смесь медленно нагревали до комнатной температуры и перемешивали в течение ночи. После завершения реакции смесь выпаривали до сухого состояния при пониженном давлении и целевое соединение 3 получали с использованием хлористоводородной кислоты и отделяли. 1H ЯМР (метанол-d4, 400 МГц): δ = 5,07-5,15 (m, 1H), 4,64-4,72 (m, 1H), 3,81-3,93 (m, 2H), 1,17-2,17 (m, 30H), 0,88-1,13 (m, 14H), 0,71-0,81 ppm (m, 3H).
[157] Вариант осуществления 4
[158] Путь синтеза:
[159] Стадия 1. Синтез соединения 4
[160] Соединение BB-1 (200,00 мг, 0,4687 ммоль) растворяли в дихлорметане (10,00 мл) с последующим добавлением 4-диметиламинопиридина (68,71 мг, 0,5624 ммоль), п-нитробензойной кислоты (93,99 мг, 0,5624 ммоль) и 1-этил-(3-диметиламинопропил)карбодиимида гидрохлорида (107,82 мг, 0,5624 ммоль) при комнатной температуре. Смесь перемешивали при комнатной температуре в течение ночи. После завершения реакции смесь концентрировали с удалением растворителя при пониженном давлении и остаток очищали с помощью колоночной хроматографии, элюировали с помощью EA/PE (0-5%) с получением целевого соединения 4. 1H ЯМР (хлороформ-d, 400 МГц): δ = 8,20-8,25 (m, 2H), 8,11-8,16 (m, 2H), 5,04 (br t, J=7,0 Гц, 1H), 4,69-4,76 (m, 1H), 1,08-2,05 (m, 29H), 0,99 (d, J=4,0 Гц, 6H), 0,89 (s, 3H), 0,85 (d, J=6,5 Гц, 3H), 0,83 (s, 3H), 0,64 ppm (s, 3H).
[161] Вариант осуществления 5
[162] Путь синтеза:
[163] Стадия 1. Синтез соединения 5
[164] Соединение 5 получали в соответствии со стадией 1 в варианте осуществления 2. 1H ЯМР (хлороформ-d, 400 МГц): δ = 9,41 (d, J=1,5 Гц, 1H), 8,76 (d, J=2,0 Гц, 1H), 8,10 (d, J=8,5 Гц, 1H), 7,88 (d, J=8,0 Гц, 1H), 7,77 (td, J=7,7, 1,3 Гц, 1H), 7,52-7,60 (m, 1H), 5,04 (br t, J=7,0 Гц, 1H), 4,79 (dd, J=11,3, 4,8 Гц, 1H), 1,94-2,07 (m, 5H), 1,71-1,91 (m, 6H), 1,60-1,68 (m, 6H), 1,49-1,57 (m, 5H), 1,12-1,39 (m, 7H), 1,02 (d, J=8,5 Гц, 6H), 0,93 (s, 3H), 0,80-0,87 (m, 6H), 0,64 ppm (s, 3H).
[165] Вариант осуществления 6
[166] Путь синтеза:
[167] Стадия 1. Синтез соединения 6-1
[168] Соединение 6-1 получали в соответствии со стадией 1 в варианте осуществления 2. 1H ЯМР (хлороформ-d, 400 МГц): δ = 7,19-7,25 (m, 2H), 7,14-7,18 (m, 1H), 7,08-7,13 (m, 2H), 5,03 (br t, J=7,0 Гц, 1H), 4,83 (br d, J=8,5 Гц, 1H), 4,39-4,63 (m, 2H), 2,90-3,13 (m, 2H), 1,73-2,01 (m, 8H), 1,39-1,69 (m, 16H), 1,32 (s, 9H), 1,21-1,27 (m, 2H), 0,95-1,14 (m, 3H), 0,92 (s, 3H), 0,84 (d, J=6,0 Гц, 3H), 0,80 (s, 3H), 0,75 (d, J=7,0 Гц, 6H), 0,61 ppm (s, 3H).
[169] Стадия 2. Синтез соединения 6
[170] Соединение 6 получали в соответствии со стадией 2 в варианте осуществления 3. 1H ЯМР (метанол-d4, 400 МГц): δ = 7,25-7,32 (m, 2H), 7,19-7,25 (m, 3H), 5,00 (br t, J=6,8 Гц, 1H), 4,50 (br dd, J=10,8, 5,3 Гц, 1H), 4,25 (br t, J=7,3 Гц, 1H), 3,19 (br s, 1H), 3,03 (dd, J=14,3, 7,8 Гц, 1H), 1,98 (br s, 5H), 1,40-1,74 (m, 15H), 1,12- 1,29 (m, 7H), 0,91-0,96 (m, 3H), 0,56-0,86 ppm (m, 17H).
[171] Вариант осуществления 7
[172] Путь синтеза:
[173] Стадия 1. Синтез соединения 7
[174] Соединение 7 получали в соответствии со стадией 1 в варианте осуществления 2. 1H ЯМР (хлороформ-d, 400 МГц): δ = 9,30 (s, 1H), 9,22 (s, 2H), 5,03 (br t, J=7,0 Гц, 1H), 4,75 (dd, J=11,0, 4,5 Гц, 1H), 1,65-2,04 (m, 13H), 1,62 (s, 3H), 1,54 (s, 3H), 1,05-1,50 (m, 10H), 0,98 (d, J=7,5 Гц, 6H), 0,89 (s, 3H), 0,85 (br d, J=6,5 Гц, 3H), 0,80-0,83 (m, 3H), 0,63 ppm (s, 3H).
[175] Вариант осуществления 8
[176] Путь синтеза:
[177] Стадия 1. Синтез соединения 8
[178] Соединение 8 получали в соответствии со стадией 1 в варианте осуществления 2. 1H ЯМР (хлороформ-d, 400 МГц): δ = 10,97 (s, 1H), 7,85 (dd, J=8,0, 1,5 Гц, 1H), 7,41-7,53 (m, 1H), 6,99 (d, J=8,5 Гц,1H), 6,89 (t, J=7,5 Гц, 1H), 5,12 (br t, J=7,0 Гц, 1H), 4,77-4,85 (m, 1H), 1,68-2,13 (m, 16H), 1,13-1,64 (m, 13H), 1,07 (d, J=3,0 Гц, 6H), 0,98 (s, 3H), 0,94 (d, J=6,5 Гц, 3H), 0,91 (s, 3H), 0,72 ppm (s, 3H).
[179] Вариант осуществления 9
[180] Путь синтеза:
[181] Стадия 1. Синтез соединения 9
[182] Соединение 9 получали в соответствии со стадией 1 в варианте осуществления 2. 1H ЯМР (400 МГц, хлороформ-d) δ = 8,36 (d, J=1,8 Гц, 1H), 6,93 (d, J=1,8 Гц, 1H), 5,10 (br t, J=7,2 Гц, 1H), 4,78 (dd, J=4,8, 11,0 Гц, 1H), 2,10-1,66 (m, 17H), 1,58-1,16 (m, 12H), 1,03 (d, J=14,6 Гц, 6H), 0,97-0,83 (m, 9H), 0,70 (s, 3H).
[183] Вариант осуществления 10

[184] Путь синтеза:
[185] Стадия 1. Синтез соединения 10
[186] Соединение 10 получали в соответствии со стадией 1 в варианте осуществления 2. 1H ЯМР (400 МГц, хлороформ-d) δ = 8,05 (s, 1H), 5,03 (br t, J=7,0 Гц, 1H), 4,66-4,49 (m, 1H), 2,06-1,89 (m, 5H), 1,74-1,62 (m, 3H), 1,55-1,16 (m, 17H), 0,95 (s, 3H), 0,87-0,75 (m, 16H), 0,62 (s, 3H).
[187] Вариант осуществления 11
[188] Путь синтеза:

[189] Стадия 1. Синтез соединения 11-1
[190] Соединение 11-1 получали в соответствии со стадией 1 в варианте осуществления 2. 1H ЯМР (400 МГц, хлороформ-d) δ = 5,13-4,92 (m, 2H), 4,48 (dd, J=5,0, 11,0 Гц, 1H), 4,24 (br t, J=7,0 Гц, 1H), 2,13-1,74 (m, 8H), 1,69-1,47 (m, 13H), 1,38 (s, 12H), 1,34 (br d, J=7,0 Гц, 5H), 1,20-0,72 (m, 18H), 0,62 (s, 3H).
[191] Стадия 2. Синтез соединения 11
[192] Соединение 11 получали в соответствии со стадией 2 в варианте осуществления 3. 1H ЯМР (400 МГц, метанол-d4) δ = 5,12 (br t, J=7,3 Гц, 1H), 4,78-4,54 (m, 1H), 4,12 (q, J=7,0 Гц, 1H), 2,15-1,73 (m, 13H), 1,77-1,58 (m, 11H), 1,49-1,20 (m, 7H), 1,17-0,85 (m, 16H), 0,80-0,64 (m, 3H).
[193] Вариант осуществления 12
[194] Путь синтеза:
[195] Стадия 1. Синтез соединения 12
[196] Салициловую кислоту (632,35 мг, 3,51 ммоль) добавляли в реакционную колбу и растворяли в дихлорметане (10,00 мл), и оксалилхлорид (594,03 мг, 4,68 ммоль) по каплям добавляли в реакционную колбу. Смесь перемешивали при 25oC в течение 2 часов. Реакционную смесь выпаривали до сухого состояния с получением неочищенного продукта. Неочищенный продукт повторно растворяли в дихлорметане (20,00 мл) с последующим добавлением соединения BB-1 (500,00 мг, 1,17 ммоль) и триметиламина (710,35 мг, 7,02 ммоль). Смесь перемешивали при 25oC в течение 10,0 часов. Реакционную смесь разбавляли водой (100 мл) и экстрагировали с помощью дихлорметана (100 мл x 2). Объединенную органическую фазу выпаривали до сухого состояния с получением неочищенного продукта, который очищали с помощью колоночной хроматографии с получением целевого соединения 12. 1H ЯМР (400 МГц, хлороформ-d) δ = 7,96 (d, J=8,0 Гц, 1H), 7,63-7,46 (m, 1H), 7,13 (t, J=7,5 Гц, 1H), 6,98 (t, J=8,8 Гц, 1H), 5,21-4,99 (m, 1H), 3,84-3,57 (m, 1H), 2,04-1,61 (m, 17H), 1,60 (s, 3H), 1,49-1,05 (m, 11H), 1,01-0,82 (m, 13H), 0,74 (s, 3H), 0,70-0,64 (m, 3H).
[197] Вариант осуществления 14
[198] Путь синтеза:
[199] Стадия 1. Синтез соединения 14
[200] Соединение 14 получали в соответствии со стадией 1 в варианте осуществления 2. 1H ЯМР (хлороформ-d, 400 МГц): δ = 8,06 (d, J=8,0 Гц, 2H), 7,68 (d, J=8,5 Гц, 2H), 5,04 (br t, J=7,0 Гц, 1H), 4,68-4,74 (m, 1H), 1,63-2,04 (m, 13H), 1,62 (s, 3H), 1,54 (s, 3H), 1,25-1,50 (m, 7H), 1,01-1,19 (m, 3H), 0,99 (s, 3H), 0,97 (s, 3H), 0,88 (s, 3H), 0,85 (d, J=6,0 Гц, 3H), 0,82 (s, 3H), 0,63 ppm (s, 3H).
[201] Вариант осуществления 15
[202] Путь синтеза:
[203] Стадия 1. Синтез соединения 15
[204] Соединение 15 получали в соответствии со стадией 1 в варианте осуществления 2. 1H ЯМР (хлороформ-d, 400 МГц): δ = 8,08 (d, J=8,0 Гц, 2H), 7,64 (d, J=8,5 Гц, 2H), 5,04 (br t, J=7,0 Гц, 1H), 4,68-4,74 (m, 1H), 1,75-2,04 (m, 8H), 1,60-1,73 (m, 7H), 1,37-1,55 (m, 7H), 1,02-1,37 (m, 7H), 0,98 (d, J=5,0 Гц, 6H), 0,81-0,90 (m,9H), 0,64 ppm (s, 3H).
[205] 19F ЯМР (хлороформ-d, 377 МГц): δ = -63,06 ppm (br s, 3F).
[206] Вариант осуществления 16
[207] Путь синтеза:
[208] Стадия 1. Синтез соединения 16
[209] Соединение 16 получали в соответствии со стадией 1 в варианте осуществления 2. 1H ЯМР (хлороформ-d, 400 МГц): δ = 7,72-7,81 (m, 2H), 7,11-7,19 (m, 1H), 5,03 (br t, J=7,0 Гц, 1H), 4,63-4,74 (m,1H), 1,60-2,04 (m, 16H), 1,40-1,56 (m, 7H), 1,04-1,35 (m, 6H), 0,97 (d, J=9,0 Гц, 6H), 0,81-0,89 (m, 9H), 0,63 ppm (s, 3H).
[210] 19F ЯМР (хлороформ-d, 377 МГц): δ = -150,84 – -103,14 ppm (m, 1F).
[211] Анализ биологической активности
[212] Экспериментальный вариант осуществления 1. Исследование внутриглазного проникновения лекарственного средства и превращения лекарственного средства в ланостерин in vivo
[213] В данном исследовании в качестве экспериментальных животных использовали новозеландских белых кроликов (масса тела составляла более 2 кг, возраст составлял более 12 недель). Каждое соединение исследовали с использованием двух новозеландских белых кроликов. Каждому кролику инстиллировали 50 мкл глазных капель в каждый глаз, причем три глаза использовали для сбора образцов водянистой влаги и один глаз использовали в качестве резервного. Состав глазных капель содержал 1,2% гидроксипропилметилцеллюлозу (с размером E5), 20,5% полоксамер (с размером P407), 1,6% полоксамер (с размером P188), концентрация соединения составляла 5 мМ, и глазные капли представляли собой гомогенную суспензию. После закапывания глазных капель в глаза кроликов собирали водянистую влагу из передней камеры через 0,5, 2, 4 и 6 часов после введения. Объем каждого образца составлял не более 50 мкл. Каждое животное получало слабую анестезию перед сбором образцов. В каждую временную точку собирали по три образца. Собранные образцы водянистой влаги помещали на хранение в сухой лед сразу после сбора или на хранение в холодильнике при -80 ± 10°C. После сбора образцов животных умерщвляли. Концентрацию соединения в каждом образце определяли с использованием тройного квадрупольного масс-спектрометра (API 4000). В таблицах 1 и 2 приведены данные анализа DMPK in vivo; в таблицах 3-9 приведена концентрация лекарственного средства в водянистой влаге после закапывания в глаза (250 нМ на каждый глаз) соединения, представляющего собой ланостерин (исходного лекарственного средства), и соединения, представляющего собой пролекарство.
[214] Результаты указывают на то, что как сам ланостерин, так и соединение, представляющее собой его пролекарство, по настоящему изобретению были способны к проникновению в водянистую влагу через роговицу или посредством других путей, и соединение, представляющее собой пролекарство, было способно подвергаться превращению в ланостерин, представляющий собой исходное лекарственное средство, в ходе процесса инфильтрации и продемонстрировало более высокие значения концентрации и воздействия для ланостерина в водянистой влаге.
[215] Таблица 1. Анализ DMPK in vivo
[216] Таблица 2. Градиент, используемый в методе жидкостной хроматографии, для DMPK ланостерина и соединения 8 in vivo

[217] Таблица 3. Средняя концентрация в образце водянистой влаги (нМ) после закапывания 250 нмоль ланостерина в каждый глаз новозеландского белого кролика
[218] * BQL: ниже предела количественного обнаружения, AUC: степень воздействия.
[219] Таблица 4. Средняя концентрация в образце водянистой влаги (нМ) после закапывания 250 нмоль соединения 1 в каждый глаз новозеландского белого кролика
[220] * BQL: ниже предела количественного обнаружения
[221] Таблица 5. Средняя концентрация в образце водянистой влаги (нМ) после закапывания 250 нмоль соединения 4 в каждый глаз новозеландского белого кролика


[222] * BQL: ниже предела количественного обнаружения
[223] Таблица 6. Средняя концентрация в образце водянистой влаги (нМ) после закапывания 250 нмоль соединения 8 в каждый глаз новозеландского белого кролика
[224] * BQL: ниже предела количественного обнаружения, AUC: степень воздействия.
[225] Таблица 7. Средняя концентрация в образце водянистой влаги (нМ) после закапывания 250 нмоль соединения 9 в каждый глаз новозеландского белого кролика
[226] * BQL: ниже предела количественного обнаружения
[227] Таблица 8. Средняя концентрация в образце водянистой влаги (нМ) после закапывания 250 нмоль соединения 10 в каждый глаз новозеландского белого кролика
[228] * BQL: ниже предела количественного обнаружения
[229] Таблица 9. Средняя концентрация в образце водянистой влаги (нМ) после закапывания 250 нмоль соединения 12 в каждый глаз новозеландского белого кролика
[230] * BQL: ниже предела количественного обнаружения, AUC: степень воздействия.
[231] Экспериментальный вариант осуществления 2. Исследование фармакодинамики глазных капель, содержащих ланостерин и его пролекарство, на модели индуцированной селенитом натрия катаракты у неонатальных новозеландских кроликов
[232] 1. Экспериментальное животное
[233] Неонатальные новозеландские кролики возрастом P7 дней, нормального типа и по 5 крольчат на помет находились на грудном вскармливании матерью-крольчихой.
[234] 2. Распределение на группы и обработка
[235] Экспериментальных крольчат произвольным образом разделяли на 5 групп по 5 кроликов на группу.
[236] 1) Нормальная контрольная группа (NC). В день P10 крольчатам вводили подкожно 0,25 мл физиологического солевого раствора в шею, и после дня P15 введение больше не производили.
[237] 2) Модельная контрольная группа (MC). В день P10 крольчатам вводили подкожно раствор селенита натрия (в физиологическом солевом растворе) в количестве 20 мкмоль/кг массы тела, и после дня P15 контрольные не содержащие лекарственного средства глазные капли закапывали в правый глаз 3 раза каждый день в течение 42 дней.
[238] 3) Группа положительного контроля (PC). В день P10 крольчатам вводили подкожно раствор селенита натрия (в физиологическом солевом растворе) в количестве 20 мкмоль/кг массы тела, и после дня P15 глазные капли Kary Uni (Santen Pharmaceutical Co., Ltd, Япония) закапывали в правый глаз 3 раза каждый день в течение 42 дней.
[239] 4) Группа с обработкой глазными каплями, содержащими ланостерин (LT). В день P10 крольчатам вводили подкожно раствор селенита натрия (в физиологическом солевом растворе) в количестве 20 мкмоль/кг массы тела, и после дня P15 глазные капли, содержащие ланостерин, закапывали в правый глаз 3 раза каждый день в течение 42 дней.
[240] 5) Группа с обработкой глазными каплями, содержащими пролекарство 026 ланостерина (026). В день P10 крольчатам вводили подкожно раствор селенита натрия (в физиологическом солевом растворе) в количестве 20 мкмоль/кг массы тела, и после дня P15 глазные капли, содержащие пролекарство 026 ланостерина, закапывали в правый глаз 3 раза каждый день в течение 42 дней.
[241] 3. Экспериментальное тестирование
[242] 1) Получение фотографий с использованием щелевой лампы. Обработанных селенитом натрия неонатальных новозеландских кроликов в каждой группе осматривали с помощью щелевой лампы перед осуществлением введения и через 7 дней, 14 дней, 21 день и 42 дня после введения соответственно.
[243] 2) Тестирование хрусталика на прозрачность in vitro. В последний день глазное яблоко животного препарировали, хрусталик, находящийся в капсуле, полностью отделяли и хрусталик помещали на бумагу с нанесенной сеткой (2,12 × 2,12 мм). На фотографиях показана степень четкости сетки, сфотографированной через хрусталик.
[244] 3) Анализ активности глутатионпероксидазы (GSH-PX). Активность GSH-PX отделенного хрусталика кролика в каждой группе определяли с помощью способа, представленного в инструкции к набору для определения активности GSH-PX (Nanjing Jiancheng Bioengineering Institute). Экспериментальные данные анализировали с помощью однофакторного ANOVA с использованием программного обеспечения для статистического анализа SPSS. Способ LSD использовали для сравнения групп, а уровень статистически значимого различия составлял p < 0,05.
[245] 4. Экспериментальные результаты
[246] 1) Осмотр с помощью щелевой лампы: на фигуре 1 показано, что селенит натрия был способен индуцировать катаракту в хрусталике неонатального новозеландского кролика. Осмотр с помощью щелевой лампы показал, что симптомы катаракты были значительно снижены после введения глазных капель, содержащих пролекарство 026 ланостерина, в течение 42 дней (фигура 1-I) по сравнению с симптомами до введения доз (фигура 1-J). Симптомы катаракты не изменялись в значительной степени до и после введения глазных капель Kary Uni (фигура 1-E, 1-F) и глазных капель, содержащих ланостерин (фигура 1-G, 1-H).
[247] 2) Тестирование хрусталика на прозрачность in vitro. На фигуре 2 показана прозрачность хрусталика неонатальных новозеландских кроликов с индуцированной селенитом натрия катарактой в каждой группе после 42 дней введения. В левой части каждой фотографии показан хрусталик левого глаза (в левый глаз введение не производили для обеспечения индивидуального контроля), а в правой части показан хрусталик правого глаза (введение в правый глаз производили в соответствии с распределением на группы). После 42 дней введения глазных капель, содержащих пролекарство 026 ланостерина, степень прозрачности хрусталика правого глаза была значительно выше, чем таковая для левого глаза, а также значительно выше, чем таковая для MC-группы, но все же она была ниже, чем таковая для NC-группы. Не наблюдалось какого-либо значительного изменения прозрачности хрусталика после осуществления введения в правый глаз в LT-группе.
[248] 3) Анализ активности GSH-PX. Результаты анализа активности GSH-PX хрусталика в каждой группе после 42 дней введения показали (см. фигуру 3), что после подкожной инъекции селенита натрия активность GSH-PX в хрусталиках глаз кроликов была значительно снижена и имелось статистически значимое различие (p < 0,01) по сравнению с NC-группой. Глазные капли, содержащие пролекарство 026 ланостерина, и глазные капли, содержащие лекарственное средство Kary Uni, в качестве положительного контроля были способны увеличивать активность GSH-PX хрусталика, и имелось статистически значимое различие по сравнению с MC-группой (p < 0,01), и положительный эффект, оказываемый 026, является более значительным, чем таковой, оказываемый Kary Uni (p < 0,01). Эффект глазных капель, содержащих ланостерин, в отношении активности GSH-PX хрусталика был значительно ниже, чем таковой для 026 и Kary Uni, и не имелось статистически значимого различия по сравнению с MC-группой (p>0,05).
[249] 5. Заключение
[250] Вышеприведенные результаты указывают на то, что глазные капли, содержащие пролекарство 026 ланостерина, способны ослаблять симптомы катаракты у неонатальных новозеландских кроликов, индуцированной селенитом натрия, и улучшать прозрачность хрусталика и активность GSH-PX хрусталика.
[251] Экспериментальный вариант осуществления 3. Исследование фармакодинамики глазных капель, содержащих ланостерин и его пролекарство, на модели индуцированной ультрафиолетовым излучением катаракты у неонатальных новозеландских кроликов
[252] 1. Экспериментальное животное
[253] Взрослые новозеландские кролики 2,0-2,5 кг, нормального типа, самцы и самки, в общем количестве 25.
[254] Распределение на группы и обработка
[255] Экспериментальных кроликов произвольным образом разделяли на 5 групп по 5 кроликов на группу.
[256] 1) Нормальная контрольная группа (NC). Нормальный режим кормления, без введения лекарственного средства.
[257] 2) Модельная контрольная группа (MC). Производили УФ-облучение при длине волны 313 нм в течение 24 часов для получения модели, затем контрольные не содержащие лекарственного средства глазные капли закапывали в правый глаз 3 раза каждый день в течение 42 дней.
[258] 3) Группа положительного контроля (PC). Производили УФ-облучение при длине волны 313 нм в течение 24 часов для получения модели, затем глазные капли Kary Uni (Santen Pharmaceutical Co., Ltd, Япония) закапывали в правый глаз 3 раза каждый день в течение 42 дней.
[259] 4) Группа с обработкой глазными каплями, содержащими ланостерин (LT). Производили УФ-облучение при длине волны 313 нм в течение 24 часов для получения модели, затем глазные капли, содержащие ланостерин, закапывали в правый глаз 3 раза каждый день в течение 42 дней.
[260] 5) Группа с обработкой глазными каплями, содержащими пролекарство 026 ланостерина (026). Производили УФ-облучение при длине волны 313 нм в течение 24 часов для получения модели, затем глазные капли, содержащие пролекарство 026 ланостерина, закапывали в правый глаз 3 раза каждый день в течение 42 дней.
[261] 3. Экспериментальное тестирование
[262] 1) Получение фотографий с использованием щелевой лампы. Каждую группу осматривали с помощью щелевой лампы перед введением и через 7 дней, 14 дней, 21 день и 42 дня после введения соответственно.
[263] 2) Тестирование хрусталика на прозрачность in vitro. В последний день глазное яблоко животного препарировали, хрусталик, находящийся в капсуле, полностью отделяли, и хрусталик помещали на бумагу с нанесенной сеткой (2,12 × 2,12 мм). На фотографиях показана степень четкости сетки, сфотографированной через хрусталик.
[264] 3) Анализ активности глутатионпероксидазы (GSH-PX). Активность GSH-PX отделенного хрусталика кролика в каждой группе определяли с помощью способа, представленного в инструкции к набору для определения активности GSH-PX (Nanjing Jiancheng Bioengineering Institute). Экспериментальные данные анализировали с помощью однофакторного ANOVA с использованием программного обеспечения для статистического анализа SPSS. Способ LSD использовали для сравнения групп, а уровень статистически значимого различия составлял p < 0,05.
[265] 4. Экспериментальные результаты
[266] 1) Осмотр с помощью щелевой лампы. На фигуре 4 показано, что ультрафиолетовое излучение было способно индуцировать катаракту в хрусталике новозеландского кролика. Осмотр с помощью щелевой лампы показал, что симптомы катаракты были значительно снижены после введения глазных капель, содержащих пролекарство 026 ланостерина, в течение 42 дней (фигура 4-I) по сравнению с симптомами до введения доз (фигура 4-J). Симптомы катаракты не изменялись в значительной степени до и после введения глазных капель Kary Uni (фигура 4-E, 4-F) и глазных капель, содержащих ланостерин (фигура 4-G, 4-H).
[267] 2) Тестирование хрусталика на прозрачность in vitro. На фигуре 5 показана прозрачность хрусталика новозеландских кроликов с индуцированной ультрафиолетовым излучением катарактой в каждой группе после 42 дней введения. В левой части каждой фотографии показан хрусталик левого глаза (в левый глаз введение не производили для обеспечения индивидуального контроля), а в правой части показан хрусталик правого глаза (введение в правый глаз производили в соответствии с распределением на группы). После 42 дней введения глазных капель, содержащих пролекарство 026 ланостерина, степень прозрачности хрусталика правого глаза была значительно выше, чем таковая для левого глаза, а также значительно выше, чем таковая для MC-группы, но все же она была ниже, чем таковая для NC-группы. Не наблюдалось какого-либо значительного изменения прозрачности хрусталика после осуществления введения в правый глаз в LT-группе.
[268] 3) Анализ активности GSH-PX. После 42 дней введения анализ активности GSH-PX хрусталика в каждой группе показал (см. фигуру 6), что после УФ-облучения активность GSH-PX в хрусталиках глаз кроликов была значительно снижена и имелось статистически значимое различие по сравнению с NC-группой (p < 0,01 или p < 0,05). Глазные капли, содержащие пролекарство 026 ланостерина, и глазные капли, содержащие лекарственное средство Kary Uni, в качестве положительного контроля были способны увеличивать активность GSH-PX хрусталика, и имелось статистически значимое различие по сравнению с MC-группой (p < 0,01), и положительный эффект 026 являлся более значительным, чем таковой, оказываемый Kary Uni (p < 0,05). Эффект глазных капель, содержащих ланостерин, в отношении активности GSH-PX хрусталика был значительно ниже, чем таковой для 026 и Kary Uni, и не имелось статистически значимого различия по сравнению с MC-группой (p > 0,05).
[269] 5. Заключение
[270] Вышеприведенные результаты указывают на то, что глазные капли, содержащие пролекарство 026 ланостерина, способны ослаблять симптомы катаракты у новозеландских кроликов, индуцированной УФ-облучением, и улучшать прозрачность хрусталика и активность GSH-PX хрусталика.