Результат интеллектуальной деятельности: ГЛЮКОЗИДГИДРОЛАЗЫ И ИХ ПРИМЕНЕНИЕ В ПРЕДУПРЕЖДЕНИИ И/ИЛИ ЛЕЧЕНИИ ПАТОГЕННОЙ ИНФЕКЦИИ У ЖИВОТНОГО
Вид РИД
Изобретение
Настоящая заявка испрашивает приоритет по предварительной заявке на патент США № 62/213564, поданной 2 сентября 2015 г., которая включена в данный документ посредством ссылки во всей своей полноте.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Область настоящего изобретения касается гликозидгидролаз, таких как альфа-L-фукозидазы, и, в частности, их применения в предупреждении и/или лечении кишечных патогенных инфекций и/или диареи у животных.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Применение антибиотиков при лечении как людей, так и животных привело к возникновению резистентности к противомикробным препаратам, которая в настоящее время стала серьезной проблемой всемирного здравоохранения. Таким образом, с целью решения этой проблемы всемирного здравоохранения ведется поиск для разработки альтернатив антибиотикам.
Потребители очень обеспокоены широко распространенным применением антибиотиков в корме для животных. Как розничным торговцам, так и фермерам понадобится изменить свою практику с учетом этого изменения предпочтений потребителей в отношении мяса без антибиотиков.
Энтеротоксигенная Escherichia (E.) coli (ETEC) является наиболее распространенным типом колибактериоза у молодых животных, таких как поросята и телята, обычно проявляющимся как тяжелая водянистая диарея. Она также является существенной причиной диареи среди путешественников ("диарея путешественника") и детей в развивающихся странах.
Известно, что почти все бактерии ETEC прикрепляются к рецепторам на эпителии тонкого кишечника с помощью расположенных на поверхности белковых отростков (фимбрий и пили) или с помощью афимбриальных белков. Более того, они секретируют белковые токсины (энтеротоксины) для уменьшения абсорбции и увеличения секреции жидкости и электролитов в эпителиальных клетках тонкого кишечника. Энтеротоксины действуют локально на энтероциты. Подробности эпидемиологии, патогенеза, диагностики и предупреждения инфекций и диареи, вызываемых ETEC, у животных можно найти в Nagy and Fekete (1999) Vet Res. 30:259-84.
Более конкретно, было обнаружено, что у ETEC и энтеротоксемической (ETEEC) Escherichia coli (F18+ E. Coli) экспрессируются фимбрии F18, с помощью которых они колонизируют тонкий кишечник и которые вызывают диарею у очень молодых животных, таких как поросята и телята, и являются основной причиной смертности людей в странах третьего мира. Защиту от таких заболеваний можно организовать путем предотвращения фимбриальной адгезии таких патогенов к клеткам кишечника животных. Таким образом, существует необходимость обнаружения новых и альтернативных подходов к предупреждению и лечению патогенных инфекций, таких как вызываемых ETEC.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном аспекте раскрыт способ предупреждения и/или лечения у животного кишечной патогенной инфекции и/или диареи, где патогенная инфекция и/или диарея вызваны патогеном, способным связываться с клеткой кишечника животного, где указанное связывание патогена зависит от наличия участка связывания с патогеном, содержащего по меньшей мере одну гликановую структуру, замещенную по меньшей мере одним альфа-1,2-L-фукозным фрагментом, предусматривающий введение животному эффективного количества гликозидгидролазы, способной удалять по меньшей мере один альфа-1,2-L-фукозный фрагмент из участка связывания с патогеном. В некоторых аспектах гликозидгидролаза представляет собой альфа-L-фукозидазу.
В другом аспекте альфа-L-фукозидаза способна удалять концевую связанную альфа-1,2-связью фукозную группу из гликансодержащей структуры либо самостоятельно, либо в комбинации с ферментом, способным (а) превращать группоспецифический антиген А в группоспецифический антиген H или (b) превращать группоспецифический антиген B в группоспецифический антиген H. Более конкретно, альфа-L-фукозидаза выбрана из группы, состоящей из семейства гликозидгидролаз 95 (GH95) и семейства гликозидгидролаз 29 (GH 29).
В третьем аспекте патоген представляет собой Escherichia coli, экспрессирующую фимбрии F18.
В четвертом аспекте раскрытый способ дополнительно предусматривает введение животному эффективного количества альфа-L-фукозидазы в комбинации с по меньшей мере одним пробиотиком либо отдельно, либо в комбинации с по меньшей мере одной протеазой, и при этом альфа-L-фукозидаза является инкапсулированой.
В пятом аспекте раскрытый способ дополнительно предусматривает то, что альфа-L-фукозидазу, будь то инкапсулированную либо неинкапсулированную, и/или пробиотик, и/или протеазу вводят с кормом или премиксом для животных. Более того, альфа-L-фукозидаза, будь то инкапсулированная либо неинкапсулированная, может быть в форме гранулы для применения в корме или премиксе для животных.
В шестом аспекте раскрыта композиция для предупреждения и/или лечения у животного кишечной патогенной инфекции и/или диареи, где патогенная инфекция и/или диарея вызваны патогеном, способным связываться с клеткой кишечника животного, где указанное связывание патогена зависит от наличия участка связывания с патогеном, содержащего по меньшей мере одну гликановую структуру, замещенную по меньшей мере одним альфа-1,2-L-фукозным фрагментом, при этом предусматривается введение животному эффективного количества гликозидгидролазы, способной удалять по меньшей мере один альфа-1,2-L-фукозный фрагмент из участка связывания с патогеном. В некоторых аспектах гликозидгидролаза представляет собой альфа-L-фукозидазу.
Эта альфа-L-фукозидаза способна удалять концевую связанную альфа-1,2-связью фукозную группу из гликансодержащей структуры либо самостоятельно, либо в комбинации с ферментом, способным (а) превращать группоспецифический антиген А в группоспецифический антиген H или (b) превращать группоспецифический антиген B в группоспецифический антиген H. Более того, альфа-L-фукозидаза выбрана из группы, состоящей из семейства гликозидгидролаз 95 (GH95) и семейства гликозидгидролаз 29 (GH 29).
В седьмом аспекте патоген представляет собой Escherichia coli, экспрессирующую фимбрии F18.
В восьмом аспекте раскрытая композиция дополнительно содержит по меньшей мере один пробиотик либо отдельно, либо в комбинации с по меньшей мере одной протеазой, где альфа-L-фукозидаза может быть инкапсулированной или неинкапсулированной и может применяться в корме или премиксе для животных.
В девятом аспекте раскрытая композиция может содержать альфа-L-фукозидазу, будь то инкапсулированную либо неинкапсулированную, по меньшей мере один пробиотик и/или по меньшей мере одну протеазу, которые вводят животному в виде корма или премикса, и альфа-L-фукозидаза может быть в форме гранулы для применения в корме или премиксе для животных.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
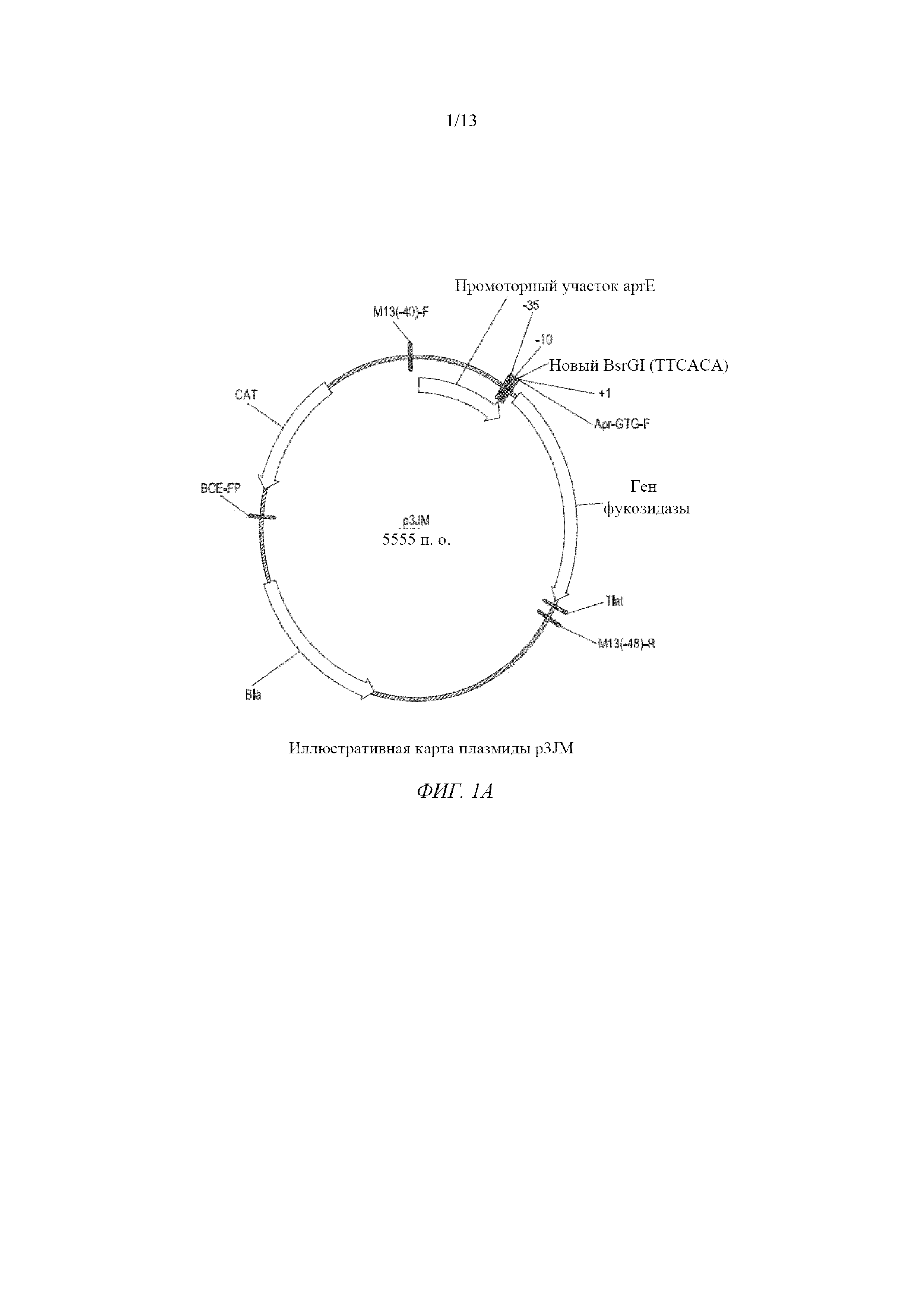
На фигуре 1A изображена иллюстративная карта плазмиды p3JM.
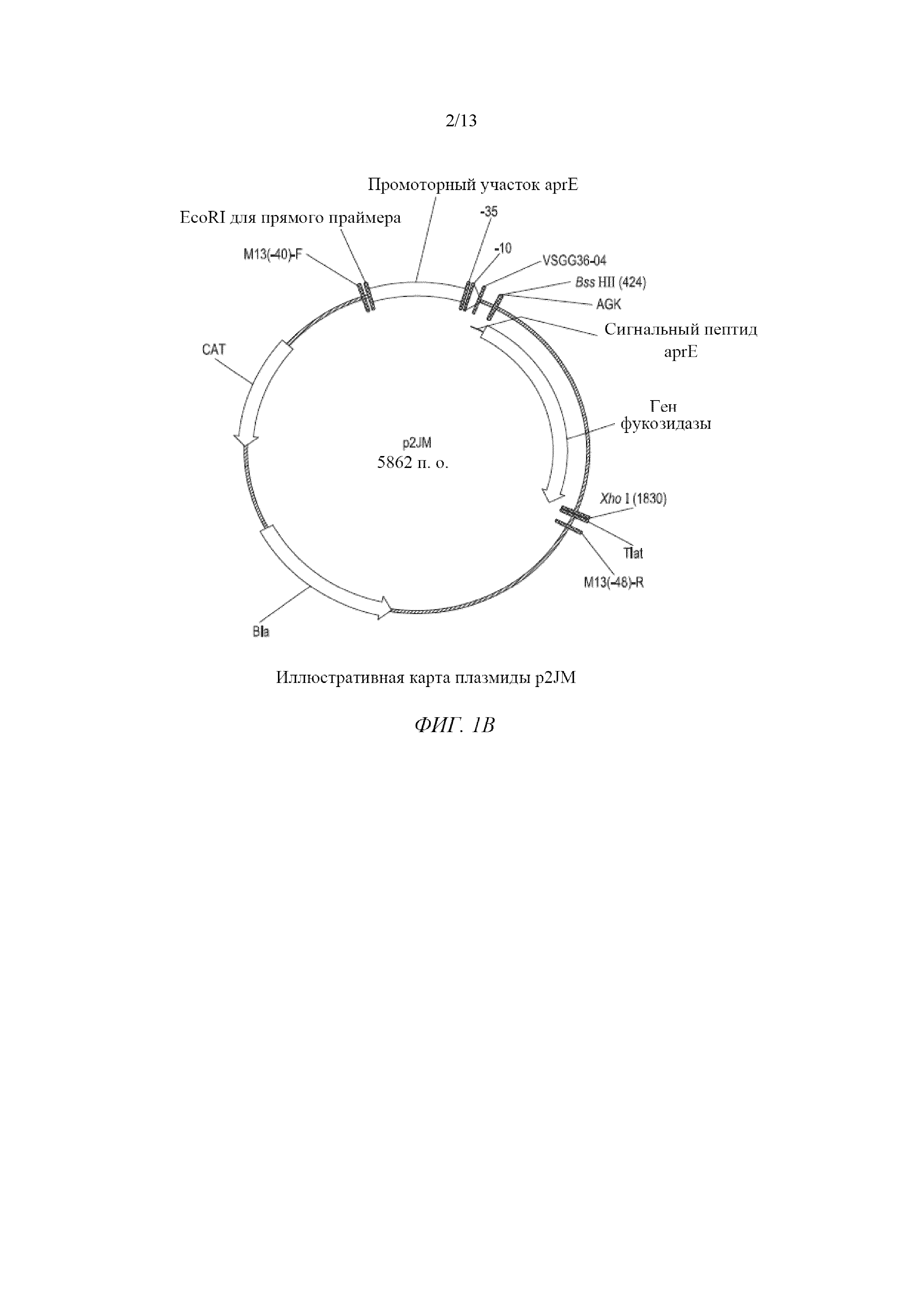
На фигуре 1B изображена иллюстративная карта плазмиды p2JM.
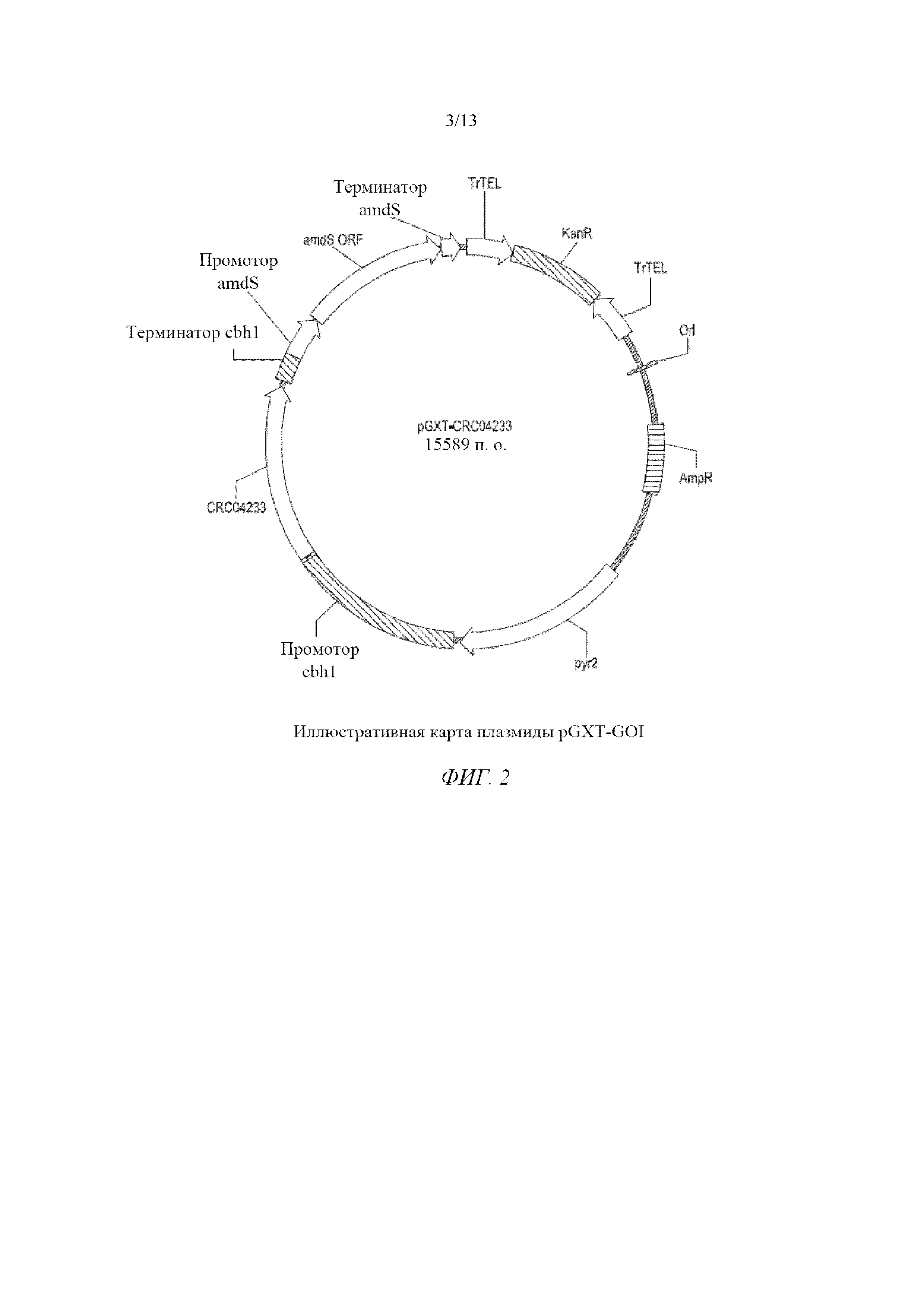
На фигуре 2 изображена иллюстративная карта плазмиды pGXT-GOI.
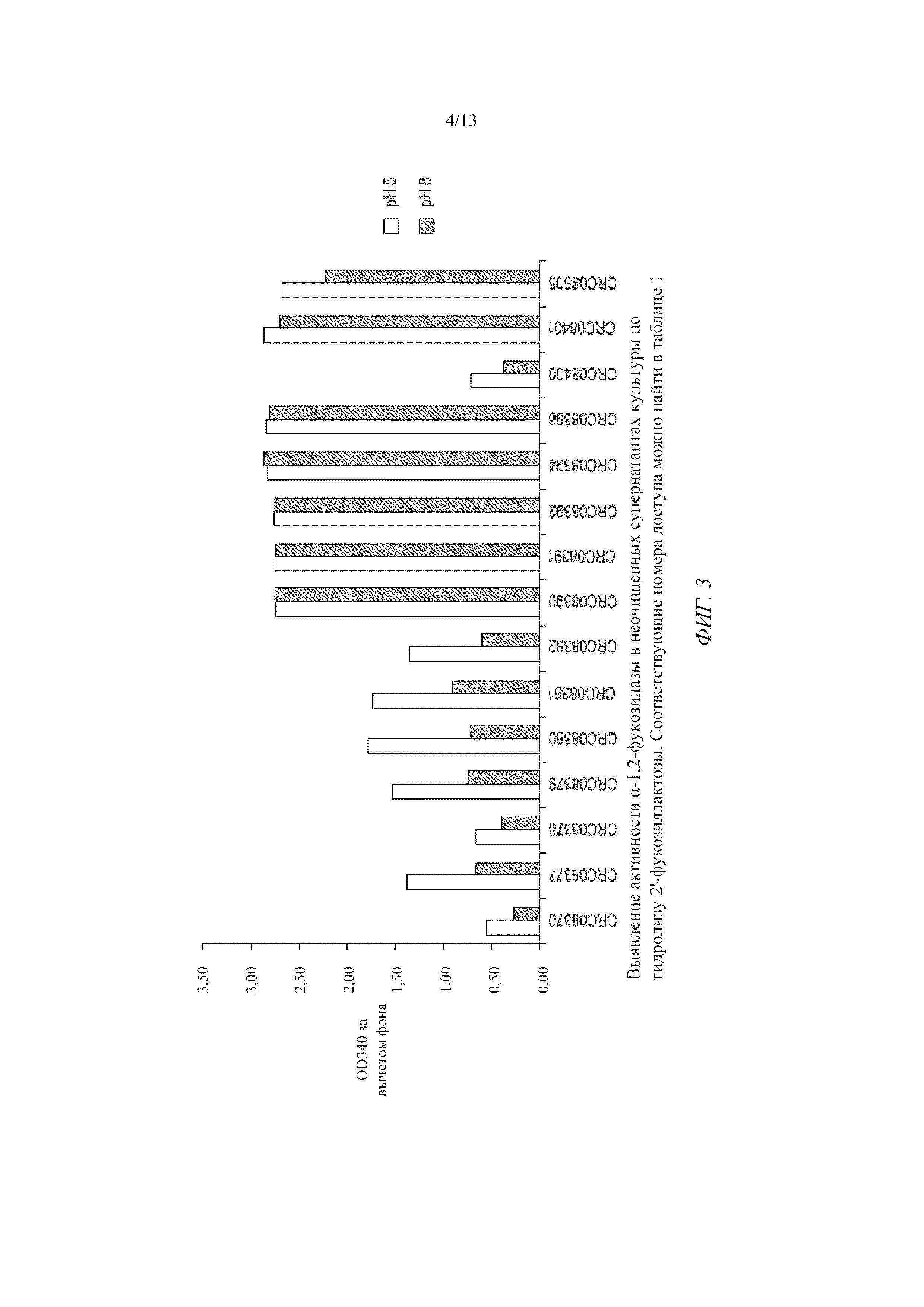
Фигура 3 представляет собой график, демонстрирующий активность альфа-1,2-фукозидазы в неочищенных супернатантах культуры по гидролизу 2'-фукозиллактозы.
Фигура 4 представляет собой график, демонстрирующий влияние рН на активность фукозидазы в отношении 2'-фукозиллактозы.
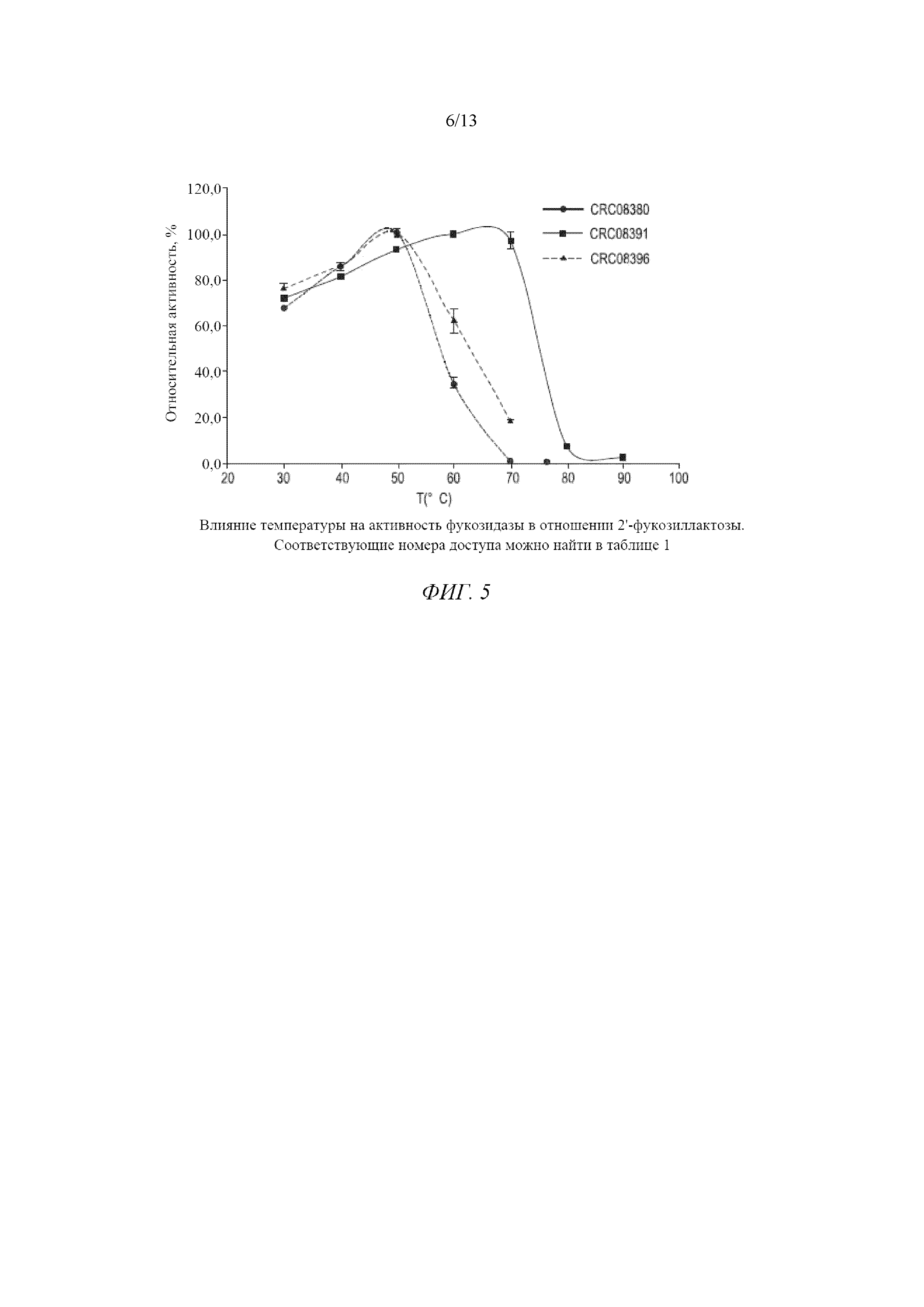
Фигура 5 представляет собой график, демонстрирующий влияние температуры на активность фукозидазы в отношении 2'-фукозиллактозы.
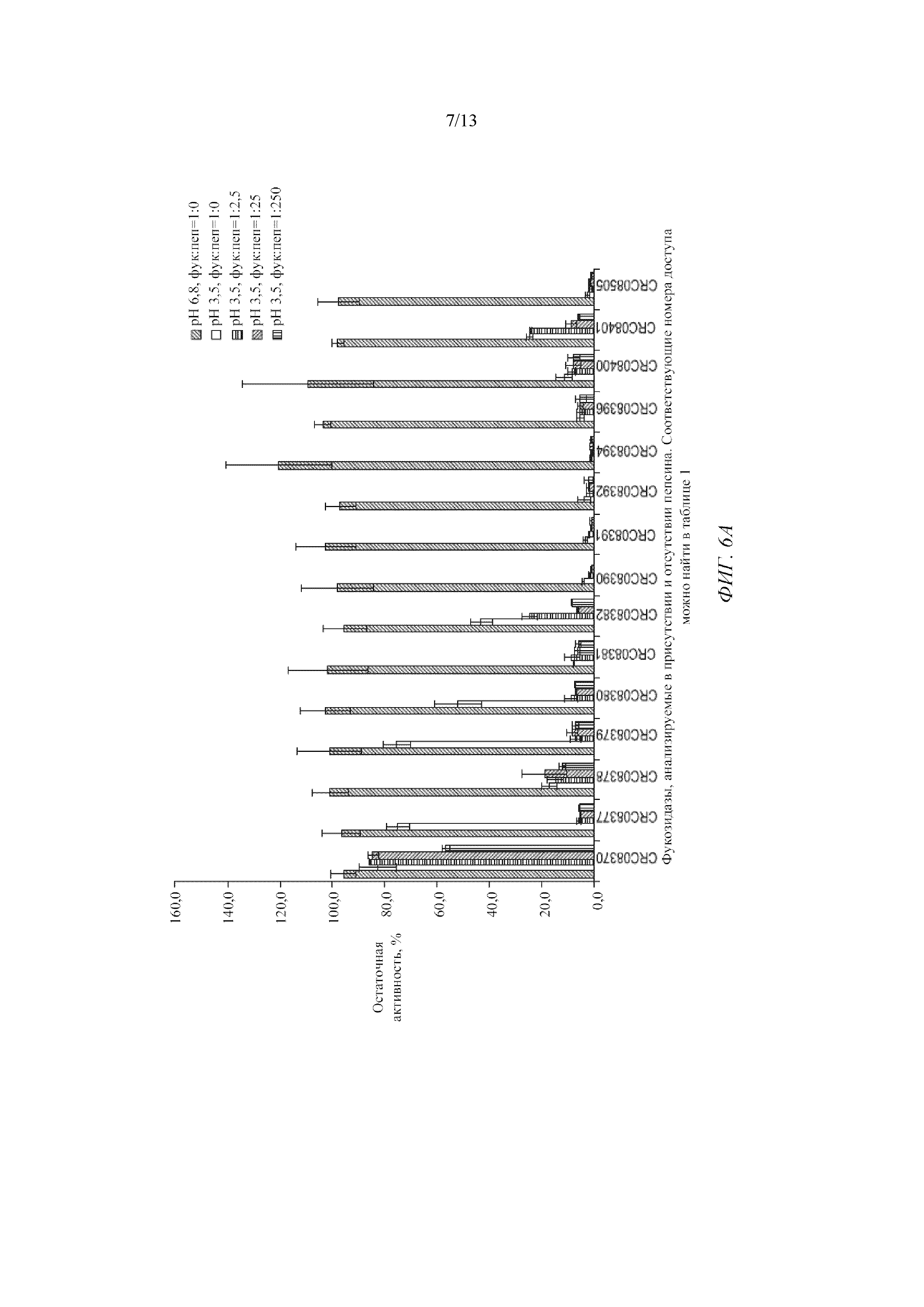
Фигура 6A представляет собой график для фукозидаз, анализируемых в присутствии и отсутствии пепсина.
Фигура 6B представляет собой график для фукозидаз, анализируемых в присутствии и отсутствии пепсина.
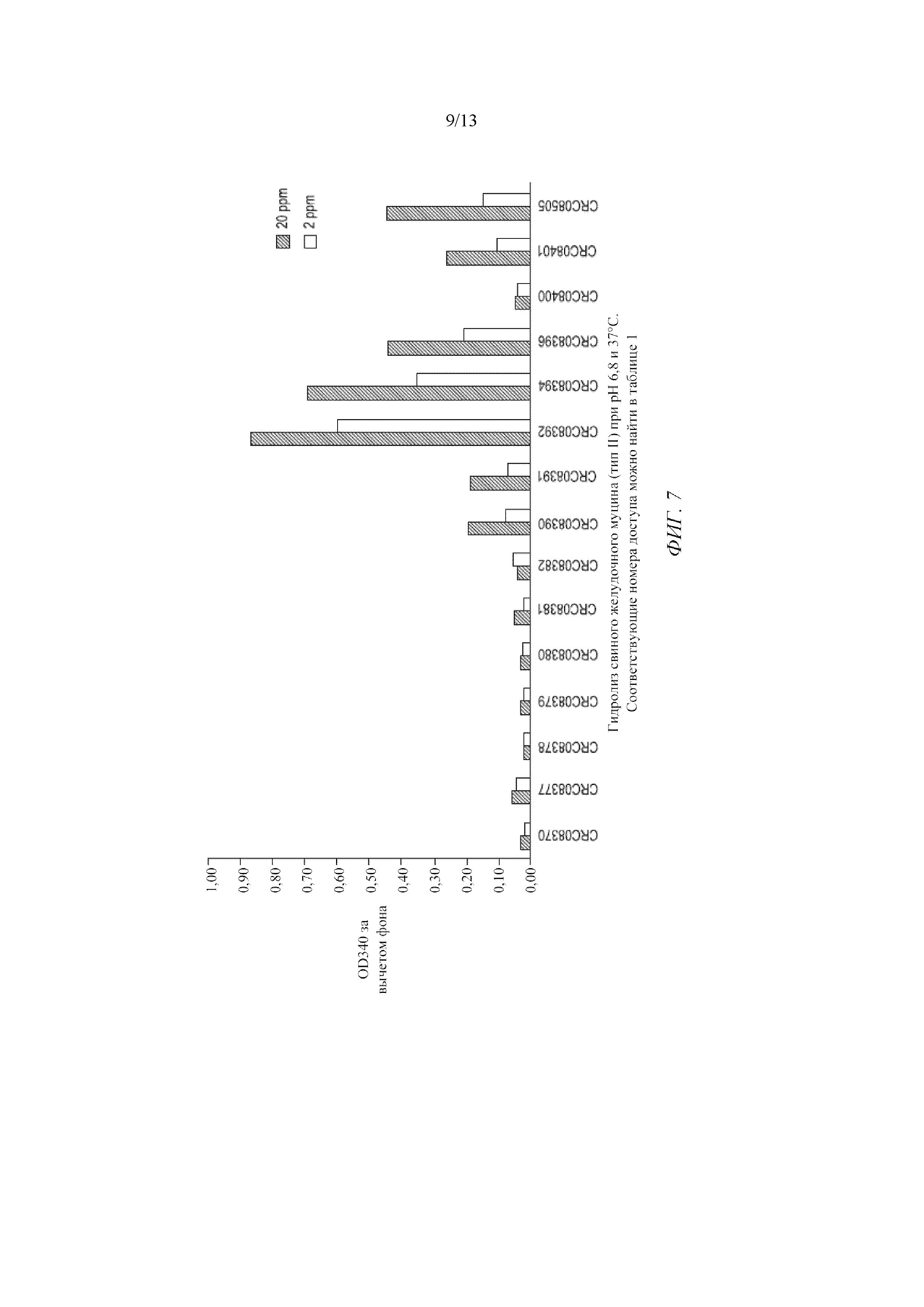
Фигура 7 представляет собой график, демонстрирующий гидролиз свиного желудочного муцина (тип II) при pH 6,8 и 37°C.
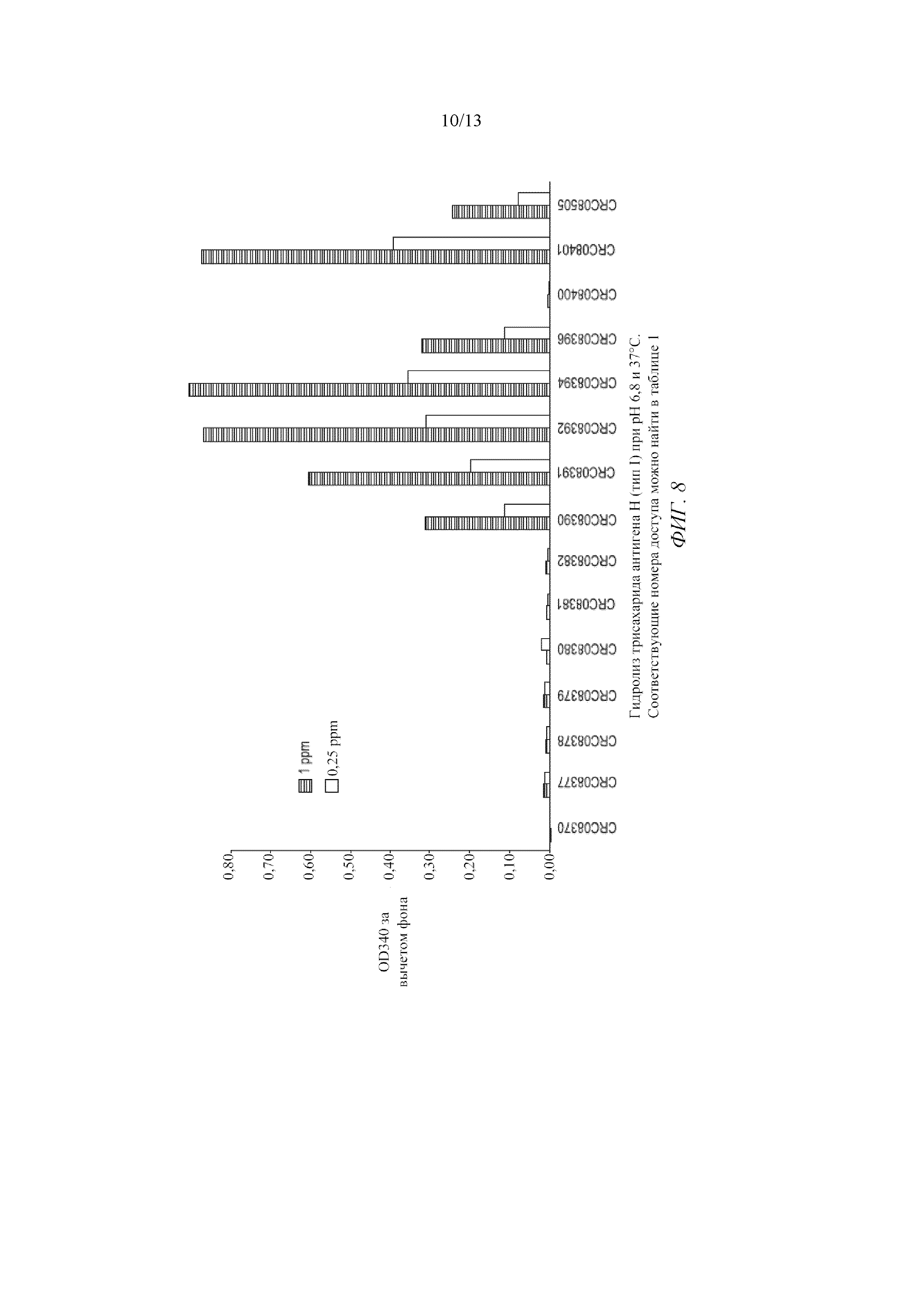
Фигура 8 представляет собой график, демонстрирующий гидролиз трисахарида антигена H (тип I) при pH 6,8 и 37°C.
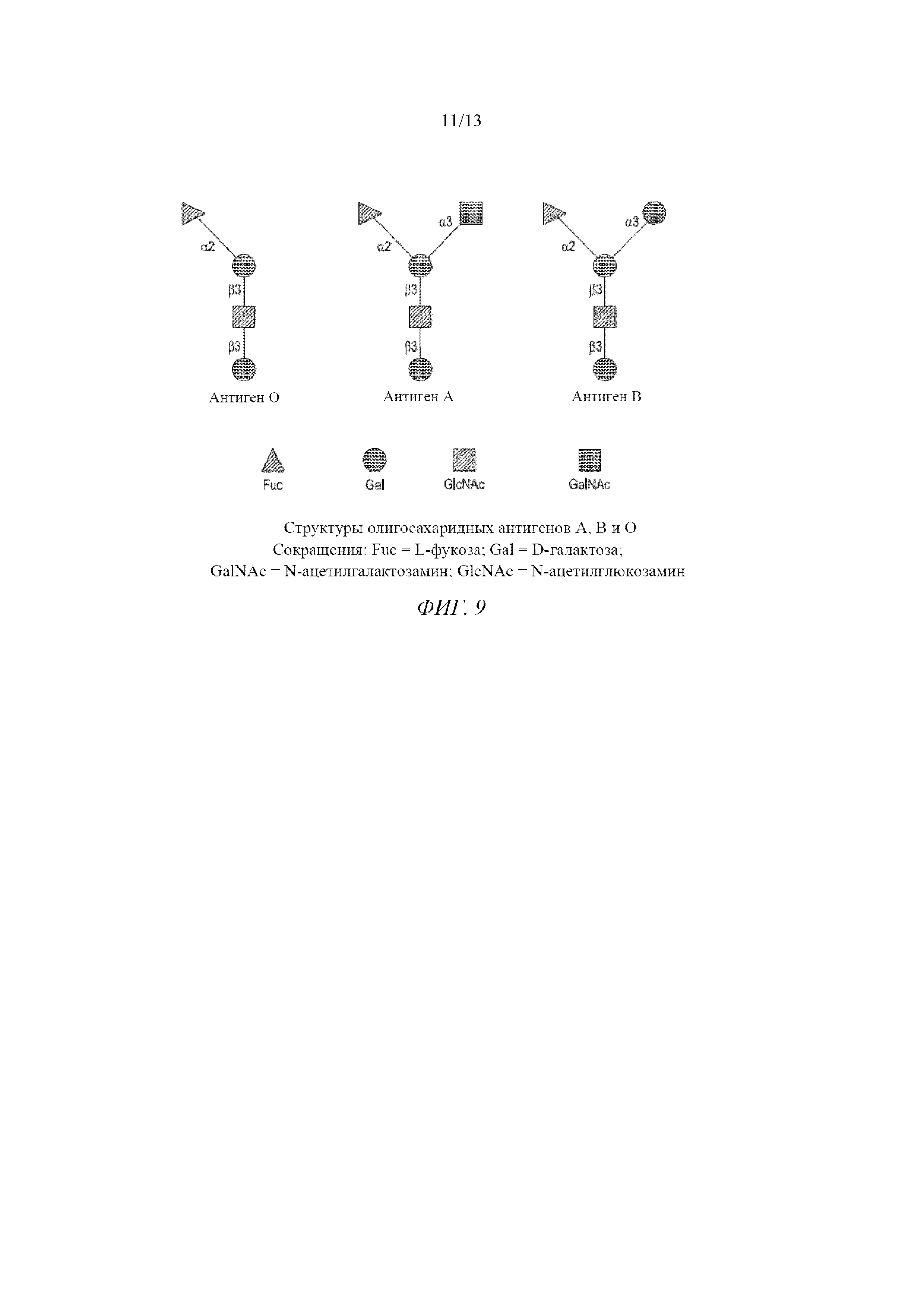
На фигуре 9 изображена концевая структура антигенов A, B и O.
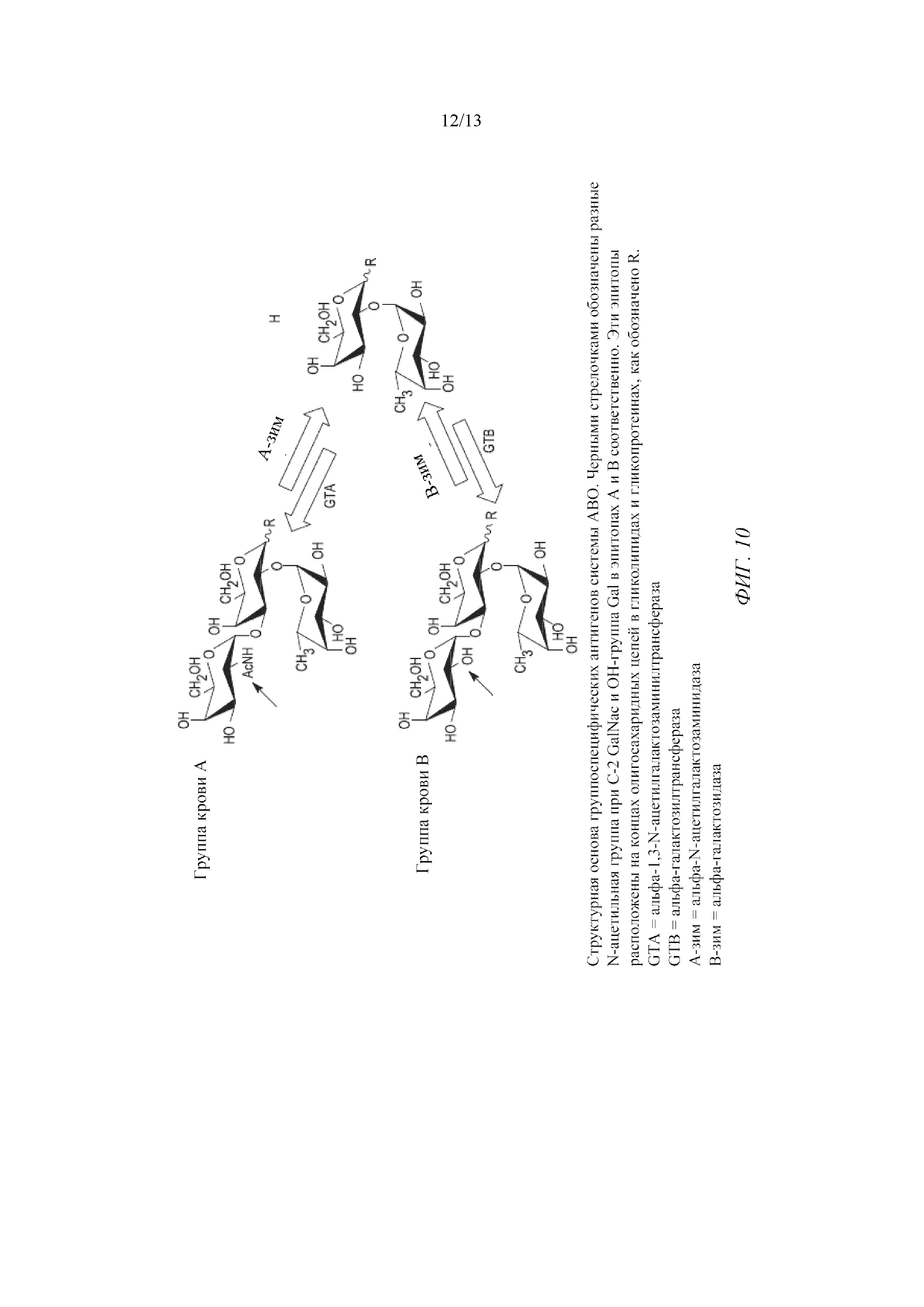
На фигуре 10 изображена структурная основа группоспецифических антигенов системы ABO.
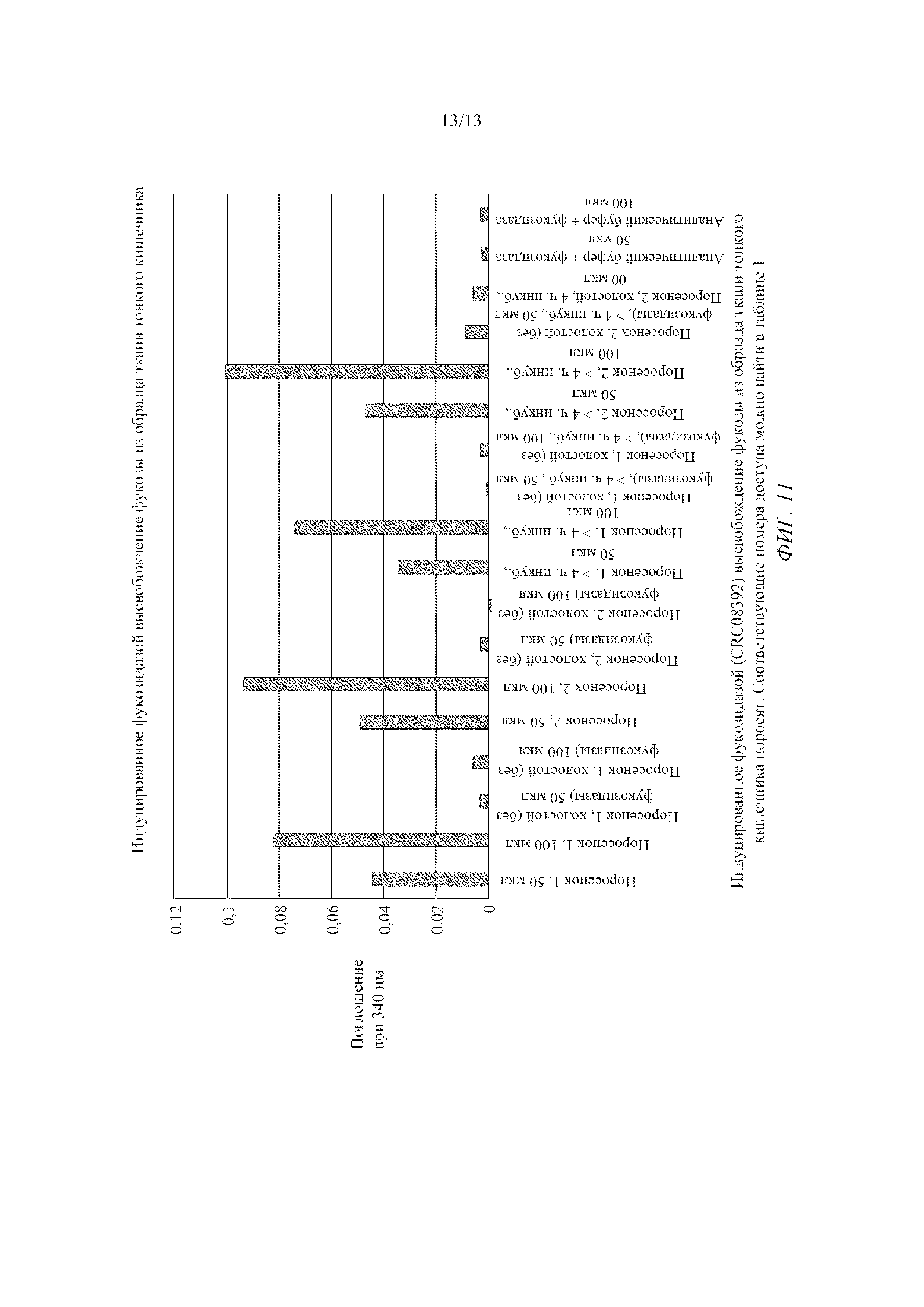
На фигуре 11 показано индуцированное фукозидазой высвобождение фукозы из образца ткани тонкого кишечника поросят.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Все цитируемые патенты, заявки на патенты и публикации включены в данный документ посредством ссылки во всей своей полноте.
В данном раскрытии используют ряд терминов и сокращений. Если четко не указано иное, то применяют следующие определения.
Подразумевается, что формы единственного числа элемента или компонента являются неограничивающими в отношении числа примеров (т. е. случаев) элемента или компонента. Поэтому формы единственного числа следует понимать как включающие одно или по меньшей мере одно, а форма единственного числа для обозначения элемента или компонента также включает множественное число, за исключением случаев, когда явно подразумевается единственное число.
Термин "включающий" означает наличие установленных признаков, целых чисел, стадий или компонентов, которые изложены в формуле изобретения, но так, чтобы он не исключал наличие или добавление одного или нескольких признаков, целых чисел, стадий, компонентов или групп из них. Термин "включающий" подразумевают как включающий варианты осуществления, охватываемые терминами "по сути состоящий из" и "состоящий из". Подобным образом, термин "по сути состоящий из" подразумевают как включающий варианты осуществления, охватываемые термином "состоящий из".
Все диапазоны, при наличии таковых, являются включающими и комбинируемыми. Например, при упоминании диапазона "от 1 до 5" упомянутый диапазон следует рассматривать как включающий диапазоны "от 1 до 4", "от 1 до 3", "1-2", "1-2 и 4-5", "1-3 и 5" и т. п.
Используемый в данном документе в отношении числового значения термин "приблизительно" относится к диапазону +/- 0,5 от числового значения, если указанный термин иным образом конкретно не определен в контексте. Например, фраза "значение pH, составляющее приблизительно 6" относится к значениям pH от 5,5 до 6,5, если конкретно не определено иное значение pH.
Подразумевается, что каждая максимальная числовая граница, раскрываемая в настоящем описании, включает каждую нижнюю числовую границу, как если бы такие нижние числовые границы были бы явно приведены в данном документе. Каждая минимальная числовая граница, раскрываемая в настоящем описании, будет включать каждую верхнюю числовую границу, как если бы такие верхние числовые границы были бы явно приведены в данном документе. Каждый числовой диапазон, приведенный в настоящем описании, будет включать каждый более узкий числовой диапазон, который находится в пределах такого более широкого числового диапазона, как если бы такие более узкие числовые диапазоны были явно приведены в данном документе.
Термин "гликозидгидролаза" используется взаимозаменяемо с "гликозидазами" и "гликозилгидролазами". Гликозидгидролазы содействуют гидролизу гликозидных связей в сложных сахарах (полисахаридах). Вместе с гликозилтрансферазами гликозидазы образуют основной каталитический аппарат для синтеза и разрушения гликозидных связей. Гликозидгидролазы отнесены к классу EC 3.2.1 как ферменты, катализирующие гидролиз O- или S-гликозидов. Гликозидгидролазы также можно классифицировать в соответствии со стереохимическим результатом реакции гидролиза; таким образом, их можно классифицировать как сохраняющие или инвертирующие ферменты. Гликозидгидролазы также можно классифицировать как действующие экзо- или эндо-, в зависимости от того, действуют ли они на (обычно не восстанавливающем) конце или в середине, соответственно, олиго/полисахаридной цепи. Гликозидгидролазы также можно классифицировать способами, основанными на последовательности или структуре. Их обычно называют по субстрату, на который они действуют.
Термин "гликозилтрансфераза" относится к ферменту, который катализирует образование гликозидной связи между моносахаридами.
Термины "альфа-L-фукозидаза", "альфа-L-фукозидфукогидролаза" и "альфа-фукозидаза" используются в данном документе взаимозаменяемо и относятся к ферменту класса EC 3.2.1.51, который удаляет L-фукозу из альфа-L-фукозида. Альфа-L-фукозидазы представляют собой экзогликозидазы, обнаруженные у различных организмов и млекопитающих. Альфа-L-фукозидазы были разделены на два различных семейства гликозидгидролаз: альфа-L-фукозидазы, которые катализируют гидролиз с использованием сохраняющего механизма, принадлежат к хорошо известному семейству гликозидгидролаз 29 (GH29). Альфа-L-фукозидазы, которые катализируют гидролиз с использованием инвертирующего механизма, принадлежат к семейству гликозидгидролаз 95 (GH95).
Термины "альфа-1,2-L-фукозидаза", "фукозидаза миндальной эмульсии II", "альфа-2-L-фукопиранозил-бета-D-галактозидфукогидролаза" и "альфа-(1->2)-L-фукозидаза" используются в данном документе взаимозаменяемо и относятся к ферменту класса EC 3.2.1.63, который катализирует гидролиз остатков L-фукозы с не восстанавливающего конца, связанных с остатками D-галактозы с помощью 1,2-альфа-связи. Термины "альфа-1,3-L-фукозидаза", "фукозидаза миндальной эмульсии I" и "альфа-3-L-фукоза-N-ацетилглюкозаминил-гликопротеинфукогидролаза" используются в данном документе взаимозаменяемо и относятся к ферменту класса EC 3.2.1.111, который гидролизует (1->3)-связи между остатками альфа-L-фукозы и N-ацетилглюкозамина.
Термины "альфа-1,6-L-фукозидаза", "альфа-L-фукозидаза" и "1,6-L-фукоза-N-ацетил-D-глюкозаминил-гликопептидфукогидролаза" используются в данном документе взаимозаменяемо и относятся к ферменту класса EC 3.2.1.127, который гидролизует (1->6)-связи между остатками альфа-L-фукозы и N-ацетил-D-глюкозамина.
Термины "дефукозилировать" и "дефукозилирующий" используются взаимозаменяемо и относятся к ферменту, способному удалять фукозильную группу из гликансодержащей структуры.
Термины "гликан" и "полисахарид" используются в данном документе взаимозаменяемо. Гликан относится к полисахариду или олигосахариду либо к углеводной части гликоконъюгата, такого как гликопротеин, гликолипид или протеогликан, даже если углевод является только олигосахаридом. Гликаны могут представлять собой гомо- или гетерополимеры из моносахаридных остатков. Они могут быть линейными или разветвленными молекулами. Гликаны могут обнаруживаться в виде прикрепленных к белкам, как в гликопротеинах и протеогликанах. Как правило, они находятся на внешней поверхности клеток. O- и N-связанные гликаны очень распространены у эукариот, но также могут быть обнаружены, хотя и реже, у прокариот.
Используемый в данном документе термин "гликансодержащая структура" относится к любой структуре, такой как белки, липиды и т. п., к которой гликан может быть прикреплен любым способом.
Термин "N-ацетилгалактозиламинсодержащий фрагмент" представляет собой структуру, к которой прикреплен N-ацетилгалакатозиламин. Такие структуры включают без ограничения углеводы и т. п.
Используемый в данном документе термин "FUT 1" относится к альфа-1,2-фукозилтрансферазе 1. Фукозилтрансфераза представляет собой фермент, который переносит сахар L-фукозу с донорного субстрата GDP-фукозы на акцепторный субстрат. Акцепторным субстратом может быть другой сахар, как, например, перенос фукозы на центральный сахар GlcNAc, как в случае N-связанного гликозилирования, или белок, как в случае O-связанного гликозилирования с помощью O-фукозилтрансферазы. Некоторые из белков в этой группе ответственны за молекулярную основу группоспецифических антигенов, поверхностных маркеров на внешней стороне мембраны эритроцитов.
Используемый в данном документе термин "животное" включает всех нежвачных (включая людей) и жвачных животных. В конкретном варианте осуществления животное представляет собой нежвачное животное, такое как лошадь и животное с однокамерным желудком. Примеры животных с однокамерным желудком включают без ограничения свиней и домашних свиней, таких как поросята, выращиваемые свиньи, свиноматки; птицу, такую как индюшки, утки, куры, бройлерные цыплята, несушки; рыбу, такую как лосось, форель, тилапия, сомы и карпы; и ракообразные, такие как мелкие креветки и крупные креветки. В дополнительном варианте осуществления животное представляет собой жвачное животное, в том числе без ограничения крупный рогатый скот, молодых телят, коз, овец, жирафов, бизонов, лосей, вапити, яков, индийских буйволов, оленей, верблюдов, альпак, лам, антилоп, вилорогов и антилоп-нилгау.
Используемый в данном документе термин "патоген" означает любого возбудителя заболевания. Такие возбудители могут включать без ограничения бактериальных, вирусных, грибковых возбудителей и т. п.
Используемый в данном документе термин "участок связывания с патогеном" означает участок или область, где фермент может прикрепляться к соединению и реагировать с ним. В настоящем изобретении предпочтительным участком связывания с патогеном является участок, имеющий по меньшей мере одну гликановую структуру, замещенную по меньшей мере одним альфа-1,2-L-фукозным фрагментом.
Термин "F18+ E. Coli" означает любую E. coli, способную экспрессировать фимбрии F18.
Используемый в данном документе род "Bacillus" включает все виды в пределах рода "Bacillus", известные специалисту в данной области техники, в том числе без ограничения B. subtilis, B. licheniformis, B. lentus, B. brevis, B. stearothermophilus, B. alkalophilus, B. amyloliquefaciens, B. clausii, B. halodurans, B. megaterium, B. coagulans, B. circulans, B. gibsonii и B. thuringiensis. Следует признать, что род Bacillus продолжает проходить таксономическую реорганизацию. Таким образом, подразумевается, что этот род включает виды, которые были переклассифицированы, в том числе без ограничения такие организмы, как Bacillus stearothermophilus, который в настоящее время называется "Geobacillus stearothermophilus", или Bacillus polymyxa, который в настоящее время называется "Paenibacillus polymyxa". Образование устойчивых эндоспор в стрессовых условиях окружающей среды считается определяющей чертой рода Bacillus, хотя эта характеристика также присуща недавно названным Alicyclobacillus, Amphibacillus, Aneurinibacillus, Anoxybacillus, Brevibacillus, Filobacillus, Gracilibacillus, Halobacillus, Paenibacillus, Salibacillus, Thermobacillus, Ureibacillus и Virgibacillus.
"Корм" и "пищевой продукт", соответственно, означают любой натуральный или искусственный рацион, еду или подобное или компоненты такой еды, предназначенные или пригодные для употребления в пищу, принятия, переваривания животным, отличным от человека, и человеком, соответственно.
Используемый в данном документе термин "пищевой продукт" применяется в широком смысле и охватывает пищевой продукт и продукты питания для людей, а также пищевой продукт для животных, отличных от человека, (т. е. корм).
Термин "корм" используется в отношении продуктов, которыми кормят животных при выращивании сельскохозяйственных животных. Термины "корм" и "корм для животных" используются взаимозаменяемо. В предпочтительном варианте осуществления пищевой продукт или корм подходит для потребления нежвачными и жвачными.
Используемый в данном документе термин "пробиотик" ("DFM") является источником живых (жизнеспособных) встречающихся в природе микроорганизмов. Категории DFM включают Bacillus, молочнокислые бактерии и дрожжи. Bacillus представляют собой уникальные грамположительные палочки, которые образуют споры. Эти споры очень стабильны и могут выдерживать такие условия окружающей среды, как тепло, влагу и определенный диапазон рН. Эти споры прорастают в активные вегетативные клетки при проглатывании животным и могут быть использованы в тонкоизмельченных и гранулированных рационах. Молочнокислые бактерии представляют собой грамположительные кокки, продуцирующие молочную кислоту, которые являются антагонистами патогенов. Поскольку молочнокислые бактерии, по-видимому, до некоторой степени являются чувствительными к нагреванию, их не используют в гранулированных рационах. Молочнокислые бактерии включают род Bifidobacterium, Lactobacillus и Streptococcus. Дрожжи не являются бактериями. Эти микроорганизмы относятся к растительной группе грибов.
Используемый в данном документе термин "протеаза" относится к ферменту, способному расщеплять пептидную связь. Термины "протеаза", "пептидаза" и "протеиназа" могут использоваться взаимозаменяемо. Протеазы могут быть обнаружены у животных, растений, бактерий, архей и вирусов. Протеолиз может обеспечиваться с помощью ферментов, которые в настоящее время разделены на шесть широких групп: аспарагиновые протеазы, цистеиновые протеазы, сериновые протеазы, треониновые протеазы, глутаминовые протеазы и металлопротеазы.
Термин "выделенный" означает вещество в форме или окружении, которые не встречаются в природе. Неограничивающие примеры выделенных веществ включают: (1) любое не встречающееся в природе вещество, (2) любое вещество, включая без ограничения любую клетку-хозяина, фермент, вариант, нуклеиновую кислоту, белок, пептид или кофактор, которое по меньшей мере частично извлечено из одного или нескольких или всех встречающихся в природе компонентов, с которыми оно связано в природе; (3) любое вещество, модифицированное человеком по сравнению с этим веществом, обнаруженным в природе; или (4) любое вещество, модифицированное путем увеличения количества вещества по сравнению с другими компонентами, с которыми оно связано в природе. Термины "выделенная молекула нуклеиновой кислоты", "выделенный полинуклеотид" и "выделенный фрагмент нуклеиновой кислоты" будут использоваться взаимозаменяемо и относятся к полимеру РНК или ДНК, который является одно- или двухцепочечным, необязательно содержащим синтетические, отличные от природных или измененные нуклеотидные основания. Выделенная молекула нуклеиновой кислоты в форме полимера ДНК может состоять из одного или нескольких сегментов кДНК, геномной ДНК или синтетической ДНК.
Термин "очищенный" применительно к нуклеиновым кислотам или полипептидам, как правило, обозначает нуклеиновую кислоту или полипептид, которые фактически не содержат других компонентов, что определяют с помощью аналитических методик, хорошо известных из уровня техники (например, очищенный полипептид или полинуклеотид образуют отдельную полосу в электрофоретическом геле, хроматографическом элюате и/или средах, подвергаемых центрифугированию в градиенте плотности). Например, нуклеиновая кислота или полипептид, которые дают фактически одну полосу в электрофоретическом геле, являются "очищенными". Чистота очищенных нуклеиновой кислоты или полипептида составляет по меньшей мере приблизительно 50%, обычно по меньшей мере приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 91%, приблизительно 92%, приблизительно 93%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99%, приблизительно 99,5%, приблизительно 99,6%, приблизительно 99,7%, приблизительно 99,8% или больше (например, весовой процент в молях). Иными словами, композиция обогащена молекулой, если имеет место значительное увеличение концентрации молекулы после применения методики очистки или обогащения. Термин "обогащенный" относится к соединению, полипептиду, клетке, нуклеиновой кислоте, аминокислоте или другому определенному материалу или компоненту, который присутствует в композиции в относительной или абсолютной концентрации, которая выше, чем в исходной композиции.
Термины "пептиды", "белки" и "полипептиды" используются в данном документе взаимозаменяемо и относятся к полимеру из аминокислот, соединенных вместе пептидными связями. "Белок" или "полипептид" содержит полимерную последовательность аминокислотных остатков. В данном раскрытии используется одно- и 3-буквенный код для аминокислот, который определен согласно IUPAC-IUB объединенным комитетом по биохимической номенклатуре (JCBN). Одна буква X относится к любой из двадцати аминокислот. Также понятно, что полипептид может быть закодирован несколькими нуклеотидными последовательностями из-за вырожденности генетического кода. Мутации могут быть названы с помощью однобуквенного кода исходной аминокислоты, за которым следует номер положения, а затем однобуквенный код вариантной аминокислоты. Например, мутация с заменой глицина (G) в положении 87 на серин (S) представлена как "G087S" или "G87S". При описании модификаций положение, за которым следуют аминокислоты, перечисленные в скобках, указывает на перечень замен в этом положении любой из перечисленных аминокислот. Например, 6(L,I) означает, что положение 6 может быть замещено лейцином или изолейцином. Также в последовательности используется косая черта (/) для обозначения замен, например, F/V указывает на то, что в конкретном положении может находится фенилаланин или валин.
Мутации могут быть названы с помощью однобуквенного кода исходной аминокислоты, за которым следует номер положения, а затем однобуквенный код вариантной аминокислоты. Например, мутация с заменой глицина (G) в положении 87 на серин (S) представлена как "G087S" или "G87S".
Термин "зрелая" форма белка, полипептида или пептида относится к функциональной форме белка, полипептида или фермента без сигнальной пептидной последовательности и пропептидной последовательности.
Термин форма "предшественника" белка или пептида относится к зрелой форме белка с пропоследовательностью, функционально связанной с амино- или карбонильным концом белка. Предшественник может также иметь "сигнальную" последовательность, функционально связанную с аминоконцом пропоследовательности. Предшественник также может иметь дополнительные полипептиды, которые вовлечены в посттрансляционную активность (например, полипептиды, отщепляемые от него с тем, чтобы оставить зрелую форму белка или пептида).
"Пропоследовательность" или "пропептидная последовательность" относится к аминокислотной последовательности между сигнальной пептидной последовательностью и зрелой последовательностью фермента (например, фукозидазы), которая необходима для правильного сворачивания и секреции фермента; их иногда называют внутримолекулярными шаперонами. Расщепление пропоследовательности или последовательности пропептида приводит к образованию зрелого активного фермента, который часто экспрессируется в виде проферментов.
Термины "сигнальная последовательность" и "сигнальный пептид" относятся к последовательности аминокислотных остатков, которая может участвовать в секреции или направлении транспорта зрелой формы или формы-предшественника белка. Сигнальная последовательность обычно расположена на N-конце по отношению к последовательности белка-предшественника или последовательности зрелого белка. Сигнальная последовательность может быть эндогенной или экзогенной. Сигнальная последовательность в норме отсутствует у зрелого белка. Сигнальная последовательность обычно отщепляется от белка сигнальной пептидазой после осуществления транспорта белка. Представляющий интерес ген может экспрессироваться с сигнальной последовательностью или без нее.
Термин "дикий тип" в отношении аминокислотной последовательности или последовательности нуклеиновой кислоты указывает на то, что аминокислотная последовательность или последовательность нуклеиновой кислоты является нативной или встречающейся в природе последовательностью. Используемый в данном документе термин "встречающийся в природе" относится к любым объектам (например, белкам, аминокислотам или последовательностям нуклеиновых кислот), обнаруживаемым в природе. И наоборот, термин "не встречающийся в природе" относится к объектам, не обнаруживаемым в природе (например, рекомбинантным нуклеиновым кислотам и белковым последовательностям, полученным в лаборатории, или модификации последовательности дикого типа).
Используемые в данном документе в отношении положений аминокислотных остатков выражения "соответствующий чему-либо", или "соответствует чему-либо", или "соответствует" относятся к аминокислотному остатку в пронумерованном положении в белке или пептиде или аминокислотному остатку, который аналогичен, гомологичен или эквивалентен пронумерованному остатку в белке или пептиде. Используемый в данном документе термин "соответствующая область", как правило, относится к аналогичному положению в родственных белках или эталонном белке.
Термины "происходящий из" и "полученный из" относятся не только к белку, продуцированному или продуцируемому штаммом рассматриваемого организма, но также к белку, кодируемому последовательностью ДНК, выделенной из такого штамма, и продуцируемому в организме-хозяине, содержащем такую последовательность ДНК. Кроме того, данный термин относится к белку, который кодируется последовательностью ДНК синтетического и/или кДНК-происхождения и который имеет отличительные характеристики рассматриваемого белка.
Термин "аминокислота" относится к основной химической структурной единице белка или полипептида. Таким образом, кодон для аминокислоты аланин, являющейся гидрофобной аминокислотой, можно заменить кодоном, который кодирует другой менее гидрофобный остаток (такой как глицин) или более гидрофобный остаток (такой как валин, лейцин или изолейцин). Аналогично, также можно ожидать, что изменения, которые приводят к замене одного отрицательно заряженного остатка на другой (как, например, аспарагиновая кислота на глутаминовую кислоту) или одного положительно заряженного остатка на другой (как, например, лизин на аргинин), дадут функционально эквивалентный продукт. Во многих случаях ожидается, что изменения нуклеотидов, которые приводят к изменениям N-концевой и C-концевой частей белковой молекулы, также не приведут к изменениям активности белка. Каждая из предложенных модификаций находится в пределах квалификации рядового специалиста в данной области техники, равно как и определение сохранения биологической активности кодируемых продуктов.
Термин "кодон-оптимизированный", относящийся к генам или кодирующим участкам молекул нуклеиновой кислоты для трансформации различных хозяев, относится к изменению кодонов в гене или кодирующих участках молекул нуклеиновой кислоты с тем, чтобы отражать обычное использование кодонов у организма-хозяина без изменения полипептида, который кодируется ДНК.
Термин "ген" относится к молекуле нуклеиновой кислоты, которая экспрессирует конкретный белок, включающей регуляторные последовательности предшествующие (5'-некодирующие последовательности) кодирующей последовательности и следующие за ней (3'-некодирующие последовательности). Термин "нативный ген" означает ген, обнаруживаемый в природе, со своими собственными регуляторными последовательностями. "Химерный ген" относится к любому гену, который не является нативным геном, содержащему регуляторные и кодирующие последовательности, которые совместно не обнаруживаются в природе. Соответственно, химерный ген может содержать регуляторные последовательности и кодирующие последовательности, которые происходят из различных источников, или регуляторные последовательности и кодирующие последовательности, которые происходят из одного источника, но расположены в порядке, отличающемся от обнаруживаемого в природе. "Эндогенный ген" относится к нативному гену в его естественном расположении в геноме организма. "Чужеродный" ген относится к гену, не обнаруживаемому в норме в организме хозяина, а который введен в организм хозяина путем переноса генов. Чужеродные гены могут включать нативные гены, введенные в организм, не являющийся нативным, или химерные гены. "Трансген" представляет собой ген, который ввели в геном с помощью процедуры трансформации.
Термин "кодирующая последовательность" относится к нуклеотидной последовательности, которая кодирует конкретную аминокислотную последовательность. "Подходящие регуляторные последовательности" относятся к нуклеотидным последовательностям, расположенным выше (5'-некодирующие последовательности), в пределах или ниже (3'-некодирующие последовательности) кодирующей последовательности и которые влияют на транскрипцию, процессинг или стабильность РНК или трансляцию ассоциированной кодирующей последовательности. Регуляторные последовательности могут включать промоторы, лидерные последовательности трансляции, сайт процессинга РНК, сайты связывания эффекторов и структуры "стебель-петля".
Термин "функционально связанный" относится к ассоциации последовательностей нуклеиновой кислоты в одной молекуле нуклеиновой кислоты таким образом, что функция одной влияет на другую. Например, промотор функционально связан с кодирующей последовательностью, если он способен влиять на экспрессию такой кодирующей последовательности, т. е. кодирующая последовательность находится под транскрипционный контролем промотора. Кодирующие последовательности могут быть функционально связаны с регуляторными последовательностями в смысловой или антисмысловой ориентации.
Термины "регуляторная последовательность" или "контрольная последовательность" используются в данном документе взаимозаменяемо и относятся к сегменту нуклеотидной последовательности, который способен повышать или снижать экспрессию конкретных генов внутри организма. Примеры регуляторных последовательностей включают без ограничения промоторы, сигнальную последовательность, операторы и т. п. Как отмечено выше, регуляторные последовательности могут быть функционально связаны в смысловой или антисмысловой ориентации с представляющими интерес кодирующей последовательностью/геном.
"Промотор" или "промоторные последовательности" относятся к последовательностям ДНК, которые определяют, где начинается транскрипция гена с помощью РНК-полимеразы. Промоторные последовательности обычно располагаются непосредственно выше или на 5'-конце сайта инициации транскрипции. Промоторы могут быть получены целиком из нативной или встречающейся в природе последовательности или могут состоять из разных элементов, полученных из разных промоторов, обнаруживаемых в природе, или даже содержать сегменты синтетической ДНК. Специалистам в данной области техники будет понятно, что различные промоторы могут управлять экспрессией гена в различных тканях или типах клеток или на различных стадиях развития или в ответ на различные условия окружающей среды или физиологические условия ("индуцируемые промоторы").
Выражение "3'-некодирующие последовательности" относится к последовательностям ДНК, расположенным ниже кодирующей последовательности, и включает последовательности, кодирующие регуляторные сигналы, способные влиять на процессинг мРНК или экспрессию генов, такие как терминация транскрипции.
Используемый в данном документе термин "трансформация" относится к переносу или введению молекулы нуклеиновой кислоты в организм-хозяин. Молекулу нуклеиновой кислоты можно вводить в виде линейной или кольцевой формы ДНК. Молекула нуклеиновой кислоты может представлять собой плазмиду, которая реплицируется автономно, или она может интегрироваться в геном продуцирующего хозяина. Продуцирующие хозяева, содержащие трансформированную нуклеиновую кислоту, называются "трансформированными", или "рекомбинантными", или "трансгенными" организмами или "трансформантами".
Используемый в данном документе термин "рекомбинантный" относится к искусственной комбинации двух в ином случае отделенных друг от друга сегментов последовательностей нуклеиновых кислот, например, путем химического синтеза или манипуляции выделенными сегментами нуклеиновых кислот с помощью методик генной инженерии. Например, ДНК, в которой один или несколько сегментов или генов были вставлены, естественным образом либо с помощью лабораторной манипуляции, из другой молекулы, из другой части той же молекулы или из искусственной последовательности, что привело к введению новой последовательности в ген и соответственно в организм. Термины "рекомбинантный", "трансгенный", "трансформированный", "сконструированный" или "модифицированный для экспрессии экзогенного гена" используются в данном документе взаимозаменяемо.
Термины "рекомбинантная конструкция", "конструкция экспрессии", "рекомбинантная конструкция экспрессии" и "кассета экспрессии" используются в данном документе взаимозаменяемо. Рекомбинантная конструкция содержит искусственную комбинацию фрагментов нуклеиновых кислот, например регуляторных и кодирующих последовательностей, которые не все встречаются вместе в природе. Например, конструкция может содержать регуляторные последовательности и кодирующие последовательности, которые происходят из разных источников, или регуляторные последовательности и кодирующие последовательности, которые происходят из одного источника, но расположены в порядке, отличающемся от обнаруживаемого в природе. Такую конструкцию можно использовать саму по себе или можно использовать в сочетании с вектором. Если используют вектор, тогда выбор вектора зависит от способа, который будут использовать для трансформации клеток-хозяев, что хорошо известно специалистам в данной области техники. Например, можно использовать плазмидный вектор. Специалисту в данной области техники хорошо известны генетические элементы, которые должны присутствовать в векторе для успешной трансформации, отбора и размножения клеток-хозяев. Специалисту в данной области техники также будет понятно, что у различных независимых трансформантов могут проявляться различные уровни и паттерны экспрессии (Jones et al., (1985) EMBO J 4:2411-2418; De Almeida et al., (1989) Mol Gen Genetics 218:78-86), и, таким образом, для того, чтобы получить линии, характеризующиеся требуемым уровнем и паттерном экспрессии, обычно проводят скрининг множества объектов. Такой скрининг можно осуществлять с помощью стандартных молекулярно-биологических, биохимических и других анализов, в том числе Саузерн-анализа ДНК, нозерн-анализа экспрессии мРНК, ПЦР, количественной ПЦР в реальном времени (qPCR), ПЦР с обратной транскрипцией (RT-PCR), анализа экспрессии белков с помощью иммуноблоттинга, ферментативных анализов или анализов активности и/или фенотипического анализа.
Термины "продуцирующий хозяин", "хозяин" и "клетка-хозяин" используются в данном документе взаимозаменяемо и относятся к любому организму или его клетке, независимо от того, является ли он человеком или отличным от человека, в который может быть стабильно или временно введена рекомбинантная конструкция для экспрессии гена. Этот термин охватывает любое потомство родительской клетки, которое не идентично родительской клетке из-за мутаций, возникших во время размножения.
Термин "процент идентичности" представляет собой взаимоотношение между двумя или более полипептидными последовательностями или двумя или более полинуклеотидными последовательностями, определенное путем сравнения последовательностей. В данной области техники "идентичность" также означает степень родства последовательностей между полипептидными или полинуклеотидными последовательностями, в зависимости от конкретного случая, определенный по количеству совпадающих нуклеотидов или аминокислот между нитями таких последовательностей. "Идентичность" и "сходство" могут быть легко вычислены с помощью известных способов, в том числе без ограничения тех, которые описаны в Computational Molecular Biology (Lesk, A. M., ed.) Oxford University Press, NY (1988); Biocomputing: Informatics and Genome Projects (Smith, D. W., ed.) Academic Press, NY (1993); Computer Analysis of Sequence Data, Part I (Griffin, A. M., and Griffin, H. G., eds.) Humana Press, NJ (1994); Sequence Analysis in Molecular Biology (von Heinje, G., ed.) Academic Press (1987); и Sequence Analysis Primer (Gribskov, M. and Devereux, J., eds.) Stockton Press, NY (1991). Способы определения идентичности и сходства прописаны в коде общедоступных компьютерных программ.
Используемый в данном документе термин "% идентичности", или "процент идентичности", или "PID" относится к идентичности белковой последовательности. Процент идентичности может быть определен с использованием стандартных методик, известных из уровня техники. Полезные алгоритмы включают алгоритмы BLAST (см., Altschul et al., J Mol Biol, 215:403-410, 1990; и Karlin and Altschul, Proc Natl Acad Sci USA, 90:5873-5787, 1993). В программе BLAST используются несколько параметров поиска, большинство из которых выставлены на значения по умолчанию. Алгоритм NCBI BLAST находит наиболее релевантные последовательности с точки зрения биологического сходства, но не рекомендуется для запрашиваемых последовательностей из менее 20 остатков (Altschul et al., Nucleic Acids Res, 25:3389-3402, 1997; и Schaffer et al., Nucleic Acids Res, 29:2994-3005, 2001). Иллюстративные параметры BLAST по умолчанию для поиска последовательностей нуклеиновой кислоты включают: пороговая длина смежного слова=11; отсечка E‐значения=10; матрица замен=NUC.3.1 (соответствие=1, несоответствие=‐3); открытие гэпа=5 и продление гэпа=2. Иллюстративные параметры BLAST по умолчанию для поиска аминокислотных последовательностей включают: размер слова=3; отсечка E‐ значения=10; матрица замен=BLOSUM62; открытие гэпа=11 и продление гэпа=1. Значение процента (%) идентичности аминокислотной последовательности определяется по количеству совпадающих идентичных остатков, деленному на общее количество остатков "эталонной" последовательности, включая любые гэпы, созданные программой для оптимального/максимального выравнивания. Алгоритмы BLAST обращаются к "эталонной" последовательности как к "запрашиваемой" последовательности.
Используемые в данном документе термины "гомологичные белки" или "гомологичные ферменты" относятся к белкам, которые имеют отчетливое сходство первичной, вторичной и/или третичной структуры. Гомология белка может относиться к сходству в линейной аминокислотной последовательности при выравнивании белков. Гомологичный поиск белковых последовательностей может быть выполнен с использованием BLASTP и PSI-BLAST из NCBI BLAST с порогом (отсечка E-значения) при 0,001. (Altschul SF, Madde TL, Shaffer AA, Zhang J, Zhang Z, Miller W, Lipman DJ. Gapped BLAST and PSI BLAST a new generation of protein database search programs. Nucleic Acids Res 1997 Set 1;25(17):3389-402). Используя эту информацию, можно сгруппировать последовательности белков. Можно построить филогенетическое древо с использованием аминокислотных последовательностей.
Выравнивания последовательностей и расчеты процента идентичности можно произвести с помощью программы Megalign из пакета программ для расчета данных по биоинформатике LASERGENE (DNASTAR Inc., Мэдисон, Висконсин), программы AlignX из Vector NTI, версия 7.0 (Informax, Inc., Бетезда, Мериленд), или пакета открытого программного обеспечения EMBOSS (EMBL-EBI; Rice et al., Trends in Genetics 16, (6):276-277 (2000)). Множественное выравнивание последовательностей можно выполнить с помощью способа выравнивания Clustal (такого как CLUSTALW; например версии 1.83) (Higgins and Sharp, CABIOS, 5:151-153 (1989); Higgins et al., Nucleic Acids Res. 22:4673-4680 (1994); и Chenna et al., Nucleic Acids Res 31 (13):3497-500 (2003)), доступный от Европейской молекулярно-биологической лаборатории через Европейский институт биоинформатики) с параметрами по умолчанию. Подходящие параметры для выравниваний белка в CLUSTALW включают следующие: штраф за наличие гэпа=15, продление гэпа=0,2, матрица=Gonnet (например, Gonnet250), ENDGAP белка=-1, GAPDIST белка=4 и KTUPLE=1. В одном варианте осуществления быстрое или медленное выравнивание применяют с настройками по умолчанию для медленного выравнивания. В качестве альтернативы, параметры, применяемые в способе CLUSTALW (например, версии 1.83), можно модифицировать, чтобы также использовать KTUPLE=1, штраф за введение гэпа=10, продление гэпа=1, матрицу=BLOSUM (например, BLOSUM64), окно=5 и TOP DIAGONALS SAVED=5.
Различные аминокислотные последовательности полипептидов и полинуклеотидные последовательности раскрыты в данном документе в качестве признаков определенных аспектов. В определенных вариантах осуществления могут применяться варианты этих последовательностей, которые по меньшей мере на приблизительно 70-85%, 85-90% или 90%-95% идентичны последовательностям, раскрытым в данном документе. В качестве альтернативы, в определенных вариантах осуществления полипептидная последовательность или полинуклеотидная последовательность варианта может быть по меньшей мере на 60%, 61%, 62%,63%,64%, 65%, 66%, 67%, 68%,69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична последовательности, раскрытой в данном документе. Аминокислотная последовательность или полинуклеотидная последовательность варианта имеет аналогичную раскрытой последовательности функцию или по меньшей мере приблизительно 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% функции раскрытой последовательности.
Термин "вариант" в отношении полипептида относится к полипептиду, который отличается от указанного полипептида дикого типа, исходного или эталонного полипептида тем, что он включает одну или несколько естественных или искусственных замен, вставок или делеций аминокислоты. Аналогично, термин "вариант" в отношении полинуклеотида относится к полинуклеотиду, который отличается нуклеотидной последовательностью от указанного полинуклеотида дикого типа, исходного или эталонного полинуклеотида. Идентичность полипептида или полинуклеотида дикого типа, исходного или эталонного полипептида или полинуклеотида будет очевидна из контекста.
Термины "плазмида", "вектор" и "кассета" относятся к внехромосомному элементу, часто несущему гены, которые не являются частью центрального метаболизма клетки, и обычно находящемуся в форме двухцепочечной ДНК. Такие элементы могут представлять собой автономно реплицирующиеся последовательности, интегрируемые в геном последовательности, фаговые или нуклеотидные последовательности, в линейной или кольцевой форме, одно- или двухцепочечной ДНК или РНК, происходящей из любого источника, в которых ряд нуклеотидных последовательностей соединен или подвергнут рекомбинации в уникальную конструкцию, которая способна вводить представляющий интерес полинуклеотид в клетку. "Кассета для трансформации" относится к конкретному вектору, содержащему ген и имеющему элементы в дополнение к гену, которые способствуют трансформации конкретной клетки-хозяина. Термины "кассета экспрессии" и "вектор экспрессии" используются в данном документе взаимозаменяемо и относятся к конкретному вектору, содержащему ген и имеющему элементы в дополнение к гену, которые обеспечивают возможность экспрессии этого гена в хозяине.
Используемый в данном документе термин "экспрессия" относится к получению функционального конечного продукта (например, мРНК или белка) в форме белка-предшественника либо в зрелой форме. Экспрессия также может относиться к трансляции мРНК в полипептид.
Экспрессия гена подразумевает транскрипцию гена и трансляцию мРНК в белок-предшественник или зрелый белок. "Антисмысловое подавление" относится к продуцированию антисмысловых РНК-транскриптов, способных обеспечивать супрессию экспрессии целевого белка. "Косупрессия" относится к продуцированию смысловых РНК-транскриптов, способных обеспечивать супрессию экспрессии идентичных или существенно сходных чужеродных или эндогенных генов (патент США № 5231020). "Зрелый" белок относится к полипептиду, подвергнутому посттрансляционному процессингу; т. е. полипептиду, из которого удалены какие-либо пре- или пропептиды, присутствовавшие в первичном продукте трансляции. "Белок-предшественник" относится к первичному продукту трансляции мРНК; т. е. с еще присутствующими пре- и пропептидами. Пре- и пропептиды могут представлять собой без ограничения сигналы внутриклеточной локализации. "Стабильная трансформация" относится к переносу фрагмента нуклеиновой кислоты в геном организма-хозяина, в том числе геномы как ядра, так и органелл, что приводит к генетически стабильному наследованию. В отличие от этого "временная трансформация" относится к переносу фрагмента нуклеиновой кислоты в ядро или ДНК-содержащую органеллу организма-хозяина, что приводит к экспрессии гена без интеграции или стабильного наследования. Организмы-хозяева, содержащие трансформированные фрагменты нуклеиновой кислоты, называются "трансгенными" организмами.
Вектор экспрессии может быть одним из множества векторов или кассет, пригодных для трансформации подходящих продуцирующих хозяев, известных в данной области техники. Обычно вектор или кассета будет включать последовательности, управляющие транскрипцией и трансляцией соответствующего гена, селектируемый маркер и последовательности, обеспечивающие автономную репликацию или интеграцию в хромосому. Подходящие векторы, как правило, включают 5'-участок гена, который несет элементы, управляющие инициацией транскрипции, и 3'-участок фрагмента ДНК, который управляет терминацией транскрипции. Оба управляющих участка можно получить из генов, гомологичных генам трансформированной продуцирующей клетки-хозяина, и/или генов, нативных для продуцирующего хозяина, хотя такие управляющие участки могут быть получены и не таким способом.
Используемые в данном документе термины "гомологичные белки" или "гомологичные ферменты" относятся к белкам, которые имеют отчетливое сходство первичной, вторичной и/или третичной структуры. Гомология белка может относиться к сходству в линейной аминокислотной последовательности при выравнивании белков. Гомологичный поиск белковых последовательностей может быть выполнен с использованием BLASTP и PSI-BLAST из NCBI BLAST с порогом (отсечка E-значения) при 0,001. (Altschul SF, Madde TL, Shaffer AA, Zhang J, Zhang Z, Miller W, Lipman DJ. Gapped BLAST and PSI BLAST a new generation of protein database search programs. Nucleic Acids Res 1997 Set 1; 25(17):3389-402). Используя эту информацию, можно сгруппировать последовательности белков. Можно построить филогенетическое древо с использованием аминокислотных последовательностей. Аминокислотные последовательности можно вводить в программу, такую как из пакета Vector NTI Advance, и древо направляющих можно создать с использованием метода присоединения соседей (NJ) (Saitou and Nei, Mol Biol Evol, 4:406-425, 1987). Конструкцию древа можно рассчитать с использованием коррекции Кимуры для расстояния последовательностей и игнорируя положения с гэпами. Программа, такая как AlignX, может отображать вычисленные значения расстояния в скобках после названия молекулы, отображаемого на филогенетическом древе.
Понимание гомологии между молекулами может выявить историю эволюции молекул, а также информацию об их функции; если новый секвенированный белок гомологичен уже охарактеризованному белку, то имеет место строгое указание на биохимическую функцию нового белка. Гомология является наиболее фундаментальной взаимосвязью между двумя объектами; две молекулы называются гомологичными, если они происходят от общего предка. Гомологичные молекулы или гомологи можно разделить на два класса: паралоги и ортологи. Паралоги представляют собой гомологи, которые присутствуют в пределах одного вида. Паралоги часто отличаются своими конкретными биохимическими функциями. Ортологи представляют собой гомологи, которые присутствуют у разных видов и имеют очень похожие или идентичные функции. Суперсемейство белков представляет собой наиболее широкую группу (клада) белков, для которых может быть выведено общее происхождение. Обычно это общее происхождение основано на выравнивании последовательности и сходстве механизма действия. Суперсемейства обычно содержат несколько семейств белков, которые характеризуются сходством последовательностей в пределах семейства. Термин "клан белков" обычно используется для суперсемейств протеаз, основанных на системе классификации протеаз MEROPS.
Алгоритм CLUSTAL W является еще одним примером алгоритма выравнивания последовательностей (см. Thompson et al., Nucleic Acids Res, 22:4673-4680, 1994). Параметры по умолчанию для алгоритма CLUSTAL W включают следующие: штраф за открытие гэпа=10,0; штраф за продление гэпа=0,05; матрица весов выравнивания белка=серия BLOSUM; матрица весов выравнивания ДНК=IUB; отсрочка различающихся последовательностей %=40; расстояние между гэпами=8; вес переходов в ДНК=0,50; перечень гидрофильных остатков=GPSNDQEKR; применение отрицательной матрицы=OFF; переключение специфичных для остатка штрафов=ON; переключение штрафов за гидрофильность=ON и переключение штрафов за выделение концевых гэпов=OFF. В алгоритмы CLUSTAL включены делеции, встречающиеся на любом конце. Например, вариант с делецией пяти аминокислот на любом конце (или в полипептиде) полипептида из 500 аминокислот будет характеризоваться процентной идентичностью последовательности, составляющей 99% (495/500 идентичных остатков × 100), относительно "эталонного" полипептида. Такой вариант будет охвачен вариантом, характеризующимся "по меньшей мере 99% идентичностью последовательности" относительно полипептида.
Используемый в данном документе термин "функциональный анализ" относится к анализу, который обеспечивает показатель активности белка. В некоторых вариантах осуществления данный термин относится к аналитическим системам, в которых белок анализируется на предмет его способности функционировать в контексте его обычной функциональной активности. Например, в случае альфа-L-фукозидазы функциональный анализ может включать определение эффективности альфа-L-фукозидазы в отношении гидролиза альфа-L-фукозидного субстрата.
Гликоконъюгаты, содержащие L-фукозу, важны для множества видов физиологической и патологической активности, таких как воспаление, бактериальные и вирусные инфекции и т. д.
Фукозилированные гликаны распространены в желудочно-кишечном тракте, где их обнаруживают на поверхностях клеток и на муцинах. Муцины представляют собой высокомолекулярные высокогликозилированные белки, обнаруживаемые как в связанной с мембраной, так и в секретируемой форме.
Наличие или отсутствие кишечных рецепторов для F18 обусловлено генетическим фактором. Было продемонстрировано, что восприимчивость к колонизации E. coli, имеющей F18, при отечной болезни обусловлена доминантным аллелем, а устойчивость - рецессивным аллелем (Vogeli et al. (1996) Anim Genet. 27(5): 321-8).
Было показано, что ген, контролирующий экспрессию рецептора F18 E. coli, связан с генами альфа-1,2-L-фукозилтрансферазы 1 (FUT1). Ген FUT1 кодирует галактозид 2-альфа-L-фукозилтрансферазу, которая модифицирует концы гликанов, где происходит адгезия.
У устойчивых к ETEC животных были продемонстрированы значительно более низкие уровни фермента FUT1 (Francis DH (2002) J Swine Health Prod. 10(4):171-5; Meijerink et al. (1997) Mammalian Genome 8:736-41). Было показано, что фукозилтрансферазы участвуют в фукозилировании кишечного эпителия, и, кроме того, уровень фукозилирования изменяется в ходе развития животного (Torres-Pinedo and Mahmood (2004) Biochem Biophys Res Commun 125:546-53; Ruggiero-Lopez et al. (1991) Biochem J 279:801-6; Biol et al. (1987) Pediatr Res 22:250-6).
Группоспецифические антигены являются поверхностными маркерами на мембранах эритроцитов. В целом их определяют как молекулы, образованные путем последовательного добавления сахаридов к углеводным боковым цепям липидов и белков, обнаруженные на эритроцитах и определенных эпителиальных клетках, в том числе тех, которые выстилают желудочно-кишечный, мочевой и дыхательный пути.
Специфические олигосахаридные антигены прикрепляются к белкам и липидам на поверхности эритроцитов. Самый основной прикрепленный олигосахарид называется антигеном О (также называется антигеном H). Группы крови человека зависят от функционирования гликозилтрансфераз, ферментов, которые катализируют образование гликозидных связей между моносахаридами. Специфические олигосахаридные антигены прикрепляются к белкам и липидам на поверхности эритроцитов.
Этот антиген О (или H) является основным олигосахаридом, обнаруженным во всех трех типах крови AB, A и B. Антиген О имеет форму (-липид-глюкоза-галактоза-N-ацетилглюкозамин-галактоза-фукоза). Для группы крови О характерен только антиген О, прикрепленный к эритроцитам.
Было обнаружено, что альфа-1,2-фукозилтрансферазы необходимы для образования группоспецифических антигенов. Антиген О или Н представляет собой фукозу, связанную альфа-1,2-связью с галактозой. В группоспецифических антигенах А GalNAc добавляется к галактозе H-антигена. H- и A-антигены присутствуют у людей и свиней.
Иммунодоминантный моносахарид, который определяет специфичность группы крови А, представляет собой концевой связанный альфа-1,3-связью N-ацетилгалактозамин (GalNAc), тогда как соответствующий моносахарид, специфичный для группы крови B, представляет собой связанную альфа-1,3-связью галактозу (Gal). В клетках группы О отсутствуют оба этих моносахарида на концах их олигосахаридных цепей, которые вместо этого заканчиваются остатками связанной альфа-1,2-связью фукозы (Fuc) и обозначают антиген H.
На фигуре 9 изображена концевая структура антигенов A, B и O. Следует отметить, что, хотя они хорошо известны как антигены крови, эти антигены экспрессируются на большинстве тканей организма и на эпителиальных и эндотелиальных клетках.
На фигуре 10 изображена структурная основа группоспецифических антигенов системы ABО. Трисахаридные эпитопы A и B образуются из общего Н-дисахаридного субстрата альфа-1,3-N-ацетилгалактозаминилтрансферазы (GTA) и альфа-галактозилтрансферазы (GTB). В отличие от этого, стратегия, используемая для ферментативного превращения группоспецифических антигенов А и В в H, предусматривает экзогликозидазы, которые специфически гидролизуют альфа-1,3-GalNAc (с помощью альфа-N-ацетилгалактозидазы, A-зим) или альфа-1,3-галактозу (с помощью альфа-галактозидазы, B-зим) для образования общей структуры H, обнаруживаемой на эритроцитах группы О.
Как показано в нижеприведенных примерах, оказалось, что альфа-L-фукозидаза способна удалять остаток фукозы из трисахарида антигена H1, но, по-видимому, имеет трудности с удалением остатка фукозы из тетрасахарида антигена A, что может быть вызвано пространственным затруднением. Однако полагают, что если альфа-L-фукозидазу объединить с ферментом, способным удалять фрагмент, содержащий альфа-N-ацетилгалактозиламин, тогда альфа-L-фукозидаза сможет удалить фукозу из глюкансодержащей структуры антигена А.
Также возможно превратить группоспецифические антигены B в антигены H с использованием альфа-галактозидазы. Примеры таких ферментов, способных удалять фрагмент, содержащий альфа-N-ацетилгалактозиламин, из глюкансодержащей структуры, включают без ограничения N-ацетилгалактозаминидазу, доступную от New England Biolabs (№ P0734).
Настоящее изобретение относится к способу предупреждения и/или лечения у животного кишечной патогенной инфекции и/или диареи, где патогенная инфекция и/или диарея вызваны патогеном, способным связываться с клеткой кишечника животного, где указанное связывание патогена зависит от наличия участка связывания с патогеном, содержащего по меньшей мере одну гликановую структуру, замещенную по меньшей мере одним альфа-1,2-L-фукозным фрагментом, предусматривающему введение животному эффективного количества гликозидгидролазы, способной удалять по меньшей мере один альфа-1,2-L-фукозный фрагмент из участка связывания с патогеном.
Также в пределах объема настоящего изобретения находятся композиции для предупреждения и/или лечения у животного кишечной патогенной инфекции и/или диареи, где патогенная инфекция и/или диарея вызваны патогеном, способным связываться с клеткой кишечника животного, где указанное связывание патогена зависит от наличия участка связывания с патогеном, содержащего по меньшей мере одну гликановую структуру, замещенную по меньшей мере одним альфа-1,2-L-фукозным фрагментом, предусматривающих введение животному эффективного количества гликозидгидролазы, способной удалять по меньшей мере один альфа-1,2-L-фукозный фрагмент из участка связывания с патогеном.
Во всех раскрытых в данном документе аспектах (способ, композиция или их применения) альфа-L-фукозидаза способна удалять концевую связанную альфа-1,2-связью фукозную группу из гликансодержащей структуры либо самостоятельно, либо в комбинации с ферментом, способным удалять фрагмент, содержащий N-ацетил-галактозиламин, из гликансодержащей структуры. Это дополнительно обсуждается в примерах ниже.
Не вдаваясь в теорию, полагают, что гидролиз концевой связанной альфа-1,2-связью фукозы предотвращает адгезию к клеткам кишечика, например, как в случае фимбрий F18, экспрессируемых ETEC.
Можно использовать любой фермент, такой как гликозидгидролаза, способный удалять по меньшей мере один фукозильный фрагмент, при условии что фукозильный фрагмент удаляется из участка связывания с патогеном или удаляется большая часть участка связывания с патогеном до тех пор, пока удаляется также фукозильный фрагмент. Предпочтительно использовать полипептиды альфа-L-фукозидазы. Гликозидгидролазы, такие как полипептиды альфа-L-фукозидазы по настоящему изобретению, включают выделенные, рекомбинантные, существенно чистые или не встречающиеся в природе полипептиды.
Предпочтительно, полипептиды альфа-L-фукозидазы происходят из семейства гликозидгидролаз 95 (GH95) или семейства гликозидгидролаз 29 (GH 29). Наиболее предпочтительно такие полипептиды альфа-L-фукозидазы входят в семейство GH95.
Целесообразным может быть сконструировать альфа-L-фукозидазу так, чтобы она была стабильной при низком значении рН, а также устойчивой к пепсину. Более того, также целесообразным может быть сконструировать альфа-L-фукозидазу с более широкой субстратной специфичностью, например, со способностью принимать группоспецифические антигены A (и даже B) в качестве субстрата. Другими словами, расширять субстратную специфичность так, чтобы сконструированная альфа-L-фукозидаза была способна удалять остаток фукозы из тетрасахарида А без необходимости добавления альфа-N-ацетилгалактозаминидазы.
В некоторых вариантах осуществления полипептиды пригодны для предупреждения и/или лечения патогенной инфекции и могут быть включены в профилактические и/или терапевтические композиции.
Подходящие альфа-L-фукозидазы можно получить из различных источников, как, например, из Arcanobacterium, Bacillus, Bacteroides, Corynebacterium, Streptococcus, Dictyostelium, Fusarium, Aspergillus, Bifidobacterium, Ignisphaera, Mahella, Cellulophaga, Rubinisphaera, Niastella, Haliscomenobacter, Rhodopirellula, Mycobacterium, Clostridium, Flavobacteriaceae, Ktedonobacter, Listeria, Paludibacter, Prunus, Propionibacterium, Ruminococcus, Thermotoga, Xanthomonas и Lactobacillus. Примеры видов, из которых можно получить альфа-L-фукозидазу, включают Arcanobacterium haemolyticum, Bacillus cereus, Bacillus thuringiensis, Bacillus sp. TS-2, Bacillus bataviensis, Bacillus niacini, Bacillus sp. J13, Bacillus sp. J37, Bacillus lehensis, Bacillus halodurans, Bacillus alcalophilus, Bacillus megaterium, Bacillus cellulosilyticus, Bacillus hemicellulosilyticus, Bacillus okuhidensis, Bacillus butanolivorans, Bacillus pseudalcaliphilus, Bacillus bogoriensis, Bacillus akibai, Bacillus fulminans, Bacteroides fragilis, Bacteroides helcogenes, Streptococcus mitis B6, Streptococcus pneumoniae, Dictyostelium discoideum, Flavobacteriaceae bacterium S85, Fusarium graminearum, Aspergillus niger, Bifidobacterium bifidum, Bifidobacterium longum, Ignispheaera aggregans, Mahella australiensis, Cellulophaga lytica, Cellulophaga algicola, Rubinisphaera brasinliensis, Niastella koreensis, Haliscomenobacter hydrossis, Rhodopirellula baltica, Mycobacterium tuberculosis, Clostridium perfringens, Ktedonobacter racemifer, Listeria monocytogenes, Paludibacter propionicigenes, Prunus dulcis, Propionibacterium acnes, Ruminococcus gnavus, Ruminococcus torques, Thermotoga maritima, Lactobacillus paracasei, Lactobacillus casei и Xanthomonas manihotis.
В еще одном варианте осуществления любые альфа-L-фукозидазы можно применять для реализации на практике раскрытых в данном документе способов и композиций. Например, полипептиды, обладающие фукозидазной активностью, можно получить из Arcanobacterium haemolyticum, Bacillus cereus, Bacillus thuringiensis, Bacillus sp. TS-2, Bacillus bataviensis, Bacillus niacini, Bacillus sp. J13, Bacillus sp. J37, Bacillus lehensis, Bacillus halodurans, Bacillus alcalophilus, Bacillus megaterium, Bacillus cellulosilyticus, Bacillus hemicellulosilyticus, Bacillus okuhidensis, Bacillus butanolivorans, Bacillus pseudalcaliphilus, Bacillus bogoriensis, Bacillus akibai, Bacillus fulminans, Bacteroides fragilis, Bacteroides helcogenes, Streptococcus mitis B6, Streptococcus pneumoniae, Dictyostelium discoideum, Flavobacteriaceae bacterium S85, Fusarium graminearum, Aspergillus niger, Bifidobacterium bifidum, Bifidobacterium longum, Ignispheaera aggregans, Mahella australiensis, Cellulophaga lytica, Cellulophaga algicola, Rubinisphaera brasinliensis, Niastella koreensis, Haliscomenobacter hydrossis, Rhodopirellula baltica, Mycobacterium tuberculosis, Clostridium perfringens, Ktedonobacter racemifer, Listeria monocytogenes, Paludibacter propionicigenes, Prunus dulcis, Propionibacterium acnes, Ruminococcus gnavus, Ruminococcus torques, Thermotoga maritima, Lactobacillus paracasei, Lactobacillus casei и Xanthomonas manihotis, или из последовательности, характеризующейся по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 90%, 95%, 98%, 99% идентичностью с последовательностью фукозидазы из Arcanobacterium haemolyticum, Bacillus cereus, Bacillus thuringiensis, Bacillus sp. TS-2, Bacillus bataviensis, Bacillus niacini, Bacillus sp. J13, Bacillus sp. J37, Bacillus lehensis, Bacillus halodurans, Bacillus alcalophilus, Bacillus megaterium, Bacillus cellulosilyticus, Bacillus hemicellulosilyticus, Bacillus okuhidensis, Bacillus butanolivorans, Bacillus pseudalcaliphilus, Bacillus bogoriensis, Bacillus akibai, Bacillus fulminans, Bacteroides fragilis, Bacteroides helcogenes, Streptococcus mitis B6, Streptococcus pneumoniae, Dictyostelium discoideum, Flavobacteriaceae bacterium S85, Fusarium graminearum, Aspergillus niger, Bifidobacterium bifidum, Bifidobacterium longum, Ignispheaera aggregans, Mahella australiensis, Cellulophaga lytica, Cellulophaga algicola, Rubinisphaera brasinliensis, Niastella koreensis, Haliscomenobacter hydrossis, Rhodopirellula baltica, Mycobacterium tuberculosis, Clostridium perfringens, Ktedonobacter racemifer, Listeria monocytogenes, Paludibacter propionicigenes, Prunus dulcis, Propionibacterium acnes, Ruminococcus gnavus, Ruminococcus torques, Thermotoga maritima, Lactobacillus paracasei, Lactobacillus casei и Xanthomonas manihotis, или из полипептида, который отличается от любой из вышеупомянутых последовательностей одним или несколькими аминокислотными добавлениями, делециями и/или заменами; или из полинуклеотида, который экспрессирует любую из вышеуказанных фукозидазных последовательностей.
Гомология может быть определена путем выравнивания аминокислотных последовательностей, например, с использованием программы, такой как BLAST, ALIGN или CLUSTAL, которые описаны в данном документе. В некоторых вариантах осуществления полипептид представляет собой выделенный, рекомбинантный, существенно чистый или не встречающийся в природе фермент, который способен удалять, как минимум, по меньшей мере один фукозильный фрагмент из участка связывания с патогеном. Возможно, что этот полипептид может удалять большую часть участка связывания с патогеном при условии, что также удаляется по меньшей мере один фукозильный фрагмент. Предпочтительно, данный фермент обладает альфа-L-фукозидазной активностью или катализирует отщепление концевой связанной альфа-1,2-связью фукозной группы от полисахарида, такого как альфа-L-фукозид.
Специалисту в данной области техники будет очевидно, что полноразмерную и/или зрелую альфа-L-фукозидазу можно получить с применением любой известной из уровня техники методики.
В другом аспекте предусмотрена любая выделенная, рекомбинантная, существенно чистая, полученная синтетическим способом или не встречающаяся в природе нуклеиновая кислота, содержащая нуклеотидную последовательность, кодирующую любой полипептид (в том числе любой слитый белок и т. д.), который способен удалять, как минимум, по меньшей мере один фукозильный фрагмент из участка связывания с патогеном. Возможно, что этот полипептид может удалять большую часть участка связывания с патогеном при условии, что также удаляется по меньшей мере один фукозильный фрагмент.
Также представляет интерес вектор, содержащий полинуклеотид, кодирующий глюкозогидролазу, такую как альфа-L-фукозидазный фермент, который гидролизует L-фукозный фрагмент в альфа-1,2-L-фукозиде.
Специалисту в данной области техники будет очевидно, что вектор может представлять собой любой подходящий вектор экспрессии и что выбор вектора может изменяться в зависимости от типа клетки, в которую предполагают вставлять вектор. Подходящие векторы включают pGAPT-PG, pRAX1, pGAMD, pGPT-pyrG1, pC194, pJH101, pE194 и pHP13 (см. Harwood и Cutting [eds.], Chapter 3, Molecular Biological Methods for Bacillus, John Wiley & Sons [1990]). См. также Perego, Integrational Vectors for Genetic Manipulations in Bacillus subtilis в Sonenshein et al., [eds.] Bacillus subtilis and Other Gram-Positive Bacteria: Biochemistry, Physiology and Molecular Genetics, American Society for Microbiology, Washington, D.C. [1993], pp. 615-624) и p2JM103BBI.
Вектор экспрессии может быть одним из множества векторов или кассет, пригодных для трансформации подходящих продуцирующих хозяев, известных в данной области техники. Обычно вектор или кассета будет включать последовательности, управляющие транскрипцией и трансляцией соответствующего гена, селектируемый маркер и последовательности, обеспечивающие автономную репликацию или интеграцию в хромосому. Подходящие векторы, как правило, включают 5'-участок гена, который несет элементы, управляющие инициацией транскрипции, и 3'-участок фрагмента ДНК, который управляет терминацией транскрипции. Оба управляющих участка можно получить из генов, гомологичных генам трансформированной продуцирующей клетки-хозяина, и/или генов, нативных для продуцирующего хозяина, хотя такие управляющие участки могут быть получены и не таким способом.
Фрагменты ДНК, которые управляют терминацией транскрипции, также можно получить из различных генов, нативных для предпочтительной продуцирующей клетки-хозяина. В определенных вариантах осуществления включение участка для управления терминацией является необязательным. В определенных вариантах осуществления вектор экспрессии включает участок управления терминацией, полученный из предпочтительной клетки-хозяина.
Вектор экспрессии может быть включен в продуцирующего хозяина, в частности в клетки микробных продуцирующих хозяев. Продуцирующие клетки-хозяева могут быть микробными хозяевами, обнаруживаемыми среди семейств грибов или бактерий, и которые растут в широком диапазоне значений температуры, рН и устойчивости к растворителям. Например, предполагается, что любая из бактерий, водорослей и грибов, таких как нитчатые грибы и дрожжи, может соответствующим образом вмещать вектор экспрессии.
Включение вектора экспрессии в продуцирующую клетку-хозяина можно использовать для экспрессии представляющего интерес белка, так что он может находиться внутриклеточно, внеклеточно или комбинированно как внутри, так и снаружи клетки. Внеклеточная экспрессия обеспечивает более легкое извлечение требуемого белка из продукта ферментации, чем в случае способов извлечения белка, получаемого при внутриклеточной экспрессии.
Рекомбинантным вектором экспрессии может быть любой вектор, такой как плазмида или вирус, который может быть легко подвергнут процедурам рекомбинантной ДНК и привести к экспрессии нуклеотидной последовательности. Выбор вектора обычно зависит от совместимости вектора с продуцирующим хозяином, в который предполагают вводить вектор. Векторами могут быть линейные или замкнутые кольцевые плазмиды. Вектор может представлять собой автономно реплицирующийся вектор, т. е. вектор, который существует как внехромосомный объект, репликация которого не зависит от репликации хромосом, например, плазмида, внехромосомный элемент, минихромосома или искусственная хромосома. Вектор может содержать любые средства для обеспечения саморепликации. В качестве альтернативы, вектор может представлять собой такой вектор, который при введении в продуцирующего хозяина интегрируется в геном и реплицируется вместе с хромосомой(хромосомами), в которую(которые) он интегрировался. Некоторые неограничивающие примеры таких векторов приведены в каталоге штаммов Fungal Genetics Stock Center (FGSC, "www.fgsc.net"). Дополнительные примеры подходящих векторов экспрессии и/или интеграции представлены в Sambrook et al., (1989) выше, Ausubel (1987) выше, van den Hondel et al. (1991) в Bennett и Lasure (Eds.) MORE GENE MANIPULATIONS IN FUNGI, Academic Press. 396-428 и в патенте США № 5874276. Особенно пригодные векторы включают pTREX, pFB6, pBR322, PUCI8, pUCI00 и pENTR/D. Подходящие для применения в бактериальных клетках плазмиды включают pBR322 и pUC19, обеспечивающие возможность репликации в E. coli, и pE194, например, обеспечивающая возможность репликации в Bacillus.
Вкратце, что касается продуцирования в продуцирующих клетках-хозяевах можно сделать ссылку на Sambrook et al., (1989) выше, Ausubel (1987) выше, van den Hondel et al. (1991) в Bennett и Lasure (Eds.) MORE GENE MANIPULATIONS IN FUNGI, Academic Press (1991) pp. 70-76 и 396-428; Nunberg et al., (1984) Mol. Cell BioI. 4:2306-2315; Boel et al., (1984) 30 EMBO J. 3:1581-1585; Finkelstein в BIOTECHNOLOGY OF FILAMENTOUS FUNGI, Finkelstein et al. Eds. Butterworth-Heinemann, Boston, MA (1992), Chap. 6; Kinghorn et al. (1992) APPLIED MOLECULAR GENETICS OF FILAMENTOUS FUNGI, Blackie Academic and Professional, Chapman and Hall, London; Kelley et al., (1985) EMBO J. 4:475-479; Penttila et al., (1987) Gene 61: 155-164; и патент США № 5874276. Перечень подходящих векторов можно найти в каталоге штаммов Fungal Genetics Stock Center (FGSC, www at fgsc.net). Подходящие векторы включают векторы, полученные, например, от Invitrogen Life Technologies и Promega. Конкретные векторы, подходящие для применения в грибковых клетках-хозяевах, включают такие векторы, как pFB6, pBR322, pUC 18, pUC100, pDON™201, pDONR™221, pENTR™, pGEM®3Z и pGEM®4Z.
Векторная система может представлять собой один вектор или плазмиду или два или более векторов или плазмид, которые вместе содержат полную ДНК, подлежащую введению в геном клетки-хозяина, или транспозон.
Вектор также может содержать один или несколько селектируемых маркеров для обеспечения легкого отбора трансформированных клеток. Селектируемым маркером является ген, продукт которого обеспечивает биоцидную или вирусную резистентность и т. п. Примеры селектируемых маркеров включают таковые, которые придают противомикробную резистентность. Маркеры, связанные с питанием, также находят применение в настоящем изобретении, в том числе те маркеры, которые известны из уровня техники как amdS, argB и pyr4. Маркеры, пригодные для трансформации Trichoderma, известны из уровня техники (см., например, Finkelstein, chapter 6 в Biotechnology of Filamentous Fungi, Finkelstein et al., EDS Butterworth-Heinemann, Boston, MA (1992) и Kinghorn et al., (1992) Applied Molecular Genetics of Filamentous Fungi, Blackie Academic and Professional, Chapman and Hall, London). В некоторых вариантах осуществления векторы экспрессии также будут включать репликон, ген, кодирующий резистентность к антибиотикам, для обеспечения отбора бактерий, несущих рекомбинантные плазмиды, и уникальные сайты рестрикции в несущественных участках плазмиды для обеспечения возможности вставки гетерологичных последовательностей. Выбор конкретного гена резистентности к антибиотикам не является критическим; подходит любой из множества генов резистентности, известных из уровня техники. Прокариотические последовательности предпочтительно выбирают так, чтобы они не мешали репликации или интеграции ДНК в Trichoderma reesei.
Вектор также может содержать элемент(элементы), обеспечивающий(обеспечивающие) возможность стабильной интеграции вектора в геном продуцирующего хозяина или автономной репликации вектора в продуцирующем хозяине независимо от генома клетки. Для интеграции в геном клетки-хозяина вектор может опираться на нуклеотидную последовательность, кодирующую аспарагиновую протеазу, или любой другой элемент вектора для стабильной интеграции вектора в геном путем гомологичной или негомологичной рекомбинации.
Для автономной репликации вектор может дополнительно содержать точку начала репликации, позволяющую вектору автономно реплицироваться в продуцирующем хозяине.
Более чем одна копия нуклеотидной последовательности, кодирующей альфа-L-фукозидазу, может быть вставлена в продуцирующего хозяина для увеличения продуцирования альфа-L-фукозидазы. Увеличение количества копий нуклеотидной последовательности можно получить путем интеграции по меньшей мере одной дополнительной копии последовательности в геном продуцирующего хозяина или путем включения амплифицируемого селектируемого маркерного гена, и при этом дополнительные копии нуклеотидной последовательности можно отобрать при культивировании продуцирующих клеток-хозяев в присутствии подходящего селектирующего средства.
Вектор, содержащий нуклеотидную последовательность, кодирующую альфа-L-фукозидазу, вводят в продуцирующего хозяина таким образом, что вектор поддерживается как компонент хромосомы или как самореплицирующийся внехромосомный вектор. Как правило, интеграция рассматривается как преимущество, поскольку нуклеотидная последовательность с большей вероятностью будет стабильно поддерживаться продуцирующим хозяином. Интеграция вектора в хромосому продуцирующего хозяина может происходить путем гомологичной или негомологичной рекомбинации, как обсуждалось выше.
Иллюстративные векторы включают без ограничения pGXT (аналогичен вектору pTTTpyr2, описанному в опубликованной заявке согласно РСТ WO2015/017256). Можно также упомянуть стандартные бактериальные векторы экспрессии, включающие бактериофаги λ и М13, а также плазмиды, такие как плазмиды на основе pBR322, pSKF, pET23D, и слитые системы экспрессии, такие как MBP, GST и LacZ. Также эпитопные метки могут быть добавлены к рекомбинантным белкам для обеспечения удобных способов выделения, например, c-myc.
Примеры подходящих векторов экспрессии и/или интеграции приведены в Sambrook et al., (1989) выше, Bennett и Lasure (Eds.) More Gene Manipulations in Fungi, (1991) Academic Press pp. 70-76 и pp. 396-428 и статьях, цитируемых в ней; в патенте США № 5874276 и каталоге штаммов Fungal Genetic Stock Center (FGSC, www.fgsc.net.). Пригодные векторы могут быть получены от Promega и Invitrogen. Некоторые конкретные пригодные векторы включают pBR322, pUC18, pUC100, pDON™201, pENTR™, pGEN®3Z и pGEN®4Z. Однако можно также применять другие формы векторов экспрессии, которые выполняют эквивалентные функции и которые являются или становятся известными в данной области техники. Таким образом, для экспрессии последовательностей ДНК, раскрытых в данном документе, можно использовать большое количество комбинаций хозяин/вектор экспрессии. Например, пригодные векторы экспрессии могут состоять из сегментов хромосомных, нехромосомных и синтетических последовательностей ДНК, таких как различные известные производные SV40 и известные бактериальные плазмиды, например, плазмиды из E. coli, в том числе col E1, pCR1, pBR322, pMb9, pUC19 и их производные, плазмиды для более широкого диапазона хозяев, например RP4, фаговые ДНК, например, многочисленные производные фага лямбда, например NM989, и другие ДНК-содержащие фаги, например M13 и нитчатые фаги, содержащие одноцепочечную ДНК, дрожжевые плазмиды, такие как плазмида 2.mu или ее производные.
Выбор продуцирующего хозяина может представлять собой любой подходящий микроорганизм, такой как бактерии, грибы и водоросли. Обычно выбор будет зависеть от гена, кодирующего представляющую интерес гликозидгидролазу, такую как альфа-L-фукозидаза.
Примеры подходящих продуцирующих хозяев включают без ограничения бактериальные, грибковые, растительные клетки и т. д. Предпочтительно, продуцирующий хозяин может быть выбран из E. coli, Streptomyces, Hansenula, Trichoderma (в частности T. reesei), Bacillus, Lactobacillus, Aspergillus (в частности A. niger), растительной клетки и/или спор Bacillus, Trichoderma или Aspergillus.
В некоторых вариантах осуществления рекомбинантный альфа-L-фукозидазный фермент можно применять в раскрытых в данном документе способах и композициях. В предпочтительном аспекте предусмотрена пищевая или кормовая добавка, содержащая альфа-L-фукозидазный фермент, который способен гидролизировать L-фукозу в альфа-L-фукозидазе.
Множество стандартных способов трансфекции можно применять для получения линий клеток бактерий и нитчатых грибов (например, Aspergillus или Trichoderma), которые экспрессируют большие количества требуемой гликозидгидролазы, такой как альфа-L-фукозидаза. Некоторые из опубликованных способов введения ДНК-конструкций в продуцирующие целлюлазу штаммы Trichoderma включают Lorito, Hayes, DiPietro and Harman, (1993) Curr. Genet. 24: 349-356; Goldman, VanMontagu and Herrera-Estrella, (1990) Curr. Genet. 17:169-174; и Penttila, Nevalainen, Ratto, Salminen and Knowles, (1987) Gene 6: 155-164, также см. патент США № 6022725; патент США № 6268328 и Nevalainen et al., "The Molecular Biology of Trichoderma and its Application to the Expression of Both Homologous and Heterologous Genes" в Molecular Industrial Mycology, Eds, Leong and Berka, Marcel Dekker Inc., NY (1992) pp. 129-148; для Aspergillus включают Yelton, Hamer and Timberlake, (1984) Proc. Natl. Acad. Sci. USA 81: 1470-1474, для Fusarium включают Bajar, Podila and Kolattukudy, (1991) Proc. Natl. Acad. Sci. USA 88: 8202-8212, для Streptomyces включают Hopwood et al., 1985, Genetic Manipulation of Streptomyces: Laboratory Manual, The John Innes Foundation, Norwich, UK, и Fernandez-Abalos et al., Microbiol 149:1623-1632 (2003), и для Bacillus включают Brigidi, DeRossi, Bertarini, Riccardi and Matteuzzi, (1990) FEMS Microbiol. Lett. 55: 135-138).
Однако можно применять любую из хорошо известных процедур введения чужеродных нуклеотидных последовательностей в клетки-хозяева. Они включают применение трансфекции с фосфатом кальция, полибрена, слияния протопластов, электропорации, биолистики, липосом, микроинъекции, плазматических векторов, вирусных векторов и любых других хорошо известных способов введения клонируемой геномной ДНК, кДНК, синтетической ДНК или другого чужеродного генетического материала в клетку-хозяина (см., например, Sambrook et al. выше). Также применим способ трансфекции, опосредованной Agrobacterium, описанный в патенте США № 6255115. Необходимо только, чтобы конкретная применяемая процедура генетической инженерии могла обеспечить успешное введение по меньшей мере одного гена в клетку-хозяина, способную экспрессировать этот ген.
В зависимости от применяемой клетки-хозяина могут быть выполнены посттранскрипционные и/или посттрансляционные модификации. Одним из неограничивающих примеров посттранскрипционной и/или посттрансляционной модификации является "обрезание" или "усечение" полипептида. Например, это может привести к переходу гликозидгидролазы, описанной в данном документе, такой как альфа-L-фукозидаза, из неактивного или по сути неактивного состояния в активное состояние, как в случае пропептида, подвергающегося дополнительному посттрансляционному процессингу в зрелый пептид, обладающий ферментативной активностью. В другом случае это обрезание может приводить к получению зрелой гликозидгидролазы, описанной в данном документе, такой как полипептид альфа-L-фукозидазы, и дополнительному удалению N- или C-концевых аминокислот с образованием усеченных форм альфа-L-фукозидазы, которые сохраняют ферментативную активность.
Другие примеры посттранскрипционных или посттрансляционных модификаций включают без ограничения миристоилирование, гликозилирование, усечение, липидизацию и фосфорилирование тирозина, серина или треонина. Специалисту в данной области техники будет понятно, что тип посттранскрипционных или посттрансляционных модификаций, которым может подвергаться белок, может зависеть от организма-хозяина, в котором экспрессируется белок.
Способы трансформации Aspergillus и Trichoderma описаны, например, в Yelton et al. (1984) Proc. Natl. Acad. Sci. USA 81: 1470-1474; Berka et al., (1991) в Applications of Enzyme Biotechnology, Eds. Kelly and Baldwin, Plenum Press (NY); Cao et al., (2000) Sci. 9:991-1001; Campbell et al., (1989) Curro Genet. 16:53-56; Pentilla et al., (1987) Gene 61:155-164); de Groot et al., (1998) Nat. Biotechnol. 16:839-842; в патенте США № 6022725; патенте США № 6268328 и Европейском патенте № 238023. Экспрессия гетерологичного белка в Trichoderma описана в патенте США № 6022725; патенте США № 6268328; Harkki et al. (1991); Enzyme Microb. Technol. 13:227-233; Harkki et al., (1989) Bio Technol. 7:596-603; Европейском патенте № 244234; Европейском патенте № 215594 и Nevalainen et al., "The Molecular Biology of Trichoderma and its Application to the Expression of Both Homologous and Heterologous Genes", в MOLECULAR INDUSTRIAL MYCOLOGY, Eds. Leong and Berka, Marcel Dekker Inc., NY (1992) pp. 129-148). Что касается трансформации штаммов Fusarium, ссылка также делается на W096100787 и Bajar et al., (1991) Proc. Natl. Acad. Sci. USA 88:8202-28212.
После введения вектора экспрессии в клетки трансфицированные или трансформированные клетки культивируют в условиях, способствующих экспрессии генов под управлением промоторных последовательностей. В некоторых случаях промоторная последовательность представляет собой промотор cbh1. Большие партии трансформированных клеток можно культивировать, как описано в Ilmen et al 1997 ("Regulation of cellulase gene expression in the filamentous fungus Trichoderma reesei." Appl. Envir. Microbiol. 63:1298-1306).
Поглощение ДНК штаммом-хозяином вида Trichoderma зависит от концентрации ионов кальция. Как правило, в поглощаемом растворе используют приблизительно 10-50 мM CaCl2. Дополнительные подходящие соединения включают буферную систему, такую как буфер TE (10 мM Tris, pH 7,4; 1 мM EDTA) или 10 мM MOPS, pH 6,0 и полиэтиленгликоль. Предполагается, что полиэтиленгликоль сливает клеточные мембраны, за счет чего обеспечивается возможность доставки содержимого среды в цитоплазму штамма из вида Trichoderma. Это слияние зачастую обеспечивает интеграцию нескольких копий плазмидной ДНК в хромосому хозяина.
Обычно при трансформации вида Trichoderma используют протопласты или клетки, которые были подвергнуты обработке для проницаемости, как правило, при плотности 105-107/мл, в частности 2×106/мл. Эти протопласты или клетки в объеме 100 мкл в соответствующем растворе (например, 1,2 M сорбита и 50 мM CaCl2) можно смешать с требуемой ДНК. Как правило, в поглощаемый раствор добавляют PEG в высокой концентрации. От 0,1 до 1 объема 25% PEG 4000 можно добавлять в суспензию протопластов; однако целесообразно добавлять приблизительно 0,25 объема в суспензию протопластов. Добавки, такие как диметилсульфоксид, гепарин, спермидин, хлорид калия и т. п., также можно добавлять в поглощаемый раствор для содействия трансформации. Подобные методики доступны для других грибковых клеток-хозяев. См., например, патент США № 6022725.
Средой, применяемой для культивирования клеток, может быть любая традиционная среда, подходящая для выращивания клетки-хозяина и обеспечения экспрессии полипептида альфа-фукозидазы. Подходящие среды и компоненты сред доступны от коммерческих поставщиков или могут быть получены в соответствии с опубликованными рецептурами (например, описанными в каталогах Американской коллекции типовых культур).
В некоторых вариантах осуществления получения отработанного цельного ферментационного бульона с рекомбинантным микроорганизмом можно достичь с применением любого способа культивирования, известного из уровня техники, приводящего к экспрессии представляющего интерес фермента. Таким образом, ферментация может подразумеваться как включающая культивирование во встряхиваемой колбе, мелкомасштабную или крупномасштабную ферментацию (в том числе непрерывный, периодический, периодический с подпиткой или твердофазный типы ферментации) в лабораторных или промышленных ферментерах, выполненную в подходящей среде и в условиях, обеспечивающих возможность экспрессии или выделения фермента. Термин "отработанный цельный ферментационный бульон" определяется в данном документе как нефракционированное содержимое ферментационного материала, которое включает культуральную среду, внеклеточные белки (например, ферменты) и клеточную биомассу. Понятно, что термин "отработанный цельный ферментационный бульон" также охватывает клеточную биомассу, которая была подвергнута лизису или пермеабилизации с применением способов, хорошо известных из уровня техники.
Клетки-хозяева можно культивировать в подходящих условиях, которые обеспечивают возможность экспрессии альфа-глюкозидазы. Экспрессия ферментов может быть конститутивной, такой, при которой они продуцируются непрерывно, или индуцируемой, требующей стимуляции для инициирования экспрессии. В случае индуцируемой экспрессии продуцирование белка можно инициировать, когда это необходимо, путем, например, добавления в культуральную среду вещества-стимулятора, например, дексаметазона, или IPTG, или софорозы.
Полипептиды также можно получить рекомбинантным способом в бесклеточной системе in vitro, такой как система ретикулоцитов кролика TNT™ (Promega). Экспрессирующий хозяин также может культивироваться в соответствующей для хозяина среде в аэробных условиях. Может быть предусмотрено встряхивание или сочетание перемешивания и аэрации, при этом продуцирование происходит при соответствующей температуре для этого хозяина, например, от приблизительно 25°C до приблизительно 75°C (например, от 30°C до 45°C), в зависимости от потребности хозяина и получения требуемой альфа-глюкозидазы. Культивирование может происходить в течение от приблизительно 12 до приблизительно 100 часов или более (и любое значение для времени в этом промежутке, например, 24-72 часа). Обычно значение рН культурального бульона составляет от приблизительно 4,0 до приблизительно 8,0, также в зависимости от условий культивирования, необходимых хозяину для получения представляющего интерес фермента, такого как фукозидаза. В силу этого продуцирующих хозяев и трансформированные клетки можно культивировать в традиционных питательных средах. Культуральная среда для трансформированных клеток-хозяев может быть модифицирована соответствующим образом для активации промоторов и отбора трансформированных клеток. Конкретными условиями культивирования, такими как температура, рН и т. п., могут быть таковые, которые используются для клетки-хозяина, выбранной для экспрессии, и будут очевидны для специалистов в данной области техники. Кроме того, предпочтительные условия культивирования можно найти в научной литературе, такой как Sambrook, (1982) выше; Kieser, T, MJ. Bibb, MJ. Buttner, KF Chater and D.A. Hopwood (2000) Practical Streptomyces Genetics. John Innes Foundation, Norwich UK; Harwood, et al., (1990) Molecular Biological Methods for Bacillus, John Wiley и/или от Американской коллекции типовых культур (ATCC; www.atcc.org).
Любой из способов ферментации, хорошо известных в данной области техники, можно подходящим образом применять для ферментации трансформированного или производного грибкового штамма, описанного выше.
Классическая периодическая ферментация представляет собой замкнутую систему, в которой композицию среды устанавливают в начале ферментации и эту композицию не изменяют в ходе ферментации. В начале ферментации среду инокулируют требуемым(требуемыми) организмом(организмами). Другими словами, весь процесс ферментации происходит без добавления каких-либо компонентов в систему ферментации в течение всего периода.
В качестве альтернативы, периодическая ферментация определяется как "периодическая" в отношении добавления источника углерода. Кроме того, часто предпринимаются попытки контролировать такие факторы, как рН и концентрация кислорода в процессе ферментации. Обычно композиции метаболитов и биомассы периодической системы постоянно изменяются до момента прекращения ферментации. В периодических культурах клетки проходят через статическую лаг-фазу в экспоненциальную фазу высокого роста и, наконец, в стационарную фазу, где скорость роста уменьшается или останавливается. Необработанные клетки в стационарной фазе в конечном итоге погибают. Как правило, клетки в экспоненциальной фазе отвечают за основную часть продуцирования продукта. Подходящим вариантом стандартной периодической системы является система "периодической ферментации с подпиткой". В этом варианте типичной периодической системы субстрат добавляют постепенно, по мере того, как проходит ферментация. Периодические системы с подпиткой пригодны, если известно, что катаболитная репрессия будет ингибировать метаболизм клеток, и/или в случае, когда желательно иметь ограниченное количество субстратов в ферментационной среде. Измерение фактической концентрации субстрата в периодических системах с подпиткой затруднено, и поэтому ее оценивают на основании изменений измеряемых факторов, таких как pH, растворенный кислород и парциальное давление отходящих газов, таких как CO2. Периодический и периодический с подпиткой типы ферментации хорошо известны из уровня техники.
Непрерывная ферментация является еще одним известным способом ферментации. Она представляет собой открытую систему, в которой определенную ферментационную среду непрерывно добавляют в биореактор и равное количество кондиционированной среды одновременно удаляют на переработку. При непрерывной ферментации культуры, как правило, поддерживают при постоянной плотности, где клетки преимущественно находятся в экспоненциальной фазе роста. Непрерывная ферментация позволяет модулировать один или несколько факторов, влияющих на рост клеток и/или концентрацию продукта. Например, лимитирующее питательное вещество, такое как источник углерода или источник азота, может поддерживаться на фиксированном уровне, а всем другим параметрам позволяют снижаться. В других системах ряд факторов, влияющих на рост, может изменяться непрерывно, тогда как концентрация клеток, измеряемая по мутности среды, поддерживается постоянной. В непрерывных системах стремятся поддерживать устойчивые условия роста. Таким образом, потеря клеток из-за извлечения среды должна быть пропорциональной скорости роста клеток при ферментации. Способы модуляции питательных веществ и факторов роста для непрерывных способов ферментации, а также методики увеличения до максимума скорости образования продукта хорошо известны в области промышленной микробиологии.
Методики разделения и концентрирования известны из уровня техники, и традиционные способы можно применять для получения концентрированного раствора или бульона, содержащего полипептид альфа-глюкозидазы по настоящему изобретению.
После ферментации получают ферментационный бульон, удаляют микробные клетки и различные взвешенные твердые вещества, в том числе остаточные сырьевые материалы для ферментации, с помощью традиционных методик разделения с целью получения раствора, содержащего фермент. Как правило, применяют фильтрацию, центрифугирование, микрофильтрацию, вакуум-фильтрацию во вращающемся барабане, ультрафильтрацию, центрифугирование с последующей ультрафильтрацией, экстракцией или хроматографией или подобное.
Иногда может быть целесообразно сконцентрировать раствор или бульон, содержащий представляющий интерес полипептид, для оптимизации извлечения. Применение неконцентрированных растворов или бульона обычно увеличивает время инкубации для сбора осадка обогащенного или очищенного фермента.
Раствор, содержащий фермент, можно концентрировать с применением традиционных методик концентрирования до тех пор, пока не будет достигнут требуемый уровень фермента. Концентрирование раствора, содержащего фермент, может быть достигнуто с помощью методик, описанных в данном документе. Примеры способов обогащения и очистки включают без ограничения вакуум-фильтрацию во вращающемся барабане и/или ультрафильтрацию.
Гликозидгидролазу, описываемую в данном документе, такую как альфа-L-фукозидазный фермент, описываемый в данном документе, можно тестировать в отношении активности с применением ряда тестов, известных из уровня техники. Например, активность можно тестировать путем объединения фермента с гликопротеином или олигосахаридом и водой при необходимости. Активность можно измерить путем анализа продуктов реакции, которые можно разделить и визуализировать, например, с помощью тонкослойной хроматографии или спектрофотометрии. Примером спектрофотометрического анализа фукозы является набор K-FUCOSE от Megazyme (Cao et al. (2014) J Biol Chem 289(37):25624-38).
Способ, раскрытый в данном документе, дополнительно предусматривает введение животному эффективного количества гликозидгидролазы, такой как альфа-L-фукозидаза, в комбинации с по меньшей мере одним пробиотиком отдельно, либо в комбинации с по меньшей мере одной протеазой.
Более того, гликозидгидролаза, описанная в данном документе, такая как альфа-L-фукозидаза, либо отдельно, либо в комбинации с по меньшей мере одним пробиотиком отдельно и/или в комбинации с по меньшей мере одной протеазой, может быть инкапсулирована для применения в корме или премиксе для животных. Кроме того, гликозидгидролаза, описанная в данном документе, такая как альфа-L-фукозидаза, либо отдельно, либо в комбинации с по меньшей мере одним пробиотиком отдельно и/или в комбинации с по меньшей мере одной протеазой, будь то инкапсулированная либо неинкапсулированная, может быть в форме гранулы.
Считается, что гликозидгидролазу, описанную в данном документе, такую как альфа-L-фукозидазный фермент, описанный в данном документе, можно применять в комбинации с одним или несколькими дополнительными ферментами. В некоторых вариантах осуществления один или несколько дополнительных ферментов выбраны из группы, состоящей из ферментов, которые участвуют в разрушении белка, в том числе карбоксипептидаз, предпочтительно карбоксипептидазы А, карбоксипептидазы Y, протеаз аспарагиновой кислоты PEPAa, PEPAb, PEPAc и PEPAd из A. niger, эластазы, аминопептидаз, пепсина или пепсиноподобных, трипсина или трипсиноподобных протеаз, кислых грибковых протеаз и бактериальных протеаз, в том числе субтилизина и его вариантов, а также ферментов, которые участвует в метаболизме крахмала, разрушении волокон, метаболизме липидов, белков или ферментов, участвующих в метаболизме гликогена, ферментов, которые разрушают другие загрязнители, ацетилэстераз, амилаз, арабиназ, арабинофуранозидаз, экзо- и эндопептидаз, каталаз, целлюлаз, хитиназ, химозина, кутиназы, дезоксирибонуклеаз, эпимераз, эстераз, формамидазы, галактозидаз, например α- или β-галактозидазы, экзоглюканаз, глюканлиаз, эндоглюканаз, глюкоамилаз, глюкозооксидаз, глюкозидаз, например α- или β-глюкозидаз, глюкуронидаз, гемицеллюлаз, гидролаз, инвертаз, изомераз, лакказ, фенолоксидаз, липазы, лиаз, маннозидаз, оксидаз, оксидоредуктаз, пектиназы, пектатлиаз, пектинацетилэстераз, пектиндеполимераз, пептидазы, пектинметилэстераз, пектинолитических ферментов, пероксидаз, фенолоксидаз, фитазы, полигалактуроназ, рамногалактуроназ, рибонуклеаз, тауматина, трансфераз, транспортных белков, трансглутаминаз, ксиланаз, гексозоксидазы (D-гексоза: (3/4-оксидоредуктаза, ЕС 1.1.3.5), кислых фосфатаз и/или других или их комбинаций. Они включают ферменты, которые, например, модулируют вязкость композиции или корма.
Более того, гликозидгидролаза, описанная в данном документе, такая как альфа-L-фукозидаза, может быть инкапсулирована так, чтобы выдерживать кислый рН, создаваемый в желудке.
Гликозидгидролаза, описанная в данном документе, такая как альфа-L-фукозидаза, будь то инкапсулированная либо неинкапсулированная, может применяться отдельно или в комбинации с по меньшей мере одним пробиотиком и может вводиться с кормом или премиксом для животных.
Гликозидгидролаза, описанная в данном документе, такая как альфа-L-фукозидаза, будь то инкапсулированная либо неинкапсулированная, может применяться отдельно или в комбинации с по меньшей мере одним пробиотиком и по меньшей мере одной протеазой и может вводиться с кормом или премиксом для животных.
Более того, гликозидгидролаза, описанная в данном документе, такая как альфа-L-фукозидаза, будь то инкапсулированная либо неинкапсулированная, может применяться отдельно или в комбинации с по меньшей мере одним пробиотиком и может вводиться с кормом или премиксом для животных, и при этом альфа-L-фукозидаза может быть в форме гранул или жидкости. Предпочтительной формой является гранула.
Также в объем настоящего изобретения включены композиции для предупреждения и/или лечения у животного кишечной патогенной инфекции и/или диареи, где патогенная инфекция вызвана патогеном, способным связываться с клеткой кишечника животного, где указанное связывание патогена зависит от наличия участка связывания с патогеном, содержащего по меньшей мере одну гликановую структуру, замещенную по меньшей мере одним альфа-1,2-L-фукозным фрагментом, предусматривающих введение животному эффективного количества гликозидгидролазы, способной удалять по меньшей мере один альфа-1,2-L-фукозный фрагмент из участка связывания с патогеном.
Как было отмечено выше, гликозидгидролаза, такая как альфа-L-фукозидаза, должна быть способна удалять концевую связанную альфа-1,2-связью фукозную группу из гликансодержащей структуры либо самостоятельно, либо в комбинации с ферментом, способным удалять фрагмент, содержащий N-ацетилгалактозиламин, из гликансодержащей структуры. Предпочтительно альфа-L-фукозидаза выбрана из группы, состоящей из семейства гликозидгидролаз 95 (GH95) и семейства гликозидгидролаз 29 (GH 29), и наиболее предпочтительно альфа-L-фукозидаза выбрана из группы, состоящей из семейства гликозидгидролаз 95 (GH95).
Эту композицию можно применять для предупреждения и/или лечения любой кишечной патогенной инфекции, как обсуждалось выше. Одним из патогенов, представляющих интерес, является Escherichia coli, экспрессирующая фимбрии F18.
Из обсуждаемого выше ясно, что композиция может дополнительно содержать по меньшей мере один пробиотик либо отдельно, либо в комбинации с по меньшей мере одной протеазой.
Гликозидгидролаза, такая как альфа-L-фукозидаза, либо отдельно, либо в комбинации с по меньшей мере одним пробиотиком отдельно и/или в комбинации с по меньшей мере одной протеазой, может быть инкапсулирована для применения в корме или премиксе для животных. Кроме того, гликозидгидролаза, такая как альфа-L-фукозидаза, либо отдельно, либо в комбинации с по меньшей мере одним пробиотиком отдельно и/или в комбинации с по меньшей мере с одной протеазой, будь то инкапсулированная либо неинкапсулированная, может быть в форме гранулы.
Корма для животных могут включать растительный материал, такой как кукуруза, пшеница, сорго, соевые бобы, канола, подсолнечник или смеси любого из этих растительных материалов или источников растительных белков для домашней птицы, свиней, жвачных животных, водной культуры и домашних животных. Предполагается, что будут улучшены параметры продуктивности животного, такие как рост, потребление корма и эффективность корма, а также улучшена его однородность, снижена концентрация аммиака в помещении для животных и, следовательно, улучшено качество жизни и состояние здоровья животных. Более конкретно, используемое в данном документе выражение "продуктивность животного" может определяться эффективностью корма, и/или приростом массы тела животного, и/или коэффициентом кормоотдачи, и/или усвояемостью питательных веществ в корме (например, усвояемостью аминокислот), и/или усвояемой энергией или метаболизируемой энергией в корме, и/или удержанием азота, и/или способностью животных избегать неблагоприятных воздействий некротического энтерита, и/или иммунным ответом субъекта.
Термины "корм для животных", "корм", "кормовой продукт" и "фураж" используются взаимозаменяемо и могут включать один или несколько кормовых материалов, выбранных из группы, содержащей a) злаки, такие как мелкие зерна (например, пшеницу, ячмень, рожь, овес и их комбинации) и/или крупные зерна, такие как маис или сорго; b) отходы от переработки зерновых, такие как кукурузная глютеновая мука, сушеная барда с растворимыми веществами (DDGS) (в частности сушеная барда с растворимыми веществами на основе кукурузы (cDDGS), пшеничные отруби, пшеничная крупка, пшеничные мелкие отруби, рисовые отруби, рисовая шелуха, овсяная шелуха, ядро кокосового ореха и цитрусовый жом; c) белок, полученный из таких источников, как соя, подсолнечник, арахис, люпин, виды гороха, конские бобы, хлопчатник, канола, рыбная мука, сухой белок плазмы, мясо-костная мука, картофельный белок, сыворотка, копра, кунжут; d) масла и жиры, полученные из растительных и животных источников; и/или e) минералы и витамины.
В случае применения в качестве корма, такого как функциональный корм, или при его получении, композицию фермента или кормовой добавки по настоящему изобретению можно применять в сочетании с одним или несколькими из приемлемого в пищевом отношении носителя, приемлемого в пищевом отношении разбавителя, приемлемого в пищевом отношении наполнителя, приемлемого в пищевом отношении вспомогательного вещества, активного в пищевом отношении ингредиента. Например, можно упомянуть по меньшей мере один компонент, выбранный из группы, состоящей из белка, пептида, сахарозы, лактозы, сорбита, глицерина, пропиленгликоля, хлорида натрия, сульфата натрия, ацетата натрия, цитрата натрия, формиата натрия, сорбата натрия, хлорида калия, сульфата калия, ацетата калия, цитрата калия, формиата калия, ацетата калия, сорбата калия, хлорида магния, сульфата магния, ацетата магния, цитрата магния, формиата магния, сорбата магния, метабисульфита натрия, метилпарабена и пропилпарабена.
В предпочтительном варианте осуществления к композиции фермента или кормовой добавки по настоящему изобретению примешивают кормовой компонент с образованием кормового продукта. Используемый в данном документе термин "кормовой компонент" означает весь кормовой продукт или его часть. Часть кормового продукта может означать один составляющий компонент кормового продукта или более чем один составляющий компонент кормового продукта, например, 2, или 3, или 4, или более. В одном варианте осуществления термин "кормовой компонент" охватывает премикс или составляющие компоненты премикса. Предпочтительно корм может представлять собой фураж или его премикс, комбикорм или его премикс. К композиции кормовой добавки в соответствии с настоящим изобретением может быть примешан комбикорм, компонент комбикорма или премикс комбикорма или фураж, компонент фуража или премикс фуража.
Любой кормовой продукт, описанный в данном документе, может включать один или несколько кормовых материалов, выбранных из группы, содержащей a) злаки, такие как мелкие зерна (например, пшеницу, ячмень, рожь, овес, тритикале и их комбинации) и/или крупные зерна, такие как маис или сорго; b) отходы от переработки зерновых, такие как кукурузная глютеновая мука, влажная барда (в частности кукурузная влажная барда), сушеная барда (DDG) (в частности кукурузная сушеная барда (cDDG)), сушеная барда с растворимыми веществами (DDGS) (в частности кукурузная сушеная барда с растворимыми веществами (cDDGS)), пшеничные отруби, пшеничная крупка, пшеничные мелкие отруби, рисовые отруби, рисовая шелуха, овсяная шелуха, ядро кокосового ореха и цитрусовый жом; c) белок, полученный из таких источников, как соя, подсолнечник, арахис, люпин, виды гороха, конские бобы, хлопчатник, канола, рыбная мука, сухой белок плазмы, мясо-костная мука, картофельный белок, сыворотка, копра, кунжут; d) масла и жиры, полученные из растительных и животных источников; e) минералы и витамины.
Термин "фураж", используемый в данном документе, означает любую пищу, которая задается животному (в отличие от пищи, которую животное добывает самостоятельно). Фураж охватывает растения, которые были срезаны. Более того, фураж включает силос, прессованные и гранулированные корма, масла и смешанные рационы, а также проросшие зерновые и бобовые.
Фураж может быть получен из одного или нескольких растений, выбранных из: кукурузы (маиса), люцерны (люцерны посевной), ячменя, ледвенца рогатого, представителей рода капусты, капусты огородной сорта Chau moellier, кормовой капусты, семени рапса (канолы), репы (брюквы), турнепса, клевера, гибридного клевера, красного клевера, подземного клевера, белого клевера, овсяницы, костра, проса, овса, сорго, соевых бобов, деревьев (побегов подстриженных деревьев для древесного сена), пшеницы и бобовых.
Термин "комбикорм" означает промышленный корм в форме муки, гранулы, орешков, жмыха или крошки. Комбикорма можно смешивать с различным сырьем и добавками. Эти смеси составляют в соответствии с конкретными требованиями для целевого животного.
Комбикорма могут быть полными кормами, которые обеспечивают все суточно необходимые питательные вещества, концентратами, которые обеспечивают часть рациона (белковую, энергетическую), или добавками, которые обеспечивают только дополнительные питательные микроэлементы, такие как минералы и витамины.
Основными ингредиентами, применяемыми в комбикорме, являются кормовые зерновые, которые включают кукурузу, пшеницу, каноловый шрот, рапсовый шрот, люпин, соевые бобы, сорго, овес и ячмень.
Соответственно, премиксом, как обозначается в данном документе, может быть композиция, состоящая из микроингредиентов, таких как витамины, минералы, химические консерванты, антибиотики, продукты ферментации и другие необходимые ингредиенты. Премиксами обычно являются композиции, подходящие для смешивания в промышленных рационах.
В одном варианте осуществления кормовой продукт содержит или состоит из кукурузы, DDGS (например, cDDGS), пшеницы, пшеничных отрубей или любой их комбинации.
В одном варианте осуществления кормовой компонент может представлять собой кукурузу, DDGS (например, cDDGS), пшеницу, пшеничные отруби или их комбинацию. В одном варианте осуществления кормовой продукт содержит или состоит из кукурузы, DDGS (например, cDDGS) или их комбинации.
Кормовой продукт, описанный в данном документе, может содержать по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50% или по меньшей мере 60% по весу кукурузной и соевой муки или кукурузы и необезжиренной сои, или пшеничной муки, или кормовой муки из жмыха семян подсолнечника.
Например, кормовой продукт может содержать от приблизительно 5 до приблизительно 40% кукурузной DDGS. Для домашней птицы кормовой продукт может содержать в среднем от приблизительно 7 до приблизительно 15% кукурузной DDGS. Для домашних свиней (свиней) кормовой продукт может содержать в среднем 5-40% кукурузной DDGS. Он также может содержать кукурузу в виде цельного зерна, и в этом случае кормовой продукт может содержать от приблизительно 35% до приблизительно 80% кукурузы.
В кормовых продуктах, содержащих зерновую смесь, например, содержащих кукурузу и пшеницу, например, кормовой продукт может содержать по меньшей мере 10% кукурузы.
Дополнительно или в качестве альтернативы кормовой продукт также может содержать по меньшей мере один кормовой материал с высоким содержанием клетчатки и/или по меньшей мере один продукт переработки по меньшей мере одного кормового материала c высоким содержанием клетчатки для получения кормового продукта с высоким содержанием клетчатки. Примеры кормовых материалов с высоким содержанием клетчатки включают пшеницу, ячмень, рожь, овес, отходы от переработки зерновых, такие как кукурузная глютеновая мука, кукурузный глютеновый кормовой продукт, влажная барда, сушеная барда (DDG), сушеная барда с растворимыми веществами (DDGS), пшеничные отруби, пшеничная крупка, пшеничные мелкие отруби, рисовые отруби, рисовая шелуха, овсяная шелуха, ядро кокосового ореха и цитрусовый жом. Некоторые источники белка также можно рассматривать как источники с высоким содержанием клетчатки: белок, полученный из таких источников, как подсолнечник, люпин, конские бобы и хлопчатник. В одном аспекте кормовой продукт, описанный в данном документе, содержит по меньшей мере один материал с высоким содержанием клетчатки и/или по меньшей мере один продукт переработки по меньшей мере одного кормового материала c высоким содержанием клетчатки, выбранный из группы, состоящей, например, из сушеной барды с растворимыми веществами (DDGS), в частности cDDGS, влажной барды, сушеной барды (DDG), в частности cDDG, пшеничных отрубей и пшеницы. В одном варианте осуществления изобретения кормовой продукт по настоящему изобретению содержит по меньшей мере один материал с высоким содержанием клетчатки и/или по меньшей мере один продукт переработки по меньшей мере одного кормового материала c высоким содержанием клетчатки, выбранный из группы, состоящей, например, из сушеной барды с растворимыми веществами (DDGS), в частности cDDGS, пшеничных отрубей и пшеницы.
Корм может представлять собой один или несколько из следующего: комбикорм и премикс, в том числе гранулы, орешки или жмых (для крупного рогатого скота); сельскохозяйственная культура или остатки сельскохозяйственных культур: кукуруза, соевые бобы, сорго, овес, ячмень, копра, солома, мякина, отходы сахарной свеклы; рыбная мука; мясо-костная мука; меласса; масличный жмых и прессованный жмых; олигосахариды; консервированные кормовые растения: силос; водоросли; семена и зерна, цельные или подготовленные дроблением, измельчением и т. д.; проросшие зерновые и бобовые; экстракт дрожжей.
Используемый в данном документе термин "корм" охватывает в некоторых вариантах осуществления корм для домашних животных. Корм для домашних животных представляет собой материал растительного или животного происхождения, предназначенный для потребления домашними животными, такой как корм для собак или корм для кошек. Корм для домашних животных, такой как корм для собак и кошек, может быть либо в сухой форме, такой как гранулированный корм для собак, либо во влажной консервированной форме. Корм для кошек может содержать аминокислоту таурин.
Корм для животных может также включать корм для рыб. Корм для рыб в норме содержит питательные макроэлементы, микроэлементы и витамины, необходимые для поддержания здоровыми рыб, содержащихся в неволе. Корм для рыб может быть в форме хлопьевидной частицы, гранулы или таблетки. Гранулированные формы, некоторые из которых быстро тонут в воде, часто используют для более крупных видов рыбы или видов, питающихся на дне. Некоторые корма для рыб также содержат добавки, такие как бета-каротин или половые гормоны для искусственного усиления окраски и узора рыб.
В еще одном аспекте корм для животных охватывает корм для птиц. Корм для птиц включает пищу, которую используют как в кормушках для птиц, так и для кормления комнатных птиц. Обычно корм для птиц содержит разные семена, но также может включать нутряное сало (говяжий или бараний жир).
Используемый в данном документе термин "приводить в контакт" относится к косвенному или непосредственному применению гликозидгидролазы, описанной в данном документе, такой как альфа-L-фукозидаза (или композиции, содержащей гликозидгидролазу, описанную в данном документе, такую как альфа-L-фукозидаза), к продукту (например, корму). Примеры способов применения, которые можно использовать, включают без ограничения обработку продукта в материале, содержащем композицию кормовой добавки, непосредственное применение путем смешивания композиции кормовой добавки с продуктом, нанесение распылением композиции кормовой добавки на поверхность продукта или погружение продукта в препарат на основе композиции кормовой добавки. В одном варианте осуществления композицию кормовой добавки по настоящему изобретению предпочтительно примешивают к продукту (например, кормовому продукту). В качестве альтернативы композицию кормовой добавки можно включать в эмульсию или сырьевые ингредиенты кормового продукта. Это позволяет улучшить характеристики композиции.
Термин "термически стабильный" означает, что по меньшей мере приблизительно 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97% или 98% фермента, который присутствовал/был активен в добавке перед нагреванием до указанной температуры, все еще присутствует/активен после охлаждения до комнатной температуры. Предпочтительно по меньшей мере приблизительно 80% фермента, присутствующего и активного в добавке перед нагреванием до указанной температуры, все еще присутствует и активен после охлаждения до комнатной температуры.
Также возможно, что альфа-L-фукозидазы (или композиция, содержащая альфа-L-фукозидазы), описанные в данном документе, могут быть гомогенизированы с получением порошка.
В альтернативном предпочтительном варианте осуществления гликозидгидролаза, описанная в данном документе, такая как альфа-L-фукозидаза (или композиция, содержащая гликозидгидролазу, описанную в данном документе, такую как альфа-L-фукозидаза), может быть составлена в виде гранул, как описано в WO2007/044968 (называемых гранулами TPT) или WО1997/016076 или WO1992/012645, включенных в данный документ посредством ссылки. "TPT" означает технологию термозащиты.
В другом аспекте, когда композицию кормовой добавки составляют в виде гранул, эти гранулы содержат гидратированную соль, являющуюся барьером, которая покрывает белковое ядро. Преимуществом такого солевого покрытия является улучшенная термоустойчивость, улучшенная стабильность при хранении и защита от других кормовых добавок, неблагоприятно воздействующих каким-либо образом на фермент. Предпочтительно соль, используемая для солевого покрытия, характеризуется активностью воды более 0,25 или постоянной влажностью более 60% при 20°C. В некоторых вариантах осуществления солевое покрытие содержит Na2SО4.
Способ получения гликозидгидролазы, описанной в данном документе, такой как альфа-L-фукозидаза (или композиции, содержащей гликозидгидролазу, описанную в данном документе, такую как альфа-L-фукозидаза), может также включать дополнительную стадию гранулирования порошка. Порошок можно смешивать с другими компонентами, известными из уровня техники. Порошок или смесь, содержащую порошок, можно продавить через форму и полученные нити разрезать на подходящие гранулы различной длины.
Необязательно стадия гранулирования может включать обработку паром или стадию кондиционирования перед образованием гранул. Смесь, содержащую порошок, можно поместить в кондиционирующее устройство, например, смеситель со впрыском пара. Смесь нагревают в кондиционирующем устройстве до заданной температуры, например, 60-100°C, типичные температуры будут составлять 70°C, 80°C, 85°C, 90°C или 95°C. Время пребывания может варьироваться от секунд до минут и даже часов. Например, 5 секунд, 10 секунд, 15 секунд, 30 секунд, 1 минута, 2 минуты, 5 минут, 10 минут, 15 минут, 30 минут и 1 час. Будет понятно, что гликозидгидролаза, описанная в данном документе, такая как альфа-L-фукозидаза (или композиция, содержащая гликозидгидролазу, описанную в данном документе, такую как альфа-L-фукозидаза), описанная в данном документе, подходит для добавления в любой подходящий кормовой материал.
Специалисту в данной области техники будет понятно, что разные животные нуждаются в разных кормовых продуктах, и даже одному и тому же животному могут требоваться различные кормовые продукты в зависимости от цели, ради которой выращивают животное.
Необязательно кормовой продукт может также содержать дополнительные минералы, такие как, например, кальций и/или дополнительные витамины. В некоторых вариантах осуществления кормовой продукт представляет собой смесь кукурузной и соевой муки.
Кормовой продукт обычно получают в кормодробилках, в которых сырье сначала измельчают до подходящего размера частиц, а затем смешивают с соответствующими добавками. Затем кормовой продукт можно получить в виде кашицы или гранул; последние, как правило, предполагают способ, с помощью которого температуру поднимают до заданного уровня, а затем корм пропускают через форму с получением гранул конкретного размера. Гранулам дают остыть. Впоследствии можно добавлять жидкие добавки, такие как жир и фермент. Получение кормового продукта также может включать дополнительную стадию, которая до гранулирования включает экструзию или разбухание, в частности с помощью подходящих методик, которые могут включать по меньшей мере применение пара.
Кормовой продукт может представлять собой кормовой продукт для животных с однокамерным желудком, таких как домашняя птица (например, бройлер, несушка, несушки бройлерного типа, индейка, утка, гуси, водоплавающая птица) и домашняя свинья (все возрастные категории), жвачных животных, таких как крупный рогатый скот (например, коров или быков (в том числе телят)), лошадей, овец, домашних животных (например, собак, кошек) или рыбы (например, рыбы без желудка, рыбы с желудком, пресноводной рыбы, такой как лосось, треска, форель и карп, например карп кои, морской рыбы, такой как морской окунь, и ракообразных, таких как мелкие креветки, мидии и гребешки). Предпочтительно кормовой продукт предназначен для свиней.
Композицию кормовой добавки и/или кормовой продукт, содержащий ее, можно применять в любой подходящей форме. Композицию кормовой добавки можно применять в форме твердых или жидких препаратов или их альтернативных вариантов. Примеры твердых препаратов включают порошки, пасты, болюсы, капсулы, драже, таблетки, присыпки и гранулы, которые могут быть смачиваемыми, высушенными распылительной сушкой или лиофилизированными. Примеры жидких препаратов включают без ограничения водные, органические или водно-органические растворы, суспензии и эмульсии.
В некоторых применениях композиции кормовой добавки можно смешивать с кормом или вводить в питьевую воду.
Композиция кормовой добавки содержит примешанную фукозидазу, как изложено в данном документе, с приемлемым для корма носителем, разбавителем или наполнителем и (необязательно) упаковку.
Кормовой продукт и/или композицию кормовой добавки можно комбинировать c по меньшей мере одним минералом и/или по меньшей мере одним витамином. Полученные таким образом композиции могут упоминаться в данном документе как премикс. Кормовой продукт может содержать по меньшей мере 0,0001% по весу кормовой добавки. Соответственно, кормовой продукт может содержать по меньшей мере 0,0005%; по меньшей мере 0,0010%; по меньшей мере 0,0020%; по меньшей мере 0,0025%; по меньшей мере 0,0050%; по меньшей мере 0,0100%; по меньшей мере 0,020%; по меньшей мере 0,100%, по меньшей мере 0,200%; по меньшей мере 0,250%; по меньшей мере 0,500% по весу кормовой добавки.
Предпочтительно композиция пищевой или кормовой добавки может дополнительно содержать по меньшей мере один физиологически приемлемый носитель. Физиологически приемлемый носитель предпочтительно выбран из по меньшей мере одного из мальтодекстрина, известняка (карбоната кальция), циклодекстрина, пшеницы или компонента пшеницы, сахарозы, крахмала, Na[2]SО[4], талька, PVA и их смесей. В дополнительном варианте осуществления пищевая или кормовая добавка может дополнительно содержать хелатор ионов металлов. Хелатор ионов металлов может быть выбран из EDTA или лимонной кислоты.
В некоторых вариантах осуществления композиция пищевой или кормовой добавки содержит гликозидгидролазу, описанную в данном документе, такую как альфа-L-фукозидаза, на уровне по меньшей мере 0,0001 г/кг, 0,001 г/кг, по меньшей мере 0,01 г/кг, по меньшей мере 0,1 г/кг, по меньшей мере 1 г/кг, по меньшей мере 5 г/кг, по меньшей мере 7,5 г/кг, по меньшей мере 10,0 г/кг, по меньшей мере 15,0 г/кг, по меньшей мере 20,0 г/кг, по меньшей мере 25,0 г/кг. В некоторых вариантах осуществления пищевая или кормовая добавка содержит альфа-L-фукозидазу на таком уровне, что при добавлении к пищевому или кормовому материалу этот кормовой материал содержит альфа-L-фукозидазу в диапазоне 1-500 мг/кг, 1-100 мг/кг, 2-50 мг/кг или 2-10 мг/кг. В некоторых вариантах осуществления настоящего изобретения пищевой или кормовой материал содержит по меньшей мере 100, 1000, 2000, 3000, 4000, 5000, 10000, 20000, 30000, 50000, 100000, 500000, 1000000 или 2000000 единиц гликозидгидролазы, такой как альфа-L-фукозидаза, на килограмм кормового или пищевого материала. В некоторых вариантах осуществления одна единица α-1,2-фукозидазной активности может быть определена как количество фермента, которое может катализировать высвобождение одного мкмоля L-фукозы в минуту из 2'-фукозиллактозы в условиях анализа, описанных в примере 2.
Диапазоны могут включать без ограничения любую комбинацию нижних и верхних пределов диапазонов, рассмотренных выше.
Составы, содержащие любую гликозидгидролазу, описанную в данном документе, такую как альфа-L-фукозидазу, и композиции, описанные в данном документе, могут быть получены любым подходящим способом с гарантией того, что состав будет содержать активные ферменты. Такие составы могут представлять собой жидкость, сухой порошок или гранулу. Предпочтительно композиция кормовой добавки находится в твердой форме, подходящей для добавления на кормовую гранулу или в нее.
Сухой порошок или гранулы можно получить с помощью способов, известных специалистам в данной области техники, таких как гранулирование с высоким сдвиговым усилием, барабанное гранулирование, экструзия, сферонизация, агломерация с псевдоожиженным слоем, сушка распылением с псевдоожиженным слоем.
Гликозидгидролаза, описанная в данном документе, такая как альфа-L-фукозидаза, и композиции, описанные в данном документе, могут иметь покрытие, например, быть инкапсулированными. В одном варианте осуществления покрытие защищает ферменты от воздействия тепла и может считаться термозащитным средством. В одном варианте осуществления покрытие защищает фермент от воздействия низкого рН. Eudragit® является одним примером материала для покрытия, который можно применять.
Композиция кормовой добавки, описанная в данном документе, может быть составлена в виде сухого порошка или гранул, как описано в WO2007/044968 (называемых гранулами TPT) или WO1997/016076 или WO1992/012645 (каждый из которых включен в данный документ посредством ссылки).
В одном варианте осуществления корм для животных может быть составлен в виде гранул для кормовых композиций, содержащих: ядро; активное средство и по меньшей мере одно покрытие, при этом активное средство гранулы сохраняет по меньшей мере 50% активность, по меньшей мере 60% активность, по меньшей мере 70% активность, по меньшей мере 80% активность после воздействия условий, выбранных из одного или нескольких из: а) способа гранулирования корма, b) способа предварительной обработки корма с паровым нагревом, c) хранения, d) хранения в виде ингредиента в негранулированной смеси и e) хранения в виде ингредиента в исходной кормовой смеси или кормовом премиксе, содержащем по меньшей мере одно соединение, выбранное из микроэлементов, органических кислот, восстанавливающих сахаров, витаминов, хлорида холина и соединений, которые дают обеспечивают кислотность или основность исходной кормовой смеси или кормовому премиксу.
Что касается гранулы, по меньшей мере одно покрытие может содержать увлажняющий гидратирующий материал, который составляет по меньшей мере 55% вес/вес гранулы; и/или по меньшей мере одно покрытие может содержать два покрытия. Эти два покрытия могут представлять собой увлажняющее гидратирующее покрытие и влагоудерживающее покрытие. В некоторых вариантах осуществления увлажняющее гидратирующее покрытие может составлять от 25% до 60% вес/вес гранулы, а влагоудерживающее покрытие может составлять от 2% до 15% вес/вес гранулы. Увлажняющее гидратирующее покрытие может быть выбрано из неорганических солей, сахарозы, крахмала и мальтодекстрина, а влагоудерживающее покрытие может быть выбрано из полимеров, смол, молочной сыворотки и крахмала.
Гранула может быть получена с помощью способа гранулирования корма, и способ предварительной обработки корма может проводиться при 70°C-95°C в течение нескольких минут, например, при 85°C - 95°C.
Композиция кормовой добавки может быть составлена в виде гранул для корма для животных, содержащих: ядро; активное средство, при этом активное средство гранулы сохраняет по меньшей мере 80% активность после хранения и после осуществления способа гранулирования с паровым нагревом, где гранула представляет собой ингредиент; влагоудерживающее покрытие; и увлажняющее гидратирующее покрытие, которое составляет по меньшей мере 25% вес/вес гранулы, при этом гранула характеризуется активностью воды менее 0,5 до осуществления способа гранулирования с паровым нагревом.
Гранула может иметь влагоудерживающее покрытие, выбранное из полимеров и смол, а увлажняющий гидратирующий материал может представлять собой неорганическую соль. Увлажняющее гидратирующее покрытие может составлять от 25% до 45% вес/вес гранулы, а влагоудерживающее покрытие может составлять от 2% до 10% вес/вес гранулы.
Гранула может быть получена с помощью способа гранулирования с паровым нагревом, который может проводиться при 85°C-95°C в течение нескольких минут.
В качестве альтернативы, композиция находится в виде жидкого состава, подходящего для потребления, предпочтительно, такая потребляемая жидкость содержит одно или несколько из следующего: буфер, соль, сорбит и/или глицерин.
Кроме того, композиция кормовой добавки может быть составлена путем нанесения, например распыления, фермента(ферментов) на подложку-носитель, такую как, например, молотая пшеница.
В одном варианте осуществления композиция кормовой добавки может быть составлена в виде премикса. Только в качестве примера премикс может содержать один или несколько кормовых компонентов, таких как один или несколько минералов и/или один или несколько витаминов.
В одном варианте осуществления по меньшей мере одна DFM, и/или гликозидгидролаза, такая как альфа-L-фукозидаза (будь то инкапсулированная либо неинкапсулированная), и/или по меньшей мере одна протеаза составлена по с меньшей мере одним физиологически приемлемым носителем, выбранным из по меньшей мере одного из мальтодекстрина, известняка (карбоната кальция), циклодекстрина, пшеницы или компонента пшеницы, сахарозы, крахмала, Na2SO4, талька, PVA, сорбита, бензоата, сорбата, глицерина, сахарозы, пропиленгликоля, 1,3-пропандиола, глюкозы, парабенов, хлорида натрия, цитрата, ацетата, фосфата, кальция, метабисульфата, формиата и их смесей.
В некоторых вариантах осуществления гликозидгидролаза, такая как альфа-L-фукозидаза, будет находиться в физиологически приемлемом носителе. Подходящими носителями могут быть крупные медленно метаболизируемые макромолекулы, такие как белки, полипептиды, липосомы, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот и неактивные вирусные частицы. Можно использовать фармацевтически приемлемые соли, например соли минеральных кислот, такие как гидрохлориды, гидробромиды, фосфаты и сульфаты, или соли органических кислот, такие как ацетаты, пропионаты, малонаты и бензоаты. Фармацевтически приемлемые носители в терапевтических композициях могут дополнительно содержать жидкости, такие как вода, физиологический раствор, глицерин и этанол. Дополнительно, в таких композициях могут присутствовать вспомогательные вещества, такие как смачивающие или эмульгирующие средства или регулирующие рН буферные вещества. Такие носители позволяют составлять фармацевтические композиции в виде таблеток, пилюль, драже, капсул, жидкостей, гелей, сиропов, взвесей и суспензий для приема пациентом внутрь. После составления композиции по настоящему изобретению можно вводить непосредственно субъекту. Субъектами, подлежащими лечению, могут быть животные. Однако в одном или нескольких вариантах осуществления композиции адаптированы для введения субъектам-людям.
Неограничивающие примеры композиций и способов, раскрытых в данном документе, включают следующие.
1. Способ предупреждения и/или лечения у животного кишечной патогенной инфекции и/или диареи, где патогенная инфекция и/или диарея вызваны патогеном, способным связываться с клеткой кишечника животного, где указанное связывание патогена зависит от наличия участка связывания с патогеном, содержащего по меньшей мере одну гликановую структуру, замещенную по меньшей мере одним альфа-1,2-L-фукозным фрагментом, предусматривающий введение животному эффективного количества гликозидгидролазы, способной удалять по меньшей мере один альфа-1,2-L-фукозный фрагмент из участка связывания с патогеном.
2. Способ согласно варианту осуществления 1, где гликозидгидролаза представляет собой альфа-L-фукозидазу.
3. Способ согласно варианту осуществления 2, где альфа-L-фукозидаза выбрана из группы, состоящей из семейства гликозидгидролаз 95 (GH95) и семейства гликозидгидролаз 29 (GH 29).
4. Способ согласно варианту осуществления 2, где альфа-L-фукозидаза способна удалять концевую альфа-1,2-связанную фукозную группу из гликансодержащей структуры либо самостоятельно, либо в комбинации с ферментом, способным (а) превращать группоспецифический антиген А в группоспецифический антиген H или (b) превращать группоспецифический антиген B в группоспецифический антиген H.
5. Способ согласно варианту осуществления 1, где патогенный микроорганизм представляет собой Escherichia coli, экспрессирующую фимбрии F18.
6. Способ согласно варианту осуществления 1 или 2, где способ дополнительно предусматривает введение животному эффективного количества гликозидгидролазы или альфа-L-фукозидазы в комбинации с по меньшей мере одним пробиотиком.
7. Способ согласно варианту осуществления 6, где способ дополнительно предусматривает введение животному эффективного количества гликозидгидролазы или альфа-L-фукозидазы в комбинации с по меньшей мере одним пробиотиком и по меньшей мере одной протеазой.
8. Способ согласно любому варианту осуществления 1 или 7, где альфа-L-фукозидаза является инкапсулированной.
9. Способ согласно варианту осуществления 6, где альфа-L-фукозидаза является инкапсулированной.
10. Способ согласно любому варианту осуществления 1 или 7, где альфа-L-фукозидазу, и/или пробиотик, и/или протеазу вводят с кормом или премиксом для животных.
11. Способ согласно варианту осуществления 6, где альфа-L-фукозидазу, и/или пробиотик, и/или протеазу вводят с кормом или премиксом для животных.
12. Способ согласно любому варианту осуществления 1 или 7, где альфа-L-фукозидаза находится в форме гранулы.
11. Способ согласно варианту осуществления 6, где альфа-L-фукозидаза находится в форме гранулы.
12. Композиция для предупреждения и/или лечения у животного кишечной патогенной инфекции и/или диареи, где патогенная инфекция вызвана патогеном, способным связываться с клеткой кишечника животного, где указанное связывание патогена зависит от наличия участка связывания с патогеном, содержащего по меньшей мере одну гликановую структуру, замещенную по меньшей мере одним альфа-1,2-L-фукозным фрагментом, при этом предусматривается введение животному эффективного количества гликозидгидролазы, способной удалять по меньшей мере один альфа-1,2-L-фукозный фрагмент из участка связывания с патогеном.
13. Композиция согласно варианту осуществления 12, где гликозидгидролаза представляет собой альфа-L-фукозидазу.
14. Композиция согласно варианту осуществления 13, где альфа-L-фукозидаза выбрана из группы, состоящей из семейства гликозидгидролаз 95 (GH95) и семейства гликозидгидролаз 29 (GH 29).
15. Композиция согласно варианту осуществления 13, где альфа-L-фукозидаза способна удалять концевую альфа-1,2-связанную фукозную группу из гликансодержащей структуры либо самостоятельно, либо в комбинации с ферментом, способным (а) превращать группоспецифический антиген А в группоспецифический антиген H или (b) превращать группоспецифический антиген B в группоспецифический антиген H.
16. Способ согласно варианту осуществления 12, где патогенный микроорганизм представляет собой Escherichia coli, экспрессирующую фимбрии F18.
17. Композиция согласно варианту осуществления 12 или 13, где указанная композиция дополнительно содержит по меньшей мере один пробиотик.
18. Композиция согласно варианту осуществления 17, где указанная композиция дополнительно содержит по меньшей мере один пробиотик и по меньшей мере одну протеазу.
19. Композиция согласно любому варианту осуществления 12 или 18, где альфа-L-фукозидаза является инкапсулированной.
20. Композиция согласно варианту осуществления 17, где альфа-L-фукозидаза является инкапсулированной.
21. Композиция согласно любому варианту осуществления 12 или 18, где альфа-L-фукозидазу, и/или пробиотик, и/или протеазу вводят животному в виде корма или премикса.
22. Композиция согласно варианту осуществления 17, где альфа-L-фукозидазу, и/или по меньшей мере один пробиотик, и/или по меньшей мере одну протеазу вводят животному в виде корма или премикса.
23. Композиция согласно любому варианту осуществления 12 или 18, где альфа-L-фукозидазу вводят в форме гранул.
24. Композиция согласно варианту осуществления 17, где альфа-L-фукозидазу вводят в форме гранул.
ПРИМЕРЫ
Если в данном документе не определено иное, все технические и научные термины, используемые в данном документе, имеют то же самое значение, которое обычно понимает специалист в данной области, к которой принадлежит настоящее изобретение. Singleton, et al., DICTIONARY OF MICROBIOLOGY AND MOLECULAR BIOLOGY, 2D ED., John Wiley and Sons, New York (1994) и Hale & Marham, THE HARPER COLLINS DICTIONARY OF BIOLOGY, Harper Perennial, N.Y. (1991) предоставляют для специалиста общий словарь для многих терминов, используемых в данном раскрытии.
Настоящее изобретение дополнительно определено в следующих примерах. Следует понимать, что примеры, хотя и показывают определенные варианты осуществления, приводятся исключительно в целях иллюстрации. Из приведенного выше обсуждения и примеров специалист в данной области техники сможет установить существенные характеристики настоящего изобретения, и не отклоняясь от его идеи и объема, сможет осуществить различные изменения и модификации для его адаптации к различным областям применения и условиям.
Общие способы
Стандартные методики рекомбинантных ДНК и молекулярного клонирования хорошо известны из уровня техники и описаны в Sambrook, J. and Russell, D., Molecular Cloning: A Laboratory Manual, Third Edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY (2001); и Silhavy, T. J., Bennan, M. L. and Enquist, L. W., Experiments with Gene Fusions, Cold Spring Harbor Laboratory Cold Press Spring Harbor, NY (1984); и Ausubel, F. M. et. al., Short Protocols in Molecular Biology, 5th Ed. Current Protocols and John Wiley and Sons, Inc., NY, 2002.
ПРИМЕР 1
Идентификация, клонирование и экспрессия фукозидаз
На основании обзора литературы α-1,2-L-фукозидазы сгруппировали в два семейства гликозилгидролаз (GH), GH29 и GH95 (классификация CaZy (Carbohydrate-Active EnZymes; ферменты, активные в отношении углеводов)). Последовательности белков, принадлежащих к этим двум семействам GH, выводили из баз данных CaZy и NCBI и филогенетически анализировали с использованием программного обеспечения Mega 6. Несколько типичных фукозидаз GH95 и GH29 выбирали для экспрессии с учетом их филогенетического распределения и биологического происхождения (фукозидазы из пробиотиков были предпочтительными). Перечень экспрессированных фукозидаз показан в таблице 1.
|
A. Клонирование и экспрессия бактериальных фукозидаз в Bacillus subtilis
Синтетические гены, кодирующие зрелые последовательности бактериальных фукозидаз, оптимизировали по кодонам и синтезировали у GeneRay (Шанхай, Китай). Синтезированные гены вставляли в векторы p2JM и p3JM (Vogtentanz (2007) Protein Expr. Purif., 55:40-52). Гены, клонированные в оба вектора, находились под управлением промотора aprE, за исключением того, что вектор p2JM также содержал сигнальную последовательность aprE, которую использовали для направленной секреции целевого белка в B. subtilis, и олигонуклеотид под названием AGK-proAprE, который кодирует пептид Ala-Gly-Lys для облегчения секреции целевого белка. Для генов, вставленных в векторы p3JM, стартовый кодон и последовательность гена, кодирующую зрелый белок, помещали сразу после промотора aprE. Иллюстративные карты плазмид показаны на фигурах 1A и 1B.
Плазмиды амплифицировали с применением набора для амплификации Illustra TempliPhi 100 (GE Healthcare Life Sciences, Нью Джерси). Подходящий штамм B. subtilis трансформировали с помощью продукта амплификации с применением способа, известного из уровня техники (WO 01/14490). Трансформанты B. subtilis отбирали на чашках с агаром Луриа, дополненным 5 ppm хлорамфеникола. Колонии с чашек для трансформации инокулировали в 5 мл среды LB и инкубировали при 37°C в течение ночи. Селективное выращивание трансформантов B. subtilis, несущих плазмиды, проводили при 37°C в течение 40 часов в среде MBD (обогащенная среда полуопределенного состава на основе буфера MOPs с мочевиной в качестве основного источника азота, глюкозой в качестве основного источника углерода и дополненная 4% сойтоном для активного клеточного роста), содержащей 5 ppm хлорамфеникола. Клетки собирали путем центрифугирования и как клетки, так и супернатант анализировали с помощью SDS-PAGE. Экспрессию бактериальной фукозидазы подтверждали видимыми полосами белка на гелях SDS-PAGE.
B. Клонирование и экспрессия отобранных фукозидаз в Trichoderma reesei
Гены грибковой фукозидазы оптимизировали по кодонам на основании предсказанных последовательностей белка и синтезировали у GeneRay (Шанхай, Китай). Синтезированные и амплифицированные гены вставляли в векторы pGXT (аналогичен вектору pTTTpyr2, описанному в опубликованной заявке согласно РСТ WO 2015/017256). Гены, клонированные в вектор pGXT, находились под управлением промотора CBH1, и для экспрессии использовали нативный сигнальный пептид. Иллюстративная карта плазмиды показана на фигуре 2.
Подходящий штамм Trichoderma reesei трансформировали с помощью экспрессирующих плазмид (способ, описанный в опубликованной заявке согласно PCT WO 05/001036) с использованием методики трансформации протопластов (Te'o et al. (2002) J. Microbiol. Methods 51:393-99). Трансформанты отбирали на среде, содержащей ацетамид в качестве единственного источника азота. После выращивания в течение 5 дней на чашках с ацетамидом трансформанты собирали и подвергали ферментации во встряхиваемых колбах объемом 250 мл с определенной средой, содержащей смесь глюкозы и софорозы. Супернатант ферментационного бульона собирали путем фильтрования и подвергали SDS-PAGE для выявления экспрессии.
Экспрессию грибковой фукозидазы подтверждали видимыми полосами белка на гелях SDS-PAGE.
ПРИМЕР 2
Биохимическое определение характеристик фукозидаз с использованием фукозиллактозного субстрата
1. Анализ активности α-1,2-фукозидазы в неочищенных супернатантах культуры
Для идентификации активных α-1,2-фукозидаз неочищенные супернатанты культур с экспрессированными бактериальными и грибковыми фукозидазами анализировали при 37°С с использованием 10 мМ 2'-фукозиллактозы в качестве субстрата. Реакцию
инициировали путем добавления 5 мкл неочищенного образца к 45 мкл раствора субстрата в 50 мМ натрий-ацетатном буфере (pH 5, 0) и 50 мM буфере NaOH-HEPES (pH 8,2) соответственно. Неочищенный образец без экспрессированного фермента анализировали при тех же условиях в качестве холостого контроля. Через 10 мин. высвобожденную
L-фукозу выявляли с применением набора K-fucose (Megazyme, Ирландия). Наблюдаемая фукозидазная активность, измеренная как поглощение при 340 нм (с вычитанием холостой пробы без фермента), представлена на фигуре 3.
2. Измерение специфической α-1,2-фукозидазной активности
Несколько экспрессированных фукозидаз очищали для дальнейшего определения характеристик. Специфическую активность очищенных фукозидаз измеряли с 10 мM 2′-фукозиллактозы. Перед реакцией раствор фермента получали в шести раундах 2-кратного серийного разведения, начиная с соответствующей дозы (например, 5 ppm). Реакцию инициировали путем добавления 5 мкл разбавленного образца фермента или воды (холостой контроль) к 45 мкл раствора субстрата в 50 мM натрий-фосфатном буфере (pH 6,8) с последующей инкубацией при 37°C в течение 10 мин. Высвобожденную L-фукозу выявляли с применением набора K-fucose. Кривые зависимости доза-эффект строили с изменением значений поглощения в качестве значений по оси Y и дозами фермента в качестве значений по оси X, и линейную часть кривых использовали для расчета специфической активности очищенных образцов ферментов. Одну единицу α-1,2-фукозидазной активности определяли как количество фермента, которое может катализировать высвобождение одного мкмоля L-фукозы в минуту при описанных условиях анализа. Специфическая α-1,2-фукозидазная активность всех фукозидаз приведена в таблице 2. Было отмечено, что в этих условиях бактериальные α-1,2-фукозидазы из семейства GH95 проявляли более высокую
специфическую активность, чем другие ферменты.
|
ПРИМЕР 3
Профиль pH и температур для различных фукозидаз
Фукозидазы анализировали для определения их профилей рН и температур. Для определения оптимального pH измеряли способность α-1,2-фукозидаз-кандидатов к гидролизу 2′-фукозиллактозы при 37°C в 50 мM ацетат натрия/HEPES/глициновом буфере с pH в диапазоне от 3,0 до 10,0. Для определения оптимальной температуры измеряли способность фукозидаз-кандидатов к гидролизу 2'-фукозиллактозы в 50 мM натрий-фосфатном буфере при температуре от 30°C до 90°C с шагом 10°С. Все реакции выполняли в двух повторностях и проводили в течение 10 мин. Результаты показаны на фигурах 4, 5 и в таблице 3.
|
ПРИМЕР 4
Оценка активности фукозидаз при низком значении pH и в присутствии пепсина
Для оценки фукозидазной активности при низком значении рН и устойчивости к пепсину α-1,2-фукозидаз-кандидатов образцы ферментов инкубировали с пепсином (Sigma, кат. № P7000) в 50 мM буфере глицин-HCl (pH 3,5) и 50 мM натрий-ацетатном буфере (pH 5,0) соответственно. 100 ppm фукозидазы смешивали с пепсином в соотношениях 1:0, 1:2,5, 1:25 и 1:250 и смеси ферментов инкубировали при 37°C. В то же время 100 ppm фукозидазы инкубировали отдельно в 50 мМ натрий-фосфатном буфере (рН 6,8) при 37°С и 4°С (в качестве контроля). После инкубации в течение 30 мин. образцы ферментов разбавляли до соответствующей дозы и затем анализировали с 2'-фукозиллактозой при 37°С в 50 мМ натрий-фосфатном буфере (рН 6,8). Очищенную воду анализировали в тех же условиях в качестве холостого контроля. Остаточную α-1,2-фукозидазную активность рассчитывали как 100 X OD340 за вычетом фона (инкубированного фермента)/OD340 за вычетом фона (фермента, хранившегося при 4°C). Все реакции выполняли в двух повторностях. Результаты, проиллюстрированные на фигурах 6A и 6B, показывают, что бактериальные α-1,2-фукозидазы не переносили кислые условия (pH 3,5) данного анализа, но были стабильны при менее кислых условиях (pH 5,0).
ПРИМЕР 5
Оценка фукозидазной активности на различных природных субстратах
Гидролитическую активность α-1,2-фукозидаз-кандидатов оценивали в отношении свиного желудочного муцина (тип II) и трисахарида антигена H (тип I). Гидролиз 40 мг/мл
свиного желудочного муцина (тип II) анализировали с использованием образцов с 2 и 20 ppm фермента, тогда как гидролиз 3 мМ трисахарида антигена H (тип I) анализировали с использованием образцов с 0,25 ppm и 1 ppm фермента. Обе реакции проводили в течение 10 минут с использованием условий анализа, описанных в разделе 2 примера 4. Все реакции проводили при 37°C в 50 мM натрий-фосфатном буфере (pH 6,8). Очищенную воду анализировали в тех же условиях в качестве холостого контроля. Проиллюстрированные на фигурах 7 и 8 бактериальные α-1,2-фукозидазы из семейства GH95, за исключением CRC08400, демонстрировали высокую гидролитическую активность как в отношении муцина, так и в отношении трисахарида антигена H (тип I). В частности, CRC08392 показал наиболее высокую активность в отношении разрушения муцина (таблица 4), тогда как CRC08394 и CRC08401 были наиболее активны при гидролизе трисахарида антигена H (тип I) (фигура 8).
|
ПРИМЕР 6
Влияние фукозидаз на адгезию штамма F18+ ETEC к культуре клеток кишечника in vitro
Клетки IPEC-1, полученные из тонкой кишки новорожденного поросенка (ACC-705; DSMZ, Брауншвейг, Германия), высевали в 96-луночные планшеты (NUNC) и давали прикрепиться в течение 16 часов. В контрольные лунки помещали только культуральную среду без клеток, и они служили в качестве контроля. Фукозидазы разбавляли в буфере 1 (12,5 мM HEPES, 141 мM NaCl, 0,5 мM MgCl2, 0,15 мM CaCl2, 0,1% желатина, pH 6) и добавляли в
96-луночный планшет, содержащий клетки IPEC-1 или только среду, в конечной концентрации 2, 20 или 200 ppm в общем объеме 100 мкл. Планшет инкубировали при 37°С в течение 30 минут. После инкубации планшет промывали 100 мкл буфера 2 (12,5 мМ HEPES, 141 мМ NaCl, 0,5 мМ MgCl2, 0,15 мМ CaCl2, 0,1% желатина, pH 7,4). Адгезию F18 ETEC к клеткам IPEC-1 измеряли по сути, как описано в Hedegaard CJ, Strube ML, Hansen MB, Lindved BK, Lihme A, Boye M, et al. (2016). Natural Pig Plasma Immunoglobulins Have Anti-Bacterial Effects: Potential for Use as Feed Supplement for Treatment of Intestinal Infections in Pigs. PLoS ONE 11(1): e0147373, за исключением того, что в настоящих экспериментах штамм F18+ ETEC использовали без инкубации с иммуноглобулинами.
ПРИМЕР 7
Влияние фукозидаз на снижение колонизации F18 ETEC in vivo
A. Получение гранул фукозидаз с контролируемым высвобождением
Гранулы фукозидазы с контролируемым высвобождением получали согласно рецептуре, приведенной в таблице 5 ниже. В устройство для нанесения покрытия из псевдоожиженного слоя Vector FL-1 добавляли 670 г кристаллов сульфата натрия (Minera Santa Marta, Испания), просеянных до 150-355 микронов, в качестве ядер для гранул. Ядра псевдоожижали при температуре на входе 70°С и потоке псевдоожижения 50 куб. фут/мин.
Получали раствор фермента, состоящий из 400 г 25% вес/вес ультрафильтрационного концентрата фукозидазного фермента, тщательно смешанного с 250 г 16% вес/вес водного раствора частично гидролизованного поливинилового спирта Erkol 5-88 (Erkol Corporation, Гуардо, Испания). Раствор фермента-PVA, обозначенный как "SP1", распыляли на псевдоожиженные ядра при давлении распыления 20 фунтов/кв. дюйм и скорости распыления 7 г/мин, увеличивая до 12 г/мин через 30 минут, поддерживая температуру на входе 70°С. Раствор PVA/тальк (SP2) получали путем объединения 250 г раствора 15% вес/вес PVA с 200 г 30% суспензии талька. Смесь PVA/тальк распыляли на покрытые ферментом ядра со скоростью 10 г/мин, поддерживая указанные выше температуру на входе и давление распыления. Два килограмма 25% вес/вес раствора сульфата натрия (SP3) распыляли на покрытые PVA/тальком ядра при скорости распыления 15 г/мин, поддерживая указанные выше температуру на входе и давление распыления. Наконец, покрытие с контролируемым высвобождением (SP4) получали путем объединения 1200 г 30% вес/вес латексной суспензии Eudragit L 30 D-55 (Evonik Corporation, Кеннесо, Джорджия) с 800 г 30% вес/вес суспензии талька, поддерживая указанные выше температуру на входе и давление распыления. Из устройства для нанесения покрытия Vector FL-1 собирали 2000 г гранул фукозидазы с контролируемым высвобождением.
|
B. Влияние рациона с фукозидазой на снижение колонизации F18 ETEC
Гранулы фукозидазы с контролируемым высвобождением из раздела А примера 7 объединяли с кукурузно-соевым кормом в дозе 1000 грамм на тонну. Гранулы скармливали поросятам на доращивании. Покрытие с контролируемым высвобождением предотвращает высвобождение фукозидазы во время прохождения через желудок (приблизительно при рН 3), но обеспечивает высвобождение фукозидазного фермента
в кишечнике поросят, где фукозидаза удаляет альфа-1,2-фукозные группы из гликанов, тем самым значительно снижая вероятность колонизации
кишечника энтеротоксической F18 E. coli и связанной с этим диареи.
ПРИМЕР 8
Оценка индуцированного фукозидазой высвобождения фукозы из образцов ткани тонкого кишечника (двенадцатиперстной кишки)
Образец ткани размером примерно 1 см2 получали из двенадцатиперстной кишки двух разных 24-дневных поросят с неизвестным типом крови (поросенок_1 и поросенок_2). Эти образцы ткани помещали в пробирку объемом 12 мл и заливали 3 мл аналитического буфера (аналитический буфер: 50 мM натрий-фосфатный буфер, pH 6,+137 мM NaCl, 2,7 мM KCl) с 100 ppm фукозидазы CRC08392 или без нее. (См. таблицу 1 для соответствующего номера доступа.) Образцы инкубировали при 37°С в течение 1 часа. Одну аликвоту удаляли, а остаток образцов оставляли в инкубаторе. Образцы центрифугировали в настольной центрифуге. Супернатанты переносили в устройство центрифужного фильтра (с отсечкой 10 кДа), центрифугировали в течение ~ 1 часа. Высвобожденную фукозу количественно оценивали с применением набора L-Fucose от Megazyme в соответствии с инструкциями производителя для процедуры анализа в микропланшетах.
Результаты, изображенные на фигуре 11, показывают, что фукоза высвобождалась из образца ткани с использованием фукозидазы (CRC08392, имеющей номер доступа AAQ72464 (таблица 1)). По-видимому, эти результаты in vitro могут коррелировать с результатами, ожидаемыми при использовании этой фукозидазы in vivo.