Результат интеллектуальной деятельности: КОМПОЗИЦИЯ ДЛЯ ПРИСОЕДИНЕНИЯ РАДИОИЗОТОПА К ПОЛИПЕПТИДАМ И СПОСОБ ПРИСОЕДИНЕНИЯ РАДИОИЗОТОПА К ПОЛИПЕПТИДАМ
Вид РИД
Изобретение
Введение
Изобретение направлено на решение задачи возможно более простого и эффективного получения широкого круга радиофармацевтических препаратов, прежде всего полипептидных радиофармпрепаратов, которые могут быть использованы для терапии и диагностики, в частности для терапии и диагностики онкологических заболеваний. Эффективность радиофармацевтических препаратов, в особенности в случае применения их для терапии, во многом зависит от возможности получать их с высокой удельной радиоактивностью. Потребность в новых эффективных средствах диагностики и терапии рака велика, что обусловлено медленным прогрессом в развитии методов лечения многих онкологических заболеваний, смертность от которых практически не снижается на протяжении десятилетий.
Область техники
Изобретение относится к области фармацевтики и касается радиофармацевтических препаратов (РФП) на основе полипептидных носителей, может быть использовано в биотехнологии в экспериментальной медицине, клеточной и молекулярной биологии.
Уровень техники
Получение ряда готовых к употреблению РФП осуществляется путем смешивания в специально подобранном буферном растворе соответствующих радиоизотопов, например, 99mTc, 111In, 67Ga, 90Y и других, с определенным компонентом, обеспечивающим заданные диагностические или терапевтические характеристики. В настоящее время уже используется в практике ряд РФП на основе полипептидных носителей и разрабатывается намного большее количество подобных РФП (Reilly, 2010). Эффективность такого рода РФП зависит от полипептидного носителя, применяемого изотопа и эффективности присоединения одного к другому, что определяет удельную радиоактивность получаемых РФП. В наибольшей мере высокая удельная радиоактивность необходима для радиотерапевтических РФП на основе полипептидов, взаимодействующих со специфическими мишенями в организме. Полипептиды в составе РФП, не несущие радиоизотоп, конкурируют с полипептидами, несущими реальное действующее начало, снижая за счет этого эффект. Предпочтительными для РФП являются радиоизотопы с относительно небольшим, но достаточным для удобного практического применения периодом полураспада. К этим изотопам, с периодом полураспада в несколько дней, относятся, например, 111In, 67Ga и 90Y, с теоретически достижимой при присоединении одного атома радиоизотопа к одному носителю удельной радиоактивностью 40-49 мКи на нмоль пептидного носителя (Breeman et al., 2003). Для такого рода изотопов, известен, например, используемый для присоединения радиоизотопов буферный раствор ацетата натрия в концентрации 10 мМ - 1 М с pH 3-6 (патент RU 2251110, см. также аналогичный европейский патент EP 2112512). Подобные слабокислые ацетатные буферные растворы в большинстве случаев используют для присоединения изотопов индия, галлия, иттрия, лютеция к диагностическим и терапевтическим агентам при помощи ковалентно присоединенных к этим агентам хелаторов, таких как 1,4,7,10-тетраазоциклододекан-N,N'N'',N'''-тетрауксусная кислота (ДОТА), 1,4,7-триазоциклононан-1,4,7-триуксусная кислота (НОТА), диэтилентриаминпентауксусная кислота (ДТПА) и многих других (патенты US 7230085, US 7541018; US 8815211; US 8268781; US 7011816; US 7259249; US 8603435; EP 1156835; EP 1603598; заявки EP0264333A2; EP2962699A2; заявки US20140328754A1, US20050249671A9; см. также непатентные источники, например: Breeman et al., 2003; Wadas et al. 2010; Malmberg et al. 2012; Nayak & Brechbiel, 2009; Price & Orvig, 2013; Mukai et al., 2002; Varasteh et al., 2013; Lee et al., 1997; Andersson et al. 2015; Ju et al., 2010; Gao et al. 2016 и др.). В более щелочных условиях многие удобные для диагностики и радиотерапии изотопы, например, таких элементов, как In, Ga, Y, образуют плохо растворимые гидроксиды. Так, галлий легко образует нерастворимые гидроксиды при pH > 3, а индий - при pH > 3,4 (Anderson & Welch, 1999). Отмечается, что, хотя в некоторых случаях присоединение вышеупомянутых радиоизотопов проводили при pH 7-8 (Kukis et al. 1998), проблемы с их растворимостью в нейтральной и слабощелочной среде мешают добиваться получения препаратов с высокой удельной радиоактивностью (Breeman et al., 2003). Считается, что ацетат препятствует образованию гидроксидов за счет образования слабых комплексов с металлами (Clausen et al., 2002), что способствует более эффективному встраиванию в хелаторы, обладающие высоким сродством к ионам металлов. Несмотря на широкое применение ацетата в качестве средства для образования промежуточных комплексов с ионами для последующего встраивания в координационный центр высокоаффинного хелатора, этот подход обладает рядом недостатков, поскольку не всегда обеспечивает достаточно полное встраивание радиоизотопа и требует кислых условий, что создает проблемы для веществ, которые плохо растворимы в кислой среде.
Исследования, в которых присоединение радиоизотопов таких элементов, как галлий, проводили в нейтральной или слабощелочной среде позволяли получать препараты с невысокой удельной радиоактивностью. Так, например, присоединение 68Ga к маннозилированному альбумину происходило и при pH 7,4 в фосфатном буфере, однако полученная при этом удельная радиоактивность была даже менее 5 мКи/мг белка (Choi et al., 2011).
Другим вариантом буферного раствора для создания радиофармпрепаратов с помощью встраивания ионов используемых в медицине радиоизотопов в соответствующий хелатор является использование цитратного буфера (заявка EP 0264333A2; заявка WO1999036105A2; патенты US 5130118; US 5217704; EP 0315188; EP 0649857; EP 0495878). Как показали проведенные кинетические исследования, в результате взаимодействия галлия с хелатором НОТА, сначала быстро образуется промежуточный комплекс галлия с цитратом и хелатором, после чего этот комплекс в результате следующего скорость-лимитирующего шага переходит в комплекс галлий(III)-НОТА (Morfin & Tóth, 2011). Авторы отмечают также, что наибольшая скорость образования комплекса наблюдается при этом в достаточно кислой среде (pH~4). Недостатками цитратных буферных растворов или смесей на их основе для присоединения радиоактивных изотопов являются достаточно узкий диапазон значений pH, находящийся в кислой области, и невысокие удельные активности, которых достигали в упомянутых источниках в результате использования цитратного буфера или его смесей с ацетатом. Так, например, патент US 6024938 предлагает смесь, в которой кроме целевого белка (иммуноглобулин с присоединенным хелатором ДТПА) присутствует цитратный буфер, pH 4,5, хлорид натрия, мальтоза, полисорбат-80. На 1 мг белка в этом случае предлагается добавлять 1,25 мКи 111In, что при выходе присоединения 90% дает получаемую в итоге удельную радиоактивность немногим более 1 мКи/мг белка. Аналогичные удельные активности получаются и в результате применения вариантов, описанных для 111In в патентах US 5130118, несколько большие (4,5 мКи/мг белка) – для патента US 5217704. В заявке WO1999036105A2 для 111In описана удельная радиоактивность 2 мКи/мг белка (10 мКи/мг для 90Y). Кроме того, отмечают, что цитрат в определенных условиях может мешать образованию комплексов радиоизотопов с хелаторами (Lewis et al., 1994).
Еще одним вариантом буферного раствора для присоединения радиоизотопов с использованием хелаторов является использование 4-(2-гидроксиэтил)пиперазин-1-этансульфоновой кислоты (HEPES) (патент US 5225181; заявка US 20150231285A1). Использование этого буферного раствора в той области, в которой он обладает выраженными буферными свойствами (6,8 – 8,2) для присоединения таких радиоизотопов, как индий, требует последующей очистки (US 5225181). В то же время, мечение полипептидов индием в присутствии HEPES или другого подобного соединения 2-(N-морфолино)этансульфоновой кислоты (MES) в более кислой среде (pH 5,5) позволяет добиваться высокой удельной радиоактивности (Brom et al., 2012). Недостатком этого подхода является трудности, которые возникают при попытке присоединить полипептиды, которые плохо растворимы в слабокислой области.
Для решения этой проблемы предложен также метод гетерогенного присоединения радиоизотопов к полипептидам, плохо растворимым в слабокислой среде. В этом случае полипептид, плохо растворимый в кислой среде, с присоединенным хелатором НОТА в процессе получения конъюгата с 67Ga выпадал в осадок, после чего полученный конъюгат отделяли центрифугированием от несвязанного галлия, перерастворяли в фосфатном буфере с ДМСО при pH 8 и доочищали при помощи повторного центрифугирования и гель-фильтрации (Koumarianou et al., 2014). Такой вариант присоединения радиоизотопа требует проведения нескольких стадий очистки и плохо приспособлен для широкого применения при рутинном приготовлении РФП.
Задача изобретения.
Задачей настоящего изобретения является создание композиции, позволяющей присоединять радиоизотопы, легко образующие нерастворимые гидроксиды при pH больше 3-3,5, к полипептидам, которые плохо растворимы в слабокислой среде (pH 3-6). Композиция должна обеспечивать высокоэффективное присоединение такого рода изотопа при высокой степени радиохимической чистоты получаемого продукта. Кроме этого, метод применения, основанный на использовании такой композиции должен быть достаточно простым, без применений стадий очистки с тем, чтобы его можно было бы впоследствии использовать в широкой практике.
В качестве примера такого рода полипептидов можно привести модульные транспортные полипептиды, описанные в патенте US 9095624, которые плохо растворимы в диапазоне pH от 3,5 до 7.
Сущность изобретения.
Сущность изобретения состоит в получении композиции из нескольких соединений, способствующих как растворимости ионов радиоизотопов таких элементов, как индий, галлий, иттрий и им подобных, в области значений pH, в которой они образуют нерастворимые гидроксиды, так и растворимости полипептидов, которые плохо растворимы в той же области значений pH. В результате применения композиции создаются условия для хелатирования этих радиоизотопов хелаторами, присоединенными к вышеупомянутым полипептидам. Для этой цели на основании соображений о том, что несколько веществ, способных образовывать слабые комплексы с ионами вышеупомянутых радиоизотопов, будут способствовать более полному образованию комплексов с хелаторами, присоединенными к вышеупомянутым полипептидам, а додецилсульфат в концентрациях ниже критической концентрации мицеллообразования будет способствовать тому, что полипептиды с присоединенными хелаторами будут оставаться в растворе в процессе присоединения, был разработан соответствующий состав композиции.
Эта композиция для присоединения радиоизотопа к полипептиду с ковалентно присоединенным хелатором, включает помимо полипептида и присоединяемого радиоизотопа цитрат натрия, 4-(2-гидроксиэтил)пиперазин-1-этансульфоновую кислоту (HEPES), хлорид натрия, додецилсульфат натрия (SDS). Эта композиция способна обеспечивать присоединение радиоизотопа при значениях pH, находящихся в диапазоне 4-7 единиц.
В качестве одного из компонентов композиции, а именно, в качестве вещества, способного образовывать слабые комплексы с радиоизотопом, используется цитрат натрия. Данная композиция для присоединения радиоизотопа к полипептиду с ковалентно присоединенным хелатором обеспечивает присоединение радиоизотопа при концентрациях цитрата натрия в диапазоне 1-20 мМ и наилучшим образом работает при концентрации цитрата натрия 6 мМ.
В качестве другого компонента композиции, а именно, в качестве вещества, способного образовывать комплексы с радиоизотопом, используется HEPES, комплексы которого с радиоизотопом слабее, чем цитратные. Проведенная в процессе создания композиции работа показала, что композиция для присоединения радиоизотопа к полипептиду с ковалентно присоединенным хелатором обеспечивает присоединение изотопа в присутствии 80 мМ HEPES.
В качестве компонента композиции для присоединения радиоизотопа к полипептиду с ковалентно присоединенным хелатором, способствующего тому, что полипептиды с присоединенными хелаторами будут оставаться в растворе в процессе присоединения, используется додецилсульфат натрия в концентрации ниже критической концентрации мицеллообразования. Такие концентрации додецилсульфата должны обеспечивать экранирование гидрофобных участков образующихся на молекулах полипептидов, имеющих изоэлектрическую точку в области pH, в которой происходит эффективное присоединение радиоизотопа к полипептиду с ковалентно присоединенным хелатором, без образования мицелл. В качестве предпочтительной в композиции используется концентрация додецилсульфата натрия 0,02%.
Проведенные исследования по подбору состава композиции для присоединения радиоизотопа к полипептиду с ковалентно присоединенным хелатором выявили, что pH 4,5 является предпочтительным для присоединения, хотя достаточно эффективное присоединение происходит и в области pH от 3 до 7,5.
Композиция для присоединения радиоизотопа к полипептиду с ковалентно присоединенным хелатором предназначена для искусственных химерных полипептидов, которые создаются для направленного транспорта различных активных веществ в клетки-мишени. Такие искусственные транспортные конструкции рассматриваются как перспективное средство для создания нового поколения лекарственных препаратов (Sobolev, 2008; Costantini et al., 2008; Lorberboum-Galski, 2011; Weldon & Pastan, 2011; Rosenkranz et al., 2014). Поскольку во многих случаях для создания таких конструкций используются амфифильные последовательности для взаимодействия с липидным бислоем, гидрофильность которых уменьшается в слабокислой среде, заявляемая композиция является средством решения проблемы присоединения ионов таких радиоактивных изотопов таких элементов, как индий, галлий, иттрий к необходимым полипептидам. В качестве примера таких химерных полипептидов можно назвать модульные транспортные полипептиды (модульные нанотранспортеры), состоящие из интернализуемого лигандного модуля для взаимодействия с клеткой-мишенью, эндосомолитического модуля, модуля для транспорта в ядро и модуля носителя (Rosenkranz et al., 2000, 2003, 2008, 2014; Gilyazova et al., 2005, 2006; Sobolev 2008, 2009, 2013; Slastnikova et al., 2012a,b, 2015; Koumarianou E. et al., 2014; патент US 9095624). Кроме таких искусственных полипептидов с присоединенными хелаторами, композиция может быть использована для присоединения соответствующих радиоизотопов к полипептидам, модифицированным дополнительными ковалентно присоединенными активными компонентами, обеспечивающими, например, взаимодействие с клетками-мишенями. Иными словами, композиция обеспечивает также присоединение радиоизотопов к конъюгатам полипептидов с активными в отношении клеток компонентами, для обеспечения чего к этим полипептидам присоединены также и хелаторы, способные взаимодействовать с необходимыми радиоизотопами.
Композиция для присоединения радиоизотопа к полипептиду с ковалентно присоединенным хелатором может быть использована для присоединения соответствующих радиоизотопов к природным полипептидам (белкам).
Композиция для присоединения радиоизотопа к полипептиду с ковалентно присоединенным хелатором может быть использована для присоединения ионов радиоизотопов таких элементов, как индий, галлий, иттрий, технеций, лютеций и других подобных элементов, способных образовывать комплексы с соответствующими присоединенными к полипептидам хелаторами.
Заявляемая композиция может быть использована для присоединения вышеупомянутых радиоизотопов к полипептидам при помощи таких ковалентно присоединенных к полипептидам хелаторов, как 1,4,7-триазоциклононан-1,4,7-триуксусная кислота (НОТА), 1,4,7,10-тетраазоциклододекан-N,N'N'',N'''-тетрауксусная кислота (ДОТА), диэтилентриаминпентауксусная кислота (ДТПА), а также других хелаторов.
Процесс присоединения радиоизотопа к полипептиду с ковалентно присоединенным хелатором, состоит в том, что радиоизотоп добавляют к полипептиду с присоединенным хелатором и инкубируют в среде, содержащей цитрат натрия, 4-(2-гидроксиэтил)пиперазин-1-этансульфоновую кислоту (HEPES), хлорид натрия, додецилсульфат натрия (SDS), с подобранными концентрациями вышеуказанных компонентов, при подобранной температуре в течение подобранного времени с подобранным значением pH, находящимся в диапазоне 4-7,5 единиц, после чего добавляют хлорид натрия до физиологической концентрации ионов в смеси и гидроксид натрия до pH 7,5. Инкубацию можно производить при разной температуре, в зависимости от устойчивости полпептида и удобства работы, в частности, инкубацию можно производить при температуре 37°С, а также при комнатной температуре. Инкубацию проводят в течение необходимого времени, которое зависит от используемых температуры, радиоизотопа и хелатора, который присоединен к полипептиду.
Технический результат.
Достигаемый технический результат заключается в том, что при использовании простого метода смешения радиоизотопа и плохо растворимого в слабокислой среде полипептида в буферном растворе заявляемой композиции можно получить РФП с высокой радиохимической чистотой и высокой удельной радиоактивностью, не требующий в процессе получения отдельной стадии очистки. Для полипептидов с присоединенным радиоизотопом 111In достигается 95 – 99% радиохимическая чистота при удельной радиоактивности не менее 70 мКи/мг полипептида. Метод работает также и для полипептидов, которые хорошо растворимы в слабокислой среде. Метод может быть применен для изотопов таких элементов, как индий, галлий, иттрий, лютеций и других.
Предполагается, что специалист в данной области техники может, применяя предыдущее описание, использовать настоящее изобретение в его полном объеме. Последующие предпочтительные специфические варианты осуществления интерпретируются исключительно как иллюстративные и не могут рассматриваться в качестве материала, ограничивающего объем настоящего изобретения.
Краткое описание иллюстраций к примерам, описывающим композицию для присоединения радиоизотопа к полипептидам.
Фиг. 1. Анализ распределения в полиакриламидном геле (ПААГ) радиоактивности образца 111In-НОТА-полипептид-1 (111In-НОТА-ПП1), полученного с помощью композиции для присоединения радиоизотопа к полипептидам. 111In-НОТА-ПП1 был получен, как описано в примере 10, после чего аликвота препарата была разделена электрофорезом в ПААГ (Any kD™ Mini-PROTEAN® TGX™ Precast Protein Gel, Biorad, Россия) по Лэммли (Laemmli, 1970) с последующей детекцией радиоактивного излучения при помощи фосфоримеджера Storm 865 (GE Healthcare, Швеция). Слева – отметки, соответствующие расположению цветных маркеров молекулярной массы на геле (ColorBurst™ Electrophoresis Marker, Sigma, США). Содержание свободного, не присоединенного к полипептиду 111In составило 0,95%. Количественный анализ распределения радиоактивности выполнен с использованием программы ImageQuant TL 5.0 (Bio-Rad, США).
Фиг. 2. Анализ распределения в ПААГ радиоактивности образца 111In-НОТА-полипептид-2 (111In-НОТА-ПП2), полученного с помощью композиции для присоединения радиоизотопа к полипептидам. 111In-НОТА-ПП2 был получен, как описано в примере 10, после чего аликвота препарата была разделена электрофорезом в ПААГ (Any kD™ Mini-PROTEAN® TGX™ Precast Protein Gel) по Лэммли (Laemmli, 1970) с последующей детекцией радиоактивного излучения при помощи фосфоримеджера Storm 865. Слева – отметки, соответствующие расположению цветных маркеров молекулярной массы на геле (ColorBurst™ Electrophoresis Marker). Содержание свободного, не присоединенного к полипептиду 111In составило 3,7%. Количественный анализ распределения радиоактивности выполнен с использованием программы ImageQuant TL 5.0.
Фиг. 3. Анализ распределения в ПААГ радиоактивности образца 111In-НОТА-полипептид-3 (111In-НОТА-ПП3), полученного с помощью композиции для присоединения радиоизотопа к полипептидам. 111In-НОТА-ПП3 был получен, как описано в примере 10, после чего аликвота препарата была разделена электрофорезом в ПААГ (Any kD™ Mini-PROTEAN® TGX™ Precast Protein Gel) по Лэммли (Laemmli, 1970) с последующей детекцией радиоактивного излучения при помощи фосфоримеджера Storm 865. Слева – отметки, соответствующие расположению цветных маркеров молекулярной массы на геле (ColorBurst™ Electrophoresis Marker). Содержание свободного, не присоединенного к полипептиду 111In составило 2,1%. Количественный анализ распределения радиоактивности выполнен с использованием программы ImageQuant TL 5.0.
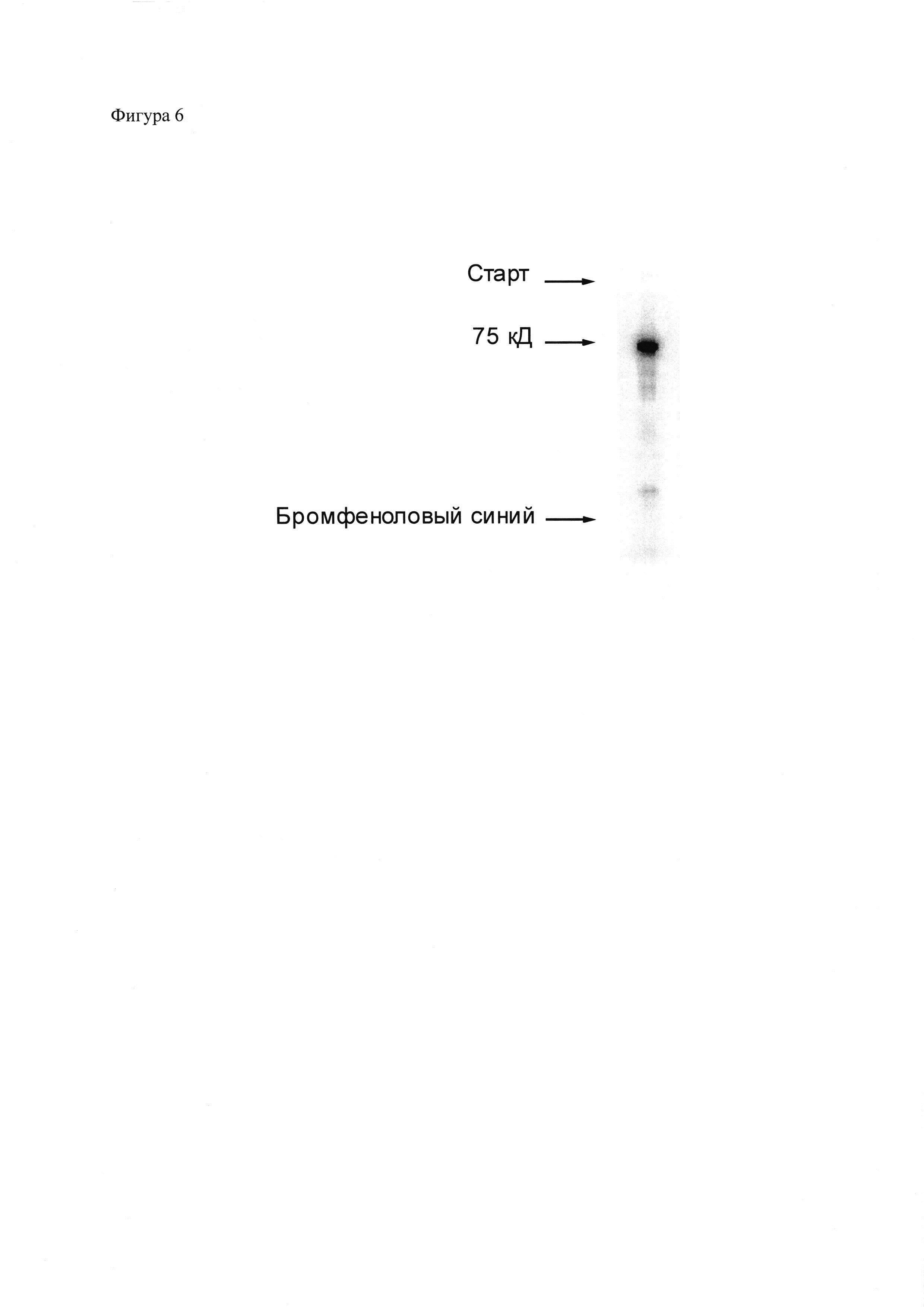
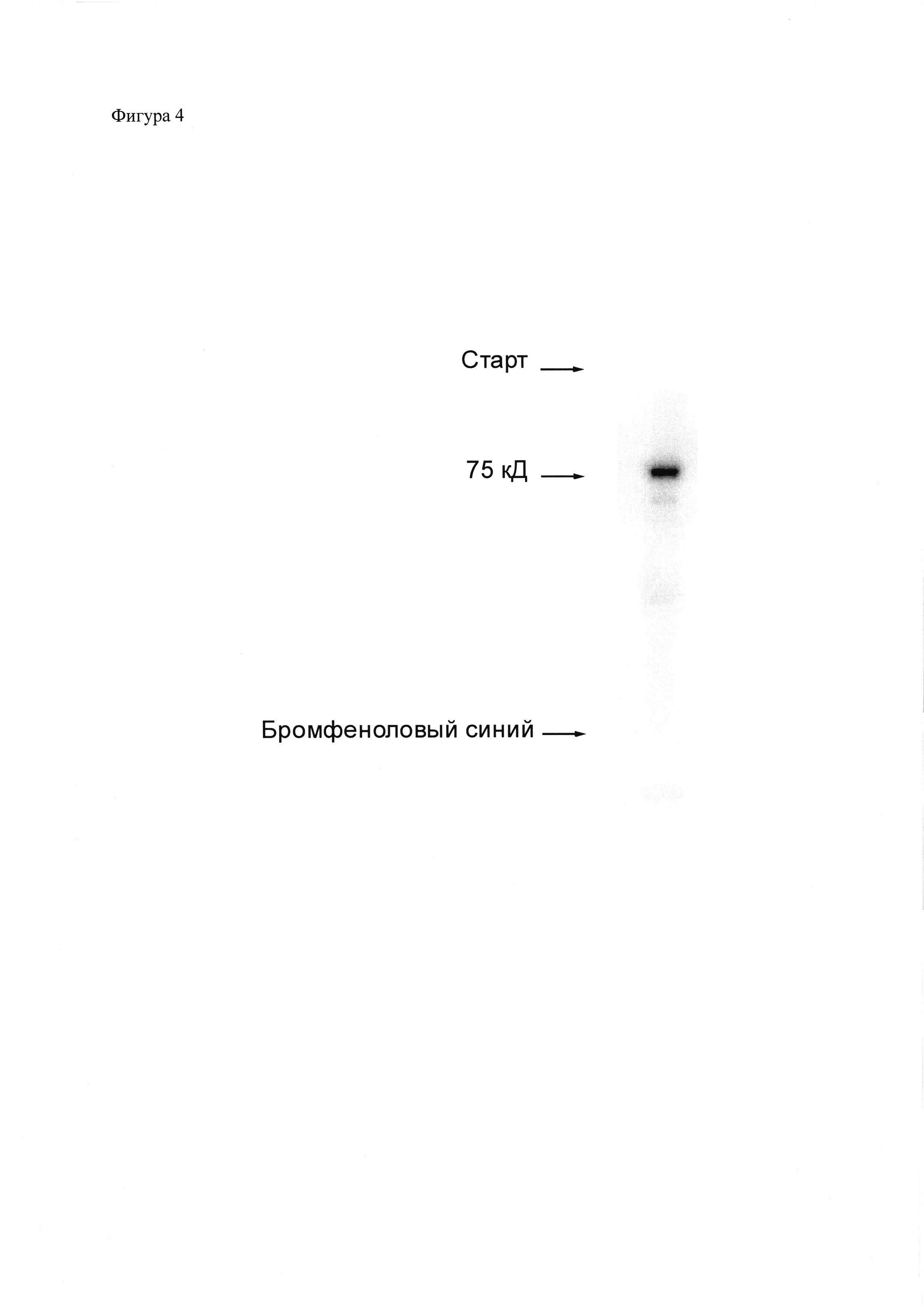
Фиг. 4. Анализ распределения в ПААГ радиоактивности образца 111In-НОТА-(полипептид-4)-(фолиевая кислота) (111In-НОТА-ПП4-ФК), полученного с помощью композиции для присоединения радиоизотопа к полипептидам. 111In-НОТА-ПП4-ФК был получен, как описано в примере 10, после чего аликвота препарата была разделена электрофорезом в ПААГ (Any kD™ Mini-PROTEAN® TGX™ Precast Protein Gel) по Лэммли (Laemmli, 1970) с последующей детекцией радиоактивного излучения при помощи фосфоримеджера Storm 865. Слева – отметки, соответствующие расположению старта, флуоресцентно-меченного полипептида с молекулярной массой 75 кД и бромфенолового синего. Содержание свободного, не присоединенного к полипептиду 111In составило 3,3%. Количественный анализ распределения радиоактивности выполнен с использованием программы ImageQuant TL 5.0.
Фиг. 5. Анализ распределения в ПААГ радиоактивности образца 111In-НОТА-(полипептид-4)-(полиэтиленгликоль-фолиевая кислота) (111In-НОТА-ПП4-ПЭГ-ФК), полученного с помощью композиции для присоединения радиоизотопа к полипептидам. 111In-НОТА-ПП4-ПЭГ-ФК был получен, как описано в примере 10, после чего аликвота препарата была разделена электрофорезом в ПААГ (Any kD™ Mini-PROTEAN® TGX™ Precast Protein Gel) по Лэммли (Laemmli, 1970) с последующей детекцией радиоактивного излучения при помощи фосфоримеджера Storm 865. Слева – отметки, соответствующие расположению цветных маркеров молекулярной массы на геле (ColorBurst™ Electrophoresis Marker). Содержание свободного, не присоединенного к полипептиду 111In составило 1,4%. Количественный анализ распределения радиоактивности выполнен с использованием программы ImageQuant TL 5.0.
Фиг. 6. Анализ распределения в ПААГ радиоактивности образца 111In-НОТА-полипептид-5 (111In-НОТА-ПП5), полученного с помощью композиции для присоединения радиоизотопа к полипептидам. 111In-НОТА-ПП5 был получен, как описано в примере 10, после чего аликвота препарата была разделена электрофорезом в ПААГ (Any kD™ Mini-PROTEAN® TGX™ Precast Protein Gel) по Лэммли (Laemmli, 1970) с последующей детекцией радиоактивного излучения при помощи фосфоримеджера Storm 865. Слева – отметки, соответствующие расположению старта, флуоресцентно-меченного полипептида с молекулярной массой 70 кД и бромфенолового синего. Содержание свободного, не присоединенного к полипептиду 111In составило 2,5%. Количественный анализ распределения радиоактивности выполнен с использованием программы ImageQuant TL 5.0.
Фиг. 7. Анализ распределения в ПААГ радиоактивности образца 111In-НОТА-полипептид-6 (111In-НОТА-ПП6), полученного с помощью композиции для присоединения радиоизотопа к полипептидам. 111In-НОТА-ПП6 был получен, как описано в примере 10, после чего аликвота препарата была разделена электрофорезом в ПААГ (Any kD™ Mini-PROTEAN® TGX™ Precast Protein Gel, Biorad, Россия) по Лэммли (Laemmli, 1970) с последующей детекцией радиоактивного излучения при помощи фосфоримеджера Storm 865 (GE Healthcare, Швеция). Слева – отметки, соответствующие расположению цветных маркеров молекулярной массы на геле (ColorBurst™ Electrophoresis Marker, Sigma, США). Содержание свободного, не присоединенного к полипептиду 111In составило 4,8%. Количественный анализ распределения радиоактивности выполнен с использованием программы ImageQuant TL 5.0 (Bio-Rad, США).
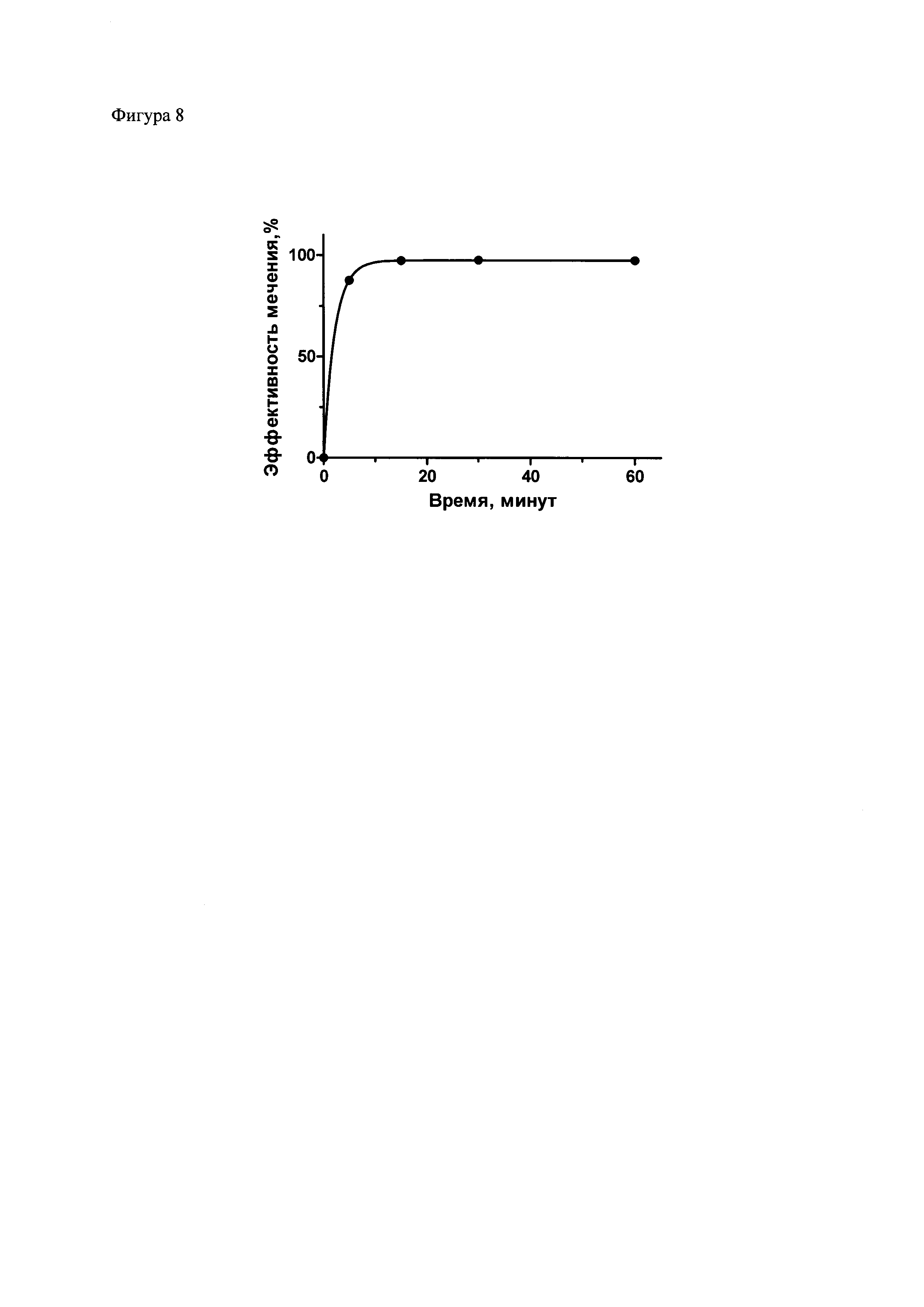
Фиг. 8. Кинетика присоединения 111In к НОТА-полипептид-2 (НОТА-ПП2). 111In-НОТА-ПП2 был получен, как описано в примере 10, за исключением времени инкубации радиоизотопа с НОТА-ПП2, которое указано на графике. После окончания инкубации к образцам был добавлен ЭДТА, после чего аликвоты препаратов были разделены электрофорезом в ПААГ (Any kD™ Mini-PROTEAN® TGX™ Precast Protein Gel, Biorad, Россия) по Лэммли (Laemmli, 1970) с последующей детекцией радиоактивного излучения при помощи фосфоримеджера Storm 865 (GE Healthcare, Швеция). Количественный анализ распределения радиоактивности выполнен с использованием программы ImageQuant TL 5.0 (Bio-Rad, США).
Фиг. 9. Анализ распределения в ПААГ радиоактивности образца 111In-ДОТА-полипептид-2 (111In-ДОТА-ПП2), полученного с помощью композиции для присоединения радиоизотопа к полипептидам. 111In-ДОТА-ПП2 был получен, как описано в примере 11, после чего аликвота препарата была разделена электрофорезом в ПААГ (Any kD™ Mini-PROTEAN® TGX™ Precast Protein Gel) по Лэммли (Laemmli, 1970) с последующей детекцией радиоактивного излучения при помощи фосфоримеджера Storm 865. Слева – отметки, соответствующие расположению цветных маркеров молекулярной массы на геле (ColorBurst™ Electrophoresis Marker). Содержание свободного, не присоединенного к полипептиду 111In составило 1,5%. Количественный анализ распределения радиоактивности по гелю выполнен с использованием программы ImageQuant TL 5.0.
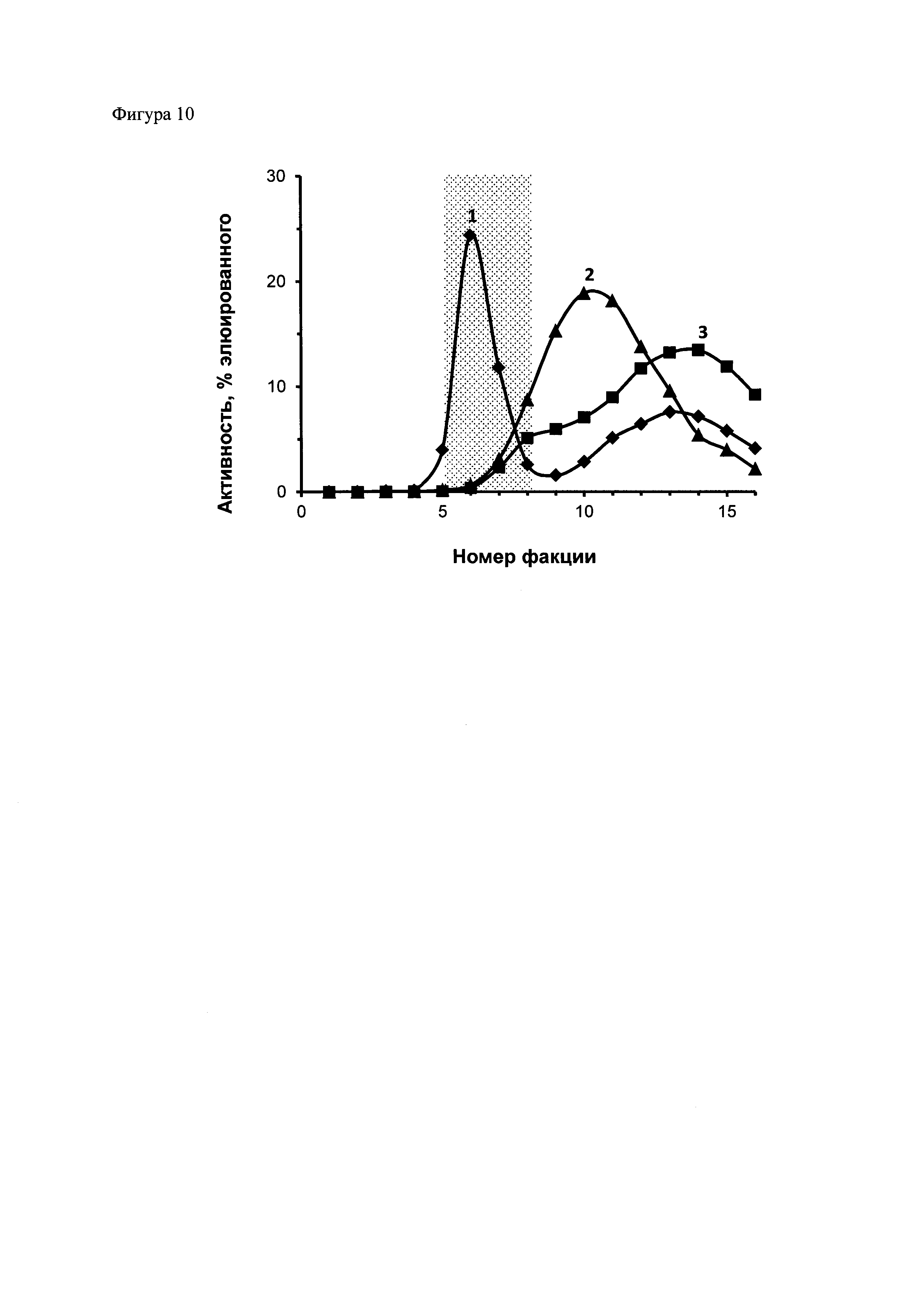
Фиг. 10. Хроматография растворов радиоизотопов после их инкубации в растворе для мечения полипептидов. 111In или 67Ga были проинкубированы при 37ºС в течение 2 часов в растворе для мечения полипептидов, после чего к ним был добавлен ЭДТА до концентрации 1,5 мМ и проведена гель-фильтрация на готовых колонках с Сефадексом G-25 (PD-10, GE-HeallthCare, США) при сборе фракций по 10 капель (около 400 мкл). 1 – хроматография раствора 111In без цитрата, 2 – хроматография раствора 111In с 6 мМ цитратом, 3 – хроматография раствора 67Ga с 6 мМ цитратом. Заштрихована область элюции полипептидов, описанных в примерах 1-6.
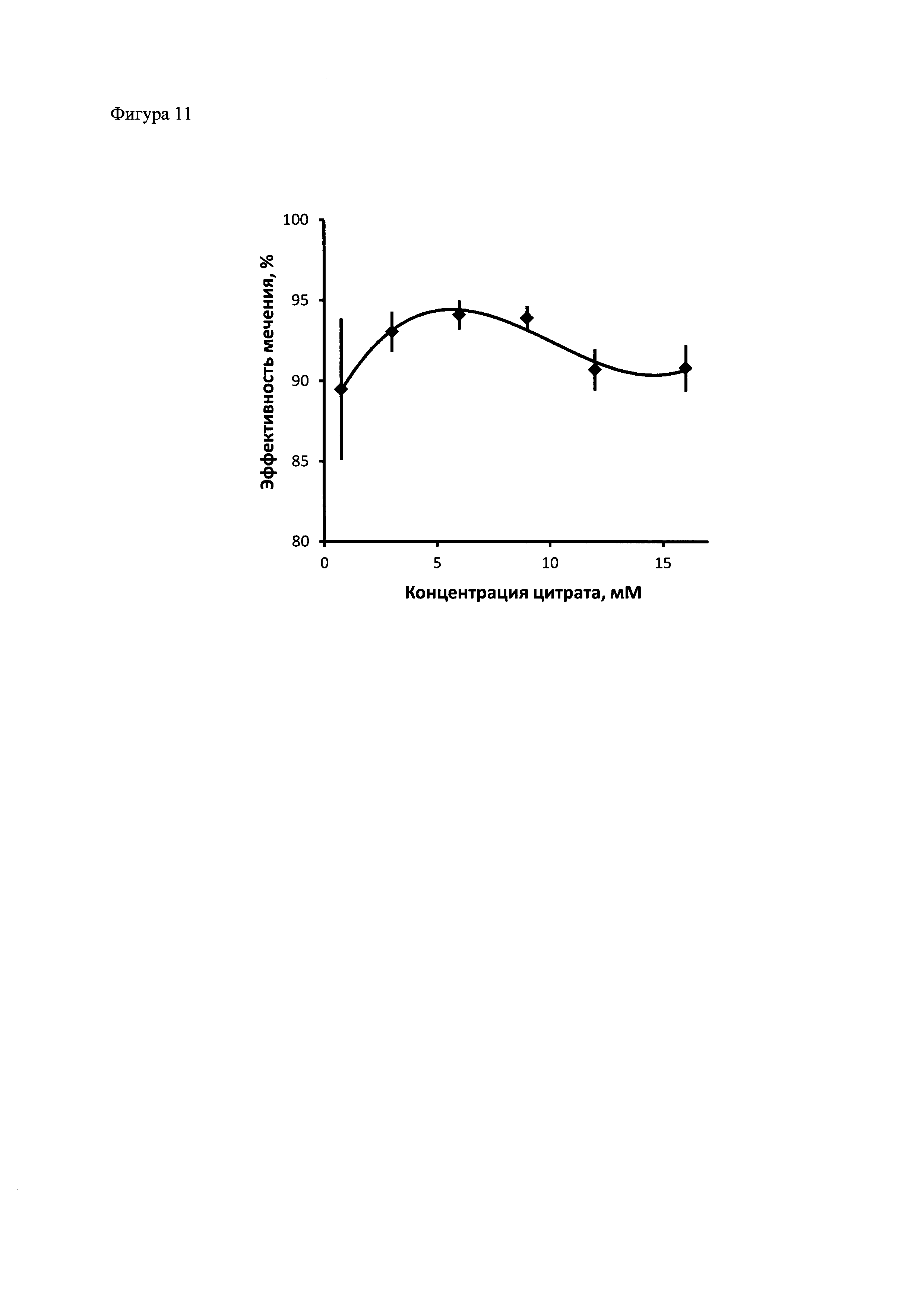
Фиг. 11. Влияние концентрации цитрата на эффективность присоединения радиоизотопа к полипептиду. Полипептид 2 был проинкубирован с 111In, в условиях, описанных в примере 10, с различными концентрациями цитрата, после чего аликвоты растворов были подвергнуты электрофорезу в полиакриламидном геле (Any kD™ Mini-PROTEAN® TGX™ Precast Protein Gel) по Лэммли (Laemmli, 1970) с последующей детекцией радиоактивного излучения при помощи фосфоримеджера Storm 865. Количественный анализ распределения радиоактивности выполнен с использованием программы ImageQuant TL 5.0. Данные на графике представляют собой средние значения 2-4 независимых экспериментов ± стандартная ошибка среднего.
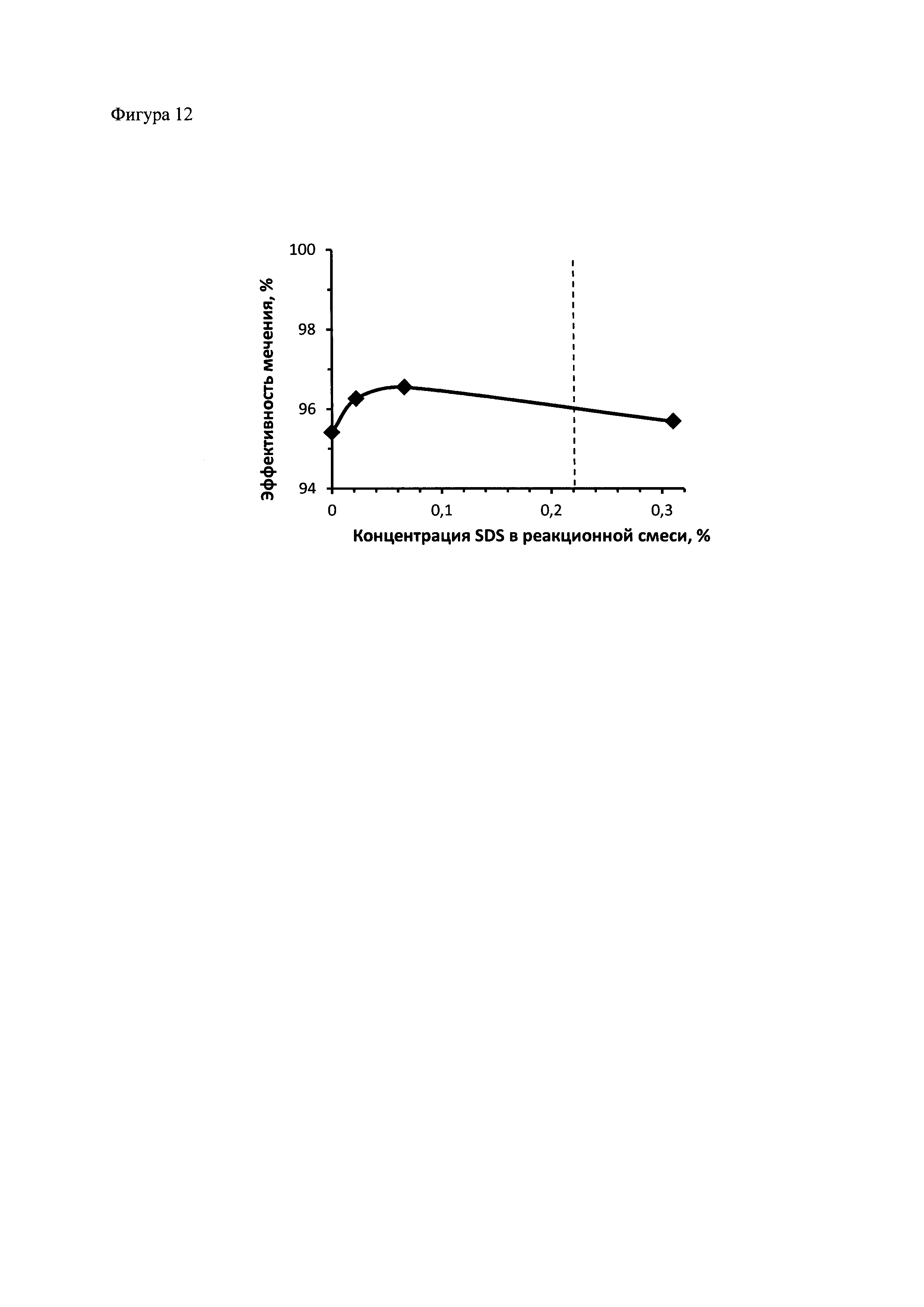
Фиг. 12. Влияние добавления в состав композиции для присоединения радиоизотопа к полипептидам SDS на эффективность присоединения 111In к НОТА-полипептид 2 (НОТА-ПП2). Присоединение 111In к НОТА-ПП2 было проведено, как описано в примере 10 за исключением концентрации SDS, концентрации которого была различной. Вертикальной прерывистой линией отмечена критическая концентрация мицеллообразования для SDS.
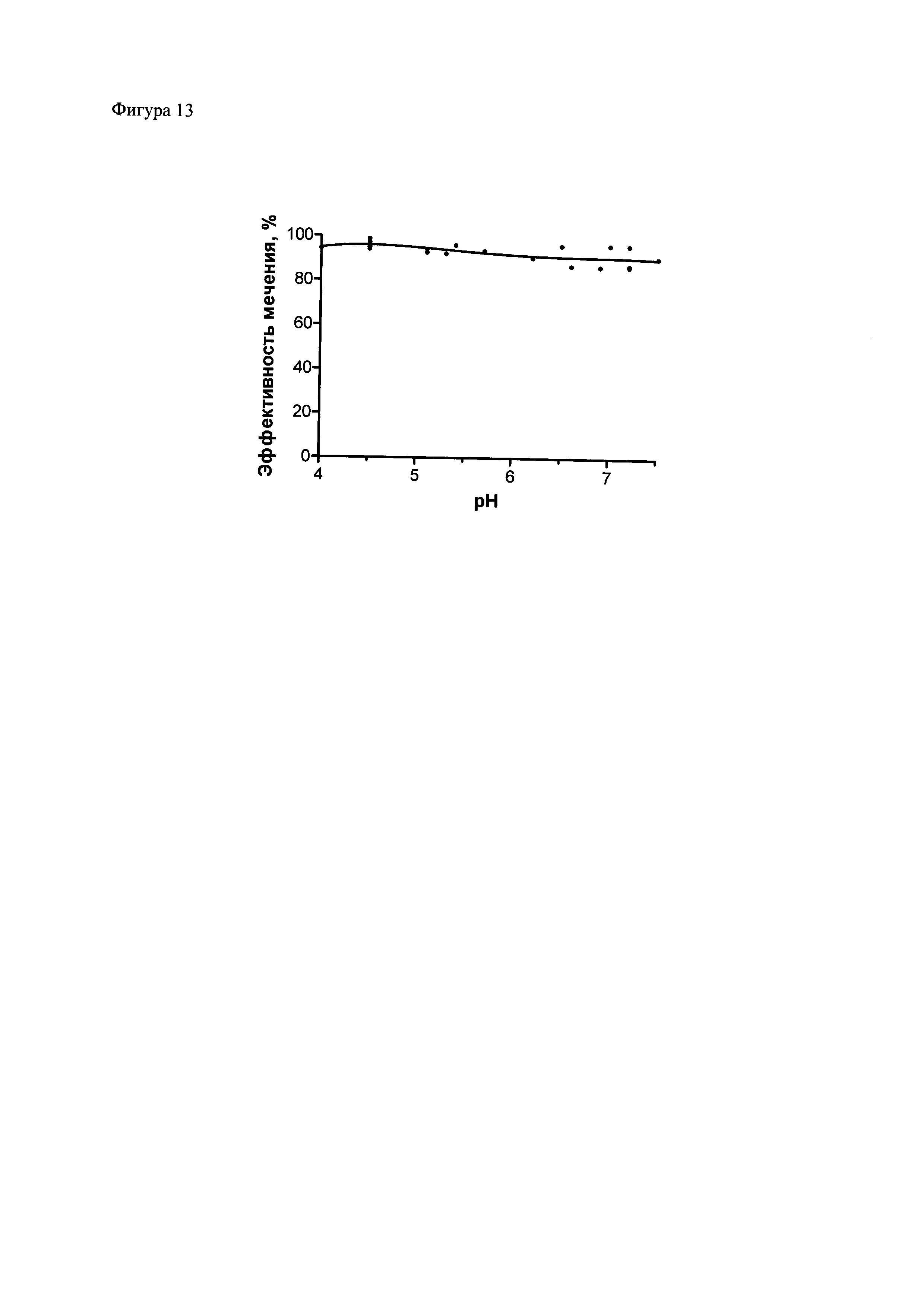
Фиг. 13. Зависимость эффективности присоединения 111In к полипептиду при помощи композиции для присоединения радиоизотопа к полипептидам от pH. Полипептид 2 был проинкубирован 111In, в условиях, описанных в примере 10, за исключением добавляемого количества 0,25 М HCl для обеспечения различных pH, после чего аликвоты растворов были подвергнуты электрофорезу в ПААГ (Any kD™ Mini-PROTEAN® TGX™ Precast Protein Gel) по Лэммли (Laemmli, 1970) с последующей детекцией радиоактивного излучения при помощи фосфоримеджера Storm 865. Количественный анализ распределения радиоактивности выполнен с использованием программы ImageQuant TL 5.0.
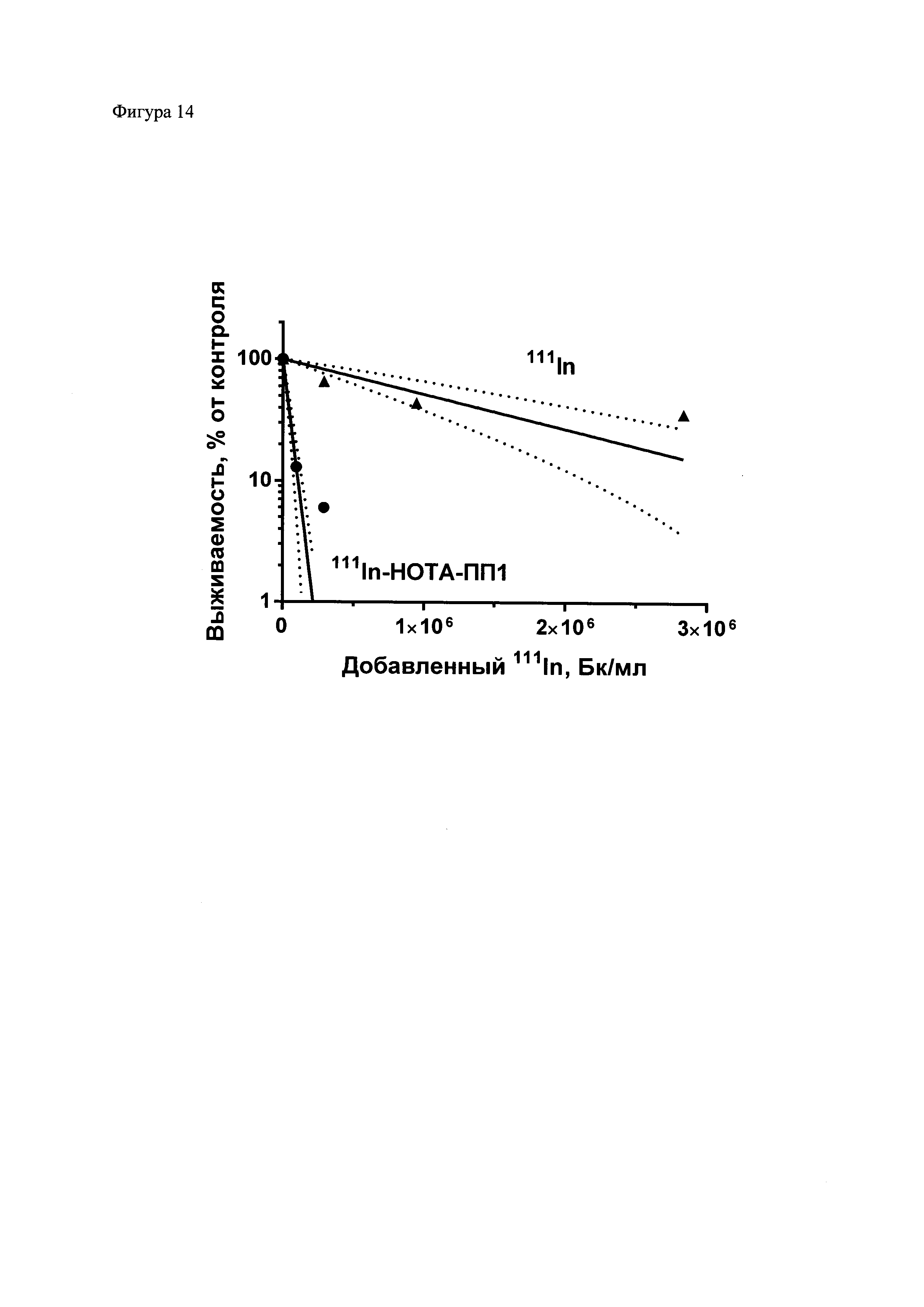
Фиг. 14. Усиление цитотоксического действия 111In в результате его присоединения при помощи композиции для присоединения радиоизотопа к полипептидам. 111In был присоединен к полипептиду 1 (ПП1), модифицированному хелатором НОТА. 111In-полипептид и 111In в различных концентрациях был добавлен к клеткам рака мочевого пузыря человека линии EJ, и после инкубации в течение 48 часов выживаемость была определена методом колониеобразования. Результаты типичного эксперимента приведены в виде среднего значения ± стандартная ошибка среднего (3-6 повторов), значение которой не выходит за пределы символа, обозначающего среднее значение. Прерывистыми линиями обозначены границы 95% доверительного интервала. Данные были оценены по одноэкспоненциальному уравнению y=A⋅e-k·x, для обоих наборов данных. Соотношение A37 (1/k) = 32,6, достоверность различия констант p<0,0001 по f-критерию Фишера.
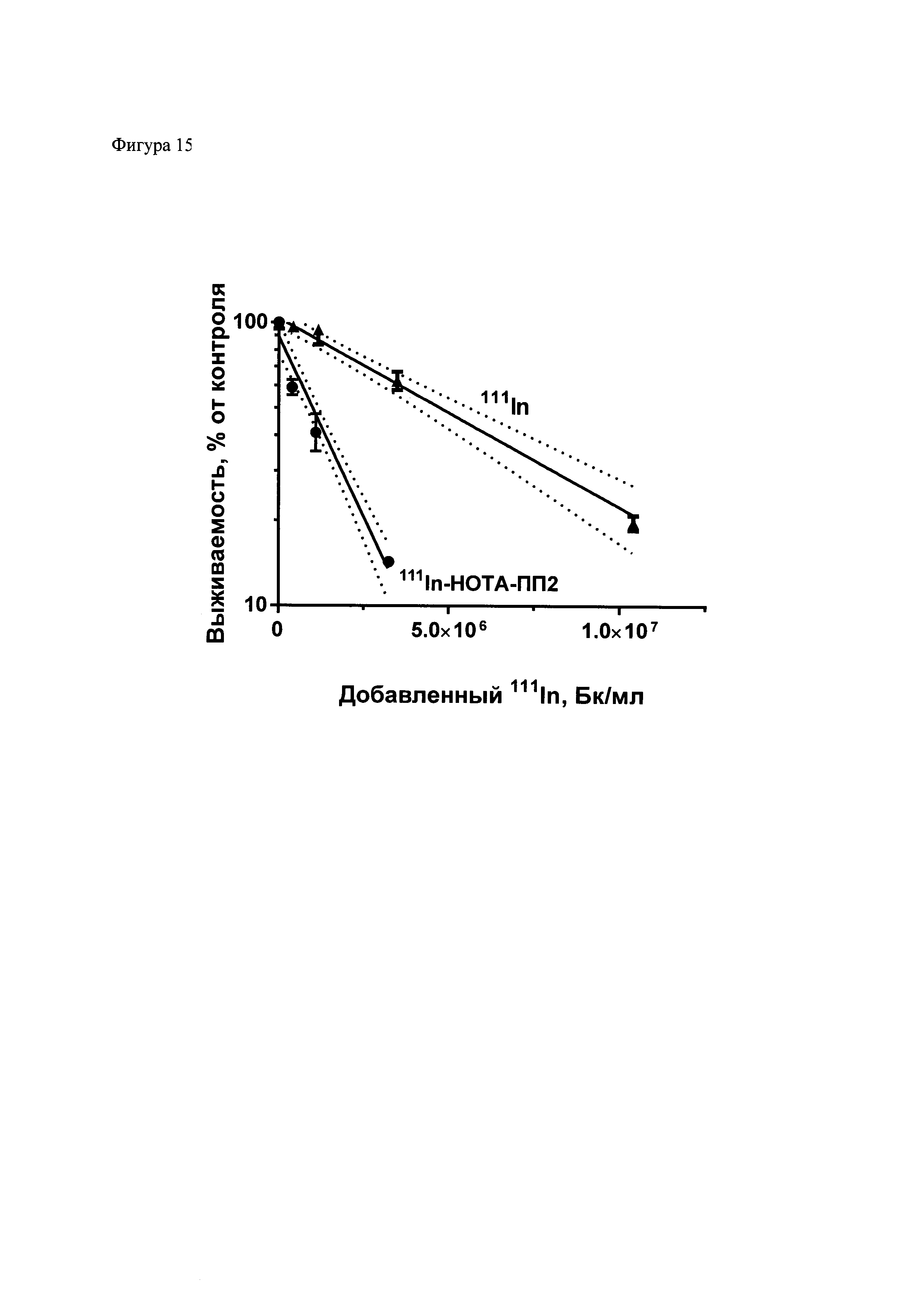
Фиг. 15. Усиление цитотоксического действия 111In в результате его присоединения при помощи композиции для присоединения радиоизотопа к полипептидам. 111In был присоединен к полипептиду 2 (ПП2), модифицированному хелатором НОТА. 111In-полипептид и 111In в различных концентрациях был добавлен к клеткам меланомы мыши B16-F1, и после инкубации в течение 48 часов выживаемость была определена методом колониеобразования. Результаты типичного эксперимента приведены в виде среднего значения ± стандартная ошибка среднего, прерывистыми линиями обозначены границы 95% доверительного интервала. Данные были оценены по одноэкспоненциальному уравнению y=A⋅e-k·x, для обоих наборов данных. Соотношение A37 (1/k) = 3,7, достоверность различия констант p<0,0001 по f-критерию Фишера.
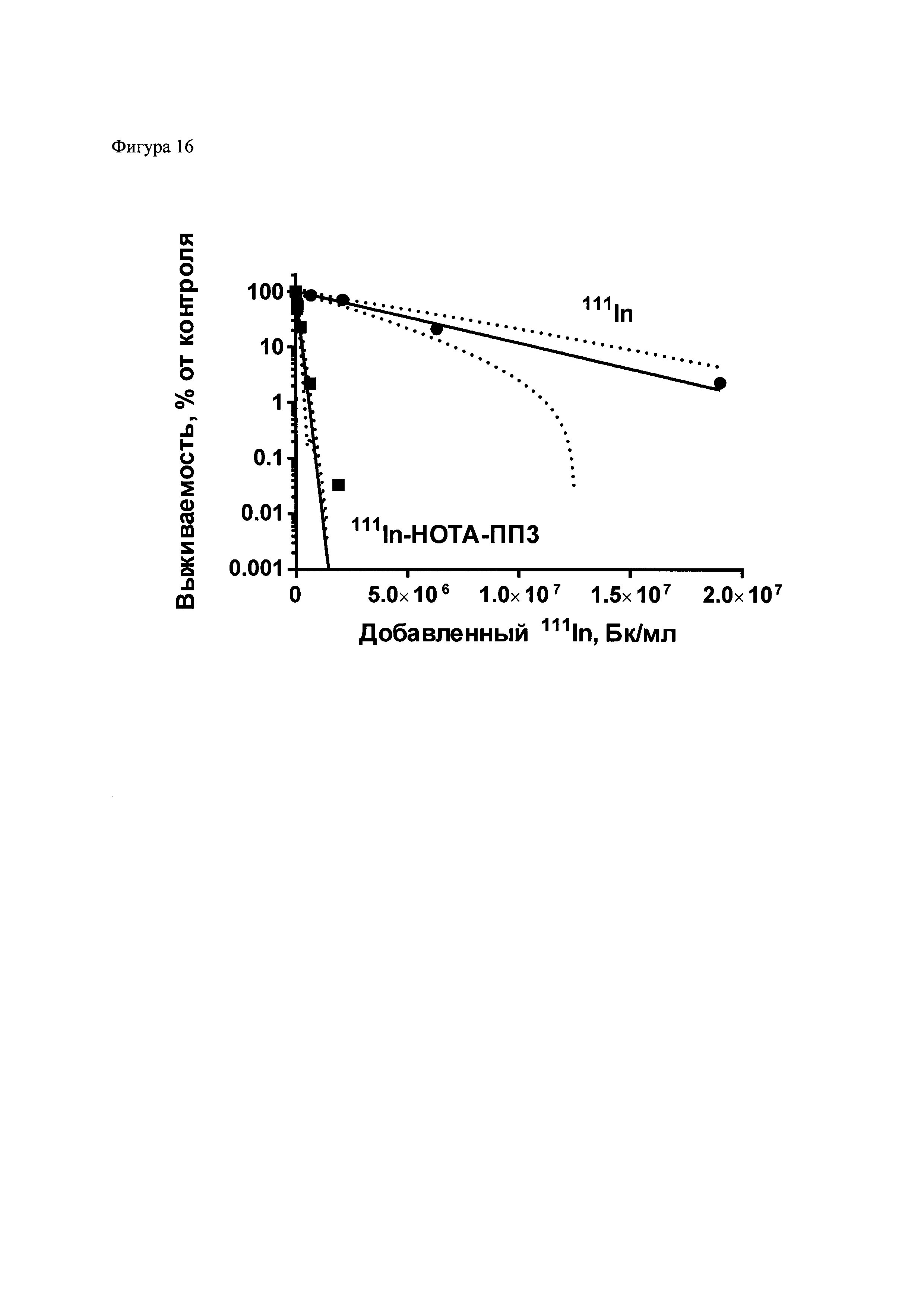
Фиг. 16. Усиление цитотоксического действия 111In в результате его присоединения при помощи композиции для присоединения радиоизотопа к полипептидам. 111In был присоединен к полипептиду 3 (ПП3), модифицированному хелатором НОТА. 111In-полипептид и 111In в различных концентрациях был добавлен к клеткам эпидермоидной карциномы человека линии А431, и после инкубации в течение 48 часов выживаемость была определена методом колониеобразования. Результаты типичного эксперимента приведены в виде среднего значения ± стандартная ошибка среднего, прерывистыми линиями обозначены границы 95% доверительного интервала. Данные были оценены по одноэкспоненциальному уравнению y=A⋅e-k·x, для обоих наборов данных. Соотношение A37 (1/k) = 36,6, достоверность различия констант p<0,0001 по f-критерию Фишера.
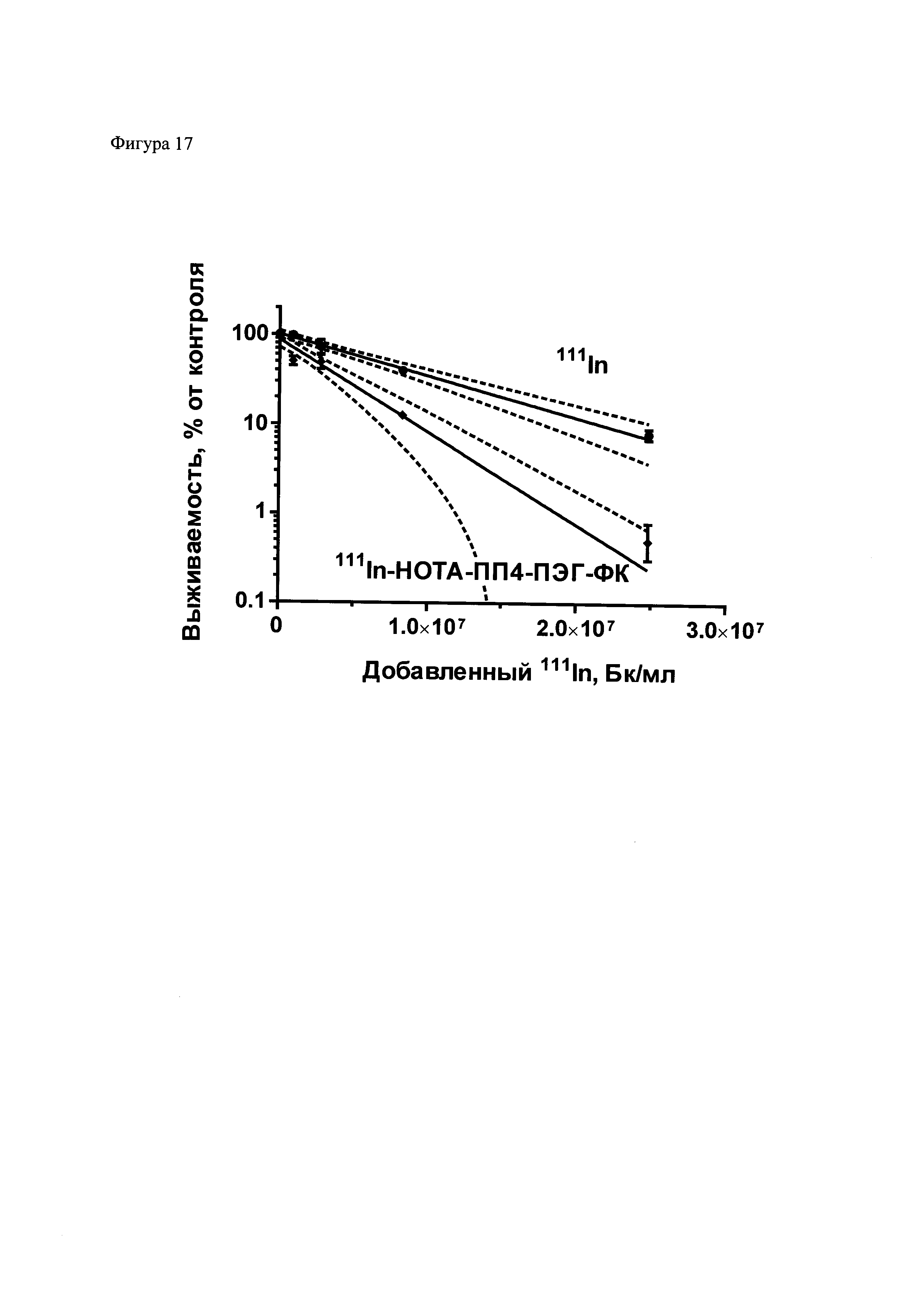
Фиг. 17. Усиление цитотоксического действия 111In в результате его присоединения при помощи композиции для присоединения радиоизотопа к полипептидам. 111In был присоединен к полипептиду 4, модифицированному малеимдным производным ПЭГ-фолата, который был также модифицирован хелатором НОТА. 111In-полипептид и 111In в различных концентрациях был добавлен к клеткам эпидермоидной карциномы человека линии А431, и после инкубации в течение 48 часов выживаемость была определена методом колониеобразования. Результаты типичного эксперимента приведены в виде среднего значения ± стандартная ошибка среднего, прерывистыми линиями обозначены границы 95% доверительного интервала. Данные были оценены по одноэкспоненциальному уравнению y=A⋅e-k·x, для обоих наборов данных. Соотношение A37 (1/k) = 2,2, достоверность различия констант p<0,0001 по f-критерию Фишера.
Примеры осуществления изобретения.
Пример 1
Полипептид 1.
Полипептид 1 (ПП1) – модульный нанотранспортер для доставки терапевтических агентов в опухолевые клетки с повышенной экспрессией рецептора эпидермального фактора роста человека, состоящий из лигандного модуля, в качестве которого был использована последовательность эпидермального фактора роста человека; эндосомолитического модуля, в качестве которого была использована последовательность транслокационного домена дифтерийного токсина; модуля ядерной локализации, в качестве которого была использована оптимизированная последовательность сигнала ядерной локализации большого Т-антигена вируса SV-40; и модуля-носителя, в качестве которого была использована последовательность гемоглобиноподобного белка Escherichia coli, нарабатывали биосинтетически в E. coli и очищали при помощи аффинной хроматографии на Ni-NTA-агарозе, как описано Гилязовой с соавт. (Gilyazova et al., 2006).
Пример 2
Полипептид 2.
Полипептид 2 (ПП2) – модульный нанотранспортер для доставки терапевтических агентов в клетки меланомы состоящий из лигандного модуля, в качестве которого был использована последовательность α-меланоцит-стимулирующего гормона человека; эндосомолитического модуля, в качестве которого была использована последовательность транслокационного домена дифтерийного токсина; модуля ядерной локализации, в качестве которого была использована оптимизированная последовательность сигнала ядерной локализации большого Т-антигена вируса SV-40; и модуля-носителя, в качестве которого была использована последовательность гемоглобиноподобного белка, нарабатывали в E. coli и очищали при помощи аффинной хроматографии на Ni-NTA-агарозе, как описано в примере 1.
Пример 3
Полипептид 3.
Полипептид 3 (ПП3) – модульный нанотранспортер для доставки терапевтических агентов в опухолевые клетки с повышенной экспрессией рецептора эпидермального фактора роста человека состоящий из лигандного модуля, в качестве которого был использована последовательность эпидермального фактора роста человека; эндосомолитического модуля, в качестве которого была использована последовательность транслокационного домена дифтерийного токсина; модуля ядерной локализации, в качестве которого была использована оптимизированная последовательность сигнала ядерной локализации большого Т-антигена вируса SV-40; и модуля-носителя, в качестве которого была использована последовательность миоглобина человека, нарабатывали в E. coli, штамм C3029 (New England Biolabs, США), и очищали при помощи аффинной хроматографии на Ni-NTA-агарозе следующим образом: индукцию синтеза полипептида проводили при помощи добавления изопропил-β-D-1-тиогалактопиранозида до концентрации 200 мкМ и температуре 22°С в течение 15-18 часов. Выделение полипептида проводили из телец включения в денатурирующих условиях. Тельца включения солюбилизировали раствором 50 мМ NaHPO4, 300 мМ NaCl, 8М мочевина, pH 8,0. После аффинной очистки на Ni-NTA-сефарозе белок элюировали раствором 50 мМ NaHPO4, 300 мМ NaCl, 8М мочевина, 250 мМ имидазола, pH 8,0. Элюат, содержащий очищенный ПП3, диализовали против изотонического буферного раствора.
Пример 4
Конъюгат полипептида с ковалентно присоединенным дополнительным функциональным компонентом.
Полипептид 4 (ПП 4) состоит из последовательности транслокационного домена дифтерийного токсина; оптимизированной последовательности сигнала ядерной локализации большого Т-антигена вируса SV-40 и последовательности гемоглобиноподобного белка. Полипептид нарабатывали в E. coli и очищали при помощи аффинной хроматографии на Ni-NTA-агарозе (Gilyazova et al., 2006). Полипептид был модифицирован при помощи ковалентного присоединения по аминогруппам полипептида дополнительного компонента, обеспечивающего клеточную специфичность. В качестве компонента, обеспечивающего клеточную специфичность, использовали фолиевую кислоту, рецепторы к которой сверх-экспрессированы при ряде заболеваний, в том числе онкологических (Sudimack & Lee, 2000; Lu & Low, 2012; Slastnikova et al., 2015). Присоединение фолата осуществляли при помощи 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимида (NHS) согласно опубликованной ранее методике (Leamon et al., 1992). Для этого к 0,1 М раствору фолиевой кислоты (ФК) в диметилсульфоксиде добавляли раствор EDC в ДМСО в 1,2-молярном избытке по отношению к ФК. Спустя час инкубации при комнатной температуре к полученной смеси добавляли раствор NHS в ДМСО в молярном избытке 2,4 по отношению к фолиевой кислоте и продолжали инкубацию в течение 4 часов, после чего в реакционную смесь добавляли раствор полипептида 5 в соотношении фолат : МНТ=15:1. Реакцию синтеза проводили в течение 12 часов при комнатной температуре в отсутствии доступа света. Очистку полученного конъюгата (ПП4-ФК) проводили при помощи ультрафильтрации. Присоединение ФК к полипептиду определяли спектрофотометрически при длине волны 367 нм.
Пример 5
Конъюгат полипептида с ковалентно присоединенным по уникальному месту присоединения дополнительным функциональным компонентом.
Конъюгат ПП4 с дополнительным компонентом, обеспечивающим взаимодействие с клетками-мишенями, в качестве которого использовали фолиевую кислоту. ПП4 имеет 3 сульфгидрильных группы, из которых только одна реакционноспособна. Для проведения реакции присоединения сначала доступную для модификации сульфгидрильную группу ПП4 (2,5 мг/мл) восстанавливали в натрий-фосфатном буфере (pH 7,5) при помощи добавления трис(2-карбоксиэтил)фосфина (TCEP, Thermo Fisher Scientific, США) до конечной концентрации 2 мМ в течение 40 минут при температуре 37°С. Полученный раствор диализовали от избытка TCEP против натрий-фосфатного буфера (pH 7,3) с 1 мМ ЭДТА до соотношения TCEP:полипептид=2,5:1. Затем к диализованному восстановленному раствору ПП4 добавляли 50-кратный мольный избыток раствора N-этилмалеимид-полиэтиленгликоль-фолата (Мал-ПЭГ-ФК, Nanocs, США, мол. масса ПЭГ – 3,4 кД) в натрий-фосфатном буфере, pH 7,3 с 1 мМ ЭДТА. pH реакционной смеси поддерживали на уровне 7,2-7,4, чтобы избежать с одной стороны преципитации МНТ (pH<7,0), а с другой стороны – конкурирующей реакции малеимида со свободными аминогруппами (pH>8,5). Реакционную смесь инкубировали при постоянном мягком перемешивании при +4°С в течение ночи.
Очистку модифицированного МНТ (Mw более 72000 Да) от неприсоединенного производного фолата проводили при помощи ультрафильтрации (5 циклов ультрафильтрации) в натрий-фосфатном буферном растворе через мембрану, пропускающую соединения с молекулярной массой до 30 кД.
Присоединение ФК к полипептиду определяли при помощи электрофореза в ПААГ по Лэммли (Laemmli, 1970).
Пример 6
Полипептид 5.
Полипептид 5 (ПП5) – модульный нанотранспортер для доставки терапевтических агентов в опухолевые клетки с повышенной экспрессией рецептора эпидермального фактора роста человека, состоящий из лигандного модуля, в качестве которого был использована последовательность эпидермального фактора роста человека; эндосомолитического модуля, в качестве которого была использована последовательность транслокационного домена дифтерийного токсина; модуля ядерной локализации, в качестве которого была использована оптимизированная последовательность сигнала ядерной локализации большого Т-антигена вируса SV-40; модуля внутриклеточного взаимодействия для связывания с ядерным антигеном пролиферирующих клеток (PCNA), в качестве которого был использован С-концевой фрагмент (аминокислоты 87-164) белка р21 человека; и модуля-носителя, в качестве которого была использована последовательность гемоглобиноподобного белка Escherichia coli (HMP), нарабатывали в E. coli и очищали при помощи аффинной хроматографии на Ni-NTA-агарозе как описано в примере 3.
Пример 7
Полипептид 6.
В качестве полипептида 6 использовали природный бычий сывороточный альбумин (Amresco, США).
Пример 8
Присоединение хелатора НОТА к полипептидам.
Для присоединения НОТА к полипептидам использовали бифункциональный хелатор, - S-2-(4-изотиоцианатобензил)-1,4,7-триазоциклононан-1,4,7-триуксусную кислоту (p-SCN-Bn-NOTA, Macrocyclics, США), - способный к специфическому ковалентному присоединению к аминогруппам полипептидов. Все использованные растворы были очищены от ионов, способных связываться с высоким сродством с хелатором, при помощи ионообменной смолы Chelex-100 (BioRad, США) и стерилизованы при помощи фильтрации под вакуумом через фильтры с размером пор 0,22 мкм. Полипептиды перед реакцией были диализованы против раствора содержащего 50 мМ NaHCO3, 150 мМ NaCl и 5 мМ ЭДТА, pH 8,6. p-SCN-Bn-NOTA в том же растворе был добавлен к одному из полипептидов из примеров 1-7 (2-4 мг/мл) в 10-кратном молярном избытке. Реакцию проводили течение 18-20 часов при комнатной температуре, после чего полученный конъюгат очищали при помощи ультрафильтрации через мембрану с размером пор 30 кД в буфере, содержащем 15 мМ NaCl и 10 мМ HEPES, pH 7,5. Полученные конъюгаты НОТА-полипептид лиофилизовали в необходимых порциях и хранили при -20°С.
Пример 9
Присоединение хелатора ДОТА к полипептидам.
Для присоединения ДОТА к полипептидам использовали S-2-(4-изотиоцианатобензил)-1,4,7-10-тетраазоциклододекан-1,4,7-тетрауксусную кислоту (p-SCN-Bn-DOTA, Macrocyclics). Присоединение проводили, как описано в примере 7.
Пример 10
Присоединение 111In к НОТА-полипептидам.
Присоединение 111In проводили при помощи специально разработанной одностадийной методики с последующим определением доли неприсоединенного изотопа при помощи электрофореза по Лэммли (Laemmli, 1970). Типичное присоединение 111In к НОТА-полипептиду осуществляли следующим образом: 0,12 мг лиофилизованного НОТА-полипептида растворяли в стерильных условиях в 0,04 мл стерильной деионизированной воды. К восстановленному НОТА-полипептиду добавляли 108,3 мкл буферного раствора, содержащего 10 мМ HEPES и 15 мМ хлорид натрия, pH 7,5; 28,7 мкл буферного раствора 1 М HEPES, pH 7,5; 21,2 мкл буферного раствора 0,1 М цитрата, pH 6,7, 8,1 мкл раствора 1% додецилсульфата натрия (SDS) и 42,3 мкл 0,25 M соляной кислоты (Ultrapure Grade, Merck, Germany), после чего добавляли к полученной смеси 101,6 мкл (8,7 мКи на момент готовности полученного меченого полипептида для применения) 111In в 0,048 M соляной кислоте. Пробирку с реакционной смесью инкубировали при температуре +37 С в течение 1 часа. По окончании инкубации в пробирку с реакционной смесью добавляли 3 мкл раствора 0,05 М ЭДТА, pH 8,0 для остановки реакции, мягко перемешивали и инкубировали при 37°С ещё в течение 10 минут. Затем в пробирку добавляли 24 мкл 1 М гидроксида натрия для достижения физиологических значений pH смеси. Для анализа результата мечения аликвоту полученного 111In-НОТА-полипептид подвергали денатурирующему электрофорезу с SDS в готовом ПААГ (Mini-Protean TGX Any kD, BioRad) по Лэммли (Laemmli, 1970) с последующим детектированием радиоактивного излучения геля при помощи специального экрана и фосфоримеджера Storm 865 (GE HealthCare, Швеция) при времени экспозиции геля 15 минут и последующим анализом полученного изображения при помощи программы ImageQuant TL 5.0 (Bio-Rad, США). Результаты проведенных работ по присоединению 111In к МНТ-НОТА показывают, что применяемый метод обеспечивает одностадийное присоединение, не требующее дальнейшей очистки, и доля неприсоединенного изотопа составляет около 5% или менее. Типичные примеры результатов присоединения 111In к различным полипептидам приведены на фигурах 1-7. При использовании данного метода удельная радиоактивность полипептидов с присоединенным 111In составляла 72 мкКи/мкг полипептида (2,7 МБк/мкг) на момент окончания анализа полученного продукта. Кинетика присоединения 111In к НОТА-полипептиду представлена на фигуре 8.
Пример 11
Присоединение 111In к ДОТА-полипептидам.
Присоединение 111In к ДОТА-полипептидам проводили, как описано в примере 10, за исключением времени инкубации, которое составило 3 часа 40 минут (фиг. 9).
Пример 12
Влияние цитрата на присоединение радиоизотопа к полипептиду с ковалентно присоединенным хелатором.
Добавление таких изотопов, как 111In или 67Ga, в растворы, подходящие для мечения полипептидов, приводит к образованию плохо растворимых гидроксидов, которые в низких концентрациях формируют агрегаты небольшого размера, которые плохо разделяются с полипептидами при использовании гель-фильтрации даже при последующем добавлении избытка свободного хелатора (например, ЭДТА до 1,5 мМ, фиг. 10), имеющего высокое сродство к этим ионам – lg(константы комплексообразования) для комплекса In3+-ЭДТА – 24,9, а для комплекса Ga3+-ЭДТА – 21,0 (Sun et al., 1996). Это указывает на необходимость разработки одностадийного метода, обеспечивающего присоединение таких радиоизотопов к полипептидам с хелатором, не требующего дальнейшей очистки. Добавление в состав композиции для присоединения радиоизотопов к полипептидам цитрата приводит к исчезновению агрегатов, сопоставимых по гидродинамическому размеру с используемыми пептидами.
На фигуре 11 представлена зависимость эффективности присоединения радиоизотопа 111In к полипептиду 2 от концентрации цитрата в композиции для присоединения радиоизотопа к полипептидам, полученная при помощи анализа получаемых продуктов электрофорезом в полиакриламидном геле. При добавлении цитрата до конечной концентрации 6-9 мМ эффективность присоединения радиоизотопа к полипептиду с хелатором увеличивается, при больших концентрациях цитрата эффективность присоединения начинает снижаться.
Пример 13
Влияние SDS на присоединение радиоизотопа к полипептиду с ковалентно присоединенным хелатором.
Ряд искусственных полипептидов, в первую очередь, полипептиды богатые амфифильными мембранотропными последовательностями, обладает ограниченной растворимостью в слабокислой среде, в условиях, при которых образуются комплексы ионов таких элементов как галлий, индий, иттрий. Для обеспечения лучшей растворимости таких полипептидов в состав композиции для присоединения радиоизотопа к полипептидам был добавлен SDS в концентрации ниже критической концентрации мицеллообразования (ККМ). Данная добавка позволяет плохорастворимым в этих условиях полипептидам оставаться в растворе в течение времени, необходимого для присоединения радиоизотопа к полипептиду с хелатором. SDS мало влиял на эффективность присоединения индия к ПП2-НОТА (фиг. 12), как в концентрациях ниже ККМ, так и в концентрациях выше ККМ.
Пример 14
Влияние pH на присоединение 111In к полипептиду с ковалентно присоединенным хелатором.
Композицию для присоединения радиоизотопов к полипептидам можно использовать для присоединения радиоизотопов в слабокислой или нейтральной среде. Так эффективность присоединения 111In к НОТА-полипептиду 2 слабо изменялось в диапазоне pH от 4 до 7,5, с несколько большей эффективностью при pH около 4,5 (фиг. 13). Средняя эффективность присоединения оцененная при помощи электрофореза в полиакриламидном геле в этих условиях для этого полипептида составила 96,2±0,5% (n=9). Для другого полипептида (ПП1) средняя эффективность была близкой – 96,5±0,7% (n=7).
Пример 15
Цитотоксическая активность индия, присоединенного к полипептиду-1 с ковалентно присоединенным хелатором.
Для определения увеличения цитотоксической активности 111In в результате его присоединения при помощи хелатора НОТА к полипептиду-1 (ПП1), способному доставлять действующее начало в ядра клеток с повышенной экспрессией рецептора эпидермального фактора роста использовали клетки рака мочевого пузыря человека линии EJ, обладающими 1,6×105 рецепторов на клетку. Клетки культивировали в среде ДМЕМ/F12 с 10% фетальной телячьей сывороткой при 37°С и 5% углекислого газа. Для определения цитотоксичности клетки рассевали в 24-луночные плашки по 25 000 клеток на лунку и на следующий день добавляли 111In-НОТА-ПП1, приготовленный как описано в примере 10, или 111In без ПП1, но со всеми компонентами заявляемой композиции, приготовленный таким же образом, с указанной активностью препаратов в 1 мл свежей среды. Через 48 часов лунки отмывали от среды с препаратами, клетки снимали с подложки и рассевали на определение выживаемости по тесту колониеобразования по 2000 клеток в 25 см2 культуральные флаконы. Через 7-9 дней клетки фиксировали 0,3% раствором кристаллического фиолетового в этаноле, после чего просчитывали количество колоний. Результаты обрабатывали при помощи нелинейной регрессии с использованием GraphPad Prism (GraphPad Software, США), согласно одноэкспоненциальному уравнению y=A⋅e-k·x, где y – выживаемость в процентах от контроля, х – добавленная активность в беккерелях на мл среды, A и k – оцениваемые параметры (количество клеток в контроле, не подвергнувшемуся воздействию, и константа уменьшения выживаемости клеток, соответственно). Соотношение констант, характеризующих цитотоксичность радиоизотопа (k), составило 32,6 раза для присоединенного к ПП1 111In по отношению к неприсоединенному, что свидетельствует об увеличении его цитотоксичности (фиг. 14) в результате присоединения к ПП1.
Пример 16
Цитотоксическая активность индия, присоединенного к полипептиду-2 с ковалентно присоединенным хелатором.
Для определения увеличения цитотоксической активности 111In в результате его присоединения при помощи хелатора НОТА к полипептиду-2 (ПП2), способному доставлять действующее начало в ядра клеток с повышенной экспрессией меланокортинового рецептора первого типа (прежде всего, клетки меланомы), использовали клетки меланомы мыши линии B16-F1, обладающими 104 рецепторов на клетку (Siegrist et al., 1989). Клетки культивировали в среде ДМЕМ с фетальной телячьей сывороткой при 37°С и 5% углекислого газа. Клетки рассевали в 24-луночные плашки по 12 000 клеток на лунку и на следующий день добавляли 111In-НОТА-ПП1, приготовленный как описано в примере 10, или 111In без ПП1, но со всеми компонентами заявляемой композиции, приготовленный таким же образом, с указанной активностью препаратов в 1 мл свежей среды. Через 48 часов лунки отмывали от среды с препаратами, клетки снимали с подложки и рассевали на определение выживаемости по тесту колониеобразования по 500 клеток в 25 см2 культуральные флаконы. Через 7 дней клетки фиксировали 0,3% раствором кристаллического фиолетового в этаноле, после чего просчитывали количество колоний. Результаты обрабатывали нелинейной регрессией при помощи GraphPad Prism, согласно одноэкспоненциальному уравнению y=A⋅e-k·x, где y – выживаемость в процентах от контроля, х – добавленная активность в беккерелях на мл среды, A и k – оцениваемые параметры (количество клеток в контроле, не подвергнувшемуся воздействию, и константа уменьшения выживаемости клеток, соответственно). Результаты свидетельствуют об увеличении цитотоксичности 111In в результате его доставки в ядра клеток меланомы, в результате чего начинает сказываться токсическое действие электронов Оже, образующихся в результате распада 111In (фиг. 15). Соотношение констант, характеризующих цитотоксичность радиоизотопа (k), составило 3,7 раза для присоединенного к ПП2 111In по отношению к неприсоединенному изотопу, что свидетельствует об увеличении его цитотоксичности в результате присоединения к ПП2.
Пример 18
Цитотоксическая активность индия, присоединенного к полипептиду-3
Для определения увеличения цитотоксической активности 111In в результате его присоединения при помощи хелатора НОТА к полипептиду-3 (ПП3), способному доставлять действующее начало в ядра клеток с повышенной экспрессией рецептора эпидермального фактора роста, использовали клетки меланомы мыши линии A431, обладающими 2-3×106 рецепторов на клетку (Rosenkranz et al., 1989). Клетки культивировали в среде ДМЕМ с фетальной телячьей сывороткой при 37°С и 5% углекислого газа. Для эксперимента клетки рассевали в 24-луночные плашки по 25 000 клеток на лунку и через двое суток добавляли 111In-НОТА-ПП1, приготовленный как описано в примере 10, или 111In без ПП1, но со всеми компонентами заявляемой композиции, приготовленный таким же образом, с указанной активностью препаратов в 1 мл свежей среды. Через 48 часов лунки отмывали от среды с препаратами, клетки снимали с подложки и рассевали на определение выживаемости по тесту колониеобразования по 500 клеток в 25 см2 культуральные флаконы в среде “Improved MEM zink option medium” (Life Technology, США) с добавлением 1 мг/л инсулина и 8 мМ (4-(2-гидроксиэтил)-1-пиперазинэтансульоната (HEPES) (среда ZO). Через 7 дней клетки фиксировали 0,3% раствором кристаллического фиолетового в этаноле, после чего просчитывали количество колоний. Результаты обрабатывали нелинейной регрессией при помощи GraphPad Prism, согласно одноэкспоненциальному уравнению y=A⋅e-k·x, где y – выживаемость в процентах от контроля, х – добавленная активность в беккерелях на мл среды, A и k – оцениваемые параметры (количество клеток в контроле, не подвергнувшемуся воздействию, и константа уменьшения выживаемости клеток, соответственно). Результаты свидетельствуют об увеличении цитотоксичности 111In в результате его доставки в ядра клеток меланомы, в результате чего начинает сказываться токсическое действие электронов Оже, образующихся в результате распада 111In (фиг. 16). Соотношение констант, характеризующих цитотоксичность радиоизотопа (k), составило 36,6 раза для присоединенного к ПП3 111In по отношению к неприсоединенному изотопу, что свидетельствует об увеличении его цитотоксичности в результате присоединения к ПП3.
Пример 19
Цитотоксическая активность индия, присоединенного к полипептиду-4, модифицированному ПЭГ-ФК
Для определения увеличения цитотоксической активности 111In в результате его присоединения при помощи хелатора НОТА к полипептиду-4, с присоединенным ПЭГ-фолатом (ПП4-ПЭГ-ФК), способному доставлять действующее начало в ядра клеток с повышенной экспрессией рецептора фолиевой кислоты, использовали клетки глиомы человека линии U-87 MG. Клетки культивировали в дефицитной по фолату среде с 10% фетальной телячьей сывороткой при 37°С и 5% углекислого газа. Для эксперимента клетки рассевали в 24-луночные плашки по 30 000 клеток на лунку и через двое суток добавляли 111In-НОТА-ПП1, приготовленный как описано в примере 10, или 111In без ПП1, но со всеми компонентами заявляемой композиции, приготовленный таким же образом, с указанной активностью препаратов в 1 мл свежей среды. Через 48 часов лунки отмывали от среды с препаратами, клетки снимали с подложки и рассевали на определение выживаемости по тесту колониеобразования по 5000 клеток в 25 см2 культуральные флаконы в среде ZO. Через 7 дней клетки фиксировали 0,3% раствором кристаллического фиолетового в этаноле, после чего просчитывали количество колоний. Результаты обрабатывали нелинейной регрессией при помощи GraphPad Prism, согласно одноэкспоненциальному уравнению y=A⋅e-k·x, где y – выживаемость в процентах от контроля, х – добавленная активность в беккерелях на мл среды, A и k – оцениваемые параметры (количество клеток в контроле, не подвергнувшемуся воздействию, и константа уменьшения выживаемости клеток, соответственно). Результаты свидетельствуют об увеличении цитотоксичности 111In в результате его доставки в ядра клеток меланомы, в результате чего начинает сказываться токсическое действие электронов Оже, образующихся в результате распада 111In (фиг. 17). Соотношение констант, характеризующих цитотоксичность радиоизотопа (k), составило 2,2 раза для присоединенного к ПП3 111In по отношению к неприсоединенному изотопу, что свидетельствует об увеличении его цитотоксичности в результате присоединения к ПП4-ПЭГ-ФК.
Цитируемые патентные документы
RU 2251110 (29.02.2000). Чинн П. и др. Набор для радиоактивного мечения и анализ связывания.
EP 2112512 (29.02.2000). Chinn P., et al. Radiolabeling kit and binding assay. (US 6994840)
US 7230085 (27.11.2002). Griffiths G.L. et al. Anti-DOTA antibody.
US 7259249 (01.12.2004). Griffiths G.L. & Govindan S.V. Method for preparing conjugates of proteins and chelating agents.
EP 2962699 A2 (01.12.2004). Griffiths G.L. & Govindan S.V. Improved method for preparing conjugates of proteins and chelating agents.
US 8815211 (09.02.2011). Hino A. Radioactive metal-labeled anti-cadherin antibody.
US 8268781 (02.03.2007). Gotthardt M., et al. Peptide derivatives of exendin-4.
EP 1156835 (29.02.2000). Chinn P. Method for radiolabeling proteins with yttrium-90.
EP 1603598 (18.03.2004). Merlo A., et al. Radiolabeled conjugates based on Substance P and the use thereof.
US 7541018 (08.03.2007). Maecke H.R., et al. Treatment process using somatostatin analogues.
US 20140328754 A1 (18.06.2014). Hino A. et al. Radioactive metal-labeled anti-cadherin antibody
US 8603435 (12.01.2009). Miao Y. & Guo H. Compounds and methods for use in diagnosing and treating melanoma, including metastatic melanoma and methods relating to same.
US 7011816 (13.12.2002). Griffiths G. & Mcbride W. Labeling targeting agents with gallium-68 and gallium-67.
US 20050249671 A9 (22.12.2003). Parmelee D. et al. Neutrokine-alpha conjugate, neutrokine-alpha complex, and uses thereof.
EP 0264333 A2 (15.10.1987). Siegel R.C. & Alvarez V.L. Method for preparation of protein-chelator-metal ion compositions suitable for injection.
EP 0315188 (04.11.1988). Johnson, D.K. & Rogers, P.E. Methods and materials for the preparation of metal labelled antibody solutions.
US 5217704 (27.12.1991). Johnson, D.K. & Rogers P.E. Methods and materials for the preparation of metal labelled antibody solutions.
EP 0495878 (10.10.1990). Akzo N.N.V & Subramanian, R. Method for purifying chelator conjugated compounds.
WO 1999036105 A2 (15.01.1999). Borchardt P.E. et al. Use of radiolabeled monoclonal IgM in therapy for cancer and autoimmune disease.
US 9095624 (10.02.2012). Sobolev et al. Modular transport platform for targeted delivery of therapeutic agents.
Цитируемые непатентные документы
1. Anderson C.J., Welch M.J. Radiometal-labeled agents (non-technetium) for diagnostic imaging // Chem. Rev. – 1999. – Т. 99. – №. 9. – С. 2219-2234.
2. Andersson K.G. et al. Comparative evaluation of 111In-labeled NOTA-conjugated affibody molecules for visualization of HER3 expression in malignant tumors // Oncol. Rep. – 2015. – Т. 34. – №. 2. – С. 1042-1048.
3. Breeman W.A.P. et al. Optimising conditions for radiolabelling of DOTA-peptides with 90Y, 111In and 177Lu at high specific activities // Eur. J. Nucl. Med. Mol. Imaging. – 2003. – Т. 30. – №. 6. – С. 917-920.
4. Brom M. et al. Improved labelling of DTPA-and DOTA-conjugated peptides and antibodies with 111In in HEPES and MES buffer // EJNMMI Res. – 2012. – Т. 2. – №. 1. – С. 1-11.
5. Choi J.Y. et al. Development of 68 Ga-labeled mannosylated human serum albumin (MSA) as a lymph node imaging agent for positron emission tomography // Nucl. Med. Biol. – 2011. – Т. 38. – №. 3. – С. 371-379.
6. Clausén M. et al. Characterisation of gallium (III)-acetate complexes in aqueous solution: A potentiometric, EXAFS, IR and molecular orbital modelling study // Dalton Trans. – 2002. – №. 12. – С. 2559-2564.
7. Costantini D.L., Hu M., Reilly R.M. Update: peptide motifs for insertion of radiolabeled biomolecules into cells and routing to the nucleus for cancer imaging or radiotherapeutic applications // Cancer biotherapy & radiopharmaceuticals. – 2008. – Т. 23. – №. 1. – С. 3-24.
8. Gao C. et al. Auger electron-emitting 111 In-DTPA-NLS-CSL360 radioimmunoconjugates are cytotoxic to human acute myeloid leukemia (AML) cells displaying the CD123+/CD131− phenotype of leukemia stem cells // Appl. Radiat. Isot. – 2016. – Т. 110. – С. 1-7.
9. Gilyazova D.G. et al. Recombinant modular transporters on the basis of epidermal growth factor for targeted intracellular delivery of photosensitizers // Current Research on Laser Use in Oncology: 2000-2004. – International Society for Optics and Photonics, 2005. – С. 59730E-59730E-10.
10. Gilyazova D.G. et al. Targeting cancer cells by novel engineered modular transporters // Cancer Res. – 2006. – Т. 66. – №. 21. – С. 10534-10540.
11. Ju C.H. et al. Development of a 177Lu-labeled RGD derivative for targeting angiogenesis // Cancer Biother. Radiopharm. – 2010. – Т. 25. – №6. – С. 687-691.
12. Kukis D.L. et al. Optimized conditions for chelation of yttrium-90-DOTA immunoconjugates // J. Nucl. Med. – 1998. – Т. 39. – №. 12. – С. 2105.
13. Koumarianou E. et al. Radiolabeling and in vitro evaluation of 67 Ga-NOTA-modular nanotransporter–A potential Auger electron emitting EGFR-targeted radiotherapeutic // Nucl. Med. Biol. – 2014. – Т. 41. – №. 6. – С. 441-449.
14. Laemmli U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4 // Nature. – 1970. – Т. 227. – С. 680-685.
15. Leamon C.P., Low P.S. Cytotoxicity of momordin-folate conjugates in cultured human cells //J. Biol. Chem. – 1992. – Т. 267. – №. 35. – С. 24966-24971.
16. Lee J. et al. In vitro and in vivo evaluation of structure-stability relationship of 111 In-and 67 Ga-labeled antibody via 1B4M or C-NOTA chelates // Nucl. Med. Biol. – 1997. – Т. 24. – №. 3. – С. 225-230.
17. Lewis M.R., Raubitschek A., Shively J.E. A facile, water-soluble method for modification of proteins with DOTA. Use of elevated temperature and optimized pH to achieve high specific activity and high chelate stability in radiolabeled immunoconjugates // Bioconjug. Chem. – 1994. – Т. 5. – №. 6. – С. 565-576.
18. Lorberboum-Galski H. Human toxin-based recombinant immunotoxins/chimeric proteins as a drug delivery system for targeted treatment of human diseases //Expert opinion on drug delivery. – 2011. – Т. 8. – №. 5. – С. 605-621.
19. Lu Y., Low P.S. Folate-mediated delivery of macromolecular anticancer therapeutic agents // Adv. Drug Deliv. Rev. – 2012. – Т. 64. – С. 342-352.
20. Malmberg J. et al. Comparative evaluation of synthetic anti-HER2 Affibody molecules site-specifically labelled with 111In using N-terminal DOTA, NOTA and NODAGA chelators in mice bearing prostate cancer xenografts // Eur. J. Nucl. Med. Mol. Imaging. – 2012. – Т. 39. – №. 3. – С. 481-492.
21. Morfin J.F., Tóth É. Kinetics of Ga (NOTA) formation from weak Ga-citrate complexes // Inorg. Chem. – 2011. – Т. 50. – №. 20. – С. 10371-10378.
22. Mukai T. et al. Synthesis and evaluation of a monoreactive DOTA derivative for indium-111-based residualizing label to estimate protein pharmacokinetics //J. Pharm. Pharmacol. – 2002. – Т. 54. – №. 8. – С. 1073-1081.
23. Nayak T.K., Brechbiel M.W. Radioimmunoimaging with longer-lived positron-emitting radionuclides: potentials and challenges // Bioconjug. Chem. – 2009. – Т. 20. – №. 5. – С. 825-841.
24. Reilly R.M. (ed.). Monoclonal antibody and peptide-targeted radiotherapy of cancer. – John Wiley & Sons, Singapore, 2010, 632 p.
25. Rosenkranz A.A., Jans D.A., Sobolev A.S. Targeted intracellular delivery of photosensitizers to enhance photodynamic efficiency // Immunol. Cell Biol. – 2000. – Т. 78. – №. 4. – С. 452-464.
26. Rosenkranz A.A. et al. Recombinant modular transporters for cell-specific nuclear delivery of locally acting drugs enhance photosensitizer activity // FASEB J. – 2003. – Т. 17. – №. 9. – С. 1121-1123.
27. Rosenkranz A.A. et al. Engineered modular recombinant transporters: application of new platform for targeted radiotherapeutic agents to α-particle emitting 211 At // Int. J. Radiat. Oncology* Biology* Physics. – 2008. – Т. 72. – №. 1. – С. 193-200.
28. Rosenkranz A.A. et al. Use of intracellular transport processes for targeted drug delivery into a specified cellular compartment // Biochemistry (Moscow). – 2014. – Т. 79. – №. 9. – С. 928-946.
29. Siegrist W. et al. Characterization of receptors for α-melanocyte-stimulating hormone on human melanoma cells // Cancer Res. – 1989. – Т. 49. – №. 22. – С. 6352-6358.
30. Slastnikova T.A. et al. Modular nanotransporters: a multipurpose in vivo working platform for targeted drug delivery // Int. J. Nanomed. – 2012a. – Т. 7. – С. 467-482.
31. Slastnikova T.A. et al. Modular nanotransporters: a versatile approach for enhancing nuclear delivery and cytotoxicity of Auger electron-emitting 125I // EJNMMI Res. – 2012b. – Т. 2. – С. 59.
32. Slastnikova T.A. et al. Modular nanotransporters for targeted intracellular delivery of drugs: folate receptors as potential targets // Curr. Pharm. Design. – 2015. – Т. 21. – №. 9. – С. 1227-1238.
33. Sobolev A.S. Modular transporters for subcellular cell-specific targeting of anti-tumor drugs // BioEssays. – 2008. – Т. 30. – №. 3. – С. 278-287.
34. Sobolev A.S. Modular nanotransporters of anticancer drugs conferring cell specificity and higher efficiency // Biochemistry (Moscow). – 2009. – Т. 74. – №. 13. – С. 1567-1574.
35. Sobolev A.S. Modular nanotransporters: A multitarget platform for anticancer drug delivery // Herald Rus. Acad. Sci. – 2013. – Т. 83. – №. 4. – С. 324-335.
36. Sudimack J., Lee R.J. Targeted drug delivery via the folate receptor // Adv. Drug Deliv. Rev. – 2000. – Т. 41. – №. 2. – С. 147-162.
37. Sun Y. et al. Indium (III) and gallium (III) complexes of bis (aminoethanethiol) ligands with different denticities: stabilities, molecular modeling, and in vivo behavior // J. Med. Chem. – 1996. – Т. 39. – №. 2. – С. 458-470.
38. Varasteh Z. et al. Synthesis and characterization of a high-affinity NOTA-conjugated bombesin antagonist for GRPR-targeted tumor imaging // Bioconjug. Chem. – 2013. – Т. 24. – №. 7. – С. 1144-1153.
39. Wadas T.J. et al. Coordinating radiometals of copper, gallium, indium, yttrium, and zirconium for PET and SPECT imaging of disease // Chem. Rev. – 2010. – Т. 110. – №. 5. – С. 2858-2902.
40. Weldon J.E., Pastan I. A guide to taming a toxin–recombinant immunotoxins constructed from Pseudomonas exotoxin A for the treatment of cancer // FEBS J. – 2011. – Т. 278. – №. 23. – С. 4683-4700.