НАЛМЕФЕН, НАЛТРЕКСОН ИЛИ ИХ ПРОИЗВОДНЫЕ ДЛЯ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ (НЕ)АЛКОГОЛЬНОГО СТЕАТОГЕПАТИТА ИЛИ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ
Вид РИД
Изобретение
Уровень техники изобретения
Настоящее изобретение относится к новому способу применения морфинанов. Настоящее изобретение относится к налтрексону или 17-циклопропилметил-4,5α-эпокси-6-оксомофоминан-3,14-диолу и налмефену или 17-циклопропилметил-4,5α-эпокси-6-метиленморфинан-3,14-диолу или налмефену, их аналогам и их фармацевтическим композициям, и к их применению для предотвращения и лечения НАСГ (неалкогольного стеатогепатита), НЖБП (неалкогольной жировой болезни печени) и АСГ (алкогольного стеатогепатита).
В публикации Международной патентной заявки WO03/097608 авторами настоящего изобретения был описан ряд новых медицинских применений опиоидных и опиоидоподобных химических соединений, включая налтрексон и налмефен. В публикации Международной патентной заявки WO WO2006029167 авторами настоящего изобретения был описан ряд новых медицинских применений 17-циклопропилметил-4,5α-эпокси-6-метиленморфинан-3,14-диола.
Недавние успехи в исследовании нейродегенеративных заболеваний центральной нервной системы показали, что опиоиды могут играть определенную роль в модулировании экспрессии факторов воспаления, таких как провоспалительные цитокины, свободные радикалы и метаболиты арахидоновой кислоты в микроглии, а также в опосредовании нейродегенерации, связанной с иммунной системой [Adv. Exp. Med. Biol. 1996, 402: 29-33; Mov. Disord. 1997; 12: 855-858], и нейропатической боли [Hutchinson MR, et al. Eur J Neurosci. 2008; 28:20-299]. В заявке на китайский патент (CN102048733) предлагается применение налмефена в виде инъекции для лечения ожирения печени, вызванной рационом питания с высоким содержанием жиров.
В настоящей заявке авторы раскрывают, что налмефен и налтрексон показали свою эффективность в предотвращении и лечении НЖБП, НАСГ и АСГ.
Настоящее изобретение относится к способу предотвращения воспалительного повреждения печени при НЖБП и её перехода в НАСГ.
Возникшая эпидемия ожирения и метаболического синдрома способствовала увеличению распространенности НАСГ, который в настоящее время считается главной причиной хронической печеночной недостаточности в западном мире (Clark, J.M., et al., Nonalcoholic fatty liver disease. Gastroenterology, 2002; 122: 1649-1657). НАСГ поражает от 2 до 5 процентов американцев. Еще от 10 до 20 процентов американцев имеют жир в печени, но без воспаления или повреждения печени, это состояние называется «жировая дегенерация печени». Хотя наличие жира в печении само по себе не является нормой, оно, вероятно, причиняет небольшой вред или вызывает постоянное повреждение. Если наличие жира предполагается на основании результатов анализа крови или сканирования печени, то это состояние называется неалкогольной жировой болезнью печени (НЖБП). Если в этом случае провести биопсию печени, то она покажет, что некоторые люди имеют НАСГ, в то время как другие имеют простое ожирение печени. НАСГ или НЖБП сходны с АСГ (алкогольным стеатогепатитом) или АБП (алкогольной болезнью печени), соответственно, но они встречается у людей, которые мало или вообще не употребляют алкоголь [Ludwig, J., et al., Nonalcoholic steatohepatitis: Mayo Clinic experiences with a hitherto unnamed disease. Mayo Clin Proc, 1980; 55: p. 434-438].
Хотя основные причины НАСГ остаются невыясненными, несколько факторов, таких как инсулинрезистентность, выделение токсичных воспалительных белков адипоцитами (цитокины) и окислительный стресс (повреждение клеток) внутри клеток печени, могут способствовать клиническим проявлениям НАСГ (http://digestive.niddk.nih.gov/ddiseases/pubs/nash).
Точные механизмы, ответственные за патогенез и прогрессирование жировой болезнью печени, не совсем ясны. В нескольких исследованиях показано, что стеатоз печени провоцирует у животных бóльшие повреждения при наличии последующего стресса, такого как эндотоксемия. Давно общепризнанным является то, что переход от стеатоза к стеатогепатиту (от НЖБП к НАСГ) зависит от «второго удара», такого как окислительный стресс или эндотоксемия (Wanless IR, Shiota K. The pathogenesis of nonalcoholic steatohepatitis and other fatty liver diseases: a four-step model including the role of lipid release and hepatic venular obstruction in the progression to cirrhosis. Semin Liver Dis. 2004; 24:99-106; Duvnjak M, et al. Pathogenesis and management issues for non-alcoholic fatty liver disease. World J Gastroenterol. 2007; 14;13:4539-4550). В настоящее время общепринятым является то, что прогрессирование происходит при осуществлении действия механизма «двух ударов», в котором «первым ударом» является накопление липидов в гепатоцитах (стеатоз) (Day CP, James OF. Steatohepatitis: a tale of two «hits»? Gastroenterology 1998; 114: 842-845; Sanches SC et al. Nonalcoholic Steatohepatitis: A Search for Factual Animal Models. Biomed Res Int. 2015;2015:574832), а «вторым ударом» считается окислительный, эндотоксический или воспалительный стресс. При повторных стрессах усиленный воспалительный ответ приводит к повреждению печени и возникновению фиброза. Хотя основным эффективным способом лечения жировой болезни печени является стимуляция обратного развития стеатоза путем снижения массы тела и восстановления чувствительности к инсулину, обычно это нельзя осуществить полностью, а во многих случаях это вообще является неосуществимым.
В настоящее время не существует одобренных Управлением по контролю качества пищевых продуктов и лекарственных средств США методов лечения жировой болезни печени и НАСГ или АСГ. Экспериментальные подходы к клинической оценке у пациентов с НАСГ включают в себя антиоксиданты (например, витамин Е), селен и бетаин, а также новые антидиабетические препараты. Потребность в специальной фармакотерапии в настоящее время признается практикующими врачами, фармацевтической промышленностью и регуляторами, и её очень ожидают пациенты. Результатом является явно выраженное движение от продуктов, созданных для лечения других заболеваний и предлагаемых для лечения НАСГ в качестве дополнительного заболевания (таких как пиоглитазон или метформин), или от универсальных, неспецифических гепатопротекторов (таких как пентоксифиллин, урсодезоксихолевая кислота или антиоксиданты) к молекулам, разработанным и протестированным специально для лечения НАСГ, которые нацелены на исправление одного или нескольких путей поражения печени при этом заболевании. Две наиболее эффективные молекулы, обетихолевая кислота и элафибранор, показали обнадеживающие результаты по улучшению гистологии печени. Оба эти химические соединения, по-видимому, устраняют НАСГ, где обетихолевая кислота облегчает фиброз печени, а элафибранор улучшает гликемический и липидный профиль [Ratziu V., Novel Pharmacotherapy Options for NASH. Dig Dis Sci. 2016 Mar 22. (Epub ahead of print)].
Мышиная модель метионин-холин-дефицитного (MCD) рациона является общепринятой моделью НАСГ, как описано выше (см. Rivera CA, et al. 2007; Sanches SC et al. Nonalcoholic Steatohepatitis: A Search for Factual Animal Models. Biomed Res Int. 2015; 2015:574832). Как следствие, мышей, получавших MCD рацион, широко использовали для изучения гепатопротекторных свойств соединений против НЖБП/НАСГ.
Налмефен показал свою эффективность в предотвращении воспалительного повреждения печени в крысиной модели MCD, после «второго удара» ЛПС.
Алкогольная болезнь печени (АБП). Алкогольная болезнь печени (АБП) является основной причиной заболеваемости и смертности от болезней печени во всем мире (Arsene et al. Hepatol Int. 2016; 10:538-552). Клинический и патологический спектр АБП варьируется от алкогольной жировой болезни печени (алкогольный стеатоз) до цирроза (Saberi et al. J Clin Translat Hepatol. 2016; 4: 113-122). АБП можно разделить на вызванный алкоголем стеатоз (микровезикулярный, макровезикулярный), алкогольный стеатогепатит (АСГ) и алкогольный цирроз. Патология АБП схожа с патологией НЖБП/НАСГ. АБП и НЖБП имеют сходный патологический спектр, и они, как было описано, сосуществуют в клинических условиях (Toshikuni et al World J Gastroenterol 2014; 20: 8393–8406; Brunt and Tiniakos. World J Gastroenterol 2010; 16: 5286–5296). Острое и хроническое употребление алкоголя приводит к сильному повышению воротного и системного уровней эндотоксина у животных моделей и людей (Parlesak et al. J Hepatol 2000; 32: 742–747). Эндотоксин является ключевым медиатором поражения печени при алкогольной болезни печени, что подтверждается значительным уменьшением алкогольного поражения печени после устранения грамотрицательной микрофлоры антибиотиками и сенсибилизацией к ЛПС-индуцированному поражению печени после длительного воздействия этанола. Повышение уровня эндотоксина, по-видимому, обусловлено главным образом двумя механизмами. Во-первых, потребление алкоголя приводит к изменениям в микрофлоре кишечника с чрезмерным развитием бактериальной микрофлоры в верхнем отделе желудочно-кишечного тракта (Hauge et al. Digestion 1997; 58:591–595). Во-вторых, употребление алкоголя, как известно, разрушает кишечный эпителиальный барьер, вызывая повышенную проницаемость, что позволяет большему количеству ЛПС проникать в систему кровообращения воротной вены (Bjarnason et al. Lancet 1984; 1: 179–182). Было установлено, что купферовские клетки печени являются основной клеточной мишенью ЛПС при вызванном этанолом поражении печени (Adachi et al. Hepatology 1994; 20: 453–460). Экспериментальные модели АБП показали, что транслокация бактериальных продуктов через кишечный барьер в систему кровообращения воротной вены вызывает воспалительные реакции в печени и способствует развитию стеатогепатита. Наиболее эффективной мерой для лечения АСГ является полный отказ от употребления алкоголя алкогольными пациентами. Стероиды оказывают краткосрочное благоприятное действие при лечении тяжелой формы АСГ, но их долгосрочный эффект неясен из-за многочисленных побочных эффектов. Следовательно, существует острая необходимость сосредоточить усилия на разработке эффективных терапевтических средств для лечения АСГ.
Сущность изобретения
Настоящее изобретение относится к морфинановым химическим соединениям и их фармацевтическим композициям, а также к их применению для предотвращения и лечения НАСГ (неалкогольного стеатогепатита), НЖБП (неалкогольной жировой болезни печени) и АСГ (алкогольного стеатогепатита).
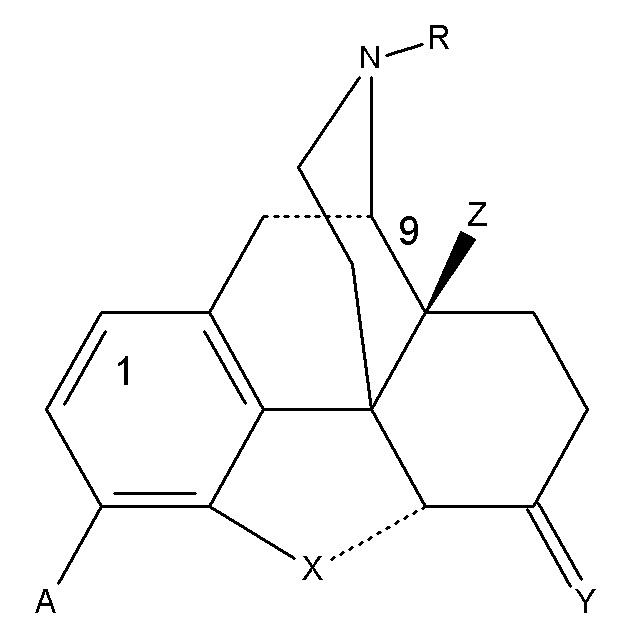
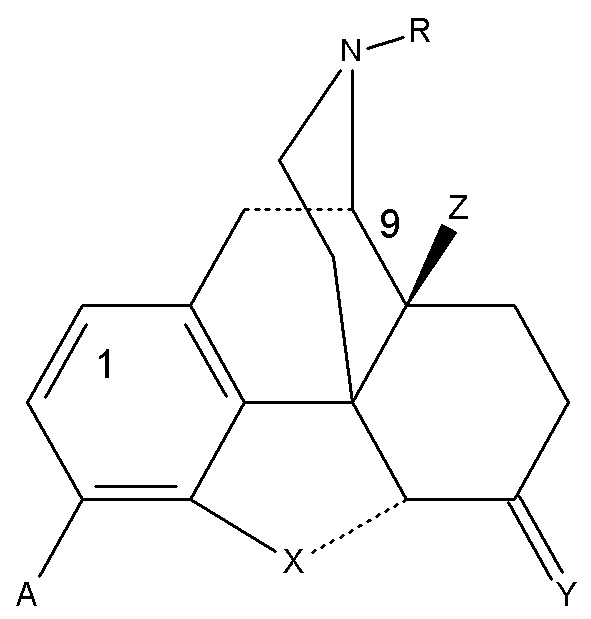
Настоящее изобретение относится к применению морфинанового химического соединения формулы (I) для лечения НЖБП, НАСГ и АСГ или состояний или для получения лекарственных препаратов для лечения таких состояний, где:
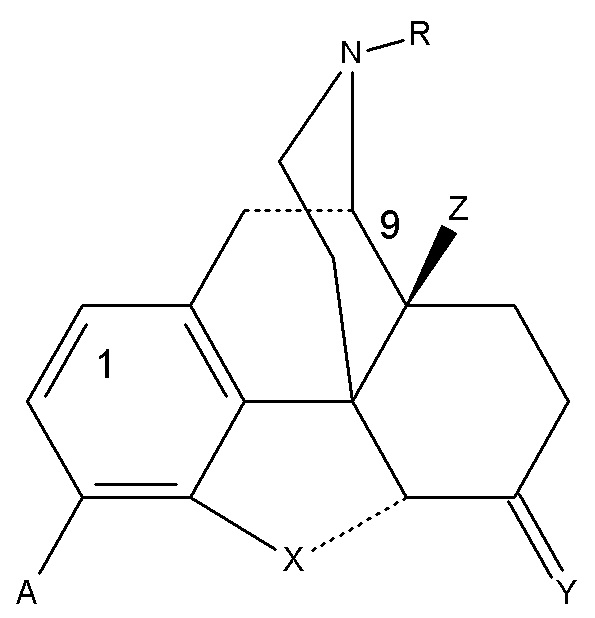
(I)
A может представлять собой OH или OCH3; R может представлять собой H, CH3 или циклопропилметил; X представляет собой атом кислорода, Y представляет собой O или CH2, Z может представлять собой H или OH. Химические соединениями формулы (I) могут представлять собой энантиомеры, диастереоизомеры и их фармацевтически приемлемые соли.
Формула (I) может представлять собой структуру, такую как одна из следующих структур:
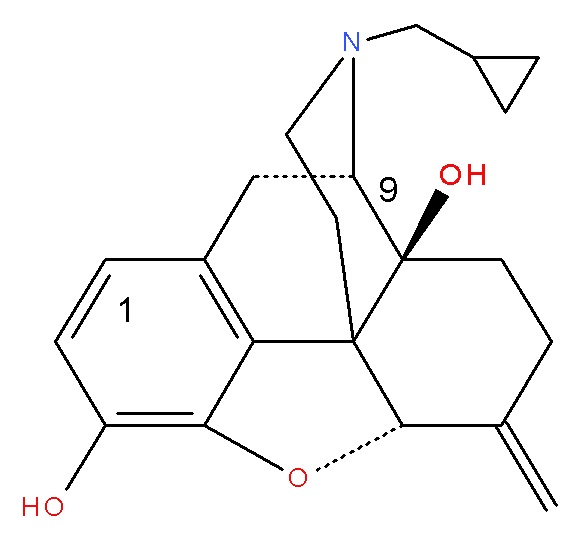
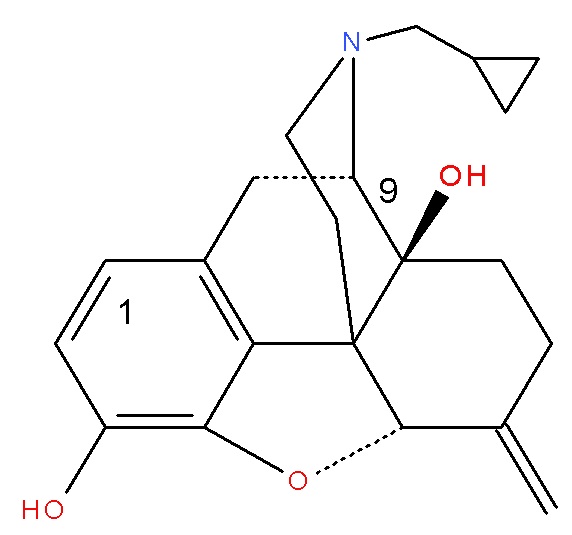
(Соединение A)
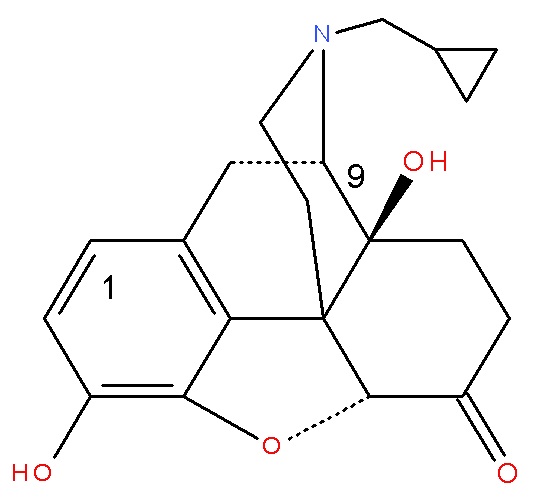
Особенно предпочтительным является Соединение A (налмефен), химическое соединение (I), где A представляет собой OH, R представляет собой циклопропил, метил, X представляет собой O, Y представляет собой CH2 и Z представляет собой OH.
Формула (I) может представлять собой структуру, такую как одна из следующих структур:
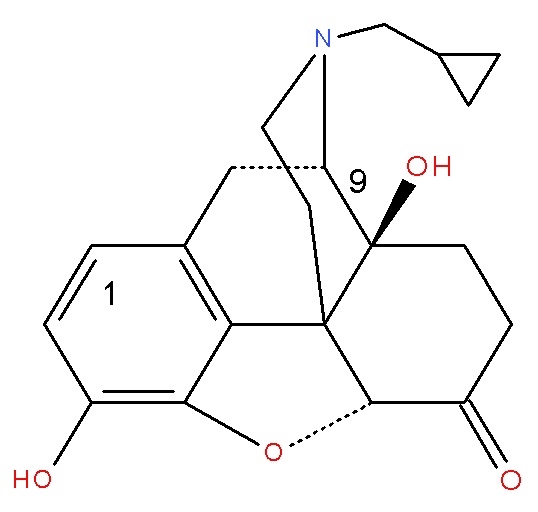
(Соединение B)
Особенно предпочтительным является Соединение B (налтрексон), химическое соединение (I), где A представляет собой OH, R представляет собой циклопропилметил, X представляет собой O, Y представляет собой O, и Z представляет собой OH.
Краткое описание чертежей
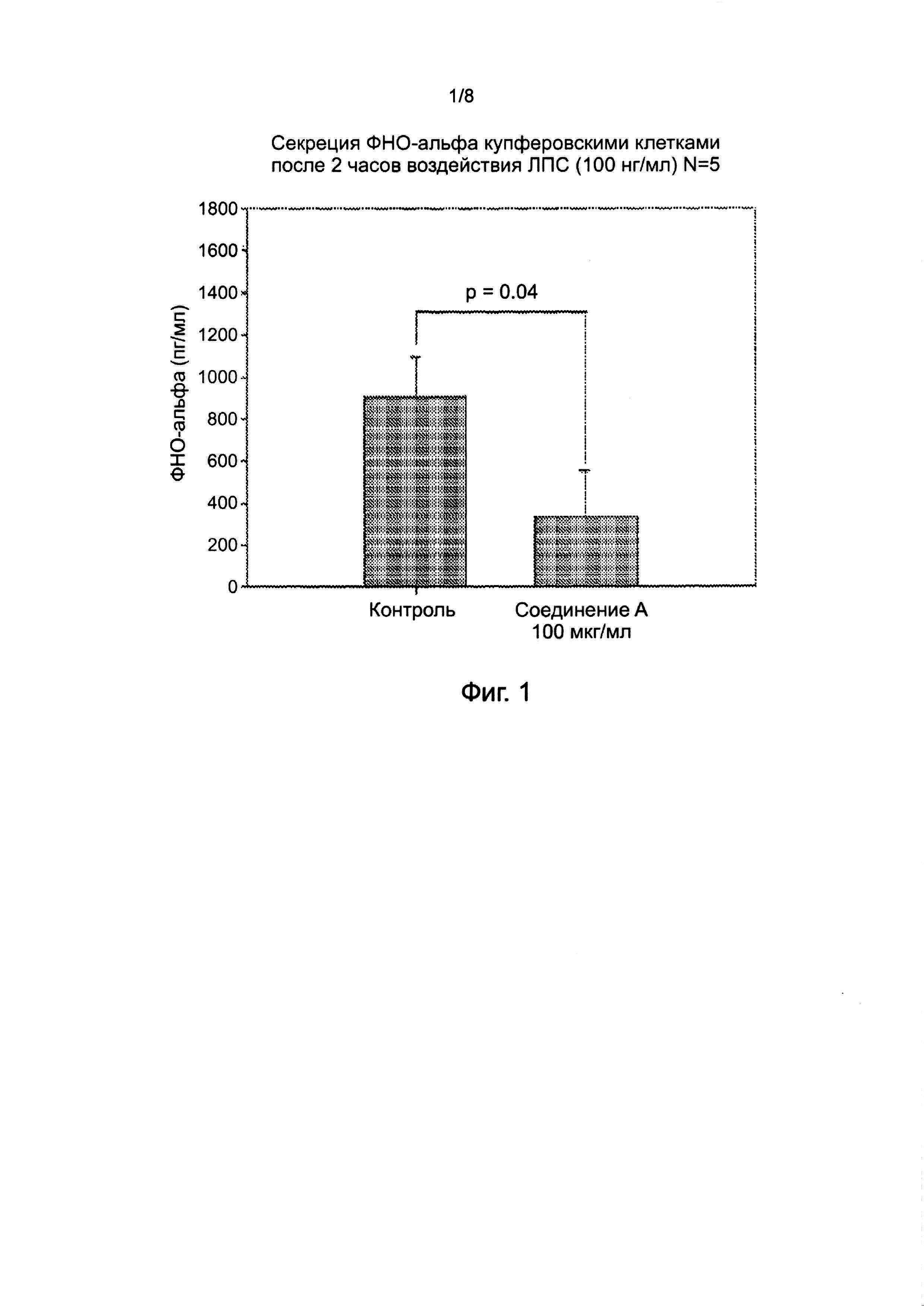
На фиг. 1 показано уменьшение высвобождения ФНО-α в купферовских клетках.
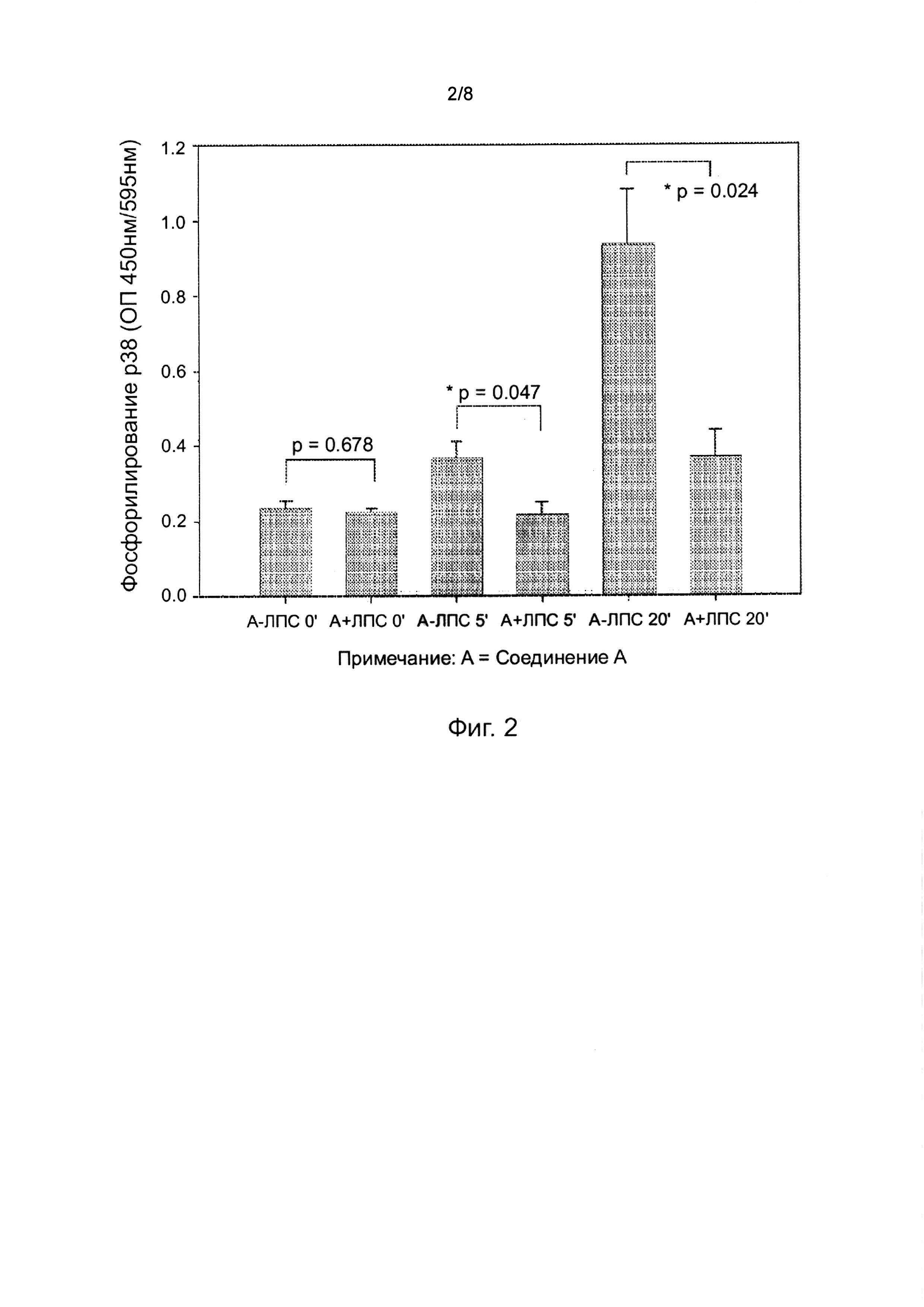
На фиг. 2 показано уменьшение ЛПС-индуцированного фосфорилирования p38 MAP-киназы в купферовских клетках. Фосфорилирование p38 MAP-киназы определяли через 5 и 20 мин; Соединение A (A = Соединение A) в дозе 100 нг/мл; n = 3 повтора.
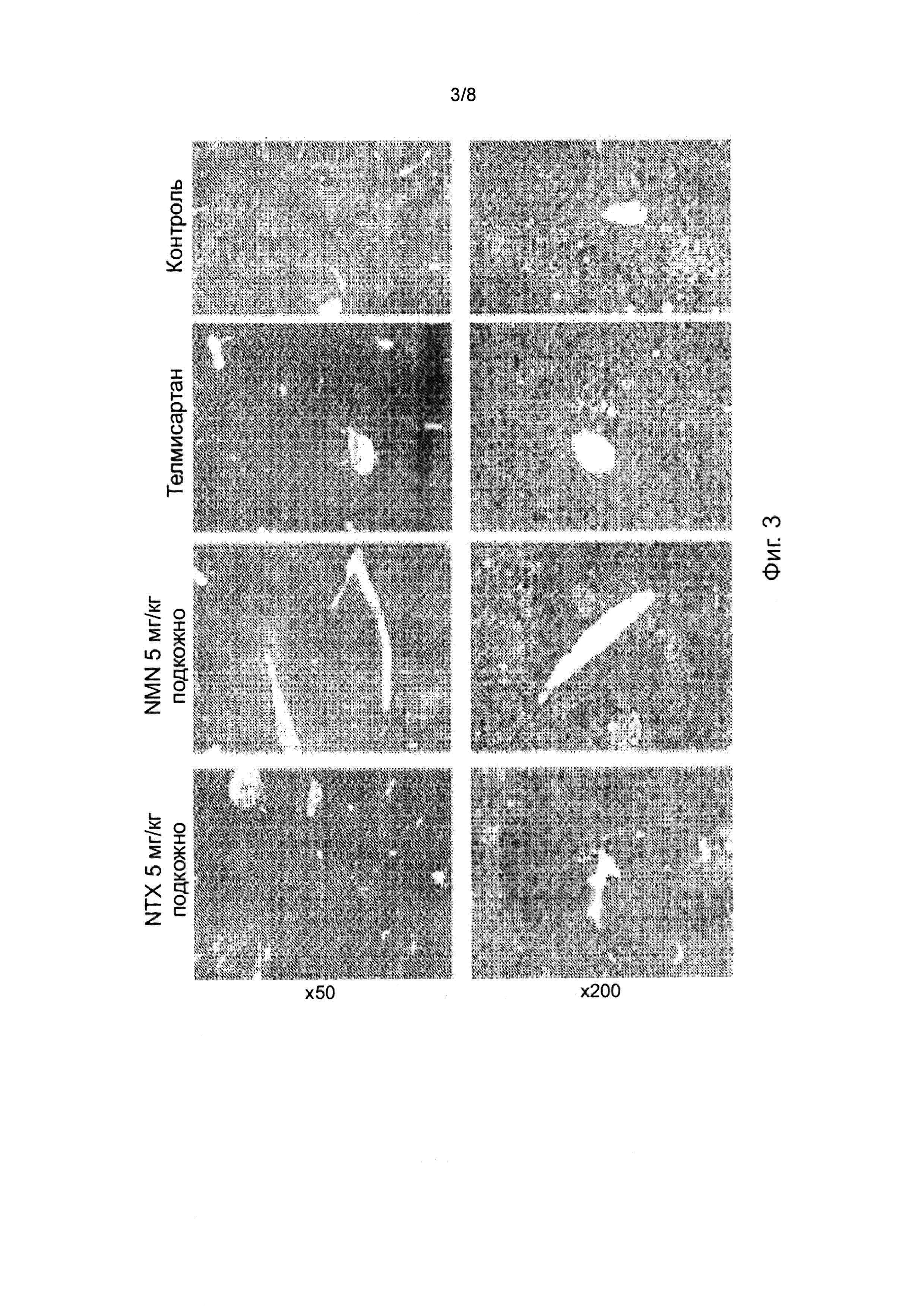
На фиг. 3 представлены репрезентативные микрофотографии окрашенных гематоксилином и эозином срезов печени, полученных из STAM модели НАСГ. Срезы вырезали из парафиновых блоков ткани печени, предварительно зафиксированной в растворе Боуина, и окрашивалиь раствором гематоксилина Лилли-Майера и эозина. Показатель активности НЖБП (ПАН) рассчитывали в соответствии с критериями Кляйнера (Kleiner et al, 2005).
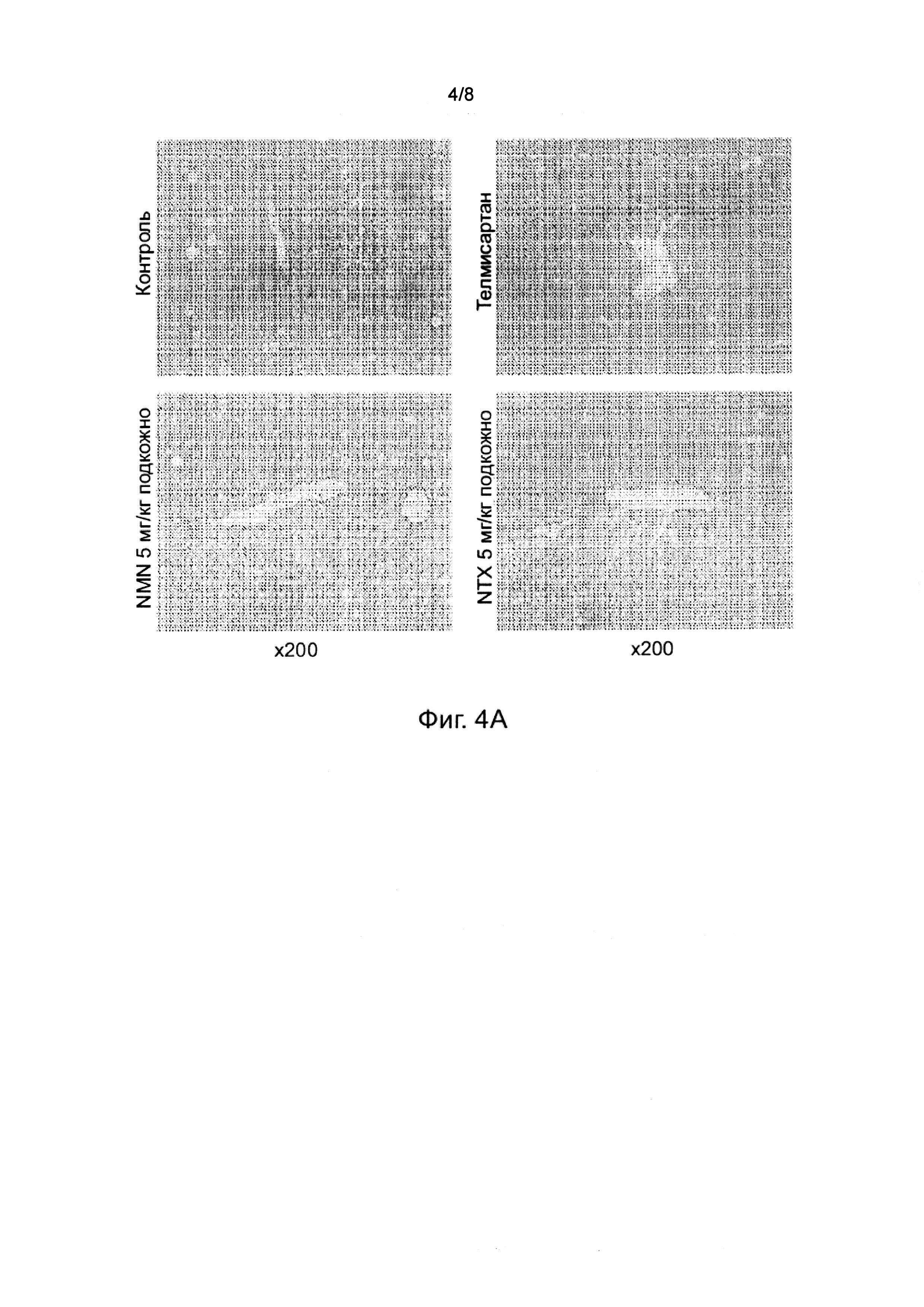
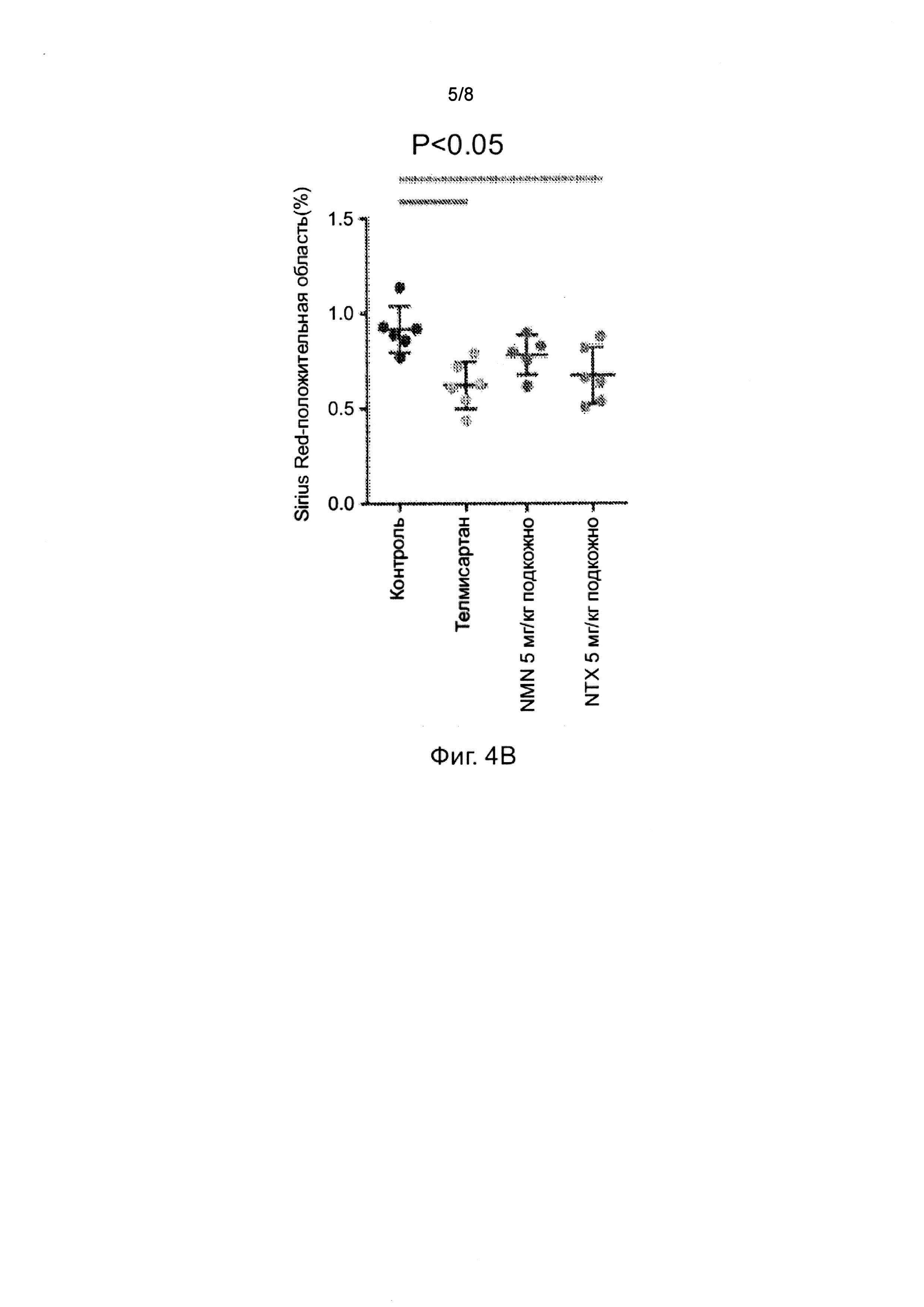
На фиг. 4A-4B показана Sirius Red-положительная область(%) в STAM модели НАСГ. a) Репрезентативные микрофотографии окрашенных Sirius Red срезов печени. Чтобы визуализировать отложение коллагена, фиксированные в растворе Боуина левые боковые срезы печени окрашивали с использованием раствора picro-Sirius Red (Вальдек, Германия). b) Для количественного анализа области фиброза светлопольные изображения окрашенных Sirius Red срезов фотографировали вокруг центральной вены с использованием цифровой камеры (DFC295, Leica, Германия) при 200-кратном увеличении, и положительные области в 5 полях/срезах измеряли с использованием программного обеспечения ImageJ (Национальный институт здравоохранения, США). Представлены индивидуальные значения и среднее ± СОС для каждой группы лечения.
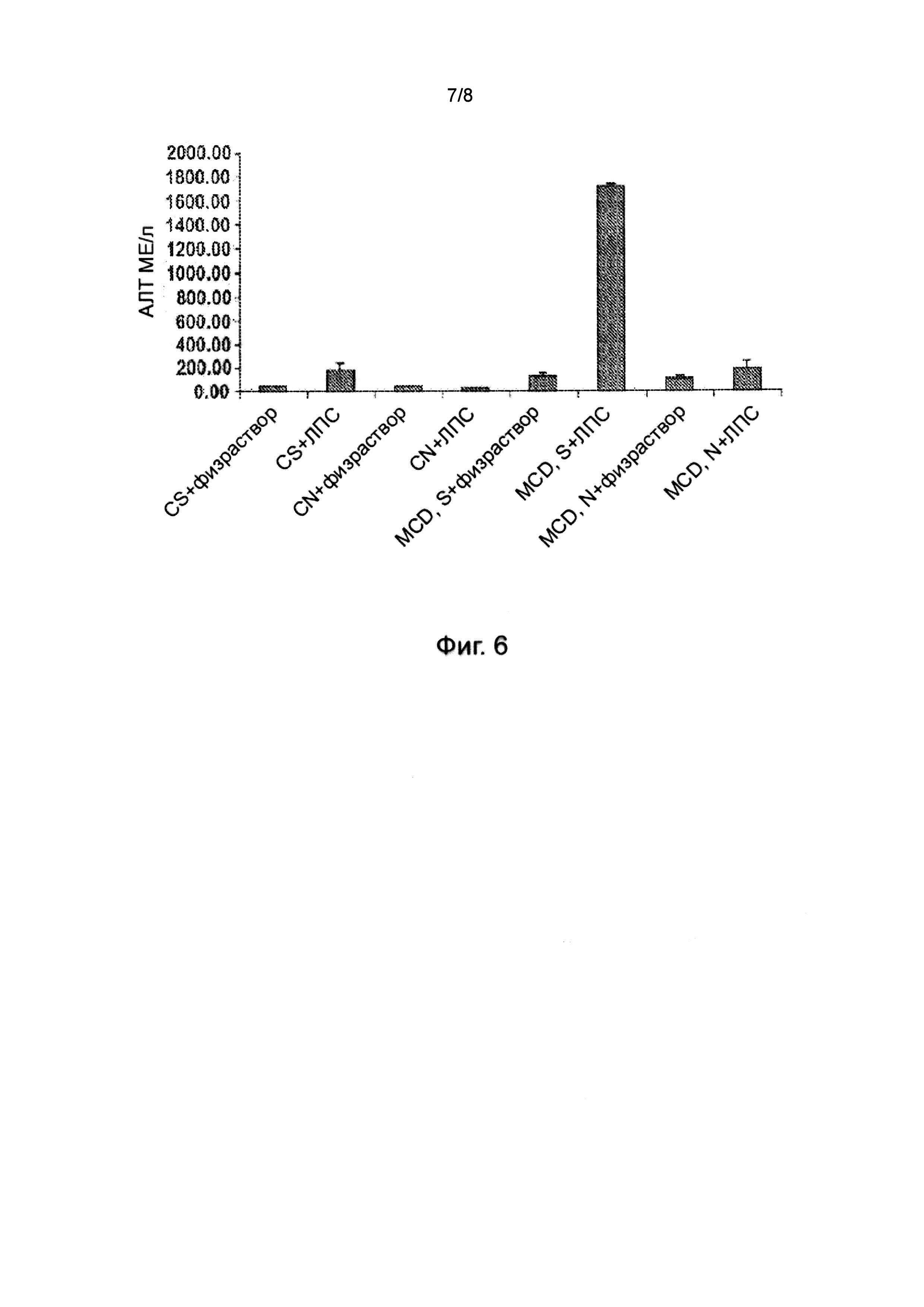
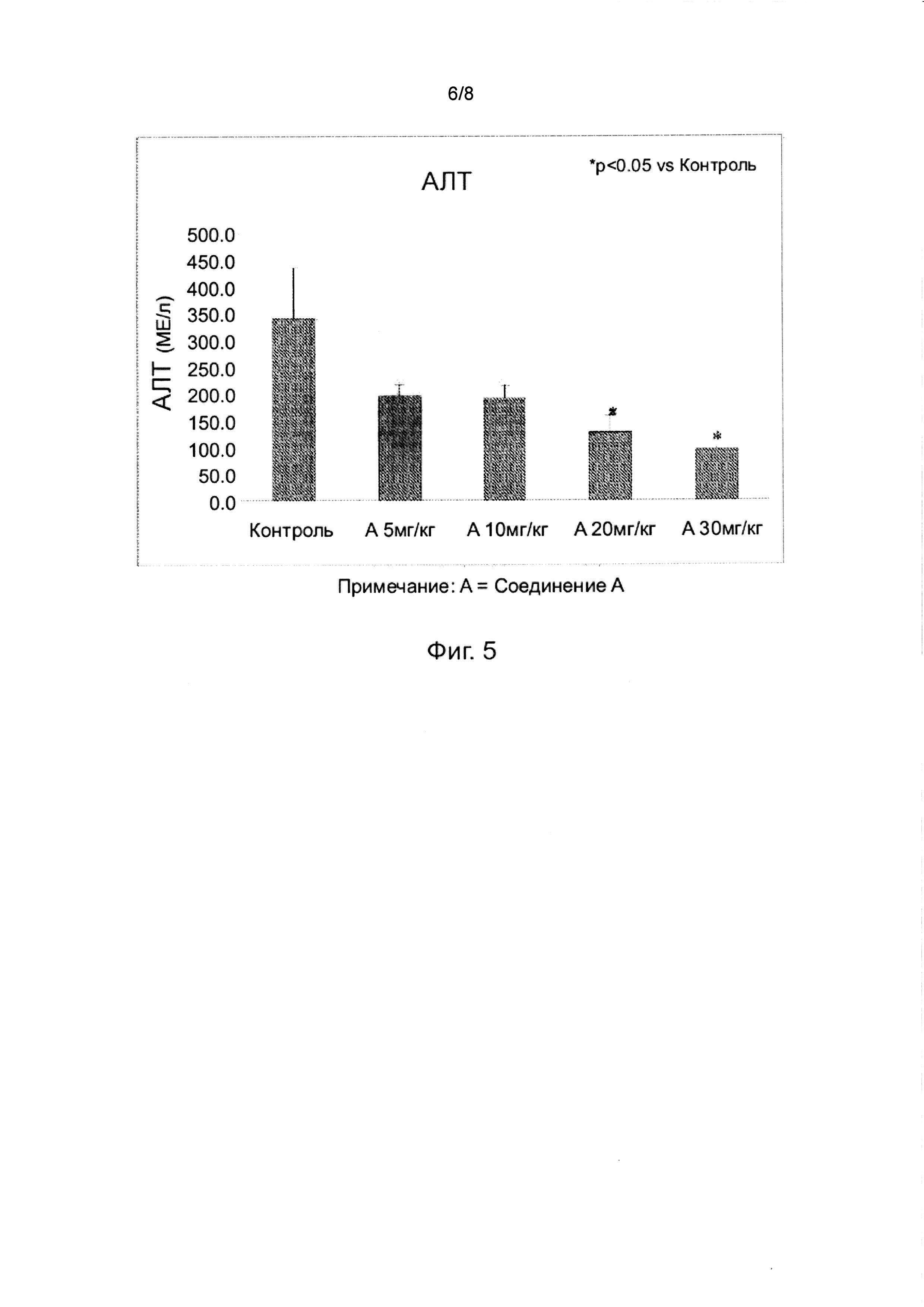
На фиг. 5 показано дозозависимое предотвращение повреждения печени у крыс со стеатозной печенью. Эксперимент с дозой 20 мг повторяли с n = 5 особей в группе, как показано на фиг. 6, и получали те же результаты, что и на фиг. 5.
На фиг. 6 показано дозозависимое предотвращение повреждения печени у крыс со стеатозной печенью при 20 мг/кг (N = Соединение A).
На фиг. 7 показано повреждение печени, оцененное при помощи гистопатологического исследования крыс, получавших Соединение A/ЛПС, из этого эксперимента. Гистопатология показывает, что Соединение A предотвращает накопление жира в печени у получавших лечение крыс по сравнению с контролем. На фиг. 7 показано, что при лечении Соединением A имеет место положительная динамика стеатоза и уменьшается повреждение печени при ЛПС-индуцированном жировом поражении печени. На фиг. 7: a) Левое верхнее изображение [контроль (крысы, получавшие MCD)]: показывает, что имеет место макровезикулярный стеатоз с небольшим проявлением микровезикулярного стеатоза; b) Левое нижнее изображение [крысы, получавшие MCD и Соединение A]: небольшое перипортальное хроническое воспаление (легкий неспецифический хронический гепатит); c) Правое верхнее изображение: MCD + ЛПС обработанные крысы: черные точки (стрелка) представляют собой погибающие гепатоциты; область со светлым оттенком (прямоугольник) указывает на некроз. Имеет место геморрагический и перипортальный (зона 1) некроз. Отсутствует значительная гиперемия или утрата архитектуры; и d) Правое нижнее изображение [крысы, получавшие MCD + ЛПС + Соединение A]: незначительное перипортальное хроническое воспаление.
Подробное описание изобретения
Способы лечения или лекарственные препараты, полученные в соответствии с настоящим изобретением, включают в себя препараты для предотвращения или лечения НАСГ (неалкогольного стеатогепатита), НЖБП (неалкогольной жировой болезни печени) и/или АСГ (алкогольного стеатогепатита).
В соответствии с другими вариантам осуществления настоящего изобретения настоящее изобретение относится к способам предотвращения или лечения НАСГ, НЖБП и/или АСГ, включающим в себя введение нуждающемуся в этом субъекту фармацевтической композиции, содержащей терапевтически эффективное количество одного или нескольких из указанных химических соединений. Вышеизложенные и другие аспекты настоящего изобретения далее будут более подробно описаны, принимая во внимание другие варианты осуществления изобретения, описанные здесь. Следует понимать, что настоящее изобретение может быть осуществлено в различных формах и не должно рассматриваться как ограниченное изложенными здесь вариантами осуществления. То есть, эти варианты осуществления изобретения приведены для того, чтобы сделать настоящее раскрытие исчерпывающим и полным и полностью передать объём изобретения специалистам в данной области техники.
Терминология, используемая в описании настоящего изобретения, предназначена только для описания конкретных вариантов осуществления изобретения и не предназначена для ограничения изобретения. Предполагается, что используемые в описании изобретения и прилагаемой формуле изобретения, формы единственного числа также включают в себя формы множественного числа, если из контекста явно не следует иное.
Если не указано иное, то все технические и научные термины, используемые здесь, имеют то же значение, которое обычно понимается средним специалистом в той области техники, к которой относится настоящее изобретение.
Все публикации, патентные заявки, патенты и другие ссылки, приведенные здесь, полностью включены путем ссылки для информации, содержащейся в предложении и/или абзаце, в котором эта ссылка присутствует.
Используемый здесь термин «опиоид» относится к химическим соединениям, которые обладают опиумными или морфиноподобными свойствами, включая агонистическую и антагонистическую активность, где такие химические соединения могут взаимодействовать с сайтами стереоспецифичного и насыщаемого связывания в головном мозге и других тканях. Фармакологические свойства ранее включали в себя сонливость, угнетение дыхания, изменения настроения и умственное помутнение без потери сознания. Используемый здесь термин «опиоидоподобный» относится к химическим соединениям, которые сходны по структуре и/или фармакологическому профилю с известными опиоидными соединениями.
Используемый здесь термин «лечить» или «лечение» относится к любому типу лечения, которое приносит пользу пациенту, страдающему от заболевания, включая улучшение состояния пациента (например, облегчение одного или нескольких симптомов), замедление прогрессирования патологического состояния, предотвращение или задержку начала заболевания и т.д.
Используемый здесь термин «фармацевтически приемлемый» компонент (такой как соль, носитель, вспомогательное вещество или разбавитель) означает, что это химическое соединение или композиция пригодны для введения субъекту для обеспечения описанных здесь способов лечения без чрезмерно вредных побочных эффектов в свете тяжести заболевания и необходимости лечения.
Используемый здесь термин «профилактика», «предупреждение» или «предотвращение» означает введение лекарственного средства субъекту до появления соответствующих симптомов для уменьшения риска проявления самого заболевания или снижения его тяжести, если оно проявляется.
Используемый здесь термин «терапевтически эффективное количество» относится к количеству, необходимому для предотвращения, задержки или уменьшения тяжести соответствующего патологического состояния, а также включает в себя количество, необходимое для улучшения нормальной физиологической деятельности.
Активные химические соединения настоящего изобретения могут быть водорастворимыми и также могут содержать известные водорастворимые опиоиды и опиоидоподобные производные.
Химические соединения настоящего изобретения могут иметь асимметричный атом(мы) углерода и, следовательно, способны существовать в форме энантиомеров или диастереоизомеров. Таким образом, химические соединения настоящего изобретения включают в себя энантиомеры и диастереоизомеры, а также фармацевтически приемлемые соли химических соединений настоящего изобретения.
Активные соединения настоящего изобретения могут быть введены. Например, активные соединения настоящего изобретения могут быть введены совместно с известными или открытыми в будущем химическими соединениями, которые являются пригодными для предотвращения и/или лечения НАСГ, НЖБП и/или АСГ.
Как указано выше, налмефен и налтрексон являются хорошо описанными в научной литературе химическими соединениями и являются коммерчески доступными. Другие химические соединения, используемые в настоящем изобретении, могут быть получены путем модификации налмефена при помощи стандартных химических способов или с использованием методов, аналогичных тем, которые описанным в публикации Международной патентной заявки WO03/097608.
Используемый здесь термин «активный агент» включает в себя фармацевтически приемлемые соли химического соединения. Фармацевтически приемлемые соли представляют собой соли, которые сохраняют желаемую биологическую активность исходного химического соединения и не вызывают нежелательных токсикологических эффектов. Примерами таких солей являются (a) соли присоединения кислоты, образованные с неорганическими кислотами, например, соляной кислотой, бромистоводородной кислотой, серной кислотой, фосфорной кислотой, азотной кислотой и тому подобное; и соли, образованные с органическими кислотами, такими как, например, уксусная кислота, щавелевая кислота, винная кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, глюконовая кислота, лимонная кислота, яблочная кислота, аскорбиновая кислота, бензойная кислота, дубильная кислота, пальмитиновая кислота, альгиновая кислота, полиглутаминовая кислота, нафталинсульфоновая кислота, метансульфоновая кислота, п-толуолсульфоновая кислота, нафталиндисульфоновая кислота, полигалактуроновая кислота и тому подобное; и (b) соли, образованные из элементарных анионов, таких как хлор, бром и йод. В других конкретных вариантах осуществления изобретения фармацевтически приемлемые соли образованы с яблочной кислотой. В конкретных вариантах осуществления изобретения фармацевтически приемлемые соли образованы с соляной кислотой.
Активные агенты, используемые для получения композиций настоящего изобретения, могут альтернативно быть в форме фармацевтически приемлемого свободного основания активного агента. Так как химическое соединение в форме свободного основания менее растворимо, чем соль, то композиции в форме свободного основания используют для обеспечения более длительного высвобождения активного агента в целевую область. Активный агент, присутствующий в целевой области, который не перешел в раствор, недоступен для индукции физиологического ответа, но служит в качестве запаса биологически доступного лекарственного средства, которое постепенно переходит в раствор.
Фармацевтические композиции
Опиоидные и опиоидоподобные химические соединения настоящего изобретения пригодны в качестве фармацевтически активных агентов и могут использоваться в виде нерасфасованной лекарственной формы. Однако, более предпочтительно, эти химические соединения являются компонентами состава фармацевтических композиций для введения. Любая из ряда подходящих фармацевтических композиций может быть использована в качестве носителя для введения химических соединений настоящего изобретения.
Следует понимать, что некоторые соединения вышеуказанных формул могут обладать асимметричным атомом(ами) углерода и, таким образом, способны существовать в виде энантиомеров. Если не указано иное, то настоящее изобретение включает в себя такие энантиомеры, в том числе рацематы. Отдельные энантиомеры могут быть синтезированы из хиральных исходных материалов или рацематы могут быть выделены с помощью процедур, которые хорошо известны в обасти химии, таких как хиральная хроматография, фракционная кристаллизация диастереомерных солей и тому подобное.
Химические соединения настоящего изобретения могут быть включены в рецептуру, предназначенную для введения с целью лечения различных патологических состояний. При изготовлении фармацевтической композиции в соответствии с настоящим изобретением соединения настоящего изобретения и их физиологически приемлемые соли или кислотные производные тех и других (далее именуются «активное соединение») как правило, смешивают, помимо прочего, с приемлемым носителем. Разумеется, носитель должен быть приемлемым в смысле совместимости с любыми другими ингредиентами в составе композиции и не должен быть вредным для пациента. Носитель может быть твердым или жидким или и тем и другим и предпочтительно включен в рецептуру с химическим соединением в виде лекарственной формой с единичной дозой, например таблеткой, которая может содержать от 0,5 до 95% по массе активного соединения. В одном конкретном варианте осуществления изобретения фармацевтическая композиция содержит менее 80% по массе активного соединения. В других конкретных вариантах осуществления изобретения фармацевтическая композиция содержит менее 50% по массе активного соединения. Одно или несколько из каждого из активных соединений могут быть включены в композиции настоящего изобретения, которые могут быть получены любым из хорошо известных методов фармацевтической промышленности, состоящих в основном из смешивания компонентов, необязательно включающих в себя один или несколько вспомогательных ингредиентов.
Композиции настоящего изобретения включают в себя композиции, подходящие для перорального, ректального, местного, буккального (например, подъязычного), парентерального (например, подкожного, внутримышечного, внутрикожного или внутривенного) и трансдермального введения, хотя наиболее подходящий способ введения в любом конкретном случае будет зависеть от природы и тяжести подлежащего лечению патологического состояния и от природы конкретного применяемого активного вещества.
Композиции, подходящие для перорального введения, могут быть представлены в виде отдельных единиц, таких как капсулы, облатки, пастилки, таблетки, драже или сиропы, каждая из которых содержит заранее определенное количество активного соединения; в виде порошка или гранул; в виде раствора или суспензии в водной или неводной жидкости; или в виде эмульсии типа «масло-в-воде» или «вода-в-масле». Такие композиции могут быть получены любым подходящим способом фармацевтической промышлености, который включает в себя этап приведения в контакт активного соединения и подходящего носителя (который может содержать один или несколько вспомогательных ингредиентов, как указано выше).
Как правило, композиции настоящего изобретения получают путем равномерного и тщательного смешивания активного соединения с жидким или мелкодисперсным твердым носителем или с ними обоими, а затем, при необходимости, проводят формование полученной смеси. Например, таблетку можно получить путем прессования или формования порошка или гранул, содержащих активное соединение, при необходимости с одним или несколькими вспомогательными ингредиентами. Прессованные таблетки могут быть получены путем прессования в подходящей машине химического соединения в сыпучей форме, такого как порошок или гранулы, при необходимости смешанного со связующим веществом, смазывающим веществом, инертным разбавителем и/или поверхностно-активным/диспергирующим агентом (агентами). Формованные таблетки могут быть изготовлены путем формования в подходящей машине порошкообразного химического соединения, увлажненного инертным жидким связующим веществом.
Композиции, подходящие для буккального (подъязычного) введения, включают в себя пастилки, содержащие активное соединение в ароматизированной основе, как правило, сахарозе, и аравийскую камедь или трагакант; и таблетки, содержащие химическое соединение в инертной основе, такой как желатин и глицерин или сахароза и аравийская камедь.
Композиции настоящего изобретения, подходящие для парентерального введения, обычно включают в себя стерильные водные препараты активного соединения, причем эти препараты предпочтительно изотоничны с кровью предполагаемого реципиента. Эти препараты можно вводить путем подкожной, внутривенной, внутримышечной или внутрикожной инъекции. Такие препараты могут быть легко приготовлены путем смешивания химического соединения с водой или глициновым буфером и стерилизации полученного раствора и доведения значения его осмотического давления до значения осмотического давления крови.
Композиции, подходящие для ректального введения, предпочтительно представляют собой суппозитории с однократной дозой. Они могут быть получены путем смешивания активного соединения с одним или несколькими общепринятыми твердыми носителями, например с маслом какао, с последующим формованием полученной смеси.
Композиции, подходящие для местного нанесения на кожу, предпочтительно имеют форму мази, крема, лосьона, пасты, геля, спрея, аэрозоля или масла.
Композиции, подходящие для трансдермального введения, могут представлять собой отдельные пластыри, приспособленные для длительного пребывания в тесном контакте с эпидермисом кожи реципиента. Композиции, подходящие для трансдермального введения, также могут быть доставлены путем ионтофореза (см., например, Pharmaceutical Research 3(6): 318 (1986)) и, как правило, они находятся в виде при необходимости забуференного водного раствора активного соединения. Подходящие композиции включают в себя цитрат или бис\трис-буфер (pH 6) или смесь этанол/вода и содержат от 0,01 до 0,2 М активного ингредиента.
Настоящее изобретение также может представлять собой композицию с замедленным высвобождением. Композиция с замедленным высвобождением включает в себя, без ограничений композиции, в которых активный ингредиент связан с ионообменной смолой, которая при необходимости покрыта диффузионным барьером для изменения свойств высвобождения смолы.
Носители и/или разбавители, которые могут быть использованы, включают в себя вазелин, ланолин, глицерин, растительные масла или жировые эмульсии, полиэтиленгликоли, спирты, агенты, усиливающие трансдермальный перенос, натуральные или отвержденные масла или воски и комбинации двух или более из них.
Способы применения
В дополнение к химическим соединениям описанных здесь структурных формул, настоящее изобретение также относится к практическим способам лечения. Например, настоящее изобретение относится к способу лечения НАСГ, НЖБП и/или АСГ.
Примеры птиц в соответствии с настоящим изобретением включают в себя кур, уток, индеек, гусей, перепелов, фазанов, бескилевых птиц (например, страус) и домашних птиц (например, попугаев и канареек), а также включают в себя эмбрионы птиц в яйце. Предпочтительными являются куры и индейки.
Любой млекопитающий субъект, нуждающийся в лечении в соответствии с настоящим изобретением, является подходящим. Предпочтительным является человек. Люди обоих полов и на любой стадии развития (то есть новорожденные, дети до семи лет, дети, подростки, взрослые) могут получать лечение в соответствии с настоящим изобретением.
Как указано выше, настоящее изобретение относится к фармацевтическим композициям, содержащим химические соединения описанных здесь структурных формул, или их фармацевтически приемлемые соли в фармацевтически приемлемых носителях для любого подходящего способа введения, включая без ограничений пероральное, ректальное, местное, буккальное, парентеральное, внутримышечное, внутрикожное, внутривенное и трансдермальное введение.
В соответствии с настоящим изобретением способы настоящего изобретения включают в себя введение субъекту эффективного количества композиции настоящего изобретения, как описано выше. Эффективное количество композиции, применение которой включено в объём настоящего изобретения, будет несколько отличаться у разных субъектов, и будет зависеть от таких факторов, как возраст и состояние субъекта, а также способ доставки. Такие дозы могут быть определены при помощи стандартных фармакологических процедур, известных специалистам в данной области техники. Например, химические соединения настоящего изобретения могут вводиться субъекту в количестве от нижнего предела, находящегося в диапазоне от примерно 0,01, 0,02, 0,03, 0,04, 0,05, 0,06, 0,07, 0,08, 0,09, 0,10, 0,20, 0,30, 0,40 , 0,50, 0,60, 0,70, 0,80, 0,90, 1,0, 2,0, 3,0, 4,0, 5,0, 6,0, 7,0, 8,0, 9,0 или 10% до верхнего предела, находящегося в диапазоне от 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100% от массы композиции. В некоторых вариантах осуществления изобретения химические соединения составляют от примерно 0,05 до примерно 95% от массы композиции. В других вариантах осуществления изобретения химические соединения составляют от примерно 0,05 до примерно 60% от массы композиции. В других вариантах осуществления изобретения химические соединения составляют от примерно 0,05 до примерно 10% от массы композиции.
Терапевтически эффективная доза любого конкретного химического соединения будет немного различаться у разных соединений, у разных пациентов и будет зависеть от состояния пациента и способа доставки. В качестве общей рекомендации доза от примерно 0,1 до примерно 50 мг/кг будет обладать терапевтической эффективностью, причем еще более высокие дозы могут применяться для перорального и/или аэрозольного введения. Проблемы токсичности при более высоком уровне могут ограничивать величину внутривенных доз до более низкого уровня, такого как до примерно 10 мг/кг, причем все массы рассчитываются на основе массы активного основания, включая случаи, когда применяется соль. Как правило, для внутривенного или внутримышечного введения применяют дозу от примерно 0,5 мг/кг до примерно 5 мг/кг. Для перорального введения можно использовать дозу от примерно 1 мг/кг до примерно 50 мг/кг.
В конкретных вариантах осуществления соединения настоящего изобретения могут быть введены в суточной дозе от примерно 0,1 мг до примерно 20 мг на кг массы тела животного, которая может быть введена в виде разделенных доз от одного раза в сутки до четырех раз в сутки или в виде формы с замедленным высвобождением. Для человека общая суточная доза может находиться в диапазоне от примерно 1 мг до примерно 1400 мг, например от 1 до 50 мг в сутки, а в других конкретных вариантах осуществления изобретения общая суточная доза может находиться в диапазоне от 10 мг до примерно 100 мг. В других вариантах осуществления изобретения лекарственные формы с однократной дозировкой, подходящие для перорального введения, могут содержать от примерно 1 мг до примерно 1400 мг химического соединения, при необходимости смешанного с твердым или жидким фармацевтическим носителем или разбавителем. Химические соединения настоящего изобретения могут быть введены в любом количестве, подходящем для введения субъекту для лечения состояния, подлежащего лечению, определенном средним специалистом в данной области техники со ссылкой на соответствующие тексты и литературу и/или с использованием стандартных экспериментов. (см., например, Remington, The Science And Practice of Pharmacy (9th Ed. 1995). Однако в целом удовлетворительные результаты получают, когда химические соединения настоящего изобретения вводят в суточной дозе от примерно 0,1 мг до примерно 20 мг на кг массы тела животного, предпочтительно в виде разовых доз от 1 до 4 раз в сутки или в виде формы с замедленным высвобождением.
Вышеизложенная информация иллюстрирует настоящее изобретение и не должна истолковываться как его ограничение. Настоящее изобретение определяется следующей формулой изобретения, с эквивалентами формулы изобретения, которые должны быть включены в нее.
Пример 1. Синтез химических соединений настоящего изобретения
Соединение A (налмефен) и Соединение B (налтрексон) являются коммерчески доступными.
Пример 2. Соединение A уменьшает стимулированное высвобождение ФНО-α в купферовских клетках и фосфорилирование MAPK в купферовских клетках, обработанных ЛПС
Основными двигателями воспалительного ответа в печени являются купферовские клетки. Известно, что ФНО-α играет важную роль в повреждении печени, и его концентрация в плазме крови коррелирует с тяжестью повреждения печени. Фосфорилирование p38 является ключевым этапом в одном из основных путей, приводящих к продуцированию провоспалительного медиатора купферовскими клетками.
2.1. Схема эксперимента
Купферовские клетки выделяли у нормальных крыс при помощи ферментативного расщепления, очищали центрифугированием и культивировали в течение ночи. Затем их стимулировали ЛПС E. coli с добавлением или без добавления Соединения A в среду. Содержание ФНО-α в супернатанте измеряли через 2, 4 и 6 часов.
2.2 Результаты
Соединение A ингибировало ЛПС/время-зависимое увеличение высвобождения ФНО-α купферовскими клетками. [Через 2 ч чрезмерное накопление ФНО-α в клетках препятствовало получению результатов]. (Фигура 1). Соединение A также уменьшало ЛПС-индуцированное фосфорилирование p38 MAP-киназы в купферовских клетках (Фигура 2).
Пример 3. Изучение эффективности in vivo в STAM модели неалкогольного стеатогепатита (НАСГ)
Общая методика. НАСГ индуцировали у самцов мышей линии C57BL/6 путем однократной подкожной инъекции 200 мкг раствора стрептозотоцина через 2 дня после рождения и кормления рационом с высоким содержанием жиров (HFD, 57 ккал% жира, каталожный номер #HFD32, CLEA Япония, Япония) после 4-недельного возраста. Животных разделяли на группы по шесть особей в каждой и вводили перорально (1% Твин 80) в дозе 10 мл/кг или телмисартан в дозе 10 мг/кг два раза в суутке в возрасте от 6 до 9 недель. Аналогичным образом, Соединение A/налмефен (NMN) и Соединение B/налтрексон (NTX) вводили подкожно в дозе 5 мг/кг два раза в сутки. Животных умерщвляли на 9-ой неделе. Средняя масса тела в группе, получавшей телмисартан, постепенно уменьшалась в течение периода лечения. В течение периода лечения одна из шести мышей была найдена мертвой в группе, получавшей NMN, до достижения 9-й недели. В группе, получавшей телмисартан, было отмечено уменьшение средней массы тела в день умерщвления по сравнению с группой, получавшей инертный носитель (Контроль). Не было существенных различий в средней массе тела в день умерщвления между контрольной группой и любой из групп, получавших исследуемое химическое соединение (данные не приводятся).
Репрезентативные микрофотографии окрашенных гематоксилином и эозином срезов печени животных из контрольной группы и групп, получавших телмисартан, NTX и NMN показаны на фиг. 3. В срезах печени животных из контрольной группы были обнаружены микро- и макровезикулярное отложение жира, гепатоцеллюлярное вздутие и инфильтрация воспалительных клеток. У животных из групп, получавших телмисартан и NTX, было отмечено значительное уменьшение ПАН (показатель активности НЖБП) по сравнению с контрольной группой. Животные из группы, получавшей NMN, демонстрировали тенденцию к снижению ПАН по сравнению с контрольной группой.
Таблица 1a. Гистопатология и показатель активности НЖБП в STAM модели НАСГ
|
ПАН: показатель активности НЖБП (см. Таблицу 1b)
Все значения представляют собой среднее ± СОС для 5 (налмефен) или 6 животных. * P <0,05 по сравнению с контролем; непарный двусторонний t-критерий Стьюдента.
Таблица 1b. Определение баллов ПАН
|
В срезах печени животных из контрольной группы было обнаружено повышенное отложение коллагена в перицентральной области дольки печени (Таблица 1а, Фигура 3). Область фиброза (Sirius Red-положительная область) значительно уменьшилась в группах, получавших телмисартан и NTX, по сравнению с контрольной группой. У животных из группы, получавшей NMN, было обнаружено уменьшение области фиброза по сравнению с контрольной группой.
Пример 4. Крысиная модель метионин-холин-дефицитного (MCD) рациона (см. Szabo G. et al 2005)
4.1. Схема эксперимента
20 крысам линии Спрег-Доули перорально через желудочный зонд вводили Соединением A один раз в сутки в дозе 0, 5, 10, 20 или 30 мг/кг (4 крысы в группе) в течение 4 недель. Все животные получали рацион с дефицитом метионина и холинова (MCD) (от Dyets, Inc) пять раз в неделю во время периода кормления, для того, чтобы развилось индуцируемое рационом ожирение печени. Крыс взвешивали ежедневно, а также учитывали массу потребленного корма. В конце четырехнедельного периода крысам внутрибрюшинно вводили 2 мг/кг эндотоксина E. coli (ЛПС), и через 6 часов крыс умерщвляли и собирали ткань печени и сыворотку крови. Печень как кровь отбирали в момент смерти. Гистологические образцы также были отобраны.
4.2 Результаты
Как показано на фиг. 5, Соединение A продемонстрировало дозозависимое предотвращение поражения печени после введения дозы ЛПС у крыс с ожирением печени (n = 3 особи в группе, mpk = мг/кг, A = Соединение A). В отсутствие лечения Соединением A уровни АЛТ в сыворотке крови составляли 339 ед./л. ЛПС вызвал патологическое увеличение уровня АЛТ. Лечение 5 и 10 мг/кг Соединения A снижало повышенные уровни АЛТ почти на 50%, но это не было статистически значимым из-за небольшого n (n = 3 особи в группе) в этом пилотном исследовании режима дозировки. Однако при 20 и 30 мг/кг наблюдалось дальнейшее снижение, которое было значимым даже при небольшом количестве животных (p<0,05). При 30 мг/кг уровень АЛТ составлял 94,9 ± 5,5 ед./л. Эти результаты демонстрируют дозозависимое предотвращение поражения печени Соединением A после эндотоксемии у крыс с неалкогольной жировой болезнью печени.