Результат интеллектуальной деятельности: Варианты химозина с улучшенными молокосвертывающими свойствами
Вид РИД
Изобретение
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к вариантам химозина с улучшенными молокосвертывающими свойствами.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Ферментативное свертывание молока молокосвертывающими ферментами, такими как химозин и пепсин, представляет собой один из важнейших процессов в производстве сыров. Ферментативное свертывание молока представляет собой двухфазный процесс: первую фазу, где протеолитический фермент, такой как химозин или пепсин, атакует κ-казеин, что приводит в результате к метастабильному состоянию мицеллярной структуры казеина, и вторую фазу, где молоко впоследствии свертывается и образует коагулят.
Молокосвертывающие ферменты желудка млекопитающих химозин (ЕС 3.4.23.4) и пепсин (ЕС 3.4.23.1) представляют собой аспарагиновые протеазы, принадлежащие к широкому классу пептидаз.
При продуцировании в клетках слизистой оболочки желудка химозин и пепсин образуются в виде ферментативно неактивных препрохимозина и препепсиногена соответственно. При экскреции химозина отщепляется N-концевой пептидный фрагмент, префрагмент (сигнальный пептид), с образованием прохимозина, включающего профрагмент. Прохимозин представляет собой по существу неактивную форму фермента, которая, тем не менее, активируется в кислых условиях до активного химозина за счет автокаталитического удаления профрагмента. Эта активация происходит in vivo в полости желудка при подходящих условиях рН или in vitro в кислых условиях.
Структурные и функциональные характеристики бычьего препрохимозина, прохимозина и химозина, т.е. препрохимозина, прохимозина и химозина Bos taurus, широко изучены. Пре-участок молекулы бычьего препрохимозина содержит 16 аминокислотных (аа) остатков, а про-участок соответствующего прохимозина имеет длину 42 аа остатка. Активный бычий химозин, содержащий 323 аа, представляет собой смесь двух форм А и В, обе из которых активны.
Химозин продуцируется в природе у таких видов млекопитающих, как крупный рогатый скот, верблюды, козы, буйволы, овцы, свиньи, люди, обезьяны и крысы.
На протяжении многих лет бычий химозин имеется в продаже для молочной промышленности.
В WO 02/36752 A2 (Chr. Hansen) описано рекомбинантное продуцирование верблюжьего химозина.
В WO 2013/174840 A1 (Chr. Hansen) описаны мутанты/варианты бычьего и верблюжьего химозина.
В WO 2013/164479 A2 (DSM) описаны мутанты бычьего химозина.
Ссылки, приведенные непосредственно ниже, в настоящем контексте можно рассматривать как источники, в которых описаны мутанты химозина:
- Suzuki et al: Site directed mutagenesis reveals functional contribution of Thr218, Lys220 and Asp304 in chymosin, Protein Engineering, vol. 4, January 1990, pp. 69-71;
- Suzuki et al: Alteration of catalytic properties of chymosin by site-directed mutagenesis, Protein Engineering, vol. 2, May 1989, pp. 563-569;
- van den Brink et al: Increased production of chymosin by glycosylation, Journal of biotechnology, vol. 125, September 2006, pp.304-310;
- Pitts et al: Expression and characterisation of chymosin pH optima mutants produced in Tricoderma reesei, Journal of biotechnology, vol. 28, March 1993, pp. 69-83;
- M.G. Williams et al: Mutagenesis, biochemical characterization and X-ray structural analysis of point mutants of bovine chymosin, Protein engineering design and selection, vol. 10, September 1997, pp. 991-997;
- Strop et al: Engineering enzyme subsite specificity: preparation, kinetic characterization, and x-ray analysis at 2.0 ANG resolution of Val111phe site mutated calf chymosin, Biochemistry, vol. 29, October 1990, pp. 9863-9871;
- Supannee et al: Site-specific mutations of calf chymosin В which influence milk-clotting activity, Food Chemistry, vol. 62, June 1998, pp. 133-139;
- Zhang et al: Functional implications of disulfide bond, Cys45-Cys50, in recombinant prochymosin, Biochimica et biophysica acta, vol. 1343, December 1997, pp. 278-286.
Ни в одном из упомянутых выше источников из предшествующего уровня техники прямо и явным образом не описан ни один из мутантов/вариантов химозина, описанных/заявленных в настоящем документе ниже.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Задача, которая должна быть решена настоящим изобретением, состоит в разработке вариантов химозина с улучшенными молокосвертывающими свойствами.
Как обсуждено в рабочих примерах настоящего документа, авторы настоящего изобретения идентифицировали ряд усовершенствованных вариантов верблюжьего (см. пример 6 настоящего документа) и бычьего/верблюжьего (см. пример 7 настоящего документа) химозина.
На основании сравнительного анализа верблюжьих и бычьих вариантов авторы настоящего изобретения идентифицировали ряд дополнительных аминокислотных положений, которые важны в настоящем изобретении в том смысле, что в результате получения варианта в одном или более чем одном из этих положений можно получить улучшенный вариант химозина.
Как известно в данной области техники, различные последовательности природного полипептида химозина дикого типа, полученные из различных видов млекопитающих (таких как, например, крупный рогатый скот, верблюды, овцы, свиньи или крысы) обладают относительно высоким сходством/идентичностью последовательности.
На Фиг. 1 настоящего документа это проиллюстрировано в виде выравнивания различных релевантных для настоящего изобретения последовательностей химозина.
В свете этих близкородственных взаимоотношений последовательностей считают, что трехмерные (3D) структуры различных природных химозинов дикого типа также относительно сходны.
В контексте настоящего изобретения полученный из природных источников химозин дикого типа (такой как бычий химозин или верблюжий химозин) в настоящем описании может представлять собой пример родительского полипептида, т.е. родительского полипептида, в котором производят изменения, чтобы получить вариантный полипептид химозин по настоящему изобретению.
Не ограничиваясь какой-либо теорией, считают, что обсуждаемые в настоящем документе аминокислотные положения, относящихся к химозину, обладают общей значимостью в любом релевантном для настоящего изобретения ферменте химозине, представляющем интерес (например, в химозинах крупного рогатого скота, верблюдов, овец, свиней, крыс и т.д.), в том смысле, что путем получения варианта в одном или более чем одном из этих положений можно в общем получить улучшенный вариант химозина (например, улучшенный вариант химозина крупного рогатого скота, верблюдов, овец, свиней или крыс).
Как обсуждено в настоящем документе, в качестве эталонной последовательности для аминокислотных положений интересующего родительского полипептида химозина (например, верблюжьего, овечьего, бычьего и т.д.) в настоящем изобретении используют последовательность препрохимозина общеизвестного бычьего химозина В (номер доступа Genbank Р00794, в настоящем документе описана как SEQ ID NO: 1).
Препрохимозин бычьего химозина В с SEQ ID NO: 1 в настоящем документе альтернативно может называться бычьим (Bos bovis) химозином В или просто бычьим химозином. Последовательность также представлена на Фиг.1 настоящего документа.
Другая релевантная для настоящего изобретения последовательность химозина представляет собой общеизвестную последовательность химозина Camelius dromedarius, обозначенную в настоящем документе как SEQ ID NO: 2. Альтернативно в настоящем документе она может быть названа верблюжьим химозином. Эта последовательность также представлена на Фиг.1 настоящего документа.
В настоящем контексте считают, что родительский полипептид химозин (например, из овцы или крысы), обладающий по меньшей мере 65% идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 1 (бычьим химозином), в настоящем изобретении можно рассматривать как достаточно структурно родственный, например, бычьему или верблюжьему химозину для его улучшения в результате получения варианта в любом из аминокислотных положений, как описано в настоящем документе.
Соответственно, первый аспект изобретения относится к способу получения выделенного варианта полипептида химозина, включающему следующие стадии:
(а): создание изменения в одном или более положений в родительском полипептиде, обладающем активностью химозина, где изменение включает замену, делецию или инсерцию по меньшей мере в одном аминокислотном положении, соответствующем любому из положений 70; 75; 77; 79; 90; 102; 103; 108; 114; 117; 120; 124; 134; 154; 156, 163; 212; 222; 223; 224; 238; 246; 256; 261; K279V; L280; F281; R300D,E,S,T,N,Q,C,U,G,P,A,V,I,L,M,F,Y,W; G309; R312D,E,S,T,N,Q,C,U,G,P,A,V,I,L,M,F,Y,W; 320; 324; D325Q; 326; 331; 336; 346; 361; 367 и 379; и
(б): продуцирование и выделение измененного полипептида стадии (а) и получение, таким образом, выделенного варианта полипептида химозина, где этот вариант обладает активностью химозина;
и где:
(1): аминокислотное положение родительского полипептида определяют путем выравнивания родительского полипептида с полипептидом с SEQ ID NO: 1 (бычий химозин), т.е. полипептид с SEQ ID NO: 1 используют для определения соответствующей аминокислотной последовательности в родительском полипептиде; и
(2): родительский полипептид обладает по меньшей мере 65%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин), находится от аминокислотного положения 59 до аминокислотного положения 381 SEQ ID NO: 1;
и при условии, что выделенный вариант полипептида химозина НЕ представляет собой конкретный вариант, выбранный из группы, состоящей из:


Приведенное выше условие можно рассматривать как относящееся к обсуждаемому выше документу WO 2013/174840 A1 (Chr. Hansen), поскольку в этом документе явным образом описаны приведенные выше варианты.
Как понятно специалистам в данной области техники в контексте описанного выше изобретения, это условие относится только к упомянутым конкретным вариантам.
Например, вариант, содержащий только замену Q246E (т.е. не G309D, S329P и/или D337E), не является таким конкретным вариантом в рамках этого условия, т.е. он не исключается в настоящем контексте.
Как известно в данной области техники, на основании своих общих знаний специалист в данной области техники может обычным путем получать и очищать химозин и варианты химозина.
Иными словами, как только специалист в данной области техники получит релевантный для настоящего изобретения родительский полипептид, обладающий интересующей активностью химозина (например, из крупного рогатого скота, верблюдов, овец, свиней или крыс), получение интересующего варианта такого родительского химозина является обычной работой для специалиста в данной области техники.
Второй аспект изобретения относится к выделенному варианту полипептида химозина, полученному способом по первому аспекту или любым из его релевантных воплощений.
Термин «полученный» по отношению к описанному выше второму аспекту следует понимать как выделенный вариант полипептида химозина, который получили способом по первому аспекту или любым из его релевантных воплощений.
Соответственно, термин «полученный» по отношению ко второму аспекту не следует истолковывать как «получаемый».
Как обсуждено в настоящем документе, в его рабочих примерах были созданы варианты с использованием полипептида с SEQ ID NO: 1 (бычий) в качестве родительского полипептида, и такой вариант в настоящем документе может быть назван как варианты бычьего химозина.
Соответственно, третий аспект изобретения относится к выделенному варианту полипептида химозина, содержащему:
(а): изменение в одном или более положений в родительском полипептиде, обладающем активностью химозина, где изменение включает замену, делецию или инсерцию по меньшей мере в одном аминокислотном положении, соответствующем любому из положений 70; 75; 77; 79; 90; 102; 103; 108; 114; 117; 120; 124; 134; 154; 156; 163; 212; 222; 223; 224; 238; 246; 256; 261; K279V; L280; F281; R300D,E,S,T,N,Q,C,U,G,P,A,V,I,L,M,F,Y,W; G309; R312D,E,S,T,N,Q,C,U,G,P,A,V,I,L,M,F,Y,W; 320; 324; D325Q; 326; 331; 336; 346; 361; 367 и 379; и
(б): где вариант обладает активностью химозина;
и где:
(1): аминокислотное положение родительского полипептида определяют путем выравнивания родительского полипептида с полипептидом с SEQ ID NO: 1 (бычий химозин), т.е. полипептид с SEQ ID NO: 1 используют для определения соответствующей аминокислотной последовательности в родительском полипептиде; и
(2): родительский полипептид обладает по меньшей мере 90%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин), находится от аминокислотного положения 59 до аминокислотного положения 381 SEQ ID NO: 1; и
(3): выделенный вариантный полипептид обладает менее чем 100%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин);
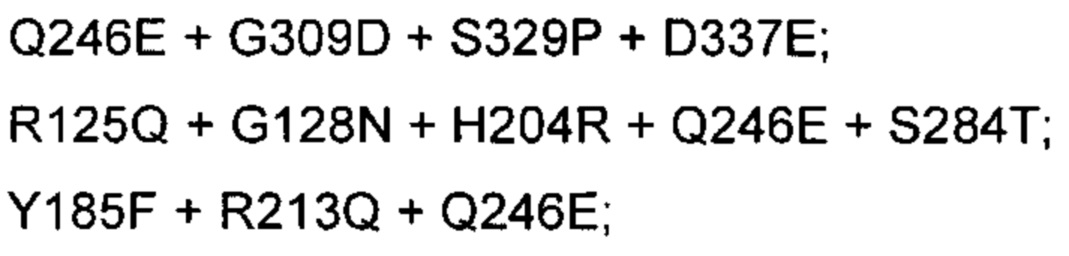
и при условии, что выделенный вариант полипептида химозина НЕ представляет собой конкретный вариант, выбранный из группы, состоящей из:

Как обсуждено в настоящем документе, в его рабочих примерах были получены варианты с использованием полипептида с SEQ ID NO: 2 (верблюжий химозин) в качестве родительского полипептида - такой вариант в настоящем документе может быть назван вариантом верблюжьего химозина.
Соответственно, четвертый аспект изобретения относится к выделенному варианту полипептидна химозина, содержащему:
(а): изменение в одном или более положений в родительском полипептиде, обладающем активностью химозина, где изменение включает замену, делецию или инсерцию по меньшей мере в одном аминокислотном положении, соответствующем любому из положений 70; 75; 77; 79; 90; 102; 103; 108; 114; 117; 120; 124; 134; 154; 156; 163; 212; 222; 223; 224; 238; 246; 256; 261; K279V; L280; F281; R300D,E,S,T,N,Q,C,U,G,P,A,V,I,L,M,F,Y,W; G309; R312D,E,S,T,N,Q,C,U,G,P,A,V,I,L,M,F,Y,W; 320; 324; D325Q; 326; 331; 336; 346; 361; 367 и 379; и
(б): где вариант обладает активностью химозина;
и где:
(1): аминокислотное положение родительского полипептида определяют путем выравнивания родительского полипептида с полипептидом с SEQ ID NO: 1 (бычий химозин), т.е. полипептид SEQ ID NO: 1 используют для определения соответствующей аминокислотной последовательности в родительском полипептиде; и
(2): родительский полипептид обладает по меньшей мере 90%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 2 (верблюжий химозин), который находится от аминокислотного положения 59 до аминокислотного положения 381 SEQ ID NO: 2; и дальнейших этапов производства
(3): выделенный вариантный полипептид обладает менее чем 100% идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 2 (верблюжий химозин);
и при условии, что выделенный вариант полипептида химозина НЕ представляет собой конкретный вариант, выбранный из группы, состоящей из:

Выделенный вариант полипептида химозина, как описано в настоящем документе, можно применять согласно уровню техники, например для изготовления представляющего интерес пищевого или кормового продукта (такого как, например, представляющий интерес продукт на основе молока, который может представлять собой, например, сырный продукт).
Соответственно, пятый аспект изобретения относится к способу изготовления пищевого или кормового продукта, включающему добавление эффективного количества выделенного варианта полипептида химозина, как описано в настоящем документе, к пищевому(ым) или кормовому(ым) ингредиенту(ам) и осуществление дальнейших этапов производства с получением пищевого или кормового продукта.
Воплощение настоящего изобретения описано ниже только с помощью примеров.
ОПРЕДЕЛЕНИЯ
Все определения релевантных терминов, относящихся к настоящему документу, находятся в соответствии с определениями, понятными специалистам в данной области техники по отношению к релевантному для настоящего документа техническому контексту.
Термин «химозин» относится к ферменту класса ЕС 3.4.23.4. Химозин обладает высокой специфичностью и свертывает молоко в результате расщепления единственной связи 105-Ser-Phe-|-Met-Ala-108 в каппа-цепи казеина. В данной области техники используют его альтернативное название реннин.
Термин «активность химозина» относится к химозиновой активности фермента химозина, как понятно специалистам в данной области техники.
Специалисту в данной области техники известно, как определить активность химозина, релевантную для настоящего документа.
В рабочем примере 4 настоящего документа приведен пример стандартного способа определения удельной активности химозина, альтернативно называемой свертывающей активностью или молокосвертывающей активностью.
В рабочем примере 5 настоящего документа приведен пример стандартного способа определения протеолитической активности.
Как известно в данной области техники, релевантное для настоящего документа так называемое отношение С/Р определяют путем деления удельной свертывающей активности (С) на протеолитическую активность (Р).
Как известно в данной области техники, повышенное отношение С/Р в целом подразумевает, что потеря белка в процессе, например, производства сыра за счет неспецифической деградации белка уменьшается, т.е. улучшается выход сыра, и что уменьшается образование горького вкуса в сыре в процессе созревания.
Термин «выделенный вариант» означает вариант, который модифицирован человеком. В одном аспекте вариант по меньшей мере на 1% очищен, например, по меньшей мере на 5% очищен, по меньшей мере на 10% очищен, по меньшей мере на 20% очищен, по меньшей мере на 40% очищен, по меньшей мере на 60% очищен, по меньшей мере на 80% очищен и по меньшей мере на 90% очищен, как определено с помощью SDS PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия).
Термин «зрелый полипептид» означает пептид в его конечной форме после трансляции и любых посттрансляционных модификаций, таких как N-концевой процессинг, С-концевое усечение, гликозилирование, фосфорилирование и т.д. В настоящем контексте релевантный для настоящего документа зрелый полипептид химозин можно рассматривать как последовательность активного полипептида химозина, т.е. без пре-участка и/или про-участка последовательности. Релевантными в настоящем документе примерами зрелого полипептида являются, например, зрелый полипептид с SEQ ID NO: 1 (бычий химозин), который находится от аминокислотного положения 59 до аминокислотного положения 381 SEQ ID NO: 1 или зрелый полипептид с SEQ ID NO: 2 (верблюжий химозин), который находится от аминокислотного положения 59 до аминокислотного положения 381 SEQ ID NO: 2.
Термин «родительский» или «родительский полипептид, обладающий активностью химозина», означает полипептид, в котором выполнены изменения с получением вариантов фермента по настоящему изобретению. Родительский полипептид может представлять собой встречающийся в природе (дикого типа) полипептид или его вариант.
Термин «идентичность последовательности» относится к родству между двумя аминокислотными последовательностями или между двумя нуклеотидными последовательностями.
Для задач настоящего изобретения степень идентичности последовательности между двумя аминокислотными последовательностями определяют с использованием алгоритма Нидлмана-Вунша (Needleman, Wunsch, 1970, J. Mol. Biol. 48: 443-453), используемого в программе Needle пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16: 276-277), предпочтительно версия 3.0.0 или более поздние версии. Возможными используемыми параметрами являются штраф за внесение пробела 10, штраф за удлинение пробела 0,5 и матрица замен EBLOSUM62 (EMBOSS версия BLOSUM62). Результат программы Needle на выходе, маркированный как «самая длинная идентичность» (полученный с использованием опции - nobrief), используют в качестве процента идентичности и вычисляют, как описано ниже:
(идентичные остатки × 100) / (длина выравнивания - общее число пробелов в выравнивании).
Для задач настоящего изобретения степень идентичности последовательности между двумя дезоксирибонуклеотидными последовательностями определяют с использованием алгоритма Нидлмана-Вунша (Needleman, Wunsch, 1970, см. выше), используемого в программе Needle пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, см. выше), предпочтительно версия 3.0.0 или более поздняя версия. Возможными используемыми параметрами являются штраф за внесение пробела 10, штраф за удлинение пробела 0,5 и матрица замен EDNAFULL (EMBOSS версия NCBI (Национальный центр биотехнологической информации) NUC4.4). Результат программы Needle на выходе, маркированный как «самая длинная идентичность» (полученный с использованием опции - nobrief), используют в качестве процента идентичности и вычисляют, как описано ниже:
(идентичные дезоксирибонуклеотиды × 100) / (длина выравнивания - общее число пробелов в выравнивании).
Термин «вариант» означает пептид, обладающий активностью химозина, содержащий изменение, т.е. замену, инсерцию и/или делецию, в одном или более положений (нескольких положениях). Замена означает замещение аминокислоты, занимающей положение, другой аминокислотой; делеция означает удаление аминокислоты, занимающей положение; и инсерция означает добавление 1-3 аминокислот по соседству с аминокислотой, занимающей положение.
Аминокислота может представлять собой природные или неприродные аминокислоты, например, теоретически возможна замена, например, конкретно D-изомерами (или D-формами), например, D-аланином.
Термин пептид химозин «дикого типа» означает химозин, экспрессируемый встречающимся в природе организмом, таким как млекопитающее (например, верблюд или крупный рогатый скот), обнаруживаемое в природе.
ГРАФИЧЕСКИЕ МАТЕРИАЛЫ
Фигура 1: Выравнивание релевантных в настоящем документе различных последовательностей химозина. Показанный «Bos_bovis_chymosin_B» в настоящем документе представляет собой бычий химозин с SEQ ID NO: 1, а показанный «Camelus_dromedarius» в настоящем документе представляет собой верблюжий химозин с SEQ ID NO: 2. Используя бычий химозин SEQ ID NO: 1 в качестве эталонной последовательности, как описано в настоящем документе, видно, что, например, бычий химозин имеет «V» в положении 10, а верблюжий химозин имеет «А» в том же положении 10. Например, также видно, что последовательность крупного рогатого скота/крысы имеет «Q» в положении 352, а верблюжья последовательность/C._bactrianus имеет «Е» в том же положении 352.
В отношении последовательностей химозина, показанных на фиг. 1, последовательность овцы обладает 94,5%-ной идентичностью последовательности с бычьей последовательностью SEQ ID NO: 1; C._bactrianus обладает 83,2%-ной идентичностью последовательности с бычьей последовательностью SEQ ID NO: 1; Camelus_dromedarius (верблюжий химозин с SEQ ID NO: 2) обладает 84%-ной идентичностью последовательности с бычьей последовательностью SEQ ID NO: 1; последовательность свиньи обладает 80,3%-ной идентичностью последовательности с бычьей последовательностью SEQ ID NO: 1, и последовательность крысы обладает 71,9%-ной идентичностью с бычьей последовательностью SEQ ID NO: 1.
Как понятно специалисту в данной области техники в настоящем контексте, релевантные в настоящем документе проценты идентичности последовательности зрелых полипептидных последовательностей химозина, например, овцы, C._bactrianus, верблюда, свиньи или крысы зрелому полипептиду с SEQ ID NO: 1 (бычий химозин, т.е. аминокислотные положения от 59 до 381 SEQ ID NO: 1), относительно подобны упомянутым выше процентам идентичности последовательности.
Фигура 2: Трехмерная (3D) структура бычьего химозина - эта 3D структура публично доступна. В качестве примера показано, где находятся аминокислотные положения 296 и 294 в бычьем химозине.
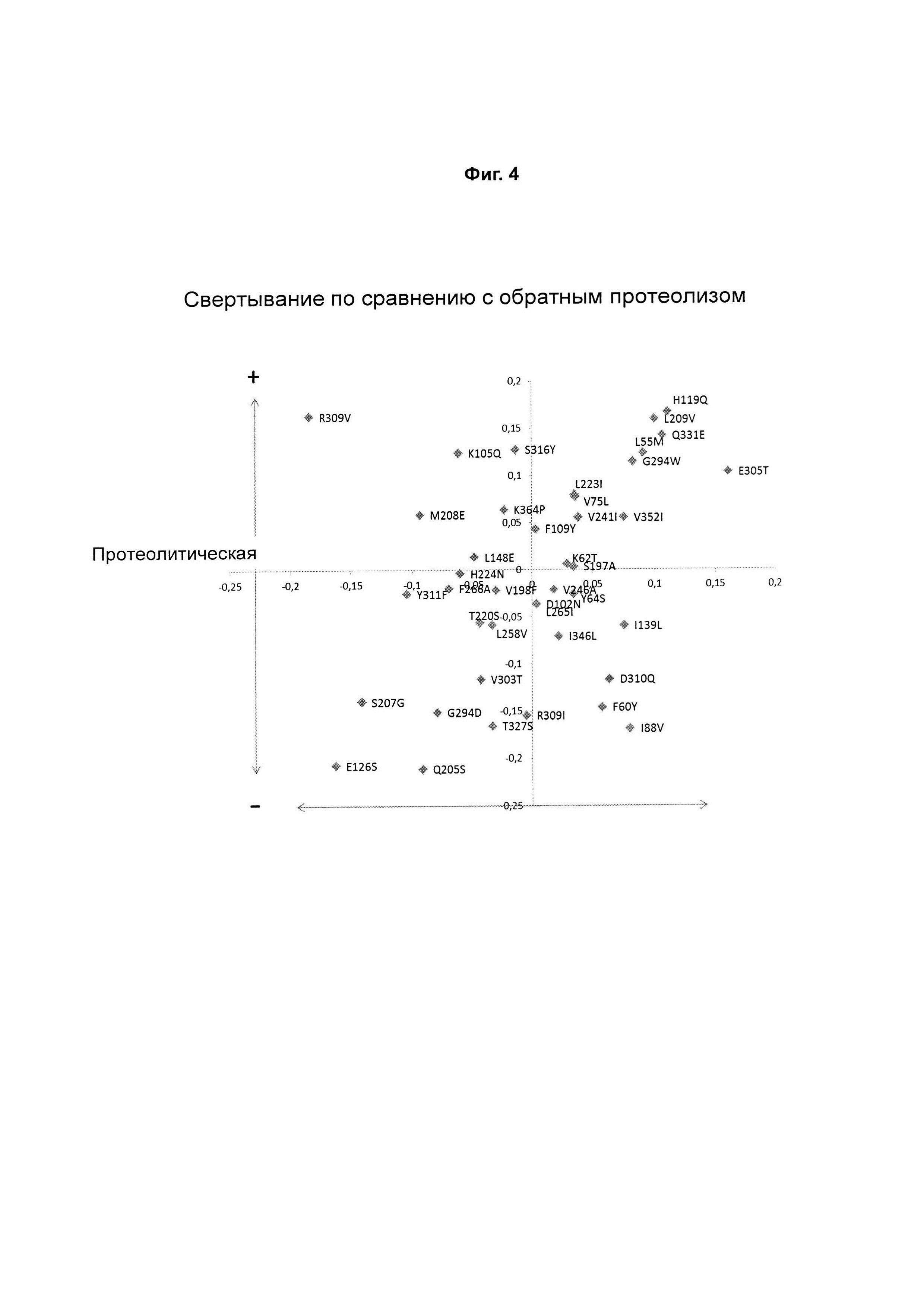
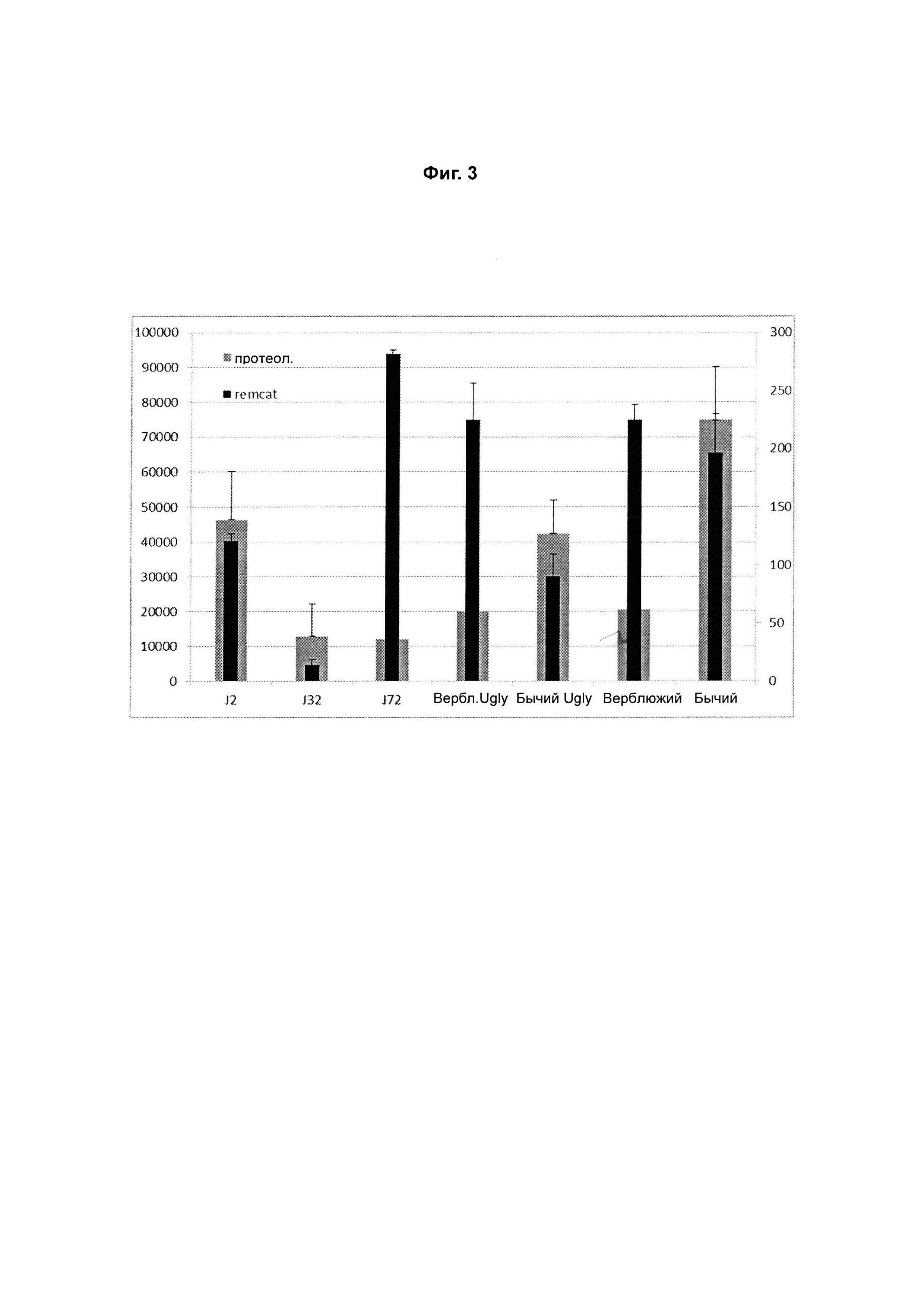
Фигура 3: Показано графическое изображение значений REMCAT и Proteol ряда вариантов химозина.
Фигура 4: Диаграмма РСА (метод главных компонент) действия индивидуальных замен. Все номера положений находятся на 15 ниже номеров, используемых в тексте.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определение аминокислотного положения интересующего химозина
Как обсуждено выше, в качестве эталонной последовательности для определения аминокислотного положения релевантного для настоящего документа интересующего полипептида химозина (например, верблюда, овцы, крупного рогатого скота и т.д.) в настоящем документе используют публично известную последовательность бычьего химозина, раскрытую в настоящем документе как SEQ ID NO: 1.
Для задач настоящего изобретения полипептид, раскрытый в SEQ ID NO: 1 (бычий химозин), используют для определения соответствующего аминокислотного остатка в другом полипептиде химозине. Аминокислотную последовательность другого полипептида химозина выравнивают с полипептидом, раскрытым в SEQ ID NO: 1, и на основании выравнивания номер аминокислотного положения, соответствующего любому аминокислотному остатку полипептида, раскрытого в SEQ ID NO: 1, определяют с использованием алгоритма ClustalW, как описано в рабочем примере 1 настоящего документа.
Идентификация соответствующего аминокислотного остатка в другом полипептиде химозине может быть подтверждена с применением алгоритма Нидлмана-Вунша (Needleman, Wunsch, 1970, J. Mol. Biol. 48: 443-453), используемого в программе Needle пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16: 276-277), предпочтительно версия 3.0.0 или более поздние версии.
На основании описанных выше хорошо известных компьютерных программ определение аминокислотного положения релевантного для настоящего документа интересующего полипептида химозина (например, верблюда, овцы, крупного рогатого скота и т.д.) представляет рутинную работу для специалиста в данной области техники.
На фиг. 1 настоящего документа показан пример выравнивания.
Только в качестве примера, на фиг. 1 видно, что, например, используемая в настоящем документе эталонная последовательность крупного рогатого скота SEQ ID NO: 1 имеет «G» в положении 50 и «Camelus_dromedarius» (SEQ ID NO: 2 в настоящем документе) имеет «А» в этом положении 50.
Номенклатура вариантов
При описании вариантов настоящего изобретения для простоты ссылок адаптирована описанная ниже номенклатура. Применяются принятые IUPAC (Международный союз теоретической и прикладной химии) однобуквенные или трехбуквенные сокращения аминокислот.
Конкретные варианты, обсуждаемые ниже в данном разделе «номенклатура», могут не представлять собой релевантные для настоящего документа варианты по настоящему изобретению, т.е. данный раздел «номенклатура» предназначен только для описания релевантной в настоящем документе номенклатуры как таковой.
Замены. Для замены аминокислот используют следующую номенклатуру: исходная аминокислота, положение, заменяющая аминокислота. Соответственно, теоретическую замену треонина аланином в положении 226 обозначают как «Thr226Ala» или «Т226А». Множественные мутанты разделяют знаками прибавления («+»), например «Gly205Arg + Ser411Phe» или «G205R + S411F», представляющие собой замены в положениях 205 и 411 глицина (G) аргинином (R) и серина (S) фенилаланином (F) соответственно. Замена, например, обозначенная «226А», относится к замене родительской аминокислоты (например, Т, Q, S или другой родительской аминокислоты) аланином в положении 226.
Делеции. Для делеции аминокислот используют следующую номенклатуру: Положение исходной аминокислоты, *. Соответственно, делецию глицина в положении 195 обозначают как «Gly195*» или «G195*». Множественные делеции разделяют знаками прибавления («+»), например «Gly195* + Ser411*» или «G195* + S411*».
Инсерции. Для инсерции аминокислот используют следующую номенклатуру: Исходная аминокислота, положение, исходная аминокислота, вставленная аминокислота. Соответственно, инсерцию лизина после глицина в положении 195 обозначают «Gly195GlyLys» или «G195GK». Инсерцию множественных аминокислот обозначают [исходная аминокислота, положение, исходная аминокислота, вставленная аминокислота №1, вставленная аминокислота №2; и т.д.]. Например, инсерцию лизина и аланина после глицина в положении 195 указывают как «Gly195GlyLysAla» или «G195GKA».
В таких случаях вставленный(е) аминокислотный(е) остаток(ки) нумеруют путем добавления строчных букв к номеру положения аминокислотного остатка, предшествующего вставленному(ым) аминокислотному(ым) остатку(ам). В приведенном выше примере последовательность, таким образом, будет представлять собой:

Множественные изменения. Варианты, содержащие множественные изменения, разделяют знаками прибавления («+»), например «Arg170Tyr + Gly195Glu» или «R170Y + G195E» представляют собой замену тирозина и глутаминовой кислоты аргинином и глицином в положениях 170 и 195 соответственно.
Различные замены. Если в положение могут быть введены различные замены, различные замены разделяют запятой, например «Arg170Tyr,Glu» или «R170Y,E» представляет собой замену аргинина тирозином или глутаминовой кислотой в положении 170. Так, «Tyr167Gly,Ala + Arg170Gly,Ala» или «Y167G,A + R170G,A» обозначает следующие варианты:
«Tyr167Gly + Arg 170Gly», «Tyr167Gly + Arg170Ala», «Tyr167Ala + Arg170Gly» и «Tyr167Ala + Arg170Ala».
Способ получения выделенного варианта полипептида химозина Как обсуждено выше, как известно в данной области техники, специалист в данной области техники на основании его общих знаний может рутинно получать и очищать химозин и варианты химозина.
Иными словами, как только специалист в данной области техники имеет релевантный для настоящего документа родительский полипептид, обладающий интересующей активностью химозина (например, из крупного рогатого скота, верблюдов, овец, свиней или крыс), получение варианта такого интересующего родительского полипептида является рутинной работой для этого специалиста.
Пример подходящего способа получения и выделения химозина (варианта или родительского) может быть хорошо известен, например технология, основанная на рекомбинантной экспрессии/продуцировании в грибах, как описано в WO 02/36752 A2 (Chr. Hansen).
Рутинной работой для специалиста в данной области техники также является выполнение изменения в одном или более положений в родительском полипептиде, обладающем активностью химозина, где изменение включает замену, делецию или инсерцию по меньшей мере в одном аминокислотном положении.
Как известно специалистам в данной области техники, это может быть сделано, например, с помощью так называемого сайт-направленного мутагенеза и технологии, основанной на рекомбинантной экспрессии/продуцировании.
Рутинной работой для специалиста в данной области техники также является определение, обладает ли релевантный для настоящего документа родительский полипептид (например, верблюжий или бычий химозин дикого типа) и/или его релевантный для настоящего документа вариант активностью химозина или нет.
Как известно в данной области техники, активность химозина можно определить с помощью так называемого отношения С/Р, которое определяют путем деления удельной свертывающей активности (С) на протеолитическую активность (Р).
Как известно в данной области техники, повышенное отношение С/Р в целом подразумевает, что потеря белка в процессе, например, производства сыра, за счет неспецифической деградации белка уменьшается, т.е. улучшается выход сыра, и что уменьшается образование горького вкуса в сыре в процессе созревания.
В рабочем примере 4 настоящего документа описан подходящий способ определения удельной свертывающей активности (С), а в рабочем примере 5 настоящего документа описан подходящий способ определения протеолитической активности (Р).
Предпочтительно выделенный вариант полипептида химозина, как описано в настоящем документе, представляет собой вариант, обладающий активностью химозина, обеспечивающей повышенное отношение С/Р по сравнению с отношением С/Р бычьего химозина, содержащего зрелый полипептид с SEQ ID NO: 1 согласно настоящему документу.
Предпочтительно выделенный вариант полипептида химозина, как описано в настоящем документе, представляет собой вариант, обладающий активностью химозина, обеспечивающей повышенное отношение С/Р по сравнению с отношением С/Р верблюжьего химозина, содержащего зрелый полипептид с SEQ ID NO: 2 согласно настоящему документу.
Более предпочтительно, выделенный вариант полипептида химозина, как описано в настоящем документе, представляет собой вариант, обладающий
- активностью химозина, обеспечивающей повышенное отношение С/Р по сравнению с отношением С/Р бычьего химозина, содержащего зрелый полипептид с SEQ ID NO: 1 согласно настоящему документу; и
- активностью химозина, обеспечивающей повышенное отношение С/Р по сравнению с отношением С/Р верблюжьего химозина, содержащего зрелый полипептид с SEQ ID NO: 2 согласно настоящему документу.
Как обсуждено выше, в качестве эталонной последовательности для определения аминокислотного положения релевантного для настоящего документа интересующего полипептида химозина (например, верблюда, овцы, крупного рогатого скота и т.д.) в настоящем документе используют публично известную последовательность бычьего химозина, раскрытую как SEQ ID NO: 1 в настоящем документе.
Как обсуждено выше, на основании, например, компьютерных программ выравнивания последовательностей, обсуждаемых выше, определение аминокислотного положения релевантного для настоящего документа интересующего полипептида химозина (например, верблюда, овцы, крупного рогатого скота и т.д.) представляет рутинную работу для специалиста в данной области техники.
Термин «родительский полипептид имеет по меньшей мере 65%-ную идентичность последовательности со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин)», например, способа по первому аспекту настоящего документа, можно рассматривать как относящийся к ограничению родительского полипептида химозина последовательностью, используемой для получения его варианта, релевантного для настоящего документа.
Иными словами, зрелый родительский полипептид химозин (например, овцы или свиньи), обладающий по меньшей мере 65%-ной идентичностью последовательности со зрелым бычьим химозином, считают достаточно структурно идентичным, например, бычьему или верблюжьему химозину для релевантности в настоящем документе, то есть в настоящем контексте считают, что зрелый родительский полипептид химозин (например, из овцы или крысы), обладающий по меньшей мере 65%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин), можно рассматривать в настоящем документе как достаточно структурно родственный, например, бычьему или верблюжьему химозину, чтобы усовершенствовать его путем получения варианта в любом из аминокислотных положений, как описано в настоящем документе.
Верблюжий полипептид химозин с SEQ ID NO: 2 обладает 84% идентичностью последовательности с бычьим полипептидом SEQ ID NO: 1 (т.е. полноразмерной SEQ ID NO: 1 от положения 1 до 381, который включает пре- и про-последовательность).
Как понятно специалисту в данной области техники, в настоящем контексте релевантный в настоящем документе родительский полипептид, обладающий активностью химозина, может уже представлять собой, например, вариант, например, соответствующего химозина дикого типа.
Например, вариант верблюжьего химозина, например, с 5-10 изменениями (например, заменами) по сравнению с верблюжьим полипептидом химозином с SEQ ID NO: 2 будет все еще представлять собой родительский полипептид, который обладает по меньшей мере 65%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 1 (бычий) согласно требованиям, например, первого аспекта настоящего документа.
Иными словами, релевантный в настоящем документе выделенный вариант полипептида химозина может содержать изменения (например, замены) в положении, отличающемся от положений, например, по первому аспекту настоящего документа.
В отношении последовательностей химозина, показанных на фиг. 1, последовательность овцы обладает 94,5%-ной идентичностью последовательности с бычьей последовательностью с SEQ ID NO: 1; C._bactrianus обладает 83,2%-ной идентичностью последовательности с бычьей последовательностью с SEQ ID NO: 1; последовательность свиньи обладает 80,3%-ной идентичностью последовательности с бычьей последовательностью с SEQ ID NO: 1, и последовательность крысы обладает 71,9%-ной идентичностью с бычьей последовательностью с SEQ ID NO: 1.
Как понятно специалисту в данной области техники в настоящем контексте, релевантные в настоящем документе проценты идентичности последовательности, например зрелого химозина овцы, C._bactrianus, верблюда, свиньи или крысы зрелому полипептиду с SEQ ID NO: 1 (бычий химозин - т.е. аминокислотные положения 59-381 SEQ ID NO: 1), относительно подобны упомянутым выше процентам идентичности последовательности.
Предпочтительные варианты
Как обсуждено выше, например, первый аспект относится к выделенному варианту полипептида химозина, где изменение включает замену, делецию или инсерцию по меньшей мере в одном аминокислотном положении, соответствующем любому из положений 70; 75; 77; 79; 90; 102; 103; 108; 114; 117; 120; 124; 134; 154; 156; 163; 212; 223; 224; 238; 246; 256; 261; K279V; L280; F281; R300D,E,S,T,N,Q,C,U,G,P,A,V,I,L,M,F,Y,W; G309; R312D,E,S,T,N,Q,C,U,G,P,A,V,I,L,M,F,Y,W; 320; 324; D325Q; 326; 331; 336; 346; 361; 367 и 379.
Предпочтительное воплощение изобретения относится к выделенному полипептидному варианту химозина, где изменение включает замену, делецию или инсерцию по меньшей мере в одном аминокислотном положении, соответствующем любому из положений, например, по первому аспекту настоящего документа.
Может быть предпочтительным, чтобы по меньшей мере одно изменение представляло собой замену - например релевантное в настоящем документе предпочтительное воплощение изобретения относится к выделенному варианту полипептида химозина, где изменение содержит замену по меньшей мере в одном аминокислотном положении, соответствующем любому из положений, например, по первому аспекту настоящего документа.
Предпочтительно выделенный вариант полипептида химозина, где изменение включает замену по меньшей мере в одном аминокислотном положении, соответствующем любому из положений L70M; F75Y; K77Т; Y79S; V90L; D102N; I103V; K120Q; F124Y; H134Q; I154L; D156V; L163E; S212A; S222G; М223Е; L224V; L238I; Q246E; V256I; V261A; K279V; L280I; F281A; R300D,E,S,T,N,Q; R312D,E,S,T,N,Q; Е320Т; R324V; D325Q; Y326F; K336D,E,S,T,N,Q,C,U,G,P,A,V,I,L,M,F,Y,W; S331Y; Q346E; I361L; V367I; или K379P.
Предпочтительно замена представляет собой замену Q246E; K279V; R300Q; R312S; Y326F или K336D,E,S,T,N,Q, где предпочтительная замена К336 представляет собой замену K336Q.
В настоящем контексте специалисту в данной области техники понятно, что, если родительский полипептид химозин уже имеет, например, «V» в положении 156, то не имеет смысла говорить о получении замены 156V для данного конкретного родительского полипептида химозина. Как видно на Фиг. 1 настоящего документа, химозин крысы дикого типа имеет «V» в положении 156, и замену 156V можно рассматривать как не релевантную в настоящем документе для конкретной полипептидной последовательности химозина крысы, представленной на Фиг. 1.
В настоящем контексте специалисту в данной области техники понятно, что если родительский полипептид химозин не имеет, например, «D» в положении 156, то не имеет смысла говорить о получении замены D156V для данного конкретного родительского полипептида химозина. Как видно на Фиг. 1 настоящего документа, химозин крысы дикого типа имеет «V» в положении 156, и замену D156V можно, таким образом, рассматривать как не релевантную в настоящем документе для конкретной полипептидной последовательности химозина крысы, представленной на Фиг. 1.
В предпочтительном воплощении изобретения замена представляет собой замену:


В более предпочтительном воплощении изобретения замена представляет собой замену:

Предпочтительный родительский полипептид, обладающий активностью химозина
Предпочтительно родительский полипептид обладает по меньшей мере 70%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин), более предпочтительно родительский полипептид обладает по меньшей мере 75%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин).
Только в качестве примера - релевантный в настоящем документе подходящий родительский полипептид может представлять собой, например, бычий химозин А - как известно в данной области техники, бычий химозин А может обладать только одним аминокислотным отличием от бычьего химозина В с SEQ ID NO: 1 согласно настоящему документу.
Как обсуждено выше, в рабочих примерах настоящего документа были получены варианты с использованием полипептида SEQ ID NO: 1 (бычий) в качестве родительского полипептида, и такой вариант в настоящем документе может быть назван вариантами бычьего химозина.
Соответственно, в предпочтительном воплощении настоящего изобретения родительский полипептид обладает по меньшей мере 90%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин), более предпочтительно родительский полипептид обладает по меньшей мере 95%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин), и даже более предпочтительно родительский полипептид обладает по меньшей мере 97%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин). Может быть предпочтительным, чтобы родительский полипептид представлял собой зрелый полипептид с SEQ ID NO: 1 (бычий химозин).
Как понятно специалисту в данной области техники, в настоящем контексте релевантный в настоящем документе родительский полипептид, обладающий активностью химозина, может уже представлять собой, например, вариант, например, соответствующего химозина дикого типа.
Например, вариант бычьего химозина, например, с 5-10 изменениями (например, заменами) по сравнению со зрелым бычьим полипептидом химозином дикого типа с SEQ ID NO: 1 будет все еще представлять собой родительский полипептид, который обладает по меньшей мере 95%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин).
Зрелый полипептид с SEQ ID NO: 1 (бычий) имеет длину 323 аминокислоты, соответственно, вариант бычьего химозина, например, с 25 аминокислотными заменами по сравнению со зрелым бычьим полипептидом химозином дикого типа с SEQ ID NO: 1 не будет представлять собой родительский полипептид, обладающий по меньшей мере 95%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин).
Иными словами и в целом, релевантный в настоящем документе выделенный вариант полипептида химозина может содержать изменения (например, замены) в положениях, отличающихся от положений, например, по первому аспекту настоящего документа.
Как обсуждено выше, в рабочих примерах настоящего документа были получены варианты с использованием полипептида с SEQ ID NO: 2 (верблюжий) в качестве родительского полипептида, и такой вариант может быть назван в настоящем документе вариантом верблюжьего химозина.
Соответственно, в предпочтительном воплощении настоящего изобретения родительский полипептид обладает по меньшей мере 90%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 2 (верблюжий химозин), более предпочтительно родительский полипептид обладает по меньшей мере 95%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 2 (верблюжий химозин), и еще более предпочтительно родительский полипептид обладает по меньшей мере 97%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 2 (верблюжий химозин). Может быть предпочтительным, чтобы родительский полипептид представлял собой зрелый полипептид с SEQ ID NO: 2 (верблюжий химозин).
Как понятно специалисту в данной области техники, в настоящем контексте родительский полипептид, обладающий по меньшей мере 90%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 2 (верблюжий), все еще находится в пределах SEQ ID NO: 1 (бычий) на основании требования к идентичности последовательности пункта (2) по первому аспекту настоящего документа, т.е. он будет представлять собой родительский полипептид, обладающий по меньшей мере 65%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин).
Выделенный вариант бычьего химозина
Как обсуждено выше, в рабочих примерах настоящего документа были получены варианты с использованием полипептида с SEQ ID NO: 1 (бычий) в качестве родительского полипептида, и такой вариант в настоящем документе может быть назван вариантами бычьего химозина.
Как обсуждено выше, третий аспект соответственно относится к выделенному варианту полипептида химозина, содержащему:
(а): изменение в одном или более положений в родительском полипептиде, обладающем активностью химозина, где изменение включает замену, делецию или инсерцию по меньшей мере в одном аминокислотном положении, соответствующем любому из положений 70; 75; 77; 79; 90; 102; 103; 108; 114; 117; 120; 124; 134; 154; 156; 163; 212; 222; 223; 224; 238; 246; 256; 261; K279V; L280; F281; R300D,E,S,T,N,Q,C,U,G,P,A,V,I,L,M,F,Y,W; G309; R312D,E,S,T,N,Q,C,U,G,P,A,V,I,L,M,F,Y,W; 320; 324; D325Q; 326; 331; 336; 346; 361; 367 и 379; и
(б): где вариант обладает активностью химозина;
и где:
(1): аминокислотное положение родительского полипептида определяют путем выравнивания родительского полипептида с полипептидом с SEQ ID NO: 1 (бычий химозин), т.е. полипептид с SEQ ID NO: 1 используют для определения соответствующей аминокислотной последовательности в родительском полипептиде; и
(2): родительский полипептид обладает по меньшей мере 90%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин), который находится от аминокислотного положения 59 до аминокислотного положения 381 SEQ ID NO: 1; и
(3): выделенный полипептидный вариант обладает менее чем 100%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин);
и при условии, что выделенный вариант полипептида химозина НЕ представляет собой конкретный вариант, выбранный из группы, состоящей из:

Описанные выше определения и предпочтительные воплощения также релевантны для данного аспекта.
Предпочтительно выделенный вариант бычьего полипептида химозина, как описано в настоящем документе, представляет собой вариант, обладающий активностью химозина, обеспечивающей повышенное отношение С/Р по сравнению с отношением С/Р бычьего химозина, содержащего зрелый полипептид с SEQ ID NO: 1.
В предпочтительном воплощении изобретения родительский полипептид обладает по меньшей мере 92%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин), более предпочтительно родительский полипептид обладает по меньшей мере 95%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин), и даже более предпочтительно родительский полипептид обладает по меньшей мере 97%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин). Может быть предпочтительным, чтобы родительский полипептид представлял собой зрелый полипептид с SEQ ID NO: 1 (бычий химозин).
Как понятно специалисту в данной области техники в настоящем контексте, вариант выделенного химозина может содержать изменения (например, замены) в положениях аминокислот, отличных от приведенных выше.
Например, вариант бычьего химозина, например, с 5-10 изменениями (например, заменами) по сравнению с бычьим полипептидом химозином с SEQ ID NO: 1 будет все еще представлять собой родительский полипептид, который обладает по меньшей мере 95%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин).
Может быть предпочтительным, чтобы выделенный вариант бычьего химозина содержал менее 30 изменений аминокислот (например, замен) по сравнению со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин), или может быть предпочтительным, чтобы выделенный вариант бычьего химозина содержал менее 20 изменений аминокислот (например, замен) по сравнению со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин), или может быть предпочтительным, чтобы выделенный вариант бычьего химозина содержал менее 10 изменений аминокислот (например, замен) по сравнению со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин), или может быть предпочтительным, чтобы выделенный вариант бычьего химозина содержал менее 5 изменений аминокислот (например, замен) по сравнению со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин).
Как понятно специалисту в данной области техники, в настоящем контексте термин «выделенный вариантный полипептид обладает менее чем 100%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин)» по пункту (3) выше относится к тому, что описанный в настоящем документе выделенный вариант бычьего химозина, конечно, не должен иметь полипептидную последовательность, на 100% идентичную публично известной последовательности бычьего химозина дикого типа SEQ ID NO: 1.
Предпочтительное воплощение изобретения относится к выделенному варианту бычьего полипептида химозина, где изменение включает замену, делецию или инсерцию по меньшей мере в одном аминокислотном положении, соответствующем любому из положений по третьему аспекту.
Может быть предпочтительным, чтобы по меньшей мере одно изменение представляло собой замену, т.е. релевантное в настоящем документе предпочтительное воплощение изобретения относится к выделенному варианту полипептида химозина, где изменение включает замену в по меньшей мере одном аминокислотном положении, соответствующем любому из положений по третьему аспекту.
Предпочтительно замена представляет собой L70M; F75Y; K77Т; Y79S; V90L; D102N; I103V; N108D; D117N; F114Y; K120Q; F124Y; H134Q; I154L; D156V; L163E; S212A; М223Е; L224V; L238I; Q246E; V256I; V261A; K279V; L280I; F281A; R300D,E,S,T,N,Q; R312D,E,S,T,N,Q; Е320Т; R324V; D325Q; Y326F; K336D,E,S,T,N,Q,C,U,G,P,A,V,I,L,M,F,Y,W; S331Y; Q346E; I361L; V367I; или K379P.
Предпочтительно замена представляет собой Q246E; K279V; R300Q; R312S; Y326F или K336D,E,S,T,N,Q, где предпочтительная замена К336 представляет собой замену K336Q.
В предпочтительном воплощении изобретения замена представляет собой:



В более предпочтительном воплощении изобретения замена представляет собой замену:

Выделенный вариант верблюжьего химозина
Как обсуждено выше, в рабочих примерах настоящего документа были получены варианты с использованием полипептида SEQ ID NO: 2 (верблюжий химозин) в качестве родительского полипептида - такой вариант в настоящем документе может быть назван вариантом верблюжьего химозина.
Как обсуждено выше, четвертый аспект соответственно относится к выделенному варианту полипептида химозина, содержащему:
(а): изменение в одном или более положений в родительском полипептиде, обладающем активностью химозина, где изменение включает замену, делецию или инсерцию по меньшей мере в одном аминокислотном положении, соответствующем любому из положений 70; 75; 77; 79; 90; 102; 103; 108; 114; 117; 120; 124; 134; 154; 156; 163; 212; 223; 224; 238; 246; 256; 261; K279V; L280; F281; R300D,E,S,T,N,Q,C,U,G,P,A,V,I,L,M,F,Y,W; G309; R312D,E,S,T,N,Q,C,U,G,P,A,V,I,L,M,F,Y,W; 320; 324; D325Q; 326; 331; 336; 346; 361; 367 и 379; и
(б): где вариант обладает активностью химозина;
и где:
(1): аминокислотное положение родительского полипептида определяют путем выравнивания родительского полипептида с полипептидом с SEQ ID NO: 1 (бычий химозин), т.е. полипептид с SEQ ID NO: 1 используют для определения соответствующей аминокислотной последовательности в родительском полипептиде; и
(2): родительский полипептид обладает по меньшей мере 90%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 2 (верблюжий химозин), который находится от аминокислотного положения 59 до аминокислотного положения 381 SEQ ID NO: 2; и
(3): выделенный вариантный полипептид обладает менее чем 100%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 2 (верблюжий химозин);
и при условии, что выделенный вариант полипептида химозина НЕ представляет собой конкретный вариант, выбранный из группы, состоящей из:

Описанные выше определения и предпочтительные воплощения также релевантны для данного аспекта.
Предпочтительно выделенный вариант верблюжьего полипептида химозина, как описано в настоящем документе, представляет собой вариант, обладающий активностью химозина, обеспечивающей повышенное отношение С/Р по сравнению с отношением С/Р верблюжьего химозина по сравнению со зрелым полипептидом с SEQ ID NO: 2.
В предпочтительном воплощении изобретения родительский полипептид обладает по меньшей мере 92%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 2 (верблюжий химозин), более предпочтительно родительский полипептид обладает по меньшей мере 95%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 2 (верблюжий химозин), и еще более предпочтительно родительский полипептид обладает по меньшей мере 97%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 2 (верблюжий химозин). Может быть предпочтительным, чтобы родительский полипептид представлял собой зрелый полипептид с SEQ ID NO: 2 (верблюжий химозин).
Как понятно специалисту в данной области техники в настоящем контексте, выделенный вариант химозина может содержать изменения (например, замены) в положениях аминокислот, отличных от приведенных выше.
Например, вариант верблюжьего химозина, например, с 5-10 изменениями (например, заменами) по сравнению с верблюжьим полипептидом химозином с SEQ ID NO: 2 будет все еще представлять собой родительский полипептид, который обладает по меньшей мере 95%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 2 (верблюжий химозин).
Может быть предпочтительным, чтобы выделенный вариант верблюжьего химозина содержал менее 30 изменений аминокислот (например, замен) по сравнению со зрелым полипептидом с SEQ ID NO: 2 (верблюжий химозин), или может быть предпочтительным, чтобы выделенный вариант верблюжьего химозина содержал менее 20 изменений аминокислот (например, замен) по сравнению со зрелым полипептидом с SEQ ID NO: 2 (верблюжий химозин), или может быть предпочтительным, чтобы выделенный вариант верблюжьего химозина содержал менее 10 изменений аминокислот (например, замен) по сравнению со зрелым полипептидом с SEQ ID NO: 2 (верблюжий химозин), или может быть предпочтительным, чтобы выделенный вариант верблюжьего химозина содержал менее 5 изменений аминокислот (например, замен) по сравнению со зрелым полипептидом с SEQ ID NO: 2 (верблюжий химозин).
Как понятно специалисту в данной области техники, в настоящем контексте термин «выделенный вариантный полипептид обладает менее чем 100%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 2 (верблюжий химозин)» по пункту (3) выше относится к тому, что описанный в настоящем документе выделенный вариант верблюжьего химозина, конечно, не должен иметь полипептидную последовательность, на 100% идентичную публично известной последовательности верблюжьего химозина дикого типа SEQ ID NO: 2.
Предпочтительное воплощение изобретения относится к выделенному варианту верблюжьего полипептида химозина, где изменение включает замену, делецию или инсерцию по меньшей мере в одном аминокислотном положении, соответствующем любому из положений по третьему аспекту.
Может быть предпочтительным, чтобы по меньшей мере одно изменение представляло собой замену, т.е. релевантное в настоящем документе предпочтительное воплощение изобретения относится к выделенному варианту полипептида химозина, где изменение включает замену по меньшей мере одного аминокислотного положения, соответствующего любому из положений по четвертому аспекту.
Предпочтительно замена представляет собой L70M; F75Y; K77Т; Y79S; V90L; D102N; I103V; K120Q; F124Y; I154L; L163E; S212A; М223Е; L224V; L238I; Q246E; V256I; V261A; K279V; R300D,E,S,T,N,Q; R312D,E,S,T,N,Q; Е320Т; R324V; Y326F; K336D,E,S,T,N,Q,C,U,G,P,A,V,I,L,M,F,Y,W; S331Y; Q346E; I361L; V367I; или K379P.
Предпочтительно замена представляет собой Q246E; K279V; R300Q; R312S; Y326F или K336D,E,S,T,N,Q, где предпочтительная замена К336 представляет собой замену K336Q.
В предпочтительном воплощении изобретения замена представляет собой:



В более предпочтительном воплощении изобретения замена представляет собой замену:

Способ получения продукта на основе молока
Как обсуждено выше, выделенный вариант полипептида химозина, как описано в настоящем документе, можно применять в соответствии с данной областью техники, например для изготовления интересующего продукта на основе молока (такого как, например, сырный продукт).
Как обсуждено выше, аспект изобретения относится к способу изготовления пищевого или кормового продукта, включающему добавление эффективного количества выделенного варианта полипептида химозина, как описано в настоящем документе, к пищевому(ым) или кормовому(ым) ингредиенту(ам) и осуществление дальнейших этапов производства с получением пищевого или кормового продукта.
Предпочтительно пищевой или кормовой продукт представляет собой продукт на основе молока, и при этом способ включает добавление эффективного количества выделенного варианта полипептида химозина, как описано в настоящем документе, к молоку и осуществление дальнейших этапов производства с получением продукта на основе молока.
Молоко может представлять собой, например, соевое молоко, овечье молоко, козье молоко, молоко буйволиц, молоко яков, молоко лам, верблюжье молоко или коровье молоко.
Продукт на основе молока может представлять собой, например, кисломолочный продукт, творог или сыр.
Аспекты/воплощения настоящего изобретения, представленные в формате формулы изобретения
Описанные в настоящем документе аспекты и предпочтительные воплощения изобретения могут быть представлены/описаны в так называемом формате формулы изобретения, см. ниже.
1. Способ получения выделенного варианта полипептида химозина, включающий стадии:
(а): получение изменения в одном или более положений в родительском полипептиде, обладающем активностью химозина, где изменение включает замену, делецию или инсерцию по меньшей мере в одном аминокислотном положении, соответствующем любому из положений 70; 75; 77; 79; 90; 102; 103; 108; 114; 117; 120; 124; 134; 154; 156; 163; 212; 222; 223; 224; 238; 246; 256; 261; K279V; L280; F281; R300D,E,S,T,N,Q,C,U,G,P,A,V,I,L,M,F,Y,W; G309; R312D,E,S,T,N,Q,C,U,G,P,A,V,I,L,M,F,Y,W; 320; 324; D325Q; 326; 331; 336; 346; 361; 367 и 379; и
(б): продуцирование и выделение измененного полипептида стадии (а) и, таким образом, получение выделенного варианта полипептида химозина, где вариант обладает активностью химозина;
и где:
(1): аминокислотное положение родительского полипептида определяют путем выравнивания родительского полипептида с полипептидом с SEQ ID NO: 1 (бычий химозин), т.е. полипептид с SEQ ID NO: 1 используют для определения соответствующей аминокислотной последовательности в родительском полипептиде; и
(2): родительский полипептид обладает по меньшей мере 65%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин), который находится от аминокислотного положения 59 до аминокислотного положения 381 SEQ ID NO: 1;
и при условии, что выделенный вариант полипептида химозина НЕ представляет собой конкретный вариант, выбранный из группы, состоящей из:

2. Способ получения выделенного варианта полипептида химозина по п. 1, где выделенный вариант полипептида химозина обладает:
- активностью химозина, обеспечивающей повышенное отношение С/Р по сравнению с отношением С/Р бычьего химозина, содержащего зрелый полипептид с SEQ ID NO: 1; и
- активностью химозина, обеспечивающей повышенное отношение С/Р по сравнению с отношением С/Р верблюжьего химозина, содержащего зрелый полипептид с SEQ ID NO: 2.
3. Способ получения выделенного варианта полипептида химозина по любому из п.п. 1-2, где изменение включает замену, делецию или инсерцию по меньшей мере в одном аминокислотном положении, соответствующем любому из положений по п. 1.
4. Способ получения выделенного варианта полипептида химозина по любому из п.п. 1-3, где изменение включает замену по меньшей мере в одном аминокислотном положении, соответствующем любому из положений по п. 1.
5. Способ получения выделенного варианта полипептида химозина по п. 4, где замена представляет собой L70M; F75Y; K77Т; Y79S; V90L; D102N; I103V; N108D; D117N; F114Y; K120Q; F124Y; H134Q; I154L; D156V; L163E; S212A; S222G; М223Е; L224V; L238I; Q246E; V256I; V261A; K279V; L280I; F281A; R300D,E,S,T,N,Q; R312D,E,S,T,N,Q; Е320Т; R324V; D325Q; Y326F; K336D,E,D,T,N,Q,C,U,G,P,A,V,I,L,M,F,Y,W; S331Y; Q346E; I361L; V367I; или K379P.
6. Способ получения выделенного варианта полипептида химозина по п. 5, где замена представляет собой Q246E; K279V; R300Q; R312S; Y326F или K336D,E,S,T,N,Q.
7. Способ получения выделенного варианта полипептида химозина по п. 6, где замена представляет собой K336Q.
8. Способ получения выделенного варианта полипептида химозина по п. 4, где замена представляет собой:



9. Способ получения выделенного варианта полипептида химозина по п. 4, где замена представляет собой:

10. Способ получения выделенного варианта полипептида химозина по любому из п.п. 1-9, где родительский полипептид обладает по меньшей мере 75%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин).
11. Способ получения выделенного варианта полипептида химозина по п. 10, где родительский полипептид обладает по меньшей мере 95%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин).
12. Способ получения выделенного варианта полипептида химозина по любому из п.п. 1-9, где родительский полипептид обладает по меньшей мере 95%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 2 (верблюжий химозин), который находится от аминокислотного положения 59 до аминокислотного положения 381 SEQ ID NO: 2.
13. Выделенный вариант полипептида химозина, полученный способом по любому из п.п. 1-12.
14. Выделенный вариант полипептида химозина, содержащий:
(а): изменение в одном или более положений в родительском полипептиде, обладающем активностью химозина, где изменение включает замену, делецию или инсерцию по меньшей мере в одном аминокислотном положении, соответствующем любому из положений 70; 75; 77; 79; 90; 102; 103; 108; 114; 117; 120; 124; 134; 154; 156; 163; 212; 222; 223; 224; 238; 246; 256; 261; K279V; L280; F281; R300D,E,S,T,N,Q,C,U,G,P,A,V,I,L,M,F,Y,W; G309; R312D,E,S,T,N,Q,C,U,G,P,A,V,I,L,M,F,Y,W; 320; 324; D325Q; 326; 331; 336; 346; 361; 367 и 379; и
(б): где вариант обладает активностью химозина;
и где:
(1): положение аминокислоты родительского полипептида определяют путем выравниванием родительского полипептида с полипептидом с SEQ ID NO: 1 (бычий химозин), т.е. полипептид с SEQ ID NO: 1 используют для определения соответствующей аминокислотной последовательности в родительском полипептиде; и
(2): родительский полипептид обладает по меньшей мере 90%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин), который находится от аминокислотного положения 59 до аминокислотного положения 381 SEQ ID NO: 1; и
(3): выделенный вариантный полипептид обладает менее чем 100%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин);
и при условии, что выделенный вариант полипептида химозина НЕ представляет собой конкретный вариант, выбранный из группы, состоящей из:

15. Выделенный вариант полипептида химозина по п. 14, обладающий активностью химозина, обеспечивающей повышенное отношение С/Р по сравнению с отношением С/Р бычьего химозина, содержащего зрелый полипептид с SEQ ID NO: 1.
16. Выделенный вариант полипептида химозина по любому из п.п. 14-15, где родительский полипептид обладает по меньшей мере 97%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин).
17. Выделенный вариант полипептида химозина по любому из п.п. 14-16, где выделенный вариант бычьего химозина содержит менее 10 изменений аминокислот (например, замен) по сравнению со зрелым полипептидом с SEQ ID NO: 1 (бычий химозин).
18. Выделенный вариант полипептида химозина по любому из п.п. 14-17, где изменение включает замену, делецию или инсерцию по меньшей мере в одном аминокислотном положении, соответствующем любому из положений по п. 14.
19. Выделенный вариант полипептида химозина по любому из п.п. 16-18, где изменение включает замену по меньшей мере в одном аминокислотном положении, соответствующем любому из положений по п. 14.
20. Выделенный вариант полипептида химозина по п. 19, где замена представляет собой L70M; F75Y; K77Т; Y79S; V90L; D102N; I103V; N108D; D117N; F114Y; K120Q; F124Y; H134Q; I154L; D156V; L163E; S212A; S222G; М223Е; L224V; L238I; Q246E; V256I; V261A; K279V; L280I; F281A; R300D,E,S,T,N,Q; G309D,W; R312D,E,S,T,N,Q; Е320Т; R324V; D325Q; Y326F; K336D,E,S,T,N,Q,C,U,G,P,A,V,I,L,M,F,Y,W; S331Y; Q346E; I361L; V367I; или K379P.
21. Выделенный вариант полипептида химозина по п. 20, где замена представляет собой Q246E; K279V; R300Q; R312S; Y326F или K336D,E,S,T,N,Q.
22. Выделенный вариант полипептида химозина по п. 21, где замена представляет собой K336Q.
23. Выделенный вариант полипептида химозина по п. 19, где замена представляет собой:
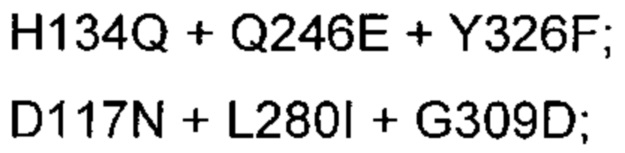


24. Выделенный вариант полипептида химозина по п. 19, где замена представляет собой:

25. Выделенный вариант полипептида химозина, содержащий:
(а): изменение в одном или более положений в родительском полипептиде, обладающем активностью химозина, где изменение включает замену, делецию или инсерцию по меньшей мере в одном аминокислотном положении, соответствующем любому из положений 70; 75; 77; 79; 90; 102; 103; 108; 114; 117; 120; 124; 134; 154; 156; 163; 212; 222; 223; 224; 238; 246; 256; 261; K279V; L280; F281; R300D,E,S,T,N,Q,C,U,G,P,A,V,I,L,M,F,Y,W; G309; R312D,E,S,T,N,Q,C,U,G,P,A,V,I,L,M,F,Y,W; 320; 324; D325Q; 326; 331; 336; 346; 361; 367 и 379; и
(б): где вариант обладает активностью химозина;
и где:
(1): аминокислотное положение родительского полипептида определяют путем выравнивания родительского полипептида с полипептидом с SEQ ID NO: 1 (бычий химозин), т.е. полипептид с SEQ ID NO: 1 используют для определения соответствующей аминокислотной последовательности в родительском полипептиде; и
(2): родительский полипептид обладает по меньшей мере 90%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 2 (верблюжий химозин), который находится от аминокислотного положения 59 до аминокислотного положения 381 SEQ ID NO: 2; и
(3): выделенный вариантный полипептид обладает менее чем 100%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 2 (верблюжий химозин);
и при условии, что выделенный вариант полипептида химозина НЕ представляет собой конкретный вариант, выбранный из группы, состоящей из:

26. Выделенный вариант полипептида химозина по п. 25, где выделенный вариант обладает активностью химозина, обеспечивающей повышенное отношение С/Р по сравнению с отношением С/Р верблюжьего химозина, содержащего зрелый полипептид с SEQ ID NO: 2.
27. Выделенный вариант полипептида химозина по любому из п.п. 25-26, где родительский полипептид обладает по меньшей мере 97%-ной идентичностью последовательности со зрелым полипептидом с SEQ ID NO: 2 (верблюжий химозин).
28. Выделенный вариант полипептида химозина по любому из п.п. 25-26, где выделенный вариант верблюжьего химозина содержит менее 10 изменений аминокислот (например, замен) по сравнению со зрелым полипептидом с SEQ ID NO: 2 (верблюжий химозин).
29. Выделенный вариант полипептида химозина по любому из п.п. 25-28, где изменение включает замену, делецию или инсерцию по меньшей мере в одном аминокислотном положении, соответствующем любому из положений по п. 23.
30. Выделенный вариант полипептида химозина по любому из п.п. 25-29, где изменение включает замену в по меньшей мере одном аминокислотном положении, соответствующем любому из положений по п. 23.
31. Выделенный вариант полипептида химозина по п. 30, где замена представляет собой L70M; F75Y; K77Т; Y79S; V90L; D102N; I103V; N108D; D117N; F114Y; K120Q; F124Y; H134Q; I154L; D156V, L163E; S212A; S222G; М223Е; L224V; D325Q; L238I; Q246E; V256I; V261A; K279V; L280I; F281A; R300D,E,S,T,N,Q; G309D,W; R312D,E,S,T,N,Q; Е320Т; R324V; Y326F; K336D,E,S,T,N,Q,C,U,G,P,A,V,I,L,M,F,Y,W; S331Y; Q346E; I361L; V367I; или K379P.
32. Выделенный вариант полипептида химозина по п. 31, где замена представляет собой Q246E; K279V; R300Q; R312S; Y326F или K336D,E,S,T,N,Q.
33. Выделенный вариант полипептида химозина по п. 32, где замена представляет собой K336Q.
34. Выделенный вариант полипептида химозина по п. 30, где замена представляет собой:



35. Выделенный вариант полипептида химозина по п. 30, где замена представляет собой:

36: Способ изготовления пищевого или кормового продукта, включающий добавление эффективного количества выделенного варианта полипептида химозина по любому из п.п. 14-35 к пищевому(ым) или кормовому(ым) ингредиенту(ам) и осуществление дальнейших этапов производства с получением пищевого или кормового продукта.
37: Способ изготовления пищевого или кормового продукта по п. 35, где продукт представляет собой продукт на основе молока, и где способ включает добавление эффективного количества выделенного варианта полипептида химозина по любому из п.п. 14-36 к молоку и осуществление дальнейших этапов производства с получением продукта на основе молока.
38: Способ изготовления продукта на основе молока по п. 37, где молоко представляет собой соевое молоко, овечье молоко, козье молоко, молоко буйволиц, молоко яков, молоко лам, верблюжье молоко или коровье молоко.
39: Способ изготовления продукта на основе молока по любому из п.п. 36-38, где продукт на основе молока представляет собой кисломолочный продукт, творог или сыр.
ПРИМЕРЫ
ПРИМЕР 1: Выравнивание и нумерация белковых последовательностей химозина и вариантных последовательностей
Белковые последовательности химозина выравнивали, используя алгоритм ClustalW, предложенный EBI (EBI, вспомогательные программные средства, множественное выравнивание последовательностей, CLUSTALW", http://www.ebi.ac.uk/Tools/msa/clustalw2/) и описанный в документе Larkin MA, Blackshields G, Brown NP, Chenna R, McGettigan PA, McWilliam H, Valentin F, Wallace IM, Wilm A, Lopez R, Thompson JD, Gibson TJ, Higgins DG (2007). Bioinformatics 23 (21), 2947-2948.
Установки ClustalW2 для множественных выравниваний последовательностей представляли собой следующие: матрица сравнения аминокислот - BLOSUM, внесение пробела - 10, удлинение пробела - 0,05, промежутки между пробелами - 8, отсутствие концевых пробелов, итерация - нет, число итераций - 1, кластерирование - NJ.
В качестве эталонной последовательности использовали препрохимозин бычьего химозина В (номер доступа Genbank Р00794 - в настоящем документе описан как SEQ ID NO: 1), где N-концевой метионин имеет номер 1 (MRCL…), а С-концевой изолейцин (в последовательности белка …LAKAI) имеет номер 381. Варианты выравнивали по сравнению с бычьим препрохимозином В, и остатки нумеровали по соответствующему остатку бычьего химозина.
ПРИМЕР 2: Конструирование вариантов химозина
Варианты химозина конструировали, с использованием различных стратегий.
Когда приведена ссылка на верблюжий химозин, приведена ссылка верблюжий химозин, содержащий полипептид с SEQ ID NO: 2 в настоящем документе.
Верблюжий химозин с SEQ ID NO: 2 можно рассматривать как релевантный в настоящем документе родительский полипептид, обладающий активностью химозина, используемый для получения его вариантов верблюжьего химозина.
Когда приведена ссылка на бычий химозин, приведена ссылка бычий химозин, содержащий полипептид с SEQ ID NO: 1 в настоящем документе.
Бычий химозин с SEQ ID NO: 1 можно рассматривать как релевантный в настоящем документе родительский полипептид, обладающий активностью химозина, используемый для получения его вариантов бычьего химозина.
Варианты верблюжьего химозина конструировали на основании выравнивания большой серии публично известных последовательностей аспарагиновых протеаз, обладающих идентичностью 25% или более по сравнению с бычьим химозином В.
Изменения обычно вносили в гипервариабельные участки, при этом консервативные участки не изменяли. Множественные изменения вносили в каждую вариантную конструкцию, гарантируя, что каждая отдельная мутация присутствует во множестве вариантов конструкций (обсуждение результатов см. в примере 6 ниже).
Варианты бычьего химозина были сконструированы на основании сравнения бычьего и верблюжьего химозина. Остатки бычьей последовательности, например, изменяли на соответствующие остатки верблюжьей последовательности (обсуждение результатов см. в примере 7 ниже).
ПРИМЕР 3: Получение ферментного материала варианта химозина
Все варианты химозина синтезировали в виде синтетических генов и клонировали в экспрессионном векторе грибов, по существу соответствующем pGAMpR-C (описан в WO 02/36752 A2)
Векторами трансформировали Е. coli, и плазмидную ДНК очищали, используя стандартные протоколы молекулярной биологии, известные специалистам в данной области техники.
Вариантными плазмидами по отдельности трансформировали штамм Aspergillus niger или Aspergillus nidulans, и белок продуцировали, по существу как описано в WO 02/36752 A2, и очищали с использованием стандартных методик хроматографии.
Как известно в данной области техники, специалист может на основании его обычных общих знаний получать и очищать химозин и варианты химозина, такие как описанные в настоящем документе варианты бычьего и верблюжьего химозина.
ПРИМЕР 4: Определение удельной активности химозина
4.1 Определение свертывающей активности
Молокосвертывающую активность определяли с использованием способа REMCAT, который представляет собой стандартный способ, разработанный Международной федерацией по молочному животноводству (способ IDF).
Молокосвертывающую активность определяют на основании периода времени, необходимого для видимого образования хлопьев стандартного молочного субстрата, полученного из сухого молока низкотемпературного сгущения с низким содержанием жира с раствором хлорида кальция 0,5 г на литр (рН примерно 6,5). Время свертывания образца сычужного фермента сравнивают со временем свертывания эталонного стандарта, обладающего известной молокосвертывающей активностью и имеющего такую же ферментную композицию, с помощью стандарта IDF 110В в качестве образца. Измерения на образцах и эталонных стандартах проводили в идентичных химических и физических условиях. Образцы-варианты доводили до приблизительно 3 IMCU (Международная молокосвертывающая единица)/мл, используя буфер, представляющий собой 84 мМ уксусную кислоту рН 5,5. После этого 200 мкл фермента добавляли к 10 мл подогретого молока (32°С) в стеклянной пробирке, помещенной в водяную баню, способную поддерживать постоянную температуру 32°С ± 1°С при постоянном перемешивании.
Общую молокосвертывающую активность (эффективность) сычужного фермента вычисляли в Международных молокосвертывающих единицах (IMCU) на мл относительно стандарта, имеющего такой же ферментный состав, как в образце, в соответствии с формулой:

Sстандарт: Молокосвертывающая активность международного эталонного стандарта для сычужного фермента.
Тстандарт: Время свертывания в секундах, полученное для разведения стандарта.
Dобразец: Коэффициент разведения для образца
Dстандарт: Коэффициент разведения для стандарта
Тобразец: Время свертывания в секундах, полученное для разведенного образца сычужного фермента от добавления фермента до времени образования хлопьев.
Для определения свертывающей активности при оценке верблюжьего варианта в примере 9 вместо способа REMCAT используют способ μIMCU. По сравнению с REMCAT время образования хлопьев для вариантов химозина в μIMCU определяли с помощью измерений OD (оптическая плотность) в 96-луночных микротитрационных планшетах при 800 нм в считывающем устройстве для планшетов UV/VIS. Для каждого планшета строили стандартную кривую различных разведений эталонного стандарта с известной свертывающей эффективностью. Образцы получали путем разведения фермента в 84 мМ ацетатном буфере, 0,1% Тритон Х-100, рН 5,5. Реакцию при 32°С запускали добавлением 250 мкл стандартного молочного субстрата, содержащего 4% (масс/масс.) сухого молока низкотемпературного сгущения с низким содержанием жира и 7,5% (масс/масс.) хлорида кальция (рН примерно 6,5) к 25 мкл образца фермента. Молокосвертывающая активность вариантов химозина в Международных молокосвертывающих единицах (IMCU) на мл определяли на основании времени образования хлопьев образца относительно стандартной кривой.
4.2 Определение общего содержания белка
Общее содержание белка определяли с использованием набора Pierce ВСА Protein Assay Kit от компании Thermo Scientific, следуя инструкциям поставщиков.
4.3 Вычисление удельной свертывающей активности
Удельную свертывающую активность (IMCU/мг общего содержания белка) определяли путем деления свертывающей активности (IMCU/мл) на общее содержание белка (мг общего белка на мл).
ПРИМЕР 5: Определение протеолитической активности
Общую протеолитическую активность измеряли с использованием флуоресцентно меченного казеина Bodipy-FL в качестве субстрата (EnzChek; Molecular Bioprobes, Е6638). Производные казеина, интенсивно меченные нечувствительной к рН зеленой флуоресцентной меткой Bodipy-FL, приводят к почти полному гашению флуоресценции конъюгата. Катализируемый протеазой гидролиз приводит к высвобождению метки Bodipy-FL. Этот способ обладает высокой чувствительностью, что было существенно для данного эксперимента, поскольку CHYMAX М обладает самой низкой протеолитической активностью из всех коагулянтов, известных к настоящему времени.
Анализ проводили в 0,2 М фосфатном буфере, доведенном до желаемого рН при конечной концентрации субстрата 0,04 мг/мл. Перед смешиванием 1 части субстрата с 1 частью фермента и субстрат, и фермент готовили в фосфатном буфере, и все варианты фермента нормализовали до 50 IMCU/мл (в соответствии с примером 4). Субстрат и фермент смешивали в 96-луночных микротитрационных планшетах Nunc Fluoro, герметично закрывали и инкубировали при 32°С в течение 60 мин. После инкубации укупорку удаляли, и флуоресценцию регистрировали во флуориметре. Для вариантов, оцениваемых в примерах 9 и 10, 1 часть субстрата смешивали с 1 частью образцов ненормализованного фермента в 386-луночных микротитрационных планшетах Nunc Fluoro, и флуоресценцию непрерывно регистрировали во флуориметре при 32°С в течение 10 часов. Наклоны линейной части кривой увеличения флуоресценции использовали для определения общей протеолитической активности.
ПРИМЕР 6: Оценка вариантов верблюжьего химозина
Для всех вариантов удельную свертывающую активность (IMCU/мг общего белка) определяли при рН 6,5 согласно примеру 4, и протеолитическую активность определяли в соответствии с примером 5 при рН 6,5. Отношение С/Р определяли для всех вариантов при рН 6,5 путем деления удельной свертывающей активности (IMCU/мг) на протеолитическую активность.
В качестве эталона включали верблюжий ген дикого типа.
Варианты с множественными заменами
Можно заключить, что существуют четкие комбинационные эффекты при влиянии различных замен на соответствующие эффекты.
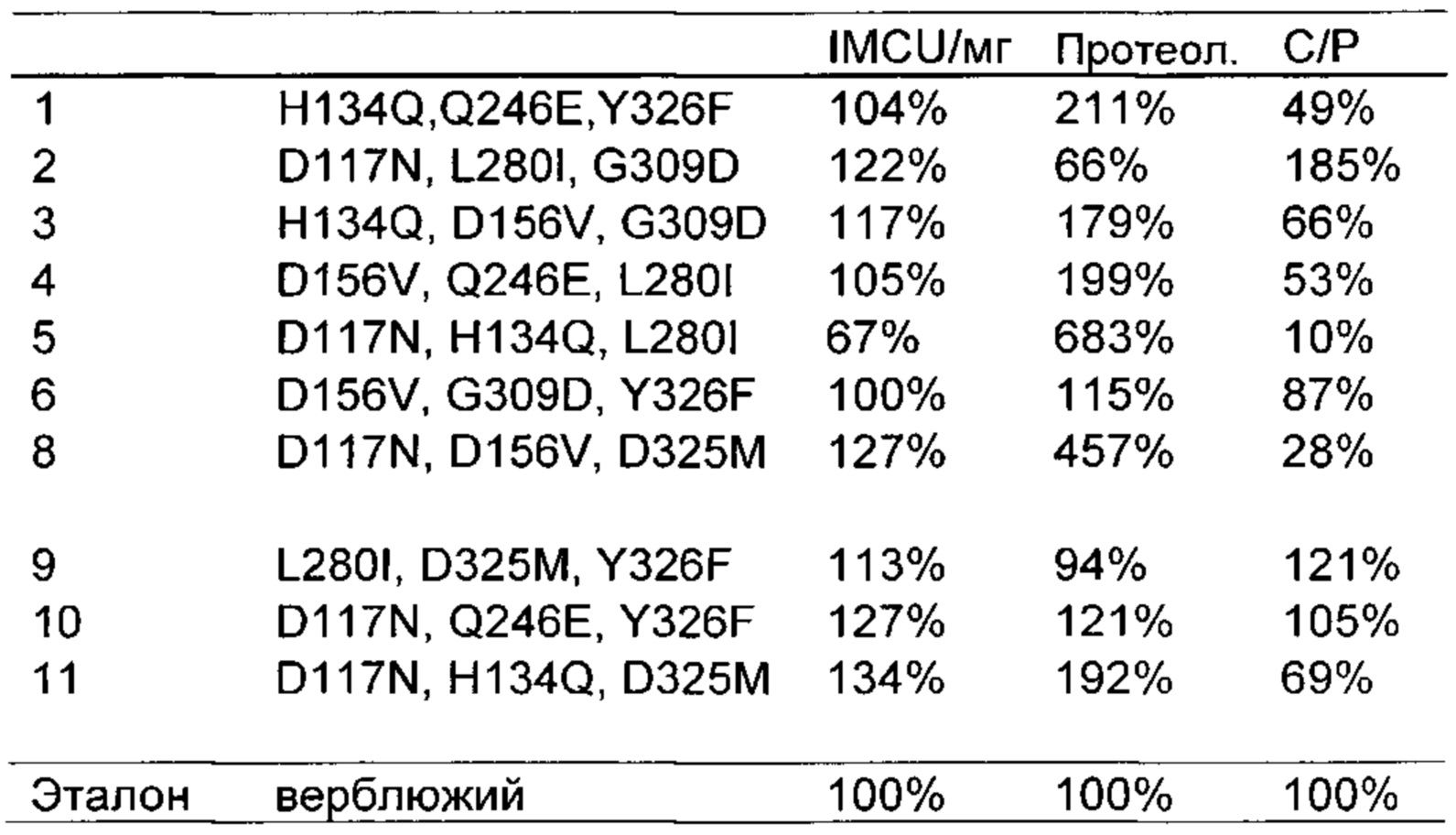
Можно заключить, что варианты 1, 2, 3, 4, 8, 9, 10 и 11 обладают повышенной удельной молокосвертывающей активностью, при этом варианты 2, 8, 10 и 11 обладают самым значительным улучшением.
Можно заключить, что варианты 2 и 9 обладают сниженной протеолитической активностью.
Можно заключить, что варианты 2, 9 и 10 обладают повышенным отношением С/Р.
На основании этих результатов вариант 2 представляет собой наиболее предпочтительный вариант, тогда как варианты 9 и 10 также обладают предпочтительными характеристиками.
Индивидуальные мутации
Поскольку все варианты включали множественные мутации, данные оцененных вариантов изучали более подробно с использованием статистических методов и анализа 3D структуры, чтобы определить индивидуальные аминокислотные замены, оказывающие положительное или отрицательное влияние.
Влияния изменений индивидуальных аминокислот можно обобщить, как описано ниже, но они в значительной степени зависят от других изменений аминокислот в различных вариантах. На этом основании предпочтительными мутациями являются D117N, Q246E, G 309D, Y326F и L280I.
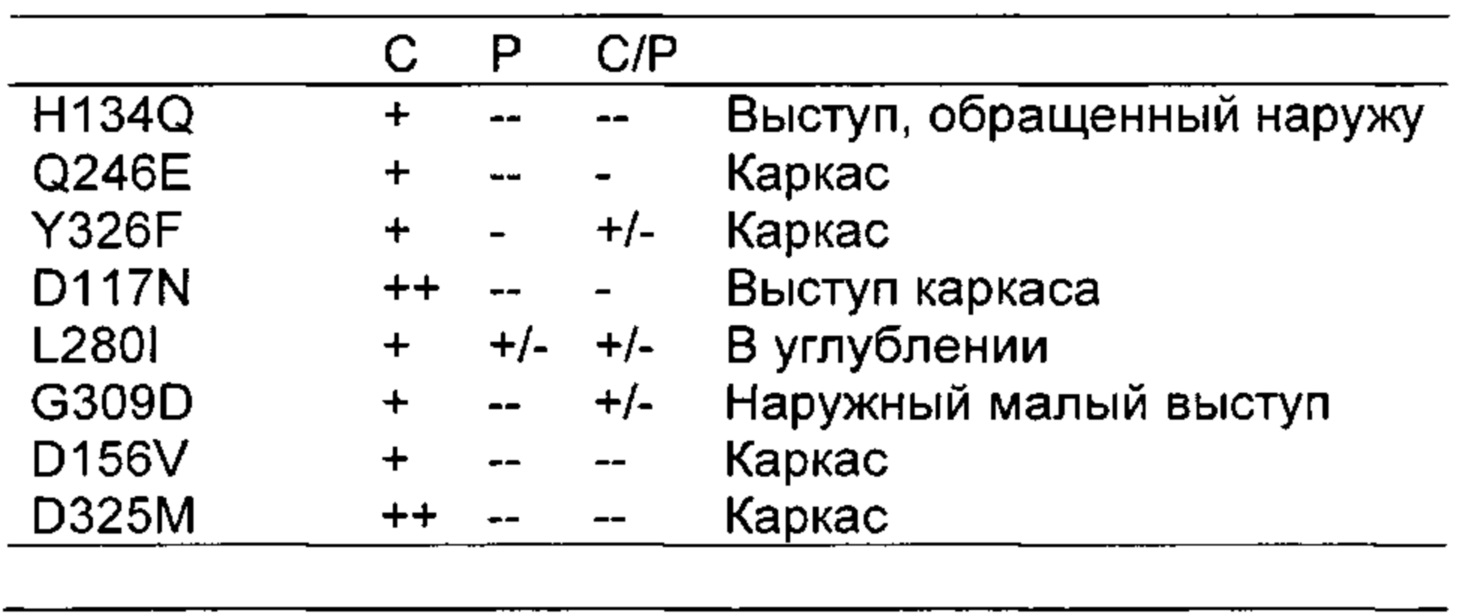
Обозначение «+» относится к положительному обмену аминокислот, т.е. «++» является более положительным, чем «+».
Обозначение «-» относится к отрицательному обмену аминокислот, т.е. «--» является более отрицательным, чем «-».
Термин «положительный» относится к положительному влиянию на свойства вариантов, относящихся к получению сыра, т.е. улучшенную свертывающую активность («С») и повышенное отношение С/Р рассматривают как положительное («+» или «++»), тогда как повышенную общую протеолитическую активность («Р») рассматривают как отрицательное свойство («-» или «--»). Обозначение «+/-» указывает на относительно нейтральное влияние.
Описания правой колонки таблицы относятся к тому, где индивидуальные мутации расположены в 3D структуре верблюжьего химозина. 3D структура верблюжьего химозина публично доступна.
Выводы:
Описанные выше результаты демонстрируют, что следующие индивидуальные мутации в верблюжьем химозине были предпочтительными (т.е. с улучшенным отношением С/Р по сравнению с верблюжьим химозином дикого типа): D117N, Q246E, G 309D, Y326F, L280I.
Приведенные выше результаты демонстрируют, что следующие множественные замены/мутации в верблюжьем химозине были предпочтительными (т.е. с улучшенным отношением С/Р по сравнению с верблюжьим химозином дикого типа):

ПРИМЕР 7: Оценка вариантов верблюжьего и бычьего химозина
Для всех вариантов удельную свертывающую активность (IMCU/мг общего белка) определяли при рН 6,5 в соответствии с примером 4, при этом общую или неспецифическую протеолитическую активность определяли, как описано в примере 5.
Отношение С/Р определяли для всех вариантов при рН 6,5 путем деления удельной свертывающей активности (IMCU/мг) на протеолитическую активность.
В качестве эталона включали верблюжий ген дикого типа.
Для лучшего сравнения все варианты были получены на фоне, который не имел активных центров N-гликозилирования, так называемые варианты Ugly. Эти варианты были получены путем замены N в двух потенциальных центрах N-гликозилирования на Q.
Дополнительные результаты см. на фиг. 3.
Описание вариантов
В варианте J2 K279 была заменена на V в бычьем негликозилированном химозине.
В варианте J32 флэп-участок из бычьего негликозилированного химозина был заменен флэп-участком из пепсина.
В варианте J72 отрицательный фрагмент из бычьего химозина использовали для замены соответствующих участков в верблюжьем химозине. В варианте J44 R300 в верблюжьем химозине была заменена Q, соответствующей аминокислотой в бычьем химозине. Эта мутация также находится в варианте J72.
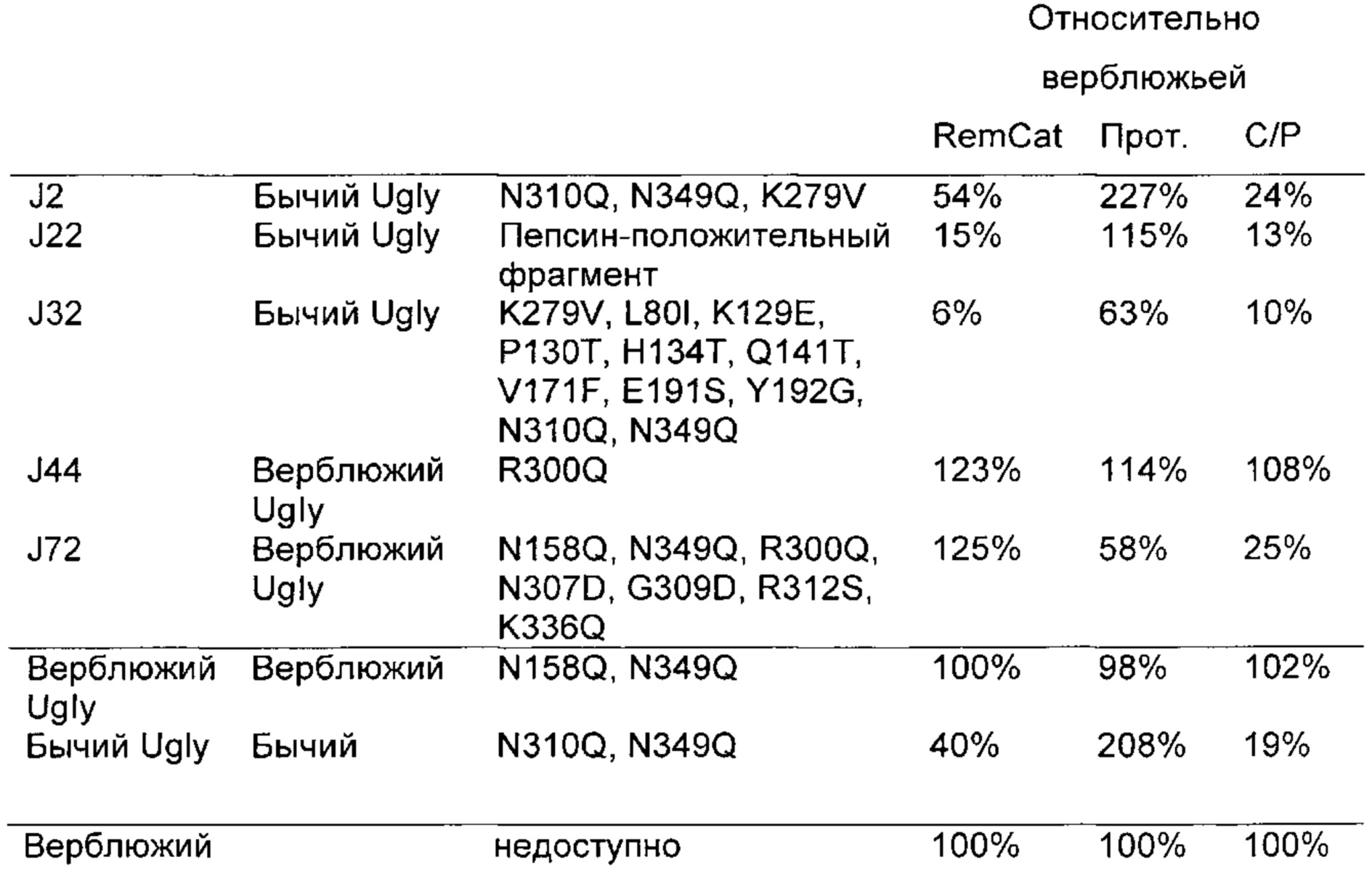
Выводы:
Мутация лизина в положении 279 бычьего химозина привела в результате к варианту, который проявлял сравнимую протеолитическую активность и повышенную удельную свертывающую активность по сравнению с бычьим химозином (вариант J2). Соответственно, можно заключить, что валин в положении 279 является предпочтительной аминокислотой.
Влияние гликозилирования верблюжьего химозина на свойства получения сыра пренебрежимо мало. Сравнение негликозилированного верблюжьего варианта с верблюжьим химозином дикого типа показывает отсутствие значительных изменений. Однако введение мотива отрицательного фрагмента из бычьего химозина в верблюжий химозин (вариант J72) оказывает положительное влияние на удельную свертывающую активность, при этом общая протеолитическая активность снижается приблизительно в 2 раза, что приводит в результате к удвоению отношения С/Р. Показано, что введение одиночной мутации R300Q из этого фрагмента (вариант J44) проявляет сходное положительное влияние на свертывающую активность, как показано для варианта J72. Заключили, что Q является предпочтительной аминокислотой в положении 300.
Ожидается, что участок негативного фрагмента в бычьем химозине оказывает важное влияние на расположение фермента снаружи от корректного сайта расщепления, что повышает специфичность фермента. Ожидается, что влияние, в основном, обусловлено зарядом, т.е. любое изменение, которое увеличивает отрицательный заряд в данном мотиве, приведет к повышенной специфичности.
Ниже показано выравнивание отрицательно заряженного участка бычьего и верблюжьего химозина. Указаны только заряженные остатки.
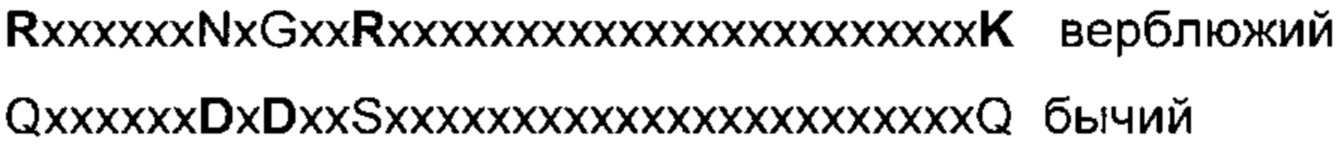
Что касается номеров положений и использования верблюжьего химозина в качестве эталона, нумерация начинается справа:
R300
N307
G309
R312
K336
ПРИМЕР 8: Оценка вариантов верблюжьего химозина
Анализировали ряд различных вариантов, каждый из которых имеет множественные замены по сравнению с верблюжьим химозином дикого типа.
Для всех вариантов удельную свертывающую активность (IMCU/мг общего белка) определяли при рН 6,5 в соответствии с примером 4, при этом неспецифическую протеолитическую активность определяли, как описано в примере 5, путем измерения протеолитической активности на 100 IMCU. В качестве эталона включали верблюжий ген дикого типа.
Анализ вариантов
Варианты, указанные в таблице, имеют аминокислотную последовательность, идентичную гену верблюжьего химозина (указанному как верблюжий wt), за исключением изменений, упомянутых для каждого варианта.
Свертывающая активность указана как IMCU на мг общего белка. Улучшенные свертывающие активности указаны одним или более символом «+». Протеолитическую активность выражают в условных единицах (AU) на 100 IMCU. Улучшенные варианты, т.е. варианты со сниженными протеолитическими активностями, указаны одним или более символов «+». Большее число символов «+» указывает на более значительное улучшение. В колонке «Общая активность» символы «+» указывают варианты, обладающие в целом улучшенными свойствами, т.е. низкой протеолитической активностью с высокой свертывающей активностью.
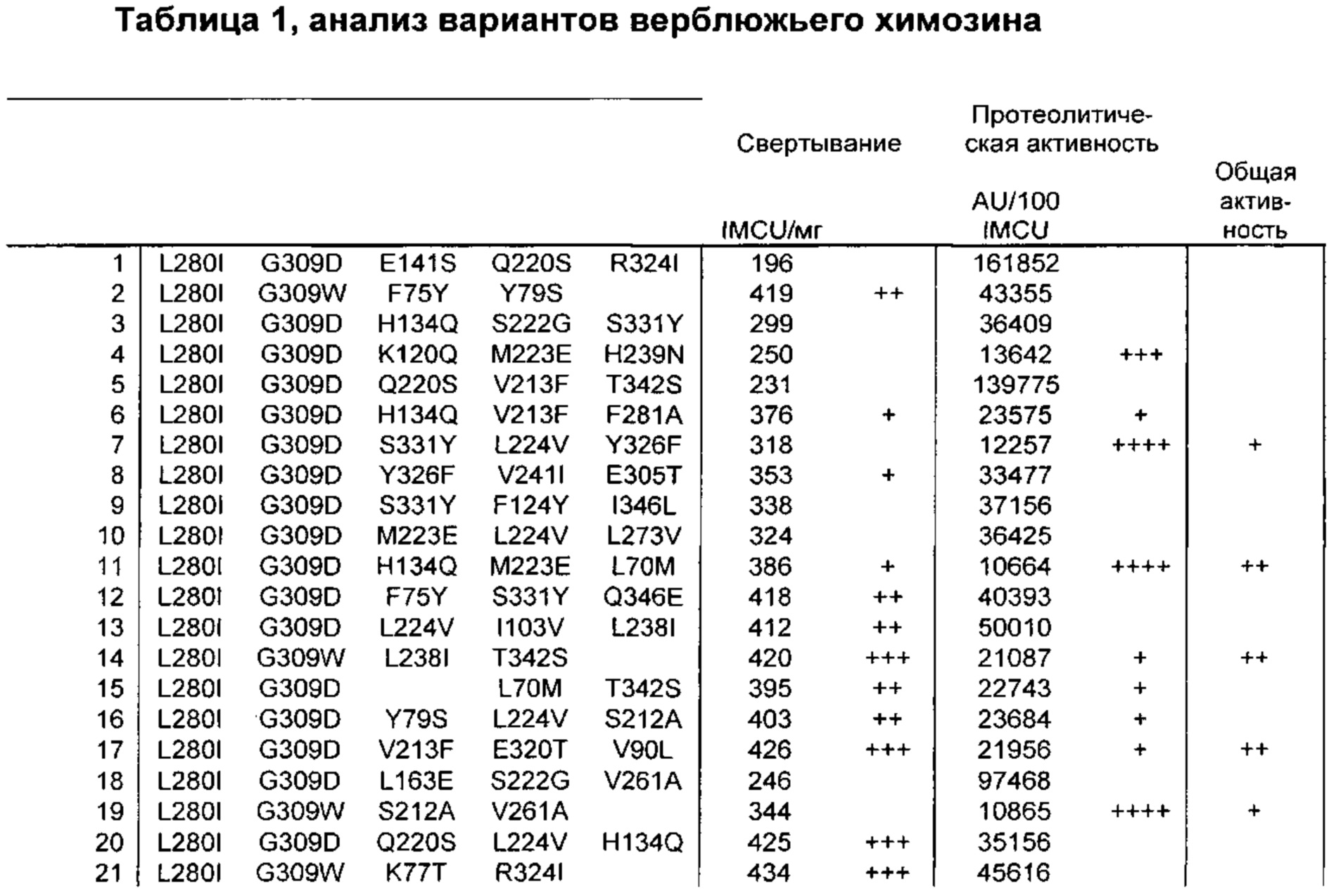
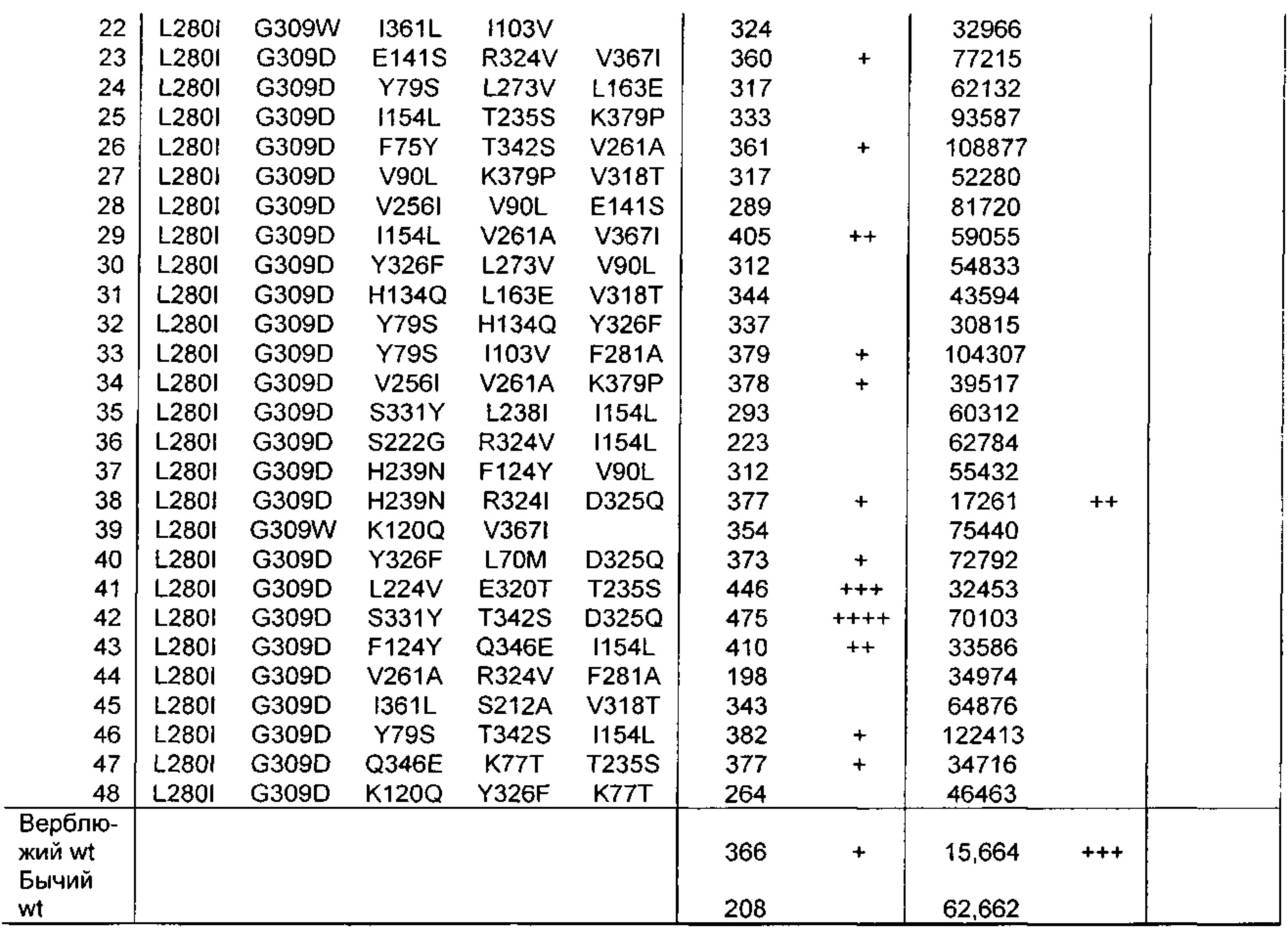
Высокая удельная свертывающая активность существенна для высококачественных молокосвертывающих ферментов. В общей сложности был идентифицирован 21 вариант с повышенной удельной свертывающей активностью относительно верблюжьего химозина и включен в таблицу 2 ниже.
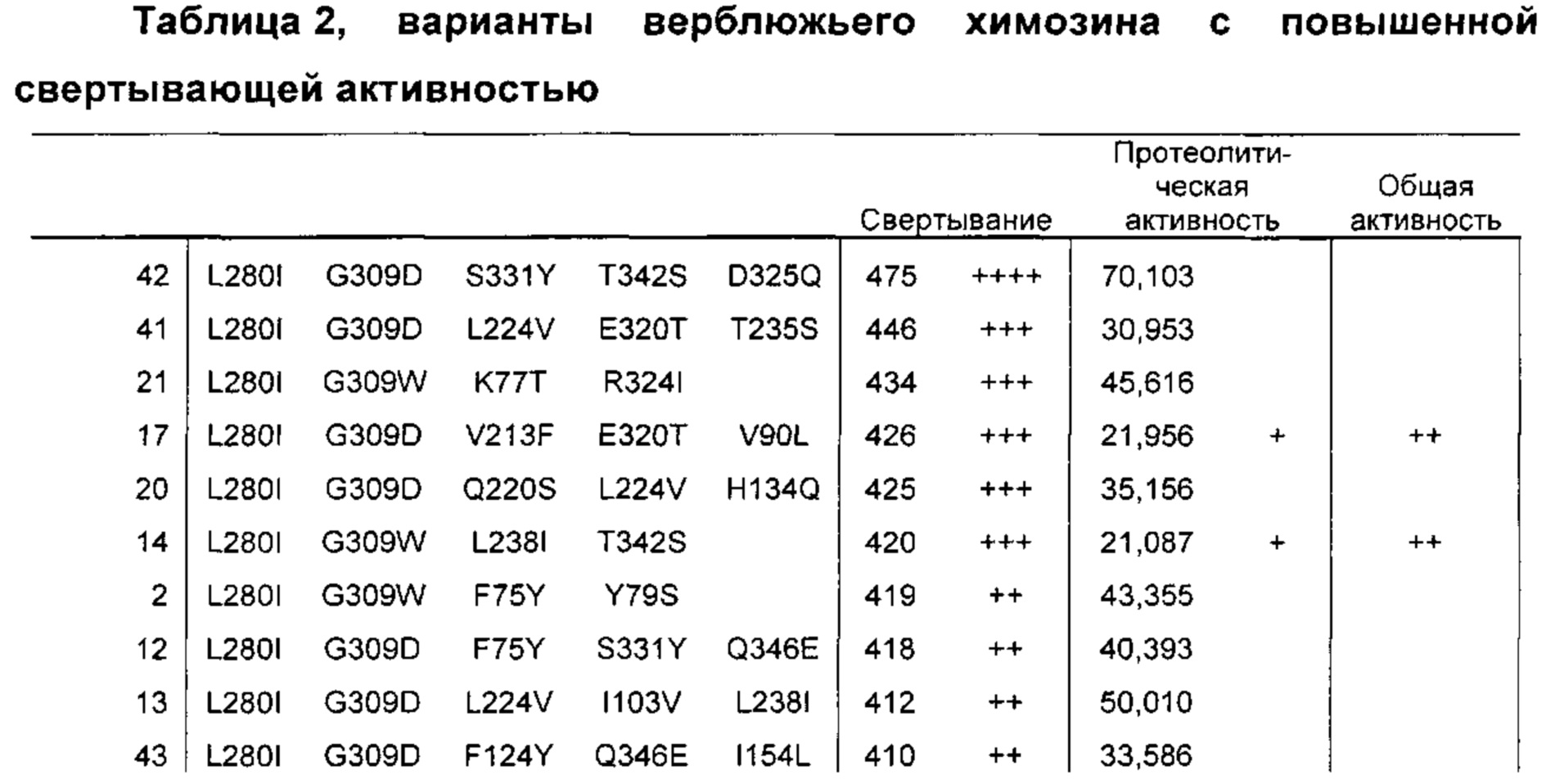
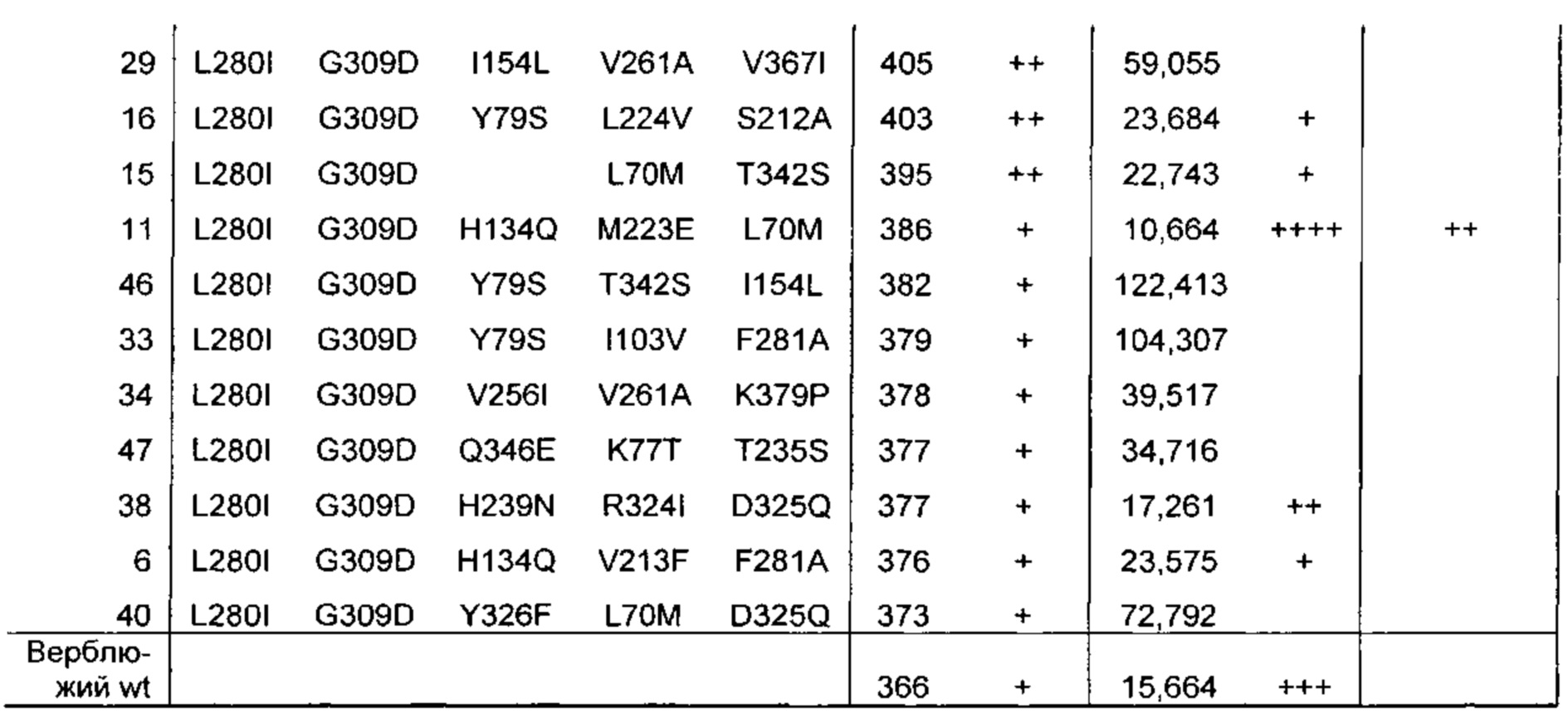
Сниженная протеолитическая активность является предпосылкой для высококачественных молокосвертывающих ферментов. В общей сложности было идентифицировано 10 вариантов со сниженной протеолитической активностью относительно верблюжьего химозина (см. таблицу 3 ниже).
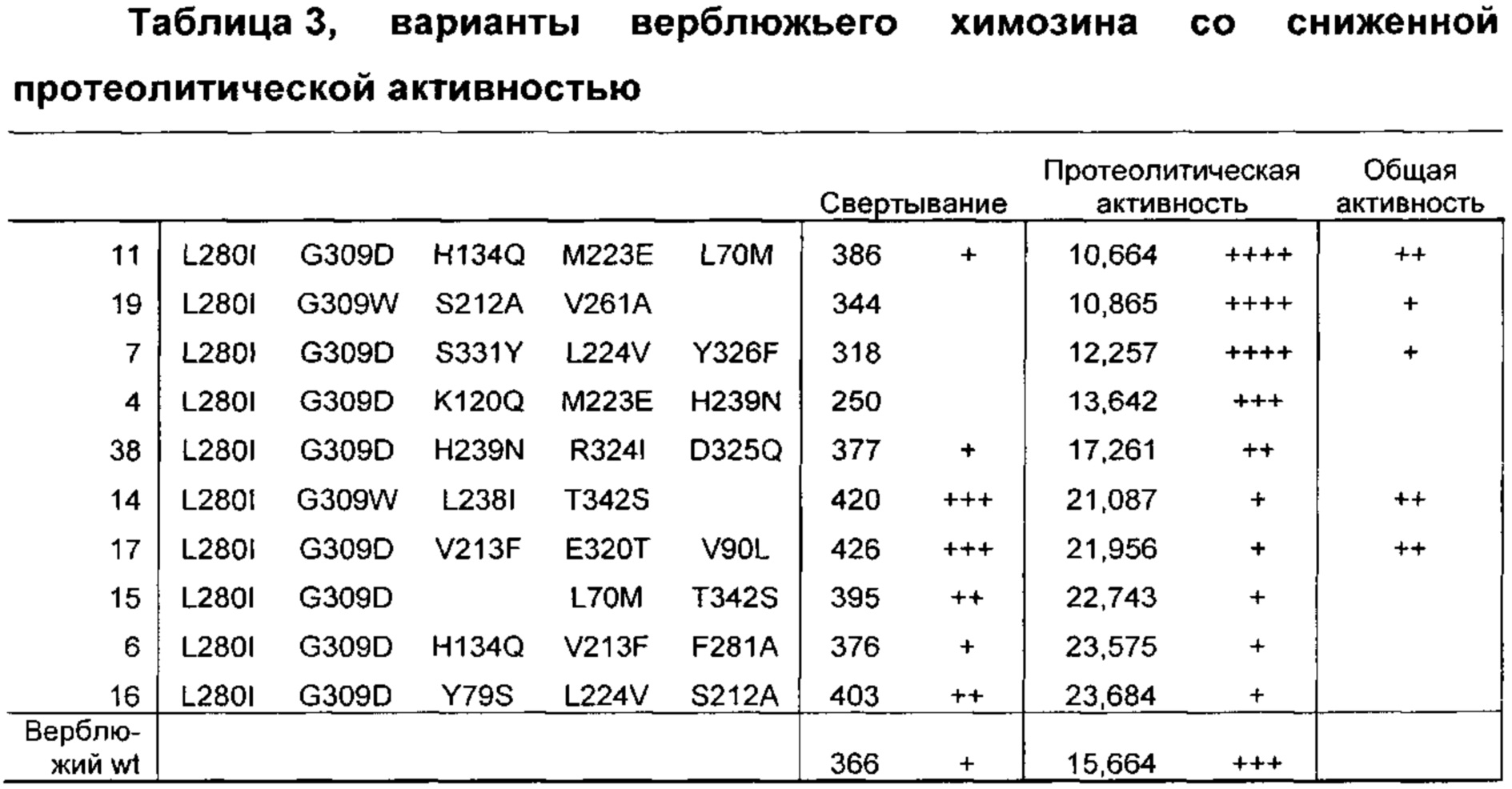
На основании общего анализа было идентифицировано пять вариантов, обладающих улучшенными свойствами как в отношении молокосвертывающей, так и в отношении протеолитической активности. Эти пять вариантов указаны в таблице 4 ниже.
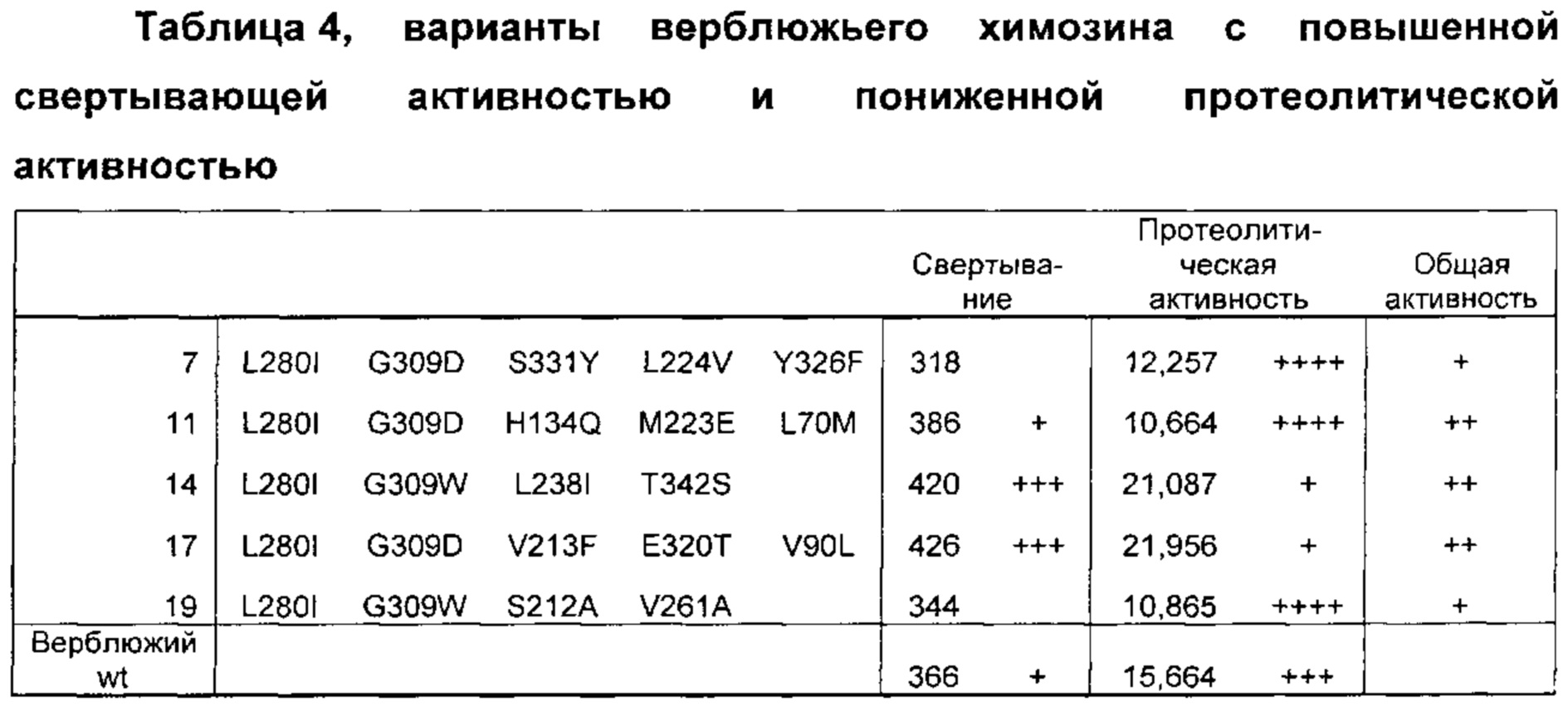
Статистический анализ эффектов индивидуальных мутаций Для идентификации одиночных мутаций с положительными эффектами либо на молокосвертывающую активность, либо на протеолитическую активность, либо оба типа активности использовали статистический анализ на основе метода главных компонент (РСА). В приведенной ниже таблице обобщены мутации, приводящие к повышенной свертывающей активности, к пониженной протеолитической активности или и к повышенной свертывающей, и к пониженной протеолитической активности. Диаграмма РСА представлена на Фиг. 4.
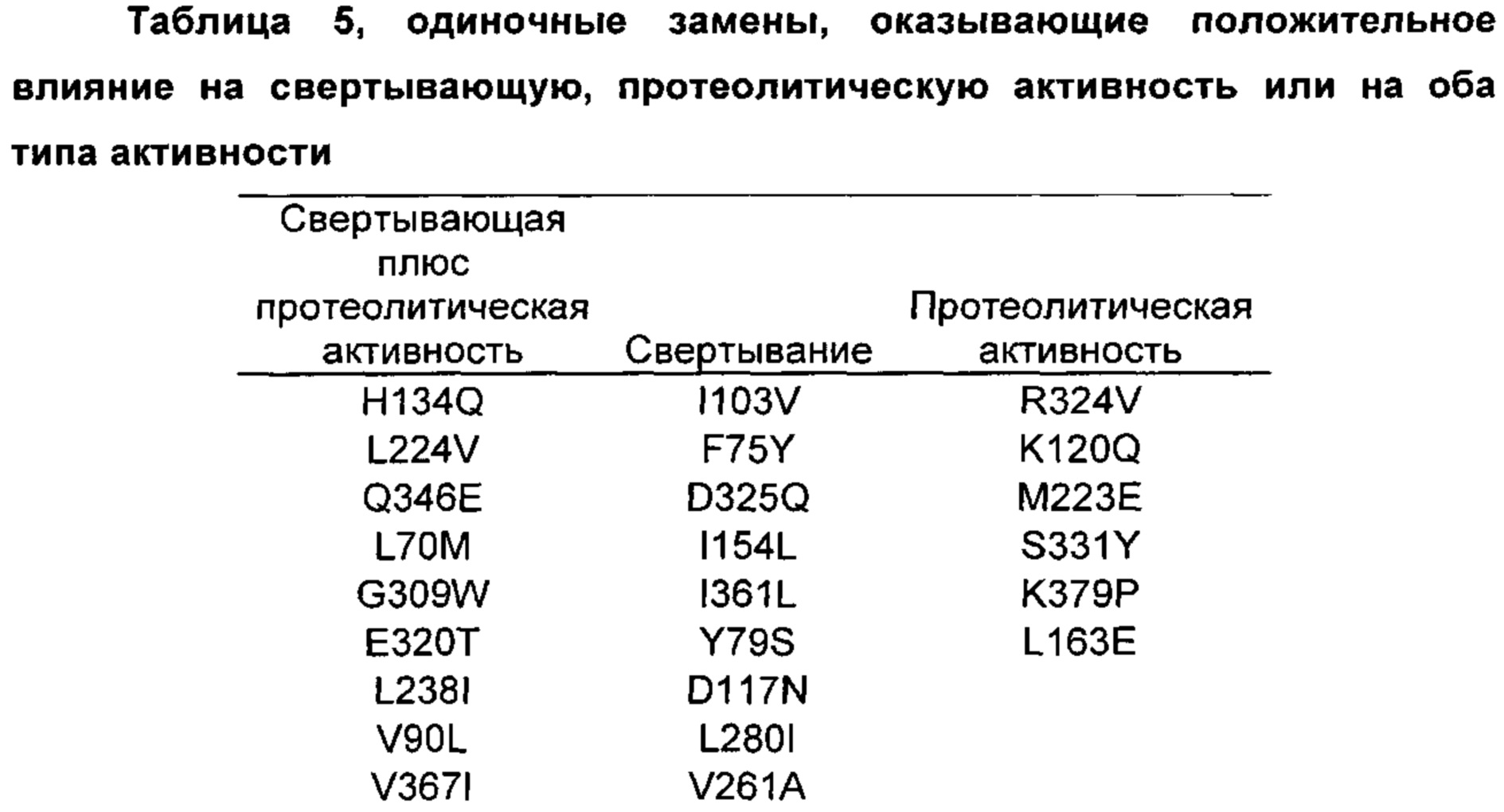
V256I
K77Т
S212A
F124Y
Эффекты положения
Ожидается, что большинство мутаций, которые оказали бы влияние на свертывающую активность или на общую протеолитическую активность (т.е. специфичность), должно располагаться в каталитическом углублении или вблизи него. Субстрат входит в каталитическое углубление, и именно в нем происходит расщепление.
Неожиданно лишь небольшое число замен, для которых было показано положительное влияние на свертывающую активность и/или специфичность, было расположено в этом участке (например, L280I, L70M и F75Y). Многие мутации, обладающие положительным влиянием, были обнаружены в других частях молекулы.
Замены, приводящие к улучшенной свертывающей активности Большинство замен, приводящих к улучшенной свертывающей активности, были расположены в теле фермента и, вероятно, вызвали конформационные изменения в молекуле. Замена F75Y расположена при входе в углубление и является достаточно малозаметной, приводя к повышенной полярности.
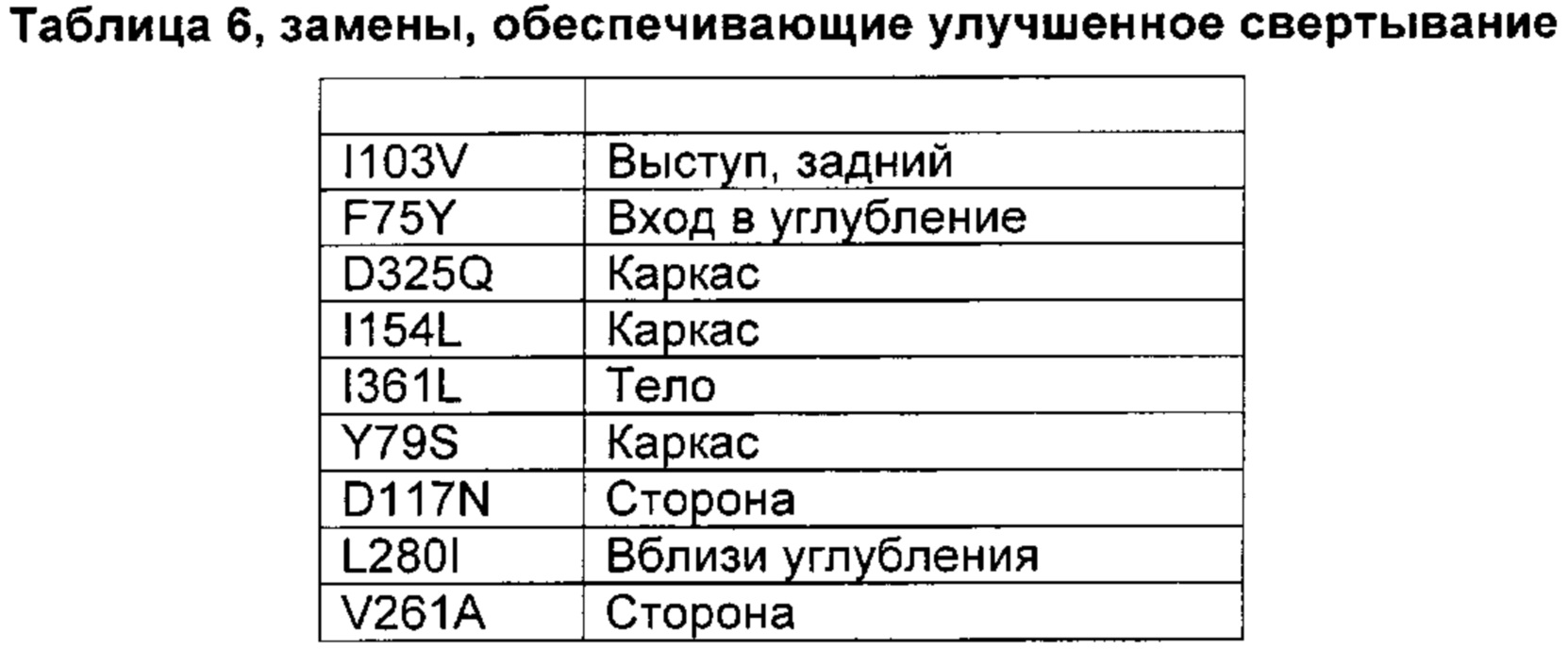
Замены, приводящие к сниженной протеолитической активности Большинство замен расположено в теле молекулы. Полученные в результате конформационные изменения могут привести к повышенной доступности для субстрата. Две мутации были обнаружены в выступах, которые отмечают вход в каталитическое углубление. Замена L163E увеличивает отрицательный заряд. Это усиливает результаты, полученные в примере 7, что показывает значимость изменения в данных положениях.
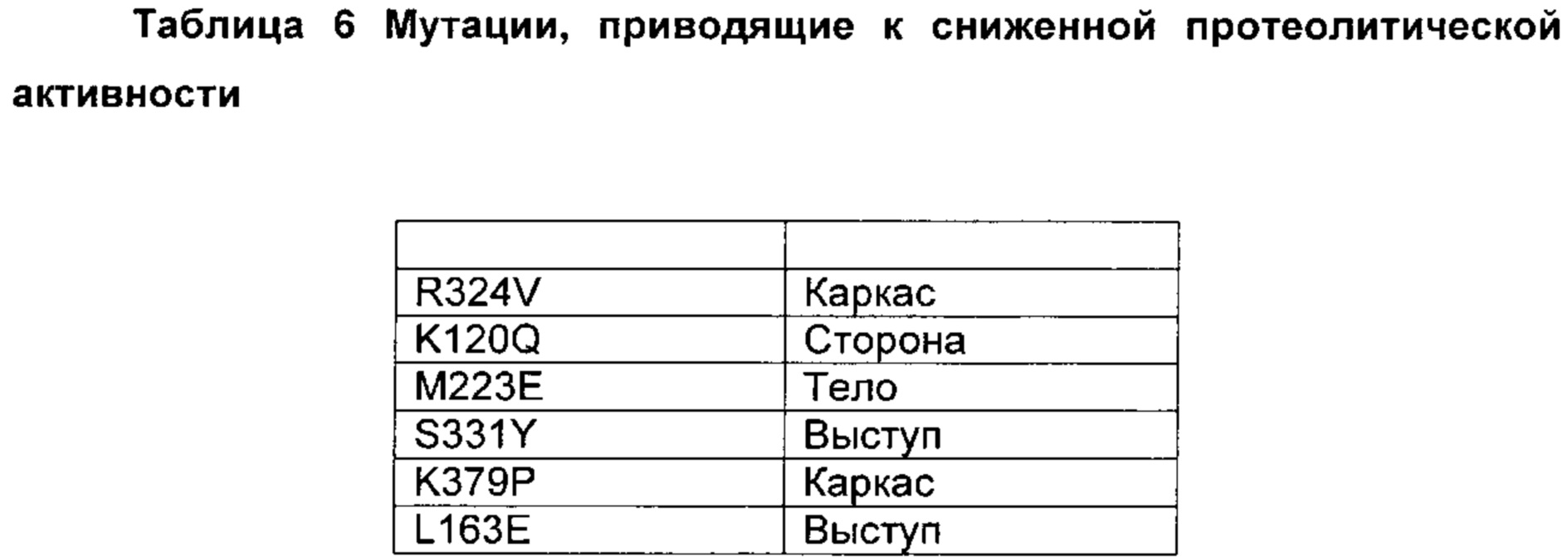
Замены, приводящие к улучшенной свертывающей и сниженной протеолитической активностью
Некоторые из замен, приводящие к общему улучшению молокосвертывающих способностей, приводят к изменениям заряда, которые, вероятно, вовлечены в распознавание субстрата. Эти замены включают H134Q, приводящую к большему положительному заряду, а также замену Q346E, приводящую к большему отрицательному заряду. Другие замены с положительными влияниями как на свертывание, так и на специфичность наиболее вероятно приводят к общее обширным конформационным изменениям молекулы химозина.
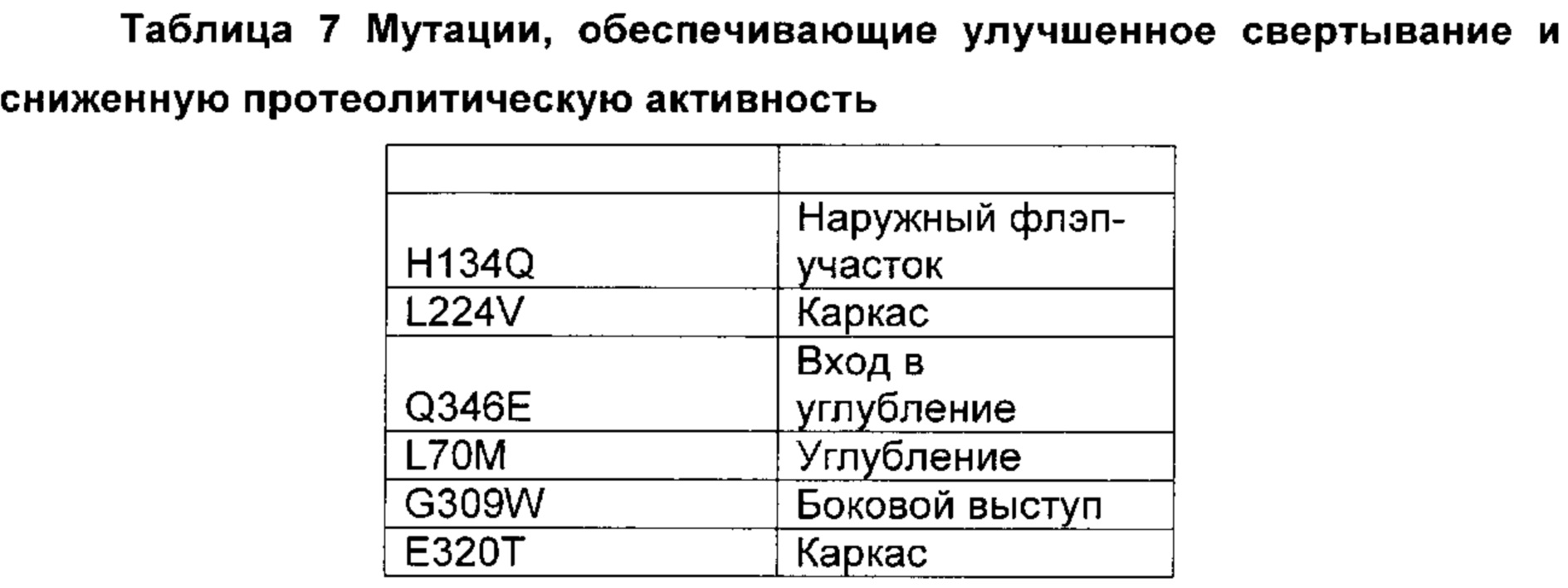
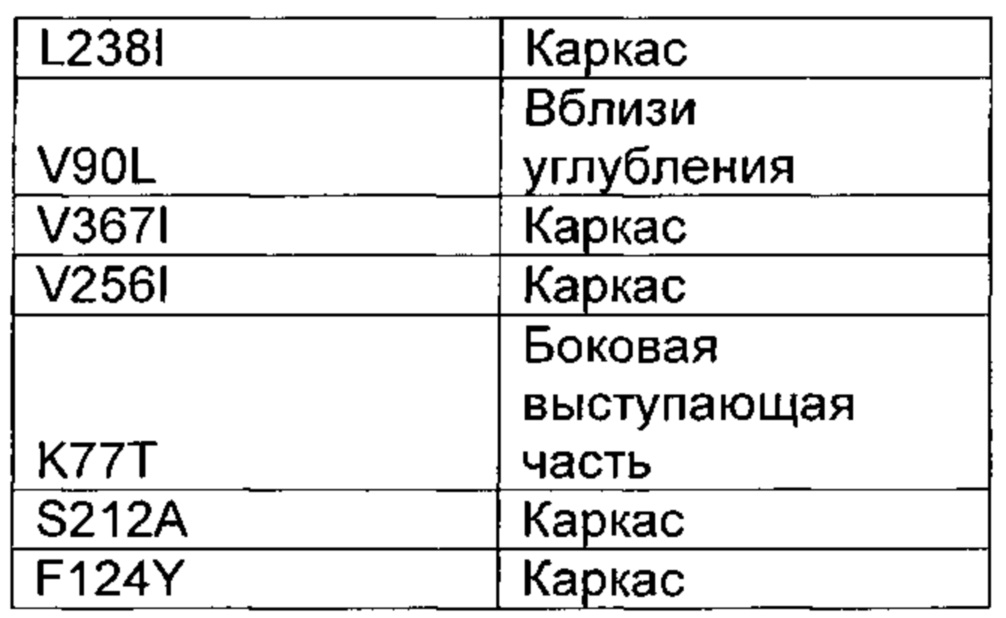
ПРИМЕР 9: Оценка вариантов верблюжьего химозина
Характеризация вариантов
Варианты верблюжьего химозина, оцениваемые в примере 7 в отношении их молокосвертывающей (С) и общей протеолитической (Р) активностей, получали снова и оценивали в отношении их специфичности расщепления казеина С/Р (таблица 1 ниже). Отношение С/Р является показателем эффективности коагулянта при изготовлении сыра, т.е. выход сырной массы, полученной из определенного объема молока. Молокосвертывающую и общую протеолитическую активности определяли, как описано в примерах 4 и 5 соответственно. В данном примере, однако, протеолитическую активность измеряли без нормализации по свертывающей активности.
Верблюжий химозин анализировали в качестве эталона. Значения С/Р всех вариантов представлены как относительные значения по отношению к верблюжьему химозину дикого типа. Было обнаружено влияние общей концентрации белка в образцах ферментов на С/Р, и значения С/Р были скорректированы соответственно этой корреляции.
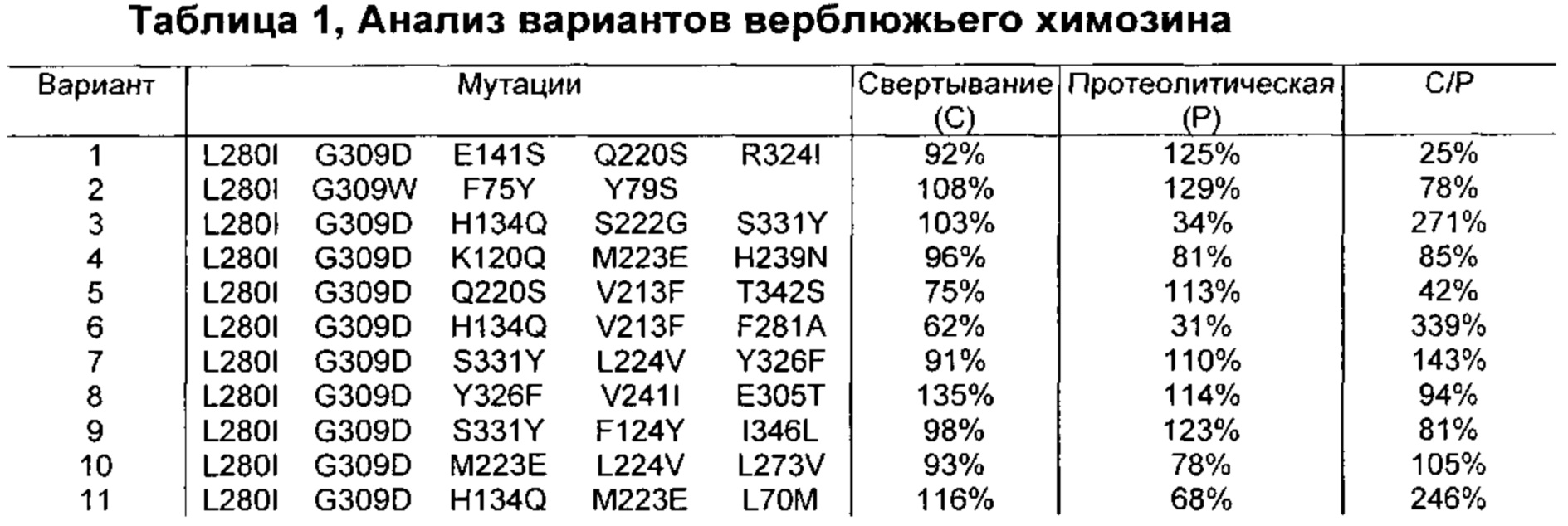
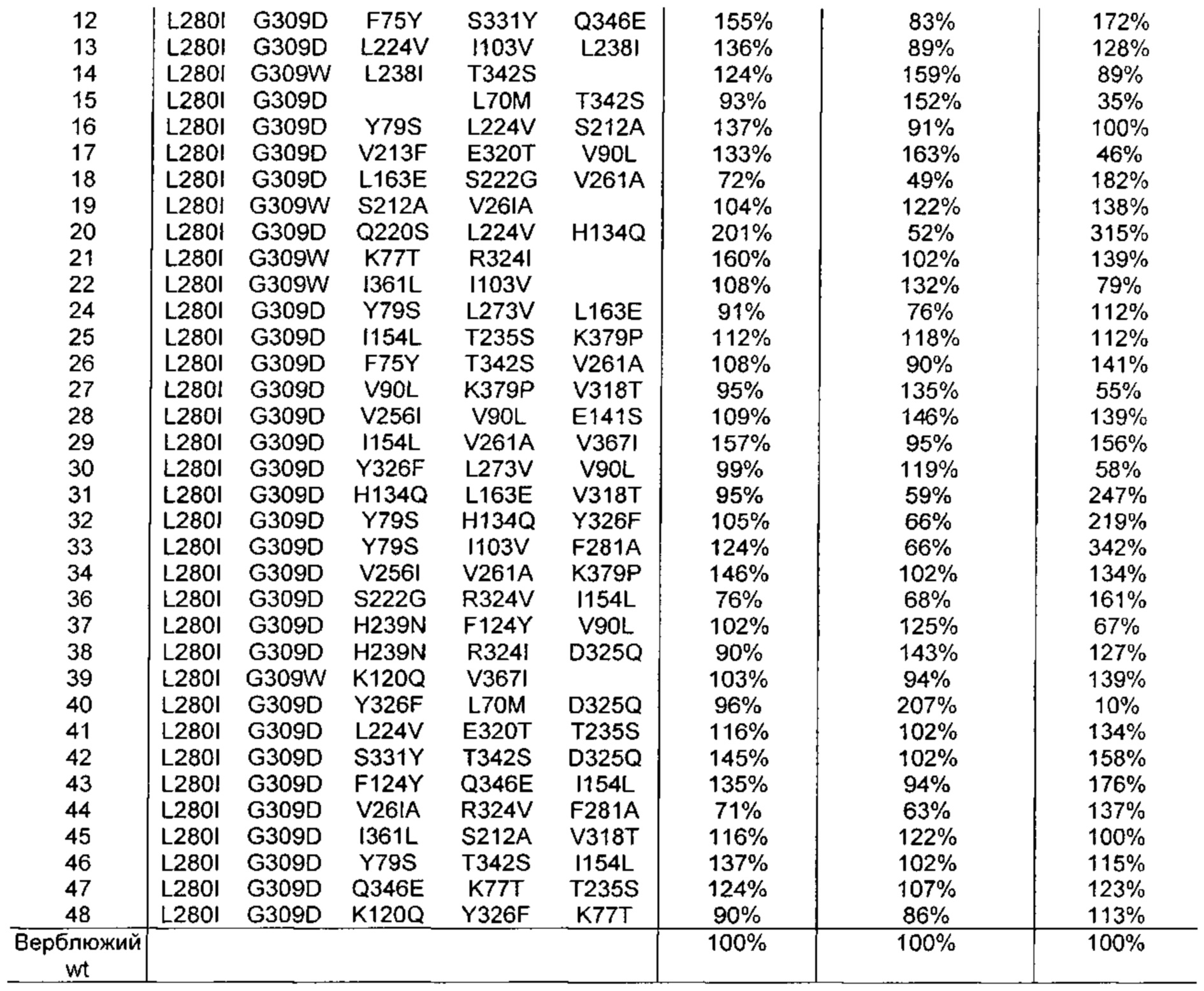
В общей сложности 30 из 46 охарактеризованных вариантов демонстрируют улучшенное С/Р по сравнению с верблюжьим химозином дикого типа (таблица 2 ниже). Более чем 3-кратное улучшение наблюдали для трех лучших вариантов 33, 6 и 20.
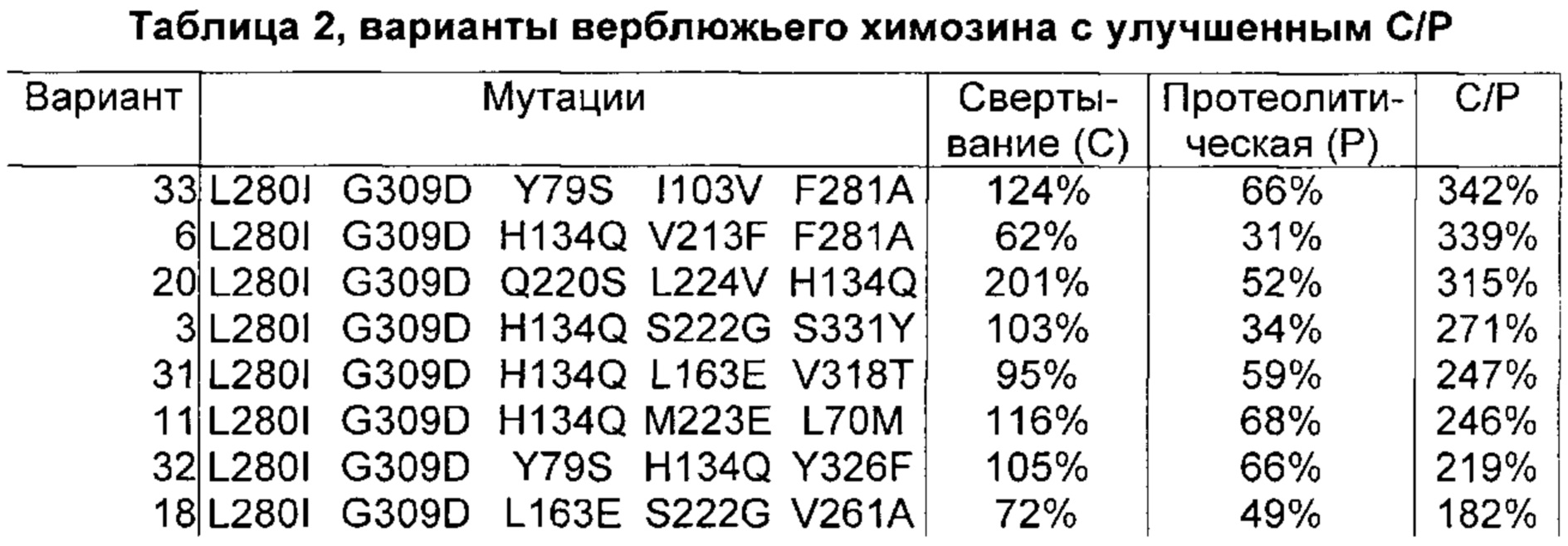
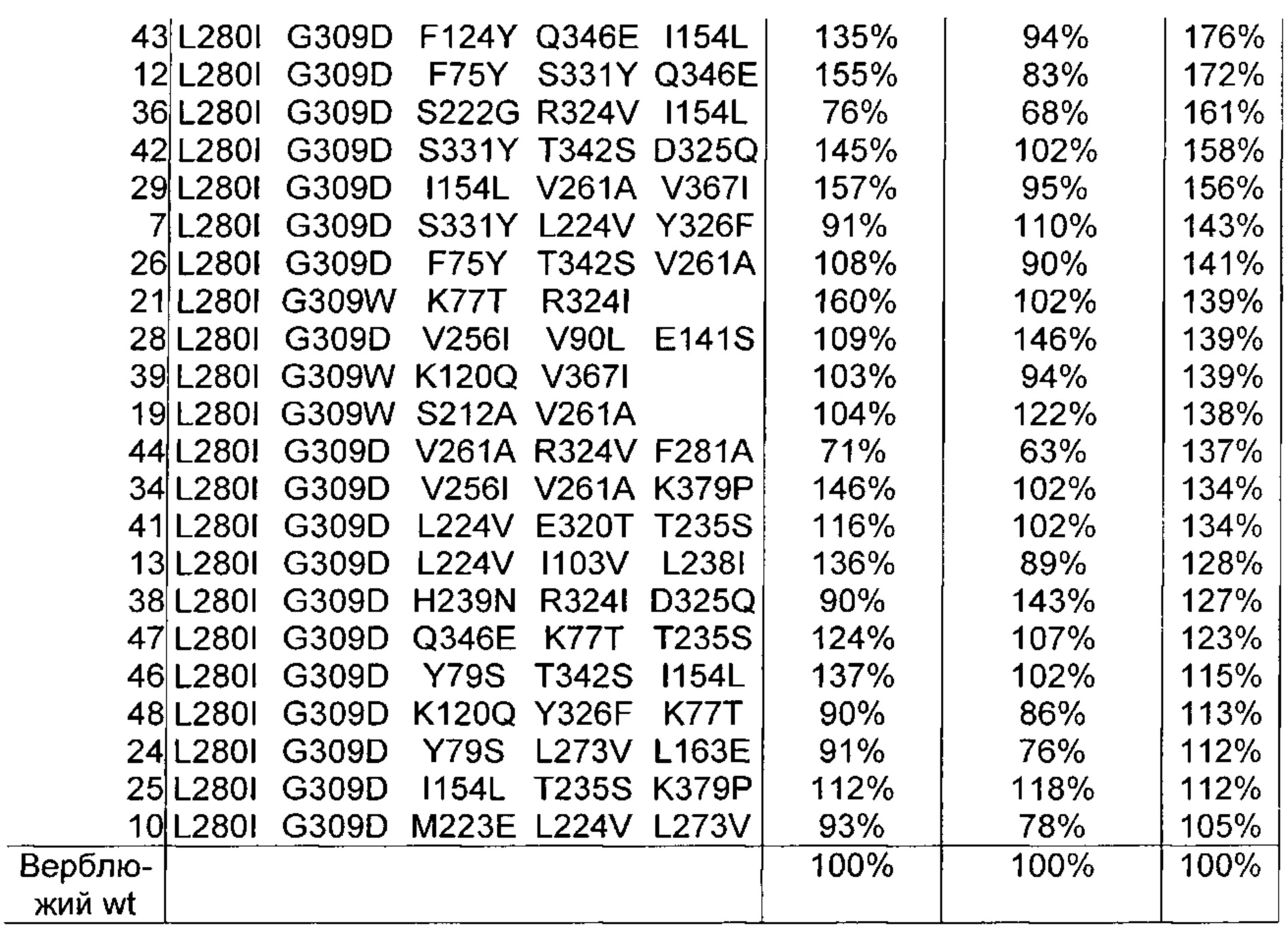
Статистический анализ эффектов положения и мутаций на С/Р Статистический анализ, основанный на РСА, использовали для идентификации одиночных мутаций с положительными эффектами на специфичность молокосвертывающей активности по сравнению с общим протеолизом казеина (С/Р) верблюжьего химозина. Было обнаружено, что для высоких отношений С/Р полезны следующие мутации:
H134Q, F281A, I103V, V256I, I154L, S222G, L224V, Q346E, S331Y, K77Т, V367I, G309D, V261A, D325Q, L280I, D117N, L163E, S212A.
ПРИМЕР 10: Оценка вариантов верблюжьего химозина
Характеризация вариантов
На основании эффектов положения и мутаций, определенных в примере 7, была получена другая серия вариантов верблюжьего химозина с множественными заменами по сравнению с верблюжьим химозином дикого типа и оценена в отношении их специфичности к субстрату казеину (С/Р), как описано в примере 9 (таблица 1 ниже).
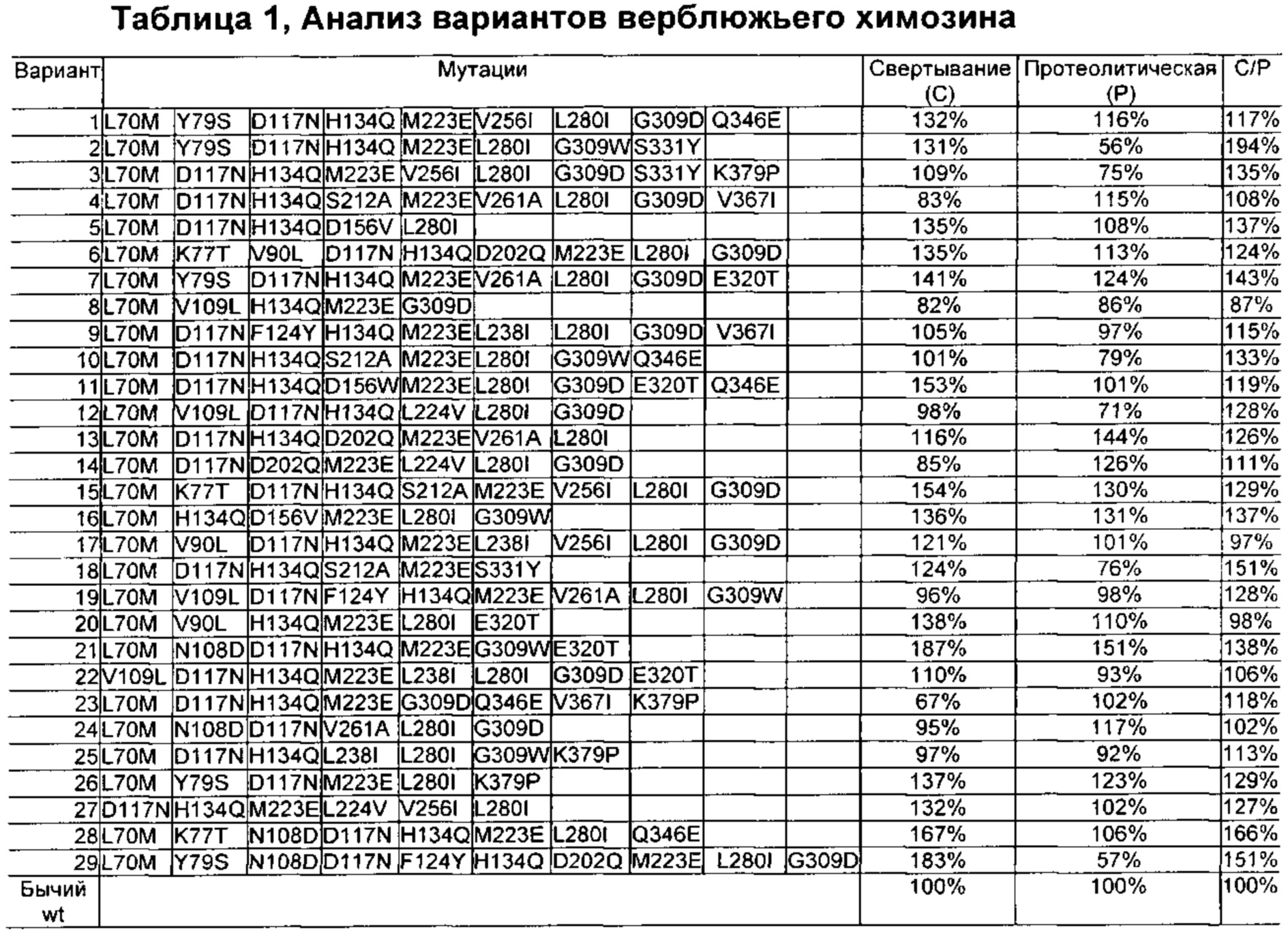
В общей сложности 26 из 29 вариантов демонстрируют улучшенные отношения С/Р по сравнению с верблюжьим химозином дикого типа. 2-кратное улучшение наблюдали для лучшего варианта (таблица 2 ниже).
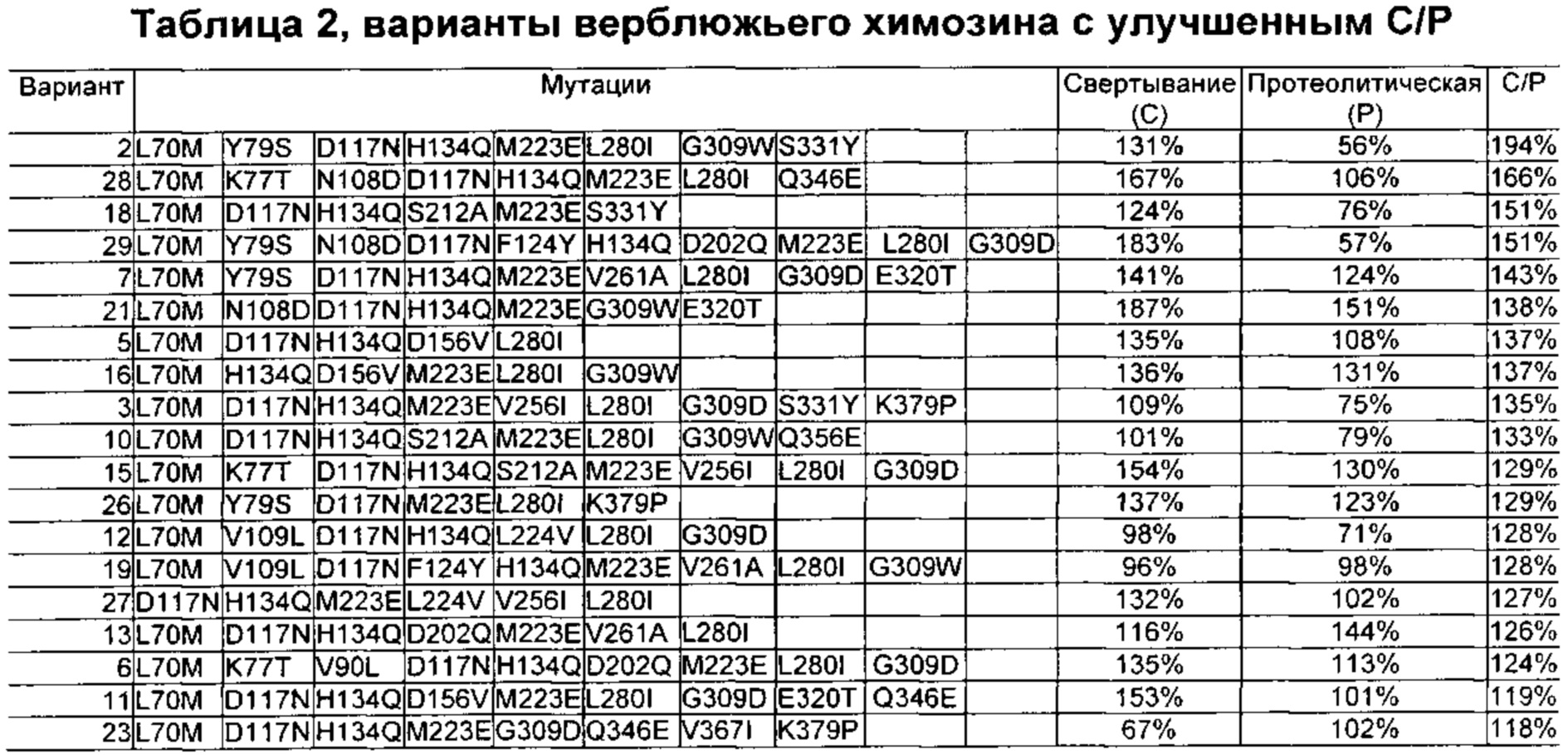
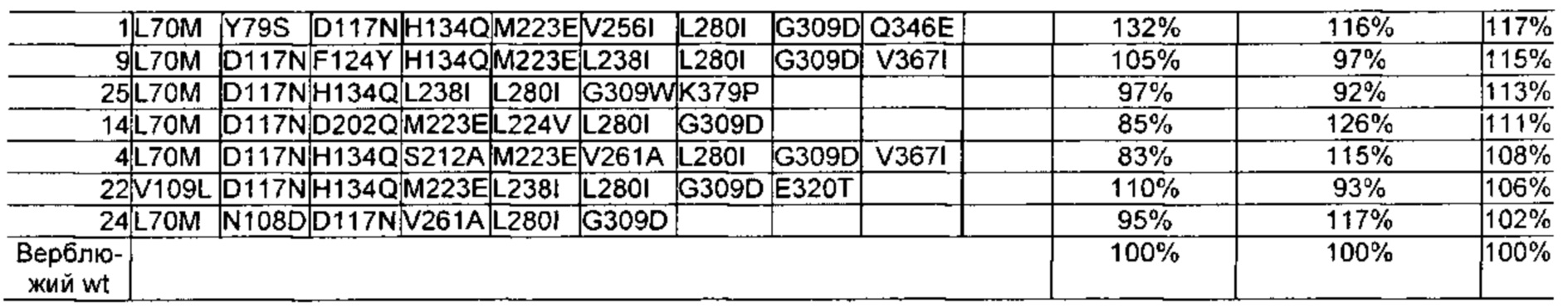
Статистический анализ эффектов положения и мутаций на С/Р Статистический анализ, основанный на РСА, использовали для идентификации одиночных мутаций с положительными эффектами на специфичность молокосвертывающей активности по сравнению с общим протеолизом казеина (С/Р) верблюжьего химозина. Было обнаружено, что для высоких отношений С/Р полезны следующие мутации:
S331Y, Y79S, K77Т, D117N, H134Q, N108D, G309W, L224V, D156V, L280I, М223Е, V367I, F114Y.
ПРИМЕР 11: Оценка вариантов верблюжьего химозина
Статистический анализ, основанный на РСА, был проведен на комбинированной серии вариантов из примеров 9 и 10, и были идентифицированы одиночные мутации с положительными эффектами на специфичность молокосвертывающей активности по сравнению с общим протеолизом казеина (С/Р) верблюжьего химозина. Было обнаружено, что для высоких отношений С/Р полезны следующие мутации:
F281A, H134Q, I103V, S331Y, S222G, I154L, L280I, G309D, D117N, L224V, N108D, L163E, G309W, K77Т, Y79S.
Эти мутации хорошо согласуются с полезными мутациями, определенными в примерах 9 и 10.
Статистическая оценка эффектов положения и мутаций на С/Р
Как видно в примере 8, большинство полезных мутаций снова располагаются на расстоянии от углубления, связывающего субстрат. Только L280I и F281A расположены непосредственно в углублении (Gilliland et al. 1990). I280 указывает на гидрофобное ядро С-концевого выступа. Данная мутация может, следовательно, привести к небольшим конформационным изменениям связывающего углубления и, следовательно, влияет на субстратную специфичность. Положение 281 составляет часть сайта связывания S2 и взаимодействует с положением Р2 в казеиновом субстрате. Весьма вероятно, что мутация в этом положении действует на связывание казеина и, следовательно, протеолиз. Мутации G309W и S331Y расположены на поверхности С-концевого выступа в участке, который, как описано, взаимодействует с κ-казеином, что способствует связыванию субстрата в каталитическом углублении (Gilliland et al. 1990). Следовательно, эти мутации могут положительно действовать на связывание субстрата. I154L и D156V, а также L163E представляют собой изменения в ядре N-концевого выступа, возможно, приводящие к незначительным структурным перегруппировкам фермента, что действует на каталитическую активность. Мутации S222G и L224V вносят изменения в бета-слой, который может взаимодействовать с N-концом белка в его активированной форме (Langholm Jensen et al.). Потенциальные эффекты на активированное состояние фермента могут привести к смещенной специфичности к казеиновому субстрату. Остальные удачные мутации K77Т, Y79S, 1103V, N108D, D117N и H134Q расположены на поверхности N-концевого выступа и, за исключением I103V, представляют собой замены полярных аминокислот. Эти изменения на поверхности фермента наиболее вероятно влияют на взаимодействия с молекулами казеина, приводящие к улучшенной специфичности в пользу κ-казеина.
СПИСОК ЛИТЕРАТУРЫ
1: WO 02/36752 A2 (Chr. Hansen).
2: Suzuki et al: Site directed mutagenesis reveals functional contribution of Thr218, Lys220 and Asp304 in chymosin, Protein Engineering, vol. 4, January 1990, pages 69-71.
3: Suzuki et al: Alteration of catalytic properties of chymosin by site-directed mutagenesis, Protein Engineering, vol. 2, May 1989, pages 563-569.
4: van den Brink et al: Increased production of chymosin by glycosylation, Journal of biotechnology, vol. 125, September 2006, pages 304-310.
5: Pitts et al: Expression and characterisation of chymosin pH optima mutants produced in Tricoderma reesei, Journal of biotechnology, vol. 28, March 1993, pages 69-83.
6: M.G. Williams et al: Mutagenesis, biochemical characterization and X-ray structural analysis of point mutants of bovine chymosin, Protein engineering design and selection, vol. 10, September 1997, pages 991-997.
7: Strop et al: Engineering enzyme subsite specificity: preparation, kinetic characterization, and x-ray analysis at 2.0 ANG resolution of Val111phe site mutated calf chymosin, Biochemistry, vol. 29, October 1990, pages 9863-9871.
8: Supannee et al: Site-specific mutations of calf chymosin В which influence milk-clotting activity, Food Chemistry, vol. 62, June 1998, pages 133-139.
9: Zhang et al: Functional implications of disulfide bond, Cys45-Cys50, in recombinant prochymosin, Biochimica et biophysica acta, vol. 1343, December 1997, pages 278-286.
10: WO 2013/174840 A1 (Chr. Hansen).
11: WO 2013/164479 A2 (DSM).
12: Langholm Jensen et al: Camel and bovine chymosin: the relationship between their structures and cheese-making properties, Acta Crystallographica Section D: Biological Crystallography, vol. 69, 2013, pages 901-913.
13: Gilliland et al: The three-dimentional structure of bovine chymosin at 2.3  resolution, Proteins, vol. 8, 1990, pages 82-101.
resolution, Proteins, vol. 8, 1990, pages 82-101.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> КХР. ХАНСЕН А/С
<120> Варианты химозина с улучшенными молокосвертывающими свойствами
<130> P5130EP01
<160> 2
<170> BiSSAP 1.0
<210> 1
<211> 381
<212> ПРТ
<213> Bos taurus
<220>
<221> ИСТОЧНИК
<222> 1..381
<223> /тип_молекулы="белок"
/организм="Bos taurus"
<400> 1
Met Arg Cys Leu Val Val Leu Leu Ala Val Phe Ala Leu Ser Gln Gly
1 5 10 15
Ala Glu Ile Thr Arg Ile Pro Leu Tyr Lys Gly Lys Ser Leu Arg Lys
20 25 30
Ala Leu Lys Glu His Gly Leu Leu Glu Asp Phe Leu Gln Lys Gln Gln
35 40 45
Tyr Gly Ile Ser Ser Lys Tyr Ser Gly Phe Gly Glu Val Ala Ser Val
50 55 60
Pro Leu Thr Asn Tyr Leu Asp Ser Gln Tyr Phe Gly Lys Ile Tyr Leu
65 70 75 80
Gly Thr Pro Pro Gln Glu Phe Thr Val Leu Phe Asp Thr Gly Ser Ser
85 90 95
Asp Phe Trp Val Pro Ser Ile Tyr Cys Lys Ser Asn Ala Cys Lys Asn
100 105 110
His Gln Arg Phe Asp Pro Arg Lys Ser Ser Thr Phe Gln Asn Leu Gly
115 120 125
Lys Pro Leu Ser Ile His Tyr Gly Thr Gly Ser Met Gln Gly Ile Leu
130 135 140
Gly Tyr Asp Thr Val Thr Val Ser Asn Ile Val Asp Ile Gln Gln Thr
145 150 155 160
Val Gly Leu Ser Thr Gln Glu Pro Gly Asp Val Phe Thr Tyr Ala Glu
165 170 175
Phe Asp Gly Ile Leu Gly Met Ala Tyr Pro Ser Leu Ala Ser Glu Tyr
180 185 190
Ser Ile Pro Val Phe Asp Asn Met Met Asn Arg His Leu Val Ala Gln
195 200 205
Asp Leu Phe Ser Val Tyr Met Asp Arg Asn Gly Gln Glu Ser Met Leu
210 215 220
Thr Leu Gly Ala Ile Asp Pro Ser Tyr Tyr Thr Gly Ser Leu His Trp
225 230 235 240
Val Pro Val Thr Val Gln Gln Tyr Trp Gln Phe Thr Val Asp Ser Val
245 250 255
Thr Ile Ser Gly Val Val Val Ala Cys Glu Gly Gly Cys Gln Ala Ile
260 265 270
Leu Asp Thr Gly Thr Ser Lys Leu Val Gly Pro Ser Ser Asp Ile Leu
275 280 285
Asn Ile Gln Gln Ala Ile Gly Ala Thr Gln Asn Gln Tyr Gly Glu Phe
290 295 300
Asp Ile Asp Cys Asp Asn Leu Ser Tyr Met Pro Thr Val Val Phe Glu
305 310 315 320
Ile Asn Gly Lys Met Tyr Pro Leu Thr Pro Ser Ala Tyr Thr Ser Gln
325 330 335
Asp Gln Gly Phe Cys Thr Ser Gly Phe Gln Ser Glu Asn His Ser Gln
340 345 350
Lys Trp Ile Leu Gly Asp Val Phe Ile Arg Glu Tyr Tyr Ser Val Phe
355 360 365
Asp Arg Ala Asn Asn Leu Val Gly Leu Ala Lys Ala Ile
370 375 380
<210> 2
<211> 381
<212> ПРТ
<213> Camelus dromedarius
<220>
<221> ИСТОЧНИК
<222> 1..381
<223> /тип_молекулы="белок"
/организм="Camelus dromedarius"
<400> 2
Met Arg Cys Leu Val Val Leu Leu Ala Ala Leu Ala Leu Ser Gln Ala
1 5 10 15
Ser Gly Ile Thr Arg Ile Pro Leu His Lys Gly Lys Thr Leu Arg Lys
20 25 30
Ala Leu Lys Glu Arg Gly Leu Leu Glu Asp Phe Leu Gln Arg Gln Gln
35 40 45
Tyr Ala Val Ser Ser Lys Tyr Ser Ser Leu Gly Lys Val Ala Arg Glu
50 55 60
Pro Leu Thr Ser Tyr Leu Asp Ser Gln Tyr Phe Gly Lys Ile Tyr Ile
65 70 75 80
Gly Thr Pro Pro Gln Glu Phe Thr Val Val Phe Asp Thr Gly Ser Ser
85 90 95
Asp Leu Trp Val Pro Ser Ile Tyr Cys Lys Ser Asn Val Cys Lys Asn
100 105 110
His His Arg Phe Asp Pro Arg Lys Ser Ser Thr Phe Arg Asn Leu Gly
115 120 125
Lys Pro Leu Ser Ile His Tyr Gly Thr Gly Ser Met Glu Gly Phe Leu
130 135 140
Gly Tyr Asp Thr Val Thr Val Ser Asn Ile Val Asp Pro Asn Gln Thr
145 150 155 160
Val Gly Leu Ser Thr Glu Gln Pro Gly Glu Val Phe Thr Tyr Ser Glu
165 170 175
Phe Asp Gly Ile Leu Gly Leu Ala Tyr Pro Ser Leu Ala Ser Glu Tyr
180 185 190
Ser Val Pro Val Phe Asp Asn Met Met Asp Arg His Leu Val Ala Arg
195 200 205
Asp Leu Phe Ser Val Tyr Met Asp Arg Asn Gly Gln Gly Ser Met Leu
210 215 220
Thr Leu Gly Ala Ile Asp Pro Ser Tyr Tyr Thr Gly Ser Leu His Trp
225 230 235 240
Val Pro Val Thr Leu Gln Gln Tyr Trp Gln Phe Thr Val Asp Ser Val
245 250 255
Thr Ile Asn Gly Val Ala Val Ala Cys Val Gly Gly Cys Gln Ala Ile
260 265 270
Leu Asp Thr Gly Thr Ser Val Leu Phe Gly Pro Ser Ser Asp Ile Leu
275 280 285
Lys Ile Gln Met Ala Ile Gly Ala Thr Glu Asn Arg Tyr Gly Glu Phe
290 295 300
Asp Val Asn Cys Gly Asn Leu Arg Ser Met Pro Thr Val Val Phe Glu
305 310 315 320
Ile Asn Gly Arg Asp Tyr Pro Leu Ser Pro Ser Ala Tyr Thr Ser Lys
325 330 335
Asp Gln Gly Phe Cys Thr Ser Gly Phe Gln Gly Asp Asn Asn Ser Glu
340 345 350
Leu Trp Ile Leu Gly Asp Val Phe Ile Arg Glu Tyr Tyr Ser Val Phe
355 360 365
Asp Arg Ala Asn Asn Arg Val Gly Leu Ala Lys Ala Ile
370 375 380
<---