КОМПОЗИЦИИ
Вид РИД
Изобретение
Настоящее изобретение относится к спрессованной таблетке, покрытой оболочкой и обеспечивающей отсроченное высвобождение активного ингредиента из ядра таблетки посредством эродирования высвобождающего барьера, окружающего ядро.
Способность высвобождать активные фармацевтические ингредиенты с отсрочкой желательна в лечении многих болезненных состояний. Например, при заболеваниях, на которые влияют циркадианные ритмы (см. Stevens HNE Chronopharmaceutical Drug Delivery J. Pharm Pharmac, 50(s) 5 (1998)). Известны методы лечения с пероральным назначением вещества, при которых желательно, чтобы это вещество высвобождалось спустя отсроченный период времени. Подобные методы лечения могут использоваться для высвобождения препарата в течение сна пациента или лечения состояний в соответствии с конкретным режимом. Подобные известные механизмы отсроченного высвобождения подразумевают сложные производственные процессы и/или опираются на механизм "разрыва", когда контакт с жидкостями в желудочно-кишечном тракте приводит к разбуханию таблетированной формы и структурному разрыву, высвобождающему препарат спустя определенный период времени. Подобный механизм разрыва может характеризоваться наличием наружного высвобождающего барьера, который окружает ядро, наполненное препаратом, и резко разрывается после разбухания ядра таблетки, формируя открытую конфигурацию "ракушки". Высвобождение препарата посредством подобных механизмов может физически затрудняться в зонах желудочно-кишечного тракта с недостаточной моторикой, вязким или твердым содержимым в его просвете, или уплотнением кала, с ограниченной доступностью воды. Вследствие этого подобные известные таблетки с отсроченным высвобождением могут оказаться неэффективными из-за отсутствия или неполного раскрытия, а также прохождения через желудочно-кишечный тракт в относительно неизмененном виде без полного высвобождения препарата, или приводить к высвобождению, которое активируется после прохождения таблеткой части желудочно-кишечного тракта, предусмотренной для местного действия препарата.
Множество стратегий, позволяющих контролировать высвобождение из ядра, доступно специалистам при разработке высвобождающего барьера. Могут применяться структуры на основе полимерных мембран, однако они часто являются сложными и дорогими, а при их обработке обычно используются растворители. Альтернативная и более простая стратегия включает создание высвобождающего барьера, включающего воск и разрыхлитель; разрыхлитель разбухает при воздействии на него жидкости и вызывает поверхностное ослабление высвобождающего барьера, который в значительной степени скрепляется воском, до момента, когда начинается эродирование барьера на поверхности таблетки; оно постепенно продолжается до полного удаления барьерного слоя с последующим высвобождением препарата из внутреннего ядра таблетки. Однако, подбор разрыхлителей достаточно широк, и трудно предсказать, как они будут взаимодействовать в желудочно-кишечном тракте, будучи встроенными в восковой барьер.
Одним из множества возможных доступных разрыхлителей является низкозамещенная гидроксипропилцеллюлоза (L-HPC). Поскольку L-HPC используется в лекарственных формах, она должна быть знакома специалистам. L-HPC не растворима в воде, а, напротив, поглощает воду, тем самым увеличиваясь в объеме. В результате L-НРС обычно считается полезной в качестве разрыхлителя благодаря быстрому увеличению в объеме в присутствии воды; она также доступна в виде нескольких фракций, функционируя в качестве связывающих веществ. Однако, преимущества, установленные настоящими изобретателями и полученные в результате комбинации фракций L-HPC, являются новыми. Химическое наименование IUPAC для L-HPC: 2-гидроксипропиловый эфир целлюлозы (низкозамещенный). L-HPC имеет тот же CAS-номер, что и гидроксипропилцеллюлоза (9004-64-2). L-HPC, однако, отличается от гидроксипропилцеллюлозы тем, что ее целлюлозный каркас содержит меньше гидроксипропоксильных групп. После высушивания при 105°С в течение 1 часа L-HPC содержит не менее 5,0% и не более 16,0% гидроксипропоксильных групп (по весу молекулы).
Было неожиданно установлено, что использование комбинированных высвобождающих барьеров с L-HPC на основе воска обеспечивает более широкий диапазон контроля периода отсроченного высвобождения, сохраняя при этом поведенческие характеристики эродирования. Обычно отсроченное высвобождение активного вещества в рамках данного изобретения достигается путем выпуска прессованной таблетки, покрытой оболочкой и включающей слой отсроченного высвобождения, окружающий ядро, содержащее активное вещество. Слой отсроченного высвобождения может включать воск, а также комбинацию двух или более различных фракций низкозамещенной гидроксипропилцеллюлозы (L-HPC), например, комбинацию ее фракций с меньшими (например, LH32) и большими размерами частиц (например, LH21).
В соответствии с этим, в первом аспекте настоящего изобретения представлена прессованная таблетка, покрытая оболочкой, с отсроченным высвобождением активного ингредиента, содержащая:
(а) ядро с одним или несколькими активными ингредиентами, и;
(б) эродируемый барьер с отсроченным высвобождением, окружающий ядро и содержащий воск и две или более фракции L-HPC, при этом воск и L-HPC содержатся в весовом отношении воска к L-HPC" от 30%:70% до 70%:30%.
Эродируемый барьер с отсроченным высвобождением обеспечивает отсроченное высвобождение активного ингредиента из таблетки. Характер и скорость высвобождения после его начала зависит от рецептуры ядра. При подобных рецептурах ядра активный ингредиент может высвобождаться из ядра в течение продолжительного времени - нескольких часов после начала высвобождения препарата (например, в течение 2-12 часов). В ином случае, ядро высвобождает по меньшей мере 70% активного вещества в течение 5-80 минут после начала высвобождения. Эродируемый барьерный слой функционирует независимо от рецептуры или содержания активного ингредиента в ядре.
Не желая ограничений в дальнейшем, но в интересах ясности предполагается, что рецептуры в рамках настоящего изобретения способны обеспечивать профиль отсроченного высвобождения, при котором интервал отсроченного периода контролируется шире, чем это обеспечивается стандартными комбинациями воска и одиночной L-HPC; при этом поддерживается контролируемое поведение эродирования, в отличие от разрыва по типу механизма открытой ракушки в известном уровне техники. Восковые механизмы отсроченного высвобождения в рамках известного уровня техники обычно работают посредством механизма разбухания и разрыва, а не механизма эродирования, описанного в настоящем изобретении (см. US 2012/0177739 A1 Vergnault et al.) В настоящем способе используется комбинация фракций L-HPC, обеспечивающая продление отсроченного периода и при этом поддерживающая эродирование барьерного слоя.
Удивительно, что механизм эродирования способен обеспечивать подобный широкий диапазон контроля отсроченного периода, поскольку несколько известных технологий контролируемого отсроченного высвобождения не способны обеспечить сопоставимые расширенные отсроченные периоды перед высвобождением препарата в комбинации с процессом эродирования. См., например, Ghimire et al. European Journal Pharmaceutics (67) 2007 515-523. Механизм эродирования обеспечивает стабильное и воспроизводимое высвобождение in vitro и in vivo, независимо от локализации таблетки в желудочно-кишечном тракте. Использование механизма эродирования для достижения отсроченного высвобождения позволяет преодолеть потенциальные трудности, встречающиеся при иных технологиях отсроченного высвобождения на известном уровне техники, в которых используется система разбухания и разрыва. Кроме того, данная технология использует более простой процесс производства, чем другие технологии в известном уровне техники. Подобные рецептуры могут использоваться, но не ограничиваться этим, для обеспечения ночного дозирования, к примеру, для лечения бессонницы; для лечения патологий, проявляющихся ранним утром, например утренней скованности, связанной с артритными состояниями, или для укорочения периодов повышенных сердечно-сосудистых рисков, например при инфаркте миокарда; или в рамках других временных режимов дозирования.
L-HPC может иметь несколько фракций, различающихся, например, по размеру частиц или содержанию гидроксипропоксильных групп.
При фракционировании L-HPC по размеру частиц они обычно делятся на крупные частицы, частицы среднего размера и микронизированные частицы.
Крупные частицы могут иметь средний размер 50 мкм и больше, от 50 мкм до 65 мкм, и от 53 мкм до 57 мкм. Крупные частицы могут иметь средний размер 55 мкм. Примерами L-HPC с крупными частицами могут быть LH-11 и/или LH-B1.
Частицы среднего размера могут иметь средний размер менее 50 мкм и до 30 мкм, менее 50 мкм и до 40 мкм, или от 42 мкм до 48 мкм. Частицы среднего размера могут иметь средний размер 45 мкм. Примерами L-HPC среднего размера могут быть одна или несколько следующих фракций: LH-21, LH-22, NBD-22, NBD-021 и/или NBD-020.
Микронизированные частицы могут иметь средний размер менее 30 мкм, менее 30 мкм и до 1 мкм, менее 30 мкм и до 10 мкм, от 15 мкм до 25 мкм, или от 17 мкм до 23 мкм. Микронизированные частицы могут иметь средний размер 20 мкм. Примерами микронизированных фракций L-HPC могут быть LH-31 и/или LH-32.
Специалист должен хорошо знать о соответствующих способах определения среднего размера частиц. Исключительно в качестве примера, средний размер частиц может определяться в соответствии с протоколами Sympatec, используемыми для их системы лазерной дифракции (например, HELOS или MYTOS).
При фракционировании L-HPC по содержанию гидроксипропоксильных групп их обычно разделяют на высокий или низкий уровень содержания гидроксипропоксильных групп (высокий и низкий - это относительные термины, относящиеся к L-HPC).
L-HPC с высоким уровнем содержания гидроксипропоксильных групп могут содержать их в количестве 10% и выше, от 10% до 16%, от 10% до 15%, от 10% до 14%, от 10% до 13%, и от 10% до 12%. L-HPC с высоким уровнем содержания гидроксипропоксильных групп могут содержать их в количестве 11%. Примерами L-HPC с высоким уровнем содержания гидроксипропоксильных групп могут быть одна или несколько следующих фракций: NBD-021, NBD-020, LH-11, LH-21, LH-31 и/или LH-B1.
L-HPC с низким уровнем содержания гидроксипропоксильных групп могут содержать их в количестве менее 10%, менее 10% и до 5%, менее 10% и до 6%, от 5% до 9%, от 6% до 9%, от 7% до 9%, или от 8% до 9%. L-HPC с низким уровнем содержания гидроксипропоксильных групп могут содержать их в количестве 8%. Примерами L-HPC с низким уровнем содержания гидроксипропоксильных групп могут быть одна или несколько следующих фракций: NBD-022, LH-22 и/или LH-32.
Спрессованная таблетка в соответствии с настоящим изобретением может, например, включать одну или комбинацию нескольких L-HPC из следующего перечня: LH-11, LH-21, LH-22, LH-32, LH-B1, LH-31, NBD-022, NBD-021 и NBD-020.
Поскольку высвобождающий барьер включает две или более фракции L-HPC, в состав высвобождающего барьера может входить смесь фракций L-HPC.
Например, высвобождающий барьер может включать по меньшей мере две фракции L-HPC из группы, куда входят L-HPC с крупными частицами, L-HPC с частицами средних размеров и L-HPC с микронизированными частицами. Иным образом, или дополнительно, высвобождающий барьер может включать L-HPC с низким и высоким уровнем содержания гидроксипропоксильных групп. Например, высвобождающий барьер может включать:
а) L-HPC с частицами крупного и среднего размера (например, любую из следующих комбинаций: - LH-11 и LH-21, LH-11 и LH-22, LH-11 и NBD-022, LH-11 и NBD-021, LH-11 и NBD-020, LH-B1 и LH-21, LH-B1 и LH-22, LH-B1 и NBD-22, LH-B1 и NBD-021, LH-B1 и NBD-020);
б) L-HPC с крупными и микронизированными частицами (например, любую из следующих комбинаций: - LH-11 и LH-31, LH-11 и LH-32, LH-B1 и LH-31, LH-B1 и LH-32);
в) L-HPC с частицами среднего размера и микронизированными частицами (например, любую из следующих комбинаций: - LH-21 и LH-31, LH-22 и LH-31, NBD-022 и LH-31, NBD-021 и LH-31, NBD-020 и LH-31, LH-21 и LH-32, LH-22 и LH-32, NBD-022 и LH-32, NBD-021 и LH-32, NBD-020 и LH-32);
г) L-HPC с низким и высоким содержанием гидроксипропоксильных групп (например, любую из следующих комбинаций: - NBD-021 и NBD-022, NBD-020 и NBD-022, LH-11 и NBD-022, LH-21 и NBD-022, LH-31 и NBD-022, LH-B1 и NBD-022, NBD-021 и LH-22, NBD-020 и LH-22, LH-11 и LH-22, LH-21 и LH-22, LH-31 и LH-22, LH-B1 и LH-22, NBD-021 и LH-32, NBD-020 и LH-32, LH-11 и LH-32, LH-21 и LH-32, LH-31 и LH-32, LH-B1 и LH-32);
д) L-HPC с низким и высоким содержанием гидроксипропоксильных групп, которые также включают комбинацию L-HPC с частицами крупного и среднего размера (например, любую из следующих комбинаций: - LH-11 и LH-22, LH11 и NBD-022, LH-B1 и LH-22, LH-B1 и NBD-022);
е) L-HPC с низким и высоким содержанием гидроксипропоксильных групп, которые также включают комбинацию L-HPC с крупными и микронизированными частицами (например, любую из следующих комбинаций: - LH-11 и LH-32, LH-B1 и LH-32); или;
ж) L-HPC с низким и высоким содержанием гидроксипропоксильных групп, которые также включают комбинацию L-HPC с частицами среднего размера и микронизированными частицами (например, любую из следующих комбинаций: - LH-22 и LH-31, NBD-022 и LH-31, LH-21 и LH-32, NBD-021 и LH-32, NBD-020 и LH-32).
Следовательно, например, спрессованная таблетка, покрытая оболочкой, в рамках настоящего изобретения может включать:
(а) ядро с одним или несколькими активными ингредиентами, и;
(б) эродируемый барьер с отсроченным высвобождением, окружающий ядро и содержащий воск, LH-21 и LH-32, при этом воск и L-HPC содержатся в весовом соотношении воска к общему L-HPC от 30%:70% до 70%:30%.
Могут быть выбраны альтернативные комбинации, например, комбинации, включающие NBD-022 и LH-32.
Весовое соотношение одной фракции L-HPC к другой фракции L-HPC в высвобождающем барьере может составлять от 5%:95% до 95%:5%, от 15%:85% до 85%: 15%, или от 30%:70% до 70%:30%. Соотношение каждой фракции L-HPC может контролироваться для достижения идеального профиля высвобождения.
Обеспечение большего количества L-HPC с крупными частицами и/или высоким уровнем гидроксипропоксильных групп по отношению к L-HPC с частицами среднего размера, микронизированными частицами и/или низким содержанием гидроксипропоксильных групп в высвобождающем барьере может увеличить скорость эродирования.
Например, использование весового соотношения L-HPC с крупными частицами и/или высоким уровнем гидроксипропоксильных групп: L-HPC с частицами среднего размера, микронизированными частицами и/или низким содержанием гидроксипропоксильных групп >50%:<50%, >55%:<45%, >60%:<40%, >70%:<30%, >80%:<20% или >90%:<10%. Как следствие, высвобождающий барьер может содержать больше LH-11, чем LH-32. Воск в настоящем изобретении может являться любым фармацевтически приемлемым воском, способным связать содержимое высвобождающего слоя с наружной поверхностью ядра. Специалист должен достаточно хорошо знать о пригодных восках, например, воск может быть выбран из группы веществ, включающей пчелиный воск, микрокристаллический воск, глицериновый эфир, гидрогенизированное касторовое масло, карнаубский воск или любую комбинацию восков. Воск может представлять собой бегенат глицерина. Воск и L-HPC могут быть представлены в следующих весовых соотношениях: 30:70 к 70:30%, 30:70 к 65:35%, 30:70 к 60:40%, 30:70 к 55:45% или 30:70 к 50:50%.
Барьер отсроченного высвобождения в соответствии с настоящим изобретением является эродируемым. Этот термин должен быть знаком специалисту. Однако, во избежание разночтений, термин следует понимать в плане того, что слой барьера отсроченного высвобождения непрерывно отделяется от таблетки. Данный процесс происходит постепенно и занимает от 2 до 12 часов. Данный процесс может достаточно функционировать даже в присутствии относительно малого объема воды.
Ядро включает один или несколько активных ингредиентов. Ядро также может включать иные фармацевтически приемлемые вспомогательные вещества или разбавители. Ядро может включать матрицу, с которой связаны один или несколько активных ингредиентов. Матрицы, пригодные для удерживания и постепенного высвобождения активных ингредиентов, хорошо известны специалисту.
Активный ингредиент может представлять собой любое вещество, используемое в рамках терапевтического (в том числе профилактического) лечения. Было показано, что таблетка, разработанная в соответствии с настоящим изобретением, может быть носителем для введения любого терапевтического вещества. Например, активный ингредиент может являться любым веществом, используемым в лечении любого или нескольких следующих заболеваний: - Болезни центральной нервной системы (например, неврогенная боль, инсульт, деменция, болезнь Альцгеймера, болезнь Паркинсона, нейрональная дегенерация, менингит, повреждение спинного мозга, церебральный вазоспазм, боковой амиотрофический склероз), сердечно-сосудистые заболевания (например, артериальная гипертензия, атеросклероз, стенокардия, артериальная обструкция, заболевание периферических артерий, патология миокарда, аритмия, острый инфаркт миокарда, кардиомиопатия, застойная сердечная недостаточность, болезнь коронарных артерий, эндокардит, гиперхолестеринемия, гиперлипидемия, заболевание периферических артерий (ЗПА) или любая их комбинация), заболевания мочеполовой системы (например, эректильная дисфункция, болезни мочевых органов доброкачественная гипертрофия предстательной железы (ДГПЖ), почечный тубулярный ацидоз, диабетическая нефропатия, гломерулонефрит, гломерулосклероз, инфекция мочевых путей, недержание мочи или любая их комбинация), заболевания глаз (например, глаукома, блефарит, повышение внутриглазного давления, ретинопатия, конъюнктивит, склерит, ретинит, кератит, язва роговицы, ирит, хориоретинит, макулярный отек, ксерофтальмия или любая их комбинация), болезни легких (например, бронхиальная астма, легочная гипертензия, острый респираторный дистресс-синдром, ХОБЛ, эмфизема, пневмония, туберкулез, бронхит, острый бронхит, бронхоэктатическая болезнь, бронхиолит, бронхолегочная дисплазия, биссиноз, кокцидиомикоз, муковисцидоз, грипп, рак легких, мезотелиома или любая их комбинация), метаболические заболевания (например, гиперкальциурия, гипергликемия, гиперинсулинемическая гипогликемия, гиперинсулинизм, гиперлизинурия, гипогликемия или любая их комбинация), экзокринные и эндокринные заболевания (например, болезнь Аддисона, гипоальдостеронизм, синдром Кушинга, сахарный диабет, зоб, гипертиреоз, гипотиреоз, тиреоидит, панкреатит или любая их комбинация), болезни печени (например, гепатит, неалкогольная жировая болезнь печени, цирроз, рак печени, первичный склерозирующий холангит, первичный билиарный цирроз, синдром Бадда-Киари или любая их комбинация), аутоиммунные и воспалительные заболевания (например, рассеянный склероз, ревматоидный артрит, псориаз, сахарный диабет, саркоидоз, болезнь Аддисона, очаговая алопеция, боковой амиотрофический склероз, анкилозирующий спондилит, полиартрит, атопическая аллергия, топический дерматит, аутоиммунный гепатит, целиакия, болезнь Чагаса, целиакия, синдром Когана, болезнь Крона, синдром Кушинга, сахарный диабет 1 типа, эндометриоз, эозинофильный фасциит, фибромиалгия/фибромиозит, гастрит, гломерулонефрит, болезнь Грейвса, синдром Гийена-Барре (СГБ), энцефалит Хашимото, тиреоидит Хашимото, гемолитическая анемия, идиопатические воспалительные демиелинизирующие заболевания, идиопатический легочный фиброз, интерстициальный цистит, ювенильный идиопатический артрит, ювенильный ревматоидный артрит, болезнь Кавасаки, склерозирующий лишай, красная волчанка, болезнь Меньера, миастения гравис, миозит, нарколепсия, пернициозная анемия, перивенозный энцефаломиелит, ревматическая полимиалгия, первичный билиарный цирроз, псориатический артрит, синдром Рейтера, ревматическая лихорадка, саркоидоз, шизофрения, синдром Шегрена, спондилоартропатия, язвенный колит или любая их комбинация), болезни костно-мышечной системы (например, остеоартроз, остеопороз, остеонекроз, артрит, болезнь Педжета, бурсит, костохондрит, тендинит или любая их комбинация), заболевания кожи (например, акне, алопеция, кандидоз, целлюлит, дерматит, экзема, буллезный эпидермолиз, эритразма, герпес, рожа, фолликулит, импетиго, дерматофития, чесотка, трихофития, трихомикоз или любая их комбинация), ЛОР-болезни (например, отит, синусит, ларингит, фарингит, болезнь Меньера, лабиринтит или любая их комбинация), болезни желудочно-кишечного тракта (например, синдром раздраженного кишечника (СРК), некротизирующий энтероколит (НЭК), неязвенная диспепсия, хроническая кишечная псевдообструкция, функциональная диспепсия, псевдообструкция толстого кишечника, гастроэзофагеальная рефлюксная болезнь, воспаление подвздошной кишки, гастропарез, изжога, запоры (например, запоры, связанные с приемом лекарственных препаратов, в частности опиоидов), колоректальный рак, полипы толстого кишечника, дивертикулит, пищевод Баррета, желудочно-кишечное кровотечение, целиакия, полипы толстой кишки, запоры, болезнь Крона, циклический рвотный синдром, замедленное опорожнение желудка (гастропарез), диарея, дивертикулез, язвы двенадцатиперстной кишки, недержание кала, камни желчного пузыря, газообразование в желудочно-кишечном тракте, гастрит, гастроэзофагеальная рефлюксная болезнь (ГЭРБ), изжога, грыжа пищеводного отверстия диафрагмы, гемохроматоз, геморрой, болезнь Гиршпрунга, несварение, паховая грыжа, непереносимость лактозы, пептические язвы, полипы, порфирия, первичный билиарный цирроз, первичный склерозирующий холангит, проктит, быстрое опорожнение желудка, синдром короткого кишечника, язвы желудка, язвенный колит, язвы, болезнь Уиппла или любая их комбинация), острые и/или хронические боли, вирусная инфекция, рак, ларингит, мастоидит, мирингит, средний отит, ринит, синусит, сиаладенит, тонзиллофарингит или любая их комбинация.
Соответственно, активным ингредиентом может быть парацетамол, метформин, диклофенак или их комбинация.
Как упомянуто выше, барьер отсроченного высвобождения окружает ядро. Высвобождающий барьер может иметь толщину от 0,5 мм до 3 мм+/- 10% вдоль поверхности ядра. Один или несколько функциональных слоев могут находиться между ядром и барьером отсроченного высвобождения.
Таблетки в настоящем изобретении являются спрессованными таблетками, покрытыми оболочкой. Специалист должен хорошо знать данный термин. Однако, во избежание разночтений, спрессованными таблетками, покрытыми оболочкой, являются таковые с ядром, покрытым слоем (например, барьером отсроченного высвобождения), который наносится путем давления на наружную поверхность ядра.
Спрессованная таблетка, покрытая оболочкой, может включать одну или несколько оболочек, которые могут быть рН-зависимыми или независимыми, функциональными или эстетическими, а также при необходимости могут содержать активный ингредиент. Одна или несколько оболочек могут быть кишечнорастворимыми, которые предотвращают высвобождение вещества в желудке, при этом отсчет отсроченного высвобождения не начинается до тех пор, пока таблетка не пройдет желудок. Подобные одна или несколько оболочек могут располагаться кнаружи от слоя отсроченного высвобождения.
Барьер отсроченного высвобождения и/или одна или несколько оболочек могут также включать активный ингредиент. Активный ингредиент в барьере отсроченного высвобождения и/или одной или нескольких оболочках может совпадать с активными ингредиентом или ингредиентами ядра, или отличаться от них. В качестве альтернативы, барьер отсроченного высвобождения и/или прочие покрытия могут не включать активный ингредиент.
Как понятно из вышесказанного, контроль высвобождения и время отсрочки высвобождения может осуществляться путем одного из следующих методов или их комбинации:
1) Соотношение L-HPC к воску;
2) Толщина барьерного слоя, спрессованного на ядре таблетки, и;
3) Соотношение различных фракций L-HPC между собой.
Таблетка, кроме того, может включать верхний слой (например, внешний слой на ядре и эродируемый слой отсроченного высвобождения, вероятно самый наружный слой), который может содержать выборочный слой промежуточного высвобождения, включающий вещество, идентичное таковому в ядре или отличное от такового. Вышеописанная оболочка может быть добавлена к таблеткам такого вида, или, в качестве альтернативы, верхний слой может быть добавлен на уже покрытую таблетку, согласно описанию выше.
Во втором аспекте настоящего изобретения представлен способ создания спрессованной таблетки, покрытой оболочкой, в соответствии с первым аспектом настоящего изобретения; данный способ включает следующие этапы:
а) активный ингредиент и фармацевтически приемлемые вспомогательные вещества и/или разбавители перемешивают и прессуют для получения ядра;
б) один или несколько восков, а также две или несколько фракций L-HPC перемешивают и полученную смесь спрессовывают вокруг наружной поверхности ядра, образуя барьерный слой.
Все свойства первого аспекта настоящего изобретения могут быть поняты для того, чтобы применить их ко второму аспекту настоящего изобретения.
Активный ингредиент может гранулироваться с применением фармацевтически приемлемых вспомогательных веществ и/или разбавителей, при необходимости с применением метода влажного гранулирования, или перемешиваться в виде смеси сухого порошка перед формированием спрессованного ядра. Гранулы или порошковая смесь для ядра могут перемешиваться с дополнительными фармацевтически приемлемыми вспомогательными веществами и/или разбавителями перед формированием спрессованного ядра. Ядро может быть изготовлено альтернативными способами, например, при помощи литья под давлением или 3D-печати.
Воск можно нагревать перед перемешиванием с L-HPC для формирования гранул при помощи взбалтывания или гранулирования с охлаждением, или он может перемешиваться с L-HPC, а затем нагреваться с ней вместе в процессе термоплавкого гранулирования перед прессованием по наружной поверхности ядра.
Если не указано иное, все условия, представленные в данном документе, измерены при 100 кПа (т.е. 0,987 атм, 1 бар) и при 20°С.
Если не указано иное, когда изобретение определяется в рамках свойств, представленных в перечне, или любой их комбинации, каждая комбинация предполагается как отдельно раскрытая в виде одиночного выборочного пункта, который может являться частью настоящего изобретения.
Все выборочные свойства настоящего изобретения могут комбинироваться с другими выборочными свойствами настоящего изобретения, за исключением случаев, когда контекст исключает такую возможность.
Настоящее изобретение далее описывается, в качестве примера, со ссылкой на фигуры, в которых:
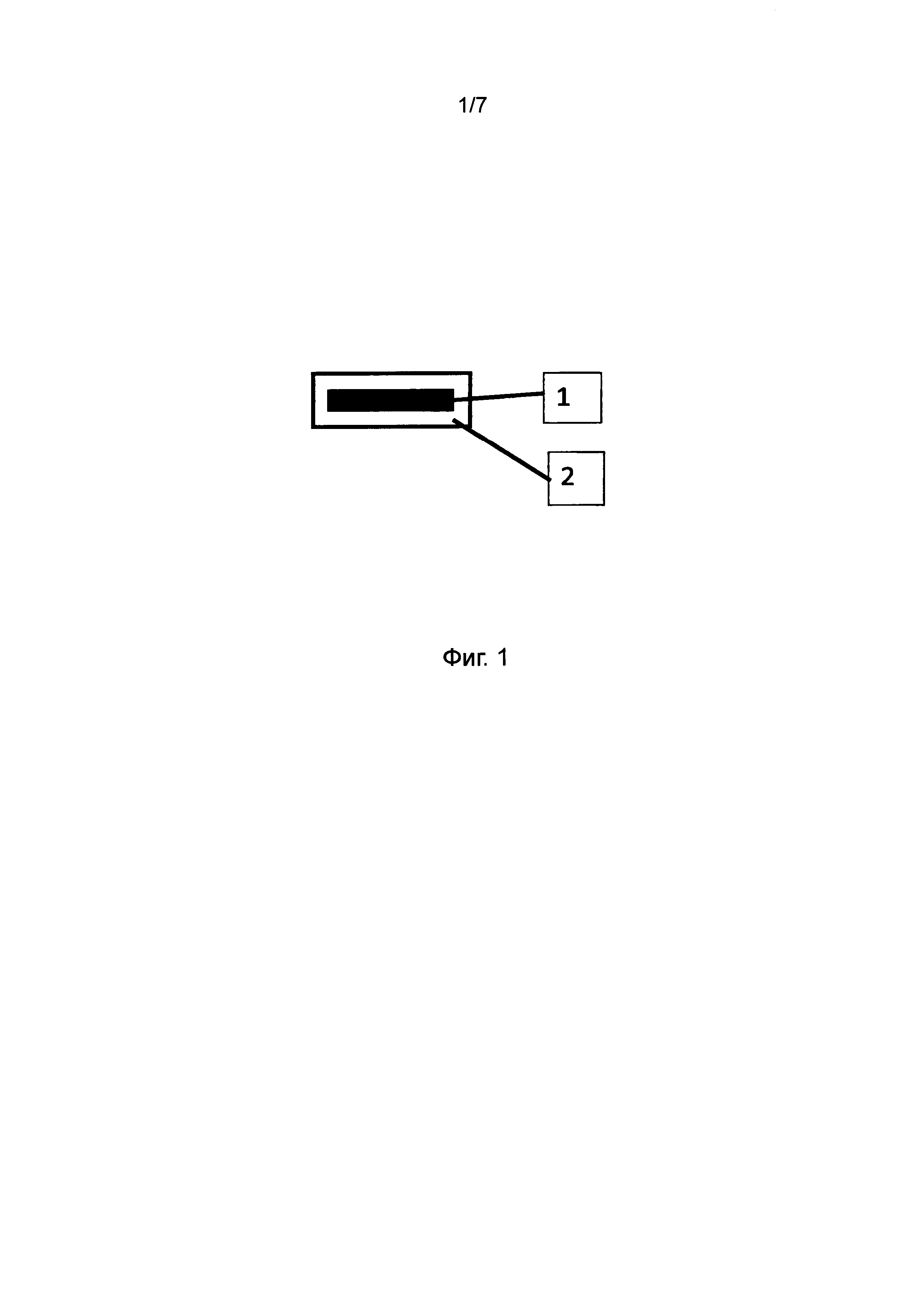
Фиг. 1 представляет схему таблетки с отсроченным высвобождением настоящего изобретения, имеющую ядро таблетки, содержащее препарат, который может высвобождаться немедленно или постепенно, а также наружный эродируемый барьерный слой, контролирующий отсроченное высвобождение. Позиционное обозначение 1 представляет ядро таблетки, а позиционное обозначение 2 - эродируемый барьерный слой.
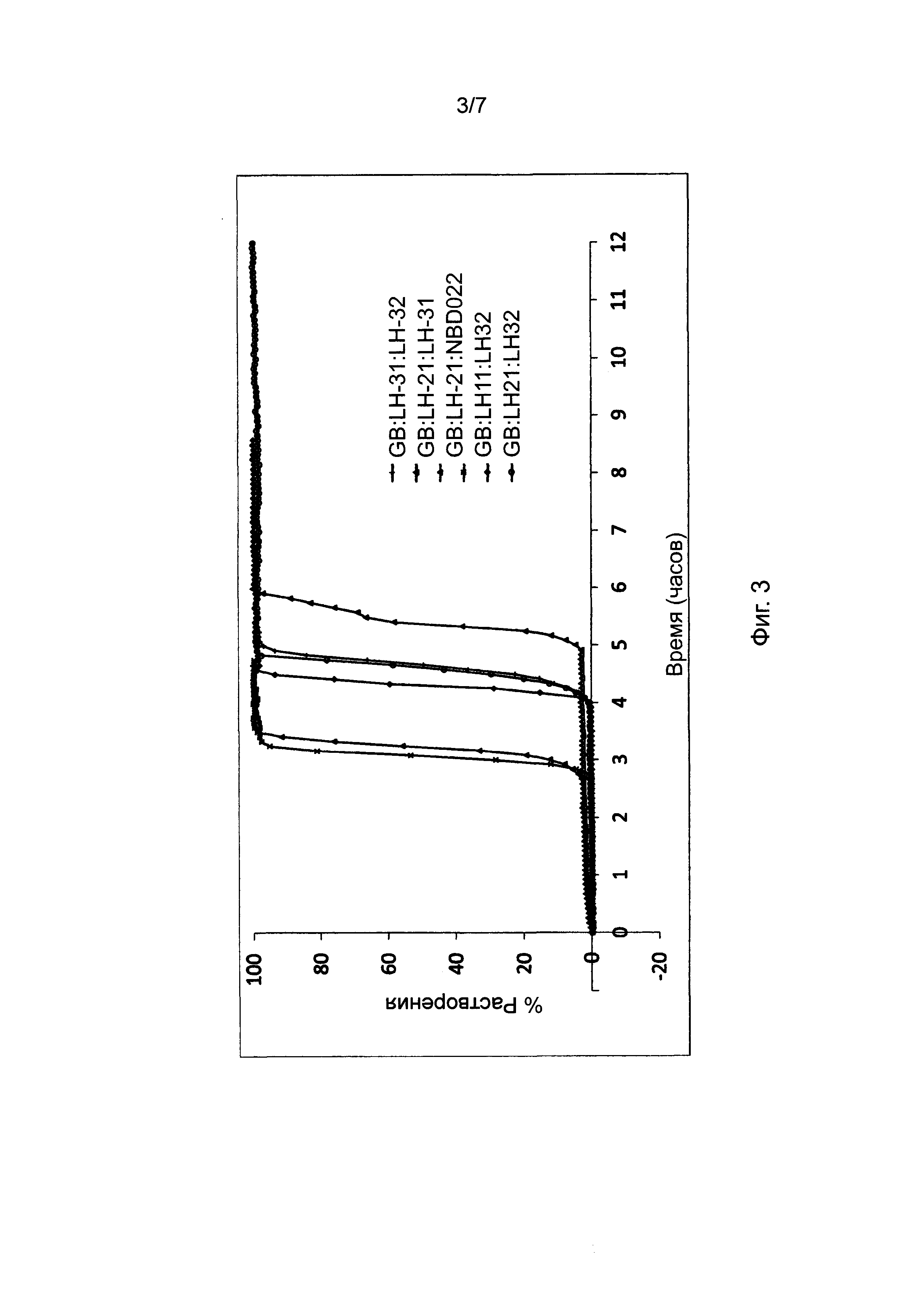
Фиг. 2 представляет профили растворения, полученные для таблеток, в соответствии с настоящим изобретением, при различных соотношениях воск : разрыхлитель в составе барьерного слоя, при фиксированном весе барьерного слоя и фиксированном соотношении LH21:32.
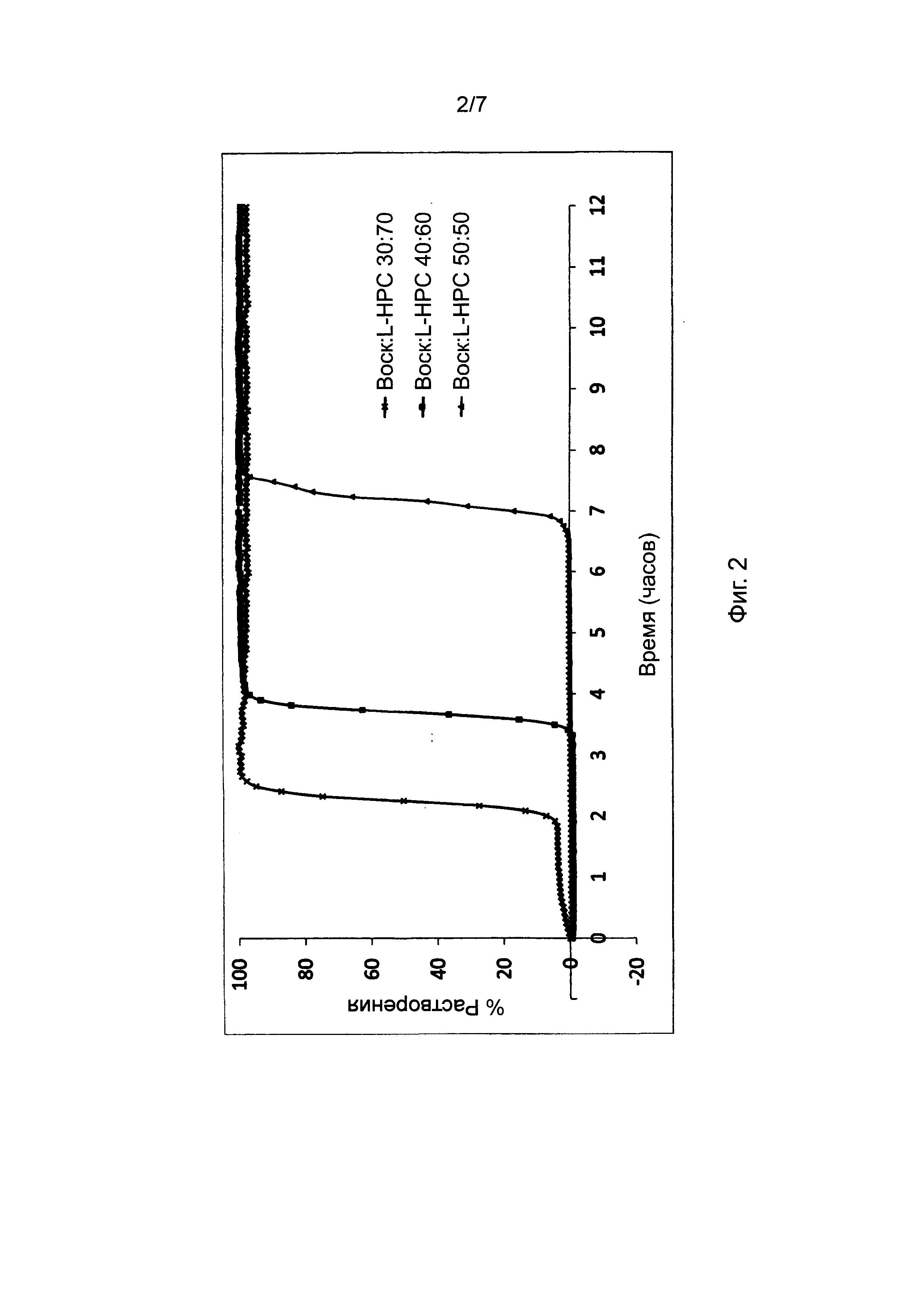
Фиг. 3 представляет профили растворения, полученные для таблеток, в соответствии с настоящим изобретением, при постоянном содержании воска в барьерном слое и постоянном соотношении комбинированных фракций L-HPC, но различных комбинациях L-HPC.
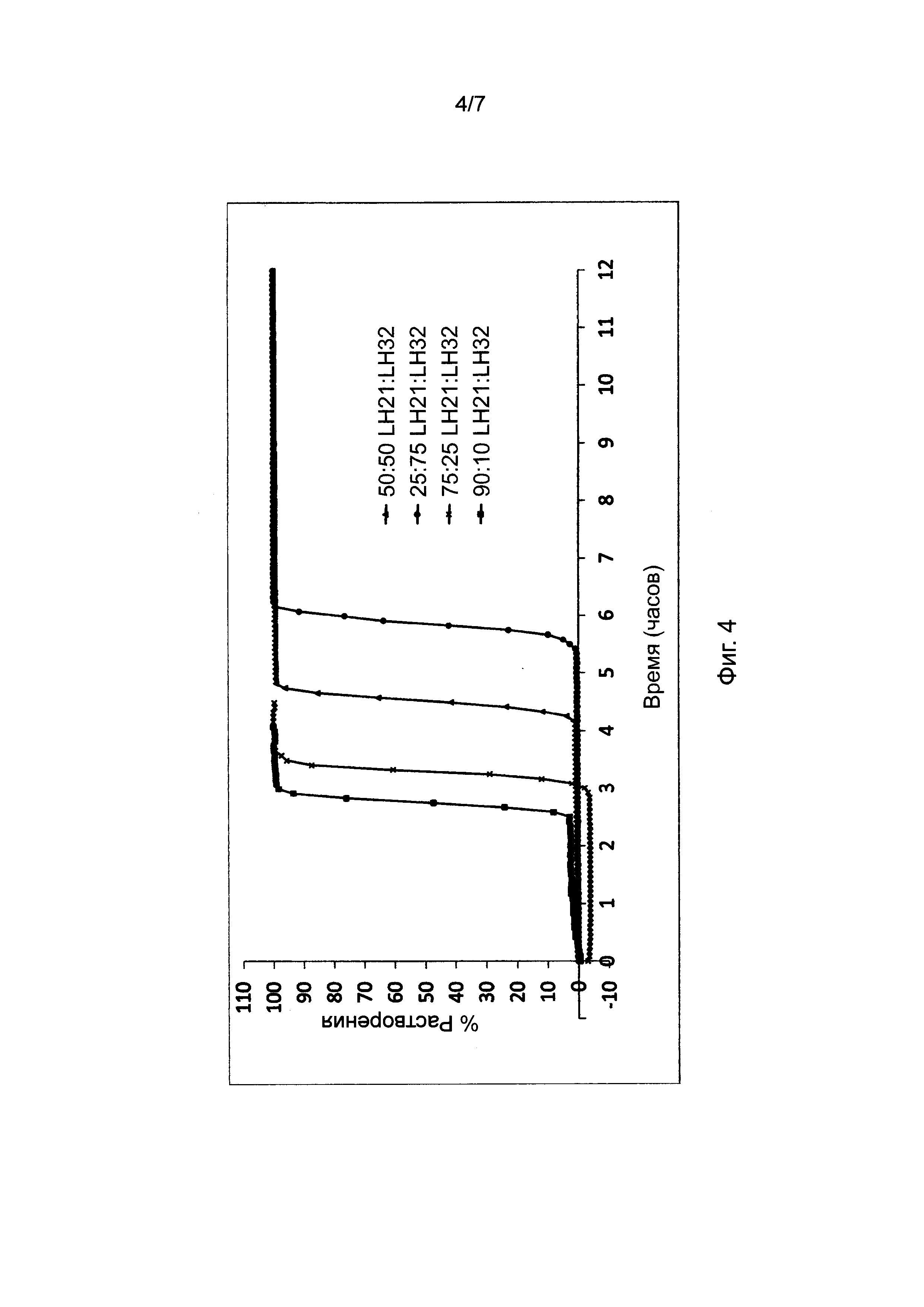
Фиг. 4 представляет профили растворения, полученные для таблеток, в соответствии с настоящим изобретением, при постоянном содержании воска в барьерном слое и постоянном общем весе барьерного слоя. Отношение L-HPC, используемое в данном исследовании (LH-21 и LH-32), однако, варьирует.
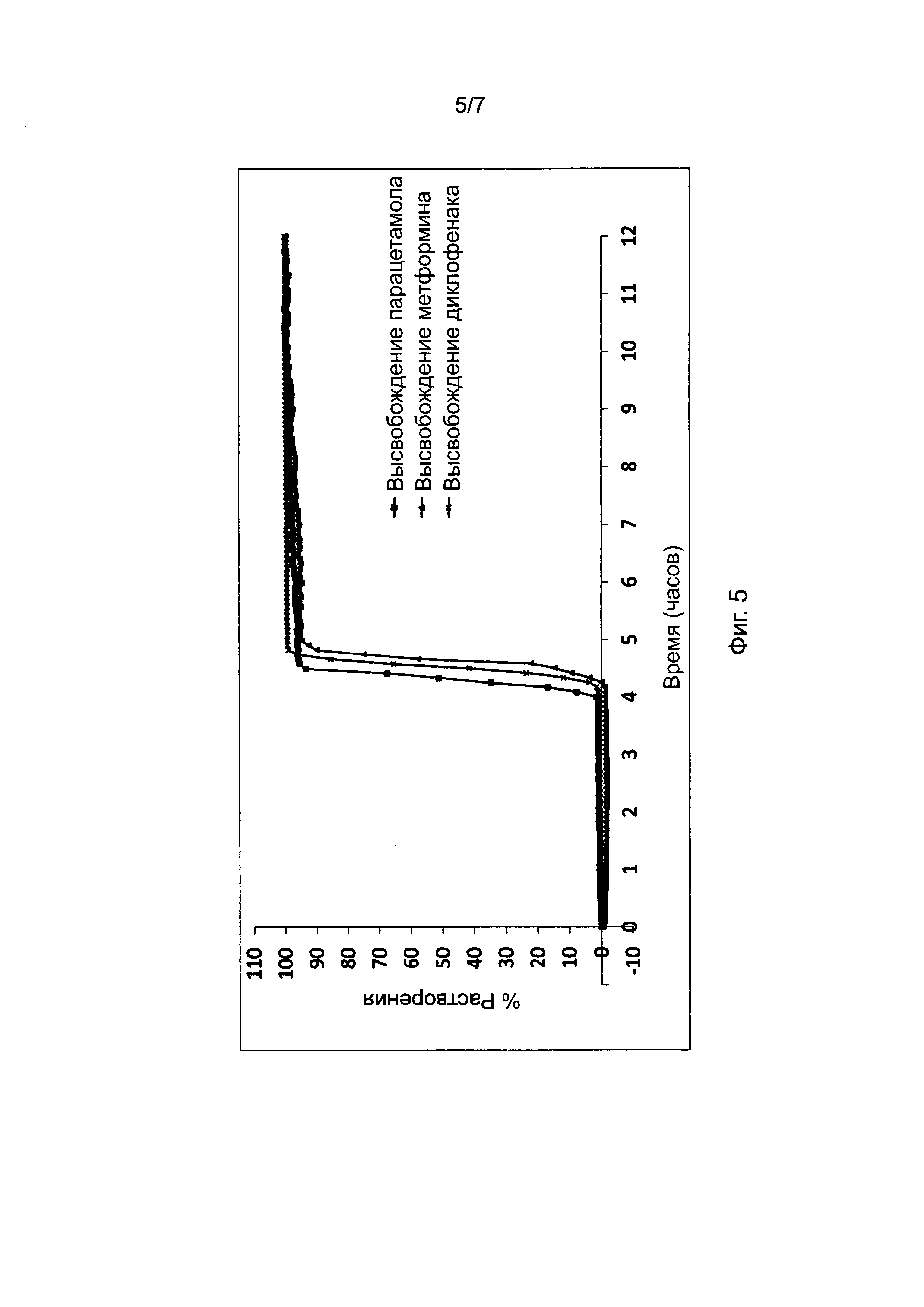
Фиг. 5 представляет профили растворения, полученные для таблеток, в соответствии с настоящим изобретением, и включающие различные варианты активного ингредиента, высвобождаемого из ядра.
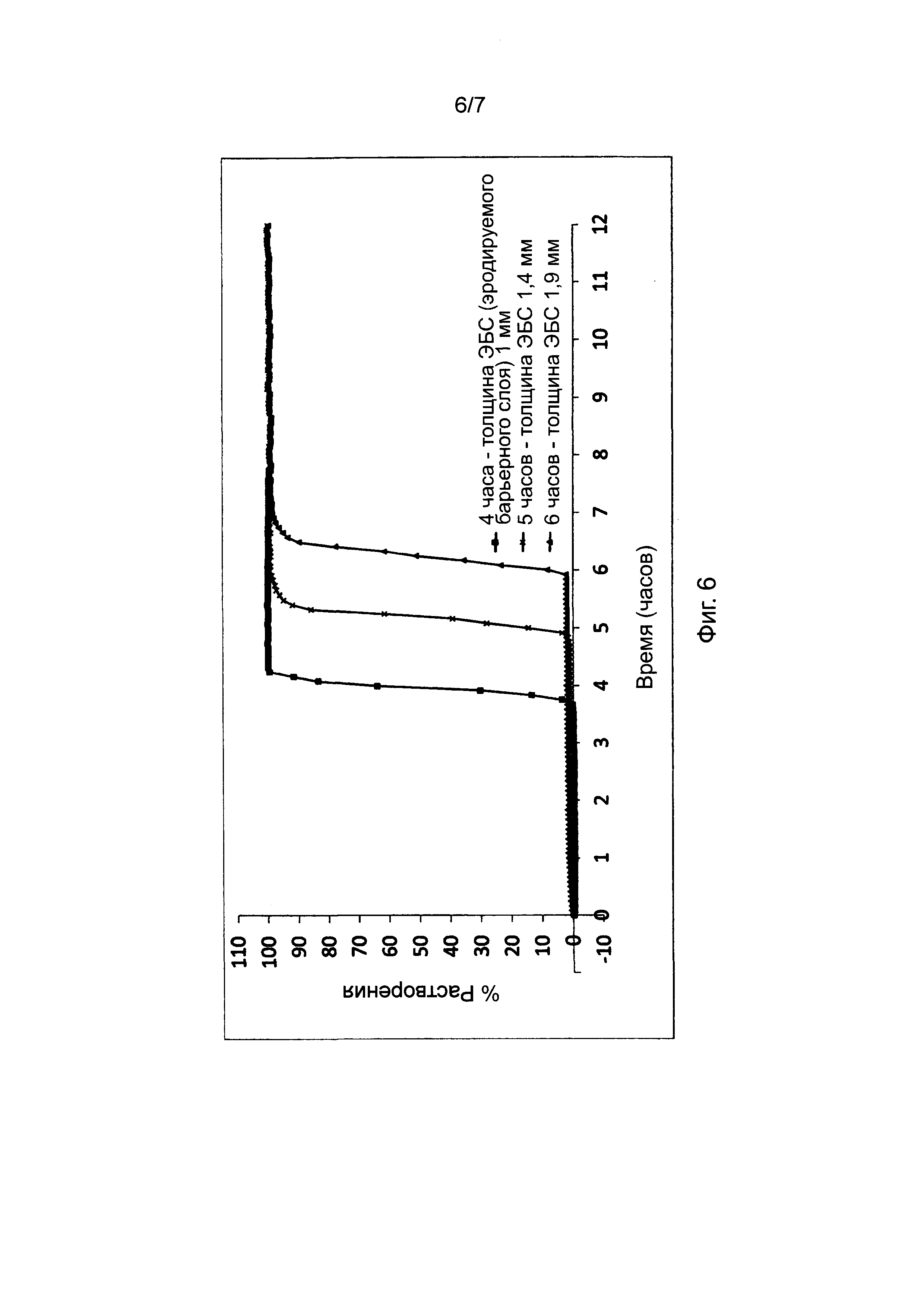
Фиг. 6 представляет профили растворения, полученные для таблеток в соответствии с настоящим изобретением с различной толщиной барьерного слоя и фиксированным рецептурным составом барьерного слоя.
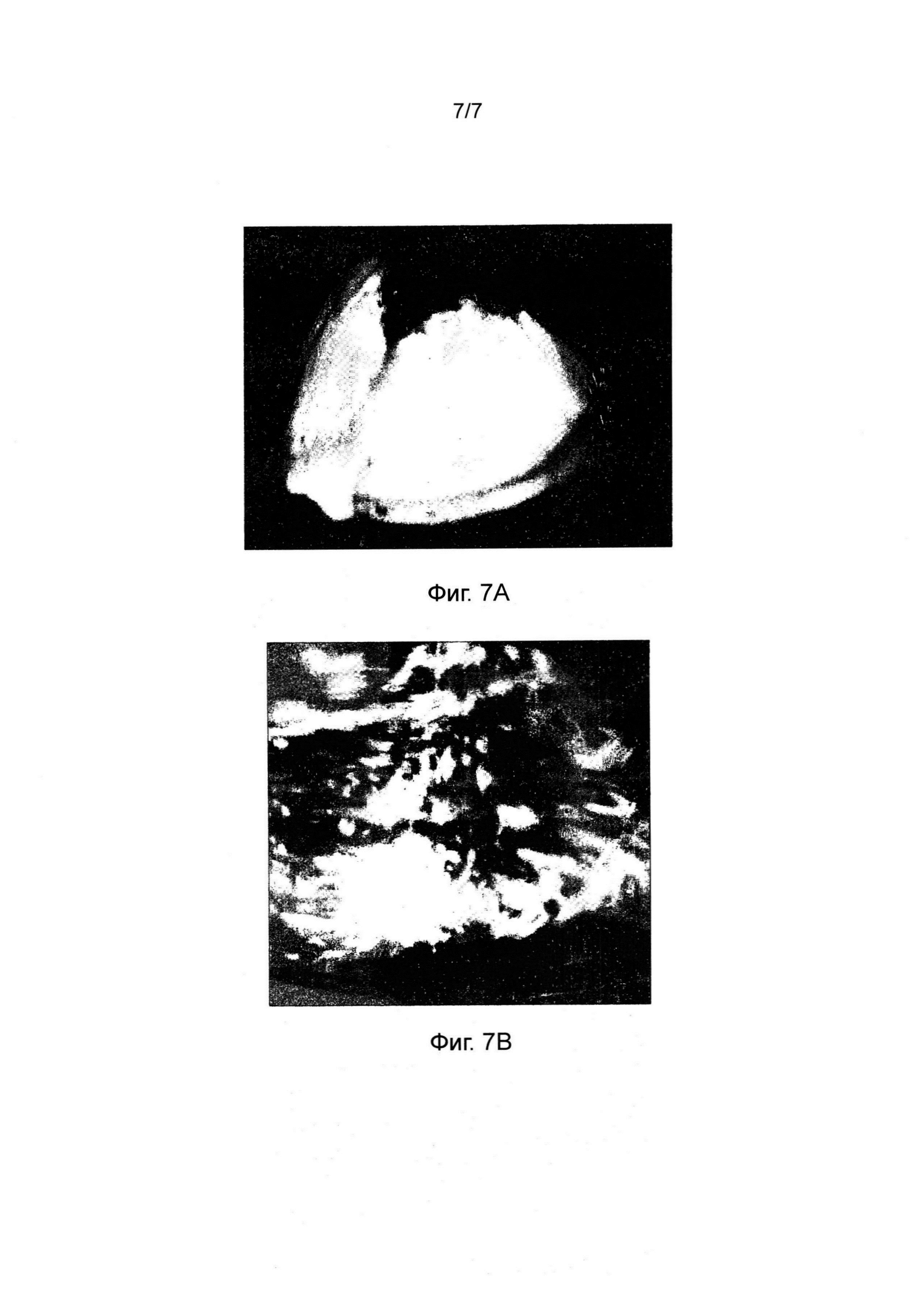
Фиг. 7 представляет изображение эродирования таблетки, изготовленной в соответствии с настоящим изобретением (В), в сравнении с разрывом таблетки, включающей лишь одну фракцию L-HPC (А).
1. Структура таблетки
Формулировка изобретения обеспечивает лечение с отсроченным высвобождением активного ингредиента или ингредиентов. Формулировка представляет собой спрессованную таблетку, покрытую оболочкой и произведенную при помощи простых, хорошо понятных фармацевтических процессов. Контроль периода отсрочки перед высвобождением достигается путем стабильного эродирования барьерного слоя, который покрывает ядро таблетки, содержащее препарат, путем прессования, с образованием таблетки со специфической структурой (фиг. 1). Контроль эродирования в течение продленного периода достигается путем комбинирования двух или более различных фракций низкозамещенной гидроксипропилцеллюлозы (L-HPC), предпочтительно с различными размерами частиц и предпочтительно с по меньшей мере одними частицами малого размера и одними частицами крупного размера.
2. Производство ядра таблетки.
Может использоваться любое ядро таблетки при условии того, что ее размер является приемлемым для приема внутрь, например, человеком. В данном примере использовался следующий процесс влажного гранулирования для получения ядра таблетки с немедленным высвобождением.

Вес воды, использованной в процессе гранулирования, составляет примерно 72% (по весу) от веса окончательной готовой смеси (или 81% (по весу) от веса внутригранулярной смеси). 100 мг смеси для ядра спрессовывают до твердости 4-5 килопондов (39,23-49,03 Н) и толщины 3,4 мм ± 0,17 мм при помощи 6 мм двояковыпуклого пуансона и матрицы.
3. Производство гранул эродируемого барьерного слоя

- Все вспомогательные вещества перемешивают путем переворачивания в течение 5 минут.
- Смесь обрабатывают посредством термоплавкого гранулирования (хотя также могут использоваться иные процессы гранулирования). Будучи еще теплыми, гранулы пропускают через вибрационный гранулятор при помощи 1 мм сита и собирают.
Компрессия состава:
Проводят компрессию гранул эродируемого барьерного слоя вокруг 6 мм ядра таблетки при помощи стандартных методик компрессии оболочек, используя 10 мм двояковыпуклый пуансон и матрицу, до достижения твердости от 5 до 10 килопондов (от 49,03Н до 98,07Н). Ядро таблетки полностью покрывают равномерным слоем гранул.
4. Исследования высвобождения препарата in vitro
Исследования растворения проводились на таблетках, приготовленных в соответствии с настоящим изобретением, при помощи автоматизированного аппарата для растворения ADT8 USP типа II (TDT08L Bath 1105230, Electrolab Inc., Купертино, США); скорость лопасти-мешалки составила 50 об/мин, исследование проводилось при температуре 37°С ± 0,5°С. Растворение проводили в 900 мл фосфатного буфера с рН 6,8. Образцы среды растворения забирали каждые 5 минут и измеряли с применением УФ-анализа при помощи высокоэффективного спектрометра для УФ- и видимой области спектра SP700 (Т70+18- 1815-1-0054, PG Instruments Ltd., Уибтофт, Великобритания). Соответствующие стандартные образцы для активного ингредиента, использованного для приготовления таблеток, измеряли до растворения, используя фосфатный буфер с рН 6,8 в качестве холостого раствора, для получения значения поглощения для 100% высвобождения препарата.
5. Влияние изменения пропорции фракций L-HPC в смеси на высвобождение

В Таблице 1 представлены результаты исследования профиля высвобождения (см. описание в пункте 4 выше) диклофенака калия из состава, соответствующего настоящему изобретению и произведенного в соответствии с описанием, представленным в нумерованных параграфах 2 и 3 выше, с пропорциями воск: L-HPC согласно Таблице 1. Количество бегената глицерина (т.е. воска) в каждой испытуемой таблетке поддерживалось на постоянном уровне, а пропорция L-HPC варьировалась. Результаты четко показывают, что перемешивание пропорции одной фракции L-HPC с другой фракцией в высвобождающем барьере может контролировать эродирование слоя отсроченного высвобождения и, следовательно, время высвобождения вещества из ядра.
6. Влияние увеличения веса барьера отсроченного высвобождения на высвобождение активного ингредиента.
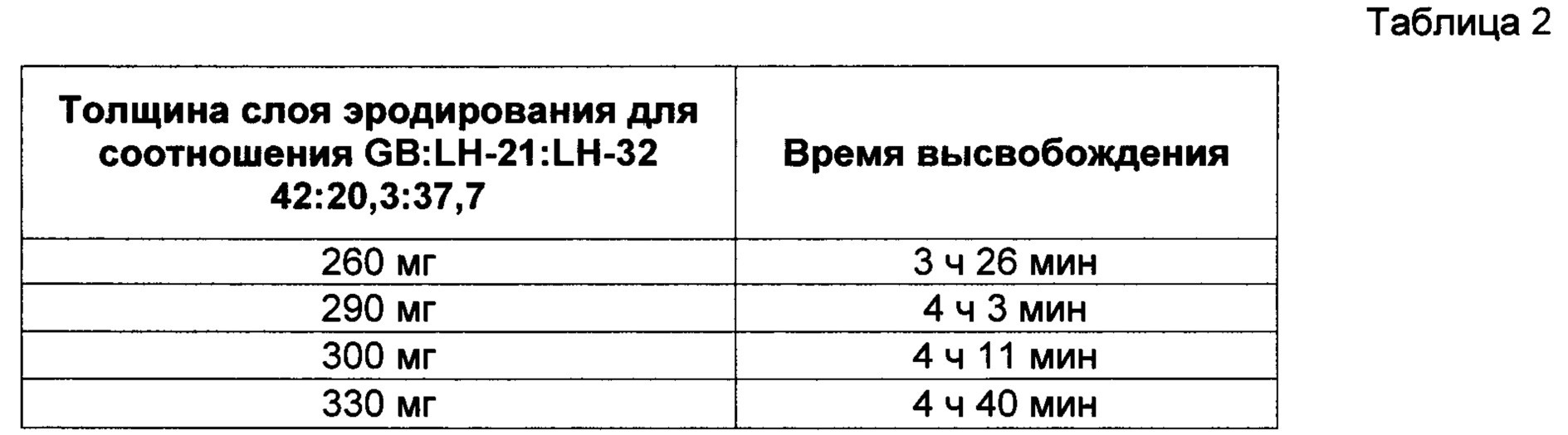
В Таблице 2 представлены результаты исследования профиля высвобождения (см. описание в пункте 4 выше) диклофенака калия из состава, соответствующего настоящему изобретению и произведенного в соответствии с описанием, представленным в нумерованных параграфах 2 и 3 выше, с пропорциями воск : L-НРС согласно Таблице 2. Результаты демонстрируют, что увеличение толщины высвобождающего барьера соответствует увеличению времени отсрочки высвобождения диклофенака калия; тем самым демонстрируется контролируемость высвобождения путем контроля толщины высвобождающего барьера в настоящем изобретении.
7 Влияние изменений пропорции воск : L-НРС в высвобождающем барьере
Проведено исследование профиля высвобождения (см. описание в пункте 4 выше) диклофенака калия из состава, соответствующего настоящему изобретению и произведенного в соответствии с описанием, представленным в нумерованных параграфах 2 и 3 выше, и пропорциями воск : L-НРС согласно данным, представленным ниже. Использовались соотношения воск: разрыхлитель от 30:70 до 70:30 (с фиксированным соотношением LH 21:32 и постоянным весом высвобождающего барьера):
i. 30:70 (поддерживалось соотношение LH21 : LH32, равное 38:68)
ii. 40:60 (поддерживалось соотношение LH21 : LH32, равное 38:68)
iii. 50:50 (поддерживалось соотношение LH21 : LH32, равное 38:68)
iv. 70:30 (поддерживалось соотношение LH21 : LH32, равное 38:68)
Результаты представлены в Фигуре 2, Таблицах 3 и 4. По мере увеличения содержания воска в высвобождающем барьере время отсрочки до высвобождения увеличивается. Было обнаружено, что при используемом составе смеси LH таблетка 70:30 не высвобождала активный ингредиент из своего ядра в течение периода исследования.

(ОСО = относительное стандартное отклонение)
Данные по растворению, полученные для различных соотношений воск : разрыхлитель в составе барьерного слоя, фиксированного веса высвобождающего барьера и фиксированного отношения LH21:32, демонстрирующие влияние общего содержания воска на продолжительность периода отсрочки до высвобождения; в ядре с немедленным высвобождением содержался диклофенак.
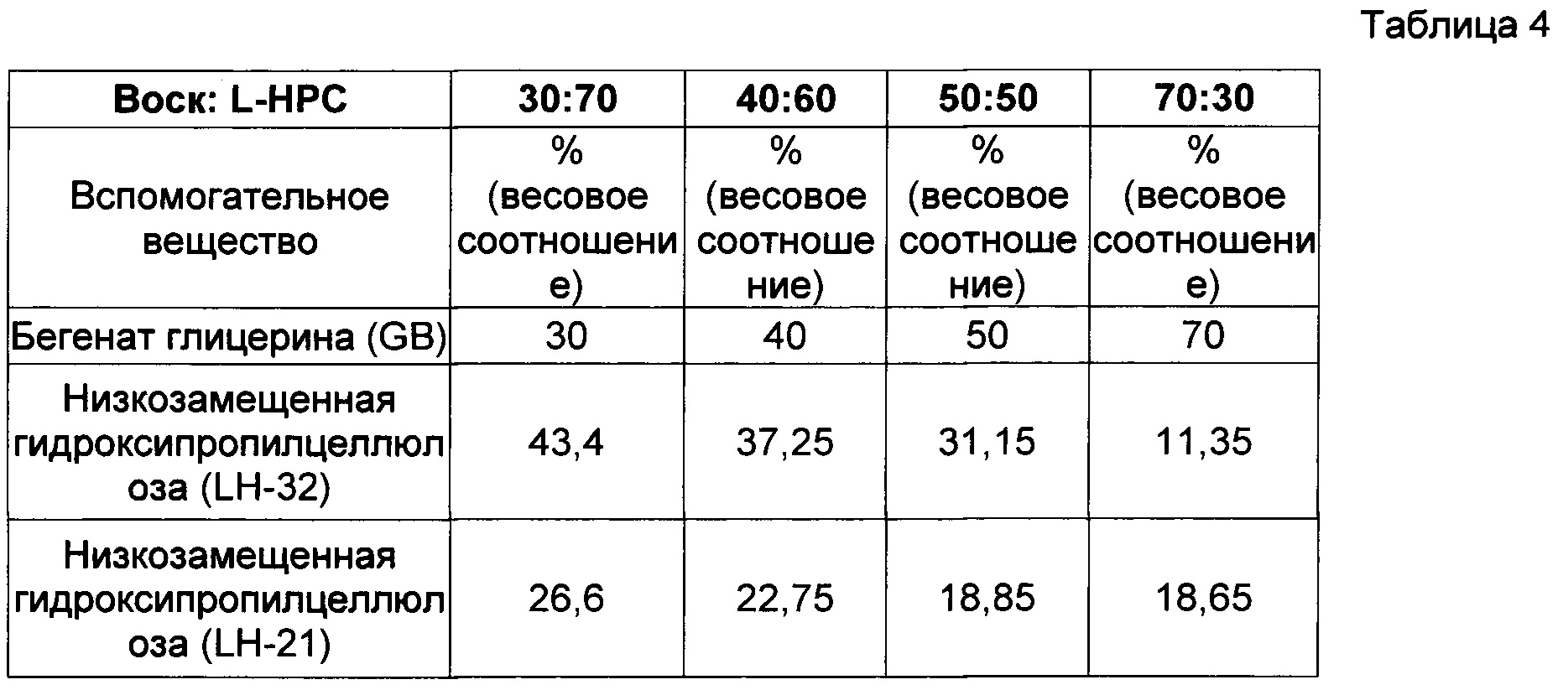
Состав рецептур, использованных для получения вышеописанных профилей растворения с различными соотношения воск : разрыхлитель в составе барьерного слоя и фиксированным соотношением LH21:32.
8. Влияние комбинаций фракций L-HPC на профиль растворения
В Фигуре 3 представлены результаты исследования профиля высвобождения (см. описание в пункте 4 выше) диклофенака калия из состава, соответствующего настоящему изобретению и произведенного в соответствии с описанием, представленным в нумерованных параграфах 2 и 3 выше, и пропорциями воск: комбинации L-HPC согласно Таблице 5. Содержание воска в высвобождающем барьере было постоянным, как и соотношение комбинированных фракций L-HPC.
Представленные ниже данные говорят о том, что комбинирование фракций L-HPC с различными химическими свойствами в рамках одного и того же фиксированного соотношения их в барьерном слое может иметь значительное влияние на время отсрочки высвобождения активного ингредиента. Таким образом, демонстрируется, что достаточные уровни контроля профиля высвобождения могут достигаться путем контроля комбинации фракций L-HPC.
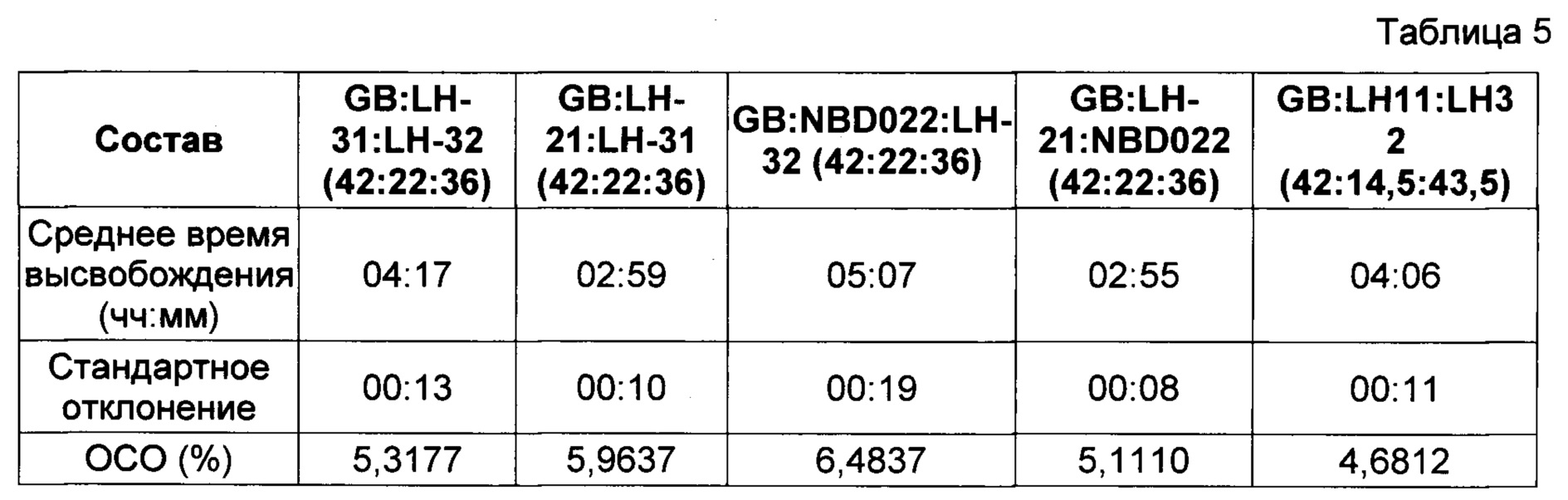
Хотя можно увидеть, что типичный подбор комбинаций фракций L-HPC с высоким уровнем гидроксипропоксильных групп обеспечивает укорочение периода отсрочки (см. комбинацию LH-21 и LH-31), а подбор комбинаций фракций L-HPC с низким уровнем гидроксипропильных групп обеспечивает удлинение периода отсрочки (см. комбинацию NBD-022 и LH-32), подбор L-HPC с комбинациями содержания гидроксипропоксильных групп обеспечивает получение промежуточных периодов отсрочки высвобождения. Помимо этого, подбор комбинаций L-HPC с достаточным различием размеров частиц может значительно изменять время отсрочки высвобождения; сравните результаты для LH-21 и NBD-022 (обе фракции с частицами среднего размера) с таковыми для LH-11 и LH-32 (фракции с крупными и микронизированными частицами, соответственно).
9. Влияние пропорции комбинации фракций L-HPC в высвобождающем барьере с постоянным весом и содержанием воска
В фиг. 4 представлены результаты исследования профиля высвобождения (в соответствии с пунктом 4 выше) диклофенака калия из состава, соответствующего настоящему изобретению и произведенного в соответствии с описанием, представленным в нумерованных параграфах 2 и 3 выше, и пропорциями воск: комбинации L-HPC согласно Таблице 6. Содержание воска в высвобождающем барьере и общий вес высвобождающего барьера оставались постоянными. Соотношения L-HPC, использованные в данном исследовании (LH-21 и LH-32), были следующими: 25:75, 50:50, 75:25, 90:10.
Как мы видим из следующего графика, повышение количества LH32 по отношению к LH21 приводит к увеличению времени отсрочки. В прошлых исследованиях было установлено, что при отдельном использовании фракции LH32 (например, в рецептуре, соответствующей настоящему изобретению, но в случае использования всего одной фракции L-HPC в высвобождающем барьере) получали большее время отсрочки, чем при отдельном использовании фракции LH31. Была обнаружена проблема, связанная с данной одиночной рецептурой L-HPC, которая состояла в том, что при ее отдельном использовании фракция LH32 не эродировалась, а вместо этого рецептура раскрывалась по механизму разрыва. Таким образом, манипуляции с соотношениями фракций LH обеспечивают более контролируемое высвобождение с большими временами отсрочки, при это поддерживая ключевые свойства эродирования.
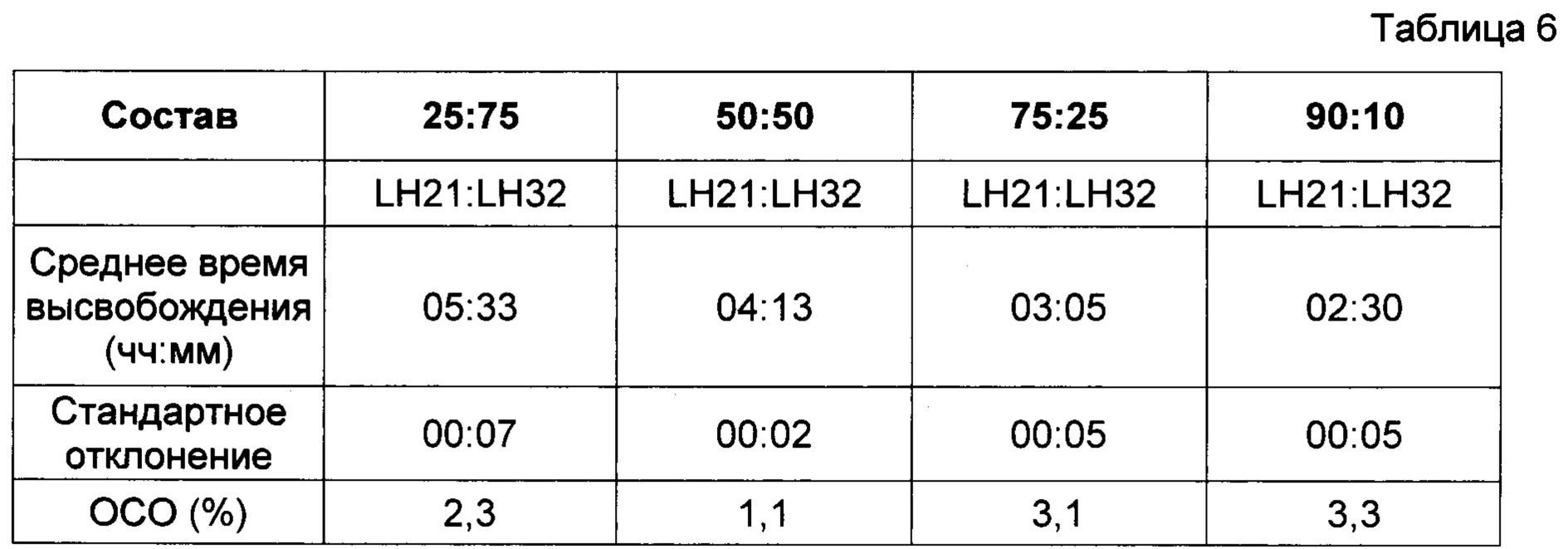
(ОСО = относительное стандартное отклонение)
10. Эффект различных активных ингредиентов в ядре таблетки
Фиг. 5 показывает, что активный ингредиент в ядре таблетки не влияет на период отсрочки до высвобождения активного ингредиента. Пропорции воска и комбинаций фракций L-HPC были постоянными для каждой таблетки и представлены в Таблице 7. Таблетки в исследовании, однако, отличались друг от друг активным ингредиентом, содержавшимся в их ядре. Различные активные ингредиенты, включавшиеся в ядро изучаемых таблеток, отбирались из следующего перечня: - Парацетамол 25 мг, Метформин 25 мг и Диклофенак 25 мг.
Как видно из результатов (после практического анализа в соответствии с пунктом 4 - см. выше), на характер поведения рецептур, соответствующих настоящему изобретению, не влиял выбор активного ингредиента, включенного в рецептуру. Следовательно, можно заключить, что таблетки, соответствующие настоящему изобретению, являются надежным носителем для доставки любого активного ингредиента, назначаемого внутрь.
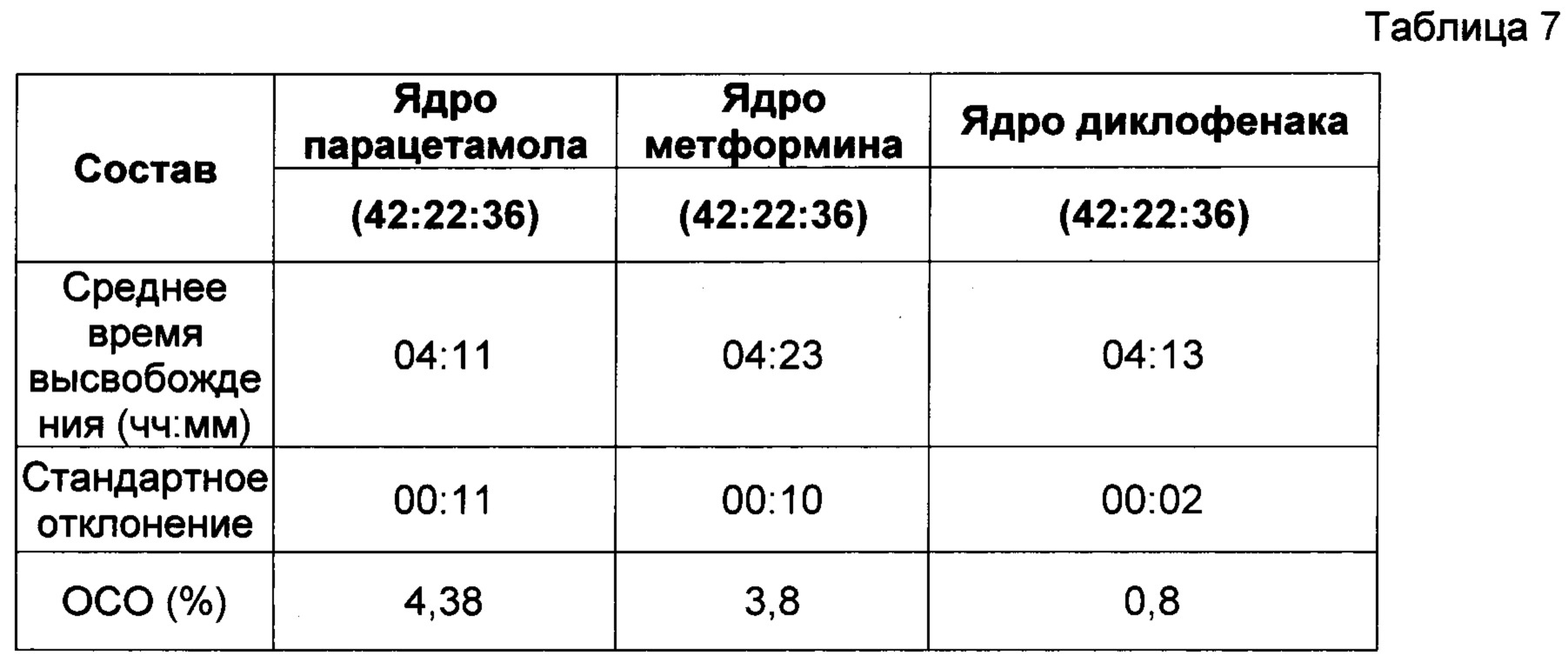
Вышеописанные пропорции 42:22:36 соответствуют соотношению воск : LH21 : LH32.
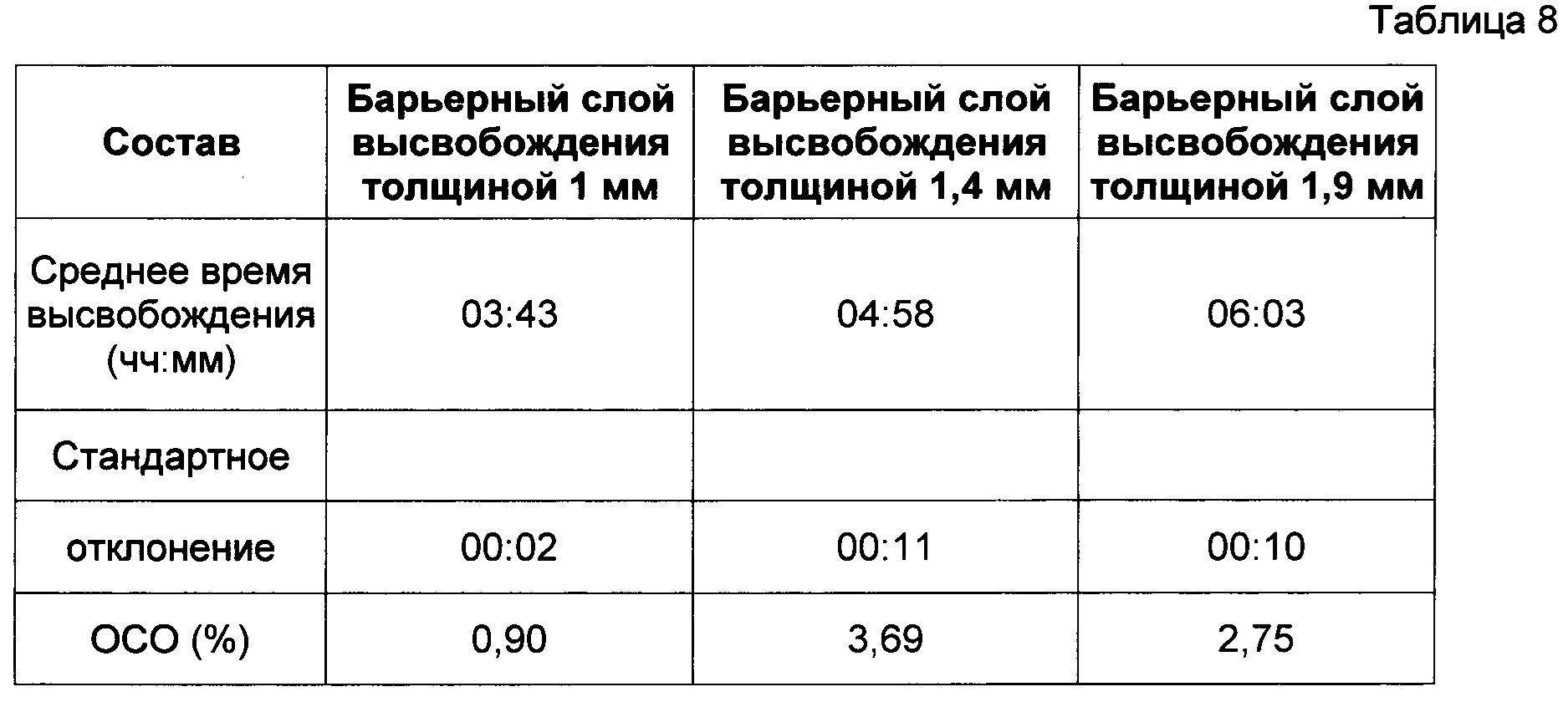
11. Влияние толщины высвобождающего барьера
В Таблице 6 представлены результаты исследования влияния толщины высвобождающего барьера на профиль высвобождения (см. описание в пункте 4 выше) диклофенака калия из состава, соответствующего настоящему изобретению и произведенного в соответствии с описанием, представленным в нумерованных параграфах 2 и 3 выше, и пропорциями согласно Таблице 8. Пропорции воска и комбинаций фракций L-HPC были постоянными для каждой таблетки, т.е. 42:22:36 для GB : LH21 : LH32.
Как мы видим из Фигуры 6, увеличение толщины барьерного слоя, который мы добавляем к ядру таблетки, приводит к увеличению времени отсрочки до высвобождения. Толщину измеряли при помощи цифровых толщиномеров на таблетке, которую разделяли пополам для демонстрации слоев. Величину толщины ядра вычитали из общей толщины таблетки для получения величины высвобождающего барьера.
12. Влияние комбинации фракций L-HPC в сравнении с одиночной фракцией L-НРС в рецептуре
Первую таблетку готовили в соответствии с настоящим изобретением и описанию в пунктах 2 и 3 выше. Вторую таблетку готовили так же, лишь с тем отличием, что она содержала 58% (по весу) фракции LH-32 в высвобождающем слое (т.е. она была единственной фракцией L-HPC в рецептуре). Эродирование каждой таблетки изучали в соответствии с описанием в пункте 4 выше. Изображения, снятые в момент высвобождения активного вещества из каждой таблетки, представлены на фиг. 7(A) (для второй таблетки) и фиг. 7(B) (для первой таблетки).
Из этих изображений ясно, что рецептура, включающая лишь одну фракцию L-HPC, подверглась разрыву с образованием конфигурации "открытой ракушки", в то время как таблетка с рецептурой, соответствующей настоящему изобретению, продемонстрировала более последовательное эродирование.