Результат интеллектуальной деятельности: Новый способ получения эверолимуса
Вид РИД
Изобретение
Область техники
Настоящее изобретение раскрывает способы получения эверолимуса, а также его промежуточных соединений с использованием 2-((тризамещенныхсилил)окси)этил сульфонатов.
Уровень техники
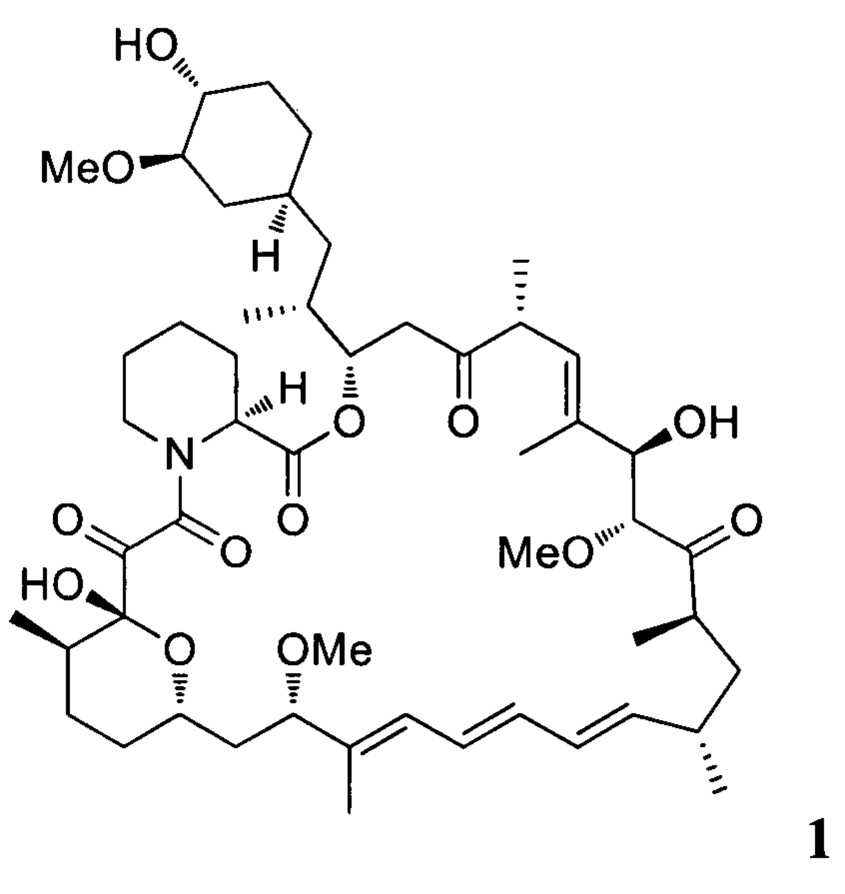
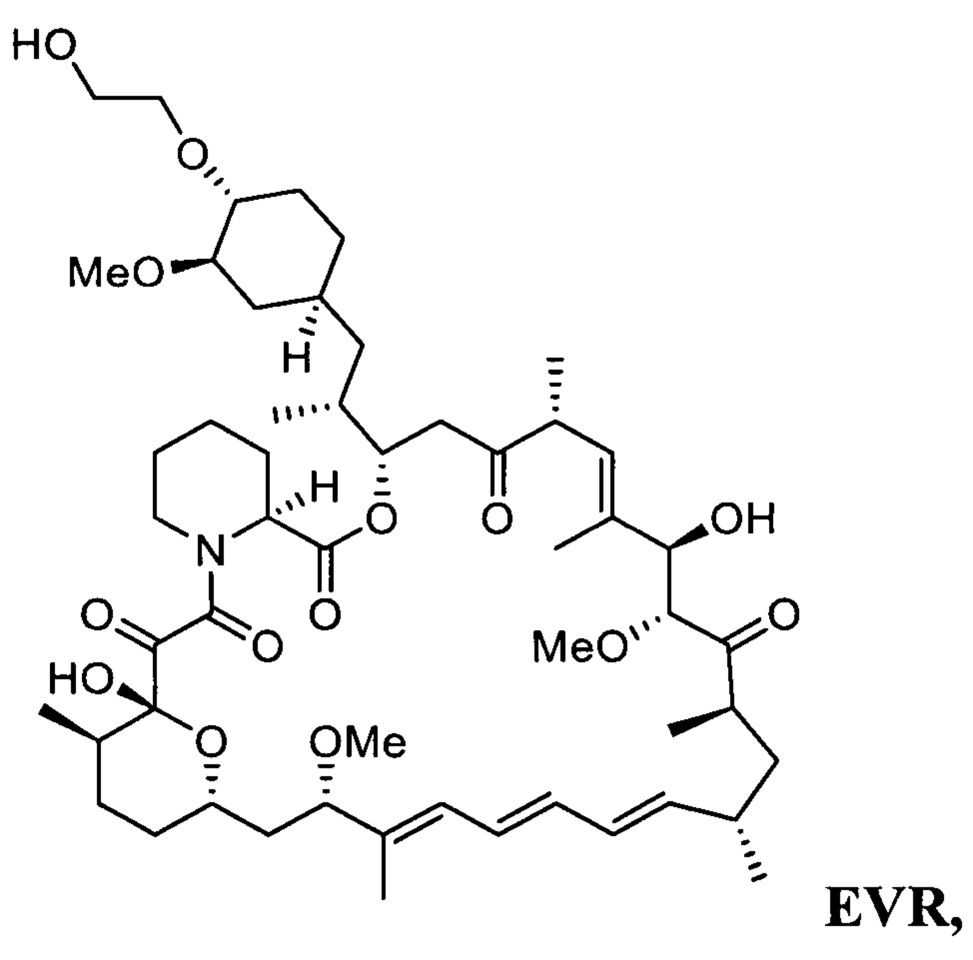
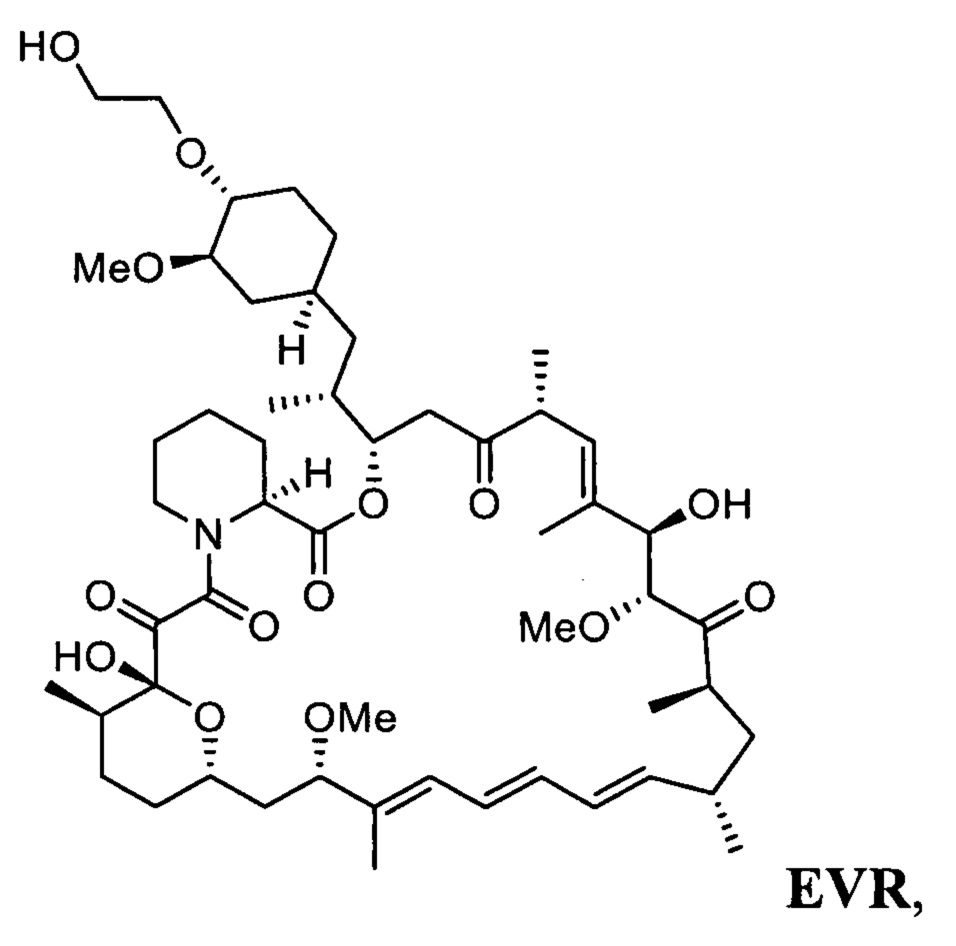
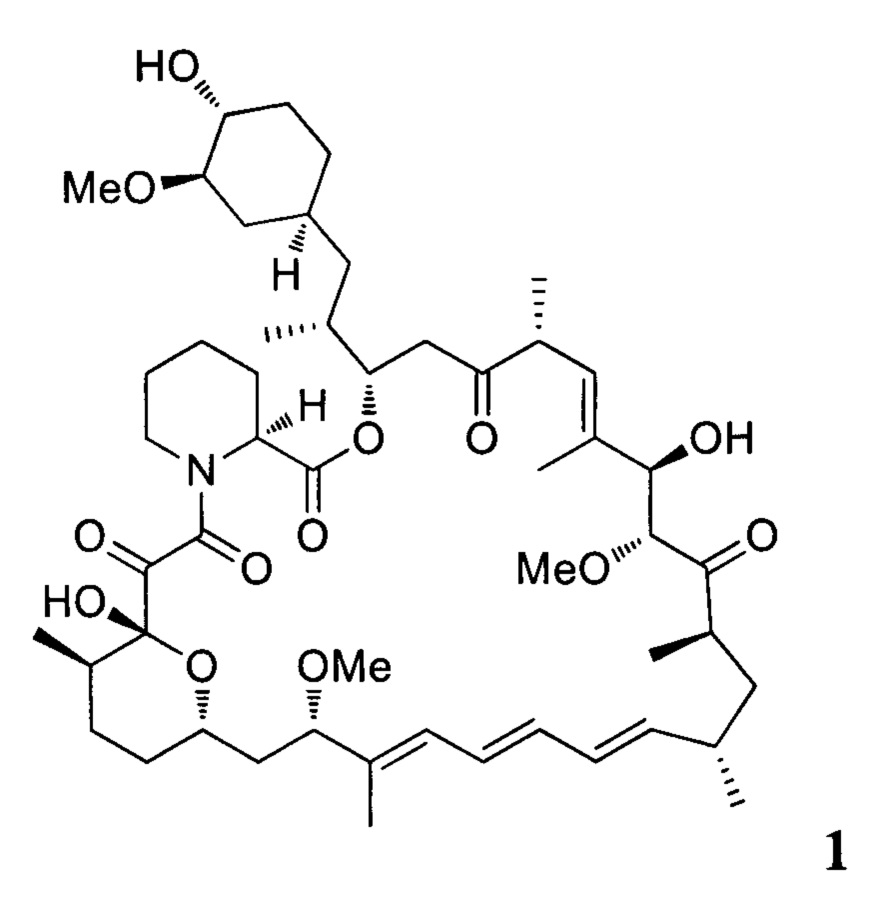
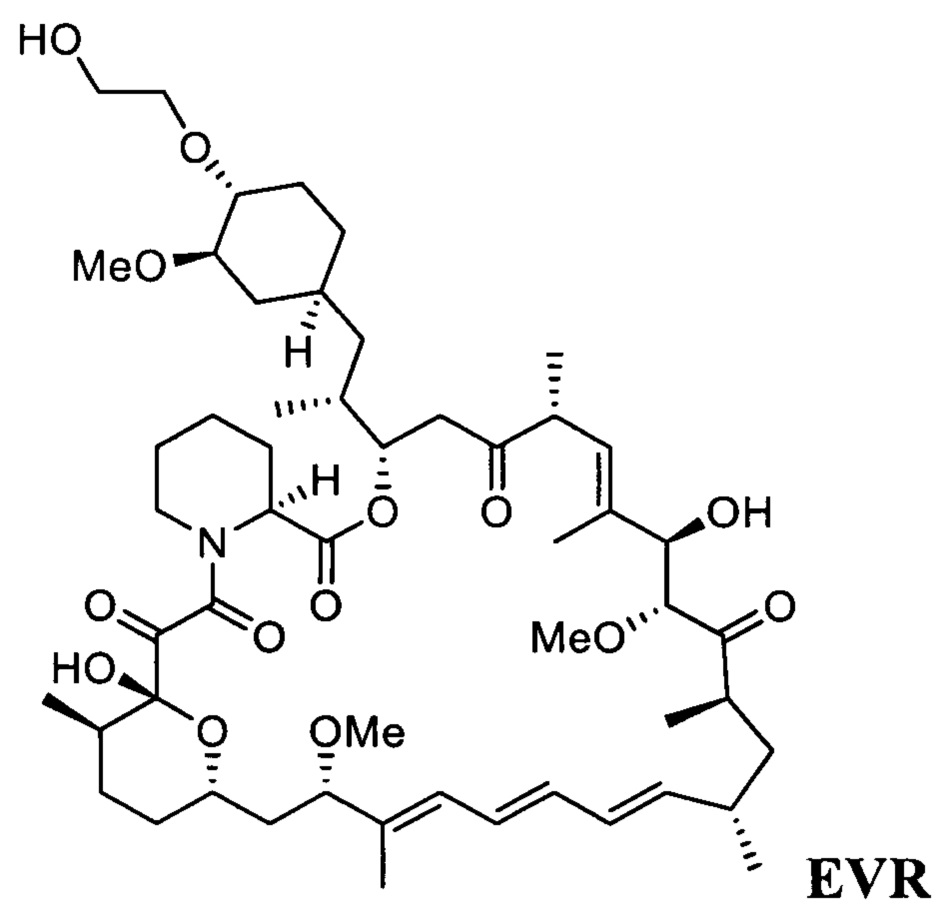
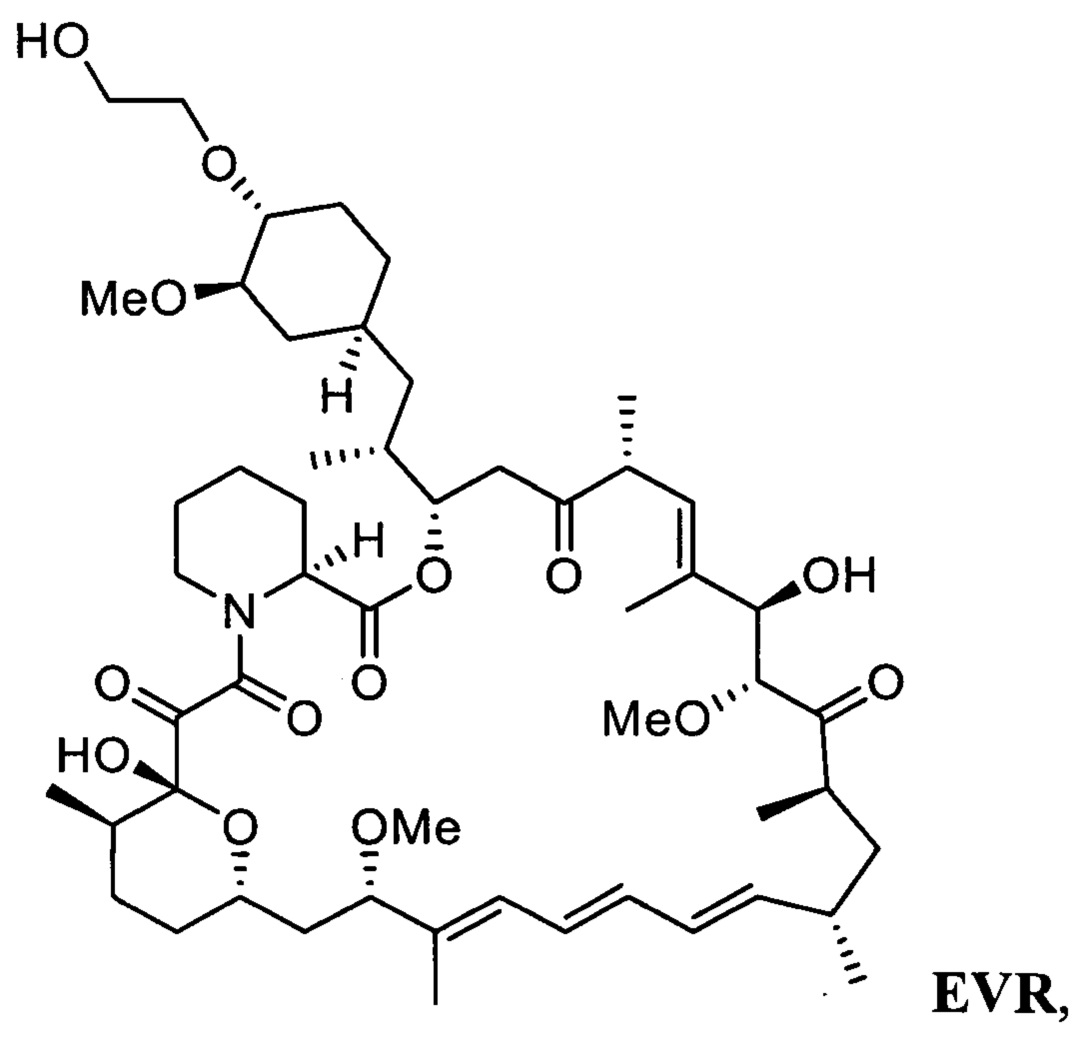
Эверолимус (40-О-(2-гидрокси)этилрапамицин, EVR) - синтетическое производное рапамицина (сиролимуса) - принадлежит к классу mTOR ингибиторов и главным образом используется как иммуносапрессант для подавления отторжения трансплантируемых органов и при лечении разных типов рака, таких как рак желудка, почек и лимфом [СНМР assessment report for Afmitor, ЕМЕА/533232/2009].
Способы получения эверолимуса раскрываются в документах WO 1994/09010 A1, [Moenius, Т. et al. (2000) J. Labelled Cpd. Radiopharm. 43, 113-120], WO 2012/066502 A1, WO 2012/103959 A1 и заключаются во взаимодействии рапамицина с большими избытками (4-8 эквивалентов) 2-((тризамещенныхсилил)окси)этил трифторметансульфонатов при 50-70°С и использовании 2,6-лутидина или N,N-диизопропилэтиламина в качестве основания с последующим снятием защиты действием растворов минеральных кислот. При этом, выход неочищенного эверолимуса не превышает 17-52%. Недостатками данных способов являются необходимость высокой температуры (50-70°С) для алкилирования рапамицина, которая повышает вероятность деградации рапамицина и протекания побочных процессов, а также использование больших избытков алкилирующего агента, что показывает неэффективность процесса и способствует протеканию побочных процессов.
В международной публикации заявки WO 2014/203185 А1 раскрывается способ использования замещенных аминов в качестве оснований в синтезе эверолимуса, заключающемся в реакции рапамицина с 2-((тризамещеннымисилил)окси)этил трифторметансульфонатами и последующем снятии защиты с получением эверолимуса. Использование таких аминов, как N,N-диизопропилпипент-3-иламин, N,N-диизопропилнон-5-иламин и N,N-диизобутил-(2,4-диметилпент-3-ил)амин привело к уменьшению необходимого избытка алкилирующего агента до 2.5-4 эквивалентов. Суммарный выход неочищенного эверолимуса достигал примерно 67%. Основным недостатком данного способа получения является использование коммерчески недоступных аминов.
В международной публикации заявки WO 2016/207205 А1 раскрывается способ получения эверолимуса из рапамицина. Изобретение заключается в получении 2-((тризамещенныхсилил)окси)этил трифторметансульфонатов из этилен оксида и тризамещенныхсилиловых трифлатов с последующим алкилированием рапамицина при 40-55°С в присутствии N,N-диизопропилэтиламина в качестве основания. Снятие силильной защиты проводят под действием смеси фосфорной и соляной кислот в смеси растворителей с получением неочищенного эверолимуса с суммарным выходом примерно 52%. Основным недостатком изобретения является использование коммерчески недоступных растворов этилен оксида в толуоле. Этилен оксид является газом при нормальных условиях, поставляемом в сжиженном виде в баллонах, приготовление его растворов сопряжено с необходимостью наличия специализированного оборудования и дополнительных рисков, связанных с высокими давлениями и высокой взрывоопасностью при работе со сжиженными газами. Помимо этого, в документе WO 2016/207205 А1 не представлены примеры получения чистого эверолимуса.
Альтернативный способ получения эверолимуса из рапамицина, заключающийся в приготовлении in-situ трифторацетата или трифторметансульфоната этиленгликоля с последующим алкилированием рапамицина при -10°С в присутствии эфирата трехфтористого бора, раскрывает заявка CN 106146535. Выход эверолимуса с чистотой до 98.8% (по данным ВЭЖХ) составил примерно 59%. Недостатком изобретения является использование эфирата трехфтористого бора, который способен расщеплять простые эфиры [Journal of the American Chemical Society, 2007, vol. 129, # 6, p. 1480-1481], что увеличивает вероятность протекания побочных процессов.
В заявке CN 104478898 А раскрывается способ получения эверолимуса, заключающийся в алкилировании рапамицина 2-((трет-бутилдиметилсилил)окси)этил трифторметансульфонатом с использованием в качестве основания гидроксида натрия при 80°С и с последующим снятием защиты с образующегося силил-содержащего производного эверолимуса. В заявке не раскрывается количество эквивалентов алкилирующего агента и выход продукта алкилирования рапамицина. Недостатком является использование сильного неорганического основания и высокой температуры, что способно вызывать деградацию рапамицина и его целевого производного [Tetrahedron Lett., 1993, Vol. 34, # 23, p. 3699-3702].
Таким образом, реакция алкилирования рапамицина протекает с образованием большого числа побочных продуктов, что сильно затрудняет выделение и очистку промежуточных продуктов. В настоящее время существует необходимость в улучшенных способах получения эверолимуса и промежуточных химических соединений, полезных в синтезе эверолимуса. Улучшенные способы получения, позволяющие переводить промежуточные химические соединения, включая возможные примеси, в целевые продукты, могут приводить к улучшению выхода и чистоты конечного продукта, снижать время и/или количество отходов, связанных с существующими способами получения эверолимуса.
Описание изобретения
Ниже приведены определения терминов, которые использованы в описании этого изобретения.
В некоторых вариантах воплощения термин "около" или "приблизительно" или "примерно" означает в пределах 30%, 25%, 20%, 15%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,5%, 0,1% или 0,05% от данного значения или диапазона.
Необязательно замещенный в одном, двух, трех или нескольких положениях обозначает, что описанная группа может быть замещена в одном, двух, трех или от одного до шести положениях любым одним или любой комбинацией радикалов.
«Алкил» означает алифатическую углеводородную линейную или разветвленную группу с 1-12 атомами углерода в цепи, более предпочтительно с 1-6 атомами углерода в цепи. Разветвленная означает, что алкильная цепь имеет один или несколько «низших алкильных» заместителей. Примеры алкильных групп включают, но не ограничиваются ими, низший (C1-С4) алкил или метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил, втор-бутил, трет-бутил, н-пентил, 2-пентил, 3-пентил, нео-пентил, н-гексил. Алкил может иметь заместители.
«Низший алкил» означает линейный или разветвленный алкил с 1-4 атомами углерода.
«Циклоалкил» означает полностью насыщенное карбоциклическое кольцо, содержащее 3-10 атомов углерода в цикле. Примеры циклоалкильных групп включают, но не ограничиваются ими, моноциклические группы, такие как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил или циклодецил, бициклические группы, такие как бициклогептил или бициклооктил. Циклоалкил может иметь заместители, которые могут быть одинаковыми или разными.
«Арил» означает ароматическую моноциклическую или полициклическую систему, включающую от 6 до 14 атомов углерода, преимущественно от 6 до 10 атомов углерода. Примеры арильных групп включают, но не ограничиваются ими, фенил, фенилен, бензолтриил, инданил, нафтил, нафтилен, нафталентриил и антрилен. Арил может иметь заместители циклической системы, которые могут быть одинаковыми или разными. Арил может быть аннелирован с неароматической циклической системой или гетероциклом.
«Гало» или «Галоген» (Hal) означает фтор, хлор, бром и йод.
«Заместитель» означает химический радикал, который присоединяется к молекулярному остову (скэффолду, фрагменту).
«Минеральная кислота» означает неорганическое вещество, способное протонировать воду, обладающее комплексом физико-химических свойств, которые присущи кислотам. Примеры минеральных кислот включают, но не ограничиваются ими, соляная, фосфорная, азотная, серная кислоты.
«Органическая кислота» означает органическое вещество, проявляющее кислотные свойства по отношению к воде, являющееся карбоновой или сульфоновой кислотой. Примеры органических кислот включают, но не ограничиваются ими, карбоновые кислоты: трифторуксусная, муравьиная, щавелевая, сульфоновые кислоты: пара-толуолсульфокислота, бензолсульфокислота.
«С1-С4-алкил спирты» или «низшие спирты» означает органические соединения, содержащие одну или более гидроксильных групп, непосредственно связанных с насыщенным (находящимся в состоянии sp3-гибридизации) атомом углерода С1-С4 алкильной группы. Примеры низших спиртов включают, но не ограничиваются ими, метанол, этанол, 1-пропанол, 2-пропанол, 1-бутанол, 2-бутанол, 3-метилпропан-1-ол, 3-метилпропан-2-ол, этандиол, трет-бутанол, 1,2-пропандиол, 1,3-пропандиол.
Термин «защитная группа» относится к группам, которые применяются для блокирования реакционной способности функциональных групп, таких как аминогруппа, карбоксильная группа или гидроксигруппа. Примерами, без ограничения, защитных групп являются метоксикарбонил, этоксикарбонил, mpem-бутоксикарбонил (Вос), трет-бутил, трифенилметил, пивалоил, бензилоксикарбонил (Cbz), 2-(триметилсилил)этокси) метилацеталь (SEM), триалкилсилил, алкил(диарил)силил или алкил.
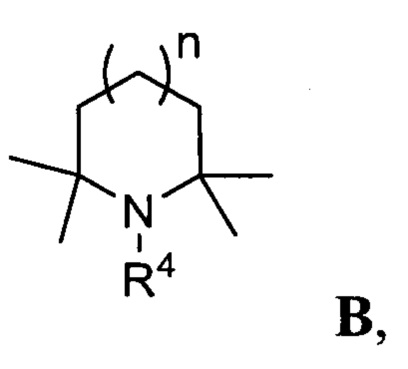
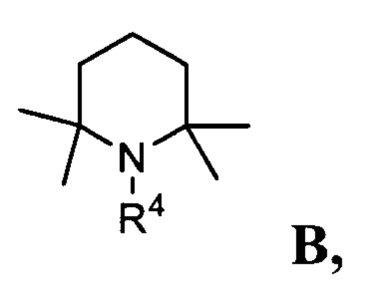
Термин «плотно упакованные основания» относится к соединениям, являющимся циклическими N,α,α,α',α'-пентазамещенными аминами, формулы В

где R4 представляет собой C1-C5 алкил, незамещенный или замещенный одним или несколькими атомами галогена; С6-С14 арил или C5-C8 циклоалкил, незамещенные или замещенные одним или несколькими атомами галогена, C1-С5 алкила, n равно от 0 до 2.
One-pot реакция (реакция в одном сосуде) - это процесс получения веществ путем проведения двух или более последовательных химических реакций в одном реакторе без выделения образующихся промежуточных соединений.
Количество эквивалентов - коэффициент, определяющий соотношение молей реагирующих веществ.
В настоящем описании и в последующей формуле изобретения, если контекстом не предусмотрено иное, слова «иметь», «включать» и «содержать» или их вариации, такие как «имеет», «имеющий», «включает», «включающий», «содержит» или «содержащий», следует понимать, как включение указанного целого или группы целых, но не исключение любого другого целого или группы целых.
Список условный сокращений


Подробное описание изобретения.
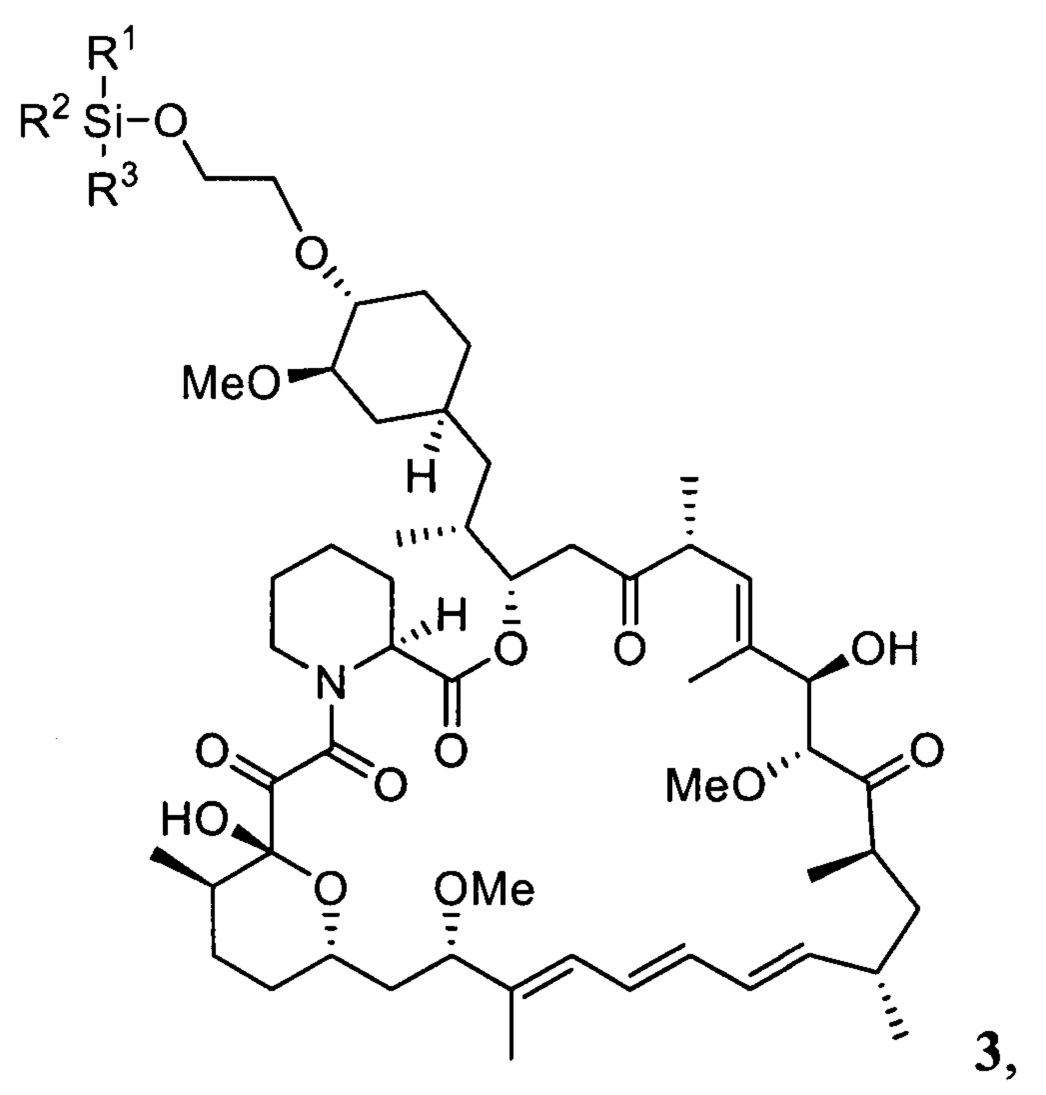
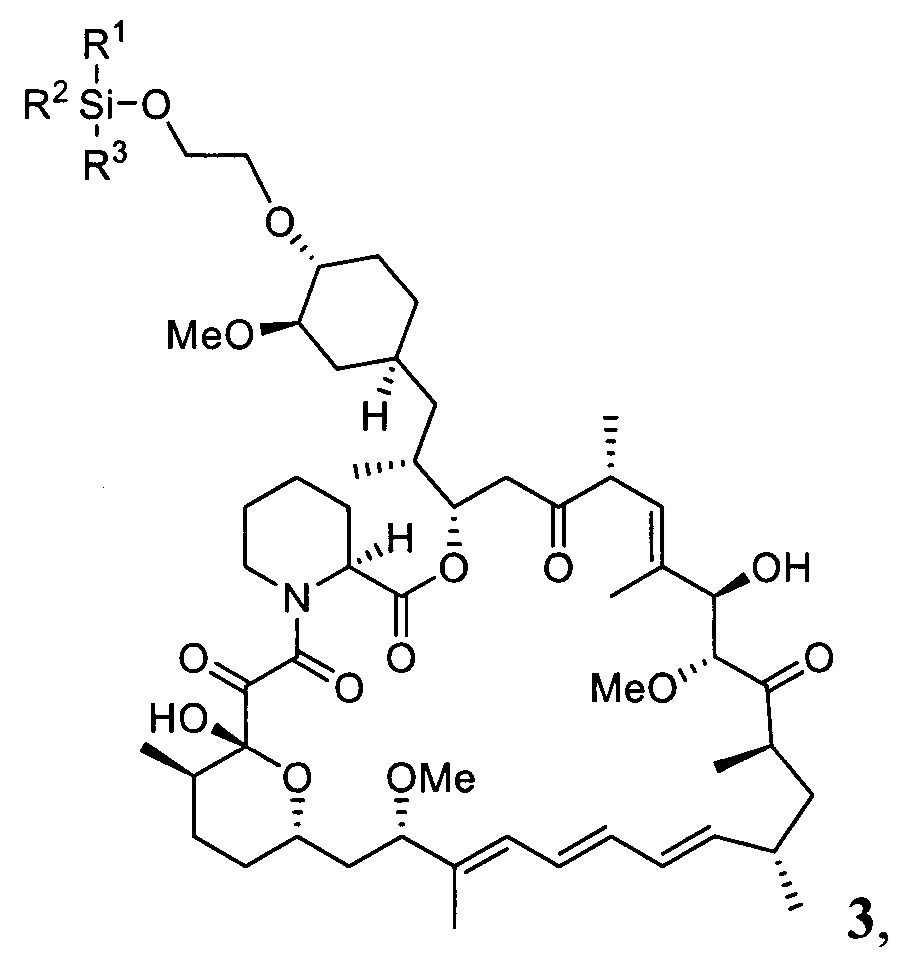
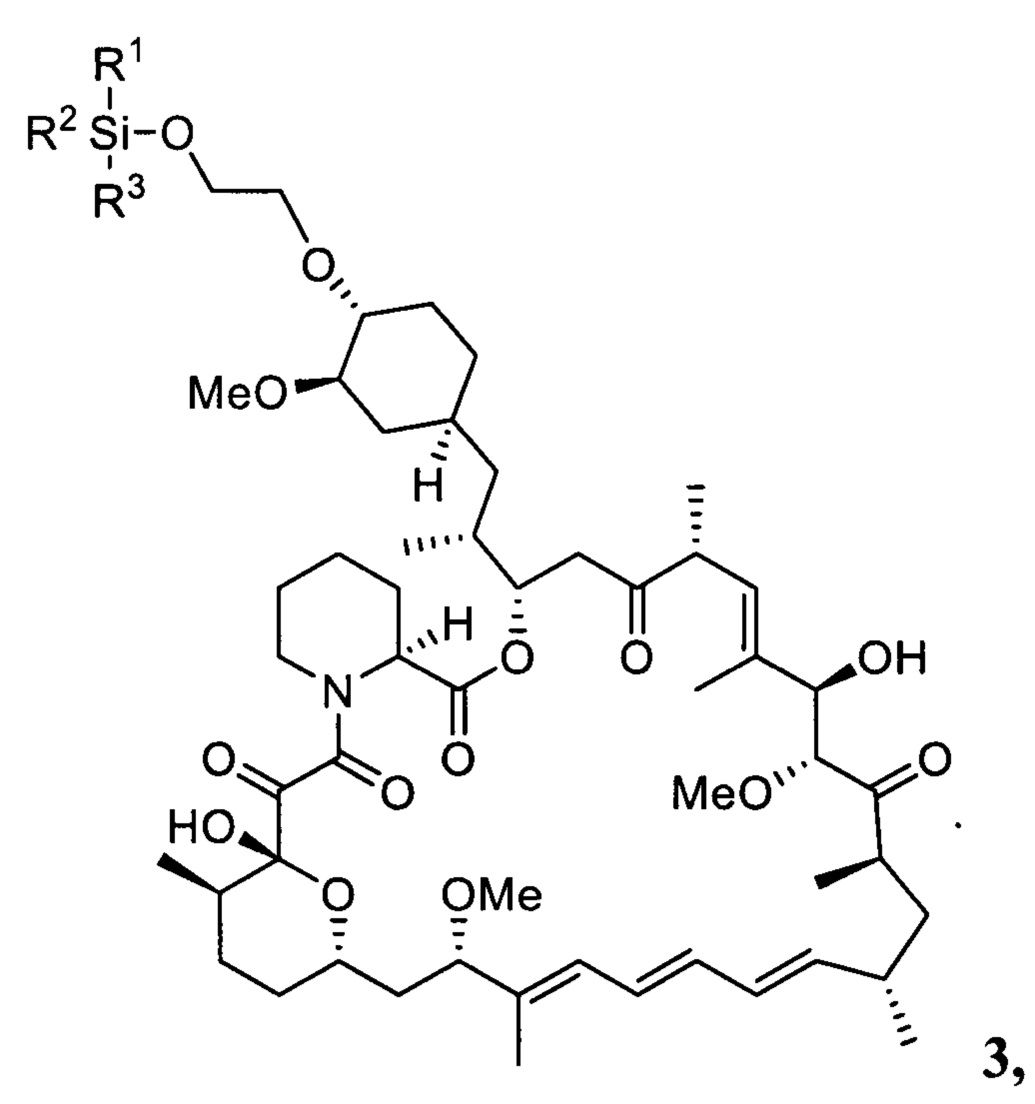
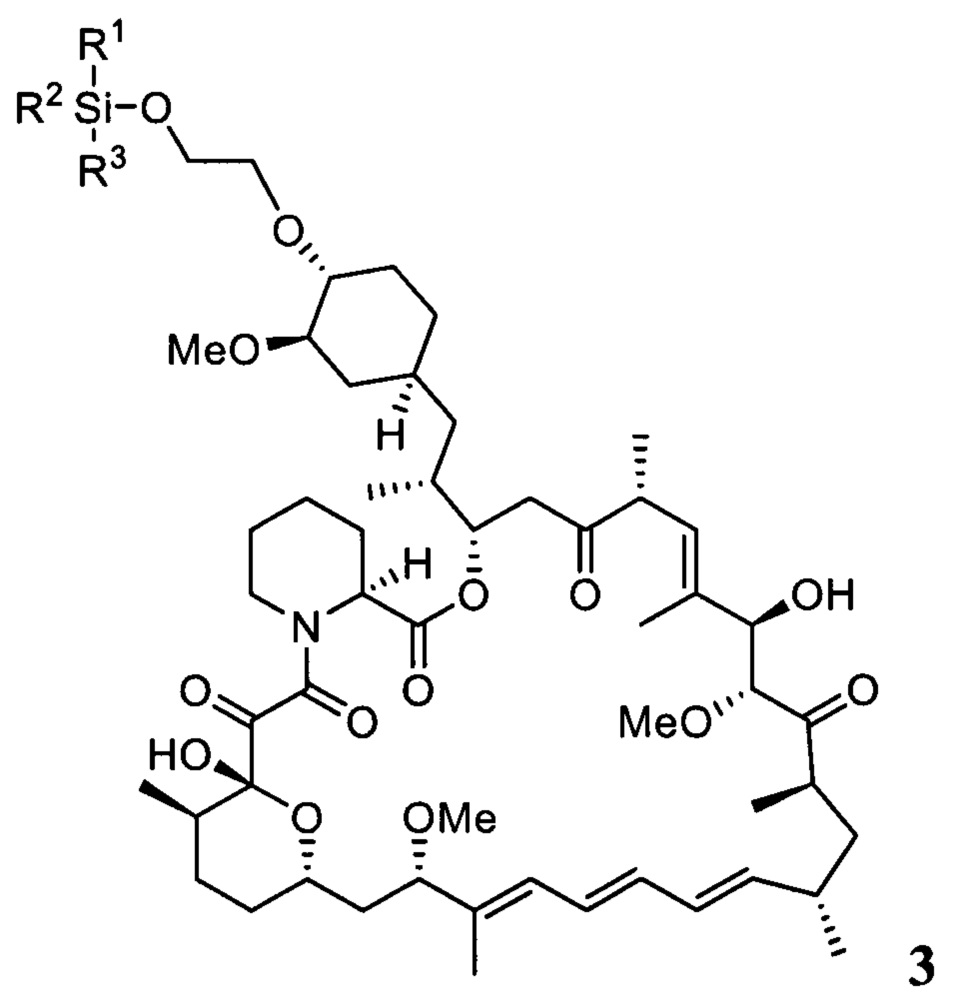
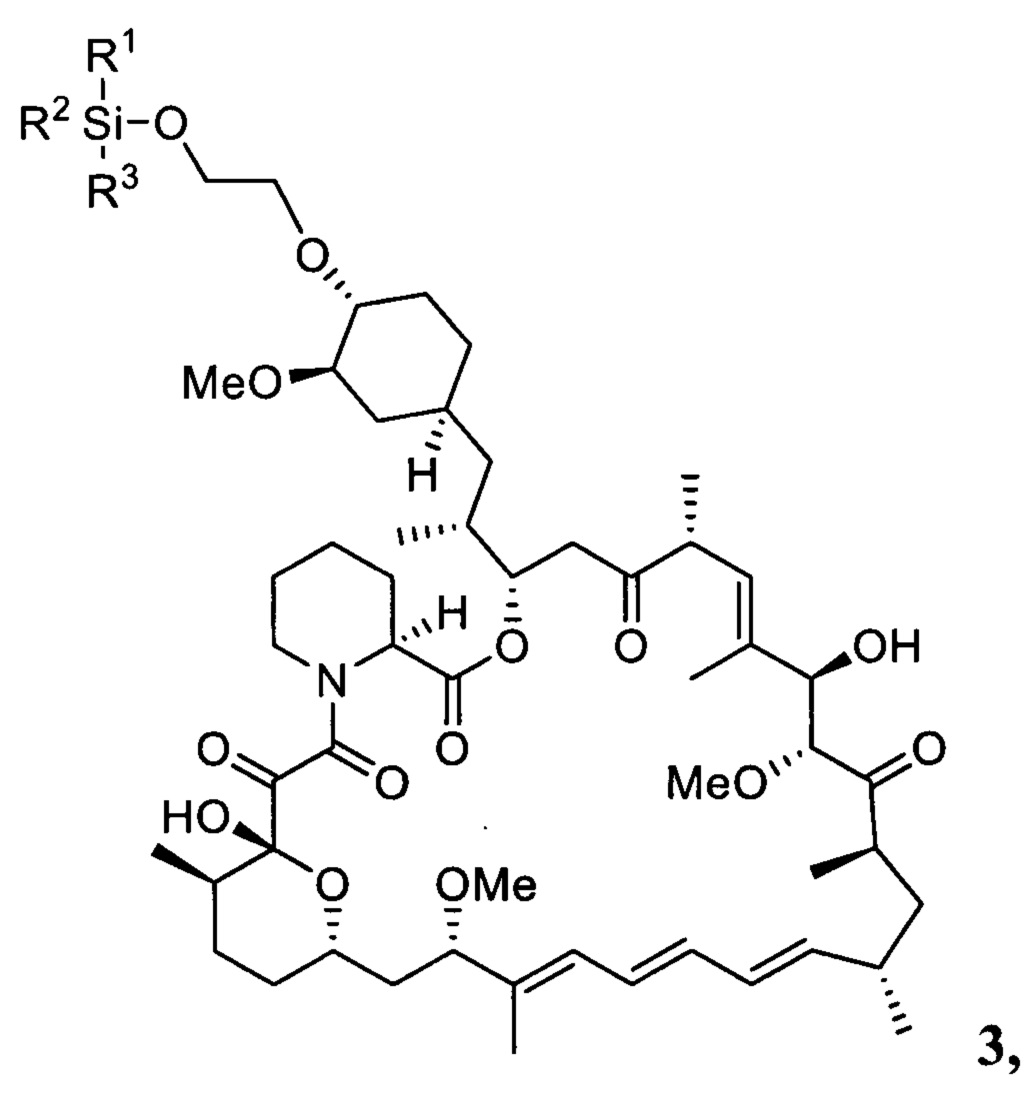
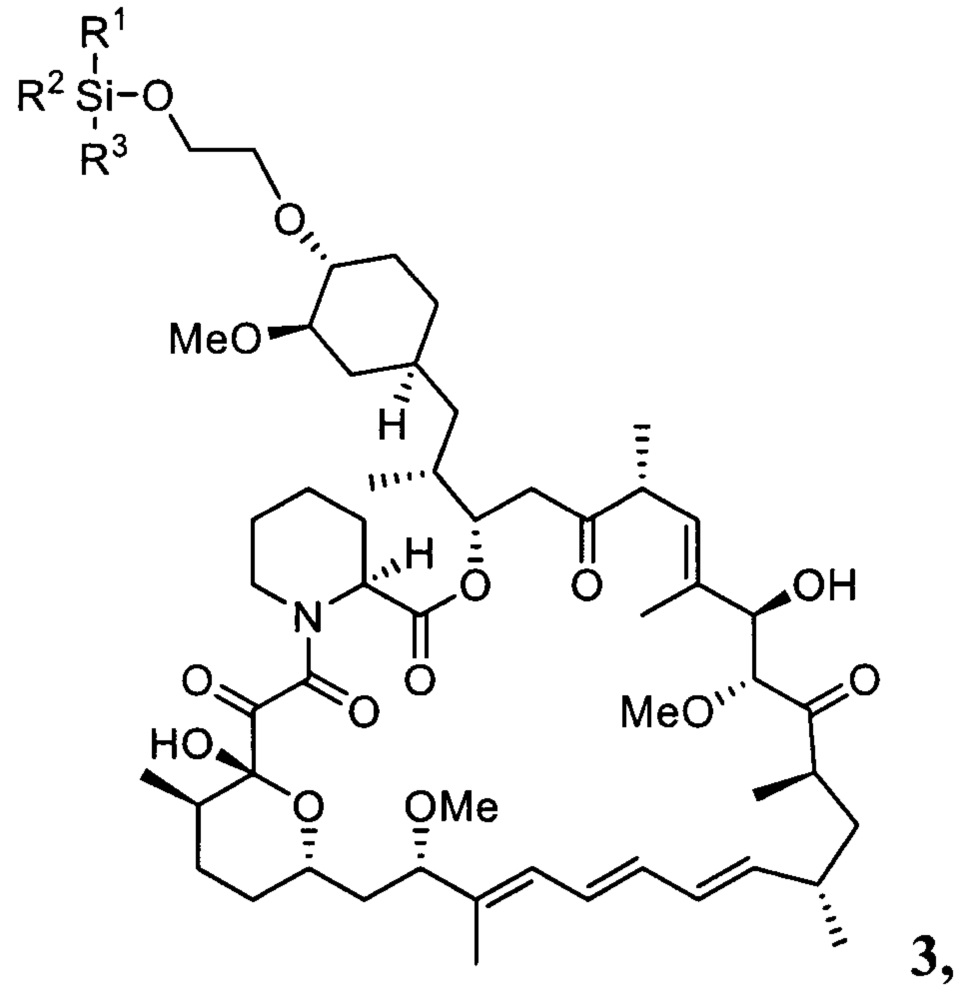
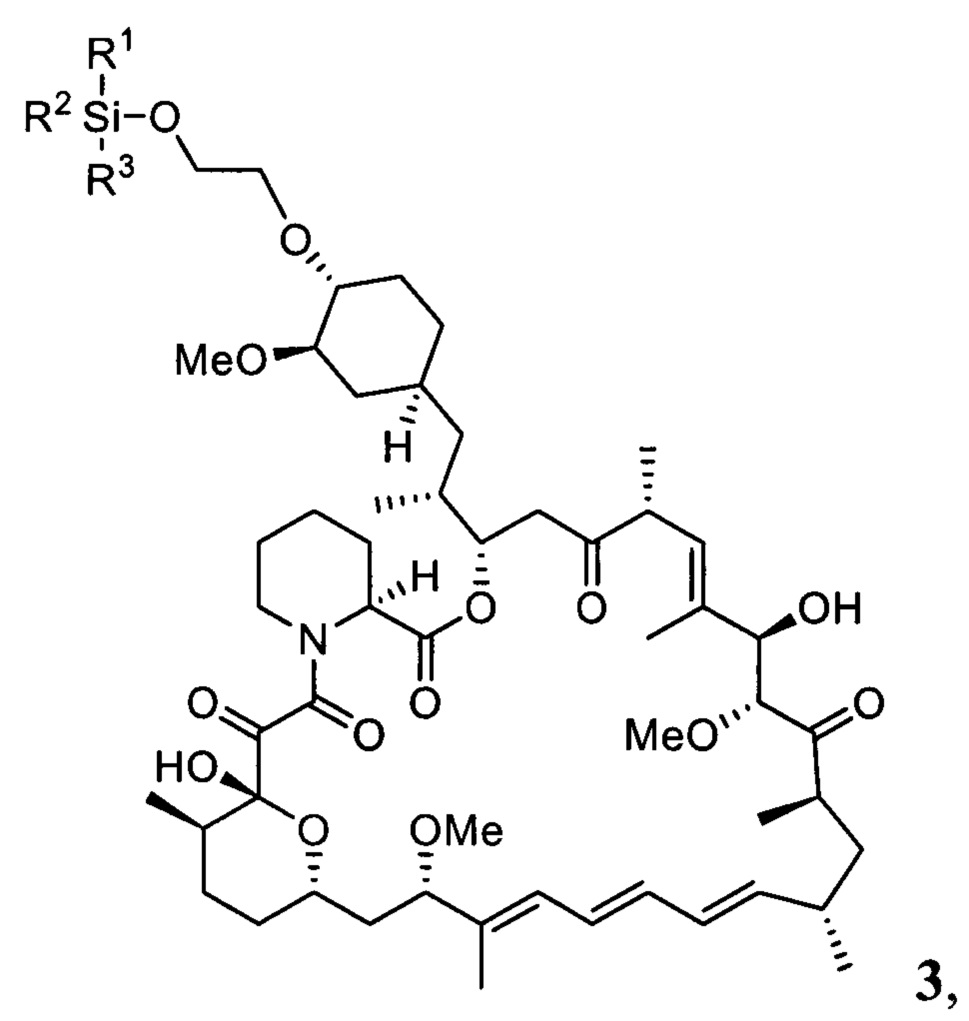
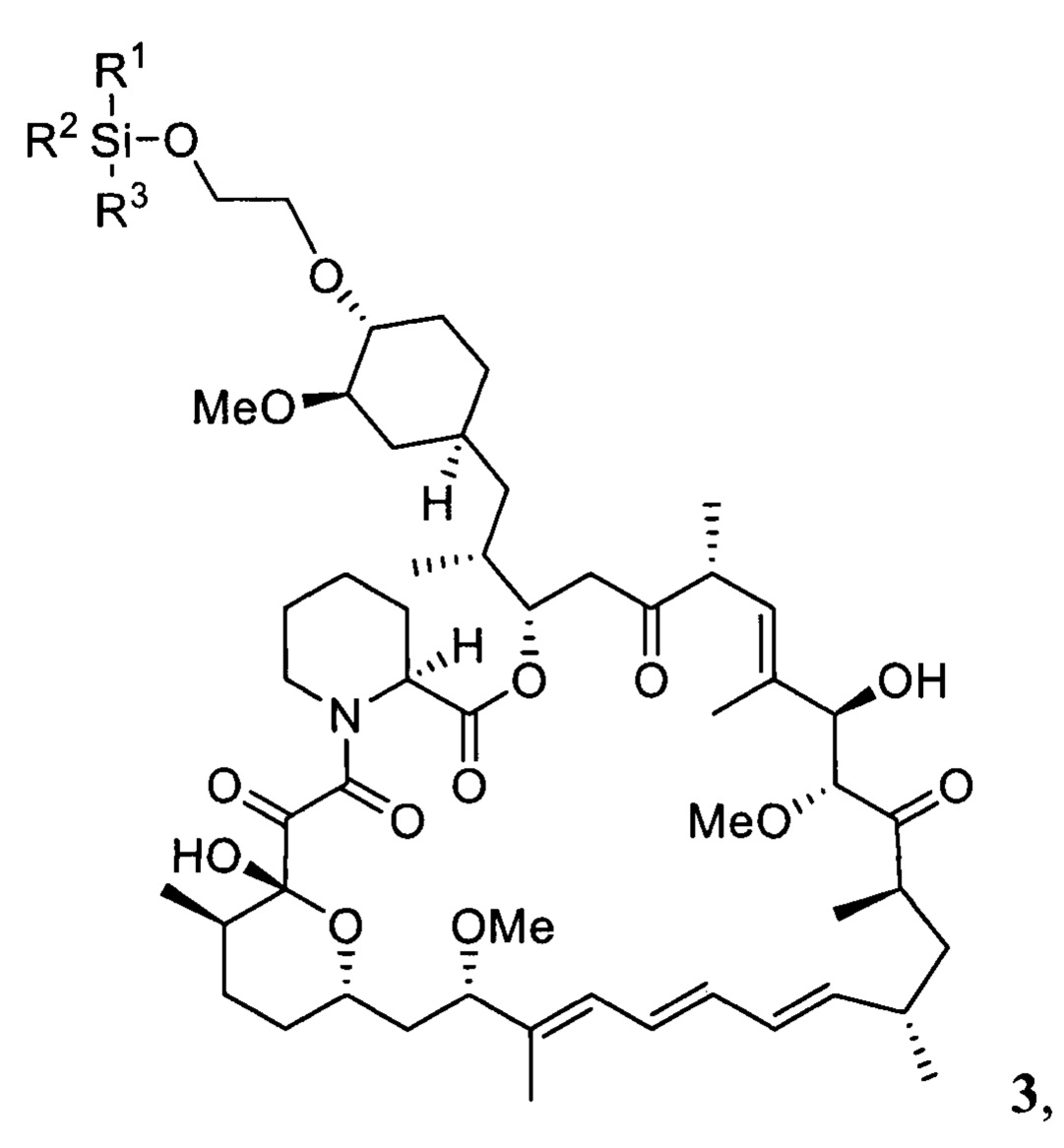
Настоящее изобретение относится к способам получения соединений формулы 3

где R1, R2, R3 представляют собой С1-С5 алкил, С6-С14 арил или C5-C8 циклоалкил,
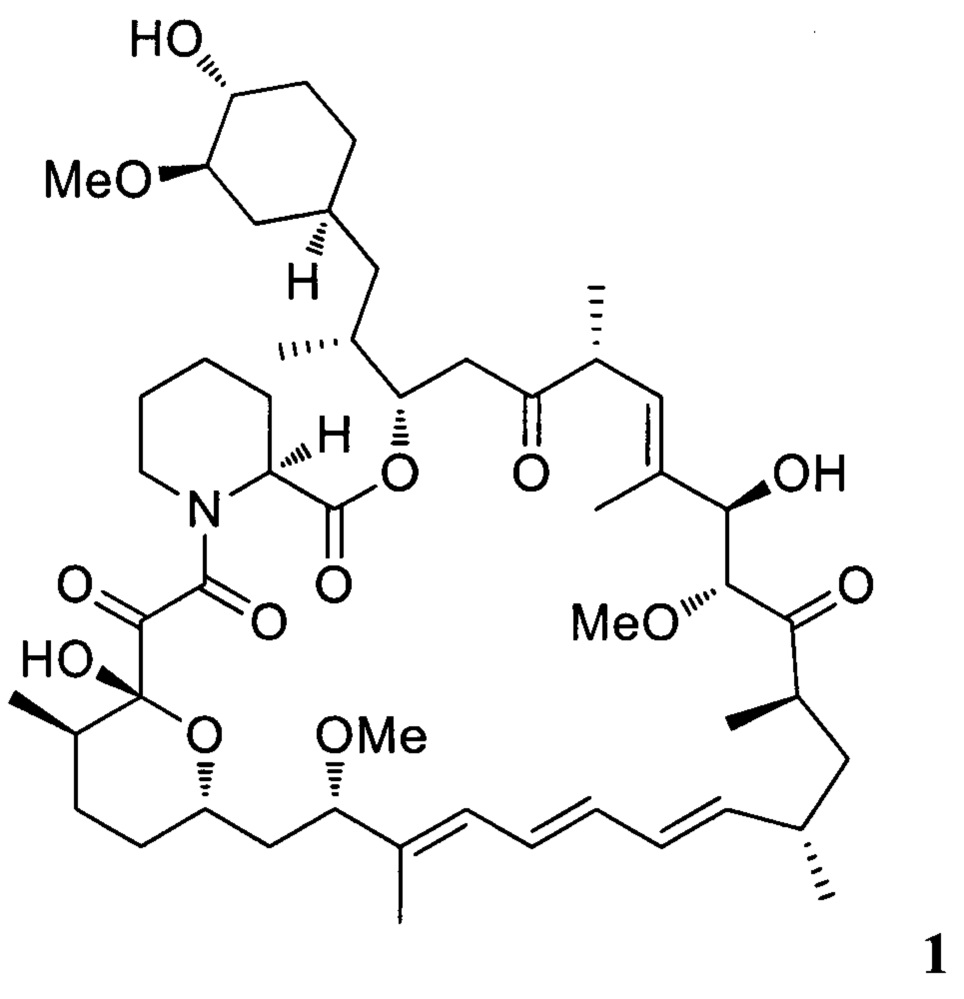
включающим взаимодействие рапамицина 1

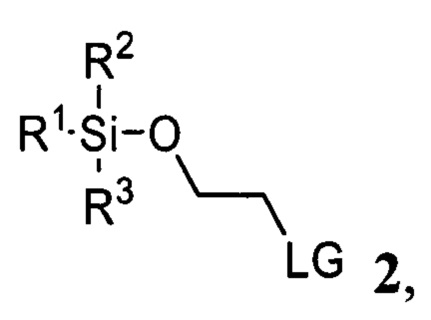
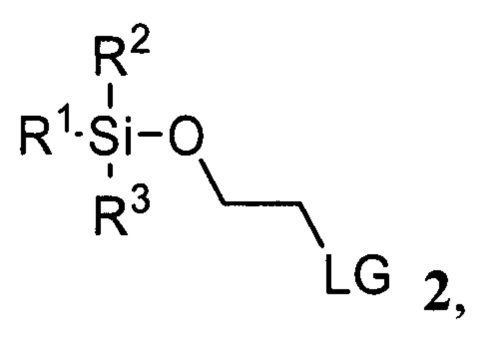
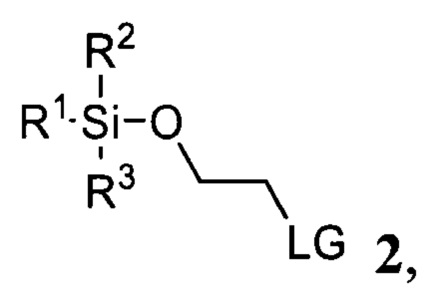
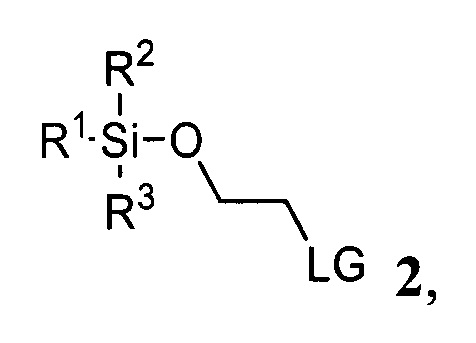
и соединения 2

где R1, R2, R3 представляют собой С1-С5 алкил, С6-C14 арил или C5-C8 циклоалкил, LG представляет собой С1-С5 алкилсульфонат, незамещенный или замещенный одним или несколькими атомами галогена, С6-С14 арилсульфонат, незамещенный или замещенный одним или несколькими атомами галогена, С1-С5 алкилами
в присутствии одного или нескольких соединений В

где R4 представляет собой С1-С5 алкил, незамещенный или замещенный одним или несколькими атомами галогена; С6-С14 арил, незамещенный или замещенный одним или несколькими атомами галогена, С1-С5 алкилами; С5-C8 циклоалкил, незамещенный или замещенный одним или несколькими атомами галогена, С1-С5 алкилами;
n равно от 0 до 2.
В одном варианте осуществления настоящее изобретение относится к способу получения указанного выше соединения 3, который дополнительно может включать последующее снятие защитной группы - SiR1R2R3 с соединения 3 с получением эверолимуса EVR

где R1, R2, R3 представляют собой С1-С5 алкил, С6-С14 арил или C5-C8 циклоалкил.
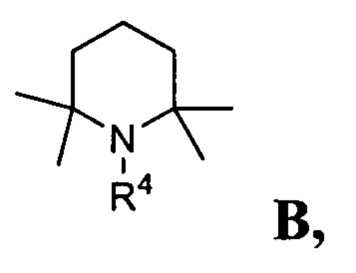
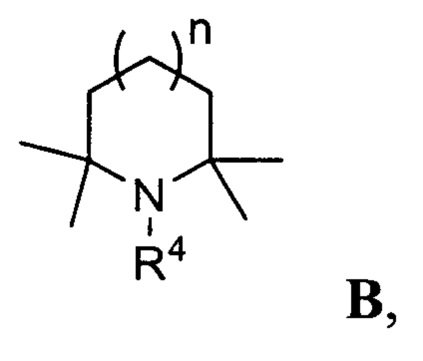
В одном варианте осуществления настоящее изобретение относится к способу получения указанного выше соединения 3, в котором соединение В представлено формулой, где n равно 1:

и R4 представляет собой С1-С5 алкил, незамещенный или замещенный одним или несколькими атомами галогена; С6-С14 арил, незамещенный или замещенный одним или несколькими атомами галогена, С1-С5 алкилами; С5-С8 циклоалкил, незамещенный или замещенный одним или несколькими атомами галогена, С1-С5 алкилами.
В одном варианте осуществления настоящее изобретение относится к способу получения указанного выше соединения 3, в котором R4 представляет собой метил, пропил, фенил или смесь таких соединений.
В одном варианте осуществления настоящее изобретение относится к способу получения указанного выше соединения 3, где R1, R2, R3 представляют собой независимо друг от друга метил, фенил, трет-бутил, циклогексил, LG представляет собой трифторметилсульфонат.
В одном варианте осуществления настоящее изобретение относится к способу получения указанного выше соединения 3, в котором дополнительно используют инертный органический растворитель, выбранный из бензола, незамещенного или замещенного одним или несколькими атомами галогена, CN-группами, C1-C5 алкилами, незамещенными или замещенными одним или несколькими атомами галогена, CN-группами; незамещенного C5-C8 алкана; C1-C8 алкана, замещенного одним или несколькими атомами галогена, CN-группами; незамещенного C5-C8 циклоалкана; С3-C8 циклоалкана, замещенного одним или несколькими атомами галогена, CN-группами; циклического простого эфира, содержащего от 5 до 6 атомов в циклена также простых или сложных эфиров, выбранных из C1-C8 алкил-O-C1-C8 алкила, C1-С8 алкил-O-C1-C8 алкил-О- C1-C8 алкила, C1-C8 алкил-О-С6 арила, С6 арил-О-С6 арила, C1-C8 алкил-С(O)O-С1-С8 алкила, C1-C8 алкил-С(O)O-С6 арила, С6 арил-С(O)O-С1-С8 алкила, С6 арил-С(O)O-С6 арила, где C1-C8 алкил, незамещенный или замещенный одним или несколькими атомами галогена или CN-группами; С6 арил, незамещенный или замещенный одним или несколькими атомами галогена, C1-C5 алкилами или CN-группами, или их смеси. Предпочтительно инертный органический растворитель выбирают из бензола, толуола, трифтортолуола, ксилолов, ацетонитрила, пропионитрила, бензонитрила, диоксана, тетрагидрофурана, хлористого метилена, диметоксиэтана, метил трет-бутилового эфира, или их смеси.
В одном варианте осуществления настоящее изобретение относится к способу получения указанного выше соединения 3, в котором снятие защитной группы - SiR1R2R3 с соединения 3 проводят под действием раствора фтороводорода в пиридине или триэтиламине или в их смеси, где R1, R2, R3 описаны выше. При необходимости дополнительно к раствору фтороводорода добавляют минеральную или органическую кислоту, при этом минеральная кислота представляет собой соляную или серную кислоты, органическая кислота представляет собой муравьиную кислоту.
В одном варианте осуществления настоящее изобретение относится к способу получения указанного выше соединения 3, в котором защитную группу SiR1R2R3 снимают в растворителе, выбранном из группы, включающей тетрагидрофуран, метилтетрагидрофуран, ацетон, гептан, метанол, ацетонитрил и гексафторизопропанол или в их смеси, где R1, R2, R3 описаны выше.
В одном варианте осуществления настоящее изобретение относится к способу получения указанного выше соединения 3, в котором поддерживают температуру реакции от приблизительно 10°С до приблизительно 70°С, а именно поддерживают температуру приблизительно 10°С, приблизительно 15°С, приблизительно 20°С, приблизительно 25°С, приблизительно 30°С, приблизительно 35°С, приблизительно 40°С, приблизительно 45°С, приблизительно 50°С, приблизительно 55°С, приблизительно 60°С, приблизительно 65°С, приблизительно 70°С, предпочтительно поддерживают температуру реакции от приблизительно 20°С до приблизительно 50°С.
В одном варианте осуществления настоящее изобретение относится к способу получения указанного выше соединения 3, в котором при снятии защитной группы - SiR1R2R3 с соединения 3 поддерживают температуру реакции от приблизительно -20°С до приблизительно 60°С, а именно поддерживают температуру приблизительно -20°С, приблизительно -15°С, приблизительно -10°С, приблизительно -5°С, приблизительно 0°С, приблизительно 5°С, приблизительно 10°С, приблизительно 15°С, приблизительно 20°С, приблизительно 25°С, приблизительно 30°С, приблизительно 35°С, приблизительно 40°С, приблизительно 45°С, приблизительно 50°С, приблизительно 55°С, приблизительно 60°С, предпочтительно от приблизительно 0°С до приблизительно 15°С, где R1, R2, R3 описаны выше.
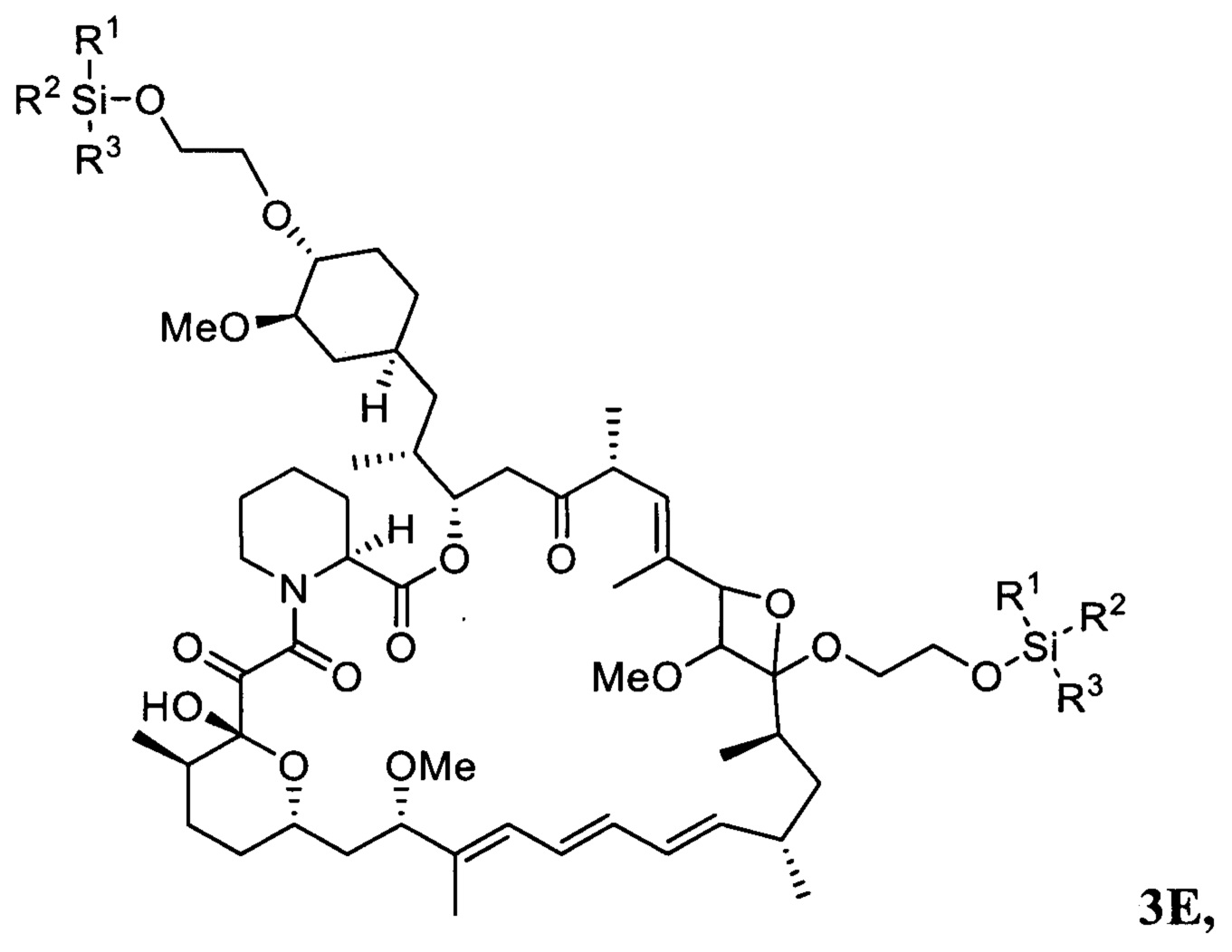
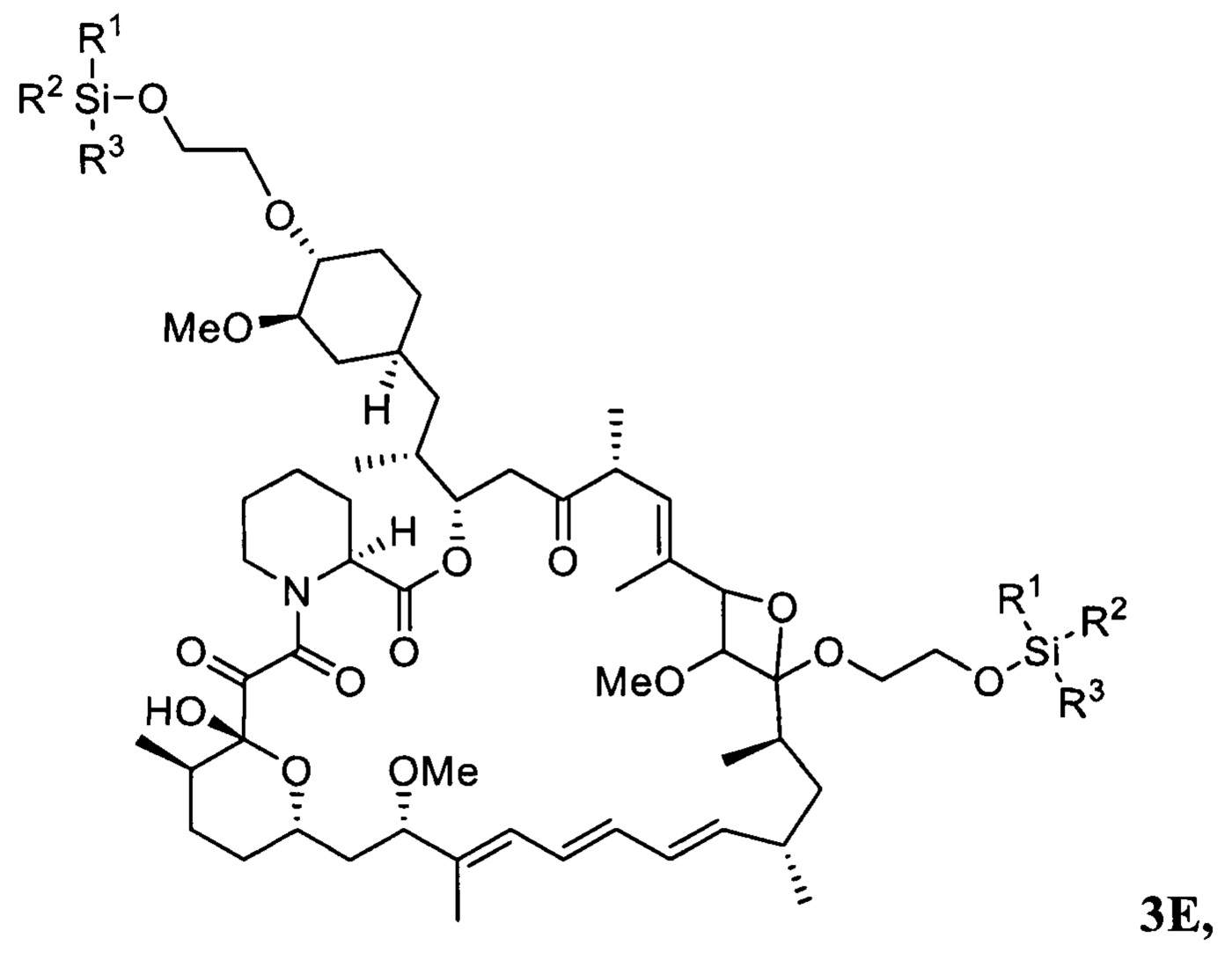
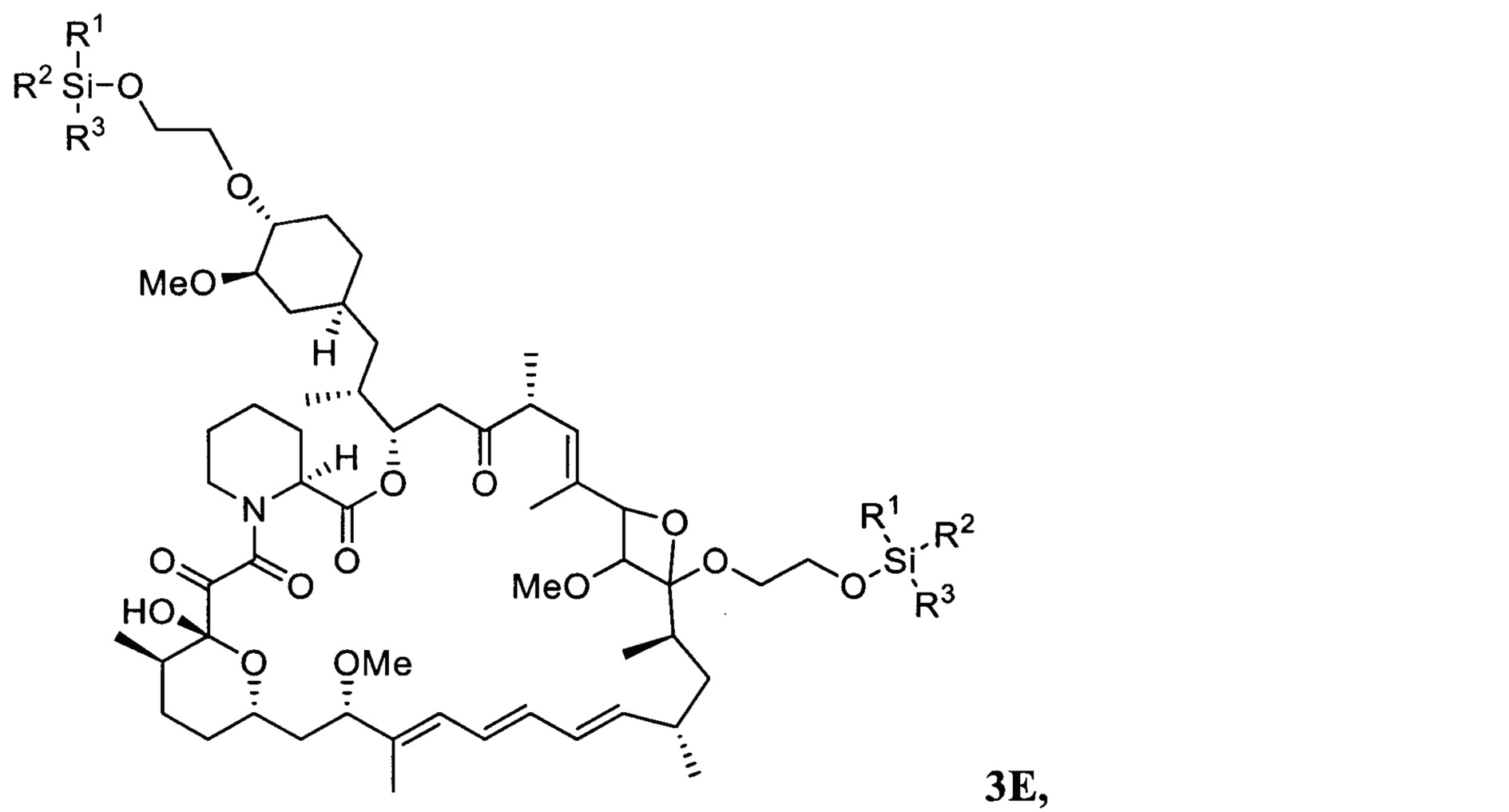
В одном варианте осуществления настоящее изобретение относится к способу получения указанного выше соединения 3, в котором на стадии протекания реакции между соединениями 1 и 2 дополнительно образуется соединение 3Е

где R1, R2, R3 представляют собой C1-C5 алкил, С6-С14 арил или С5-С8 циклоалкил.
В одном варианте осуществления настоящее изобретение относится к способу получения указанного выше соединения 3, в котором на стадии протекания реакции между соединениями 1 и 2 дополнительно образуется соединение 3Е, которое путем кислотного гидролиза переводят в соединение 3
 где R1, R2, R3 представляют собой C1-C5 алкил, С6-С14 арил или C5-C8 циклоалкил.
где R1, R2, R3 представляют собой C1-C5 алкил, С6-С14 арил или C5-C8 циклоалкил.
В одном варианте исполнения настоящего изобретения кислотный гидролиз соединения 3Е в соединение 3 проводят в присутствии минеральной или органической кислоты в органическом растворителе, при этом рН составляет приблизительно ниже 3, а именно: ниже 3, ниже 2.9, ниже 2.8, ниже 2.7, ниже 2.6, ниже 2.5, ниже 2.4, ниже 2.3, ниже 2.2, ниже 2.1, ниже 2.0, ниже 1.9, ниже 1.8, ниже 1.7, ниже 1.6, ниже 1.5, ниже 1.4, ниже 1.3, ниже 1.2, ниже 1.1, ниже 1.0. Минеральную кислоту выбирают из соляной, серной, или фосфорной кислот. Органический растворитель выбирают из метанола, этанола, 1-пропанола, 2-пропанола, 1-бутанола, 2-бутанола, 3-метилпропан-1-ола, 3-метилпропан-2-ола, этандиола, трет-бутанола, 1,2-пропандиола, 1,3-пропандиола или их смеси. Органическую кислоту выбирают из трифторуксусной кислоты. Органический растворитель выбирают из комбинации протонного органического растворителя, выбранного из метанола, этанола, 1-пропанола, 2-пропанола, 1-бутанола, 2-бутанола, 3-метилпропан-1-ола, 3-метилпропан-2-ола, этандиола, трет-бутанола, 1,2-пропандиола, 1,3-пропандиола или их смеси, с инертным органическим растворителем, выбранным из бензола, незамещенного или замещенного одним или несколькими атомами галогена, CN-группами, С1-С5 алкилами, незамещенными или замещенными одним или несколькими атомами галогена, CN-группами; незамещенного С5-С8 алкана; C1-C8 алкана, замещенного одним или несколькими атомами галогена, CN-группами; незамещенного C5-C8 циклоалкана; C3-C8 циклоалкана, замещенного одним или несколькими атомами галогена, CN-группами; циклического простого эфира, содержащего от 5 до 6 атомов в цикле, а также простых или сложных эфиров, выбранных из C1-C8 алкил-O-C1-C8 алкила, C1-C8 алкил-O-C1-C8 алкил-О- C1-C8 алкила, C1-C8 алкил-О-С6 арила, С6 арил-О-С6 арила, C1-C8 алкил-С(O)O-С1-С8 алкила, C1-C8 алкил-С(O)O-С6 арила, С6 арил-C(O)O-C1-C8 алкила, С6 арил-С(O)O-С6 арила, где C1-C8 алкил, незамещенный или замещенный одним или несколькими атомами галогена или CN-группами; С6 арил, незамещенный или замещенный одним или несколькими атомами галогена, C1-C5 алкилами или CN-группами, или их смеси. Предпочтительно инертный органический растворитель выбирают из бензола, толуола, трифтортолуола, ксилолов, ацетонитрила, пропионитрила, бензонитрила, диоксана, тетрагидрофурана, хлористого метилена, диметоксиэтана, метил трет-бутилового эфира, или их смеси.
В одном варианте исполнения настоящего изобретения кислотный гидролиз соединения 3Е в соединение 3 проводят при температуре от приблизительно -20°С до приблизительно 50°С, а именно поддерживают температуру приблизительно -20°С, приблизительно -15°С, приблизительно -10°С, приблизительно -5°С, приблизительно 0°С, приблизительно 5°С, приблизительно 10°С, приблизительно 15°С, приблизительно 20°С, приблизительно 25°С, приблизительно 30°С, приблизительно 35°С, приблизительно 40°С, приблизительно 45°С, приблизительно 50°С, предпочтительно от приблизительно 0°С до приблизительно 10°С.
В одном варианте исполнения настоящего изобретения стадию получения соединения 3, стадию получения соединения 3Е и последующий кислотный гидролиз соединения 3Е в соединение 3 проводят в одном реакторе (one-pot реакция) без выделения соединений 3 и 3Е.
В одном варианте осуществления настоящего изобретения стадию получения соединения 3 и стадию получения соединения 3Е проводят в одном реакторе, а последующий кислотный гидролиз соединения 3Е в соединение 3 проводят во втором реакторе.
В одном варианте осуществления настоящее изобретение относится к способу получения соединений формулы 3, в котором соотношение объема инертного органического растворителя к массе соединения 1 составляет от приблизительно 1 до приблизительно 10, предпочтительно от приблизительно 1 до приблизительно 4.
В одном варианте осуществления настоящее изобретение относится к способу получения соединений формулы 3, в котором количество эквивалентов соединения 2 к соединению 1 составляет от приблизительно 1,5 до приблизительно 5, предпочтительно от приблизительно 2,0 до приблизительно 3,0.
В одном варианте осуществления настоящее изобретение относится к способу получения соединений формулы 3, в котором количество эквивалентов соединения В к соединению 1 составляет от приблизительно 1,6 до приблизительно 6, предпочтительно от приблизительно 2,5 до приблизительно 3,5.
В одном варианте осуществления настоящее изобретение относится к способу получения соединений формулы 3, в котором стадия кислотного гидролиза соединения 3Е в соединение 3 происходит при соотношении объема органического растворителя к массе соединения 1 составляет от приблизительно 5 до приблизительно 30, предпочтительно от приблизительно 10 до приблизительно 15.
Настоящее изобретение относится к способам получения соединения 3
 где R1, R2, R3 представляют собой C1-C5 алкил, С6-С14 арил или C5-C8 циклоалкил
где R1, R2, R3 представляют собой C1-C5 алкил, С6-С14 арил или C5-C8 циклоалкил
и соединения 3Е
 где R1, R2, R3 представляют собой С1-С5 алкил, С6-С14 арил или C5-C8 циклоалкил,
где R1, R2, R3 представляют собой С1-С5 алкил, С6-С14 арил или C5-C8 циклоалкил,
включающий взаимодействие рапамицина 1

и соединения 2

где R1, R2, R3 представляют собой С1-С5 алкил, С6-С14 арил или C5-C8 циклоалкил, LG представляет собой С1-С5 алкилсульфонат, незамещенный или замещенный одним или несколькими атомами галогена, С6-С14 арилсульфонат, незамещенный или замещенный одним или несколькими атомами галогена, C1-C5 алкилами,
в присутствии одного или нескольких соединений, представляющих собой третичные аминные основания.
В одном варианте осуществления настоящее изобретение относится к способу получения указанного выше соединения 3, дополнительно включающему последующий кислотный гидролиз соединения 3Е в соединение 3
 где R1, R2, R3 представляют собой C1-C5 алкил, С6-С14 арил или C5-C8 циклоалкил.
где R1, R2, R3 представляют собой C1-C5 алкил, С6-С14 арил или C5-C8 циклоалкил.
В одном варианте осуществления настоящее изобретение относится к способу получения указанного выше соединения 3, дополнительно включающему снятие защитной группы -SiR1R2R3 у соединения 3

с получением эверолимуса EVR
 где R1, R2, R3 представляют собой C1-C5 алкил, C6-C14 арил или C5-C8 циклоалкил.
где R1, R2, R3 представляют собой C1-C5 алкил, C6-C14 арил или C5-C8 циклоалкил.
В одном варианте осуществления настоящее изобретение относится к способу получения указанного выше соединения 3, в котором третичное аминное основание представляет 2,6-диалкилпиридин, 4-незамещенный или 4-замещенный атомом галогена, CN-группой, С1-С5 алкилом, незамещенным или замещенным одним или несколькими атомами галогена, CN-группами; 2,6-диалкилпиридин, 4-замещенный С(O)O-С1-С8-алкил группой, С(O)O-С6 арил группой, где C1-C8 алкил - незамещенный или замещенный одним или несколькими атомами галогена или CN-группами, С6 арил - незамещенный или замещенный одним или несколькими атомами галогена, С1-С5 алкилами или CN-группами; тризамещенный амин, где заместители представляют независимо C1-C5 алкил, С6-С14 арил или C5-C8 циклоалкил или их смесь. Предпочтительно в качестве третичного аминного основания выбирают 2,6-диметилпиридин, 2,6-ди-(трет-бутил)пиридин, 2,4,6-триметилпиридин, 2,6-диметил-4-(трет-бутил)пиридин, 4-метил-2,6-ди-(трет-бутил)пиридин, N,N-диизопропилэтиламин, N,N-диизопропилпент-3-иламин, N,N-диизопропилнон-5-иламин и N,N-диизобутил(2,4-диметилпент-3-ил)амин, N,N-диизопропилфениламин.
В одном варианте осуществления настоящее изобретение относится к способу получения указанного выше соединения 3, где R1, R2, R3, представляют собой независимо друг от друга метил, фенил, трет-бутил, циклогексил, LG представляет собой трифторметилсульфонат.
В одном варианте осуществления настоящее изобретение относится к способу получения указанного выше соединения 3, в котором дополнительно используют инертный органический растворитель, выбранный из бензола, незамещенного или замещенного одним или несколькими атомами галогена, CN-группами, С1-С5 алкилами, незамещенными или замещенными одним или несколькими атомами галогена, CN-группами; незамещенного С5-С8 алкана; C1-C8 алкана, замещенного одним или несколькими атомами галогена, CN-группами; незамещенного C5-C8 циклоалкана; C3-C8 циклоалкана, замещенного одним или несколькими атомами галогена, CN-группами; циклического простого эфира, содержащего от 5 до 6 атомов в цикле, а также простых или сложных эфиров, выбранных из C1-C8 алкил-O-C1-C8 алкила, C1-C8 алкил-O-C1-C8 алкил-О- C1-C8 алкила, C1-C8 алкил-O-C6 арила, С6 арил-О-С6 арила, C1-C8 алкил-С(O)O-С1-С8 алкила, C1-C8 алкил-С(O)O-С6 арила, С6 арил-С(O)O-С1-С8 алкила, С6 арил-С(O)O-С6 арила, где C1-C8 алкил, незамещенный или замещенный одним или несколькими атомами галогена или CN-группами; С6 арил, незамещенный или замещенный одним или несколькими атомами галогена, C1-C5 алкилами или CN-группами, или их смеси. Предпочтительно инертный органический растворитель выбирают из бензола, толуола, трифтортолуола, ксилолов, ацетонитрила, пропионитрила, бензонитрила, диоксана, тетрагидрофурана, хлористого метилена, диметоксиэтана, метил трет-бутилового эфира, или их смеси.
В одном варианте осуществления настоящее изобретение относится к способу получения указанного выше соединения 3, в котором поддерживают температуру реакции от приблизительно 10°С до приблизительно 70°С, а именно поддерживают температуру приблизительно 10°С, приблизительно 15°С, приблизительно 20°С, приблизительно 25°С, приблизительно 30°С, приблизительно 35°С, приблизительно 40°С, приблизительно 45°С, приблизительно 50°С, приблизительно 55°С, приблизительно 60°С, приблизительно 65°С, приблизительно 70°С, предпочтительно от приблизительно 20°С до приблизительно 50°С.
В одном варианте осуществления настоящее изобретение относится к способу получения указанного выше соединения 3, в котором кислотный гидролиз соединения 3Е в соединение 3 проводят в минеральной или органической кислоте в органическом растворителе, при этом рН составляет приблизительно ниже 3, а именно: ниже 3, ниже 2.9, ниже 2.8, ниже 2.7, ниже 2.6, ниже 2.5, ниже 2.4, ниже 2.3, ниже 2.2, ниже 2.1, ниже 2.0, ниже 1.9, ниже 1.8, ниже 1.7, ниже 1.6, ниже 1.5, ниже 1.4, ниже 1.3, ниже 1.2, ниже 1.1, ниже 1.0. Минеральную кислоту выбирают из соляной, серной, или фосфорной кислот. Органический растворитель выбирают из метанола, этанола, 1-пропанола, 2-пропанола, 1-бутанола, 2-бутанола, 3-метилпропан-1-ола, 3-метилпропан-2-ола, этандиола, трет-бутанола, 1,2-пропандиола, 1,3-пропандиола или их смесь. Органический растворитель выбирают из комбинации протонного органического растворителя, выбранного из метанола, этанола, 1-пропанола, 2-пропанола, 1-бутанола, 2-бутанола, 3-метилпропан-1-ола, 3-метилпропан-2-ола, этандиола, трет-бутанола, 1,2-пропандиола, 1,3-пропандиола или их смеси, с инертным органическим растворителем, выбранным из бензола, незамещенного или замещенного одним или несколькими атомами галогена, CN-группами, C1-C5 алкилами, незамещенными или замещенными одним или несколькими атомами галогена, CN-группами; незамещенного C5-C8 алкана; C1-C8 алкана, замещенного одним или несколькими атомами галогена, CN-группами; незамещенного C5-C8 циклоалкана; C3-C8 циклоалкана, замещенного одним или несколькими атомами галогена, CN-группами; циклического простого эфира, содержащего от 5 до 6 атомов в цикле, а также простых или сложных эфиров, выбранных из C1-С8 алкил-O-C1-C8 алкила, С1-C8 алкил-O-C1-С8 алкил-О-C1-C8 алкила, C1-C8 алкил-O-С6 арила, С6 арил-O-C6 арила, C1-C8 алкил-С(O)O-С1-С8 алкила, C1-C8 алкил-С(O)O-С6 арила, С6 арил-С(O)O-С1-С8 алкила, С6 арил-С(O)O-С6 арила, где C1-C8 алкил, незамещенный или замещенный одним или несколькими атомами галогена или CN-группами; С6 арил, незамещенный или замещенный одним или несколькими атомами галогена, C1-C5 алкилами или CN-группами, или их смеси. Предпочтительно инертный органический растворитель выбирают из бензола, толуола, трифтортолуола, ксилолов, ацетонитрила, пропионитрила, бензонитрила, диоксана, тетрагидрофурана, хлористого метилена, диметоксиэтана, метил трет-бутилового эфира, или их смеси.
В одном варианте осуществления настоящее изобретение относится к способу получения указанного выше соединения 3, в котором снятие защитной группы - SiR1R2R3 у соединения 3 проводят под действием раствора фтороводорода в пиридине или триэтиламине или их смеси. При необходимости дополнительно к раствору фтороводорода добавляют минеральную или органическую кислоту, при этом минеральная кислота представляет собой соляную или серную кислоты, органическая кислота представляет собой муравьиную кислоту. При необходимости снятие защитной группы - SiR1R2R3 у соединения 3 проводят в растворителе, выбранном из группы, включающей тетрагидрофуран, метилтетрагидрофуран, ацетон, гептан, метанол, ацетонитрил и гексафторизопропанол или в их смеси.
В одном варианте осуществления настоящее изобретение относится к способу получения указанного выше соединения 3, в котором стадию кислотного гидролиза соединения 3Е в соединение 3 проводят при температуре от приблизительно -20°С до приблизительно 50°С, а именно поддерживают температуру приблизительно -20°С, приблизительно -15°С, приблизительно -10°С, приблизительно -5°С, приблизительно 0°С, приблизительно 5°С, приблизительно 10°С, приблизительно 15°С, приблизительно 20°С, приблизительно 25°С, приблизительно 30°С, приблизительно 35°С, приблизительно 40°С, приблизительно 45°С, приблизительно 50°С, предпочтительно при температуре от приблизительно 0°С до приблизительно 10°С.
В одном варианте осуществления настоящее изобретение относится к способу получения указанного выше соединения 3, в котором поддерживают температуру реакции от приблизительно -20°С до приблизительно 60°С, а именно поддерживают температуру приблизительно -20°С, приблизительно -15°С, приблизительно -10°С, приблизительно -5°С, приблизительно 0°С, приблизительно 5°С, приблизительно 10°С, приблизительно 15°С, приблизительно 20°С, приблизительно 25°С, приблизительно 30°С, приблизительно 35°С, приблизительно 40°С, приблизительно 45°С, приблизительно 50°С, приблизительно 55°С, приблизительно 60°С, предпочтительно от приблизительно 0°С до приблизительно 15°С.
В одном варианте осуществления настоящего изобретения стадию получения соединений 3 и 3Е и последующий кислотный гидролиз соединения 3Е в соединение 3 проводят в одном реакторе (one-pot реакция) без выделения соединений 3 и 3Е.
В одном варианте осуществления настоящего изобретения стадию получения соединений 3 и 3Е проводят в одном реакторе, а последующий кислотный гидролиз соединения 3Е в соединение 3 проводят во втором реакторе.
В одном варианте осуществления настоящее изобретение относится к способу получения соединений формулы 3, в котором соотношение объема инертного органического растворителя к массе соединения 1 составляет от приблизительно 1 до приблизительно 10, предпочтительно от приблизительно 1 до приблизительно 4.
В одном варианте осуществления настоящее изобретение относится к способу получения соединений формулы 3, в котором количество эквивалентов соединения 2 к соединению 1 составляет от приблизительно 1,5 до приблизительно 5, предпочтительно от приблизительно 2,0 до приблизительно 3,0.
В одном варианте осуществления настоящее изобретение относится к способу получения соединений формулы 3, в котором количество эквивалентов третичного аминного основания к соединению 1 составляет от приблизительно 1,6 до приблизительно 6, предпочтительно от приблизительно 2,5 до приблизительно 3,5.
В одном варианте осуществления настоящее изобретение относится к способу получения соединений формулы 3, в котором стадия кислотного гидролиза соединения 3Е в соединение 3 происходит при соотношении объема органического растворителя к массе соединения 1 составляет от приблизительно 5 до приблизительно 30, предпочтительно от приблизительно 10 до приблизительно 15.
Настоящее изобретение относится к способу получения эверолимуса EVR,

включающему
а) взаимодействие рапамицина 1

и соединения 2

где R1, R2, R3 представляют собой С1-С5 алкил, C6-C14 арил или C5-C8 циклоалкил, LG представляет собой С1-С5 алкилсульфонат, незамещенный или замещенный одним или несколькими атомами галогена, С6-С14 арилсульфонат, незамещенный или замещенный одним или несколькими атомами галогена, С1-С5 алкилами
в присутствии одного или нескольких соединений В

где R4 представляет собой C1-C5 алкил, незамещенный или замещенный одним или несколькими атомами галогена; С6-С14 арил, незамещенный или замещенный одним или несколькими атомами галогена, C1-C5 алкилами; C5-C8 циклоалкил, незамещенный или замещенный одним или несколькими атомами галогена, C1-C5 алкилами;
n равно от 0 до 2;
с получением соединения 3

где R1, R2, R3 описаны выше,
b) последующее снятие защитной группы - SiR1R2R3 с соединения 3 с получением эверолимуса EVR, где R1, R2, R3 определены выше.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором соединение В представлено формулой, где n равно 1:

a R4 представляет собой C1-C5 алкил, незамещенный или замещенный одним или несколькими атомами галогена; С6-С14 арил, незамещенный или замещенный одним или несколькими атомами галогена, C1-C5 алкилами; C5-C8 циклоалкил, незамещенный или замещенный одним или несколькими атомами галогена, C1-C5 алкилами.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором R4 представляет собой метил, пропил, фенил или смесь таких соединений.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, где R1, R2, R3, представляют собой независимо друг от друга метил, фенил, трет-бутил, циклогексил, LG представляет собой трифторметилсульфонат.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором дополнительно используется инертный органический растворитель, выбранный из бензола, незамещенного или замещенного одним или несколькими атомами галогена, CN-группами, С1-С5 алкилами, незамещенными или замещенными одним или несколькими атомами галогена, CN-группами; незамещенного C5-C8 алкана; C1-C8 алкана, замещенного одним или несколькими атомами галогена, CN-группами; незамещенного C5-C8 циклоалкана; C3-C8 циклоалкана, замещенного одним или несколькими атомами галогена, CN-группами; циклического простого эфира, содержащего от 5 до 6 атомов в цикле, а также простых или сложных эфиров, выбранных из C1-C8 алкил-O-C1-C8 алкила, C1-C8 алкил-O-C1-C8 алкил-О-C1-C8 алкила, C1-C8 алкил-O-C6 арила, С6 арил-O-C6 арила, C1-C8 алкил-С(O)O-С1-С8 алкила, C1-C8 алкил-С(O)O-С6 арила, С6 арил-C(O)O-C1-C8 алкила, С6 арил-С(O)O-С6 арила, где C1-C8 алкил, незамещенный или замещенный одним или несколькими атомами галогена или CN-группами; С6 арил, незамещенный или замещенный одним или несколькими атомами галогена, C1-C5 алкилами или CN-группами, или их смеси. Предпочтительно инертный органический растворитель выбирают из бензола, толуола, трифтортолуола, ксилолов, ацетонитрила, пропионитрила, бензонитрила, диоксана, тетрагидрофурана, хлористого метилена, диметоксиэтана, метил трет-бутилового эфира, или их смеси.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором снятие защитной группы -SiR1R2R3 с соединения 3 проводят под действием раствора фтороводорода в пиридине или триэтиламине или в их смеси. При необходимости дополнительно к раствору фтороводорода добавляют минеральную или органическую кислоту. Минеральная кислота представляет собой соляную или серную кислоты, органическая кислота представляет собой муравьиную кислоту. При необходимости защитную группу снимают в растворителе, выбранном из группы, включающей тетрагидрофуран, метилтетрагидрофуран, ацетон, гептан, метанол, ацетонитрил и гексафторизопропанол или в их смеси.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором поддерживают температуру реакции на стадии а) от приблизительно 10°С до приблизительно 70°С, а именно поддерживают температуру приблизительно 10°С, приблизительно 15°С, приблизительно 20°С, приблизительно 25°С, приблизительно 30°С, приблизительно 35°С, приблизительно 40°С, приблизительно 45°С, приблизительно 50°С, приблизительно 55°С, приблизительно 60°С, приблизительно 65°С, приблизительно 70°С, предпочтительно от приблизительно 20°С до приблизительно 50°С.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором поддерживают температуру реакции на стадии b) от приблизительно -20°С до приблизительно 60°С, а именно поддерживают температуру приблизительно -20°С, приблизительно -15°С, приблизительно -10°С, приблизительно -5°С, приблизительно 0°С, приблизительно 5°С, приблизительно 10°С, приблизительно 15°С, приблизительно 20°С, приблизительно 25°С, приблизительно 30°С, приблизительно 35°С, приблизительно 40°С, приблизительно 45°С, приблизительно 50°С, приблизительно 55°С, приблизительно 60°С, предпочтительно от приблизительно 0°С до приблизительно 15°С.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором на стадии протекания реакции между соединениями 1 и 2 дополнительно образуется соединение 3Е

где R1, R2, R3 представляют собой C1-C5 алкил, С6-С14 арил или C5-C8 циклоалкил.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором соединение 3Е путем кислотного гидролиза переводят в соединение 3
 где R1, R2, R3 представляют собой C1-C5 алкил, С6-С14 арил или C5-C8 циклоалкил.
где R1, R2, R3 представляют собой C1-C5 алкил, С6-С14 арил или C5-C8 циклоалкил.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором кислотный гидролиз соединения 3Е в соединение 3 проводят в присутствии минеральной или органической кислоты в органическом растворителе, при этом рН составляет приблизительно ниже 3, а именно: ниже 3, ниже 2.9, ниже 2.8, ниже 2.7, ниже 2.6, ниже 2.5, ниже 2.4, ниже 2.3, ниже 2.2, ниже 2.1, ниже 2.0, ниже 1.9, ниже 1.8, ниже 1.7, ниже 1.6, ниже 1.5, ниже 1.4, ниже 1.3, ниже 1.2, ниже 1.1, ниже 1.0. Минеральную кислоту выбирают из соляной, серной, или фосфорной кислот. Органическую кислоту выбирают из трифторуксусной кислоты. Органический растворитель выбирают из метанола, этанола, 1-пропанола, 2-пропанола, 1-бутанола, 2-бутанола, 3-метилпропан-1-ола, 3-метилпропан-2-ола, этандиола, трет-бутанола, 1,2-пропандиола, 1,3-пропандиола или их смеси. Органический растворитель выбирают из комбинации протонного органического растворителя, выбранного из метанола, этанола, 1-пропанола, 2-пропанола, 1-бутанола, 2-бутанола, 3-метилпропан-1-ола, 3-метилпропан-2-ола, этандиола, трет-бутанола, 1,2-пропандиола, 1,3-пропандиола или их смеси, с инертным органическим растворителем, выбранным из бензола, незамещенного или замещенного одним или несколькими атомами галогена, CN-группами, C1-C5 алкилами, незамещенными или замещенными одним или несколькими атомами галогена, CN-группами; незамещенного C5-C8 алкана; C1-C8 алкана, замещенного одним или несколькими атомами галогена, CN-группами; незамещенного C5-C8 циклоалкана; С3-C8 циклоалкана, замещенного одним или несколькими атомами галогена, CN-группами; циклического простого эфира, содержащего от 5 до 6 атомов в цикле, а также простых или сложных эфиров, выбранных из C1-C8 алкил-O-C1-C8 алкила, C1-С8 алкил-O-С1-С8 алкил-О- C1-C8 алкила, C1-C8 алкил-O-C6 арила, С6 арил-О-С6 арила, C1-C8 алкил-С(O)O-С1-С8 алкила, C1-C8 алкил-C(O)O-C6 арила, С6 арил-C(O)O-C1-C8 алкила, С6 арил-С(O)O-С6 арила, где C1-C8 алкил, незамещенный или замещенный одним или несколькими атомами галогена или CN-группами; С6 арил, незамещенный или замещенный одним или несколькими атомами галогена, C1-C5 алкилами или CN-группами, или их смеси. Предпочтительно инертный органический растворитель выбирают из бензола, толуола, трифтортолуола, ксилолов, ацетонитрила, пропионитрила, бензонитрила, диоксана, тетрагидрофурана, хлористого метилена, диметоксиэтана, метил трет-бутилового эфира, или их смеси.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором стадию кислотного гидролиза соединения 3Е в соединение 3 проводят при температуре от приблизительно -20°С до приблизительно 50°С, а именно поддерживают температуру приблизительно -20°С, приблизительно -15°С, приблизительно -10°С, приблизительно -5°С, приблизительно 0°С, приблизительно 5°С, приблизительно 10°С, приблизительно 15°С, приблизительно 20°С, приблизительно 25°С, приблизительно 30°С, приблизительно 35°С, приблизительно 40°С, приблизительно 45°С, приблизительно 50°С, предпочтительно от приблизительно 0°С до приблизительно 10°С.
В одном варианте осуществления настоящего изобретения стадию получения соединения 3 стадия а) и стадию получения соединения 3Е и последующий кислотный гидролиз соединения 3Е в соединение 3 проводят в одном реакторе (one-pot реакция) без выделения соединений 3 и 3Е.
В одном варианте осуществления настоящего изобретения стадию получения соединения 3 стадия а) и стадию получения соединения 3Е проводят в одном реакторе и последующий кислотный гидролиз соединения 3Е в соединение 3 проводят во втором реакторе.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором выход соединения 3 составляет от приблизительно 30% до приблизительно 95%, предпочтительно от приблизительно 45% до приблизительно 75%.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором чистота соединения 3 составляет от приблизительно 80 до приблизительно 98%, предпочтительно от приблизительно 90 до приблизительно 96%.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором чистота эверолимуса EVR составляет от приблизительно 85 до приблизительно 99,9%, предпочтительно от приблизительно 95 до приблизительно 99,7%.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором соотношение объема инертного органического растворителя к массе соединения 1 составляет от приблизительно 1 до приблизительно 10, предпочтительно от приблизительно 1 до приблизительно 4.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором количество эквивалентов соединения 2 к соединению 1 составляет от приблизительно 1,5 до приблизительно 5, предпочтительно от приблизительно 2,0 до приблизительно 3,0.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором количество эквивалентов соединения В к соединению 1 составляет от приблизительно 1,6 до приблизительно 6, предпочтительно от приблизительно 2,5 до приблизительно 3,5.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором стадия кислотного гидролиза соединения 3Е в соединение 3 происходит при соотношении объема органического растворителя к массе соединения 1 составляет от приблизительно 5 до приблизительно 30, предпочтительно от приблизительно 10 до приблизительно 15.
Настоящее изобретение относится к способу получения эверолимуса EVR

включающему
а) взаимодействие рапамицина 1

и соединения 2

где R1, R2, R3 представляют собой С1-С5 алкил, С6-С14 арил или C5-C8 циклоалкил, LG представляет собой С1-С5 алкилсульфонат, незамещенный или замещенный одним или несколькими атомами галогена, C6-C14 арилсульфонат, незамещенный или замещенный одним или несколькими атомами галогена, C1-C5 алкилами,
в присутствии одного или нескольких соединений, представляющих собой третичные аминные основания,
с получением соединения 3
 где R1, R2, R3 представляют собой C1-C5 алкил, C6-C14 арил или C5-C8 циклоалкил,
где R1, R2, R3 представляют собой C1-C5 алкил, C6-C14 арил или C5-C8 циклоалкил,
и соединения 3Е
 где R1, R2, R3 представляют собой C1-C5 алкил, C6-C14 арил или C5-C8 циклоалкил,
где R1, R2, R3 представляют собой C1-C5 алкил, C6-C14 арил или C5-C8 циклоалкил,
b) последующий кислотный гидролиз соединения 3Е в соединение 3,
c) снятие защитной группы -SiR1R2R3 у соединения 3, где R1, R2, R3 представляют собой C1-C5 алкил, C6-C14 арил или C5-C8 циклоалкил, с получением эверолимуса EVR.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором третичное аминное основание представляет 2,6-диалкилпиридин, 4-незамещенный или 4-замещенный атомом галогена, CN-группой, C1-C5 алкилом, незамещенным или замещенным одним или несколькими атомами галогена, CN-группами; 2,6-диалкилпиридин, 4-замещенный С(O)O-С1-С8-алкил группой, C(O)O-C6 арил группой, где C1-C8 алкил - незамещенный или замещенный одним или несколькими атомами галогена или CN-группами, С6 арил - незамещенный или замещенный одним или несколькими атомами галогена, C1-C5 алкилами или CN-группами; тризамещенный амин, где заместители представляют независимо C1-C5 алкил, C6-C14 арил или C5-C8 циклоалкил или их смесь. Предпочтительно в качестве третичного аминного основания выбирают 2,6-диметилпиридин, 2,6-ди-(трет-бутил)пиридин, 2,4,6-триметилпиридин, 2,6-диметил-4-(трет-бутил)пиридин, 4-метил-2,6-ди-(трет-бутил)пиридин, N,N-диизопропилэтиламин, N,N-диизопропилпент-3-иламин, N,N-диизопропилнон-5-иламин и N,N-диизобутил(2,4-диметилпент-3-ил)амин, N,N-диизопропифениламин.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором R1, R2, R3, представляют собой независимо друг от друга метил, фенил, трет-бутил, циклогексил, LG представляет собой трифторметилсульфонат.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором дополнительно используют инертный органический растворитель, выбранный из бензола, незамещенного или замещенного одним или несколькими атомами галогена, CN-группами, С1-С5 алкилами, незамещенными или замещенными одним или несколькими атомами галогена, CN-группами; незамещенного С5-С8 алкана; C1-C8 алкана, замещенного одним или несколькими атомами галогена, CN-группами; незамещенного С5-С8 циклоалкана; C3-C8 циклоалкана, замещенного одним или несколькими атомами галогена, CN-группами; циклического простого эфира, содержащего от 5 до 6 атомов в цикле, а также простых или сложных эфиров, выбранных из C1-C8 алкил-O-С1-С8 алкила, C1-C8 алкил-O-C1-C8 алкил-О- C1-C8 алкила, C1-C8 алкил-O-C6 арила, С6 арил-O-C6 арила, C1-C8 алкил-С(O)O-С1-С8 алкила, C1-C8 алкил-С(O)O-С6 арила, С6 арил-С(O)O-С1-С8 алкила, С6 арил-С(O)O-С6 арила, где C1-C8 алкил, незамещенный или замещенный одним или несколькими атомами галогена или CN-группами; С6 арил, незамещенный или замещенный одним или несколькими атомами галогена, C1-C5 алкилами или CN-группами, или их смеси, предпочтительно инертный органический растворитель выбирают из бензола, толуола, трифтортолуола, ксилолов, ацетонитрила, пропионитрила, бензонитрила, диоксана, тетрагидрофурана, хлористого метилена, диметоксиэтана, метил трет-бутилового эфира, или их смеси.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором поддерживают температуру реакции на стадии а) от приблизительно 10°С до приблизительно 70°С, а именно поддерживают температуру приблизительно 10°С, приблизительно 15°С, приблизительно 20°С, приблизительно 25°С, приблизительно 30°С, приблизительно 35°С, приблизительно 40°С, приблизительно 45°С, приблизительно 50°С, приблизительно 55°С, приблизительно 60°С, приблизительно 65°С, приблизительно 70°С, предпочтительно от приблизительно 20°С до приблизительно 50°С.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором кислотный гидролиз соединения 3Е в соединение 3 проводят в минеральной или органической кислоте в органическом растворителе, при этом рН составляет приблизительно ниже 3, а именно: ниже 3, ниже 2.9, ниже 2.8, ниже 2.7, ниже 2.6, ниже 2.5, ниже 2.4, ниже 2.3, ниже 2.2, ниже 2.1, ниже 2.0, ниже 1.9, ниже 1.8, ниже 1.7, ниже 1.6, ниже 1.5, ниже 1.4, ниже 1.3, ниже 1.2, ниже 1.1, ниже 1.0. Минеральную кислоту выбирают из соляной, серной, или фосфорной кислот. Органическую кислоту выбирают из трифторуксусной кислоты. Органический растворитель выбирают из метанола, этанола, 1-пропанола, 2-пропанола, 1-бутанола, 2-бутанола, 3-метилпропан-1-ола, 3-метилпропан-2-ола, этандиола, трет-бутанола, 1,2-пропандиола, 1,3-пропандиола или их смесь. Органический растворитель выбирают из комбинации протонного органического растворителя, выбранного из метанола, этанола, 1-пропанола, 2-пропанола, 1-бутанола, 2-бутанола, 3-метилпропан-1-ола, 3-метилпропан-2-ола, этандиола, трет-бутанола, 1,2-пропандиола, 1,3-пропандиола или их смеси, с инертным органическим растворителем, выбранным из бензола, незамещенного или замещенного одним или несколькими атомами галогена, CN-группами, C1-C5 алкилами, незамещенными или замещенными одним или несколькими атомами галогена, CN-группами; незамещенного C5-C8 алкана; C1-C8 алкана, замещенного одним или несколькими атомами галогена, CN-группами; незамещенного C5-C8 циклоалкана; С3-C8 циклоалкана, замещенного одним или несколькими атомами галогена, CN-группами; циклического простого эфира, содержащего от 5 до 6 атомов в цикле, а также простых или сложных эфиров, выбранных из C1-С8 алкил-O-С1-С8 алкила, C1-С8 алкил-O-С1-С8 алкил-О-C1-C8 алкила, C1-C8 алкил-O-C6 арила, С6 арил-О-С6 арила, C1-C8 алкил-С(O)O-С1-С8 алкила, C1-C8 алкил-С(O)O-С6 арила, С6 арил-С(O)O-С1-С8 алкила, С6 арил-С(O)O-С6 арила, где C1-C8 алкил, незамещенный или замещенный одним или несколькими атомами галогена или CN-группами; С6 арил, незамещенный или замещенный одним или несколькими атомами галогена, C1-C5 алкилами или CN-группами, или их смеси, предпочтительно инертный органический растворитель выбирают из бензола, толуола, трифтортолуола, ксилолов, ацетонитрила, пропионитрила, бензонитрила, диоксана, тетрагидрофурана, хлористого метилена, диметоксиэтана, метил трет-бутилового эфира, или их смеси.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором снятие защитной группы -SiR1R2R3 у соединения 3 проводят под действием раствора фтороводорода в пиридине или триэтиламине или их смеси. При необходимости дополнительно к раствору фтороводорода добавляют минеральную или органическую кислоту. Минеральная кислота представляет собой соляную или серную кислоты, органическая кислота представляет собой муравьиную кислоту. При необходимости защитную группу снимают в растворителе, выбранном из группы, включающей тетрагидрофуран, метилтетрагидрофуран, ацетон, гептан, метанол, ацетонитрил и гексафторизопропанол или в их смеси.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором стадию кислотного гидролиза соединения 3Е в соединение 3 проводят при температуре от приблизительно -20°С до приблизительно 50°С, а именно поддерживают температуру приблизительно -20°С, приблизительно -15°С, приблизительно -10°С, приблизительно -5°С, приблизительно 0°С, приблизительно 5°С, приблизительно 10°С, приблизительно 15°С, приблизительно 20°С, приблизительно 25°С, приблизительно 30°С, приблизительно 35°С, приблизительно 40°С, приблизительно 45°С, приблизительно 50°С, предпочтительно от приблизительно 0°С до приблизительно 10°С.
В одном варианте осуществления настоящего изобретения стадию b) кислотного гидролиза соединения 3Е в соединение 3 проводят в одном реакторе (one-pot реакция) со стадией а) без выделения соединений 3 и 3Е.
В одном варианте осуществления настоящего изобретения стадию а) проводят в одном реакторе, а стадию b) кислотного гидролиза соединения 3Е в соединение 3 проводят во втором реакторе.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором поддерживают температуру реакции на стадии с) от приблизительно -20°С до приблизительно 60°С, а именно поддерживают температуру приблизительно -20°С, приблизительно -15°С, приблизительно -10°С, приблизительно -5°С, приблизительно 0°С, приблизительно 5°С, приблизительно 10°С, приблизительно 15°С, приблизительно 20°С, приблизительно 25°С, приблизительно 30°С, приблизительно 35°С, приблизительно 40°С, приблизительно 45°С, приблизительно 50°С, приблизительно 55°С, приблизительно 60°С, предпочтительно от приблизительно 0°С до приблизительно 15°С.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором выход соединения 3 составляет от приблизительно 30% до приблизительно 95%, предпочтительно от приблизительно 45% до приблизительно 75%.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором чистота соединения 3 составляет от приблизительно 80 до приблизительно 98%, предпочтительно от приблизительно 90 до приблизительно 96%.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором чистота эверолимуса EVR составляет от приблизительно 85 до приблизительно 99,9%, предпочтительно от приблизительно 95 до приблизительно 99,7%.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором соотношение объема инертного органического растворителя к массе соединения 1 составляет от приблизительно 1 до приблизительно 10, предпочтительно от приблизительно 1 до приблизительно 4.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором количество эквивалентов соединения 2 к соединению 1 составляет от приблизительно 1,5 до приблизительно 5, предпочтительно от приблизительно 2,0 до приблизительно 3,0.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором количество эквивалентов третичного аминного основания к соединению 1 составляет от приблизительно 1,6 до приблизительно 6, предпочтительно от приблизительно 2,5 до приблизительно 3,5.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором стадия кислотного гидролиза соединения 3Е в соединение 3 происходит при соотношении объема органического растворителя к массе соединения 1 составляет от приблизительно 5 до приблизительно 30, предпочтительно от приблизительно 10 до приблизительно 15.
В одном варианте осуществления настоящее изобретение относится к способу получения эверолимуса EVR, в котором выход соединения 3 составляет от приблизительно 30% до приблизительно 95%, предпочтительно от приблизительно 45% до приблизительно 75%.
Изобретение также относится к новому соединению 3Е, получающемуся при реакции соединения 1 и соединения 2 и использующемуся в качестве промежуточного соединения в способе получения эверолимуса,

где R1, R2, R3 представляют собой C1-C5 алкил, С6-С14 арил или C5-C8 циклоалкил.
В одном варианте осуществления настоящее изобретение относится к новому соединению 3Е, представляющему собой 18.20-оксетановое производное 20-О,40-О-ди-(2-((трет-бутилдифенилсилил)окси)этил)рапамицина
Новые способы по настоящему изобретению представлены на Схеме 1.
Схема 1. Способы получения эверолимуса.

Радикалы R1, R2, R3 и LG определены выше.
На Схеме 1 раскрывается способ получения эверолимуса, а также промежуточных соединений, заключающийся в реакции между соединением 1 и соединением 2 в присутствии одного или нескольких оснований в инертном органическом растворителе с получением соединения 3 и соединения 3Е на стадии 1. Дополнительно можно осуществить гидролиз соединения 3Е в соединение 3 в присутствии кислоты на стадии 1а. На Схеме 1 также представлена стадия 2, заключающаяся в снятии защитной группы с соединения 3 с получением эверолимуса EVR.
Известные способы получения промежуточного в синтезе эверолимуса соединения 3 приводят либо к низкой конверсии рапамицина, либо к образованию большого количества побочных продуктов. Был разработан кардинально отличающийся от известных подходов способ получения эверолимуса, заключающийся в том, что один из побочных продуктов алкилирования рапамицина - соединение 3Е - возможно гидролизовать в соединение 3 (Схема 1). На стадии 1а обработка реакционной смеси кислотой в органическом растворителе позволяет перевести соединение 3Е в соединение 3, при этом уже имеющееся в реакционной смеси соединение 3 не деградирует, т.е. можно проводить гидролиз в одном реакторе (one-pot реакция). Это позволяет уменьшить общее содержание примесей, значительно облегчить последующее выделение соединения 3, повысить чистоту получаемого соединения 3 и как результат увеличить выход эверолимуса.
Неожиданно удалось обнаружить, что использование в способе получения эверолимуса соединений В, повышает конверсию соединения 1 до более 90% при использовании небольшого количества эквивалентов алкилирующего соединения 2. Неожиданным открытием стало, что при использовании соединений В основным продуктом помимо соединения 3 становится соединение 3Е, тем самым повышается выход соединения 3 (в пересчете на сумму 3 и 3Е). Проведение дополнительной стадии гидролиза соединения 3Е в 3 уменьшает количество примесей, облегчает выделение и очистку продукта 3, что в конечном итоге увеличивает выход конечного продукта - эверолимуса более, чем на 17%.
Для наилучшего понимания изобретения приводятся следующие примеры. Эти примеры приведены только в иллюстративных целях и не должны толковаться как ограничивающие сферу применения изобретения в любой форме. Эффективность условий способа получения эверолимуса оценивали по сумме площадей соединений 3 и 3Е на ВЭЖХ хроматограмме.
Все публикации, патенты и патентные заявки, указанные в этой спецификации, включены в данный документ путем отсылки. Хотя вышеупомянутое изобретение было довольно подробно описано путем иллюстрации и примерах в целях исключения двусмысленного толкования, специалистам в данной области на основе идей, раскрытых в данном изобретении, будет вполне понятно, что могут быть внесены определенные изменения и модификации без отклонения от сущности и объема прилагаемых вариантов осуществления изобретения.
Примеры
Пример 1. Способ получения соединения 2 2-((трет-Бутилдифенилсилил)окси)этил трифторметансульфоната (TBDPSEG-OTf). Синтез 2-((трет-Бутилдифенилсилил)окси)этан-1-ола (TBDPSEG-OH).
К смеси 189,2 г (2,99 моль) этиленгликоля и 236,5 г (2,99 моль) пиридина прибавили раствор 83.05 г (0,299 моль) TBDPS-C1 в 180 мл хлористого метилена. Смесь перемешивали при 20-22°С в течение трех часов. Прибавили 320 мл воды, органический слой отделили, водный экстрагировали гексаном. Объединенные органические вытяжки промыли 20% раствором лимонной кислоты, насыщенным раствором NaHCO3 и насыщенным раствором NaCl, сушили над MgSO4 и концентрировали в вакууме. Остаток перегнали в вакууме.
Получили 71 г (80%) т. кип. 140-142°С (0,01 мм рт.ст.): бесцветная вязкая жидкость.
Синтез 2-((трет-Бутилдифенилсилил)окси)этил трифторметансульфоната (TBDPSEG-OTf).
К раствору 23,42 г (0,083 моль) ангидрида трифторметансульфокислоты в 300 мл гексана прибавили 24,9 г (0,083 моль) TBDPSEG-OH и 11,24 г (0,087 моль) дизопропилэтиламина в 400 мл гексана с такой скоростью, чтобы температура реакционной смеси не поднималась выше -15°С. Смесь нагрели до комнатной температуры в течение часа и перемешивали при 20-22°С 2 часа. Смесь фильтровали через силикагель, промыли смесью этилацетата и гексана. Маточный раствор концентрировали в вакууме роторного испарителя. Получили 34,7 г продукта (97%).
Аналогично получают соединение 2, где R1=t-Bu, R2=Me, R3=Me, (TBSEG-OTf).
Пример 2. Получение 40-О-(2-гидроксиэтил)рапамицина (EVR), с использованием соединения В - 1,2,2,6,6-пентаметилпиперидин (РМР)
Стадия 1. Получение соединения 3 40-О-(2-((трет-Бутилдифенилсилил)окси)этил)рапамицин (TBDPS-EVR).
В колбу на 100 мл поместили 24,5 г (0,027 моль) соединения 1, прибавили раствор 28,75 г (0,068 моль) соединения 2 (TBDPSEG-OTf) и 12,35 г (0,081 моль) РМР в 27 мл ацетонитрила (1 объем по соединению 1) и перемешивали в атмосфере азота при 40°С в течение 24 часов. К реакционной смеси добавили 10,3 г (0,13 моль) пиридина, упарили в вакууме роторного испарителя. К остатку прибавили 200 мл МТБЭ, промыли раствором лимонной кислоты, раствором NaHCO3 и насыщенным раствором NaCl, сушили над MgSO4 и концентрировали в вакууме. По данным ВЭЖХ конверсия рапамицина 1 составляет 97.9%, суммарное содержание соединения 3 - TBDPS-EVR и примеси 3Е, где R1=t-Bu, R2=Ph, R3=Ph, 78.1%.
Стадия 1a. Перевод 3Е (R1=t-Bu, R2=Ph, R3=Ph) в соединение 3 - TBDPS-EVR
Часть полученного остатка (26 г) растворили в 250 мл метанола, охладили до 2-5°С, добавили из капельной воронки 0.1 М HCl в метаноле до рН 1.9 и перемешивали в течение 1.5 часов. Затем добавили 200 мл воды и экстрагировали этилацетатом. Органические вытяжки промыли водой и насыщенным раствором NaCl, сушили над MgSO4 и концентрировали в вакууме. Остаток очистили с помощью Flash-хроматографии в системе гексан и этилацетат, выход продукта 11.22 г (66%) с хроматографической чистотой более 96%.
Стадия 2. Получение 40-О-(2-гидроксиэтил)рапамицина (эверолимус)
К раствору соединения 3 - TBDPS-EVR 5,15 г (0,0043 моль) в 21 мл ацетонитрила прибавили 15,45 г 25% раствора фтороводорода в пиридине. Смесь перемешивали при 0-5°С в атмосфере азота в течение часа. После вылили в смесь 100 мл воды и 50 мл этилацетата. Водный слой отделили, органический промыли последовательно раствором гидрокарбоната натрия, раствором лимонной кислоты, и насыщенным раствором NaCl. Сушили над сульфатом натрия, сконцентрировали в вакууме, остаток очистили на колонке с силикагелем смесью гексана и этилацетата. Выход эверолимуса 3.83 г (93%), хроматографическая чистота более 98,9%.
Очистка эверолимуса.
Продукт с предыдущей стадии (3,7 г) растворили при 30°С в 14,9 мл этилацетата, затем прибавили по каплям 22,3 мл гептана. После кратковременной продувки азотом бросили затравочные кристаллы эверолимуса (3,7 мг, 0.1% по массе), перемешивали при 30°С 2 часа, при 25°С 1 час, при 10°С 1 час. Осадок фильтровали, промыли смесью гептана и этилацетата и сушили осадок в вакууме масляного насоса (10-2 mbar) при 50°С в течение 16-24 часов. Выход 2,56 г (69%), хроматографическая чистота более 99,5%.
Пример 3. Выделение соединений 3 - TBDPS-EVR и 3Е, где R1=t-Bu, R2=Ph, R3=Ph.
Реакционную смесь, полученную на стадии 1 примера 2, подвергают разделению и очистке с помощью Flash-хроматографии в системе гексан и этилацетат, получают соединение 3 - TBDPS-EVR с выходом 54% и 3Е, где R1=t-Bu, R2=Ph, R3=Ph, с выходом 12% и с чистотой каждого продукта выше 95%.



Данные на оборудование: Масс-спектрометрия

Спектрометр ЯМР

Жидкостной хроматограф

Пример 4. Получение 40-O-(2-гидроксиэтил)рапамицина (EVR) с использованием соединения В - 1,2,2,6,6-пентаметилпиперидина (РМР) в однореакторном исполнении стадии 1 и стадии 1а
Однореакторное исполнение Стадии 1 и 1а. Получение соединения 3 (TBDPS-EVR)
К 105 г (0,114 моль) соединения 1 прибавили раствор 123 г (0,285 моль) соединения 2 (TBDPSEG-OTf) и 53,1 г (0,342 моль) РМР в 105 мл ацетонитрила и перемешивали в атмосфере азота при 30°С в течение 43 часов. К реакционной смеси добавили 1000 мл метанола, охладили до 2-5°С, добавили из капельной воронки 0.1 М HCl в метаноле до рН 1.9 и перемешивали в течение 1.5 часов. Затем добавили 800 мл воды и экстрагировали этилацетатом. Органические вытяжки промыли водой и насыщенным раствором NaCl, сушили над MgSO4 и концентрировали в вакууме. Остаток очистили с помощью Flash-хроматографии в системе гексан и этилацетат, выход продукта TBDPS-EVR 88.53 г (65%) с хроматографической чистотой более 96%.
Стадия 2. Получение 40-О-(2-гидроксиэтил)рапамицина (EVR)
Методика проведения аналогична стадии 2 примера 2. Смесь соединения 3 - TBDPS-EVR 81,2 г (0,064 моль) и 25% раствора фтороводорода в пиридине перемешивали в 325 мл ацетонитрила при 0°С в атмосфере азота в течение часа. После стандартной обработки выход эверолимуса составил 56,8 г (92%), хроматографическая чистота более 98,9%.
Пример 5. Получение соединения 3 - 40-О-(2-((трет-бутилдиметилсилил)окси)этил)рапамицина (TBS-EVR), с использованием соединения В - РМР.
Методика проведения реакции аналогична стадии 1 примера 2. Смесь 1 г (1,11 ммоль) соединения 1, 0,83 г (2,73 ммоль) TBSEG-OTf и 0,50 г (3,27 ммоль) РМР в 1 мл ацетонитрила перемешивали при 10°С в течение 44 часов. К реакционной смеси добавили 0,5 г пиридина, упарили в вакууме роторного испарителя. Суммарный выход по данным ВЭЖХ TBS-EVR и примеси 3Е, где R1=t-Bu, R2=Me, R3=Me, 52,2%.
Пример 6. Повтор примера 5 из документа WO 2014203185 A1 в масштабе 1:5.
Для проверки эффективности существующих методик воспроизведен пример 5 из документа WO 2014203185 A1 в масштабе 1:5. Установлено, что однореакторный процесс (one-pot) протекает с низким выходом и образованием большого числа побочных продуктов. Полная конверсия не достигается даже через 48 часов, через 24 - содержание рапамицина 55.2% (в документе WO 2014203185 A1 заявлено менее 5% после 21 часа), содержание продукта - 35.5%).
Приготовление 1М раствора лимонной кислоты: в мерную колбу 100 мл поместили 19.20 г лимонной кислоты (Panreac), растворили в 75 мл воды (Milli-Q), довели до метки водой (Milli-Q). Приготовление 10% раствора NaHCO3: в конической колбе растворили 10 г NaHCO3 (Вектон, хч) в 90.О г воды (Milli-Q). Толуол выдержали над молекулярными ситами не менее 24 часов перед реакцией. Ангидрид трифторметансульфоновой кислоты перегнали непосредственно перед реакцией над 5% (масс.) Р2О5, собрали фракцию с Ткип=83-84°С. Рапамицин сушили непосредственно перед реакцией при 50°С при 10-2 mbar в течение 16 часов. В круглодонную колбу поместили 2-((трет-бутилдифенилсилил)окси)этан-1-ол (1.64 г, 5.46 ммоль), промыли толуолом (3 г) и (ди-изопропил)пент-2-иламин (1.08 г, 6.30 ммоль), охладили до 0°С, барботируя слабым током азота. Добавили по каплям ангидрид трифторметансульфоновой кислоты (1.46 г, 5.17 ммоль) с такой скоростью, чтобы температура реакционной смеси не превышала 2°С, промыли толуолом (1 г), закрыли реакционную колбу септой и перемешивали 1.5 часа при температуре -2 - 2°С. Добавили (ди-изопропил)пент-2-иламин (1.08 г, 6.30 ммоль), промыли толуолом (0.5 г), добавили рапамицин (2.0 г, 2.19 ммоль), промыли толуолом (2.5 г), продули слабым током азота, закрыли реакционную колбу и перемешивали при температуре 45°С. Через 24 и 48 часов отбирали аликвоты (310 мг) для определения конверсии методом ВЭЖХ. В реакционной смеси содержалось 55.1% рапамицина через 24 часа и 54.8% через 48 часов (по данным ВЭЖХ). Реакционную смесь охладили до комнатной температуры, добавили пиридин (0.2 г), перемешивали при комнатной температуре 30 минут. Разбавили изопропил ацетатом (50 мл), органический слой промыли 1М раствором лимонной кислоты (25 мл), 10% раствором NaHCO3 (25 мл), водой (Milli-Q, 2×25 мл), насыщенным раствором NaCl (25 мл), сушили над MgSO4 (5 г), концентрировали в вакууме. Получили 4.14 г (0.97 г TBDPS-EVR, 37% выход) реакционной смеси, выход определен по данным ВЭЖХ с использованием стандарта.
Полученный выход соединения 3 - TBDPS-EVR меньше заявленного в документе на стр. 26: масса половины реакционной смеси = 5,7 г, что соответствует 88% выходу.
Жидкостной хроматограф

Пример 7. Скрининг условий проведения алкилирования рапамицина.
Методика проведения реакции аналогична стадии 1 примера 2. Смесь 1 г (1,11 ммоль) соединения 1, 1,17 г (2,73 ммоль) TBDPSEG-OTf и 3,27 ммоль, соединения В в указанном объеме растворителя перемешивали при определенной температур. По данным ВЭЖХ определяли конверсию 1, эффективность определяли по суммарному содержанию TBDPS-EVR и примеси 3Е в смеси. Информация представлена в таблице 2.