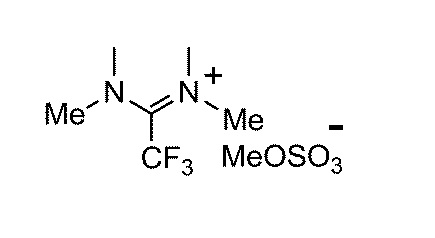
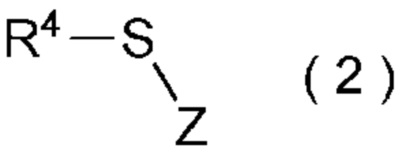Результат интеллектуальной деятельности: ФТОРАЛКИЛИРУЮЩИЙ АГЕНТ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
[0001]
Настоящее изобретение относится к новому фторалкилирующему агенту.
[0002]
Также настоящее изобретение относится к новому соединению, способу его получения и его применению в качестве фторалкилирующего агента.
Уровень техники
[0003]
Соединения, содержащие фторалкилирующую группу, используются в качестве различных химических продуктов (например, фармацевтических препаратов, сельскохозяйственных химикатов, материалов для электронного оборудования и так далее), а также производства их промежуточных соединений.
[0004]
Для получения соединений, содержащих фторалкильную группу, реакции фторалкилирования и фторалкилирующие агенты были разработаны ранее. Реакция фторалкилирования представляет собой реакцию, посредством которой фторалкилирующую группу вводят в исходное соединение (соединение материала), который представляет собой органическое соединение. Другими словами, реакция фторалкилирования представляет собой реакцию, посредством которой получают целевое соединение, содержащее фторалкилирующую группу, путем взаимодействия исходного соединения (соединения материала), который представляет собой органическое соединение, с фторалкилирующим агентом.
[0005]
(Фторалкил)триалкилсиланы, представленные (трифторметил)триметилсиланом (реагент Руперта-Пракаша), известны как фторалкилирующие агенты, которые традиционно используются для реакции фторалкилирования (см. непатентный документ 1). Реакции фторалкилирования, в которых используются указанные фторалкилирующие агенты, определяются как нуклеофильные реакции. Кроме того, указанные фторалкилирующие агенты демонстрируют хорошую реакционную способность. Тем не менее, для получения фторалкилирующих агентов необходим, в качестве их материала, трифторметан (CHF3 HFC-23) - газ, вызывающий парниковый эффект, или трифториодметан (CF3I) или бромтрифторметан (CBrF3) - газообразный фреон. Соответственно, эти фторалкилирующие агенты дают большую нагрузку на окружающую среду. Кроме того, в реакциях фторалкилирования для этих фторалкилирующих агентов необходим инициатор, такой как фториды. Кроме того, в реакции с использованием некоторых исходных соединений, таких как альдегиды, эти фторалкилирующие агенты имеют недостаток, заключающийся в том, что, вследствие экзотермического эффекта, температура не может контролироваться.
[0006]
Что касается реакции фторалкилирования, также известна реакция с использованием трифторметана (CHF3) при низкой температуре (см. непатентный документ 2). Тем не менее, существует недостаток, заключающийся в том, что для этого метода необходим трифторметан, который, как описано выше, представляет собой газ, вызывающий парниковый эффект.
[0007]
В то же время, разработка новых продуктов с использованием соединения, содержащего фторалкилирующую группу, осуществлялась в различных областях биологически активных агентов, функциональных агентов и тому подобное. В последние годы, в целях удовлетворения их спроса, были разработаны различные фторалкилирующие агенты.
[0008]
Например, в качестве фторалкилирующего агента, известно производное фторалкилфенилсульфона (см. непатентные документы 3 и 4). Сообщалось, что производное фторалкилфенилсульфона является превосходным фторалкилирующим агентом для альдегидов, иминов и тому подобное. Тем не менее, условия проведения реакции с использованием производного фторалкилфенилсульфона включают низкую температуру от -70°C до 30°C. Таким образом, указанный фторалкилирующий агент не является предпочтительным с промышленной точки зрения, поскольку требуется специальное промышленное оборудование.
[0009]
Известно, что, как и другой фторалкилирующий агент, безводная соль, полученная из гидрата гексафторацетона и 1,8-диазабицикло[5.4.0]-7-унден-7-ена (DBU), вступает во взаимодействие аналогично описанному производному фторалкилфенилсульфону, указанному выше (см. патентный документ 3 и непатентный документ 5). Во взаимодействии этой безводной соли, только одна из двух фторалкильных групп, которые содержатся в той же самой молекуле безводной соли, может быть использована для взаимодействия. Таким образом, этот способ является неэффективным. Кроме того, способ с использованием этой безводной соли требует, в большинстве случаев, избыточное количество соли четвертичного аммония и низкую температуру. Таким образом, этот способ является сложным.
[0010]
В качестве другого фторалкилирующего агента, сообщалось о соединениях, содержащих фторалкилирующую группу на своем гетероатоме, таком как сера или фосфор. Известно, что эти соединения, то есть, фторалкилирующие агенты, также взаимодействуют аналогичным образом (непатентные документы 6, 7 и 8). Эти фторалкилирующие агенты могут вводить фторалкилирующую группу в альдегиды или кетоны в мягких условиях взаимодействия. Тем не менее, для способов получения этих фторалкилирующих агентов необходим, в качестве их материала, вышеуказанный (трифторметил)триметилсилан (реагент Руперта-Пракаша), трифторметан (CHF3, HFC-23) - газ, вызывающий парниковый эффект, или трифториодметан (CF3I) или бромтрифторметан (CBrF3) - газообразный фреон. Таким образом, эти фторалкилирующие агенты не могут по существу устранить вышеуказанные недостатки.
[0011]
Как описано выше, обычные фторалкилирующие агенты в значительной степени находятся в зависимости от газа, вызывающего парниковый эффект, (например, CHF3) или фреона (например, CF3I или CBrF3). С учетом экологических аспектов, усовершенствование промышленно используемого фторалкилирующего агента до сих пор не было осуществлено удовлетворительным образом.
Перечень ссылок
Патентные документы
[0012]
Патентный документ 1: WO96/33168
Патентный документ 2: WO2013/157229 A1
Патентный документ 3: WO2012/129384 A2
Непатентные документы
[0013]
Непатентный документ 1: Tetrahedon Lett., 25 (21), 2195-2198 (1984)
Непатентный документ 2: Tetrahedon, 54, 13771-13782 (1998)
Непатентный документ 3: Org. Lett., 5 (18), 3253-3256 (2003)
Непатентный документ 4: Org. Lett., 12 (13), 2932-2935 (2010)
Непатентный документ 5: Org. Lett., 15 (1), 208-211 (2013)
Непатентный документ 6: J. Am. Chem. Soc., 125, 12366-12367 (2003)
Непатентный документ 7: J. Fluoro. Chem., 70, 271-276 (1995)
Непатентный документ 8: Tetrahedon Lett., 51 (2), 252-255 (2010)
Сущность изобретения
Техническая задача, на решение которой направлено изобретение
[0014]
Целью настоящего изобретения является обеспечение предпочтительного, с промышленной точки зрения, фторалкилирующего агента и его использования, что может устранить вышеуказанные один или несколько недостатков и проблем предшествующего уровня техники.
[0015]
Другой целью по настоящему изобретению является обеспечение фторалкилирующего агента, которое пригодно для промышленного производства, является экономически более предпочтительным и экологически более совершенным.
[0016]
В частности, например, одной из целей по настоящему изобретению является снижение нагрузки на окружающую среду путем исключения использования газа, вызывающего парниковый эффект, (например, CHF3) или фреона (например, CF3I или CBrF3) в качестве материала для фторалкилирующего агента.
[0017]
Еще одной целью настоящего изобретения является обеспечение реакции фторалкилирования, которая может быть осуществлена посредством простого реакционного процесса в мягких условиях реакции и без необходимости специальных технических средств.
Решение задачи
[0018]
С учетом обстоятельств, описанных выше, авторы настоящего изобретения тщательно изучали способ получения соединения, содержащего фторалкильную группу. В результате авторы настоящего изобретения неожиданно обнаружили, что соединение, содержащее фторалкилирующую группу, может быть получено с использованием соединения, представленного общей формулой (1), описанной ниже. На основании этих результатов авторы настоящего изобретения осуществили настоящее изобретение.
[0019]
Настоящее изобретение устраняет вышеуказанные недостатки путем обеспечения объектов, описанных ниже. То есть, в одном из вариантов осуществления настоящее изобретение относится к следующему:
[0020]
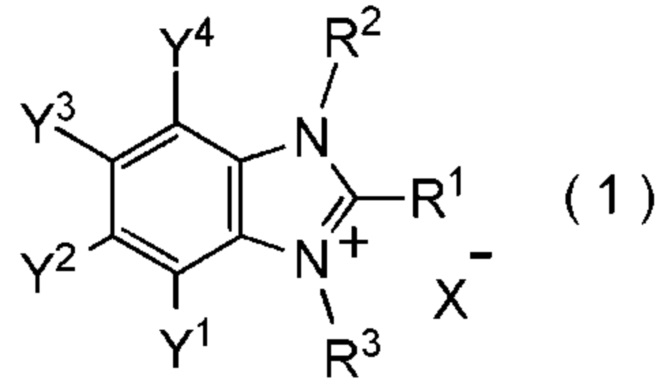
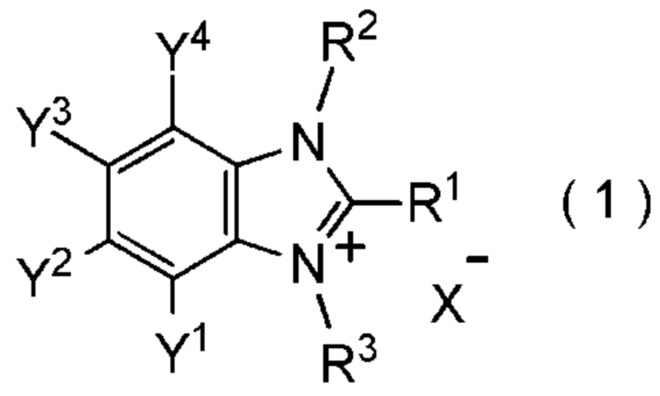
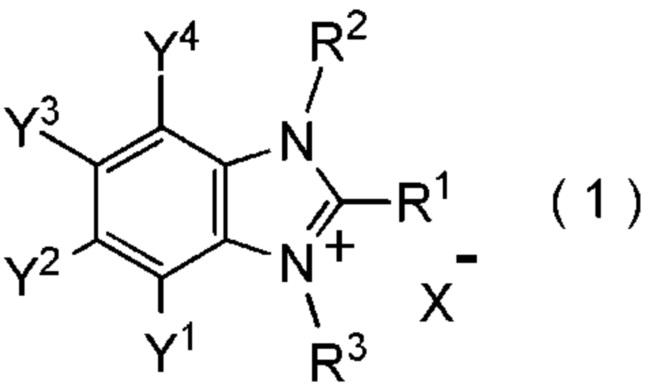
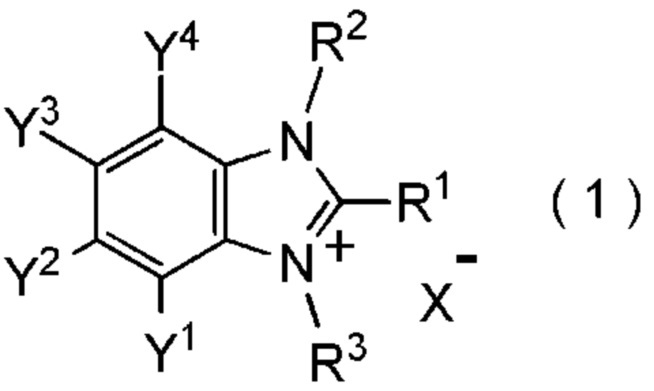
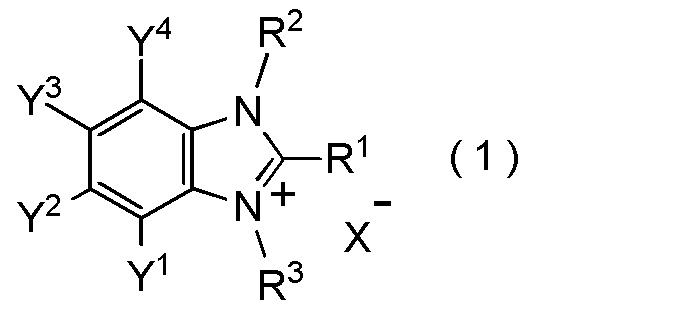
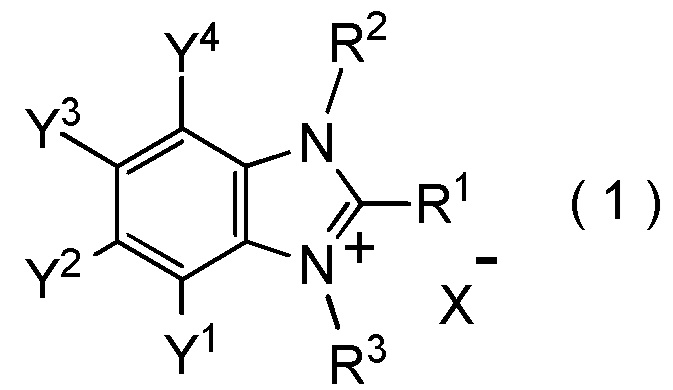
[I-1] фторалкилирующий агент, представленный общей формулой (1):
[0021]
[Химическая формула 1]
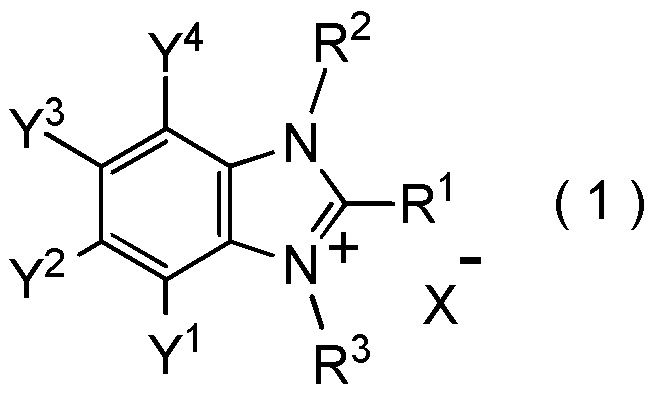
где R1 представляет собой C1-C8 фторалкильную группу;
R2 и R3 представляют собой, каждый, независимо
C1-C12 алкильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкенильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкинильную группу, которая может содержать один или несколько заместителей,
C3-C8 циклоалкильную группу, которая может содержать один или несколько заместителей или
C6-C10 арильную группу, которая может содержать один или несколько заместителей;
Y1, Y2, Y3 и Y4 представляют собой, каждый, независимо
атом водорода, атом галогена, нитрогруппу, цианогруппу,
C1-C12 алкильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкенильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкинильную группу, которая может содержать один или несколько заместителей,
C3-C8 циклоалкильную группу, которая может содержать один или несколько заместителей,
гидрокси группу,
C1-C6 алкокси группу,
C1-C6 алкилтио группу, C1-C6 алкилсульфинильную группу, C1-C6 алкилсульфонильную группу,
амино группу, моно (C1-C6 алкил) амино группу, ди(C1-C6 алкил) амино группу,
C1-C6 ациламино группу,
формильную группу, C2-C6 ацильную группу,
C1-C6 алкоксикарбонильную группу,
C6-C10 арильную группу, которая может содержать один или несколько заместителей, или
гетероциклическую группу, которая может содержать один или несколько заместителей, где гетероциклическая группа представляет собой 5-10-членную гетероциклическую группу, содержащую от 1 до 9 атомов углерода и от 1 до 4 гетероатомов, независимо выбранных из атома азота, атома кислорода и атома серы, или
два смежных заместителя Y1 и Y2, Y2 и Y3, или Y3 и Y4, вместе с атомами углерода, к которым эти заместители присоединены, образуют 4-8-членное карбоциклическое кольцо или 4-8-членное гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, выбранных независимо из атома кислорода, атома серы и атома азота, где образованное кольцо может иметь один или несколько заместителей; и
X- представляет собой моновалентный анион.
[0022]
[I-2] Агент по п.[I-1], где R1 представляет собой C1-C8 перфторалкильную группу.
[0023]
[I-3] Агент по п.[I-1], где R1 представляет собой C1-C4 перфторалкильную группу.
[0024]
[I-4] Агент по п.[I-1], где R1 представляет собой трифторметильную группу или пентафторэтильную группу.
[0025]
[I-5] Агент в соответствии с пунктом [I-1], где R1 представляет собой трифторметильную группу.
[0026]
[I-6] Агент в соответствии с любым из пунктов [I-1] - [I-5], где R2 и R3 представляют собой, каждый, независимо
C1-C6 алкильную группу,
фенильную группу, где фенильная группа может иметь от 1 до 5 заместителей, выбранных независимо из атома галогена, нитрогруппы, циано группы, C1-C6 алкильной группы, C1-C6 галогеналкильной группы, C2-C6 ацильной группы и C1-C6 алкоксикарбонильной группы, или
фенил C1-C2 алкильную группу, где фрагмент фенильной группы может содержать от 1 до 5 заместителей, выбранных независимо из атома галогена, C1-C6 алкильной группы и C1-C6 галогеналкильной группы.
[0027]
[I-7] Агент в соответствии с любым из пунктов [I-1] - [I-5], где R2 и R3 представляют собой, каждый, независимо C1-C4 алкильную группу или фенильную группу.
[0028]
[I-8] Агент в соответствии с любым из пунктов [I-1] - [I-5], где R2 и R3 представляют собой, каждый, независимо метильную группу, этильную группу или фенильную группу.
[0029]
[I-9] Агент в соответствии с любым из пунктов [I-1] - [I-5], где R2 и R3 представляют собой, каждый, метильную группу.
[0030]
[I-10] Агент в соответствии с любым из пунктов [I-1] - [I-9], где Y1, Y2, Y3 и Y4 представляют собой, каждый, независимо
атом водорода, атом галогена, нитрогруппу, цианогруппу,
C1-C12 алкильную группу, C1-C6 галогеналкильную группу,
C1-C6 алкилтио группу, C1-C6 алкилсульфинильную группу, C1-C6 алкилсульфонильную группу,
C2-C6 ацильную группу,
C1-C6 алкоксикарбонильную группу,
фенильную группу или
пиридильную группу.
[0031]
[I-11] Агент в соответствии с любым из пунктов [I-1] - [I-9], где Y1, Y2, Y3 и Y4 представляют собой, каждый, независимо
атом водорода, атом галогена, нитрогруппу, цианогруппу,
C1-C4 алкильную группу или C1-C4 галогеналкильную группу.
[0032]
[I-12] Агент в соответствии с любым из пунктов [I-1] - [I-9], где Y1, Y2, Y3 и Y4 представляют собой, каждый, независимо атом водорода, атом хлора или нитрогруппу.
[0033]
[I-13] Агент в соответствии с любым из пунктов [I-1] - [I-9], где Y1, Y2, Y3 и Y4 представляют собой, каждый, атом водорода.
[0034]
[I-14] Агент в соответствии с любым из пунктов [I-1] - [I-9], где Y1, Y3 и Y4 представляют собой, каждый, атом водорода; и Y2 представляет собой атом хлора.
[0035]
[I-15] Агент в соответствии с любым из пунктов [I-1] - [I-9], где Y1, Y3 и Y4 представляют собой, каждый, атом водорода; и Y2 представляет собой нитро группу.
[0036]
[I-16] Агент в соответствии с любым из пунктов [I-1] - [I-9], где Y1, Y2, Y3 и Y4 представляют собой, каждый, атом хлора.
[0037]
[I-17] Агент в соответствии с любым из пунктов [I-1] - [I-16], где X- представляет собой любой из галогенид-ионов, борат-ионов, фосфат-ионов, антимонат-ионов, карбоксилат-ионов, сульфонат-ионов, сульфат-ионов, карбонат-ионов, нитрат-ионов и амид-ионов.
[0038]
[I-18-1] Агент в соответствии с любым из пунктов [I-1] - [I-16], где X- представляет собой F-, Cl-, Br-, I-,
BF4-, C6H5BF3-,
PF6-,
SbF6-,
CH3CO2-, CF3CO2-, C2F5CO2-,
CH3SO3-, C2H5SO3-, CF3SO3-, C6H5SO3-, 4-CH3-C6H4SO3-, 4-Cl-C6H4SO3-, 4-NO2-C6H4SO3-,
HOSO3-, CH3OSO3-, C2H5OSO3-, C3H7OSO3-, изо-C3H7OSO3-, C4H9OSO3-, C6H5OSO3-,
HCO3-, CH3OCO2-
NO3-,
(CN)2N- или (CF3SO2)2N-.
[0039]
[I-18-2-1] Агент в соответствии с любым из пунктов [I-1] - [I-16], где X- представляет собой F-, Cl-, Br-, I-,
BF4-,
CH3CO2-, CF3CO2-,
CH3SO3-, CF3SO3-,
HOSO3-, CH3OSO3- или C2H5OSO3-.
[0040]
[I-18-2-2] Агент в соответствии с любым из пунктов [I-1] - [I-16], где X- представляет собой I-,
BF4-,
CF3CO2-,
CF3SO3-,
HOSO3-, CH3OSO3- или C2H5OSO3-.
[0041]
[I-18-2-3] Агент в соответствии с любым из пунктов [I-1] - [I-16], где X- представляет собой I-,
BF4-,
CF3SO3-,
HOSO3-, CH3OSO3- или C2H5OSO3-.
[0042]
[I-18-2-4] Агент в соответствии с любым из пунктов [I-1] - [I-16], где X- представляет собой I-,
BF4-,
CF3SO3-,
CH3OSO3- или C2H5OSO3-.
[0043]
[I-18-2-5] Агент в соответствии с любым из пунктов [I-1] - [I-16], где X- представляет собой I-,
BF4-,
CF3SO3-,
CH3OSO3-.
[0044]
[I-18-3] Агент в соответствии с любым из пунктов [I-1] - [I-16], где X- представляет собой F-, Cl-, Br-, I-,
BF4-,
CH3CO2-, CF3CO2-,
CH3SO3-, CF3SO3-,
CH3OSO3- или C2H5OSO3-.
[0045]
[I-19-1] Агент в соответствии с любым из пунктов [I-1] - [I-16], где X- представляет собой Cl-, Br-, I-,
BF4-,
CF3SO3-,
HOSO3-, CH3OSO3- или C2H5OSO3-.
[0046]
[I-19-2] Агент в соответствии с любым из пунктов [I-1] - [I-16], где X- представляет собой Cl-, Br-, I-,
BF4-,
CF3SO3-,
CH3OSO3- или C2H5OSO3-.
[0047]
[I-20] Агент в соответствии с любым из пунктов [I-1] - [I-16], где X- представляет собой CH3OSO3-.
[0048]
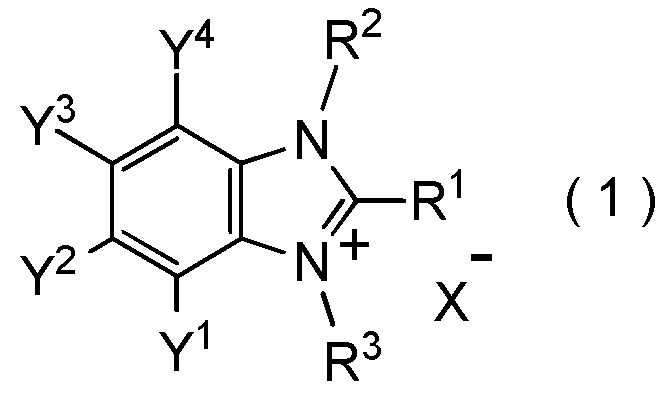
[I-21] Способ получения целевого соединения, содержащего R1, где R1 является таким, как определено ниже, который включает взаимодействие исходного соединения с фторалкилирующим агентом, представленным общей формулой (1):
[0049]
[Химическая формула 2]
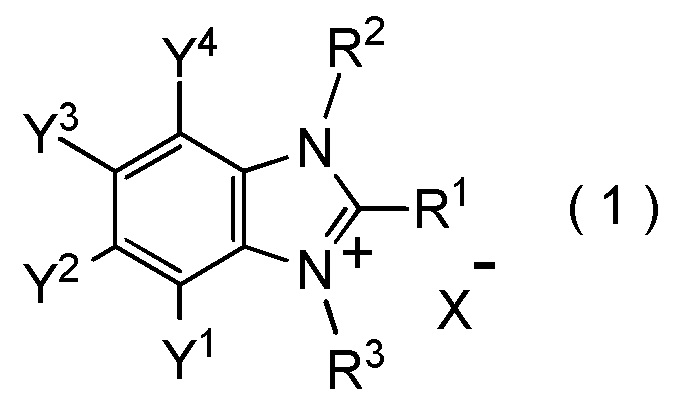
где R1 представляет собой C1-C8 фторалкильную группу;
R2 и R3 представляют собой, каждый, независимо
C1-C12 алкильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкенильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкинильную группу, которая может содержать один или несколько заместителей,
C3-C8 циклоалкильную группу, которая может содержать один или несколько заместителей или
C6-C10 арильную группу, которая может содержать один или несколько заместителей;
Y1, Y2, Y3 и Y4 представляют собой, каждый, независимо
атом водорода, атом галогена, нитрогруппу, цианогруппу,
C1-C12 алкильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкенильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкинильную группу, которая может содержать один или несколько заместителей,
C3-C8 циклоалкильную группу, которая может содержать один или несколько заместителей,
гидрокси группу,
C1-C6 алкокси группу,
C1-C6 алкилтио группу, C1-C6 алкилсульфинильную группу, C1-C6 алкилсульфонильную группу,
амино группу, моно (C1-C6 алкил) амино группу, ди(C1-C6 алкил) амино группу,
C1-C6 ациламино группу,
формильную группу, C2-C6 ацильную группу,
C1-C6 алкоксикарбонильную группу,
C6-C10 арильную группу, которая может содержать один или несколько заместителей, или
гетероциклическую группу, которая может содержать один или несколько заместителей, где гетероциклическая группа представляет собой 5-10-членную гетероциклическую группу, содержащую от 1 до 9 атомов углерода и от 1 до 4 гетероатомов, независимо выбранных из атома азота, атома кислорода и атома серы, или
два смежных заместителя Y1 и Y2, Y2 и Y3, или Y3 и Y4, вместе с атомами углерода, к которым эти заместители присоединены, образуют 4-8-членное карбоциклическое кольцо или 4-8-членное гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, выбранных независимо из атома кислорода, атома серы и атома азота, где образованное кольцо может иметь один или несколько заместителей; и
X- представляет собой моновалентный анион.
[0050]
[I-22] Способ в соответствии с пунктом [I-21], где R1 представляет собой C1-C8 перфторалкильную группу.
[0051]
[I-23] Способ в соответствии с пунктом [I-21], где R1 представляет собой C1-C4 перфторалкильную группу.
[0052]
[I-24] Способ в соответствии с пунктом [I-21], где R1 представляет собой трифторметильную группу или пентафторэтильную группу.
[0053]
[I-25] Способ в соответствии с пунктом [I-21], где R1 представляет собой трифторметильную группу.
[0054]
[I-26] Способ в соответствии с любым из пунктов [I-21] - [I-25], где R2 и R3 представляют собой, каждый, независимо
C1-C6 алкильную группу,
фенильную группу, где фенильная группа может иметь от 1 до 5 заместителей, выбранных независимо из атома галогена, нитрогруппы, циано группы, C1-C6 алкильной группы, C1-C6 галогеналкильной группы, C2-C6 ацильной группы и C1-C6 алкоксикарбонильной группы, или
фенил C1-C2 алкильную группу, где фрагмент фенильной группы может содержать от 1 до 5 заместителей, выбранных независимо из атома галогена, C1-C6 алкильной группы и C1-C6 галогеналкильной группы.
[0055]
[I-27] Способ в соответствии с любым из пунктов [I-21] - [I-25], где R2 и R3 представляют собой, каждый, независимо C1-C4 алкильную группу или фенильную группу.
[0056]
[I-28] Способ в соответствии с любым из пунктов [I-21] - [I-25], где R2 и R3 представляют собой, каждый, независимо метильную группу, этильную группу или фенильную группу.
[0057]
[I-29] Способ в соответствии с любым из пунктов [I-21] - [I-25], где R2 и R3 представляют собой, каждый, метильную группу.
[0058]
[I-30] Способ в соответствии с любым из пунктов [I-21] - [I-29], где Y1, Y2, Y3 и Y4 представляют собой, каждый, независимо
атом водорода, атом галогена, нитрогруппу, цианогруппу,
C1-C12 алкильную группу, C1-C6 галогеналкильную группу,
C1-C6 алкилтио группу, C1-C6 алкилсульфинильную группу, C1-C6 алкилсульфонильную группу,
C2-C6 ацильную группу,
C1-C6 алкоксикарбонильную группу,
фенильную группу или
пиридильную группу.
[0059]
[I-31] Способ в соответствии с любым из пунктов [I-21] - [I-29], где Y1, Y2, Y3 и Y4 представляют собой, каждый, независимо
атом водорода, атом галогена, нитрогруппу, цианогруппу,
C1-C4 алкильную группу или C1-C4 галогеналкильную группу.
[0060]
[I-32] Способ в соответствии с любым из пунктов [I-21] - [I-29], где Y1, Y2, Y3 и Y4 представляют собой, каждый, независимо атом водорода, атом хлора или нитрогруппу.
[0061]
[I-33] Способ в соответствии с любым из пунктов [I-21] - [I-29], где Y1, Y2, Y3 и Y4 представляют собой, каждый, атом водорода.
[0062]
[I-34] Способ в соответствии с любым из пунктов [I-21] - [I-29], где Y1, Y3 и Y4 представляют собой, каждый, атом водорода; и Y2 представляет собой атом хлора.
[0063]
[I-35] Способ в соответствии с любым из пунктов [I-21] - [I-29], где Y1, Y3 и Y4 представляют собой, каждый, атом водорода; и Y2 представляет собой нитро группу.
[0064]
[I-36] Способ в соответствии с любым из пунктов [I-21] - [I-29], где Y1, Y2, Y3 и Y4 представляют собой, каждый, атом хлора.
[0065]
[I-37] Способ в соответствии с любым из пунктов [I-21] - [I-36], где X- представляет собой любой из галогенид-ионов, борат-ионов, фосфат-ионов, антимонат-ионов, карбоксилат-ионов, сульфонат-ионов, сульфат-ионов, карбонат-ионов, нитрат-ионов и амид-ионов.
[0066]
[I-38-1] Способ в соответствии с любым из пунктов [I-21] - [I-36], где X- представляет собой F-, Cl-, Br-, I-,
BF4-, C6H5BF3-,
PF6-,
SbF6-,
CH3CO2-, CF3CO2-, C2F5CO2-,
CH3SO3-, C2H5SO3-, CF3SO3-, C6H5SO3-, 4-CH3-C6H4SO3-, 4-Cl-C6H4SO3-, 4-NO2-C6H4SO3-,
HOSO3-, CH3OSO3-, C2H5OSO3-, C3H7OSO3-, изо-C3H7OSO3-, C4H9OSO3-, C6H5OSO3-,
HCO3-, CH3OCO2-
NO3-,
(CN)2N- или (CF3SO2)2N-.
[0067]
[I-38-2-1] Способ в соответствии с любым из пунктов [I-21] - [I-36], где X- представляет собой F-, Cl-, Br-, I-,
BF4-,
CH3CO2-, CF3CO2-,
CH3SO3-, CF3SO3-,
HOSO3-, CH3OSO3- или C2H5OSO3-.
[0068]
[I-38-2-2] Способ в соответствии с любым из пунктов [I-21] - [I-36], где X- представляет собой I-,
BF4-,
CF3CO2-,
CF3SO3-,
HOSO3-, CH3OSO3- или C2H5OSO3-.
[0069]
[I-38-2-3] Способ в соответствии с любым из пунктов [I-21] - [I-36], где X- представляет собой I-,
BF4-,
CF3SO3-,
HOSO3-, CH3OSO3- или C2H5OSO3-.
[0070]
[I-38-2-4] Способ в соответствии с любым из пунктов [I-21] - [I-36], где X- представляет собой I-,
BF4-,
CF3SO3-,
CH3OSO3- или C2H5OSO3-.
[0071]
[I-38-2-5] Способ в соответствии с любым из пунктов [I-21] - [I-36], где X- представляет собой I-,
BF4-,
CF3SO3-,
CH3OSO3-.
[0072]
[I-38-3] Способ в соответствии с любым из пунктов [I-21] - [I-36], где X- представляет собой F-, Cl-, Br-, I-,
BF4-,
CH3CO2-, CF3CO2-,
CH3SO3-, CF3SO3-,
CH3OSO3- или C2H5OSO3-.
[0073]
[I-39-1] Способ в соответствии с любым из пунктов [I-21] - [I-36], где X- представляет собой Cl-, Br-, I-,
BF4-,
CF3SO3-,
HOSO3-, CH3OSO3- или C2H5OSO3-.
[0074]
[I-39-2] Способ в соответствии с любым из пунктов [I-21] - [I-36], где X- представляет собой Cl-, Br-, I-,
BF4-,
CF3SO3-,
CH3OSO3- или C2H5OSO3-.
[0075]
[I-40] Способ в соответствии с любым из пунктов [I-21] - [I-36], где X- представляет собой CH3OSO3-.
[0076]
[I-41-A] Способ в соответствии с любым из пунктов [I-21] - [I-40], где взаимодействие исходного соединения с фторалкилирующим агентом, представленным общей формулой (1), выполняется в присутствии основания.
[0077]
[I-42-A-1] Способ в соответствии с пунктом [I-41-A], где основание представляет собой гидроксид щелочного металла, карбонат щелочного металла, гидрид щелочного металла или их смесь.
[0078]
[I-42-A-2] Способ в соответствии с пунктом [I-41-A], где основание представляет собой гидроксид щелочного металла, гидрид щелочного металла или их смесь.
[0079]
[I-42-A-3] Способ в соответствии с пунктом [I-41-A], где основание представляет собой гидроксид щелочного металла.
[0080]
[I-42-A-4] Способ в соответствии с пунктом [I-41-A], где основание представляет собой гидрид щелочного металла.
[0081]
[I-42-A-5] Способ в соответствии с пунктом [I-41-A], где основание представляет собой смесь гидроксида щелочного металла и гидрида щелочного металла.
[0082]
[I-43-A-1] Способ в соответствии с пунктом [I-41-A], где основание представляет собой
гидроксид лития, гидроксид натрия, гидроксид калия,
карбонат натрия, карбонат калия, карбонат цезия,
гидрид натрия
гидроксид лития, гидроксид натрия, гидроксид калия,
карбонат натрия, карбонат калия, карбонат цезия,
гидрид натрия или
их смесь.
[0083]
[I-43-A-2] Способ в соответствии с пунктом [I-41-A], где основание представляет собой гидроксид натрия, гидроксид калия, гидрид натрия или их смесь.
[0084]
[I-43-A-3] Способ в соответствии с пунктом [I-41-A], где основание представляет собой гидроксид калия, гидрид натрия или их смесь.
[0085]
[I-43-A-4] Способ в соответствии с пунктом [I-41-A], где основание представляет собой гидроксид натрия.
[0086]
[I-43-A-5] Способ в соответствии с пунктом [I-41-A], где основание представляет собой гидроксид калия.
[0087]
[I-43-A-6] Способ в соответствии с пунктом [I-41-A], где основание представляет собой гидрид натрия.
[0088]
[I-43-A-7] Способ в соответствии с пунктом [I-41-A], где основание представляет собой смесь гидроксида калия и гидрида натрия.
[0089]
[I-41-B] Способ в соответствии с любым из пунктов [I-21] - [I-40], где взаимодействие исходного соединения с фторалкилирующим агентом, представленным общей формулой (1), осуществляется с использованием основания.
[0090]
[I-42-B-1] Способ в соответствии с пунктом [I-41-B], где основание представляет собой гидроксид щелочного металла, карбонат щелочного металла, гидрид щелочного металла или их сочетание.
[0091]
[I-42-B-2] Способ в соответствии с пунктом [I-41-B], где основание представляет собой гидроксид щелочного металла, гидрид щелочного металла или их сочетание.
[0092]
[I-42-B-3] Способ в соответствии с пунктом [I-41-B], где основание представляет собой гидроксид щелочного металла.
[0093]
[I-42-B-4] Способ в соответствии с пунктом [I-41-B], где основание представляет собой гидрид щелочного металла.
[0094]
[I-42-B-5] Способ в соответствии с пунктом [I-41-B], где основание представляет собой сочетание гидроксида щелочного металла и гидрида щелочного металла.
[0095]
[I-43-B-1] Способ в соответствии с пунктом [I-41-B], где основание представляет собой
гидроксид лития, гидроксид натрия, гидроксид калия,
карбонат натрия, карбонат калия, карбонат цезия,
гидрид натрия или
их сочетание.
[0096]
[I-43-B-2] Способ в соответствии с пунктом [I-41-B], где основание представляет собой гидроксид натрия, гидроксид калия, гидрид натрия или их сочетание.
[0097]
[I-43-B-3] Способ в соответствии с пунктом [I-41-B], где основание представляет собой гидроксид калия, гидрид натрия или их сочетание.
[0098]
[I-43-B-4] Способ в соответствии с пунктом [I-41-B], где основание представляет собой гидроксид натрия.
[0099]
[I-43-B-5] Способ в соответствии с пунктом [I-41-B], где основание представляет собой гидроксид калия.
[0100]
[I-43-B-6] Способ в соответствии с пунктом [I-41-B], где основание представляет собой гидрид натрия.
[0101]
[I-43-B-7] Способ в соответствии с пунктом [I-41-B], где основание представляет собой сочетание гидроксида калия и гидрида натрия.
[0102]
[I-44] Способ в соответствии с любым из пунктов [I-21] - [I-43-B-7], где взаимодействие исходного соединения с фторалкилирующим агентом, представленным общей формулой (1), осуществляют в присутствии цеолита.
[0103]
[I-45-1] Способ в соответствии с пунктом [I-44], где цеолит представляет собой молекулярное сито 3A, молекулярное сито 4A или молекулярное сито 5A.
[0104]
[I-45-2] Способ в соответствии с пунктом [I-44], где цеолит представляет собой молекулярное сито 4A.
[0105]
[I-46] Способ в соответствии с любым из пунктов [I-21] - [I-43-B-7], где взаимодействие исходного соединения с фторалкилирующим агентом, представленным общей формулой (1), осуществляют в присутствии молекулярного сита.
[0106]
[I-47-1] Способ в соответствии с пунктом [I-46], где молекулярное сито представляет собой молекулярное сито 3A, молекулярное сито 4A или молекулярное сито 5A.
[0107]
[I-47-2] Способ в соответствии с пунктом [I-46], где молекулярное сито представляет собой молекулярное сито 4A.
[0108]
[I-48] Способ в соответствии с любым из пунктов [I-21] - [I-47-2], где взаимодействие исходного соединения с фторалкилирующим агентом, представленным общей формулой (1), осуществляется в присутствии катализатора межфазного переноса.
[0109]
[I-49] Способ в соответствии с пунктом [I-48], где катализатор межфазного переноса представляет собой соль четвертичного аммония.
[0110]
[I-50] Способ в соответствии с пунктом [I-48], где катализатор межфазного переноса представляет собой бромид тетрабутиламмония.
[0111]
[I-51] Способ в соответствии с любым из пунктов [I-21] - [I-50], где исходное соединение представляет собой соединение, представленное общей формулой (2):
[0112]
[Химическая формула 3]
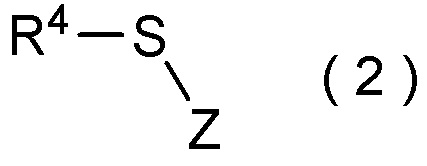
где R4 представляет собой
углеводородную группу с прямой или разветвленную цепью, которая может содержать один или несколько заместителей,
циклическую углеводородную группу, которая может содержать один или несколько заместителей, или
гетероциклическую группу, которая может содержать один или несколько заместителей; и
Z представляет собой уходящую группу; и
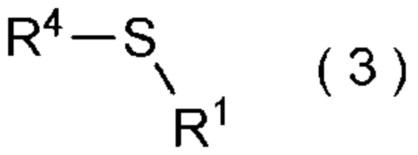
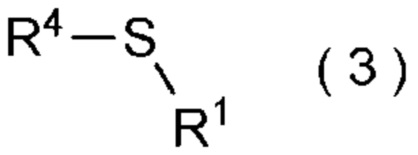
целевое соединение, содержащее R1, представляет собой соединение, представленное общей формулой (3):
[0113]
[Химическая формула 4]
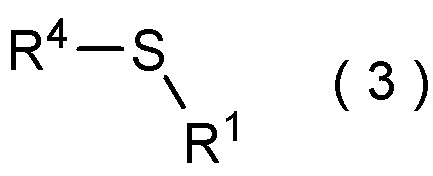
где R1 является таким, как определено в пункте [I-21] - [I-50]; и R4 является таким как, определено выше.
[0114]
[I-52] Способ в соответствии с пунктом [I-51], где R4 представляет собой
C1-C12 алкильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкенильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкинильную группу, которая может содержать один или несколько заместителей,
C3-C8 циклоалкильную группу, которая может содержать один или несколько заместителей,
C6-C10 арильную группу, которая может содержать один или несколько заместителей, или
гетероциклическую группу, которая может содержать один или несколько заместителей, где гетероциклическая группа представляет собой 5-10-членную гетероциклическую группу, содержащую от 1 до 9 атомов углерода и от 1 до 4 гетероатомов, независимо выбранных из атома азота, атома кислорода и атома серы.
[0115]
[I-53-1] Способ в соответствии с пунктом [I-51], где R4 представляет собой
C3-C7 алкильную группу,
C3-C7 алкильную группу, содержащую бензилокси группу,
C3-C7 алкильную группу, содержащую C2-C4 ацилокси группу,
C3-C7 алкильную группу, содержащую фенилокси группу, которая может иметь от 1 до 4 заместителей, независимо выбранных из атома галогена, C1-C4 алкильной группы, C1-C6 галогеналкилтио группы и C1-C6 галогеналкилсульфинильной группы,
C6-C10 арильную группу, которая может иметь от 1 до 4 заместителей, независимо выбранных из атома галогена, C1-C4 алкильной группы, C1-C4 галогеналкильной группы, C1-C4 алкокси группы, C1-C4 галогеналкокси группы и C6-C10 арильной группы, или
тиенильную группу, пиразолильную группу, имидазолильную группу, тиазолильную группу, изотиазолильную группу, пиридильную группу или пиримидильную группу, которая может иметь от 1 до 4 заместителей, независимо выбранных из атома галогена, C1-C4 алкильной группы, C1-C4 галогеналкильной группы, C1-C4 алкокси группы, C1-C4 галогеналкокси группы и C6-C10 арильной группы.
[0116]
[I-53-2] Способ в соответствии с пунктом [I-51], где R4 представляет собой
C3-C7 алкильную группу,
C3-C7 алкильную группу, содержащую бензилокси группу,
C3-C7 алкильную группу, содержащую C2-C4 ацилокси группу,
C3-C7 алкильную группу, содержащую фенилокси группу, которая может иметь от 1 до 4 заместителей, независимо выбранных из атома галогена, C1-C4 алкильной группы и C1-C6 галогеналкилтио группы,
C6-C10 арильную группу, которая может иметь от 1 до 4 заместителей, независимо выбранных из атома галогена, C1-C4 алкильной группы, C1-C4 галогеналкильной группы, C1-C4 алкокси группы, C1-C4 галогеналкокси группы и C6-C10 арильной группы, или
пиразолильную группу или пиридильную группу, которая может иметь от 1 до 4 заместителей, независимо выбранных из атома галогена, C1-C4 алкильной группы, C1-C4 галогеналкильной группы, C1-C4 алкокси группы, C1-C4 галогеналкокси группы и C6-C10 арильной группы.
[0117]
[I-53-3] Способ в соответствии с пунктом [I-51], где R4 представляет собой
C3-C7 алкильную группу,
C3-C7 алкильную группу, содержащую бензилокси группу,
C3-C7 алкильную группу, содержащую C2-C4 ацилокси группу,
C3-C7 алкильную группу, содержащую фенилокси группу, которая может иметь от 1 до 4 заместителей, независимо выбранных из атома галогена и C1-C6 галогеналкилтио группы, или
C6-C10 арильную группу, которая может иметь от 1 до 4 заместителей, независимо выбранных из атома галогена, C1-C4 алкильной группы, C1-C4 галогеналкильной группы, C1-C4 алкокси группы и C1-C4 галогеналкокси группы.
[0118]
[I-53-4] Способ в соответствии с пунктом [I-51], где R4 представляет собой
C3-C7 алкильную группу,
C3-C7 алкильную группу, содержащую бензилокси группу,
C3-C7 алкильную группу, содержащую C2-C4 ацилокси группу,
C3-C7 алкильную группу, содержащую фенилокси группу, которая может иметь от 1 до 4 заместителей, независимо выбранных из атома галогена и C1-C6 галогеналкилтио группы, или
C6-C10 арильную группу, которая может иметь от 1 до 4 заместителей, независимо выбранных из атома галогена, C1-C4 алкильной группы и C1-C4 алкокси группы.
[0119]
[I-53-5] Способ в соответствии с пунктом [I-51], где R4 представляет собой
C3-C7 алкильную группу,
C3-C7 алкильную группу, содержащую бензилокси группу,
C3-C7 алкильную группу, содержащую C2-C4 ацилокси группу,
C3-C7 алкильную группу, содержащую фенилокси группу, которая может иметь от 1 до 4 заместителей, независимо выбранных из атома галогена и C1-C6 галогеналкилтио группы, или
фенильную группу, которая может иметь от 1 до 4 заместителей, независимо выбранных из атома галогена, C1-C4 алкильной группы и C1-C4 алкокси группы.
[0120]
[I-53-6] Способ в соответствии с пунктом [I-51], где R4 представляет собой
C3-C7 алкильную группу,
C3-C7 алкильную группу, содержащую бензилокси группу,
C3-C7 алкильную группу, содержащую C2-C4 ацилокси группу, или
C3-C7 алкильную группу, содержащую фенилокси группу, которая может иметь от 1 до 4 заместителей, независимо выбранных из атома галогена, C1-C4 алкильной группы, C1-C6 галогеналкилтио группы и C1-C6 галогеналкилсульфинильной группы.
[0121]
[I-53-7] Способ в соответствии с пунктом [I-51], где R4 представляет собой
C3-C7 алкильную группу,
C3-C7 алкильную группу, содержащую бензилокси группу,
C3-C7 алкильную группу, содержащую C2-C4 ацилокси группу, или
C3-C7 алкильную группу, содержащую фенилокси группу, которая может иметь от 1 до 4 заместителей, независимо выбранных из атома галогена и C1-C6 галогеналкилтио группы.
[0122]
[I-53-8] Способ в соответствии с пунктом [I-51], где R4 представляет собой C3-C7 алкильную группу, содержащую бензилокси группу или C3-C7 алкильную группу, содержащую C2-C4 ацилокси группу.
[0123]
[I-53-9] Способ в соответствии с пунктом [I-51], где R4 представляет собой C3-C7 алкильную группу, содержащую фенилокси группу, которая может иметь от 1 до 4 заместителей, независимо выбранных из атома галогена, C1-C4 алкильной группы, C1-C6 галогеналкилтио группы и C1-C6 галогеналкилсульфинильной группы.
[0124]
[I-53-10] Способ в соответствии с пунктом [I-51], где R4 представляет собой C3-C7 алкильную группу, содержащую фенилокси группу, которая может иметь от 1 до 4 заместителей, независимо выбранных из атома галогена и C1-C6 галогеналкилтио группы.
[0125]
[I-54-1] Способ в соответствии с пунктом [I-51], где R4 представляет собой
5-бензилоксипентильную группу, 5-ацетилоксипентильную группу, 6-бензилоксигексильную группу, 6-ацетилоксигексильную группу,
5-[4-хлор-2-фтор-5-(2,2,2-трифторэтилтио)фенокси]пентильную группу или
6-[2,4-диметил-5-(2,2,2-трифторэтилтио)фенокси]гексильную группу.
[0126]
[I-54-2] Способ в соответствии с пунктом [I-51], где R4 представляет собой
5-бензилоксипентильную группу, 5-ацетилоксипентильную группу, 6-бензилоксигексильную группу, 6-ацетилоксигексильную группу или
5-[4-хлор-2-фтор-5-(2,2,2-трифторэтилтио)фенокси]пентильную группу.
[0127]
[I-54-3] Способ в соответствии с пунктом [I-51], где R4 представляет собой 5-бензилоксипентильную группу, 5-ацетилоксипентильную группу, 6-бензилоксигексильную группу или 6-ацетилоксигексильную группу.
[0128]
[I-54-4] Способ в соответствии с пунктом [I-51], где R4 представляет собой
5-[4-хлор-2-фтор-5-(2,2,2-трифторэтилтио)фенокси]пентильную группу или
6-[2,4-диметил-5-(2,2,2-трифторэтилтио)фенокси]гексильную группу.
[0129]
[I-54-5] Способ в соответствии с пунктом [I-51], где R4 представляет собой 5-[4-хлор-2-фтор-5-(2,2,2-трифторэтилтио)фенокси]пентильную группу.
[0130]
[I-55-1] Способ в соответствии с любым из пунктов [I-51] - [I-54-5], где Z представляет собой циано группу,
C1-C4 алкилсульфонильную группу, или
фенилсульфонильную группу, где фрагмент фенильной группы может содержать от 1 до 5 заместителей, выбранных независимо из атома галогена и C1-C4 алкильной группы.
[0131]
[I-55-2] Способ в соответствии с любым из пунктов [I-51] - [I-54-5], где Z представляет собой циано группу, или
фенилсульфонильную группу, где фрагмент фенильной группы может содержать от 1 до 5 заместителей, выбранных независимо из атома галогена и C1-C4 алкильной группы.
[0132]
[I-55-3] Способ в соответствии с любым из пунктов [I-51] - [I-54-5], где Z представляет собой циано группу или
фенилсульфонильную группу, где фрагмент фенильной группы может содержать от 1 до 5 заместителей, независимо выбранных из C1-C4 алкильной группы.
[0133]
[I-55-4] Способ в соответствии с любым из пунктов [I-51] - [I-54-5], где Z представляет собой C1-C4 алкилсульфонильную группу или
фенилсульфонильную группу, где фрагмент фенильной группы может содержать от 1 до 5 заместителей, выбранных независимо из атома галогена и C1-C4 алкильной группы.
[0134]
[I-55-5] Способ в соответствии с любым из пунктов [I-51] - [I-54-5], где Z представляет собой фенилсульфонильную группу, где фрагмент фенильной группы может содержать от 1 до 5 заместителей, выбранных независимо из атома галогена и C1-C4 алкильной группы.
[0135]
[I-55-6] Способ в соответствии с любым из пунктов [I-51] - [I-54-5], где Z представляет собой фенилсульфонильную группу, где фрагмент фенильной группы может содержать от 1 до 5 заместителей, независимо выбранных из C1-C4 алкильной группы.
[0136]
[I-56-1] Способ в соответствии с любым из пунктов [I-51] - [I-54-5], где Z представляет собой циано группу,
метилсульфонильную группу,
фенилсульфонильную группу, 4-метилфенилсульфонильную группу или 4-хлорфенилсульфонильную группу.
[0137]
[I-56-2] Способ в соответствии с любым из пунктов [I-51] - [I-54-5], где Z представляет собой циано группу,
фенилсульфонильную группу, 4-метилфенилсульфонильную группу или 4-хлорфенилсульфонильную группу.
[0138]
[I-56-3] Способ в соответствии с любым из пунктов [I-51] - [I-54-5], где Z представляет собой циано группу,
фенилсульфонильную группу или 4-метилфенилсульфонильную группу.
[0139]
[I-56-4] Способ в соответствии с любым из пунктов [I-51] - [I-54-5], где Z представляет собой циано группу или 4-метилфенилсульфонильную группу.
[0140]
[I-57-1] Способ в соответствии с любым из пунктов [I-51] - [I-54-5], где Z представляет собой циано группу.
[0141]
[I-57-2] Способ в соответствии с любым из пунктов [I-51] - [I-54-5], где Z представляет собой фенилсульфонильную группу, 4-метилфенилсульфонильную группу или 4-хлорфенилсульфонильную группу.
[0142]
[I-57-3] Способ в соответствии с любым из пунктов [I-51] - [I-54-5], где Z представляет собой 4-метилфенилсульфонильную группу.
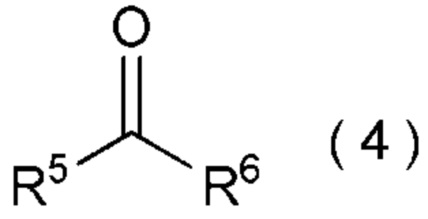
[0143]
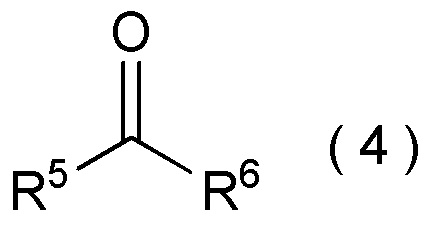
[I-58] Способ в соответствии с любым из пунктов [I-21] - [I-50], где исходное соединение представляет собой соединение, представленное общей формулой (4):
[0144]
[Химическая формула 5]
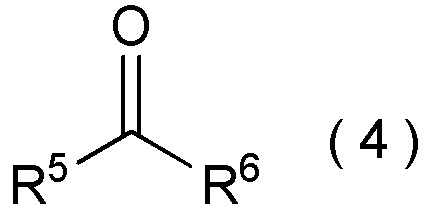
где R5 представляет собой
углеводородную группу с прямой или разветвленную цепью, которая может содержать один или несколько заместителей,
циклическую углеводородную группу, которая может содержать один или несколько заместителей или
гетероциклическую группу, которая может содержать один или несколько заместителей; и
R6 представляет собой
атом водорода,
углеводородную группу с прямой или разветвленную цепью, которая может содержать один или несколько заместителей,
циклическую углеводородную группу, которая может содержать один или несколько заместителей или
гетероциклическую группу, которая может содержать один или несколько заместителей; и
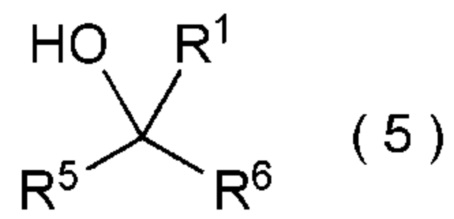
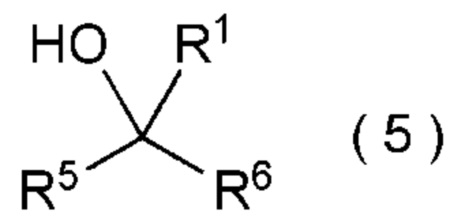
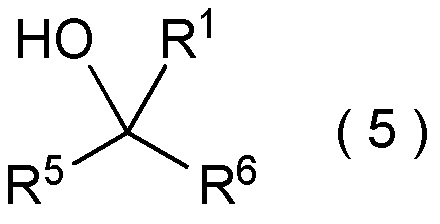
целевое соединение, содержащее R1, представляет собой соединение, представленное общей формулой (5):
[0145]
[Химическая формула 6]
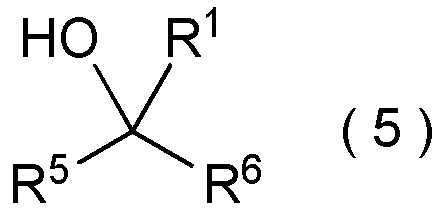
где R1 является таким, как определено в пункте [I-21] - [I-50]; и R5 и R6 являются такими, как определено выше.
[0146]
[I-59] Способ в соответствии с пунктом [I-58], где R5 представляет собой
C1-C12 алкильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкенильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкинильную группу, которая может содержать один или несколько заместителей,
C3-C8 циклоалкильную группу, которая может содержать один или несколько заместителей,
C6-C10 арильную группу, которая может содержать один или несколько заместителей или
гетероциклическую группу, которая может содержать один или несколько заместителей, где гетероциклическая группа представляет собой 5-10-членную гетероциклическую группу, содержащую от 1 до 9 атомов углерода и от 1 до 4 гетероатомов, независимо выбранных из атома азота, атома кислорода и атома серы.
[0147]
[I-60] Способ в соответствии с пунктом [I-58] или [I-59], где R6 представляет собой атом водорода, C1-C4 алкильную группу или C1-C4 галогеналкильную группу.
[0148]
[I-61] Способ в соответствии с пунктом [I-58] или [I-59], где R6 представляет собой атом водорода.
[0149]
[I-62] Соединение, представленное общей формулой (1):
[0150]
[Химическая формула 7]
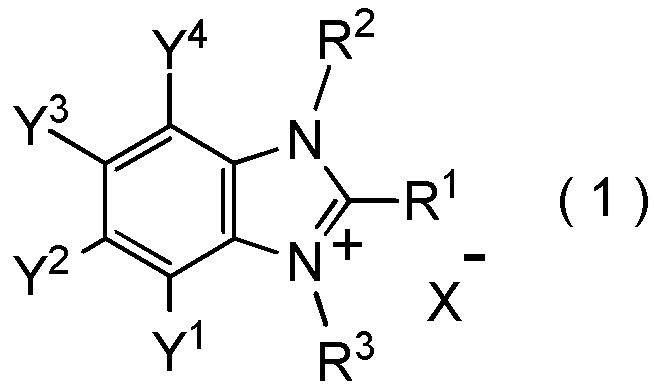
где R1 представляет собой C1-C8 фторалкильную группу;
R2 и R3 представляют собой, каждый, независимо
C1-C12 алкильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкенильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкинильную группу, которая может содержать один или несколько заместителей,
C3-C8 циклоалкильную группу, которая может содержать один или несколько заместителей или
C6-C10 арильную группу, которая может содержать один или несколько заместителей;
Y1, Y2, Y3 и Y4 представляют собой, каждый, независимо
атом водорода, атом галогена, нитрогруппу, цианогруппу,
C1-C12 алкильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкенильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкинильную группу, которая может содержать один или несколько заместителей,
C3-C8 циклоалкильную группу, которая может содержать один или несколько заместителей,
гидрокси группу,
C1-C6 алкокси группу,
C1-C6 алкилтио группу, C1-C6 алкилсульфинильную группу, C1-C6 алкилсульфонильную группу,
амино группу, моно (C1-C6 алкил) амино группу, ди(C1-C6 алкил) амино группу,
C1-C6 ациламино группу,
формильную группу, C2-C6 ацильную группу,
C1-C6 алкоксикарбонильную группу,
C6-C10 арильную группу, которая может содержать один или несколько заместителей, или
гетероциклическую группу, которая может содержать один или несколько заместителей, где гетероциклическая группа представляет собой 5-10-членную гетероциклическую группу, содержащую от 1 до 9 атомов углерода и от 1 до 4 гетероатомов, независимо выбранных из атома азота, атома кислорода и атома серы, или
два смежных заместителя Y1 и Y2, Y2 и Y3, или Y3 и Y4, вместе с атомами углерода, к которым эти заместители присоединены, образуют 4-8-членное карбоциклическое кольцо или 4-8-членное гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, выбранных независимо из атома кислорода, атома серы и атома азота, где образованное кольцо может иметь один или несколько заместителей; и
X- представляет собой моновалентный анион.
[0151]
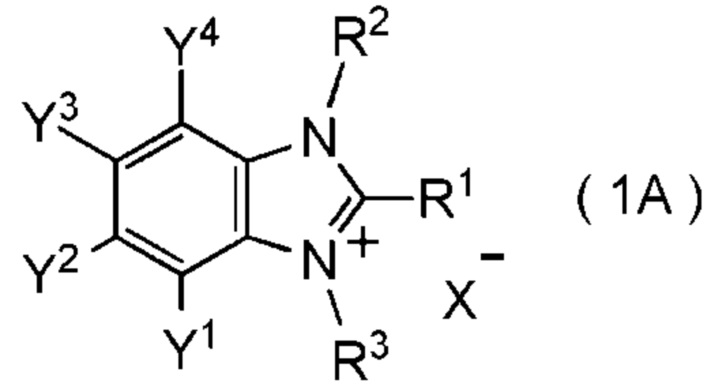
[I-63] Соединение, представленное общей формулой (1A):
[0152]
[Химическая формула 8]
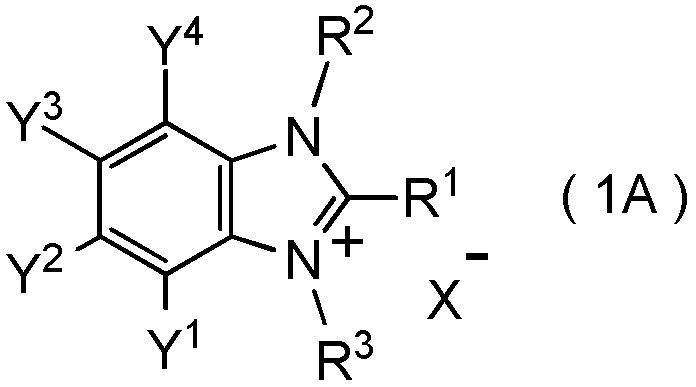
где R1 представляет собой C1-C8 фторалкильную группу;
R2 и R3 представляют собой, каждый, независимо
C1-C12 алкильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкенильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкинильную группу, которая может содержать один или несколько заместителей,
C3-C8 циклоалкильную группу, которая может содержать один или несколько заместителей, или
C6-C10 арильную группу, которая может содержать один или несколько заместителей;
Y1, Y2, Y3 и Y4 представляют собой, каждый, независимо
атом водорода, атом галогена, нитрогруппу, цианогруппу,
C1-C12 алкильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкенильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкинильную группу, которая может содержать один или несколько заместителей,
C3-C8 циклоалкильную группу, которая может содержать один или несколько заместителей,
гидрокси группу,
C1-C6 алкокси группу,
C1-C6 алкилтио группу, C1-C6 алкилсульфинильную группу, C1-C6 алкилсульфонильную группу,
амино группу, моно (C1-C6 алкил) амино группу, ди(C1-C6 алкил) амино группу,
C1-C6 ациламино группу,
формильную группу, C2-C6 ацильную группу,
C1-C6 алкоксикарбонильную группу,
C6-C10 арильную группу, которая может содержать один или несколько заместителей, или
гетероциклическую группу, которая может содержать один или несколько заместителей, где гетероциклическая группа представляет собой 5-10-членную гетероциклическую группу, содержащую от 1 до 9 атомов углерода и от 1 до 4 гетероатомов, независимо выбранных из атома азота, атома кислорода и атома серы, или
два смежных заместителя Y1 и Y2, Y2 и Y3, или Y3 и Y4, вместе с атомами углерода, к которым эти заместители присоединены, образуют 4-8-членное карбоциклическое кольцо или 4-8-членное гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, выбранных независимо из атома кислорода, атома серы и атома азота, где образованное кольцо может иметь один или несколько заместителей; и
X- представляет собой моновалентный анион;
при условии, что следующие случаи (I) - (V) исключены:
(i) R1 представляет собой трифторметильную группу,
R2 и R3 представляют собой, каждый, метильную группу,
Y1, Y2, Y3 и Y4 представляют собой, каждый, атом водорода, и
X- представляет собой Br-;
(ii) R1 представляет собой трифторметильную группу,
R2 и R3 представляют собой, каждый, метильную группу,
Y1, Y2, Y3 и Y4 представляют собой, каждый, атом водорода, и
X- представляет собой I-;
(iii) R1 представляет собой трифторметильную группу,
R2 и R3 представляют собой, каждый, метильную группу,
Y1 представляет собой атом водорода,
Y2 представляет собой метильную группу,
Y3 представляет собой метильную группу,
Y4 представляет собой атом водорода, и
X- представляет собой I-;
(iv) R1 представляет собой трифторметильную группу,
R2 и R3 представляют собой, каждый, метильную группу,
Y1 представляет собой атом водорода,
Y2 представляет собой атом хлора,
Y3 представляет собой атом водорода,
Y4 представляет собой атом водорода, и
X- представляет собой Br-; и
(v) R1 представляет собой трифторметильную группу,
R2 и R3 представляют собой, каждый, метильную группу,
Y1, Y2, Y3 и Y4 представляют собой, каждый, атом брома, и
X- представляет собой Br-.
[0153]
[I-64] Соединение в соответствии с пунктом [I-62] или [I-63], где R1 представляет собой C1-C8 перфторалкильную группу.
[0154]
[I-65] Соединение в соответствии с пунктом [I-62] или [I-63], где R1 представляет собой C1-C4 перфторалкильную группу.
[0155]
[I-66] Соединение в соответствии с пунктом [I-62] или [I-63], где R1 представляет собой трифторметильную группу или пентафторэтильную группу.
[0156]
[I-67] Соединение в соответствии с пунктом [I-62] или [I-63], где R1 представляет собой трифторметильную группу.
[0157]
[I-68] Соединение в соответствии с любым из пунктов [I-62] - [I-67], где R2 и R3 представляют собой, каждый, независимо
C1-C6 алкильную группу,
фенильную группу, где фенильная группа может иметь от 1 до 5 заместителей, выбранных независимо из атома галогена, нитрогруппы, циано группы, C1-C6 алкильной группы, C1-C6 галогеналкильной группы, C2-C6 ацильной группы и C1-C6 алкоксикарбонильной группы, или
фенил C1-C2 алкильную группу, где фрагмент фенильной группы может содержать от 1 до 5 заместителей, выбранных независимо из атома галогена, C1-C6 алкильной группы и C1-C6 галогеналкильной группы.
[0158]
[I-69] Соединение в соответствии с любым из пунктов [I-62] - [I-67], где R2 и R3 представляют собой, каждый, независимо C1-C4 алкильную группу или фенильную группу.
[0159]
[I-70] Соединение в соответствии с любым из пунктов [I-62] - [I-67], где R2 и R3 представляют собой, каждый, независимо метильную группу, этильную группу или фенильную группу.
[0160]
[I-71] Соединение в соответствии с любым из пунктов [I-62] - [I-67], где R2 и R3 представляют собой, каждый, метильную группу.
[0161]
[I-72] Соединение в соответствии с любым из пунктов [I-62] - [I-71], где Y1, Y2, Y3 и Y4 представляют собой, каждый, независимо
атом водорода, атом галогена, нитрогруппу, цианогруппу,
C1-C12 алкильную группу, C1-C6 галогеналкильную группу,
C1-C6 алкилтио группу, C1-C6 алкилсульфинильную группу, C1-C6 алкилсульфонильную группу,
C2-C6 ацильную группу,
C1-C6 алкоксикарбонильную группу,
фенильную группу, или
пиридильную группу.
[0162]
[I-73] Соединение в соответствии с любым из пунктов [I-62] - [I-71], где Y1, Y2, Y3 и Y4 представляют собой, каждый, независимо
атом водорода, атом галогена, нитрогруппу, цианогруппу,
C1-C4 алкильную группу или C1-C4 галогеналкильную группу.
[0163]
[I-74] Соединение в соответствии с любым из пунктов [I-62] - [I-71], где Y1, Y2, Y3 и Y4 представляют собой, каждый, независимо атом водорода, атом хлора или нитрогруппу.
[0164]
[I-75] Соединение в соответствии с любым из пунктов [I-62] - [I-71], где Y1, Y2, Y3 и Y4 представляют собой, каждый, атом водорода.
[0165]
[I-76] Соединение в соответствии с любым из пунктов [I-62] - [I-71], где Y1, Y3 и Y4 представляют собой, каждый, атом водорода; и Y2 представляет собой атом хлора.
[0166]
[I-77] Соединение в соответствии с любым из пунктов [I-62] - [I-71], где Y1, Y3 и Y4 представляют собой, каждый, атом водорода; и Y2 представляет собой нитро группу.
[0167]
[I-78] Соединение в соответствии с любым из пунктов [I-62] - [I-71], где Y1, Y2, Y3 и Y4 представляют собой, каждый, атом хлора.
[0168]
[I-79] Соединение в соответствии с любым из пунктов [I-62] - [I-78], где X- представляет собой любой из галогенид-ионов, борат-ионов, фосфат-ионов, антимонат-ионов, карбоксилат-ионов, сульфонат-ионов, сульфат-ионов, карбонат-ионов, нитрат-ионов и амид-ионов.
[0169]
[I-80-1] Соединение в соответствии с любым из пунктов [I-62] - [I-78], где X- представляет собой F-, Cl-, Br-, I-,
BF4-, C6H5BF3-,
PF6-,
SbF6-,
CH3CO2-, CF3CO2-, C2F5CO2-,
CH3SO3-, C2H5SO3-, CF3SO3-, C6H5SO3-, 4-CH3-C6H4SO3-, 4-Cl-C6H4SO3-, 4-NO2-C6H4SO3-,
HOSO3-, CH3OSO3-, C2H5OSO3-, C3H7OSO3-, изо-C3H7OSO3-, C4H9OSO3-, C6H5OSO3-,
HCO3-, CH3OCO2-
NO3-,
(CN)2N- или (CF3SO2)2N-.
[0170]
[I-80-2-1] Соединение в соответствии с любым из пунктов [I-62] - [I-78], где X- представляет собой F-, Cl-, Br-, I-,
BF4-,
CH3CO2-, CF3CO2-,
CH3SO3-, CF3SO3-,
HOSO3-, CH3OSO3- или C2H5OSO3-.
[0171]
[I-80-2-2] Соединение в соответствии с любым из пунктов [I-62] - [I-78], где X- представляет собой I-,
BF4-,
CF3CO2-,
CF3SO3-,
HOSO3-, CH3OSO3- или C2H5OSO3-.
[0172]
[I-80-2-3] Соединение в соответствии с любым из пунктов [I-62] - [I-78], где X- представляет собой I-,
BF4-,
CF3SO3-,
HOSO3-, CH3OSO3- или C2H5OSO3-.
[0173]
[I-80-2-4] Соединение в соответствии с любым из пунктов [I-62] - [I-78], где X- представляет собой I-,
BF4-,
CF3SO3-,
CH3OSO3- или C2H5OSO3-.
[0174]
[I-80-2-5] Соединение в соответствии с любым из пунктов [I-62] - [I-78], где X- представляет собой I-,
BF4-,
CF3SO3-,
CH3OSO3-.
[0175]
[I-80-3] Соединение в соответствии с любым из пунктов [I-62] - [I-78], где X- представляет собой F-, Cl-, Br-, I-,
BF4-,
CH3CO2-, CF3CO2-,
CH3SO3-, CF3SO3-,
CH3OSO3- или C2H5OSO3-.
[0176]
[I-81-1] Соединение в соответствии с любым из пунктов [I-62] - [I-78], где X- представляет собой Cl-, Br-, I-,
BF4-,
CF3SO3-,
HOSO3-, CH3OSO3- или C2H5OSO3-.
[0177]
[I-81-2] Соединение в соответствии с любым из пунктов [I-62] - [I-78], где X- представляет собой Cl-, Br-, I-,
BF4-,
CF3SO3-,
CH3OSO3- или C2H5OSO3-.
[0178]
[I-82] Соединение в соответствии с любым из пунктов [I-62] - [I-78], где X- представляет собой CF3SO3-, CH3OSO3- или C2H5OSO3-.
[0179]
[I-83] Соединение в соответствии с любым из пунктов [I-62] - [I-78], где X- представляет собой CH3OSO3- или C2H5OSO3-.
[0180]
[I-84] Соединение в соответствии с любым из пунктов [I-62] - [I-78], где X- представляет собой CH3OSO3-.
[0181]
[I-85] Применение соединения по любому из пунктов [I-62] - [I-84] в качестве фторалкилирующего агента.
[0182]
[I-86] Способ получения соединения, представленного общей формулой (1):
[0185]
[Химическая формула 11]
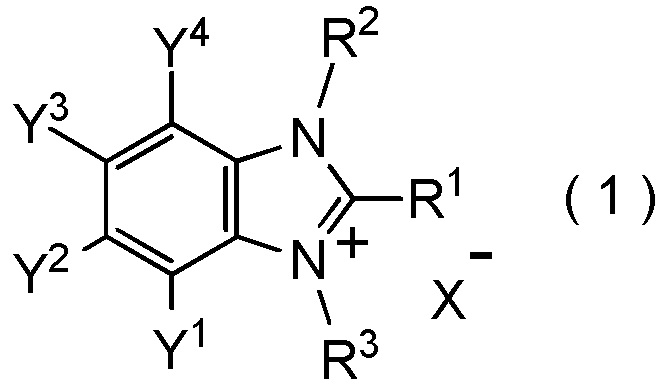
где R1, R2, R3, Y1, Y2, Y3, Y4 и X- являются такими, как определено в пункте [I-1],
который включает взаимодействие соединения, представленного общей формулой (6):
[0183]
[Химическая формула 9]
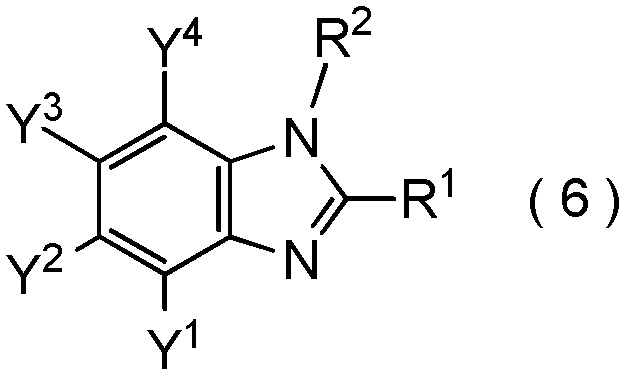
где R1, R2, Y1, Y2, Y3 и Y4 являются такими, как определено в пункте [I-1],
с соединением, представленным общей формулой (7):
[0184]
[Химическая формула 10]
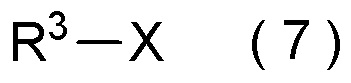
где R3 является таким, как определено в пункте [I-1];
X представляет собой уходящую группу, соответствующую X-, определенную в пункте [I-1].
[0186]
[I-87] Способ получения соединения, представленного общей формулой (1):
[0188]
[Химическая формула 13]
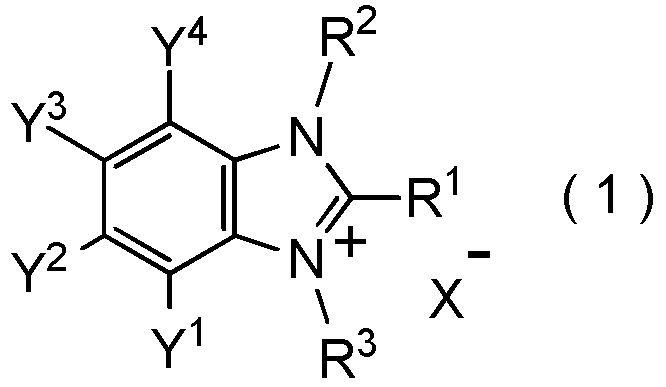
где R1, R2, Y1, Y2, Y3 и Y4 являются такими, как определено в пункте [I-1];
R3 представляет собой C1-C4 алкильную группу; и
X- представляет собой BF4-,
который включает взаимодействие соединения, представленное общей формулой (6):
[0187]
[Химическая формула 12]
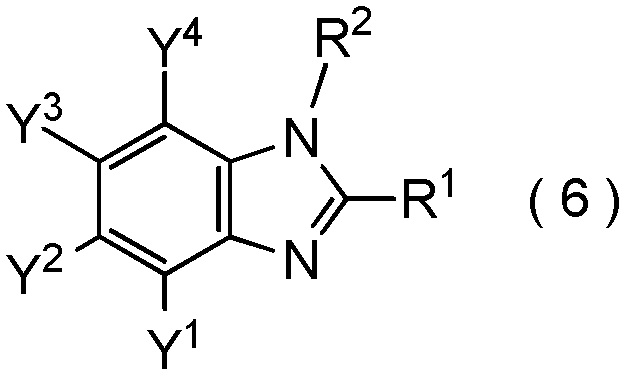
где R1, R2, Y1, Y2, Y3 и Y4 являются такими, как определено в пункте [I-1]
c три(C1-C4 алкил) оксоний тетрафторборат. [0189]
[I-88] Способ в соответствии с пунктом [I-87], где
тетрафторборат три(C1-C4 алкил)оксония представляет собой тетрафторборат триметилоксония;
R3 представляет собой метильную группу; и
X- представляет собой BF4-.
[0190]
[I-89] Способ в соответствии с любым из пунктов [I-86] - [I-88], где соединение, представленное общей формулой (6):
[0191]
[Химическая формула 14]
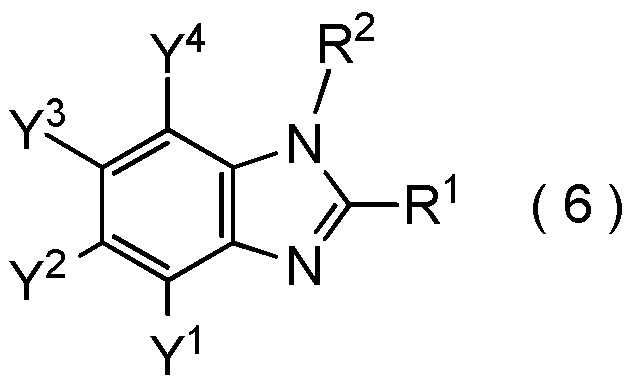
где R1, R2, Y1, Y2, Y3 и Y4 являются такими, как определено в пункте [I-1],
получают путем взаимодействия соединения, представленного общей формулой (8):
[0192]
[Химическая формула 15]
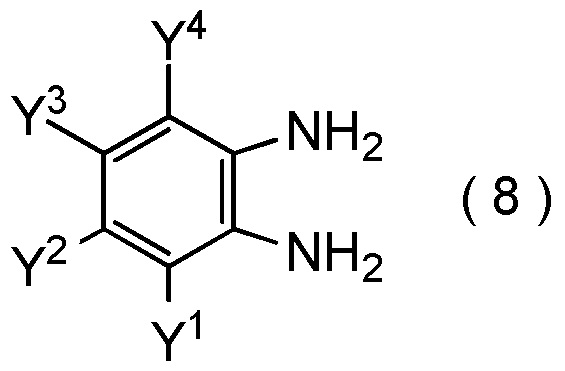
где Y1, Y2, Y3 и Y4 являются такими, как определено в пункте [I-1],
с соединением, представленным общей формулой (9):
[0193]
[Химическая формула 16]
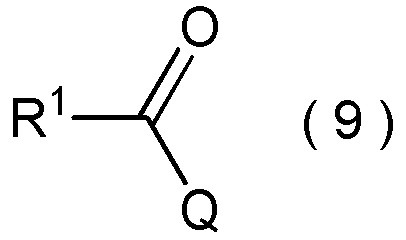
где R1 является таким, как определено в пункте [I-1]; и
Q представляет собой гидрокси группу, атом галогена или -O-C(=O)-R7 группу, где R7 является таким же, как R1,
с получением соединения, представленного общей формулой (10):
[0194]
[Химическая формула 17]
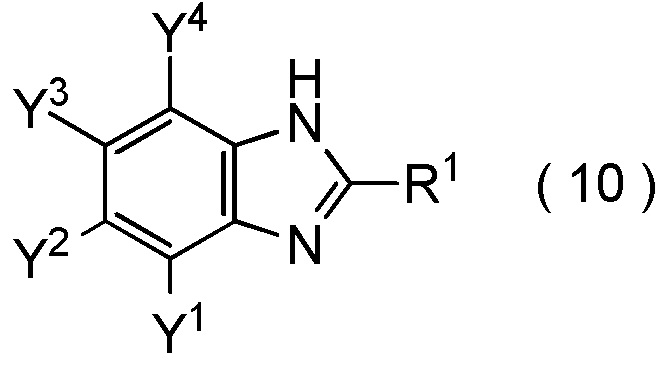
где R1, Y1, Y2, Y3 и Y4 являются такими, как определено в пункте [I-1],
и затем взаимодействия полученного соединения, представленного общей формулой (10), с соединением, представленным общей формулой (11):
[0195]
[Химическая формула 18]

где R2 является таким, как определено в пункте [I-1]; и
W представляет собой уходящую группу.
[0196]
[I-90] Способ в соответствии с любым из пунктов [I-86] - [I-88], где соединение, представленное общей формулой (6):
[0197]
[Химическая формула 19]
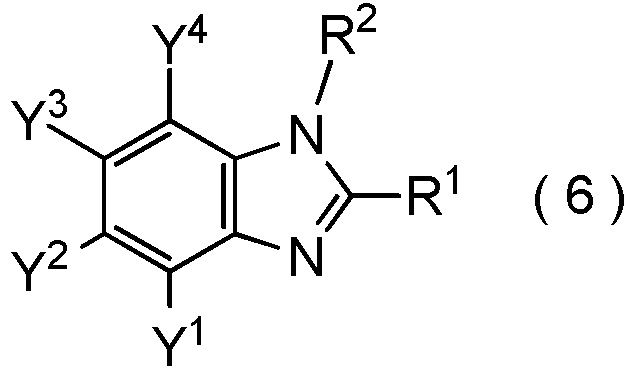
где R1, R2, Y1, Y2, Y3 и Y4 являются такими, как определено в пункте [I-1],
получают путем взаимодействия соединения, представленного общей формулой (12):
[0198]
[Химическая формула 20]
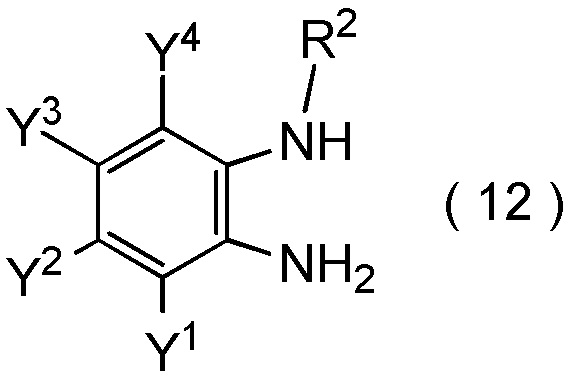
где R2, Y1, Y2, Y3 и Y4 являются такими, как определено в пункте [I-1],
с соединением, представленным общей формулой (9):
[0199]
[Химическая формула 21]
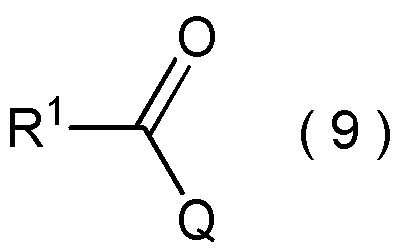
где R1 является таким, как определено в пункте [I-1]; и
Q представляет собой гидрокси группу, атом галогена или -O-C(=O)-R7 группу, где R7 является таким же, как R1.
[0200]
Здесь номера пунктов в настоящем описании будут описаны ниже.
Например, фраза "от I-a до I-d-z" включает I-a, I-b, I-c и I-d, и, при использовании, включает все номера в подгруппе пункта, например, I-b-x, I-b-y и I-b-z, и I-d-x, I-d-y и I-d-z.
Кроме того, например, фраза "от I-a до I-d" также включает I-a, I-b, I-c и I-d, и, при использовании, включает все номера в подгруппе пункта, например I-b-x, I-b-y и I-b-z, и I-d-x, I-d-y и I-d-z.
В частности, например, фраза "от I-21 до I-43-B-7" включает I-21, I-22, I-23..., и включает все номера в подгруппе пункта I-42-A-1, I-42-A-2... I-43-A-1, I-43-A-2... I-42-B-1, I-42-B-2... I-43-B-1, I-43-B-2... I-43-B-7.
Кроме того, например, также когда указывается "от I-21 до I-43", фраза "от I-21 до I-43" включает I-21, I-22, I-23..., и включает все номера в подгруппе пункта I-42-A-1, I-42-A-2... I-43-A-1, I-43-A-2... I-42-B-1, I-42-B-2... I-43-B-1, I-43-B-2... I-43-B-7.
[0201]
В другом варианте осуществления, настоящее изобретение относится к следующему:
[0202]
[II-1] фторалкилирующий агент, представленный общей формулой (1):
[Химическая формула 22]
где R1 представляет собой C1-C8 фторалкильную группу;
R2 и R3 представляют собой, каждый, независимо
C1-C12 алкильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкенильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкинильную группу, которая может содержать один или несколько заместителей,
C3-C8 циклоалкильную группу, которая может содержать один или несколько заместителей, или
C6-C10 арильную группу, которая может содержать один или несколько заместителей;
Y1, Y2, Y3 и Y4 представляют собой, каждый, независимо
атом водорода, атом галогена, нитрогруппу, цианогруппу,
C1-C12 алкильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкенильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкинильную группу, которая может содержать один или несколько заместителей,
C3-C8 циклоалкильную группу, которая может содержать один или несколько заместителей,
гидрокси группу,
C1-C6 алкокси группу,
C1-C6 алкилтио группу, C1-C6 алкилсульфинильную группу, C1-C6 алкилсульфонильную группу,
амино группу, моно (C1-C6 алкил) амино группу, ди(C1-C6 алкил)амино группу,
C1-C6 ациламино группу,
формильную группу, C2-C6 ацильную группу,
C1-C6 алкоксикарбонильную группу,
C6-C10 арильную группу, которая может содержать один или несколько заместителей, или
гетероциклическую группу, которая может содержать один или несколько заместителей, где гетероциклическая группа представляет собой 5-10-членную гетероциклическую группу, содержащую от 1 до 9 атомов углерода и от 1 до 4 гетероатомов, независимо выбранных из атома азота, атома кислорода и атома серы, или
два смежных заместителя Y1 и Y2, Y2 и Y3, или Y3 и Y4, вместе с атомами углерода, к которым эти заместители присоединены, образуют 4-8-членное карбоциклическое кольцо или 4-8-членное гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, выбранных независимо из атома кислорода, атома серы и атома азота, где образованное кольцо может иметь один или несколько заместителей; и
X- представляет собой моновалентный анион.
[0203]
[II-2] Агент в соответствии с пунктом [II-1], где
R1 представляет собой C1-C4 перфторалкильную группу;
R2 и R3 представляют собой, каждый, независимо C1-C4 алкильную группу или фенильную группу;
Y1, Y2, Y3 и Y4 представляют собой, каждый, независимо
атом водорода, атом галогена, нитрогруппу, цианогруппу,
C1-C4 алкильную группу или C1-C4 галогеналкильную группу; и
X- представляет собой Cl-, Br-, I-,
BF4-,
CF3SO3-,
HOSO3-, CH3OSO3- или C2H5OSO3-.
[0204]
[II-3] Агент по п.[II-1], где
R1 представляет собой трифторметильную группу или пентафторэтильную группу;
R2 и R3 представляют собой, каждый, независимо метильную группу, этильную группу или фенильную группу;
Y1, Y2, Y3 и Y4 представляют собой, каждый, независимо атом водорода, атом хлора или нитрогруппу; и
X- представляет собой Cl-, Br-, I-,
BF4-,
CF3SO3-,
HOSO3-, CH3OSO3- или C2H5OSO3-.
[0205]
[II-4] Агент в соответствии с пунктом [II-1], где
R1 представляет собой трифторметильную группу;
R2 и R3 представляют собой, каждый, метильную группу;
Y1, Y2, Y3 и Y4 представляют собой, каждый, атом водорода; и
X- представляет собой CH3OSO3-.
[0206]
[II-5] Способ получения целевого соединения, содержащего R1, где R1 является таким, как определено ниже, который включает взаимодействие исходного соединения с фторалкилирующим агентом, представленным общей формулой (1):
[Химическая формула 23]
где R1 представляет собой C1-C8 фторалкильную группу;
R2 и R3 представляют собой, каждый, независимо
C1-C12 алкильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкенильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкинильную группу, которая может содержать один или несколько заместителей,
C3-C8 циклоалкильную группу, которая может содержать один или несколько заместителей, или
C6-C10 арильную группу, которая может содержать один или несколько заместителей;
Y1, Y2, Y3 и Y4 представляют собой, каждый, независимо
атом водорода, атом галогена, нитрогруппу, цианогруппу,
C1-C12 алкильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкенильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкинильную группу, которая может содержать один или несколько заместителей,
C3-C8 циклоалкильную группу, которая может содержать один или несколько заместителей,
гидрокси группу,
C1-C6 алкокси группу,
C1-C6 алкилтио группу, C1-C6 алкилсульфинильную группу, C1-C6 алкилсульфонильную группу,
амино группу, моно (C1-C6 алкил) амино группу, ди(C1-C6 алкил) амино группу,
C1-C6 ациламино группу,
формильную группу, C2-C6 ацильную группу,
C1-C6 алкоксикарбонильную группу,
C6-C10 арильную группу, которая может содержать один или несколько заместителей, или
гетероциклическую группу, которая может содержать один или несколько заместителей, где гетероциклическая группа представляет собой 5-10-членную гетероциклическую группу, содержащую от 1 до 9 атомов углерода и от 1 до 4 гетероатомов, независимо выбранных из атома азота, атома кислорода и атома серы, или
два смежных заместителя Y1 и Y2, Y2 и Y3, или Y3 и Y4, вместе с атомами углерода, к которым эти заместители присоединены, образуют 4-8-членное карбоциклическое кольцо или 4-8-членное гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, выбранных независимо из атома кислорода, атома серы и атома азота, где образованное кольцо может иметь один или несколько заместителей; и
X- представляет собой моновалентный анион.
[0207]
[II-6] Способ в соответствии с пунктом [II-5], где
R1 представляет собой C1-C4 перфторалкильную группу;
R2 и R3 представляют собой, каждый, независимо C1-C4 алкильную группу или фенильную группу;
Y1, Y2, Y3 и Y4 представляют собой, каждый, независимо
атом водорода, атом галогена, нитрогруппу, цианогруппу,
C1-C4 алкильную группу или C1-C4 галогеналкильную группу; и
X- представляет собой Cl-, Br-, I-,
BF4-,
CF3SO3-,
HOSO3-, CH3OSO3- или C2H5OSO3-.
[0208]
[II-7] Способ в соответствии с пунктом [II-5], где
R1 представляет собой трифторметильную группу или пентафторэтильную группу;
R2 и R3 представляют собой, каждый, независимо метильную группу, этильную группу или фенильную группу;
Y1, Y2, Y3 и Y4 представляют собой, каждый, независимо атом водорода, атом хлора или нитрогруппу; и
X- представляет собой Cl-, Br-, I-,
BF4-,
CF3SO3-,
HOSO3-, CH3OSO3- или C2H5OSO3-.
[0209]
[II-8] Способ в соответствии с пунктом [II-5], где
R1 представляет собой трифторметильную группу;
R2 и R3 представляют собой, каждый, метильную группу;
Y1, Y2, Y3 и Y4 представляют собой, каждый, атом водорода; и
X- представляет собой CH3OSO3-.
[0210]
[II-9] Способ в соответствии с любым из пунктов [II-5] - [II-8], где взаимодействие осуществляют в присутствии цеолита.
[0211]
[II-10] Способ в соответствии с пунктом [II-9], где цеолит представляет собой молекулярное сито 3A, молекулярное сито 4A или молекулярное сито 5A.
[0212]
[II-11] Способ в соответствии с пунктом [II-5], где исходное соединение представляет собой соединение, представленное общей формулой (2):
[Химическая формула 24]
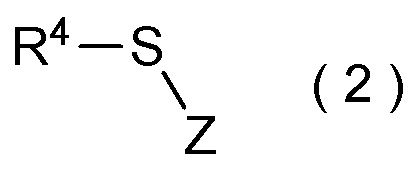
где R4 представляет собой
углеводородную группу с прямой или разветвленную цепью, которая может содержать один или несколько заместителей,
циклическую углеводородную группу, которая может содержать один или несколько заместителей, или
гетероциклическую группу, которая может содержать один или несколько заместителей; и
Z представляет собой уходящую группу; и
целевое соединение, содержащее R1, представляет собой соединение, представленное общей формулой (3):
[Химическая формула 25]
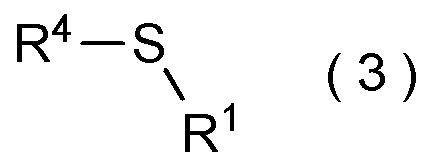
где R1 является таким, как определено в пункте [II-5]; и R4 является таким как, определено выше.
[0213]
[II-12] Способ в соответствии с пунктом [II-11], где
R1 представляет собой C1-C4 перфторалкильную группу;
R2 и R3 представляют собой, каждый, независимо C1-C4 алкильную группу или фенильную группу;
Y1, Y2, Y3 и Y4 представляют собой, каждый, независимо
атом водорода, атом галогена, нитрогруппу, цианогруппу,
C1-C4 алкильную группу или C1-C4 галогеналкильную группу; и
X- представляет собой Cl-, Br-, I-,
BF4-,
CF3SO3-,
HOSO3-, CH3OSO3- или C2H5OSO3-;
R4 представляет собой
C1-C12 алкильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкенильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкинильную группу, которая может содержать один или несколько заместителей,
C3-C8 циклоалкильную группу, которая может содержать один или несколько заместителей,
C6-C10 арильную группу, которая может содержать один или несколько заместителей, или
гетероциклическую группу, которая может содержать один или несколько заместителей, где гетероциклическая группа представляет собой 5-10-членную гетероциклическую группу, содержащую от 1 до 9 атомов углерода и от 1 до 4 гетероатомов, независимо выбранных из атома азота, атома кислорода и атома серы; и
Z представляет собой циано группу,
C1-C4 алкилсульфонильную группу, или
фенилсульфонильную группу, где фрагмент фенильной группы может содержать от 1 до 5 заместителей, выбранных независимо из атома галогена и C1-C4 алкильная группа.
[0214]
[II-13] Способ в соответствии с пунктом [II-11], где
R1 представляет собой трифторметильную группу или пентафторэтильную группу;
R2 и R3 представляют собой, каждый, независимо метильную группу, этильную группу или фенильную группу;
Y1, Y2, Y3 и Y4 представляют собой, каждый, независимо атом водорода, атом хлора или нитрогруппу;
X- представляет собой Cl-, Br-, I-,
BF4-,
CF3SO3-,
HOSO3-, CH3OSO3- или C2H5OSO3-;
R4 представляет собой C3-C7 алкильную группу,
C3-C7 алкильную группу, содержащую бензилокси группу,
C3-C7 алкильную группу, содержащую C2-C4 ацилокси группу,
C3-C7 алкильную группу, содержащую фенилокси группу, которая может иметь от 1 до 4 заместителей, независимо выбранных из атома галогена, C1-C4 алкильной группы, C1-C6 галогеналкилтио группы и C1-C6 галогеналкилсульфинильной группы,
C6-C10 арильную группу, которая может иметь от 1 до 4 заместителей, независимо выбранных из атома галогена, C1-C4 алкильной группы, C1-C4 галогеналкильной группы, C1-C4 алкокси группы, C1-C4 галогеналкокси группы и C6-C10 арильной группы, или
тиенильную группу, пиразолильную группу, имидазолильную группу, тиазолильную группу, изотиазолильную группу, пиридильную группу или пиримидильную группу, которая может иметь от 1 до 4 заместителей, независимо выбранных из атома галогена, C1-C4 алкильной группы, C1-C4 галогеналкильной группы, C1-C4 алкокси группы, C1-C4 галогеналкокси группы и C6-C10 арильной группы; и
Z представляет собой циано группу,
C1-C4 алкилсульфонильную группу, или
фенилсульфонильную группу, где фрагмент фенильной группы может содержать от 1 до 5 заместителей, выбранных независимо из атома галогена и C1-C4 алкильной группы.
[0215]
[II-14] Способ в соответствии с пунктом [II-11], где
R1 представляет собой трифторметильную группу;
R2 и R3 представляют собой, каждый, метильную группу;
Y1, Y2, Y3 и Y4 представляют собой, каждый, атом водорода;
X- представляет собой CH3OSO3-;
R4 представляет собой 5-бензилоксипентильную группу, 5-ацетилоксипентильную группу, 6-бензилоксигексильную группу, 6-ацетилоксигексильную группу,
5-[4-хлор-2-фтор-5-(2,2,2-трифторэтилтио)фенокси]пентильную группу или
6-[2,4-диметил-5-(2,2,2-трифторэтилтио)фенокси]гексильную группу; и
Z представляет собой циано группу,
метилсульфонильную группу,
фенилсульфонильную группу, 4-метилфенилсульфонильную группу или 4-хлорфенилсульфонильную группу.
[0216]
[II-15] Способ в соответствии с любым из пунктов [II-11] - [II-14], где взаимодействие осуществляют в присутствии цеолита.
[0217]
[II-16] Способ в соответствии с пунктом [II-15], где цеолит представляет собой молекулярное сито 3A, молекулярное сито 4A или молекулярное сито 5A.
[0218]
[II-17] Способ в соответствии с пунктом [II-5], где исходное соединение представляет собой соединение, представленное общей формулой (4):
[Химическая формула 26]
где R5 представляет собой
углеводородную группу с прямой или разветвленную цепью, которая может содержать один или несколько заместителей,
циклическую углеводородную группу, которая может содержать один или несколько заместителей, или
гетероциклическую группу, которая может содержать один или несколько заместителей; и
R6 представляет собой
атом водорода,
углеводородную группу с прямой или разветвленную цепью, которая может содержать один или несколько заместителей,
циклическую углеводородную группу, которая может содержать один или несколько заместителей, или
гетероциклическую группу, которая может содержать один или несколько заместителей; и
целевое соединение, содержащее R1, представляет собой соединение, представленное общей формулой (5):
[Химическая формула 27]
где R1 является таким, как определено в пункте [II-5]; и R5 и R6 являются такими, как определено выше.
[0219]
[II-18] Способ в соответствии с пунктом [II-17], где
R1 представляет собой C1-C4 перфторалкильную группу;
R2 и R3 представляют собой, каждый, независимо C1-C4 алкильную группу или фенильную группу;
Y1, Y2, Y3 и Y4 представляют собой, каждый, независимо
атом водорода, атом галогена, нитрогруппу, цианогруппу,
C1-C4 алкильную группу или C1-C4 галогеналкильную группу; и
X- представляет собой Cl-, Br-, I-,
BF4-,
CF3SO3-,
HOSO3-, CH3OSO3- или C2H5OSO3-.
[0220]
[II-19] Способ в соответствии с пунктом [II-17], где
R1 представляет собой трифторметильную группу или пентафторэтильную группу;
R2 и R3 представляют собой, каждый, независимо метильную группу, этильную группу или фенильную группу;
Y1, Y2, Y3 и Y4 представляют собой, каждый, независимо атом водорода, атом хлора или нитрогруппу;
X- представляет собой Cl-, Br-, I-,
BF4-,
CF3SO3-,
HOSO3-, CH3OSO3- или C2H5OSO3-;
R5 представляет собой
C1-C12 алкильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкенильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкинильную группу, которая может содержать один или несколько заместителей,
C3-C8 циклоалкильную группу, которая может содержать один или несколько заместителей,
C6-C10 арильную группу, которая может содержать один или несколько заместителей, или
гетероциклическую группу, которая может содержать один или несколько заместителей, где гетероциклическая группа представляет собой 5-10-членную гетероциклическую группу, содержащую от 1 до 9 атомов углерода и от 1 до 4 гетероатомов, независимо выбранных из атома азота, атома кислорода и атома серы; и
R6 представляет собой атом водорода, C1-C4 алкильную группу или C1-C4 галогеналкильную группу.
[0221]
[II-20] Способ в соответствии с пунктом [II-17], где
R1 представляет собой трифторметильную группу;
R2 и R3 представляют собой, каждый, метильную группу;
Y1, Y2, Y3 и Y4 представляют собой, каждый, атом водорода;
X- представляет собой CH3OSO3-;
R5 представляет собой
C1-C12 алкильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкенильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкинильную группу, которая может содержать один или несколько заместителей,
C3-C8 циклоалкильную группу, которая может содержать один или несколько заместителей,
C6-C10 арильную группу, которая может содержать один или несколько заместителей, или
гетероциклическую группу, которая может содержать один или несколько заместителей, где гетероциклическая группа представляет собой 5-10-членную гетероциклическую группу, содержащую от 1 до 9 атомов углерода и от 1 до 4 гетероатомов, независимо выбранных из атома азота, атома кислорода и атома серы; и
R6 представляет собой атом водорода.
[0222]
[II-21] Способ в соответствии с любым из пунктов [II-17] - [II-20], где взаимодействие осуществляют в присутствии цеолита.
[0223]
[II-22] Способ в соответствии с пунктом [II-21], где цеолит представляет собой молекулярное сито 3A, молекулярное сито 4A или молекулярное сито 5A.
[0224]
[II-23] Соединение, представленное общей формулой (1A):
[Химическая формула 28]

где R1 представляет собой C1-C8 фторалкильную группу;
R2 и R3 представляют собой, каждый, независимо
C1-C12 алкильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкенильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкинильную группу, которая может содержать один или несколько заместителей,
C3-C8 циклоалкильную группу, которая может содержать один или несколько заместителей, или
C6-C10 арильную группу, которая может содержать один или несколько заместителей;
Y1, Y2, Y3 и Y4 представляют собой, каждый, независимо
атом водорода, атом галогена, нитрогруппу, цианогруппу,
C1-C12 алкильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкенильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкинильную группу, которая может содержать один или несколько заместителей,
C3-C8 циклоалкильную группу, которая может содержать один или несколько заместителей,
гидрокси группу,
C1-C6 алкокси группу,
C1-C6 алкилтио группу, C1-C6 алкилсульфинильную группу, C1-C6 алкилсульфонильную группу,
амино группу, моно (C1-C6 алкил) амино группу, ди(C1-C6 алкил) амино группу,
C1-C6 ациламино группу,
формильную группу, C2-C6 ацильную группу,
C1-C6 алкоксикарбонильную группу,
C6-C10 арильную группу, которая может содержать один или несколько заместителей, или
гетероциклическую группу, которая может содержать один или несколько заместителей, где гетероциклическая группа представляет собой 5-10-членную гетероциклическую группу, содержащую от 1 до 9 атомов углерода и от 1 до 4 гетероатомов, независимо выбранных из атома азота, атома кислорода и атома серы, или
два смежных заместителя Y1 и Y2, Y2 и Y3, или Y3 и Y4, вместе с атомами углерода, к которым эти заместители присоединены, образуют 4-8-членное карбоциклическое кольцо или 4-8-членное гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, выбранных независимо из атома кислорода, атома серы и атома азота, где образованное кольцо может иметь один или несколько заместителей; и
X- представляет собой моновалентный анион;
при условии, что следующие случаи (I)-(V) исключены:
(i) R1 представляет собой трифторметильную группу,
R2 и R3 представляют собой, каждый, метильную группу,
Y1, Y2, Y3 и Y4 представляют собой, каждый, атом водорода, и
X- представляет собой Br-;
(ii) R1 представляет собой трифторметильную группу,
R2 и R3 представляют собой, каждый, метильную группу,
Y1, Y2, Y3 и Y4 представляют собой, каждый, атом водорода, и
X- представляет собой I-;
(iii) R1 представляет собой трифторметильную группу,
R2 и R3 представляют собой, каждый, метильную группу,
Y1 представляет собой атом водорода,
Y2 представляет собой метильную группу,
Y3 представляет собой метильную группу,
Y4 представляет собой атом водорода, и
X- представляет собой I-;
(iv) R1 представляет собой трифторметильную группу,
R2 и R3 представляют собой, каждый, метильную группу,
Y1 представляет собой атом водорода,
Y2 представляет собой атом хлора,
Y3 представляет собой атом водорода,
Y4 представляет собой атом водорода, и
X- представляет собой Br-; и
(v) R1 представляет собой трифторметильную группу,
R2 и R3 представляют собой, каждый, метильную группу,
Y1, Y2, Y3 и Y4 представляют собой, каждый, атом брома, и
X- представляет собой Br-.
[0225]
[II-24] Соединение в соответствии с пунктом [II-23], где
R1 представляет собой C1-C4 перфторалкильную группу;
R2 и R3 представляют собой, каждый, независимо C1-C4 алкильную группу или фенильную группу;
Y1, Y2, Y3 и Y4 представляют собой, каждый, независимо
атом водорода, атом галогена, нитрогруппу, цианогруппу,
C1-C4 алкильную группу или C1-C4 галогеналкильную группу; и
X- представляет собой Cl-, Br-, I-,
BF4-,
CF3SO3-,
HOSO3-, CH3OSO3- или C2H5OSO3-.
[0226]
[II-25] Соединение в соответствии с пунктом [II-23], где
R1 представляет собой трифторметильную группу или пентафторэтильную группу;
R2 и R3 представляют собой, каждый, независимо метильную группу, этильную группу или фенильную группу;
Y1, Y2, Y3 и Y4 представляют собой, каждый, независимо атом водорода, атом хлора или нитрогруппу; и
X- представляет собой Cl-, Br-, I-,
BF4-,
CF3SO3-,
HOSO3-, CH3OSO3- или C2H5OSO3-.
[0227]
[II-26] Соединение в соответствии с пунктом [II-23], где
R1 представляет собой трифторметильную группу;
R2 и R3 представляют собой, каждый, метильную группу;
Y1, Y2, Y3 и Y4 представляют собой, каждый, атом водорода; и
X- представляет собой CH3OSO3-.
[0228]
[II-27] Применение соединения, представленного общей формулой (1):
[Химическая формула 29]
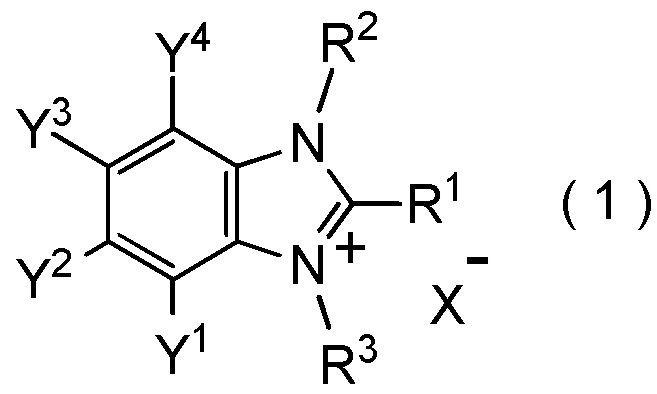
где R1 представляет собой C1-C8 фторалкильную группу;
R2 и R3 представляют собой, каждый, независимо
C1-C12 алкильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкенильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкинильную группу, которая может содержать один или несколько заместителей,
C3-C8 циклоалкильную группу, которая может содержать один или несколько заместителей, или
C6-C10 арильную группу, которая может содержать один или несколько заместителей;
Y1, Y2, Y3 и Y4 представляют собой, каждый, независимо
атом водорода, атом галогена, нитрогруппу, цианогруппу,
C1-C12 алкильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкенильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкинильную группу, которая может содержать один или несколько заместителей,
C3-C8 циклоалкильную группу, которая может содержать один или несколько заместителей,
гидрокси группу,
C1-C6 алкокси группу,
C1-C6 алкилтио группу, C1-C6 алкилсульфинильную группу, C1-C6 алкилсульфонильную группу,
амино группу, моно (C1-C6 алкил) амино группу, ди(C1-C6 алкил) амино группу,
C1-C6 ациламино группу,
формильную группу, C2-C6 ацильную группу,
C1-C6 алкоксикарбонильную группу,
C6-C10 арильную группу, которая может содержать один или несколько заместителей, или
гетероциклическую группу, которая может содержать один или несколько заместителей, где гетероциклическая группа представляет собой 5-10-членную гетероциклическую группу, содержащую от 1 до 9 атомов углерода и от 1 до 4 гетероатомов, независимо выбранных из атома азота, атома кислорода и атома серы, или
два смежных заместителя Y1 и Y2, Y2 и Y3, или Y3 и Y4, вместе с атомами углерода, к которым эти заместители присоединены, образуют 4-8-членное карбоциклическое кольцо или 4-8-членное гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, выбранных независимо из атома кислорода, атома серы и атома азота, где образованное кольцо может иметь один или несколько заместителей; и
X- представляет собой моновалентный анион, в качестве фторалкилирующего агента.
[0229]
[II-28] Применение по п.[II-27], где
R1 представляет собой C1-C4 перфторалкильную группу;
R2 и R3 представляют собой, каждый, независимо C1-C4 алкильную группу или фенильную группу;
Y1, Y2, Y3 и Y4 представляют собой, каждый, независимо
атом водорода, атом галогена, нитрогруппу, цианогруппу,
C1-C4 алкильную группу или C1-C4 галогеналкильную группу; и
X- представляет собой Cl-, Br-, I-,
BF4-,
CF3SO3-,
HOSO3-, CH3OSO3- или C2H5OSO3-.
[0230]
[II-29] Применение в соответствии с пунктом [II-27], где
R1 представляет собой трифторметильную группу или пентафторэтильную группу;
R2 и R3 представляют собой, каждый, независимо метильную группу, этильную группу или фенильную группу;
Y1, Y2, Y3 и Y4 представляют собой, каждый, независимо атом водорода, атом хлора или нитрогруппу; и
X- представляет собой Cl-, Br-, I-,
BF4-,
CF3SO3-,
HOSO3-, CH3OSO3- или C2H5OSO3-.
[0231]
[II-30] Применение в соответствии с пунктом [II-27], где
R1 представляет собой трифторметильную группу;
R2 и R3 представляют собой, каждый, метильную группу;
Y1, Y2, Y3 и Y4 представляют собой, каждый, атом водорода; и
X- представляет собой CH3OSO3-.
Положительные эффекты изобретения
[0232]
Настоящее изобретение относится к предпочтительному, с промышленной точки зрения, и новому фторалкилирующему агенту и его применению (то есть, способу получения соединения, содержащего фторалкильную группу), которое может устранить один или несколько из вышеуказанных недостатков и проблем в предшествующем уровне техники. Кроме того, настоящее изобретение также относится к новому соединению, которое используется в качестве фторалкилирующего агента.
[0233]
Кроме того, фторалкилирующий агент по настоящему изобретению может быть эффективно получено из легко доступного производного уксусной кислоты, такого как трифторуксусная кислота, в качестве агента. Другими словами, фторалкилирующий агент по настоящему изобретению может быть получено без использования газа, вызывающего парниковый эффект (например, CHF3), или газообразного фреона (например, CF3I или CBrF3) в качестве источника фтора. Таким образом, настоящее изобретение может снизить нагрузку на окружающую среду.
[0234]
Кроме того, в соответствии с настоящим изобретением, реакция фторалкилирования может быть осуществлена путем проведения простых манипуляций для взаимодействия в мягких реакционных условиях, и без применения специального оборудования. В частности, например, настоящее изобретение относится к новому фторалкилирующему агенту, и таким образом легко контролировать температуру реакции фторалкилирования, а также не требуется крайне низкая температура.
[0235]
Кроме того, в настоящем изобретении, безопасность реакции фторалкилирования может быть повышена, поскольку температура реакции легко контролируется.
[0236]
Кроме того, в соответствии с настоящим изобретением можно эффективно использовать фрагмент фторалкилирующей группы в молекуле фторалкилирующего агента. Соответственно может быть устранено образование фторсодержащих отходов. При этом новый фторалкилирующий агент по настоящему изобретению не нуждается в инициаторе, таком как фториды, и обычно избыточном количестве соли четвертичного аммония. Также, с учетом этих факторов, настоящее изобретение является экономичным, простым и экологически более совершенным.
[0237]
Как было описано выше, с технической и экономической точек зрения, способ получения соединения, содержащего фторалкилирующую группу, существенно улучшен. Таким образом, настоящее изобретение является более экономически выгодным, а также более благоприятным для окружающей среды и имеет высокую ценность с промышленной точки зрения.
Описание вариантов осуществления
[0238]
Настоящее изобретение будет подробно описано ниже.
[0239]
Термины и символы, используемые в настоящем описании, будут описаны ниже.
[0240]
Термин "реакция фторалкилирования" обозначает взаимодействие, посредством которого фторалкилирующую группу вводят в исходное соединение (соединение материала), которое представляет собой органическое соединение. Другими словами, термин "реакция фторалкилирования" обозначает взаимодействие, которое обеспечивает целевое соединение, содержащее фторалкилирующую группу путем взаимодействия исходного соединения (соединение материала), который представляет собой органическое соединение, с фторалкилирующим агентом.
[0241]
Термин "фторалкилирующий агент" обозначает агент, который используется в качестве источника фторалкилирующей группы в реакции фторалкилирования, описанной выше.
[0242]
"Реакция фторалкилирования" включает "реакцию перфторалкилирования".
[0243]
"Фторалкилирующий агент" включает "перфторалкилирующий агент".
[0244]
Термин "реакция перфторалкилирования" обозначает взаимодействие, посредством которого перфторалкилирующую группу вводят в исходное соединение (соединение материала), которое представляет собой органическое соединение. Другими словами, термин "реакция перфторалкилирования" обозначает реакцию, которая дает целевое соединение, содержащее перфторалкилирующую группу, путем взаимодействия исходного соединения (соединение материала), которое представляет собой органическое соединение, с перфторалкилирующим агентом.
[0245]
Термин "перфторалкилирующий агент" обозначает агент, который используется в качестве источника перфторалкилирующей группы в реакции перфторалкилирования, определенной выше.
[0246]
Атом галогена представляет собой атом фтора, атом хлора, атом брома или атом иода.
[0247]
Фраза "Ca - Cb" обозначает, что количество атомов углерода равно b. Например, фраза "C1-C4" в "C1-C4 алкильной группе" обозначает, что количество атомов углерода в алкильной группе составляет от 1 до 4. Фраза "Са-Cb" в настоящем описании исключает количество атомов углерода в "заместителе(заместителях)" в фразах "может иметь заместитель(заместители)" и "может быть замещенной". Например, фраза "С1-С12" в "С1-С12 алкильной группе, которая может иметь заместитель(заместители)", исключает количество атомов углерода в "заместителе(заместителях)" в фразе "может иметь заместитель(заместители)". Например, фраза "С1-С12" в "С1-С12 алкильной группе, которая может быть замещенной", исключает количество атомов углерода в "заместителе(заместителях)" в фразе "может быть замещен".
[0248]
В настоящем описании, когда не описано определение заместителя, содержащего определенное количество атомов углерода, определение, обычно, следует понимать путем замены, соответствующим образом, количества атомов углерода и так далее, в определении родственного заместителя, содержащего количество атомов углерода, отличное от конкретного количества атомов углерода.
[0249]
В настоящем описании, когда не описаны конкретные примеры заместителя, содержащего определенное количество углерода, обычно могут быть указаны соответствующие примеры в числе конкретных примеров родственного заместителя, содержащего количество углерода больше, чем конкретное количество атомов углерода.
[0250]
При этом следует иметь в виду, что общие термины, такие как "алкил", включают как группу с прямой цепью, так и с разветвленной цепью, такие как бутильная группа и трет-бутильная группа. Тем не менее, когда используется специальный термин, такой как "бутильная группа", он является специальным для "нормальной бутильной группы", то есть, "н-бутильной группы". Другими словами, специальный термин "бутильная группа" относится к "нормальной бутильной группе" в группе с прямой цепью, и изомеры с разветвленной цепью, такие как "трет-бутильная группа", указываются специально при использовании. В качестве другого примера, специфический термин "пентильная группа" относится к "нормальной пентильной группе" группы с прямой цепью. Для еще одного примера, конкретный термин "гексильная группа" относится к "нормальной гексильной группе" группы с прямой цепью.
[0251]
Префиксы "n-", "s-" и "sec-", "i-", "t-" и "tert-", "neo-", "c-" и "cyc-", "o-", "m-" и "p-" имеют свои обычные следующие значения: нормальный, вторичный ("s-" и "sec-"), изо, третичный ("t-" и "tert-"), нео, цикло, орто, мета и пара.
[0252]
При этом могут быть использованы следующие сокращения:
"Me" обозначает метильную группу;
"Et" обозначает этильную группу;
"Pr", "n-Pr" и "Pr-n" означают пропильную группу (то есть, нормальную пропильную группу);
"i-Pr" и "Pr-i" означают изопропильную группу;
"Bu", "n-Bu" и "Bu-n" означают бутильную группу (то есть, нормальную бутильную группу);
"s-Bu" и "Bu-s" означают втор-бутильную группу;
"i-Bu" и "Bu-i" означают изобутильную группу;
"t-Bu" и "Bu-t" означают трет-бутильную группу;
"Pen", "n-Pen" и "Pen-n" означают пентильную группу (то есть, нормальную пентильную группу);
"Hex", "n-Hex" и "Hex-n" означают гексильную группу (то есть, нормальную гексильную группу);
"Dec", "n-Dec" и "Dec-n" означают децильную группу (то есть, нормальную децильную группу);
"c-Pr" и "Pr-c" означают циклопропильную группу;
"c-Bu" и "Bu-c" означают циклобутильную группу;
"c-Pen" и "Pen-c" означают циклопентильную группу;
"c-Hex" и "Hex-c" означают циклогексильную группу;
"Ph" означает фенильную группу; и
"Bn" означает бензильную группу.
[0253]
Примеры углеводородной группы включают углеводородную группу с прямой или разветвленную цепью, и циклическую углеводородную группу, каждая из которых может прерываться одной или несколькими -O- группами, -S- группами, -SO- группами, -SO2- группами, и/или -NRa- группами. Примеры Ra включают атом водорода, алкильную группу, алкенильную группу, алкинильную группу, циклоалкильную группу, арильную группу и тому подобное.
"Углеводородная группа" также обозначается в настоящем документе как "гидрокарбильная группа".
[0254]
Примеры углеводородной группы с прямой цепью или неразветвленной цепью включают алкильную группу, алкенильную группу, алкинильную группу и тому подобное.
[0255]
В настоящем описании циклическая углеводородная группа обозначает циклическую группу, которая является ароматической или неароматической, и является моноциклической или полициклической, где все образующие кольцо атомы являются атомами углерода.
[0256]
В одном из вариантов осуществления, примеры циклической углеводородной группы включают, но ими не ограничиваются, 3-14-членную (предпочтительно 4-14-членную, более предпочтительно 5-14-членную, еще более предпочтительно 5-10-членную, особенно предпочтительно 6-10-членную) циклическую углеводородную группу, которая является ароматической или неароматической, и является моноциклической, бициклической или трициклической.
[0257]
В другом варианте осуществления, примеры циклической углеводородной группы включают, но ими не ограничиваются, 4-8-членную (предпочтительно 5-6-членную) циклическую углеводородную группу, которая является ароматической или неароматической, и является моноциклической или бициклической (предпочтительно моноциклическая).
[0258]
Примеры циклической углеводородной группы включают циклоалкильную группу, арильную группу и тому подобное.
[0259]
Арильная группа представляет собой ароматическую циклическую группу в числе циклических углеводородных групп, определенных выше.
[0260]
"Арильная группа" также обозначается в настоящем документе как "ароматическая карбоциклическая группа".
[0261]
Циклическая углеводородная группа, определенная выше или примеры которой приведены выше, может включать неконденсированную циклическую группу (например, моноциклическую группу или спироциклическую группу) и конденсированную циклическую группу, по возможности.
[0262]
Циклическая углеводородная группа, определенная выше или примеры которой приведены выше, может быть ненасыщенной, частично насыщенной или насыщенной, по возможности.
[0263]
Циклическая углеводородная группа, определенная выше или примеры которой приведены выше, также обозначается в настоящем документе как карбоциклическая группа. Кроме того, циклическая углеводородная группа также обозначается в настоящем документе как карбоциклильная группа.
[0264]
В настоящем описании карбоциклическое кольцо представляет собой кольцо, которое соответствует циклической углеводородной группе, определенной выше или примеры которой приведены выше.
[0265]
Примеры алкильной группы включают, но ими не ограничиваются, C1-C12 алкильную группу, C1-C6 алкильную группу, C1-C4 алкильную группу, C1-C2 алкильную группу и тому подобное.
[0266]
C1-C12 алкильная группа означает алкильную группу с прямой или разветвленной цепью, содержащую от 1 до 12 атомов углерода.
[0267]
Конкретные примеры C1-C12 алкильной группы включают, но ими не ограничиваются,
метильную группу, этильную группу, пропильную группу, изопропильную группу,
бутильную группу, втор-бутильную группу, изобутильную группу, трет-бутильную группу,
пентильную группу, 1-метилбутильную группу, 2-метилбутильную группу, изопентильную группу, 1-этилпропильную группу, 1,1-диметилпропильную группу, 1,2-диметилпропильную группу, неопентильную группу,
гексильную группу, 1-метилпентильную группу, 2-метилпентильную группу, 3-метилпентильную группу, изогексильную группу, 1-этилбутильную группу, 2-этилбутильную группу, 1,1-диметилбутильную группу, 1,2-диметилбутильную группу, 1,3-диметилбутильную группу, 2,2-диметилбутильную группу, 2,3-диметилбутильную группу, 3,3-диметилбутильную группу, 1,1,2-триметилпропильную группу, 1,2,2-триметилпропильную группу, 1-этил-1-метилпропильную группу, 1-этил-2-метилпропильную группу,
гептильную группу, 1-метилгексильную группу, 2-метилгексильную группу, 3-метилгексильную группу, 4-метилгексильную группу, изогептильную группу, 1,1-диметилпентильную группу, 2,2-диметилпентильную группу, 4,4-диметилпентильную группу, 1-этилпентильную группу, 2-этилпентильную группу, 1,1,3-триметилбутильную группу, 1,2,2-триметилбутильную группу, 1,3,3-триметилбутильную группу, 2,2,3-триметилбутильную группу, 2,3,3-триметилбутильную группу, 1-пропилбутильную группу, 1,1,2,2-тетраметилпропильную группу,
октильную группу, 1-метилгептильную группу, 3-метилгептильную группу, изооктильную группу, 2-этилгексильную группу, 5,5-диметилгексильную группу, 2,4,4-триметилпентильную группу, 1-этил-1-метилпентильную группу, 1-пропилпентильную группу,
нонильную группу, 1-метилоктильную группу, 2-метилоктильную группу, 3-метилоктильную группу, изононильную группу, 1-этилгептильную группу, 1,1-диметилгептильную группу, 6,6-диметилгептильную группу,
децильную группу, 1-метилнонильную группу, 2-метилнонильную группу, 6-метилнонильную группу, изодецильную группу, 1-этилоктильную группу, 1-пропилгептильную группу,
ундецильную группу, 1-метилдецильную группу, изоундецильную группу,
додецильную группу, 1-метилундецильную группу, изододецильную группу и тому подобное.
[0268]
C3-C7 алкильная группа обозначает алкильную группу с прямой цепью или разветвленной цепью, содержащей от 3 до 7 атомов углерода.
[0269]
Конкретные примеры C3-C7 алкильной группы включают соответствующие примеры в числе вышеуказанных конкретных примеров C1-C12 алкильной группы.
[0270]
C1-C6 алкильная группа обозначает алкильную группу с прямой цепью или разветвленной цепью, содержащую от 1 до 6 атомов углерода.
[0271]
Конкретные примеры C1-C6 алкильной группы включают соответствующие примеры в числе вышеуказанных конкретных примеров C1-C12 алкильной группы.
[0272]
C1-C4 алкильная группа обозначает алкильную группу с прямой цепью или разветвленной цепью, содержащую от 1 до 4 атомов углерода.
[0273]
Конкретные примеры C1-C4 алкильной группы представляют собой соответствующие примеры в числе вышеуказанных конкретных примеров C1-C12 алкильной группы
[0274]
C1-C2 алкильная группа обозначает алкильную группу с неразветвленной цепью, содержащую от 1 до 2 атомов углерода.
[0275]
Конкретными примерами C1-C2 алкильной группы являются соответствующие примеры в числе вышеуказанных конкретных примеров C1-C12 алкильной группы.
[0276]
Примеры алкенильной группы включают, но ими не ограничиваются, C2-C6 алкенильную группу и тому подобное.
[0277]
C2-C6 алкенильная группа обозначает алкенильную группу с прямой цепью или неразветвленной цепью, содержащую от 2 до 6 атомов углерода.
[0278]
Конкретные примеры C2-C6 алкенильной группы включают, но ими не ограничиваются,
винильную группу, 1-пропенильную группу, изопропенильную группу, 2-пропенильную группу,
1-бутенильную группу, 1-метил-1-пропенильную группу, 2-метил-1-пропенильную группу, 2-бутенильную группу, 1-метил-2-пропенильную группу, 2-метил-2-пропенильную группу, 3-бутенильную группу, 1,3-бутадиенильную группу,
1-пентенильную группу, 2-пентенильную группу, 3-пентенильную группу, 4-пентенильную группу,
1,3-пентадиенильную группу, 1-винил-2-пропенильную группу,
1-гексенильную группу и тому подобное.
[0279]
Примеры алкинильной группы включают, но ими не ограничиваются, C2-C6 алкинильную группу и тому подобное.
[0280]
C2-C6 алкинильная группа обозначает алкинильную группу с прямой цепью или неразветвленной цепью, содержащую от 2 до 6 атомов углерода.
[0281]
Конкретные примеры C2-C6 алкинильной группы включают, но ими не ограничиваются,
этинильную группу, 1-пропинильную группу, 2-пропинильную группу,
1-бутинильную группу, 1-метил-2-пропинильную группу, 2-бутинильную группу, 3-бутинильную группу,
1-пентинильную группу, 3-метил-1-бутинильную группу, 2-пентинильную группу, 1-метил-2-бутинильную группу, 1-этил-2-пропинильную группу, 3-пентинильную группу, 1-метил-3-бутинильную группу, 2-метил-3-бутинильную группу, 4-пентинильную группу,
1-гексинильную группу и тому подобное.
[0282]
Примеры циклоалкильной группы включают, но ими не ограничиваются, C3-C8 циклоалкильную группу,
предпочтительно C5-C6 циклоалкильную группу.
[0283]
C3-C8 циклоалкильная группа обозначает циклоалкильную группу, содержащую от 3 до 8 атомов углерода.
[0284]
Конкретными примерами C3-C8 циклоалкильной группы являются циклопропильная группа, циклобутильная группа, циклопентильная группа, циклогексильная группа, циклогептильная группа и циклооктильная группа.
[0285]
Конкретными примерами C5-C6 циклоалкильной группы являются циклопентильная группа и циклогексильная группа.
[0286]
Примеры галогеналкильной группы включают, но ими не ограничиваются, C1-C6 галогеналкильную группу,
предпочтительно C1-C4 галогеналкильную группу.
[0287]
C1-C6 галогеналкильная группа обозначает алкильную группу с прямой цепью или разветвленной цепью, содержащую от 1 до 6 атомов углерода, которая замещена от 1 до 13 одинаковыми или различными атомами галогена, где атомы галогена имеют аналогичное значение, описанное выше.
[0288]
Конкретные примеры C1-C6 галогеналкильной группы включают, но ими не ограничиваются,
фторметильную группу, хлорметильную группу, бромметильную группу, дифторметильную группу, дихлорметильную группу, трифторметильную группу, трихлорметильную группу, хлордифторметильную группу, бромдифторметильную группу,
2-фторэтильную группу, 1-хлорэтильную группу, 2-хлорэтильную группу, 2,2,2-трифторэтильную группу, пентафторэтильную группу,
3-фторпропильную группу, 3-хлорпропильную группу, 2-хлор-1-метилэтильную группу, 2,2,3,3,3-пентафторпропильную группу, 2,2,2-трифтор-1-трифторметилэтильную группу, гептафторпропильную группу, 1,2,2,2-тетрафтор-1-трифторметилэтильную группу,
4-фторбутильную группу, 4-хлорбутильную группу, 2,2,3,3,4,4,4-гептафторбутильную группу, нонафторбутильную группу, 1,1,2,3,3,3-гексафтор-2-трифторметилпропильную группу, 2,2,2-трифтор-1,1-ди(трифторметил)этильную группу,
ундекафторпентильную группу,
тридекафторгексильную группу и тому подобное.
[0289]
C1-C4 галогеналкильная группа обозначает алкильную группу с прямой цепью или разветвленной цепью, содержащую от 1 до 4 атомов углерода, которая замещена от 1 до 9 одинаковыми или различными атомами галогена.
[0290]
Конкретные примеры C1-C4 галогеналкильной группы включают, но ими не ограничиваются, соответствующие примеры в числе вышеуказанных конкретных примеров C1-C6 галогеналкильной группы.
[0291]
Фторалкилирующая группа обозначает алкильную группу с прямой цепью или разветвленной цепью, где один или несколько атомов углерода замещены атомами фтора.
[0292]
Примеры фторалкилирующей группы включают, но ими не ограничиваются,
C1-C8 фторалкильную группу, C1-C4 фторалкильную группу,
C1-C8 перфторалкильную группу, C1-C4 перфторалкилирующую группу и тому подобное.
[0293]
C1-C8 фторалкилирующая группа обозначает алкильную группу с прямой цепью или разветвленной цепью, содержащую от 1 до 8 атомов углерода, которая замещена от 1 до 17 атомами фтора.
[0294]
Конкретные примеры C1-C8 фторалкилирующой группы включают, но ими не ограничиваются,
фторметильную группу (то есть, -CH2F), дифторметильную группу (то есть, -CHF2), трифторметильную группу (то есть, -CF3),
2-фторэтильную группу (то есть, -CH2CH2F), 1-фторэтильную группу (то есть, -CHFCH3), 2,2,2-трифторэтильную группу (то есть, -CH2CF3), пентафторэтильную группу (то есть, -CF2CF3),
3-фторпропильную группу (то есть, -CH2CH2CH2F), 2,2,3,3,3-пентафторпропильную группу (то есть, -CH2CF2CF3), 2,2,2-трифтор-1-трифторметилэтильную группу (то есть, -CH(CF3)2), гептафторпропильную группу (то есть, -CF2CF2CF3), 1,2,2,2-тетрафтор-1-трифторметилэтильную группу (то есть, -CF(CF3)2),
2,2,3,3,4,4,4-гептафторбутильную группу (то есть, -CH2CF2CF2CF3), нонафторбутильную группу (то есть, -CF2CF2CF2CF3), 1,2,2,3,3,3-гексафтор-1-трифторметилпропильную группу (то есть, -CF(CF3)CF2CF3), 1,1,2,3,3,3-гексафтор-2-трифторметилпропильную группу (то есть, -CF2CF(CF3)2), 2,2,2-трифтор-1,1-ди(трифторметил)этильную группу (то есть, -C(CF3)3),
ундекафторпентильную группу и ее изомеры,
тридекафторгексильную группу и ее изомеры,
пентадекафторпентильную группу и ее изомеры,
гептадекафторгексильную группу и ее изомеры и тому подобное.
[0295]
В одном из вариантов осуществления, предпочтительные конкретные примеры C1-C8 фторалкилирующей группы включают
дифторметильную группу (то есть, -CHF2), трифторметильную группу (то есть, -CF3),
пентафторэтильную группу (то есть, -CF2CF3),
2,2,2-трифтор-1-трифторметилэтильную группу (то есть, -CH(CF3)2), гептафторпропильную группу (то есть, -CF2CF2CF3), 1,2,2,2-тетрафтор-1-трифторметилэтильную группу (то есть, -CF(CF3)2),
нонафторбутильную группу (то есть, -CF2CF2CF2CF3), 1,2,2,3,3,3-гексафтор-1-трифторметилпропильную группу (то есть, -CF(CF3)CF2CF3), 1,1,2,3,3,3-гексафтор-2-трифторметилпропильную группу (то есть, -CF2CF(CF3)2), 2,2,2-трифтор-1,1-ди(трифторметил)этильную группу (то есть, -C(CF3)3),
ундекафторпентильную группу и ее изомеры,
тридекафторгексильную группу и ее изомеры,
пентадекафторпентильную группу и ее изомеры,
гептадекафторгексильную группу и ее изомеры.
[0296]
C1-C4 фторалкилирующая группа обозначает алкильную группу с прямой цепью или разветвленной цепью, содержащую от 1 до 4 атомов углерода, которая замещена от 1 до 9 атомами фтора.
[0297]
Конкретные примеры C1-C4 фторалкилирующей группы включают, но ими не ограничиваются, соответствующие примеры в числе вышеуказанных конкретных примеров C1-C8 фторалкильной группы.
[0298]
В одном из вариантов осуществления, предпочтительные конкретные примеры C1-C4 фторалкилирующей группы включают соответствующие примеры в числе вышеуказанных предпочтительных конкретных примеров C1-C8 фторалкильной группы.
[0299]
Перфторалкилирующая группа обозначает алкильную группу с прямой цепью или разветвленной цепью, где все атомы водорода замещены атомами фтора.
[0300]
Примеры перфторалкилирующей группы включают, но ими не ограничиваются, C1-C8 перфторалкильную группу, C1-C4 перфторалкилирующую группу и тому подобное.
[0301]
C1-C8 перфторалкилирующая группа обозначает алкильную группу с прямой цепью или разветвленной цепью, содержащую от 1 до 8 атомов углерода, где все атомы водорода замещены атомами фтора.
[0302]
Конкретные примеры C1-C8 перфторалкилирующей группы включают
трифторметильную группу (то есть, -CF3),
пентафторэтильную группу (то есть, -CF2CF3),
гептафторпропильную группу (то есть, -CF2CF2CF3), 1,2,2,2-тетрафтор-1-трифторметилэтильную группу (то есть, -CF(CF3)2),
нонафторбутильную группу (то есть, -CF2CF2CF2CF3), 1,2,2,3,3,3-гексафтор-1-трифторметилпропильную группу (то есть, -CF(CF3)CF2CF3), 1,1,2,3,3,3-гексафтор-2-трифторметилпропильную группу (то есть, -CF2CF(CF3)2), 2,2,2-трифтор-1,1-ди(трифторметил)этильную группу (то есть, -C(CF3)3),
ундекафторпентильную группу и ее изомеры,
тридекафторгексильную группу и ее изомеры,
пентадекафторпентильную группу и ее изомеры,
гептадекафторгексильную группу и ее изомеры.
[0303]
C1-C4 перфторалкилирующая группа обозначает алкильную группу с прямой цепью или разветвленной цепью, содержащую от 1 до 4 атомов углерода, которая замещена от 1 до 9 атомами фтора.
[0304]
Конкретные примеры C1-C4 перфторалкилирующей группы включают, но ими не ограничиваются, соответствующие примеры в числе вышеуказанных конкретных примеров C1-C8 перфторалкильной группы.
[0305]
Примеры алкокси группы включают, но ими не ограничиваются, C1-C6 алкокси группу, C1-C4 алкокси группу и тому подобное.
[0306]
C1-C6 алкокси группа обозначает (C1-C6 алкил)-O- группу, где фрагмент C1-C6 алкильной группы имеет такое же значение, как определено выше.
[0307]
Конкретные примеры C1-C6 алкокси группы включают, но ими не ограничиваются, метокси группу, этокси группу, пропокси группу, изопропокси группу, бутокси группу, втор-бутокси группу, изобутокси группу, трет-бутокси группу, пентилокси группу, изопентилокси группу, гексилокси группу, изогексилокси группу и тому подобное.
[0308]
C1-C4 алкокси группа обозначает (C1-C4 алкил)-O- группу, где фрагмент C1-C4 алкильной группы имеет такое же значение, как определено выше.
[0309]
Конкретные примеры C1-C4 алкокси группы представляют собой соответствующие примеры в числе вышеуказанных конкретных примеров C1-C6 алкокси группы.
[0310]
C1-C6 галогеналкокси группа обозначает (C1-C6 галогеналкил)-O- группу, где фрагмент C1-C6 галогеналкильной группы имеет такое же значение, как описано выше.
[0311]
Примеры C1-C6 галогеналкокси группы включают, но ими не ограничиваются,
фторметокси группу, дифторметокси группу, трифторметокси группу, хлордифторметокси группу,
2-фторэтокси группу, 2-хлорэтокси группу, 2,2,2-трифторэтокси группу, пентафторэтокси группу,
3-фторпропокси группу, 3-хлорпропокси группу, 2,2,3,3,3-пентафторпропокси группу, гептафторпропокси группу, 2,2,2-трифтор-1-трифторметилэтокси группу,
4-фторбутокси группу, 2,2,3,3,4,4,4-гептафторбутокси группу,
2,2,3,3,4,4,5,5,5-нонафторпентилокси группу,
2,2,3,3,4,4,5,5,6,6,6-ундекафторгексилокси группу и тому подобное.
[0312]
Примеры алкилтио группы включают, но ими не ограничиваются, C1-C6 алкилтио группу и тому подобное.
[0313]
C1-C6 алкилтио группа обозначает (C1-C6 алкил)-S- группу, где фрагмент C1-C6 алкильной группы имеет такое же значение, как определено выше.
[0314]
Конкретные примеры C1-C6 алкилтио группы включают, но ими не ограничиваются, метилтио группу, этилтио группу, пропилтио группу, изопропилтио группу, бутилтио группу, пентилтио группу, гексилтио группу и тому подобное.
[0315]
Примеры алкилсульфинильной группы включают, но ими не ограничиваются, C1-C6 алкилсульфинильную группу и тому подобное.
[0316]
C1-C6 алкилсульфинильная группа обозначает (C1-C6 алкил)-SO- группу, где фрагмент C1-C6 алкильной группы имеет такое же значение, как определено выше.
[0317]
Конкретные примеры C1-C6 алкилсульфинильной группы включают, но ими не ограничиваются, метилсульфинильную группу, этилсульфинильную группу, пропилсульфинильную группу, изопропилсульфинильную группу, бутилсульфинильную группу, пентилсульфинильную группу, гексильную группу и тому подобное.
[0318]
Примеры алкилсульфонильной группы включают, но ими не ограничиваются, C1-C6 алкилсульфонильную группу и тому подобное.
[0319]
C1-C6 алкилсульфонильная группа обозначает (C1-C6 алкил)-SO2- группу, где фрагмент C1-C6 алкильной группы имеет такое же значение, как определено выше.
[0320]
Конкретные примеры C1-C6 алкилсульфонильной группы включают, но ими не ограничиваются, метилсульфонильную группу, этилсульфонильную группу, пропилсульфонильную группу, изопропилсульфонильную группу, бутилсульфонильную группу, пентилсульфонильную группу, гексилсульфонильную группу и тому подобное.
[0321]
C1-C6 галогеналкилтио группа обозначает (C1-C6 галогеналкил)-S- группу, где фрагмент C1-C6 галогеналкильной группы имеет такое же значение, как описано выше.
[0322]
Примеры C1-C6 галогеналкилтио группы включают, но ими не ограничиваются,
фторметилтио группу, дифторметилтио группу, трифторметилтио группу, хлордифторметилтио группу,
2-фторэтилтио группу, 2-хлорэтилтио группу, 2,2,2-трифторэтилтио группу, пентафторэтилтио группу,
3-фторпропилтио группу, 3-хлорпропилтио группу, 2,2,3,3,3-пентафторпропилтио группу, гептафторпропилтио группу, 2,2,2-трифтор-1-трифторметилэтилтио группу,
4-фторбутилтио группу, 2,2,3,3,4,4,4-гептафторбутилтио группу,
2,2,3,3,4,4,5,5,5-нонафторпентилтио группу,
2,2,3,3,4,4,5,5,6,6,6-ундекафторгексилтио группу и тому подобное.
[0323]
C1-C6 галогеналкилсульфинильная группа обозначает (C1-C6 галогеналкил)-SO- группу, где фрагмент C1-C6 галогеналкильной группы имеет такое же значение, как описано выше.
[0324]
Примеры C1-C6 галогеналкилсульфинильной группы включают, но ими не ограничиваются,
фторметилсульфинильную группу, дифторметилсульфинильную группу, трифторметилсульфинильную группу, хлордифторметилсульфинильную группу,
2-фторэтилсульфинильную группу, 2-хлорэтилсульфинильную группу, 2,2,2-трифторэтилсульфинильную группу, пентафторэтилсульфинильную группу,
3-фторпропилсульфинильную группу, 3-хлорпропилсульфинильную группу, 2,2,3,3,3-пентафторпропилсульфинильную группу, гептафторпропилсульфинильную группу, 2,2,2-трифтор-1-трифторметилэтилсульфинильную группу,
4-фторбутилсульфинильную группу, 2,2,3,3,4,4,4-гептафторбутилсульфинильную группу,
2,2,3,3,4,4,5,5,5-нонафторпентилсульфинильную группу,
2,2,3,3,4,4,5,5,6,6,6-ундекафторгексилсульфинильную группу и тому подобное.
[0325]
C1-C6 галогеналкилсульфонильная группа обозначает (C1-C6 галогеналкил)-SO2- группу, где фрагмент C1-C6 галогеналкильной группы имеет такое же значение, как описано выше.
[0326]
Примеры C1-C6 галогеналкилсульфонильной группы включают, но ими не ограничиваются,
фторметилсульфонильную группу, дифторметилсульфонильную группу, трифторметилсульфонильную группу, хлордифторметилсульфонильную группу,
2-фторэтилсульфонильную группу, 2-хлорэтилсульфонильную группу, 2,2,2-трифторэтилсульфонильную группу, пентафторэтилсульфонильную группу,
3-фторпропилсульфонильную группу, 3-хлорпропилсульфонильную группу, 2,2,3,3,3-пентафторпропилсульфонильную группу, гептафторпропилсульфонильную группу, 2,2,2-трифтор-1-трифторметилэтилсульфонильную группу,
4-фторбутилсульфонильную группу, 2,2,3,3,4,4,4-гептафторбутилсульфонильную группу,
2,2,3,3,4,4,5,5,5-нонафторпентилсульфонильную группу,
2,2,3,3,4,4,5,5,6,6,6-ундекафторгексилсульфонильную группу и тому подобное.
[0327]
Примеры моноалкиламино группы включают, но ими не ограничиваются, моно (C1-C6 алкил) амино группу и тому подобное.
[0328]
Моно (C1-C6 алкил) амино группа обозначает (C1-C6 алкил)-NH- группу, где фрагмент C1-C6 алкильной группы имеет такое же значение, как определено выше.
[0329]
Конкретные примеры моно (C1-C6 алкил) амино группы включают, но ими не ограничиваются, метиламино группу, этиламино группу, пропиламино группу, изопропиламино группу, бутиламино группу, пентиламино группу, гексиламино группа и тому подобное.
[0330]
Примеры диалкиламино группы включают, но ими не ограничиваются, ди(C1-C6 алкил) амино группу и тому подобное.
[0331]
Ди (C1-C6 алкил) амино группа обозначает (C1-C6 алкил)2N- группу, где фрагменты C1-C6 алкильной группы могут быть одинаковыми или различными, и имеет аналогичное значение, описанное выше.
[0332]
Конкретные примеры ди (C1-C6 алкил) амино группы включают, но ими не ограничиваются, диметиламино группу, диэтиламино группу, дипропиламино группу, дибутиламино группу, дипентиламино группу, дигексиламино группу, метилэтиламино группу, метилгексиламино группу и тому подобное.
[0333]
Примеры ацильной группы включают, но ими не ограничиваются,
формильную группу,
C1-C6 ацильную группу, C2-C6 ацильную группу,
C1-C4 ацильную группу, C2-C4 ацильную группу и тому подобное.
[0334]
C1-C6 ацильная группа представляет собой
формильную группу,
алканоильную группу с прямой цепью или неразветвленной цепью, содержащую от 2 до 6 атомов углерода, (то есть, C2-C6 алканоильную группу) или
алкеноильную группу с прямой цепью или неразветвленной цепью, содержащую от 2 до 6 атомов углерода (то есть, C2-C6 алкеноильную группу).
[0335]
C1-C6 ацильная группа представляет собой предпочтительно
формильную группу или
алканоильную группу с прямой цепью или неразветвленной цепью, содержащую от 2 до 6 атомов углерода.
[0336]
C2-C6 ацильная группа представляет собой
алканоильную группу с прямой цепью или неразветвленной цепью, содержащую от 2 до 6 атомов углерода, (то есть, C2-C6 алканоильную группу) или
алкеноильную группу с прямой цепью или неразветвленной цепью, содержащую от 2 до 6 атомов углерода (то есть, C2-C6 алкеноильную группу).
[0337]
C2-C6 ацильная группа представляет собой предпочтительно
алканоильную группу с прямой цепью или неразветвленной цепью, содержащую от 2 до 6 атомов углерода.
[0338]
C1-C4 ацильная группа представляет собой
формильную группу,
алканоильную группу с прямой цепью или неразветвленной цепью, содержащую от 2 до 4 атомов углерода (то есть, C2-C4 алканоильную группу), или
алкеноильную группу с прямой цепью или неразветвленной цепью, содержащую от 2 до 4 атомов углерода (то есть, C2-C4 алкеноильную группу).
[0339]
C1-C4 ацильная группа представляет собой предпочтительно
формильную группу или
алканоильную группу с прямой цепью или неразветвленной цепью, содержащую от 2 до 4 атомов углерода.
[0340]
C2-C4 ацильная группа представляет собой
алканоильную группу с прямой цепью или неразветвленной цепью, содержащую от 2 до 4 атомов углерода (то есть, C2-C4 алканоильную группу) или
алкеноильную группу с прямой цепью или неразветвленной цепью, содержащую от 2 до 4 атомов углерода (то есть, C2-C4 алкеноильную группу).
[0341]
C2-C4 ацильная группа представляет собой предпочтительно
алканоильную группу с прямой цепью или неразветвленной цепью, содержащую от 2 до 4 атомов углерода.
[0342]
Конкретные примеры C2-C6 алканоильной группы включают, но ими не ограничиваются,
ацетильную группу, пропионильную группу, бутирильную группу, изобутирильную группу,
валерильную группу, 2-метилбутаноильную группу, изовалерильную группу, пивалоильную группу,
гексаноильную группу и тому подобное.
[0343]
Конкретные примеры C2-C4 алканоильной группы включают, но ими не ограничиваются, соответствующие примеры в числе вышеуказанных конкретных примеров C2-C6 алканоильной группы.
[0344]
Конкретные примеры C2-C6 алкеноильной группы включают, но ими не ограничиваются,
акрилоильную группу, кротоноильную группу, изокротоноильную группу, метакрилоильную группу и тому подобное.
[0345]
Конкретные примеры C2-C4 алкеноильной группы включают, но ими не ограничиваются, соответствующие примеры в числе вышеуказанных конкретных примеров C2-C6 алкеноильной группы.
[0346]
Примеры ацилокси группы включают, но ими не ограничиваются,
C1-C6 ацилокси группу, C2-C6 ацилокси группу,
C1-C4 ацилокси группу, C2-C4 ацилокси группу и тому подобное.
[0347]
C1-C6 ацилокси группа обозначает (C1-C6 ацил)-O- группу, где фрагмент C1-C6 ацильной группы имеет такое же значение, как определено выше.
[0348]
Конкретные примеры C1-C6 ацилокси группы включают, но ими не ограничиваются,
формилокси группу, ацетилокси группу, пропионилокси группу, бутирилокси группу, изобутирилокси группу,
валерилокси группу, 2-метилбутаноилокси группу, изовалерилокси группу, пивалоилокси группу, гексаноилокси группу,
акрилоилокси группу, кротоноилокси группу, изокротоноилокси группу, метакрилоилокси группа и тому подобное.
[0349]
Предпочтительные конкретные примеры C1-C6 ацилокси группы включают
формилокси группу, ацетилокси группу, пропионилокси группу, бутирилокси группу, изобутирилокси группу,
валерилокси группу, 2-метилбутаноилокси группу, изовалерилокси группу, пивалоилокси группу,
гексаноилокси группу и тому подобное.
[0350]
Более предпочтительные конкретные примеры C1-C6 ацилокси группы включают ацетилокси группу, пропионилокси группу, бутирилокси группу и изобутирилокси группу.
[0351]
Дополнительные предпочтительные конкретные примеры C1-C6 ацилокси группы включают ацетилокси группу.
[0352]
C2-C6 ацилокси группа обозначает (C2-C6 ацил)-O- группу, где фрагмент C2-C6 ацильной группы имеет такое же значение, как определено выше.
[0353]
Конкретные примеры C2-C6 ацилокси группы включают, но ими не ограничиваются, соответствующие примеры в числе вышеуказанных конкретных примеров C1-C6 ацилокси группы.
[0354]
Предпочтительные конкретные примеры C2-C6 ацилокси группы включают соответствующие примеры в числе вышеуказанных предпочтительных конкретных примеров C1-C6 ацилокси группы.
[0355]
Более предпочтительные конкретные примеры C2-C6 ацилокси группы включают соответствующие примеры в числе вышеуказанных более предпочтительные конкретные примеры C1-C6 ацилокси группы.
[0356]
Дополнительные предпочтительные конкретные примеры C2-C6 ацилокси группы включают соответствующие примеры, в числе вышеуказанных дополнительных предпочтительных конкретных примеров C1-C6 ацилокси группы.
[0357]
C1-C4 ацилокси группа обозначает (C1-C4 ацил)-O- группу, где фрагмент C1-C4 ацильной группы имеет такое же значение, как определено выше.
[0358]
Конкретные примеры C1-C4 ацилокси группы включают
формилокси группу, ацетилокси группу, пропионилокси группу, бутирилокси группу, изобутирилокси группу,
акрилоилокси группу, кротоноилокси группу, изокротоноилокси группу и метакрилоилокси группу.
[0359]
Предпочтительные конкретные примеры C1-C4 ацилокси группы включают формилокси группу, ацетилокси группу, пропионилокси группу, бутирилокси группу и изобутирилокси группу.
[0360]
Более предпочтительные конкретные примеры C1-C4 ацилокси группы включают ацетилокси группу.
[0361]
C2-C4 ацилокси группа обозначает (C2-C4 ацил)-O- группу, где фрагмент C1-C4 ацильной группы имеет такое же значение, как определено выше.
[0362]
Конкретные примеры C1-C4 ацилокси группы включают
ацетилокси группу, пропионилокси группу, бутирилокси группу, изобутирилокси группу,
акрилоилокси группу, кротоноилокси группу, изокротоноилокси группу и метакрилоилокси группу.
[0363]
Предпочтительные конкретные примеры C1-C4 ацилокси группы включают ацетилокси группу, пропионилокси группу, бутирилокси группу и изобутирилокси группу.
[0364]
Более предпочтительные конкретные примеры C1-C4 ацилокси группы включают ацетилокси группу.
[0365]
Примеры ациламино группы включают, но ими не ограничиваются, C1-C6 ациламино группу и тому подобное.
[0366]
C1-C6 ациламино группа обозначает амино группу, которая замещена C1-C6 ацильной группой, где фрагмент C1-C6 ацильной группы имеет такое же значение, как определено выше.
[0367]
Конкретные примеры C1-C6 ациламино группы включают, но ими не ограничиваются,
формиламино группу, ацетиламино группу, пропиониламино группу, изопропиониламино группу,
бутириламино группу, изобутириламино группу, валериламино группу, изовалериламино группу, пивалоиламино группу,
гексаноиламино группу,
акрилоиламино группу, кротоноиламино группу, метакрилоиламино группу и тому подобное.
[0368]
Примеры алкоксикарбонильной группы включают, но ими не ограничиваются, C1-C6 алкоксикарбонильную группу и тому подобное.
[0369]
C1-C6 алкоксикарбонильная группа обозначает (C1-C6 алкил)-O-C(=O)- группу, где фрагмент C1-C6 алкильной группы имеет такое же значение, как определено выше.
[0370]
Конкретные примеры C1-C6 алкоксикарбонильной группы включают, но ими не ограничиваются,
метоксикарбонильную группу, этоксикарбонильную группу, пропоксикарбонильную группу, изопропоксикарбонильную группу,
бутоксикарбонильную группу, пентилоксикарбонильную группу, гексилоксикарбонильную группу и тому подобное.
[0371]
Примеры алкоксиимино группы включают, но ими не ограничиваются, C1-C6 алкоксиимино группу и тому подобное.
[0372]
C1-C6 алкоксиимино группа обозначает (C1-C6 алкил)-O-N= группу, где фрагмент C1-C6 алкильной группы имеет такое же значение, как определено выше.
[0373]
Конкретные примеры C1-C6 алкоксиимино группы включают, но ими не ограничиваются,
метоксиимино группу, этоксиимино группу, пропоксиимино группу, изопропоксиимино группу,
бутоксиимино группу, пентилоксиимино группу и гексилоксиимино группу.
[0374]
Примеры моноалкиламинокарбонильной группы включают, но ими не ограничиваются, моно (C1-C6 алкил) аминокарбонильную группу, моно (C1-C4 алкил) аминокарбонильную группу и тому подобное.
[0375]
Моно (C1-C6 алкил) аминокарбонильная группа обозначает (C1-C6 алкил)-NH-C(=O)- группу, где фрагмент C1-C6 алкильной группы имеет такое же значение, как определено выше.
[0376]
Конкретные примеры моно (C1-C6 алкил) аминокарбонильной группы включают, но ими не ограничиваются, N-метиламинокарбонильную группу, N-этиламинокарбонильную группу, N-пропиламинокарбонильную группу, N-изопропиламинокарбонильную группу, N-бутиламинокарбонильную группу, N-пентиламинокарбонильную группу, N-гексиламинокарбонильную группу и тому подобное.
[0377]
Моно (C1-C4 алкил) аминокарбонильная группа обозначает (C1-C4 алкил)-NH-C(=O)- группу, где фрагмент C1-C4 алкильной группы имеет такое же значение, как определено выше.
[0378]
Конкретные примеры моно (C1-C4 алкил) аминокарбонильной группы включают, но ими не ограничиваются, соответствующие примеры в числе вышеуказанных конкретных примеров моно (C1-C6 алкил) аминокарбонильной группы.
[0379]
Примеры диалкиламинокарбонильной группы включают, но ими не ограничиваются, ди(C1-C6 алкил) аминокарбонильную группу, ди(C1-C4 алкил) аминокарбонильную группу и тому подобное.
[0380]
Ди (C1-C6 алкил) аминокарбонильная группа обозначает (C1-C6 алкил)2N-C(=O)- группу, где фрагменты C1-C6 алкильной группы могут быть одинаковыми или различными, и имеют аналогичное значение, описанное выше.
[0381]
Конкретные примеры (C1-C6 алкил) аминокарбонильной группы включают, но ими не ограничиваются, N,N-диметиламинокарбонильную группу, N,N-диэтиламинокарбонильную группу, N,N-дипропиламинокарбонильную группу, N,N-дибутиламинокарбонильную группу, N,N-дипентиламинокарбонильную группу, N,N-дигексиламинокарбонильную группу, N,N-метилэтиламинокарбонильную группу, N,N-метилгексиламинокарбонильную группу и тому подобное.
[0382]
Ди (C1-C4 алкил) аминокарбонильная группа обозначает (C1-C4 алкил)2N-C(=O)- группу, где фрагменты C1-C4 алкильной группы могут быть одинаковыми или различными, и имеют аналогичное значение, описанное выше.
[0383]
Конкретные примеры ди (C1-C4 алкил) аминокарбонильной группы включают, но ими не ограничиваются, соответствующие примеры в числе вышеуказанных конкретных примеров ди (C1-C6 алкил) аминокарбонильной группы.
[0384]
Примеры арильной группы включают, но ими не ограничиваются, C6-C10 арильную группу и тому подобное.
[0385]
C6-C10 арильная группа обозначает арильную группу, содержащую 6-10 атомов углерода.
[0386]
Конкретными примерами C6-C10 арильной группы являются фенильная группа, 1-нафтильная группа и 2-нафтильная группа. 1-Нафтильная группа также называется нафталин-1-ильной группой. 2-Нафтильная группа также называется нафталин-2-ильной группой.
[0387]
C6-C10 арилокси группа обозначает (C6-C10 арил)-O- группу, где фрагмент C6-C10 арильной группы имеет такое же значение, как определено выше.
[0388]
Конкретными примерами C6-C10 арилокси группы являются фенокси группа, нафталин-1-илокси группа и нафталин-2-илокси группа.
[0389]
Примеры арилалкильной группы включают, но ими не ограничиваются, C6-C10 арил C1-C4 алкильную группу, C6-C10 арил C1-C2 алкильную группу, фенил C1-C2 алкильную группу и тому подобное.
Арилалкильная группа также называется аралкильной группой.
[0390]
C6-C10 арил C1-C4 алкильная группа обозначает C1-C4 алкильную группу, которая замещена C6-10 арильной группой, где фрагмент C6-C10 арильной группы и фрагмент C1-C4 алкильной группы имеют аналогичное значение, описанное выше.
[0391]
Конкретные примеры C6-C10 арил C1-C4 алкильной группы включают, но ими не ограничиваются, бензильную группу, 1-фенилэтильную группу, 2-фенилэтильную группу, 3-фенилпропильную группу, 4-фенилбутильную группу, нафталин-1-илметильную группу, нафталин-2-илметильную группу и тому подобное.
[0392]
C6-C10 арил C1-C2 алкильная группа обозначает C1-C2 алкильную группу, которая замещена C6-10 арильной группой, где фрагмент C6- C10 арильной группы и фрагмент C1-C2 алкильной группы имеют аналогичное значение, описанное выше.
[0393]
Конкретные примеры C6-C10 арил C1-C2 алкильной группы включают, но ими не ограничиваются, соответствующие примеры в числе вышеуказанных конкретных примеров C6-C10 арил C1-C4 алкильной группы.
[0394]
Фенил C1-C2 алкильная группа обозначает C1-C2 алкильную группу, которая замещена фенильной группой, где фрагмент C1-C2 алкильной группы имеет такое же значение, как определено выше.
[0395]
Конкретные примеры фенил C1-C2 алкильной группы представляют собой соответствующие примеры в числе вышеуказанных конкретных примеров C6-C10 арил C1-C4 алкильной группы.
[0396]
В настоящем описании, гетероциклическая группа обозначает циклическую группу, содержащую один или несколько одинаковых или различных гетероатомов (например, атом азота, атом кислорода и/или атом серы) вместо одного или нескольких атомов углерода, которая является ароматической или неароматической, и является моноциклической или полициклической.
[0397]
В одном из вариантов осуществления, примеры гетероциклической группы включают, но ими не ограничиваются, 3-14-членную (предпочтительно 4-14-членную, более предпочтительно 5-14-членную) гетероциклическую группу, содержащую от 1 до 13 атомов углерода и от 1 до 4 гетероатомов, выбранных независимо из атома азота, атома кислорода и атома серы, которая является ароматической или неароматической, и является моноциклической, бициклической или трициклической.
[0398]
В другом варианте осуществления, примеры гетероциклической группы включают, но ими не ограничиваются, 3-10-членную (предпочтительно 4-10-членную, более предпочтительно 5-10-членную, еще более предпочтительно 5-7-членную) гетероциклическую группу, содержащую от 1 до 9 атомов углерода и от 1 до 4 гетероатомов, выбранных независимо из атома азота, атома кислорода и атома серы, которая является ароматической или неароматической, и является моноциклической или бициклической.
[0399]
В еще одном варианте осуществления, примеры гетероциклической группы включают, но ими не ограничиваются, 4-8-членную (предпочтительно 5-6-членную) гетероциклическую группу, содержащую от 1 до 5 атомов углерода и от 1 до 4 гетероатомов, выбранных независимо из атома азота, атома кислорода и атома серы, которая является ароматической или неароматической, и является моноциклической.
[0400]
Конкретные примеры моноциклической гетероциклической группы включают, но ими не ограничиваются,
пирролильную группу, фурильную группу, тиенильную группу,
пиразолильную группу, имидазолильную группу, оксазолильную группу, изоксазолильную группу, тиазолильную группу, изотиазолильную группу,
триазолильную группу, оксадиазолильную группу (например, 1,2,4-оксадиазолильную группу, 1,2,5-оксадиазолильную группу и тому подобное), тиадиазолильную группу (например, 1,2,3-тиадиазолильную группу, 1,3,4-тиадиазолильную группу и тому подобное),
тетразолильную группу,
пиридильную группу, пиридазинильную группу, пиримидильную группу, пиразинильную группу, триазинильную группу (например, 1,3,5-триазинильную группу и тому подобное),
пиперидинильную группу, пиперазинильную группу, морфолинильную группу и тому подобное.
[0401]
Конкретные примеры бициклической гетероциклической группы включают, но ими не ограничиваются,
индолильную группу, изоиндолильную группу, индолизинильную группу, бензофурильную группу, бензотиенильную группу, бензимидазолильную группу, индазолильную группу, бензоксазолильную группу, бензизоксазолильную группу, бензотиазолильную группу, бензизотиазолильную группу,
хинолильную группу, изохинолильную группу, хинолизинильную группу,
циннолинильную группу, хиноксалинильную группу, хиназолинильную группу, фталазинильную группу, нафтиридинильную группу (например, 1,5-нафтиридинильную группу, 1,6-нафтиридинильную группу, 1,7-нафтиридинильную группу, 1,8-нафтиридинильную группу, 2,6-нафтиридинильную группу и 2,7-нафтиридинильную группу),
индолинильную группу, изоиндолинильную группу,
хроманильную группу, изохроманильную группу, кумаринильную группу, изокумаринильную группу,
бензотриазинильную группу, тетрагидроизохинолинильную группу, пиридопиридильную группу, пиридопиразильную группу, изобензотиенильную группу, бензотетрагидрофурильную группу, бензотетрагидротиенильную группу, изобензотетрагидрофурильную группу, изобензотетрагидротиенильную группу, пуринильную группу, бензодиоксолильную группу, феноксазинильную группу, фенотиазинильную группу, птеридинильную группу, оксазолопиридильную группу, имидазопиридильную группу, имидазотиазолильную группу, дигидробензизоксазинильную группу, бензоксазинильную группу, бензизоксазинильную группу, дигидробензизотиазинильную группу, бензопиранильную группу, бензотиопиранильную группу, хромонильную группу, хроманонильную группу, пиридил-N-оксид тетрагидрохинолинильную группу, дигидрохинолинильную группу, дигидрохинолиноильную группу, дигидроизохинолиноильную группу, дигидрокумаринильную группу, дигидроизокумаринильную группу, изоиндолинонильную группу, бензодиоксанильную группу, бензоксазолинонильную группу и тому подобное.
[0402]
Конкретные примеры трициклической гетероциклической группы включают, но ими не ограничиваются, карбозолильную группу, β-карболинильную группу, акридинильную группу, фенантридинильную группу, фенантролинильную группу (например, 4,7-фенантролинильную группу, 1,10-фенантролинильную группу и тому подобное) и феназинильную группу.
[0403]
Предпочтительные конкретные примеры гетероциклической группы включают
пирролильную группу, фурильную группу, тиенильную группу,
пиразолильную группу, имидазолильную группу, оксазолильную группу, изоксазолильную группу, тиазолильную группу, изотиазолильную группу,
триазолильную группу, оксадиазолильную группу, тиадиазолильную группу,
тетразолильную группу,
пиридильную группу, пиридазинильную группу, пиримидильную группу, пиразинильную группу, триазинильную группу,
индолильную группу, бензофурильную группу, бензотиенильную группу, бензимидазолильную группу, индазолильную группу, бензоксазолильную группу, бензизоксазолильную группу, бензoтиазолильную группу, бензизотиазолильную группу,
хинолильную группу и изохинолильную группу.
[0404]
Более предпочтительные конкретные примеры гетероциклической группы включают
пирролильную группу, тиенильную группу,
пиразолильную группу, имидазолильную группу, оксазолильную группу, изоксазолильную группу, тиазолильную группу, изотиазолильную группу,
триазолильную группу,
пиридильную группу, пиридазинильную группу, пиримидильную группу, пиразинильную группу и триазинильную группу.
[0405]
Дополнительные предпочтительные конкретные примеры гетероциклической группы включают тиенильную группу, пиразолильную группу, имидазолильную группу, тиазолильную группу, изотиазолильную группу, пиридильную группу и пиримидильную группу.
[0406]
Дополнительные предпочтительные конкретные примеры гетероциклической группы включают тиенильную группу, пиразолильную группу и пиридильную группу.
[0407]
Особенно предпочтительные конкретные примеры гетероциклической группы включают пиразолильную группу и пиридильную группу.
[0408]
В этом контексте, нет каких-либо конкретных ограничений в отношении положения замещения. То есть, гетероциклическая группа включает все свои позиционные изомеры. Например, когда гетероциклическая группа представляет собой пиридильную группу, пиридильная группа включает 2-пиридильную группу, 3-пиридильную группу и 4-пиридильную группу.
[0409]
Гетероциклическая группа, определенная выше или примеры которой приведены выше, может включать неконденсированную циклическую группу (например, моноциклическую группу или спироциклическую группу) и конденсированную циклическую группу, по возможности.
[0410]
Гетероциклическая группа, определенная выше или примеры которой приведены выше, может быть ненасыщенной, частично насыщенной или насыщенной, по возможности.
[0411]
Гетероциклическая группа, определенная выше или примеры которой приведены выше, также обозначается в настоящем документе как гетероциклильная группа.
[0412]
Когда гетероатом в гетероциклической группе, определенной выше, или примеры которой приведены выше, представляет собой атом азота, атом азота может представлять собой N-оксидную группу.
[0413]
Когда гетероатом в гетероциклической группе, определенной выше, или примеры которой приведены выше, представляет собой атом серы, атом серы может представлять собой сульфинильную группу (-SO- группу) или сульфонильную группу (-SO2- группу).
[0414]
В настоящем описании, гетероциклическое кольцо представляет собой кольцо, которое соответствует гетероциклической группе, определенной выше или примеры которой приведены выше.
[0415]
В настоящем документе отсутствуют какие-либо конкретные ограничения в отношении "заместителей" в фразе "может иметь один или несколько заместителей" до тех пор, как они являются химически приемлемыми и обеспечивают эффекты по настоящему изобретению, которые будут продемонстрированы.
[0416]
В настоящем документе примеры "одного или нескольких заместителей" в фразе "может иметь один или несколько заместителей", включают, но ими не ограничиваются, один или несколько заместителей (предпочтительно от 1 до 4 заместителей), выбранных независимо из группы заместителей (а).
[0417]
Группа заместителей (a) представляет собой группу, содержащую
атом галогена, нитрогруппу, циано группу,
C1-C6 алкильную группу (предпочтительно C1-C4 алкильную группу),
C2-C6 алкенильную группу (предпочтительно C2-C4 алкенильную группу),
C2-C6 алкинильную группу (предпочтительно C2-C4 алкинильную группу),
C3-C8 циклоалкильную группу (предпочтительно C3-C6 циклоалкильную группу),
C1-C6 галогеналкильную группу (предпочтительно C1-C4 галогеналкильную группу),
гидрокси группу,
C1-C6 алкокси группу (предпочтительно C1-C4 алкокси группу),
C1-C6 галогеналкокси группу (предпочтительно C1-C4 галогеналкокси группу),
C1-C6 алкилтио группу (предпочтительно C1-C4 алкилтио группу), C1-C6 алкилсульфинильную группу (предпочтительно C1-C4 алкилсульфинильную группу), C1-C6 алкилсульфонильную группу (предпочтительно C1-C4 алкилсульфонильную группу),
C1-C6 галогеналкилтио группу (предпочтительно C1-C4 галогеналкилтио группу), C1-C6 галогеналкилсульфинильную группу (предпочтительно C1-C4 галогеналкилсульфинильную группу), C1-C6 галогеналкилсульфонильную группу (предпочтительно C1-C4 галогеналкилсульфонильную группу),
амино группу, моно (C1-C6 алкил) амино группу (предпочтительно моно (C1-C4 алкил) амино группу), ди(C1-C6 алкил) амино группу (предпочтительно ди(C1-C4 алкил) амино группу),
C1-C6 ациламино группу (предпочтительно C1-C4 ациламино группу),
формильную группу, C2-C6 ацильную группу (предпочтительно C2-C4 ацильную группу),
C1-C6 алкоксикарбонильную группу (предпочтительно C1-C4 алкоксикарбонильную группу),
моно (C1-C6 алкил) аминокарбонильную группу (предпочтительно моно (C1-C4 алкил) аминокарбонильную группу), ди(C1-C6 алкил) аминокарбонильную группу (предпочтительно ди(C1-C4 алкил) аминокарбонильную группу),
C6-C10 арильную группу (предпочтительно фенильную группу),
C6-C10 арилокси группу (предпочтительно фенокси группу),
C6-C10 арил C1-C4 алкильную группу (предпочтительно фенил C1-C2 алкильную группу), и
гетероциклическую группу, где гетероциклическая группа представляет собой 5-10-членную гетероциклическую группу, содержащую от 1 до 9 атомов углерода и от 1 до 4 гетероатомов, независимо выбранных из атома азота, атома кислорода и атома серы,
и тому подобное.
[0418]
Кроме того, один или несколько заместителей (предпочтительно от одного до четырех заместителей, независимо друг от друга), выбранных из группы заместителей (а), каждый независимо может иметь один или несколько заместителей (предпочтительно от одного до четырех заместителей, независимо друг от друга), выбранных из группы заместителей (b).
[0419]
В этом контексте, группа заместителей (b) аналогична группе заместителей (a).
[0420]
Примеры моновалентного аниона включают, но ими не ограничиваются, любой из галогенид-ионов, борат-ионов, фосфат-ионов, антимонат-ионов, карбоксилат-ионов, сульфонат-ионов, сульфат-ионов, карбонат-ионов, нитрат-ионов и амид-ионов и тому подобное.
[0421]
Примеры галогенид-ионов включают, но ими не ограничиваются, F- (фторид-ион), Cl- (хлорид-ион), Br- (бромид-ион), I- (иодид-ион) и тому подобное.
[0422]
Примеры борат-ионов включают, но ими не ограничиваются, BF4- (тетрафторборат-ион), C6H5BF3- (фенилтрифторборат-ион) и тому подобное.
[0423]
Примеры фосфат-ионов включают, но ими не ограничиваются, PF6- (гексафторфосфат-ион) и тому подобное.
[0424]
Примеры антимонат-ионов включают, но ими не ограничиваются, SbF6- (гексафторантимонат-ион) и тому подобное.
[0425]
Примеры карбоксилат-ионов включают, но ими не ограничиваются, CH3CO2- (ацетат-ион), CF3CO2- (трифторацетат-ион), C2F5CO2- (пентафторпропионат-ион) и тому подобное.
[0426]
Примеры сульфонат-ионов включают, но ими не ограничиваются, CH3SO3- (метансульфонат-ион), C2H5SO3- (этансульфонат-ион), CF3SO3- (трифторметансульфонат-ион), C6H5SO3- (бензолсульфонат-ион), 4-CH3-C6H4SO3- (п-толуолсульфонат-ион), 4-Cl-C6H4SO3- (p-хлорбензолсульфонат-ион), 4-NO2-C6H4SO3- (p-нитробензолсульфонат-ион) и тому подобное.
[0427]
Примеры сульфат-ионов включают, но ими не ограничиваются, HOSO3- (бисульфат-ион), CH3OSO3- (метил сульфат-ион), C2H5OSO3- (этил сульфат-ион), C3H7OSO3- (пропил сульфат-ион), изо-C3H7OSO3- (изопропил сульфат-ион), C4H9OSO3- (бутил сульфат-ион), C6H5OSO3- (фенил сульфат-ион) и тому подобное.
[0428]
Примеры карбонат-ионов включают, но ими не ограничиваются, HCO3- (бикарбонат-ион), CH3OCO2- (метилкарбонат-ион) и тому подобное.
[0429]
Примеры нитрат-ионов включают, но ими не ограничиваются, NO3- (нитрат ион) и тому подобное.
[0430]
Примеры амид-ионов включают, но ими не ограничиваются, (CN)2N- (дицианамид-ион или дицианоамин-ион), (CF3SO2)2N- (бис(трифторметилсульфонил)амид-анион) и тому подобное.
[0431]
Примеры неорганических оснований включают, но ими не ограничиваются,
гидроксиды щелочных металлов, гидроксиды щелочно-земельных металлов,
карбонаты щелочных металлов, карбонаты щелочно-земельных металлов, бикарбонаты щелочных металлов, бикарбонаты щелочно-земельных металлов,
фосфаты щелочных металлов, фосфаты щелочно-земельных металлов, дифосфаты щелочных металлов, дифосфаты щелочно-земельных металлов,
гидриды щелочных металлов, гидриды щелочно-земельных металлов и тому подобное.
[0432]
Примеры гидроксидов щелочных металлов включают гидроксид лития, гидроксид натрия, гидроксид калия и тому подобное.
[0433]
Примеры гидроксидов щелочно-земельных металлов включают гидроксид магния, гидроксид кальция, гидроксид бария и тому подобное.
[0434]
Примеры карбонатов щелочных металлов включают карбонат лития, карбонат натрия, карбонат калия, карбонат цезия и тому подобное.
[0435]
Примеры карбонатов щелочно-земельных металлов включают карбонат магния, карбонат кальция, карбонат бария и тому подобное.
[0436]
Примеры щелочных металлов бикарбонаты включают бикарбонаты лития, бикарбонаты натрия, бикарбонаты калия, бикарбонат цезия и тому подобное.
[0437]
Примеры бикарбонатов щелочно-земельных металлов включают бикарбонат магния, бикарбонат кальция, бикарбонат бария и тому подобное.
[0438]
Примеры фосфата включают фосфаты щелочных металлов, фосфаты щелочно-земельных металлов и тому подобное.
[0439]
Примеры фосфатов щелочных металлов включают фосфат натрия, фосфат калия и тому подобное.
[0440]
Примеры фосфатов щелочно-земельных металлов включают фосфат кальция и тому подобное.
[0441]
Примеры дифосфатов щелочных металлов включают дифосфат натрия, дифосфат калия и тому подобное.
[0442]
Примеры дифосфатов щелочно-земельных металлов включают дифосфат кальция и тому подобное.
[0443]
Примеры гидридов металлов включают гидриды щелочных металлов, гидриды щелочно-земельных металлов и тому подобное.
[0444]
Примеры гидридов щелочных металлов включают гидрид лития, гидрид натрия, гидрид калия и тому подобное.
[0445]
Примеры гидридов щелочно-земельных металлов включают гидрид кальция и тому подобное.
[0446]
Примеры органических оснований включают, но ими не ограничиваются, пиридины, хинолины, изохинолины, третичные амины, вторичные амины, первичные амины, ароматические амины, циклические амины и тому подобное.
[0447]
Примеры пиридинов включают пиридин, 4-(диметиламино)пиридин, 4-пирролидинопиридин, 2,6-лутидин и тому подобное.
[0448]
Примеры хинолинов включают хинолин, 2-метилхинолин, 3-метилхинолин, 4-метилхинолин и тому подобное.
[0449]
Примеры изохинолинов включают изохинолин, 1-метилизохинолин и тому подобное.
[0450]
Примеры третичных аминов включают триметиламин, триэтиламин, трибутиламин, диизопропилэтиламин, триизопропиламин и тому подобное.
[0451]
Примеры вторичных аминов включают диэтиламин, дипропиламин, диизопропиламин и тому подобное.
[0452]
Примеры первичных аминов включают пропиламин, бутиламин и тому подобное.
[0453]
Примеры ароматических аминов включают анилин, N,N-диэтиланилин, N,N-диметиланилин и тому подобное.
[0454]
Примеры циклических аминов включают пирролидин, пиперидин, морфолин, N-метилморфолин, пиперазин, 1,8-диазабицикло[5.4.0]-7-ундец-7-ен (DBU), 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,4-диазабицикло[2.2.2]октан (DABCO) и тому подобное.
[0455]
Примеры алкоксида металла включают алкоксиды щелочных металлов, алкоксиды щелочно-земельных металлов и тому подобное.
[0456]
Примеры алкоксидов щелочных металлов включают метоксид натрия, этоксид натрия, трет-бутоксид натрия, трет-бутоксид калия и тому подобное.
[0457]
Примеры алкоксидов щелочно-земельных металлов включают этоксид магния и тому подобное.
[0458]
Примеры карбоксилата включают соли щелочных металлов карбоновой кислоты, соли щелочно-земельных металлов карбоновой кислоты и тому подобное.
[0459]
Примеры солей щелочных металлов карбоновой кислоты включают соли щелочных металлов муравьиной кислоты (например, формиат натрия, формиат калия и тому подобное), соли щелочных металлов уксусной кислоты (например, ацетат лития, ацетат натрия, ацетат калия и тому подобное), соли щелочных металлов пропионовой кислоты (например, пропионат натрия, пропионат калия и тому подобное) и тому подобное.
[0460]
Примеры солей щелочно-земельных металлов карбоновой кислоты включают соли щелочно-земельных металлов уксусной кислоты (например, ацетат магния, ацетат кальция и тому подобное), соли щелочно-земельных металлов пропионовой кислоты (например, пропионат магния, пропионат кальция и тому подобное) и тому подобное.
[0461]
Примеры цианида включают цианиды щелочных металлов и тому подобное.
[0462]
Примеры цианидов щелочных металлов включают цианид калия, цианид натрия и тому подобное.
[0463]
Примеры фторида включают фториды щелочных металлов, фториды четвертичного аммония и тому подобное.
[0464]
Примеры фторидов щелочных металлов включают фторид натрия, фторид калия и тому подобное.
[0465]
Примеры фторидов четвертичного аммония включают фторид тетрабутиламмония и тому подобное.
[0466]
Примеры силаноильной соли включают силанолаты щелочных металлов и тому подобное.
[0467]
Примеры силанолатов щелочных металлов включают триметилсиланолат натрия, триметилсиланолат калия и тому подобное.
[0468]
Примеры амидов включают N,N-диметилформамид (ДМФ), N,N-диэтилформамид, N,N-диметилацетамид (DMAC), N,N-диэтилацетамид, N-метилпирролидон (NMP) и тому подобное.
[0469]
Примеры алкилмочевин включают тетраметилмочевину, N,N'-диметилимидазолидинон (DMI) и тому подобное.
[0470]
Примеры сульфоксидов включают диметилсульфоксид (ДМСО) и тому подобное.
[0471]
Примеры сульфонов включают сульфолан, диметилсульфон и тому подобное.
[0472]
Примеры эфиров включают тетрагидрофуран (ТГФ), 2-метилтетрагидрофуран, 1,4-диоксан, диэтиловый эфир, дипропиловый эфир, диизопропиловый эфир, дибутиловый эфир, ди-трет-бутиловый эфир, циклопентил метиловый эфир (CPME), метил-трет-бутиловый эфир, 1,2-диметоксиэтан (DME), диглим, триглим, дифениловый эфир и тому подобное.
[0473]
Примеры кетонов включают ацетон, этилметилкетон, изопропилметилкетон, изобутилметилкетон (MIBK) циклогексанон и тому подобное.
[0474]
Примеры эфиров карбоновой кислоты включают метил ацетат, этилацетат, пропил ацетат, бутил ацетат и тому подобное.
[0475]
Примеры нитрилов включают ацетонитрил и тому подобное.
[0476]
Примеры спиртов включают метанол, этанол, пропанол, 2-пропанол, бутанол, этиленгликоль и тому подобное.
[0477]
Примеры карбоновых кислот включают муравьиную кислоту, уксусную кислоту, пропионовую кислоту и тому подобное.
[0478]
Примеры производных ароматических углеводородов включают
бензол, толуол, ксилол, триметилбензол,
метилнафталин, диметилнафталин,
хлорбензол, дихлорбензол, трихлорбензол,
нитробензол и тому подобное
предпочтительно толуол, ксилол, хлорбензол и дихлорбензол,
более предпочтительно толуол, ксилол и хлорбензол,
еще более предпочтительно толуол.
В этом контексте, соединение, содержащее изомеры включает все изомеры и любые их смеси в любом соотношении.
Например, ксилол включает oрто-ксилол, мета-ксилол, пара-ксилол и любые их смеси в любом соотношении.
Например, дихлорбензол включает o-дихлорбензол, м-дихлорбензол, п-дихлорбензол и любые их смеси в любом соотношении.
[0479]
Примеры ароматических гетероциклических колец в качестве растворителей включают пиридин и тому подобное.
[0480]
Примеры алифатических углеводородов включают
гексан, октан, декан, гексадекан, изогексадекан,
циклогексан, этилциклогексан, декалин, метилдекалин и тому подобное.
[0481]
Примеры галогенированных алифатических углеводородов включают дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан и тому подобное,
предпочтительно дихлорметан.
[0482]
(фторалкилирующий агент, представленный общей формулой (1))
Фторалкилирующий агент, представленное общей формулой (1), по настоящему изобретению будет описано ниже. Соединение, представленное общей формулой (1A), представляет собой новое соединение. Описание соединения, представленного общей формулой (1А), соответствует описанию фторалкилирующего агента, представленного общей формулой (1), за исключением условий в отношении R1, R2, R3, Y1, Y2, Y3, Y4 и X-.
[0483]
Фторалкилирующий агент по настоящему изобретению представляет собой соединение, представленное общей формулой (1):
[0484]
[Химическая формула 30]
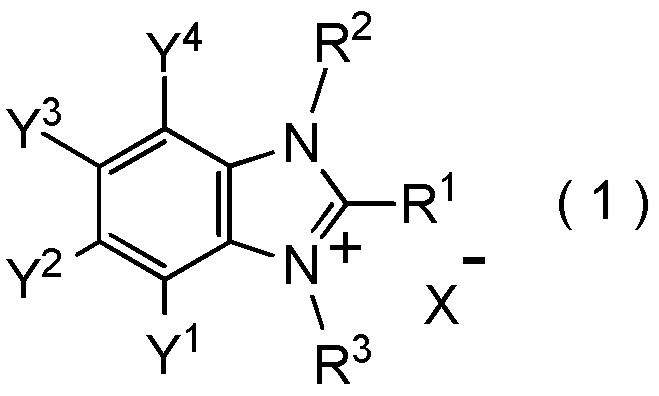
где R1, R2, R3, Y1, Y2, Y3, Y4 и X- являются такими, как описано ниже.
[0485]
Соединение, представленное общей формулой (1), может иметь таутомеры, показанные ниже. Каждый из них и их смесь включены в объем настоящего изобретения. То есть, соединение, представленное следующей общей формулой (1), представляет собой эквивалент соединения, представленного следующей общей формулой (1').
[0486]
[Химическая формула 31]
где R1, R2, R3, Y1, Y2, Y3, Y4 и X- являются такими, как описано ниже.
[0487]
В настоящем описании, цифры, показывающие положения заместителей, представлены следующим образом.
[Химическая формула 32]
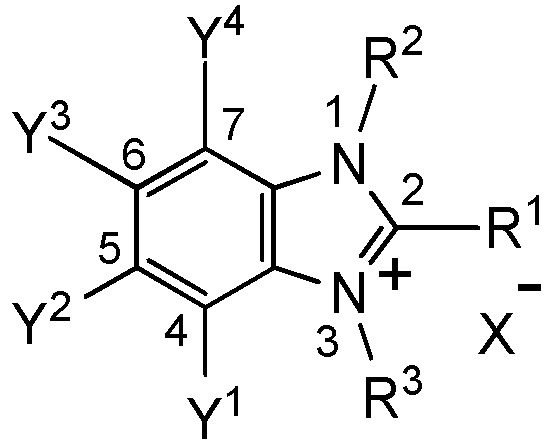
[0488]
Настоящее изобретение также включает соединение по настоящему изобретению в любой изомерной форме и в любой изомерной смеси.
[0489]
Примеры R1 в общей формуле (1) по настоящему изобретению включают, но ими не ограничиваются, C1-C8 фторалкильную группу.
[0490]
С учетом факторов, таких как применимость фторалкилирующего агента, представленного общей формулой (1), экономической эффективности и тому подобное, предпочтительные примеры R1 включают
C1-C8 перфторалкильную группу,
более предпочтительно C1-C4 перфторалкильную группу,
еще более предпочтительно трифторметильную группу и пентафторэтильную группу, особенно предпочтительно трифторметильную группу.
[0491]
Примеры R2 и R3 в общей формуле (1) по настоящему изобретению включают, но ими не ограничиваются,
C1-C12 алкильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкенильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкинильную группу, которая может содержать один или несколько заместителей,
C3-C8 циклоалкильную группу, которая может содержать один или несколько заместителей, и
C6-C10 арильную группу, которая может содержать один или несколько заместителей. В этом контексте, R2 и R3 могут быть одинаковыми или различными.
[0492]
С учетом факторов, таких как применимость фторалкилирующего агента, представленного общей формулой (1), экономической эффективности и тому подобное, предпочтительные примеры R2 и R3 включают
C1-C6 алкильную группу,
фенильную группу, где фенильная группа может иметь от 1 до 5 заместителей, независимо выбранных из атома галогена, нитрогруппы, циано группы, C1-C6 алкильной группы, C1-C6 галогеналкильной группы, C2-C6 ацильной группы и C1-C6 алкоксикарбонильной группы, и
фенил C1-C2 алкильную группу, где фрагмент фенильной группы может содержать от 1 до 5 заместителей, выбранных независимо из атома галогена, C1-C6 алкильной группы и C1-C6 галогеналкильной группы. В этом контексте, R2 и R3 могут быть одинаковыми или различными.
[0493]
Более предпочтительные примеры R2 и R3 включают C1-C4 алкильную группу и фенильную группу. В этом контексте, R2 и R3 могут быть одинаковыми или различными.
[0494]
Дополнительные предпочтительные примеры R2 и R3 включают метильную группу, этильную группу и фенильную группу. В этом контексте, R2 и R3 могут быть одинаковыми или различными.
[0495]
Особенно предпочтительные примеры R2 и R3 включают метильную группу. В этом контексте, R2 и R3 могут быть одинаковыми или различными.
[0496]
Примеры Y1, Y2, Y3 и Y4 в общей формуле (1) по настоящему изобретению включают, но ими не ограничиваются,
атом водорода, атом галогена, нитрогруппу, цианогруппу,
C1-C12 алкильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкенильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкинильную группу, которая может содержать один или несколько заместителей,
C3-C8 циклоалкильную группу, которая может содержать один или несколько заместителей,
гидрокси группу,
C1-C6 алкокси группу,
C1-C6 алкилтио группу, C1-C6 алкилсульфинильную группу, C1-C6 алкилсульфонильную группу,
амино группу, моно (C1-C6 алкил) амино группу, ди(C1-C6 алкил) амино группу,
C1-C6 ациламино группу,
формильную группу, C2-C6 ацильную группу,
C1-C6 алкоксикарбонильную группу,
C6-C10 арильную группу, которая может содержать один или несколько заместителей, и
гетероциклическую группу, которая может содержать один или несколько заместителей, где гетероциклическая группа представляет собой 5-10-членную гетероциклическую группу, содержащую от 1 до 9 атомов углерода и от 1 до 4 гетероатомов, независимо выбранных из атома азота, атома кислорода и атома серы, и
4-8-членное карбоциклическое кольцо или 4-8-членное гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, выбранных независимо из атома кислорода, атома серы и атома азота, которое образовано двумя смежными заместителями Y1 и Y2, Y2 и Y3, или Y3 и Y4, вместе с атомами углерода, к которым эти заместители присоединены, где образованное кольцо может иметь один или несколько заместителей.
[0497]
С учетом факторов, таких как применимость фторалкилирующего агента, представленного общей формулой (1), экономическая эффективность и тому подобное, предпочтительные примеры Y1, Y2, Y3 и Y4 включают
атом водорода, атом галогена, нитрогруппу, цианогруппу,
C1-C12 алкильную группу, C1-C6 галогеналкильную группу,
C1-C6 алкилтио группу, C1-C6 алкилсульфинильную группу, C1-C6 алкилсульфонильную группу,
C2-C6 ацильную группу,
C1-C6 алкоксикарбонильную группу,
фенильную группу и
пиридильную группу. В этом контексте, Y1, Y2, Y3 и Y4 могут быть одинаковыми или различными.
[0498]
Более предпочтительные примеры Y1, Y2, Y3 и Y4 включают атом водорода, атом галогена, нитрогруппу, цианогруппу, C1-C4 алкильную группу и C1-C4 галогеналкильную группу. В этом контексте, Y1, Y2, Y3 и Y4 могут быть одинаковыми или различными.
[0499]
Дополнительные предпочтительные примеры Y1, Y2, Y3 и Y4 включают атом водорода, атом хлора и нитрогруппу. В этом контексте, Y1, Y2, Y3 и Y4 могут быть одинаковыми или различными.
[0500]
Особенно предпочтительные примеры Y1, Y2, Y3 и Y4 включают
сочетание, в котором Y1, Y2, Y3 и Y4 представляют собой, каждый, атом водорода;
сочетание, в котором Y1, Y3 и Y4 представляют собой, каждый, атом водорода, и Y2 представляет собой атом хлора;
сочетание, в котором Y1, Y3 и Y4 представляют собой, каждый, атом водорода, и Y2 представляет собой нитро группу; и
сочетание, в котором Y1, Y2, Y3 и Y4 представляют собой, каждый, атом хлора.
[0501]
Примеры X- в общей формуле (1) по настоящему изобретению включают, но им не ограничиваются, моновалентный анион.
[0502]
С учетом факторов, таких как применимость фторалкилирующего агента, представленного общей формулой (1), экономической эффективности и тому подобное, предпочтительные примеры X- включают галогенид-ионы, борат-ионы, фосфат-ионы, антимонат-ионы, карбоксилат-ионы, сульфонат-ионы, сульфат-ионы, карбонат-ионы, нитрат-ионы и амид-ионы.
[0503]
Более предпочтительные примеры X- включают
F-, Cl-, Br-, I-,
BF4-, C6H5BF3-,
PF6-,
SbF6-,
CH3CO2-, CF3CO2-, C2F5CO2-,
CH3SO3-, C2H5SO3-, CF3SO3-, C6H5SO3-, 4-CH3-C6H4SO3-, 4-Cl-C6H4SO3-, 4-NO2-C6H4SO3-,
HOSO3-, CH3OSO3-, C2H5OSO3-, C3H7OSO3-, изо-C3H7OSO3-, C4H9OSO3-, C6H5OSO3-,
HCO3-, CH3OCO2-
NO3-,
(CN)2N- и (CF3SO2)2N-.
[0504]
Дополнительные предпочтительные примеры X- включают
F-, Cl-, Br-, I-,
BF4-,
CH3CO2-, CF3CO2-,
CH3SO3-, CF3SO3-,
HOSO3-, CH3OSO3- и C2H5OSO3-.
[0505]
Дополнительные предпочтительные примеры X- включают
Cl-, Br-, I-,
BF4-,
CF3SO3-,
CH3OSO3- и C2H5OSO3-.
[0506]
Дополнительные предпочтительные примеры X- включают
I-,
BF4-,
CF3SO3-,
CH3OSO3- и C2H5OSO3-.
[0507]
Особенно предпочтительные примеры X- включают CH3OSO3-.
[0508]
В одном из вариантов осуществления, конкретные примеры соединения, представленного общей формулой (1), в качестве фторалкилирующего агента включают, но ими не ограничиваются, соединения, представленные в таблицах 1-18 ниже. Номера соединений в следующих таблицах 1-18 приведены в настоящем документе.
[0509]
[таблица 1]
|
[0510]
[таблица 2]
|
[0511]
[таблица 3]
|
[0512]
[таблица 4]
|
[0513]
[таблица 5]
|
[0514]
[таблица 6]
|
[0515]
[таблица 7]
|
[0516]
[таблица 8]
|
[0517]
[таблица 9]
|
[0518]
[таблица 10]
|
[0519]
[таблица 11]
|
[0520]
[таблица 12]
|
[0521]
[таблица 13]
|
[0522]
[таблица 14]
|
[0523]
[таблица 15]
|
[0524]
[таблица 16]
|
[0525]
[таблица 17]
|
[0526]
[таблица 18]
|
[0527]
В другом варианте осуществления, конкретные примеры соединения, представленного общей формулой (1), в качестве фторалкилирующего агента включают, но ими не ограничиваются, следующие соединения:
фторид 1,3-диметил-2-трифторметилбензимидазолия,
хлорид 1,3-диметил-2-трифторметилбензимидазолия,
бромид 1,3-диметил-2-трифторметилбензимидазолия,
иодид 1,3-диметил-2-трифторметилбензимидазолия,
тетрафторборат 1,3-диметил-2-трифторметилбензимидазолия,
гексафторфосфат 1,3-диметил-2-трифторметилбензимидазолия,
метансульфонат 1,3-диметил-2-трифторметилбензимидазолия,
трифлат 1,3-диметил-2-трифторметилбензимидазолия,
метилсульфат 1,3-диметил-2-трифторметилбензимидазолия,
фторид 3-этил-1-метил-2-трифторметилбензимидазолия,
хлорид 3-этил-1-метил-2-трифторметилбензимидазолия,
бромид 3-этил-1-метил-2-трифторметилбензимидазолия,
иодид 3-этил-1-метил-2-трифторметилбензимидазолия,
тетрафторборат 3-этил-1-метил-2-трифторметилбензимидазолия,
гексафторфосфат 3-этил-1-метил-2-трифторметилбензимидазолия,
метансульфонат 3-этил-1-метил-2-трифторметилбензимидазолия,
трифлат 3-этил-1-метил-2-трифторметилбензимидазолия,
метилсульфат 3-этил-1-метил-2-трифторметилбензимидазолия,
3-этил-1-метил-2-трифторметилбензимидазолия этил сульфат,
фторид 1-метил-3-фенил-2-трифторметилбензимидазолия,
хлорид 1-метил-3-фенил-2-трифторметилбензимидазолия,
бромид 1-метил-3-фенил-2-трифторметилбензимидазолия,
иодид 1-метил-3-фенил-2-трифторметилбензимидазолия,
тетрафторборат 1-метил-3-фенил-2-трифторметилбензимидазолия,
гексафторфосфат 1-метил-3-фенил-2-трифторметилбензимидазолия,
метансульфонат 1-метил-3-фенил-2-трифторметилбензимидазолия,
трифлат 1-метил-3-фенил-2-трифторметилбензимидазолия,
метилсульфат 1-метил-3-фенил-2-трифторметилбензимидазолия,
фторид 3-бензил-1-метил-2-трифторметилбензимидазолия,
хлорид 3-бензил-1-метил-2-трифторметилбензимидазолия,
бромид 3-бензил-1-метил-2-трифторметилбензимидазолия,
иодид 3-бензил-1-метил-2-трифторметилбензимидазолия,
тетрафторборат гексафторфосфат 3-бензил-1-метил-2-трифторметилбензимидазолия,
3-бензил-1-метил-2-трифторметилбензимидазолия,
метансульфонат 3-бензил-1-метил-2-трифторметилбензимидазолия,
трифлат 3-бензил-1-метил-2-трифторметилбензимидазолия,
метилсульфат 3-бензил-1-метил-2-трифторметилбензимидазолия,
фторид 5-хлор-1,3-диметил-2-трифторметилбензимидазолия,
хлорид 5-хлор-1,3-диметил-2-трифторметилбензимидазолия,
бромид 5-хлор-1,3-диметил-2-трифторметилбензимидазолия,
иодид 5-хлор-1,3-диметил-2-трифторметилбензимидазолия,
тетрафторборат 5-хлор-1,3-диметил-2-трифторметилбензимидазолия,
гексафторфосфат 5-хлор-1,3-диметил-2-трифторметилбензимидазолия,
метансульфонат 5-хлор-1,3-диметил-2-трифторметилбензимидазолия,
трифлат 5-хлор-1,3-диметил-2-трифторметилбензимидазолия,
метилсульфат 5-хлор-1,3-диметил-2-трифторметилбензимидазолия,
фторид 5,6-дихлор-1,3-диметил-2-трифторметилбензимидазолия,
хлорид 5,6-дихлор-1,3-диметил-2-трифторметилбензимидазолия,
бромид 5,6-дихлор-1,3-диметил-2-трифторметилбензимидазолия,
иодид 5,6-дихлор-1,3-диметил-2-трифторметилбензимидазолия,
тетрафторборат 5,6-дихлор-1,3-диметил-2-трифторметилбензимидазолия,
гексафторфосфат 5,6-дихлор-1,3-диметил-2-трифторметилбензимидазолия,
метансульфонат 5,6-дихлор-1,3-диметил-2-трифторметилбензимидазолия,
трифлат 5,6-дихлор-1,3-диметил-2-трифторметилбензимидазолия,
метилсульфат 5,6-дихлор-1,3-диметил-2-трифторметилбензимидазолия,
фторид 1,3-диметил-4,5,6,7-тетрахлор-2-трифторметилбензимидазолия,
хлорид 1,3-диметил-4,5,6,7-тетрахлор-2-трифторметилбензимидазолия,
бромид 1,3-диметил-4,5,6,7-тетрахлор-2-трифторметилбензимидазолия,
иодид 1,3-диметил-4,5,6,7-тетрахлор-2-трифторметилбензимидазолия,
тетрафторборат 1,3-диметил-4,5,6,7-тетрахлор-2-трифторметилбензимидазолия,
гексафторфосфат 1,3-диметил-4,5,6,7-тетрахлор-2-трифторметилбензимидазолия,
метансульфонат 1,3-диметил-4,5,6,7-тетрахлор-2-трифторметилбензимидазолия,
трифлат 1,3-диметил-4,5,6,7-тетрахлор-2-трифторметилбензимидазолия,
метилсульфат 1,3-диметил-4,5,6,7-тетрахлор-2-трифторметилбензимидазолия,
фторид 1,3,5-триметил-2-трифторметилбензимидазолия,
хлорид 1,3,5-триметил-2-трифторметилбензимидазолия,
бромид 1,3,5-триметил-2-трифторметилбензимидазолия,
иодид 1,3,5-триметил-2-трифторметилбензимидазолия,
тетрафторборат 1,3,5-триметил-2-трифторметилбензимидазолия,
гексафторфосфат 1,3,5-триметил-2-трифторметилбензимидазолия,
метансульфонат 1,3,5-триметил-2-трифторметилбензимидазолия,
трифлат 1,3,5-триметил-2-трифторметилбензимидазолия,
метилсульфат 1,3,5-триметил-2-трифторметилбензимидазолия,
фторид 1,3,5,6-тетраметил-2-трифторметилбензимидазолия,
хлорид 1,3,5,6-тетраметил-2-трифторметилбензимидазолия,
бромид 1,3,5,6-тетраметил-2-трифторметилбензимидазолия,
иодид 1,3,5,6-тетраметил-2-трифторметилбензимидазолия,
тетрафторборат 1,3,5,6-тетраметил-2-трифторметилбензимидазолия,
гексафторфосфат 1,3,5,6-тетраметил-2-трифторметилбензимидазолия,
метансульфонат 1,3,5,6-тетраметил-2-трифторметилбензимидазолия,
трифлат 1,3,5,6-тетраметил-2-трифторметилбензимидазолия,
метилсульфат 1,3,5,6-тетраметил-2-трифторметилбензимидазолия,
фторид 1,3-диметил-5-нитро-2-трифторметилбензимидазолия,
хлорид 1,3-диметил-5-нитро-2-трифторметилбензимидазолия,
бромид 1,3-диметил-5-нитро-2-трифторметилбензимидазолия,
иодид 1,3-диметил-5-нитро-2-трифторметилбензимидазолия,
тетрафторборат 1,3-диметил-5-нитро-2-трифторметилбензимидазолия,
гексафторфосфат 1,3-диметил-5-нитро-2-трифторметилбензимидазолия,
метансульфонат 1,3-диметил-5-нитро-2-трифторметилбензимидазолия,
трифлат 1,3-диметил-5-нитро-2-трифторметилбензимидазолия,
метилсульфат 1,3-диметил-5-нитро-2-трифторметилбензимидазолия,
фторид 1,3-диметил-2-пентафторэтилбензимидазолия,
хлорид 1,3-диметил-2-пентафторэтилбензимидазолия,
бромид 1,3-диметил-2-пентафторэтилбензимидазолия,
иодид 1,3-диметил-2-пентафторэтилбензимидазолия,
тетрафторборат 1,3-диметил-2-пентафторэтилбензимидазолия,
гексафторфосфат 1,3-диметил-2-пентафторэтилбензимидазолия,
метансульфонат 1,3-диметил-2-пентафторэтилбензимидазолия,
трифлат 1,3-диметил-2-пентафторэтилбензимидазолия,
метилсульфат 1,3-диметил-2-пентафторэтилбензимидазолия,
фторид 1,3-диметил-2-гептафторпропилбензимидазолия,
хлорид 1,3-диметил-2-гептафторпропилбензимидазолия,
бромид 1,3-диметил-2-гептафторпропилбензимидазолия,
иодид 1,3-диметил-2-гептафторпропилбензимидазолия,
тетрафторборат 1,3-диметил-2-гептафторпропилбензимидазолия,
гексафторфосфат 1,3-диметил-2-гептафторпропилбензимидазолия,
метансульфонат 1,3-диметил-2-гептафторпропилбензимидазолия,
трифлат 1,3-диметил-2-гептафторпропилбензимидазолия,
метилсульфат 1,3-диметил-2-гептафторпропилбензимидазолия,
фторид 1,3-диметил-2-нонафторбутилбензимидазолия,
хлорид 1,3-диметил-2-нонафторбутилбензимидазолия,
бромид 1,3-диметил-2-нонафторбутилбензимидазолия,
иодид 1,3-диметил-2-нонафторбутилбензимидазолия,
тетрафторборат 1,3-диметил-2-нонафторбутилбензимидазолия,
гексафторфосфат 1,3-диметил-2-нонафторбутилбензимидазолия,
метансульфонат 1,3-диметил-2-нонафторбутилбензимидазолия,
трифлат 1,3-диметил-2-нонафторбутилбензимидазолия,
метилсульфат 1,3-диметил-2-нонафторбутилбензимидазолия,
фторид 1,3-диметил-2-ундекафторпентилбензимидазолия,
хлорид 1,3-диметил-2-ундекафторпентилбензимидазолия,
бромид 1,3-диметил-2-ундекафторпентилбензимидазолия,
иодид 1,3-диметил-2-ундекафторпентилбензимидазолия,
тетрафторборат 1,3-диметил-2-ундекафторпентилбензимидазолия,
гексафторфосфат 1,3-диметил-2-ундекафторпентилбензимидазолия,
метансульфонат 1,3-диметил-2-ундекафторпентилбензимидазолия,
трифлат 1,3-диметил-2-ундекафторпентилбензимидазолия,
метилсульфат 1,3-диметил-2-ундекафторпентилбензимидазолия,
бисфторид 1,3,5,7-тетраметил-2,6-бис(трифторметил)-3,5-дигидробензодиимидазолия,
бисхлорид 1,3,5,7-тетраметил-2,6-бис(трифторметил)-3,5-дигидробензодиимидазолия,
бисбромид 1,3,5,7-тетраметил-2,6-бис(трифторметил)-3,5-дигидробензодиимидазолия,
бисиодид 1,3,5,7-тетраметил-2,6-бис(трифторметил)-3,5-дигидробензодиимидазолия,
бистетрафторборат 1,3,5,7-тетраметил-2,6-бис(трифторметил)-3,5-дигидробензодиимидазолия,
бисгексафторфосфат 1,3,5,7-тетраметил-2,6-бис(трифторметил)-3,5-дигидробензодиимидазолия,
бисметансульфонат 1,3,5,7-тетраметил-2,6-бис(трифторметил)-3,5-дигидробензодиимидазолия,
бистрифлат 1,3,5,7-тетраметил-2,6-бис(трифторметил)-3,5-дигидробензодиимидазолия,
бисметилсульфат 1,3,5,7-тетраметил-2,6-бис(трифторметил)-3,5-дигидробензодиимидазолия и тому подобное.
[0528]
Предпочтительные конкретные примеры соединения, представленного общей формулой (1) в качестве фторалкилирующего агента, включают следующие соединения:
трифлат 1,3-диметил-2-трифторметилбензимидазолия,
метилсульфат 1,3-диметил-2-трифторметилбензимидазолия,
трифлат 5-хлор-1,3-диметил-2-трифторметилбензимидазолия,
метилсульфат 5-хлор-1,3-диметил-2-трифторметилбензимидазолия,
трифлат 1,3-диметил-4,5,6,7-тетрахлор-2-трифторметилбензимидазолия,
метилсульфат 1,3-диметил-4,5,6,7-тетрахлор-2-трифторметилбензимидазолия,
трифлат 1,3-диметил-5-нитро-2-трифторметилбензимидазолия,
метилсульфат 1,3-диметил-5-нитро-2-трифторметилбензимидазолия,
метилсульфат 1,3-диметил-2-пентафторэтилбензимидазолия и
трифлат 1,3-диметил-2-пентафторэтилбензимидазолия.
[0529]
Более предпочтительные конкретные примеры соединения, представленного общей формулой (1) в качестве фторалкилирующего агента, включают следующие соединения:
трифлат 1,3-диметил-2-трифторметилбензимидазолия,
метилсульфат 1,3-диметил-2-трифторметилбензимидазолия,
трифлат 5-хлор-1,3-диметил-2-трифторметилбензимидазолия,
метилсульфат 5-хлор-1,3-диметил-2-трифторметилбензимидазолия,
трифлат 1,3-диметил-5-нитро-2-трифторметилбензимидазолия,
метилсульфат 1,3-диметил-5-нитро-2-трифторметилбензимидазолия,
метилсульфат 1,3-диметил-2-пентафторэтилбензимидазолия и
трифлат 1,3-диметил-2-пентафторэтилбензимидазолия.
[0530]
(Способ получения соединения, представленного общей формулой (1))
Способы получения соединения, представленного общей формулой (1) (то есть, фторалкилирующий агент по настоящему изобретению), будет описано ниже. Тем не менее, способы получения соединения, представленного общей формулой (1), не ограничиваются этими способами.
[0531]
В соответствии со способом, показанным на следующей схеме реакции, соединение, представленное общей формулой (1) (то есть, фторалкилирующий агент по настоящему изобретению), может быть получено.
[0532]
[Химическая формула 33]
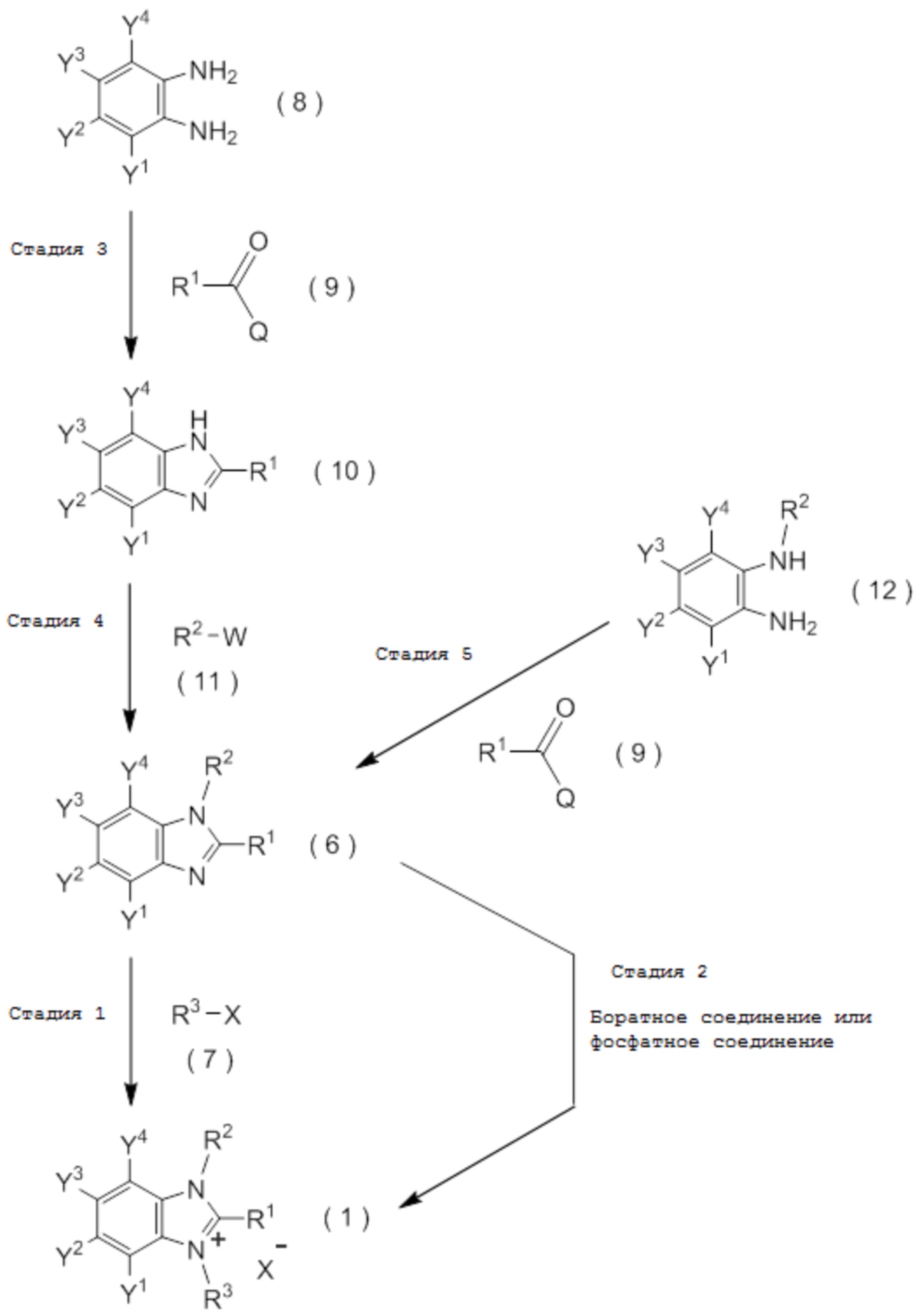
[0533]
(Стадия 1)
(Способ получения соединения, представленного общей формулой (1), путем взаимодействия соединения, представленного общей формулой (6), с соединением, представленным общей формулой (7)).
Один из способов получения соединения, представленного общей формулой (1), (фторалкилирующий агент) будет описано ниже. Как показано на следующей схеме реакции, соединение, представленное общей формулой (1), может быть получено путем взаимодействия соединения, представленного общей формулой (6), с соединением, представленным общей формулой (7).
[0534]
[Химическая формула 34]
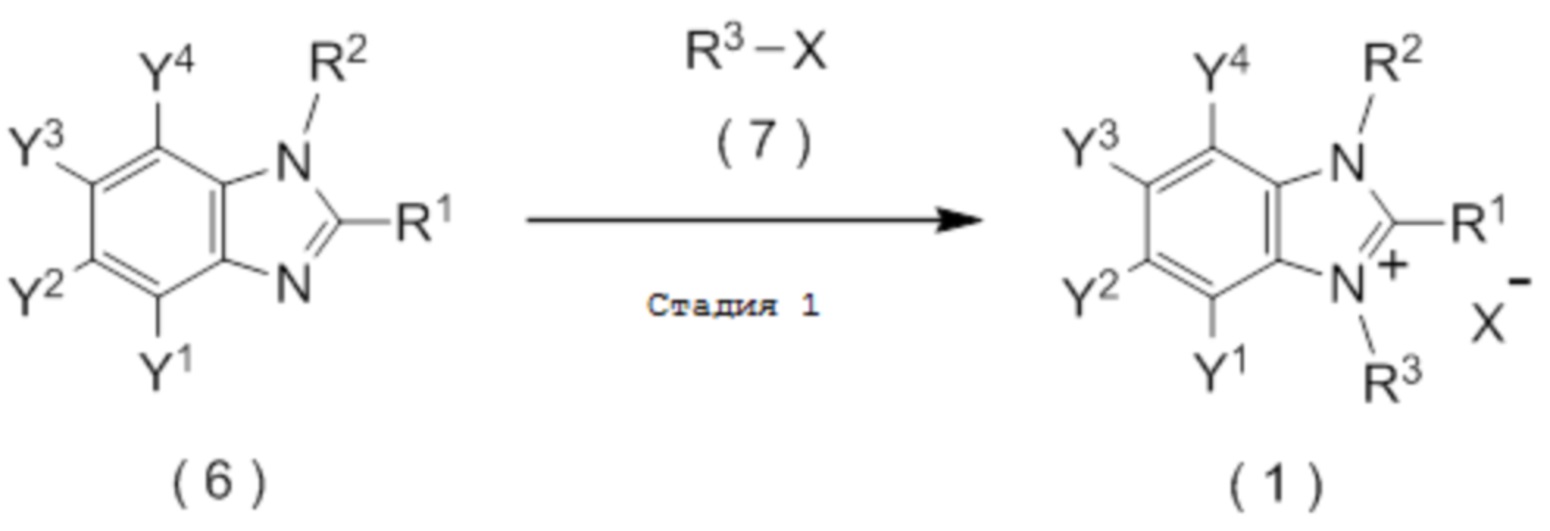
В выше приведенной реакционной схеме, R1, R2, R3, Y1, Y2, Y3, Y4 и X- являются такими, как описано выше; и X является таким, как описано ниже.
[0535]
(Соединение материала-1 на стадии 1)
(Соединение, представленное общей формулой (6))
Соединение, представленное общей формулой (6), может быть получено способом, описанным далее. Кроме того, соединение, представленное общей формулой (6), может также быть получено из известного соединения в соответствии с известным способом.
[0536]
(Соединение материала-2 на стадии 1)
(Соединение, представленное общей формулой (7))
X в общей формуле (7) представляет собой уходящую группу, соответствующую X- в общей формуле (1).
[0537]
В качестве соединения, представленного общей формулой (7), может быть использовано известное алкилирующий агент без каких-либо конкретных ограничений.
[0538]
Примеры соединения, представленного общей формулой (7), включают, но ими не ограничиваются,
метилхлорид, метилбромид, метилиодид, метилметансульфонат, метилтрифлат, метил п-толуолсульфонат, диметилсульфат,
этилхлорид, этилбромид, этилиодид, этилметансульфонат, этилтрифлат, этил п-толуолсульфонат, диэтилсульфат,
пропилбромид, пропилиодид, пропилметансульфонат, пропилтрифлат, дипропилсульфат,
изопропилбромид, изопропил иодид, изопропил метансульфонат, изопропилтрифлат, диизопропилсульфат,
бутилбромид, бутилиодид, бутилметансульфонат, бутилтрифлат, дибутилсульфат,
бензилхлорид, бензилбромид и тому подобное. "Алкил п-толуолсульфонат" также называется как "алкил 4-метилбензолсульфонат" или "алкил 4-метилфенилсульфонат". Например, "метил п-толуолсульфонат" также называется как "метил 4-метилбензолсульфонат" или "метил 4-метилфенилсульфонат". То же самое относится и к их аналогам и их производным. Кроме того, в настоящем документе, "бензолсульфоновая кислота", во всех терминах, также называется как "фенилсульфоновая кислота". То есть, в настоящем документе "бензолсульфоновая кислота", во всех терминах, можно заменить на "фенилсульфоновая кислота".
[0539]
С учетом факторов, таких как реакционная способность, выход продукта, применимость фторалкилирующего агента, представленного общей формулой (1), экономическая эффективность и тому подобное,
предпочтительные примеры соединения, представленного общей формулой (7), включают
метилиодид, метилметансульфонат, метилтрифлат, метил п-толуолсульфонат, диметилсульфат,
этилиодид, этилметансульфонат, этилтрифлат, этил п-толуолсульфонат, диэтилсульфат,
бензил хлорид и бензил бромид.
[0540]
Более предпочтительные примеры соединения, представленного общей формулой (7), включают
метилиодид, метилметансульфонат, метилтрифлат, диметилсульфат,
этилиодид, этилметансульфонат, этилтрифлат и диэтилсульфат.
[0541]
Дополнительные предпочтительные примеры соединения, представленного общей формулой (7) включают диметилсульфат.
[0542]
(Количество соединения, представленного общей формулой (7), используемого на стадии 1)
Количество используемого соединения, представленного общей формулой (7), может соответствовать любому количеству, при условии, что реакция осуществляется. С учетом факторов, таких как выход продукта, исключение побочных продуктов, экономическая эффективность и тому подобное, в качестве примеров может быть указан диапазон, составляющий, главным образом, 1 эквивалент или больше,
предпочтительно от 1 до 50 эквивалентов,
более предпочтительно от 1 до 10 эквивалентов,
еще более предпочтительно от 1 до 3 эквивалентов, в расчете на соединение, представленное общей формулой (6). Количество меньше, чем 1 эквивалент, оставляет непрореагировавшим соединение, представленное общей формулой (6). Количество больше, чем 50 эквивалентов, не обеспечивает значительное повышение выхода продукта реакции.
[0543]
(Растворитель на стадии 1)
Реакция на стадии 1 может быть осуществлена без растворителя. Тем не менее, с учетом факторов, таких как постепенное протекание реакции, экономическая эффективность и тому подобное, в реакции на стадии 1 может быть использован растворитель. Растворитель, используемый в реакции на стадии 1, может быть любым растворителем при условии, что реакция осуществляется.
[0544]
Примеры растворителя, используемого в реакции на стадии 1, включают, но ими не ограничиваются, амиды, алкилмочевины, сульфоксиды, сульфоны, эфиры, кетоны, эфиры карбоновой кислоты, нитрилы, производные ароматических углеводородов, алифатические углеводороды, галогенированные алифатические углеводороды, и любое их сочетание в любом соотношении.
[0545]
Предпочтительные примеры растворителя, используемого в реакции на стадии 1, включают амиды, алкилмочевины, сульфоксиды, сульфоны, эфиры, кетоны, нитрилы, производные ароматических углеводородов, галогенированные алифатические углеводороды и любое их сочетание в любом соотношении,
более предпочтительно амиды, алкилмочевины, кетоны, нитрилы, производные ароматических углеводородов, галогенированные алифатические углеводороды, и любое их сочетание в любом соотношении.
[0546]
Предпочтительные конкретные примеры растворителя, используемого в реакции на стадии 1, включают, но ими не ограничиваются,
N,N-диметилформамид (ДМФ), N,N-диэтилформамид, N,N-диметилацетамид (DMAC), N,N-диэтилацетамид, N-метилпирролидон (NMP),
N,N'-диметилимидазолидинон (DMI),
диметилсульфоксид (ДМСО),
сульфолан, диметилсульфон,
тетрагидрофуран (ТГФ), 2-метилтетрагидрофуран, 1,4-диоксан, диизопропиловый эфир, дибутиловый эфир, ди-трет-бутиловый эфир, циклопентил метиловый эфир (CPME), метил трет-бутиловый эфир, 1,2-диметоксиэтан (DME), диглим
ацетон, этилметилкетон, изопропилметилкетон, изобутилметилкетон (MIBK),
ацетонитрил,
толуол, ксилол, хлорбензол, дихлорбензол, трихлорбензол,
дихлорметан и
любое их сочетание в любом соотношении.
[0547]
Более предпочтительные конкретные примеры растворителя, используемого в реакции на стадии 1, включают
N,N-диметилформамид (ДМФ), N,N-диметилацетамид (DMAC), N-метилпирролидон (NMP),
N,N'-диметилимидазолидинон (DMI),
ацетон, этилметилкетон, изопропилметилкетон, изобутилметилкетон (MIBK),
ацетонитрил,
толуол, ксилол, хлорбензол, дихлорбензол и
любое их сочетание в любом соотношении.
[0548]
(Количество растворителя, используемого на стадии 1)
Количество растворителя, используемого в реакции на стадии 1, может соответствовать любому количеству, при условии, что реакция осуществляется. С учетом факторов, таких как эффективность реакции и легкость применения и тому подобное, в качестве примеров может быть указан диапазон, составляющий, главным образом, от 0 (ноль) до 10,0 л (литров),
предпочтительно от 0,01 до 10 л,
еще более предпочтительно от 0,1 до 5 л, в расчете на 1 моль соединения, представленного общей формулой (6). Тем не менее, используемое количество может соответствующим образом быть определено специалистом в данной области техники. Когда используется сочетание двух или больше растворителей, соотношение двух или больше растворителей, может быть любым соотношением при условии, что реакция осуществляется.
[0549]
(Температура реакции на стадии 1)
Температура реакции не является конкретно ограниченной. С учетом факторов, таких как выход продукта, исключение побочных продуктов, экономическая эффективность и тому подобное, более конкретно, например, с учетом факторов, таких как скорость реакции, стабильность продукта и тому подобное, в качестве примеров могут быть указаны диапазон, составляющий, главным образом, от -20 (минус 20) до 200°C,
предпочтительно от -20 до 150°C,
более предпочтительно от 0 до 150°C,
еще более предпочтительно от 20 до 130°C.
[0550]
(Время реакции на стадии 1)
Время реакции не является конкретно ограничеснным. С учетом факторов, таких как выход продукта, исключение побочных продуктов, экономическая эффективность и тому подобное, в качестве примеров может быть указан диапазон, составляющий от 0,5 до 72 часов или от 0,5 часов до 48 часов,
предпочтительно от 1 до 36 часов или от 1 до 24 часов. Тем не менее, время реакции может определяться соответствующим образом специалистом в этой области техники.
[0551]
(Стадия 2)
(Способ получения соединения, представленного общей формулой (1), путем взаимодействия соединения, представленного общей формулой (6), с боратным соединением или фосфатным соединением)
Будет описан другой способ получения соединения, представленного общей формулой (1), (фторалкилирующий агент). Как показано на следующей схеме реакции, соединение, представленное общей формулой (1), может быть получено путем взаимодействия соединения, представленного общей формулой (6), с боратным соединением или фосфатным соединением.
[0552]
[Химическая формула 35]

В выше приведенной реакционной схеме, R1, R2, R3, Y1, Y2, Y3 и Y4 являются такими, как описано выше; и X- является таким, как описано далее.
[0553]
(Соединение материала-1 на стадии 2)
(Соединение, представленное общей формулой (6))
Соединение, представленное общей формулой (6), может быть получено способом, описанным далее. Кроме того, соединение, представленное общей формулой (6), может также быть получено из известного соединения в соответствии с известным способом.
[0554]
(Соединение материала-2-1 на стадии 2)
(Боратное соединение)
Примеры боратного соединения включают, но ими не ограничиваются, тетрафторборат триалкилоксония и тому подобное.
[0555]
С учетом факторов, таких как реакционная способность, выход продукта, применимость фторалкилирующего агента, представленного общей формулой (1), экономической эффективности и тому подобное, предпочтительные примеры боратного соединения включают тетрафторборат три(C1-C4 алкил)оксония и тому подобное.
[0556]
Конкретные примеры тетрафторбората три(C1-C4 алкил)оксония включают тетрафторборат триметилоксония, тетрафторборат триэтилоксония и тому подобное,
предпочтительно тетрафторборат триметилоксония.
[0557]
Известное соединение может быть использовано в качестве такого боратного соединения.
[0558]
(Соединение материала-2-2 на стадии 2)
(Фосфатное соединение)
Примеры фосфатного соединения включают, но ими не ограничиваются, гексафторфосфат триалкилоксония и тому подобное.
[0559]
С учетом факторов, таких как реакционная способность, выход продукта, применимость фторалкилирующего агента, представленного общей формулой (1), экономической эффективности и тому подобное, предпочтительные примеры фосфатного соединения включают гексафторфосфат три(C1-C4 алкил)оксония и тому подобное.
[0560]
Конкретные примеры гексафторфосфата три(C1-C4 алкил)оксония включают гексафторфосфат триметилоксония, гексафторфосфат триэтилоксония и тому подобное,
предпочтительно гексафторфосфат триметилоксония.
[0561]
Известное соединение может быть использовано в качестве такого фосфатного соединения.
[0562]
(Количества боратного соединения и фосфатного соединения, используемого на стадии 2)
Количества используемого боратного соединения или фосфатного соединения может соответствовать любому количеству, при условии, что реакция осуществляется. С учетом факторов, таких как выход продукта, исключение побочных продуктов, экономическая эффективность и тому подобное, в качестве примеров может быть указан диапазон, составляющий, главным образом, 1 эквивалент или больше,
предпочтительно от 1 до 10 эквивалентов,
более предпочтительно от 1 до 3 эквивалентов,
еще более предпочтительно от 1 до 2 эквивалентов, в расчете на соединение, представленное общей формулой (6).
[0563]
(Растворитель на стадии 2)
Реакция на стадии 2 может быть осуществлена без растворителя. Тем не менее, с учетом факторов, таких как постепенное протекание реакции, экономическая эффективность и тому подобное, растворитель может быть использован в реакции на стадии 2. Растворитель, используемый в реакции на стадии 2, может быть любым растворителем при условии, что реакция осуществляется.
[0564]
Примеры растворителя, используемого в реакции на стадии 2, включают, но ими не ограничиваются, нитрилы, производные ароматических углеводородов, алифатические углеводороды, галогенированные алифатические углеводороды, и любое их сочетание в любом соотношении.
[0565]
Предпочтительные примеры растворителя, используемого в реакции на стадии 2, включают галогенированные алифатические углеводороды.
[0566]
Конкретные примеры растворителя, используемого в реакции на стадии 2, включают, но ими не ограничиваются,
ацетонитрил,
толуол, ксилол, хлорбензол, дихлорбензол, трихлорбензол,
гексан, циклогексан, этилциклогексан,
дихлорметан и
любое их сочетание в любом соотношении.
[0567]
Предпочтительные конкретные примеры растворителя, используемого в реакции на стадии 2, включают дихлорметан.
[0568]
(Количество растворителя, используемого на стадии 2)
Количество растворителя, используемого в реакции на стадии 2, может соответствовать любому количеству, при условии, что реакция осуществляется. В качестве примеров может быть указан диапазон, составляющий, главным образом, от 0 (ноль) до 10,0 л (литров),
предпочтительно от 0,01 до 10 л,
еще более предпочтительно от 0,1 до 5 л, в расчете на 1 моль соединения, представленного общей формулой (6). Тем не менее, используемое количество может соответствующим образом быть определено специалистом в данной области техники. Когда используется сочетание двух или больше растворителей, соотношение двух или больше растворителей, может быть любым соотношением при условии, что реакция осуществляется.
[0569]
(Температура реакции на стадии 2)
Температура реакции не является конкретно ограниченной. С учетом факторов, таких как выход продукта, исключение побочных продуктов, экономическая эффективность и тому подобное, более конкретно, например, с учетом факторов, таких как скорость реакции, стабильность продукта и тому подобное, в качестве примеров может быть указан диапазон, составляющий, главным образом, от -20 (минус 20) до 200°C,
предпочтительно от -20 до 150°C,
более предпочтительно от 0 до 150°C,
еще более предпочтительно от 0 до 70°C.
[0570]
(Время реакции на стадии 2)
Время реакции не является конкретно ограничеснным. С учетом факторов, таких как выход продукта, исключение побочных продуктов, экономическая эффективность и тому подобное, в качестве примеров может быть указан диапазон, составляющий от 0,5 до 48 часов,
предпочтительно от 1 до 24 часов. Тем не менее, время реакции может определяться соответствующим образом специалистом в этой области техники.
[0571]
(Продукт на стадии 2)
На стадии 2, X- в общей формуле (1) представляет собой моновалентный анион, полученный из боратного соединения или фосфатного соединения. Примеры X- включают, но ими не ограничиваются, борат-ионы (например, BF4- (тетрафторборат ион)), фосфат-ионы (например, PF6- (гексафторфосфат-ион)) и тому подобное.
[0572]
(Стадии 3 и 4)
Далее будет описан один из способов получения соединения, представленного общей формулой (6), которое представляет собой промежуточное соединение для соединения, представленного общей формулой (1) (фторалкилирующий агент). Как показано на следующей схеме реакции, соединение, представленное общей формулой (6), может быть получено путем взаимодействия соединения, представленного общей формулой (8), с соединением, представленным общей формулой (9), с получением соединения, представленного общей формулой (10), и последующим взаимодействием полученного соединения, представленного общей формулой (10), с соединением, представленным общей формулой (11).
[0573]
[Химическая формула 36]
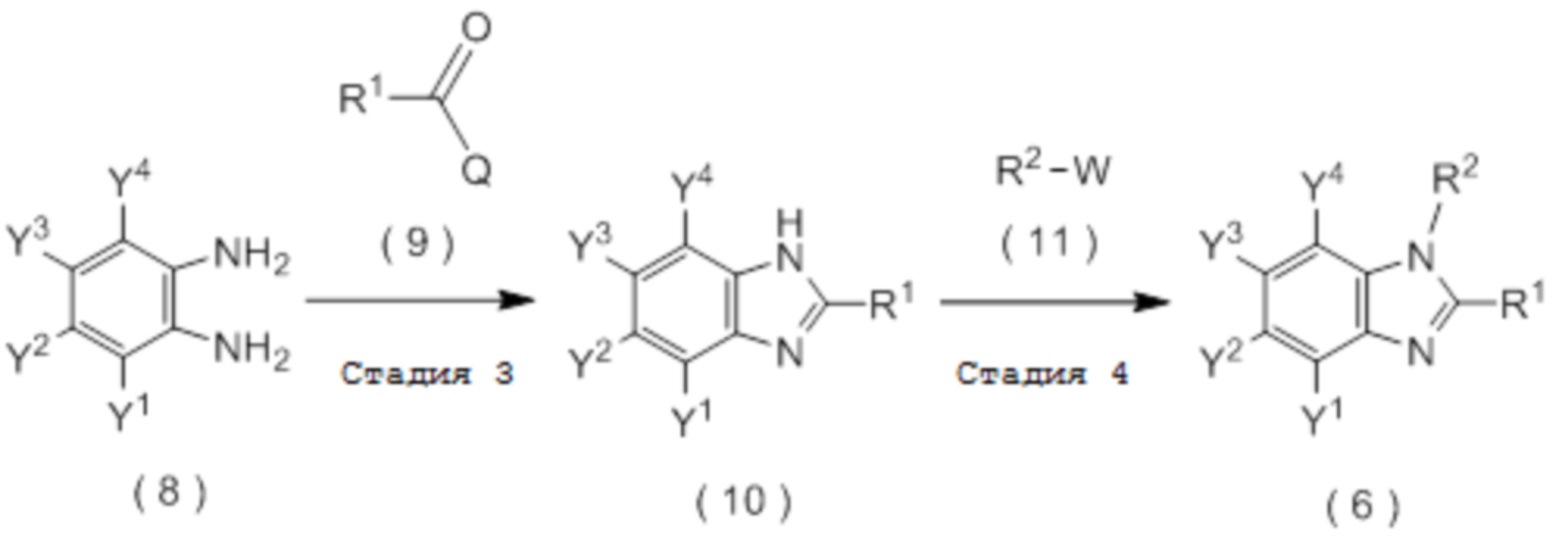
В выше приведенной реакционной схеме, R1, R2, Y1, Y2, Y3 и Y4 являются такими, как описано выше; и Q и W являются такими, как описано ниже.
[0574]
(Стадия 3)
(Способ получения соединения, представленного общей формулой (10), путем взаимодействия соединения, представленного общей формулой (8), с соединением, представленным общей формулой (9))
Будет описана стадия получения соединения, представленного общей формулой (10), путем взаимодействия соединения, представленного общей формулой (8), с соединением, представленным общей формулой (9), как показано на следующей схеме реакции.
[0575]
[Химическая формула 37]
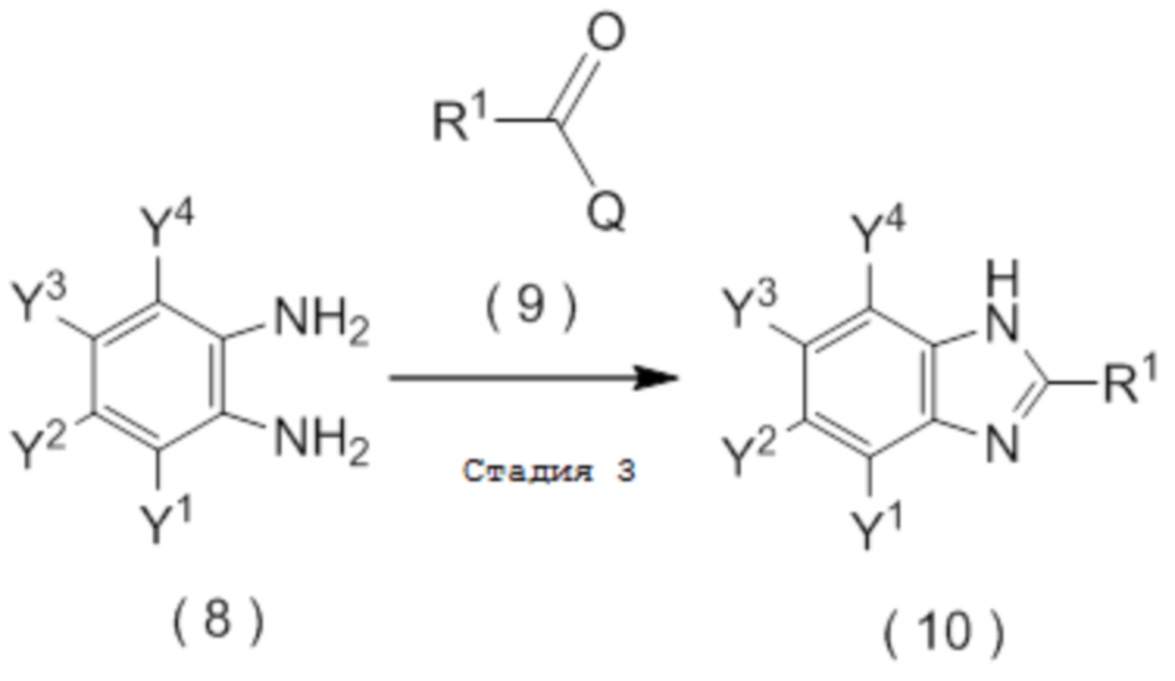
В выше приведенной реакционной схеме, R1, Y1, Y2, Y3 и Y4 являются такими, как описано выше; и Q является таким, как описано ниже.
[0576]
(Соединение материала-1 на стадии 3)
(Соединение, представленное общей формулой (8))
Соединение, представленное общей формулой (8), представляет собой известное соединение или представляет собой соединение, которое может быть получено из известного соединения в соответствии с известным способом.
[0577]
Примеры соединения, представленного общей формулой (8) включают, но ими не ограничиваются,
1,2-фенилендиамин,
4-хлор-1,2-фенилендиамин,
4,5-дихлор-1,2-фенилендиамин,
3,4,5,6-тетрахлор-1,2-фенилендиамин,
4-метил-1,2-фенилендиамин,
4,5-диметил-1,2-фенилендиамин,
4-нитро-1,2-фенилендиамин и тому подобное.
[0578]
Предпочтительные примеры соединения, представленного общей формулой (8) включают
1,2-фенилендиамин,
4-хлор-1,2-фенилендиамин,
3,4,5,6-тетрахлор-1,2-фенилендиамин и
4-нитро-1,2-фенилендиамин.
[0579]
Более предпочтительные примеры соединения, представленного общей формулой (8) включают
1,2-фенилендиамин,
4-хлор-1,2-фенилендиамин и
4-нитро-1,2-фенилендиамин.
[0580]
(Соединение материала-2 на стадии 3)
(Соединение, представленное общей формулой (9))
Q в общей формуле (9) представляет собой гидрокси группу, атом галогена (предпочтительно атом хлора) или группу -O-C(=O)-R7.
[0581]
R7 в общей формуле (9) является таким же, как R1 в общей формуле (9).
[0582]
Соединение, представленное общей формулой (9), представляет собой известное соединение или представляет собой соединение, которое может быть получено из известного соединения в соответствии с известным способом.
[0583]
Примеры соединения, представленного общей формулой (9) включают, но ими не ограничиваются,
трифторуксусную кислоту, хлорид трифторуксусной кислоты, ангидрид трифторуксусной кислоты,
пентафторпропионовую кислоту, хлорид пентафторпропионовой кислоты, ангидрид пентафторпропионовой кислоты,
гептафторбутановую кислоту, хлорид гептафторбутановой кислоты, ангидрид гептафторбутановой кислоты,
нонафторпентановую кислоту, хлорид нонафторпентановой кислоты, ангидрид нонафторпентановой кислоты,
ундекафторгексановую кислоту, хлорид ундекафторгексановой кислоты, ангидрид ундекафторгексановой кислоты,
дифторуксусную кислоту, хлорид дифторуксусной кислоты, ангидрид трифторуксусной кислоты и тому подобное.
[0584]
С учетом факторов, таких как применимость фторалкилирующего агента, представленного общей формулой (1), экономической эффективности и тому подобное, предпочтительные примеры соединения, представленного общей формулой (9), включают
трифторуксусную кислоту, хлорид трифторуксусной кислоты, ангидрид трифторуксусной кислоты,
пентафторпропионовую кислоту, хлорид пентафторпропионовой кислоты и хлорид ангидрид пентафторпропионовой кислоты.
[0585]
Соединение, представленное общей формулой (9), представляет собой карбоновую кислоту или ее производное. Одна карбоновая кислота имеет производные, такие как галогенангидриды (предпочтительно хлорангидрид) и ангидриды кислоты. В случае, когда Q в общей формуле (9) представляет собой гидрокси группу, соединение, представленное общей формулой (9), представляет собой карбоновую кислоту. Конкретным примером карбоновой кислоты является трифторуксусная кислота. В случае, когда Q в общей формуле (9) представляет собой атом галогена, соединение, представленное общей формулой (9), представляет собой галогенангидрид. Конкретным примером галогенида карбоновой кислоты является хлорид трифторуксусной кислоты. В случае, когда Q в общей формуле (9) представляет собой группу -O-C(=O)-R7, соединение, представленное общей формулой (9), представляет собой ангидрид кислоты. Конкретным примером ангидрида кислоты является ангидрид трифторуксусной кислоты. В отношении одного производного карбоновой кислоты, одна из карбоновых кислот, галогенангидридов и ангидридов кислоты могут быть использованы самостоятельно, или может быть использовано сочетание двух или больше этих агентов в любом соотношении.
[0586]
(Количество соединения, представленного общей формулой (9), используемого на стадии 3)
Количество используемого соединения, представленного общей формулой (9), может соответствовать любому количеству, при условии, что реакция осуществляется. С учетом факторов, таких как выход продукта, исключение побочных продуктов, экономическая эффективность и тому подобное, в качестве примеров может быть указан диапазон, составляющий, главным образом, 1 эквивалент или больше,
предпочтительно от 1 до 10 эквивалентов,
более предпочтительно от 1 до 5 эквивалентов, в расчете на соединение, представленное общей формулой (8). Тем не менее, используемое количество может быть соответствующим образом определено специалистом в данной области техники. Количество меньше, чем 1 эквивалент, оставляет непрореагировавшим соединение, представленное общей формулой (8). Количество больше, чем 10 эквивалентов, не обеспечивает значительное повышение выхода продукта реакции.
[0587]
(Основание на стадии 3)
При необходимости, в реакции на стадии 3 может быть использовано основание. Например, в случае, когда соединение, представленное общей формулой (9), представляет собой хлорангидрид, может быть использовано основание. Основание может быть использовано или не может быть использовано при условии, что реакция осуществляется. В случае использования основания в реакции на стадии 3, основанием может быть любое основание при условии, что реакция осуществляется. Примеры основания, которое может быть использовано в реакции на стадии 3, включают, но ими не ограничиваются, неорганические основания и органические основания.
[0588]
Примеры неорганического основания, которое может быть использовано в реакции на стадии 3, включают, но ими не ограничиваются,
гидроксиды щелочных металлов (например, гидроксид лития, гидроксид натрия, гидроксид калия и тому подобное),
гидроксиды щелочно-земельных металлов (например, гидроксид магния, гидроксид кальция, гидроксид бария и тому подобное),
карбонаты щелочных металлов (например, карбонат лития, карбонат натрия, карбонат калия и тому подобное),
карбонаты щелочно-земельных металлов (например, карбонат магния, карбонат кальция, карбонат бария и тому подобное),
бикарбонаты щелочных металлов (например, бикарбонаты лития, бикарбонаты натрия, бикарбонаты калия и тому подобное),
бикарбонаты щелочно-земельных металлов (например, бикарбонат магния, бикарбонат кальция, бикарбонат бария и тому подобное) и тому подобное.
[0589]
Примеры органического основания, которое может быть использовано в реакции на стадии 3, включают
пиридины (например, пиридин, 4-(диметиламино)пиридин, 4-пирролидинопиридин, 2,6-лутидин и тому подобное),
хинолины и их изомеры (например, хинолин, изохинолин и тому подобное),
третичные амины (например, триэтиламин, трибутиламин, диизопропилэтиламин и тому подобное),
вторичные амины (например, диэтиламин, дипропиламин, диизопропиламин и тому подобное),
первичные амины (например, бутиламин и тому подобное),
ароматические амины (например, N,N-диэтиланилин, N,N-диметиланилин и тому подобное),
циклические амины (например, пиперидин, морфолин, 1,8-диазабицикло[5.4.0]-7-ундец-7-ен (DBU), 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,4-диазабицикло[2.2.2]октан (DABCO) и тому подобное) и тому подобное.
[0590]
(Количество основания, используемого на стадии 3)
Количество используемого основания в реакции на стадии 3 может соответствовать любому количеству, при условии, что реакция осуществляется. В случае использования основания в реакции на стадии 3, с учетом факторов, таких как выход продукта, исключение побочных продуктов, экономическая эффективность и тому подобное, в качестве примеров может быть указан диапазон, составляющий, главным образом, от 1 до 10 эквивалентов
предпочтительно от 1 до 5 эквивалентов,
более предпочтительно от 1 до 2 эквивалентов, в расчете на соединение, представленное общей формулой (8).
[0591]
(Растворитель на стадии 3)
Реакцию на стадии 3 осуществляют в присутствии или в отсутствии растворителя. Как показано в примерах, реакция на стадии 3 может быть выполнена без растворителя. С другой стороны, растворитель может быть также использован в реакции на стадии 3. В случае использования растворителя в реакции на стадии 3, растворитель может быть любым растворителем при условии, что реакция осуществляется.
[0592]
Примеры растворителя, который может быть использован в реакции на стадии 3, включают, но ими не ограничиваются,
амиды (например, N,N-диметилформамид (ДМФ), N,N-диметилацетамид (DMAC), N-метилпирролидон (NMP) и тому подобное),
алкилмочевины (например, N,N'-диметилимидазолидинон (DMI) и тому подобное),
сульфоксиды (например, диметилсульфоксид (ДМСО) и тому подобное),
сульфоны (например, сульфолан и тому подобное),
простые эфиры (например, тетрагидрофуран (ТГФ), 1,4-диоксан, диизопропиловый эфир, дибутиловый эфир, ди-трет-бутиловый эфир, циклопентил метиловый эфир (CPME), метил трет-бутиловый эфир, 1,2-диметоксиэтан (DME), диглим и тому подобное),
нитрилы (например, ацетонитрил и тому подобное),
производные ароматических углеводородов (например, бензол, толуол, ксилол, хлорбензол, дихлорбензол, трихлорбензол, нитробензол и тому подобное),
галогенированные алифатические углеводороды (например, дихлорметан и тому подобное) и
любое их сочетание в любом соотношении.
[0593]
Предпочтительные примеры растворителя, который может быть использован в реакции на стадии 3, включают, но ими не ограничиваются, N,N-диметилформамид (ДМФ), N,N'-диметилимидазолидинон, ацетонитрил, дихлорметан, толуол, ксилол, хлорбензол, дихлорбензол и любое их сочетание в любом соотношении.
[0594]
(Количество растворителя, используемого на стадии 3)
Количество растворителя, используемого в реакции на стадии 3, может соответствовать любому количеству, при условии, что реакция осуществляется.
[0595]
В одном из вариантов осуществления, с учетом факторов, таких как эффективность реакции и тому подобное, количество растворителя, используемого в реакции на стадии 3, составляет 0 л (ноль литров) в расчете на 1 моль соединения, представленного общей формулой (8).
[0596]
В другом варианте осуществления, с учетом факторов, таких как эффективность реакции и легкость применения и тому подобное, в качестве примеров количества растворителя, используемого в реакции на стадии 3, может быть указан диапазон, составляющий, главным образом, от 0 (ноль) до 10,0 л (литров),
предпочтительно от 0 до 5 л, в расчете на 1 моль соединения, представленного общей формулой (8). Тем не менее, используемое количество может соответствующим образом быть определено специалистом в данной области техники. Когда используется сочетание двух или больше растворителей, соотношение двух или больше растворителей может быть любым соотношением при условии, что реакция осуществляется.
[0597]
(Температура реакции на стадии 3)
Температура реакции не является конкретно ограниченной. С учетом факторов, таких как выход продукта, исключение побочных продуктов, экономическая эффективность и тому подобное, более конкретно, например, с учетом факторов, таких как скорость реакции, стабильность продукта и тому подобное, в качестве примеров может быть указан диапазон, составляющий, главным образом, от -20 (минус 20) до 200°C,
предпочтительно от -20 до 150°C,
более предпочтительно от 0 до 130°C. Температура реакции может быть подобрана соответствующим образом специалистом в этой области техники.
[0598]
(Время реакции на стадии 3)
Время реакции не является конкретно ограничеснным. С учетом факторов, таких как выход продукта, исключение побочных продуктов, экономическая эффективность и тому подобное, в качестве примеров может быть указан диапазон, составляющий от 0,5 до 48 часов,
предпочтительно от 1 до 24 часов. Тем не менее, время реакции может определяться соответствующим образом специалистом в этой области техники.
[0599]
(Стадия 4)
(Способ получения соединения, представленного общей формулой (6), путем взаимодействия соединения, представленного общей формулой (10), с соединением, представленным общей формулой (11))
Будет описана стадия получения соединения, представленного общей формулой (6), путем взаимодействия соединения, представленного общей формулой (10), с соединением, представленным общей формулой (11), как показано на следующей схеме реакции.
[0600]
[Химическая формула 38]
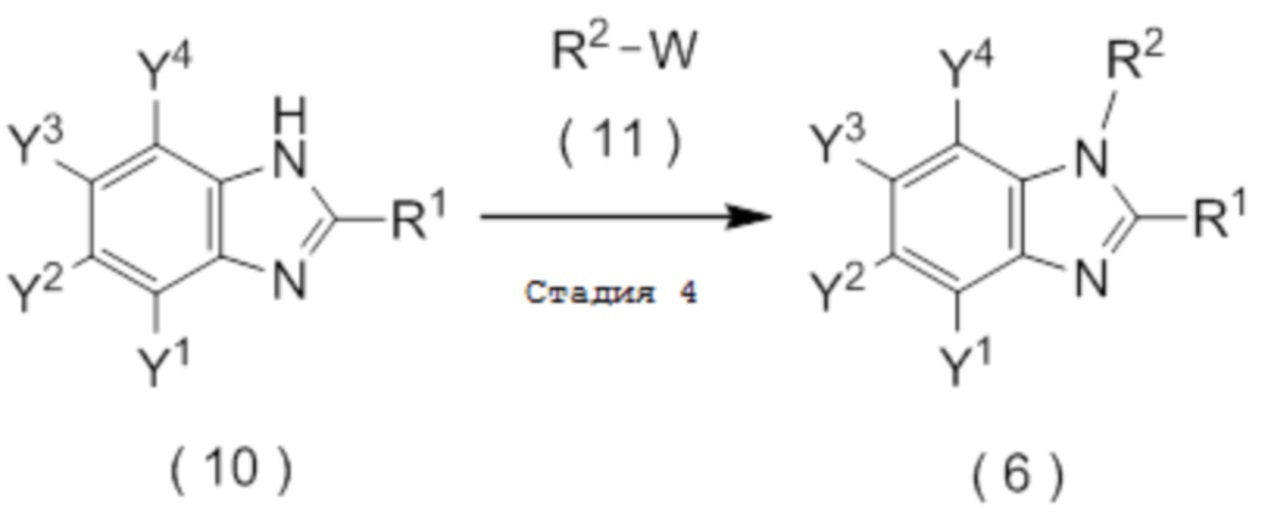
В выше приведенной реакционной схеме, R1, R2, Y1, Y2, Y3 и Y4 являются такими, как описано выше; и W является таким, как описано ниже.
[0601]
(Соединение материала-1 на стадии 4)
(Соединение, представленное общей формулой (10))
Соединение, представленное общей формулой (10), может быть получено в соответствии с вышеописанным способом. Кроме того, соединение, представленное общей формулой (10), может также быть получено из известного соединения в соответствии с известным способом.
[0602]
(Соединение материала-2 на стадии 4)
(Соединение, представленное общей формулой (11))
В качестве соединения, представленного общей формулой (11), может быть использован известный алкилирующий агент без каких-либо конкретных ограничений.
[0603]
Примеры соединения, представленного общей формулой (11), включают, но ими не ограничиваются,
метилхлорид, метилбромид, метилиодид, метилметансульфонат, метилтрифлат, метил п-толуолсульфонат, диметилсульфат,
этилхлорид, этилбромид, этилиодид, этилметансульфонат, этилтрифлат, этил п-толуолсульфонат, диэтилсульфат,
пропилбромид, пропилиодид, пропилметансульфонат, пропилтрифлат, дипропилсульфат,
изопропилбромид, изопропилиодид, изопропилметансульфонат, изопропилтрифлат, диизопропилсульфат,
бутил бромид, бутил иодид, бутил метансульфонат, бутил трифлат, дибутил сульфат,
бензил хлорид, бензил бромид и тому подобное.
[0604]
С учетом факторов, таких как реакционная способность, выход продукта, применимость фторалкилирующего агента, представленного общей формулой (1), экономической эффективности и тому подобное, предпочтительные примеры соединения, представленного общей формулой (11) включают
метилиодид, метилметансульфонат, метилтрифлат, метил п-толуолсульфонат, диметилсульфат,
этилиодид, этилметансульфонат, этилтрифлат, этил п-толуолсульфонат, диэтилсульфат,
бензил хлорид и бензил бромид.
[0605]
Более предпочтительные примеры соединения, представленного общей формулой (11), включают
метилиодид, метилметансульфонат, метилтрифлат, диметилсульфат,
этилиодид, этилметансульфонат, этилтрифлат и диэтилсульфат.
[0606]
Дополнительные предпочтительные примеры соединения, представленного общей формулой (11), включают метилиодид, метилметансульфонат, метилтрифлат и диметилсульфат.
[0607]
W в общей формуле (11) представляет собой уходящую группу. W в общей формуле (11) может представлять собой любой атом или атомную группу при условии, что она функционирует в качестве уходящей группы в реакции на стадии 4. Примеры уходящей группы в виде W в общей формуле (11) включают, но ими не ограничиваются,
атом галогена (например, атом хлора, атом брома, атом иода и тому подобное),
C1-C4 алкилсульфонилокси группу (например, метансульфонилокси группу, этансульфонилокси группу и тому подобное),
C1-C4 галогеналкилсульфонилокси группу (например, дифторметансульфонилокси группу, трифторметансульфонилокси группу и тому подобное),
бензолсульфонилокси группу, которая может иметь C1-C4 алкильную группу или атом галогена (например, бензолсульфонилокси группу, 4-метилбензолсульфонилокси группу, 4-хлорбензолсульфонилокси группу и тому подобное) и тому подобное.
"Метансульфонилокси группа" также называется как "метилсульфонилокси группа". То же самое относится и к их аналогам и их производным. Соответственно, например, "трифторметансульфонилокси группа" также называется как "трифторметилсульфонилокси группа".
Кроме того, "бензолсульфонилокси группа" также называется как "фенилсульфонилокси группа". То же самое относится и к их аналогам и их производным. Соответственно, например, "4-метилбензолсульфонилокси группа" также называется как "4-метилфенилсульфонилокси группа". Кроме того, "4-метилбензолсульфонилокси группа" также называется как "п-толуолсульфонилокси группа". Кроме того, в настоящем документе, "бензолсульфонилокси", во всех терминах, также называется как "фенилсульфонилокси". То есть, в настоящем документе во всех терминах, "бензолсульфонилокси" может быть заменен на "фенилсульфонилокси".
[0608]
(Количество соединения, представленного общей формулой (11), используемого на стадии 4)
Количество используемого соединения, представленного общей формулой (11), может соответствовать любому количеству, при условии, что реакция осуществляется. С учетом факторов, таких как выход продукта, исключение побочных продуктов, экономическая эффективность и тому подобное, в качестве примеров может быть указан диапазон, составляющий, главным образом, 1 эквивалент или больше,
предпочтительно от 1 до 10 эквивалентов,
более предпочтительно от 1 до 5 эквивалентов,
еще более предпочтительно от 1 до 3 эквивалентов, в расчете на соединение, представленное общей формулой (11). Тем не менее, используемое количество может соответствующим образом быть определено специалистом в данной области техники. Количество меньше, чем 1 эквивалент, оставляет непрореагировавшим соединение, представленное общей формулой (10). Количество больше, чем 10 эквивалентов, не обеспечивает значительное повышение выхода продукта реакции.
[0609]
(Основание на стадии 4)
Реакция на стадии 4 выполняется в присутствии основания. Основанием может быть любое основание при условии, что реакция осуществляется. Примеры основания, которое может быть использовано в реакции на стадии 4, включают, но ими не ограничиваются, неорганические основания и органические основания.
[0610]
Примеры неорганического основания, которое может быть использовано в реакции на стадии 4, включают, но ими не ограничиваются,
гидроксиды щелочных металлов (например, гидроксид лития, гидроксид натрия, гидроксид калия и тому подобное),
гидроксиды щелочно-земельных металлов (например, гидроксид магния, гидроксид кальция, гидроксид бария и тому подобное),
карбонаты щелочных металлов (например, карбонат лития, карбонат натрия, карбонат калия и тому подобное),
карбонаты щелочно-земельных металлов (например, карбонат магния, карбонат кальция, карбонат бария и тому подобное),
бикарбонаты щелочных металлов (например, бикарбонаты лития, бикарбонаты натрия, бикарбонаты калия и тому подобное),
бикарбонаты щелочно-земельных металлов (например, бикарбонат магния, бикарбонат кальция, бикарбонат бария и тому подобное),
гидриды щелочных металлов (например, гидрид лития, гидрид натрия, гидрид калия и тому подобное) и тому подобное.
[0611]
Примеры органического основания, которое может быть использовано в реакции на стадии 4, включают
пиридины (например, пиридин, 4-(диметиламино)пиридин, 4-пирролидинопиридин, 2,6-лутидин и тому подобное),
хинолины и их изомеры (например, хинолин, изохинолин и тому подобное),
третичные амины (например, триэтиламин, трибутиламин, диизопропилэтиламин и тому подобное),
вторичные амины (например, диэтиламин, дипропиламин, диизопропиламин и тому подобное),
первичные амины (например, бутиламин и тому подобное),
ароматические амины (например, N,N-диэтиланилин, N,N-диметиланилин и тому подобное),
циклические амины (например, пиперидин, морфолин, 1,8-диазабицикло[5.4.0]-7-ундец-7-ен (DBU), 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,4-диазабицикло[2.2.2]октан (DABCO) и тому подобное) и тому подобное. Эти основания могут быть использованы самостоятельно или в сочетании их двух или больше указанных оснований в любом соотношении. Форма основания может быть любой формой, при условии, что реакция осуществляется. Форма основания может быть выбрана соответствующим образом специалистом в данной области техники.
[0612]
С учетом факторов, таких как выход продукта, исключение побочных продуктов, экономическая эффективность и тому подобное, предпочтительные примеры основания, которое может быть использовано в реакции на стадии 4, включают гидроксиды щелочных металлов, карбонаты щелочных металлов, бикарбонаты щелочных металлов и гидриды щелочных металлов,
более предпочтительно гидроксиды щелочных металлов, карбонаты щелочных металлов и бикарбонаты щелочных металлов.
[0613]
Предпочтительные конкретные примеры основания, которое может быть использовано в реакции на стадии 4, включают гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, бикарбонаты натрия, бикарбонаты калия, гидрид натрия и гидрид калия,
более предпочтительно гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия бикарбонаты натрия.
[0614]
(Количество основания, используемого на стадии 4)
Количество используемого основания в реакции на стадии 4 может соответствовать любому количеству, при условии, что реакция осуществляется. С учетом факторов, таких как выход продукта, исключение побочных продуктов, экономическая эффективность и тому подобное, в качестве примеров может быть указан диапазон, составляющий, главным образом, от 1 до 10 эквивалентов
предпочтительно от 1 до 5 эквивалентов,
более предпочтительно от 1 до 2 эквивалентов, в расчете на соединение, представленное общей формулой (10).
[0615]
(Растворитель на стадии 4)
Реакция на стадии 4 может быть осуществлена без растворителя. Тем не менее, с учетом факторов, таких как постепенное протекание реакции, экономическая эффективность и тому подобное, в реакции на стадии 4 может быть использован растворитель. Растворитель, используемый в реакции на стадии 4, может быть любым растворителем при условии, что реакция осуществляется.
[0616]
Примеры растворителя, используемого в реакции на стадии 4, включают, но ими не ограничиваются, амиды, алкилмочевины, сульфоксиды, сульфоны, эфиры, кетоны, эфиры карбоновой кислоты, нитрилы, производные ароматических углеводородов, алифатические углеводороды, галогенированные алифатические углеводороды, воду и любое их сочетание в любом соотношении.
[0617]
Предпочтительные примеры растворителя, используемого в реакции на стадии 4, включают амиды, алкилмочевины, сульфоксиды, сульфоны, эфиры, кетоны, нитрилы, производные ароматических углеводородов, галогенированные алифатические углеводороды и любое их сочетание в любом соотношении,
более предпочтительно амиды, алкилмочевины, кетоны, нитрилы, производные ароматических углеводородов, галогенированные алифатические углеводороды и любое их сочетание в любом соотношении.
[0618]
Предпочтительные конкретные примеры растворителя, используемого в реакции на стадии 4, включают, но ими не ограничиваются,
N,N-диметилформамид (ДМФ), N,N-диэтилформамид, N,N-диметилацетамид (DMAC), N,N-диэтилацетамид, N-метилпирролидон (NMP),
N,N'-диметилимидазолидинон (DMI),
диметилсульфоксид (ДМСО),
сульфолан, диметилсульфон,
тетрагидрофуран (ТГФ), 2-метилтетрагидрофуран, 1,4-диоксан, диизопропиловый эфир, дибутиловый эфир, ди-трет-бутиловый эфир, циклопентил метиловый эфир (CPME), метил трет-бутиловый эфир, 1,2-диметоксиэтан (DME), диглим,
ацетон, этилметилкетон, изопропилметилкетон, изобутилметилкетон (MIBK),
ацетонитрил,
толуол, ксилол, хлорбензол, дихлорбензол, трихлорбензол,
дихлорметан и
любое их сочетание в любом соотношении.
[0619]
Более предпочтительные конкретные примеры растворителя, используемого в реакции на стадии 4, включают
N,N-диметилформамид (ДМФ), N,N-диметилацетамид (DMAC), N-метилпирролидон (NMP),
N,N'-диметилимидазолидинон (DMI),
ацетон, этилметилкетон, изопропилметилкетон, изобутилметилкетон (MIBK),
ацетонитрил,
толуол, ксилол, хлорбензол, дихлорбензол и
любое их сочетание в любом соотношении. Тем не менее, растворитель может быть выбран соответствующим образом специалистом в данной области техники.
[0620]
(Количество растворителя, используемого на стадии 4)
Количество растворителя, используемого в реакции на стадии 4, может соответствовать любому количеству, при условии, что реакция осуществляется. С учетом факторов, таких как эффективность реакции и легкость применения и тому подобное, в качестве примеров может быть указан диапазон, составляющий, главным образом, от 0 (ноль) до 10,0 л (литров),
предпочтительно от 0,01 до 10 л,
еще более предпочтительно от 0,1 до 5 л, в расчете на 1 моль соединения, представленного общей формулой (6). Тем не менее, используемое количество может соответствующим образом быть определено специалистом в данной области техники. Когда используется сочетание двух или больше растворителей, соотношение двух или больше растворителей может быть любым соотношением при условии, что реакция осуществляется.
[0621]
(Температура реакции на стадии 4)
Температура реакции не является конкретно ограниченной. С учетом факторов, таких как выход продукта, исключение побочных продуктов, экономическая эффективность и тому подобное, более конкретно, например, с учетом факторов, таких как скорость реакции, стабильность продукта и тому подобное, в качестве примеров может быть указан диапазон, составляющий, главным образом, от -20 (минус 20) до 200°C,
предпочтительно от -20 до 150°C,
более предпочтительно от 0 до 150°C,
еще более предпочтительно от 50 до 120°C. Температура реакции может быть подобрана соответствующим образом специалистом в этой области техники.
[0622]
(Время реакции на стадии 4)
Время реакции не является конкретно ограничеснным. С учетом факторов, таких как выход продукта, исключение побочных продуктов, экономическая эффективность и тому подобное, в качестве примеров может быть указан диапазон, составляющий от 0,5 до 48 часов,
предпочтительно от 1 до 24 часов. Тем не менее, время реакции может определяться соответствующим образом специалистом в этой области техники.
[0623]
(Стадия 5)
(Способ получения соединения, представленного общей формулой (6), путем взаимодействия соединения, представленного общей формулой (12), с соединением, представленным общей формулой (9))
Будет описан другой способ получения соединения, представленного общей формулой (6), которое представляет собой промежуточное соединение для соединения, представленного общей формулой (1) (фторалкилирующий агент). Как показано на следующей схеме реакции, соединение, представленное общей формулой (6), может быть получено путем взаимодействия соединения, представленного общей формулой (12), с соединением, представленным общей формулой (9).
[0624]
[Химическая формула 39]
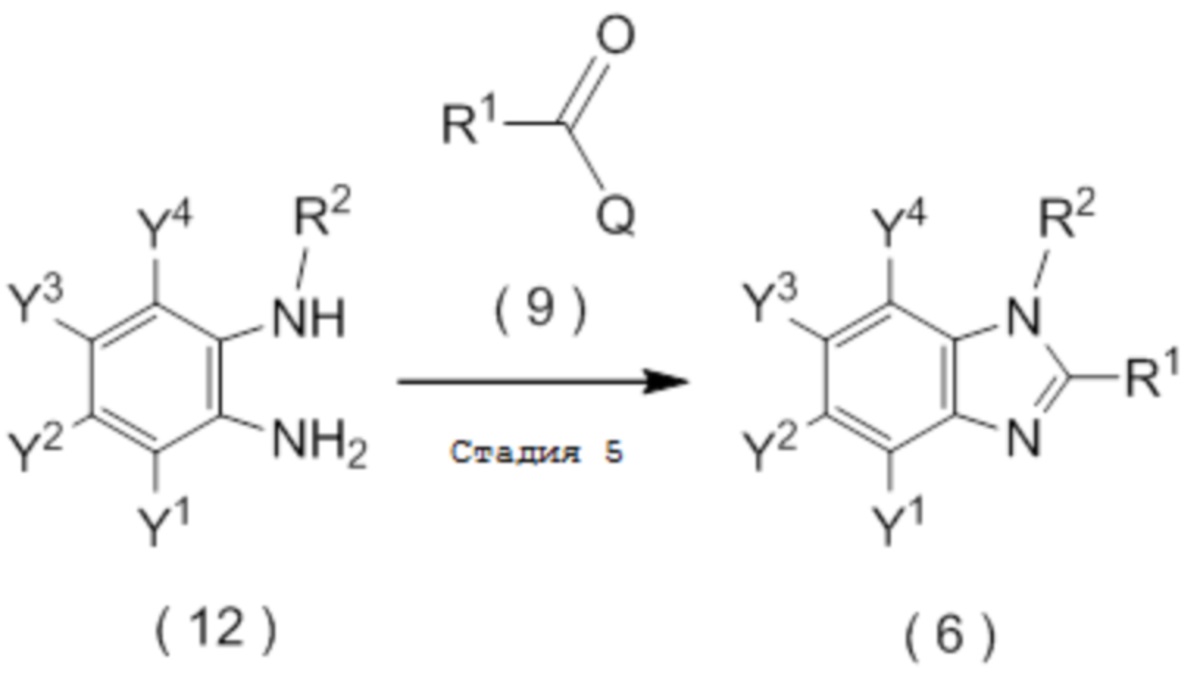
В выше приведенной реакционной схеме, R1, R2, Y1, Y2, Y3, Y4 и Q являются такими, как описано выше.
[0625]
(Соединение материала на стадии 5)
(Соединение, представленное общей формулой (12))
Соединение, представленное общей формулой (12), представляет собой известное соединение или представляет собой соединение, которое может быть получено из известного соединения в соответствии с известным способом.
[0626]
Примеры соединения, представленного общей формулой (12), включают, но ими не ограничиваются,
N1-метил-1,2-фенилендиамин,
4,5-дихлор-N1-метил-1,2-фенилендиамин,
N1-метил-3,4,5,6-тетрахлор-1,2-фенилендиамин,
4-N1-диметил-1,2-фенилендиамин и
4-нитро-N1-метил-1,2-фенилендиамин.
[0627]
Предпочтительные примеры соединения, представленного общей формулой (12), включают
N1-метил-1,2-фенилендиамин,
4-хлор-N1-метил-1,2-фенилендиамин,
N1-метил-3,4,5,6-тетрахлор-1,2-фенилендиамин и
4-нитро-N1-метил-1,2-фенилендиамин.
[0628]
Более предпочтительные примеры соединения, представленного общей формулой (12), включают
1,2-фенилендиамин,
4-хлор-1,2-фенилендиамин и
4-нитро-1,2-фенилендиамин.
[0629]
Соединение, представленное общей формулой (9), его используемое количество и способ его использования и так далее, на стадии 5 аналогичны используемым на стадии 3.
[0630]
Основание, его используемое количество и его форма и так далее, на стадии 5 аналогичны используемым на стадии 3.
[0631]
Растворитель и его используемое количество и так далее, на стадии 5 аналогичны используемым на стадии 3.
[0632]
Температура реакции на стадии 5 аналогична температуре, которую используют на стадии 3.
[0633]
Время реакции на стадии 5 является таким же, как время на стадии 3.
[0634]
(Способ получения соединения, содержащего фторалкильную группу)
(Реакция фторалкилирования)
Способы получения соединения, содержащего фторалкилирующую группу, (то есть, реакции фторалкилирования) в соответствии с настоящим изобретением, будут описаны ниже.
[0635]
Способ получения соединения, содержащего фторалкилирующую группу, в соответствии с настоящим изобретением относится к следующему:
способ получения целевого соединения, содержащего фторалкильную группу, представленную R1, где R1 является таким, как описано выше, который включает взаимодействие исходного соединения, которое представляет собой органическое соединение, с фторалкилирующим агентом, представленным общей формулой (1):
[0636]
[Химическая формула 40]
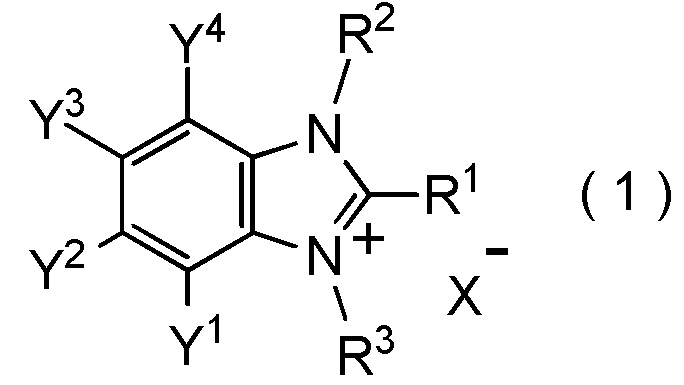
где R1, R2, R3, Y1, Y2, Y3, Y4 и X- являются такими, как описано выше.
[0637]
Соответственно, в реакции фторалкилирования по настоящему изобретению, фторалкилирующую группу, представленную R1, вводят в исходное соединение (соединение материала), которое представляет собой органическое соединение, путем использования фторалкилирующего агента, представленного общей формулой (1).
[0638]
(Количество используемого фторалкилирующего агента)
Количество фторалкилирующего агента, представленного общей формулой (1), используемого в реакции фторалкилирования по настоящему изобретению, является таким, как подробно описано в параграфах "Способ получения соединения, содержащего фторалкилирующую группу(A)" и "Реакция фторалкилирования (A)", описанных далее.
[0639]
(Основание в способе получения соединения, содержащего фторалкильную группу)
В способе получения соединения, содержащего фторалкилирующую группу, по настоящему изобретению используется основание. Иными словами, реакция фторалкилирования по настоящему изобретению выполняется в присутствии основания.
[0640]
В способе, описанном в непатентном документе 2, с использованием трифторметана (CHF3), взаимодействие осуществляют в присутствии сильного основания. Кроме того, способ, описанный в непатентных документах 3 и 4, с использованием производного фторалкилфенилсульфона, предусматривает избыточное количество трет-бутоксида калия в качестве сильного основания. Даже в способе с использованием безводной соли, полученной из гидрата гексафторацетона и 1,8-диазабицикло[5.4.0]-7-ундец-7-ена (DBU), который описан в патентном документе 3 и непатентном документе 5, используется трет-бутоксид калия в качестве сильного основания. Кроме того, в этом способе также используется DBU. Вкратце, во всех этих способах используется сильное основание.
[0641]
С другой стороны, фторалкилирующий агент по настоящему изобретению обладает превосходной реакционной способностью. Соответственно, настоящее изобретение может обеспечить, при необходимости, возможность не использовать сильное основание. Иными словами, существует возможность того, что фторалкилирующий агент по настоящему изобретению может применяться к исходному соединению, которое является неустойчивым по отношению к сильному основанию. Соответственно, считается, что настоящее изобретение обладает широким диапазоном применения, то есть широкой функциональностью.
[0642]
Основание, его используемое количество и его форма и так далее в реакции фторалкилирования по настоящему изобретению являются такими, как подробно описано в параграфах "Способ получения соединения, содержащего фторалкилирующую группу (A)" и "Реакция фторалкилирования (A)", описанных далее.
[0643]
(Цеолит (например, молекулярное сито) в способе получения соединения, содержащего фторалкильную группу)
В способе получения соединения, содержащего фторалкилирующую группу, по настоящему изобретению цеолит (например, молекулярное сито) может или не может быть использован при условии, что реакция осуществляется. Например, как показано в примерах 37-39, реакция осуществляется в достаточной степени даже в случае, когда цеолит (например, молекулярное сито) не используется. Тем не менее, с учетом таких факторов, как выход продукта, многофункциональность, применимость, экономическая эффективность и тому подобное, предпочтительно, цеолит (например, молекулярное сито) используется в реакции фторалкилирования по настоящему изобретению. Иными словами, реакция фторалкилирования по настоящему изобретению предпочтительно осуществляется в присутствии цеолита (например, молекулярного сита). Цеолит (например, молекулярное сито), его используемое количество, его форма и способ его использования, и так далее, в реакции фторалкилирования по настоящему изобретению являются такими, как подробно описано в параграфах "Способ получения соединения, содержащего фторалкилирующую группу (A)" и "Реакция фторалкилирования (A)", описанных далее.
[0644]
(Катализатор межфазного переноса в способе получения соединения, содержащего фторалкильную группу)
В способе получения соединения, содержащего фторалкилирующую группу, по настоящему изобретению катализатор межфазного переноса может быть использован. Иными словами, реакция фторалкилирования по настоящему изобретению может быть выполнена в присутствии катализатора межфазного переноса. Тем не менее, как показано в примерах, реакция протекает в достаточной степени даже в случае, когда катализатор межфазного переноса не используется. Катализатор межфазного переноса, его используемое количество и его форма и так далее, в реакции фторалкилирования по настоящему изобретению являются такими, как подробно описано в параграфах "Способ получения соединения, содержащего фторалкилирующую группу (A)" и "Реакция фторалкилирования (A)", описанных далее.
[0645]
(растворитель в способе получения соединения, содержащего фторалкильную группу)
Растворитель и его используемое количество и так далее, в способе получения соединения, содержащего фторалкилирующую группу по настоящему изобретению являются такими, как подробно описано в параграфах "Способ получения соединения, содержащего фторалкилирующую группу (A)" и "Реакция фторалкилирования (A)", описанных далее.
[0646]
(Температура реакции в способе получения соединения, содержащего фторалкильную группу)
Температура реакции в способе получения соединения, содержащего фторалкилирующую группу, по настоящему изобретению является такой, как подробно описано в параграфах "Способ получения соединения, содержащего фторалкилирующую группу (A)" и "Реакция фторалкилирования (A)", описанных далее.
[0647]
(Время реакции в способе получения соединения, содержащего фторалкильную группу)
Время реакции в способе получения соединения, содержащего фторалкилирующую группу, по настоящему изобретению является таким, как подробно описано в параграфах "Способ получения соединения, содержащего фторалкилирующую группу (A)" и "Реакция фторалкилирования (A)", описанных далее.
[0648]
(Продукт в способе получения соединения, содержащего фторалкильную группу)
Целевое соединение, полученное в способе получения соединения, содержащего фторалкилирующую группу, по настоящему изобретению представляет собой органическое соединение, содержащее фторалкилирующую группу, представленную R1.
[0649]
R1 в полученном целевом соединении является таким же, как и во фторалкилирующем агенте, представленном общей формулой (1).
[0650]
Соединение, содержащее фторалкилирующую группу, R1, которое образовано посредством реакции фторалкилирования, по настоящему изобретению может быть выделено из реакционной смеси обычным способом, известным специалисту в данной области (например, отгонкой, экстракцией, перекристаллизацией, колоночной хроматографией и/или другими способами, и предпочтительно отгонкой и тому подобное).
[0651]
Реакция фторалкилирования по настоящему изобретению дает соединение 2,3-дигидро-1,3-диметилбензимидазол-2-он, представленное общей формулой (13):
[0652]
[Химическая формула 41]
в виде продукта, полученного из фторалкилирующего агента. Это соединение может быть удалено из реакционной смеси обычным способом, известным специалисту в данной области (например, отгонкой, экстракцией, перекристаллизацией, колоночной хроматографией и/или другими способами, и предпочтительно отгонкой и тому подобное).
[0653]
Более конкретно, способы получения соединения, содержащего фторалкилирующую группу, (то есть, реакции фторалкилирования) в соответствии с настоящим изобретением показаны в следующих реакционных схемах.
[0654]
[Химическая формула 42]
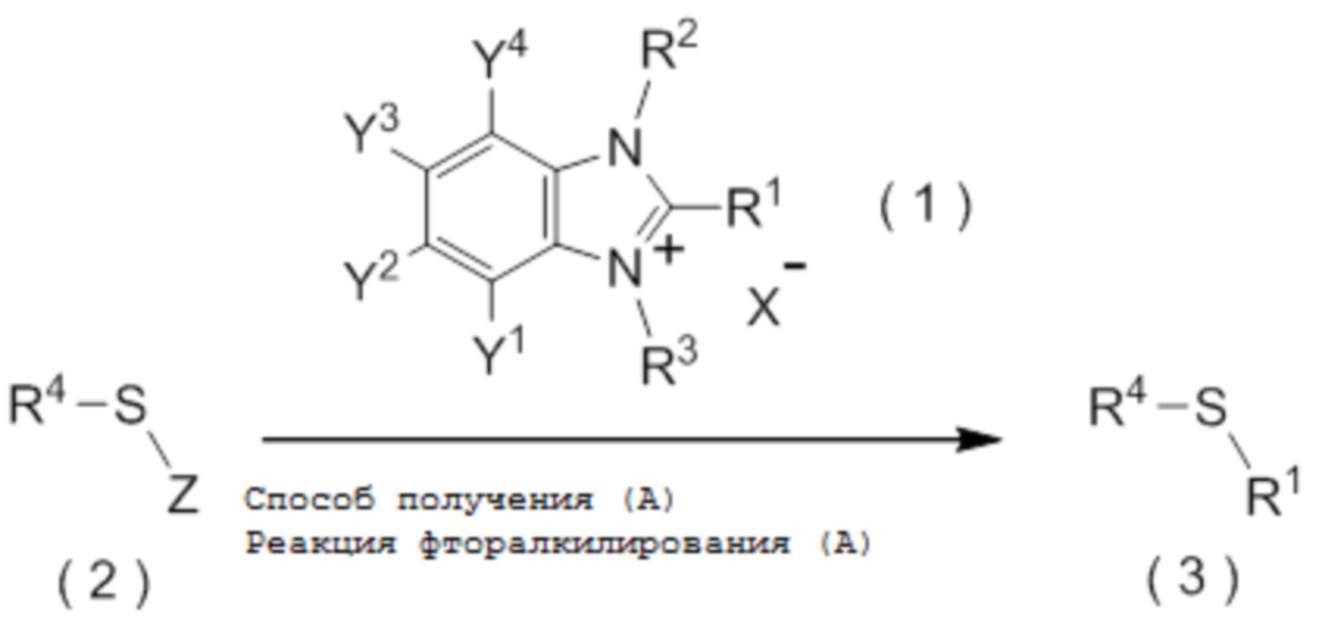
[0655]
[Химическая формула 43]
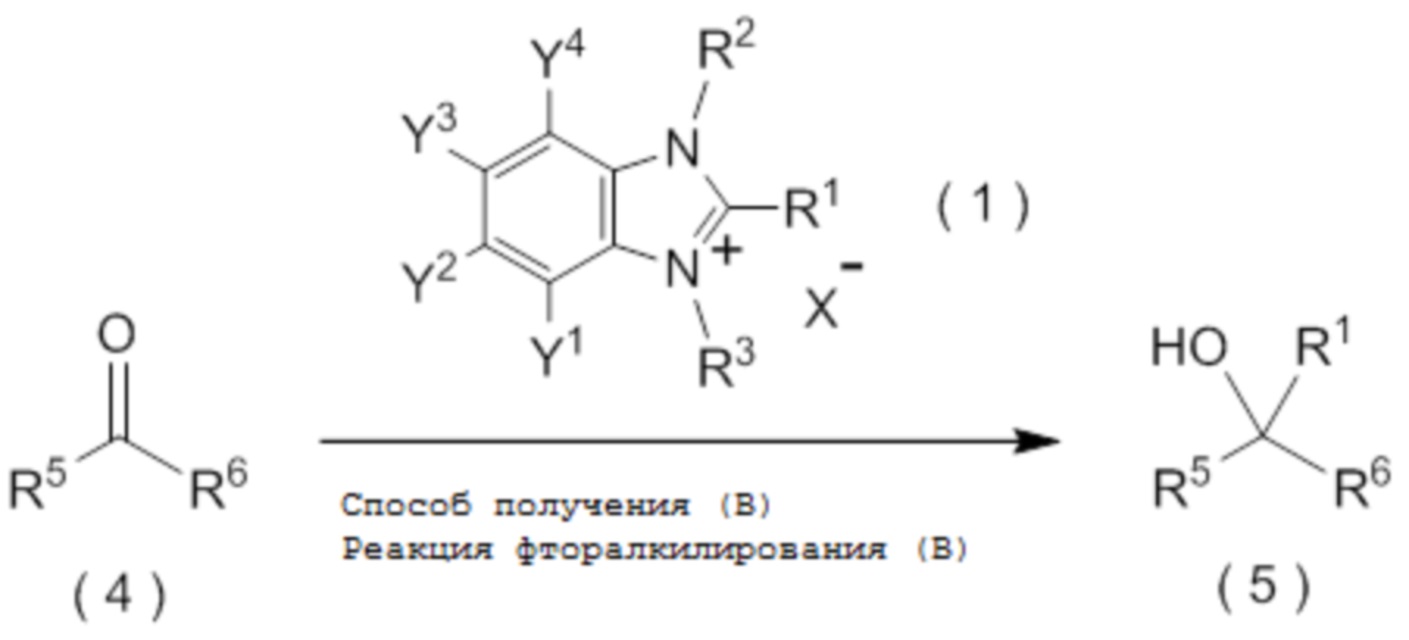
Тем не менее, способы получения соединения, содержащего фторалкилирующую группу, (то есть, реакция фторалкилирования) в соответствии с настоящим изобретением не ограничиваются описанными выше способами.
[0656]
(Способ получения соединения, содержащего фторалкилирующую группу (A))
(Реакция фторалкилирования (A))
[0657]
[Химическая формула 44]
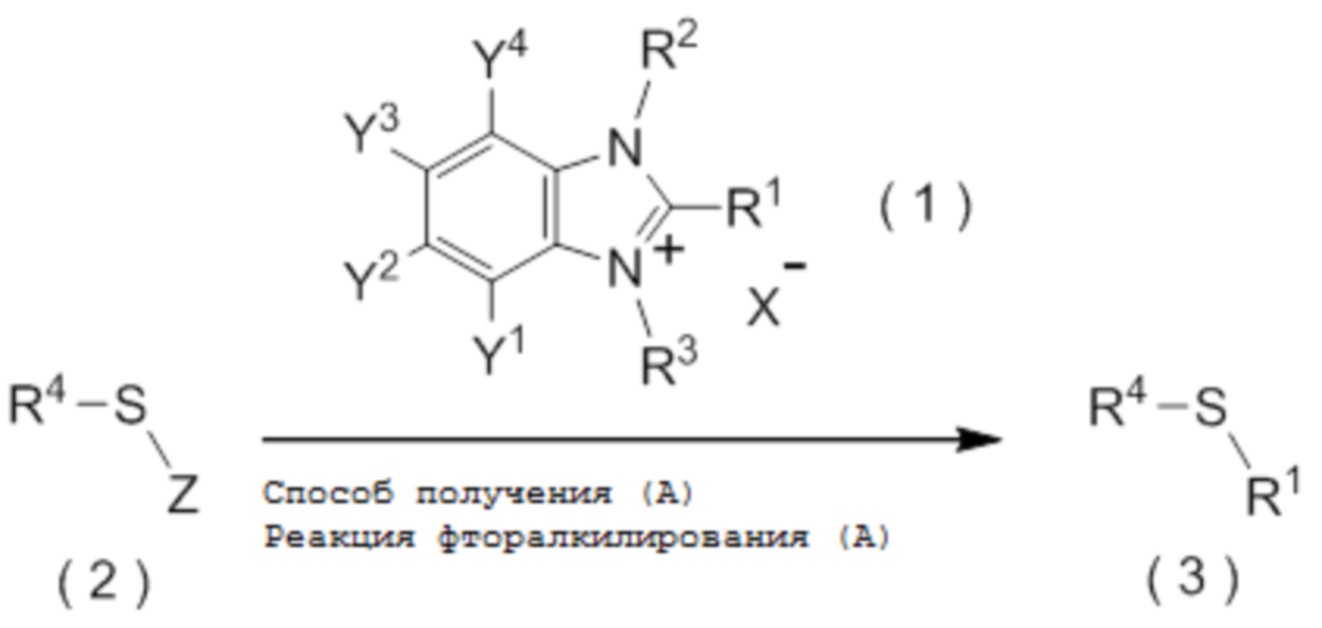
В выше приведенной реакционной схеме, R1, R2, R3, Y1, Y2, Y3, Y4 и X- являются такими, как описано выше; и R4 и Z являются такими, как описано ниже.
Как показано в выше приведенной реакционной схеме, соединение, представленное общей формулой (3), может быть получено путем взаимодействия соединения, представленного общей формулой (2), с фторалкилирующим агентом, представленным общей формулой (1). В настоящем документе, как показано на приведенной выше реакционной схеме, "Способ получения соединения, содержащего фторалкилирующую группу (A)" представляет собой способ получения соединения, представленного общей формулой (3), путем взаимодействия соединения, представленного общей формулой (2), со фторалкилирующим агентом, представленным общей формулой (1). В настоящем документе, фраза "Способ получения соединения, содержащего фторалкилирующую группу (A)" может быть кратко обозначен как "способ получения (А)". В настоящем документе, как показано в выше приведенной реакционной схеме, "реакция фторалкилирования (A)" представляет собой взаимодействие соединения, представленного общей формулой (2), с фторалкилирующим агентом, представленным общей формулой (1), с получением соединения, представленного общей формулой (3).
[0658]
(Исходное соединение способа получения (A))
(Соединение, представленное общей формулой (2))
Соединение, представленное общей формулой (2), используется в качестве исходного соединения (соединение материала) в способе получения (A).
[0659]
Соединение, представленное общей формулой (2), представляет собой известное соединение или представляет собой соединение, которое может быть получено из известного соединения в соответствии с известным способом.
[0660]
Примеры R4 в общей формуле (2) включают, но ими не ограничиваются,
углеводородную группу с прямой или разветвленную цепью, которая может содержать один или несколько заместителей,
циклическую углеводородную группу, которая может содержать один или несколько заместителей, и
гетероциклическую группу, которая может содержать один или несколько заместителей.
[0661]
С учетом таких факторов, как применимость продукта и тому подобное, предпочтительные примеры R4 включают
C1-C12 алкильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкенильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкинильную группу, которая может содержать один или несколько заместителей,
C3-C8 циклоалкильную группу, которая может содержать один или несколько заместителей,
C6-C10 арильную группу, которая может содержать один или несколько заместителей, и
гетероциклическую группу, которая может содержать один или несколько заместителей, где гетероциклическая группа представляет собой 5-10-членную гетероциклическую группу, содержащую от 1 до 9 атомов углерода и от 1 до 4 гетероатомов, независимо выбранных из атома азота, атома кислорода и атома серы,
более предпочтительно C3-C7 алкильная группа, которая может иметь бензилокси группу или C2-C4 ацилокси группу,
еще более предпочтительно 5-бензилоксипентильную группу, 5-ацетилоксипентильную группу, 6-бензилоксигексильную группу и 6-ацетилоксигексильную группу.
[0662]
Z в общей формуле (2) представляет собой уходящую группу. Z в общей формуле (2) может представлять собой любой атом или атомную группу при условии, что она функционирует в качестве уходящей группы в реакции фторалкилирования (A).
[0663]
С учетом таких факторов, как реакционная способность, выход продукта, применимость продукта, экономическая эффективность и тому подобное, предпочтительные примеры Z включают
циано группу,
C1-C4 алкилсульфонильную группу и
фенилсульфонильную группу, где фрагмент фенильной группы может содержать от 1 до 5 заместителей, выбранных независимо из атома галогена и C1-C4 алкильной группы,
более предпочтительно
циано группу,
метилсульфонильную группу,
фенилсульфонильную группу, 4-метилфенилсульфонильную группу и 4-хлорфенилсульфонильную группу,
еще более предпочтительно циано группу, фенилсульфонильную группу, 4-метилфенилсульфонильную группу и 4-хлорфенилсульфонильную группу.
В одном из вариантов осуществления, дополнительные предпочтительные примеры Z включают фенилсульфонильную группу, 4-метилфенилсульфонильную группу и 4-хлорфенилсульфонильную группу. Особенно предпочтительные примеры Z включают 4-метилфенилсульфонильную группу.
В другом варианте осуществления, особенно предпочтительные примеры Z включают циано группу.
[0664]
Примеры соединения, представленного общей формулой (2), включают, но ими не ограничиваются,
метил тиоцианат, этил тиоцианат, пропил тиоцианат, изопропил тиоцианат, бутил тиоцианат, изобутил тиоцианат, бутил тиоцианат, втор-бутил тиоцианат, изобутил тиоцианат, трет-бутил тиоцианат, пентил тиоцианат, гексил тиоцианат, гептил тиоцианат, октил тиоцианат, нонил тиоцианат, децил тиоцианат, ундецил тиоцианат, додецил тиоцианат,
бензилокситиоцианатометан,
1-бензилокси-2-тиоцианатоэтан,
1-бензилокси-3-тиоцианатопропан,
1-бензилокси-4-тиоцианатобутан,
1-бензилокси-5-тиоцианатопентан,
1-бензилокси-6-тиоцианатогексан,
1-бензилокси-7-тиоцианатогептан,
1-бензилокси-8-тиоцианатооктан,
1-бензилокси-9-тиоцианатононан,
1-бензилокси-10-тиоцианатодекан,
1-бензилокси-11-тиоцианатоундекан,
1-бензилокси-12-тиоцианатододекан,
1-ацетилокситиоцианатометан,
1-ацетилокси-2-тиоцианатоэтан,
1-ацетилокси-3-тиоцианатопропан,
1-ацетилокси-4-тиоцианатобутан,
1-ацетилокси-5-тиоцианатопентан,
1-ацетилокси-6-тиоцианатогексан,
1-ацетилокси-7-тиоцианатогептан,
1-ацетилокси-8-тиоцианатооктан,
1-ацетилокси-9-тиоцианатононан,
1-ацетилокси-10-тиоцианатодекан,
1-ацетилокси-11-тиоцианатоундекан,
1-ацетилокси-12-тиоцианатододекан,
1-пропионилокси-5-тиоцианатопентан,
1-пропионилокси-6-тиоцианатогексан,
1-бутирилокси-5-тиоцианатопентан,
1-бутирилокси-6-тиоцианатогексан,
1-изобутирилокси-5-тиоцианатопентан,
1-изобутирилокси-6-тиоцианатогексан,
S-метил метансульфонотиоат, S-этил метансульфонотиоат, S-пропил метансульфонотиоат, S-изопропил метансульфонотиоат, S-бутил метансульфонотиоат,
метантиосульфоновая кислота-5-(1-бензилокси)пентан,
метантиосульфоновая кислота-6-(1-бензилокси)гексан,
S-метил п-толуолсульфонотиоат,
S-этил п-толуолсульфонотиоат,
S-пропил п-толуолсульфонотиоат,
S-изопропил п-толуолсульфонотиоат,
S-бутил п-толуолсульфонотиоат,
бензолтиосульфоновая кислота-5-(1-бензилокси)пентил,
бензолтиосульфоновая кислота-6-(1-бензилокси)гексил,
п-толуолтиосульфоновая кислота-5-(1-бензилокси)пентил,
п-толуолтиосульфоновая кислота-6-(1-бензилокси)гексил,
4-хлорбензолтиосульфоновая кислота-5-(1-бензилокси)пентил,
4-хлорбензолтиосульфоновая кислота-6-(1-бензилокси)гексил,
бензолтиосульфоновая кислота-5-(1-ацетилокси)пентил,
бензолтиосульфоновая кислота-6-(1-ацетилокси)гексил,
п-толуолтиосульфоновая кислота-5-(1-ацетилокси)пентил,
п-толуолтиосульфоновая кислота-6-(1-ацетилокси)гексил,
4-хлорбензолтиосульфоновая кислота-5-(1-ацетилокси)пентил,
4-хлорбензолтиосульфоновая кислота-6-(1-ацетилокси)гексил и тому подобное.
[0665]
С учетом таких факторов, как реакционная способность, выход продукта, применимость продукта, экономическая эффективность и тому подобное, предпочтительные примеры соединения, представленного общей формулой (2), включают
1-бензилокси-3-тиоцианатопропан,
1-бензилокси-4-тиоцианатобутан,
1-бензилокси-5-тиоцианатопентан,
1-бензилокси-6-тиоцианатогексан,
1-бензилокси-7-тиоцианатогептан,
1-ацетилокси-3-тиоцианатопропан,
1-ацетилокси-4-тиоцианатобутан,
1-ацетилокси-5-тиоцианатопентан,
1-ацетилокси-6-тиоцианатогексан,
1-ацетилокси-7-тиоцианатогептан,
метантиосульфоновая кислота-5-(1-бензилокси)пентан,
метантиосульфоновая кислота-6-(1-бензилокси)гексан,
бензолтиосульфоновая кислота-5-(1-бензилокси)пентил,
бензолтиосульфоновая кислота-6-(1-бензилокси)гексил,
п-толуолтиосульфоновая кислота-5-(1-бензилокси)пентил,
п-толуолтиосульфоновая кислота-6-(1-бензилокси)гексил,
4-хлорбензолтиосульфоновая кислота-5-(1-бензилокси)пентил,
4-хлорбензолтиосульфоновая кислота-6-(1-бензилокси)гексил,
бензолтиосульфоновая кислота-5-(1-ацетилокси)пентил,
бензолтиосульфоновая кислота-6-(1-ацетилокси)гексил,
п-толуолтиосульфоновая кислота-5-(1-ацетилокси)пентил,
п-толуолтиосульфоновая кислота-6-(1-ацетилокси)гексил,
4-хлорбензолтиосульфоновая кислота-5-(1-ацетилокси)пентил, и
4-хлорбензолтиосульфоновая кислота-6-(1-ацетилокси)гексил.
[0666]
Более предпочтительные примеры соединения, представленного общей формулой (2), включают
1-бензилокси-5-тиоцианатопентан,
1-бензилокси-6-тиоцианатогексан,
1-ацетилокси-5-тиоцианатопентан,
1-ацетилокси-6-тиоцианатогексан,
метантиосульфоновая кислота-5-(1-бензилокси)пентан,
метантиосульфоновая кислота-6-(1-бензилокси)гексан,
бензолтиосульфоновая кислота-5-(1-бензилокси)пентил,
бензолтиосульфоновая кислота-6-(1-бензилокси)гексил,
п-толуолтиосульфоновая кислота-5-(1-бензилокси)пентил,
п-толуолтиосульфоновая кислота-6-(1-бензилокси)гексил,
4-хлорбензолтиосульфоновая кислота-5-(1-бензилокси)пентил,
4-хлорбензолтиосульфоновая кислота-6-(1-бензилокси)гексил,
бензолтиосульфоновая кислота-5-(1-ацетилокси)пентил,
бензолтиосульфоновая кислота-6-(1-ацетилокси)гексил,
п-толуолтиосульфоновая кислота-5-(1-ацетилокси)пентил,
п-толуолтиосульфоновая кислота-6-(1-ацетилокси)гексил,
4-хлорбензолтиосульфоновая кислота-5-(1-ацетилокси)пентил и
4-хлорбензолтиосульфоновая кислота-6-(1-ацетилокси)гексил.
[0667]
Дополнительные предпочтительные примеры соединения, представленного общей формулой (2), включают
1-бензилокси-5-тиоцианатопентан,
1-бензилокси-6-тиоцианатогексан,
1-ацетилокси-5-тиоцианатопентан,
1-ацетилокси-6-тиоцианатогексан,
бензолтиосульфоновая кислота-5-(1-бензилокси)пентил,
бензолтиосульфоновая кислота-6-(1-бензилокси)гексил,
п-толуолтиосульфоновая кислота-5-(1-бензилокси)пентил,
п-толуолтиосульфоновая кислота-6-(1-бензилокси)гексил,
4-хлорбензолтиосульфоновая кислота-5-(1-бензилокси)пентил,
4-хлорбензолтиосульфоновая кислота-6-(1-бензилокси)гексил,
бензолтиосульфоновая кислота-5-(1-ацетилокси)пентил,
бензолтиосульфоновая кислота-6-(1-ацетилокси)гексил,
п-толуолтиосульфоновая кислота-5-(1-ацетилокси)пентил,
п-толуолтиосульфоновая кислота-6-(1-ацетилокси)гексил,
4-хлорбензолтиосульфоновая кислота-5-(1-ацетилокси)пентил и
4-хлорбензолтиосульфоновая кислота-6-(1-ацетилокси)гексил.
[0668]
Дополнительные предпочтительные примеры соединения, представленного общей формулой (2), включают
1-ацетилокси-5-тиоцианатопентан,
1-ацетилокси-6-тиоцианатогексан,
бензолтиосульфоновая кислота-5-(1-ацетилокси)пентил,
бензолтиосульфоновая кислота-6-(1-ацетилокси)гексил,
п-толуолтиосульфоновая кислота-5-(1-ацетилокси)пентил,
п-толуолтиосульфоновая кислота-6-(1-ацетилокси)гексил,
4-хлорбензолтиосульфоновая кислота-5-(1-ацетилокси)пентил и
4-хлорбензолтиосульфоновая кислота-6-(1-ацетилокси)гексил.
[0669]
В частности, предпочтительные примеры соединения, представленного общей формулой (2), включают
1-ацетилокси-5-тиоцианатопентан,
1-ацетилокси-6-тиоцианатогексан,
п-толуолтиосульфоновая кислота-5-(1-ацетилокси)пентил и
п-толуолтиосульфоновая кислота-6-(1-ацетилокси)гексил.
[0670]
п-Толуолтиосульфоновая кислота-5-(1-бензилокси)пентил также называется как 1-бензилокси-5-тиотозилат пентан.
п-Толуолтиосульфоновая кислота-6-(1-бензилокси)гексил также называется как 1-бензилокси-6-тиотозилат гексан.
п-Толуолтиосульфоновая кислота-5-(1-ацетилокси)пентил также называемый как 1-ацетилокси-5-тиотозилат пентан.
п-Толуолтиосульфоновая кислота-6-(1-ацетилокси)гексил также называется как 1-ацетилокси-6-тиотозилат гексан.
[0671]
(Фторалкилирующий агент в способе получения (A))
(Соединение, представленное общей формулой (1) в способе получения (A))
Фторалкилирующий агент, используемый в способе получения (А), представляет собой фторалкилирующий агент, представленный общей формулой (1). R1, R2, R3, Y1, Y2, Y3, Y4 и X- во фторалкилирующем агенте, представленном общей формулой (1), используемом в способе получения (А), являются такими, как описано выше.
[0672]
(Количество фторалкилирующего агента, используемого в способе получения (A))
Количество используемого фторалкилирующего агента, представленного общей формулой (1), может соответствовать любому количеству при условии, что реакция фторалкилирования (A) осуществляется. С учетом факторов, таких как выход продукта, исключение побочных продуктов, экономическая эффективность и тому подобное, количество используемого фторалкилирующего агента, представленного общей формулой (1), может соответствовать главным образом 1 эквиваленту или больше,
предпочтительно от 1 до 10 эквивалентов,
более предпочтительно от 1 до 5 эквивалентов,
еще более предпочтительно от 1 до 2 эквивалентов, в расчете на 1 моль соединения, представленного общей формулой (2) (исходное соединение).
[0673]
(Основание в способе получения (A))
В реакции способа получения (A) используется основание. Иными словами, реакция фторалкилирования (A) выполняется в присутствии основания. Основание, используемое в реакции фторалкилирования (A), может быть любым известным основанием при условии, что реакция осуществляется.
[0674]
Примеры основания, используемого в реакции фторалкилирования (A), включают, но ими не ограничиваются,
гидроксиды щелочных металлов, гидроксиды щелочно-земельных металлов,
карбонаты щелочных металлов, карбонаты щелочно-земельных бикарбонаты металлов, щелочных металлов, бикарбонаты щелочно-земельных металлов,
фосфаты щелочных металлов, фосфаты щелочно-земельных металлов, дифосфаты щелочных металлов, дифосфаты щелочно-земельных металлов,
гидриды щелочных металлов, гидриды щелочно-земельных металлов,
алкоксиды щелочных металлов, алкоксиды щелочно-земельных металлов,
соли щелочных металлов карбоновых кислот, соли щелочно-земельных металлов карбоновых кислот,
цианиды щелочных металлов,
фториды щелочных металлов, фториды четвертичного аммония,
силанолаты щелочных металлов,
пиридины, хинолины, изохинолины,
третичные амины, вторичные амины, первичные амины,
ароматические амины,
циклические амины и
их сочетания.
[0675]
С учетом таких факторов, как реакционная способность, выход продукта, экономическая эффективность и тому подобное, предпочтительные примеры основания, используемого в реакции фторалкилирования (A) включают
гидроксиды щелочных металлов, гидроксиды щелочно-земельных металлов,
карбонаты щелочных металлов, карбонаты щелочно-земельных металлов, бикарбонаты щелочных металлов, бикарбонаты щелочно-земельных металлов,
гидриды щелочных металлов, гидриды щелочно-земельных металлов,
алкоксиды щелочных металлов, алкоксиды щелочно-земельных металлов,
соли щелочных металлов карбоновых кислот, соли щелочно-земельных металлов карбоновых кислот,
цианиды щелочных металлов,
фториды щелочных металлов, фториды четвертичного аммония,
силанолаты щелочных металлов,
циклические амины и
их сочетания.
[0676]
Более предпочтительные примеры основания, используемого в реакции фторалкилирования (A), включают гидроксиды щелочных металлов, карбонаты щелочных металлов, бикарбонаты щелочных металлов, гидриды щелочных металлов, алкоксиды щелочных металлов, соли щелочных металлов карбоновых кислот, цианиды щелочных металлов, фториды щелочных металлов, фториды четвертичного аммония, циклические амины, и их сочетания.
[0677]
Дополнительные предпочтительные примеры основания, используемого в реакции фторалкилирования (A), включают гидроксиды щелочных металлов, карбонаты щелочных металлов, гидриды щелочных металлов и их сочетания.
[0678]
Особенно предпочтительные примеры основания, используемого в реакции фторалкилирования (A), включают гидроксиды щелочных металлов, гидриды щелочных металлов и их сочетания.
[0679]
С учетом таких факторов, как реакционная способность, выход продукта, экономическая эффективность и тому подобное, предпочтительные конкретные примеры основания, используемого в реакции фторалкилирования (A), включают гидроксид лития, гидроксид натрия, гидроксид калия, гидроксид магния, гидроксид кальция, гидроксид бария, карбонат лития, карбонат натрия, карбонат калия, карбонат цезия, карбонат магния, карбонат кальция, карбонат бария, бикарбонаты лития, бикарбонаты натрия, бикарбонаты калия, бикарбонат цезия, бикарбонат магния, бикарбонат кальция, бикарбонат бария, гидрид лития, гидрид натрия, гидрид калия, гидрид кальция, метоксид натрия, этоксид натрия, трет-бутоксид натрия, трет-бутоксид калия, этоксид магния, натрия формиат, формиат калия, ацетат лития, ацетат натрия, ацетат калия, пропионат натрия, пропионат калия, ацетат магния, ацетат кальция, цианид калия, цианид натрия, фторид натрия, фторид калия, фторид тетрабутиламмония, натрия триметил силанолат, калия триметил силанолат, 1,8-диазабицикло[5.4.0]-7-ундец-7-ен (DBU), 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,4-диазабицикло[2.2.2]октан (DABCO) и их сочетания.
[0680]
Более предпочтительные конкретные примеры основания, используемого в реакции фторалкилирования (A), включают
гидроксид лития, гидроксид натрия, гидроксид калия,
карбонат лития, карбонат натрия, карбонат калия, карбонат цезия, бикарбонаты лития, бикарбонаты натрия, бикарбонаты калия, бикарбонат цезия,
гидрид лития, гидрид натрия, гидрид калия,
метоксид натрия, этоксид натрия, трет-бутоксид натрия, трет-бутоксид калия,
формиат натрия, формиат калия, ацетат натрия, ацетат калия,
цианид калия, цианид натрия,
фторид натрия, фторид калия, фторид тетрабутиламмония,
1,8-диазабицикло[5.4.0]-7-ундец-7-ен (DBU), 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,4-диазабицикло[2.2.2]октан (DABCO) и
их сочетания.
[0681]
Дополнительные предпочтительные конкретные примеры основания, используемого в реакции фторалкилирования (A), включают
гидроксид лития, гидроксид натрия, гидроксид калия,
карбонат натрия, карбонат калия, карбонат цезия,
гидрид натрия и
их сочетания.
[0682]
Дополнительные предпочтительные конкретные примеры основания, используемого в реакции фторалкилирования (A), включают гидроксид лития, гидроксид натрия, гидроксид калия, гидрид натрия и их сочетания.
[0683]
Дополнительные предпочтительные конкретные примеры основания, используемого в реакции фторалкилирования (A), включают гидроксид натрия, гидроксид калия, гидрид натрия и их сочетания.
[0684]
В частности, предпочтительные конкретные примеры основания, используемого в реакции фторалкилирования (A), включают гидроксид калия, гидрид натрия и их сочетания.
[0685]
Эти основания могут быть использованы самостоятельно или в сочетании их двух или больше указанных оснований в любом соотношении в реакции фторалкилирования (A). В случае, когда используется сочетание оснований, два или больше оснований могут быть добавлены по отдельности в реакционную систему. В этом случае порядок, в котором добавляются два или больше оснований, не является конкретно ограниченным. В случае, когда используется сочетание оснований, два или больше оснований могут быть добавлены одновременно в реакционную систему. Сочетание оснований может представлять собой смесь оснований.
Форма основания, используемая в реакции фторалкилирования (A), может быть любой формой при условии, что реакция осуществляется. Форма основания, используемая в реакции фторалкилирования (A), может быть выбрана соответствующим образом специалистом в данной области техники.
[0686]
(Количество основания, используемого в способе получения (A))
Количество используемого основания в реакции фторалкилирования (A) может соответствовать любому количеству при условии, что реакция осуществляется. С учетом факторов, таких как выход продукта, исключение побочных продуктов, экономическая эффективность и тому подобное, в качестве примеров может быть указан диапазон, составляющий, главным образом, 1 эквивалент или больше,
предпочтительно от 1 до 10 эквивалентов, от 1 до 5 эквивалентов или от 1 до 3 эквивалентов,
более предпочтительно от 2 до 10 эквивалентов, от 2 до 5 эквивалентов или от 2 до 3 эквивалентов,
еще более предпочтительно от 2 до 5 эквивалентов,
особенно предпочтительно от 2 до 3 эквивалентов, в расчете на 1 моль фторалкилирующего агента, представленного общей формулой (1).
В случае, когда используется сочетание оснований, количество используемого основания, приведенное в качестве примера выше, обозначает суммарное количество всех используемых оснований.
[0687]
(Цеолит (например, молекулярное сито) в способе получения (A))
В реакции способа получения (A), цеолит (например, молекулярное сито) может или не может быть использован при условии, что реакция осуществляется.
[0688]
Например, как показано в примерах 37-39, реакция протекает в достаточной степени даже в случае, когда цеолит (например, молекулярное сито) не используется. Тем не менее, с учетом таких факторов, как выход продукта, многофункциональность, применимость, экономическая эффективность и тому подобное, предпочтительно, в реакции способа получения (A) используется цеолит (например, молекулярное сито). Иными словами, реакция фторалкилирования (A) предпочтительно осуществляют в присутствии цеолита (например, молекулярного сита).
[0689]
Цеолит представляет собой алюминосиликат, представленный следующей общей формулой, но им не ограничиваясь:
xM2/nO⋅Al2O3⋅ySiO2⋅zH2O
где
M представляет собой катион (например, ион щелочных металлов, такой как Li+, Na+ или K+, и/или ион щелочно-земельных металлов, такой как Mg2+, Ca2+ или Ba2+, и тому подобное),
n обозначает валентность катиона M,
x соответствует числу 1 или меньше (например, от 0,01 до 1),
y соответствует числу 2 или больше (например, от 2 до 100), и
z соответствует числу больше, чем 0 (например, от 0 до 10).
Цеолит (например, молекулярное сито) может удерживать катион щелочных металлов и/или щелочно-земельных металлов и тому подобное, и/или молекулу воды, и тому подобное в порах. Тем не менее, цеолит используется, при необходимости, в реакции после удаления катиона щелочных металлов и/или щелочно-земельных металлов и тому подобное, и/или молекулы воды, и тому подобное, в порах. Обычно, специалистам в этой области техники хорошо известно, что цеолит, после удаления молекулы воды в порах цеолита путем нагрева и тому подобное, используется в качестве активированного цеолита. Степень и способ удаления катиона щелочных металлов и/или щелочно-земельных металлов и тому подобное, и/или молекулы воды и тому подобное, в порах (то есть, очистка и активация цеолита) могут быть выбраны и соответствующим образом скорректированы специалистом в данной области техники. Например, степень и способ для удаления молекулы воды путем нагревания, или нагревания и снижения давления, могут быть выбраны и соответствующим образом скорректированы специалистом в данной области техники. Также может быть использован коммерчески доступный активированный цеолит (например, активированное молекулярное сито).
[0690]
Цеолит (например, молекулярное сито), используемый в реакции фторалкилирования (A), может быть любым цеолитом (например, любым молекулярным ситом) при условии, что реакция осуществляется.
[0691]
Цеолит (например, молекулярное сито), используемый в реакции фторалкилирования (A), может быть природным цеолитом или может быть синтетическим цеолитом.
[0692]
Примеры цеолита (например, молекулярное сито), используемого в реакции фторалкилирования (A), включают, но ими не ограничиваются, цеолит A, ZK-5, Cabazite, ZSM-5, цеолит L, цеолит Y, цеолит X и тому подобное,.
[0693]
Размер пор цеолита (например, молекулярное сито), используемый в реакции фторалкилирования (A), может соответствовать любому размеру пор при условии, что реакция осуществляется. С учетом таких факторов, как выход продукта, экономическая эффективность и тому подобное, в качестве примеров может быть указан диапазон, составляющий, главным образом, 10 ангстрем или меньше,
предпочтительно от 1 до 10 ангстрем,
более предпочтительно от 2 до 7 ангстрем, от 2 до 6 ангстрем, от 2 до 5 ангстрем или от 2 до 4 ангстрем,
еще более предпочтительно от 3 до 7 ангстрем,
еще более предпочтительно от 3 до 5 ангстрем,
еще более предпочтительно от 3 до 4 ангстрем.
4 ангстрем являются, в частности, предпочтительными.
[0694]
Предпочтительные примеры цеолита (например, молекулярное сито), используемые в реакции фторалкилирования (A), включают, но ими не ограничиваются, цеолит A и их смеси.
[0695]
Предпочтительные конкретные примеры цеолита (например, молекулярное сито), используемого в реакции фторалкилирования (A), включают, но ими не ограничиваются,
молекулярное сито 3A, молекулярное сито 4A, молекулярное сито 5A, молекулярное сито 13X и их смеси,
более предпочтительно молекулярное сито 3A, молекулярное сито 4A, молекулярное сито 5A и их смеси,
еще более предпочтительно молекулярное сито 3A, молекулярное сито 4A и их смеси,
особенно предпочтительно молекулярное сито 4A.
[0696]
Эти цеолиты (например, молекулярные сита) могут быть использованы самостоятельно или в сочетании двух или больше указанных цеолитов в любом соотношении в реакции фторалкилирования (A). Форма цеолита (например, молекулярное сито), используемая в реакции фторалкилирования (A), может быть любой формой при условии, что реакция осуществляется. Примеры формы цеолита (например, молекулярное сито), используемой в реакции фторалкилирования (A), включают, но ими не ограничиваются, порошки, шарики, гранулы (например, цилиндры) и тому подобное, предпочтительно порошки. Форма цеолита (например, молекулярное сито), используемая в реакции фторалкилирования (A), может быть выбрана соответствующим образом специалистом в данной области техники.
[0697]
(Количество цеолита (например, молекулярное сито), используемого в способе получения (A))
Количество цеолита (например, молекулярное сито), используемого в реакции фторалкилирования (A), может соответствовать любому количеству, при условии, что реакция осуществляется. С учетом таких факторов, как выход продукта, экономическая эффективность и тому подобное, в качестве примеров может быть указан диапазон, составляющий, главным образом, от 0 (ноль) до 10 кг,
предпочтительно от 0 до 2 кг или от 0 до 1 кг,
более предпочтительно от 0,1 до 2 кг или от 0,1 до 1 кг,
еще более предпочтительно от 0,15 до 2 кг или от 0,15 до 1 кг,
особенно предпочтительно от 0,17 до 1 кг, в расчете на 1 моль соединения, представленного общей формулой (2) (исходное соединение).
[0698]
Соответственно, обычно, в качестве примеров может быть указано количество цеолита (например, молекулярного сита), используемого в реакции фторалкилирования по настоящему изобретению, в диапазоне, составляющем главным образом от 0 (ноль) до 10 кг,
предпочтительно от 0 до 2 кг или от 0 до 1 кг,
более предпочтительно от 0,1 до 2 кг или от 0,1 до 1 кг,
еще более предпочтительно от 0,15 до 2 кг или от 0,15 до 1 кг,
особенно предпочтительно от 0,17 до 1 кг в расчете на 1 моль исходного соединения.
[0699]
(Катализатор межфазного переноса в способе получения (A))
В реакции способа получения (A), может быть использован катализатор межфазного переноса. Иными словами, реакция фторалкилирования (A) может быть выполнена в присутствии катализатора межфазного переноса. Тем не менее, как показано в примерах, реакция протекает в достаточной степени даже в случае, когда катализатор межфазного переноса не используется. Катализатор межфазного переноса, который может быть использован в реакции фторалкилирования (A), может быть любым известным катализатором межфазного переноса при условии, что реакция осуществляется.
[0700]
Примеры катализатора межфазного переноса, который может быть использован в реакции фторалкилирования (A), включают, но ими не ограничиваются, соли четвертичного аммония, соли четвертичного фосфония, краун-эфиры и тому подобное.
[0701]
Примеры солей четвертичного аммония включают, но ими не ограничиваются,
хлорид тетрабутиламмония, бромид тетрабутиламмония, иодид тетрабутиламмония, бисульфат тетрабутиламмония,
хлорид бензилтриметиламмония, бромид бензилтриметиламмония,
хлорид октилтриметиламмония, бромид октилтриметиламмония,
хлорид триоктилметиламмония, бромид триоктилметиламмония,
хлорид бензиллаурилдиметиламмония (хлорид бензилдодецилдиметиламмония), бромид бензиллаурилдиметиламмония (бромид бензилдодецилдиметиламмония),
хлорид миристилтриметиламмония (хлорид тетрадецилтриметиламмония), бромид миристилтриметиламмония (бромид тетрадецилтриметиламмония),
хлорид бензилдиметилстеариламмония (хлорид бензилоктадецилдиметиламмония), бромид бензилдиметилстеариламмония (бромид бензилоктадецилдиметиламмония) и тому подобное.
[0702]
Примеры солей четвертичного фосфония включают, но ими не ограничиваются, бромид тетрабутилфосфония, бромид тетраоктилфосфония, бромид тетрафенилфосфония и тому подобное.
[0703]
Примеры краун-эфиров включают, но ими не ограничиваются, 12-краун-4, 15-краун-5, 18-краун-6 и тому подобное.
[0704]
С учетом таких факторов, как реакционная способность, выход продукта, экономическая эффективность и тому подобное, катализатор межфазного переноса представляет собой
предпочтительно соль четвертичного аммония,
более предпочтительно бромид тетрабутиламмония.
[0705]
Эти катализаторы межфазного переноса могут быть использованы самостоятельно или в сочетании двух или больше указанных катализаторов в любом соотношении. Форма катализатора межфазного переноса может быть любой формой при условии, что реакция осуществляется. Форма катализатора межфазного переноса может быть выбрана соответствующим образом специалистом в данной области техники.
[0706]
(Количество катализатора межфазного переноса, используемого в способе получения (A))
Количество катализатора межфазного переноса, используемого в реакции фторалкилирования (A), может соответствовать любому количеству, при условии, что реакция осуществляется. С учетом факторов, таких как выход продукта, исключение побочных продуктов, экономическая эффективность и тому подобное, в качестве примеров может быть указан диапазон, составляющий, главным образом, от 0 (ноль) до 1,5 моль или от 0 до 1 моль,
предпочтительно от 0 до 0,3 моль или от 0 до 0,2 моль,
более предпочтительно от 0 до 0,1 моль, в расчете на 1 моль соединения, представленного общей формулой (2) (исходное соединение).
[0707]
(Растворитель в способе получения (A))
Реакция способа получения (A) может быть осуществлена без растворителя. Тем не менее, с учетом факторов, таких как постепенное протекание реакции, экономическая эффективность и тому подобное, растворитель может быть использован в реакции. Растворитель, используемый в реакции фторалкилирования (A), может быть любым растворителем при условии, что реакция осуществляется.
[0708]
Примеры растворителя, используемого в реакции фторалкилирования (A) включают, но ими не ограничиваются, амиды, алкилмочевины, сульфоксиды, сульфоны, эфиры, кетоны, эфиры карбоновой кислоты, нитрилы, производные ароматических углеводородов, алифатические углеводороды, галогенированные алифатические углеводороды и любое их сочетание в любом соотношении.
[0709]
С учетом таких факторов, как реакционная способность, выход продукта, экономическая эффективность и тому подобное, предпочтительные примеры растворителя, используемого в реакции фторалкилирования (A), включают
амиды, алкилмочевины, сульфоксиды, сульфоны, эфиры, нитрилы, производные ароматических углеводородов, галогенированные алифатические углеводороды и любое их сочетание в любом соотношении,
более предпочтительно амиды, алкилмочевины, сульфоксиды, сульфоны, нитрилы, производные ароматических углеводородов и любое их сочетание в любом соотношении,
еще более предпочтительно амиды, сульфоксиды, нитрилы, производные ароматических углеводородов и любое их сочетание в любом соотношении,
особенно предпочтительно амиды, производные ароматических углеводородов и любое их сочетание в любом соотношении.
[0710]
Конкретные примеры растворителя, используемого в реакции фторалкилирования (A), включают, но ими не ограничиваются,
N,N-диметилформамид (ДМФ), N,N-диэтилформамид, N,N-диметилацетамид (DMAC), N,N-диэтилацетамид, N-метилпирролидон (NMP),
N,N'-диметилимидазолидинон (DMI),
диметилсульфоксид (ДМСО),
сульфолан, диметилсульфон,
тетрагидрофуран (ТГФ), 2-метилтетрагидрофуран, 1,4-диоксан, диизопропиловый эфир, дибутиловый эфир, ди-трет-бутиловый эфир, циклопентил метиловый эфир (CPME), метил трет-бутиловый эфир, 1,2-диметоксиэтан (DME), диглим,
ацетон, этилметилкетон, изопропилметилкетон, изобутилметилкетон (MIBK),
этилацетат, бутил ацетат,
ацетонитрил,
толуол, ксилол, хлорбензол, дихлорбензол, трихлорбензол, нитробензол,
дихлорметан и
любое их сочетание в любом соотношении.
[0711]
С учетом таких факторов, как реакционная способность, выход продукта, экономическая эффективность и тому подобное, предпочтительные конкретные примеры растворителя, используемого в реакции фторалкилирования (A), включают
N,N-диметилформамид (ДМФ), N,N-диэтилформамид, N,N-диметилацетамид (DMAC), N,N-диэтилацетамид, N-метилпирролидон (NMP),
N,N'-диметилимидазолидинон (DMI),
диметилсульфоксид (ДМСО),
сульфолан, диметилсульфон,
тетрагидрофуран (ТГФ), 2-метилтетрагидрофуран,
1,4-диоксан, диизопропиловый эфир, дибутиловый эфир, ди-трет-бутиловый эфир, циклопентил метиловый эфир (CPME), метил трет-бутиловый эфир, 1,2-диметоксиэтан (DME), диглим,
ацетонитрил,
толуол, ксилол, хлорбензол, дихлорбензол, трихлорбензол,
дихлорметан и
любое их сочетание в любом соотношении.
[0712]
Исходя из аналогичных точек зрения, описанных выше, более предпочтительные конкретные примеры растворителя, используемого в реакции фторалкилирования (A), включают
N,N-диметилформамид (ДМФ), N,N-диметилацетамид (DMAC), N-метилпирролидон (NMP),
N,N'-диметилимидазолидинон (DMI),
диметилсульфоксид (ДМСО),
сульфолан, диметилсульфон,
ацетонитрил,
толуол, ксилол, хлорбензол, дихлорбензол и
любое их сочетание в любом соотношении.
[0713]
Исходя из аналогичных точек зрения, описанных выше, дополнительные предпочтительные конкретные примеры растворителя, используемого в реакции фторалкилирования (A) включают
N,N-диметилформамид (ДМФ), N,N-диметилацетамид (DMAC), N-метилпирролидон (NMP),
диметилсульфоксид (ДМСО),
ацетонитрил,
толуол, ксилол, хлорбензол, дихлорбензол и
любое их сочетание в любом соотношении.
[0714]
Исходя из аналогичных точек зрения, описанных выше, дополнительные предпочтительные конкретные примеры растворителя, используемого в реакции фторалкилирования (A), включают
N,N-диметилформамид (ДМФ), N,N-диметилацетамид (DMAC), N-метилпирролидон (NMP),
толуол, ксилол, хлорбензол, дихлорбензол и
любое их сочетание в любом соотношении.
[0715]
Исходя из аналогичных точек зрения, описанных выше, особенно предпочтительные конкретные примеры растворителя, используемого в реакции фторалкилирования (A), включают
N,N-диметилформамид (ДМФ), N,N-диметилацетамид (DMAC),
толуол, ксилол и
любое их сочетание в любом соотношении.
[0716]
(Количество растворителя, используемого в способе получения (A))
Количество растворителя, используемого в реакции способа получения (A), может соответствовать любому количеству, при условии, что реакция осуществляется. С учетом факторов, таких как эффективность реакции и легкость применения и тому подобное, в качестве примеров может быть указан диапазон, составляющий, главным образом, от 0 (ноль) до 10,0 л (литров),
предпочтительно от 0,01 до 10 л,
еще более предпочтительно от 0,1 до 5 л в расчете на 1 моль соединения, представленного общей формулой (2) (исходное соединение). Тем не менее, используемое количество может соответствующим образом быть определено специалистом в данной области техники. Когда используется сочетание двух или больше растворителей, соотношение двух или больше растворителей может быть любым соотношением при условии, что реакция осуществляется. Соотношение может быть подобрано соответствующим образом специалистом в этой области техники.
[0717]
(Температура реакции способа получения (A))
Температура реакции не является конкретно ограниченной. С учетом факторов, таких как выход продукта, исключение побочных продуктов, экономическая эффективность и тому подобное, более конкретно, например, с учетом факторов, таких как скорость реакции, стабильность продукта и тому подобное, температура реакции находится в диапазоне, составляющем главным образом от -80°C (минус 80°C) до 200°C (плюс 200°C), от -80°C до 150°C или от -80°C до 100°C,
предпочтительно от -80°C (минус 80°C) до 60°C (плюс 60°C), от -60°C до 60°C или от -50°C до 60°C,
более предпочтительно от -80°C (минус 80°C) до 40°C (плюс 40°C), от -60°C до 40°C или от -50°C до 40°C,
еще более предпочтительно от -80°C (минус 80°C) до 0°C (ноль °C), -60°C до 0°C или от -50°C до 0°C,
еще более предпочтительно от -50°C до 0°C (от минус 50°C до ноль °C),
особенно предпочтительно от -50°C до -5°C (от минус 50°C до минус 5°C).
[0718]
(Время реакции способа получения (A))
Время реакции не является конкретно ограниченным. С учетом факторов, таких как выход продукта, исключение побочных продуктов, экономическая эффективность и тому подобное, в качестве примеров может быть указан, диапазон, составляющий, главным образом, от 0,5 до 120 часов или от 0,5 часов до 48 часов,
предпочтительно от 1 часа до 48 часов или от 1 часа до 24 часов. Тем не менее, время реакции может определяться соответствующим образом специалистом в этой области техники.
[0719]
(Продукт способа получения (A))
(Соединение, представленное общей формулой (3))
Целевое соединение, полученное в способе получения (A), представляет собой соединение, представленное общей формулой (3).
[0720]
R1 в общей формуле (3) является таким же, как и во фторалкилирующем агенте, представленном общей формулой (1).
[0721]
Соединение, представленное общей формулой (3), содержащее фторалкилирующую группу R1, которое образовано посредством реакции фторалкилирования (A), может быть выделено из реакционной смеси обычным способом, известным специалисту в данной области (например, отгонкой, экстракцией, перекристаллизацией, колоночной хроматографией и/или другими способами, и предпочтительно отгонкой и тому подобное).
[0722]
(Способ получения соединения, содержащего фторалкилирующую группу (B))
(Реакция фторалкилирования (B))
[0723]
[Химическая формула 45]
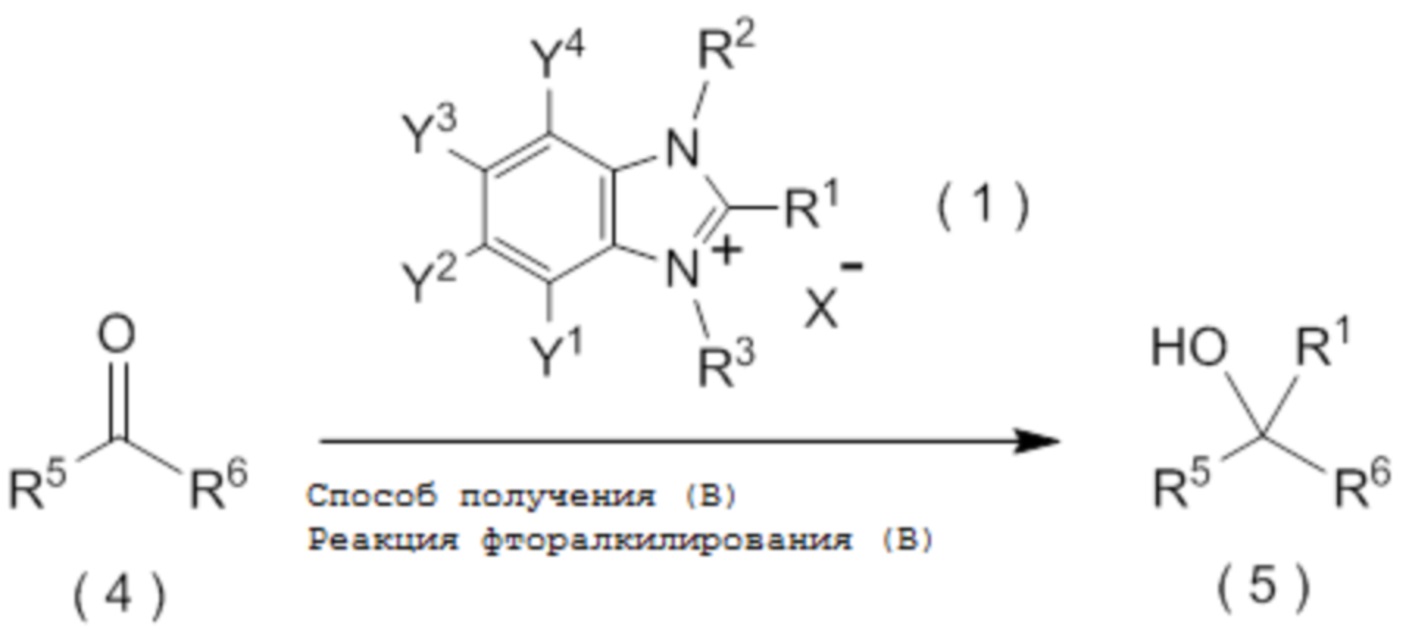
В выше приведенной реакционной схеме, R1, R2, R3, Y1, Y2, Y3, Y4 и X- являются такими, как описано выше; и R5 и R6 являются такими, как описано ниже.
Как показано в выше приведенной реакционной схеме, соединение, представленное общей формулой (5), может быть получено путем взаимодействия соединения, представленного общей формулой (4), с фторалкилирующим агентом, представленным общей формулой (1). В настоящем документе, как показано в выше приведенной реакционной схеме, "Способ получения соединения, содержащего фторалкилирующую группу (B)" представляет собой способ получения соединения, представленного общей формулой (5), путем взаимодействия соединения, представленного общей формулой (4), с фторалкилирующим агентом, представленным общей формулой (1). В настоящем документе, фраза "Способ получения соединения, содержащего фторалкилирующую группу (B)", может кратко называться как "способ производства (B)". В настоящем документе, как показано в выше приведенной реакционной схеме, "реакция фторалкилирования (B)" представляет собой взаимодействие соединения, представленного общей формулой (4), с фторалкилирующим агентом, представленным общей формулой (1), с получением соединения, представленного общей формулой (5).
[0724]
(Исходное соединение способа получения (B))
(Соединение, представленное общей формулой (4))
Соединение, представленное общей формулой (4), используется в качестве исходного соединения (соединение материала) в способе получения (B).
[0725]
Соединение, представленное общей формулой (4), представляет собой известное соединение или представляет собой соединение, которое может быть получено из известного соединения в соответствии с известным способом.
[0726]
Примеры R5 в общей формуле (4) включают, но ими не ограничиваются,
углеводородную группу с прямой или разветвленную цепью, которая может содержать один или несколько заместителей,
циклическую углеводородную группу, которая может содержать один или несколько заместителей, и
гетероциклическую группу, которая может содержать один или несколько заместителей.
[0727]
С учетом таких факторов, как применимость продукта и тому подобное, предпочтительные примеры R5 включают
C1-C12 алкильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкенильную группу, которая может содержать один или несколько заместителей,
C2-C6 алкинильную группу, которая может содержать один или несколько заместителей,
C3-C8 циклоалкильную группу, которая может содержать один или несколько заместителей,
C6-C10 арильную группу, которая может содержать один или несколько заместителей и
гетероциклическую группу, которая может содержать один или несколько заместителей, где гетероциклическая группа представляет собой 5-10-членную гетероциклическую группу, содержащую от 1 до 9 атомов углерода и от 1 до 4 гетероатомов, независимо выбранных из атома азота, атома кислорода и атома серы.
[0728]
Примеры R6 в общей формуле (4) включают, но ими не ограничиваются,
атом водорода,
углеводородную группу с прямой или разветвленную цепью, которая может содержать один или несколько заместителей,
циклическую углеводородную группу, которая может содержать один или несколько заместителей, и
гетероциклическую группу, которая может содержать один или несколько заместителей.
[0729]
С учетом таких факторов, как применимость продукта и тому подобное, предпочтительные примеры R6 включают
атом водорода, C1-C4 алкильную группу и C1-C4 галогеналкильную группу,
более предпочтительно атом водорода.
[0730]
Примеры соединения, представленного общей формулой (4), включают, но ими не ограничиваются,
ацетальдегид, пропиональдегид, бутаналь, пентаналь, гексаналь, гептаналь, октаналь,
фенилацетальдегид, 3-фенилпропиональдегид, 4-фенилбутаналь, 5-фенилпентаналь,
бензальдегид,
2-фторбензальдегид, 3-фторбензальдегид, 4-фторбензальдегид,
2,4-дифторбензальдегид, 3,4-дифторбензальдегид,
2-хлорбензальдегид, 3-хлорбензальдегид, 4-хлорбензальдегид,
2,4-дихлорбензальдегид, 3,4-дихлорбензальдегид,
2-нитробензальдегид, 3-нитробензальдегид, 4-нитробензальдегид,
2-цианобензальдегид, 3-цианобензальдегид, 4-цианобензальдегид,
2-метилбензальдегид, 3-метилбензальдегид, 4-метилбензальдегид,
2-метоксибензальдегид, 3-метоксибензальдегид, 4-метоксибензальдегид,
2-пиридинкарбоксальдегид, 3-пиридинкарбоксальдегид, 4-пиридинкарбоксальдегид,
2-тиофенкарбоксальдегид, 3-тиофенкарбоксальдегид, 4-тиофенкарбоксальдегид
ацетон, этилметилкетон, диэтилкетон,
бензилацетон, 5-фенил-2-пропанон,
ацетофенон,
2'-хлорацетофенон, 3'-хлорацетофенон, 4'-хлорацетофенон,
2'-нитроацетофенон, 3'-нитроацетофенон, 4'-нитроацетофенон,
2'-цианоацетофенон, 3'-цианоацетофенон, 4'-цианоацетофенон,
2'-метилацетофенон, 3'-метилацетофенон, 4'-метилацетофенон,
2'-метоксиацетофенон, 3'-метоксиацетофенон, 4'-метоксиацетофенон,
2-ацетилпиридин, 3-ацетилпиридин, 4-ацетилпиридин,
2-ацетилтиофен, 3-ацетилтиофен, 4-ацетилтиофен,
бензофенон,
2-хлорбензофенон, 3-хлорбензофенон, 4-хлорбензофенон,
2-нитробензофенон, 3-нитробензофенон, 4-нитробензофенон,
2-цианобензофенон, 3-цианобензофенон, 4-цианобензофенон,
2-метилбензофенон, 3-метилбензофенон, 4-метилбензофенон,
2-метоксибензофенон, 3-метоксибензофенон, 4-метоксибензофенон,
2-бензоилпиридин, 3-бензоилпиридин, 4-бензоилпиридин,
2-бензоилтиофен, 3-бензоилтиофен, 4-бензоилтиофен и тому подобное.
[0731]
(Фторалкилирующий агент в способе получения (B))
(Соединение, представленное общей формулой (1), в способе получения (B))
Фторалкилирующий агент, представленное общей формулой (1), и его используемое количество и так далее, в способе получения соединения, содержащего фторалкилирующую группу (B), являются такими же, как в параграфах "Способ получения соединения, содержащего фторалкилирующую группу(A)" и "Реакция фторалкилирования (A)", описанных выше.
[0732]
(Основание в способе получения (B))
Основание, его используемое количество и его форма и так далее, в способе получения соединения, содержащего фторалкилирующую группу, (B) являются такими же, как описано в параграфах "Способ получения соединения, содержащего фторалкилирующую группу (A)" и "Реакция фторалкилирования (A)", описанных выше.
[0733]
(Цеолит (например, молекулярное сито) в способе получения (B))
Цеолит (например, молекулярное сито), его используемое количество, его форма и способ его использования и так далее, в способе получения соединения, содержащего фторалкилирующую группу (B), являются такими же, как описано в параграфах "Способ получения соединения, содержащего фторалкилирующую группу (A)" и "Реакция фторалкилирования (A)", описанных выше.
[0734]
(Катализатор межфазного переноса в способе получения (B))
Катализатор межфазного переноса, его используемое количество и его форма и так далее, в способе получения соединения, содержащего фторалкилирующую группу (B), являются такими же, как в параграфах "Способ получения соединения, содержащего фторалкилирующую группу(A)" и "Реакция фторалкилирования (A)", описанных выше.
[0735]
(Растворитель в способе получения (B))
Растворитель и его используемое количество и так далее, в способе получения соединения, содержащего фторалкилирующую группу (B), являются такими же, как в параграфах "Способ получения соединения, содержащего фторалкилирующую группу (A)" и "Реакция фторалкилирования (A)", описанных выше.
[0736]
(Температура реакции способа получения (B))
Температура реакции в способе получения соединения, содержащего фторалкилирующую группу (B), аналогична температуре, указанной в параграфах "Способ получения соединения, содержащего фторалкилирующую группу (A)" и "Реакция фторалкилирования (A)", описанных выше.
[0737]
(Время реакции способа получения (B))
Время реакции в способе получения соединения, содержащего фторалкилирующую группу (B), аналогично времени, которое указано в параграфах "Способ получения соединения, содержащего фторалкилирующую группу (A)" и "Реакция фторалкилирования (A)", описанных выше.
[0738]
(Продукт способа получения (B))
(Соединение, представленное общей формулой (5))
Целевое соединение, полученное в способе получения (B), представляет собой соединение, представленное общей формулой (5).
[0739]
R1 в общей формуле (5) является таким же, как и во фторалкилирующем агенте, представленном общей формулой (1).
[0740]
Соединение, представленное общей формулой (5), содержащее фторалкилирующую группу R1, которое образовано посредством реакции фторалкилирования (B), может быть выделено из реакционной смеси обычным способом, известным специалисту в данной области (например, отгонкой, экстракцией, перекристаллизацией, колоночной хроматографией и/или другими способами, и предпочтительно отгонкой и тому подобное).
[0741]
Далее в настоящем документе, настоящее изобретение будет описано более подробно с помощью примеров. Тем не менее, настоящее изобретение не ограничивается каким-либо образом этими примерами.
[0742]
В настоящем документе комнатная температура составляет от 10°C до 35°C.
[0743]
В настоящем документе, для определения каждого физического свойства в примерах и ссылочные примеры, были использованы следующие приборы.
[0744]
1H спектр ядерного магнитного резонанса (1H-ЯМР); JEOL JMN-Lambda 300 или JEOL JMN-Lambda-400 (производство JEOL Ltd.), Внутренний стандарт: тетраметилсилан (TMS)
[0745]
Температура плавления; Yanaco MP-500V (производство ANATEC YANACO CORPORATION).
[0746]
Анализ методом газовой хроматографии (ГХ анализ); GC-2025 (производство SHIMADZU CORPORATION), метод обнаружения: FID
[0747]
Анализ методом газовой хроматографии (GC); В отношении анализа методом GC, при необходимости, могут быть указаны следующие документы.
Документ (a): The Chemical Society of Japan ed., "Shin Jikken Kagaku Koza (New Experimental Chemistry Course) 9 Bunseki Kagaku (Analytical Chemistry) II", стр. 60-86 (1977), опубликовано Shingo Iizumi, Maruzen Co., Ltd. (например, в отношении жидкостей для стационарной фазы, которую можно использовать в колонке, можно сослаться на страницу 66.)
Документ (b): The Chemical Society of Japan ed., "Jikken Kagaku Koza (Experimental Chemistry Course) 20-1 Bunseki Kagaku (Analytical Chemistry)", 5th ed., стр. 121-129 (2007), опубликовано Seishiro Murata, Maruzen Co., Ltd. (Например, в отношении конкретного использования полой капиллярной разделительной колонки, можно сослаться на страницы 124-125.)
[0748]
Газовая хромато-масс-спектрометрия (ГХ-МС анализ); инструмент анализа: 6890N Network ГХ System (производство Agilent Technologies), масс-детектор: 5973N MSD (производство Agilent Technologies)
[0749]
Анализ методом высокоэффективной жидкостной хроматографией (ВЭЖХ); относительно анализа методом ВЭЖХ, при необходимости могут быть указаны следующие документы.
Документ (c): The Chemical Society of Japan ed., "Shin Jikken Kagaku Koza (New Experimental Chemistry Course) 9 Bunseki Kagaku (Analytical Chemistry) II", стр. 86-112 (1977), опубликовано Shingo Iizumi, Maruzen Co., Ltd. (Например, относительно сочетаний наполнителей и подвижных фаз, которые могут быть использованы в колонке, можно сослаться на страницы 93-96.)
Документ (b): The Chemical Society of Japan ed., "Jikken Kagaku Koza (Experimental Chemistry Course) 20-1 Bunseki Kagaku (Analytical Chemistry)", 5-ое издание, стр. 130-151 (2007), опубликовано Seishiro Murata, Maruzen Co., Ltd. (Например, относительно конкретного применения и условий анализа методом хроматографии с обращенной фазой, можно сослаться на страницы 135-137.)
[0750]
(Способ измерения pH)
Значение рН измеряли с помощью индикатора концентрации ионов водорода типа стеклянный электрод. В качестве индикатора концентрации ионов водорода типа стеклянный электрод, например, может быть использован тип: HM-20P производства компании DKK-TOA CORPORATION.
[0751]
В настоящем документе, гидроксид калия, используемый в примерах, имеет чистоту, составляющую 95,5%.
[0752]
Пример 1
Получение 2-трифторметилбензимидазола
[Химическая формула 46]
В 100 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 10,8 г (100 ммоль) 1,2-фенилендиамина и 17,1 г (150 ммоль) трифторуксусной кислоты. Смесь нагревали с обратным холодильником в течение 4 часов. После охлаждения реакционную смесь выливали в водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Слой этилацетата промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении с получением 18,7 г серых кристаллов. Выход: 100%.
1H-ЯМР (400 МГц, CDCl3, относительно TMS) δ (м.д.): 7,37-7,47 (м, 2H), 7,56 (д, J=7,2 Гц, 1H), 7,90 (д, J=7,8 Гц, 1H), 9,96 (ушир, 1H).
[0753]
Пример 2
Получение 1-метил-2-трифторметилбензимидазола
[Химическая формула 47]
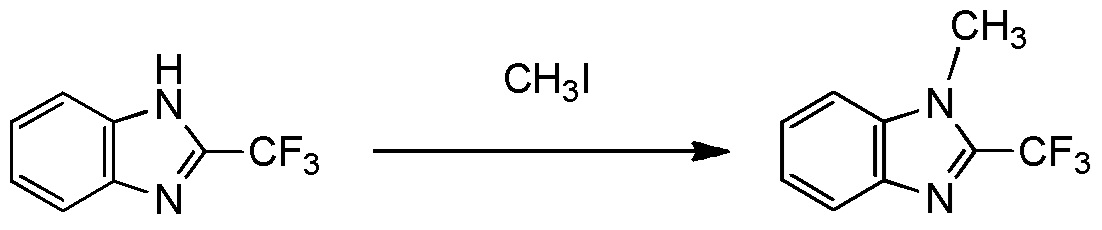
В 200 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 18,7 г (100 ммоль) 2-трифторметилбензимидазола, 16,6 г (120 ммоль) карбоната калия, 17,0 г (120 ммоль) метилиодида и 100 мл ацетона. Смесь нагревали с обратным холодильником в течение 3 часов. После того, как реакционная смесь охладилась, добавляли воду и полученную смесь экстрагировали этилацетатом. После того, как реакционная смесь охладилась, добавляли воду и полученную смесь экстрагировали этилацетатом. Слой этилацетата промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении с получением 19,7 г кристаллов серого цвета. Выход: 98%.
1H-ЯМР (400 МГц, CDCl3, относительно TMS) δ (м.д.): 3,96 (с, 3H), 7,37-7,46 (м, 3H), 7,88 (д, J=6,0 Гц, 1H).
[0754]
Пример 3
Получение 1,3-диметил-2-трифторметилбензимидазолия метилсульфата
[Химическая формула 48]
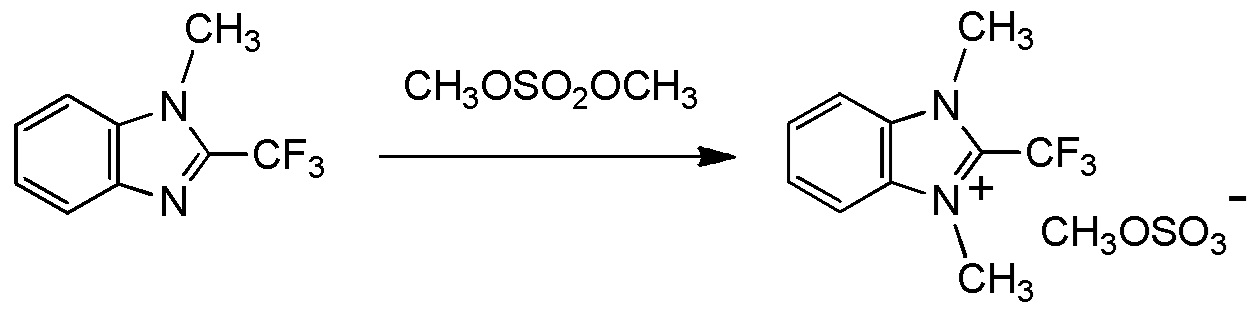
В 200 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 15,3 г (76 ммоль) 1-метил-2-трифторметилбензимидазола, 14,7 г (117 ммоль) диметилсульфата и 100 мл толуола. Смесь нагревали с обратным холодильником в течение 4 часов. После того, как реакционная смесь охладилась, растворитель отгоняли при пониженном давлении. Полученный остаток растворяли в дихлорметане, и затем добавляли диэтиловый эфир. Осажденные кристаллы собирали фильтрованием и сушили с получением 21,8 г кристаллов серого цвета. Выход: 88%.
1H-ЯМР (300 МГц, CDCl3, относительно TMS) δ (м.д.): 3,38 (с, 3H), 4,321 (с, 3H), 4,326 (с, 3H), 7,78-7,82, м, 2H), 7,91-7,94 (м, 2H).
[0755]
Пример 4
Получение 1,3-диметил-2-трифторметилбензимидазолия трифлата
[Химическая формула 49]
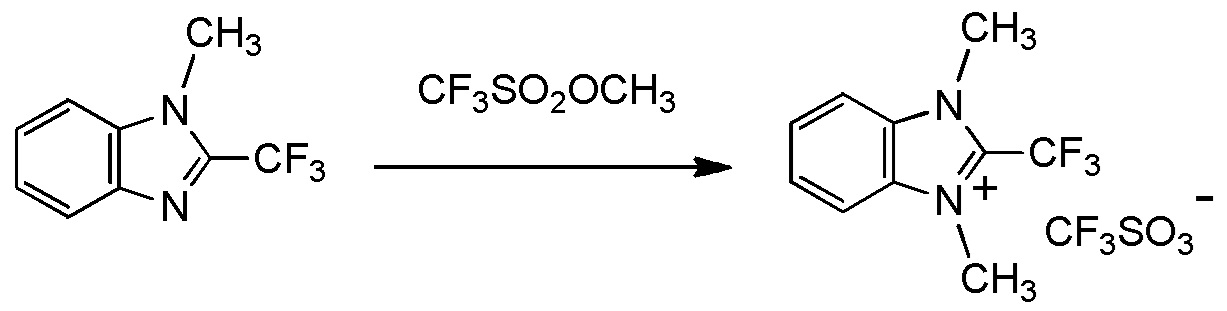
В 200 мл-овой грушевидной колбе, снабженной магнитной мешалкой, в 100 мл ацетонитрила растворяли 7,0 г (35 ммоль) 1-метил-2-трифторметилбензимидазола. Добавляли по каплям 10,3 г (62,5 ммоль) метилтрифлата (CF3SO2OCH3). Смесь перемешивали при комнатной температуре в течение 3 часов. Растворитель отгоняли при пониженном давлении. Полученный остаток растворяли в ацетонитрил, и затем добавляли диэтиловый эфир. Осажденные кристаллы собирали фильтрованием и сушили с получением 1,3 г кристаллов белого цвета. Полученный фильтрат концентрировали при пониженном давлении, и полученный остаток растворяли в дихлорметане, и затем добавляли диэтиловый эфир. Осажденные кристаллы собирали фильтрованием и сушили с получением 8,1 г кристаллов белого цвета. Выход: 74%.
1H-ЯМР (400 МГц, CDCl3, относительно TMS) δ (м.д.): 4,34 (с, 6H), 7,88-7,91, м, 2H), 8,01-8,04 (м, 2H).
[0756]
Пример 5
Получение 1,3-диметил-2-трифторметилбензимидазолия иодида
[Химическая формула 50]
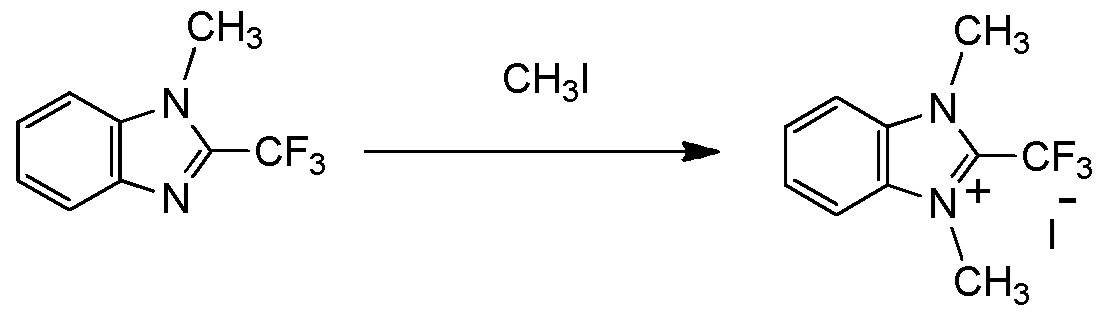
В 50 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 4,0 г (20 ммоль) 1-метил-2-трифторметилбензимидазола, 2,8 г (20 ммоль) метилиодида и 20 мл ацетонитрила. Смесь нагревали с обратным холодильником в течение 6 часов. После того, как реакционная смесь охладилась, растворитель отгоняли при пониженном давлении. Полученный остаток растворяли в дихлорметане, и затем добавляли диэтиловый эфир. Осажденные кристаллы собирали фильтрованием и сушили с получением 0,8 г кристаллов серого цвета. Выход: 12%.
1H-ЯМР (300 МГц, CDCl3, относительно TMS) δ (м.д.): 4,315 (с, 3H), 4,320 (с, 3H), 7,81-7,85 (м, 2H), 7,93-7,96 (м, 2H).
[0757]
Пример 6
Получение 1,3-диметил-2-трифторметилбензимидазолий тетрафторбората
[Химическая формула 51]
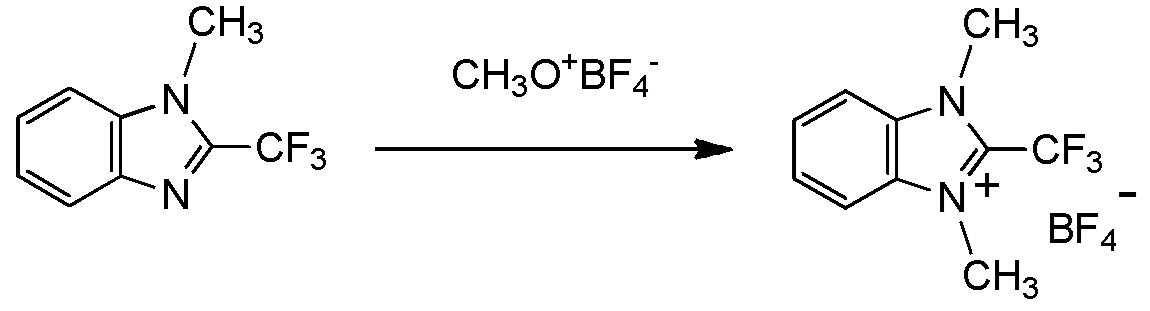
В 50 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 4,0 г (20 ммоль) 1-метил-2-трифторметилбензимидазола, 3,6 г (24 ммоль) тетрафторбората триметилоксония (CH3O+BF4-) и 20 мл дихлорметана, и смесь перемешивали при комнатной температуре в течение 8 часов. К реакционной смеси добавляли ацетонитрил и диэтиловый эфир. Осажденные кристаллы собирали фильтрованием и сушили с получением 4,9 г кристаллов серого цвета. К полученному фильтрату добавляли диэтиловый эфир. Осажденные кристаллы собирали фильтрованием и сушили с получением 0,7 г кристаллов серого цвета. Выход: 93%.
1H-ЯМР (400 МГц, CDCl3, относительно TMS) δ (м.д.): 4,26 (с, 6H), 7,86 (м, 2H), 8,25 (м, 2H).
[0758]
Пример 7
Получение 2-пентафторэтилбензимидазола
[Химическая формула 52]
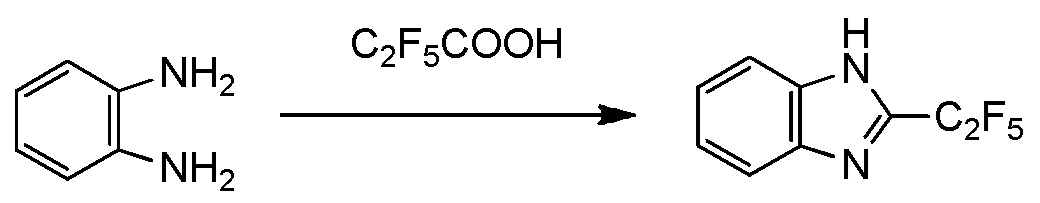
В 50 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 3,2 г (30 ммоль) 1,2-фенилендиамина и 9,8 г (60 ммоль) пентафторпропионовой кислоты. Смесь нагревали с обратным холодильником в течение 4 часов. После охлаждения реакционную смесь выливали в водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Слой этилацетата промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении с получением 7,3 г кристаллов. Выход: 100%.
1H-ЯМР (400 МГц, CDCl3, относительно TMS) δ (м.д.): 7,43 (м, 2H), 7,58 (м, 1H), 7,92 (м, 1H), 9,87 (ушир, 1H).
[0759]
Пример 8
Получение 1-метил-2-пентафторэтилбензимидазола
[Химическая формула 53]
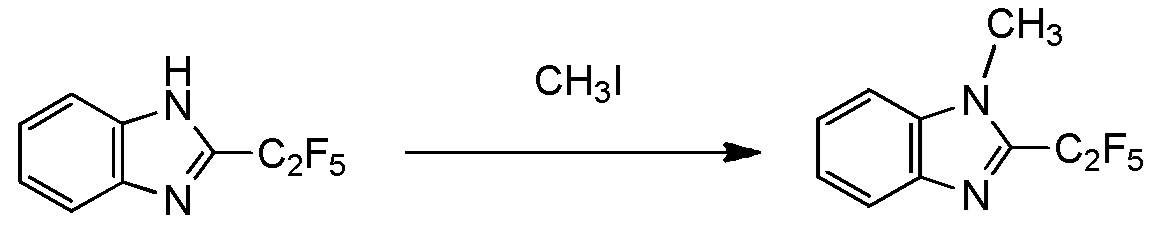
В 100 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 7,3 г (30 ммоль) 2-пентафторэтилбензимидазола, 4,6 г (33 ммоль) карбоната калия, 4,7 г (33 ммоль) метилиодида и 60 мл ацетона. Смесь нагревали с обратным холодильником в течение 3 часов. После того, как реакционная смесь охладилась, добавляли воду и полученную смесь экстрагировали этилацетатом. Слой этилацетата промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением 7,5 г кристаллов белого цвета. Выход: 99%.
-1H-ЯМР (400 МГц, CDCl3, относительно TMS) δ (м.д.): 3,98 (с, 3H), 7,37-7,47 (м, 3H), 7,91 (д, J=6,0 Гц, 1H).
[0760]
Пример 9
Получение 1,3-диметил-2-пентафторэтилбензимидазолия метилсульфата
[Химическая формула 54]
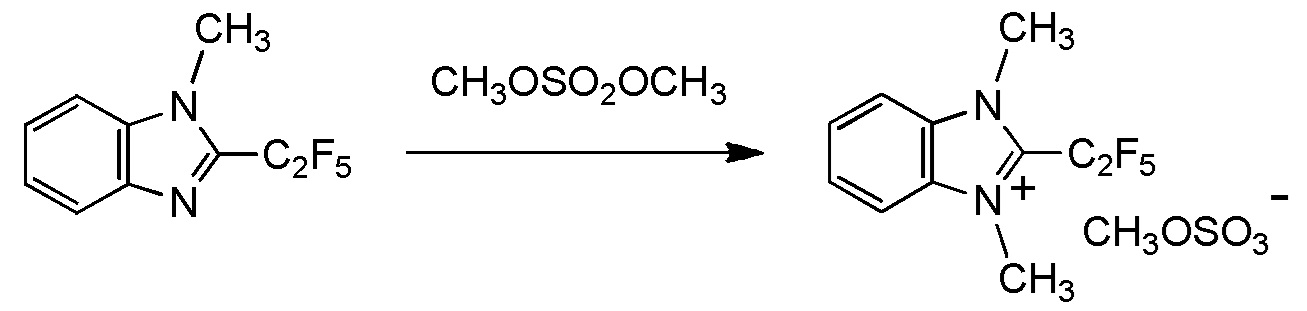
В 50 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 7,5 г (30 ммоль) 1-метил-2-пентафторэтилбензимидазола, 5,7 г (45 ммоль) диметилсульфата и 30 мл хлороформа. Смесь нагревали с обратным холодильником в течение 4 часов. Реакционную смесь охлаждали. Растворитель отгоняли при пониженном давлении, и полученный остаток растворяли в дихлорметане, и затем добавляли диэтиловый эфир, и осажденные кристаллы собирали фильтрацией. Эту операцию повторяли на фильтрате. В общей сложности получали 5,5 г кристаллов серого цвета. Выход: 49%.
1H-ЯМР (400 МГц, CDCl3, относительно TMS) δ (м.д.): 3,40 (с, 3H), 4,314 (с, 3H), 4,318 (с, 3H), 7,80-7,82, м, 2H), 7,95-7,98 (м, 2H).
[0761]
Пример 10
Получение 1,3-диметил-5-нитро-2-трифторметилбензимидазолия трифлата
[Химическая формула 55]
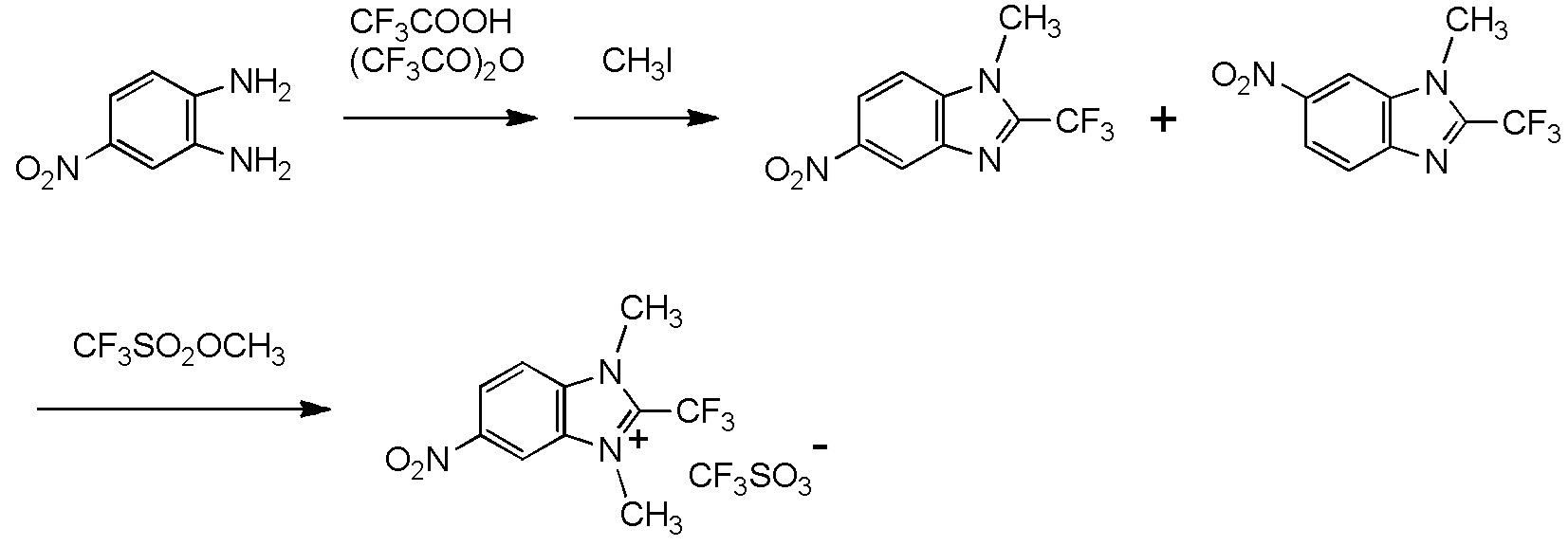
[0762]
(1)
В реакционный сосуд добавляли 6,1 г (40 ммоль) 4-нитро-1,2-фенилендиамина и 10 мл (135 ммоль) трифторуксусной кислоты, и затем добавляли 10 мл (71 ммоль) ангидрида трифторуксусной кислоты. Смесь нагревали с обратным холодильником в течение 48 часов. После охлаждения реакционную смесь выливали в водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Слой этилацетата промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния, и потом растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением 12,6 г кристаллов белого цвета.
[0763]
(2)
В другой реакционный сосуд добавляли кристаллы, полученные в пункте (1) выше, 5,6 г (40 ммоль) карбоната калия, 5,6 г (40 ммоль) метилиодида и 50 мл ацетона. Смесь нагревали с обратным холодильником в течение 4 часов. После того, как реакционная смесь охладилась, добавляли воду и полученную смесь экстрагировали этилацетатом. Слой этилацетата промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении, и оставшиеся кристаллы промывали растворителем, состоящим из смеси диизопропиловый эфир-этилацетат (7: 1). К промытым остаточным кристаллам добавляли хлороформ, и осажденный N,N'-дитрифторацетил-4-нитро-1,2-фенилендиамин собирали фильтрованием. Полученный фильтрат концентрировали при пониженном давлении с получением 3,9 г кристаллов белого цвета в виде смеси 1-метил-5-нитро-2-трифторметилбензимидазола и 1-метил-6-нитро-2-трифторметилбензимидазола.
[0764]
(3)
В еще один реакционный сосуд, кристаллы, полученные в пункте (2) выше, растворяли в 100 мл ацетонитрила, и затем добавляли по каплям 3,9 г (23,6 ммоль) метилтрифлата (CF3SO2OCH3). Смесь перемешивали при комнатной температуре в течение 3 часов, и перемешивали при 50°C в течение 1 часа. Растворитель отгоняли при пониженном давлении. Полученный остаток растворяли в дихлорметане и ацетонитриле, и затем добавляли диэтиловый эфир. Осажденные кристаллы собирали фильтрованием и сушили с получением 1,3 г трифлата 1,3-диметил-5-нитро-2-трифторметилбензимидазолия в виде кристаллов белого цвета. Полученный фильтрат концентрировали при пониженном давлении, и полученный остаток растворяли в дихлорметане, и затем добавляли диэтиловый эфир. Осажденные кристаллы собирали фильтрованием и сушили с получением 4,1 г трифлата 1,3-диметил-5-нитро-2-трифторметилбензимидазолия в виде кристаллов белого цвета. Выход: 25%.
1H-ЯМР (300 МГц, CDCl3, относительно TMS) δ (м.д.): 4,39 (с, 3H), 4,45 (с, 3H), 8,33 (д, J=9,4 Гц, 1H), 8,66 (д, J=9,4 Гц, 1H), 9,2 (с, 1H).
[0765]
Изомер, который можно было бы рассматривать как таутомер, подтверждали в 1H-ЯМР полученного соединения.
1H-ЯМР изомера (300 МГц, CDCl3, относительно TMS) δ (м.д.): 3,04 (с, 3H), 3,08 (с, 3H), 6,36 (д, J=12,5 Гц, 1H), 7,14 (д, J=1,1 Гц, 1H), 7,79 (дд, J=12,5 Гц, J=1,1 Гц, 1H).
[0766]
Пример 11
Получение 1-фенил-2-трифторметилбензимидазола
[Химическая формула 56]
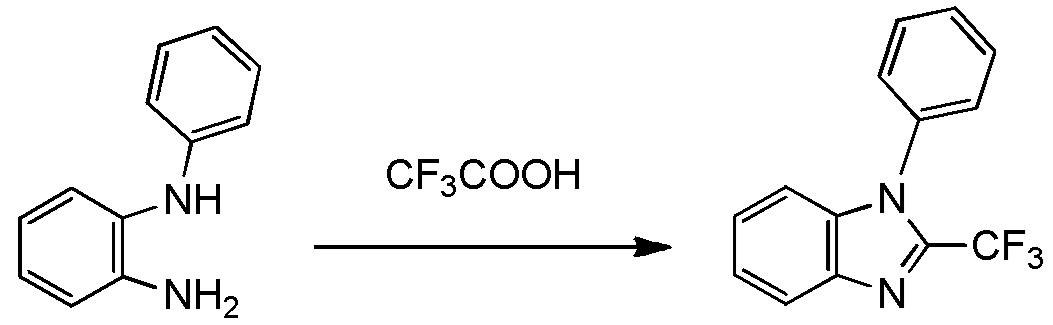
В 50 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 3,7 г (20 ммоль) N-фенил-1,2-фенилендиамина и 8,0 г (70 ммоль) трифторуксусной кислоты, и смесь нагревали с обратным холодильником в течение 4 часов. После охлаждения реакционную смесь выливали в водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Слой этилацетата промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением 4,8 г масла желтого цвета. Выход: 92%.
1H-ЯМР (400 МГц, CDCl3, относительно TMS) δ (м.д.): 7,15 (д, J=5,5 Гц, 1H), 7,37-7,45 (м, 4H), 7,59-7,60 (м, 3H), 7,94 (д, J=5,1 Гц, 1H).
[0767]
Пример 12
Получение 1-метил-3-фенил-2-трифторметилбензимидазолия метилсульфата
[Химическая формула 57]
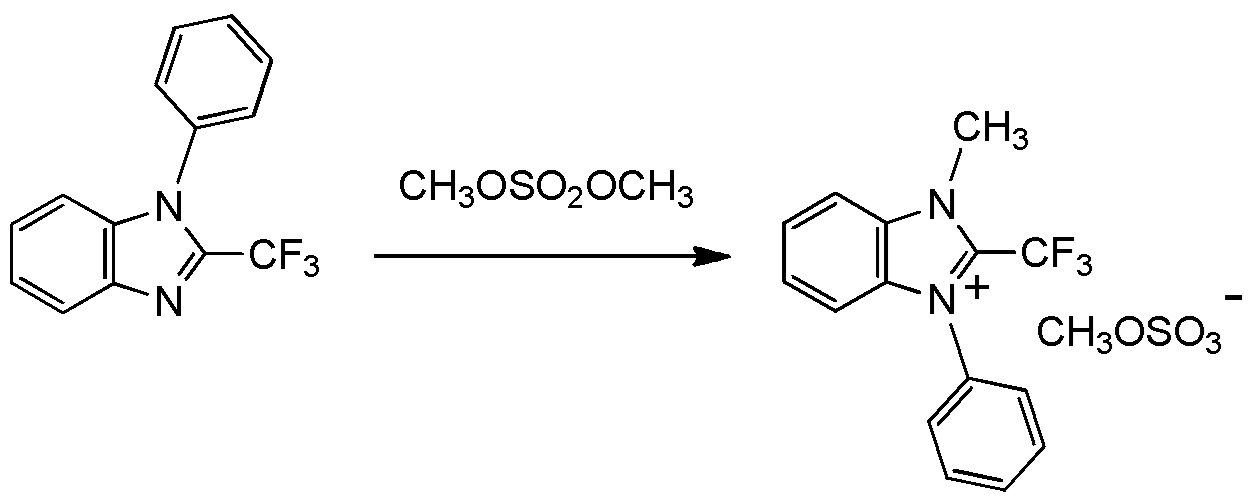
В 100 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 4,8 г (18 ммоль) 1-фенил-2-трифторметилбензимидазола, 3,5 г (28 ммоль) диметилсульфата и 30 мл ацетонитрила. Смесь нагревали с обратным холодильником в течение 4 часов. После того, как реакционная смесь охладилась, растворитель отгоняли при пониженном давлении. Полученный остаток растворяли в дихлорметане, и затем добавляли диэтиловый эфир. Осажденные кристаллы собирали фильтрованием и сушили с получением 6,4 г кристаллов светло-желтого цвета. Выход: 89%.
1H-ЯМР (400 МГц, CDCl3, относительно TMS) δ (м.д.): 3,13 (с, 3H), 4,50 (с, 3H), 7,30 (д, J=6,4 Гц, 1H), 7,67-7,74 (м, 4H), 7,78 (д, J=5,1 Гц, 2H), 7,84 (т, J=6,0 Гц, 1H), 8,06 (д, J=6,3 Гц, 1H).
[0768]
Пример 13
Получение 5-хлор-1,3-диметил-2-трифторметилбензимидазолия трифлата
[Химическая формула 58]
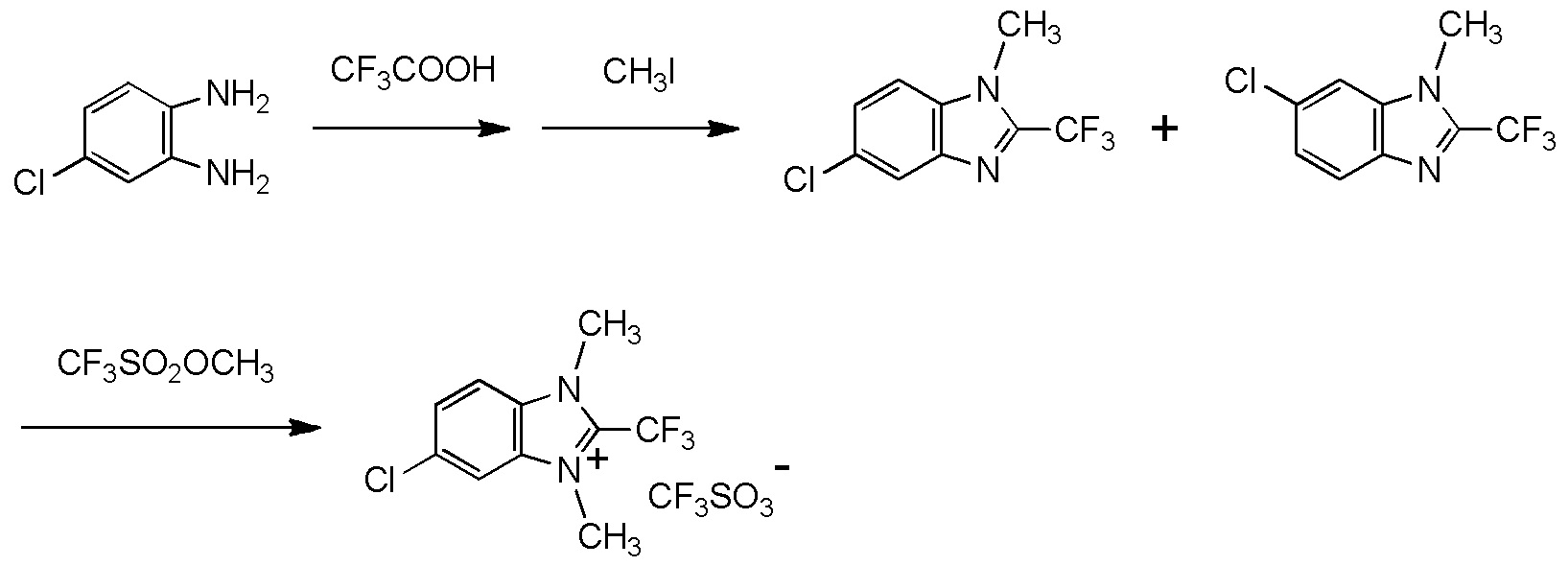
(1)
В реакционный сосуд добавляли 4,3 г (30 ммоль) 4-хлор-1,2-фенилендиамина и 10 мл (135 ммоль) трифторуксусной кислоты. Смесь нагревали с обратным холодильником в течение 5 часов. После охлаждения реакционную смесь выливали в водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Слой этилацетата промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении с получением 6,7 г кристаллов темно-коричневого цвета.
[0769]
(2)
В другой реакционный сосуд добавляли кристаллы, полученные в пункте (1) выше, 5,5 г (40 ммоль) карбоната калия, 5,7 г (40 ммоль) метилиодида и 80 мл ацетона. Смесь нагревали с обратным холодильником в течение 4 часов. После того, как реакционная смесь охладилась, добавляли воду и полученную смесь экстрагировали этилацетатом. Слой этилацетата промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении, и остаток очищали с помощью колоночной хроматографии на силикагеле с получением 7,0 г кристаллов белого цвета в виде смеси 5-хлор-1-метил-2-трифторметилбензимидазола и 6-хлор-1-метил-2-трифторметилбензимидазола.
[0770]
(3)
В еще один реакционный сосуд, кристаллы, полученные в пункте (2) выше, растворяли в 100 мл ацетонитрила, и затем 3,9 г (23,6 ммоль) метилтрифлата (CF3SO2OCH3) добавляли по каплям. Смесь перемешивали при комнатной температуре в течение 3 часов. Растворитель отгоняли при пониженном давлении. Полученный остаток растворяли в дихлорметане и ацетонитрил, и затем добавляли диэтиловый эфир. Осажденные кристаллы собирали фильтрованием и сушили с получением 1,3 г кристаллов белого цвета. Полученный фильтрат концентрировали при пониженном давлении, и полученный остаток растворяли в дихлорметане, и затем добавляли диэтиловый эфир. Осажденные кристаллы собирали фильтрованием и сушили с получением 10,5 г трифлата 5-хлор-1,3-диметил-2-трифторметилбензимидазолия в виде кристаллов белого цвета. Выход: 88%.
1H-ЯМР (300 МГц, CDCl3, относительно TMS) δ (м.д.): 4,24 (с, 3H), 4,27 (с, 3H), 7,75 (д, J=10,6 Гц, 1H), 7,85-7,88 (м, 2H).
[0771]
Пример 14
Получение 1-метил-4,5,6,7-тетрахлор-2-трифторметилбензимидазола
[Химическая формула 59]
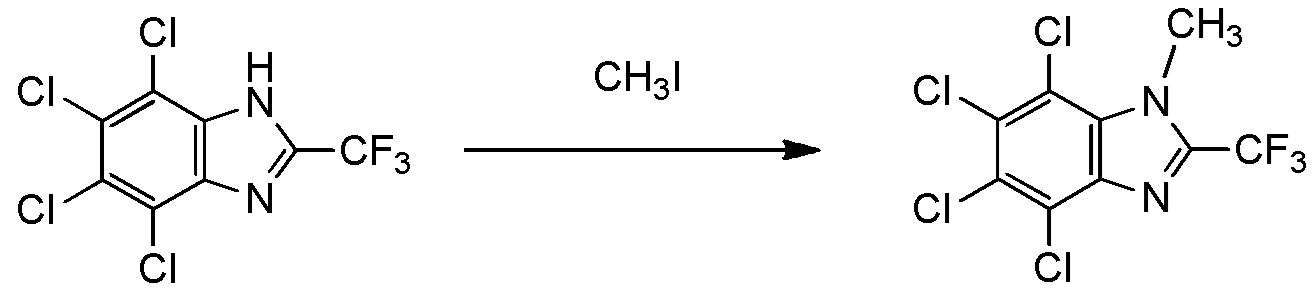
В 50 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 3,5 г (11 ммоль) 4,5,6,7-тетрахлор-2-трифторметилбензимидазола, 1,8 г (13 ммоль) карбоната калия, 1,7 г (12 ммоль) метилиодида и 30 мл ацетона. Смесь нагревали с обратным холодильником в течение 3 часов. Добавляли 5,1 г (36 ммоль) метилиодида и смесь нагревали с обратным холодильником в течение 1 часа. После того, как реакционная смесь охладилась, добавляли воду и полученную смесь экстрагировали этилацетатом. Слой этилацетата промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении с получением, 3,2 г кристаллов молочно-белого цвета. Выход: 88%.
1H-ЯМР (400 МГц, CDCl3, относительно TMS) δ (м.д.): 4,28 (с, 3H).
[0772]
Пример 15
Получение 1,3-диметил-4,5,6,7-тетрахлор-2-трифторметилбензимидазолия метилсульфата
[Химическая формула 60]
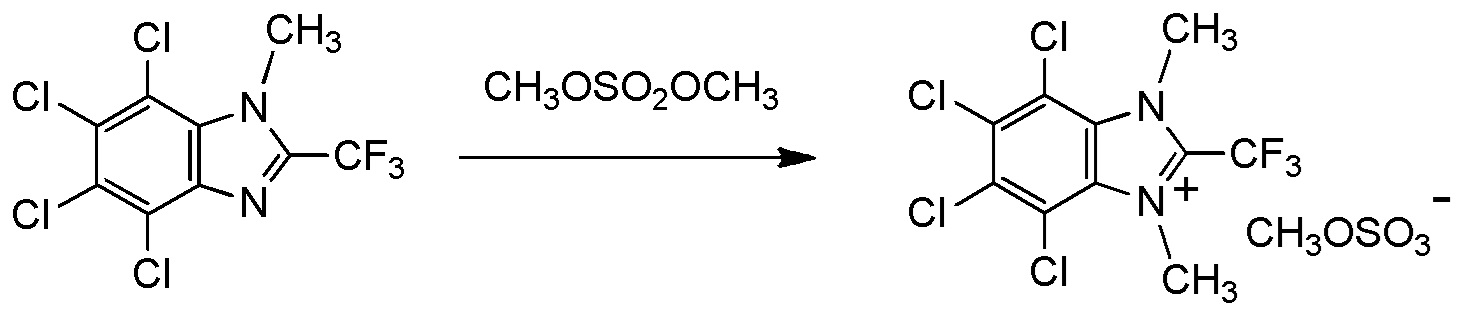
В 50 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 0,67 г (2 ммоль) 1-метил-4,5,6,7-тетрахлор-2-трифторметилбензимидазола и 2,8 г (22 ммоль) диметилсульфата. Смесь перемешивали при 140°C в течение 3 часов. Реакционную смесь охлаждали. Добавляли дихлорметан, и затем добавляли диизопропиловый эфир, и осажденные кристаллы собирали фильтрованием и сушили. Полученный фильтрат концентрировали, и полученный остаток растворяли в дихлорметане, и затем добавляли диэтиловый эфир. Осажденные кристаллы собирали фильтрованием и сушили. Получали в общей сложности 0,74 г кристаллов белого цвета. Выход: 80%.
1H-ЯМР (400 МГц, CDCl3, относительно TMS) δ (м.д.): 3,48 (с, 3H), 4,64 (с, 6H).
[0773]
Пример 16
Получение 1,3,5,7-тетраметил-2,6-бис(трифторметил)-3,5-дигидробензимидазолий бисметилсульфата
[Химическая формула 61]
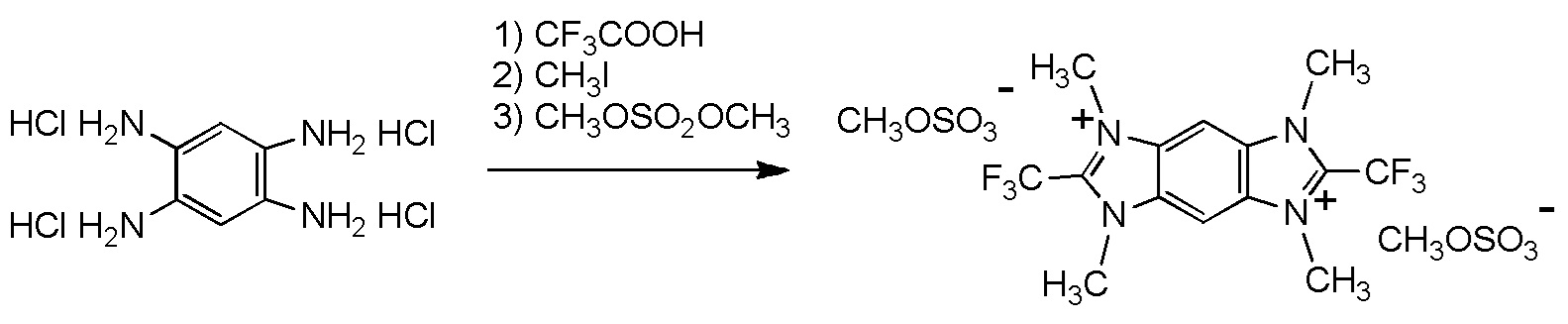
[0774]
(1)
В реакционный сосуд добавляли 2,2 г (7,6 ммоль)) 1,2,4,5-бензолтетрамин тетрагидрохлорида и 7,0 г (61 ммоль) трифторуксусной кислоты, и смесь нагревали с обратным холодильником в течение 3 часов, и затем добавляли 1,6 г (16 ммоль) триэтиламина, и смесь нагревали с обратным холодильником в течение 2 часов. После охлаждения реакционную смесь выливали в водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Слой этилацетата промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении с получением 0,8 г кристаллов насыщенно-черного цвета.
[0775]
(2)
В другой реакционный сосуд добавляли кристаллы, полученные в пункте (1) выше, 0,9 г (6,5 ммоль) карбоната калия, 3,9 г (27 ммоль) метилиодида и 30 мл ацетона, и смесь нагревали с обратным холодильником в течение 3 часов. После того, как реакционная смесь охладилась, добавляли воду и полученную смесь экстрагировали этилацетатом. Слой этилацетата промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении с получением 0,3 г кристаллов насыщенно-черного цвета.
[0776]
(3)
В другой реакционный сосуд добавляли кристаллы, полученные в пункте (2) выше, и 5,8 г (46 ммоль) диметилсульфата. Смесь перемешивали при 140°C в течение 4 часов. К реакционной смеси добавляли диизопропиловый эфир и осажденные кристаллы собирали фильтрованием и сушили с получением 0,51 г бисметилсульфата 1,3,5,7-тетраметил-2,6-бис(трифторметил)-3,5-дигидробензимидазолия в виде кристаллов насыщенно-черного цвета. Выход: 12%.
1H-ЯМР (300 МГц, CDCl3, относительно TMS) δ (м.д.): 3,14 (с, 6H), 3,34 (с, 6H), 4,20 (с, 6H), 6,78 (с, 2H).
[0777]
Пример 17
Получение 1,3,5-триметил-2-трифторметилбензимидазолия метилсульфата
[Химическая формула 62]
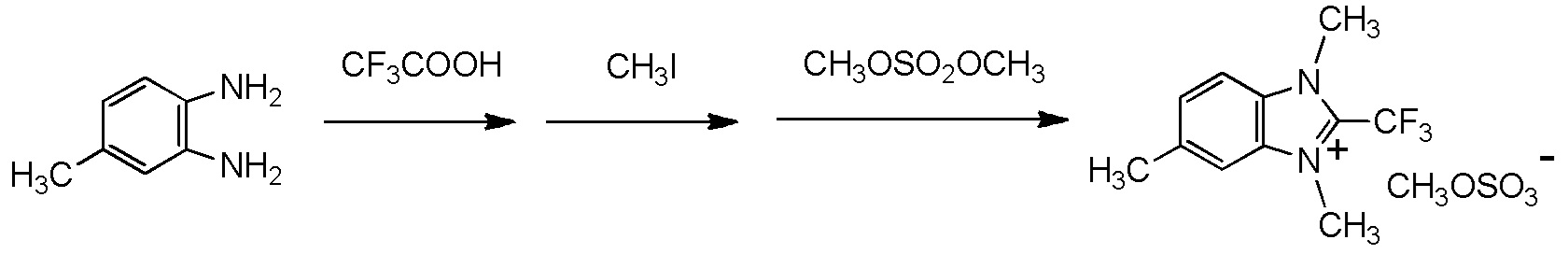
[0778]
(1)
В реакционный сосуд добавляли 2,44 г (20 ммоль) 4-метил-1,2-фенилендиамина и 10 г (88 ммоль) трифторуксусной кислоты. Смесь нагревали с обратным холодильником в течение 3 часов. После охлаждения реакционную смесь выливали в водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Слой этилацетата промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении с получением 4,08 г кристаллов светло-коричневого цвета.
[0779]
(2)
В другой реакционный сосуд добавляли кристаллы, полученные в пункте (1) выше, 3,3 г (24 ммоль) карбоната калия, 3,12 г (22 ммоль) метилиодида и 30 мл ацетона. Смесь нагревали с обратным холодильником в течение 2 часов. После того, как реакционная смесь охладилась, добавляли воду и полученную смесь экстрагировали этилацетатом. Слой этилацетата промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении с получением 4,26 г кристаллов коричневого цвета.
[0780]
(3)
В еще одном реакционном сосуде кристаллы, полученные в пункте (2) выше, растворяли в 30 мл хлороформа, и затем добавляли 3,78 г (30 ммоль) диметилсульфата. Смесь нагревали с обратным холодильником в течение 5 часов. К реакционной смеси добавляли диэтиловый эфир, и осажденные кристаллы собирали фильтрованием и сушили с получением 5,88 г кристаллов фиолетового цвета. Выход: 87%.
1H-ЯМР (300 МГц, CDCl3, относительно TMS) δ (м.д.): 2,60 (с, 3H), 3,38 (с, 3H), 4,25-4,28 (м, 6H), 7,58 (д, J=8,7 Гц, 1H), 7,71 (с, 1H), 7,83 (д, J=8,7 Гц, 1H).
[0781]
Пример 18
Получение 1,3,5,6-тетраметил-2-трифторметилбензимидазолия метилсульфата
[Химическая формула 63]
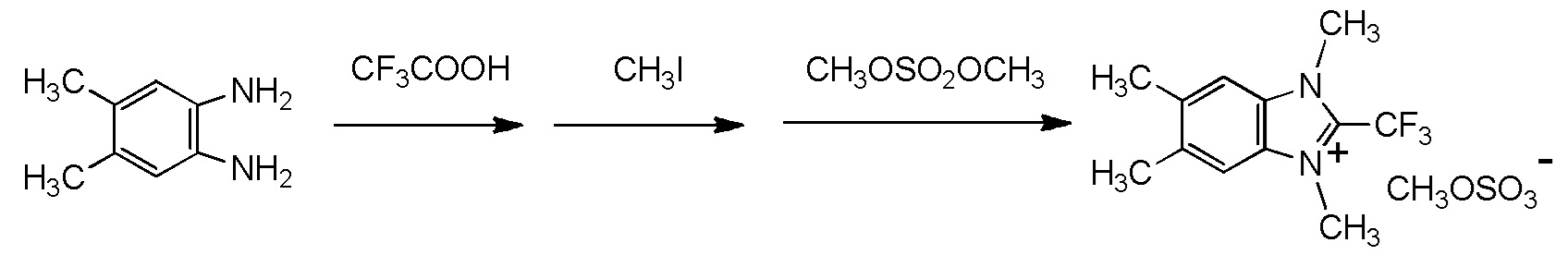
[0782]
(1)
В реакционный сосуд добавляли 2,72 г (20 ммоль) 4,5-диметил-1,2-фенилендиамина и 6 г (53 ммоль) трифторуксусной кислоты. Смесь нагревали с обратным холодильником в течение 3 часов. После охлаждения реакционную смесь выливали в водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Слой этилацетата промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении с получением 4,08 г кристаллов светло-коричневого цвета.
[0783]
(2)
В другой реакционный сосуд добавляли кристаллы, полученные в пункте (1) выше, 3,31 г (24 ммоль) карбоната калия, 3,12 г (22 ммоль) метилиодида и 30 мл ацетона. Смесь нагревали с обратным холодильником в течение 2 часов. После того, как реакционная смесь охладилась, добавляли воду и полученную смесь экстрагировали этилацетатом. Слой этилацетата промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении с получением 4,35 г кристаллов коричневого цвета.
[0784]
(3)
В еще один реакционный сосуд, кристаллы, полученные в пункте (2) выше, растворяли в 30 мл хлороформа, и затем добавляли 3,78 г (30 ммоль) диметилсульфата. Смесь нагревали с обратным холодильником в течение 5 часов. К реакционной смеси добавляли диэтиловый эфир, и осажденные кристаллы собирали фильтрованием и сушили с получением 6,1 г кристаллов коричневого цвета. Выход: 86%.
1H-ЯМР (300 МГц, CDCl3, относительно TMS) δ (м.д.): 2,49 (с, 6H), 3,42 (с, 3H), 4,258 (с, 3H), 4,263 (с, 3H), 7,68 (с, 2H).
[0785]
Пример 19
Получение 5,6-дихлор-1,3-диметил-2-трифторметилбензимидазолия метилсульфата
[Химическая формула 64]
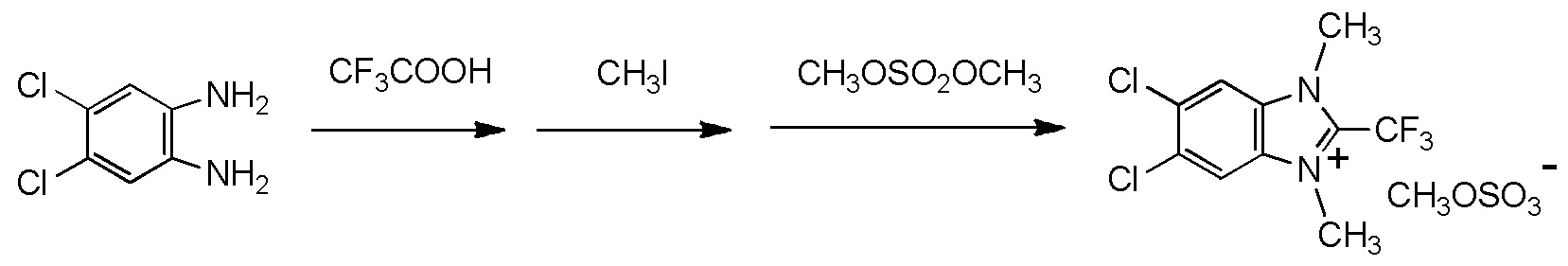
[0786]
(1)
В реакционный сосуд добавляли 5,23 г (29,5 ммоль) 4,5-дихлор-1,2-фенилендиамина, 16,85 г (148 ммоль) трифторуксусной кислоты и 30 мл толуола. Смесь нагревали с обратным холодильником в течение 3 часов. После охлаждения реакционную смесь выливали в водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Слой этилацетата промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении. Полученный остаток промывали растворителем, состоящим из смеси диизопропиловый эфир-гексан с получением 6,75 г кристаллов светло-коричневого цвета.
[0787]
(2)
В другой реакционный сосуд добавляли 2,55 г (10 ммоль) кристаллов, полученных в пункте (1) выше, 1,66 г (12 ммоль) карбоната калия, 1,56 г (11 ммоль) метилиодида и 30 мл ацетона. Смесь нагревали с обратным холодильником в течение 2 часов. После того, как реакционная смесь охладилась, добавляли воду и полученную смесь экстрагировали этилацетатом. Слой этилацетата промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении с получением 2,65 г кристаллов коричневого цвета.
[0788]
(3)
В еще одном реакционном сосуде растворяли кристаллы, полученные в пункте (2) выше, в 20 мл хлороформа, и затем добавляли 1,89 г (15 ммоль) диметилсульфата, и смесь нагревали с обратным холодильником в течение 4 часов. Хлороформ отгоняли при пониженном давлении, и затем добавляли 3,17 г (25 ммоль) диметилсульфата, и смесь перемешивали при 140°C в течение 1 часа. К реакционной смеси добавляли диэтиловый эфир и дихлорметан, и осажденные кристаллы собирали фильтрованием и сушили с получением 3,06 г кристаллов серого цвета. Выход: 79%.
1H-ЯМР (400 МГц, CDCl3, относительно TMS) δ (м.д.): 3,47 (с, 3H), 4,31 (с, 3H), 4,32 (с, 3H) 8,55 (с, 2H).
[0789]
Пример 20
Получение 1-метил-3-этил-2-трифторметилбензимидазолия этилсульфата
[Химическая формула 65]
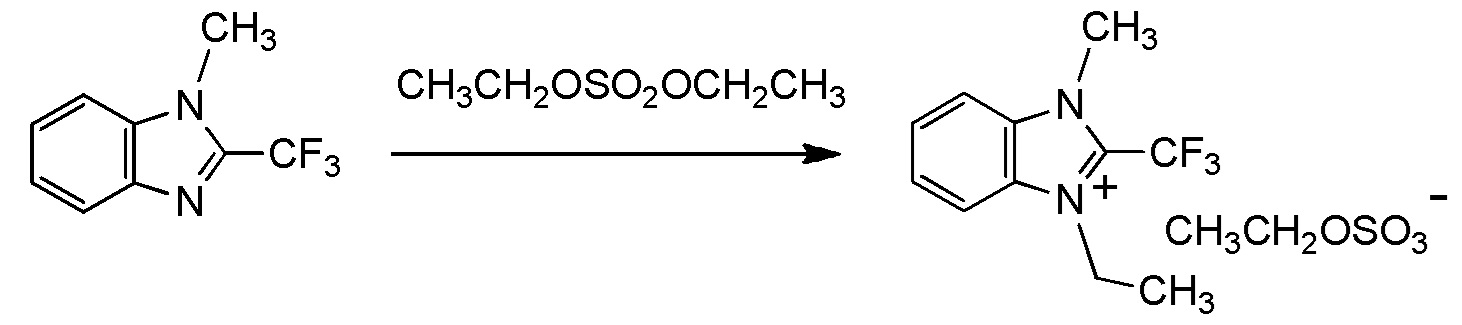
В реакционный сосуд, 2,0 г (10 ммоль) 1-метил-2-трифторметилбензимидазола растворяли в 10 мл толуола, и затем добавляли 2,8 г (18 ммоль) диэтилсульфата. Смесь нагревали с обратным холодильником в течение 2 часов. После охлаждения до комнатной температуры, к реакционному раствору добавляли ацетон и гексан. Осажденные кристаллы собирали фильтрованием и сушили с получением 1,2 г кристаллов белого цвета. Выход: 34%.
1H-ЯМР (400 МГц, CDCl3, относительно TMS) δ (м.д.): 1,13 (т, J=7,1 Гц, 3H), 1,65 (т, J=7,3 Гц, 3H), 3,82 (кв, J=7,1 Гц, 2H), 4,35 (с, 3H), 4,79 (кв, J=7,3 Гц, 2H), 7,77-7,82 (м, 2H), 7,89-8,01 (м, 2H).
[0790]
Пример 21
Получение 1-N,N-диметиламинокарбонилметил-3-метил-2-трифторметилбензимидазолия метилсульфата
[Химическая формула 66]
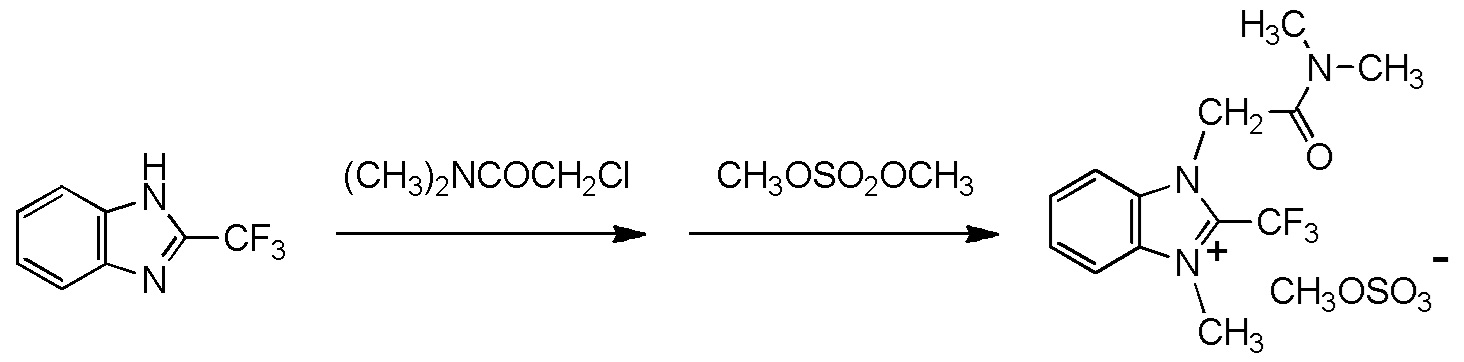
[0791]
(1)
В реакционный сосуд добавляли 0,93 г (5 ммоль) 2-трифторметилбензимидазола,0,67 г (5,5 ммоль) α-хлор-N,N-диметилацетамида, 1,08 г (7,8 ммоль) карбоната калия и 10 мл ДМФ. Смесь перемешивали при 50°C в течение 8 часов. После того, как реакционная смесь охладилась, добавляли воду и полученную смесь экстрагировали этилацетатом. Слой этилацетата промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением 0,84 г масла.
[0792]
(2)
В другом реакционном сосуде в 10 мл ацетонитрила растворяли масло, полученное в пункте (1) выше, и затем добавляли 0,59 г (4,7 ммоль) диметилсульфата. Смесь нагревали с обратным холодильником в течение 4 часов. Ацетонитрил отгоняли при пониженном давлении, и затем к остатку добавляли диэтиловый эфир и дихлорметан. Осажденные кристаллы собирали фильтрованием и сушили с получением 0,47 г кристаллов белого цвета. Выход: 24%.
1H-ЯМР (400 МГц, CDCl3, относительно TMS) δ (м.д.): 3,00 (с, 3H), 3,26 (с, 3H), 3,52 (с, 3H) 4,27 (с, 3H), 5,89 (с, 2H), 7,72-7,76 (м, 2H), 7,80-7,83 (м, 1H), 8,16-8,18 (м, 1H).
[0793]
Пример 22
Получение 1,3-диметил-2-гептафторпропилбензимидазолия метилсульфата
[Химическая формула 67]
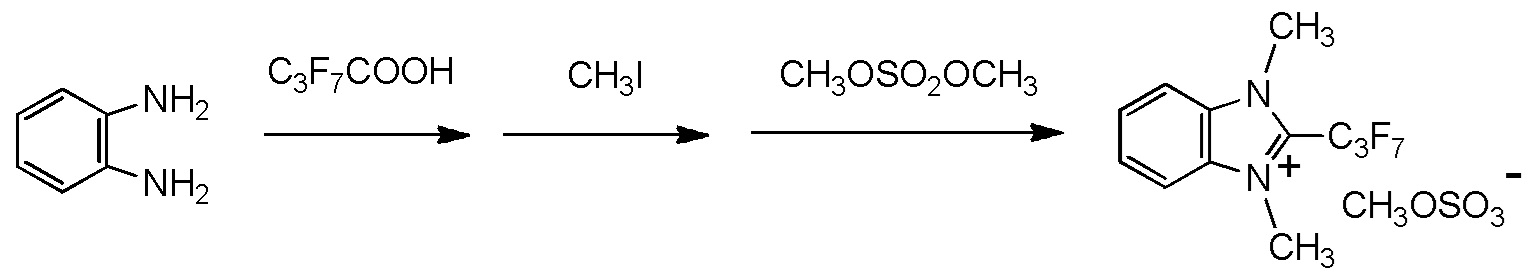
[0794]
(1)
В реакционный сосуд добавляли 1,08 г (10 ммоль) 1,2-фенилендиамина и 4,28 г (20 ммоль) гептафторбутановой кислоты, и смесь нагревали с обратным холодильником в течение 4 часов. После охлаждения реакционную смесь выливали в водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Слой этилацетата промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении с получением 2,7 г кристаллов.
[0795]
(2)
В другой реакционный сосуд добавляли кристаллы, полученные в пункте (1) выше, 1,96 г (14 ммоль) карбоната калия, 2,01 г (14 ммоль) метилиодида и 30 мл ацетона. Смесь нагревали с обратным холодильником в течение 3 часов. После того, как реакционная смесь охладилась, добавляли воду и полученную смесь экстрагировали этилацетатом. Слой этилацетата промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением 2,86 г масла.
[0796]
(3)
В еще одном реакционном сосуде, масло, полученное в пункте (2) выше, растворяли в 20 мл ацетонитрила, и затем добавляли 1,8 г (14 ммоль) диметилсульфата. Смесь нагревали с обратным холодильником в течение 15 часов. Ацетонитрил отгоняли при пониженном давлении. Процедуру добавления этилацетата к полученному остатку и удаление раствора супернатанта этилацетата повторяли несколько раз. Растворитель отгоняли при пониженном давлении из полученного остатка с получением 2,0 г похожих на щербет твердых веществ. Выход: 49%.
1H-ЯМР (400 МГц, CDCl3, относительно TMS) δ (м.д.): 3,48 (с, 3H), 4,32 (с, 6H), 7,81-7,84 (м, 2H), 7,98-8,00 (м, 2H).
[0797]
Пример 23
Получение 1,3-диметил-2-ундекафторпентилбензимидазолия метилсульфата
[Химическая формула 68]
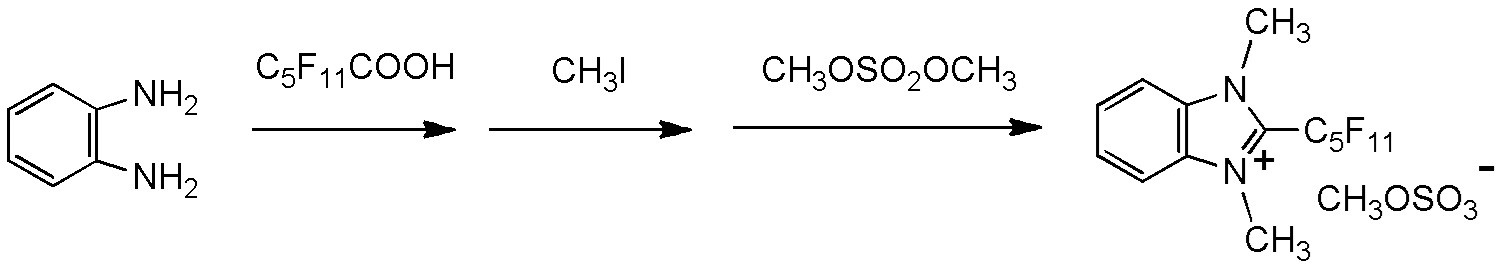
[0798]
(1)
В реакционный сосуд добавляли 0,54 г (5 ммоль) 1,2-фенилендиамина и 3,14 г (10 ммоль) ундекафторгексановой кислоты, и смесь нагревали с обратным холодильником в течение 5 часов. После охлаждения реакционную смесь выливали в водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Слой этилацетата промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении с получением кристаллов.
[0799]
(2)
В другой реакционный сосуд добавляли кристаллы, полученные в пункте (1) выше, 1,04 г (7,5 ммоль) карбоната калия, 1,06 г (7,5 ммоль) метилиодида и 30 мл ацетона. Смесь нагревали с обратным холодильником в течение 3 часов. После того, как реакционная смесь охладилась, добавляли воду и полученную смесь экстрагировали этилацетатом. Слой этилацетата промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением 1,9 г кристаллов.
[0800]
(3)
В еще один реакционный сосуд, кристаллы, полученные в пункте (2) выше, растворяли в 7,5 мл ацетонитрила и затем добавляли 0,95 г (7,5 ммоль) диметилсульфата. Смесь нагревали с обратным холодильником в течение 6 часов. Ацетонитрил отгоняли при пониженном давлении. Процедуру добавления этилацетата к полученному остатку и удаление раствора супернатанта этилацетата повторяли несколько раз. К полученному остатку добавляли этилацетат, и осажденные кристаллы собирали фильтрованием и сушили с получением 0,9 г кристаллов. Выход: 36%.
1H-ЯМР (400 МГц, CDCl3, относительно TMS) δ (м.д.): 3,40 (с, 3H), 4,33 (с, 6H), 7,81-7,84 (м, 2H), 7,94-7,96 (м, 2H).
[0801]
Пример 24
Получение 1,3-диметил-2-трифторметилбензимидазолий трифторацетата
[Химическая формула 69]
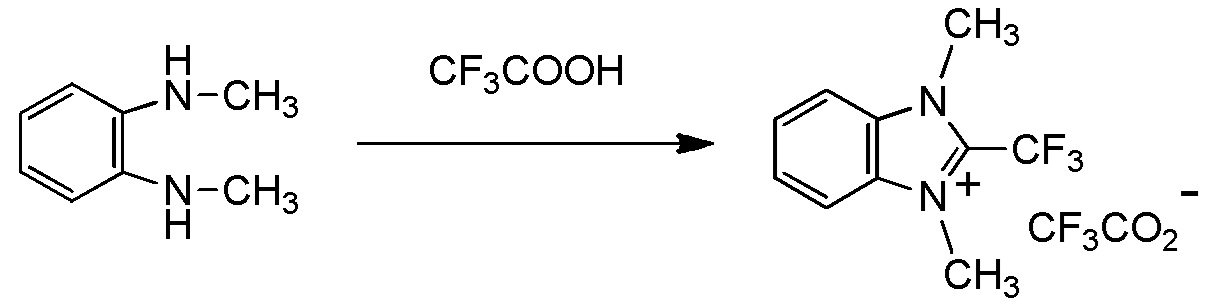
В 50 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 0,42 г (3,08 ммоль) N,N'-диметил-1,2-фенилендиамина и около 10 мл трифторуксусной кислоты. Смесь нагревали с обратным холодильником в течение 4 часов. После того, как реакционная смесь охладилась, растворитель отгоняли при пониженном давлении с получением 1,68 г масла насыщенно-черного цвета. ЯМР анализ подтверждал, что указанное масло содержит трифторацетат 1,3-диметил-2-трифторметилбензимидазолия в качестве основного компонента.
1H-ЯМР (400 МГц, CDCl3, относительно TMS) δ (м.д.): 4,33 (с, 6H), 7,85-7,92 (м, 4H).
[0802]
Некоторые из соединений, представленных общей формулой (1), могут также быть получены аналогичным или подобным способом, описанным в примере 24.
[0803]
Пример 25
Получение (5-бензилоксипентил)трифторметилсульфида
[Химическая формула 70]
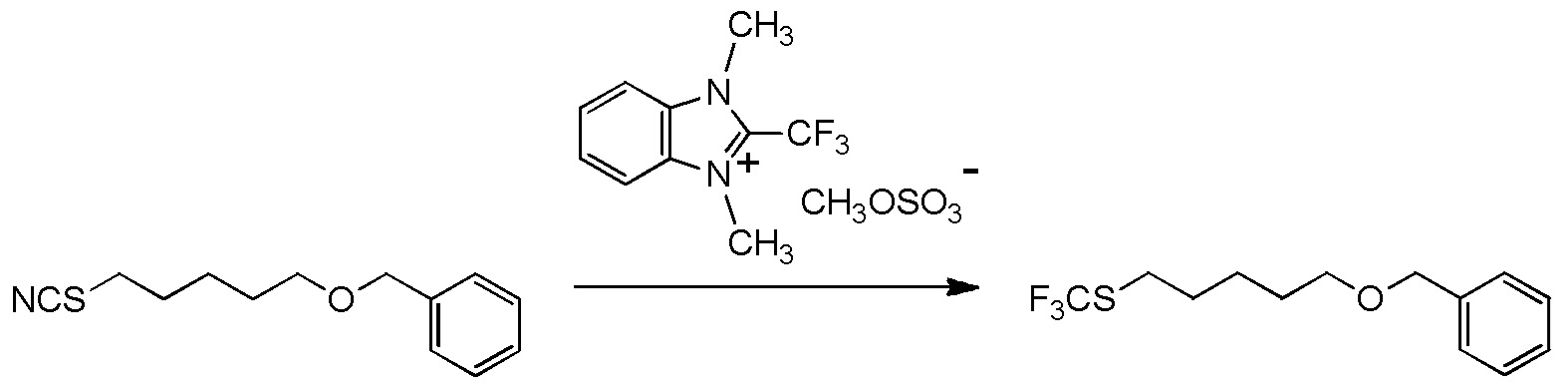
В 6 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 118 мг (0,5 ммоль) 1-бензилокси-5-тиоцианатопентана, 300 мг молекулярного сита 4A (производство Sigma-Aldrich Co. LLC.; Молекулярные сита, 4A, порошок, <5 микрон, активированный), 196 мг (0,6 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 1,5 мл ДМФ. Смесь перемешивали при -10°C в течение 30 минут, и затем добавляли 52 мг (1,26 ммоль) гидроксида натрия. Смесь перемешивали при -10°C в течение 16 часов. Образование (5-бензилоксипентил)трифторметилсульфида (ион-предшественник; 278) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 58% (5-бензилоксипентил)трифторметилсульфида (целевое соединение), 3% 1-бензилокси-5-тиоцианатопентана (исходное соединение), 6% 1,2-бис[5-(бензилокси)пентил] дисульфида (побочный продукт), 31% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента) и 2% 1,3-диметил-2,2-бис(трифторметил)-2,3-дигидро-бензимидазола (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-бензилоксипентил)трифторметилсульфида (целевое соединение) составлял 87%.
[0804]
Пример 26
Получение (5-бензилоксипентил)трифторметилсульфида
[Химическая формула 71]
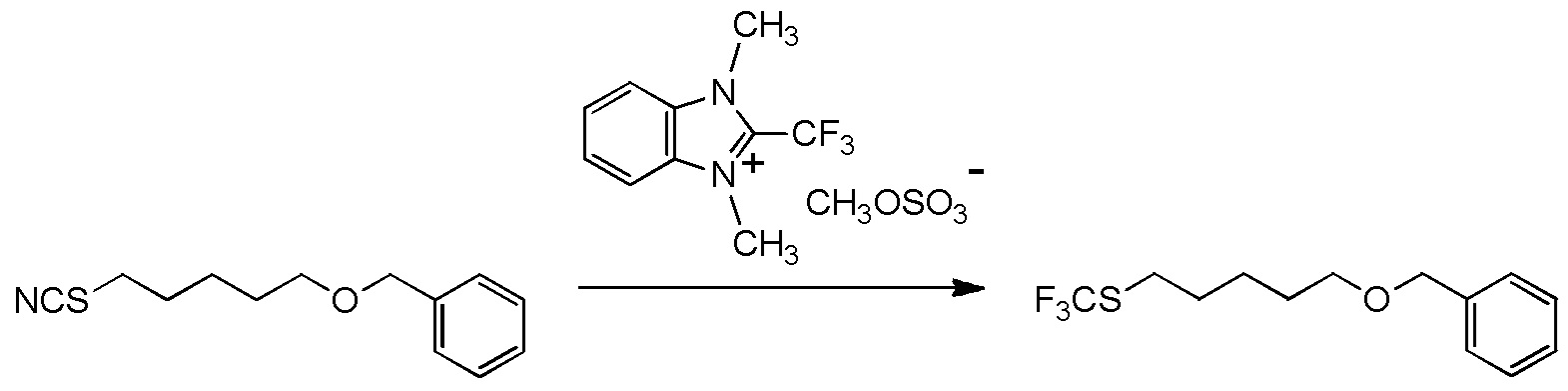
В 20 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 471 мг (2 ммоль) 1-бензилокси-5-тиоцианатопентана, 1,2 г молекулярного сита 4A (производство Sigma-Aldrich Co. LLC.; Молекулярные сита, 4A, порошок, <5 микрон, активированный), 783 мг (2,4 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 6 мл ДМФ. Смесь перемешивали при -10°C в течение 30 минут, и затем добавляли 294 мг (5,04 ммоль) гидроксида калия. Смесь перемешивали при -10°C в течение 16 часов. Образование (5-бензилоксипентил)трифторметилсульфида (ион-предшественник; 278) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 59% (5-бензилоксипентил)трифторметилсульфида (целевое соединение), 5% 1-бензилокси-5-тиоцианатопентана (исходное соединение), 1% 1,2-бис[5-(бензилокси)пентил]дисульфида (побочный продукт), 32% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента) и 1% 1,3-диметил-2,2-бис(трифторметил)-2,3-дигидро-бензимидазола (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-бензилоксипентил)трифторметилсульфида (целевое соединение) составлял 90%.
[0805]
Пример 27
Получение (5-бензилоксипентил)трифторметилсульфида
[Химическая формула 72]
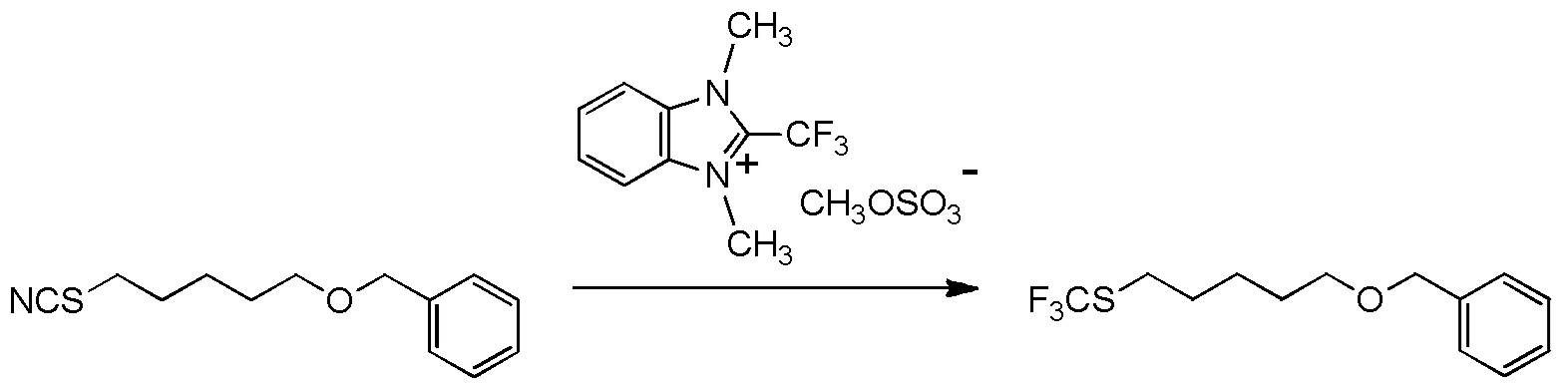
В 6 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 118 мг (0,5 ммоль) 1-бензилокси-5-тиоцианатопентана, 300 мг молекулярного сита 4A (производство Sigma-Aldrich Co. LLC.; молекулярные сита, 4A, порошок, <5 микрон, активированный), 196 мг (0,6 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 1,5 мл ДМФ. Смесь перемешивали при -10°C в течение 30 минут и затем добавляли 31 мг (1,26 ммоль) гидроксида лития. Смесь перемешивали при -10°C в течение 16 часов. Образование (5-бензилоксипентил)трифторметилсульфида (ион-предшественник; 278) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 59% (5-бензилоксипентил)трифторметилсульфида (целевое соединение), 5% 1-бензилокси-5-тиоцианатопентана (исходное соединение), 33% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента) и 1% 1,3-диметил-2,2-бис(трифторметил)-2,3-дигидро-бензимидазола (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-бензилоксипентил)трифторметилсульфида (целевое соединение) составлял 96%.
[0806]
Пример 28
Получение (5-бензилоксипентил)трифторметилсульфида
[Химическая формула 73]
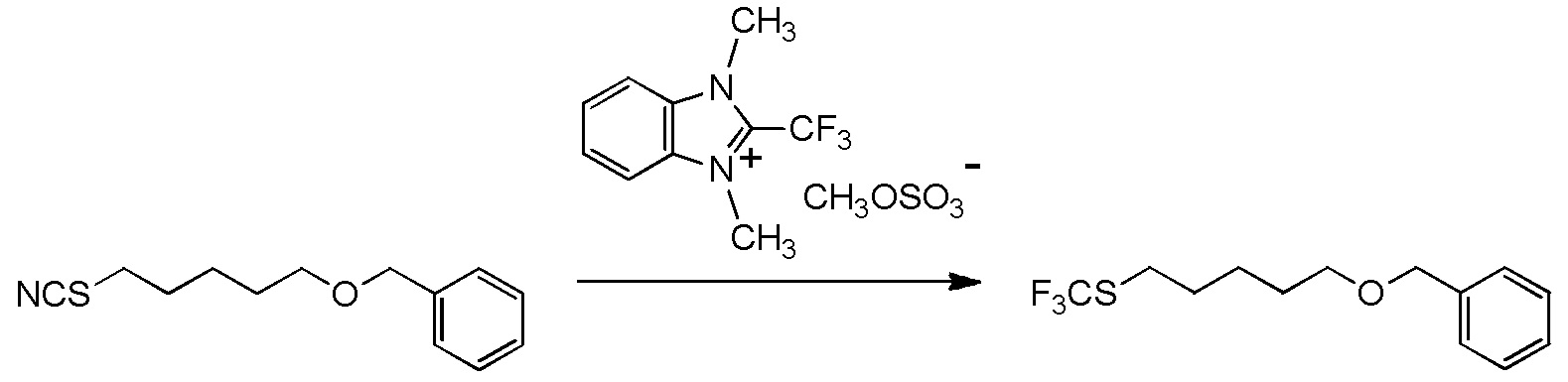
В 6 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 118 мг (0,5 ммоль) 1-бензилокси-5-тиоцианатопентана, 196 мг (0,6 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия, 207 мг (1,5 ммоль) карбоната калия, 161 мг (0,5 ммоль) бромида тетрабутиламмония и 1,5 мл толуола. Смесь перемешивали при комнатной температуре в течение 15 часов. Образование (5-бензилоксипентил)трифторметилсульфида (ион-предшественник; 278) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 19% (5-бензилоксипентил)трифторметилсульфида (целевое соединение), 35% 1-бензилокси-5-тиоцианатопентана (исходное соединение), 3% 1,2-бис[5-(бензилокси)пентил] дисульфида (побочный продукт) и 42% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-бензилоксипентил)трифторметилсульфида (целевое соединение) составлял 44%.
[0807]
Пример 29
Получение (5-бензилоксипентил)трифторметилсульфида
[Химическая формула 74]
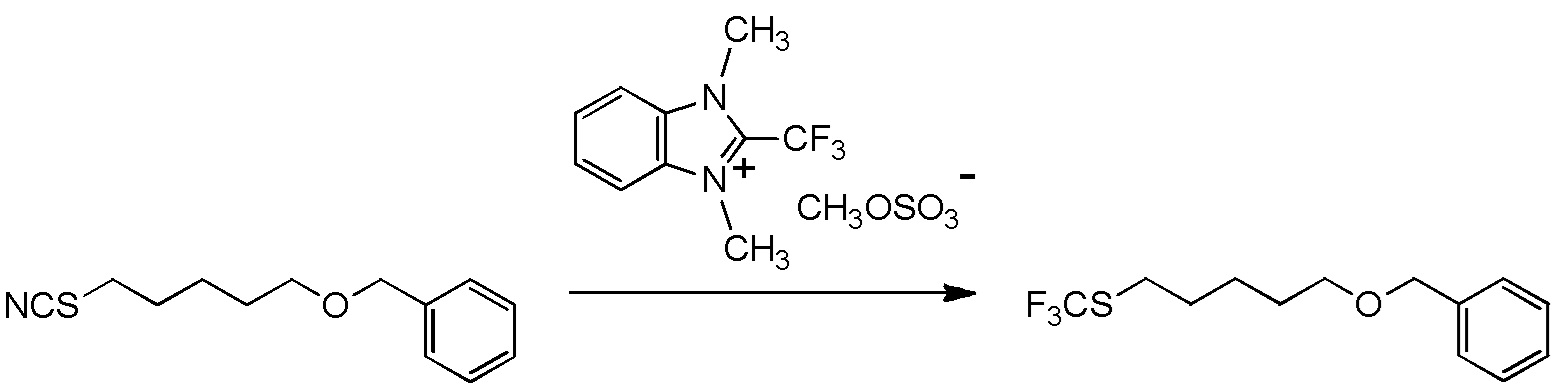
В 6 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 118 мг (0,5 ммоль) 1-бензилокси-5-тиоцианатопентана, 196 мг (0,6 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия, 50 мг (1,26 ммоль) гидроксида натрия, 161 мг (0,5 ммоль) бромида тетрабутиламмония и 1,5 мл толуола. Смесь перемешивали при комнатной температуре в течение 15 часов. Образование (5-бензилоксипентил)трифторметилсульфида (ион-предшественник; 278) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 27% (5-бензилоксипентил)трифторметилсульфида (целевое соединение), 10% 1-бензилокси-5-тиоцианатопентана (исходное соединение), 18% 1,2-бис[5-(бензилокси)пентил] дисульфида (побочный продукт) и 43% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-бензилоксипентил)трифторметилсульфида (целевое соединение) составлял 42%.
[0808]
Пример 30
Получение (5-бензилоксипентил)трифторметилсульфида
[Химическая формула 75]
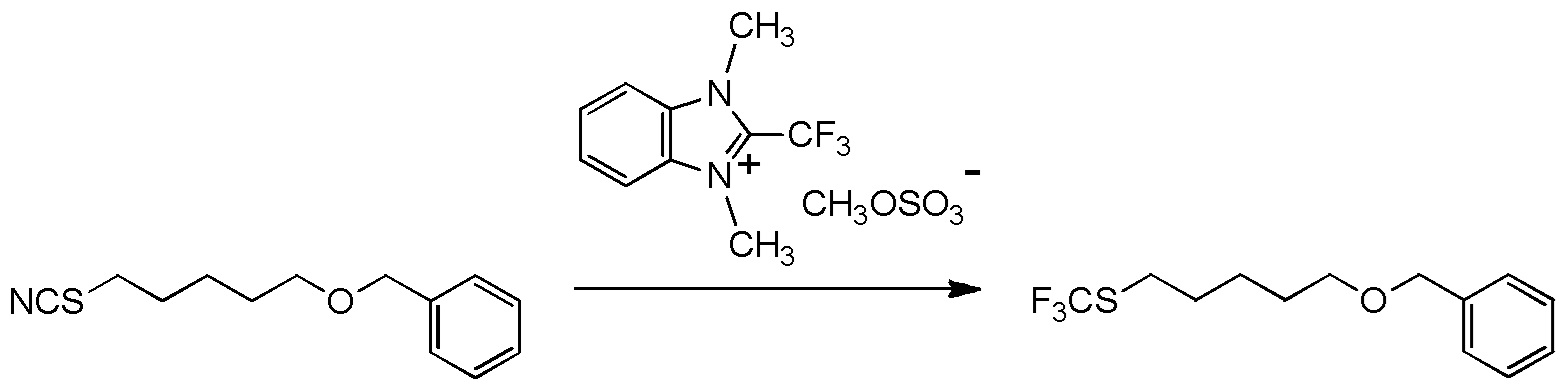
В 6 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 118 мг (0,5 ммоль) 1-бензилокси-5-тиоцианатопентана, 196 мг (0,6 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 1,5 мл ДМФ. Смесь перемешивали при -10°C в течение 30 минут и затем добавляли 72 мг (1,8 ммоль) 60% гидрида натрия. Смесь перемешивали при -10°C в течение 30 минут. Затем добавляли 37 мг (0,63 ммоль) гидроксида калия и смесь перемешивали при -10°C в течение 16 часов. Образование (5-бензилоксипентил)трифторметилсульфида (ион-предшественник; 278) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 43% (5-бензилоксипентил)трифторметилсульфида (целевое соединение), 17% 1-бензилокси-5-тиоцианатопентана (исходное соединение), 38% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента) и 2% 1,3-диметил-2,2-бис(трифторметил)-2,3-дигидро-бензимидазола (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-бензилоксипентил)трифторметилсульфида (целевое соединение) составлял 66%.
[0809]
Пример 31
Получение (5-ацетилоксипентил)трифторметилсульфида
[Химическая формула 76]
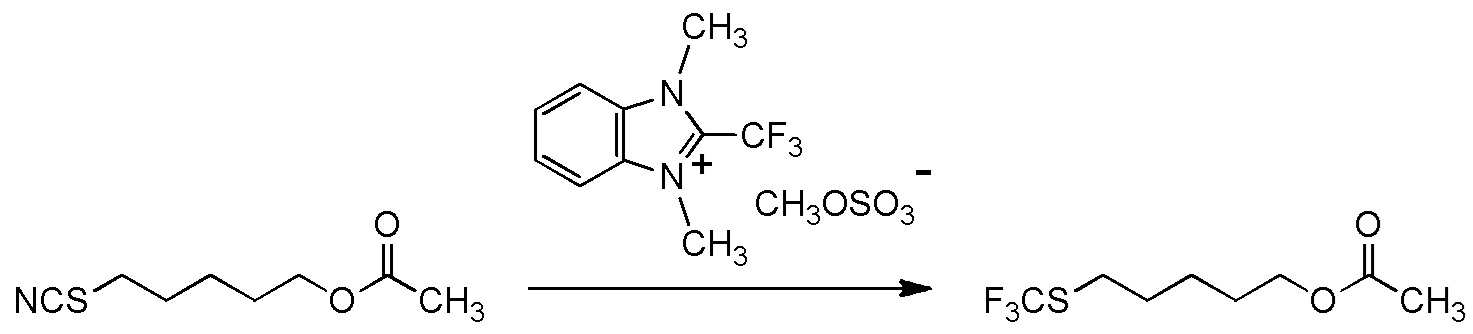
В 6 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 187 мг (1 ммоль) 1-ацетилокси-5-тиоцианатопентана, 300 мг молекулярного сита 4A (производство Sigma-Aldrich Co. LLC.; молекулярные сита, 4A, порошок, <5 микрон, активированный), 392 мг (1,2 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 0,5 мл ДМФ. Смесь перемешивали при -10°C в течение 30 минут и затем добавляли 148 мг (2,52 ммоль) гидроксида калия. Смесь перемешивали при -10°C в течение 1 часа. Образование (5-ацетилоксипентил)трифторметилсульфида (ион-предшественник; 230) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 39% (5-ацетилоксипентил)трифторметилсульфида (целевое соединение), 4% 1-ацетилокси-5-тиоцианатопентана (исходное соединение), 1% 1,2-бис[5-(ацетилокси)пентил]дисульфида (побочный продукт) и 51% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-ацетилоксипентил)трифторметилсульфида (целевое соединение) составлял 79%.
[0810]
Пример 32
Получение (5-ацетилоксипентил)трифторметилсульфида
[Химическая формула 77]
В 6 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 187 мг (1 ммоль) 1-ацетилокси-5-тиоцианатопентана, 392 мг (1,2 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 0,5 мл ДМФ. Смесь перемешивали при -10°C в течение 30 минут, и затем добавляли 144 мг (3,6 ммоль) 60% гидрида натрия. Смесь перемешивали при -10°C в течение 30 минут. Далее добавляли 74 мг (1,26 ммоль) гидроксида калия, и смесь перемешивали при -10°C в течение 30 минут. Образование (5-ацетилоксипентил)трифторметилсульфида (ион-предшественник; 230) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 31% (5-ацетилоксипентил)трифторметилсульфида (целевое соединение), 12% 1-ацетилокси-5-тиоцианатопентана (исходное соединение), 1% 1,2-бис(5-(ацетилокси)пентил)дисульфида (побочный продукт), 49% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента) и 2% 1,3-диметил-2,2-бис(трифторметил)-2,3-дигидро-бензимидазола (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-ацетилоксипентил)трифторметилсульфида (целевое соединение) составлял 68%.
[0811]
Пример 33
Получение (5-бензилоксипентил)трифторметилсульфида
[Химическая формула 78]
В 10 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 30 мг (0,125 ммоль) 1-бензилокси-5-тиоцианатопентана, 35 мг (0,25 ммоль) карбоната калия и 1 мл ДМФ. В процессе перемешивания смеси на ледяной бане добавляли 45 мг (0,15 ммоль) тетрафторбората 1,3-диметил-2-трифторметилбензимидазолия. В то время, когда температура медленно повышалась до значения комнатной температуры, смесь перемешивали в течение 15 часов. Образование (5-бензилоксипентил)трифторметилсульфида (ион-предшественник; 278) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 20% (5-бензилоксипентил)трифторметилсульфида (целевое соединение), 27% 1-бензилокси-5-тиоцианатопентана (исходное соединение) и 53% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). Выход (5-бензилоксипентил)трифторметилсульфида (целевое соединение) составлял 43% по расчетам процентов площади ГХ.
[0812]
Пример 34
Получение (5-бензилоксипентил)трифторметилсульфида
[Химическая формула 79]
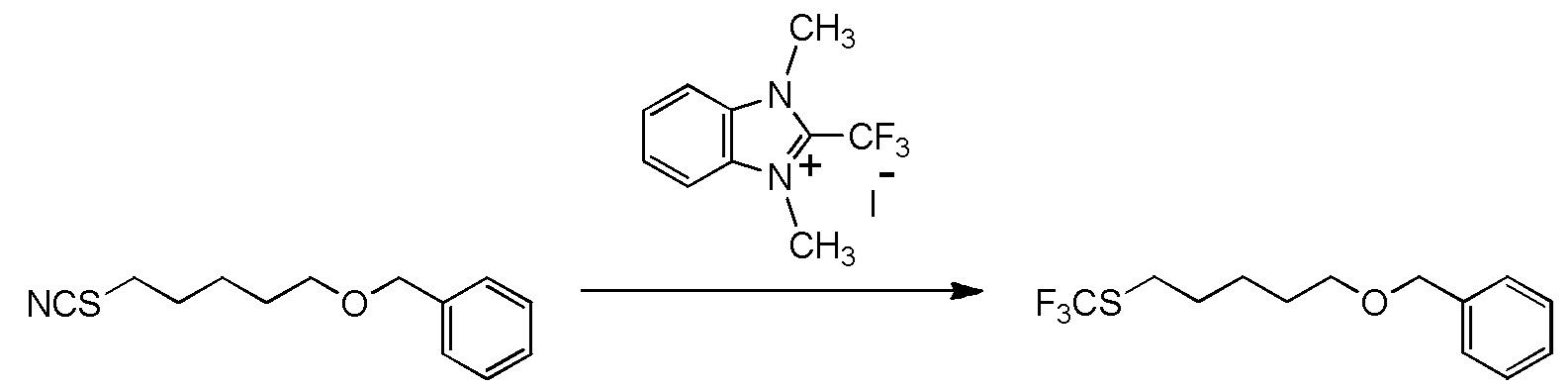
В 10 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 30 мг (0,125 ммоль) 1-бензилокси-5-тиоцианатопентана, 35 мг (0,25 ммоль) карбоната калия и 1 мл ДМФ. В процессе перемешивания смеси на ледяной бане, добавляли 51 мг (0,15 ммоль) иодида 1,3-диметил-2-трифторметилбензимидазолия. В то время, когда температура медленно повышалась до значения комнатной температуры, смесь перемешивали в течение 15 часов. Образование (5-бензилоксипентил)трифторметилсульфида (ион-предшественник; 278) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 20% (5-бензилоксипентил)трифторметилсульфида (целевое соединение), 31% 1-бензилокси-5-тиоцианатопентана (исходное соединение) и 42% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). Выход (5-бензилоксипентил)трифторметилсульфидаа (целевое соединение) составлял 34% по расчетам процентов площади ГХ.
[0813]
Пример 35
Получение (5-бензилоксипентил)трифторметилсульфида
[Химическая формула 80]
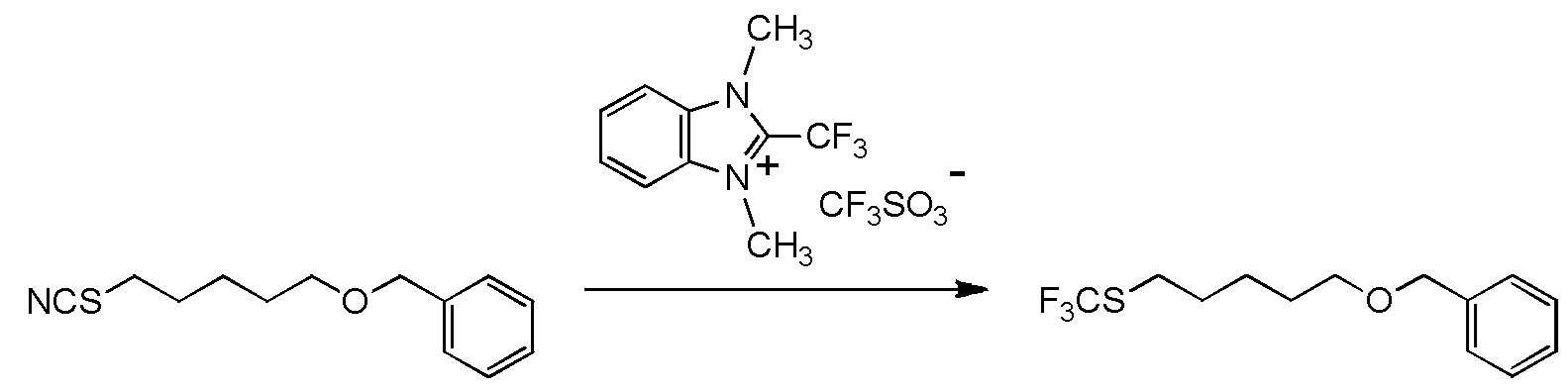
В 10 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 60 мг (0,25 ммоль) 1-бензилокси-5-тиоцианатопентана, 70 мг (0,5 ммоль) карбоната калия и 0,5 мл ДМФ. В то время, когда смесь перемешивали при комнатной температуре, добавляли 110 мг (0,3 ммоль) трифлата 1,3-диметил-2-трифторметилбензимидазолия. Смесь перемешивали при комнатной температуре в течение 2 часов. Образование (5-бензилоксипентил)трифторметилсульфида (ион-предшественник; 278) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 24% (5-бензилоксипентил)трифторметилсульфида (целевое соединение), 31% 1-бензилокси-5-тиоцианатопентана (исходное соединение) и 45% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). Выход (5-бензилоксипентил)трифторметилсульфида (целевое соединение) составлял 44% по расчетам процентов площади ГХ.
[0814]
Пример 36
Получение (5-бензилоксипентил)трифторметилсульфида
[Химическая формула 81]
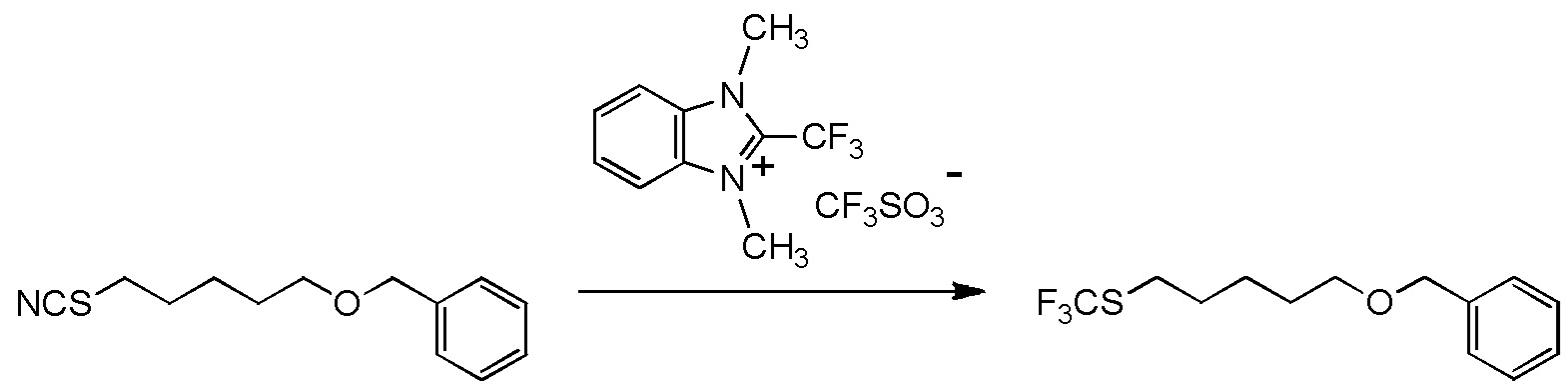
В 10 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 60 мг (0,25 ммоль) 1-бензилокси-5-тиоцианатопентана, 70 мг (0,5 ммоль) карбоната калия и 1 мл ДМСО. В то время, когда смесь перемешивали при комнатной температуре, добавляли 110 мг (0,3 ммоль) трифлата 1,3-диметил-2-трифторметилбензимидазолия. Смесь перемешивали при комнатной температуре в течение 2 часов. Образование (5-бензилоксипентил)трифторметилсульфида (ион-предшественник; 278) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 31% (5-бензилоксипентил)трифторметилсульфида (целевое соединение), 29% 1-бензилокси-5-тиоцианатопентана (исходное соединение) и 40% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). Выход (5-бензилоксипентил)трифторметилсульфида (целевое соединение) составлял 52% по расчетам процентов площади ГХ.
[0815]
Пример 37
Получение (5-бензилоксипентил)трифторметилсульфида
[Химическая формула 82]
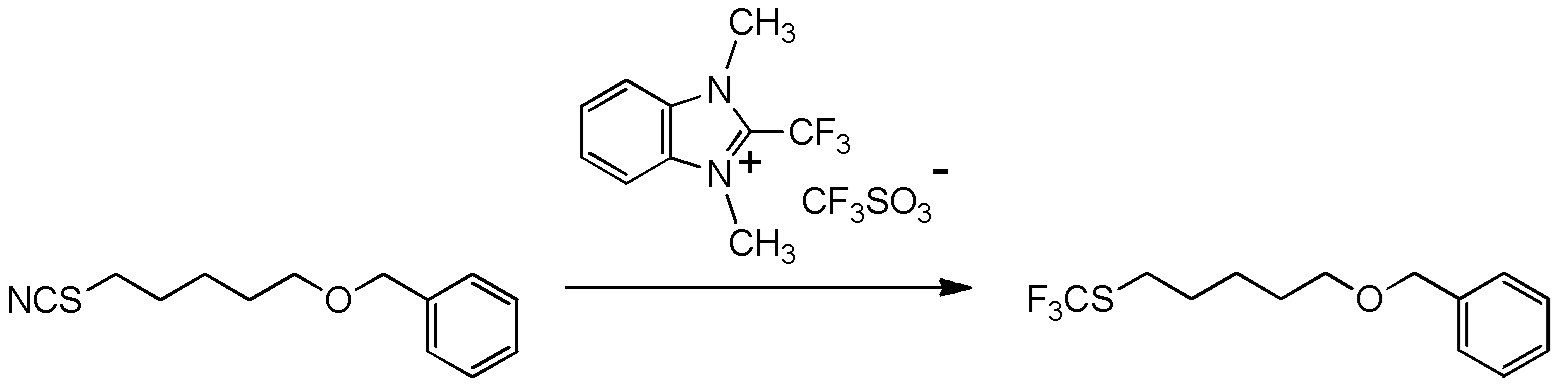
В 10 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 30 мг (0,125 ммоль) 1-бензилокси-5-тиоцианатопентана, 98 мг (0,3 ммоль) карбоната цезия и 0,3 мл ДМФ. В то время, когда смесь перемешивали при -50°C или ниже, добавляли 55 мг (0,15 ммоль) трифлата 1,3-диметил-2-трифторметилбензимидазолия. В то время, когда температура медленно повышалась до значения комнатной температуры, смесь перемешивали в течение 15 часов. Образование (5-бензилоксипентил)трифторметилсульфида (ион-предшественник; 278) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 42% (5-бензилоксипентил)трифторметилсульфида (целевое соединение), 14% 1-бензилокси-5-тиоцианатопентана (исходное соединение) и 44% 1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). Выход (5-бензилоксипентил)трифторметилсульфида (целевое соединение) составлял 75% по расчетам процентов площади ГХ.
[0816]
Пример 38
Получение (5-бензилоксипентил)трифторметилсульфида
[Химическая формула 83]
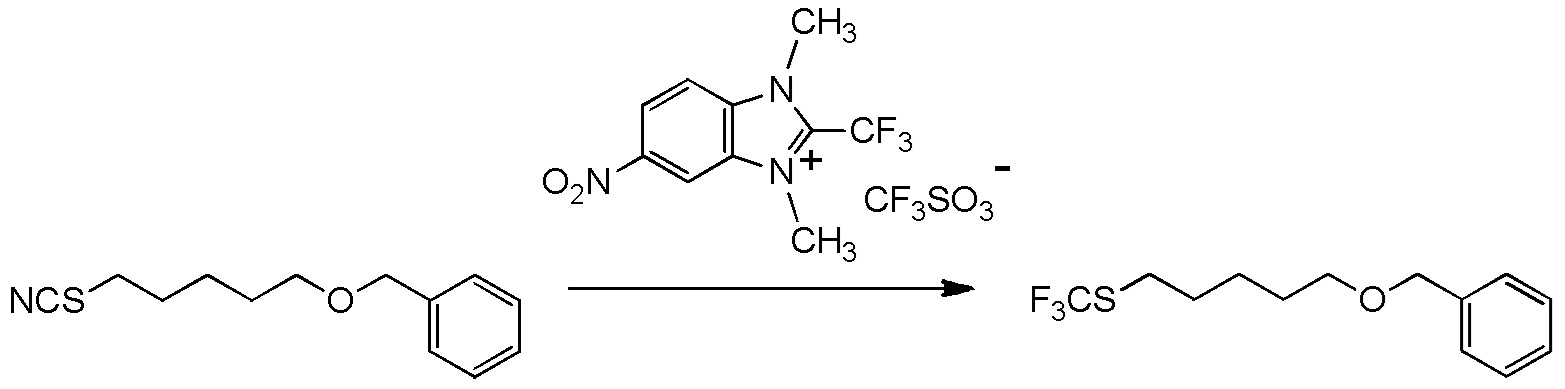
В 50 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 0,47 г (2 ммоль) 1-бензилокси-5-тиоцианатопентана, 0,83 г (6 ммоль) карбоната калия и 4 мл ДМФ. Добавляли по каплям раствор, полученный путем растворения 1,64 г (4 ммоль) трифлата 1,3-диметил-5-нитро-2-трифторметилбензимидазолия в 4 мл ДМФ, при комнатной температуре в течение 2 часов. Смесь, в том виде, как она есть, перемешивали в течение 15 часов. Образование (5-бензилоксипентил)трифторметилсульфида (ион-предшественник; 278) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 41% (5-бензилоксипентил)трифторметилсульфида (целевое соединение), 12% 1-бензилокси-5-тиоцианатопентана (исходное соединение) и 47% 2,3-дигидро-1,3-диметил-5-нитро-бензимидазол-2-она (соединение, полученное из фторалкилирующего агента). Выход (5-бензилоксипентил)трифторметилсульфида (целевое соединение) составлял 77% по расчетам процентов площади ГХ.
[0817]
Пример 39
Получение (5-бензилоксипентил)трифторметилсульфида
[Химическая формула 84]
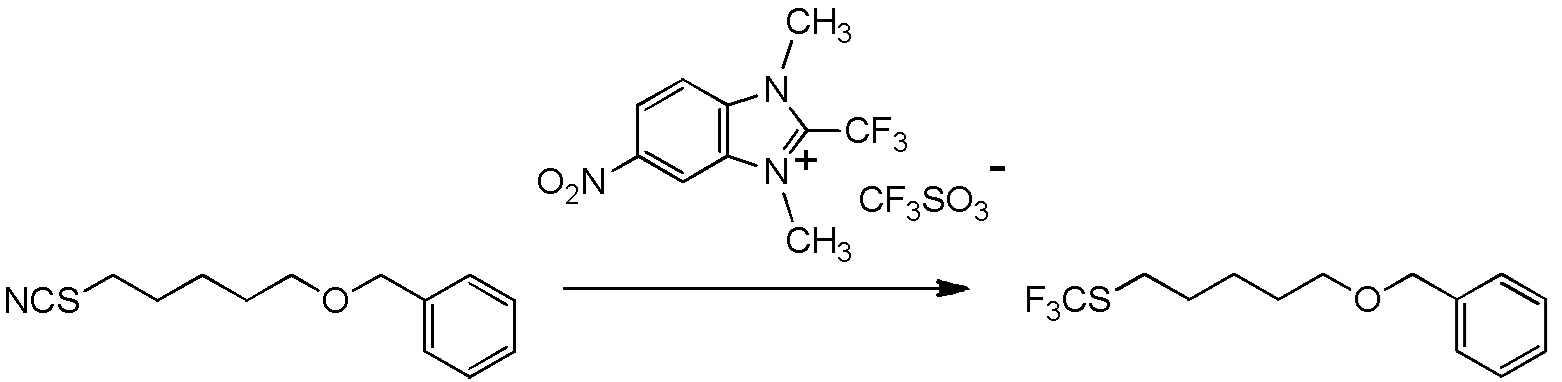
В 50 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 0,47 г (2 ммоль) 1-бензилокси-5-тиоцианатопентана, 0,83 г (6 ммоль) карбоната калия и 4 мл ДМФ. Добавляли по каплям раствор, полученный путем растворения 1,6 г (4 ммоль) трифлата 5-хлор-1,3-диметил-2-трифторметилбензимидазолия в 4 мл ДМФ, при комнатной температуре в течение 2 часов. Смесь, в том виде, как она есть, перемешивали в течение 15 часов. Образование (5-бензилоксипентил)трифторметилсульфида (ион-предшественник; 278) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 28% (5-бензилоксипентил)трифторметилсульфида (целевое соединение), 6% 1-бензилокси-5-тиоцианатопентана (исходное соединение) и 66% 2,3-дигидро-1,3-диметил-бензимидазол-2-она (соединение, полученное из фторалкилирующего агента). Выход (5-бензилоксипентил)трифторметилсульфида (целевое соединение) составлял 82% по расчетам процентов площади ГХ.
[0818]
Пример 40
Получение (5-бензилоксипентил)пентафторэтил сульфида
[Химическая формула 85]
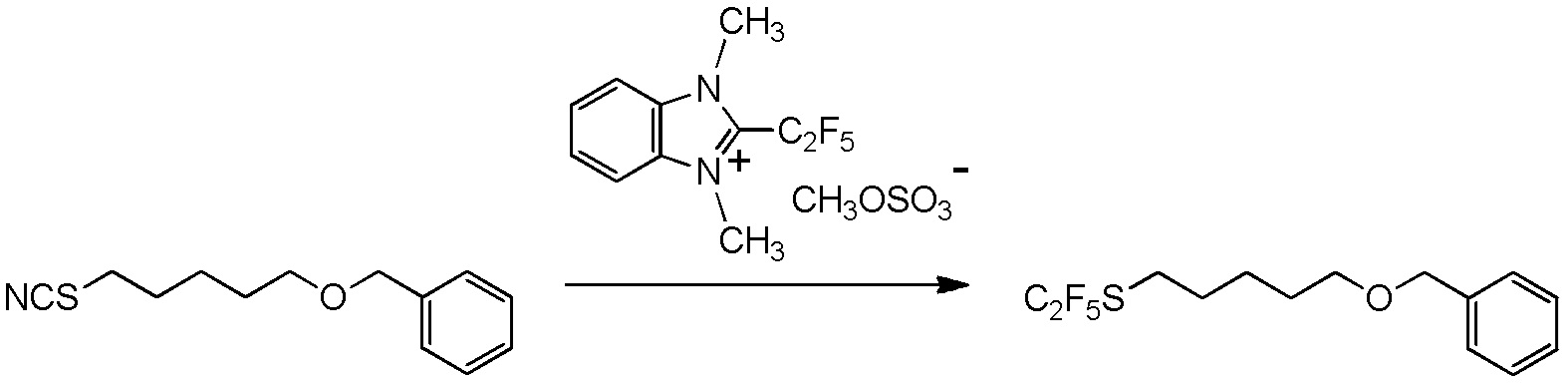
В 10 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 30 мг (0,125 ммоль) 1-бензилокси-5-тиоцианатопентана, 35 мг (0,3 ммоль) карбоната калия и 0,5 мл ДМФ. В то время, когда смесь перемешивали при комнатной температуре, добавляли 56 мг (0,15 ммоль) метилсульфата 1,3-диметил-2-пентафторэтилбензимидазолия. Смесь перемешивали при комнатной температуре в течение 3 часов. Образование (5-бензилоксипентил)пентафторэтилсульфида (ион-предшественник; 328) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 18% (5-бензилоксипентил) пентафторэтилсульфида (целевое соединение), 39% 1-бензилокси-5-тиоцианатопентана (исходное соединение) и 40% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). Выход (5-бензилоксипентил) пентафторэтилсульфида (целевое соединение) составлял 30% по расчетам процентов площади ГХ.
[0819]
Пример 41
Получение (5-бензилоксипентил)трифторметилсульфида
[Химическая формула 86]
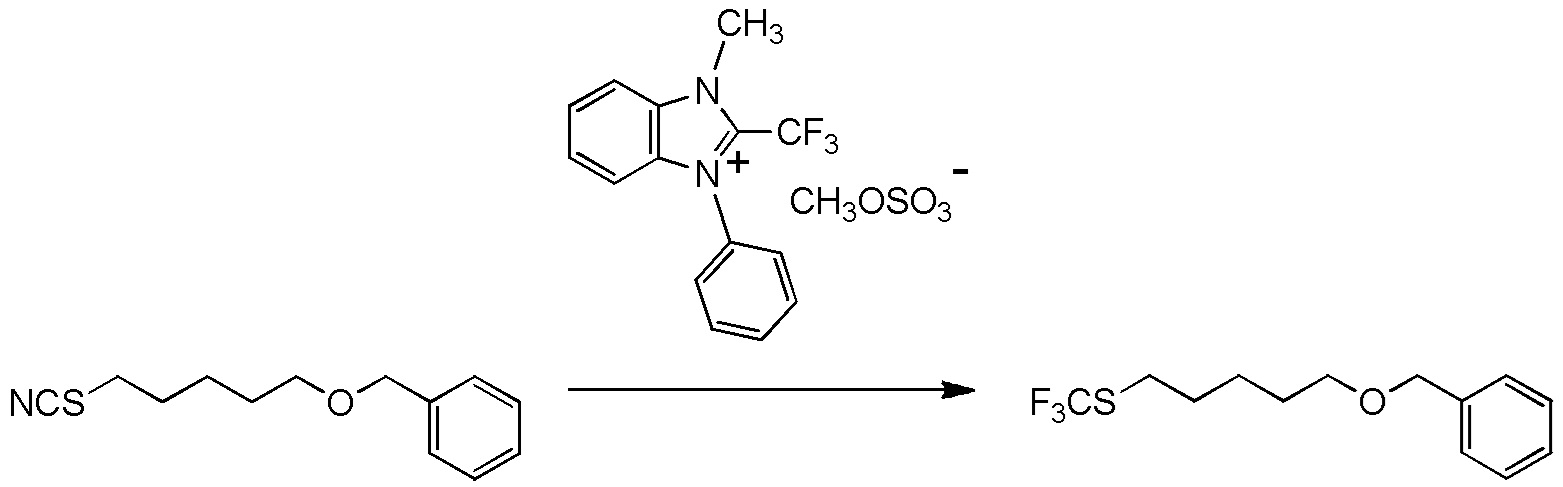
В 10 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 30 мг (0,125 ммоль) 1-бензилокси-5-тиоцианатопентана, 35 мг (0,3 ммоль) карбоната калия и 0,3 мл ДМФ. В то время, когда смесь перемешивали при комнатной температуре, добавляли 58 мг (0,15 ммоль) метилсульфата 1-метил-3-фенил-2-трифторметилбензимидазолия. Смесь перемешивали при комнатной температуре в течение 3 часов. Образование (5-бензилоксипентил)трифторметилсульфида (ион-предшественник; 278) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 16% (5-бензилоксипентил)трифторметилсульфида (целевое соединение), 27% 1-бензилокси-5-тиоцианатопентана (исходное соединение) и 52% 2,3-дигидро-1-метил-3-фенилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). Выход (5-бензилоксипентил)трифторметилсульфида (целевое соединение) составлял 33% по расчетам процентов площади ГХ.
[0820]
Пример 42
Получение (5-бензилоксипентил)трифторметилсульфида
[Химическая формула 87]
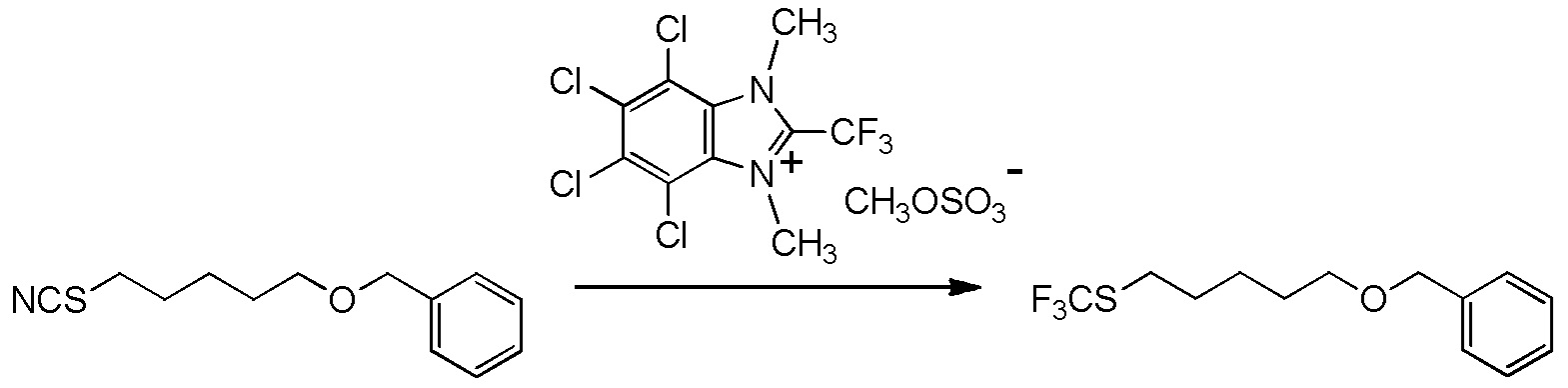
В 10 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 30 мг (0,125 ммоль) 1-бензилокси-5-тиоцианатопентана, 35 мг (0,3 ммоль) карбоната калия и 0,5 мл ДМФ. В то время, когда смесь перемешивали при комнатной температуре, добавляли 70 мг (0,15 ммоль) метилсульфата 1,3-диметил-4,5,6,7-тетрахлор-2-трифторметилбензимидазолия. Смесь перемешивали при комнатной температуре в течение 15 часов. Образование (5-бензилоксипентил)трифторметилсульфида (ион-предшественник; 278) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 21% (5-бензилоксипентил)трифторметилсульфида (целевое соединение), 31% 1-бензилокси-5-тиоцианатопентана (исходное соединение) и 46% 2,3-дигидро-1,3-диметил-4,5,6,7-тетрахлор-бензимидазол-2-она (соединение, полученное из фторалкилирующего агента). Выход (5-бензилоксипентил)трифторметилсульфида (целевое соединение) составлял 39% по расчетам процентов площади ГХ.
[0821]
Пример 43
Получение (5-бензилоксипентил)трифторметилсульфида
[Химическая формула 88]
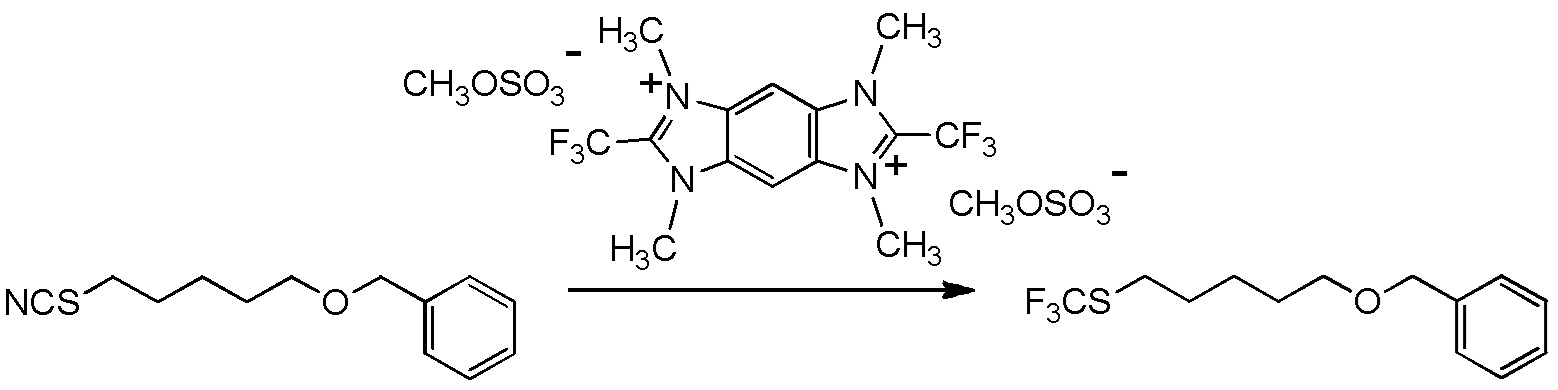
В 10 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 30 мг (0,125 ммоль) 1-бензилокси-5-тиоцианатопентана, 35 мг (0,3 ммоль) карбоната калия и 0,5 мл ДМФ. В то время, когда смесь перемешивали при комнатной температуре, добавляли 43 мг (0,075 ммоль) бисметилсульфата 1,3,5,7-тетраметил-2,6-бис(трифторметил)-3,5-дигидробензодиимидазолий. Смесь перемешивали при комнатной температуре в течение 15 часов. Образование (5-бензилоксипентил)трифторметилсульфида (ион-предшественник; 278) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 8% (5-бензилоксипентил)трифторметилсульфида (целевое соединение), 68% 1-бензилокси-5-тиоцианатопентана (исходное соединение), 3% 1,3,5,7-тетраметил-5,7-дигидробензодиимидазол-2,6-диона (соединение, полученное из фторалкилирующего агента) и 18% 1,3,5,7-тетраметил-6,6-бистрифторметил-3,5,6,7-тетрагидробензодиимидазол-2-она (соединение, полученное из фторалкилирующего агента). Выход (5-бензилоксипентил)трифторметилсульфида (целевое соединение) составлял 10% по расчетам процентов площади ГХ.
[0822]
Пример 44
Получение 1-(2,4-дифторфенил)-2,2,2-трифторэтанола
[Химическая формула 89]
В 10 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 0,03 г (0,21 ммоль) 2,4-дифторбензальдегида, 0,06 г (0,42 ммоль) карбоната калия и 1 мл ДМФ. В то время, когда смесь перемешивали при комнатной температуре, добавляли 0,12 г (0,32 ммоль) трифлата 1,3-диметил-2-трифторметилбензимидазолия. Смесь перемешивали при комнатной температуре в течение 2 часов. Образование 1-(2,4-дифторфенил)-2,2,2-трифторэтанола (ион-предшественник; 212) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 15% 1-(2,4-дифторфенил)-2,2,2-трифторэтанола (целевое соединение), 13% 2,4-дифторбензальдегида (исходное соединение) и 71% 1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). Выход 1-(2,4-дифторфенил)-2,2,2-трифторэтанола (целевое соединение) составлял 52% по расчетам процентов площади ГХ.
[0823]
Пример 45
Получение 1-(4-метилфенил)-2,2,2-трифторэтанола
[Химическая формула 90]
В 10 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 0,06 г (0,5 ммоль) 4-метилбензальдегида, 0,28 г (2 ммоль) карбоната калия и 1 мл ДМФ. В то время, когда смесь перемешивали при комнатной температуре, добавляли 0,33 г (1 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия. Смесь перемешивали при комнатной температуре в течение 15 часов. Образование 1-(4-метилфенил)-2,2,2-трифторэтанола (ион-предшественник; 190) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 6% 1-(4-метилфенил)-2,2,2-трифторэтанола (целевое соединение), 31% 4-метилбензальдегида (исходное соединение) и 63% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). Выход 1-(4-метилфенил)-2,2,2-трифторэтанола (целевое соединение) составлял 16% по расчетам процентов площади ГХ.
[0824]
Пример 46
Получение 1-(3,4-дифторфенил)-2,2,2-трифторэтанола
[Химическая формула 91]
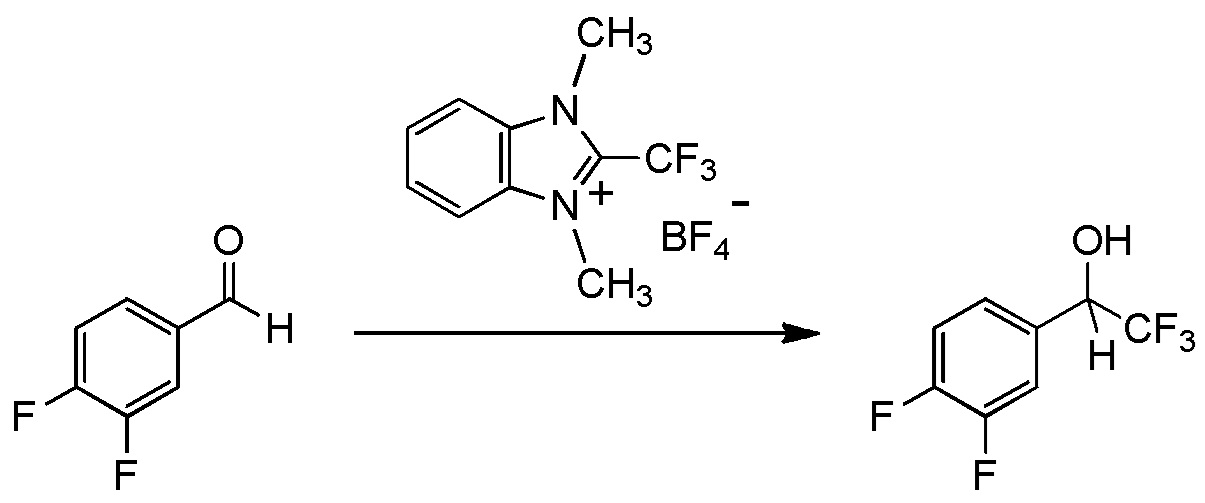
В 10 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 18 мг (0,125 ммоль) 3,4-дифторбензальдегида, 35 мг (0,25 ммоль) карбоната калия и 1 мл ДМФ. В то время, когда смесь перемешивали при комнатной температуре, добавляли 45 мг (0,15 ммоль) тетрафторбората 1,3-диметил-2-трифторметилбензимидазолия. Смесь перемешивали при комнатной температуре в течение 15 часов. Образование 1-(3,4-дифторфенил)-2,2,2-трифторэтанола (ион-предшественник; 212) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 5% 1-(3,4-дифторфенил)-2,2,2-трифторэтанола (целевое соединение), 35% 3,4-дифторбензальдегида (исходное соединение) и 59% 1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). Выход 1-(3,4-дифторфенил)-2,2,2-трифторэтанола (целевое соединение) составлял 12% по расчетам процентов площади ГХ.
[0825]
Пример 47
Получение 1-(4-цианофенил)-2,2,2-трифторэтанола
[Химическая формула 92]
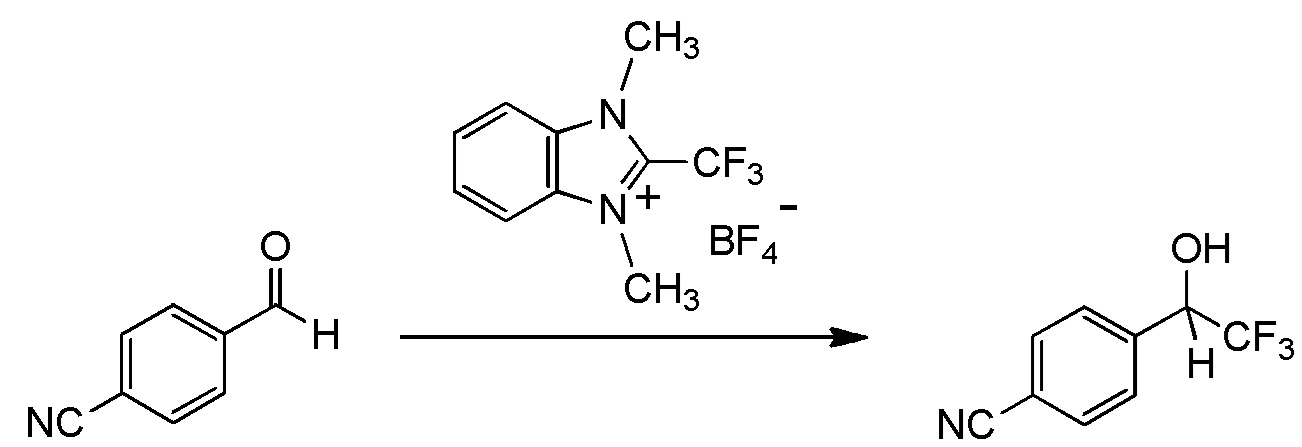
В 10 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 16 мг (0,125 ммоль) 4-цианобензальдегида, 35 мг (0,25 ммоль) карбоната калия и 1 мл ДМФ. В то время, когда смесь перемешивали при комнатной температуре, добавляли 45 мг (0,15 ммоль) тетрафторбората 1,3-диметил-2-трифторметилбензимидазолия. Смесь перемешивали при комнатной температуре в течение 15 часов. Образование 1-(4-цианофенил)-2,2,2-трифторэтанола (ион-предшественник; 201) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 17% 1-(4-цианофенил)-2,2,2-трифторэтанола (целевое соединение), 24% 4-цианобензальдегида (исходное соединение) и 59% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). Выход 1-(4-цианофенил)-2,2,2-трифторэтанола (целевое соединение) составлял 41% по расчетам процентов площади ГХ.
[0826]
Пример 48
Получение 1-(4-нитрофенил)-2,2,2-трифторэтанола
[Химическая формула 93]
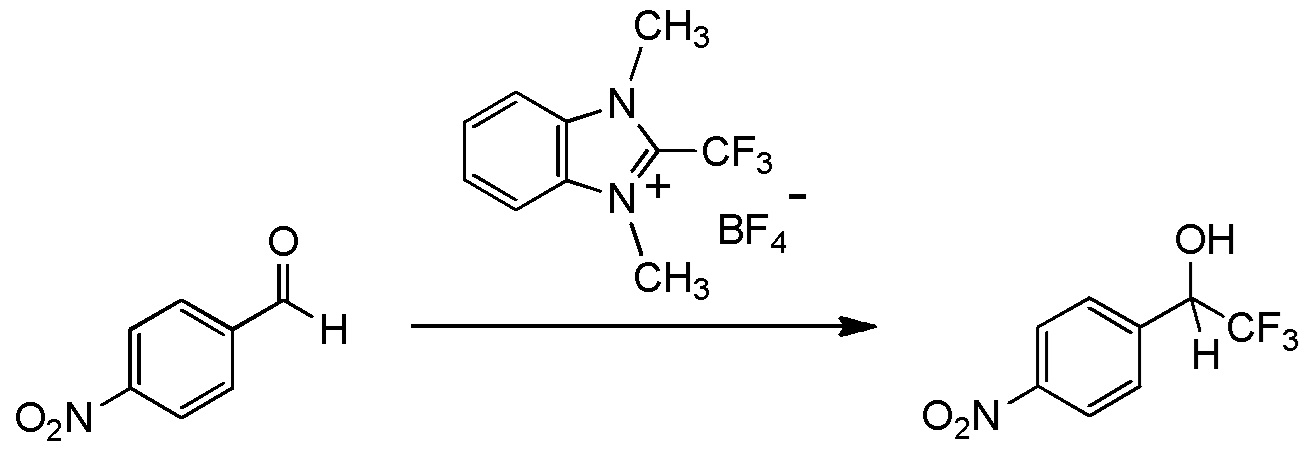
В 10 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 19 мг (0,125 ммоль) 4-нитробензальдегида, 35 мг (0,25 ммоль) карбоната калия и 1 мл ДМФ. В то время, когда смесь перемешивали при комнатной температуре, добавляли 45 мг (0,15 ммоль) тетрафторбората 1,3-диметил-2-трифторметилбензимидазолия. Смесь перемешивали при комнатной температуре в течение 15 часов. Образование 1-(4-нитрофенил)-2,2,2-трифторэтанола (ион-предшественник; 221) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 23% 1-(4-нитрофенил)-2,2,2-трифторэтанола (целевое соединение), 19% 4-нитробензальдегида (исходное соединение) и 58% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). Выход 1-(4-нитрофенил)-2,2,2-трифторэтанола (целевое соединение) составлял 55% по расчетам процентов площади ГХ.
[0827]
Пример 49
Получение 1-фенилэтил-2,2,2-трифторэтанола
[Химическая формула 94]
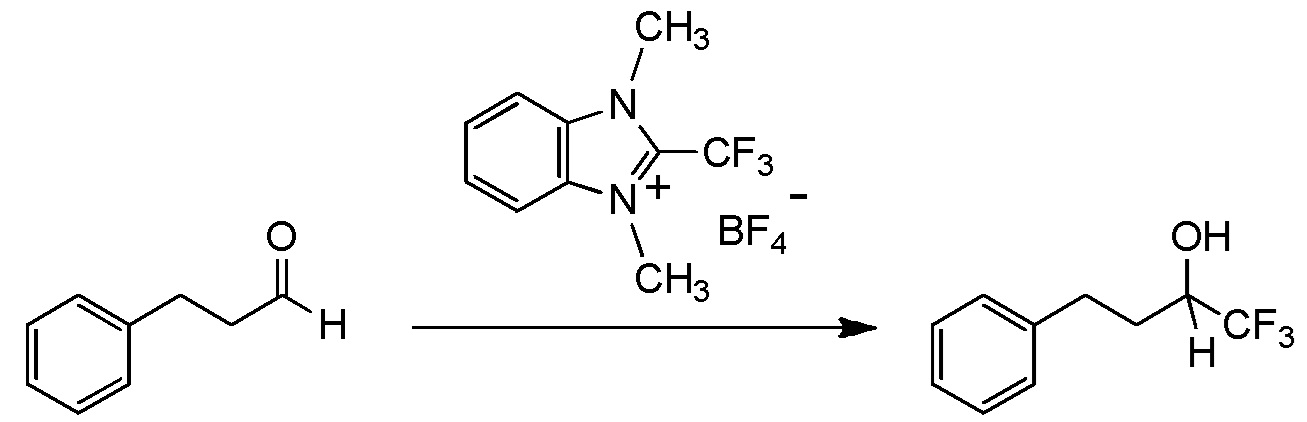
В 10 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 17 мг (0,125 ммоль) 3-фенилпропиональдегида, 35 мг (0,25 ммоль) карбоната калия и 0,5 мл ДМФ. В то время, когда смесь перемешивали при комнатной температуре, добавляли 45 мг (0,15 ммоль) тетрафторбората 1,3-диметил-2-трифторметилбензимидазолия. Смесь перемешивали при комнатной температуре в течение 15 часов. Образование 1-фенилэтил-2,2,2-трифторэтанола (ион-предшественник; 204) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 21% 1-фенилэтил-2,2,2-трифторэтанола (целевое соединение), 24% 3-фенилпропиональдегида (исходное соединение) и 46% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). Выход 1-фенилэтил-2,2,2-трифторэтанола (целевое соединение) составлял 39% по расчетам процентов площади ГХ.
[0828]
Пример 50
Получение 1-(3-пиридил)-2,2,2-трифторэтанола
[Химическая формула 95]
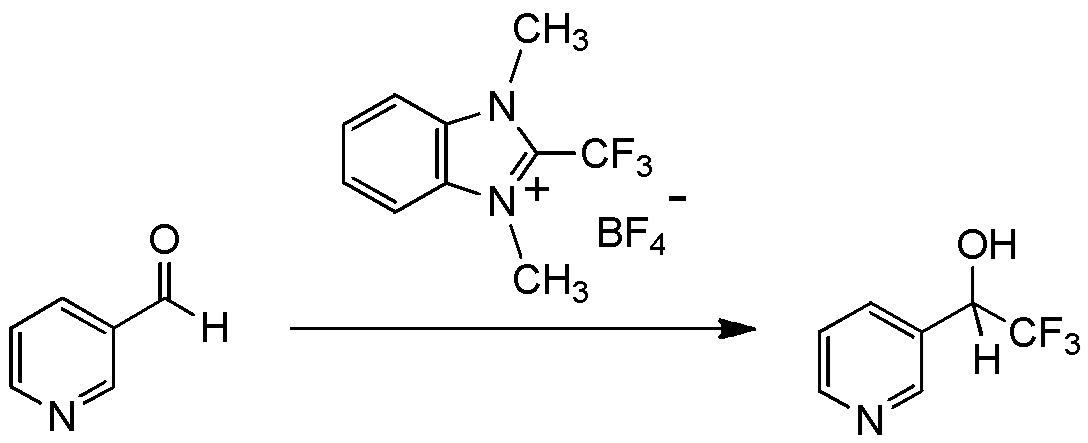
В 10 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 13 мг (0,125 ммоль) 3-пиридилкарбоальдегида, 35 мг (0,25 ммоль) карбоната калия и 1 мл ДМФ. В то время, когда смесь перемешивали при комнатной температуре, добавляли 45 мг (0,15 ммоль) тетрафторбората 1,3-диметил-2-трифторметилбензимидазолия. Смесь перемешивали при комнатной температуре в течение 15 часов. Образование 1-(3-пиридил)-2,2,2-трифторэтанола (ион-предшественник; 177) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 19% 1-(3-пиридил)-2,2,2-трифторэтанола (целевое соединение), 11% 3-пиридилкарбоальдегид (исходное соединение) и 70% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). Выход 1-(3-пиридил)-2,2,2-трифторэтанола (целевое соединение) составлял 63% по расчетам процентов площади ГХ.
[0829]
Пример 51
Получение 1-(5-фенил-2-тиенил)-2,2,2-трифторэтанола
[Химическая формула 96]
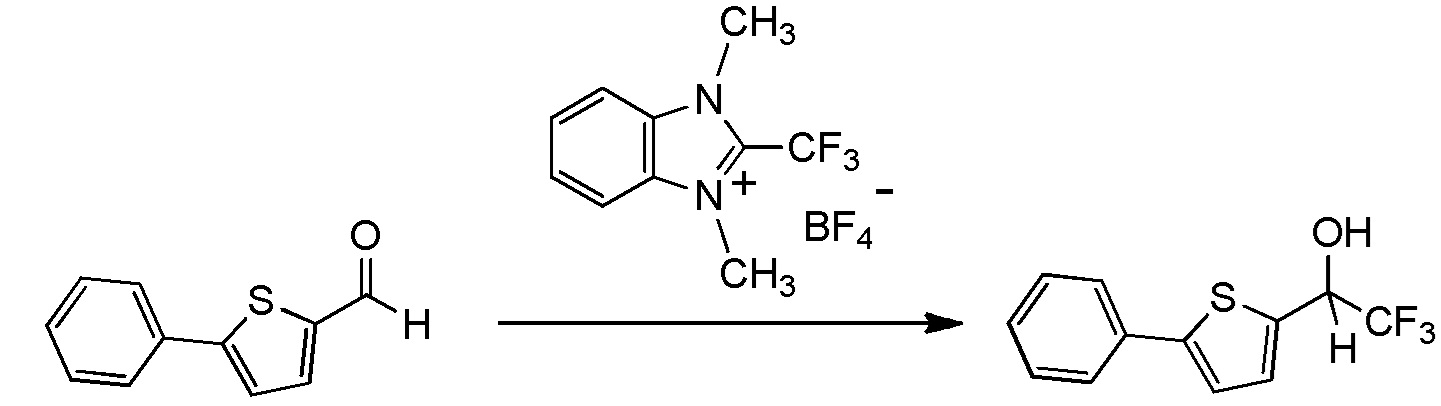
В 10 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 24 мг (0,125 ммоль) 5-фенил-2-тиенилкарбоальдегида, 35 мг (0,25 ммоль) карбоната калия и 1 мл ДМФ. В то время, когда смесь перемешивали при комнатной температуре, добавляли 45 мг (0,15 ммоль) тетрафторбората 1,3-диметил-2-трифторметилбензимидазолия. Смесь перемешивали при комнатной температуре в течение 15 часов. Образование 1-(5-фенил-2-тиенил)-2,2,2-трифторэтанола (ион-предшественник; 258) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 9% 1-(5-фенил-2-тиенил)-2,2,2-трифторэтанола (целевое соединение), 40% 5-фенил-2-тиенилкарбоальдегида (исходное соединение) и 50% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). Выход 1-(5-фенил-2-тиенил)-2,2,2-трифторэтанола (целевое соединение) составлял 18% по расчетам процентов площади ГХ.
[0830]
Пример 52
Получение метил 4-(2,2,2-трифтор-1-гидроксиэтил)бензоата
[Химическая формула 97]
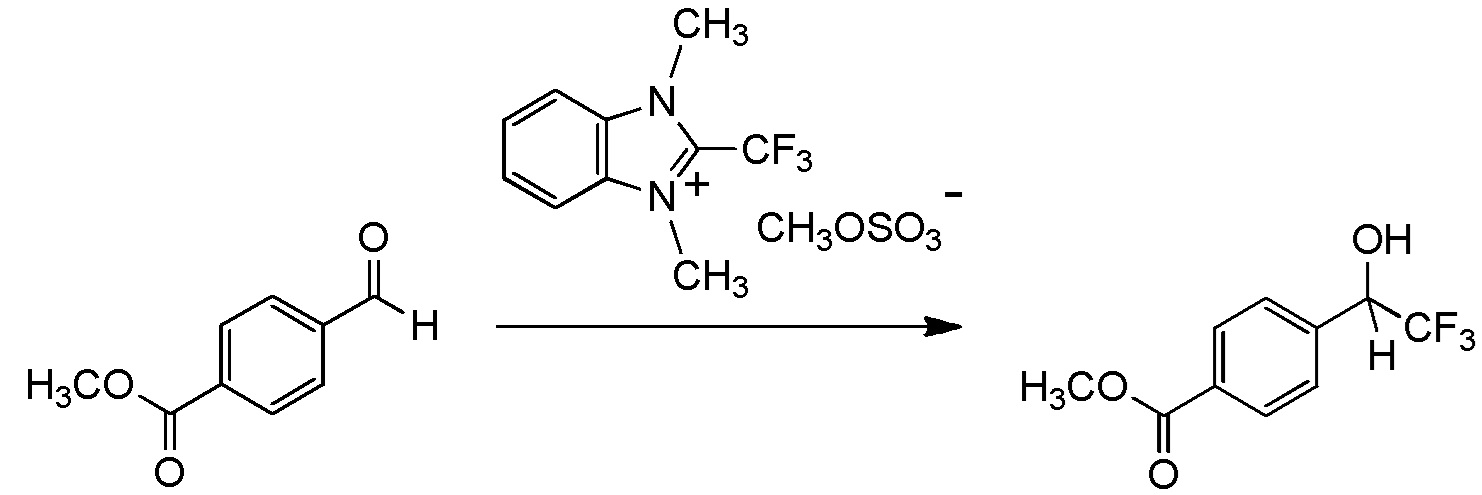
В 10 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 0,08 г (0,5 ммоль) метил 4-формилбензоата (исходное соединение), 0,14 г (1 ммоль) карбоната калия и 1 мл ДМФ. В то время, когда смесь перемешивали при охлаждении льдом, добавляли 0,2 г (0,6 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия (фторалкилирующий агент). В то время, когда температура медленно повышалась до значения комнатной температуры, смесь перемешивали в течение 15 часов. Образование метил 4-(2,2,2-трифтор-1-гидроксиэтил)бензоата (ион-предшественник; 234) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 21% метил 4-(2,2,2-трифтор-1-гидроксиэтил)бензоата (целевое соединение), 28% метил 4-формилбензоата (исходное соединение), 44% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента) и 6% 1,3-диметил-2,2-бис(трифторметил)-2,3-дигидро-бензимидазола (соединение, полученное из трифторалкилирующего агента). Выход метил 4-(2,2,2-трифтор-1-гидроксиэтил) бензоата (целевое соединение) составлял 43% по расчетам процентов площади ГХ.
[0831]
Пример 53
Взаимодействие осуществляли способом, аналогичным описанному в примере 52, за исключением того, что следующее соединение использовали вместо метилсульфата 1,3-диметил-2-трифторметилбензимидазолия в качестве фторалкилирующего агента и количество растворителя изменяли с 2 л/моль на 5 л/моль, исходя из исходного соединения. Выход целевого соединения составлял 41% по расчетам процентов площади ГХ.
[Химическая формула 98]
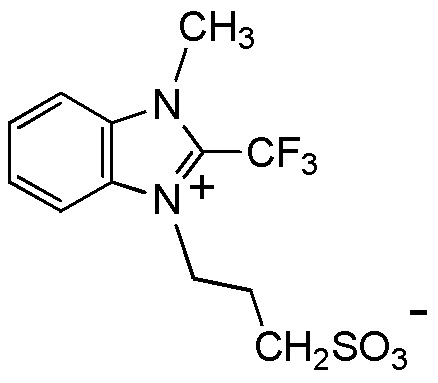
[0832]
Пример 54
Взаимодействие осуществляли способом, аналогичным описанному в примере 52, за исключением того, что следующее соединение использовали вместо метилсульфата 1,3-диметил-2-трифторметилбензимидазолия в качестве фторалкилирующего агента. Выход целевого соединения составлял 33% по расчетам процентов площади ГХ.
[Химическая формула 99]
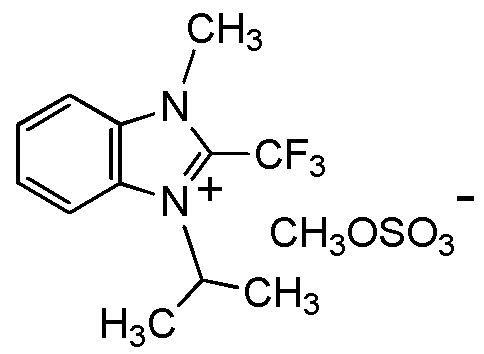
[0833]
Пример 55
Взаимодействие осуществляли способом, аналогичным описанному в примере 52, за исключением того, что следующее соединение использовали вместо метилсульфата 1,3-диметил-2-трифторметилбензимидазолия в качестве фторалкилирующего агента и количество растворителя изменяли с 2 л/моль на 1 л/моль исходя из исходного соединения. Выход целевого соединения составлял 53% по расчетам процентов площади ГХ.
[Химическая формула 100]
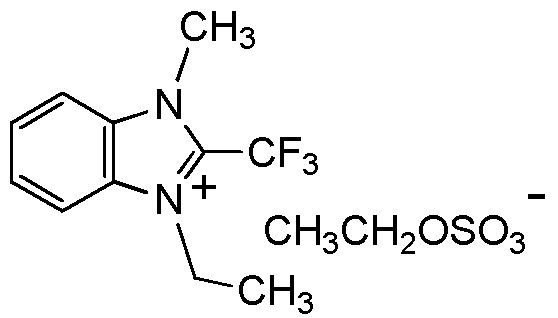
[0834]
Пример 56
Взаимодействие осуществляли способом, аналогичным описанному в примере 52, за исключением того, что следующее соединение использовали вместо метилсульфата 1,3-диметил-2-трифторметилбензимидазолия в качестве фторалкилирующего агента. Выход целевого соединения составлял 58% по расчетам процентов площади ГХ.
[Химическая формула 101]
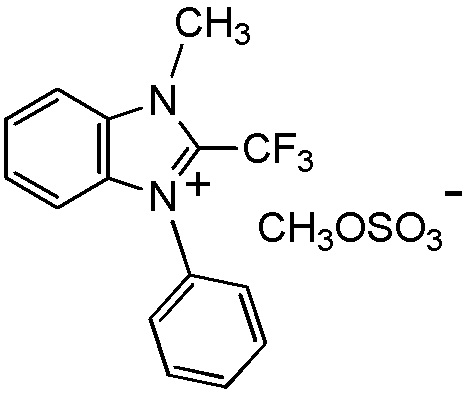
[0835]
Пример 57
Взаимодействие осуществляли способом, аналогичным описанному в примере 52, за исключением того, что следующее соединение использовали вместо метилсульфата 1,3-диметил-2-трифторметилбензимидазолия в качестве фторалкилирующего агента и количество растворителя изменяли с 2 л/моль на 1 л/моль, исходя из исходного соединения. Выход целевого соединения составлял 48% по расчетам процентов площади ГХ.
[Химическая формула 102]
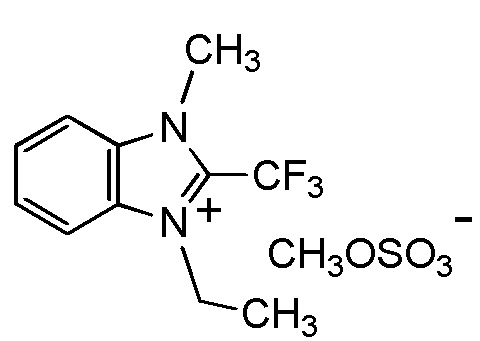
[0836]
Пример 58
Взаимодействие осуществляли способом, аналогичным описанному в примере 52, за исключением того, что следующее соединение использовали вместо метилсульфата 1,3-диметил-2-трифторметилбензимидазолия в качестве фторалкилирующего агента. Выход целевого соединения составлял 74% по расчетам процентов площади ГХ.
[Химическая формула 103]
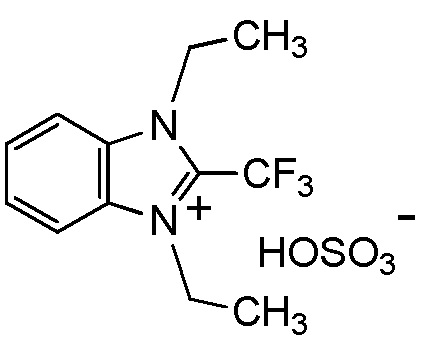
[0837]
Пример 59
Получение 1-фенил-2,2,2-трифторэтанола
[Химическая формула 104]
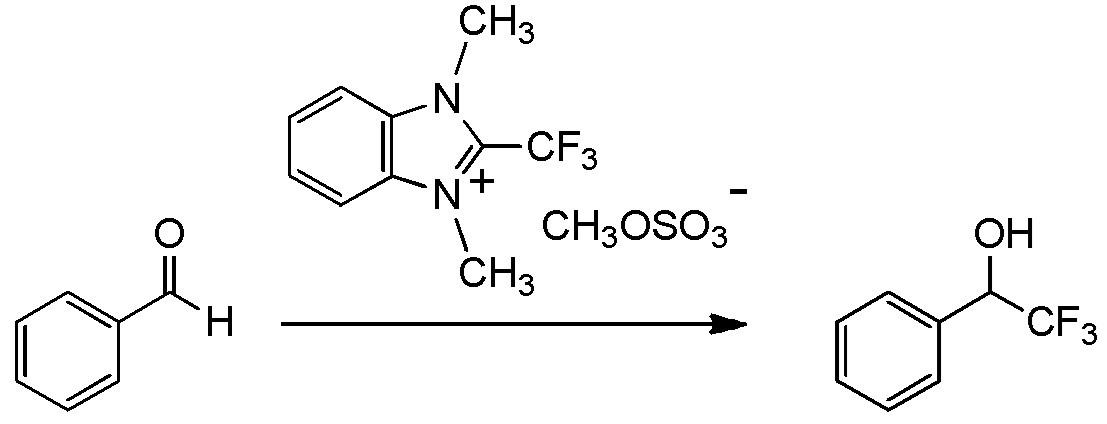
В 6 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 106 мг (1 ммоль) бензальдегида, 300 мг молекулярного сита 4A (производство Tosoh Corporation; Zeolum (торговое наименование); A-4; порошок), 392 мг (1,2 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 1 мл ДМФ. Смесь перемешивали при -10°C в течение 30 минут, и затем добавляли 148 мг (2,52 ммоль) гидроксида калия, и смесь перемешивали при -10°C в течение 14 часов. Потом смесь перемешивали при 50°C в течение 5 часов. Образование 1-фенил-2,2,2-трифторэтанола (ион-предшественник; 176) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 35% 1-фенил-2,2,2-трифторэтанола (целевое соединение) и 54% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход 1-фенил-2,2,2-трифторэтанола (целевое соединение) составлял 59%.
[0838]
Пример 60
Получение иодида 1,3-диметил-2-трифторметилбензимидазолия
[Химическая формула 105]
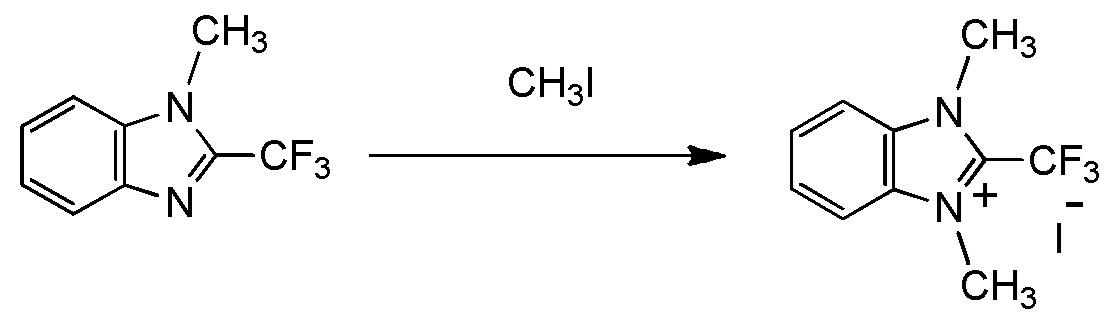
В 50 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 2,0 г (10 ммоль) 1-метил-2-трифторметилбензимидазола, 2,1 г (15 ммоль) метилиодида и 10 мл толуола. Смесь перемешивали при 80°C в течение 48 часов. После охлаждения до комнатной температуры, осажденные кристаллы собирали фильтрованием и сушили с получением 0,36 г кристаллов белого цвета. Выход: 10%.
В примере 60, фторалкилирующий агент, где Х- представлял собой I-, получали с использованием метилиодида в качестве алкилирующего агента. Тем не менее, выход продукта по примеру 60 был ниже по сравнению со случаем, когда фторалкилирующий агент, где Х- представлял собой CH3OSO3-, получали с использованием диметилсульфата в качестве алкилирующего агента в аналогичных условиях реакции.
[0839]
Пример 61
Получение (5-ацетилоксипентил)трифторметилсульфида
[Химическая формула 106]
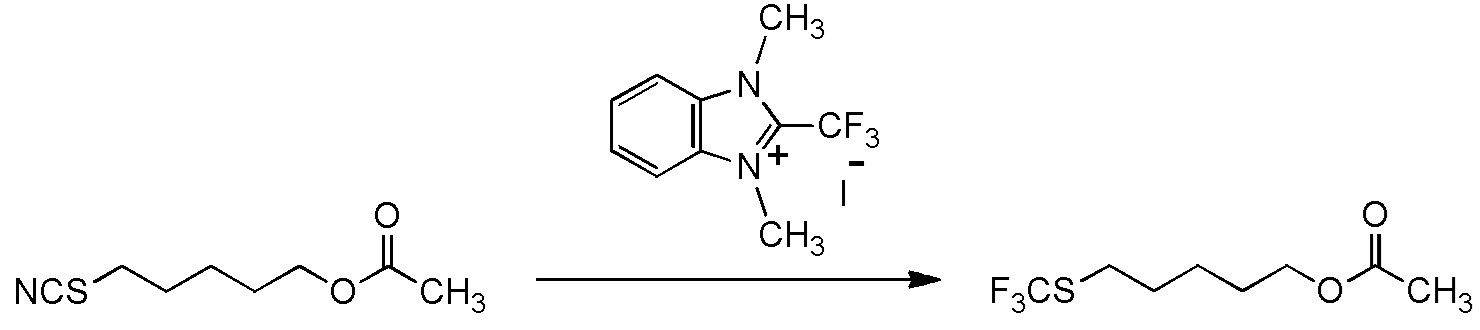
В 6 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 94 мг (0,5 ммоль) 1-ацетилокси-5-тиоцианатопентана, 150 мг молекулярного сита 4A (производство Tosoh Corporation; Zeolum (торговое наименование); A-4; порошок), 205 мг (0,6 ммоль) иодида 1,3-диметил-2-трифторметилбензимидазолия и 0,5 мл ДМФ. Смесь перемешивали при -10°C в течение 30 минут, и затем добавляли 74 мг (1,26 ммоль) гидроксида калия, и смесь перемешивали при -10°C в течение 14 часов. Образование (5-ацетилоксипентил)трифторметилсульфида (ион-предшественник; 230) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 47% (5-ацетилоксипентил)трифторметилсульфида (целевое соединение), 8% 1-ацетилокси-5-тиоцианатопентана (исходное соединение) и 45% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-ацетилоксипентил)трифторметилсульфида (целевое соединение) составлял 77%.
[0840]
Пример 62
Получение 1,3-диэтил-2-трифторметилбензимидазолия этилсульфата
[Химическая формула 107]
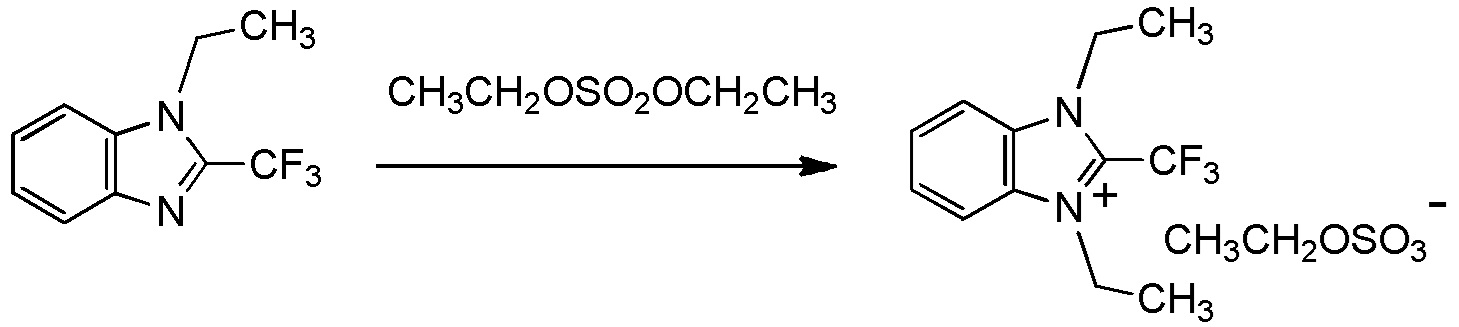
В 50 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 4,3 г (20 ммоль) 1-этил-2-трифторметилбензимидазола, 4,7 г (30 ммоль) диэтилсульфата и 20 мл толуола. Смесь перемешивали при 80°C в течение 24 часов. После охлаждения до комнатной температуры, добавляли 20 мл толуола, смесь интенсивно перемешивали и затем растворитель отгоняли при пониженном давлении. Полученный остаток растворяли в дихлорметане и затем добавляли диэтиловый эфир. Осажденные кристаллы собирали фильтрованием и сушили с получением 2,9 г кристаллов белого цвета. Выход: 39%.
1H-ЯМР (300 МГц, CDCl3, относительно TMS) δ (м.д.): 1,14 (т, J=7,2 Гц, 3H), 1,65 (т, J=7,4 Гц, 6H), 3,84 (кв, J=7,1 Гц, 2H), 4,84 (кв, J=7,4 Гц, 2H), 4,84 (кв, J=7,4 Гц, 2H), 7,76-7,87 (м, 2H), 7,96-8,03 (м, 2H).
[0841]
Пример 63
Получение (5-ацетилоксипентил)трифторметилсульфида
[Химическая формула 108]
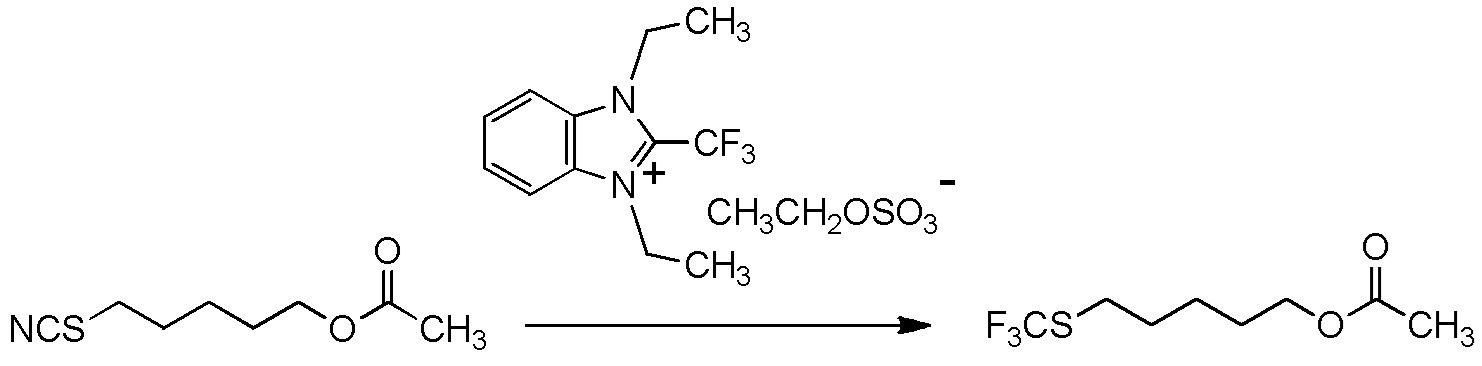
В 6 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 187 мг (1 ммоль) 1-ацетилокси-5-тиоцианатопентана, 442 мг (1,2 ммоль) этилсульфат 1,3-диэтил-2-трифторметилбензимидазолия, 415 мг (3 ммоль) карбоната калия и 1 мл ДМФ. Смесь перемешивали при комнатной температуре в течение 14 часов. Образование (5-ацетилоксипентил)трифторметилсульфида (ион-предшественник; 230) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 11% (5-ацетилоксипентил)трифторметилсульфида (целевое соединение), 20% 1-ацетилокси-5-тиоцианатопентана (исходное соединение), 0,5% 1,2-бис[5-(ацетилокси)пентил]дисульфида (побочный продукт) и 68% 2,3-дигидро-1,3-диэтилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-ацетилоксипентил)трифторметилсульфида (целевое соединение) составлял 31%.
[0842]
Пример 64
Получение 1,3-диметил-5-нитро-2-трифторметилбензимидазолия метилсульфата
[Химическая формула 109]
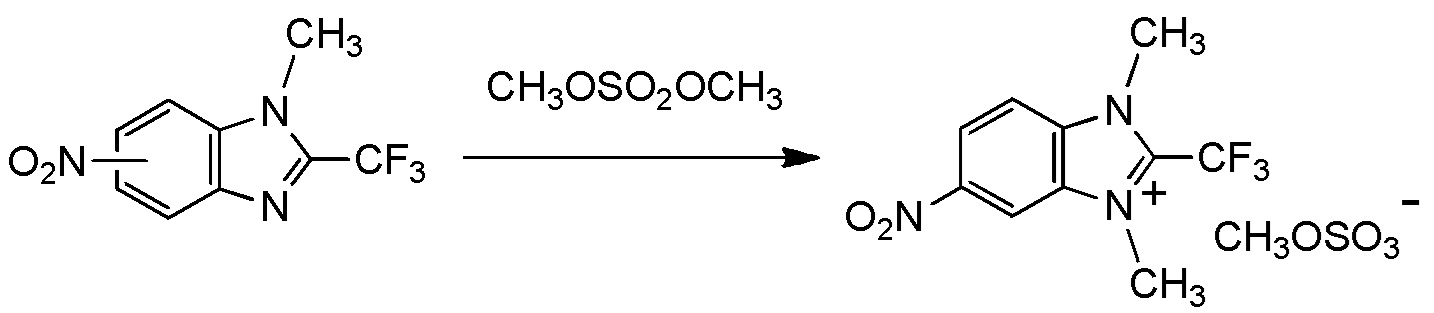
В 50 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 2,5 г (10 ммоль) смеси 1-метил-5-нитро-2-трифторметилбензимидазола и 1-метил-6-нитро-2-трифторметилбензимидазола, полученной способом, аналогичным описанному в примерах 10(1) и 10(2), 1,9 г (15 ммоль) диметилсульфата и 20 мл толуола. Смесь нагревали с обратным холодильником в течение 24 часов. После охлаждения до комнатной температуры, растворитель отгоняли при пониженном давлении. Полученный остаток повторно суспендировали в дихлорметане, кристаллы собирали фильтрацией и сушили с получением 3,0 г кристаллов белого цвета. Выход: 81%.
1H-ЯМР (300 МГц, D2O, относительно D2O) δ (м.д.): 3,58 (с, 3H), 4,24 (кв, J=1,6 Гц, 3H), 4,28 (кв, J=1,6 Гц, 3H), 8,15 (дд, J=9,3, 0,6 Гц, 1H), 8,58 (дд, J=9,3, 2,1 Гц, 1H), 8,99 (дд, J=2,1, 0,6 Гц, 1H).
[0843]
Пример 65
Получение (5-ацетилоксипентил)трифторметилсульфида
[Химическая формула 110]
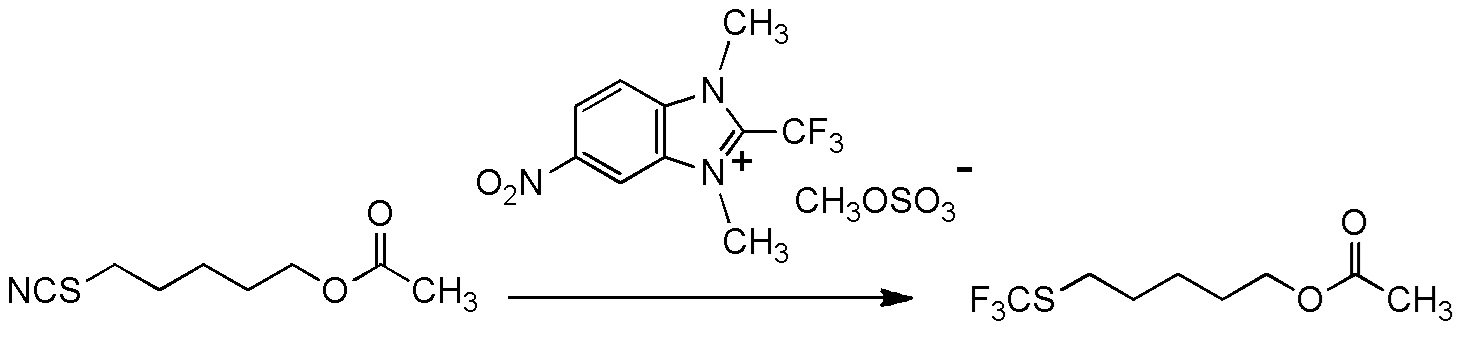
В 6 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 187 мг (1 ммоль) 1-ацетилокси-5-тиоцианатопентана, 415 мг (1,2 ммоль) метилсульфата 1,3-диметил-5-нитро-2-трифторметилбензимидазолия, 415 мг (3 ммоль) карбоната калия и 1 мл ДМФ. Смесь перемешивали при комнатной температуре в течение 24 часов. Образование (5-ацетилоксипентил)трифторметилсульфида (ион-предшественник; 230) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 24% (5-ацетилоксипентил)трифторметилсульфида (целевое соединение) и 53% 1-ацетилокси-5-тиоцианатопентана (исходное соединение). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-ацетилоксипентил)трифторметилсульфида (целевое соединение) составлял 27%.
[0844]
Пример 66
Метилсульфат 1,3-диметил-5-метилтио-2-трифторметилбензимидазолия
[Химическая формула 111]
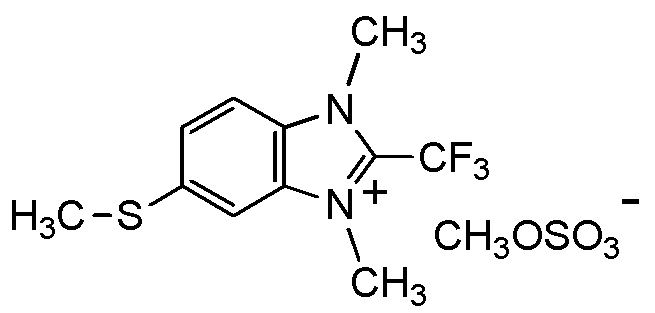
Вышеуказанное соединение синтезировали способом, аналогичным описанному в примерах по настоящему описанию, и идентифицировали посредством 1H-ЯМР анализа.
1H-ЯМР (300 МГц, CDCl3, относительно TMS) δ (м.д.): 2,99 (с, 6H), 3,16 (с, 3H), 3,18 (с, 3H), 6,68 (д, J=7,8 Гц, 1H), 7,28 (д, J=7,8 Гц, 1H), 8,48 (с, 1H).
1H-ЯМР изомера (300 МГц, CDCl3, относительно TMS) δ (м.д.): 3,40 (с, 6H), 4,32 (с, 3H), 4,34 (с, 3H), 8,47 (д, J=8,8 Гц, 1H), 8,63 (д, J=8,8 Гц, 1H), 9,09 (с, 1H).
[0845]
Пример 67
Метилсульфат 1,3-диметил-5-метилсульфинил-2-трифторметилбензимидазолия
[Химическая формула 112]
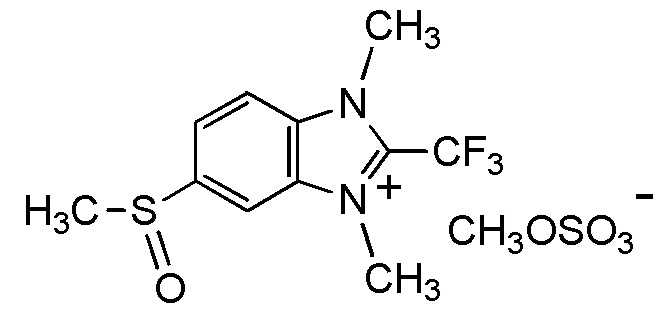
Вышеуказанное соединение синтезировали способом, аналогичным описанному в примерах по настоящему описанию, и идентифицировали посредством 1H-ЯМР анализа.
1H-ЯМР (300 МГц, CDCl3, относительно TMS) δ (м.д.): 3,00 (с, 6H), 3,16 (с, 3H), 3,18 (с, 3H), 6,68 (д, J=8,0 Гц, 1H), 7,28 (д, J=8,0 Гц, 1H), 8,49 (с, 1H).
1H-ЯМР изомера (300 МГц, CDCl3, относительно TMS) δ (м.д.): 3,41 (с, 6H), 4,32 (с, 3H), 4,35 (с, 3H), 8,48 (д, J=8,8 Гц, 1H), 8,63 (д, J=8,8 Гц, 1H), 9,12 (с, 1H).
[0846]
Пример 68
Метилсульфат 1,3-диметил-5-метилсульфонил-2-трифторметилбензимидазолия
[Химическая формула 113]
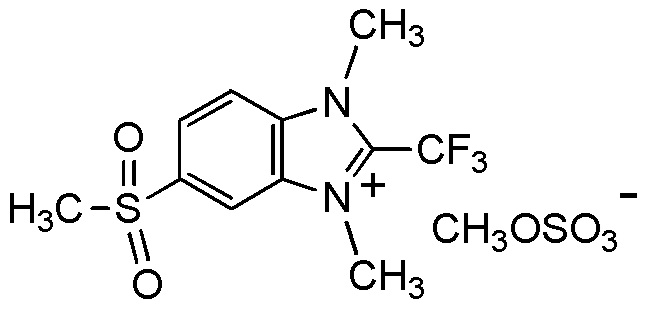
Вышеуказанное соединение синтезировали способом, аналогичным описанному в примерах по настоящему описанию, и идентифицировали посредством 1H-ЯМР анализа.
1H-ЯМР (300 МГц, CDCl3, относительно TMS) δ (м.д.): 2,97 (м, 9H), 3,09 (с, 3H), 6,64 (д, J=7,6 Гц, 1H), 7,23 (д, J=7,6 Гц, 1H), 8,41 (с, 1H).
1H-ЯМР изомера (300 МГц, CDCl3, относительно TMS) δ (м.д.): 3,54 (с, 3H), 3,42 (с, 3H), 4,32 (с, 3H), 4,37 (с, 3H), 8,40 (д, J=8,8 Гц, 1H), 8,58 (д, J=8,8 Гц, 1H), 8,96 (с, 1H).
[0847]
Пример 69
Метилсульфат 1,3-диметил-4-фтор-2-трифторметилбензимидазолия
[Химическая формула 114]
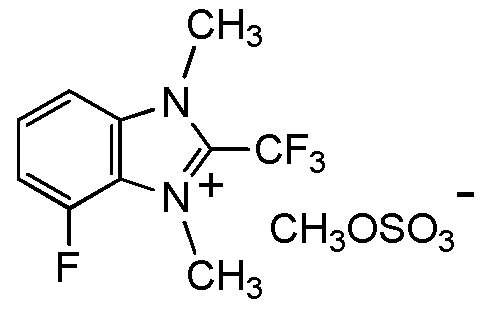
Вышеуказанное соединение синтезировали способом, аналогичным описанному в примерах по настоящему описанию, и идентифицировали посредством 1H-ЯМР анализа.
1H-ЯМР (300 МГц, CDCl3, относительно TMS) δ (м.д.): 3,36 (с, 3H), 4,29 (с, 3H), 4,35 (с, 3H), 7,77-7,81 (м, 1H), 7,85-7,91 (м, 1H), 8,16 (д, J=8,8 Гц, 1H).
[0848]
Пример 70
Получение (6-ацетилоксигексил)трифторметилсульфида
[Химическая формула 115]
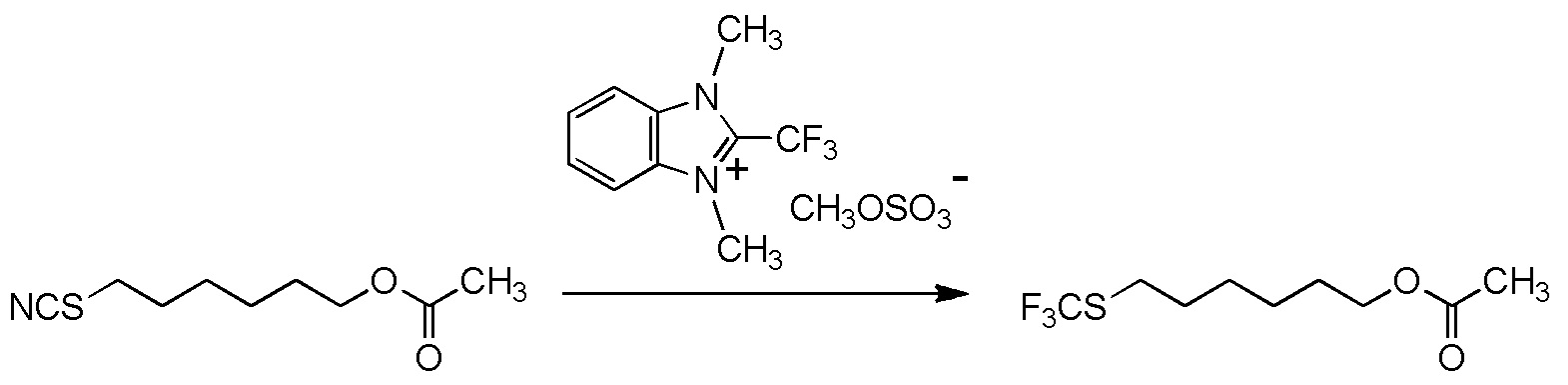
В 50 мл-овую трехгорлую колбу, снабженную механической мешалкой, добавляли 2 г (10 ммоль) 1-ацетилокси-6-тиоцианатогексана, 3 г молекулярного сита 4A (производство Tosoh Corporation; Zeolum (торговое наименование); A-4; порошок), 3,9 г (12 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 5 мл ДМФ. Смесь перемешивали при -10°C в течение 30 минут, и затем небольшими частями в течение 1 часа добавляли 1,5 г (25,2 ммоль) гидроксида калия, и смесь перемешивали при -10°C в течение 2 часов. Образование (6-ацетилоксигексил)трифторметилсульфида (ион-предшественник; 244) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 41% (6-ацетилоксигексил)трифторметилсульфида (целевое соединение), 11% 1-ацетилокси-6-тиоцианатогексана (исходное соединение) и 47% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (6-ацетилоксигексил)трифторметилсульфида (целевое соединение) составлял 75%.
[0849]
Пример 71
Получение (6-ацетилоксигексил)трифторметилсульфида
[Химическая формула 116]
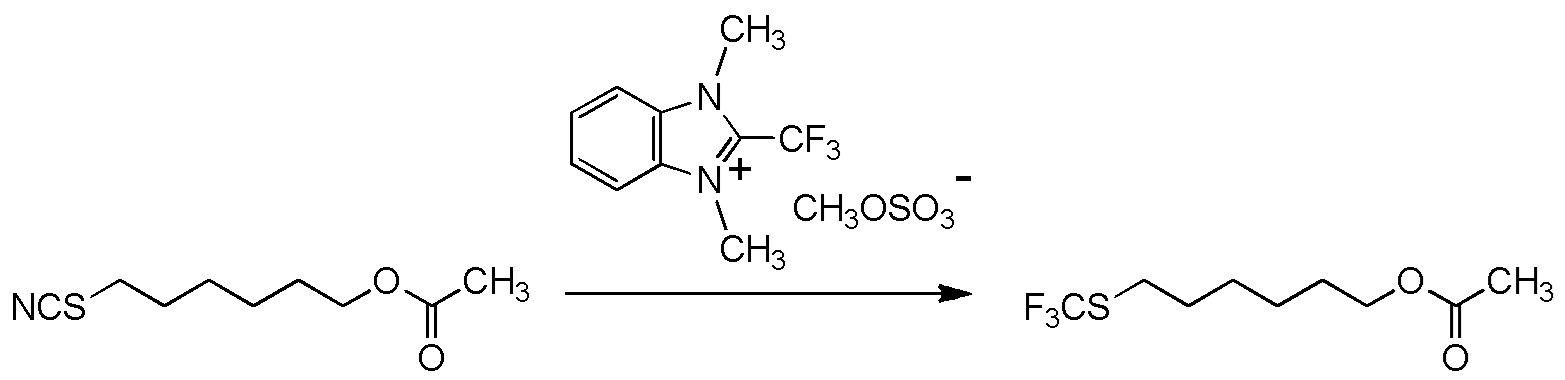
В 50 мл-овую трехгорлую колбу, снабженную механической мешалкой, добавляли 2 г (10 ммоль) 1-ацетилокси-6-тиоцианатогексана, 3 г молекулярного сита 4A (производство Tosoh Corporation; Zeolum (торговое наименование); A-4; порошок), 3,9 г (12 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 5 мл ДМФ. Смесь перемешивали при -20°C в течение 30 минут, и затем небольшими частями в течение 1 часа добавляли 1,5 г (25,2 ммоль) гидроксида калия и смесь перемешивали при -20°C в течение 1 часов. Образование (6-ацетилоксигексил)трифторметилсульфида (ион-предшественник; 244) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 48% (6-ацетилоксигексил)трифторметилсульфида (целевое соединение), 3% 1-ацетилокси-6-тиоцианатогексана (исходное соединение) и 47% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (6-ацетилоксигексил)трифторметилсульфида (целевое соединение) составлял 89%.
[0850]
Пример 72
Получение (6-ацетилоксигексил)трифторметилсульфида
[Химическая формула 117]
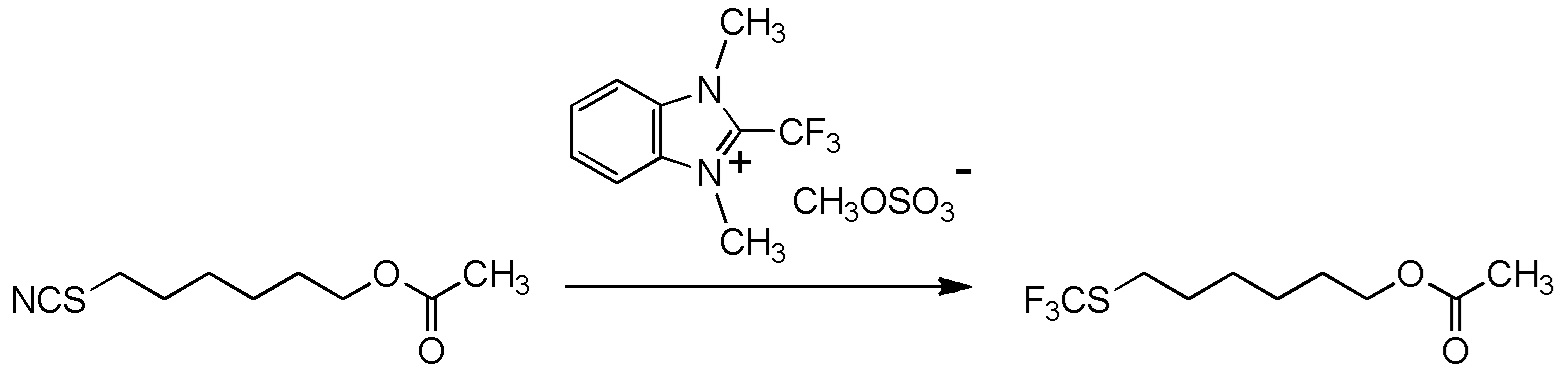
В 50 мл-овую трехгорлую колбу, снабженную механической мешалкой, добавляли 2 г (10 ммоль) 1-ацетилокси-6-тиоцианатогексана, 3 г молекулярного сита 4A (производство Tosoh Corporation; Zeolum (торговое наименование); A-4; порошок), 3,9 г (12 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 5 мл ДМФ. Смесь перемешивали при -30°C в течение 30 минут, и затем небольшими частями в течение 2 часов добавляли 1,5 г (25,2 ммоль) гидроксида калия и смесь перемешивали при -30°C в течение 4 часов. Образование (6-ацетилоксигексил)трифторметилсульфида (ион-предшественник; 244) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 52% (6-ацетилоксигексил)трифторметилсульфида (целевое соединение) и 46% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (6-ацетилоксигексил)трифторметилсульфида (целевое соединение) составлял 97%.
[0851]
Пример 73
Получение (6-ацетилоксигексил)трифторметилсульфида
[Химическая формула 118]

В 6 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 201 мг (1 ммоль) 1-ацетилокси-6-тиоцианатогексана, 300 мг молекулярного сита 4A (производство Tosoh Corporation; Zeolum (торговое наименование); A-4; порошок), 392 мг (1,2 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 1 мл ацетонитрила (MeCN). Смесь перемешивали при -10°C в течение 30 минут, и затем добавляли 148 мг (2,52 ммоль) гидроксида калия, и смесь перемешивали при -10°C в течение 14 часов. Образование (6-ацетилоксигексил)трифторметилсульфида (ион-предшественник; 244) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 25% (6-ацетилоксигексил)трифторметилсульфида (целевое соединение), 10% 1-ацетилокси-6-тиоцианатогексана (исходное соединение), 5% 1,2-бис[6-(ацетилокси)гексил] дисульфида (побочный продукт) и 60% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (6-ацетилоксигексил)трифторметилсульфида (целевое соединение) составлял 38%.
[0852]
Пример 74
Получение (6-ацетилоксигексил)трифторметилсульфида
[Химическая формула 119]
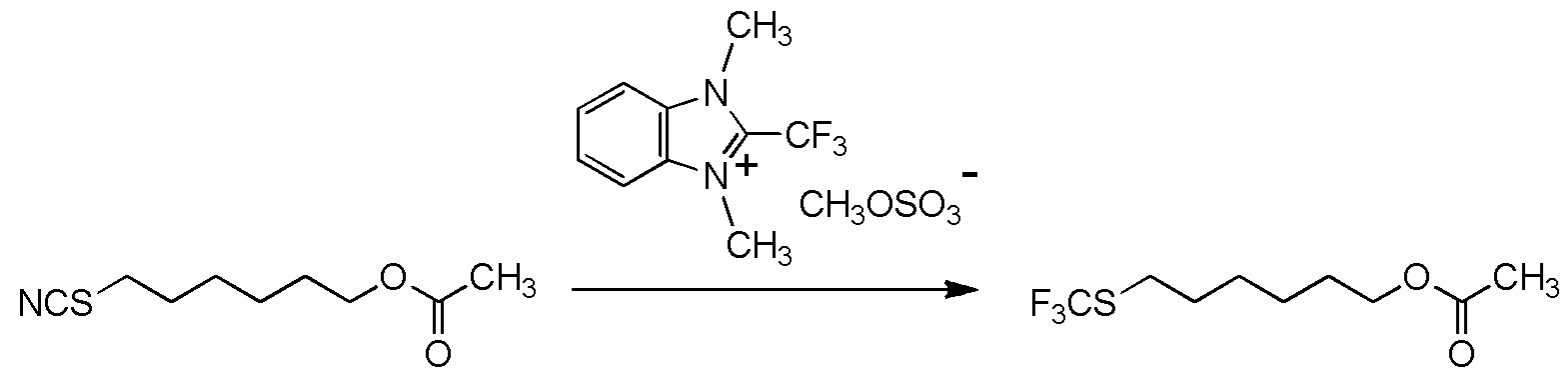
В 6 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 201 мг (1 ммоль) 1-ацетилокси-6-тиоцианатогексана, 300 мг молекулярного сита 4A (производство Tosoh Corporation; Zeolum (торговое наименование); A-4; порошок), 392 мг (1,2 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 0,5 мл N,N-диметилацетамида (DMAC). Смесь перемешивали при -10°C в течение 30 минут, и затем добавляли 148 мг (2,52 ммоль) гидроксида калия, и смесь перемешивали при -10°C в течение 14 часов. Образование (6-ацетилоксигексил)трифторметилсульфида (ион-предшественник; 244) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 45% (6-ацетилоксигексил)трифторметилсульфида (целевое соединение), 2% 1-ацетилокси-6-тиоцианатогексана (исходное соединение) и 48% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (6-ацетилоксигексил)трифторметилсульфида (целевое соединение) составлял 81%.
[0853]
Пример 75
Взаимодействие осуществляли способом, аналогичным описанному в примере 74, за исключением того, что вместо 0,5 мл N,N-диметилацетамида (DMAC) использовали 0,5 мл N-метилпирролидона (NMP) в качестве реакционного растворителя. Образование (6-ацетилоксигексил)трифторметилсульфида (ион-предшественник; 244) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 48% (6-ацетилоксигексил)трифторметилсульфида (целевое соединение), 5% 1-ацетилокси-6-тиоцианатогексана (исходное соединение), 2% 1,2-бис[6-(ацетилокси)гексил]дисульфида (побочный продукт) и 45% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (6-ацетилоксигексил)трифторметилсульфида (целевое соединение) составлял 80%.
[0854]
Пример 76
Взаимодействие осуществляли способом, аналогичным описанному в примере 74, за исключением того, что 1 мл ТГФ (тетрагидрофуран) использовали вместо 0,5 мл N,N-диметилацетамида (DMAC) в качестве реакционного растворителя. Образование (6-ацетилоксигексил)трифторметилсульфида (ион-предшественник; 244) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 24% (6-ацетилоксигексил)трифторметилсульфида (целевое соединение), 20% 1-ацетилокси-6-тиоцианатогексана (исходное соединение), 4% 1,2-бис[6-(ацетилокси)гексил]дисульфида (побочный продукт) и 52% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (6-ацетилоксигексил)трифторметилсульфида (целевое соединение) составлял 42%.
[0855]
Пример 77
Получение (6-ацетилоксигексил)трифторметилсульфида
[Химическая формула 120]
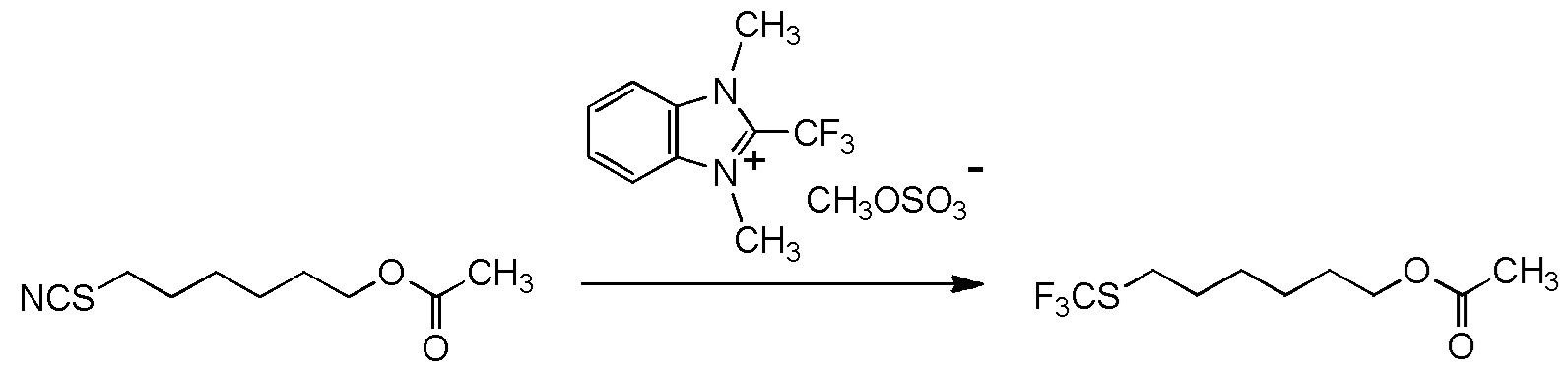
В 100 мл-овую четырехгорлую колбу, снабженную механической мешалкой, добавляли 6 г (30 ммоль) 1-ацетилокси-6-тиоцианатогексана, 9 г молекулярного сита 4A (производство Tosoh Corporation; Zeolum (торговое наименование); A-4; порошок), 11,7 г (36 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 15 мл ДМФ. Смесь перемешивали при -30°C в течение 30 минут, и затем по каплям в течение 1 часа добавляли суспензию, полученную диспергированием 4,4 г (75,6 ммоль) гидроксида калия в 15 мл толуола. После прекращения добавления по каплям, смесь перемешивали при -30°C в течение 24 часов. Образование (6-ацетилоксигексил)трифторметилсульфида (ион-предшественник; 244) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 52% (6-ацетилоксигексил)трифторметилсульфида (целевое соединение) и 48% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (6-ацетилоксигексил)трифторметилсульфида (целевое соединение) составлял 92%.
[0856]
Пример 78
Получение (6-ацетилоксигексил)трифторметилсульфида
[Химическая формула 121]
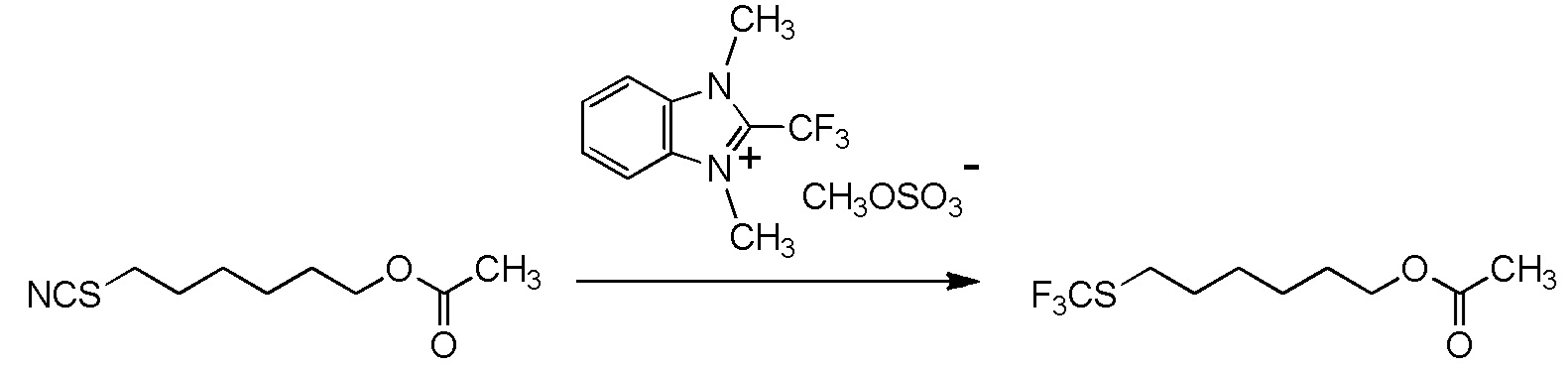
В 50 мл-овую трехгорлую колбу, снабженную механической мешалкой, добавляли 2 г (10 ммоль) 1-ацетилокси-6-тиоцианатогексана, 3 г молекулярного сита 4A (производство Tosoh Corporation; Zeolum (торговое наименование); A-4; порошок), 3,9 г (12 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 5 мл ДМФ. Смесь перемешивали при -30°C в течение 30 минут и затем по каплям в течение 1 часа добавляли суспензию, полученную диспергированием 1,5 г (25,2 ммоль) гидроксида калия в 7 мл толуола, и смесь перемешивали при -30°C в течение 24 часов. Образование (6-ацетилоксигексил)трифторметилсульфида (ион-предшественник; 244) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 52% (6-ацетилоксигексил)трифторметилсульфида (целевое соединение) и 48% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (6-ацетилоксигексил)трифторметилсульфида (целевое соединение) составлял 99%.
[0857]
Пример 79
Получение (6-ацетилоксигексил)трифторметилсульфида
[Химическая формула 122]
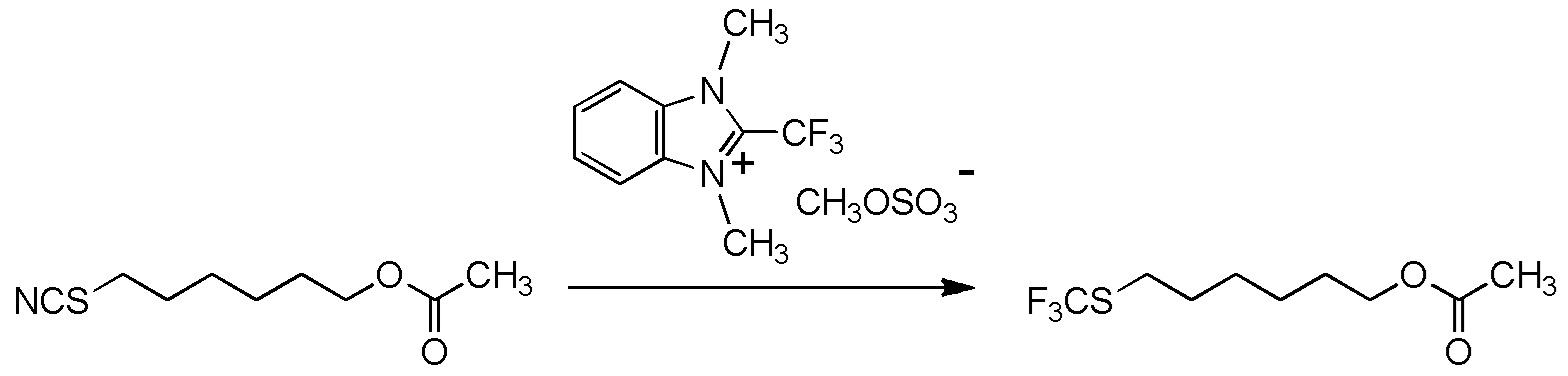
В 6 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 101 мг (0,5 ммоль) 1-ацетилокси-6-тиоцианатогексана, 203 мг (0,63 ммоль) бромида тетрабутиламмония, 196 мг (0,6 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 0,5 мл толуола. Смесь перемешивали при комнатной температуре в течение 30 минут, и затем добавляли 74 мг (1,26 ммоль) гидроксида калия, и смесь перемешивали при комнатной температуре в течение 24 часов. Образование (6-ацетилоксигексил)трифторметилсульфида (ион-предшественник; 244) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 24% (6-ацетилоксигексил)трифторметилсульфида (целевое соединение), 12% 1-ацетилокси-6-тиоцианатогексана (исходное соединение), 9% 1,2-бис[6-(ацетилокси)гексил] дисульфида (побочный продукт) и 53% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (6-ацетилоксигексил)трифторметилсульфида (целевое соединение) составлял 48%.
[0858]
Пример 80
Производство (6-ацетилоксигексил)трифторметилсульфида
[Химическая формула 123]
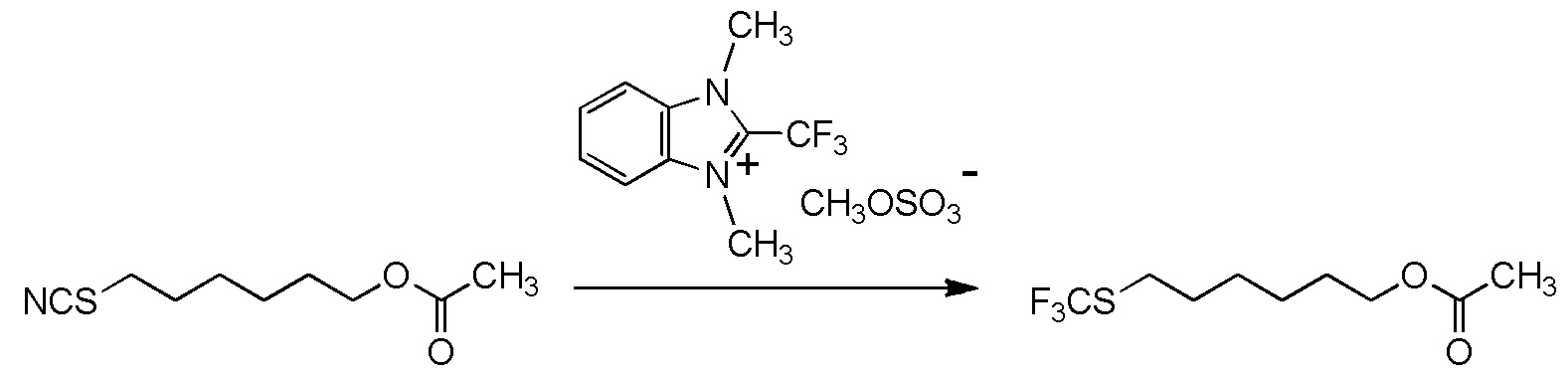
В 6 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 201 мг (1 ммоль) 1-ацетилокси-6-тиоцианатогексана, 32 мг (0,1 ммоль) бромида тетрабутиламмония, 392 мг (1,2 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 1 мл толуола. Смесь перемешивали при комнатной температуре в течение 30 минут, и затем добавляли 415 мг (3 ммоль) карбоната калия, и смесь перемешивали при комнатной температуре в течение 96 часов. Образование (6-ацетилоксигексил)трифторметилсульфида (ион-предшественник; 244) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 23% (6-ацетилоксигексил)трифторметилсульфида (целевое соединение), 27% 1-ацетилокси-6-тиоцианатогексана (исходное соединение) и 50% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (6-ацетилоксигексил)трифторметилсульфида (целевое соединение) составлял 48%.
[0859]
Пример 81
Получение (6-ацетилоксигексил)трифторметилсульфида
[Химическая формула 124]
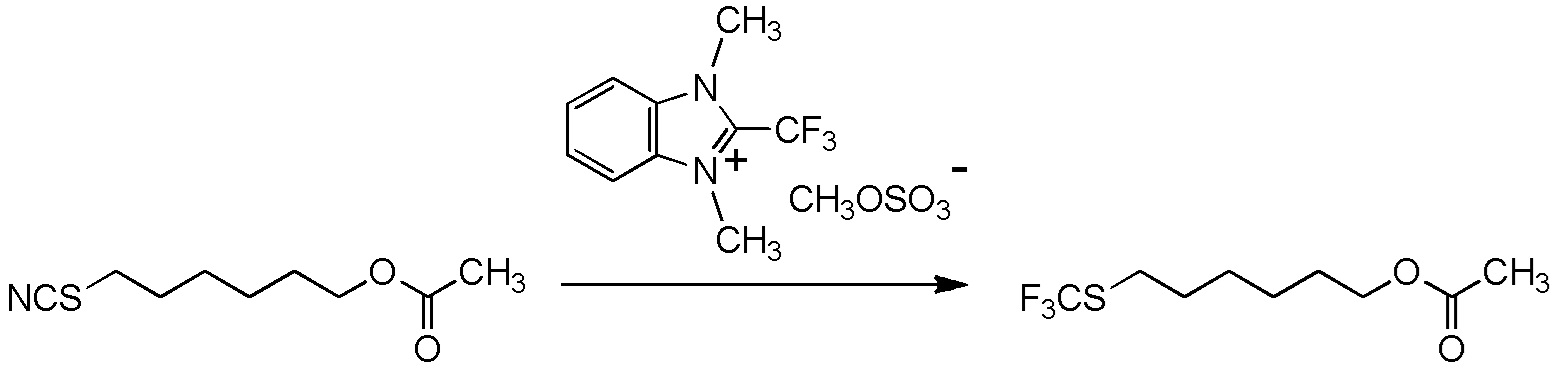
В 6 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 201 мг (1 ммоль) 1-ацетилокси-6-тиоцианатогексана, 32 мг (0,1 ммоль) бромида тетрабутиламмония, 392 мг (1,2 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 1 мл ТГФ. Смесь перемешивали при комнатной температуре в течение 30 минут, и затем добавляли 174 мг (1,26 ммоль) карбоната калия, и смесь перемешивали при комнатной температуре в течение 14 часов. Затем смесь перемешивали при 50°C в течение 5 часов. Образование (6-ацетилоксигексил)трифторметилсульфида (ион-предшественник; 244) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 22% (6-ацетилоксигексил)трифторметилсульфида (целевое соединение), 27% 1-ацетилокси-6-тиоцианатогексана (исходное соединение), 3% 1,2-бис[6-(ацетилокси)гексил] дисульфида (побочный продукт), 44% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента) и 1% 1,3-диметил-2,2-бис(трифторметил)-2,3-дигидро-бензимидазола (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (6-ацетилоксигексил)трифторметилсульфида (целевое соединение) составлял 42%.
[0860]
Пример 82
Взаимодействие осуществляли способом, аналогичным описанному в примере 81, за исключением того, что 36 мг (0,1 ммоль) бромида бензилтрибутиламмония использовали вместо 32 мг (0,1 ммоль) бромида тетрабутиламмония в качестве катализатора межфазного переноса. Образование (6-ацетилоксигексил)трифторметилсульфида (ион-предшественник; 244) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 23% (6-ацетилоксигексил)трифторметилсульфида (целевое соединение), 26% 1-ацетилокси-6-тиоцианатогексана (исходное соединение), 4% 1,2-бис[6-(ацетилокси)гексил]дисульфида (побочный продукт), 44% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента) и 1% 1,3-диметил-2,2-бис(трифторметил)-2,3-дигидро-бензимидазола (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (6-ацетилоксигексил)трифторметилсульфида (целевое соединение) составлял 45%.
[0861]
Пример 83
Взаимодействие осуществляли способом, аналогичным описанному в примере 81, за исключением того, что 55 мг (0,1 ммоль) бромида тетраоктиламмония использовали вместо 32 мг (0,1 ммоль) бромида тетрабутиламмония в качестве катализатора межфазного переноса. Образование (6-ацетилоксигексил)трифторметилсульфида (ион-предшественник; 244) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 25% (6-ацетилоксигексил)трифторметилсульфида (целевое соединение), 26% 1-ацетилокси-6-тиоцианатогексана (исходное соединение), 3% 1,2-бис[6-(ацетилокси)гексил] дисульфида (побочный продукт), 41% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента) и 1% 1,3-диметил-2,2-бис(трифторметил)-2,3-дигидро-бензимидазола (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (6-ацетилоксигексил)трифторметилсульфида (целевое соединение) составлял 47%.
[0862]
Пример 84
Получение (5-ацетилоксипентил)трифторметилсульфида
[Химическая формула 125]
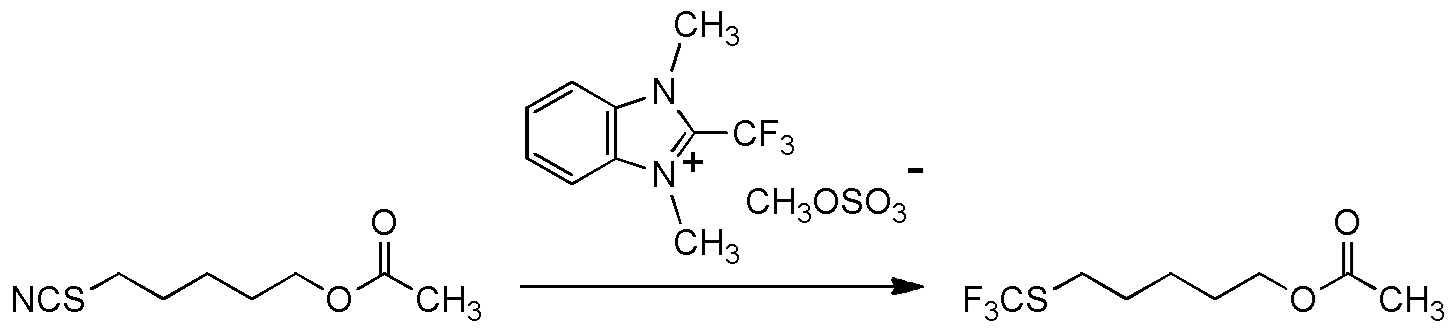
В 9 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 187 мг (1 ммоль) 1-ацетилокси-5-тиоцианатопентана, 1,6 г (5 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 5 мл ДМФ. Смесь перемешивали при комнатной температуре в течение 30 минут, и затем добавляли 1,7 г (12,5 ммоль) карбоната калия, и смесь перемешивали при комнатной температуре в течение 14 часов. Образование (5-ацетилоксипентил)трифторметилсульфида (ион-предшественник; 230) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 9% (5-ацетилоксипентил)трифторметилсульфида (целевое соединение), 5% 1-ацетилокси-5-тиоцианатопентана (исходное соединение) и 85% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-ацетилоксипентил)трифторметилсульфида (целевое соединение) составлял 55%.
[0863]
Пример 85
Получение (5-бензилоксипентил)трифторметилсульфида
[Химическая формула 126]
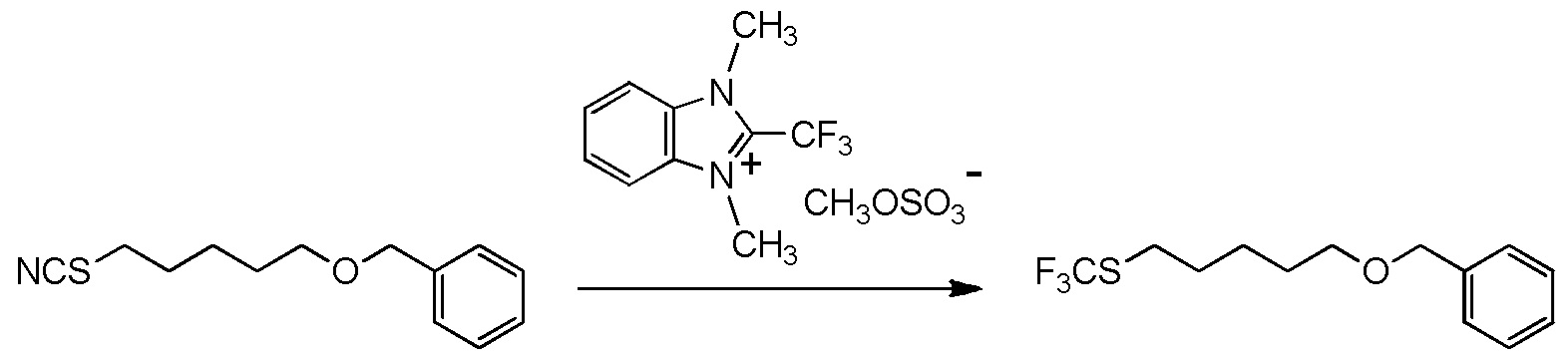
В 6 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 118 мг (0,5 ммоль) 1-бензилокси-5-тиоцианатопентана, 300 мг молекулярного сита 4A (производство Tosoh Corporation; Zeolum (торговое наименование); A-4; порошок), 196 мг (0,6 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 1,5 мл ДМФ. Смесь перемешивали при -10°C в течение 30 минут, и затем добавляли 50 мг (1,26 ммоль) 60% гидрида натрия, и смесь перемешивали при -10°C в течение 48 часов. Образование (5-бензилоксипентил)трифторметилсульфида (ион-предшественник; 278) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 51% (5-бензилоксипентил)трифторметилсульфида (целевое соединение), 8% 1-бензилокси-5-тиоцианатопентана (исходное соединение) и 27% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-бензилоксипентил)трифторметилсульфида (целевое соединение) составлял 70%.
[0864]
Пример 86
Получение (5-бензилоксипентил)трифторметилсульфида
[Химическая формула 127]
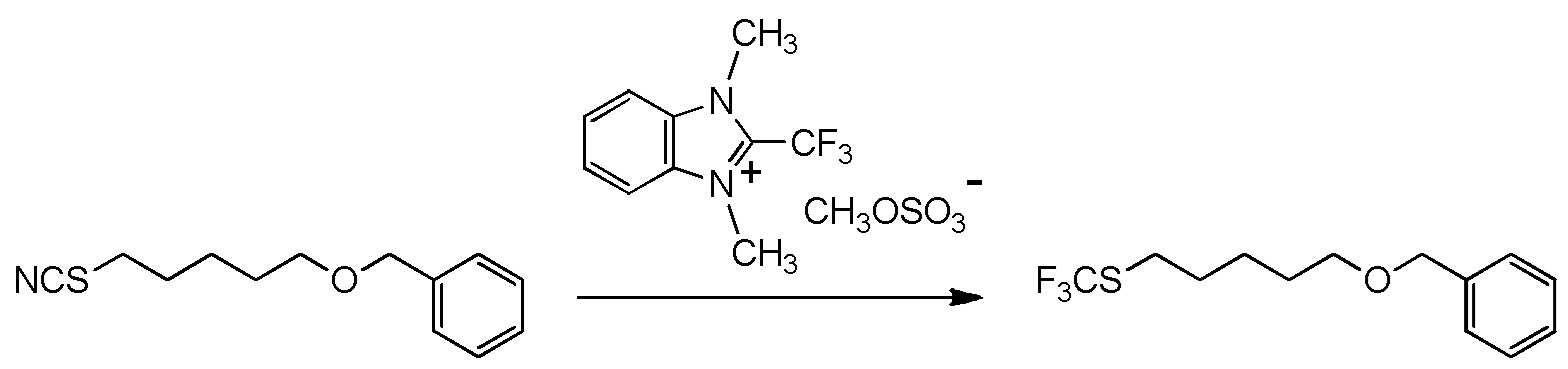
В 6 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 118 мг (0,5 ммоль) 1-бензилокси-5-тиоцианатопентана, 196 мг (0,6 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 1,5 мл ДМФ. Смесь перемешивали при -10°C в течение 30 минут, и затем добавляли 50 мг (1,26 ммоль) 60% гидрида натрия, и смесь перемешивали при -10°C в течение 48 часов. Образование (5-бензилоксипентил)трифторметилсульфида (ион-предшественник; 278) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 40% (5-бензилоксипентил)трифторметилсульфида (целевое соединение), 23% 1-бензилокси-5-тиоцианатопентана (исходное соединение) и 36% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-бензилоксипентил)трифторметилсульфида (целевое соединение) составлял 41%.
[0865]
Пример 87
Получение 5-трифторметилтиопентил-[4-хлор-2-фтор-5-(2,2,2-трифторэтилтио)фенил]эфира
[Химическая формула 128]
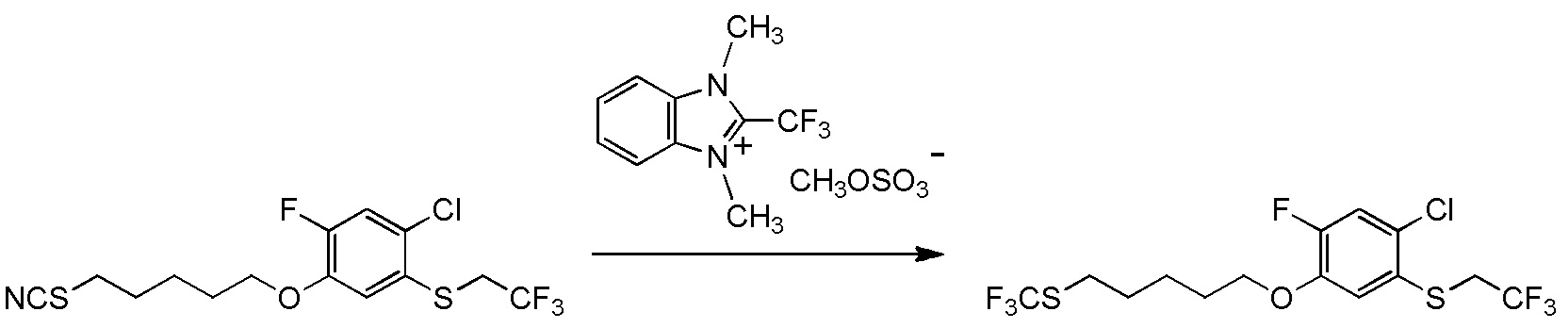
В 6 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 388 мг (1 ммоль) 5-тиоцианатопентил-[4-хлор-2-фтор-5-(2,2,2-трифторэтилтио)фенил] эфира (исходное соединение), 300 мг молекулярного сита 4A (производство Tosoh Corporation; Zeolum (торговое наименование); A-4; порошок), 392 мг (1,2 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 1 мл ДМФ. Смесь перемешивали при -10°C в течение 30 минут, затем добавляли 148 мг (2,52 ммоль) гидроксида калия и смесь перемешивали при -10°C в течение 14 часов. Образование указанного в заголовке целевого соединения (ион-предшественник; 430) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом:
61% целевого соединения, 5% исходного соединения и 34% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента).
Выход целевого соединения составлял 92% по расчетам процентов площади ГХ.
[0866]
Пример 88
Получение (2,5-дихлорфенил)трифторметилсульфида
[Химическая формула 129]
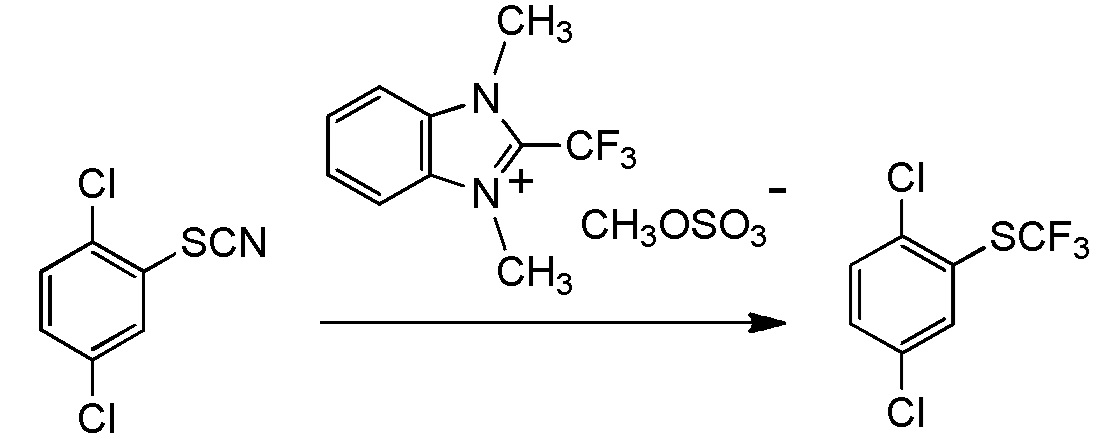
В 10 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 26 мг (0,125 ммоль) 1,4-дихлор-2-тиоцианатобензола (исходное соединение), 35 мг (0,25 ммоль) карбоната калия и 0,5 мл ДМФ. В то время, когда смесь перемешивали при охлаждении льдом, добавляли 55 мг (0,17 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия. В то время, когда температура медленно повышалась до значения комнатной температуры, смесь перемешивали в течение 15 часов. Образование (2,5-дихлорфенил)трифторметилсульфида (ион-предшественник; 245) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 5% (2,5-дихлорфенил)трифторметилсульфида (целевое соединение), 41% 1,2-бис(2,5-дихлорфенил) дисульфида (побочный продукт) и 54% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). Выход (2,5-дихлорфенил)трифторметилсульфида (целевое соединение) составлял 11% по расчетам процентов площади ГХ. (2,5-Дихлорфенил)трифторметилсульфид (целевое соединение) также называется как (2,5-дихлорфенил)(трифторметил) сульфан.
[0867]
Пример 89
Получение (3-метоксифенил)трифторметилсульфида
[Химическая формула 130]
Взаимодействие осуществляли способом, аналогичным описанному в примере 88, за исключением того, что вместо 1,4-дихлор-2-тиоцианатобензола использовали 1-метокси-3-тиоцианатобензол в качестве исходного соединения. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 19% (3-метоксифенил)трифторметилсульфида (целевое соединение), 3% 1,2-бис(3-метоксифенил) дисульфида (побочный продукт) и 64% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). Выход (3-метоксифенил)трифторметилсульфида (целевое соединение) составлял 53% по расчетам процентов площади ГХ. (3-Метоксифенил)трифторметилсульфид (целевое соединение) также называется как (3-метоксифенил)(трифторметил) сульфан.
[0868]
Пример 90
Получение (2,5-дихлорфенил)трифторметилсульфида
[Химическая формула 131]
В 10 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 26 мг (0,125 ммоль) 1,4-дихлор-2-тиоцианатобензола (исходное соединение), 55 мг (0,17 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 0,5 мл ДМФ. В то время, когда смесь перемешивали при охлаждении льдом, добавляли 35 мг (0,25 ммоль) карбоната калия. В то время, когда температура медленно повышалась до значения комнатной температуры, смесь перемешивали в течение 15 часов. Образование (2,5-дихлорфенил)трифторметилсульфида (ион-предшественник; 245) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 8% (2,5-дихлорфенил)трифторметилсульфида (целевое соединение), 36% 1,2-бис(2,5-дихлорфенил) дисульфида (побочный продукт) и 57% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). Выход (2,5-дихлорфенил)трифторметилсульфида (целевое соединение) составлял 18% по расчетам процентов площади ГХ. В результате анализа методом ГХ, с использованием хлорбензола в качестве внутреннего стандарта, выход целевого соединения составлял 25%.
[0869]
Пример 91
Получение (3-метоксифенил)трифторметилсульфида
[Химическая формула 132]
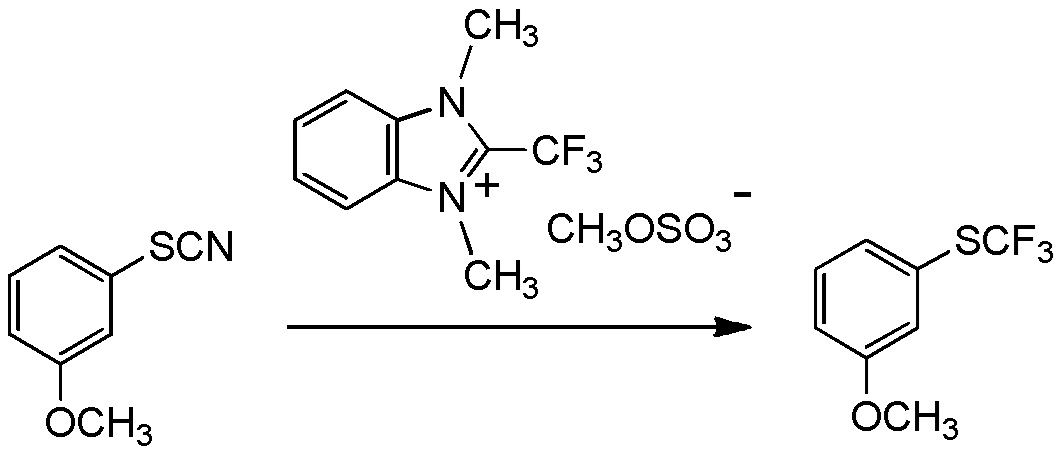
Взаимодействие осуществляли способом, аналогичным описанному в примере 90, за исключением того, что вместо 1,4-дихлор-2-тиоцианатобензола использовали 1-метокси-3-тиоцианатобензол в качестве исходного соединения. Выход (3-метоксифенил)трифторметилсульфида в качестве целевого соединения составлял 53% по расчетам процентов площади ГХ.
[0870]
Пример 92
Взаимодействие осуществляли способом, аналогичным описанному в примере 90, за исключением того, что вместо 1,4-дихлор-2-тиоцианатобензола использовали смесь 1-метил-3-фенил-4-тиоцианато-1H-пиразола и 1-метил-5-фенил-4-тиоцианато-1H-пиразола в качестве исходного соединения. Выход смеси 1-метил-3-фенил-4-трифторметилтио-1H-пиразола и 1-метил-5-фенил-4-трифторметилтио-1H-пиразола в качестве целевого соединения составлял 40% по расчетам процентов площади ГХ.
[0871]
Пример 93
Взаимодействие осуществляли способом, аналогичным описанному в примере 90, за исключением того, что вместо 1,4-дихлор-2-тиоцианатобензола использовали 2-тиоцианатопиридин в качестве исходного соединения. Выход 2-трифторметилтиопиридина в качестве целевого соединения составлял 35% по расчетам процентов площади ГХ.
[0872]
Пример 94
Получение (3-метоксифенил)трифторметилсульфида
[Химическая формула 133]
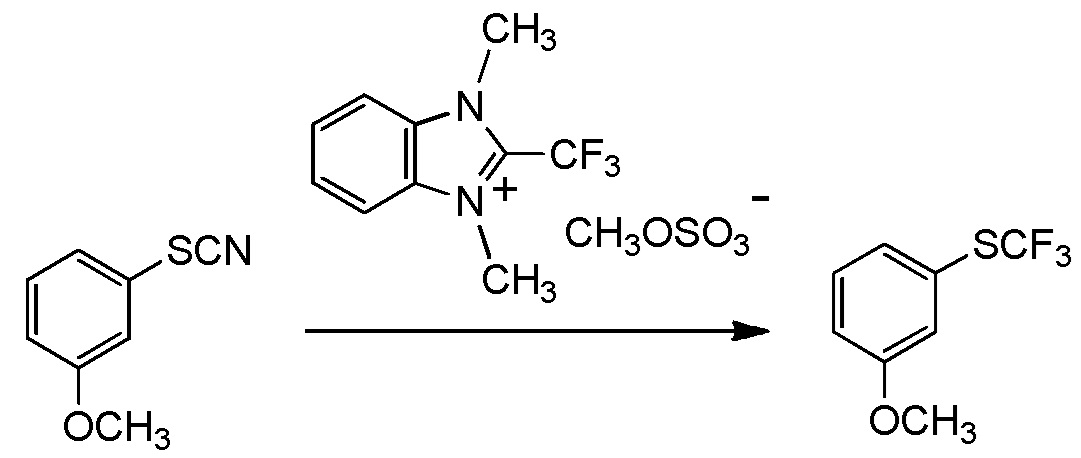
В 6 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 165 мг (1 ммоль) 1-метокси-3-тиоцианатобензола, 300 мг молекулярного сита 4A (производство Tosoh Corporation; Zeolum (торговое наименование); A-4; порошок), 392 мг (1,2 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 1 мл ДМФ. Смесь перемешивали при -10°C в течение 30 минут, и затем добавляли 148 мг (2,52 ммоль) гидроксида калия, и смесь перемешивали при -10°C в течение 40 часов. Образование (3-метоксифенил)трифторметилсульфида подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 39% (3-метоксифенил)трифторметилсульфида (целевое соединение), 6% 1,2-бис(3-(метилокси)фенил) дисульфида (побочный продукт) и 51% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). Выход целевого соединения составлял 80% по расчетам процентов площади ГХ.
[0873]
Пример 95
Получение (5-ацетилоксипентил)трифторметилсульфида
[Химическая формула 134]
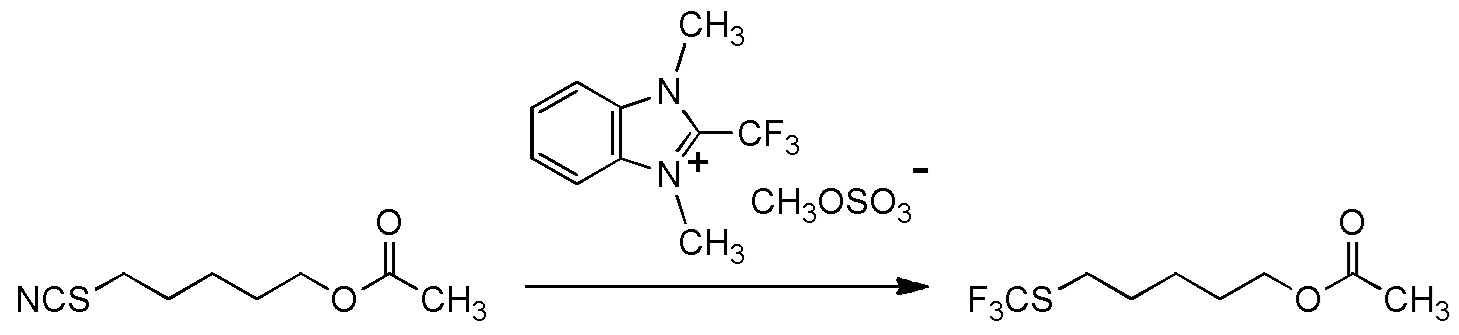
В 6 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 187 мг (1 ммоль) 1-ацетилокси-5-тиоцианатопентана, 300 мг молекулярного сита 3A (производство Tosoh Corporation; Zeolum (торговое наименование); A-3; порошок), 392 мг (1,2 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 1 мл ДМФ. Смесь перемешивали при -10°C в течение 30 минут, и затем добавляли 148 мг (2,52 ммоль) гидроксида калия, и смесь перемешивали при -10°C в течение 3 часов. Образование (5-ацетилоксипентил)трифторметилсульфида (ион-предшественник; 230) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 39% (5-ацетилоксипентил)трифторметилсульфида (целевое соединение), 7% 1-ацетилокси-5-тиоцианатопентана (исходное соединение), 1% 1,2-бис[5-(ацетилокси)пентил]дисульфида (побочный продукт) и 51% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-ацетилоксипентил)трифторметилсульфида (целевое соединение) составлял 76%.
[0874]
Пример 96
Получение (5-ацетилоксипентил)трифторметилсульфида
[Химическая формула 135]
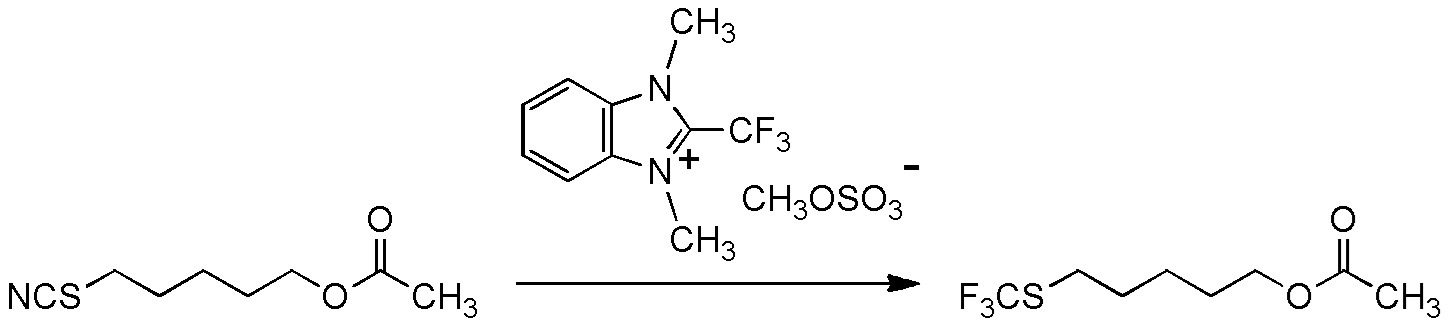
В 6 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 187 мг (1 ммоль) 1-ацетилокси-5-тиоцианатопентана, 300 мг молекулярного сита 5A (производство GL Sciences Inc.; порошок), 392 мг (1,2 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 1 мл ДМФ. Смесь перемешивали при -10°C в течение 30 минут, и затем добавляли 148 мг (2,52 ммоль) гидроксида калия и смесь перемешивали при -10°C в течение 12 часов. Образование (5-ацетилоксипентил)трифторметилсульфида (ион-предшественник; 230) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 52% (5-ацетилоксипентил)трифторметилсульфида (целевое соединение), 1% 1-ацетилокси-5-тиоцианатопентана (исходное соединение), 0,4% 1,2-бис[5-(ацетилокси)пентил]дисульфида (побочный продукт) и 47% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-ацетилоксипентил)трифторметилсульфида (целевое соединение) составлял 76%.
[0875]
Пример 97
Получение (5-ацетилоксипентил)трифторметилсульфида
[Химическая формула 136]
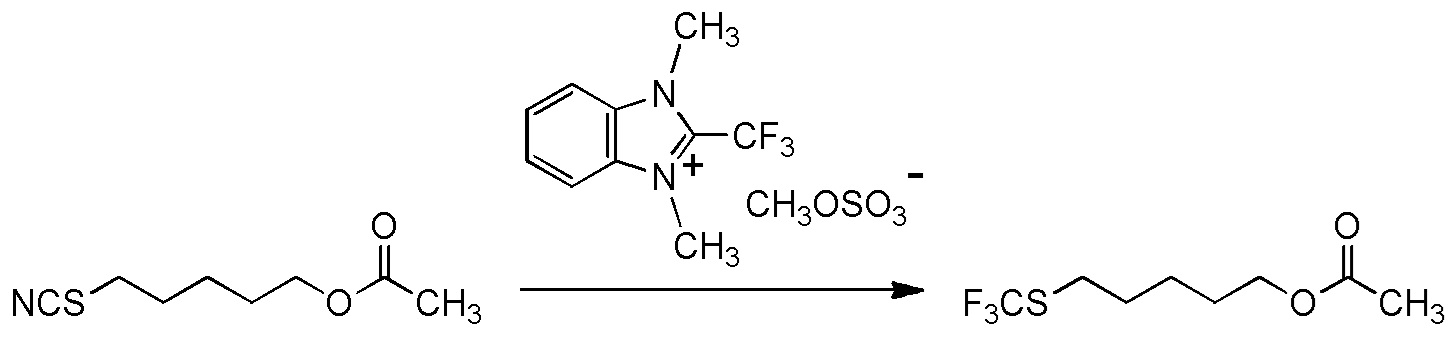
В 6 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 187 мг (1 ммоль) 1-ацетилокси-5-тиоцианатопентана, 300 мг молекулярного сита 13X (производство GL Sciences Inc.; порошок), 392 мг (1,2 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 1 мл ДМФ. Смесь перемешивали при -10°C в течение 30 минут, и затем добавляли 148 мг (2,52 ммоль) гидроксида калия, и смесь перемешивали при -10°C в течение 12 часов. Образование (5-ацетилоксипентил)трифторметилсульфида (ион-предшественник; 230) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 20% (5-ацетилоксипентил)трифторметилсульфида (целевое соединение), 14% 1-ацетилокси-5-тиоцианатопентана (исходное соединение), 4% 1,2-бис[5-(ацетилокси)пентил]дисульфида (побочный продукт) и 62% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-ацетилоксипентил)трифторметилсульфида (целевое соединение) составлял 53%.
[0876]
Пример 98
Получение (5-ацетилоксипентил)трифторметилсульфида
[Химическая формула 137]
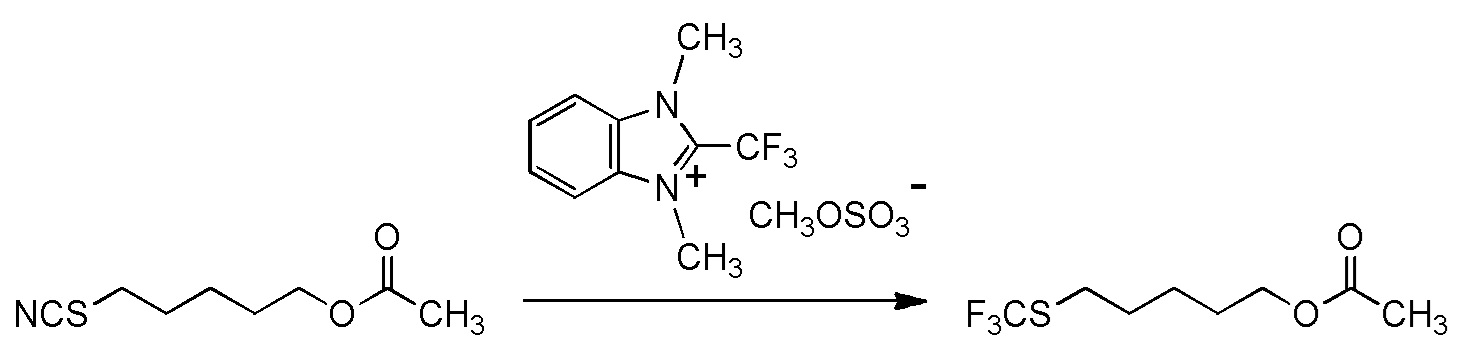
В 6 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 187 мг (1 ммоль) 1-ацетилокси-5-тиоцианатопентана, 392 мг (1,2 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 0,5 мл ДМФ. Смесь перемешивали при -10°C в течение 30 минут, затем добавляли 148 мг (2,52 ммоль) гидроксида калия и смесь перемешивали при -10°C в течение 14 часов. Образование (5-ацетилоксипентил)трифторметилсульфида (ион-предшественник; 230) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 10% (5-ацетилоксипентил)трифторметилсульфида (целевое соединение), 7% 1-ацетилокси-5-тиоцианатопентана (исходное соединение), 10% 1,2-бис[5-(ацетилокси)пентил]дисульфида (побочный продукт) и 64% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-ацетилоксипентил)трифторметилсульфида (целевое соединение) составлял 21%.
[0877]
Пример 99
Получение (6-ацетилоксигексил)трифторметилсульфида
[Химическая формула 138]
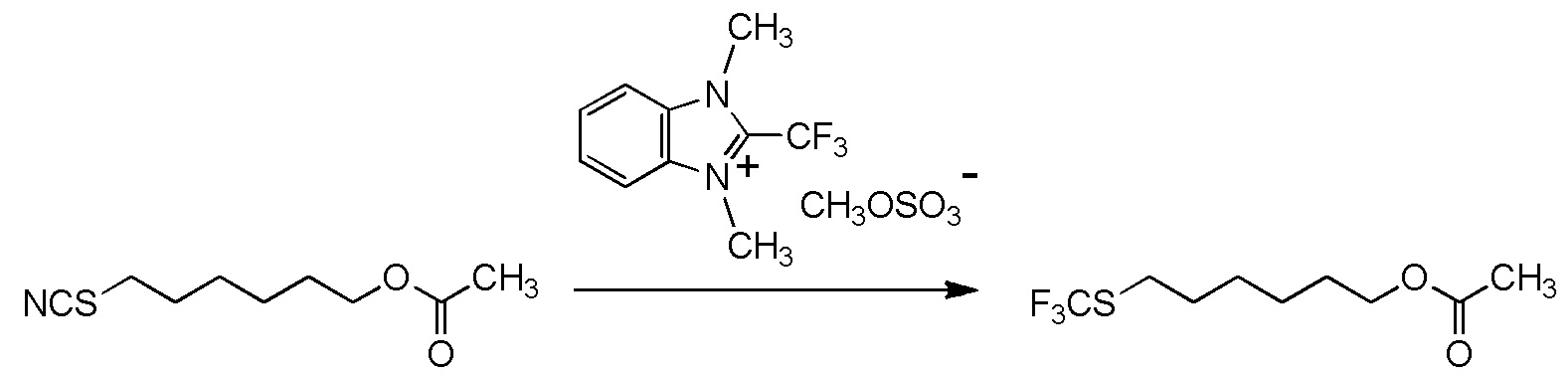
В 50 мл-овую трехгорлую колбу, снабженную механической мешалкой, добавляли 2 г (10 ммоль) 1-ацетилокси-6-тиоцианатогексана, 3 г молекулярного сита 4A (производство Tosoh Corporation; Zeolum (торговое наименование); A-4; порошок), 3,9 г (12 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 5 мл ДМФ. Смесь перемешивали при -30°C в течение 30 минут, и затем по каплям в течение 1 часа добавляли суспензию, полученную диспергированием 1,5 г (25,2 ммоль) гидроксида калия в 7 мл толуола. Смесь перемешивали при -30°C в течение 24 часов. Образование (6-ацетилоксигексил)трифторметилсульфида (ион-предшественник; 244) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 52% (6-ацетилоксигексил)трифторметилсульфида (целевое соединение) и 48% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (6-ацетилоксигексил)трифторметилсульфида (целевое соединение) составлял 99%.
[0878]
Пример 100
Получение (6-ацетилоксигексил)трифторметилсульфида
[Химическая формула 139]
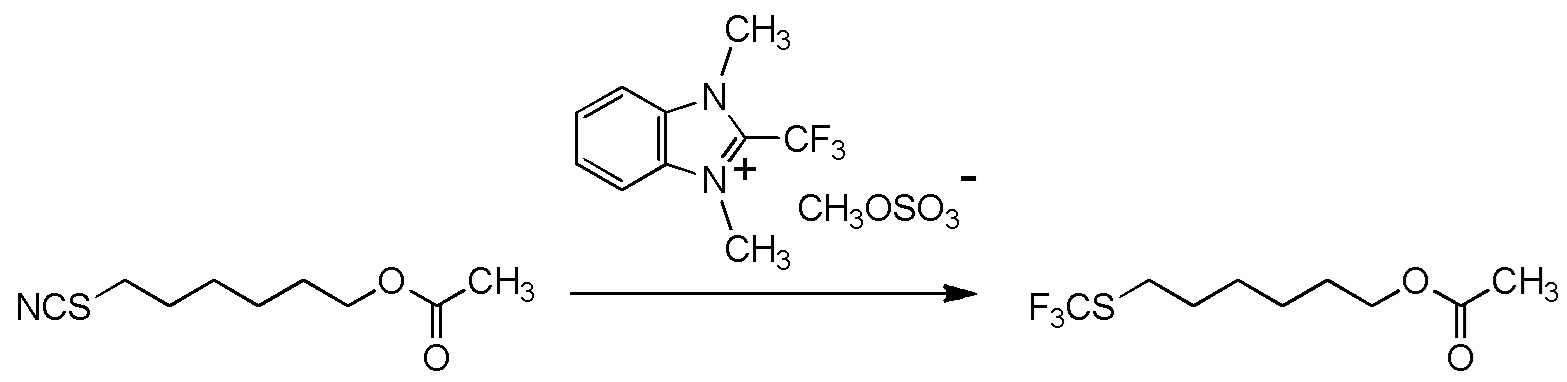
В 50 мл-овую трехгорлую колбу, снабженную механической мешалкой, добавляли 2 г (10 ммоль) 1-ацетилокси-6-тиоцианатогексана, 2 г молекулярного сита 4A (производство Tosoh Corporation; Zeolum (торговое наименование); A-4; порошок), 3,9 г (12 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 5 мл ДМФ. Смесь перемешивали при -30°C в течение 30 минут, и затем по каплям в течение 1 часа добавляли суспензию, полученную диспергированием 1,5 г (25,2 ммоль) гидроксида калия в 7 мл толуола. Смесь перемешивали при -30°C в течение 14 часов. Образование (6-ацетилоксигексил)трифторметилсульфида (ион-предшественник; 244) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 52% (6-ацетилоксигексил)трифторметилсульфида (целевое соединение) и 48% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (6-ацетилоксигексил)трифторметилсульфида (целевое соединение) составлял 93%.
[0879]
Пример 101
Получение (6-ацетилоксигексил)трифторметилсульфида
[Химическая формула 140]
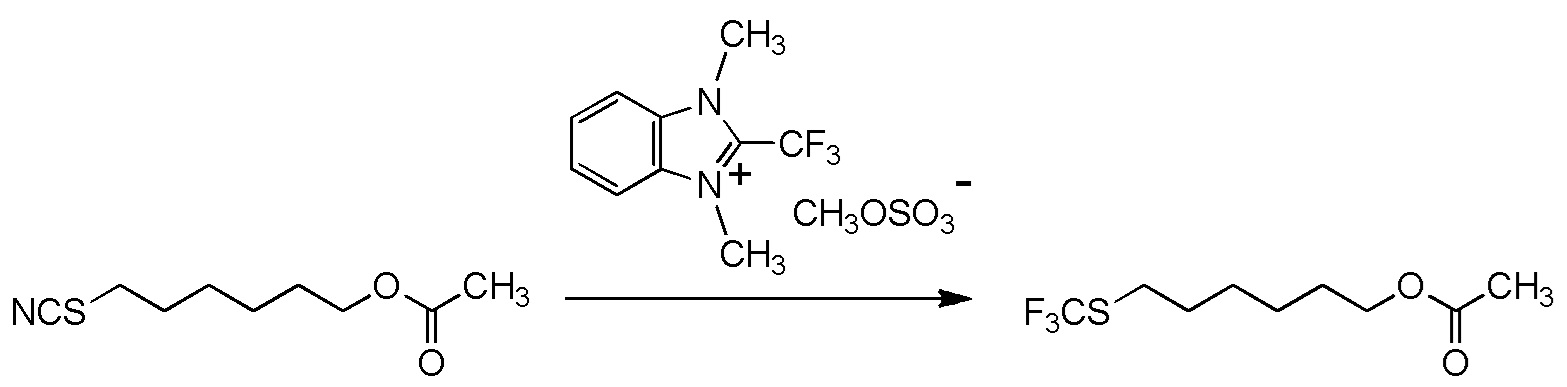
В 50 мл-овую трехгорлую колбу, снабженную механической мешалкой, добавляли 2 г (10 ммоль) 1-ацетилокси-6-тиоцианатогексана, 1,5 г молекулярного сита 4A (производство Tosoh Corporation; Zeolum (торговое наименование); A-4; порошок), 3,9 г (12 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 5 мл ДМФ. Смесь перемешивали при -30°C в течение 30 минут, и затем по каплям в течение 1 часа добавляли суспензию, полученную диспергированием 1,5 г (25,2 ммоль) гидроксида калия в 7 мл толуола. Смесь перемешивали при -30°C в течение 16 часов. Образование (6-ацетилоксигексил)трифторметилсульфида (ион-предшественник; 244) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 26% (6-ацетилоксигексил)трифторметилсульфида (целевое соединение), 24% 1-ацетилокси-6-тиоцианатогексана (исходное соединение) и 49% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (6-ацетилоксигексил)трифторметилсульфида (целевое соединение) составлял 48%.
[0880]
В случае, когда настоящее изобретение было рассмотрено после осуществления настоящего изобретения, существовала возможность того, что цеолит (например, молекулярное сито) функционирует в качестве дегидратирующего агента. Результаты исследования дегидратирующих агентов, иных чем цеолит (например, молекулярное сито), показаны в примерах 102-108.
[0881]
Пример 102
Получение (5-бензилоксипентил)трифторметилсульфида
[Химическая формула 141]
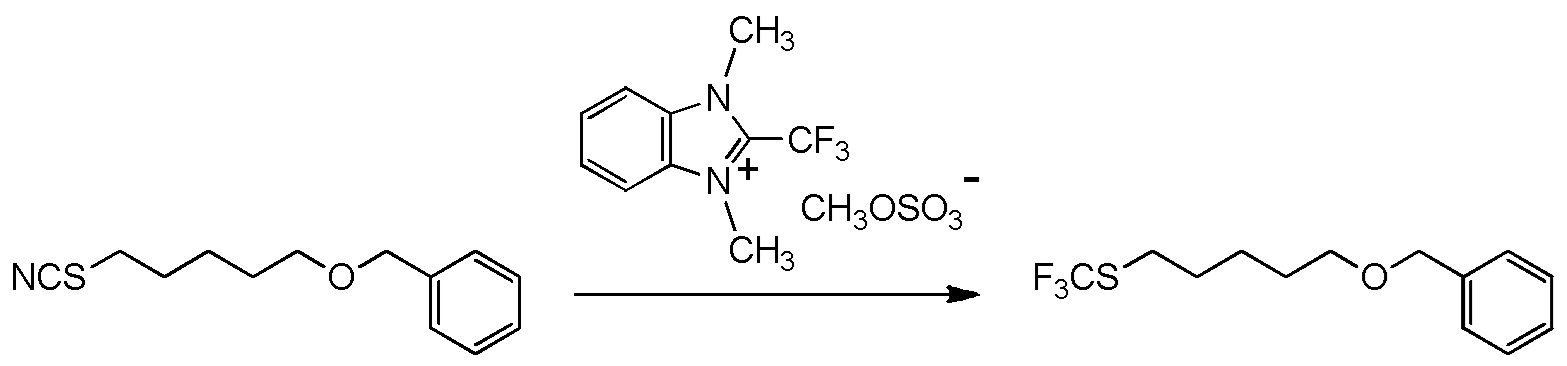
В 6 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 235 мг (1 ммоль) 1-бензилокси-5-тиоцианатопентана, 300 мг хлорида кальция, 392 мг (1,2 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 1 мл ДМФ. Смесь перемешивали при -10°C в течение 30 минут, затем добавляли 148 мг (2,52 ммоль) гидроксида калия и смесь перемешивали при -10°C в течение 14 часов. Образование (5-бензилоксипентил)трифторметилсульфида (ион-предшественник; 278) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 25% (5-бензилоксипентил)трифторметилсульфида (целевое соединение), 31% 1-бензилокси-5-тиоцианатопентана (исходное соединение), 2% 1,2-бис[5-(бензилокси)пентил] дисульфида (побочный продукт) и 41% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-бензилоксипентил)трифторметилсульфида (целевое соединение) составлял 31%.
[0882]
Пример 103
Взаимодействие осуществляли способом, аналогичным описанному в примере 102, за исключением того, что вместо 300 мг хлорида кальция использовали 300 мг хлорида магния. Образование целевого соединения подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 24% (5-бензилоксипентил)трифторметилсульфида (целевое соединение), 33% 1-бензилокси-5-тиоцианатопентана (исходное соединение) и 42% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-бензилоксипентил)трифторметилсульфида (целевое соединение) составлял 31%.
[0883]
Пример 104
Взаимодействие осуществляли способом, аналогичным описанному в примере 102, за исключением того, что вместо 300 мг хлорида кальция использовали 300 мг сульфата натрия. Образование целевого соединения подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 28% (5-бензилоксипентил)трифторметилсульфида (целевое соединение), 6% 1-бензилокси-5-тиоцианатопентана (исходное соединение), 22% 1,2-бис[5-(бензилокси)пентил] дисульфида (побочный продукт) и 41% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-бензилоксипентил)трифторметилсульфида (целевое соединение) составлял 30%.
[0884]
Пример 105
Взаимодействие осуществляли способом, аналогичным описанному в примере 102, за исключением того, что вместо 300 мг хлорида кальция использовали 300 мг сульфата магния. Образование целевого соединения подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 26% (5-бензилоксипентил)трифторметилсульфида (целевое соединение), 16% 1-бензилокси-5-тиоцианатопентана (исходное соединение), 15% 1,2-бис[5-(бензилокси)пентил]дисульфида (побочный продукт) и 40% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-бензилоксипентил)трифторметилсульфида (целевое соединение) составлял 30%.
[0885]
Пример 106
Взаимодействие осуществляли способом, аналогичным описанному в примере 102, за исключением того, что вместо 300 мг хлорида кальция использовали 300 мг силикагеля. Образование целевого соединения подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 10% (5-бензилоксипентил)трифторметилсульфида (целевое соединение), 58% 1-бензилокси-5-тиоцианатопентана (исходное соединение) и 32% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-бензилоксипентил)трифторметилсульфида (целевое соединение) составлял 13%.
[0886]
Пример 107
Взаимодействие осуществляли способом, аналогичным описанному в примере 102, за исключением того, что вместо 300 мг хлорида кальция использовали 134 мг (1,26 ммоль) триметилортоформиата. Образование целевого соединения подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 15% (5-бензилоксипентил)трифторметилсульфида (целевое соединение), 6% 1-бензилокси-5-тиоцианатопентана (исходное соединение), 42% 1,2-бис[5-(бензилокси)пентил] дисульфида (побочный продукт) и 35% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-бензилоксипентил)трифторметилсульфида (целевое соединение) составлял 14%.
[0887]
Пример 108
Взаимодействие осуществляли способом, аналогичным описанному в примере 102, за исключением того, что вместо 300 мг хлорида кальция использовали 300 мг сульфата натрия. Образование целевого соединения подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 15% (5-бензилоксипентил)трифторметилсульфида (целевое соединение), 48% 1-бензилокси-5-тиоцианатопентана (исходное соединение) и 33% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-бензилоксипентил)трифторметилсульфида (целевое соединение) составлял 22%.
[0888]
Пример 109
Получение (5-ацетилоксипентил)трифторметилсульфида
[Химическая формула 142]
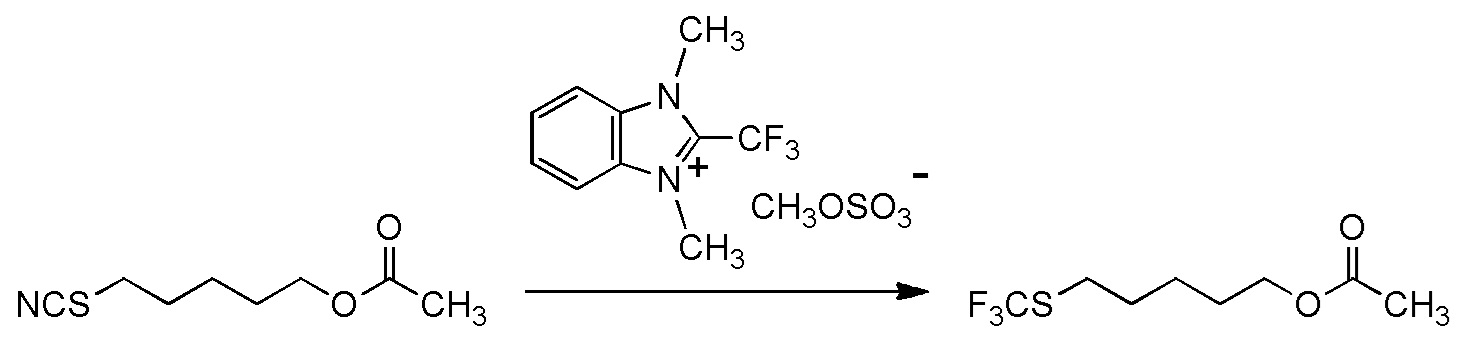
В 6 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 187 мг (1 ммоль) 1-ацетилокси-5-тиоцианатопентана, 300 мг молекулярного сита 4A (производство Tosoh Corporation; Zeolum (торговое наименование); A-4; порошок), 392 мг (1,2 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 0,5 мл ДМФ. Смесь перемешивали при 0°C в течение 30 минут, затем добавляли 148 мг (2,52 ммоль) гидроксида калия и смесь перемешивали при 0°C в течение 5 часов. Образование (5-ацетилоксипентил)трифторметилсульфида (ион-предшественник; 230) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 26% (5-ацетилоксипентил)трифторметилсульфида (целевое соединение), 23% 1-ацетилокси-5-тиоцианатопентана (исходное соединение) и 50% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-ацетилоксипентил)трифторметилсульфида (целевое соединение) составлял 44%.
[0889]
Пример 110
Получение (5-ацетилоксипентил)трифторметилсульфида
[Химическая формула 143]
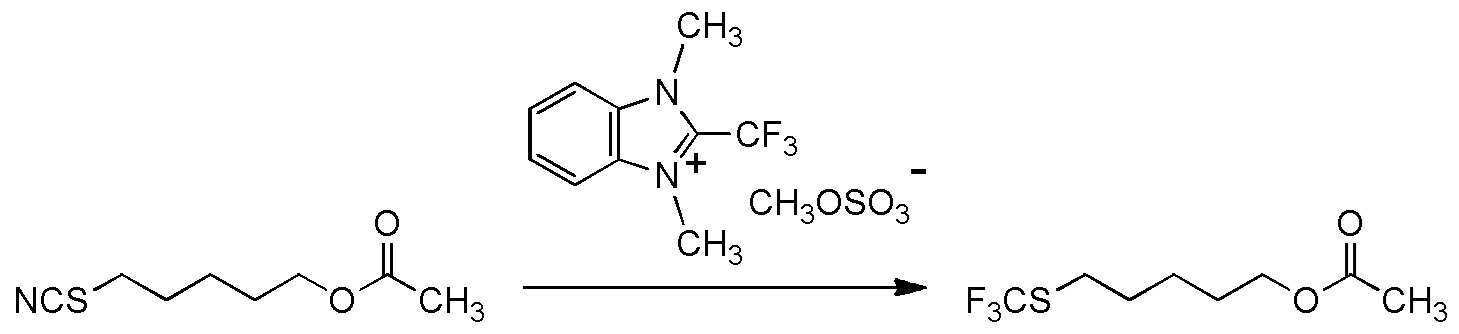
(1)
В 100 мл-овую четырехгорлую колбу, снабженную механической мешалкой, 7,2 г (36 ммоль) 1-метил-2-трифторметилбензимидазола и 36 мл толуола добавляли. Смесь перемешивали при 80°C в течение 30 минут, и затем по каплям в течение 1 часа добавляли 6,8 г (54 ммоль) диметилсульфата. После прекращения добавления по каплям, смесь перемешивали при 80°C в течение 42 часов. Потом добавляли 50 мл толуола, и смесь охлаждали до комнатной температуры. Кристаллы метилсульфата 1,3-диметил-2-трифторметилбензимидазолия осаждались в реакционной системе. После охлаждения, скорость перемешивание снижали для декантации, и из реакционной смеси с помощью пипетки отбирали 50 мл толуолового слоя (надосадочная жидкость). Затем к оставшейся реакционной смеси (суспензии) добавляли 50 мл толуола, с последующим перемешиванием в течение 5 минут, и потом скорость перемешивания понижали, и далее 50 мл толуолового слоя (надосадочная жидкость) отбирали из реакционной смеси с помощью пипетки. Аналогичную операцию добавления толуола, с последующим перемешиванием и затем снижением скорости перемешивания и далее отбором толуолового слоя с помощью пипетки, повторяли еще 4 раза с получением смеси (суспензии) очищенного 1,3-диметил-2-трифторметилбензимидазолия метилсульфат и толуол.
[0890]
(2)
К смеси метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и толуола, полученного в пункте (1) выше, добавляли 9 г молекулярного сита 4A (производство Tosoh Corporation; Zeolum (торговое наименование); A-4; порошок) и 10 мл ДМФ, с последующим охлаждением до -30°C, и затем добавляли раствор, полученный путем разбавления 5,6 г (30 ммоль) 1-ацетилокси-5-тиоцианатопентана 5 мл ДМФ, и смесь перемешивали при -30°C в течение 30 минут. Потом по каплям в течение 1 часа добавляли суспензию, полученную диспергированием 4,4 г (75,6 ммоль) гидроксида калия в 15 мл толуола. После прекращения добавления по каплям, смесь перемешивали при -30°C в течение 13 часов. Образование (5-ацетилоксипентил)трифторметилсульфида (ион-предшественник; 230) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 54% (5-ацетилоксипентил)трифторметилсульфида (целевое соединение) и 46% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-ацетилоксипентил)трифторметилсульфида (целевое соединение) составлял 96%.
[0891]
Пример 111
Получение (5-ацетилоксипентил)трифторметилсульфида
[Химическая формула 144]
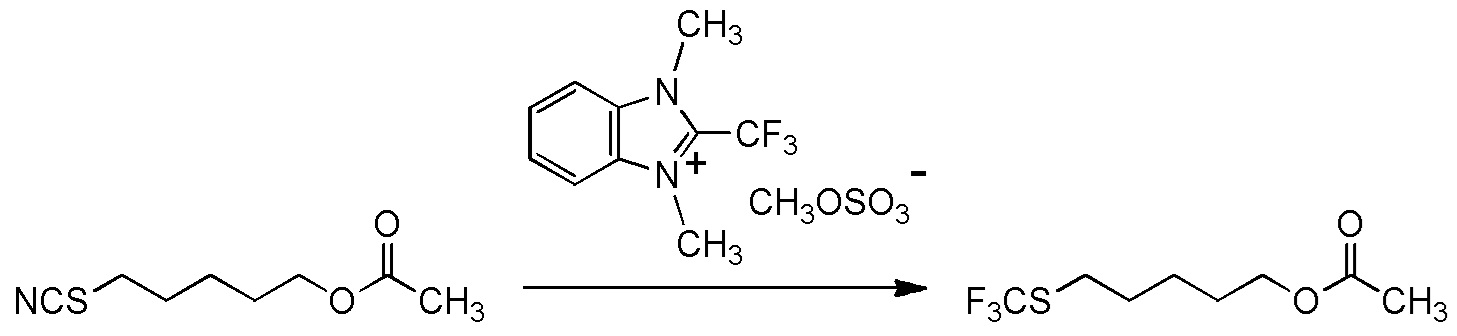
(1)
В 100 мл-овую четырехгорлую колбу, снабженную механической мешалкой, добавляли 7,2 г (36 ммоль) 1-метил-2-трифторметилбензимидазола и 36 мл толуола. Смесь перемешивали при 80°C в течение 30 минут, и затем по каплям в течение 1 часа добавляли 6,8 г (54 ммоль) диметилсульфата. После прекращения добавления по каплям, смесь перемешивали при 80°C в течение 42 часов. Затем добавляли 50 мл толуола, и смесь охлаждали до комнатной температуры. Кристаллы метилсульфата 1,3-диметил-2-трифторметилбензимидазолия осаждались в реакционной системе. После охлаждения, скорость перемешивание снижали для декантации, и из реакционной смеси с помощью пипетки отбирали 50 мл толуолового слоя (надосадочная жидкость). Затем к оставшейся реакционной смеси (суспензии) добавляли 50 мл толуола, с последующим перемешиванием в течение 5 минут, потом скорость перемешивания понижали и затем из реакционной смеси с помощью пипетки отбирали 50 мл толуолового слоя (надосадочная жидкость). Аналогичную операцию добавления толуола, с последующим перемешиванием и затем снижением скорости перемешивания и далее отбором толуолового слоя с помощью пипетки, повторяли еще 4 раза с получением смеси (суспензии) очищенного метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и толуола.
[0892]
(2)
К смеси метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и толуола, полученного в пункте (1) выше, добавляли 9 г молекулярного сита 4A (производство Tosoh Corporation; Zeolum (торговое наименование); A-4; порошок) и 10 мл ДМФ, с последующим охлаждением до -40°C, и затем добавляли раствор, полученный путем разбавления 5,6 г (30 ммоль) 1-ацетилокси-5-тиоцианатопентана 5 мл ДМФ, и смесь перемешивали при -40°C в течение 30 минут. Потом по каплям в течение 1 часа добавляли суспензию, полученную диспергированием 4,4 г (75,6 ммоль) гидроксида калия в 15 мл толуола. После прекращения добавления по каплям, смесь перемешивали при -40°C в течение 8 часов. Образование (5-ацетилоксипентил)трифторметилсульфида (ион-предшественник; 230) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 49% (5-ацетилоксипентил)трифторметилсульфида (целевое соединение) и 51% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-ацетилоксипентил)трифторметилсульфида (целевое соединение) составлял 96%.
[0893]
Пример 112
Получение 1-ацетилокси-5-тиотозилат пентана
[Химическая формула 145]
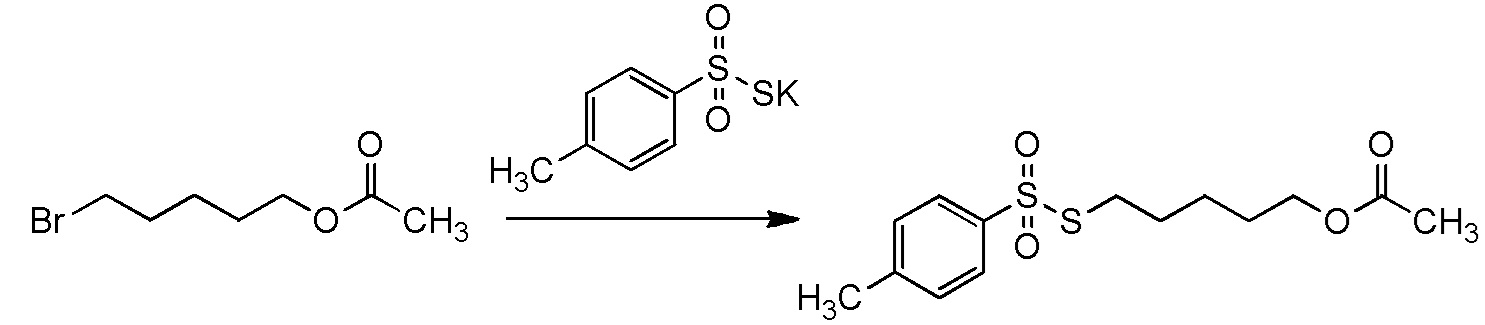
В 100 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 10,5 г (50 ммоль) 1-ацетилокси-5-бромпентана, 14,2 г (60 ммоль) п-толуолтиосульфоната калия и 50 мл ацетонитрила. Смесь нагревали с обратным холодильником в течение 5 часов. После охлаждения до комнатной температуры, растворитель отгоняли при пониженном давлении. Добавляли воду и смесь экстрагировали толуолом. Растворитель отгоняли при пониженном давлении с получением 13,5 г масла желтого цвета. Выход: 85%.
1H-ЯМР (300 МГц, CDCl3) δ (м.д.): 1,31-1,42 (м, 2H), 1,52-1,70 (м, 4H), 2,04 (с, 3H), 2,46 (с, 3H), 2,99 (т, J=7,2 Гц, 2H), 4,00 (т, J=6,5 Гц, 2H), 7,35 (д, J=8,1 Гц, 2H), 7,81 (д, J=8,1 Гц, 2H).
[0894]
Пример 113
Получение (5-ацетилоксипентил)трифторметилсульфида
[Химическая формула 146]
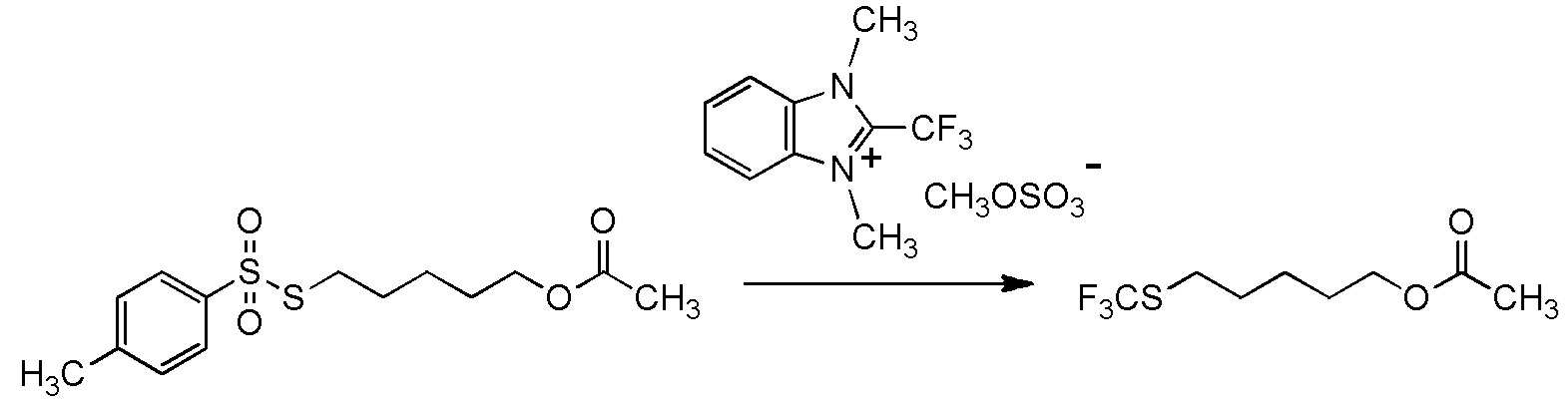
(1)
В 100 мл-овую четырехгорлую колбу, снабженную механической мешалкой, добавляли 7,2 г (36 ммоль) 1-метил-2-трифторметилбензимидазола и 36 мл толуола. Смесь перемешивали при 80°C в течение 30 минут, и затем по каплям в течение 1 часа добавляли 6,8 г (54 ммоль) диметилсульфата. После прекращения добавления по каплям, смесь перемешивали при 80°C в течение 42 часов. Затем добавляли 50 мл толуола, и смесь охлаждали до комнатной температуры. Кристаллы метилсульфата 1,3-диметил-2-трифторметилбензимидазолия осаждались в реакционной системе. После охлаждения, скорость перемешивание снижали для декантации, и из реакционной смеси с помощью пипетки отбирали 50 мл толуолового слоя (надосадочная жидкость). Затем к оставшейся реакционной смеси (суспензии) добавляли 50 мл толуола, с последующим перемешиванием в течение 5 минут, потом скорость перемешивания понижали и затем из реакционной смеси с помощью пипетки отбирали 50 мл толуолового слоя (надосадочная жидкость). Аналогичную операцию добавления толуола, с последующим перемешиванием и затем снижением скорости перемешивания и далее отбором толуолового слоя с помощью пипетки, повторяли еще 4 раза с получением смеси (суспензии) очищенного метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и толуола.
[0895]
(2)
К смеси метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и толуола, полученного в пункте (1) выше, добавляли 9 г молекулярного сита 4A (производство Tosoh Corporation; Zeolum (торговое наименование); A-4; порошок) и 10 мл ДМФ, с последующим охлаждением до -40°C, и затем добавляли раствор, полученный путем разбавления 9,5 г (30 ммоль) 1-ацетилокси-5-тиотозилат пентана 5 мл ДМФ, и смесь перемешивали при -30°C в течение 30 минут. Потом по каплям в течение 1 часа добавляли суспензию, полученную диспергированием 4,4 г (75,6 ммоль) гидроксида калия в 15 мл толуола. После прекращения добавления по каплям, смесь перемешивали при -30°C в течение 17 часов. Образование (5-ацетилоксипентил)трифторметилсульфида (ион-предшественник; 230) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 48% (5-ацетилоксипентил)трифторметилсульфида (целевое соединение) и 52% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-ацетилоксипентил)трифторметилсульфида (целевое соединение) составлял 90%.
[0896]
Пример 114
Получение 1-ацетилокси-6-тиотозилат гексана
[Химическая формула 147]
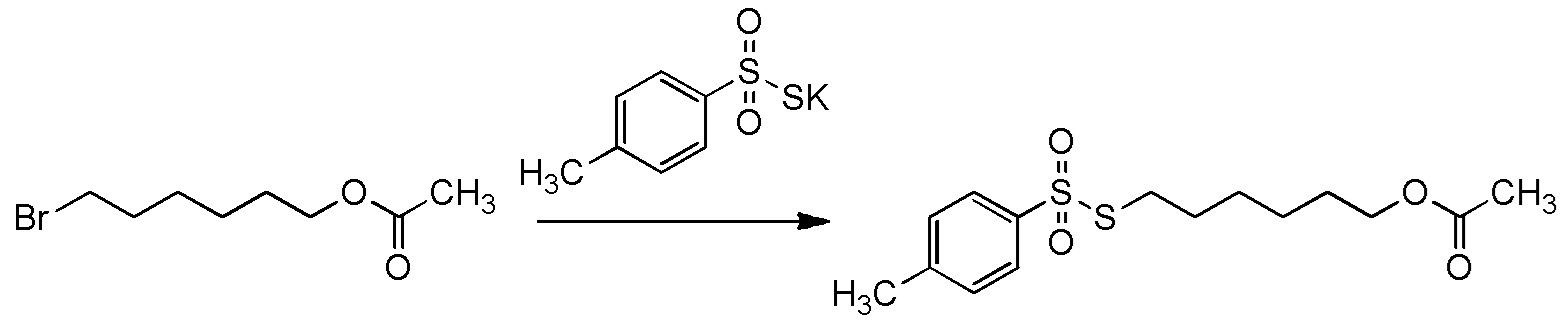
В 50 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 6,6 г (29,5 ммоль) 1-ацетилокси-6-бромгексана, 10,5 г (44,3 ммоль) п-толуолтиосульфоната калия и 29,5 мл ацетонитрила. Смесь нагревали с обратным холодильником в течение 5 часов. После охлаждения до комнатной температуры, растворитель отгоняли при пониженном давлении. Добавляли воду, и смесь экстрагировали толуолом. Растворитель отгоняли при пониженном давлении с получением 9,6 г масла желтого цвета. Выход: 98%.
1H-ЯМР (300 МГц, CDCl3) δ (м.д.): 1,22-1,40 (м, 4H), 1,51-1,67 (м, 4H), 2,04 (с, 3H), 2,46 (с, 3H), 2,98 (т, J=7,4 Гц, 2H), 4,00 (т, J=6,5 Гц, 2H), 7,35 (д, J=8,4 Гц, 2H), 7,81 (д, J=8,4 Гц, 2H).
[0897]
Пример 115
Получение (6-ацетилоксигексил)трифторметилсульфида
[Химическая формула 148]
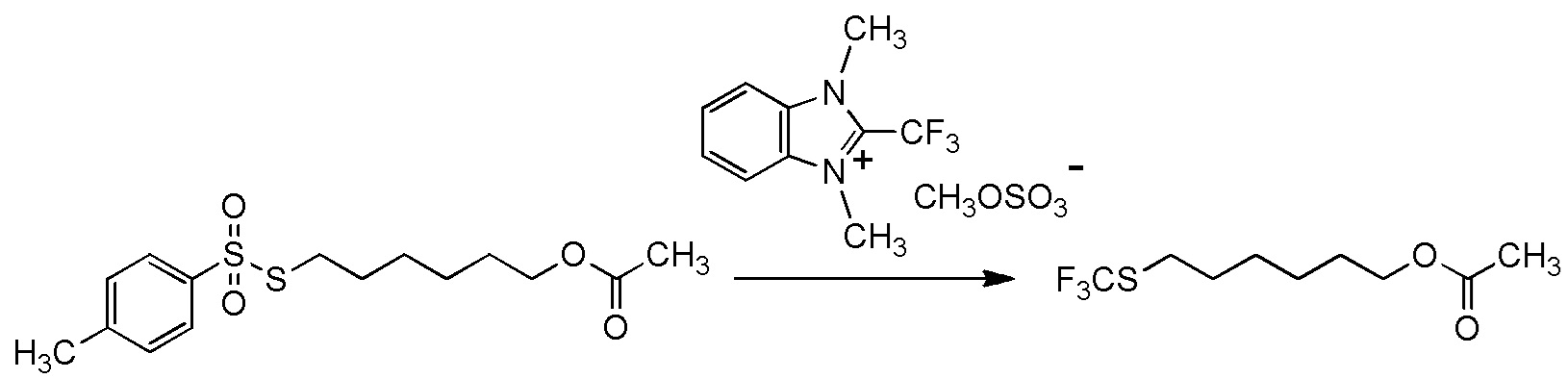
В 6 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 331 мг (1 ммоль) 1-ацетилокси-6-тиотозилат гексана, 300 мг молекулярного сита 4A (производство Tosoh Corporation; Zeolum (торговое наименование); A-4; порошок), 392 мг (1,2 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 2 мл ДМФ. Смесь перемешивали при -10°C в течение 30 минут, и затем добавляли 148 мг (2,52 ммоль) гидроксида калия, и смесь перемешивали при -10°C в течение 24 часов. Образование (6-ацетилоксигексил)трифторметилсульфида (ион-предшественник; 244) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 42% (6-ацетилоксигексил)трифторметилсульфида (целевое соединение), 2% 1-ацетилокси-6-тиотозилат гексан (исходное соединение) и 48% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (6-ацетилоксигексил)трифторметилсульфида (целевое соединение) составлял 61%.
[0898]
Пример 116
Получение 1-бензилокси-5-тиотозилат пентана
[Химическая формула 149]
В 50 мл-овую грушевидную колбу, снабженную магнитной мешалкой, добавляли 5,1 г (20 ммоль) 1-бензилокси-5-бромпентана, 5,4 г (24 ммоль) п-толуолтиосульфоната калия и 20 мл ацетонитрила. Смесь перемешивали при 70°C в течение 6 часов. После охлаждения до комнатной температуры, растворитель отгоняли при пониженном давлении. Добавляли воду и смесь экстрагировали диэтиловым эфиром. Растворитель отгоняли при пониженном давлении. Полученные твердые вещества растворяли в этилацетате и затем добавляли гексан. Осажденные кристаллы собирали фильтрацией с получением 5,5 г кристаллов желто-белого цвета. Выход: 75%.
1H-ЯМР (400 МГц, CDCl3, относительно TMS) δ (м.д.): будет описано.
1H-ЯМР (300 МГц, CDCl3) δ (м.д.): 1,34-1,46 (м, 2H), 1,49-1,1,70 (м, 4H), 2,46 (с, 3H), 2,98 (т, J=7,4 Гц, 2H), 3,41 (т, J=6,3 Гц, 2H), 4,47 (с, 2H), 7,26-7,38 (м, 7H), 7,81 (т, J=8,4 Гц, 2H).
[0899]
Пример 117
Получение (5-бензилоксипентил)трифторметилсульфида
[Химическая формула 150]
В 6 мл-овый сосуд, снабженный магнитной мешалкой, добавляли 365 мг (1 ммоль) 1-бензилокси-5-тиотозилат пентана, 300 мг молекулярного сита 4A (производство Tosoh Corporation; Zeolum (торговое наименование); A-4; порошок), 392 мг (1,2 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 2 мл ДМФ. Смесь перемешивали при -10°C в течение 30 минут, затем добавляли 148 мг (2,52 ммоль) гидроксида калия и смесь перемешивали при -10°C в течение 24 часов. Образование (5-бензилоксипентил)трифторметилсульфида (ион-предшественник; 278) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 57% (5-бензилоксипентил)трифторметилсульфида (целевое соединение) и 41% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-бензилоксипентил)трифторметилсульфида (целевое соединение) составлял 72%.
[0900]
Пример 118
Получение 5-(ацетилоксипентил)трифторметилсульфида
[Химическая формула 151]
[0901]
(1)
В 100 мл-овую четырехгорлую колбу, снабженную механической мешалкой, добавляли 7,2 г (36 ммоль) 1-метил-2-трифторметилбензимидазола и 36 мл толуола. Смесь перемешивали при 80°C в течение 30 минут, и затем по каплям в течение 1 часа добавляли 6,8 г (54 ммоль) диметилсульфата. После прекращения добавления по каплям, смесь перемешивали при 80°C в течение 42 часов. Затем добавляли 50 мл толуола, и смесь охлаждали до комнатной температуры. Кристаллы метилсульфата 1,3-диметил-2-трифторметилбензимидазолия осаждались в реакционной системе. После охлаждения, скорость перемешивание снижали для декантации, и из реакционной смеси с помощью пипетки отбирали 50 мл толуолового слоя (надосадочная жидкость). Затем к оставшейся реакционной смеси (суспензии) добавляли 50 мл толуола, с последующим перемешиванием в течение 5 минут, и далее скорость перемешивания понижали, и затем из реакционной смеси с помощью пипетки отбирали 50 мл толуолового слоя (надосадочную жидкость). Аналогичную операцию добавления толуола, с последующим перемешиванием и дальнейшим снижением скорости перемешивания и потом отбором толуолового слоя с помощью пипетки, повторяли еще 4 раза с получением смеси (суспензии) очищенного метилсульфата 1,3-диметил-2- трифторметилбензимидазолия и толуола.
[0902]
(2)
К смеси метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и толуола, полученной в пункте (1) выше, добавляли 9 г молекулярного сита 4A (производство Tosoh Corporation; Zeolum (торговое наименование); A-4; порошок) и 10 мл ДМФ, с последующим охлаждением до -30°C, и затем добавляли раствор, полученный путем разбавления 5,6 г (30 ммоль) 1-ацетилокси-5-тиоцианатопентана 5 мл ДМФ, и смесь перемешивали при -30°C в течение 30 минут. Потом в течение 1 часа добавляли по каплям суспензию, полученную диспергированием 2,2 г (37,8 ммоль) гидроксида калия в 15 мл толуола. После прекращения добавления по каплям, небольшими частями добавляли 1,5 г (37,8 ммоль) 60% гидрида натрия в течение 1 часа. Затем смесь перемешивали при -30°C в течение 13 часов. Образование (5-ацетилоксипентил)трифторметилсульфида (ион-предшественник; 230) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 55% (5-ацетилоксипентил)трифторметилсульфида (целевое соединение) и 45% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-ацетилоксипентил)трифторметилсульфида (целевое соединение) составлял 99%.
[0903]
Пример 119
Получение (5-ацетилоксипентил)трифторметилсульфида
[Химическая формула 152]
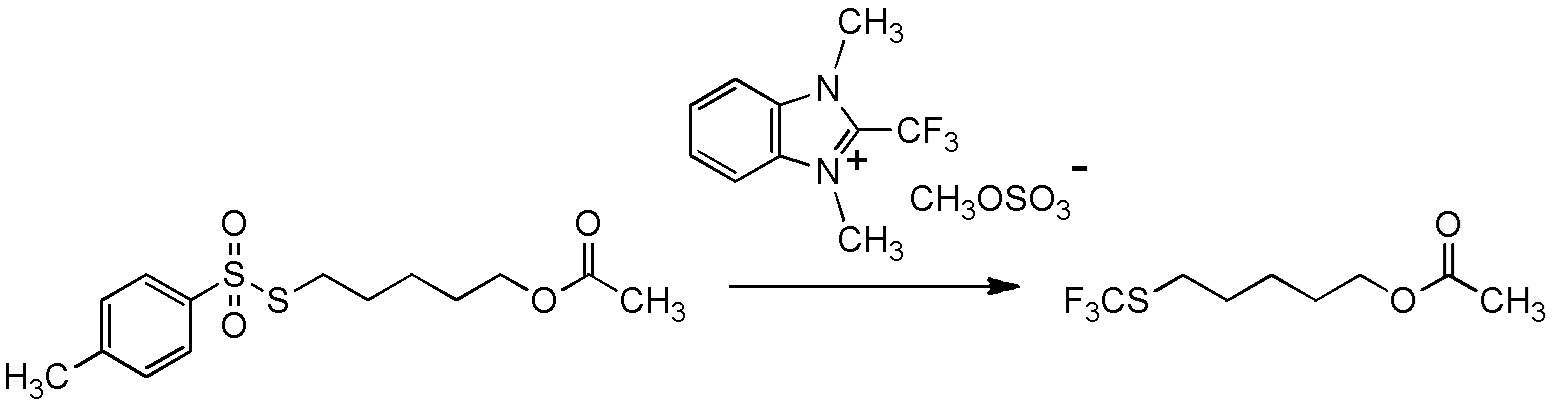
(1)
В 100 мл-овую четырехгорлую колбу, снабженную механической мешалкой, добавляли 7,2 г (36 ммоль) 1-метил-2-трифторметилбензимидазола и 36 мл толуола. Смесь перемешивали при 80°C в течение 30 минут, и затем по каплям в течение 1 часа добавляли 6,8 г (54 ммоль) диметилсульфата. После прекращения добавления по каплям, смесь перемешивали при 80°C в течение 42 часов. Затем добавляли 50 мл толуола, и смесь охлаждали до комнатной температуры. Кристаллы метилсульфата 1,3-диметил-2-трифторметилбензимидазолия осаждались в реакционной системе. После охлаждения, скорость перемешивание снижали для декантации, и из реакционной смеси с помощью пипетки отбирали 50 мл толуолового слоя (надосадочная жидкость). Затем к оставшейся реакционной смеси (суспензии) добавляли 50 мл толуола, с последующим перемешиванием в течение 5 минут, потом скорость перемешивания понижали и затем из реакционной смеси с помощью пипетки отбирали 50 мл толуолового слоя (надосадочная жидкость). Аналогичную операцию добавления толуола, с последующим перемешиванием и затем снижением скорости перемешивания и далее отбором толуолового слоя с помощью пипетки, повторяли еще 4 раза с получением смеси (суспензии) очищенного метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и толуола.
[0904]
(2)
К смеси метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и толуола, полученного в пункте (1) выше, добавляли 9 г молекулярного сита 4A (производство Tosoh Corporation; Zeolum (торговое наименование); A-4; порошок) и 10 мл ДМФ, с последующим охлаждением до -30°C, и затем добавляли раствор, полученный путем разбавления 9,5 г (30 ммоль) 1-ацетилокси-5-тиотозилат пентана 5 мл ДМФ, и смесь перемешивали при -30°C в течение 30 минут. Потом по каплям в течение 1 часа добавляли суспензию, полученную диспергированием 2,2 г (37,8 ммоль) гидроксида калия в 15 мл толуола. После прекращения добавления по каплям, небольшими частями в течение 1 часа добавляли 1,5 г (37,8 ммоль) 60% гидрида натрия. Затем смесь перемешивали при -30°C в течение 36 часов. Образование (5-ацетилоксипентил)трифторметилсульфида (ион-предшественник; 230) подтверждали анализом реакционной смеси посредством ГХ-МС. В результате анализа реакционной смеси посредством ГХ (процент площади), компоненты в реакционной смеси, за исключением растворителей и тому подобное, представлены следующим образом: 43% (5-ацетилоксипентил)трифторметилсульфида (целевое соединение) и 57% 2,3-дигидро-1,3-диметилбензимидазол-2-она (соединение, полученное из фторалкилирующего агента). В результате анализа методом ГХ, с использованием 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-ацетилоксипентил)трифторметилсульфида (целевое соединение) составлял 83%.
[0905]
Пример 120
Получение 1-ацетилокси-6-тиоцианатогексана
(1) Получение 6-бромгексил ацетата
[Химическая формула 153]

В реакционный сосуд добавляли 93,3 г (515 ммоль) 6-бром-1-гексанола, 65,5 г (618 ммоль) безводного карбоната натрия, 6,3 г (52 ммоль) N,N-диметил-4-аминопиридина и 515 мл толуола. В то время, когда смесь перемешивали при охлаждении льдом, добавляли по каплям 59,6 г (584 ммоль) ангидрида уксусной кислоты. После прекращения добавления по каплям, смесь перемешивали в течение 1 часа при охлаждении льдом. Полученную реакционную смесь последовательно дважды промывали водой, разбавленной соляной кислотой и затем водой. Толуол отгоняли при пониженном давлении с получением 114,9 г 6-бромгексил ацетата. Выход: количественный.
[0906]
(2) Получение 1-ацетилокси-6-тиоцианатогексана
[Химическая формула 154]

В реакционный сосуд добавляли 114,9 г (515 ммоль) 6-бромгексил ацетата, полученного в пункте (1) выше, 62,6 г (773 ммоль) тиоцианата натрия, 17 г (52 ммоль) бромида тетрабутиламмония, 515 мл толуола и 515 мл воды. Затем смесь перемешивали при 50°C в течение 24 часов. Полученную реакционную смесь распределяли между водой и толуолом, и толуоловый слой отделяли. Полученный толуоловый слой промывали 5 раз водой. Потом толуол отгоняли при пониженном давлении с получением 90,0 г 1-ацетилокси-6-тиоцианатогексана (чистота: 94%). Выход в показателях чистоты: 82%.
1H-ЯМР (300 МГц, CDCl3) δ (м.д.): 4,07 (т, J=6,6 Гц, 2H), 2,96 (т, J=6,9 Гц, 2H), 2,06 (с, 3H), 1,85 (кв, J=6,6 Гц, 2H), 1,66 (кв, J=6,9 Гц, 2H), 1,43 (м, 4H).
[0907]
Пример 121
Получение (6-ацетилоксигексил)трифторметилсульфида
[Химическая формула 155]

В 500 мл-овую четырехгорлую колбу, снабженную механической мешалкой, добавляли 64 г (300 ммоль) 1-ацетилокси-6-тиоцианатогексана (чистота: 94%), полученного в примере 120, 90 г молекулярного сита 4A (производство Tosoh Corporation; Zeolum (торговое наименование); A-4; порошок), 118 г (360 ммоль) метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и 150 мл ДМФ. Смесь перемешивали при -30°C в течение 30 минут, и затем по каплям в течение 3 часов добавляли суспензию, полученную диспергированием 44,4 г (756 ммоль) гидроксида калия (чистота: 95,5%) в 150 мл толуола. Смесь перемешивали при -30°C в течение 16 часов. Затем добавляли 90 мл толуола, и смесь перемешивали при 0°C в течение 30 минут, и потом смесь фильтровали. К полученному фильтрату добавляли воду, и смесь распределяли между водой и толуолом, и толуоловый слой отделяли. Полученный толуоловый слой промывали водой, и толуол отгоняли при пониженном давлении с получением сырого продукта указанного в заголовке целевого соединения. В результате анализа методом ГХ с добавлением 1,4-диэтилбензола в качестве внутреннего стандарта, выход (6-ацетилоксигексил)трифторметилсульфида (целевое соединение) составлял 90%.
[0908]
Кроме того, (6-ацетилоксигексил)трифторметилсульфид полученный способом, аналогичным описанному в примере 121, очищали и идентифицировали обычным способом.
1H-ЯМР (300 МГц, CDCl3) δ (м.д.): 4,06 (т, J=6,6 Гц, 2H), 2,88 (т, J=7,2 Гц, 2H), 2,05 (с, 3H), 1,67 (м, 4H), 1,41 (м, 4H).
[0909]
Пример 122
Получение 1-ацетилокси-5-тиоцианатопентана
(1) Получение 5-бромпентил ацетата
[Химическая формула 156]
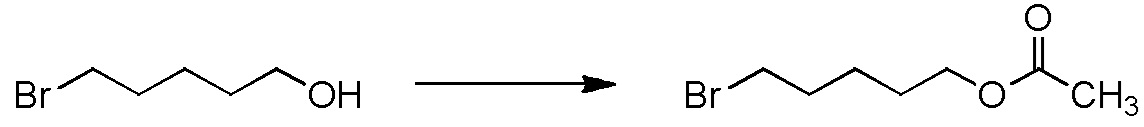
В реакционный сосуд, 33,4 г (200 ммоль) 5-бром-1-пентанола, добавляли 25,4 г (240 ммоль) безводного карбоната натрия, 2,4 г (20 ммоль) N,N-диметил-4-аминопиридина и 200 мл толуола. В то время, когда смесь перемешивали при охлаждении льдом, добавляли по каплям 22,5 г (220 ммоль) ангидрида уксусной кислоты. После прекращения добавления по каплям, смесь перемешивали в течение 1 часа при охлаждении льдом. Полученную реакционную смесь последовательно дважды промывали водой, разбавленной соляной кислотой и затем водой. Толуол отгоняли при пониженном давлении с получением 41,8 г 5-бромпентил ацетата. Выход: количественный.
[0910]
(2) Получение 1-ацетилокси-5-тиоцианатопентана
[Химическая формула 157]

В реакционный сосуд, добавляли 41,8 г (200 ммоль) 5-бромпентил ацетата полученного в пункте (1) выше, 24,3 г (300 ммоль) тиоцианата натрия, 3,2 г (10 ммоль) бромида тетрабутиламмония, 100 мл толуола и 100 мл воды. Затем смесь перемешивали при 50°C в течение 24 часов. Полученную реакционную смесь распределяли между водой и толуолом, и толуоловый слой отделяли. Полученный толуоловый слой промывали 5 раз водой. Далее толуол отгоняли при пониженном давлении с получением 35,1 г 1-ацетилокси-5-тиоцианатопентана (чистота: 92%). Выход в показателях чистоты: 86%.
1H-ЯМР (300 МГц, CDCl3) δ (м.д.): 4,09 (т, J=6,3 Гц, 2H), 2,96 (т, J=7,2 Гц, 2H), 2,06 (с, 3H), 1,88 (м, 2H), 1,71 (м, 2H), 1,53 (м, 2H).
[0911]
Пример 123
Получение (5-ацетилоксипентил)трифторметилсульфида
[Химическая формула 158]
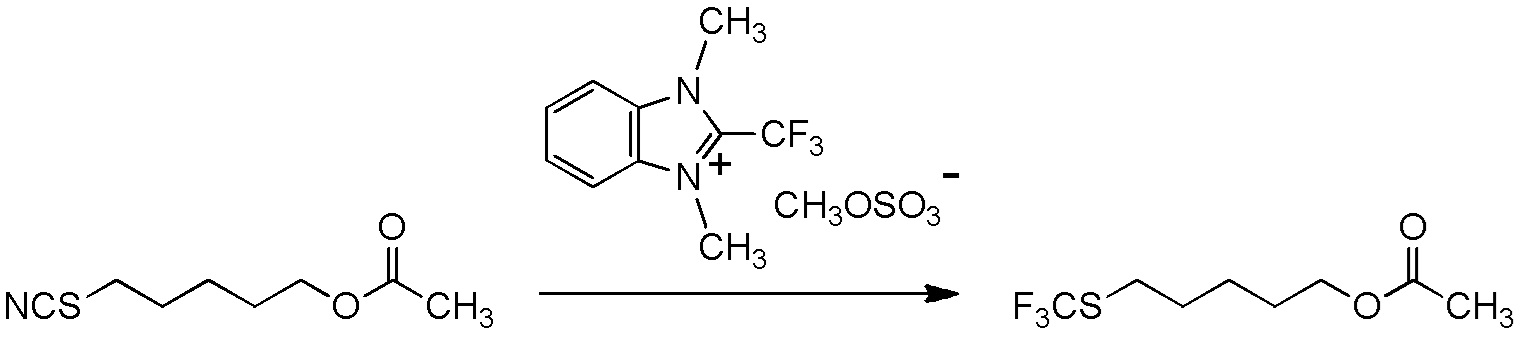
(1)
В 100 мл-овую четырехгорлую колбу, снабженную механической мешалкой, добавляли 7,2 г (36 ммоль) 1-метил-2-трифторметилбензимидазола и 36 мл толуола. Смесь перемешивали при 80°C в течение 30 минут, и затем по каплям в течение 1 часа добавляли 6,8 г (54 ммоль) диметилсульфата. После прекращения добавления по каплям, смесь перемешивали при 80°C в течение 40 часов. Затем добавляли 50 мл толуола, и смесь охлаждали до комнатной температуры. Кристаллы метилсульфата 1,3-диметил-2-трифторметилбензимидазолия осаждались в реакционной системе. После охлаждения, скорость перемешивание снижали для декантации, и из реакционной смеси с помощью пипетки отбирали 50 мл толуолового слоя (надосадочная жидкость). Затем к оставшейся реакционной смеси (суспензии) добавляли 50 мл толуола, с последующим перемешиванием в течение 5 минут, и потом скорость перемешивания понижали, и затем из реакционной смеси с помощью пипетки отбирали 50 мл толуолового слоя (надосадочная жидкость). Аналогичную операцию добавления толуола, с последующим перемешиванием и затем снижением скорости перемешивания и далее отбором толуолового слоя с помощью пипетки, повторяли еще 4 раза с получением смеси (суспензии) очищенного метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и толуола.
[0912]
(2)
К смеси метилсульфата 1,3-диметил-2-трифторметилбензимидазолия и толуола, полученного в пункте (1) выше, добавляли 9 г молекулярного сита 4A (производство Tosoh Corporation; Zeolum (торговое наименование); A-4; порошок) и 10 мл ДМФ, с последующим охлаждением до -30°C, и затем добавляли раствор, полученный путем разбавления 5,6 г (30 ммоль) 1-ацетилокси-5-тиоцианатопентана 5 мл ДМФ, и смесь перемешивали при -30°C в течение 30 минут. Потом по каплям в течение 1 часа добавляли суспензию, полученную диспергированием 4,4 г (75,6 ммоль) гидроксида калия (чистота: 95,5%) в 15 мл толуола. После прекращения добавления по каплям, смесь перемешивали при -30°C в течение 14 часов. Затем добавляли 9 мл толуола, смесь перемешивали при 0°C в течение 30 минут и потом смесь фильтровали. К полученному фильтрату добавляли воду, смесь распределяли между водой и толуолом, и толуоловый слой отделяли. Полученный толуоловый слой промывали водой, и толуол отгоняли при пониженном давлении с получением сырого продукта указанного в заголовке целевого соединения. В результате анализа методом ГХ с добавлением 1,4-диэтилбензола в качестве внутреннего стандарта, выход (5-ацетилоксипентил)трифторметилсульфида (целевое соединение) составлял 90%.
[0913]
Кроме того, (5-ацетилоксипентил)трифторметилсульфид, полученный способом, аналогичным описанному в примере 123, очищали и идентифицировали обычным способом.
1H-ЯМР (300 МГц, CDCl3) δ (м.д.): 4,07 (т, J=6,3 Гц, 2H), 2,89 (т, J=7,5 Гц, 2H), 2,05 (с, 3H), 1,70 (м, 4H), 1,48 (м, 2H).
[0914]
Пример 124
Получение 1-бензилокси-5-бромпентана
[Химическая формула 159]
В реакционный сосуд добавляли 49 г (1230 ммоль) гидроксида натрия и 196 мл воды. Смесь перемешивали при комнатной температуре в течение 30 минут, и затем добавляли 113 г (490 ммоль) 1,5-дибромпентана, 122 г (1130 ммоль) бензилового спирта и 4 г (12,3 ммоль) бромида тетрабутиламмония. Смесь перемешивали при 70°C в течение 4 часов. Затем смесь распределяли между органическим слоем и водным слоем, и органический слой отделяли. Полученный органический слой очищали отгонкой при пониженном давлении с получением 79,6 г 1-бензилокси-5-бромпентана. Выход: 63%.
[0915]
Пример 125
Получение 1-бензилокси-5-тиоцианатопентана
[Химическая формула 160]

В реакционный сосуд добавляли 25,7 г (100 ммоль) 1-бензилокси-5-бромпентана, 12,2 г (150 ммоль) тиоцианата натрия и 100 мл этанола. Смесь перемешивали при 80°C в течение 4 часов. Этанол отгоняли при пониженном давлении из полученной реакционной смеси. К полученному остатку добавляли этилацетат и воду, и смесь распределяли между этилацетатом и водой, и этилацетатный слой отделяли. Потом уксусную кислоту отгоняли при пониженном давлении. Полученный сырой продукт очищали с помощью колоночной хроматографии на силикагеле с получением 17,1 г 1-бензилокси-5-тиоцианатопентана. Выход: 73%.
1H-ЯМР (300 МГц, CDCl3) δ (м.д.): 1,48-1,70 (м, 4H), 1,84 (кв, J=7,4 Гц, 2H), 2,93 (т, J=7,4 Гц, 2H), 3,48 (т, J=6,3 Гц, 2H), 4,50 (с, 2H), 7,25-7,38 (м, 5H).
ГХ-МС (m/z): M+=235.
[0916]
Значения физических параметров соединения, представленного общей формулой (1), и его аналогов, полученных в примерах в настоящем описании, приведены в таблице 19. Кроме того, значения физических параметров (температура плавления или коэффициент рефракции) соединения, представленного общей формулой (1), и его аналогов, которые получали способом, аналогичным описанному в примерах в настоящем описании, также приведены в таблице 19. Символ * в таблице 19 обозначает коэффициент рефракции.
[0917]
[таблица 19]
|
Ссылочный пример 1
Получение 1-бром-6-трифторметилтиогексана
(1) Получение 6-трифторметилтиогексан-1-ола
[Химическая формула 161]

В реакционный сосуд добавляли суммарное количество (6-ацетилоксигексил)трифторметилсульфида, полученного в примере 121, 46 г (333 ммоль) карбоната калия и 269 мл метанола. Затем смесь перемешивали при комнатной температуре в течение 6 часов. К полученной реакционной смеси по каплям при охлаждении льдом добавляли разбавленную соляную кислоту и затем добавляли толуол. Смесь распределяли между водой и толуолом, и толуоловый слой отделяли. Потом толуол отгоняли при пониженном давлении с получением сырого продукта 6-трифторметилтиогексан-1-ола.
[0918]
Кроме того, 6-трифторметилтиогексан-1-ол, полученный способом, аналогичным описанному в ссылочном примере 1, очищали и идентифицировали обычным способом.
1H-ЯМР (300 МГц, CDCl3) δ (м.д.): 3,66 (т, J=6,6 Гц, 2H), 2,89 (т, J=7,5 Гц, 2H), 1,72 (кв, J=7,5 Гц, 2H), 1,59 (кв, J=6,6 Гц, 2H), 1,43 (м, 4H).
[0919]
(2) Получение 1-бром-6-трифторметилтиогексана
[Химическая формула 162]

В реакционный сосуд добавляли суммарное количество 6-трифторметилтиогексан-1-ола, полученного в пункте (1) выше, 90,7 г (538 ммоль) 48% бромистоводородной кислоты и 8,7 г (27 ммоль) бромида тетрабутиламмония. Затем смесь нагревали с обратным холодильником в течение 13 часов. Полученную реакционную смесь охлаждали до комнатной температуры и добавляли толуол, и смесь распределяли между водой и толуолом, и толуоловый слой отделяли. Потом толуол отгоняли при пониженном давлении. Полученный остаток очищали путем отгонки при пониженном давлении, и добавляли гептан и воду, и смесь распределяли между гептаном и водой, и получали гептановый слой. Далее, гептан отгоняли при пониженном давлении с получением 52,2 г 1-бром-6-трифторметилтиогексана. Выход: 74% (2 стадии).
1H-ЯМР (300 МГц, CDCl3) δ (м.д.): 3,41 (т, J=6,9 Гц, 2H), 2,89 (т, J=7,2 Гц, 2H), 1,87 (кв, J=7,2 Гц, 2H), 1,72 (кв, J=6,9 Гц, 2H), 1,47 (м, 4H).
[0920]
Ссылочный пример 2
Получение 1-бром-5-трифторметилтиопентана
(1) Получение 5-трифторметилтиопентан-1-ола
[Химическая формула 163]
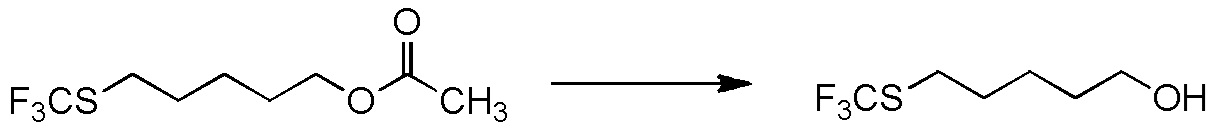
В реакционный сосуд добавляли суммарное количество (5-ацетилоксипентил)трифторметилсульфида, полученного в примере 123, 4,5 г (32,4 ммоль) карбоната калия и 27 мл метанола. Затем смесь перемешивали при комнатной температуре в течение 6 часов. К полученной реакционной смеси по каплям при охлаждении льдом добавляли разбавленную соляную кислоту и затем добавляли толуол. Смесь распределяли между водой и толуолом, и толуоловый слой отделяли. Потом толуол отгоняли при пониженном давлении с получением сырого продукта 5-трифторметилтиопентан-1-ол.
[0921]
Кроме того, 5-трифторметилтиопентан-1-ол, полученный способом, аналогичным описанному в ссылочном примере 2, очищали и идентифицировали обычным способом.
1H-ЯМР (300 МГц, CDCl3) δ (м.д.): 3,67 (т, J=6,0 Гц, 2H), 2,90 (т, J=7,2 Гц, 2H), 1,74 (м, 2H), 1,54 (м, 4H).
[0922]
(2) Получение 1-бром-5-трифторметилтиопентана
[Химическая формула 164]

В реакционный сосуд добавляли суммарное количество 5-трифторметилтиопентан-1-ола, полученного в пункте (1) выше, 9,1 г (54 ммоль) 48% бромистоводородной кислоты и 0,87 г (2,7 ммоль) бромида тетрабутиламмония. Затем смесь нагревали с обратным холодильником в течение 14 часов. К полученной реакционной смеси добавляли толуол, и смесь распределяли между водой и толуолом, и толуоловый слой отделяли. Далее, толуол отгоняли при пониженном давлении. Полученный остаток очищали путем отгонки при пониженном давлении с получением 4,9 г 1-бром-5-трифторметилтиопентана. Выход: 72% (2 стадии)
1H-ЯМР (300 МГц, CDCl3) δ (м.д.): 3,42 (т, J=6,9 Гц, 2H), 2,90 (т, J=7,2 Гц, 2H), 1,90 (м, 2H), 1,74 (м, 2H), 1,57 (м, 2H).
[0923]
Ссылочный пример 3
Получение 5-меркапто-2,4-диметилфенола
(1) Получение 2,4-диметилфенилметансульфоната
[Химическая формула 165]
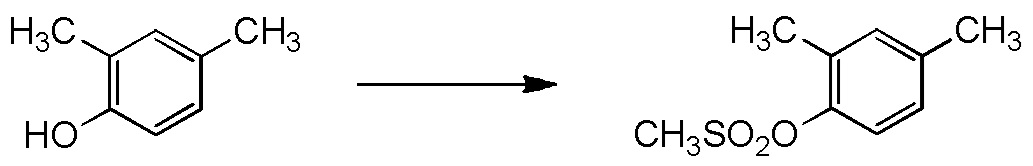
В реакционный сосуд добавляли 12,22 г (100,0 ммоль) 2,4-диметилфенола, 11,68 г (102,0 ммоль) метансульфонилхлорида и 100 мл дихлорметана. Далее, в то время, когда смесь перемешивали при охлаждении льдом, медленно добавляли по каплям раствор 11,13 г (110,0 ммоль) триэтиламина в 50 мл дихлорметана. После прекращения добавления по каплям, смесь перемешивали при комнатной температуре в течение 1 часа. К полученной реакционной смеси добавляли воду, и смесь распределяли между дихлорметаном и водой, и дихлорметановый слой отделяли. Далее, дихлорметановый слой сушили над безводным сульфатом магния и фильтровали, и затем дихлорметан отгоняли при пониженном давлении с получением 19,78 г 2,4-диметилфенилметансульфоната с выходом 99%.
1H-ЯМР (300 МГц, CDCl3) δ (м.д.): 7,16 (д, J=8,1 Гц, 1H), 7,07 (д, J=0,6 Гц, 1H), 7,01 (дд, J=8,1, 0,6 Гц, 1H), 3,17 (с, 3H), 2,32 (с, 3H), 2,31 (с, 3H).
(2) Получение 5-хлорсульфонил-2,4-диметилфенилметансульфоната
[Химическая формула 166]
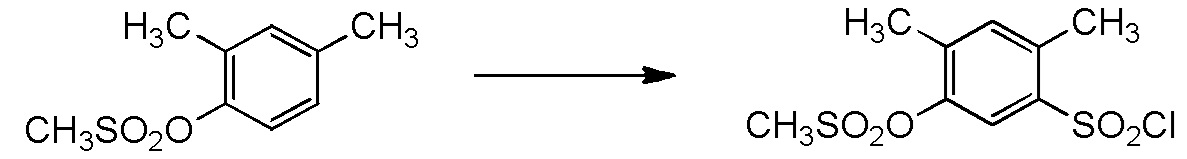
В реакционный сосуд добавляли 5,91 г (22,2 ммоль) 30% дымящей серной кислоты и 10 мл дихлорметана. Далее, в то время, когда смесь перемешивали при охлаждении льдом, добавляли по каплям раствор, полученный растворением 4,35 г (21,7 ммоль) 2,4-диметилфенилметансульфоната в 12 мл дихлорметана. После прекращения добавления по каплям, смесь перемешивали при охлаждении льдом в течение 1 часа. Затем к смеси добавляли 6,45 г (54,3 ммоль) тионилхлорида. Потом смесь перемешивали при 50°C в течение 3 часов. Полученную реакционную смесь добавляли по каплям в воду со льдом, и затем смесь распределяли между дихлорметаном и водой, и дихлорметановый слой отделяли. Далее дихлорметановый слой сушили над безводным сульфатом магния и фильтровали, и затем дихлорметан отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением 5,65 г 5-хлорсульфонил-2,4-диметилфенилметансульфоната с выходом 87%.
1H-ЯМР (300 МГц, CDCl3) δ (м.д.): 7,93 (с, 1H), 7,35 (с, 1H), 3,30 (с, 3H), 2,75 (с, 3H), 2,45 (с, 3H).
(3) Получение 5-меркапто-2,4-диметилфенилметансульфоната
[Химическая формула 167]
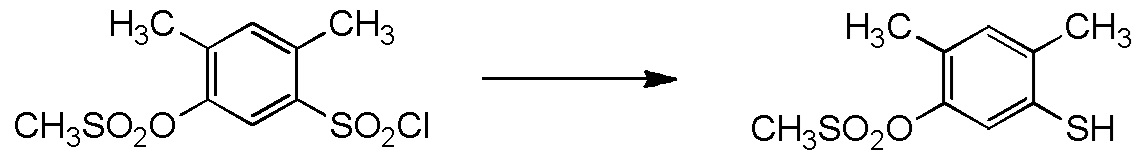
В реакционный сосуд добавляли 610,0 мг (2,0 ммоль) 5-хлорсульфонил-2,4-диметилфенилметансульфоната, 2 мл 18% соляной кислоты и 2 мл метанола. Далее, в то время, когда смесь перемешивали при комнатной температуре, добавляли 484,8 мг (4,1 ммоль) порошкообразного олова. Затем смесь перемешивали при 80°C в течение 1 часа. Из полученной реакционной смеси при пониженном давлении отгоняли метанол. К полученному остатку добавляли дихлорметан и воду, и смесь распределяли между дихлорметаном и водой, и дихлорметановый слой отделяли. Потом дихлорметановый слой сушили над безводным сульфатом магния и фильтровали, и затем дихлорметан отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением 400,0 мг 5-меркапто-2,4-диметилфенилметансульфоната с выходом 84%.
1H-ЯМР (300 МГц, CDCl3) δ (м.д.): 7,22 (с, 1H), 7,06 (с, 1H), 3,18 (с, 3H), 2,28 (с, 3H), 2,27 (с, 3H).
(4) Получение 5-меркапто-2,4-диметилфенола
[Химическая формула 168]
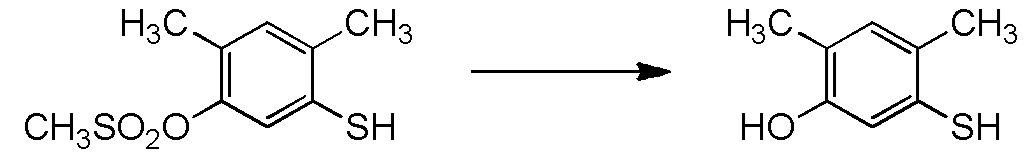
В реакционный сосуд добавляли 2,32 г (10,0 ммоль) 5-меркапто-2,4-диметилфенилметансульфоната, 4,00 г (100,0 ммоль) гидроксида натрия и 15 мл воды. Затем смесь перемешивали при 80°C в течение 1 часа. К полученной реакционной смеси добавляли соляную кислоту для доведения значения рН до около 1. Потом добавляли дихлорметан и смесь распределяли между дихлорметаном и водой, и дихлорметановый слой отделяли. Далее дихлорметановый слой сушили над безводным сульфатом магния и фильтровали, и затем дихлорметан отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением 1,48 г 5-меркапто-2,4-диметилфенола с выходом 96%.
1H-ЯМР (300 МГц, CDCl3) δ (м.д.): 6,90 (с, 1H), 6,74 (с, 1H), 3,19 (с, 1H), 2,22 (с, 1H), 2,17 (с, 1H).
[0924]
Ссылочный пример 4
Получение бис(2,4-диметил-5-гидроксифенил)дисульфида
[Химическая формула 169]
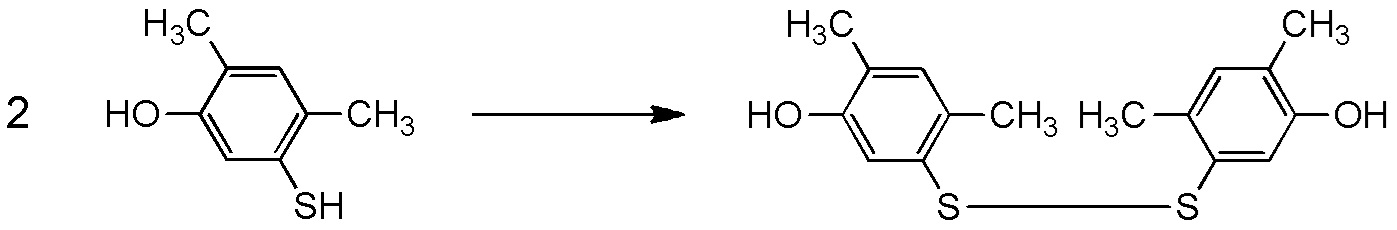
В реакционный сосуд добавляли 4,32 г (28,0 ммоль) 5-меркапто-2,4-диметилфенола, 42 мг (0,28 ммоль) иодида натрия и 80 мл этилацетата. В то время, когда смесь перемешивали при комнатной температуре, медленно добавляли по каплям 1,59 г (14 ммоль) 30% водного раствора перекиси водорода. Смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли 5 мл насыщенного водного раствора сульфита натрия и смесь перемешивали при комнатной температуре в течение 10 минут, и затем значение рН водного слоя доводили до около 1-2 путем добавления концентрированной соляной кислоты. Полученную смесь распределяли между органическим слоем и водным слоем, и органический слой отделяли. Органический слой сушили над безводным сульфатом магния и фильтровали, и затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением 3,03 г бис(2,4-диметил-5-гидроксифенил) дисульфида с выходом 71%.
1H-ЯМР (300 МГц, CDCl3) δ (м.д.): 6,94 (с, 2H), 6,90 (с, 2H), 4,87 (с, 2H), 2,30 (с, 6H), 2,17 (с, 6H).
Температура плавления: 125-127°C
[0925]
Ссылочный пример 5
Получение бис[2,4-диметил-5-(6-трифторметилтиогексилокси)фенил]дисульфида
[Химическая формула 170]
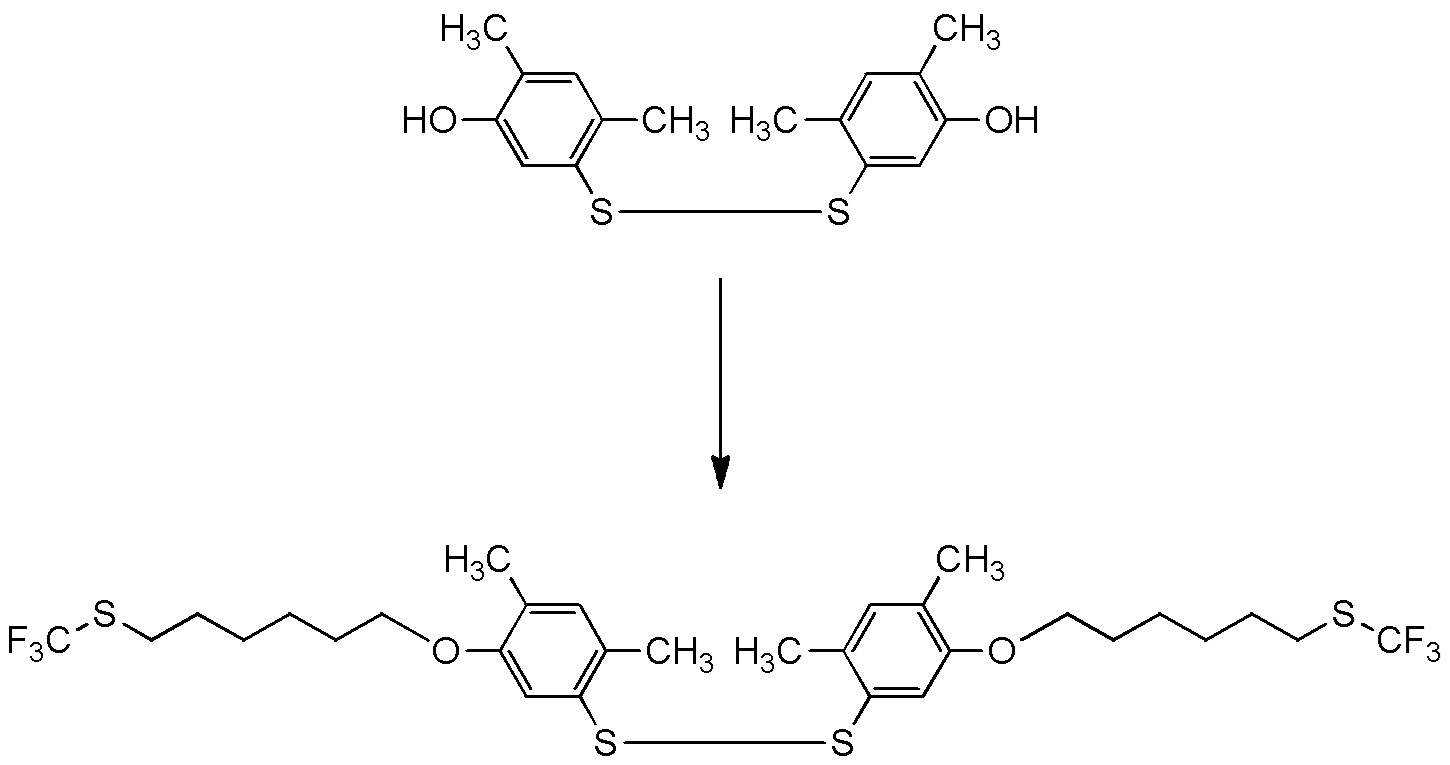
В реакционный сосуд добавляли 2,60 г (8,5 ммоль) бис(2,4-диметил-5-гидроксифенил) дисульфида, 4,73 г (17,9 ммоль) 1-бром-6-трифторметилтиогексана, 2,58 г (18,7 ммоль) карбоната калия, 0,63 г (1,7 ммоль) иодида тетрабутиламмония и 17 мл N,N-диметилформамида. Смесь перемешивали при 80°C в течение 20 часов в атмосфере азота. К реакционной смеси добавляли рзбавленную соляную кислоту, воду и диэтиловый эфир, и смесь распределяли между органическим слоем и водным слоем, и органический слой отделяли. Органический слой сушили над безводным сульфатом магния и фильтровали, и затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением 4,95 г бис[2,4-диметил-5-(6-трифторметилтиогексилокси)фенил] дисульфида с выходом 86%.
1H-ЯМР (300 МГц, CDCl3) δ (м.д.): 6,92 (с, 2H), 6,90 (с, 2H), 3,78 (т, 4H), 2,88 (т, 4H), 2,30 (с, 6H), 2,14 (с, 6H), 1,72 (м, 8H), 1,45 (м, 8H).
[0926]
Ссылочный пример 6
Получение 6-трифторметилтиогексил-[2,4-диметил-5-(2,2,2-трифторэтилтио)фенил]эфира
[Химическая формула 171]
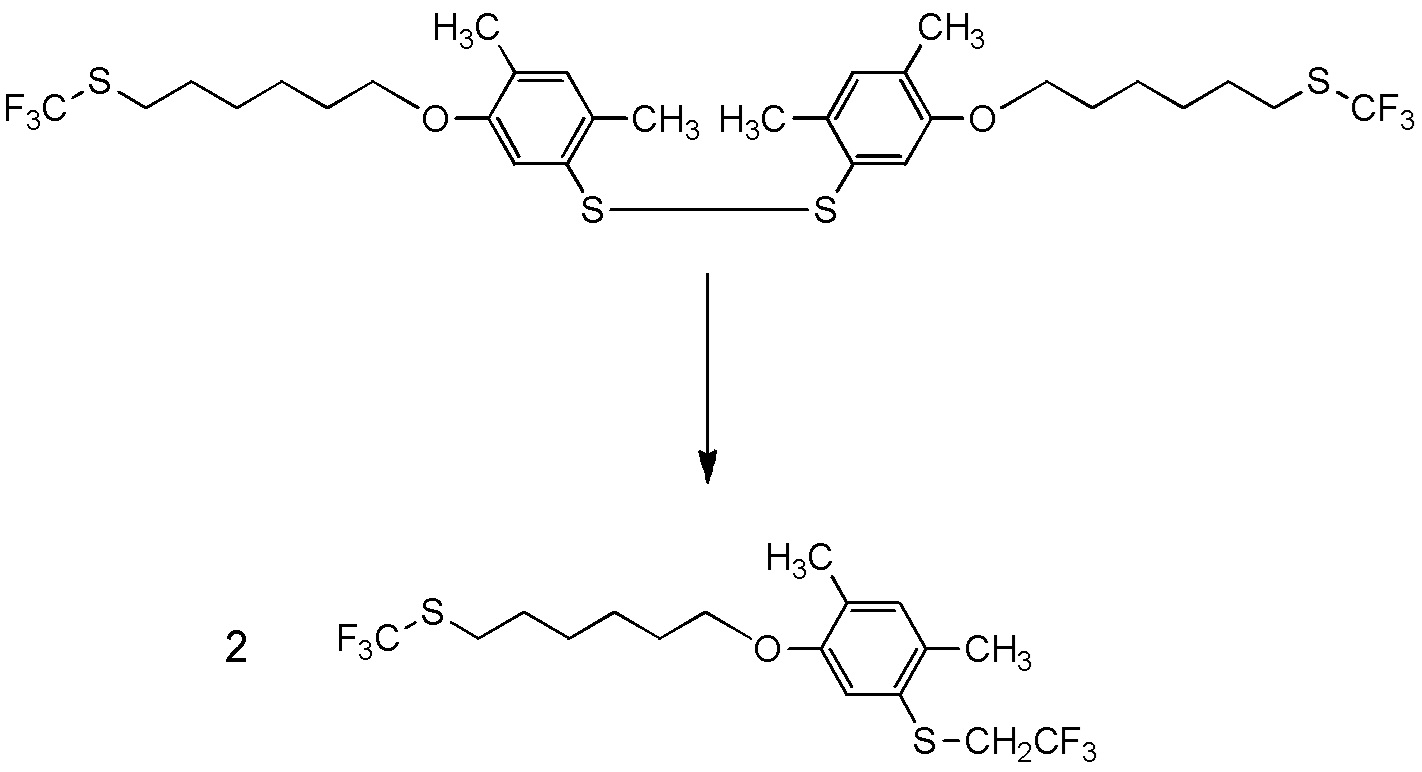
В реакционный сосуд добавляли 337,4 мг (0,50 ммоль) бис[2,4-диметил-5-(6-трифторметилтиогексилокси)фенил]дисульфида, 266,9 мг (1,05 ммоль) 2,2,2-трифторэтил п-толуолсульфоната, 152,0 мг (1,10 ммоль) карбоната калия, 231,2 мг (1,50 ммоль) ронгалита (торговое наименование) (дигидрат формальдегидсульфоксилата натрия) и 2 мл N,N-диметилформамида. Смесь перемешивали при 50°C в течение 16 часов в атмосфере азота. К реакционной смеси добавляли разбавленную соляную кислоту, воду и диэтиловый эфир, и смесь распределяли между органическим слоем и водным слоем, и органический слой отделяли. Органический слой сушили над безводным сульфатом магния и фильтровали, и затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением 242,0 мг 6-трифторметилтиогексил-[2,4-диметил-5-(2,2,2-трифторэтилтио)фенил]эфира с выходом 58%.
1H-ЯМР (300 МГц, CDCl3) δ (м.д.): 6,96 (с, 1H), 6,70 (с, 1H), 3,94 (т, 2H), 3,30 (кв, 2H), 2,90 (т, 2H), 2,38 (с, 3H), 2,17 (с, 3H), 1,71-1,82 (м, 4H), 1,49-1,53 (м, 4H).
[0927]
Ссылочный пример 7
Получение 4-хлор-2-фтор-5-меркаптофенола
(1) Получение 4-хлор-5-хлорсульфонил-2-фторфенола
[Химическая формула 172]
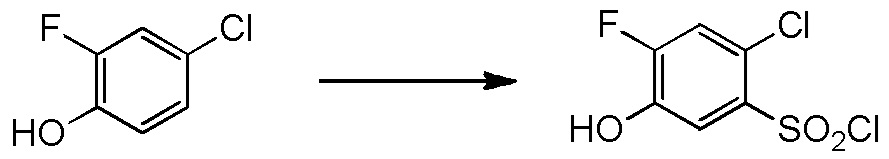
В реакционный сосуд добавляли 6,67 г (25,0 ммоль) 30% дымящей серной кислоты и 2,5 мл дихлорметана. Далее, в то время, когда смесь перемешивали при комнатной температуре, добавляли по каплям раствор, полученный растворением 732,8 мг (5,0 ммоль) 4-хлор-2-фторфенола в 2,5 мл дихлорметана. После прекращения добавления по каплям, смесь перемешивали при комнатной температуре в течение 1 часа. Затем к смеси добавляли 5,95 г (50,0 ммоль) тионилхлорида. Далее, смесь перемешивали при 50°C в течение 1 часа. Полученную реакционную смесь добавляли по каплям в воду со льдом, и затем смесь распределяли между дихлорметаном и водой, и дихлорметановый слой отделяли. Потом дихлорметановый слой сушили над безводным сульфатом магния и фильтровали, и затем дихлорметан отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением 941,0 мг 4-хлор-5-хлорсульфонил-2-фторфенола с выходом 77%.
1H-ЯМР (300 МГц, CDCl3) δ (м.д.): 7,83 (д, J=8,4 Гц, 1H), 7,38 (д, J=9,9 Гц, 1H).
(2) Получение 4-хлор-2-фтор-5-меркаптофенола
[Химическая формула 173]
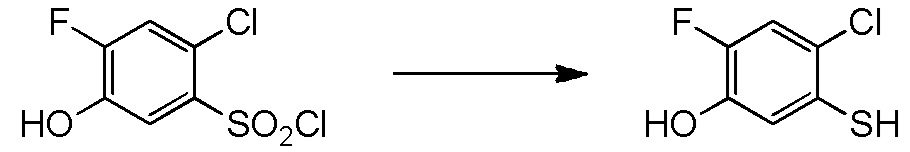
В реакционный сосуд добавляли 245,1 мг (1,0 ммоль) 4-хлор-5-хлорсульфонил-2-фторфенола, 1 мл 18% соляной кислоты и 1 мл метанола. Далее, в то время, когда смесь перемешивали при комнатной температуре, добавляли 237,4 мг (2,0 ммоль) порошкообразного олова. Затем смесь перемешивали при 80°C в течение 1 часа. Из полученной реакционной смеси при пониженном давлении отгоняли метанол. К полученному остатку добавляли дихлорметан и воду, и смесь распределяли между дихлорметаном и водой, и дихлорметановый слой отделяли. Потом дихлорметановый слой сушили над безводным сульфатом магния и фильтровали, и затем дихлорметан отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением 152,0 мг 4-хлор-2-фтор-5-меркаптофенола с выходом 85%.
1H-ЯМР (300 МГц, CDCl3) δ (м.д.): 7,14 (д, J=10,2 Гц, 1H), 7,01 (д, J=8,7 Гц, 1H), 3,82 (с, 1H).
[0928]
Ссылочный пример 8
Получение бис(2-хлор-4-фтор-5-гидроксифенил)дисульфида
[Химическая формула 174]
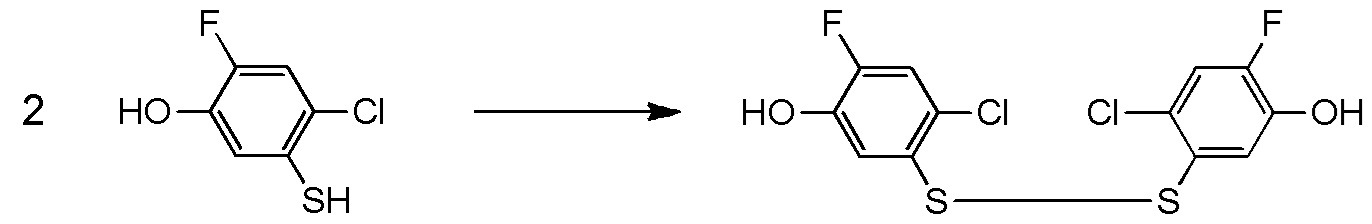
В реакционный сосуд добавляли 44,7 мг (0,25 ммоль) 4-хлор-2-фтор-5-меркаптофенола и 1 мл воды. В то время, когда смесь перемешивали при комнатной температуре, медленно добавляли по каплям 26,7 мг (0,28 ммоль) 30% водного раствора перекиси водорода. Смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь фильтровали, и затем осадок на фильтре промывали водой и сушили с получением 39,9 мг бис(2-хлор-4-фтор-5-гидроксифенил)дисульфида с выходом 90%.
1H-ЯМР (300 МГц, CDCl3) δ (м.д.): 7,22 (д, J=8,7 Гц, 2H), 7,16 (д, J=9,6 Гц, 2H).
Температура плавления: 160°C
[0929]
Ссылочный пример 9
Получение бис[2-хлор-4-фтор-5-(5-трифторметилтиопентилокси)фенил]дисульфида
[Химическая формула 175]
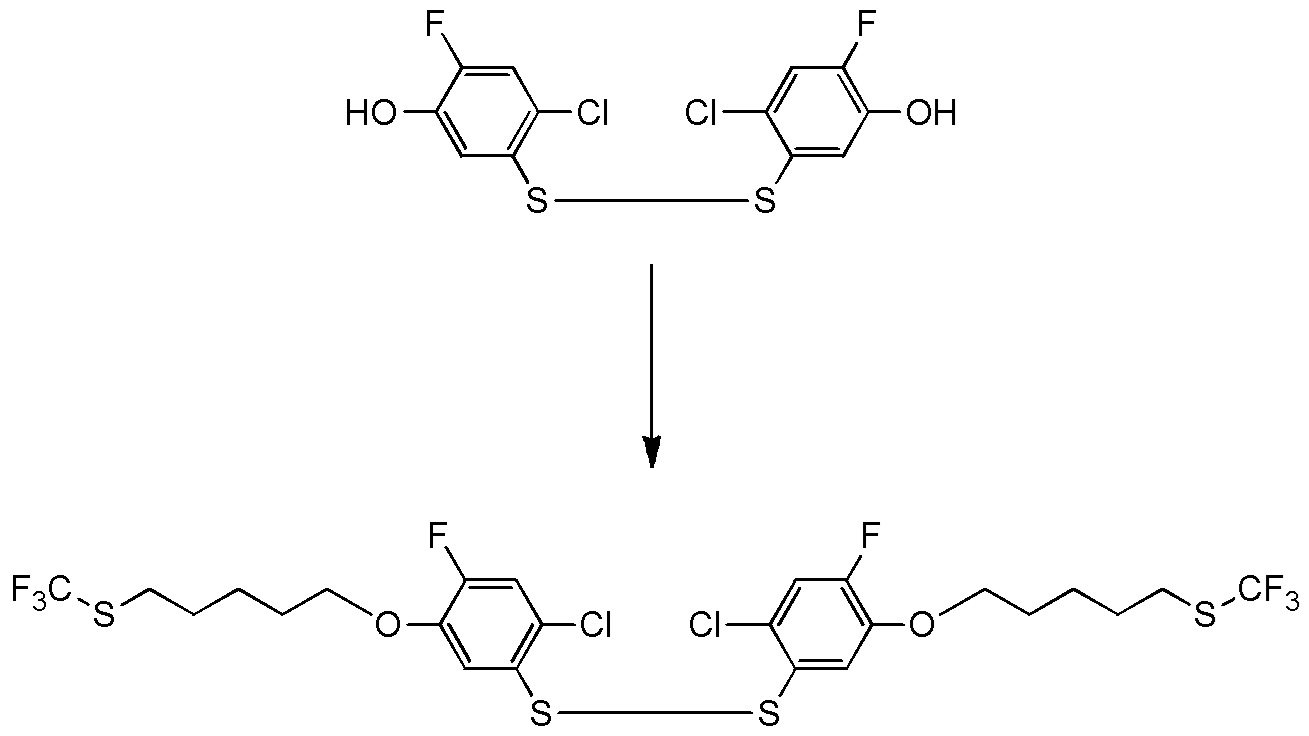
В реакционный сосуд добавляли 177,6 мг (0,50 ммоль) бис(2-хлор-4-фтор-5-гидроксифенил) дисульфида, 263,7 мг (1,05 ммоль) 1-бром-5-трифторметилтиопентана, 152,0 мг (1,10 ммоль) карбоната калия и 1 мл N,N-диметилформамида. Смесь перемешивали при 50°C в течение 15 часов в атмосфере азота. К реакционной смеси добавляли разбавленную соляную кислоту, воду и диэтиловый эфир, и смесь распределяли между органическим слоем и водным слоем, и органический слой отделяли. Органический слой сушили над безводным сульфатом магния и фильтровали, и затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением 277,0 мг бис[2-хлор-4-фтор-5-(5-трифторметилтиопентилокси)фенил] дисульфида с выходом 80%.
1H-ЯМР (300 МГц, CDCl3) δ (м.д.): 7,21 (д, J=8,4 Гц, 2H), 7,12 (д, J=10,2 Гц, 2H), 3,97 (т, J=6,3 Гц, 4H), 2,90 (т, J=7,2 Гц, 4H), 1,78 (м, 8H), 1,56 (м, 4H).
[0930]
Ссылочный пример 10
Получение 5-трифторметилтиопентил-[4-хлор-2-фтор-5-(2,2,2-трифторэтилтио)фенил]эфира
[Химическая формула 176]
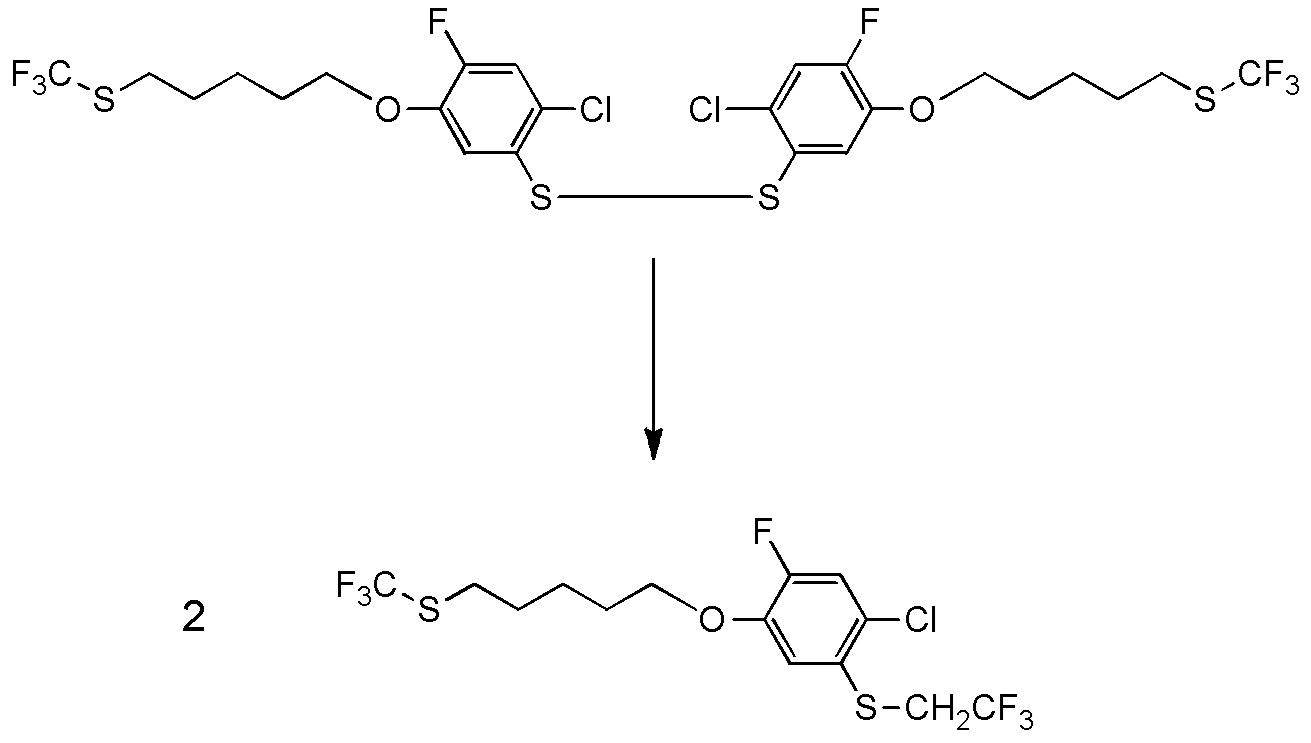
В реакционный сосуд добавляли 277,0 мг (0,40 ммоль) бис[2-хлор-4-фтор-5-(5-трифторметилтиопентилокси)фенил]дисульфида, 213,5 мг (0,84 ммоль) 2,2,2-трифторэтил п-толуолсульфоната, 121,6 мг (0,88 ммоль) карбоната калия, 184,9 мг (1,20 ммоль) ронгалита (торговое наименование) (дигидрат формальдегидсульфоксилата натрия ), 72,0 мг (4,0 ммоль) воды и 1 мл N,N-диметилформамида. Смесь перемешивали при 50°C в течение 12 часов в атмосфере азота. К реакционной смеси добавляли разбавленную соляную кислоту, воду и диэтиловый эфир, и смесь распределяли между органическим слоем и водным слоем, и органический слой отделяли. Органический слой сушили над безводным сульфатом магния и фильтровали, и затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением 306,0 мг 5-трифторметилтиопентил-[4-хлор-2-фтор-5-(2,2,2-трифторэтилтио)фенил]эфира с выходом 89%.
1H-ЯМР (300 МГц, CDCl3) δ (м.д.): 7,23 (д, J=8,4 Гц, 1H), 7,21 (д, J=10,8 Гц, 1H), 4,03 (т, J=6,3 Гц, 2H), 3,41 (д, J=9,6 Гц, 2H), 2,92 (т, J=7,5 Гц, 2H), 1,82 (м, 4H), 1,61 (м, 2H).
[0931]
Ссылочный пример 11
Получение 5-трифторметилтиопентил-[4-хлор-2-фтор-5-(2,2,2-трифторэтилсульфинил)фенил]эфира
[Химическая формула 177]
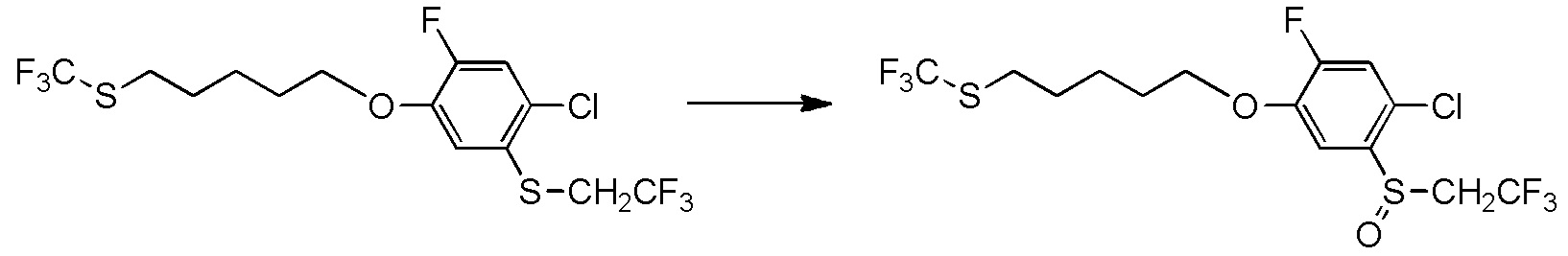
В реакционный сосуд добавляли 86,2 мг (0,20 ммоль) 5-трифторметилтиопентил-[4-хлор-2-фтор-5-(2,2,2-трифторэтилтио)фенил]эфира и 2 мл дихлорметана. В то время, когда смесь перемешивали при комнатной температуре, добавляли 50,6 мг (0,22 ммоль) м-хлорпербензойной кислоты. Смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли водный раствор сульфита натрия, воду и дихлорметан, и смесь распределяли между органическим слоем и водным слоем, и органический слой отделяли. Органический слой сушили над безводным сульфатом магния и фильтровали, и затем растворитель отгоняли при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле с получением 68,0 мг 5-трифторметилтиопентил-[4-хлор-2-фтор-5-(2,2,2-трифторэтилсульфинил)фенил]эфира с выходом 76%.
1H-ЯМР (300 МГц, CDCl3) δ (м.д.): 7,54 (д, J=8,1 Гц, 1H), 7,21 (д, J=9,9 Гц, 1H), 4,13 (т, J=6,3 Гц, 2H), 3,72 (м, 1H), 3,37 (м, 1H), 2,92 (т, J=7,2 Гц, 2H), 1,84 (м, 4H), 1,62 (м, 2H).
[0932]
Используя фторалкилирующий агент по настоящему изобретению, в соответствии со способом, описанным в примерах и ссылочных примерах по настоящему описанию, может быть обеспечен предпочтительный, с промышленной точки зрения, способ получения эффективных акарицидов и/или эффективных инсектицидов (см. патентный документ 2), и предпочтительный, с промышленной точки зрения, способ получения их промежуточных соединений.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
[0933]
Соединения, содержащие фторалкилирующую группу, используются в качестве различных химических продуктов (например, фармацевтических препаратов, сельскохозяйственных химикатов, материалов для электронного оборудования и так далее), а также получения их промежуточных соединений.
[0934]
Например, широко известен ряд соединений, содержащих трифторметильную группу, в качестве эффективных соединений.
[0935]
В частности, соединения, содержащие трифторметилтио группу (CF3S-), используются в качестве инсектицидов и/или акарицидов самостоятельно, и также используются в качестве промежуточных соединений для получения других инсектицидов и/или других акарицидов (например, см. пример исследования 1 в патентном документе 1 и пример исследования 1 в патентном документе 2).
[0936]
Фторалкилирующий агент по настоящему изобретению является простым с точки зрения обработки и безопасности. Кроме того, реакция фторалкилирования по настоящему изобретению осуществляется легко и безопасно, и высоко селективно. При этом фторалкилирующий агент по настоящему изобретению может снизить стоимость производства в процессе получения соединения, содержащего фторалкильную группу.
[0937]
Фторалкилирующий агент по настоящему изобретению может быть получен из легко доступного производного фторкарбоновой кислоты, такого как трифторуксусная кислота, без использования газа, вызывающего парниковый эффект (например, CHF3), или газообразного фреона (например, CF3I или CBrF3). Кроме того, фторалкилирующий агент по настоящему изобретению может быть получено экономически приемлемым образом, не требуя специального оборудования и техники. Соответственно, способ получения фторалкилирующего агента по настоящему изобретению устраняет недостатки предшествующего уровня техники, является предпочтительным, с промышленной точки зрения, и может снизить нагрузку на окружающую среду.
[0938]
Фторалкилирующий агент по настоящему изобретению обладает превосходной реакционной способностью. Соответственно, настоящее изобретение может обеспечить, при необходимости, возможность не использовать сильное основание. Иными словами, существует возможность того, что фторалкилирующий агент по настоящему изобретению может применяться к исходному соединению, которое является неустойчивым по отношению к сильному основанию. Соответственно, считается, что настоящее изобретение обладает широким диапазоном применения, то есть широкой функциональностью.
[0939]
Как было описано выше, новое фторалкилирующий агент по настоящему изобретению и его использование (то есть, способ получения соединения, содержащего фторалкильную группу) обладают большой ценностью с промышленной точки зрения. Кроме того, новое соединение, применяемое в качестве фторалкилирующего агента по настоящему изобретению, также обладает большой ценностью с промышленной точки зрения. Вкратце, настоящее изобретение имеет высокую промышленную применимость.