Результат интеллектуальной деятельности: ПЛАЗМИДА ДЛЯ ВЫЯВЛЕНИЯ ЭПИТЕЛИАЛЬНОГО СОСТОЯНИЯ КЛЕТКИ ЧЕЛОВЕКА
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к биотехнологии и генной инженерии, а именно касается генетической конструкции, позволяющей оценивать эпителиальное состояние клеток человека. Представленная конструкция включают помимо стандартных элементов для функционирования данной конструкции участок промотера эпителиального кадгерина (CDH1) с нуклеотидной последовательностью Cdh1 - SEQ ID N0:1, а также флуорофор. Решение можно реализовать в высокопроизводительном поиске лекарственных средств, а также для выявления факторов, влияющих на эффективность метастазирования.
Уровень техники
Причиной более 90% смертельных исходов при онкологических заболеваниях является развитие метастазов [Каприн А.Д., Старинский В., Петрова Г.В. Злокачественные новообразования в России в 2015 году (заболеваемость и смертность). 2015; Samatov T.R. et al. Novel biomarkers in cancer: The whole is greater than the sum of its parts // Seminars in Cancer Biology. 2016] Малигнизация опухолевых клеток сопровождается фенотипическими и функциональными изменениями, которые приводят к повышению пролиферативной активности и инвазивного потенциала. Приобретение клетками инвазивного фенотипа обусловлено процессом эпителиально-мезенхимальной трансформации (ЭМТ) [Samatov T.R. et al. Modelling the metastatic cascade by in vitro microfluidic platforms. // Prog. Histochem. Cytochem. 2015. Vol. 49, №4. P. 21-29]. При ЭМТ происходит разрушение межклеточных контактов, перестройка цитоскелета, а также повышение уровня экспрессии ряда генов-маркеров мезехимального состояния, таких как виментин, десмин и интегрин α5β1. Многочисленные исследования показали, что данный процесс ассоциирован с ключевыми стадиями процесса метастазирования [Yang J., Weinberg R.A. Epithelial-mesenchymal transition: at the crossroads of development and tumor metastasis. // Dev. Cell. 2008. Vol. 14, №6. P. 818-829]. Таким образом ЭМТ рассматривается как потенциальная мишень при разработке противоопухолевых препаратов [Marcucci F., Stassi G., De Maria R. Epithelial-mesenchymal transition: a new target in anticancer drug discovery // Nat. Rev. Drug Discov. Nature Publishing Group, 2016. Vol. 15, №5. P. 311-325].
В отличии от большинства систем скрининга противоопухолевых препаратов, основанных на измерении активности определенных молекулярных мишеней, все описанные на сегодняшний день подходы к выявлению молекул-ингибиторов ЭМТ основаны на регистрации изменения фенотипа модельных клеток. Это объясняется комплексностью процесса перехода клетки из эпителиального состояния в мезенхимальное. Так, стимулами данного процесса могут являться гипоксия, механический стресс, иммунный ответ, состав внеклеточного матрикса и противоопухолевые препараты [Marcucci F., Stassi G., De Maria R. Epithelial-mesenchymal transition: a new target in anticancer drug discovery // Nat. Rev. Drug Discov. Nature Publishing Group, 2016. Vol. 15, №5. P. 311-325]. В ряде работ были предприняты попытки идентифицировать отдельные молекулярные мишени для ингибирования ЭМТ, однако полученные данные являются противоречивыми [Reka А.K. et al. Identifying inhibitors of epithelial-mesenchymal transition by connectivity map-based systems approach. // J. Thorac. Oncol. 2011. Vol. 6, №11. P. 1784-1792; Polireddy K. et al. Targeting Epithelial-Mesenchymal Transition for Identification of Inhibitors for Pancreatic Cancer Cell Invasion and Tumor Spheres Formation. // PLoS One. 2016. Vol. 11, №10. P. e0164811; Lotz-Jenne C. et al. A high-content EMT screen identifies multiple receptor tyrosine kinase inhibitors with activity on TGFβ receptor. // Oncotarget. 2016. Vol. 7, №18].
Одним из способов определения соединений, влияющих на процесс ЭМТ, является регистрация изменения уровня экспрессии генов-маркеров эпителиального и мезенхимального состояний.
Из уровня техники известен способ выявления циркулирующих опухолевых клеток, сущность которого заключается в сборе цельной крови пациентов, удалении эритроцитов, выделении рибонуклеиновых кислот (РНК) опухолевых клеток и проведении полимеразной цепной реакции (ПЦР) с специфичными праймерами к генам-маркерам эпителиального (ЕРСАМ, CDH1, KRT7, KRT19 и KRT20) и мезенхимального (CDH2, виментин, фибронектин, ММР9 и AKT2) состояния с регистрацией сигнала флуориметрическим детектором. Данное решение также применимо и к культурам клеток (CN 106868101, 2017-06-20). Недостатком данного способа является высокая длительность процедур выделения РНК и ПЦР, что не позволяет использовать данное решение для высокопроизводительного поиска лекарств.
Из уровня техники также известен способ определения и типирования циркулирующих опухолевых клеток, сущность которого заключается в регистрации количества клеток, находящихся в эпителиальном или в мезенхимальном состоянии, методом проточной цитометрии и антител, меченных флуорофорами, специфичных к белкам-маркерам эпителиального (ЕРСАМ, CDH1, KRT5, KRT7, KRT8, KRT16, KRT17, KRT18, KRT19, KRT20) и мезенхимального (CDH2, виментин, фибронектин, ММР2, ММР3, ММР9, AKT2, ZEB1, FOXC1, FOXC2, SNAI1, SNAI2, SERPINE1) состояния (CN 106996975, 2017-08-01). Недостатком данного способа является длительность процедуры проточной цитометрии, высокой стоимости используемых антител и оборудования.
Из уровня техники также известен способ выявления терапевтических мишеней, ассоциированных с ЭМТ, который заключается в определение содержания РНК генов-мишеней нейронального кадгерина и белков-мишеней в опухолевых тканях методами ПЦР, иммуноблоттинга, секвенирования и масс-спектрометрии (US 20130137584, 2013-05-30). Недостатком данного способа является отсутствие маркеров эпителиального состояния, что не позволяет оценивать соотношение клеток, находящихся в эпителиальном и мезенхимальном состоянии клеток, а также низкую производительность, что не позволяет использовать данный способ для высокопроизводительного поиска лекарств.
Из уровня техники также известен способ определения ЭМТ, который заключается в магнитной сепарации опухолевых клеток из цельной крови пациента с последующей оценкой уровня экспрессии генов-маркеров мезенхимального состояния (CDH2, виментин, фибронектин, Snail1, Snail2, Twist1 и др.) и стволовых клеток (FGF2, BMI1, ALDH1, CD44, CD24, KRT19 и др.) методом ПЦР (WO 200936968, 2009-03-26). Недостатком данного способа является высокая длительность процедур выделения РНК и ПЦР, что не позволяет использовать данный способ для высокопроизводительного поиска лекарств.
Наиболее близким решением является способ определения состояния клеток с использованием флуоресцентных репортеров, описанный в работе [Toneff M.J. et al. The Z-cad dual fluorescent sensor detects dynamic changes between the epithelial and mesenchymal cellular states // BMC Biol. 2016. Vol. 14, №1.P. 1-16], которой заключается в применении разработанного клеточного сенсора для слежения за динамикой перехода из эпителиального в мезенхимальные состояние и обратно. В качестве репортера эпителиального состояния используется флуоресцентный белок RFP, экспрессируемый под промотором CDH1, а в качестве маркера мезенхимального состояния - флуоресцентный белок GFP 3'-некодируемой областью (3'-UTR) ZEB1. Недостатком данного сенсора является механизм активации репортера мезехимального состояния, которая указывает не на транскрипционную регуляцию транскрипционного фактора CDH2, а на его пост-транскипционную регуляцию с помощью микроРНК.
Отличительной чертой ЭМТ является снижение уровня экспрессии эпителиального кадгерина (Е-кадгерина, ген CDH1), что приводит к разрушению межклеточных контактов. Подавление экспрессии генов, кодирующих белки эпителиальных клеточных контактов, сопровождается активацией генов, способствующих мезенхимальной адгезии. В частности, понижение экспрессии Е-кадгерина сопровождается повышением экспрессии мезенхимального нейронального кадгерина, N-кадгерина (CDH2). В результате у клеток появляется аффинность к мезенхимальным клеткам за счет гомотипичных белковых взаимодействий N-кадгеринов. Эти взаимодействия слабее, чем гомотипичные взаимодействия Е-кадгеринов, и способствуют клеточной миграции и инвазии [Theveneau Е., Mayor R. Cadherins in collective cell migration of mesenchymal cells // Current Opinion in Cell Biology. 2012. Vol. 24, №5. P. 677-684]. Таким образом, определение уровней экспрессии генов CDH1 и CDH2 может быть использовано для определения мезенхимального или эпителиального состояния клетки.
Раскрытие изобретения
Задачей настоящего изобретения является создание генетической конструкции, обеспечивающей быструю и достоверную оценку эпителиального состояния клетки.
Сущностью заявленного технического решения является генетическая конструкция, способные обеспечивать экспрессию различных флуорофоров в клетках человека, находящихся в эпителиальном состоянии.
Техническим результатом изобретения является сокращение по времени выявление фенотипического состояния клеток до 2-3 часов, с высокой степенью достоверности.
Поставленная задача решается плазмидой для трансфекции в клетки человека для выявления их эпителиального состояния, включающей участок с нуклеотидной последовательностью промотера гена-маркера эпителиального состояния и по меньшей мере одну последовательность флуоресцентного белка, при этом участок нуклеотидной последовательности флуоресцентного белка находится под контролем промотера гена-маркера эпителиального состояния, при этом в качестве гена-маркера эпителиального состояния используют эпителиальный кадгерин человека с нуклеотидной последовательностью SEQ ID NO:1.
Краткое описание чертежей
Заявленное техническое решение иллюстрируется следующими материалами.
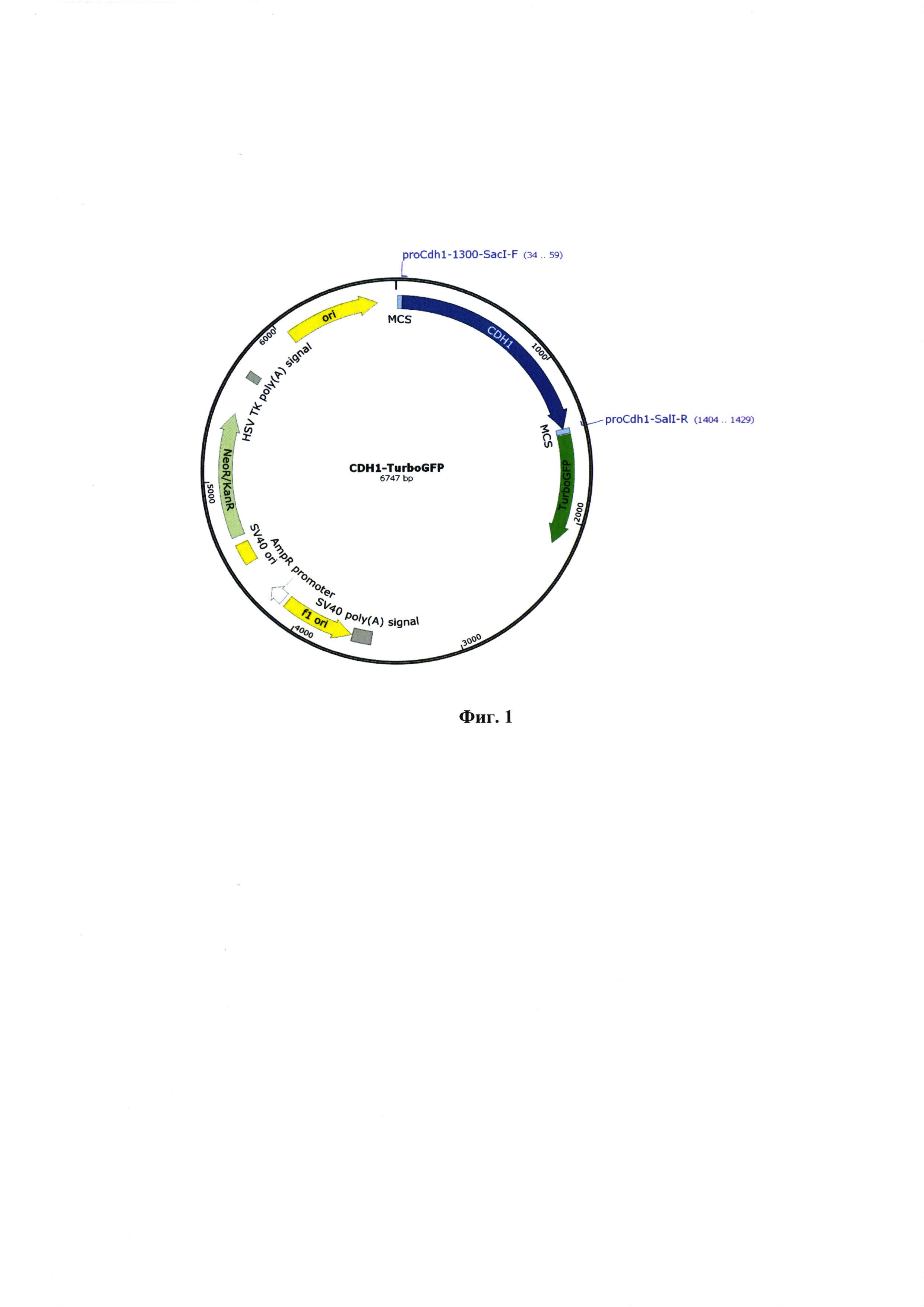
Фиг. 1 - Физическая карта генетической конструкции CDH1-TurboGFP.
Фиг. 2 - Фотография флюоресценции культуры клеток SH-SY5Y, находящихся в эпителиальном состоянии и экспрессирующих ген GFP после трансфекции конструкцией CDH1-TurboGFP.
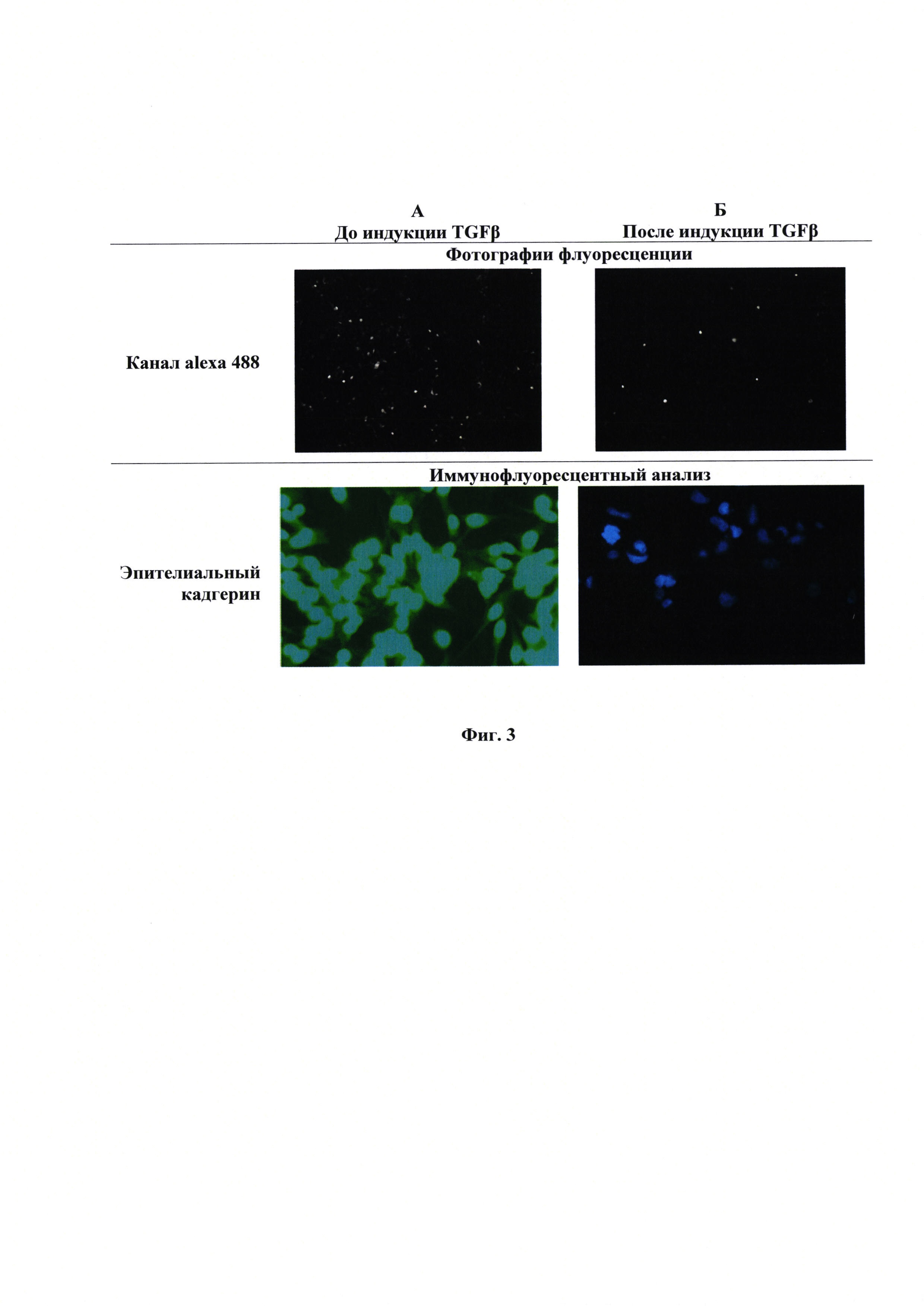
Фиг. 3 - Фотография флюоресценции и культуры клеток иммунофлуоресцентный анализ состояния клеток MDA-MB-231 до индукции (А), фотография флюоресценции и культуры клеток иммунофлуоресцентный анализ состояния клеток MDA-MB-231 после индукции (Б.)
Осуществление изобретения
Средства и методы конструирования широко известны и описаны [Lundblad, R., Macdonald, F. (Ed.). Handbook of Biochemistry and Molecular Biology, Fourth Edition. 2010. Boca Raton: CRC Press].
Получение конструкций проводят, выделяя общую ДНК из первичных клеток или клеточных линий человека с использованием предназначенных для этого коммерческих наборов, например, PureLink™ Genomic DNA Mini Kit (Thermo Scientific, США) или аналогичных. Для этого отбирают образец ткани или проводят культивирование клеток в лабораторных условиях, отделяют клетки от культуральной среды центрифугированием, и далее следуют инструкции производителя. Отдельно синтезируются праймеры, специфичные к началу и концу промотера эпителиального кадгерина (CDH1). Праймеры должны дополнительно содержать участки с последовательностями, распознаваемыми эндонуклеазами рестрикции, аналогичные тем, что присутствуют в выбранном векторе, например SacI, Sall, XbaI, XhoI и др., причем при выборе сайтов рестрикции необходимо руководствоваться тем, содержащиеся в векторе последовательности флуоресцентных белков, должны находиться под контролем промотера CDH1. Для этого встраиваемая последовательность промотера CDH1 должна находиться на 5' конце последовательности последовательности флуоресцентного белка.
Затем проводят реакцию ПЦР с праймерами и используя полученную ДНК в качестве матрицы, а также коммерчески-доступных высокоточных полимераз, например Q5® High-Fidelity DNA Polymerase в буфере High GC Enhancer (New England Biolabs, США).
При выборе вектора руководствуются не только наличием необходимых сайтов рестрикции, но и наличием регуляторных элементов. В качестве векторов для создания генетических векторов могут быть использованы любые коммерческие векторы, содержащие ген устойчивости к антибиотикам для возможности селекции, например, ампициллин, канамицин, зеомицин и др., регуляторные элементы для экспрессии в эукариотических клетках, селективный маркер для возможности селекции плазмиды в бактериях, SV40 концевой интрон, ро1у(А)-сигнал, последовательность флуорофора, например, pNeoEGFP, pTurboRFP-PRL и другие. В качестве флуорофоров могут быть использованы и флуоресцентные белки, способные экспрессироваться в эукариотических клетках, например, зеленый флуоресцентный белок, красный флуоресцентный белок, синий флуоресцентный белок и другие.
Полученные в результате реакции ПЦР фрагменты и выбранный вектор подвергаются рестрикции по соответствующим сайтам. После этого, продукты рестрикции очищают, проводя электрофорез в 1% агарозном геле и выделяя с использованием коммерчески-доступных наборов для выделения из агарозного геля, innuPREP Gel Extraction Kit (Analytik Jena, Германия). Очищенный продукты рестрикции смешивают следующим образом: рестрицированный фрагмент промотора эпителиального кадгерина смешивают с рестрицированным вектором, рестрицированный фрагмент промотора нейронального кадгерина смешивают с рестрицированным вектором. Полученные смеси лигируют с использованием коммерчески-доступных лигаз, например, с помощью набора Quick Ligation™ Kit (New England Biolabs, США). После проведения лигирования, проводят трансфекцию клеток линий человека. В качестве клеточных линий могут быть использованы любые иммортализованные клеточные культуры человека, за исключением эмбриональных клеток человека. Так, например, могут быть использованы клеточные линии: SH-SY5Y, MCF-7, А-549, MDA-MB-231, DU-4477 и другие. Трансфекцию проводят с использованием и по протоколу коммерчески-доступных реагентов для трансфекции, например, Turbofect (Thermo Scientific Fisher).
Затем проводят селекцию на антибиотике, к которому в векторе содержится ген устойчивости, например, на ампициллине, канамицине, зеомицине и др. Для этого проводят культивирование клеток в среде, содержащей соответствующий антибиотик, например, 700 мкг/мл G-418 (Thermo Fischer Scientific) в течение трех недель со сменой среды каждые 3 дня. В результате получают клетки, трансфецированные вектором, содержащим участок промотера CDH1.
После этого полученные клетки используют для изучения воздействия лекарственных соединений на эпителиальное состояние трансфецированных клеток. Для этого проводят культивирование клеток в планшетах, в среде, содержащей различные концентрации изучаемого вещества или различные изучаемые соединения. После инкубации в течение 3-5 часов, проводят визуализацию клеток проводили с использованием флуоресцентного микроскопа, например, Carl Zeiss Axio Observer Z1 на каналах флуоресценции alexa 488 (для GFP) и в фазовом контрасте. По соотношению количества клеток, видимых на канале alexa 488 до и после инкубации с изучаемым соединением, оценивают его эффективность.
Осуществление заявленного технического решения демонстрируется следующими примерами.
Пример 1.
В примере продемонстрирован процесс получения генетических конструкции, включающей участки промоторов промотеров эпителиального кадгерина (CDH1) с нуклеотидной последовательностью SEQ ID NO:1, а также флуорофор на основе генетической последовательности peTurboGFP-PRL-dest1.
При выборе длины клонируемого участка промоторов CDH1 учитывали два фактора: фрагмент промотора должен содержать сайты связывания с известными факторами транскрипции данных генов и в то же время обладать минимальным размером во избежание сложностей при амплификации.
В промоторной области CDH1 находятся несколько сайтов связывания транскрипционных факторов, регулирующих ЭМТ: Nf-kappaB (-516 п.н.), РАХ4 (-211 п.н.), ZEB1 (-1423 п.н.) и CREB1 (-480, -1404 п.н.). Помимо этого, на участке -1133 - -212 п.н. расположено 12 сайтов связывания ESR1, который является лиганд-независимым регулятором CDH1 [Cardamone M.D. et al. ERalpha as ligand-independent activator of CDH-1 regulates determination and maintenance of epithelial morphology in breast cancer cells. // Proc. Natl. Acad. Sci. U.S.A. 2009. Vol. 106, №18. P. 7420-7425]. Существует ряд работ по исследованию эффективности люциферазного репортера в зависимости от длины контролирующего его участка промотора Е-кадгерина (от -1484 до -108 п.н.) в различных типах клеток, в том числе в клетках рака молочной железы [Hajra K.М., Ji X., Fearon E.R. Extinction of E-cadherin expression in breast cancer via a dominant repression pathway acting on proximal promoter elements. // Oncogene. 1999. Vol. 18. P. 7274-7279; Hajra K.M., David Y.S.C., Fearon E.R. The SLUG zinc-finger protein represses E-cadherin in breast cancer // Cancer Res. 2002. Vol. 62, №6. P. 1613-1618; Ji X. et al. Transcriptional defects underlie loss of E-cadherin expression in breast cancer. // Cell Growth Differ. 1997. Vol. 8, №7. P. 773-778]. Было показано, что участок промотора от -400 п.н. достаточен для экспрессии люциферазного репортера, однако его может быть недостаточно для негативной регуляции экспрессии Е-кадгерина. В работе [Toneff M.J. et al. The Z-cad dual fluorescent sensor detects dynamic changes between the epithelial and mesenchymal cellular states // BMC Biol. 2016. Vol. 14, №1. P. 1-16] был получен флуоресцентный репортер, экспрессирующий RFP под фрагментом промотора Е-кадгерина длиной 1370 п.н.; с использованием данного репортера было показано, что при индукции ЭМТ экспрессия RFP падала, что свидетельствует о том, что на участке промотора длиной 1370 п.н. содержатся сайты связывания факторов подавления экспрессии Е-кадгерина. Для создания репортерной системы был выбран участок промотора CDH1 -1433 - -48 п.н.
Культивируют любые клетки человека, например клетки линии SH-SY5Y или HEK-293 в культуральных флаконах с площадью поверхности 25 см2 в 5 мл среды DMEM (Gibco, США) с добавлением 10% фетальной бычьей сыворотки (HyClone, Thermo Scientific, США) и 0,1% пенициллин/стрептомицина (Gibco, США). Из клеток выделяют общую ДНК, например, с использованием специализированного коммерческого набора Nucleospin tissue kit (производства фирмы Macherey Nagel, Германия). Последовательность участка промотера CDH1 представлена последовательностью SEQ ID NO:l. Данный фрагмент получают с использование выделенной ДНК в качестве матрицы, специфичных праймеров, представленных последовательностям SEQ ID NO:2 и SEQ ID NO:3, а также высокоточной полимеразы, например Q5® High-Fidelity DNA Polymerase в буфере High GC Enhancer (New England Biolabs, США).
После проведения амплификации промоторный участок гена CDH1 клонируют по сайтам рестрикции SacI и SalI, а участок промотора CDH2 по сайтам рестрикции NdeI и BblII, с использованием соответствующих эндонуклеаз рестрикции (Thermo Fischer, США). Затем проводят электрофорез для полученных реакционных смесей в 0,5% агарозном геле, фрагменты с нужной массой выделяют с помощью набора innuPREP Gel Extraction Kit (Analytik Jena, Германия). Очищенный фрагмент промотора CDH1 лигируют с помощью набора Quick Ligation™ Kit (New England Biolabs, США) с предварительно рестрицированой плазмидой peTurboGFP-PRL-dest1 (Евроген, Россия). В результате был получен репортеры CDH1-TurboGFP (Фиг. 1).
Пример 2.
Накопление флуорофоров в клетках, находящихся в эпителиальном (на примере клеток линии SH-SY5Y).
Полученной в примере 1 репортерной конструкцией CDH1-TurboGFP трансфецируют клетки эпителиального (SH-SY5Y) фенотипа. Трансфекцию проводят с помощью трансфекционного агента Turbofect (Thermo Scientific Fisher) в двух повторах. Для получения стабильных линий клетки инкубируют в селективной среде, содержащей 700 мкг/мл G-418 (Thermo Fischer Scientific) в течение трех недель со сменой среды каждые 3 дня. Визуализацию клеток проводят с использованием микроскопа Carl Zeiss Axio Observer Z1 на каналах флуоресценции alexa 488 (для GFP) и в фазовом контрасте. На Фиг. 2 представлена фотография культуры клеток эпителиального фенотипа (SH-SY5Y). Установленная флюоресценция на канале флуоресценции alexa 488 свидетельствует о наличии зеленого флуоресцентного белка в данных клетках и об успешной экспрессии гена зеленого флуоресцентного белка с использованием генетической конструкции-репортера эпителиального состояния.
Пример 3
Изменение количества флуорофора в клетках при изменении их фенотипа. Полученную в примере 1 репортерную конструкцию CDH1-TurboGFP трансфецируют в клетки MDA-MB-231 как указано в примере 2. Проводят визуализацию клеток с использованием микроскопа Carl Zeiss Axio Observer Z1 на канале флуоресценции alexa 488 (для GFP) и в фазовом контрасте. Клетки культивируют, как указано во примере 2, затем меняют среду на бессывороточную и культивируют еще 24 часа. После этого индуруют ЭМТ с помощью раствора TGFβ (5 нг/мл) в бессывороточной среде и инкубируют в течение 72 часов. Затем часть клеток клеток повторно визуализируют с использованием флуоресцентного микроскопа, другую часть клеток фиксируют в 4% формальдегиде в фосфатном буфере (0,01 М фосфатно-солевой буфер) в течение 20 минут при комнатной температуре, а затем обрабатывают 10% метанолом при -20°С в течение 5 минут. Клетки отмывают в фосфатном буфере и блокируют 1 час в 2% бычьей фетальной сыворотке в фосфатном буфере. Затем клетки инкубируют в течение двух часов с первичными антителами к Е-кадгерину (Invitrogen), в качестве маркера эпителиального состояния. Далее клетки промывают 5 раз по 5 минут фосфатным буфером, а затем инкубируют один час с вторичными антителами, конъюгированными с флуоресцентными метками AlexaFluor488 (1:1000, Abcam), и промывают 5 раз по 5 минут буфером ПБС. Клетки окрашивают DAPI (1:2000), промывают дважды ПБС и анализируют при помощи флуоресцентного микроскопа Фиг. 3.
Из данных, представленных на Фиг. 3 видно, что данные иммунофлуоресцентного анализа и фотографий флуоресценции репортера сходятся. Без индукции ЭМТ наблюдается экспрессия Е-кадгерина и накопление зеленого флуоресцентного белка.
Приведенные примеры осуществления предлагаемого изобретения показывают его осуществимость с использованием стандартного оборудования и материалов, полезность для применения в биотехнологиях, например, для высокопроизводительного поиска лекарств - ингибиторов ЭМТ.
Плазмида для трансфекции в клетки человека для выявления их эпителиального состояния в отношении процесса эпителиально-мезенхимальной трансформации, включающая участок с нуклеотидной последовательностью SEQ ID NO:l промотера гена-маркера эпителиального состояния, в качестве которого используют эпителиальный кадгерин человека и по меньшей мере одну последовательность флуоресцентного белка TurboGFP, при этом участок нуклеотидной последовательности флуоресцентного белка находится под контролем промотера гена-маркера эпителиального состояния.