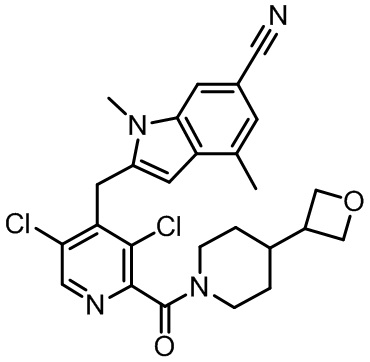
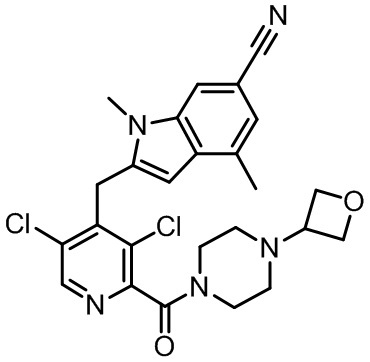
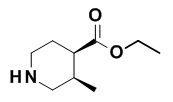
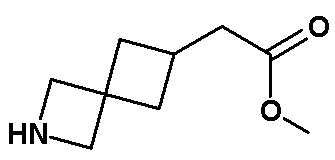
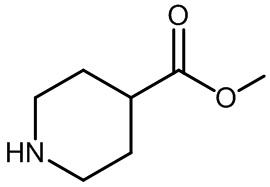
Результат интеллектуальной деятельности: МОДУЛЯТОРЫ ЯДЕРНЫХ РЕЦЕПТОРОВ
Вид РИД
Изобретение
ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка испрашивает приоритет в соответствии с предварительной заявкой на выдачу патента США № 62/257806, поданной 20 ноября 2015 г.; и предварительной заявкой на выдачу патента США № 62/343905, поданной 1 июня 2016 г. Данная заявка также испрашивает приоритет в соответствии с международной заявкой № PCT/IB2015/001693, поданной 9 июня 2015 г. Полное содержание каждой из вышеуказанных заявок включено в настоящий документ с помощью ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к новым соединениям, которые модулируют активность Rorc и рецептора RORγt, и их применению в качестве лекарственных средств.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Изоформы RORα, RORβ и RORγ связанного с ретиноевой кислотой орфанного рецептора (ROR) являются представителями суперсемейства ядерных рецепторов стероидных гормонов и играют значительные роли в разнообразных биологических процессах, включая развитие органов, иммунитет, липидный гомеостаз и метаболизм и циркадные ритмы (Jetten et al. NURSA 2009, 7, 1). Представители семейства ROR состоят как из лиганд-связывающего домена (LBD), так и ДНК-связывающего домена (DBD). Связывание лигандов вызывает конформационное изменение, которое модулирует связывание совместно участвующих в регуляции белков: агонисты привлекают коактиваторы; антагонисты и обратные агонисты нарушают способность связывания коактиваторов или усиливают способность связывания корепрессоров, при этом подавляя транскрипцию целевых генов (Fauber et al. J. Med. Chem. 2014, 57, 5871).
Связанный с ретиноевой кислотой орфанный рецептор γ в тимусе (RORγ, также называемый RORc и NR1F3) кодируется Rorc; RORγ человека и мыши характеризуются высокой гомологией последовательностей и практически одинаковой гомологией сайтов связывания (Jin, L. et al. Mol. Endocrinol. 2010, 24, 923). RORγ млекопитающих существует в двух отдельных изоформах, RORγ и RORγt, которые характеризуются одинаковыми LBD и отличаются только своими N-концевыми последовательностями (Medvedev et al. Gene 1996, 181, 199). Экспрессия изоформы RORγt ограничена лимфоидными органами, включая тимус, тогда как RORγ экспрессируется более широко (печень, мышцы, почки), аналогично RORα, который также присутствует в мозговой и жировой тканях (Kurebayashi, S. et al. Proc. Natl. Acad. Sci., U.S.A. 2000, 97, 10132). RORβ локализуется в коре головного мозга (Hirose, T. et al. Biochem. Biophys Res. Commun. 1993, 194, 1371). RORγt важен для развития лимфатических узлов и пейеровых бляшек и для нормальной дифференциации клеток T-хелперов-17 (Th17), γδ T-клеток и LTi-клеток (Sun et al. Science 2000, 288, 2369).
RORγt является обязательным транскрипционным фактором, который контролирует дифференциацию наивных CD4+ T-клеток в линию дифференцировки Th17 и регулирует транскрипцию эффекторного цитокина IL-17 в Th17-клетках и клетках, участвующих в природном иммунном ответе, как у грызунов, так и у людей (Ivanov, I. et al. Cell 2006, 126, 1121). Провоспалительные цитокины, в том числе IL-17A, IL-17F и IL-22, продуцируемые Th17-клетками и другими RORγt+ лимфоцитами, активируют и направляют иммунную реакцию на внеклеточные патогены (Eberl, G. et al. Nat. Immunol. 2004, 5, 64). Разрушение RORγ при помощи генетического нарушения функции Rorc у мышей уменьшает тяжесть заболевания на мышиных моделях аутоиммунной реакции и воспаления, в том числе экспериментального аутоиммунного энцефаломиелита (EAE), индуцированного антигенным пептидом, индуцированного имиквимодом псориазоподобного дерматита и аллергического заболевания дыхательных путей. Нарушение регуляции транскрипции и секреции IL-17 влечет за собой множество аутоиммунных нарушений у людей, в том числе псориаз, ревматоидный артрит, воспалительные заболевания кишечника (IBD), астму и рассеянный склероз (MS) (например, см.: Yang, X. et al. Immunity 2008, 28, 29; Pantelyushin, S. et al. J. Clin. Invest. 2012, 122, 2252; Leppkes, M. et al. Gastroenterology 2009, 136, 257 и Tilley, J. et al. J. Immunol. 2007, 178, 3208). Результат недавних клинических испытаний с использованием нейтрализующих антител к IL-17A и его рецептору IL-17RA способствует освещению роли этого цитокина в патогенезе заболевания, представляющего собой псориаз (Papp, K. et al. New. Engl. J. Med. 2012, 366, 1181; Leonardi, C. et al. New. Engl. J. Med. 2012, 366, 1190. Снижение продуцирования IL-17 активированными T-клетками и Th17, например посредством ингибирования или RORγt, может обеспечивать аналогичный терапевтический эффект.
Существуют терапевтические средства для лечения разнообразных воспалительных и аутоиммунных заболеваний, но все еще остается значительная неудовлетворенная медицинская необходимость в этих областях, относящихся к терапевтическим средствам. Учитывая роль IL-17 в заболевании человека и подтверждение, что IL-17 и RORγ являются мишенями в мышиных моделях заболеваний, соединения, способные модулировать активность RORγt, предусматриваются для обеспечения терапевтического эффекта при лечении множества иммунных и воспалительных нарушений.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В первом варианте осуществления настоящее изобретение обеспечивает соединение формулы (I),
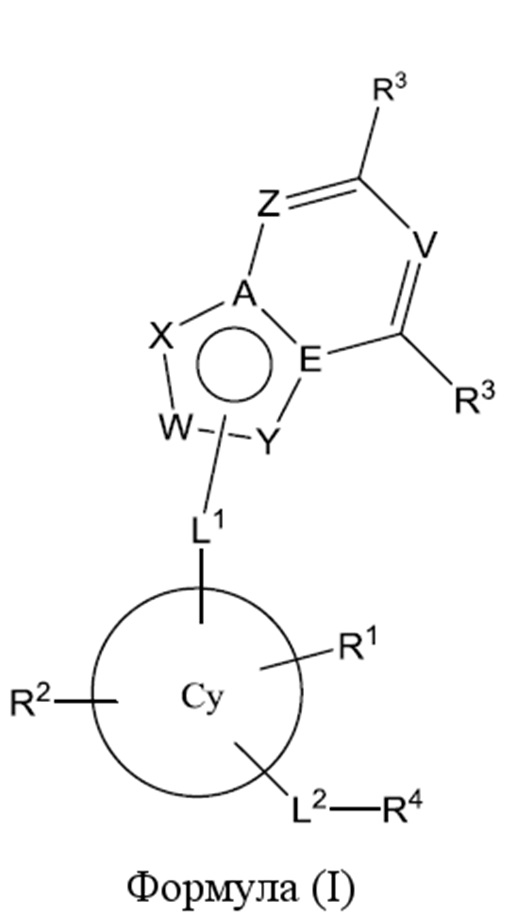 ,
,
его фармацевтически приемлемую соль или стереоизомер, где
W представляет собой C или CRa, L1 соединен с W или Y; и
A и E независимо представляют собой C или N, при условии, что оба одновременно не представляют собой N;
V представляет собой CR3 или N;
X представляет собой CRa, NRa, N или O;
Y представляет собой C, CRa, NRa, N, O или S;
Z представляет собой CR3 или N; или
W представляет собой N или NRa, L1 соединен с W или Y; и
A и E независимо представляют собой C или N, при условии, что оба одновременно не представляют собой N;
V представляет собой CR3 или N;
X представляет собой CRa, NRa или N;
Y представляет собой C, CRa или N;
Z представляет собой CR3 или N; или
Cy представляет собой шестичленное ароматическое, гетероароматическое или частично насыщенное кольцо, замещенное с помощью R1 и R2;
L1 представляет собой -CH(Rb)-, -C(Rb)(Rd)-, C(O) или -N(Rc)-;
L2 представляет собой -C(O)-, -O-, -C(Rb)(Rd)-, -S-, -S(O)-, -S(O)2-;
R1 и R2 независимо представляют собой галоген, -O-(C1-C3)алкил, -O-(C3-C6)циклоалкил, необязательно замещенный (C3-C6)циклоалкил или (C1-C3)алкил;
каждый R3 независимо представляет собой H, CF3, CN, галоген, -C(=O)(C1-C3)алкил, -C(O)N(Re)2, -NReCORe, -OCHF2, OCF3, -O-(C1-C3)алкил, -O-(C3-C6)циклоалкил, -S-(C1-C3)алкил, необязательно замещенный (C1-C6)алкил, необязательно замещенный (C3-C6)циклоалкил, необязательно замещенный гетероарил или необязательно замещенный гетероциклил;
R4 представляет собой H, -OH, необязательно замещенный (C1-C6)алкил, -NR5R6, необязательно замещенный (C3-C6)циклоалкил или -(CH2)m-необязательно-замещенный-гетероциклил;
причем R5 представляет собой H или -(C1-C3)алкил, а R6 представляет собой необязательно замещенный (C1-C4)алкил, необязательно замещенный (C3-C6)циклоалкил или -(CH2)m-необязательно-замещенный-гетероциклил; или
R5 и R6 вместе с атомом азота, к которому они прикреплены, образуют необязательно замещенный гетероциклил;
каждый Ra независимо представляет собой H, -C(O)CH3, необязательно замещенный (C1-C6)алкил, необязательно замещенный (C3-C6)циклоалкил или -S(O)2-фенил;
каждый Rb независимо представляет собой H, F, OH, -O-(C1-C3)алкил или (C1-C3)алкил;
Rc независимо представляет собой H или (C1-C3)алкил;
каждый Rd независимо представляет собой H, F или (C1-C3)алкил; или Rd и Rb образуют (C3-C5)спироцикл;
Re независимо представляет собой H или (C1-C3)алкил; и
m независимо равняется 0 или 1;
при условии, что не более двух из A, E, W, X и Y представляют собой N.
Во втором варианте осуществления настоящее изобретение обеспечивает соединение согласно первому варианту осуществления, где Cy представляет собой
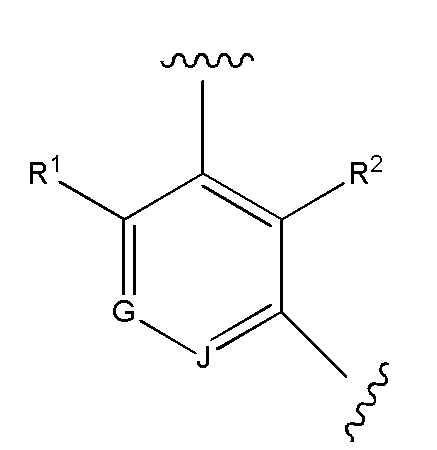
где G и J независимо представляют собой CH или N.
В третьем варианте осуществления настоящее изобретение обеспечивает соединение согласно любому из вышеуказанных вариантов осуществления, где соединение представляет собой соединение формулы (Ia),
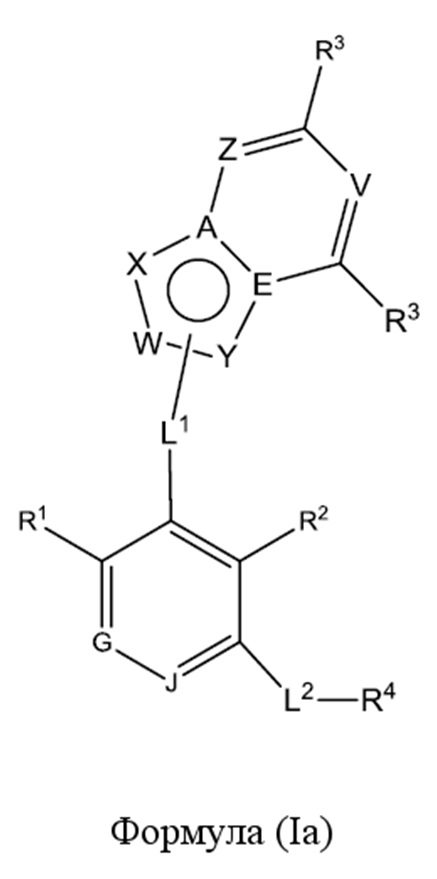 .
.
В четвертом варианте осуществления настоящее изобретение обеспечивает соединение согласно любому из вышеуказанных вариантов осуществления, где L1 представляет собой -CH2-, -C(O)-, -C(H)(OH)-, -C(H)(OCH3)- или -C(H)(CH3)-.
В пятом варианте осуществления настоящее изобретение обеспечивает соединение согласно любому из вышеуказанных вариантов осуществления, где L2 представляет собой -C(O)-, -O- или -CH2-.
В шестом варианте осуществления настоящее изобретение обеспечивает соединение согласно любому из вышеуказанных вариантов осуществления, где R1 и R2 независимо представляют собой галоген, -O-(C1-C3)алкил, циклопропил или (C1-C3)алкил.
В седьмом варианте осуществления настоящее изобретение обеспечивает соединение согласно любому из вышеуказанных вариантов осуществления, где R3 независимо представляет собой H, -CF3, -CN, галоген, -OCHF2, -OCF3, -C(O)N(Re)2, -NReCORe, -(C1-C3)алкил, -O-(C1-C3)алкил, -S-(C1-C3)алкил, (C3-C6)циклоалкил или морфолинил.
В восьмом варианте осуществления настоящее изобретение обеспечивает соединение согласно любому из вышеуказанных вариантов осуществления, где R4 представляет собой H, OH, необязательно замещенный (C1-C6)алкил, -CH2-необязательно-замещенный-тетрагидро-2H-пиранил, -N(CH2CH3)-CH2CH2OH, -NH-CH2-необязательно замещенный-тетрагидро-2H-пиранил, -N(H)-необязательно-замещенный-(C3-C6)циклоалкил, -NH-необязательно-замещенный-оксетанил, -NH-необязательно-замещенный-тетерагидро-2H-пиранил, необязательно замещенный (C3-C6)циклоалкил, необязательно замещенный азабицикло[2.2.1]гептанил, необязательно замещенный азабицикло[3.1.0]гексанил, необязательно замещенный азаспиро[3.3]гептанил, необязательно замещенный 2-окса-6-азаспиро[3.3]гептанил, необязательно замещенный 2-окса-7-азаспиро[3.5]нонанил, необязательно замещенный 2-окса-8-азаспиро[4.5]деканил, необязательно замещенный азепанил, необязательно замещенный азетидинил, необязательно замещенный 1,2-диазепанил, необязательно замещенный 1,4-диазепанил, необязательно замещенный морфолинил, необязательно замещенный оксетанил, необязательно замещенный пиперазинил, необязательно замещенный пиперидинил, необязательно замещенный пирролидинил или тиоморфолин-1,1-диоксид.
В девятом варианте осуществления настоящее изобретение обеспечивает соединение согласно любому из вышеуказанных вариантов осуществления, где (C1-C6)алкил необязательно замещен одним или несколькими из галогена, -CO2H или -CO2(C1-C4)алкила;
-NH-CH2-тетрагидро-2H-пиранил необязательно замещен одним или двумя из -OH или -O(C1-C4)алкила;
-N(H)-(C3-C6)циклоалкил необязательно замещен одним или несколькими из F, -OH, -COOH или -CO2(C1-C4)алкила;
(C3-C6)циклоалкил необязательно замещен одним или несколькими из F, -OH, -COOH или -CO2(C1-C4)алкила;
каждый из азабицикло[2.2.1]гептанила и азабицикло[3.1.0]гексанила независимо необязательно замещен -CO2H или -CO2(C1-C4)алкилом;
азаспиро[3.3]гептанил необязательно замещен -CH2CO2H, -CH2CO2CH3, -CO2H,
-CO2 CH3;
каждый из 2-окса-6-азаспиро[3.3]гептанила, 2-окса-7-азаспиро[3.5]нонанила, 2-окса-8-азаспиро[4.5]деканила независимо необязательно замещен -CH2CO2H;
азетидинил необязательно замещен одним или двумя из -CH3, -OH, -OCH3, -(C1-C4)алкилен-OH, -CH2OCH3, -(C1-C4)алкиленO(C1-C4)алкила, -CO2(C1-C4)алкила, -CO2H, -(C1-C4)алкилен-CO2H, -(C1-C4)алкилен-CO2-(C1-C4)алкила, -N(CH3)2, пирролидинила;
1,2-диазепанил или 1,4-диазепанил необязательно замещен -(C1-C4)алкилен-OH;
морфолинил необязательно замещен =O;
каждый из пиперазинила, пиперидинила и пирролидинила независимо необязательно замещен одним или несколькими из -галогена, -CN, -(C1-C4)алкила, -CH2-циклопропила, -(C1-C4)алкилен-F, -CF3, -CH2CF3, -COOH, -(C1-C4)алкиленCOOH, -CH(OH)CO2H, -COCH3, -CO2(C1-C4)алкила, -CH(OH)CO2CH3, -(C1-C4)алкилен-C(=O)O(C1-C4)алкила, -(C1-C4)алкилен-OH, -OH, -O(C1-C4)алкила, -(C1-C4)алкиленO(C1-C4)алкила, -O(C1-C4)алкиленCO2H, -O(C1-C4)алкиленC(=O)O(C1-C4)алкила, -CONHCH3, -SO2-(C1-C4)алкила, -NH2, -NH(C1-C4)алкила, -N((C1-C4)алкил)2, циклобутанкарбоновой кислоты или оксетанила.
В десятом варианте осуществления настоящее изобретение обеспечивает соединение согласно любому из вышеуказанных вариантов осуществления, где R1 и R2 одновременно представляют собой галоген или -CH3.
В одиннадцатом варианте осуществления настоящее изобретение обеспечивает соединение согласно любому из вышеуказанных вариантов осуществления, где W представляет собой C или CH, A представляет собой C, а E представляет собой C.
В двенадцатом варианте осуществления настоящее изобретение обеспечивает соединение согласно любому из вышеуказанных вариантов осуществления, где L1 представляет собой CH2 или C(O), а L2 представляет собой C(O).
В тринадцатом варианте осуществления настоящее изобретение обеспечивает соединение согласно любому из вышеуказанных вариантов осуществления, где G представляет собой CH.
В четырнадцатом варианте осуществления настоящее изобретение обеспечивает соединение согласно любому из вышеуказанных вариантов осуществления, где J представляет собой CH.
В пятнадцатом варианте осуществления настоящее изобретение обеспечивает соединение согласно любому из первого-четырнадцатого вариантов осуществления, где W представляет собой CH; X представляет собой CRa, где Ra представляет собой H или -CH3; Y представляет собой N; A представляет собой C; E представляет собой C; V представляет собой CR3, где R3 представляет собой H; Z представляет собой N или CR3, где R3 представляет собой H, -CH3 или -CF3; L1 соединен с Y; L1 представляет собой -CH2- или -C(O)-; L2 представляет собой -C(O)-; R1 представляет собой -Cl или -CH3; R2 представляет собой -Cl или -CH3; каждый R3 независимо представляет собой H, -F, -Cl, -CN, -CH3, -CH(CH3)2, -CF3, -OCHF2, -OCF3, -SCH3 или циклопропил; а R4 представляет собой необязательно замещенный 2-окса-6-азаспиро[3.3]гептанил, необязательно замещенный пиперидинил.
В шестнадцатом варианте осуществления настоящее изобретение обеспечивает соединение согласно пятнадцатому варианту осуществления, где R4, представляющий собой необязательно замещенный 2-окса-6-азаспиро[3.3]гептанил, необязательно замещен -CH2CO2H.
В семнадцатом варианте осуществления настоящее изобретение обеспечивает соединение согласно пятнадцатому варианту осуществления, где R4, представляющий собой необязательно замещенный пиперидинил, необязательно замещен -CH3, -COOH, -CH2CO2H, -CH2CH2CO2H, -CO2CH3, -CO2CH2CH3 или -OH.
В восемнадцатом варианте осуществления настоящее изобретение обеспечивает соединение согласно любому из первого-четырнадцатого вариантов осуществления, где W представляет собой C; X представляет собой NRa, где Ra представляет собой -CH3, -CH2CH3, -CH2CH(CH3)2; Y представляет собой N; A представляет собой C; E представляет собой C; V представляет собой CR3, где R3 представляет собой H, Br, -CN или -CF3; Z представляет собой CR3 или N, где Ra представляет собой H или CH3; L1 соединен с W; L1 представляет собой -CH2- или -C(O)-; L2 представляет собой -CH2- или -C(O)-; R1 представляет собой -Cl или -CH3; R2 представляет собой -Cl или -CH3; каждый R3 независимо представляет собой -Br, -Cl, -CN, -CH3 или -CF3; а R4 представляет собой -N(CH2CH3)-CH2CH2OH, -NH-необязательно-замещенный-циклогексил, -NH-необязательно-замещенный-оксетанил, необязательно замещенный азетидинил, необязательно замещенный 1,4-диазепанил, необязательно замещенный 3-азабицикло[3.1.0]гексанил, необязательно замещенный морфолинил, необязательно замещенный 2-окса-6-азаспиро[3.3]гептанил, необязательно замещенный 2-окса-7-азаспиро[3.5]нонанил, необязательно замещенный 2-окса-8-азаспиро[4.5]деканил, необязательно замещенный пиперазинил, необязательно замещенный или необязательно замещенный пирролидинил.
В девятнадцатом варианте осуществления настоящее изобретение обеспечивает соединение согласно восемнадцатому варианту осуществления, где R4, представляющий собой необязательно замещенный R4, представляющий собой необязательно замещенный 1,4-диазепанил, необязательно замещен -CH2CH2OH; R4, представляющий собой необязательно замещенный азетидинил, необязательно замещен -OH, -CH2OH, -CH2CH2OH, -CH2OCH3, -CH2CH2OCH3, -N(CH3)2 или пирролидинилом; R4, представляющий собой необязательно замещенный 1,4-диазепанил, необязательно замещен -CH2CH2OH; R4, представляющий собой необязательно замещенный 3-азабицикло[3.1.0]гексанил, необязательно замещен -COOH или -CO2CH3CH3; R4, представляющий собой необязательно замещенный морфолинил, необязательно замещен =O; R4, представляющий собой необязательно замещенный пиперазинил, необязательно замещен -F, -CH3, -CH(CH3)2, -CH2CF3, -COOH, -CH2-циклопропилом, -CH2CH2OH, -CH2CH2OCH3, -CH2CH(OH)CH3, -CH2CH(F)CH3, циклобутанкарбоновой кислотой или оксетанилом; R4, представляющий собой необязательно замещенный пиперидинил, необязательно замещен -CH3, -CH2COOH, -CH2OH, -CH2CH2OH, -CH2CH2OCH3, -C(CH3)2CH2OH, -C(CH3)2OH, -C(CH3)2CH2OH, -CH(OH)CH3, -CH2CH(OH)CH3, -CH2C(CH3)2OH, -CH2OCH3, -COOH, -OH, -OCH3, -N(CH3)2 или оксетанилом; или R4, представляющий собой необязательно замещенный пирролидинил, необязательно замещен -CH2CH2OH, -CH2OCH3,-CONHCH3, -OH или -OCH3.
В двадцатом варианте осуществления настоящее изобретение обеспечивает соединение согласно любому из первого-четырнадцатого вариантов осуществления, где W представляет собой C; X представляет собой NRa, где Ra представляет собой H, -CH3, -CH2CH3, -COCH3 или -CH2CH(CH3)2; Y представляет собой CRa, где Ra представляет собой H; Z представляет собой CR3, где R3 представляет собой H или -CH3; A представляет собой C; E представляет собой C; V представляет собой CR3, где R3 представляет собой H, -CN, -CH3 или -CF3; L1 соединен с W; L1 представляет собой -CH2-, -C(O)-, -CH(OH)- или -CH(OCH3)-; L2 представляет собой -O-, -CH2- или -C(O)-; R1 представляет собой -Cl, -CH3 или циклопропил; R2 представляет собой -Cl или -CH3; каждый R3 независимо представляет собой H, -F, -Br, -Cl, -CN, -CH3, -CF3, -OCH3, -OCHF2, -OCF3, -CONHCH3, -CON(CH3)2, -NHCOCH3, циклопропил или морфолинил; а R4 представляет собой H, -OH, необязательно замещенный (C1-C6)алкил-(-CO2H), -CH2-необязательно-замещенный-тетрагидро-2H-пиранил, -NH-CH2-необязательно-замещенный-тетрагидро-2H-пиранил, -NH-необязательно-замещенный-циклогексил-(-OH, -COOH), -NH-необязательно-замещенный-оксетанил, -NH-необязательно-замещенный-тетрагидро-2H-пиранил, необязательно замещенный азабицикло[2.2.1]гептанил, необязательно замещенный 3-азабицикло[3.1.0]гексанил, необязательно замещенный азаспиро[3.3]гептанил, необязательно замещенный азетидинил, необязательно замещенный циклобутил, необязательно замещенный циклогексил, необязательно замещенный циклопентил, необязательно замещенный 1,4-диазепанил, необязательно замещенный морфолинил, необязательно замещенный 2-окса-6-азаспиро[3.3]гептанил, необязательно замещенный 2-окса-7-азаспиро[3.5]нонанил, необязательно замещенный 2-окса-8-азаспиро[4.5]деканил, необязательно замещенный пиперазинил, необязательно замещенный пиперидинил или необязательно замещенный пирролидинил.
В двадцать первом варианте осуществления настоящее изобретение обеспечивает соединение согласно девятнадцатому варианту осуществления, где R4, представляющий собой необязательно замещенный (C1-C6)алкил, необязательно замещен -CO2H, в R4 циклогексил -NH-необязательно-замещенного-циклогексила необязательно замещен -OH или -COOH; необязательно замещенный азабицикло[2.2.1]гептанил-(-CO2H, -CO2Me), R4, представляющий собой необязательно замещенный 3-азабицикло[3.1.0]гексанил, необязательно замещен -CO2H или -CO2CH2CH3; R4, представляющий собой необязательно замещенный азаспиро[3.3]гептанил, необязательно замещен -CH2CO2H, -CH2CO2CH3, -CO2H или -CO2CH3; R4, представляющий собой необязательно замещенный азетидинил, необязательно замещен -CH3, -OH, -OCH3, -CO2CH3, -CO2H, -CO2CH2CH3, -CH2CO2H, -CH2CO2CH2CH3 или пирролидинилом; R4, представляющий собой необязательно замещенный циклобутил, необязательно замещен -COOH или -CO2(C1-C4)алкилом; R4, представляющий собой необязательно замещенный циклогексил, необязательно замещен -COOH или -CO2(C1-C4)алкилом; R4, представляющий собой необязательно замещенный циклопентил, необязательно замещен -COOH или -CO2(C1-C4)алкилом; R4, представляющий собой необязательно замещенный 1,4-диазепанил, необязательно замещен -CH2CH2OH, R4, представляющий собой необязательно замещенный морфолинил, необязательно замещен =O; необязательно замещенный 2-окса-6-азаспиро[3.3]гептанил, необязательно замещенный 2-окса-7-азаспиро[3.5]нонанил, R4, представляющий собой необязательно замещенный 2-окса-8-азаспиро[4.5]деканил, необязательно замещенный пиперазинил необязательно замещен -CH3, -CH(CH3)2, -CH2CH2OH, -CH2CH(F)CH3, -COCH3, -CH2CH2OCH3, -CH2CO2H, -CH(CH3)CO2H, -C(CH3)2CO2H, -CH2CO2Me, -CH2CO2CH2CH3, оксетанилом или циклобутанкарбоновой кислотой; R4, представляющий собой необязательно замещенный пиперидинил, необязательно замещен -CH3, -F, -CH2OH, -CH2CH2OH, -CH2CH2OCH3, -CH2OCH3, -C(CH3)2CH2OH, -CH2C(CH3)2OH, -CH2CH(OH)CH3, -CH(OH)CH3, -C(OH)(CH3)2, -CO2H, -CO2Me, -CO2CH2CH3, -CH2CO2H, -CH2CH2CO2H, -CH(CH3)CO2H, -C(CH3)2CO2H, -CH(OH)CO2H, -CH(OH)CO2CH3, -CH(CH3)CO2CH2CH3, -CH2CO2CH3, -CH2CO2CH2CH3, -N(CH3)2, -OH, -OCH3, -OCH2CO2H, -OCH2CO2CH2CH3, -SO2CH3 или оксетанилом; или R4, представляющий собой необязательно замещенный пирролидинил, необязательно замещен -OH, -CH2OH, -CO2H, -CO2CH3, -CH2CO2H, -CH2CO2CH3, -CH2OCH3, -C(O)NHCH3 или -N(CH3)2.
В двадцать втором варианте осуществления настоящее изобретение обеспечивает соединение согласно любому из первого-четырнадцатого вариантов осуществления, где W представляет собой C; X представляет собой CRa, где Ra представляет собой H; Y представляет собой NRa, где Ra представляет собой H или -CH3; Z представляет собой N; A представляет собой C; E представляет собой C; V представляет собой CR3, где R3 представляет собой H или -CF3; L1 соединен с W; L1 представляет собой -CH2-, -C(O)- или -CH(OH)-; L2 представляет собой -C(O)-; R1 представляет собой Cl; R2 представляет собой Cl; каждый R3 независимо представляет собой H или -CF3; а R4 представляет собой необязательно замещенный морфолинил.
В двадцать третьем варианте осуществления настоящее изобретение обеспечивает соединение согласно любому из первого-четырнадцатого вариантов осуществления, где W представляет собой CH; X представляет собой N; Y представляет собой N; Z представляет собой CR3; A представляет собой C; E представляет собой C; V представляет собой CR3; а L1 соединен с Y.
В двадцать четвертом варианте осуществления настоящее изобретение обеспечивает соединение согласно любому из первого-четырнадцатого вариантов осуществления, где W представляет собой C; X представляет собой NRa, где Ra представляет собой H или -CH3; Y представляет собой CRa, где Ra представляет собой H; Z представляет собой N; A представляет собой C; E представляет собой C; V представляет собой CR3, где R3 представляет собой H; L1 соединен с W; L1 представляет собой -CH2- или -C(O)-; L2 представляет собой -C(O)-; R1 представляет собой -Cl; R2 представляет собой -Cl; каждый R3 независимо представляет собой H, -CH3 или -CF3; и R4 представляет собой необязательно замещенный морфолинил, необязательно замещенный пиперазинил или необязательно замещенный пиперидинил.
В двадцать пятом варианте осуществления настоящее изобретение обеспечивает соединение согласно двадцать третьему варианту осуществления, где R4, представляющий собой необязательно замещенный пиперазинил, необязательно замещен -SO2CH3; необязательно замещенный пиперидинил необязательно замещен -CN, -CH3, -OH, -COOH, -CH2COOH, -CH2CH2OCH3 или -SO2CH3.
В двадцать шестом варианте осуществления настоящее изобретение обеспечивает соединение согласно любому из первого-четырнадцатого вариантов осуществления, где W представляет собой C; X представляет собой CRa, где Ra представляет собой H или -CH3; Y представляет собой N; A представляет собой N; E представляет собой C; Z представляет собой N; V представляет собой CR3, где R3 представляет собой H или -CH3; L1 соединен с W; L1 представляет собой -CH2- или -C(O)-; L2 представляет собой -C(O)-; R1 представляет собой -Cl; R2 представляет собой -Cl; каждый R3 представляет собой независимо H, -Cl, -CN, -CH3 или -CF3; а R4 представляет собой необязательно замещенный морфолинил, необязательно замещенный пиперазинил (например, замещенный -CH3, -SO2CH3 или оксетанилом) или необязательно замещенный пиперидинил (например, замещенный -CH2COOH, оксетанилом).
В двадцать седьмом варианте осуществления настоящее изобретение обеспечивает соединение согласно любому из первого-четырнадцатого вариантов осуществления, где W представляет собой C; X представляет собой CRa, где Ra представляет собой H или -CH3; Y представляет собой N; Z представляет собой CR3, где R3 представляет собой H; A представляет собой N; E представляет собой C; V представляет собой CR3, где R3 представляет собой H; L1 соединен с W; L1 представляет собой -CH2-; L2 представляет собой -C(O)-; R1 представляет собой -Cl; R2 представляет собой -Cl; каждый R3 независимо представляет собой H, -CN, -CH3 или -CF3; R4 представляет собой необязательно замещенный морфолинил, необязательно замещенный пиперазинил (например, замещенный оксетанилом), необязательно замещенный пиперидинил (например, замещенный -OH, -OCH3, -CH2OH, -CH2CH2OH, -CH2CH2OCH3, -CH(OH)CH3, -C(OH)(CH3)2, -CH2CO2H, -CH2CO2Me, -N(CH3)2, оксетанилом) или необязательно замещенный пирролидинил (например, замещенный с помощью -OH).
В двадцать восьмом варианте осуществления настоящее изобретение обеспечивает соединение согласно любому из первого-четырнадцатого вариантов осуществления, где W представляет собой N; X представляет собой CRa, где Ra представляет собой H или -CH3; Y представляет собой N; Z представляет собой CR3, где R3 представляет собой H; A представляет собой C; E представляет собой C; V представляет собой CR3, где R3 представляет собой H; L1 соединен с W; L1 представляет собой -CH2- или -C(O)-; L2 представляет собой -C(O)-; R1 представляет собой -Cl; R2 представляет собой -Cl; каждый R3 независимо представляет собой H, -CH3 или -CF3; а R4 представляет собой необязательно замещенный морфолинил или необязательно замещенный пиперидинил (например, замещенный с помощью -CH2COOH).
В двадцать девятом варианте осуществления настоящее изобретение обеспечивает соединение согласно любому из первого-четырнадцатого вариантов осуществления, где W представляет собой N; X представляет собой CRa, где Ra представляет собой H или -CH3; Y представляет собой N; Z представляет собой CR3, где R3 представляет собой H; E представляет собой C; V представляет собой CR3, где R3 представляет собой H; L1 соединен с Y; L1 представляет собой -CH2- или -C(O)-; L2 представляет собой -C(O)-; R1 представляет собой -Cl; R2 представляет собой -Cl; каждый R3 независимо представляет собой H, -CH3 или -CF3; а R4 представляет собой необязательно замещенный морфолинил или необязательно замещенный пиперидинил (например, замещенный -CH2COOH, оксетанилом).
В тридцатом варианте осуществления настоящее изобретение обеспечивает соединение согласно любому из первого-четырнадцатого вариантов осуществления, где W представляет собой N; X представляет собой NRa, где Ra представляет собой H или -CH3; Y представляет собой C; Z представляет собой CR3, где R3 представляет собой H; A представляет собой C; E представляет собой C; V представляет собой CR3, где R3 представляет собой H; L1 соединен с Y; L1 представляет собой -CH2-; L2 представляет собой -C(O)-; R1 представляет собой -Cl; R2 представляет собой -Cl; каждый R3 независимо представляет собой H, -CH3 или -CF3; а R4 представляет собой необязательно замещенный пиперидинил (например, замещенный с помощью -CH2COOH).
В тридцать первом варианте осуществления настоящее изобретение обеспечивает соединение согласно любому из первого-четырнадцатого вариантов осуществления, где W представляет собой C; X представляет собой NRa, где Ra представляет собой H или CH3; Y представляет собой CRa, где Ra представляет собой H; Z представляет собой CR3, где R3 представляет собой H; A представляет собой C; E представляет собой C; V представляет собой N; L1 соединен с W; L1 представляет собой -CH2-; L2 представляет собой -C(O)-; R1 представляет собой -Cl; R2 представляет собой -Cl; каждый R3 независимо представляет собой H, -CN, -CF3 или CH3; а R4 представляет собой необязательно замещенный морфолинил или необязательно замещенный пиперазинил (например, замещенный оксетанилом).
В тридцать втором варианте осуществления настоящее изобретение обеспечивает соединение согласно любому из первого-четырнадцатого вариантов осуществления, где W представляет собой C; X представляет собой CRa, где Ra представляет собой H или CH3; Y представляет собой N; Z представляет собой CR3, где R3 представляет собой H; A представляет собой C; E представляет собой C; V представляет собой N; L1 соединен с Y; L1 представляет собой -CH2- или -C(O)-; L2 представляет собой -C(O)-; R1 представляет собой -Cl; R2 представляет собой -Cl; каждый R3 независимо представляет собой H, -CF3 или -CH3; а R4 представляет собой необязательно замещенный морфолинил или необязательно замещенный пиперидинил (например, замещенный с помощью -CH2COOH).
В тридцать третьем варианте осуществления настоящее изобретение обеспечивает соединение согласно любому из первого-четырнадцатого вариантов осуществления, где W представляет собой CRa, где Ra представляет собой H; X представляет собой O или NRa, где Ra представляет собой H или -CH3; Y представляет собой C; Z представляет собой CR3, где R3 представляет собой H или -CF3; A представляет собой C; E представляет собой C; V представляет собой CR3, где R3 представляет собой H; L1 соединен с Y; L1 представляет собой -CH2-; L2 представляет собой -C(O)-; R1 представляет собой -Cl; R2 представляет собой -Cl; каждый R3 независимо представляет собой H, -CH3, -CF3 или -OCF3; а R4 представляет собой необязательно замещенный пиперидинил (например, замещенный с помощью -CH3, -COOH, -CH2COOH, -CH2CO2CH3, -CO2CH2CH3).
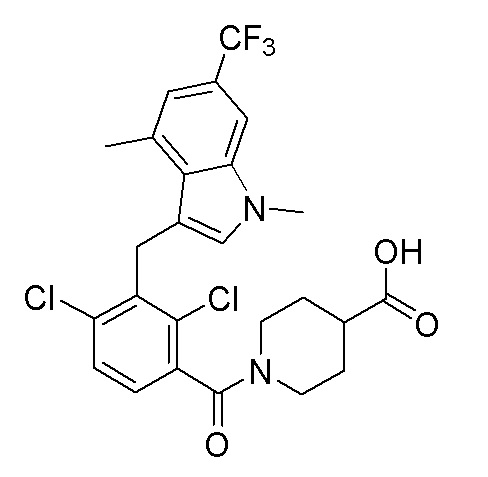
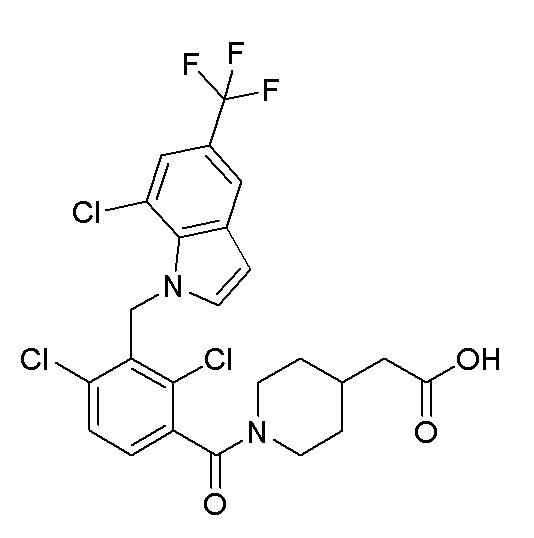
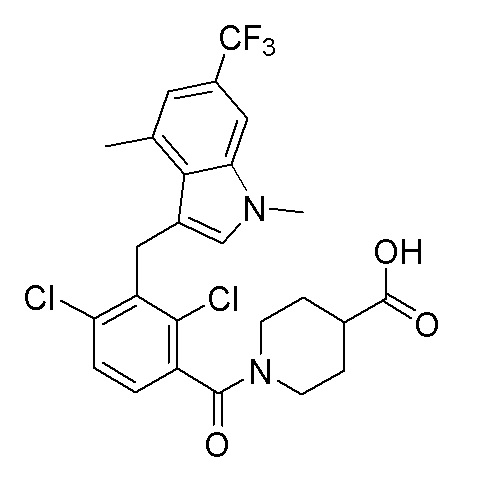
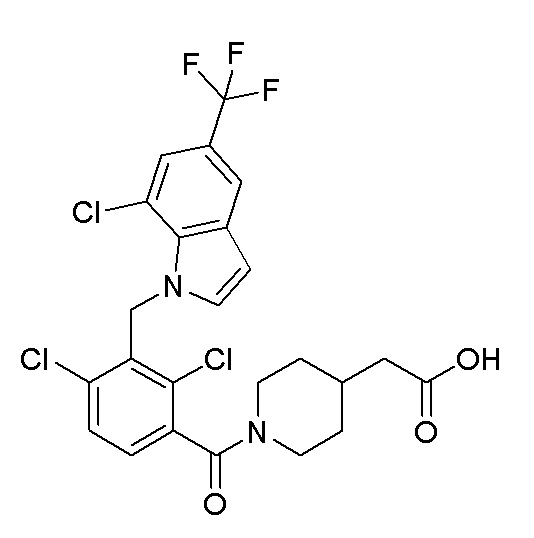
В тридцать четвертом варианте осуществления настоящее изобретение обеспечивает соединение согласно любому из вышеуказанных вариантов осуществления, где соединение представляет собой
1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-карбоновую кислоту;
2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-пирроло[2,3-b]пиридин-6-карбонитрил;
2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индазол-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
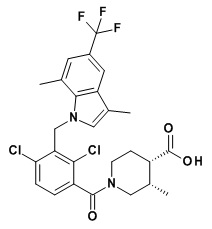
(3R,4R)-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-карбоновую кислоту;
2-(1-(2,4-дихлор-3-((5-циано-3,7-диметил-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-(5-циано-3,7-диметил-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)пропановую кислоту;
2-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-2-азаспиро[3.3]гептан-6-карбоновую кислоту;
1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-карбоновую кислоту;
3-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)циклобутанкарбоновую кислоту;
2-((1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)окси)уксусную кислоту;
2-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)пропановую кислоту;
2-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)уксусную кислоту;
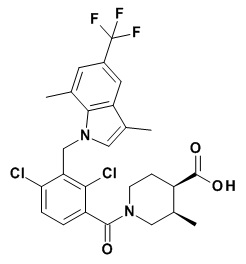
(3S,4S)-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-карбоновую кислоту;
(3R,4R)-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-карбоновую кислоту;
2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)фенил)(4-гидроксипиперидин-1-ил)метанон;
2-(2,6-дихлор-3-(4-(оксетан-3-ил)пиперазин-1-карбонил)бензоил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-2H-индазол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)пропановую кислоту;
2-(2-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-2-азаспиро[3.3]гептан-6-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-ил)уксусную кислоту;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(4-(оксетан-3-ил)пиперазин-1-ил)метанон;
метил-2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат;
(1R,5S)-этил-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3-азабицикло[3.1.0]гексан-6-карбоксилат;
этил-2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)азетидин-3-ил)ацетат;
метил-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-4-гидроксипиперидин-3-карбоксилат;
метил-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-3-карбоксилат;
метил-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3-метоксиазетидин-3-карбоксилат;
метил-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-4-метилпиперидин-4-карбоксилат;
этил-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-4-фторпиперидин-4-карбоксилат;
этил-2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)пропаноат;
метил-2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-ил)ацетат;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(4(метилсульфонил)пиперидин-1-ил)метанон;
1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пирролидин-3-карбоновую кислоту;
1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)азетидин-3-карбоновую кислоту;
1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3-метилазетидин-3-карбоновую кислоту;
2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пирролидин-3-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
(1R,5S)-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3-азабицикло[3.1.0]гексан-6-карбоновую кислоту;
2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)азетидин-3-ил)уксусную кислоту;
1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-4-гидроксипиперидин-3-карбоновую кислоту;
1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-3-карбоновую кислоту;
1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3-метоксиазетидин-3-карбоновую кислоту;
1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-4-метилпиперидин-4-карбоновую кислоту;
1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-4-фторпиперидин-4-карбоновую кислоту;
(3S,4S)-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-4-(метоксиметил)пирролидин-3-карбоновую кислоту;
(1R,4R)-2-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-2-азабицикло[2.2.1]гептан-4-карбоновую кислоту;
2-(1-(4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)никотиноил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)-2-метилпропановую кислоту;
3-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)пропановую кислоту;
(1s,4s)-4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензамидо)циклогексанкарбоновую кислоту;
(2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон;
(2,4-дихлор-3-((1-этил-4-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон;
1-(2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-4-метил-6-(трифторметил)-1H-индол-1-ил)этанон;
(2,4-дихлор-3-((1-изобутил-4-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон;
(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон;
2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-3-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
(1R,5S,6r)-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-3-ил)метил)бензоил)-3-азабицикло[3.1.0]гексан-6-карбоновую кислоту;
(3S,4S)-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-3-ил)метил)бензоил)-3-метилпиперидин-4-карбоновую кислоту;
(3R,4R)-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-3-ил)метил)бензоил)-3-метилпиперидин-4-карбоновую кислоту;
(3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)-2,4-диметилфенил)(морфолинo)метанон;
2,6-диметил-3-(морфолин-4-карбонил)фенил)(1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метанон;
(2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(4-(диметиламино)пиперидин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(4-(диметиламино)пиперидин-1-ил)метанон;
(3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)(гидрокси)метил)-2,4-диметилфенил)(морфолинo)метанон;
(3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)(метокси)метил)-2,4-диметилфенил)(морфолинo)метанон;
(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(4-гидроксипиперидин-1-ил)метанон;
(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(4-(диметиламино)пиперидин-1-ил)метанон;
(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(4-(гидроксиметил)пиперидин-1-ил)метанон;
1-(4-(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)этанон;
(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(3-гидроксипиперидин-1-ил)метанон;
(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)((3R,4R)-4-фтор-3-гидроксипиперидин-1-ил)метанон;
1-(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-карбоновую кислоту;
1-(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3-гидроксипиперидин-4-карбоновую кислоту;
3-(4-(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)циклобутанкарбоновую кислоту;
(2,4-дихлор-3-((1-метил-5-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)индолин-2-ил)метил)фенил)(морфолинo)метанон;
2-(1-(2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)-2-метилпропановую кислоту;
1-(2,4-дихлор-3-((1,5-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-карбоновую кислоту;
2-(2,6-дихлор-3-метоксибензил)-1,4-диметил-6-(трифторметил)-1H-индол;
2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенол;
2-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)уксусную кислоту;
3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)пропановую кислоту;
2-((3,5-дихлор-2-метоксипиридин-4-ил)метил)-1,4-диметил-6-(трифторметил)-1H-индол;
2-(2,6-дихлор-3-(4-(оксетан-3-ил)пиперазин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(4-(1-гидроксиэтил)пиперидин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(4-(2-гидроксипропан-2-ил)пиперидин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(4-метоксипиперидин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(4-гидроксипиперидин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(3-гидроксипиперидин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(4-(диметиламино)пиперидин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(4-(гидроксиметил)пиперидин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(4-(1-гидрокси-2-метилпропан-2-ил)пиперидин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(4-метилпиперазин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(3,4-диметилпиперазин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(4-изопропилпиперазин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(4-(2-гидроксиэтил)пиперазин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(4-(2-гидроксиэтил)-1,4-диазепан-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(3-(диметиламино)пирролидин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(4-(2-метоксиэтил)пиперазин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(3-(пирролидин-1-ил)азетидин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(4-(2-фторпропил)пиперазин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(3-гидроксипирролидин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(3-(гидроксиметил)пирролидин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(3-гидроксиазетидин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(3-метоксиазетидин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)-N-(4-гидроксициклогексил)бензамид;
2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)-N-(тетрагидро-2H-пиран-4-ил)бензамид;
2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)-N-(оксетан-3-ил)бензамид;
2-(2,6-дихлор-3-(2-окса-7-азаспиро[3.5]нонан-7-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(2-окса-6-азаспиро[3.3]гептан-6-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(4-(2-метоксиэтил)пиперидин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(4-(оксетан-3-ил)пиперидин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(4-(2-гидроксиэтил)пиперидин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(4-(метоксиметил)пиперидин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(4-(2-гидрокси-2-метилпропил)пиперидин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
(S)-1-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)бензоил)-N-метилпирролидин-2-карбоксамид;
метил-1-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-карбоксилат;
метил-1-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-карбоксилат;
2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(2-окса-8-азаспиро[4.5]декан-8-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(4-(2-гидроксипропил)пиперидин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
метил-2-(1-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат;
(R)-2-(2,6-дихлор-3-(3-гидроксипирролидин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
(S)-2-(2,6-дихлор-3-(3-гидроксипирролидин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-метил-1H-индол-5-карбонитрил;
2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-метил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(морфолин-4-карбонил)бензоил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-диметил-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
цис-4-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклогексанкарбоновую кислоту;
транс-3-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклопентанкарбоновую кислоту;
цис-3-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклопентанкарбоновую кислоту;
транс-3-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклобутанкарбоновую кислоту;
цис-3-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклобутанкарбоновую кислоту;
транс-4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклогексанкарбоновую кислоту;
цис-4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклогексанкарбоновую кислоту;
транс-4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклогексанкарбоновую кислоту;
цис-4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклогексанкарбоновую кислоту;
транс-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклопентанкарбоновую кислоту;
цис-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклопентанкарбоновую кислоту;
2-((3,5-дихлор-2-((тетрагидро-2H-пиран-4-ил)метокси)пиридин-4-ил)метил)-1,4-диметил-6-(трифторметил)-1H-индол;
2-((1-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)окси)уксусную кислоту;
1-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-карбоновую кислоту;
1-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-карбоновую кислоту;
2-(1-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(2,6-дихлор-3-(4-гидроксипиперидин-1-карбонил)бензоил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(3-гидроксиазетидин-1-карбонил)бензоил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(4-(1-гидрокси-2-метилпропан-2-ил)пиперидин-1-карбонил)бензоил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(4-(2-метоксиэтил)пиперидин-1-карбонил)бензоил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-(4-(2-гидроксиэтил)пиперидин-1-карбонил)бензоил)-1,4-диметил-1H-индол-6-карбонитрил;
метил-2-(1-(2,4-дихлор-3-(6-циано-1,4-диметил-1H-индол-2-карбонил)бензоил)пиперидин-4-ил)ацетат;
2-(1-(2,4-дихлор-3-(6-циано-1,4-диметил-1H-индол-2-карбонил)бензоил)пиперидин-4-ил)уксусную кислоту;
(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)фенил)(морфолинo)метанон;
(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)фенил)(4-(оксетан-3-ил)пиперазин-1-ил)метанон;
метил-2-(1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)бензоил)пиперидин-4-ил)ацетат;
этил-2-(4-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)бензоил)пиперазин-1-ил)ацетат;
(1R,5S,6r)-этил-3-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)бензоил)-3-азабицикло[3.1.0]гексан-6-карбоксилат;
(3S,4S)-метил-1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)бензоил)-3-метилпиперидин-4-карбоксилат;
(3S,4S)-метил-1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)бензоил)-3-метилпиперидин-4-карбоксилат;
(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)фенил)(4-(оксетан-3-ил)пиперидин-1-ил)метанон;
(3S,4S)-этил-1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)бензоил)-3-метилпиперидин-4-карбоксилат;
(3R,4R)-этил-1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)бензоил)-3-метилпиперидин-4-карбоксилат;
2-(1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(4-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)бензоил)пиперазин-1-ил)уксусную кислоту;
(1R,5S,6r)-3-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)бензоил)-3-азабицикло[3.1.0]гексан-6-карбоновую кислоту;
(1R,5S,6r)-3-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)бензоил)-3-азабицикло[3.1.0]гексан-6-карбоновую кислоту;
(3S,4S)-1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)бензоил)-3-метилпиперидин-4-карбоновую кислоту;
(3R,4R)-1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)бензоил)-3-метилпиперидин-4-карбоновую кислоту;
(2,6-дихлор-3-(гидроксиметил)фенил)(1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метанон;
(2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон;
(2,4-дихлор-3-((1,7-диметил-5-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон;
2-(2,6-дихлор-3-((3-оксоморфолинo)метил)бензил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(2,6-дихлор-3-((3-оксоморфолинo)метил)бензоил)-1,4-диметил-1H-индол-6-карбонитрил;
этил-2-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)ацетат;
(3-((6-бром-1,4-диметил-1H-индол-2-ил)метил)-2,4-дихлорфенил)(морфолинo)метанон;
(2,4-дихлор-3-((1,4-диметил-6-морфолинo-1H-индол-2-ил)метил)фенил)(морфолинo)метанон;
1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3,3-дифторпиперидин-4-карбоновую кислоту;
1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3-фторпиперидин-4-карбоновую кислоту;
5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)-4,6-диметилпиридин-3-ил)(морфолинo)метанон;
2-(1-(5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)-4,6-диметилникотиноил)пиперидин-4-ил)уксусную кислоту;
2-[2,4-диметил-5-[4-(оксетан-3-ил)пиперидин-1-карбонил]пиридин-3-карбонил]-1,4-диметил-индол-6-карбонитрил;
(3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиридин-2-ил)(морфолинo)метанон;
2-[[3,5-дихлор-2-(морфолин-4-карбонил)-4-пиридил]метил]-1,4-диметилиндол-6-карбонитрил;
2-((3,5-дихлор-2-(4-(оксетан-3-ил)пиперидин-1-карбонил)пиридин-4-ил)метил)-1,4-диметил-1H-индол-6-карбонитрил;
2-((3,5-дихлор-2-(4-гидроксипиперидин-1-карбонил)пиридин-4-ил)метил)-1,4-диметил-1H-индол-6-карбонитрил;
2-((3,5-дихлор-2-(3-гидроксиазетидин-1-карбонил)пиридин-4-ил)метил)-1,4-диметил-1H-индол-6-карбонитрил;
2-((3,5-дихлор-2-(4-(оксетан-3-ил)пиперазин-1-карбонил)пиридин-4-ил)метил)-1,4-диметил-1H-индол-6-карбонитрил;
2-((3,5-дихлор-2-(3-гидроксипирролидин-1-карбонил)пиридин-4-ил)метил)-1,4-диметил-1H-индол-6-карбонитрил;
метил-2-(1-(3,5-дихлор-4-((6-циано-1,4-диметил-1H-индол-2-ил)метил)пиколиноил)пиперидин-4-ил)ацетат;
2-[1-[3,5-дихлор-4-[(6-циано-1,4-диметил-индол-2-ил)метил]пиридин-2-карбонил]-4-пиперидил]уксусную кислоту;
(4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиридин-3-ил)(морфолинo)метанон;
метил-2-(1-(4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)никотиноил)пиперидин-4-ил)ацетат;
(4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиридин-3-ил)(4-гидрокси-4-(2-гидроксиэтил)пиперидин-1-ил)метанон;
3-(3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)-2-оксопиридин-1(2H)-ил)пропановую кислоту;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(морфолинo)метанон;
(S)-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)-N-метилпирролидин-2-карбоксамид;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(3-(2-гидроксиэтил)азетидин-1-ил)метанон;
A(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(3-гидроксиазетидин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(3-(2-гидроксиэтил)пирролидин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(3-(метоксиметил)пирролидин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(3-метоксипирролидин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(3-гидроксипирролидин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(2-окса-8-азаспиро[4.5]декан-8-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(4-(2-гидроксипропан-2-ил)пиперидин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(4-(1-гидрокси-2-метилпропан-2-ил)пиперидин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(4-(гидроксиметил)пиперидин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(4-(1-гидроксиэтил)пиперидин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(4-(метоксиметил)пиперидин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(4-(2-гидрокси-2-метилпропил)пиперидин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(4-метоксипиперидин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(4-(2-гидроксиэтил)пиперидин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(4-(оксетан-3-ил)пиперидин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(4-(2-метоксиэтил)пиперидин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(4-(2-гидроксипропил)пиперидин-1-ил)метанон;
2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)-N-(оксетан-3-ил)бензамид;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(3-(2-метоксиэтил)азетидин-1-ил)метанон;
2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)-N-(4-метоксициклогексил)бензамид;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(3-(пирролидин-1-ил)азетидин-1-ил)метанон;
2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)-N-(4-гидроксициклогексил)бензамид;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(2-окса-7-азаспиро[3.5]нонан-7-ил)метанон;
2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)-N-((тетрагидрофуран-2-ил)метил)бензамид;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(3-(гидроксиметил)азетидин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(2-окса-6-азаспиро[3.3]гептан-6-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(3-гидроксипиперидин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(4-(диметиламино)пиперидин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(3,4-диметилпиперазин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(4-(2-гидроксиэтил)пиперазин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(4-(2-гидроксипропил)пиперазин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(3-(диметиламино)азетидин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(4-(2-метоксиэтил)пиперазин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(4-(2-фторпропил)пиперазин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(3-(метоксиметил)азетидин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(4-(оксетан-3-ил)пиперазин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(4-метилпиперазин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(4-изопропилпиперазин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(4-(2,2,2-трифторэтил)пиперазин-1-ил)метанон;
(4-(циклопропилметил)пиперазин-1-ил)(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(4-(2-гидроксиэтил)-1,4-диазепан-1-ил)метанон;
1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)-4-фторпиперидин-4-карбоновую кислоту;
1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперидин-4-карбоновую кислоту;
(1R, 5S, 6r)-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)-3-азабицикло[3.1.0]гексан-6-карбоновую кислоту;
1-[2,4-дихлор-3-[[1,4-диметил-6-(трифторметил)бензимидазол-2-ил]метил]бензоил]-3-метил-пиперидин-4-карбоновую кислоту;
2-(2,6-дихлор-3-(4-(2-гидроксиэтил)пиперидин-1-карбонил)бензил)-1,4-диметил-1H-бензо[d]имидазол-6-карбонитрил;
2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-бензо[d]имидазол-6-карбонитрил;
2,4-дихлор-3-((6-циано-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-N-((1s,4s)-4-гидроксициклогексил)бензамид;
2-(2,6-дихлор-3-(4-(2-метоксиэтил)пиперидин-1-карбонил)бензил)-1,4-диметил-1H-бензо[d]имидазол-6-карбонитрил;
2-(2,6-дихлор-3-(4-(метоксиметил)пиперидин-1-карбонил)бензил)-1,4-диметил-1H-бензо[d]имидазол-6-карбонитрил;
2-(2,6-дихлор-3-(4-(гидроксиметил)пиперидин-1-карбонил)бензил)-1,4-диметил-1H-бензо[d]имидазол-6-карбонитрил;
2-(2,6-дихлор-3-(4-(1-гидрокси-2-метилпропан-2-ил)пиперидин-1-карбонил)бензил)-1,4-диметил-1H-бензо[d]имидазол-6-карбонитрил;
2-(2,6-дихлор-3-(4-(2-гидроксипропан-2-ил)пиперидин-1-карбонил)бензил)-1,4-диметил-1H-бензо[d]имидазол-6-карбонитрил;
2-(2,6-дихлор-3-(2-окса-8-азаспиро[4.5]декан-8-карбонил)бензил)-1,4-диметил-1H-бензо[d]имидазол-6-карбонитрил;
2-(2,6-дихлор-3-(4-(2-гидроксиэтил)пиперазин-1-карбонил)бензил)-1,4-диметил-1H-бензо[d]имидазол-6-карбонитрил;
2-(2,6-дихлор-3-(4-(2-фторпропил)пиперазин-1-карбонил)бензил)-1,4-диметил-1H-бензо[d]имидазол-6-карбонитрил;
2-(2,6-дихлор-3-(4-(оксетан-3-ил)пиперазин-1-карбонил)бензил)-1,4-диметил-1H-бензо[d]имидазол-6-карбонитрил;
2-(2,6-дихлор-3-(4-(оксетан-3-ил)пиперидин-1-карбонил)бензил)-1,4-диметил-1H-бензо[d]имидазол-6-карбонитрил;
2-(2,6-дихлор-3-(4-метоксипиперидин-1-карбонил)бензил)-1,4-диметил-1H-бензо[d]имидазол-6-карбонитрил;
2-(2,6-дихлор-3-(4-(диметиламино)пиперидин-1-карбонил)бензил)-1,4-диметил-1H-бензо[d]имидазол-6-карбонитрил;
2-(2,6-дихлор-3-(4-(2-метоксиэтил)пиперазин-1-карбонил)бензил)-1,4-диметил-1H-бензо[d]имидазол-6-карбонитрил;
2-(2,6-дихлор-3-(4-(2-гидрокси-2-метилпропил)пиперидин-1-карбонил)бензил)-1,4-диметил-1H-бензо[d]имидазол-6-карбонитрил;
2-(2,6-дихлор-3-(4-метилпиперазин-1-карбонил)бензил)-1,4-диметил-1H-бензо[d]имидазол-6-карбонитрил;
(2,4-дихлор-3-((1,4,6-триметил-1H-бензо[d]имидазол-2-ил)метил)фенил)(морфолинo)метанон;
(2,4-дихлор-3-((1,7-диметил-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(морфолинo)метанон;
(3-((6-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорфенил)(морфолинo)метанон;
(3-((6-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-диметилфенил)(морфолинo)метанон;
2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-карбонил)фенил)(морфолинo)метанон;
2-(2,6-дихлор-3-(морфолин-4-карбонил)бензоил)-1,4-диметил-1H-бензо[d]имидазол-6-карбоксамид;
3-[4-[2,4-дихлор-3-[[1,4-диметил-6-(трифторметил)бензимидазол-2-ил]метил]бензоил]пиперазин-1-ил]циклобутанкарбоновую кислоту;
2-[[2,6-дихлор-3-[[4-(2-метоксиэтил)-1-пиперидил]метил]фенил]метил]-1,4-диметил-6-(трифторметил)бензимидазол;
2-(2,6-дихлор-3-((4-(оксетан-3-ил)пиперидин-1-ил)метил)бензил)-1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол;
2-(2,6-дихлор-3-((4-метоксипиперидин-1-ил)метил)бензил)-1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол;
2-(2,6-дихлор-3-((4-(метоксиметил)пиперидин-1-ил)метил)бензил)-1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол;
1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензил)пиперидин-4-ол;
1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензил)пиперидин-3-ол;
2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензил)пиперидин-4-ил)-2-метилпропан-1-ол;
2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензил)пиперидин-4-ил)пропан-2-ол;
8-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензил)-2-окса-8-азаспиро[4.5]декан;
2-(2,6-дихлор-3-((4-(2-метоксиэтил)пиперазин-1-ил)метил)бензил)-1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол;
4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензил)морфолин;
2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензил)пиперидин-4-ил)этанол;
1-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензил)пиперидин-4-ил)-2-метилпропан-2-ол;
1-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензил)пиперидин-4-ил)этанол;
(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензил)пиперидин-4-ил)метанол;
2-(2,6-дихлор-3-((4-(2,2,2-трифторэтил)пиперазин-1-ил)метил)бензил)-1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол;
1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензил)-N,N-диметилпиперидин-4-амин;
1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензил)-3-метилпиперидин-3-ол;
2-((2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензил)(этил)амино)этанол;
4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензил)морфолин-3-он;
1-(2,4-дихлор-3-((1,4-диметил-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперидин-4-карбоновую кислоту;
2-(1-(2,4-дихлор-3-((1,4-диметил-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
(2,4-дихлор-3-((1,4-диметил-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(морфолинo)метанон;
(3-((5-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорфенил)(морфолинo)метанон;
2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-бензо[d]имидазол-5-карбонитрил;
2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-метил-1H-бензо[d]имидазол-5-карбонитрил;
(3-((6-бром-1-метил-4-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорфенил)(морфолинo)метанон;
2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-метил-4-(трифторметил)-1H-бензо[d]имидазол-6-карбонитрил;
2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-этил-4-метил-1H-бензо[d]имидазол-6-карбонитрил;
2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-изопропил-4-метил-1H-бензо[d]имидазол-6-карбонитрил;
2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-3,7-диметил-3H-имидазо[4,5-b]пиридин-5-карбонитрил;
4-хлор-2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-метил-1H-индол-6-карбонитрил;
(2,4-дихлор-3-((1-метил-1H-пирроло[2,3-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон;
2-(2,6-дихлор-3-(4-(оксетан-3-ил)пиперидин-1-карбонил)бензил)-1,4-диметил-1H-пирроло[2,3-b]пиридин-6-карбонитрил;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон;
(2,4-дихлор-3-((6-хлор-1,4-диметил-1H-пирроло[2,3-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон;
(2,4-дихлор-3-(гидрокси(1-метил-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон;
(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон;
(2,4-дихлор-3-(1-метил-6-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-карбонил)фенил)(морфолинo)метанон;
(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(морфолинo)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(морфолинo)метанон;
2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-пирроло[3,2-c]пиридин-6-карбонитрил;
(2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-a]пиридин-2-ил)метил)фенил)(морфолинo)метанон;
(2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-a]пиридин-2-ил)метил)фенил)(4-гидроксипиперидин-1-ил)метанон;
(2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-a]пиридин-2-ил)метил)фенил)(4-(2-гидроксиэтил)пиперидин-1-ил)метанон;
(2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-a]пиридин-2-ил)метил)фенил)(4-(2-гидроксипропан-2-ил)пиперидин-1-ил)метанон;
(2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-a]пиридин-2-ил)метил)фенил)(3-гидроксипирролидин-1-ил)метанон;
(2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-a]пиридин-2-ил)метил)фенил)(4-(диметиламино)пиперидин-1-ил)метанон;
(2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-a]пиридин-2-ил)метил)фенил)(4-метоксипиперидин-1-ил)метанон;
(2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-a]пиридин-2-ил)метил)фенил)(4-(2-метоксиэтил)пиперидин-1-ил)метанон;
(2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-a]пиридин-2-ил)метил)фенил)(4-(оксетан-3-ил)пиперидин-1-ил)метанон;
(2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-a]пиридин-2-ил)метил)фенил)(4-(оксетан-3-ил)пиперазин-1-ил)метанон;
(2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-a]пиридин-2-ил)метил)фенил)(4-(гидроксиметил)пиперидин-1-ил)метанон;
(2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-a]пиридин-2-ил)метил)фенил)(4-(1-гидроксиэтил)пиперидин-1-ил)метанон;
метил-2-(1-(2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-a]пиридин-2-ил)метил)бензоил)пиперидин-4-ил)ацетат;
2-(1-(2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-a]пиридин-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-[[2,6-дихлор-3-[4-(2-гидроксиэтил)пиперидин-1-карбонил]фенил]метил]-3,8-диметилимидазо[1,2-a]пиридин-6-карбонитрил;
2-(2,6-дихлор-3-(4-(гидроксиметил)пиперидин-1-карбонил)бензил)-3,8-диметилимидазо[1,2-a]пиридин-6-карбонитрил;
2-(2,6-дихлор-3-(4-метоксипиперидин-1-карбонил)бензил)-3,8-диметилимидазо[1,2-a]пиридин-6-карбонитрил;
2-(2,6-дихлор-3-(4-(2-гидроксипропан-2-ил)пиперидин-1-карбонил)бензил)-3,8-диметилимидазо[1,2-a]пиридин-6-карбонитрил;
2-(2,6-дихлор-3-(4-(1-гидроксиэтил)пиперидин-1-карбонил)бензил)-3,8-диметилимидазо[1,2-a]пиридин-6-карбонитрил;
2-(2,6-дихлор-3-(4-(оксетан-3-ил)пиперидин-1-карбонил)бензил)-3,8-диметилимидазо[1,2-a]пиридин-6-карбонитрил;
2-(2,6-дихлор-3-(4-(2-метоксиэтил)пиперидин-1-карбонил)бензил)-3,8-диметилимидазо[1,2-a]пиридин-6-карбонитрил;
(2,4-дихлор-3-((6-хлор-3,8-диметилимидазо[1,2-b]пиридазин-2-ил)метил)фенил)(морфолинo)метанон;
(2,4-дихлор-3-((6-хлор-3,7-диметилимидазо[1,2-b]пиридазин-2-ил)метил)фенил)(морфолинo)метанон;
(2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-b]пиридазин-2-ил)метил)фенил)(морфолинo)метанон;
(2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-b]пиридазин-2-ил)метил)фенил)(4-(оксетан-3-ил)пиперазин-1-ил)метанон;
(2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-b]пиридазин-2-ил)метил)фенил)(4-(оксетан-3-ил)пиперидин-1-ил)метанон;
(R)-(2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-b]пиридазин-2-ил)метил)фенил)(3-метил-4-(метилсульфонил)пиперазин-1-ил)метанон;
2-(1-(2,4-дихлор-3-(3,8-диметил-6-(трифторметил)имидазо[1,2-b]пиридазин-2-карбонил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-3,8-диметилимидазо[1,2-b]пиридазин-6-карбонитрил;
2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-3,7-диметилимидазо[1,2-b]пиридазин-6-карбонитрил;
(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-3H-имидазо[4,5-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон;
(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индазол-1-ил)метил)фенил)(морфолинo)метанон;
(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индазол-1-ил)метил)фенил)(4-(оксетан-3-ил)пиперидин-1-ил)метанон;
(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-2H-индазол-2-ил)метил)фенил)(морфолинo)метанон;
1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-карбоновую кислоту;
(3S,4S)-этил-1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)-3-метилпиперидин-4-карбоксилат;
(3R,4R)-этил-1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)-3-метилпиперидин-4-карбоксилат;
(3S,4S)-1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)-3-метилпиперидин-4-карбоновую кислоту;
(3R,4R)-1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)-3-метилпиперидин-4-карбоновую кислоту;
метил-1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)бензоил)пиперидин-4-карбоксилат;
(3S,4S)-этил-1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)бензоил)-3-метилпиперидин-4-карбоксилат;
(3R,4R)-этил-1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)бензоил)-3-метилпиперидин-4-карбоксилат;
1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)бензоил)пиперидин-4-карбоновую кислоту;
(3S,4S)-1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)бензоил)-3-метилпиперидин-4-карбоновую кислоту;
(3R,4R)-1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)бензоил)-3-метилпиперидин-4-карбоновую кислоту;
1-(2,6-дихлор-3-(4-гидроксипиперидин-1-карбонил)бензил)-3,7-диметил-1H-индол-5-карбонитрил;
1-(2,6-дихлор-3-(4-гидроксипиперидин-1-карбонил)бензоил)-3,7-диметил-1H-индол-5-карбонитрил;
(4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-3-ил)(4-гидроксипиперидин-1-ил)метанон;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон;
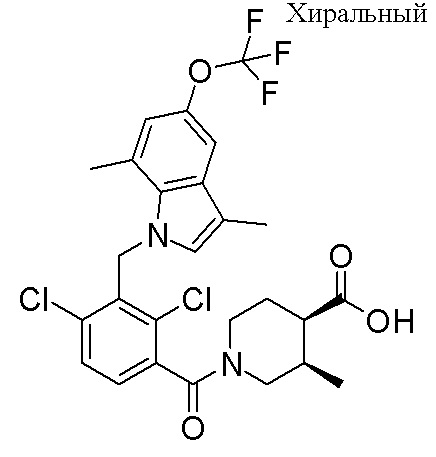
(3S,4S)-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-карбоновую кислоту;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон;
(3S,4S)-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-карбоновую кислоту;
(3R,4R)-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-карбоновую кислоту;
(4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-3-ил)(4-гидроксипиперидин-1-ил)метанон;
1-[2,4-дихлор-3-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]бензоил]пиперидин-4-карбоновую кислоту;
метил-2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-3-ил)метил)бензоил)пиперидин-4-ил)ацетат;
(3R,4R)-этил-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-3-ил)метил)бензоил)-3-метилпиперидин-4-карбоксилат;
2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-3-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
(3R,4R)-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-3-ил)метил)бензоил)-3-метилпиперидин-4-карбоновую кислоту;
2-[1-[4,6-дихлор-5-[[1,4-диметил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-3-карбонил]-4-пиперидил]уксусную кислоту;
2-[1-[3,5-дихлор-4-[[1,4-диметил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-2-карбонил]-4-пиперидил]уксусную кислоту;
2-[1-[3,5-дихлор-4-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-2-карбонил]-4-пиперидил]уксусную кислоту;
2-[1-[4,6-дихлор-5-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-3-карбонил]-4-пиперидил]уксусную кислоту;
2-(1-(2,4-дихлор-3-((4-метил-6-(трифторметил)бензофуран-3-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индазол-1-карбонил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-2H-индазол-2-карбонил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индазол-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметил)-2H-индазол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индазол-3-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-((3-метил-5-(трифторметил)-1H-индазол-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-[1-[2,4-дихлор-3-[[3,7-диметил-5-(трифторметокси)-1H-индол-1-ил]метил]бензоил]-4-пиперидил]уксусную кислоту;
2-[1-[2,4-дихлор-3-[3,7-диметил-5-(трифторметокси)индол-1-карбонил]бензоил]-4-пиперидил]уксусную кислоту;
1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметокси)-1H-индол-1-карбонил)бензоил)пиперидин-4-карбоновую кислоту;
2-(1-(2,4-дихлор-3-((5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-диметил-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-(7-метил-5-(трифторметокси)-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-диметил-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-(7-метил-5-(трифторметокси)-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-((5-(дифторметокси)-7-метил-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-((5-циклопропил-7-фтор-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-(5-циклопропил-7-фтор-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-((7-фтор-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(4,6-дихлор-5-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)никотиноил)пиперидин-4-ил)уксусную кислоту;
2-(1-(4,6-дихлор-5-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)никотиноил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-(7-метил-5-(трифторметил)-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)уксусную кислоту;
(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин-1-ил)метил)фенил)(морфолинo)метанон;
2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин-1-карбонил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-индол-5-карбонитрил;
2-(1-(2,4-дихлор-3-((5-циано-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
(2,4-дихлор-3-((4,6-дихлор-1-метил-1H-индол-2-ил)метил)фенил)(морфолинo)метанон;
2-(1-(2,4-дихлор-3-((4,6-дихлор-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-((2,4-дихлор-5-(2-окса-8-азаспиро[4.5]декан-8-карбонил)пиридин-3-ил)метил)-1,4-диметил-1H-индол-6-карбонитрил;
2-((2,4-дихлор-5-(4-(оксетан-3-ил)пиперидин-1-карбонил)пиридин-3-ил)метил)-1,4-диметил-1H-индол-6-карбонитрил;
2-(1-(2,4-дихлор-3-((6-метокси-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-((4-фтор-1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-((6-(дифторметокси)-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(4,6-дихлор-5-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)никотиноил)пиперидин-4-ил)уксусную кислоту;
2-(1-(3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиколиноил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(4-(оксетан-3-ил)пиперазин-1-ил)метанон;
N-(2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-индол-6-ил)ацетамид;
2-(1-(2-хлор-4-циклопропил-3-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(2,4-дихлор-3-((6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
1-(2,4-дихлор-3-((6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-карбоновую кислоту;
2-[[2,6-дихлор-3-(морфолин-4-карбонил)фенил]метил]-N,N,1,4-тетраметил-индол-6-карбоксамид;
2-[[2,6-дихлор-3-(морфолин-4-карбонил)фенил]метил]-N,1,4-триметилиндол-6-карбоксамид;
1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-3-ил)метил)бензоил)пиперидин-4-карбоновую кислоту;
2-(1-(3,5-дихлор-4-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)пиколиноил)пиперидин-4-ил)уксусную кислоту;
1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоил)пиперидин-4-карбоновую кислоту;
(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)фенил)(4-(2-метоксиэтил)пиперидин-1-ил)метанон;
2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту;
этил-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоил)пиперидин-4-карбоксилат;
2-(1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензоил)пиперидин-4-ил)уксусную кислоту;
1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензоил)пиперидин-4-карбонитрил;
(3R,4R)-1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензоил)-3-метилпиперидин-4-карбоновую кислоту;
(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)фенил)(4-(2-метоксиэтил)пиперидин-1-ил)метанон;
(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)фенил)(4-гидроксипиперидин-1-ил)метанон;
2-((3R,4S)-1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензоил)-3-метилпиперидин-4-ил)уксусную кислоту;
(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)фенил)(4-(метилсульфонил)пиперидин-1-ил)метанон;
2-((3S,4R)-1-(4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотиноил)-3-метилпиперидин-4-ил)уксусную кислоту;
(4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-3-ил)(морфолинo)метанон;
(4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-3-ил)(4-(метилсульфонил)пиперидин-1-ил)метанон;
(3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-2-ил)(морфолинo)метанон;
2-(1-(2,4-дихлор-3-(1-метил-6-(трифторметокси)-1H-индол-2-карбонил)бензоил)пиперидин-4-ил)уксусную кислоту;
2-(1-(4,6-дихлор-5-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)никотиноил)пиперидин-4-ил)уксусную кислоту;
2-(1-(4,6-дихлор-5-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)никотиноил)пиперидин-4-ил)уксусную кислоту;
2-[1-[2,4-дихлор-3-[[1-метил-7-(трифторметил)-1H-индол-3-ил]метил]бензоил]-4-пиперидил]уксусную кислоту;
2-[1-[4,6-дихлор-5-[(6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил]пиридин-3-карбонил]-4-пиперидил]уксусную кислоту;
2-(1-(2,4-дихлор-3-((4-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту или
2-[1-[2,4-дихлор-3-[[7-хлор-5-(трифторметил)индол-1-ил]метил]бензоил]-4-пиперидил]уксусную кислоту.
В тридцать пятом варианте осуществления настоящее изобретение обеспечивает фармацевтическую композицию, содержащую соединение согласно любому из вышеуказанных вариантов осуществления и одно или несколько фармацевтически приемлемых вспомогательных веществ.
В тридцать шестом варианте осуществления настоящее изобретение обеспечивает способ лечения заболевания, включающий введение терапевтически эффективного количества соединения по любому из пп. 1-29, где заболевание представляет собой ревматоидный артрит, ювенильный ревматоидный артрит, псориаз, псориатический артрит, болезнь Крона, воспалительное заболевание кишечника, язвенный колит, анкилозирующий спондилит, реактивный артрит, артрит, связанный с воспалительным заболеванием кишечника, недифференцированный спондилоартрит, системную красную волчанку, люпус-нефрит, увеит, атопический дерматит, рассеянный склероз, типы аксиального спондилоартрита и гнойный гидраденит.
В тридцать седьмом варианте осуществления настоящее изобретение обеспечивает набор, содержащий упакованный продукт, содержащий компоненты, при помощи которых вводят соединение по любому из вышеуказанных вариантов осуществления для лечения аутоиммунного нарушения.
В тридцать восьмом варианте осуществления настоящее изобретение обеспечивает набор согласно тридцать седьмому варианту осуществления, где упакованный продукт предусматривает соединение согласно любому из вышеуказанных вариантов осуществления и инструкции по применению.
ПОДРОБНОЕ ОПИСАНИЕ
Соединения по настоящему изобретению пригодны для предупреждения, диагностики и лечения различных медицинских нарушений у людей или животных. Соединения по настоящему изобретению используют для ингибирования или снижения одного или нескольких видов активности, связанной с рецепторами RORγt, относительно рецепторов RORγt в отсутствие таких же соединений. Таким образом, в одном аспекте настоящего изобретения способ лечения заболевания или нарушения, выбранного из аутоиммунного заболевания или нарушения, псориаза, псориатического артрита, астмы, аллергического заболевания или нарушения, заболевания или нарушения обмена веществ и рака, у субъекта включает введение субъекту терапевтически эффективного количества соединения формулы (I), стереоизомерной формы, N-оксида, фармацевтически приемлемой соли, сольвата, гидрата или фармацевтической композиции, описанной в данном документе. В некоторых вариантах осуществления аутоиммунное заболевание или нарушение выбрано из псориаза, псориатического артрита, анкилозирующего спондилита, ревматоидного артрита, рассеянного склероза, воспалительного заболевания кишечника, болезни Крона, язвенного колита, увеита, реакции "трансплантат против хозяина" и волчанки. В некоторых вариантах осуществления аллергическое заболевание или нарушение выбрано из атопического дерматита, аллергического ринита, астмы или хронического обструктивного заболевания легких (COPD). В некоторых вариантах осуществления заболевание или нарушение обмена веществ выбрано из ожирения, вызванной ожирением резистентности к инсулину, атеросклероза и диабета II типа. В некоторых вариантах осуществления онкологическое заболевание или нарушение представляет собой меланому.
В одном варианте осуществления заболевание или нарушение представляет собой псориаз или псориатический артрит. См., например: Pantelyushin, S. et al. "RORγt+ innate lymphocytes and γδ T cells initiate psoriasiform plaque formation in mice" J. Clin. Invest. 2012, 122:2252 и Raychaudhuri, S. et al. "Role of IL-17 in psoriasis and psoriatic arthritis," Clin. Rev. Allergy Immunol. 2013, 44: 183.
В одном варианте осуществления заболевание или нарушение представляет собой атопический дерматит. См., например: Ma, L. et al. "The imbalance of Th17 cells and CD4+CD25highFoxp3+ Treg cells in patients with atopic dermatitis" J. Eur. Acad. Dermatol. Venereol. 2014, 28:1079 и Peiser, M. "Role of Th17 cells in skin inflammation of allergic contact dermatitis" Clin. Dev. Immunol. 2013, 261037.
В другом варианте осуществления заболевание или нарушение представляет собой ревматоидный артрит. См., например: Park, T.-Y. et al. "RORγt-specific transcriptional interactomic inhibition suppresses autoimmunity associated with TH17 cells" Proc. Natl. Acad. Sci. USA 2014, 111:18673; и Solt, L. et al. "Action of RORs and their ligands in (patho)\physiology" Trends Endocrinol. Metab. 2012, 23:619; и Chang, M. et al. "Pharmacologic repression of retinoic acid receptor-related orphan nuclear receptor γ is therapeutic in the collagen-induced arthritis experimental model" Arthritis Rheumatol., 2014, 66:579.
В другом варианте осуществления заболевание или нарушение представляет собой анкилозирующий спондилит. См., например: Bidad, K. et al "Effect of all-transretinoic acid on Th17 and T regulatory cell subsets in patients with ankylosing spondylitis" J. Rheumatol. 2013, 40:476 и Toussirot, E. et al. "The IL-23/Thl7 pathway as a therapeutic target in chronic inflammatory diseases," Inflamm. Allergy Drug Targets 2012, 1:159.
В другом варианте осуществления заболевание или нарушение представляет собой рассеянный склероз. См., например: Martinez, N. et al. "RORγt, but not T-bet, overexpression exacerbates an autoimmune model for multiple sclerosis" J. Neuroimmunol. 2014, 276:(1/2) 142-149 и Codarri, L. et al., "RORγt drives production of the cytokine GM-CSF in helper T cells, which is essential for the effector phase of autoimmune neuroinflammation" Nat. Immunol. 2011, 12:560.
В другом варианте осуществления заболевание или нарушение представляет собой воспалительное заболевание кишечника. См., например: Troncone, E. et al. "Th17 cytokines in inflammatory bowel diseases: discerning the good from the bad" Intl. Rev. Immunol. 2013, 32:526 и Leppkes, M. et al. "RORgamma-expressing Th17 cells induce murine chronic intestinal inflammation via redundant effects of IL-17A and IL-17F" Gastroenterology 2009, 136:257-267.
В другом варианте осуществления заболевания или нарушения представляют собой язвенный колит или болезнь Крона. См., например: Dong, Z. et al. "Aberrant expression of circulating Th17, Th1 and Tc1 cells in patients with active and inactive ulcerative colitis" Intl. J. Mol. Med. 2013, 31:989 и Kumawat, A. et al. "Microscopic colitis patients demonstrate a mixed Th17/Tc17 and Th1/Tc1 mucosal cytokine profile" Mol Immunol. 2013, 55:355.
В другом варианте осуществления заболевание или нарушение представляет собой аутоиммунный увеит. См., например: Horai, R. et al. "Cytokines in autoimmune uveitis" J. Interferon Cytokine Res. 2011, 31:733.
В другом варианте осуществления заболевание или нарушение представляет собой волчанку. См., например: Yoh, K. et al. "Overexpression of RORγt under control of the CD2 promoter induces polyclonal plasmacytosis and autoantibody production in transgenic mice" Eur. J. Immunol. 2012, 42:1999.
В другом варианте осуществления заболевание или нарушение представляет собой реакцию "трансплантат против хозяина" (GVHD). См., например: Yu, Y. et al. "Prevention of GVHD while sparing GVL effect by targeting Th1 and Th17 transcription factor T-bet and RORγt in mice" Blood 2011, 118:5011.
В другом варианте осуществления заболевание или нарушение представляет собой атеросклероз. См., например: Erbel, C. et al. "IL-17A influences essential functions of the monocyte/macrophage lineage and is involved in advanced murine and human atherosclerosis" J. Immunol. 2014, 193, 4344.
В другом варианте осуществления заболевания или нарушения представляют собой аллергический ринит, астму или хроническое обструктивное заболевание легких (COPD). См., например: Loubaki, L. et al. "Co-culture of human bronchial fibroblasts and CD4+ T cells increases Th17 cytokine signature" PLoS One 2013, 8:e81938/1 и Solt, L. et al. "Action of RORs and their ligands in (patho)\physiology" Trends Endocrinol. Metab. 2012, 23:619.
В другом варианте осуществления заболевания или нарушения представляют собой ожирение, и/или резистентность к инсулину, и/или диабет II типа. См., например: Solt, L. et al. "ROR inverse agonist suppresses insulitis and prevents hyperglycemia in a mouse model of type 1 diabetes" Endocrinology 2015, 156:869; и Meissburger, B. et al. "Adipogenesis and insulin sensitivity in obesity are regulated by retinoid-related orphan receptor gamma" EMBO Mol. Med. 2011, 3:637; и Solt, L. "Ligand regulation of retinoic acid receptor-related orphan receptors: implications for development of novel therapeutics" Curr. Opin. Lipidology 2010, 21:204.
В другом варианте осуществления заболевание или нарушение представляет собой меланому. См., например: Purwar, R. et al. "Robust tumor immunity to melanoma mediated by interleukin-9-producing T cells" Nat. Med. 2012, 18:1248.
Также следует понимать, что комбинации, которые должны быть включены в настоящее изобретение, представляют собой те комбинации, которые пригодны для их целевого назначения. Средства, изложенные ниже, приводятся с целью иллюстрации и не подразумеваются как ограничивающие. Комбинации, которые представляют собой часть настоящего изобретения, могут представлять собой соединения по настоящему изобретению и по меньшей мере одно дополнительное средство, выбранное из перечней ниже. Комбинация также может включать более одного дополнительного средства, например два или три дополнительных средства, если комбинация является такой, что сформированная композиция может выполнять свою предусмотренную функцию.
Предпочтительные комбинации представляют собой нестериодное(-ые) противовоспалительное(-ые) лекарственное(-ые) средство(-а), также называемое(-ые) NSAID, которое(-ые) включает(-ют) лекарственные средства, подобные ибупрофену. Другие предпочтительные комбинации представляют собой кортикостероиды, в том числе преднизолон; хорошо известные побочные эффекты использования стероидов можно уменьшать или даже устранять путем снижения дозы стероидов, требуемой при лечении пациентов в комбинации с соединениями данного изобретения. Неограничивающие примеры терапевтических средств для лечения ревматоидного артрита, с которыми соединение формулы (I) по настоящему изобретению можно комбинировать, включают следующие: супрессирующий(-ие) цитокины противовоспалительный(-ые) препарат(-ы) (CSAID); антитела к или антагонисты других цитокинов или факторов роста человека, например LT, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-12, IL-15, IL-16, IL-21, IL-23, интерфероны, EMAP-II, GM-CSF, FGF, MMP-13 и PDGF. Соединения по настоящему изобретению можно объединять с антителами к молекулам клеточной поверхности, таким как CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD80 (B7.1), CD86 (B7.2), CD90, CTLA или их лигандам, в том числе CD154 (gp39 или CD40L).
Предпочтительные комбинации терапевтических средств могут влиять в различных точках в аутоиммунном и последующем воспалительном каскаде; предпочтительные примеры включают ингибиторы IL-1 (ингибиторы интерлейкин-1-превращающего фермента, IL-1RA и т.д.), которые могут быть эффективными по той же причине. Другие предпочтительные комбинации включают интерлейкин 11. Еще одни предпочтительные комбинации являются другими ключевыми участниками аутоиммунной реакции, которые могут действовать параллельно, зависимо от или согласованно с функцией IL-18; особенно предпочтительными являются антагонисты IL-12, в том числе антитела к IL-12, или растворимые рецепторы IL-12, или связывающие IL-12 белки. Было показано, что IL-12 и IL-18 имеют перекрывающиеся, но отличные функции, и комбинация антагонистов к обоим может быть наиболее эффективной. Еще одна предпочтительная комбинация представляет собой неистощающиеся антитела-ингибиторы к CD4. Еще одни предпочтительные комбинации включают антагонисты костимуляторного пути CD80 (B7.1) или CD86 (B7.2), в том числе антитела, растворимые рецепторы или лиганды антагонистов.
Соединение формулы (I) по настоящему изобретению можно также объединять со средствами, такими как метотрексат, 6-меркаптопурин, азатиоприн, сульфасалазин, месалазин, олсалазин, хлорохинин/гидроксихлорохин, пеницилламин, ауротиомалат (внутримышечный и пероральный), азатиоприн, колхицин, кортикостероиды (пероральные, вдыхаемые и вводимые с помощью местной инъекции), агонисты бета-2 адренорецепторов (сальбутамол, тербуталин, салметерол), ксантины (теофиллин, аминофиллин), кромогликат, недокромил, кетотифен, ипратропий и окситропий, циклоспорин, FK506, рапамицин, микофенолата мофетил, лефлуномид, NSAID, например ибупрофен, кортикостероиды, такие как преднизолон, ингибиторы фосфодиэстеразы, агонисты аденозина, антитромботические средства, ингибиторы комплемента, адренергические средства, средства, которые препятствуют передаче сигнала с участием провоспалительных цитокинов, таких как IL-1 (например, ингибиторы киназ NIK, IKK, JAK1, JAK2, JAK3, p38 или MAP), ингибиторы IL-1β-превращающего фермента, ингибиторы передачи сигнала с участием T-клеток, такие как ингибиторы киназ, ингибиторы металлопротеиназ, сульфасалазин, 6-меркаптопурины, ингибиторы ангиотензин-превращающего фермента, растворимые рецепторы цитокинов и их производные (например, sIL-1RI, sIL-1RII, sIL-6R), противовоспалительные цитокины (например, IL-4, IL-10, IL-11, IL-13), целекоксиб, фолиевая кислота, гидроксихлорохина сульфат, рофекоксиб, напроксен, вальдекоксиб, сульфасалазин, метилпреднизолон, мелоксикам, метилпреднизолона ацетат, ауротиомалат натрия, аспирин, триамцинолона ацетонид, пропоксифена напсилат/апап, фолат, набуметон, диклофенак, пироксикам, этодолак, диклофенак натрия, оксапрозин, оксикодона HCl, гирокодона битартрат/апап, диклофенак натрия/мизопростол, фентанил, анакинра, трамадола HCl, салсалат, сулиндак, цианокобаламин/ф. к./пиридоксин, ацетаминофен, алендронат натрия, преднизолон, морфина сульфат, лидокаина гидрохлорид, индометацин, глюкозамина сульфат/хондроитин, амитриптилина HCl, сульфадиазин, оксикодона HCl/ацетаминофен, олопатадина HCl мизопростол, напроксен натрия, омепразол, циклофосфамид, ритуксимаб, тофацитиниб, IL-1 TRAP, MRA, CTLA4-IG, IL-18 BP, антитело к IL-12, антитело к IL15, BIRB-796, SCIO-469, VX-702, AMG-548, VX-740, рофлумиласт, IC-485, CDC-801, агонисты S1P1 (такие как FTY720), ингибиторы семейства PKC (такие как рубоксистаурин или AEB-071) и мезопрам. Предпочтительные комбинации включают метотрексат или лефлуномид, и в случаях умеренного или тяжелого ревматоидного артрита, и циклоспорин.
Неограничивающие примеры терапевтических средств для лечения воспалительного заболевания кишечника, с которыми соединение формулы (I) по настоящему изобретению можно объединять, включают следующие: буденозид; фактор роста эпидермиса; кортикостероиды; циклоспорин, сульфасалазин; аминосалицилаты; 6-меркаптопурин; азатиоприн; метронидазол; ингибиторы липоксигеназы; месаламин; олсалазин; балсалазид; антиоксиданты; ингибиторы тромбоксана; антагонисты рецептора IL-1; моноклональные антитела к IL-1β; моноклональные антитела к IL-6; факторы роста; ингибиторы эластазы; пиридинил-имидазольные соединения; антитела к другим цитокинам или фаторам роста человека или их антагонисты, например LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-12, IL-15, IL-16, IL-23, EMAP-II, GM-CSF, FGF и PDGF; молекулы клеточной поверхности, такие как CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD90 или их лиганды; метотрексат; циклоспорин; FK506; рапамицин; микофенолата мофетил; лефлуномид; NSAID, например ибупрофен; кортикостероиды, такие как преднизолон; ингибиторы фосфодиэстеразы; агонисты аденозина; антитромботические средства; ингибиторы комплемента; адренергические средства; средства, которые препятствуют передаче сигнала с участием провоспалительных цитокинов, таких как IL-1 (например, ингибиторы киназ NIK, IKK, p38 или MAP); ингибиторы IL-1β-превращающего фермента; ингибиторы передачи сигнала с участием T-клеток, такие как ингибиторы киназ; ингибиторы металлопротеиназ; сульфасалазин; азатиоприн; 6-меркаптопурины; ингибиторы ангиотензин-превращающего фермента; растворимые рецепторы цитокинов и их производные (например, sIL-1RI, sIL-1RII, sIL-6R) и противовоспалительные цитокины (например, IL-4, IL-10, IL-11, IL-13). Предпочтительные примеры терапевтических средств для лечения болезни Крона, с которыми соединение формулы (I) можно объединять, включают ингибиторы PDE4. Соединение формулы (I) можно объединять с кортикостероидами, например буденозидом и дексаметазоном; сульфасалазином, 5-аминосалициловой кислотой; олсалазином; и средствами, которые препятствуют синтезу или действию провоспалительных цитокинов, таких как IL-1, например ингибиторами IL-1β-превращающего фермента и IL-1ra; ингибиторами передачи сигнала с участием T-клеток, например ингибиторами тирозинкиназы; 6-меркаптопурином; IL-11; месаламином; преднизоном; азатиоприном; меркаптопурином; инфликсимабом; метилпреднизолона натрия сукцинатом; дифеноксилатом/атропа сульфатом; лоперамида гидрохлоридом; метотрексатом; омепразолом; фолатом; ципрофлоксацином/смесью декстроза-вода; гирокодона битартратом/апапом; тетрациклина гидрохлоридом; флуоцинонидом; метронидазолом; тимеросалом/борной кислотой; холестирамином/сахарозой; ципрофлоксацина гидрохлоридом; сульфатом гиосциамина; меперидина гидрохлоридом; мидазолама гидрохлоридом; оксикодона HCl/ацетаминофеном; прометазином гидрохлорида; фосфатом натрия; сульфаметоксазолом/триметопримом; целекоксибом; поликарбофилом; пропоксифена напсилатом; гидрокортизоном; поливитаминами; балсалазидом динатрия; кодеина фосфатом/апапом; колесевелама HCl; цианокобаламином; фолиевой кислотой; левофлоксацином; метилпреднизолоном; натализумабом и интерфероном-гамма.
Неограничивающие примеры терапевтических средств для лечения рассеянного склероза, с которыми соединение формулы (I) можно объединять, включают следующие: кортикостероиды; преднизолон; метилпреднизолон; азатиоприн; циклофосфамид; циклоспорин; метотрексат; 4-аминопиридин; тизанидин; интерферон-β1a (Avonex®; Biogen); интерферон-β1b (Betaseron®; Chiron/Berlex); интерферон α-n3) (Interferon Sciences/Fujimoto), интерферон-α (Alfa Wassermann/J&J), интерферон β1A-IF (Serono/Inhale Therapeutics), пегинтерферон α 2b (Enzon/Schering-Plough), сополимер 1 (Cop-1; COPAXONE®; Teva Pharmaceutical Industries, Inc.); гипербарический кислород; внутривенный иммуноглобулин; кладрибин; антитела к или антагонисты других цитокинов или фактор роста человека и их рецепторов, например LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-12, IL-23, IL-15, IL-16, EMAP-II, GM-CSF, FGF и PDGF. Соединение формулы (I) можно объединять с антителами к молекулам клеточной поверхности, таким как CD2, CD3, CD4, CD8, CD19, CD20, CD25, CD28, CD30, CD40, CD45, CD69, CD80, CD86, CD90 или их лиганды. Соединение формулы (I) можно также объединять со средствами, такими как метотрексат, циклоспорин, FK506, рапамицин, микофенолата мофетил, лефлуномид, агонист S1P1, NSAID, например ибупрофен, кортикостероиды, такие как преднизолон, ингибиторы фосфодиэстеразы, агонисты аденозина, антитромботические средства, ингибиторы комплемента, адренергические средства, средства, которые препятствуют передаче сигнала с участием провоспалительных цитокинов, таких как IL-1 (например, ингибиторы киназ NIK, IKK, p38 или MAP), ингибиторы IL-1β-превращающего фермента, ингибиторы TACE, ингибиторы передачи сигнала с участием T-клеток, такие как ингибиторы киназ, ингибиторы металлопротеиназ, сульфасалазин, азатиоприн, 6-меркаптопурины, ингибиторы ангиотензин-превращающего фермента, растворимые рецепторы цитокинов и их производные (например, sIL-1RI, sIL-1RII, sIL-6R) и противовоспалительные цитокины (например, IL-4, IL-10, IL-13 и TGFβ).
Предпочтительные примеры терапевтических средств для лечения рассеянного склероза, с которыми соединение формулы (I) можно объединять, включают интерферон-β, например IFNβ1a и IFNβ1b; копаксон, кортикостероиды, ингибиторы каспаз, например ингибиторы каспазы-1, ингибиторы IL-1 и антитела к лиганду CD40 и CD80.
Соединение формулы (I) можно также объединять со средствами, такими как алемтузумаб, дронабинол, даклизумаб, митоксантрон, ксалипродена гидрохлорид, фампридин, глатирамера ацетат, натализумаб, синнабидол, α-иммунокин NNSO3, ABR-215062, AnergiX.MS, антагонисты хемокиновых рецепторов, BBR-2778, калагуалин, CPI-1189, LEM (включенный в липосомы митоксантрон), THC.CBD (агонист каннабиноидов), MBP-8298, мезопрам (ингибитор PDE4), MNA-715, антитело к рецептору IL-6, нейровакс, пирфенидон аллотрап 1258 (RDP-1258), sTNF-R1, антитело или низкомолекулярные ингибиторы TNF, талампанел, терифлуномид, TGF-бета2, типлимотид, антагонисты VLA-4 (например, TR-14035, VLA4 Ultrahaler, Antegran-ELAN/Biogen), антагонисты интерферона-гамма и агонисты IL-4.
Неограничивающие примеры терапевтических средств для лечения анкилозирующего спондилита, с которыми соединение формулы (I) можно объединять, включают следующие: ибупрофен, диклофенак, мизопростол, напроксен, мелоксикам, индометацин, диклофенак, целекоксиб, рофекоксиб, сульфасалазин, метотрексат, азатиоприн, миноциклин и преднизон.
Неограничивающие примеры терапевтических средств для лечения псориаза, с которыми соединение формулы (I) можно объединять, включают следующие: кальципотриен, клобетазола пропионат, триамцинолона ацетонид, галобетазола пропионат, тазаротен, метотрексат, флуоцинонид, бетаметазона дипроп дополненный, флуоцинолона ацетонид, ацитретин, дегтярный шампунь, бетаметазона валерат, мометазона фуроат, кетоконазол, прамоксин/флуоцинолон, гидрокортизона валерат, флурандренолид, мочевину, бетаметазон, клобетазола пропионат/смягчающее средство, флутиказона пропионат, азитромицин, гидрокортизон, увлажняющий состав, фолиевую кислоту, дезонид, пимекролимус, коксовый деготь, дифлоразона диацетат, этанерцепт фолат, молочную кислоту, метоксален, hc/висмута субгаллат/оксид Zn/resor, метилпреднизолона ацетат, преднизон, солнцезащитное вещество, галцинонид, салициловую кислоту, антралин, клокортолона пивалат, угольный экстракт, коксовый деготь/салициловую кислоту, коксовый деготь/салициловую кислоту/серу, дезоксиметазон, диазепам, смягчающее средство, флуоцинонид/смягчающее средство, минеральное масло/касторовое масло/na lact, минеральное масло/арахисовое масло, нефтепродукт/изопропилмиристат, псорален, салициловую кислоту, мыло/трибромсалан, тимеросал/борную кислоту, целекоксиб, инфликсимаб, циклоспорин, алефацепт, эфализумаб, такролимус, пимекролимус, PUVA, UVB, сульфасалазин, ABT-874 и устекинамаб.
Неограничивающие примеры терапевтических средств для лечения псориатического артрита, с которыми соединение формулы (I) можно объединять, включают следующие: метотрексат, этанерцепт, рофекоксиб, целекоксиб, фолиевую кислоту, сульфасалазин, напроксен, лефлуномид, метилпреднизолона ацетат, индометацин, гидроксихлорохина сульфат, преднизон, сулиндак, бетаметазона дипроп дополненный, инфликсимаб, метотрексат, фолат, триамцинолона ацетонид, диклофенак, диметилсульфоксид, пироксикам, диклофенак натрия, кетопрофен, мелоксикам, метилпреднизолон, набуметон, толметин натрия, кальципотриен, циклоспорин, диклофенак натрия/мизопростол, флуоцинонид, глюкозамина сульфат, ауротиомалат натрия, гидрокодона битартрат/апап, ибупрофен, ризедронат натрия, сульфадиазин, тиогуанин, вальдекоксиб и алефасепт.
Неограничивающие примеры терапевтических средств для лечения рестеноза, с которыми соединение формулы (I) можно объединять, включают следующие: сиролимус, паклитаксел, эверолимус, такролимус, ABT-578 и ацетаминофен.
Предпочтительные примеры терапевтических средств для лечения SLE (волчанки), с которыми соединение формулы (I) можно объединять, включают следующие: NSAID, например диклофенак, напроксен, ибупрофен, пироксикам, индометацин; ингибиторы COX2, например целекоксиб, рофекоксиб, вальдекоксиб; противомалярийные препараты, например гидроксихлорохин; стероиды, например преднизон, преднизолон, буденозид, дексаметазон; цитотоксические вещества, например азатиоприн, циклофосфамид, микофенолата мофетил, метотрексат; ингибиторы PDE4 или ингибиторы синтеза пурина, например Cellcept®. Соединение формулы (I) можно также объединять со средствами, такими как сульфасалазин, 5-аминосалициловая кислота, олсалазин, Imuran®, и средствами, которые препятствуют синтезу, продуцированию или действию провоспалительных цитокинов, таких как IL-1, например ингибиторами каспазы, такими как ингибиторы IL-1β-превращающего фермента и IL-1ra. Соединение формулы (I) можно также использовать с ингибиторами передачи сигнала с участием T-клеток, например ингибиторами тирозинкиназы; или молекулами, которые нацелены на молекулы активации T-клеток, например CTLA-4-IgG или антитела к семейству B7, антитела к семейству PD-1. Соединение формулы (I) можно объединять с IL-11, или антителами к цитокинам, например фонотолизумабом (антителом к IFNg), или антителами к рецепторам, например антителом к рецептору IL-6, и антителами к поверхностным молекулам B-клеток. Соединение формулы (I) можно также использовать с LJP 394 (абетимусом), средствами, которые истощают или дезактивируют B-клетки, например ритуксимабом (антителом к CD20) и лимфостатом-B (антителом к BlyS).
В настоящем изобретении применимы приведенные ниже определения.
"Терапевтически эффективное количество" представляет собой количество соединения формулы (I) или комбинации двух или более таких соединений, которые ингибируют, полностью или частично, прогрессирование патологического состояния или облегчают, по меньшей мере частично, один или несколько симптомов патологического состояния. Терапевтически эффективное количество может также быть количеством, которое является профилактически эффективным. Количество, которое является терапевтически эффективным, будет зависеть от размера и пола пациента, патологического состояния, подлежащего лечению, тяжести патологического состояния и необходимого результата. Для данного пациента терапевтически эффективное количество можно определять при помощи способов, известных специалистам в данной области.
"Фармацевтически приемлемые соли" относятся к таким солям, которые сохраняют биологическую действенность и свойства свободных оснований и которые получают с помощью реакции с неорганическими кислотами, например хлористоводородной кислотой, бромистоводородной кислотой, серной кислотой, азотной кислотой и фосфорной кислотой, или органическими кислотами, такими как сульфоновая кислота, карбоновая кислота, органическая фосфорная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, лимонная кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, бензойная кислота, салициловая кислота, молочная кислота, виннокаменная кислота (например (+) или (-)-виннокаменная кислота или их смеси), аминокислоты (например, (+) или (-)-аминокислоты или их смеси) и подобное. Эти соли можно получать при помощи способов, известных специалистам в данной области.
Некоторые соединения формулы (I), которые характеризуются кислотными заместителями, могут существовать в виде солей с фармацевтически приемлемыми основаниями. Настоящее изобретение включает в себя такие соли. Примеры таких солей включают натриевые соли, калиевые соли, соли лизина и соли аргинина. Эти соли можно получать при помощи способов, известных специалистам в данной области.
Некоторые соединения формулы (I) и их соли могут существовать в более чем одной кристаллической форме, и настоящее изобретение включает в себя каждую кристаллическую форму и их смеси.
Некоторые соединения формулы (I) и их соли могут также существовать в форме сольватов, например гидратов, и настоящее изобретение включает в себя каждый сольват и их смеси.
Некоторые соединения формулы (I) могут содержать один или несколько хиральных центров и существуют в различных оптически активных формах. Когда соединения формулы (I) содержат один хиральный центр, соединения существуют в двух энантиомерных формах, и настоящее изобретение включает в себя как энантиомеры, так и смеси энантиомеров, такие как рацемические смеси. Энантиомеры можно разделять при помощи способов, известных специалистам в данной области, например путем образования диастереоизомерных солей, которые можно разделять, например кристаллизацией; образования диастереоизомерных производных или комплексов, которые можно разделять, например кристаллизацией, газожидкостной или жидкостной хроматографией; селективной реакции одного энантиомера со специфичным к энантиомеру реагентом, например ферментативной эстерификации; или газожидкостной или жидкостной хроматографии в хиральной среде, например на хиральной подложке, например диоксиде кремния, со связанным хиральным лигандом или в присутствии хирального растворителя. Понятно, что, если необходимый энантиомер превращается в другое химическое вещество при помощи одной из процедур разделения, описанных выше, дополнительная стадия требуется для выделения необходимой энантиомерной формы. Альтернативно, конкретные энантиомеры можно синтезировать асимметричным синтезом при помощи оптически активных реагентов, субстратов, катализаторов или растворителей или путем превращения одного энантиомера в другой асимметричным преобразованием.
Когда соединение формулы (I) содержит больше одного хирального центра, оно может существовать в диастереоизомерных формах. Диастереоизомерные соединения можно разделять способами, известными специалистам в данной области, например хроматографией или кристаллизацией, и отдельные энантиомеры можно выделять, как описано выше. Настоящее изобретение включает в себя каждый диастереоизомер соединений формулы (I) (и их смеси).
Некоторые соединения формулы (I) могут существовать в различных таутомерных формах или в виде различных геометрических изомеров, и настоящее изобретение включает в себя каждый таутомер и/или геометрический изомер соединений формулы (I) и их смеси.
Некоторые соединения формулы (I) могут существовать в различных стабильных конформационных формах, которые можно разделять. Асимметрия скручивания из-за ограниченного вращения относительно асимметричной простой связи, например из-за пространственного затруднения или деформации кольца, может обеспечивать разделение различных конформеров. Настоящее изобретение включает в себя каждый конформационный изомер соединений формулы (I) и их смеси.
Некоторые соединения формулы (I) могут существовать в цвиттер-ионной форме, и настоящее изобретение включает в себя каждую цвиттер-ионную форму соединений формулы (I) (и их смеси).
При использовании в данном документе, термин "пролекарство" относится к средству, которое превращается в исходное лекарственное средство in vivo путем некоторого физиологического химического процесса (например, пролекарство при введении при физиологическом pH превращается в необходимую лекарственную форму). Пролекарства часто являются целесообразными, поскольку в некоторых ситуациях их можно легче вводить, чем исходное лекарственное средство. Они могут, например, быть биодоступными при пероральном введении, тогда как исходное лекарственное средство - нет. Пролекарство может также иметь улучшенную растворимость в фармакологических композициях по сравнению с исходным лекарственным средством. Пример, без ограничения, пролекарства будет представлять собой соединение по настоящему изобретению, где его вводят в виде сложного эфира ("пролекарства") для облегчения перехода через клеточную мембрану, если растворимость в воде не выгодна, а затем оно метаболически гидролизуется до карбоновой кислоты сразу внутри клетки, где растворимость в воде выгодна.
Пролекарства имеют множество полезных свойств. Например, пролекарство может быть в большей степени растворимым в воде, чем итоговое лекарственное средство, при этом облегчая внутривенное введение лекарственного средства. Пролекарство может также иметь более высокий уровень пероральной биодоступности, чем итоговое лекарственное средство. После введения пролекарство ферментативно или химически расщепляется для доставки итогового лекарственного средства в кровь или ткань.
Типичные пролекарства при расщеплении высвобождают соответствующую свободную кислоту, и такие гидролизуемые образующие сложный эфир остатки соединений по настоящему изобретению включают в себя без ограничения заместители, представляющие собой карбоновые кислоты, где свободный водород замещен (C1-C4)алкилом, (C1-C12)алканоилоксиметилом, (C4-C9)1-(алканоилокси)этилом, 1-метил-1-(алканоилокси)-этилом с 5-10 атомами углерода, алкоксикарбонилоксиметилом с 3-6 атомами углерода, 1-(алкоксикарбонилокси)этилом с 4-7 атомами углерода, 1-метил-1-(алкоксикарбонилокси)этилом с 5-8 атомами углерода, N-(алкоксикарбонил)аминометилом с 3-9 атомами углерода, 1-(N-(алкоксикарбонил)амино)этилом с 4-10 атомами углерода, 3-фталидилом, 4-кротонолактонилом, гамма-бутиролактон-4-илом, ди-N,N-(C1-C2)алкиламино(C2-C3)алкилом (таким как β-диметиламиноэтил), карбамоил-(C1-C2)алкилом, N,N-ди(C1-C2)-алкилкарбамоил-(C1-C2)алкилом и пиперидинo-, пирролидинo- или морфолинo(C2-C3)алкилом.
Другие типичные пролекарства высвобождают спирт формулы (I), где свободный водород заместителя, представляющего собой гидроксил (например, R1 предусматривает гидроксил), замещен (C1-C6)алканоилоксиметилом, 1-((C1-C6)алканоилокси)этилом, 1-метил-1-((C1-C6)алканоилокси)этилом, (C1-C12)алкоксикарбонилоксиметилом, N-(C1-C6)алкоксикарбониламинометилом, сукциноилом, (C1-C6)алканоилом, α-амино(C1-C4)алканоилом, арилактилом и α-аминоацилом или α-аминоацил-α-аминоацилом, где указанные фрагменты, представляющие собой α-аминоацил, независимо представляют собой любую из встречающихся в природе L-аминокислот, присутствующих в белках, P(O)(OH)2, -P(O)(O(C1-C6)алкил)2 или гликозилом (радикалом, получающимся при отщеплении гидроксила полуацеталя углевода).
Термин "гетероциклический", "гетероциклил" или "гетероциклилен", при использовании в данном документе, включает в себя неароматические кольцевые системы, в том числе без ограничения моноциклические, бициклические, трициклические и спироциклические кольца, которые могут быть полностью насыщенными или которые могут содержать один или несколько элементов ненасыщенности, во избежание недоразумений, степень ненасыщенности не дает ароматическую кольцевую систему), и они характеризуются 5-12 атомами, в том числе по меньшей мере одним гетероатомом, таким как азот, кислород или сера. Для иллюстративных целей, которые не должны толковаться как ограничивающие объем настоящего изобретения, следующие являются примерами гетероциклических колец: азепинил, азетидинил, индолинил, изоиндолинил, морфолинил, пиперазинил, пиперидинил, пирролидинил, хинуклидинил, тиоморфолинил, тетрагидропиранил, тетрагидрофуранил, тетрагидроиндолил, тиоморфолинил и тропанил.
Термин "гетероарил" или "гетероарилен", при использовании в данном документе, включает в себя ароматические кольцевые системы, в том числе без ограничения моноциклические, бициклические и трициклические кольца, и они характеризуются 5-12 атомами, в том числе по меньшей мере одним гетероатомом, таким как азот, кислород или сера. Для иллюстративных целей, которые не должны толковаться как ограничивающие объем настоящего изобретения: азаиндолил, бензо(b)тиенил, бензимидазолил, бензофуранил, бензоксазолил, бензотиазолил, бензотиадиазолил, бензоксадиазолил, фуранил, имидазолил, имидазопиридинил, индолил, индазолил, изоксазолил, изотиазолил, оксадиазолил, оксазолил, пуринил, пиранил, пиразинил, пиразолил, пиридинил, пиримидинил, пирролил, пирроло[2,3-d]пиримидинил, пиразоло[3,4-d]пиримидинил, хинолинил, хиназолинил, триазолил, тиазолил, тиофенил, тетразолил, тиадиазолил, тиенил, 6H-пирроло[2,3-e][1,2,4]триазоло[4,3-a]пиразинил, 6H-имидазо[1,5-a]пирроло[2,3-e]пиразинил, 1,6-дигидропиразоло[3,4-d]пирроло[2,3-b]пиридин, 3H-3,4,6,8a-тетраазаазиндаценил, 3H-имидазо[1,2-a]пирроло[2,3-e]пиразинил, пиразоло[3,4-d]пирроло[2,3-b]пиридинил, 1,6-дигидро-1,2,5,6-тетраза-аз-индаценил, 3H-3,4,8a-триаза-аз-индаценил, 6H-3-окса-2,5,6-триаза-аз-индаценил, 3,6-дигидро-2,3,6-тетрааза-аз-индаценил, 1,6-дигидродипирроло[2,3-b;2'3'-d]пиридинил, 6H-3-тиа-2,5,6-триаза-аз-индаценил, 4,5-дигидро-1H-бензо[b]азепин-2(3H)-он, 3,4-дигидрохинолин-2(1H)-он, 2H-бензо[b][1,4]оксазин-3(4H)-он или 6,7-дигидро-4H-пиразоло[5,1-c][1,4]оксазинил или 1,6-дигидроимидазо[4,5-d]пирроло[2,3-b]пиридин.
При использовании в данном документе, "алкил" "алкилен" или обозначения, такие как "(C1-C8)", включают в себя углеводороды с прямой или разветвленной цепью, которые полностью насыщены. Примерами алкилов являются метил, этил, пропил, изопропил, бутил, пентил, гексил и их изомеры. При использовании в данном документе, "алкенил", "алкенилен", "алкинилен" и "алкинил" означают C2-C8 и включают в себя углеводороды с прямой или разветвленной цепью, которые содержат один или несколько элементов ненасыщенности, одну или несколько двойных связей в случае алкенила и одну или несколько тройных связей в случае алкинила.
При использовании в данном документе, "ароматические" группы (или "арильные", или "ариленовые" группы) включают в себя ароматические карбоциклические кольцевые системы (например, фенил) и конденсированные полициклические ароматические кольцевые системы (например, нафтил, бифенил и 1,2,3,4-тетрагидронафтил).
При использовании в данном документе, "циклоалкил" или "циклоалкилен" означает C3-C12 моноциклические или полициклические (например, бициклические, трициклические, спироциклические и т. п.) углеводороды, которые полностью насыщены. Примерами циклоалкильной группы являются циклопропил, циклобутил, циклопентил, бицикло[1.1.1]пентил и циклогексил.
При использовании в данном документе, "циклоалкенил" означает C3-C12 моноциклические или полициклические (например, бициклические, трициклические, спироциклические и т.п.) углеводороды, которые имеют одну или несколько ненасыщенных связей, но их не причисляют к ароматической группе. Примерами циклоалкенильной группы являются циклопентенил и циклогексенил.
При использовании в данном документе, многие фрагменты или заместители называют как либо "замещенные", либо "необязательно замещенные". Когда фрагмент модифицирован одним из этих терминов, если иное не указано, это означает, что любая часть фрагмента, которая известна специалисту в данной области как доступная для замещения, может быть замещенной, что предусматривает один или несколько заместителей, где, если есть более одного заместителя, тогда каждый заместитель выбран независимо. Такие средства для замещения хорошо известны из уровня техники и/или сообщаются в данном раскрытии. Для иллюстративных целей, которые не должны толковаться как ограничивающие объем настоящего изобретения, некоторые примеры групп, которые являются заместителями, представляют собой: (C1-C8)алкильные группы, (C2-C8)алкенильные группы, (C2-C8)алкинильные группы, (C3-C10)циклоалкильные группы, галоген (F, Cl, Br или I), галогенированные (C1-C8)алкильные группы (например, без ограничения -CF3), -O-(C1-C8)алкильные группы, =O, =CH2, -OH, -CH2OH, -CH2NH2, (C1-C4)алкил-OH, -CH2CH2OCH2CH3, -S-(C1-C8)алкильные группы, -SH, -NH(C1-C8)алкильные группы, -N((C1-C8)алкил)2 группы, -NH2, -C(O)NH2, -CH2NHC(O)(C1-C4)алкил, -CH2NHC(O)CH2Cl, -CH2NHC(O)CH2CN, -CH2NHC(O)CH2CH2N(CH3)2, -CH2NHC(O)C(=CH2)CH3, -CH2NHC(O)(C2-C4)алкинил, -CH2NHC(O)CH2CH2-пиперидинил, -(C1-C4)алкилморфолинил, -CH2NHC(O)CH2O-фенил, где фенил необязательно замещен галогеном, (C1-C4)алкокси, -C(O)(C1-C4)алкил, -C(O)(C1-C4)алкокси, -C(O)N(H)2, -C(O)N(CH3)2, -C(O)(C1-C6)гетероарил, -N(CH3)2, -NHC(O)(C1-C4)алкил, -NHC(O)(C2-C4)алкенил, -NHC(O)CH2CN, -S(O)2(C1-C4)алкил, -S(O)2(C1-C6)гетероарил, -S(O)2(C1-C6)(C1-C6)гетероциклил, 4-метилпиперазинкарбонил, -(C1-C4)алкилC(O)NH2, -C(O)NH(C1-C8)алкильные группы, -C(O)N((C1-C8)алкил)2, -C(O)N(H)(C3-C8)циклоалкильные группы, -C(O)(C1-C4)алкокси, -NHC(O)H, -NHC(O)(C1-C8)алкильные группы, -NHC(O)(C3-C8)циклоалкильные группы, -N((C1-C8)алкил)C(O)H, -N((C1-C8)алкил)C(O)(C1-C8)алкильные группы, -NHC(O)NH2, -NHC(O)NH(C1-C8)алкильные группы, -N((C1-C8)алкил)C(O)NH2 группы, -NHC(O)N((C1-C8)алкил)2 группы, -N((C1-C8)алкил)C(O)N((C1-C8)алкил)2 группы, -N((C1-C8)алкил)C(O)NH((C1-C8)алкил), -NHCH2-гетероарил, бензил, -OCH2-гетероарил, -C(O)H, -C(O)(C1-C8)алкильные группы, -CN, -NO2, -S(O)(C1-C8)алкильные группы, -S(O)2(C1-C8)алкильные группы, -S(O)2N((C1-C8)алкил)2 группы, -S(O)2NH(C1-C8)алкильные группы, -S(O)2NH(C3-C8)циклоалкильные группы, -S(O)2NH2 группы, -NHS(O)2(C1-C8)алкильные группы, -N((C1-C8)алкил)S(O)2(C1-C8)алкильные группы, -(C1-C8)алкил-O-(C1-C8)алкильные группы, -O-(C1-C8)алкил-O-(C1-C8)алкильные группы, -C(O)OH, -C(O)O(C1-C8)алкильные группы, NHOH, NHO(C1-C8)алкильные группы, -O-галогенированные (C1-C8)алкильные группы (например, без ограничения -OCF3), -S(O)2-галогенированные (C1-C8)алкильные группы (например, без ограничения -S(O)2CF3), -S-галогенированные (C1-C8)алкильные группы (например, без ограничения -SCF3), -(C1-C6)гетероциклил (например, без ограничения пирролидин, тетрагидрофуран, пиран или морфолин), -(C1-C6)гетероарил (например, без ограничения тетразол, имидазол, фуран, пиразин или пиразол), -фенил, необязательно замещенный бензил, -NHC(O)O-(C1-C6)алкильные группы, -N((C1-C6)алкил)C(O)O-(C1-C6)алкильные группы, -C(=NH)-(C1-C6)алкильные группы, -C(=NOH)-(C1-C6)алкильные группы или -C(=N-O-(C1-C6)алкил)-(C1-C6)алкильные группы.
Термин "набор", при использовании в данном документе, относится к упакованному продукту, содержащему компоненты, с помощью которых вводят соединение формулы (I) по настоящему изобретению для лечения аутоиммунного нарушения. Набор предпочтительно содержит коробку или контейнер, в которых находятся компоненты набора. К коробке или контейнеру прикреплена этикетка или протокол, утвержденный Управлением по контролю за продуктами и лекарствами США. Коробка или контейнер содержат компоненты по настоящему изобретению, которые предпочтительно находятся в пластиковых, полиэтиленовых, полипропиленовых, этиленовых или пропиленовых емкостях. Емкости могут быть пробирками с крышками или бутылками. Набор также может предусматривать инструкции по введению соединения формулы (I).
Одно или несколько соединений по настоящему изобретению можно вводить пациенту-человеку само по себе или в фармацевтических композициях, где их смешивают с биологически подходящими носителями или вспомогательным(-и) веществом(-ами) в дозах для лечения или облегчения заболевания или патологического состояния, которые описаны в данном документе. Смеси этих соединений можно также вводить пациенту в виде простой смеси или в подходящих составленных фармацевтических композициях. Терапевтически эффективная доза относится к такому количеству соединения или соединений, которое достаточно для предупреждения или ослабления заболевания или патологического состояния, которые описаны в данном документе. Техники составления и введения соединений согласно настоящей заявке можно найти в литературе, хорошо известной специалисту в данной области, такой как "Remington's Pharmaceutical Sciences," Mack Publishing Co., Easton, PA, последнее издание.
Подходящие пути введения могут, например, включать пероральное введение, введение в виде глазных капель, ректальное, чресслизистое, местное или интестинальное введение; парентеральную доставку, в том числе внутримышечные, подкожные, интрамедуллярные инъекции, а также подоболочечные, прямые внутрижелудочковые, внутривенные, внутрибрюшинные, интраназальные или внутриглазные инъекции.
Альтернативно, можно вводить соединение местным, а не системным образом, например посредством инъекции соединения непосредственно в место отека, часто в составе-депо или составе замедленного высвобождения.
Кроме того, можно вводить лекарственное средство в целенаправленно воздействующей системе доставки лекарственного средства, например в липосоме, покрытой специфичным к клеткам эндотелия антителом.
Фармацевтические композиции по настоящему изобретению можно получать таким образом, который известен как таковой, например посредством обычных способов смешивания, растворения, гранулирования, получения драже, растирания в порошок, эмульгирования, инкапсуляции, захвата или сублимационной сушки.
Фармацевтические композиции для применения согласно настоящему изобретению, таким образом, можно составлять обычным образом при помощи одного или нескольких физиологически приемлемых носителей, предусматривающих вспомогательные вещества и вспомогательные средства, которые облегчают обработку активных соединений в препараты, которые можно использовать с фармацевтической точки зрения. Подходящий состав зависит от выбранного пути введения.
Для инъекции средства по настоящему изобретению можно составлять в водные растворы, предпочтительно в физиологически совместимых буферах, таких как раствор Хэнкса, раствор Рингера или физиологический солевой буфер. Для чресслизистого введения в составах используют обеспечивающие проникновение вещества, соответствующие барьеру, через который необходимо проникнуть. Такие обеспечивающие проникновение вещества обычно известны из уровня техники.
Для перорального введения соединения можно легко составлять путем объединения активных соединений с фармацевтически приемлемыми носителями, хорошо известными из уровня техники. Такие носители облегчают составление соединений по настоящему изобретению в форму таблеток, пилюль, драже, капсул, жидкостей, гелей, сиропов, взвесей, суспензий и подобного для перорального приема пациентом, подлежащим лечению. Фармацевтические препараты для перорального применения можно получать объединением активного соединения с твердым вспомогательным веществом, необязательно размолом полученной смеси и обработкой смеси гранул, после добавления подходящих вспомогательных средств, при необходимости, с получением таблеток или ядер драже. Подходящие вспомогательные вещества представляют собой, в частности, наполнители, такие как сахара, в том числе лактозу, сахарозу, маннит или сорбит; препараты целлюлозы, такие как, например, маисовый крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакантовая камедь, метилцеллюлоза, гидроксипропилметилцеллюлоза, натрий-карбоксиметилцеллюлоза и/или поливинилпирролидон (PVP). При необходимости, можно добавлять средства для улучшения распадаемости таблеток, такие как сшитый поливинилпирролидон, агар или альгиновая кислота или ее соль, такая как альгинат натрия.
Ядра драже обеспечивают подходящими покрытиями. Для этой цели можно использовать концентрированные растворы сахаров, которые могут необязательно содержать аравийскую камедь, тальк, поливинилпирролидон, карбопол гель, полиэтиленгликоль и/или диоксид титана, растворы глазури и подходящие органические растворители или смеси растворителей. В покрытия таблеток или драже для идентификации или для отличия различных комбинаций доз активных соединений можно добавлять красители или пигменты.
Фармацевтические препараты, которые можно принимать перорально, включают твердые капсулы, полученные из желатина, а также мягкие, герметичные капсулы, полученные из желатина и пластификатора, такого как глицерин или сорбит. Твердые капсулы могут содержать активные ингредиенты в смеси с наполнителем, таким как лактоза, связующими веществами, такими как виды крахмала, и/или смазывающими веществами, такими как тальк или стеарат магния, и необязательно стабилизаторами. В мягких капсулах активные соединения могут быть растворены или суспендированы в подходящих жидкостях, таких как жирные масла, жидкий парафин или жидкие полиэтиленгликоли. Кроме того, можно добавлять стабилизаторы. Все составы для перорального введения должны иметь дозы, подходящие для такого введения.
Для буккального введения композиции могут быть в форме таблеток или пастилок, составленных традиционным способом.
Для введения путем ингаляции соединения для применения в соответствии с настоящим изобретением обычно доставляют в форме распыляемого аэрозоля из находящихся под давлением упаковок или небулайзера с применением подходящего газа-вытеснителя, например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, углекислого газа или другого подходящего газа. В случае находящегося под давлением аэрозоля единица дозирования может определяться путем обеспечения клапана для доставки отмеренного количества. Капсулы и картриджи, например, из желатина для применения в ингаляторе или инсуффляторе могут быть составлены так, чтобы содержать порошковую смесь соединения и подходящую порошковую основу, такую как лактоза или крахмал.
Соединения можно составлять для парентерального введения путем инъекции, например болюсной инъекции или непрерывной инфузии. Составы для инъекции могут быть представлены в виде единичной лекарственной формы, например в ампулах или многодозных контейнерах, с добавленным консервантом. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в маслянистых или водных средах и могут содержать средства для составления, такие как суспендирующие, стабилизирующие и/или диспергирующие средства.
Фармацевтические составы для парентерального введения включают водные растворы активных соединений в растворимой в воде форме. Кроме того, суспензии активных соединений можно получать в виде соответствующих масляных суспензий для инъекций. Подходящие липофильные растворители или среды включают жирные масла, такие как кунжутное масло, или синтетические сложные эфиры жирных кислот, такие как этилолеат или триглицериды, или липосомы. Водные суспензии для инъекций могут содержать вещества, которые повышают вязкость суспензии, такие как натрий карбоксиметилцеллюлоза, сорбит или декстран. Необязательно суспензия может также содержать подходящие стабилизаторы или средства, которые повышают растворимость соединений, для обеспечения получения высококонцентрированных растворов.
В качестве альтернативы активный ингредиент может находиться в форме порошка для разбавления с помощью подходящей среды, например стерильной воды, не содержащей пирогены, перед применением.
Соединения можно также составлять в виде композиций для ректального введения, таких как суппозитории или удерживающие клизмы, например, содержащие традиционные основы для суппозиториев, такие как какао-масло или другие глицериды.
Помимо составов, описанных ранее, соединения можно также составлять в виде препарата-депо. Такие составы длительного действия можно вводить путем имплантации (например, подкожно или внутримышечно или с помощью внутримышечной инъекции). Таким образом, например, соединения могут быть составлены с подходящими полимерными или гидрофобными материалами (например, как эмульсия в приемлемом масле) или ионообменными смолами или в качестве умеренно растворимых производных, например в качестве умеренно растворимой соли.
Пример фармацевтического носителя в случае гидрофобных соединений по настоящему изобретению представляет собой систему сорастворителей, содержащую бензиловый спирт, неполярное поверхностно-активное вещество, смешиваемый с водой органический полимер и водную фазу. Система сорастворителей может быть системой сорастворителей VPD. VPD представляет собой раствор из 3% вес/об. бензилового спирта, 8% вес/об. неполярного поверхностно-активного вещества полисорбата 80 и 65% вес/об. полиэтиленгликоля 300, доведенный до необходимого объема абсолютным этанолом. Система сорастворителей VPD (VPD:5W) состоит из VPD, разбавленного 1:1 с помощью 5% декстрозы в водном растворе. Эта система сорастворителей хорошо растворяет гидрофобные соединения, и сама имеет низкую токсичность при системном введении. Конечно, пропорции в системе сорастворителей могут значительно изменяться без ухудшения ее характеристик растворимости и токсичности. Кроме того, тождественность компонентов-сорастворителей может изменяться: например, другие слаботоксичные неполярные поверхностно-активные вещества можно использовать вместо полисорбата 80; размер фракции полиэтиленгликоля может изменяться; другие биосовместимые полимеры могут замещать полиэтиленгликоль, например поливинилпирролидон; и другие сахара или полисахариды могут подменять декстрозу.
Альтернативно, можно использовать другие системы доставки для гидрофобных фармацевтических соединений. Липосомы и эмульсии являются хорошо известными примерами сред или носителей доставки для гидрофобных лекарственных средств. Также можно использовать некоторые органические растворители, такие как диметилсульфоксид, хотя обычно за счет большей токсичности. Кроме того, соединения можно доставлять при помощи системы замедленного высвобождения, такой как полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие терапевтическое средство. Различные материалы замедленного высвобождения являются общепринятыми и хорошо известными для специалистов в данной области. Капсулы замедленного высвобождения могут, в зависимости от своей химической природы, высвобождать соединения в течение от нескольких недель до свыше 100 дней. В зависимости от химической природы и биологической стабильности терапевтического реагента можно использовать дополнительные стратегии для стабилизации белка.
Фармацевтические композиции также могут содержать подходящие твердые или гелеобразные носители или вспомогательные вещества. Примеры таких носителей или вспомогательных веществ включают без ограничения карбонат кальция, фосфат кальция, различные сахара, виды крахмала, производные целлюлозы, желатин и полимеры, такие как полиэтиленгликоли.
Многие из соединений по настоящему изобретению могут предусматриваться в виде солей с фармацевтически совместимыми противоионами. Фармацевтически совместимые соли могут быть образованы с помощью многих кислот, в том числе без ограничения хлористоводородной, серной, уксусной, молочной, виннокаменной, яблочной, янтарной и пр. Соли, как правило, более растворимы в водных или других протонных растворителях, чем соответствующие формы свободного основания.
Фармацевтические композиции, подходящие для применения в настоящем изобретении, включают композиции, где активные ингредиенты содержатся в эффективном количестве для достижения своей предполагаемой цели. Более конкретно, терапевтически эффективное количество означает количество, эффективное для предупреждения развития или для облегчения существующих симптомов у субъекта, подлежащего лечению. Определение эффективных количеств находится в пределах компетенции специалистов в данной области.
Для любого соединения, используемого в способе по настоящему изобретению, терапевтически эффективную дозу можно установить изначально из клеточных анализов. Например, дозу можно составлять с использованием клеточной и животной моделей для достижения диапазона циркулирующей концентрации, который включает в себя IC50, определенную в клеточных анализах (например, концентрацию тестового соединения, при которой достигается половина максимального ингибирования активности заданной протеинкиназы). В некоторых случаях уместно определять IC50 в присутствии 3-5% сывороточного альбумина, поскольку такое определение приблизительно соответствует эффектам связывания белка плазмы на соединение. Такую информацию можно использовать для более точного определения пригодных доз для людей. Кроме того, наиболее предпочтительные соединения для системного введения эффективно ингибируют передачу сигнала с участием протеинкиназы в интактных клетках на уровнях, которые безопасно достигаются в плазме.
Терапевтически эффективная доза относится к такому количеству соединения, которое приводит к облегчению симптомов у пациента. Токсичность и терапевтическую эффективность таких соединений можно определять стандартными фармацевтическими процедурами на клеточных культурах или экспериментальных животных, например для определения максимальной переносимой дозы (MTD) и ED50 (эффективной дозы для 50% максимального ответа). Соотношение между эффектами токсичности и терапевтическими эффектами для дозы представляет собой терапевтический индекс, и его можно выражать как соотношение между MTD и ED50. Соединения, которые проявляют высокие терапевтические индексы, являются предпочтительными. Данные, полученные из этих анализов клеточных культур и исследований на животных, можно использовать в составлении диапазона доз для применения для людей. Доза таких соединений лежит предпочтительно в диапазоне циркулирующих концентраций, которые включают в себя ED50 с небольшой токсичностью или без нее. Доза может изменяться в пределах этого диапазона в зависимости от используемой лекарственной формы и используемого пути введения. Точный состав, путь введения и дозу может выбирать лечащий врач, учитывая состояние пациента (см., например, Fingl et al., 1975, в The Pharmacological Basis of Therapeutics, Ch. 1, p. 1). При лечении кризисов для получения быстрой реакции может требоваться введение экстренной разовой дозы или инфузии, приближающейся к MTD.
Количество и интервал дозирования можно регулировать индивидуально для обеспечения уровней активного фрагмента в плазме крови, которые достаточны для поддержания эффектов модулирования киназы или минимальной эффективной концентрации (MEC). MEC будет изменяться для каждого соединения, но может быть определена из in vitro данных; например концентрация, необходимая для достижения 50-90% ингибирования протеинкиназы, определенная при помощи анализов, описанных в данном документе. Дозы, необходимые для достижения MEC, будут зависеть от индивидуальных особенностей и пути введения. Однако результаты анализов с использованием HPLC или биоанализов можно использовать для определения концентраций в плазме крови.
Интервалы дозирования можно также определять при помощи значения MEC. Соединения следует вводить с использованием режима, который поддерживает уровни в плазме крови выше MEC в течение 10-90% времени, предпочтительно 30-90% и наиболее предпочтительно 50-90%, пока необходимое облегчение симптомов не будет достигнуто. В случаях местного введения или селективного поглощения эффективная местная концентрация лекарственного средства может быть не связана с концентрацией в плазме крови.
Количество вводимой композиции будет, конечно, зависеть от субъекта, подлежащего лечению, от веса субъекта, тяжести болезни, способа введения и заключения лечащего врача.
Композиции могут, при необходимости, находиться в упаковке или распределительном устройстве, которое может содержать одну или несколько стандартных лекарственных форм, содержащих активный ингредиент. Упаковка может, например, содержать металлическую или полимерную пленку, такая как блистерная упаковка. Упаковка или распределительное устройство могут иметь инструкции по применению. Композиции, содержащие соединение по настоящему изобретению, составленные в совместимом фармацевтическом носителе, можно также получать, помещать в соответствующий контейнер и маркировать для лечения указанного патологического состояния.
В некоторых составах может быть предпочтительно использовать соединения по настоящему изобретению в форме частиц очень малого размера, например получаемых при измельчении в псевдоожиженном слое.
Применение соединений по настоящему изобретению при получении фармацевтических композиций показано в приведенном ниже описании. В этом описании термин "активное соединение" означает любое соединение по настоящему изобретению, но особенно любое соединение, которое является готовым продуктом одного из приведенных ниже примеров.
a) Капсулы
При получении капсул 10 частей по весу активного соединения и 240 частей по весу лактозы можно подвергать дезагрегации и смешивать. Смесь можно заполнять в твердые желатиновые капсулы, причем каждая капсула содержит разовую дозу или часть разовой дозы активного соединения.
b) Таблетки
Таблетки можно получать, например, из приведенных ниже ингредиентов.
Части по весу
Активное соединение 10
Лактоза 190
Маисовый крахмал 22
Поливинилпирролидон 10
Стеарат магния 3.
Активное соединение, лактоза и некоторое количество крахмала можно подвергать дезагрегации, смешивать и полученную смесь можно гранулировать с раствором поливинилпирролидона в EtOH. Сухой гранулят можно смешивать со стеаратом магния и остатком крахмала. Смесь затем прессуют в таблеточной машине с получением таблеток, причем каждая содержит разовую дозу или часть разовой дозы активного соединения.
c) Таблетки с энтеросолюбильным покрытием
Таблетки можно получать способом, описанным в (b), выше. Таблетки могут быть покрыты энтеросолюбильным покрытием традиционным способом, используя раствор 20% ацетатфталата целлюлозы и 3% диэтилфталата в EtOH:DCM (1:1).
d) Суппозитории
При получении суппозиториев, например, 100 частей по весу активного соединения можно включать в 1300 частей по весу основы суппозитория, представляющей собой триглицерид, и
смесь формируют в суппозитории, при этом каждый содержит терапевтически эффективное количество активного ингредиента.
В композициях по настоящему изобретению активное соединение может, при необходимости, быть связано с другими совместимыми фармакологически активными ингредиентами. Например, соединения по настоящему изобретению можно вводить в комбинации с другим терапевтическим средством, которое известно для лечения заболевания или патологического состояния, описанного в данном документе. Соединения по настоящему изобретению можно вводить перед дополнительным фармацевтическим средством, после него или одновременно с ним, независимо от того, какой путь является подходящим. Дополнительные фармацевтические средства включают в себя без ограничения противоотечные стероиды, NSAID, ингибиторы ras, средства к IL1, антигистаминные средства, антагонисты PAF, ингибиторы COX-1, ингибиторы COX-2, ингибиторы NO-синтазы, ингибиторы Akt/PTB, ингибиторы IGF-1R, ингибиторы PKC, ингибиторы PI3 киназы, ингибиторы кальциневрина и иммунодепрессанты. Соединения по настоящему изобретению и дополнительные фармацевтические средства работают либо аддитивно, либо синергетически.
Настоящее изобретение также включает применение соединения формулы (I) в качестве лекарственного препарата.
Настоящее изобретение также обеспечивает способ лечения ревматоидного артрита, ювенильного ревматоидного артрита, псориаза, псориатического артрита, болезни Крона, воспалительного заболевания кишечника, язвенного колита, анкилозирующего спондилита, реактивного артрита, артрита, связанного с воспалительным заболеванием кишечника, недифференцированного спондилоартрита, системной красной волчанки, люпус-нефрита, увеита, атопического дерматита, рассеянного склероза, типов аксиального спондилоартрита или гнойного гидраденита и/или других нарушений иммунной системы, который включает введение терапевтически эффективного количества соединения формулы (I) млекопитающему, в частности человеку, нуждающемуся в этом.
СОКРАЩЕНИЯ
|
ОБЩИЕ СХЕМЫ СИНТЕЗА
Соединения по настоящему изобретению можно получать при помощи синтетических преобразований, показанных на схемах I-XXIII. Исходные материалы коммерчески доступны, могут быть получены с помощью процедур, описанных в данном документе, с помощью процедур из литературы или с помощью процедур, которые должны быть хорошо известны специалисту в области органической химии.
Схема I. Общие способы получения 2,4-дихлор-3-((1-метил-1H-индол-2-ил)метил)бензамидных соединений по настоящему изобретению показаны на схеме I, а также описаны в примере A, A1, L, M, V, AA, AC, AX: (R= Br, CN, CF3, Me, H; R1= CN, CF3, Me, H; R2= CN, CF3, Me, H; R3= первичный или вторичный амин).

Схема II. Общие способы получения (2,4-дихлор-3-((1-алкил-1H-индол-2-ил)метил)фенил)(морфолинo)метаноновых соединений по настоящему изобретению показаны на схеме II, а также описаны в примере C, D, E, P, AB, AE: (R= CN, CF3, Me, H; R1= CN, CF3, Me, H; R2= CN, CF3, Me, H; R3= Cl, Me, H; R4= Cl, Me, H: R5= H, алкильный или ацильный заместитель).

Схема III. Общие способы получения 2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-3-ил)метил)бензамидных)) соединений по настоящему изобретению показаны на схеме III, а также описаны в примере F: (R= CN, CF3, Me, H; R1= CN, CF3, Me, H; R2= первичный или вторичный амин).
Схема IV. Общие способы получения 2-(2,6-дихлор-3-алкоксибензил)-1-метил-1H-индольных соединений по настоящему изобретению показаны на схеме IV, а также описаны в примерах W, X, Y, Z, AF, AG, AH, AI, AJ, AK, AL, BI: (R= CN, CF3, Me, H; R1= CN, CF3, Me, H; R2= CN, CF3, Me, H; R3= H, алкил, циклоалкил, CH2-гетероцикл; X= C или N).

Схема V. Общие способы получения 3,5-дихлор-4-((1-метил-1H-индол-2-ил)метил)бензамидных соединений по настоящему изобретению показаны на схеме V, а также описаны в примере R: (R= CN, CF3, Me, Cl, H; R1= CN, CF3, Me, Cl, H; R2= CN, CF3, Me, Cl, H; R3= первичный или вторичный амин).

Схема VI. Общие способы получения 2,4-дизамещенных-3-((1-метил-1H-бензо[d]имидазол-2-ил)метил)бензамидных соединений по настоящему изобретению показаны на схеме VI, а также описаны в примере BJ, BK, BL, BM, BN, BQ, BR, BU, BV, BY, BZ, CA, CB: (R= CN, CF3, алкил, галогенид, амид, H; R1= CN, CF3, алкил, галогенид, амид, H; R2= CN, CF3, алкил, галогенид, амид, H; R3= CN, CF3, алкил, галогенид, амид, H; R4= Cl, алкил; R5 первичный или вторичный амин).
Схема VII. Общие способы получения (2,4-дихлор-3-((3-метил-3H-имидазо[4,5-b]пиридин-2-ил)метил)фенил)(морфолинo)метаноновых соединений по настоящему изобретению показаны на схеме VII, а также описаны в примере CI, DA: (R= CN, CF3, алкил, галогенид, амид, H).

Схема VIII. Общие способы получения N-(3,5-дихлор-4-((1-метил-1H-бензо[d]имидазол-2-ил)метил)фенил)ацетамидных соединений по настоящему изобретению показаны на схеме VIII, а также описаны в примере CJ: (R= CN, CF3, алкил, H; R1= CN, CF3, алкил, H; R2= алкил или циклоалкил).

Схема IX. Общие способы получения 2,4-дихлор-3-((1-метил-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензамидных соединений по настоящему изобретению показаны на схеме IX, а также описаны в примере CL: (R= CN, CF3, алкил, H; R1= CN, CF3, алкил, H, галоген; R2= первичный или вторичный амин).
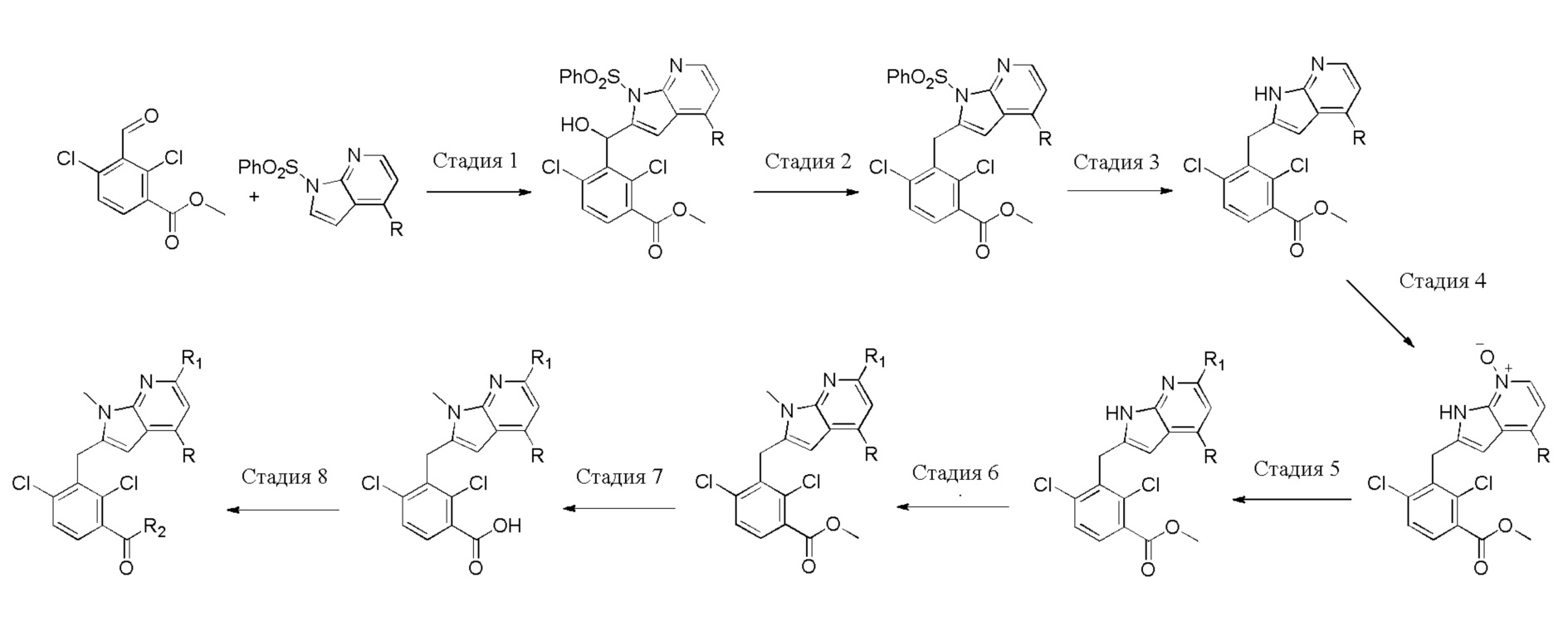
Схема X. Общие способы получения (2,4-дихлор-3-((1-метил-1H-пирроло[3,2-b]пиридин-2-ил)метил)фенил)(морфолинo)метаноновых соединений по настоящему изобретению показаны на схеме X, а также описаны в примере CO: (R= CN, CF3, алкил, H; R1= CN, CF3, алкил, H; R2= первичный или вторичный амин).
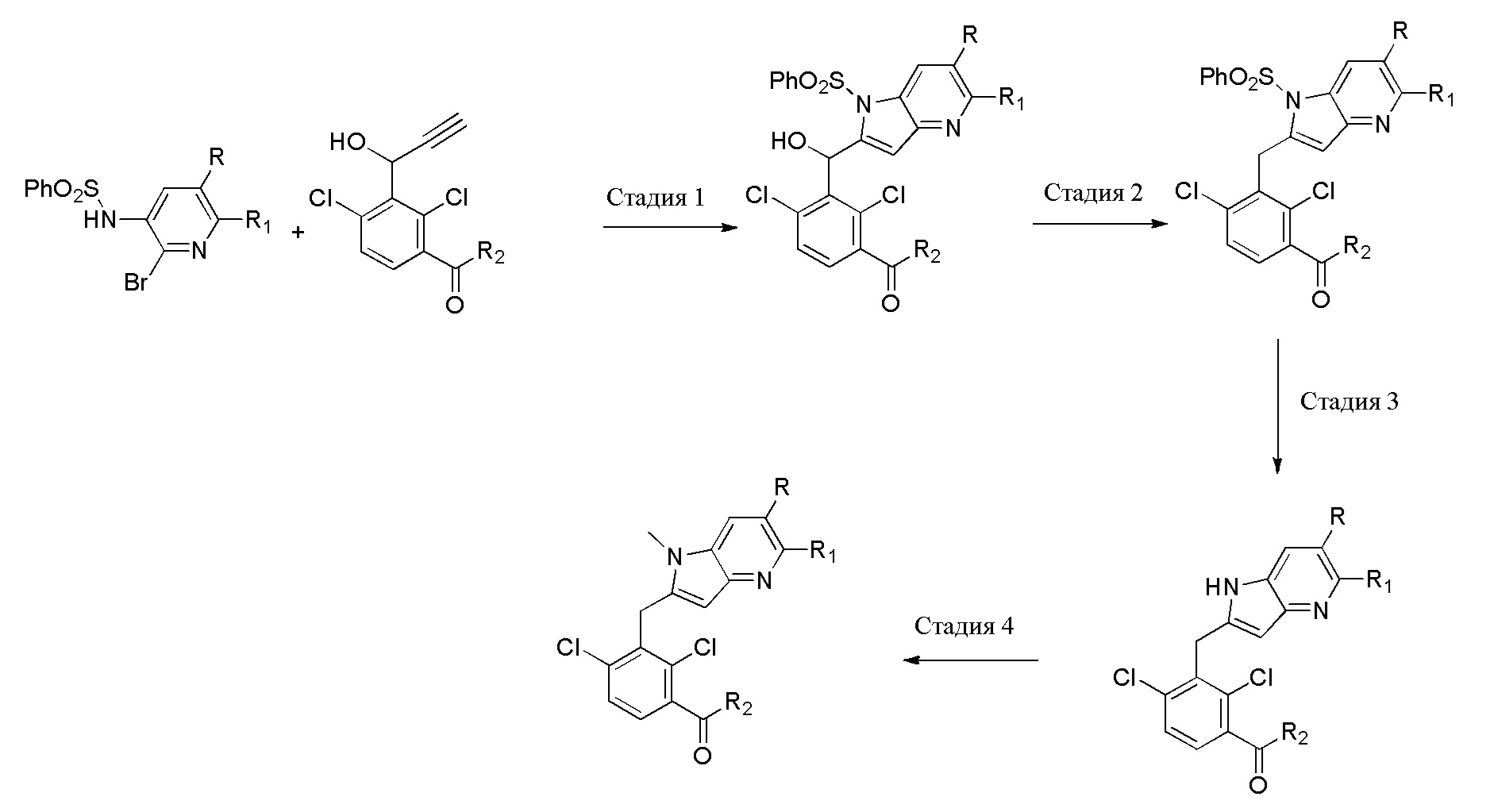
Схема XI. Общие способы получения 2,4-дихлор-3-((1-метил-1H-пирроло[3,2-c]пиридин-2-ил)метил)бензамидных соединений по настоящему изобретению показаны на схеме XI, а также описаны в примере CQ, CR и CS: (R= CN, CF3, алкил, H; R1= CN, CF3, алкил, H; R2= первичный или вторичный амин).
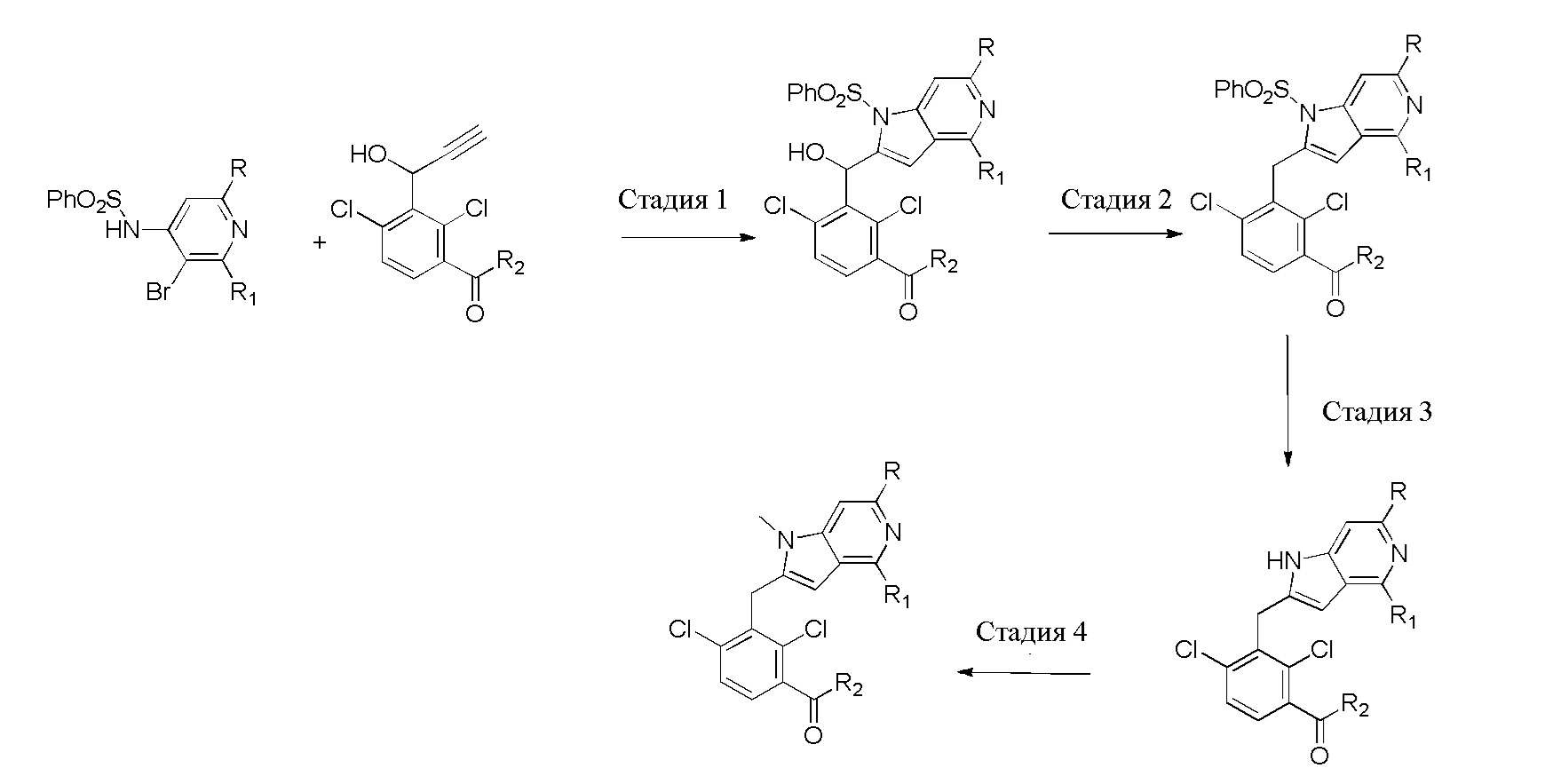
Схема XII. Общие способы получения 2,4-дихлор-3-((3-метилимидазо[1,2-a]пиридин-2-ил)метил)бензамидных соединений по настоящему изобретению показаны на схеме XII, а также описаны в примере CT, CV, CW и CZ: (R= CN, CF3, алкил, галогенид, H; R1= CN, CF3, алкил, галогенид, H; R2= CN, CF3, алкил, галогенид, H; R3= первичный или вторичный амин; X= C или N).

Схема XIII. Общие способы получения 2,4-дихлор-3-((1-метил-3,4-дигидроизохинолин-2(1H)-ил)метил)бензамидных соединений по настоящему изобретению показаны на схеме XIII, а также описаны в примере DO:
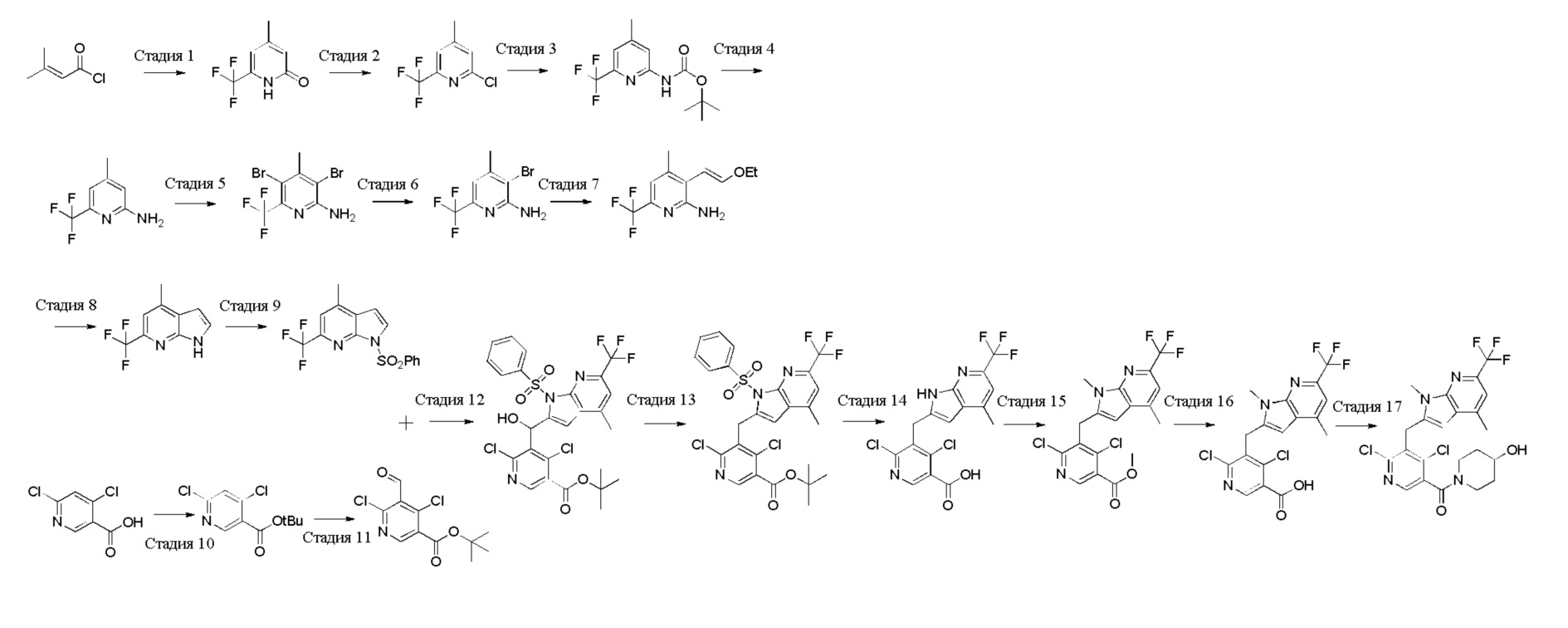
Схема XIV. Общие способы получения 2,4-дизамещенных-3-((1-алкил-1H-бензо[d]имидазол-2-ил)метил)бензамидных соединений по настоящему изобретению показаны на схеме XIV, а также описаны в примерах CG и CH: (R= H; R1= CN, CF3, алкил, галогенид, амид, H; R2= CN, CF3, алкил, галогенид, амид, H; R3= CN, CF3, алкил, галогенид, амид, H; R4=Cl, алкил; R5=первичный или вторичный амин; R6=алкил).

Схема XV. Общие способы получения 2,4-дизамещенных-3-((1-метил-1H-бензо[d]имидазол-2-ил)метил)бензиламинных соединений по настоящему изобретению показаны на схеме XV, а также описаны в примерах BW и BX: (R= CN, CF3, алкил, галогенид, амид, H; R1= CN, CF3, алкил, галогенид, амид, H; R2= CN, CF3, алкил, галогенид, амид, H; R3= CN, CF3, алкил, галогенид, амид, H; R4= Cl, алкил; R5=первичный или вторичный амин).
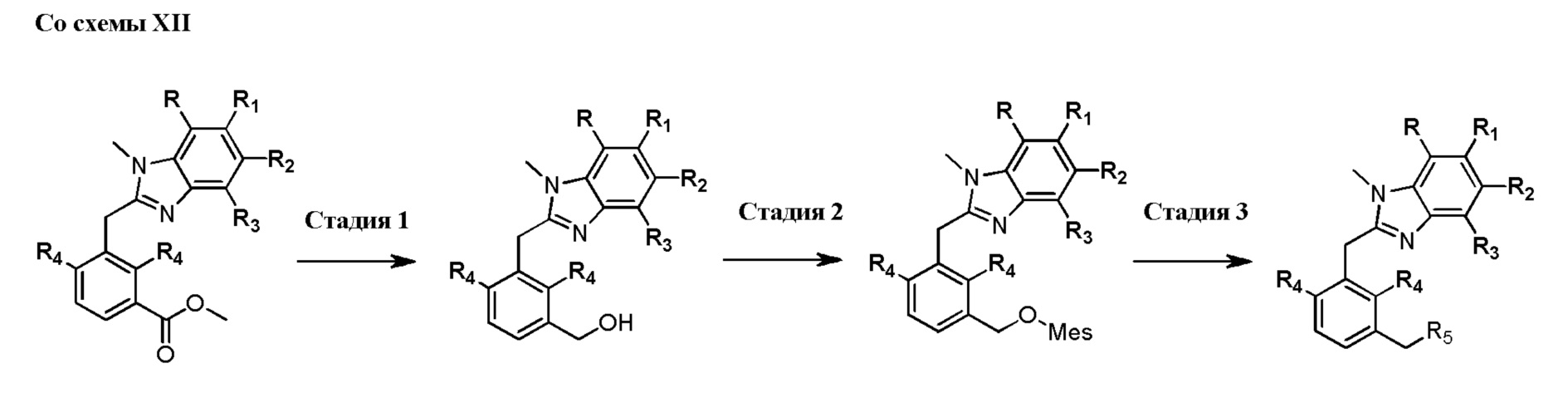
Схема XVI. Общие способы получения (2,4-дихлор-3-((3-метил-1H-индазол-1-ил)метил)бензамидных или (2,4-дихлор-3-((3-метил-2H-индазол-2-ил)метил)бензамидных соединений по настоящему изобретению показаны на схеме XVI, а также описаны в примерах DD, DD1, DE, DF и DG: (R1= CN, CF3, алкил, галогенид, амид, H; R2= CN, CF3, алкил, галогенид, амид, H; R3= CN, CF3, алкил, галогенид, амид, H; R4= CN, CF3, алкил, галогенид, амид, H; R5= метил; R6=первичный или вторичный амин; R7=хлор).
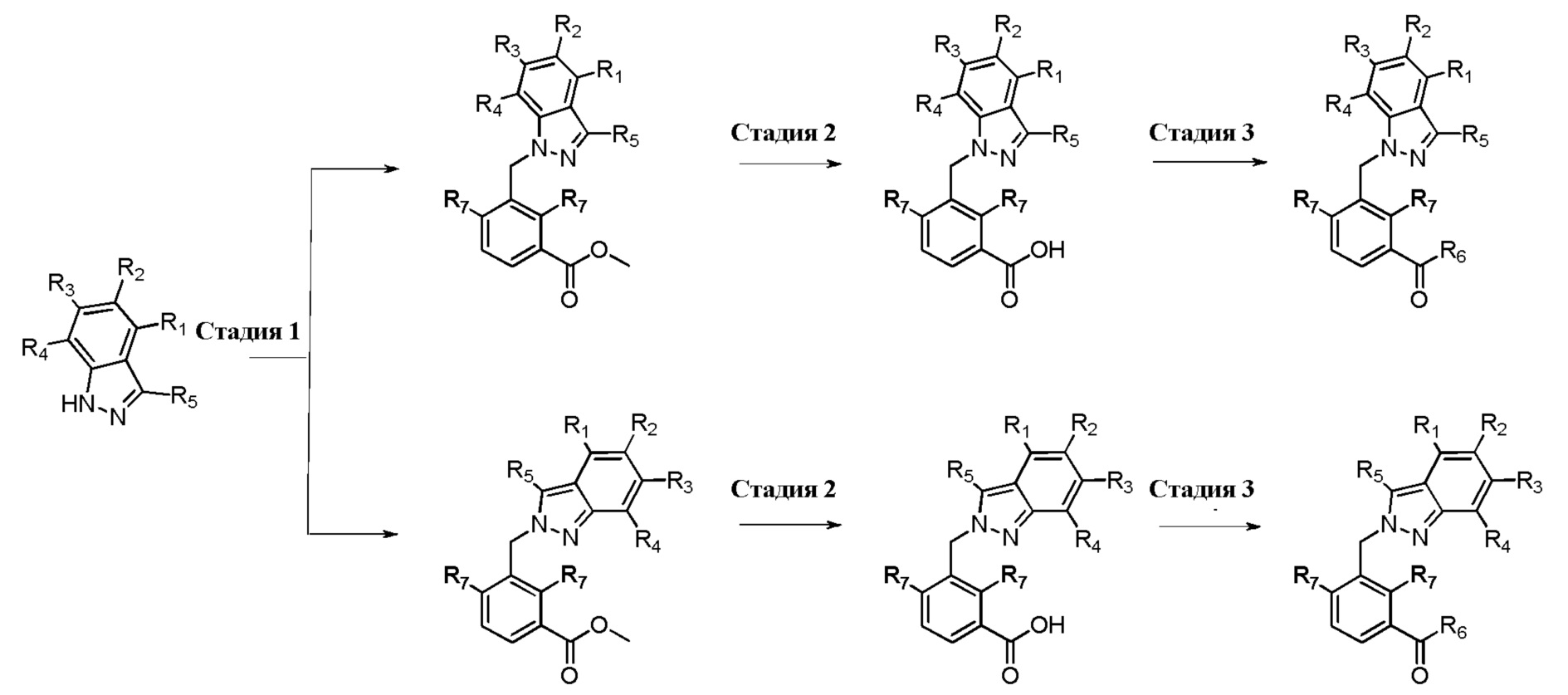
Схема XVII. Общие способы получения (2,4-дихлор-3-((3-метил-3H-имидазо[4,5-b]пиридин-2-ил)метил)фенил)(морфолинo)метаноновых соединений по настоящему изобретению показаны на схеме XVII, а также описаны в примере DC: (R= CN, CF3, алкил, галогенид, амид, H).

Схема XVIII. Общие способы получения 2,4-дихлор-3-((1-метил-1H-индол-2-ил)метил)пиридилкарбоксамидных соединений по настоящему изобретению показаны на схеме XVIII, а также описаны в примерах BB, BC, BE, BF, BG и BH: (A=A=C=N или N=C; R= CN, CF3, Me, H; R1= CN, CF3, Me, H; R2= CN, CF3, Me, H; R3= первичный или вторичный амин, R4= Cl, Me, H).
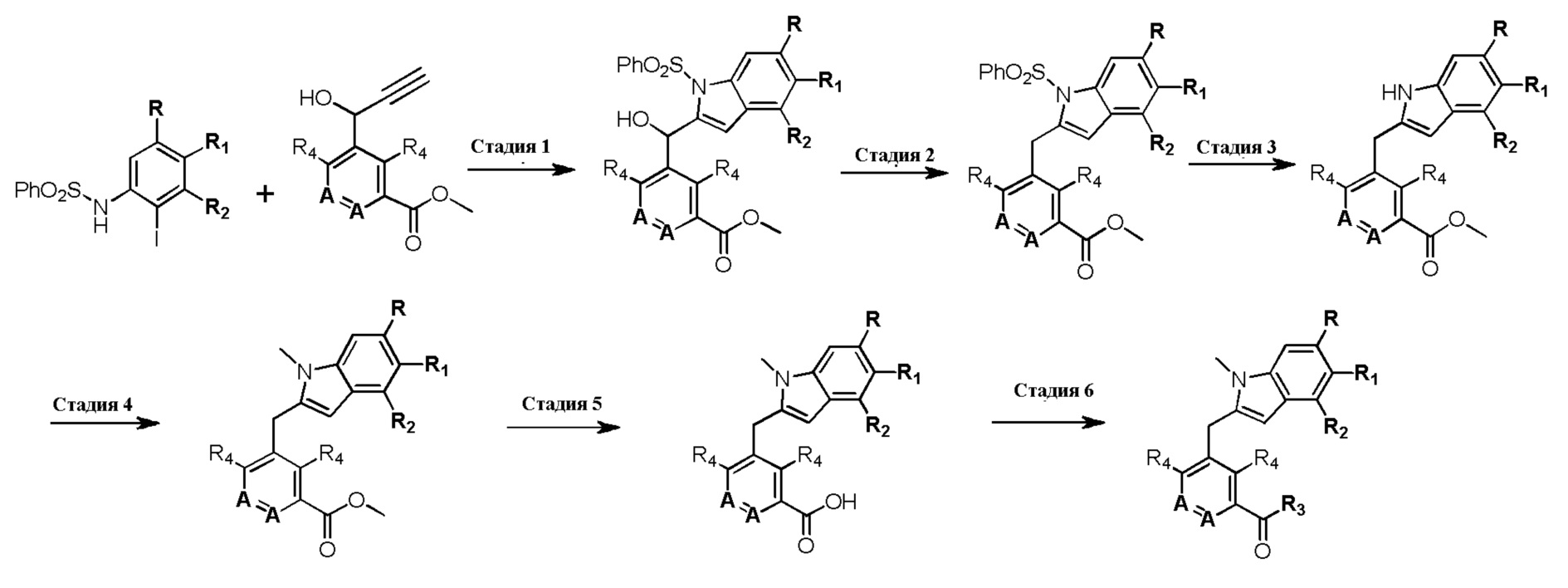
Схема XIX. Общие способы получения 2,4-дизамещенных-3-((1H-индол-2-ил)метил)бензамидных соединений по настоящему изобретению показаны на схеме XIX, а также описаны в примере AS: (R= CN, CF3, Me, H; R1= CN, CF3, Me, H; R2= CN, CF3, Me, H; R4= Cl, Me; R5= CN, CF3, Me, H; R3= первичный или вторичный амин).

Схема XX. Общие способы получения 2,4-дихлор-3-(1-метил-1H-индол-2-карбонил)бензамидных соединений по настоящему изобретению показаны на схеме XX, а также описаны в примерах AN, AO, AP и AQ: (A= C, N; R= CN, CF3, Me, H; R1= CN, CF3, Me, H; R2= CN, CF3, Me, H; R3= первичный или вторичный амин).
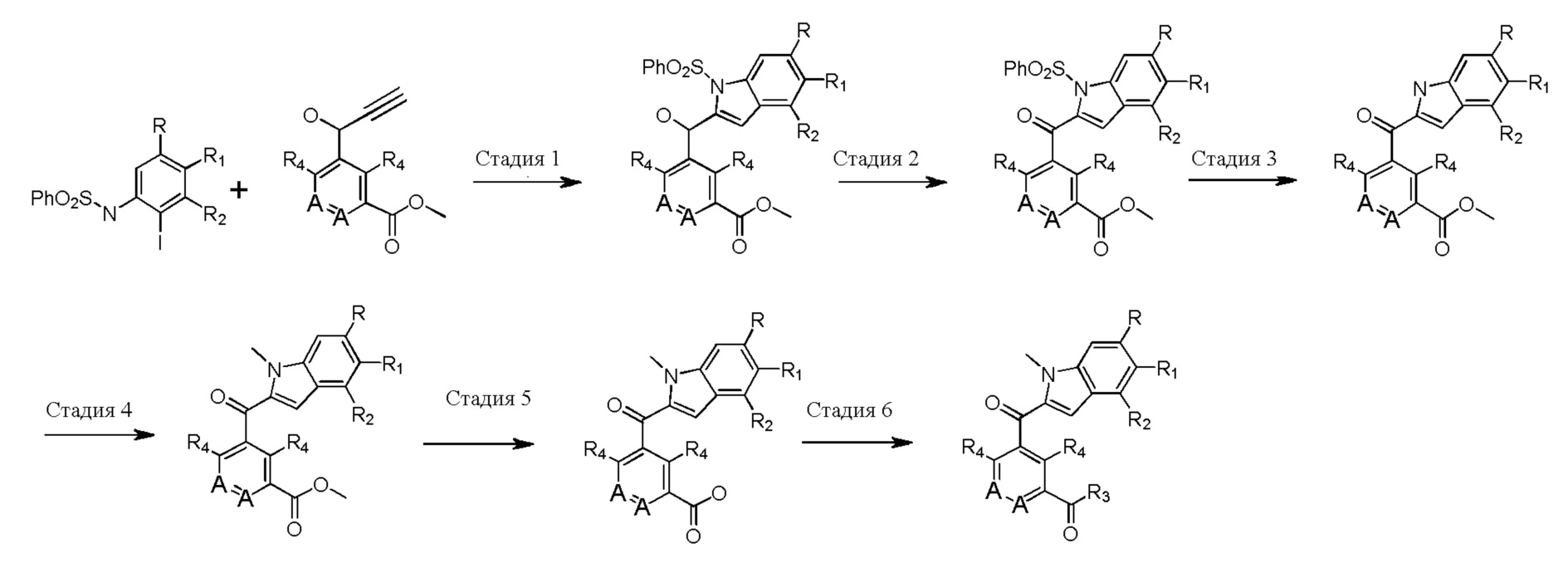
Схема XXI. Общие способы получения 2,4-дизамещенных-3-((1-метил-1H-индол-2-ил)метил)бензиламинных соединений по настоящему изобретению показаны на схеме XXI, а также описаны в примере AU: (R= CN, CF3, алкил, галогенид, амид, H; R1= CN, CF3, алкил, галогенид, амид, H; R2= CN, CF3, алкил, галогенид, амид, H; R3= CN, CF3, алкил, галогенид, амид, H; R4=Cl, алкил; R5=первичный или вторичный амин).
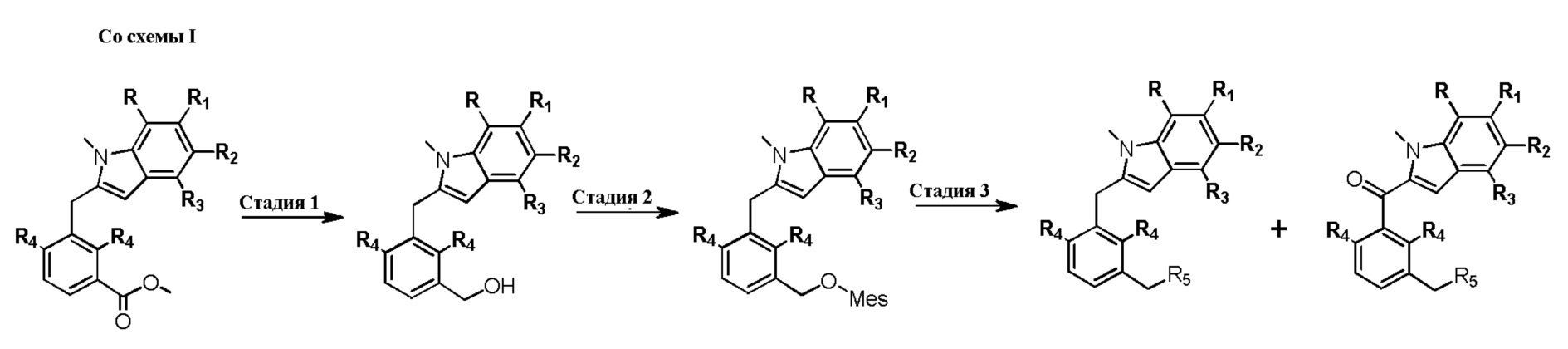
Схема XXII. Общие способы получения 2,4-дихлор-3-((1-метил-6-морфолинo-1H-индол-2-ил)метил)бензамидных соединений по настоящему изобретению показаны на схеме XXII, а также описаны в примере AY: (R1= CN, CF3, Me, H; R2= CN, CF3, Me, H; R3= первичный или вторичный амин).

Схема XXIII. Общие способы получения 2,4-дихлор-3-(1H-индол-1-ил)метил)бензамидных соединений по настоящему изобретению показаны на схеме XXIII, а также описаны в примерах J, DH, DI, DJ, DK, DL, DM и DN: (R1= CN, CF3, Me, H; R2= CN, CF3, Me, H; R3= CN, CF3, Me, H; R4= CN, CF3, Me, H; R5= Me, H; R6= первичный или вторичный амин; X= H, O, R7= Me или трет-Bu).
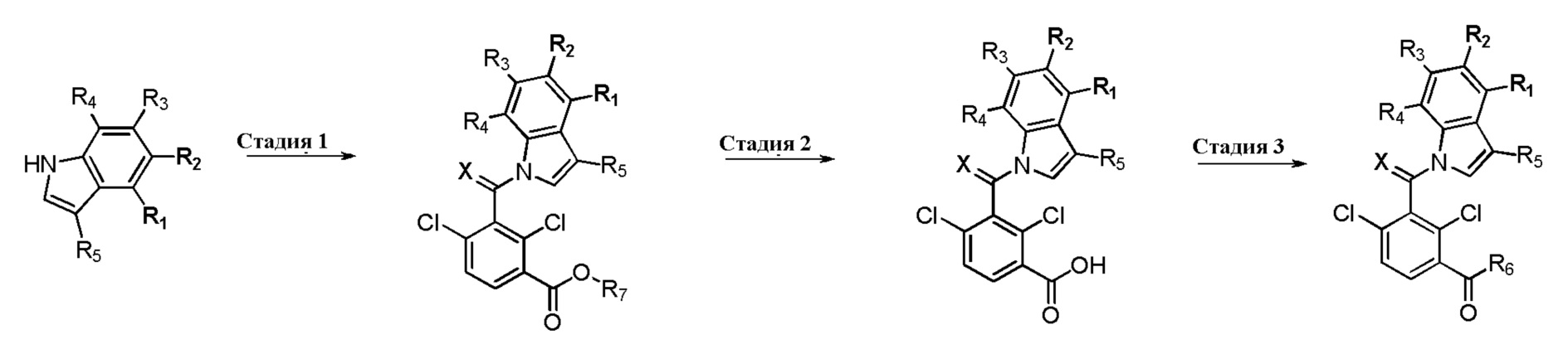
АНАЛИТИЧЕСКИЕ СПОСОБЫ
Аналитические данные включены в процедуры, приведенные ниже, в иллюстрации общих процедур или в таблицы примеров. Если иное не указано, все данные 1H-ЯМР получали на приборе Varian Mercury Plus, 400 МГц или Varian Inova, 600 МГц и химические сдвиги указаны в частях на миллион (ppm). При получении данных с помощью LC/MS и HPLC ссылаются на таблицу условий для LC/MS и HPLC, используя букву способа, набранную нижним регистром, указанную в таблице 1.
Таблица 1. Способы LC/MS и HPLC.
|
Таблица 2. Способы хиральной HPLC
|
ПОЛУЧЕНИЯ И ПРИМЕРЫ
Общие способы синтеза, используемые в каждом получении, следуют далее и включают пример соединения, которое синтезировали. Ни одно из конкретных условий и реагентов, указанных в данном документе, не следует рассматривать как ограничивающее объем настоящего изобретения, и они представлены только для иллюстративных целей. Все исходные материалы коммерчески доступны от компании Sigma-Aldrich (в том числе Fluka и Discovery CPR), если иное не указано после химического названия. Данные названия реагентов/реактивов являются такими как наименования на продаваемой бутылке или образованными согласно условным обозначениям IUPAC, CambridgeSoft® ChemDraw Ultra 9.0.7, CambridgeSoft® Chemistry E-Notebook 9.0.127 или AutoNom 2000. Соединения, обозначенные как соли (например, гидрохлорид, ацетат), могут содержать более одного молярного эквивалента соли. Соединения по настоящему изобретению, где абсолютная стереохимия была определена при помощи коммерчески доступного энантиомерно чистого исходного материала или стереохимически определенного промежуточного соединения или при помощи рентгеновской дифракции, обозначаются звездочкой после номера примера.
Получение №1. Метил-2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)бензоат

Стадия A: метил-2,4-дихлор-3-метилбензоат

В раствор 2,4-дихлор-3-метилбензойной кислоты (250 г, 1219 ммоль) в MeOH (1,5 л) добавляли серную кислоту (78 мл, 1463 ммоль) и реакционную смесь перемешивали с обратным холодильником в течение 20 часов. Реакционную смесь концентрировали под вакуумом. Неочищенный продукт растворяли в дихлорметане. Органический слой промывали водой, затем насыщенным водным раствором NaHCO3 и солевым раствором, высушивали над сульфатом магния и концентрировали под вакуумом с получением метил-2,4-дихлор-3-метилбензоата (196 г, 73,4%) в виде бесцветного масла, которое медленно осаждалось. LC/MS (Способ h), Время удерживания=2,78 минуты; MS масса/заряд: 217 [M-H]-. 1H ЯМР (DMSO-d6, 300 МГц): δ 7,61 (d, J=8,4 Гц, 1H), 7,55 (d, J=8,4 Гц, 1H), 3,87 (s, 3H), 2,37 (s, 3H).
Стадия B: метил 3-(бромметил)-2,4-дихлорбензоат
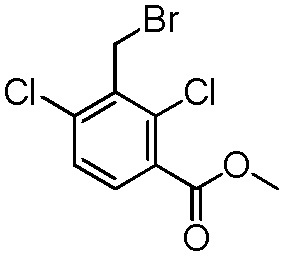
В раствор метил-2,4-дихлор-3-метилбензоата (19,6 г, 89 ммоль) в ACN (100 мл) добавляли N-бромсукцинимид (20,70 г, 116 ммоль) и 2,2'-азобис(2-метилпропионитрил) (0,735 г, 4,47 ммоль) небольшими фракциями при комнатной температуре. Реакционную смесь перемешивали с обратным холодильником 18 часов, затем концентрировали под вакуумом. Неочищенный продукт разбавляли с помощью EtOAc и твердое вещество отфильтровывали и промывали с помощью EtOAc. Органический слой промывали последовательно насыщенным водным раствором NaHCO3, 10% водным раствором Na2S2O3, высушивали над сульфатом магния, фильтровали и выпаривали с получением метил-3-(бромметил)-2,4-дихлорбензоата (24,9 г, выход 93%) в виде рассыпчатого белого твердого вещества. Без LC/MS 1H ЯМР (DMSO-d6, 300 МГц): δ 7,78 (d, J=9 Гц, 1H), 7,67 (d, J=9 Гц, 1H), 4,84 (s, 2H), 3,88 (s, 3H).
Стадия C: метил-2,4-дихлор-3-формилбензоат
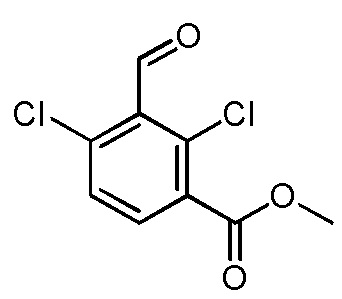
В раствор метил-3-(бромметил)-2,4-дихлорбензоата (51,6 г, 173 ммоль) в ACN (400 мл) добавляли N-оксид 4-метилморфолина (81 г, 693 ммоль) в растворе с водой (160 мл). Реакционную смесь перемешивали с обратным холодильником в течение 1,5 часа, охлаждали до комнатной температуры и разбавляли водой до осаждения ожидаемого соединения. Твердое вещество отфильтровывали, промывали водой и высушивали под вакуумом с получением метил-2,4-дихлор-3-формилбензоата (25,48 г, 63,1%) в виде белого твердого вещества.
LC/MS (Способ h), Время удерживания=2,21 минуты; без ионизации 1H ЯМР (DMSO-d6, 300 МГц): δ 10,33 (s, 1H), 7,95 (d, J=8,4 Гц, 1H), 7,72 (d, J=8,4 Гц, 1H), 3,89 (s, 3H).
Стадия D: метил-2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)бензоат

В суспензию метил-2,4-дихлор-3-формилбензоата (19,36 г, 83 ммоль) в THF (80 мл) добавляли по каплям бромид этинилмагния (0,5 M в THF, 199 мл, 100 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Ее затем разбавляли 1 н. раствором HCl и экстрагировали с помощью EtOAc. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-30% EtOAc в циклогексане) с получением метил-2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)бензоата (19,6 г, 91%) в виде белого твердого вещества. LC/MS (Способ h), Время удерживания=1,95 минуты; MS масса/заряд: 259 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 7,67 (d, J=9 Гц, 1H), 7,59 (d, J=9 Гц, 1H), 6,29 (s, 1H), 6,15 (d, J=2,48Гц, 1H), 3,87 (s, 3H), 3,51 (d, J=2,48Гц, 1H).
Получение №2. 2-(2,6-дихлор-3-(метоксикарбонил)фенил)уксусная кислота

Стадия A: метил-2,4-дихлор-3-(цианометил)бензоат
В нагретый раствор (40°C) KCN (8,52 г, 131 ммоль) в DMSO (150 мл) добавляли по каплям раствор метил-3-(бромметил)-2,4-дихлорбензоата (получение №1, стадия B) (30 г, 101 ммоль) в DMSO (90 мл). Реакционную смесь перемешивали при 40°C в течение 2 ч. 30 мин. Ее затем охлаждали до комнатной температуры и добавляли насыщенный водный раствор NaHCO3. Продукт экстрагировали при помощи EtOAc. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 5-50% EtOAc в циклогексане) с получением метил-2,4-дихлор-3-(цианометил)бензоата (19,1 г, 78%) в виде белого твердого вещества. LC/MS (Способ h), Время удерживания=2,19 минуты; MS масса/заряд: 242 [M-H]-. 1H ЯМР (DMSO-d6, 300 МГц): δ 7,83 (d, J=9 Гц, 1H), 7,72 (d, J=9 Гц, 1H), 4,26 (s, 2H), 3,89 (s, 3H).
Стадия B: метил-2,4-дихлор-3-(2-оксоэтил)бензоат
В раствор метил-2,4-дихлор-3-(цианометил)бензоата (11 г, 45,1 ммоль) в смеси пиридина (171 мл), уксусной кислоты (85 мл) и воды (85 мл) добавляли гипофосфит натрия (31,7 г, 361 ммоль). Реакционную смесь перемешивали 15 мин. при комнатной температуре. Добавляли активированный никель Ренея (13,13 мл, 77 ммоль) и реакционную смесь перемешивали при 80°C в течение 1,5 часа. Реакционную смесь фильтровали, промывали с помощью EtOAc и воды. Слои разделяли и органический слой промывали 1 M раствором HCl, затем высушивали над сульфатом магния, фильтровали и концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 10-25% EtOAc в циклогексане) с получением метил-2,4-дихлор-3-(2-оксоэтил)бензоата (10,24 г, выход 65,3%). LC/MS (Способ h), Время удерживания=2,19 минуты, 1,59 минуты (гидрат); MS масса/заряд: 323 [M-H]-+CH3COOH 1H ЯМР (DMSO-d6, 300 МГц): δ 9,76 (s, 1H), 7,72 (d, J=9 Гц, 1H), 7,64 (d, J=9 Гц, 1H), 4,27 (s, 2H), 3,87 (s, 3H).
Стадия C: 2-(2,6-дихлор-3-(метоксикарбонил)фенил)уксусная кислота

В раствор метил-2,4-дихлор-3-(2-оксоэтил)бензоата (3 г, 12,14 ммоль) в THF (50 мл) и воде (50,0 мл) добавляли последовательно 2-метил-2-бутен (60,7 мл, 121 ммоль), хлорит натрия (8,79 г, 97 ммоль) и фосфат натрия, одноосновный, моногидрат (15,08 г, 109 ммоль). Смесь перемешивали при комнатной температуре в течение 1,5 часа, затем разбавляли дихлорметаном и насыщенным водным раствором NaHCO3. Слои разделяли и водный слой повторно подкисляли 1 н. раствором HCl и экстрагировали дихлорметаном. Органический слой высушивали над сульфатом магния и концентрировали под пониженным давлением. Остаток растирали в пентане с получением 2-(2,6-дихлор-3-(метоксикарбонил)фенил)уксусной кислоты (3 г, 94%). LC/MS (Способ h), Время удерживания=1,91 минуты; MS масса/заряд: 263 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 12,78 (широкий, 1H), 7,70 (d, J=9 Гц, 1H), 7,62 (d, J=9 Гц, 1H), 3,97 (s, 2H), 3,87 (s, 3H).
Получение №3. (2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)фенил)(морфолинo)метанон

Стадия A: 2,4-дихлор-3-формилбензойная кислота

В раствор метил-2,4-дихлор-3-формилбензоата (получение №1, стадия C) (20 г, 86 ммоль) в THF (240 мл) и воде (120 мл) добавляли гидроксид лития (3083 мг, 129 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь частично выпаривали. Полученный водный слой промывали дихлорметаном, затем подкисляли 1 M раствором HCl до (pH=2-3) и соединение экстрагировали последовательно дихлорметаном и с помощью EtOAc. Органические слои высушивали над сульфатом магния и концентрировали под пониженным давлением с получением 2,4-дихлор-3-формилбензойной кислоты (17,6 г, 94%). LC/MS (Способ h), Время удерживания=1,02 минуты; MS масса/заряд: 217 [M-H]- 1H ЯМР (DMSO-d6, 300 МГц): δ 13,88 (широкий, 1H), 10,36 (s, 1H), 7,92 (d, J=9 Гц, 1H), 7,67 (d, J=9 Гц, 1H).
Стадия B: 2,6-дихлор-3-(морфолин-4-карбонил)бензальдегид

В суспензию 2,4-дихлор-3-формилбензойной кислоты (17,2 г, 79 ммоль) в дихлорметане (340 мл) добавляли HATU (32,8 г, 86 ммоль) и 4-метилморфолин (9,51 мл, 86 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 20 минут, затем добавляли морфолин (10,19 мл, 118 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение одной ночи. Реакционную смесь разбавляли дихлорметаном и промывали насыщенным водным раствором NaHCO3. Полученный органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 5-40% EtOAc в циклогексане) с получением 2,6-дихлор-3-(морфолин-4-карбонил)бензальдегида (23,8 г, 100%) в виде белого твердого вещества.
LC/MS (Способ h), Время удерживания=1,58 минуты; MS масса/заряд: 288 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 10,36(s, 1H), 7,69 (d, J=9Гц, 1H), 7,64 (d, J=9Гц, 1H), 3,66 (m, 4H), 3,54 (m, 2H), 3,16 (m, 2H).
Стадия C: (2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)фенил)(морфолинo)метанон
Используя процедуру, аналогичную получению №1, (2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)фенил)(морфолинo)метанон (14,1 г, 99%) получали из 2,6-дихлор-3-(морфолин-4-карбонил)бензальдегида (13 г, 45,1 ммоль). LC/MS (Способ h), Время удерживания=1,43 минуты; MS масса/заряд: 314 [M+H]+.
1H ЯМР (DMSO-d6, 300 МГц): δ 7,55 (d, J=9Гц, 1H), 7,38 (d, J=9Гц, 1H), 6,26 (s, 1H), 6,09 (d d, J=3Гц, 1H), 3,65 (m, 4H), 3,54 (m, 2H), 3,51 (d, J=3Гц, 1H), 3,12 (m, 2H).
Получение №4. (3-(1-гидроксипроп-2-ин-1-ил)-2,4-диметилфенил)(морфолинo)метанон
Стадия A: 3-бром-2,6-диметилбензальдегид
В суспензию трихлорида алюминия (14,91 г, 112 ммоль) в дихлорметане (80 мл) добавляли по каплям при 0°C 2,6-диметилбензальдегид (10 г, 74,5 ммоль) в растворе дихлорметана (80 мл) и диброма (3,72 мл, 72,3 ммоль). Смесь перемешивали 4 часа при 0°C. Реакционную смесь выливали на лед и экстрагировали дважды дихлорметаном. Органические слои промывали 1 н. раствором HCl, насыщенным водным раствором NaHCO3, высушивали над сульфатом магния и концентрировали под пониженным давлением с получением 3-бром-2,6-диметилбензальдегида (14,4 г, выход 91%) в виде желтого масла.
LC/MS (Способ h), Время удерживания=2,62 минуты; без ионизации. 1H ЯМР (DMSO-d6, 300 МГц): δ 10,47 (s, 1H), 7,72 (d, J=9Гц, 1H), 7,12 (d, J=9Гц, 1H), 2,57 (s, 3H), 2,47 (s, 3H).
Стадия B: 3-формил-2,4-диметилбензойная кислота

В реактор для микроволновой обработки добавляли ацетат палладия (II) (13,70 мг, 0,061 ммоль), три-трет-бутилфосфония тетрафторборат (17,70 мг, 0,061 ммоль) и гексакарбонил молибдена (354 мг, 1,342 ммоль), 3-бром-2,6-диметилбензальдегид (260 мг, 1,220 ммоль) в растворе диметоксиэтана (2 мл) и карбонат натрия (194 мг, 1,830 ммоль) в растворе воды (0,5 мл). Реакционную смесь перемешивали один час при 120°C под микроволновым облучением. Диметоксиэтан выпаривали и остаток разбавляли водой и промывали с помощью EtOAc. Водный слой подкисляли 1 н. раствором HCl (pH 1) и экстрагировали дихлорметаном, высушивали над сульфатом магния и концентрировали под пониженным давлением с получением 3-формил-2,4-диметилбензойной кислоты (150 мг, 69%) в виде белого порошка. LC/MS (Способ h), Время удерживания=1,50 минуты; MS масса/заряд: 177 [M-H]-. 1H ЯМР (DMSO-d6, 300 МГц): δ 13,06(широкий, 1H), 10,56 (s, 1H), 7,78 (d, J=9Гц, 1H), 7,24 (d, J=9Гц, 1H), 2,65 (s, 3H), 2,52 (s, 3H).
Стадия C: 2,6-диметил-3-(морфолин-4-карбонил)бензальдегид

В раствор 3-формил-2,4-диметилбензойной кислоты (1 г, 5,61 ммоль) в DMF (5 мл) добавляли 1,1'-карбонилдиимидазол (1,183 г, 7,30 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 4 часов. Добавляли морфолин (0,971 мл, 11,22 ммоль) и триэтиламин (1,564 мл, 11,22 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение одной ночи. Реакционную смесь разбавляли водой и с помощью EtOAc. Слои разделяли и полученный водный слой экстрагировали с помощью EtOAc. Полученный органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0,1-5% MeOH в дихлорметане) с получением 2,6-диметил-3-(морфолин-4-карбонил)бензальдегида (780 мг, 56%).
LC/MS (Способ h), Время удерживания=1,46 минуты; MS масса/заряд: 248 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 10,53 (s, 1H), 7,32 (d, J=9Гц, 1H), 7,24 (d, J=9Гц, 1H), 3,65(m, 4H), 3,48 (m, 2H), 3,11 (m, 2H), 2,54 (s, 3H), 2,42 (s, 3H).
Стадия D: (3-(1-гидроксипроп-2-ин-1-ил)-2,4-диметилфенил)(морфолинo)метанон:

Используя процедуру, аналогичную получению №1, (3-(1-гидроксипроп-2-ин-1-ил)-2,4-диметилфенил)(морфолинo)метанон (680 мг, 64%) получали из 2,6-диметил-3-(морфолин-4-карбонил)бензальдегида (953 мг, 3,85 ммоль). LC/MS (Способ h), Время удерживания=1,39 минуты; MS масса/заряд: 274 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 7,06 (d, J=7,6Гц, 1H), 6,98 (d, J=7,6Гц, 1H), 5,83 (m, 1H), 5,76 (m, 1H), 3,64 (m, 4H), 3,47 (m, 2H), 3,41 (d, J=2,3Гц, 1H), 3,10 (m, 2H), 2,44 (s, 3H), 2,34 (s, 3H).
Получение №5. (3-(1-гидроксипроп-2-ин-1-ил)фенил)(морфолинo)метанон
Используя процедуру, аналогичную получению №1, (3-(1-гидроксипроп-2-ин-1-ил)фенил)(морфолинo)метанон (2 г, 73%) получали из 3-(морфолин-4-карбонил)бензальдегида (описанного в WO2004/058762) (2,54 г, 11,59 ммоль). LC/MS (Способ h), Время удерживания=1,09 минуты; MS масса/заряд: 246 [M+H]+. 1H ЯМР (DMSO d-, 300 МГц): δ 7,62 (m, 2H), 7,47-7,34 (m, 2H), 5,47 (d, J=2Гц, 1H), 3,90-3,30 (m широкий, 9H), 2,67 (d, J=2Гц, 1H).
Получение №6: метил-3,5-дихлор-4-(1-гидроксипроп-2-ин-1-ил)бензоат

Используя процедуру, аналогичную получению №1, метил-3,5-дихлор-4-(1-гидроксипроп-2-ин-1-ил)бензоат (1 г, 60%) получали из метил-3,5-дихлор-4-формилбензоата (описанного в WO2013/149997) (1,5 г, 6,44 ммоль). LC/MS (Способ h), Время удерживания=2,14 минуты; без ионизации 1H ЯМР (DMSO-d6, 300 МГц): δ 7,91 (s, 2H), 6,37 (s, 1H), 6,09 (d, J=2Гц, 1H), 3,88 (s, 3H), 3,54 (d, J=2Гц, 1H).
Получение №7. 1-(2,6-дихлор-3-метоксифенил)проп-2-ин-1-ол

Используя процедуру, аналогичную получению №1, 1-(2,6-дихлор-3-метоксифенил)проп-2-ин-1-ол (1,68 г, 93%) получали из 2,6-дихлор-3-метоксибензальдегида (описанного в WO2006/049952) (1,6 г, 7,80 ммоль). LC/MS (Способ h), Время удерживания=1,95 минуты; без ионизации 1H ЯМР (DMSO-d6, 300 МГц): δ 7,42 (d, J=9Гц, 1H), 7,14 (d, J=9Гц, 1H), 6,12 (s, 1H), 6,05 (d, J=2,4Гц, 1H), 3,86 (s, 3H), 3,41 (d, J=2,4Гц, 1H).
Получение №8. 2-(2,6-дихлор-3-(морфолин-4-карбонил)фенил)уксусная кислота
Стадия A: метил-2,4-дихлор-3-(2-гидроксиэтил)бензоат

В раствор метил-2,4-дихлор-3-(2-оксоэтил)бензоата (получение №2, стадия B) (1,88 г, 7,61 ммоль) в MeOH (28 мл), охлажденный до 0°C, добавляли боргидрид натрия (0,288 г, 7,61 ммоль) и реакционную смесь перемешивали при 0°C в течение 30 минут. Добавляли воду и выпаривали MeOH. Полученный водный слой экстрагировали дихлорметаном. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением с получением метил-2,4-дихлор-3-(2-гидроксиэтил)бензоата (1,6 г, 84%). LC/MS (Способ h), Время удерживания=1,93 минуты; MS масса/заряд: 249 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 7,61 (d, J=8,4Гц, 1H), 7,56 (d, J=8,4Гц, 1H), 4,92 (широкий, 1H), 3,85 (s, 3H), 3,56 (m, 2H), 3,13 (t, J=7,8Гц, 2H).
Стадия B: 2,4-дихлор-3-(2-гидроксиэтил)бензойная кислота
Используя процедуру, аналогичную получению №3, стадии A, 2,4-дихлор-3-(2-гидроксиэтил)бензойную кислоту (1,41 г, 93%) получали из метил-2,4-дихлор-3-(2-гидроксиэтил)бензоата (1,60 г, 6,42 ммоль). LC/MS (Способ h), Время удерживания=1,20 минуты; MS масса/заряд: 233 [M-H]-. 1H ЯМР (DMSO-d6, 300 МГц): δ 13,56 (широкий, 1H), 7,56 (d, J=8,4Гц, 1H), 7,51 (d, J=8,4Гц, 1H), 4,92 (широкий, 1H), 3,55 (t, J=2,7Гц, 2H), 3,12 (t, J=7,8Гц, 2H).
Стадия C: (2,4-дихлор-3-(2-гидроксиэтил)фенил)(морфолинo)метанон
В суспензию 2,4-дихлор-3-(2-гидроксиэтил)бензойной кислоты (1,4 г, 5,96 ммоль) в дихлорметане (75 мл) добавляли 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (1,484 г, 7,74 ммоль) и 1-гидроксибензотриазол (1,046 г, 7,74 ммоль), морфолин (1,031 мл, 11,91 ммоль) и триэтиламин (1,660 мл, 11,91 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение одной ночи. Ее затем разбавляли дихлорметаном. Слои разделяли и полученный органический слой промывали водой, высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 5-40% EtOAc в циклогексане) с получением (2,4-дихлор-3-(2-гидроксиэтил)фенил)(морфолинo)метанона (1,2 г, 66%) в виде белого твердого вещества.
LC/MS (Способ h), Время удерживания=1,41 минуты; MS масса/заряд: 304 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 7,53 (d, J=9Гц, 1H), 7,27 (d, J=9Гц, 1H), 4,91 (t, J=6Гц, 1H), 3,65-3,50 (m, 8H), 3,10 (m, 4H).
Стадия D: 2-(2,6-дихлор-3-(морфолин-4-карбонил)фенил)уксусная кислота
В раствор оксида хрома(vi) (182 мг, 1,816 ммоль) в воде (325 мкл), охлажденный до 0°C, добавляли серную кислоту (162 мкл, 3,05 ммоль) и реакционную смесь перемешивали при 0°C в течение 10 мин. Этот раствор медленно добавляли в раствор (2,4-дихлор-3-(2-гидроксиэтил)фенил)(морфолинo)метанона (325 мг, 1,068 ммоль) в ацетоне (3898 мкл), охлажденном до 0°C. Реакционную смесь перемешивали при 0°C в течение 15 мин., затем при комнатной температуре в течение 30 минут. Реакционную смесь фильтровали и промывали ацетоном. Фильтрат концентрировали. Остаток разбавляли с помощью EtOAc и промывали 1 н. раствором HCl. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали с получением 2-(2,6-дихлор-3-(морфолин-4-карбонил)фенил)уксусной кислоты (283 мг, 83%). LC/MS (Способ h), Время удерживания=1,42 минуты; MS масса/заряд: 318 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 12,74 (широкий, 1H), 7,59 (d, J=9Гц, 1H), 7,36 (d, J=9Гц, 1H), 3,93 (s, 2H), 3,66 (m, 4H), 3,52 (m, 2H), 3,11 (m, 2H).
Получение №9. 2-(3-(метоксикарбонил)-2,6-диметилфенил)уксусная кислота

Стадия A: 2-(3-бром-2,6-диметилфенил)уксусная кислота

В нагретый (40°C) раствор 2-(2,6-диметилфенил)уксусной кислоты (2 г, 12,18 ммоль) в уксусной кислоте (12 мл) добавляли по каплям за 1 час раствор диброма (0,845 мл, 16,44 ммоль) в уксусной кислоте (5 мл). Реакционную смесь перемешивали при 45°C в течение 18 часов, затем концентрировали досуха. Остаток растирали в циклогексане и твердое вещество фильтровали и промывали циклогексаном с получением 2-(3-бром-2,6-диметилфенил)уксусной кислоты (2,4 г, 71%) в виде белого твердого вещества. LC/MS (Способ h), Время удерживания=2,26 минуты; MS масса/заряд: 241 [M-H]-. 1H ЯМР (DMSO-d6, 300 МГц): δ 12,45 (широкий, 1H), 7,38 (d, J=8,1Гц, 1H), 6,97 (d, J=8,1Гц, 1H), 3,69 (s, 2H), 2,33 (s, 3H), 2,24 (s, 3H).
Стадия B: 2-(3-(метоксикарбонил)-2,6-диметилфенил)уксусная кислота

В сосуд для микроволновой обработки добавляли 2-(3-бром-2,6-диметилфенил)уксусную кислоту (1,5 г, 6,17 ммоль), транс-бис(ацетато)бис[o-(ди-o-толилфосфино)бензил]дипалладия(II) (0,289 г, 0,309 ммоль), три-трет-бутилфосфония тетрафторборат (0,358 г, 1,234 ммоль) и гексакарбонил молибдена (1,629 г, 6,17 ммоль) в MeOH (30 мл). 1,8-диазабицикло[5.4.0]ундец-7-ен (2,82 г, 18,51 ммоль) добавляли по каплям и смесь перемешивали энергично при комнатной температуре в течение 5 минут. Затем сосуд нагревали под воздействием микроволн при 110°C в течение 30 минут и при 140°C в течение 15 минут. После охлаждения до комнатной температуры реакционную смесь фильтровали и растворитель удаляли под пониженным давлением. Остаток разбавляли водой и с помощью EtOAc. Фазы разделяли и водную фазу экстрагировали с помощью EtOAc. Органические слои объединяли и отбрасывали. Основной водный слой подкисляли до pH 2-3 при помощи 1 н. раствора HCl и тщательно экстрагировали с помощью EtOAc. Органические фазы объединяли, промывали солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением с получением 2-(3-(метоксикарбонил)-2,6-диметилфенил)уксусной кислоты (1,17 г, 79%) в виде зеленого твердого вещества. LC/MS (Способ h), Время удерживания=1,86 минуты; MS масса/заряд: 223 [M+H]+ 1H ЯМР (CDCl3, 300 МГц): δ 7,66 (d, J=9Гц, 1H), 7,11 (d, J=9Гц, 1H), 3,89 (s, 3H), 3,81 (s, 2H), 2,54 (s, 3H), 2,39 (s, 3H).
Получение №10. 2-(2,6-дихлор-4-нитрофенил)уксусная кислота
В суспензию диэтилмалоната (1,006 мл, 6,62 ммоль) и карбоната цезия (3,60 г, 11,04 ммоль) в DMF (5 мл), нагретую до 70°C, добавляли 3,4,5-трихлорнитробензол (1 г, 4,42 ммоль) и смесь перемешивали при 70°C в течение 3 часов. Смесь охлаждали до комнатной температуры. Добавляли 2 M раствор HCl и реакционную смесь экстрагировали с помощью EtOAc. Объединенные органические слои промывали солевым раствором, высушивали над сульфатом магния и концентрировали. Остаток суспендировали в хлористоводородной кислоте (7,36 мл, 44,2 ммоль) и перемешивали при 100°C в течение 24 часов. Смесь охлаждали до комнатной температуры, вводили в холодную воду и реакционную смесь экстрагировали дважды с помощью EtOAc. Объединенные органические слои промывали солевым раствором, высушивали над сульфатом магния и концентрировали. Остаток растворяли в диоксане (15 мл). Добавляли гидроксид натрия (11,99 мл, 11,99 ммоль) и смесь перемешивали при комнатной температуре в течение 48 часов. Добавляли избыток гидроксида натрия (11,99 мл, 11,99 ммоль) и перемешивание продолжали в течение 24 часов. Добавляли дополнительное количество избытка гидроксида натрия (11,99 мл, 11,99 ммоль) и перемешивание продолжали в течение 48 часов. Смесь разбавляли водой и промывали дважды с помощью EtOAc. Водные слои подкисляли 10 M раствором HCl (pH= 2) и экстрагировали дихлорметаном. Объединенные органические слои промывали солевым раствором, высушивали над сульфатом магния и концентрировали с получением 2-(2,6-дихлор-4-нитрофенил)уксусной кислоты (465 мг, 42%) в виде белого твердого вещества. LC/MS (Способ h), Время удерживания=1,98 минуты; MS масса/заряд: 497 [2M-H]- 1H ЯМР (DMSO-d6, 300 МГц): δ 12,96 (широкий, 1H), 8,32 (s, 2H), 4,03 (s, 2H).
Получение №11. (2,4-дихлор-3-(хлорметил)фенил)(морфолинo)метанон

Стадия A: 2,4-дихлор-3-(гидроксиметил)бензойная кислота
В раствор метил-3-(бромметил)-2,4-дихлорбензоата (получение №1, стадия B) (10 г, 33,6 ммоль) в диоксане (100 мл) добавляли гидроксид натрия (84 мл, 84 ммоль) и реакционную смесь перемешивали с обратным холодильником в течение 5 часов. Реакционную смесь концентрировали досуха. Остаток растворяли в воде и подкисляли до pH 1. Белое твердое вещество фильтровали, промывали водой и высушивали под вакуумом с получением 2,4-дихлор-3-(гидроксиметил)бензойной кислоты (5,9 г, 80%). LC/MS (Способ h), Время удерживания=0,70 минуты; MS масса/заряд: 219 [M-H]- 1H ЯМР (DMSO-d6, 300 МГц): δ 13,58 (широкий, 1H), 7,67 (d, J=9Гц, 1H), 7,52 (d, J=9Гц, 1H), 5,28 (m, 1H), 4,74 (s, 2H).
Стадия B: (2,4-дихлор-3-(гидроксиметил)фенил)(морфолинo)метанон

Используя процедуру, аналогичную получению №8, (2,4-дихлор-3-(гидроксиметил)фенил)(морфолинo)метанон (2,6 г, 41%) получали из 2,4-дихлор-3-(гидроксиметил)бензойной кислоты (4,8 г, 21,72 ммоль). LC/MS (Способ h), Время удерживания=1,19 минуты; MS масса/заряд: 290 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 7,53 (d, J=9Гц, 1H), 7,34 (d, J=9Гц, 1H), 5,28 (s, 1H), 4,70 (s, 2H), 3,64 (m, 4H), 3,52 (m, 2H), 3,12 (m, 2H).
Стадия C: (2,4-дихлор-3-(хлорметил)фенил)(морфолинo)метанон

В раствор (2,4-дихлор-3-(гидроксиметил)фенил)(морфолинo)метанона (653 мг, 2,251 ммоль) в DCM (18 мл) добавляли метансульфонилхлорид (0,349 мл, 4,50 ммоль) и триэтиламин (0,627 мл, 4,50 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь разбавляли с помощью DCM. Полученный органический слой промывали водой и солевым раствором. Полученный органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 7-60% EtOAc в DCM) с получением (2,4-дихлор-3-(хлорметил)фенил)(морфолинo)метанона (548 мг, 79%). LC/MS (Способ h), Время удерживания=2,12 минуты; MS масса/заряд: 308 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 7,62 (d, J=9Гц, 1H), 7,44 (d, J=9Гц, 1H), 4,93 (s, 2H), 3,65 (m, 4H), 3,52 (m, 2H), 3,12 (m, 2H).
Получение №12. Этил-3-((метилсульфонил)окси)циклопентанкарбоксилат

В раствор этил-3-гидроксициклопентанкарбоксилата (0,8 г, 5,06 ммоль) и триэтиламина (1,762 мл, 12,64 ммоль) в DCM (8 мл), охлажденный до 0°C, добавляли раствор метансульфонилхлорида (0,588 мл, 7,59 ммоль) в DCM (3 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли воду и реакционную смесь экстрагировали с помощью DCM. Органический слой промывали солевым раствором, высушивали над MgSO4, фильтровали и выпаривали с получением этил-3-((метилсульфонил)окси)циклопентанкарбоксилата (1,1 г, 92%) в виде бесцветной жидкости: без LC/MS. 1H ЯМР (DMSO-d6, 300 МГц): δ 5,08 (m, 1H), 4,05 (m, 2H), 3,60 (m, 4H), 2,86 (m, 1H), 2,30 (m, 1H), 2,05 (m, 1H), 1,80 (m, 3H), 1,18 (m, 3H).
Получение №13. Метил-2,4-дихлор-3-(3-хлор-2-оксобутил)бензоат

Суспензию цинка (0,241 г, 3,69 ммоль) в THF (1 мл) нагревали до температуры возврата флегмы и добавляли 1,2-дибромэтан (0,025 г, 0,134 ммоль) и хлортриметилсилан (0,015 г, 0,134 ммоль). Реакционную смесь перемешивали 30 минут. Раствор метил-3-(бромметил)-2,4-дихлорбензоата (1 г, 3,36 ммоль) (получение №1, стадия B) в THF (3 мл) затем добавляли по каплям на протяжении 5 минут и смесь перемешивали с обратным холодильником в течение 2 часов. Этот раствор добавляли при комнатной температуре в смесь комплекса цианида меди(I) и ди(лития хлорида) (3,36 мл, 3,36 ммоль) и N,N-диметилформамида (246 мг, 3,36 ммоль) и раствор перемешивали 30 минут при комнатной температуре. Затем добавляли раствор 2-хлорпропионилхлорида (427 мг, 3,36 ммоль) в толуоле (4 мл) и тетракис(трифенилфосфин)палладий (0) (116 мг, 0,101 ммоль). Реакционную смесь перемешивали один час при комнатной температуре, разбавляли с помощью 10 мл гексана и 10 мл EtOAc и добавляли твердый силикагель. Смесь перемешивали 5 минут и твердое вещество фильтровали и промывали с помощью EtOAc. Органический слой концентрировали. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-20% EtOAc в циклогексане) с получением метил-2,4-дихлор-3-(3-хлор-2-оксобутил)бензоата (560 мг, 54%) в виде бесцветного масла. LC/MS (Способ h), Время удерживания=2,75 минуты; MS масса/заряд: 309 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 7,71 (d, J=9Гц, 1H), 7,62 (d, J=9Гц, 1H), 5,05 (q, J=7Гц, 1H), 4,56 (d, J=15Гц, 1H), 4,43 (d, J=15Гц, 1H), 3,87 (s, 3H), 1,63 (d, J=7Гц, 3H).
Получение №14. Метил-3-(3-бром-2-оксобутил)-2,4-дихлорбензоат
Стадия A: метил-2,4-дихлор-3-(2-гидроксибутил)бензоат
В раствор метил-2,4-дихлор-3-(2-оксоэтил)бензоата (получение №2, стадия B) (100 мг, 0,405 ммоль) в THF (1 мл) добавляли этилмагния бромид (1 M в THF, 0,486 мл, 0,486 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь разбавляли раствором 1 н. водного раствора HCl и полученный водный слой экстрагировали с помощью EtOAc. Органический слой высушивали над MgSO4, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 5-20% EtOAc в циклогексане) с получением метил-2,4-дихлор-3-(2-гидроксибутил)бензоата (100 мг, 89%) в виде бесцветного масла. LC/MS (Способ h), Время удерживания=2,39 минуты; MS масса/заряд: 277 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 7,58 (m, 2H), 4,65 (d, J=6Гц, 1H), 3,85 (s, 3H), 3,72 (m, 1H), 3,05 (m, 2H), 1,42 (m, 2H), 0,89 (t, J=6Гц, 3H).
Стадия B: метил-2,4-дихлор-3-(2-оксобутил)бензоат
В раствор метил-2,4-дихлор-3-(2-гидроксибутил)бензоата (100 мг, 0,361 ммоль) в DCM (1,5 мл) добавляли периодинан Десса-Мартина (0,750 мл, 0,361 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь разбавляли с помощью DCM. Органический слой промывали насыщенным водным раствором Na2S2O3, затем высушивали над MgSO4, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 5-20% EtOAc в циклогексане) с получением метил-2,4-дихлор-3-(2-оксобутил)бензоата (63 мг, 63%) в виде бесцветного масла. LC/MS (Способ h), Время удерживания=2,53 минуты; MS масса/заряд: 275 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 7,69 (d, J=9Гц, 1H), 7,60 (d, J=9Гц, 1H), 4,21 (s, 2H), 3,86 (s, 3H), 2,64 (q, J=7,2Гц, 2H), 0,99 (t, J=7,2, 3H).
Стадия C: метил-3-(3-бром-2-оксобутил)-2,4-дихлорбензоат

Суспензию бромида меди (81 мг, 0,363 ммоль) в хлороформе (300 мкл) и EtOAc (300 мкл) нагревали до температуры возврата флегмы. Добавляли метил-2,4-дихлор-3-(2-оксобутил)бензоат (100 мг, 0,363 ммоль) в растворе хлороформа (80 мкл) и EtOAc (80 мкл) и реакционную смесь перемешивали с обратным холодильником в течение 72 часов. Реакционную смесь концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 5-20% EtOAc в циклогексане) с получением метил-3-(3-бром-2-оксобутил)-2,4-дихлорбензоата (105 мг, 47%) в виде бесцветного масла. LC/MS (Способ h), Время удерживания=2,82 минуты; MS масса/заряд: 353 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 7,70 (d, J=9Гц, 1H), 7,63 (d, J=9Гц, 1H), 5,10 (q, J=6,6Гц, 1H), 4,63 (d, J=18Гц, 1H), 4,46 (d, J=18Гц, 1H), 3,86 (s, 3H), 1,72 (d, J=6,65Гц, 3H).
Получение №15. 1-(3,5-дихлор-2-метоксипиридин-4-ил)проп-2-ин-1-ол

Стадия A: 3,5-дихлор-2-метоксиизоникотинальдегид

Раствор 3,5-дихлор-2-метоксипиридина (16 г, 90 ммоль) в THF (100 мл) медленно добавляли в раствор LDA (53,9 мл, 108 ммоль) (2 M в THF) при -78°C. В реакционную смесь добавляли DMF (14 мл, 180 ммоль) и полученный раствор перемешивали при -78°C в течение приблизительно 1 ч. Реакционную смесь затем выливали в насыщенный водный раствор NH4Cl. Водный слой экстрагировали с помощью EtOAc (3×20 мл). Объединенную органическую часть высушивали над безводным Na2SO4, фильтровали и концентрировали под пониженным давлением с получением 3,5-дихлор-2-метоксиизоникотинальдегида (17,54 г, 90%). LC/MS (таблица 1, Способ d), Время удерживания=1,86 минуты; MS масса/заряд: 205, 207 [M+H]+.
Стадия B: 1-(3,5-дихлор-2-метоксипиридин-4-ил)проп-2-ин-1-ол

Используя процедуру, аналогичную получению №1, 1-(3,5-дихлор-2-метоксипиридин-4-ил)проп-2-ин-1-ол (8,74 г, 76%) получали из 3,5-дихлор-2-метоксиизоникотинальдегида (10 г, 48,5 ммоль). LC/MS (таблица 1, Способ b), Время удерживания=1,90 минуты; MS(M+1)= 231, 233
1H ЯМР (DMSO-d6, 400 МГц): δ 8,24 (s,1H), 6,42 (s, 1H), 6,00 (s, 1H), 3,95 (s, 3H), 3,56 (s, 1H).
Получение №16. N-(2-йод-3-метил-5-(трифторметил)фенил)бензолсульфонамид

Стадия A: 2-йод-3-метил-5-(трифторметил)анилин
В раствор 3-амино-5-метилбензотрифторида (10 г, 57,1 ммоль) в DCM (200 мл) и MeOH (50 мл) добавляли бензилтриметиламмония дихлорйодат (39,7 г, 114 ммоль) и карбонат кальция (14,29 г, 143 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, фильтровали и твердое вещество промывали с помощью DCM. Фильтрат промывали насыщенным водным раствором Na2S2O3 и полученный органический слой промывали водой, затем высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 5-100% EtOAc в циклогексане) с получением 2-йод-3-метил-5-(трифторметил)анилина (9,1 г, 53%) в виде оранжевой жидкости. LC/MS (Способ h), Время удерживания=2,83 минуты; MS масса/заряд: 302 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 6,87 (d, J=1,8 Гц, 1H), 6,81 (d, J=1,8 Гц, 1H), 5,68 (s, 2H), 2,38 (s, 3H).
Стадия B: N-(2-йод-3-метил-5-(трифторметил)фенил)бензолсульфонамид
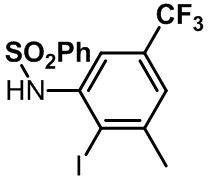
В раствор 2-йод-3-метил-5-(трифторметил)анилина (9,1 г, 30,2 ммоль) в пиридине (50 мл) добавляли бензолсульфонилхлорид (7,75 мл, 60,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем разделяли между водой и EtOAc. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток растворяли в 1,4-диоксане (66,7 мл) и 3 н. гидроксид калия (40,3 мл, 121 ммоль) добавляли в реакционную смесь. Реакционную смесь нагревали с обратным холодильником в течение двух часов, затем разбавляли водой и подкисляли концентрированной HCl. Водный слой экстрагировали с помощью DCM, а органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением с получением N-(2-йод-3-метил-5-(трифторметил)фенил)бензолсульфонамида (13,1 г, 98%) в виде коричневого твердого вещества. LC/MS (Способ h), Время удерживания=2,96 минуты; MS масса/заряд: 440 [M-H]-.
1H ЯМР (DMSO-d6, 300 МГц): δ 10,9 (s, 1H), 7,71 (m, 3H), 7,59 (m, 3H), 6,92 (s, 1H), 2,46 (s, 3H).
Получение №17. N-(2-йод-4-метил-5-(трифторметил)фенил)бензолсульфонамид
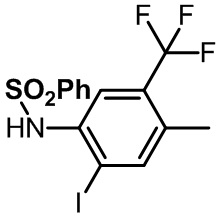
Используя процедуру, аналогичную получению №16, стадии B, N-(2-йод-4-метил-5-(трифторметил)фенил)бензолсульфонамид (3 г, 100%) получали из 2-йод-4-метил-5-(трифторметил)анилина (описанного в WO2006/002342) (2 г, 6,64 ммоль). LC/MS (Способ h), Время удерживания=2,95 минуты; MS масса/заряд: 440 [M-H]- 1H ЯМР (DMSO-d6, 300 МГц): δ 10,02 (s, 1H), 7,97 (s, 1H), 7,70 (m, 3H), 7,66 (m, 2H), 7,07 (s, 1H), 2,33 (s, 3H).
Получение №18. N-(5-циано-2-йод-3-метилфенил)бензолсульфонамид

Стадия A: 4-амино-3-метил-5-нитробензонитрил

В суспензию 4-бром-2-метил-6-нитроанилина (25 г, 108 ммоль) в DMF (300 мл) добавляли йодид меди(I) (1,030 г, 5,41 ммоль) и цианид цинка (38,1 г, 325 ммоль). Смесь перемешивали при комнатной температуре в течение 15 минут, затем добавляли палладия тетракис (12,50 г, 10,82 ммоль) и смесь перемешивали при 100°C в течение 24 часов. Добавляли дополнительное количество палладия тетракис (12,50 г, 10,82 ммоль) и смесь перемешивали при 130°C в течение 6 часов. Реакционную смесь фильтровали и промывали с помощью EtOAc. Фильтрат промывали последовательно насыщенным водным раствором NaHCO3 и солевым раствором, затем высушивали над сульфатом магния и концентрировали под пониженным давлением. Остаток перекристаллизовывали в 600 мл EtOH и получали 4-амино-3-метил-5-нитробензонитрил (12 г, 63%) в виде желтого твердого вещества. LC/MS (Способ h), Время удерживания=1,77 минуты; MS масса/заряд: 176 [M-H]-. 1H ЯМР (DMSO-d6, 300 МГц): δ 8,35 (s, 1H), 7,65 (широкий, 2H), 7,68 (s, 1H), 2,22 (s, 3H).
Стадия B: 4-йод-3-метил-5-нитробензонитрил
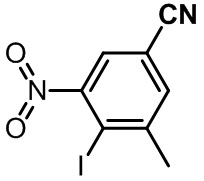
В раствор 4-амино-3-метил-5-нитробензонитрила (12 г, 67,7 ммоль) в DMSO (176 мл), охлажденный до 0°C, добавляли по каплям серную кислоту (240 мл, 67,7 ммоль). Температуру поддерживали ниже 10°C без замораживания DMSO. Затем нитрит натрия (7,01 г, 102 ммоль) в воде (25 мл) добавляли по каплям в реакционную смесь для поддержания температуры на уровне 0°C и реакционную смесь перемешивали в течение 1 часа при 0-5°C. Раствор йодида калия (33,7 г, 203 ммоль) и йода (12,89 г, 50,8 ммоль) в воде (100 мл) добавляли по каплям, поддерживая температуру на уровне 0-5°C, и реакционную смесь перемешивали при 0°C в течение 1 часа. 20% водный раствор Na2S2O3 добавляли в смесь и твердое вещество фильтровали и промывали водой. Твердое вещество перекристаллизовывали в чистом EtOH (150 мл) и все маточные жидкости очищали колоночной хроматографией на силикагеле (элюирование с помощью 5-100% EtOAc в циклогексане). 4-йод-3-метил-5-нитробензонитрил (23,5 г, 70%) получали в виде желтого твердого вещества.
LC/MS (Способ h), Время удерживания=1,77 минуты; no ionization. 1H ЯМР (CDCl3, 300 МГц): δ 7,69 (m, 2H), 2,64 (s, 3H).
Стадия C: 3-амино-4-йод-5-метилбензонитрил
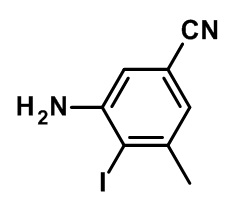
В раствор 4-йод-3-метил-5-нитробензонитрила (3,11 г, 10,80 ммоль) в EtOH (100 мл) добавляли железо (6,03 г, 108 ммоль), хлорид аммония (1,733 г, 32,4 ммоль) и воду (30 мл). Реакционную смесь перемешивали с обратным холодильником в течение 1 часа. Реакционную смесь фильтровали через целит и промывали с помощью EtOH и EtOAc. Фильтрат концентрировали, остаток растворяли в EtOAc и промывали последовательно 2 M водным раствором NH4Cl и солевым раствором, высушивали над сульфатом магния и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 10% EtOAc в циклогексане) с получением 3-амино-4-йод-5-метилбензонитрила (2,55 г, 80%) в виде коричневого твердого вещества. LC/MS (Способ h), Время удерживания=2,29 минуты; MS масса/заряд: 259 [M+H]+. 1H ЯМР (CDCl3, 300 МГц): δ 6,87 (s, 1H), 6,77 (s, 1H), 4,41 (широкий, 2H), 2,24 (s, 3H).
Стадия D: N-(5-циано-2-йод-3-метилфенил)бензолсульфонамид
Используя процедуру, аналогичную получению №16, стадии B, N-(5-циано-2-йод-3-метилфенил)бензолсульфонамид (9,43 г, 91%) получали в виде оранжевого твердого вещества из 3-амино-4-йод-5-метилбензонитрила (6,7 г, 26 ммоль). LC/MS (Способ k), Время удерживания=2,68 минуты; MS масса/заряд: 397 [M-H]-. 1H ЯМР (CDCl3, 300 МГц): δ 7,72 (m, 2H), 7,64 (m, 1H), 7,50 (m, 1H), 7,41 (m, 2H), 7,16 (m, 1H), 7,09 (s, 1H), 2,34 (s, 3H).
Получение №19. N-(4-циано-2-йодфенил)бензолсульфонамид

Используя процедуру, аналогичную получению №16, стадии B, N-(4-циано-2-йодфенил)бензолсульфонамид (3,7 г, 100%) получали в виде оранжевого твердого вещества из 4-амино-3-йодбензонитрила (2 г, 8,20 ммоль). LC/MS (Способ h), Время удерживания=2,41 минуты; MS масса/заряд: 383 [M-H]-.
1H ЯМР (CDCl3, 300 МГц): δ 7,96 (m, 1H), 7,83 (m, 2H), 7,71 (m, 1H), 7,60 (m, 2H), 7,51 (m, 2H), 7,17 (m, 1H).
Получение №20: N-(5-циано-2-йодфенил)бензолсульфонамид

Используя процедуру, аналогичную получению №16, стадии B, N-(5-циано-2-йодфенил)бензолсульфонамид (1,6 г, 51%) получали в виде оранжевого твердого вещества из 3-амино-4-йодбензонитрила (2 г, 8,20 ммоль). LC/MS (Способ h), Время удерживания=2,38 минуты; MS масса/заряд: 383 [M-H]-.
1H ЯМР (DMSO-d6, 300 МГц): δ 10,14 (широкий, 1H), 8,05 (d, J=6Гц, 1H), 7,70 (m, 3H), 7,61 (m, 2H), 7,42 (d, J=9Гц, 1H), 7,36 (d, J=3Гц, 1H).
Получение №21: N-1,3-диметил-5-(трифторметил)бензол-1,2-диамин
В реактор Парра вводили в атмосфере азота 2-бром-6-метил-4-(трифторметил)анилин (описанный в WO2009/009411) (14,5 г, 57,1 ммоль) в THF (14,5 мл). Добавляли метиламин (40% в воде) (72,5 мл, 2094 ммоль) и оксид меди(I) (0,817 г, 5,71 ммоль). Реактор закрывали в атмосфере азота и нагревали при 110°C в течение 16 часов. Воду добавляли в смесь и ее экстрагировали с помощью EtOAc. Органический слой промывали водой, высушивали над сульфатом магния, фильтровали и выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 5-40% EtOAc в циклогексане) с получением N-1,3-диметил-5-(трифторметил)бензол-1,2-диамина (2,26 г, 19%). LC/MS (Способ h), Время удерживания=2,07 минуты; MS масса/заряд: 205 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 6,68 (s, 1H), 6,42 (s, 1H), 4,99 (d, J=5Гц, 1H), 4,85 (s, 2H), 2,73 (d, J=5Гц, 3H).
Получение №22: 4-амино-3-метил-5-(метиламино)бензонитрил

Стадия A: 5-бром-N,3-диметил-2-нитроанилин
В раствор 5-бром-1-фтор-3-метил-2-нитробензола (5 г, 21,37 ммоль) в EtOH (50 мл) добавляли метиламин (2 M в THF) (32,0 мл, 64,1 ммоль) и реакционную смесь перемешивали при 70°C в течение 1,5 часа и в течение ночи при комнатной температуре. 0 (2 M в THF) (32,0 мл, 64,1 ммоль) добавляли и реакционную смесь перемешивали при 70°C в течение 1 часа. Реакционную смесь концентрировали под пониженным давлением. Остаток разбавляли с помощью EtOAc и промывали солевым раствором, высушивали над сульфатом магния и выпаривали с получением 5-бром-N,3-диметил-2-нитроанилина (5,13 г, 98%) в виде оранжевого твердого вещества.
LC/MS (Способ h), Время удерживания=2,77 минуты; MS масса/заряд: 245 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ. 6,86 (s, 1H), 6,77 (s, 1H), 6,72 (m, 1H), 2,77 (d, J=3Гц, 3H), 2,28 (s, 3H).
Стадия B: 3-метил-5-(метиламино)-4-нитробензонитрил
В реактор для микроволновой обработки добавляли ферроцианид калия (3006 мг, 8,16 ммоль), Pd(dppf)Cl2 (179 мг, 0,245 ммоль), карбонат натрия (865 мг, 8,16 ммоль) и 5-бром-N,3-диметил-2-нитроанилин (2000 мг, 8,16 ммоль) в NMP (15 мл). Реакционную смесь перемешивали под микроволновым облучением 2 часа при 130°C. Реакционную смесь фильтровали и промывали с помощью EtOAc. Фильтрат промывали водой и солевым раствором. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 5-25% EtOAc в циклогексане) с получением 3-метил-5-(метиламино)-4-нитробензонитрила (1,21 г, 64%). LC/MS (Способ h), Время удерживания=2,28 минуты; MS масса/заряд: 192 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ.7,13 (s, 1H), 7,01(s, 1H), 6,60 (q, J=4,8Гц, 1H), 2,76 (d, J=4,8Гц, 3H), 2,25 (s, 3H).
Стадия C: 4-амино-3-метил-5-(метиламино)бензонитрил

В суспензию 3-метил-5-(метиламино)-4-нитробензонитрила (1,795 г, 9,39 ммоль) в EtOAc (84 мл) и MeOH (84 мл) добавляли Pd/C (0,400 г, 1,878 ммоль) и реакционную смесь перемешивали при комнатной температуре в атмосфере H2 (1 бар) в течение 1 часа. Реакционную смесь фильтровали и промывали с помощью EtOAc. Фильтрат концентрировали под пониженным давлением с получением 4-амино-3-метил-5-(метиламино)бензонитрила (1,51 г, 100%) в виде красного твердого вещества. LC/MS (Способ h), Время удерживания=1,40 минуты; MS масса/заряд: 162 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ.6,79 (s, 1H), 6,50(s, 1H), 5,18 (s, 2H), 5,02(m, 1H), 2,72 (d, J=5,1Гц, 3H), 2,06 (s, 3H).
Получение №23: N-1,3,5-триметилбензол-1,2-диамин

Стадия A: N-(2-метил-4-(трифторметил)фенил)ацетамид
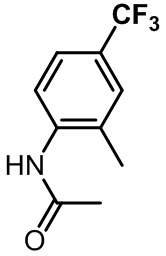
Уксусный ангидрид (8,08 мл, 86 ммоль) добавляли в 2-метил-4-(трифторметил)анилин (5 г, 28,5 ммоль) при 0°C и реакционную смесь перемешивали при 0°C в течение 20 минут. Образовавшееся твердое вещество дробили в ступке, помещали в суспензию в воде и нейтрализовали аммиаком. Осадок фильтровали и высушивали под вакуумом с получением N-(2-метил-4-(трифторметил)фенил)ацетамида (5,91 г, 95%) в виде бежевого твердого вещества.
LC/MS (Способ h), Время удерживания=1,99 минуты; MS масса/заряд: 218 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ. 9,45 (s, 1H), 7,76 (d, J=8,4Гц, 1H), 7,57 (s, 1H), 7,50 (d, J=8,4Гц, 1H), 2,30 (s, 3H), 2,11 (s, 3H).
Стадия B: N-(2-метил-6-нитро-4-(трифторметил)фенил)ацетамид
В раствор N-(2-метил-4-(трифторметил)фенил)ацетамида (5,9 г, 27,2 ммоль) в серной кислоте (20 мл, 375 ммоль) при 0°C добавляли по каплям азотную кислоту (20 мл, 448 ммоль). Реакционную смесь перемешивали при 0°C в течение 2 часов и при комнатной температуре в течение ночи. Реакционную смесь разбавляли в воде и экстрагировали с помощью EtOAc. Слои разделяли и органический слой промывали насыщенным водным раствором NaHCO3 и солевым раствором. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали с получением N-(2-метил-6-нитро-4-(трифторметил)фенил)ацетамида (6,6 г, 93%).
LC/MS (Способ h), Время удерживания=2,00 минуты; MS масса/заряд: 263 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ. 10,14 (широкий, 1H), 8,08 (s, 1H), 8,04 (s, 1H), 2,39 (s, 3H), 2,07 (s, 3H).
Стадия C: 2-метил-6-нитро-4-(трифторметил)анилин
В раствор N-(2-метил-6-нитро-4-(трифторметил)фенил)ацетамида (2,95 г, 11,25 ммоль) в MeOH (2,5 мл) и воде (1 мл) добавляли гидроксид калия (0,189 г, 3,38 ммоль) и реакционную смесь перемешивали при 60°C в течение 18 часов. Лед добавляли в реакционную смесь и получали осадок, его фильтровали и промывали холодной водой. Твердое вещество высушивали под вакуумом с получением 2-метил-6-нитро-4-(трифторметил)анилина (1,65 г, 67%). LC/MS (Способ h), Время удерживания=2,51 минуты; MS масса/заряд: 219 [M-H]-.
1H ЯМР (DMSO-d6, 300 МГц): δ. 8,16 (s, 1H), 7,66 (s, 1H), 7,62 (s, 2H), 2,27 (s, 3H).
Стадия D: 3-метил-5-(трифторметил)бензол-1,2-диамин
В раствор 2-метил-6-нитро-4-(трифторметил)анилина (1,33 г, 6,04 ммоль) в EtOH (22 мл) и воде (11 мл) добавляли железо (1,687 г, 30,2 ммоль) и хлорид кальция (1,341 г, 12,08 ммоль) и реакционную смесь перемешивали с обратным холодильником в течение 5 часов. Реакционную смесь фильтровали и фильтрат концентрировали. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-5% MeOH в DCM) с получением 3-метил-5-(трифторметил)бензол-1,2-диамина (862 мг, 75%).
LC/MS (Способ h), Время удерживания=1,86 минуты; MS масса/заряд: 191 [M+H]+.
1H ЯМР (DMSO-d6, 300 МГц): δ. 6,68 (s, 1H), 6,61 (s, 1H), 4,81 (m, 4H), 2,07 (s, 3H).
Стадия E: этил-(2-амино-3-метил-5-(трифторметил)фенил)карбамат
В раствор 3-метил-5-(трифторметил)бензол-1,2-диамина (860 мг, 4,52 ммоль) в DMF (9 мл), охлажденный до 0°C, добавляли гидрид натрия (109 мг, 4,52 ммоль) и реакционную смесь перемешивали при 0°C в течение 1 часа. Добавляли этилхлорформиат (0,432 мл, 4,52 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь гидролизовали при помощи насыщенного водного раствора NH4Cl и экстрагировали с помощью EtOAc. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-40% EtOAc в DCM) с получением этил-(2-амино-3-метил-5-(трифторметил)фенил)карбамата (512 мг, 43%) LC/MS (Способ h), Время удерживания=2,28 минуты; MS масса/заряд: 263 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ. 8,69 (s, 1H), 7,44 (s, 1H), 7,10 (s, 1H), 5,30 (s, 2H), 4,11 (q, J=7,2Гц, 2H), 2,13 (s, 3H), 1,24 (t, J=7,2Гц, 3H).
Стадия F: N-1,3,5-триметилбензол-1,2-диамин
В раствор этил-(2-амино-3-метил-5-(трифторметил)фенил)карбамата (510 мг, 1,945 ммоль) в THF (12 мл), охлажденный до 0°C, добавляли суспензию LiAlH4 (9,72 мл, 9,72 ммоль) в THF (5 мл) и реакционную смесь нагревали с обратным холодильником в течение 18 часов. Реакционную смесь обрабатывали при комнатной температуре глауберовой солью в течение 7 часов и фильтровали. Фильтрат концентрировали. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-40% EtOAc в DCM) с получением N1,3,5-триметилбензол-1,2-диамина (197 мг, 67%). LC/MS (Способ h), Время удерживания=1,05 минуты; MS масса/заряд: 151 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ. 6,16 (s, 1H), 6,10 (s, 1H), 4,53 (m, 1H), 3,95 (s, 2H), 2,67 (d, J=5,1Гц, 3H), 2,10 (s, 3H), 2,00 (s, 3H).
Получение №24: 5-бром-N-1,3-диметилбензол-1,2-диамин

Используя процедуру, аналогичную получению №23, стадии D, 5-бром-N-1,3-диметилбензил-1,2-диамин (712 мг, 100%) получали из 6-бром-N,3-диметил-2-нитропиридин-2-нитроанилин (получение № 22, стадии A) (815 vu, 3.33 ммоль). LC/MS (Способ h), Время удерживания=1,93 минуты; MS масса/заряд: 215 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ. 6,49 (s, 1H), 6,32 (s, 1H), 4,91 (m, 1H), 4,34 (широкий, 2H), 2,67 (d, J=4,8Гц, 3H), 2,03 (s, 3H).
Получение №25: 6-хлор-N-2,4-диметилпиридин-2,3-диамин

Стадия A: 6-хлор-N,4-диметил-3-нитропиридин-2-амин
В раствор 2,6-дихлор-4-метил-3-нитропиридина (2,2 г, 10,63 ммоль) в ACN (60 мл) добавляли триэтиламин (4,44 мл, 31,9 ммоль) и метиламин (2 M в THF) (6,38 мл, 12,75 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь быстро охлаждали насыщенным водным раствором NaHCO3 и разбавляли водой и с помощью EtOAc. Слои разделяли и водный слой экстрагировали с помощью EtOAc. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-30% EtOAc в циклогексане) с получением 6-хлор-N,4-диметил-3-нитропиридин-2-амина (2,05 г, 43%) в виде желтого твердого вещества. LC/MS (Способ h), Время удерживания=2,45 минуты; MS масса/заряд: 202 [M+H]+. 1H ЯМР (DMSO-d6, 400 МГц): δ 7,93 (широкий, 1H), 6,72 (s, 1H), 2,89 (s, 3H), 2,38 (s, 3H).
Стадия B: 6-хлор-N2,4-диметилпиридин-2,3-диамин

Используя процедуру, аналогичную примеру получения №23, стадии D, 6-хлор-N2,4-диметилпиридин-2,3-диамин (90 мг, 51%) получали из 6-хлор-N,4-диметил-3-нитропиридин-2-амина (200 мг, 0,992 ммоль). LC/MS (Способ h), Время удерживания=1,40 минуты; MS масса/заряд: 172 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 6,30 (s, 1H), 5,93 (широкий, 1H), 4,48 (широкий, 2H), 2,78 (d, J=3Гц, 3H), 2,00 (s, 3H).
Получение №26: N-(2-бром-5-(трифторметил)пиридин-3-ил)бензолсульфонамид
Стадия A: 2-бром-5-(трифторметил)пиридин-3-амин

В раствор 2-бром-3-нитро-5-(трифторметил)пиридина (описанного в WO2013/038381) (2,6 г, 9,59 ммоль) в EtOH (40 мл) и воде (16 мл) добавляли железо (4,02 г, 72,0 ммоль) и уксусную кислоту (3,7 мл). Реакционную смесь перемешивали при 110°C в течение 3 часов, затем ее фильтровали и растворитель выпаривали. Остаток разбавляли EtOAc и насыщенным водным раствором NaHCO3, экстрагировали, высушивали над сульфатом магния, фильтровали и выпаривали с получением 2-бром-5-(трифторметил)пиридин-3-амина (2,35 г, 100%) в виде белого твердого вещества. LC/MS (Способ h), Время удерживания=1,91 минуты; MS масса/заряд: 241 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ. 7,98(s, 1H), 7,34 (s, 1H), 6,06 (s, 2H).
Стадия B: N-(2-бром-5-(трифторметил)пиридин-3-ил)бензолсульфонамид

Используя процедуру, аналогичную получению №16, стадии B, N-(2-бром-5-(трифторметил)пиридин-3-ил)бензолсульфонамид (954 мг, 50%) получали из 2-бром-5-(трифторметил)пиридин-3-амина (1,2 г, 4,98 ммоль) LC/MS (Способ h), Время удерживания=2,52 минуты; MS масса/заряд: 381 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц,) δ 10,67 (широкий, 1H), 8,66 (s, 1H), 7,85 (d, J=2,3 Гц, 1H), 7,73 (m, 3H), 7,59 (m, 2H).
Получение №27: N-(5-йод-2-(трифторметил)пиридин-4-ил)бензолсульфонамид

Используя процедуру, аналогичную получению №16, стадии B, N-(5-йод-2-(трифторметил)пиридин-4-ил)бензолсульфонамид (13,32 г, 52%) получали из 5-йод-2-(трифторметил)пиридин-4-амина (описанного в WO2010/091310) (17,3 г, 60,1 ммоль) LC/MS (Способ h), Время удерживания=2,57 минуты; MS масса/заряд: 429 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц,) δ 8,99 (s, 1H), 7,93 (m, 2H), 7,66 (m, 3H), 7,48 (s, 1H).
Получение №28: 6-хлор-4-метилпиридазин-3-амин и 6-хлор-5-метилпиридазин-3-амин

Суспензию 3,6-дихлор-4-метилпиридазина (3,38 г, 20,74 ммоль) в гидроксиде аммония (55 мл, 1412 ммоль) нагревали в реакторе при 130°C в течение приблизительно 16 ч. Реакционную смесь охлаждали до комнатной температуры. Возникал осадок, который фильтровали, промывали водой и высушивали под вакуумом с получением неразделимой смеси 6-хлор-4-метилпиридазин-3-амина и 6-хлор-5-метилпиридазин-3-амина (соотношение 57/43) (2,25 г, 76%). 1H ЯМР (DMSO-d6, 300МГц,) δ 7,30 (s, 1H), 6,45 (широкий, 2H), 2,08 (s, 3H) и 6,74 (s, 1H), 6,47 (широкий, 2H), 2,19 (s, 3H).
Получение №29: N-(2-йод-5-(трифторметил)фенил)бензолсульфонамид
Используя процедуру, аналогичную получению №16, стадии B, N-[2-йод-5-(трифторметил)фенил]бензолсульфонамид (136 г, 100%) получали из 2-йод-5-(трифторметил)анилина (85 г, 296 ммоль) (описанного в US20070129334).
Получение №30: N1,3-диметил-4-(трифторметил)бензол-1,2-диамин

Стадия A: 1-фтор-4-йод-3-метил-2-нитробензол
В раствор 3-фтор-2-нитротолуола (1 г, 6,45 ммоль) в трифторметансульфоновой кислоте (2,83 мл, 32,2 ммоль), охлажденный до 0°C, добавляли порциями N-йодсукцинимид (1,740 г, 7,74 ммоль) и смесь перемешивали при комнатной температуре в течение 1 часа. Смесь выливали в воду и экстрагировали дважды диэтиловым эфиром. Органический слой промывали последовательно 10% водным раствором Na2S2O3, затем солевым раствором и концентрировали с получением 1-фтор-4-йод-3-метил-2-нитробензола в виде бежевого твердого вещества (1,86 г, 74%).
LC/MS (Способ i), Время удерживания=2,28 минуты; без ионизации 1H ЯМР (DMSO-d6, 300МГц): δ 8,16 (dd, J=6 Гц, 9Гц, 1H), 7,31 (t, J=9 Гц, 1H), 2,39 ppm (s, 3H).
Стадия B: 1-фтор-3-метил-2-нитро-4-(трифторметил)бензол
В суспензию 1-фтор-4-йод-3-метил-2-нитробензола (2,39 г, 8,50 ммоль), йодида меди(I) (2,430 г, 12,76 ммоль) и N,N-диизопропилэтиламина (4,41 мл, 25,5 ммоль) в DMF (8 мл) добавляли метил-2,2-дифтор-2-(фторсульфонил)ацетат (3,25 мл, 25,5 ммоль) и смесь нагревали при 80°C в течение 20 часов в закрытой пробирке. Реакционную смесь выливали в воду и экстрагировали дважды с помощью EtOAc. Органический слой промывали последовательно 10% водным раствором NaHCO3 и солевым раствором, высушивали над сульфатом магния и концентрировали с получением 1-фтор-3-метил-2-нитро-4-(трифторметил)бензола (2,37 г, 62%). LC/MS (Способ i), Время удерживания=2,25 минуты; без ионизации.
1H ЯМР (DMSO-d6, 300МГц): δ 8,09 (dd, J=6 Гц, 9Гц, 1H), 7,71 (t, J=9 Гц, 1H), 2,43 (m, 1H).
Стадия C: N,3-диметил-2-нитро-4-(трифторметил)анилин

В раствор 1-фтор-3-метил-2-нитро-4-(трифторметил)бензола (2,3 г, 10,31 ммоль) в MeOH (15 мл) добавляли метиламин (15,46 мл, 30,9 ммоль) (2 M в THF) и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали под пониженным давлением и остаток разбавляли с помощью EtOAc и промывали солевым раствором. Органическую фазу высушивали над сульфатом магния и выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 5% EtOAc в циклогексане) с получением N,3-диметил-2-нитро-4-(трифторметил)анилина (1 г, 43%) в виде желтого твердого вещества. LC/MS (Способ i), Время удерживания=2,29 минуты; MS масса/заряд: 235 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц): δ 7,63 (d, J=8,9 Гц, 1H), 6,77 (d, J=8,9 Гц, 1H), 6,59 (широкий, 1H), 2,77 (d, J=4,5 Гц, 3H), 2,24 (m, 3H).
Стадия D: N1,3-диметил-4-(трифторметил)бензол-1,2-диамин

В суспензию N,3-диметил-2-нитро-4-(трифторметил)анилина (1 г, 4,27 ммоль) в EtOH (48 мл) добавляли железо (2,385 г, 42,7 ммоль), хлорид аммония (0,685 г, 12,81 ммоль) и воду (16 мл) и реакционную смесь перемешивали с обратным холодильником в течение 1 часа. Реакционную смесь фильтровали через целит и фильтрат концентрировали. Остаток растворяли в DCM и промывали последовательно 2 M водным раствором NH4Cl и солевым раствором; затем органическую фазу высушивали над сульфатом магния и концентрировали с получением N-1,3-диметил-4-(трифторметил)бензол-1,2-диамина в виде желтого твердого вещества (884 мг, 77%). LC/MS (Способ i), Время удерживания=1,96 минуты; MS масса/заряд: 205 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц): δ 6,87 (d, J=8,4 Гц, 1H), 6,33 (d, J=8,4 Гц, 1H), 5,28 (широкий d, J=5,0 Гц, 1H), 4,57 (s, 2H), 2,75 (d, J=5,0 Гц, 3H), 2,12 ppm (m, 3H).
Получение №31: 4-бром-N1,3-диметилбензол-1,2-диамин
Стадия A: 4-бром-N,3-диметил-2-нитроанилин

Используя процедуру, аналогичную получению №30, стадии C, 4-бром-N,3-диметил-2-нитроанилин (428 мг, 82%) получали из 1-бром-4-фтор-2-метил-3-нитробензола (0,5 г, 2,14 ммоль). LC/MS (Способ h), Время удерживания=2,73 минуты; MS масса/заряд: 245 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц): δ 7,55 (d, J=9,1 Гц, 1H), 6,65 (d, J=9,1 Гц, 1H), 6,23 (m, 1H), 2,71 (d, J=4,8 Гц, 3H), 2,24 (s, 3H).
Стадия B: 4-бром-N1,3-диметилбензол-1,2-диамин
Используя процедуру, аналогичную получению №30, стадии D, 4-бром-N1,3-диметилбензол-1,2-диамин (360 мг, 82%) получали из 4-бром-N,3-диметил-2-нитроанилина (425 мг, 1,73 ммоль). LC/MS (Способ h), Время удерживания=1,73 минуты; MS масса/заряд: 215 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц): δ 6,73 (d, J=8,4 Гц, 1H), 6,21 (d, J=8,4 Гц, 1H), 4,60 (широкий, 3H), 2,67 (s, 3H), 2,15 (s, 3H).
Получение №32: 5-бром-N1-метил-3-(трифторметил)бензол-1,2-диамин
Стадия A: 5-бром-1-хлор-2-нитрозо-3-(трифторметил)бензол

В раствор 4-бром-2-хлор-6-(трифторметил)анилин (1,396 мл, 9,00 ммоль) в 1,2-дихлорэтане (60 мл) добавляли 3-хлорпероксибензойную кислоту (4,66 г, 27,0 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 20 минут и при 50°C в течение ночи. Добавляли DCM и органический слой промывали последовательно насыщенным водным раствором тиосульфата аммония и насыщенным раствором бикарбоната натрия, затем органическую фазу высушивали над сульфатом магния и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью от 5% до 20% EtOAc в циклогексане) с получением 5-бром-1-хлор-2-нитрозо-3-(трифторметил)бензола в виде бежевого твердого вещества (1,89 г, 69%). LC/MS (Способ h), Время удерживания=2,98 минуты; без ионизации.
1H ЯМР (DMSO-d6, 300МГц): δ 8,48 (d, J=1,8 Гц, 1H), 8,33 (d, J=1,8 Гц, 1H).
Стадия B: 5-бром-N-метил-2-нитрозо-3-(трифторметил)анилин
В раствор 5-бром-1-хлор-2-нитрозо-3-(трифторметил)бензола (2,7 г, 9,36 ммоль) в THF (25 мл) добавляли метиламин (10,30 мл, 20,59 ммоль) (2 M в THF) и реакционную смесь перемешивали при комнатной температуре в течение 5 минут. Реакционную смесь быстро охлаждали водой и экстрагировали с помощью EtOAc. Органический слой высушивали с помощью сульфата магния, фильтровали и концентрировали под пониженным давлением с получением 5-бром-N-метил-2-нитрозо-3-(трифторметил)анилина в виде коричневой жидкости (2,65 г, 89%).
LC/MS (Способ h), Время удерживания=2,60 минуты; MS масса/заряд: 283 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц): δ 11,56 (широкий, 1H), 7,69 (d, J=1,8 Гц, 1H), 7,39 (d, J=1,8 Гц, 1H), 2,92 (d, J=5,3 Гц, 3H).
Стадия C: 5-бром-N1-метил-3-(трифторметил)бензол-1,2-диамин
Используя процедуру, аналогичную получению №23, стадии D, 5-бром-N1-метил-3-(трифторметил)бензол-1,2-диамин (1,33 г, 51%) получали из 5-бром-N-метил-2-нитрозо-3-(трифторметил)анилина (2,65 г, 9,36 ммоль). LC/MS (Способ h), Время удерживания=2,67 минуты; MS масса/заряд: 269 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц): δ 6,77 (d, J=2,1 Гц, 1H), 6,60 (d, J=2,1 Гц, 1H), 5,48 (m, 1H), 5,10 (s, 2H), 2,73 (d, J=4,8 Гц, 3H).
Получение №33: трет-бутил-2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)бензоат

Стадия A: трет-бутил-2,4-дихлорбензоат
В раствор 2,4-дихлорбензойной кислоты (13,15 г, 68,8 ммоль) в THF (68,5 мл) добавляли ди-трет-бутилдикарбонат (15,98 мл, 68,8 ммоль) и N,N-диметилпиридин-4-амин (0,841 г, 6,88 ммоль) и реакционную смесь перемешивали при 40°C в течение 24 часов, затем выпаривали досуха. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 5-10% EtOAc в циклогексане) с получением трет-бутил-2,4-дихлорбензоата (13,1 г, 72%) в виде бесцветного масла. LC/MS (Способ i), Время удерживания=2,60 минуты; MS масса/заряд: 247 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц): δ 7,75 (m, 2H), 7,53 (dd, J=8,3, 2,1 Гц, 1H), 1,55 ppm (s, 9H).
Стадия B: трет-бутил-2,4-дихлор-3-формилбензоат
В раствор трет-бутил-2,4-дихлорбензоата (13,1 г, 53,0 ммоль) в THF (130 мл), охлажденный до -78°C, добавляли по каплям на протяжении 10 минут диизопропиламид лития (31,8 мл, 63,6 ммоль), разбавленный в THF (25 мл) и уже охлажденный до 0°C. Реакционную смесь перемешивали в течение 90 минут при -75°C, затем добавляли DMF (12,31 мл, 159 ммоль) и реакционную смесь перемешивали в течение 10 минут при температуре от -65°C до -75°C. Реакционную смесь быстро охлаждали уксусной кислотой (6 мл) и позволяли нагреваться до комнатной температуры. Реакционную смесь разделяли между диэтиловым эфиром и 1 н. раствором HCl. Водный слой экстрагировали диэтиловым эфиром, органический слой высушивали над сульфатом магния и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 5-10% EtOAc в циклогексане) с получением трет-бутил-2,4-дихлор-3-формилбензоата (10,6 г, 71%) в виде желтого масла.
LC/MS (Способ h), Время удерживания=2,88 минуты; MS масса/заряд: 275 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц): δ 10,34 (s, 1H), 7,86 (d, J=8,4 Гц, 1H), 7,69 (d, J=8,4 Гц, 1H), 1,56 (s, 9H).
Стадия C: трет-бутил-2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)бензоат

Используя процедуру, аналогичную получению №1, стадии D, трет-бутил-2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)бензоат (4 г, 100%) получали из трет-бутил-2,4-дихлор-3-формилбензоата (3,39 г, 12,3 ммоль). LC/MS (Способ i), Время удерживания=2,14 минуты; MS масса/заряд: 301 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц): δ 7,56 (s, 2H), 6,26 (d, J=5,0 Гц, 1H), 6,10 (dd, d, J=5,0 Гц и 2,3 Гц, 1H), 3,51 (d, J=2,3 Гц, 1H), 1,55 (s, 9H).
Получение №34: N-(2-йод-6-метил-4-(трифторметил)фенил)бензолсульфонамид
Стадия A: 2-йод-6-метил-4-(трифторметил)анилин

В раствор 2-метил-4-(трифторметил)анилина (3,5 г, 19,98 ммоль) в EtOH (80 мл) добавляли йод (5,07 г, 19,98 ммоль) и сульфат серебра (6,23 г, 19,98 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь разбавляли 10% водным раствором Na2S2O3. Полученный водный слой экстрагировали с помощью EtOAc и органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением с получением 2-йод-6-метил-4-(трифторметил)анилина в виде оранжевой смолы (6,3 г, 90%). LC/MS (Способ i), Время удерживания=2,32 минуты; MS масса/заряд: 302 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц): δ 7,70 (s, 1H), 7,31 (s, 1H), 5,55 (s, 2H), 2,20 (s, 3H).
Стадия B: N-(2-йод-6-метил-4-(трифторметил)фенил)бензолсульфонамид
Используя процедуру, аналогичную получению №16, стадии B, N-(2-йод-6-метил-4-(трифторметил)фенил)бензолсульфонамид (2,73 г, 32%) получали из 2-йод-6-метил-4-(трифторметил)анилина (5,8 г, 19,3 ммоль). LC/MS (Способ i), Время удерживания=2,35 минуты; MS масса/заряд: 442 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц): δ 10,03 (s, 1H), 8,01 (d, J=2,1 Гц, 1H), 7,60 (m, 6H), 2,04 (s, 3H).
Получение №35: N-(5-бром-2-йод-3-метилфенил)бензолсульфонамид
Стадия A: 5-бром-2-йод-1-метил-3-нитробензол
В раствор 4-бром-2-метил-6-нитроанилина (250 мг, 1,082 ммоль) в хлороформе (1,6 мл) добавляли изоамилнитрит (190 мг, 1,623 ммоль) и йод (549 мг, 2,164 ммоль) и реакционную смесь перемешивали с обратным холодильником в течение 3,5 часа. Реакционную смесь разбавляли 50% водным раствором Na2S2O3. Полученный водный слой экстрагировали с помощью EtOAc. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением с получением 5-бром-2-йод-1-метил-3-нитробензола (350 мг, 30%) в виде коричневой смолы. Ее использовали неочищенной на следующей стадии. LC/MS (Способ h), Время удерживания=2,90 минуты; без ионизации.
Стадия B: 5-бром-2-йод-3-метиланилин

Используя процедуру, аналогичную получению №23, стадии D, 5-бром-2-йод-3-метиланилин (1,6 г, 56%) получали из 5-бром-2-йод-1-метил-3-нитробензола (7,25 г, 8,69 ммоль). Ее использовали неочищенной на следующей стадии. LC/MS (Способ h), Время удерживания=2,74 минуты; MS масса/заряд: 312 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц): δ 6,76 (d, J=2,5 Гц, 1H), 6,70 (m, 1H), 5,49 (s, 2H), 2,29 (s, 3H).
Стадия C: N-(5-бром-2-йод-3-метилфенил)бензолсульфонамид

Используя процедуру, аналогичную получению №16, стадии B, N-(5-бром-2-йод-3-метилфенил)бензолсульфонамид (2,21 г, 95%) получали из 5-бром-2-йод-3-метиланилина (1,6 г, 5,13 ммоль). LC/MS (Способ h), Время удерживания=2,94 минуты; MS масса/заряд: 450 [M-H]-.
1H ЯМР (DMSO-d6, 300МГц): δ 9,95 (s, 1H), 7,65 (m, 5H), 7,44 (d, J=2,1 Гц, 1H), 6,87 (d, J=2,1 Гц, 1H), 2,36 (s, 3H).
Получение №36: получение метил-5-(1-гидроксипроп-2-ин-1-ил)-4,6-диметилникотината

Стадия A: 5-бром-4,6-диметил-2-оксо-1,2-дигидропиридин-3-карбонитрил
В раствор 4,6-диметил-2-оксо-1,2-дигидропиридин-3-карбонитрила (35 г, 236 ммоль) в уксусной кислоте (200 мл) добавляли бром (41,5 г, 260 ммоль). Реакционную смесь перемешивали в течение приблизительно 30 мин. при температуре окружающей среды. Реакционную смесь затем концентрировали досуха под пониженным давлением. Полученную смолу осаждали из водного раствора EtOH с получением5-бром-4,6-диметил-2-оксо-1,2-дигидропиридин-3-карбонитрила (70 г, 95%). LCMS (таблица 1, Способ c) RT= 1,63 минуты; MS масса/заряд=226, 228 (M+H).
Стадия B: 5-бром-2-хлор-4,6-диметилникотинонитрил
В раствор 5-бром-4,6-диметил-2-оксо-1,2-дигидропиридин-3-карбонитрила (14 г, 61,7 ммоль) в POCl3 (10 мл) добавляли пентахлорфосфоран (12,84 г, 61,7 ммоль). Реакционную смесь нагревали до температуры возврата флегмы в течение приблизительно 8 ч. POCl3 концентрировали под пониженным давлением. Полученный остаток разделяли между DCM (100 мл) и 5% водным раствором NaOH (100 мл). Объединенные органические экстракты высушивали над безводным MgSO4, фильтровали и концентрировали in vacuo. Полученный остаток растворяли в POCl3 (20 мл) и обрабатывали пентахлорфосфораном (13 г, 62,4 ммоль). Реакционную смесь нагревали до температуры возврата флегмы в течение приблизительно 12 ч. POCl3 концентрировали под пониженным давлением. Полученный остаток разделяли между DCM (100 мл) и 5% водным раствором NaOH (100 мл). Объединенные органические экстракты высушивали над безводным MgSO4, фильтровали и концентрировали in vacuo с получением 5-бром-2-хлор-4,6-диметилникотинонитрила (12 г, 79%). LCMS (таблица 1, Способ d) RT= 2,12 минуты; MS масса/заряд=246, 248 (M+H).
Стадия C: 5-бром-4,6-диметилникотинонитрил

В смесь 5-бром-2-хлор-4,6-диметилникотинонитрила (10 г, 40,7 ммоль) и красного фосфора (12,62 г, 407 ммоль) добавляли HI (44,7 мл, 489 ммоль). Реакционную смесь перемешивали при приблизительно 120°C в течение приблизительно 4 ч. Смесь охлаждали до температуры окружающей среды, затем выливали в насыщенный водный NaHCO3 (500 мл) и Na2SO3 (10 г). Твердые вещества отфильтровывали и оставшийся фильтрат концентрировали in vacuo. Полученное твердое вещество экстрагировали с помощью MeOH, затем концентрировали под пониженным давлением с получением 5-бром-4,6-диметилникотинонитрила (7 г, 44,0%). LCMS (таблица 1, Способ f) RT= 1,63 минуты; MS масса/заряд=211, 213 (M+H).
Стадия D: 5-бром-4,6-диметилникотиновая кислота
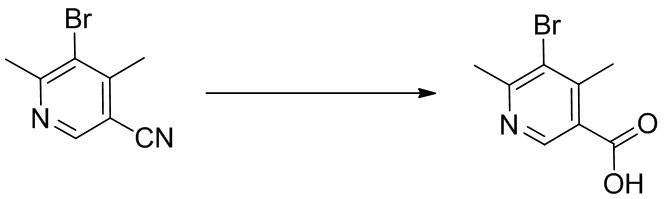
В смесь 5-бром-4,6-диметилникотинонитрила (10 г, 47,4 ммоль) в воде (20 мл) добавляли KOH (26,6 г, 47,4 ммоль). Реакционную смесь перемешивали при приблизительно 110°C в течение приблизительно 16 ч. Реакционную смесь затем охлаждали до температуры окружающей среды и нейтрализовали добавлением концентрированной HCl. Полученное твердое вещество фильтровали с получением 5-бром-4,6-диметилникотиновой кислоты (9 г, 79%). LCMS (таблица 1, Способ e) RT= 1,61 минуты; MS масса/заряд=232, 233 (M+H).
Стадия E: метил 5-бром-4,6-диметилникотинат

В раствор 5-бром-4,6-диметилникотиновой кислоты (10 г, 43,5 ммоль) в MeOH (10 мл) добавляли тионилхлорид (5,17 г, 43,5 ммоль) при приблизительно 0°C. Реакционную смесь нагревали до приблизительно 80°C. Через приблизительно 12 ч. реакционную смесь концентрировали in vacuo. Полученный остаток разбавляли с помощью DCM, высушивали над безводным Na2SO4, фильтровали и концентрировали под пониженным давлением с получением метил-5-бром-4,6-диметилникотината (9,6 г, 81%). LCMS (таблица 1, Способ e) RT= 1,99 минуты; MS масса/заряд=245, 246 (M+H).
Стадия F: метил-4,6-диметил-5-винилникотинат
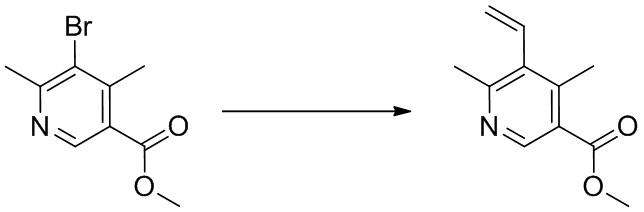
Метил-5-бром-4,6-диметилникотинат (15 г, 61,5 ммоль), 4,4,5,5-тетраметил-2-винил-1,3,2-диоксаборолан (14,2 г, 92 ммоль), Pd(PPh3)4 (7,1 г, 6,1 ммоль) и KF (5,4 г, 92 ммоль) объединяли в DMF (20 мл). Смесь нагревали до приблизительно 100°C в течение приблизительно 16 ч. Смесь охлаждали до к.т. и растворитель концентрировали in vacuo. Оставшийся остаток очищали хроматографией на силикагеле (10:1 петролейный эфир/EtOAc) с получением метил-4,6-диметил-5-винилникотината (9 г, 56%). LC/MS (таблица 1, Способ e) RT= 1,23 минуты; MS масса/заряд=192 (M+H).
Стадия G: метил-5-формил-4,6-диметилникотинат

В раствор метил-4,6-диметил-5-винилникотината (12 г, 62,8 ммоль) и 2,6-диметилпиридина (8 мл, 69 ммоль) в смеси 3:1 1,4-диоксана:воды (50,0 мл) добавляли OsO4 (12 мл, 0,94 ммоль, 0,08 M в t-BuOH) и перйодат натрия (40 г, 188 ммоль). Смесь перемешивали при к. т. в течение приблизительно 36 ч. Реакционную смесь фильтровали и фильтрат промывали насыщенным водным Na2S2O3. Смесь экстрагировали с помощью EtOAc, высушивали над безводным Na2SO4, фильтровали и концентрировали in vacuo. Неочищенный материал очищали хроматографией на силикагеле (от 5:1 до 2:1 петролейный эфир: EtOAc) с получением метил-5-формил-4,6-диметилникотината (8 г, 59%). LCMS (таблица 1, Способ d) RT= 1,55 минуты; MS масса/заряд=194 (M+H).
Стадия H: метил-5-(1-гидроксипроп-2-ин-1-ил)-4,6-диметилникотинат
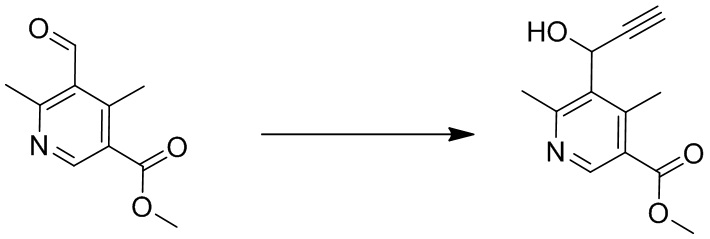
В раствор метил-5-формил-4,6-диметилникотината (8 г, 37,3 ммоль) в безводном THF (100 мл) при приблизительно 0°C добавляли этинилмагния бромид (82 мл, 41 ммоль). Полученную реакционную смесь перемешивали при приблизительно 0°C в течение приблизительно 1 ч. Реакционную смесь разбавляли метиленхлоридом, промывали насыщенным водным NH4Cl (3×100 мл). Органический слой высушивали над безводным Na2SO4, фильтровали и концентрировали in vacuo. Неочищенный материал очищали хроматографией на силикагеле (2:1 гексаны:EtOAc) с получением метил-5-(1-гидроксипроп-2-ин-1-ил)-4,6-диметилникотината (6 г, 73%). LCMS (таблица 1, Способ c) RT= 1,73 минуты; MS масса/заряд=220 (M+H).
Получение №37: этил-3,5-дихлор-4-(1-гидроксипроп-2-ин-1-ил)пиколинат

Стадия A: 2,3,5-трихлоризоникотинальдегид

В раствор LDA (99 мл, 197 ммоль) в THF (100 мл), добавляли раствор 2,3,5-трихлорпиридина (30 г, 164 ммоль) в THF (200 мл) при приблизительно -78°C. Полученную реакционную смесь перемешивали при приблизительно -78°C в течение приблизительно 1 ч. Метилформиат (20 мл, 329 ммоль) добавляли аккуратно в реакционную смесь, затем смесь перемешивали при приблизительно -78°C в течение приблизительно 1 ч., затем нагревали до к. т. и перемешивали в течение 16 ч. Реакционную смесь выливали в насыщенный водный NH4Cl. Водный слой экстрагировали с помощью EtOAc (3×20 мл). Объединенные органические слои высушивали над безводным Na2SO4, фильтровали через воронку из спеченного стекла и концентрировали под пониженным давлением с получением 2,3,5-трихлоризоникотинальдегида (26,2 г, 53%, чистота 70%). LCMS (таблица 1, Способ c) RT= 1,83 минуты; MS масса/заряд=209, 211 (M+H).
Стадия B: 2,3,5-трихлор-4-(диэтоксиметил)пиридин
Смесь 2,3,5-трихлоризоникотинальдегида (26,2 г, 87 ммоль), моногидрата п-толуолсульфоновой кислоты (18,23 г, 96 ммоль), MgSO4 (11,54 г, 96 ммоль) и триэтилортоформиата (21,77 мл, 131 ммоль) в DCE (300 мл) нагревали до приблизительно 50°C в течение приблизительно 5 ч. Раствор разбавляли водой, экстрагировали с помощью DCM (3×50 мл). Объединенные органические слои высушивали над безводным Na2SO4, фильтровали и концентрировали под пониженным давлением с получением 2,3,5-трихлор-4-(диэтоксиметил)пиридина (20,67 г, 75%). LCMS (таблица 1, Способ d) RT= 2,12 минуты; MS масса/заряд=284, 286 (M+H).
Стадия C: этил-3,5-дихлор-4-(диэтоксиметил)пиколинат
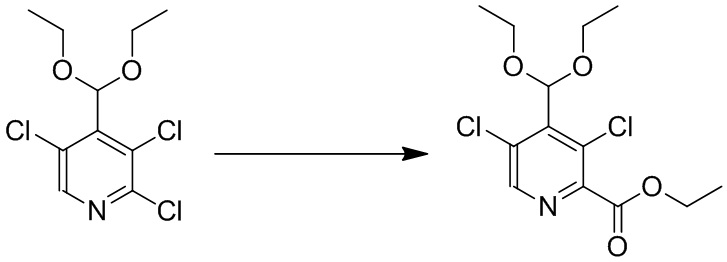
Раствор 2,3,5-трихлор-4-(диэтоксиметил)пиридина (20 г, 70,3 ммоль), PdCl2(PPh3)2 (4,93 г, 7,03 ммоль) и TEA (29 мл, 211 ммоль) в EtOH (200 мл) обрабатывали с помощью CO под давлением, составляющим 30 бар, и нагревали до приблизительно 100°C в закрытой пробирке в течение приблизительно 24 ч. Реакционную смесь фильтровали через подушку целита и фильтрат концентрировали под пониженным давлением. Неочищенный материал очищали посредством хроматографии на силикагеле, элюирование с помощью 5% смеси EtOAc/гептанов с получением этил-3,5-дихлор-4-(диэтоксиметил)пиколината (14 г, 61,8%). LCMS (таблица 1, Способ d) RT= 2,02 минуты; MS масса/заряд=322, 324 (M+H).
Стадия D: этил-3,5-дихлор-4-формилпиколинат
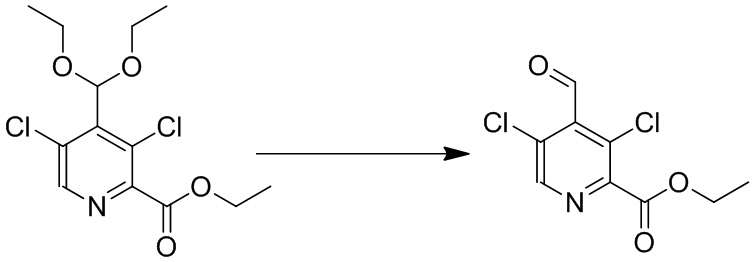
В круглодонную колбу загружали смесь этил-3,5-дихлор-4-(диэтоксиметил)пиколината (14 г, 43,5 ммоль) и HCl (100 мл, 3291 ммоль). Реакционную смесь перемешивали в течение приблизительно 1 часа при к. т. Реакционную смесь разбавляли с помощью EtOAc, промывали с помощью 1 н. водн. раствора NaOH (3×50 мл). Органическую часть высушивали над безводным Na2SO4, фильтровали через воронку из спеченного стекла и концентрировали под пониженным давлением с получением этил- 3,5-дихлор-4-формилпиколината (10 г, 93%). LCMS (таблица 1, Способ d) RT= 1,92 минуты; MS масса/заряд=247, 249 (M+H).
Стадия E: этил-3,5-дихлор-4-(1-гидроксипроп-2-ин-1-ил)пиколинат
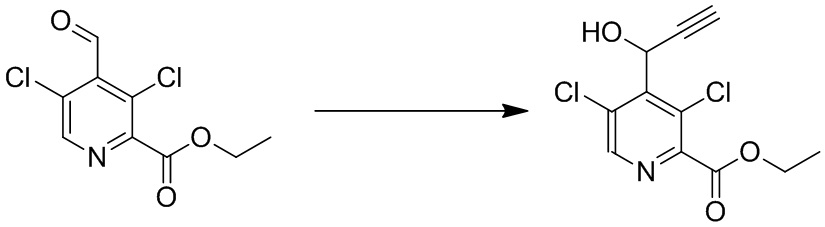
В раствор этил 3,5-дихлор-4-формилпиколината (9,6 г, 32,9 ммоль) в безводном THF (100 мл) при приблизительно 0°C добавляли этинилмагния бромид (72 мл, 36,2 ммоль). Полученную реакционную смесь перемешивали при приблизительно 0°C в течение приблизительно 1 ч. Реакционную смесь разбавляли метиленхлоридом, промывали насыщенным водным NH4Cl (3×100 мл). Органический слой высушивали над безводным Na2SO4, фильтровали и концентрировали in vacuo. Неочищенный материал очищали хроматографией на силикагеле (10% смеси EtOAc/гептанов) с получением этил-3,5-дихлор-4-(1-гидроксипроп-2-ин-1-ил)пиколината (7,9 г, 88%). LC/MS (таблица 1, Способ d) RT= 1,65минуты; MS масса/заряд=274, 276 (M+H).
Получение №38: получение этил-4,6-дихлор-5-(1-гидроксипроп-2-ин-1-ил)никотината

Стадия A: этил-4,6-дихлорникотинат

Смесь 4,6-дихлорникотиновой кислоты (20 г, 104 ммоль) в DCM (200 мл) охлаждали до 0°C перед добавлением DMF (0,807 мл, 10,42 ммоль) и оксалилхлорида (10,94 мл, 125 ммоль). Полученную реакционную смесь перемешивали при приблизительно 0°C-25°C. Через приблизительно 2 ч медленно добавляли EtOH (48,7 мл, 833 ммоль) и перемешивали при приблизительно 25°C в течение 2 ч. Реакционную смесь разбавляли эфиром (50 мл) и полученный раствор промывали насыщенным водным NaHCO3 (3×50 мл). Экстракты объединяли и высушивали над безводным Na2SO4, фильтровали и растворитель удаляли in vacuo с получением этил-4,6-дихлорникотината (18 г, 79%): LC/MS (таблица 1, Способ d), Время удерживания=1,91 минуты; MS масса/заряд =220 (M+H).
Стадия B: этил-4,6-дихлор-5-формилникотинат

В колбу, содержащую LDA (27,3 мл, 54,5 ммоль) в THF (100 мл) добавляли раствор этил-4,6-дихлорникотината (10 г, 45,4 ммоль) в THF (200 мл), так что внутренняя температура сохранялась на уровне приблизительно -78°C. Через приблизительно 30 мин. метилформиат (5,57 мл, 91 ммоль) добавляли по каплям в реакционную смесь и перемешивали при -78°C в течение 1 ч. Реакционную смесь затем выливали в насыщенный водный Na2SO4, фильтровали и концентрировали in vacuo. Остаток очищали хроматографией на силикагеле (20:1 гексаны:EtOAc) с получением этил-4,6-дихлор-5-формилникотината (5,19 г, 46%). LCMS (таблица 1, Способ c) RT= 1,95 минуты; MS масса/заряд=248 (M+H).
Стадия C: этил-4,6-дихлор-5-(1-гидроксипроп-2-ин-1-ил)никотинат

В раствор этил-4,6-дихлор-5-формилникотината (12,9 г, 52,0 ммоль) в безводном THF (120 мл) при приблизительно 0°C добавляли этинилмагния бромид (114 мл, 57,2 ммоль). Полученную реакционную смесь перемешивали при приблизительно 0°C в течение приблизительно 1 ч. Реакционную смесь разбавляли метиленхлоридом, промывали насыщенным водным NH4Cl (3×100 мл). Органический слой высушивали над безводным Na2SO4, фильтровали и концентрировали in vacuo. Неочищенный материал очищали хроматографией на силикагеле (10:1 гексаны/EtOAc) с получением этил-4,6-дихлор-5-(1-гидроксипроп-2-ин-1-ил)никотината (11,1 г, 78%). LCMS (таблица 1, Способ d), Время удерживания= 1,70 минуты; MS масса/заряд=274 (M+H).
Получение №39: N-(3-йод-2-метил-6-(трифторметил)пиридин-4-ил)бензолсульфонамид
Стадия A: 2-метил-4-нитро-6-(трифторметил)пиридин
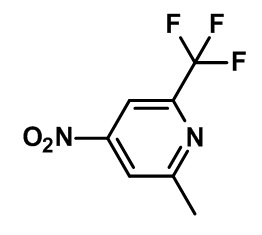
В раствор 2-бром-6-метил-4-нитропиридина (WO2013/059587) (1,84 г, 8,48 ммоль) и йодида меди(I) (1,938 г, 10,17 ммоль) в NMP (15,73 мл) добавляли метил-2,2-дифтор-2-(фторсульфонил)ацетат (3,24 мл, 25,4 ммоль) и реакционную смесь облучали микроволнами при 100°C в течение 5 часов. Реакционную смесь промывали водой и экстрагировали с помощью EtOAc. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением с получением 2-метил-4-нитро-6-(трифторметил)пиридина (1,48 г, 80%). LC/MS (Способ h), Время удерживания=2,16 мин.; без ионизации 1H ЯМР (DMSO-d6, 300МГц): δ 8,41 (d, J=1,8 Гц, 1H), 8,32 (d, J=1,8 Гц, 1H), 2,74 (s, 3H).
Стадия B: 2-метил-6-(трифторметил)пиридин-4-амин
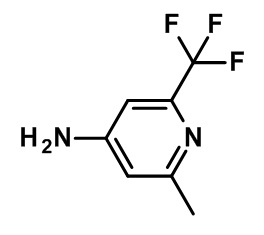
Используя процедуру, аналогичную описанной в получении №18, стадии C, метил-6-(трифторметил)пиридин-4-амин (409 мг, 42%) получали из 2-метил-4-нитро-6-(трифторметил)пиридина (1,05 г, 5,09 ммоль). LC/MS (Способ k), Время удерживания=2,15 минуты; MS масса/заряд: 177 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц): δ 6,73 (d, J=1,7 Гц, 1H), 6,49 (d, J=1,7 Гц, 1H), 6,42 (s, 2H), 2,29 (s, 3H).
Стадия C: 3-йод-2-метил-6-(трифторметил)пиридин-4-амин
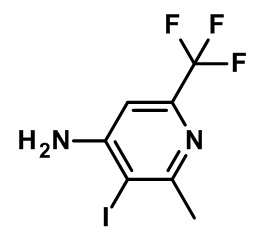
В раствор 2-метил-6-(трифторметил)пиридин-4-амина (405 мг, 2,299 ммоль) в EtOH (8 мл) добавляли сульфат серебра (717 мг, 2,299 ммоль) и йод (584 мг, 2,299 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь быстро охлаждали насыщенным водным раствором Na2S2O3 и экстрагировали дважды с помощью EtOAc. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 5-40% EtOAc в циклогексане) с получением 3-йод-2-метил-6-(трифторметил)пиридин-4-амина (608 мг, 88%) в виде аморфного твердого вещества. LC/MS (Способ i), Время удерживания=1,78 минуты; MS масса/заряд: 303 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц): δ 6,86 (s, 1H), 6,63 (широкий, 2H), 2,59 (s, 3H).
Стадия D: N-(3-йод-2-метил-6-(трифторметил)пиридин-4-ил)бензолсульфонамид

Используя процедуру, аналогичную получению №16, стадии B, N-(3-йод-2-метил-6-(трифторметил)пиридин-4-ил)бензолсульфонамид (414 мг, 33%) получали из 3-йод-2-метил-6-(трифторметил)пиридин-4-амина (740 мг, 2,45 ммоль). LC/MS (Способ i), Время удерживания=2,24 минуты; MS масса/заряд: 443 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц): δ 7,90 (m, 2H), 7,64 (m, 3H), 7,22 (s, 1H), 2,70 (s, 3H).
Получение №40: N-(6-циано-3-йод-2-метилпиридин-4-ил)бензолсульфонамид
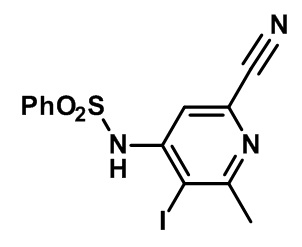
Стадия A: 4-амино-5-йод-6-метилпиколинонитрил

В раствор 4-амино-6-метилпиколинонитрила (1,756 г, 13,19 ммоль) (описанного в WO2005/030213) в ACN (44,0 мл) добавляли N-йодсукцинимид (3,26 г, 14,51 ммоль) и реакционную смесь перемешивали с обратным холодильником в течение 24 часов. Реакционную смесь гидролизовали насыщенным водным раствором Na2S2O3 и экстрагировали с помощью EtOAc. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 5-60% EtOAc в циклогексане) с получением 4-амино-5-йод-6-метилпиколинонитрила (1,18 г, 34%) в виде коричневого твердого вещества. LC/MS (Способ h), Время удерживания=1,55 минуты; MS масса/заряд: 260 [M+H]+.
1H ЯМР (DMSO-d6, 500МГц): δ 6,88 (s, 1H), 6,66 (широкий, 2H), 2,55 (s, 3H).
Стадия B: N-(6-циано-3-йод-2-метилпиридин-4-ил)бензолсульфонамид
Используя процедуру, аналогичную получению №16, стадии B, N-(6-циано-3-йод-2-метилпиридин-4-ил)бензолсульфонамид (400 мг, 23%) получали из 4-амино-5-йод-6-метилпиколинонитрила (1,15 г, 4,44 ммоль). Соединение использовали непосредственно на следующей стадии.
LC/MS (Способ h), Время удерживания=2,28 минуты; MS масса/заряд: 400 [M+H]+.
Получение №41: 4-метил-6-(трифторметил)пиридазин-3-амин
Стадия A: 4-бром-6-(трифторметил)пиридазин-3-амин
В раствор 6-(трифторметил)пиридазин-3-амина (730 мг, 4,48 ммоль) и бикарбоната натрия (752 мг, 8,95 ммоль) в MeOH (15 мл) по каплям добавляли бром (0,231 мл, 4,48 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение одной ночи, затем гидролизовали насыщенным водным раствором Na2S2O3. MeOH выпаривали и полученный раствор разбавляли EtOAc и две фазы разделяли. Органический слой промывали насыщенным водным раствором Na2S2O3, высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 7-60% EtOAc в циклогексане) с получением 4-бром-6-(трифторметил)пиридазин-3-амина (513 мг, 47%) в виде бежевого твердого вещества. LC/MS (Способ i), Время удерживания=1,33 минуты; MS масса/заряд: 242 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц): δ 8,23 (s, 1H), 7,55 (широкий, 2H).
Стадия B: 4-метил-6-(трифторметил)пиридазин-3-амин

В раствор 4-бром-6-(трифторметил)пиридазин-3-амина (460 мг, 1,901 ммоль), трис(дибензилиденацетон)дипалладия(0) (17,41 мг, 0,019 ммоль), 2-(дициклогексилфосфино)-2',4',6'-триизопропилбифенила (36,2 мг, 0,076 ммоль) и фосфата калия трехосновного (807 мг, 3,80 ммоль) в 1,4-диоксане (3,7 мл) добавляли триметилбороксин (0,398 мл, 2,85 ммоль). Реакционную смесь перемешивали при 100°C в течение одной ночи, затем разбавляли с помощью H2O. Полученный водный слой экстрагировали с помощью EtOAc и полученный органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Такую же процедуру проводили три раза с полученным остатком для повышения степени превращения. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 7-60% EtOAc в циклогексане) с получением 4-метил-6-(трифторметил)пиридазин-3-амина (318 мг, 94%) в виде бежевого твердого вещества. LC/MS (Способ i), Время удерживания=0,88 минуты; MS масса/заряд: 178 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц): δ 7,54 (s, 1H), 6,94 (br. s., 2H), 2,09 (s, 3H).
Получение №42: 3,7-диметил-5-(трифторметил)-1H-индазол

Стадия A: 2-фтор-3-метил-5-(трифторметил)бензальдегид

В раствор 4-фтор-3-метилбензотрифторида (1,5 г, 8,42 ммоль) в THF (11 мл), охлажденный при -78°C, добавляли бутиллитий (5,42 мл, 8,67 ммоль). Смесь перемешивали в течение 30 минут при -78°C, затем раствор DMF (0,724 мл, 9,35 ммоль) в THF (3 мл) добавляли по каплям. Реакционную смесь перемешивали при -78°C в течение 1 часа, а затем нагревали до 0°C. 10% раствор лимонной кислоты добавляли в реакционную смесь при 0°C и смесь экстрагировали с помощью EtOAc. Органический слой промывали солевым раствором и высушивали над сульфатом магния, фильтровали и выпаривали с получением 2-фтор-3-метил-5-(трифторметил)бензальдегида (2 г, 100%) в виде бесцветной жидкости. LC/MS (Способ h), Время удерживания=2,52 минуты; без ионизации 1H ЯМР (DMSO-d6, 300МГц): δ 10,23 (s, 1H), 8,09 (m, 1H), 7,97 (m, 1H), 2,39 ppm (m, 3H).
Стадия B: 1-(2-фтор-3-метил-5-(трифторметил)фенил)этанол

В раствор 2-фтор-3-метил-5-(трифторметил)бензальдегида (2 г, 9,70 ммоль) в THF (42 мл), охлажденный при -50°C, добавляли метилмагния бромид (3,88 мл, 11,64 ммоль) и смесь перемешивали при комнатной температуре в течение 2 часов. Смесь быстро охлаждали насыщенным водным раствором NH4Cl и экстрагировали с помощью EtOAc. Органический слой промывали солевым раствором, высушивали над сульфатом магния, фильтровали и выпаривали с получением 1-(2-фтор-3-метил-5-(трифторметил)фенил)этанола (1,21 г, 41%) в виде бесцветной жидкости: LC/MS (Способ h), Время удерживания=2,42 минуты; MS масса/заряд: 281 [M-H]-+CH3COOH.
1H ЯМР (DMSO-d6, 300МГц): δ 7,65 (m, 1H), 7,59 (m, 1H), 5,53 (d, J=4,6 Гц, 1H), 5,00 (m, 1H), 2,30 (d, J=2,3 Гц, 3H), 1,34 (d, J=6,6 Гц, 3H).
Стадия C: 1-(2-фтор-3-метил-5-(трифторметил)фенил)этанон
Используя процедуру, аналогичную получению №14, стадии B, 1-(2-фтор-3-метил-5-(трифторметил)фенил)этанон (854 мг, 75%) получали из 1-(2-фтор-3-метил-5-(трифторметил)фенил)этанола (1,1 г, 4,95 ммоль). LC/MS (Способ h), Время удерживания=2,63 минуты; без ионизации.
1H ЯМР (DMSO-d6, 300МГц): δ 7,99 (m, 1H), 7,91 (m, 1H), 2,63 (d, J=4,3 Гц, 3H), 2,37 (d, J=2,5 Гц, 3H).
Стадия D: 3,7-диметил-5-(трифторметил)-1H-индазол

В раствор 1-(2-фтор-3-метил-5-(трифторметил)фенил)этанона (200 мг, 0,908 ммоль) в этан-1,2-диоле (700 мкл, 12,55 ммоль) добавляли гидрат гидразина (53,0 мкл, 1,090 ммоль) и смесь перемешивали при комнатной температуре в течение 20 часов. Добавляли дополнительное количество гидрата гидразина (53,0 мкл, 1,090 ммоль) и смесь нагревали до 50°C в течение 1 часа. Температуру нагрева повышали до 170°C и нагрев продолжали в течение 2 часов. Смесь охлаждали до комнатной температуры: готовый индазол осаждался. Его разбавляли водой, фильтровали, и промывали водой, и высушивали при 50°C под вакуумом с получением 3,7-диметил-5-(трифторметил)-1H-индазола (130 мг, 61%) в виде белого твердого вещества. LC/MS (Способ i), Время удерживания=1,99 минуты; MS масса/заряд: 215 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 13,14 (широкий, 1H), 7,97 (s, 1H), 7,39 (s, 1H), 2,55 (s, 3H), 2,54 (s, 3H).
Получение №43: 3,7-диметил-5-(трифторметил)-1H-индол
Стадия A: N-аллил-2-йод-6-метил-4-(трифторметил)анилин

В раствор 2-йод-6-метил-4-(трифторметил)анилина (получение №34, стадия A) (11,1 г, 36,9 ммоль) в толуоле (56 мл) добавляли карбонат калия (7,64 г, 55,3 ммоль), тетрабутиламмония бромид (1,189 г, 3,69 ммоль), гидроксид калия (2,276 г, 40,6 ммоль) и аллилбромид (5,80 г, 47,9 ммоль). Реакционную смесь перемешивали при 65°C в течение 18 часов. Затем добавляли дополнительное количество карбоната калия (0,8 экв.), тетрабутиламмония бромида (0,05 экв.), гидроксида калия (0,5 экв.) и аллилбромида (0,6 экв.). Реакционную смесь перемешивали при 65°C в течение 18 часов. Затем добавляли дополнительное количество карбоната калия (0,8 экв.), тетрабутиламмония бромида (0,05 экв.), гидроксида калия (0,5 экв.) и аллилбромида (0,6 экв.). Реакционную смесь перемешивали при 65°C в течение 18 часов. Затем добавляли дополнительное количество карбоната калия (0,8 экв.), тетрабутиламмония бромида (0,05 экв.), гидроксида калия (0,5 экв.) и аллилбромида (0,6 экв.). Реакционную смесь перемешивали при 65°C в течение 18 часов. Реакционную смесь охлаждали до 5°C. Ее разбавляли водой и подкисляли 5 н. раствором HCl до pH=3-4. Водный слой экстрагировали с помощью EtOAc. Органический слой промывали водой, солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали дважды колоночной хроматографией на силикагеле (элюирование с помощью 0-30% EtOAc в циклогексане), затем (элюирование с помощью 5-10% EtOAc в циклогексане) с получением N-аллил-2-йод-6-метил-4-(трифторметил)анилина (7,25 г, 57%) в виде оранжевого масла. LC/MS (Способ i), Время удерживания=2,69 минуты; MS масса/заряд: 342 [M+H]+ 1H ЯМР (ХЛОРОФОРМ-d, 300МГц): δ 7,82 (s, 1H), 7,32 (s, 1H), 5,96 (dd, J=17,2, 10,2 Гц, 1H), 5,30 (dd, J=17,2, 1,4 Гц, 1,4H, 1H), 5,16 (dd, J=10,2, 1,4 Гц, 1H), 3,84 (широкий, 1H), 3,73 (d, J=5,8 Гц, 2H), 2,38 (s, 3H).
Стадия B: 3,7-диметил-5-(трифторметил)-1H-индол
В раствор N-аллил-2-йод-6-метил-4-(трифторметил)анилина (1 г, 2,93 ммоль) в ACN (5 мл) добавляли палладия(II) ацетат (0,013 г, 0,059 ммоль) и три-o-толилфосфин (0,036 г, 0,117 ммоль). Реакционную смесь нагревали до 45°C и добавляли триэтиламин (1,5 мл). Реакционную смесь перемешивали при 75°C в течение 15 часов. Добавляли дополнительное количество палладия(II) ацетата (0,05 экв.) и три-o-толилфосфина (0,1 экв.) и перемешивание продолжали в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и растворитель удаляли под пониженным давлением. EtOAc добавляли в остаток и полученный осадок фильтровали и промывали с помощью EtOAc. Фильтрат концентрировали под пониженным давлением. Этот остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-15% EtOAc в циклогексане) с получением 3,7-диметил-5-(трифторметил)-1H-индола (460 мг, 68%) в виде оранжевого масла. LC/MS (Способ i), Время удерживания=2,32 минуты; MS масса/заряд: 214 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 11,18 (широкий, 1H), 7,67 (s, 1H), 7,28 (s, 1H), 7,16 (s, 1H), 2,51 (s, 3H), 2,29 (s, 3H).
Получение №44: трет-бутил-2,4-дихлор-3-(хлоркарбонил)бензоат

Стадия A: 3-(трет-бутоксикарбонил)-2,6-дихлорбензойная кислота

В раствор трет-бутил-2,4-дихлорбензоата (получение №33, стадия A) (15 г, 60,7 ммоль) в THF (100 мл), охлажденного при -70°C, добавляли лития диизопропиламид (36,4 мл, 72,8 ммоль). Реакционную смесь перемешивали в течение 90 минут при -70°C, затем добавляли дробленый диоксид углерода (30 г, 682 ммоль), высушенный над сульфатом магния. Реакционную смесь перемешивали в течение 15 минут при температуре от -65°C до -70°C, затем нагревали до комнатной температуры. Реакционную смесь разбавляли водой и THF выпаривали. Основный водный слой промывали диэтиловым эфиром, затем подкисляли до pH=1 добавлением 1 н. раствора HCl и экстрагировали с помощью EtOAc. Органический слой промывали насыщенным раствором NaCl, высушивали над сульфатом магния и концентрировали с получением 3-(трет-бутоксикарбонил)-2,6-дихлорбензойной кислоты (13 г, 74%) в виде бежевого твердого вещества. LC/MS (Способ i), Время удерживания=1,53 минуты; без ионизации.
1H ЯМР (DMSO-d6, 300МГц): δ 7,76 (d, J=8,4 Гц, 1H), 7,65 (d, J=8,4 Гц, 1H), 1,55 (s, 9H).
Стадия B: трет-бутил-2,4-дихлор-3-(хлоркарбонил)бензоат

В раствор 3-(трет-бутоксикарбонил)-2,6-дихлорбензойной кислоты (455 мг, 1,563 ммоль) в DCM (23 мл), охлажденный при 0°C, добавляли оксалилхлорид (0,205 мл, 2,344 ммоль), разбавленный в DCM (2 мл) 2 каплями DMF. Реакционную смесь перемешивали в течение 45 минут при 0°C. Реакционную смесь концентрировали in vacuo с получением трет-бутил-2,4-дихлор-3-(хлоркарбонил)бензоата, который использовали неочищенным непосредственно на следующей стадии.
Получение №45: 3,7-диметил-1H-индол-5-карбонитрил

4-амино-3-хлор-5-метилбензонитрил (250 мг, 1,501 ммоль), карбонат калия (622 мг, 4,50 ммоль), 3-бромпроп-1-ен (0,130 мл, 1,501 ммоль), дициклогексил(2',4',6'-триизопропил-[1,1'-бифенил]-2-ил)фосфин (71,5 мг, 0,150 ммоль) растворяли в DME (7,5 мл) и добавляли палладия(II) ацетат (16,84 мг, 0,075 ммоль). Реакционную смесь перемешивали 95 минут при 150°C под микроволновым облучением. Реакционную смесь концентрировали досуха и остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 15-20% EtOAc в циклогексане) с получением 3,7-диметил-1H-индол-5-карбонитрила (107 мг, 25%) в виде бледно-желтого твердого вещества. LC/MS (Способ i), Время удерживания=1,91 минуты; MS масса/заряд: 171 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 11,34 (широкий, 1H), 7,86 (s, 1H), 7,30 (s, 1H), 7,22 (s, 1H), 2,47 (s, 3H), 2,27 (s, 3H).
Получение №46: N-(2-бром-5-циано-3-метилфенил)бензолсульфонамид
Используя процедуру, аналогичную получению №16, стадии B, N-(2-бром-5-циано-3-метилфенил)бензолсульфонамид (2,03 г, 67%) получали в виде оранжевого твердого вещества из 3-амино-4-бром-5-метилбензонитрила (описанного в Journal of Medicinal Chemistry, 2007, 50, 6519-6534) (1,5 г, 7,11 ммоль). LC/MS (Способ h), Время удерживания=2,48 минуты; MS масса/заряд: 349 [M-H]-.
1H ЯМР (CDCl3, 300 МГц): δ 7,81 (m, 3H), 7,59 (m, 1H), 7,49 (m, 2H), 7,24 (m, 2H), 2,36 (s, 3H).
Получение №47: N-(2-йод-3-метил-5-(трифторметокси)фенил)бензолсульфонамид
Стадия A: 2,2,2-трифтор-N-(2-метил-6-нитро-4-(трифторметокси)фенил)ацетамид
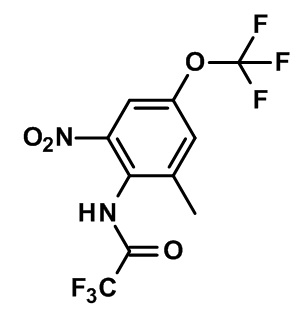
В раствор 2-метил-4-(трифторметокси)анилина (1 г, 5,23 ммоль) в DCM (4 мл), охлажденный до 0°C, добавляли 2,2,2-трифторуксусный ангидрид (1,921 мл, 13,60 ммоль) и смесь перемешивали в течение одного часа при 0°C. Нитрат калия (0,661 г, 6,54 ммоль) медленно добавляли при 0°C и смесь перемешивали при комнатной температуре в течение 3 часов. Смесь разбавляли водой и экстрагировали три раза с помощью DCM. Органические фазы промывали насыщенным раствором NaCl, высушивали над сульфатом магния, фильтровали и выпаривали с получением 2,2,2-трифтор-N-(2-метил-6-нитро-4-(трифторметокси)фенил)ацетамида (1,7 г, 100%) в виде желтого твердого вещества. LC/MS (Способ i), Время удерживания=2,17 минуты; MS масса/заряд: 331 [M-H]- 1H ЯМР (DMSO-d6, 300МГц): δ=11,59 (s, 1H), 8,05 (m, 1H), 7,88 (m, 1H), 2,35 (s, 3H).
Стадия B: 2-метил-6-нитро-4-(трифторметокси)анилин

В раствор 2,2,2-трифтор-N-(2-метил-6-нитро-4-(трифторметокси)фенил)ацетамида (4 г, 12,04 ммоль) в MeOH (80 мл) добавляли карбонат калия (6,66 г, 48,2 ммоль) и реакционную смесь перемешивали при 85°C в течение 36 часов. Растворитель выпаривали, остаток разбавляли этилацетатом и водой и нейтрализовали добавлением 1 н. раствора HCl. После двух экстракций этилацетатом органические слои промывали солевым раствором, высушивали над сульфатом магния и выпаривали с получением 2-метил-6-нитро-4-(трифторметокси)анилина (3,24 г, 100%). LC/MS (Способ i), Время удерживания=2,16 минуты; MS масса/заряд: 235 [M-H]-.
1H ЯМР (DMSO-d6, 300МГц): d=7,83 (d, J=2,8 Гц, 1H), 7,47 (d, J=2,8 Гц, 1H), 7,33 (br, 2H), 2,25 (s, 3H).
Стадия C: 2-йод-1-метил-3-нитро-5-(трифторметокси)бензол
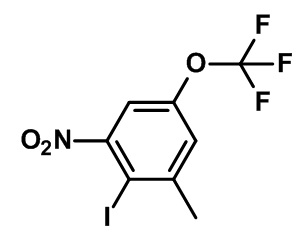
В раствор 2-метил-6-нитро-4-(трифторметокси)анилина (2,5 г, 10,59 ммоль) в воде (10,6 мл) добавляли по каплям концентрированную хлористоводородную кислоту (10,61 мл, 349 ммоль). Нерастворимый раствор охлаждали до 0°C, затем раствор нитрита натрия (1,169 г, 16,94 ммоль) в воде (15 мл) добавляли по каплям для поддержания температуры ниже 10°C. Реакционную смесь перемешивали 1 час при температуре от 0°C до 10°C. Раствор йодида калия (5,27 г, 31,8 ммоль) в воде (15 мл) добавляли по каплям для поддержания температуры ниже 10°C и реакционную смесь перемешивали один час при 5-10°C. Добавляли насыщенный раствор тиосульфата натрия и реакционную смесь экстрагировали три раза с помощью EtOAc. Органические слои промывали насыщенным раствором NaCl, высушивали над сульфатом магния, фильтровали и выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 5-20% EtOAc в циклогексане) с получением 2-йод-1-метил-3-нитро-5-(трифторметокси)бензола (2,81 г, 76%) в виде желтого масла. LC/MS (Способ i), Время удерживания=2,43 минуты; без ионизации.
1H ЯМР (DMSO-d6, 300МГц): d=7,89 (d, J=2,0 Гц, 1H), 7,72 (d, J=2,0 Гц, 1H), 2,55 (s, 3H).
Стадия D: 2-йод-3-метил-5-(трифторметокси)анилин
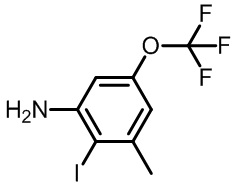
В раствор 2-йод-1-метил-3-нитро-5-(трифторметокси)бензола (2 г, 5,76 ммоль) в EtOH (50 мл) добавляли железо (0,805 г, 14,41 ммоль), воду (10,42 мл) и хлористоводородную кислоту (0,154 мл, 5,07 ммоль) и реакционную смесь перемешивали при 80°C в течение одной ночи. Реакционную смесь фильтровали и твердое вещество промывали с помощью EtOH. Фильтрат концентрировали под пониженным давлением и остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 5-20% EtOAc в циклогексане) с получением 2-йод-3-метил-5-(трифторметокси)анилина (1,36 г, 75%) в виде коричневой жидкости. LC/MS (Способ i), Время удерживания=2,38 минуты; MS масса/заряд: 318 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 6,56 (s, 1H), 6,52 (s, 1H), 5,62 (s, 2H), 2,33 (s, 3H).
Стадия E: N-(2-йод-3-метил-5-(трифторметокси)фенил)бензолсульфонамид

Используя процедуру, аналогичную получению №16, стадии B, N-(2-йод-3-метил-5-(трифторметокси)фенил)бензолсульфонамид (1,98 г, 100%) получали из 2-йод-3-метил-5-(трифторметокси)анилина (1,36 г, 4,29 ммоль). LC/MS (Способ i), Время удерживания=2,47 минуты; MS масса/заряд: 456 [M-H]- 1H ЯМР (DMSO-d6, 300МГц): δ 10,02 (s, 1H), 7,71 (m, 3H), 7,59 (m, 2H), 7,28 (m, 1H), 6,62-6,70 (m, 1H), 2,41 (s, 3H).
Получение №48: 6-бром-4-хлор-1-(фенилсульфонил)-1H-индол
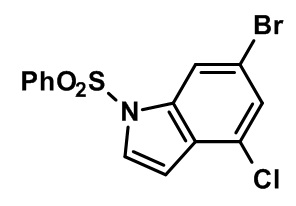
В раствор 6-бром-4-хлор-1H-индола (1 г, 4,34 ммоль) в N,N-диметилформамиде (10 мл), охлажденный до 0°C, добавляли гидрид натрия (0,208 г, 5,21 ммоль) и реакционную смесь перемешивали при 0°C в течение 1 часа. Добавляли бензолсульфонилхлорид (0,668 мл, 5,21 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь разбавляли насыщенным раствором NH4Cl и экстрагировали с помощью EtOAc. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 5-40% EtOAc в циклогексане) с получением 6-бром-4-хлор-1-(фенилсульфонил)-1H-индола (1,57 г, 98%) в виде бежевого твердого вещества. LC/MS (Способ i), Время удерживания=2,71 минуты; без ионизации.
1H ЯМР (DMSO-d6, 300МГц): δ 8,05 (m, 4H), 7,75 (m, 1H), 7,65 (m, 3H), 6,90 (dd, J=3,8, 0,8 Гц, 1H).
Получение №49: 7-метил-5-(трифторметил)-1H-индол

Стадия A: N-(2-метил-4-(трифторметил)-6-((триметилсилил)этинил)фенил)бензолсульфонамид
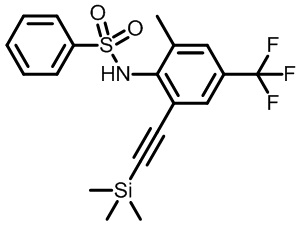
В раствор N-(2-йод-6-метил-4-(трифторметил)фенил)бензолсульфонамида (получение №34) (400 мг, 0,907 ммоль) в THF (4,5 мл) добавляли бис(трифенилфосфин)палладия дихлорид (31,8 мг, 0,045 ммоль), йодид меди(I) (17,27 мг, 0,091 ммоль), триметилсилилацетилен (351 мкл, 2,54 ммоль) и триэтиламин (4,5 мл). Реакционную смесь перемешивали при 65°C под воздействием микроволн в течение 1,5 часа. Реакционную смесь фильтровали, прополаскивали с помощью EtOAc и фильтрат выпаривали с получением N-(2-метил-4-(трифторметил)-6-((триметилсилил)этинил)фенил)бензолсульфонамида (495 мг, 100%) в виде коричневого твердого вещества. LC/MS (Способ i), Время удерживания=2,76 минуты; MS масса/заряд: 412 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц): δ 9,65 (br, 1H), 7,70 (m, 2H), 7,55 (m, 5H), 2,07 (s, 3H), 0,15 (m, 9H).
Стадия B: N-(2-этинил-6-метил-4-(трифторметил)фенил)бензолсульфонамид

В раствор N-(2-метил-4-(трифторметил)-6-((триметилсилил)этинил)фенил)бензолсульфонамида (373 мг, 0,906 ммоль) в THF (3,2 мл), охлажденный до 0°C, добавляли тетрабутиламмония фторид (4,08 мл, 4,08 ммоль) и реакционную смесь перемешивали при 0°C в течение 15 минут. Реакционную смесь быстро охлаждали лимонной кислотой и разбавляли водой. Ее затем экстрагировали с помощью EtOAc. Органический слой промывали солевым раствором, высушивали над сульфатом магния, фильтровали и выпаривали под пониженным давлением с получением N-(2-этинил-6-метил-4-(трифторметил)фенил)бензолсульфонамида (413 мг, 100%). Соединение использовали неочищенным на следующей стадии. LC/MS (Способ i), Время удерживания=2,28 минуты; MS масса/заряд: 338 [M-H]-.
Стадия C: 7-метил-1-(фенилсульфонил)-5-(трифторметил)-1H-индол

В раствор N-(2-этинил-6-метил-4-(трифторметил)фенил)бензолсульфонамида (308 мг, 0,908 ммоль) в дихлорэтане (4,5 мл) добавляли ацетат меди (II) (165 мг, 0,908 ммоль) и реакционную смесь нагревали при 150°C под микроволновым облучением. Реакционную смесь фильтровали и фильтрат концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-15% EtOAc в циклогексане) с получением 7-метил-1-(фенилсульфонил)-5-(трифторметил)-1H-индола (231 мг, 75%) в виде розового масла. LC/MS (Способ i), Время удерживания=2,59 минуты; MS масса/заряд: 340 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц): δ 8,06 (d, J=3,8 Гц, 1H), 7,93 (s, 1H), 7,76 (m, 3H), 7,64 (m, 2H), 7,41 (m, 1H), 7,05 (d, J=3,8 Гц, 1H), 2,53 (s, 3H).
Стадия D: 7-метил-5-(трифторметил)-1H-индол

В раствор 7-метил-1-(фенилсульфонил)-5-(трифторметил)-1H-индола (230 мг, 0,68 ммоль) в THF (8,4 мл) добавляли тетрабутиламмония фторид (813 мкл, 0,813 ммоль) и реакционную смесь перемешивали при 65 C в течение 2,5 часа. Реакционную смесь концентрировали под пониженным давлением. Остаток поглощали с помощью DCM и промывали насыщенным раствором NaHCO3. Органический слой затем высушивали над сульфатом магния, фильтровали и выпаривали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-20% EtOAc в циклогексане) с получением 7-метил-5-(трифторметил)-1H-индола (83 мг, 61%). LC/MS (Способ i), Время удерживания=2,20 минуты; MS масса/заряд: 198 [M-H]- 1H ЯМР (DMSO-d6, 300МГц): δ 11,52 (br, 1H), 7,77 (m, 1H), 7,50 (m, 1H), 7,17 (s, 1H), 6,60 (m, 1H), 2,54 (s, 3H).
Получение №50: метил-2-(3-метилпиперидин-4-ил)ацетата гидрохлорид
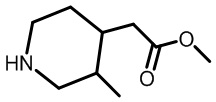
Стадия A: (E)-этил-4-(2-этокси-2-оксоэтилиден)-3-метилпиперидин-1-карбоксилат
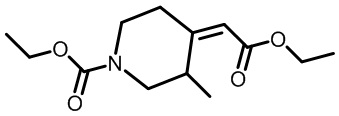
В суспензию гидрида натрия (0,972 г, 24,30 ммоль) в 1,2-диметоксиэтане (30 мл), охлажденную до 0°C, добавляли триэтилфосфоноацетат (4,52 мл, 22,68 ммоль) в растворе 1,2-диметоксиэтана (30,0 мл) и реакционную смесь перемешивали при 0°C в течение 30 минут и 1 часа при комнатной температуре. Реакционную смесь охлаждали до 10°C и этил-3-метил-4-оксопиперидин-1-карбоксилат (3 г, 16,20 ммоль) в 1,2-диметоксиэтане (30,0 мл) добавляли по каплям в реакционную смесь. Реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь быстро охлаждали водой и экстрагировали с помощью EtOAc. Полученный органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-20% EtOAc в циклогексане) с получением (E)-этил-4-(2-этокси-2-оксоэтилиден)-3-метилпиперидин-1-карбоксилата (3,6 г, 87%) в виде бледно-желтой жидкости. LC/MS (Способ i), Время удерживания=2,05 минуты; MS масса/заряд: 256 [M+H]+.
Стадия B: этил-4-(2-этокси-2-оксоэтил)-3-метилпиперидин-1-карбоксилат

В раствор (E)-этил-4-(2-этокси-2-оксоэтилоксоэтилиден)-3-метилпиперидин-1-карбоксилата (3,60 г, 14,10 ммоль) в EtOH (100 мл) добавляли палладий на угле (0,36 г, 3,38 ммоль) и реакционную смесь перемешивали в атмосфере водорода (1 атм.) в течение 3 часов. Реакционную смесь фильтровали и фильтрат концентрировали под пониженным давлением с получением этил-4-(2-этокси-2-оксоэтил)-3-метилпиперидин-1-карбоксилата (3,6 г, 100%).
Стадия C: 2-(3-метилпиперидин-4-ил)уксусной кислоты гидрохлорид

Раствор этил-4-(2-этокси-2-оксоэтил)-3-метилпиперидин-1-карбоксилата (200 мг, 0,777 ммоль) в хлористоводородной кислоте (1 мл, 3,29 ммоль) перемешивали с обратным холодильником в течение одной ночи. Реакционную смесь разбавляли с помощью H2O и лиофилизировали с получением гидрохлорида 2-(3-метилпиперидин-4-ил)уксусной кислоты (151 мг, 100%).
Стадия D: метил-2-(3-метилпиперидин-4-ил)ацетата гидрохлорид
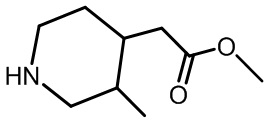
В раствор гидрохлорида 2-(3-метилпиперидин-4-ил)уксусной кислоты (151 мг, 0,780 ммоль) в MeOH (2 мл), охлажденный до 0°C, добавляли тионилхлорид (0,566 мл, 7,80 ммоль) и реакционную смесь перемешивали с обратным холодильником в течение 4 часов. Реакционную смесь концентрировали под вакуумом с получением гидрохлорида метил-2-(3-метилпиперидин-4-ил)ацетата (151 мг, 93%) в виде желтого масла. (70% цис, 30% транс).
Получение №51: 1,4-диметил-6-(трифторметил)-1H-индол-3-карбальдегид
Стадия A: N-(3-метил-5-(трифторметил)-2-((триметилсилил)этинил)фенил)бензолсульфонамид

В раствор N-(2-йод-3-метил-5-(трифторметил)фенил)бензолсульфонамида (5 г, 11,33 ммоль) в THF (40 мл) добавляли бис(трифенилфосфин)палладия(II) дихлорид (0,398 г, 0,567 ммоль), йодид меди (0,216 г, 1,133 ммоль), триметилсилилацетилен (3,12 г, 31,7 ммоль) и триэтиламин (40,0 мл) и реакционную смесь перемешивали при 65°C под воздействием микроволн в течение 1,5 часа. Реакционную смесь фильтровали и концентрировали под пониженным давлением с получением N-(3-метил-5-(трифторметил)-2-((триметилсилил)этинил)фенил)бензолсульфонамида (4,5 г, 85%) в виде оранжевой смолы. Продукт использовали неочищенным на следующей стадии.
LC/MS (Способ j), Время удерживания=2,85 минуты; MS масса/заряд: 412 [M+H]+.
Стадия B: 4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол
В раствор N-(3-метил-5-(трифторметил)-2-((триметилсилил)этинил)фенил)бензолсульфонамида (4,5 г, 10,94 ммоль) в THF (40 мл), охлажденный до 0°C, добавляли тетрабутиламмония фторид (12,87 г, 49,2 ммоль) и реакционную смесь перемешивали при 0°C в течение 1 часа и при комнатной температуре в течение 1 часа. Реакционную смесь быстро охлаждали лимонной кислотой и разбавляли водой. Ее экстрагировали с помощью EtOAc. Органический слой промывали солевым раствором, высушивали над сульфатом магния, фильтровали и выпаривали под пониженным давлением с получением 4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индола (3,5 г, 84%) в виде коричневого твердого вещества. LC/MS (Способ i), Время удерживания=2,58 минуты; MS масса/заряд: 338 [M-H]- 1H ЯМР (ХЛОРОФОРМ-d, 300МГц): δ 8,12 (s, 1H), 7,90 (m, 2H), 7,70 (d, J=3,3 Гц, 1H), 7,56 (m, 1H), 7,48 (m, 2H), 7,28 (m, 1H), 6,74 (d, J=3,3 Гц, 1H), 2,52 (s, 3H).
Стадия C: 4-метил-6-(трифторметил)-1H-индол

В раствор 4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индола (3,1 г, 9,14 ммоль) в THF (10 мл) добавляли тетрабутиламмония фторид (10,96 мл, 10,96 ммоль) и реакционную смесь перемешивали при 60°C в течение 1,5 часа. Добавляли дополнительное количество тетрабутиламмония фторида (0,6 экв.) и перемешивание продолжали в течение 3 часов. Добавляли дополнительное количество тетрабутиламмония фторида (0,9 экв.) и перемешивание продолжали в течение 18 часов. Добавляли дополнительное количество тетрабутиламмония фторида (0,9 экв.) и перемешивание продолжали в течение 3 часов. Реакционную смесь концентрировали под пониженным давлением. Остаток поглощали с помощью дихлорметана и промывали насыщенным раствором NaHCO3. Органический слой затем высушивали над сульфатом магния, фильтровали и выпаривали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-20% EtOAc в циклогексане) с получением 4-метил-6-(трифторметил)-1H-индола (1,18 г, 62%) в виде бледно-коричневого масла. LC/MS (Способ i), Время удерживания=2,24 минуты; MS масса/заряд: 198 [M-H]- 1H ЯМР (ХЛОРОФОРМ-d, 300МГц): δ 8,30 (br, 1H), 7,53 (s, 1H), 7,34 (t, J=2,9 Гц, 1H), 7,15 (s, 1H), 6,62 (td, J=2,9, 1,1 Гц, 1H), 2,60 (s, 3H).
Стадия D: 4-метил-6-(трифторметил)-1H-индол-3-карбальдегид

В раствор N,N-диметилформамида (1,431 мл, 18,48 ммоль) в DCM (15 мл), охлажденный при 0°C, добавляли оксалилхлорид (1,617 мл, 18,48 ммоль), разбавленный в DCM (15 мл), и реакционную смесь перемешивали в течение 30 минут. Ее затем добавляли по каплям в раствор 4-метил-6-(трифторметил)-1H-индола (920 мг, 4,62 ммоль) в DCM (15 мл) и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. 5 н. раствор NaOH добавляли до достижения pH 10. Водный слой экстрагировали с помощью DCM. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением с получением 4-метил-6-(трифторметил)-1H-индол-3-карбальдегида (1 г, 78%) в виде коричневого твердого вещества. Соединение использовали неочищенным на следующей стадии.
LC/MS (Способ i), Время удерживания=1,96 минуты; MS масса/заряд: 228 [M+H]+.
Стадия E: 1,4-диметил-6-(трифторметил)-1H-индол-3-карбальдегид
В раствор 4-метил-6-(трифторметил)-1H-индол-3-карбальдегида (1,09 г, 4,80 ммоль) в DMF (60 мл) добавляли гидрид натрия (0,192 г, 4,80 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 30 минут, добавляли йодметан (0,300 мл, 4,80 ммоль) и реакционную смесь перемешивали один час при комнатной температуре. Реакционную смесь разбавляли водой. Полученный осадок фильтровали, промывали водой и концентрировали досуха с получением 1,4-диметил-6-(трифторметил)-1H-индол-3-карбальдегида (815 мг, 70%) в виде розового твердого вещества. LC/MS (Способ i), Время удерживания=2,09 минуты; MS масса/заряд: 242 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 9,98 (s, 1H), 8,46 (s, 1H), 7,83 (s, 1H), 7,35 (s, 1H), 3,96 (s, 3H), 2,84 (s, 3H).
Получение №52: 1-метил-6-(трифторметокси)-1H-индол-2-карбальдегид

Стадия A: метил-(Z)-2-азидо-3-(4-(трифторметокси)фенил)акрилат
В круглодонную колбу, оснащенную механической мешалкой, 25% метоксид натрия в MeOH (107 мл, 480 ммоль) добавляли в MeOH (MeOH) (80 мл) с получением бесцветного раствора и его охлаждали до прим. -20°C. Смесь 4-(трифторметокси)бензальдегида (38,8 г, 204 ммоль) и метил-2-азидоацетата (55,22 г, 480 ммоль) добавляли по каплям на протяжении 15 минут, поддерживая температуру на уровне прим. -20°C. После завершения добавления реакционная смесь становилась густым желтым маслом. Нагревали до 0-5°C. Через 1 ч. смесь выливали в 2 M смесь водной HCl (400 мл)/MTBE (400 мл). Разделяли слои и экстрагировали водную фазу с помощью MTBE (2×200 мл). Объединенные органические вещества промывали солевым раствором, высушивали над сульфатом натрия и растворитель удаляли in vacuo. Получали 80,43 г неочищенного материала в виде оранжевого масла. Неочищенный материал подвергали хроматографии на системе Intelliflash 280 при помощи 330 г колонки Silicycle SiliaSep с силикагелем с использованием следующего градиента: A: гептан; B: 10% EtOAc в гептане; от 0% B до 100% B на протяжении 30 мин. Объединенные фракции продукта концентрировали in vacuo с получением 37,85 г (выход 65%) метил-(Z)-2-азидо-3-(4-(трифторметокси)фенил)акрилата. 1H ЯМР (400 МГц, DMSO-d6) δ 8,00 (d, J=9,0 Гц, 1H), 7,40 (d, J=8,0 Гц, 1H), 6,97 (s, 1H), 3,87 (s, 3H).
Стадия B: метил-6-(трифторметокси)-1H-индол-2-карбоксилат
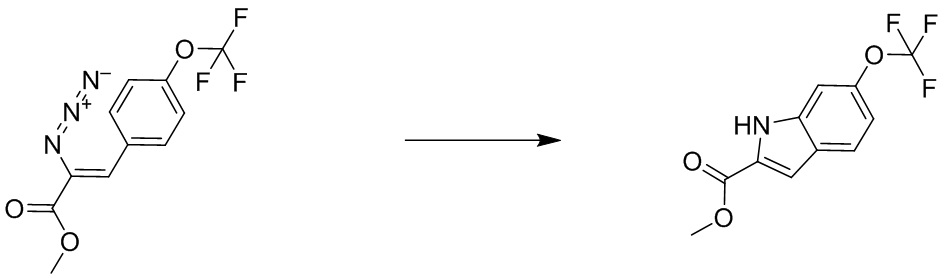
В круглодонной колбе ксилол (500 мл), который высушивали в течение выходных над молекулярными ситами, а затем продували азотом в течение 1 часа, нагревали до 140°C. Раствор (Z)-метил 2-азидо-3-(4-(трифторметокси)фенил)акрилата (37,85 г, 132 ммоль) в ксилоле (75 мл) добавляли по каплям в раствор на протяжении 45 минут. LC/MS материала после завершения добавления показала полное потребление исходного материала. Позволили остыть до температуры окружающей среды. Удаляли растворитель in vacuo, растирали с гептанами (100 мл) в течение выходных. Фильтровали, промывали гептаном. Высушивали in vacuo. Получали 25,08 г (выход 73%) метил-6-(трифторметокси)-1H-индол-2-карбоксилата в виде кристаллического твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 12,15 (s, 1H), 7,78 (d, J=8,8 Гц, 1H), 7,42-7,32 (m, 1H), 7,23 (dd, J=2,2, 0,9 Гц, 1H), 7,07 (ddt, J=8,7, 2,1, 1,0 Гц, 1H), 3,89 (s, 3H); LC/MS (Способ i), Время удерживания=1,59 минуты; MS масса/заряд: 258,17 (M-H)-.
Стадия C: N-метокси-N-метил-6-(трифторметокси)-1H-индол-2-карбоксамид

В круглодонную колбу метил-6-(трифторметокси)-1H-индол-2-карбоксилат (25,08 г, 97 ммоль) в THF (150 мл) добавляли с получением желтого раствора. N,O-диметилгидроксиламина гидрохлорид (10,38 г, 106 ммоль) добавляли и смесь охлаждали до 0°C. 1,0 M лития бис(триметилсилил)амид в THF (300 мл, 300 ммоль) добавляли по каплям, поддерживая температуру < 5°C. LC/MS через 10 минут после завершения добавления показала практически завершение. Добавляли 2 н. водную HCl (275 мл), поддерживая температуру < 25°C. Экстрагировали водн. слой с помощью MTBE (275 мл) и промывали органическое вещество солевым раствором (75 мл). Высушивали над сульфатом магния и удаляли растворитель in vacuo. Суспендировали остаток в гептане (100 мл) в течение 20 минут, затем фильтровали, промывали минимумом гептана. Желтое твердое вещество высушивали in vacuo с получением 25,57 г (выход 92%) N-метокси-N-метил-6-(трифторметокси)-1H-индол-2-карбоксамида, который отбирали непосредственно на следующую стадию без дополнительной очистки. 1H ЯМР (400 МГц, DMSO-d6) δ 11,77 (s, 1H), 7,78 (d, J=8,7 Гц, 1H), 7,42-7,38 (m, 1H), 7,22 (dd, J=2,2, 0,9 Гц, 1H), 7,03 (ddt, J=8,8, 2,1, 1,0 Гц, 1H), 3,81 (s, 3H), 3,34 (s, 3H); LC/MS (Способ i), Время удерживания=1,48 минуты; MS масса/заряд: 289,26 (M+H)+; MS масса/заряд: 287,17 (M-H)-.
Стадия D: N-метокси-N,1-диметил-6-(трифторметокси)-1H-индол-2-карбоксамид

В круглодонную колбу добавляли N-метокси-N-метил-6-(трифторметокси)-1H-индол-2-карбоксамид (25.57 г, 89 ммоль) в диметилформамиде (DMF) (250 мл) с получением желтого раствора. Охлаждали до 0°C и добавляли натрия трет-бутоксид (8,95 г, 93 ммоль), поддерживая температуру < 5 °C. Раствор перемешивали 30 минут при 0°C, затем добавляли по каплям раствор 2,0 M йодметана в MTBE (46,6 мл, 93 ммоль), поддерживая температуру < 5°C. Перемешивали при ~ 0°C. Через 2 часа практически весь исходный материал расходовался. Добавляли MTBE (600 мл) и 2 н. хлористоводородную кислоту (250 мл). Слои разделяли и водный слой экстрагировали с помощью MTBE (200 мл), а затем объединенные органические слои промывали солевым раствором (2×150 мл). Объединенные органические слои высушивали над сульфатом магния и удаляли растворитель in vacuo. Неочищенный материал подвергали хроматографии на системе Intelliflash 280 при помощи 220 г колонки Silicycle SiliaSep с силикагелем с использованием следующего градиента: A: гептан; B: EtOAc; от 20% B до 100% B за 30 мин. с получением 21,67 г (выход 80%) N-метокси-N,1-диметил-6-(трифторметокси)-1H-индол-2-карбоксамида. 1H ЯМР (400 МГц, DMSO-d6) δ 7,75 (dd, J=8,6, 0,5 Гц, 1H), 7,61 (tt, J=1,4, 0,8 Гц, 1H), 7,08 (ddq, J=8,6, 2,1, 1,0 Гц, 1H), 7,05 (d, J=0,9 Гц, 1H), 3,85 (s, 3H), 3,65 (s, 3H), 3,33 (s, 3H); LC/MS (Способ i), Время удерживания=1,57 минуты; MS масса/заряд: 303,14(M+H)+.
Стадия E: 1-метил-6-(трифторметокси)-1H-индол-2-карбальдегид
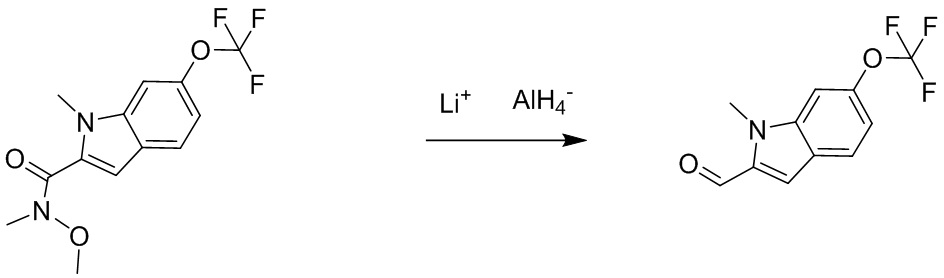
В круглодонную колбу добавляли N-метокси-N,1-диметил-6-(трифторметокси)-1H-индол-2-карбоксамид (21,67 г, 71,7 ммоль) в THF (200 мл) с получением желтого раствора. Раствор охлаждали до -78°C и добавляли по каплям 2,0 M алюмогидрида лития в THF (50,2 мл, 100 ммоль), поддерживая температуру < -65°C. После завершения добавления LC/MS показала полное потребление исходного материала. Декагидрат сульфата натрия (23,10 г, 71,7 ммоль) добавляли порциями, поддерживая температуру < -60°C, а затем MTBE (300 мл). Раствор нагревали до температуры окружающей среды. При примерно -10°C образовывался осадок. Дополнительное количество MTBE добавляли до тех пор, пока происходило свободное перемешивание. Фильтровали через подушку Celite® 545, промывали с помощью MTBE (2×120 мл). Растворитель удаляли in vacuo, заменяли на гептан (2×120 мл) с получением 14,29 г желтой маслянистой смеси. Неочищенный материал подвергали хроматографии на системе Intelliflash 280 при помощи 220 г колонки Grace с силикагелем с использованием следующего градиента: A: гептан; B: EtOAc; от 0% B до 60% B за 30 мин., получая 11,21 г (выход 64%) 1-метил-6-(трифторметокси)-1H-индол-2-карбальдегида. 1H ЯМР (400 МГц, DMSO-d6) δ 9,93 (s, 1H), 7,89 (dd, J=8,7, 0,5 Гц, 1H), 7,68 (dp, J=2,5, 0,9 Гц, 1H), 7,51 (d, J=0,9 Гц, 1H), 7,14 (ddq, J=8,7, 2,1, 1,0 Гц, 1H), 4,04 (s, 3H). LC/MS (Способ i), Время удерживания=1,62 минуты; MS масса/заряд: 244,19 (M+H)+.
Получение №53: метил-2-(1-(2,4-дихлор-3-(((метилсульфонил)окси)метил)бензоил)пиперидин-4-ил)ацетат
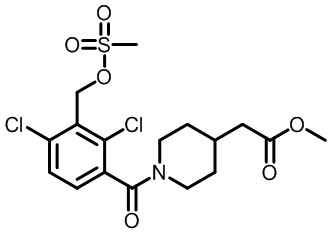
Стадия A: трет-бутил-2,4-дихлор-3-(гидроксиметил)бензоат

Используя процедуру, аналогичную получению №8, стадии A, трет-бутил-2,4-дихлор-3-(гидроксиметил)бензоат (11,8 г, 97%) получали из трет-бутил-2,4-дихлор-3-формилбензоата (13,5 г, 44 ммоль) (получение №33, стадия B). LC/MS (Способ i): Время удерживания=2,02 мин.; MS масса/заряд: 277 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,55 (m, 2H), 5,28 (s, 1H), 4,72 (s, 2H), 1,54 (s, 9H).
Стадия B: трет-бутил-2,4-дихлор-3-(((метилсульфонил)окси)метил)бензоат
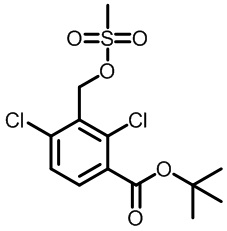
В раствор трет-бутил-2,4-дихлор-3-(гидроксиметил)бензоата (11,9 г, 42,9 ммоль) в DCM (472 мл), охлажденный до -10°C, добавляли триэтиламин (8,98 мл, 64,4 ммоль) и метансульфонилхлорид (5,33 мл, 68,7 ммоль). Реакционную смесь перемешивали при -10°C в течение 1 часа, затем разбавляли с помощью DCM и промывали водой. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали под вакуумом с получением трет-бутил-2,4-дихлор-3-(((метилсульфонил)окси)метил)бензоата (15,04 г, 99%) в виде желтого масла. LC/MS (Способ i): Время удерживания=2,25 мин.; MS масса/заряд: 355 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,76 (d, J=8,9 Гц, 1H), 7,68 (d, J=8,9 Гц, 1H), 5,48 (s, 2H) 3,32 (s, 3H), 1,55 (s, 9H).
Стадия C: метил-2-(1-(2,4-дихлор-3-(((метилсульфонил)окси)метил)бензоил)пиперидин-4-ил)ацетат

В раствор 2,4-дихлор-3-(((метилсульфонил)окси)метил)бензойной кислоты (7,56 г, 25,3 ммоль) в DCM (145 мл), охлажденный до 0°C, добавляли 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (4,84 г, 25,3 ммоль) и 1-гидроксибензотриазол (3,42 г, 25,3 ммоль). Реакционную смесь перемешивали в течение 10 минут при 0°C, затем добавляли метил-2-(пиперидин-4-ил)ацетата гидрохлорид (4,89 г, 25,3 ммоль) и триэтиламин (3,52 мл, 25,3 ммоль). Реакционную смесь перемешивали при 0°C в течение 50 минут и разбавляли водой и с помощью DCM. Слои разделяли и органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-5% EtOAc в циклогексане) с получением метил-2-(1-(2,4-дихлор-3-(((метилсульфонил)окси)метил)бензоил)пиперидин-4-ил)ацетата (6,74 г, 61%). LC/MS (Способ i): Время удерживания=1,80 мин.; MS масса/заряд: 438 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,66 и 7,64 (d, J=8,3 Гц, 1H), 7,53 и 7,45 (m, 1H), 5,46 и 5,45 (s, 2H), 4,47 (m, 1H), 3,58 (s, 3H), 3,33 (широкий, 3H), 3,20 (m, 1H), 3,03 (m, 1H), 2,81 (m, 1H), 2,27 (m, 2H), 1,96 (m, 1H), 1,75 (m, 1H), 1,58 (m, 1H), 1,16 (m, 2H).
Получение №54: метил-3-(хлорметил)-2,4-диметилбензоат

Стадия A: метил-3-формил-2,4-диметилбензоат

Используя процедуру, аналогичную получению №1, стадии A, метил-3-формил-2,4-диметилбензоат (7 г, 93%) получали из 3-формил-2,4-диметилбензойной кислоты (7 г, 39,3 ммоль) (получение №4, стадия B). LC/MS (Способ h): Время удерживания=2,15 мин.; 1H ЯМР (DMSO-d6, 300 МГц): δ 10,55 (s, 1H), 7,78 (d, J=7,5 Гц, 1H), 7,27 (d, J=7,5 Гц, 1H), 3,83 (s, 3H), 2,51 (s, 3H), 2,46 (s, 3H).
Стадия B: метил-3-(гидроксиметил)-2,4-диметилбензоат

Используя процедуру, аналогичную получению №8, стадии A, метил-3-(гидроксиметил)-2,4-диметилбензоат (6,08 г, 86%) получали из метил-3-формил-2,4-диметилбензоата (7 г, 36,4 ммоль). LC/MS (Способ h): Время удерживания=1,65 мин.; MS масса/заряд: 195 [M+H]+; 1H ЯМР (DMSO-d6, 300 МГц): δ 7,52 (d, J=7,5 Гц, 1H), 7,09 (d, J=7,5 Гц, 1H), 4,83 (t, J=5,4 Гц, 1H), 4,53 (d, J=5,4 Гц, 2H), 3,80 (s, 3H), 2,49 (s, 3H), 2,39 (s, 3H).
Стадия C: метил-3-(хлорметил)-2,4-диметилбензоат
Используя процедуру, аналогичную получению №11, стадии C, метил-3-(хлорметил)-2,4-диметилбензоат (2,6 г, 88%) получали из метил-3-(гидроксиметил)-2,4-диметилбензоата (2,5 г, 12,87 ммоль). LC/MS (Способ h): Время удерживания=2,66 мин.; MS масса/заряд: 213 [M+H]+; 1H ЯМР (DMSO-d6, 300 МГц): δ 7,60 (d, J=7,9 Гц, 1H), 7,19 (d, J=7,9 Гц, 1H), 4,84 (s, 2H), 3,82 (s, 3H), 2,52 (s, 3H), 2,43 (s, 3H).
Получение №55: трет-бутил-2,4-дихлор-3-(фторкарбонил)бензоат

В раствор 3-(трет-бутоксикарбонил)-2,6-дихлорбензойной кислоты (0,95 г, 3,26 ммоль) (получение №44, стадия A) в DCM (32,6 мл) добавляли диизопропилэтиламин (2,26 мл, 13,05 ммоль), а затем бис(2-метоксиэтил)аминосеры трифторид (2,65 мл, 7,18 ммоль) по каплям. Реакционную смесь несколько экзотермичную перемешивали при комнатной температуре в течение 22 часов. Реакционную смесь промывали 10% водной лимонной кислотой, насыщенным раствором NaHCO3 и солевым раствором. Органический слой высушивали над сульфатом магния и концентрировали под пониженным давлением с получением трет-бутил-2,4-дихлор-3-(фторкарбонил)бензоата (1 г, 100%) в виде оранжевого масла. LC/MS (Способ j): Время удерживания=1,98 мин.; MS масса/заряд: 291 [M-H]-; H ЯМР (CDCl3, 300МГц): δ 7,83 (d, J=8,4 Гц, 1H), 7,44 (d, J=8,4 Гц, 1H), 1,60 (s, 9H).
Получение №56: трет-бутил-4,6-дихлор-5-(хлоркарбонил)никотинат

Стадия A: 5-(трет-бутоксикарбонил)-2,4-дихлорникотиновая кислота

Используя процедуру, аналогичную получению №44, стадии A, 5-(трет-бутоксикарбонил)-2,4-дихлорникотиновую кислоту (1,96 г, 43%) получали из трет-бутил-4,6-дихлорникотината (3,85 г, 15,5 ммоль) (пример DO, стадия 11). LC/MS (Способ i): Время удерживания=1,31 мин.; MS масса/заряд: 292 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 8,78 (s, 1H), 1,56 (s, 9H).
Стадия 2: трет-бутил-4,6-дихлор-5-(хлоркарбонил)никотинат
Используя процедуру, аналогичную получению №44, стадии B, трет-бутил-4,6-дихлор-5-(хлоркарбонил)никотинат (2 г, 100%) получали из 5-(трет-бутоксикарбонил)-2,4-дихлорникотиновой кислоты (1,96 г, 6,71 ммоль). Остаток использовали на следующей стадии без дополнительной очистки.
Получение №57: трет-бутил-4,6-дихлор-5-(((метилсульфонил)окси)метил)никотинат
Стадия A: трет-бутил-4,6-дихлор-5-(гидроксиметил)никотинат

Используя процедуру, аналогичную получению №8, стадии A, трет-бутил-4,6-дихлор-5-(гидроксиметил)никотинат (503 мг, 97%) получали из трет-бутил-4,6-дихлор-5-формилникотината (500 мг, 1,8 ммоль) (пример DO, стадия 12). LC/MS (Способ i): Время удерживания=1,83 мин.; MS масса/заряд: 278 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 8,63 (s, 1H), 5,45 (t, J=5,4 Гц, 1H), 4,72 (d, J=5,4 Гц, 2H), 1,56 (s, 9H).
Стадия B: трет-бутил-4,6-дихлор-5-(((метилсульфонил)окси)метил)никотинат
Используя процедуру, аналогичную получению №11, стадии C, трет-бутил-4,6-дихлор-5-(((метилсульфонил)окси)метил)никотинат и трет-бутил-4,6-дихлор-5-(хлорметил)никотинат (160 мг) получали из трет-бутил-4,6-дихлор-5-(гидроксиметил)никотината (130 мг, 0,47 ммоль). Остаток использовали неочищенным на следующей стадии. LC/MS (Способ j): Время удерживания=1,37 мин.; MS масса/заряд: 356 [M+H]+; 1H ЯМР (CDCl3, 300МГц): δ 8,73 (s, 1H), 5,55 (s, 2H), 3,67 (s, 3H), 161 (s, 9H).
Получение №58: трет-бутил-2-хлор-4-циклопропил-3-(1-гидроксипроп-2-ин-1-ил)бензоат
Стадия A: трет-бутил-4-бром-2-хлор-3-формилбензоат
Используя процедуру, аналогичную получению №33, стадии B, трет-бутил-4-бром-2-хлор-3-формилбензоат (2,66 г, 32%) получали из трет-бутил-4-бром-2-хлорбензоата (5 г, 17,15 ммоль). LC/MS (Способ i): Время удерживания=2,38 мин.; MS масса/заряд: 319 [M+H]+ ; 1H ЯМР (DMSO-d6, 300МГц): δ 10,23 (s, 1H), 7,85 (d, J=7,8 Гц, 1H), 7,75 (d, J=7,8 Гц, 1H), 1,55 (s, 9H).
Стадия B: трет-бутил-2-хлор-4-циклопропил-3-формилбензоат
Используя процедуру, аналогичную получению №66, трет-бутил-2-хлор-4-циклопропил-3-формилбензоат (1,18 г, 88%) получали из трет-бутил-4-циклопропил-2-хлорбензоата (2 г, 4,17 ммоль). LC/MS (Способ i): Время удерживания=2,49 мин.; MS масса/заряд: 281 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 10,56 (s, 1H), 7,71 (d, J=8,3 Гц, 1H), 7,12 (d, J=8,3 Гц, 1H), 2,45 (m, 1H), 1,53 (m, 9H), 1,03 (m, 2H), 0,77 (m, 2H).
Стадия C: трет-бутил-2-хлор-4-циклопропил-3-(1-гидроксипроп-2-ин-1-ил)бензоат

Используя процедуру, аналогичную получению №1, стадии D, трет-бутил-2-хлор-4-циклопропил-3-(1-гидроксипроп-2-ин-1-ил)бензоат (1,11 г, 86%) получали из трет-бутил-2-хлор-4-циклопропил-3-формилбензоата (1,18 г, 4,2 ммоль). LC/MS (Способ j): Время удерживания=1,28 мин.; MS масса/заряд: 365 [M-H]-+ CH3COOH; 1H ЯМР (DMSO-d6, 300МГц): δ 7,41 (d, J=8,1 Гц, 1H), 6,91 (d, J=8,1 Гц, 1H), 6,26 (m, 1H), 6,19 (s, 1H), 3,49 (d, J=2,3 Гц, 1H), 2,73 (m, 1H), 1,53 (s, 9H), 1,03 (m, 2H), 0,83 (m, 1H), 0,70 (m, 1H).
Получение №59: (E)-трет-бутил-2,4-дихлор-3-(3-((метилсульфонил)окси)проп-1-ен-1-ил)бензоат

Стадия A: (E)-трет-бутил-2,4-дихлор-3-(3-этокси-3-оксопроп-1-ен-1-ил)бензоат

В суспензию гидрида натрия (0,407 г, 10,18 ммоль) в THF (6,2 мл), охлажденную до 0°C, добавляли по каплям триэтилфосфоноацетат (2,03 мл, 10,18 ммоль) и обеспечивали возможность нагрева реакционной смеси до комнатной температуры и перемешивали, пока она не становилась гомогенной. Реакционную смесь охлаждали до 0°C и раствор трет-бутил-2,4-дихлор-3-формилбензоата (2,8 г, 10,18 ммоль) (получение №33, стадия B) в THF (16 мл) добавляли по каплям в реакционную смесь, появлялась коричневая смола, и ее было сложно перемешивать. Обеспечивали возможность нагрева реакционной смеси до комнатной температуры и реакционную смесь быстро охлаждали по каплям насыщенным раствором NaHCO3. Полученный водный слой экстрагировали три раза с помощью EtOAc и объединенные органические слои высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 5-20% EtOAc в DCM) с получением (E)-трет-бутил-2,4-дихлор-3-(3-этокси-3-оксопроп-1-ен-1-ил)бензоата (2,6 г, 77%) в виде желтого масла. LC/MS (Способ i): Время удерживания=2,68 мин.; MS масса/заряд: 345 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,66 (s, 2H), 7,62 (d, J=16,3 Гц, 1H), 6,48 (d, J=16,3 Гц, 1H), 4,24 (q, J=7,1 Гц, 2H), 1,55 (s, 9H), 1,27 (t, J=7,1 Гц, 3H).
Стадия B: (E)-трет-бутил-2,4-дихлор-3-(3-гидроксипроп-1-ен-1-ил)бензоат

В раствор (E)-трет-бутил-2,4-дихлор-3-(3-этокси-3-оксопроп-1-ен-1-ил)бензоата (2,59 г, 7,50 ммоль) в THF (68 мл), охлажденный до -78°C, добавляли по каплям диизобутилалюминия гидрид (24,38 мл, 29,3 ммоль) и реакционную смесь перемешивали в течение 30 минут при -78°C. EtOAc добавляли медленно, а затем 68 мл 30% раствора тартрата калия-натрия. Смесь перемешивали пока не получали два слоя. Смесь экстрагировали дважды с помощью EtOAc и полученный органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 7-60% EtOAc в DCM) с получением (E)-трет-бутил-2,4-дихлор-3-(3-гидроксипроп-1-ен-1-ил)бензоата (2,19 г, 96%). LC/MS (Способ i): Время удерживания=2,19 мин.; MS масса/заряд: 303 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ=7,56 (d, J=7,9 Гц, 1H), 7,51 (d, J=7,9 Гц, 1H), 6,53 (dd, J=15, 3,3 Гц, 1H), 6,26 (dd, J=15, 4,3 Гц, 1H), 5,08 (t, J=5,6Гц,1H), 4,19 (m, 2H), 1,54 (s, 9H).
Стадия C: (E)-трет-бутил-2,4-дихлор-3-(3-((метилсульфонил)окси)проп-1-ен-1-ил)бензоат

Используя процедуру, аналогичную получению 53, стадии B, (E)-трет-бутил-2,4-дихлор-3-(3-((метилсульфонил)окси)проп-1-ен-1-ил)бензоат (2,95 г, 86%) получали из (E)-трет-бутил-2,4-дихлор-3-(3-гидроксипроп-1-ен-1-ил)бензоата (2,18 г, 7,19 ммоль). LC/MS (Способ i): Время удерживания=2,39 мин.; MS масса/заряд: 381 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,60 (m, 2H), 6,77 (d, J=15 Гц, 1H), 6,26 (dt, J=15, 5,9 Гц, 1H), 4,98 (dd, J=5,9, 1,6 Гц, 2H), 3,26 (s, 3H), 1,54 (s, 9H).
Получение №60: трет-бутил-4,6-дихлор-5-(1-гидроксипроп-2-ин-1-ил)никотинат

Используя процедуру, аналогичную получению №1, стадии D, трет-бутил-4,6-дихлор-5-(1-гидроксипроп-2-ин-1-ил)никотинат (5,8 г, 79%) получали из трет-бутил-4,6-дихлор-5-формилникотината (6,75 г, 24,45 ммоль) (пример DO, стадия 12). LC/MS (Способ i): Время удерживания=2,00 мин.; MS масса/заряд: 302 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,65 (s, 1H), 6,43 (d, J=4,8 Гц, 1H), 6,10 (dd, J=4,8, 2,5 Гц, 1H), 3,60 (d, J=2,5 Гц, 1H), 1,56 (s, 9H).
Получение №61: 3,7-диметил-5-(трифторметокси)-1H-индол

Стадия A: 2-йод-6-метил-4-(трифторметокси)анилин
Используя процедуру, аналогичную получению №34, стадии A, 2-йод-6-метил-4-(трифторметокси)анилин (5,25 г, 79%) получали из 2-метил-4-(трифторметокси)анилина (4 г, 20,9 ммоль). LC/MS (Способ i): Время удерживания=2,32 мин.; MS масса/заряд: 318 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,43 (s, 1H), 7,05 (s, 1H), 5,07 (s, 2H), 2,17 (s, 3H).
Стадия B: 3,7-диметил-5-(трифторметокси)-1H-индол
В раствор 2-йод-6-метил-4-(трифторметокси)анилина (500 мг, 1,57 ммоль) в N,N-диметилформамиде (3 мл) добавляли палладия(II) ацетат (35,4 мг, 0,16 ммоль), хлорид лития (66,9 мг, 1,58 ммоль), трифенилфосфин (41,4 мг, 0,16 ммоль), ацетат натрия (259 мг, 3,15 ммоль) и 1-(триметилсилил)-1-пропин (0,470 мл, 3,15 ммоль) и реакционную смесь нагревали при 140°C в течение 1 часа под микроволновым облучением. Реакционную смесь промывали водой и экстрагировали дважды с помощью EtOAc. Органический слой промывали последовательно солевым раствором и водой, высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток растворяли в THF (8 мл) и добавляли тетрабутиламмония фторид (0,718 мл, 2,481 ммоль). Реакционную смесь перемешивали с обратным холодильником в течение 4 часов, затем концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 5-60% EtOAc в циклогексане) с получением 3,7-диметил-5-(трифторметокси)-1H-индола (285 мг, 79%) в виде коричневой жидкости. LC/MS (Способ i): Время удерживания=2,34 мин.; MS масса/заряд: 230 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 11,00 (s, 1H), 7,23 (s, 2H), 6,85 (s, 1H), 2,46 (s, 3H), 2,24 (s, 3H).
Получение №62: 7-хлор-5-(трифторметил)-1H-индол
В раствор 2-хлор-6-йод-4-(трифторметил)анилина (3,2 г, 9,95 ммоль) в DMF (64 мл) добавляли триметилсилилацетилен (1,075 г, 10,95 ммоль), палладия(II) ацетат (0,335 г, 1,493 ммоль) и карбонат натрия (3,17 г, 29,9 ммоль) и реакционную смесь перемешивали при 120°C под воздействием микроволн в течение 20 минут. Остаток суспендировали в солевом растворе и экстрагировали дважды с помощью DMC. Органический слой затем высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-5% EtOAc в циклогексане) с получением 7-хлор-5-(трифторметил)-2-(триметилсилил)-1H-индола (1 г, 20%). Остаток растворяли в THF (11 мл), добавляли тетрабутиламмония фторид (3,65 мл, 3,65 ммоль) и реакционную смесь перемешивали при 50°C в течение 30 минут. Реакционную смесь концентрировали под пониженным давлением. Остаток поглощали с помощью DCM и промывали водным раствором NaHCO3. Органический слой затем высушивали над сульфатом магния, фильтровали и выпаривали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-10% EtOAc в циклогексане) с получением 7-хлор-5-(трифторметил)-1H-индола (470 мг, 46%). LC/MS (Способ i): Время удерживания=2,23 мин.; MS масса/заряд: 218 [M-H]-; 1H ЯМР (CDCl3, 300МГц): δ 8,54 (широкий, 1H), 7,86 (s, 1H), 7,45 (m, 1H), 7,36 (m, 1H), 6,70 (m, 1H).
Получение №63: 7-этил-5-(трифторметил)-1H-индол

Стадия A: 5-(трифторметил)-7-винил-1H-индол

В раствор 7-хлор-5-(трифторметил)-1H-индола (115 мг, 0,52 ммоль) (получение №62) в 1,4-диоксане (3,4 мл) добавляли фторид цезия (159 мг, 1,05 ммоль) и бис(три-трет-бутилфосфин)палладий(0) (53,5 мг, 0,10 ммоль) и трибутил(винил)олово (830 мг, 2,62 ммоль) и реакционную смесь перемешивали при 120°C в течение 45 минут. Обеспечивали возможность остывания реакционной смеси до комнатной температуры и растворитель затем удаляли под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-5% EtOAc в циклогексане) с получением 5-(трифторметил)-7-винил-1H-индола (110 мг, 81%) в виде коричневого масла. LC/MS (Способ i): Время удерживания=2,23 мин.; MS масса/заряд: 212 [M+H]+; 1H ЯМР (CDCl3, 300МГц): δ 8,56 (широкий, 1H), 7,86 (s, 1H), 7,46 (s, 1H), 7,34 (s, 1H), 7,00 (dd, J=17,7, 11,2 Гц, 1H), 6,67 (m, 1H), 5,87 (d, J=17,7 Гц, 1H), 5,55 (d, J=11,2 Гц, 1H).
Стадия B: 7-этил-5-(трифторметил)-1H-индол
В раствор 5-(трифторметил)-7-винил-1H-индола (110 мг, 0,52 ммоль) в EtOH (2 мл) в атмосфере аргона добавляли палладий на угле (11,09 мг, 10,42 мкмоль). Реакционную смесь перемешивали при комнатной температуре под атмосферным давлением водорода в течение 5 часов. Реакционную смесь фильтровали и промывали с помощью EtOH. Растворитель удаляли под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-1% EtOAc в циклогексане) с получением 7-этил-5-(трифторметил)-1H-индола (30 мг, 18%) в виде бежевой смолы. LC/MS (Способ i): Время удерживания=2,22 мин.; MS масса/заряд: 214 [M+H]+.
Получение №64: 7-метил-5-(трифторметокси)-1H-индол
Стадия A: 2-йод-6-метил-4-(трифторметокси)анилин
Используя процедуру, аналогичную получению №34, стадии A, 2-йод-6-метил-4-(трифторметокси)анилин (6,8 г, 82%) получали из 2-метил-4-(трифторметокси)анилина (5 г, 26,2 ммоль). LC/MS (Способ i): Время удерживания=2,33 мин.; MS масса/заряд: 318 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,43 (s, 1H), 7,05 (s, 1H), 5,07 (s, 2H), 2,17 (s, 3H).
Стадия B: 7-метил-5-(трифторметокси)-1H-индол

В раствор 2-йод-6-метил-4-(трифторметокси)анилина (3,3 г, 10,41 ммоль) в N,N-диметилформамиде (24 мл) добавляли Pd(PPh3)2Cl2 (0,14 г, 0,21 ммоль), йодид меди(I) (0,099 г, 0,520 ммоль), этинилтриметилсилан (1,584 мл, 11,45 ммоль) и диэтиламин (2,392 мл, 22,90 ммоль). Реакционную смесь перемешивали при 120°C под микроволновым облучением в течение 40 минут. Реакционную смесь фильтровали и промывали с помощью EtOAc. Смесь разбавляли водой и экстрагировали дважды с помощью EtOAc. Органический слой промывали солевым раствором, высушивали над сульфатом магния и концентрировали. Остаток растворяли в DMF (30 мл), и добавляли карбонат кальция (1,045 г, 10,44 ммоль) и йодид меди(I) (1,988 г, 10,44 ммоль), и реакционную смесь перемешивали 20 минут при 150°C под микроволновым облучением. Реакционную смесь разбавляли водой. Водный слой экстрагировали дважды с помощью EtOAc, и объединенные органические слои высушивали над сульфатом магния, фильтровали и выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 5-20% EtOAc в циклогексане) с получением 7-метил-5-(трифторметокси)-1H-индола (1 г, 49%) в виде желтого твердого вещества. LC/MS (Способ j): Время удерживания=1,49 мин.; MS масса/заряд: 216 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 11,34 (s, 1H), 7,46 (t, J=2,9 Гц, 1H), 7,34 (s, 1H), 6,87 (m, 1H), 6,50 (m, 1H), 2,50 (s, 3H).
Получение №65: 5-(дифторметокси)-7-метил-1H-индол
Стадия A: 5-бром-7-метил-1-(фенилсульфонил)-1H-индол

Используя процедуру, аналогичную получению №48, 5-бром-7-метил-1-(фенилсульфонил)-1H-индол (1,6 г, 63%) получали из 5-бром-7-метил-1H-индола (1 г, 4,76 ммоль). LC/MS (Способ i): Время удерживания=2,58 мин.; MS масса/заряд: 350 [M+H]+; 1H ЯМР (CDCl3, 300МГц): δ=7,79 (d, J=3,8 Гц, 1H), 7,40-7,69 (m, 6H), 7,14 (m, 1H), 6,64 (d, J=3,8 Гц, 1H), 2,50 (s, 3H).
Стадия B: 7-метил-1-(фенилсульфонил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индол
В раствор 5-бром-7-метил-1-(фенилсульфонил)-1H-индола (1,6 г, 4,57 ммоль) в THF (55 мл) добавляли бис(пинаколато)дибор (2,32 г, 9,14 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (0,83 г, 1,14 ммоль) и ацетат калия (1,12 г, 11,42 ммоль). Пробирку закрывали и нагревали при 80°C в течение ночи. Обеспечивали возможность остывания реакционной смеси до комнатной температуры и ее быстро охлаждали водой. Водный слой экстрагировали дважды с помощью DCM. Органический слой промывали водой и солевым раствором, высушивали над сульфатом магния и концентрировали досуха. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-10% EtOAc в циклогексане) с получением 7-метил-1-(фенилсульфонил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индола (1,45 г, 74%) в виде желтой смолы. LC/MS (Способ i): Время удерживания=2,73 мин.; MS масса/заряд: 398 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ=7,88 (d, J=3,8 Гц, 1H), 7,81 (s, 1H), 7,70 (m, 3H), 7,61 (m, 2H), 7,34 (s, 1H), 6,94 (d, J=3,8 Гц, 1H), 2,47 (s, 3H), 1,28 (s, 12H).
Стадия C: 7-метил-1-(фенилсульфонил)-1H-индол-5-ол
В раствор 7-метил-1-(фенилсульфонил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индола (1,6 г, 4,6 ммоль) в THF (40 мл), охлажденный до 5°C, добавляли пероксид водорода (0,59 г, 8,68 ммоль) и гидроксид натрия (0,27 г, 6,85 ммоль) и реакционную смесь перемешивали при 5°C в течение 7 часов. Реакционную смесь быстро охлаждали водой и экстрагировали дважды с помощью DCM. Органический слой промывали солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали досуха с получением 7-метил-1-(фенилсульфонил)-1H-индол-5-ола (1,1 г, 73%) в виде коричневой смолы. LC/MS (Способ i): Время удерживания=1,96 мин.; MS масса/заряд: 288 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ=9,27 (s, 1H), 7,68 (m, 4H), 7,57 (m, 2H), 6,72 (m, 2H), 6,52 (m, 1H), 2,42 (s, 3H).
Стадия D: 5-(дифторметокси)-7-метил-1-(фенилсульфонил)-1H-индол
В раствор 7-метил-1-(фенилсульфонил)-1H-индол-5-ола (1 г, 3,48 ммоль) в ACN (11 мл) и воде (11 мл), охлажденный до 0°C, добавляли гидроксид калия (3,91 г, 69,6 ммоль) и реакционную смесь перемешивали при 0°C в течение 15 минут. Добавляли диэтил(бромдифторметил)фосфонат (1,67 г, 6,26 ммоль) и реакционную смесь перемешивали при 0°C в течение 5 минут перед нагреванием до комнатной температуры. Перемешивание продолжали в течение 1,5 часа. Реакционную смесь быстро охлаждали водой и подкисляли с помощью (1 н.) HCl до pH=1. Ее затем экстрагировали дважды с помощью DCM. Органический слой промывали водой и солевым раствором, высушивали над сульфатом магния и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-10% EtOAc в циклогексане) с получением 5-(дифторметокси)-7-метил-1-(фенилсульфонил)-1H-индола (550 мг, 43%) в виде желтой смолы. LC/MS (Способ i): Время удерживания=2,42 мин.; MS масса/заряд: 338 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,93 (d, J=3,8 Гц, 1H), 7,73 (m, 3H), 7,61 (m, 2H), 7,29 (d, J=2,3 Гц, 1H), 7,17 (t, J=74 Гц, 1H), 6,92 (d, J=2,3 Гц, 2H), 2,48 (s, 3H).
Стадия E: 5-(дифторметокси)-7-метил-1H-индол
Используя процедуру, аналогичную получению №51, стадии C, 5-(дифторметокси)-7-метил-1H-индол (280 мг, 73%) получали из 5-(дифторметокси)-7-метил-1-(фенилсульфонил)-1H-индола (550 мг, 1,63 ммоль). LC/MS (Способ i): Время удерживания=1,98 мин.; MS масса/заряд: 198 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 11,19 (s, 1H), 7,39 (m, 1H), 7,15 (s, 1H), 7,05 (t, J=74 Гц, 1H), 6,74 (s, 1H), 6,43 (m, 1H), 2,47 (s, 3H).
Получение №66: 5-циклопропил-7-фтор-1H-индол (10467249-0995)

Смешивали 5-бром-7-фториндол (1 г, 4,67 ммоль), циклопропилбороновую кислоту (0,602 г, 7,01 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (0,308 г, 0,420 ммоль) и карбонат цезия (4,57 г, 14,02 ммоль) и добавляли 1,4-диоксан (12,6 мл) и воду (1,3 мл). Реакционную смесь перемешивали при 110°C под микроволновым облучением в течение 30 минут. Добавляли циклопропилбороновую кислоту (0,201 г, 2,336 ммоль) и [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (0,154 г, 0,210 ммоль) и реакционную смесь перемешивали при 110°C под микроволновым облучением в течение 30 минут. Реакционную смесь разбавляли водой. Водный слой экстрагировали с помощью EtOAc. Полученный органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-10% EtOAc в циклогексане) с получением 5-циклопропил-7-фтор-1H-индола (1,19 г, 73%) в виде желтой жидкости. LC/MS (Способ i): Время удерживания=2,12 мин.; MS масса/заряд: 174 [M-H]-; 1H ЯМР (DMSO-d6, 300МГц): δ 11,39 (широкий, 1H), 7,33 (d, J=3,0 Гц, 1H), 7,10 (s, 1H), 6,63 (d, J=12,9, 1H), 6,39 (t, J=3,0 Гц, 1H), 1,97 (m, 1H), 0,89 (m, 2H), 0,63 (m, 2H).
Получение №67: 7-фтор-5-(трифторметил)-1H-индол

Используя процедуру, аналогичную получению 64, стадии B, 7-фтор-5-(трифторметил)-1H-индол (230 мг, 22%) получали из 2-фтор-6-йод-4-(трифторметил)анилина (1 г, 3,61 ммоль). LC/MS (Способ i): Время удерживания=2,12 мин.; MS масса/заряд: 202 [M-H]-; 1H ЯМР (DMSO-d6, 300МГц): δ 12,10 (широкий, 1H), 7,83 (s, 1H), 7,61 (d, J=3,1 Гц, 1H), 7,27 (d, J=11,5, 1H), 6,71 (t, J=3,1 Гц, 1H).
Получение №68: 3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин
Стадия A: 4-йод-2-метил-6-(трифторметил)пиридин-3-амин

Используя процедуру, аналогичную получению №34, стадии A, 4-йод-2-метил-6-(трифторметил)пиридин-3-амин (3,4 г, 37%) получали из 2-метил-6-(трифторметил)пиридин-3-амина (4,9 г, 27,8 ммоль). LC/MS (Способ i): Время удерживания=1,92 мин.; MS масса/заряд: 303 [M+H]+; 1H ЯМР (CDCl3, 300МГц): δ 7,79 (s, 1H), 4,43 (широкий, 2H), 2,53 (s, 3H).
Стадия B: N-аллил-4-йод-2-метил-6-(трифторметил)пиридин-3-амин
Используя процедуру, аналогичную получению №43, стадии A, N-аллил-4-йод-2-метил-6-(трифторметил)пиридин-3-амин (3,7 г, 87%) получали из 4-йод-2-метил-6-(трифторметил)пиридин-3-амина (3,4 г, 11,26 ммоль). LC/MS (Способ i): Время удерживания=2,35 мин.; MS масса/заряд: 343 [M+H]+; 1H ЯМР (CDCl3, 300МГц): δ 7,85 (s, 1H), 5,93 (m, 1H), 5,34 (d, J=17 Гц, 1H), 5,20 (d, J=9 Гц, 1H), 3,83 (широкий, 3H), 2,62 (s, 3H).
Стадия C: 3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин
Используя процедуру, аналогичную получению №43, стадии B, 3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин (2 г, 85%) получали из N-аллил-4-йод-2-метил-6-(трифторметил)пиридин-3-амина (3,7 г, 10,82 ммоль). LC/MS (Способ i): Время удерживания=1,81 мин.; MS масса/заряд: 215 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ=11,78 (широкий, 1H), 7,84 (s, 1H), 7,52 (s, 1H), 2,70 (s, 3H), 2,30 ppm (s, 3H).
Получение №69: 3,7-диметил-5-(трифторметил)-1H-пирроло[3,2-b]пиридин
Стадия A: 2-бром-4-метил-6-(трифторметил)пиридин-3-амин

В раствор 4-метил-6-(трифторметил)пиридин-3-амина (3,4 г, 19,30 ммоль) в диметилсульфоксиде (83 мл) и воде (4,5 мл) добавляли 1-бромпирролидин-2,5-дион (8,59 г, 48,3 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь быстро охлаждали водой, и образовавшееся твердое вещество фильтровали. Фильтрат экстрагировали дважды с помощью EtOAc. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Два остатка очищали колоночной хроматографией на силикагеле (элюирование с помощью 10-30% EtOAc в циклогексане) с получением 2-бром-4-метил-6-(трифторметил)пиридин-3-амина (4,3 г, 85%). LC/MS (Способ i): Время удерживания=1,86 мин.; MS масса/заряд: 255 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,52 (s, 1H), 5,97 (s, 2H), 2,23 (s, 3H).
Стадия B: N-(2-бром-4-метил-6-(трифторметил)пиридин-3-ил)-2,2,2-трифторацетамид
В раствор 2-бром-4-метил-6-(трифторметил)пиридин-3-амина (522 мг, 2,05 ммоль в DCM (6 мл) медленно добавляли пиридин (0,33 мл, 4,09 ммоль) и трифторуксусный ангидрид (0,572 мл, 4,09 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь промывали водой и экстрагировали дважды с помощью DCM. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением с получением N-(2-бром-4-метил-6-(трифторметил)пиридин-3-ил)-2,2,2-трифторацетамида (764 мг, 100%) в виде бежевого твердого вещества. LC/MS (Способ i): Время удерживания=2,01 мин.; MS масса/заряд: 351 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 11,80 (широкий, 1H), 8,09 (s, 1H), 2,37 (s, 3H).
Стадия C: N-аллил-N-(2-бром-4-метил-6-(трифторметил)пиридин-3-ил)-2,2,2-трифторацетамид

В раствор N-(2-бром-4-метил-6-(трифторметил)пиридин-3-ил)-2,2,2-трифторацетамида (719 мг, 2,048 ммоль) в ACN (5 мл) добавляли карбонат натрия (651 мг, 6,14 ммоль) и аллилбромид (0,71 мл, 8,19 ммоль) и реакционную смесь перемешивали при 70°C в течение 2 часов. Реакционную смесь концентрировали под пониженным давлением, и остаток разбавляли с помощью EtOAc и промывали водой. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением с получением N-аллил-N-(2-бром-4-метил-6-(трифторметил)пиридин-3-ил)-2,2,2-трифторацетамида (795 мг, 99%). LC/MS (Способ i): Время удерживания=2,40 мин.; MS масса/заряд: 392 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,15 (s, 1H), 5,94 (m, 1H), 5,32 (dq, J=17, 1,5 Гц, 1H), 5,23 (m, 1H), 4,53 (dd, J=14,2, 6,3 Гц, 1H), 4,21 (dd, J=14,2, 7,6 Гц, 1H), 2,44 (s, 3H).
Стадия D: 3,7-диметил-5-(трифторметил)-1H-пирроло[3,2-b]пиридин

В раствор N-аллил-N-(2-бром-4-метил-6-(трифторметил)пиридин-3-ил)-2,2,2-трифторацетамида (200 мг, 0,256 ммоль) в N,N-диметилформамиде (1 мл) добавляли палладия(II) ацетат (2,296 мг, 10,23 мкмоль), тетрабутиламмония хлорид (78 мг, 0,281 ммоль) и триэтиламин (0,078 мл, 0,563 ммоль) и реакционную смесь перемешивали при 110°C в течение 1,5 часа. Реакционную смесь промывали водой и экстрагировали с помощью EtOAc. Органический слой промывали водой, затем высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 10-60% EtOAc в циклогексане) с получением 3,7-диметил-5-(трифторметил)-1H-пирроло[3,2-b]пиридина (29 мг, 53%). LC/MS (Способ i): Время удерживания=1,86 мин.; MS масса/заряд: 215 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 11,53 (широкий, 1H), 7,61 (s, 1H), 7,39 (s, 1H), 2,57 (s, 3H), 2,30 (s, 3H).
Получение №70: N-(4-циано-2-йод-3-метилфенил)бензолсульфонамид
Стадия A: 3-йод-2-метил-4-нитробензонитрил

В раствор 3-амино-2-метил-4-нитробензонитрила (870 мг, 4,91 ммоль) в THF (2,5 мл), охлажденный до -10°C, добавляли по каплям трифторида бора диэтилэфират (1,079 мл, 8,59 ммоль) и реакционную смесь перемешивали в течение 15 минут при -10°C. Затем добавляли по каплям изоамилнитрит (0,986 мл, 7,37 ммоль) и реакционную смесь перемешивали в течение 2 часов до 0°C. В реакционную смесь добавляли пентан (2 мл) и получали бежевый осадок, его фильтровали и промывали несколько раз диэтиловым эфиром. Этот остаток добавляли в смесь йода (935 мг, 3,68 ммоль) и йодида калия (1,6 г, 9,82 ммоль) в ацетоне (6 мл) при 0°C и реакционную смесь перемешивали до тех пор, пока не прекратится выделение N2 (15 минут при 0°C, затем 1 час при комнатной температуре). 10% водный раствор тиосульфата натрия добавляли в реакционную смесь и перемешивали в течение 15 минут. Ее затем экстрагировали дважды с помощью DCM. Объединенные органические слои промывали солевым раствором, и высушивали над сульфатом магния, и концентрировали с получением 3-йод-2-метил-4-нитробензонитрила (1,3 г, 88%) в виде желтого твердого вещества. LC/MS (Способ i): Время удерживания=2,06 мин.; MS масса/заряд: 287 [M-H]-; 1H ЯМР (DMSO-d6, 300МГц): δ 8,08 (d, J=8,3 Гц, 1H), 7,84 (d, J=8,3 Гц, 1H), 2,73 (s, 3H).
Стадия B: 4-амино-3-йод-2-метилбензонитрил

Используя процедуру, аналогичную получению №18, стадии C, 4-амино-3-йод-2-метилбензонитрил (990 мг, 85%) получали из 3-йод-2-метил-4-нитробензонитрила (1,3 г, 4,51 ммоль). LC/MS (Способ i): Время удерживания=1,84 мин.; MS масса/заряд: 259 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,39 (d, J=8,4 Гц, 1H), 6,64 (d, J=8,4 Гц, 1H), 6,23 (s, 2H), 2,51 (s, 3H).
Стадия C: N-(4-циано-2-йод-3-метилфенил)бензолсульфонамид
Используя процедуру, аналогичную получению №16, стадии B, N-(4-циано-2-йод-3-метилфенил)бензолсульфонамид (1,8 г, 97%) получали из 4-амино-3-йод-2-метилбензонитрила (1,2 г, 4,65 ммоль). LC/MS (Способ i): Время удерживания=2,15 мин.; MS масса/заряд: 397 [M-H]-; 1H ЯМР (DMSO-d6, 300МГц): δ 10,11 (m, 1H), 7,81 (m, 2H), 7,70 (m, 2H), 7,59 (m, 2H), 7,01 (d, J=8,4 Гц, 1H), 2,59 (s, 3H).
Получение №71: 4,6-дихлор-1-(фенилсульфонил)-1H-индол
Используя процедуру, аналогичную получению №48, 4,6-дихлор-1-(фенилсульфонил)-1H-индол (1,3 г, 74%) получали из 4,6-дихлор-1H-индола (1 г, 5,38 ммоль). LC/MS (Способ i): Время удерживания=2,67 мин.; MS масса/заряд: 326 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,10 (m, 1H), 8,06 (m, 1H), 8,03 (d, J=3,6 Гц, 1H), 7,94 (m, 1H), 7,75 (m, 1H), 7,65 (m, 2H), 7,54 (s, 1H), 6,90 (m, 1H).
Получение №72: 6-метокси-4-метил-1-(фенилсульфонил)-1H-индол

Используя процедуру, аналогичную получению №48, 6-метокси-4-метил-1-(фенилсульфонил)-1H-индол (1,3 г, 81%) получали из 6-метокси-4-метил-1H-индола (900 мг, 5,58 ммоль). LC/MS (Способ i): Время удерживания=2,36 мин.; MS масса/заряд: 302 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,96 (m, 2H), 7,63 (m, 4H), 7,25 (m, 1H), 6,80 (dd, J=3,6, 0,8 Гц, 1H), 6,72 (m, 1H), 3,80 (s, 3H), 2,37 (s, 3H).
Получение №73: 4-фтор-1-метил-6-(трифторметил)-1H-индол-2-карбальдегид
Стадия A: (Z)-этил 2-азидо-3-(2-фтор-4-(трифторметил)фенил)акрилат

В раствор 2-фтор-4-(трифторметил)бензальдегида (2,128 мл, 15,62 ммоль) в EtOH (40 мл), реакционную смесь охлаждали при -5°C при помощи льдосоляной только что полученной ванны, добавляли этилазидоацетат (7,14 мл, 62,5 ммоль) и этанолат натрия (5,31 г, 78 ммоль). Реакционную смесь перемешивали при 0°C в течение 1 часа и одну ночь при комнатной температуре. Реакционную смесь промывали водой и экстрагировали с помощью EtOAc. Полученный органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 5-20% EtOAc в циклогексане) с получением (Z)-этил-2-азидо-3-(2-фтор-4-(трифторметил)фенил)акрилата (1,75 г, 34%) в виде желтой жидкости. LC/MS (Способ i): Время удерживания=2,69 мин.; MS масса/заряд: 276 [M-N2+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,41 (dd, J=8,9, 7,8 Гц, 1H), 7,77 (dd, J=10,7, 1 Гц, 1H), 7,67 (dd, J=8,9, 1 Гц, 1H), 6,95 (s, 1H), 4,35 (q, J=7,1 Гц, 2H), 1,33 ppm (t, J=7,1 Гц, 3H).
Стадия B: этил-4-фтор-6-(трифторметил)-1H-индол-2-карбоксилат
Раствор (Z)-этил-2-азидо-3-(2-фтор-4-(трифторметил)фенил)акрилата (1,75 г, 5,77 ммоль) в ксилоле (5 мл) перемешивали при 140°C в течение 5 часов. Остаток непосредственно очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-40% EtOAc в циклогексане) с получением этил-4-фтор-6-(трифторметил)-1H-индол-2-карбоксилата (1,2 г, 64%) в виде желтого твердого вещества. LC/MS (Способ i): Время удерживания=2,41 мин.; MS масса/заряд: 274 [M-H]-; 1H ЯМР (DMSO-d6, 300МГц): δ 12,74 (широкий, 1H), 7,64 (s, 1H), 7,29 (m, 2H), 4,39 (q, J=7,1 Гц, 2H), 1,36 ppm (t, J=7,1 Гц, 3H).
Стадия C: этил-4-фтор-1-метил-6-(трифторметил)-1H-индол-2-карбоксилат
В раствор этил-4-фтор-6-(трифторметил)-1H-индол-2-карбоксилата (1 г, 3,63 ммоль) в ACN (35 мл) добавляли диметилсульфат (1,7 мл, 18,17 ммоль) и карбонат цезия (5,92 г, 18,17 ммоль) и реакционную смесь перемешивали при 50°C в течение ночи. Реакционную смесь разбавляли с помощью H2O и экстрагировали с помощью EtOAc. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 5-20% EtOAc в циклогексане) с получением этил-4-фтор-1-метил-6-(трифторметил)-1H-индол-2-карбоксилата (240 мг, 23%). LC/MS (Способ i): Время удерживания=2,61 мин.; MS масса/заряд: 290 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,99 (s, 1H), 7,36 (s, 1H), 7,30 (d, J=10 Гц, 1H), 4,37 (q, J=7,1 Гц, 2H), 4,13 (s, 3H), 1,36 (t, J=7,1 Гц, 3H).
Стадия D: (4-фтор-1-метил-6-(трифторметил)-1H-индол-2-ил)метанол

В раствор этил-4-фтор-1-метил-6-(трифторметил)-1H-индол-2-карбоксилата (232 мг, 0,802 ммоль) в THF (5 мл), охлажденный до 0°C, медленно добавляли алюмогидрид лития (91 мг, 2,406 ммоль). Реакционную смесь перемешивали при 0°C в течение 30 минут. Глауберову соль добавляли порционно в реакционную смесь и перемешивали в течение одной ночи. Соль фильтровали и промывали с помощью DCM. Фильтрат концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 5-40% EtOAc в DCM) с получением (4-фтор-1-метил-6-(трифторметил)-1H-индол-2-ил)метанола (166 мг, 84%) в виде белого твердого вещества. LC/MS (Способ i): Время удерживания=2,02 мин.; MS масса/заряд: 248 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ=7,78 (s, 1H), 7,13 (d, J=10,6 Гц, 1H), 6,56 (s, 1H), 5,43 (t, J=5,5 Гц, 1H), 4,69 (d, J=5,5 Гц, 2H), 3,84 (s, 3H).
Стадия E: 4-фтор-1-метил-6-(трифторметил)-1H-индол-2-карбальдегид

В раствор (4-фтор-1-метил-6-(трифторметил)-1H-индол-2-ил)метанола (162 мг, 0,65 ммоль) в DCM (2 мл) добавляли диоксид марганца (342 мг, 3,93 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 2 дней. Реакционную смесь фильтровали и твердое вещество промывали с помощью DCM. Фильтрат концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 5-20% EtOAc в DCM) с получением 4-фтор-1-метил-6-(трифторметил)-1H-индол-2-карбальдегида (117 мг, 73%) в виде бежевого твердого вещества. LC/MS (Способ i): Время удерживания=2,28 мин.; MS масса/заряд: 246 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 10,02 (s, 1H), 8,01 (s, 1H), 7,63 (s, 1H), 7,32 (d, J=10,3 Гц, 1H), 4,14 (s, 3H).
Получение №74: 6-(дифторметокси)-4-метил-1-(фенилсульфонил)-1H-индол

Стадия A: 6-бром-4-метил-1-(фенилсульфонил)-1H-индол
Используя процедуру, аналогичную описанной в получении №48, 6-бром-4-метил-1-(фенилсульфонил)-1H-индол (3,49 г, 84%) получали из 6-бром-4-метил-1H-индола (2,5 г, 11,9 ммоль). LC/MS (Способ i): Время удерживания=2,41 мин.; MS масса/заряд: 350 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,99 (m, 2H), 7,89 (m, 1H), 7,85 (d, J=3,8 Гц, 1H), 7,72 (m, 1H), 7,62 (m, 2H), 7,28 (m, 1H), 6,92 (d, J=3,6 Гц, 1H), 2,43 (s, 3H).
Стадия B: 4-метил-1-(фенилсульфонил)-1H-индол-6-ол
Используя процедуру, аналогичную описанной в получении №65, стадии B и стадии C, 4-метил-1-(фенилсульфонил)-1H-индол-6-ол (2,35 г, 82%) получали из 6-бром-4-метил-1-(фенилсульфонил)-1H-индола (3,49 г, 9,96 ммоль). LC/MS (Способ i): Время удерживания=2,03 мин.; MS масса/заряд: 288 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 9,48 (s, 1H), 7,87 (m, 2H), 7,69 (m, 1H), 7,61 (m, 2H), 7,54 (d, J=3,8 Гц, 1H), 7,14-7,19 (m, 1H), 6,74 (d, J=3,8 Гц, 1H), 6,55 (m, 1H), 2,32 (s, 3H).
Стадия C: 6-(дифторметокси)-4-метил-1-(фенилсульфонил)-1H-индол

Используя процедуру, аналогичную получению 65, стадии D, 6-(дифторметокси)-4-метил-1-(фенилсульфонил)-1H-индол (1,73 г, 63%) получали из 4-метил-1-(фенилсульфонил)-1H-индол-6-ола (2,35 г, 8,18 ммоль). LC/MS (Способ i): Время удерживания=2,44 мин.; MS масса/заряд: 338 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ=7,99 (m, 2H), 7,83 (d, J=3,6 Гц, 1H), 7,71 (m, 1H), 7,60 (m, 2H), 7,54 (m, 1H), 7,24 (t, J=74,0 Гц, 1H), 6,95 (m, 1H), 6,91 (d, J=3,8 Гц, 1H), 2,43 (s, 3H).
Получение №75: N-(2-йод-5-(трифторметокси)фенил)бензолсульфонамид
Используя процедуру, аналогичную описанной в получении №16, стадии B, N-(2-йод-5-(трифторметокси)фенил)бензолсульфонамид (4,28 г, 86%) получали из 2-йод-5-(трифторметокси)анилина (3,2 г, 10,56 ммоль). LC/MS (Способ i): Время удерживания=2,28 мин.; MS масса/заряд: 444 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 10,06 (s, 1H), 7,95 (d, J=8,8 Гц, 1H), 7,70 (m, 3H), 759 (m, 2H), 7,04 (m, 1H), 6,88 (m, 1H).
Получение №76: N-(2-бром-3-метил-5-нитрофенил)бензолсульфонамид
Используя процедуру, аналогичную описанной в получении №16, стадии B, N-(2-бром-3-метил-5-нитрофенил)бензолсульфонамид (3,24 г, 38%) получали из 2-бром-3-метил-5-нитроанилина (5,3 г, 22,94 ммоль). LC/MS (Способ i): Время удерживания=2,16 мин.; MS масса/заряд: 369 [M-H]-; 1H ЯМР (DMSO-d6, 300МГц): δ 10,42 (широкий, 1H), 8,10 (d, J=2,5 Гц, 1H), 7,77 (m, 3H), 7,99 (m, 1H), 7,59 (m, 2H), 2,42 (s, 3H).
Получение №77: 6-циклопропил-4-фтор-1-(фенилсульфонил)-1H-индол

Стадия A: 6-бром-4-фтор-1-(фенилсульфонил)-1H-индол

Используя процедуру, аналогичную описанной в получении №48, 6-бром-4-фтор-1-(фенилсульфонил)-1H-индол (251 мг, 76%) получали из 6-бром-4-фтор-1H-индола (200 мг, 0,93 ммоль). LC/MS (Способ j): Время удерживания=1,93 мин.; MS масса/заряд: 354 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ=8,06 (m, 2H), 7,95 (m, 2H), 7,76 (m, 1H), 7,65 (m, 2H), 7,44 (d, J=9,4 Гц, 1H), 6,96 ppm (d, J=3,8 Гц, 1H).
Стадия B: 6-циклопропил-4-фтор-1-(фенилсульфонил)-1H-индол
Используя процедуру, аналогичную описанной в получении №12, 6-циклопропил-4-фтор-1-(фенилсульфонил)-1H-индол (100 мг, 80%) получали из 6-бром-4-фтор-1H-индола (140 мг, 0,39 ммоль). 1H ЯМР (DMSO-d6, 300МГц): δ 8,01 (m, 2H), 7,78 (d, J=3,8 Гц, 1H), 7,73 (m, 1H), 7,63 (m, 2H), 7,52 (s, 1H), 6,84 (dd, J=3,6, 0,7 Гц, 1H), 6,78 (dd, J=11,5, 1,2 Гц, 1H), 2,11 (m, 1H), 1,02 (m, 2H), 0,72 (m, 2H).
Получение №78: 7-метил-5-(трифторметил)-1H-индазол
Используя процедуру, аналогичную описанной в получении №42, стадии D, 7-метил-5-(трифторметил)-1H-индазол (550 мг, 46%) получали из 2-фтор-3-метил-5-(трифторметил)бензальдегида (1 г, 4,85 ммоль) (получение №42, стадия A). LC/MS (Способ i): Время удерживания=1,87 мин.; MS масса/заряд: 201 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ=13,58 (m, 1H), 8,25 (s, 1H), 8,04 (s, 1H), 7,41 (s, 1H), 2,59 (s, 3H).
Получение №79: 1,4-диметил-6-(трифторметил)-1H-индазол-3-карбальдегид
Стадия A: 4-метил-6-(трифторметил)-1H-индазол
Используя процедуру, аналогичную описанной в получении №41, стадии B, 4-метил-6-(трифторметил)-1H-индазол (4,91 г, 72%) получали из 4-бром-6-(трифторметил)-1H-индазола (9 г, 34 ммоль). LC/MS (Способ i): Время удерживания=1,89 мин.; MS масса/заряд: 201 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 13,49 (широкий, 1H), 8,30 (s, 1H), 7,73 (s, 1H), 7,18 (s, 1H), 2,64 (s, 3H).
Стадия B: 3-йод-4-метил-6-(трифторметил)-1H-индазол
В раствор 4-метил-6-(трифторметил)-1H-индазола (3 г, 14,99 ммоль) в 1,4-диоксане (89,7 мл) добавляли 2 н. раствор гидроксида натрия (11,24 мл, 22,48 ммоль) и реакционную смесь перемешивали при комнатной температуре 1 час. Затем добавляли дийод (4,5 г, 17,99 ммоль) и реакционную смесь перемешивали при комнатной температуре 20 часов. Добавляли 10% раствор Na2S2O3 и смесь перемешивали 15 минут при комнатной температуре, затем экстрагировали с помощью EtOAc. 1 M HCl добавляли в водный слой и его экстрагировали дважды с помощью EtOAc. Объединенные органические слои высушивали над сульфатом магния, фильтровали и концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 5-15% EtOAc в циклогексане) с получением 3-йод-4-метил-6-(трифторметил)-1H-индазола (4,33 г, 89%) в виде белого порошка. LC/MS (Способ i): Время удерживания=2,22 мин.; MS масса/заряд: 327 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 13,89 (широкий, 1H), 7,80 (s, 1H), 7,20 (s, 1H), 2,85 (s, 3H).
Стадия C: 3-йод-1,4-диметил-6-(трифторметил)-1H-индазол
Используя процедуру, аналогичную описанной в получении №51, стадии E, 3-йод-1,4-диметил-6-(трифторметил)-1H-индазол (3,5 г, 67%) получали из 3-йод-4-метил-6-(трифторметил)-1H-индазола (4,3 г, 13,3 ммоль). LC/MS (Способ i): Время удерживания=2,44 мин.; MS масса/заряд: 341 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,06 (s, 1H), 7,22 (s, 1H), 4,12 (s, 3H), 2,83 (s, 3H).
Стадия D: 1,4-диметил-6-(трифторметил)-3-винил-1H-индазол
В раствор 3-йод-1,4-диметил-6-(трифторметил)-1H-индазола (3,3 г, 9,70 ммоль) в толуоле (105 мл) добавляли бис(трифенилфосфин)палладия(II) хлорид (681 мг, 0,970 ммоль) и трибутил(винил)олово (3,97 мл, 13,58 ммоль), и реакционную смесь перемешивали 2 часа при 90°C. Добавляли SiO2 и реакционную смесь выпаривали досуха и очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-20% EtOAc в циклогексане) с получением 1,4-диметил-6-(трифторметил)-3-винил-1H-индазола (2,33 г, 90%) в виде белого порошка. LC/MS (Способ i): Время удерживания=2,33 мин.; MS масса/заряд: 241 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,95 (s, 1H), 7,19 (s, 1H), 7,22 (dd, J=17,3, 11,1 Гц, 1H), 6,02 (dd, J=17,3, 2,1 Гц, 1H), 5,40 (dd, J=11,1, 2,1 Гц, 1H), 4,12 (s, 3H), 2,71 (s, 3H).
Стадия E: 1,4-диметил-6-(трифторметил)-1H-индазол-3-карбальдегид
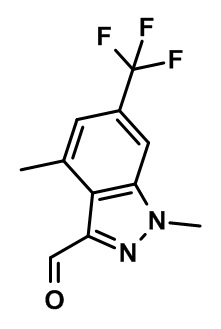
В раствор 1,4-диметил-6-(трифторметил)-3-винил-1H-индазола (2,3 г, 9,70 ммоль) в ACN (66 мл) и воде (14,51 мл) добавляли раствор рутения(III) хлорид-гидрата (9,70 мл, 0,388 ммоль) в воде (9,70 мл), а затем перйодат натрия (4,1 г, 19,40 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Добавляли насыщенный раствор тиосульфата натрия и смесь экстрагировали дважды с помощью EtOAc. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-20% EtOAc в циклогексане) с получением 1,4-диметил-6-(трифторметил)-1H-индазол-3-карбальдегида (1,1 г, 47%) в виде белого порошка. LC/MS (Способ i): Время удерживания=2,15 мин.; MS масса/заряд: 243 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 10,14 (s, 1H), 8,15 (s, 1H), 7,45 (s, 1H), 4,29 (s, 3H), 2,87 (s, 3H).
Получение №80: 4-метил-6-(трифторметокси)-1H-индол

Используя процедуру, аналогичную описанной в получении 64, стадии B, 4-метил-6-(трифторметокси)-1H-индол (373 мг, 57%) получали из 2-йод-3-метил-5-(трифторметокси)анилина (1,1 г, 3,47 ммоль) (получение №47, стадия D). LC/MS (Способ i): Время удерживания=2,24 мин.; MS масса/заряд: 214 [M-H]-; 1H ЯМР (DMSO-d6, 300МГц): δ=11,27 (широкий, 1H), 7,42 (m, 1H), 7,17 (m, 1H), 6,79 (m, 1H), 6,50 (m, 1H), 2,49 (s, 3H).
Получение №81: метил-2-азаспиро[3.3]гептан-6-карбоксилат-2,2,2-трифторацетат
В раствор метил-2-boc-2-аза-спиро[3.3]гептан-6-карбоксилата (400 мг, 1,57 ммоль) в DCM (6 мл) добавляли TFA (3,02 мл, 39,2 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь концентрировали под пониженным давлением с получением метил-2-азаспиро[3.3]гептан-6-карбоксилат-2,2,2-трифторацетата (422 мг, 100%). 1H ЯМР (DMSO-d6, 300МГц): δ 3,98 (t, J=6,2 Гц, 2H), 3,90 (t, J=6,2 Гц, 2H), 3,59 (s, 3H), 3,01 (m, 1H), 2,50 (m, 4H).
Получение №82: метил-2-(2-азаспиро[3.3]гептан-6-ил)ацетата гидрохлорид

В раствор 2-(2-(трет-бутоксикарбонил)-2-азаспиро[3.3]гептан-6-ил)уксусной кислоты (309 мг, 1,21 ммоль) в EtOH/MeOH (2,3 мл) добавляли по каплям оксалилхлорид (0,21 мл, 2,42 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 20 часов, затем концентрировали под пониженным давлением с получением метил-2-(2-азаспиро[3.3]гептан-6-ил)ацетата гидрохлорида (249 мг, 100%) в виде белого твердого вещества. 1H ЯМР (DMSO-d6, 300МГц): δ 3,94 (m, 2H), 3,81 (m, 2H), 3,76 (s, 1H), 3,56 (s, 3H), 2,38 (m, 4H), 1,88 (m, 2H).
Получение №83: (3S,4S)-этил-3-метилпиперидин-4-карбоксилат, хлористоводородная кислота
Стадия 1: (цис)-этил-3-метилпиперидин-4-карбоксилат

В колбу загружали Pd(OH)2 (2,71 г, 3,86 ммоль) и растворяли в EtOH (100 мл) в атмосфере азота. Добавляли раствор этил-1-бензил-5-метил-1,2,3,6-тетрагидропиридин-4-карбоксилата (10 г, 38,6 ммоль) (Journal of Med Chem, 2010, vol. 53, # 21 p. 7682-7698) в EtOH (50 мл) и реакционную смесь продували водородом из баллона и перемешивали при комнатной температуре. Катализатор отфильтровывали и растворитель концентрировали под пониженным давлением с получением масла (цис)-этил-3-метилпиперидин-4-карбоксилата (29 г, 169 ммоль, выход 97%). LC/MS (Способ i) Время удерживания=0,1 минуты; MS масса/заряд: 130 (M+H)+.
Стадия 2: (3R,4R)-этил-3-метилпиперидин-4-карбоксилат, хлористоводородная кислота и (3S,4S)-этил-3-метилпиперидин-4-карбоксилат, хлористоводородная кислота

N-этил-N-изопропилпропан-2-амин (5,35 мл, 30,7 ммоль) добавляли в раствор rac-(3R,4R)-этил-3-метилпиперидин-4-карбоксилата (5,00 г, 29,2 ммоль) (смесь 10:1 цис/транс-изомеров), растворенного в DCM (97 мл), при комнатной температуре в 250 мл колбе. Бензил-2,5-диоксопирролидин-1-карбоксилат (6,81 г, 28,6 ммоль) добавляли порционно при комнатной температуре. Через 3 часа реакционную смесь концентрировали досуха, затем повторно растворяли в эфире. Раствор промывали водой, 10% раствором HCl (2x 20 мл), а затем солевым раствором (20 мл), а затем высушивали над сульфатом магния. Цис-изомеры отделяли препаративной SFC: 10% изопропанол в CO2 (60 мл/мин., 140 бар, 40°C). Время цикла составляло 4,40 мин., со временем одного прохода, составляющим 22 мин. Изопропанол степени чистоты для HPLC использовали с CO2 степени чистоты для SFC. При хроматографии использовали колонку YMC-SC, 30×150 мм (частицы 5 мкм).
LC/MS (Способ i) Время удерживания=1,60 минуты; MS масса/заряд: 306 (M+H)+.
Стадия 3: (3S,4S)-этил-3-метилпиперидин-4-карбоксилат, хлористоводородная кислота
Палладий на угле (4,18 г, 3,93 ммоль) добавляли в 50 мл круглодонную колбу в атмосфере азота. (3S,4S)-1-бензил-4-этил-3-метилпиперидин-1,4-дикарбоксилат (12 г, 39,3 ммоль) растворяли в EtOH (7 мл) и добавляли в реакционную колбу. Колбу продували водородом и затем перемешивали в течение приблизительно 18 ч. После завершения водород удаляли и смесь фильтровали через подушку Celite®. Раствор концентрировали досуха. Добавляли эфир (10 мл), а затем HCl в эфире (58,9 мл, 58,9 ммоль), которая высаживалась белым твердым веществом. Твердое вещество фильтровали в потоке азота, а затем его высушивали в вакуумной печи в течение приблизительно двух часов. Материал собирали в виде чистого белого твердого вещества (3S,4S)-этил-3-метилпиперидин-4-карбоксилата, хлористоводородной кислоты (5,3 г, 25,5 ммоль, выход 64,9%). LC/MS (Способ i) Время удерживания=0,1 минуты; MS масса/заряд: 130 (M+H)+.
Получение #84: (3R,4R)-этил-3-метилпиперидин-4-карбоксилат, хлористоводородная кислота

Стадия 1: (цис)-этил-3-метилпиперидин-4-карбоксилат

В колбу загружали Pd(OH)2 (2,71 г, 3,86 ммоль) и растворяли в EtOH (100 мл) в атмосфере азота. Добавляли раствор этил-1-бензил-5-метил-1,2,3,6-тетрагидропиридин-4-карбоксилата (10 г, 38,6 ммоль) (Journal of Med Chem, 2010, vol. 53, # 21 p. 7682-7698) в EtOH (50 мл) и реакционную смесь продували водородом из баллона и перемешивали при комнатной температуре в течение приблизительно 18 часов. Катализатор отфильтровывали и растворитель концентрировали под пониженным давлением с получением (цис)-этил-3-метилпиперидин-4-карбоксилата (29 г, 169 ммоль, выход 97%) в виде масла. LC/MS (Способ i) Время удерживания=0,1 минуты; MS масса/заряд: 130 (M+H)+.
Стадия 2: (3R,4R)-этил-3-метилпиперидин-4-карбоксилат, хлористоводородная кислота

N-этил-N-изопропилпропан-2-амин (5,35 мл, 30,7 ммоль) добавляли в раствор rac-(3R,4R)-этил-3-метилпиперидин-4-карбоксилата (5,00 г, 29,2 ммоль) (смесь 10:1 цис/транс-изомеров), растворенного в DCM (97 мл), при комнатной температуре в 250 мл колбе. Бензил-2,5-диоксопирролидин-1-карбоксилат (6,81 г, 28,6 ммоль) добавляли порционно при комнатной температуре. Через 3 часа реакционную смесь концентрировали досуха, затем повторно растворяли в эфире. Раствор промывали водой, 10% раствором HCl (2x 20 мл), а затем солевым раствором (20 мл), а затем высушивали над сульфатом магния. Цис-изомеры отделяли препаративной SFC: 10% изопропанол в CO2 (60 мл/мин., 140 бар, 40°C). Время цикла составляло 4,40 мин., со временем одного прохода, составляющим 22 мин. Изопропанол степени чистоты для HPLC использовали с CO2 степени чистоты для SFC. При хроматографии использовали колонку YMC-SC, 30×150 мм (частицы 5 мкм). LC/MS (Способ i) Время удерживания=1,60 минуты; MS масса/заряд: 306 (M+H)+.
Стадия 3: (3R,4R)-этил-3-метилпиперидин-4-карбоксилат, хлористоводородная кислота

Палладий на угле (2,67 г, 2,505 ммоль) добавляли в продутую сухим азотом 2-горлую 500 мл колбу. Минимальное количество EtOAc добавляли для смачивания катализатора, а затем EtOH (200 мл) аккуратно добавляли в колбу при перемешивании. (3R,4R)-1-бензил 4-этил-3-метилпиперидин-1,4-дикарбоксилат (15,3 г, 50,1 ммоль) добавляли в 50 мл EtOH, а затем колбу продували три раза водородом. Обеспечивали возможность перемешивания реакционной смеси в течение ночи. Из смеси затем выкачивали азот, а затем фильтровали через подушку Celite® и фильтрат концентрировали до неочищенного масла. Масло растворяли в эфире (50 мл), а затем добавляли 4 M HCl в эфире. Раствор фильтровали в воронке из спеченного стекла в потоке азота и затем высушивали в вакуумной печи в течение пары часов с получением (3R,4R)-этил-3-метилпиперидин-4-карбоксилата, хлористоводородной кислоты (6,88 г, 66%). LC/MS (Способ i) Время удерживания=0,1 минуты; MS масса/заряд: 130 (M+H)+.
Получение №85: 2-йод-3-метил-5-(трифторметил)фенол
В раствор 2-йод-3-метил-5-(трифторметил)анилина (3 г, 9,97 ммоль) (получение №16, стадия A) в уксусной кислоте (30 мл, 9,97 ммоль), охлажденный до 10°C, добавляли по каплям нитрит натрия (1,031 г, 14,95 ммоль) в растворе серной кислоты (18 мл, 9,97 ммоль). Реакционную смесь перемешивали 30 минут при температуре от 10 до 15°C. Этот раствор добавляли по каплям в нагретый до температуры возврата флегмы раствор воды (54 мл) и реакционную смесь перемешивали 30 минут с обратным холодильником. Реакционную смесь охлаждали до комнатной температуры и смесь экстрагировали дважды с помощью EtOAc. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением с получением 2-йод-3-метил-5-(трифторметил)фенола (3 г, 100%) в виде оранжевого масла. LC/MS (Способ i): Время удерживания=2,19 мин.; MS масса/заряд: 301 [M-H]-; 1H ЯМР (DMSO-d6, 300МГц): δ 10,96 (s, 1H), 7,13 (s, 1H), 6,93 (s, 1H), 2,44 (s, 3H).
Пример A: (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(4-(2-метоксиэтил)пиперазин-1-ил)метанон
Стадия 1: метил-2,4-дихлор-3-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)бензоат

В раствор N-(2-йод-3-метил-5-(трифторметил)фенил)бензолсульфонамида (получение №16) (300 мг, 0,680 ммоль) в DMF (2 мл) добавляли Pd(PPh3)2Cl2 (23,86 мг, 0,034 ммоль), йодид меди(I) (6,47 мг, 0,034 ммоль), триэтиламин (2 мл) и метил-2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)бензоат (229 мг, 0,884 ммоль) (получение №1). Реакционную смесь нагревали при приблизительно 110°C под микроволновым облучением в течение 20 минут, а затем разбавляли водой. Водный слой экстрагировали с помощью EtOAc, высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-60% EtOAc в циклогексане) с получением метил-2,4-дихлор-3-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)бензоата (400 мг, 99%) в виде коричневого масла. LC/MS (Способ h), Время удерживания=3,33 минуты; MS масса/заряд: 630 [M-H]-+CH3COOH. 1H ЯМР (DMSO-d6, 300 МГц): δ 8,08 (s, 1H) 7,80 (m, 1H), 7,78 (m, 1H), 7,68 (m, 2H), 5,56 (m, 3H), 7,43 (s, 1H), 7,02 (d, 1H), 6,88 (s, 1H), 6,75 (d, 1H), 3,86 (s, 3H), 2,47 (s, 3H).
Стадия 2: метил-2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)бензоат
В раствор метил-2,4-дихлор-3-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)бензоата (440 мг, 0,769 ммоль) в DCM (4,6 мл), охлажденный до 0°C, добавляли триэтилсилан (0,613 мл, 3,84 ммоль), диэтилэфират трифторида бора (0,483 мл, 3,84 ммоль) и TFA (0,046 мл). Реакционную смесь перемешивали при комнатной температуре в течение одного часа, затем разбавляли водой. Полученный водный слой экстрагировали с помощью DCM и органический слой промывали насыщенным водным раствором NaHCO3, высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением с получением метил-2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)бензоата (413 мг, 94%) в виде черного твердого вещества. LC/MS (Способ h), Время удерживания=3,79 минуты; MS масса/заряд: 556 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 8,24 (s, 1H), 7,92 (m, 2H), 7,81 (m, 2H), 7,70 (m, 3H), 7,42 (s, 1H), 5,98 (s, 1H), 4,61 (s, 2H), 3,86 (s, 3H), 2,35 (s, 3H).
Стадия 3: метил-2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоат

В раствор метил 2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)бензоата (6,16 г, 11,07 ммоль) в THF (200 мл) добавляли по каплям тетрабутиламмония фторид (13,29 мл, 13,29 ммоль). Реакционную смесь перемешивали с обратным холодильником в течение одного часа, и добавляли тетрабутиламмония фторид (3,3 мл, 3,3 ммоль), и нагревали с обратным холодильником в течение еще одного часа. Реакционную смесь концентрировали под пониженным давлением и остаток поглощали с помощью EtOAc и промывали насыщенным водным раствором NaHCO3. Органический слой затем высушивали над сульфатом магния, фильтровали и выпаривали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-20% EtOAc в циклогексане) с получением метил-2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоата (3,8 г, 66%) в виде желтого твердого вещества. LC/MS (Способ h), Время удерживания=3,39 минуты; MS масса/заряд: 416 [M+H]+. 1H ЯМР (CDCl3, 300 МГц): δ 8,36 (s, 1H), 7,64 (d, J=9,0 Гц, 1H), 7,43 (m, 2H), 7,09 (s, 1H), 6,39 (s, 1H), 4,56 (s, 2H), 3,94 (s, 3H), 2,52 (s, 3H).
Стадия 4: метил-2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоат
В раствор метил-2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоата (3,80 г, 9,13 ммоль) в DMF (100 мл) добавляли порционно гидрид натрия (0,402 г, 10,04 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 10 минут, затем добавляли йодметан (0,628 мл, 10,04 ммоль) и реакционную смесь перемешивали в течение одного часа. Реакционную смесь разбавляли водой. Полученный осадок фильтровали, промывали водой и высушивали с получением метил-2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоата (3,7 г, 94%) в виде бежевого твердого вещества.
LC/MS (Способ h), Время удерживания=3,51 минуты; MS масса/заряд: 430 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 7,80 (d, J=9,0 Гц,1H), 7,70 (m, 2H), 7,06 (s, 1H), 5,67 (s, 1H), 4,50 (s, 2H), 3,92 (s, 3H), 3,88 (s, 3H), 2,36 (s, 3H).
Стадия 5: 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензойная кислота
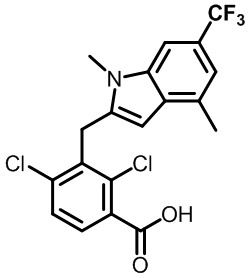
В раствор метил-2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоата (3,7 г, 8,60 ммоль) в THF (100 мл) добавляли гидроксид лития (0,722 г, 17,20 ммоль) в воде (50 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем концентрировали под пониженным давлением. Остаток поглощали водой и подкисляли до pH=3-4 добавлением 1 н. раствора HCl. Полученный осадок фильтровали, промывали водой и высушивали с получением 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензойной кислоты (3,5 г, выход 95%) в виде белого порошка.
LC/MS (Способ h), Время удерживания=3,08 минуты; MS масса/заряд: 416 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 13,55 (широкий, 1H), 7,76 (d, J=9,0 Гц, 1H), 7,68 (m, 2H), 7,06 (s, 1H), 5,67 (s, 1H), 4,84 (s, 2H), 3,92 (s, 3H), 2,49 (s, 3H).
Стадия 6: (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(4-(2-метоксиэтил)пиперазин-1-ил)метанон

В раствор 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензойной кислоты (102 мг, 0,245 ммоль) в DCM (2 мл) добавляли триэтиламин (0,044 мл, 0,319 ммоль), 1-(3-диметиламинопропил)-3-этилкарбодиимид (49,5 мг, 0,319 ммоль) и 1-гидроксибензотриазол (43,0 мг, 0,319 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 30 минут. Добавляли 1-(2-метоксиэтил)пиперазин (0,044 мл, 0,294 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи, затем разбавляли водой и экстрагировали с помощью DCM. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-5% MeOH в DCM) с получением (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(4-(2-метоксиэтил)пиперазин-1-ил)метанона (59 мг, 43,6%) в виде белого твердого вещества. LC/MS (Способ g), Время удерживания=1,34 минуты; MS масса/заряд: 542 [M+H]+.
1H ЯМР (DMSO-d6, 400 МГц): δ 7,70 (s, 1H), 7,67 (d, J=8,1Гц, 1H), 7,41 (d, J=8,1Гц, 1H), 7,07 (s, 1H), 5,67 (s, 1H), 4,49 (d, J=16,7Гц,1H), 4,43 (d, J=16,7Гц,1H), 3,92 (s, 3H), 3,68-3,56 (m, 2H), 3,42 (t, J=5,7Гц, 2H), 3,21 (s, 3H), 3,16 (m, 2H), 2,50-2,34 (m, 6H), 2,36 (s, 3H).
Таблица A. Следующие промежуточные соединения получали из 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензойной кислоты (пример A, стадия 5) при помощи такой же процедуры с соответствующим амином.
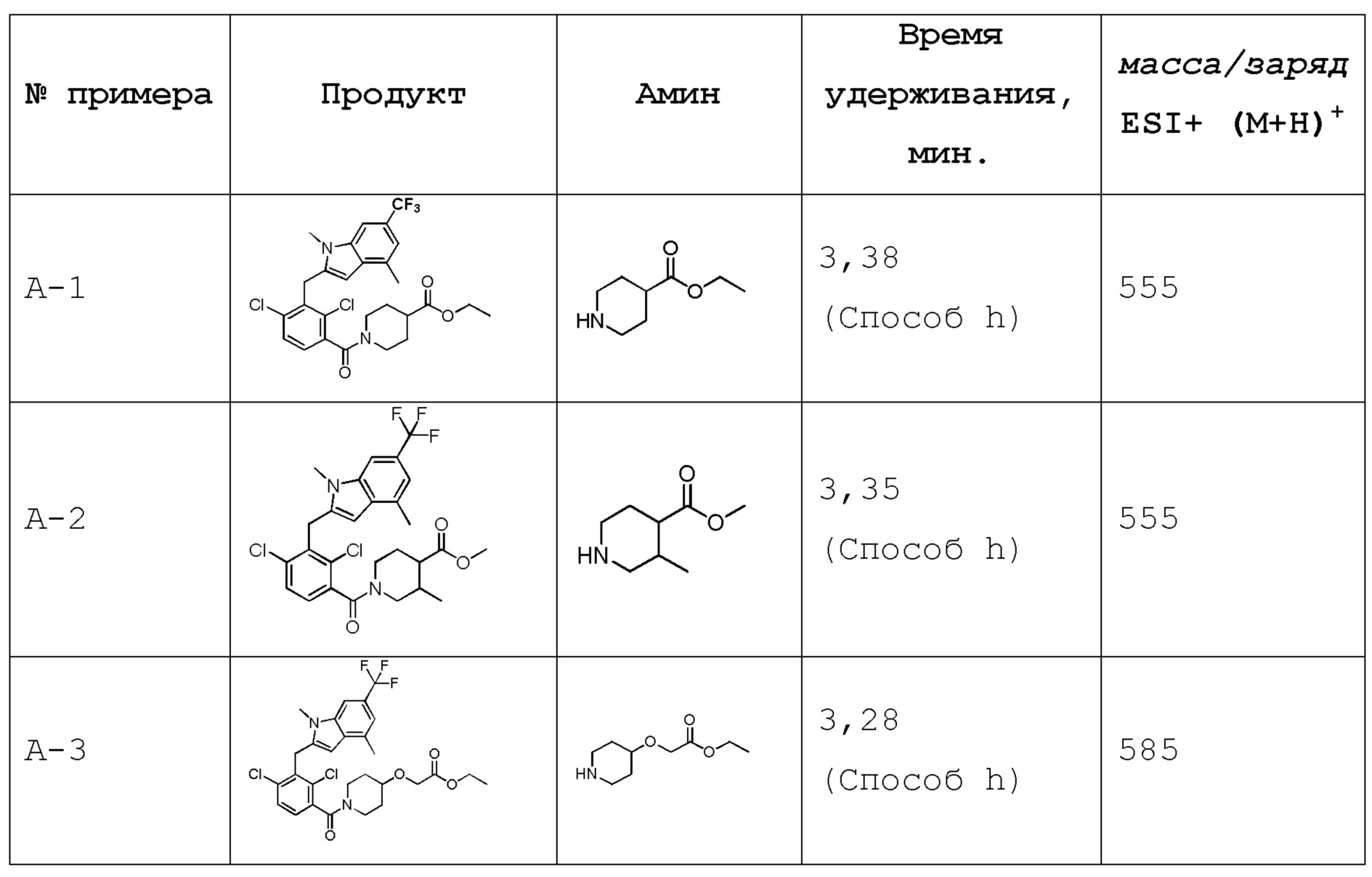


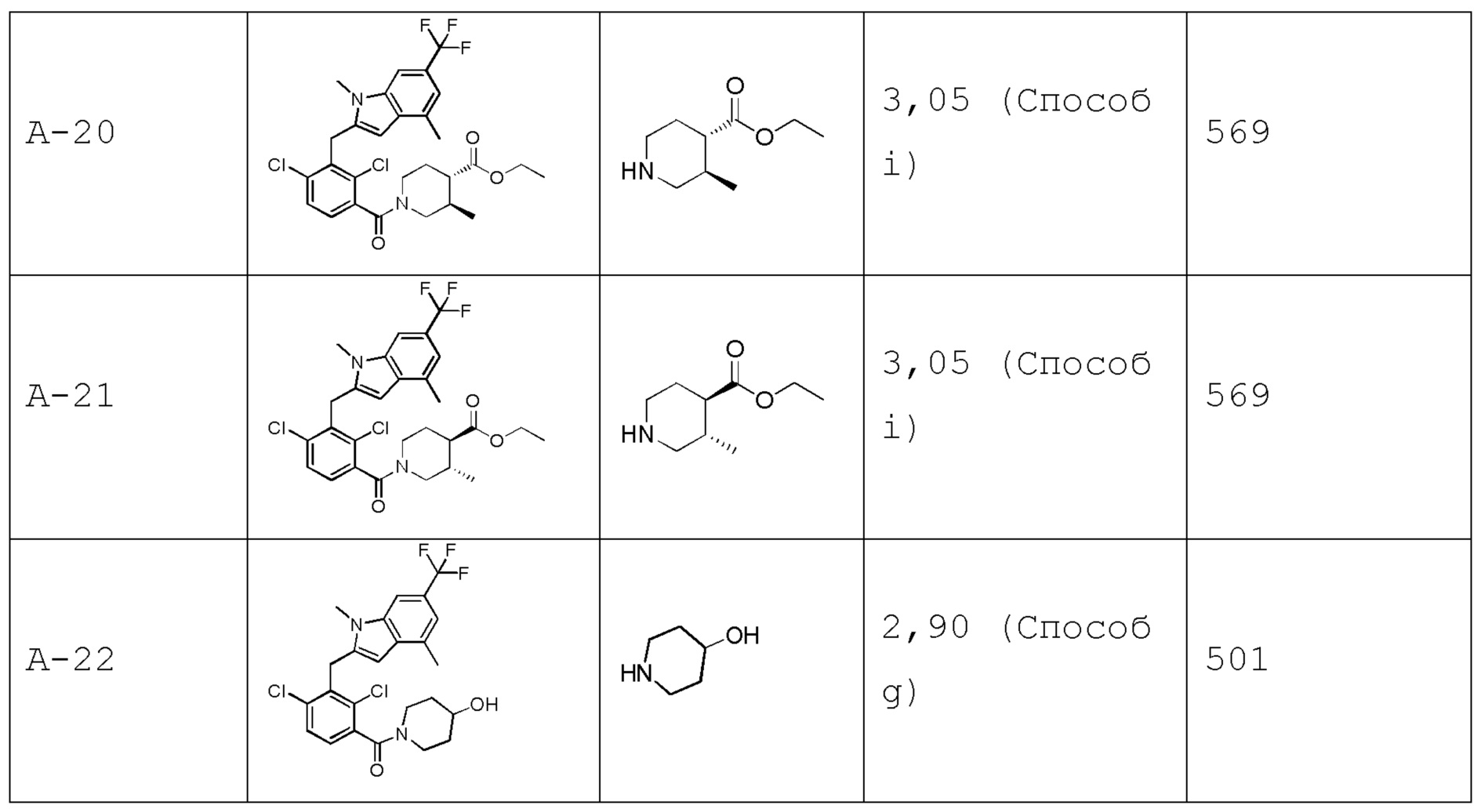
Пример A1: (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(4-(оксетан-3-ил)пиперазин-1-ил)метанон

В раствор 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензойной кислоты (пример A, стадия 5) (100 мг, 0,240 ммоль) в DMF (519 мкл) добавляли HATU (110 мг, 0,288 ммоль) и 4-метилморфолин (106 мкл, 0,961 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 15 минут, затем добавляли 1-(оксетан-3-ил)пиперазин (41,0 мг, 0,288 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду и образовавшийся осадок фильтровали и промывали водой и растирали в диэтиловом эфире с получением (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(4-(оксетан-3-ил)пиперазин-1-ил)метанона (81 мг, 62%) в виде белого твердого вещества. LC/MS (Способ g), Время удерживания=1,73 минуты; MS масса/заряд: 540 [M+H]+. 1H ЯМР (DMSO-d6, 400 МГц): δ 7,70 (s, 1H), 7,68 (d, J=8,1Гц, 1H), 7,43 (d, J=8,1Гц, 1H), 7,06 (s, 1H), 5,68 (s, 1H), 4,52 (m, 2H), 4,43 (m, 4H), 3,92 (s, 3H), 3,67 (m; 2H), 3,43 (m, 1H), 3,20 (m, 2H), 2,36 (s, 3H), 2,38-2,18 (m, 4H).
Таблица A1. Следующие промежуточные соединения получали из 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензойной кислоты (пример A, стадия 5) при помощи такой же процедуры с соответствующим амином.
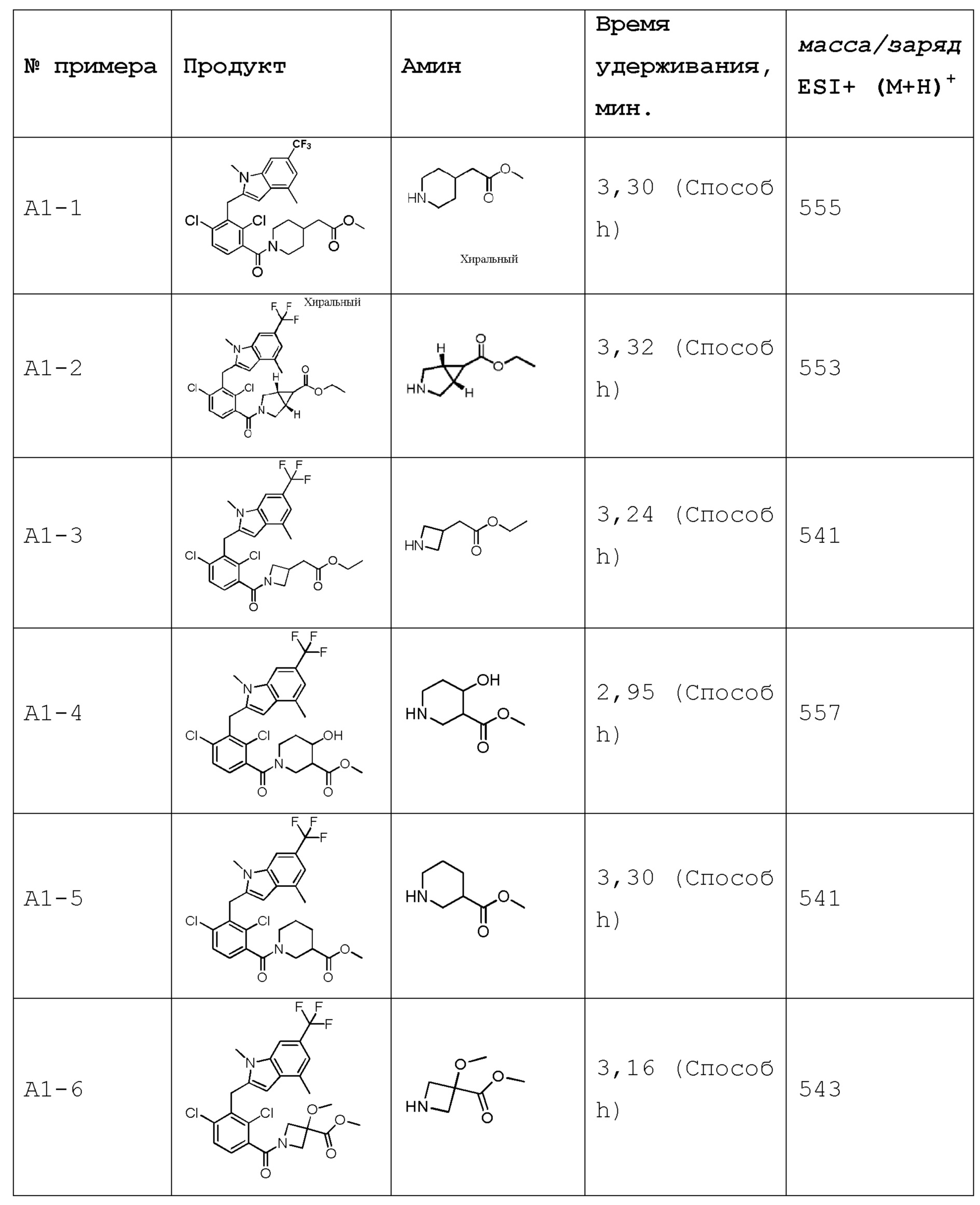
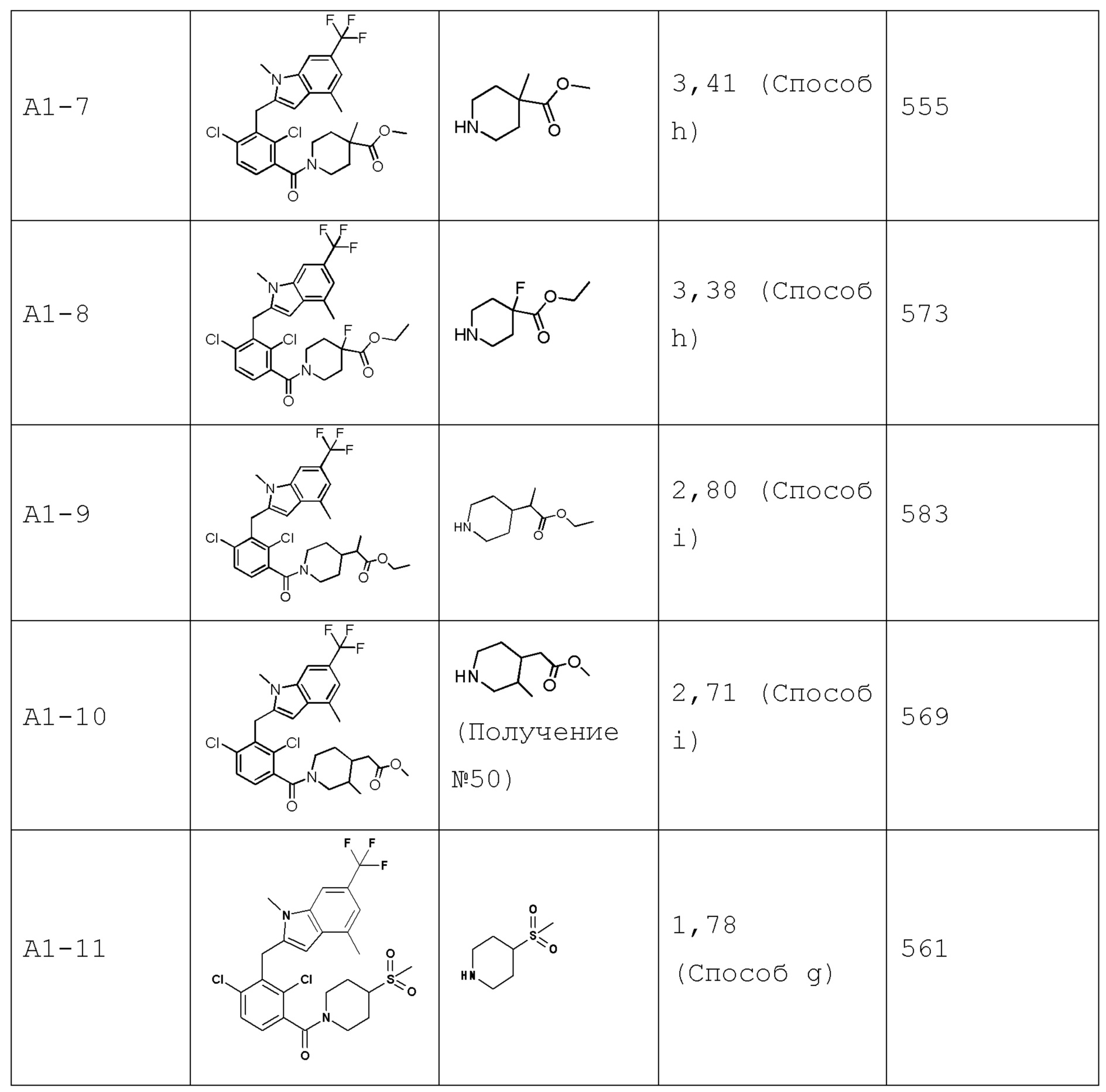
Пример B: 1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-карбоновая кислота
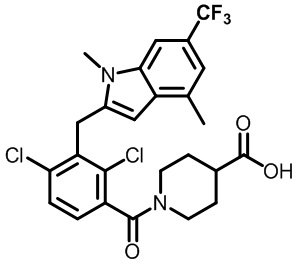
Используя процедуру, аналогичную примеру A, стадии 5, 1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-карбоновую кислоту (1,465 г, выход 95%) получали из этил-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-карбоксилата (таблица A, A-1) (1,6 г, 2,88 ммоль). LC/MS (Способ g), Время удерживания=1,79 минуты; MS масса/заряд: 527 [M+H]+. 1H ЯМР (DMSO-d6, 500 МГц): δ 13,36 (широкий, 1H), 7,87 (s, 1H), 7,67 (m, 1H), 7,42 (m, 1H), 6,87 (s, 1H), 5,67 (m, 1H), 4,48 (m, 2H), 4,35 (m, 1H), 3,92 (s, 3H), 3,31 (m, 1H), 3,08 (m, 1H), 2,97 (m, 1H), 2,58 (m, 1H), 2,35 (s, 3H), 1,93 (m, 1H), 1,75 (m, 1H), 1,50 (m, 2H)
Таблица B. Следующие примеры получали при помощи такой же процедуры, начиная с соответствующих сложных эфиров (как описано в таблицах A и A1, BH).
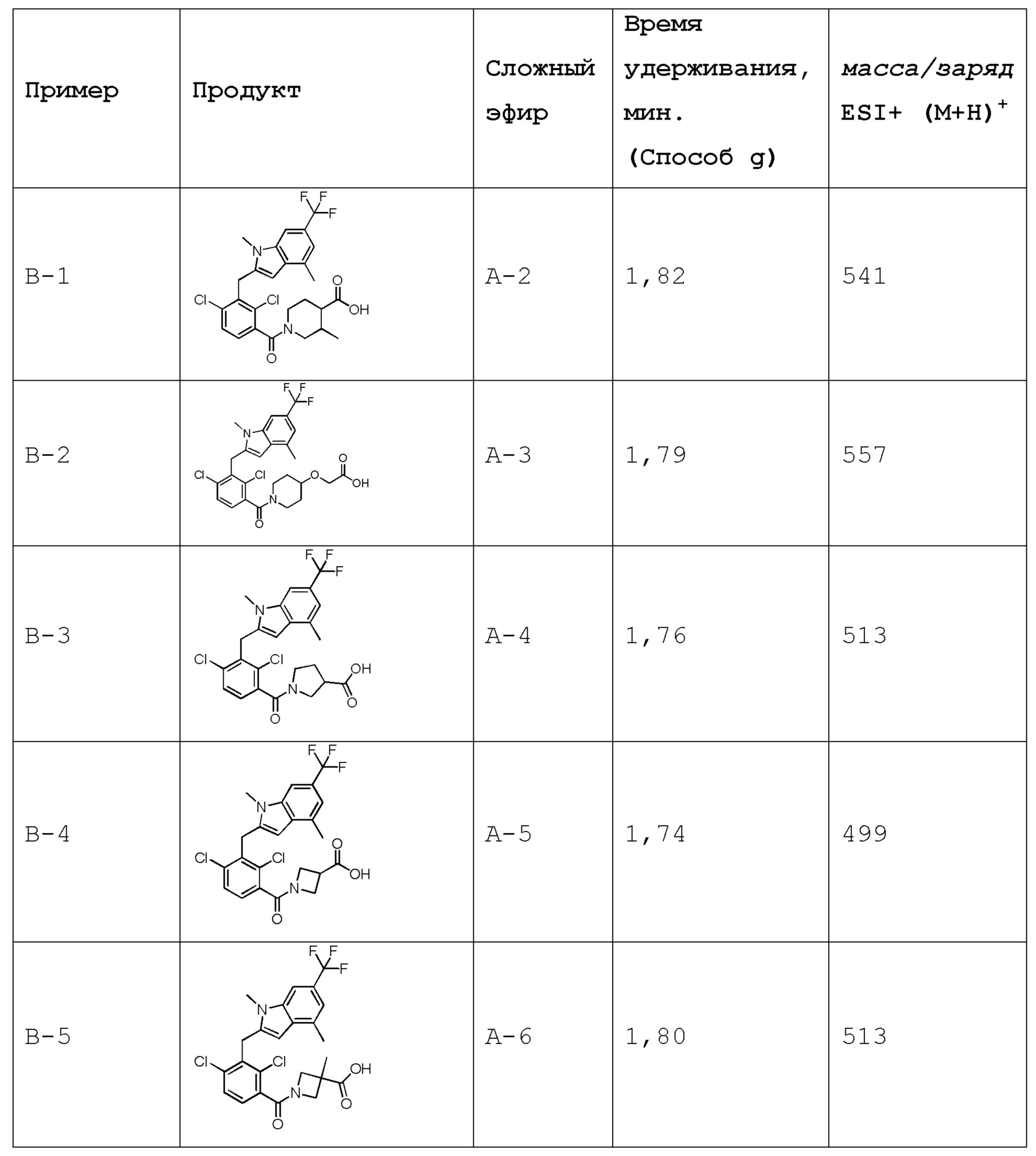
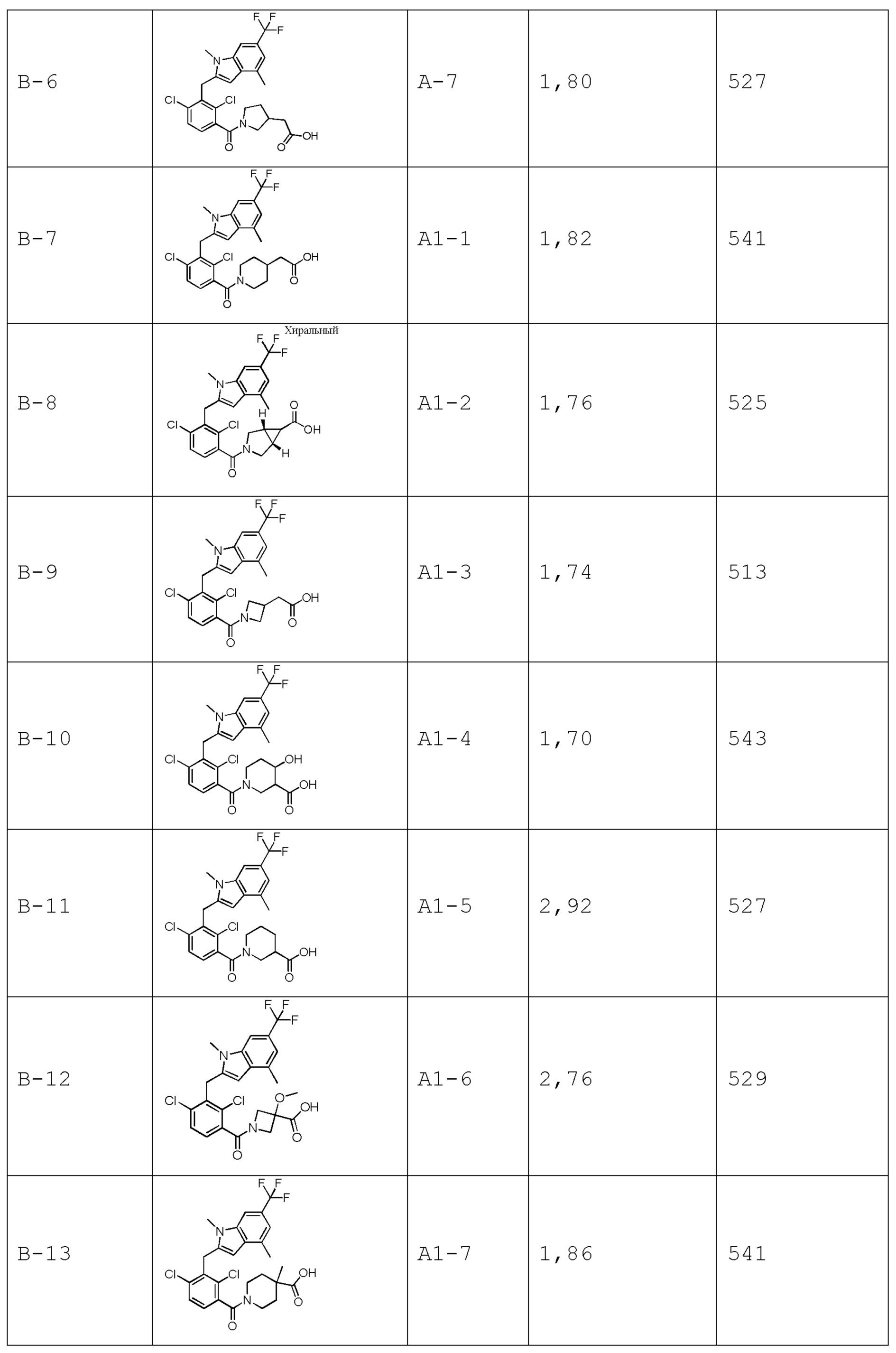
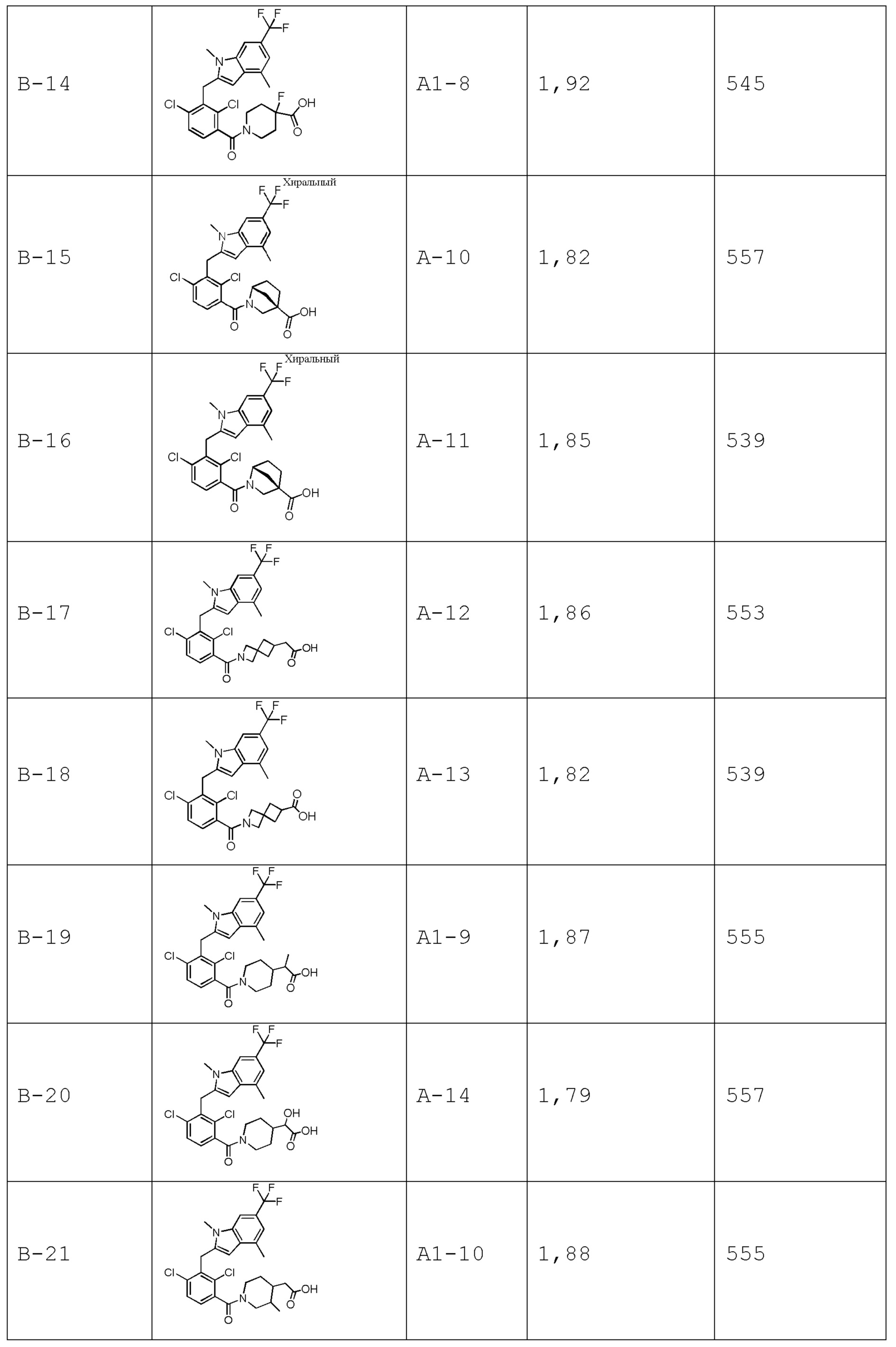
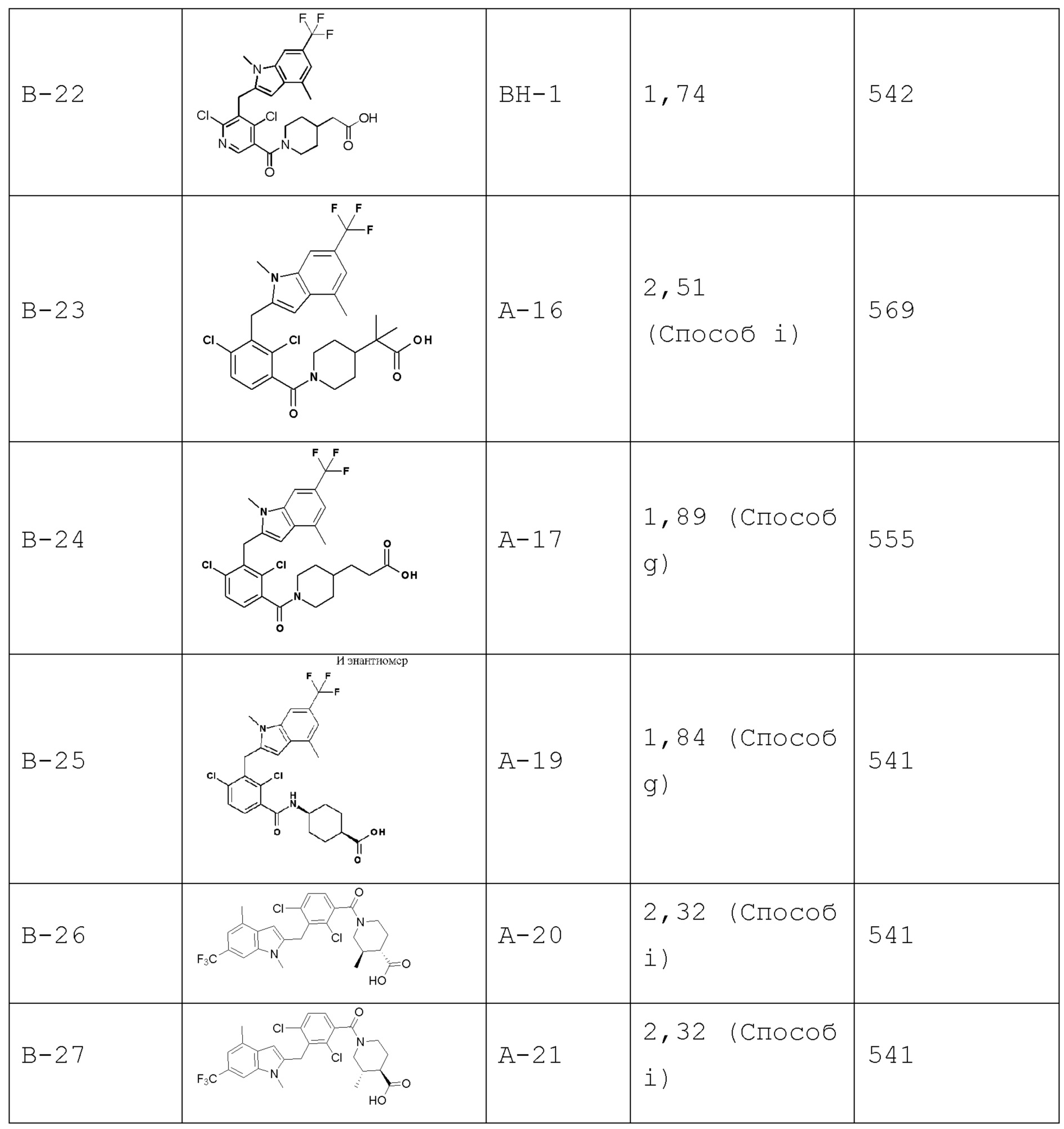
Пример B.2: (3S,4S)-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-карбоновая кислота и (3R,4R)-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-карбоновая кислота

1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-карбоновую кислоту (пример B1, таблица B, 400 мг) растворяли в метиленхлориде и очищали при помощи способа o из способов хиральной очистки (таблица 2). Фракции первого элюируемого изомера объединяли и анализировали.
(3S,4S)-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-карбоновая кислота (0,123 г, 0,227 ммоль, выход 28,7%) LC/MS (Способ l), Время удерживания=2,5 минуты; MS масса/заряд: 539 [M-H]-, 541 [M+H]+. 1H ЯМР (CDCl3, 400 МГц): δ 12,33 (bs, 1H), 7,73-7,64 (m, 2H), 7,47-7,37 (m, 1H), 7,07 (s, 1H), 4,15-4,55 (m, 3H), 3,91-3,94 (m, 3H), 3,28-3,22 (m, 1H), 3,18-2,92 (m, 2H), 2,72-2,63 (m, 1H), 2,38-2,34 (m, 3H), 2,34-2,06 (m, 1H), 1,74-1,50 (m, 2H), 0,95-0,70 (m,4H).
Хиральная HPLC 2,9 мин. (способ n, >99% ee).
Фракции второго элюируемого пика объединяли и анализировали.
(3R,4R)-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-карбоновая кислота (0,138 г, 0,255 ммоль, выход 32,2%) LC/MS (Способ l), Время удерживания=2,5 минуты; MS масса/заряд: 539 [M-H]-, 541 [M+H]+. 1H ЯМР (CDCl3, 400 МГц): δ 12,33 (bs, 1H), 7,73-7,64 (m, 2H), 7,47-7,37 (m, 1H), 7,07 (s, 1H), 4,15-4,55 (m, 3H), 3,91-3,94 (m, 3H), 3,28-3,22 (m, 1H), 3,18-2,92 (m, 2H), 2,72-2,63 (m, 1H), 2,38-2,34 (m, 3H), 2,34-2,06 (m, 1H), 1,74-1,50 (m, 2H), 0,95-0,70 (m,4H).
Хиральная HPLC 3,7 мин. (способ n, >99% ee).
Пример C: (2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон

Стадия 1: (2,4-дихлор-3-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон
Используя процедуру, аналогичную примеру A, стадии 1, (2,4-дихлор-3-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон (3,7 г, 87%) получали из N-(2-йод-3-метил-5-(трифторметил)фенил)бензолсульфонамида (получение №16) (3 г, 6,80 ммоль) и (2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)фенил)(морфолинo)метанона (2,78 г, 8,84 ммоль) (получение №3). LC/MS (Способ k), Время удерживания=3,10 минуты; MS масса/заряд: 627[M+H]+.
1H ЯМР (CDCl3, 300 МГц): δ 8,25 (s, 1H), 7,90 (m, 2H), 7,52 (m, 1H), 7,45 (m, 3H), 7,30 (m, 2H), 7,12 (m, 1H), 6,35 (m, 1H), 4,02 (m, 1H), 3,82 (m, 4H), 3,79 (m, 2H), 3,30 (m, 2H), 2,41 (s, 3H).
Стадия 2: (2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон

Используя процедуру, аналогичную примеру A, стадии 2, (2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон (3 г, 86%) получали из (2,4-дихлор-3-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанона (3,67 г, 5,85 ммоль). LC/MS (Способ k), Время удерживания=3,56 минуты; MS масса/заряд: 611[M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 8,24 (s, 1H), 7,92 (m, 2H), 7,68 (m, 1H), 7,65 (m, 3H), 7,46 (m, 1H), 7,42 (s, 1H), 6,00 (s, 1H), 4,57 (m, 2H), 3,62 (m, 4H), 3,47 (m, 2H), 3,18 (m, 2H), 2,35 (s, 3H).
Стадия 3: (2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон
Используя процедуру, аналогичную примеру A, стадии 3, (2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон (130 мг, 59%) получали из (2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанона (286 мг, 0,468 ммоль). LC/MS (Способ g), Время удерживания=1,36минуты; MS масса/заряд: 471 [M+H]+. 1H ЯМР (DMSO-d6, 400 МГц): δ 11,55 (s, 1H), 7,66 (m, 1H), 7,48 (m, 1H), 7,42 (m, 1H), 7,02 (s, 1H), 5,97 (s, 1H), 4,48 (m, 2H), 3,65 (m, 4H), 3,52 (m, 2H), 3,18 (m, 2H), 2,40 (s, 3H).
Пример D: (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон

Используя процедуру, аналогичную примеру A, стадии 4, (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон (26 мг, 50%) получали из (2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанона (пример C) (50 мг, 0,106 ммоль). LC/MS (Способ g), Время удерживания=1,91 минуты; MS масса/заряд: 485[M+H]+.
1H ЯМР (DMSO-d6, 400 МГц): δ 7,75 (s, 1H), 7,70 (d, J=9,0Гц, 1H), 7,49 (d, J=9,0Гц, 1H), 7,06 (s, 1H), 5,67 (s, 1H), 4,48 (m, 2H), 3,92 (s, 3H), 3,62 (m, 4H), 3,51 (m, 2H), 3,20 (m, 2H), 2,36 (s, 3H).
Таблица D. Следующие аналоги получали из (2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанона (пример C) при помощи такой же процедуры и с помощью соответствующего электрофила.

Пример E: (2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон

Стадия 1: (2,4-дихлор-3-(гидрокси(1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон

Используя процедуру, аналогичную примеру A, стадии 1, (2,4-дихлор-3-(гидрокси(1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон (491 мг, 81%) получали из N-(2-йод-5-(трифторметил)фенил)бензолсульфонамид (420 мг, 0,983 ммоль) (получение №29) и (2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)фенил)(морфолинo)метанона (402 мг, 1,28 ммоль) (получение №3). LC/MS (Способ g), Время удерживания=1,77 минуты; MS масса/заряд: 612[M+H]+. 1H ЯМР (DMSO-d6, 400 МГц): δ 8,21 (s, 1H), 7,91 (m, 1H), 7,85 (m, 2H), 7,72 (m, 1H), 7,61 (m, 3H), 7,53 (m, 1H), 7,38 (m, 1H), 6,98 (m, 1H), 6,82 (m, 1H), 6,65 (m, 1H), 3,68 (m, 4H), 3,57 (m, 2H), 3,15 (m, 2H).
Стадия 2: (2,4-дихлор-3-((1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон
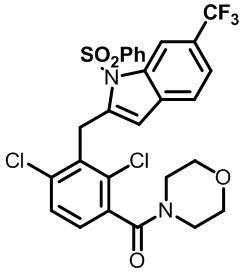
Используя процедуру, аналогичную примеру A, стадии 2, (2,4-дихлор-3-((1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон (196 мг, 47%) получали из (2,4-дихлор-3-(гидрокси(1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанона (430 мг, 0,701 ммоль). LC/MS (Способ g), Время удерживания=2,00 минуты; MS масса/заряд: 597 [M+H]+. 1H ЯМР (DMSO-d6, 400 МГц): δ 8,41 (s, 1H), 7,94 (m, 2H), 7,80 (m, 1H), 7,68 (m, 4H), 7,60 (m, 1H), 6,48 (m, 1H), 6,06 (s, 1H), 4,55 (m, 2H), 3,65 (m, 4H), 3,51 (m, 2H), 3,21 (m, 2H).
Стадия 3: (2,4-дихлор-3-((6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон

Используя процедуру, аналогичную примеру A, стадии 3, (2,4-дихлор-3-((6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон (103 мг, 69%) получали из (2,4-дихлор-3-((1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанона (182 мг, 0,305 ммоль). LC/MS (Способ g), Время удерживания=1,76 минуты; MS масса/заряд: 457 [M+H]+. 1H ЯМР (DMSO-d6, 400 МГц): δ 11,53 (s, 1H),7,65 (m, 2H), 7,57 (d, J=8,0Гц, 1H), 7,41 (d, J=8,0Гц, 1H), 7,21 (dd, J=8,0Гц, J=4,0Гц, 1H), 5,97 (s, 1H), 4,46 (s, 2H), 3,64 (m, 4H), 3,53 (m, 2H), 3,18 (m, 2H).
Стадия 4: (2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон
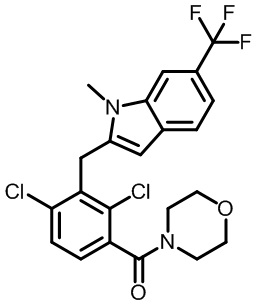
Используя процедуру, аналогичную примеру A, стадии 4, (2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон (68 мг, 77%) получали из (2,4-дихлор-3-((6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанона (86 мг, 0,188 ммоль). LC/MS (Способ g), Время удерживания=1,83 минуты; MS масса/заряд: 471 [M+H]+. 1H ЯМР (DMSO-d6, 400 МГц): δ 7,87 (s, 1H), 7,67 (d, J=8,0Гц, 1H), 7,56 (d, J=8,0Гц, 1H), 7,45 (d, J=8,0Гц, 1H), 7,25 (d, J=8,0Гц, 1H), 5,72 (s, 1H), 4,45 (s, 2H), 3,93 (s, 3H), 4,65 (m, 4H), 3,52 (m, 2H), 3,18 (m, 2H).
Пример F: 2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-3-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Стадия 1: трет-бутил-2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-3-ил)(гидрокси)метил)бензоат
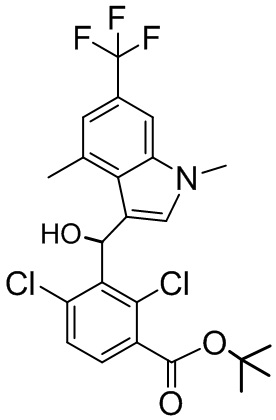
В раствор трет-бутил-2,4-дихлорбензоата (получение №33, стадия A) (748 мг, 3,03 ммоль) в THF (20 мл), охлажденный до -78°C, добавляли диизопропиламид лития (1,816 мл, 3,63 ммоль), разбавленный в THF (10 мл) и уже охлажденный до 0°C. Реакционную смесь перемешивали при -78°C в течение 1 часа. При -78°C добавляли 1,4-диметил-6-(трифторметил)-1H-индол-3-карбальдегид (получение №51) (730 мг, 3,03 ммоль) и реакционную смесь перемешивали в течение 15 минут. Обеспечивали возможность ее нагрева до комнатной температуры и перемешивание продолжали в течение 30 минут. Реакционную смесь быстро охлаждали насыщенным раствором NH4Cl. Водный слой экстрагировали с помощью EtOAc. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали досуха под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-50% EtOAc в циклогексане) с получением трет-бутил-2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-3-ил)(гидрокси)метил)бензоата (355 мг, 23%) в виде оранжевого твердого вещества. LC/MS (Способ i), Время удерживания=2,79 минуты; MS масса/заряд: 546 [M-H]-+CH3COOH 1H ЯМР (DMSO-d6, 300МГц): δ 7,64 (s, 1H), 7,58 (s, 2H), 7,13 (s, 1H), 6,98 (s, 1H), 6,87 (d, J=5,6 Гц, 1H), 5,93 (d, J=5,6 Гц, 1H), 3,75 (s, 3H), 2,85 (s, 3H), 1,54 (s, 9H).
Стадия 2: 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-3-ил)метил)бензойная кислота
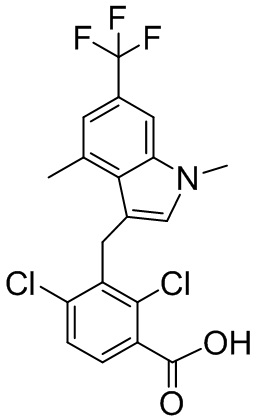
Используя процедуру, аналогичную примеру A, стадии 2, 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-3-ил)метил)бензойную кислоту (20 мг, 31%) получали из трет-бутил-2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-3-ил)(гидрокси)метил)бензоата (50 мг, 0,10 ммоль). Смесь с соответствующим индолином (30%) LC/MS (Способ i), Время удерживания=2,56 минуты; MS масса/заряд: 416 [M+H]+.
Стадия 3: метил-2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-3-ил)метил)бензоил)пиперидин-4-ил)ацетат

Используя процедуру, аналогичную примеру A, стадии 6, метил 2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-3-ил)метил)бензоил)пиперидин-4-ил)ацетат (65 мг, 77%) получали из 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-3-ил)метил)бензойной кислоты (50 мг, 0,12 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (26 мг, 0,13 ммоль). Смесь с соответствующим индолином (22%). LC/MS (Способ i), Время удерживания=2,72 минуты; MS масса/заряд: 555 [M+H]+.
Стадия 4: 2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-3-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

В раствор метил-2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-3-ил)метил)бензоил)пиперидин-4-ил)ацетата (65 мг, 0,117 ммоль) в диоксане (1,25 мл) и воде (0,5 мл) добавляли гидроксид натрия (11,70 мг, 0,293 ммоль) и реакционную смесь перемешивали при 45°C в течение 1 часа. Реакционную смесь концентрировали под пониженным давлением. Остаток поглощали водой и подкисляли до pH=3-4 добавлением 1 н. раствора HCl. Полученный осадок промывали водой и высушивали под пониженным давлением. Остаток очищали препаративной LC/MS (способ l2) с получением 2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-3-ил)метил)бензоил)пиперидин-4-ил)уксусной кислоты (18 мг, 28%) в виде белого твердого вещества. LC/MS (Способ g), Время удерживания=1,92 минуты; MS масса/заряд: 541 [M+H]+. 1H ЯМР (DMSO-d6, 400МГц): δ 12,12 (br, 1H), 7,63 (m, 2H), 7,39 и 7,32 (d, J= 8,1 Гц, 1H), 7,09 (s, 1H), 6,53 (m, 1H), 4,60 (m, 2H), 4,47 (m, 1H), 3,70 (m, 3H), 3,30 (m, 1H), 3,03 (m, 1H), 2,78 (m, 4H), 2,17 (m, 2H), 1,91 (m, 1H), 1,77 (m, 1H), 1,62 (m, 1H), 1,16 (m, 2H).
Таблица F. Следующие примеры получали из 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-3-ил)метил)бензойной кислоты (пример F, стадия 2) при помощи такой же процедуры с соответствующим амином.

Пример G: (3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)-2,4-диметилфенил)(морфолинo)метанон
Пример G1: (2,6-диметил-3-(морфолин-4-карбонил)фенил)(1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метанон
Стадия 1: (3-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)-2,4-диметилфенил)(морфолинo)метанон
Используя процедуру, аналогичную примеру A, стадии 1, (3-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)-2,4-диметилфенил)(морфолинo)метанон (374 мг, 94%) получали из N-(2-йод-3-метил-5-(трифторметил)фенил)бензолсульфонамида (получение №16) (300 мг, 0,680 ммоль) и (3-(1-гидроксипроп-2-ин-1-ил)-2,4-диметилфенил)(морфолинo)метанона (223 мг, 0,816 ммоль) (получение №4). LC/MS (Способ h), Время удерживания=3,05 минуты; MS масса/заряд: 587 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 8,08 (m, 1H), 7,98 (m, 2H), 7,85 (m, 1H), 7,68 (m, 1H), 7,60 (m, 2H), 7,48 (s, 1H), 7,06 (m, 2H), 6,75 (m, 1H), 6,25 (m, 1H), 3,63 (m, 4H), 3,46 (m, 2H), 3,12 (m, 2H), 2,89 (s, 3H), 2,73 (s, 3H), 2,45 (m, 3H).
Стадия 2: (2,4-диметил-3-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон

Используя процедуру, аналогичную примеру A, стадии 2, (2,4-диметил-3-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон (346 мг, 95%) получали из (3-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)-2,4-диметилфенил)(морфолинo)метанона (374 мг, 0,638 ммоль). LC/MS (Способ h), Время удерживания=3,30 минуты; MS масса/заряд: 571 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 8,29 (s, 1H), 7,96 (m, 2H), 7,76 (m, 1H), 7,68 (m, 2H), 7,41 (s, 1H), 7,17 (m, 1H), 7,08 (m, 1H), 5,73 (s, 1H), 4,25 (m, 2H), 3,62 (m, 4H), 3,44 (m, 2H), 3,10 (m, 2H), 2,30 (s, 3H), 2,05 (s, 3H), 1,90 (s, 3H).
Стадия 3: (2,4-диметил-3-((4-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон
Используя процедуру, аналогичную примеру A, стадии 3, (2,4-диметил-3-((4-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон (198 мг, 76%) получали из (2,4-диметил-3-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанона (346 мг, 0,606 ммоль). LC/MS (Способ g), Время удерживания=1,80минуты; MS масса/заряд: 431 [M+H]+. 1H ЯМР (DMSO-d6, 400 МГц): δ 11,39 (s, 1H), 7,46 (s, 1H), 7,17 (d, J=8,0Гц, 1H), 7,02 (m, 2H), 5,81 (s, 1H), 4,19 (s, 2H), 3,64 (m, 4H), 3,48 (m, 2H), 3,13 (m, 2H), 2,38 (s, 3H), 2,30 (s, 3H), 2,15 (s, 3H).
Стадия 4: (3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)-2,4-диметилфенил)(морфолинo)метанон и (2,6-диметил-3-(морфолин-4-карбонил)фенил)(1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метанон

Используя процедуру, аналогичную примеру A, стадии 4, (3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)-2,4-диметилфенил)(морфолинo)метанон (30 мг, 19%) получали из (2,4-диметил-3-((4-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанона (154 мг, 0,358 ммоль). LC/MS (Способ g), Время удерживания=1,87 минуты; MS масса/заряд: 445[M+H]+. 1H ЯМР (DMSO-d6, 400 МГц): δ 7,69 (s, 1H), 7,19 (d, J=8Гц, 1H), 7,06 (m, 2H), 5,51 (s, 1H), 4,17 (m, 2H), 3,91 (s, 3H), 3,65 (m, 4H), 3,48 (m, 2H), 3,13 (m, 2H), 2,33 (s, 3H), 2,25 (s, 3H), 2,11 (s, 3H).
Эта реакционная смесь также давала продукт окисления, который выделяли и анализировали: (2,6-диметил-3-(морфолин-4-карбонил)фенил)(1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метанон (32 мг, 19%). LC/MS (Способ g), Время удерживания=1,84 минуты; MS масса/заряд: 459[M+H]+.
1H ЯМР (DMSO-d6, 400 МГц): δ 7,95 (s, 1H), 7,26 (s, 2H), 7,22 (s, 1H), 6,82 (s, 1H), 4,24 (s, 3H), 3,62 (m, 4H), 3,48 (m, 2H), 3,16 (m, 2H), 2,44 (s, 3H), 2,17 (s, 3H), 2,00 (s, 3H).
Пример H: (2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(4-(диметиламино)пиперидин-1-ил)метанон
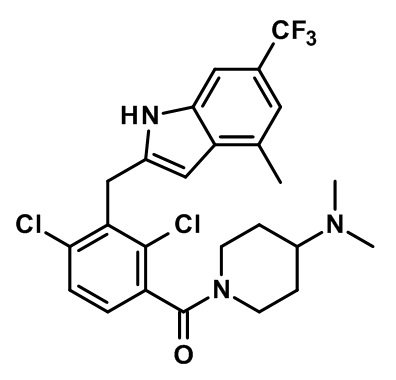
Стадия 1: 2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)бензойную кислоту (280 мг, 82%) получали из метил-2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)бензоата (пример A, стадия 2) (350 мг, 0,629 ммоль). LC/MS (Способ h), Время удерживания=3,33 минуты; MS масса/заряд: 542 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 8,25 (s, 1H), 7,92 (m, 2H), 7,75 (m, 1H), 7,67 (m, 3H), 7,58 (m, 1H), 7,41 (s, 1H), 5,93 (s, 1H), 4,58 (s, 2H), 2,35 (s, 3H).
Стадия 2: (2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(4-(диметиламино)пиперидин-1-ил)метанон

Используя процедуру, аналогичную примеру A, стадии 6, (2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(4-(диметиламино)пиперидин-1-ил)метанон (305 мг, 72%) получали из 2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)бензойной кислоты (350 мг, 0,645 ммоль) и N,N-диметилпиперидин-4-амина (165 мг, 1,29 ммоль). LC/MS (Способ h), Время удерживания=3,34 минуты; MS масса/заряд: 652 [M+H]+.
1H ЯМР (DMSO-d6, 300 МГц): δ 8,25 (s, 1H), 7,92 (m, 2H), 7,75 (m, 1H), 7,66 (m, 3H), 7,48 (m, 2H), 5,98 (m, 1H), 4,50 (m, 2H), 4,41 (m, 1H), 2,98 (m, 1H), 2,80 (m, 1H), 2,36 (s, 3H), 2,30 (m, 2H), 2,20 (s, 3H), 2,09 (s, 3H), 1,82 (m, 1H), 1,64 (m, 1H), 1,27 (m, 2H).
Стадия 3: (2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(4-(диметиламино)пиперидин-1-ил)метанон

Используя процедуру, аналогичную примеру A, стадии 3, (2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(4-(диметиламино)пиперидин-1-ил)метанон (190 мг, 86%) получали из (2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(4-(диметиламино)пиперидин-1-ил)метанона (280 мг, 0,429 ммоль).
LC/MS (Способ g), Время удерживания=1,22 минуты; MS масса/заряд: 512 [M+H]+. 1H ЯМР (DMSO-d6, 400 МГц): δ 11,40 (s, 1H), 7,64 (m, 1H), 7,48 (s, 1H), 7,38 (m, 1H), 7,03 (s, 1H), 5,95 (s, 1H), 4,46 (m, 3H), 3,30 (m, 1H), 3,00 (m, 1H), 2,85 (m, 1H), 2,41 (s, 3H), 2,32 (m, 1H), 2,16 (s, 3H), 2,12 (s, 3H), 1,82 (m, 1H), 1,65 (m, 1H), 1,32 (m, 2H).
Пример I: (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(4-(диметиламино)пиперидин-1-ил)метанон

Используя процедуру, аналогичную примеру A, стадии 4, (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(4-(диметиламино)пиперидин-1-ил)метанон (10 мг, 13%) получали из (2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(4-(диметиламино)пиперидин-1-ил)метанона (пример H, стадия 3) (75 мг, 0,146 ммоль). LC/MS (Способ g), Время удерживания=1,29 минуты; MS масса/заряд: 526 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 7,70 (m, 1H), 7,65 (m, 1H), 7,43 (m, 1H), 7,07 (s, 1H), 5,68 (m, 1H), 4,46 (m, 3H), 3,92 (m, 3H), 2,99 (m, 1H), 2,85 (m, 1H), 2,36 (s, 3H), 2,32 (m, 1H), 2,17 (s, 3H), 2,11 (s, 3H), 1,83 (m, 1H), 1,68 (m, 1H), 1,32 (m, 2H).
Пример J: 2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
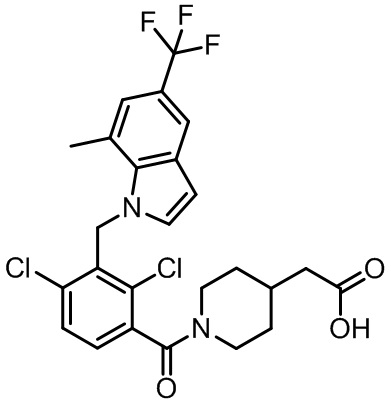
Стадия 1: метил-2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-1-ил)метил)бензоат
В раствор 7-метил-5-(трифторметил)-1H-индола (получение №49) (0,850 г, 4,27 ммоль) в N,N-диметилформамиде (10,67 мл), охлажденный до 0°C, добавляли гидрид натрия (0,188 г, 4,69 ммоль) и реакционную смесь перемешивали 30 минут. Добавляли метил-3-(бромметил)-2,4-дихлорбензоат (получение №1, стадия B) (1,272 г, 4,27 ммоль) и реакционную смесь перемешивали 1 час при 0°C. Реакционную смесь разбавляли водой и с помощью EtOAc. Слои разделяли и водный слой экстрагировали с помощью EtOAc. Объединенные органические слои промывали водой, затем насыщенным раствором NaCl, высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-10% EtOAc в циклогексане) с получением метил-2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-1-ил)метил)бензоата (1,55 г, 80%). LC/MS (Способ j), Время удерживания=2,32 минуты; MS масса/заряд: 416 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,89 (d, J=8,4 Гц, 1H), 7,79 (m, 1H), 7,76 (d, J=8,4 Гц, 1H), 7,23 (m, 1H), 6,74 (d, J=3,3 Гц, 1H), 6,56 (d, J=3,3 Гц, 1H), 5,98 (s, 2H), 3,88 (s, 3H), 2,94 (s, 3H).
Стадия 2: 2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-1-ил)метил)бензойная кислота
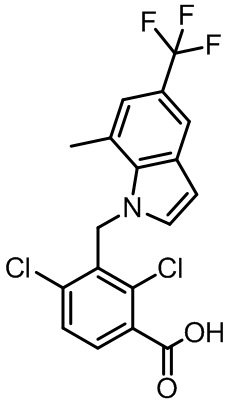
Используя процедуру, аналогичную примеру F, стадии 4, 2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-1-ил)метил)бензойную кислоту (1,44 г, 96%) получали из метил-2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-1-ил)метил)бензоата (1,55 г, 3,72 ммоль). LC/MS (Способ j), Время удерживания=1,86 минуты; MS масса/заряд: 402 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 13,8 (br, 1H), 7,82 (d, J=8,3 Гц, 1H), 7,79 (s, 1H), 7,69 (d, J=8,3 Гц, 1H), 7,23 (s, 1H), 6,73 (d, J=3,3 Гц, 1H), 6,56 (d, J=3,3 Гц, 1H), 5,97 (s, 2H), 2,95 (s, 3H).
Стадия 3: метил-2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетат

Используя процедуру, аналогичную примеру A, стадии 6, метил-2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетат (118 мг, 88%) получали из 2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-1-ил)метил)бензойной кислоты (100 мг, 0,25 ммоль) и метил-2-(пиперидин-4-ил)ацетата гидрохлорида (62,6, 0,32 ммоль).
LC/MS (Способ j), Время удерживания=2,10 минуты; MS масса/заряд: 541 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,79 (s, 1H), 7,70 и 7,69 (d, J=8,3 Гц, 1H), 7,53 и 7,46 (d, J=8,3 Гц, 1H), 7,23 (s, 1H), 6,76 (m, 1H), 6,57 (m, 1H), 5,94 (m, 2H), 4,46 (m, 1H), 3,59 и 3,57 (s, 3H), 3,21 (m, 1H), 3,03 (m, 1H), 2,94 (s, 3H), 2,80 (m, 1H), 2,28 (m, 2H), 1,96 (m, 1H), 1,75 (m, 1H), 1,59 (m, 1H), 1,17 (m, 2H).
Стадия 4: 2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
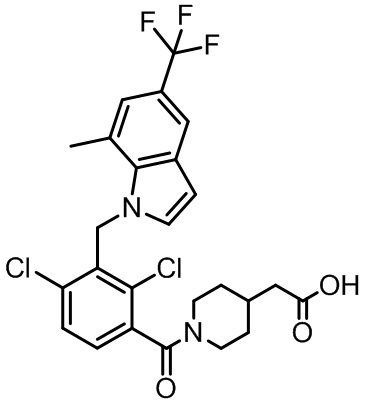
Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (99 мг, 89%) получали из метил-2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетата (114 мг, 0,21 ммоль). LC/MS (Способ g), Время удерживания=1,85 минуты; MS масса/заряд: 527 [M+H]+.
1H ЯМР (DMSO-d6, 400МГц): δ 12,10 (br, 1H), 7,79 (s, 1H), 7,70 и 7,69 (d, J=8,3 Гц, 1H), 7,53 и 7,46 (d, J=8,3 Гц, 1H), 7,23 (s, 1H), 6,76 (m, 1H), 6,58 (m, 1H), 5,94 (m, 2H), 4,46 (m, 1H), 3,27 (m, 1H), 3,03 (m, 1H), 2,94 (s, 3H), 2,80 (m, 1H), 2,17 (m, 2H), 1,93 (m, 1H), 1,77 (m, 1H), 1,61 (m, 1H), 1,14 (m, 2H).
Пример K: (3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)(гидрокси)метил)-2,4-диметилфенил)(морфолинo)метанон
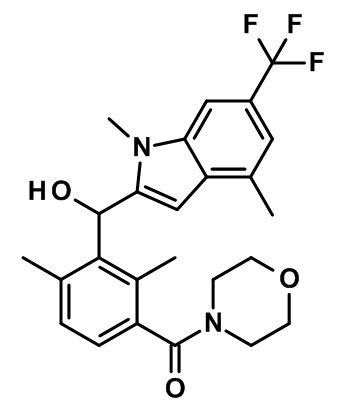
Пример K1: (3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)(метокси)метил)-2,4-диметилфенил)(морфолинo)метанон

Стадия 1: (3-(гидрокси(4-метил-6-(трифторметил)-1H-индол-2-ил)метил)-2,4-диметилфенил)(морфолинo)метанон

Используя процедуру, аналогичную примеру A, стадии 3, (3-(гидрокси(4-метил-6-(трифторметил)-1H-индол-2-ил)метил)-2,4-диметилфенил)(морфолинo)метанон (189 мг, 39%) получали из (3-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)-2,4-диметилфенил)(морфолинo)метанона (пример G, стадия 1) (629 мг, 1,072 ммоль). LC/MS (Способ h), Время удерживания=2,66 минуты; MS масса/заряд: 447 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 11,32 (s, 1H), 7,52 (d, J=4,8Гц, 1H), 7,12 (m, 1H), 7,03 (m, 2H) 6,38 (s, 1H), 6,24 (d, J=4Гц, 1H), 5,94 (s, 1H), 3,62 (m, 4H), 3,49 (m, 2H), 3,136 (m, 2H), 2,41 (s, 3H), 2,40 (s, 3H), 2,12 (s, 3H).
Стадия 2: (3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)(гидрокси)метил)-2,4-диметилфенил)(морфолинo)метанон и (3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)(метокси)метил)-2,4-диметилфенил)(морфолинo)метанон

Используя процедуру, аналогичную примеру A, стадии 4, (3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)(гидрокси)метил)-2,4-диметилфенил)(морфолинo)метанон (14 мг, 7%) получали из (3-(гидрокси(4-метил-6-(трифторметил)-1H-индол-2-ил)метил)-2,4-диметилфенил)(морфолинo)метанона (189 мг, 0,423 ммоль). LC/MS (Способ g), Время удерживания=1,70 минуты; MS масса/заряд: 461 [M+H]+. 1H ЯМР (DMSO-d6, 500 МГц): δ 7,68 (s, 1H), 7,14 (m, 1H), 7,07 (m, 2H), 6,39 (s, 1H), 6,10 (s, 1H), 5,96 и 5,92 (s, 1H), 3,86 и 3,82 (s, 3H), 3,63 (m, 4H), 3,48 (m, 2H), 3,16 (m, 2H), 2,39 и 2,38 (s, 3H), 2,34 и 2,31 (s, 3H), 2,21 и 2,19 (s, 3H).
В ходе данной реакции продукт двойного метилирования также выделяли и определяли как (3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)(метокси)метил)-2,4-диметилфенил)(морфолинo)метанон (0,5 мг, 0,2%). LC/MS (Способ g), Время удерживания=1,85 минуты; MS масса/заряд: 475 [M+H]+. 1H ЯМР (DMSO-d6, 500 МГц): δ 7,72 (s, 1H), 7,20 (m, 1H), 7,14 (m, 1H), 7,08 (s, 1H), 6,05 (s, 1H), 5,80 (s, 1H), 3,91 (s, 3H), 3,65-3,48 (m, 6H), 3,33 (s, 3H), 3,12 (m, 2H), 2,36 (s, 3H), 2,32 (s, 3H), 2,19 (s, 3H).
Пример L: (2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(4-гидроксипиперидин-1-ил)метанон
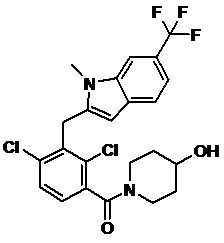
Стадия 1: метил 2,4-дихлор-3-(гидрокси(1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)бензоат

Используя процедуру, аналогичную примеру A, стадии 1, метил-2,4-дихлор-3-(гидрокси(1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)бензоат (7,8 г, 78%) получали из N-(2-йод-5-(трифторметил)фенил)бензолсульфонамида (получение №29) (7,00 г, 16,4 ммоль) и метил-2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)бензоата (получение №1) (4,7 г, 18,1 ммоль).
LC/MS (Способ h), Время удерживания=3,27 минуты; MS масса/заряд: 540 [M-H]- +CH3COOH. 1H ЯМР (DMSO-d6, 300 МГц): δ 8,24 (s, 1H), 7,85 (m, 3H), 7,69 (m, 2H), 7,58 (m, 4H), 7,03 (m, 1H), 6,84 (s, 1H), 6,73 (m, 1H), 3,87 (s, 3H).
Стадия 2: метил-2,4-дихлор-3-((1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)бензоат

Используя процедуру, аналогичную примеру A, стадии 2, метил-2,4-дихлор-3-((1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)бензоат (6,3 г, 90%) получали из метил-2,4-дихлор-3-(гидрокси(1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)бензоата (7,15 г, 12,8 ммоль). LC/MS (Способ h), Время удерживания=3,73 минуты; MS масса/заряд: 540 [M-H]-.
1H ЯМР (CDCl3, 300 МГц): δ 8,45 (s, 1H), 7,80 (m, 2H), 7,63 (d, J=9Гц, 1H), 7,51 (m, 1H), 7,38 (m, 5H), 5,68 (s, 1H), 4,63 (m, 2H), 3,86 (s, 3H).
Стадия 3: метил-2,4-дихлор-3-((6-(трифторметил)-1H-индол-2-ил)метил)бензоат

Используя процедуру, аналогичную примеру A, стадии 3, метил-2,4-дихлор-3-((6-(трифторметил)-1H-индол-2-ил)метил)бензоат (4,3 г, 93%) получали из метил-2,4-дихлор-3-((1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)бензоата (6,2 г, 11,4 ммоль).
LC/MS (Способ h), Время удерживания=3,23 минуты; MS масса/заряд: 402 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 11,5 (широкий, 1H), 7,75 (d, J=9Гц, 1H), 7,69 (d, J=9Гц, 1H), 7,65 (s, 1H), 7,57 (d, J=6Гц, 1H), 7,23 (dd, J=6Гц, J=1,5Гц, 1H), 5,96 (s, 1H), 4,50 (s, 2H), 2,87 (s, 3H).
Стадия 4: метил-2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоат
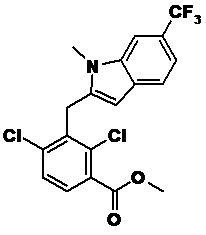
Используя процедуру, аналогичную примеру A, стадии 4, метил-2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоат (3,86 г, 89%) получали из метил-2,4-дихлор-3-((6-(трифторметил)-1H-индол-2-ил)метил)бензоата (4,17 г, 10,37 ммоль). LC/MS (Способ g), Время удерживания=2,06 минуты; MS масса/заряд: 416 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 7,87 (s, 1H), 7,79 (d, J=9Гц, 1H), 7,71 (d, J=9Гц, 1H), 7,55 (d, J=9Гц, 1H), 7,24 (d, J=9Гц, 1H), 5,68 (s, 1H), 4,50 (s, 2H), 3,94 (s, 3H), 3,88 (s, 3H).
Стадия 5: 2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензойная кислота
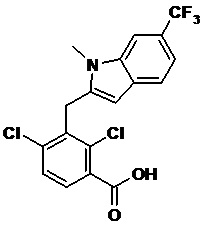
Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензойную кислоту (1,53 г, 87%) получали из метил-2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоата (1,81 г, 4,35 ммоль).
LC/MS (Способ h), Время удерживания=3,08 минуты; MS масса/заряд: 402 [M+H]+.
1H ЯМР (DMSO-d6, 300 МГц): δ 7,87 (s, 1H), 7,74 (d, J=9Гц, 1H), 7,67 (d, J=9Гц, 1H), 7,56 (d, J=9Гц, 1H), 7,24 (dd, J=9Гц, J=1,5Гц, 1H), 5,68 (s, 1H), 4,49 (s, 2H), 3,94 (s, 3H).
Стадия 6: (2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(4-гидроксипиперидин-1-ил)метанон

Используя процедуру, аналогичную примеру A, стадии 6, (2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(4-гидроксипиперидин-1-ил)метанон (65 мг, 53%) получали из 2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензойной кислоты (100 мг, 0,249 ммоль) и пиперидин-4-ола (37,7 мг, 0,37 ммоль). LC/MS (Способ g), Время удерживания=1,70 минуты; MS масса/заряд: 485 [M+H]+. 1H ЯМР (DMSO-d6, 400 МГц): δ 7,87 (s, 1H), 7,65 (dd, J=6,3Гц, J=1,8Гц, 1H), 7,56 (d, J=6,3Гц, 1H), 7,41 (m, 1H), 7,25 (d, J=6Гц, 1H), 5,70 (m, 1H), 4,80 (m, 1H), 4,38 (m, 2H), 4,05 (m, 1H), 3,96 (s, 3H), 3,73 (m, 1H), 3,20 (m, 2H), 3,07 (m, 1H), 1,81 (m, 1H), 1,75 (m, 1H), 1,39 (m, 2H).
Таблица L. Следующие аналоги получали из 2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензойной кислоты (пример L, стадия 5) при помощи такой же процедуры с соответствующим амином.

Пример M: 1-(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-карбоновая кислота

Стадия 1: метил-1-(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-карбоксилат
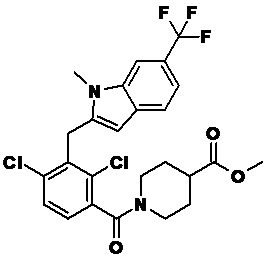
Используя процедуру, аналогичную примеру A, стадии 6, метил-1-(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-карбоксилат (172 мг, 73%) получали из 2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензойной кислоты (пример L, стадия 5) (180 мг, 0,448 ммоль) и метил-4-пиперидинкарбоксилата (96 мг, 0,67 ммоль).
LC/MS (Способ h), Время удерживания=3,17 минуты; MS масса/заряд: 527 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 7,81 (s, 1H), 7,65 (d, J=8,4Гц, 1H), 7,56 (d, J=7,8Гц, 1H), 7,46 (d, J=8,4Гц, 0,5H), 7,39 (d, J=8,4Гц, 0,5H), 7,26 (d, J=7,8Гц, 1H), 5,72 и 5,69 (s, 1H), 4,46 (m, 2H), 4,38 (m, 1H), 3,93 (s, 3H), 3,62 и 3,58 (s, 3H), 3,27 (m, 1H), 3,13-2,94 (m, 2H), 2,67 (m, 1H), 1,82 (m, 2H), 1,52 (m, 2H).
Стадия 2: 1-(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-карбоновая кислота
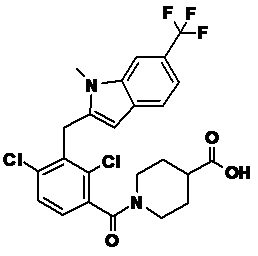
Используя процедуру, аналогичную примеру A, стадии 5, 1-(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-карбоновую кислоту (154 мг, 93%) получали из метил-1-(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-карбоксилата (170 мг, 0,32 ммоль). LC/MS (Способ g), Время удерживания=1,73 минуты; MS масса/заряд: 513 [M+H]+. 1H ЯМР (DMSO-d6, 400 МГц): δ 12,32 (широкий, 1H), 7,87 (s, 1H), 7,65 (d, J=8,4Гц, 1H), 7,56 (d, J=8,4Гц, 1H), 7,46 (d, J=8,4Гц, 0,5H), 7,39 (d, J=8,4Гц, 0,5H), 7,24 (d, J=8,4Гц, 1H), 5,71 (m, 1H), 4,51 (m, 2H), 4,45 (m, 1H), 3,93 (s, 3H), 3,29 (m, 1H), 3,12 (m, 1H), 2,95 (m, 1H), 2,54 (m, 1H), 1,95 (m, 1H), 1,76 (m, 1H), 1,50 (m, 2H).
Пример N: 1-(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3-гидроксипиперидин-4-карбоновая кислота
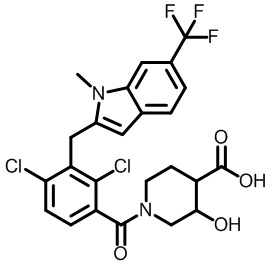
Стадия 1: этил-1-(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H--индол-2-ил)метил)бензоил)-3-оксопиперидин-4-карбоксилат

Используя процедуру, аналогичную примеру A, стадии 6, этил-1-(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3-оксопиперидин-4-карбоксилат (221 мг, 59%) получали из 2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензойной кислоты (пример L, стадия 5) (250 мг, 0,62 ммоль) и этил-3-оксопиперидин-4-карбоксилата гидрохлорида (194 мг, 0,93 ммоль). LC/MS (Способ h), Время удерживания=3,52 минуты; MS масса/заряд: 555 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): 7,87 (s, 1H), 7,69 (m, 1H), 7,65 (m, 1H), 7,46 (m, 1H), 7,26 (m, 1H), 5,74 (s, 1H), 5,73 и 5,69 (s, 1H), 4,48 (s, 2H), 4,30 (m, 1H), 4,17 (m, 2H), 3,92 (m, 3H), 3,51 (m,2H), 3,32 (m, 1H), 3,30 (m, 2H), 1,20 (m, 3H).
Стадия 2: этил-1-(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3-гидроксипиперидин-4-карбоксилат

В суспензию этил-1-(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3-оксопиперидин-4-карбоксилата (218 мг, 0,393 ммоль) в EtOHMeOH (4 мл), охлажденную до 0°C, добавляли NaBH4 (7,43 мг, 0,196 ммоль) и смесь перемешивали при 5°C в течение 4 часов. NaBH4 (7,43 мг, 0,196 ммоль) добавляли снова и реакционную смесь перемешивали в течение 5 часов при 5°C. Реакционную смесь гидролизовали насыщенным водным раствором NH4Cl и экстрагировали с помощью DCM. Органический слой промывали солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-70% EtOAc в циклогексане) с получением этил-1-(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3-гидроксипиперидин-4-карбоксилата (150 мг, 69%). LC/MS (Способ g), Время удерживания=1,85 минуты; MS масса/заряд: 557 [M+H]+. 1H ЯМР (DMSO-d6, 400 МГц): δ 7,87 (s, 1H), 7,69 (m, 1H), 7,51 (m, 1H), 7,38 (m, 1H), 7,25 (m, 1H), 5,72 (m, 1H), 5,40 и 5,22 и 5,13 и 5,00 и 4,82 (m, 1H), 4,52-4,25 (m, 3H), 4,22-4,00 (m, 3H), 3,94 (s, 3H), 3,60 (m, 0,5H), 3,38-3,18 (m, 0,5H), 3,10-2,55 (m, 2,5H), 2,45 (m, 0,5H), 2,00-1,40 (m, 2H), 1,18 (m, 3H).
Стадия 3: 1-(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3-гидроксипиперидин-4-карбоновая кислота

Используя процедуру, аналогичную примеру A, стадии 5, 1-(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3-гидроксипиперидин-4-карбоновую кислоту (73 мг, 66%) получали из этил-1-(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3-гидроксипиперидин-4-карбоксилата (пример M, стадия 2) (116 мг, 0,208 ммоль). LC/MS (Способ g), Время удерживания=2,60 минуты; MS масса/заряд: 527 [M-H]-. 1H ЯМР (DMSO-d6, 400 МГц): δ 7,87 (s, 1H), 7,68 (m, 1H), 7,58 (m, 1H), 7,38 (m, 1H), 7,23 (m, 1H), 5,70 (m, 1H), 4,47 (m, 3H), 4,19 и 4,02 (m, 1H), 3,93 (s, 3H), 3,20 (m, 1H), 3,09 (m, 1H), 2,70 (m, 2H), 1,85 (m, 1H), 1,63 и 1,50 (m, 1H).
Пример O: 3-(4-(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)циклобутанкарбоновая кислота

Стадия 1: трет-бутил-4-(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-карбоксилат

Используя процедуру, аналогичную примеру A, стадии 6, трет-бутил-4-(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-карбоксилат (840 мг, 100%) получали из 2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензойной кислоты (пример L, стадия 5) (500 мг, 1,243 ммоль) и 1-boc-пиперазина (347 мг, 1,86 ммоль). LC /MS (способ h), Время удерживания=3,42 мин.; MS масса/заряд: 570 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 7,88 (s, 1H), 7,68 (d, J=9Гц, 1H), 7,56 (d, J=9Гц, 1H), 7,46 (d, J=9Гц, 1H), 7,26 (J=9Гц, 1H), 5,74 (s, 1H), 4,46 (s, 2H), 3,94 (s, 3H), 3,60 (m, 2H), 3,42 (m, 2H), 3,20 (m, 4H), 1,40 (s, 9H).
Стадия 2: (2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(пиперазин-1-ил)метанон

В раствор трет-бутил-4-(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-карбоксилата (840 мг, 1,473 ммоль) в DCM (32 мл), охлажденный до 0°C, добавляли TFA (8 мл, 104 ммоль). Ледяную баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение 1,5 часа. Реакционную смесь концентрировали под пониженным давлением. Неочищенное вещество разбавляли с помощью DCM и его промывали насыщенным водным раствором NaHCO3. Органический слой промывали водой, высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением с получением (2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(пиперазин-1-ил)метанона (850 мг, 100%) в виде оранжевого порошка. LC/MS (Способ h), Время удерживания=2,07 минуты; MS масса/заряд: 470 [M+H]+. 1H ЯМР (CDCl3, 300 МГц): δ 7,51 (s, 1H), 7,40 (m, 2H), 7,19 (m, 2H), 5,73 (s, 1H), 4,36 (s, 2H), 3,81 (s, 3H), 3,72 (m, 2H), 3,16 (m, 2H), 2,89 (m, 2H), 2,73 (m, 2H).
Стадия 3: метил-3-(4-(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)циклобутанкарбоксилат
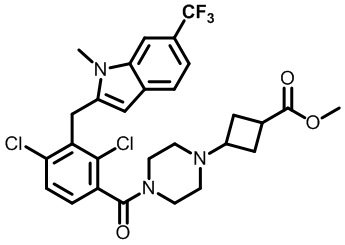
В раствор (2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(пиперазин-1-ил)метанона (50 мг, 0,106 ммоль) и метил-3-оксоциклобутанкарбоксилата (31,8 мг, 0,149 ммоль) в 1,2-дихлорэтане (1,4 мл) добавляли уксусную кислоту (50 мкл, 0,873 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 45 минут. Триацетоксиборгидрид натрия (33,8 мг, 0,159 ммоль) затем добавляли и перемешивание продолжали в течение 2,5 часов. Реакционную смесь концентрировали под пониженным давлением с получением метил-3-(4-(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)циклобутанкарбоксилата (80 мг, 100%). LC/MS (Способ h), Время удерживания=2,46 минуты; MS масса/заряд: 582 [M+H]+. 1H ЯМР (CDCl3, 300 МГц): δ 7,51 (s, 1H), 7,41 (m, 2H), 7,18 (m, 2H), 5,72 (s, 1H), 4,36 (s, 2H), 3,81 (s, 3H), 3,75 (m, 2H), 3,60 (s, 3H), 3,20 (m, 2H), 2,68 (m, 2H), 2,36-2,05 (m, 8H).
Стадия 4: 3-(4-(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)циклобутанкарбоновая кислота

В раствор метил-3-(4-(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)циклобутанкарбоксилата (200 мг, 0,343 ммоль) в диоксане (3,75 мл) и воде (1,5 мл) добавляли гидроксид натрия (54,9 мг, 1,374 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа и концентрировали под пониженным давлением. Остаток поглощали водой и подкисляли до pH=3-4 добавлением 1 н. раствора HCl. После экстракции при помощи EtOAc органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-10% MeOH в DCM) с получением 3-(4-(2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)циклобутанкарбоновой кислоты (115 мг, 57%). LC/MS (Способ g), Время удерживания=1,30 минуты, 1,33мин.; MS масса/заряд: 568 [M+H]+. 1H ЯМР (DMSO-d6, 400 МГц): δ 7,87 (s, 1H), 7,65 (d, J=8Гц, 1H), 7,56 (d, J=8,4Гц, 1H), 7,41 (d, J=8Гц, 1H), 7,25 (d, J=8,4Гц, 1H), 5,71 (s, 1H), 4,49 (s, 2H), 3,93 (s, 3H), 3,62 (m, 2H), 3,17 (m, 2H), 2,69 (m, 2H), 2,31 (m, 2H), 2,21 (m, 4H), 1,90 (m, 2H).
Пример P: (2,4-дихлор-3-((1-метил-5-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон

Стадия 1: (2,4-дихлор-3-(гидрокси(1-(фенилсульфонил)-5-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон

Используя процедуру, аналогичную примеру A, стадии 1, (2,4-дихлор-3-(гидрокси(1-(фенилсульфонил)-5-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон (850 мг, 74%) получали из N-(2-йод-4-(трифторметил)фенил)бензолсульфонамида (описанного в патенте FR2890071) (800 мг, 1,873 ммоль), и (2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)фенил)(морфолинo)метанона (647 мг, 2,060 ммоль) (получение №3). LC/MS (Способ h), Время удерживания=2,92 минуты; MS масса/заряд: 613 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 8,01 (m, 1H), 7,95 (m, 2H), 7,91 (m, 1H), 7,65 (m, 4H), 7,53 (m, 1H), 7,40 (m, 1H), 6,95 (m, 1H), 6,77 и 6,71 (s, 1H), 6,69 (m, 1H), 3,64 (m, 4H), 3,52 (m, 2H), 3,16 (m, 2H).
Стадия 2: (2,4-дихлор-3-((1-(фенилсульфонил)-5-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон

Используя процедуру, аналогичную примеру A, стадии 2, (2,4-дихлор-3-((1-(фенилсульфонил)-5-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон (540 мг, 58%) получали из (2,4-дихлор-3-(гидрокси(1-(фенилсульфонил)-5-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанона (840 мг, 1,369 ммоль). LC/MS (Способ h), Время удерживания=3,33 минуты; MS масса/заряд: 597 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 8,33 (d, J=8,4Гц, 1H), 7,98 (m, 2H), 7,90 (s, 1H), 7,77 (m, 1H), 7,67 (m, 4H), 7,49 (d, J=8,1Гц, 1H), 6,03 (s, 1H), 4,59 (m, 2H), 3,63 (m, 4H), 3,51 (m, 2H), 3,17 (m, 2H).
Стадия 3: (2,4-дихлор-3-((5-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон
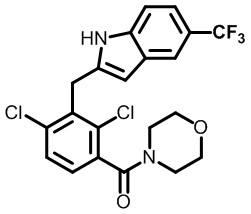
Используя процедуру, аналогичную примеру A, стадии 3 (2,4-дихлор-3-((5-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон (230 мг, 69%) получали из (2,4-дихлор-3-((1-(фенилсульфонил)-5-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанона (500 мг, 0,837 ммоль). LC/MS (Способ h), Время удерживания=2,86 минуты; MS масса/заряд: 457 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 11,55 (широкий, 1H), 7,78 (s, 1H), 7,65 (d, J=8,1Гц, 1H), 7,50 (d, J=8,7Гц, 1H), 7,41 (d, J=8,7Гц, 1H), 7,30 (d, J=8,1Гц, 1H), 5,97 (s, 1H), 4,44 (s, 2H), 3,65 (m, 4H), 3,52 (m, 2H), 3,17 (m, 2H).
Стадия 4: (2,4-дихлор-3-((1-метил-5-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон
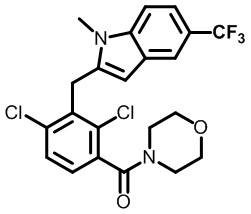
В раствор (2,4-дихлор-3-((5-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанона (100 мг, 0,219 ммоль) в ACNACN (2 мл) добавляли диметилсульфат (0,031 мл, 0,328 ммоль) и карбонат цезия (143 мг, 0,437 ммоль). Смесь перемешивали при комнатной температуре в течение 24 часов, затем разбавляли водой и экстрагировали с помощью DCM. Органический слой промывали солевым раствором и высушивали над сульфатом магния. Остаток очищали препаративной LC/MS с получением (2,4-дихлор-3-((1-метил-5-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанона (50 мг, 45%). LC/MS (Способ g), Время удерживания=1,78 минуты; MS масса/заряд: 471 [M+H]+. 1H ЯМР (DMSO-d6, 400 МГц): δ 7,78 (s, 1H), 7,66 (m, 2H), 7,45 (d, J=8,4Гц, 1H), 7,38 (d, J=8,8Гц, 1H), 5,75 (s, 1H), 4,44 (s, 2H), 3,91 (s, 3H), 3,66 (m, 4H), 3,55 (m, 2H), 3,17 (m, 2H).
Пример Q: (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)индолин-2-ил)метил)фенил)(морфолинo)метанон

Стадия 1: (2,4-дихлор-3-((4-метил-6-(трифторметил)индолин-2-ил)метил)фенил)(морфолинo)метанон
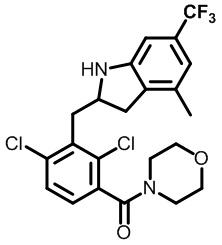
В раствор (2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанона (пример C) (256 мг, 0,543 ммоль) в TFA (4 мл) добавляли цианоборгидрид натрия (170 мг, 2,71 ммоль) на фракцию. Реакционную смесь перемешивали при комнатной температуре в течение 2 часов и добавляли 1 н. водный раствор NaOH (pH 7). Водный слой экстрагировали с помощью DCM. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали препаративной LC/MS с получением (2,4-дихлор-3-((4-метил-6-(трифторметил)индолин-2-ил)метил)фенил)(морфолинo)метанона (82 мг, 43%) в виде желтого твердого вещества. LC/MS (Способ h), Время удерживания=3,08 минуты; MS масса/заряд: 473 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 7,58 (d, J=9Гц, 1H), 7,32 (J=9Гц, 1H), 6,67 (s, 1H), 6,49 (dm, 1H), 6,14 (m, 1H), 4,22 (m, 1H), 3,65 (m, 4H), 3,54 (m, 2H), 3,16 (m, 4H), 2,90 (m, 1H), 2,72 (m, 1H), 2,17 (s, 3H).
Стадия 2: (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)индолин-2-ил)метил)фенил)(морфолинo)метанон
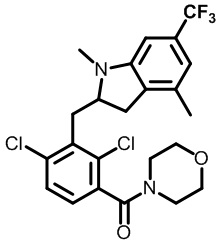
Используя процедуру, аналогичную примеру A, стадии 4, (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)индолин-2-ил)метил)фенил)(морфолинo)метанон (5 мг, 20%) получали из (2,4-дихлор-3-((4-метил-6-(трифторметил)индолин-2-ил)метил)фенил)(морфолинo)метанона (24 мг, 0,051 ммоль). LC/MS (Способ g), Время удерживания=1,97 минуты; MS масса/заряд: 487 [M+H]+. 1H ЯМР (DMSO-d6, 400 МГц): δ 7,61 (d, J=8,4Гц, 1H), 7,35 (d, J=8,4Гц, 1H), 6,76 (s, 1H), 6,57 (s, 1H), 3,90 (m, 1H), 3,69 (m, 4H), 3,54 (m, 2H), 3,40 (m, 1H), 3,13 (m, 3H), 2,93 (m, 1H), 2,82 (m, 3H), 2,72 (m, 1H), 2,14 (s, 3H).
Пример R: 2-(1-(2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Стадия 1: метил-2-(1-(2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат
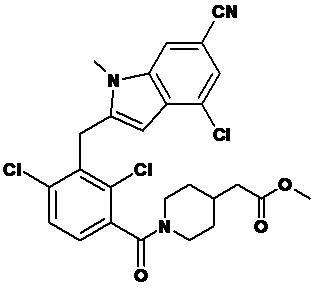
Используя процедуру, аналогичную примеру A1, метил-2-(1-(2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат (101 мг, 83%) получали из 2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензойной кислоты (пример DQ, стадия 6) (90 мг, 0,23 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (66,4 мг, 0,34 ммоль).
LC/MS (Способ i), Время удерживания=2,43 минуты; MS масса/заряд: 532 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 8,17 (m, 1H), 7,68 и 7,67 (d, J=8,4 Гц, 1H), 7,51 и 7,50 (s, 1H), 7,47 и 7,40 (d, J=8,4 Гц, 1H), 5,68 и 5,65 (m, 1H), 4,47 (m, 3H), 3,96 и 3,95 (s, 3H), 3,59 и 3,56 (s, 3H), 3,25 (m, 1H), 3,05 (m, 1H), 2,80 (m, 1H), 2,25 (m, 2H), 1,95 (m, 1H), 1,75 (m, 1H), 1,59 (m, 1H), 1,17 (m, 2H).
Стадия 2: 2-(1-(2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (93 мг, 95%) получали из метил-2-(1-(2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетата (101 мг, 0,19 ммоль). LC/MS (Способ g), Время удерживания=1,63 минуты; MS масса/заряд: 518 [M+H]+.
1H ЯМР (DMSO-d6, 400МГц): δ 12,09 (m, 1H), 8,17 (s, 1H), 7,68 и 7,67 (d, J=8,4 Гц, 1H), 7,50 (m, 1H), 7,46 и 7,39 (d, J=8,4 Гц, 1H), 5,68 и 5,66 (m, 1H), 4,49 (m, 3H), 3,96 и 3,95 (s, 3H), 3,27 (m, 1H), 3,05 (m, 1H), 2,80 (m, 1H), 2,15 (m, 2H), 193 (m, 1H), 1,77 (m, 1H), 1,61 (m, 1H), 1,15 (m, 2H).
Пример S: 3-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)циклобутанкарбоновая кислота

Стадия 1: трет-бутил-4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-карбоксилат
Используя процедуру, аналогичную примеру A, стадии 6, трет-бутил-4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-карбоксилат (700 мг, 100%) получали из 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензойной кислоты (пример A, стадия 5) (500 мг, 1,201 ммоль) и 1-boc-пиперазина (336 мг, 1,8 ммоль). LC/MS (Способ h), Время удерживания=3,49 минуты; MS масса/заряд: 584 [M+H]+ 1H ЯМР (CDCl3, 300 МГц): δ 7,49 (d, J=9Гц, 1H), 7,43 (s, 1H), 7,26 (d, J=9Гц, 1H), 7,09 (s, 1H), 5,76 (s, 1H), 4,44 (m, 2H), 3,87 (s, 3H), 3,75 (m, 2H), 3,53 (m, 2H), 3,39 (m, 2H), 3,22 (m, 2H), 2,43 (s, 3H), 1,46 (m, 9H).
Стадия 2: (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(пиперазин-1-ил)метанон
Используя процедуру, аналогичную примеру O, стадии 2, (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(пиперазин-1-ил)метанон (535 мг, 92%) получали из трет-бутил-4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-карбоксилата (700 мг, 1,198 ммоль). LC/MS (Способ h), Время удерживания=2,73 минуты; MS масса/заряд: 483 [M+H]+ 1H ЯМР (CDCl3, 300 МГц): δ 7,49 (d, J=9Гц, 1H), 7,43 (s, 1H), 7,26 (d, J=9Гц, 1H), 7,08 (s, 1H), 5,78 (s, 1H), 4,43 (m, 2H), 3,87 (s, 3H), 3,80 (m, 2H), 3,23 (m, 2H), 2,95 (m, 2H), 2,88 (m, 1H), 2,80 (m, 1H), 2,42 (s, 3H).
Стадия 3: трет-бутил-3-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)циклобутанкарбоксилат
Используя процедуру, аналогичную примеру O, стадии 3, трет-бутил-3-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)циклобутанкарбоксилат (105 мг, 80%) получали из (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(пиперазин-1-ил)метанона (100 мг, 0,206 ммоль) и трет-бутил-3-оксоциклобутанкарбоксилата (52,7 мг, 0,310 ммоль). LC/MS (Способ h), Время удерживания=3,39 минуты; MS масса/заряд: 638 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 7,70 (s, 1H), 7,67 (d, J=9Гц, 1H), 7,42 (d, J=9Гц, 1H), 7,06 (s, 1H), 5,67 (s, 1H), 4,46 (m, 2H), 3,92 (s, 3H), 3,60 (m, 2H), 3,15 (m, 2H), 2,70 (m, 2H), 2,28 (s, 3H), 2,20 (m, 6H), 2,17 (m, 2H), 1,39 (s, 9H).
Стадия 4: 3-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)циклобутанкарбоновая кислота
В раствор трет-бутил-3-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)циклобутанкарбоксилата (105 мг, 0,164 ммоль) в DCM (3,5 мл), охлажденный до 0°C, добавляли TFA (0,8 мл, 10,38 ммоль). Ледяную баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали под пониженным давлением. Неочищенное вещество разбавляли с помощью DCM и промывали насыщенным водным раствором NaHCO3. Органический слой промывали водой, высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Неочищенное вещество поглощали водой и pH доводили до 7. Водный слой экстрагировали с помощью DCM. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением с получением 3-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)циклобутанкарбоновой кислоты (45 мг, 45,8%). LC/MS (Способ g), Время удерживания=1,38 минуты; MS масса/заряд: 582 [M+H]+ 1H ЯМР (пиридин-d5, 500 МГц): δ 7,66 (s, 1H), 7,53 (d, J=8Гц, 1H), 7,44 (d, J=8Гц, 1H), 7,18 (s, 1H), 6,10 (s, 1H), 4,48 (m, 2H), 3,90 (m, 2H), 3,76 (s, 3H), 3,32 (m, 2H), 2,98 (m, 1H), 2,56 (m, 1H), 2,32 (m, 8H), 2,26 (s, 3H).
Пример T: 2-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)-2-метилпропановая кислота
Стадия 1: этил-2-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)-2-метилпропаноат
В раствор (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(пиперазин-1-ил)метанона (пример S, стадия 2) (50 мг, 0,103 ммоль) и этил-2-бромизобутирата (60,4 мг, 0,310 ммоль) в DMF (0,3 мл) добавляли карбонат калия (42,8 мг, 0,310 ммоль) и реакционную смесь перемешивали при 60°C в течение ночи. Добавляли карбонат калия (3 экв.) и этил-2-бромизобутират (3 экв.) и перемешивание продолжали в течение 24 часов. Реакционную смесь разбавляли водой и с помощью EtOAc. Водный слой экстрагировали с помощью EtOAc. Органические слои объединяли, высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 20-80% EtOAc в циклогексане) с получением этил-2-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)-2-метилпропаноата (30 мг, 49%).
LC/MS (Способ h), Время удерживания=3,35 минуты; MS масса/заряд: 598 [M+H]+.
Стадия 2: 2-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)-2-метилпропановая кислота

Используя процедуру, аналогичную примеру O, стадии 4, 2-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)-2-метилпропановую кислоту (60 мг, 96%) получали из этил-2-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)-2-метилпропаноата (60 мг, 0,100 ммоль). LC/MS (Способ g), Время удерживания=1,59 минуты; MS масса/заряд: 570 [M+H]+ 1H ЯМР (DMSO-d6, 400 МГц): δ 7,70 (s, 1H), 7,66 (d, J=8Гц, 1H), 7,47 (d, J=8Гц, 1H), 7,06 (s, 1H), 5,68 (s, 1H), 4,49 (m, 2H), 3,90 (s, 3H), 3,65 (m, 2H), 3,18 (m, 2H), 2,62 (m, 2H), 2,58 (m, 2H), 2,36 (s, 3H), 1,19 (s, 6H).
Пример U: 2-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)пропановая кислота

Стадия 1: этил-2-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)пропаноат
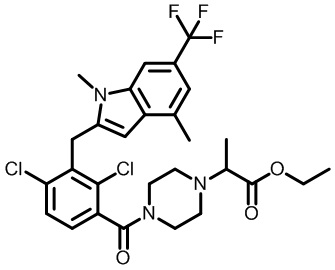
Используя процедуру, аналогичную примеру T, стадии 1, этил-2-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)пропаноат (43 мг, 66%) получали из (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(пиперазин-1-ил)метанона (пример S, стадия 2) (50 мг, 0,103 ммоль) и этил-2-бромпропионата (28 мг, 0,155 ммоль). LC/MS (Способ k), Время удерживания=3,05 минуты; MS масса/заряд: 584 [M+H]+ 1H ЯМР (CDCl3, 300 МГц): δ 7,48 (d, J=9Гц, 1H), 7,43 (s, 1H), 7,25 (d, J=9Гц, 1H), 7,08 (s, 1H), 5,78 (s, 1H), 4,42 (m, 2H), 4,14 (m, 2H), 3,86 (s, 3H), 3,84 (m, 2H), 3,28 (m, 3H), 2,71 (m, 4H), 2,43 (s, 3H), 1,28 (m, 6H).
Стадия 2: 2-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)пропановая кислота
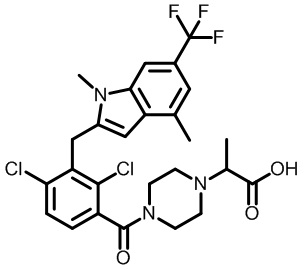
Используя процедуру, аналогичную примеру O, стадии 4, 2-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)пропановую кислоту (45 мг, 53%) получали из этил-2-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)пропана (85 мг, 0,145 ммоль). LC/MS (Способ g), Время удерживания=1,52 минуты; MS масса/заряд: 556 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 7,70 (s, 1H), 7,66 (d, J=8Гц, 1H), 7,40 (d, J=8Гц, 1H), 7,06 (s, 1H), 5,67 (s, 1H), 4,46 (m, 2H), 3,92 (s, 3H), 3,63 (m, 3H), 3,16 (m, 4H), 2,57 (m, 2H), 2,36 (s, 3H), 1,73 (m, 3H).
Пример V: 1-(2,4-дихлор-3-((1,5-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-карбоновая кислота

Стадия 1: метил-2,4-дихлор-3-(гидрокси(5-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)бензоат
Используя процедуру, аналогичную примеру A, стадии 1, метил-2,4-дихлор-3-(гидрокси(5-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)бензоат (1 г, 96%) получали из N-(2-йод-4-метил-5-(трифторметил)фенил)бензолсульфонамида (получение №17) (800 мг, 1,813 ммоль) и метил-2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)бензоата (получение №1) (564 мг, 2,176 ммоль). LC/MS (Способ h), Время удерживания=3,36 минуты; MS масса/заряд: 630 [M-H]-+CH3COOH 1H ЯМР (DMSO-d6, 300 МГц): δ 8,29 (s, 1H), 7,79 (m, 2H), 7,68-7,53 (m, 6H), 6,97 (d, J=3Гц, 1H), 6,77 (s, 1H), 6,72 (d, J=8Гц, 1H), 3,86 (s, 3H), 2,46 (s, 3H).
Стадия 2: метил-2,4-дихлор-3-((5-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)бензоат
Используя процедуру, аналогичную примеру A, стадии 2, метил-2,4-дихлор-3-((5-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)бензоат (841 мг, 87%) получали из метил-2,4-дихлор-3-(гидрокси(5-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метила) (1 г, 1,747 ммоль). LC/MS (Способ h), Время удерживания=3,80 минуты; MS масса/заряд: 556 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 8,38 (s, 1H), 7,90 (d, J=8Гц, 1H), 7,79 (m, 3H), 7,69 (m, 3H), 7,50 (s, 1H), 5,88 (s, 1H), 4,58 (s, 2H), 3,87 (s, 3H), 2,44 (s, 3H).
Стадия 3: метил-2,4-дихлор-3-((5-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоат

Используя процедуру, аналогичную примеру A, стадии 3, метил-2,4-дихлор-3-((5-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоат (420 мг, 67%) получали из метил-2,4-дихлор-3-((5-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)бензоата (841 мг, 1,512 ммоль) LC/MS (Способ h), Время удерживания=3,43 минуты; MS масса/заряд: 416 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 11,35 (s, 1H), 7,75 (d, J=9Гц, 1H), 7,68 (d, J=9Гц, 1H), 7,62 (s, 1H), 7,37 (s, 1H), 5,87 (s, 1H), 4,47 (s, 2H), 3,87 (s, 3H), 2,42 (s, 3H).
Стадия 4: метил-2,4-дихлор-3-((1,5-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоат
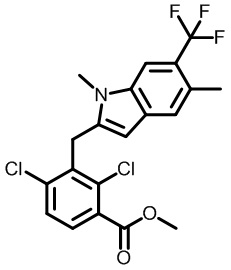
Используя процедуру, аналогичную примеру P, стадии 4, метил-2,4-дихлор-3-((1,5-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоат (530 мг, 84%) получали из метил-2,4-дихлор-3-((5-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоата (592 мг, 1,422 ммоль) LC/MS (Способ h), Время удерживания=3,57 минуты; MS масса/заряд: 430 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 7,79 (s, 1H), 7,78 (d, J=8Гц, 1H), 7,71 (d, J=8Гц, 1H), 7,36 (s, 1H), 5,56 (s, 1H), 4,47 (s, 2H), 3,90 (s, 3H), 3,86 (s, 3H), 2,42 (s, 3H).
Стадия 5: 2,4-дихлор-3-((1,5-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((1,5-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензойную кислоту (424 мг, 100%) получали из метил-2,4-дихлор-3-((1,5-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоата (438 мг, 1,018 ммоль) LC/MS (Способ h), Время удерживания=3,13 минуты; MS масса/заряд: 416 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 13,67 (широкий, 1H), 7,79 (s, 1H), 7,75 (d, J=9Гц, 1H), 7,67 (d, J=9Гц, 1H), 7,36 (s, 1H), 5,57 (s, 1H), 4,47 (d, 2H), 3,90 (s, 3H), 2,43 (s, 3H).
Стадия 6: этил-1-(2,4-дихлор-3-((1,5-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-карбоксилат
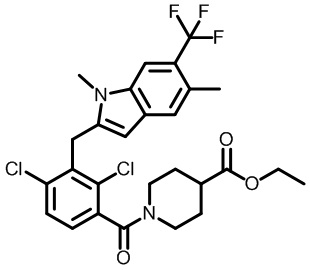
Используя процедуру, аналогичную примеру A1, этил-1-(2,4-дихлор-3-((1,5-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-карбоксилат (133 мг, 100%) получали из 2,4-дихлор-3-((1,5-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензойной кислоты (100 мг, 0,240 ммоль) и этилпиперидин-4-карбоксилата (37,8 мг, 0,24 ммоль). LC/MS (Способ h), Время удерживания=3,43 минуты; MS масса/заряд: 555 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 7,79 (s, 1H), 7,65 (d, J=6Гц, 1H), 7,46 (d, J=6Гц, 0,5H), 7,38 (m, 1,5H), 5,60 и 5,58 (s, 1H), 4,43 (m, 2H), 4,37 (m, 1H), 4,07 (m, 2H), 3,89 (s, 3H), 3,27 (m, 1H), 3,13 (m, 2H), 2,65 (m, 1H), 2,43 (s, 3H), 1,93 (m, 1H), 1,81 (m, 1H), 1,51 (m, 2H), 1,18 (m, 3H).
Стадия 7: 1-(2,4-дихлор-3-((1,5-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-карбоновая кислота

Используя процедуру, аналогичную примеру A, стадии 5, 1-(2,4-дихлор-3-((1,5-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-карбоновую кислоту (102 мг, 77%) получали из этил-1-(2,4-дихлор-3-((1,5-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-карбоксилата (133 мг, 0,239 ммоль). LC/MS (Способ g), Время удерживания=1,82 минуты; MS масса/заряд: 527 [M+H]+ 1H ЯМР (DMSO-d6, 400 МГц): δ 12,40 (широкий, 1H), 7,79 (s, 1H), 7,67 (d, J=10Гц, 1H), 7,45 (d, J=10Гц, 0,5H), 7,37 (m, 1,5H), 5,60 и 5,58 (s, 1H), 4,46 (s, 2H), 4,36 (m, 1H), 3,96 (s, 3H), 3,29 (m, 1H), 3,12 (m, 1H), 3,01 (m, 1H), 2,56 (m, 1H), 2,49 (s, 3H), 1,92 (m, 1H), 1,78 (m, 1H), 1,53 (m, 2H).
Пример W: 2-(2,6-дихлор-3-метоксибензил)-1,4-диметил-6-(трифторметил)-1H-индол
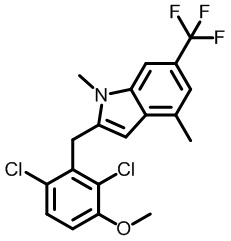
Стадия 1: (2,6-дихлор-3-метоксифенил)(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метанол

Используя процедуру, аналогичную примеру A, стадии 1, (2,6-дихлор-3-метоксифенил)(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метанол (2,51 г, 90%) получали из N-(2-йод-3-метил-5-(трифторметил)фенил)бензолсульфонамида (получение №16) (2,262 г, 5,13 ммоль) и 1-(2,6-дихлор-3-метоксифенил)проп-2-ин-1-ола (получение №7 (1,54 г, 6,66 ммоль). LC/MS (Способ h), Время удерживания=3,39 минуты; MS масса/заряд: 602 [M-H]-+CH3COOH 1H ЯМР (DMSO-d6, 300 МГц): δ 8,08 (m, 1H), 7,82 (m, 2H), 7,67 (m, 1H), 7,56 (m, 2H), 7,40 (m, 2H), 7,14 (d, J=9Гц, 1H), 6,98 (d, 6Гц, 1H), 6,79 (s, 1H), 6,57 (d, J=6Гц, 1H), 3,87 (s, 3H), 2,45 (s, 3H).
Стадия 2: 2-(2,6-дихлор-3-метоксибензил)-4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол

Используя процедуру, аналогичную примеру A, стадии 2, 2-(2,6-дихлор-3-метоксибензил)-4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол (2,12 г, 87%) получали из (2,6-дихлор-3-метоксифенил)(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метанола (2,5 г, 4,59 ммоль). LC/MS (Способ h), Время удерживания=3,85 минуты; MS масса/заряд: 528 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 8,24 (s, 1H), 7,93 (m, 2H), 7,76 (m, 1H), 7,68 (m, 2H), 7,53 (d, J=9Гц, 1H), 7,41 (s, 1H), 7,23 (d, J=9Гц, 1H), 5,90 (s, 1H), 4,54 (s, 2H), 3,90 (s, 3H), 2,34 (s, 3H).
Стадия 3: 2-(2,6-дихлор-3-метоксибензил)-4-метил-6-(трифторметил)-1H-индол

Используя процедуру, аналогичную примеру A, стадии 3, 2-(2,6-дихлор-3-метоксибензил)-4-метил-6-(трифторметил)-1H-индол (1,52 г, 98%) получали из 2-(2,6-дихлор-3-метоксибензил)-4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индола (2,12 г, 4,01 ммоль). LC/MS (Способ h), Время удерживания=3,47 минуты; MS масса/заряд: 388 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 11,50 (широкий, 1H), 7,52 (d, J=9Гц, 1H), 7,48 (s, 1H), 7,17 (d, J=9Гц, 1H), 7,02 (s, 1H), 5,95 (s, 1H), 4,42 (s, 2H), 3,89 (s, 3H), 2,40 (s, 3H).
Стадия 4: 2-(2,6-дихлор-3-метоксибензил)-1,4-диметил-6-(трифторметил)-1H-индол

Используя процедуру, аналогичную примеру P, стадии 4, 2-(2,6-дихлор-3-метоксибензил)-1,4-диметил-6-(трифторметил)-1H-индол (517 мг, 93%) получали из 2-(2,6-дихлор-3-метоксибензил)-4-метил-6-(трифторметил)-1H-индола (1,36 г, 3,50 ммоль) LC/MS (Способ g), Время удерживания 2,17 минуты; MS масса/заряд: 402 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 7,69 (s, 1H), 7,54 (d, J=9Гц, 1H), 7,22 (d, J=9Гц, 1H), 7,05 (s, 1H), 5,65 (s, 1H), 4,41 (s, 2H), 3,91 (s, 6H), 2,35 (s, 3H).
Пример X: 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенол
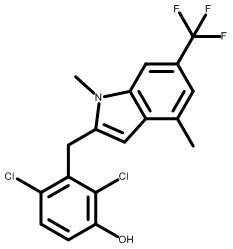
В раствор 2-(2,6-дихлор-3-метоксибензил)-1,4-диметил-6-(трифторметил)-1H-индола (пример W) (0,517 г, 1,285 ммоль) в DCM (51,4 мл), охлажденный до -10°C, добавляли BBr3 (3,86 мл, 3,86 ммоль). Реакционную смесь перемешивали при -10°C в течение 1 часа и нагревали при комнатной температуре в течение 1,5 часа. Реакционную смесь гидролизовали добавлением насыщенного водного раствора NaHCO3 и основную смесь экстрагировали с помощью DCM. Органический слой промывали последовательно водой и насыщенным раствором NaCl, высушивали над сульфатом магния, фильтровали и выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-30% EtOAc в циклогексане) с получением 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенола (389 мг, 78%). LC/MS (Способ g), Время удерживания 1,97 минуты; MS масса/заряд: 388 [M+H]+ 1H ЯМР (DMSO-d6, 400 МГц): δ 10,58 (широкий, 1H), 7,68 (s, 1H), 7,35 (d, J=8,8Гц, 1H), 7,05 (s, 1H), 7,01 (d, J=8,8Гц, 1H), 5,66 (s, 1H), 4,37 (s, 2H), 3,90 (s, 3H), 2,36 (s, 3H).
Пример Y: 2-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)уксусная кислота

Стадия 1: метил-2-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)ацетат
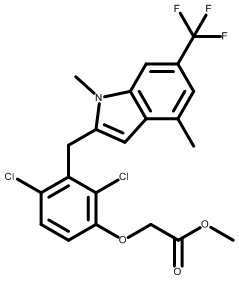
В раствор 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенола (пример X) (100 мг, 0,258 ммоль) в ACN (1 мл) добавляли Cs2CO3 (92 мг, 0,283 ммоль) и смесь перемешивали при комнатной температуре в течение 10 минут. Метилбромацетат (0,036 мл, 0,386 ммоль) добавляли и смесь перемешивали при комнатной температуре в течение 7 часов. Реакционную смесь разбавляли водой и экстрагировали с помощью DCM. Органический слой промывали солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-30% EtOAc в циклогексане) с получением метил-2-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)ацетата (98 мг, 83%). LC/MS (Способ h), Время удерживания 3,46 минуты; MS масса/заряд: 460 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 7,70 (s, 1H), 7,52 (d, J=9Гц, 1H), 7,16 (d, J=9Гц, 1H), 7,06 (s, 1H), 5,65 (s, 1H), 5,00 (s, 2H), 4,43 (s, 2H), 3,92 (s, 3H), 3,72 (s, 3H), 2,36 (s, 3H).
Стадия 2: 2-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)уксусная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)уксусную кислоту (88 мг, 93%) получали из метил-2-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)ацетата (98 мг, 0,213 ммоль) LC/MS (Способ g), Время удерживания 1,98 минуты; MS масса/заряд: 446 [M+H]+ 1H ЯМР (DMSO-d6, 400 МГц): δ 13,30 (широкий, 1H), 7,70 (s, 1H), 7,50 (d, J=8,8Гц, 1H), 7,09 (d, J=8,8Гц, 1H), 7,06 (s, 1H), 5,66 (s, 1H), 4,83 (s, 2H), 4,42 (s, 2H), 3,91 (s, 3H), 2,34 (s, 3H).
Пример Y1: 3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)пропановая кислота
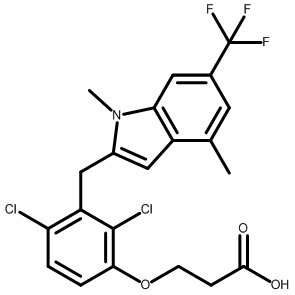
В раствор 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенола (пример X) (150 мг, 0,386 ммоль) в DMF (2 мл) добавляли NaH (23,18 мг, 0,580 ммоль) и смесь перемешивали при комнатной температуре в течение 10 минут. Бета-пропиолактон (0,036 мл, 0,580 ммоль) добавляли и смесь перемешивали при комнатной температуре в течение ночи. Воду добавляли в смесь, и смесь подкисляли до pH=3-4 с помощью 1 н. раствора HCl. Твердое вещество фильтровали, промывали водой и диэтиловым эфиром и высушивали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-20% MeOH в DCM) с получением 3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)пропановой кислоты (101 мг, 37%) в виде белого твердого вещества. LC/MS (Способ g), Время удерживания 1,97 минуты; MS масса/заряд: 460 [M+H]+ 1H ЯМР (DMSO-d6, 400 МГц): δ 12,56 (широкий, 1H), 7,67 (s, 1H), 7,52 (d, J=9,2Гц, 1H), 7,24 (d, J=9,2Гц, 1H), 7,05 (s, 1H), 5,65 (s, 1H), 4,40 (s, 2H), 4,30 (t, J=6Гц, 2H), 3,90 (s, 3H), 2,74 (t, J=6Гц, 2H), 2,36 (s, 3H).
Пример Z: 2-((3,5-дихлор-2-метоксипиридин-4-ил)метил)-1,4-диметил-6-(трифторметил)-1H-индол

Стадия 1: (3,5-дихлор-2-метоксипиридин-4-ил)(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метанол

Используя процедуру, аналогичную примеру A, стадии 1, (3,5-дихлор-2-метоксипиридин-4-ил)(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метанол (3,47 г, 94%) получали из N-(2-йод-3-метил-5-(трифторметил)фенил)бензолсульфонамида (получение №16) (3 г, 6,80 ммоль) и 1-(3,5-дихлор-2-метоксипиридин-4-ил)проп-2-ин-1-ола (получение №15) (1,894 г, 8,16 ммоль). LC/MS (Способ k), Время удерживания 3,59 минуты; MS масса/заряд: 545 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 8,21 (s, 1H), 8,09 (s, 1H), 7,82 (m, 2H), 7,71 (m, 1H), 7,58 (m, 1H), 7,44 (s, 1H), 6,94 (s, 1H), 6,87 (m, 2H), 3,95 (s, 3H), 2,48 (s, 3H).
Стадия 2: 2-((3,5-дихлор-2-метоксипиридин-4-ил)метил)-4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол
В раствор (3,5-дихлор-2-метоксипиридин-4-ил)(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метанола (50 мг, 0,092 ммоль) в хлороформе (420 мкл) добавляли тионилхлорид (19,95 мкл, 0,275 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение одной ночи. Повышали основность реакционной смеси (pH 8) при помощи насыщенного водного раствора NaHCO3. Полученный водный слой экстрагировали с помощью EtOAc. Полученный органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток растворяли в уксусной кислоте (420 мкл) и добавляли цинк (30,0 мг, 0,458 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов, затем фильтровали, промывали с помощью DCM и фильтрат концентрировали под пониженным давлением. Остаток разбавляли с помощью EtOAc и промывали водой. Полученный органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением с получением 2-((3,5-дихлор-2-метоксипиридин-4-ил)метил)-4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индола (50 мг, 94%) в виде бежевого твердого вещества. LC/MS (Способ k), Время удерживания 4,19 минуты; MS масса/заряд: 529 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 8,32 (s, 1H), 8,22 (s, 1H), 7,92 (m, 2H), 7,77 (m, 1H), 7,67 (m, 2H), 7,41 (s, 1H), 6,21 (s, 1H), 4,54 (s, 2H), 3,39 (s, 3H), 2,37 (s, 3H).
Стадия 3: 2-((3,5-дихлор-2-метоксипиридин-4-ил)метил)-4-метил-6-(трифторметил)-1H-индол

Используя процедуру, аналогичную примеру A, стадии 3, 2-((3,5-дихлор-2-метоксипиридин-4-ил)метил)-4-метил-6-(трифторметил)-1H-индол (1,2 г, 86%) получали из 2-((3,5-дихлор-2-метоксипиридин-4-ил)метил)-4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индола (1,9 г, 3,59 ммоль) LC/MS (Способ h), Время удерживания 3,45 минуты; MS масса/заряд: 389 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 11,49 (s, 1H), 8,31 (s, 1H), 7,48 (s, 1H), 7,03 (s, 1H), 6,06 (s, 1H), 4,42 (s, 2H), 3,98 (s, 3H), 2,42 (s, 3H).
Стадия 4: 2-((3,5-дихлор-2-метоксипиридин-4-ил)метил)-1,4-диметил-6-(трифторметил)-1H-индол
Используя процедуру, аналогичную примеру A, стадии 4, 2-((3,5-дихлор-2-метоксипиридин-4-ил)метил)-1,4-диметил-6-(трифторметил)-1H-индол (963 мг, 77%) получали из 2-((3,5-дихлор-2-метоксипиридин-4-ил)метил)-4-метил-6-(трифторметил)-1H-индола (1,2 г, 3,08 ммоль). LC/MS (Способ h), Время удерживания 3,60 минуты; MS масса/заряд: 403 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 8,35 (s, 1H), 7,70 (s, 1H), 7,07 (s, 1H), 5,80 (s, 1H), 4,43 (s, 2H), 4,00 (s, 3H), 3,92 (s, 3H), 2,38 (s, 3H).
Пример AA: 2-(2,6-дихлор-3-(4-(оксетан-3-ил)пиперазин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил
Стадия 1: метил-2,4-дихлор-3-((6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)бензоат
Используя процедуру, аналогичную примеру A, стадии 1, метил-2,4-дихлор-3-((6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)бензоат (1,32 г, 71%) получали в виде коричневого твердого вещества из N-(5-циано-2-йод-3-метилфенил)бензолсульфонамида (получение №18) (1,4 г, 3,52 ммоль) и метил-2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)бензоата (получение №1) (1,093 г, 4,22 ммоль). LC/MS (Способ h), Время удерживания=2,97 минуты; MS масса/заряд: 587[M-H]-+CH3COOH.
1H ЯМР (DMSO-d6, 300 МГц): δ 8,24 (s, 1H), 7,90 (m, 2H), 7,67 (m, 2H), 7,53 (m, 4H), 7,02 (m, 1H), 6,89 (s, 1H), 6,77 (d, J=6Гц, 1H), 3,87 (s, 3H), 2,43 (s, 3H).
Стадия 2: метил-2,4-дихлор-3-((6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)метил)бензоат
Используя процедуру, аналогичную примеру A, стадии 2, метил-2,4-дихлор-3-((6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)метил)бензоат (1,6 г, 100%) получали в виде желтого твердого вещества из метил-2,4-дихлор-3-((6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)бензоата (1,52 г, 2,87ммоль). LC/MS (Способ h), Время удерживания=3,45 минуты; MS масса/заряд: 513 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 8,36 (s, 1H), 8,07 (d, J=9Гц, 2H), 7,81 (m, 2H), 7,69 (m, 3H), 7,48 (s, 1H), 5,98 (s, 1H), 4,63 (s, 2H), 3,86 (s, 3H), 2,31 (s, 3H).
Стадия 3: метил-2,4-дихлор-3-((6-циано-4-метил-1H-индол-2-ил)метил)бензоат
Используя процедуру, аналогичную примеру A, стадии 3, метил-2,4-дихлор-3-((6-циано-4-метил-1H-индол-2-ил)метил)бензоат (850 мг, 67%) получали в виде коричневого твердого вещества из метил-2,4-дихлор-3-((6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)метил)бензоата (1,6 г, 3,12 ммоль).
LC/MS (Способ h), Время удерживания=3,03 минуты; MS масса/заряд: 373 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 11,66 (широкий, 1H), 7,76 (d, J=6Гц, 1H), 7,68 (d, J=6Гц, 1H), 7,64 (s, 1H), 7,08 (s, 1H), 5,99 (s, 1H), 4,50 (s, 2H), 3,87 (s, 3H), 2,37 (s, 3H).
Стадия 4: метил-2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)бензоат

Используя процедуру, аналогичную примеру A, стадии 4, метил-2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)бензоат (660 мг, 75%) получали в виде бежевого твердого вещества из метил-2,4-дихлор-3-((6-циано-4-метил-1H-индол-2-ил)метил)бензоата (847 мг, 2,27 ммоль).
LC/MS (Способ k), Время удерживания=3,29 минуты; MS масса/заряд: 387 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 7,92 (s, 1H), 7,80 (d, J=9Гц, 1H), 7,72 (d, J=9Гц, 1H), 7,11 (s, 1H), 5,70 (s, 1H), 4,50 (s, 2H), 3,91 (s, 3H), 3,88 (s, 3H), 2,33 (s, 3H).
Стадия 5: 2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)бензойная кислота
Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)бензойную кислоту (660 мг, 100%) получали в виде белого твердого вещества из метил-2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)бензоата (655 мг, 1,69 ммоль). LC/MS (Способ k), Время удерживания=2,82 минуты; MS масса/заряд: 373 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 7,92 (s, 1H), 7,77 (d, J=9Гц, 1H), 7,68 (d, J=9Гц, 1H), 7,11 (s, 1H), 5,70 (s, 1H), 4,49 (s, 2H), 3,91 (s, 3H), 2,33 (s, 3H).
Стадия 6: 2-(2,6-дихлор-3-(4-(оксетан-3-ил)пиперазин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил
Используя процедуру, аналогичную примеру A.1, 2-(2,6-дихлор-3-(4-(оксетан-3-ил)пиперазин-1-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил (700 мг, 88%) получали в виде белого твердого вещества из 2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)бензойной кислоты (600 мг, 1,608 ммоль) и 1-(оксетан-3-ил)пиперазина (260 мг, 1,83 ммоль). LC/MS (Способ g), Время удерживания=1,47 минуты; MS масса/заряд: 497 [M+H]+ 1H ЯМР (DMSO-d6, 400 МГц): δ 7,92 (s, 1H), 7,67 (d, J=8Гц, 1H), 7,43 (d, J=8Гц, 1H), 7,11 (s, 1H), 5,71 (s, 1H), 4,53 (m, 2H), 4,47 (m, 4H), 3,90 (s, 3H), 3,69 (m, 2H), 3,48 (m, 1H), 3,20 (m, 2H), 2,38 (m, 2H), 2,23 (s, 3H), 2,18 (m, 2H).
Таблица AA. Следующие примеры получали из 2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)бензойной кислоты (пример AA, стадия 5) при помощи такой же процедуры с соответствующим амином.
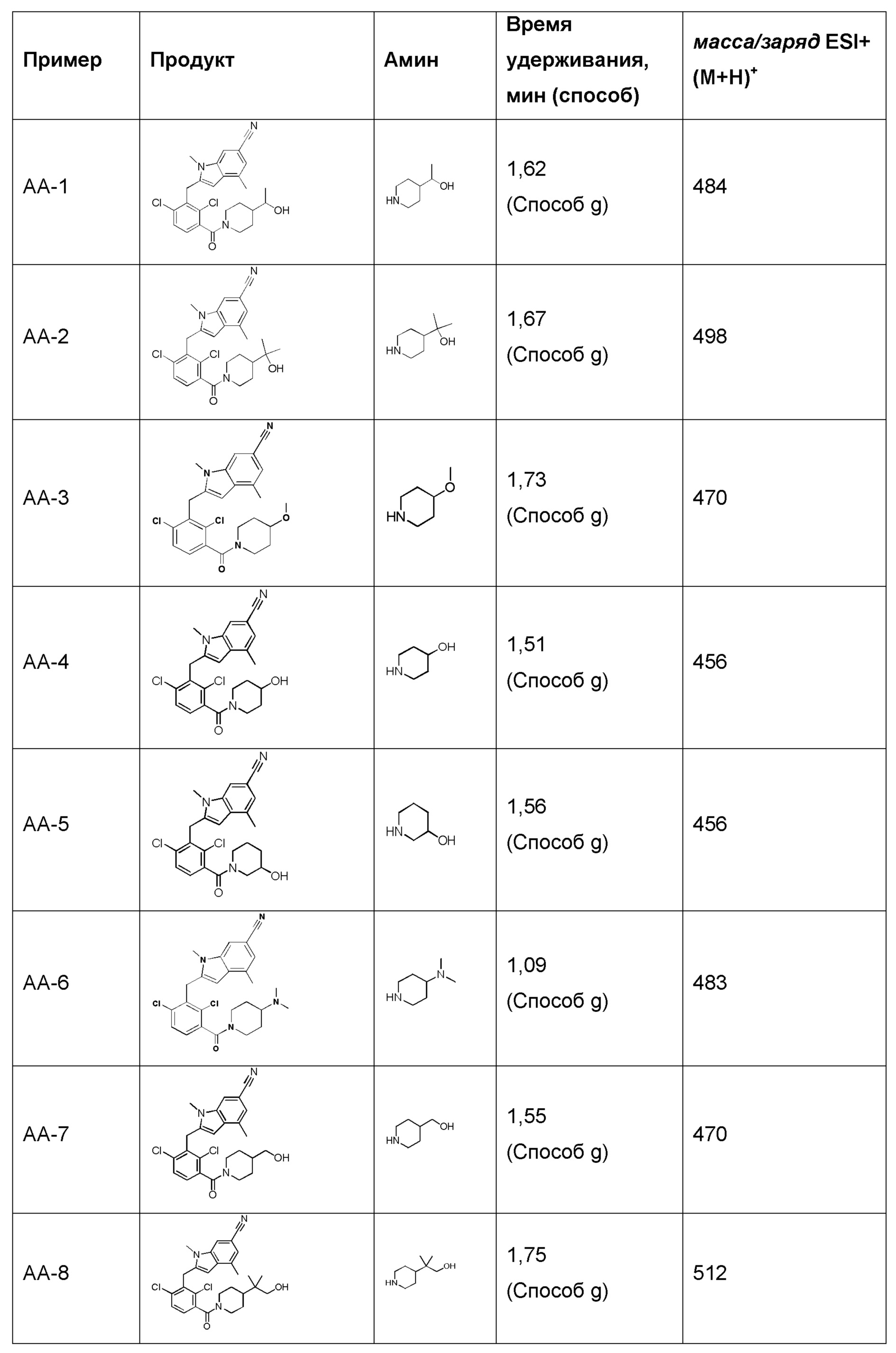
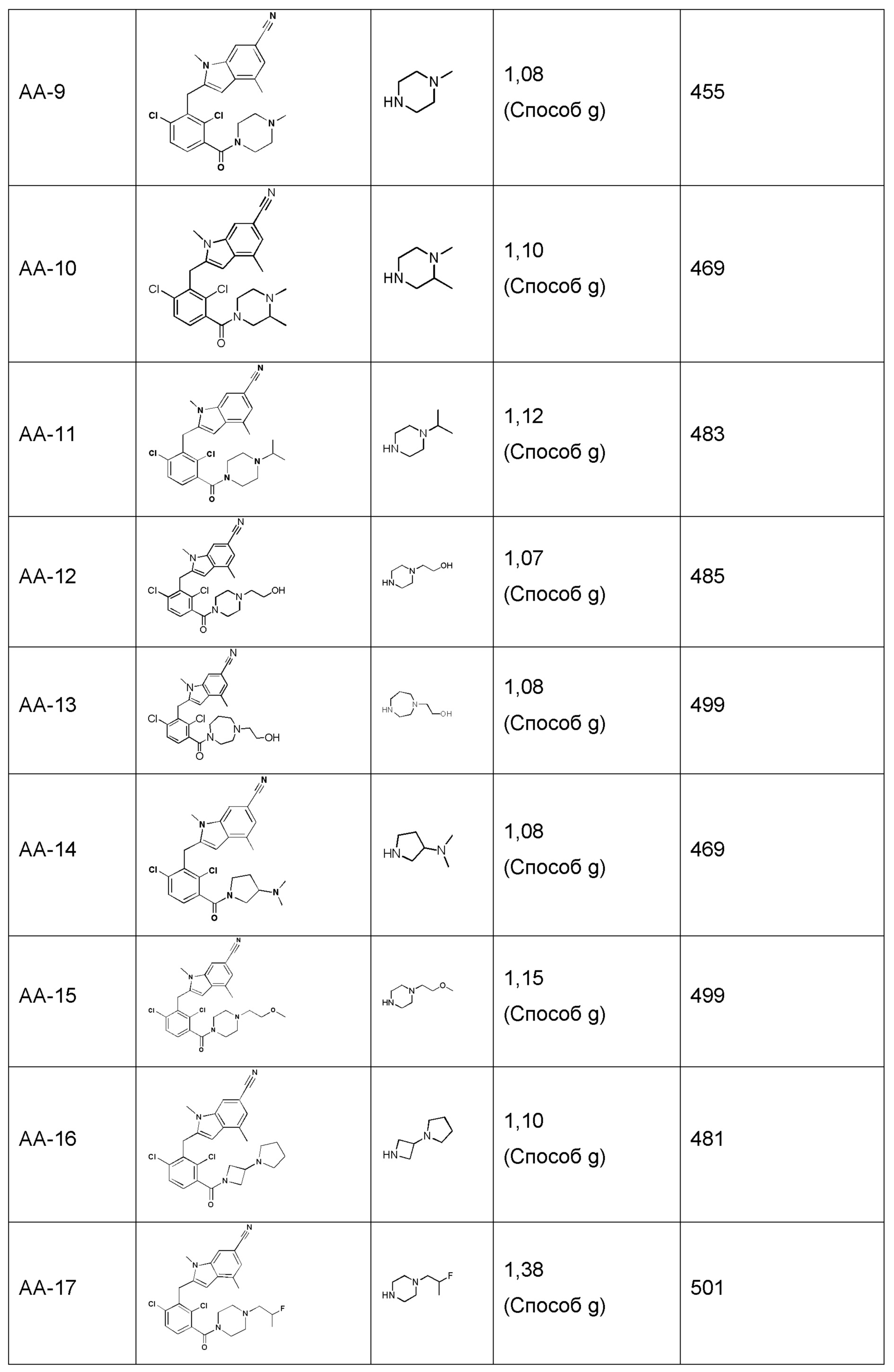

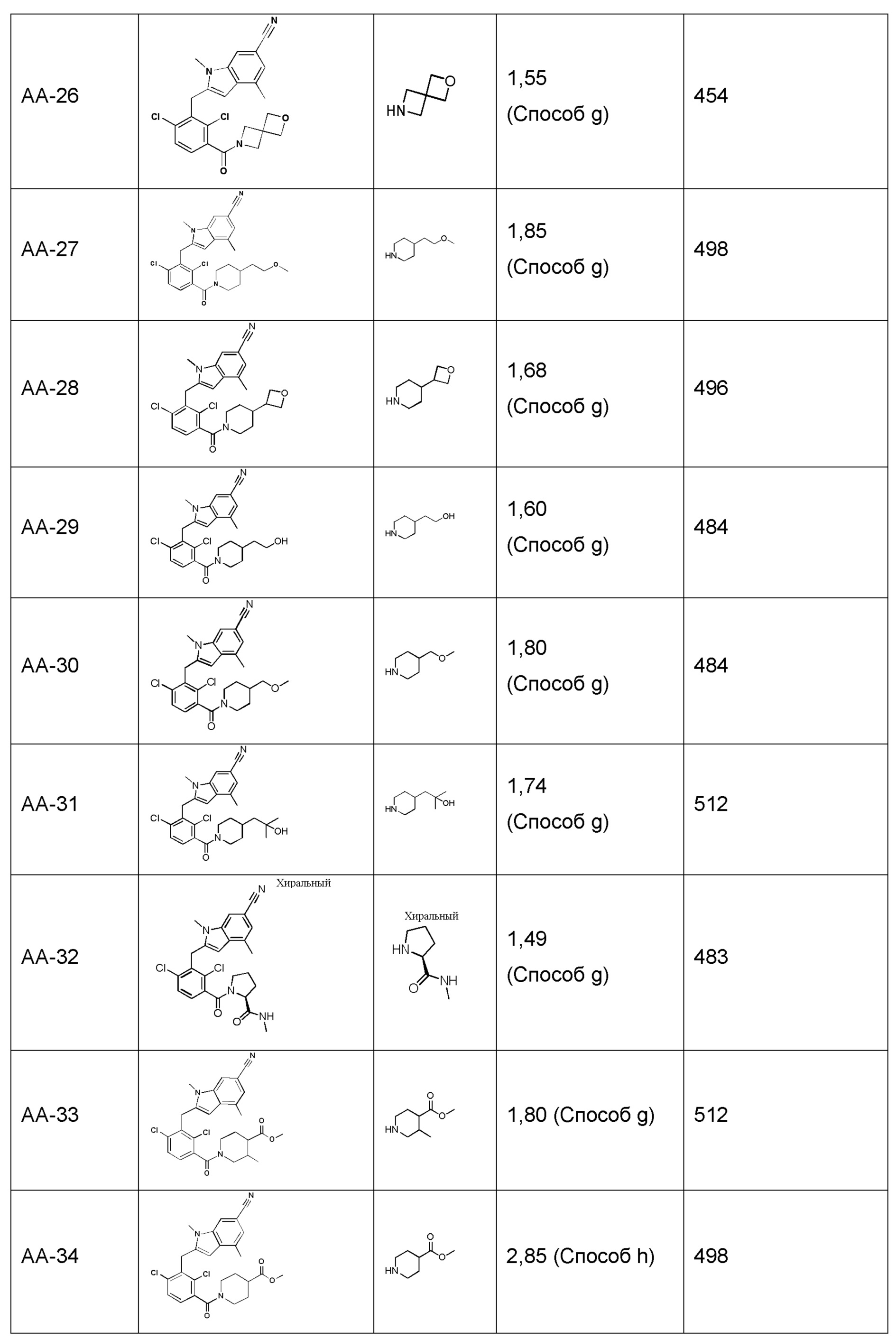
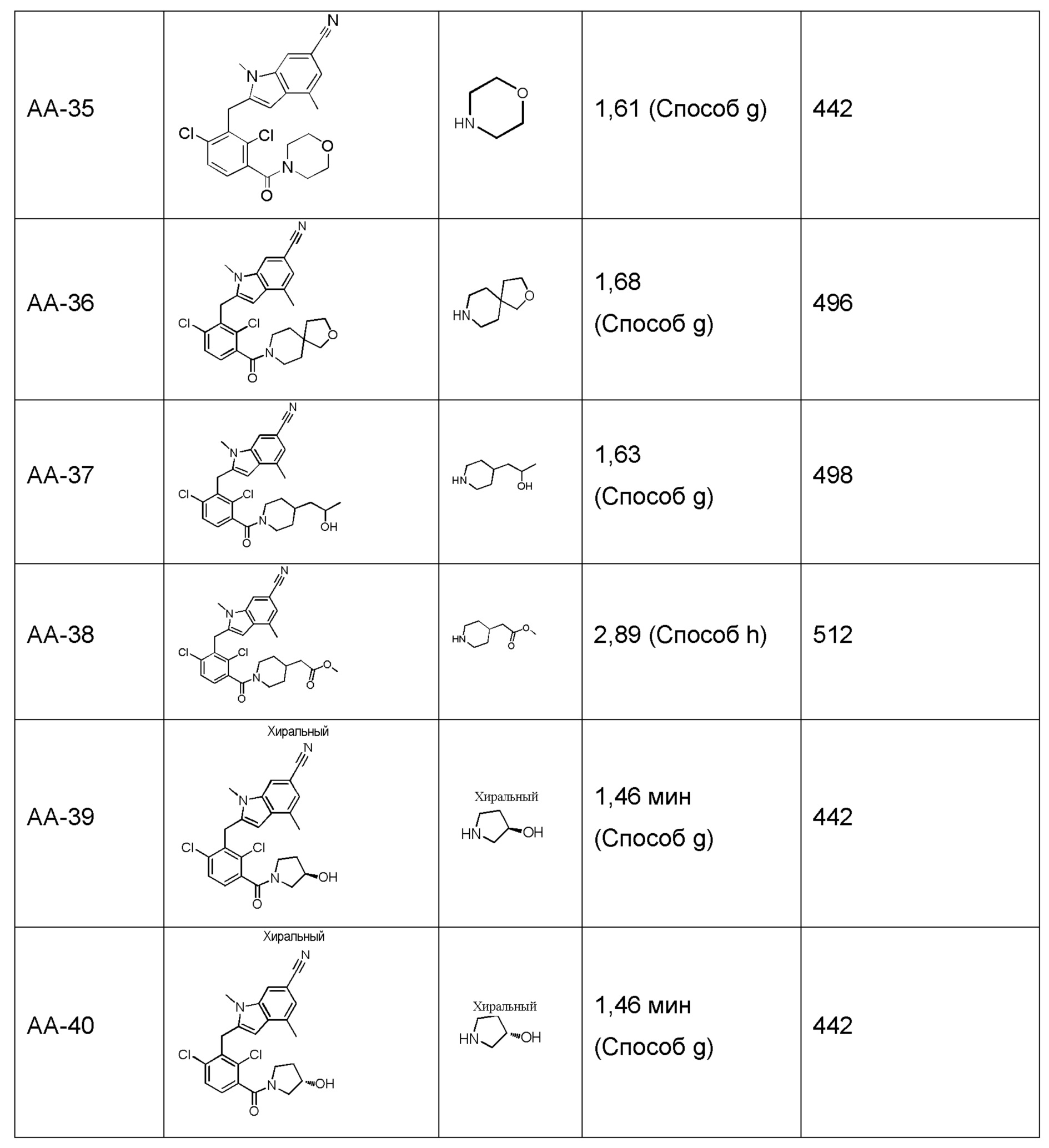
Пример AB: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-метил-1H-индол-5-карбонитрил
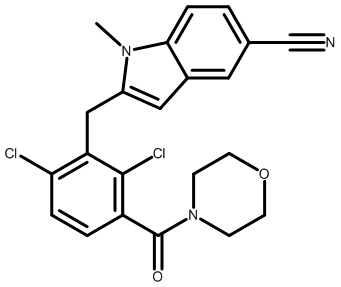
Стадия 1: 2-((2,6-дихлор-3-(морфолин-4-карбонил)фенил)(гидрокси)метил)-1-(фенилсульфонил)-1H-индол-5-карбонитрил
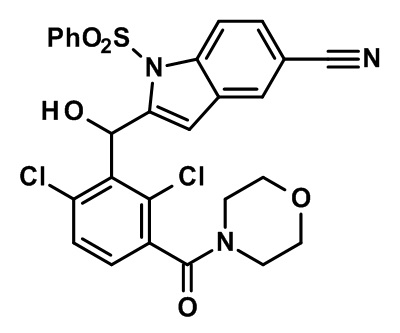
Используя процедуру, аналогичную используя процедуру, аналогичную примеру A, стадии 1, 2-((2,6-дихлор-3-(морфолин-4-карбонил)фенил)(гидрокси)метил)-1-(фенилсульфонил)-1H-индол-5-карбонитрил (500 мг, 100%) получали в виде коричневого твердого вещества из (2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)фенил)(морфолинo)метанона (получение №3) (319 мг, 1,015 ммоль) и N-(4-циано-2-йодфенил)бензолсульфонамида (получение №19) (300 мг, 0,781 ммоль). LC/MS (Способ h), Время удерживания=2,52 минуты; MS масса/заряд: 570 [M+H]+.
1H ЯМР (DMSO-d6, 300 МГц): δ 8,14 (m, 2H), 7,94 (m, 2H), 7,70 (m, 1H), 7,55 (m, 4H), 7,52 (m, 2H), 7,01 (m, 1H), 6,71 (m, 1H), 3,65 (m, 4H), 3,53 (m, 2H), 3,17 (m, 2H).
Стадия 2: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-(фенилсульфонил)-1H-индол-5-карбонитрил

Используя процедуру, аналогичную примеру A, стадии 2, 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-(фенилсульфонил)-1H-индол-5-карбонитрил (20 мг, 29%) получали в виде белого твердого вещества из 2-((2,6-дихлор-3-(морфолин-4-карбонил)фенил)(гидрокси)метил)-1-(фенилсульфонил)-1H-индол-5-карбонитрила (70 мг, 0,123 ммоль). LC/MS (Способ g), Время удерживания=1,78 минуты; MS масса/заряд: 554 [M+H]+.
1H ЯМР (DMSO-d6, 300 МГц): δ 8,30 (d, J=9Гц, 1H), 7,98 (m, 3H), 7,77 (m, 2H), 7,68 (m, 3H), 7,48 (d, J=9Гц, 1H), 5,99 (s, 1H), 4,58 (m, 2H), 3,65 (m, 4H), 3,53 (m, 2H), 3,17 (m, 2H).
Стадия 3: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1H-индол-5-карбонитрил

Используя процедуру, аналогичную примеру A, стадии 3, 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1H-индол-5-карбонитрил (465 мг, 85%) получали в виде желтого твердого вещества из 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-(фенилсульфонил)-1H-индол-5-карбонитрила (670 мг, 1,208 ммоль). LC/MS (Способ h), Время удерживания=2,40 минуты; MS масса/заряд: 414 [M+H]+.
1H ЯМР (DMSO-d6, 300 МГц): δ 11,70 (s, 1H), 7,90 (s, 1H), 7,64 (d, J=9Гц, 1H), 7,47 (m, 1H), 7,39 (m, 2H), 5,96 (s, 1H), 4,44 (s, 2H), 3,65 (m, 4H), 3,52 (m, 2H), 3,17 (m, 2H).
Стадия 4: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-метил-1H-индол-5-карбонитрил
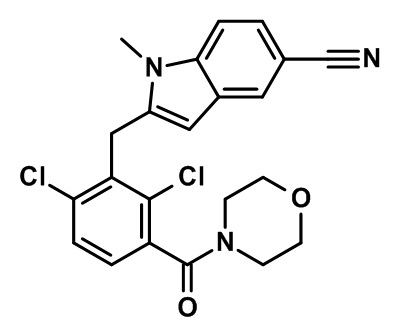
Используя процедуру, аналогичную примеру P, стадии 4, 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-метил-1H-индол-5-карбонитрил (115 мг, 56%) получали в виде белого твердого вещества из 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1H-индол-5-карбонитрила (200 мг, 0,483 ммоль).
LC/MS (Способ g), Время удерживания=1,49 минуты; MS масса/заряд: 428 [M+H]+.
1H ЯМР (DMSO-d6, 400 МГц): δ 7,90 (m, 1H), 7,68 (d, J=8Гц, 1H), 7,65 (d, J=8Гц, 1H), 7,46 (m, 2H), 5,73 (s, 1H), 4,44 (s, 2H), 3,90 (s, 3H), 3,65 (m, 4H), 3,55 (m, 2H), 3,19 (m, 2H).
Пример AC: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-метил-1H-индол-6-карбонитрил

Стадия 1: метил-2,4-дихлор-3-((6-циано-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)бензоат

Используя процедуру, аналогичную примеру A, стадии 1, метил-2,4-дихлор-3-((6-циано-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)бензоат (715 мг, 89%) получали в виде белого твердого вещества из N-(5-циано-2-йодфенил)бензолсульфонамида (получение №20) (600 мг, 1,562 ммоль) и метил-2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)бензоата (получение №1) (445 мг, 1,718 ммоль). LC/MS (Способ h), Время удерживания=2,87 минуты; MS масса/заряд: 573 [M-H]- +CH3COOH 1H ЯМР (DMSO-d6, 300 МГц): δ 8,40 (s, 1H), 7,98 (dd, J=3Гц, 9Гц, 2H), 7,79 (d, J=6Гц, 1H), 7,68 (m, 3H), 7,58 (m, 3H), 7,03 (dd, J=3Гц, 6Гц, 1H), 6,82 (s, 1H), 6,76 (d, J=6Гц, 1H), 3,86 (s, 3H).
Стадия 2: метил-2,4-дихлор-3-((6-циано-1-(фенилсульфонил)-1H-индол-2-ил)метил)бензоат
Используя процедуру, аналогичную примеру A, стадии 2, метил-2,4-дихлор-3-((6-циано-1-(фенилсульфонил)-1H-индол-2-ил)метил)бензоат (400 мг, 100%) получали в виде желтого твердого вещества из метил-2,4-дихлор-3-((6-циано-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)бензоата (400 мг, 0,776 ммоль). LC/MS (Способ h), Время удерживания=3,39 минуты; MS масса/заряд: 497 [M-H]- 1H ЯМР (DMSO-d6, 300 МГц): δ 8,51 (s, 1H), 8,07 (d, J=9Гц, 2H), 7,80 (m, 2H), 7,68 (m, 5H), 6,00 (s, 1H), 4,62 (s, 2H), 3,86 (s, 3H).
Стадия 3: метил-2,4-дихлор-3-((6-циано-1H-индол-2-ил)метил)бензоат

Используя процедуру, аналогичную примеру A, стадии 3, метил-2,4-дихлор-3-((6-циано-1H-индол-2-ил)метил)бензоат (213 мг, 74%) получали в виде желтого твердого вещества из метил-2,4-дихлор-3-((6-циано-1-(фенилсульфонил)-1H-индол-2-ил)метил)бензоата (400 мг, 0,801 ммоль). LC/MS (Способ h), Время удерживания=2,93 минуты; MS масса/заряд: 359 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 11,65 (широкий, 1H), 7,79 (d, J=9Гц, 1H), 7,74 (s, 1H), 7,68 (d, J=9Гц, 1H), 7,54 (d, J=9Гц, 1H), 7,27 (dd, J=3Гц, 9Гц, 1H), 7,98 (s, 1H), 4,50 (s, 2H), 3,87 (s, 3H).
Стадия 4: метил-2,4-дихлор-3-((6-циано-1-метил-1H-индол-2-ил)метил)бензоат

Используя процедуру, аналогичную примеру P, стадии 4, метил-2,4-дихлор-3-((6-циано-1-метил-1H-индол-2-ил)метил)бензоат (210 мг, 93%) получали в виде белого твердого вещества из метил-2,4-дихлор-3-((6-циано-1H-индол-2-ил)метил)бензоата (210 мг, 0,585 ммоль). LC/MS (Способ h), Время удерживания=3,04 минуты; MS масса/заряд: 373 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 8,08 (s, 1H), 7,80 (d, J=9Гц, 1H), 7,72 (d, J=9Гц, 1H), 7,53 (d, J=9Гц, 1H), 7,30 (dd, J=3Гц, 9Гц, 1H), 5,71 (s, 1H), 4,50 (s, 2H), 3,92 (s, 3H), 3,88 (s, 3H).
Стадия 5: 2,4-дихлор-3-((6-циано-1-метил-1H-индол-2-ил)метил)бензойная кислота
Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((6-циано-1-метил-1H-индол-2-ил)метил)бензойную кислоту (170 мг, 88%) получали в виде белого твердого вещества из метил-2,4-дихлор-3-((6-циано-1-метил-1H-индол-2-ил)метил)бензоата (200 мг, 0,536 ммоль). LC/MS (Способ h), Время удерживания=2,61 минуты; MS масса/заряд: 359 [M+H]+.
1H ЯМР (DMSO-d6, 300 МГц): δ 8,08 (d, J=3Гц, 1H), 7,75 (d, J=9Гц, 1H), 7,66 (d, J=9Гц, 1H), 7,54 (d, J=9Гц, 1H), 7,30 (dd, J=3Гц, 9Гц, 1H), 5,71 (s, 1H), 4,50 (s, 2H), 3,92 (s, 3H).
Стадия 6: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-метил-1H-индол-6-карбонитрил
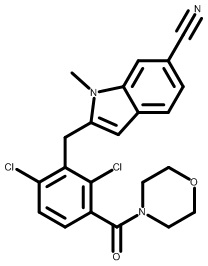
Используя процедуру, аналогичную примеру A, стадии 6, 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-метил-1H-индол-6-карбонитрил (100 мг, 50%) получали в виде белого твердого вещества из 2,4-дихлор-3-((6-циано-1-метил-1H-индол-2-ил)метил)бензойной кислоты (165 мг, 0,459 ммоль) и морфолина (80 мг, 0,92 ммоль). LC/MS (Способ g), Время удерживания=1,53 минуты; MS масса/заряд: 428 [M+H]+ 1H ЯМР (DMSO-d6, 400 МГц): δ 8,08 (s, 1H), 7,67 (d, J=8Гц, 1H), 7,54 (d, J=8Гц, 1H), 7,45 (d, J=8Гц, 1H), 7,30 (dd, J=3Гц, 8Гц, 1H), 5,75 (s, 1H), 4,46 (s, 2H), 3,92 (s, 3H), 3,65 (m, 4H), 3,54 (m, 2H), 3,18 (m, 2H).
Пример AD: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензоил)-1,4-диметил-1H-индол-6-карбонитрил

Стадия 1: 2-((2,6-дихлор-3-(морфолин-4-карбонил)фенил)(гидрокси)метил)-4-метил-1-(фенилсульфонил)-1H-индол-6-карбонитрил
Используя процедуру, аналогичную примеру A, стадии 1, 2-((2,6-дихлор-3-(морфолин-4-карбонил)фенил)(гидрокси)метил)-4-метил-1-(фенилсульфонил)-1H-индол-6-карбонитрил (3 г, 41%) получали в виде оранжевого твердого вещества из N-(2-бром-5-циано-3-метилфенил)бензолсульфонамида (получение №46) (3,6 г, 10,25 ммоль) и (2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)фенил)(морфолинo)метанона (получение №3) (4,83 г, 15,38 ммоль). LC/MS (Способ h), Время удерживания=2,60 минуты; MS масса/заряд: 584 [M+H]+ 1H ЯМР (CDCl3, 300 МГц): δ 8,30 (s, 1H), 7,92 (m, 2H), 7,54 (m, 2H), 7,47 (m, 3H), 7,28 (m, 3H), 6,43 и 6,31 (s, 1H), 3,81 (m, 4H), 3,67 (m, 2H), 3,29 (m, 2H), 2,40 (s, 3H).
Стадия 2: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензоил)-4-метил-1-(фенилсульфонил)-1H-индол-6-карбонитрил
В раствор 2-((2,6-дихлор-3-(морфолин-4-карбонил)фенил)(гидрокси)метил)-4-метил-1-(фенилсульфонил)-1H-индол-6-карбонитрила (321 мг, 0,549 ммоль) в DCM (5 мл) добавляли периодинан Десса-Мартина (2,284 мл, 1,098 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов, затем фильтровали и промывали с помощью ACN. Фильтрат промывали насыщенным водным раствором NaHCO3, солевым раствором и высушивали над сульфатом магния; затем концентрировали с получением 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензоил)-4-метил-1-(фенилсульфонил)-1H-индол-6-карбонитрила в виде желтого твердого вещества (252 мг, 72%). LC/MS (Способ h), Время удерживания=2,79 минуты; MS масса/заряд: 582 [M+H]+.
1H ЯМР (DMSO-d6, 300 МГц): δ 8,53 (s, 1H), 8,28 (m, 2H), 7,80 (m, 1H), 7,73 (m, 4H), 7,65 (m, 2H), 3,63 (m, 4H), 3,52 (m, 2H), 3,23 (m, 2H), 2,48 (s, 3H).
Стадия 3: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензоил)-4-метил-1H-индол-6-карбонитрил
Используя процедуру, аналогичную примеру A, стадии 3, 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензоил)-4-метил-1H-индол-6-карбонитрил (165 мг, 73%) получали в виде желтого твердого вещества из 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензоил)-4-метил-1-(фенилсульфонил)-1H-индол-6-карбонитрила (250 мг, 0,429 ммоль). LC/MS (Способ h), Время удерживания=2,34 минуты; MS масса/заряд: 442 [M+H]+.
1H ЯМР (DMSO-d6, 300 МГц): δ 12,72 (широкий, 1H), 7,79 (m, 2H), 7,66 (d, J=6Гц, 1H), 7,33 и 7,12 (s, 1H), 7,24 (s, 1H), 3,66 (m, 4H), 3,56 (m, 2H), 3,18 (m, 2H), 2,48 (s, 3H).
Стадия 4: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензоил)-1,4-диметил-1H-индол-6-карбонитрил

Используя процедуру, аналогичную примеру A, стадии 4, 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензоил)-1,4-диметил-1H-индол-6-карбонитрил (49 мг, 29%) получали в виде желтого твердого вещества из 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензоил)-4-метил-1H-индол-6-карбонитрила (160 мг, 0,362 ммоль). LC/MS (Способ g), Время удерживания=1,58 минуты; MS масса/заряд: 456 [M+H]+.
1H ЯМР (DMSO-d6, 400 МГц): δ 8,21 (s, 1H), 7,75 (d, J=8Гц, 1H), 7,65 (d, J=8Гц, 1H), 7,30 и 7,10 (широкий, 1H), 7,29 (s, 1H), 4,20 (s, 3H), 3,65 (m, 4H), 3,54 (m, 2H), 3,19 (m, 2H), 2,48 (s, 3H).
Пример AE: 2-(2,6-диметил-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил
Стадия 1: 2-((2,6-диметил-3-(морфолин-4-карбонил)фенил)(гидрокси)метил)-4-метил-1-(фенилсульфонил)-1H-индол-6-карбонитрил
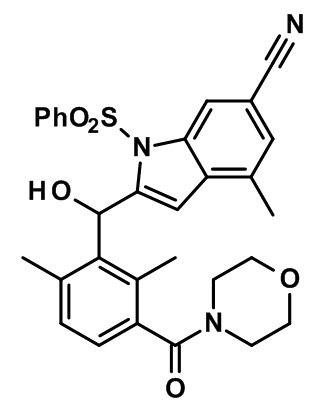
Используя процедуру, аналогичную примеру A, стадии 1, 2-((2,6-диметил-3-(морфолин-4-карбонил)фенил)(гидрокси)метил)-4-метил-1-(фенилсульфонил)-1H-индол-6-карбонитрил (730 мг, 71%) получали в виде желтого масла из N-(5-циано-2-йод-3-метилфенил)бензолсульфонамида (получение №18) (730 мг, 1,833 ммоль) и (3-(1-гидроксипроп-2-ин-1-ил)-2,4-диметилфенил)(морфолинo)метанона (получение №4) (601 мг, 2,2 ммоль).
LC/MS (Способ h), Время удерживания=2,66минуты; MS масса/заряд: 544 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 8,24 (d, J=9Гц, 1H), 8,08 (d, J=9Гц, 1H), 7,97 (d, J=9Гц, 1H), 7,95 (s, 1H), 7,71 (t, J=9Гц, 1H), 7,59 (t, J=9Гц, 2H), 7,48 (s, 1H), 7,06 (m, 1H), 6,78 и 6,72 (s, 1H), 6,80 и 6,42 (s, 1H), 6,30 (широкий, 1H), 3,64 (m, 4H), 3,47 (m, 2H), 3,12 (m, 2H), 2,89 (s, 3H), 2,73 (s, 3H), 2,36 и 2,39 (s, 3H).
Стадия 2: 2-(2,6-диметил-3-(морфолин-4-карбонил)бензил)-4-метил-1-(фенилсульфонил)-1H-индол-6-карбонитрил
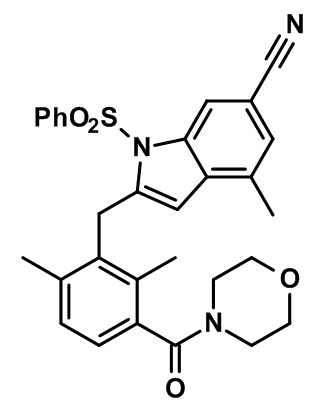
Используя процедуру, аналогичную примеру A, стадии 2, 2-(2,6-диметил-3-(морфолин-4-карбонил)бензил)-4-метил-1-(фенилсульфонил)-1H-индол-6-карбонитрил (700 мг, 100%) получали в виде желтого твердого вещества из 2-((2,6-диметил-3-(морфолин-4-карбонил)фенил)(гидрокси)метил)-4-метил-1-(фенилсульфонил)индолин-6-карбонитрила (725 мг, 1,329 ммоль). LC/MS (Способ h), Время удерживания=2,94 минуты; MS масса/заряд: 528 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 8,39 (s, 1H), 8,08 (m, 2H), 7,81 (m, 1H), 7,67 (m, 2H), 7,47 (s, 1H), 7,18 (d, J=9Гц, 1H), 7,07 (d, J=9Гц, 1H), 5,73 (s, 1H), 4,28 (m, 2H), 3,62 (m, 4H), 3,44 (m, 2H), 3,09 (m, 2H), 2,26 (s, 3H), 2,06 (s, 3H), 1,89 (s, 3H).
Стадия 3: 2-(2,6-диметил-3-(морфолин-4-карбонил)бензил)-4-метил-1H-индол-6-карбонитрил

Используя процедуру, аналогичную примеру A, стадии 3, 2-(2,6-диметил-3-(морфолин-4-карбонил)бензил)-4-метил-1H-индол-6-карбонитрил (380 мг, 64%) получали в виде желтого твердого вещества из 2-(2,6-диметил-3-(морфолин-4-карбонил)бензил)-4-метил-1-(фенилсульфонил)-1H-индол-6-карбонитрила (700 мг, 1,327 ммоль). LC/MS (Способ h), Время удерживания=2,52минуты; MS масса/заряд: 388 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 11,56 (широкий, 1H), 7,61 (s, 1H), 7,17 (d, J=6Гц, 1H), 7,06 (m, 1H), 7,03 (d, J=6Гц, 1H), 5,83 (s,1H), 4,18 (s, 2H), 3,64 (m, 4H), 3,47 (m, 2H), 3,12 (m, 2H), 2,35 (s, 3H), 2,30 (s, 3H), 2,13 (s, 3H).
Стадия 4: 2-(2,6-диметил-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил
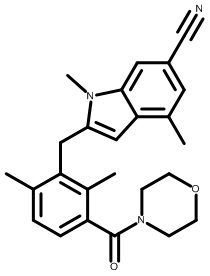
Используя процедуру, аналогичную примеру P, стадии 4, 2-(2,6-диметил-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрил (70 мг, 33%) получали в виде розового твердого вещества из 2-(2,6-диметил-3-(морфолин-4-карбонил)бензил)-4-метил-1H-индол-6-карбонитрила (200 мг, 0,516 ммоль). LC/MS (Способ g), Время удерживания=1,56минуты; MS масса/заряд: 402 [M+H]+ 1H ЯМР (DMSO-d6, 400 МГц): δ 7,90 (s, 1H), 7,19 (d, J=8Гц, 1H), 7,09 (m, 1H), 7,07 (d, J=8Гц, 1H), 5,53 (s, 1H), 4,18 (m, 2H), 3,90 (s, 3H), 3,65 (m, 4H), 3,50 (m, 2H), 3,13 (m, 2H), 2,29 (s, 3H), 2,25 (s, 3H), 2,10 (s, 3H).
Пример AF: транс-4-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклогексанкарбоновая кислота
Пример AF1: цис-4-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклогексанкарбоновая кислота
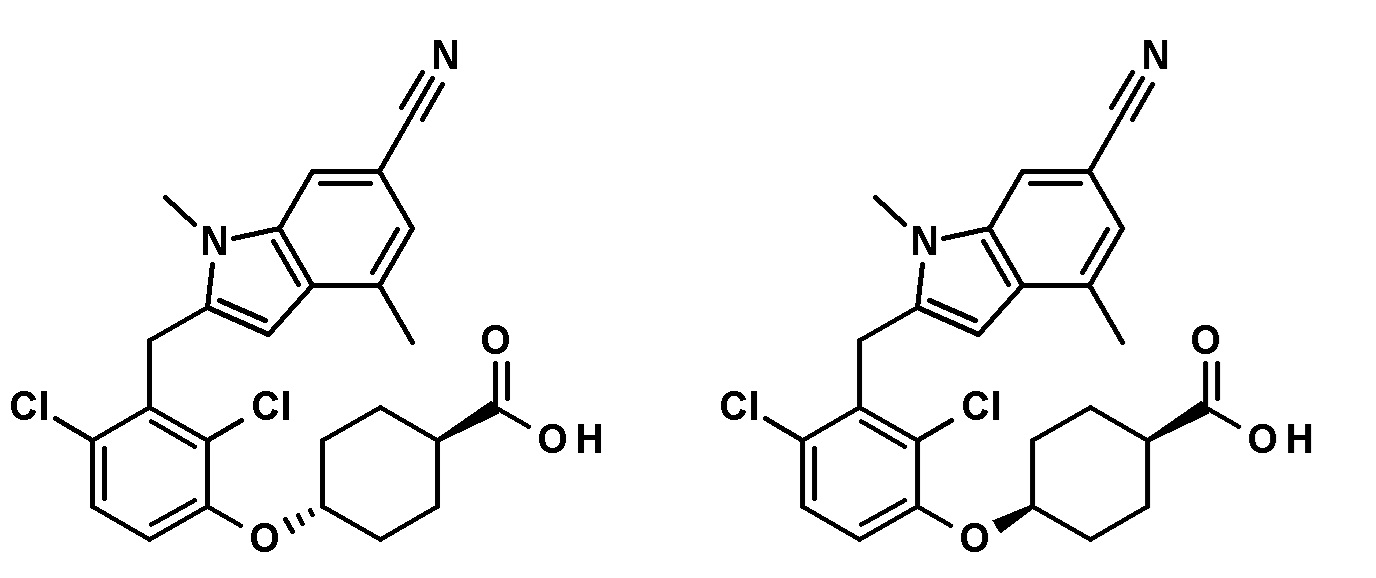
Стадия 1: 2-((2,6-дихлор-3-метоксифенил)(гидрокси)метил)-4-метил-1-(фенилсульфонил)-1H-индол-6-карбонитрил

Используя процедуру, аналогичную примеру A, стадии 1, 2-((2,6-дихлор-3-метоксифенил)(гидрокси)метил)-4-метил-1-(фенилсульфонил)-1H-индол-6-карбонитрил (2,25 г, 67%) получали в виде бежевого твердого вещества из 1-(2,6-дихлор-3-метоксифенил)проп-2-ин-1-ола (получение №7) (1,810 г, 7,83 ммоль) и N-(5-циано-2-йод-3-метилфенил)бензолсульфонамида (получение №18) (2,4 г, 6,03 ммоль). LC/MS (Способ h), Время удерживания=2,99минуты; MS масса/заряд: 559 [M-H]- +CH3COOH.
1H ЯМР (DMSO-d6, 300 МГц): δ 8,24 (s, 1H), 7,90 (m, 2H), 7,68 (m, 1H), 7,57 (m, 2H), 7,49 (s, 1H), 7,40 (d, J=9Гц, 1H), 7,14 (d, J=9Гц, 1H), 6,98 (dd, J=3Гц, 6Гц, 1H), 6,79 (s, 1H), 6,62 (d, J=6Гц, 1H), 3,86 (s, 3H), 2,41 (s, 3H).
Стадия 2: 2-(2,6-дихлор-3-метоксибензил)-4-метил-1-(фенилсульфонил)-1H-индол-6-карбонитрил
Используя процедуру, аналогичную примеру A, стадии 2, 2-(2,6-дихлор-3-метоксибензил)-4-метил-1-(фенилсульфонил)-1H-индол-6-карбонитрил (1,99 г, 84%) получали в виде желтого твердого вещества из 2-((2,6-дихлор-3-метоксифенил)(гидрокси)метил)-4-метил-1-(фенилсульфонил)-1H-индол-6-карбонитрила (2,2 г, 4,39 ммоль). LC/MS (Способ h), Время удерживания=3,50минуты; MS масса/заряд: 485 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 8,36 (s, 1H), 8,06 (m, 2H), 7,79 (t, J=9Гц, 1H), 7,67 (t, J=9Гц, 2H), 7,52 (d, J=9Гц, 1H), 7,48 (s, 1H), 7,28 (d, J=9H, 1H), 7,89 (s, 1H), 4,56 (s, 2H), 3,89 (s, 3H), 2,30 (s, 3H).
Стадия 3: 2-(2,6-дихлор-3-метоксибензил)-4-метил-1H-индол-6-карбонитрил

Используя процедуру, аналогичную примеру A, стадии 3, 2-(2,6-дихлор-3-метоксибензил)-4-метил-1H-индол-6-карбонитрил (1,22 г, 78%) получали в виде бежевого твердого вещества из 2-(2,6-дихлор-3-метоксибензил)-4-метил-1-(фенилсульфонил)-1H-индол-6-карбонитрила (1,99 г, 4,10 ммоль).
LC/MS (Способ h), Время удерживания=3,10минуты; MS масса/заряд: 345 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 11,61 (широкий, 1H), 7,63 (s, 1H), 7,52 (d, J=9Гц, 1H), 7,18 (d, J=9Гц, 1H), 7,07 (s, 1H), 5,96 (s, 1H), 4,42 (s, 2H), 3,89 (s, 3H), 2,36 (s, 3H).
Стадия 4: 2-(2,6-дихлор-3-метоксибензил)-1,4-диметил-1H-индол-6-карбонитрил

Используя процедуру, аналогичную примеру P, стадии 4, 2-(2,6-дихлор-3-метоксибензил)-1,4-диметил-1H-индол-6-карбонитрил (1,20 г, 80%) получали в виде розового твердого вещества из 2-(2,6-дихлор-3-метоксибензил)-4-метил-1H-индол-6-карбонитрила (1,2 г, 3,48 ммоль) LC/MS (Способ g), Время удерживания=1,96 минуты; MS масса/заряд: 359 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 7,91 (s, 1H), 7,55 (d, J=9Гц, 1H), 7,21 (d, J=9Гц, 1H), 7,10 (s, 1H), 5,68 (s, 1H), 4,41 (s, 2H), 3,91 (s, 3H), 3,90 (s, 3H), 2,32 (s, 3H).
Стадия 5: 2-(2,6-дихлор-3-гидроксибензил)-1,4-диметил-1H-индол-6-карбонитрил

Используя процедуру, аналогичную примеру X, 2-(2,6-дихлор-3-гидроксибензил)-1,4-диметил-1H-индол-6-карбонитрил (63 мг, 67%) получали в виде белого твердого вещества из 2-(2,6-дихлор-3-метоксибензил)-1,4-диметил-1H-индол-6-карбонитрила (200 мг, 0,557 ммоль). LC/MS (Способ g), Время удерживания=1,71 минуты; MS масса/заряд: 345 [M+H]+ 1H ЯМР (DMSO-d6, 400 МГц): δ 10,58 (широкий, 1H), 7,90 (s, 1H), 7,36 (d, J=8Гц, 1H), 7,10 (s, 1H), 7,02 (d, J=8Гц, 1H), 5,69 (s, 1H), 4,38 (s, 2H), 3,89 (s, 3H), 2,33 (s, 3H).
Стадия 6: этил-транс-4-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклогексанкарбоксилат и этил-цис-4-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклогексанкарбоксилат

В раствор этил-4-((метилсульфонил)окси)циклогексанкарбоксилата (описанного в WO2011/035159) (75 мг, 0,300 ммоль) в DMSO (0,5 мл) добавляли 2-(2,6-дихлор-3-гидроксибензил)-1,4-диметил-1H-индол-6-карбонитрил (100 мг, 0,290 ммоль) и карбонат цезия (123 мг, 0,377 ммоль) в DMSO (0,5 мл). Реакционную смесь перемешивали при 90°C в течение 26 часов. Смесь разбавляли водой и экстрагировали с помощью EtOAc. Органический слой промывали солевым раствором и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 10% EtOAc в циклогексане) с получением этил-транс-4-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклогексанкарбоксилата (15 мг, 10%) LC/MS (Способ k), Время удерживания=4,04 минуты; MS масса/заряд: 499 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 7,91 (s, 1H), 7,48 (d, J=9Гц, 1H), 7,31 (d, J=9Гц, 1H), 7,11 (s, 1H), 5,68 (s, 1H), 4,47 (m, 1H), 4,40 (s, 2H), 4,08 (m, 2H), 3,89 (s, 3H), 2,37 (m, 1H), 2,32 (s, 3H), 2,06 (m, 2H), 1,94 (m, 2H), 1,51 (m, 4H), 1,16 (m, 3H) и этил-цис-4-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклогексанкарбоксилата (26 мг, 18%) в виде белых твердых веществ. LC/MS (Способ k), Время удерживания=4,04 минуты; MS масса/заряд: 499 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 7,91 (s, 1H), 7,48 (d, J=9Гц, 1H), 7,31 (d, J=9Гц, 1H), 7,11 (s, 1H), 5,68 (s, 1H), 4,47 (m, 1H), 4,40 (s, 2H), 4,08 (m, 2H), 3,89 (s, 3H), 2,37 (m, 1H), 2,32 (s, 3H), 2,06 (m, 2H), 1,94 (m, 2H), 1,51 (m, 4H), 1,16 (m, 3H).
Стадия 7: транс-4-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклогексанкарбоновая кислота

Используя процедуру, аналогичную примеру A, стадии 5, транс-4-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклогексанкарбоновую кислоту (16,5 мг, 45%) получали в виде белого твердого вещества из этил-транс-4-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклогексанкарбоксилата (37 мг, 0,074 ммоль). LC/MS (Способ g), Время удерживания=1,87 минуты; MS масса/заряд: 471 [M+H]+ 1H ЯМР (DMSO-d6, 500 МГц): δ 12,12 (широкий, 1H), 7,90 (s, 1H), 7,48 (d, J=9Гц, 1H), 7,30 (d, J=9Гц, 1H), 7,10 (s, 1H), 5,69 (s, 1H), 4,45 (m, 1H), 4,40 (s, 2H), 3,89 (s, 3H), 2,32 (s, 3H), 2,28 (m, 1H), 2,08 (m, 2H), 1,95 (m, 2H), 1,49 (m, 4H).
Стадия 7a: цис-4-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклогексанкарбоновая кислота
Используя процедуру, аналогичную примеру A, стадии 5, цис-4-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклогексанкарбоновую кислоту (14,5 мг, 54%) получали в виде белого твердого вещества из этил-цис-4-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклогексанкарбоксилата (26 мг, 0,052 ммоль). LC/MS (Способ g), Время удерживания=1,89 минуты; MS масса/заряд: 471 [M+H]+ 1H ЯМР (DMSO-d6, 500 МГц): δ 12,10 (широкий, 1H), 7,91 (s, 1H), 7,49 (d, J=9Гц, 1H), 7,26 (d, J=9Гц, 1H), 7,11 (s, 1H), 5,69 (s, 1H), 4,72 (m, 1H), 4,41 (s, 2H), 3,90 (s, 3H), 2,39 (m, 1H), 2,32 (s, 3H), 1,87 (m, 2H), 1,77 (m, 2H), 1,69 (m, 4H).
Пример AG: транс-3-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклопентанкарбоновая кислота
Пример AG1: цис-3-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклопентанкарбоновая кислота
Стадия 1: этил-транс-3-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклопентанкарбоксилат и этил-цис-3-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклопентанкарбоксилат

Используя процедуру, аналогичную примеру AF, стадии 6, этил-транс-3-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклопентанкарбоксилат (52 мг, 32%) LC/MS (Способ h), Время удерживания=3,62 минуты; MS масса/заряд: 485 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 7,90 (s, 1H), 7,51 (d, J=9Гц, 1H), 7,21 (d, J=9Гц, 1H), 7,11 (s, 1H), 5,68 (s, 1H), 5,05 (m, 1H), 4,40 (s, 2H), 4,07 (q, J=6Гц, 2H), 3,89 (s, 3H), 3,01 (m, 1H), 2,32 (s, 3H), 2,09 (m, 4H), 1,81 (m, 2H), 1,18 (t, J=6Гц, 3H);
и этил-цис-3-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклопентанкарбоксилат (15 мг, 9%) получали из 2-(2,6-дихлор-3-гидроксибензил)-1,4-диметил-1H-индол-6-карбонитрила (пример AF, стадия 5) (100 мг, 0,290 ммоль) и этил-3-((метилсульфонил)окси)циклопентанкарбоксилата (получение №12) (90 мг, 0,381 ммоль).
LC/MS (Способ h), Время удерживания=3,54 минуты; MS масса/заряд: 485 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 7,90 (s, 1H), 7,50 (d, J=9Гц, 1H), 7,20 (d, J=9Гц, 1H), 7,11 (s, 1H), 5,70 (s, 1H), 4,97 (m, 1H), 4,40 (s, 2H), 4,01 (q, J=6Гц, 2H), 3,89 (s, 3H), 2,92 (m, 1H), 2,32 (s, 3H), 2,28 (m, 1H), 2,09 (m, 2H), 1,94 (m, 3H), 1,10 (t, J=6Гц, 3H).
Стадия 2: транс-3-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклопентанкарбоновая кислота

Используя процедуру, аналогичную примеру A, стадии 5, транс-3-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклопентанкарбоновую кислоту (35 мг, 48%) получали из этил-транс-3-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклопентанкарбоксилата (73 мг, 0,150 ммоль). LC/MS (Способ g), Время удерживания=1,85 минуты; MS масса/заряд: 457 [M+H]+ 1H ЯМР (DMSO-d6, 500 МГц): δ 12,21 (широкий, 1H), 7,90 (s, 1H), 7,50 (d, J=9Гц, 1H), 7,22 (d, J=9Гц, 1H), 7,10 (s, 1H), 5,69 (s, 1H), 5,04 (m, 1H), 4,40 (s, 2H), 3,89 (s, 3H), 2,94 (m, 1H), 2,32 (s, 3H), 2,11 (m, 2H), 2,05 (m, 2H), 1;80 (m, 2H).
Стадия 2a: цис-3-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклопентанкарбоновая кислота
Используя процедуру, аналогичную примеру A, стадии 5, цис-3-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклопентанкарбоновую кислоту (5 мг, 21%) получали из этил-цис-3-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклопентанкарбоксилата (24 мг, 0,049 ммоль). LC/MS (Способ g), Время удерживания=1,83 минуты; MS масса/заряд: 457 [M+H]+ 1H ЯМР (DMSO-d6, 500 МГц): δ 12,15 (широкий, 1H), 7,90 (s, 1H), 7,50 (d, J=9Гц, 1H), 7,19 (d, J=9Гц, 1H), 7,10 (s, 1H), 5,69 (s, 1H), 4,94 (m, 1H), 4,40 (s, 2H), 3,89 (s, 3H), 2,81 (s, 1H), 2,36 (m, 1H), 2,32 (s, 3H), 1,94 (m, 5H).
Пример AH: транс-3-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклобутанкарбоновая кислота
Пример AH1: цис-3-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклобутанкарбоновая кислота

Стадия 1: этил-транс-3-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклобутанкарбоксилат и этил-цис-3-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклобутанкарбоксилат

Используя процедуру, аналогичную примеру AF, стадии 6, метил-транс-3-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклобутанкарбоксилат (200 мг, 29%).
LC/MS (Способ h), Время удерживания=3,37 минуты; MS масса/заряд: 457 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,91 (s, 1H), 7,49 (d, J=8,9 Гц, 1H), 7,11 (s, 1H), 6,99 (d, J=8,9 Гц, 1H), 5,68 (s, 1H), 4,96 (m, 1H), 4,41 (s, 2H), 3,90 (s, 3H), 3,67 (s, 3H), 3,23 (m, 1H), 2,73 (m, 2H), 2,43 (m, 2H), 2,32 (s, 3H) и метил-цис-3-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклобутанкарбоксилат (75 мг, 11%) LC/MS (Способ h), Время удерживания=3,30 минуты; MS масса/заряд: 457 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,91 (s, 1H), 7,50 (d, J=8,9 Гц, 1H), 7,11 (s, 1H), 7,05 (d, J=9,1 Гц, 1H), 5,68 (m, 1H), 4,79 (m, 1H), 4,41 (s, 2H), 3,90 (s, 3H), 3,63 (s, 3H), 2,80 (m, 3H), 2,32 (s, 3H), 2,25 (m, 2H) получали из 2-(2,6-дихлор-3-гидроксибензил)-1,4-диметил-1H-индол-6-карбонитрила (пример AF, стадия 5) (400 мг, 1,16 ммоль) и метил-3-((метилсульфонил)окси)циклобутанкарбоксилата (описанного в WO2011/035159) (314 мг, 1,50 ммоль).
Стадия 2: транс-3-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклобутанкарбоновая кислота

Используя процедуру, аналогичную примеру A, стадии 5, транс-3-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклобутанкарбоновую кислоту (130 мг, 71%) получали из метил-транс-3-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклобутанкарбоксилата (180 мг, 0,38 ммоль). LC/MS (Способ g), Время удерживания=1,79 минуты; MS масса/заряд: 443 [M+H]+ 1H ЯМР (DMSO-d6, 500МГц): δ 12,40 (широкий, 1H), 7,91 (s, 1H), 7,49 (d, J=8,9 Гц, 1H), 7,11 (s, 1H), 7,00 (d, J=9,1 Гц, 1H), 5,70 (s, 1H), 4,96 (m, 1H), 4,42 (s, 2H), 3,91 (s, 3H), 3,11 (m, 1H), 2,72 (m, 2H), 2,41 (m, 2H), 2,33 (s, 3H).
Step 2a: цис-3-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклобутанкарбоновая кислота

Используя процедуру, аналогичную примеру A, стадии 5, цис-3-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклобутанкарбоновую кислоту (35 мг, 44%) получали из метил-цис-3-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)фенокси)циклобутанкарбоксилата (70 мг, 0,15 ммоль). LC/MS (Способ g), Время удерживания=1,76 минуты; MS масса/заряд: 443 [M+H]+ 1H ЯМР (DMSO-d6, 500МГц): δ 12,34 (широкий, 1H), 7,91 (s, 1H), 7,50 (d, J=8,9 Гц, 1H), 7,10-7,15 (m, 1H), 7,06 (d, J=8,9 Гц, 1H), 5,69 (s, 1H), 4,78 (m, 1H), 4,42 (s, 2H), 3,91 (s, 3H), 2,77 (m, 3H), 2,33 (s, 3H), 2,24 (m, 2H).
Пример AI: транс-4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклогексанкарбоновая кислота
Example AI1: цис-4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклогексанкарбоновая кислота

Стадия 1: этил-транс-4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклогексанкарбоксилат и этил-цис-4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклогексанкарбоксилат
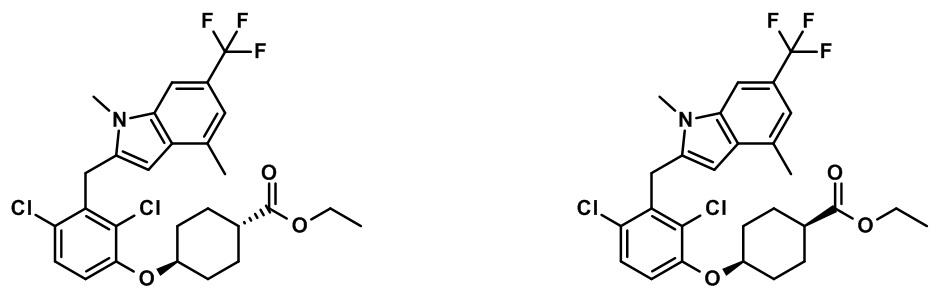
Используя процедуру, аналогичную примеру AF, стадии 6, этил-транс-4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклогексанкарбоксилат (48 мг, 14%)
LC/MS (Способ h), Время удерживания=3,99 минуты; MS масса/заряд: 542 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,69 (s, 1H), 7,49 (d, J=9,1 Гц, 1H), 7,30 (d, J=9,1 Гц, 1H), 7,05 (s, 1H), 5,66 (s, 1H), 4,47 (m, 2H), 4,40 (q, J=7,1 Гц, 2H), 4,07 (m, 2H), 3,91 (s, 3H), 3,30 (s, 1H), 2,32 (m, 4H), 2,08 (m, 1H), 1,95 (m, 1H), 1,52 (m, 4H), 1,19 (t, J=7,1 Гц, 3H) и этил-цис-4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклогексанкарбоксилат (70 мг, 25%) LC/MS (Способ h), Время удерживания=3,96 минуты; MS масса/заряд: 542 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,69 (s, 1H), 7,49 (d, J=9,1 Гц, 1H), 7,26 (d, J=9,1 Гц, 1H), 7,06 (s, 1H), 5,66 (s, 1H), 4,74 (m, 1H), 4,41 (m, 2H), 4,05 (q, J=7,0 Гц, 2H), 3,91 (m, 4H), 3,30 (s, 1H), 2,36 (m, 4H), 1,87 (m, 2H), 1,65 (m, 4H), 1,16 (t, J=7,1 Гц, 3H) получали из 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенола (200 мг, 0,51 ммоль) (пример X) и этил-4-((метилсульфонил)окси)циклогексанкарбоксилата (193 мг, 0,77 ммоль).
Стадия 7: транс-4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклогексанкарбоновая кислота

Используя процедуру, аналогичную примеру A, стадии 5, транс-4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклогексанкарбоновую кислоту (13 мг, 28%) получали из этил-транс-4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклогексанкарбоксилата (48 мг, 0,088 ммоль). LC/MS (Способ g), Время удерживания=2,12 минуты; MS масса/заряд: 514 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 12,15 (широкий 1H), 7,69 (s, 1H), 7,49 (d, J=9,0 Гц, 1H), 7,30 (d, J=9,0 Гц, 1H), 7,05 (s, 1H), 5,66 (s, 1H), 4,46 (m, 1H), 4,40 (s, 2H), 3,91 (s, 3H), 2,32 (s, 3H), 2,30 (m, 1H), 2,08 (m, 2H), 1,97 (m, 2H), 149 (m, 4H).
Стадия 7a: цис-4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклогексанкарбоновая кислота

Используя процедуру, аналогичную примеру A, стадии 5, цис-4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклогексанкарбоновую кислоту (23 мг, 46%) получали из этил-цис-4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклогексанкарбоксилата (52 мг, 0,096 ммоль). LC/MS (Способ g), Время удерживания=2,11 минуты; MS масса/заряд: 514 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 12,08 (широкий, 1H), 7,69 (s, 1H), 7,49 (d, J=9,0 Гц, 1H), 7,26 (d, J=9,0 Гц, 1H), 7,05 (s, 1H), 5,66 (s, 1H), 4,72 (m, 1H), 4,41 (s, 2H), 3,91 (s, 3H), 2,36 (s, 4H), 1,87 (широкий, 2H), 1,78 (t, J=10,2 Гц, 2H), 1,61-1,74 (m, 4H).
Пример AJ: транс-4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклогексанкарбоновая кислота
Пример AJ1: цис-4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклогексанкарбоновая кислота
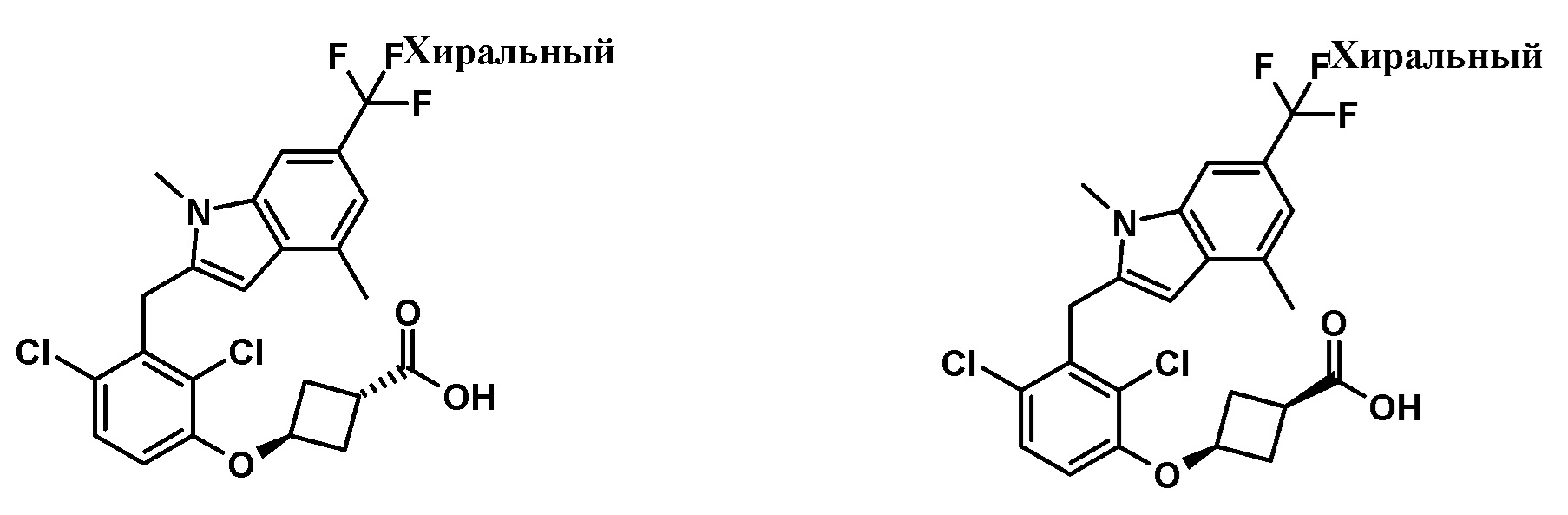
Стадия 1: метил-транс-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклобутанкарбоксилат и метил-цис-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклобутанкарбоксилат

Используя процедуру, аналогичную примеру AF, стадии 6, метил-транс-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклобутанкарбоксилат (200 мг, 63%).
LC/MS (Способ h), Время удерживания=3,72 минуты; MS масса/заряд: 500 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,69 (s, 1H), 7,49 (d, J=8,9 Гц, 1H), 7,06 (s, 1H), 6,99 (d, J=8,9 Гц, 1H), 5,66 (s, 1H), 4,97 (m, 1H), 4,41 (s, 2H), 3,91 (s, 3H), 3,67 (s, 3H), 3,23 (m, 1H), 2,72 (m, 2H), 2,44 (m, 2H), 2,36 (s, 3H) и метил-цис-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклобутанкарбоксилат.
LC/MS (Способ h), Время удерживания=3,65 минуты; MS масса/заряд: 500 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,69 (s, 1H), 7,50 (d, J=8,9 Гц, 1H), 7,02-7,09 (m, 2H), 5,65 (s, 1H), 4,80 (m, 1H), 4,40 (s, 2H), 3,91 (s, 3H), 3,63 (s, 3H), 2,86 (m, 3H), 2,36 (s, 3H), 2,26 (m, 2H) получали из 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенола (пример AI, стадия 5) (200 мг, 0,51 ммоль) и метил-3-((метилсульфонил)окси)циклобутанкарбоксилата (161 мг, 0,77 ммоль).
Стадия 2: транс-4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклогексанкарбоновая кислота
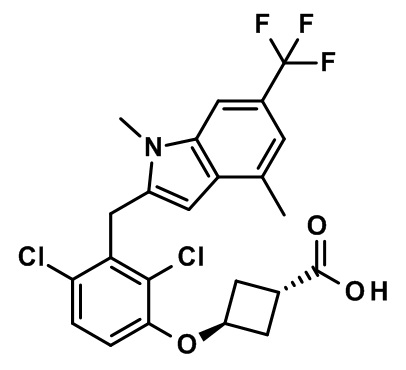
Используя процедуру, аналогичную примеру A, стадии 5, транс-4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклогексанкарбоновую кислоту (125 мг, 98%) получали из метил-транс-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклобутанкарбоксилата (130 мг, 0,26 ммоль). LC/MS (Способ g), Время удерживания=2,05 минуты; MS масса/заряд: 486 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 12,36 (широкий, 1H), 7,69 (s, 1H), 7,48 (d, J=9,0 Гц, 1H), 7,05 (s, 1H), 6,99 (d, J=9,0 Гц, 1H), 5,66 (s, 1H), 4,95 (m, 1H), 4,41 (s, 2H), 3,91 (s, 3H), 3,12 (m, 1H), 2,70 (m, 2H), 2,41 (m, 2H), 2,36 (s, 3H).
Стадия 2a: цис-4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклогексанкарбоновая кислота

Используя процедуру, аналогичную примеру A, стадии 5, цис-4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклогексанкарбоновую кислоту (25 мг, 70%) получали из метил-цис-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклобутанкарбоксилата (33 мг, 0,066 ммоль). LC/MS (Способ g), Время удерживания=2,02 минуты; MS масса/заряд: 486 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 12,35 (широкий, 1H), 7,69 (s, 1H), 7,49 (d, J=8,8 Гц, 1H), 7,03-7,08 (m, 2H), 5,66 (s, 1H), 4,78 (m, 1H), 4,40 (s, 2H), 3,91 (s, 3H), 2,76 (m, 3H), 2,36 (s, 3H), 2,22 (m, 2H).
Пример AK: транс-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклопентанкарбоновая кислота
Пример AK1: цис-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклопентанкарбоновая кислота

Стадия 1: этил-транс-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклопентанкарбоксилат и этил-цис-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклопентанкарбоксилат

Используя процедуру, аналогичную примеру AF, стадии 6, этил-транс-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклопентанкарбоксилат (125 мг, 46%).
LC/MS (Способ h), Время удерживания=3,94 минуты; MS масса/заряд: 528 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,69 (s, 1H), 7,51 (d, J=9,1 Гц, 1H), 7,22 (d, J=9,1 Гц, 1H), 7,06 (s, 1H), 5,66 (s, 1H), 5,06 (m, 1H), 4,40 (s, 2H), 4,03 (q, J= 7,1Гц, 2H), 3,91 (s, 3H), 3,02 (m, 1H), 2,36 (s, 3H), 2,10 (m, 4H), 1,80 (m, 2H), 1,20 (t, J= 7,1Гц, 3H) и этил-цис-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклопентанкарбоксилат (55 мг, 20%) (содержащий 20% транс-изомера).
LC/MS (Способ h), Время удерживания=3,86 минуты; MS масса/заряд: 528 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,69 (s, 1H), 7,50 (d, J=9,1 Гц, 1H), 7,19 (d, J=9,1 Гц, 1H), 7,05 (s, 1H), 5,67 (s, 1H), 4,97 (m, 1H), 4,39 (s, 3H), 3,02 (q, J=7,1 Гц, 2H), 3,91 (s, 3H), 2,92 (m, 1H), 2,32 (m, 4H), 1,95 (m, 4H), 1,11 (t, J=7,1 Гц, 3H).
получали из 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенола (пример AI, стадия 5) (200 мг, 0,51 ммоль) и этил-3-((метилсульфонил)окси)циклопентанкарбоксилата (получение №12) (183 мг, 0,77 ммоль).
Стадия 2: транс-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклопентанкарбоновая кислота

Используя процедуру, аналогичную примеру A, стадии 5, транс-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклопентанкарбоновую кислоту (80 мг, 68%) получали из этил-транс-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклопентанкарбоксилата (122 мг, 0,23 ммоль). LC/MS (Способ g), Время удерживания=2,09 минуты; MS масса/заряд: 500 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 12,21 (широкий, 1H), 7,69 (s, 1H), 7,51 (d, J=9,0 Гц, 1H), 7,22 (d, J=9,0 Гц, 1H), 7,05 (s, 1H), 5,66 (s, 1H), 5,04 (m, 1H), 4,40 (s, 2H), 3,91 (s, 3H), 2,95 (m, 1H), 2,36 (s, 3H), 2,08 (m, 4H), 1,81 (m, 2H).
Стадия 2a: цис-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклопентанкарбоновая кислота
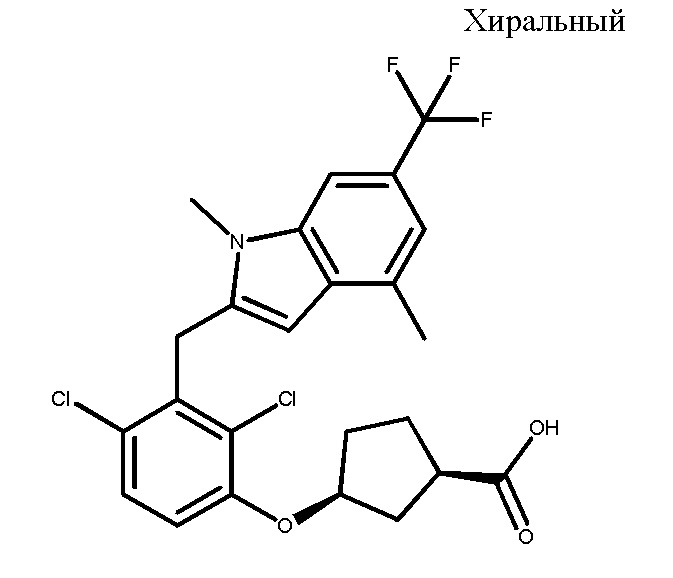
Используя процедуру, аналогичную примеру A, стадии 5, цис-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклопентанкарбоновую кислоту (18 мг, 34%) (содержащую 20% транс-изомера) получали из этил-цис-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенокси)циклопентанкарбоксилата (52 мг, 0,098 ммоль).
LC/MS (Способ g), Время удерживания=2,07 минуты; MS масса/заряд: 500 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 12,14 (широкий, 1H), 7,69 (s, 1H), 7,50 (d, J=9,2 Гц, 1H), 7,19 (d, J=9,2 Гц, 1H), 7,05 (s, 1H), 5,66 (s, 1H), 4,95 (m, 1H), 4,39 (s, 2H), 3,91 (s, 3H), 2,80 (m, 1H), 2,36 (m, 4H), 1,92 (m, 5H).
Пример AL: 2-((3,5-дихлор-2-((тетрагидро-2H-пиран-4-ил)метокси)пиридин-4-ил)метил)-1,4-диметил-6-(трифторметил)-1H-индол
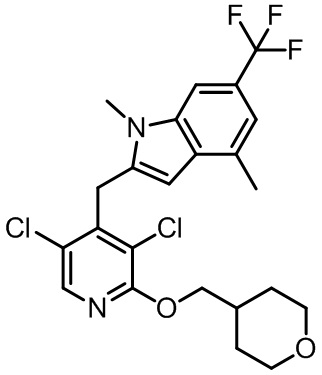
Стадия 1: 3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиридин-2-ол
Используя процедуру, аналогичную примеру X, 3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиридин-2-ол (716 мг, 100%) получали из 2-((3,5-дихлор-2-метоксипиридин-4-ил)метил)-1,4-диметил-6-(трифторметил)-1H-индола (пример Z, стадия 4) (647 мг, 1,6 ммоль).LC/MS (Способ h), Время удерживания=2,68 минуты; MS масса/заряд: 389 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 12,60 (широкий, 1H), 7,81 (s, 1H), 7,70 (s, 1H), 7,07 (s, 1H), 5,97 (s, 1H), 4,31 (s, 2H), 3,89 (s, 3H), 2,41 (s, 3H).
Стадия 2: 2-((3,5-дихлор-2-((тетрагидро-2H-пиран-4-ил)метокси)пиридин-4-ил)метил)-1,4-диметил-6-(трифторметил)-1H-индол и 3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)-1-((тетрагидро-2H-пиран-4-ил)метил)пиридин-2(1H)-он
В раствор 3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиридин-2-ола (200 мг, 0,514 ммоль) в DMF (2,6 мл) добавляли карбонат калия (284 мг, 2,056 ммоль) и 4-(бромметил)тетрагидропиран (0,135 мл, 1,028 ммоль) и реакционную смесь перемешивали при 100°C в течение 2 часов. Реакционную смесь разбавляли водой и полученный водный слой экстрагировали с помощью EtOAc. Полученный органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 5-100% EtOAc в DCM), затем препаративной LCMS с получением 2-((3,5-дихлор-2-((тетрагидро-2H-пиран-4-ил)метокси)пиридин-4-ил)метил)-1,4-диметил-6-(трифторметил)-1H-индола (108 мг, 40%) в виде белого твердого вещества LC/MS (Способ g), Время удерживания=2,26 минуты; MS масса/заряд: 487 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 8,32 (m, 1H), 7,70 (s, 1H), 7,07 (s, 1H), 5,80 (s, 1H), 4,42 (s, 2H), 4,24 (d, J=6,3 Гц, 2H), 3,91 (s, 3H), 3,88 (m, 2H), 3,34 (m, 2H), 2,38 (s, 3H), 2,07 (m, 1H), 1,68 (m, 2H), 1,39 (m, 2H) и 3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)-1-((тетрагидро-2H-пиран-4-ил)метил)пиридин-2(1H)-она (46 мг, 18%) в виде белого твердого вещества. LC/MS (Способ g), Время удерживания=1,84 минуты; MS масса/заряд: 487 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 8,14 (s, 1H), 7,69 (s, 1H), 7,07 (s, 1H), 6,00 (s, 1H), 4,30 (s, 2H), 3,82-3,95 (m, 7H), 3,20-3,30 (m, 2H), 2,41 (s, 3H), 2,09 (m, 1H), 1,48 (m, 2H), 1,30 (m, 2H).
Пример AM: 2-((1-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)окси)уксусная кислота

Стадия 1: этил-2-((1-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)окси)ацетат

Используя процедуру, аналогичную примеру A, стадии 6, этил-2-((1-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)окси)ацетат (337 мг, 88%) получали в виде оранжевого масла из 2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)бензойной кислоты (пример AA, стадия 5) (150 мг, 0,402 ммоль) и N-1-((этилимино)метилен)-N3,N3-диметилпропан-1,3-диамина гидрохлорида (100 мг, 0,52 ммоль) и использовали неочищенным на следующей стадии.
LC/MS (Способ h), Время удерживания=2,90 минуты; MS масса/заряд: 542 [M+H]+.
Стадия 2: 2-((1-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)окси)уксусная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2-((1-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)окси)уксусную кислоту (33 мг, 18%) получали в виде белого твердого вещества из этил-2-((1-(2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)окси)ацетата (336 мг, 0,353 ммоль). LC/MS (Способ g), Время удерживания=1,52 минуты; MS масса/заряд: 514 [M+H]+ 1H ЯМР (DMSO-d6, 400 МГц): δ 12,57 (широкий, 1H), 7,92 (s, 1H), 7,66 (d, J=9Гц, 1H), 7,46 и 7,42 (d, J=9Гц, 1H), 7,12 (s, 1H), 5,70 (m, 1H), 4,47 (m, 2H), 4,05 и 4,03 (s, 2H), 3,96 (m, 1H), 3,90 (s, 3H), 3,63 (m, 1H), 3,37 (m, 2H), 3,05 (m, 1H), 2,33 (s, 3H), 1,91 (m, 1H), 1,78 (m, 1H), 1,60-1,40 (m, 2H).
Таблица AM. Следующие примеры получали при помощи такой же процедуры, начиная с соответствующих сложных эфиров из таблицы AA.
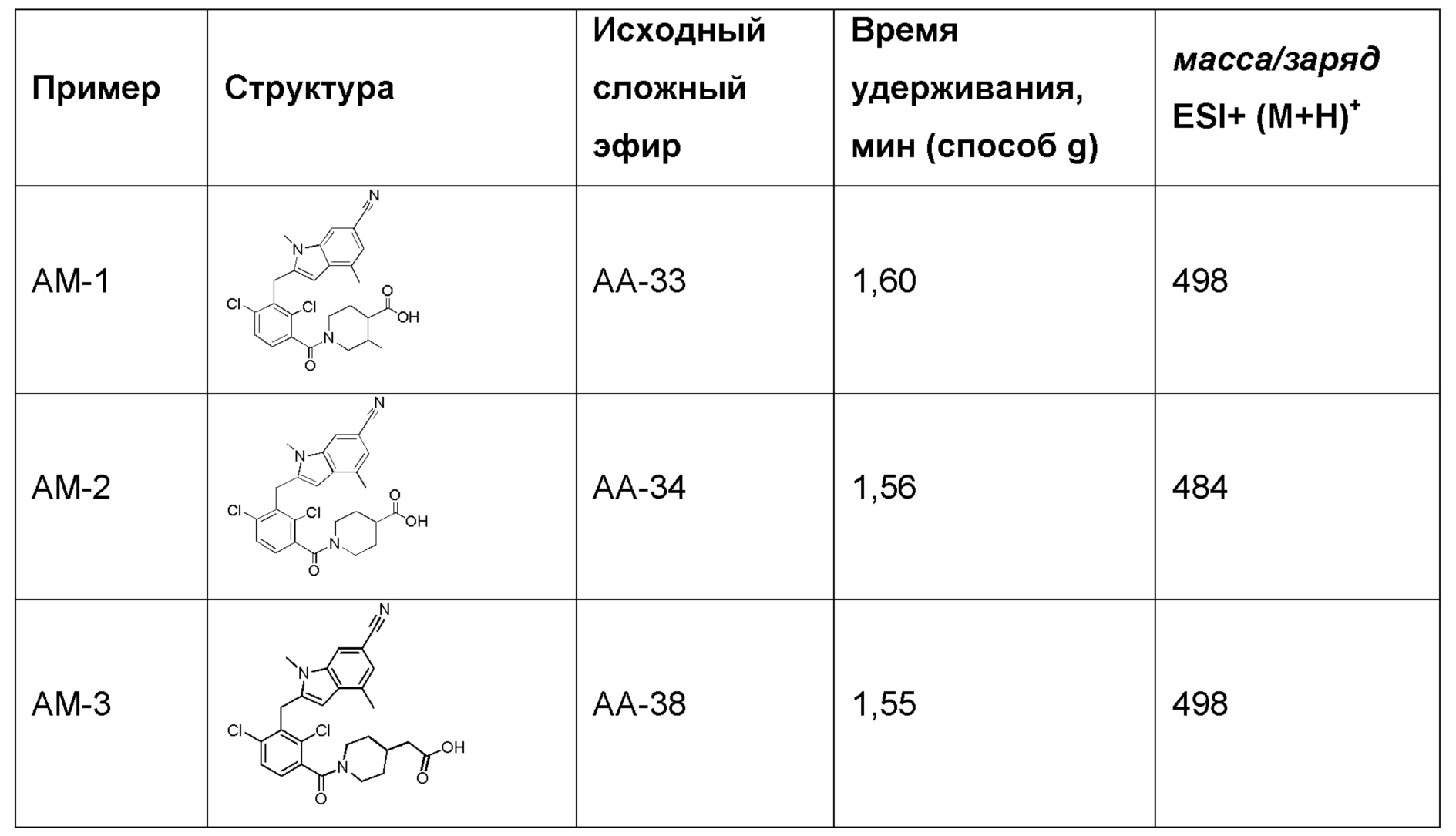
Пример AN: 2-(2,6-дихлор-3-(4-гидроксипиперидин-1-карбонил)бензоил)-1,4-диметил-1H-индол-6-карбонитрил

Стадия 1: метил-2,4-дихлор-3-(6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-карбонил)бензоат


Используя процедуру, аналогичную примеру AD, стадии 2, метил-2,4-дихлор-3-(6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-карбонил)бензоат (5,98 г, 100%) получали в виде бежевой пены из метил-2,4-дихлор-3-((6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)бензоата (пример AA, стадия 1) (6 г, 11,33 ммоль). LC/MS (Способ i), Время удерживания=2,57 минуты; MS масса/заряд: 527 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 8,54 (s, 1H), 8,29 (m, 2H), 8,05 (m, 2H), 7,68-7,91 (m, 4H), 7,63 (m, 1H), 3,88 (s, 3H), 2,26 (s, 3H).
Стадия 2: метил-2,4-дихлор-3-(6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-карбонил)бензоат
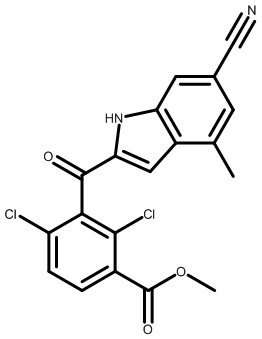
Используя процедуру, аналогичную примеру A, стадии 3, метил-2,4-дихлор-3-(6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-карбонил)бензоат (3,32 г, 76%) получали в виде бежевой пены из метил-2,4-дихлор-3-(6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-карбонил)бензоата (5,98 г, 11,34 ммоль). LC/MS (Способ i), Время удерживания=2,33 минуты; MS масса/заряд: 387 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 12,72 (s, 1H), 8,03 (d, J=8,4 Гц, 1H), 7,80 (m, 2H), 7,15 (m, 2H), 3,90 (s, 3H), 2,50 (s, 3H).
Стадия 3: метил-2,4-дихлор-3-(6-циано-1,4-диметил-1H-индол-2-карбонил)бензоат
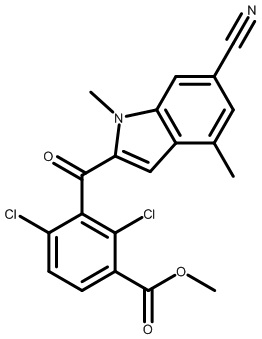
Используя процедуру, аналогичную примеру A, стадии 4, метил-2,4-дихлор-3-(6-циано-1,4-диметил-1H-индол-2-карбонил)бензоат (3,34 г, 97%) получали в виде белого твердого вещества из метил-2,4-дихлор-3-(6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-карбонил)бензоата (3,32 г, 8,57 ммоль).
LC/MS (Способ i), Время удерживания=2,49 минуты; MS масса/заряд: 401 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 8,20 (s, 1H), 8,03 (d, J=8,1 Гц, 1H), 7,79 (d, J=8,1 Гц, 1H), 7,26-7,34 (m, 1H), 7,20 (s, 1H), 4,20 (s, 3H), 3,90 (s, 3H), 2,47 (s, 3H).
Стадия 4: 2,4-дихлор-3-(6-циано-1,4-диметил-1H-индол-2-карбонил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-(6-циано-1,4-диметил-1H-индол-2-карбонил)бензойную кислоту (3,22 г, 100%) получали в виде белого твердого вещества из метил-2,4-дихлор-3-(6-циано-1,4-диметил-1H-индол-2-карбонил)бензоата (3,34 г, 8,32 ммоль).
LC/MS (Способ i), Время удерживания=2,12 минуты; MS масса/заряд: 387 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 8,20 (s, 1H), 8,00 (d, J=8,6 Гц, 1H), 7,75 (d, J=8,6 Гц, 1H), 7,29 (m, 1H), 7,17 (m, 1H), 4,20 (s, 3H), 2,47 (s, 3H).
Стадия 5: 2-(2,6-дихлор-3-(4-гидроксипиперидин-1-карбонил)бензоил)-1,4-диметил-1H-индол-6-карбонитрил

Используя процедуру, аналогичную примеру A, стадии 6, 2-(2,6-дихлор-3-(4-гидроксипиперидин-1-карбонил)бензоил)-1,4-диметил-1H-индол-6-карбонитрил (101 мг, 83%) получали в виде желтого твердого вещества из 2,4-дихлор-3-(6-циано-1,4-диметил-1H-индол-2-карбонил)бензойной кислоты (100 мг, 0,26 ммоль) и пиперидин-4-ола (39 мг, 0,38 ммоль). LC/MS (Способ g), Время удерживания=1,47 минуты; MS масса/заряд: 470 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 8,20 (s, 1H), 7,74 (d, J=8,4 Гц, 1H), 7,61 (m, 1H), 7,29 (s, 1H), 7,20 и 7,07 (m, 1H), 4,81 и 4,76 (m, 1H), 4,20 и 4,19 (s, 3H), 4,02 (m, 1H), 3,75 (m, 1H), 3,25 (m, 1H), 3,08 (m, 1H), 2,48 (s, 3H), 1,70 (m, 2H), 1,35 (m, 2H).
Таблица AN. Следующие промежуточные соединения получали из 2,4-дихлор-3-(6-циано-1,4-диметил-1H-индол-2-карбонил)бензойной кислоты (пример AN, стадия 4) при помощи такой же процедуры с соответствующим амином.

Пример AO: 2-(1-(2,4-дихлор-3-(6-циано-1,4-диметил-1H-индол-2-карбонил)бензоил)пиперидин-4-ил)уксусная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-(6-циано-1,4-диметил-1H-индол-2-карбонил)бензоил)пиперидин-4-ил)уксусную кислоту (107 мг, 94%) получали в виде белого твердого вещества из метил-2-(1-(2,4-дихлор-3-(6-циано-1,4-диметил-1H-индол-2-карбонил)бензоил)пиперидин-4-ил)ацетата (таблица AN, пример AN-6) (116 мг, 0,22 ммоль). LC/MS (Способ g), Время удерживания=1,54 минуты; MS масса/заряд: 512 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 12,12 (широкий., 1H), 8,20 (s, 1H), 7,75 (m, 1H), 7,63 и 7,57 (d, J=8,4 Гц, 1H), 7,29 (s, 1H), 7,01-7,26 (m, 1H), 4,47 (m, 1H), 4,20 и 4,19 (s, 3H), 3,55 (m, 1H), 3,06 (m, 1H), 2,81 (m, 1H), 2,48 (m, 3H), 2,19 (m, 1H), 2,13 (m, 1H), 1,95 (m, 1H), 1,77 (m, 1H), 1,64 (m, 1H), 1,14 (m, 2H).
Пример AP: (2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)фенил)(морфолинo)метанон
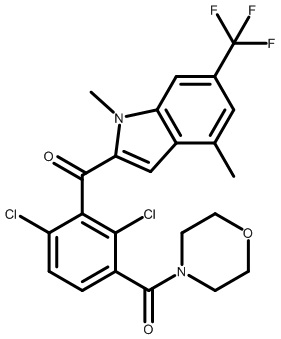
Стадия 1: метил-2,4-дихлор-3-(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-карбонил)бензоат

Используя процедуру, аналогичную примеру AD, стадии 2, метил-2,4-дихлор-3-(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-карбонил)бензоат (5,88 г, 100%) получали в виде бежевой пены из метил-2,4-дихлор-3-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)бензоата (пример A, стадия 1) (5,9 г, 10,3 ммоль). LC/MS (Способ i), Время удерживания=2,80 минуты; MS масса/заряд: 570 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 8,37 (s, 1H), 8,12 (m, 2H), 8,01 (d, J=8,4 Гц, 1H), 7,70 (m, 5H), 7,58 (s, 1H), 3,88 (s, 3H), 2,56 (s, 3H).
Стадия 2: метил-2,4-дихлор-3-(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-карбонил)бензоат

Используя процедуру, аналогичную примеру A, стадии 3, метил-2,4-дихлор-3-(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-карбонил)бензоат (4 г, 79%) получали в виде бесцветной пены из метил-2,4-дихлор-3-(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-карбонил)бензоата (5,88 г, 10,3 ммоль). LC/MS (Способ i), Время удерживания=2,59минуты; MS масса/заряд: 430 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц): δ 12,64 (s, 1H), 8,03 (d, J=8,4 Гц, 1H), 7,80 (d, J=8,4 Гц, 1H), 7,62 (s, 1H), 7,18 (s, 2H), 3,90 (s, 3H), 2,56 (s, 3H).
Стадия 3: метил-2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)бензоат
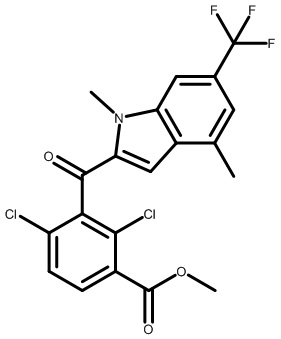
Используя процедуру, аналогичную примеру A, стадии 4, метил-2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)бензоат (2,45 г, 92%) получали в виде белого твердого вещества из метил-2,4-дихлор-3-(4-метил-6-(трифторметил)-1H-индол-2-карбонил)бензоата (2,58 г, 6 ммоль). LC/MS (Способ i), Время удерживания=2,75 минуты; MS масса/заряд: 444 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц): δ 8,02 (d, J=8,5 Гц, 1H), 7,96 (s, 1H), 7,79 (d, J=8,5 Гц, 1H), 7,24 (s, 1H), 7,18 (s, 1H), 4,24 (s, 3H), 3,32 (s, 3H), 2,50 (s, 3H).
Стадия 4: 2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)бензойная кислота
Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)бензойную кислоту (2,37 г, 100%) получали в виде белого твердого вещества из метил-2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)бензоата (2,45 г, 5,52 ммоль). LC/MS (Способ i), Время удерживания=2,42 минуты; MS масса/заряд: 430 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц): δ 13,84 (широкий, 1H), 7,99 (d, J=8,4 Гц, 1H), 7,96 (s, 1H), 7,75 (d, J=8,4 Гц, 1H), 7,24 (s, 1H), 7,15 (s, 1H), 4,24 (s, 3H), 2,50 (s, 3H).
Стадия 5: (2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)фенил)(морфолинo)метанон
Используя процедуру, аналогичную примеру A1, (2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)фенил)(морфолинo)метанон (101 мг, 87%) получали в виде белого твердого вещества из 2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)бензойной кислоты (100 мг, 0,23 ммоль) и морфолина (26,3 мг, 0,30 ммоль).
LC/MS (Способ g), Время удерживания=1,87 минуты; MS масса/заряд: 499 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 7,96 (s, 1H), 7,76 (d, J=8,1 Гц, 1H), 7,65 (d, J=8,1 Гц, 1H), 7,30 и 7,09 (m, 1H), 7,24 (s, 1H), 4,23 (s, 3H), 3,65 (m, 4H), 3,55 (m, 2H), 3,36 (m, 1H), 3,15 (m, 1H), 2,50 (s, 3H).
Таблица AP. Следующие промежуточные вещества получали из 2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)бензойной кислоты (пример AP, стадия 4) при помощи такой же процедуры с соответствующим амином.
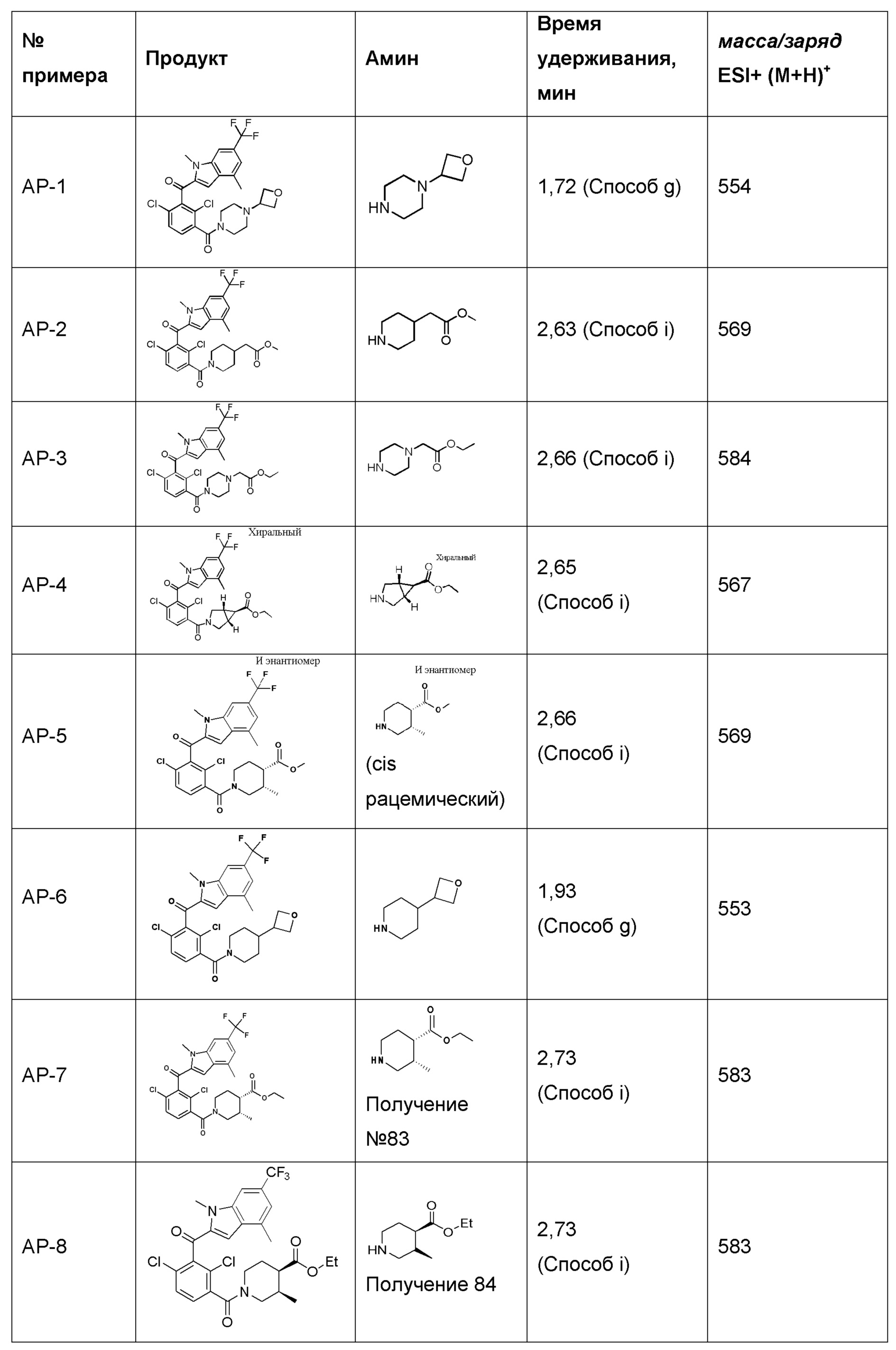
Пример AQ: 2-(1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)бензоил)пиперидин-4-ил)уксусная кислота
Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)бензоил)пиперидин-4-ил)уксусную кислоту (108 мг, 82%) получали в виде белого твердого вещества из 2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)бензойной кислоты (пример AP, стадия 4) (100 мг, 0,23 ммоль). LC/MS (Способ g), Время удерживания=1,80 минуты; MS масса/заряд: 555 [M+H]+.
1H ЯМР (DMSO-d6, 400МГц): δ 12,10 (широкий, 1H), 7,96 (s, 1H), 7,74 (m, 1H), 7,63 и 7,57 (d, J=8 Гц, 1H), 7,24-7,00 (m, 2H), 4,47 (m, 1H), 4,23 и 4,22 (s, 3H), 3,20 (m, 1H), 3,06 (m, 1H), 2,81 (m, 1H), 2,50 (s, 3H), 2,20 (m, 2H), 1,94 (m, 1H), 1,78 (m, 1H), 1,65 (m, 1H), 1,15 (m, 2H).
Таблица AQ. Следующие примеры получали при помощи такой же процедуры, начиная с соответствующих сложных эфиров (описанных в таблице AP).

Пример AR: (2,6-дихлор-3-(гидроксиметил)фенил)(1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метанон

В раствор метил-2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)бензоата (пример AP, стадия 3) (250 мг, 0,563 ммоль) в EtOHMeOH (10 мл) добавляли при комнатной температуре тетрагидроборат натрия (63,9 мг, 1,688 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли дополнительное количество тетрагидробората натрия (63,9 мг, 1,688 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь быстро охлаждали насыщенным водным раствором NH4Cl. Реакционную смесь экстрагировали с помощью EtOAc и органический слой высушивали над сульфатом магния и концентрировали досуха. Неочищенный продукт очищали препаративной LCMS с получением (2,6-дихлор-3-(гидроксиметил)фенил)(1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метанона (71 мг, 29%). LC/MS (Способ g), Время удерживания=1,92 минуты; MS масса/заряд: 416 [M+H]+.
1H ЯМР (DMSO-d6, 400МГц): δ 7,95 (s, 1H), 7,73 (d, J=8 Гц, 1H), 7,66 (d, J=8 Гц, 1H), 7,23 (s, 1H), 7,02 (s, 1H), 5,62 (t, J=5,4 Гц, 1H), 4,61 (d, J=5,4 Гц, 2H), 4,23 (s, 3H), 2,50 (s, 3H).
Пример AS: (2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон
Стадия 1: трет-бутил-2,4-дихлор-3-(гидрокси(7-метил-1-(фенилсульфонил)-5-(трифторметил)-1H-индол-2-ил)метил)бензоат
Используя процедуру, аналогичную примеру A, стадии 1, трет-бутил-2,4-дихлор-3-(гидрокси(7-метил-1-(фенилсульфонил)-5-(трифторметил)-1H-индол-2-ил)метил)бензоат (1,75 г, 49%) получали в виде оранжевой смолы из N-(2-йод-6-метил-4-(трифторметил)фенил)бензолсульфонамида (получение №34) (2 г, 4,53 ммоль) и трет-бутил-2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)бензоата (получение №33) (1,23 г, 4,08 ммоль). LC/MS (Способ i), Время удерживания=2,84 минуты; MS масса/заряд: 672 [M-H]-+CH3COOH 1H ЯМР (DMSO-d6, 300МГц): δ 7,60 (m, 8H), 7,44 (s, 1H), 6,97 (dd, J=5,9 и 1,5Гц, 1H), 6,74 (d, J=1,5 Гц, 1H), 6,66 (d, J=5,9 Гц, 1H), 2,45 (s, 3H), 1,49 (s, 9H).
Стадия 2: 2,4-дихлор-3-((7-метил-1-(фенилсульфонил)-5-(трифторметил)-1H-индол-2-ил)метил)бензойная кислота
Используя процедуру, аналогичную примеру A, стадии 2, 2,4-дихлор-3-((7-метил-1-(фенилсульфонил)-5-(трифторметил)-1H-индол-2-ил)метил)бензойную кислоту (800 мг, 52%) получали в виде желтого порошка из трет-бутил-2,4-дихлор-3-(гидрокси(7-метил-1-(фенилсульфонил)-5-(трифторметил)-1H-индол-2-ил)метил)бензоата (1,7 г, 2,77 ммоль). LC/MS (Способ i), Время удерживания=2,67 минуты; MS масса/заряд: 542 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,51-7,80 (m, 6H), 7,40 (m, 3H), 5,98 (s, 1H), 4,49 (s, 2H), 2,66 (s, 3H).
Стадия 3: 2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-2-ил)метил)бензойная кислота
Используя процедуру, аналогичную примеру A, стадии 3, 2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-2-ил)метил)бензойную кислоту (620 мг, 99%) получали в виде оранжевого порошка из 2,4-дихлор-3-((7-метил-1-(фенилсульфонил)-5-(трифторметил)-1H-индол-2-ил)метил)бензойной кислоты (800 мг, 1,47 ммоль). LC/MS (Способ i), Время удерживания=2,37 минуты; MS масса/заряд: 402 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц): δ 11,57 (s, 1H), 7,55 (s, 1H), 7,41 (m, 1H), 7,29 (m, 2H), 7,10 (s, 1H), 5,77 (s, 1H), 4,40 (s, 2H), 2,54 (s, 3H).
Стадия 4: (2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон

Используя процедуру, аналогичную примеру A, стадии 6, (2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон (95 мг, 20%) получали в виде оранжевого порошка из 2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-2-ил)метил)бензойной кислоты (400 мг, 0,99 ммоль). LC/MS (Способ g), Время удерживания=1,79 минуты; MS масса/заряд: 471 [M+H]+.
1H ЯМР (DMSO-d6, 500МГц): δ 11,56 (s, 1H), 7,65 (d, J=8,4 Гц, 1H), 7,58 (s, 1H), 7,42 (d, J=8,4 Гц, 1H), 7,12 (s, 1H), 5,80 (m, 1H), 4,45 (s, 2H), 3,65 (m, 4H), 3,55 (m, 2H), 3,17 (m, 2H), 2,54 (s, 3H).
Пример AT: (2,4-дихлор-3-((1,7-диметил-5-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон

Используя процедуру, аналогичную примеру A, стадии 4, (2,4-дихлор-3-((1,7-диметил-5-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон (48 мг, 63%) получали в виде бежевого порошка из (2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-2-ил)метил)фенил)(морфолинo)метанона (пример AS, стадия 4) (70 мг, 0,149 ммоль).
LC/MS (Способ g), Время удерживания=1,88 минуты; MS масса/заряд: 485 [M+H]+.
1H ЯМР (DMSO-d6, 400МГц): δ 7,67 (d, J=8,1 Гц, 1H), 7,59 (s, 1H), 7,45 (d, J=8,1 Гц, 1H), 7,09 (s, 1H), 5,67 (s, 1H), 4,39 (m, 2H), 4,12 (s, 3H), 3,65 (m, 4H), 3,55 (m, 2H), 3,20 (m, 2H), 2,83 (s, 3H).
Пример AU: 2-(2,6-дихлор-3-((3-оксоморфолинo)метил)бензил)-1,4-диметил-1H-индол-6-карбонитрил
Пример AU1: 2-(2,6-дихлор-3-((3-оксоморфолинo)метил)бензоил)-1,4-диметил-1H-индол-6-карбонитрил

Стадия 1: 2-(2,6-дихлор-3-(гидроксиметил)бензил)-1,4-диметил-1H-индол-6-карбонитрил

В раствор метил-2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)бензоата (пример AA, стадия 4) (300 мг, 0,775 ммоль) в THF (10 мл) добавляли боргидрид лития (1,162 мл, 2,32 ммоль) (2 M в THF) и смесь перемешивали при комнатной температуре в течение ночи. Добавляли дополнительное количество боргидрида лития (0,5 мл, 1,17 ммоль) (2 M в THF) и смесь перемешивали при 50°C в течение одного часа, затем охлаждали до 0°C и охлаждали медленно добавлением 1 M водного раствора HCl. THF концентрировали, осадок фильтровали, промывали водой и высушивали под вакуумом. Остаток растворяли в DCM, высушивали с помощью сульфата магния и концентрировали с получением 2-(2,6-дихлор-3-(гидроксиметил)бензил)-1,4-диметил-1H-индол-6-карбонитрила (290 мг, 89%) в виде белого твердого вещества. LC/MS (Способ h), Время удерживания=2,77 минуты; MS масса/заряд: 359 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,91 (s, 1H), 7,60 (m, 2H), 7,11 (s, 1H), 5,67 (s, 1H), 5,55 (t, J=5,5 Гц, 1H), 4,59 (d, J=5,5 Гц, 2H), 4,44 (s, 2H), 3,91 (s, 3H), 2,31 (s, 3H).
Стадия 2: 2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)бензилметансульфонат

Используя процедуру, аналогичную получению №12, 2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)бензилметансульфонат (327 мг, 54%) получали в виде желтого твердого вещества из 2-(2,6-дихлор-3-(гидроксиметил)бензил)-1,4-диметил-1H-индол-6-карбонитрила (290 мг, 0,80 ммоль).
LC/MS (Способ h), Время удерживания=2,95 минуты; MS масса/заряд: 437 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,92 (s, 1H), 7,67 (m, 2H), 7,10 (m, 1H), 5,70 (m, 1H), 5,39 (s, 2H), 4,48 (s, 2H), 3,92 (s, 3H), 3,30 (s, 3H), 2,32 (m, 3H).
Стадия 3: 2-(2,6-дихлор-3-((3-оксоморфолинo)метил)бензил)-1,4-диметил-1H-индол-6-карбонитрил
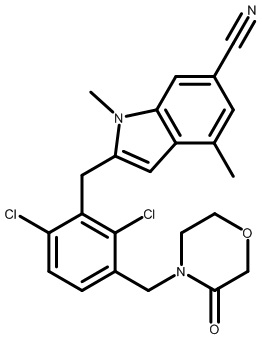

В раствор морфолин-3-она (139 мг, 1,372 ммоль) в DMF (9 мл) добавляли гидрид натрия (63,1 мг, 1,578 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 15 минут. 2,4-дихлор-3-((6-циано-1,4-диметил-1H-индол-2-ил)метил)бензилметансульфонат (300 мг, 0,686 ммоль) добавляли в реакционную смесь и ее перемешивали при комнатной температуре в течение 20 часов. Реакционную смесь выливали в раствор воды и EtOAc; органический слой экстрагировали, промывали солевым раствором; высушивали над сульфатом магния и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 30-70% EtOAc в циклогексане), затем очищали препаративной LCMS с получением 2-(2,6-дихлор-3-((3-оксоморфолинo)метил)бензил)-1,4-диметил-1H-индол-6-карбонитрила (35 мг, 11%) в виде желтого твердого вещества. LC/MS (Способ g), Время удерживания=1,65 минуты; MS масса/заряд: 443 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 7,91 (s, 1H), 7,60 (d, J=8,4 Гц, 1H), 7,30 (d, J=8,4 Гц, 1H), 7,04-7,14 (m, 1H), 5,70 (s, 1H), 4,66 (s, 2H), 4,46 (s, 2H), 4,16 (s, 2H), 3,91 (s, 3H), 3,89 (m, 2H), 3,35 (m, 2H), 2,32 (s, 3H).
В ходе данной реакции побочный продукт окисления выделяли и определяли как 2-(2,6-дихлор-3-((3-оксоморфолинo)метил)бензоил)-1,4-диметил-1H-индол-6-карбонитрил (30 мг, 9%) в виде белого твердого вещества.
LC/MS (Способ g), Время удерживания=1,62 минуты; MS масса/заряд: 456 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 8,20 (s, 1H), 7,66 (d, J=8,4 Гц, 1H), 7,46 (d, J=8,4 Гц, 1H), 7,29 (m, 1H), 7,09 (s, 1H), 4,67 (m, 2H), 4,20 (s, 3H), 4,17 (s, 2H), 3,91 (m, 2H), 3,40 (m, 2H), 2,47 (s, 3H).
Пример AV: этил-2-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)ацетат
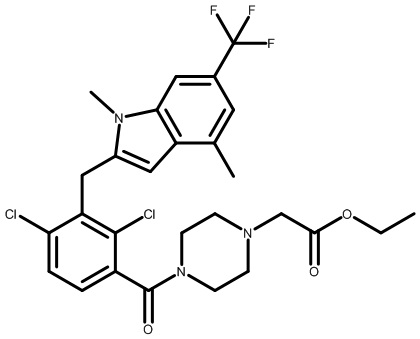
Используя процедуру, аналогичную примеру T, стадии 1, этил-2-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)ацетат (51 мг, 49%) получали из (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(пиперазин-1-ил)метанона (пример S, стадия 2) (85 мг, 0,17 ммоль) и этилбромацетата (30 мг, 0,18 ммоль). LC/MS (Способ g), Время удерживания=1,90 минуты; MS масса/заряд: 570 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 7,70 (s, 1H), 7,67 (d, J=8,1 Гц, 1H), 7,41 (d, J=8,1 Гц, 1H), 7,06 (s, 1H), 5,68 (s, 1H), 4,48 (d, J=16 Гц, 1H), 4,43 (d, J=16 Гц, 1H), 4,06 (q, J=7,2 Гц, 2H), 3,92 (s, 3H), 3,68 (m, 1H), 3,61 (m, 1H), 3,27 (s, 2H), 3,16 (m, 2H), 2,60 (m, 2H), 2,50 (m, 2H), 2,36 (s, 3H), 1,16 (t, J=7,2 Гц, 3H).
Пример AW: 2-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)уксусная кислота
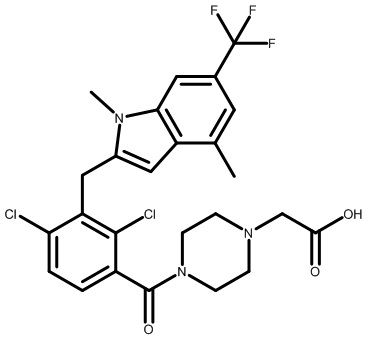
Стадия 1: метил-2-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)ацетат

Используя процедуру, аналогичную примеру T, стадии 1, метил-2-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)ацетат (115 мг, 100%) получали из (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)фенил)(пиперазин-1-ил)метанона (пример S, стадия 2) (100 мг, 0,206 ммоль) и метилбромацетата (42,8 мг, 0,31 ммоль). LC/MS (Способ h), Время удерживания=3,11 минуты; MS масса/заряд: 556 [M+H]+ 1H ЯМР (ХЛОРОФОРМ-d, 300МГц): δ 7,41 (d, J=8,1 Гц, 1H), 7,36 (s, 1H), 7,19 (d, J=8,1 Гц, 1H), 7,01 (s, 1H), 5,70 (s, 1H), 4,36 (m, 2H), 3,80 (m, 5H), 3,65 (s, 3H), 3,25 (m, 2H), 3,20 (s, 2H), 2,62 (m, 2H), 2,50 (m, 2H), 2,35 (s, 3H).
Стадия 2: 2-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)уксусная кислота

Используя процедуру, аналогичную примеру O, стадии 4, 2-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)уксусную кислоту (25 мг, 15%) получали из метил-2-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперазин-1-ил)ацетата (170 мг, 0,30 ммоль). LC/MS (Способ g), Время удерживания=1,50 минуты; MS масса/заряд: 542 [M+H]+ 1H ЯМР (DMSO-d6, 500МГц): δ 7,70 (s, 1H), 7,66 (d, J=8,4 Гц, 1H), 7,41 (d, J=8,4 Гц, 1H), 7,06 (s, 1H), 5,68 (s, 1H), 4,46 (m, 2H), 3,91 (s, 3H), 3,65 (m, 2H), 3,19 (m, 4H), 3,06 (m, 2H), 2,58 (m, 1H), 2,48 (m, 1H), 2,36 (s, 3H).
Пример AX: (3-((6-бром-1,4-диметил-1H-индол-2-ил)метил)-2,4-дихлорфенил)(морфолинo)метанон
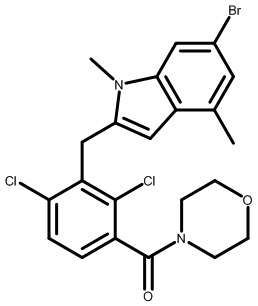
Стадия 1: метил 3-((6-бром-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)-2,4-дихлорбензоат

Используя процедуру, аналогичную примеру A, стадии 1, метил-3-((6-бром-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)-2,4-дихлорбензоат (1,9 г, 66%) получали из N-(5-бром-2-йод-3-метилфенил)бензолсульфонамида (получение №35) (2,21 г, 4,89 ммоль) и метил-2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)бензоата (получение №1) (1,39 г, 5,38 ммоль). LC/MS (Способ h), Время удерживания=3,33 минуты; MS масса/заряд:640 [M-H]-+CH3COOH 1H ЯМР (DMSO-d6, 300МГц): δ 7,94 (s, 1H), 7,85 (m, 2H), 7,60 (m, 5H), 7,28 (s, 1H), 6,98 (dd, J=5,8, 1,2 Гц, 1H), 6,71 (s, 1H), 6,64 (d, J=5,8 Гц, 1H, 3,86 (s, 3H), 2,37 (s, 3H).
Стадия 2: метил-3-((6-бром-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)метил)-2,4-дихлорбензоат

Используя процедуру, аналогичную примеру A, стадии 2, метил-3-((6-бром-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)метил)-2,4-дихлорбензоат (1,73 г, 94%) получали из метил-3-((6-бром-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)-2,4-дихлорбензоата (1,9 г, 3,26 ммоль). LC/MS (Способ h), Время удерживания=3,77 минуты; MS масса/заряд: 566 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 8,10 (s, 1H), 7,93 (m, 2H), 7,79 (m, 2H), 7,69 (m, 3H), 7,27 (s, 1H), 5,84 (s, 1H), 4,55 (s, 2H), 3,86 (s, 3H), 2,26 (s, 3H).
Стадия 3: метил-3-((6-бром-4-метил-1H-индол-2-ил)метил)-2,4-дихлорбензоат
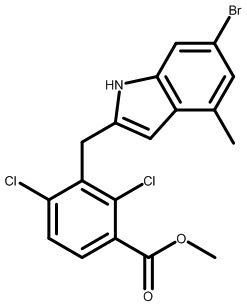
Используя процедуру, аналогичную примеру A, стадии 3, метил-3-((6-бром-4-метил-1H-индол-2-ил)метил)-2,4-дихлорбензоат (1,05 г, 81%) получали из метил-3-((6-бром-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)метил)-2,4-дихлорбензоата (1,73 г, 3,05 ммоль). LC/MS (Способ h), Время удерживания=3,36 минуты; MS масса/заряд: 426 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 11,19 (s, 1H), 7,75 (m, 1H), 7,65 (m, 1H), 7,32 (s, 1H), 6,88 (s, 1H), 5,84 (s, 1H), 4,43 (s, 2H), 3,87 (s, 3H), 2,32 (s, 3H).
Стадия 4: метил-3-((6-бром-1,4-диметил-1H-индол-2-ил)метил)-2,4-дихлорбензоат

Используя процедуру, аналогичную примеру P, стадии 4, метил-3-((6-бром-1,4-диметил-1H-индол-2-ил)метил)-2,4-дихлорбензоат (916 мг, 89%) получали из метил-3-((6-бром-4-метил-1H-индол-2-ил)метил)-2,4-дихлорбензоата (1 г, 2,34 ммоль). LC/MS (Способ h), Время удерживания=3,52 минуты; MS масса/заряд: 440 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,80 (m, 1H), 7,70 (m, 1H), 7,54 (s, 1H), 6,91 (s, 1H), 5,54 (m, 1H), 4,43 (s, 2H), 3,88 (s, 3H), 3,82 (s, 3H), 2,27 (s, 3H).
Стадия 5: 3-((6-бром-1,4-диметил-1H-индол-2-ил)метил)-2,4-дихлорбензойная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 3-((6-бром-1,4-диметил-1H-индол-2-ил)метил)-2,4-дихлорбензойную кислоту (850 мг, 96%) получали из метил-3-((6-бром-1,4-диметил-1H-индол-2-ил)метил)-2,4-дихлорбензоата (916 мг, 2,07 ммоль). Соединение использовали непосредственно на следующей стадии. LC/MS (Способ h), Время удерживания=3,06 минуты; MS масса/заряд: 426 [M+H]+
Стадия 6: (3-((6-бром-1,4-диметил-1H-индол-2-ил)метил)-2,4-дихлорфенил)(морфолинo)метанон
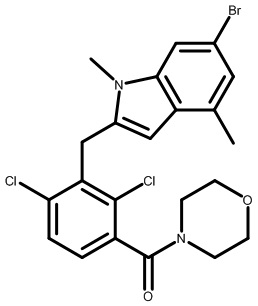
Используя процедуру, аналогичную примеру A1, (3-((6-бром-1,4-диметил-1H-индол-2-ил)метил)-2,4-дихлорфенил)(морфолинo)метанон (970 мг, 97%) получали из 3-((6-бром-1,4-диметил-1H-индол-2-ил)метил)-2,4-дихлорбензойной кислоты (850 мг, 1,99 ммоль) и морфолина (260 мг, 2,99 ммоль). LC/MS (Способ g), Время удерживания=1,90 минуты; MS масса/заряд: 495 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 7,67 (d, J=8,4 Гц, 1H), 7,53 (m, 1H), 7,44 (d, J=8,4 Гц, 1H), 6,92 (s, 1H), 5,57 (s, 1H), 4,39 (m, 2H), 3,81 (s, 3H), 3,65 (m, 4H), 3,53 (m, 2H), 3,17 (m, 2H), 2,28 (s, 3H).
Пример AY: (2,4-дихлор-3-((1,4-диметил-6-морфолинo-1H-индол-2-ил)метил)фенил)(морфолинo)метанон

В суспензию (3-((6-бром-1,4-диметил-1H-индол-2-ил)метил)-2,4-дихлорфенил)(морфолинo)метанона (пример AW, стадия 6) (200 мг, 0,403 ммоль) и фосфата калия трехосновного (171 мг, 0,806 ммоль) в диоксане (2,5 мл) добавляли 2-дициклогексилфосфино-2',6'-диизопропокси-1,1'-бифенил (11,28 мг, 0,024 ммоль), хлор(2-дициклогексилфосфино-2',6'-диизопропокси-1,1'-бифенил)[2-(2-аминоэтилфенил)]палладий(II), аддукт метил-трет-бутилового эфира (9,88 мг, 0,012 ммоль) и морфолин (38,6 мг, 0,443 ммоль). Смесь перемешивали с обратным холодильником в течение 8 часов. Добавляли дополнительное количество фосфата калия трехосновного (171 мг, 0,806 ммоль), 2-дициклогексилфосфино-2',6'-диизопропокси-1,1'-бифенила (11,28 мг, 0,024 ммоль), хлор(2-дициклогексилфосфино-2',6'-диизопропокси-1,1'-бифенил)[2-(2-аминоэтилфенил)]палладия(II), аддукта метил-трет-бутилового эфира (9,88 мг, 0,012 ммоль) и морфолина (38,6 мг, 0,443 ммоль) и смесь перемешивали с обратным холодильником в течение ночи. Смесь разбавляли с помощью EtOAc и органическую фазу промывали последовательно водой и насыщенным водным раствором NaCl, высушивали над сульфатом магния и концентрировали. Остаток очищали препаративной LCMS с получением (2,4-дихлор-3-((1,4-диметил-6-морфолинo-1H-индол-2-ил)метил)фенил)(морфолинo)метанона (25 мг, 12%) в виде бежевого твердого вещества. LC/MS (Способ g), Время удерживания=1,38 минуты; MS масса/заряд: 502 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 7,65 (d, J=8,1 Гц, 1H), 7,42 (d, J=8,1 Гц, 1H), 6,73 (s, 1H), 6,55 s, 1H), 5,40 (s, 1H), 4,36 (m, 2H), 3,76 (m, 7H), 3,65 (m, 4H), 3,54 (m, 2H), 3,17 (m, 2H), 3,07 (m, 4H), 2,23 (s, 3H).
Пример AZ: 1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3,3-дифторпиперидин-4-карбоновая кислота

В раствор этил-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3,3-дифторпиперидин-4-карбоксилата (таблица A, пример A-8) (100 мг, 0,169 ммоль) в уксусной кислоте (6,5 мл) добавляли при комнатной температуре хлористоводородную кислоту (323 мкл, 3,34 ммоль) и реакционную смесь перемешивали с обратным холодильником в течение 18 часов. Добавляли дополнительное количество хлороводорода (140 мкл, 1,449 ммоль) при комнатной температуре и реакционную смесь перемешивали с обратным холодильником в течение 24 часов. Реакционную смесь концентрировали досуха и остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 7-10% MeOH в DCM) с получением 1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3,3-дифторпиперидин-4-карбоновой кислоты (16 мг, 16%) в виде белого твердого вещества. LC/MS (Способ g), Время удерживания=1,86 минуты; MS масса/заряд: 563 [M+H]+ 1H ЯМР (DMSO-d6, 500МГц): δ 7,70 (m, 2H), 7,38 (m, 1H), 7,06 (s, 1H), 5,67 (m, 1H), 4,47 (m, 2H), 4,28 (m, 1H), 4,10 (m, 1H), 3,92 (s, 3H), 3,39 (m, 1H), 3,17 (m, 1H), 2,82 (m, 1H), 2,36 и 2,34 (s, 3H), 1,90 (m, 2H).
Пример BA: 1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3-фторпиперидин-4-карбоновая кислота

Используя процедуру, аналогичную примеру AZ, 1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3-фторпиперидин-4-карбоновую кислоту (11 мг, 13%) получали из этил-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-3-фторпиперидин-4-карбоксилата (таблица A, пример A-9) (80 мг, 0,14 ммоль). LC/MS (Способ i), Время удерживания=2,42 минуты; MS масса/заряд: 545 [M+H]+ 1H ЯМР (DMSO-d6, 500МГц): δ 12,81 (широкий, 1H), 7,70 (m, 2H), 7,50 и 7,40 (m, 1H), 7,06 (s, 1H), 5,68 (m, 1H), 4,89-4,70 (m, 1H), 4,39-4,58 (m, 2H), 4,31-3,90 (m, 4H), 3,40-3,58 (m, 2H), 3,10-3,26 (m, 2H), 2,38 (m, 3H), 1,85-2,08 (m, 1H), 1,56-1,76 (m, 1H).
Пример BB: (5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)-4,6-диметилпиридин-3-ил)(морфолинo)метанон
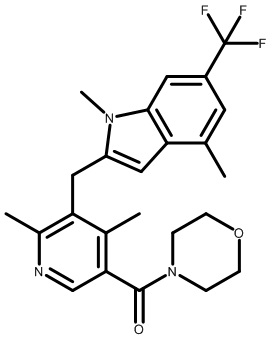
Стадия 1: метил-5-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)-4,6-диметилникотинат

Используя процедуру, аналогичную примеру A, стадии 1, метил-5-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)-4,6-диметилникотинат (1,4 г, 69%) получали из N-(2-йод-3-метил-5-(трифторметил)фенил)бензолсульфонамида (получение №16) (1,8 г, 4,16 ммоль) и метил-5-(1-гидроксипроп-2-ин-1-ил)-4,6-диметилникотината (получение №36) (830 мг, 3,79 ммоль). Соединение использовали непосредственно на следующей стадии. LC/MS (Способ i), Время удерживания=2,51 минуты; MS масса/заряд: 533 [M+H]+
Стадия 2: метил-4,6-диметил-5-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)никотинат

Используя процедуру, аналогичную примеру Z, стадии 2, метил-4,6-диметил-5-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)никотинат (1,28 г, 94%) получали из метил-5-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)-4,6-диметилникотината (1,4 г, 2,63 ммоль). Неочищенный продукт использовали непосредственно на следующей стадии. LC/MS (Способ i), Время удерживания=2,74 минуты; MS масса/заряд: 517 [M+H]+
Стадия 3: метил-4,6-диметил-5-((4-метил-6-(трифторметил)-1H-индол-2-ил)метил)никотинат
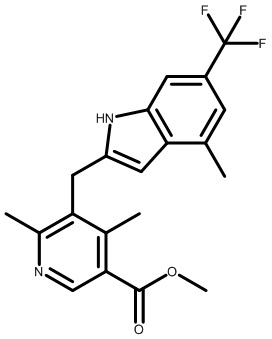
Используя процедуру, аналогичную примеру A, стадии 3, метил-4,6-диметил-5-((4-метил-6-(трифторметил)-1H-индол-2-ил)метил)никотинат (700 мг, 75%) получали из метил-4,6-диметил-5-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)никотината (1,28 г, 2,48 ммоль). LC/MS (Способ i), Время удерживания=2,45 минуты; MS масса/заряд: 377 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 11,42 (s, 1H), 8,72 (s, 1H), 7,46 (s, 1H), 7,02 (s, 1H), 5,91 (s, 1H), 4,26 (s, 2H), 3,32 (s, 3H), 2,54 (s, 3H), 2,47 (s, 3H), 2,40 (s, 3H).
Стадия 4: метил-5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)-4,6-диметилникотинат
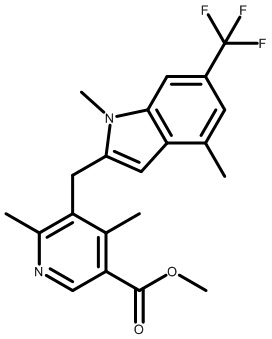
Используя процедуру, аналогичную примеру A, стадии 4, метил-5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)-4,6-диметилникотинат (540 мг, 75%) получали из метил-4,6-диметил-5-((4-метил-6-(трифторметил)-1H-индол-2-ил)метил)никотината (700 мг, 1,86 ммоль). LC/MS (Способ i), Время удерживания=2,53 минуты; MS масса/заряд: 391 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 8,76 (s, 1H), 7,70 (s, 1H), 7,05 (s, 1H), 5,57 (s, 1H), 4,27 (s, 2H), 3,93 (s, 3H), 3,32 (s, 3H), 2,50 (s, 3H), 2,43 (s, 3H), 2,34 (s, 3H).
Стадия 5: 5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)-4,6-диметилникотиновая кислота

Используя процедуру, аналогичную примеру A, стадии 5, 5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)-4,6-диметилникотиновую кислоту (420 мг, 81%) получали из метил-5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)-4,6-диметилникотината (540 мг, 1,38 ммоль). LC/MS (Способ i), Время удерживания=1,89 минуты; MS масса/заряд: 377 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 13,21 (широкий, 1H), 8,76 (s, 1H), 7,70 (s, 1H), 7,05 (s, 1H), 5,57 (s, 1H), 4,25 (s, 2H), 3,92 (s, 3H), 2,48 (s., 3H), 2,45 (s, 3H), 2,34 (s, 3H).
Стадия 6: (5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)-4,6-диметилпиридин-3-ил)(морфолинo)метанон

Используя процедуру, аналогичную примеру A1, (5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)-4,6-диметилпиридин-3-ил)(морфолинo)метанон (19 мг, 26%) получали из 5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)-4,6-диметилникотиновой кислоты (59 мг, 0,16 ммоль) и морфолина (25 мг, 0,29 ммоль). LC/MS (Способ g), Время удерживания=1,50 минуты; MS масса/заряд: 446 [M+H]+.
1H ЯМР (DMSO-d6, 400МГц): δ 8,26 (s, 1H), 7,70 (s, 1H), 7,05 (s, 1H), 5,58 (s, 1H), 4,23 (s, 2H), 3,92 (s, 3H), 3,67 (m, 4H), 3,51 (m, 2H), 3,18 (m, 2H), 2,46 (s, 3H), 2,35 (s, 3H), 2,14 (s, 3H).
Пример BC: 2-(1-(5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)-4,6-диметилникотиноил)пиперидин-4-ил)уксусная кислота
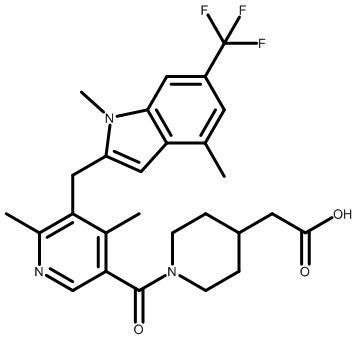
Стадия 1: метил-2-(1-(5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)-4,6-диметилникотиноил)пиперидин-4-ил)ацетат
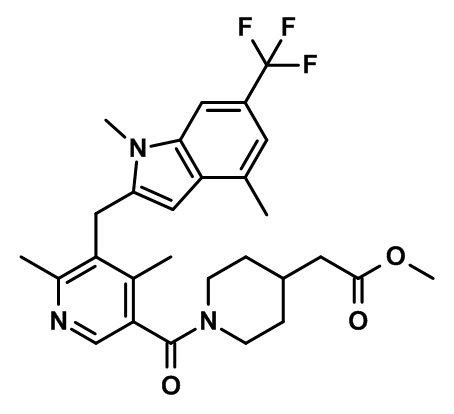
Используя процедуру, аналогичную примеру A1, метил-2-(1-(5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)-4,6-диметилникотиноил)пиперидин-4-ил)ацетат (137 мг, 100%) получали из 5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)-4,6-диметилникотиновой кислоты (пример BB, стадия 5) (100 мг, 0,26 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (66,9 мг, 0,34 ммоль). Соединение использовали неочищенным на следующей стадии. LC/MS (Способ i), Время удерживания=2,41 минуты; MS масса/заряд: 516 [M+H]+.
Стадия 2: 2-(1-(5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)-4,6-диметилникотиноил)пиперидин-4-ил)уксусная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)-4,6-диметилникотиноил)пиперидин-4-ил)уксусную кислоту (116 мг, 87%) получали из метил-2-(1-(5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)-4,6-диметилникотиноил)пиперидин-4-ил)ацетата (137 мг, 0,26 ммоль).
LC/MS (Способ g), Время удерживания=1,43 минуты; MS масса/заряд: 502 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 12,09 (широкий, 1H), 8,30 и 8,24 (s, 1H), 7,70 (s, 1H), 7,05 (s, 1H), 5,57 (m, 1H), 4,52 (m, 1H), 4,25 (m, 2H), 3,92 (s, 3H), 3,34 (m, 1H), 3,05 (m, 1H), 2,81 (m, 1H), 2,48 (s, 3H), 2,35 и 2,34 (s, 3H), 2,06-2,25 (m, 5H), 1,92 (m, 1H), 1,78 (m, 1H), 1,63 (m, 1H), 1,17 (m, 2H).
Пример BD: 2-[2,4-диметил-5-[4-(оксетан-3-ил)пиперидин-1-карбонил]пиридин-3-карбонил]-1,4-диметил-индол-6-карбонитрил

Стадия 1: метил-5-((6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)-4,6-диметилникотинат

Используя процедуру, аналогичную примеру A, стадии 1, метил-5-((6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)-4,6-диметилникотинат (14 г, 81%) получали из N-(5-циано-2-йод-3-метилфенил)бензолсульфонамида (получение №18) (14 г, 35,2 ммоль) и метил-5-(1-гидроксипроп-2-ин-1-ил)-4,6-диметилникотината (получение №36) (8,86 г, 40,4 ммоль). LC/MS (Способ i), Время удерживания=2,22 минуты; MS масса/заряд: 490 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 8,65 (s, 1H), 8,25 (s, 1H), 7,93 (m, 2H), 7,69 (m, 1H), 7,52-7,64 (m, 2H), 7,50 (s, 1H), 6,75 (s, 2H), 6,54 (s, 1H), 3,85 (s, 3H), 2,46 (s, 3H), 2,42 (s, 3H), 2,41 (s, 3H).
Стадия 2: метил 5-(6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-карбонил)-4,6-диметилникотинат

Используя процедуру, аналогичную примеру AD, стадии 2, метил-5-(6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-карбонил)-4,6-диметилникотинат (7,5 г, 100%) получали из метил-5-((6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)-4,6-диметилникотината (6,9 г, 14 ммоль). LC/MS (Способ i), Время удерживания=2,40 минуты; MS масса/заряд: 488 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 8,96 (s, 1H), 8,51 (s, 1H), 8,37 (m, 2H), 7,88 (m, 1H), 7,75 (m, 2H), 7,62 (m, 1H), 7,55 (s, 1H), 3,88 (s, 3H), 2,50 (s, 3H), 2,37 (s, 3H), 2,36 (s, 3H).
Стадия 3: метил-5-(6-циано-4-метил-1H-индол-2-карбонил)-4,6-диметилникотинат
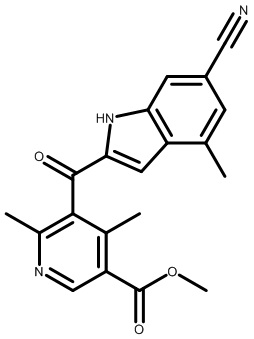
Используя процедуру, аналогичную примеру A, стадии 3, метил-5-(6-циано-4-метил-1H-индол-2-карбонил)-4,6-диметилникотинат (5 г, 100%) получали из метил-5-(6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-карбонил)-4,6-диметилникотината (6,87 г, 14 ммоль). LC/MS (Способ i), Время удерживания=2,05 минуты; MS масса/заряд: 348 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 12,64 (широкий, 1H), 8,97 (s, 1H), 7,78 (s, 1H), 7,23 (s, 1H), 7,09 (s, 1H), 3,89 (s, 3H), 2,47 (s, 3H), 2,36 (s, 6H).
Стадия 4: метил-5-(6-циано-1,4-диметил-1H-индол-2-карбонил)-4,6-диметилникотинат

Используя процедуру, аналогичную примеру A, стадии 4, метил-5-(6-циано-1,4-диметил-1H-индол-2-карбонил)-4,6-диметилникотинат (2,6 г, 51%) получали из метил-5-(6-циано-4-метил-1H-индол-2-карбонил)-4,6-диметилникотината (4,89 г, 14 ммоль). LC/MS (Способ i), Время удерживания=2,20 минуты; MS масса/заряд: 362 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 8,96 (s, 1H), 8,21 (s, 1H), 7,27 (s, 1H), 7,06 (s, 1H), 4,23 (s, 3H), 3,32 (s, 3H), 2,45 (s, 3H), 2,38 (s, 3H), 2,37 (s, 3H).
Стадия 5: 5-(6-циано-1,4-диметил-1H-индол-2-карбонил)-4,6-диметилникотиновая кислота
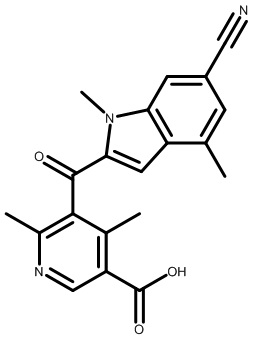
Используя процедуру, аналогичную примеру A, стадии 5, 5-(6-циано-1,4-диметил-1H-индол-2-карбонил)-4,6-диметилникотиновую кислоту (2 г, 95%) получали из метил-5-(6-циано-1,4-диметил-1H-индол-2-карбонил)-4,6-диметилникотината (2,19 г, 6,06 ммоль). LC/MS (Способ i), Время удерживания=1,80 минуты; MS масса/заряд: 348 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 13,42 (широкий, 1H), 8,96 (s, 1H), 8,21 (s, 1H), 7,27 (s, 1H), 7,05 (s, 1H), 4,23 (s, 3H), 2,45 (s, 3H), 2,39 (s, 3H), 2,36 (s, 3H).
Стадия 6: 2-[2,4-диметил-5-[4-(оксетан-3-ил)пиперидин-1-карбонил]пиридин-3-карбонил]-1,4-диметил-индол-6-карбонитрил
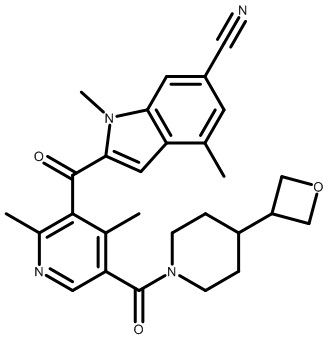
Используя процедуру, аналогичную примеру A1, 2-[2,4-диметил-5-[4-(оксетан-3-ил)пиперидин-1-карбонил]пиридин-3-карбонил]-1,4-диметил-индол-6-карбонитрил (73 мг, 54%) получали из 5-(6-циано-1,4-диметил-1H-индол-2-карбонил)-4,6-диметилникотиновой кислоты (100 мг, 0,28 ммоль) и 4-(оксетан-3-ил)пиперидина (53 мг, 0,374 ммоль). LC/MS (Способ g), Время удерживания=1,42 минуты; MS масса/заряд: 471 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 8,44 (широкий, 1H), 8,20 (s, 1H), 7,27 (s, 1H), 7,02 (широкий, 1H), 4,58 (m, 3H), 4,34 (m, 2H), 4,21 (s, 3H), 3,44 (m, 1H), 3,08 (m, 1H), 2,78 (m, 2H), 2,46 (m, 3H), 2,35 (s, 3H), 2,04 (m, 3H), 1,90 (m, 1H), 1,69 (m, 1H), 1,56 (m, 1H), 1,06 (m, 2H).
Пример BE: (3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиридин-2-ил)(морфолинo)метанон
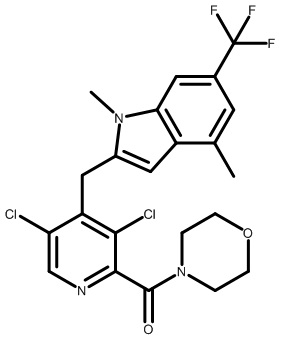
Стадия 1: этил-3,5-дихлор-4-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)пиколинат

Используя процедуру, аналогичную примеру A, стадии 1, этил-3,5-дихлор-4-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)пиколинат (702 мг, 53%) получали из N-(2-йод-3-метил-5-(трифторметил)фенил)бензолсульфонамида (получение №16) (1 г, 0,267 ммоль) и этил-3,5-дихлор-4-(1-гидроксипроп-2-ин-1-ил)пиколината (получение №37) (0,87 мг, 3,17 ммоль). LC/MS (Способ h), Время удерживания=3,30 минуты; MS масса/заряд: 587 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 8,65 (s, 1H), 8,08 (s, 1H), 7,84 (m, 2H), 7,70 (m, 1H), 7,61 (m, 2H), 7,45 (s, 1H), 7,03 (m, 2H), 6,94 (s, 1H), 4,40 (q, J=7,1 Гц, 2H), 2,50 (s, 3H), 1,33 (t, J=7,1 Гц, 3H).
Стадия 2: этил-3,5-дихлор-4-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)пиколинат

Используя процедуру, аналогичную примеру Z, стадии 2, этил-3,5-дихлор-4-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)пиколинат (474 мг, 69%) получали из этил-3,5-дихлор-4-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)пиколината (702 мг, 1,19 ммоль). LC/MS (Способ h), Время удерживания=3,65 минуты; MS масса/заряд: 571 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 8,77 (s, 1H), 8,23 (s, 1H), 7,91 (m, 2H), 7,77 (m, 1H), 7,69 (m, 2H), 7,42 (s, 1H), 6,31 (s, 1H), 4,61 (s, 2H), 4,39 (q, J=7,1 Гц, 2H), 2,38 (s, 3H), 1,32 (t, J=7,1 Гц, 3H).
Стадия 3: этил-3,5-дихлор-4-((4-метил-6-(трифторметил)-1H-индол-2-ил)метил)пиколинат

Используя процедуру, аналогичную примеру A, стадии 3, этил-3,5-дихлор-4-((4-метил-6-(трифторметил)-1H-индол-2-ил)метил)пиколинат (221 мг, 51%) получали из этил-3,5-дихлор-4-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)пиколината (427 мг, 0,82 ммоль). LC/MS (Способ h), Время удерживания=3,27 минуты; MS масса/заряд: 431 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 11,53 (s, 1H), 8,77 (s, 1H), 7,48 (s, 1H), 7,04 (s, 1H), 6,10 (m, 1H), 4,50 (s, 2H), 4,40 (q, J=7,1 Гц, 2H), 2,43 (s, 3H), 1,32 (t, J=7,1 Гц, 3H).
Стадия 4: этил-3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиколинат

Используя процедуру, аналогичную примеру P, стадии 4, этил-3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиколинат (191 мг, 69%) получали из этил-3,5-дихлор-4-((4-метил-6-(трифторметил)-1H-индол-2-ил)метил)пиколината (220 мг, 0,51 ммоль). LC/MS (Способ h), Время удерживания=3,37 минуты; MS масса/заряд: 445 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 8,80 (s, 1H), 7,72 (s, 1H), 7,07 (s, 1H), 5,83 (s, 1H), 4,51 (s, 2H), 4,41 (d, J=7,1 Гц, 2H), 3,92 (s, 3H), 2,38 (s, 3H), 1,33 (t, J=7,1 Гц, 3H).
Стадия 5: 3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиколиновая кислота
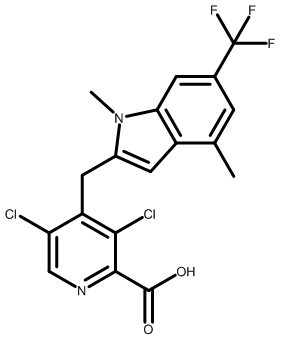
Используя процедуру, аналогичную примеру A, стадии 5, 3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиколиновую кислоту (154 мг, 97%) получали из этил-3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиколината (170 мг, 0,38 ммоль). LC/MS (Способ h), Время удерживания=2,61 минуты; MS масса/заряд: 417 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 8,74 (s, 1H), 7,72 (s, 1H), 7,07 (s, 1H), 5,79 (s, 1H), 4,50 (s, 2H), 3,93 (s, 3H), 2,38 (s, 3H).
Стадия 6: (3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиридин-2-ил)(морфолинo)метанон

Используя процедуру, аналогичную примеру A, стадии 6, (3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиридин-2-ил)(морфолинo)метанон (108 мг, 72%) получали из 3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиколиновой кислоты (129 мг, 0,30 ммоль). LC/MS (Способ g), Время удерживания=1,79 минуты; MS масса/заряд: 486 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 8,78 (s, 1H), 7,72 (s, 1H), 7,07 (s, 1H), 5,83 (s, 1H), 4,48 (s, 2H), 3,92 (s, 3H), 3,54 (s, 2H), 3,31 (m, 4H), 3,21 (m, 2H), 2,38 (s, 3H).
Пример BF: 2-[[3,5-дихлор-2-(морфолин-4-карбонил)-4-пиридил]метил]-1,4-диметил-индол-6-карбонитрил
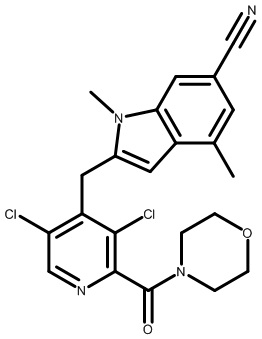
Стадия 1: этил-3,5-дихлор-4-((6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)пиколинат
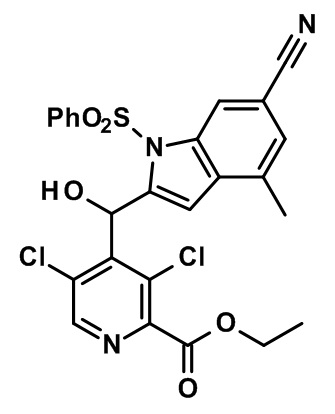
Используя процедуру, аналогичную примеру A, стадии 1, этил-3,5-дихлор-4-((6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)пиколинат (7,6 мг, 39%) получали из N-(5-циано-2-йод-3-метилфенил)бензолсульфонамида (получение №18) (12 г, 30 ммоль) и этил-3,5-дихлор-4-(1-гидроксипроп-2-ин-1-ил)пиколината (получение №37) (9,42 г, 34,4 ммоль). LC/MS (Способ i), Время удерживания=2,39 минуты; MS масса/заряд: 544 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 8,64 (s, 1H), 8,25 (s, 1H), 7,95 (m, 2H), 7,71 (m, 1H), 7,60 (m, 2H), 7,52 (m, 1H), 7,06 (s, 1H), 7,02 (m, 1H), 6,92 (m, 1H), 4,40 (q, J=7,1 Гц, 2H), 2,44 (s, 3H), 1,32 (t, J=7,1 Гц, 3H).
Стадия 2: этил-3,5-дихлор-4-((6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)метил)пиколинат
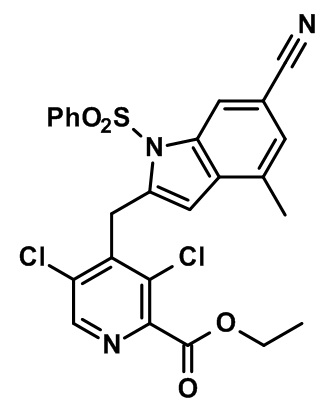
Используя процедуру, аналогичную примеру Z, стадии 2, этил-3,5-дихлор-4-((6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)метил)пиколинат (5,3 г, 56%) получали из этил-3,5-дихлор-4-((6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)пиколината (7,3 г, 13,4 ммоль). LC/MS (Способ i), Время удерживания=2,67 минуты; MS масса/заряд: 528 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 8,77 (s, 1H), 8,35 (s, 1H), 8,05 (m, 2H), 7,78 (m, 1H), 7,65 (m, 2H), 7,48 (s, 1H), 6,32 (s, 1H), 4,63 (s, 2H), 4,39 (q, J=7,1 Гц, 2H), 2,33 (s, 3H), 1,32 (t, J=7,1 Гц, 3H).
Стадия 3: этил-3,5-дихлор-4-((6-циано-4-метил-1H-индол-2-ил)метил)пиколинат

Используя процедуру, аналогичную примеру A, стадии 3, этил-3,5-дихлор-4-((6-циано-4-метил-1H-индол-2-ил)метил)пиколинат (4,9 г, 100%) получали из этил-3,5-дихлор-4-((6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)метил)пиколината (5,3 г, 10 ммоль). Продукт использовали неочищенным на следующей стадии. LC/MS (Способ i), Время удерживания=2,36 минуты; MS масса/заряд: 388 [M+H]+.
Стадия 4: этил-3,5-дихлор-4-((6-циано-1,4-диметил-1H-индол-2-ил)метил)пиколинат

Используя процедуру, аналогичную примеру P, стадии 4, этил-3,5-дихлор-4-((6-циано-1,4-диметил-1H-индол-2-ил)метил)пиколинат (1,25 г, 31%) получали из этил-3,5-дихлор-4-((6-циано-4-метил-1H-индол-2-ил)метил)пиколината (3,89 г, 10,02 ммоль). Продукт использовали непосредственно на следующей стадии. LC/MS (Способ i), Время удерживания=2,41 минуты; MS масса/заряд: 402 [M+H]+.
Стадия 5: 3,5-дихлор-4-((6-циано-1,4-диметил-1H-индол-2-ил)метил)пиколиновая кислота
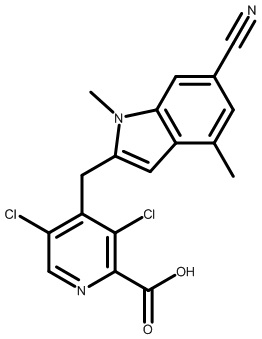
Используя процедуру, аналогичную примеру A, стадии 5, 3,5-дихлор-4-((6-циано-1,4-диметил-1H-индол-2-ил)метил)пиколиновую кислоту (1,06 г, 88%) получали из этил-3,5-дихлор-4-((6-циано-1,4-диметил-1H-индол-2-ил)метил)пиколината (1,25 г, 3,11 ммоль). LC/MS (Способ i), Время удерживания=1,80 минуты; MS масса/заряд: 374 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 14,15 (широкий., 1H), 8,76 (s, 1H), 7,93 (s, 1H), 7,13 (s, 1H), 5,83 (s, 1H), 4,51 (s, 2H), 3,91 (s, 3H), 2,35 (s, 3H).
Стадия 6: 2-[[3,5-дихлор-2-(морфолин-4-карбонил)-4-пиридил]метил]-1,4-диметил-индол-6-карбонитрил
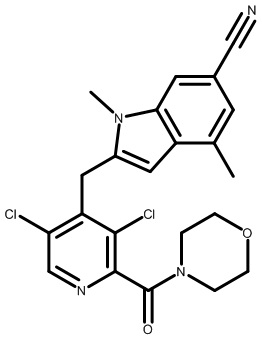
Используя процедуру, аналогичную примеру A1, 2-[[3,5-дихлор-2-(морфолин-4-карбонил)-4-пиридил]метил]-1,4-диметил-индол-6-карбонитрил (49 мг, 41%) получали из 3,5-дихлор-4-((6-циано-1,4-диметил-1H-индол-2-ил)метил)пиколиновой кислоты (100 мг, 0,26 ммоль) и морфолина (30 мг, 0,347 ммоль). LC/MS (Способ g), Время удерживания=1,53 минуты; MS масса/заряд: 443 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 8,78 (s, 1H), 7,93 (s, 1H), 7,12 (m, 1H), 5,87 (s, 1H), 4,49 (s, 2H), 3,91 (s, 3H), 3,67 (s, 4H), 3,53 (m, 2H), 3,22 (m, 2H), 2,35 (s, 3H).
Таблица BF. Следующие примеры получали из 3,5-дихлор-4-((6-циано-1,4-диметил-1H-индол-2-ил)метил)пиколиновой кислоты (пример BA, стадия 5) при помощи такой же процедуры с соответствующим амином.
|
Пример BG:
 2-[1-[3,5-дихлор-4-[(6-циано-1,4-диметил-индол-2-ил)метил]пиридин-2-карбонил]-4-пиперидил]уксусную кислоту;
2-[1-[3,5-дихлор-4-[(6-циано-1,4-диметил-индол-2-ил)метил]пиридин-2-карбонил]-4-пиперидил]уксусную кислоту;

Используя процедуру, аналогичную примеру A, стадии 5, 2-[1-[3,5-дихлор-4-[(6-циано-1,4-диметил-индол-2-ил)метил]пиридин-2-карбонил]-4-пиперидил]уксусную кислоту (49 мг, 37%) получали из метил-2-[1-[3,5-дихлор-4-[(6-циано-1,4-диметил-индол-2-ил)метил]пиридин-2-карбонил]-4-пиперидил]ацетата (таблица BF, пример BF-6) (0,27 ммоль). LC/MS (Способ g), Время удерживания=1,48 минуты; MS масса/заряд: 499 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 12,11 (широкий, 1H), 8,76 (s, 1H), 7,93 (s, 1H), 7,10 (m, 1H), 5,83 (s, 1H), 4,49 (m, 2H), 4,44 (m, 1H), 3,91 (s, 3H), 3,25 (m, 1H), 3,07 (m, 1H), 2,85 (m, 1H), 2,34 (s, 3H), 2,17 (m, 2H), 1,96 (m, 1H), 1,79 (m, 1H), 1,63 (m, 1H), 1,14 (m, 2H).
Пример BH: (4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиридин-3-ил)(морфолинo)метанон

Стадия 1: (4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиридин-3-ил)(морфолинo)метанон
Используя процедуру, аналогичную примеру A, стадии 1, (4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиридин-3-ил)(морфолинo)метанон (4,3 мг, 32%) получали из N-(2-йод-3-метил-5-(трифторметил)фенил)бензолсульфонамида (получение №16) (8,72 г, 19,7 ммоль) и этил-4,6-дихлор-5-(1-гидроксипроп-2-ин-1-ил)никотината (получение №38) (6,5 г, 23,7 ммоль). LC/MS (Способ h), Время удерживания=2,65 минуты; MS масса/заряд: 587 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 8,69 (s, 1H), 8,08 (s, 1H), 7,80 (m, 2H), 7,69 (m, 1H), 7,60 (m, 2H), 7,45 (s, 1H), 7,07 (s, 1H), 6,91 (m, 2H), 4,37 (q, J=7,1 Гц, 2H), 2,50 (s, 3H), 1,33 (t, J=7,1 Гц, 3H).
Стадия 2: этил-4,6-дихлор-5-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)никотинат

Используя процедуру, аналогичную примеру Z, стадии 2, этил-4,6-дихлор-5-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)никотинат (3,35 г, 80%) получали из (4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиридин-3-ил)(морфолинo)метанона (4,3 г, 7,32 ммоль). LC/MS (Способ h), Время удерживания=2,57 минуты; MS масса/заряд: 571 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 8,84 (s, 1H), 8,23 (s, 1H), 7,93 (m, 2H), 7,77 (m, 1H), 7,69 (m, 2H), 7,42 (s, 1H), 6,33 (s, 1H), 4,60 (s, 2H), 4,38 (q, J=7,1 Гц, 2H), 2,38 (s, 3H), 1,34 (t, J=7,1 Гц, 3H).
Стадия 3: 4,6-дихлор-5-((4-метил-6-(трифторметил)-1H-индол-2-ил)метил)никотиновая кислота

В раствор этил-4,6-дихлор-5-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)никотината (3,29 г, 5,76 ммоль) в THF (30 мл) и MeOH (30 мл) добавляли гидроксид натрия (28 мл) и смесь перемешивали при комнатной температуре в течение ночи. Растворители концентрировали под вакуумом и остаток разбавляли водой. pH доводили до 5 добавлением 1 н. водного раствора HCl и полученный осадок фильтровали, промывали водой и высушивали с получением 4,6-дихлор-5-((4-метил-6-(трифторметил)-1H-индол-2-ил)метил)никотиновой кислоты (2,27 г, 98%) в виде бежевого порошка. Продукт использовали непосредственно на следующей стадии. LC/MS (Способ h), Время удерживания=1,46 минуты; MS масса/заряд: 403 [M+H]+.
Стадия 4: метил-4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)никотинат
В раствор 4,6-дихлор-5-((4-метил-6-(трифторметил)-1H-индол-2-ил)метил)никотиновой кислоты (2 г, 4,96 ммоль) в ACN (50 мл) добавляли карбонат цезия (4,85 г, 14,88 ммоль) и диметилсульфат (1,176 мл, 12,40 ммоль) и смесь перемешивали в течение ночи при 45°C. Добавляли дополнительное количество диметилсульфата (624 мг, 4,9 ммоль) и смесь перемешивали в течение 6 часов. В смесь добавляли воду и водный слой экстрагировали с помощью EtOAc. Органическую фазу промывали насыщенным водным раствором NaCl, высушивали над сульфатом магния и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-80% EtOAc в циклогексане) с получением метил-4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)никотината (1 г, 47%) в виде розового порошка. LC/MS (Способ h), Время удерживания=2,13 минуты; MS масса/заряд: 431 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 8,84 (s, 1H), 7,71 (s, 1H), 7,07 (s, 1H), 5,82 (s, 1H), 4,50 (s, 2H), 3,92 (s, 6H), 2,38 (s, 3H).
Стадия 5: 4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)никотиновая кислота

Используя процедуру, аналогичную примеру A, стадии 5, 4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)никотиновую кислоту (88 мг, 100%) получали из метил-4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)никотината (92 мг, 0,21 ммоль). LC/MS (Способ h), Время удерживания=2,70 минуты; MS масса/заряд: 417 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 8,79 (s, 1H), 7,71 (s, 1H), 7,07 (s, 1H), 5,81 (s, 1H), 4,49 (s, 2H), 3,92 (s, 3H), 2,38 (s, 3H).
Стадия 6: (4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиридин-3-ил)(морфолинo)метанон

Используя процедуру, аналогичную примеру A, стадии 6, (4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиридин-3-ил)(морфолинo)метанон (81 мг, 78%) получали из 4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)никотиновой кислоты (85 мг, 0,20 ммоль). LC/MS (Способ g), Время удерживания=1,78 минуты; MS масса/заряд: 486 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 8,51 (s, 1H), 7,71 (s, 1H), 7,07 (s, 1H), 5,85 (s, 1H), 4,46 (m, 2H), 3,92 (s, 3H), 3,70(m, 4H), 3,55 (m, 2H), 3,25 (m, 2H), 2,39 (s, 3H).
Таблица BH. Следующие примеры получали из 4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)никотиновой кислоты (пример BH, стадия 5) при помощи такой же процедуры с соответствующим амином.
|
Пример BI: 3-(3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)-2-оксопиридин-1(2H)-ил)пропановая кислота

В суспензию 3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиридин-2-ола (пример AL, стадия 1) (50 мг, 0,128 ммоль) в DMF (700 мкл) добавляли гидрид натрия (4,62 мг, 0,193 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 15 минут. Бета-пропиолактон (12,12 мкл, 0,193 ммоль) добавляли в реакционную смесь и реакционную смесь перемешивали при 50°C в течение 24 часов. Реакционную смесь разбавляли водой. Полученный водный слой экстрагировали с помощью EtOAc. Полученный органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали препаративной LCMS с получением 3-(3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)-2-оксопиридин-1(2H)-ил)пропановой кислоты (7 мг, 12%) в виде белого твердого вещества. LC/MS (Способ g), Время удерживания=1,68 минуты; MS масса/заряд: 461 [M+H]+
1H ЯМР (DMSO-d6, 500МГц): δ 8,15 (s, 1H), 7,69 (s, 1H), 7,07 (s, 1H), 5,98 (s, 1H), 4,30 (s, 2H), 4,17 (t, J=6,9 Гц, 2H), 3,89 (s, 3H), 2,66 (m, 2H), 2,41 ppm (s, 3H)
Пример BJ: (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(морфолинo)метанон

Стадия 1: метил-2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоат

Смесь N-1,3-диметил-5-(трифторметил)бензол-1,2-диамина (получение №21) (100 мг, 0,490 ммоль), 2-(2,6-дихлор-3-(метоксикарбонил)фенил)уксусной кислоты (получение №2) (129 мг, 0,490 ммоль), HATU (186 мг, 0,490 ммоль) и 4-метилморфолина (216 мкл, 1,959 ммоль) нагревали при 100°C при быстром перемешивании в течение 18 часов. Добавляли уксусную кислоту (245 мкл) и смесь перемешивали при 100°C в течение 1 дополнительного часа. Реакционную смесь разбавляли водой, экстрагировали с помощью EtOAc. Органический слой промывали насыщенным водным раствором NaHCO3, водой и солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали с получением метил-2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоата (199 мг, 94%) в виде бежевого твердого вещества. LC/ MS (способ k), Время удерживания=2,98 мин.; MS масса/заряд: 431 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 7,83 (s, 1H), 7,76 (d, J=9Гц, 1H), 7,67 (d, J=9Гц, 1H), 7,27 (s, 1H), 4,63 (s, 2H), 3,98 (s, 3H), 3,87 (s, 3H), 2,41 (s, 3H).
Стадия 2: 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензойную кислоту (7,4 г, 98%) получали из метил-2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоата (7,81 г, 18,16 ммоль). LC/MS (Способ h), Время удерживания=2,41 минуты; MS масса/заряд: 417 [M+H]+.
1H ЯМР (DMSO-d6, 300 МГц): δ 13,67 (широкий, 1H), 7,82 (s, 1H), 7,73 (d, J=9Гц, 1H), 7,62 (d, J=9Гц, 1H), 7,27 (s, 1H), 4,63 (s, 2H), 3,97 (s, 3H), 2,41 (s, 3H).
Стадия 3: (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(морфолинo)метанон
Используя процедуру, аналогичную примеру A1, (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(морфолинo)метанон (191 мг, 56%) получали из 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензойной кислоты (290 мг, 0,695 ммоль) и морфолина (79 мг, 0,90 ммоль).
LC/MS (Способ h), Время удерживания=2,59 минуты; MS масса/заряд: 486 [M+H]+. 1H ЯМР (DMSO-d6, 400 МГц): δ 7,82 (s, 1H), 7,65 (d, J=8Гц, 1H), 7,41 (d, J=8Гц, 1H), 7,26 (s, 1H), 4,63 (d, J=16Гц, 1H), 4,56 (d, J=16Гц, 1H), 3,97 (s, 3H), 3,63 (m, 4H), 3,52 (m, 2H), 3,17 (m, 2H), 2,39 (s, 3H).
Таблица BJ. Следующие примеры получали из 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензойной кислоты при помощи такой же процедуры с соответствующим амином.





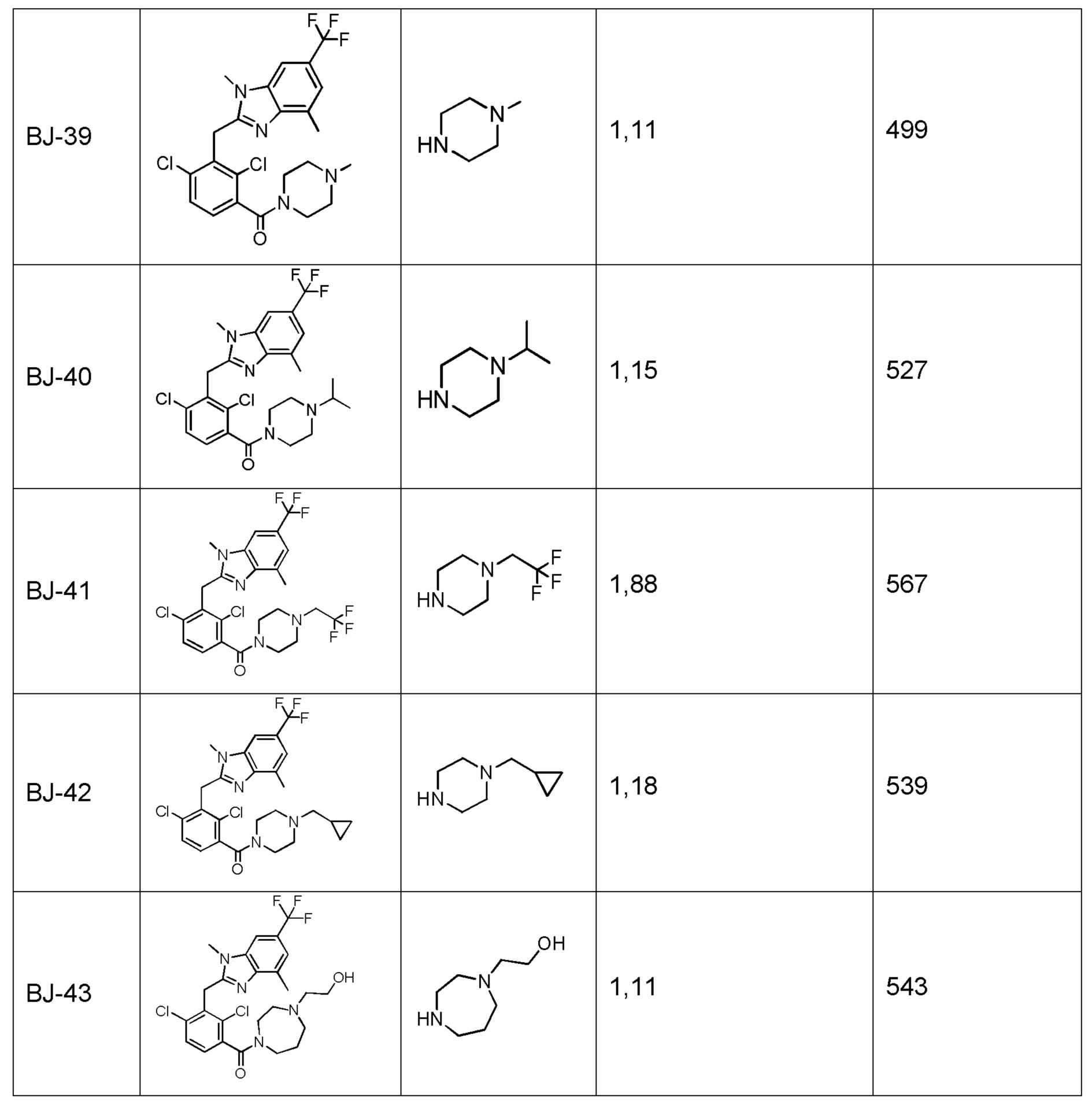
Пример BK: 1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперидин-4-карбоновая кислота
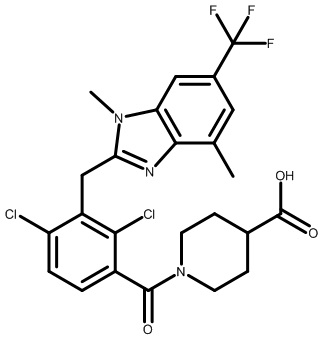
Стадия 1: этил-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперидин-4-карбоксилат
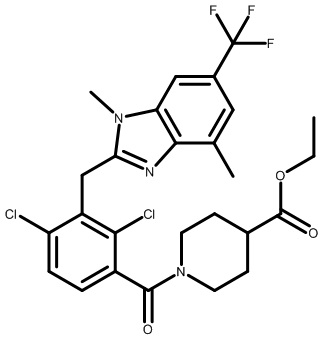
Используя процедуру, аналогичную примеру A, стадии 6, этил-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперидин-4-карбоксилат (110 мг, 63%) получали из 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензойной кислоты (пример BJ, стадия 2) (130 мг, 0,312 ммоль) и этил-пиперидин-4-карбоксилата (73,5 мг, 0,467 ммоль). LC/MS (Способ h), Время удерживания=2,97 минуты; MS масса/заряд: 556 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 7,82 (s, 1H), 7,62 (d, J=9Гц, 1H), 7,42 и 7,35 (d, J=9Гц, 1H), 7,26 (s, 1H), 4,65 (m, 1H), 4,56 (d, J=16Гц, 1H), 4,38 и 4,34 (m, 1H), 4,04 (m, 2H), 3,97 (s, 3H), 3,27 (m, 1H), 3,09 (m, 1H), 2,97 (m, 1H), 2,64 (m, 1H), 2,40 (s, 3H), 1,93 (m, 1H), 1,76 (m, 1H), 1,50 (m, 2H), 1,16 (m, 3H).
Стадия 2: 1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперидин-4-карбоновая кислота

Используя процедуру, аналогичную примеру A, стадии 5, 1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперидин-4-карбоновую кислоту (88 мг, 83%) получали из этил-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперидин-4-карбоксилата (110 мг, 0,198 ммоль). LC/MS (Способ g), Время удерживания=1,53 минуты; MS масса/заряд: 528 [M+H]+. 1H ЯМР (DMSO-d6, 400 МГц): δ 7,83 (s, 1H), 7,62 (d, J=8Гц, 1H), 7,42 и 7,35 (d, J=8Гц, 1H), 7,27 (s, 1H), 4,65 (dd, J=6Гц, 12Гц, 1H), 4,56 (d, J=12Гц, 1H), 4,36 и 4,33 (m, 1H), 3,97 (s, 3H), 3,28 (m, 1H), 3,07 (m, 1H), 2,96 (m, 1H), 2,54 (m, 1H), 2,40 (s, 3H), 1,92 (m, 1H), 1,76 (m, 1H), 1,60-1,40 (m, 2H).
Пример BL: (1R, 5S, 6r)-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)-3-азабицикло[3.1.0]гексан-6-карбоновая кислота
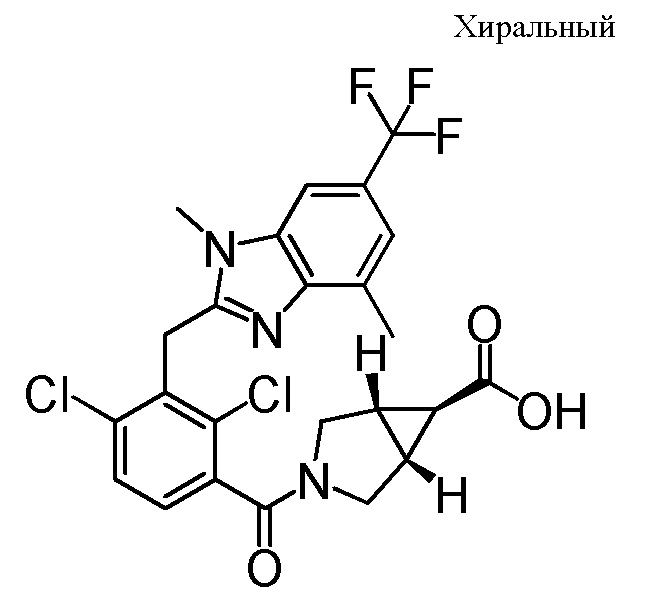
Step 1: (1R, 5S)-этил-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)-3-азабицикло[3.1.0]гексан-6-карбоксилат

Используя процедуру, аналогичную примеру A, стадии 6, (1R,5S)-этил-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)-3-азабицикло[3.1.0]гексан-6-карбоксилат (110 мг, 52%) получали из 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензойной кислоты (пример BJ, стадия 2) (160 мг, 0,384 ммоль) и (1R,5S)-этил-3-азабицикло[3.1.0]гексан-6-карбоксилата гидрохлорида (89 мг, 0,464 ммоль).
LC/MS (Способ g), Время удерживания=1,77 минуты; MS масса/заряд: 554 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 7,82 (s, 1H), 7,63 (d, J=9Гц, 1H), 7,42 (d, J=9Гц, 1H), 7,26 (s, 1H), 4,60 (m, 2H), 4,05 (m, 2H), 3,97 (s, 3H), 3,91 (m, 1H), 3,50 (m, 2H), 3,29 (m, 1H), 3,20 (m, 1H), 2,40 (s, 3H), 2,13 (m, 1H), 2,05 (m, 1H), 1,15 (m, 3H).
Стадия 2: (1R, 5S, 6r)-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)-3-азабицикло[3.1.0]гексан-6-карбоновая кислота

Используя процедуру, аналогичную примеру A, стадии 5 (1R, 5S, 6r)-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)-3-азабицикло[3.1.0]гексан-6-карбоновую кислоту (74 мг, 62%) получали из этил-(1R, 5S, 6r)-3-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)-3-азабицикло[3.1.0]гексан-6-карбоксилата (122 мг, 0,220 ммоль). LC/MS (Способ g), Время удерживания=1,50 минуты; MS масса/заряд: 526 [M+H]+. 1H ЯМР (DMSO-d6, 400 МГц): δ 7,82 (s, 1H), 7,62 (d, J=9Гц, 1H), 7,41 (d, J=9Гц, 1H), 7,26 (s, 1H), 4,60 (m, 2H), 3,97 (s, 3H), 3,88 (m, 1H), 3,48 (m, 2H), 3,20 (m, 1H), 2,40 (s, 3H), 2,07 (m, 1H), 1,99 (m, 1H), 1,33 (m, 1H).
Пример BM: 1-[2,4-дихлор-3-[[1,4-диметил-6-(трифторметил)бензимидазол-2-ил]метил]бензоил]-3-метил-пиперидин-4-карбоновая кислота
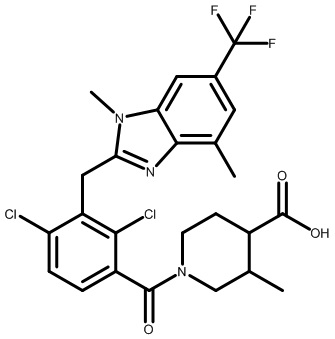
Используя процедуру, аналогичную примеру A, стадии 6 и 5, 1-[2,4-дихлор-3-[[1,4-диметил-6-(трифторметил)бензимидазол-2-ил]метил]бензоил]-3-метилпиперидин-4-карбоновую кислоту получали из 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензойной кислоты (пример BJ, стадия 2) (60 мг, 0,144 ммоль) и метил-3-метилпиперидин-4-карбоксилата гидрохлорида (0,216 ммоль). LC/MS (Способ g), Время удерживания=1,61 минуты; MS масса/заряд: 542 [M+H]+.
1H ЯМР (DMSO-d6, 400 МГц): δ 12,26 (широкий, 1H), 7,83 (s, 1H), 7,61 (m, 1H), 7,37 (m, 1H), 7,27 (s, 1H), 4,62 (m, 2H), 4,38 и 4,23 (m, 1H), 3,97 (m, 3H), 3,28-2,95 (m, 3H), 2,69 (m, 1H), 2,40 (m, 3H), 2,29 и 2,10 (m, 1H), 1,75-1,48 (m, 2H), 0,89 и 0,74 (m, 3H).
Пример BM-1: 1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-4-фторпиперидин-4-карбоновая кислота

Используя процедуру, аналогичную примеру A, стадии 6 и 5, 1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)-4-фторпиперидин-4-карбоновую кислоту (91 мг, 99%) получали из 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензойной кислоты (пример BJ, стадия 2) (95 мг, 0,166 ммоль) и этил-4-фторпиперидин-4-карбоксилата гидрохлорида (76 мг, 0,36 ммоль). LC/MS (Способ g), Время удерживания=1,92 минуты; MS масса/заряд: 545 [M+H]+.
1H ЯМР (DMSO-d6, 400МГц): δ 7,69 (m, 2H), 7,54 и 7,44 (d, J=, 8Гц 1H), 7,06 (s, 1H), 5,69 (m, 1H), 4,48 (m, 3H), 3,92 (s, 3H), 3,26 (m, 1H), 3,08 (m, 1H), 2,37 и 2,36 (s, 3H), 2,00 (m, 2H), 1,88 (m, 2H).
Пример BN: 2-(2,6-дихлор-3-(4-(2-гидроксиэтил)пиперидин-1-карбонил)бензил)-1,4-диметил-1H-бензо[d]имидазол-6-карбонитрил

Стадия 1: метил-2,4-дихлор-3-((6-циано-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)бензоат

Используя процедуру, аналогичную примеру BJ, стадии 1, метил-2,4-дихлор-3-((6-циано-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)бензоат (1,65 г, 44%) получали из 4-амино-3-метил-5-(метиламино)бензонитрила (получение №22) (1,55 г, 9,62 ммоль) и 2-(2,6-дихлор-3-(метоксикарбонил)фенил)уксусной кислоты (получение №2) (2,53 г, 9,62 ммоль). LC/MS (Способ k), Время удерживания=2,69 минуты; MS масса/заряд: 388 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ. 8,02 (s, 1H), 7,76 (d, J=9Гц, 1H), 7,68 (d, J=9Гц, 1H), 7,34 (s, 1H), 4,64 (s, 2H), 3,95 (s, 3H), 3,87 (s, 3H), 2,37 (s, 3H).
Стадия 2: 2,4-дихлор-3-((6-циано-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((6-циано-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)бензойную кислоту (1,7 г, 87%) получали из метил-2,4-дихлор-3-((6-циано-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)бензоата (2,028 г, 5,22 ммоль).
LC/MS (Способ h), Время удерживания=2,04 минуты; MS масса/заряд: 374 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ. 13,63 (широкий, 1H), 8,02 (s, 1H), 7,73 (d, J=9Гц, 1H), 7,63 (d, J=9Гц, 1H), 7,34 (s, 1H), 4,63 (s, 2H), 3,95 (s, 3H), 2,37 (s, 3H).
Стадия 3: 2-(2,6-дихлор-3-(4-(2-гидроксиэтил)пиперидин-1-карбонил)бензил)-1,4-диметил-1H-бензо[d]имидазол-6-карбонитрил:

Используя процедуру, аналогичную примеру A1, 2-(2,6-дихлор-3-(4-(2-гидроксиэтил)пиперидин-1-карбонил)бензил)-1,4-диметил-1H-бензо[d]имидазол-6-карбонитрил (55 мг, 65%) получали из 2,4-дихлор-3-((6-циано-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)бензойной кислоты (65 мг, 0,174 ммоль) и 4-пиперидинэтанола (0,26 ммоль). LC/MS (Способ h), Время удерживания=2,04 минуты; MS масса/заряд: 485 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ. 8,02 (s, 1H), 7,61 и 7,60 (d, J=8,1Гц, 1H), 7,40 и 7,32 (d, J=8,1Гц, 1H), 7,34 (s, 1H), 4,66 и 6,64 (d, J=17,1, 1H), 4,56 (d, J=17,1, 1H), 4,46 (m, 1H), 3,95 (s, 3H), 3,42 (m, 3H), 3,27 (m, 1H), 2,99 (m, 1H), 2,75 (m, 1H), 2,36 (m, 3H), 1,75 (m, 1H), 1,86 (m, 1H), 1,57 (m, 1H), 1,35 (m, 2H), 1,06 (m, 2H)
Таблица BN. Следующие примеры получали из 2,4-дихлор-3-((6-циано-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)бензойной кислоты (пример BN, стадия 2) при помощи такой же процедуры с соответствующим амином.

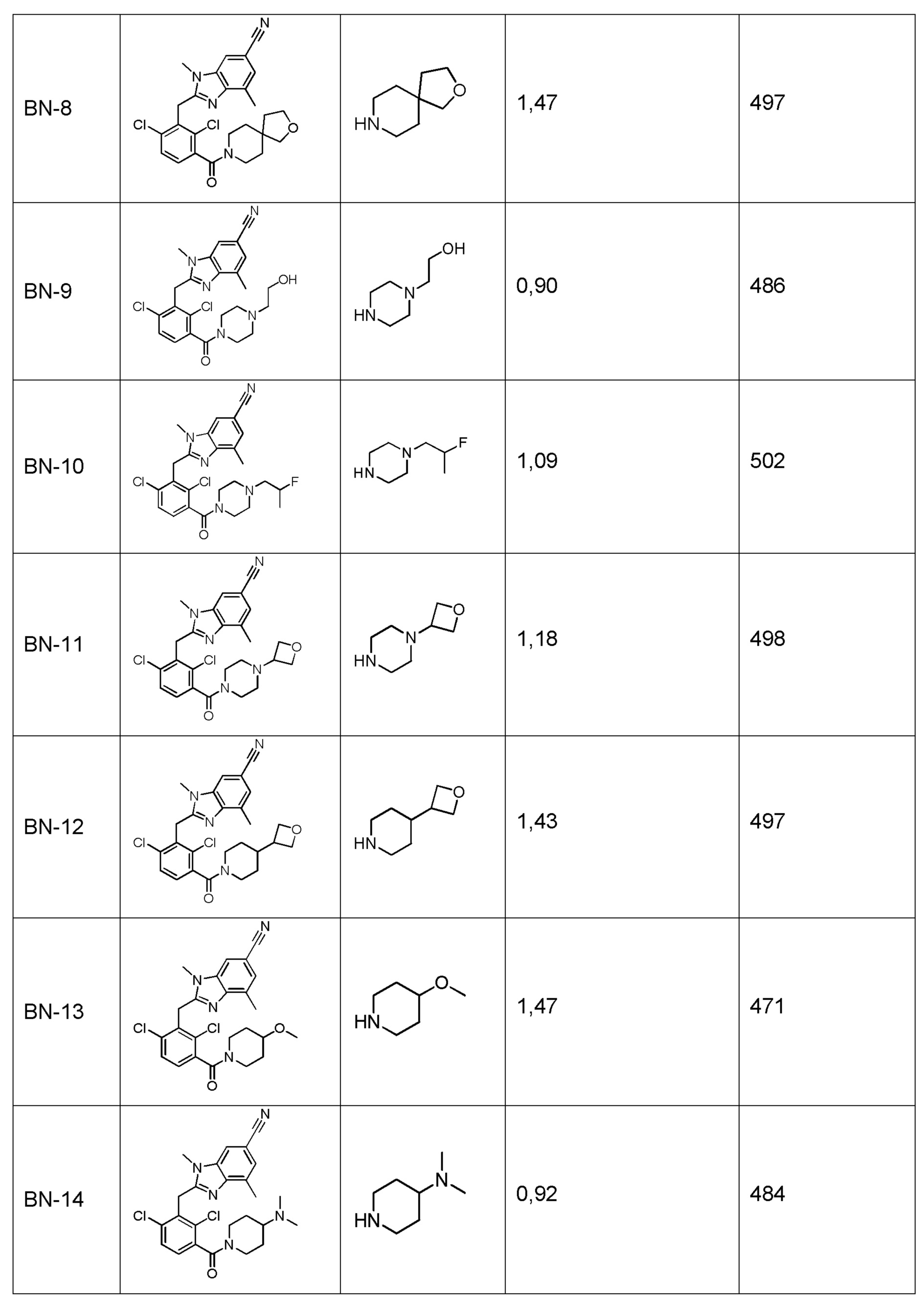

Пример BO: (2,4-дихлор-3-((1,4,6-триметил-1H-бензо[d]имидазол-2-ил)метил)фенил)(морфолинo)метанон
Стадия 1: (2,4-дихлор-3-((1,4,6-триметил-1H-бензо[d]имидазол-2-ил)метил)фенил)(морфолинo)метанон
Используя процедуру, аналогичную примеру BJ, стадии 1, (2,4-дихлор-3-((1,4,6-триметил-1H-бензо[d]имидазол-2-ил)метил)фенил)(морфолинo)метанон (17 мг, 12%) получали из N-1,3,5-триметилбензол-1,2-диамина (получение №23) (50 мг, 0,333 ммоль) и 2-(2,6-дихлор-3-(морфолин-4-карбонил)фенил)уксусной кислоты (получение №8) (100 мг, 0,314 ммоль).
LC/MS (Способ g), Время удерживания=1,05 минуты; MS масса/заряд: 432 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ. 7,62 (d, J=9Гц, 1H), 7,38 (d, J=9Гц, 1H), 7,11 (s, 1H), 6,75 (s, 1H), 4,55 (d, J=15Гц, 1H), 4,46 (d, J=15Гц, 1H), 3,82 (s, 3H), 3,64 (m, 4H), 3,53 (m, 2H), 3,17 (m, 2H), 2,38 (s, 3H), 2,27 (s, 3H).
Пример BP: (2,4-дихлор-3-((1,7-диметил-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(морфолинo)метанон
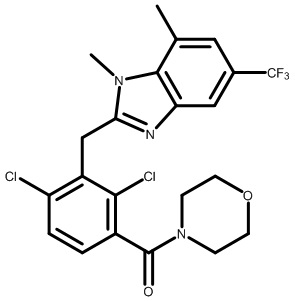
Стадия 1: (2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(морфолинo)метанон
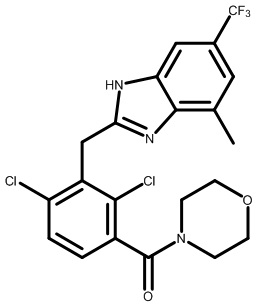
Используя процедуру, аналогичную примеру BJ, стадии 1, (2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(морфолинo)метанон (70 мг, 11%) получали из 3-метил-5-(трифторметил)бензол-1,2-диамина (получение №23, стадия 4) (251 мг, 1,320 ммоль) и 2-(2,6-дихлор-3-(морфолин-4-карбонил)фенил)уксусной кислоты (получение №8) (420 мг, 1,320 ммоль) LC/MS (Способ h), Время удерживания=2,32 минуты; MS масса/заряд: 472 [M+H]+.
1H ЯМР (DMSO-d6, 300 МГц): δ. 12,92 и 12,62 (широкий, 1H), 7,63 (m, 2H), 7,41 (m, 1H), 7,24 и 7,16 (m, 1H), 4,56 (m, 2H), 3,64 (m, 4H), 3,53 (m, 2H), 3,17 (m, 2H), 2,56 и 2,50 (s, 3H).
Стадия 2: (2,4-дихлор-3-((1,7-диметил-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(морфолинo)метанон
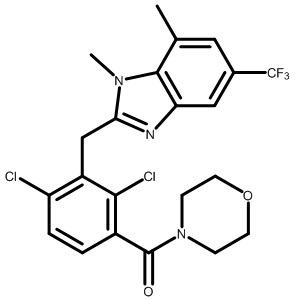
Используя процедуру, аналогичную примеру A, стадии 4, (2,4-дихлор-3-((1,7-диметил-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(морфолинo)метанон (8 мг, 11%) получали из (2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(морфолинo)метанона (70 мг, 0,148 ммоль). LC/MS (Способ g), Время удерживания=1,54 минуты; MS масса/заряд: 486 [M+H]+. 1H ЯМР (DMSO-d6, 400 МГц): δ. 7,69 (s, 1H), 7,62 (d, J=9Гц, 1H), 7,41 (d, J=9Гц, 1H), 7,25 (s, 1H), 4,56 (m, 2H), 4,15 (s, 3H), 3,65 (m, 4H), 3,53 (m, 2H), 3,16 (m, 2H), 2,81 (s, 3H).
Пример BQ: (3-((6-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорфенил)(морфолинo)метанон
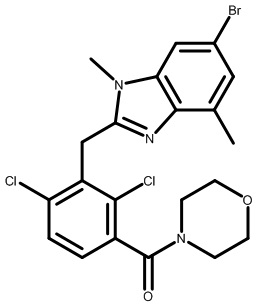
Стадия 1: метил-3-((6-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорбензоат

Используя процедуру, аналогичную примеру BJ, стадии 1, метил-3-((6-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорбензоат (451 мг, 42%) получали из 5-бром-N-1,3-диметилбензол-1,2-диамина (получение №24) (440 мг, 2,046 ммоль) и 2-(2,6-дихлор-3-(метоксикарбонил)фенил)уксусной кислоты (получение №2) (538 мг, 2,046 ммоль). LC/MS (Способ h), Время удерживания=2,89 минуты; MS масса/заряд: 441 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ. 7,75 (d, J=9Гц, 1H), 7,67 (d, J=9Гц, 1H), 7,63 (m, 1H), 7,10 (m, 1H), 4,57 (s, 2H), 3,88 (s, 3H), 3,87 (s, 3H), 2,32 (s, 3H).
Стадия 2: 3-((6-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорбензойная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 3-((6-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорбензойную кислоту (248 мг, 57%) получали из метил-3-((6-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорбензоата (445 мг, 1,006 ммоль).
LC/MS (Способ h), Время удерживания=2,16 минуты; MS масса/заряд: 427 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ. 7,72 (d, J=9Гц, 1H), 7,65 (s, 1H), 7,62 (d, J=9Гц, 1H), 7,11 (s, 1H), 4,57 (s, 2H), 3,88 (s, 3H), 2,33 (s, 3H).
Стадия 3: (3-((6-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорфенил)(морфолинo)метанон
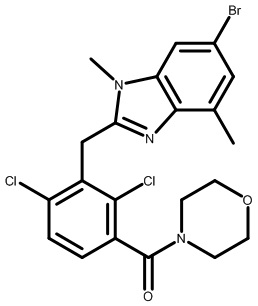
Используя процедуру, аналогичную примеру A1, (3-((6-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорфенил)(морфолинo)метанон (223 мг, 78%) получали из 3-((6-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорбензойной кислоты (245 мг, 0,572 ммоль) и морфолина (64,8 мг, 0,744 ммоль). LC/MS (Способ g), Время удерживания=1,53 минуты; MS масса/заряд: 496 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ. 7,63 (s, 1H), 7,62 (d, J=9Гц, 1H), 7,40 (d, J=9Гц, 1H), 7,10 (s, 1H), 4,56 (d, J=15Гц, 1H), 4,48 (d, J=15Гц, 1H), 3,87 (s, 3H), 3,64 (m, 4H), 3,52 (m, 2H), 3,17 (m, 2H), 2,31 (s, 3H).
Пример BR: (3-((6-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-диметилфенил)(морфолинo)метанон

Стадия 1: метил-3-((6-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-диметилбензоат
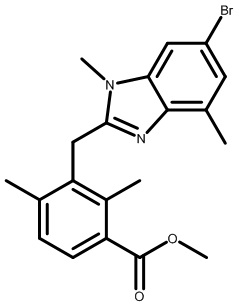
Используя процедуру, аналогичную примеру BJ, стадии 1, метил-3-((6-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-диметилбензоат (620 мг, 70%) получали из 2-(3-(метоксикарбонил)-2,6-диметилфенил)уксусной кислоты (получение №9) (500 мг, 2,250 ммоль) и 5-бром-N1,3-диметилбензол-1,2-диамина (получение №24) (484 мг, 2,250 ммоль) LC/MS (Способ h), Время удерживания=2,62 минуты; MS масса/заряд: 401 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 7,61 (m, 1H), 7,55 (d, J=9Гц, 1H), 7,18 (d, J=9Гц, 1H), 7,08 (m, 1H), 4,28 (s, 2H), 3,85 (s, 3H), 3,81 (s, 3H), 2,36 (s, 3H), 2,33 (s, 3H), 2,28 (s, 3H).
Стадия 2: 3-((6-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-диметилбензойная кислота
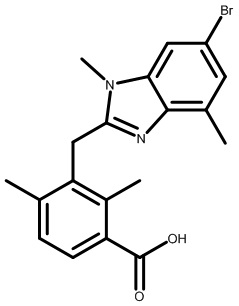
Используя процедуру, аналогичную примеру E, стадии 1, 3-((6-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-диметилбензойную кислоту (580 мг, 94%) получали из метил-3-((6-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-диметилбензоата (620 мг, 1,545 ммоль) LC/MS (Способ h), Время удерживания=2,09 минуты; MS масса/заряд: 387 [M+H]+. 1H ЯМР (DMSO-d6, 400 МГц): δ 12,72 (широкий, 1H), 7,63 (s, 1H), 7,57 (d, J=9Гц, 1H), 7,14 (d, J=9Гц, 1H), 7,09 (s, 1H), 4,27 (s, 2H), 3,33 (s, 3H), 2,38 (s, 3H), 2,33 (s, 3H), 2,28 (s, 3H).
Стадия 3: (3-((6-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-диметилфенил)(морфолинo)метанон
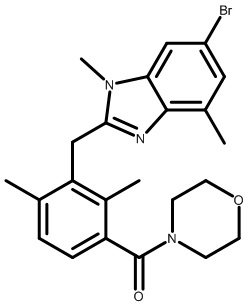
Используя процедуру, аналогичную примеру A, стадии 6, (3-((6-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-диметилфенил)(морфолинo)метанон (580 мг, 97%) получали из 3-((6-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-диметилбензойной кислоты (465 мг, 1,201 ммоль) и морфолина (157 мг, 1,80 ммоль). LC/MS (Способ g), Время удерживания=1,99 минуты; MS масса/заряд: 456 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 7,61 (m, 1H), 7,12 (d, J=9Гц, 1H), 7,08 (m, 1H), 7,01 (d, J=9Гц, 1H), 4,26 (m, 2H), 3,83 (s, 3H), 3,64 (m, 4H), 3,48 (m, 2H), 3,14 (m, 2H), 2,32 (s, 3H), 2,25 (s, 3H), 2,12 (s, 3H).
Пример BS: (2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-карбонил)фенил)(морфолинo)метанон

В раствор (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(морфолинo)метанона (пример BJ, стадия 3) (35 мг, 0,072 ммоль) в диоксане (500 мкл) добавляли диоксид марганца (67 мг, 0,771 ммоль). Реакционную смесь перемешивали при 65°C в течение 24 часов. Добавляли диоксид марганца (55 мг, 0,633 ммоль) и реакционную смесь перемешивали при 65°C в течение 24 часов. Добавляли диоксид марганца (55 мг, 0,633 ммоль) и реакционную смесь перемешивали при 80°C в течение 24 часов. Добавляли диоксид марганца (55 мг, 0,633 ммоль) и реакционную смесь перемешивали при 80°C в течение 36 часов. Реакционную смесь фильтровали и промывали с помощью EtOAc. Фильтрат концентрировали под пониженным давлением. Остаток очищали препаративной LCMS с получением (2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-карбонил)фенил)(морфолинo)метанона (20 мг, 55%). LC/MS (Способ g), Время удерживания=1,77 минуты; MS масса/заряд: 500 [M+H]+. 1H ЯМР (DMSO-d6, 400 МГц): δ 8,16 (s, 1H), 7,76 (d, J=9Гц, 1H), 7,66 (d, J=9Гц, 1H), 7,51 (s, 1H), 4,31 (s, 3H), 3,65 (m, 4H), 3,56 (m, 2H), 3,20 (m, 2H), 2,51 (s, 3H).
Пример BT: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензоил)-1,4-диметил-1H-бензо[d]имидазол-6-карбоксамид

Используя процедуру, аналогичную примеру BS, 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензоил)-1,4-диметил-1H-бензо[d]имидазол-6-карбоксамид (15 мг, 18%) получали из 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-бензо[d]имидазол-6-карбонитрила (таблица BN, пример BN-1) (180 мг, 0,406 ммоль). LC/MS (Способ g), Время удерживания=1,12 минуты; MS масса/заряд: 475 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 8,18 (s, 1H), 8,06 (широкий, 1H), 7,75 (d, J=9Гц, 1H), 7,71 (m, 1H), 7,64 (d, J=9Гц, 1H), 7,46 (широкий, 1H), 4,27 (s, 3H), 3,65 (m, 4H), 3,55 (m, 2H), 3,20 (m, 2H), 2,46 (s, 3H).
Пример BU: 2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Стадия 1: метил-2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат
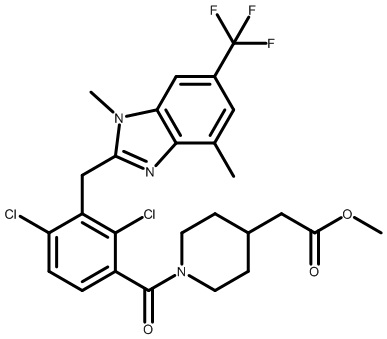
Используя процедуру, аналогичную примеру A1, метил-2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат (163 мг, 100%) получали из 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензойной кислоты (пример BJ, стадия 2) (120 мг, 0,288 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (67 мг, 0,345 ммоль). LC/MS (Способ i), Время удерживания=2,37 минуты; MS масса/заряд: 556 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц): δ 7,85 (s, 1H), 7,62 (m, 1H), 7,40 и 7,33 (d, J=8,3 Гц, 1H), 7,29 (s, 1H), 4,64 (m, 2H), 4,47 (m, 1H), 3,98 и 3,97 (s, 3H), 3,59 и 3,56 (s, 3H), 3,28 (m, 1H), 3,04 (m, 1H), 2,80 (m, 1H), 2,40 (s, 3H), 2,26 (m, 2H), 1,95 (m, 1H), 1,74 (m, 1H), 1,56 (m, 1H), 1,13 (m, 2H).
Стадия 2: 2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (130 мг, 81%) получали из метил-2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперидин-4-ил)ацетата (163 мг, 0,0,293 ммоль). LC/MS (Способ g), Время удерживания=1,56 минуты; MS масса/заряд: 542 [M+H]+. 1H ЯМР (DMSO-d6, 400МГц): δ 12,01 (s, 1H), 7,85 (s, 1H), 7,61 (m, 1H), 7,40 и 7,33 (d, J=8,4 Гц, 1H), 7,29 (s, 1H), 4,65(m, 2H), 4,47 (m, 1H), 3,98 и 3,97 (s, 3H), 3,29 (m, 1H), 3,04 (m, 1H), 2,79 (m, 1H), 2,40 (s, 3H), 2,18 (m, 1H), 2,13 (m, 1H), 1,91 (m, 1H), 1,62(m, 1H), 1,59 (m, 1H), 1,17 (m, 2H).
Пример BV: 3-[4-[2,4-дихлор-3-[[1,4-диметил-6-(трифторметил)бензимидазол-2-ил]метил]бензоил]пиперазин-1-ил]циклобутанкарбоновая кислота
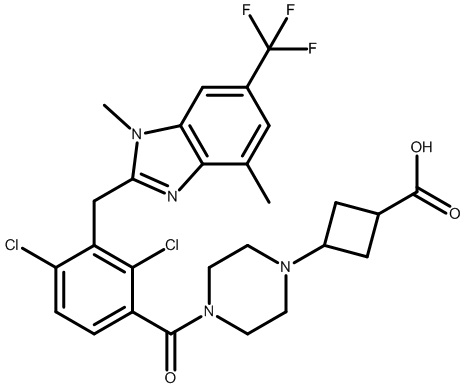
Стадия 1: трет-бутил-4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперазин-1-карбоксилат
Используя процедуру, аналогичную примеру A, стадии 6, трет-бутил-4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперазин-1-карбоксилат (480 мг, 100%) получали из 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензойной кислоты (пример BJ, стадия 2) (300 мг, 0,719 ммоль) и трет-бутил-пиперазин-1-карбоксилат (201 мг, 1,079 ммоль). LC/MS (Способ h), Время удерживания=3,11 минуты; MS масса/заряд: 585 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц): δ 7,83 (s, 1H), 7,64 (d, J=8,3 Гц, 1H), 7,41 (d, J=8,3 Гц, 1H), 7,27 (s, 1H), 4,65 (d, J=16 Гц, 1H), 4,53 (d, J=16 Гц, 1H), 3,97 (s, 3H), 3,61 (m, 2H), 3,21 (m, 2H), 3,15 (m, 2H), 2,58 (m, 2H), 2,41 (s, 3H), 1,30 (s, 9H).
Стадия 2: (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(пиперазин-1-ил)метанон
Используя процедуру, аналогичную примеру O, стадии 2, (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(пиперазин-1-ил)метанон (340 мг, 98%) получали из трет-бутил-4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперазин-1-карбоксилат (420 мг, 0,717 ммоль). LC/MS (Способ h), Время удерживания=2,46 минуты; MS масса/заряд: 485 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц): δ 7,82 (s, 1H), 7,61 (d, J=8,3 Гц, 1H), 7,37 (d, J=8,3 Гц, 1H), 7,26 (s, 1H), 4,66 (d, J=16 Гц, 1H), 4,53 (d, J=16 Гц, 1H), 3,97 (s, 3H), 3,53 (m, 2H), 3,07 (m, 2H), 2,6770 (m, 2H), 2,60 (m, 2H), 2,39 (s, 3H).
Стадия 3: метил-3-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперазин-1-ил)циклобутанкарбоксилат
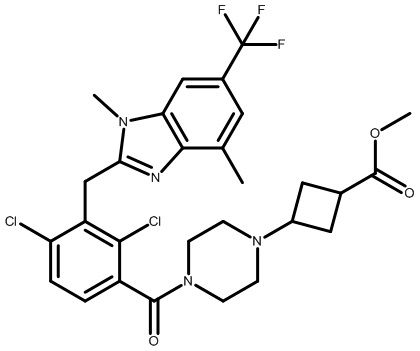
Используя процедуру, аналогичную примеру O, стадии 3, метил-3-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперазин-1-ил)циклобутанкарбоксилат (105 мг, 65%) получали из (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(пиперазин-1-ил)метанона (130 мг, 0,268 ммоль) и метил-3-оксоциклобутанкарбоксилата (85,8 мг, 0,67 ммоль). LC/MS (Способ h), Время удерживания=2,89 минуты; MS масса/заряд: 597 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц): δ 7,82 (s, 1H), 7,62 (d, J=8,1 Гц, 1H), 7,37 (d, J=8,1 Гц, 1H), 7,27 (s, 1H), 4,65 (d, J=16 Гц, 1H), 4,53 (d, J=16 Гц, 1H), 3,97 (s, 3H), 3,65 (m, 1H), 3,58 (s, 3H), 3,14 (m, 2H), 2,82 (m, 1H), 2,65 (m, 1H), 2,39 (s, 3H), 2,32 (m, 1H), 2,20 (m, 6H), 1,93 (m, 2H).
Стадия 4: 3-[4-[2,4-дихлор-3-[[1,4-диметил-6-(трифторметил)бензимидазол-2-ил]метил]бензоил]пиперазин-1-ил]циклобутанкарбоновая кислота

Используя процедуру, аналогичную примеру A, стадии 5, 3-[4-[2,4-дихлор-3-[[1,4-диметил-6-(трифторметил)бензимидазол-2-ил]метил]бензоил]пиперазин-1-ил]циклобутанкарбоновую кислоту (65 мг, 63%) получали из метил-3-(4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперазин-1-ил)циклобутанкарбоксилата (105 мг, 0,176 ммоль).
LC/MS (Способ g), Время удерживания=1,16 минуты; MS масса/заряд: 583 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц,): δ 7,82 (s, 1H), 7,61 (d, J=8,3 Гц, 1H), 7,37 (d, J=8,3 Гц, 1H), 7,27 (s, 1H), 4,65 (d, J=16 Гц, 1H), 4,53 (d, J=16 Гц, 1H), 3,96 (s, 3H), 3,61 (m, 2H), 3,13 (m, 2H), 2,40 (s, 3H), 2,18 (m, 6H), 1,97 (m, 2H), 1,81 (m, 2H)
Пример BW: 2-[[2,6-дихлор-3-[[4-(2-метоксиэтил)-1-пиперидил]метил]фенил]метил]-1,4-диметил-6-(трифторметил)бензимидазол
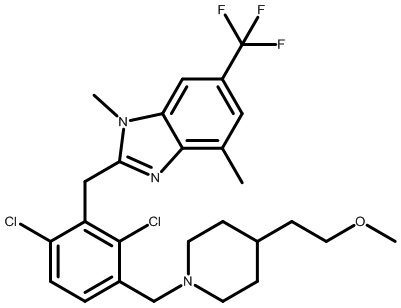
Стадия 1: (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)метанол
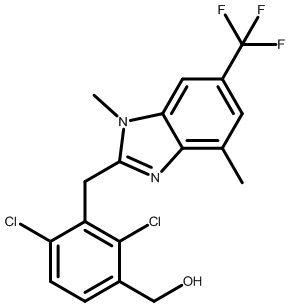
В раствор метил-2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоата (пример BJ, стадия 1) (2,45 г, 5,68 ммоль) в THF (100 мл) порционно добавляли боргидрид лития (0,371 г, 17,04 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Добавляли дополнительное количество боргидрида лития (0,185 г, 8,5 ммоль) и реакционную смесь перемешивали при 50°C в течение 3 часов. Смесь охлаждали до 0°C и медленно охлаждали добавлением 1 н. водного раствора HCl. Получали белый осадок. THF концентрировали и осадок фильтровали, промывали водой и высушивали под вакуумом с получением (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)метанола (1,83 г, 80%) в виде белого порошка.
LC/MS (Способ h), Время удерживания=2,66 минуты; MS масса/заряд: 403 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц): δ 7,82 (s, 1H), 7,55 (s, 2H), 7,26 (s, 1H), 5,54 (t, J=5,6 Гц, 1H), 4,53-4,60 (m, 4H), 3,97 (s, 3H), 2,41 (s, 3H).
Стадия 2: 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензилметансульфонат
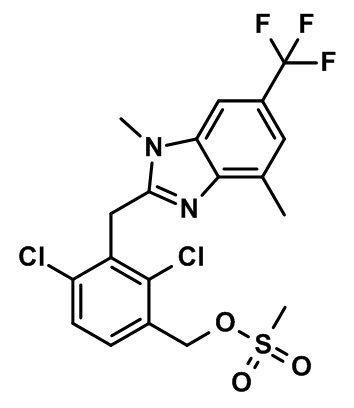
В суспензию (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)метанола (1,820 г, 4,51 ммоль) в DCM (150 мл) добавляли триэтиламин (0,913 г, 9,03 ммоль) и метансульфонилхлорид (0,776 г, 6,77 ммоль) и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь разбавляли с помощью DCM. Полученный органический слой последовательно промывали водой и 1 н. водным раствором HCl. Полученный органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением с получением 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензилметансульфоната (2,1 г, 97%) в виде белого порошка. LC/MS (Способ h), Время удерживания=2,92 минуты; MS масса/заряд: 481 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц): δ 7,83 (s, 1H), 7,64 (m, 2H), 7,26 (s, 1H), 5,37 (s, 2H), 4,62 (s, 2H), 3,98 (s, 3H), 3,28 (s, 3H), 2,40 ppm (s, 3H).
Стадия 3: 2-[[2,6-дихлор-3-[[4-(2-метоксиэтил)-1-пиперидил]метил]фенил]метил]-1,4-диметил-6-(трифторметил)бензимидазол
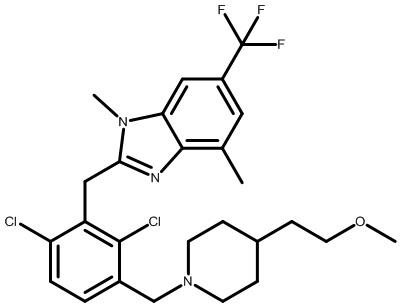
В раствор 4-(2-метоксиэтил)пиперидина гидрохлорида (52 мг, 0,29 ммоль) в DMF (0,5 мл) добавляли карбонат калия (40 мг, 0,29 ммоль) и 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензилметансульфонат (70 мг, 0,145 ммоль) в растворе DMF (1,5 мл). Смесь перемешивали при 60°C в течение 18 часов. Воду добавляли и смесь экстрагировали с помощью DCM. Органическую фазу высушивали фильтрацией через гидрофобную мембрану и концентрировали. Остаток очищали препаративной LCMS с получением 2-[[2,6-дихлор-3-[[4-(2-метоксиэтил)-1-пиперидил]метил]фенил]метил]-1,4-диметил-6-(трифторметил)бензимидазола (52 мг, 68%). LC/MS (HPLC), Время удерживания=1,24 минуты; MS масса/заряд: 528 [M+H]+.
1H ЯМР (DMSO-d6, 400МГц): δ 7,79 (s, 1H), 7,50 (d, J=8 Гц, 1H), 7,45 (d, J=8 Гц, 1H), 7,23 (s, 1H), 4,58 (s, 2H), 3,96 (s, 3H), 3,54 (s, 2H), 3,32 (t, J= 6Гц, 2H), 3,21 (s, 3H), 2,80 (m, 2H), 2,40 (s, 3H), 2,00 (m, 2H), 1,60 (m, 2H), 1,42 (m, 2H), 1,32 (m, 1H), 1,10 (m, 2H)
Таблица BW. Следующие примеры получали из 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензилметансульфоната при помощи такой же процедуры с соответствующим амином.
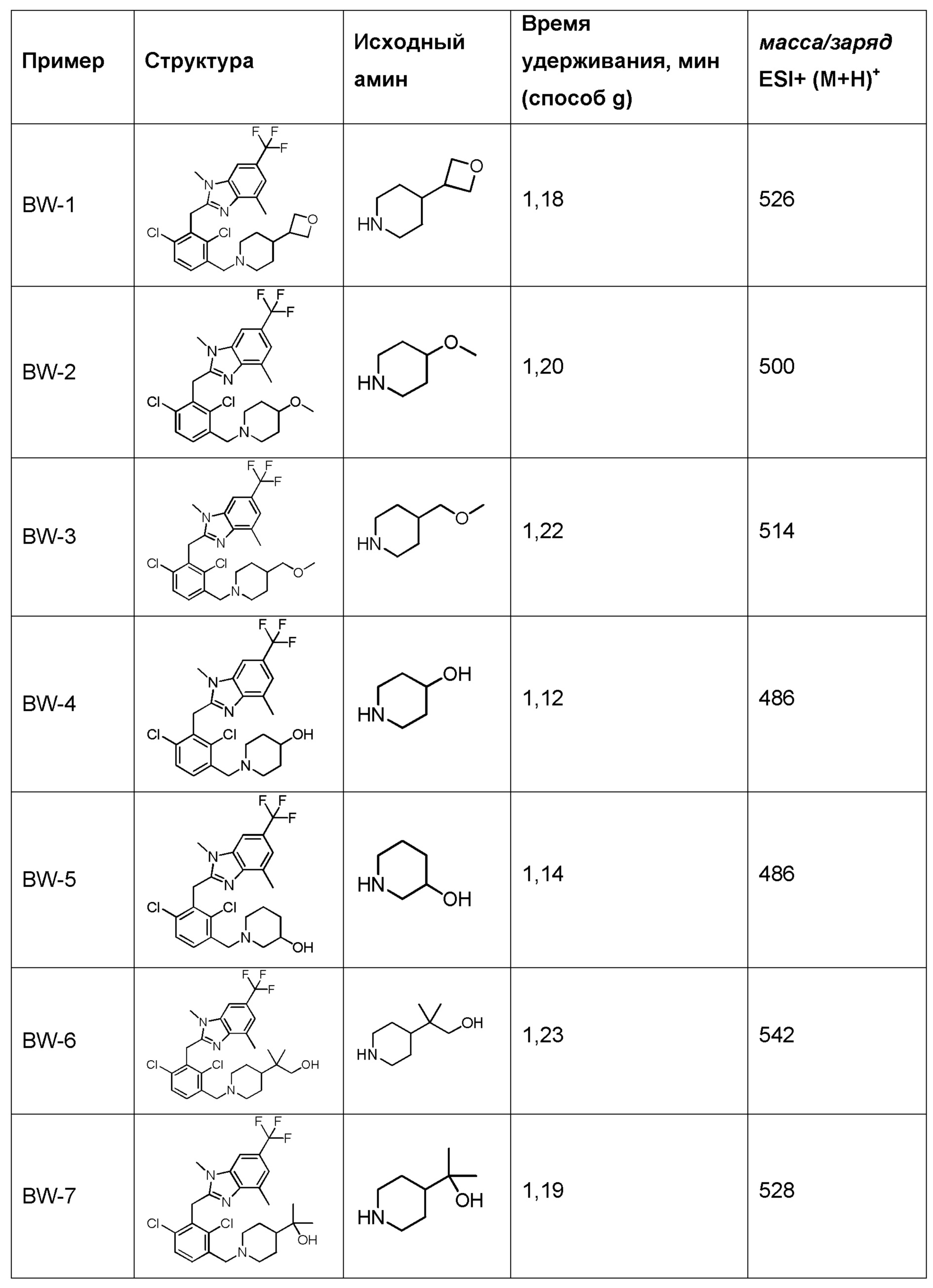


Пример BX: 4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензил)морфолин-3-он
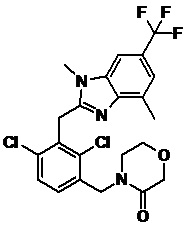
В раствор морфолин-3-она (42,0 мг, 0,416 ммоль) в DMF (3 мл) добавляли гидрид натрия (19,11 мг, 0,478 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 15 минут. Добавляли 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензилметансульфонат (пример BW, стадия 2) (100 мг, 0,208 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 часа, затем добавляли воду и EtOAc. Органический слой декантировали, промывали солевым раствором; высушивали над сульфатом магния и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 40-70% EtOAc в циклогексане) с получением 4-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензил)морфолин-3-она (20 мг, 19%) в виде белого твердого вещества. LC/MS (HPLC), Время удерживания=1,62 мин.; MS масса/заряд: 486 [M+H]+.
1H ЯМР (DMSO-d6, 400МГц): δ 7,82 (s, 1H), 7,55 (d, J=8,4 Гц, 1H), 7,26 (m, 2H), 4,64 (s, 2H), 4,60 (s, 2H), 4,16 (s, 2H), 3,97 (s, 3H), 3,89 (m, 2H), 3,34 (m, 2H), 2,41 (s, 3H).
Пример BY: 1-(2,4-дихлор-3-((1,4-диметил-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперидин-4-карбоновая кислота

Стадия 1: метил-2,4-дихлор-3-((1,4-диметил-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоат
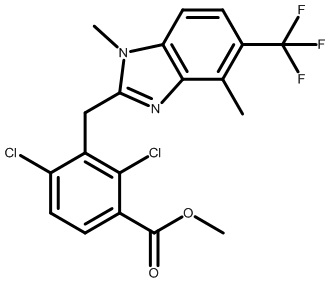
Используя процедуру, аналогичную примеру BJ, стадии 1, метил-2,4-дихлор-3-((1,4-диметил-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоат (1,2 г, 61%) получали из N-1,3-диметил-4-(трифторметил)бензол-1,2-диамина (получение №30) (880 мг, 4,31 ммоль) и 2-(2,6-дихлор-3-(метоксикарбонил)фенил)уксусной кислоты (получение №2) (1,13 г, 4,31 ммоль). LC/MS (Способ i), Время удерживания=2,50 минуты; MS масса/заряд: 431 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц): δ 7,6 (d, J=9 Гц, 1H), 7,68 (d, J=9 Гц, 1H), 7,54 (d, J=9 Гц, 1H), 7,50 (d, J=9 Гц, 1H), 4,63 (s, 2H), 3,95 (s, 3H), 3,87 (s, 3H), 2,49 (s, 3H).
Стадия 2: 2,4-дихлор-3-((1,4-диметил-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензойная кислота
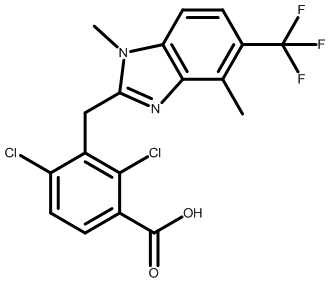
Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((1,4-диметил-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензойную кислоту (1,09 г, 98%) получали из метил-2,4-дихлор-3-((1,4-диметил-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоата(1,1 г, 2,55 ммоль). LC/MS (Способ i), Время удерживания=2,08 минуты; MS масса/заряд: 417 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц): δ 13,63 (широкий, 1H), 7,73 (d, J=9 Гц, 1H), 7,63 (d, J=9 Гц, 1H), 7,54 (d, J=9 Гц, 1H),7,50 (d, J=9 Гц, 1H), 4,62 (s, 2H), 3,95 (s, 3H), 2,50 (s, 3H).
Стадия 3: метил-1-(2,4-дихлор-3-((1,4-диметил-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперидин-4-карбоксилат

Используя процедуру, аналогичную примеру A1, метил-1-(2,4-дихлор-3-((1,4-диметил-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперидин-4-карбоксилат (255 мг, 70%) получали из 2,4-дихлор-3-((1,4-диметил-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензойной кислоты (200 мг, 0,479 ммоль) и метилпиперидин-4-карбоксилата гидрохлорида (103 мг, 0,575 ммоль). LC/MS (Способ i), Время удерживания=2,34 минуты; MS масса/заряд: 542 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц): δ 7,62 (d, J=8,3 Гц, 1H), 7,56 (d, J=9 Гц, 1H), 7,50 (d, J=9 Гц, 1H), 7,43 и 7,35 (d, J=8,3 Гц, 1H), 4,60 (m, 2H), 4,36 (m, 1H), 3,94 (m, 3H), 3,62 и 3,57 (s, 3H), 3,30 (m., 1H), 3,10 (m, 1H), 2,94 (m, 1H), 2,69 (m, 1H), 2,50 (m, 3H), 1,93 (m, 1H), 1,77 (m, 1H), 1,38-1,66 (m, 2H).
Стадия 4: 1-(2,4-дихлор-3-((1,4-диметил-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперидин-4-карбоновая кислота
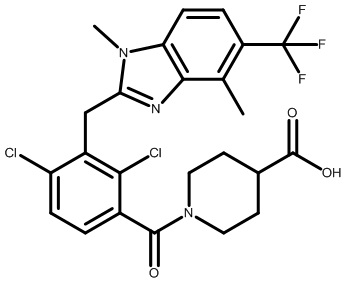
Используя процедуру, аналогичную примеру A, стадии 5, 1-(2,4-дихлор-3-((1,4-диметил-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперидин-4-карбоновую кислоту (80 мг, 32%) получали из метил-1-(2,4-дихлор-3-((1,4-диметил-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперидин-4-карбоксилата (254 мг, 0,468 ммоль). LC/MS (Способ g), Время удерживания=1,55 минуты; MS масса/заряд: 528 [M+H]+. 1H ЯМР (DMSO-d6, 400МГц): δ 12,31 (широкий, 1H), 7,61 (m, 1H), 7,52 (d, J=9 Гц, 1H), 7,50 (d, J=9 Гц, 1H), 7,42 и 7,35 (d, J=8 Гц, 1H), 4,59 (m, 2H), 4,35 (m, 1H), 3,94 (m, 3H), 3,21 (m, 1H), 3,09 (m, 1H), 2,96 (m, 1H), 2,54 (m, 1H), 2,50 (m, 3H), 1,91 (m, 1H), 1,74 (m, 1H), 1,50 (m, 2H).
Пример BZ: 2-(1-(2,4-дихлор-3-((1,4-диметил-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
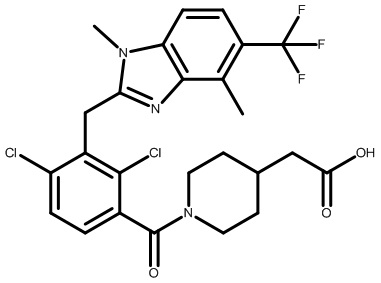
Стадия 1: метил-2-(1-(2,4-дихлор-3-((1,4-диметил-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат
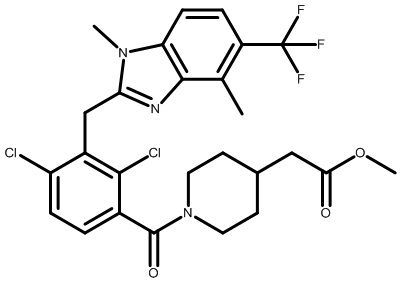
Используя процедуру, аналогичную примеру A1, метил-2-(1-(2,4-дихлор-3-((1,4-диметил-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат (275 мг, 100%) получали из 2,4-дихлор-3-((1,4-диметил-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензойной кислоты (пример BY, стадия 2) (200 мг, 0,479 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (111 мг, 0,57 ммоль). LC/MS (Способ i), Время удерживания=2,39 минуты; MS масса/заряд: 556 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц): δ 7,61 (m, 1H), 7,55 (d, J=9 Гц, 1H), 7,51 (d, J=9 Гц, 1H), 7,40 и 7,33 (d, J=8,3 Гц, 1H), 4,62 (m, 2H), 4,46 (m, 1H), 3,94 (m, 3H), 3,59 и 3,55 (s, 3H), 3,28 (m, 1H), 3,06 (m, 1H), 2,78 (m, 1H), 2,47 (m, 3H), 2,25 (m, 2H), 1,94 (m, 1H), 1,75 (m, 1H), 1,57 (m, 1H), 1,14 (m, 2H).
Стадия 2: 2-(1-(2,4-дихлор-3-((1,4-диметил-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
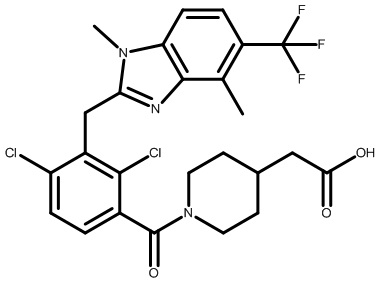
Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((1,4-диметил-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (210 мг, 76%) получали из метил-2-(1-(2,4-дихлор-3-((1,4-диметил-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензоил)пиперидин-4-ил)ацетата (272 мг, 0,46 ммоль). LC/MS (Способ g), Время удерживания=1,57 минуты; MS масса/заряд: 542 [M+H]+. 1H ЯМР (DMSO-d6, 400МГц): δ 12,07 (широкий, 1H), 7,61 (m, 1H), 7,54 (d, J=9 Гц, 1H), 7,50(d, J=9 Гц, 1H), 7,40 и 7,32 (d, J=8,1 Гц, 1H), 4,4.62 (m, 2H), 4,47 (m, 1H), 3,94 (m, 3H), 3,30 (m, 1H), 3,04 (m, 1H), 2,79 (m, 1H), 2,48, 2,47 (s, 3H), 2,10 (m, 2H), 1,93 (m, 1H), 1,77 (m, 1H), 1,57 (m, 1H), 1,10 (m, 2H).
Пример CA: (2,4-дихлор-3-((1,4-диметил-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(морфолинo)метанон
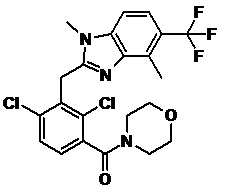
Используя процедуру, аналогичную примеру A1, (2,4-дихлор-3-((1,4-диметил-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)фенил)(морфолинo)метанон (90 мг, 76%) получали из 2,4-дихлор-3-((1,4-диметил-5-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)бензойной кислоты (пример BY, стадия 2) (200 мг, 0,479 ммоль) и морфолина (31 мг, 0,360 ммоль). LC/MS (Способ g), Время удерживания=1,63 минуты; MS масса/заряд: 486 [M+H]+. 1H ЯМР (DMSO-d6, 400МГц): δ=7,63 (d, J=8,1 Гц, 1H), 7,55 (d, J=8 Гц, 1H), 7,50 (d, J=8 Гц, 1H), 7,41 (d, J=8,1 Гц, 1H), 4,64 (d, J=16 Гц, 1H), 4,56 (d, J=16 Гц, 1H), 3,94 (s, 3H), 3,64 (m, 4H), 3,53 (m, 2H), 3,17 (m, 2H), 2,48 (s, 3H).
Пример CB: (3-((5-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорфенил)(морфолинo)метанон
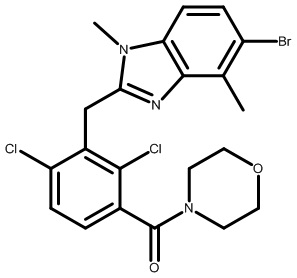
Стадия 1: метил-3-((5-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорбензоат

Используя процедуру, аналогичную примеру BJ, стадии 1, метил-3-((5-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорбензоат (508 мг, 67%) получали из 4-бром-N1,3-диметилбензол-1,2-диамина (получение №31) (350 мг, 1,63 ммоль) и 2-(2,6-дихлор-3-(метоксикарбонил)фенил)уксусной кислоты (получение №2) (428 мг, 1,63 ммоль). LC/MS (Способ h), Время удерживания=2,98 минуты; MS масса/заряд: 441 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц): δ 7,75 (d, J=9 Гц, 1H), 7,66 (d, J=9 Гц, 1H), 7,38 (d, J=9 Гц, 1H), 7,34 (d, J=9 Гц, 1H), 4,58 (s, 2H), 3,88 (s, 3H), 3,86 (s, 3H), 2,37 (s, 3H).
Стадия 2: 3-((5-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорбензойная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 3-((5-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорбензойную кислоту (450 мг, 93%) получали из метил-3-((5-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорбензоата (500 мг, 1,13 ммоль).
LC/MS (Способ h), Время удерживания=2,14 минуты; MS масса/заряд: 427 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц): δ 7,71 (d, J=9 Гц, 1H), 7,63 (d, J=9 Гц, 1H), 7,37 (d, J=9 Гц, 1H), 7,34 (d, J=9 Гц, 1H), 4,57 (s, 2H), 3,88 (s, 3H), 2,37 (s, 3H).
Стадия 3: (3-((5-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорфенил)(морфолинo)метанон
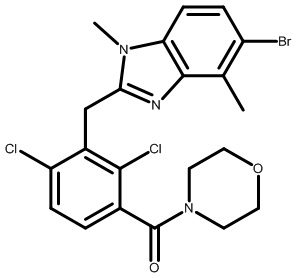
Используя процедуру, аналогичную примеру A1, (3-((5-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорфенил)(морфолинo)метанон (465 мг, 84%) получали из 3-((5-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорбензойной кислоты (436 мг, 4,02 ммоль) и морфолина (133 мг, 1,53 ммоль). LC/MS (Способ g), Время удерживания=1,53 минуты; MS масса/заряд: 496 [M+H]+. 1H ЯМР (DMSO-d6, 400МГц): δ 7,63 (d, J=8,1 Гц, 1H), 7,40 (m, 3H), 4,63 (d, J=16 Гц, 1H), 4,55 (d, J=16 Гц, 1H), 3,89 (s, 3H), 3,65 (m, 4H), 3,52 (m, 2H), 3,17 (m, 2H), 2,38 (s, 3H).
Пример CC: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-бензо[d]имидазол-5-карбонитрил
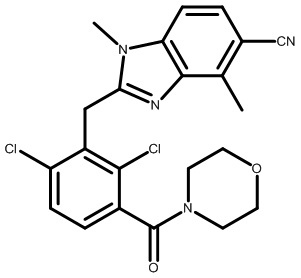
В сосуд для микроволновой обработки помещали (3-((5-бром-1,4-диметил-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорфенил)(морфолинo)метанон (пример CB, стадия 3) (140 мг, 0,28 ммоль), цианид цинка (24,8 мг, 0,211 ммоль) и Pd(Ph3P)4 (32,5 мг, 0,028 ммоль) в DMF (800 мкл) и реакционную смесь перемешивали при 120°C в течение 60 минут под микроволновым облучением. Реакционную смесь разбавляли с помощью EtOAc и фильтровали. Воду добавляли в фильтрат. Слои разделяли и водный слой промывали с помощью EtOAc. Органические слои высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 50-60% EtOAc в циклогексане) с получением 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-бензо[d]имидазол-5-карбонитрила (30 мг, 23%). LC/MS (Способ g), Время удерживания=1,32 минуты; MS масса/заряд: 443 [M+H]+. 1H ЯМР (DMSO-d6, 400МГц): δ 7,63 (d, J=8,1 Гц, 1H), 7,56 (m, 2H), 7,41 (d, J=8,1 Гц, 1H), 4,64 (d, J=16 Гц, 1H), 4,56 (d, J=16 Гц, 1H), 3,94 (s, 3H), 3,60 (m, 4H), 3,53 (m, 2H), 3,17 (m, 2H), 2,50 (s, 3H).
Пример CD: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-метил-1H-бензо[d]имидазол-5-карбонитрил

Стадия 1: метил-2,4-дихлор-3-((5-циано-1-метил-1H-бензо[d]имидазол-2-ил)метил)бензоат
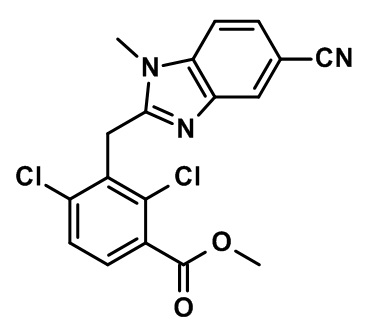
Используя процедуру, аналогичную примеру BJ, стадии 1, метил-2,4-дихлор-3-((5-циано-1-метил-1H-бензо[d]имидазол-2-ил)метил)бензоат (460 мг, 82%) получали из 3-амино-4-(метиламино)бензонитрила (WO 2003060078) (220 мг, 1,49 ммоль) и 2-(2,6-дихлор-3-(метоксикарбонил)фенил)уксусной кислоты (получение №2) (393 мг, 1,49 ммоль). LC/MS (Способ h), Время удерживания=2,39 минуты; MS масса/заряд: 374 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц): δ 8,04 (d, J=1,5 Гц, 1H), 7,76 (m, 2H), 7,66 (d, J=9 Гц, 1H), 7,62 (dd, J=9, 1,5 Гц, 1H), 4,64 (s, 2H), 3,97 (s, 3H), 3,87 (s, 3H).
Стадия 2: 2,4-дихлор-3-((5-циано-1-метил-1H-бензо[d]имидазол-2-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((5-циано-1-метил-1H-бензо[d]имидазол-2-ил)метил)бензойную кислоту (400 мг, 92%) получали из метил-2,4-дихлор-3-((5-циано-1-метил-1H-бензо[d]имидазол-2-ил)метил)бензоата (450 мг, 1,20 ммоль).
LC/MS (Способ h), Время удерживания=1,80 минуты; MS масса/заряд: 360 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц): δ 8,04 (d, J=1,3 Гц, 1H), 7,77 (d, J=8,4 Гц, 1H), 7,72 (d, J=9 Гц, 1H), 7,62 (m, 2H), 4,63 (s, 2H), 3,97 (s, 3H).
Стадия 3: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-метил-1H-бензо[d]имидазол-5-карбонитрил

Используя процедуру, аналогичную примеру A1, 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-метил-1H-бензо[d]имидазол-5-карбонитрил (178 мг, 38%) получали из 2,4-дихлор-3-((5-циано-1-метил-1H-бензо[d]имидазол-2-ил)метил)бензойной кислоты (387 мг, 1,07 ммоль) и морфолина (140 мг, 1,61 ммоль). LC/MS (HPLC), Время удерживания=1,19 мин.; MS масса/заряд: 429 [M+H]+.
1H ЯМР (DMSO-d6, 400МГц): δ 8,05 (s, 1H), 7,77 (d, J=8,4 Гц, 1H), 7,62 (m, 2H), 7,41 (d, J=8,4 Гц, 1H), 4,61 (m, 2H), 3,97 (s, 3H), 3,64 (m, 4H), 3,54 (m, 2H), 3,16 (m, 2H).
Пример CE: (3-((6-бром-1-метил-4-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорфенил)(морфолинo)метанон
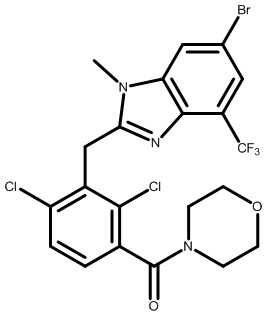
Стадия 1: метил-3-((6-бром-1-метил-4-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорбензоат

Используя процедуру, аналогичную примеру BJ, стадии 1, метил-3-((6-бром-1-метил-4-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорбензоат (827 мг) получали из 5-бром-N1-метил-3-(трифторметил)бензол-1,2-диамина (получение №32) (450 мг, 1,67 ммоль) и 2-(2,6-дихлор-3-(метоксикарбонил)фенил)уксусной кислоты (получение №2) (440 мг, 1,67 ммоль). Ее использовали неочищенной на следующей стадии. LC/MS (Способ h), Время удерживания=3,19 минуты; MS масса/заряд: 494 [M+H]+.
Стадия 2: 3-((6-бром-1-метил-4-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорбензойная кислота
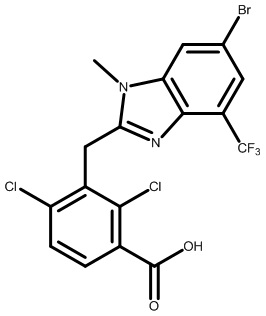
Используя процедуру, аналогичную примеру A, стадии 5, 3-((6-бром-1-метил-4-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорбензойную кислоту (487 мг, 88%) получали из метил-3-((6-бром-1-метил-4-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорбензоата (830 мг, 1,67 ммоль). LC/MS (Способ h), Время удерживания=2,77 минуты; MS масса/заряд: 481 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц): δ 8,24 (d, J=1,0 Гц, 1H), 7,74 (d, J=9 Гц, 1H), 7,63 (d, J=9 Гц, 1H), 7,59 (d, J=1,0 Гц, 1H), 4,64 (s, 2H), 3,97 (s, 3H).
Стадия 3: (3-((6-бром-1-метил-4-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорфенил)(морфолинo)метанон

Используя процедуру, аналогичную примеру A1, (3-((6-бром-1-метил-4-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорфенил)(морфолинo)метанон (442 мг, 79%) получали из 3-((6-бром-1-метил-4-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорбензойной кислоты (478 мг, 0,99 ммоль) и морфолина (86 мг, 0,99 ммоль). LC/MS (Способ g), Время удерживания=1,76 минуты; MS масса/заряд: 550 [M+H]+. 1H ЯМР (DMSO-d6, 400МГц): δ 8,23 (s, 1H), 7,63 (d, J=8,4 Гц, 1H), 7,58 (s, 1H), 7,40 (d, J=8,4 Гц, 1H), 4,66 (d, J=16 Гц, 1H), 4,56 (d, J=16 Гц, 1H), 3,96 (s, 3H), 3,63 (m, 4H), 3,40-3,54 (m, 2H), 3,12 (m, 2H).
Пример CF: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-метил-4-(трифторметил)-1H-бензо[d]имидазол-6-карбонитрил

Используя процедуру, аналогичную примеру CC, 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-метил-4-(трифторметил)-1H-бензо[d]имидазол-6-карбонитрил (57 мг, 42%) получали из (3-((6-бром-1-метил-4-(трифторметил)-1H-бензо[d]имидазол-2-ил)метил)-2,4-дихлорфенил)(морфолинo)метанона (пример CE, стадия 3) (151 мг, 0,27 ммоль). LC/MS (Способ g), Время удерживания=1,50 минуты; MS масса/заряд: 497 [M+H]+. 1H ЯМР (DMSO-d6, 400МГц): δ 8,58 (s, 1H), 7,94 (m, 1H), 7,64 (d, J=8,4 Гц, 1H), 7,41 (d, J=8,4 Гц, 1H), 4,74 (d, J=16 Гц, 1H), 4,64 (d, J=16 Гц, 1H), 4,03 (s, 3H), 3,63 (m, 4H), 3,48 (m, 2H), 3,12 (m, 2H).
Пример CG: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-этил-4-метил-1H-бензо[d]имидазол-6-карбонитрил
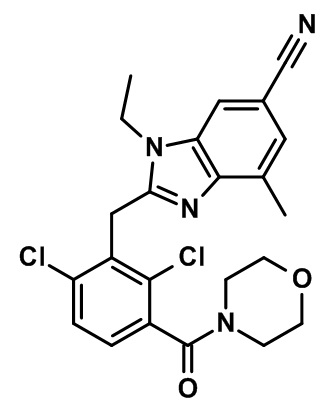
Стадия 1: метил-2,4-дихлор-3-((6-циано-4-метил-1H-бензо[d]имидазол-2-ил)метил)бензоат
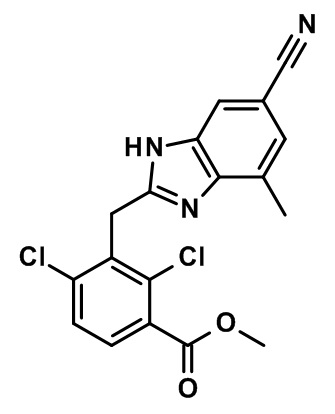
Используя процедуру, аналогичную примеру BJ, стадии 1, метил-2,4-дихлор-3-((6-циано-4-метил-1H-бензо[d]имидазол-2-ил)метил)бензоат (1,16 г, 76%) получали из 3,4-диамино-5-метилбензонитрила (WO2005021510) (600 мг, 4,08 ммоль) и 2-(2,6-дихлор-3-(метоксикарбонил)фенил)уксусной кислоты (получение №2) (440 мг, 1,67 ммоль). LC/MS (Способ h), Время удерживания=2,35 минуты; MS масса/заряд: 374 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц): δ 13,07 и 12,78 (широкий, 1H), 7,77 (m, 2H), 7,66 (d, J=9 Гц, 1H), 7,36 (s, 1H), 4,61 (s, 2H), 3,87 (s, 3H), 2,48 (s, 3H).
Стадия 2: 2,4-дихлор-3-((6-циано-4-метил-1H-бензо[d]имидазол-2-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((6-циано-4-метил-1H-бензо[d]имидазол-2-ил)метил)бензойную кислоту (462 мг, 76%) получали из метил-2,4-дихлор-3-((6-циано-4-метил-1H-бензо[d]имидазол-2-ил)метил)бензоата (600 мг, 1,60 ммоль).
LC/MS (Способ h), Время удерживания=1,72 минуты; MS масса/заряд: 360 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц): δ 7,85 (d, J=8,4 Гц, 1H), 7,78 (s, 1H), 7,52 (d, J=8,4 Гц, 1H), 7,47 (s, 1H), 5,03 (s, 2H), 2,74 (s, 3H).
Стадия 3: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-4-метил-1H-бензо[d]имидазол-6-карбонитрил
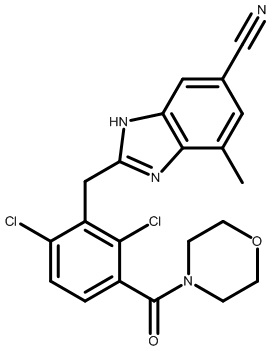
Используя процедуру, аналогичную примеру A1, 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-4-метил-1H-бензо[d]имидазол-6-карбонитрил (129 мг, 71%) получали из 2,4-дихлор-3-((6-циано-4-метил-1H-бензо[d]имидазол-2-ил)метил)бензойной кислоты (150 мг, 0,416 ммоль) и морфолина (43,5 мг, 0,5 ммоль). LC/MS (Способ h), Время удерживания=1,97 минуты; MS масса/заряд: 429 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц): δ 13,04 и 12,76 (s, 1H), 7,85 и 7,76 (s, 1H), 7,63 (m, 1H), 7,39 (m, 2H), 4,57 (m, 2H), 3,65 (m, 4H), 3,53 (m, 2H), 3,16 (m, 2H), 2,50 и 2,45 (s, 3H).
Стадия 4: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-этил-4-метил-1H-бензо[d]имидазол-6-карбонитрил

Используя процедуру, аналогичную примеру A, стадии 4, 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-этил-4-метил-1H-бензо[d]имидазол-6-карбонитрил (63 мг, 47%) получали из 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-4-метил-1H-бензо[d]имидазол-6-карбонитрила (125 мг, 0,29 ммоль) и бромэтана (56 мг, 0,52 ммоль). LC/MS (Способ g), Время удерживания=1,43 минуты; MS масса/заряд: 457 [M+H]+. 1H ЯМР (DMSO-d6, 500МГц): δ 8,05 (s, 1H), 7,64 (d, J=8,2 Гц, 1H), 7,42 (d, J=8,4 Гц, 1H), 7,34 (s, 1H), 4,65 (d, J=16 Гц, 1H), 4,57 (d, J=8,2 Гц, 1H), 4,45 (q, J=7,1 Гц, 2H), 3,65 (m, 4H), 3,53 (m, 2H), 3,16 (m, 2H), 2,34 (s, 3H), 1,39 (t, J=7,1 Гц, 3H).
Пример CH: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-изопропил-4-метил-1H-бензо[d]имидазол-6-карбонитрил

Используя процедуру, аналогичную примеру A1, стадии 4, 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-изопропил-4-метил-1H-бензо[d]имидазол-6-карбонитрил (20 мг, 14%) получали из 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-4-метил-1H-бензо[d]имидазол-6-карбонитрила (пример CG, стадия 3) (130 мг, 0,30 ммоль) и 2-йодпропана (61 мг, 0,36 ммоль). LC/MS (Способ g), Время удерживания=1,52 минуты; MS масса/заряд: 471 [M+H]+. 1H ЯМР (DMSO-d6, 500МГц): δ 8,15 (s, 1H), 7,63 (d, J=8,2 Гц, 1H), 7,41 (d, J=8,2 Гц, 1H), 7,33 (s, 1H), 5,05 (sept, J=6,9 Гц, 1H), 4,66 (d, J=16 Гц, 1H), 4,58 (d, J=16 Гц, 1H), 3,65 (m, 4H), 3,52 (m, 2H), 3,16 (m, 2H), 2,31 (s, 3H), 1,64 (d, J=6,9 Гц, 6H).
Пример CI: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-3,7-диметил-3H-имидазо[4,5-b]пиридин-5-карбонитрил
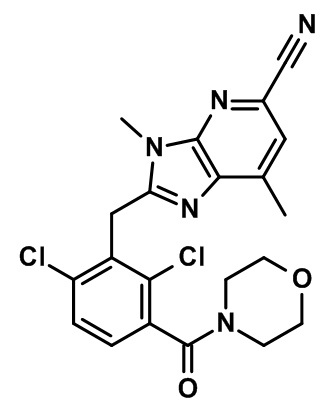
Стадия 1: метил-2,4-дихлор-3-((5-хлор-3,7-диметил-3H-имидазо[4,5-b]пиридин-2-ил)метил)бензоат
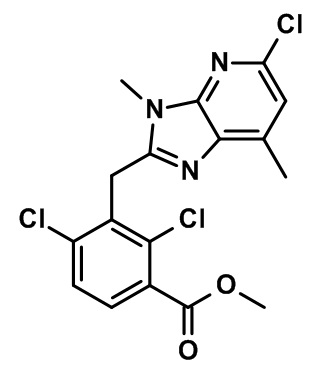
Используя процедуру, аналогичную примеру BJ, стадии 1, метил-2,4-дихлор-3-((5-хлор-3,7-диметил-3H-имидазо[4,5-b]пиридин-2-ил)метил)бензоат (350 мг, 50%) получали из 6-хлор-N2,4-диметилпиридин-2,3-диамина (получение №25) (150 мг, 0,874 ммоль) и 2-(2,6-дихлор-3-(метоксикарбонил)фенил)уксусной кислоты (получение №2) (230 мг, 0,874 ммоль) и использовали неочищенным на следующей стадии. LC/MS (Способ h), Время удерживания=2,78 минуты; MS масса/заряд: 398 [M+H]+.
Стадия 2: 2,4-дихлор-3-((5-хлор-3,7-диметил-3H-имидазо[4,5-b]пиридин-2-ил)метил)бензойная кислота
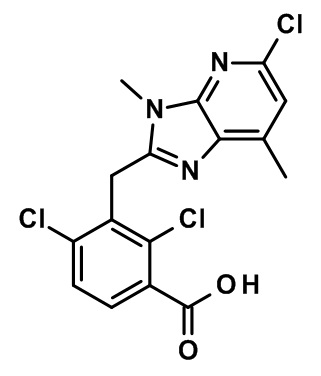
Используя процедуру, аналогичную примеру F, стадии 4, 2,4-дихлор-3-((5-хлор-3,7-диметил-3H-имидазо[4,5-b]пиридин-2-ил)метил)бензойную кислоту (250 мг, 86%) получали из метил-2,4-дихлор-3-((5-хлор-3,7-диметил-3H-имидазо[4,5-b]пиридин-2-ил)метил)бензоата (300 мг, 0,753 ммоль). LC/MS (Способ h), Время удерживания=2,21 минуты; MS масса/заряд: 384 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 13,64 (широкий, 1H), 7,72 (d, J=9Гц, 1H), 7,62 (d, J=9Гц, 1H), 7,14 (s, 1H), 4,62 (s, 2H), 3,88 (s, 3H), 2,39 (s, 3H).
Стадия 3: (2,4-дихлор-3-((5-хлор-3,7-диметил-3H-имидазо[4,5-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон
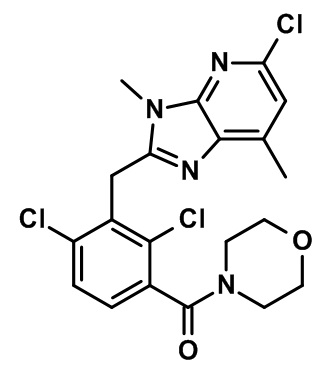
Используя процедуру, аналогичную примеру A, стадии 6, (2,4-дихлор-3-((5-хлор-3,7-диметил-3H-имидазо[4,5-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон (160 мг, 87%) получали из 2,4-дихлор-3-((5-хлор-3,7-диметил-3H-имидазо[4,5-b]пиридин-2-ил)метил)бензойной кислоты (150 мг, 0,390 ммоль) и морфолина (51 мг, 0,585 ммоль). LC/MS (Способ g), Время удерживания=1,43 минуты; MS масса/заряд: 453 [M+H]+. 1H ЯМР (DMSO-d6, 400 МГц): δ 7,63 (d, J=9Гц, 1H), 7,41 (d, J=9Гц, 1H), 7,13 (s,1H), 4,63 (d, J=12Гц, 1H), 4,56 (d, J=12Гц, 1H), 3,87 (s, 3H), 3,64 (m, 4H), 3,52 (m, 2H), 3,15 (m, 2H), 2,38 (s, 3H).
Стадия 4: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-3,7-диметил-3H-имидазо[4,5-b]пиридин-5-карбонитрил
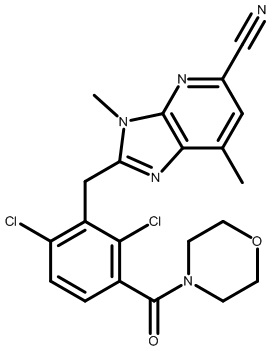
В сосуд для микроволновой обработки помещали (2,4-дихлор-3-((5-хлор-3,7-диметил-3H-имидазо[4,5-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон (70 мг, 0,154 ммоль), цианид цинка (15,40 мг, 0,131 ммоль) и Pd(Ph3P)4 (17,83 мг, 0,015 ммоль) в DMF (250 мкл) и реакционную смесь перемешивали при 110°C в течение 30 минут под микроволновым облучением. Реакционную смесь разбавляли с помощью EtOAc и фильтровали. Фильтрат затем промывали водой. Слои разделяли и водный слой промывали с помощью EtOAc. Органические слои объединяли, высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-100% EtOAc в циклогексане) с получением 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-3,7-диметил-3H-имидазо[4,5-b]пиридин-5-карбонитрила (18 мг, 26%). LC/MS (Способ g), Время удерживания=1,32 минуты; MS масса/заряд: 444 [M+H]+. 1H ЯМР (DMSO-d6, 400 МГц): δ 7,70 (s, 1H), 7,64 (d, J=9Гц, 1H), 7,43 (d, J=9Гц, 1H), 4,72 (d, J=16Гц, 1H), 4,64 (d, J=16Гц, 1H), 3,94 (s, 3H), 3,65 (m, 4H), 3,53 (m, 2H), 3,15 (m, 2H), 2,43 (s, 3H).
Пример CJ: 4-хлор-2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-метил-1H-индол-6-карбонитрил

Стадия 1: трет-бутил-3-((6-бром-4-хлор-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)-2,4-дихлорбензоат
В раствор 6-бром-4-хлор-1-(фенилсульфонил)-1H-индола (получение №48) (200 мг, 0,54 ммоль) в THF (1,5 мл), охлажденный до -78°C, добавляли диизопропиламид лития (0,30 мл, 0,59 ммоль) и реакционную смесь перемешивали в течение 1 часа при -78°C. Трет-бутил-2,4-дихлор-3-формилбензоат (получение №33, стадия B) (178 мг, 0,65 ммоль) в растворе THF (1,5 мл) добавляли в реакционную смесь и реакционную смесь перемешивали в течение 2 часов при -78°C. Реакционную смесь быстро охлаждали насыщенным раствором NH4Cl и экстрагировали с помощью EtOAc. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-10% EtOAc в циклогексане) с получением трет-бутил-3-((6-бром-4-хлор-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)-2,4-дихлорбензоата (262 мг, 75%). LC/MS (Способ j), Время удерживания=2,75 минуты; MS масса/заряд: 702 [M-H]-+CH3COOH.
1H ЯМР (DMSO-d6, 300МГц): δ 8,11 (m, 1H), 7,85 (m, 2H), 7,72 (m, 1H), 7,66 (d, J=6 Гц, 1H), 7,55 (m, 4H), 6,95 (m, 1H), 6,75 (m, 1H), 6,66 (m, 1H), 1,54 ppm (s, 9H).
Стадия 2: 3-((6-бром-4-хлор-1-(фенилсульфонил)-1H-индол-2-ил)метил)-2,4-дихлорбензойная кислота

Используя процедуру, аналогичную примеру A, стадии 2, 3-((6-бром-4-хлор-1-(фенилсульфонил)-1H-индол-2-ил)метил)-2,4-дихлорбензойную кислоту (1,17 г, 93%) получали из трет-бутил-3-((6-бром-4-хлор-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)-2,4-дихлорбензоата (1,42 г, 2,2 ммоль). LC/MS (Способ i), Время удерживания=2,81 минуты; MS масса/заряд: 570 [M-H]- 1H ЯМР (DMSO-d6, 300МГц): δ 8,27 (m, 1H), 8,00 (m, 2H), 7,80 (m, 2H), 7,69 (m, 4H), 5,70 (m, 1H), 4,55 (s, 2H).
Стадия 3: 3-((6-бром-4-хлор-1H-индол-2-ил)метил)-2,4-дихлорбензойная кислота
Используя процедуру, аналогичную примеру A, стадии 3, 3-((6-бром-4-хлор-1H-индол-2-ил)метил)-2,4-дихлорбензойную кислоту (657 мг, 100%) получали из 3-((6-бром-4-хлор-1-(фенилсульфонил)-1H-индол-2-ил)метил)-2,4-дихлорбензойной кислоты (870 мг, 1,52 ммоль). Соединение использовали непосредственно на следующей стадии. LC/MS (Способ i), Время удерживания=2,48 минуты; MS масса/заряд: 432 [M+H]+.
Стадия 4: метил-3-((6-бром-4-хлор-1-метил-1H-индол-2-ил)метил)-2,4-дихлорбензоат

Используя процедуру, аналогичную примеру P, стадии 4, метил-3-((6-бром-4-хлор-1-метил-1H-индол-2-ил)метил)-2,4-дихлорбензоат (568 мг, 81%) получали из 3-((6-бром-4-хлор-1H-индол-2-ил)метил)-2,4-дихлорбензойной кислоты (657 мг, 1,52 ммоль). LC/MS (Способ j), Время удерживания=2,46 минуты; MS масса/заряд: 460 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,80 (m, 2H), 7,72 (m, 1H), 7,23 (d, J=1,5 Гц, 1H), 5,52 (m, 1H), 4,46 (s, 2H), 3,89 (s, 3H), 3,88 (s, 3H).
Стадия 5: метил-2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензоат

В раствор метил-3-((6-бром-4-хлор-1-метил-1H-индол-2-ил)метил)-2,4-дихлорбензоата (559 мг, 1,211 ммоль) в N,N-диметилформамиде (4,3 мл) добавляли цианид цинка (107 мг, 0,908 ммоль) и тетракис(трифенилфосфин)палладий (140 мг, 0,121 ммоль) и реакционную смесь нагревали при 120°C под микроволновым облучением в течение 1 часа. Реакционную смесь разбавляли водой и экстрагировали с помощью EtOAc. Полученный органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-40% EtOAc в циклогексане) с получением метил-2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензоата (200 мг, 40%). LC/MS (Способ i), Время удерживания=2,59 минуты; MS масса/заряд: 405 [M-H]-.
1H ЯМР (DMSO-d6, 300МГц): δ=8,18 (m, 1H), 7,83 (d, J=8,4 Гц, 1H), 7,73 (d, J=8,4 Гц, 1H), 7,50 (d, J=1,2 Гц, 1H), 5,67 (m, 1H), 4,54 (s, 2H), 3,96 (s, 3H), 3,88 (s, 3H).
Стадия 6: 2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензойную кислоту (180 мг, 94%) получали из метил-2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензоата (198 мг, 0,48 ммоль). LC/MS (Способ i), Время удерживания=2,25 минуты; MS масса/заряд: 393 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 13,60 (br, 1H), 8,18 (m, 1H), 7,79 (d, J=8,4 Гц,, 1H), 7,69 (d, J=8,4 Гц,, 1H), 7,50 (d, J=1,2 Гц, 1H), 5,67 (m, 1H), 4,53 (s, 2H), 3,96 (s, 3H).
Стадия 7: 4-хлор-2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-метил-1H-индол-6-карбонитрил
Используя процедуру, аналогичную примеру A1, 4-хлор-2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-метил-1H-индол-6-карбонитрил (89 мг, 82%) получали из 2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензойной кислоты (90 мг, 0,23 ммоль) и морфолина (23,9 мг, 0,27 ммоль). LC/MS (Способ g), Время удерживания=1,69 минуты; MS масса/заряд: 462 [M+H]+.
1H ЯМР (DMSO-d6, 400МГц): δ 8,17 (s, 1H), 7,69 (d, J=8,1 Гц, 1H), 7,50 (d, J=1,3 Гц, 1H), 7,47 (d, J=8,1 Гц, 1H), 5,70 (m, 1H), 4,50 (m, 2H), 3,96 (s, 3H), 3,65 (m, 4H), 3,55 (m, 2H), 3,15 (m, 2H).
Пример CK: (2,4-дихлор-3-((1-метил-1H-пирроло[2,3-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон
Стадия 1: метил-2,4-дихлор-3-((1-(фенилсульфонил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоат
В раствор 1-(фенилсульфонил)-1H-пирроло[2,3-b]пиридина (описанного в WO2006/050076) (1,5 г, 5,81 ммоль) в THF (45 мл), охлажденный до -78°C, по каплям добавляли бутиллитий (2,439 мл, 6,10 ммоль) и реакционную смесь перемешивали в течение 45 минут при -78°C. Реакционную смесь нагревали до -20°C и перемешивали 5 минут при этой температуре. При -78°C метил-3-(бромметил)-2,4-дихлорбензоат (получение №1, стадия B) (2,249 г, 7,55 ммоль), предварительно растворенный в THF (20 мл), добавляли по каплям и реакционную смесь перемешивали в течение 10 минут при -78°C и в течение 18 часов при комнатной температуре. Реакционную смесь быстро охлаждали насыщенным водным раствором NH4Cl и экстрагировали с помощью EtOAc. Органический слой промывали солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали досуха под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 10-20% EtOAc в циклогексане) с получением метил-2,4-дихлор-3-((1-(фенилсульфонил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоата (1 г, 22%). LC/MS (Способ h), Время удерживания=3,09 минуты; MS масса/заряд: 475 [M+H]+. 1H ЯМР (DMSO-d6, 300 МГц): δ 8,32 (dd, J=4,8Гц, 1,6Гц, 1H), 8,15 (m, 2H), 7,87-7,62 (m, 6H), 7,23 (dd, J=4,8Гц, 7,7Гц, 1H), 5,81 (m, 1H), 4,79 (s, 2H), 3,88 (s, 3H).
Стадия 2: метил-3-((1H-пирроло[2,3-b]пиридин-2-ил)метил)-2,4-дихлорбензоат
Используя процедуру, аналогичную примеру A, стадии 3, метил-3-((1H-пирроло[2,3-b]пиридин-2-ил)метил)-2,4-дихлорбензоат (125 мг, 71%) получали в виде белого твердого вещества из метил-2,4-дихлор-3-((1-(фенилсульфонил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоата (250 мг, 0,526 ммоль). LC/MS (Способ h), Время удерживания=2,34 минуты; MS масса/заряд: 335 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 11,71 (широкий, 1H), 8,12 (dd, J=5Гц, 1,6Гц, 1H), 7,75 (d, J=8,4Гц, 1H), 7,74 (dd, J=7,7Гц, 1,6Гц, 1H), 7,68 (d, J=8,4Гц, 1H), 6,97 (dd, J=7,7Гц, 5Гц, 1H), 5,68 (m, 1H), 4,46 (s, 2H), 3,87 (s, 3H).
Стадия 3: метил-2,4-дихлор-3-((1-метил-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоат
Используя процедуру, аналогичную примеру A, стадии 4, метил-2,4-дихлор-3-((1-метил-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоат (97 мг, 76%) получали в виде желтого твердого вещества из метил-3-((1H-пирроло[2,3-b]пиридин-2-ил)метил)-2,4-дихлорбензоата (123 мг, 0,367 ммоль). LC/MS (Способ h), Время удерживания=2,70 минуты; MS масса/заряд: 349 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 8,19 (dd, J=4,6Гц и 1,5Гц, 1H), 7,80 (d, J=8,4Гц, 1H), 7,76 (dd, J=7,1Гц и 1,5Гц, 1H), 7,71 (d, J=8,4Гц, 1H), 7,01 (dd, J=4,6Гц и 7,1Гц, 1H), 5,56 (m, 1H), 4,50 (s, 2H), 3,90 (s, 3H), 3,88 (s, 3H).
Стадия 4: 2,4-дихлор-3-((1-метил-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензойная кислота
Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((1-метил-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензойную кислоту (87 мг, 96%) получали из метил-2,4-дихлор-3-((1-метил-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоата (94 мг, 0,269 ммоль).
LC/MS (Способ h), Время удерживания=2,44 минуты; MS масса/заряд: 335 [M+H]+.
Стадия 5: (2,4-дихлор-3-((1-метил-1H-пирроло[2,3-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон:

Используя процедуру, аналогичную примеру A, стадии 6, (2,4-дихлор-3-((1-метил-1H-пирроло[2,3-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон (82 мг, 79%) получали в виде желтого твердого вещества из 2,4-дихлор-3-((1-метил-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензойной кислоты (86 мг, 0,257 ммоль) и морфолина (33,5 мг, 0,385 ммоль). LC/MS (Способ g), Время удерживания=1,34 минуты; MS масса/заряд: 404 [M+H]+ 1H ЯМР (DMSO-d6, 400 МГц): δ 8,19 (dd, J=4,6Гц, и 1,5Гц, 1H), 7,77 (dd, J=7,9Гц, и 1,5Гц, 1H), 7,67(d, J=8,4Гц, 1H), 7,45 (d, J=8,4Гц, 1H), 7,02 (dd, J=4,6Гц, и 7,9Гц, 1H), 5,60 (m, 1H), 4,46 (s, 2H), 3,90 (s, 3H), 3,65 (m, 4H), 3,55 (m, 2H), 3,18 (m, 2H).
Пример CL: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-пирроло[2,3-b]пиридин-6-карбонитрил
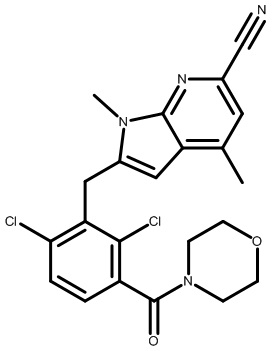
Стадия 1: метил-2,4-дихлор-3-(гидрокси(4-метил-1-(фенилсульфонил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоат

В раствор диизопропиламида лития (8,81 мл, 17,63 ммоль) в THF (27 мл), охлажденный до -25°C, на протяжении 10 минут по каплям добавляли 4-метил-1-(фенилсульфонил)-1H-пирроло[2,3-b]пиридин (описанный в WO2013/015984) (2,40 г, 8,81 ммоль) в растворе THF (44 мл) и реакционную смесь перемешивали в течение 20-25 минут при -25°C. Метил-2,4-дихлор-3-формилбензоат (получение №1, стадия C) (2,157 г, 9,25 ммоль), ранее растворенный в THF (22 мл), добавляли по каплям на протяжении 15 минут при -25°C. Реакционную смесь перемешивали в течение 1,5 часов при -25°C. Реакционную смесь быстро охлаждали насыщенным водным раствором NH4Cl и экстрагировали с помощью EtOAc. Органический слой промывали солевым раствором, высушивали над сульфатом магния и концентрировали досуха. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 10-20% EtOAc в циклогексане) с получением метил-2,4-дихлор-3-(гидрокси(4-метил-1-(фенилсульфонил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоата (1,32 г, 27%) в виде оранжевой пены. LC/MS (Способ h), Время удерживания=2,69 минуты; MS масса/заряд: 505 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 8,20 (d, J=4,9Гц, 1H), 8,00 (m, 2H), 7,68 (m, 2H), 7,56 (m, 3H), 7,13 (dd, J=1,1Гц, 6,1Гц, 1H), 7,10 (d, J=4,9Гц, 1H), 6,70 (d, J=1,1Гц, 1H), 6,68 (d, J=6,1Гц, 1H), 3,86 (s, 3H), 2,42 (s, 3H).
Стадия 2: метил-2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоат
Используя процедуру, аналогичную примеру Z, стадии 2, метил-2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоат (1,85 г, 70%) (смесь с экзоциклической двойной связью) получали из метил-2,4-дихлор-3-(гидрокси(4-метил-1-(фенилсульфонил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоата (2,12 г, 4,19 ммоль). LC/MS (Способ h), Время удерживания=3,00 минуты и 3,11 мин.; MS масса/заряд: 489 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 8,15 (m, 3H), 7,85 (d, J=8,4Гц, 1H), 7,76-7,60 (m, 4H), 7,06 (d, J=5,2Гц, 1H), 5,85 (m, 1H), 4,79 (s, 2H), 3,88 (s, 3H), 2,29 (s, 3H).
Стадия 3: метил-2,4-дихлор-3-((4-метил-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоат

Используя процедуру, аналогичную примеру A, стадии 3, метил-2,4-дихлор-3-((4-метил-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоат (86 мг, 93%) получали в виде желтого твердого вещества из метил-2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоата (130 мг, 0,266 ммоль). LC/MS (Способ h), Время удерживания=2,27 мин.; MS масса/заряд: 349 [M+H]+.
1H ЯМР (DMSO-d6, 300 МГц): δ 11,55 (широкий, 1H), 8,00 (d, J=4,9Гц, 1H), 7,75 (d, J=8,4Гц, 1H), 7,68 (d, J=8,4Гц, 1H), 6,80 (d, J=4,9Гц, 1H), 5,72 (m, 1H), 4,45 (s, 2H), 3,87 (s, 3H), 2,34 (s, 3H).
Стадия 4: 2-(2,6-дихлор-3-(метоксикарбонил)бензил)-4-метил-1H-пирроло[2,3-b]пиридин-7-оксид
В раствор метил-2,4-дихлор-3-((4-метил-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоата (160 мг, 0,458 ммоль) в DME (6 мл), охлажденный до 0°C, добавляли 3-хлорбензопероксокислоту (138 мг, 0,802 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали досуха, остаток растворяли в EtOAc и промывали насыщенным водным раствором NaHCO3 и солевым раствором. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали досуха с получением 2-(2,6-дихлор-3-(метоксикарбонил)бензил)-4-метил-1H-пирроло[2,3-b]пиридин-7-оксида (140 мг, 84%). LC/MS (Способ h), Время удерживания=2,14 мин.; MS масса/заряд: 365 [M+H]+.
1H ЯМР (DMSO-d6, 300 МГц): δ 12,60 (широкий, 1H), 7,95 (d, J=6,2Гц, 1H), 7,77 (d, J=8,4Гц, 1H), 7,69 (d, J=8,4Гц, 1H), 6,82 (d, J=6,4Гц, 1H), 5,78 (s, 1H), 4,46 (s, 2H), 3,87 (s, 3H), 2,33 (s, 3H).
Стадия 5: метил-2,4-дихлор-3-((6-циано-4-метил-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоат
В раствор 2-(2,6-дихлор-3-(метоксикарбонил)бензил)-4-метил-1H-пирроло[2,3-b]пиридин-7-оксида (70 мг, 0,192 ммоль) в ACN (4 мл) добавляли триэтиламин (0,067 мл, 0,479 ммоль), затем триметилсилилцианид (0,154 мл, 1,150 ммоль). Реакционную смесь перемешивали с обратным холодильником в течение ночи. Добавляли дополнительное количество триэтиламина (0,067 мл, 0,479 ммоль) и триметилсилилцианида (0,154 мл, 1,150 ммоль). Реакционную смесь перемешивали с обратным холодильником в течение 24 часов. Реакционную смесь быстро охлаждали насыщенным водным раствором NaHCO3 и экстрагировали с помощью DCM. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали досуха. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 5-20% EtOAc в циклогексане) с получением метил-2,4-дихлор-3-((6-циано-4-метил-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоата (22 мг, 30%).
LC/MS (Способ k), Время удерживания=2,93 мин.; MS масса/заряд: 374 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 12,29 (широкий, 1H), 7,78 (d, J=8,4Гц, 1H), 7,69 (d, J=8,4Гц, 1H), 7,41 (s, 1H), 5,95 (s, 1H), 4,51 (s, 2H), 3,87 (s, 3H), 2,43 (s, 3H).
Стадия 6: метил-2,4-дихлор-3-((6-циано-1,4-диметил-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоат

Используя процедуру, аналогичную примеру P, стадии 4, метил-2,4-дихлор-3-((6-циано-1,4-диметил-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоат (63 мг, 95%) получали из метил-2,4-дихлор-3-((6-циано-4-метил-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоата (64 мг, 0,171 ммоль).
LC/MS (Способ h), Время удерживания=3,06 мин.; MS масса/заряд: 388 [M+H]+ 1H ЯМР (DMSO-d6, 300 МГц): δ 7,83 (d, J=8,4Гц, 1H), 7,73 (d, J=8,4Гц, 1H), 7,45 (s, 1H), 5,82 (s, 1H), 4,56 (s, 2H), 3,93 (s, 3H), 3,88 (s, 3H), 2,41 (s, 3H).
Стадия 7: 2,4-дихлор-3-((6-циано-1,4-диметил-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензойная кислота
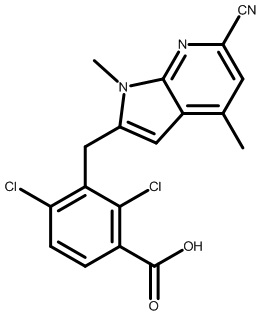
Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((6-циано-1,4-диметил-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензойную кислоту (59 мг, 99%) получали из метил-2,4-дихлор-3-((6-циано-1,4-диметил-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоата (62 мг, 0,160 ммоль). LC/MS (Способ h), Время удерживания=2,56 мин.; MS масса/заряд: 374 [M+H]+.
1H ЯМР (DMSO-d6, 300 МГц): δ 13,66 (широкий, 1H), 7,76 (d, J=8,4Гц, 1H), 7,67 (d, J=8,4Гц, 1H), 7,45 (s, 1H), 5,81 (s, 1H), 4,55 (s, 2H), 3,93 (s, 3H), 2,42 (s, 3H).
Стадия 8: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-пирроло[2,3-b]пиридин-6-карбонитрил
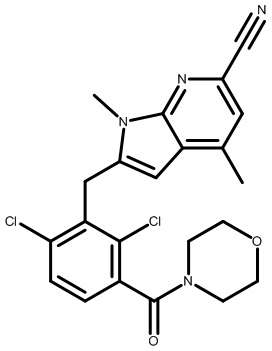
Используя процедуру, аналогичную примеру A, стадии 6, 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-пирроло[2,3-b]пиридин-6-карбонитрил (55 мг, 79%) получали из 2,4-дихлор-3-((6-циано-1,4-диметил-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензойной кислоты (58 мг, 0,155 ммоль) и морфолина (23,5 мг, 0,23 ммоль). LC/MS (Способ g), Время удерживания=1,57 мин.; MS масса/заряд: 443 [M+H]+.
1H ЯМР (DMSO-d6, 400 МГц): δ 7,69 (d, J=8,4Гц, 1H), 7,47 (d, J=8,4Гц, 1H), 7,46 (m, 1H), 5,76 (s, 1H), 4,53 (m, 2H), 3,92 (s, 3H), 3,65 (m, 4H), 3,53 (m, 2H), 3,18 (m, 2H), 2,42 (s, 3H).
Таблица CL. Следующие промежуточные соединения получали из 2,4-дихлор-3-((6-циано-1,4-диметил-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензойной кислоты (пример CL, стадия 7) при помощи такой же процедуры с соответствующим амином.

Пример CM: (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон
Пример CM1: (2,4-дихлор-3-((6-хлор-1,4-диметил-1H-пирроло[2,3-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон
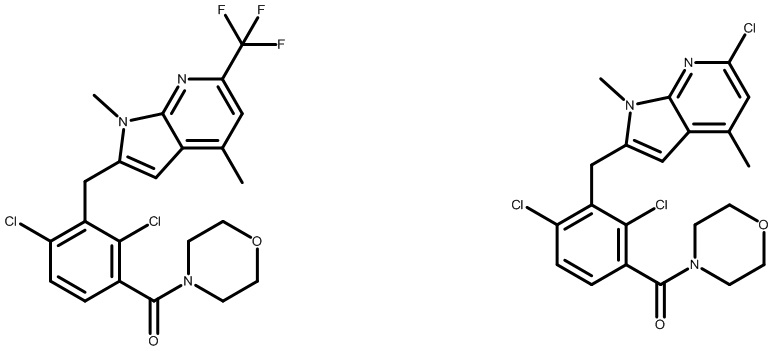
Стадия 1: метил-2-(2,6-дихлор-3-(метоксикарбонил)бензил)-6-йод-4-метил-1H-пирроло[2,3-b]пиридин-1-карбоксилат
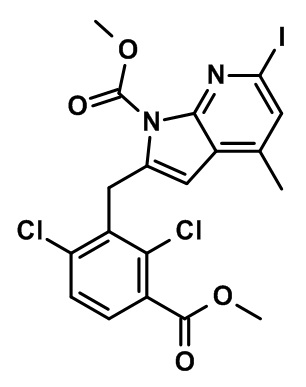
В раствор 2-(2,6-дихлор-3-(метоксикарбонил)бензил)-4-метил-1H-пирроло[2,3-b]пиридин 7-оксида (полученного аналогично примеру CL, стадии 4) (60 мг, 0,164 ммоль) в THF (3 мл) добавляли бис(триметилсилил)амин (0,034 мл, 0,164 ммоль), йодтриметилсилан (0,067 мл, 0,493 ммоль), затем метилхлорформиат (0,025 мл, 0,33 ммоль) по каплям. Реакционную смесь перемешивали 20 часов при комнатной температуре. Реакционную смесь концентрировали под пониженным давлением и остаток растворяли в EtOAc. Органический слой промывали последовательно насыщенным водным раствором NaHCO3, солевым раствором и высушивали над сульфатом магния, фильтровали, затем концентрировали. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-5% EtOAc в циклогексане) с получением метил-2-(2,6-дихлор-3-(метоксикарбонил)бензил)-6-йод-4-метил-1H-пирроло[2,3-b]пиридин-1-карбоксилата (33 мг, 14%) в виде бледно-желтого твердого вещества. Соединение использовали непосредственно на следующей стадии. LC/MS (Способ h), Время удерживания=3,30 мин.; MS масса/заряд: 533 [M+H]+.
Стадия 2: метил-2-(2,6-дихлор-3-(метоксикарбонил)бензил)-4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-1-карбоксилат и метил-6-хлор-2-(2,6-дихлор-3-(метоксикарбонил)бензил)-4-метил-1H-пирроло[2,3-b]пиридин-1-карбоксилат
В раствор метил-2-(2,6-дихлор-3-(метоксикарбонил)бензил)-6-йод-4-метил-1H-пирроло[2,3-b]пиридин-1-карбоксилата (134 мг, 0,251 ммоль) в DMF (3 мл) добавляли при комнатной температуре метил-2,2-дифтор-2-(фторсульфонил)ацетат (0,127 мл, 1,005 ммоль) и йодид меди(I) (47,9 мг, 0,251 ммоль), и реакционную смесь перемешивали при 115°C в течение 24 часов в закрытой пробирке. Остаток разбавляли с помощью EtOAc. Органический слой промывали последовательно водой, 10% водным раствором LiCl и солевым раствором и высушивали над сульфатом магния, фильтровали, затем концентрировали. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 10-20% EtOAc в циклогексане) с получением смеси метил-2-(2,6-дихлор-3-(метоксикарбонил)бензил)-4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-1-карбоксилата LC/MS (Способ h), Время удерживания=3,30 мин.; MS масса/заряд: 475 [M+H]+ и метил-6-хлор-2-(2,6-дихлор-3-(метоксикарбонил)бензил)-4-метил-1H-пирроло[2,3-b]пиридин-1-карбоксилата (120 мг) в соотношении 43/57. LC/MS (Способ h), Время удерживания=3,12 мин.; MS масса/заряд: 441 [M+H]+.
Стадия 3: 2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензойная кислота и 2,4-дихлор-3-((6-хлор-4-метил-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру F, стадии 4, 2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензойную кислоту LC/MS (Способ h), Время удерживания=2,65 мин.; MS масса/заряд: 403 [M+H]+ и 2,4-дихлор-3-((6-хлор-4-метил-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензойную кислоту (85 мг) LC/MS (Способ h), Время удерживания=2,48 мин.; MS масса/заряд: 369 [M+H]+ получали с соотношением 35/65 из смеси метил-2-(2,6-дихлор-3-(метоксикарбонил)бензил)-4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-1-карбоксилата и метил-6-хлор-2-(2,6-дихлор-3-(метоксикарбонил)бензил)-4-метил-1H-пирроло[2,3-b]пиридин-1-карбоксилата (120 мг) с соотношением 43/57.
Стадия 4: (2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон и (2,4-дихлор-3-((6-хлор-4-метил-1H-пирроло[2,3-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон

Используя процедуру, аналогичную примеру A, стадии 6, (2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон LC/MS (Способ h), Время удерживания=2,68 мин.; MS масса/заряд: 472 [M+H]+ и (2,4-дихлор-3-((6-хлор-4-метил-1H-пирроло[2,3-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон (102 мг) LC/MS (Способ h), Время удерживания=2,51 мин.; MS масса/заряд: 438 [M+H]+ получали с соотношением 39/61 из смеси 2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензойной кислоты и 2,4-дихлор-3-((6-хлор-4-метил-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензойной кислоты (102 мг) с соотношением 35/65.
Стадия 5: (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон и (2,4-дихлор-3-((6-хлор-1,4-диметил-1H-пирроло[2,3-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон

Используя процедуру, аналогичную примеру P, стадии 4, (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон (24 мг, 23%) LC/MS (Способ g), Время удерживания=1,83 мин.; MS масса/заряд: 486 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 7,69 (d, J=8,4 Гц, 1H), 7,47 (d, J=8,4 Гц, 1H), 7,34 (d, J=0,9 Гц, 1H), 5,81 (m, 1H), 4,51 (m, 2H), 3,93 (s, 3H), 3,65 (m, 4H), 3,54 (m, 2H), 3,20 (m, 2H), 2,46 (s, 3H) и (2,4-дихлор-3-((6-хлор-1,4-диметил-1H-пирроло[2,3-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон (30 мг, 31%) LC/MS (Способ g), Время удерживания=1,72 мин.; MS масса/заряд: 452 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 7,67 (d, J=8,4 Гц, 1H), 7,45 (d, J=8,4 Гц, 1H), 6,94 (d, J=0,9 Гц, 1H), 5,68 (m, 1H), 4,44 (m, 2H), 3,84 (s, 3H), 3,65 (m, 4H), 3,52 (m, 2H), 3,19 (m, 2H), 2,35 (s, 3H) получали из смеси (2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)фенил)(морфолинo)метанона и (2,4-дихлор-3-((6-хлор-4-метил-1H-пирроло[2,3-b]пиридин-2-ил)метил)фенил)(морфолинo)метанона (100 мг) с соотношением 39/61.
Пример CN: (2,4-дихлор-3-(гидрокси(1-метил-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон

Стадия 1: метил-3-((1-((3-(трет-бутил)фенил)сульфонил)-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-ил)(гидрокси)метил)-2,4-дихлорбензоат
Используя процедуру, аналогичную примеру A, стадии 1, метил-3-((1-((3-(трет-бутил)фенил)сульфонил)-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-ил)(гидрокси)метил)-2,4-дихлорбензоат (540 мг, 76%) получали из 3-(трет-бутил)-N-(2-йод-6-(трифторметил)пиридин-3-ил)бензолсульфонамида (описанного в WO2007/026104) (500 мг, 1,032 ммоль) и метил-2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)бензоата (получение №1) (348 мг, 1,342 ммоль) LC/MS (Способ h), Время удерживания=3,43 минуты; MS масса/заряд: 615 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц,) δ 8,70 (d, J=8,7Гц, 1H), 7,94 (m, 1H), 7,87 (d, J=8,7Гц, 1H), 7,76 (d, J=7,9Гц, 1H), 7,70 (d, J=7,9Гц, 1H), 7,68 (d, J=8,7Гц, 1H), 7,53 (m, 2H), 7,02 (широкий, 1H), 6,95 (широкий, 1H), 6,92 (s, 1H), 3,86 (s, 3H), 1,21 (s, 9H).
Стадия 2: 2,4-дихлор-3-(гидрокси(5-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)бензойная кислота

В раствор метил-3-((1-((3-(трет-бутил)фенил)сульфонил)-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-ил)(гидрокси)метил)-2,4-дихлорбензоата (500 мг, 0,812 ммоль) в THF (5 мл) и воде (2 мл) добавляли гидроксид лития (97 мг, 4,06 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавляли гидроксид лития (97 мг, 4,06 ммоль) (10 мг, 1 экв.) и реакционную смесь нагревали с обратным холодильником в течение 5 часов и перемешивали в течение ночи при комнатной температуре. Реакционную смесь разбавляли водой и подкисляли 1 M водным раствором HCl. Полученный водный слой экстрагировали с помощью DCM и полученный органический слой промывали солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением с получением 2,4-дихлор-3-(гидрокси(5-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)бензойной кислоты (374 мг, 45%) в виде коричневого твердого вещества. LC/MS (Способ h), Время удерживания=1,85 минуты; MS масса/заряд: 405 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц,) δ 11,76 (s, 1H), 7,90 (d, J=9Гц, 1H), 7,68 (d, J=9Гц, 1H), 7,56 (d, J=9Гц, 1H), 7,50 (d, J=9Гц, 1H), 6,82 (широкий, 1H), 6,20 (s, 1H).
Стадия 3: (2,4-дихлор-3-(гидрокси(5-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон

Используя процедуру, аналогичную примеру A, стадии 6, (2,4-дихлор-3-(гидрокси(5-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон (87 мг, 15%) получали из 2,4-дихлор-3-(гидрокси(5-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)бензойной кислоты (370 мг, 0,913 ммоль) и использовали неочищенным на следующей стадии и морфолин (239 мг, 2,74 ммоль). LC/MS (Способ h), Время удерживания=2,07 минуты; MS масса/заряд: 474 [M+H]+.
Стадия 4: (2,4-дихлор-3-(гидрокси(1-метил-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон
Используя процедуру, аналогичную примеру P, стадии 4 (2,4-дихлор-3-(гидрокси(1-метил-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон (28 мг, 34%) получали из (2,4-дихлор-3-(гидрокси(5-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)фенил)(морфолинo)метанона (80 мг, 0,169 ммоль). LC/MS (Способ g), Время удерживания=1,36 минуты; MS масса/заряд: 488 [M+H]+. 1H ЯМР (DMSO-d6, 400МГц,) δ 8,13 (m, 1H), 7,62 (m, 2H), 7,46 (d, J=8Гц, 1H), 6,73 (m, 1H), 6,65 (m, 1H), 6,32 и 6,29 (s, 1H), 3,88 и 3,86 (s, 3H), 3,66 (m, 3H), 3,55 (m, 3H), 3,21 (m, 2H).
Пример CO: (2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон
Стадия 1: (2,4-дихлор-3-(гидрокси(1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон

Используя процедуру, аналогичную примеру A, стадии 1, (2,4-дихлор-3-(гидрокси(1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон (520 мг, 87%) получали из N-(2-бром-5-(трифторметил)пиридин-3-ил)бензолсульфонамида (получение №26) (370 мг, 0,971 ммоль) и (2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)фенил)(морфолинo)метанона (получение №3) (396 мг, 1,262 ммоль). LC/MS (Способ g), Время удерживания=1,62 минуты; MS масса/заряд: 614 [M+H]+. 1H ЯМР (DMSO-d6, 400МГц,) δ 8,92 (s, 1H), 8,56 (m, 1H), 7,89 (m, 2H), 7,74 (m, 1H), 7,60 (m, 2H), 7,52 и 7,45 (d, J=8Гц, 1H), 7,39 (m, 1H), 7,03 и 6,92 (s, 1H), 6,98 и 6,88 (m, 1H), 6,87 и 6,83 (d, J=8Гц, 1H), 3,64 (m, 4H), 3,54 (m, 2H), 3,17 (m, 2H).
Стадия 2: (2,4-дихлор-3-((1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон
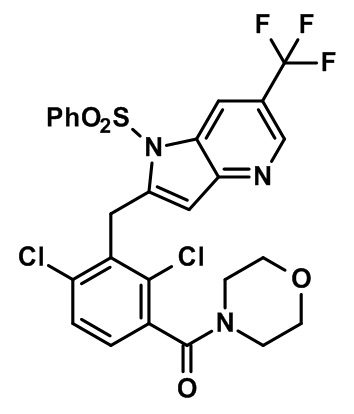
Используя процедуру, аналогичную примеру Z, стадии 2, (2,4-дихлор-3-((1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон (314 мг, 96%) получали из (2,4-дихлор-3-(гидрокси(1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)фенил)(морфолинo)метанона (336 мг, 0,547 ммоль). LC/MS (Способ h), Время удерживания=3,05 минуты; MS масса/заряд: 598 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц,) δ 8,89 (m, 1H), 8,70 (m, 1H), 8,05 (m, 2H), 7,83 (m, 1H), 7,67 (m, 3H), 7,46 (d, J=9Гц, 1H), 6,18 (s, 1H), 4,58 (m, 2H), 3,64 (m, 4H), 3,49 (m, 2H), 3,21 (m, 2H).
Стадия 3: (2,4-дихлор-3-((6-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон
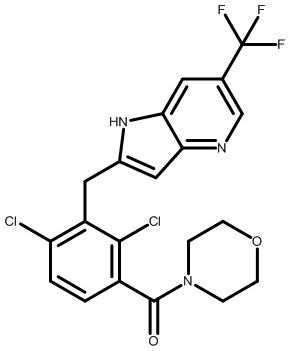
Используя процедуру, аналогичную примеру A, стадии 3, (2,4-дихлор-3-((6-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон (237 мг, 100%) получали из (2,4-дихлор-3-((1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)фенил)(морфолинo)метанона (310 мг, 0,518 ммоль) LC/MS (Способ h), Время удерживания=2,10 минуты; MS масса/заряд: 456 [M-H]-. 1H ЯМР (DMSO-d6, 300МГц,) δ 11,83 (широкий, 1H), 8,56 (m, 1H), 8,02 (m, 1H), 7,66 (d, J=9Гц, 1H), 7,46 (d, J=9Гц, 1H), 6,13 (s, 1H), 4,53 (s, 2H), 3,65 (m, 4H), 3,54 (m, 2H), 3,19 (m, 2H).
Стадия 4: (2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон

Используя процедуру, аналогичную примеру A, стадии 4, (2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон (16 мг, 31%) получали из (2,4-дихлор-3-((6-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)фенил)(морфолинo)метанона (50 мг, 0,109 ммоль) LC/MS (Способ g), Время удерживания=1,46 минуты; MS масса/заряд: 472 [M+H]+. 1H ЯМР (DMSO-d6, 400МГц,) δ 8,57 (m, 1H), 8,37 (m, 1H), 7,69 (d, J=8Гц, 1H), 7,47 (d, J=8Гц, 1H), 5,85 (s, 1H), 4,52 (s, 2H), 3,98 (s, 3H), 3,56 (m, 4H), 3,55 (m, 2H), 3,21 (m, 2H).
Пример CP: (2,4-дихлор-3-(1-метил-6-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-карбонил)фенил)(морфолинo)метанон

Стадия 1: (2,4-дихлор-3-(1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-карбонил)фенил)(морфолинo)метанон
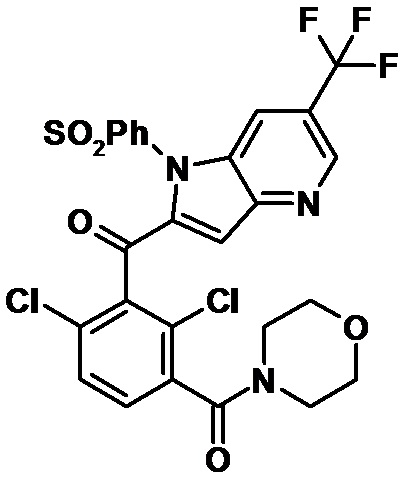
В раствор (2,4-дихлор-3-(гидрокси(1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-ил)метил)фенил)(морфолинo)метанона (пример CO, стадия 1) (580 мг, 0,944 ммоль) в дихлорэтане (10 мл) добавляли диоксид марганца (821 мг, 9,44 ммоль) и смесь перемешивали при 85°C в течение 24 часов. Смесь фильтровали и промывали с помощью DCM и ACN. Фильтрат концентрировали с получением (2,4-дихлор-3-(1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-карбонил)фенил)(морфолинo)метанона (540 мг, 80%) в виде бежевого порошка. LC/MS (Способ h), Время удерживания=2,92 минуты; MS масса/заряд: 612 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц,) δ 9,13 (s, 1H), 8,93 (s, 1H), 8,26 (d, J=9Гц, 2H), 7,85 (широкий, 1H), 7,84 (m, 1H), 7,71 (m, 3H), 7,64 (d, J=9Гц, 1H), 3,66 (m, 4H), 3,53 (m, 2H), 3,25 (m, 2H).
Стадия 2: (2,4-дихлор-3-(6-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-карбонил)фенил)(морфолинo)метанон

Используя процедуру, аналогичную примеру A, стадии 3, (2,4-дихлор-3-(6-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-карбонил)фенил)(морфолинo)метанон (363 мг, 86%) получали из (2,4-дихлор-3-(1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-карбонил)фенил)(морфолинo)метанона (530 мг, 0,865 ммоль). LC/MS (Способ h), Время удерживания=2,31 минуты; MS масса/заряд: 472 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц,) δ 13,00 (широкий, 1H), 8,84 (m, 1H), 8,20 (m, 1H), 7,77 (d, J=9Гц, 1H), 7,68 (d, J=9Гц, 1H), 7,50 и 7,20 (широкий, 1H), 3,66 (m, 4H), 3,57 (m, 2H), 3,40 (m, 1H), 3,19 (m, 1H).
Стадия 3: (2,4-дихлор-3-(1-метил-6-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-карбонил)фенил)(морфолинo)метанон
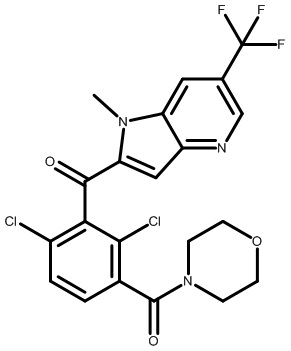
Используя процедуру, аналогичную примеру A, стадии 4, (2,4-дихлор-3-(1-метил-6-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-карбонил)фенил)(морфолинo)метанон (28 мг, 27%) получали из (2,4-дихлор-3-(6-(трифторметил)-1H-пирроло[3,2-b]пиридин-2-карбонил)фенил)(морфолинo)метанона (100 мг, 0,212 ммоль). LC/MS (Способ g), Время удерживания=1,56 минуты; MS масса/заряд: 486 [M+H]+. 1H ЯМР (DMSO-d6, 400МГц,) δ 8,87 (m, 1H), 8,75 (m, 1H), 7,77 (d, J=8Гц, 1H), 7,66 (d, J=8Гц, 1H), 7,45 (широкий, 1H), 4,27 (s, 3H), 3,66 (m, 4H), 3,55 (m, 2H), 3,26 (m, 2H).
Пример CQ: (2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(морфолинo)метанон
Стадия 1: (2,4-дихлор-3-(гидрокси(1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(морфолинo)метанон
Используя процедуру, аналогичную примеру A, стадии 1, (2,4-дихлор-3-(гидрокси(1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(морфолинo)метанон (1,94 г, 68%) получали из N-(5-йод-2-(трифторметил)пиридин-4-ил)бензолсульфонамида (получение №27) (2 г, 4,67 ммоль) и (2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)фенил)(тетрагидро-2H-пиран-4-ил)метанона (получение №3) (1,902 г, 6,07 ммоль). LC/MS (Способ h), Время удерживания=2,63 минуты; MS масса/заряд: 614 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц) δ 9,07 и 9,05 (s, 1H), 8,32 и 8,29 (s, 1H), 7,95 (m, 2H), 7,75 (m, 1H), 7,63 (m, 2H), 7,51 (m, 1H), 7,40 (m, 1H), 6,97 (m, 2H), 6,79 и 6,74 (d, J=8Гц, 1H), 3,65 (m, 4H), 3,54 (m, 2H), 3,16 (m, 2H).
Стадия 2: (2,4-дихлор-3-((1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(морфолинo)метанон

Используя процедуру, аналогичную примеру Z, стадии 2, (2,4-дихлор-3-((1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(морфолинo)метанон (2,1 г, 100%) получали из (2,4-дихлор-3-(гидрокси(1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(морфолинo)метанона (1,93 г, 3,14 ммоль). LC/MS (Способ k), Время удерживания=3,14 минуты; MS масса/заряд: 598 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц,) δ 8,94 (s, 1H), 8,48 (s, 1H), 8,05 (m, 1H), 7,96 (m, 1H), 7,81 (m, 1H), 7,66 (m, 2H), 7,47 (m, 1H), 7,41 (m, 1H), 6,21 (s, 1H), 4,52 (m, 2H), 3,64 (m, 4H), 3,49 (m, 2H), 3,16 (m, 2H).
Стадия 3: (2,4-дихлор-3-((6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(морфолинo)метанон
Используя процедуру, аналогичную примеру A, стадии 3, (2,4-дихлор-3-((6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(морфолинo)метанон (1,05 г, 65%) получали из (2,4-дихлор-3-((1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(морфолинo)метанона (2,1 г, 3,51 ммоль). LC/MS (Способ k), Время удерживания=2,35 минуты; MS масса/заряд: 458 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц,) δ 12,05(широкий, 1H), 8,80 (s, 1H), 7,78 (s, 1H), 7,66 (d, J=9Гц, 1H), 7,43 (d, J=9Гц, 1H), 6,14 (s, 1H), 4,49 (s, 2H), 3,66 (m, 4H), 3,54 (m, 2H), 3,18 (m, 2H).
Стадия 4: (2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(морфолинo)метанон

Используя процедуру, аналогичную примеру A, стадии 4, (2,4-дихлор-3-((1-метил-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(морфолинo)метанон (78 мг, 50%) получали из (2,4-дихлор-3-((6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(морфолинo)метанона (150 мг, 0,327 ммоль) LC/MS (Способ g), Время удерживания=2,36 минуты; MS масса/заряд: 472 [M+H]+. 1H ЯМР (DMSO-d6, 400МГц,) δ 8,76 (s, 1H), 8,09 (s, 1H), 7,69 (d, J=8Гц, 1H), 7,47 (d, J=8Гц, 1H), 5,91 (s, 1H), 4,49 (s, 2H), 3,98 (s, 3H), 3,65 (m, 4H), 3,55 (m, 2H), 3,19 (m, 2H).
Пример CR: (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(морфолинo)метанон

Стадия 1: (2,4-дихлор-3-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(морфолинo)метанон
Используя процедуру, аналогичную примеру A, стадии 1, (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(морфолинo)метанон (180 мг, 50%) получали из N-(3-йод-2-метил-6-(трифторметил)пиридин-4-ил)бензолсульфонамида (получение №39) (233 мг, 0,53 ммоль) и (2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)фенил)(морфолинo)метанона (199 мг, 0,63 ммоль) (получение №3). LC/MS (Способ i), Время удерживания=2,21 мин.; MS масса/заряд: 628 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 8,14 (m, 1H), 7,94 (d, J=7,8 Гц, 1H), 7,86 (d, J=7,8 Гц, 1H), 7,75 (m, 1H), 7,62 (m, 2H), 7,50 (m, 1H), 7,40 (m, 1H), 7,00 (m, 1H), 6,91 (m, 1H), 6,74 и 6,81 (d, J=6 Гц, 1H), 3,65 (m, 4H), 3,55 (m, 2H), 3,18 (m, 2H), 2,68 и 2,69 (s, 3H).
Стадия 2: (2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(морфолинo)метанон
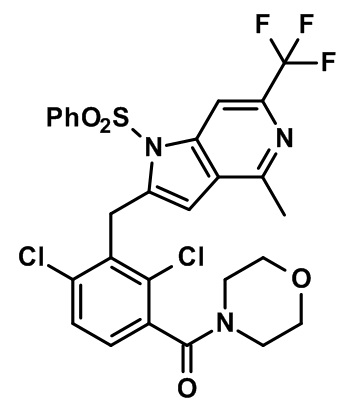
Используя процедуру, аналогичную примеру Z, стадии 2, (2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(морфолинo)метанон (202 мг, 100%) получали из (2,4-дихлор-3-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(морфолинo)метанона (175 мг, 0,28 ммоль) в виде желтой смолы. Соединение использовали непосредственно на следующей стадии. LC/MS (Способ i), Время удерживания=2,48 мин.; MS масса/заряд: 612 [M+H]+.
Стадия 3: (2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(морфолинo)метанон
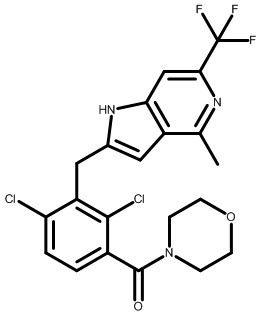
Используя процедуру, аналогичную примеру A, стадии 3, (2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(морфолинo)метанон (115 мг, 87%) получали из (2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(морфолинo)метанона (171 мг, 0,28 ммоль). LC/MS (Способ i), Время удерживания=1,98 мин.; MS масса/заряд: 472 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 11,96 (s, 1H), 7,65 (m, 2H), 7,43 (d, J=8,3 Гц, 1H), 6,13 (s, 1H), 4,48 (s, 2H), 3,65 (dm, 4H), 3,53 (m, 2H), 3,17 (m, 2H), 2,58 (s, 3H).
Стадия 4: (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(морфолинo)метанон

Используя процедуру, аналогичную примеру A, стадии 4, (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(морфолинo)метанон (25 мг, 21%) получали из (2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(морфолинo)метанона (112 мг, 0,24 ммоль). LC/MS (Способ g), Время удерживания=1,53 мин.; MS масса/заряд: 486 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 7,92 (s, 1H), 7,69 (d, J=8,4 Гц, 1H), 7,47 (d, J=8,4 Гц, 1H), 5,88 (s, 1H), 4,48 (m, 2H), 3,96 (s, 3H), 3,65 (m, 4H), 3,55 (m, 2H), 3,21 (m, 2H), 2,54 (s, 3H).
Пример CS: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-пирроло[3,2-c]пиридин-6-карбонитрил

Стадия 1: 2-((2,6-дихлор-3-(морфолин-4-карбонил)фенил)(гидрокси)метил)-4-метил-1-(фенилсульфонил)-1H-пирроло[3,2-c]пиридин-6-карбонитрил

Используя процедуру, аналогичную примеру A, стадии 1, 2-((2,6-дихлор-3-(морфолин-4-карбонил)фенил)(гидрокси)метил)-4-метил-1-(фенилсульфонил)-1H-пирроло[3,2-c]пиридин-6-карбонитрил (204 мг, 42%) получали из N-(6-циано-3-йод-2-метилпиридин-4-ил)бензолсульфонамида (получение №40) (300 мг, 0,75 ммоль) и (2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)фенил)(морфолинo)метанона (283 мг, 0,90 ммоль) (получение №3). LC/MS (Способ h), Время удерживания=2,37 мин.; MS масса/заряд: 585 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 8,44 и 8,42 (s, 1H), 8,07 (m, 1H), 7,99 (m, 1H), 7,75 (m, 1H), 7,63 (m, 2H), 7,52 и 7,49 (d, J= 8,1 Гц, 1H), 7,40 и 7,39 (d, J= 8,1 Гц, 1H), 7,06 и 6,89 (s, 1H), 7,03 и 6,93 (d, J= 5,5 Гц, 1H), 6,83 и 6,77 (d, J= 5,5 Гц, 1H), 3,64 (m, 4H), 3,55 (m, 2H), 3,16 (m, 2H), 2,65 и 2,63 (s, 3H).
Стадия 2: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-4-метил-1-(фенилсульфонил)-1H-пирроло[3,2-c]пиридин-6-карбонитрил
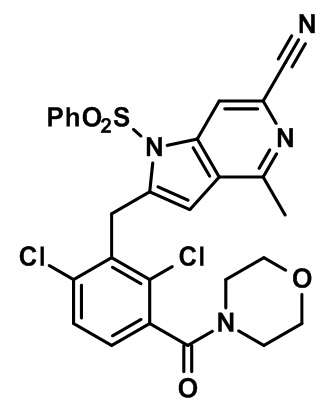
Используя процедуру, аналогичную примеру Z, стадии 2, 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-4-метил-1-(фенилсульфонил)-1H-пирроло[3,2-c]пиридин-6-карбонитрил (248 мг, 100%) получали из 2-((2,6-дихлор-3-(морфолин-4-карбонил)фенил)(гидрокси)метил)-4-метил-1-(фенилсульфонил)-1H-пирроло[3,2-c]пиридин-6-карбонитрила (200 мг, 0,34 ммоль) в виде желтой смолы. Соединение использовали непосредственно на следующей стадии. LC/MS (Способ h), Время удерживания=2,77 мин.; MS масса/заряд: 569 [M+H]+.
Стадия 3: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-4-метил-1H-пирроло[3,2-c]пиридин-6-карбонитрил
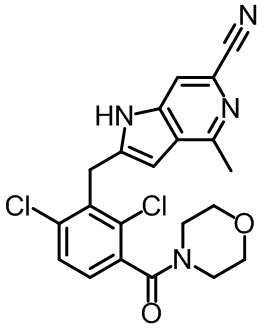
Используя процедуру, аналогичную примеру A, стадии 3, 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-4-метил-1H-пирроло[3,2-c]пиридин-6-карбонитрил (100 мг, 47%) получали из 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-4-метил-1-(фенилсульфонил)-1H-пирроло[3,2-c]пиридин-6-карбонитрила (248 мг, 0,43 ммоль). LC/MS (Способ h), Время удерживания=2,07 мин.; MS масса/заряд: 429 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц): δ 12,14 (широкий, 1H), 7,85 (s, 1H), 7,66 (d, J=8,3 Гц, 1H), 7,43 (d, J=8,3 Гц, 1H), 6,15 (s, 1H), 4,48 (s, 2H), 3,65 (m, 4H), 3,53 (m, 2H), 3,17 (m, 2H), 2,56 (s, 3H).
Стадия 4: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-пирроло[3,2-c]пиридин-6-карбонитрил

Используя процедуру, аналогичную примеру A, стадии 4, 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-пирроло[3,2-c]пиридин-6-карбонитрил (18 мг, 16%) получали из 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-4-метил-1H-пирроло[3,2-c]пиридин-6-карбонитрила (100 мг, 0,23 ммоль). LC/MS (Способ g), Время удерживания=1,31 мин.; MS масса/заряд: 443 [M+H]+.
1H ЯМР (DMSO-d6, 400МГц): δ 8,17 (s, 1H), 7,69 (d, J=8,1 Гц, 1H), 7,47 (d, J=8,1 Гц, 1H), 5,92 (s, 1H), 4,48 (m, 2H), 3,94 (s, 3H), 3,64 (m, 4H), 3,54 (m, 2H), 3,20 (m, 2H), 2,52 (s, 3H).
Пример CT: (2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-a]пиридин-2-ил)метил)фенил)(морфолинo)метанон

Стадия 1: метил-2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-a]пиридин-2-ил)метил)бензоат

В раствор метил-2,4-дихлор-3-(3-хлор-2-оксобутил)бензоата (получение №13) (176 мг, 0,568 ммоль) в N-метил-2-пирролидиноне (300 мкл) добавляли 3-метил-5-(трифторметил)пиридин-2-амин (описанный в WO2007/089034) (100 мг, 0,568 ммоль). Реакционную смесь перемешивали при 120°C в течение 48 часов и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 5-20% EtOAc в циклогексане) с получением метил-2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-a]пиридин-2-ил)метил)бензоата (55 мг, 22%) LC/MS (Способ h), Время удерживания=2,96 минуты; MS масса/заряд: 431 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц) δ 8,59 (s, 1H), 7,67 (d, J=8Гц, 1H), 7,62 (d,J=8Гц, 1H), 7,22 (s, 1H), 4,43 (s, 2H), 3,85 (s, 3H), 2,48 (s, 3H), 2,42 (s, 3H).
Стадия 2: 2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-a]пиридин-2-ил)метил)бензойная кислота
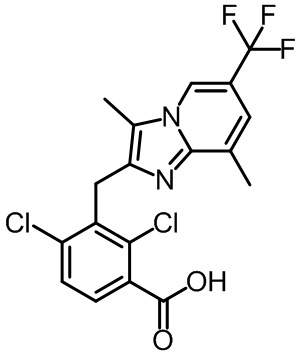
Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-a]пиридин-2-ил)метил)бензойную кислоту (18 мг, 35%) получали из метил-2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-a]пиридин-2-ил)метил)бензоата (53 мг, 0,123 ммоль) LC/MS (Способ h), Время удерживания=2,03 минуты; MS масса/заряд: 417 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц,) δ 13,57 (широкий, 1H), 8,59 (s, 1H), 7,61 (d, J=9Гц, 1H), 7,55 (d, J=9Гц, 1H), 7,22 (s, 1H), 4,42 (s, 2H), 2,47 (s, 3H), 2,43 (s, 3H).
Стадия 3: (2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-a]пиридин-2-ил)метил)фенил)(морфолинo)метанон
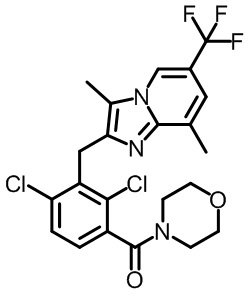
Используя процедуру, аналогичную примеру A1, (2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-a]пиридин-2-ил)метил)фенил)(морфолинo)метанон (14 мг, 19%) получали из 2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-a]пиридин-2-ил)метил)бензойной кислоты (62 мг, 0,149 ммоль) и морфолина (19,4 мг, 0,22 ммоль). LC/MS (Способ g), Время удерживания=1,47 минуты; MS масса/заряд: 486 [M+H]+. 1H ЯМР (DMSO-d6, 400МГц,) δ 8,59 (s, 1H), 7,56 (d, J=8Гц, 1H), 7,32 (d, J=8Гц, 1H), 7,22 (s, 1H), 4,40 (m, 2H), 3,66 (m, 4H), 3,55 (m, 2H), 3,14 (m, 2H), 2,48 (s, 3H), 2,41 (s, 3H).
Таблица CT. Следующие промежуточные соединения получали из 2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-a]пиридин-2-ил)метил)бензойной кислоты (пример CT, стадия 2) при помощи такой же процедуры с соответствующим амином.
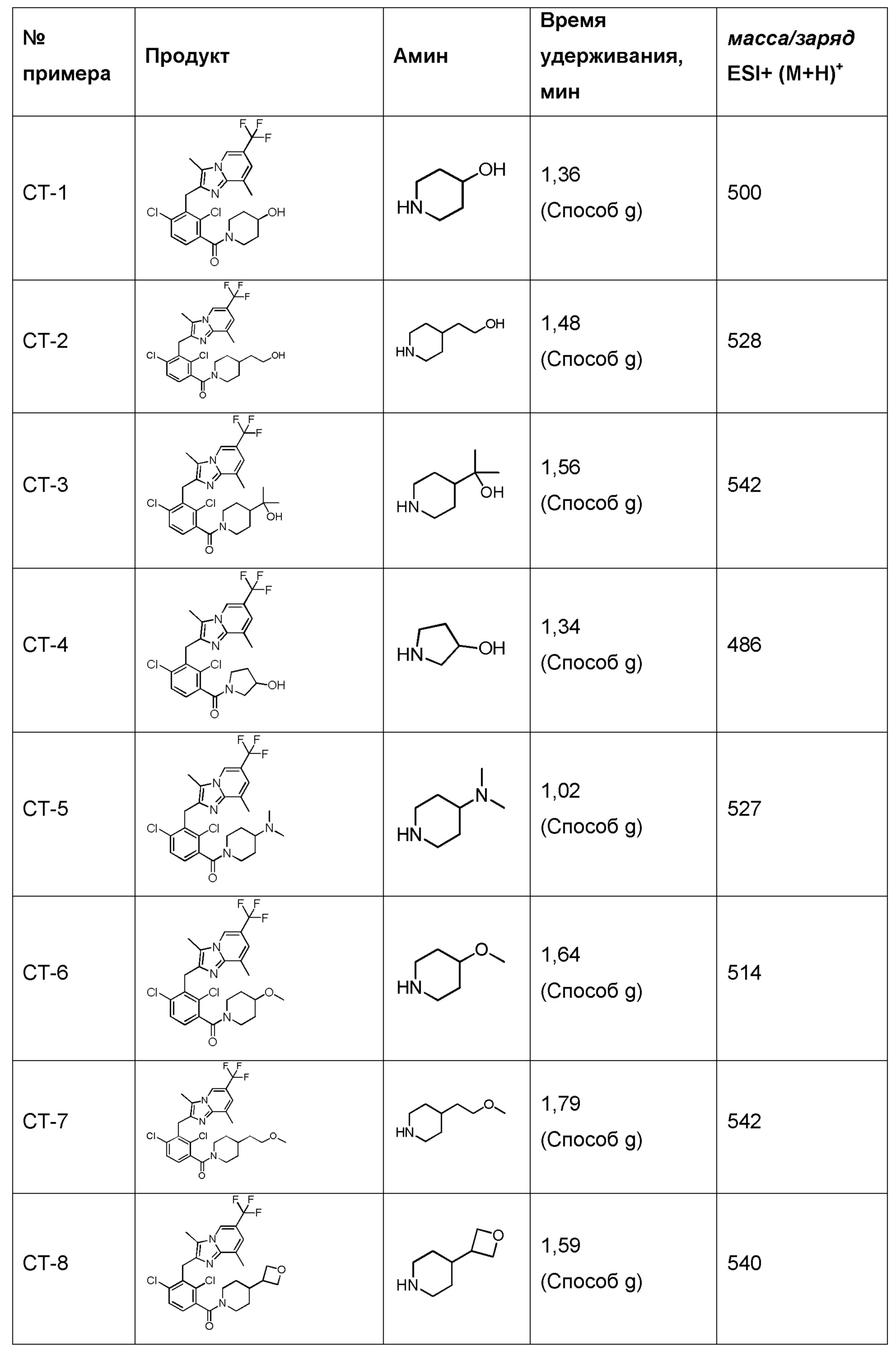

Пример CU: 2-(1-(2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-a]пиридин-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
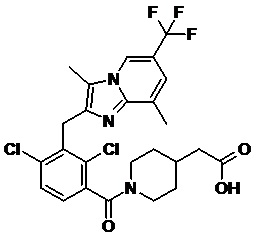
Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-a]пиридин-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (73 мг, 48%) получали из метил-2-(1-(2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-a]пиридин-2-ил)метил)бензоил)пиперидин-4-ил)ацетата (таблица CT, CT-12) (155 мг, 0,28 ммоль). LC/MS (Способ g), Время удерживания=1,43 мин.; MS масса/заряд: 542 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 12,08 (широкий, 1H), 8,60 (s, 1H), 7,54 (m, 1H), 7,32 и 7,24 (d, J=8,1 Гц, 1H), 7,22 (s, 1H), 4,43 (m, 3H), 3,23 (m, 1H), 3,02 (m, 1H), 2,79 (m, 1H), 2,47 (s, 3H), 2,41 (s, 3H), 2,15 (m, 2H), 1,96 (m, 1H), 1,75 (m, 1H), 1,61 (m, 1H), 1,15 (m, 2H).
Пример CV: 2-[[2,6-дихлор-3-[4-(2-гидроксиэтил)пиперидин-1-карбонил]фенил]метил]-3,8-диметил-имидазо[1,2-a]пиридин-6-карбонитрил
Стадия 1: 2,4-дихлор-3-((6-циано-3,8-диметилимидазо[1,2-a]пиридин-2-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру CT, стадии 1, следуя примеру A, стадии 5, 2,4-дихлор-3-((6-циано-3,8-диметилимидазо[1,2-a]пиридин-2-ил)метил)бензойную кислоту (1,17 г, 34%) получали из метил-2,4-дихлор-3-(3-хлор-2-оксобутил)бензоата (получение №13) (2,67 г, 8,64 ммоль) и 6-амино-5-метилникотинонитрила (1,15 г, 8,64 ммоль). LC/MS (Способ g), Время удерживания=1,74 мин.; MS масса/заряд: 374 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 13,55 (широкий, 1H), 8,95 (s, 1H), 7,63 (d, J=9 Гц, 1H), 7,57 (d, J=9 Гц, 1H), 7,24 (s, 1H), 4,42 (s, 2H), 2,44 (s, 3H), 2,38 (s, 3H).
Стадия 2: 2-[[2,6-дихлор-3-[4-(2-гидроксиэтил)пиперидин-1-карбонил]фенил]метил]-3,8-диметил-имидазо[1,2-a]пиридин-6-карбонитрил

Используя процедуру, аналогичную примеру A1, 2-[[2,6-дихлор-3-[4-(2-гидроксиэтил)пиперидин-1-карбонил]фенил]метил]-3,8-диметил-имидазо[1,2-a]пиридин-6-карбонитрил (40 мг, 52%) получали из 2,4-дихлор-3-((6-циано-3,8-диметилимидазо[1,2-a]пиридин-2-ил)метил)бензойной кислоты (60 мг, 0,16 ммоль). LC/MS (Способ g), Время удерживания=1,33 мин.; MS масса/заряд: 485 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 8,94 (s, 1H), 7,54 и 7,53 (d, J=8,1, 1H), 7,31 и 7,24 (d, J=8,4 Гц, 1H), 7,22 (m, 1H), 4,45 (m, 1H), 4,38 (m, 3H), 3,42 (m, 2H), 3,24 (m, 1H), 2,98 (m, 1H), 2,75 (m, 1H), 2,44 (s, 3H), 2,35 (m, 3H), 1,75 (m, 1H), 1,66 (m, 1H), 1,57 (m, 1H), 1,36 (m, 2H), 0,94-1,20 (m, 2H).
Таблица CV. Следующие промежуточные соединения получали из 2,4-дихлор-3-((6-циано-3,8-диметилимидазо[1,2-a]пиридин-2-ил)метил)бензойной кислоты (пример CV, стадия 1) при помощи такой же процедуры с соответствующим амином.

Пример CW: (2,4-дихлор-3-((6-хлор-3,8-диметилимидазо[1,2-b]пиридазин-2-ил)метил)фенил)(морфолинo)метанон
Стадия 1: метил-2,4-дихлор-3-((6-хлор-3,8-диметилимидазо[1,2-b]пиридазин-2-ил)метил)бензоат и метил-2,4-дихлор-3-((6-хлор-3,7-диметилимидазо[1,2-b]пиридазин-2-ил)метил)бензоат
Используя процедуру, аналогичную примеру CT, стадии 1, метил-2,4-дихлор-3-((6-хлор-3,8-диметилимидазо[1,2-b]пиридазин-2-ил)метил)бензоат (47 мг, 34%). LC/MS (Способ h), Время удерживания=3,10 минуты; MS масса/заряд: 398 [M+H]+. 1H ЯМР (DMSO-d6, 400МГц) δ 7,68 (d, J=8Гц, 1H), 7,63 (d, J=8Гц, 1H), 7,15 (s, 1H), 4,45 (s, 2H), 3,87 (s, 3H), 2,44 (s, 6H); и метил-2,4-дихлор-3-((6-хлор-3,7-диметилимидазо[1,2-b]пиридазин-2-ил)метил)бензоат (38 мг, 28%) получали из смеси 6-хлор-5-метилпиридазин-3-амина и 6-хлор-4-метилпиридазин-3-амина (получение №28) (23,12 мг, 0,161 ммоль) и метил-3-(3-бром-2-оксобутил)-2,4-дихлорбензоата (получение №14) (57 мг, 0,161 ммоль). LC/MS (Способ h), Время удерживания=2,98 минуты; MS масса/заряд: 398 [M+H]+. 1H ЯМР (DMSO-d6, 400МГц,) δ 7,98 (s, 1H), 7,66 (d, J=8Гц, 1H), 7,60 (d, J=8Гц, 1H), 4,43 (s, 2H), 3,85 (s, 3H), 2,49 (s, 3H), 2,33 (s, 3H).
Стадия 2: 2,4-дихлор-3-((6-хлор-3,8-диметилимидазо[1,2-b]пиридазин-2-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((6-хлор-3,8-диметилимидазо[1,2-b]пиридазин-2-ил)метил)бензойную кислоту (330 мг, 93%) получали из метил-2,4-дихлор-3-((6-хлор-3,8-диметилимидазо[1,2-b]пиридазин-2-ил)метил)бензоата(366 мг, 0,918 ммоль) LC/MS (Способ h), Время удерживания=2,47 минуты; MS масса/заряд: 384 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц,) δ 13,57 (широкий, 1H), 7,65 (d, J=9Гц, 1H), 7,57 (d, J=9Гц, 1H), 7,15 (s, 1H), 4,45 (s, 2H), 2,45 (s, 3H), 2,43 (s, 3H).
Стадия 3: (2,4-дихлор-3-((6-хлор-3,8-диметилимидазо[1,2-b]пиридазин-2-ил)метил)фенил)(морфолинo)метанон
Используя процедуру, аналогичную примеру A1, (2,4-дихлор-3-((6-хлор-3,8-диметилимидазо[1,2-b]пиридазин-2-ил)метил)фенил)(морфолинo)метанон (356 мг, 92%) получали из 2,4-дихлор-3-((6-хлор-3,8-диметилимидазо[1,2-b]пиридазин-2-ил)метил)бензойной кислоты (327 мг, 0,850 ммоль) и морфолина (89 мг, 1,02 ммоль). LC/MS (Способ g), Время удерживания=1,62 минуты; MS масса/заряд: 453 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц,) δ 7,57 (d, J=8Гц, 1H), 7,33 (d, J=8Гц, 1H), 7,15 (m, 1H), 4,42 (m, 2H), 3,65 (m, 4H), 3,54 (m, 2H), 3,14 (m, 2H), 2,44 (s, 6H).
Пример CY: (2,4-дихлор-3-((6-хлор-3,7-диметилимидазо[1,2-b]пиридазин-2-ил)метил)фенил)(морфолинo)метанон
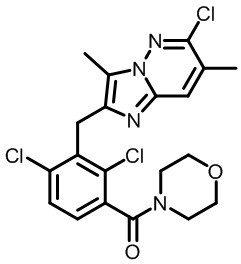
Стадия 1: 2,4-дихлор-3-((6-хлор-3,7-диметилимидазо[1,2-b]пиридазин-2-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((6-хлор-3,7-диметилимидазо[1,2-b]пиридазин-2-ил)метил)бензойную кислоту (21 мг, 66%) получали из метил-2,4-дихлор-3-((6-хлор-3,7-диметилимидазо[1,2-b]пиридазин-2-ил)метил)бензоата (пример CW, стадия 1) (33 мг, 0,083 ммоль). LC/MS (Способ h), Время удерживания=2,30 минуты; MS масса/заряд: 384 [M+H]+. 1H ЯМР (DMSO-d6, 300МГц,) δ 13,55 (широкий, 1H), 8,01 (s, 1H), 7,64 (d, J=9Гц, 1H), 7,56 (d, J=9Гц, 1H), 4,45 (s, 2H), 2,48 (s, 3H), 2,36 (s, 3H).
Стадия 2: (2,4-дихлор-3-((6-хлор-3,7-диметилимидазо[1,2-b]пиридазин-2-ил)метил)фенил)(морфолинo)метанон
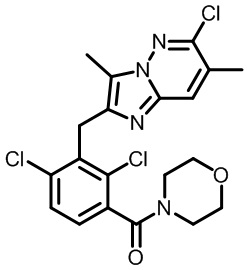
Используя процедуру, аналогичную примеру A1, (2,4-дихлор-3-((6-хлор-3,7-диметилимидазо[1,2-b]пиридазин-2-ил)метил)фенил)(морфолинo)метанон (15 мг, 70%) получали из 2,4-дихлор-3-((6-хлор-3,7-диметилимидазо[1,2-b]пиридазин-2-ил)метил)бензойной кислоты (18 мг, 0,047 ммоль) и морфолина (6,12 мг, 0,07 ммоль). LC/MS (Способ g), Время удерживания=1,56 минуты; MS масса/заряд: 453 [M+H]+. 1H ЯМР (DMSO-d6, 400МГц,) δ 7,99 (s, 1H), 7,55 (d, J=8Гц, 1H), 7,33 (d, J=8Гц, 1H), 4,40 (m, 2H), 3,63 (m, 4H), 3,52 (m, 2H), 3,12 (m, 2H), 2,48 (s, 3H), 2,34 (s, 3H).
Пример CZ: (2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-b]пиридазин-2-ил)метил)фенил)(морфолинo)метанон
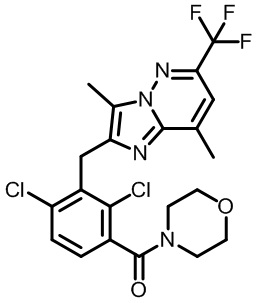
Стадия 1: метил-2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-b]пиридазин-2-ил)метил)бензоат

Используя процедуру, аналогичную примеру CT, стадии 1, метил-2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-b]пиридазин-2-ил)метил)бензоат (135 мг, 37%) получали из метил-2,4-дихлор-3-(3-хлор-2-оксобутил)бензоата (получение №13) (262 мг, 0,847 ммоль) и 4-метил-6-(трифторметил)пиридазин-3-амина (получение №41) (150 мг, 0,847 ммоль). LC/MS (Способ i), Время удерживания=2,65 мин.; MS масса/заряд: 432 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,69 (d, J=9 Гц, 1H), 7,64 (, J=9 Гц, 1H), 7,47 (d, J=1,0 Гц, 1H), 4,52 (s, 2H), 3,86 (s, 3H), 2,55 (d, J=1 Гц, 3H), 2,51 (s, 3H).
Стадия 2: 2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-b]пиридазин-2-ил)метил)бензойная кислота
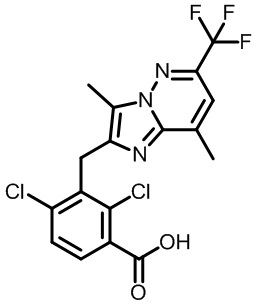
Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-b]пиридазин-2-ил)метил)бензойную кислоту (100 мг, 80%) получали из метил-2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-b]пиридазин-2-ил)метил)бензоата (129 мг, 0,29 ммоль). LC/MS (Способ i), Время удерживания=2,27 мин.; MS масса/заряд: 418 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц): δ 13,61 (широкий, 1H), 7,65 (d, J=9 Гц, 1H), 7,61 (d, J=9 Гц, 1H), 7,47 (d, J=1,0 Гц, 1H), 4,52 (s, 2H), 2,55 (d, J=0,8 Гц, 3H), 2,50 (s, 3H).
Стадия 3: (2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-b]пиридазин-2-ил)метил)фенил)(морфолинo)метанон
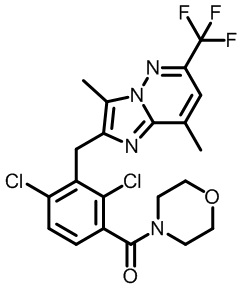
Используя процедуру, аналогичную примеру A1, (2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-b]пиридазин-2-ил)метил)фенил)(морфолинo)метанон (22 мг, 38%) получали из метил-2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-b]пиридазин-2-ил)метил)бензоата (48 мг, 0,11 ммоль). LC/MS (Способ g), Время удерживания=1,75 мин.; MS масса/заряд: 487 [M+H]+.
1H ЯМР (DMSO-d6, 400МГц): δ 7,58 (d, J=8,4 Гц, 1H), 7,46 (d, J=1,1 Гц, 1H), 7,35 (d, J=8,4 Гц, 1H), 4,49 (m, 2H), 3,64 (m, 4H), 3,54 (m, 2H), 3,15 (m, 2H), 2,54 (d, J=0,9 Гц, 3H) 2,50 (s, 3H).
Таблица CZ. Следующие примеры получали при помощи такой же процедуры, что и пример CZ, стадия 3, с соответствующими аминами.
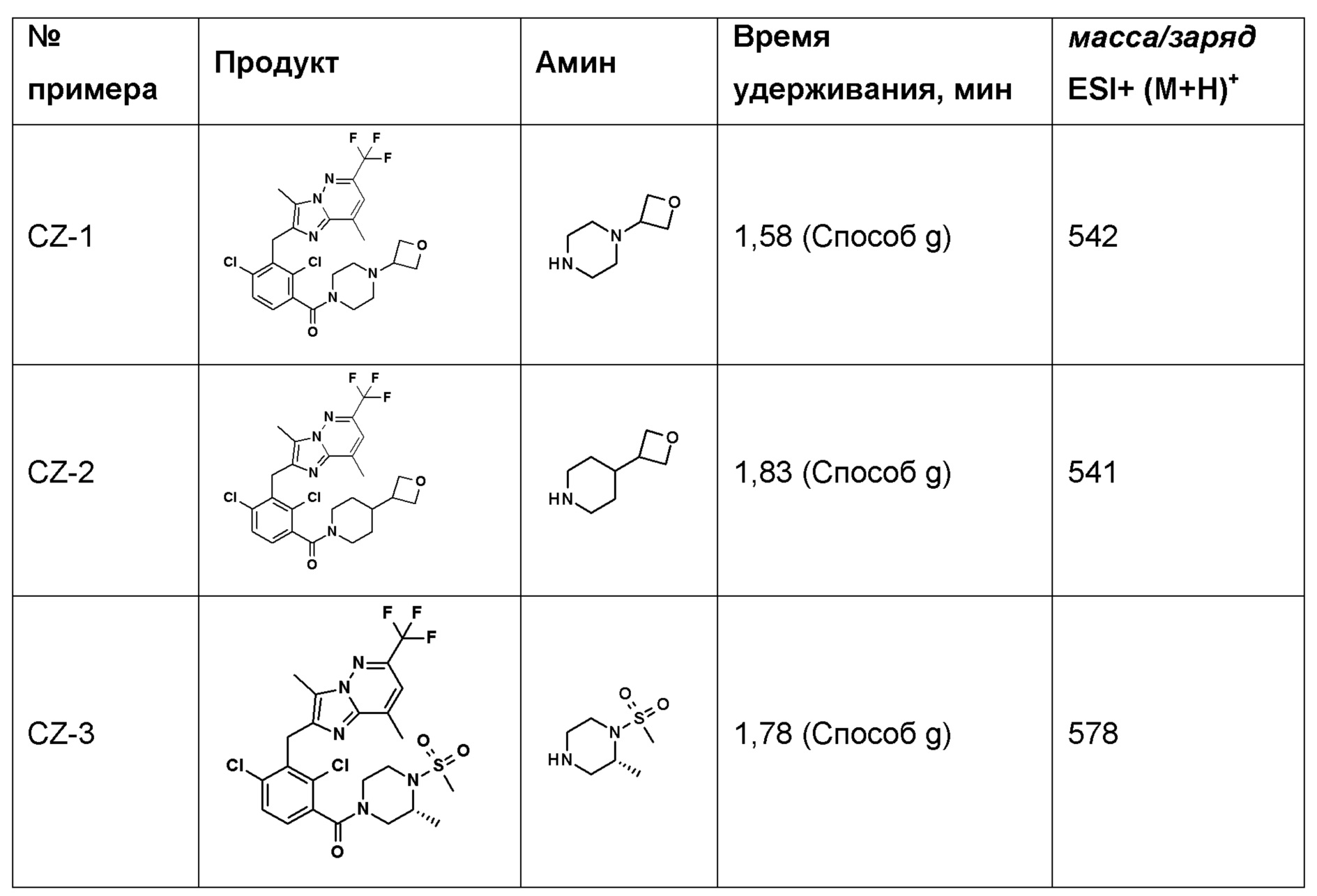
Пример CZ-1A: 2-(1-(2,4-дихлор-3-(3,8-диметил-6-(трифторметил)имидазо[1,2-b]пиридазин-2-карбонил)бензоил)пиперидин-4-ил)уксусная кислота
Стадия 1: 2,4-дихлор-3-(3,8-диметил-6-(трифторметил)имидазо[1,2-b]пиридазин-2-карбонил)бензойная кислота

Используя процедуру, аналогичную примеру AD, стадии 2, 2,4-дихлор-3-(3,8-диметил-6-(трифторметил)имидазо[1,2-b]пиридазин-2-карбонил)бензойную кислоту (347 мг, 43%) получали из 2,4-дихлор-3-((3,8-диметил-6-(трифторметил)имидазо[1,2-b]пиридазин-2-ил)метил)бензойной кислоты (420 мг, 1 ммоль) (пример CZ, стадия 2). LC/MS (Способ g): Время удерживания=1,78 мин.; MS масса/заряд: 432 [M+H]+; 1H ЯМР (DMSO-d6, 500МГц): δ 13,67 (широкий,1H), 7,92 (d, J=8,5 Гц, 1H), 7,70 (d, J=8,5 Гц, 1H), 7,68 (s, 1H), 2,87 (s, 3H), 2,56 (s, 3H).
Стадия 2: метил-2-(1-(2,4-дихлор-3-(3,8-диметил-6-(трифторметил)имидазо[1,2-b]пиридазин-2-карбонил)бензоил)пиперидин-4-ил)ацетат
Используя процедуру, аналогичную примеру A, стадии 6, метил-2-(1-(2,4-дихлор-3-(3,8-диметил-6-(трифторметил)имидазо[1,2-b]пиридазин-2-карбонил)бензоил)пиперидин-4-ил)ацетат (45 мг, 57%) получали из 2,4-дихлор-3-(3,8-диметил-6-(трифторметил)имидазо[1,2-b]пиридазин-2-карбонил)бензойной кислоты (60 мг, 0,14 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (40 мг, 0,21 ммоль). LC/MS (Способ i): Время удерживания=2,33 мин.; MS масса/заряд: 571 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,95 (s, 1H), 7,60 (m, 2H), 4,47 (m, 1H), 3,60 (m, 3H), 3,27 (m, 1H), 3,09 (m, 1H), 2,87 (s, 3H), 2,80 (m, 1H), 2,55 (m, 3H), 2,27 (m, 2H), 1,97 (m, 1H), 1,75 (m, 1H), 1,62 (m, 1H), 1,15 (m, 2H).
Стадия 3: 2-(1-(2,4-дихлор-3-(3,8-диметил-6-(трифторметил)имидазо[1,2-b]пиридазин-2-карбонил)бензоил)пиперидин-4-ил)уксусная кислота
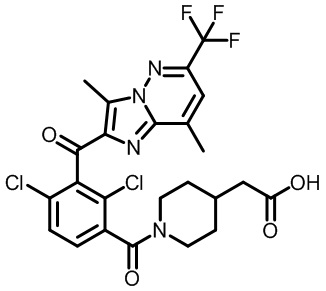
Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-(3,8-диметил-6-(трифторметил)имидазо[1,2-b]пиридазин-2-карбонил)бензоил)пиперидин-4-ил)уксусную кислоту (31 мг, 70%) получали из метил-2-(1-(2,4-дихлор-3-(3,8-диметил-6-(трифторметил)имидазо[1,2-b]пиридазин-2-карбонил)бензоил)пиперидин-4-ил)ацетата (45 мг, 0,08 ммоль). LC/MS (Способ g): Время удерживания=1,66 мин.; MS масса/заряд: 557 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ=12,11 (широкий, 1H), 7,69 (m, 2H), 7,59 и 7,52 (d, J=8,6 Гц, 1H), 4,46 (m, 1H), 3,24 (m, 1H), 3,10 (m, 1H), 2,87 (s, 3H), 2,81 (m, 1H), 2,57 (m, 3H), 2,16 (m, 2H), 1,95 (m, 1H), 1,77 (m, 1H), 1,64 (m, 1H), 1,18 (m, 2H).
Пример DA: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-3,8-диметилимидазо[1,2-b]пиридазин-6-карбонитрил

Используя процедуру, аналогичную примеру CI, стадии 4, 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-3,8-диметилимидазо[1,2-b]пиридазин-6-карбонитрил (41 мг, 79%) получали из (2,4-дихлор-3-((6-хлор-3,8-диметилимидазо[1,2-b]пиридазин-2-ил)метил)фенил)(морфолинo)метанона (пример CW, стадия 3) (50 мг, 0,11 ммоль). LC/MS (Способ g), Время удерживания=1,52мин.; MS масса/заряд: 444 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 7,58 (d, J=8,4 Гц, 1H), 7,53 (d, J=1,1 Гц, 1H), 7,35 (d, J=8,4 Гц, 1H), 4,49 (m, 2H), 3,64 (m, 4H), 3,54 (m, 2H), 3,14 (m, 2H), 2,54 m (s, 3H), 2,50 (s, 3H).
Пример DB: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-3,7-диметилимидазо[1,2-b]пиридазин-6-карбонитрил
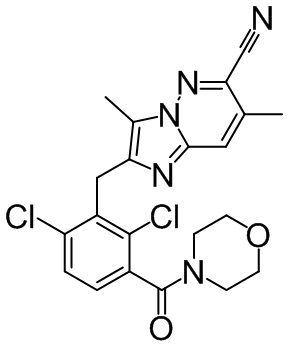
Используя процедуру, аналогичную примеру CI, стадии 4, 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-3,7-диметилимидазо[1,2-b]пиридазин-6-карбонитрил (30 мг, 13%) получали из (2,4-дихлор-3-((6-хлор-3,7-диметилимидазо[1,2-b]пиридазин-2-ил)метил)фенил)(морфолинo)метанона (пример CY, стадия 2) (100 мг, 0,22 ммоль). LC/MS (Способ g), Время удерживания=1,48 мин.; MS масса/заряд: 444 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 8,10 (d, J=1,1 Гц, 1H), 7,56 (d, J=8,4 Гц, 1H), 7,34 (d, J=8,4 Гц, 1H), 4,47 (m, 2H), 3,65 (m, 4H), 3,53 (m, 2H), 3,13 (m, 2H), 2,53 (s, 3H), 2,47 (m, 3H).
Пример DC: (2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-3H-имидазо[4,5-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон
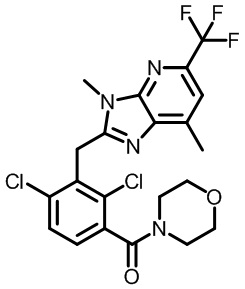
Стадия 1: метил-2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-3H-имидазо[4,5-b]пиридин-2-ил)метил)бензоат

В раствор метил-2,4-дихлор-3-((5-хлор-3,7-диметил-3H-имидазо[4,5-b]пиридин-2-ил)метил)бензоата (пример CI, стадия 1) (350 мг, 0,878 ммоль) в DMF (2,5 мл) добавляли метил-2,2-дифтор-2-(фторсульфонил)ацетат (0,333 мл, 2,63 ммоль) и йодид меди(I) (167 мг, 0,878 ммоль) и реакционную смесь перемешивали при 115°C в течение 24 часов. Реакционную смесь разбавляли с помощью EtOAc. Органический слой промывали водой, 10% водным раствором LiCl, солевым раствором и его высушивали над сульфатом магния, фильтровали, концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-5% EtOAc в циклогексане) с получением метил-2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-3H-имидазо[4,5-b]пиридин-2-ил)метил)бензоата (165 мг, 17%) в виде бледно-желтого порошка. Продукт использовали непосредственно на следующей стадии. LC/MS (Способ h), Время удерживания=2,86 мин.; MS масса/заряд: 432 [M+H]+.
Стадия 2: 2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-3H-имидазо[4,5-b]пиридин-2-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру F, стадии 4, 2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-3H-имидазо[4,5-b]пиридин-2-ил)метил)бензойную кислоту (210 мг, 94%) получали из метил-2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-3H-имидазо[4,5-b]пиридин-2-ил)метил)бензоата (230 мг, 0,53 ммоль). LC/MS (Способ h), Время удерживания=2,15 мин.; MS масса/заряд: 418 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц): δ 7,84 и 7,66 (d, J=8,4 Гц, 1H), 7,50 (m, 1H), 7,13 (m, 1H), 4,61 (s, 1H), 4,53 (s, 1H), 3,87 (m, 3H), 2,39 и 2,37 (s, 3H).
Стадия 3: (2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-3H-имидазо[4,5-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон

Используя процедуру, аналогичную примеру A, стадии 6, (2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-3H-имидазо[4,5-b]пиридин-2-ил)метил)фенил)(морфолинo)метанон (33 мг, 13%) получали из 2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-3H-имидазо[4,5-b]пиридин-2-ил)метил)бензойной кислоты (210 мг, 0,50 ммоль) и морфолина (125 мг, 0,65 ммоль). LC/MS (Способ g), Время удерживания=1,49 мин.; MS масса/заряд: 487 [M+H]+.
1H ЯМР (DMSO-d6, 500МГц): δ 7,93 (d, J=8,4 Гц, 1H), 7,49 (d, J=8,4 Гц, 1H), 7,13 (d, J=0,7 Гц, 1H), 4,55 (s, 2H), 3,86 (m, 3H), 3,53-3,73 (m, 5H), 3,47 (m, 1H), 3,20 (m, 1H), 3,10 (m, 1H), 2,37 (s, 3H).
Пример DD: (2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индазол-1-ил)метил)фенил)(морфолинo)метанон

Стадия 1: метил-2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индазол-1-ил)метил)бензоат и метил-2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-2H-индазол-2-ил)метил)бензоат

В раствор 3,7-диметил-5-(трифторметил)-1H-индазола (получение №42) (140 мг, 0,654 ммоль) в DMF (5 мл) добавляли карбонат калия (117 мг, 0,850 ммоль) и реакционную смесь перемешивали 30 минут при комнатной температуре. Добавляли метил-3-(бромметил)-2,4-дихлорбензоат (получение №1, стадия B) (214 мг, 0,719 ммоль) и реакционную смесь нагревали при 50°C в течение 2 часов. Реакционную смесь выливали в воду (100 мл) и экстрагировали с помощью EtOAc. Объединенный органический слой промывали солевым раствором и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 10-20% EtOAc в циклогексане) с получением метил-2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индазол-1-ил)метил)бензоата (82 мг, 17%) LC/MS (Способ h), Время удерживания=3,39 мин.; MS масса/заряд: 431 [M+H]+ 1H ЯМР (DMSO-d6, 500МГц): δ 7,98 (s, 1H), 7,78 (d, J=8,5 Гц, 1H), 7,67 (d, J=8,5 Гц, 1H), 7,47 (s, 1H), 6,02 (s, 2H), 3,86 (s, 3H), 2,94 (s, 3H), 2,39 (s, 3H) и метил-2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-2H-индазол-2-ил)метил)бензоата (215 мг, 49%). LC/MS (Способ h), Время удерживания=3,28 мин.; MS масса/заряд: 431 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 8,05 (s, 1H), 7,82 (d, J=8,5 Гц, 1H), 7,70 (d, J=8,5 Гц, 1H), 7,15 (s, 1H), 5,85 (s, 2H), 3,86 (s, 3H), 2,83 (s, 3H), 2,36 (s, 3H).
Стадия 2: 2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индазол-1-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индазол-1-ил)метил)бензойную кислоту (75 мг, 90%) получали из метил-2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индазол-1-ил)метил)бензоата (80 мг, 0,18 ммоль). LC/MS (Способ h), Время удерживания=2,93 мин.; MS масса/заряд: 417 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,98 (s, 1H), 7,74 (d, J=8,5 Гц, 1H), 7,62 (d, J=8,5 Гц, 1H), 7,48 (s, 1H), 6,01 (s, 2H), 2,94 (s, 3H), 2,39 (s, 3H).
Стадия 3: (2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индазол-1-ил)метил)фенил)(морфолинo)метанон

Используя процедуру, аналогичную примеру A1, (2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индазол-1-ил)метил)фенил)(морфолинo)метанон (25 мг, 30%) получали из 2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индазол-1-ил)метил)бензойной кислоты (70 мг, 0,17 ммоль) и морфолина (29 мг, 0,33 ммоль). LC/MS (Способ g), Время удерживания=1,83 мин.; MS масса/заряд: 486 [M+H]+.
1H ЯМР (DMSO-d6, 400МГц): δ 7,98 (s, 1H), 7,62 (d, J=8,4 Гц, 1H), 7,47 (s, 1H), 7,44 (d, J=8,4 Гц, 1H), 6,00 (d, J=12 Гц, 1H), 5,97 (d, J=12 Гц, 1H), 3,60 (m, 4H), 3,52 (m, 2H), 3,13 (m, 2H), 2,93 (s, 3H), 2,39 (s, 3H).
Пример DD-1: (2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индазол-1-ил)метил)фенил)(4-(оксетан-3-ил)пиперидин-1-ил)метанон
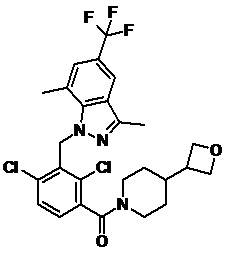
Используя процедуру, аналогичную примеру A1, (2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индазол-1-ил)метил)фенил)(4-(оксетан-3-ил)пиперидин-1-ил)метанон (128 мг, 72%) получали из 2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индазол-1-ил)метил)бензойной кислоты (133 мг, 0,32 ммоль) (пример DD, стадия 1) и 4-(оксетан-3-ил)пиперидина (58 мг, 0,41 ммоль). LC/MS (Способ g): Время удерживания=1,91 мин.; MS масса/заряд: 540 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 7,98 (s, 1H), 7,61 и 7,60 (d, J=8,3 Гц, 1H), 7,47 (s, 1H), 7,44 и 7,37 (d, J=8,3 Гц, 1H), 5,99 (m, 2H), 4,58 (m, 2H), 4,49 (m, 1H), 4,33 (m, 2H), 3,25 (m, 1H), 3,02 (m, 1H), 2,93 (s, 3H), 2,76 (m, 2H), 2,39 и 2,38 (s, 3H), 1,89 (m, 1H), 1,67 (m, 1H), 1,51 (m, 1H), 0,96 (m, 2H).
Пример DE: 2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индазол-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
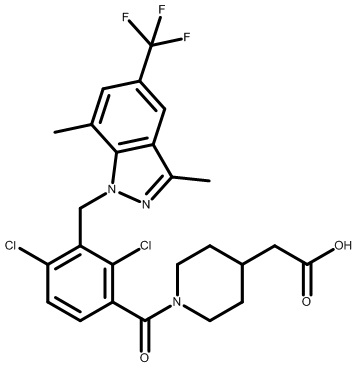
Стадия 1: метил-2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индазол-1-ил)метил)бензоил)пиперидин-4-ил)ацетат

Используя процедуру, аналогичную примеру A1, метил-2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индазол-1-ил)метил)бензоил)пиперидин-4-ил)ацетат (90 мг, 73%) получали из 2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индазол-1-ил)метил)бензойную кислоту (пример DD, стадия 2) (92 мг, 0,22 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (51 мг, 0,26 ммоль). LC/MS (Способ i), Время удерживания=2,59 мин.; MS масса/заряд: 556 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,98 (s, 1H), 7,60 и 7,59 (d, J=8,3 Гц, 1H), 7,47 (s, 1H), 7,43 и 7,36 (d, J=8,3 Гц, 1H), 5,90 (m, 2H), 4,46 (m, 1H), 3,59 и 3,57 (s, 3H), 3,22 (m, 1H), 3,02 (m, 1H), 2,93 (s, 3H), 2,79 (m, 1H), 2,39 (m, 3H), 2,27 (m, 2H), 1,97 (m, 1H), 1,74 (m, 1H), 1,57 (m, 1H), 1,15 (m, 2H).
Стадия 2: 2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индазол-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индазол-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (64 мг, 71%) получали из метил-2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индазол-1-ил)метил)бензоил)пиперидин-4-ил)ацетата (90 мг, 0,16 ммоль). LC/MS (Способ g), Время удерживания=1,77 мин.; MS масса/заряд: 542 [M+H]+ 1H ЯМР (DMSO-d6, 500МГц): δ 12,09 (широкий, 1H), 7,98 (s, 1H), 7,60 (m, 1H), 7,47 (s, 1H), 7,43 и 7,36 (d, J=8,3 Гц, 1H), 5,96 (m, 2H), 4,46 (m, 1H), 3,23 (m, 1H), 2,02 (m, 1H), 2,93 (s, 3H), 2,79 (m, 1H), 2,39 (m, 3H), 2,15 (m, 2H), 1,92 (m, 1H), 1,76 (m, 1H), 1,60 (m, 1H), 1,10 (m, 2H).
Пример DF: (2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-2H-индазол-2-ил)метил)фенил)(морфолинo)метанон
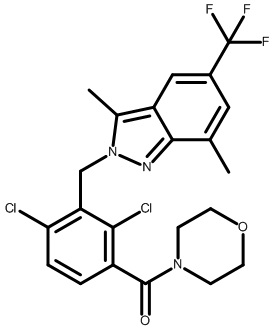
Стадия 1: 2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-2H-индазол-2-ил)метил)бензойная кислота
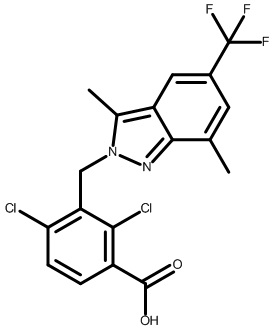
Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-2H-индазол-2-ил)метил)бензойную кислоту (160 мг, 76%) получали из метил-2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-2H-индазол-2-ил)метил)бензоата (пример DD, стадия 1) (200 мг, 0,46 ммоль). LC/MS (Способ h), Время удерживания=2,81 мин.; MS масса/заряд: 417 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц): δ 13,68 (s, 1H), 8,05 (s, 1H), 7,78 (d, J=9 Гц, 1H), 7,65 (d, J=9 Гц, 1H), 7,15 (s, 1H), 5,84 (s, 2H), 2,83 (s, 3H), 2,36 (s, 3H).
Стадия 2: (2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-2H-индазол-2-ил)метил)фенил)(морфолинo)метанон

Используя процедуру, аналогичную примеру A1, (2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-2H-индазол-2-ил)метил)фенил)(морфолинo)метанон (153 мг, 82%) получали из 2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-2H-индазол-2-ил)метил)бензойной кислоты (156 мг, 0,37 ммоль) и морфолина (65 мг, 0,75 ммоль). LC/MS (Способ g), Время удерживания=1,78 мин.; MS масса/заряд: 486 [M+H]+.
1H ЯМР (DMSO-d6, 400МГц): δ 8,05 (s, 1H), 7,64 (d, J=8,4 Гц, 1H), 7,47 (d, J=8,4 Гц, 1H), 7,15 (s, 1H), 5,81 (m, 2H), 3,60 (m, 4H), 3,53 (m, 2H), 3,14 (m, 2H), 2,83 (s, 3H), 2,34 (s, 3H).
Пример DG: 2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-2H-индазол-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Стадия 1: метил-2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-2H-индазол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат

Используя процедуру, аналогичную примеру A1, метил-2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-2H-индазол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат (192 мг, 56%) получали из 2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-2H-индазол-2-ил)метил)бензойной кислоты (пример DF, стадия 1) (237 мг, 0,56 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (132 мг, 0,68 ммоль). LC/MS (Способ i): Время удерживания=2,52 мин.; MS масса/заряд: 556 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц): δ 8,05 (s, 1H), 7,63 и 7,60 (d, J=8,3 Гц, 1H), 7,46 и 7,38 (d, J=8,3 Гц, 1H), 7,15 (s, 1H), 5,82 (m, 2H), 4,46 (m, 1H), 3,59 и 3,57 (s, 3H), 3,22 (m, 1H), 3,03 (m, 1H), 2,83 (m, 3H), 2,79 (m,1H), 2,34 (s, 3H), 2,20 (m, 2H), 1,99 (m, 1H), 1,75 (m, 1H), 1,56 (m, 1H), 1,15 (m, 2H).
Стадия 2: 2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-2H-индазол-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-2H-индазол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (170 мг, 89%) получали из метил-2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-2H-индазол-2-ил)метил)бензоил)пиперидин-4-ил)ацетата (190 мг, 0,34 ммоль). LC/MS (Способ g): Время удерживания=1,71 мин.; MS масса/заряд: 542 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 12,15 (s, 1H), 8,04 (s, 1H), 7,61 (m, 1H), 7,46 и 7,38 (d, J=8,3 Гц, 1H), 7,14 (s, 1H), 5,73-5,91 (m, 2H), 4,47 (m, 1H), 3,21 (m, 1H), 3,03 (m, 1H), 2,83 (s, 3H), 2,78 (m, 1H), 2,34 (s, 3H), 2,10 (m, 2H), 1,93 (m, 1H), 1,77 (m, 1H), 1,58 (m, 1H), 1,10 (m, 2H).
Пример DH: 1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-карбоновая кислота

Стадия 1: метил-2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)бензоат

В раствор 3,7-диметил-5-(трифторметил)-1H-индола (получение №43) (90 мг, 0,422 ммоль) в DMF (1,1 мл), охлажденный до 0°C, добавляли гидрид натрия (18,57 мг, 0,464 ммоль). Через 30 минут перемешивания добавляли метил-3-(бромметил)-2,4-дихлорбензоат (получение №1, стадия B) (126 мг, 0,422 ммоль) и перемешивание продолжали в течение 1 часа при 0°C. Реакционную смесь разбавляли водой и с помощью EtOAc. Слои разделяли и водный слой экстрагировали с помощью EtOAc. Органические слои объединяли, высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-5% EtOAc в циклогексане) с получением метил-2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)бензоата (100 мг, 53%) в виде белого порошка. LC/MS (Способ i): Время удерживания=2,86 мин.; MS масса/заряд: 430 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,88 (d, J=8,4 Гц, 1H), 7,75 (d, J=8,4 Гц, 1H), 7,68 (s, 1H), 7,23 (s, 1H), 6,55 (d, J=1,2 Гц, 1H), 5,92 (s, 2H), 3,88 (s, 3H), 2,93 (s, 3H), 2,17 (s, 3H).
Стадия 2: 2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру F, стадии 4, 2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)бензойную кислоту (90 мг, 93%) получали из метил-2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)бензоата (100 мг, 0,23 ммоль).
LC/MS (Способ i): Время удерживания=2,57 мин.; MS масса/заряд: 416 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,67 (s, 1H), 7,55 (s, 2H), 7,22 (s, 1H), 6,52 (s, 1H), 5,87 (s, 2H), 2,93 (s, 3H), 2,16 (s, 3H).
Стадия 3: метил-1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-карбоксилат
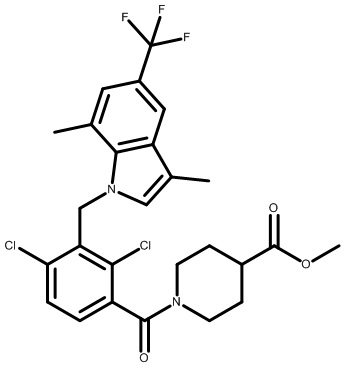
Используя процедуру, аналогичную примеру A, стадии 6, метил-1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-карбоксилат (84 мг, 72%) получали из 2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)бензойной кислоты (90 мг, 0,12 ммоль) и метилпиперидин-4-карбоксилата гидрохлорида (43 мг, 0,24 ммоль). LC/MS (Способ i): Время удерживания=2,69 мин.; MS масса/заряд: 541 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,69 (m, 2H), 7,55 и 7,48 (d, J=8,3 Гц, 1H), 7,23 (s, 1H), 6,56 (m, 1H), 5,90 (m, 2H), 4,35 (m, 1H), 3,62 и 3,60 (s, 3H), 3,31 (m, 1H), 2,94-3,15 (m, 2H), 2,92 (s, 3H), 2,67 (m, 1H), 2,18 (m, 3H), 1,90 (m, 1H), 1,77 (m, 1H), 1,50 (m, 2H).
Стадия 4: 1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-карбоновая кислота

Используя процедуру, аналогичную примеру F, стадии 4, 1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-карбоновую кислоту (67 мг, 82%) получали из метил-1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-карбоксилата (84 мг, 0,15 ммоль). LC/MS (Способ g): Время удерживания=1,87 мин.; MS масса/заряд: 527 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 12,30 (широкий, 1H), 7,70 (m, 2H), 7,55 и 7,48 (d, J=8,1 Гц, 1H), 7,22 (s, 1H), 6,57 и 6,55 (d, 1H), 5,90 (m, 2H), 4,34 (m, 1H), 3,29 (m, 1H), 3,00 (m, 2H), 2,92 (s, 3H), 2,54 (m, 1H), 2,18 (s, 3H), 1,92 (m, 1H), 1,76 (m, 1H), 1,49 (m, 2H).
Таблица DH. Следующие промежуточные соединения получали из 2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)бензойной кислоты (пример DH, стадия 2) при помощи такой же процедуры как в примере DH, стадии 3, с соответствующим амином.
|
Таблица DH1. Следующие примеры получали при помощи той же процедуры, что и в примере DH, стадии 4, с соответствующими сложными эфирами, описанными в таблице DH.
|
Пример DI: 2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
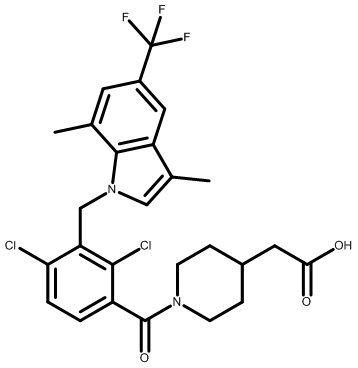
Стадия 1: метил-2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетат

Используя процедуру, аналогичную примеру A, стадии 6, метил-2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетат (120 мг, 84%) получали из 2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)бензойной кислоты (пример DH, стадия 2) (105 мг, 0,25 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (54 мг, 0,27 ммоль). LC/MS (Способ i): Время удерживания=2,73 мин.; MS масса/заряд: 555 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц): δ 7,69 (m, 2H), 7,52 и 7,45 (d, J=8,3 Гц, 1H), 7,23 (s, 1H), 6,55 (m, 1H), 5,88 (m, 2H), 4,46 (m, 1H), 3,59 и 3,57 (s, 3H), 3,25 (m, 1H), 3,04 (m, 1H), 2,92 (s, 3H), 2,80 (m, 1H), 2,27 (m, 2H), 2,17 (s, 3H), 1,95 (m, 1H), 1,75 (m, 1H), 1,58 (m, 1H), 1,10 (m, 2H).
Стадия 2: 2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
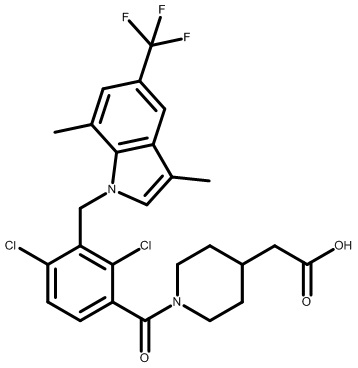
Используя процедуру, аналогичную примеру F, стадии 4, 2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (70 мг, 58%) получали из метил-2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетата (120 мг, 0,21 ммоль). LC/MS (Способ g): Время удерживания=1,89 мин.; MS масса/заряд: 541 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 12,10 (широкий, 1H), 7,71 (m, 2H), 7,52 и 7,45 (d, J=8,4 Гц, 1H), 7,22 (s, 1H), 6,55 и 6,53 (s, 1H), 5,85 (m, 2H), 4,46 (m, 1H), 3,26 (m, 1H), 3,03 (m, 1H), 2,92 (s, 3H), 2,80 (m, 1H), 2,19 (m, 5H), 1,90 (m, 1H), 1,77 (m, 1H), 1,60 (m, 1H), 1,10 (m, 2H).
Пример DJ: 2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)уксусная кислота

Стадия 1: трет-бутил-2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)бензоат
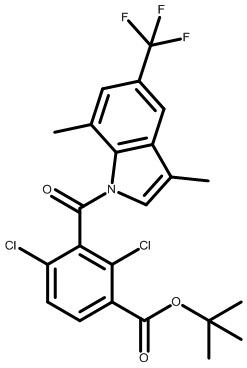
В раствор 3,7-диметил-5-(трифторметил)-1H-индола (получение №43) (170 мг, 0,797 ммоль) в DMF (5 мл), охлажденный до°C добавляли гидрид натрия (57,4 мг, 1,435 ммоль) и реакционную смесь перемешивали при 0°C в течение 20 минут. Трет-бутил-2,4-дихлор-3-(хлоркарбонил)бензоат (получение №44) (443 мг, 1,435 ммоль), разбавленный в DMF (4 мл), затем добавляли и реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь быстро охлаждали насыщенным водным раствором NH4Cl и экстрагировали с помощью EtOAc. Органический слой промывали водой и солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали досуха. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-10% EtOAc в циклогексане) с получением трет-бутил-2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)бензоата (300 мг, 76%) в виде желтой смолы. LC/MS (Способ j): Время удерживания=2,87 мин.; MS масса/заряд: 486 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,99 (d, J=8,4 Гц, 1H), 7,82 (m, 2H), 7,61 (s, 1H), 7,27 (s, 1H), 2,73 (s, 3H), 2,21 (s, 3H), 1,57 (s, 9H).
Стадия 2: 2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)бензойная кислота
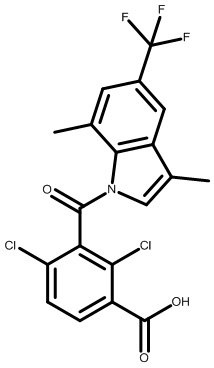
В раствор трет-бутил-2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)бензоата (300 мг, 0,617 ммоль) в DCM (5 мл) добавляли TFA (2,5 мл, 32,4 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали с помощью толуола под пониженным давлением с получением 2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)бензойной кислоты (260 мг, 96%) в виде бежевого твердого вещества.
LC/MS (Способ i): Время удерживания=2,50 мин.; MS масса/заряд: 430 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 13,87 (широкий, 1H), 8,05 (d, J=8,4 Гц, 1H), 7,81 (m, 2H), 7,61 (s, 1H), 7,25 (s, 1H), 2,74 (s, 3H), 2,21 (s, 3H).
Стадия 3: метил-2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)ацетат

Используя процедуру, аналогичную примеру A, стадии 6, метил-2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)ацетат (150 мг, 81%) получали из 2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)бензойной кислоты (105 мг, 0,25 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (64 мг, 0,33 ммоль). LC/MS (Способ i): Время удерживания=2,71 мин.; MS масса/заряд: 569 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,76-81 (m, 2H), 7,65 (m, 2H), 7,43, 7,37 и 7,17 (m, 1H), 4,47 (m, 1H), 3,60 (m, 3H), 3,23 (m, 1H), 3,07 (m, 1H), 2,85 (m, 1H), 2,72 (s, 3H), 2,30 (m, 2H), 2,23 (m, 3H), 1,92 (m, 1H), 1,77 (m, 1H), 1,62 (m, 1H), 1,06-1,27 (m, 2H).
Стадия 4: 2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)уксусная кислота
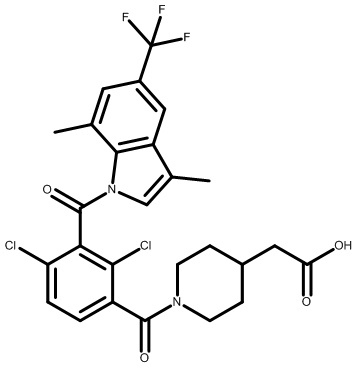
Используя процедуру, аналогичную примеру F, стадии 4, 2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)уксусную кислоту (96 мг, 65%) получали из метил-2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)ацетата (150 мг, 0,26 ммоль). LC/MS (Способ g): Время удерживания=1,89 мин.; MS масса/заряд: 555 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 12,10 (s, 1H), 7,82 (m, 2H), 7,57-7,72 (m, 2H), 7,42, 7,37 и 7,16 (m, 1H), 4,48 (m, 1H), 3,57 и 3,26 (m, 1H), 3,08 (m, 1H), 2,82 (m, 1H), 2,72 (s, 3H), 2,23 (m, 3H), 2,19 (m, 2H), 1,95 (m, 1H), 1,77 (m, 1H), 1,63 (m, 1H), 1,16 (m, 2H).
Таблица DJ. Следующие промежуточные соединения получали из (пример DJ, стадия 2) при помощи такой же процедуры, что и в примере DJ, стадии 3, с соответствующими амином.
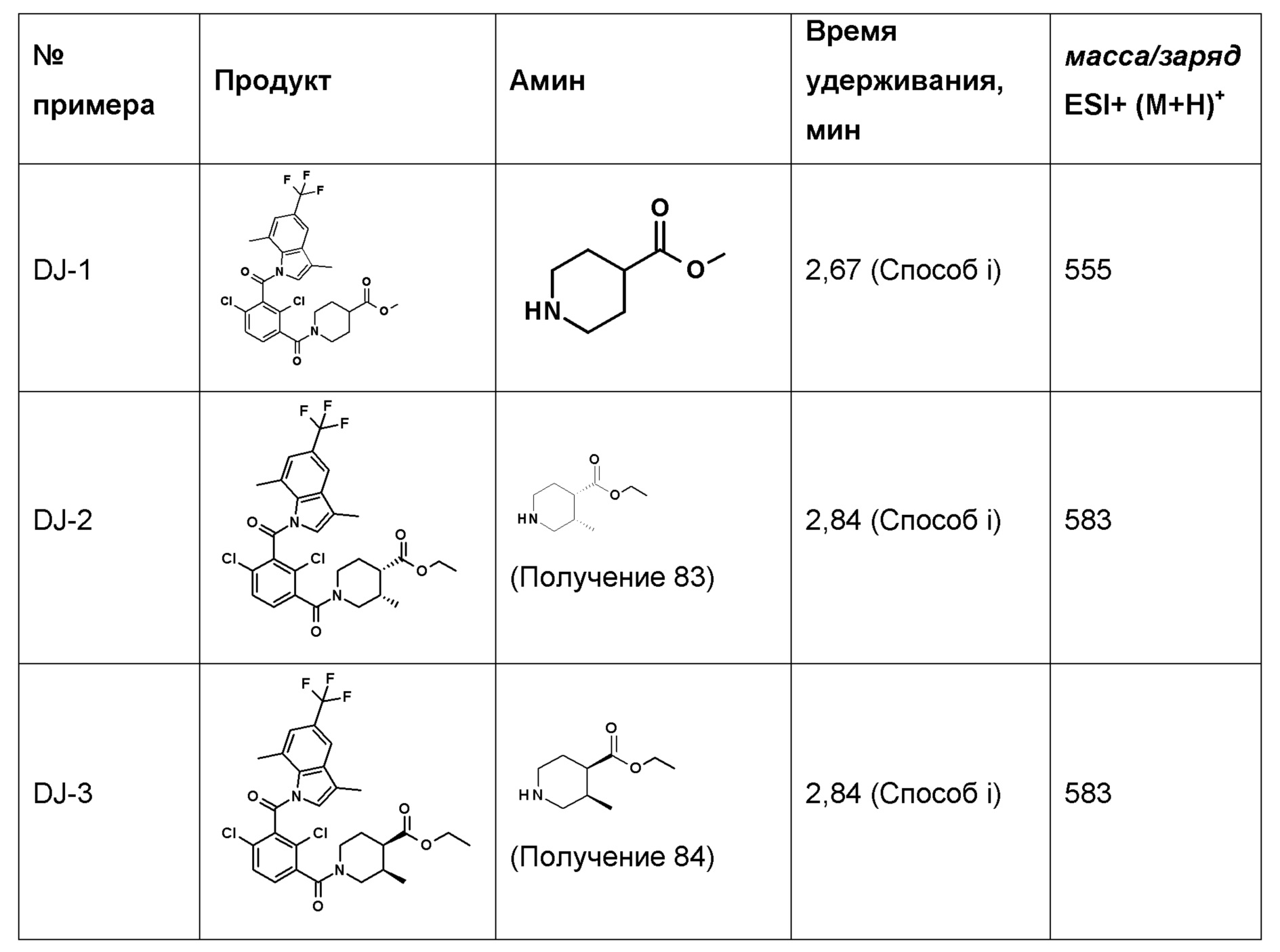
Таблица DJ1. Следующие примеры получали при помощи той же процедуры, что и в примере DJ, стадии 4, с соответствующими сложными эфирами, описанными в таблице DJ.
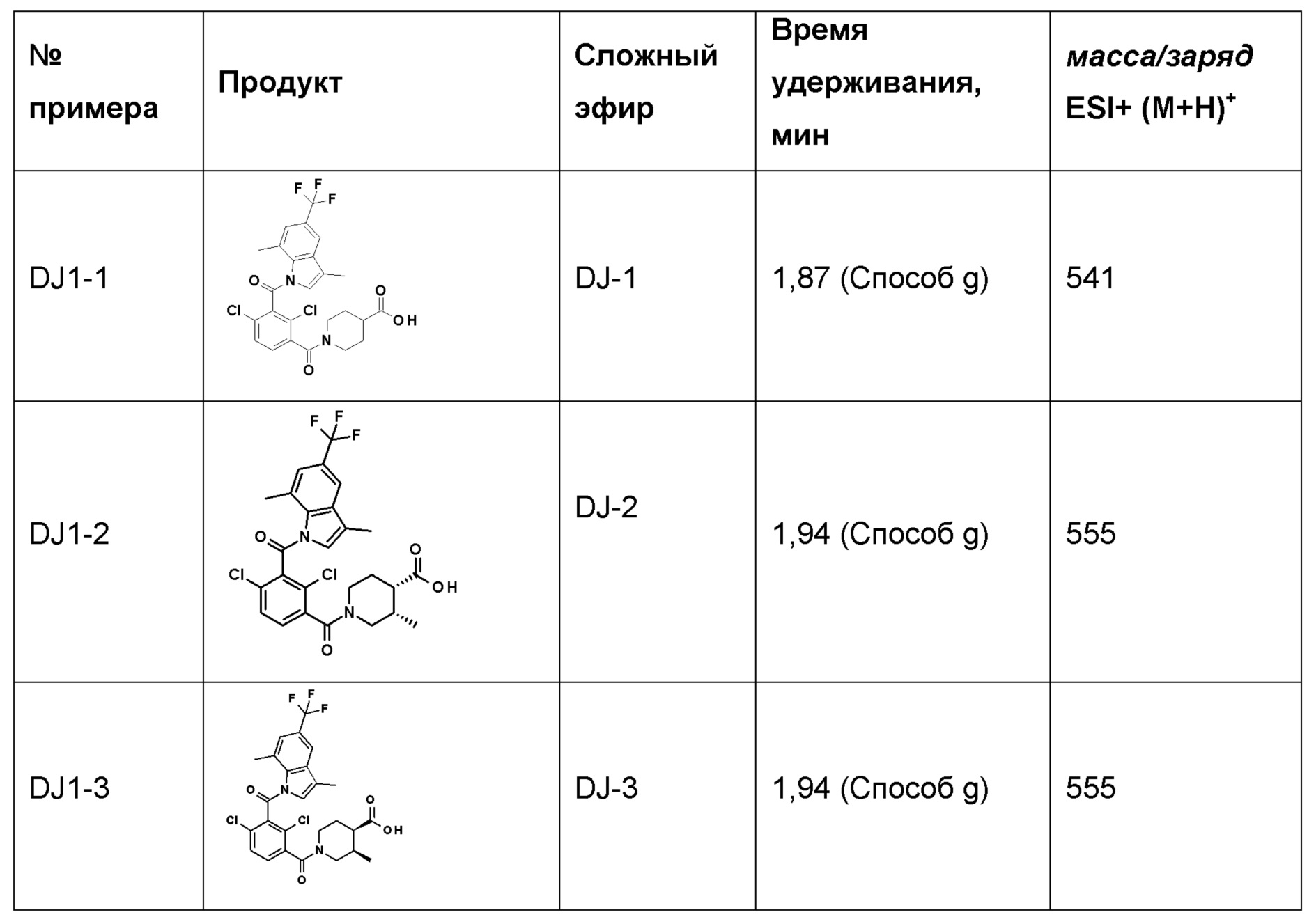
Пример DK: 1-(2,6-дихлор-3-(4-гидроксипиперидин-1-карбонил)бензил)-3,7-диметил-1H-индол-5-карбонитрил

Стадия 1: метил-2,4-дихлор-3-((5-циано-3,7-диметил-1H-индол-1-ил)метил)бензоат

Используя процедуру, аналогичную примеру DH, стадии 1, метил-2,4-дихлор-3-((5-циано-3,7-диметил-1H-индол-1-ил)метил)бензоат (262 мг, 56%) получали из 3,7-диметил-1H-индол-5-карбонитрила (получение №45) (242 мг, 0,87 ммоль) и метил-3-(бромметил)-2,4-дихлорбензоата (получение №1, стадия B) (466 мг, 1,56 ммоль). Соединение использовали непосредственно на следующей стадии.
LC/MS (Способ i): Время удерживания=2,58 мин.; MS масса/заряд: 387 [M+H]+.
Стадия 2: 2,4-дихлор-3-((5-циано-3,7-диметил-1H-индол-1-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((5-циано-3,7-диметил-1H-индол-1-ил)метил)бензойную кислоту (100 мг, 90%) получали из метил-2,4-дихлор-3-((5-циано-3,7-диметил-1H-индол-1-ил)метил)бензоата (113 мг, 0,29 ммоль). LC/MS (Способ i): Время удерживания=2,22 мин.; MS масса/заряд: 373 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 7,88 (s, 1H), 7,82 (d, J=8,4 Гц, 1H), 7,69 (d, J=8,4 Гц, 1H), 7,29 (s, 1H), 6,56 (d, J=1 Гц, 1H), 5,90 (s, 2H), 2,89 (s, 3H), 2,15 (d, J=1 Гц, 3H).
Стадия 3: 1-(2,6-дихлор-3-(4-гидроксипиперидин-1-карбонил)бензил)-3,7-диметил-1H-индол-5-карбонитрил

Используя процедуру, аналогичную примеру A, стадии 6, 1-(2,6-дихлор-3-(4-гидроксипиперидин-1-карбонил)бензил)-3,7-диметил-1H-индол-5-карбонитрил (48 мг, 65%) получали из 2,4-дихлор-3-((5-циано-3,7-диметил-1H-индол-1-ил)метил)бензойной кислоты (60 мг, 0,16 ммоль) и 4-гидроксипиперидина (19,5 мг, 0,19 ммоль). LC/MS (Способ g): Время удерживания=1,54 мин.; MS масса/заряд: 456 [M+H]+.
1H ЯМР (DMSO-d6, 400МГц): δ 7,89 (s, 1H), 7,69 и 7,68 (d, J=8,4 Гц, 1H), 7,49 и 7,48 (d, J= 8,4 Гц, 1H), 7,29 (d, J=1 Гц, 1H), 6,57 и 7,56 (d, J=1 Гц, 1H), 5,88 (m, 2H), 4,79 (m, 1H), 4,01 (m, 1H), 3,73 (m, 1H), 3,26 (m, 2H), 3,01 (m, 1H), 2,88 (m, 3H), 2,16 (s, 3H), 1,78 (m, 1H), 1,66 (m, 1H), 137 (m, 2H).
Пример DL: 2-(1-(2,4-дихлор-3-((5-циано-3,7-диметил-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Стадия 1: метил-2-(1-(2,4-дихлор-3-((5-циано-3,7-диметил-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетат

Используя процедуру, аналогичную примеру A, стадии 6, метил-2-(1-(2,4-дихлор-3-((5-циано-3,7-диметил-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетат (111 мг, 99%) получали из 2,4-дихлор-3-((5-циано-3,7-диметил-1H-индол-1-ил)метил)бензойной кислоты (пример DK, стадия 2) (80 мг, 0,21 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (49,8 мг, 0,27 ммоль). Соединение использовали непосредственно на следующей стадии. LC/MS (Способ i): Время удерживания=2,43 мин.; MS масса/заряд: 512 [M+H]+.
Стадия 2: 2-(1-(2,4-дихлор-3-((5-циано-3,7-диметил-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((5-циано-3,7-диметил-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (51 мг, 45%) получали из метил-2-(1-(2,4-дихлор-3-((5-циано-3,7-диметил-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетата (110 мг, 0,21 ммоль). LC/MS (Способ g): Время удерживания=1,62 мин.; MS масса/заряд: 498 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 12,09 (широкий, 1H), 7,88 (m, 1H), 7,69 и 7,68 (d, J=8,4 Гц, 1H), 7,52 и 7,46 (d, J=8,4 Гц, 1H), 7,29 (s, 1H), 6,58 и 6,55 (s, 1H), 5,87 (m, 2H), 4,46 (m, 1H), 3,27 (m, 1H), 3,03 (m, 1H), 2,88 (s, 3H), 2,80 (m, 1H), 2,16 (m, 5H), 1,93 (m, 1H), 1,77 (m, 1H), 1,60 (m, 1H), 1,15 (m, 2H).
Пример DM: 1-(2,6-дихлор-3-(4-гидроксипиперидин-1-карбонил)бензоил)-3,7-диметил-1H-индол-5-карбонитрил

Стадия 1: трет-бутил-2,4-дихлор-3-(5-циано-3,7-диметил-1H-индол-1-карбонил)бензоат

Используя процедуру, аналогичную примеру DJ, стадии 1, трет-бутил-2,4-дихлор-3-(5-циано-3,7-диметил-1H-индол-1-карбонил)бензоат (290 мг, 75%) получали из 3,7-диметил-1H-индол-5-карбонитрила (получение №45) (242 мг, 0,87 ммоль) и трет-бутил-2,4-дихлор-3-(хлоркарбонил)бензоата (получение №44) (483 мг, 1,56 ммоль). Продукт использовали непосредственно на следующей стадии. LC/MS (Способ i): Время удерживания=2,87 мин.; MS масса/заряд: 443 [M+H]+.
Стадия 2: 2,4-дихлор-3-(5-циано-3,7-диметил-1H-индол-1-карбонил)бензойная кислота
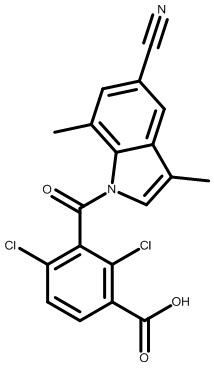
Используя процедуру, аналогичную примеру DJ, стадии 2, 2,4-дихлор-3-(5-циано-3,7-диметил-1H-индол-1-карбонил)бензойную кислоту (232 мг, 82%) получали из трет-бутил-2,4-дихлор-3-(5-циано-3,7-диметил-1H-индол-1-карбонил)бензоата (290 мг, 0,65 ммоль). LC/MS (Способ i): Время удерживания=2,17 мин.; MS масса/заряд: 387 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 13,91 (широкий, 1H), 8,05 (d, J=8,6 Гц, 1H), 8,02 (m, 1H), 7,81 (d, J=8,6 Гц, 1H), 7,71 (s, 1H), 7,27 (d, J=1,3 Гц, 1H), 2,69 (s, 3H), 2,19 (d, J=1,3 Гц, 3H).
Стадия 3: 1-(2,6-дихлор-3-(4-гидроксипиперидин-1-карбонил)бензоил)-3,7-диметил-1H-индол-5-карбонитрил

Используя процедуру, аналогичную примеру A, стадии 6, 1-(2,6-дихлор-3-(4-гидроксипиперидин-1-карбонил)бензоил)-3,7-диметил-1H-индол-5-карбонитрил (65 мг, 45%) получали из 2,4-дихлор-3-(5-циано-3,7-диметил-1H-индол-1-карбонил)бензойной кислоты (113 мг, 0,3 ммоль) и 4-гидроксипиперидина (36,4 мг, 0,36 ммоль). LC/MS (Способ g): Время удерживания=1,54 мин.; MS масса/заряд: 470 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 8,03 (s, 1H), 7,80 (m, 1H), 7,70 (m, 1H), 7,67 (m, 1H), 7,45, 7,41 и 7,19 (m, 1H), 4,80 (m, 1H), 4,02 (m, 1H), 3,75 (m, 1H), 3,50 (m, 1H), 3,27 (m, 1H), 3,12 (m, 1H), 2,67 (s, 3H), 2,20 (s, 3H), 1,80 (m, 1H), 1,70 (m, 1H), 1,35 (m, 2H).
Пример DN: 2-(1-(2,4-дихлор-3-(5-циано-3,7-диметил-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)уксусная кислота

Стадия 1: метил-2-(1-(2,4-дихлор-3-(5-циано-3,7-диметил-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)ацетат
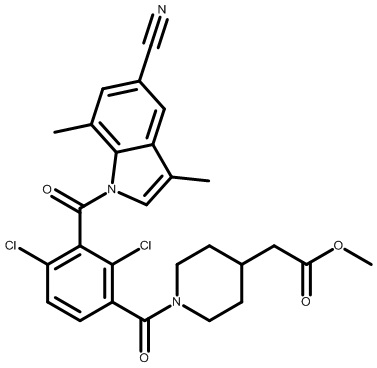
Используя процедуру, аналогичную примеру A, стадии 6, метил-2-(1-(2,4-дихлор-3-(5-циано-3,7-диметил-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)ацетат (140 мг, 72%) получали из 2,4-дихлор-3-(5-циано-3,7-диметил-1H-индол-1-карбонил)бензойной кислоты (пример DM, стадия 2) (115 мг, 0,29 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (69 мг, 0,35 ммоль). Продукт использовали непосредственно на следующей стадии. LC/MS (Способ i): Время удерживания=2,42 мин.; MS масса/заряд: 526 [M+H]+.
Стадия 2: 2-(1-(2,4-дихлор-3-(5-циано-3,7-диметил-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)уксусная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-(5-циано-3,7-диметил-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)уксусную кислоту (123 мг, 85%) получали из метил-2-(1-(2,4-дихлор-3-(5-циано-3,7-диметил-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)ацетата (138 мг, 0,26 ммоль). LC/MS (Способ i): Время удерживания=2,18 мин.; MS масса/заряд: 512 [M+H]+.
1H ЯМР (DMSO-d6, 400МГц): δ 12,10 (широкий, 1H), 8,02 (s, 1H), 7,80 (m, 1H), 7,65 (m, 2H), 7,45 и 7,39 и 7,19 (m, 1H), 4,48 (m, 1H), 3,57 (m, 1H), 3,24 (m, 1H), 3,07 (m, 1H), 2,82 (m, 1H), 2,67 (s, 3H), 2,18 (m, 4H), 1,95 (m, 1H), 1,78 (m, 1H), 1,63 (m,1H), 1,17 (m, 2H).
Пример DO: (4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-3-ил)(4-гидроксипиперидин-1-ил)метанон

Стадия 1: 4-метил-6-(трифторметил)пиридин-2(1H)-он

Раствор CHCl3 (1,25 л) охлаждали до приблизительно 0°C и добавляли 2,2,2-трифторуксусный ангидрид (0,141 л, 1012 ммоль), а затем добавляли 3-метилбут-2-еноилхлорид (0,094 л, 843 ммоль). Триэтиламин (0,259 л, 1856 ммоль) добавляли по каплям так, что внутренняя температура поддерживалась ниже приблизительно 10°C (экзотермическая). После добавления смесь перемешивали при приблизительно 0°C в течение приблизительно 1 ч., а затем медленно нагревали до к.т. и перемешивали в течение ночи. Реакционную смесь промывали водой (1 л), насыщ. NaHCO3 (1 л), водой/солевым раствором (1:1, 500 мл), высушивали над MgSO4, фильтровали и концентрировали in vacuo. Остаток растворяли в уксусной кислоте (1,250 л) и добавляли уксусную кислоту/соль аммония (130 г, 1687 ммоль). Реакционную колбу закрывали с помощью баллона и смесь нагревали при приблизительно 115°C в течение ночи. Через приблизительно 20 ч. реакционную смесь охлаждали до приблизительно 40°C и концентрировали in vacuo. Концентрированный раствор выливали в воду (~2 л) при перемешивании. Через приблизительно 1 ч. твердые вещества собирали фильтрацией с получением 4-метил-6-(трифторметил)пиридин-2(1H)-она (101 г, 68%) в виде желтовато-коричневого твердого вещества. LC/MS (Способ a), Время удерживания=1,59 минуты; MS масса/заряд: 178 [M+H]+. 1H ЯМР (CDCl3, 400 МГц): δ 6,79 (s, 1H), 6,70 (s, 1H), 2,34 (s, 3H).
Стадия 2: 2-хлор-4-метил-6-(трифторметил)пиридин

50 мл грушевидную колбу, оборудованную головкой для молекулярной перегонки, заполняли 4-метил-6-(трифторметил)пиридин-2(1H)-оном (20 г, 113 ммоль). В колбу добавляли фенилфосфониевый дихлорид (19,2 мл, 135 ммоль). Реакционную смесь нагревали до приблизительно 160°C. Через приблизительно 3 ч. давление на реакционную смесь медленно снижали до 100 мбар, и дистилляцию начинали при температуре головки приблизительно 120-130°C. Периодически, когда дистилляция значительно замедлялась, давление над реакционной смесью снижали до 80 мбар и температуру бани повышали до приблизительно 170°C. Через приблизительно 3 ч. дистилляция завершалась, обеспечивая получение 2-хлор-4-метил-6-(трифторметил)пиридина (12 г, 54%). LC/MS (Способ a), Время удерживания=2,4 минуты; MS масса/заряд: 196 [M+H]+. 1H ЯМР (DMSO-d6, 400 МГц): 7,79 (s, 1 H), 7,71 (s, 1H), 2,43 (s, 3 H).
Стадия 3: трет-бутил-(4-метил-6-(трифторметил)пиридин-2-ил)карбамат

Колбу с 2-хлор-4-метил-6-(трифторметил)пиридином (35,1 г, 180 ммоль), трет-бутилкарбаматом (42,1 г, 359 ммоль), Pd2(dba)3 (4,11 г, 4,49 ммоль), дициклогексил(2',4',6'-триизопропил-[1,1'-бифенил]-2-ил)фосфином (X-Phos) (4,28 г, 8,98 ммоль) и карбонатом цезия (205 г, 629 ммоль) вакуумировали и заполняли с помощью N2 (повторяли 3 раза) перед добавлением дегазированного 1,4-диоксана (350 мл). Смесь затем нагревали при приблизительно 80°C в течение приблизительно 2 ч. Реакционную смесь охлаждали до к.т. и реакционную смесь разделяли между водой и EtOAc. Водный слой дополнительно экстрагировали с помощью EtOAc (2×100 мл). Органический слой высушивали над Na2SO4, фильтровали и концентрировали досуха с получением темно-красного масла. Материал использовали без дополнительной очистки, обеспечивая 100% выход. LC/MS (Способ a), Время удерживания=2,71 минуты; MS масса/заряд: 275 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6) δ 10,13 (s, 1H), 7,90 (dt, J=1,3, 0,7 Гц, 1H), 7,34 (dd, J=1,3, 0,7 Гц, 1H), 2,38 (t, J=0,6 Гц, 3H), 1,45 (s, 9H).
Стадия 4: 4-метил-6-(трифторметил)пиридин-2-амин

Смесь трет-бутил-(4-метил-6-(трифторметил)пиридин-2-ил)карбамата (49,6 г, 180 ммоль) и хлороводорода (4 M в диоксане) (597 мл, 2388 ммоль) перемешивали при к.т. в течение приблизительно 2 ч. Растворитель удаляли под пониженным давлением и остаток фильтровали. Нерастворимые вещества промывали с помощью EtOAc и фильтрат разбавляли с помощью EtOAc и экстрагировали с помощью 6 н. HCl (3x). Водный слой промывали с помощью DCM (4×100 мл), а затем доводили до pH 8 медленным добавлением Na2CO3. Ярко-желтое твердое вещество собирали фильтрацией и промывали водой. Твердое вещество затем растворяли в DCM, промывали солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали практически досуха. Твердое вещество растирали с петролейным эфиром и собирали фильтрацией, промывали петролейным эфиром и высушивали воздухом с получением 4-метил-6-(трифторметил)пиридин-2-амина (27,7 г, 88%) в виде бледно-желтого твердого вещества. LC/MS (Способ a), Время удерживания=1,92 минуты; MS масса/заряд: 177 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6) δ 6,72 (s, 1 H), 6,45 (s, 1 H), 6,35 (s, 2 H), 2,20 (s, 3 H).
Стадия 5: 3,5-дибром-4-метил-6-(трифторметил)пиридин-2-амин

Смесь 4-метил-6-(трифторметил)пиридин-2-амина (31,4 г, 179 ммоль) и NBS (66,7 г, 375 ммоль) в ACN (250 мл) нагревали при приблизительно 70°C в течение приблизительно 2 ч. В реакционную колбу добавляли воду (~500 мл). Полученное твердое вещество собирали фильтрацией, промывали водой и высушивали воздухом в течение приблизительно 5 минут. Твердое вещество растворяли в DCM, промывали водой, высушивали над Na2SO4, фильтровали и концентрировали практически досуха. Твердое вещество растирали с гептаном и собирали фильтрацией, промывали гептаном и высушивали с получением 3,5-дибром-4-метил-6-(трифторметил)пиридин-2-амина (56,9 г, 96%) в виде светло-желтого твердого вещества. LC/MS (Способ a), Время удерживания=2,55 минуты; MS масса/заряд: 333 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6) δ 6,90 (s, 2H), 2,53 (s, 3H).
Стадия 6: 3-бром-4-метил-6-(трифторметил)пиридин-2-амин
В светло-оранжевый раствор 3,5-дибром-4-метил-6-(трифторметил)пиридин-2-амина (56,98 г, 171 ммоль) в THF (570 мл) при приблизительно -78°C по каплям добавляли н-бутиллитий (2,5 M в гексане) (68,3 мл, 171 ммоль) (превращался в коричневый раствор). Смесь перемешивали при приблизительно -78°C в течение приблизительно 45 минут. LCMS показывала только частичное превращение и вторую часть BuLi (2,5 M в гексане) (20,48 мл, 51,2 ммоль) добавляли по каплям. Третью часть бутиллития (2,5 M в гексане) (13,65 мл, 34,1 ммоль) добавляли по каплям для завершения превращения в продукт. Реакционную колбу переносили на баню из ледяной воды и быстро добавляли 20 мл воды. Реакционную смесь затем нагревали до комнатной температуры. Реакционную смесь разделяли между насыщенным NH4Cl и EtOAc. Органический слой промывали с помощью NaHCO3, высушивали над Na2SO4, фильтровали и концентрировали практически досуха. Твердое вещество растирали с гептаном и собирали фильтрацией, промывали гептаном с получением первой партии продукта в виде грязно-белого твердого вещества (38,9 г, 85%). Фильтрат концентрировали досуха и добавляли гептан. Твердое вещество собирали вакуумной фильтрацией и промывали гептаном и высушивали с получением второй партии продукта в виде бледно-желтого твердого вещества (1,9 г, 3%). LC/MS (Способ a), Время удерживания=2,29 минуты; MS масса/заряд: 255 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6) δ 6,96 (s, 1 H), 6,74 (s, 1 H), 2,32 (s, 3 H).
Стадия 7: (E)-2-(2-этоксивинил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан
В атмосфере азота в круглодонной колбе этоксиэтин, 50% раствор в гексанах (100 г, 710 ммоль), и DCM (996 мл) перемешивали при приблизительно 0-5°C. В перемешанный раствор добавляли 4,4,5,5-тетраметил-1,3,2-диоксаборолан(113 мл, 781 ммоль) одной порцией, а затем добавляли бис(циклопентадиенил)циркония гидрохлорид (9,16 г, 35,5 ммоль) при приблизительно 0-5°C. Обеспечивали постепенное нагревание суспензии (оранжевой) до комнатной температуры за приблизительно 30 мин. Растворение происходило за приблизительно 10 мин. Реакционную смесь перемешивали при к.т. в течение ночи (насыщенного темно-красного цвета). В реакционный раствор добавляли простой эфир (2 л) и раствор промывали насыщенным водным NH4Cl. Растворители удаляли под пониженным давлением, добавляли минимальное количество DCM (100 мл) и раствор фильтровали через подушку из оксида алюминия, покрытого целитом. Оксид алюминия промывали с помощью DCM и растворитель удаляли in vacuo с получением (E)-2-(2-этоксивинил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (114,9 г, 82%) в виде масла насыщенного темно-красного цвета. 1H ЯМР (400 МГц, DMSO-d6) δ 7,05 (d, 1 H), 4,45 (d, 1 H), 3,83 (q, 2 H), 1,30 (t, 3 H), 1,28 (s, 12 H).
Стадия 8: (E)-3-(2-этоксивинил)-4-метил-6-(трифторметил)пиридин-2-амин

Колбу с 3-бром-4-метил-6-(трифторметил)пиридин-2-амином (38,3 г, 143 ммоль), (E)-2-(2-этоксивинил)-4,4,5,5-тетраметил-1,3,2-диоксабороланом (56,5 г, 285 ммоль), диацетоксипалладием (0,960 г, 4,28 ммоль), дициклогексил(2',4',6'-триизопропил-[1,1'-бифенил]-2-ил)фосфином (XPhos) (4,28 г, 8,98 ммоль) и карбонатом цезия (116 г, 356 ммоль) дегазировали при помощи N2 в течение 15 мин. перед добавлением 320 мл дегазированного 1,4-диоксана/H2O (4:1). Смесь нагревали при приблизительно 80°C в течение приблизительно 2 ч. Смесь охлаждали до комнатной температуры. Реакционную смесь разделяли между EtOAc и водой и водный слой дополнительно экстрагировали с помощью EtOAc (2×50 мл). Органический слой высушивали над Na2SO4, фильтровали и концентрировали досуха. В остаток добавляли гептан и полученное твердое вещество собирали фильтрацией и промывали гептаном с получением грязно-белого твердого вещества (1,45 г). Фильтрат концентрировали досуха снова с получением густого черного масла, которое выдерживали при к.т. в течение ночи. Отмечали значительное образование твердого вещества и твердое вещество разбавляли гептаном, обрабатывали ультразвуком и фильтровали, промывали гептаном с получением светло-коричневого твердого вещества (15,2 г, 42%). Фильтрат концентрировали досуха с получением черного масла, которое очищали флэш-хроматографией (0-25% EtOAc/гептан за 30 мин.). Фракции, содержащие продукт, концентрировали практически досуха. Твердое вещество собирали фильтрацией, промывали небольшим количеством гептана и высушивали с получением второй партии продукта в виде светло-желтого твердого вещества (12,7 г, 35%). LC/MS (Способ l), Время удерживания=1,48 минуты; MS масса/заряд: 247 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6) δ 6,82 (s, 1H), 6,73 (d, J=13,1 Гц, 1H), 6,12 (s, 2H), 5,45 (d, J=13,1 Гц, 1H), 3,93 (q, J=7,0 Гц, 2H), 2,23 (s, 3H), 1,25 (t, J=7,0 Гц, 3H).
Стадия 9: 4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин

Смесь (E)-3-(2-этоксивинил)-4-метил-6-(трифторметил)пиридин-2-амина (27,9 г, 113 ммоль) и уксусной кислоты (130 мл) нагревали при приблизительно 100°C в течение ночи. Смесь охлаждали до к. т. и осадок собирали фильтрацией, промывали с помощью ACN и высушивали с получением первой партии продукта.
Фильтрат концентрировали до примерно 50 мл и твердое вещество собирали фильтрацией, промывали с помощью ACN и высушивали с получением второй партии продукта. Обе имели одинаковую чистоту, и их объединяли. Фильтрат все еще имел некоторое количество продукта и его отделяли. Твердое вещество суспендировали в примерно 250 мл EtOAc и нагревали до температуры образования флегмы для растворения. Большую часть растворителя удаляли под пониженным давлением и добавляли гептан. Твердое вещество собирали вакуумной фильтрацией, высушивали с получением продукта в виде грязно-белого твердого вещества (19,8 г, 87%). LC/MS (Способ l-3), Время удерживания=1,30 минуты; MS масса/заряд: 201 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6) δ 12,13-11,98 (br, 1H), 7,67 (t, J=3,1 Гц, 1H), 7,34 (d, J=1,0 Гц, 1H), 6,63 (dd, J=3,5, 1,9 Гц, 1H), 2,59 (s, 3H).
Стадия 10: 4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин
В суспензию гидрида натрия (60% в минеральном масле) (4,35 г, 109 ммоль) в DMF (40 мл) при приблизительно 0°C добавляли раствор 4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридина (19,8 г, 99 ммоль) в атмосфере N2. После добавления ледяную баню убирали и смесь перемешивали при комнатной температуре в течение приблизительно 30 мин. Ее охлаждали до приблизительно 0°C снова, по каплям добавляли бензолсульфонилхлорид (13,27 мл, 104 ммоль). После добавления обеспечивали нагревание реакционной смеси до к.т. и ее перемешивали при комнатной температуре в течение приблизительно 1 часа.
Реакционную смесь быстро охлаждали добавлением 100 мл насыщенного раствора NH4Cl с последующим добавлением 350 мл воды. Твердое вещество собирали фильтрацией, промывали водой и высушивали в вакуумной печи при приблизительно 70°C в течение приблизительно 2 дней с получением грязно-белого твердого вещества. Твердое вещество растворяли в EtOAc, фильтровали через 70 г силикагеля и подушку промывали с помощью EtOAc. Фильтрат высушивали над Na2SO4, фильтровали и концентрировали досуха. Твердое вещество растирали с EtOAc/гептаном с получением первой партии 4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридина (28,5 г, 85%) в виде белого твердого вещества.
Фильтрат концентрировали досуха и твердое вещество растирали с простым эфиром/гептаном. Полученное твердое вещество собирали фильтрацией, промывали гептаном и высушивали с получением второй партии 4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридина (3,65 г, 11%) в виде грязно-белого твердого вещества. LC/MS (Способ l-3), Время удерживания=1,84 минуты; MS масса/заряд: 341 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6) δ 8,15-8,07 (m, 3H), 7,75-7,67 (m, 1H), 7,64-7,56 (m, 3H), 7,03 (d, J=4,1 Гц, 1H), 2,57 (s, 3H).
Стадия 11: трет-бутил-4,6-дихлорникотинат
Смесь 4,6-дихлорникотиновой кислоты (8,2 г, 42,7 ммоль) и BOC2O (19,83 мл, 85 ммоль) в THF (100 мл) перемешивали при комнатной температуре, затем в раствор добавляли DMAP (1,044 г, 8,54 ммоль). Полученную смесь перемешивали при приблизительно 70°C в течение приблизительно 1 ч. Образец осаждали на силикагель и загружали в колонку из силикагеля и элюировали с помощью 5% EtOAc/гептан. Следующие фракции собирали с получением трет-бутил-4,6-дихлорникотината (10 г, 94%) в виде бесцветного масла. 1H ЯМР (400 МГц, CDCl3) δ 8,76 (s, 1 H), 7,43 (s, 1 H), 1,61 (s, 9 H).
Стадия 12: трет-бутил-4,6-дихлор-5-формилникотинат
Трет-бутил-4,6-дихлорникотинат (10 г, 40,3 ммоль) растворяли в THF (100 мл), перемешивали и охлаждали до приблизительно -78°C. В раствор добавляли LDA (22,2 мл, 44,3 ммоль) со скоростью для поддержания температуры ниже приблизительно -70°C. Полученный раствор перемешивали при приблизительно -78°C в течение приблизительно 10 мин. Затем в раствор добавляли метилформиат (4,94 мл, 81 ммоль) и смесь перемешивали при приблизительно -78°C в течение приблизительно 30 мин. Смесь выливали в насыщенный NH4Cl, экстрагировали с помощью EtOAc (3x) и объединенные органические слои высушивали с помощью Na2SO4, фильтровали и концентрировали с получением коричневого масла. Образец осаждали на силикагель и очищали хроматографией на силикагеле с элюированием с помощью 2% EtOAc/гептан. Следующие фракции собирали с получением трет-бутил-4,6-дихлор-5-формилникотината (5,0 г, выход 45%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, CDCl3) δ 10,47 (s, 1 H), 8,7 (s, 1 H), 1,65 (s, 9 H).
Стадия 13: трет-бутил-4,6-дихлор-5-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотинат
Используя процедуру, аналогичную описанной в примере CL, стадии 1, трет-бутил-4,6-дихлор-5-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотинат получали из 4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридина (6,0 г, 17,6 ммоль) и трет-бутил-4,6-дихлор-5-формилникотината (5,35 г, 19,4 ммоль). LC/MS (Способ l-3), Время удерживания=2,15 минуты; MS масса/заряд: 616 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6) δ 8,67 (s, 1 H), 7,95 (d, 2 H), 7,69 (m, 1 H), 7,61 (s, 1 H), 7,55 (m, 2 H), 7,05 (s, 1 H), 7,04 (d, 1 H), 6,92 (d, 1 H), 2,54 (s, 3 H), 1,54 (s, 9 H).
Стадия 14: трет-бутил-4,6-дихлор-5-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотинат

Используя процедуру, аналогичную примеру Z, стадии 2, трет-бутил-4,6-дихлор-5-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотинат
получали из трет-бутил-4,6-дихлор-5-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотината (1,51 г, 2,44 ммоль). LC/MS (Способ l-3), Время удерживания=2,33 минуты; MS масса/заряд: 600 [M+H]+.
Стадия 15: 4,6-дихлор-5-((4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотиновая кислота
В раствор трет-бутил-4,6-дихлор-5-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотината (334,9 мг, 0,558 ммоль) в 1,4-диоксане (7339 мкл) добавляли гидроксид натрия (2 M) (1394 мкл, 2,79 ммоль). Смесь нагревали при приблизительно 50°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры, разбавляли водой и подкисляли с помощью HCl (1 M). Смесь экстрагировали дважды с помощью EtOAc и объединенные органические экстракты высушивали над Na2SO4, фильтровали и выпаривали с получением 4,6-дихлор-5-((4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотиновой кислоты (0,23 г, 100%) в виде бледно-коричневого твердого вещества. LC/MS (Способ l-3), Время удерживания=1,02 минуты; MS масса/заряд: 404 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6) δ 12,16 (s, 1H), 8,75 (s, 1H), 7,29 (d, J=0,8 Гц, 1H), 6,09 (dd, J=2,1, 1,0 Гц, 1H), 4,48 (s, 3H).
Стадия 16: метил-4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотинат

Используя процедуру, аналогичную примеру P, стадии 4, метил-4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотинат получали из 4,6-дихлор-5-((4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотиновой кислоты (0,23 г, 0,567 ммоль) LC/MS (Способ l-3), Время удерживания=2,01 минуты; MS масса/заряд: 432 [M+H]+.
Стадия 17: 4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотиновая кислота
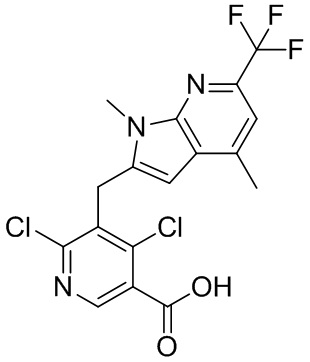
Используя процедуру, аналогичную примеру A, стадии 5, 4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотиновую кислоту получали из метил-4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотината (0,25 г, 0,578 ммоль) LC/MS (Способ l-3), Время удерживания=1,14 минуты; MS масса/заряд: 418 [M+H]+.
Стадия 18: (4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-3-ил)(4-гидроксипиперидин-1-ил)метанон

Используя процедуру, аналогичную примеру A, стадии 6, (4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-3-ил)(4-гидроксипиперидин-1-ил)метанон получали из 4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотиновой кислоты (0,116 г, 0,278 ммоль) и пиперидин-4-ола (0,042 г, 0,42 ммоль). LC/MS (Способ a), Время удерживания=2,28 минуты; MS масса/заряд: 501 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6) δ 8,31 (s, 1 H), 7,26 (s, 1 H), 7,22 (s, 1 H), 5,81 (s, 1 H), 4,46 (m, 2 H), 4,15 (m, 1 H), 4,04 (m, 1 H), 3,98 (s, 3 H), 3,65-3,45 (m, 3 H), 3,13 (m, 2 H), 2,00 (m, 1 H), 1,87 (m, 2 H), 1,70 (m, 2 H).
Пример DP: 2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Стадия 1: метил-2,4-дихлор-3-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметокси)-1H-индол-2-ил)метил)бензоат
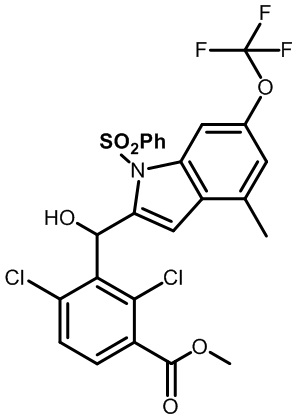
Используя процедуру, аналогичную примеру A, стадии 1, метил-2,4-дихлор-3-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметокси)-1H-индол-2-ил)метил)бензоат (814 мг, 79%) получали из N-(2-йод-3-метил-5-(трифторметокси)фенил)бензолсульфонамида (получение №47) (800 мг, 1,75 ммоль) и метил-2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)бензоата (получение №1) (544 мг, 2,1 ммоль). LC/MS (Способ i), Время удерживания=2,69 минуты; MS масса/заряд: 646 [M-H]-+ CH3COOH.
1H ЯМР (DMSO-d6, 300МГц): δ 7,89 (m, 2H), 7,74 (s, 1H), 7,69 (m, 2H), 7,58 (m, 3H), 7,12 (m, 1H), 7,03 (dd, J=5,9, 1,2 Гц, 1H), 6,74 (m, 1H), 6,67 (d, J=5,9 Гц, 1H), 3,87 (s, 3H), 2,40 (s, 3H).
Стадия 2: метил-2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-6-(трифторметокси)-1H-индол-2-ил)метил)бензоат
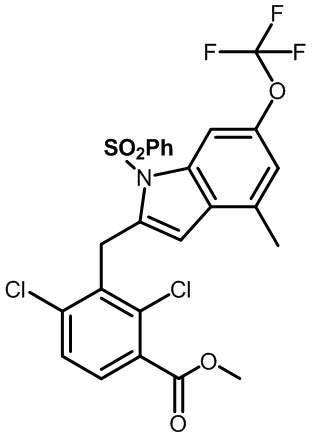
Используя процедуру, аналогичную примеру A, стадии 2, метил-2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-6-(трифторметокси)-1H-индол-2-ил)метил)бензоат (540 мг, 68%) получали из метил-2,4-дихлор-3-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметокси)-1H-индол-2-ил)метил)бензоата (811 мг, 1,38 ммоль). LC/MS (Способ j), Время удерживания=2,65 минуты; MS масса/заряд: 572 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц): δ 7,96 (m, 2H), 7,88 (s, 1H), 7,83 (m, 1H), 7,76 (d, J=7,6 Гц, 1H), 7,68 (m, 3H), 7,12 (m, 1H), 5,89 (m, 1H), 4,61 (m, 2H), 3,87 (s, 3H), 2,29 (s, 3H).
Стадия 3: метил-2,4-дихлор-3-((4-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоат
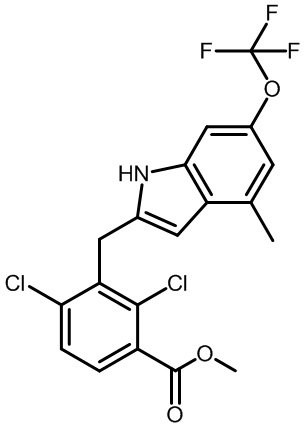
Используя процедуру, аналогичную примеру A, стадии 3, метил-2,4-дихлор-3-((4-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоат (408 мг, 100%) получали из метил-2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-6-(трифторметокси)-1H-индол-2-ил)метил)бензоата (540 мг, 0,94 ммоль). LC/MS (Способ j), Время удерживания=2,25 минуты; MS масса/заряд: 432 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц): δ 11,26 (s, 1H), 7,74 (d, J= 8,4 Гц, 1H), 7,68 (d, J= 8,4 Гц, 1H), 7,11 (s, 1H), 6,73 (s, 1H), 5,90 (s, 1H), 4,45 (s, 2H), 3,87 (s, 3H), 2,36 (s, 3H).
Стадия 4: метил-2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоат

Используя процедуру, аналогичную примеру P, стадии 4, метил-2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоат (178 мг, 42%) получали из метил-2,4-дихлор-3-((4-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоата (408 мг, 0,944 ммоль). LC/MS (Способ j), Время удерживания=2,42 минуты; MS масса/заряд: 446 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,80 (d, J=8,4 Гц, 1H), 7,71 (d, J=8,4 Гц, 1H), 7,34 (s, 1H), 6,77 (s, 1H), 5,59 (s, 1H), 4,46 (s, 2H), 3,88 (s, 3H), 3,85 (s, 3H), 2,31 (s, 3H).
Стадия 5: 2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензойную кислоту (170 мг, 97%) получали из метил-2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоата (178 мг, 0,4 ммоль). LC/MS (Способ i), Время удерживания=2,53 минуты; MS масса/заряд: 432 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 13,60 (br, 1H), 7,75 (d, J=8,4 Гц, 1H), 7,66 (d, J=8,4 Гц, 1H), 7,34 (s, 1H), 6,77 (s, 1H), 5,59 (s, 1H), 4,45 (s, 2H), 3,85 (s, 3H), 2,32 (s, 3H).
Стадия 6: метил-2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат
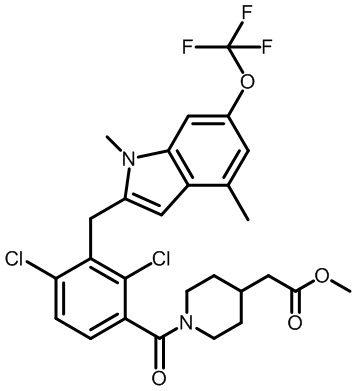
Используя процедуру, аналогичную примеру A1, метил-2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат (102 мг, 96%) получали из 2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензойной кислоты (80 мг, 0,18 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (54 мг, 0,28 ммоль). LC/MS (Способ i), Время удерживания=2,68 минуты; MS масса/заряд: 571 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,66 и 7,65 (d, J=8,4 Гц, 1H), 7,42 и 7,37 (d, J=8,4 Гц, 1H), 7,34 (m, 1H), 6,77 (m, 1H), 5,59 и 5,56 (m, 1H), 4,44 (m, 3H), 3,85 и 3,84 (s, 3H), 3,59 и 3,55 (s, 3H), 3,25 (m, 1H), 3,05 (m, 1H), 2,80 (m, 1H), 2,31 и 2,30 (s, 3H), 2,24 (m, 2H), 1,95 (m, 1H), 1,74 (m, 1H), 1,58 (m, 1H), 1,17 (m, 2H).
Стадия 7: 2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
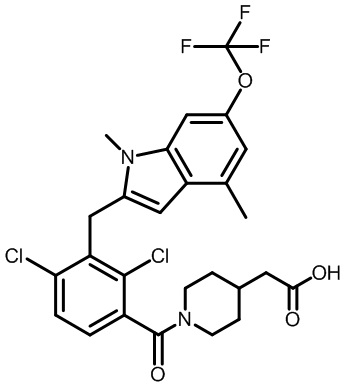
Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (90 мг, 89%) получали из метил-2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетата (102 мг, 0,18 ммоль). LC/MS (Способ g), Время удерживания=1,88 минуты; MS масса/заряд: 557 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 12,10 (m, 1H), 7,66 и 7,65 (d, J=8,3 Гц, 1H), 7,43 и 7,36 (d, J=8,3 Гц, 1H), 7,34 (s, 1H), 6,77 (m, 1H), 5,59 и 5,56 (s, 1H), 4,42 (m, 3H), 3,84 (m, 3H), 3,26 (m, 1H), 3,05 (m, 1H), 2,80 (m, 1H), 2,31 и 2,30 (s, 3H), 2,15 (m, 2H), 1,95 (m, 1H), 1,77 (m, 1H), 1,62 (m, 1H), 1,15 (m, 2H).
Пример DP-1: (2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон
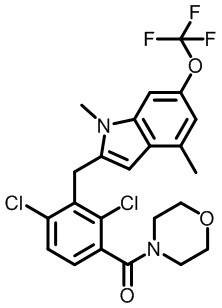
Используя процедуру, аналогичную примеру A1, (2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон (79 мг, 83%) получали из 2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензойной кислоты (80 мг, 0,18 ммоль) (пример DP, стадия 5) и морфолина (19 мг, 0,22 ммоль). LC/MS (Способ g): Время удерживания=1,96 мин.; MS масса/заряд: 501 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 7,67 (d, J=8,4 Гц, 1H), 7,44 (d, J=8,4 Гц, 1H), 7,34 (s, 1H), 6,77 (s, 1H), 5,61 (s, 1H), 4,42 (m, 2H), 3,84 (s, 3H), 3,65 (m, 4H), 3,54 (m, 2H), 3,17 (m, 2H), 2,32 (s, 3H).
Пример DP-2: (3S,4S)-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-карбоновая кислота
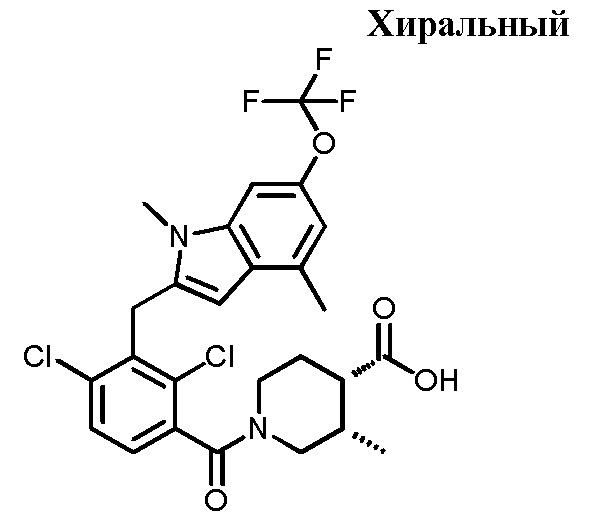
Стадия 1: (3S,4S)-этил-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-карбоксилат
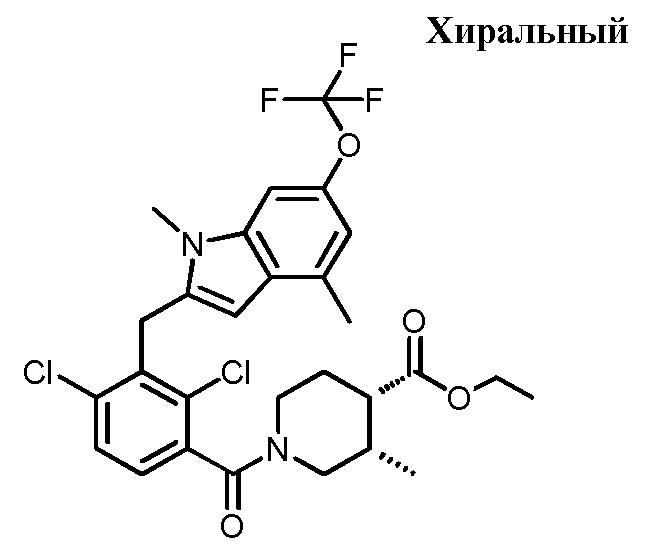
Используя процедуру, аналогичную примеру A, стадии 6, (3S,4S)-этил-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-карбоксилат (166 мг, 82%) получали из 2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензойной кислоты (80 мг, 0,18 ммоль) (пример DP, стадия 5) и (3S,4S)-этил-3-метилпиперидин-4-карбоксилата гидрохлорида (108 мг, 0,52 ммоль) (получение 83). LC/MS (Способ i): Время удерживания=2,80 мин.; MS масса/заряд: 585 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,66 (d, J=8,3 Гц, 1H), 7,42 (m, 1H), 7,34 (s, 1H), 6,77 (s, 1H), 5,59 (m, 1H), 4,41 (m, 2H), 4,08 (m, 2H), 3,85 и 3,84 (s, 3H), 3,16 (m, 3H), 2,79 (m, 1H), 2,32 (m, 3H), 2,27 (m, 1H), 2,12 (m, 1H), 1,72 (m, 2H), 1,16 (m, 3H), 0,82 (m, 3H).
Стадия 2: (3S,4S)-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-карбоновая кислота
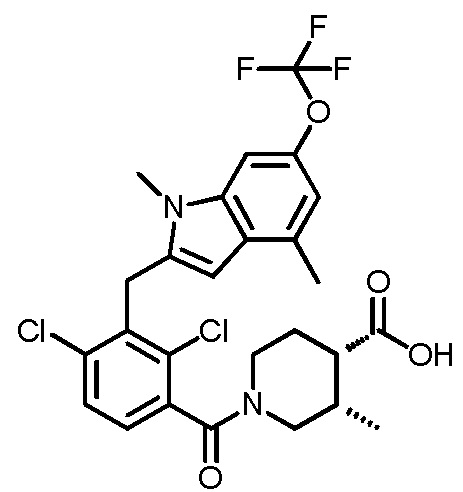
Используя процедуру, аналогичную примеру A, стадии 5, (3S,4S)-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-карбоновую кислоту (72 мг, 46%) получали из (3S,4S)-этил-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-карбоксилат (160 мг, 0,27 ммоль). LC/MS (Способ g): Время удерживания=1,90 мин.; MS масса/заряд: 557 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 12,25 (широкий, 1H), 7,65 (m, 1H), 7,41 (m, 1H), 7,34 (s, 1H), 6,77 (m, 1H), 5,58 (m, 1H), 4,30 (m, 3H), 3,85 и 3,84 (s, 3H), 3,08 (m, 3H), 2,67 (m, 1H), 2,32 (m, 3H), 2,28 и 2,11 (m, 1H), 1,65 (m, 2H), 0,84 (m, 3H).
Пример DQ: 4-хлор-2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-метил-1H-индол-6-карбонитрил

Стадия 1: трет-бутил-3-((6-бром-4-хлор-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)-2,4-дихлорбензоат
В раствор 6-бром-4-хлор-1-(фенилсульфонил)-1H-индола (получение №48) (200 мг, 0,54 ммоль) в THF (1,5 мл), охлажденный до -78°C, добавляли диизопропиламид лития (0,30 мл, 0,59 ммоль) и реакционную смесь перемешивали в течение 1 часа при -78°C. Трет-бутил-2,4-дихлор-3-формилбензоат (получение №33, стадия B) (178 мг, 0,65 ммоль) в растворе THF (1,5 мл) добавляли в реакционную смесь и реакционную смесь перемешивали в течение 2 часов при -78°C. Реакционную смесь быстро охлаждали насыщенным раствором NH4Cl и экстрагировали с помощью EtOAc. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-10% EtOAc в циклогексане) с получением трет-бутил-3-((6-бром-4-хлор-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)-2,4-дихлорбензоата (262 мг, 75%). LC/MS (Способ j), Время удерживания=2,75 минуты; MS масса/заряд: 702 [M-H]-+CH3COOH 1H ЯМР (DMSO-d6, 300МГц): δ 8,11 (m, 1H), 7,85 (m, 2H), 7,72 (m, 1H), 7,66 (d, J=6 Гц, 1H), 7,55 (m, 4H), 6,95 (m, 1H), 6,75 (m, 1H), 6,66 (m, 1H), 1,54 ppm (s, 9H).
Стадия 2: 3-((6-бром-4-хлор-1-(фенилсульфонил)-1H-индол-2-ил)метил)-2,4-дихлорбензойная кислота

Используя процедуру, аналогичную примеру A, стадии 2, 3-((6-бром-4-хлор-1-(фенилсульфонил)-1H-индол-2-ил)метил)-2,4-дихлорбензойную кислоту (1,17 г, 93%) получали из трет-бутил-3-((6-бром-4-хлор-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)-2,4-дихлорбензоата (1,42 г, 2,2 ммоль). LC/MS (Способ i), Время удерживания=2,81 минуты; MS масса/заряд: 570 [M-H]- 1H ЯМР (DMSO-d6, 300МГц): δ 8,27 (m, 1H), 8,00 (m, 2H), 7,80 (m, 2H), 7,69 (m, 4H), 5,70 (m, 1H), 4,55 (s, 2H).
Стадия 3: 3-((6-бром-4-хлор-1H-индол-2-ил)метил)-2,4-дихлорбензойная кислота

Используя процедуру, аналогичную примеру A, стадии 3, 3-((6-бром-4-хлор-1H-индол-2-ил)метил)-2,4-дихлорбензойную кислоту (657 мг, 100%) получали из 3-((6-бром-4-хлор-1-(фенилсульфонил)-1H-индол-2-ил)метил)-2,4-дихлорбензойной кислоты (870 мг, 1,52 ммоль). Соединение использовали непосредственно на следующей стадии. LC/MS (Способ i), Время удерживания=2,48 минуты; MS масса/заряд: 432 [M+H]+.
Стадия 4: метил-3-((6-бром-4-хлор-1-метил-1H-индол-2-ил)метил)-2,4-дихлорбензоат
Используя процедуру, аналогичную примеру P, стадии 4, метил-3-((6-бром-4-хлор-1-метил-1H-индол-2-ил)метил)-2,4-дихлорбензоат (568 мг, 81%) получали из 3-((6-бром-4-хлор-1H-индол-2-ил)метил)-2,4-дихлорбензойной кислоты (657 мг, 1,52 ммоль). LC/MS (Способ j), Время удерживания=2,46 минуты; MS масса/заряд: 460 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,80 (m, 2H), 7,72 (m, 1H), 7,23 (d, J=1,5 Гц, 1H), 5,52 (m, 1H), 4,46 (s, 2H), 3,89 (s, 3H), 3,88 (s, 3H).
Стадия 5: метил-2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензоат
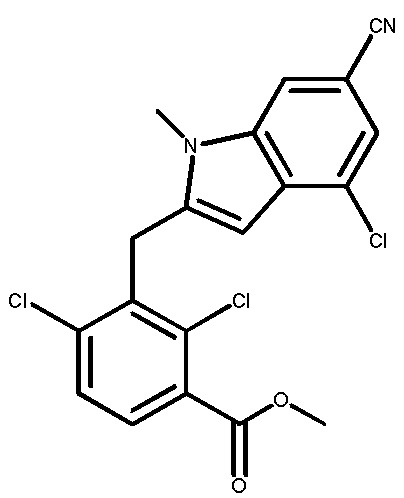
В раствор метил-3-((6-бром-4-хлор-1-метил-1H-индол-2-ил)метил)-2,4-дихлорбензоата (559 мг, 1,211 ммоль) в N,N-диметилформамиде (4,3 мл) добавляли цианид цинка (107 мг, 0,908 ммоль) и тетракис(трифенилфосфин)палладий (140 мг, 0,121 ммоль) и реакционную смесь нагревали при 120°C под микроволновым облучением в течение 1 часа. Реакционную смесь разбавляли водой и экстрагировали с помощью EtOAc. Полученный органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-40% EtOAc в циклогексане) с получением метил-2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензоата (200 мг, 40%). LC/MS (Способ i), Время удерживания=2,59 минуты; MS масса/заряд: 405 [M-H]-.
1H ЯМР (DMSO-d6, 300МГц): δ=8,18 (m, 1H), 7,83 (d, J=8,4 Гц, 1H), 7,73 (d, J=8,4 Гц, 1H), 7,50 (d, J=1,2 Гц, 1H), 5,67 (m, 1H), 4,54 (s, 2H), 3,96 (s, 3H), 3,88 (s, 3H).
Стадия 6: 2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензойная кислота
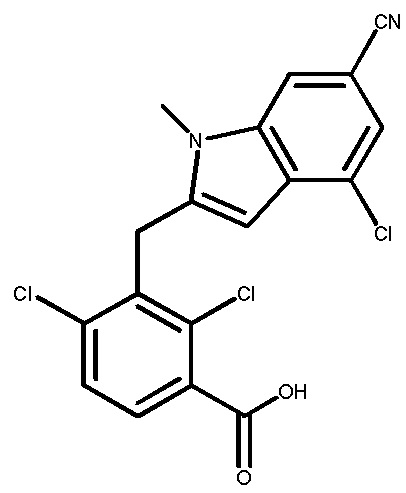
Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензойную кислоту (180 мг, 94%) получали из метил-2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензоата (198 мг, 0,48 ммоль). LC/MS (Способ i), Время удерживания=2,25 минуты; MS масса/заряд: 393 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц): δ 13,60 (br, 1H), 8,18 (m, 1H), 7,79 (d, J=8,4 Гц,, 1H), 7,69 (d, J=8,4 Гц,, 1H), 7,50 (d, J=1,2 Гц, 1H), 5,67 (m, 1H), 4,53 (s, 2H), 3,96 (s, 3H).
Стадия 7: 4-хлор-2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-метил-1H-индол-6-карбонитрил

Используя процедуру, аналогичную примеру A1, 4-хлор-2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-метил-1H-индол-6-карбонитрил (89 мг, 82%) получали из 2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензойной кислоты (90 мг, 0,23 ммоль) и морфолина (23,9 мг, 0,27 ммоль). LC/MS (Способ g), Время удерживания=1,69 минуты; MS масса/заряд: 462 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 8,17 (s, 1H), 7,69 (d, J=8,1 Гц, 1H), 7,50 (d, J=1,3 Гц, 1H), 7,47 (d, J=8,1 Гц, 1H), 5,70 (m, 1H), 4,50 (m, 2H), 3,96 (s, 3H), 3,65 (m, 4H), 3,55 (m, 2H), 3,15 (m, 2H).
Пример DP-1: (2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон
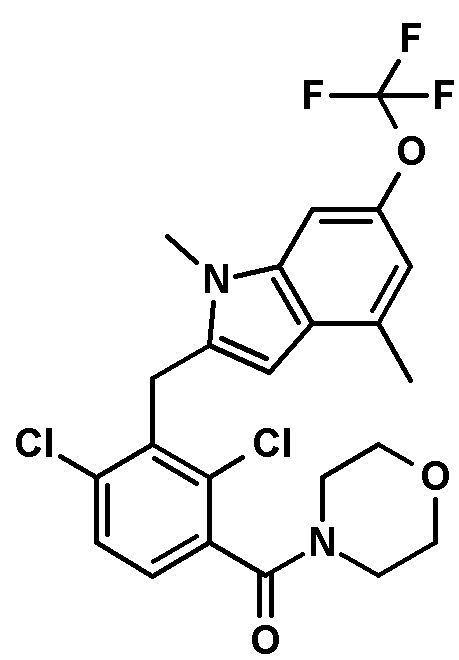
Используя процедуру, аналогичную примеру A1, (2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)фенил)(морфолинo)метанон (79 мг, 83%) получали из 2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензойной кислоты (80 мг, 0,18 ммоль) (пример DP, стадия 5) и морфолина (19 мг, 0,22 ммоль). LC/MS (Способ g): Время удерживания=1,96 мин.; MS масса/заряд: 501 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 7,67 (d, J=8,4 Гц, 1H), 7,44 (d, J=8,4 Гц, 1H), 7,34 (s, 1H), 6,77 (s, 1H), 5,61 (s, 1H), 4,42 (m, 2H), 3,84 (s, 3H), 3,65 (m, 4H), 3,54 (m, 2H), 3,17 (m, 2H), 2,32 (s, 3H).
Пример DP-2: (3S,4S)-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-карбоновая кислота
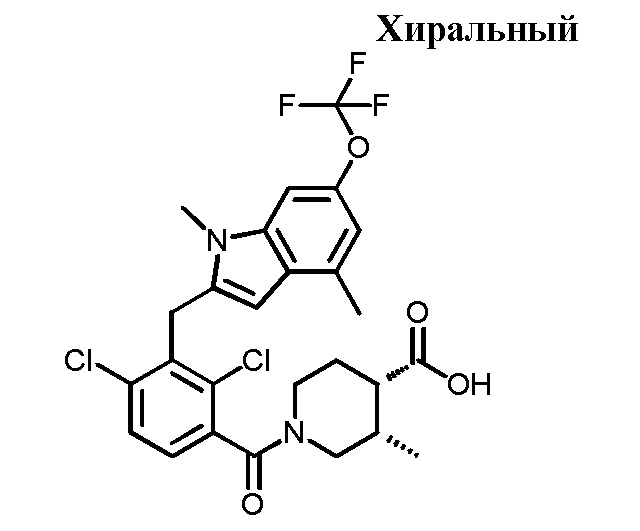
Стадия 1: (3S,4S)-этил-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-карбоксилат

Используя процедуру, аналогичную примеру A, стадии 6, (3S,4S)-этил-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-карбоксилат (166 мг, 82%) получали из 2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензойной кислоты (80 мг, 0,18 ммоль) (пример DP, стадия 5) и (3S,4S)-этил-3-метилпиперидин-4-карбоксилата гидрохлорида (108 мг, 0,52 ммоль) (получение 83). LC/MS (Способ i): Время удерживания=2,80 мин.; MS масса/заряд: 585 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,66 (d, J=8,3 Гц, 1H), 7,42 (m, 1H), 7,34 (s, 1H), 6,77 (s, 1H), 5,59 (m, 1H), 4,41 (m, 2H), 4,08 (m, 2H), 3,85 и 3,84 (s, 3H), 3,16 (m, 3H), 2,79 (m, 1H), 2,32 (m, 3H), 2,27 (m, 1H), 2,12 (m, 1H), 1,72 (m, 2H), 1,16 (m, 3H), 0,82 (m, 3H).
Стадия 2: (3S,4S)-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-карбоновая кислота
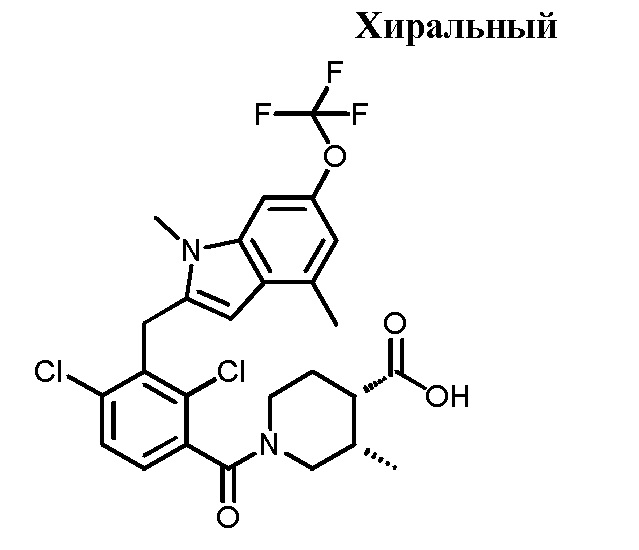
Используя процедуру, аналогичную примеру A, стадии 5, (3S,4S)-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-карбоновую кислоту (72 мг, 46%) получали из (3S,4S)-этил-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-карбоксилат (160 мг, 0,27 ммоль). LC/MS (Способ g): Время удерживания=1,90 мин.; MS масса/заряд: 557 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 12,25 (широкий, 1H), 7,65 (m, 1H), 7,41 (m, 1H), 7,34 (s, 1H), 6,77 (m, 1H), 5,58 (m, 1H), 4,30 (m, 3H), 3,85 и 3,84 (s, 3H), 3,08 (m, 3H), 2,67 (m, 1H), 2,32 (m, 3H), 2,28 и 2,11 (m, 1H), 1,65 (m, 2H), 0,84 (m, 3H).
Пример DP-3: (3R,4R)-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-карбоновая кислота
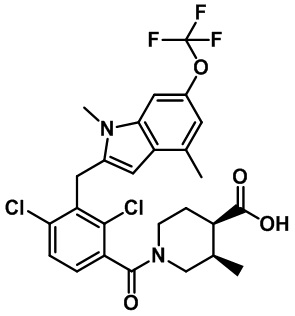
(3R,4R)-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)-3-метилпиперидин-4-карбоновую кислоту получали аналогичным способом, что и пример DP-2, используя (3R,4R)-этил-3-метилпиперидин-4-карбоксилата гидрохлорид (получение 84) на стадии 1. LC/MS (Способ g): Время удерживания=1,90 мин.; MS масса/заряд: 557 [M+H]+.
Пример DQ: 4-хлор-2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-метил-1H-индол-6-карбонитрил
Стадия 1: трет-бутил-3-((6-бром-4-хлор-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)-2,4-дихлорбензоат
В раствор 6-бром-4-хлор-1-(фенилсульфонил)-1H-индола (получение №48) (200 мг, 0,54 ммоль) в THF (1,5 мл), охлажденный до -78°C, добавляли диизопропиламид лития (0,30 мл, 0,59 ммоль) и реакционную смесь перемешивали в течение 1 часа при -78°C. Трет-бутил-2,4-дихлор-3-формилбензоат (получение №33, стадия B) (178 мг, 0,65 ммоль) в растворе THF (1,5 мл) добавляли в реакционную смесь и реакционную смесь перемешивали в течение 2 часов при -78°C. Реакционную смесь быстро охлаждали насыщенным раствором NH4Cl и экстрагировали с помощью EtOAc. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-10% EtOAc в циклогексане) с получением трет-бутил-3-((6-бром-4-хлор-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)-2,4-дихлорбензоата (262 мг, 75%). LC/MS (Способ j), Время удерживания=2,75 минуты; MS масса/заряд: 702 [M-H]-+CH3COOH; 1H ЯМР (DMSO-d6, 300МГц): δ 8,11 (m, 1H), 7,85 (m, 2H), 7,72 (m, 1H), 7,66 (d, J=6 Гц, 1H), 7,55 (m, 4H), 6,95 (m, 1H), 6,75 (m, 1H), 6,66 (m, 1H), 1,54 ppm (s, 9H).
Стадия 2: 3-((6-бром-4-хлор-1-(фенилсульфонил)-1H-индол-2-ил)метил)-2,4-дихлорбензойная кислота
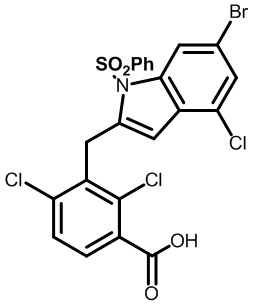
Используя процедуру, аналогичную примеру A, стадии 2, 3-((6-бром-4-хлор-1-(фенилсульфонил)-1H-индол-2-ил)метил)-2,4-дихлорбензойную кислоту (1,17 г, 93%) получали из трет-бутил-3-((6-бром-4-хлор-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)-2,4-дихлорбензоата (1,42 г, 2,2 ммоль). LC/MS (Способ i), Время удерживания=2,81 минуты; MS масса/заряд: 570 [M-H]- ; 1H ЯМР (DMSO-d6, 300МГц): δ 8,27 (m, 1H), 8,00 (m, 2H), 7,80 (m, 2H), 7,69 (m, 4H), 5,70 (m, 1H), 4,55 (s, 2H).
Стадия 3: 3-((6-бром-4-хлор-1H-индол-2-ил)метил)-2,4-дихлорбензойная кислота
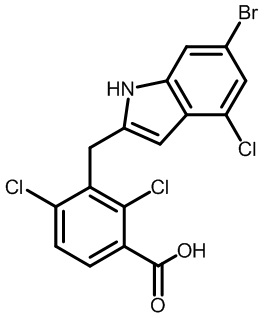
Используя процедуру, аналогичную примеру A, стадии 3, 3-((6-бром-4-хлор-1H-индол-2-ил)метил)-2,4-дихлорбензойную кислоту (657 мг, 100%) получали из 3-((6-бром-4-хлор-1-(фенилсульфонил)-1H-индол-2-ил)метил)-2,4-дихлорбензойной кислоты (870 мг, 1,52 ммоль). Соединение использовали непосредственно на следующей стадии. LC/MS (Способ i), Время удерживания=2,48 минуты; MS масса/заряд: 432 [M+H]+.
Стадия 4: метил-3-((6-бром-4-хлор-1-метил-1H-индол-2-ил)метил)-2,4-дихлорбензоат

Используя процедуру, аналогичную примеру P, стадии 4, метил-3-((6-бром-4-хлор-1-метил-1H-индол-2-ил)метил)-2,4-дихлорбензоат (568 мг, 81%) получали из 3-((6-бром-4-хлор-1H-индол-2-ил)метил)-2,4-дихлорбензойной кислоты (657 мг, 1,52 ммоль). LC/MS (Способ j), Время удерживания=2,46 минуты; MS масса/заряд: 460 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,80 (m, 2H), 7,72 (m, 1H), 7,23 (d, J=1,5 Гц, 1H), 5,52 (m, 1H), 4,46 (s, 2H), 3,89 (s, 3H), 3,88 (s, 3H).
Стадия 5: метил-2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензоат
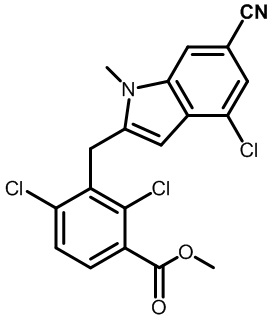
В раствор метил-3-((6-бром-4-хлор-1-метил-1H-индол-2-ил)метил)-2,4-дихлорбензоата (559 мг, 1,211 ммоль) в N,N-диметилформамиде (4,3 мл) добавляли цианид цинка (107 мг, 0,908 ммоль) и тетракис(трифенилфосфин)палладий (140 мг, 0,121 ммоль) и реакционную смесь нагревали при 120°C под микроволновым облучением в течение 1 часа. Реакционную смесь разбавляли водой и экстрагировали с помощью EtOAc. Полученный органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-40% EtOAc в циклогексане) с получением метил-2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензоата (200 мг, 40%). LC/MS (Способ i), Время удерживания=2,59 минуты; MS масса/заряд: 405 [M-H]-; 1H ЯМР (DMSO-d6, 300МГц): δ=8,18 (m, 1H), 7,83 (d, J=8,4 Гц, 1H), 7,73 (d, J=8,4 Гц, 1H), 7,50 (d, J=1,2 Гц, 1H), 5,67 (m, 1H), 4,54 (s, 2H), 3,96 (s, 3H), 3,88 (s, 3H).
Стадия 6: 2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензойную кислоту (180 мг, 94%) получали из метил-2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензоата (198 мг, 0,48 ммоль). LC/MS (Способ i), Время удерживания=2,25 минуты; MS масса/заряд: 393 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 13,60 (br, 1H), 8,18 (m, 1H), 7,79 (d, J=8,4 Гц,, 1H), 7,69 (d, J=8,4 Гц,, 1H), 7,50 (d, J=1,2 Гц, 1H), 5,67 (m, 1H), 4,53 (s, 2H), 3,96 (s, 3H).
Стадия 7: 4-хлор-2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-метил-1H-индол-6-карбонитрил
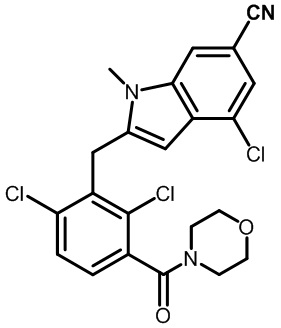
Используя процедуру, аналогичную примеру A1, 4-хлор-2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1-метил-1H-индол-6-карбонитрил (89 мг, 82%) получали из 2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензойной кислоты (90 мг, 0,23 ммоль) и морфолина (23,9 мг, 0,27 ммоль). LC/MS (Способ g), Время удерживания=1,69 минуты; MS масса/заряд: 462 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 8,17 (s, 1H), 7,69 (d, J=8,1 Гц, 1H), 7,50 (d, J=1,3 Гц, 1H), 7,47 (d, J=8,1 Гц, 1H), 5,70 (m, 1H), 4,50 (m, 2H), 3,96 (s, 3H), 3,65 (m, 4H), 3,55 (m, 2H), 3,15 (m, 2H).
Пример DR: 2-(1-(2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Стадия 1: метил-2-(1-(2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат
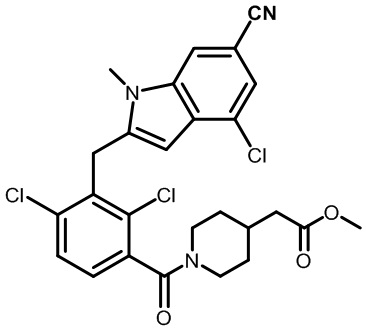
Используя процедуру, аналогичную примеру A1, метил-2-(1-(2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат (101 мг, 83%) получали из 2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензойной кислоты (пример DQ, стадия 6) (90 мг, 0,23 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (66,4 мг, 0,34 ммоль). LC/MS (Способ i), Время удерживания=2,43 минуты; MS масса/заряд: 532 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 8,17 (m, 1H), 7,68 и 7,67 (d, J=8,4 Гц, 1H), 7,51 и 7,50 (s, 1H), 7,47 и 7,40 (d, J=8,4 Гц, 1H), 5,68 и 5,65 (m, 1H), 4,47 (m, 3H), 3,96 и 3,95 (s, 3H), 3,59 и 3,56 (s, 3H), 3,25 (m, 1H), 3,05 (m, 1H), 2,80 (m, 1H), 2,25 (m, 2H), 1,95 (m, 1H), 1,75 (m, 1H), 1,59 (m, 1H), 1,17 (m, 2H).
Стадия 2: 2-(1-(2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (93 мг, 95%) получали из метил-2-(1-(2,4-дихлор-3-((4-хлор-6-циано-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетата (101 мг, 0,19 ммоль). LC/MS (Способ g), Время удерживания=1,63 минуты; MS масса/заряд: 518 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 12,09 (m, 1H), 8,17 (s, 1H), 7,68 и 7,67 (d, J=8,4 Гц, 1H), 7,50 (m, 1H), 7,46 и 7,39 (d, J=8,4 Гц, 1H), 5,68 и 5,66 (m, 1H), 4,49 (m, 3H), 3,96 и 3,95 (s, 3H), 3,27 (m, 1H), 3,05 (m, 1H), 2,80 (m, 1H), 2,15 (m, 2H), 193 (m, 1H), 1,77 (m, 1H), 1,61 (m, 1H), 1,15 (m, 2H).
Пример DS: 2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
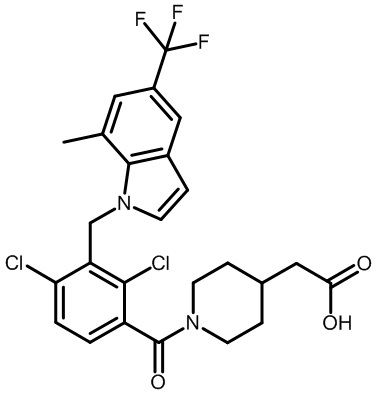
Стадия 1: метил-2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-1-ил)метил)бензоат
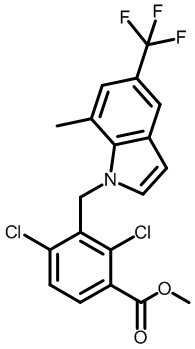
Используя процедуру, аналогичную примеру DH, стадии 1, метил-2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-1-ил)метил)бензоат (1,55 г, 80%) получали из 7-метил-5-(трифторметил)-1H-индола (получение №49) (0,85 мг, 4,27 ммоль) и метил-3-(бромметил)-2,4-дихлорбензоата (получение №1, стадия B) (1,27 г, 0,27 ммоль). LC/MS (Способ j), Время удерживания=2,32 минуты; MS масса/заряд: 416 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,89 (d, J=8,4 Гц, 1H), 7,79 (m, 1H), 7,76 (d, J=8,4 Гц, 1H), 7,23 (m, 1H), 6,74 (d, J=3,3 Гц, 1H), 6,56 (d, J=3,3 Гц, 1H), 5,98 (s, 2H), 3,88 (s, 3H), 2,94 (s, 3H).
Стадия 2: 2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-1-ил)метил)бензойная кислота
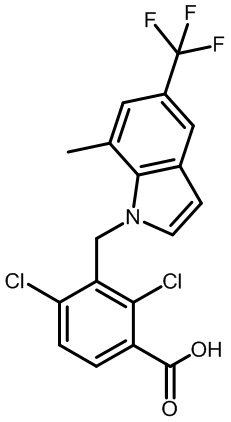
Используя процедуру, аналогичную примеру F, стадии 3, 2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-1-ил)метил)бензойную кислоту (1,44 г, 96%) получали из метил-2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-1-ил)метил)бензоата (1,55 г, 3,72 ммоль). LC/MS (Способ j), Время удерживания=1,86 минуты; MS масса/заряд: 402 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 13,8 (br, 1H), 7,82 (d, J=8,3 Гц, 1H), 7,79 (s, 1H), 7,69 (d, J=8,3 Гц, 1H), 7,23 (s, 1H), 6,73 (d, J=3,3 Гц, 1H), 6,56 (d, J=3,3 Гц, 1H), 5,97 (s, 2H), 2,95 (s, 3H).
Стадия 3: метил-2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетат

Используя процедуру, аналогичную примеру A, стадии 6, метил-2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетат (118 мг, 88%) получали из 2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-1-ил)метил)бензойной кислоты (100 мг, 0,25 ммоль) и метил-2-(пиперидин-4-ил)ацетата гидрохлорида (62,6, 0,32 ммоль). LC/MS (Способ j), Время удерживания=2,10 минуты; MS масса/заряд: 541 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц): δ 7,79 (s, 1H), 7,70 и 7,69 (d, J=8,3 Гц, 1H), 7,53 и 7,46 (d, J=8,3 Гц, 1H), 7,23 (s, 1H), 6,76 (m, 1H), 6,57 (m, 1H), 5,94 (m, 2H), 4,46 (m, 1H), 3,59 и 3,57 (s, 3H), 3,21 (m, 1H), 3,03 (m, 1H), 2,94 (s, 3H), 2,80 (m, 1H), 2,28 (m, 2H), 1,96 (m, 1H), 1,75 (m, 1H), 1,59 (m, 1H), 1,17 (m, 2H).
Стадия 4: 2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (99 мг, 89%) получали из метил-2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетата (114 мг, 0,21 ммоль). LC/MS (Способ g), Время удерживания=1,85 минуты; MS масса/заряд: 527 [M+H]+ 1H ЯМР (DMSO-d6, 400МГц): δ 12,10 (br, 1H), 7,79 (s, 1H), 7,70 и 7,69 (d, J=8,3 Гц, 1H), 7,53 и 7,46 (d, J=8,3 Гц, 1H), 7,23 (s, 1H), 6,76 (m, 1H), 6,58 (m, 1H), 5,94 (m, 2H), 4,46 (m, 1H), 3,27 (m, 1H), 3,03 (m, 1H), 2,94 (s, 3H), 2,80 (m, 1H), 2,17 (m, 2H), 1,93 (m, 1H), 1,77 (m, 1H), 1,61 (m, 1H), 1,14 (m, 2H).
Пример DT: (4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-3-ил)(4-гидроксипиперидин-1-ил)метанон
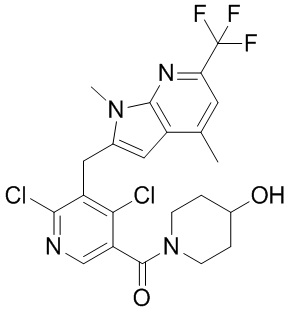
Стадия 1: 4-метил-6-(трифторметил)пиридин-2(1H)-он

Раствор CHCl3 (1,25 л) охлаждали до приблизительно 0°C и добавляли 2,2,2-трифторуксусный ангидрид (0,141 л, 1012 ммоль), а затем добавляли 3-метилбут-2-еноилхлорид (0,094 л, 843 ммоль). Триэтиламин (0,259 л, 1856 ммоль) добавляли по каплям так, что внутренняя температура поддерживалась ниже приблизительно 10°C (экзотермическая). После добавления смесь перемешивали при приблизительно 0°C в течение приблизительно 1 ч. и затем медленно нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь промывали водой (1 л), насыщенным NaHCO3 (1 л), водой/солевым раствором (1:1, 500 мл), высушивали над MgSO4, фильтровали и концентрировали in vacuo. Остаток растворяли в уксусной кислоте (1,250 л) и добавляли уксусную кислоту/соль аммония (130 г, 1687 ммоль). Реакционную колбу закрывали с помощью баллона и смесь нагревали при приблизительно 115°C в течение ночи. Через приблизительно 20 ч. реакционную смесь охлаждали до приблизительно 40°C и концентрировали in vacuo. Концентрированный раствор выливали в воду (~2 л) при перемешивании. Через приблизительно 1 ч. твердые вещества собирали фильтрацией с получением 4-метил-6-(трифторметил)пиридин-2(1H)-она (101 г, 68%) в виде желтовато-коричневого твердого вещества. LC/MS (Способ a), Время удерживания=1,59 минуты; MS масса/заряд: 178 [M+H]+. 1H ЯМР (CDCl3, 400 МГц): δ 6,79 (s, 1H), 6,70 (s, 1H), 2,34 (s, 3H).
Стадия 2: 2-хлор-4-метил-6-(трифторметил)пиридин

50 мл грушевидную колбу, оборудованную головкой для молекулярной перегонки, заполняли 4-метил-6-(трифторметил)пиридин-2(1H)-оном (20 г, 113 ммоль). В колбу добавляли фенилфосфониевый дихлорид (19,2 мл, 135 ммоль). Реакционную смесь нагревали до приблизительно 160°C. Через приблизительно 3 часа давление на реакционную смесь медленно снижали до 100 мбар, и дистилляция начиналась с температуры головки приблизительно 120-130°C. Периодически, когда дистилляция значительно замедлялась, давление над реакционной смесью снижали до 80 мбар и температуру бани повышали до приблизительно 170°C. Через приблизительно 3 часа дистилляция завершалась, обеспечивая получение 2-хлор-4-метил-6-(трифторметил)пиридина (12 г, 54%). LC/MS (Способ a), Время удерживания=2,4 минуты; MS масса/заряд: 196 [M+H]+. 1H ЯМР (DMSO-d6, 400 МГц): 7,79 (s, 1 H), 7,71 (s, 1H), 2,43 (s, 3 H).
Стадия 3: трет-бутил-(4-метил-6-(трифторметил)пиридин-2-ил)карбамат

Колбу с 2-хлор-4-метил-6-(трифторметил)пиридином (35,1 г, 180 ммоль), трет-бутилкарбаматом (42,1 г, 359 ммоль), Pd2(dba)3 (4,11 г, 4,49 ммоль), дициклогексил(2',4',6'-триизопропил-[1,1'-бифенил]-2-ил)фосфином (X-Phos) (4,28 г, 8,98 ммоль) и карбонатом цезия (205 г, 629 ммоль) вакуумировали и заполняли с помощью N2 (повторяли 3 раза) перед добавлением дегазированного 1,4-диоксана (350 мл). Смесь затем нагревали при приблизительно 80°C в течение приблизительно 2 ч. Реакционную смесь охлаждали до комнатной температуры и реакционную смесь разделяли между водой и EtOAc. Водный слой дополнительно экстрагировали с помощью EtOAc (2×100 мл). Органический слой высушивали над Na2SO4, фильтровали и концентрировали досуха с получением темно-красного масла. Материал использовали без дополнительной очистки, 100% выход. LC/MS (Способ a), Время удерживания=2,71 минуты; MS масса/заряд: 275 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6) δ 10,13 (s, 1H), 7,90 (dt, J=1,3, 0,7 Гц, 1H), 7,34 (dd, J=1,3, 0,7 Гц, 1H), 2,38 (t, J=0,6 Гц, 3H), 1,45 (s, 9H).
Стадия 4: 4-метил-6-(трифторметил)пиридин-2-амин

Смесь трет-бутил-(4-метил-6-(трифторметил)пиридин-2-ил)карбамата (49,6 г, 180 ммоль) и хлороводорода (4 M в 1,4-диоксане) (597 мл, 2388 ммоль) перемешивали при комнатной температуре в течение приблизительно 2 ч. Растворитель удаляли под пониженным давлением и остаток фильтровали. Нерастворимый материал промывали с помощью EtOAc и фильтрат разбавляли с помощью EtOAc и экстрагировали с помощью 6 н. HCl (3x). Водный слой промывали с помощью DCM (4×100 мл), а затем доводили до pH 8 медленным добавлением Na2CO3. Ярко-желтое твердое вещество собирали фильтрацией и промывали водой. Твердое вещество затем растворяли в DCM, промывали солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали практически досуха. Твердое вещество растирали с петролейным эфиром и собирали фильтрацией, промывали петролейным эфиром и высушивали воздухом с получением 4-метил-6-(трифторметил)пиридин-2-амина (27,7 г, 88%) в виде бледно-желтого твердого вещества. LC/MS (Способ a), Время удерживания=1,92 минуты; MS масса/заряд: 177 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6) δ 6,72 (s, 1 H), 6,45 (s, 1 H), 6,35 (s, 2 H), 2,20 (s, 3 H).
Стадия 5: 3,5-дибром-4-метил-6-(трифторметил)пиридин-2-амин

Смесь 4-метил-6-(трифторметил)пиридин-2-амина (31,4 г, 179 ммоль) и N-бромсукцинимида (66,7 г, 375 ммоль) в ACN (250 мл) нагревали при приблизительно 70°C в течение приблизительно 2 ч. В реакционную колбу добавляли воду (~500 мл). Полученное твердое вещество собирали фильтрацией, промывали водой и высушивали воздухом в течение приблизительно 5 минут. Твердое вещество растворяли в DCM, промывали водой, высушивали над Na2SO4, фильтровали и концентрировали практически досуха. Твердое вещество растирали с гептаном и собирали фильтрацией, промывали гептаном и высушивали с получением 3,5-дибром-4-метил-6-(трифторметил)пиридин-2-амина (56,9 г, 96%) в виде светло-желтого твердого вещества. LC/MS (Способ a), Время удерживания=2,55 минуты; MS масса/заряд: 333 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6) δ 6,90 (s, 2H), 2,53 (s, 3H).
Стадия 6: 3-бром-4-метил-6-(трифторметил)пиридин-2-амин

В светло-оранжевый раствор 3,5-дибром-4-метил-6-(трифторметил)пиридин-2-амина (56,98 г, 171 ммоль) в THF (570 мл) при приблизительно -78°C добавляли н-бутиллитий (2,5 M в гексане) (68,3 мл, 171 ммоль) по каплям (превращался в коричневый раствор). Смесь перемешивали при приблизительно -78°C в течение приблизительно 45 минут. LC/MS показывала только частичное превращение и вторую часть BuLi (2,5 M в гексане) (20,48 мл, 51,2 ммоль) добавляли по каплям. Третью часть BuLi (2,5 M в гексане) (13,65 мл, 34,1 ммоль) добавляли по каплям для завершения превращения в продукт. Реакционную колбу переносили на баню из ледяной воды и быстро добавляли 20 мл воды. Реакционную смесь затем нагревали до комнатной температуры. Реакционную смесь разделяли между насыщенным NH4Cl и EtOAc. Органический слой промывали с помощью NaHCO3, высушивали над Na2SO4, фильтровали и концентрировали практически досуха. Твердое вещество растирали с гептаном и собирали фильтрацией, промывали гептаном с получением первой партии продукта в виде грязно-белого твердого вещества (38,9 г, 85%). Фильтрат концентрировали досуха и добавляли гептан. Твердое вещество собирали вакуумной фильтрацией и промывали гептаном и высушивали с получением второй партии продукта в виде бледно-желтого твердого вещества (1,9 г, 3%). LC/MS (Способ a), Время удерживания=2,29 минуты; MS масса/заряд: 255 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6) δ 6,96 (s, 1 H), 6,74 (s, 1 H), 2,32 (s, 3 H).
Стадия 7: (E)-2-(2-этоксивинил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан

В атмосфере азота в круглодонной колбе этоксиэтин, 50% раствор в гексанах (100 г, 710 ммоль), и DCM (996 мл) перемешивали при приблизительно 0-5°C. В перемешанный раствор добавляли 4,4,5,5-тетраметил-1,3,2-диоксаборолан (113 мл, 781 ммоль) одной порцией, а затем добавляли бис(циклопентадиенил)циркония гидрохлорид (9,16 г, 35,5 ммоль) при приблизительно 0-5°C. Обеспечивали постепенное нагревание суспензии (оранжевой) до комнатной температуры за приблизительно 30 мин. Растворение происходило за приблизительно 10 мин. Реакционную смесь перемешивали при комнатной температуре в течение ночи (насыщенного темно-красного цвета). В реакционный раствор добавляли простой эфир (2 л) и раствор промывали насыщенным водным NH4Cl. Растворители удаляли под пониженным давлением, добавляли DCM (100 мл) и раствор фильтровали через подушку оксида алюминия, покрытого Celite®. Оксид алюминия промывали дихлорметаном и растворитель удаляли in vacuo с получением (E)-2-(2-этоксивинил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (114,9 г, 82%) в виде масла насыщенного темно-красного цвета. 1H ЯМР (400 МГц, DMSO-d6) δ 7,05 (d, 1 H), 4,45 (d, 1 H), 3,83 (q, 2 H), 1,30 (t, 3 H), 1,28 (s, 12 H).
Стадия 8: (E)-3-(2-этоксивинил)-4-метил-6-(трифторметил)пиридин-2-амин

Колбу с 3-бром-4-метил-6-(трифторметил)пиридин-2-амином (38,3 г, 143 ммоль), (E)-2-(2-этоксивинил)-4,4,5,5-тетраметил-1,3,2-диоксабороланом (56,5 г, 285 ммоль), диацетоксипалладием (0,960 г, 4,28 ммоль), дициклогексил(2',4',6'-триизопропил-[1,1'-бифенил]-2-ил)фосфином (XPhos) (4,28 г, 8,98 ммоль) и карбонатом цезия (116 г, 356 ммоль) дегазировали при помощи N2 в течение 15 мин. перед добавлением 320 мл дегазированного 1,4-диоксана/H2O (4:1). Смесь нагревали при приблизительно 80°C в течение приблизительно 2 часов. Смесь охлаждали до комнатной температуры. Реакционную смесь разделяли между EtOAc и водой и водный слой дополнительно экстрагировали с помощью EtOAc (2×50 мл). Органический слой высушивали над Na2SO4, фильтровали и концентрировали досуха. В остаток добавляли гептан и полученное твердое вещество собирали фильтрацией и промывали гептаном с получением грязно-белого твердого вещества (1,45 г). Фильтрат концентрировали досуха снова с получением густого черного масла, которое выдерживали при комнатной температуре в течение ночи. Отмечали значительное образование твердого вещества и твердое вещество разбавляли гептаном, обрабатывали ультразвуком и фильтровали, промывали гептаном с получением светло-коричневого твердого вещества (15,2 г, 42%). Фильтрат концентрировали досуха с получением черного масла, которое очищали флэш-хроматографией (0-25% EtOAc/гептан за 30 мин.). Фракции, содержащие продукт, концентрировали практически досуха. Твердое вещество собирали фильтрацией, промывали небольшим количеством гептана и высушивали с получением второй партии продукта в виде светло-желтого твердого вещества (12,7 г, 35%). LC/MS (Способ l), Время удерживания=1,48 минуты; MS масса/заряд: 247 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6) δ 6,82 (s, 1H), 6,73 (d, J=13,1 Гц, 1H), 6,12 (s, 2H), 5,45 (d, J=13,1 Гц, 1H), 3,93 (q, J=7,0 Гц, 2H), 2,23 (s, 3H), 1,25 (t, J=7,0 Гц, 3H).
Стадия 9: 4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин

Смесь (E)-3-(2-этоксивинил)-4-метил-6-(трифторметил)пиридин-2-амина (27,9 г, 113 ммоль) и уксусной кислоты (130 мл) нагревали при приблизительно 100°C в течение ночи. Смесь охлаждали до комнатной температуры и осадок собирали фильтрацией, промывали с помощью ACN и высушивали с получением первой партии продукта. Фильтрат концентрировали до ~ 50 мл и твердое вещество собирали фильтрацией, промывали с помощью ACN и высушивали с получением второй партии продукта. Обе партии объединяли. Фильтрат все еще имел некоторое количество продукта и его отделяли. Твердое вещество суспендировали в ~ 250 мл EtOAc и нагревали до температуры образования флегмы для растворения. Большую часть растворителя удаляли под пониженным давлением и добавляли гептан. Твердое вещество собирали вакуумной фильтрацией, высушивали с получением продукта в виде грязно-белого твердого вещества (19,8 г, 87%). LC/MS (Способ l), Время удерживания=1,30 минуты; MS масса/заряд: 201 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6) δ 12,13-11,98 (br, 1H), 7,67 (t, J=3,1 Гц, 1H), 7,34 (d, J=1,0 Гц, 1H), 6,63 (dd, J=3,5, 1,9 Гц, 1H), 2,59 (s, 3H).
Стадия 10: 4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин

В суспензию гидрида натрия (60% в минеральном масле) (4,35 г, 109 ммоль) в N,N-диметилформамиде (40 мл) при приблизительно 0°C добавляли раствор 4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридина (19,8 г, 99 ммоль) в атмосфере N2. После добавления ледяную баню убирали и смесь перемешивали при комнатной температуре в течение приблизительно 30 минут. Ее охлаждали до приблизительно 0°C снова, по каплям добавляли бензолсульфонилхлорид (13,27 мл, 104 ммоль). После добавления обеспечивали нагревание реакционной смеси до комнатной температуры и ее перемешивали в течение приблизительно 1 ч. Реакционную смесь быстро охлаждали добавлением 100 мл насыщенного раствора NH4Cl с последующим добавлением 350 мл воды. Твердое вещество собирали фильтрацией, промывали водой и высушивали в вакуумной печи при приблизительно 70°C в течение приблизительно 2 дней с получением грязно-белого твердого вещества. Твердое вещество растворяли в EtOAc, фильтровали через 70 г силикагеля и подушку промывали с помощью EtOAc. Фильтрат высушивали над Na2SO4, фильтровали и концентрировали досуха. Твердое вещество растирали с EtOAc/гептаном с получением первой партии 4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридина (28,5 г, 85%) в виде белого твердого вещества. Фильтрат концентрировали досуха и твердое вещество растирали с простым эфиром/гептаном. Полученное твердое вещество собирали фильтрацией, промывали гептаном и высушивали с получением второй партии 4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридина (3,65 г, 11%) в виде грязно-белого твердого вещества. LC/MS (Способ l), Время удерживания=1,84 минуты; MS масса/заряд: 341 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6) δ 8,15-8,07 (m, 3H), 7,75-7,67 (m, 1H), 7,64-7,56 (m, 3H), 7,03 (d, J=4,1 Гц, 1H), 2,57 (s, 3H).
Стадия 11: трет-бутил-4,6-дихлорникотинат

Смесь 4,6-дихлорникотиновой кислоты (8,2 г, 42,7 ммоль) и ди-трет-бутилдикарбоната (19,83 мл, 85 ммоль) в THF (100 мл) перемешивали при комнатной температуре, затем в раствор добавляли 4-(N,N-диметиламино)пиридин (1,044 г, 8,54 ммоль). Полученную смесь перемешивали при приблизительно 70°C в течение приблизительно 1 ч. Образец осаждали на силикагель и загружали в колонку из силикагеля и элюировали с помощью 5% EtOAc/гептан. Следующие фракции собирали с получением трет-бутил-4,6-дихлорникотината (10 г, 94%) в виде бесцветного масла. 1H ЯМР (400 МГц, CDCl3) δ 8,76 (s, 1 H), 7,43 (s, 1 H), 1,61 (s, 9 H).
Стадия 12: трет-бутил-4,6-дихлор-5-формилникотинат

Трет-бутил-4,6-дихлорникотинат (10 г, 40,3 ммоль) растворяли в THF (100 мл), перемешивали и охлаждали до приблизительно -78°C. В раствор добавляли диизопропиламид лития (22,2 мл, 44,3 ммоль) со скоростью для поддержания температуры ниже приблизительно -70°C. Полученный раствор перемешивали при приблизительно -78°C в течение приблизительно 10 минут. Затем в раствор добавляли метилформиат (4,94 мл, 81 ммоль) и смесь перемешивали при приблизительно -78°C в течение приблизительно 30 минут. Смесь выливали в насыщенный NH4Cl, экстрагировали с помощью EtOAc (3x) и объединенные органические слои высушивали с помощью Na2SO4, фильтровали и концентрировали с получением коричневого масла. Образец осаждали на силикагель и очищали хроматографией на силикагеле с элюированием с помощью 2% EtOAc/гептан. Следующие фракции собирали с получением трет-бутил-4,6-дихлор-5-формилникотината (5,0 г, выход 45%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, CDCl3) δ 10,47 (s, 1 H), 8,7 (s, 1 H), 1,65 (s, 9 H).
Стадия 13: трет-бутил-4,6-дихлор-5-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотинат

Используя процедуру, аналогичную примеру CL, стадии 1,
трет-бутил-4,6-дихлор-5-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотинат получали из 4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридина (6,0 г, 17,6 ммоль) и трет-бутил-4,6-дихлор-5-формилникотината (5,35 г, 19,4 ммоль). LC/MS (Способ l), Время удерживания=2,15 минуты; MS масса/заряд: 616 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6) δ 8,67 (s, 1 H), 7,95 (d, 2 H), 7,69 (m, 1 H), 7,61 (s, 1 H), 7,55 (m, 2 H), 7,05 (s, 1 H), 7,04 (d, 1 H), 6,92 (d, 1 H), 2,54 (s, 3 H), 1,54 (s, 9 H).
Стадия 14: трет-бутил-4,6-дихлор-5-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотинат

Используя процедуру, аналогичную примеру Z, стадии 2, трет-бутил-4,6-дихлор-5-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотинат получали из трет-бутил-4,6-дихлор-5-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотината (1,51 г, 2,44 ммоль). LC/MS (Способ l), Время удерживания=2,33 минуты; MS масса/заряд: 600 [M+H]+.
Стадия 15: 4,6-дихлор-5-((4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотиновая кислота

В раствор трет-бутил-4,6-дихлор-5-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотината (334,9 мг, 0,558 ммоль) в 1,4-диоксане (7339 мкл) добавляли гидроксид натрия (2 M) (1394 мкл, 2,79 ммоль). Смесь нагревали при приблизительно 50°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры, разбавляли водой и подкисляли с помощью HCl (1 M). Смесь экстрагировали дважды с помощью EtOAc и объединенные органические экстракты высушивали над Na2SO4, фильтровали и выпаривали с получением 4,6-дихлор-5-((4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотиновой кислоты (0,23 г, 100%) в виде бледно-коричневого твердого вещества. LC/MS (Способ l), Время удерживания=1,02 минуты; MS масса/заряд: 404 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6) δ 12,16 (s, 1H), 8,75 (s, 1H), 7,29 (d, J=0,8 Гц, 1H), 6,09 (dd, J=2,1, 1,0 Гц, 1H), 4,48 (s, 3H).
Стадия 16: метил-4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотинат

Используя процедуру, аналогичную примеру P, стадии 4, метил-4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотинат получали из 4,6-дихлор-5-((4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотиновой кислоты (0,23 г, 0,567 ммоль) LC/MS (Способ l), Время удерживания=2,01 минуты; MS масса/заряд: 432 [M+H]+.
Стадия 17: 4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотиновая кислота

Используя процедуру, аналогичную примеру A, стадии 5, 4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотиновую кислоту получали из метил-4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотината (0,25 г, 0,578 ммоль) LC/MS (Способ l), Время удерживания=1,14 минуты; MS масса/заряд: 418 [M+H]+.
Стадия 18: (4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-3-ил)(4-гидроксипиперидин-1-ил)метанон

Используя процедуру, аналогичную примеру A, стадии 6, (4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-3-ил)(4-гидроксипиперидин-1-ил)метанон получали из 4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотиновой кислоты (0,116 г, 0,278 ммоль) и пиперидин-4-ола (0,042 г, 0,42 ммоль). LC/MS (Способ a), Время удерживания=2,28 минуты; MS масса/заряд: 501 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6) δ 8,31 (s, 1 H), 7,26 (s, 1 H), 7,22 (s, 1 H), 5,81 (s, 1 H), 4,46 (m, 2 H), 4,15 (m, 1 H), 4,04 (m, 1 H), 3,98 (s, 3 H), 3,65-3,45 (m, 3 H), 3,13 (m, 2 H), 2,00 (m, 1 H), 1,87 (m, 2 H), 1,70 (m, 2 H).
Пример DU: 1-[2,4-дихлор-3-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]бензоил]пиперидин-4-карбоновая кислота

Стадия 1: трет-бутил-2,4-дихлор-3-[[4-метил-6-(трифторметокси)-1H-индол-3-ил]метил]бензоат
Раствор 4-метил-6-(трифторметокси)-1H-индола (200 мг, 0,93 ммоль) (получение 80) и трет-бутил-2,4-дихлор-3-формилбензоата (281 мг, 1,02 ммоль) (получение №33, стадия B) в DCM (3 мл) добавляли по каплям в холодный (ледяная баня) DCM (1,25 мл) раствор 2,2,2-TFA (0,11 мл, 1,39 ммоль) и триэтилсилана (0,44 мл, 2,79 ммоль) в 5 мл круглодонной колбе в атмосфере азота, поддерживая температуру на уровне ниже 5°C (желтое, затем коричневое окрашивание). Через 20 минут при 0°C реакционную смесь перемешивали 2 часов при комнатной температуре. Реакционную смесь разбавляли с помощью DCM, промывали водой, затем насыщенным водным раствором NaHCO3 и, наконец, солевым раствором. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали под вакуумом. Полученную коричневую смолу хроматографировали на силикагеле (15 г колонка, элюент циклогексан/EtOAc от 95:5 до 80/20) с получением трет-бутил-2,4-дихлорнатрия гидрида (42,1 мг, 1,054 ммоль), при этом добавляли порционно -6-(трифторметокси)-1H-индол-3-ил)метил)бензоат (266 мг, 56%) в виде бесцветной смолы. LC/MS (Способ j): Время удерживания=2,69 мин.; MS масса/заряд: 474 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 10,96 (m, 1H), 7,63 (s, 2H), 7,13 (s, 1H), 6,77 (s, 1H), 6,32 (m, 1H), 4,59 (s, 2H), 2,77 (s, 3H), 1,55 (s, 9H).
Стадия 2: трет-бутил-2,4-дихлор-3-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]бензоат

Используя процедуру, аналогичную примеру A, стадии 4, трет-бутил-2,4-дихлор-3-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]бензоат (383 мг, 74%) получали из трет-бутил-2,4-дихлор-3-((4-метил-6-(трифторметокси)-1H-индол-3-ил)метил)бензоата (476 мг, 1,0 ммоль). LC/MS (Способ j): Время удерживания=2,90 мин.; MS масса/заряд: 488 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,64 (s, 2H), 7,23 (s, 1H), 6,81 (s, 1H), 6,39 (s, 1H), 4,59 (s, 2H), 3,62 (s, 3H), 2,78 (s, 3H), 1,55 (s, 9H).
Стадия 3: 2,4-дихлор-3-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]бензойная кислота
Используя процедуру, аналогичную примеру DJ, стадии 2, 2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-3-ил)метил)бензойную кислоту в виде коричневого твердого вещества (335 мг, 99%) получали из трет-бутил-2,4-дихлор-3-((1,4-диметил-6-(трифторметокси)-1H-индол-3-ил)метил)бензоата (381 мг, 0,78 ммоль). LC/MS (Способ j): Время удерживания=2,01 мин.; MS масса/заряд: 432 [M+H]+; 1H ЯМР ((DMSO-d6, 300МГц): δ 13,58 (широкий, 1H), 7,71 (d, J=8,4 Гц, 1H), 7,64 (d, J=8,4 Гц, 1H), 7,23 (s, 1H), 6,81 (s, 1H), 6,37 (s, 1H), 4,60 (s, 2H), 3,61 (s, 3H), 2,78 (s, 3H).
Стадия 4: метил-1-[2,4-дихлор-3-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]бензоил]пиперидин-4-карбоксилат
Используя процедуру, аналогичную примеру A, стадии 6, метил-1-[2,4-дихлор-3-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]бензоил]пиперидин-4-карбоксилат (104 мг, 63%) получали из 2,4-дихлор-3-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]бензойной кислоты (125 мг) и метилпиперидин-4-карбоксилата гидрохлорида (67 мг, 0,38 ммоль). LC/MS (Способ i): Время удерживания=2,74 мин.; MS масса/заряд: 557 [M+H]+; 1H ЯМР ((DMSO-d6, 300МГц): δ 7,62 (d, J=8,3 Гц, 1H), 7,41 и 7,34 (d, J=8,3 Гц, 1H), 7,23 (s, 1H), 6,80 (s, 1H), 6,40 и 6,38 (s, 1H), 4,57 (m, 2H), 4,35 (m, 1H), 3,60 (m, 6H), 3,33 (m, 1H), 3,03 (m, 2H), 2,77 (s, 3H), 2,68 (m, 1H), 1,99 (m, 1H), 1,78 (m, 1H), 1,53 (m, 2H).
Стадия 5: 1-[2,4-дихлор-3-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]бензоил]пиперидин-4-карбоновая кислота

Используя процедуру, аналогичную примеру A, стадии 5, 1-[2,4-дихлор-3-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]бензоил]пиперидин-4-карбоновую кислоту (85 мг, 83%) получали из метил-1-[2,4-дихлор-3-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]бензоил]пиперидин-4-карбоксилата (103 мг, 0,18 ммоль). LC/MS (Способ g): Время удерживания=1,93 мин.; MS масса/заряд: 543 [M+H]+; 1H ЯМР ((DMSO-d6, 400МГц): δ=7,63 (d, J=8,4 Гц, 1H), 7,40 и 7,34 (d, J=8,4 Гц, 1H), 7,23 (s, 1H), 6,81 (s, 1H), 6,39 и 6,36 (s, 1H), 4,57 (m, 2H), 4,35 (m, 1H), 3,62 и 3,61 (s, 3H), 3,32 (m, 1H), 3,08 (m, 1H), 2,95 (m, 1H), 2,77 (s, 3H), 2,55 (m, 1H), 1,94 (m, 1H), 1,79 (m, 1H), 1,50 (m, 2H).
Таблица DU. Следующие промежуточные соединения получали из 2,4-дихлор-3-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]бензойной кислоты (пример DU, стадия 5) при помощи такой же процедуры с соответствующим амином.

Таблица DU1. Следующие примеры получали при помощи такой же процедуры, что и в примере A стадии 5, начиная с соответствующих сложных эфиров (из таблицы DU).
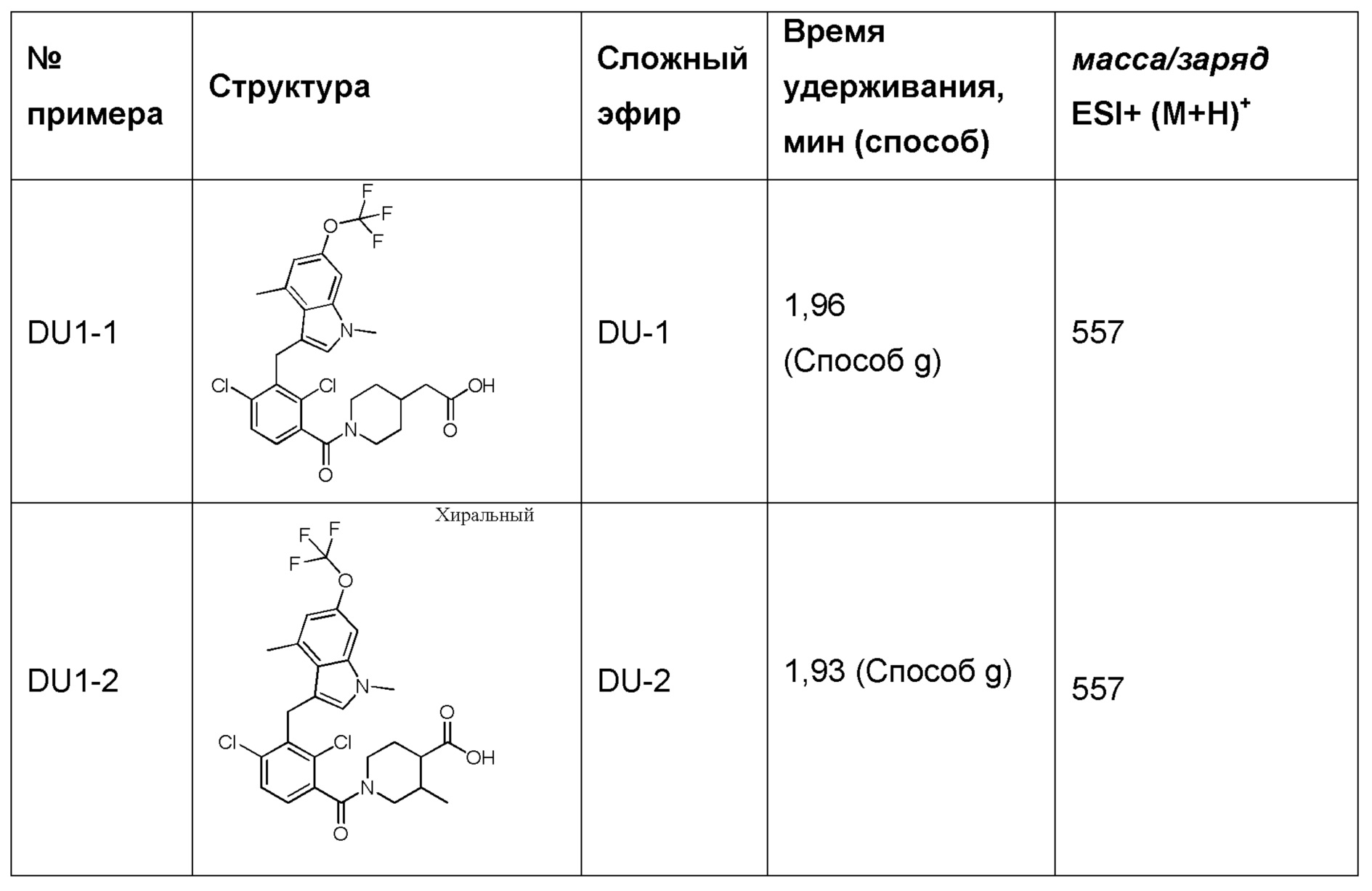
Пример DV: 2-[1-[4,6-дихлор-5-[[1,4-диметил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-3-карбонил]-4-пиперидил]уксусная кислота
Стадия 1: трет-бутил-4,6-дихлор-5-[[4-метил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-3-карбоксилат
Используя процедуру, аналогичную примеру DU, стадии 1, трет-бутил-4,6-дихлор-5-[[4-метил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-3-карбоксилат (544 мг, 79%) получали из 4-метил-6-(трифторметил)-1H-индола (250 мг, 1,255 ммоль) (получение №51, стадия C) и трет-бутил-4,6-дихлор-5-формил-пиридин-3-карбоксилата (381 мг, 1,38 ммоль) (пример DO, стадия 12). LC/MS (Способ i): Время удерживания=2,89 мин.; MS масса/заряд: 459 [M+H]+; 1H ЯМР ((DMSO-d6, 300МГц): δ=11,26 (s, 1H), 8,71 (s, 1H), 7,51 (s, 1H), 7,05 (s, 1H), 6,68 (m, 1H), 4,62 (s, 2H), 2,82 (s, 3H), 1,57 (s, 9H).
Стадия 2: трет-бутил-4,6-дихлор-5-[[1,4-диметил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-3-карбоксилат

Используя процедуру, аналогичную примеру A, стадии 4, трет-бутил-4,6-дихлор-5-[[1,4-диметил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-3-карбоксилат (353 мг, 70%) получали из трет-бутил-4,6-дихлор-5-[[4-метил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-3-карбоксилата (490 мг, 1,07 ммоль) и метилйодида (80 мкл, 1,28 ммоль). LC/MS (Способ j): Время удерживания=2,67 мин.; MS масса/заряд: 473 [M+H]+; 1H ЯМР ((DMSO-d6, 300МГц): δ 8,73 (s, 1H), 7,62 (s, 1H), 7,10 (s, 1H), 6,74 (s, 1H), 4,61 (s, 2H), 3,70 (s, 3H), 2,82 (s, 3H), 1,57 (s, 9H).
Стадия 3: 4,6-дихлор-5-[[1,4-диметил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-3-карбоновая кислота
Используя процедуру, аналогичную примеру DJ, стадии 2, 4,6-дихлор-5-[[1,4-диметил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-3-карбоновую кислоту получали (281 мг, 91%) из трет-бутил-4,6-дихлор-5-[[1,4-диметил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-3-карбоксилата (350 мг, 0,739 ммоль). LC/MS (Способ j): Время удерживания=1,63 мин.; MS масса/заряд: 417 [M+H]+; 1H ЯМР ((DMSO-d6, 300МГц): δ 13,99 (широкий, 1H), 8,76 (s, 1H), 7,62 (s, 1H), 7,10 (s, 1H), 6,71 (s, 1H), 4,62 (s, 2H), 3,70 (s, 3H), 2,83 (s, 3H).
Стадия 4: метил-2-[1-[4,6-дихлор-5-[[1,4-диметил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-3-карбонил]-4-пиперидил]ацетат
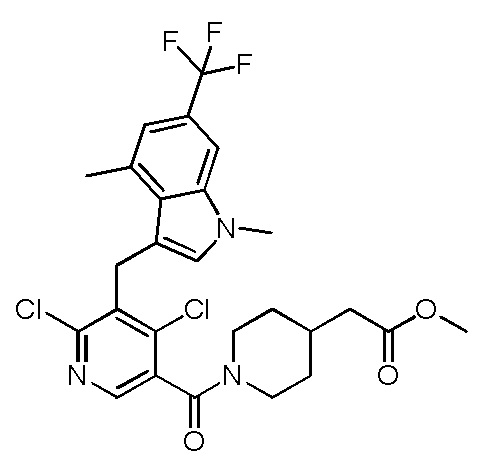
Используя процедуру, аналогичную примеру A, стадии 6, метил-2-[1-[4,6-дихлор-5-[[1,4-диметил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-3-карбонил]-4-пиперидил]ацетат (87 мг, 73%) получали из 4,6-дихлор-5-[[1,4-диметил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-3-карбоновой кислоты (90 мг, 0,216 ммоль) и метил-2-(4-пиперидил)ацетата гидрохлорида (46 мг, 0,237 ммоль). LC/MS (Способ j): Время удерживания=2,01 мин.; MS масса/заряд: 556 [M+H]+; 1H ЯМР ((DMSO-d6, 300МГц): δ 8,46 и 8,39 (s, 1H), 7,62 (s, 1H), 7,10 (s, 1H), 6,76 и 6,71 (s, 1H), 4,50 (m, 3H), 3,71 (s, 3H), 3,60 и 3,57 (s, 3H), 3,44 (m, 1H), 3,07 (m, 1H), 2,82 (m, 4H), 2,29 (m, 2H), 1,98 (m, 1H), 1,77 (m, 1H), 1,62 (br s, 1H), 1,17 (m, 2H).
Стадия 5: 2-[1-[4,6-дихлор-5-[[1,4-диметил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-3-карбонил]-4-пиперидил]уксусная кислота
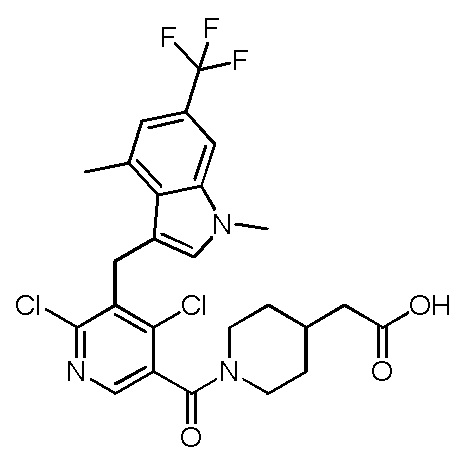
Используя процедуру, аналогичную примеру A, стадии 5, 2-[1-[4,6-дихлор-5-[[1,4-диметил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-3-карбонил]-4-пиперидил]уксусную кислоту (71 мг, 83%) получали из метил-2-[1-[4,6-дихлор-5-[[1,4-диметил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-3-карбонил]-4-пиперидил]ацетата (85 мг, 0,15 ммоль). LC/MS (Способ g): Время удерживания=1,82 мин.; MS масса/заряд: 542 [M+H]+ 1H ЯМР ((DMSO-d6, 400МГц): δ 8,45 и 8,39 (s, 1H), 7,61 (s, 1H), 7,09 (s, 1H), 6,75 и 7,71 (s, 1H), 4,54 (m, 3H), 3,71 (s, 3H), 3,40 (m, 1H), 3,06 (m, 1H), 2,82 (s, 4H), 2,15 (m, 2H), 1,93 (m, 1H), 1,79 (m, 1H), 1,64 (m, 1H), 1,14 (m, 2H).
Пример DW: 2-[1-[3,5-дихлор-4-[[1,4-диметил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-2-карбонил]-4-пиперидил]уксусная кислота
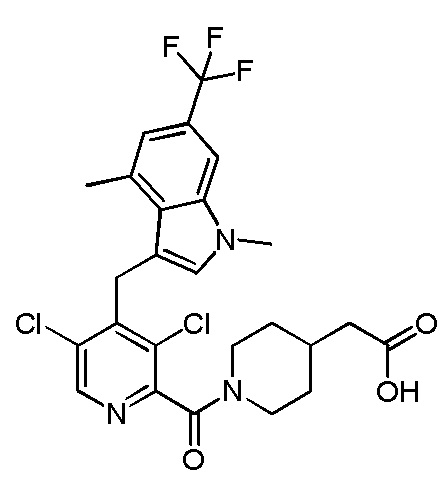
Стадия 1: этил-3,5-дихлор-4-[[4-метил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-2-карбоксилат
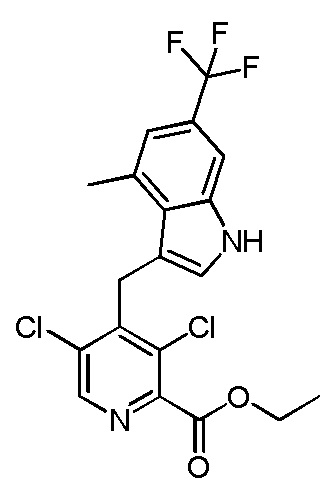
Используя процедуру, аналогичную примеру DU, стадии 1, этил-3,5-дихлор-4-[[4-метил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-2-карбоксилат (444 мг, 68%) получали из 4-метил-6-(трифторметил)-1H-индола (250 мг, 1,255 ммоль) (получение №51, стадия C) и этил-3,5-дихлор-4-формил-пиридин-2-карбоксилата (343 мг, 1,381 ммоль) (получение №37, стадия D). LC/MS (Способ i): Время удерживания=2,67 мин.; MS масса/заряд: 431 [M+H]+; 1H ЯМР ((DMSO-d6, 300МГц): δ 11,28 (s, 1H), 8,75 (s, 1H), 7,52 (s, 1H), 7,06 (s, 1H), 6,66 (m, 1H), 4,64 (s, 2H), 4,40 (q, J=7,1 Гц, 2H), 2,82 (s, 3H), 1,33 (t, J=7,1 Гц, 3H).
Стадия 2: этил-3,5-дихлор-4-[[1,4-диметил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-2-карбоксилат
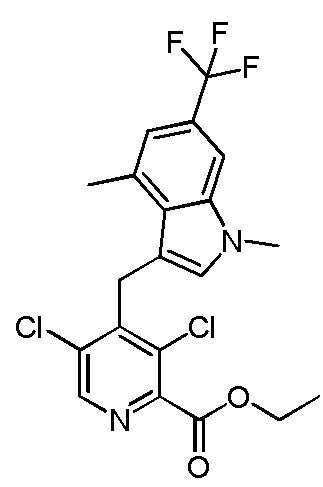
Используя процедуру, аналогичную примеру A, стадии 4, этил-3,5-дихлор-4-[[1,4-диметил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-2-карбоксилат (190 мг, 47%) получали из этил-3,5-дихлор-4-[[4-метил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-2-карбоксилата (390 мг, 0,90 ммоль) и метилйодида (79 мкл, 1,27 ммоль). LC/MS (Способ j): Время удерживания=2,32 мин.; MS масса/заряд: 445 [M+H]+; 1H ЯМР ((DMSO-d6, 300МГц): δ 8,76 (s, 1H), 7,62 (s, 1H), 7,10 (s, 1H), 6,72 (s, 1H), 4,63 (s, 2H), 4,40 (q, J=7,1 Гц, 2H), 3,70 (s, 3H), 2,82 (s, 3H), 1,33 (t, J=7,1 Гц, 3H).
Стадия 3: 3,5-дихлор-4-[[1,4-диметил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-2-карбоновая кислота

Используя процедуру, аналогичную примеру A, стадии 5, 3,5-дихлор-4-[[1,4-диметил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-2-карбоновую кислоту (195 мг, выход 100%, оранжевое твердое вещество) получали из этил-3,5-дихлор-4-[[1,4-диметил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-2-карбоксилата (190 мг, 0,427 ммоль). LC/MS (Способ j): Время удерживания=1,62 мин.; MS масса/заряд: 417 [M+H]+; 1H ЯМР ((DMSO-d6, 300МГц): δ 8,60 (s, 1H), 7,62 (s, 1H), 7,10 (s, 1H), 6,64 (s, 1H), 4,59 (s, 2H), 3,70 (s, 3H), 2,82 (s, 3H).
Стадия 4: метил-2-[1-[3,5-дихлор-4-[[1,4-диметил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-2-карбонил]-4-пиперидил]ацетат

Используя процедуру, аналогичную примеру A, стадии 6, метил-2-[1-[3,5-дихлор-4-[[1,4-диметил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-2-карбонил]-4-пиперидил]ацетат (72 мг, 67%) получали из 3,5-дихлор-4-[[1,4-диметил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-2-карбоновой кислоты (81 мг, 0,194 ммоль) и метил-2-(4-пиперидил)ацетата гидрохлорида (53 мг, 0,272 ммоль). LC/MS (Способ j): Время удерживания=2,05 мин.; MS масса/заряд: 556 [M+H]+; 1H ЯМР ((DMSO-d6, 300МГц): δ=8,72 (s, 1H), 7,63 (s, 1H), 7,10 (s, 1H), 6,69 (s, 1H), 4,60 (s, 2H), 4,46 (m, 1H), 3,70 (s, 3H), 3,58 (s, 3H), 3,28 (m, 1H), 3,05 (m, 1H), 2,81 (m, 4H), 2,29 (m, 2H), 1,99 (m, 1H), 1,78 (m, 1H), 1,61 (m, 1H), 1,16 (m, 2H).
Стадия 5: 2-[1-[3,5-дихлор-4-[[1,4-диметил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-2-карбонил]-4-пиперидил]уксусная кислота
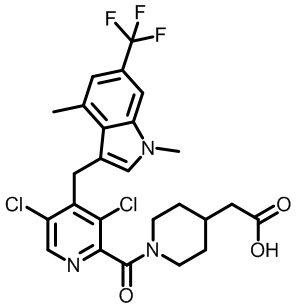
Используя процедуру, аналогичную примеру A, стадии 5, 2-[1-[3,5-дихлор-4-[[1,4-диметил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-2-карбонил]-4-пиперидил]уксусную кислоту (62 мг, 89%) получали из метил-2-[1-[3,5-дихлор-4-[[1,4-диметил-6-(трифторметил)-1H-индол-3-ил]метил]пиридин-2-карбонил]-4-пиперидил]ацетата (70 мг, 0,126 ммоль). LC/MS (Способ g): Время удерживания=1,83 мин.; MS масса/заряд: 542 [M+H]+ 1H ЯМР ((DMSO-d6, 400МГц): δ 8,72 (s, 1H), 7,62 (s, 1H), 7,10 (s, 1H), 6,69 (s, 1H), 4,60 (s, 2H), 4,46 (m, 1H), 3,70 (s, 3H), 3,28 (m, 1H), 3,04 (m, 1H), 2,82 (s, 4H), 2,16 (m, 2H), 1,95 (m, 1H), 1,80 (m, 1H), 1,62 (m, 1H), 1,14 (m, 2H).
Пример DX: 2-[1-[3,5-дихлор-4-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-2-карбонил]-4-пиперидил]уксусная кислота
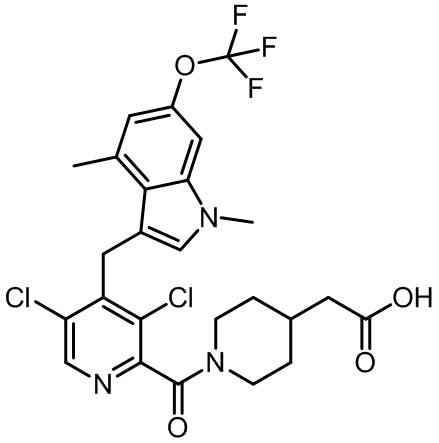
Стадия 1: этил-3,5-дихлор-4-[[4-метил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-2-карбоксилат
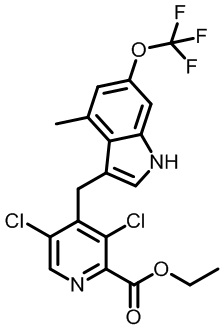
Используя процедуру, аналогичную примеру DU, стадии 1, этил-3,5-дихлор-4-[[4-метил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-2-карбоксилат (185 мг, 59%) получали из 4-метил-6-(трифторметокси)-1H-индола (150 мг, 0,697 ммоль (получение 80) и этил-3,5-дихлор-4-формил-пиридин-2-карбоксилата (190 мг, 0,767 ммоль) (получение №37, стадия D). LC/MS (Способ i): Время удерживания=2,68 мин.; MS масса/заряд: 447 [M+H]+; 1H ЯМР ((DMSO-d6, 300МГц): δ 11,05 (s, 1H), 8,75 (s, 1H), 7,14 (s, 1H), 6,78 (s, 1H), 6,49 (s, 1H), 4,60 (s, 2H), 4,40 (q, J=7,1 Гц, 2H), 2,77 (s, 3H), 1,33 (t, J=7,1 Гц, 3H).
Стадия 2: этил-3,5-дихлор-4-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-2-карбоксилат

Используя процедуру, аналогичную примеру A, стадии 4, этил-3,5-дихлор-4-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-2-карбоксилат (210 мг, 79%) получали из этил-3,5-дихлор-4-[[4-метил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-2-карбоксилата (185 мг, 0,41 ммоль) и метилйодида (26 мкл, 0,41 ммоль). LC/MS (Способ i): Время удерживания=2,82 мин.; MS масса/заряд: 461 [M+H]+; 1H ЯМР ((DMSO-d6, 300МГц): δ=8,76 (s, 1H), 7,25 (s, 1H), 6,82 (s, 1H), 6,56 (s, 1H), 4,60 (s, 2H), 4,40 (q, J=6,9 Гц, 2H), 3,62 (s, 3H), 2,73 (s, 3H), 1,33 (t, J=7,1 Гц, 3H).
Стадия 3: 3,5-дихлор-4-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-2-карбоновая кислота
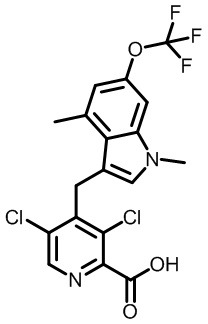
Используя процедуру, аналогичную примеру A, стадии 5, 3,5-дихлор-4-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-2-карбоновую кислоту (180 мг, 84%) получали из этил-3,5-дихлор-4-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-2-карбоксилата (210 мг, 0,45 ммоль). LC/MS (Способ i): Время удерживания=2,26 мин.; MS масса/заряд: 433 [M+H]+; 1H ЯМР ((DMSO-d6, 300МГц): δ 8,70 (s, 1H), 7,25 (s, 1H), 6,82 (m, 1H), 6,52 (s, 1H), 4,58 (s, 2H), 3,62 (s, 3H), 2,77 (s, 3H).
Стадия 4: метил-2-[1-[3,5-дихлор-4-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-2-карбонил]-4-пиперидил]ацетат

Используя процедуру, аналогичную примеру A, стадии 6, метил-2-[1-[3,5-дихлор-4-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-2-карбонил]-4-пиперидил]ацетат (110 мг, 41%) получали из 3,5-дихлор-4-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-2-карбоновой кислоты (180 мг, 0,416 ммоль) и метил-2-(4-пиперидил)ацетата гидрохлорида (89 мг, 0,457 ммоль).
LC/MS (Способ i): Время удерживания=2,65 мин.; MS масса/заряд: 572 [M+H]+; 1H ЯМР ((DMSO-d6, 300МГц): δ=8,72 (s, 1H), 7,25 (s, 1H), 6,82 (s, 1H), 6,53 (s, 1H), 4,57 (s, 2H), 4,46 (m, 1H), 3,62 (s, 3H), 3,58 (s, 3H), 3,27 (m, 1H), 3,05 (m, 1H), 2,80 (m, 4H), 2,29 (m, 2H), 1,99 (m, 1H), 1,76 (m, 1H), 1,60 (m, 1H), 1,15 (m, 2H).
Стадия 5: 2-[1-[3,5-дихлор-4-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-2-карбонил]-4-пиперидил]уксусная кислота
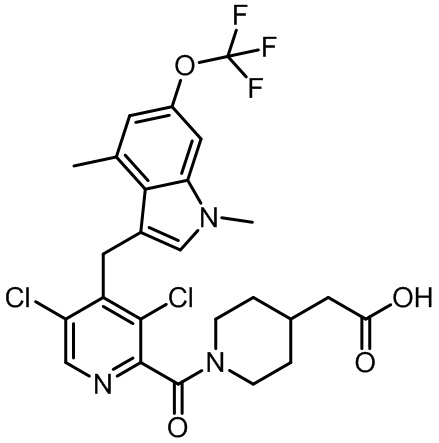
Используя процедуру, аналогичную примеру A, стадии 5, 2-[1-[3,5-дихлор-4-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-2-карбонил]-4-пиперидил]уксусную кислоту 44 мг, 80%) получали из метил-2-[1-[3,5-дихлор-4-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-2-карбонил]-4-пиперидил]ацетата (55 мг, 0,096 ммоль). LC/MS (Способ g): Время удерживания=1,86 мин.; MS масса/заряд: 558 [M+H]+; 1H ЯМР ((DMSO-d6, 400МГц): δ 12,11 (s, 1H), 8,72 (s, 1H), 7,25 (s, 1H), 6,82 (s, 1H), 6,53 (s, 1H), 4,57 (s, 2H), 4,46 (m, 1H), 3,62 (s, 3H), 3,27 (m, 1H), 3,05 (m, 1H), 2,84 (m, 1H), 2,77 (m, 3H), 2,18 (m, 2H), 1,96 (m, 1H), 1,80 (m 1H), 1,63 (m, 1H), 1,15 (m, 2H).
Пример DY: 2-[1-[4,6-дихлор-5-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-3-карбонил]-4-пиперидил]уксусная кислота

Стадия 1: трет-бутил-4,6-дихлор-5-[[4-метил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-3-карбоксилат

Используя процедуру, аналогичную примеру DU стадии 1, трет-бутил-4,6-дихлор-5-[[4-метил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-3-карбоксилат (100 мг, 45%) получали из 4-метил-6-(трифторметокси)-1H-индола (100 мг, 0,465 ммоль) (получение 80) и трет-бутил-4,6-дихлор-5-формил-пиридин-3-карбоксилата (141 мг, 0,511 ммоль) (пример DO, стадия 12). LC/MS (Способ i): Время удерживания=2,89 мин.; MS масса/заряд: 475 [M+H]+; 1H ЯМР ((DMSO-d6, 300МГц): δ 11,03 (s, 1H), 8,70 (s, 1H), 7,13 (s, 1H), 6,77 (m, 1H), 6,80 (s, 1H), 4,58 (s, 2H), 2,77 (s, 3H), 1,57 (s, 9H).
Стадия 2: трет-бутил-4,6-дихлор-5-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-3-карбоксилат

Используя процедуру, аналогичную примеру A, стадии 4, трет-бутил-4,6-дихлор-5-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-3-карбоксилат (145 мг, выход 92%) получали из трет-бутил-4,6-дихлор-5-[[4-метил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-3-карбоксилата (135 мг, 0,28 ммоль) и метилйодида (18 мкл, 0,284 ммоль). LC/MS (Способ j): Время удерживания=2,68 мин.; MS масса/заряд: 489 [M+H]+; 1H ЯМР ((DMSO-d6, 300МГц): δ=8,72 (s, 1H), 7,24 (s, 1H), 6,81 (s, 1H), 6,57 (s, 1H), 4,58 (s, 2H), 3,62 (s, 3H), 2,77 (s, 3H), 1,57 (s, 9H).
Стадия 3: 4,6-дихлор-5-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-3-карбоновая кислота

Используя процедуру, аналогичную примеру DJ, стадии 2, 4,6-дихлор-5-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-3-карбоновую кислоту (135 мг, выход 74%) получали из трет-бутил-4,6-дихлор-5-[[4-метил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-3-карбоксилата (140 мг, 0,286 ммоль). LC/MS (Способ i): Время удерживания=2,32 мин.; MS масса/заряд: 433 [M+H]+.
Стадия 4: метил-2-[1-[4,6-дихлор-5-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-3-карбонил]-4-пиперидил]ацетат
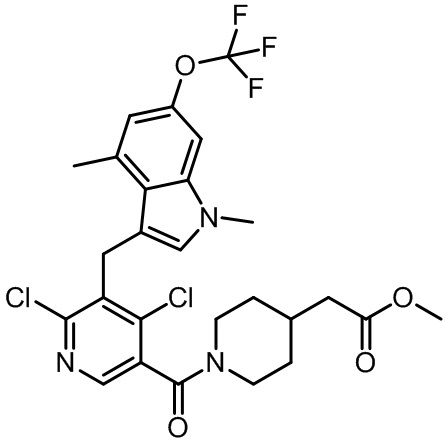
Используя процедуру, аналогичную примеру A стадии 6, 2-[1-[4,6-дихлор-5-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-3-карбонил]-4-пиперидил]ацетат (60 мг, выход 32%) получали из 4,6-дихлор-5-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-3-карбоновой кислоты (135 мг, 0,312 ммоль) и метил-2-(4-пиперидил)ацетата гидрохлорида (66,4 мг, 0,343 ммоль). LC/MS (Способ i): Время удерживания=2,63 мин.; MS масса/заряд: 572 [M+H]+; 1H ЯМР ((DMSO-d6, 300МГц): δ=8,45 и 8,38 (s, 1H), 7,24 (s, 1H), 6,81 (s, 1H), 6,59 и 6,54 (s, 1H), 4,54 (m, 3H), 3,62 (s, 3H), 3,60 и 3,57 (s, 3H), 3,41 (m, 1H), 3,07 (m, 1H), 2,81 (m, 4H), 2,29 (m, 2H), 1,99 (m, 1H), 1,78 (m, 1H), 1,61 (m, 1H), 1,17 (m, 2H).
Стадия 5: 2-[1-[4,6-дихлор-5-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-3-карбонил]-4-пиперидил]уксусная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2-[1-[4,6-дихлор-5-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-3-карбонил]-4-пиперидил]уксусную кислоту (43 мг, 78%) получали из метил-2-[1-[4,6-дихлор-5-[[1,4-диметил-6-(трифторметокси)-1H-индол-3-ил]метил]пиридин-3-карбонил]-4-пиперидил]ацетата (55 мг, 0,09 ммоль). LC/MS (Способ g): Время удерживания=1,85 мин.; MS масса/заряд: 558 [M+H]+; 1H ЯМР ((DMSO-d6, 400МГц): δ=12,11 (широкий, 1H), 8,45 и 8,38 (s, 1H), 7,24 (s, 1H), 6,81 (s, 1H), 6,59 и 6,54 (s, 1H), 4,55 (m, 3H), 3,63 (s, 3H), 3,38 (m, 1H), 3,07 (m, 1H), 2,79 (m, 4H), 2,18 (m, 2H), 1,96 (m, 1H), 1,79 (m, 1H), 1,64 (m, 1H), 1,16 (m, 2H).
Пример DZ: 2-(1-(2,4-дихлор-3-((4-метил-6-(трифторметил)бензофуран-3-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Стадия 1: трет-бутил-2,4-дихлор-3-(3-(2-йод-3-метил-5-(трифторметил)фенокси)проп-1-ен-1-ил)бензоат
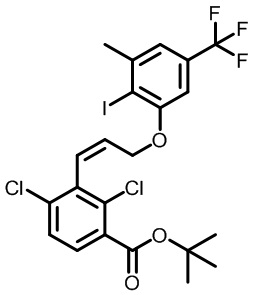
В раствор трет-бутил-2,4-дихлор-3-(3-((метилсульфонил)окси)проп-1-ен-1-ил)бензоата (2,95 г, 7,74 ммоль) (получение 59) в ACN (78 мл) добавляли карбонат калия (2,139 г, 15,47 ммоль), йодид калия (1,2 г, 7,74 ммоль) и 2-йод-3-метил-5-(трифторметил)фенол (2,3 г, 7,74 ммоль) (получение 85). Реакционную смесь перемешивали при 50°C в течение 45 минут. Реакционную смесь разбавляли с помощью H2O и экстрагировали дважды с помощью EtOAc. Полученный органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали с получением 3,7-диметил-5-(трифторметокси)-1H-индол-трет-бутил-2,4-дихлор-3-(3-(2-йод-3-метил-5-(трифторметил)фенокси)проп-1-ен-1-ил)бензоата (3,6 г, 80%) в виде бледно-желтого твердого вещества. LC/MS (Способ i): Время удерживания=3,07 минуты 1H ЯМР (DMSO-d6, 300МГц): δ 7,59 (d, J=8,6 Гц, 1H), 7,54 (d, J=8,6 Гц, 1H), 7,34 (s, 1H), 7,17 (s, 1H), 6,81 (d, J=16,3 Гц, 1H), 6,33 (dt, J=16,3, 4,8 Гц, 1H), 5,03 (m, 2H), 2,6 (s, 3H), 1,54 (s, 9H).
Стадия 2: трет-бутил-2,4-дихлор-3-((4-метил-6-(трифторметил)бензофуран-3(2H)-илиден)метил)бензоат
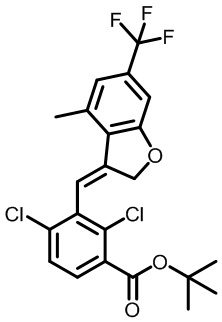
В раствор трет-бутил-2,4-дихлор-3-(3-(2-йод-3-метил-5-(трифторметил)фенокси)проп-1-ен-1-ил)бензоата (500 мг, 0,85 ммоль) в DMF (2,5 мл) добавляли тетрабутиламмония хлорид (260 мг, 0,937 ммоль), карбонат натрия (226 мг, 2,129 ммоль), натрия формиат (57,9 мг, 0,852 ммоль) и бис(ацетонитрил)дихлорпалладий(II) (17,67 мг, 0,068 ммоль). Реакционную смесь дегазировали аргоном и перемешивали при 80°C в течение 18 часов. Реакционную смесь фильтровали и фильтрат концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 0-10% EtOAc в циклогексане) с получением трет-бутил-2,4-дихлор-3-((4-метил-6-(трифторметил)бензофуран-3(2H)-илиден)метил)бензоата (240 мг, 45%) в виде желтого масла. Его использовали неочищенным на следующей стадии. LC/MS (Способ j): Время удерживания=2,88 минуты, 1H ЯМР (DMSO-d6, 300МГц): δ 7,67 (m, 2H), 7,21 (s, 1H), 7,15 (s, 1H), 6,92 (m, 1H), 5,01 (m, 2H), 2,62 (s, 3H), 1,56 (s, 9H).
Стадия 3: 2,4-дихлор-3-((4-метил-6-(трифторметил)бензофуран-3-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру DJ, стадии 2, 2,4-дихлор-3-((4-метил-6-(трифторметил)бензофуран-3-ил)метил)бензойную кислоту (100 мг, 61%) получали из неочищенного трет-бутил-2,4-дихлор-3-((4-метил-6-(трифторметил)бензофуран-3-ил)метил)бензоата (115 мг, 0,25 ммоль). Ее использовали неочищенной на следующей стадии. LC/MS (Способ i): Время удерживания=2,55 мин.; MS масса/заряд: 401 [M-H]-; 1H ЯМР (DMSO-d6, 500МГц): δ 13,59 (широкий, 1H), 7,83 (s, 1H), 7,75 (d, J=8,4 Гц, 1H), 7,66 (d, J=8,4 Гц, 1H), 7,42 (s, 1H), 7,26 (s, 1H), 4,55 (s, 2H), 2,83 (s, 3H).
Стадия 4: метил-2-(1-(2,4-дихлор-3-((4-метил-6-(трифторметил)бензофуран-3-
ил)метил)бензоил)пиперидин-4-ил)ацетат

Используя процедуру, аналогичную примеру A1, метил-2-(1-(2,4-дихлор-3-((4-метил-6-(трифторметил)бензофуран-3-ил)метил)бензоил)пиперидин-4-ил)ацетат (54 мг, 50%) получали из неочищенной 2,4-дихлор-3-((4-метил-6-(трифторметил)бензофуран-3-ил)метил)бензойной кислоты (66 мг, 0,16 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (48 мг, 0,25 ммоль). LC/MS (Способ i): Время удерживания=2,73 мин.; MS масса/заряд: 542 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,82 (s, 1H), 7,65 и 7,63 (d, J=8,3 Гц, 1H), 7,35 (m, 3H), 4,45 (m, 3H), 3,59 и 3,57 (s, 3H), 3,36 (m, 1H), 3,02 (m, 1H), 2,82 (s, 3H), 2,75 (m, 1H), 2,27 (m, 2H), 1,90 (m, 1H), 1,73 (m, 1H), 1,58 (m, 1H), 1,14 (m, 2H).
Стадия 5: 2-(1-(2,4-дихлор-3-((4-метил-6-(трифторметил)бензофуран-3-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
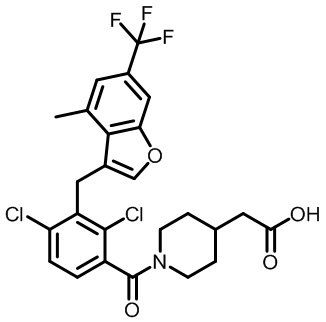
Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((4-метил-6-(трифторметил)бензофуран-3-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (25 мг, 50%) получали из метил-2-(1-(2,4-дихлор-3-((4-метил-6-(трифторметил)бензофуран-3-ил)метил)бензоил)пиперидин-4-ил)ацетата (52 мг, 0,09 ммоль). LC/MS (Способ g): Время удерживания=1,93 мин.; MS масса/заряд: 528 [M+H]+; 1H ЯМР (DMSO-d6, 500МГц): δ 12,11 (m, 1H), 7,82 (s, 1H), 7,64 и 7,63 (d, J=8,3 Гц, 1H), 7,35 (m, 3H), 4,51 (m, 3H), 3,28 (m, 1H), 3,02 (m, 1H), 2,79 (m, 4H), 2,17 (m, 2H), 1,92 (m, 1H), 1,77 (m, 1H), 1,62 (m, 1H), 1,13 (m, 2H).
Пример EA: 2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индазол-1-карбонил)бензоил)пиперидин-4-ил)уксусная кислота

Стадия 1: трет-бутил-2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индазол-1-карбонил)бензоат и трет-бутил-2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-2H-индазол-2-карбонил)бензоат

Используя процедуру, аналогичную примеру DJ, стадии 1, трет-бутил-2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индазол-1-карбонил)бензоат (120 мг, 4%) и трет-бутил-2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-2H-индазол-2-карбонил)бензоат (870 мг, 43%) получали из 3,7-диметил-5-(трифторметил)-1H-индазола (600 мг, 2,8 ммоль) (получение №42) и трет-бутил-2,4-дихлор-3-(хлоркарбонил)бензоата (1,3 г, 4,2 ммоль) (получение №44).
трет-Бутил-2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индазол-1-карбонил)бензоат. LC/MS (Способ j): Время удерживания=2,55 мин.; MS масса/заряд: 487 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,20 (s, 1H), 7,91 (d, J=8,4 Гц, 1H), 7,90 (s, 1H), 7,75 (d, J=8,4 Гц, 1H), 2,88 (s, 3H), 2,51 (s, 3H), 1,55 (s, 9H).
трет-Бутил-2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-2H-индазол-2-карбонил)бензоат. LC/MS (Способ j): Время удерживания=2,61 мин.; MS масса/заряд: 487 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,24 (s, 1H), 7,97 (d, J=8,4 Гц, 1H), 7,79 (d, J=8,4 Гц, 1H), 7,33 (s, 1H), 3,07 (s, 3H), 2,31 (s, 3H), 1,55 (s, 9H).
Стадия 2: 2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индазол-1-карбонил)бензойная кислота

Используя процедуру, аналогичную примеру DJ, стадии 2, 2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индазол-1-карбонил)бензойную кислоту (100 мг, 83%) получали из трет-бутил-2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индазол-1-карбонил)бензоата (110 мг, 0,22 ммоль). LC/MS (Способ j): Время удерживания=1,76 мин.; MS масса/заряд: 431 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,19 (m, 1H), 7,96 (d, J=8,4 Гц, 1H), 7,90 (s, 1H), 7,74 (d, J=8,4 Гц, 1H), 2,88 (s, 3H), 2,49 (s, 3H).
Стадия 3: метил-2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индазол-1-карбонил)бензоил)пиперидин-4-ил)ацетат
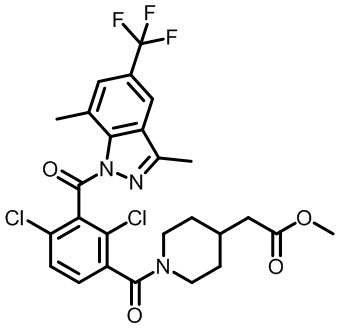
Используя процедуру, аналогичную примеру A, стадии 6, метил-2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индазол-1-карбонил)бензоил)пиперидин-4-ил)ацетат (64 мг, 42%) получали из 2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индазол-1-карбонил)бензойной кислоты (115 мг, 0,27 ммоль) и метил-2-(пиперидин-4-ил)ацетата гидрохлорида (67 мг, 0,35 ммоль). LC/MS (Способ i): Время удерживания=2,58 мин.; MS масса/заряд: 570 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,21 (s, 1H), 7,91 (s, 1H), 7,72 (m, 1H), 7,56 (m, 1H), 4,7 (m, 1H), 3,59 (m, 4H), 3,21 (m, 1H), 3,09 (m, 2H), 2,89 (m, 3H), 2,82 (m, 1H), 2,48 (m, 1H), 2,29 (m, 2H), 1,99 (m, 1H), 1,74 (m, 1H), 1,64 (m, 1H), 1,15 (m, 2H).
Стадия 4: 2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индазол-1-карбонил)бензоил)пиперидин-4-ил)уксусная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индазол-1-карбонил)бензоил)пиперидин-4-ил)уксусную кислоту (53 мг, 86%) получали из метил-2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-индазол-1-карбонил)бензоил)пиперидин-4-ил)ацетата (63 мг, 0,11 ммоль). LC/MS (Способ g): Время удерживания=1,86 мин.; MS масса/заряд: 556 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ=12,11 (широкий, 1H), 8,21 (m, 1H), 7,91 (s, 1H), 7,73 (m, 1H), 7,63 и 7,55 (m, 1H), 4,47 (m, 1H), 3,27 (m, 1H), 3,09 (m, 1H), 2,85 (m, 4H), 2,47 (m, 3H), 2,18 (m, 2H), 1,95 (m, 1H), 1,78 (m, 1H), 1,65 (m, 1H), 1,18 (m, 2H).
Пример EB: 2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-2H-индазол-2-карбонил)бензоил)пиперидин-4-ил)уксусная кислота

Стадия 1: 2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-2H-индазол-2-карбонил)бензойная кислота
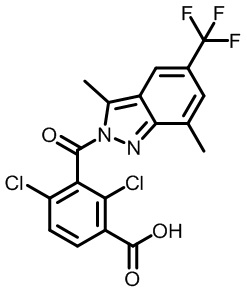
Используя процедуру, аналогичную примеру DJ, стадии 2, 2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-2H-индазол-2-карбонил)бензойную кислоту (145 мг, 86%) получали из трет-бутил-2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-2H-индазол-2-карбонил)бензоата (190 мг, 0,39 ммоль) (пример EA, стадия 1). LC/MS (Способ i): Время удерживания=2,42 мин.; MS масса/заряд: 431 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ=8,26 (s, 1H), 8,04 (d, J=8,4 Гц, 1H), 7,79 (d, J=8,4 Гц, 1H), 7,33 (s, 1H), 3,09 (s, 4H), 2,32 (s, 3H).
Стадия 2: метил-2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-2H-индазол-2-карбонил)бензоил)пиперидин-4-ил)ацетат
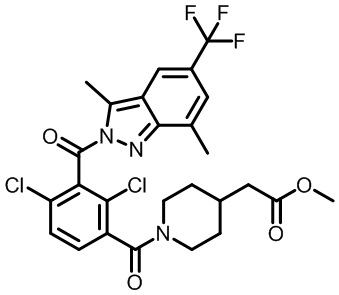
Используя процедуру, аналогичную примеру A, стадии 6, метил-2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-2H-индазол-2-карбонил)бензоил)пиперидин-4-ил)ацетат (125 мг, 63%) получали из 2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-2H-индазол-2-карбонил)бензойной кислоты (140 мг, 0,32 ммоль) и метил-2-(пиперидин-4-ил)ацетата гидрохлорида (82 мг, 0,42 ммоль). LC/MS (Способ i): Время удерживания=2,62 мин.; MS масса/заряд: 570 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,26 (s, 1H), 7,70 (m, 2H), 7,33 (s, 1H), 4,46 (m, 1H), 3,56 (m, 3H), 3,29 (m, 1H), 3,08 (s, 4H), 2,81 (m, 1H), 2,28 (m, 5H), 1,99 (m, 1H), 1,75 (m, 1H), 1,60 (m, 1H), 1,17 (m, 2H).
Стадия 3: 2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-2H-индазол-2-карбонил)бензоил)пиперидин-4-ил)уксусная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-2H-индазол-2-карбонил)бензоил)пиперидин-4-ил)уксусную кислоту (102 мг, 87%) получали из метил-2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-2H-индазол-2-карбонил)бензоил)пиперидин-4-ил)ацетата (120 мг, 0,21 ммоль). LC/MS (Способ g): Время удерживания=1,89 мин.; MS масса/заряд: 556 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ=12,12 (широкий, 1H), 8,26 (s, 1H), 7,70 (m, 2H), 7,33 (s, 1H), 4,46 (m, 1H), 3,28 (m, 1H), 3,08 (m, 4H), 2,80 (m, 1H), 2,31 (m, 4H), 2,11 (m, 1H), 1,94 (m, 1H), 1,79 (m, 1H), 1,62 (m, 1H), 0,15 (m, 2H).
Пример EC: 2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индазол-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
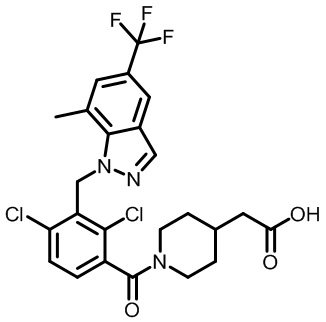
Стадия 1: метил-2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индазол-1-ил)метил)бензоил)пиперидин-4-ил)ацетат и метил 2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметил)-2H-индазол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат

Используя процедуру, аналогичную примеру DD, стадии 1, метил-2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индазол-1-ил)метил)бензоил)пиперидин-4-ил)ацетат (115 мг, 8,5%) и метил-2-[1-[2,4-дихлор-3-[[7-метил-5-(трифторметил)-2H-индазол-2-ил]метил]бензоил]-4-пиперидил]ацетат (350 мг, 26%) получали из 7-метил-5-(трифторметил)-1H-индазола (500 мг, 2,5 ммоль) (получение 78) и метил-2-(1-(2,4-дихлор-3-(((метилсульфонил)окси)метил)бензоил)пиперидин-4-ил)ацетата (1,4 г, 3,2 ммоль) (получение 53).
Метил-2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индазол-1-ил)метил)бензоил)пиперидин-4-ил)ацетат. LC/MS (Способ i): Время удерживания=2,51 мин.; MS масса/заряд: 542 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 8,14 (s, 1H), 8,06 (s, 1H), 7,61 и 7,60 (d, J=8,3 Гц, 1H), 7,50 (s, 1H), 7,45 и 7,37 (d, J=8,3 Гц, 1H), 6,06 и 6,07 (s, 2H), 4,44 (m, 1H), 3,59 и 3,57 (s, 3H), 3,20 (m, 1H), 3,03 (m, 1H), 2,97 (s, 3H), 2,78 (m, 1H), 2,50 (s, 3H), 2,27 (m, 2H), 1,95 (m, 1H), 1,74 (m, 1H), 1,57 (m 1H), 1,13 (m, 2H).
Метил-2-[1-[2,4-дихлор-3-[[7-метил-5-(трифторметил)-2H-индазол-2-ил]метил]бензоил]-4-пиперидил]ацетат. LC/MS (Способ i): Время удерживания=2,47 мин.; MS масса/заряд: 542 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,55 и 8,53 (s, 1H), 8,01 (s, 1H), 7,66 (m, 1H), 7,51 и 7,43 (d, J=8,26 Гц, 1H), 7,22 (s, 1H), 5,97 (s, 2H), 4,45 (m, 1H), 3,59 и 3,58 (s, 3H), 3,28 (m, 1H), 3,05 (m, 1H), 2,80 (m, 1H), 2,50 (m, 3H), 2,27 (m, 2H), 1,96 (m, 1H), 1,76 (m, 1H), 1,57 (m, 1H), 1,17 (m, 2H).
Стадия 2: 2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индазол-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
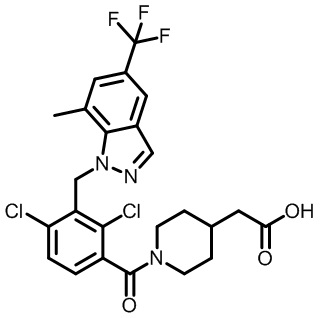
Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индазол-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (113 мг, 97%) получали из метил-2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметил)-1H-индазол-1-ил)метил)бензоил)пиперидин-4-ил)ацетата (119 мг, 0,22 ммоль). LC/MS (Способ g): Время удерживания=1,73 мин.; MS масса/заряд: 528 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 12,10 (s, 1H), 8,14 (s, 1H), 8,06 (s, 1H), 7,61 и 8,60 (d, J=8,3 Гц, 1H), 7,50 (s, 1H), 7,45 и 7,37 (d, J=8,3 Гц, 1H), 6,08 и 7,07 (s, 2H), 4,44 (m, 1H), 3,21 (m, 1H), 3,02 (m, 1H), 2,97 (s, 3H), 2,78 (m, 1H), 2,16 (m, 2H), 1,92 (m, 1H), 1,76 (m, 1H), 1,59 (m, 1H), 1,12 (m, 2H).
Пример ED: 2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметил)-2H-индазол-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
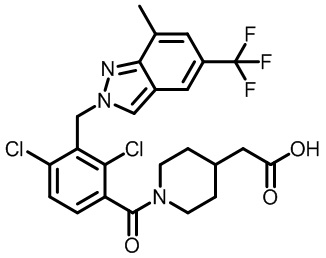
Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметил)-2H-индазол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (76 мг, 64%) получали из метил-2-[1-[2,4-дихлор-3-[[7-метил-5-(трифторметил)индазол-2-ил]метил]бензоил]-4-пиперидил]ацетата (121 мг, 0,22 ммоль) (пример EC, стадия 1). LC/MS (Способ g): Время удерживания=1,70 мин.; MS масса/заряд: 528 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 12,13 (широкий, 1H), 8,55 и 8,53 (s, 1H), 8,01 (s, 1H), 7,67 и 7,65 (d, J=8,4 Гц, 1H), 7,51 и 7,43 (d, J=8,4 Гц, 1H), 7,22 (s, 1H), 597 (m, 2H), 4,47 (m, 1H), 3,31 (m, 4H), 3,03 (m, 1H), 2,80 (m, 1H), 2,17 (m, 2H), 1,93 (m, 1H), 1,76 (m, 1H), 1,60 (m, 1H), 1,17 (m, 2H).
Пример EE: 2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индазол-3-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Стадия 1: трет-бутил-2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индазол-3-ил)(гидрокси)метил)бензоат
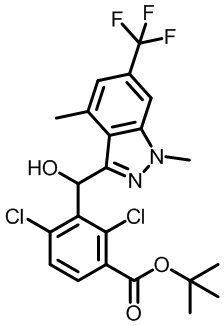
Используя процедуру, аналогичную примеру FE, стадии 1, трет-бутил-2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индазол-3-ил)(гидрокси)метил)бензоат (149 мг, 63%) получали из 1,4-диметил-6-(трифторметил)-1H-индазол-3-карбальдегида (100 мг, 0,41 ммоль) (получение 79) и трет-бутил-2,4-дихлорбензоата (153 мг, 0,62 ммоль) (получение №33, стадия A). LC/MS (Способ i): Время удерживания=2,72 мин.; MS масса/заряд: 489 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 7,93 (s, 1H), 7,56 (m, 2H), 7,24 (s, 1H), 6,95 (d, J=5,7 Гц, 1H), 6,35 (d, J=5,7 Гц, 1H), 3,96 (s, 3H), 2,88 (s, 3H), 1,55 (s, 9H).
Стадия 2: 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индазол-3-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 2, и нагревание при 50°C, 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индазол-3-ил)метил)бензойную кислоту (66 мг, 61%) получали из трет-бутил-2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индазол-3-ил)(гидрокси)метил)бензоата (149 мг, 0,26 ммоль). LC/MS (Способ i): Время удерживания=2,39 мин.; MS масса/заряд: 417 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ=13,50 (широкий, 1H), 7,89 (s, 1H), 7,65 (m, 2H), 7,19 (s, 1H), 4,80 (s, 2H), 3,92 (s, 3H), 2,85 (s, 3H).
Стадия 3: метил-2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индазол-3-ил)метил)бензоил)пиперидин-4-ил)ацетат
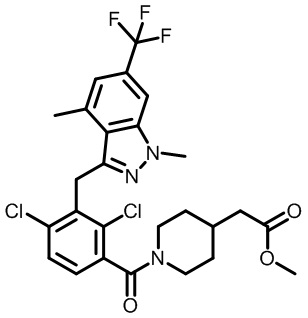
Используя процедуру, аналогичную примеру A1, метил-2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индазол-3-ил)метил)бензоил)пиперидин-4-ил)ацетат (110 мг, 82%) получали из 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индазол-3-ил)метил)бензойной кислоты (100 мг, 0,24 ммоль) и метил-2-(пиперидин-4-ил)ацетата гидрохлорида (69,6 ммоль). LC/MS (Способ i): Время удерживания=2,62 мин.; MS масса/заряд: 556 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,89 (s, 1H), 7,59 и 7,56 (d, J=8,3 Гц, 1H), 7,35 и 7,27 (d, J=8,3 Гц, 1H), 7,19 (s, 1H), 4,77 (m, 2H), 4,47 (m, 1H), 3,91 и 3,90 (s, 3H), 3,59 и 3,57 (s, 3H), 3,28 (m, 1H), 3,05 (m, 1H), 2,85 (s, 3H), 2,78 (m, 1H), 2,27 (m, 2H), 1,97 (m, 1H), 1,77 (m, 1H), 1,60 (m, 1H), 1,14 (m, 2H).
Стадия 4: 2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индазол-3-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
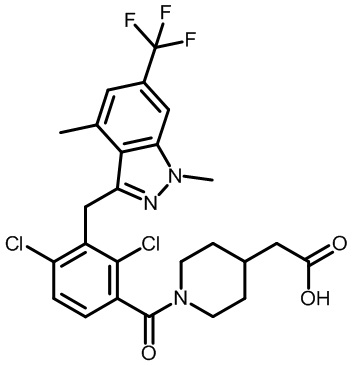
Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индазол-3-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (71 мг, 67%) получали из метил-2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индазол-3-ил)метил)бензоил)пиперидин-4-ил)ацетата (105 мг, 0,19 ммоль). LC/MS (Способ g): Время удерживания=1,78 мин.; MS масса/заряд: 542 [M+H]+; 1H ЯМР (DMSO-d6, 500МГц): δ 12,10 (широкий, 1H), 7,88 (s, 1H), 7,58 и 7,57 (d, J=8,3 Гц, 1H), 7,36 и 7,28 (d, J=8,3 Гц, 1H), 7,19 (s, 1H), 4,78 (m, 2H), 4,48 (m, 1H), 3,91 и 3,90 (s, 3H), 3,25 (m, 1H), 3,04 (m, 1H), 2,85 (s, 3H), 2,79 (m, 1H), 2,17 (m, 2H), 1,93 (m, 1H), 1,76 (m, 1H), 1,62 (m, 1H), 1,13 (m, 2H).
Пример EF: 2-(1-(2,4-дихлор-3-((3-метил-5-(трифторметил)-1H-индазол-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
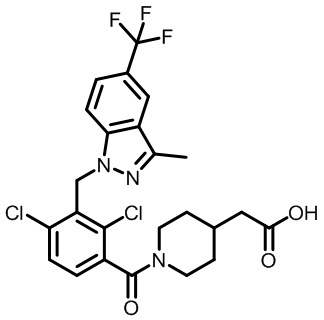
Стадия 1: метил-2,4-дихлор-3-((3-метил-5-(трифторметил)-1H-индазол-1-ил)метил)бензоат

Используя процедуру, аналогичную примеру DD, стадии 1, метил-2,4-дихлор-3-((3-метил-5-(трифторметил)-1H-индазол-1-ил)метил)бензоат (1,44 г, 86%) получали из 3-метил-5-(трифторметил)-1H-индазола (800 мг, 4 ммоль) и метил-3-(бромметил)-2,4-дихлорбензоата (1,5 г, 5,2 ммоль) (получение №1, стадия B). LC/MS (Способ i): Время удерживания=2,55 мин.; MS масса/заряд: 417 [M+H]+; 1H ЯМР (DMSO-d6, 500МГц): δ 8,17 (m, 1H), 7,94 (d, J=8,9 Гц, 1H), 7,77 (d, J=8,4 Гц, 1H), 7,71 (d, J=8,9 Гц, 1H), 7,66 (d, J=8,4 Гц, 1H), 5,82 (s, 2H), 3,84 (s, 3H), 2,45 (s, 3H).
Стадия 2: 2,4-дихлор-3-((3-метил-5-(трифторметил)-1H-индазол-1-ил)метил)бензойная кислота
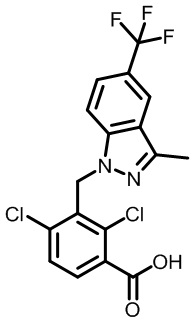
Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((3-метил-5-(трифторметил)-1H-индазол-1-ил)метил)бензойную кислоту (1,22 г, 88%) получали из метил-2,4-дихлор-3-((3-метил-5-(трифторметил)-1H-индазол-1-ил)метил)бензоата (1,44 г, 3,45 ммоль). LC/MS (Способ i): Время удерживания=2,23 мин.; MS масса/заряд: 403 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 13,69 (br., 1H), 8,19 (m, 1H), 7,96 (d, J=8,8 Гц, 1H), 7,75 (d, J=8,4 Гц, 1H), 7,73 (d, J=8,8 Гц, 1H), 7,63 (d, J=8,4 Гц, 1H), 5,83 (s, 2H), 2,47 (s, 3H).
Стадия 3: 2-(1-(2,4-дихлор-3-((3-метил-5-(трифторметил)-1H-индазол-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
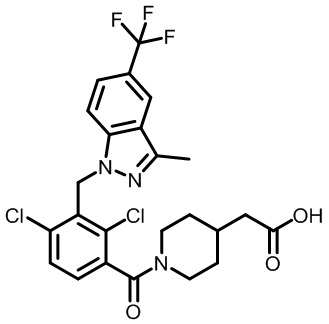
Используя процедуру, аналогичную примеру A, стадии 6, и примера A, стадии 5, 2-(1-(2,4-дихлор-3-((3-метил-5-(трифторметил)-1H-индазол-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (104 мг, 79%) получали из 2,4-дихлор-3-((3-метил-5-(трифторметил)-1H-индазол-1-ил)метил)бензойной кислоты (100 мг, 0,25 ммоль). LC/MS (Способ g): Время удерживания=1,71 мин.; MS масса/заряд: 528 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 12,10 (широкий, 1H), 8,19 (s 1H), 94 (d, J=9,0 Гц, 1H), 7,72 (d, J=9,0 Гц, 1H), 7,61 и 7,60 (d, J=8,3 Гц, 1H), 7,33-7,44 и 7,37 (d, J=8,3 Гц, 1H), 5,80 (m, 2H), 4,45 (m, 1H), 3,20 (m, 1H), 3,02 (m, 1H), 2,78 (m, 1H), 2,47 и 2,46 (ds, 3H), 2,16 (m, 2H), 1,92 (m, 1H), 1,76 (m, 1H), 1,59 (m, 1H), 1,14 (m, 2H).
Пример EG: 2-[1-[2,4-дихлор-3-[[3,7-диметил-5-(трифторметокси)-1H-индол-1-ил]метил]бензоил]-4-пиперидил]уксусная кислота
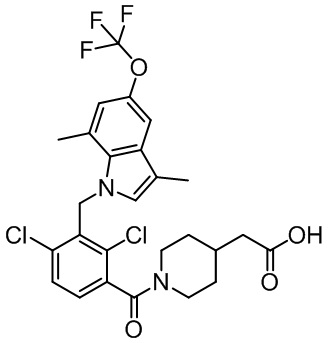
Стадия 1: метил-2,4-дихлор-3-((3,7-диметил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоат
Используя процедуру, аналогичную примеру DH, стадии 1, метил-2,4-дихлор-3-((3,7-диметил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоат (336 мг, 62%) получали из 3,7-диметил-5-(трифторметокси)-1H-индола (получение №61) (280 мг, 1,22 ммоль) и трет-бутил-3-(бромметил)-2,4-дихлорбензоата (498 мг, 1,46 ммоль) (получение №1, стадия B). LC/MS (Способ i): Время удерживания=2,82 мин.; MS масса/заряд: 446 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,87 (d, J=8,4 Гц, 1H), 7,75 (d, J=8,4 Гц, 1H), 7,26 (s, 1H), 6,93 (s, 1H), 6,48 (s, 1H), 5,86 (s, 2H), 3,88 (s, 3H), 2,88 (s, 3H), 2,11 (s, 3H).
Стадия 2: 2,4-дихлор-3-((3,7-диметил-5-(трифторметокси)-1H-индол-1-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((3,7-диметил-5-(трифторметокси)-1H-индол-1-ил)метил)бензойную кислоту (272 мг, 85%) получали из метил-2,4-дихлор-3-((3,7-диметил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоата (332 мг, 0,7 ммоль). LC/MS (Способ i): Время удерживания=2,53 мин.; MS масса/заряд: 432 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 13,65 (широкий, 1H), 7,83 (d, J=8,4 Гц, 1H), 7,71 (d, J=8,4 Гц, 1H), 7,26 (s, 1H), 6,93 (m, 1H), 6,47 (s, 1H), 5,86 (s, 2H), 2,88 (s, 3H), 2,11 (s, 3H).
Стадия 3: метил-2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетат
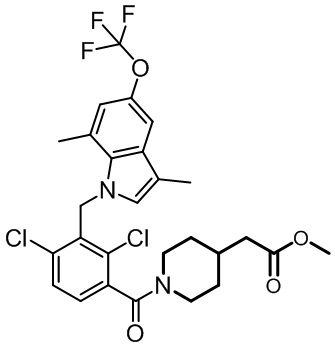
Используя процедуру, аналогичную примеру A, стадии 6, метил-2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетат (100 мг, 76%) получали из 2,4-дихлор-3-((3,7-диметил-5-(трифторметокси)-1H-индол-1-ил)метил)бензойной кислоты (100 мг, 0,2 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (90 мг, 0,4 ммоль). LC/MS (Способ i): Время удерживания=2,68 мин.; MS масса/заряд: 571 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,69 и 7,67 (d, J=8,3 Гц, 1H), 7,52 (d, J=8,3 Гц, 0,5H), 7,45 (d, J=8,3 Гц, 0,5H), 7,26 (s, 1H), 6,93 (s, 1H), 6,50 и 6,47 (s, 1H), 5,80 (m, 2H), 4,46 (m, 1H), 3,59 и 3,57 (s, 3H), 3,28 (m, 1H), 2,08 (m, 1H), 2,87 (s, 3H), 2,80 (m, 1H), 2,26 (m, 2H), 2,12 (s, 3H), 1,97 (m, 1H) 1,75 (m, 1H), 1,58 (m, 1H), 1,17 (m, 2H).
Стадия 4: 2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
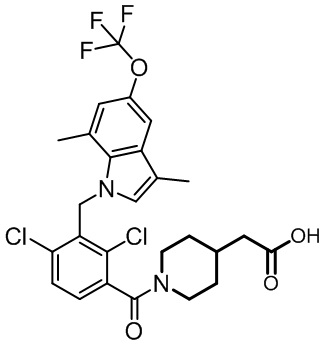
Используя процедуру, аналогичную примеру 1, стадии 5, 2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (78 мг, 83%) получали из метил-2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетата (96 мг, 0,16 ммоль). LC/MS (Способ g): Время удерживания=1,96 мин.; MS масса/заряд: 557 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 12,10 (широкий, 1H), 7,69 и 7,68 (d, J=8,3Гц, 1H), 7,52 (d, J=8,3 Гц, 0,5H), 7,46 (d, J=8,3 Гц, 0,5H), 7,26 (s, 1H), 6,93 (s, 1H), 6,50 и 6,46 (s, 1H), 5,82 (m, 2H), 4,46 (m, 1H), 3,27 (m, 1H), 3,04 (m, 1H), 2,87 (s, 3H), 2,82 (m, 1H), 2,18 (m, 2H), 2,12 (s, 3H), 1,94 (m, 1H), 1,77 (m, 1H), 1,61 (m, 1H), 1,17 (m, 2H).
Таблица EG. Следующие примеры получали из 2,4-дихлор-3-((3,7-диметил-5-(трифторметокси)-1H-индол-1-ил)метил)бензойной кислоты (пример EG, стадия 2) при помощи такой же процедуры, как описано в примере EG, стадиях 3 и 4, с соответствующими аминами.
|
Пример EH: 2-[1-[2,4-дихлор-3-[3,7-диметил-5-(трифторметокси)индол-1-карбонил]бензоил]-4-пиперидил]уксусная кислота
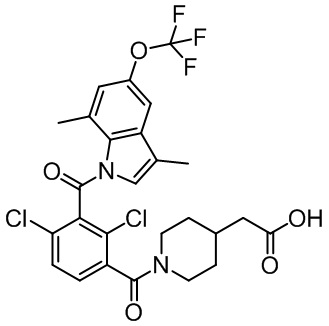
Стадия 1: трет-бутил-2,4-дихлор-3-(3,7-диметил-5-(трифторметокси)-1H-индол-1-карбонил)бензоат
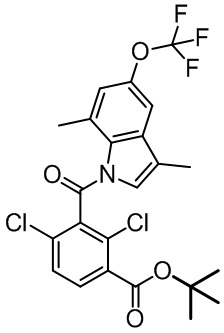
Используя процедуру, аналогичную примеру DJ, стадии 1, трет-бутил-2,4-дихлор-3-(3,7-диметил-5-(трифторметокси)-1H-индол-1-карбонил)бензоат (330 мг, 40%) получали из 3,7-диметил-5-(трифторметокси)-1H-индола (получение 61) (415 мг, 1,81 ммоль) и трет-бутил-2,4-дихлор-3-(хлоркарбонил)бензоата (513 мг, 1,65 ммоль) (получение №44). LC/MS (Способ j): Время удерживания=2,71 мин.; MS масса/заряд: 502 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,98 (d, J=8,4 Гц, 1H), 7,81 (d, J=8,4 Гц, 1H), 7,43 (s, 1H), 7,27 (m, 1H), 7,21 (s, 1H), 2,69 (s, 3H), 2,16 (d, J=1,3 Гц, 3H), 1,57 (s, 9H).
Стадия 2: трет-бутил-2,4-дихлор-3-(3,7-диметил-5-(трифторметокси)-1H-индол-1-карбонил)бензоат
Используя процедуру, аналогичную примеру DJ, стадии 2, 2,4-дихлор-3-(3,7-диметил-5-(трифторметокси)-1H-индол-1-карбонил)бензойную кислоту (280 мг, 96%) получали из трет-бутил-2,4-дихлор-3-(3,7-диметил-5-(трифторметокси)-1H-индол-1-карбонил)бензоата (330 мг, 0,65 ммоль). LC/MS (Способ k): Время удерживания=2,56 мин.; MS масса/заряд: 446 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 13,9 (широкий, 1H), 8,04 (d, J=8,4 Гц, 1H), 7,80 (d, J=8,4 Гц, 1H), 7,43 (s, 1H), 7,28 (s, 1H), 7,18 (d, J=1,2 Гц, 1H), 2,69 (s, 3H), 2,16 (d, J=1,2 Гц, 3H).
Стадия 3: метил-2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметокси)-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)ацетат

Используя процедуру, аналогичную примеру A, стадии 6, метил-2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметокси)-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)ацетат (93 мг, 71%) получали из 2,4-дихлор-3-(3,7-диметил-5-(трифторметокси)-1H-индол-1-карбонил)бензойной кислоты (100 мг, 0,22 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (87мг, 0,44 ммоль). LC/MS (Способ k): Время удерживания=2,70 мин.; MS масса/заряд: 585 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,79 (m, 1H), 7,85 (m, 1H), 7,45 (s, 1H), 7,25 (s, 1H), 7,35 и 7,31 и 7,09 (s, 1H), 4,47 (m, 1H), 3,59 (m, 3H), 3,24 (m, 1H), 3,07 (m, 1H), 2,83 (m, 1H), 2,68 (s, 3H), 2,25 (m, 2H), 2,18 (m, 3H), 1,99 (m, 1H), 1,76 (m, 1H), 1,59 (m, 1H), 1,12 (m, 2H).
Стадия 4: 2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметокси)-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)уксусная кислота
Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметокси)-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)уксусную кислоту (48 мг, 55%) получали из метил-2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметокси)-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)ацетата (90 мг, 0,15 ммоль). LC/MS (Способ g): Время удерживания=1,95 мин.; MS масса/заряд: 571 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 12,11 (широкий, 1H), 7,79 (m, 1H), 7,65 (m, 1H), 7,43 (широкий, 1H), 7,37 и 7,31 и 7,10 (m, 1H), 7,27 (широкий, 1H), 4,47 (m, 1H), 3,57 (m, 1H), 3,24 (m, 1H), 3,05 (m, 1H), 2,80 (m, 1H), 2,68 (s, 3H), 2,15 (m, 5H), 1,95 (m, 1H), 1,78 (m, 1H), 1,65 (m, 1H), 1,15 (m, 2H).
Таблица EH. Следующие примеры получали из 2,4-дихлор-3-(3,7-диметил-5-(трифторметокси)-1H-индол-1-карбонил)бензойной кислоты (пример EH, стадия 2) при помощи такой же процедуры, как описано в примере EH, стадиях 3 и 4, с соответствующими аминами.
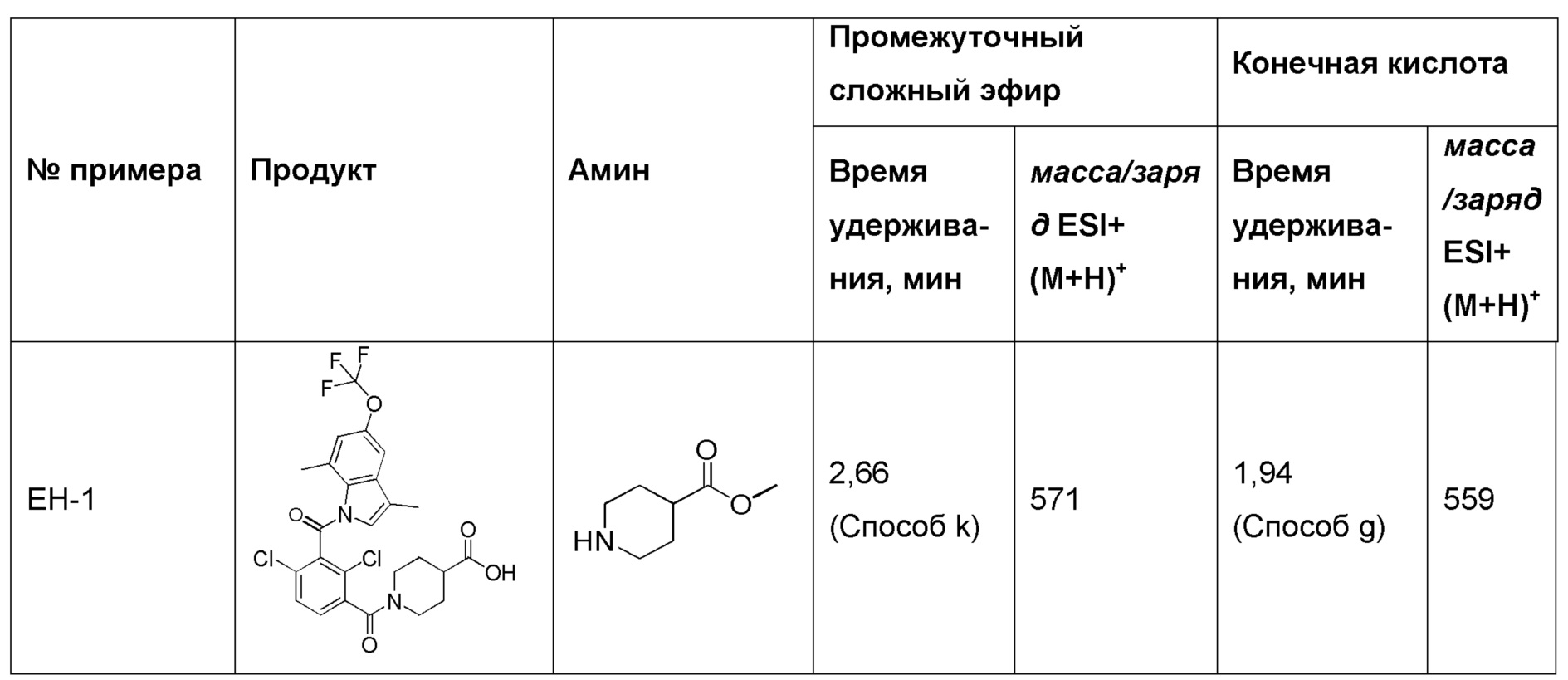
Пример EI: 2-(1-(2,4-дихлор-3-((5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Стадия 1: метил-2-(1-(2,4-дихлор-3-((5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетат

Используя процедуру, аналогичную примеру DH, стадии 1, метил-2-(1-(2,4-дихлор-3-((5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетат (141 мг, 77%) получали из 5-(трифторметокси)-1H-индола (68 мг, 0,34 ммоль) и метил-2-(1-(2,4-дихлор-3-(((метилсульфонил)окси)метил)бензоил)пиперидин-4-ил)ацетата (получение 53) (192 мг, 0,44 ммоль). LC/MS (Способ i): Время удерживания=2,60 мин.; MS масса/заряд: 543 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,69 (m, 2H), 7,56 (m, 1H), 7,50 и 7,42 (d, J=8,4Гц, 1H), 7,15 (m, 2H), 6,54 (m, 1H), 5,62 (m, 2H), 4,45 (m, 1H), 3,59 и 3,58 (s, 3H), 3,20 (m, 1H), 3,01 (m, 1H), 2,79 (m, 1H), 2,27 (m, 2H), 1,97 (m, 1H), 1,75 (m, 1H), 1,57 (m, 1H), 1,13 (m, 2H).
Стадия 2: 2-(1-(2,4-дихлор-3-((5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (75 мг, 58%) получали из метил-2-(1-(2,4-дихлор-3-((5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетата (132 мг, 0,24 ммоль). LC/MS (Способ g): Время удерживания=1,77 мин.; MS масса/заряд: 529 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 12,10 (широкий, 1H), 7,66 (m, 2H), 7,56 (s, 1H), 7,50 и 7,42 (d, J=8,4 Гц, 1H), 7,14 (m, 2H), 6,54 (m, 1H), 5,62 (m, 2H), 4,45 (m, 1H), 3,23 (m, 1H), 3,02 (m, 1H), 2,78 (m, 1H), 2,16 (m, 2H), 1,93 (m, 1H), 1,77 (m, 1H), 1,59 (m, 1H), 1,13 (m, 2H).
Таблица EI. Следующие примеры получали из метил-2-(1-(2,4-дихлор-3-(((метилсульфонил)окси)метил)бензоил)пиперидин-4-ил)ацетата (получение 53) при помощи такой же процедуры, как описано в примере EI, стадии 1 и 2, с соответствующим индолом.
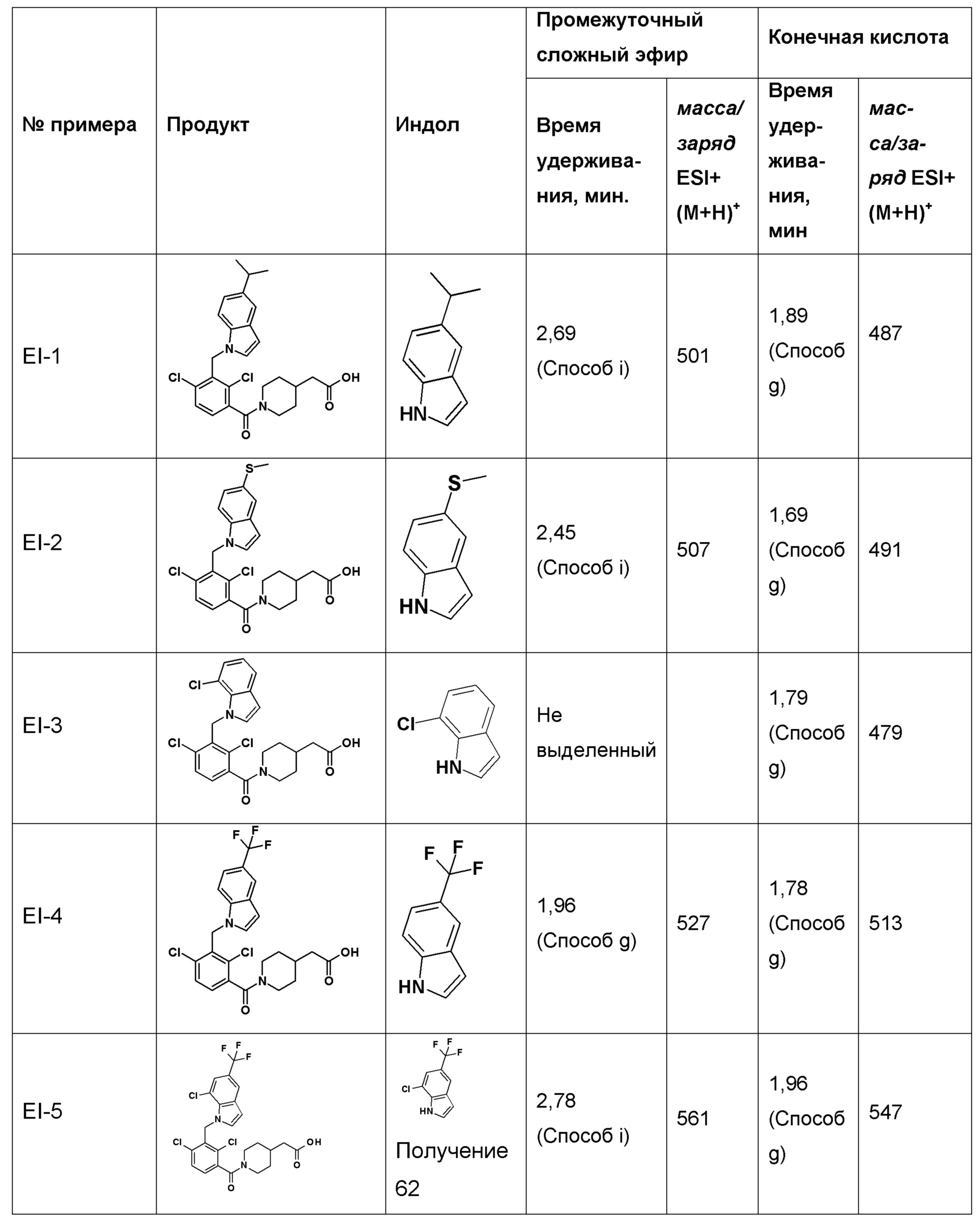
Пример EJ: 2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
Стадия 1: метил-2,4-дихлор-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)

Используя процедуру, аналогичную примеру DH, стадии 1, метил-2,4-дихлор-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоат (910 мг, 69%) получали из 7-метил-5-(трифторметокси)-1H-индола (получение №64) (600 мг, 2,8 ммоль) и трет-бутил-3-(бромметил)-2,4-дихлорбензоата (914 мг, 3,07 ммоль) (получение №1, стадия B). LC/MS (Способ j): Время удерживания=2,34 мин.; MS масса/заряд: 432 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,88 (d, J=8,4 Гц, 1H), 7,76 (d, J=8,4 Гц, 1H), 7,37 (s, 1H), 6,94 (s, 1H), 6,67 (d, J=3,3 Гц, 1H), 6,45 (d, J=3,3 Гц, 1H), 5,93 (s, 2H), 3,88 (s, 3H), 2,90 (s, 3H).
Стадия 2: 2,4-дихлор-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензойную кислоту (840 мг, 91%) получали из метил-2,4-дихлор-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоата (900 мг, 2,08 ммоль). LC/MS (Способ j): Время удерживания=1,85 мин.; MS масса/заряд: 418 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 13,78 (широкий, 1H), 7,82 (d, J=8,4 Гц, 1H), 7,70 (d, J=8,4 Гц, 1H), 7,37 (s, 1H), 6,94 (s, 1H), 6,66 (d, J=3,3 Гц, 1H), 6,45 (d, J=3,3 Гц, 1H), 5,92 (s, 2H), 2,90 (s, 3H).
Стадия 3: метил-2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетат
Используя процедуру, аналогичную примеру A, стадии 6, метил-2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетат (240 мг, 82%) получали из 2,4-дихлор-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензойной кислоты (200 мг, 0,48 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (111 мг, 0,57 ммоль). LC/MS (Способ j): Время удерживания=2,14 мин.; MS масса/заряд: 557 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,70 и 7,71 (d, J=8,3 Гц, 1H), 7,53 и 7,45 (d, J=8,3 Гц, 1H), 7,37 (s, 1H), 6,94 (s, 1H), 6,69 (m, 1H), 6,46 (m, 1H), 5,89 (m, 2H), 4,46 (m, 1H), 3,59 и 3,57 (s, 3H), 3,26 (m, 1H), 3,03 (m, 1H), 2,99 (s, 3H), 2,79 (m, 1H), 2,27 (m, 2H), 1,97 (m, 1H), 1,75 (m, 1H), 1,57 (m, 1H), 1,05-1,27 (m, 2H).
Стадия 4: 2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота A-1668537.0

Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (150 мг, 67%) получали из метил-2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетата (230 мг, 0,41 ммоль). LC/MS (Способ g): Время удерживания=1,88 мин.; MS масса/заряд: 543 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 12,08 (m, 1H), 7,69 (m, 1H), 7,53 и 7,45 (d, J=8,1Гц, 1H), 7,37 (s, 1H), 6,93 (s, 1H), 6,69 и 6,68 (d, J=8,1Гц 1H), 6,46 (m, 1H), 5,89 (m, 2H), 4,46 (m, 1H), 3,29 (m, 1H), 3,03 (m, 1H), 2,89 (s, 3H), 2,80 (m, 1H), 2,15(m, 2H), 1,93(m, 1H), 1,77 (m, 1H), 1,60 (m, 1H), 1,12( m, 2H).
Таблица EJ. Следующие примеры получали из 2,4-дихлор-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензойной кислоты (пример EJ, стадия 2) при помощи такой же процедуры, как описано в примере EJ, стадиях 3 и 4, с соответствующим аминами.

Пример EK: 2-(1-(2,4-диметил-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
Стадия 1: метил-2,4-диметил-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоат
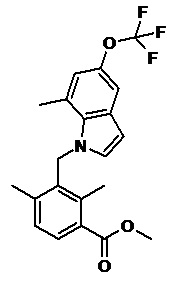
В раствор 7-метил-5-(трифторметокси)-1H-индола (получение 64) (200 мг, 0,93 ммоль) в ACN (4 мл) добавляли карбонат цезия (454 мг, 1,4 ммоль) и метил-3-(хлорметил)-2,4-диметилбензоат (227 мг, 1,1 ммоль) (получение №54) и реакционную смесь перемешивали при 70°C в течение ночи, затем фильтровали и концентрировали под пониженным давлением. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью от 10% до 20% этилацетата в циклогексане) с получением метил-2,4-диметил-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоата (300 мг, 64%). LC/MS (Способ j): Время удерживания=2,37 мин.; MS масса/заряд: 392 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,71 (d, J=7,9 Гц, 1H), 7,36 (s, 1H), 7,29 (d, J=7,9 Гц, 1H), 6,92 (s, 1H), 6,46 (d, J=3,3 Гц, 1H), 6,39 (d, J=3,3 Гц, 1H), 5,73 (m, 2H), 3,82 (s, 3H), 2,93 (s, 3H), 2,36 (s, 3H), 2,29 (s, 3H).
Стадия 2: 2,4-диметил-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2,4-диметил-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензойную кислоту (245 мг, 84%) получали из метил-2,4-диметил-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоата (292 мг, 0,75 ммоль). LC/MS (Способ j): Время удерживания=1,89 мин.; MS масса/заряд: 378 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 13,01 (широкий, 1H), 7,70 (d, J=7,9 Гц, 1H), 7,35 (s, 1H), 7,25 (d, J=7,9 Гц, 1H), 6,92 (s, 1H), 6,47 (d, J=3,3 Гц, 1H), 6,38 (d, J=3,3 Гц, 1H), 5,71 (s, 2H), 2,93 (s, 3H), 2,38 (s, 3H), 2,28 (s, 3H).
Стадия 3: метил-2-(1-(2,4-диметил-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетат
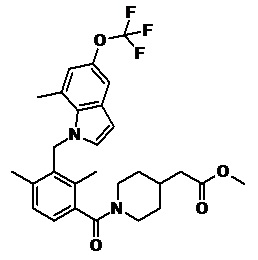
Используя процедуру, аналогичную примеру A, стадии 6, метил-2-(1-(2,4-диметил-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетат (135 мг, 90%) получали из 2,4-диметил-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензойной кислоты (110 мг, 0,29 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (68 мг, 0,35 ммоль). LC/MS (Способ j): Время удерживания=2,08 мин.; MS масса/заряд: 517 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,35 (s, 1H), 7,20 (m, 1H), 7,16 и 7,08 (d, J=9 Гц, 1H), 6,91 (s, 1H), 6,49 (m, 1H), 6,40 (m, 1H), 5,68 (s, 2H), 4,52 (m, 1H), 3,59 и 3,57 (s, 3H), 3,27 (m, 1H), 2,97 (m, 1H), 2,92 (s, 3H), 2,76 (m, 1H), 2,30 (m, 2H), 2,24 (s, 3H), 2,10 и 2,05 (s, 3H), 1,92 (m, 1H), 1,75 (m, 1H), 1,55 (m, 1H), 1,12 (m, 2H).
Стадия 4: 2-(1-(2,4-диметил-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
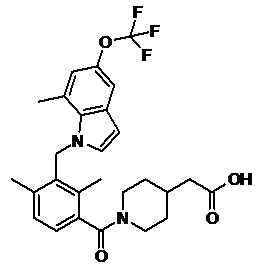
Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-диметил-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (115 мг, 85%) получали из метил-2-(1-(2,4-диметил-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетата (130 мг, 0,25 ммоль). LC/MS (Способ g): Время удерживания=1,84 мин.; MS масса/заряд: 503 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 11,90 (br, 1H), 7,35 (s, 1H), 7,22 и 7,21 (d, J=7,7 Гц, 1H), 7,16 и 7,09 (d, J=7,7 Гц, 1H), 6,91 (s, 1H), 6,49 (m, 1H), 6,40 (m, 1H), 5,68 (m, 2H), 4,51 (m, 1H), 3,27 (m, 1H), 2,98 (m, 1H), 2,92 (s, 3H), 2,75 (m, 1H), 2,25 (s, 3H), 2,16 (m, 2H), 2,10 и 2,05 (s, 3H), 1,92 (m, 1H), 1,74 (m, 1H), 1,53 (m, 1H), 1,05 (m, 2H).
Пример EL: 2-(1-(2,4-дихлор-3-(7-метил-5-(трифторметокси)-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)уксусная кислота

Стадия 1: трет-бутил-2,4-дихлор-3-(7-метил-5-(трифторметокси)-1H-индол-1-карбонил)бензоат
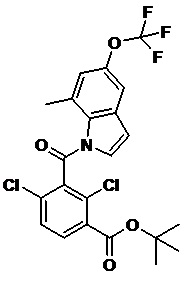
Используя процедуру, аналогичную примеру DJ, стадии 1, трет-бутил-2,4-дихлор-3-(7-метил-5-(трифторметокси)-1H-индол-1-карбонил)бензоат (840 мг, 88%) получали из 7-метил-5-(трифторметокси)-1H-индола (получение 64) (600 мг, 2,8 ммоль) и трет-бутил-2,4-дихлор-3-(фторкарбонил)бензоата (631 мг, 2 ммоль) (получение 55). LC/MS (Способ j): Время удерживания=2,74 мин.; MS масса/заряд: 488 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,99 (d, J=8,4 Гц, 1H), 7,82 (d, J=8,4 Гц, 1H), 7,54 (s, 1H), 7,41 (d, J=3,8 Гц, 1H), 7,27 (m, 1H), 6,84 (d, J=3,8 Гц, 1H), 2,69 (s, 3H), 1,57 (s, 9H).
Стадия 2: 2,4-дихлор-3-(7-метил-5-(трифторметокси)-1H-индол-1-карбонил)бензойная кислота

Используя процедуру, аналогичную примеру DJ, стадии 2, 2,4-дихлор-3-(7-метил-5-(трифторметокси)-1H-индол-1-карбонил)бензойную кислоту (705 мг, 97%) получали из трет-бутил-2,4-дихлор-3-(7-метил-5-(трифторметокси)-1H-индол-1-карбонил)бензоата (807 мг, 1,65 ммоль). LC/MS (Способ j): Время удерживания=1,77 мин.; MS масса/заряд: 432 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 13,90 (широкий, 1H), 8,03 (d, J=8,6 Гц, 1H), 7,81 (d, J=8,6 Гц, 1H), 7,54 (s, 1H), 7,38 (d, J=3,8 Гц, 1H), 7,27 (m, 1H), 6,84 (d, J=3,8 Гц, 1H), 2,70 (s, 3H).
Стадия 3: метил-2-(1-(2,4-дихлор-3-(7-метил-5-(трифторметокси)-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)ацетат
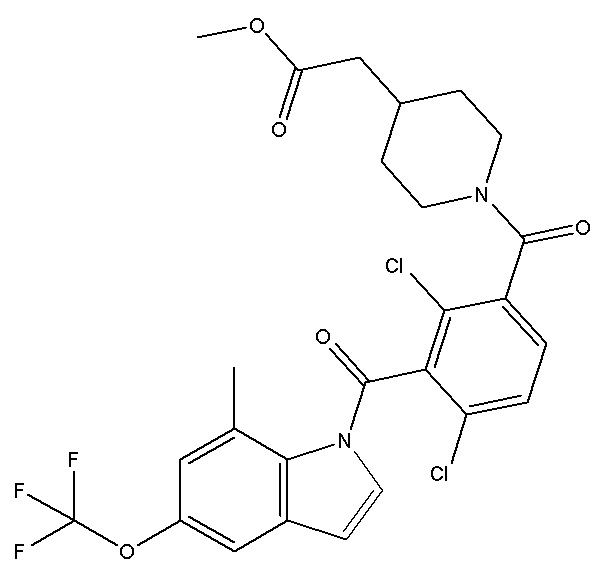
Используя процедуру, аналогичную примеру A, стадии 6, метил-2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетат (240 мг, 82%) получали из 2,4-дихлор-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензойной кислоты (200 мг, 0,48 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (111 мг, 0,57 ммоль). LC/MS (Способ j): Время удерживания=2,14 мин.; MS масса/заряд: 557 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,70 и 7,71 (d, J=8,3 Гц, 1H), 7,53 и 7,45 (d, J=8,3 Гц, 1H), 7,37 (s, 1H), 6,94 (s, 1H), 6,69 (m, 1H), 6,46 (m, 1H), 5,89 (m, 2H), 4,46 (m, 1H), 3,59 и 3,57 (s, 3H), 3,26 (m, 1H), 3,03 (m, 1H), 2,99 (s, 3H), 2,79 (m, 1H), 2,27 (m, 2H), 1,97 (m, 1H), 1,75 (m, 1H), 1,57 (m, 1H), 1,05-1,27 (m, 2H).
Стадия 4: 2-(1-(2,4-дихлор-3-(7-метил-5-(трифторметокси)-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)уксусная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (150 мг, 67%) получали из метил-2-(1-(2,4-дихлор-3-((7-метил-5-(трифторметокси)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетата (230 мг, 0,41 ммоль). LC/MS (Способ g): Время удерживания=1,88 мин.; MS масса/заряд: 543 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 12,08 (m, 1H), 7,69 (m, 1H), 7,53 и 7,45 (d, J=8,1Гц, 1H), 7,37 (s, 1H), 6,93 (s, 1H), 6,69 и 6,68 (d, J=8,1Гц 1H), 6,46 (m, 1H), 5,89 (m, 2H), 4,46 (m, 1H), 3,29 (m, 1H), 3,03 (m, 1H), 2,89 (s, 3H), 2,80 (m, 1H), 2,15(m, 2H), 1,93(m, 1H), 1,77 (m, 1H), 1,60 (m, 1H), 1,12( m, 2H).
Таблица EL. Следующие примеры получали из 2,4-дихлор-3-(7-метил-5-(трифторметокси)-1H-индол-1-карбонил)бензойной кислоты (пример EL, стадия 2) при помощи такой же процедуры с соответствующими аминами, как описано в примере EL, стадиях 3 и 4.
|
Пример EM: 2-(1-(2,4-дихлор-3-((5-(дифторметокси)-7-метил-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
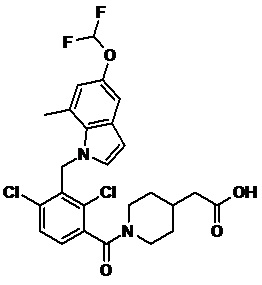
Стадия 1: метил-2,4-дихлор-3-((5-(дифторметокси)-7-метил-1H-индол-1-ил)метил)бензоат

Используя процедуру, аналогичную примеру DH, стадии 1, метил-2,4-дихлор-3-((5-(дифторметокси)-7-метил-1H-индол-1-ил)метил)бензоат (300 мг, 47%) получали из 5-(дифторметокси)-7-метил-1H-индола (получение 65) (280 мг, 1,42 ммоль) и метил-3-(бромметил)-2,4-дихлорбензоата (423 мг, 1,42 ммоль) (получение №1, стадия B). LC/MS (Способ i): Время удерживания=2,63 мин.; MS масса/заряд: 414 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,87 (d, J=8,4 Гц, 1H), 7,75 (d, J=8,4 Гц, 1H), 7,17 (s, 1H), 7,10 (t, J=75 Гц, 1H), 6,81(m, 1H), 6,61 (d, J=3,1Гц, 1H), 6,39 (d, J=3,1Гц, 1H), 5,90 (s, 2H), 3,88 (s, 3H), 2,87 (s, 3H).
Стадия 2: 2,4-дихлор-3-((5-(дифторметокси)-7-метил-1H-индол-1-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((5-(дифторметокси)-7-метил-1H-индол-1-ил)метил)бензойную кислоту (270 мг, 93%) получали из метил-2,4-дихлор-3-((5-(дифторметокси)-7-метил-1H-индол-1-ил)метил)бензоата (295 мг, 0,7 ммоль). LC/MS (Способ i): Время удерживания=2,29 мин.; MS масса/заряд: 400 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 13,74 (широкий, 1H), 7,83 (d, J=8,4 Гц, 1H), 7,70 (d, J=8,4 Гц, 1H), 7,17 (m, 1H), 7,10 (t, J=75 Гц, 1H), 6,80 (m, 1H), 6,60 (m, 1H), 6,39 (m, 1H), 5,89 (s, 2H), 2,87 (s, 3H).
Стадия 3: метил-2-(1-(2,4-дихлор-3-((5-(дифторметокси)-7-метил-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетат

Используя процедуру, аналогичную примеру A, стадии 6, метил-2-(1-(2,4-дихлор-3-((5-(дифторметокси)-7-метил-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетат (120 мг, 83%) получали из 2,4-дихлор-3-((5-(дифторметокси)-7-метил-1H-индол-1-ил)метил)бензойной кислоты (100 мг, 0,25 ммоль) и метил-2-(пиперидин-4-ил)ацетата гидрохлорида (53 мг, 0,27 ммоль). LC/MS (Способ i): Время удерживания=2,50 мин.; MS масса/заряд: 539 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,69 и 7,68 (dd, J=8,3 Гц, 1H), 7,52 и 7,44 (d, J=8,3 Гц, 1H), 7,17 (m, 1H), 7,10 (t, J=75 Гц, 1H), 6,80 (m, 1H), 6,63 (m, 1H), 6,40 (m, 1H), 5,87 (m, 2H), 4,46 (m, 1H), 3,59 и 3,57 (s, 3H), 3,26 (m, 1H), 3,03 (m, 1H), 2,88 (s, 3H), 2,81 (m, 1H), 2,28 (m, 2H), 1,97 (m, 1H), 1,75 (m, 1H), 1,56 (m, 1H), 1,13 (m, 2H).
Стадия 4: 2-(1-(2,4-дихлор-3-((5-(дифторметокси)-7-метил-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((5-(дифторметокси)-7-метил-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (105 мг, 85%) получали из метил-2-(1-(2,4-дихлор-3-((5-(дифторметокси)-7-метил-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетата (120 мг, 0,22 ммоль). LC/MS (Способ g): Время удерживания=1,71 мин.; MS масса/заряд: 525 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 11,13 (широкий, 1H), 7,69 и 7,68 (d, J=8,4 Гц, 1H), 7,52 и 7,45 (d, J=8,4 Гц, 1H), 7,17 (m, 1H), 7,10 (t, J=75 Гц 1H), 6,80 (m, 1H), 6,63 (m, 1H), 6,40 (m, 1H), 5,87 (m, 2H), 4,47 (m, 1H), 3,29 (m, 1H), 3,06 (m, 1H), 2,86 (s, 3H), 2,81 (m, 1H), 2,17 (m, 2H), 1,93 (m, 1H), 1,78 (m, 1H), 1,61 (m, 1H), 1,14 (m, 2H).
Пример EN: 2-(1-(2,4-дихлор-3-((5-циклопропил-7-фтор-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Стадия 1: метил-2,4-дихлор-3-((5-циклопропил-7-фтор-1H-индол-1-ил)метил)бензоат

Используя процедуру, аналогичную примеру DH, стадии 1, метил-2,4-дихлор-3-((5-циклопропил-7-фтор-1H-индол-1-ил)метил)бензоат (610 мг, 68%) получали из 5-циклопропил-7-фтор-1H-индола (получение 66) (400 мг, 2,28 ммоль) и метил-3-(бромметил)-2,4-дихлорбензоата (680 мг, 2,28 ммоль) (получение №1, стадия B). LC/MS (Способ i): Время удерживания=2,84 мин.; MS масса/заряд: 392 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,83 (d, J=8,4 Гц, 1H), 7,72 (d, J=8,4 Гц, 1H), 7,10 (m, 1H), 6,75 (m, 2H), 6,38 (m, 1H), 5,76 (m, 2H), 3,87 (s, 3H), 1,98 (m, 1H), 0,92 (m, 2H), 0,66 (m, 2H).
Стадия 2: 2,4-дихлор-3-((5-циклопропил-7-фтор-1H-индол-1-ил)метил)бензойная кислота
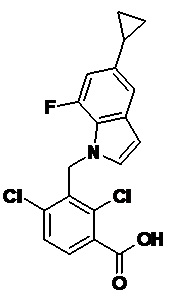
Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((5-циклопропил-7-фтор-1H-индол-1-ил)метил)бензойную кислоту (602 мг, 97%) получали из метил-2,4-дихлор-3-((5-циклопропил-7-фтор-1H-индол-1-ил)метил)бензоата (610 мг, 1,55 ммоль). LC/MS (Способ i): Время удерживания=2,49 мин.; MS масса/заряд: 378 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,77 (d, J=8,4 Гц, 1H), 7,66 (d, J=8,4 Гц, 1H), 7,10 (m, 1H), 6,76 (m, 2H), 6,38 (m, 1H), 5,75 (s, 2H), 1,98 (m, 1H), 0,93 (m, 2H), 0,67 (m, 2H).
Стадия 3: метил-2-(1-(2,4-дихлор-3-((5-циклопропил-7-фтор-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетат
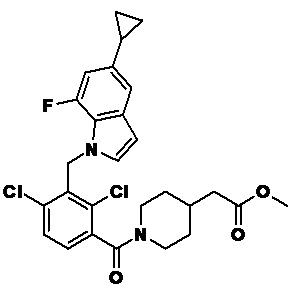
Используя процедуру, аналогичную примеру A1, метил-2-(1-(2,4-дихлор-3-((5-циклопропил-7-фтор-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетат (115 мг, 84%) получали из 2,4-дихлор-3-((5-циклопропил-7-фтор-1H-индол-1-ил)метил)бензойной кислоты (100 мг, 0,26 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (102 мг, 0,52 ммоль). LC/MS (Способ i): Время удерживания=2,69 мин.; MS масса/заряд: 517 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,67 и 7,65 (d, J=8,3 Гц, 1H), 7,48 и 7,40 (d, J=8,3 Гц, 1H), 7,10 (m, 1H), 6,80 (m, 1H), 6,74 и 6,69 (s, 1H), 6,39 (m, 1H), 5,69-5,73 (m, 2H), 4,45 (m, 1H), 3,59 и 3,57 (s, 3H), 3,28 (m, 1H), 3,02 (m, 1H), 2,77 (m, 1H), 2,27 (m, 2H), 1,98 (m, 2H), 1,75 (m, 1H), 1,57 (m, 1H), 1,17 (m, 2H), 0,90 (m, 2H), 0,66 (m, 2H).
Стадия 4: 2-(1-(2,4-дихлор-3-((5-циклопропил-7-фтор-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
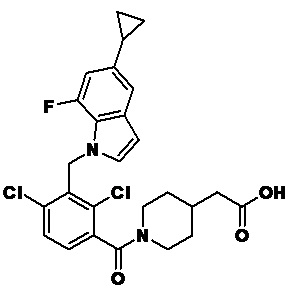
Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((5-циклопропил-7-фтор-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (114 мг, 99%) получали из метил-2-(1-(2,4-дихлор-3-((5-циклопропил-7-фтор-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетата (115 мг, 0,22 ммоль). LC/MS (Способ g): Время удерживания=1,88 мин.; MS масса/заряд: 503 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 12,10 (широкий, 1H), 7,66 и 7,64 (d, J=8,4 Гц, 1H), 7,49 и 7,41 (d, J=8,4 Гц, 1H), 7,10 (m, 1H), 6,80 (m, 1H), 6,73 и 6,70 (s, 1H), 6,40 (m, 1H), 5,73 (m, 2H), 4,46 (m, 1H), 3,25 (m, 1H), 3,02 (m, 1H), 2,78 (m, 1H), 2,17 (m, 2H), 1,94 (m, 2H), 1,76 (m, 1H), 1,59 (m, 1H), 1,13 (m, 2H), 0,90 (m, 2H), 0,66 (m, 2H).
Пример EO: 2-(1-(2,4-дихлор-3-(5-циклопропил-7-фтор-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)уксусная кислота

Стадия 1: трет-бутил-2,4-дихлор-3-(5-циклопропил-7-фтор-1H-индол-1-карбонил)бензоат
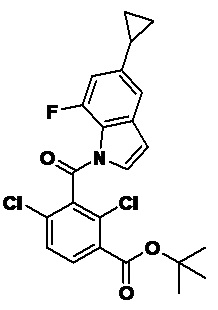
Используя процедуру, аналогичную примеру DJ, стадии 1, трет-бутил-2,4-дихлор-3-(5-циклопропил-7-фтор-1H-индол-1-карбонил)бензоат (1,05 г, 94%) получали из 5-циклопропил-7-фтор-1H-индола (получение 66) (400 мг, 2,28 ммоль) и трет-бутил-2,4-дихлор-3-(фторкарбонил)бензоата (1 г, 3,4 ммоль) (получение 55). LC/MS (Способ i): Время удерживания=2,89 мин.; MS масса/заряд: 448 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,98 (d, J=9 Гц, 1H), 7,79 (d, J=9 Гц, 1H), 7,28 (d, J=3,8 Гц, 1H), 7,21 (s, 1H), 6,99 (m, 1H), 5,76 (s, 1H), 2,05 (m, 1H), 1,56 (m, 9H), 0,99 (m, 2H), 0,75 (m, 2H).
Стадия 2: 2,4-дихлор-3-(5-циклопропил-7-фтор-1H-индол-1-карбонил)бензойная кислота

Используя процедуру, аналогичную примеру DJ, стадии 2, 2,4-дихлор-3-(5-циклопропил-7-фтор-1H-индол-1-карбонил)бензойную кислоту (834 мг, 91%) получали из трет-бутил-2,4-дихлор-3-(5-циклопропил-7-фтор-1H-индол-1-карбонил)бензоата (1 г, 2,3 ммоль). LC/MS (Способ i): Время удерживания=2,23 мин.; MS масса/заряд: 392 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 13,86 (широкий, 1H), 8,03 (d, J=9Гц, 1H), 7,79 (d, J=9Гц, 1H), 7,25 (m, 2H), 6,97 (m, 1H), 6,76 (m, 1H), 2,05 (m, 1H), 0,99 (m, 2H), 0,75 (m, 2H).
Стадия 3: метил-2-(1-(2,4-дихлор-3-(5-циклопропил-7-фтор-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)ацетат

Используя процедуру, аналогичную примеру A1, метил-2-(1-(2,4-дихлор-3-(5-циклопропил-7-фтор-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)ацетат (107 мг, 79%) получали из 2,4-дихлор-3-(5-циклопропил-7-фтор-1H-индол-1-карбонил)бензойной кислоты (100 мг, 0,25 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (74 мг, 0,38 ммоль). LC/MS (Способ i): Время удерживания=2,50 мин.; MS масса/заряд: 531 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ=8,13-7,14 (m, 4H), 7,02-6,74 (m, 2H), 4,45 (m, 1H), 3,62-3,56 (m, 3H), 3,26-3,15 (m, 1H), 3,05 (m, 1H), 2,80 (m, 1H), 2,28 (m, 2H), 1,99 (m, 2H), 1,76 (m, 1H), 1,60 (m, 1H), 1,15 (m, 2H), 0,97 (m, 2H), 0,73 (m, 2H).
Стадия 4: 2-(1-(2,4-дихлор-3-(5-циклопропил-7-фтор-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)уксусная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-(5-циклопропил-7-фтор-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)уксусную кислоту (80 мг, 77%) получали из метил-2-(1-(2,4-дихлор-3-(5-циклопропил-7-фтор-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)ацетата (107 мг, 0,2 ммоль). LC/MS (Способ g): Время удерживания=1,72 мин.; MS масса/заряд: 517 [M+H]+; 1H ЯМР (DMSO-d6, 500МГц): δ 12,04 (широкий, 1H), 8,12-7,16 (m, 4H), 7,00-6,73 (m, 2H), 4,45 (m, 1H), 3,56 (m, 1H), 3,22 (m, 1H), 3,05 (m, 1H), 2,80 (m, 1H), 2,19 (m, 1H), 2,05 (m, 1H), 1,95 (m, 1H), 1,78 (m, 1H), 1,63 (m, 1H), 1,13 (m, 2H), 0,99 (m, 2H), 0,75 (m, 2H).
Пример EP: 2-(1-(2,4-дихлор-3-((7-фтор-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Стадия 1: метил-2,4-дихлор-3-((7-фтор-5-(трифторметил)-1H-индол-1-ил)метил)бензоат

Используя процедуру, аналогичную примеру DH, стадии 1, метил-2,4-дихлор-3-((7-фтор-5-(трифторметил)-1H-индол-1-ил)метил)бензоат (324 мг, 69%) получали из 7-фтор-5-(трифторметил)-1H-индол (получение 67) (225 мг, 1,1 ммоль) и метил-3-(бромметил)-2,4-дихлорбензоата (350 мг, 1,1 ммоль) (получение №1, стадия B). LC/MS (Способ i): Время удерживания=2,81 мин.; MS масса/заряд: 420 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,85 (m, 2H), 7,72 (d, J=8,4Гц, 1H), 7,38 (m, 1H), 7,07 (d, J=3,3 Гц, 1H), 6,71 (m, 1H), 5,88 (s, 2H), 3,87 (s, 3H).
Стадия 2: 2,4-дихлор-3-((7-фтор-5-(трифторметил)-1H-индол-1-ил)метил)бензойная кислота
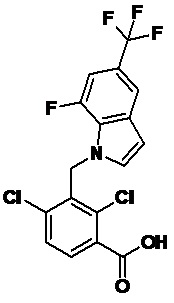
Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((7-фтор-5-(трифторметил)-1H-индол-1-ил)метил)бензойную кислоту (299 мг, 97%) получали из метил-2,4-дихлор-3-((7-фтор-5-(трифторметил)-1H-индол-1-ил)метил)бензоата (320 мг, 0,76 ммоль). LC/MS (Способ i): Время удерживания=2,47 мин.; MS масса/заряд: 406 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 13,73 (широкий, 1H), 7,85 (s, 1H), 7,82 (d, J=8,3 Гц, 1H), 7,70 (J=8,3 Гц, 1H), 7,39 (m, 1H), 7,06 (d, J=3,3 Гц, 1H), 6,71 (m, 1H), 5,88 (s, 2H).
Стадия 3: метил-2-(1-(2,4-дихлор-3-((7-фтор-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетат

Используя процедуру, аналогичную примеру A1, метил-2-(1-(2,4-дихлор-3-((7-фтор-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетат (103 мг, 77%) получали из 2,4-дихлор-3-((7-фтор-5-(трифторметил)-1H-индол-1-ил)метил)бензойной кислоты (100 мг, 0,26 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (71 мг, 0,36 ммоль). LC/MS (Способ i): Время удерживания=2,67 мин.; MS масса/заряд: 545 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,86 (s, 1H), 7,68 и 7,66 (d, J=8,3 Гц, 1H), 7,50 и 7,43 (d, J=8,3 Гц, 1H), 7,38 (m, 1H), 7,08 (m, 1H), 6,72 (m, 1H), 5,84 (m, 2H), 4,45 (m, 1H), 3,59 и 3,57 (s, 3H), 3,28 (m, 1H), 3,02 (m, 1H), 2,77 (m, 1H), 2,27 (m, 2H), 1,96 (m, 1H), 1,76 (m, 1H), 1,56 (m, 1H), 1,14 (m, 2H).
Стадия 4: 2-(1-(2,4-дихлор-3-((7-фтор-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
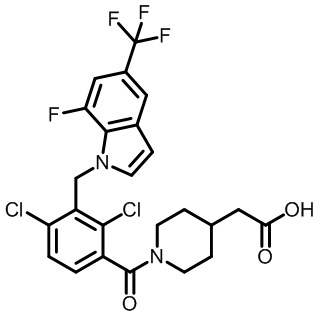
Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((7-фтор-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (84 мг, 83%) получали из метил-2-(1-(2,4-дихлор-3-((7-фтор-5-(трифторметил)-1H-индол-1-ил)метил)бензоил)пиперидин-4-ил)ацетата (103 мг, 0,17 ммоль). LC/MS (Способ g): Время удерживания=1,87 мин.; MS масса/заряд: 531 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 12,11 (br, 1H), 7,86 (s, 1H), 7,68 и 6,66 (d, J=8,3 Гц, 1H), 7,51 и 7,43 (d, J=8,3 Гц, 1H), 7,38 (m, 1H), 7,08 (m, 1H), 6,72 (m, 1H), 5,84 (m, 2H), 4,45 (m, 1H), 3,27 (m, 1H), 3,02 (m, 1H), 2,80 (m, 1H), 2,17 (m, 2H), 1,92 (m, 1H), 1,76 (m, 1H), 1,59 (m, 1H), 1,14 (m, 2H).
Пример EQ: 2-(1-(4,6-дихлор-5-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)никотиноил)пиперидин-4-ил)уксусная кислота
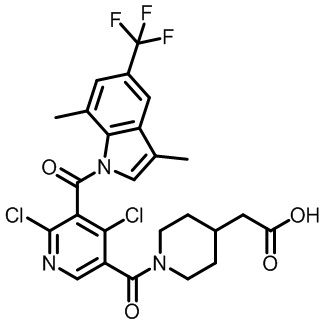
Стадия 1: трет-бутил-4,6-дихлор-5-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)никотинат

Используя процедуру, аналогичную примеру DJ, стадии 1, трет-бутил-4,6-дихлор-5-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)никотинат (1,36 г, 63%) получали из 3,7-диметил-5-(трифторметил)-1H-индола (получение №43) (0,95 г, 4,46 ммоль) и трет-бутил-4,6-дихлор-5-(хлоркарбонил)никотината (2,07 г, 6,68 ммоль) (получение 56). LC/MS (Способ i): Время удерживания=2,81 мин.; MS масса/заряд: 487 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 9,01 (s, 1H), 7,82 (s, 1H), 7,62 (s, 1H), 7,56 (s, 1H), 2,73 (s, 3H), 2,22 (s, 3H), 1,59 (s, 9H).
Стадия 2: 4,6-дихлор-5-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)никотиновая кислота

Используя процедуру, аналогичную примеру DJ, стадии 2, 4,6-дихлор-5-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)никотиновую кислоту (1,48 г, 100%) получали из трет-бутил-4,6-дихлор-5-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)никотината (1,36 г, 2,79 ммоль). LC/MS (Способ i): Время удерживания=2,30 мин.; MS масса/заряд: 431 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 14,20 (широкий, 1H), 9,04 (s, 1H), 7,82 (s, 1H), 7,62 (s, 1H), 7,54 (s, 1H), 2,73 (s, 3H), 2,22 (s, 3H).
Стадия 3: метил-2-(1-(4,6-дихлор-5-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)никотиноил)пиперидин-4-ил)ацетат

Используя процедуру, аналогичную примеру A1, метил-2-(1-(4,6-дихлор-5-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)никотиноил)пиперидин-4-ил)ацетат (280 мг, 42%) получали из 4,6-дихлор-5-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)никотиновой кислоты (500 мг, 1,16 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (337 мг, 1,74 ммоль). LC/MS (Способ i): Время удерживания=2,48 мин.; MS масса/заряд: 570 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,70 (m, 1H), 7,83 (s, 1H), 7,72 и 7,50 (m, 1H), 7,61 (s, 1H), 4,47 (m, 1H), 3,72 (m, 1H), 3,60 (m, 3H), 3,10 (m, 1H), 2,86 (m, 1H), 2,71 (s, 3H), 2,31 (m, 2H), 2,23 (s, 3H), 2,00 (m, 1H), 1,77 (m, 1H), 1,64 (m, 1H), 1,18 (m, 2H).
Стадия 4: 2-(1-(4,6-дихлор-5-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)никотиноил)пиперидин-4-ил)уксусная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(4,6-дихлор-5-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)никотиноил)пиперидин-4-ил)уксусную кислоту (176 мг, 64%) получали из метил-2-(1-(4,6-дихлор-5-(3,7-диметил-5-(трифторметил)-1H-индол-1-карбонил)никотиноил)пиперидин-4-ил)ацетата (278 мг, 0,48 ммоль). LC/MS (Способ g): Время удерживания=1,86 мин.; MS масса/заряд: 556 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 12,11 (широкий, 1H), 8,70 (m, 1H), 7,83 (s, 1H), 7,72 и 7,50 (m, 1H), 7,62 (s, 1H), 4,47 (m, 1H), 3,73 и 3,45 (m, 1H), 3,10 (m, 1H), 2,85 (m, 1H), 2,71 (s, 3H), 2,23 (s, 3H), 2,17 (m, 2H), 1,96 (m, 1H), 1,75 (m, 1H), 1,66 (m, 1H), 1,15 (m, 2H).
Пример ER: 2-(1-(4,6-дихлор-5-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)никотиноил)пиперидин-4-ил)уксусная кислота
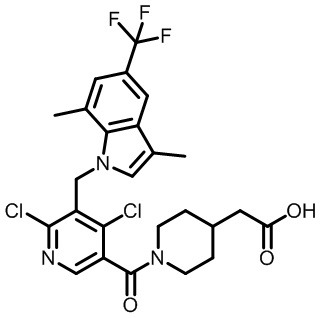
Стадия 1: трет-бутил-4,6-дихлор-5-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)никотинат

Используя процедуру, аналогичную примеру DH, стадии 1, трет-бутил-4,6-дихлор-5-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)никотинат (85 мг, 28%) получали из 3,7-диметил-5-(трифторметил)-1H-индола (получение №43) (100 мг, 0,47 ммоль) и трет-бутил-4,6-дихлор-5-(((метилсульфонил)окси)метил)никотината (167 мг, 0,47 ммоль) (получение 57). LC/MS (Способ j): Время удерживания=2,66 мин.; MS масса/заряд: 473 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,82 (s, 1H), 7,69 (s, 1H), 7,23 (s, 1H), 6,74 (s, 1H), 5,90 (s, 2H), 2,91 (s, 3H), 2,18 (s, 3H), 1,57 (s, 9H).
Стадия 2: 4,6-дихлор-5-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)никотиновая кислота

Используя процедуру, аналогичную примеру DJ, стадии 2, 4,6-дихлор-5-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)никотиновую кислоту (80 мг, 70%) получали из трет-бутил-4,6-дихлор-5-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)никотината (85 мг, 0,18 ммоль). LC/MS (Способ i): Время удерживания=2,30 мин.; MS масса/заряд: 417 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 14,14 (широкий, 1H), 8,85 (s, 1H), 7,69 (s, 1H), 7,23 (s, 1H), 6,72 (s, 1H), 5,91 (s, 2H), 2,91 (s, 3H), 2,18 (s, 3H).
Стадия 3: метил-2-(1-(4,6-дихлор-5-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)никотиноил)пиперидин-4-ил)ацетат
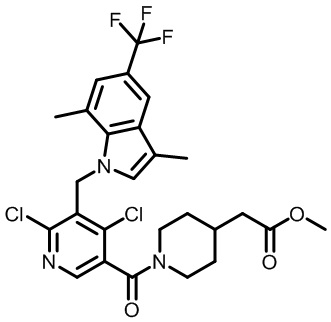
Используя процедуру, аналогичную примеру A, стадии 6, метил-2-(1-(4,6-дихлор-5-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)никотиноил)пиперидин-4-ил)ацетат (60 мг, 60%) получали из 4,6-дихлор-5-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)никотиновой кислоты (70 мг, 0,17 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (41,8 мг, 0,21 ммоль). LC/MS (Способ i): Время удерживания=2,58 мин.; MS масса/заряд: 556 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,56 и 8,49 (s, 1H), 7,69 (s, 1H), 7,23 (s, 1H), 6,76 и 6,73 (s, 1H), 5,88 (m, 2H), 4,46 (m, 1H), 3,50 и 3,57 (s, 3H), 3,40 (m, 1H), 3,07 (m, 1H), 2,90 (s, 3H), 2,84 (m, 1H), 2,29 (s, 2H), 2,19 (s, 3H), 1,99 (m, 1H), 1,76 (m, 1H), 1,60 (m, 1H), 1,17 (m, 2H).
Стадия 4: 2-(1-(4,6-дихлор-5-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)никотиноил)пиперидин-4-ил)уксусная кислота

Используя процедуру, аналогичную примеру O, стадии 4, 2-(1-(4,6-дихлор-5-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)никотиноил)пиперидин-4-ил)уксусную кислоту (36 мг, 70%) получали из метил-2-(1-(4,6-дихлор-5-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)никотиноил)пиперидин-4-ил)ацетата (50 мг, 0,09 ммоль). LC/MS (Способ g): Время удерживания=1,80 мин.; MS масса/заряд: 542 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 12,10 (широкий, 1H), 8,56 и 8,49 (s, 1H), 7,69 (s, 1H), 7,23 (s, 1H), 6,75 и 6,73 (s, 1H), 5,87 (m, 2H), 4,48 (m, 1H), 3,40 (m, 1H), 3,07 (m, 1H), 2,90 (s, 3H), 2,83 (m, 1H), 2,19 (m, 5H), 1,95 (m, 1H), 1,80 (m, 1H), 1,63 (m, 1H), 1,17 (m, 2H).
Пример ES: 2-(1-(2,4-дихлор-3-(7-метил-5-(трифторметил)-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)уксусная кислота
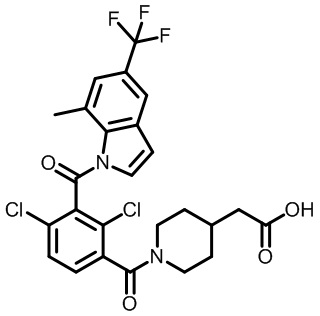
Стадия 1: трет-бутил-2,4-дихлор-3-(7-метил-5-(трифторметил)-1H-индол-1-карбонил)бензоат

Используя процедуру, аналогичную примеру DJ, стадии 1, трет-бутил-2,4-дихлор-3-(7-метил-5-(трифторметил)-1H-индол-1-карбонил)бензоат (684 мг, 72%) получали из 7-метил-5-(трифторметил)-1H-индола (получение №49) (400 мг, 2 ммоль) и трет-бутил-2,4-дихлор-3-(хлоркарбонил)бензоата (684 мг, 2,2 ммоль) (получение №44). LC/MS (Способ j): Время удерживания=2,61 мин.; MS масса/заряд: 472 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,00 (d, J=8,4 Гц, 1H), 7,93 (s, 1H), 7,83 (d, J=8,4 Гц, 1H), 7,60 (s, 1H), 7,48 (d, J=4,0 Гц, 1H), 6,92 (d, J=4,0 Гц, 1H), 2,74 (s, 3H), 1,57 (s, 9H).
Стадия 2: 2,4-дихлор-3-(7-метил-5-(трифторметил)-1H-индол-1-карбонил)бензойная кислота

Используя процедуру, аналогичную примеру DJ, стадии 2, 2,4-дихлор-3-(7-метил-5-(трифторметил)-1H-индол-1-карбонил)бензойную кислоту (595 мг, 99%) получали из трет-бутил-2,4-дихлор-3-(7-метил-5-(трифторметил)-1H-индол-1-карбонил)бензоата (684 мг, 1,5 ммоль). LC/MS (Способ j): Время удерживания=1,68 мин.; MS масса/заряд: 416 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 13,91 (широкий, 1H), 8,06 (d, J=8,4 Гц, 1H), 7,93 (s, 1H), 7,82 (d, J=8,4 Гц, 1H), 7,60 (s, 1H), 7,45 (d, J=3,8 Гц, 1H), 6,92 (d, J=3,8 Гц, 1H), 2,74 (s, 3H).
Стадия 3: метил-2-(1-(2,4-дихлор-3-(7-метил-5-(трифторметил)-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)ацетат

Используя процедуру, аналогичную примеру A, стадии 6, метил-2-(1-(2,4-дихлор-3-(7-метил-5-(трифторметил)-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)ацетат (118 мг, 88%) получали из 2,4-дихлор-3-(7-метил-5-(трифторметил)-1H-индол-1-карбонил)бензойной кислоты (100 мг, 0,24 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (93 мг, 0,48 ммоль). LC/MS (Способ i): Время удерживания=2,58 мин.; MS масса/заряд: 555 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,93 (m, 1H), 7,82 и 7,80 (d, J=8,4 Гц, 1H), 7,72-7,35 (m, 3H), 6,93 (m, 1H), 4,45 (m, 1H), 3,56 (m, 4H), 3,06 (m, 1H), 2,81 (m, 1H), 2,72 (s, 3H), 2,28 (m, 2H), 1,99 (m, 1H), 1,69-1,77 (m, 1H), 1,61 (m, 1H), 1,18 (m, 2H).
Стадия 4: 2-(1-(2,4-дихлор-3-(7-метил-5-(трифторметил)-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)уксусная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-(7-метил-5-(трифторметил)-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)уксусную кислоту (99 мг, 84%) получали из метил-2-(1-(2,4-дихлор-3-(7-метил-5-(трифторметил)-1H-индол-1-карбонил)бензоил)пиперидин-4-ил)ацетата (118 мг, 0,21 ммоль). LC/MS (Способ g): Время удерживания=1,86 мин.; MS масса/заряд: 541 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 12,16 (широкий, 1H), 7,93 (m, 1H), 7,81 и 7,80 (d, J=8,4 Гц, 1H), 7,72-7,36 (m, 3H), 6,93 (m, 1H), 4,47 (m, 1H), 3,55 и 3,24 (m, 1H), 3,06 (m, 1H), 2,81 (m, 1H), 2,72 (s, 3H), 2,18 (m, 2H), 1,95 (m, 1H), 1,77 (m, 1H), 1,63 (m, 1H), 1,16 (m, 2H).
Пример ET: (2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин-1-ил)метил)фенил)(морфолинo)метанон
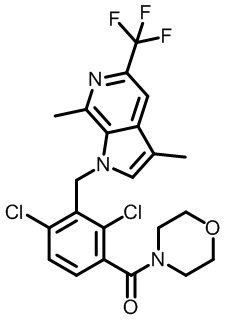
Используя процедуру, аналогичную примеру DH, стадии 1, (2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин-1-ил)метил)фенил)(морфолинo)метанон (101 мг, 67%) получали из 3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридина (получение 68) (66 мг, 0,31 ммоль) и (2,4-дихлор-3-(хлорметил)фенил)(морфолинo)метанона (105 мг, 0,34 ммоль) (получение №11). LC/MS (Способ g): Время удерживания=1,68 мин.; MS масса/заряд: 486 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 7,87 (s, 1H), 7,73 (d, J=8,4 Гц, 1H), 7,55 (d, J=8,4 Гц, 1H), 6,83 (m, 1H), 5,96 (d, J=15 Гц, 1H), 5,89 (d, J=15 Гц, 1H), 3,64 (m, 4H), 3,54 (m, 2H), 3,19 (m, 2H), 3,08 (s, 3H), 2,20 (m, 3H).
Пример EU: 2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Стадия 1: метил-2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин-1-ил)метил)бензоат

Используя процедуру, аналогичную примеру DH, стадии 1, метил-2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин-1-ил)метил)бензоат (600 мг, 74%) получали из 3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридина (получение 68) (300 мг, 1,4 ммоль) и метил-3-(бромметил)-2,4-дихлорбензоата (417 мг, 1,4 ммоль) (получение №1, стадия B). LC/MS (Способ i): Время удерживания=2,60 мин.; MS масса/заряд: 431 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,90 (d, J=8,4 Гц, 1H), 7,87 (s, 1H), 7,76 (d, J=8,4 Гц, 1H), 6,82 (s, 1H), 5,96 (s, 2H), 3,88 (s, 3H), 3,09 (s, 3H), 2,19 (s, 3H).
Стадия 2: 2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин-1-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин-1-ил)метил)бензойную кислоту (610 мг, 99%) получали из метил-2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин-1-ил)метил)бензоата (600 мг, 1,4 ммоль). LC/MS (Способ i): Время удерживания=2,23 мин.; MS масса/заряд: 417 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,86 (s, 1H), 7,70 (d, J=8,4 Гц, 1H), 7,63 (d, J=8,4 Гц, 1H), 6,78 (s, 1H), 5,93 (s, 2H), 3,09 (s, 3H), 2,18 (s, 3H).
Стадия 3: метил-2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин-1-ил)метил)бензоил)пиперидин-4-ил)ацетат

Используя процедуру, аналогичную примеру A, стадии 6, метил-2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин-1-ил)метил)бензоил)пиперидин-4-ил)ацетат (225 мг, 73%) получали из 2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин-1-ил)метил)бензойной кислоты (230 мг, 0,55 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (117 мг, 0,60 ммоль). LC/MS (Способ i): Время удерживания=2,46 мин.; MS масса/заряд: 556 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,87 (s, 1H), 7,72 и 7,71 (d, J=8,3 Гц, 1H), 7,54 и 7,47 (d, J=8,3 Гц, 1H), 6,82 и 6,80 (s, 1H), 5,92 (m, 2H), 4,44 (m, 1H), 3,59 и 3,57 (s, 3H), 3,27 (m, 1H), 3,08 (s, 3H), 3,02 (m, 1H), 2,81 (m, 1H), 2,28 (m, 2H), 2,20 (s, 3H), 1,99 (m, 1H), 1,72 (m, 1H), 1,57 (m, 1H), 1,14 (m, 2H).
Стадия 4: 2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
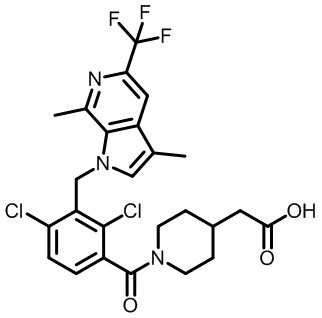
Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (130 мг, 59%) получали из метил-2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин-1-ил)метил)бензоил)пиперидин-4-ил)ацетата (225 мг, 0,40 ммоль). LC/MS (Способ g): Время удерживания=1,63 мин.; MS масса/заряд: 542 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 12,09 (широкий, 1H), 7,87 (s, 1H), 7,71 и 7,70 (d, J=8,3 Гц, 1H), 7,55 и 7,53 (d, J=8,3 Гц, 1H), 6,82 и 6,79 (s, 1H), 5,92 (m, 2H), 4,46 (m, 1H), 3,25 (m, 1H), 3,08 (s, 3H), 3,03 (m, 1H), 2,80 (m, 1H), 2,20 (s, 3H), 2,15 (m, 2H), 1,94 (m, 1H), 1,76 (m, 1H), 1,61 (m, 1H), 1,12 (m, 2H).
Пример EV: 2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин-1-карбонил)бензоил)пиперидин-4-ил)уксусная кислота
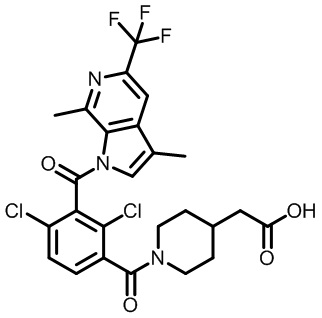
Стадия 1: трет-бутил-2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин-1-карбонил)бензоат
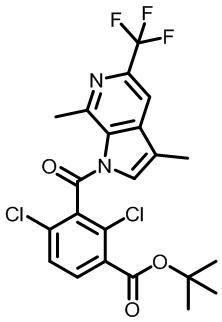
Используя процедуру, аналогичную примеру DJ, стадии 1, трет-бутил-2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин-1-карбонил)бензоат (690 мг, 68%) получали из 3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридина (получение 68) (350 мг, 1,6 ммоль) и трет-бутил-2,4-дихлор-3-(хлоркарбонил)бензоата (911 мг, 2,94 ммоль) (получение №44). LC/MS (Способ i): Время удерживания=2,80 мин.; MS масса/заряд: 487 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,05 (s, 1H), 8,03 (d, J=8,4 Гц, 1H), 7,84 (d, J=8,4 Гц, 1H), 7,57 (m, 1H), 2,92 (s, 3H), 2,24 (s, 3H), 1,57 (s, 9H).
Стадия 2: 2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин-1-карбонил)бензойная кислота
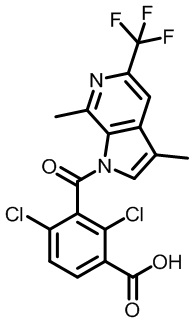
Используя процедуру, аналогичную примеру DJ, стадии 2, 2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин-1-карбонил)бензойную кислоту (370 мг, 52%) получали из трет-бутил-2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин-1-карбонил)бензоата (690 мг, 1,4 ммоль). LC/MS (Способ i): Время удерживания=2,19 мин.; MS масса/заряд: 431 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,08 (d, J=8,4 Гц, 1H), 8,05 (s, 1H), 7,84 (d, J=8,4 Гц, 1H), 7,55 (d, J=1,3 Гц, 1H), 2,93 (s, 3H), 2,24 (d, J=1,3 Гц, 3H).
Стадия 3: метил-2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин-1-карбонил)бензоил)пиперидин-4-ил)ацетат
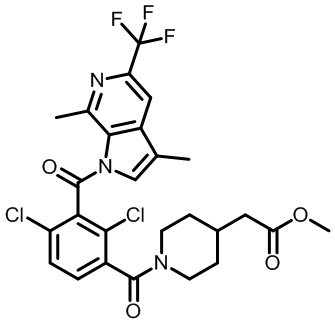
Используя процедуру, аналогичную примеру A, стадии 6, метил-2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин-1-карбонил)бензоил)пиперидин-4-ил)ацетат (85 мг, 58%) получали из 2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин-1-карбонил)бензойной кислоты (100 мг, 0,23 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (49 мг, 0,25 ммоль). LC/MS (Способ i): Время удерживания=2,45 мин.; MS масса/заряд: 570 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,05 (s, 1H), 7,83 (m, 1H), 7,67 (m, 1,5H), 7,48 (m, 0,5H), 4,46 (m, 1H), 3,60 (m, 3H), 3,28 (m, 1H), 3,06 (m, 1H), 2,91 (s, 3H), 2,82 (m, 1H), 2,30 (m, 2H), 2,25 и 2,24 (s, 3H), 1,98 (m, 1H), 1,77 (m, 1H), 1,62 (m, 1H), 1,17 (m, 2H).
Стадия 4: 2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин-1-карбонил)бензоил)пиперидин-4-ил)уксусная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин-1-карбонил)бензоил)пиперидин-4-ил)уксусную кислоту (48 мг, 57%) получали из метил-2-(1-(2,4-дихлор-3-(3,7-диметил-5-(трифторметил)-1H-пирроло[2,3-c]пиридин-1-карбонил)бензоил)пиперидин-4-ил)ацетата (85 мг, 0,15 ммоль). LC/MS (Способ g): Время удерживания=1,73 мин.; MS масса/заряд: 556 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 8,05 (s, 1H), 7,82 (m, 1H), 7,70 (m, 1,5H), 7,47 (m, 0,5H), 3,60 (m, 1H), 3,25 (m, 1H), 3,09 (m, 1H), 2,92 (s, 3H), 2,84 (m, 1H), 2,25 (s, 3H), 2,17 (m, 2H), 1,94 (m, 1H), 1,77 (m, 1H), 1,65 (m, 1H), 1,14 (m, 2H).
Пример EW: 2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Стадия 1: метил-2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-1-ил)метил)бензоат

Используя процедуру, аналогичную примеру DH, стадии 1, метил-2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-1-ил)метил)бензоат (579 мг, 96%) получали из 3,7-диметил-5-(трифторметил)-1H-пирроло[3,2-b]пиридина (300 мг, 1,4 ммоль) (получение 69) и метил-3-(бромметил)-2,4-дихлорбензоата (417 мг, 1,4 ммоль) (получение №1, стадия B). LC/MS (Способ i): Время удерживания=2,56 мин.; MS масса/заряд: 431 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,89 (d, J=8,0 Гц, 1H), 7,76 (d, J=8,0 Гц, 1H), 7,46 (s, 1H), 6,92 (m, 1H), 5,91 (s, 2H), 3,88 (s, 3H), 2,96 (s, 3H), 2,19 (m, 3H).
Стадия 2: 2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-1-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-1-ил)метил)бензойную кислоту (545 мг, 97%) получали из метил-2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-1-ил)метил)бензоата (579 мг, 1,34 ммоль). LC/MS (Способ i): Время удерживания=2,23 мин.; MS масса/заряд: 417 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 13,70 (широкий, 1H), 7,85 (d, J=8,4 Гц, 1H), 7,72 (d, J=8,4 Гц, 1H), 7,46 (s, 1H), 6,92 (m, 1H), 5,90 (s, 2H), 2,96 (s, 3H), 2,19 (m, 3H).
Стадия 3: метил-2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-1-ил)метил)бензоил)пиперидин-4-ил)ацетат

Используя процедуру, аналогичную примеру A, стадии 6, метил-2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-1-ил)метил)бензоил)пиперидин-4-ил)ацетат (86 мг, 64%) получали из 2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-1-ил)метил)бензойной кислоты (100 мг, 0,24 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (93 мг, 0,48 ммоль). LC/MS (Способ i): Время удерживания=2,44 мин.; MS масса/заряд: 556 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ=7,71 и 7,69 (d, J=8,3 Гц, 1H), 7,53 и 7,46 (d, J=8,3 Гц, 1H), 7,45 (s, 1H), 6,93 и 6,91 (m, 1H), 5,87 (m, 2H), 4,44 (m, 1H), 3,59 и 3,57 (s, 3H), 3,31 (m, 1H), 3,05 (m, 1H), 2,95 (s, 3H), 2,79 (m, 1H), 2,28 (m, 2H), 2,20 (m, 3H), 1,97 (m, 1H), 1,75 (m, 1H), 1,57 (m, 1H), 1,15 (m, 2H).
Стадия 4: 2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-1-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
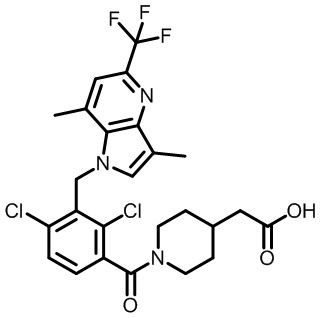
Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-1-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (64 мг, 80%) получали из метил-2-(1-(2,4-дихлор-3-((3,7-диметил-5-(трифторметил)-1H-пирроло[3,2-b]пиридин-1-ил)метил)бензоил)пиперидин-4-ил)ацетата (81 мг, 0,15 ммоль). LC/MS (Способ i): Время удерживания=2,20 мин.; MS масса/заряд: 542 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 12,18 (широкий, 1H), 7,70 и 7,69 (d, J=8,3 Гц, 1H), 7,53 и 7,46 (d, J=8,3 Гц, 1H), 7,45 (s, 1H), 6,94 и 6,91 (s, 1H), 5,87 (m, 2H), 4,46 (m, 1H), 3,28 (m, 1H), 3,03 (m, 1H), 2,94 (s, 3H), 2,79 (m, 1H), 2,20 (m, 3H), 2,13 (m, 2H), 1,92 (m, 1H), 1,76 (m, 1H), 1,61 (m, 1H), 1,14 (m, 2H).
Пример EX: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-индол-5-карбонитрил

Стадия 1: метил-2,4-дихлор-3-((5-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)бензоат
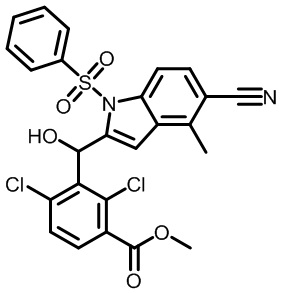
Используя процедуру, аналогичную примеру A, стадии 1, метил-2,4-дихлор-3-((5-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)бензоат (1,92 г, 76%) получали из N-(4-циано-2-йод-3-метилфенил)бензолсульфонамида (1,7 г, 4,3 ммоль) (получение 70) и метил-2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)бензоата (1,2 г, 4,7 ммоль) (получение №1). LC/MS (Способ i): Время удерживания=2,41 мин.; MS масса/заряд: 587 [M-H]-+CH3COOH; 1H ЯМР (DMSO-d6, 300МГц): δ 8,01 (d, J=8,8 Гц, 1H), 7,90 (m, 2H), 7,69 (m, 3H), 7,58 (m, 3H), 7,04 (d, J=5,8 Гц, 1H), 6,88 (s, 1H), 6,73 (d, J=5,8 Гц, 1H), 3,86 (s, 3H), 2,57 (s, 3H).
Стадия 2: метил-2,4-дихлор-3-((5-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)метил)бензоат (10459453-791-001)
Используя процедуру, аналогичную примеру A, стадии 2, метил-2,4-дихлор-3-((5-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)метил)бензоат (1,74 г, 85%) получали из метил-2,4-дихлор-3-((5-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)бензоата (1,9 г, 3,6 ммоль). LC/MS (Способ i): Время удерживания=2,74 мин.; MS масса/заряд: 513 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,14 (d, J=8,9 Гц, 1H), 7,99 (m, 2H), 7,82 (m, 2H), 7,86 (m, 4H), 6,05 (s, 1H), 4,62 (s, 2H), 3,87 (s, 3H), 2,46 (s, 3H).
Стадия 3: метил-2,4-дихлор-3-((5-циано-4-метил-1H-индол-2-ил)метил)бензоат
Используя процедуру, аналогичную примеру A, стадии 3, метил-2,4-дихлор-3-((5-циано-4-метил-1H-индол-2-ил)метил)бензоат (1,13 г, 83%) получали из метил-2,4-дихлор-3-((5-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)метил)бензоата (1,72 г, 3,3 ммоль). LC/MS (Способ i): Время удерживания=2,38 мин.; MS масса/заряд: 373 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 11,63 (s, 1H), 7,77 (d, J=8,4 Гц, 1H), 7,69 (d, J=8,4 Гц, 1H), 7,31 (s, 2H), 6,03 (m, 1H), 4,48 (s, 2H), 3,87 (s, 3H), 2,53 (s, 3H).
Стадия 4: метил-2,4-дихлор-3-((5-циано-1,4-диметил-1H-индол-2-ил)метил)бензоат

Используя процедуру, аналогичную примеру P, стадии 4, метил-2,4-дихлор-3-((5-циано-1,4-диметил-1H-индол-2-ил)метил)бензоат (1,1 г, 94%) получали из метил-2,4-дихлор-3-((5-циано-4-метил-1H-индол-2-ил)метил)бензоата (1,1 г, 2,95 ммоль). LC/MS (Способ i): Время удерживания=2,48 мин.; MS масса/заряд: 387 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,80 (d, J=8,1 Гц, 1H), 7,72 (d, J=8,1 Гц, 1H), 7,49 (d, J=8,6 Гц, 1H), 7,40 (d, J=8,6 Гц, 1H), 5,75 (s, 1H), 4,48 (s, 2H), 3,90 (s, 3H), 3,88 (s, 3H), 2,48 (s, 3H).
Стадия 5: 2,4-дихлор-3-((5-циано-1,4-диметил-1H-индол-2-ил)метил)бензойная кислота
Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((5-циано-1,4-диметил-1H-индол-2-ил)метил)бензойную кислоту (1,01 г, 93%) получали из метил-2,4-дихлор-3-((5-циано-1,4-диметил-1H-индол-2-ил)метил)бензоата (1,1 г, 2,81 ммоль). LC/MS (Способ i): Время удерживания=2,15 мин.; MS масса/заряд: 373 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 13,71 (широкий, 1H), 7,75 (d, J=8,4 Гц, 1H), 7,67 (d, J=8,4 Гц, 1H), 7,49 (d, J=8,8 Гц, 1H), 7,40 (d, J=8,8 Гц, 1H), 5,75 (s, 1H), 4,47 (s, 2H), 3,89 (s, 3H), 2,49 (s, 3H).
Стадия 6: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-индол-5-карбонитрил

Используя процедуру, аналогичную примеру A, стадии 6, 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-индол-5-карбонитрил (80 мг, 66%) получали из 2,4-дихлор-3-((5-циано-1,4-диметил-1H-индол-2-ил)метил)бензойной кислоты (100 мг, 0,27 ммоль) и морфолина (28 мг, 0,32 ммоль). LC/MS (Способ g): Время удерживания=1,60 мин.; MS масса/заряд: 442 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 7,68 (d, J=8,1 Гц, 1H), 7,49 (d, J=8,4 Гц, 1H), 7,46 (d, J=8,4 Гц, 1H), 7,40 (d, J=8,1 Гц, 1H), 5,77 (s, 1H), 4,44 (m, 2H), 3,89 (s, 3H), 3,65 (m, 4H), 3,54 (m, 2H), 3,19 (m, 2H), 2,49 (s, 3H).
Пример EY: 2-(1-(2,4-дихлор-3-((5-циано-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Стадия 1: метил-2-(1-(2,4-дихлор-3-((5-циано-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат

Используя процедуру, аналогичную примеру A, стадии 6, метил-2-(1-(2,4-дихлор-3-((5-циано-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат (150 мг, 84%) получали из 2,4-дихлор-3-((5-циано-1,4-диметил-1H-индол-2-ил)метил)бензойной кислоты (130 мг, 0,35 ммоль) (пример EX, стадия 5) и метил-(4-пиперидил)ацетата гидрохлорида (81 мг, 0,42 ммоль). LC/MS (Способ i): Время удерживания=2,33 мин.; MS масса/заряд: 512 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,66 и 7,64 (d, J=8,3 Гц, 1H), 7,43 (m, 3H), 5,76 и 7,72 (s, 1H), 4,46 (m, 3H), 3,89 (s, 3H), 3,59 и 3,56 (s, 3H), 3,30 (m, 1H), 3,04 (m, 1H), 2,80 (m, 1H), 2,49 и 2,47 (s, 3H), 2,27 (m, 2H), 1,96 (m, 1H), 1,75 (m, 1H), 1,59 (m, 1H), 1,14 (m, 2H).
Стадия 2: 2-(1-(2,4-дихлор-3-((5-циано-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((5-циано-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (122 мг, 88%) получали из метил-2-(1-(2,4-дихлор-3-((5-циано-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетата (140 мг, 0,27 ммоль). LC/MS (Способ g): Время удерживания=1,56 мин.; MS масса/заряд: 498 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 12,10 (широкий, 1H), 7,66 и 7,64 (d, J=8,4 Гц, 1H), 7,42 (m, 3H), 5,76 и 5,72 (s, 1H), 4,47 (m, 3H), 3,89 и 3,88 (s, 3H), 3,28 (m, 1H), 3,05 (m, 1H), 2,78 (m, 1H), 2,49 и 2,47 (s, 3H), 2,14 (m, 2H), 1,93 (m, 1H), 1,77 (m, 1H), 1,62 (m, 1H), 1,14 (m, 2H).
Пример EZ: (2,4-дихлор-3-((4,6-дихлор-1-метил-1H-индол-2-ил)метил)фенил)(морфолинo)метанон

Стадия 1: трет-бутил-2,4-дихлор-3-((4,6-дихлор-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)бензоат
Используя процедуру, аналогичную примеру CJ, стадии 1, трет-бутил-2,4-дихлор-3-((4,6-дихлор-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)бензоат (870 мг, 44%) получали из 4,6-дихлор-1-(фенилсульфонил)-1H-индола (1,08 г, 3,31 ммоль) (получение 71) и трет-бутил-2,4-дихлор-3-формилбензоата (900 мг, 3,27 ммоль) (получение №33, стадия B). LC/MS (Способ j): Время удерживания=2,70 мин.; MS масса/заряд: 658 [M-H]-+CH3COOH; 1H ЯМР (DMSO-d6, 300МГц): δ 7,99 (s, 1H), 7,87 (m, 2H), 7,73 (m, 1H), 7,54 (m, 5H), 6,97 (s, 1H), 6,76 (s, 1H), 6,67 (s, 1H), 1,54 (s, 9H).
Стадия 2: 2,4-дихлор-3-((4,6-дихлор-1-(фенилсульфонил)-1H-индол-2-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 2, 2,4-дихлор-3-((4,6-дихлор-1-(фенилсульфонил)-1H-индол-2-ил)метил)бензойную кислоту (565 мг, 60%) получали из трет-бутил-2,4-дихлор-3-((4,6-дихлор-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)бензоата (1 г, 1,76 ммоль). LC/MS (Способ j): Время удерживания=2,30 мин.; MS масса/заряд: 526 [M-H]-; 1H ЯМР (DMSO-d6, 300МГц): δ 13,68 (широкий, 1H), 8,14 (m, 1H), 8,02 (m, 2H), 7,80 (m, 2H), 7,69 (m, 3H), 7,55 (m, 1H), 5,71 (m, 1H), 4,57 (m, 2H).
Стадия 3: 2,4-дихлор-3-((4,6-дихлор-1H-индол-2-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 3, 2,4-дихлор-3-((4,6-дихлор-1H-индол-2-ил)метил)бензойную кислоту (416 мг, 53%) получали из 2,4-дихлор-3-((4,6-дихлор-1-(фенилсульфонил)-1H-индол-2-ил)метил)бензойной кислоты (465 мг, 0,9 ммоль). LC/MS (Способ i): Время удерживания=2,42 мин.; MS масса/заряд: 386 [M-H]-.
Стадия 4: метил-2,4-дихлор-3-((4,6-дихлор-1-метил-1H-индол-2-ил)метил)бензоат
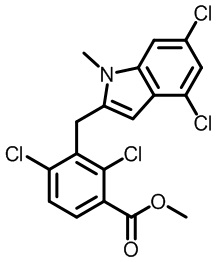
Используя процедуру, аналогичную примеру P, стадии 4, метил-2,4-дихлор-3-((4,6-дихлор-1-метил-1H-индол-2-ил)метил)бензоат (268 мг, 73%) получали из 2,4-дихлор-3-((4,6-дихлор-1H-индол-2-ил)метил)бензойной кислоты (342 мг, 0,87 ммоль). LC/MS (Способ i): Время удерживания=2,85 мин.; MS масса/заряд: 416 [M+H]+.
1H ЯМР (DMSO-d6, 300МГц): δ 7,80 (d, J=8,9 Гц, 1H), 7,73 (d, J=8,9 Гц, 1H), 7,67 (dd, J=1,7, 0,8 Гц, 1H), 7,13 (d, J=1,7 Гц, 1H), 5,52 (m, 1H), 4,47 (m, 2H), 3,88 (s, 3H), 3,86 (s, 3H).
Стадия 5: 2,4-дихлор-3-((4,6-дихлор-1-метил-1H-индол-2-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((4,6-дихлор-1-метил-1H-индол-2-ил)метил)бензойную кислоту (165 мг, 51%) получали из метил-2,4-дихлор-3-((4,6-дихлор-1-метил-1H-индол-2-ил)метил)бензоата (265 мг, 0,63 ммоль). LC/MS (Способ i): Время удерживания=2,53 мин.; MS масса/заряд: 402 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 13,68 (широкий, 1H), 7,76 (d, J=8,6 Гц, 1H), 7,68 (d, J=8,6 Гц, 1H), 7,67 (m, 1H), 7,14 (d, J=1,7 Гц, 1H), 5,53 (m, 1H), 4,46 (s, 2H), 3,88 (s, 3H).
Стадия 6: (2,4-дихлор-3-((4,6-дихлор-1-метил-1H-индол-2-ил)метил)фенил)(морфолинo)метанон
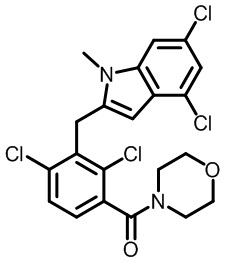
Используя процедуру, аналогичную примеру A1, (2,4-дихлор-3-((4,6-дихлор-1-метил-1H-индол-2-ил)метил)фенил)(морфолинo)метанон (39 мг, 52%) получали из 2,4-дихлор-3-((4,6-дихлор-1-метил-1H-индол-2-ил)метил)бензойной кислоты (80 мг, 0,16 ммоль) и морфолина (27,7 мг, 0,32 ммоль). LC/MS (Способ g): Время удерживания=1,96 мин.; MS масса/заряд: 471 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 7,68 (d, J=8,4 Гц, 1H), 7,66 (m, 1H), 7,46 (d, J=8,4 Гц, 1H), 7,13 (d, J=1,5 Гц, 1H), 5,55 (m, 1H), 4,43 (m, 2H), 3,87 (s, 3H), 3,65 (m, 4H), 3,54 (m, 2H), 3,20 (m, 2H).
Пример FA: 2-(1-(2,4-дихлор-3-((4,6-дихлор-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Стадия 1: метил-2-(1-(2,4-дихлор-3-((4,6-дихлор-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат

Используя процедуру, аналогичную примеру A1, метил-2-(1-(2,4-дихлор-3-((4,6-дихлор-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат (32 мг, 47%) получали из 2,4-дихлор-3-((4,6-дихлор-1-метил-1H-индол-2-ил)метил)бензойной кислоты (63 мг, 0,12 ммоль) (пример EZ, стадия 5) и метил-(4-пиперидил)ацетата гидрохлорида (96 мг, 0,5 ммоль). LC/MS (Способ i): Время удерживания=2,69 мин.; MS масса/заряд: 541 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,66 (m, 2H), 7,44 и 7,37 (d, J=8,3 Гц, 1H), 7,13 (m, 1H), 5,52 (m, 1H), 4,44 (m, 3H), 3,87 и 3,86 (s, 3H), 3,59 и 3,56 (s, 3H), 3,23 (m, 1H), 3,05 (m, 1H), 2,80 (m, 1H), 2,25 (m, 2H), 1,86 (m, 1H), 1,77 (m, 1H), 1,59 (m, 1H), 1,14 (m, 2H).
Стадия 2: 2-(1-(2,4-дихлор-3-((4,6-дихлор-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
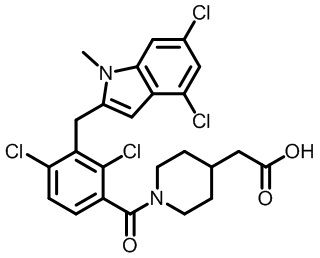
Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((4,6-дихлор-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (17 мг, 57%) получали из метил-2-(1-(2,4-дихлор-3-((4,6-дихлор-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетата (30 мг, 0,055 ммоль). LC/MS (Способ g): Время удерживания=1,87 мин.; MS масса/заряд: 527 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 12,13 (широкий, 1H), 7,66 (m, 2H), 7,44 и 7,37 (d, J=8,4 Гц, 1H), 7,13 (m, 1H), 5,53 (m, 1H), 4,44 (m, 3H), 3,87 и 3,86 (s, 3H), 3,24 (m, 1H), 3,05 (m, 1H), 2,80 (m, 1H), 2,15 (m, 2H), 1,93 (m, 1H), 1,77 (m, 1H), 1,61 (m, 1H), 1,14 (m, 2H).
Пример FB: 2-((2,4-дихлор-5-(2-окса-8-азаспиро[4.5]декан-8-карбонил)пиридин-3-ил)метил)-1,4-диметил-1H-индол-6-карбонитрил
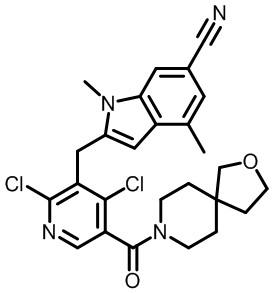
Стадия 1: этил-4,6-дихлор-5-((6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)никотинат
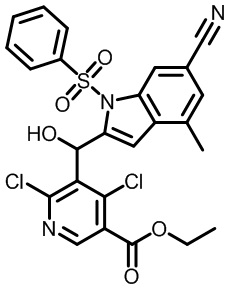
Используя процедуру, аналогичную примеру A, стадии 1, этил-4,6-дихлор-5-((6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)никотинат (4,46 г, 41%) получали из N-(5-циано-2-йод-3-метилфенил)бензолсульфонамида (7,91 г, 19,8 ммоль) (получение №18) и этил-4,6-дихлор-5-(1-гидроксипроп-2-ин-1-ил)никотината (6,53 г, 23,82 ммоль) (получение №38). LC/MS (Способ i): Время удерживания=2,40 мин.; MS масса/заряд: 544 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,70 (s, 1H), 8,24 (s, 1H), 7,89 (m, 2H), 7,71 (m, 1H), 7,56 (m, 3H), 7,07 (s, 1H), 6,93 (s, 2H), 4,37 (q, J=7,1 Гц, 2H), 2,45 (s, 3H), 1,33 (t, J=7,1 Гц, 3H).
Стадия 2: этил-4,6-дихлор-5-((6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)метил)никотинат
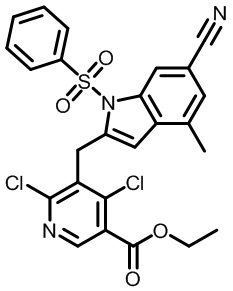
Используя процедуру, аналогичную примеру Z, стадии 2, этил-4,6-дихлор-5-((6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)метил)никотинат (3,6 г, 83%) получали из этил-4,6-дихлор-5-((6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)никотината (4,46 г, 8,19 ммоль). LC/MS (Способ i): Время удерживания=2,71 мин.; MS масса/заряд: 528 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,84 (s, 1H), 8,35 (s, 1H), 8,05 (m, 2H), 7,78 (m, 1H), 7,68 (m, 2H), 7,48 (m, 1H), 6,34 (s, 1H), 4,62 (s, 2H), 4,37 (q, J=7,1 Гц, 2H), 2,33 (s, 3H), 1,34 (t, J=7,1 Гц, 3H).
Стадия 3: 4,6-дихлор-5-((6-циано-4-метил-1H-индол-2-ил)метил)никотиновая кислота
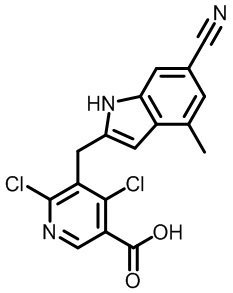
Используя процедуру, аналогичную примеру A, стадии 3, 4,6-дихлор-5-((6-циано-4-метил-1H-индол-2-ил)метил)никотиновую кислоту (3,1 г, 100%) получали из этил-4,6-дихлор-5-((6-циано-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)метил)никотината (3,55 г, 6,73 ммоль). LC/MS (Способ i): Время удерживания=1,85 мин.; MS масса/заряд: 360 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 11,67 (s, 1H), 8,63 (s, 1H), 7,63 (s, 1H), 7,09 (s, 1H), 6,08 (s, 1H), 4,47 (s, 2H), 2,39 (s, 3H).
Стадия 4: метил-4,6-дихлор-5-((6-циано-1,4-диметил-1H-индол-2-ил)метил)никотинат

Используя процедуру, аналогичную примеру P, стадии 4, метил-4,6-дихлор-5-((6-циано-1,4-диметил-1H-индол-2-ил)метил)никотинат (1,05 г, 31%) получали из 4,6-дихлор-5-((6-циано-4-метил-1H-индол-2-ил)метил)никотиновой кислоты (3,1 г, 8,61 ммоль). LC/MS (Способ i): Время удерживания=2,35 мин.; MS масса/заряд: 388 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,84 (s, 1H), 7,93 (s, 1H), 7,12 (s, 1H), 5,87 (s, 1H), 4,50 (s, 2H), 3,92 (s, 3H), 3,91 (ds, 3H), 2,34 (s, 3H).
Стадия 5: 4,6-дихлор-5-((6-циано-1,4-диметил-1H-индол-2-ил)метил)никотиновая кислота
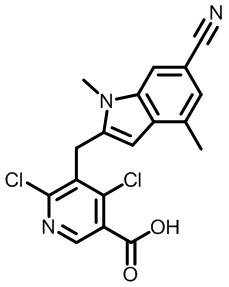
Используя процедуру, аналогичную примеру A, стадии 5, 4,6-дихлор-5-((6-циано-1,4-диметил-1H-индол-2-ил)метил)никотиновую кислоту (870 мг, 86%) получали из метил-4,6-дихлор-5-((6-циано-1,4-диметил-1H-индол-2-ил)метил)никотината (1,05 г, 2,7 ммоль). LC/MS (Способ i): Время удерживания=1,87 мин.; MS масса/заряд: 374 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,74 (s, 1H), 7,92 (s, 1H), 7,12 (s, 1H), 5,84 (s, 1H), 4,49 (s, 2H), 3,91 (s, 3H), 2,34 (s, 3H).
Стадия 6: 2-((2,4-дихлор-5-(2-окса-8-азаспиро[4.5]декан-8-карбонил)пиридин-3-ил)метил)-1,4-диметил-1H-индол-6-карбонитрил

Используя процедуру, аналогичную примеру A, стадии 6, 2-((2,4-дихлор-5-(2-окса-8-азаспиро[4.5]декан-8-карбонил)пиридин-3-ил)метил)-1,4-диметил-1H-индол-6-карбонитрил (20 мг, 15%) получали из 4,6-дихлор-5-((6-циано-1,4-диметил-1H-индол-2-ил)метил)никотиновой кислоты (100 мг, 0,27 ммоль) и 2-окса-8-азаспиро[4.5]декана (49 мг, 0,35 ммоль). LC/MS (Способ g): Время удерживания=1,60 мин.; MS масса/заряд: 497 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 8,48 (s, 1H), 7,92 (s, 1H), 7,12 (s, 1H), 5,86 (m, 1H), 4,47 (m, 2H), 3,90 (s, 3H), 3,75 (m, 4H), 3,48 (m, 2H), 3,24 (m, 2H), 2,35 (s, 3H), 1,74 (m, 2H), 1,56 (m, 4H).
Пример FC: 2-((2,4-дихлор-5-(4-(оксетан-3-ил)пиперидин-1-карбонил)пиридин-3-ил)метил)-1,4-диметил-1H-индол-6-карбонитрил
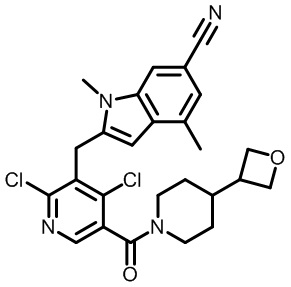
Используя процедуру, аналогичную примеру A, стадии 6, 2-((2,4-дихлор-5-(4-(оксетан-3-ил)пиперидин-1-карбонил)пиридин-3-ил)метил)-1,4-диметил-1H-индол-6-карбонитрил (54 мг, 38%) получали из 4,6-дихлор-5-((6-циано-1,4-диметил-1H-индол-2-ил)метил)никотиновой кислоты (100 мг, 0,27 ммоль) и 4-(оксетан-3-ил)пиперидина (49 мг, 0,35 ммоль) (пример FB, стадия 5). LC/MS (Способ g): Время удерживания=1,56 мин.; MS масса/заряд: 497 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 8,51 и 8,44 (s, 1H), 7,92 (s, 1H), 7,12 (s, 1H), 5,88 и 5,83 (s, 1H), 4,46 (m, 7H), 3,90 (s, 3H), 3,43 (m, 1H), 3,07 (m, 1H), 2,71 (m, 2H), 2,35 и 2,33 (s, 3H), 1,91 (m, 1H), 1,69 (m, 1H), 1,54 (m, 1H), 1,02 (m, 2H).
Пример FD: 2-(1-(2,4-дихлор-3-((6-метокси-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Стадия 1: трет-бутил-2,4-дихлор-3-(гидрокси(6-метокси-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)метил)бензоат
Используя процедуру, аналогичную примеру CJ, стадии 1, трет-бутил-2,4-дихлор-3-(гидрокси(6-метокси-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)метил)бензоат (732 мг, 45%) получали из 6-метокси-4-метил-1-(фенилсульфонил)-1H-индола (857 мг, 2,84 ммоль) (получение 72) и трет-бутил-2,4-дихлор-3-формилбензоата (939 мг, 3,41 ммоль) (получение №33, стадия B). LC/MS (Способ i): Время удерживания=2,71 мин.; MS масса/заряд: 634 [M-H]-+CH3COOH; 1H ЯМР (DMSO-d6, 300МГц): δ 7,90 (m, 2H), 7,67 (m, 1H), 7,57 (m, 4H), 7,31 (m, 1H), 7,01 (m, 1H), 6,71 (m, 1H), 6,53 (s, 1H), 6,46 (m, 1H), 3,78 (s, 3H), 2,30 (s, 3H), 1,54 (s, 9H).
Стадия 2: 2,4-дихлор-3-((6-метокси-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 2, 2,4-дихлор-3-((6-метокси-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)метил)бензойную кислоту (638 мг, 100%) получали из трет-бутил-2,4-дихлор-3-(гидрокси(6-метокси-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)метил)бензоата (730 мг, 1,27 ммоль). LC/MS (Способ i): Время удерживания=2,44 мин.; MS масса/заряд: 504 [M+H]+ ; 1H ЯМР (DMSO-d6, 300МГц): δ 13,65 (широкий, 1H), 7,92 (m, 2H), 7,75 (m, 2H), 7,66 (m, 3H), 7,47 (m 1H), 6,71 (m, 1H), 5,67 (s, 1H), 4,56 (s, 2H), 3,81 (s, 3H), 2,20 (s, 3H).
Стадия 3: 2,4-дихлор-3-((6-метокси-4-метил-1H-индол-2-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 3, 2,4-дихлор-3-((6-метокси-4-метил-1H-индол-2-ил)метил)бензойную кислоту получали из 2,4-дихлор-3-((6-метокси-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)метил)бензойной кислоты (55 мг, 1,1 ммоль) и использовали неочищенной на следующей стадии. LC/MS (Способ i): Время удерживания=2,11 мин.; MS масса/заряд: 364 [M+H]+.
Стадия 4: метил-2,4-дихлор-3-((6-метокси-1,4-диметил-1H-индол-2-ил)метил)бензоат

Используя процедуру, аналогичную примеру P, стадии 4, метил-2,4-дихлор-3-((6-метокси-1,4-диметил-1H-индол-2-ил)метил)бензоат (500 мг, 100%) получали из неочищенной 2,4-дихлор-3-((6-метокси-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)метил)бензойной кислоты. LC/MS (Способ i): Время удерживания=2,53 мин.; MS масса/заряд: 392 [M+H]+ ; 1H ЯМР (DMSO-d6, 300МГц): δ 7,77 (d, J=7,8 Гц, 1H), 7,70 (d, J=7,8 Гц, 1H), 6,81 (m, 1H), 6,43 (m, 1H), 5,41 (m, 1H), 4,40 (s, 2H), 3,88 (s, 3H), 3,77 (s, 3H), 3,76 (s, 3H), 2,22 (s, 3H).
Стадия 5: 2,4-дихлор-3-((6-метокси-1,4-диметил-1H-индол-2-ил)метил)бензойная кислота
Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((6-метокси-1,4-диметил-1H-индол-2-ил)метил)бензойную кислоту (305 мг, 62%) получали из метил-2,4-дихлор-3-((6-метокси-1,4-диметил-1H-индол-2-ил)метил)бензоата (509 мг, 1,3 ммоль). LC/MS (Способ i): Время удерживания=2,20 мин.; MS масса/заряд: 378 [M+H]+ ; 1H ЯМР (DMSO-d6, 300МГц): δ 13,59 (широкий, 1H), 7,73 (d, J=8,3 Гц, 1H), 7,65 (d, J=8,3 Гц, 1H), 6,81 (d, J=2,0 Гц, 1H), 6,43 (m, 1H), 5,42 (m, 1H), 4,39 (s, 2H), 3,77 (s, 3H), 3,76 (s, 3H), 2,23 (s, 3H).
Стадия 6: метил-2-(1-(2,4-дихлор-3-((6-метокси-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат
Используя процедуру, аналогичную примеру A, стадии 6, метил-2-(1-(2,4-дихлор-3-((6-метокси-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат (83 мг, 61%) получали из 2,4-дихлор-3-((6-метокси-1,4-диметил-1H-индол-2-ил)метил)бензойной кислоты (100 мг, 0,26 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (102 мг, 0,53 ммоль). LC/MS (Способ i): Время удерживания=2,37 мин.; MS масса/заряд: 517 [M+H]+ 1H ЯМР (DMSO-d6, 300МГц): δ 7,64 и 7,62 (d, J=8,3 Гц, 1H), 7,41 и 7,34 (d, J=8,3 Гц, 1H), 6,81 (s, 1H), 6,43 (m, 1H), 5,42 и 5,39 (s, 1H), 4,41 (m, 3H), 3,77 (s, 6H), 3,59 и 3,57 (s, 3H), 3,27 (m, 1H), 3,05 (m, 1H), 2,80 (m, 1H), 2,28 (m, 2H), 2,22 и 2,21 (s, 3H), 1,86-2,05 (m, 1H), 1,75 (m, 1H), 1,58 (m, 1H), 1,17 (m, 2H).
Стадия 7: 2-(1-(2,4-дихлор-3-((6-метокси-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((6-метокси-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (55 мг, 68%) получали из метил-2-(1-(2,4-дихлор-3-((6-метокси-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетата (80 мг, 0,15 ммоль). LC/MS (Способ i): Время удерживания=2,13 мин.; MS масса/заряд: 503 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ=12,08 (s, 1H), 7,64 и 7,62 (d, J=8,3 Гц, 1H), 7,41 и 7,34 (d, J=8,3 Гц, 1H), 6,80 (s, 1H), 6,43 (s, 1H), 5,43 и 5,40 (s, 1H), 4,36 (m, 3H), 3,77 (s, 6H), 3,27 (m, 1H), 3,04 (m, 1H), 2,80 (m, 1H), 2,21 и 2,21 (s, 3H), 2,14 (m, 2H), 1,95 (m, 1H), 1,79 (m, 1H), 1,61 (m, 1H), 1,16 (m, 2H).
Пример FE: 2-(1-(2,4-дихлор-3-((4-фтор-1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
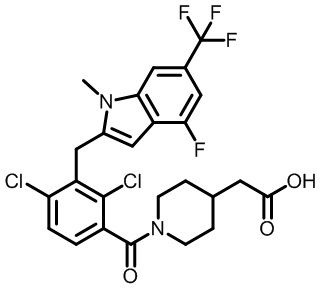
Стадия 1: трет-бутил-2,4-дихлор-3-((4-фтор-1-метил-6-(трифторметил)-1H-индол-2-ил)(гидрокси)метил)бензоат

В раствор трет-бутил-2,4-дихлорбензоата (125 мг, 0,507 ммоль) (получение №33, стадия A) в THF (1,5 мл) в атмосфере азота, охлажденный до -78°C, добавляли по каплям диизопропиламид лития (0,230 мл, 0,461 ммоль). Реакционную смесь перемешивали в течение 1 часа при -78°C, затем добавляли 4-фтор-1-метил-6-(трифторметил)-1H-индол-2-карбальдегид (113 мг, 0,461 ммоль) (получение №73) в растворе THF (1,5 мл). Реакционную смесь перемешивали в течение 30 минут при -78°C. Реакционную смесь быстро охлаждали насыщенным раствором NaHCO3 и экстрагировали дважды с помощью EtOAc. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали под пониженным давлением. Остаток очищали хроматографией на силикагеле (элюирование с помощью 5-20% EtOAc в циклогексане) с получением трет-бутил-2,4-дихлор-3-((4-фтор-1-метил-6-(трифторметил)-1H-индол-2-ил)(гидрокси)метил)бензоата (156 мг, 69%). LC/MS (Способ i): Время удерживания=2,76 мин.; MS масса/заряд: 492 [M+H]+ ; 1H ЯМР (DMSO-d6, 300МГц): δ 7,83 (s, 1H), 7,66 (d, J=8,3 Гц, 1H), 7,61 (d, J=8,3 Гц, 1H), 7,15 (dd, J=10,7, 0,7 Гц, 1H), 6,73 (d, J=5,4 Гц, 1H), 6,59 (d, J=5,6 Гц, 1H), 6,13 (s, 1H), 3,90 (s, 3H), 1,55 (s, 9H).
Стадия 2: 2,4-дихлор-3-((4-фтор-1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 2, 2,4-дихлор-3-((4-фтор-1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензойную кислоту (43 мг, 100%) получали из трет-бутил-2,4-дихлор-3-((4-фтор-1-метил-6-(трифторметил)-1H-индол-2-ил)(гидрокси)метил)бензоата (50 мг, 0,1 ммоль). LC/MS (Способ i): Время удерживания=2,43 мин.; MS масса/заряд: 420 [M+H]+ ; 1H ЯМР (DMSO-d6, 300МГц): δ 13,50 (широкий, 1H), 7,83 (s, 1H), 7,77 (d, J=8,9 Гц, 1H), 7,68 (d, J=8,9 Гц, 1H), 7,12 (dd, J=10,4, 0,7 Гц, 1H), 5,69 (d, J=0,7 Гц, 1H), 4,51 (s, 2H), 3,97 (s, 3H).
Стадия 3: метил-2-(1-(2,4-дихлор-3-((4-фтор-1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат

Используя процедуру, аналогичную примеру A1, метил-2-(1-(2,4-дихлор-3-((4-фтор-1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат (48 мг, 60%) получали из 2,4-дихлор-3-((4-фтор-1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензойной кислоты (60 мг, 0,14 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (41 мг, 0,21 ммоль). LC/MS (Способ i): Время удерживания=2,58 мин.; MS масса/заряд: 559 [M+H]+ ; 1H ЯМР (DMSO-d6, 300МГц): δ 7,83 (s, 1H), 7,66 и 7,65 (d, J=8,2 Гц, 1H), 7,45 и 7,38 (d, J=8,2 Гц, 1H), 7,12 (d, J=10,2 Гц, 1H), 5,72 и 5,68 (s, 1H), 4,47 (m, 3H), 3,97 (s, 3H), 3,59 и 3,56 (s, 3H), 3,27 (m, 1H), 3,05 (m, 1H), 2,81 (m, 1H), 2,26 (m, 2H), 1,95 (m, 1H), 1,75 (m, 1H), 1,56 (m, 1H), 1,15 (m, 2H).
Стадия 4: 2-(1-(2,4-дихлор-3-((4-фтор-1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((4-фтор-1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (40 мг, 86%) получали из метил-2-(1-(2,4-дихлор-3-((4-фтор-1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетата (46 мг, 0,08 ммоль). LC/MS (Способ g): Время удерживания=1,83 мин.; MS масса/заряд: 545 [M+H]+ ; 1H ЯМР (DMSO-d6, 400МГц): δ=12,14 (широкий, 1H), 7,82 (s, 1H), 7,66 и 7,65 (d, J=8,2 Гц, 1H), 7,45 и 7,38 (d, J=8,2 Гц, 1H), 7,12 (d, J=10,3 Гц, 1H), 5,72 и 5,68 (s, 1H), 4,47 (m, 3H), 3,97 и 3,96 (s, 3H), 3,24 (m, 1H), 3,04 (m, 1H), 2,80 (m, 1H), 2,15 (m, 2H), 1,93 (m, 1H), 1,79 (m, 1H), 1,60 (m, 1H), 1,14 (m, 2H).
Таблица FE. Следующие примеры получали из 2,4-дихлор-3-((4-фтор-1-метил-6-(трифторметил)-1H-индол-2-ил)метил)бензойной кислоты (пример FE, стадия 2) при помощи такой же процедуры с соответствующими аминами, как описано в примере FE, стадиях 3 и 4.

Пример FF: 2-(1-(2,4-дихлор-3-((6-(дифторметокси)-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
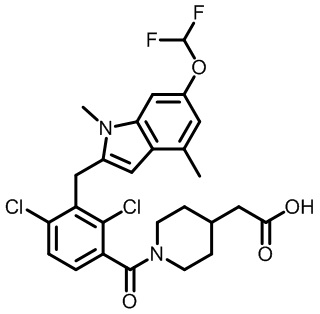
Стадия 1: трет-бутил-2,4-дихлор-3-((6-(дифторметокси)-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)бензоат
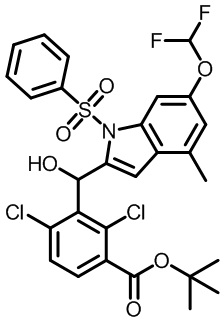
Используя процедуру, аналогичную примеру CJ, стадии 1, трет-бутил-2,4-дихлор-3-((6-(дифторметокси)-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)бензоат (807 мг, 36%) получали из 6-(дифторметокси)-4-метил-1-(фенилсульфонил)-1H-индола (1,2 г, 3,6 ммоль) (получение №ZZ-24) и трет-бутил-2,4-дихлор-3-формилбензоата (1 г, 3,97 ммоль) (получение №33, стадия B). LC/MS (Способ i): Время удерживания=2,77 мин.; MS масса/заряд: 670 [M-H]-+CH3COOH; 1H ЯМР (DMSO-d6, 300МГц): δ 7,88 (m, 2H), 7,68 (m, 1H), 7,56 (m, 5H), 7,23 (t, J=73 Гц, 1H), 6,98 (m, 2H), 6,69 (s, 1H), 6,58 (s, 1H), 2,37 (s, 3H), 1,54 (s, 9H).
Стадия 2: 2,4-дихлор-3-((6-(дифторметокси)-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 2, 2,4-дихлор-3-((6-(дифторметокси)-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)метил)бензойную кислоту (666 мг, 100%) получали из трет-бутил-2,4-дихлор-3-((6-(дифторметокси)-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)бензоата (655 мг, 1 ммоль). LC/MS (Способ j): Время удерживания=1,92 мин.; MS масса/заряд: 540 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 13,6 (широкий, 1H), 7,94 (m, 2H), 7,76 (m, 3H), 7,66 (m, 3H), 7,24 (t, J=74,3 Гц, 1H), 6,94 (s, 1H), 5,80 (s, 1H), 4,58 (s, 2H), 2,26 (s, 3H).
Стадия 3: 2,4-дихлор-3-((6-(дифторметокси)-4-метил-1H-индол-2-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадия 3, 2,4-дихлор-3-((6-(дифторметокси)-4-метил-1H-индол-2-ил)метил)бензойную кислоту (456 мг, 100%) получали из 2,4-дихлор-3-((6-(дифторметокси)-4-метил-1-(фенилсульфонил)-1H-индол-2-ил)метил)бензойной кислоты (616 мг, 1,1 ммоль). Неочищенное вещество использовали на следующей стадии без очистки. LC/MS (Способ j): Время удерживания=1,53 мин.; MS масса/заряд: 400 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ=11,05 (s, 1H), 7,45 (s, 2H), 7,21 (m, 1H), 6,99 (t, J=75,1 Гц, 1H), 6,85 (s, 1H), 6,51 (s, 1H), 5,73 (s, 1H), 4,31 (s, 2H), 2,24 (s, 3H).
Стадия 4: метил-2,4-дихлор-3-((6-(дифторметокси)-1,4-диметил-1H-индол-2-ил)метил)бензоат

Используя процедуру, аналогичную примеру P, стадии 4, метил-2,4-дихлор-3-((6-(дифторметокси)-1,4-диметил-1H-индол-2-ил)метил)бензоат (350 мг, 72%) получали из 2,4-дихлор-3-((6-(дифторметокси)-4-метил-1H-индол-2-ил)метил)бензойной кислоты (456 мг, 1,1 ммоль). LC/MS (Способ j): Время удерживания=2,10 мин.; MS масса/заряд: 428 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,78 (d, J=8,2 Гц, 1H), 7,70 (d, J=8,2 Гц, 1H), 7,14 (s, 1H), 7,11 (t, J=75 Гц, 1H), 6,64 (s, 1H), 5,53 (s, 1H), 4,44 (s, 2H), 3,88 (s, 3H), 3,81 (s, 3H), 2,28 (s, 3H).
Стадия 5: 2,4-дихлор-3-((6-(дифторметокси)-1,4-диметил-1H-индол-2-ил)метил)бензойная кислота
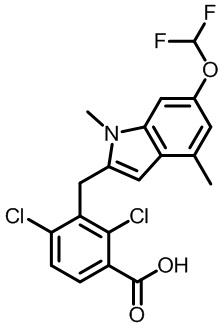
Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((6-(дифторметокси)-1,4-диметил-1H-индол-2-ил)метил)бензойную кислоту (319 мг, 94%) получали из метил-2,4-дихлор-3-((6-(дифторметокси)-1,4-диметил-1H-индол-2-ил)метил)бензоата (349 мг, 0,8 ммоль). LC/MS (Способ j): Время удерживания=1,62 мин.; MS масса/заряд: 414 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,70 (d, J=8,2 Гц, 1H), 7,64 (d, J=8,2 Гц, 1H), 7,14 (s, 1H), 7,11 (t, J=75 Гц, 1H), 6,64 (s, 1H), 5,54 (s, 1H), 4,42 (s, 2H), 3,81 (s, 3H), 2,29 (s, 3H).
Стадия 6: метил-2-(1-(2,4-дихлор-3-((6-(дифторметокси)-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат

Используя процедуру, аналогичную примеру A, стадии 6, метил-2-(1-(2,4-дихлор-3-((6-(дифторметокси)-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат (123 мг, 92%) получали из 2,4-дихлор-3-((6-(дифторметокси)-1,4-диметил-1H-индол-2-ил)метил)бензойной кислоты (100 мг, 0,24 ммоль) и метил-2-(пиперидин-4-ил)ацетата гидрохлорида (51,4 мг, 0,26 ммоль). LC/MS (Способ j): Время удерживания=1,89 мин.; MS масса/заряд: 553 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,65 (m, 1H), 7,74 и 7,36 (d, J=7,7 Гц, 1H), 7,13 (s, 1H), 7,11 (t, J=75 Гц, 1H), 6,64 (s, 1H), 5,54 и 5,51 (s, 1H), 4,42 (m, 3H), 3,80 (s, 3H), 3,59 и 3,56 (s, 3H), 3,24 (m, 1H), 3,05 (m, 1H), 2,80 (m, 1H), 2,27 (m, 5H), 1,95 (m, 1H), 1,75 (m, 1H), 1,58 (m, 1H), 1,15 (m, 2H).
Стадия 7: 2-(1-(2,4-дихлор-3-((6-(дифторметокси)-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
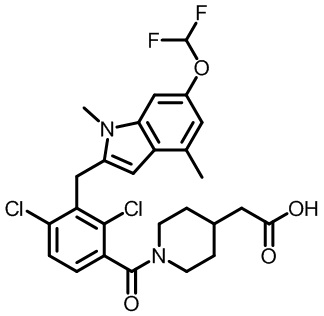
Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((6-(дифторметокси)-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (98 мг, 83%) получали из метил-2-(1-(2,4-дихлор-3-((6-(дифторметокси)-1,4-диметил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетата (120 мг, 0,22 ммоль). LC/MS (Способ g): Время удерживания=1,72 мин.; MS масса/заряд: 539 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 12,07 (широкий, 1H), 7,65 и 7,64 (d, J=8,3 Гц, 1H), 7,42 и 7,72 (d, J=8,3 Гц, 1H), 7,13 (s, 1H), 7,11 (t, J=75 Гц, 1H), 6,64 (s, 1H), 5,54 и 5,51 (s, 1H), 4,43 (m, 3H), 3,80 (s, 3H), 3,25 (m, 1H), 3,05 (m, 1H), 2,80 (m, 1H), 2,29 и 2,28 (s, 3H), 2,14 (m, 2H), 1,93 (m, 1H), 1,77 (m, 1H), 1,61 (m, 1H), 1,15 (m, 2H).
Таблица FF. Следующие примеры получали из 2,4-дихлор-3-((6-(дифторметокси)-1,4-диметил-1H-индол-2-ил)метил)бензойной кислоты (пример FF, стадия 5) при помощи такой же процедуры с соответствующими аминами, как описано в примере FF, стадиях 6 и 7.
|
Пример FG: 2-(1-(4,6-дихлор-5-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)никотиноил)пиперидин-4-ил)уксусная кислота

Стадия 1: трет-бутил-4,6-дихлор-5-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)никотинат
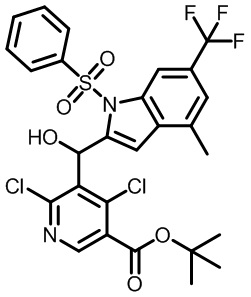
Используя процедуру, аналогичную примеру A, стадии 1, трет-бутил-4,6-дихлор-5-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)никотинат (5,45 г, 55%) получали из N-(2-йод-3-метил-5-(трифторметил)фенил)бензолсульфонамида (7,06 г, 16 ммоль) (получение №16) и трет-бутил-4,6-дихлор-5-(1-гидроксипроп-2-ин-1-ил)никотината (5,8 г, 19,2 ммоль) (получение 60). LC/MS (Способ i): Время удерживания=2,77 мин.; MS масса/заряд: 615 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,63 (s, 1H), 8,08 (s, 1H), 7,78 (m, 2H), 7,69 (m, 1H), 7,58 (m, 2H), 7,45 (s, 1H), 7,07 (s, 1H), 6,90 (m, 2H), 2,49 (s, 3H), 1,56 (s, 9H).
Стадия 2: трет-бутил-4,6-дихлор-5-(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-карбонил)никотинат

Используя процедуру, аналогичную примеру AD, стадии 2, трет-бутил-4,6-дихлор-5-(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-карбонил)никотинат (3,84 г, 71%) получали из трет-бутил-4,6-дихлор-5-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-ил)метил)никотината (5,4 г, 8,77 ммоль). LC/MS (Способ i): Время удерживания=2,91 мин.; MS масса/заряд: 613 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,97 (s, 1H), 8,33 (m, 1H), 8,12 (m, 3H), 7,80 (m, 1H), 7,71 (m, 2H), 7,59 (s, 1H), 2,58 (s, 3H), 1,57 (s, 9H).
Стадия 3: 4,6-дихлор-5-(4-метил-6-(трифторметил)-1H-индол-2-карбонил)никотиновая кислота

В раствор трет-бутил-4,6-дихлор-5-(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-индол-2-карбонил)никотината (3,74 г, 6,1 ммоль) в THF (75 мл) добавляли гидроксид натрия (30,5 мл, 30,5 ммоль) и смесь перемешивали 20 часов при комнатной температуре и 6 часов при 50°C. Реакционную смесь частично выпаривали, а затем добавляли 1 M HCl. Образовавшийся осадок фильтровали с получением 4,6-дихлор-5-(4-метил-6-(трифторметил)-1H-индол-2-карбонил)никотиновой кислоты (3,25 г, 59%). Ее использовали неочищенной на следующей стадии. LC/MS (Способ i): Время удерживания=201 мин.; MS масса/заряд: 417 [M+H]+.
Стадия 4: метил-4,6-дихлор-5-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)никотинат

Используя процедуру, аналогичную примеру P, стадии 4, метил-4,6-дихлор-5-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)никотинат (850 мг, 24%) получали из 4,6-дихлор-5-(4-метил-6-(трифторметил)-1H-индол-2-карбонил)никотиновой кислоты (3,25 г, 7,79 ммоль). LC/MS (Способ j): Время удерживания=2,06 мин.; MS масса/заряд: 445 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 9,03 (s, 1H), 7,96 (s, 1H), 7,53 (s, 1H), 7,25 (s, 1H), 4,24 (s, 3H), 3,94 (s, 3H), 2,52 (s, 3H).
Стадия 5: 4,6-дихлор-5-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)никотиновая кислота

Используя процедуру, аналогичную примеру A, стадии 5, 4,6-дихлор-5-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)никотиновую кислоту (780 мг, 95%) получали из метил-4,6-дихлор-5-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)никотината (0,85 г, 1,9 ммоль). LC/MS (Способ i): Время удерживания=2,20 мин.; MS масса/заряд: 431 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ=14,22 (широкий, 1H), 9,00 (s, 1H), 7,96 (s, 1H), 7,51 (s, 1H), 7,24 (s, 1H), 4,24 (s, 3H), 2,53 (s, 3H).
Стадия 6: 2-(1-(4,6-дихлор-5-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)никотиноил)пиперидин-4-ил)уксусная кислота
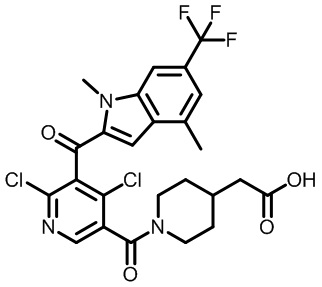
Используя процедуру, аналогичную примеру A, стадии 6, следуя примеру A, стадии 5, 2-(1-(4,6-дихлор-5-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)никотиноил)пиперидин-4-ил)уксусную кислоту (59 мг, 46%) получали из 4,6-дихлор-5-(1,4-диметил-6-(трифторметил)-1H-индол-2-карбонил)никотиновой кислоты (100 мг, 0,23 ммоль). LC/MS (Способ g): Время удерживания=1,81 мин.; MS масса/заряд: 556 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 8,66 (m, 1H), 7,96 (s, 1H), 7,55 (m, 1H), 7,24 (s, 1H), 4,46 (m, 1H), 4,23 (s, 3H), 3,74 (m, 1H), 3,11 (m, 1H), 2,85 (m, 1H), 2,53 (s, 3H), 2,19 (m, 1H), 2,13 (m, 1H), 1,96 (m, 1H), 1,80 (m, 1H), 1,66 (m, 1H), 0,18 (m, 2H).
Пример FH: 2-(1-(3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиколиноил)пиперидин-4-ил)уксусная кислота
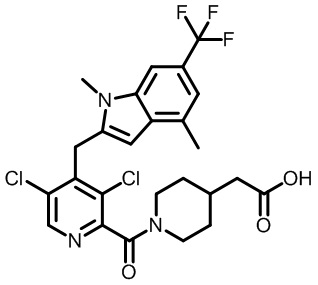
Стадия 1: метил-2-(1-(3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиколиноил)пиперидин-4-ил)ацетат

Используя процедуру, аналогичную примеру A, стадии 6, метил-2-(1-(3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиколиноил)пиперидин-4-ил)ацетат (89 мг, 74%) получали из 3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиколиновой кислоты (90 мг, 0,21 ммоль) (пример BE, стадия 5). LC/MS (Способ j): Время удерживания=1,85 мин.; MS масса/заряд: 556 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,76 (s, 1H), 7,71 (s, 1H), 7,07 (s, 1H), 5,79 (s, 1H), 4,48 (s, 3H), 3,92 (s, 3H), 3,58 (s, 3H), 3,25 (m, 1H), 3,07 (m, 1H), 2,85 (m, 1H), 2,37 (s, 3H), 2,28 (m, 2H), 1,99 (m, 1H), 1,76 (m, 1H), 1,63 (m, 1H), 1,17 (m, 2H).
Стадия 2: 2-(1-(3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиколиноил)пиперидин-4-ил)уксусная кислота
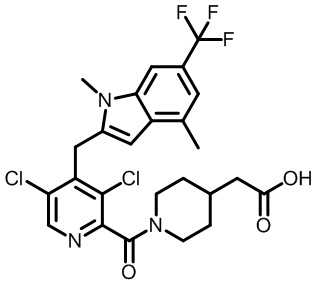
Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиколиноил)пиперидин-4-ил)уксусную кислоту 60 мг, 70%) получали из метил-2-(1-(3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-индол-2-ил)метил)пиколиноил)пиперидин-4-ил)уксусной кислоты (85 мг, 0,15 ммоль). LC/MS (Способ g): Время удерживания=1,76 мин.; MS масса/заряд: 542 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 12,10 (широкий, 1H), 8,76 (s, 1H), 7,72 (s, 1H), 7,07 (s, 1H), 5,79 (s, 1H), 4,48 (m, 3H), 3,92 (s, 3H), 3,26 (m, 1H), 3,08 (m, 1H), 2,84 (m, 1H), 2,37 (s, 3H), 2,17 (m, 2H), 1,95 (m, 1H), 1,78 (m, 1H), 1,62 (m, 1H), 1,14 (m, 2H).
Пример FI: 2-(1-(2,4-дихлор-3-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
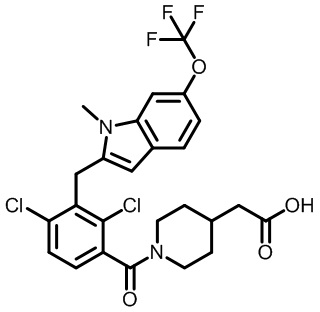
Стадия 1: метил-2,4-дихлор-3-(гидрокси(1-(фенилсульфонил)-6-(трифторметокси)-1H-индол-2-ил)метил)бензоат
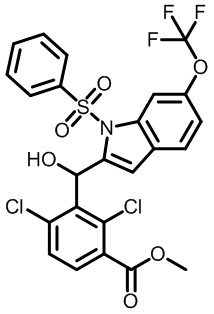
Используя процедуру, аналогичную примеру A, стадии 1, метил-2,4-дихлор-3-(гидрокси(1-(фенилсульфонил)-6-(трифторметокси)-1H-индол-2-ил)метил)бензоат (2,32 г, 80%) получали из N-(2-йод-5-(трифторметокси)фенил)бензолсульфонамида (2,2 г, 4,96 ммоль) (получение 75) и метил-2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)бензоата (1,54 г, 5,96 ммоль) (получение №1). LC/MS (Способ i): Время удерживания=2,39 мин.; MS масса/заряд: 632 [M-H]-+CH3COOH; 1H ЯМР (DMSO-d6, 300МГц): δ 7,93 (m, 3H), 7,68 (m, 3H), 7,60 (m, 3H), 7,29 (m, 1H), 7,05 (m, 1H), 6,67 (m, 2H), 3,87 (s, 3H).
Стадия 2: метил-2,4-дихлор-3-((1-(фенилсульфонил)-6-(трифторметокси)-1H-индол-2-ил)метил)бензоат
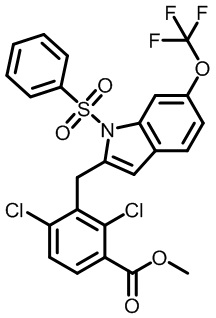
Используя процедуру, аналогичную примеру A, стадии 2, метил-2,4-дихлор-3-((1-(фенилсульфонил)-6-(трифторметокси)-1H-индол-2-ил)метил)бензоат (2,25 г, 98%) получали из метил-2,4-дихлор-3-(гидрокси(1-(фенилсульфонил)-6-(трифторметокси)-1H-индол-2-ил)метил)бензоата (2,3 г, 4 ммоль). LC/MS (Способ i): Время удерживания=2,68 мин.; MS масса/заряд: 558 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ=8,04 (s, 1H), 7,96 (m, 2H), 7,82 (m, 1H), 7,76 (m, 1H), 7,69 (m, 3H), 7,57 (m, 1H), 7,28 (m, 1H), 5,91 (m, 1H), 4,61 (m 2H), 3,87 (s, 3H).
Стадия 3: метил-2,4-дихлор-3-((6-(трифторметокси)-1H-индол-2-ил)метил)бензоат
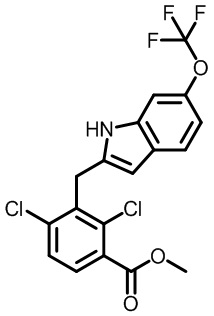
Используя процедуру, аналогичную примеру A, стадии 3, метил-2,4-дихлор-3-((6-(трифторметокси)-1H-индол-2-ил)метил)бензоат (1,4 г, 60%) получали из метил-2,4-дихлор-3-((1-(фенилсульфонил)-6-(трифторметокси)-1H-индол-2-ил)метил)бензоата (2,6 г, 4,6 ммоль). LC/MS (Способ i): Время удерживания=2,38 мин.; MS масса/заряд: 418 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 11,30 (s, 1H), 7,74 (d, J=8,3 Гц, 1H), 7,68 (d, J=8,3 Гц, 1H), 7,44 (d, J=8,6 Гц, 1H), 7,28 (m, 1H), 6,92 (m, 1H), 5,89 (s, 1H), 4,45 (s, 2H), 3,87 (s, 3H).
Стадия 4: метил-2,4-дихлор-3-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоат

Используя процедуру, аналогичную примеру P, стадии 4, метил-2,4-дихлор-3-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоат (1,1 г, 54%) получали из метил-2,4-дихлор-3-((6-(трифторметокси)-1H-индол-2-ил)метил)бензоата (1,35 г, 3,23 ммоль). LC/MS (Способ j): Время удерживания=1,79 мин.; MS масса/заряд: 432 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,80 (d, J=8,4 Гц, 1H), 7,71 (d, J=8,4 Гц, 1H), 7,52 (s, 1H), 7,44 (d, J=8,6 Гц, 1H), 6,94 (m, 1H), 5,59 (s, 1H), 4,46 (s, 2H), 3,88 (s, 3H), 3,86 (s, 3H).
Стадия 5: 2,4-дихлор-3-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензойная кислота
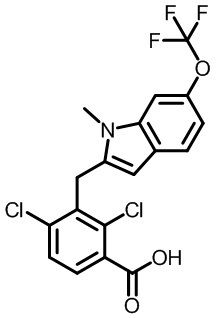
Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензойную кислоту (990 мг, 100%) получали из метил-2,4-дихлор-3-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоата (1 г, 3,3 ммоль). LC/MS (Способ i): Время удерживания=2,47 мин.; MS масса/заряд: 418 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ=13,64 (широкий, 1H), 7,74 (d, J=8,4 Гц, 1H), 7,66 (d, J=8,4 Гц, 1H), 7,52 (s, 1H), 7,44 (d, J=8,6 Гц, 1H), 6,94 (m, 1H), 5,60 (m, 1H), 4,45 (s, 2H), 3,86 (s, 3H).
Стадия 6: метил-2-(1-(2,4-дихлор-3-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат

Используя процедуру, аналогичную примеру A, стадии 6, метил-2-(1-(2,4-дихлор-3-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат (180 мг, 88%) получали из 2,4-дихлор-3-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензойной кислоты (150 мг, 0,36 ммоль) и метил-2-(пиперидин-4-ил)ацетата гидрохлорида (83 мг, 0,43 ммоль). LC/MS (Способ i): Время удерживания=2,64 мин.; MS масса/заряд: 557 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,64 и 7,63 (d, J=8,3 Гц, 1H), 7,51 (s, 1H), 7,43 (m, 1,5H), 7,36 (d, J=8,3 Гц, 0,5H), 6,94 (m, 1H), 5,63 и 6,60 (s, 1H), 4,42 (m, 3H), 3,85 (s, 3H), 3,59 и 3,56 (s, 3H), 3,28 (m, 1H), 3,05 (m, 1H), 2,80 (m, 1H), 2,29 (m, 2H), 1,97 (m, 1H), 1,73 (m, 1H), 1,59 (m, 1H), 1,16 (m, 2H).
Стадия 7: 2-(1-(2,4-дихлор-3-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
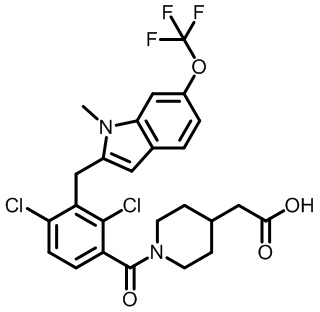
Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (150 мг, 88%) получали из метил-2-(1-(2,4-дихлор-3-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетата (170 мг, 0,30 ммоль). LC/MS (Способ g): Время удерживания=1,83 мин.; MS масса/заряд: 543 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 7,64 и 7,63 (d, J=8,1 Гц, 1H), 7,51 (s, 1H), 7,44 (m, 1,5H), 7,36 (d, J=8,4 Гц, 0,5H), 6,4 (m, 1H), 5,63 и 5,61 (s, 1H), 4,44 (m, 3H), 3,85 (s, 3H), 3,27 (m, 1H), 3,04 (m, 1H), 2,80 (m, 1H), 2,17 (m, 2H), 1,93 (m, 1H), 1,78 (m, 1H), 1,62 (m, 1H), 1,14 (m, 2H).
Таблица FI. Следующие примеры получали из 2,4-дихлор-3-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензойной кислоты (пример FI, стадия 5) при помощи такой же процедуры с соответствующими аминами, как описано в примере FI, стадиях 6 и 7.

Пример FJ: (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(4-(оксетан-3-ил)пиперазин-1-ил)метанон
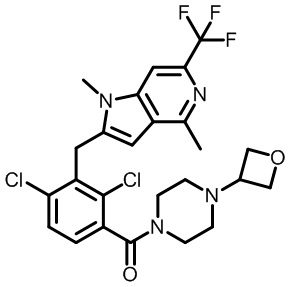
Стадия 1: метил-2,4-дихлор-3-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)бензоат
Используя процедуру, аналогичную примеру A, стадии 1, метил-2,4-дихлор-3-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)бензоат (1,16 г, 60%) получали из N-(3-йод-2-метил-6-(трифторметил)пиридин-4-ил)бензолсульфонамида (1,5 г, 3,4 ммоль) (получение №39) и метил-2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)бензоата (1,0 г, 4 ммоль) (получение №1). LC/MS (Способ i): Время удерживания=2,46 мин.; MS масса/заряд: 573 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,17 (s, 1H), 7,85 (m, 2H), 7,72 (m, 1H), 7,67 (d, J=8,4 Гц, 1H), 7,60 (m, 2H), 7,52 (d, J=8,4 Гц, 1H), 7,01 (s, 2H), 6,62 (m, 1H), 3,86 (s, 3H), 2,69 (s, 3H).
Стадия 2: метил-2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)бензоат

Используя процедуру, аналогичную примеру Z, стадии 2, метил-2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)бензоат (644 мг, 58%) получали из метил-2,4-дихлор-3-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)бензоата (946 мг, 1,6 ммоль). LC/MS (Способ i): Время удерживания=2,79 мин.; MS масса/заряд: 557 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,32 (s, 1H), 8,05 (m 2H), 7,80 (m, 2H), 7,70 (m, 3H), 6,20 (s, 1H), 4,57 (s, 2H), 3,86 (s, 3H), 2,57 (s, 3H).
Стадия 3: метил-2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)бензоат
Используя процедуру, аналогичную примеру A, стадии 3, метил-2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)бензоат (471 мг, 98%) получали из метил-2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)бензоата (644 мг, 1,15 ммоль). LC/MS (Способ i): Время удерживания=2,30 мин.; MS масса/заряд: 417 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ=11,95 (широкий, 1H), 7,77 (d, J=8,1 Гц, 1H), 7,70 (d, J=8,1 Гц, 1H), 7,61 (s, 1H), 6,13 (m, 1H), 4,52 (s, 2H), 3,88 (s, 3H), 2,58 (s, 3H).
Стадия 4: метил-2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)бензоат

Используя процедуру, аналогичную примеру P, стадии 4, метил-2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)бензоат (500 мг, 100%) получали из метил-2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)бензоата (468 мг, 1,12 ммоль). LC/MS (Способ i): Время удерживания=2,42 мин.; MS масса/заряд: 431 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,92 (s, 1H), 7,82 (d, J=8,3 Гц, 1H), 7,73 (d, J=8,3 Гц, 1H), 5,86 (s, 1H), 4,52 (s, 2H), 3,96 (s, 3H), 3,88 (s, 3H), 2,54 (s, 3H).
Стадия 5: 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)бензойную кислоту (350 мг, 75%) получали из метил-2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)бензоата (484 мг, 1,12 ммоль). LC/MS (Способ i): Время удерживания=2,03 мин.; MS масса/заряд: 417 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,92 (s, 1H), 7,65 (m, 2H), 5,84 (s, 1H), 4,49 (s, 2H), 3,96 (s, 3H), 2,53 (s, 3H).
Стадия 6: (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(4-(оксетан-3-ил)пиперазин-1-ил)метанон
Используя процедуру, аналогичную примеру A, стадии 6, (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)фенил)(4-(оксетан-3-ил)пиперазин-1-ил)метанон (64 мг, 59%) получали из 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[3,2-c]пиридин-2-ил)метил)бензойной кислоты (80 мг, 0,19 ммоль) и 1-(оксетан-3-ил)пиперазина (41 мг, 0,29 ммоль). LC/MS (Способ g): Время удерживания=1,39 мин.; MS масса/заряд: 541 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 7,92 (s, 1H), 7,68 (d, J=8,4 Гц, 1H), 7,44 (d, J=8,4 Гц, 1H), 5,86 (s, 1H), 4,48 (m, 6H), 3,96 (s, 3H), 3,67 (m, 2H), 3,43 (m, 1H), 3,21 (m, 2H), 2,54 (s, 3H), 2,33 (m, 2H), 2,23 (m, 2H).
Пример FK: N-(2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-индол-6-ил)ацетамид
Стадия 1: метил-2,4-дихлор-3-(гидрокси(4-метил-6-нитро-1-(фенилсульфонил)-1H-индол-2-ил)метил)бензоат
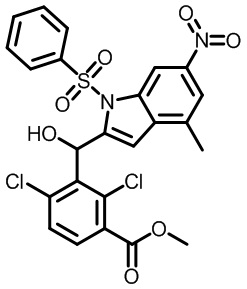
Используя процедуру, аналогичную примеру A, стадии 1, метил-2,4-дихлор-3-(гидрокси(4-метил-6-нитро-1-(фенилсульфонил)-1H-индол-2-ил)метил)бензоат (559 мг, 63%) получали из N-(2-бром-3-метил-5-нитрофенил)бензолсульфонамида (600 мг, 1,6 ммоль) (получение 76) и метил-2,4-дихлор-3-(1-гидроксипроп-2-ин-1-ил)бензоата (544 мг, 2,1 ммоль) (получение №1). LC/MS (Способ i): Время удерживания=2,49 мин.; MS масса/заряд: 531 [M+H]+ - H2O; 1H ЯМР (DMSO-d6, 300МГц): δ 8,71 (m, 1H), 8,01 (m, 1H), 7,81 (m, 2H), 7,70 (m, 2H), 7,50 (m, 3H), 6,99 (m, 2H), 6,82 (m, 1H), 3,86 (s, 3H), 2,50 (s, 3H).
Стадия 2: метил-2,4-дихлор-3-(гидрокси(4-метил-6-нитро-1H-индол-2-ил)метил)бензоат
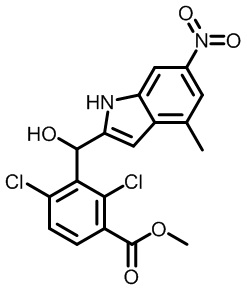
Используя процедуру, аналогичную примеру A, стадии 3, метил-2,4-дихлор-3-(гидрокси(4-метил-6-нитро-1H-индол-2-ил)метил)бензоат (506 мг, 61%) получали из метил-2,4-дихлор-3-(гидрокси(4-метил-6-нитро-1-(фенилсульфонил)-1H-индол-2-ил)метил)бензоата (1,1 г, 2,0 ммоль). LC/MS (Способ i): Время удерживания=2,26 мин.; MS масса/заряд: 409 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 11,88 (m, 1H), 8,16 (m, 1H), 7,73 (d, J=8,3 Гц, 1H), 7,67 (m, 1H), 7,63 (d, J=8,3 Гц, 1H), 6,82 (m, 2H), 6,14 (s, 1H), 3,86 (s, 3H), 2,45 (s, 3H).
Стадия 3: метил-2,4-дихлор-3-((4-метил-6-нитро-1H-индол-2-ил)метил)бензоат

Используя процедуру, аналогичную примеру A, стадии 2, метил-2,4-дихлор-3-((4-метил-6-нитро-1H-индол-2-ил)метил)бензоат (130 мг, 27%) получали из метил-2,4-дихлор-3-(гидрокси(4-метил-6-нитро-1H-индол-2-ил)метил)бензоата (493 мг, 1,2 ммоль). LC/MS (Способ i): Время удерживания=2,52 мин.; MS масса/заряд: 393 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 11,84 (s, 1H), 8,11 (m, 1H), 7,77 (d, J=8,8 Гц, 1H), 7,70 (d, J=8,8 Гц, 1H), 7,67 (m, 1H), 6,08 (m, 1H), 4,54 (s, 2H), 3,87 (s, 3H), 2,44 (s, 3H).
Стадия 4: метил-2,4-дихлор-3-((1,4-диметил-6-нитро-1H-индол-2-ил)метил)бензоат

Используя процедуру, аналогичную примеру P, стадии 4, метил-2,4-дихлор-3-((1,4-диметил-6-нитро-1H-индол-2-ил)метил)бензоат (161 мг, 100%) получали из метил-2,4-дихлор-3-((4-метил-6-нитро-1H-индол-2-ил)метил)бензоата (152 мг, 0,4 ммоль). LC/MS (Способ i): Время удерживания=2,59 мин.; MS масса/заряд: 407 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,35 (s, 1H), 7,81(d, J=8,4 Гц, 1H), 7,72 (d, J=8,4 Гц, 1H), 7,70 (s, 1H), 5,76 (s, 1H), 4,54 (s, 2H), 3,98 (s, 3H), 3,88 (s, 3H), 2,39 (s, 3H).
Стадия 5: 2,4-дихлор-3-((1,4-диметил-6-нитро-1H-индол-2-ил)метил)бензойная кислота
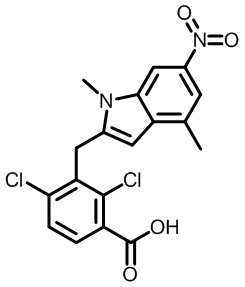
Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((1,4-диметил-6-нитро-1H-индол-2-ил)метил)бензойную кислоту (145 мг, 93%) получали из метил-2,4-дихлор-3-((1,4-диметил-6-нитро-1H-индол-2-ил)метил)бензоата (161 мг, 0,39 ммоль). LC/MS (Способ i): Время удерживания=2,24 мин.; MS масса/заряд: 393 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 13,68 (br., 1H), 8,35 (m, 1H), 7,77 (d, J=8,2 Гц, 1H), 7,71(m, 1H), 7,68 (d, J=8,2 Гц, 1H), 5,76 (s, 1H), 4,53 (s, 2H), 3,98 (s, 3H), 2,39 (s, 3H).
Стадия 6: (2,4-дихлор-3-((1,4-диметил-6-нитро-1H-индол-2-ил)метил)фенил)(морфолинo)метанон

Используя процедуру, аналогичную примеру A, стадии 6, (2,4-дихлор-3-((1,4-диметил-6-нитро-1H-индол-2-ил)метил)фенил)(морфолинo)метанон (217 мг, 100%) получали из 2,4-дихлор-3-((1,4-диметил-6-нитро-1H-индол-2-ил)метил)бензойной кислоты (145 мг, 0,36 ммоль) и морфолина (38,6 мг, 0,44 ммоль). LC/MS (Способ i): Время удерживания=2,27 мин.; MS масса/заряд: 462 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 8,35 (s, 1H), 7,70 (m, 2H), 7,47 (d, J=8,3 Гц, 1H), 5,79 (m, 1H), 4,50 (m, 2H), 3,98 (s, 3H), 3,65 (s, 4H), 3,55 (m, 2H), 3,18 (m, 2H), 2,39 (s, 3H).
Стадия 7: (3-((6-амино-1,4-диметил-1H-индол-2-ил)метил)-2,4-дихлорфенил)(морфолинo)метанон

Используя процедуру, аналогичную получению №18, стадии C, (3-((6-амино-1,4-диметил-1H-индол-2-ил)метил)-2,4-дихлорфенил)(морфолинo)метанон (91 мг, 45%) получали из (2,4-дихлор-3-((1,4-диметил-6-нитро-1H-индол-2-ил)метил)фенил)(морфолинo)метанона (217 мг, 0,5 ммоль). LC/MS (Способ i): Время удерживания=1,51 мин.; MS масса/заряд: 432 [M+H]+; 1H ЯМР (DMSO-d6, 300МГц): δ 7,65 (d, J=8,2 Гц, 1H), 7,40 (d, J=8,2 Гц, 1H), 6,32 (s, 1H), 6,15 (s, 1H), 5,30 (s, 1H), 4,64 (m, 2H), 4,31 (m, 2H), 3,65 (m, 4H), 3,63 (s, 3H), 3,54 (m, 2H), 3,20 (m, 2H), 2,13 (s, 3H).
Стадия 8: N-(2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-индол-6-ил)ацетамид

В раствор (3-((6-амино-1,4-диметил-1H-индол-2-ил)метил)-2,4-дихлорфенил)(морфолинo)метанона (91 мг, 0,21 ммоль) в DCM (2 мл) добавляли ацетилхлорид (0,016 мл, 0,232 ммоль) и триэтиламин (0,053 мл, 0,379 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Добавляли воду и смесь экстрагировали дважды DCM. Органический слой высушивали над сульфатом магния, фильтровали и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (элюирование с помощью 10% DCM в EtOAc) с получением N-(2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-индол-6-ил)ацетамида (57 мг, 54%). LC/MS (Способ g): Время удерживания=1,34 мин.; MS масса/заряд: 474 [M+H]+; 1H ЯМР (DMSO-d6, 500МГц): δ 9,76 (s, 1H), 7,69 (s, 1H), 7,66 (d, J=8,3 Гц, 1H), 7,43 (d, J=8,3 Гц, 1H), 6,80 (s, 1H), 5,46 (s, 1H), 4,41 (d, J=16,3 Гц, 1H), 4,36 (d, J=16,3 Гц, 1H), 3,74 (s, 3H), 3,65 (m, 4H), 3,54 (m, 2H), 3,17 (m, 2H), 2,24 (s, 3H), 2,03 (s, 3H).
Пример FL: 2-(1-(2-хлор-4-циклопропил-3-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
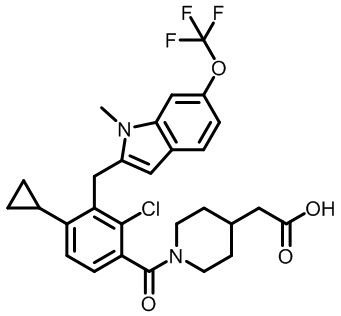
Стадия 1: трет-бутил-2-хлор-4-циклопропил-3-(гидрокси(1-(фенилсульфонил)-6-(трифторметокси)-1H-индол-2-ил)метил)бензоат
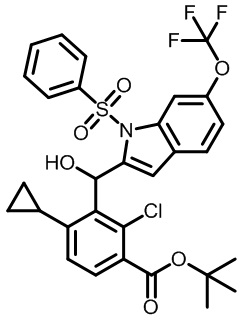
Используя процедуру, аналогичную примеру A, стадии 1, трет-бутил-2-хлор-4-циклопропил-3-(гидрокси(1-(фенилсульфонил)-6-(трифторметокси)-1H-индол-2-ил)метил)бензоат (786 мг, 38%) получали из N-(2-йод-5-(трифторметокси)фенил)бензолсульфонамида (1,26 г, 2,8 ммоль) (получение 75) и трет-бутил-2-хлор-4-циклопропил-3-(1-гидроксипроп-2-ин-1-ил)бензоата (1,05 г, 3,42 ммоль) (получение 58). LC/MS (Способ j): Время удерживания=2,65 мин.; MS масса/заряд: 680 [M-H]- +CH3COOH; 1H ЯМР (DMSO-d6, 300МГц): δ 8,04 (m, 2H), 7,92 (s, 1H), 7,65 (m, 4H), 7,48 (d, J=8,3 Гц, 1H), 7,26 (m, 2H), 6,96 (d, J=8,3 Гц, 1H), 6,60 ppm (d, J=5,6 Гц, 1H), 6,52 (s, 1H), 2,68 (m, 1H), 1,53 (s, 9H), 0,80 (m, 4H).
Стадия 2: 2-хлор-4-циклопропил-3-((1-(фенилсульфонил)-6-(трифторметокси)-1H-индол-2-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 2, 2-хлор-4-циклопропил-3-((1-(фенилсульфонил)-6-(трифторметокси)-1H-индол-2-ил)метил)бензойную кислоту (223 мг, 81%) получали из трет-бутил-2-хлор-4-циклопропил-3-(гидрокси(1-(фенилсульфонил)-6-(трифторметокси)-1H-индол-2-ил)метил)бензоата (250 мг, 0,4 ммоль). LC/MS (Способ j): Время удерживания=2,17 мин.; MS масса/заряд: 548 [M-H]- ; 1H ЯМР (DMSO-d6, 300МГц): δ 13,29 (m, 1H), 8,06 (s, 1H), 7,96 (m, 2H), 7,77 (m, 1H), 7,66 (m, 3H), 7,58 (d, J=8,6 Гц, 1H), 7,25 (m, 1H), 7,14 (d, J=8,6 Гц, 1H), 5,83 (s, 1H), 4,62 (s, 2H), 1,69 (m, 1H), 0,68 (m, 4H).
Стадия 3: 2-хлор-4-циклопропил-3-((6-(трифторметокси)-1H-индол-2-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 3, 2-хлор-4-циклопропил-3-((6-(трифторметокси)-1H-индол-2-ил)метил)бензойную кислоту (164 мг, 100%) получали из 2-хлор-4-циклопропил-3-((1-(фенилсульфонил)-6-(трифторметокси)-1H-индол-2-ил)метил)бензойной кислоты (220 мг, 0,4 ммоль). LC/MS (Способ j): Время удерживания=1,77 мин.; MS масса/заряд: 410 [M+H]+ ; 1H ЯМР (DMSO-d6, 300МГц): δ 11,29 (s, 1H), 7,53 (d, J=8,3 Гц, 1H), 7,42 (d, J=8,6 Гц, 1H), 7,27 (s, 1H), 7,08 (d, J=8,1 Гц, 1H), 6,88 (m, 1H), 5,83 (s, 1H), 4,50 (s, 2H), 1,99 (s, 1H), 0,90 (m, 2H), 0,69 (m, 2H).
Стадия 4: метил-2-хлор-4-циклопропил-3-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоат
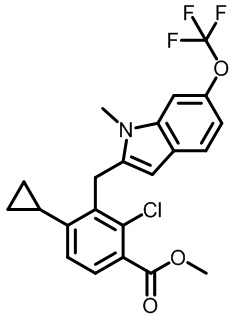
Используя процедуру, аналогичную примеру P, стадии 4, метил-2-хлор-4-циклопропил-3-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоат (100 мг, 57%) получали из 2-хлор-4-циклопропил-3-((6-(трифторметокси)-1H-индол-2-ил)метил)бензойной кислоты (131 мг, 0,32 ммоль). LC/MS (Способ j): Время удерживания=2,37 мин.; MS масса/заряд: 438 [M+H]+ ; 1H ЯМР (DMSO-d6, 300МГц): δ 7,65 (d, J=8,1 Гц, 1H), 7,51 (s, 1H), 7,42 (d, J=8,4 Гц, 1H), 7,15 (d, J=8,1 Гц, 1H), 6,93 (m, 1H), 5,56 (s, 1H), 4,50 (s, 2H), 3,87 (s, 3H), 3,84 (s, 3H), 1,94 (m, 1H), 0,91 (m, 2H), 0,71 (m, 2H).
Стадия 5: 2-хлор-4-циклопропил-3-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2-хлор-4-циклопропил-3-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензойную кислоту (77 мг, 81%) получали из метил-2-хлор-4-циклопропил-3-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоата (98 мг, 0,22 ммоль). LC/MS (Способ j): Время удерживания=1,90 мин.; MS масса/заряд: 424 [M+H]+ ; 1H ЯМР (DMSO-d6, 300МГц): δ 13,34 (широкий, 1H), 7,58 (d, J=8,1 Гц, 1H), 7,51 (s, 1H), 7,42 (d, J=8,6 Гц, 1H), 7,10 (d, J=8,1 Гц, 1H), 6,91 (m, 1H), 5,57 (s, 1H), 4,48 (s, 2H), 3,87 (s, 3H), 1,92 (s, 1H), 0,89 (m, 2H), 0,69 (m, 2H).
Стадия 6: метил-2-(1-(2-хлор-4-циклопропил-3-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат
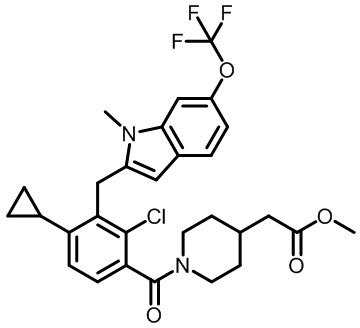
Используя процедуру, аналогичную примеру A, стадии 6, метил-2-(1-(2-хлор-4-циклопропил-3-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат (80 мг, 80%) получали из 2-хлор-4-циклопропил-3-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензойной кислоты (75 мг, 0,18 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (38 мг, 0,19 ммоль). LC/MS (Способ j): Время удерживания=2,15 мин.; MS масса/заряд: 563 [M+H]+ ; 1H ЯМР (DMSO-d6, 300МГц): δ 7,51 (s, 1H), 7,43 и 7,42 (d, J=8,5 Гц, 1H), 7,17 (m, 2H), 6,92 (m, 1H), 5,59 и 5,56 (s, 1H), 4,46 (m, 3H), 3,86 (s, 3H), 3,59 и 3,56 (s, 3H), 3,24 (m, 1H), 3,01 (m, 1H), 2,79 (m, 1H), 2,25 (m, 2H), 1,90 (m, 2H), 174 (m, 1H), 1,58 (m, 1H), 1,14 (m, 2H), 0,87 (m, 2H), 0,67 (m, 2H).
Стадия 7: 2-(1-(2-хлор-4-циклопропил-3-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
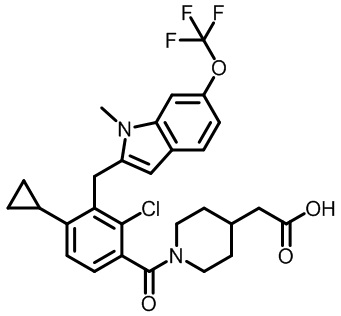
Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2-хлор-4-циклопропил-3-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (66 мг, 84%) получали из метил-2-(1-(2-хлор-4-циклопропил-3-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетата (80 мг, 0,14 ммоль). LC/MS (Способ g): Время удерживания=1,83 мин.; MS масса/заряд: 549 [M+H]+ ; 1H ЯМР (DMSO-d6, 400МГц): δ 12,21 (m, 1H), 7,51 (s, 1H), 7,43 и 7,42 (d, J=8,6 Гц, 1H), 7,25 и 7,18 (d, J=8,6 Гц, 1H), 7,11 (m, 1H), 6,92 (m, 1H), 5,59 и 5,57 (s, 1H), 4,46 (m, 3H), 3,86 (s, 3H), 3,26 (m, 1H), 3,01 (m, 1H), 2,77 (m, 1H), 2,17 (m, 1H), 2,11 (m, 1H), 1,90 (m, 2H), 1,76 (m, 1H), 1,62 (m, 1H), 1,12 (m, 2H), 0,88 (m, 2H), 0,67 (m, 2H).
Пример FM: 2-(1-(2,4-дихлор-3-((6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота
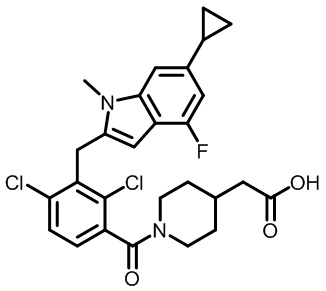
Стадия 1: трет-бутил-2,4-дихлор-3-((6-циклопропил-4-фтор-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)бензоат
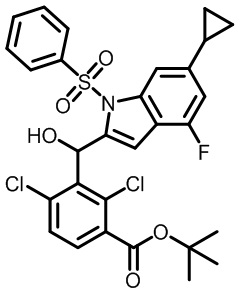
Используя процедуру, аналогичную примеру CJ, стадии 1, трет-бутил-2,4-дихлор-3-((6-циклопропил-4-фтор-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)бензоат (180 мг, 71%) получали из 6-циклопропил-4-фтор-1-(фенилсульфонил)-1H-индола (135 мг, 0,43 ммоль) (получение 77) и трет-бутил-2,4-дихлор-3-формилбензоата (177 мг, 0,64 ммоль) (получение №33, стадия B). LC/MS (Способ j): Время удерживания=2,48 мин.; MS масса/заряд: 572 [M+H]+ -H2O; 1H ЯМР (DMSO-d6, 300МГц): δ 7,89 (m, 2H), 7,69 (m, 1H), 7,56 (m, 5H), 6,99 (m, 1H), 6,79 (m, 1H), 6,61 (m, 1H), 6,56 (s, 1H), 2,09 (m, 1H), 1,54 (s, 9H), 1,01 (m, 2H), 0,70 (m, 2H).
Стадия 2: 2,4-дихлор-3-((6-циклопропил-4-фтор-1-(фенилсульфонил)-1H-индол-2-ил)метил)бензойная кислота
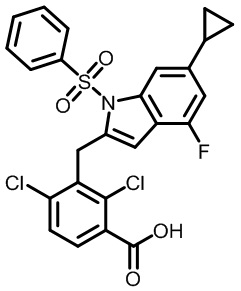
Используя процедуру, аналогичную примеру A, стадии 2, 2,4-дихлор-3-((6-циклопропил-4-фтор-1-(фенилсульфонил)-1H-индол-2-ил)метил)бензойную кислоту (700 мг, 100%) получали из трет-бутил-2,4-дихлор-3-((6-циклопропил-4-фтор-1-(фенилсульфонил)-1H-индол-2-ил)(гидрокси)метил)бензоата (920 мг, 1,2 ммоль). LC/MS (Способ j): Время удерживания=2,09 мин.; MS масса/заряд: 516 [M-H]- ; 1H ЯМР (DMSO-d6, 300МГц): δ=13,64 (широкий, 1H), 7,96 (m, 2H), 7,78 (m, 2H), 7,68 (m, 4H), 6,78 (m, 1H), 5,68 (s, 1H), 4,57 (s, 2H), 2,12 (m, 1H), 1,03 (m, 2H), 0,73 (m, 2H).
Стадия 3: 2,4-дихлор-3-((6-циклопропил-4-фтор-1H-индол-2-ил)метил)бензойная кислота

Используя процедуру, аналогичную примеру A, стадии 3, 2,4-дихлор-3-((6-циклопропил-4-фтор-1H-индол-2-ил)метил)бензойную кислоту (620 мг, 69%) получали из 2,4-дихлор-3-((6-циклопропил-4-фтор-1-(фенилсульфонил)-1H-индол-2-ил)метил)бензойной кислоты (697 мг, 1,3 ммоль). LC/MS (Способ j): Время удерживания=1,59 мин.; MS масса/заряд: 378 [M+H]+ ; 1H ЯМР (DMSO-d6, 300МГц): δ=13,60 (широкий, 1H), 11,17 (s, 1H), 7,70 (d, J=8,6 Гц, 1H), 7,63 (d, J=8,6 Гц, 1H), 6,89 (s, 1H), 6,44 (m, 1H), 5,73 (m, 1H), 4,42 (m, 2H), 1,97 (m, 1H), 0,91 (m, 2H), 0,63 (m, 2H).
Стадия 4: метил-2,4-дихлор-3-((6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил)бензоат

Используя процедуру, аналогичную примеру P, стадии 4, метил-2,4-дихлор-3-((6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил)бензоат (219 мг, 33%) получали из 2,4-дихлор-3-((6-циклопропил-4-фтор-1H-индол-2-ил)метил)бензойной кислоты (618 мг, 1,6 ммоль). LC/MS (Способ j): Время удерживания=2,26 мин.; MS масса/заряд: 406 [M+H]+ ; 1H ЯМР (DMSO-d6, 300МГц): δ 7,78 (d, J=8,8 Гц, 1H), 7,70 (d, J=8,8 Гц, 1H), 7,04 (s, 1H), 6,50 (m, 1H), 5,42 (s, 1H), 4,42 (s, 2H), 3,88 (s, 3H), 3,81 (s, 3H), 2,01 (m, 1H), 0,94 (m, 2H), 0,71 (m, 2H).
Стадия 5: 2,4-дихлор-3-((6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил)бензойная кислота
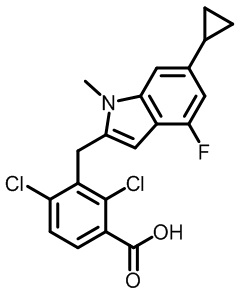
Используя процедуру, аналогичную примеру A, стадии 5, 2,4-дихлор-3-((6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил)бензойную кислоту (145 мг, 57%) получали из метил-2,4-дихлор-3-((6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил)бензоата (263 мг, 0,64 ммоль). LC/MS (Способ j): Время удерживания=1,78 мин.; MS масса/заряд: 392 [M+H]+.
Стадия 6: метил-2-(1-(2,4-дихлор-3-((6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат

Используя процедуру, аналогичную примеру A, стадии 6, метил-2-(1-(2,4-дихлор-3-((6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетат (81 мг, 84%) получали из 2,4-дихлор-3-((6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил)бензойной кислоты (71 мг, 0,18 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (70 мг, 0,36 ммоль). LC/MS (Способ i): Время удерживания=2,63 мин.; MS масса/заряд: 531 [M+H]+ ; 1H ЯМР (DMSO-d6, 300МГц): δ 7,64 и 7,63 (d, J=8,3 Гц, 1H), 7,42 и 7,35 (d, J=8,3 Гц, 1H), 7,04 (s, 1H), 6,49 (m, 1H), 5,44 (m, 1H), 4,41 (m, 3H), 3,81 (s, 3H), 3,59 и 3,56 (s, 3H), 3,27 (m, 1H), 3,05 (m, 1H), 2,78 (m, 1H), 2,26 (m, 2H), 1,99 (m, 2H), 1,75 (m, 1H), 1,59 (m, 1H), 1,17 (m, 2H), 0,94 (m, 2H), 0,70 (m, 2H).
Стадия 7: 2-(1-(2,4-дихлор-3-((6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

Используя процедуру, аналогичную примеру A, стадии 5, 2-(1-(2,4-дихлор-3-((6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту (41 мг, 53%) получали из метил-2-(1-(2,4-дихлор-3-((6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-ил)ацетата (79 мг, 0,15 ммоль). LC/MS (Способ g): Время удерживания=1,83 мин.; MS масса/заряд: 517 [M+H]+ ; 1H ЯМР (DMSO-d6, 400МГц): δ=12,10 (s, 1H), 7,64 и 7,63 (d, J=8,1 Гц, 1H), 7,42 и 7,35 (d, J=8,1 Гц, 1H), 7,04 (s, 1H), 6,49 (s, 1H), 5,45 (m, 1H), 4,42 (m, 3H), 3,81 (s, 3H), 3,26 (m, 1H), 3,04 (m, 1H), 2,80 (m, 1H), 2,15 (m, 2H), 1,97 (m, 2H), 1,77 (m, 1H), 1,61 (m, 1H), 1,14 (m, 2H), 0,93 (m, 2H), 0,70 (m, 2H).
Пример FN: 1-(2,4-дихлор-3-((6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-карбоновая кислота
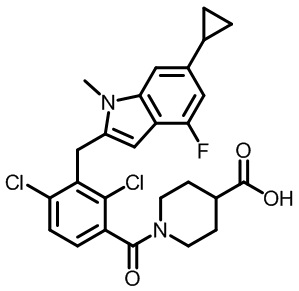
Стадия 1: метил-1-(2,4-дихлор-3-((6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-карбоксилат
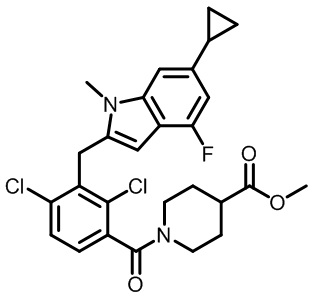
Используя процедуру, аналогичную примеру A, стадии 6, метил-1-(2,4-дихлор-3-((6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-карбоксилат (74 мг, 80%) получали из 2,4-дихлор-3-((6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил)бензойной кислоты (70 мг, 0,18 ммоль) (пример FM, стадия 5) и метилпиперидин-4-карбоксилата гидрохлорида (64 мг, 0,36 ммоль). LC/MS (Способ j): Время удерживания=1,98 мин.; MS масса/заряд: 517 [M+H]+ ; 1H ЯМР (DMSO-d6, 300МГц): δ 7,64 (d, J=8,3 Гц, 1H), 7,45 и 7,38 (d, J=8,3 Гц, 1H), 7,04 (s, 1H), 6,50 (m, 1H), 5,45 (m, 1H), 4,38 (m, 3H), 3,81 (m, 3H), 3,62 и 3,59 (s, 3H), 3,28 (m, 1H), 3,13 (m, 1H), 2,97 (m, 1H), 2,68 (m, 1H), 1,98 (m, 2H), 1,77 (m, 1H), 1,52 (m, 2H), 0,93 (m, 2H), 0,71 (m, 2H).
Стадия 2: 1-(2,4-дихлор-3-((6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-карбоновая кислота
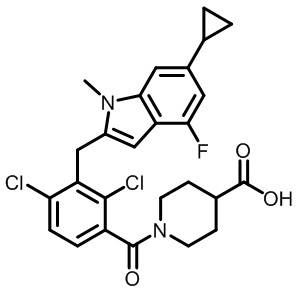
Используя процедуру, аналогичную примеру A, стадии 5, 1-(2,4-дихлор-3-((6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-карбоновую кислоту (34 мг, 48%) получали из метил-1-(2,4-дихлор-3-((6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил)бензоил)пиперидин-4-карбоксилата (72 мг, 0,13 ммоль). LC/MS (Способ g): Время удерживания=1,81 мин.; MS масса/заряд: 503 [M+H]+ ; 1H ЯМР (DMSO-d6, 400МГц): δ 12,33 (широкий, 1H), 7,64 (d, J=8,1 Гц, 1H), 7,44 и 7,38 (d, J=8,1 Гц, 1H), 7,04 (s, 1H), 6,50 (m, 1H), 5,45 (m, 1H), 4,38 (m, 3H), 3,81 (s, 3H), 3,25 (m, 1H), 3,08 (m, 1H), 2,98 (m, 1H), 2,54 (m, 1H), 2,01 (m, 1H), 1,92 (m, 1H), 1,78 (m, 1H), 1,49 (m, 2H), 0,94 (m, 2H), 0,71 (m, 2H).
Пример FO: 2-[[2,6-дихлор-3-(морфолин-4-карбонил)фенил]метил]-N,N,1,4-тетраметил-индол-6-карбоксамид
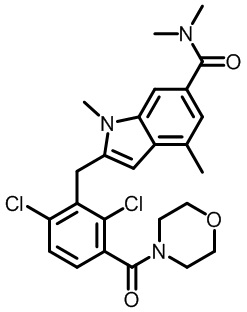
Стадия 1: 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-индол-6-карбоновая кислота

В суспензию 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-индол-6-карбонитрила (пример AA-35) в этиленгликоле (600 мкл, 10,76 ммоль) добавляли 3 M раствор гидроксида калия (400 мкл, 1,20 ммоль) и реакционную смесь перемешивали 1,5 часа при 130°C под микроволновым облучением. Реакционную смесь разбавляли водой и промывали дважды с помощью DCM. Водный слой подкисляли 1 M раствором HCl, экстрагировали с помощью DCM, высушивали над сульфатом магния, фильтровали и выпаривали. 2-(2,6-Дихлор-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-индол-6-карбоновую кислоту (16 мг, 53,4%) выделяли в виде дробленого белого порошка. LC/MS (Способ i): Время удерживания=1,90 мин.; MS масса/заряд: 461 [M+H]+ ; 1H ЯМР (DMSO-d6, 300МГц): δ 12,47 (широкий, 1H), 7,92 (s, 1H), 7,68 (d, J=8,4 Гц, 1H), 7,45 (d, J=8,4 Гц, 1H), 7,40 (s, 1H), 5,64 (m, 1H), 4,46 (m, 2H), 3,89 (s, 3H), 3,65 (m, 4H), 3,54 (m, 2H), 3,18 (m, 2H), 2,33 (m, 3H).
Стадия 2: 2-[[2,6-дихлор-3-(морфолин-4-карбонил)фенил]метил]-N,N,1,4-тетраметил-индол-6-карбоксамид

Используя процедуру, аналогичную примеру A, стадии 6, 2-[[2,6-дихлор-3-(морфолин-4-карбонил)фенил]метил]-N,N,1,4-тетраметил-индол-6-карбоксамид (29 мг, 55%) получали из 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-индол-6-карбоновой кислоты (50 мг, 0,11 ммоль). LC/MS (Способ g): Время удерживания=1,42 мин.; MS масса/заряд: 488 [M+H]+ ; 1H ЯМР (DMSO-d6, 400МГц): δ=7,68 (d, J=8,1 Гц, 1H), 7,45 (d, J=8,1 Гц, 1H), 7,35 (s, 1H), 6,81 (s, 1H), 5,58 (s, 1H), 4,43 (m, 2H), 3,85 (s, 3H), 3,65 (m, 4H), 3,54 (m, 2H), 3,12-3,26 (m, 2H), 2,98 (s, 6H), 2,30 (s, 3H).
Пример FP: 2-[[2,6-дихлор-3-(морфолин-4-карбонил)фенил]метил]-N,1,4-триметил-индол-6-карбоксамид
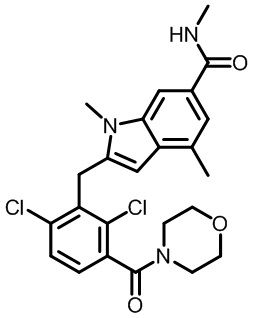
Используя процедуру, аналогичную примеру A1, 2-[[2,6-дихлор-3-(морфолин-4-карбонил)фенил]метил]-N,1,4-триметил-индол-6-карбоксамид (35 мг, 68%) получали из 2-(2,6-дихлор-3-(морфолин-4-карбонил)бензил)-1,4-диметил-1H-индол-6-карбоновой кислоты (50 мг, 0,11 ммоль) (пример FO, стадия 1) и метиламина (0,217 мкл, 0,43 ммоль). LC/MS (Способ g): Время удерживания=1,32 мин.; MS масса/заряд: 474 [M+H]+; 1H ЯМР (DMSO-d6, 400МГц): δ 8,26 (m, 1H), 7,82 (s, 1H), 7,68 (d, J=8,4 Гц, 1H), 7,45 (d, J=8,4 Гц, 1H), 7,31 (m, 1H), 5,59 (s, 1H), 4,44 (m, 2H), 3,87 (s, 3H), 3,65 (m, 4H), 3,54 (m, 2H), 3,19 (m, 2H), 2,80 (d, J=4,4 Гц, 3H), 2,32 (s, 3H).
Пример FQ: 1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-3-ил)метил)бензоил)пиперидин-4-карбоновая кислота
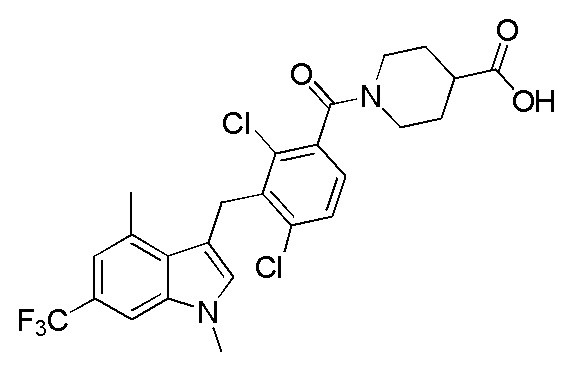
Стадия 1: 2-бром-1-метил-3-нитро-5-(трифторметил)бензол
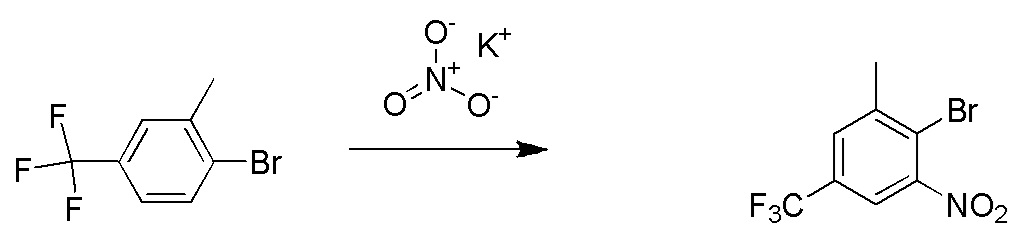
Желтый двухфазный раствор 1-бром-2-метил-4-(трифторметил)бензола (40,65 г, 170 ммоль) (Combi-blocks) и H2SO4 (203 мл) охлаждали на ледяной бане и порциями добавляли нитрат калия (20,63 г, 204 ммоль), поддерживая температуру на уровне <25oC. Ледяную баню удаляли и температуру поддерживали на уровне 20-25oC. Через 1,5 часа LC/MS показала завершение реакции. Раствор охлаждали на ледяной бане и добавляли воду (400 мл) за 10 минут, поддерживая температуру <30oC. Водный слой экстрагировали при помощи MTBE (2×100 мл), органический слой промывали солевым раствором (2×50 мл). Экстракты объединяли и высушивали над Na2SO4, фильтровали и растворитель удаляли с получением 2-бром-1-метил-3-нитро-5-(трифторметил)бензола (45,1 г, 159 ммоль, выход 93%), используемый без дополнительной очистки. LC/MS (Способ i) Время удерживания=1,73 минуты; MS масса/заряд: 282,13 & 283,95 (M-H)-; неочищенный 1H ЯМР показал соотношение изомеров 5:1
Стадия 2: бензил-2-циано-2-(2-метил-6-нитро-4-(трифторметил)фенил)ацетат
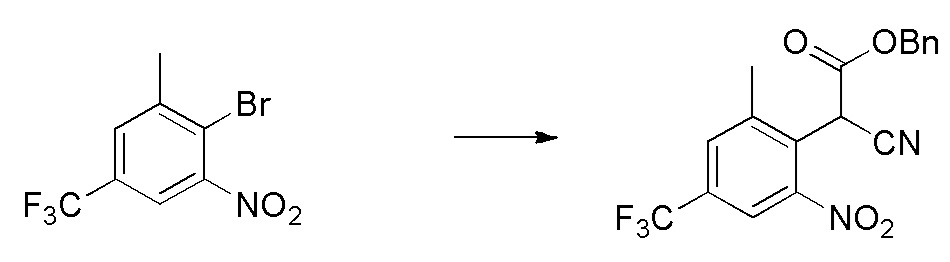
Смесь 2-бром-1-метил-3-нитро-5-(трифторметил)бензола (86,6 г, 305 ммоль), DMF (178 мл), бензилцианоацетата (46,7 мл, 305 ммоль) и карбоната калия (93 г, 671 ммоль) нагревали до 80oC. Через 90 минут раствор охлаждали до <20°C добавлением воды/льда (800 мл), а затем 2 н. HCl (534 мл, 1067 ммоль) аккуратно при <25oC. Неочищенный продукт разделяли между кислой водной фазой и EtOAc (4×150 мл). Органические экстракты объединяли, промывали водой (3×200 мл) и солевым раствором (200 мл), высушивали над Na2SO4, фильтровали и растворитель удаляли in vacuo с получением темной смолы, которая загустевала при отстаивании. Твердое вещество растирали с MTBE (100 мл) в течение 15 минут перед добавлением по каплям гептана (200 мл). Твердое вещество собирали и промывали смесью 1:2 MTBE/гептаны (2×50 мл), наконец, с помощью Et2O (2×20 мл) и высушивали с получением бежевого порошкообразного твердого вещества бензил-2-циано-2-(2-метил-6-нитро-4-(трифторметил)фенил)ацетата (71 г, 184 ммоль, 60,3%). LC/MS (Способ i) Время удерживания=1,73 минуты; MS масса/заряд: 377,31 (M-H)-.
Стадия 3: 4-метил-6-(трифторметил)-1H-индол
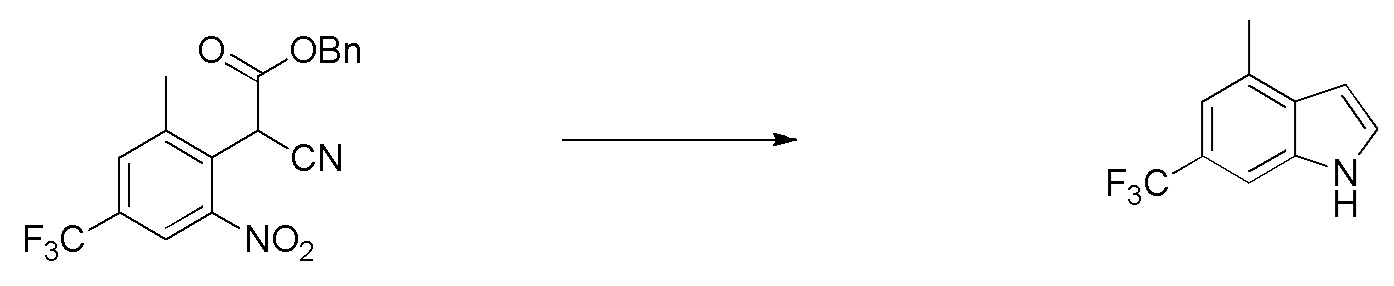
Бензил-2-циано-2-(2-метил-6-нитро-4-(трифторметил)фенил)ацетат (63,5 г, 168 ммоль), EtOH (490 мл), воду (49 мл), уксусную кислоту (49 мл) добавляли в 5% Pd/C (влажный JM№9) (21,51 г, 101 ммоль) в 1,7 л гидрогенизаторе Парра и встряхивали в течение 23 часов при давлении 70 фунтов/кв. дюйм и температуре 50°C. Смесь охлаждали до к. т. и фильтровали с концентрированием in vacuo при 50°C, разбавляли с помощью EtOAc (200 мл) и воды (200 мл). Водный слой отделяли и экстрагировали с помощью EtOAc (2×50 мл). Исходный EtOAC и экстракты объединяли, промывали с помощью 2 н. HCl (2×80 мл), а затем 10% водным Na2S2O3 (2×100 мл), насыщенным водным NaHCO3 (3×150 мл) и солевым раствором (2×50 мл), высушивали (Na2SO4), фильтровали и растворитель дистиллировали с получением жидкости пурпурного цвета, которая загустевала при отстаивании 4-метил-6-(трифторметил)-1H-индола (38 г, 191 ммоль, выход 100%). Использовали без дополнительной очистки. LC/MS (Способ i) Время удерживания=1,58 минуты; MS масса/заряд: 198,23 (M-H)-.
Стадия 4: трет-бутил-2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-индол-3-ил)метил)бензоат

Раствор 4-метил-6-(трифторметил)-1H-индола (14,4 г, 72,3 ммоль) в DCM (75 мл) охлаждали до <5°C и добавляли трет-бутил-2,4-дихлор-3-формилбензоат (21,88 г, 80 ммоль) (получение №33, стадия B), триэтилсилан (34,6 мл, 217 ммоль) и 2,2,2-TFA (8,36 мл, 108 ммоль), поддерживая температуру на уровне <5°C. Через 2 часа реакционную смесь выливали в перемешанный раствор из MTBE (200 мл) и насыщенного NaHCO3 (200 мл). Через 30 минут органический слой отделяли, промывали солевым раствором и концентрировали in vacuo с получением трет-бутил-2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-индол-3-ил)метил)бензоата в виде масла. Неочищенный продукт использовали без дополнительной очистки.
Стадия 5: 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-3-ил)метил)бензойная кислота
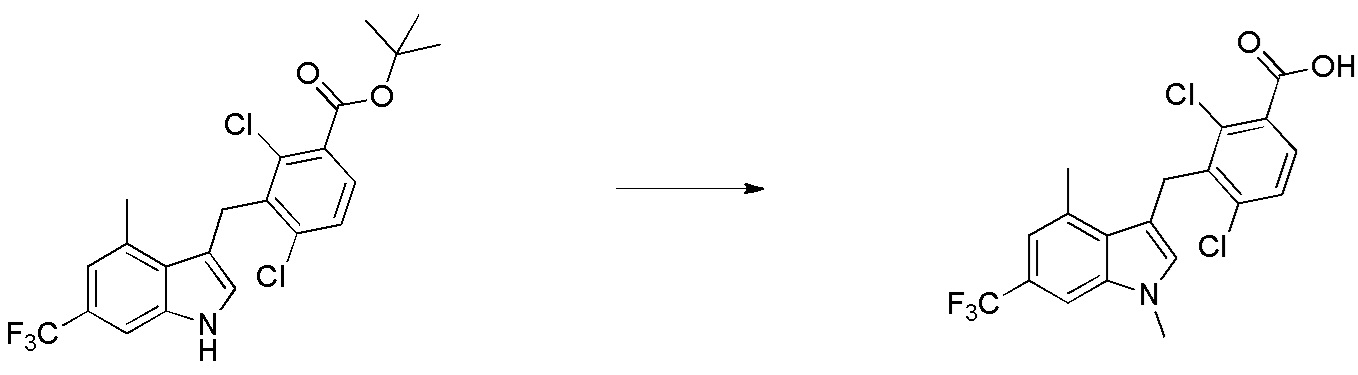
В раствор неочищенного трет-бутил-2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-индол-3-ил)метил)бензоата (33 г, 72,0 ммоль) в DMF (100 мл) добавляли йодметан (4,95 мл, 79 ммоль), а затем раствор 2-метилпропан-2-олята натрия (7,61 г, 79 ммоль) в DMF (50 мл), в то же время поддерживая температуру приблизительно 25-30°C. Через 4 ч. реакционную смесь разбавляли с помощью MTBE (200 мл) и NH4Cl (100 мл). Органический слой отделяли, промывали водой (100 мл) и солевым раствором (100 мл), высушивали (Na2SO4), фильтровали и концентрировали in vacuo. Неочищенный сложный эфир растворяли в 1,4-диоксане (240 мл) и 6 н. растворе хлороводорода (120 мл, 720 ммоль). Реакционную смесь нагревали до 85°C. Через 48 часов реакционную смесь охлаждали до комнатной температуры и добавляли MTBE (200 мл). Органический слой отделяли, промывали солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали in vacuo. Неочищенный материал суспендировали в ACN (100 мл), в течение короткого периода нагревали до 70°C, охлаждали до комнатной температуры и фильтровали. Твердые вещества содержали продукт и неорганические соли (нерастворимые в DMSO или MeOH). Твердые вещества растворяли в EtOAc (200 мл) и промывали водой (100 мл) и солевым раствором (100 мл), высушивали над Na2SO4, фильтровали и концентрировали in vacuo. Твердые вещества суспендировали в ACN (100 мл), нагревали до 70°C при перемешивании. Через 2 часа смесь охлаждали до комнатной температуры и фильтровали с получением 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-3-ил)метил)бензойной кислоты (20 г, 48,1 ммоль, 66,7% в виде желтовато-коричневого твердого вещества. LC/MS (Способ i), Время удерживания=2,18 минуты; MS масса/заряд: 414 (M-H)-.
Стадия 6: 1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-3-ил)метил)бензоил)пиперидин-4-карбоновая кислота
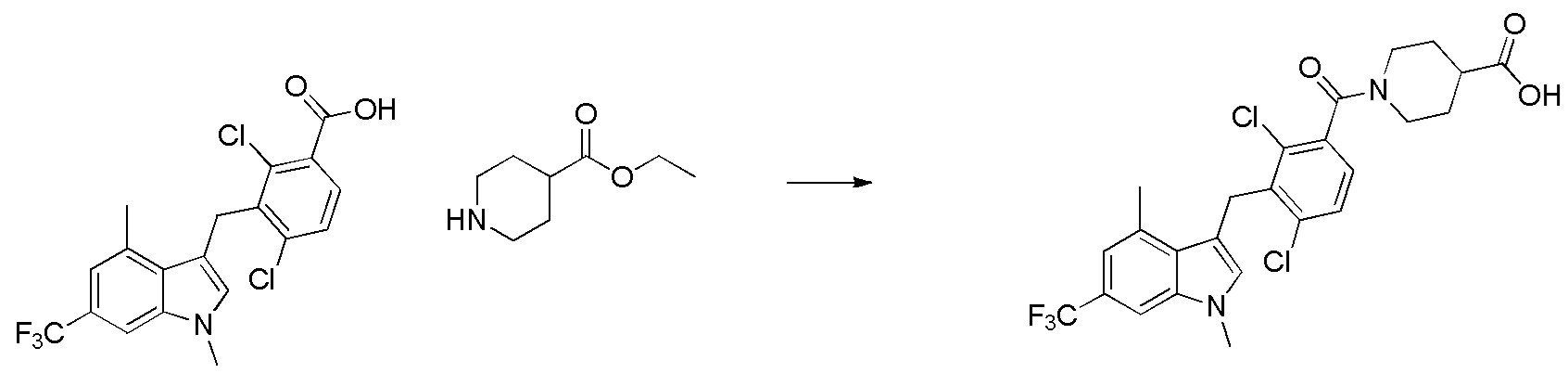
Во взвесь 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-3-ил)метил)бензойной кислоты (20 г, 48,1 ммоль) в THF (200 мл) добавляли 2-(3H-[1,2,3]триазоло[4,5-b]пиридин-3-ил)-1,1,3,3-тетраметилизоурония гексафторфосфата (V) (20,10 г, 52,9 ммоль), а затем триэтиламин (26,8 мл, 192 ммоль). Через 10 минут этилпиперидин-4-карбоксилат, хлористоводородную кислоту (10,24 г, 52,9 ммоль) добавляли одной порцией. Через 2 часа LC/MS показала завершение реакции (желтый, практически однородный раствор). Смесь разбавляли с помощью MTBE (300 мл) и промывали с помощью 1 н. HCl (50 мл x 3), 1 н. NaOH (50 мл x 3), насыщенного NH4Cl (50 мл) и солевого раствора (50 мл), высушивали над Na2SO4, фильтровали и концентрировали in vacuo с получением желтого масла. Масло растворяли в MTBE (200 мл) и добавляли обесцвечивающий уголь (15 г). Через 30 минут перемешивания смесь фильтровали и in vacuo концентрировали с получением пены. В раствор сложного эфира в 1,4-диоксане (200 мл) добавляли 2 н. гидроксид натрия (96 мл, 192 ммоль). Реакционную смесь нагревали до 75°C. Добавляли MeOH до однородности. Через 1 час гидролиз завершался. Раствор охлаждали до комнатной температуры, добавляли MTBE (500 мл) и pH доводили до 1 при помощи 5 н. HCl. Органический слой отделяли, промывали водой (2×100 мл), солевым раствором (100 мл), высушивали над Na2SO4 фильтровали и концентрировали in vacuo с получением желтого твердого вещества. Твердые вещества суспендировали в ACN и перемешивали в течение приблизительно 18 часов. Через 15 часов твердые вещества собирали фильтрацией, промывая с помощью ACN (2×10 мл). После сушки в течение 30 минут твердые вещества переносили в сосуд и высушивали в вакуумной печи при 55°C в течение приблизительно 18 часов с получением 1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-индол-3-ил)метил)бензоил)пиперидин-4-карбоновой кислоты (24,5 г, 46,5 ммоль, выход 97%) в виде белого твердого вещества. LC/MS (Способ i), Время удерживания=2,52 минуты; MS масса/заряд: 525 (M-H)-.
Пример FR: 2-(1-(3,5-дихлор-4-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)пиколиноил)пиперидин-4-ил)уксусная кислота

Стадия 1: 3,5-дихлор-4-(диэтоксиметил)пиридин 1-оксид
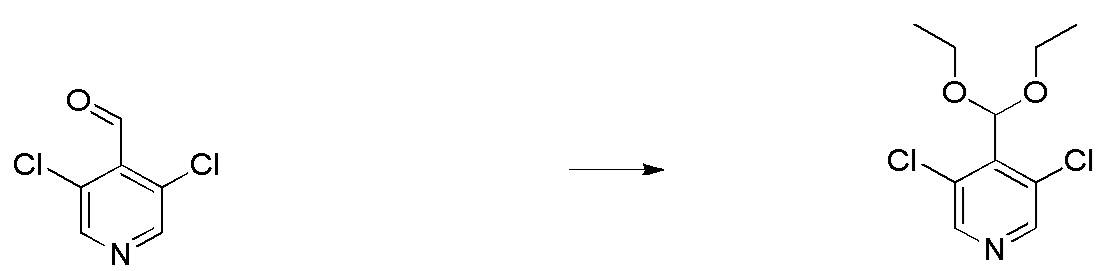
В раствор 3,5-дихлоризоникотинальдегида (50 г, 284 ммоль) в EtOH (500 мл) добавляли триэтоксиметан (47,3 мл, 284 ммоль), а затем серную кислоту (1,514 мл, 28,4 ммоль). Реакционную смесь нагревали 75°C. Через 4 часа реакционную смесь охлаждали до комнатной температуры, частично концентрировали in vacuo, и твердые вещества начинали осаждаться. Твердые вещества собирали фильтрацией и высушивали in vacuo с получением 3,5-дихлор-4-(диэтоксиметил)пиридина (41 г, 164 ммоль, 57,7%) в виде грязно-белого твердого вещества. Фильтрат частично концентрировали in vacuo до приблизительно 100 мл и охлаждали на ледяной бане. Через 30 минут дополнительные твердые вещества собирали фильтрацией, промывали ледяным EtOH и высушивали in vacuo с получением 3,5-дихлор-4-(диэтоксиметил)пиридина (20,2 г, 81 ммоль, выход 28,4%) в виде грязно-белого твердого вещества. Две партии объединяли. 1H ЯМР (400 МГц, DMSO-d6) δ 8,60 (s, 1H), 5,89 (s, 1H), 3,73 (dq, J=9,7, 7,1 Гц, 2H), 3,50 (dq, J=9,7, 7,0 Гц, 2H), 1,13 (t, J=7,0 Гц, 6H).
Стадия 2: 3,5-дихлор-4-(диэтоксиметил)пиридин 1-оксид
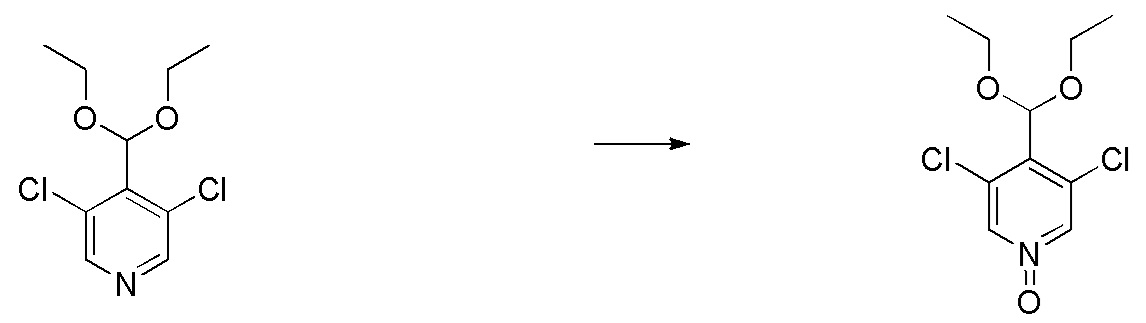
В раствор 3,5-дихлор-4-(диэтоксиметил)пиридина (41 г, 164 ммоль) в DCM (200 мл) добавляли 3-хлорбензопероксокислоту (44,1 г, 197 ммоль). Через 2 дня реакционную смесь разбавляли с помощью Et2O (приблизительно 300 мл) и промывали с помощью 2 н. NaOH (2×300 мл), солевого раствора (100 мл), высушивали над Na2SO4, фильтровали и концентрировали in vacuo. Полученные твердые вещества суспендировали в гептане (приблизительно 40 мл). Через 30 минут перемешивания твердые вещества собирали фильтрацией и высушивали in vacuo с получением 3,5-дихлор-4-(диэтоксиметил)пиридин-1-оксида (34,5 г, 130 ммоль, 79%) в виде желтовато-коричневого твердого вещества. LC/MS (Способ i), Время удерживания=1,70 минуты; MS масса/заряд: 266 (M+H)+.
Стадия 3: 3,5-дихлор-4-(гидроксиметил)пиколинат

В раствор 3,5-дихлор-4-(диэтоксиметил)пиридин-1-оксида (67 г, 252 ммоль) в ACN (140 мл) добавляли триэтиламин (70,2 мл, 504 ммоль), а затем триметилсиланкарбонитрил (101 мл, 755 ммоль). Реакционную смесь продували азотом. Через 10 минут сосуд с реакционной смесью оснащали обратным холодильником и баллоном. Реакционную смесь нагревали до 80°C. Через 15 часов реакционную смесь охлаждали до комнатной температуры и концентрировали in vacuo. Смесь разбавляли с помощью 2 н. гидроксида натрия (629 мл, 1259 ммоль) и диоксана (~60 мл). Реакционную смесь нагревали до 80°C. Через 15 часов реакционную смесь охлаждали до комнатной температуры, разбавляли с помощью EtOAc (приблизительно 600 мл) и pH реакционной смеси доводили до 1 при помощи концентрированной HCl. Органический слой отделяли, высушивали над Na2SO4, фильтровали и концентрировали in vacuo. Твердые вещества суспендировали в гептане (приблизительно 100 мл) при перемешивании. Через 2 часа твердые вещества собирали фильтрацией с получением 3,5-дихлор-4-(диэтоксиметил)пиколиновой кислоты. Ацеталь суспендировали в 6 н. HCl (500 мл) и 1,4-диоксане (приблизительно 50 мл). Через 2 часа LC/MS показала присутствие альдегида, и образовывалось значительное количество твердых веществ. Твердые вещества растворяли в EtOAc (600 мл). Кислый водный слой экстрагировали с помощью EtOAc (3×200 мл). Все органические вещества объединяли, промывали солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали in vacuo при помощи смены растворителя на гептаны при концентрировании. Полученные твердые вещества собирали фильтрацией с получением 3,5-дихлор-4-формилпиколиновой кислоты (47 г, 214 ммоль, выход 85%) в виде желтовато-коричневого твердого вещества. LC/MS (Способ i), Время удерживания=0,40 минуты; MS масса/заряд: 218 (M-H)-.
Стадия 4: 3,5-дихлор-4-(гидроксиметил)пиколинат

В раствор 3,5-дихлор-4-формилпиколиновой кислоты (51,6 г, 235 ммоль) в EtOH (500 мл) аккуратно добавляли тетрагидроборат натрия (18,63 г, 493 ммоль) для поддержания температуры около 35°C при добавлении. Осадок образовывался сразу после добавления. Через 2 часа при комнатной температуре медленно добавляли MTBE (150 мл). Через 30 минут твердые вещества собирали фильтрацией, промывая с помощью MTBE, и высушивали in vacuo при 50°C с получением неочищенного натрия 3,5-дихлор-4-(гидроксиметил)пиколината (70 г), который использовали на следующей стадии без дополнительной очистки. 1H ЯМР (DMSO, d6): δ 8,30 (s, 1H); 4,64 (s, 2H).
Стадия 5: 3,5-дихлор-4-(хлорметил)пиколиновая кислота

Во взвесь 3,5-дихлор-4-(гидроксиметил)пиколиновой кислоты (70 г, 236 ммоль) в DCM (150 мл) добавляли дихлорид серы (69,0 мл, 946 ммоль). Через 15 часов для контроля энергичного кипения аккуратно добавляли воду (5 мл), затем EtOAc (200 мл). Органические слои отделяли, высушивали над Na2SO4, фильтровали и концентрировали in vacuo с получением грязно-белого твердого вещества, 3,5-дихлор-4-(хлорметил)пиколиновой кислоты (50,7 г, 211 ммоль, 89%). LC/MS (Способ i), Время удерживания=0,30 минуты; MS масса/заряд: 240 (M-H)-.
Стадия 6: 3,5-дихлор-4-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)пиколиновая кислота

В раствор 3,7-диметил-5-(трифторметил)-1H-индола (38 г, 178 ммоль) (получение №43) в THF (400 мл) добавляли гидрид натрия (15,68 г, 392 ммоль). Через 15 минут добавляли 3,5-дихлор-4-(хлорметил)пиколиновую кислоту (42,9 г, 178 ммоль) в DMF (100 мл). Через 15 часов реакционная смесь загустевала. Реакционную смесь разбавляли с помощью MTBE (600 мл) и воды (600 мл). pH водного слоя доводили до 1 при помощи 5 н. HCl. Органические слои отделяли, промывали солевым раствором (300 мл), высушивали над Na2SO4, фильтровали и концентрировали in vacuo. Продукт концентрировали из ACN несколько раз, затем суспендировали в ACN (200 мл), перемешивали в течение ночи. Твердые вещества собирали, промывали с помощью ACN (20 мл) и высушивали in vacuo с получением 3,5-дихлор-4-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)пиколиновой кислоты (35,2 г, 84 ммоль, выход 47,3%) в виде желтовато-коричневого твердого вещества. LC/MS (Способ i), Время удерживания=1,20 минуты; MS масса/заряд: 417 (M-H)-.
Стадия 7: метил-2-(1-(3,5-дихлор-4-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)пиколиноил)пиперидин-4-ил)ацетат
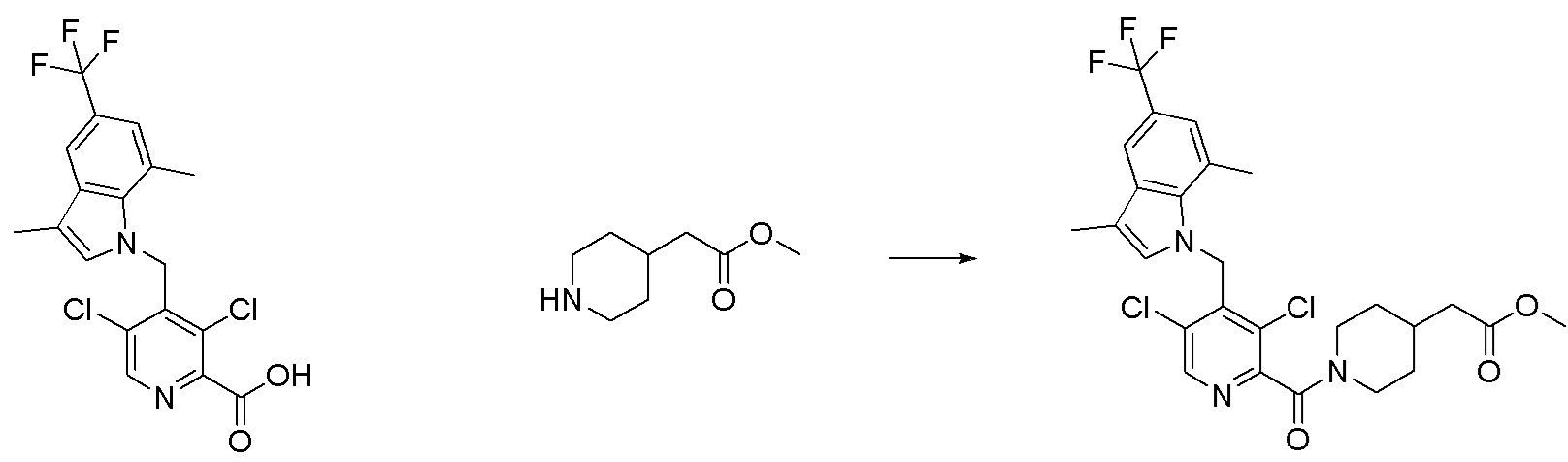
Во взвесь 3,5-дихлор-4-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)пиколиновой кислоты (30 г, 71,9 ммоль) в EtOAc (200 мл), DMF (20 мл) добавляли метил-2-(пиперидин-4-ил)ацетат, хлористоводородную кислоту (15,32 г, 79 ммоль), а затем 2-(3H-[1,2,3]триазоло[4,5-b]пиридин-3-ил)-1,1,3,3-тетраметилизоурония гексафторфосфат (V) (30,1 г, 79 ммоль). Триэтиламин (35,1 мл, 252 ммоль) добавляли медленно, поддерживая температуру на уровне 20-25°C. Через 30 минут добавляли MTBE (100 мл) и воду (200 мл). Органический слой отделяли, промывали с помощью 1 н. HCl (100 мл x 3), насыщенного Na2CO3 (100 мл × 2), насыщенного NH4Cl (100 мл) и солевого раствора (50 мл) и концентрировали in vacuo. Неочищенный продукт очищали посредством колоночной флэш-хроматографии при помощи DCM/MTBE (5-10%) в качестве элюента на колонке 330 г × 2 SiO2 с получением метил-2-(1-(3,5-дихлор-4-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)пиколиноил)пиперидин-4-ил)ацетата (35 г, 62,9 ммоль, выход 87%) в виде желтого масла. LC/MS (Способ i), Время удерживания=2,00 минуты; MS масса/заряд: 556 (M+H)+.
Стадия 8: 2-(1-(3,5-дихлор-4-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)пиколиноил)пиперидин-4-ил)уксусная кислота

В раствор метил-2-(1-(3,5-дихлор-4-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)пиколиноил)пиперидин-4-ил)ацетата (40 г, 71,9 ммоль) в THF (300 мл) добавляли 1 M раствор гидроксида натрия (71,9 мл, 144 ммоль). Реакционную смесь нагревали до 45-50°C и добавляли MeOH, пока не образовывалась однородная реакционная смесь. Через 3 часа реакционную смесь охлаждали до комнатной температуры и частично концентрировали in vacuo, удаляя примерно 200 мл растворителя. Добавляли MTBE (300 мл) и 2 н. HCl (100 мл). Органический слой отделяли, промывали водой (100 мл × 2), солевым раствором (100 мл), высушивали над Na2SO4, фильтровали и концентрировали in vacuo, растворитель заменяли на ACN. После трех циклов концентрирования добавляли ACN (400 мл) и полученную взвесь нагревали до 50°C. Через 1 час взвесь медленно при перемешивании охлаждали до комнатной температуры. Через 15 часов твердые вещества собирали фильтрацией, высушивали в вакуумной печи при 55°C с получением 2-(1-(3,5-дихлор-4-((3,7-диметил-5-(трифторметил)-1H-индол-1-ил)метил)пиколиноил)пиперидин-4-ил)уксусной кислоты (30,5 г, 56,2 ммоль, 78%) в виде белого твердого вещества. LC/MS (Способ i), Время удерживания=1,68 минуты; MS масса/заряд: 540 (M-H)-.
Пример FS: 1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоил)пиперидин-4-карбоновая кислота

Стадия 1: 4-метил-6-(трифторметил)пиридин-2(1H)-он

Колбу с CHCl3 (1,25 л) охлаждали до 0°C. Добавляли 2,2,2-трифторуксусный ангидрид (0,141 л, 1012 ммоль), а затем 3-метилбут-2-еноилхлорид (0,094 л, 843 ммоль). Триэтиламин (0,259 л, 1856 ммоль) добавляли по каплям так, что внутренняя температура поддерживалась ниже 10°C. После добавления смесь перемешивали при 0°C в течение 1 часа, а затем медленно нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь промывали водой (1 л), насыщенным NaHCO3 (1 л), водой/солевым раствором (1:1, 500 мл), высушивали над MgSO4, фильтровали и концентрировали in vacuo. Остаток растворяли в уксусной кислоте (1,25 л). Добавляли NH4OAc (130 г, 1687 ммоль). Реакционную установку закрывали с помощью баллона и смесь нагревали при 115°C в течение ночи. Через 20 часов реакционную смесь охлаждали до 40°C и концентрировали in vacuo. Концентрированный раствор при перемешивании выливали в воду (примерно 2 л). Через 1 час твердые вещества собирали фильтрацией с получением 4-метил-6-(трифторметил)пиридин-2(1H)-она (101 г, 570 ммоль, 67,6%) в виде желтовато-коричневого твердого вещества. LC/MS (Способ i), Время удерживания=1,59 минуты; MS масса/заряд: 178 (M+H)+; 1H ЯМР (400 МГц, Хлороформ-d) δ 6,79 (s, 1H), 6,70 (s, 1H), 2,34 (s, 3H).
Стадия 2: 2-хлор-4-метил-6-(трифторметил)пиридин

50 мл грушевидную колбу, оборудованную головкой для молекулярной перегонки, заполняли 4-метил-6-(трифторметил)пиридин-2(1H)-оном (20 г, 113 ммоль). В колбу добавляли фенилфосфониевый дихлорид (19,21 мл, 135 ммоль). Реакционную смесь нагревали до 160°C. Через 3 часа давление на реакционную смесь медленно снижали до 100 мбар. Дистилляцию начинали при температуре приблизительно 120-130°C. Когда дистилляция значительно замедлялась, давление на реакционную смесь снижали до 80 мбар и температуру бани повышали до 170°C. Через 3 часа дистилляция прекращалась, обеспечивая получение 2-хлор-4-метил-6-(трифторметил)пиридина (12 г, 61,4 ммоль, выход 54,3%). 1H ЯМР (400 МГц, DMSO-d6) δ 7,81 (s, 1H), 7,73 (s, 1H), 2,43 (s, 3H).
Стадия 3: трет-бутил-(4-метил-6-(трифторметил)пиридин-2-ил)карбамат

Колбу с 2-хлор-4-метил-6-(трифторметил)пиридином (35,12 г, 180 ммоль), трет-бутилкарбаматом (42,1 г, 359 ммоль), Pd2(dba)3 (4,11 г, 4,49 ммоль), дициклогексил(2',4',6'-триизопропил-[1,1'-бифенил]-2-ил)фосфином (X-Phos) (4,28 г, 8,98 ммоль) и карбонатом цезия (205 г, 629 ммоль) вакуумировали и заполняли с помощью N2 (повторяли 3 раза) перед добавлением дегазированного 1,4-диоксана (350 мл). Смесь затем нагревали при 80°C в течение 2 часов, а затем охлаждали до комнатной температуры. Реакционную смесь разделяли между водой (300 мл) и EtOAc (300 мл). Водный слой дополнительно экстрагировали с помощью EtOAc (2×100 мл). Органический слой высушивали над Na2SO4, фильтровали и концентрировали досуха с получением темно-красного масла. Использовали неочищенное вещество в следующей реакции.
Стадия 4: 4-метил-6-(трифторметил)пиридин-2-амин

Смесь трет-бутил-(4-метил-6-(трифторметил)пиридин-2-ил)карбамата (49,6 г, 180 ммоль) и хлороводорода (4 M в 1,4-диоксане) (597 мл, 2388 ммоль) перемешивали при комнатной температуре в течение 2 часов. Растворитель удаляли под пониженным давлением. Остаток суспендировали в EtOAc и фильтровали. Фильтрат разбавляли с помощью EtOAc. Органический слой экстрагировали с помощью 6 н. HCl (3×50 мл). Водный слой промывали с помощью DCM (4×100 мл). pH водного слоя доводили до pH 8 добавлением Na2CO3. Ярко-желтое твердое вещество собирали фильтрацией, промывали водой. Твердое вещество затем растворяли в DCM, промывали солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали практически досуха. Твердые вещества растирали с петролейным эфиром. Твердое вещество собирали фильтрацией, промывали петролейным эфиром и высушивали на воздухе с получением 4-метил-6-(трифторметил)пиридин-2-амина (27,73 г, 157 ммоль, 88%) в виде бледно-желтого твердого вещества. LC/MS (Способ i), Время удерживания=2,55 минуты; MS масса/заряд: 177 (M+H)+.
Стадия 5: 3,5-дибром-4-метил-6-(трифторметил)пиридин-2-амин

Смесь 4-метил-6-(трифторметил)пиридин-2-амина (31,45 г, 179 ммоль) и NBS (66,7 г, 375 ммоль) в ACN (250 мл) нагревали при 70°C в течение 2 часов. Добавляли примерно 500 мл воды. Твердое вещество собирали фильтрацией, промывали водой и высушивали на воздухе в течение 5 минут. Твердое вещество растворяли в DCM, промывали водой, высушивали над Na2SO4, фильтровали и концентрировали практически досуха. Твердые вещества растирали с гептаном. Твердое вещество собирали фильтрацией, промывали гептаном и высушивали с получением 3,5-дибром-4-метил-6-(трифторметил)пиридин-2-амина (56,99 г, 171 ммоль, 96%) в виде светло-желтого твердого вещества. LC/MS (Способ i), Время удерживания=2,55 минуты; MS масса/заряд: 333 (M+H)+; 1H ЯМР (400 МГц, DMSO-d6) δ 6,90 (s, 2H), 2,53 (s, 3H).
Стадия 6: 3-бром-4-метил-6-(трифторметил)пиридин-2-амин
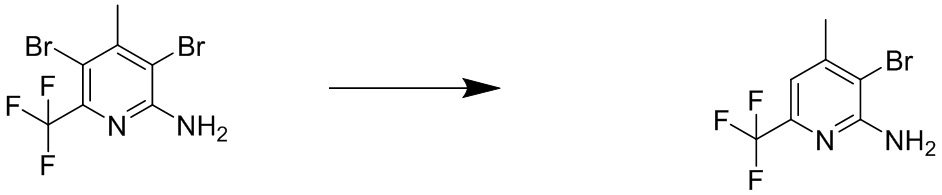
В светло-оранжевый раствор 3,5-дибром-4-метил-6-(трифторметил)пиридин-2-амина (56,98 г, 171 ммоль) в THF (570 мл) при -78°C по каплям добавляли н-бутиллитий (2,5 M в гексане) (68,3 мл, 171 ммоль). Смесь перемешивали при -78°C в течение 15 минут. Перемешивание продолжали при -78°C в течение еще 30 минут. По каплям добавляли вторую часть бутиллития (2,5 M в гексане) (20,48 мл, 51,2 ммоль). Через 30 минут по каплям добавляли третью часть бутиллития (2,5 M в гексане) (13,65 мл, 34,1 ммоль). LC/MS через 15 мин. показала завершение реакции. Реакционную колбу переносили на ледяную баню. Быстро добавляли 20 мл воды и обеспечивали нагревание реакционной смеси до комнатной температуры. Реакционную смесь разделяли между насыщенным NH4Cl (300 мл) и EtOAc (300 мл). Органический слой промывали с помощью NaHCO3 (300 мл), высушивали над Na2SO4, фильтровали и концентрировали практически досуха. Твердые вещества растирали с гептаном. Твердое вещество собирали фильтрацией, промывали гептаном с получением 3-бром-4-метил-6-(трифторметил)пиридин-2-амина (38,87 г, 145 ммоль, 85%) в виде грязно-белого твердого вещества. LC/MS (Способ i), Время удерживания=2,29 минуты; MS масса/заряд: 255 (M+H)+; 1H ЯМР (400 МГц, DMSO-d6) δ 6,96 (s, 1H), 6,74 (s, 2H), 2,32 (s, 3H).
Стадия 7: (E)-3-(2-этоксивинил)-4-метил-6-(трифторметил)пиридин-2-амин

Колбу с 3-бром-4-метил-6-(трифторметил)пиридин-2-амином (38,26 г, 143 ммоль), (E)-2-(2-этоксивинил)-4,4,5,5-тетраметил-1,3,2-диоксабороланом (56,5 г, 285 ммоль), диацетоксипалладием (0,960 г, 4,28 ммоль), дициклогексил(2',4',6'-триизопропил-[1,1'-бифенил]-2-ил)фосфином (XPhos) (4,28 г, 8,98 ммоль) и карбонатом цезия (116 г, 356 ммоль) дегазировали с помощью N2 в течение 15 минут перед добавлением 320 мл дегазированного 1,4-диоксана/H2O (4:1). Смесь нагревали при 80°C в течение 2 часов, затем охлаждали до комнатной температуры. Реакционную смесь разделяли между EtOAc (200 мл) и водой (200 мл). Водный слой дополнительно экстрагировали с помощью EtOAc (2×50 мл). Органический слой высушивали над Na2SO4, фильтровали и концентрировали досуха. Твердые вещества разбавляли гептаном, фильтровали, промывали гептаном с получением грязно-белого твердого вещества (1,45 г), которое отбрасывали. Фильтрат концентрировали досуха снова с получением густого черного масла, которое выдерживали при комнатной температуре в течение ночи. Отмечали образование значительного количества твердых веществ. Твердые вещества снова разбавляли гептаном, обрабатывали ультразвуком и фильтровали, промывали гептаном с получением светло-коричневого твердого вещества. 15,20 г с чистотой 95% по LC/MS, 1H-ЯМР. Фильтрат концентрировали досуха с получением черного масла, которое очищали флэш-хроматографией (0-25% EtOAc/гептан за 30 минут; колонка Redi-Sep, 330 г, 309 нм). Фракции концентрировали практически досуха. Твердое вещество собирали фильтрацией, промывали небольшим количеством гептана и высушивали с получением второй партии продукта в виде светло-желтого твердого вещества. 12,69 г. Две партии объединяли с получением (E)-3-(2-этоксивинил)-4-метил-6-(трифторметил)пиридин-2-амина (27,89 г, 113 ммоль, 79%). LC/MS (способ i), Время удерживания=1,48 мин.; MS масса/заряд: 247 (M+H)+.
Стадия 8: 4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин
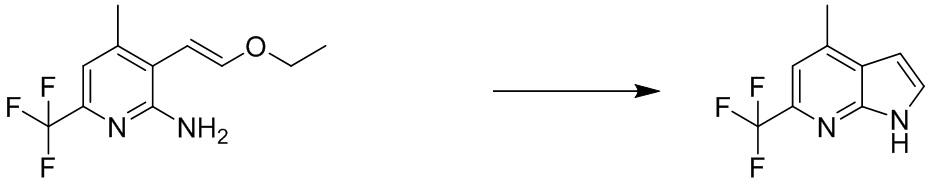
Смесь (E)-3-(2-этоксивинил)-4-метил-6-(трифторметил)пиридин-2-амина (27,89 г, 113 ммоль) и уксусной кислоты (130 мл) нагревали при 100°C в течение ночи. Охлаждали до комнатной температуры. Осадок собирали фильтрацией, промывали с помощью ACN и высушивали с получением первой партии продукта. Фильтрат концентрировали до приблизительно 50 мл. Твердое вещество собирали фильтрацией, промывали с помощью ACN и высушивали с получением второй партии продукта. Фильтрат все еще содержал некоторое количество продукта. Твердое вещество суспендировали в приблизительно 250 мл EtOAc, нагревали до температуры образования флегмы для растворения, затем выпаривали в ротационном испарителе для удаления большей части растворителя. Гептан добавляли и взвесь фильтровали и высушивали с получением продукта в виде грязно-белого твердого вещества. Три партии продукта объединяли с получением 4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридина (19,77 г, 99 ммоль, 88%). LC/MS (Способ i), Время удерживания=1,30 минуты; MS масса/заряд: 201 (M+H)+; 1H ЯМР (400 МГц, DMSO-d6) δ 12,13-11,98 (br, 1H), 7,67 (t, J=3,1 Гц, 1H), 7,34 (d, J=1,0 Гц, 1H), 6,63 (dd, J=3,5, 1,9 Гц, 1H), 2,59 (s, 3H).
Стадия 9: 4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин

В суспензию гидрида натрия (60% в минеральном масле) (4,35 г, 109 ммоль) в DMF (40 мл) при 0°C добавляли раствор 4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридина (19,77 г, 99 ммоль) в атмосфере N2. После добавления ледяную баню убирали и смесь перемешивали при комнатной температуре в течение 30 минут, затем ее охлаждали до 0°C. По каплям добавляли бензолсульфонилхлорид (13,27 мл, 104 ммоль). После добавления обеспечивали нагревание реакционной смеси до комнатной температуры и ее перемешивали в течение 1 часа. Реакционную смесь быстро охлаждали добавлением 100 мл насыщенного раствора NH4Cl с последующим добавлением 350 мл воды. Твердое вещество собирали фильтрацией, промывали водой и высушивали в вакуумной печи при 70°C в течение выходных с получением грязно-белого твердого вещества. Твердые вещества растворяли в EtOAc, фильтровали через 70 г силикагеля и промывали с помощью EtOAc. Фильтрат высушивали над Na2SO4, фильтровали и концентрировали досуха. Твердые вещества растирали с EtOAc/гептаном с получением 4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридина (28,52 г, 84 ммоль, 85%) в виде белого твердого вещества. LC/MS (Способ i): Время удерживания=1,84 минуты; MS масса/заряд: 341 (M+H)+; 1H ЯМР (400 МГц, DMSO-d6) δ 8,15-8,07 (m, 3H), 7,75-7,67 (m, 1H), 7,64-7,56 (m, 3H), 7,03 (d, J=4,1 Гц, 1H), 2,57 (s, 3H).
Стадия 10: трет-бутил-2,4-дихлор-3-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоат
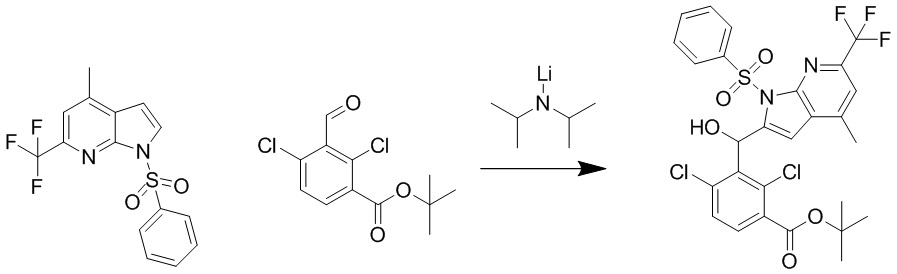
Бесцветный раствор 4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридина (3 г, 8,82 ммоль) в THF (45 мл) охлаждали до -78°C в атмосфере N2. По каплям добавляли LDA (1,0 M в THF/гексане) (10,58 мл, 10,58 ммоль) (внутренняя температура < -70°C) (раствор становился темно-оранжевым в конце добавления). Смесь перемешивали при -78°C в течение 0,5 ч. По каплям добавляли раствор трет-бутил-2,4-дихлор-3-формилбензоата (2,91 г, 10,58 ммоль) в THF (8 мл) (внутреннюю температуру поддерживали на уровне ниже -70°C) (раствор оставался красно-оранжевым). Смесь перемешивали при -78°C в течение 1 ч. Реакционную смесь быстро охлаждали насыщенным NH4Cl (50 мл) и экстрагировали с помощью EtOAc (2x 50 мл). Органический слой высушивали над Na2SO4, фильтровали и концентрировали досуха. Твердые вещества очищали флэш-хроматографией (0-25% EtOAc/гептана за 30 минут, а затем выдерживали с помощью 25% EtOAc/гептана; колонка Silicycle, 200 г, 278 нм) с получением трет-бутил-2,4-дихлор-3-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоата (4,59 г, 7,46 ммоль, 85%) в виде белого твердого вещества. LC/MS (Способ i), Время удерживания=2,18 минуты; MS масса/заряд: 615 (M+H)+.
Стадия 11: 2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензойная кислота

В раствор трет-бутил-2,4-дихлор-3-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоата (2,0571 г, 3,34 ммоль) в CHCl3 (20 мл) добавляли SOCl2 (2,440 мл, 33,4 ммоль). Смесь нагревали при 60°C в течение ночи. Добавляли дополнительное количество SOCl2 (2,440 мл, 33,4 ммоль), смесь нагревали при 60°C в течение еще 24 часов. Растворитель удаляли под пониженным давлением. Остаток разделяли между EtOAc (100 мл) и насыщенным NaHCO3 (100 мл). Органический слой концентрировали досуха с получением белой пены. TLC (25% EtOAc/гептан) показывала один основной пик. Промежуточное соединение растворяли в уксусной кислоте (45 мл). Добавляли цинк (1,093 г, 16,71 ммоль). Смесь перемешивали при комнатной температуре в течение 0,5 часа, фильтровали и промывали с помощью EtOAc. Фильтрат концентрировали досуха. Остаток разделяли между EtOAc (20 мл) и 1 н. HCl (20 мл). Органический слой промывали насыщенным NaHCO3 (20 мл), высушивали над Na2SO4, фильтровали и концентрировали досуха с получением белой пены. В вышеуказанную пену добавляли DCM (12 мл), а затем TFA (4 мл). Желтый раствор перемешивали при комнатной температуре в течение 4 часов. Летучие вещества удаляли под пониженным давлением. Остаток разделяли между EtOAc (50 мл) и насыщенным NH4Cl (50 мл). Органический слой высушивали над Na2SO4, фильтровали и концентрировали досуха с получением белой пены, которую использовали на следующей стадии без дополнительной очистки.
Стадия 12: 2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоат
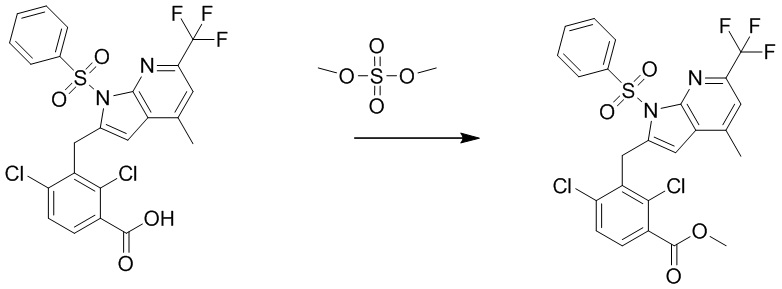
В раствор 2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензойной кислоты (1,816 г, 3,34 ммоль) в ACN (54 мл) добавляли карбонат цезия (3,27 г, 10,03 ммоль), а затем диметилсульфат (0,634 мл, 6,68 ммоль). Смесь перемешивали при комнатной температуре в течение 4 часов, а затем нагревали при 40°C в течение ночи. Реакционную смесь разделяли между EtOAc (20 мл) и водой (20 мл). Водный слой дополнительно экстрагировали с помощью EtOAc (20 мл). Органический слой промывали солевым раствором (10 мл), высушивали над Na2SO4, фильтровали и концентрировали досуха. Неочищенный продукт очищали флэш-хроматографией (0-50% EtOAc/гептан за 30 мин.; колонка Redi-Sep, 120 г, 254 нм). Вещество, представленное основным пиком, концентрировали досуха с получением метил-2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоата (1,15 г, 2,063 ммоль, 61,8%) в виде светло-желтой смолы. LC/MS (Способ i), Время удерживания=1,49 минуты; MS масса/заряд: 557 (M+H)+.
Стадия 13: 2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоат
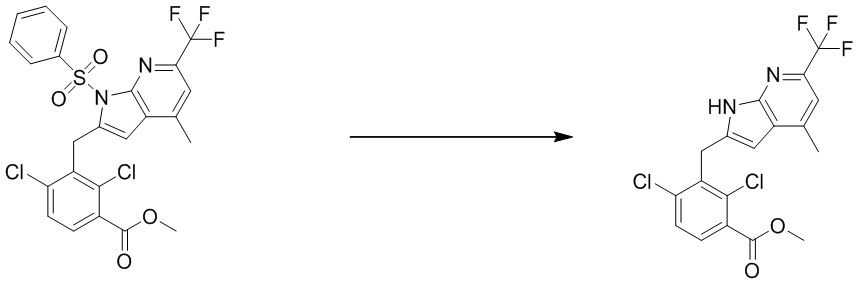
Колбу с метил-2,4-дихлор-3-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоатом (1,15 г, 2,063 ммоль) продували с помощью N2 в течение 15 мин. Добавляли THF (23 мл) с образованием желтого раствора. Добавляли TBAF (3,09 мл, 3,09 ммоль). Смесь нагревали при 50°C в течение ночи. Растворитель удаляли под пониженным давлением. Остаток растворяли в EtOAc (20 мл), промывали насыщенным NaHCO3 (2 × 10 мл), солевым раствором (10 мл), высушивали над Na2SO4, фильтровали и концентрировали досуха. Неочищенный продукт очищали флэш-хроматографией (0-25% EtOAc/гептан за 30 мин.; колонка Redi-Sep, 80 г, 284 нм) с получением метил-2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоата (662,7 мг, 1,588 ммоль, 77%) в виде белого твердого вещества. LC/MS (Способ i), Время удерживания=2,01 минуты; MS масса/заряд: 417 (M+H)+; 1H ЯМР (400 МГц, DMSO-d6) δ 12,16 (s, 1H), 7,75 (d, J=8,4 Гц, 1H), 7,67 (d, J=8,4 Гц, 1H), 7,28 (d, J=0,8 Гц, 1H), 5,93 (dd, J=2,1, 1,1 Гц, 1H), 4,49 (s, 2H), 3,86 (s, 3H), 2,45 (s, 3H).
Стадия 14: метил-2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоат
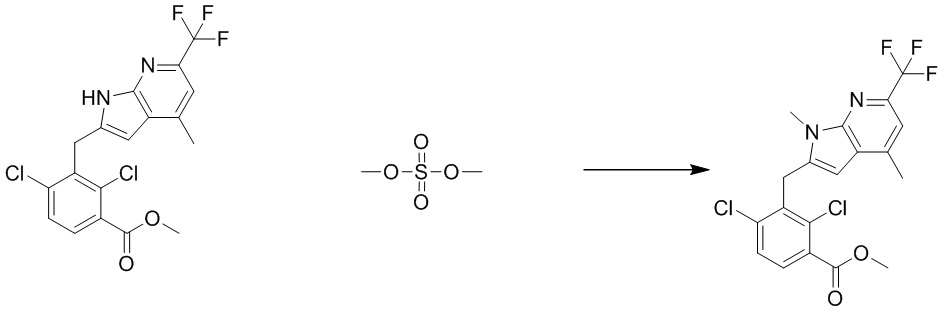
В раствор метил-2,4-дихлор-3-((4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоата (662 мг, 1,587 ммоль) в ACN (50 мл) добавляли карбонат цезия (1551 мг, 4,76 ммоль), а затем диметилсульфат (0,301 мл, 3,17 ммоль). Смесь перемешивали при комнатной температуре в течение выходных (превращалась в густую суспензию через приблизительно 30 мин. перемешивания). Реакционную смесь быстро охлаждали водой (20 мл) и экстрагировали с помощью EtOAc (20 мл). Органический слой промывали солевым раствором (3x 10 мл), высушивали над Na2SO4, фильтровали и концентрировали досуха. Твердые вещества растирали с Et2O/гептаном. Твердое вещество собирали фильтрацией, промывали гептаном, высушивали с получением метил-2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоата (632,8 мг, 1,467 ммоль, 92%) в виде белого твердого вещества. LC/MS (Способ i), Время удерживания=2,19 минуты; MS масса/заряд: 431 (M+H)+; 1H ЯМР (400 МГц, DMSO-d6) δ 7,80 (d, J=8,4 Гц, 1H), 7,71 (d, J=8,4 Гц, 1H), 7,32 (d, J=0,8 Гц, 1H), 5,80-5,75 (m, 1H), 4,54 (s, 2H), 3,92 (s, 3H), 3,87 (s, 3H), 2,44 (d, J=0,7 Гц, 3H).
Стадия 15: 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензойная кислота

В желтый раствор метил-2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоата (632,8 мг, 1,467 ммоль) в THF (12 мл) добавляли гидрат гидроксида лития (123 мг, 2,93 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. Растворитель удаляли под пониженным давлением. Раствор разбавляли водой (10 мл) и pH доводили до 2-3 при помощи 1 н. HCl. Образовывался гелеобразный осадок. Твердое вещество собирали фильтрацией, промывали водой и высушивали в вакуумной печи при 60°C в течение ночи с получением 2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензойной кислоты (389 мг, выход 64%). LC/MS (Способ i), Время удерживания=1,42 минуты; MS масса/заряд: 417 (M+H)+. 1H ЯМР (400 МГц, DMSO-d6) δ 13,63 (s, 1H), 7,74 (d, J=8,4 Гц, 1H), 7,65 (d, J=8,4 Гц, 1H), 7,34-7,30 (m, 1H), 5,77 (s, 1H), 4,52 (s, 2H), 3,92 (s, 3H), 2,44 (s, 3H).
Стадия 16: (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)фенил)(4-гидроксипиперидин-1-ил)метанон
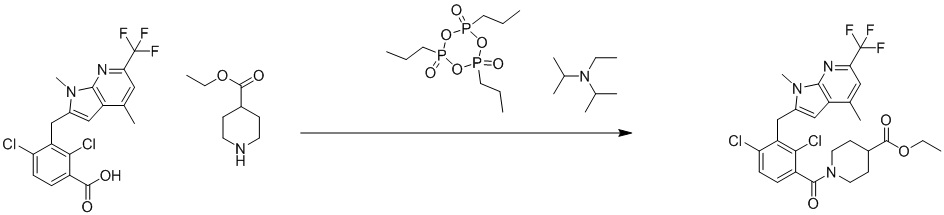
2,4-Дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензойную кислоту (120 мг, 0,288 ммоль) суспендировали в EtOAc (2,4 мл). В суспензию добавляли этилпиперидин-4-карбоксилат (66,5 мкл, 0,431 ммоль) и N-этил-N-изопропилпропан-2-амин (95 мкл, 0,546 ммоль). Суспензию охлаждали до 0-5°C на ледяной бане и по каплям добавляли 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинана 2,4,6-триоксид (308 мкл, 0,518 ммоль) (превращалась практически в прозрачный раствор при добавлении T3P). Реакционную смесь перемешивали в течение 2 часов при 0-5°C. Смесь выливали в делительную воронку, промывали с помощью 1 M HCl (3×20 мл), 1 M NaOH (3×20 мл), затем высушивали над сульфатом натрия, фильтровали через подушку из силикагеля, промывали с помощью EtOAc. Фильтрат концентрировали досуха с получением этил-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоил)пиперидин-4-карбоксилата (160 мг, 100%) в виде пены. LC/MS (Способ i), Время удерживания=2,11 минуты; MS масса/заряд: 556 (M+H)+.
Стадия 17: 1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоил)пиперидин-4-карбоновая кислота

Смесь этил-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоил)пиперидин-4-карбоксилата (160 мг, 0,288 ммоль) и гидрата гидроксида лития (12,07 мг, 0,288 ммоль) в THF (3 мл) и воде (1,000 мл) перемешивали при комнатной температуре в течение ночи. Слои разделяли между EtOAc (10 мл), ACN (2 мл) и 1 н. HCl (10 мл). Органический слой промывали солевым раствором (3x 5 мл), затем высушивали над Na2SO4, фильтровали и концентрировали досуха. Твердые вещества растирали с ACN. Твердое вещество собирали фильтрацией, промывали с помощью H2O и высушивали с получением 1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоил)пиперидин-4-карбоновой кислоты (118,7 мг, 0,220 ммоль, выход 77%) в виде белого твердого вещества. LC/MS (Способ i), Время удерживания=2,41 минуты; MS масса/заряд: 528 (M+H)+.
Пример FT: (2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)фенил)(4-(2-метоксиэтил)пиперидин-1-ил)метанон
(2,4-Дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)фенил)(4-(2-метоксиэтил)пиперидин-1-ил)метанон получали способом, аналогичным примеру FS, стадии 16. LC/MS (Способ i), Время удерживания=3,01 минуты; MS масса/заряд: 542 (M+H)+.
Пример FT-1: 2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоил)пиперидин-4-ил)уксусная кислота

2-(1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоил)пиперидин-4-ил)уксусную кислоту получали способом, аналогичным примеру FS, стадии 16. LC/MS (Способ i), Время удерживания=2,48 минуты; MS масса/заряд: 542 (M+H)+.
Пример FT-3: этил-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоил)пиперидин-4-карбоксилат
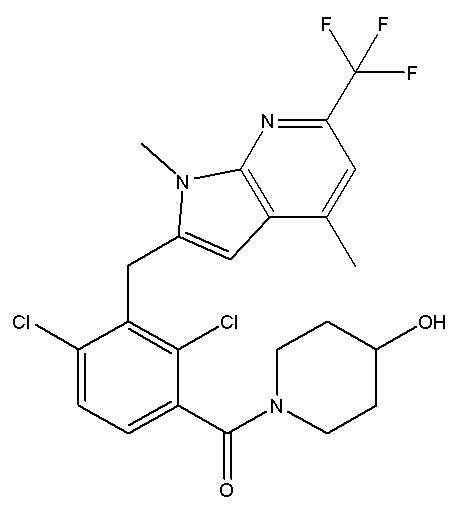
Этил-1-(2,4-дихлор-3-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоил)пиперидин-4-карбоксилат получали способом, аналогичным примеру FS, стадии 16. LC/MS (Способ i), Время удерживания=2,41 минуты; MS масса/заряд: 528 (M+H)+.
Пример FU: 2-(1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензоил)пиперидин-4-ил)уксусная кислота

Стадия 1: трет-бутил-2,4-дихлор-3-(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензоат

В прозрачный раствор трет-бутил-2,4-дихлор-3-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)бензоата (4,73 г, 7,69 ммоль) (пример FS, стадия 10) в CH2Cl2 (50 мл) при 0°C добавляли периодинан Десса-Мартина (3,59 г, 8,45 ммоль) одной порцией. Смесь перемешивали при 0°C в течение 2 часов, затем разбавляли с помощью DCM (50 мл), промывали 5% NaS2O3 (30 мл) и насыщенным NaHCO3 (30 мл), солевым раствором (20 мл), высушивали над Na2SO4, фильтровали и концентрировали досуха с получением трет-бутил-2,4-дихлор-3-(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензоата (4,7 г, 100%) в виде белой пены. LC/MS (Способ i), Время удерживания=2,28 минуты; MS масса/заряд: 613 (M+H)+.
Стадия 2: трет-бутил-2,4-дихлор-3-(4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензоат

Колбу с трет-бутил-2,4-дихлор-3-(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензоатом (4,71 г, 7,68 ммоль) дегазировали с помощью N2 в течение 15 минут. Добавляли THF (25 мл) с образованием светло-желтого раствора. Добавляли фторид тетрабутиламмония (1,0 M в THF) (7,68 мл, 7,68 ммоль) с получением коричневого раствора. Смесь нагревали при 50°C в течение ночи. Добавляли дополнительное количество фторида тетрабутиламмония (1,0 M в THF) (7,68 мл, 7,68 ммоль) и раствор нагревали при 50°C в течение 6 часов. Растворитель удаляли под пониженным давлением. Остаток растворяли в EtOAc (100 мл), фильтровали для удаления нерастворимых твердых веществ, затем промывали насыщенным NaHCO3 (2x 50 мл), солевым раствором (2x 50 мл), высушивали над Na2SO4, фильтровали и концентрировали досуха. Твердые вещества повторно растворяли в THF (25 мл). Добавляли фторид тетрабутиламмония (4,99 мл, 4,99 ммоль). Смесь нагревали при 50°C в течение 4 ч. Растворитель удаляли под пониженным давлением. Остаток растворяли в EtOAc (100 мл), промывали насыщенным NaHCO3 (2x 50 мл), солевым раствором (2x 50 мл), высушивали над Na2SO4, фильтровали и концентрировали досуха. Твердые вещества очищали через подушку из силикагеля с элюированием с помощью 40% EtOAc/гептана. Фракции, содержащие продукт, концентрировали досуха с получением трет-бутил-2,4-дихлор-3-(4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензоата (3,7127 г, 7,84 ммоль, 102%). LC/MS (Способ i), Время удерживания=2,16 минуты; MS масса/заряд: 473 (M+H)+; 1H ЯМР (400 МГц, DMSO-d6) δ 13,17 (s, 1H), 7,93 (d, J=8,5 Гц, 1H), 7,74 (d, J=8,4 Гц, 1H), 7,48 (s, 1H), 7,30 (s, 1H), 2,61 (s, 3H), 1,55 (s, 9H).
Стадия 3: трет-бутил-2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензоат

В желтый раствор трет-бутил-2,4-дихлор-3-(4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензоата (3,71 г, 7,84 ммоль) в ACN (148 мл) добавляли карбонат цезия (7,66 г, 23,52 ммоль), а затем диметилсульфат (1,487 мл, 15,68 ммоль). Смесь перемешивали при комнатной температуре в течение приблизительно 60 часов. Раствор выливали при перемешивании в 300 мл воды. Твердое вещество собирали фильтрацией, промывали водой и высушивали с получением трет-бутил-2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензоата (3,4 г, 89%) в виде светло-коричневого твердого вещества. LC/MS (Способ i), Время удерживания=2,39 минуты; MS масса/заряд: 487 (M+H)+. 1H ЯМР (400 МГц, DMSO-d6) δ 7,94 (d, J=8,4 Гц, 1H), 7,75 (d, J=8,4 Гц, 1H), 7,54 (d, J=0,9 Гц, 1H), 7,35 (s, 1H), 4,18 (s, 3H), 2,61 (d, J=0,8 Гц, 3H), 1,55 (s, 9H).
Стадия 4: 2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензойная кислота

В желтый раствор трет-бутил-2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензоата (3,4 г, 6,98 ммоль) в CH2Cl2 (17 мл) добавляли TFA (16,13 мл, 209 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов. Растворитель удаляли под пониженным давлением. В остаток добавляли простой эфир. Раствор обрабатывали ультразвуком, пока не начинало образовываться твердое вещество, и полученную взвесь перемешивали при комнатной температуре в течение 10 минут. Твердое вещество собирали фильтрацией, промывали эфиром и высушивали с получением 2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензойной кислоты (2,1816 г, 72%) в виде белого твердого вещества. LC/MS (Способ i), Время удерживания=1,39 минуты; MS масса/заряд: 431 (M+H)+; 1H ЯМР (400 МГц, DMSO-d6) δ 13,76 (s, 1H), 8,00 (d, J=8,5 Гц, 1H), 7,75 (d, J=8,4 Гц, 1H), 7,54 (d, J=1,1 Гц, 1H), 7,31 (s, 1H), 4,18 (s, 3H), 2,61 (s, 3H).
Стадия 5: этил-2-(1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензоил)пиперидин-4-ил)ацетат
2,4-Дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензойную кислоту (150 мг, 0,348 ммоль) суспендировали в EtOAc (2,319 мл). В суспензию добавляли этил-2-(пиперидин-4-ил)ацетат (89 мг, 0,522 ммоль) и N-этил-N-изопропилпропан-2-амин (0,115 мл, 0,661 ммоль). Суспензию охлаждали до 0-5°C на ледяной бане и по каплям добавляли 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинана 2,4,6-триоксид (0,372 мл, 0,626 ммоль). Реакционную смесь перемешивали в течение 2 часов при 0-5°C. Добавляли 1 M HCl (4 мл) и водную смесь экстрагировали с помощью EtOAc (3×4 мл). Органические слои концентрировали досуха и очищали флэш-хроматографией (0-75% EtOAc/гептан за 30 минут; колонка Redi-Sep, 24 г, 311 нм). Фракции концентрировали досуха с получением этил-2-(1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензоил)пиперидин-4-ил)ацетата (0,196 г, 0,335 ммоль, 96%) в виде прозрачного масла. LC/MS (Способ i), Время удерживания=2,16 минуты; MS масса/заряд: 584 (M+H)+.
Стадия 6: 2-(1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензоил)пиперидин-4-ил)уксусная кислота

Смесь этил-2-(1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензоил)пиперидин-4-ил)ацетата (0,196 г, 0,335 ммоль) и гидрата гидроксида лития (0,014 г, 0,335 ммоль) в THF (3 мл) и воде (1,000 мл) перемешивали при комнатной температуре в течение ночи. Растворитель удаляли. Добавляли воду (10 мл) и HCl (1 н., 2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Суспензию фильтровали и высушивали с получением 2-(1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензоил)пиперидин-4-ил)уксусной кислоты (0,162 г, 0,291 ммоль, 87%) в виде грязно-белого твердого вещества. LC/MS (Способ i), Время удерживания=2,52 минуты; MS масса/заряд: 556 (M+H)+.
Пример FV: 1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензоил)пиперидин-4-карбонитрил
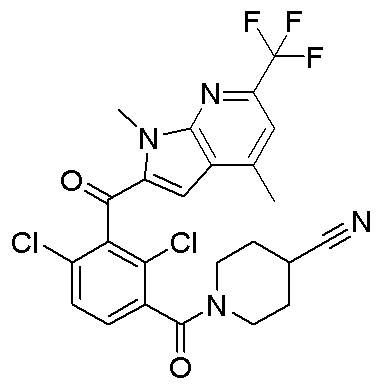
1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензоил)пиперидин-4-карбонитрил получали способом, аналогичным примеру FU, стадии 5. LC/MS (Способ i), Время удерживания=2,71 минуты; MS масса/заряд: 523 (M+H)+.
Пример FW: (2,6-дихлор-3-((3S,4S)-4-гидрокси-3-метилпиперидин-1-карбонил)фенил)(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метанон и (2,6-дихлор-3-((3R,4R)-4-гидрокси-3-метилпиперидин-1-карбонил)фенил)(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метанон

(2,6-Дихлор-3-((3S,4S)-4-гидрокси-3-метилпиперидин-1-карбонил)фенил)(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метанон и (2,6-дихлор-3-((3R,4R)-4-гидрокси-3-метилпиперидин-1-карбонил)фенил)(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метанон получали способом, аналогичным примеру FU, стадии 5. LC/MS (Способ i), Время удерживания=2,71 минуты; MS масса/заряд: 523 (M+H)+.
Пример FX: (3R,4R)-1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензоил)-3-метилпиперидин-4-карбоновая кислота

(3R,4R)-1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензоил)-3-метилпиперидин-4-карбоновую кислоту получали способом, аналогичным примеру FU, стадии 6. LC/MS (Способ i), Время удерживания=2,49 минуты; MS масса/заряд: 556 (M+H)+.
Пример FY: (2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)фенил)(4-(2-метоксиэтил)пиперидин-1-ил)метанон

(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)фенил)(4-(2-метоксиэтил)пиперидин-1-ил)метанон получали способом, аналогичным примеру FU, стадии 5. LC/MS (Способ i), Время удерживания=2,99 минуты; MS масса/заряд: 556 (M+H)+.
Пример FZ: (2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)фенил)(4-гидроксипиперидин-1-ил)метанон
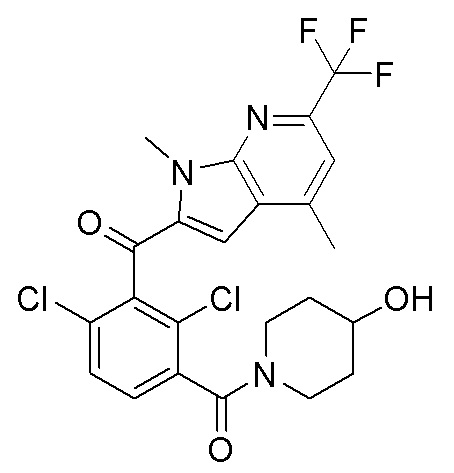
(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)фенил)(4-гидроксипиперидин-1-ил)метанон получали способом, аналогичным примеру FU, стадии 5. LC/MS (Способ i), Время удерживания=2,49 минуты; MS масса/заряд: 514 (M+H)+.
Пример GA: 2-((3R,4S)-1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензоил)-3-метилпиперидин-4-ил)уксусная кислота; 2-((3S,4R)-1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензоил)-3-метилпиперидин-4-ил)уксусная кислота; 2-((3S,4S)-1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензоил)-3-метилпиперидин-4-ил)уксусная кислота; 2-((3R,4R)-1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензоил)-3-метилпиперидин-4-ил)уксусная кислота

2-((3R,4S)-1-(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)бензоил)-3-метилпиперидин-4-ил)уксусную кислоту получали способом, аналогичным примеру FU, стадии 6. LC/MS (Способ i), Время удерживания=2,53 минуты; MS масса/заряд: 570 (M+H)+. Все четыре изомера готового продукта можно выделять хиральной хроматографией (хиральный способ p) или получать отдельно из хиральных исходных материалов, как показано в получении 83-84.
Пример GB: (2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)фенил)(4-(метилсульфонил)пиперидин-1-ил)метанон

(2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)фенил)(4-(метилсульфонил)пиперидин-1-ил)метанон получали способом, аналогичным примеру FU, стадия 5. LC/MS (Способ i), Время удерживания=2,53 минуты; MS масса/заряд: 576 (M+H)+.
Пример GC: 2-((3S,4R)-1-(4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотиноил)-3-метилпиперидин-4-ил)уксусная кислота

Стадия 1: трет-бутил-4,6-дихлор-5-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотинат

В раствор 4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридина (29 г, 85 ммоль) (пример FS, стадия 9) в THF (290 мл) по каплям добавляли 2 M диизопропиламид лития в THF (42,6 мл, 85 ммоль) при -78°C в атмосфере азота (превращался в красновато-оранжевый раствор, внутреннюю температуру поддерживали на уровне ниже -70°C). Смесь перемешивали при -78°C в течение 30 минут. По каплям добавляли раствор трет-бутил-4,6-дихлор-5-формилникотината (25,9 г, 94 ммоль) (пример DO, стадия 12) в THF (145 мл) (внутреннюю температуру поддерживали на уровне ниже -75°C). Смесь перемешивали при -78°C в течение 1 ч. Реакционную смесь быстро охлаждали добавлением насыщенного NH4Cl (120 мл). Растворитель, представляющий собой THF, удаляли in vacuo и водный слой разбавляли водой (200 мл) и продукт разделяли между EtOAc (3×100 мл) и водным слоем. Экстракты объединяли и промывали водой (3×70 мл), солевым раствором (100 мл), а затем высушивали над Na2SO4, фильтровали и растворитель удаляли in vacuo досуха с получением 68 г желтовато-коричневой смолы/пены - влажной от растворителя. Пену растирали с пентаном (3×150 мл), последовательно получая смолу/твердое вещество. Суспензию обрабатывали ультразвуком с получением мелкодисперсного порошка, охлаждали до приблизительно 15°C и твердое вещество собирали и промывали пентаном (3×80 мл) и высушивали in vacuo с получением грязно-белого твердого вещества - неочищенного продукта 42 г. Твердое вещество перемешивали с пентаном (200 мл), фильтровали и высушивали с получением 21,5 г. Твердое вещество перемешивали с эфиром (20 мл) в течение 10 минут и при 30-60°C, по каплям при перемешивании добавляли петролейный эфир (20 мл). Твердое вещество собирали и промывали петролейным эфиром (2×30 мл) с температурой 30-60°C и высушивали с получением белого твердого вещества в виде трет-бутил-4,6-дихлор-5-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотината (17,7 г, 28,7 ммоль, 33,7%). LC/MS (Способ i), Время удерживания=2,09 минуты; MS масса/заряд: 616 (M+H)+.
Стадия 2: трет-бутил-4,6-дихлор-5-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотинат

В раствор трет-бутил-4,6-дихлор-5-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотината (7,9 г, 12,82 ммоль) в CHCl3 (49,4 мл) добавляли дихлорид серы (4,68 мл, 64,1 ммоль). Смесь нагревали при 60°C в течение ночи. Реакционную смесь концентрировали под пониженным давлением с получением бледно-желтой пены. Ее растворяли в уксусной кислоте (26,0 мл). Цинк (4,19 г, 64,1 ммоль) перемешивали с уксусной кислотой в течение 10 минут и фильтровали, затем добавляли в реакционную смесь. Через 1,5 часа реакционную смесь фильтровали через подушку из Celite® и промывали с помощью EtOAc (50 мл). Фильтрат концентрировали и очищали через analogix (колонка 120 г; 0-20% EtOAc/гептан через 10 объемов колонки). Чистые фракции собирали и концентрировали с получением трет-бутил-4,6-дихлор-5-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотината (3,1 г, 5,16 ммоль, 40,3%). LC/MS (Способ i), Время удерживания=2,29 минуты; MS масса/заряд: 600,601,602 (M+H)+.
Стадия 3: трет-бутил-4,6-дихлор-5-((4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотинат
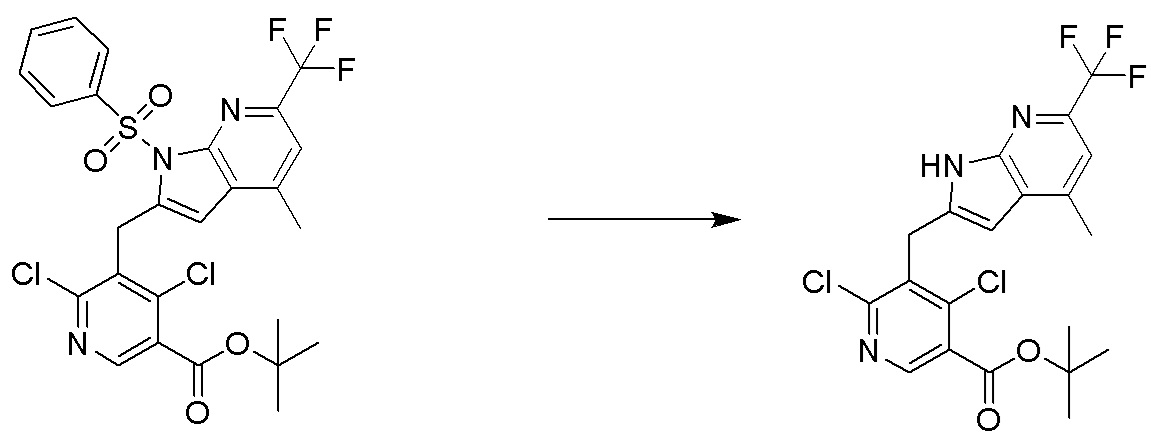
В раствор трет-бутил-4,6-дихлор-5-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотината (3 г, 5,00 ммоль) в THF (50,0 мл) добавляли фторид тетрабутиламмония (5,50 мл, 5,50 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение приблизительно 4 часов. Реакционную смесь концентрировали и очищали посредством analogix (колонка 80 г; 0-25% EtOAC/гептан через 7 объемов колонки) с получением трет-бутил-4,6-дихлор-5-((4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотината (1,83 г, 3,98 ммоль, 80%. LC/MS (Способ i), Время удерживания=2,10 минуты; MS масса/заряд: 460,461,462(M+H)+.
Стадия 4: трет-бутил-4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотинат
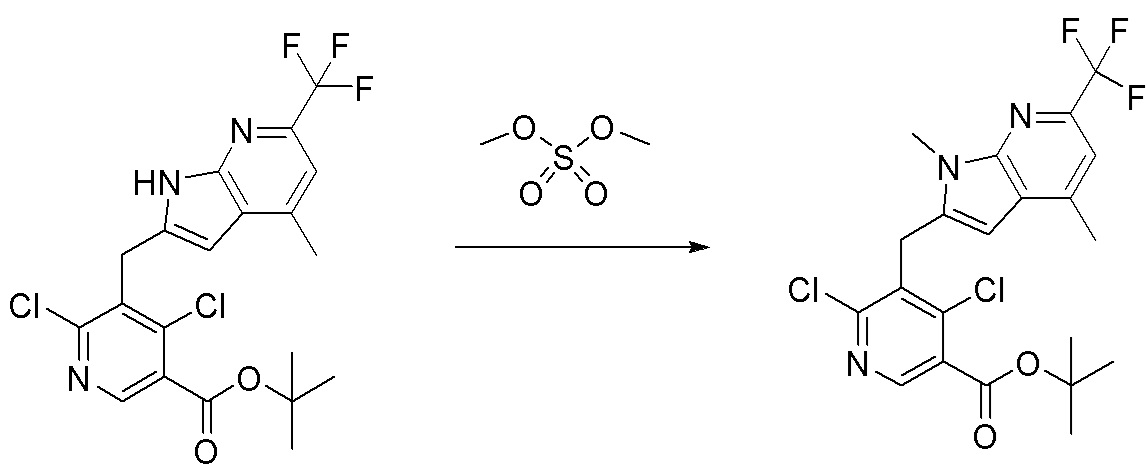
В сосуд загружали трет-бутил-4,6-дихлор-5-((4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотинат (1,48 г, 3,22 ммоль) и ACN (1,00 мл), а затем добавляли карбонат цезия (3,14 г, 9,65 ммоль) и диметилсульфат (0,768 мл, 8,04 ммоль). Смесь перемешивали при комнатной температуре в течение приблизительно 60 часов. Смесь концентрировали под пониженным давлением. Остаток разделяли между водой (50 мл) и EtOAC (60 мл). Органический слой высушивали над MgSO4, фильтровали и концентрировали. Неочищенный материал очищали с помощью Analogix (0-30% EtOAC/DCM; силикагелевая колонка, 40 г Silicycle SiliaSep). Собранные фракции концентрировали и суспендировали в простом эфире и фильтровали с получением белого твердого вещества. Материал высушивали в вакуумной печи при приблизительно 60°C с получением трет-бутил-4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотината (1,35 г, 2,85 ммоль, 89%). LC/MS (Способ i), Время удерживания=2,25 минуты; MS масса/заряд: 474,475,476 (M+H)+.
Стадия 5: 4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотиновая кислота
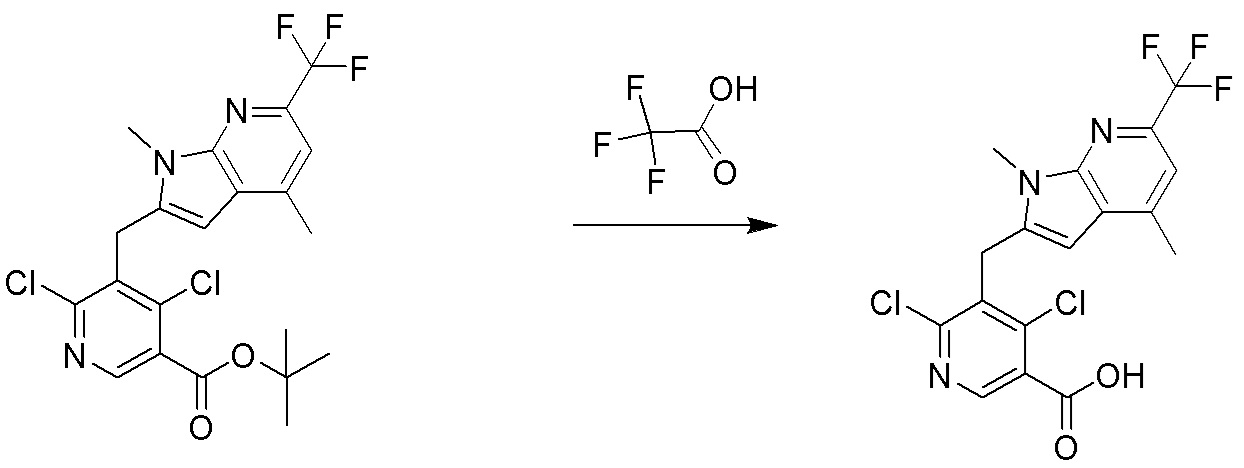
В желтый раствор трет-бутил-4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотината (1,127 г, 2,376 ммоль) в CH2Cl2 (3 мл) добавляли TFA (6,04 мл, 78 ммоль). Смесь перемешивали при комнатной температуре в течение приблизительно 5 часов. Смесь концентрировали под пониженным давлением и растворяли в DCM. При добавлении насыщенного раствора бикарбоната натрия образовывался белый осадок, который собирали посредством фильтрации и промывали водой. Осадок высушивали в вакуумной печи при приблизительно 60°C в течение ночи с получением 4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотиновой кислоты (820 мг, 1,961 ммоль, выход 83%). LC/MS (Способ i), Время удерживания=1,15 минуты; MS масса/заряд: 418,419,420 (M+H)+.
Стадия 6: этил-2-((3R,4S)-1-(4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотиноил)-3-метилпиперидин-4-ил)ацетат

В сосуд загружали 4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотиновую кислоту (162 мг, 0,387 ммоль) и этил-2-((3R,4S)-3-метилпиперидин-4-ил)ацетат, хлористоводородную кислоту (150 мг, 0,581 ммоль) в EtOAc (2 мл). Добавляли N-этил-N-изопропилпропан-2-амин (0,203 мл, 1,162 ммоль), затем по каплям добавляли 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинана 2,4,6-триоксид (T3P) (0,530 мл, 0,891 ммоль). Реакционную смесь перемешивали в течение ночи. Добавляли 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинан-2,4,6-триоксид (0,230 мл, 0,387 ммоль) и N-этил-N-изопропилпропан-2-амин (0,101 мл, 0,581 ммоль) и перемешивали 3 часа. Реакционную смесь нагревали до приблизительно 40°C. Через 2 часа добавляли 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинан-2,4,6-триоксид (0,230 мл, 0,387 ммоль) и реакционную смесь перемешивали в течение ночи при приблизительно 40°C. Реакционную смесь разбавляли с помощью EtOAc (10 мл) и промывали с помощью 1 н. HCl (10 мл), затем с помощью раствора NaHCO3 (10 мл). Органический слой высушивали над MgSO4, фильтровали, и концентрировали, и очищали посредством analogix (колонка 12 г, 10-80% EtOAc/гептан) с получением этил-2-((3R,4S)-1-(4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотиноил)-3-метилпиперидин-4-ил)ацетата (152 мг, 0,260 ммоль, выход 67,0%). LC/MS (Способ i), Время удерживания=2,01минуты; MS масса/заряд: 585,586,587(M+H)+.
Стадия 7: 2-((3R,4S)-1-(4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотиноил)-3-метилпиперидин-4-ил)уксусная кислота

В раствор этил-2-((3R,4S)-1-(4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотиноил)-3-метилпиперидин-4-ил)ацетата (151 мг, 0,258 ммоль) в смеси THF (4 мл):вода (0,800 мл) добавляли гидрат гидроксида лития (16,24 мг, 0,387 ммоль) и реакционную смесь перемешивали при приблизительно 35°C в течение ночи. Смесь концентрировали под пониженным давлением. Остаток растворяли в воде (5 мл) и водный слой экстрагировали с помощью DCM (5 мл). Образовывалась эмульсия. Всю смесь подкисляли с помощью 1 н. HCl до pH приблизительно 1-2. Добавляли дополнительное количество DCM, перемешивали и обеспечивали отстаивание в течение приблизительно 1 ч. Отделяли органический слой. Водн. слой промывали с помощью 5% MeoH/DCM. Органические слои объединяли, высушивали над MgSO4, фильтровали и концентрировали. Неочищенный продукт очищали при помощи RP-HPLC. Полученные фракции концентрировали до 60% исходного объема и полученные твердые вещества собирали посредством фильтрации и высушивали под вакуумом при приблизительно 60°C в течение ночи с получением 2-((3R,4S)-1-(4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотиноил)-3-метилпиперидин-4-ил)уксусной кислоты (102 мг, 0,183 ммоль, выход 70,9%). LC/MS (Способ i), Время удерживания=2,36 минуты; MS масса/заряд: 557,558,559 (M+H)+.
Пример GD: (2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)фенил)(4-(метилсульфонил)пиперидин-1-ил)метанон

2-((3S,4R)-1-(4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)никотиноил)-3-метилпиперидин-4-ил)уксусную кислоту (130 мг, 0,233 ммоль, выход 59,6%) получали способом, аналогичным примеру GC, стадии 7. LC/MS (Способ i), Время удерживания=2,36 минуты; MS масса/заряд: 557,558,559 (M+H)+.
Пример GE: (2,4-дихлор-3-(1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбонил)фенил)(4-(метилсульфонил)пиперидин-1-ил)метанон
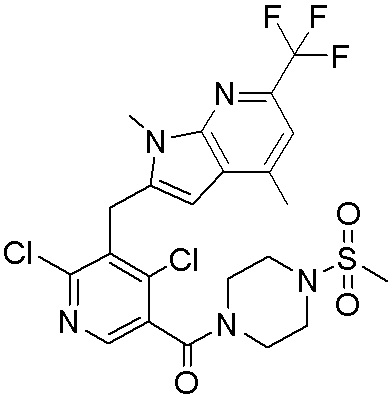
(4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-3-ил)(4-(метилсульфонил)пиперазин-1-ил)метанон (110 мг, 0,195 ммоль, выход 78%) получали способом, аналогичным примеру GC, стадии 6. LC/MS (Способ i).), Время удерживания=2,47 минуты; MS масса/заряд: 564,565, 566 (M+H)+.
Пример GF: (4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-3-ил)(морфолинo)метанон

(4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-3-ил)(морфолинo)метанон (102,7 мг, 0,207 ммоль, выход 75%) получали способом, аналогичным примеру GC, стадии 6. LC/MS (Способ i).), Время удерживания=2,52 минуты; MS масса/заряд: 487 (M+H)+.
Пример GG: (4,6-дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-3-ил)(4-(метилсульфонил)пиперидин-1-ил)метанон
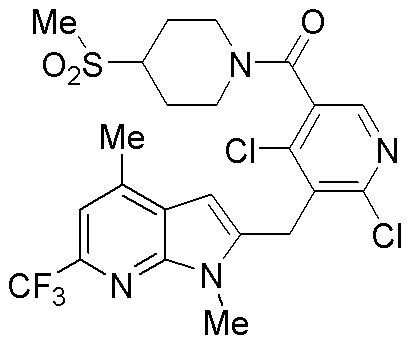
(4,6-Дихлор-5-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-3-ил)(4-(метилсульфонил)пиперидин-1-ил)метанон (35 мг, выход 10%) получали способом, аналогичным примеру GC, стадии 6. LC/MS (Способ i).), Время удерживания=1,59 минуты; MS масса/заряд: 563, 565, 567 (M+H)+.
Пример GH: (3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-2-ил)(морфолинo)метанон

Стадия 1: 3,5-дихлор-2-(морфолин-4-карбонил)изоникотинальдегид

В раствор 3,5-дихлор-4-формилпиколиновой кислоты (1,2 г, 5,45 ммоль) (пример FR, стадия 4) и 2-(3H-[1,2,3]триазоло[4,5-b]пиридин-3-ил)-1,1,3,3-тетраметилизоурония гексафторфосфата (V) (2,281 г, 6,00 ммоль) в THF (5 мл) добавляли морфолин (1,045 мл, 12,00 ммоль). Через 15 часов реакционную смесь разделяли между EtOAc (10 мл) и NaHCO3 (10 мл). Органический слой отделяли, концентрировали in vacuo и очищали хроматографией на силикагеле (EtOAc/DCM) с получением 3,5-дихлор-2-(морфолин-4-карбонил)изоникотинальдегида (900 мг, 3,11 ммоль, выход 57,1%) в виде густого масла. 1H ЯМР (400 МГц, DMSO-d6) δ 10,29 (s, 1H), 8,81 (s, 1H), 3,51 (t, J=4,8 Гц, 4H), 3,16 (t, J=4,8 Гц, 4H).
Стадия 2: (3,5-дихлор-4-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-2-ил)(морфолинo)метанон

Бесцветный раствор 4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридина (900 мг, 2,64 ммоль) (пример DO, стадия 10) в THF (15 мл) охлаждали до -78°C в атмосфере N2. По каплям добавляли LDA (1,0 M в THF/гексане) (3,17 мл, 3,17 ммоль) (поддерживая внутреннюю температуру < -75°C). Смесь перемешивали при -78°C в течение 1 часа. По каплям добавляли раствор 3,5-дихлор-2-(морфолин-4-карбонил)изоникотинальдегида (918 мг, 3,17 ммоль) в THF (8 мл) (внутреннюю температуру поддерживали на уровне ниже -75°C). Смесь перемешивали при -78°C в течение 1 часа. Раствор быстро охлаждали насыщенным NH4Cl (20 мл). Водный слой экстрагировали при помощи EtOAc (2× 30 мл). Органический слой высушивали над Na2SO4, фильтровали и концентрировали досуха. Твердое вещество очищали флэш-хроматографией (25-75% EtOAc/гептан за 30 мин.; колонка Silicycle, 40 г, 282 нм) с получением (3,5-дихлор-4-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-2-ил)(морфолинo)метанона (1,18 г, 1,875 ммоль, выход 70,9%) в виде белого твердого вещества. LC/MS (Способ i), Время удерживания=2,63 минуты; MS масса/заряд: 573 (M+H)+.
Стадия 3: (3,5-дихлор-4-(хлор(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-2-ил)(морфолинo)метанон

В прозрачный раствор (3,5-дихлор-4-(гидрокси(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-2-ил)(морфолинo)метанона (300 мг, 0,477 ммоль) в CHCl3 (3 мл) добавляли SOCl2 (0,174 мл, 2,383 ммоль). Смесь нагревали при 60°C в течение ночи. Растворитель удаляли под пониженным давлением. Остаток разделяли между EtOAc (20 мл) и насыщенным NaHCO3 (20 мл). Органический слой концентрировали досуха и очищали флэш-хроматографией (0-75% EtOAc/гептан за 30 мин.; колонка Redi-Sep, 24 г, 280 нм) с получением (3,5-дихлор-4-(хлор(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-2-ил)(морфолинo)метанона (200,3 мг, 0,309 ммоль, выход 64,9%) в виде белого твердого вещества. LC/MS (Способ i), Время удерживания=1,99 минуты; MS масса/заряд: 647 (M+H)+.
Стадия 4: (3,5-дихлор-4-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-2-ил)(морфолинo)метанон

В раствор (3,5-дихлор-4-(хлор(4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-2-ил)(морфолинo)метанона (200 мг, 0,309 ммоль) в AcOH (2 мл) добавляли цинк (101 мг, 1,543 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов, затем фильтровали и промывали с помощью EtOAc. Фильтрат концентрировали досуха. Остаток разделяли между EtOAc (20 мл) и насыщенным NaHCO3 (20 мл). Водный слой экстрагировали с помощью EtOAc (1×10 мл). Органический слой высушивали над Na2SO4, фильтровали и концентрировали досуха с получением (3,5-дихлор-4-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-2-ил)(морфолинo)метанона (176,6 мг, 0,248 ммоль, выход 80%) в виде белой пены. LC/MS (Способ i), Время удерживания=1,90 минуты; MS масса/заряд: 613 (M+H)+.
Стадия 5: (3,5-дихлор-4-((4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-2-ил)(морфолинo)метанон
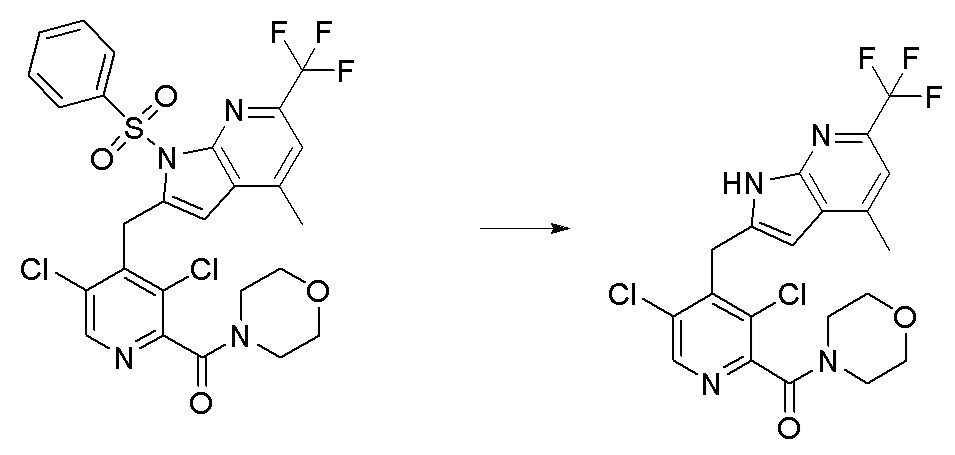
В светло-желтый раствор (3,5-дихлор-4-((4-метил-1-(фенилсульфонил)-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-2-ил)(морфолинo)метанона (176 мг, 0,247 ммоль) в THF (3 мл) в атмосфере N2 добавляли TBAF (1,0 M в THF) (0,370 мл, 0,370 ммоль). Смесь перемешивали при 50°C в течение 4 часов. Растворитель удаляли под пониженным давлением. Очищали флэш-хроматографией (0-75% EtOAc/гептан за 30 мин.; колонка Redi-Sep, 24 г, 285 нм) с получением (3,5-дихлор-4-((4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-2-ил)(морфолинo)метанона (139,1 мг, 0,294 ммоль, выход 119%) в виде белого твердого вещества. LC/MS (Способ i), Время удерживания=1,48 минуты; MS масса/заряд: 473 (M+H)+.
Стадия 6: (3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-2-ил)(морфолинo)метанон
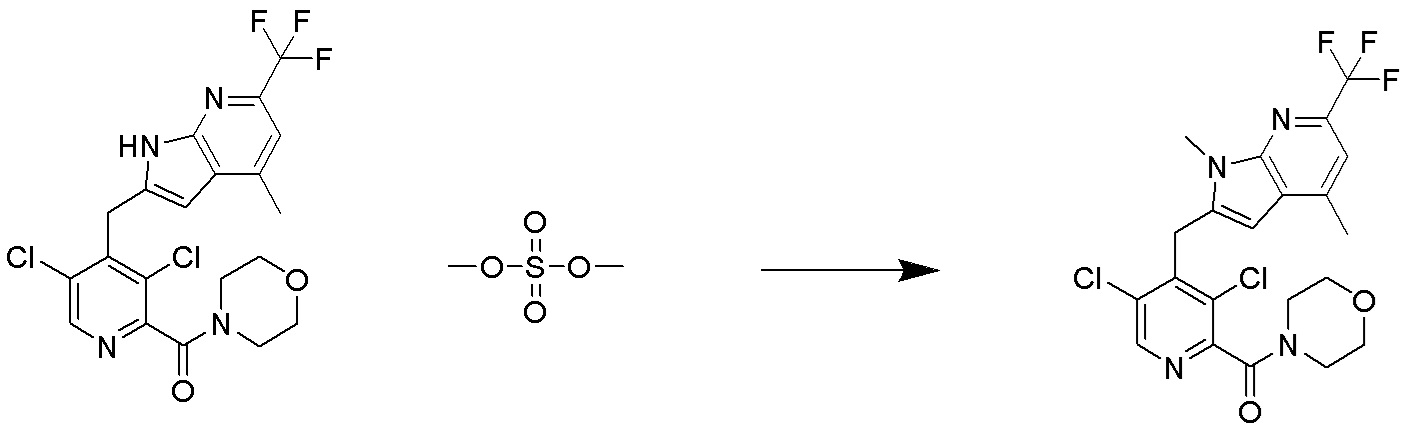
В сосуд загружали (3,5-дихлор-4-((4-метил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-2-ил)(морфолинo)метанон (139 мг, 0,294 ммоль) и карбонат цезия (239 мг, 0,734 ммоль), затем продували с помощью N2 в течение 10 мин. перед добавлением ACN (2 мл). Раствор продували с помощью N2 в течение еще 5 минут. Добавляли диметилсульфат (0,042 мл, 0,441 ммоль). Смесь перемешивали при комнатной температуре в течение 3 часов. Раствор фильтровали и промывали с помощью EtOAc. Фильтрат концентрировали досуха и очищали флэш-хроматографией (0-75% EtOAc/гептан за 30 мин.; колонка Redi-Sep, 24 г, 283 нм). Его дополнительно очищали на RP-системе Interchim с помощью 20-95% 0,1% HCO2H в воде/ACN. Фракции, содержащие продукт, концентрировали для удаления летучих веществ и лиофилизировали досуха с получением (3,5-дихлор-4-((1,4-диметил-6-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-ил)метил)пиридин-2-ил)(морфолинo)метанона (103 мг, 0,207 ммоль, выход 84%) в виде грязно-белого порошка. LC/MS (Способ i), Время удерживания=2,56 минуты; MS масса/заряд: 487 (M+H)+.
Пример GI: 2-(1-(2,4-дихлор-3-(1-метил-6-(трифторметокси)-1H-индол-2-карбонил)бензоил)пиперидин-4-ил)уксусная кислота
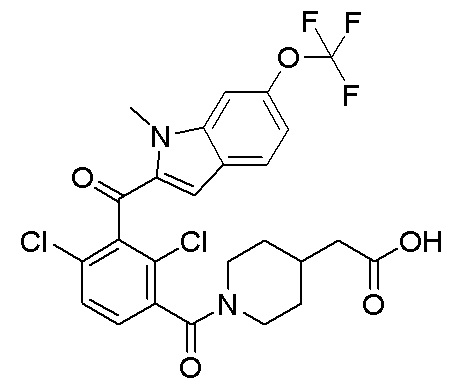
Стадия 1: трет-бутил-2,4-дихлор-3-(гидрокси(1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоат

В реакционный сосуд добавляли 2,0 M диизопропиламид лития в смеси THF/гептан/этилбензол (5,18 мл, 10,36 ммоль) в THF (THF) (20 мл) с получением бесцветного раствора. Раствор охлаждали до приблизительно -65°C с помощью бани с сухим льдом/ацетоном. Добавляли раствор трет-бутил-2,4-дихлорбензоата (2,56 г, 10,36 ммоль) (получение №33, стадия A) в THF (THF) (15 мл) и смесь перемешивали в течение 2 часов. После добавления раствор окрашивался в темный цвет. В отдельный реакционный сосуд добавляли 1-метил-6-(трифторметокси)-1H-индол-2-карбальдегид (2,10 г, 8,64 ммоль) (получение №52, стадия N) в THF (THF) (20 мл) с получением желтого раствора и смесь охлаждали до приблизительно -78°C. По каплям с помощью шприца добавляли раствор аниона, поддерживая температуру на уровне <-65°C. Перемешивали при приблизительно -65°C в течение 5 минут. LC/MS показала приблизительно 30% степень превращения. Получали дополнительный анион (1,2 экв.) и добавляли. Через 5 минут почти весь исходный материал расходовался. Добавляли 1,0 M лимонную кислоту (100 мл) и экстрагировали с помощью MTBE (100 мл). Промывали солевым раствором (50 мл) и высушивали над сульфатом магния. Неочищенный продукт растирали с гептаном (50 мл). Твердые вещества удаляли фильтрацией и обеспечивали отстаивание слоя гептана. Отфильтровывали дополнительный осадок, который образовывался в течение выходных. Растворитель, представляющий собой гептан, удаляли in vacuo с получением 5,27 г неочищенного масла. Неочищенный материал хроматографировали на системе Intelliflash 280 при помощи 120-г колонки из силикагеля Redi-Sep при помощи следующего градиента: A: гептан; B: EtOAc; от 0% B до 60% B за 30 мин. Получали трет-бутил-2,4-дихлор-3-(гидрокси(1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоат (2,072 г, выход 49%). LC/MS (Способ i) LC/MS (Способ i), Время удерживания=2,17 минуты; MS масса/заряд: 490,0 (M+H)+.
Стадия 2: трет-бутил-2,4-дихлор-3-(1-метил-6-(трифторметокси)-1H-индол-2-карбонил)бензоат
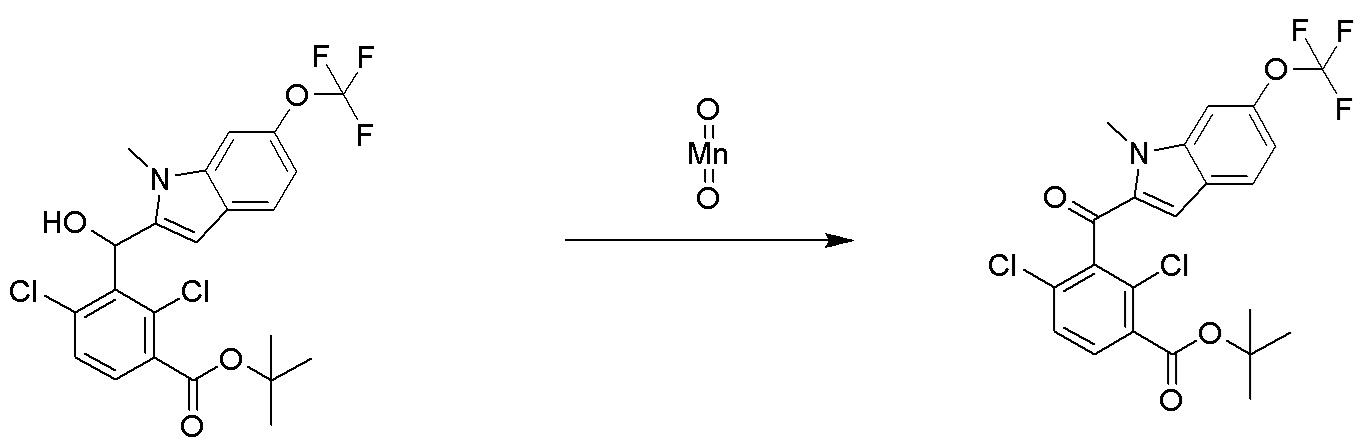
В круглодонную колбу добавляли трет-бутил-2,4-дихлор-3-(гидрокси(1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)бензоат (1,03 г, 2,101 ммоль) в DCM (10 мл) и THF (10,00 мл) с получением желтого раствора. Добавляли диоксид марганца (1,826 г, 21,01 ммоль) и смесь перемешивали при температуре окружающей среды. Обеспечивали реагирование смеси в течение выходных. Неорганический слой отфильтровывали и добавляли дополнительное количество диоксида марганца (1,826 г, 21,01 ммоль). Через 6 часов весь исходный материал расходовался. Раствор фильтровали через подушку из Celite®, промывали с помощью DCM. Растворитель удаляли in vacuo с получением 1,020 г неочищенного продукта, который использовали непосредственно на следующей стадии без дополнительной очистки. LC/MS (Способ i), Время удерживания=2,33 минуты; MS масса/заряд: 488,18 (M+H)+.
Стадия 3: 2,4-дихлор-3-(1-метил-6-(трифторметокси)-1H-индол-2-карбонил)бензойная кислота

В круглодонную колбу добавляли трет-бутил-2,4-дихлор-3-(1-метил-6-(трифторметокси)-1H-индол-2-карбонил)бензоат (1,020 г, 2,089 ммоль) в диоксане (20 мл) с получением бесцветного раствора. Добавляли 5 н. хлористоводородную кислоту (2,089 мл, 10,44 ммоль) и смесь нагревали при 85°C в течение ночи. Весь исходный материал превращался в продукт, что демонстрировалось при помощи LC/MS. Раствор охлаждали до температуры окружающей среды. Добавляли MBTE (40 мл) и воду (20 мл). Слои разделяли и органический слой промывали водой (2×10 мл), высушивали над сульфатом магния и растворитель удаляли in vacuo с получением 2,4-дихлор-3-(1-метил-6-(трифторметокси)-1H-индол-2-карбонил)бензойной кислоты (0,908 г, выход 95%) в виде твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS (Способ i) LC/MS (Способ i), Время удерживания=1,32 минуты; MS масса/заряд: 432,12 (M+H)+; MS масса/заряд: 430,22 (M-H)-.
Стадия 4: метил-2-(1-(2,4-дихлор-3-(1-метил-6-(трифторметокси)-1H-индол-2-карбонил)бензоил)пиперидин-4-ил)ацетат

В круглодонную колбу добавляли 2,4-дихлор-3-(1-метил-6-(трифторметокси)-1H-индол-2-карбонил)бензойную кислоту (1,411 г, 3,26 ммоль) в EtOAc (15 мл) с получением желтого раствора. Добавляли метил-2-(пиперидин-4-ил)ацетат и хлористоводородную кислоту (0,696 г, 3,59 ммоль) и N,N-диметилформамид (3 мл). Раствор перемешивали в течение 15 минут. Добавляли HATU (1,366 г, 3,59 ммоль), а затем по каплям добавляли триэтиламин (1,593 мл, 11,43 ммоль), поддерживая температуру на уровне <25°C. Через 1 час добавляли MBTE (40 мл) и воду (15 мл). Слои разделяли и органический слой промывали с помощью 1 н. HCl (3×15 мл), насыщенного водного раствора бикарбоната натрия (2×15 мл), насыщенного водного раствора хлорида аммония (15 мл) и солевого раствора (15 мл), затем высушивали над сульфатом магния и растворитель удаляли in vacuo с получением 1,72 г неочищенного материала. Неочищенный материал хроматографировали на системе Intelliflash 280 при помощи 120-г силикагелевой колонки Silicycle SiliaSep при помощи следующего градиента: A: гептан; B: EtOAc; от 10% B до 100% B за 30 мин. Растворитель удаляли in vacuo из фракций 3-8 с получением метил-2-(1-(2,4-дихлор-3-(1-метил-6-(трифторметокси)-1H-индол-2-карбонил)бензоил)пиперидин-4-ил)ацетата (1,724 г, выход 91%). LC/MS (Способ i) Время удерживания=1,99 минуты; MS масса/заряд: 571,17(M+H)+.
Стадия 5: 2-(1-(2,4-дихлор-3-(1-метил-6-(трифторметокси)-1H-индол-2-карбонил)бензоил)пиперидин-4-ил)уксусная кислота
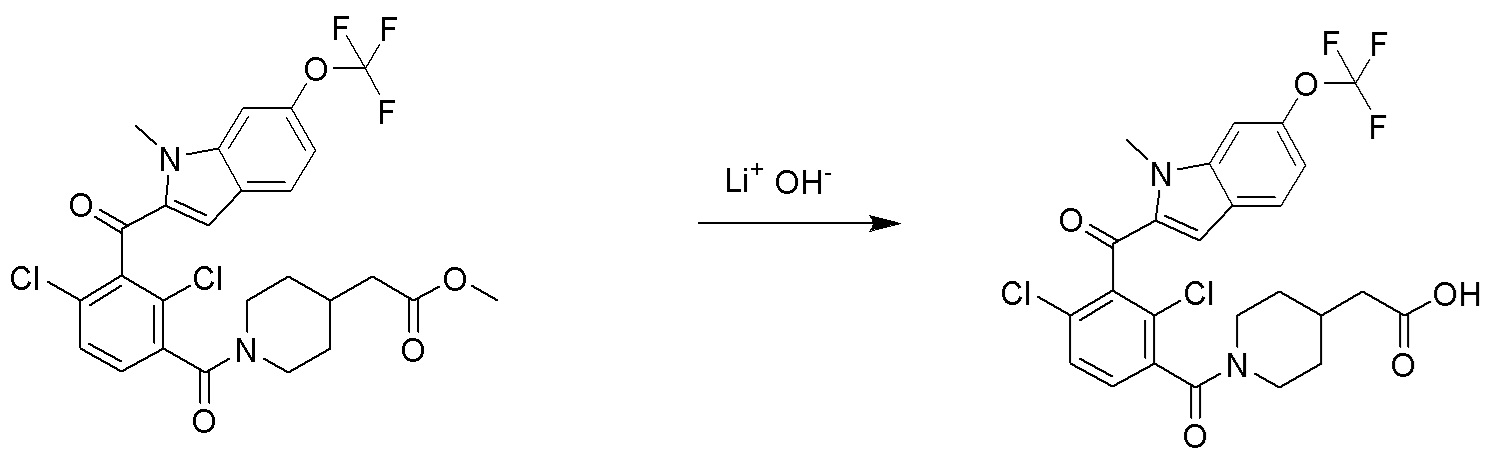
В круглодонную колбу добавляли метил-2-(1-(2,4-дихлор-3-(1-метил-6-(трифторметокси)-1H-индол-2-карбонил)бензоил)пиперидин-4-ил)ацетат (1,59 г, 2,78 ммоль) в THF (THF) (30 мл) и воду (10,0 мл) с получением бесцветного раствора. Добавляли гидроксид лития (0,133 г, 5,57 ммоль) и смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь концентрировали и добавляли воду (10 мл). Подкисляли до pH ~ 3 с помощью 1 н. HCl. Получали слежавшийся осадок. Фильтровали, промывали водой. Остаток растворяли в DCM. Отделяли воду и высушивали над сульфатом магния. Растворитель удаляли in vacuo, высушивали при 60°C. Лиофилизировали в течение выходных (из воды/ACN). Получали 2-(1-(2,4-дихлор-3-(1-метил-6-(трифторметокси)-1H-индол-2-карбонил)бензоил)пиперидин-4-ил)уксусную кислоту (0,993 г, выход 63%). LC/MS (Способ i) Время удерживания=1,69 минуты; MS масса/заряд: 557,20, 559,19 (M+H)+; MS масса/заряд: 555,20, 557,22 (M-H)-.
Пример GJ: 2-(1-(4,6-дихлор-5-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)никотиноил)пиперидин-4-ил)уксусная кислота

Стадия 1: 4,6-дихлор-5-(гидрокси(1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)никотиновая кислота
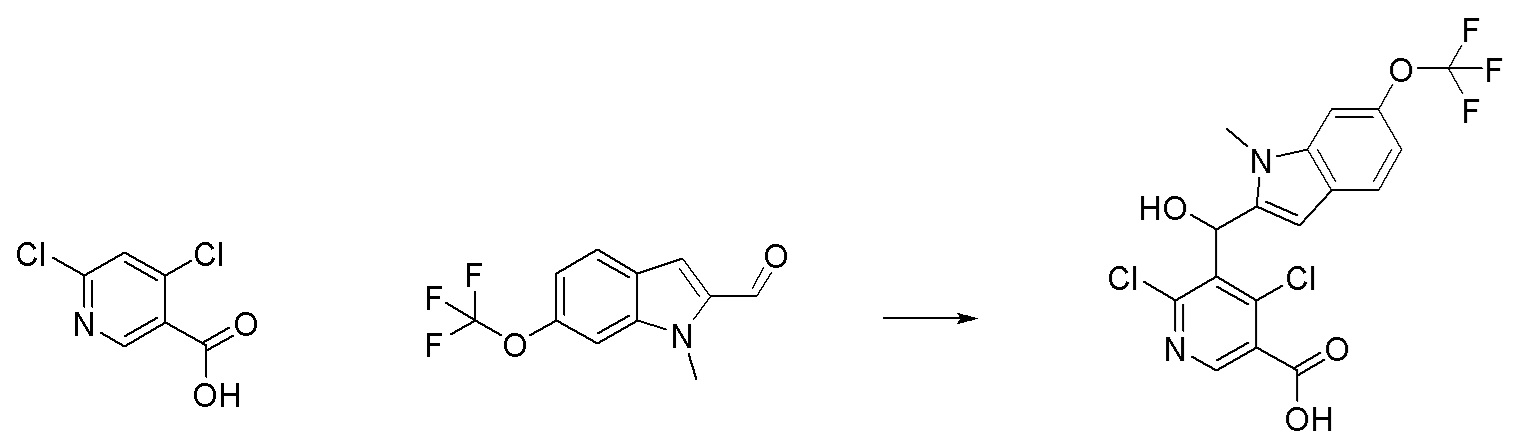
В раствор диизопропиламина (2,461 мл, 17,27 ммоль) в THF (20 мл) при 0°C добавляли 2,5 M раствор бутиллития (6,91 мл, 17,27 ммоль) в гексанах. Через 20 минут смесь охлаждали до -75°C и медленно добавляли раствор 4,6-дихлорникотиновой кислоты (1,658 г, 8,64 ммоль) в THF (25 мл), температура < 65°C. Через 30 минут медленно добавляли раствор 1-метил-6-(трифторметокси)-1H-индол-2-карбальдегида (1,05 г, 4,32 ммоль) (получение №52, стадия n) в THF (5 мл), температура < 70°C. Через 30 минут добавляли 1 н. HCl (30 мл) и реакционную смесь нагревали до комнатной температуры. Добавляли MTBE/EtOAc (1:1, 50 мл) и воду (30 мл). Органический слой отделяли, промывали солевым раствором (30 мл), высушивали (Na2SO4) фильтровали, добавляли TEA (10 мл) и смесь концентрировали in vacuo с получением неочищенной 4,6-дихлор-5-(гидрокси(1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)никотиновой кислоты (1,8 г), которую использовали без дополнительной очистки.
Стадия 2: метил-2-(1-(4,6-дихлор-5-(гидрокси(1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)никотиноил)пиперидин-4-ил)ацетат

В раствор 4,6-дихлор-5-(гидрокси(1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)никотиновой кислоты (1,8 г, 4,14 ммоль) в EtOAc (EtOAc) (9 мл) и диметилформамиде (DMF) (9,00 мл) добавляли метил-2-(пиперидин-4-ил)ацетат, хлористоводородную кислоту (1,682 г, 8,69 ммоль), 2-(3H-[1,2,3]триазоло[4,5-b]пиридин-3-ил)-1,1,3,3-тетраметилизоурония гексафторфосфат (V) (3,30 г, 8,69 ммоль) и триэтиламин (2,88 мл, 20,68 ммоль). Через 2 ч. добавляли 1 н. HCl (20 мл) и MTBE (20 мл). Органический слой отделяли, промывали с помощью NaHCO3 (20 мл). Добавляли NH4Cl (40 мл), органическое вещество отделяли, промывали солевым раствором (20 мл), высушивали (Na2SO4), фильтровали и концентрировали in vacuo. Неочищенный продукт очищали при помощи FCC на SiO2 (40 г) (EtOAc/геп.) с получением метил-2-(1-(4,6-дихлор-5-(гидрокси(1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)никотиноил)пиперидин-4-ил)ацетата (1,4 г, 2,437 ммоль, выход 58,9%) в виде пены. LC/MS (Способ i) Время удерживания=1,55 минуты; MS масса/заряд: 574 (M+H)+.
Стадия 3: метил-2-(1-(4,6-дихлор-5-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)никотиноил)пиперидин-4-ил)ацетат

В раствор метил-2-(1-(4,6-дихлор-5-(гидрокси(1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)никотиноил)пиперидин-4-ил)ацетата (1,4 г, 2,437 ммоль) в DCM (DCM) (50 мл) при 0°C добавляли триэтилсилан (11,68 мл, 73,1 ммоль) и 2,2,2-TFA (1,878 мл, 24,37 ммоль). Через 2 ч. нагревали до к.т. Через 8 ч. разбавляли с помощью MTBE (100 мл) и 2 н. NaOH (50 мл). Органическое вещество отделяли, промывали солевым раствором (50 мл), высушивали (Na2SO4), фильтровали и концентрировали in vacuo. FCC SiO2 (40 г), EtOAc/геп. с получением метил-2-(1-(4,6-дихлор-5-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)никотиноил)пиперидин-4-ил)ацетата (800 мг, 1,433 ммоль, выход 58,8%) в виде пены. LC/MS (Способ i) Время удерживания=1,95 минуты; MS масса/заряд: 556 (M+H)+.
Стадия 4: 2-(1-(4,6-дихлор-5-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)никотиноил)пиперидин-4-ил)уксусная кислота

В раствор метил-2-(1-(4,6-дихлор-5-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)никотиноил)пиперидин-4-ил)ацетата (1,2 г, 2,149 ммоль) в THF (12 мл) добавляли 1 н. раствор гидроксида натрия (4,30 мл, 4,30 ммоль). Реакционную смесь нагревали до 45°C и медленно добавляли MeOH до тех пор, пока не получали однородный раствор. Через 3 часа реакционную смесь охлаждали до комнатной температуры и добавляли MTBE:EtOAc (1:1, 30 мл) и воду (20 мл). Органический слой отделяли, промывали солевым раствором (20 мл), высушили (Na2SO4), фильтровали и концентрировали in vacuo. Остаток концентрировали из ACN несколько раз (образовывались твердые вещества). Остаток суспендировали в ACN (3 мл), нагревали до 60°C, перемешивали в течение 2 часов, и медленно охлаждали до комнатной температуры, и фильтровали. Фильтрат частично концентрировали в потоке воздуха и полученные твердые вещества собирали фильтрацией и объединяли с первой массой. Твердые вещества высушивали in vacuo при 50°C с получением 2-(1-(4,6-дихлор-5-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)никотиноил)пиперидин-4-ил)уксусной кислоты (350 мг, 0,643 ммоль, выход 29,9%) в виде белого твердого вещества. LC/MS (Способ i) Время удерживания=1,61 минуты; MS масса/заряд: 544 (M+H)+.
Пример GK: 2-(1-(4,6-дихлор-5-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)никотиноил)пиперидин-4-ил)уксусная кислота
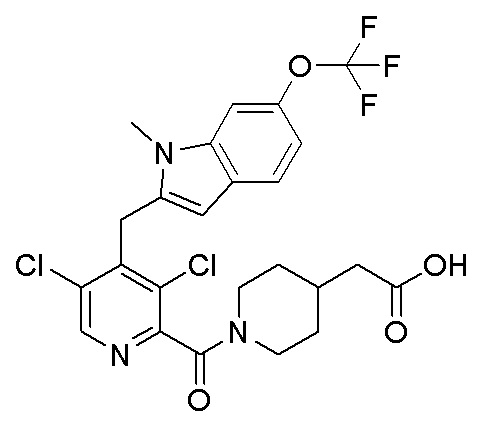
Стадия 1: метил-2-(1-(3,5-дихлор-4-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)пиколиноил)пиперидин-4-ил)ацетат
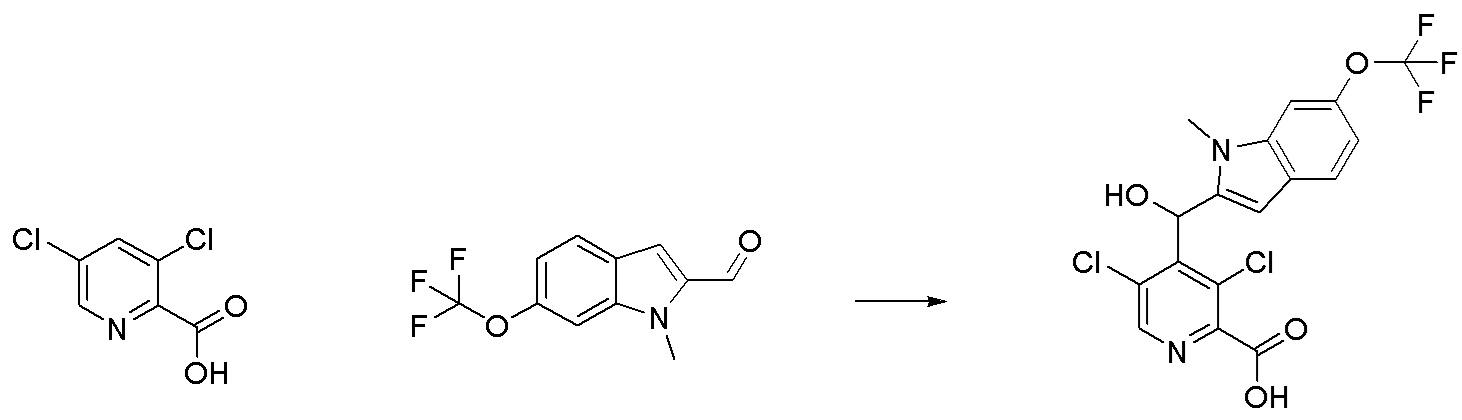
В 500 мл круглодонную колбу добавляли диизопропиламин (9,12 мл, 64,0 ммоль) в THF (53,3 мл) с получением бесцветного раствора. Раствор охлаждали до приблизительно 0°C на ледяной бане. Бутиллитий (2,5 M) (24 мл, 60,0 ммоль) и бутиллитий (2,0 M в циклогексане) (2,00 мл, 4,00 ммоль) добавляли по каплям и раствор перемешивали при 0°C в течение приблизительно 7 минут. Раствор охлаждали до приблизительно -78°C на бане из сухого льда/ацетона, затем перемешивали при -78°C в течение приблизительно 15 минут. Раствор 3,5-дихлорпиколиновой кислоты (6,14 г, 32,0 ммоль) (Ark Pharm) в THF (53,3 мл) добавляли по каплям посредством шприца (использовали еще 10 мл THF для промывания) в течение приблизительно 32 минут, и реакционную смесь перемешивали в течение приблизительно 10 минут. Раствор 1-метил-6-(трифторметокси)-1H-индол-2-карбальдегида (3,89 г, 16,00 ммоль) (получение №52, стадия n) в THF (53,3 мл) добавляли по каплям посредством шприца (использовали еще 10 мл THF для промывания) в течение приблизительно 9 минут, и реакционную смесь перемешивали в течение приблизительно 10 минут. Реакционную смесь выливали в перемешанный насыщенный NH4Cl (200 мл) плюс лед (200 г), добавляли EtOAc (400 мл), HCl (1 н., 20 мл). Два слоя разделяли, органический слой промывали насыщенным NH4Cl (2×100 мл), солевым раствором (2×100 мл), высушивали над MgSO4, фильтровали и концентрировали с получением 3,5-дихлор-4-(гидрокси(1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)пиколиновой кислоты (11 г) в виде оранжевого масла. Неочищенный продукт использовали как есть на следующей стадии. LC/MS (Способ i) Время удерживания=1,03 минуты; MS масса/заряд: 436 (M+H)+.
Стадия 2: метил-2-(1-(3,5-дихлор-4-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)пиколиноил)пиперидин-4-ил)ацетат

В оранжевый раствор 3,5-дихлор-4-(гидрокси(1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)пиколиновой кислоты (6,96 г, 16 ммоль) в диметилформамиде (DMF) (45,0 мл) добавляли метил-2-(пиперидин-4-ил)ацетат, хлористоводородную кислоту (6,51 г, 33,6 ммоль), раствор перемешивали в течение приблизительно 10 минут, затем охлаждали на ледяной бане. Добавляли 2-(3H-[1,2,3]триазоло[4,5-b]пиридин-3-ил)-1,1,3,3-тетраметилизоурония гексафторфосфат (V) (12,78 г, 33,6 ммоль) и раствор перемешивали в течение приблизительно 10 минут. Затем медленно добавляли триэтиламин (11,15 мл, 80 ммоль). Удаляли ледяную баню. Раствор перемешивали при комнатной температуре в течение 90 минут. Добавляли EtOAc (400 мл) и насыщенный NaHCO3 (250 мл). Органический слой промывали насыщенным NaHCO3 (2×150 мл) и солевым раствором (125 мл), высушивали (над Na2SO4 и MgSO4), фильтровали и концентрировали in vacuo с получением 12,7 г неочищенного вещества. FCC SiO2 (220 г) EtOAc/геп. (45-85%) с получением метил-2-(1-(3,5-дихлор-4-(гидрокси(1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)пиколиноил)пиперидин-4-ил)ацетата (4,748 г, 8,27 ммоль, выход 49,1%). LC/MS (Способ i) Время удерживания=1,71 минуты; MS масса/заряд: 575 (M+H)+.
Стадия 3: метил-2-(1-(3,5-дихлор-4-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)пиколиноил)пиперидин-4-ил)ацетат

В 2 л круглодонную колбу добавляли метил-2-(1-(3,5-дихлор-4-(гидрокси(1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)пиколиноил)пиперидин-4-ил)ацетат (4,74 г, 8,25 ммоль) в DCM (450 мл) с получением бледно-желтого раствора. Раствор охлаждали до приблизительно 0°C на ледяной бане. Добавляли триэтилсилан (52,7 мл, 330 ммоль). Добавляли по каплям 2,2,2-TFA (6,36 мл, 83 ммоль). Через 1 час удаляли ледяную баню и перемешивали при комнатной температуре. Через 15 часов добавляли триэтилсилан (25 мл, 157 ммоль), перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали и очищали посредством Isco (35-90% EtOAc/гептан) на силикагеле с получением метил-2-(1-(3,5-дихлор-4-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)пиколиноил)пиперидин-4-ил)ацетата (1,25 г, 2,194 ммоль, выход 26,6%). LC/MS (Способ i) Время удерживания=1,89 минуты; MS масса/заряд: 559 (M+H)+.
Стадия 4: 2-(1-(3,5-дихлор-4-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)пиколиноил)пиперидин-4-ил)уксусная кислота
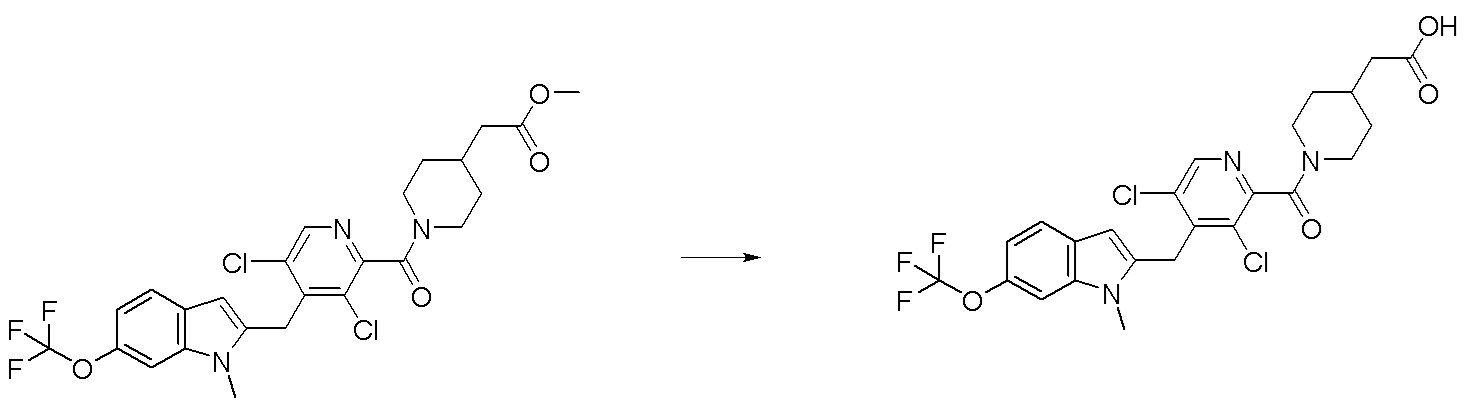
В 40 мл реакционный сосуд добавляли метил-2-(1-(3,5-дихлор-4-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)пиколиноил)пиперидин-4-ил)ацетат (1,25 г, 2,239 ммоль) в MeOH (4,33 мл) и воде (2,163 мл) с получением белой суспензии. Добавляли гидроксид натрия (2 н.) (2,239 мл, 4,48 ммоль), добавляли THF (2,2 мл), нагревали до 70°C в течение 30 минут, она становилась прозрачным красным раствором. Раствор охлаждали до приблизительно 0°C на ледяной бане. Хлороводород (0,895 мл, 4,48 ммоль) добавляли по каплям до pH=1, получали белую смолистую суспензию, ее фильтровали и промывали водой (5×10 мл) и пентаном (5×10 мл) с получением бледно-желтого твердого вещества. В твердое вещество добавляли 12 мл MeOH (10 мл/г), нагревали до 100°C в закрытом 40 мл сосуде в течение 10 минут, все еще бледно-желтая суспензия. Раствор медленно охлаждали до комнатной температуры, фильтровали, промывали с помощью MeOH (3×2 мл), высушивали на воронке в течение 2 часов с получением 970 мг бледно-желтого твердого вещества. Твердое вещество высушивали в вакуумной печи в течение ночи с получением 2-(1-(3,5-дихлор-4-((1-метил-6-(трифторметокси)-1H-индол-2-ил)метил)пиколиноил)пиперидин-4-ил)уксусной кислоты (0,97 г, 1,764 ммоль, выход 79%). LC/MS (Способ i) Время удерживания=1,62 минуты; MS масса/заряд: 545 (M+H)+.
Пример GL: 2-[1-[2,4-дихлор-3-[[1-метил-7-(трифторметил)-1H-индол-3-ил]метил]бензоил]-4-пиперидил]уксусная кислота

Стадия 1: трет-бутил-2,4-дихлор-3-[[7-(трифторметил)-1H-индол-3-ил]метил]бензоат

Используя процедуру, аналогичную примеру DU, стадии 1, трет-бутил 2,4-дихлор-3-[[7-(трифторметил)-1H-индол-3-ил]метил]бензоат (190 мг, 71%) получали из 7-(трифторметил)-1H-индола (100 мг, 0,540 ммоль) и трет-бутил-2,4-дихлор-3-формилбензоата (182 мг, 0,594 ммоль) (получение №33, стадия B). LC/MS (Способ i): Время удерживания=2,92 мин.; MS масса/заряд: 444 [M+H]+; 1H ЯМР ((DMSO-d6, 300МГц): δ=δ 11,28 (s, 1H) ; 7,96 (d, J=8,1 Гц, 1H) ; 7,60 (m, 2H) ; 7,46 (d, J=8,1 Гц, 1H) ; 7,20 (m, 1H) ; 6,80 (s, 1H) ; 4,40 (s, 2H) ; 1,53 (s, 9H).
Стадия 2: трет-бутил-2,4-дихлор-3-[[1-метил-7-(трифторметил)-1H-индол-3-ил]метил]бензоат
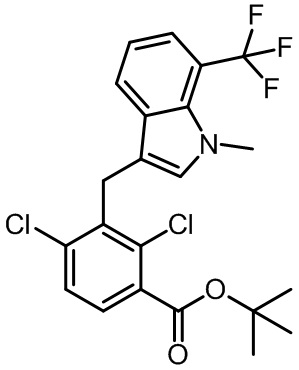
Используя процедуру, аналогичную примеру A, стадии 4, трет-бутил-2,4-дихлор-3-[[1-метил-7-(трифторметил)-1H-индол-3-ил]метил]бензоат (180 мг, 92%) получали из трет-бутил-2,4-дихлор-3-[[7-(трифторметил)-1H-индол-3-ил]метил]бензоата (180 мг, 0,405 ммоль) и метилйодида (27,9 мкл, 0,446 ммоль). LC/MS (Способ i): Время удерживания=2,79 мин.; MS масса/заряд: 458 [M+H]+; 1H ЯМР ((DMSO-d6, 300МГц): δ 8,05 (d, J=8,1 Гц, 1H) ; 7,60 (s, 2H) ; 7,59 (d, J=8,1 Гц, 1H) ; 7,25 (m, 1H) ; 6,89 (s, 1H) ; 4,38 (s, 2H) ; 3,78 (s, 3H) ; 1,54 (s, 9H).
Стадия 3: 2,4-дихлор-3-[[1-метил-7-(трифторметил)-1H-индол-3-ил]метил]бензойная кислота

Используя процедуру, аналогичную примеру DJ, стадии 2, 2,4-дихлор-3-[[1-метил-7-(трифторметил)-1H-индол-3-ил]метил]бензойную кислоту получали (150 мг, 84%) из трет-бутил-2,4-дихлор-3-[[1-метил-7-(трифторметил)-1H-индол-3-ил]метил]бензоата (170 мг, 0,371 ммоль). LC/MS (Способ j): Время удерживания=1,85 мин.; MS масса/заряд: 402 [M+H]+; 1H ЯМР ((DMSO-d6, 300МГц): δ 13,5 (m широкий, 1H) ; 8,04 (d, J=8,4 Гц, 1H) ; 7,60 (m, 3H) ; 7,32 (m, 1H) ; 6,87 (s, 1H) ; 4,39 (s, 2H) ; 3,78 (s, 3H).
Стадия 4: метил-2-[1-[2,4-дихлор-3-[[1-метил-7-(трифторметил)-1H-индол-3-ил]метил]бензоил]-4-пиперидил]ацетат

Используя процедуру, аналогичную примеру A, стадии 6, метил-2-[1-[2,4-дихлор-3-[[1-метил-7-(трифторметил)-1H-индол-3-ил]метил]бензоил]-4-пиперидил]ацетат (138 мг, 71%) получали из 2,4-дихлор-3-[[1-метил-7-(трифторметил)-1H-индол-3-ил]метил]бензойной кислоты (140 мг, 0,348 ммоль) и метил-2-(4-пиперидил)ацетата гидрохлорида (81 мг, 0,418 ммоль). LC/MS (Способ j): Время удерживания=2,15 мин.; MS масса/заряд: 541 [M+H]+; 1H ЯМР ((DMSO-d6, 300МГц): δ 8,04 (m, 1H) ; 7,59 (m, 2H) ; 7,30 и 7,25 (d, J=8,4 Гц, 1H) ; 7,20 (m, 1H) ; 6,87 (m, 1H) ; 4,48 (m, 1H) ; 4,35 (m, 2H) ; 3,79 (s, 3H) ; 3,57 и 3,59 (s, 3H) ; 3,35 (m, 1H) ; 3,02 (m, 1H) ; 2,80 (m, 1H) ; 2,27 (m, 2H) ; 1,99 (m, 1H) ; 1,75 (m, 1H) ; 1,62 (m, 1H) ; 1,15 (m, 2H).
Стадия 5: 2-[1-[2,4-дихлор-3-[[1-метил-7-(трифторметил)-1H-индол-3-ил]метил]бензоил]-4-пиперидил]уксусная кислота
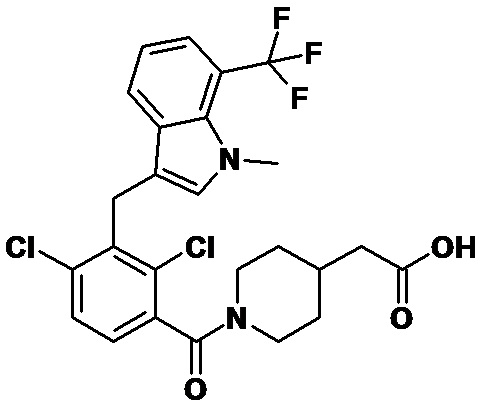
Используя процедуру, аналогичную примеру A, стадии 5, 2-[1-[2,4-дихлор-3-[[1-метил-7-(трифторметил)-1H-индол-3-ил]метил]бензоил]-4-пиперидил]уксусную кислоту (115 мг, 84%) получали из метил-2-[1-[2,4-дихлор-3-[[1-метил-7-(трифторметил)-1H-индол-3-ил]метил]бензоил]-4-пиперидил]ацетата (135 мг, 0,249 ммоль). LC/MS (Способ g): Время удерживания=1,90 мин.; MS масса/заряд: 527 [M+H]+; 1H ЯМР ((DMSO-d6, 300МГц): δ 12,11 (m широкий, 1H) ; 8,02 (m, 1H) ; 7,63 (m, 2H) ; 7,38 и 7,32 (d, J=8,4 Гц, 1H) ; 7,22 (m, 1H) ; 6,88 (m, 1H) ; 4,50 (m, 1H) ; 4,38 (m, 2H) ; 3,78 (s, 3H) ; 3,27 (m, 1H) ; 3,00 (m, 1H) ; 2,80 (m, 1H) ; 2,16 (m, 2H) ; 1,95 (m, 1H) ; 1,76 (m, 1H) ; 1,60 (m, 1H) ; 1,13 (m, 2H).
Пример GN: 2-[1-[4,6-дихлор-5-[(6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил]пиридин-3-карбонил]-4-пиперидил]уксусная кислота

Стадия 1: трет-бутил-5-[[1-(бензолсульфонил)-6-циклопропил-4-фтор-1H-индол-2-ил]-гидрокси-метил]-4,6-дихлор-пиридин-3-карбоксилат

Используя процедуру, аналогичную примеру CJ, стадии 1, трет-бутил-5-[[1-(бензолсульфонил)-6-циклопропил-4-фтор-1H-индол-2-ил]-гидрокси-метил]-4,6-дихлор-пиридин-3-карбоксилат (105 мг, 18%) получали из 6-циклопропил-4-фтор-1-(фенилсульфонил)-1H-индола (170 мг, 0,539 ммоль) (получение 77) и трет-бутил-4,6-дихлор-5-формил-пиридин-3-карбоксилата (223 мг, 0,809 ммоль) (пример DO, стадия 12). LC/MS (Способ j): Время удерживания=2,31 мин.; MS масса/заряд: 591 [M+H]+; 1H ЯМР ((DMSO-d6, 300МГц): δ=8,63 (s, 1H) ; 7,84 (d, J=7,79 Гц, 2H) ; 7,66 (m, 1H) ; 7,59 (m, 2H) ; 6,89 (m, 1H) ; 6,78 (m, 2H) ; 2,10 (m, 1H): 1,6 (s, 9H) ; 1,52 (m, 1H) ; 1,39 (s, 1H) ; 1,00 (m, 2H) ; 0,71 (m, 2H).
Стадия 2: 5-[[1-(бензолсульфонил)-6-циклопропил-4-фтор-1H-индол-2-ил]метил]-4,6-дихлор-пиридин-3-карбоновая кислота

Используя процедуру, аналогичную примеру A, стадии 2, 5-[[1-(бензолсульфонил)-6-циклопропил-4-фтор-1H-индол-2-ил]метил]-4,6-дихлор-пиридин-3-карбоновую кислоту (176 мг, 100%) получали из трет-бутил-5-[[1-(бензолсульфонил)-6-циклопропил-4-фтор-1H-индол-2-ил]-гидрокси-метил]-4,6-дихлор-пиридин-3-карбоксилата (200 мг, 0,338 ммоль). LC/MS (Способ j): Время удерживания=1,73 мин.; MS масса/заряд: 519 [M+H]+.
Стадия 3: 4,6-дихлор-5-[(6-циклопропил-4-фтор-1H-индол-2-ил)метил]пиридин-3-карбоновая кислота
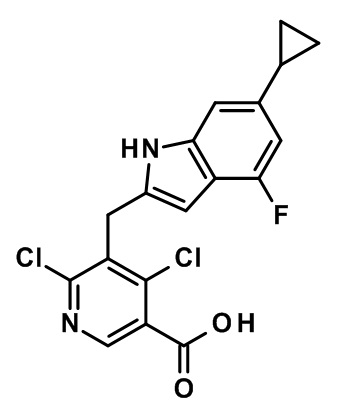
Используя процедуру, аналогичную примеру A, стадии 3, 4,6-дихлор-5-[(6-циклопропил-4-фтор-1H-индол-2-ил)метил]пиридин-3-карбоновую кислоту (165 мг, 81%) получали из 5-[[1-(бензолсульфонил)-6-циклопропил-4-фтор-1H-индол-2-ил]метил]-4,6-дихлор-пиридин-3-карбоновой кислоты (270 мг, 0,390 ммоль). LC/MS (Способ i): Время удерживания=2,04 мин.; без ионизации.
Стадия 4: метил-4,6-дихлор-5-[(6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил]пиридин-3-карбоксилат

Используя процедуру, аналогичную примеру P, стадии 4, метил-4,6-дихлор-5-[(6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил]пиридин-3-карбоксилат (172 мг, 100%) получали из 4,6-дихлор-5-[(6-циклопропил-4-фтор-1H-индол-2-ил)метил]пиридин-3-карбоновой кислоты (160 мг, 0,422 ммоль). LC/MS (Способ i): Время удерживания=2,60 мин.; MS масса/заряд: 407 [M+H]+.
Стадия 5: 4,6-дихлор-5-[(6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил]пиридин-3-карбоновая кислота

Используя процедуру, аналогичную примеру A, стадии 5, 4,6-дихлор-5-[(6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил]пиридин-3-карбоновую кислоту (125 мг, 46%) получали из метил-4,6-дихлор-5-[(6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил]пиридин-3-карбоксилата (200 мг, 0,491 ммоль). LC/MS (Способ i): Время удерживания=2,17 мин.; без ионизации.
Стадия 6: метил-2-[1-[4,6-дихлор-5-[(6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил]пиридин-3-карбонил]-4-пиперидил]ацетат

Используя процедуру, аналогичную примеру A, стадии 6, метил-2-[1-[4,6-дихлор-5-[(6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил]пиридин-3-карбонил]-4-пиперидил]ацетат (80 мг, 38%) получали из 4,6-дихлор-5-[(6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил]пиридин-3-карбоновой кислоты (120 мг, 0,305 ммоль) и метил-(4-пиперидил)ацетата гидрохлорида (76 мг, 0,397 ммоль).
LC/MS (Способ i): Время удерживания=2,49 мин.; MS масса/заряд: 532 [M+H]+; 1H ЯМР ((DMSO-d6, 300МГц): δ=8,44 и 8,40 (s, 1H) ; 7,05 (s, 1H) ; 6,50 (d, J= 11,7 Гц, 1H) ; 5,59 (d, J= 17 Гц, 1H) ; 4,48 (m, 1H) ; 4,38 (m, 2H) ; 3,81 (s, 3H) ; 3,59 (s, 3H) ; 3,39 (m, 1H) ; 3,08 (m, 1H) ; 2,83 (m, 1H) ; 2,27 (m, 1H) ; 2,03 (m, 3H) ; 1,75 (m, 1H) ; 1,40 (m, 1H) ; 1,15 (m, 2H) ; 0,93 (m, 2H) ; 0,70 (m, 2H).
Стадия 7: 2-[1-[4,6-дихлор-5-[(6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил]пиридин-3-карбонил]-4-пиперидил]уксусная кислота
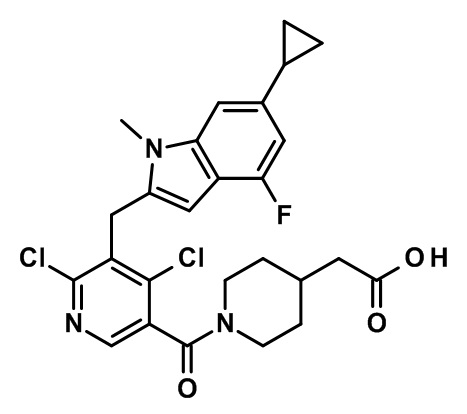
Используя процедуру, аналогичную примеру A, стадии 5, 2-[1-[4,6-дихлор-5-[(6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил]пиридин-3-карбонил]-4-пиперидил]уксусную кислоту (65 мг, 83%) получали из метил-2-[1-[4,6-дихлор-5-[(6-циклопропил-4-фтор-1-метил-1H-индол-2-ил)метил]пиридин-3-карбонил]-4-пиперидил]ацетата (80 мг, 0,15 ммоль).LC/MS (Способ g): Время удерживания=1,72 мин.; MS масса/заряд: 518 [M+H]+; 1H ЯМР ((DMSO-d6, 300МГц): δ=12,1 (m широкий, 1H) ; 8,47 и 8,40(s, 1H) ; 7,05 (s, 1H) ; 6,50 (d, J=11,5 Гц, 1H) ; 5,61 и 5,56 (s, 1H) ; 6,38 (m, 1H) ; 4,35 (s, 2H) ; 3,80 (s, 3H) ; 3,39 (m, 1H) ; 3,05 (m, 1H) ; 2,84 (m, 1H) ; 2,15 (m, 2H) ; 1,99 (m, 2H) ; 1,78 (m, 1H) ; 1,60 (m, 1H) ; 1,18 (m, 2H) ; 0,90 (m, 2H) ; 0,65 (m, 2H).
Биологическая активность
Первичный скриннинг проводили путем анализов временной трансактивации. Эти клеточные анализы проводили с использованием клеток Cos-7, трансфицированных химерной плазмидой экспрессии рецептора RORγ-Gal4 человека и плазмидой с репортерным геном 5Gal4 pGL3 TK Luc. Трансфекции проводили химическим средством (Jet PEI). Трансфицированные клетки наносили на 384-луночные планшеты и им позволяли привыкнуть в течение 24 ч. Культуральную среду затем удаляли и свежую среду, содержащую тестируемые соединения, добавляли (конечная концентрация в диапазоне от 10-4 M до 3 10-10 M). После инкубации в течение ночи измеряли уровень экспрессии люциферазы путем добавления SteadyGlo согласно инструкциям изготовителя (Promega). T0901317 при 10-5 M использовали в качестве эталона. Результаты выражены как кратная индукция по сравнению с базовым уровнем или в виде активности в процентах по сравнению с эталонами, принятыми как 100% (базовый) или 0% (T0901317). Кривые зависимости "доза-эффект" и IC50 рассчитывали при помощи программного обеспечения Assay Explorer (MDL).
IC50 для различных примеров указаны в таблице с использованием следующих категорий:
A: IC50<0,1 мкM; B: 0,1 мкM < IC50<0,5 мкM; C: 0,5 мкM < IC50<1 мкM;
D: 1 мкM < IC50<10 мкM; E: IC50 > 10 мкM.
|
Соединения по настоящему изобретению также тестировали на модели IL-23 псориазоподобного дерматита. Самок мышей C57BL/6, 18-22 г (Charles River Labs) помещали в апробированную установку AAALAC при свободных от специфической патогенной микрофлоры условиях и обеспечивали пищей и водой ad libitum. Животным вводили инъекции (уши; внутрикожно) 1 мкг рекомбинантного мышиного IL-23 на 0, 1, 2 и 3 дни под анестезией (изофлуран). На 4 день животных гуманно усыпляли и образцы плазмы крови и из уха отбирали в отношении моментов воздействия лекарственного средства и/или конечных точек модели. Животные также получали среду (0,5% гидроксипропилметилцеллюлозы/0,02% Tween 80 в воде) или тестовое соединение, суспендированное в среде, ежедневно посредством перорального зонда до завершения исследования. Соединения по настоящему изобретению обеспечивали >50% снижение воспаления в ухе относительно контроля со средой, дозируемого перорально в концентрации >1 мг/кг.