Результат интеллектуальной деятельности: Способ получения средства, обладающего антиоксидантной, гепатозащитной и желчегонной активностью
Вид РИД
Изобретение
Изобретение относится к области фармации, касается способа получения лекарственного средства из сбора растений (шиповника плоды, кориандра посевного плоды, ноготков лекарственных цветки, девясила корневища и корни, одуванчика корни), обладающего антиоксидантной, гепатозащитной и желчегонной активностью.
Проблемы профилактики и лечения заболеваний печени в современном обществе остаются актуальными ввиду широкой их распространенности, что обусловлено увеличением алкоголизации населения, ростом заболеваемости вирусными гепатитами, ухудшением экологической обстановки и неконтролируемым приемом медикаментов [1, 2, 3, 4, 8, 9, 12, 18, 26, 30, 35, 36, 37, 38, 39]. Несмотря на достигнутый прогресс в лечении заболеваний печени, связанный с появлением возможности этиотропного лечения вирусных гепатитов и применением фармакологических препаратов, тормозящих развитие фиброза печени, тем не менее терапия в целом остается сложной проблемой [7, 18, 26, 32, 33, 34, 39]. Все эти факторы обуславливают необходимость поиска новых лекарственных средств, способных повысить резистентность печени к воздействию ксенобиотиков [2, 16, 20, 25].
При лечении и профилактике заболеваний печени целесообразно назначение гепатопротекторов растительного происхождения, имеющих выраженный терапевтический эффект, постепенность наступления эффекта, минимум побочного влияния и возможность длительного курсового лечения [12, 18, 20, 25, 27]. С учетом этого, нами выбрана рецептура, применяемая при заболеваниях печени, состоящая из официнальных видов растений: шиповника майского, девясила высокого, календулы лекарственной, кориандра посевного и одуванчика лекарственного. Так, флавоноиды кверцетин, изокверцетин, кемпферол, содержащиеся в плодах шиповника, обладают желчегонным, антиоксидантным и гепатопротекторным свойствами [9, 19, 20]. Доказано, что выделенные из корневищ и корней девясила высокого производные β-селинена алантолактон, изоалактолактон и гидроалактолактон, а также инулин повышают желчеобразование и заметно усиливают желчеотделение в двенадцатиперстную кишку [11, 21, 34]. Установлено, что флавоноиды и фенолкарбоновые кислоты, содержащиеся в календуле лекарственной, способствуют стойкому понижению скорости накопления продуктов пероксидации, уменьшению выраженности основных синдромов: цитолиза и холестаза [1, 12, 13, 12, 15, 25]. Препараты из кориандра посевного используются как желчегонное, улучшающее пищеварение средство при заболеваниях печени и желчного пузыря [15, 19, 21]. Горечи, тритерпеновые соединения, органические соединения (олеановая, линолевая, пальмитиновая), содержащиеся в одуванчике лекарственном, способствуют ускорению желчеотделения и секреции пищеварительных желез [13, 19].
Таким образом, нами разработан способ получения суммарного экстракта, обладающего антиоксидантной, гепатозащитной и желчегонной активностью для лечения и профилактики заболеваний гепатобилиарной системы.
Известно лекарственное средство сироп Холосаса, действующим веществом которого является экстракт плодов шиповника. Действие препарата Холосас связано с влиянием комплекса компонентов, в том числе таких, как витамины В1, В2, С, Е, К, сахар 14-16%, яблочная и лимонная кислоты, флавоноиды, пектины - 25%, эфирные масла [12, 13, 19]. Холосас повышает функциональную способность печени, секрецию желчи, увеличивает содержание в желчи холатов и уменьшает вязкость желчи [4, 6]. Желчегонное действие препарата обусловлено содержанием флавоноидов. Органические кислоты в составе Холосаса (яблочная, лимонная) влияют на выделение желчи и панкреатического сока, улучшают аппетит и пищеварение [6].
К недостаткам указанного средства относятся: ограничение назначения при сахарном диабете, беременности и в период кормления грудью. С осторожностью назначают пациентам, склонным к тромбообразованию и развитию аллергических реакций, слабее выражены желчегонные, противовоспалительные и антиоксидантные свойства по сравнению со средством, полученным по предлагаемому способу.
Технический результат изобретения - расширение ассортимента гепатопротекторных лекарственных средств растительного происхождения, обладающих более выраженной антиоксидантной, гепатозащитной и желчегонной активностью, за счет использования широко распространенного растительного сырья, имеющего надежную и обеспеченную сырьевую базу. Использование растительного средства в виде экстракта сухого, позволит получать препарат с определенным содержанием действующих веществ.
Технический результат достигается тем, что измельченный растительный материал следующего состава (мае. части): шиповника плоды - 30%, кориандра посевного плоды -10%, ноготков лекарственных цветки - 25%, девясила корневища и корни - 25%, одуванчика корни - 10%, экстрагируют четырехкратно при отношении 1 мас. ч. сырья: 10 об. ч экстрагента при температуре 70°С. При первом и втором контактах фаз используется 70% спирт (экстракция в течение 60 минут и 60 минут), третьем и четвертом - вода очищенная (экстракция в течение 60 минут и 30 минут). Объединенные спиртовые и водные извлечения после четырех экстракций упаривают до 1/3 первоначального объема. Объединенные кубовые остатки от трех извлечений сепарируют. Полученный продукт доупаривают приблизительно до 1/5 и высушивают в вакуум-сушильном шкафу. Выход готового продукта составляет 41,00% от массы растительного материала. Сухой экстракт представляет собой аморфный порошок темно-коричневого цвета со специфическим запахом, потеря в массе при высушивании не превышает 5%.
Предлагаемый способ получения достаточно прост, не требует сложной схемы очистки, позволяет получить продукт постоянного состава. Технология может быть внедрена на предприятиях по выпуску лекарственных растительных препаратов.
На первоначальном этапе исследований проводился подбор типа экстрагента, который, действуя как активный компонент системы, влияет на скорость, полноту и качество экстрагирования биологически активных веществ из растительного материала. В качестве экстрагентов использованы вода и водно-спиртовые растворы различной концентрации. Результаты приведены в таблице 1.
Эффективность экстракции оценивали по количественному выходу экстрактивных веществ (ОФС 1.5.3.0006.15) и по выходу суммы флавоноидов, суммы полисахаридов.
Количественное определение суммы флавоноидов и суммы полисахаридов в растительной композиции проводили методом спектрофотометрии.
Методика количественного определения суммы флавоноидов в пересчете на лютеолин-7-гликозид в растительной композиции.
Аналитическую пробу растительной композиции измельчают до размера частиц, проходящих сквозь сито с отверстиями диаметром 0,5 мм.
Около 1 г (точная навеска) измельченной растительной смеси помещают в колбу со шлифом вместимостью 250 мл, прибавляют 50 мл 70% спирта (V1) взвешивают с погрешностью ±0,01. Колбу присоединяют к обратному холодильнику и экстрагируют на кипящей водяной бане в течение 45 минут. Колбу с содержимым охлаждают, взвешивают, доводят до первоначальной массы 70% спиртом.
Извлечение фильтруют через бумажный складчатый фильтр, отбрасывая первые 10 мл фильтрата (раствор А). В мерную колбу вместимостью 25 мл помещают 5 мл раствора А, прибавляют 4 капли кислоты уксусной, добавляют 2 мл 3% спиртового раствора алюминия хлорида и доводят объем раствора 70% спиртом до метки, перемешивают (раствор Б). Измеряют оптическую плотность на спектрофотометре при длине волны 400 нм в кювете толщиной слоя 10 мм. В качестве раствора сравнения используют раствор, состоящий из 5 мл раствора А, 4 капель уксусной кислоты, доведенный 70% спиртом до метки в мерной колбе вместимостью 25 мл. Содержание суммы флавоноидов (X) в процентах, в пересчете на удельный показатель раствора ГСО лютеолин-7-гликозида 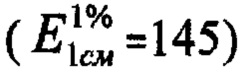 и абсолютно сухое сырье вычисляют по формуле;
и абсолютно сухое сырье вычисляют по формуле;
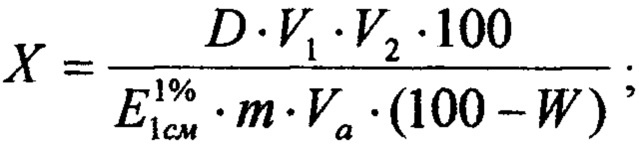 где
где
где D - оптическая плотность исследуемого раствора;
V1, V2 - разведения, мл;
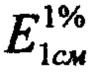 - удельный показатель поглощения раствора ГСО лютеолин-7-гликозида, 145;
- удельный показатель поглощения раствора ГСО лютеолин-7-гликозида, 145;
m - масса навески растительной композиции, г;
Va - объем аликвоты, мл;
W - потеря в массе растительной композиции при высушивании, в %.
Методика количественного определения суммы восстанавливающих моносахаров полисахаридного комплекса в растительной композиции.
Аналитическую пробу растительной композиции измельчают до размера частиц, проходящих сквозь сито с отверстиями диаметром 1 мм.
Около 1 г (точная навеска) измельченной растительной композиции помещают в коническую колбу вместимостью 250 мл, прибавляют 40 мл 70 % спирта, 0,3 г кальция карбоната и нагревают на кипящей водяной бане с обратным холодильником в течение 45 минут. Горячее извлечение сливают через бумажный фильтр, следя за тем, чтобы частицы сырья оставались в колбе. Колбу с сырьем промывают 10 мл 70 % спирта, извлечение сливают. Операцию экстрагирования повторяют с 30 мл 70 % спирта, оставшиеся на фильтре частицы сырья аккуратно смывают экстрагентом обратно в колбу, время нагревания 30 минут, извлечение сливают, сырье в колбе снова промывают дважды, используя по 10 мл того же экстрагента. Далее в колбу с сырьем приливают 50 мл воды и нагревают на кипящей водяной бане с обратным холодильником в течение 30 минут, охлаждают при комнатной температуре. Извлечение фильтруют через бумажный фильтр в мерную колбу вместимостью 100 мл, следя за тем, чтобы частицы сырья не попали на фильтр. Колбу с сырьем промывают 10 мл воды, извлечение фильтруют в ту же колбу. Экстракцию повторяют с 30 мл воды, время нагревания 15 минут. Переносят сырье на фильтр, промывают коническую колбу используя 10 мл воды. Доводят объем раствора до метки, перемешивают (раствор А).
20 мл раствора А помещают в круглодонную колбу, прибавляют 6 мл кислоты хлористоводородной и кипятят на плитке в течение 10 минут, используя обратный холодильник. К полученному извлечению прибавляют 40% раствор натрия гидроксида до получения раствора с рН 4,0-4,5. Раствор количественно переносят в мерную колбу вместимостью 50 мл, доводят объем раствора в колбе водой до метки, перемешивают. Извлечение фильтруют через бумажный фильтр, отбрасывают первые 10-15 мл фильтрата (раствор Б).
В три конические колбы вместимостью 50 мл помещают по 2,5 мл 0,05% раствора кислоты пикриновой, затем по 7,5 мл 20 % раствора натрия карбоната. В первую колбу прибавляют 5 мл раствора Б (анализируемый раствор), во вторую - 5 мл воды (раствор сравнения), в третью - 5 мл раствора рабочего стандартного образца (РСО) глюкозы. Колбы с содержимым погружают на 10 минут в кипящую водяную баню, затем охлаждают до комнатной температуры. Содержимое количественно переносят в мерные колбы вместимостью 25 мл, доводят объем растворов до меток водой и перемешивают.
Оптическую плотность анализируемого раствора и раствора РСО глюкозы измеряют относительно раствора сравнения при длине волны 460±2 нм. Содержание суммы полисахаридов в растительной композиции в пересчете на глюкозу и абсолютно сухое сырье в процентах (X) вычисляют по формуле:
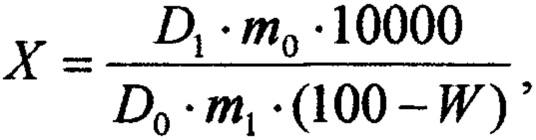 где
где
D1 - оптическая плотность исследуемого раствора;
D0 - оптическая плотность раствора РСО глюкозы;
m0 - масса навески РСО глюкозы в пересчете на безводную глюкозу, в г;
m1 - масса навески растительной композиции, в г;
W- потеря в массе растительной композиции при высушивании, в %.
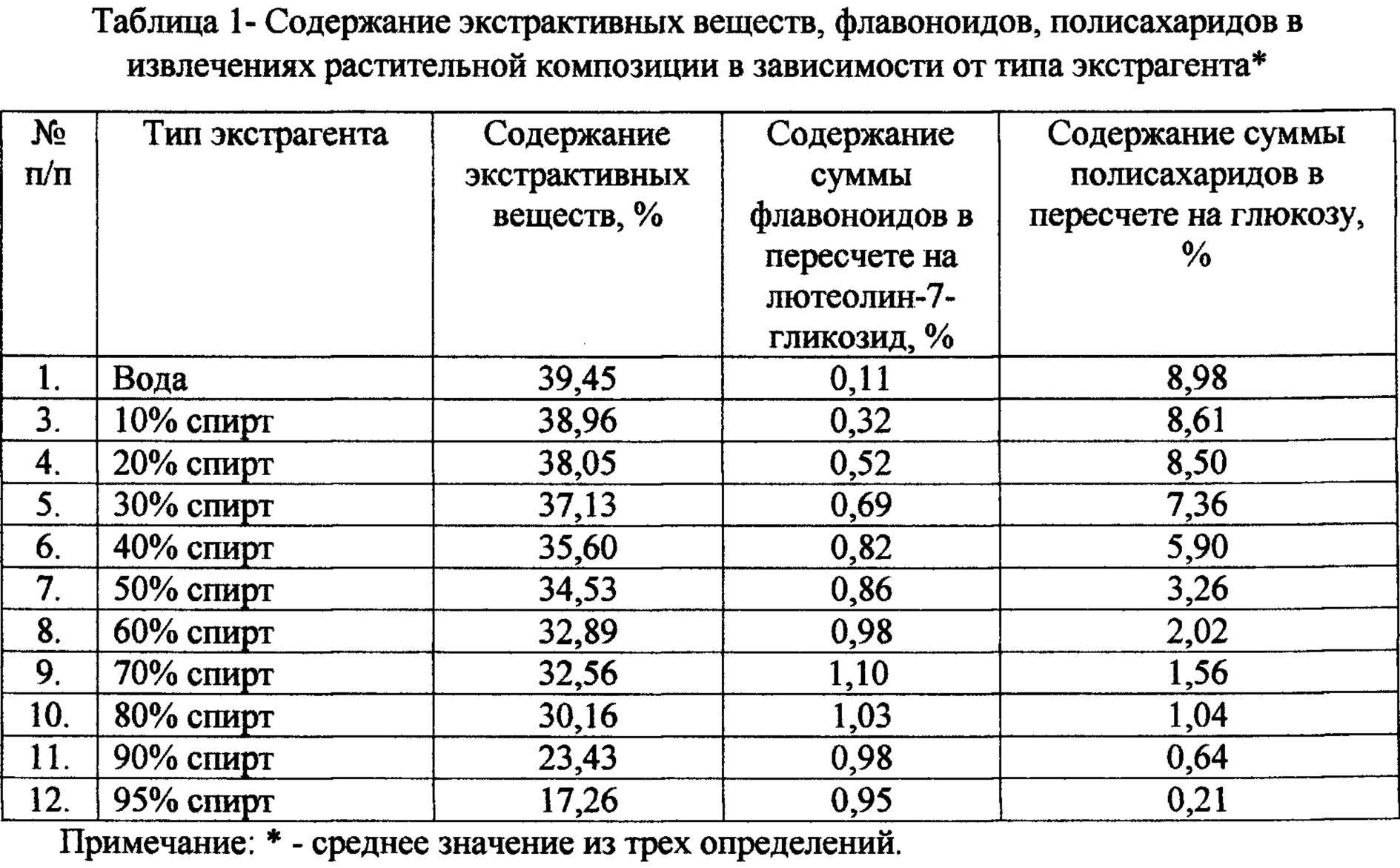
Как видно из таблицы 1 60-70% спирт обеспечивает извлечение максимального количества флавоноидов, а вода очищенная - полисахаридов и суммы экстрактивных веществ. Для получения экстракта из сырья нами предлагается использовать два экстрагента - 70% спирт и воду очищенную, которые позволят получить конечный продукт с высоким выходом флавоноидов, экстрактивных веществ и полисахаридов.
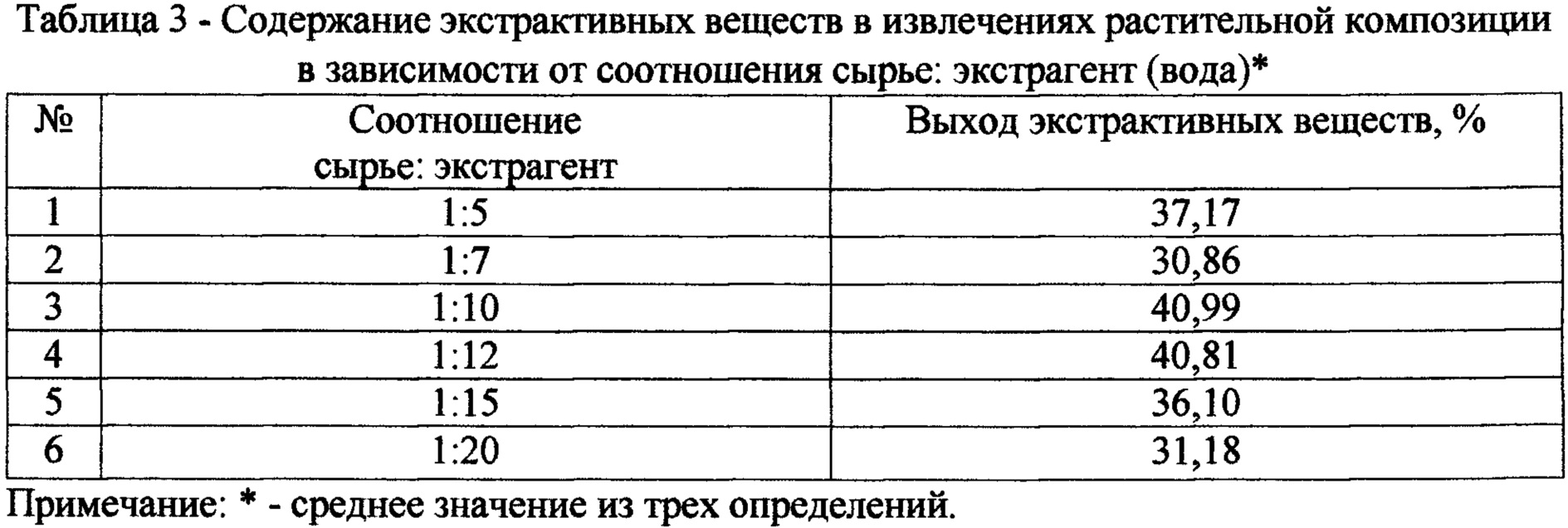
Используя для экстракции 70% спирт и воду очищенную в различных соотношениях к количеству сырья 1:5, 1:7, 1:10, 1:12, 1:15, 1:20, получили соответствующие выходы экстрактивных веществ (табл. 2, 3). Полученные данные свидетельствуют о том, что при соотношении сырья и экстрагента 1:10 и выше количество экстрагируемых веществ примерно одинаково, в этой связи нерационально увеличение объема экстрагента.

Как известно, степень измельчения растительного материала является важным фактором повышения выхода действующих веществ и интенсификации процесса экстрагирования. На основании экспериментальных данных (табл. 4, 5) для растительной композиции выбрана степень измельчения 1 мм, которая обеспечивает максимальный выход суммы экстрактивных веществ. Дальнейшее уменьшение размера частиц приводит к затруднению процесса фильтрации, а увеличение размера частиц ведет к уменьшению выхода суммы экстрактивных веществ.


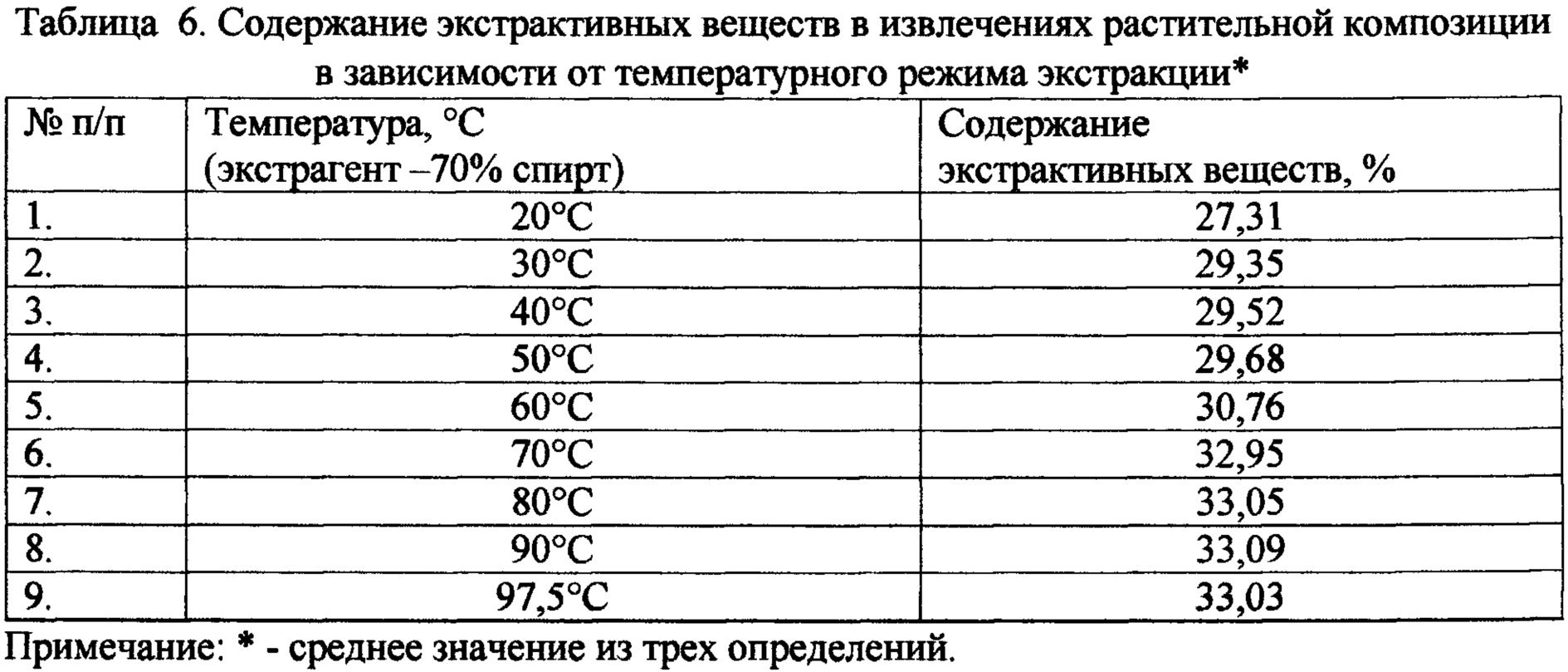
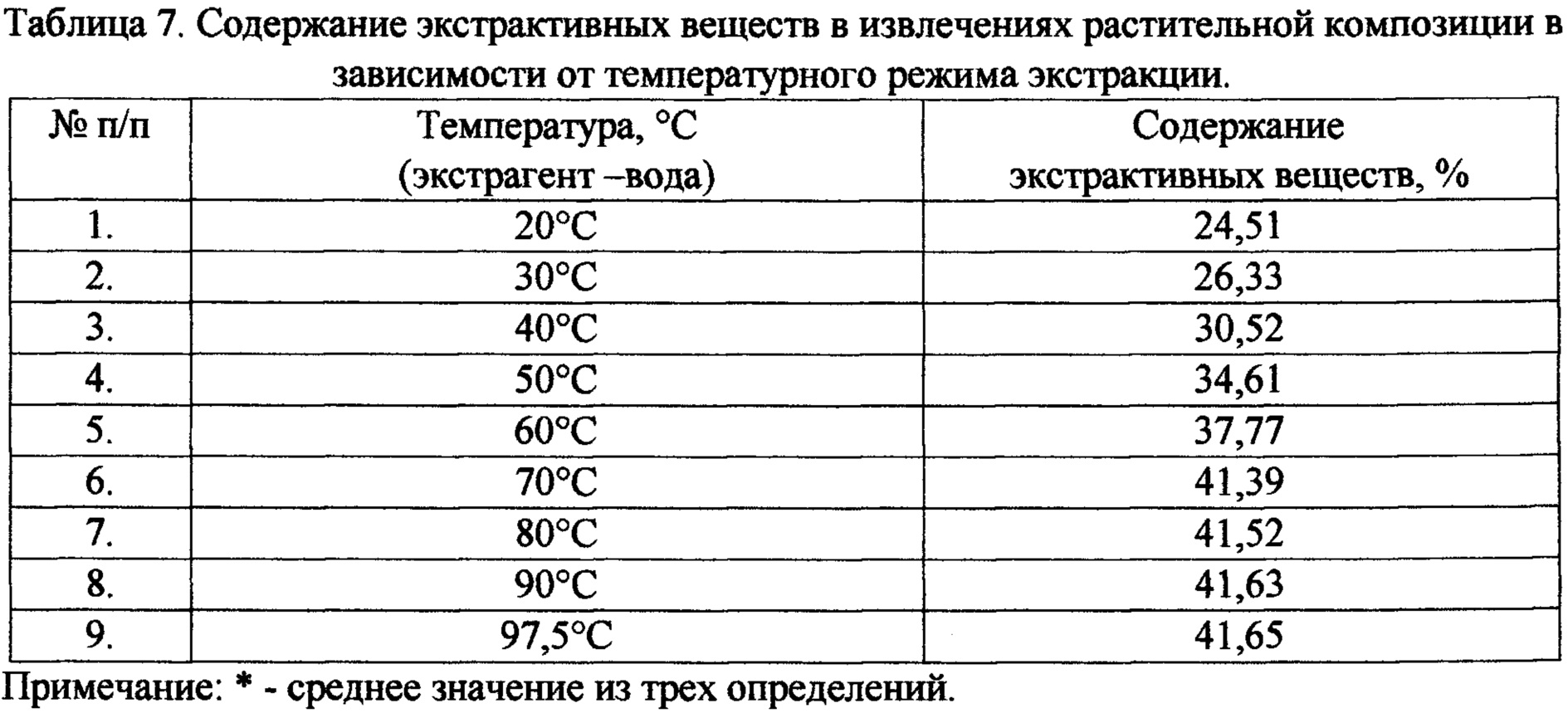
Изучено влияние температурного режима на выход суммы экстрактивных веществ (табл. 6, 7). Полученные результаты свидетельствуют о том, что с увеличением температуры повышается выход экстрактивных веществ и выбрана оптимальная температура 70°С. Использование слишком высоких температур увеличивает энергозатратность производства готового продукта, поэтому для интенсификации процесса экстракции и рационального использования сырья можно дополнительно использовать перемешивание и оптимизировать время и кратность экстракции.
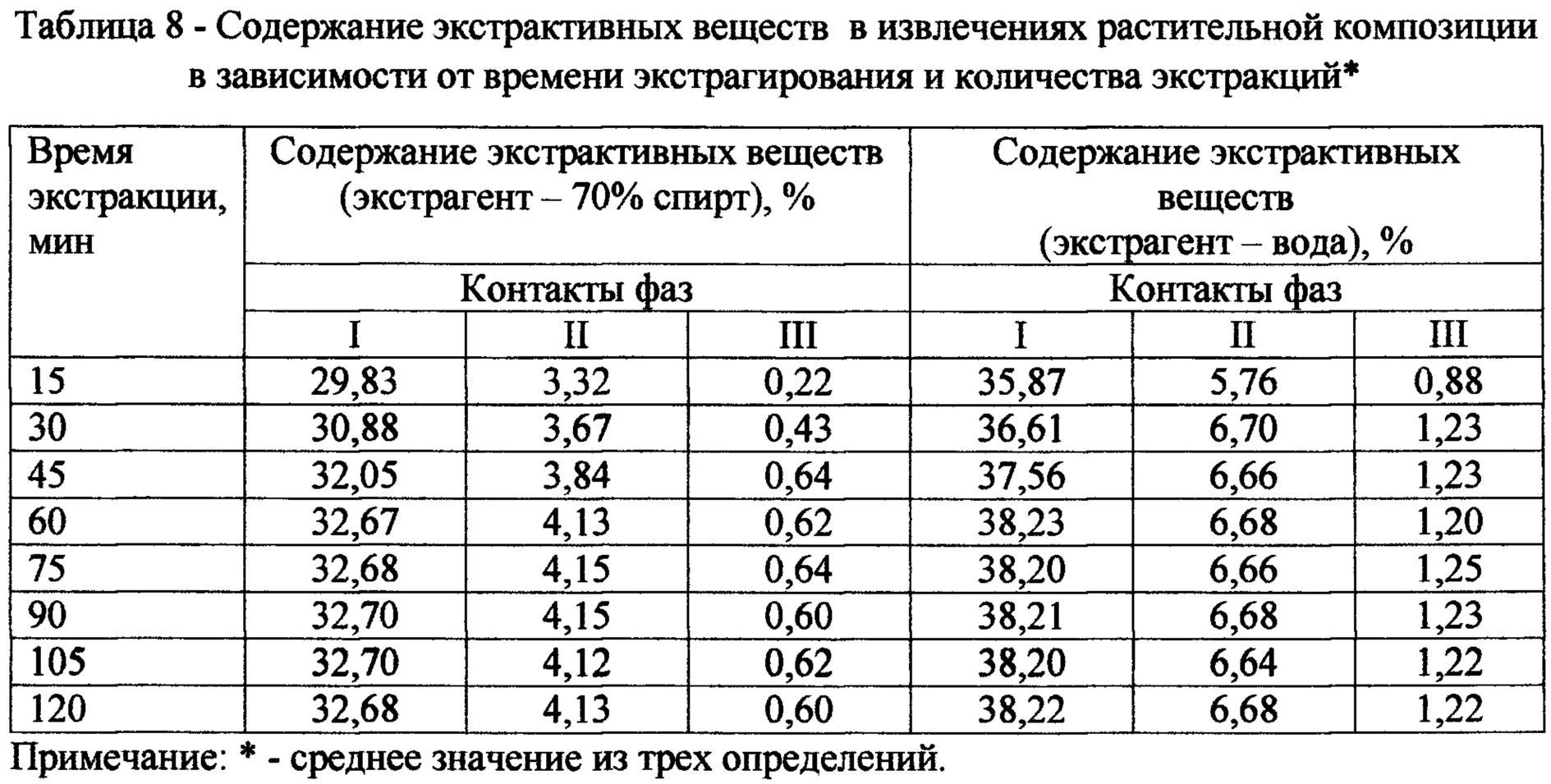
С целью определения продолжительности и кратности числа экстракций изучено время наступления равновесной концентрации в системе «сырье-экстрагент». Для этого проводили 3-хкратную 2-хчасовую экстракцию измельченной растительной композиции 70% спиртом/водой в соотношении 1:10 на водяной бане при температуре 70°С. Через заданные промежутки времени (15, 30, 45, 60, 75, 90, 105, 120 мин.) извлечения фильтровали (1-ый контакт фаз), определяя содержание суммы экстрактивных веществ. Аналогичным образом проводили две последующие экстракции отжатого сырья при том же промежутке времени, подавая каждый раз 70% спирт/воду в количестве, равном объему слитого извлечения (2-ой и 3-ий контакт фаз), полученный извлечения также анализировали на содержание экстрактивных веществ. Экспериментальные данные, представленные в таблице 8, свидетельствуют о том, что при использовании 70% спирта равновесное состояние во время I контакта фаз наступает через 60 минут, во время II -через 60 минут, при использовании воды во время I контакта фаз - через 60 минут, во время II - через 30 минут. Как видно из таблицы 8, 4-хкратная экстракция обеспечивает максимальный выход экстрактивных веществ. В качестве экстрагента мы рекомендуем использовать при 1-ом и 2 м контакте фаз - 70% спирт, при 3-ем и 4-ом контакте фаз -воду очищенную.
В результате проведенных исследований установлены оптимальные условия экстрагирования растительной композиции: экстрагент - 70% спирт и вода, его соотношение к количеству сырья - 1:10, температурный режим - 70°С, степень измельчения сбора - 1 мм. Время I экстракции - 1 час, II - 1 час, III - 1 час, IV - 30 минут.
Все подобранные оптимальные параметры процесса экстракции были положены в основу первой серии балансовых загрузок, на основании которой была разработана технологическая схема получения эстракта сухого из растительной композиции.
Способ получения иллюстрируется следующим примером: 1 кг растительной композиции следующего состава: шиповника плоды - 30%, кориандра посевного плоды -10%, ноготков лекарственных цветки - 25%, девясила корневища и корни - 25%, одуванчика корни - 10%, измельчают на мельнице до размера частиц диаметром 1 мм. Измельченное сырье загружают в экстракционный аппарат с мешалкой и внешним паровым обогревом. Заливают 10 л 70% спирта в соотношении сырье-экстрагент 1:10.
Экстрагируют при 70°С и постоянном перемешивании. Первый контакт фаз в течение 60 мин. Излечение фильтруют через серошинельное сукно в сборник. Проводят еще одну экстракцию в течение 60 мин, подавая в экстрактор 70% спирт в количестве, равном объему слитого. Проводят еще две экстракции в течение 60 мин и 30 мин, подавая в экстрактор воду очищенную в количестве, равному объему слитого. 1-й слив - 8,2 л; 2-й слив - 8,1 л; 3-й слив - 8,9 л; 4-й слив - 8,8 л. Водно-спиртовое извлечение после двух контактов фаз последовательно порциями упаривают прмерно до 1/3 первоначального объема. Водные извлечения после третьего и четвертого контактов фаз также упаривают до 1/3 объема. Объединеные кубовые остатки от четырех извлечений подвергают очистке сепарированием. Очищенный экстракт доупаривают до 1/5 первоначального объема и сушат на нержавеющих противнях в вакуумной сушилке при 65-70°С 8 ч. Получают 410,00 г готового продукта, что составляет 41,00% сухого экстракта от массы исходной растительной композиции. Сухой экстракт представляет собой аморфный порошок темно-коричневого цвета и со специфическим запахом, комкуется, потеря в массе при высушивании - 3,98%. Содержание суммы флавоноидов - 2,654%, суммы полисахаридов -21,754%.
Сравнительная характеристика заявляемого способа с выбранным прототипом представлена в табл. 8-14.
Определение антиоксидантной активности средства, обладающего антиоксидантной, гепатозащитной и желчегонной активностью.
Для оценки антиоксидантной активности определяли содержание малонового диальдегида (МДА) в гомогенате печени [26] и сыворотке крови [27]. Активность антиоксидантной системы (АОС) организма оценивали по активности каталазы в сыворотке крови [17], супероксиддисмутазы (СОД) - в плазме крови [32] и содержанию сульфгидрильных групп (SH-групп) в сыворотке крови животных [31]. В каждой группе по срокам наблюдений использовали от 8 до 10 животных. Исследования проводились при повреждении печени крыс этанолом и тетрахлорметаном (CCU). Препаратом сравнения был выбран Холосас.
Введение per os 40% этанолового спирта белым крысам вызывает активацию процессов свободнорадикального окисления (СРО) на 7 сутки наблюдения (табл. 8). Содержание МДА в гомогенате печени в контроле увеличивается на 32% и остается в последующие сроки (14-21 сутки) наблюдения на высоком уровне.
Курсовое введение средства, обладающего антиоксидантной, гепатозащитной и желчегонной активностью, уже на 7 сутки эксперимента в экспериментально-терапевтической дозе сопровождается достоверным снижением малонового диальдегида (МДА) в гомогенате печени, повышением активности ферментов АОС организма -каталазы и супероксиддисмутазы (СОД) в сыворотке крови крыс (табл. 9). Такая же тенденция сохраняется и в последующие сроки наблюдения (14-21 сутки).
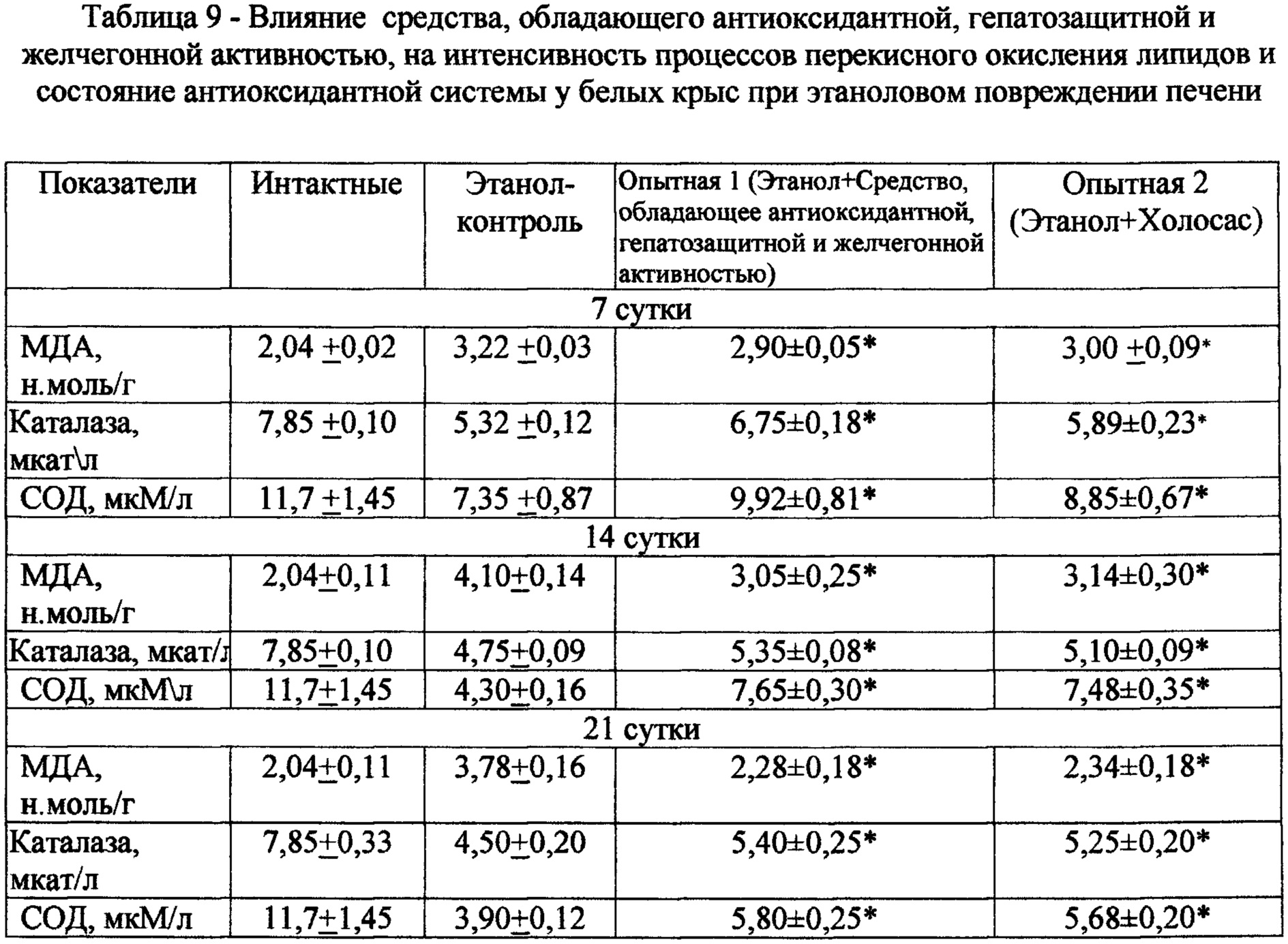
Таким образом, по результатам эксперимента выявлено, что антиоксидантное действие испытуемого экстракта проявляется в значительном снижении концентрации продуктов окисления (СРО) биомакромолекул, в частности МДА в гомогенате печени и повышением активности ферментов АОС: каталазы и СОД.
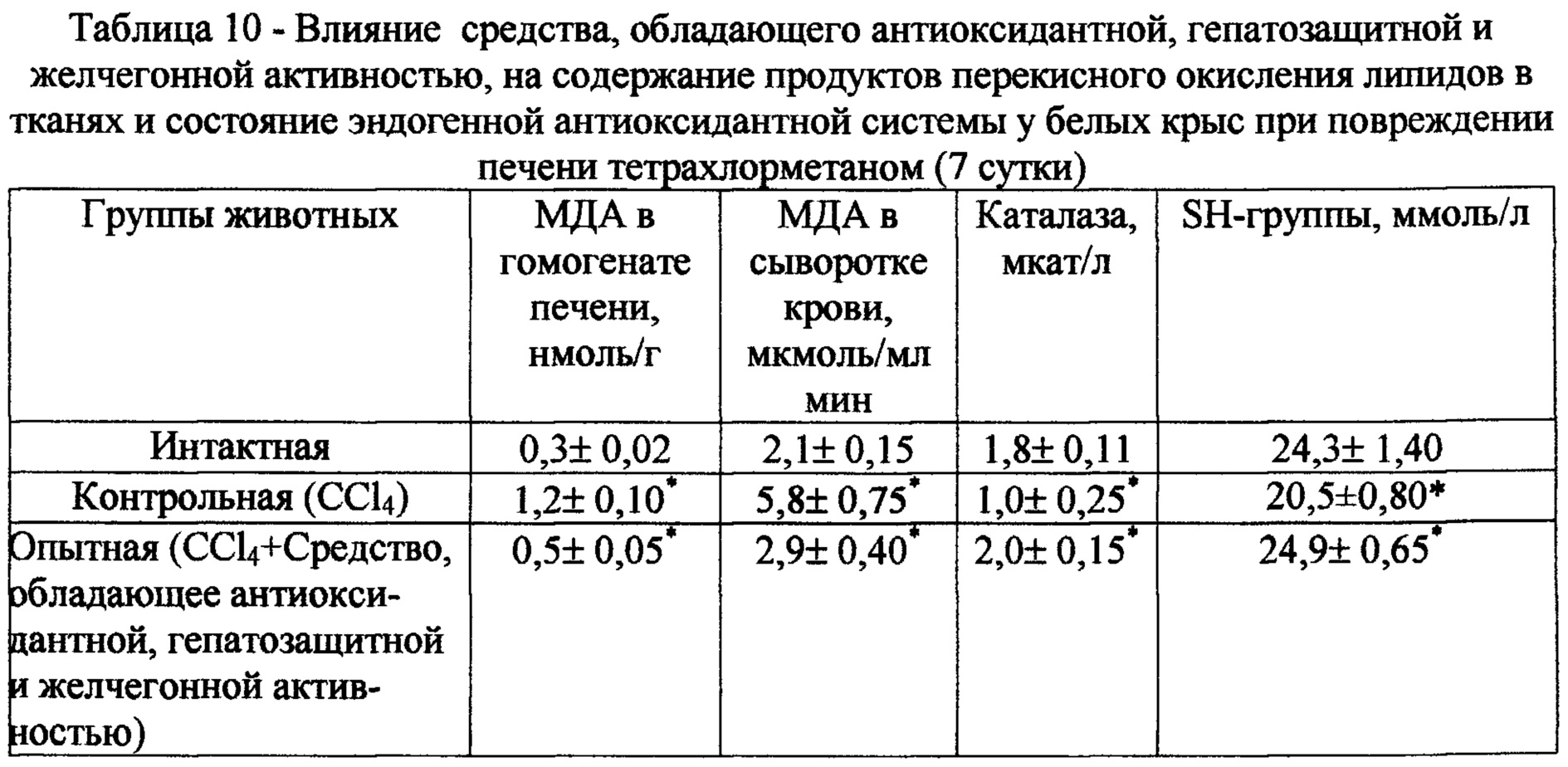
Как следует из таблицы 10, повреждение печени тетрахлорметаном вызывает резкую активацию процессов ПОЛ, о чем свидетельствуют повышение концентрации продуктов пероксидации липидов в тканях, а также угнетение активности эндогенной АОС животных контрольной группы. В частности, под влиянием ССЦ в сыворотке крови и в гомогенате печени отмечаются накопление одного из продуктов процесса ПОЛ-МДА, снижение активности каталазы и уменьшение концентрации сульфгидрильных групп в сыворотке крови крыс контрольной группы.
В ходе эксперимента установлено, что курсовое введение средства, обладающего антиоксидантной, гепатозащитной и желчегонной активностью, крысам при повреждении печени CCU сопровождается снижением интенсивности процессов ПОЛ. Так, на 7 сутки наблюдения концентрация МДА в гомогенате печени и в сыворотке крови животных этой группы снижается соответственно на 59% и 52% по сравнению с аналогичными показателями крыс контрольной группы. Одновременно с этим, под влиянием испытуемого экстракта отмечается повышение активности АОС: активность каталазы возрастает в 2 раза, а содержание SH-rpyrm в сыворотке крови повышается на 20% по сравнению с таковыми у крыс контрольной группы (табл. 10).
Определение гепатозащитного влияния средства, обладающего антиоксидантной, гепатозащитной и желчегонной активностью
Для оценки гепатозащитного влияния испытуемого экстракта определяли биохимические показатели, характеризующие функциональное состояние печени лабораторных животных: активность аланинаминотрансферазы (АлТ), аспартатаминотрансферазы (АсТ), содержание общего билирубина, холестерина и р-липопротеидов, активность щелочной фосфатазы (ЩФ), показатели тимоловой пробы в сыворотке крови, которые проводили на автоматическом анализаторе Prestige 23i (США) с применением набора реактивов Liquick Cor-ALAT, Cor-ASAT, Cor-BIL, Cor-Chol, Cor-TIM, Cor-TOTAL PROTEIN, Cor-LIPOPROTEIN (Польша).
Введение per os 40 % этилового спирта крысам вызывает повреждение печени. Так, уже на 7 сутки эксперимента на фоне введения этанола в сыворотке крови у контрольной группы животных повышаются уровни активности АлТ и АсТ на 69% и 53% соответственно. Одновременно с этим отмечаются признаки холестаза - активность щелочной фосфатазы повышается в 2,5 раза, также нарушается липопротеидный профиль в крови (табл. 11). Повышение показателей тимоловой пробы на 28% указывает на развитие диспротеинемии. Такая же тенденция сохраняется и на 14-21 сутки эксперимента.
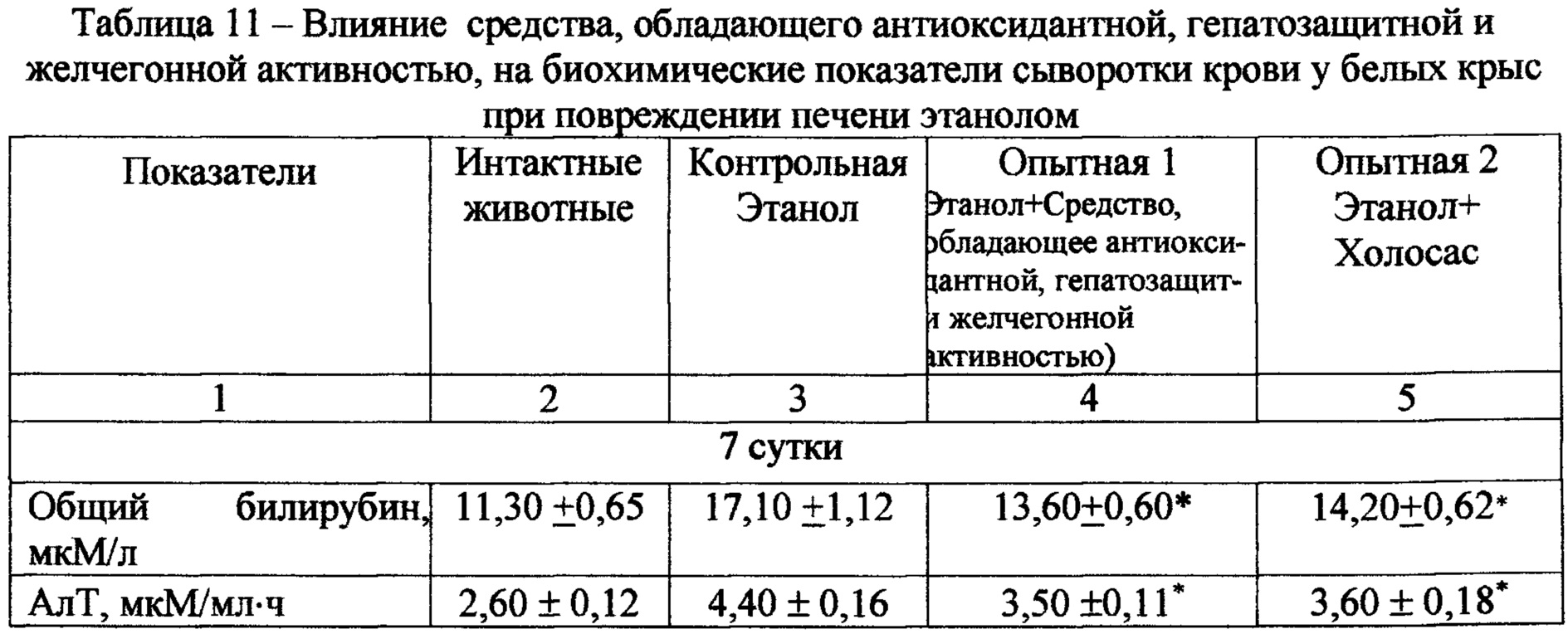
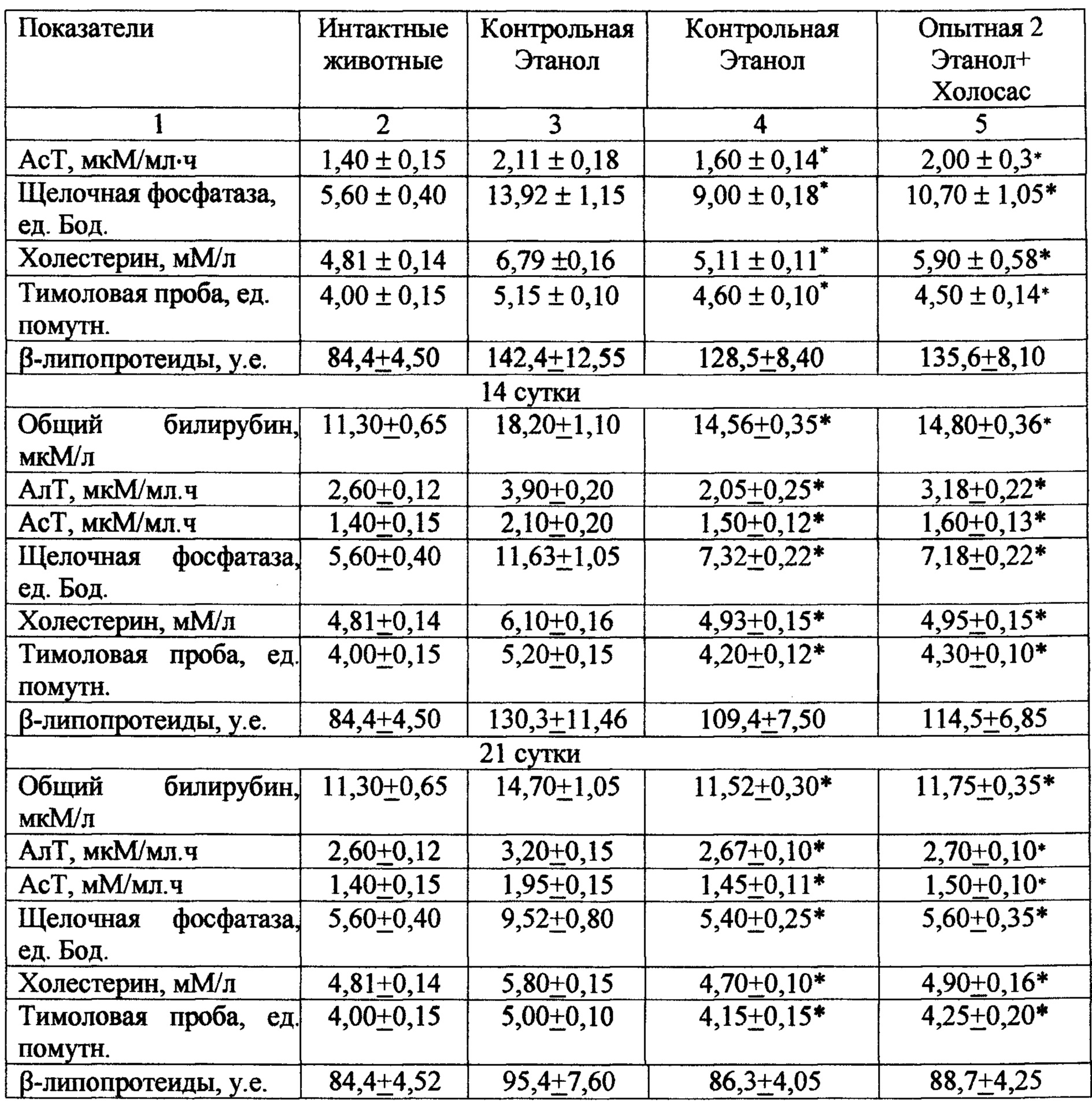
Курсовое введение испытуемого экстракта в дозе 50 мг/кг оказывало гепатозащитное действие, уменьшая выраженность нарушений функциональной состоятельности печени у животных опытной группы. Так, на 7 сутки эксперимента у животных, получавших испытуемый экстракт, отмечалось снижение активности АлТ, АсТ на 21%, 20% соответственно, уменьшение показателей тимоловой пробы на 19% и содержания общего билирубина в сыворотке крови на 20%. Кроме того, наблюдалось снижение активности щелочной фосфатазы на 34% и содержания холестерина на 25% по сравнению с соответствующими показателями в контрольной группе. На 14-21 сутки эксперимента отмечалась положительная динамика в течении патологического процесса у животных опытных групп (табл. 11).
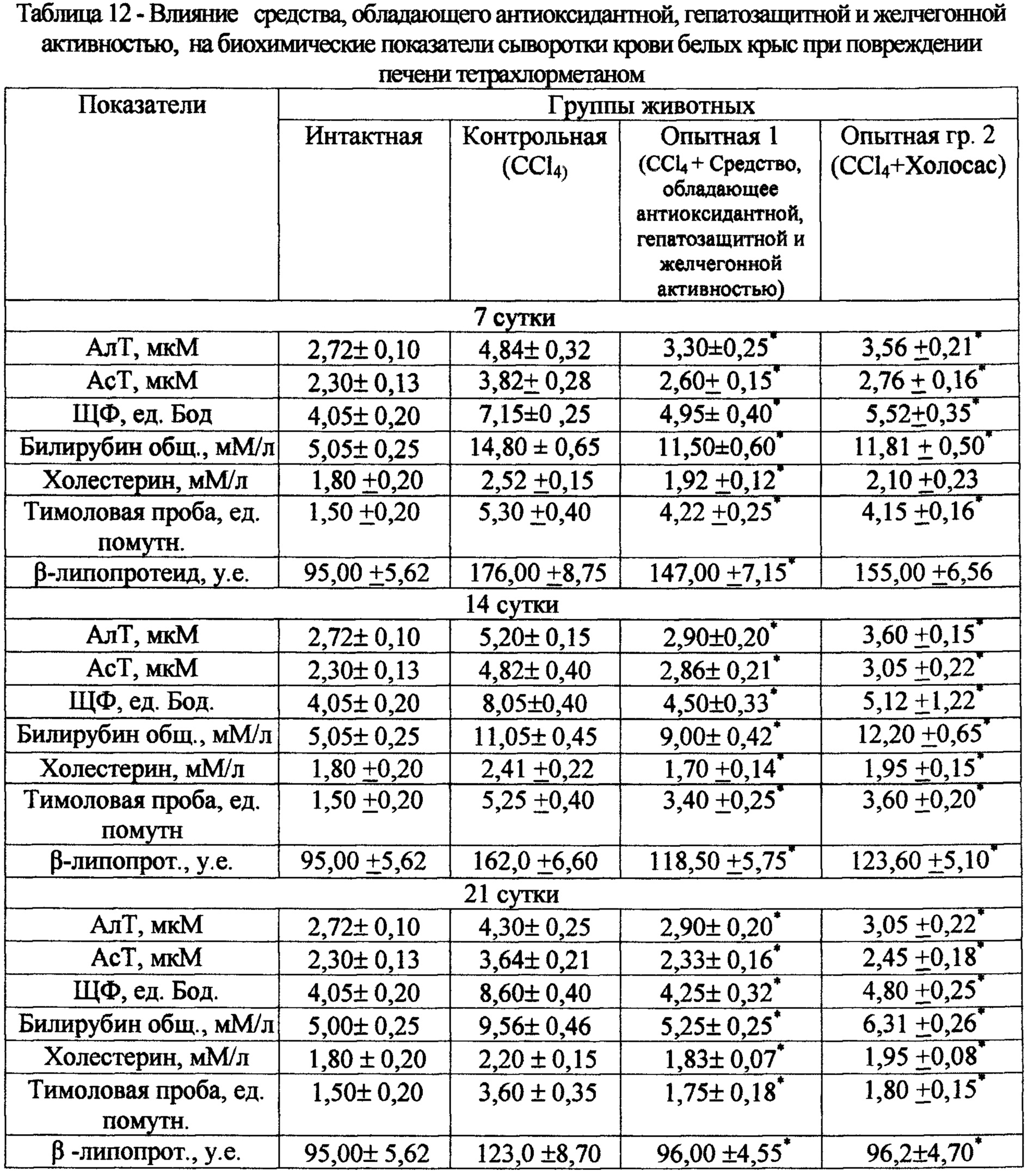
При курсовом введении испытуемого экстракта в дозе 50 мг/кг на 7 сутки при тетрахлорметановом повреждении печени активность АлТ и АсТ снижается по сравнению с контролем соответственно на 32% и 28%; активность щелочной фосфатазы и содержание билирубина в сыворотке крови уменьшаются в среднем на 32% и 23% по сравнению с показателями в контрольной группе (табл. 12). Показатели тимоловой пробы, содержание холестерина и р-липопротеидов снижаются на 21%, 24% и 18% соответственно, по сравнению с контролем. Такая же тенденция сохраняется и в последующие сроки наблюдения (14 и 21 сутки). При исследовании на 14 и 21 сутки эксперимента активность аминотрансфераз, показатели тимоловой пробы, общего билирубина у крыс опытной группы, получавших испытуемый экстракт, также были достоверно ниже, чем у животных контрольной группы. В контрольной группе к концу эксперимента остаются высокими показатели активности АлТ, АсТ, щелочной фосфатазы, содержания общего билирубина и уровня тимоловой пробы, что свидетельствует о продолжающемся патологическом процессе. Эффективность испытуемого экстракта по ряду показателей превосходила аналогичные показатели у препарата сравнения Холосаса.
Определение действия средства, обладающего антиоксидантной, гепатозащитной и желчегонной активностью, на желчеобразовательную и желчевыделительную функции печени
Действие экстракта сухого на желчеобразовательную и желчевыделительную функции печени у животных оценивали по общепринятой методике [22]. О выраженности желчегонной активности экстракта сухого судили по скорости секреции желчи, общему количеству выделенной желчи, концентрации желчных кислот в желчи [11], а также по количеству выделенных в каждой часовой порции желчи холестерина и билирубина. Концентрацию холестерина определяли по методу Дроговоз С.М. [5], билирубина - по методу Ван-ден-Берга в модификации Скакуна Н.П. [23].
Сравнение показателей холеретической реакции у крыс интактной и контрольной групп отражало холестатическое действие этанола, что проявлялось в снижении скорости секреции желчи, а также содержания в ней желчных кислот, билирубина и холестерина (табл. 13).
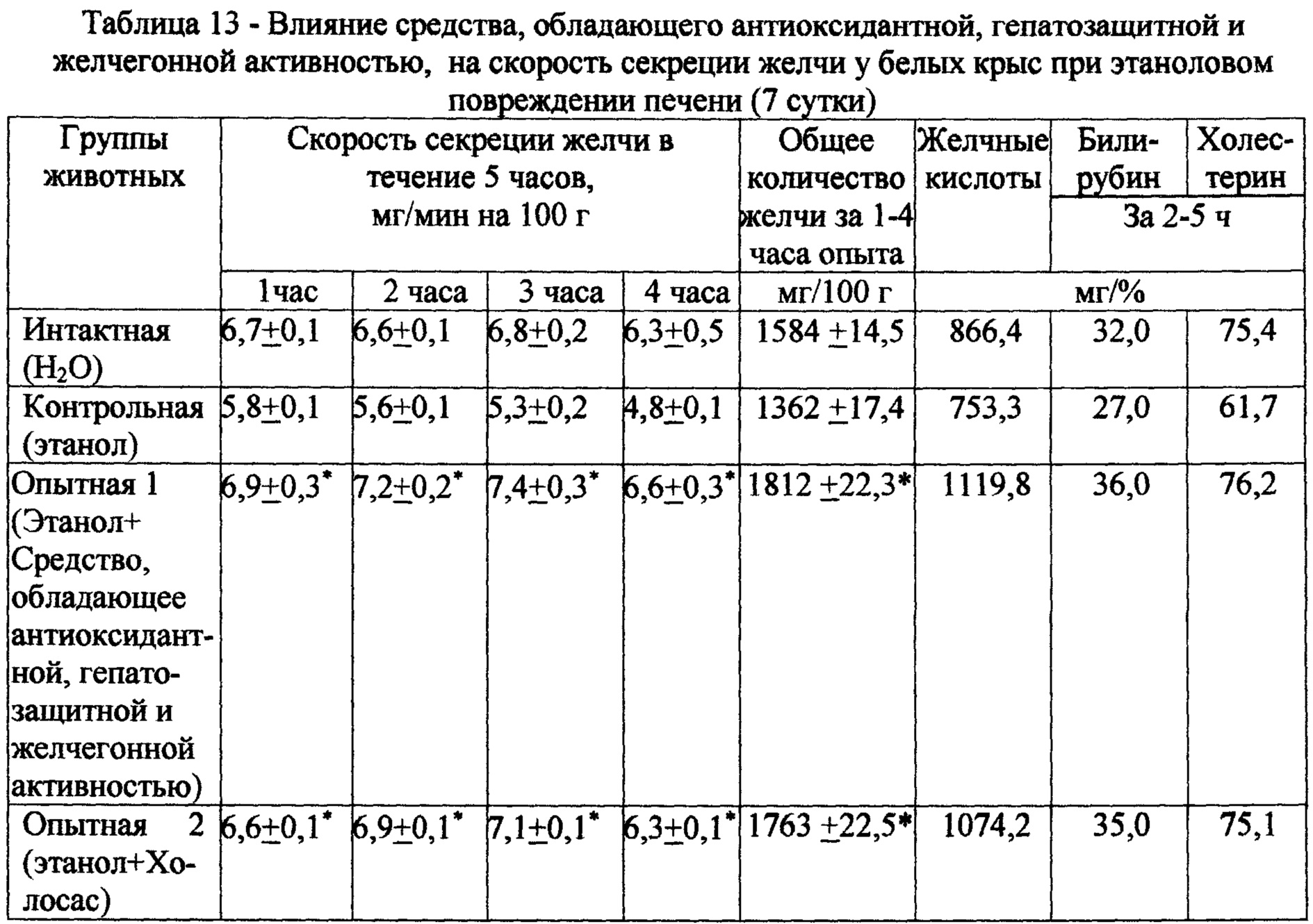
На фоне курсового введения испытуемого экстракта желчегонное действие проявлялось на ранних этапах развития этанолового повреждения печени и сопровождалось повышением общего количества выделенной желчи на 33% и увеличением концентрации желчных кислот в сецернируемой желчи на 48%. Скорость секреции желчи возрастала в среднем на 31% по сравнению с контролем. Введение испытуемого экстракта сопровождалось значительным увеличением уровня билирубина на 26%, а концентрация холестерина в желчи практически достигла уровня показателя у интактной группы. Из приведенных данных следует, что данный испытуемый экстракт в более выраженной степени, чем Холосас, стимулирует процессы желчеобразования.
Интоксикация тетрахлорметаном сопровождается выраженным нарушением секреторной функции печени крыс (табл. 14). Установлено, что курсовое введение животным испытуемого экстракта на 7 сутки опыта характеризуется умеренным желчегонным действием, с ускорением секреции желчи. Так, скорость секреции желчи возрастает в среднем на 22%, общее количество сецернируемой желчи повышается на 20%, при этом содержание в желчи желчных кислот, билирубина и холестерина повышается на 23%, 20% и 25%, соответственно, по сравнению с контролем.
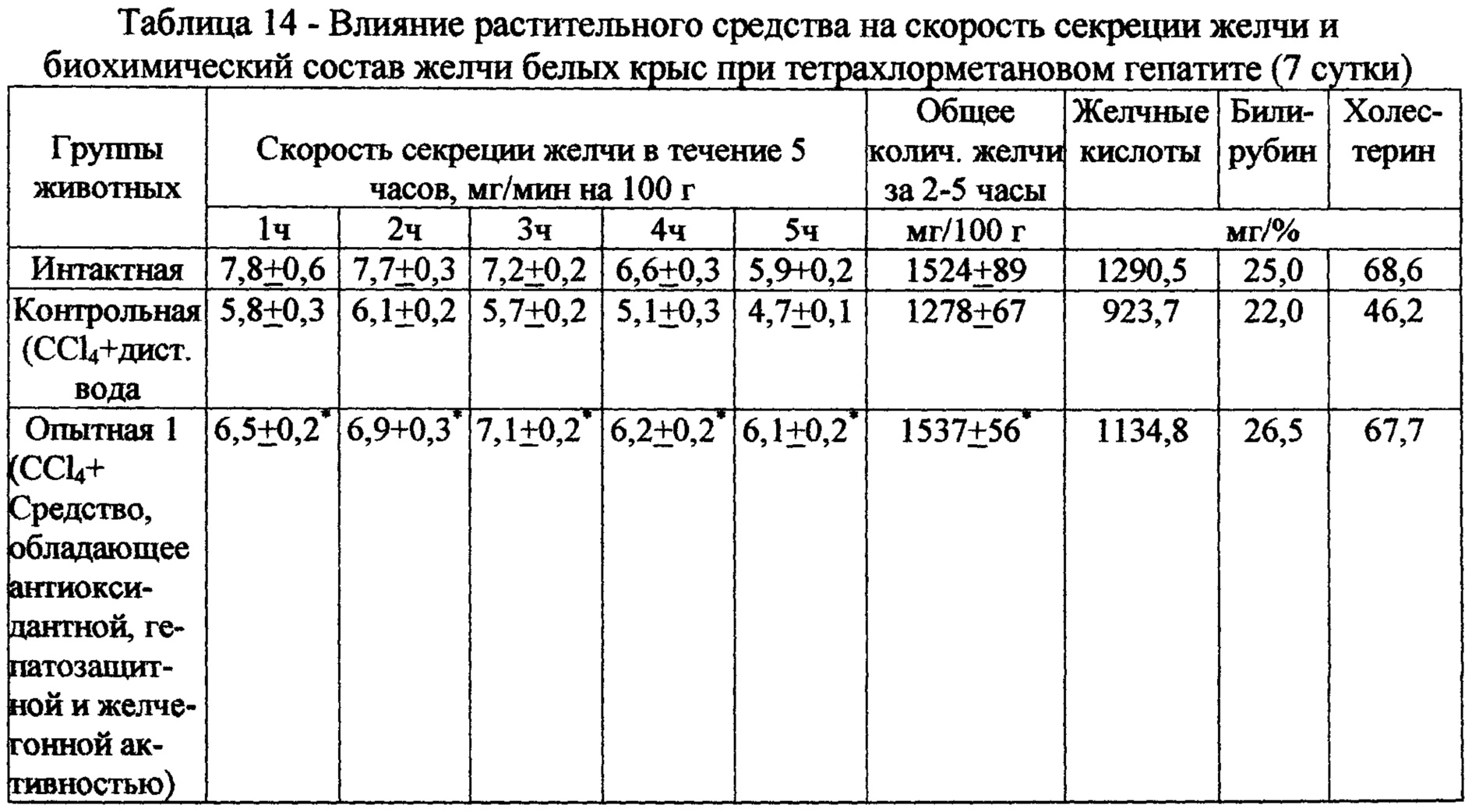
Таким образом, результаты исследований свидетельствуют о более выраженной антиоксидантной, гепатозащитной и желчегонной активности испытуемого экстракта при повреждении печени белых крыс этанолом и тетрахлорметаном в сравнении с Холосасом.
Список литературы
1. Абдурахманов, Д.Т. Хронический гепатит В и D / Д.Т. Абдурахманов. - М.: ГЭОТАР, 2010. - 286 с.
2. Авдеева, Е.В. Эффективность оксиникотиновой кислоты и ее производных в отношении функциональной активности гепатоцитов при острой токсической гепатопатии / Е.В. Авдеева, А.И. Конопля, Л.Н. Сернов // Патологическая физиология и экспериментальная терапия. - 2006. - №4. - С. 22-23.
3. Гепатопротекторы - антиоксиданты в терапии больных с хроническими диффузными заболеваниями печени / И.И. Дегтярева, И.Н. Скрыпник, А.В. Невойт и др. // Новые медицинские технологии. - 2002. - №6. - С. 18 - 23.
4. Грецкий С.В. Метод исчерпывающей экстракции из плодов шиповника собачьего / С.В. Грецкий, Л.А. Павлова. - Современные проблемы науки и образования, 2015. - 1 (Часть 1). Электр, журнал, 30.04.2015.
5. Дроговоз, С. М. Нарушение интенсивности желчеотделения и химического состава желчи при дистрофии печени, вызванной четыреххлористым углеродом / С.М. Дроговоз // Вопр. мед. химии. - 1971. - Т. 17, №4. - С. 397-400.
6. Желчегонные и гепатопротекторные свойства густого экстракта из плодов Rosa laxa (Rosaceae) / К. Шаушеков, К.Т. Омарова, Р.Н. Пак и др. // Растительные ресурсы. -2005. - Т. 41, Вып. 3. - С. 117 -124.
7. Ивашкин, В.Т. Гастроэнтерология. Национальное руководство / под редакцией В.Т. Ивашкина, Т.Л. Лапина. - М.: ГЭОТАР-Медиа, 2008. - 704 с.
8. Ивашкин, В.Т. Гастроэнтерология. Национальное руководство / под редакцией В.Т. Ивашкина, Т.Л. Лапина. - М.: ГЭОТАР-Медиа, 2008. - 704 с.
9. Ивашкин, В.Т. О состоянии организации медицинской помощи больным с заболеваниями органов пищеварения в Российской Федерации / В.Т. Ивашкин // РЖГТК. - 2004. - Т. 14, №3. - С. 4-8.
10. Игнатова, Т.М. Телапревир в лечении больных хроническим гепатитом С: вопросы безопасности / Т.М. Игнатова // РЖГТК. - 2012. - Т. 22, №4. - С. 47-57.
11. Карбач, Я.И. Количественное определение желчных кислот в желчи и крови с применением хроматографического метода / Я.И. Карбач // Биохимия. - 1961. - Т. 26, №2. - С. 305-307.
12. Корсун, В.Ф. Лекарственные растения в лечении болезней и оздоровлении населения Бурятии / В.Ф. Корсун, И.Э. Матханов, А.Г. Мондодоев. - Улан-Удэ: Издательство БНЦ, 2014. - 376 с.
13. Кьосев, П.А. Полный справочник лекарственных растений / П.А. Кьосев // М.: Медицина, 2002. - 883 с.
14. Лекарственные растительные средства в терапии повреждений гепатобилиарной системы / А.О. Занданов, Т.А. Ажунова, Т.А. Алексеева, С.М. Николаев. - Улан-Удэ: Изд-во БНЦ СО РАН, 2010. - 270 с.
15. Мазнев, Н.И. Лекарственные растения / Н.И. Мазнев. - М.: Медицина, 2006. - 852 с.
16. Максимов, В.А. Современная терапия заболеваний органов пищеварения / В.А. Максимов, К. К. Дамедович, А. Л. Чернышев. - М.: АдамантЪ, 2011. - 837 с.
17. Метод определения активности каталазы / М.А. Королюк, Л.И. Иванова, И.Г. Майорова, В.Е. Токарев В.Е // Лабораторное дело. - 1988. - №6. - С. 16-19.
18. Никитин, И.Г. Гепатопротекторы: миф и реальные возможности / И.Г. Никитин // Фарматека. - 2007. - №13 (147). - С. 14-18.
19. Николаев, С.М. Фармакотерапия и фитофармакопрофилактика заболеваний / С.М. Николаев // Улан-Удэ: Изд-во Бурят.гос. ун-та, 2012. - 285 с.
20. Оковитый, С.В. Клиническая фармакология гепатопротекторов / С.В. Оковитый, С.Н. Шуленин. - СПб.: Военно-мед. акад., 2006. - 80 с.
21. Практикум по фармакогнозии / В.Н. Ковалев, В.С. Попова, В.С. Кисличенко и др.; под ред. В.Н. Ковалева. - Харьков: Изд-во НфаУ; Золотые страницы, 2003. - 512 с.
22. Скакун, Н.П. Нейрогуморальный механизм желчегонного действия инсулина / Н.П. Скакун// Проблемы эндокринологии. - 1956. - №6. - С. 75-78.
23. Скакун, Н.П. Сравнительное действие атропина и метацина на внешнесекреторную функцию печени / Н.П. Скакун, А.Н. Олейник // Фармакология и токсикология. - 1967. - №3. - С. 334.
24. Соколов, С.Я. Справочник по лекарственным растениям // М, 2006. - 562 с.
25. Соколов, С.Я. Фитотерапия и фитофармакология / Соколов С.Я // Медицинское информационное агенство. - Москва, 2000. - 967 с.
26. Стальная, И.Д. Метод определения малонового диальдегида с помощью тиобарбитуровой кислоты / И.Д. Стальная, Т.Г. Гаришвили // Современные методы в биохимии. - М: Медицина, 1977. - С. 66-68.
27. Тарских, М.М. Промышленный мономер акриламид: взаимосвязь окислительного метаболизма, гепатотоксических эффектов и механизмов их развития / М.М. Тарских // Сиб. мед. журн. (Иркутск). - 2004. - Т. 45, №4. - С. 36-40.
28. Темирбулатов, Р.А. Метод повышения интенсивности свободнорадикального окисления липидсодержащих компонентов крови и его диагностическое значение / Р.А. Темирбулатов, Е.И. Селезнев // Лабораторное дело. - 1981. - №4. - С. 209-211.
29. Ткач, Т.А. Об исследованиях хофитола при гепатобилиарной патологии / Е.А. Ткач, Ю.И. Пожидаев // Практическая фитотерапия. - 2003, №1. - С. 20-23.
30. Ушкалова, Е. А. Проблемы применения гепатопротекторов / Е. А. Ушкалова // Фарматека. - 2004. - №6 (84). - С. 45-55.
31. Фармакотерапевтическое влияние «гепатофита» при экспериментальном гепатите / С.М. Николаев, З.Г. Самбуева, А.В. Цыренжапов, Г.В. Чехирова // Сиб. мед. журн. (Иркутск). - 2003. - Т. 39, №4. - С. 68 - 71.
32. Фоломеев, В.Ф. Количественное определение в тканях тиоловых и дисульфидных групп / В.Ф. Фоломеев // Лабораторное дело. - 1980. - №11. - С. 653-657.
33. Чевари, С. Роль супероксиддисмутазы в окислительных процессах клетки и метод определения ее в биологических материалах / С. Чевари, И. Чаба, И. Секей // Лабораторное дело. - 1985. - №11. - С. 678-681.
34. Чистов, В. И. Злокачественные новообразования в России в 2000 г/ В.И. Чистов, В.В. Старинский // Москва, 2002. - 87 с.
35. Яковлев, Г.П. Лекарственное сырье растительного и животного происхождения. Фармакогнозия: учебное пособие / под ред. Г.П. Яковлева. - СПб: СпецЛит., 2006. - 845 с.
36. Bartholomeusz, A. Antiviral drug resistanse: clinical consequences and molecular aspects / A. Bartholomeusz, S. A. Lokarnini // Semin. Liver Dis. - 2006. - Vol. 26, №2. - P. 162-170.
37. Denk, H. Drug-inducend liver ingjury / H. Denk // Verh. Dtsch. Ges. Pathol. - 2002. - Vol. 86. - P. 120-125.
38. High viral load is a risk factor for hepatocellular carcinoma in patients with chronic hepatitis В virus infection / K. Ohata, K. Hamasaki, K. Toriyama et al. // J. Gastroenterol. Hepatol. -2004. - Vol. 19, №6. - P. 670-675.
39. Iravani, Y. Antituberculosis drug related liver dysfunction hepatitis B,C and role of age as a risk factor / Y Iravani, M. Masjedi, M. Yasdanpanach // Int. J. Tuberc. Lung Dis. - 2001. - Vol. 5, №11.-Suppl. 1. - P. 118.
40. Israel, H.L. Perspective: preventive isoniazid therapy and the liver / H.L. Israel, J.E. Gottlieb, W.C. Maddrey // Chest. -1992. - Vol. 101, №5. - P. 1298-1302.
41. Kerr, W.C. Beverage-specific alcohol consumption and cirrhosis mortality in a group of English-speaking beer-drinking countries / W.C. Kerr, К.M. Fillmore, P. Marvy // Addiction. - 2003. - Vol. 95, №3. - P. 339-346.
42. Mauss. Hepatology / Mauss, Berg, Rockstroh // Flying Publisher.-USA.-2010.- 509 p.
43. Nishikimi, Biochem. Biophys. Res. Commun. - 1972. - Vol. 46, №2. - P. 849-854.
Способ получения средства, обладающего выраженной антиоксидантной, гепатозащитной и желчегонной активностью, для этого растительный материал, состоящий из измельченной до 1 мм растительной композиции (шиповника плоды - 30 частей, кориандра посевного плоды - 10 частей, ноготков лекарственных цветки - 25 частей, девясила корневища и корни - 25 частей, одуванчика корни - 10 частей), экстрагируют двухкратно 70% спиртом и двухкратно водой при температуре 70°С при отношении 1 мас. ч. сырья 10 об. ч. экстрагента, время первого, второго и третьего контакта фаз составляет по 60 минут, четвертого контакта фаз - 30 минут, далее объединенные водно-спиртовые извлечения фильтруют, упаривают, очищают сепарированием, доупаривают, затем высушивают в вакуум-сушильном аппарате.
