Результат интеллектуальной деятельности: КОМБИНИРОВАННОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ ПОКСВИРУСА, ЭКСПРЕССИРУЮЩЕГО ОПУХОЛЕВЫЙ АНТИГЕН, И АНТАГОНИСТА И/ИЛИ АГОНИСТА ИНГИБИТОРА ИМУННОЙ КОНТРОЛЬНОЙ ТОЧКИ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
[001] Изобретение относится к лечению рака с использованием рекомбинантных поксвирусов, кодирующих опухолевый антиген. Конкретнее, настоящее изобретение относится к лечению рака с использованием одного или более рекомбинантных поксвирусов, кодирующих опухолевый антиген, в комбинации с одним или более агонистами и/или антагонистами ингибитора иммунной контрольной точки.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
[002] Рекомбинантные поксвирусы использовались в качестве вакцин против инфекционных организмов, а в последнее время - против опухолей. Mastrangelo et al. J Clin Invest. 2000;105(8):1031-1034. Продемонстрирована эффективность представителей двух групп поксвирусов: авипоксвируса и ортопоксвируса при опухолевом процессе и возможность их применения для лечения рака.
[003] Показано, что один из типичных представителей рода авипоксвирусов, вирус оспы кур, может быть безопасной несущей средой лекарственной формы при введении человеку, в силу того, что вирус оспы кур входит в клетки млекопитающих и экспрессирует белки, а реплицируется безуспешно. Skinner et al. Expert Rev Vaccines. 2005 Feb;4(1):63-76. Кроме того, использование вируса оспы кур в качестве безопасной несущей среды лекарственной формы для экспрессии в настоящее время оценивается в многочисленных клинических исследованиях вакцины против рака, малярии, туберкулеза и СПИДа. Id.
[004] Продемонстрирована способность ортопоксвирусов быть пригодными векторами для введения антигенов пациентам с целью индукции иммунного ответа, направленного против антигена. Вирус осповакцины, наиболее известный из ортопоксвирусов, использовался для ликвидации оспы во всем мире и показал свою пригодность в качестве вектора и/или вакцины. Рекомбинантный вектор вируса осповакцины был разработан с целью экспрессии широкого спектра вставленных генов, в том числе некоторых генов, ассоциированных с опухолью, таких как p97, HER-2/neu, p53 и ETA (Paoletti, et al., 1993).
[005] Другой известный ортопоксвирус - это модифицированный вирус осповакцины Ankara (MVA). MVA состоит в родстве с вирусом осповакцины, представителем рода ортопоксвирусов, семейства Poxviridae. MVA был получен путем 516 последовательных пассажей штамма Ankara вируса осповакцины (CVA) на фибробластах куриных эмбрионов (для обзора см.Mayr, A., et al. Infection 3, 6-14 (1975)). В результате этих долгосрочных пассажей, в гене полученного вируса MVA удалены около 31 тысяч пар нуклеотидов геномной последовательности, и, следовательно, было продемонстрировано, что в клетках птиц в качестве клеток хозяина, репликация вируса существенно ограничена (Meyer, H. et al., J. Gen. Virol. 72, 1031-1038 (1991)). Как было показано в различных моделях на животных, полученный MVA был значительно авирулентным (Mayr, A. & Danner, K., Dev. Biol. Stand. 41: 225-34 (1978)). Кроме того, этот штамм MVA исследовали в клинических испытаниях в качестве вакцины для иммунизации против оспы человека (Mayr et al., Zbl. Bakt. Hyg. I, Abt. Org. B 167, 375-390 (1987); Stickl et al., Dtsch. med. Wschr. 99, 2386-2392 (1974)).В этих исследованиях на людях MVA уменьшал вирулентность или инфекционность по сравнению с вакцинами на основе вируса осповакцины, вместе с тем MVA продолжал индуцировать достаточный специфический иммунный ответ.
[006] В последующие десятилетия MVA разрабатывали для использования в качестве вирусного вектора для экспрессии рекомбинантного гена или в качестве рекомбинантной вакцины (Sutter, G. et al., Vaccine 12: 1032-40 (1994)).
[007] Несмотря на то, что Mayr et al. в 1970-е годы продемонстрировал существенное аттенуирование и авирулентность MVA в организме человека и млекопитающих, некоторые исследователи сообщали, что MVA в клеточных линиях млекопитающих и человека аттенуированный не в полной мере, так как в этих клетках могла осуществляться остаточная репликация. (Blanchard et al., J Gen Virol 79, 1159-1167 (1998); Carroll & Moss, Virology 238, 198-211 (1997); Altenberger, U.S. Pat. No. 5,185,146; Ambrosini et al., J Neurosci Res 55(5), 569 (1999)). Предполагается, что результаты, представленные в этих публикациях, были получены с использованием различных известных штаммов MVA, так как используемые вирусы существенно отличаются по своим свойствам, особенно по динамике роста в различных клеточных линиях. Такая остаточная репликация является нежелательной по различным причинам, включая проблемы безопасности в связи с использованием в организме человека.
[008] Описаны штаммы MVA, имеющие улучшенные профили безопасности и используемые для разработки более безопасных продуктов, таких как вакцины или фармацевтические препараты. См. патент США № 6761893 и № 6193752. Такие штаммы способны к репродуктивной репликации в клетках и клеточных линиях, не относящихся к человеку, особенно в фибробластах куриных эмбрионов (CEF), но не способны к существенной репродуктивной репликации в некоторых клеточных линиях человека с доказанной возможностью репликацию с известными штаммами вируса осповакцины. Такие клеточные линии включают человеческую клеточную линию кератиноцитов - HaCat (Boukamp et al. J Cell Biol 106 (3): 761-71 (1988)), клеточную линию человеческой аденокарциномы шейки матки - HeLa (АТСС № CCL-2), клеточную линию почки человеческого эмбриона - 293 (ЕСАСС No. 85120602), и клеточную линию человеческой остеосаркомы кости - 143В (ЕСАСС № 91112502). Такие штаммы также не способны к существенной репродуктивной репликации in vivo, например, в некоторых линиях мышей, таких, как трансгенные мышиные модели AGR 129, которые имеют выраженный иммунодефицит и являются высоковосприимчивыми к реплицирующемуся вирусу. См. патент США № 6761893. Был описан один из таких штаммов MVA, именуемый «MVA-BN», его производные и рекомбинанты. См. патент США № 6761893 и № 6193752, которые включены в настоящий документ посредством ссылки.
[009] Как MVA, так и MVA-BN разработаны для использования в качестве вирусного вектора для экспрессии рекомбинантного гена или в качестве рекомбинантной вакцины. См., например, Sutter, G. et al., Vaccine 12: 1032-40 (1994), патент США. № 6761893 и №6193752.
[010] Некоторые подходы к иммунотерапии рака предусматривали вакцинацию антигенами, ассоциированными с опухолью. В некоторых случаях такие подходы предусматривали использование системы доставки для стимуляции иммунного ответа на антигены, ассоциированные с опухолью. В некоторых случаях такие системы доставки включали рекомбинантные вирусные векторы. См., например, Harrop et al., Front. Biosci. 11:804-817 (2006); Arlen et al., Semin. Oncol. 32:549-555 (2005); Liu et al., Proc. Natl. Acad. Sci. USA 101 (suppl. 2):14567-14571 (2004).
[011] HER-2 представляет собой антиген, ассоциированный с опухолью, который сверхэкспрессирован в опухолевых клетках многих пациентов с раком. Для генерации иммунного ответа, направленного против опухолевых клеток, экспрессирующих этот антиген, проводилась иммунизация различными полипептидами HER-2. См., например, Renard et al., J. Immunology 171:1588-1595 (2003); Mittendorf et al., Cancer 106:2309-2317 (2006).
[012] Продемонстрировано, что MVA, кодирующий антиген HER-2, MVA-BN-HER2, оказывает мощный противоопухолевый эффект в мышиной модели экспериментального легочного метастазирования, несмотря на среду с сильной опухоль-опосредованной иммуносупрессией, которая характеризуется высокой частотой регуляторных Т -клеток (Тreg) в легких. Mandl et al., Cancer Immunol Immunother (2012) 61:19-29. Сообщалось о выраженном индуцировании Th1-доминирующего HER-2-специфического антитела и Т-клеточного ответа рекомбинантным MVA. Id. Противоопухолевая активность характеризовалась повышенной инфильтрацией легких высокоактивированными HER-2-специфическими, CD8+CD11c+ T-клетками, и сопровождалась уменьшением частоты клеток Treg в легких, что приводило к значительному увеличению соотношения эффекторных Т-клеток к клеткам Тreg. Id.
[013] Также была продемонстрирована безопасность и нарушение толерантности MVA-BN-HER2 при применении в клинических исследованиях с участием людей в условиях метастазирования с целью индуцирования специфических Т- и В-клеточных реакции Guardino et al., Cancer Research: December 15, 2009; Volume 69, Issue 24, Supplement 3.
[014] Трастузумаб (Герцептин) представляет собой гуманизированное моноклональное антитело (mAb), нацеленное на внеклеточный домен HER2, с доказанной клинической эффективностью при лечении HER2-положительного рака молочной железы. Wang et al., Cancer Res. 2012 September 1; 72(17): 4417-4428. Тем не менее, значительное количество пациентов не отвечают на первичное лечение трастузумабом, а многие опухоли, чувствительные к трастузумабу, развивают резистентность после длительного лечения. Id.
[015] Ингибирующие рецепторы на иммунных клетках являются ключевыми регуляторами ускользания от иммунного ответа при раке. Woo et al., Cancer Res; 72(4); 917-27, 2011. Среди этих ингибирующих рецепторов, CTLA-4 (цитотоксический Т-лимфоцит-ассоциированный белок 4) служит в качестве доминантного «выключателя», в то время как другие рецепторы, такие как PD-1 (рецептор программированной смерти 1, CD279) и LAG-3 (ген активации лимфоцитов, CD223), вероятно, имеют более тонкие функции реостата. Id.
[016] CTLA-4 представляет собой иммунную молекулу контрольной точки, которая усиливает функции активированных Т-клеток. Mackiewicz, Wspolczesna onkol 2012; I6 (5):363-370. Моноклональное антитело (mAb) анти-CTLA4 может блокировать взаимодействие CTLA-4 с CD80/86, «выключить» механизм иммунной супрессии и запустить непрерывную стимуляцию Т-клеток с помощью DCs. Два mAb IgG, направленных против CTLA-4, ипилимумаб и тремелимумаб, изучались в клинических исследованиях у пациентов с меланомой. Вместе с тем, при лечении антителами анти-CTLA-4 отмечалась высокая частота иммуноопосредованных нежелательных явлений. Id.
[017] Другим человеческим mAb, модулирующим иммунную систему, является BMS-936558 (MDX-1106), направленное против рецептора смерти-1 (PD-1R), лиганд которого (PD-1L) может быть непосредственно экспрессирован на клетках меланомы. Id. PD-1R является представителем семейства костимуляторных молекул В7:CD28, которые регулируют активацию Т-клеток и толерантность, и, таким образом, анти-PD-1R может играть определенную роль в нарушении толерантности. Id.
[018] Включение пути D-1/PD-L1 приводит к ингибированию эффекторной функции Т-клеток, секреции цитокинов и пролиферации. Turnis et al., OncoImmunology 1:7, 1172-1174; 2012. Высокие уровни PD-1 ассоциируются с истощенными или хронически стимулированными Т-клетками. Id. Кроме того, увеличение экспрессии PD-1 коррелирует со снижением выживаемости у пациентов с раком. Id.
[019] В то время как эти недавние исследования показали, что экспрессия PD-1 может быть связана с показателями выживаемости при раке, в более ранних исследованиях с ингибированием PD-1 при лечении рака продемонстрирован широкий спектр нежелательных побочных эффектов. Mellman et al. Nature 2011; 480(7378): 480-489; см. также Chow, Am Soc Clin Oncol Educ Book, 2013, ʺExploring novel immune-related toxicities and endpoints with immune-checkpoint inhibitors in non-small cell lung cancerʺ.
[020] LAG-3 представляет собой отрицательную регуляторную молекулу, экспрессируемую при активации различных типов лимфоидных клеток. Id. LAG-3 необходим для оптимального функционирования как естественных, так и индуцированных иммуносупрессивных Treg клеток. Id.
[021] Комбинаторная блокада PD-1 и LAG-3 моноклональными антителами синергически ограничивала рост развившихся опухолей. Woo et al., Cancer Res; 72(4); 917-27, 2011. Несмотря на то, что комбинаторная иммунотерапия антителами анти-LAG-3/анти-PD-1 продемонстрировала эффективность при развившихся опухолях Sa1N и МС38, эта терапия не эффективна при развившихся опухолях В16. Id. Turnis et al. сообщили, что их исследование «освещает трудности в прогнозировании результатов комбинированного лечения». Turnis et al., OncoImmunology 1:7, 1172-1174; 2012.
[022] Сообщается, что индуцибельная костимуляторная молекула (ICOS) была высоко экспрессированной при различных опухолях, инфильтрированных Tregs, включая меланому и рак яичников. Faget et al., OncoImmunology 2:3, e23185; March 2013. Кроме того, было сообщено, что при карциноме молочной железы взаимодействие ICOSL/МСОН происходит при взаимодействии TA-Tregs с TA-PDCs. Id. Антагонистические антитела против ICOS использовались для ингибирования взаимодействия ICOS:ICOS-L и подавления пролиферации Treg, индуцированной pDC. WO 2012/131004. Антагонистическое антитело использовали в мышиной модели опухоли молочной железы с целью замедления прогрессирования опухоли. Id.
[023] Агонистическое антитело, направленное против ICOS было предложено в качестве пригодного для комбинации с блокирующим антителом анти-CTLA-4 и блокирующим антителом анти-PD-1 для лечения опухолей. WO 2011/041613.
[024] Существует явная существенная нереализованная медицинская потребность в дополнительных методах лечения рака, включая активные иммунотерапевтические воздействия и вакцины от рака. Во многих аспектах варианты реализации настоящего изобретения направлены на удовлетворение этих потребностей путем предоставления комбинированной терапии, которая дополняет и усовершенствует методы лечения рака, доступные в настоящее время.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[025] В одном общем аспекте настоящее изобретение относится к терапии, композиции и способам лечения пациентов с раком с использованием рекомбинантных поксвирусов, кодирующих по меньшей мере один опухолевый антиген, в комбинации с одним или более антагонистами или агонистами ингибитора иммунной контрольной точки.
[026] В более конкретном аспекте настоящее изобретение включает применение, способы и композиции, использующие комбинацию ортопоксвирусов и/или авипоксвирусов, экспрессирующих опухолевый антиген с одним или более комбинациями антагонистов PD-1, LAG-3 и/или агонистов ICOS.
[027] В одном варианте реализации настоящее изобретение включает терапевтическое средство для лечения пациента-человека, больного раком. Терапевтическое средство включает: (а) рекомбинантный ортопоксвирус, содержащий нуклеиновую кислоту, кодирующую полипептид по меньшей мере одного опухолевого антигена; и (b) по меньшей мере один из агентов: антагонист анти-PD-1, антагонист анти-LAG-3 или агонистанти-ICOS. Настоящим изобретением предполагается, что (a) и (b) вводят в виде комбинации.
[028] В другом варианте реализации настоящее изобретение относится к способу лечения пациента-человека с раком, причем указанный способ включает: (а) введение пациенту рекомбинантного ортопоксвируса, содержащего нуклеиновую кислоту, кодирующую полипептид по меньшей мере одного опухолевого антигена; и (b) введение пациенту по меньшей мере одного из агентов: антагониста анти-PD-1, антагониста анти-LAG-3 или агониста анти-ICOS.
[029] В еще одном варианте реализации изобретения терапевтическое средство и способ лечения пациента-человека с раком дополнительно включают рекомбинантный авипоксвирус, содержащий нуклеиновую кислоту, кодирующую полипептид по меньшей мере одного опухолевого антигена, и введение их пациенту-человеку с раком в комбинации по меньшей мере с одним из агентов: антагонистом анти-PD-1, антагонистом анти-LAG-3 или агонистом анти-ICOS.
[030] В еще одном варианте реализации изобретения терапевтическое средство и способ лечения пациента-человека с раком дополнительно включает два или более рекомбинантных ортопоксвирусов, содержащих нуклеиновую кислоту, кодирующую полипептид по меньшей мере одного опухолевого антигена, и введение их пациенту-человеку с раком в комбинации по меньшей мере с одним из агентов: антагонистом анти-PD-1, антагонистом анти-LAG-3 или агонистом анти-ICOS.
[031] В дополнительном варианте реализации настоящее изобретение включает лекарственное средство или композицию для применения в лечении пациента-человека с раком. Лекарственное средство или композиция содержит: (а) рекомбинантный ортопоксвирус, содержащий нуклеиновую кислоту, кодирующую полипептид по меньшей мере одного опухолевого антигена; и (b) по меньшей мере один из агентов: антагонист анти-PD-1, антагонист анти-LAG-3, или агонист анти-ICOS. В дополнительных вариантах реализации настоящего изобретения лекарственный препарат или композиция дополнительно включает: (а) рекомбинантный авипоксвирус, содержащий нуклеиновую кислоту, кодирующую полипептид по меньшей мере одного опухолевого антигена; и (b) по меньшей мере один из агентов: антагонист анти-PD-1, антагонист анти-LAG-3 или агониста анти-ICOS.
[032] В еще одном варианте реализации настоящее изобретение включает использование композиции в приготовлении фармацевтической композиции или лекарственного средства для лечения пациента-человека с раком, при этом композиция содержит: (а) рекомбинантный ортопоксвирус, содержащий нуклеиновую кислоту, кодирующую полипептид по меньшей мере одного опухолевого антигена; и (b) по меньшей мере один из агентов: антагонист анти-PD-1, антагонист анти-LAG-3 или агонист анти-ICOS. В дополнительных вариантах реализации настоящего изобретения лекарственный препарат или композиция дополнительно включает: (а) рекомбинантный авипоксвирус, содержащий нуклеиновую кислоту, кодирующую полипептид по меньшей мере одного опухолевого антигена; и (b) по меньшей мере один из агентов: антагонист анти-PD-1, антагонист анти-LAG-3 или агонист анти-ICOS.
[033] В некоторых вариантах реализации изобретения, как описано в настоящем документе, рекомбинантный ортопоксвирус выбирается из вируса осповакцины, модифицированного вируса осповакцины Ankara (MVA) и/или MVA-BN. В некоторых дополнительных вариантах реализации изобретения рекомбинантный авипоксвирус представляет собой вирус оспы кур.
[034] В некоторых вариантах реализации изобретения, как описано в настоящем документе, каждый из агентов: антагонист анти-PD-1, антагонист анти-LAG-3 и агонист анти-ICOS содержит антитело.
[035] В некоторых вариантах реализации изобретения, как описано в настоящем документе, по меньшей мере один опухолевый антиген, кодируемый рекомбинантным ортопоксвирусом и рекомбинантным авипоксвирусом, может быть выбран из антигена СЕА, MUC-1, PAP, PSA и HER-2. В предпочтительных вариантах реализации изобретения по меньшей мере один опухолевый антиген выбирается из РАР и PSA. В другом предпочтительном варианте реализации изобретения антиген по меньшей мере один опухолевый антиген выбирается из CEA и MUC-1. Еще в одном предпочтительном варианте реализации изобретения по меньшей мере один опухолевый антиген представляет собой антиген HER-2.
[036] В некоторых дополнительных вариантах реализации изобретения лечение пациента-человека с раком охватывает рак, выбранный из рака молочной железы, колоректального рака, рака легких, рака желудка, рака поджелудочной железы, рака предстательной железы, рака мочевого пузыря и/или рака яичников.
[037] Дополнительные цели и преимущества настоящего изобретения будут частично изложены в описании, которое следует, частично станут очевидны из описания или могут быть изучены посредством реализации настоящего изобретения на практике. Цели и преимущества настоящего изобретения будут реализованы и достигнуты посредством элементов и комбинаций, конкретно указанных в прилагаемой формуле изобретения.
[038] Следует понимать, что и предшествующее общее описание, и последующее подробное описание являются только иллюстративными и пояснительными и не ограничивают настоящего заявленного изобретения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[039] Прилагаемые графические материалы включены в настоящий документ, составляют его часть, иллюстрируют один или более вариантов реализации изобретения и вместе с описанием служат для объяснения принципов настоящего изобретения.
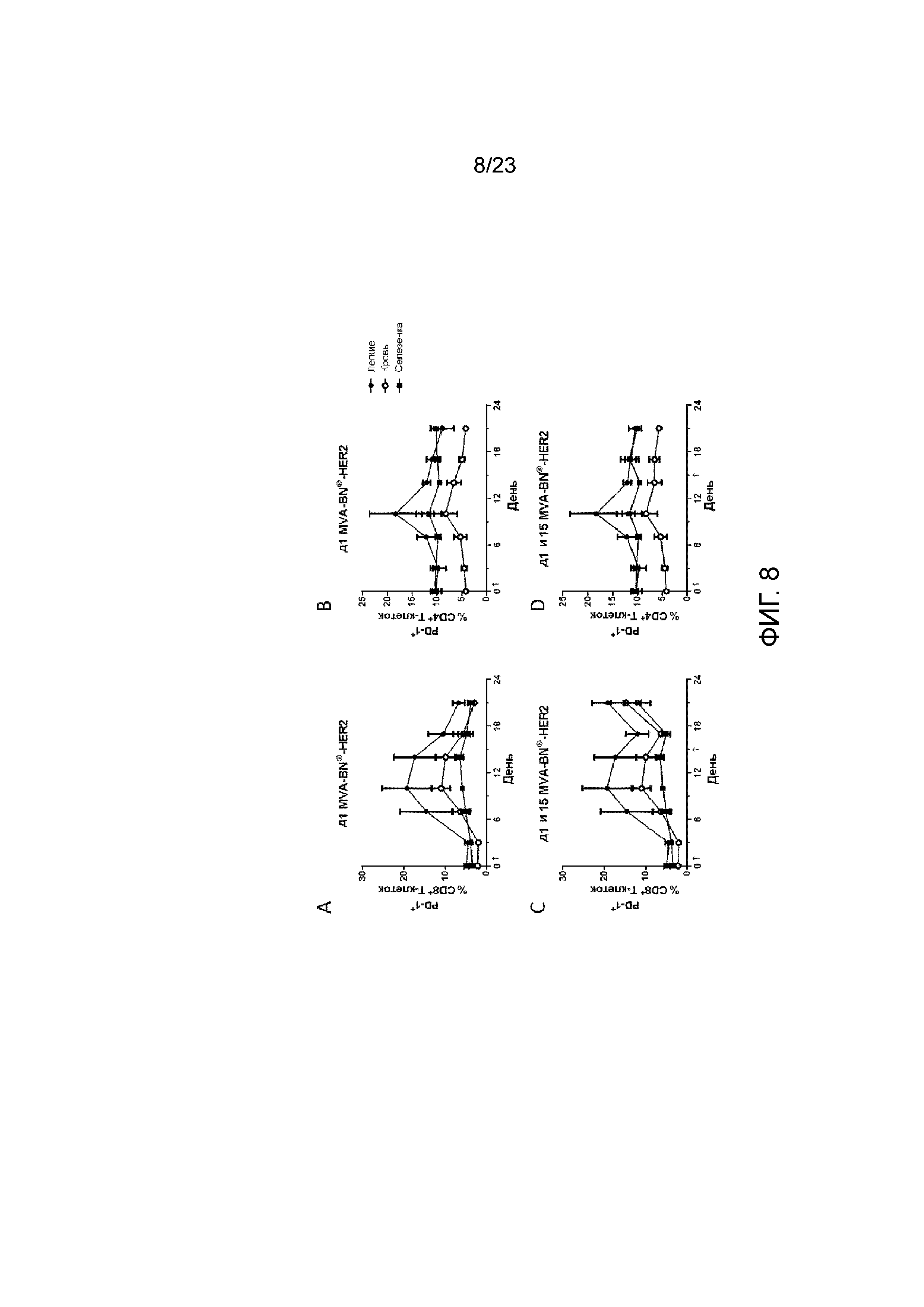
[040] Фигура 1. Демонстрирует экспрессию ICOS в легких, селезенке и крови на Т-клетках после лечения с применением MVA-BN-HER2. Наивные (без опухолей) мыши получали MVA-BN-HER2 в день 1 (А и В) или дни 1 и 15 (C и D). Экспрессия ICOS на CD8+ T-клетках (А и С) и CD4+ T-клетках (В и D). Данные представлены как средние значения ±СОС, три мыши на группу в каждый момент времени.
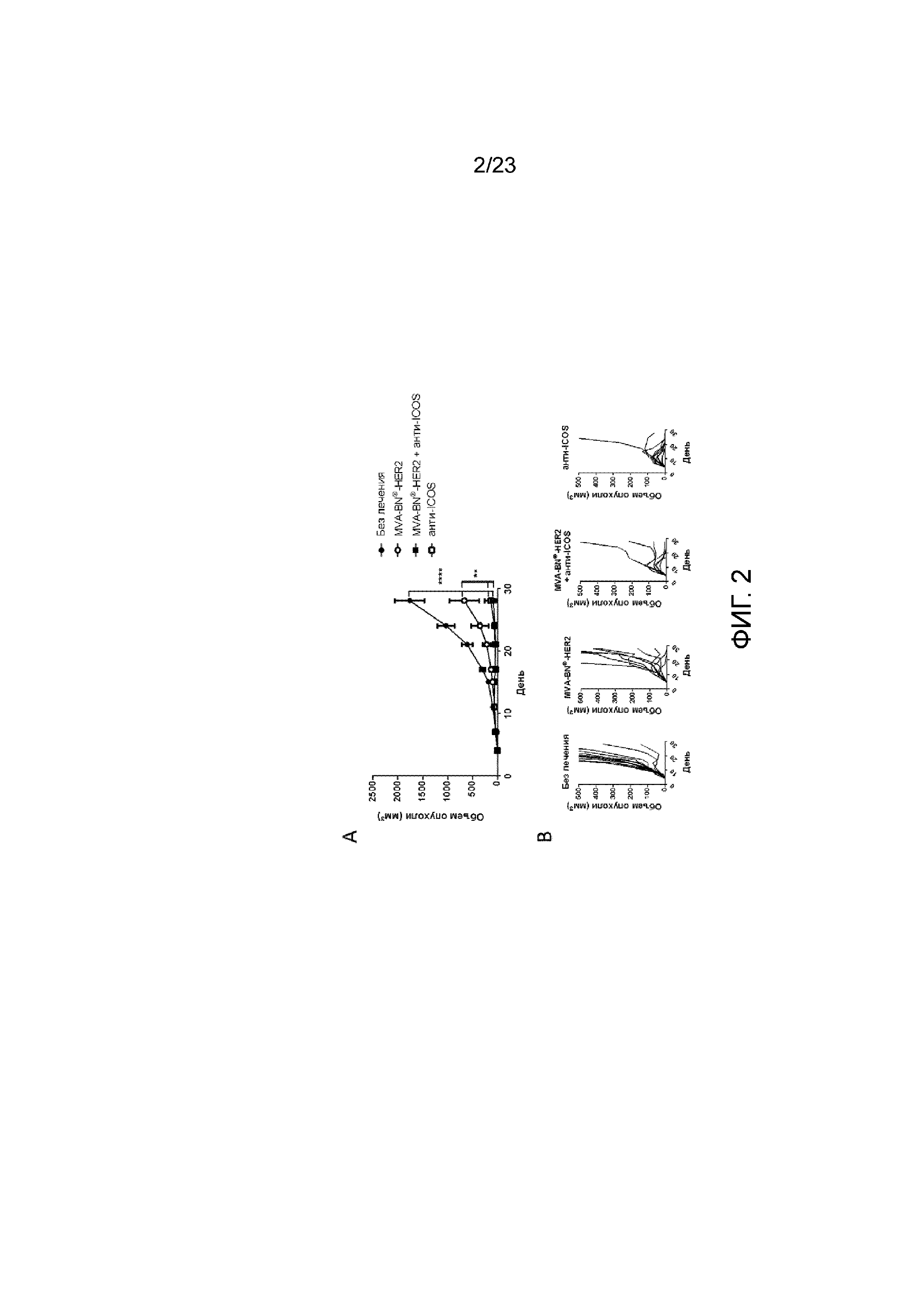
[041] Фигура 2. Демонстрирует объем опухоли после введения MVA-BN-HER2 в комбинации с агонистом анти-ICOS. Мыши с солидными опухолями CT26-HER-2 получали MVA-BN-HER2 в дни 1 и 15, и анти-ICOS в дни 1, 4, 8, 11, 15, 18, 22, 25 (i.p.). А) Средний рост опухоли. B) Рост опухоли у отдельных мышей.
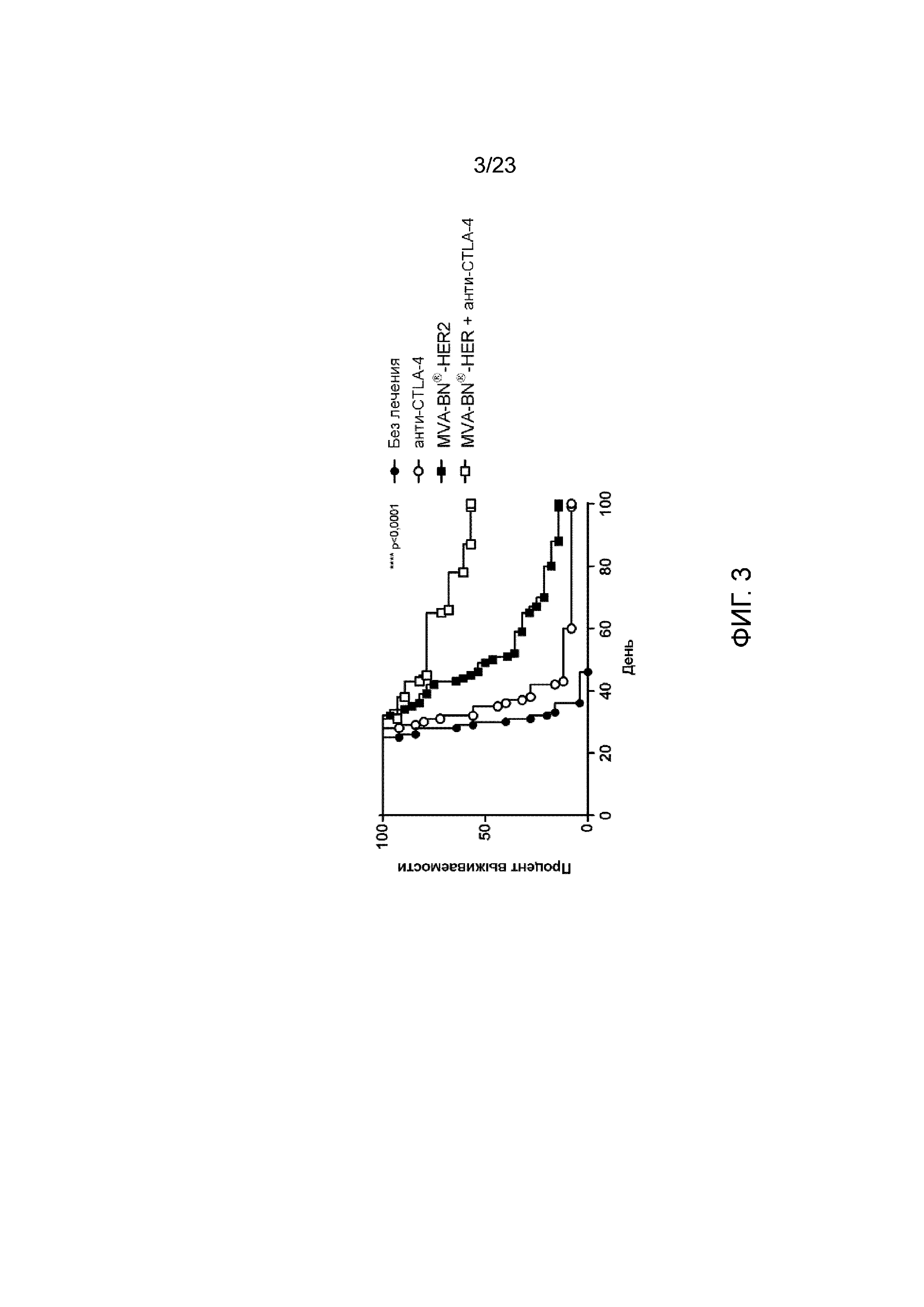
[042] Фигура 3. Демонстрирует синергитическое комбинирование MVA-BN-HER2 с анти-CTLA-4 с целью устранения опухоли и увеличения продолжительности жизни в экспериментальной модели легочных метастазов. Мыши с опухолями СТ26-HER-2 в легких получали MVA-BN-HER2 в дни 4 и 18, и анти-CTLA-4 в дни 3 и 17.
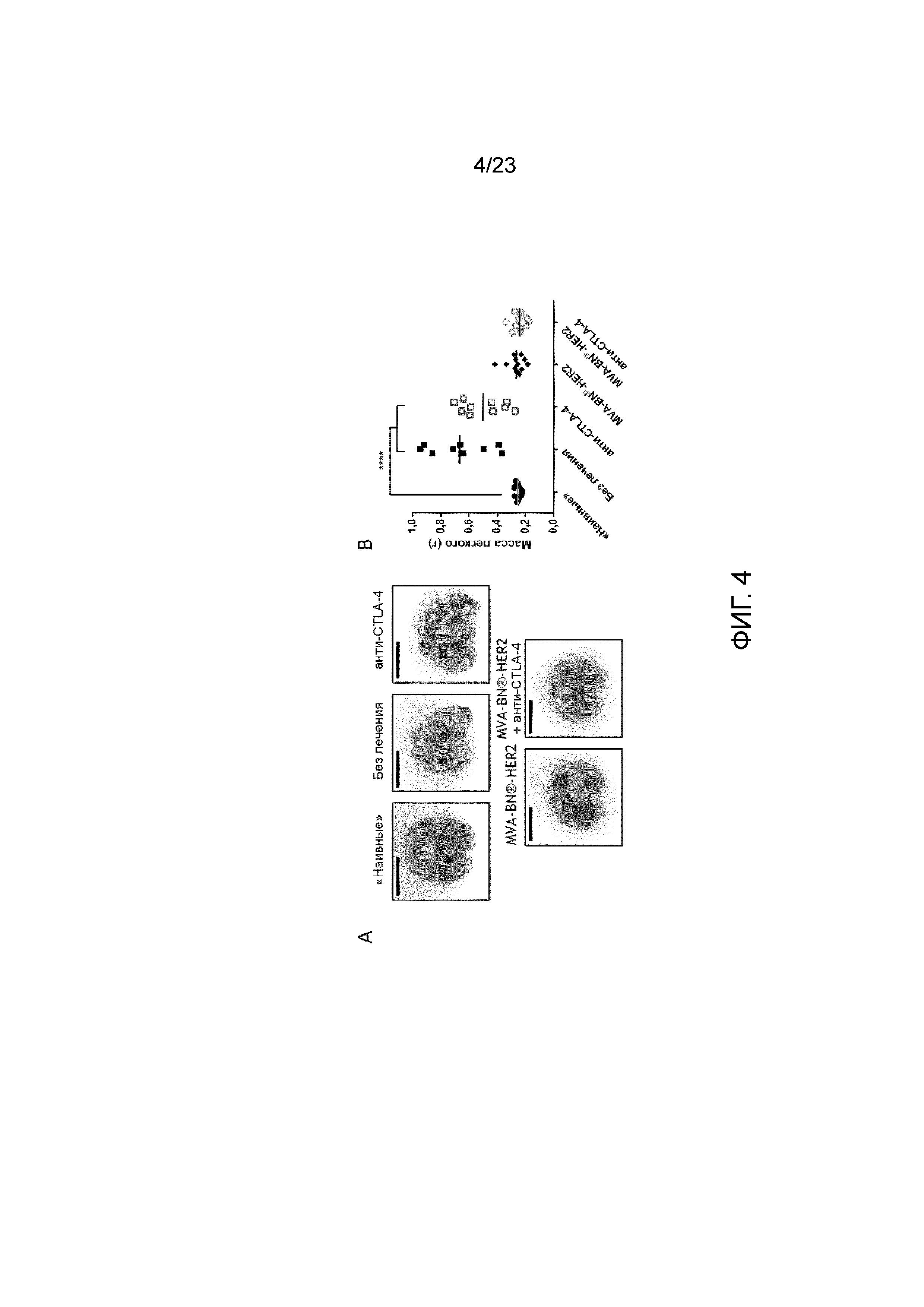
[043] Фигура 4. Демонстрирует, как MVA-BN-HER2 в качестве моноагента и в комбинации с анти-CTLA-4 уменьшает опухолевую нагрузку CT26-HER2 в легких через 25 дней после имплантации опухоли. Мыши с опухолями в легких СТ26-HER-2 получали MVA-BN-HER2 в дни 4 и 18, и анти-CTLA-4 в дни 3 и 17; опухолевую нагрузку анализировали в день 25. А) Представлены легкие из каждой группы: опухоли видны как небольшие массы в легких у мышей, не получающих лечения, и при прнменении анти-CTLA-4. Видимых опухолей у мышей, получающих MVA-BN-HER2, не было. Масштабная метка составляет 1 см. В) Вес легкого у мышей, получающих MVA-BN-HER2, в день 25 аналогичный наивным мышам, в то время как вес легкого у мышей, не получающих лечения, и при воздействии анти-CTLA-4, в день 25 определяется достоверно большим.
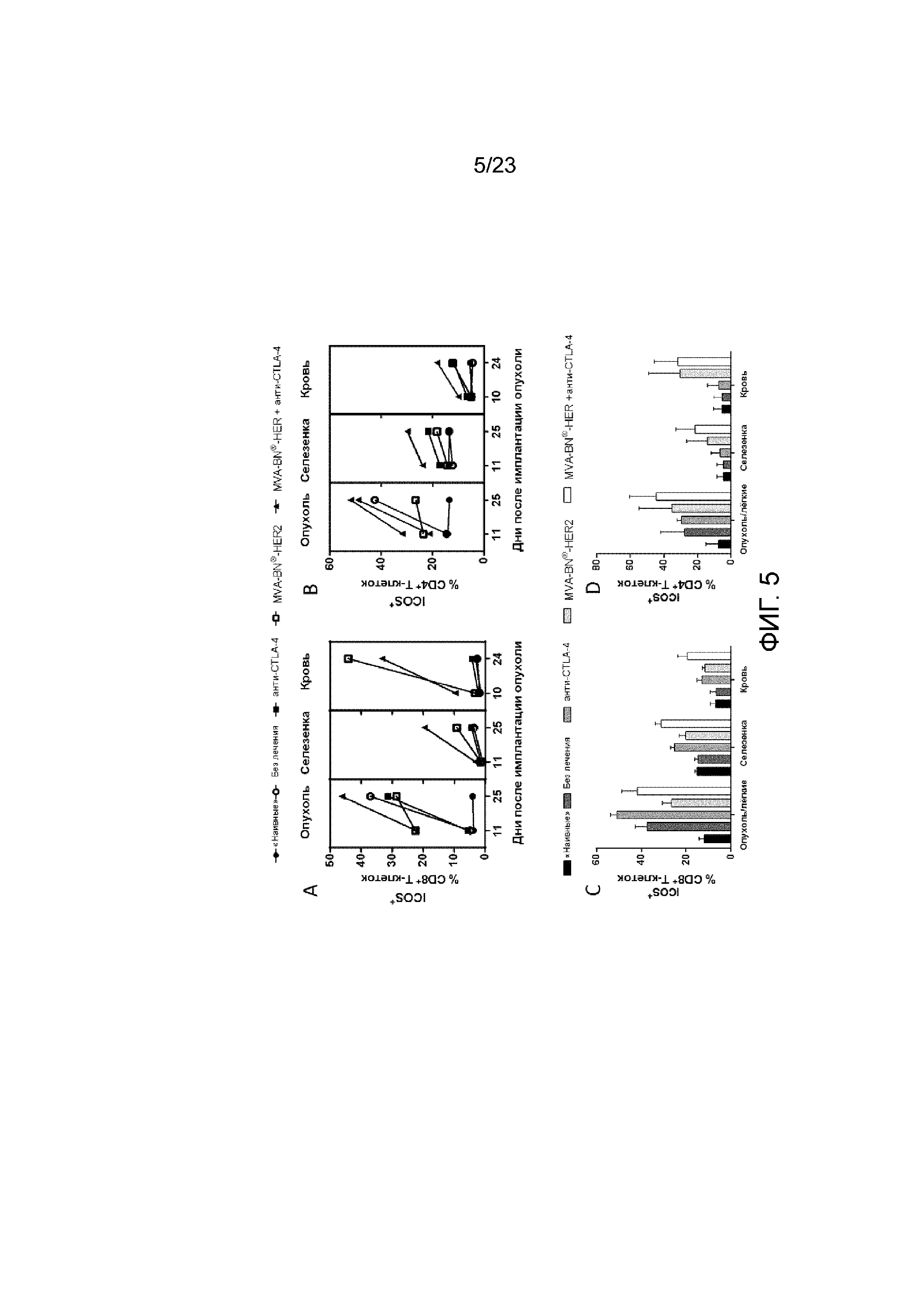
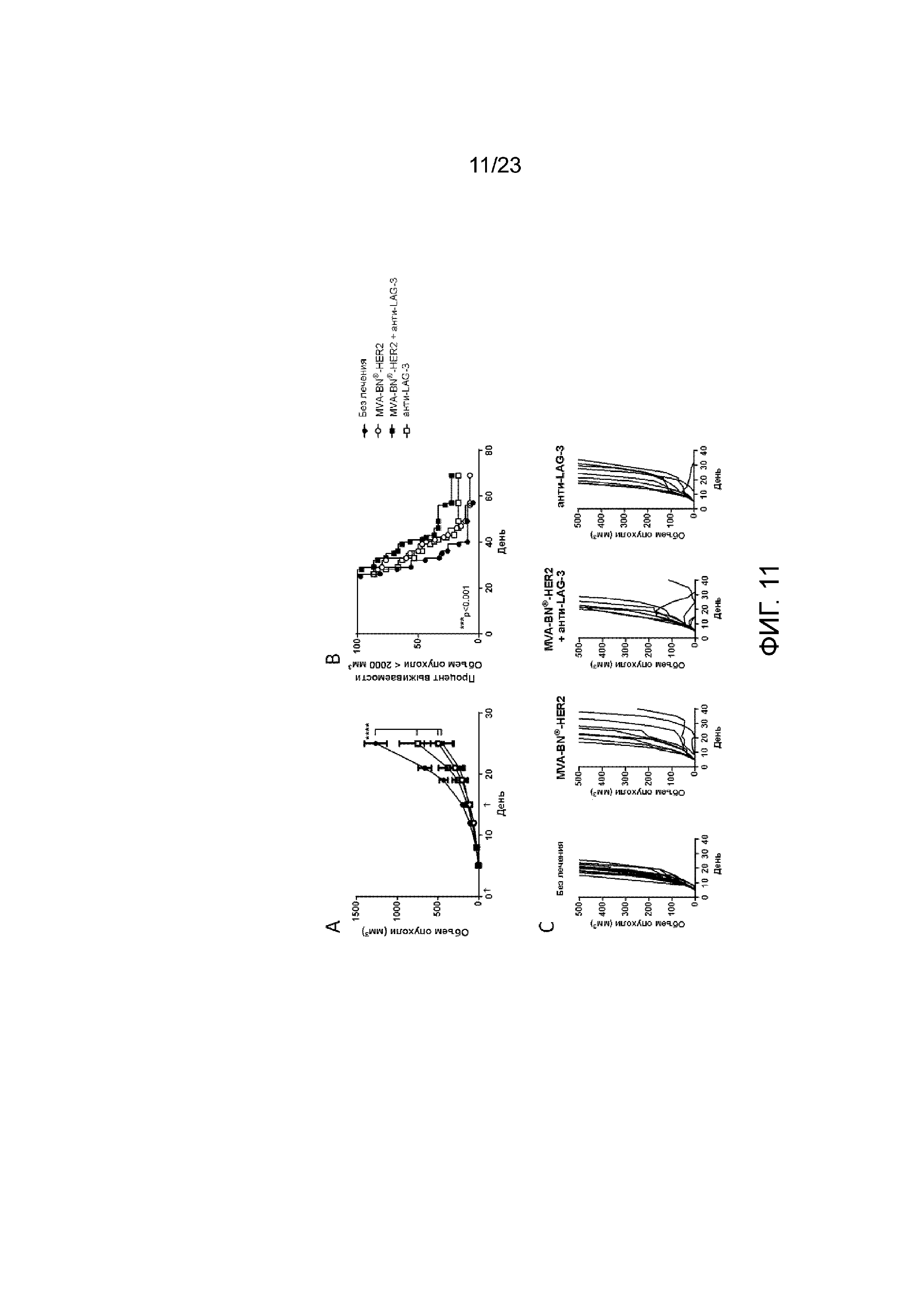
[044] Фигура 5. Демонстрирует увеличение экспрессии ICOS на Т-клетках из опухоли/легких и в периферических органах мышей, получающих MVA-BN-HER2, и в опухоли/легких мышей с высокой опухолевой нагрузкой. Мыши с опухолями СТ26-HER-2 в легких получали MVA-BN-HER2 в дни 4 и 18, и анти-CTLA-4 в дни 3 и 17. А) Экспрессия ICOS на CD4+ Т-клетках в день 11 и 25. Б) Экспрессия ICOS на CD8+ Т-клетках в день 11 и 25. C) Средняя экспрессия ICOS на CD4+ Т-клетках на день 25 из трех независимых экспериментов с 3-4 мышами на группу. D) Средняя экспрессия ICOS на CD8+ Т-клетках на день 25 из трех независимых экспериментов с 3-4 мышами на группу.
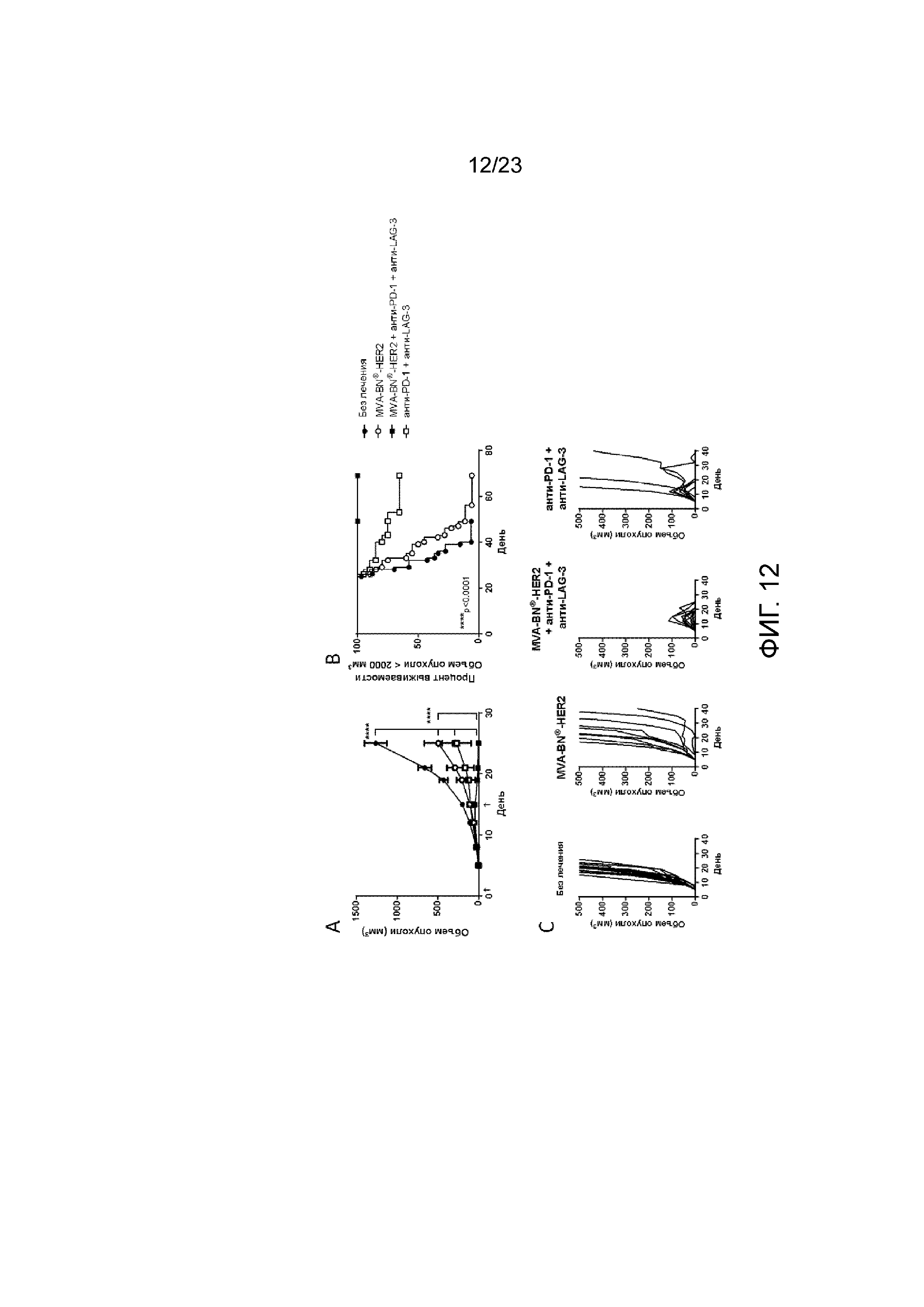
[045] Фигура 6. Демонстрирует то, что в мышей с опухолями ICOS+ CD4+ Т-клетки имеют приблизительно равные пропорции FoxP3+, но у мышей, отвечающих на лечение, первоначально определяется FoxP3-. Мыши с опухолями в легких СТ26-HER-2 получали MVA-BN-HER2 в дни 4 и 18, и анти-CTLA-4 в дни 3 и 17, а анализ FACS проводили в день 24 или 25 после имплантации опухоли. А) Экспрессия ICOS на FoxP3+ Tregs. В) Экспрессия ICOS на FoxP3- CD4 T-клетках. C) Средняя экспрессия ICOS на FoxP3+ Tregs из трех независимых экспериментов с 3-4 мышами на группу. D) Экспрессия ICOS на FoxP3- CD4 Т-клетках из трех независимых экспериментов с 3-4 мышами на группу.
[046] Фигура 7.Демонстрирует то, что применение MVA-BN-HER2 и комбинированное лечение с анти-CTLA-4 повышало соотношение эффекторных Т-клеток к регуляторным Т-клеткам. Мыши с опухолями в легких СТ26-HER-2 получали MVA-BN-HER2 в дни 4 и 18, и анти-CTLA-4 в дни 3 и 17, а анализ FACS проводили в день 24 или 25 после имплантации опухоли. А) Соотношение CD8 Teff:Treg (CD8+ICOS+FoxP3-/CD4+ICOS+FoxP3+)и В) соотношение CD4 Teff:Treg (CD4+ICOS+FoxP3-/CD4+ICOS+FoxP3 из одного эксперимента с 3-4 мышами на группу. С) Среднее соотношение CD8 Teff:Treg и D) Среднее соотношение CD4 Teff:Treg из трех независимых экспериментов с 3-4 мышами на группу.
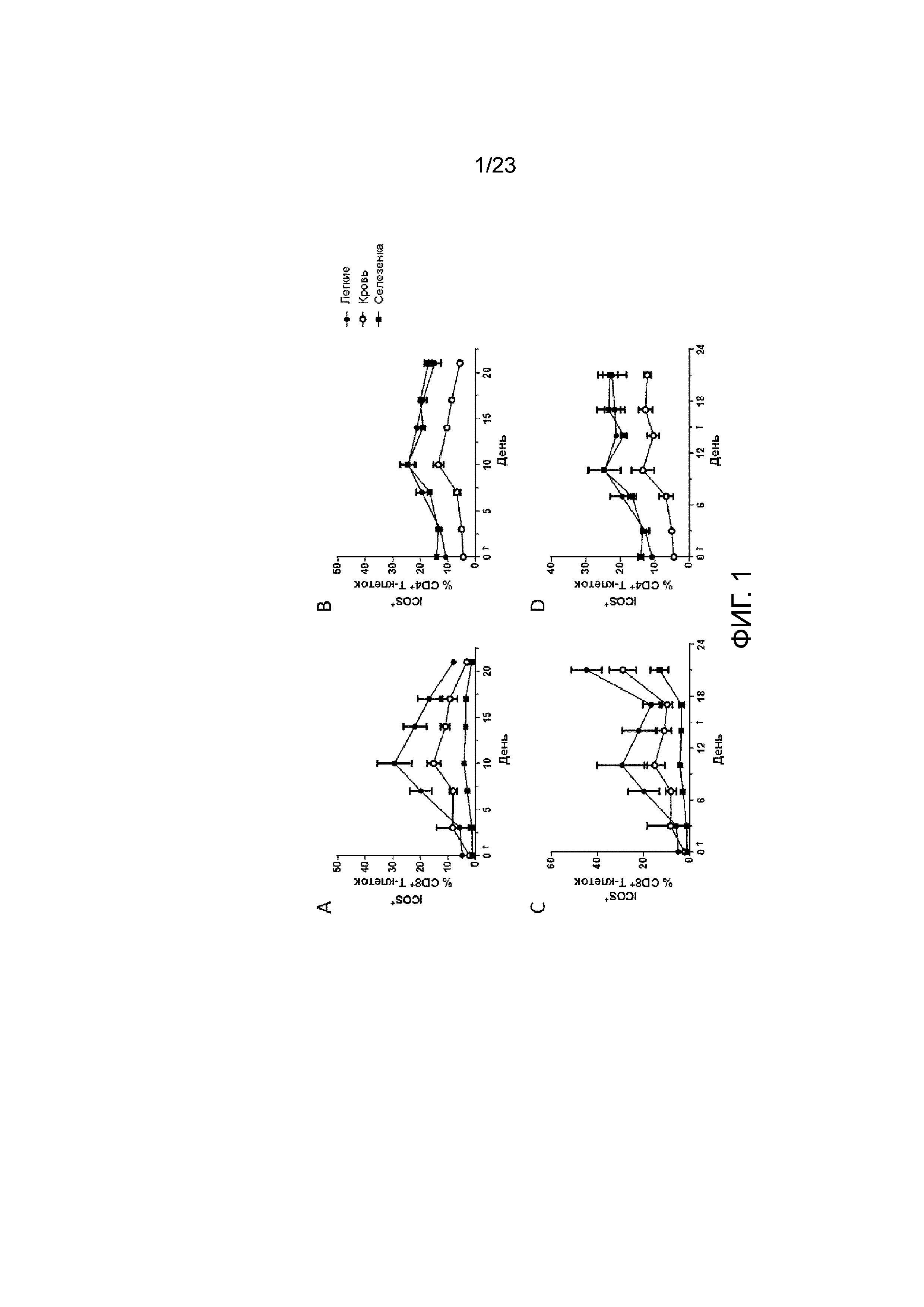
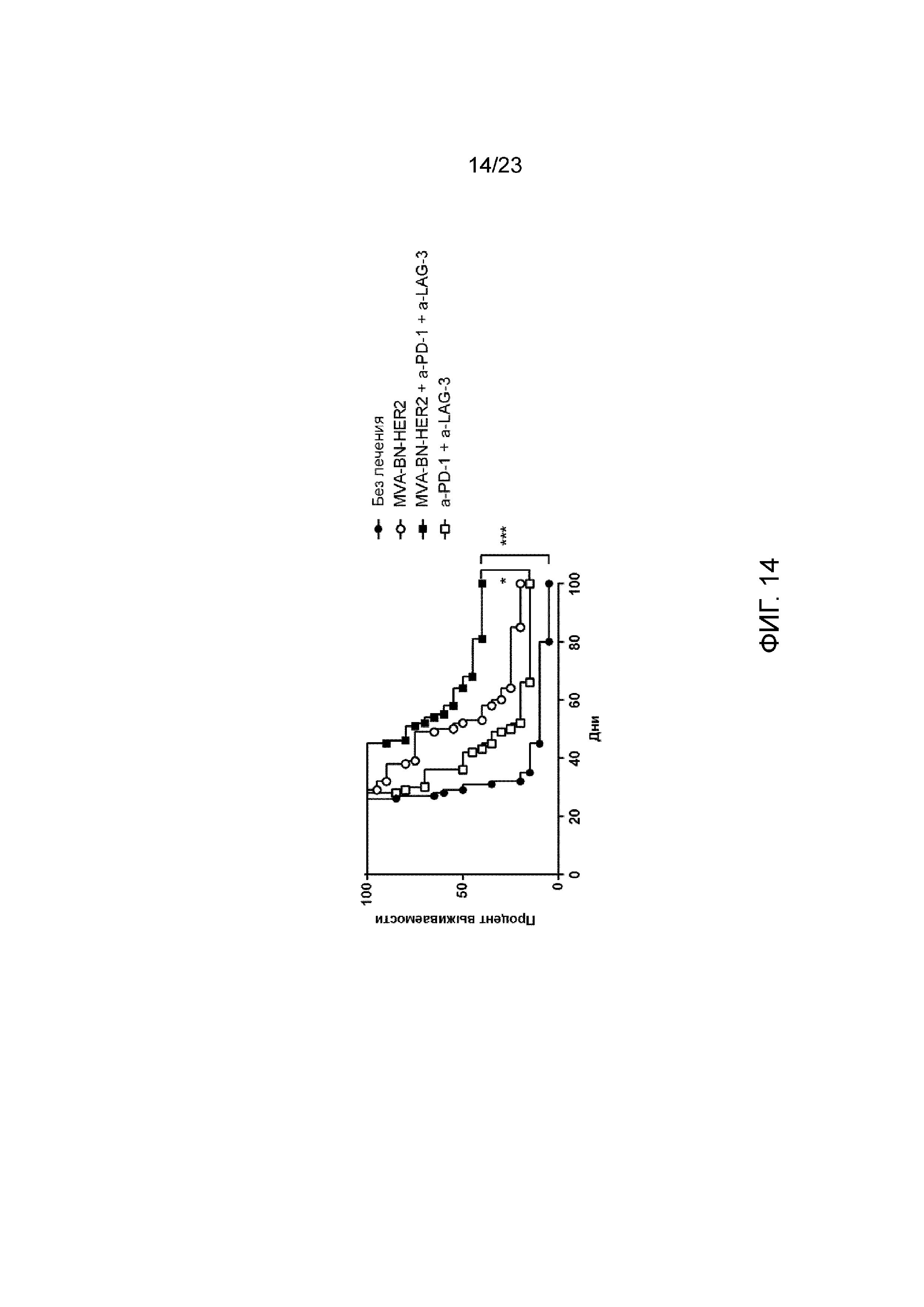
[047] Фигура 8. Демонстрирует экспрессию PD-1 в легких, селезенке и крови на Т-клетках после лечения с применением MVA-BN-HER2. Наивные (без опухолей) мыши получали MVA-BN-HER2 в день 1 (А и В) или дни 1 и 15 (C и D). Экспрессия PD-1 на CD8+ T-клетках (А и С) и CD4+ T-клетках (В и D). Данные представлены как средние значения ± СОС, три мыши на группу в каждый момент времени.
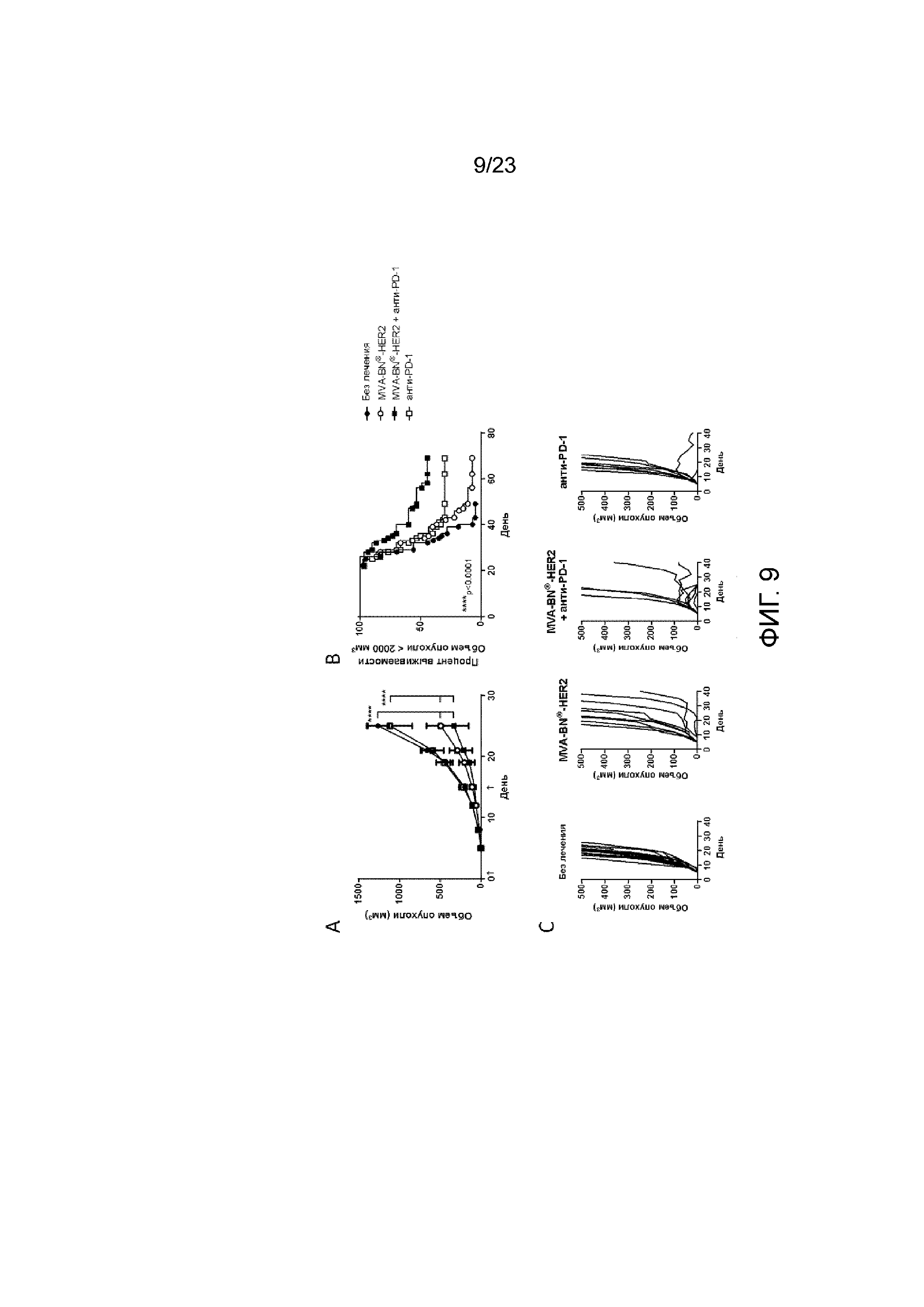
[048] Фигура 9. Демонстрирует замедленный рост опухоли и увеличение выживаемости при лечении с применением MVA-BN-HER2 и анти-PD-1. Мышам имплантировали солидные опухоли HER-2-СТ26 и вводили MVA-BN-HER2 и анти-PD-1 в день 1 и день 15. А) Средний объем опухоли у мышей. B) Процент выживаемости у мышей исходя из объема опухоли <2000 мм3. C) Индивидуальный рост опухоли у мышей.
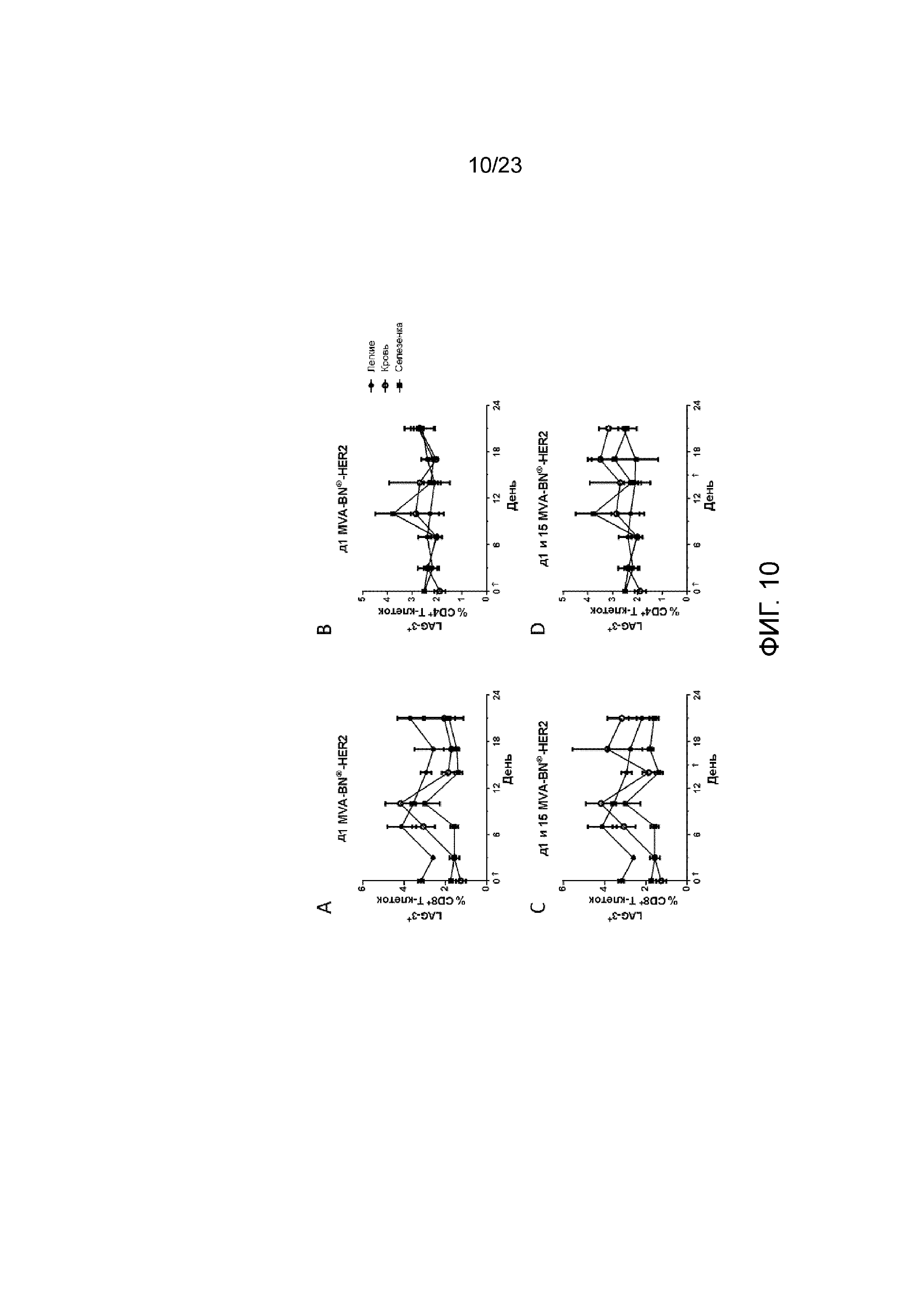
[049] Фигура 10. Демонстрирует экспрессию LAG-3 в легких, селезенке и крови на Т-клетках после лечения с применением MVA-BN-HER2. Наивные (без опухолей) мыши получали MVA-BN-HER2 в день 1 (А и В) или дни 1 и 15 (C и D). Экспрессия LAG-3 на CD8+ T-клетках (А и С) и CD4+ T-клетках (В и D). Данные представлены как средние значения ± СОС, три мыши на группу в каждый момент времени.
[050] Фигура 11. Демонстрирует замедленный рост опухоли и увеличение выживаемости при лечении MVA-BN-HER2 и анти-LAG-3. Мышам имплантировали солидные опухоли СТ26-HER-2 в день 1 и вводили MVA-BN-HER2 и анти-LAG-3 в день 1 и день 15. А) Средний объем опухоли у мышей. B) Процент выживаемости у мышей исходя из объема опухоли <2000 мм3. C) Индивидуальный рост опухоли у мышей.
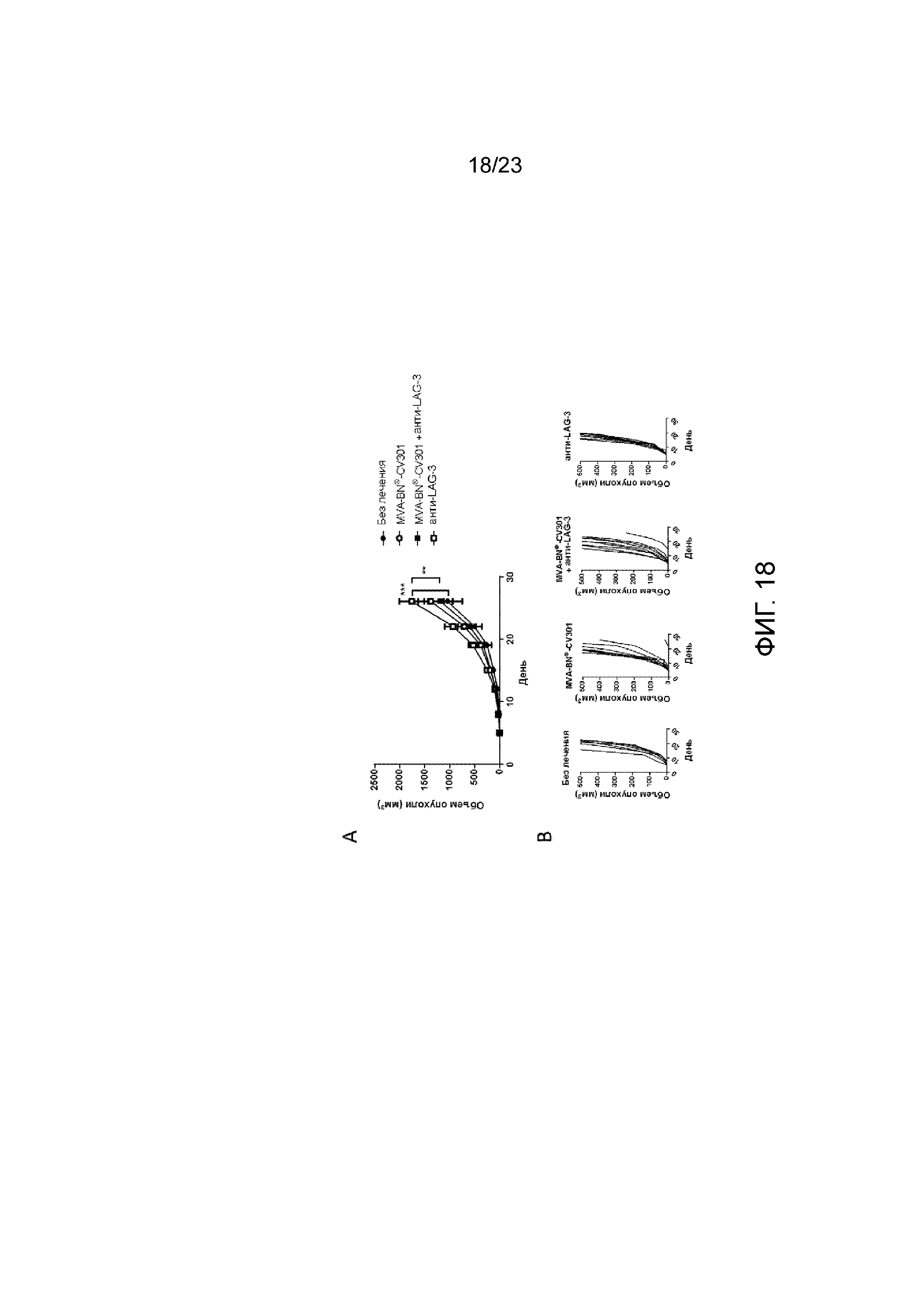
[051] Фигура 12. Демонстрирует полную регрессию опухоли у мышей в результате лечения с применением MVA-BN-HER2, анти-PD-1 и анти-LAG-3. Мышам имплантировали солидные опухоли СТ26-HER-2 в день 1 и вводили MVA-BN-HER2 и анти-LAG-3 в день 1 и день 15. А) Средний объем опухоли у мышей. B) Процент выживаемости у мышей исходя из объема опухоли <2000 мм3. C) Индивидуальный рост опухоли у мышей.
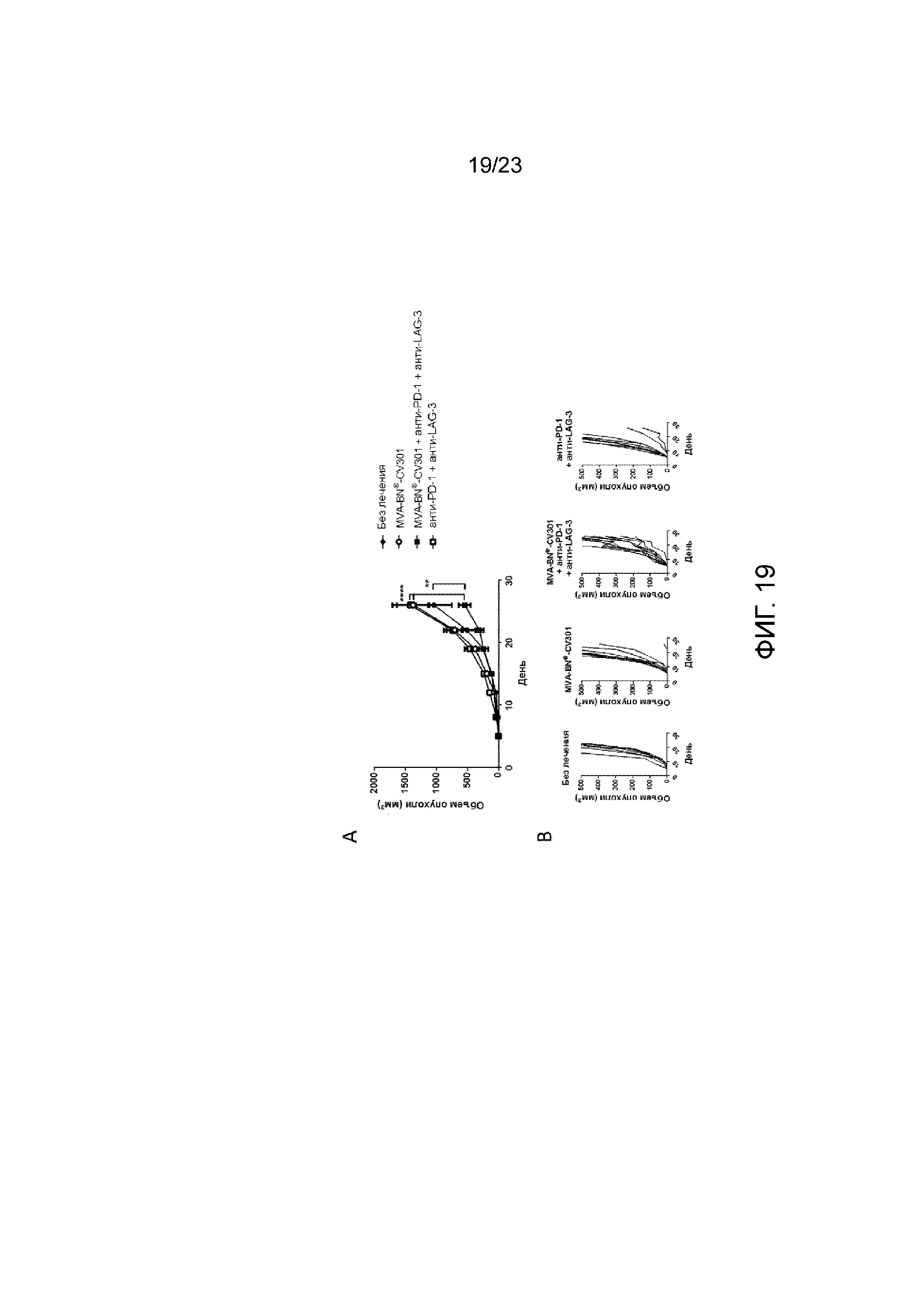
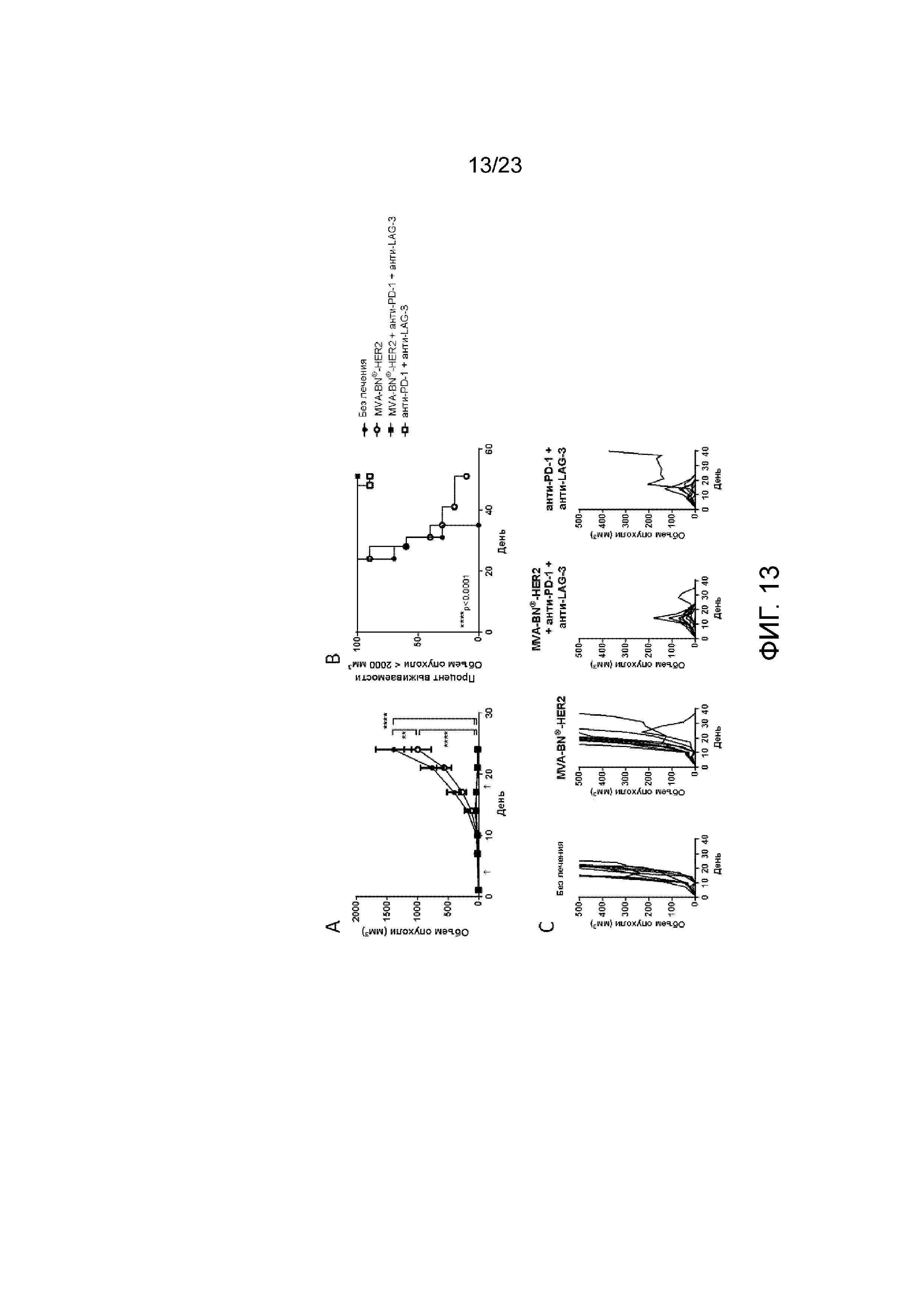
[052] Фигура 13. Демонстрирует регрессию опухоли у мышей в результате лечения с применением MVA-BN-HER2, анти-PD-1 и анти-LAG-3. Мышам имплантировали солидные опухоли СТ26-HER-2 в день 1 и вводили MVA-BN-HER2, анти-PD-1 и анти-LAG-3 в день 4 и день 18. (По сравнению с Фигурой 12, лечение было отложено до дня 4 и дня 18 (Фигура 12, в день 1 и день 15). А) Средний объем опухоли у мышей. B) Процент выживаемости у мышей исходя из объема опухоли <2000 мм3. C) Индивидуальный рост опухоли у мышей.
[053] Фигура 14. Демонстрирует увеличение выживаемости в экспериментальной модели легочных метастазов при лечении с применением MVA-BN-HER2 как монотерапии и в комбинации с анти-PD-1 и анти-LAG-3. Мышам с опухолями СТ26-HER-2 в легких вводили MVA-BN-HER2, анти-PD-1 и анти-LAG-3 в день 4 и день 18.
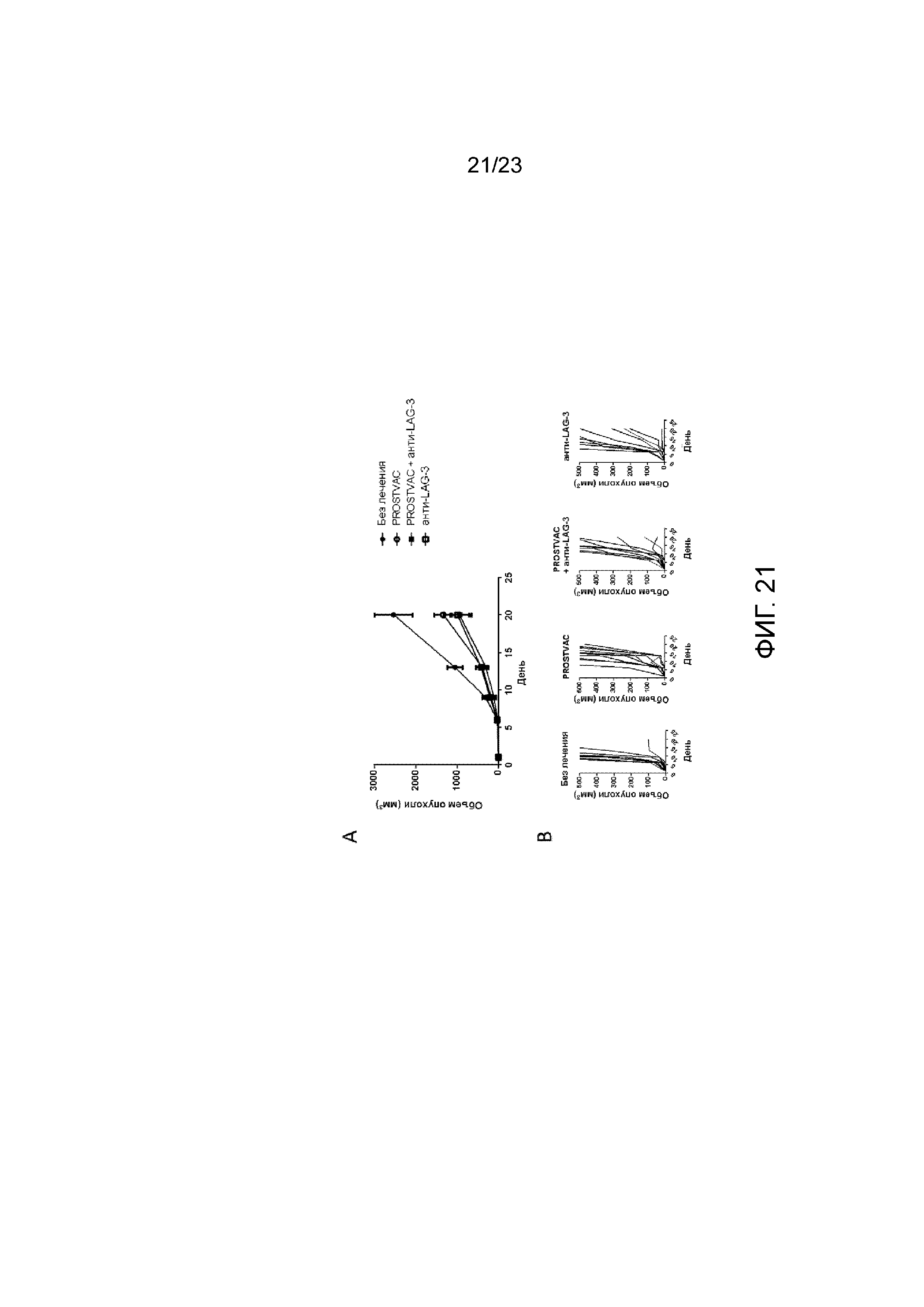
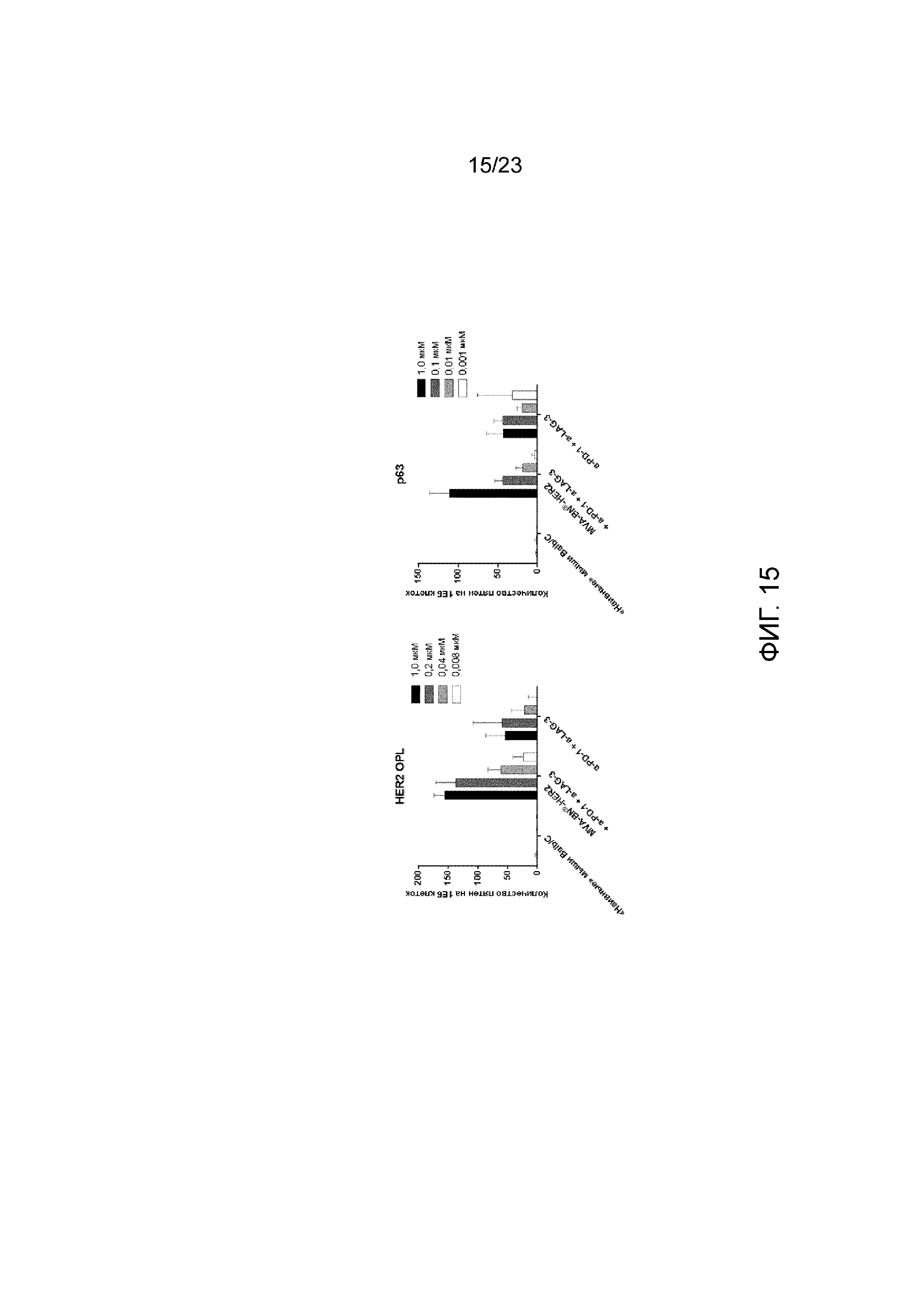
[054] Фигура 15. Демонстрирует более сильный HER2-специфический Т-клеточный ответ у мышей, получавших MVA-BN-HER2, антитела анти-PD-1 и анти-LAG-3 в качестве тройной комбинированной терапии. Мышам имплантировали солидные опухоли СТ26-HER-2 в день 1 и вводили MVA-BN-HER2, анти-PD-1 и анти-LAG-3 в дни 4 и 18, а ИФН-γ измеряли с помощью ELISPOT через четыре недели после последнего лечения. Спленоциты из опухолей мышей повторно стимулировали HER-2 ECD, перекрывающим пептидную библиотеку (A, 166 перекрывающих 15мер) или Kd-связывающим HER-2-пептидом p63 (В).
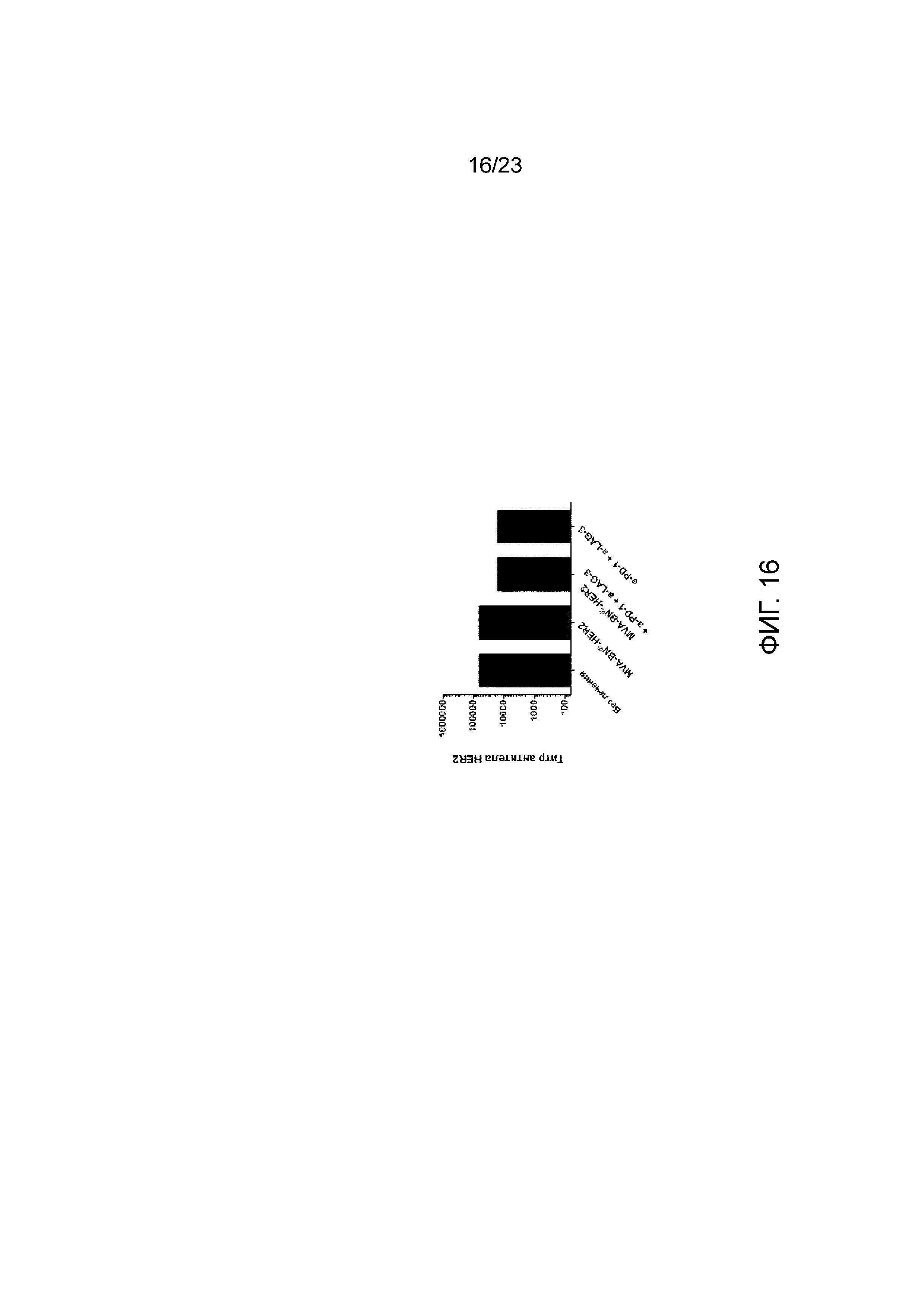
[055] Фигура 16. Демонстрирует рост опухоли CT26-HER-2, индуцированный HER2-специфическими антителами, которые аналогичны между всеми группами лечения. Мышам имплантировали солидные опухоли СТ26-HER-2 в день 1 и вводили MVA-BN-HER2, анти-PD-1 и анти-LAG-3 в день 4 и день 18. Сыворотку у мышей собирали в день 25, а титры HER-2 измеряли методом ELISA.
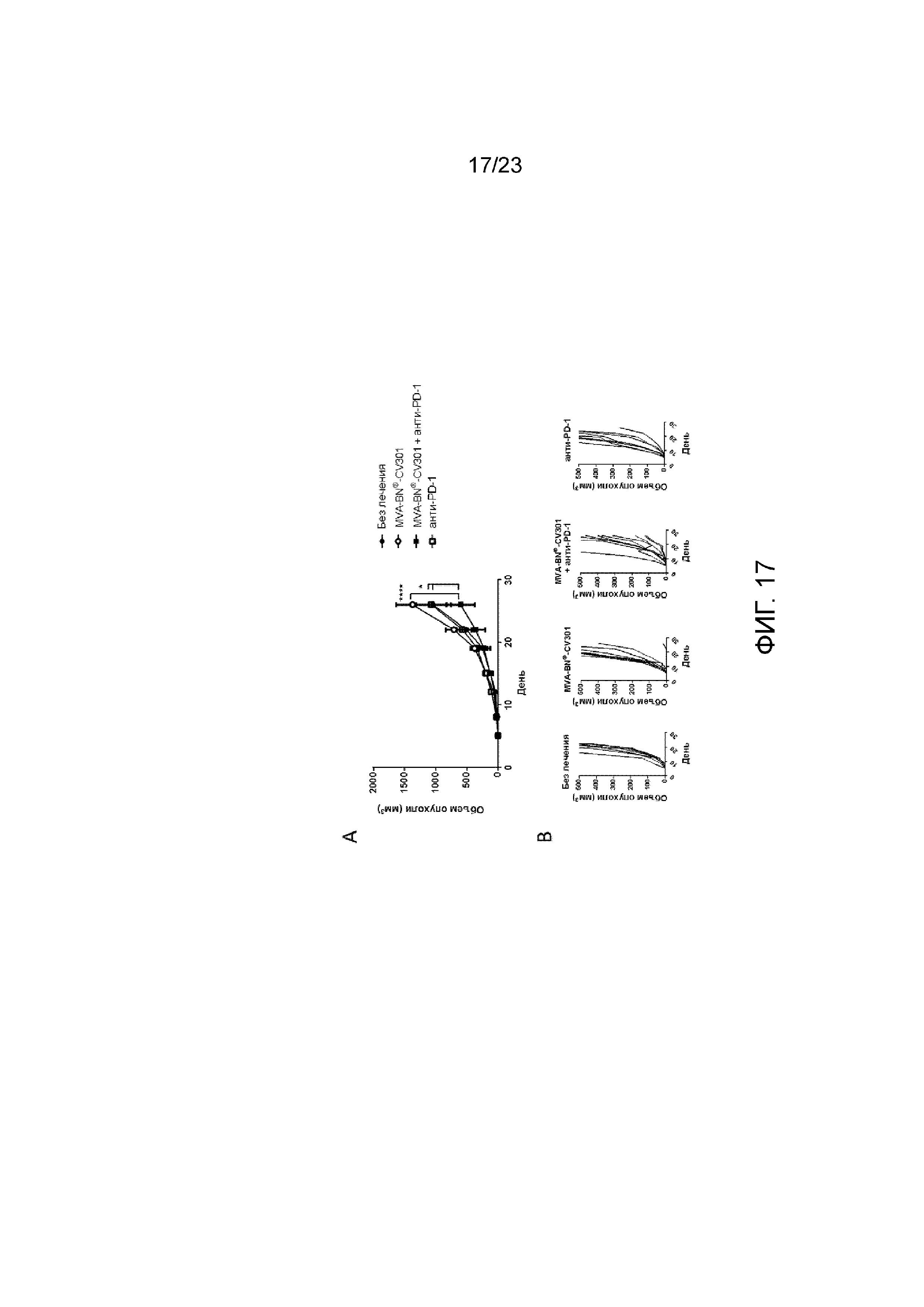
[056] Фигура 17. Демонстрирует замедленный рост опухоли при применении MVA-BN-CV301 и анти-PD-1. Мышам имплантировали солидные опухоли MC38-CEA и вводили MVA-BN-CV301 и анти-PD-1 в день 1 и день 15. А) Средний объем опухоли у мышей. B) Индивидуальный рост опухоли у мышей.
[057] Фигура 18. Демонстрирует объем опухоли после введения MVA-BN-CV301 и анти-LAG-3. Мышам имплантировали солидные опухоли MC38-CEA и вводили MVA-BN-CV301 и анти-LAG-3 в день 1 и день 15. А) Средний объем опухоли у мышей. B) Индивидуальный рост опухоли у мышей.
[058] Фигура 19. Демонстрирует объем опухоли после введения MVA-BN-CV301 в комбинации с анти-PD-1 и анти-LAG-3. Мышам имплантировали солидные опухоли MC38-CEA и вводили MVA-BN-CV301, анти-PD-1 и анти-LAG-3 в день 1 и день 15. А) Средний объем опухоли у мышей. B) Индивидуальный рост опухоли у мышей.
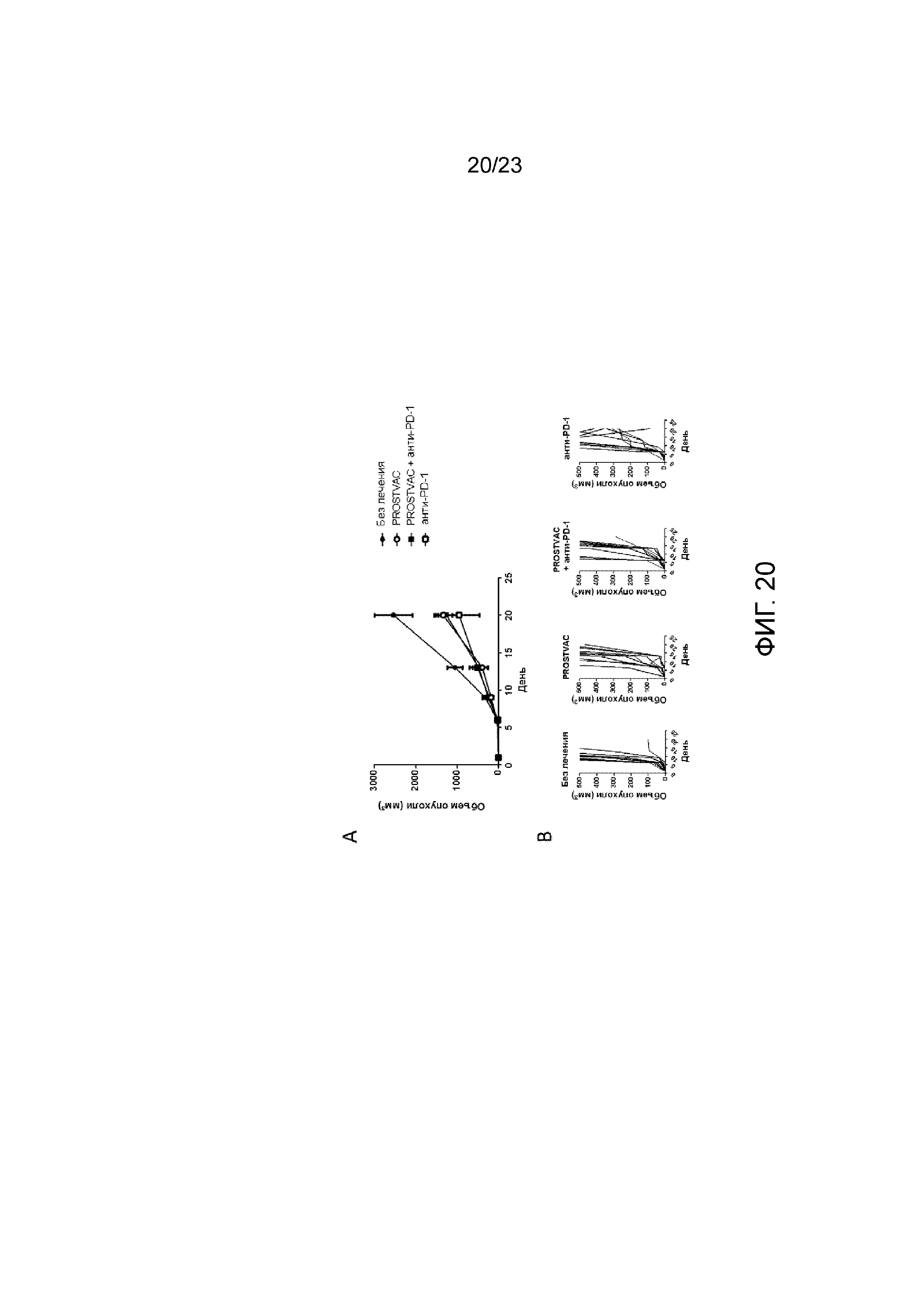
[059] Фигура 20. Демонстрирует объем опухоли после введения PROSTVAC и анти-PD-1. Мышам имплантировали солидные опухоли E6 (RM11-PSA), вводили PROSTVAC-V в день 1 и PROSTVAC-F - в день 8 и день 15. Анти-PD-1 вводили в день 1 и день 15. А) Средний объем опухоли у мышей. B) Индивидуальный рост опухоли у мышей.
[060] Фигура 21. Демонстрирует объем опухоли после введения PROSTVAC и анти-LAG-3. Мышам имплантировали солидные опухоли E6 (RM11-PSA), вводили PROSTVAC-V в день 1 и PROSTVAC-F - в день 8 и день 15. Анти-LAG-3 вводили в день 1 и день 15. А) Средний объем опухоли у мышей. B) Индивидуальный рост опухоли у мышей.
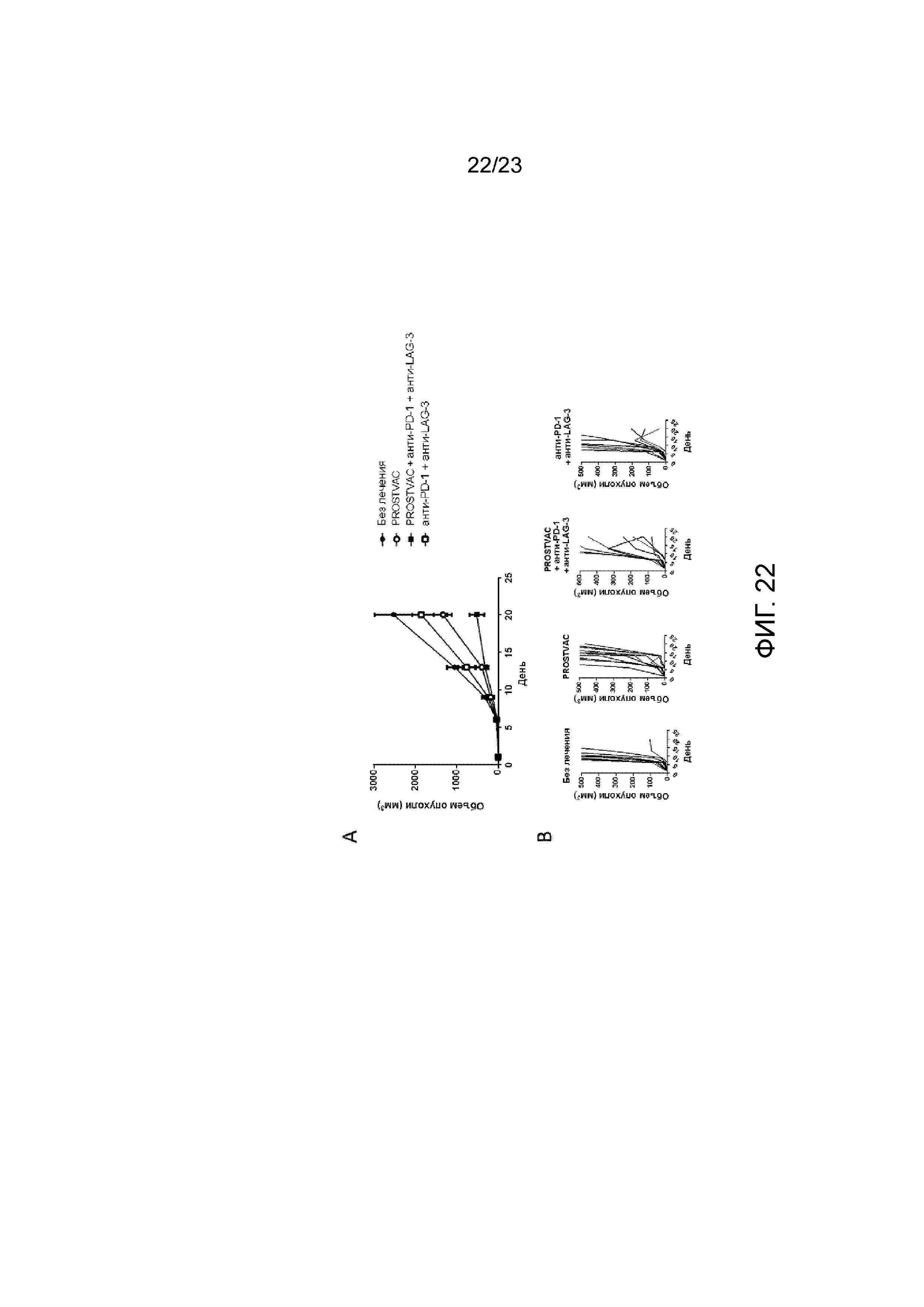
[061] Фигура 22. Демонстрирует объем опухоли после введения PROSTVAC, анти-PD-1 и анти-LAG-3. Мышам имплантировали солидные опухоли E6 (RM11-PSA), вводили PROSTVAC-V в день 1 и PROSTVAC-F - в день 8 и день 15. Анти-PD-1 и анти-LAG-3 вводили в день 1 и день 15. А) Средний объем опухоли у мышей. B) Индивидуальный рост опухоли у мышей.
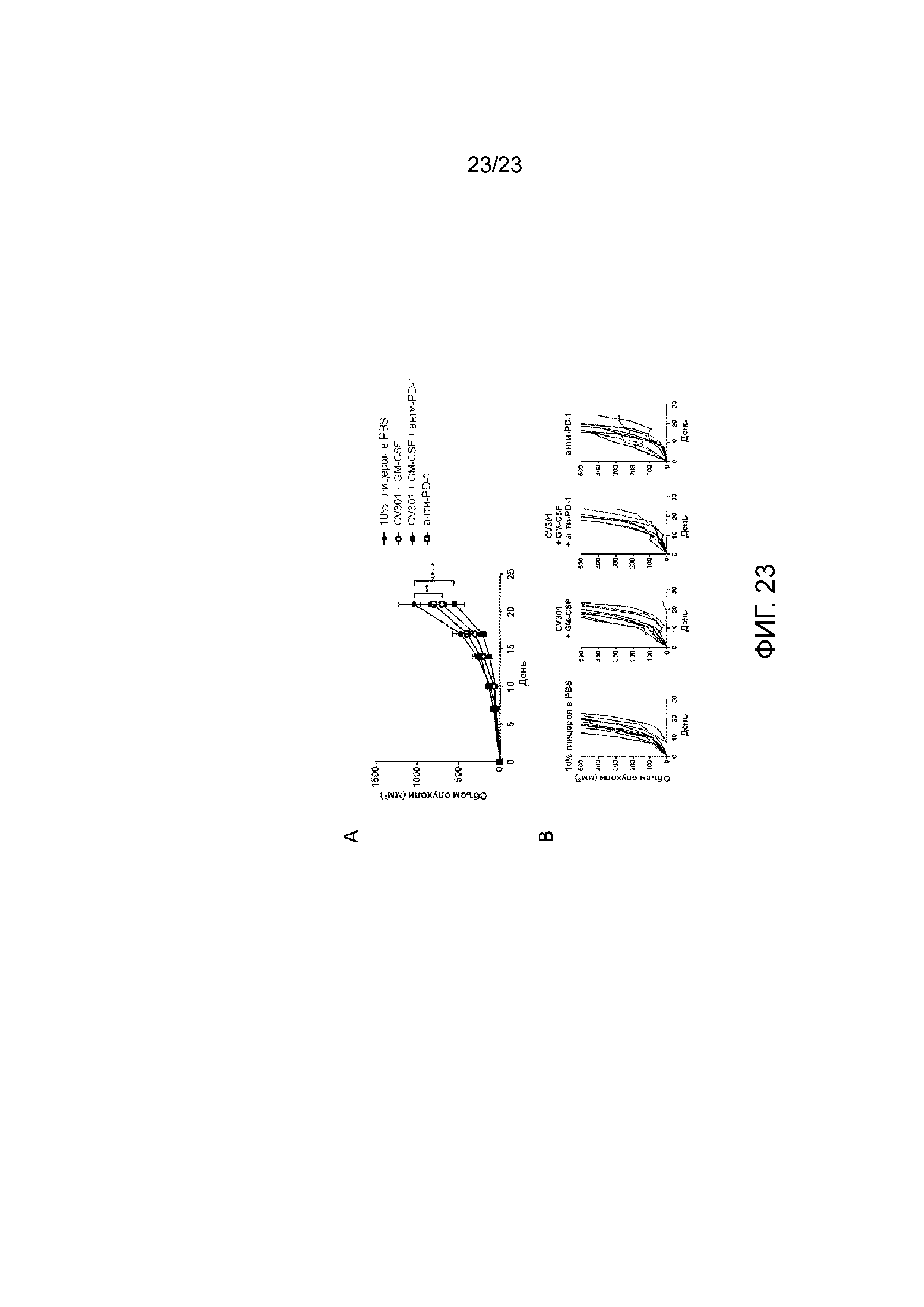
[062] Фигура 23. Демонстрирует объем опухоли после введения CV301 и анти-PD-1. СЕА-трансгенным мышам имплантировали солидные опухоли МС38-СЕА, вводили CV301-V в день 4 и CV301-F - в день 11 и день 18. Вирус оспы кур GM-CSF (с добавлением CV301-V/F) и анти-PD-1 вводили в день 4, день 11 и день 18. А) Средний объем опухоли у мышей. B) Индивидуальный рост опухоли у мышей.
КРАТКОЕ ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[063] SEQ ID NO:1 представляет собой нуклеотидную последовательность конструкта, кодирующую белок HER2, содержащий два TH-клеточные эпитопа, полученные из столбнячного токсина.
[064] SEQ ID NO:2 представляет собой аминокислотную последовательность модифицированного белка HER2, кодируемого нуклеотидной последовательностью SEQ ID NO:1.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[065] Во многих текущих клинических исследований изучаются терапевтические методы, использующие вирус осповакцины, модифицированный вирус осповакцины Ankara (MVA) и векторы на основе вируса оспы кур, которые были сконструированы для экспрессии одного или более опухолевых антигенов (ТАА). Эти векторы используются отдельно или в стратегии «прайм-буст» для создания активного иммунного ответа, направленного против различных видов рака. PROSTVAC®, в котором применяется гетерологичная стратегия «прайм-буст» с использованием вируса осповакцины и вируса оспы кур, экспрессирующих PSA и TRICOMТМ, в настоящее время изучается в III фазе всемирного клинического исследования (PROSPECT) при метастатическом кастрационно-резистентном раке предстательной железы.
[066] MVA-BN-HER2 (Mandl et al, 2012) изучается в I фазе клинических исследований для лечения рака молочной железы HER-2+. Этот рекомбинантный вектор получают из сильно аттенурированного материала модифицированного вируса осповакцины Ankara (MVA), известного как MVA-BN. Он экспрессирует модифицированную форму HER-2 (обозначенный HER2), состоящий из внеклеточного домена HER-2, который был разработан с целью включения двух универсальных Т-клеточных эпитопов из столбнячного токсина (TTp2 и TTp30) для облегчения индукции эффективных иммунных ответов, направленных против HER-2.
[067] Для дополнительного повышения противоопухолевой эффективности иммунотерапии на основе поксвирусов, MVA-BN-HER2 комбинировали с моноклональными антителами, которые блокируют активность CTLA-4, белка иммунной контрольной точки, препятствующего активации Т-клеток. В экспериментальной модели легочных метастазов CT26-HER-2 медиана выживаемости увеличилась с 30 дней в мышей, не получавших лечения, до 49,5 дней - в мышей, которым вводился MVA-BN-HER2, в то время как лечение с применением анти-CTLA-4 само по себе продемонстрировало небольшое преимущество в выживаемости (медиана выживаемости 35 дней). В отличие от этого, MVA-BN-HER2 в комбинации с анти-CTLA-4 достоверно повышал выживаемость до более чем 100 дней (р <0,0001), в более чем 50% мышей. По истечению 100 дней у выживших мышей исследовали легкие, при этом каких-либо видимых опухолей обнаружено не было. В отдельных экспериментах проводился фенотипический анализ. Лечение с применением MVA-BN-HER2 приводило к резкому увеличению индуцируемой костимуляторной молекулы (ICOS) на CD8+ Т-клетках в легких наивных мышей (без опухолей). У мышей с опухолью, как нелеченных, так и получавших анти-CTLA-4, на день 25 в легких отмечалось увеличение числа регуляторных Т-клеток (CD4+FoxP3+), которые коррелировали с увеличением опухолевой нагрузки в легких. Регуляторные Т-клетки были положительными на ICOS. У мышей, получавших MVA-BN-HER2, отмечалось увеличение ICOS+ CD4+ T-клеток, которые были FoxP3 отрицательными.
[068] MVA-BN-HER2 исследовали в комбинации с различными агониститческими и антагонистическими антителами, направленными против PD-1, LAG-3, а также ICOS в различных моделях опухолей. Обнаружено, что комбинации усиливали эффекты MVA-BN-HER2.
[069] Кроме того, различные антагонистические антитела, направленные против PD-1 и LAG-3, исследовали в комбинации с режимами гетерологичных «прайм-буст»-дозировок с использованием рекомбинантного ортопоксвируса и рекомбинантного авипоксвируса. Например, PROSTVAC®, содержащий вирус осповакцины и вирус оспы кур, каждый из которых экспрессирует PSA и TRICOM, исследовали в комбинации с различными антагонистическими антителами. CV301 (также известный как PANVAC), содержащий вирус осповакцины и вирус оспы кур, каждый из которых экспрессирует СЕА, MUC-1 и TRICOM, также исследовали в комбинации с различными антагонистическими антителами. Эффективность гетерологичных режимов «прайм-буст»-дозировки повышалась при введении в комбинации с различными антагонистическими антителами.
[070] Различные антагонистические антитела, направленные против PD-1 и LAG-3, дополнительно исследовали в гомологичном режиме «прайм-буст»-дозировки MVA-CV301.Обнаружено, что эффективность MVA-CV301, содержащего прайм- и бустинг-дозу вируса MVA, который экспрессирует СЕА, MUC-1 и TRICOM, повышалась в комбинации с антителами, направленными против PD-1 и/или LAG- 3.
Ортопоксвирус и/или авипоксвирус, кодирующие полипептид, содержащий опухолевый антиген
[071] В различных аспектах настоящее изобретение включает рекомбинантный ортопоксвирус и/или рекомбинантный авипоксвирус, каждый из которых кодирует и/или экспрессирует опухолевый антиген. В одном или более предпочтительных аспектах ортопоксвирус и авипоксвирус представляют собой вирус осповакцины и вирус оспы кур, соответственно.
[072] Термин «авипоксвирус» относится к любому авипоксвирусу, такому как вирус оспы кур, вирус оспы канареек, вирус неизвестной оспы, вирус оспы майн, вирус оспы голубей, вирус оспы попугаев, вирус оспы перепелов, вирус оспы павлинов, вирус оспы пингвинов, вирус оспы воробьев, вирус оспы скворцов и вирус оспы индеек. Предпочтительными являются вирус оспы канареек и вирус оспы кур.
[073] Примером вируса оспы канареек является штамм Рентшлер. Очищенный от бляшек штамм вируса оспы канареек называется ALVAC (патент США № 5766598) был сдан на хранение в соответствии с условиями Будапештского договора в Американскую коллекцию типовых культур (АТСС) с номером доступа VR-2547. Другой штамм вируса оспы канареек представляет собой коммерческий вакцинный штамм вируса оспы канареек, обозначаемый LF2 СЕР 524 24 10 75 и поставляемый из института Merieux, Inc.
[074] Примеры вируса оспы кур включают, но не ограничиваются ими, штаммы FP-1, FP-5, TROVAC (патент США № 5766598) и POXVAC-TC (патент США 7410644). FP-1 представляет собой штамм Duvette, модифицированный для использования в качестве вакцины в однодневных цыплят. Штамм представляет собой коммерческий вакцинный штамм вируса оспы кур, обозначаемый O DCEP 25/CEP67/2309 октябрь 1980 и поставляемый из института Merieux, Inc. FP-5 представляет собой коммерческий вакцинный штамм вируса оспы кур, получаемый из куриного эмбриона и поставляемый из Американской научной лаборатории (Отдел Schering Corp.) Мэдисон, штат Висконсин, ветеринарная лицензия США № 165, серийный номер 30321.
[075] В одном или более вариантах реализации изобретения рекомбинантный ортопоксвирус предпочтительно выбирается из вируса осповакцины, модифицированного вируса осповакцины Ankara (MVA) и MVA-BN.
[076] Примеры штаммов вируса осповакцины включают, но не ограничиваются ими, штаммы Temple of Heaven, Copenhagen, Paris, Budapest, Dairen, Gam, MRIVP, Per, Tashkent, TBK, Tom, Bern, Patwadangar, BIEM, B-15, Lister, EM-63, New York City Board of Health, Elstree, Ikeda and WR. Предпочтительным штаммом вируса осповакцины (VV) является штамм Wyeth (DRYVAX) (патент США 7410644).
[077] Другим предпочтительным штаммом VV является модифицированный вирус осповакцины Ankara (MVA) (Sutter, G. et al. [1994], Vaccine 12: 1032-40). Примеры штаммов вируса MVA, которые пригодны для использования в практике настоящего изобретения и были депонированы в соответствии с требованиями Будапештского договора включают, но не ограничиваются ими, штаммы MVA 572, хранящиеся в Европейской коллекции клеточных культур животных (ЕСАСС), Лаборатории исследования и производства вакцин, Лабораторной службе общественного здравоохранения, Центре практической микробиологии и исследований, Портон, Солсбери, Уилтшир SP4 0JG, Соединенное Королевство, с номером депонирования ЕСАСС 94012707 от 27 января 1994 года, и MVA 575, с номером депонирования ЕСАСС 00120707 от 7 декабря 2000 года. MVA-BN, депонированный от 30 августа 2000 года в Европейской коллекции клеточных культур (ЕСАСС) под номером V00083008 и его производные, которые являются дополнительными типовыми штаммами.
[078] Несмотря на то, MVA-BN является предпочтительным из-за его более высокой безопасности (меньшая продуктивность репликации), все MVA пригодны для настоящего изобретения. Согласно варианту реализации настоящего изобретения штамм MVA представляет собой MVA-BN и его производные. Определение MVA-BN и его производных приведено в PCT/EP01/13628, что включено в настоящий документ в полном объеме посредством ссылки.
[079] В некоторых вариантах реализации изобретения MVA представляет собой MVA-BN, депонированный от 30 августа 2000 года в Европейской коллекции клеточных культур (ЕСАСС) под номером V00083008 и описан в международной публикации РСТ WO2002042480 (см. также, например, патент США № 6761893 и № 6913752), все из которых включены в настоящее описание посредством ссылки. Как описано в этих патентных публикациях, MVA-BN не репродуктивно реплицируется в клеточных линиях 293, 143B, HeLa и HaCat. В частности, MVA-BN демонстрирует коэффициент амплификации от 0,05 до 0,2 в человеческой эмбриональной клеточной линии почек 293. В человеческой клеточной линии костной остеосаркомы 143B, MVA-BN демонстрирует коэффициент усиления от 0,0 до 0,6. MVA-BN демонстрирует коэффициент амплификации от 0,04 до 0,8 в человеческой клеточной линии аденокарциномы шейки матки HeLa, и от 0,02 до 0,8 - в человеческой клеточной линии кератиноцитов НаСаТ. MVA-BN имеет коэффициент амплификации от 0,01 до 0,06 в клеточной линии почек африканских зеленых обезьян (CV1: АТСС № CCL-70).
[080] Коэффициент амплификации MVA-BN составляет выше 1 в фибробластах куриных эмбрионов (CEF: первичные культуры), как описано в публикацииРСТ WO2002042480 (см. также, например, патент США № 6761893 и № 6913752). Вирус может легко размножаться и амплифицироваться в CEF первичных культурах CEF с коэффициентом выше 500.
[081] В некоторых вариантах реализации изобретения рекомбинантный MVA представляет собой производное MVA-BN. Такие «производные» включают вирусы, проявляющие по существу аналогичные репликационные характеристики с депонированным штаммом (ЕСАСС № V00083008), но имеющие различия в одной или более частей своего генома. Вирусы, имеющие аналогичные «репликационные характеристики» с депонированным вирусом, представляют собой вирусы, которые реплицируются с аналогичными коэффициентами амплификации с депонированным штаммом в клетках и клеточных линий CEF, HeLa, HaCat и 143B; и которые демонстрируют аналогичные репликационные характеристики in vivo, как определено, например, в трансгенной мышиной модели AGR129.
[082] В некоторых вариантах реализации изобретения ортопоксвирус представляет собой рекомбинантный вирус осповакцины, содержащий дополнительные нуклеотидные последовательности, которые являются гетерологичными по отношению к ортопоксвирусу. В некоторых таких вариантах реализации изобретения гетерологичные последовательности кодируют эпитопы, которые индуцируют ответ иммунной системы. Таким образом, в некоторых вариантах реализации изобретения рекомбинантный ортопоксвирус используется для вакцинации против белков или агентов, содержащих эпитоп.
[083] В некоторых вариантах реализации изобретения ортопоксвирус и авипоксвирус согласно настоящему изобретению содержат по меньшей мере один антиген, ассоциированный с опухолью. В предпочтительном варианте реализации изобретения антиген, ассоциированный с опухолью, включает, но не ограничивается ими, HER-2, PSA, PAP, CEA или MUC-1 отдельно или в комбинации (например, СЕА и MUC-1 или PAP и PSA).
[084] В дополнительных вариантах реализации изобретения антиген, ассоциированный с опухолью, является модифицированным с целью включения одного или более чужеродных TH-эпитопов. Такой иммунотерапевтический агент для лечения рака описан в настоящем документе в качестве неограничивающего примера и называется как «MVA-BN-mHER2». Как описано в настоящем описании, такие противораковые иммунотерапевтические агенты, включают, но не ограничиваются ими, MVA-BN-mHER2, которые пригодны для лечения рака. Изобретение позволяет использовать такие агенты в режимах вакцинации «прайм/буст» для людей и других млекопитающих, включая пациентов с иммунодефицитом; и индуцировать как гуморальный, так и клеточный иммунный ответ, такой как иммунный ответ Th1 в уже существующей среде Th2.
[085] В некоторых вариантах реализации изобретения антиген, ассоциированный с опухолью? воплощен в гетерологичной последовательности нуклеиновой кислоты, которая вставляется в несущественную область генома вируса. В некоторых из этих вариантов реализации изобретения гетерологичная последовательность нуклеиновой кислоты вставляется в природный сайт делеции генома MVA, как описано в PCT/EP96/02926. Способы вставки гетерологичных последовательностей в геном поксвируса известны специалисту в данной области техники.
[086] В некоторых вариантах реализации изобретения фармацевтические композиции содержат один или более фармацевтически приемлемых и/или одобренных носителей, добавок, антибиотиков, консервантов, адъювантов, разбавителей и/или стабилизаторов. Такие добавки включают, например, но не ограничиваясь ими, воду, солевой раствор, глицерол, этанол, увлажняющие или эмульгирующие агенты и рН-буферные вещества. Типичные носители обычно представляют собой большие, медленно метаболизирующиеся молекулы, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, аминокислотные сополимеры, липидные агрегаты или тому подобное.
[087] Для приготовления вакцины ортопоксвирус может быть превращен в физиологически приемлемую форму. В некоторых вариантах реализации изобретения такое приготовление основано на опыте получения поксвирусных вакцин, используемых для вакцинации против натуральной оспы, как описано, например, в Stickl, H. et al., Dtsch. med. Wschr. 99, 2386-2392 (1974).
[088] Типовое приготовление следующее. Очищенный вирус хранят при -80°С с титром 5×108 TCID50/мл в смеси 10 мМ Трис, 140 мМ NaCl, рН 7,4. Для подготовки дозы вакцины, например, 102-108частиц вируса могут быть лиофилизированы в фосфатно-солевом буфере (PBS) при наличии 2% пептона и 1% человеческого альбумина в ампуле, предпочтительно стеклянной ампуле. В альтернативном варианте дозы вакцин могут быть получены путем ступенчатой лиофилизации вируса в составе смеси. В некоторых вариантах реализации изобретения состав содержит дополнительные добавки, такие как маннит, декстран, сахар, глицин, лактоза, поливинилпирролидон или другие добавки, такие как, в том числе, но не ограничиваясь ими, антиоксиданты или инертный газ, стабилизаторы или рекомбинантные белки (например, человеческий сывороточный альбумин) пригодные для введения in vivo. Ампулы затем герметизируются и могут храниться при соответствующей температуре, например, между 4°С и комнатной температурой в течение нескольких месяцев. Тем не менее, до тех пор, пока отсутствует необходимость использования, ампулу предпочтительно хранят при температуре ниже -20°C.
[089] В различных вариантах реализации изобретения, включающих вакцинацию или терапию, лиофилизат растворяют в 0,1-0,5 мл водного раствора, предпочтительно физиологического солевого раствора или трис-буфера, и вводят либо системно, либо местно, то есть, с помощью парентерального, подкожного, внутривенного, внутримышечного, интраназального, внутрикожного или любого другого пути введения, известного квалифицированному специалисту. Оптимизация пути введения, доза и количество введений находятся в пределах опыта и знаний специалиста в данной области техники.
[090] В некоторых вариантах реализации изобретения аттенуированные штаммы вируса осповакцины пригодны для индукции иммунного ответа у животных с иммунодефицитом, например, обезьян (CD4 <400 /мкл крови), инфицированных ВИО, или людей с иммунодефицитом. Термин «иммунодефицит» описывает состояние иммунной системы индивидуума, которое характеризуется только неполными иммунными ответами или снижением эффективной защиты от инфекционных агентов.
Некоторые типовые антигены, ассоциированные с опухолями
[091] В некоторых вариантах реализации изобретения иммунный ответ вырабатывается у субъекта против клеточно-ассоциированного полипептидного антигена. В некоторых таких вариантах реализации изобретения клеточно-ассоциированный полипептидный антиген представляет собой антиген, ассоциированный с опухолью.
[092] Термин «полипептид» относится к полимеру, из двух или более аминокислот, соединенных друг с другом пептидными связями или модифицированными пептидными связями. Аминокислоты могут быть природного происхождения, а также не встречающимися в природе, или химическим аналогом природной аминокислоты. Термин также относится к белкам, т.е. функциональным биомолекулам, содержащим по меньшей мере один полипептид; если содержатся по меньшей мере два полипептида, то они могут образовывать комплексы, быть ковалентно связаны или нековалентно связаны. Полипептид (полипептиды) в белке могут быть гликозилированные и/или липидизированными и/или включать простетические группы.
[093] Как описано в настоящем документе, предпочтительно, антиген, ассоциированный с опухолью, представляет собой HER-2, PSA, PAP, СЕА или MUC-1 по отдельности или в комбинации (например, СЕА и MUC-1 или PAP и PSA).
[094] В данной области техники известны многочисленные антигены, ассоциированные с опухолью. Типовые антигены, ассоциированные с опухолью, включают, но не ограничиваются ими, 5 альфа-редуктазу, альфа-фетопротеин, AM-1, APC, April, BAGE, бета-катенин, Bcl12, bcr-abl, CA-125, CASP-8/FLICE, катепсины, CD19, CD20, CD21, CD23, CD22, CD33 CD35, CD44, CD45, CD46, CD5, CD52, CD55, CD59, CDC27, CDK4, CEA, c-myc, Cox-2, DCC, DcR3, E6/E7, CGFR, EMBP, Dna78, фарнезилтрансферазу, FGF8b, FGF8a, FLK-1/KDR, рецептор фолиевой кислоты, G250, GAGE-семейство, гастрин-17, гастрин-рилизинг гормон, GD2/GD3/GM2, GnRH, GnTV, GP1, gp100/Pmel17, gp-100-in4, gp15, gp75/TRP-1, hCG, гепараназу, Her2/neu, HMTV, Hsp70, hTERT, IGFR1, IL-13R, iNOS, Ki67, KIAA0205, K-ras, H-ras, N-ras, KSA, LKLR-FUT, MAGE-семейство, маммаглобин, MAP17, мелан-A/MART-1, мезотелин, MIC A/B, MT-MMPs, муцин, NY-ESO-1, остеонектин, p15, P170/MDR1, p53, p97/меланотрасферрин, PAI-1, PDGF, uPA, PRAME, пробазин, прогенипоэтин, PSA, PSM, RAGE-1, Rb, RCAS1, SART-1, SSX-семейство, STAT3, STn, TAG-72,TGF-альфа, TGF-бета, тимозин-бета-15, ФНО-альфа, TRP-1, TRP-2, тирозиназу, VEGF, ZAG, p16INK4 и глутатион-S-трансферазу.
[095] В предпочтительном антигене PSA произведена замена аминокислоты изолейцина на лейцин в положении 155, как описано в патенте США 7247615, который включен в настоящий документ посредством ссылки.
[096] Один или более предпочтительных антигенов СЕА включают, но не ограничиваются ими, антигены СЕА, описанные в патенте США 7723096 и заявке РСТ № PCT/US2004/037810 и № PCT/US2004/038643; все из которых включены в настоящий документ посредством ссылки.
[097] Один или более предпочтительных антигенов MUC-1 включают, но не ограничиваются ими, антигены MUC-1, описанных в патенте США 7118738 и заявке РСТ № PCT/US2013/020058, PCT/US2004/037810 и PCT/US2004/038643; все из которых включены в настоящий документ посредством ссылки.
[098] Другой типовый антиген, ассоциированный с опухолью - это HER-2. HER-2 является членом семейства рецепторов эпидермального фактора роста (c-erbB), которое на сегодняшний день состоит из четырех различных рецепторов:c-erbB-1 (EGFr), c-erbB-2 (HER-2, c-Neu), c-erbB-3 и c-erbB-4 (Salomon et al, 1995). C-erbB-3 и c-erbB-4 изучены не так детально, как EGFr и HER-2. HER-2 представляет собой интегральный мембранный гликопротеин. Зрелый белок имеет молекулярную массу 185 кДа, со структурными особенностями, которые очень напоминают рецептор EGFr (Prigent et al, 1992). EGFr также представляет собой интегральный мембранный рецептор, состоящий из одной субъединицы. Он имеет кажущуюся молекулярную массу 170 кДа и состоит из поверхностного лиганд-связывающего домена 621 аминокислоты, единичного гидрофобного трансмембранного домена 23 аминокислот и высококонсервативной цитоплазматического домена тирозинкиназы 542 аминокислот. Белок является N-гликозилированным (Prigent et al, 1994).
[099] Все белки этого семейства представляют собой тирозинкиназы. Взаимодействие с лигандом приводит к димеризации рецептора, что повышает каталитическое действие тирозинкиназы (Bernard. 1995, Chantry 1995). Белки в пределах семейства способны к гомо- и гетеродимеризации, что очень важно для их функционирования. EGFr передает эффект стимуляции роста и стимулирует поглощение глюкозы и аминокислот клетками (Prigent et al 1992). HER-2 также передает сигналы стимуляции роста.
[0100] В нормальных тканях рецептор эпидермального фактора роста экспрессируется в малых количествах, но при многих типах рака - сверхэкспрессируется. EGFr сверхэкспрессируется при опухолях молочной железы (Earp et al, 1993, Eppenberger 1994), глиомах (Schlegel et al, 1994), раке желудка (Tkunaga et al, 1995), плоскоклеточном раке кожи (Fujii 1995), раке яичника (van Dam et al, 1994) и других. В малом количестве HER-2 также экспрессируется на некоторых нормальных человеческих тканях, в большинстве случаев - на секреторном эпителии. Сверхэкспрессию HER-2 определяют приблизительно в 30% рака молочной железы, желудка, поджелудочной железы, мочевого пузыря и яичников.
[0101] Экспрессия этих рецепторов варьирует в зависимости от степени дифференцировки опухоли и типа рака, например, при раке молочной железы, первичные опухоли сверхэкспрессируют оба рецептора; в то время как при раке желудка, сверхэкспрессия происходит на более поздней стадии в метастатических опухолях (Salomon et al, 1995). Количество суперэкспрессированных рецепторов на клетках карциномы больше, чем 106/клетка для некоторых раков головы и шеи, раковых линий вульвы, молочной железы и яичников, выделенных от пациентов (Dean et al, 1994).
[0102] Есть несколько причин, почему представители семейства рецепторов EGFr представляют собой пригодные мишени для иммунотерапии опухолей. Во-первых, они сверхэкспрессируются при многих типах рака и должны направить иммунный ответ на опухоль. Во-вторых, опухоли часто экспрессируют или сверхэкспрессируют лиганды для этого семейства рецепторов, и некоторые из них имеют повышенную чувствительность к пролиферативным эффектам, опосредованным лигандами. В-третьих, пациенты с опухолями, сверхэкспрессирующими рецепторы фактора роста, часто имеют плохой прогноз. Сверхэкспрессия была тесно связана с плохим прогнозом особенно при раке молочной железы, раке легких и раке мочевого пузыря, и может быть ассоциирована с инвазивными/метастатическими фенотипами, которые являются в значительной степени нечувствительными к обычным методам лечения (Eccles et al, 1994).
[0103] Предполагается, что нуклеиновые кислоты, кодирующие опухолевый антиген (или антиген, ассоциированный с опухолью), могут быть функционально связаны с последовательностями, контролирующими экспрессию. Последовательность, контролирующая экспрессию, функционально связана с кодирующей последовательностью, таким образом, что экспрессия кодирующей последовательности достигается в условиях, совместимых с последовательностями, контролирующими экспрессию. Последовательности, контролирующие экспрессию, включают, но не ограничиваются ими, соответствующие промоторы, энхансеры, терминаторы транскрипции, инициирующий кодон в начале белок-кодирующей открытой рамки считывания, сигналы сплайсинга для интронов, и внутрирамкочный стоп-кодон. Пригодные промоторы включают, но не ограничиваются ими, ранний промотор SV40, промотор RSV, ретровирус LTR, аденовирусный основной поздний промотор, ранний I промотор, опосредованный человеческим ЦМВ, а также различные поксвирусные промоторы, включая, но не ограничиваясь ими, следующие вирусы осповакцины или промоторы, производные MVA: промотор ATI, промотор 30К, промотор I3, промотор PrS, Pr7.5K, промотор 40К, промотор PrSynIIm, промотор PrLE1 и промотор PrSSL (как описано в заявке РСТ PCT/EP2009/008459).
[0104] Дополнительные последовательности, контролирующие экспрессию, включают, но не ограничиваются ими, лидерные последовательности, терминирующие кодоны, сигналы полиаденилирования и любые другие последовательности, необходимые для соответствующей транскрипции и последующей трансляции последовательности нуклеиновой кислоты, кодирующей желаемый рекомбинантный белок (например, HER-2, PSA, РАР, СЕА или MUC-1) в нужной системе хозяина. Поксвирусный вектор может также содержать дополнительные элементы, необходимые для передачи и последующей репликации экспрессионного вектора, содержащего последовательность нуклеиновой кислоты в нужной системе хозяина. Также специалисту в этой области техники будет понятно, что такие векторы легко конструируются с использованием традиционных способов (Ausubel et al., (1987) в ʺCurrent Protocols in Molecular Biologyʺ, John Wiley and Sons, New York, N.Y.) и являются доступными на рынке.
Модифицированные антигены, ассоциированные с опухолью
[0105] В некоторых вариантах реализации изобретения клеточно-ассоциированный полипептидный антиген модифицирован таким образом, что ответ CTL индуцируется против клетки, которая представляет эпитопы, полученные из полипептидного антигена на его поверхности, при представлении в ассоциации с молекулой MHC класса I на поверхности APC. В некоторых таких вариантах реализации изобретения по меньшей мере один первый чужеродный TH- эпитоп ассоциирован с молекулой MHC класса II на поверхности APC при представлении. В некоторых таких вариантах реализации изобретения клеточно-ассоциированный антиген представляет собой антиген, ассоциированный с опухолью (TAA).
[0106] Тиовые АРС, способные представлять эпитопы, включают дендритные клетки и макрофаги. Дополнительные типовые АРС включают любой пино- или фагоцитирующий APC, который способен одновременно представлять 1) CTL-эпитопы, связанные с молекулами MHC класса I и 2) TH-эпитопы, связанные с молекулами МНС класса II.
[0107] В некоторых вариантах реализации настоящего изобретения представленные модификации одного или более антигенов, ассоциированных с опухолью (ТАА), таких как, но не ограничиваясь ими, СЕА, MUC-1, PAP, PSA, HER2, исполнены таким образом, что после введения субъекту полученные поликлональные антитела преимущественно реагируют с одним или более ТАА, описанных в настоящем документе. Такие антитела могут атаковать и устранять раковые клетки, а также предотвращать развитие метастатических клеток в метастазы. Эффекторный механизм этого противоопухолевого эффекта будет опосредован комплементом и антителозависимой клеточной цитотоксичностью. Кроме того, индуцированные антитела могут также ингибировать рост раковых клеток путем ингибирования олигодимеризации и интернализации рецепторов, зависимых от фактора роста. В некоторых вариантах реализации изобретения такие модифицированные полипептидные антигены могут индуцировать ответы CTL, направленные против известных и/или прогнозируемых эпитопов TAA, представленных в опухолевых клетках.
[0108] В некоторых вариантах реализации изобретения модифицированный полипептидный антиген ТАА содержит CTL-эпитоп клеточно-ассоциированного полипептидного антигена и вариацию, причем вариация содержит по меньшей мере один CTL-эпитоп чужеродного TH-эпитопа. Некоторые такие модифицированные ТАА могут включать, в одном неограничивающем примере, один или более модифицированных полипептидных антигенов HER-2, содержащих по меньшей мере один CTL-эпитоп и вариацию, содержащую по меньшей мере один CTL-эпитоп чужеродного TH-эпитопа. Способы получения вышеуказанного описаны в патенте США № 7005498 и патенте США Pub. № 2004/0141958 и № 2006/0008465.
[0109] В некоторых вариантах реализации изобретения чужеродный TH-эпитоп представляет собой встречающийся в природе «разнородный» Т-клеточный эпитоп.Такие разнородные Т-клеточные эпитопы активны в большой части особей животных видов или животной популяции. В некоторых вариантах реализации изобретения вакцина содержит такие разнородные Т-клеточные эпитопы. В некоторых таких вариантах реализации изобретения использование разнородных Т-клеточных эпитопов уменьшает потребность в очень большом количестве различных CTL-эпитопов в той же вакцине. Типовые разнородные Т-клеточные эпитопы включают, но не ограничиваются ими, эпитопы из столбнячного токсина, включая, но не ограничиваясь ими, эпитопы Р2 и Р30 (Panina-Bordignon et al., 1989), дифтерийный токсин, гемаглютинин вируса гриппа (HA) и антиген CS P.falciparum.
[0110] Дополнительные разнородные Т-клеточные эпитопы включают пептиды, способные связывать большую часть молекул HLA-DR, кодируемых различными HLA-DR. См., например, WO 98/23635 (Frazer IH et al., закрепленный за Университетом Квинсленда.);Southwood S et. al, 1998, J. Immunol. 160: 3363 3373; Sinigaglia F et al., 1988, Nature 336: 778 780; Rammensee HG et al., 1995, Immunogenetics 41: 4 178 228; Chicz RM et al., 1993, J. Exp. Med 178: 27 47; Hammer J et al., 1993, Cell 74: 197 203; and Falk K et al., 1994, Immunogenetics 39: 230 242. Последняя ссылка также относится к HLA-DQ и -DP лигандам. Все эпитопы, перечисленные в этих ссылках, являются пригодными в качестве кандидатов природных эпитопов, как описано в настоящем документе, так же как и эпитопов, которые имеют общие мотивы с ними.
[0111] В некоторых других вариантах реализации изобретения разнородный Т-клеточный эпитоп представляет собой искусственный Т-клеточный эпитоп, который способен связывать большую часть гаплотипов. В некоторых таких вариантах реализации изобретения искусственный Т-клеточный эпитоп представляет собой пан-DR-эпитопный пептид («PADRE»), как описано в WO 95/07707 и в соответствующей статье Alexander J et al., 1994, Immunity 1: 751 761.
mHER2
[0112] Различные модифицированные полипептидные антигены HER-2 и способы их получения описаны в патенте США № 7005498 и патенте США Pub. № 2004/0141958 и №2006/0008465, которые включены в настоящий документ посредством ссылки. Эти документы описывают различные модифицированные полипептидные антигены HER-2, содержащие разнородные Т-клеточные эпитопы в разных положениях в полипептиде HER-2.
[0113] Человеческая последовательность HER-2 может быть разделена на несколько доменов, основанных исключительно на первичной структуре белка. Эти домены являются следующие. Внеклеточный (рецепторный) домен простирается от аминокислот 1-654 и содержит несколько следующих субдоменов: домен I (N-терминальный домен зрелого полипептида) простирается от аминокислот 1-173; домен II (домен, богатый цистеином, 24 остатка цистеина) простирается от аминокислот 174-323; домен III (лиганд-связывающий домен в гомологичном рецепторе EGF) простирается от аминокислот 324-483; и домен IV (домен, богатый цистеином, 20 остатков цистеина) простирается от аминокислот 484-623. Трансмембранные остатки простираются от аминокислот 654-675. Внутриклеточный (киназный) домен простирается от аминокислот 655-1235 и содержит домен тирозинкиназы, который простирается от аминокислот 655-1010 (ядро домена ТК простирается от 725-992); и С-терминальный домен, который простирается от аминокислот 1011-1235.
[0114] Выбор сайтов в аминокислотной последовательности HER-2, которые будут заменены человеческим Т-хелперным эпитопов Р2 либо Р30, описан в патенте США № 7005498 и патенте США Пуб. № 2004/0141958 и № 2006/0008465. Подводя итог, были рассмотрены следующие параметры:
1. Известные и прогнозируемые CTL-эпитопы;
2. Гомология связанных рецепторов (EGFR, в частности);
3. Сохранение остатков цистеина;
4. Прогнозированные петли, α-спиральные и ß-складчатые структуры;
5. Потенциальные сайты N-гликозилирования;
6. Прогнозирование доступных и погруженных аминокислотных остатков;
7. Организация домена.
[0115] CTL-эпитопы, по всей видимости, группируются в домене I, домене III, домене ТМ и в двух или трех «горячих точках» в домене TK. Как описано в патенте США № 7005498 и патенте США Пуб. № 2004/0141958 и № 2006/0008465, они должны быть в значительной степени сохранены.
[0116] Области с высокой степенью гомологии с другими рецепторами, вероятно, будут структурно важны для «общей» третичной структуры HER-2, и, следовательно, для распознавания антител, в то время как области с низкой гомологией, возможно, могут быть заменены только локальными модификациями структуры в результате этого.
[0117] Остатки цистеина часто участвуют в образовании внутримолекулярного дисульфидного мостика и, таким образом, участвуют в третичной структуре и не должны заменяться. Областей с прогнозируемым образованием альфа-спиральных или бета-складчатых структур следует избегать, поскольку, как полагают, точки вставки чужеродных эпитопов, как и эти области участвуют в складчатости протеина.
[0118] Потенциальные сайты N-гликозилирования следует сохранять, если желательным есть маннозилирование белка.
[0119] Области с прогнозируемой локализацией внутри молекулы (по их гидрофобных свойствах) предпочтительно должны быть сохранены, поскольку они могут участвовать в складчатости. В отличие от этого, области, обработанные растворителем, могли бы служить в качестве потенциальными позициями для вставки модели TH -эпитопов Р2 и Р30.
[0120] И, наконец, доменную организацию белка следует принимать во внимание из-за ее значимости для структуры и функции белков.
[0121] Как описано в патенте США № 7005498 и патенте США Пуб. № 2004/0141958 и № 2006/0008465, основная цель стратегии состоит в том, чтобы сохранить структуру внеклеточной части HER-2 насколько это возможно, поскольку это часть белка, которая представляет собой соответствующую мишень для нейтрализирующего антитела. В противоположность этому, внутриклеточная часть нативного мембраносвязанного HER-2 на поверхности раковых клеток является недоступном для гуморальной иммунной системы.
[0122] Различные типовые конструкции с использованием эпитопов столбнячного токсина Р2 и Р30, вставленных в различные домены HER-2, представлены в патенте США № 7005498 и патент США Пуб. № 2004/0141958 и № 2006/0008465. Один типовый модифицированный полипептидный антиген HER-2, называемый «mHER2», содержит внеклеточные домены и девять аминокислот трансмембранного домена; эпитоп Р2 вставляется в домен II между аминокислотными остатками от 273 до 287 модифицированного полипептида HER-2; а эпитоп Р30 вставляется в домен IV между аминокислотными остатками от 655 до 675 модифицированного полипептида HER-2.
Рекомбинантный MVA-BN-mHER2
[0123] В не ограничивающем варианте реализации изобретения рекомбинантный MVA, содержащий антиген, ассоциированный с опухолью, например, MVA-BN-mHER2, конструируется следующим образом. Исходный вирусный материал генерируется путем рекомбинации в культуре клеток с использованием типа клеток с возможностью репликации, например, клеток CEF. Клетки инокулируют аттенуированным вирусом осповакцины, например, MVA-BN, и трансфицируют рекомбинантной плазмидой (например, pBN279), которая кодирует антиген, ассоциированный с опухолью, например, mHER2, последовательность и фланкирующие области вирусного генома. В одном не ограничивающем варианте реализации изобретения плазмида pBN279 содержит последовательности, которые также присутствуют в MVA-BN (фланкирующая межгенная область между ORF 64 и 65, IGR 64/65). Последовательность mHER2 вставляется между последовательностями MVA-BN для обеспечения рекомбинации в вирусном геноме MVA-BN. В некоторых вариантах реализации изобретения плазмида также содержит кассету выбора, имеющую один или более генов выбора для обеспечения выбора рекомбинантных конструкций в клетках CEF. В предпочтительном варианте реализации изобретения рекомбинантный MVA кодирует полипептид, содержащий последовательность SEQ ID NO:2.
[0124] Одновременное инфецирование и трансфецирование культур позволяет гомологичной рекомбинации происходить между вирусным геномом и рекомбинационной плазмидой. Вставочно-несущий вирус затем изолируют, характеризуют и готовят вирусный материал. В некоторых вариантах реализации изобретения вирус пересевают в культуры клеток CEF в отсутствие отбора для обеспечения потери области, кодирующей гены выбора, GPT и mRFP1.
Антагонисты PD-1 и LAG-3
[0125] В некоторых вариантах реализации настоящее изобретение включает антагонисты PD-1 и LAG-3. Антагонисты PD-1 и LAG-3 препятствуют активности PD-1 и LAG-3, соответственно.
[0126] Такие антагонисты включают: антитела, которые специфически связываются с PD-1 или LAG-3 и ингибируют биологическую активность PD-1 или LAG-3; антисмысловые нуклеиновые кислоты РНК, которые препятствуют экспрессии PD-1 или LAG-3; малые интерферирующие РНК, которые препятствуют экспрессии PD-1, LAG-3; и низкомолекулярные ингибиторы PD-1 или LAG-3.
[0127] Потенциальные антагонисты PD-1 или LAG-3 могут быть проскринированы на функциональность с помощью различных методов, известных в данной области техники, и/или описаны в настоящей заявке, включая способность препятствовать ингибированию PD-1 или функционированию LAG-3 в мышиной модели in vitro.
Агонисты ICOS
[0128] Изобретение дополнительно охватывает агонисты ICOS. Агонист ICOS активирует ICOS. В одном варианте реализации изобретения агонист представляет собой ICOS-L, природный лиганд ICOS. Агонист может быть мутировавшей формой ICOS-L из сохраненными связывающими и активационными свойствами. Мутировавшие формы ICOS-L могут быть проскринированы на активность стимулирования ICOS in vitro.
[0129] Предпочтительно, агонист ICOS представляет собой антитело.
Антитела
[0130] В одном варианте реализации изобретения антагонист PD-1 или LAG-3 или агонист ICOS представляет собой антитело. Антитела могут быть синтетическими, моноклональными или поликлональными, и могут быть получены с помощью методов, хорошо известных в данной области техники. Такие антитела специфически связываются с PD-1, LAG-3 или ICOS с помощью антиген-связывающих сайтов антител (в отличие от неспецифического связывания). Полипептиды PD-1, LAG-3 или ICOS, фрагменты, варианты, химерные белки и т.д., могут быть использованы в качестве иммуногенов в производстве антител, иммунореактивных по отношению к ним. Более конкретно, полипептиды, фрагмент, варианты, химерные белки и т.д. содержат антигенные детерминанты или эпитопы, которые индуцируют образование антител.
[0131] Эти антигенные детерминанты или эпитопы могут быть линейными или конформационными (прерывистыми). Линейные эпитопы состоят из одной секции аминокислот полипептида, в то время как конформационные или прерывистые эпитопы состоят из секций аминокислот из разных областей полипептидной цепи, которые вводятся в непосредственной близости от складчатости белка (C. A. Janeway, Jr. and P. Travers, Immuno Biology 3:9 (Garland Publishing Inc., 2nd ed. 1996)). Поскольку складчатые белки имеют сложные поверхности, количество доступных эпитопов довольно большое; тем не менее, из-за конформации белка и стерических препятствий, количество антител, которые фактически связываются с эпитопами, меньше, чем количество доступных эпитопов (C. A. Janeway, Jr. and P. Travers, Immuno Biology 2:14 (Garland Publishing Inc., 2nd ed. 1996)). Эпитопы могут быть идентифицированы с помощью любого из способов, известных в данной области техники.
[0132] В настоящем изобретении предлагаются антитела, включающие фрагменты ScFv, которые специфически связываются с PD-1, LAG-3 или ICOS, и либо блокируют («антагонистические антитела») либо активируют их функции (агонистические антитела). Такие антитела могут быть получены с помощью обычных способов.
[0133] Настоящее изобретение охватывает моноклональные антитела против PD-1, LAG-3 или ICOS, которые блокируют ( «антагонистические антитела») или активируют их функции (агонистические антитела). Типовые блокирующие моноклональные антитела против PD-1, LAG-3 и ICOS описаны в WO 2012/131004 и WO 2011/041613, что включено в настоящий документ посредством ссылки.
[0134] Антитела способны связываться со своими мишенями с высокой авидностью и специфичностью. Это относительно большие молекулы (~ 150 кДа), которые могут стерически ингибировать взаимодействие между двумя белками (например, PD-1, LAG-3 или ICOS и его целевым лигандом), когда сайт связывания антитела находится в пределах непосредственной близости от сайта взаимодействия белок-белок. Настоящее изобретение дополнительно включает антитела, которые связываются с эпитопами в непосредственной близости к сайту связывания PD-1, LAG-3 или ICOS-лиганда.
[0135] В различных вариантах реализации настоящее изобретение включает антитела, которые препятствуют межмолекулярным взаимодействиям (например, взаимодействиям белок-белок), а также антитела, которые нарушают внутримолекулярные взаимодействия (например, конформационные изменения в молекуле). Антитела могут быть проскринированы на способность блокировать биологическую активность PD-1 или LAG-3, или связывать PD-1 или LAG-3 с лигандом и/или другие свойства. Агонистические антитела дополнительно могут быть проскринированы на способность активировать биологическую активность ICOS.
[0136] Как поликлональные, так и моноклональные антитела могут быть получены с помощью обычных методов.
[0137] PD-1, LAG-3, ICOS и пептиды на основе аминокислотной последовательности PD-1, LAG-3 и ICOS могут быть использованы для получения антител, которые специфически связываются с PD-1, LAG-3 или ICOS. Под термином «антитела» понимают поликлональные антитела, моноклональные антитела, их фрагменты, такие как F(ab')2 и Fab-фрагменты, одноцепочечные вариабельные фрагменты (scFvs), однодоменные фрагменты антител (VHHs или нанотела), двухвалентные фрагменты антител (диатела), а также любые рекомбинантные и синтетически полученные связывающие партнеры.
[0138] Антитела определяются как специфически связывающиеся, если они связывают полипептид PD-1, LAG-3 или ICOS с Ка больше или равно около 107 M-1. Аффинность связывания партнеров или антител может быть легко определена с использованием обычных методов, например, описанных Scatchard et al., Ann. N.Y. Acad. Sci., 51:660 (1949).
[0139] Поликлональные антитела могут быть легко получены из различных источников, например, лошадей, коров, коз, овец, собак, кур, кроликов, мышей или крыс, с использованием процедур, которые хорошо известны в данной области техники. В общем, очищенный PD-1, LAG-3, ICOS или пептид на основе аминокислотной последовательности PD-1, LAG-3 или ICOS, который соответствующим образом конъюгирован, вводят животному-хозяину, как правило, путем парентеральной инъекции. Иммуногенность PD-1, LAG-3 или ICOS может быть повышена за счет использования адъюванта, например, полного или неполного адъюванта Фрейнда. После бустер-иммунизации собирают небольшие образцы сыворотки и тестируют на реактивность к полипептиду PD-1, LAG-3 или ICOS. Примеры различных анализов, пригодные для такого определения, включают анализы, описанные в Antibodies: A Laboratory Manual, Harlow and Lane (eds.), Cold Spring Harbor Laboratory Press, 1988; а также процедуры, такие как противоточный иммуноэлектрофорез (CIEP), радиоиммуноанализ, радиоиммунопреципитация, иммуноферментные твердофазные анализы (ELISA), дот-блот анализы и сэндвич-анализы. См. патент США № 4376110 и № 4486530.
[0140] Моноклональные антитела могут быть легко получены с использованием хорошо известных процедур. См., например, процедуры, описанные в патенте США № RE 32011, 4902614, 4543439 и 4411993; Monoclonal Antibodies, Hybridomas: A New Dimension in Biological Analyses, Plenum Press, Kennett, McKeam, and Bechtol (eds.), 1980.
[0141] Например, животным-хозяевам, таким как мыши, можно вводить изолированный и очищенный пептид PD-1, LAG-3 или ICOS или конъюгированный пептид PD-1, LAG-3 или ICOS внутрибрюшинно по меньшей мере один раз, а, предпочтительно, по меньшей мере два раза приблизительно с 3-недельными интервалами, необязательно при наличии адъюванта. Мышиные сыворотки затем анализируют с помощью обычного метода дот-блот или иммобилизованного антитела (ABC), чтобы определить, какое животное лучше всего использовать. По истечению около двух-трех недель мышам вводят внутривенную бустерную дозу пептида PD-1, LAG-3 или ICOS или конъюгированного пептида PD-1, LAG-3 или ICOS. Позже мышей умерщвляли и проводили слияние клеток селезенки с коммерчески доступными клетками миеломы, такими как Ag8.653 (АТСС) в соответствии с установленными протоколами. Вкратце, клетки миеломы промывали несколько раз в среде и проводили слияние с клетками селезенки мыши в соотношении около трех клеток селезенки на одну миеломную клетку. Агентом слияния может быть любой пригодный агент, используемый в данной области техники, например, полиэтиленгликоль (ПЭГ).Материал слияния высевают в чашки, содержащие среду, которая обеспечивает селективный рост слитых клеток. Затем слитым клеткам дают возможность расти в течение около восьми дней. Супернатанты из полученных гибридом, собирают и добавляют в чашку, которую сначала покрывают козьим антимышиным Ig. После промывок метку, такую как меченый полипептид PD-1, LAG-3 или ICOS добавляют в каждую лунку с последующей инкубацией. Впоследствии могут быть обнаружены положительные лунки. Положительные клоны могут выращиваться в объемной культуре, а супернатанты затем очищаются с использованием колонки Protein A (Pharmacia).
[0142] Моноклональные антитела по изобретению могут быть получены с использованием альтернативных методов, таких как те, которые описаны Alting-Mees et al., "Monoclonal Antibody Expression Libraries: A Rapid Alternative to Hybridomas", Strategies in Molecular Biology 3:1-9 (1990), что включено в настоящий документ посредством ссылки. Аналогично, связывающие партнеры могут быть сконструированы с использованием технологии рекомбинантной ДНК для включения вариабельных областей гена, кодирующего специфическое связывающее антитело. Такой метод описан в Larrick et al., Biotechnology, 7:394 (1989).
[0143] Антигенсвязывающие фрагменты таких антител, которые могут быть получены традиционными методами, также охватываются настоящим изобретением. Примеры таких фрагментов включают, но не ограничиваются ими, фрагменты Fab и F(ab')2. Также предлагаются фрагменты антител и их производные, полученные методами генной инженерии.
[0144] Моноклональные антитела по настоящему изобретению включают химерные антитела, например, гуманизированные варианты мышиных моноклональных антител. Такие гуманизированные антитела могут быть получены известными методами и обеспечивают преимущество сниженной иммуногенности при введении таких антител человеку. В одном варианте реализации изобретения гуманизированное моноклональное антитело содержит вариабельную область мышиного антитела (или просто его антигенсвязывающий сайт) и константную область, полученную из человеческого антитела. В альтернативном варианте фрагмент гуманизированного антитела может содержать антигенсвязывающий сайт мышиного моноклонального антитела, и фрагмент вариабельной области (без антигенсвязывающего сайта), полученный из человеческого антитела. Процедуры получения химерных и дополнительно сконструированных моноклональных антител включают те, которые описаны в Riechmannet al. (Nature 332:323, 1988), Liu et al. (PNAS 84:3439, 1987), Larrick et al. (Bio/Technology 7:934, 1989), and Winter and Harris (TIPS 14:139, May, 1993). Процедуры получения антител трансгенным путем можно найти в патенте Великобритании 2272440, патенте США № 5569825 и № 5545806.
[0145] Могут использоваться антитела, произведенные с помощью методов генной инженерии, такие как химерные и гуманизированные моноклональные антитела, содержащие как человеческие, так и нечеловеческие участки, которые могут быть получены с использованием стандартных методик рекомбинантной ДНК. Такие химерные и гуманизированные моноклональные антитела могут быть получены методами генной инженерии с использованием стандартных методик рекомбинантной ДНК, известных в данной области техники, например, с использованием способов, описанных в Robinson et al. Номер международной публикации WO 87/02671; Akira, et al. Европейская патентная заявка 0184187; Taniguchi, M., Европейская патентная заявка 0171496; Morrison et al. Европейская патентная заявка 0173494; Neuberger et al. Номер международной публикации РСТ WO 86/01533; Cabilly et al. патент США № 4816567; Cabilly et al. Европейская патентная заявка 0125023; Better et al., Science 240:1041 1043, 1988; Liu et al., PNAS 84:3439 3443, 1987; Liu et al., J. Immunol. 139:3521 3526, 1987; Sun et al. PNAS 84:214 218, 1987; Nishimura et al., Canc. Res. 47:999 1005, 1987; Wood et al., Nature 314:446 449, 1985; и Shaw et al., J. Natl. Cancer Inst. 80:1553 1559, 1988); Morrison, S. L., Science 229:1202 1207, 1985; Oi et al., BioTechniques 4:214, 1986; Winter патент США № 5225539; Jones et al., Nature 321:552 525, 1986; Verhoeyan et al., Science 239:1534, 1988; and Beidler et al., J. Immunol. 141:4053 4060, 1988.
[0146] В части, касающейся использования терминов «синтетические и полусинтетические антитела», то такие термины предназначены для обозначения, но не ограничиваются ими, фрагментов антител, антител переключения изотипа, гуманизированных антител (например, мышь-человек, человек-мышь), гибридов, антител с множественной специфичностью и полностью синтетических антителоподобных молекул.
[0147] Для терапевтического применения «человеческие» моноклональные антитела, имеющие человеческие константные и вариабельные области, часто являются предпочтительными, с возможностью свести к минимуму иммунный ответ на антитело у пациента. Такие антитела могут быть получены путем иммунизации трансгенных животных, которые содержат человеческие иммуноглобулиновые гены. См. Jakobovits et al. Ann NY Acad Sci 764:525-535 (1995).
[0148] Человеческие моноклональные антитела против полипептидов PD-1, LAG-3 или ICOS могут быть также получены путем конструирования комбинаторной иммуноглобулиновой библиотеки, такой как библиотека фагового дисплея Fab или библиотека фагового дисплея ScFv с использованием иммуноглобулиновой легкой цепи и тяжелой цепи кДНК, полученных из мРНК, производной из лимфоцитов субъекта См., например, McCafferty et al. Публикация РСТ WO 92/01047; Marks et al. (1991) J. Mol. Biol. 222:581 597; и Griffths et al. (1993) EMBO J 12:725 734. Кроме того, комбинаторная библиотека вариабельные области антитела могут быть созданы с помощью мутации известного человеческого антитела. Например, вариабельная область человеческого антитела, известная своей способностью связывать PD-1, LAG-3 или ICOS, может быть подвергнута мутации, например, с использованием измененных случайным образом мутагенизированных олигонуклеотидов с целью создания библиотеки мутировавших вариабельных областей, которые затем могут быть проскринированы на способность связываться с PD-1, LAG-3 или ICOS. Способы индукции случайного мутагенеза в пределах областей CDR иммуноглобулиновых тяжелой и/или легкой цепей, способы пересечения случайным образом отобранных тяжелой и легкой цепей для формирования спариваний и спопобы скринингового анализа описаны, например, в Barbas et al. Публикация PCT WO 96/07754; Barbas et al. (1992) Proc. Nat'l Acad. Sci. USA 89:4457 4461.
[0149] Иммуноглобулиновая библиотека может быть экспрессирована дисплейными пакетами, предпочтительно полученными из нитевидного фага с целью формирования дисплейной библиотеки антител. Примеры способов и реагентов, особенно пригодных для использования в получении дисплейной библиотеки антител описаны, например, Ladner et al. патент США № 5223409; Kang et al. Публикации РСТ WO 92/18619; Dower et al. Публикация РСТ WO 91/17271; Winter et al. Публикация РСТ WO 92/20791; Markland et al. Публикация РСТ WO 92/15679; Breitling et al. Публикация РСТ WO 93/01288; McCafferty et al. Публикация РСТ WO 92/01047; Garrard et al. Публикация РСТ WO 92/09690; Ladner et al. Публикация РСТ WO 90/02809; Fuchs et al. (1991) Bio/Technology 9:1370 1372; Hay et al. (1992) Hum Antibod Hybridomas 3:81 85; Huse et al. (1989) Science 246:1275 1281; Griffths et al. (1993) supra; Hawkins et al. (1992) J Mol Biol 226:889 896; Clackson et al. (1991) Nature 352:624 628; Gram et al. (1992) PNAS 89:3576 3580; Garrad et al. (1991) Bio/Technology 9:1373 1377; Hoogenboom et al. (1991) Nuc Acid Res 19:4133 4137; и Barbas et al. (1991) PNAS 88:7978 7982. После отображения на поверхности дисплейного пакета (например, нитевидного фага), библиотеку антител скринируют для идентификации и изоляции пакетов, которые экспрессируют антитела, связывающие полипептид PD-1, LAG-3 или ICOS. В предпочтительном варианте реализации изобретения первичный скрининг библиотеки включает пэннинг с иммобилизованным полипептидом PD-1, LAG-3 или ICOS и дисплейными пакетами, экспрессирующими антитела, которые связывают выбранный иммобилизованный полипептид PD-1, LAG-3 или ICOS.
Типовые способы комбинированной терапии с применением рекомбинантного ортопоксвирус-экспрессирующего опухолевого антигена и агонистов/антагонистов PD-1, LAG-3 и ICOS
[0150] По меньшей мере в одном из аспектов настоящее изобретение относится к способам лечения с применением комбинации рекомбинантного ортопоксвируса и/или авипоксвируса, каждый из которых содержит нуклеиновую кислоту, кодирующую опухолевый антиген, с одним или более антителами, агонистами или антагонистами согласно изобретению.
[0151] В одном типовом варианте реализации изобретения пациентов с раком, опосредованным клетками, сверхэкспресирующими антиген HER-2, ассоциированный с опухолью, (например, рак молочной железы), можно лечить с помощью следующих комбинаций: 1) один или более рекомбинантных ортопоксвирусов, например, вирус осповакцины (например, Wyeth или MVA), кодирующий антиген HER-2 или 2) комбинация рекомбинантного ортопоксвируса и рекомбинантного авипоксвируса (например, вирус оспы кур, POXVAC-TC), кодирующего антиген HER-2; с комбинацией 1) или 2), вводимых совместно с одним или более антителами, агонистами и/или антагонистами согласно настоящему изобретению. В предпочтительном варианте реализации изобретения MVA представляет собой MVA-BN. В особенно предпочтительном варианте реализации изобретения рекомбинантный MVA кодирует полипептид, содержащий SEQ ID NO:2.
[0152] В дополнительных типовых вариантах реализации изобретения пациентов с раком предстательной железы можно лечить с помощью комбинации рекомбинантного ортопоксвируса, например вируса осповакцины (например, Wyeth или MVA), и рекомбинантного авипоксвируса (например, вирус оспы кур, POXVAC-TC), кодирующего антиген PSA и/или PAP, с одним или более антителами, агонистами и/или антагонистами согласно настоящему изобретению. В особенно предпочтительном варианте реализации изобретения комбинацией рекомбинантного вируса осповакцины и вируса оспы кур является PROSTVAC® (вирус осповакцины и вирус оспы кур, каждый из которых экспрессирует PSA и TRICOM), вводимая с одним или более антителами, агонистами и/или антагонистами согласно настоящему изобретению.
[0153] В еще одном дополнительном варианте реализации изобретения пациентов с раком, опосредованным клетками, сверхэкспресирующими антиген CEA и/или MUC-1, ассоциированный с опухолью, можно лечить с помощью комбинации рекомбинантного ортопоксвируса, например вируса осповакцины (например, Wyeth, MVA или MVA-BN), и рекомбинантного авипоксвируса (например, вирус оспы кур, POXVAC-TC), кодирующего антиген CEA и MUC-1, с одним или более антителами, агонистами и/или антагонистами согласно настоящему изобретению.Некоторые не ограничивающие примеры раковых заболеваний, опосредованных клетками с сверхэкспрессией СЕА и MUC-1, включают, но не ограничиваются ими, рак молочной железы, колоректальный рак, рак легких, рак желудка, рак поджелудочной железы, рак мочевого пузыря и рак яичников. В одном или более предпочтительных вариантах реализации изобретения комбинированная терапия включает CV301 (вирус осповакцины и вирус оспы кур, каждый из которых экспрессирует СЕА, MUC-1 и TRICOM).В другом предпочтительном варианте реализации изобретения комбинированная терапия включает MVA/вирус оспы кур-CV301, гетерологичный «прайм-буст», который включает MVA (или MVA-BN) и вирус оспы кур, каждый из которых экспрессирует CEA, MUC-1 и TRICOM.
[0154] В еще одном варианте реализации изобретения пациентов с раком, опосредованным клетками, сверхэкспресирующим антиген СЕА и/или MUC-1, ассоциированный с опухолью, можно лечить с помощью гомологичного «прайм-буст», кодирующего антигены СЕА и/или MUC-1, в комбинации с одним или более антителами, агонистами и/или антагонистами согласно настоящему изобретению. Предполагается, что два или более рекомбинантных ортопоксвирусов может быть вирусом осповакцины (например, Wyeth, MVA или MVA-BN). Некоторые не ограничивающие примеры раковых заболеваний, опосредованных клетками с сверхэкспрессией СЕА и MUC-1, включают, но не ограничиваются ими, рак молочной железы, колоректальный рак, рак легких, рак желудка, рак поджелудочной железы, рак мочевого пузыря и рак яичников. В одном или более предпочтительных вариантах реализации изобретения лечение может быть с применением MVA-CV301, которое включает два или более вируса MVA (или MVA-BN), каждый из которых экспрессирует СЕА, MUC-1 и TRICOM) и вводится как гомологичный «прайм-буст».
[0155] Рекомбинантный ортопоксвирус и/или авипоксвирус могут вводиться либо системно, либо местно, то есть, парентерально, подкожно, внутривенно, внутримышечно, интраназально, внутрикожно, скарификационно или с помощью любого другого пути введения, известного квалифицированному специалисту. Предпочтительным является скарификационное введение. Более предпочтительно подкожное или внутримышечное введение. В одном варианте реализации изобретения пациенту вводят 105-1010 TCID50 рекомбинантного ортопоксвируса и/или авипоксвируса. Предпочтительно, пациенту вводят 107-1010 TCID50 рекомбинантного ортопоксвируса и/или авипоксвируса. Более предпочтительно, пациенту вводят 108-1010 TCID50 рекомбинантного ортопоксвируса и/или авипоксвируса. Наиболее предпочтительно, пациенту вводят 108-109 TCID50 рекомбинантного ортопоксвируса и/или авипоксвируса.
[0156] Иммунный ответ можно индуцировать однократным введением рекомбинантного ортопоксвируса и/или авипоксвируса, как определено выше. Ортопоксвирус и/или авипоксвирус согласно настоящему изобретению также могут использоваться для первой вакцинации и для усиления иммунного ответа, сгенерированного при первой вакцинации, путем введения аналогичного или родственного рекомбинантного ортопоксвируса и/или авипоксвируса по отношению к тому, который использовался при первой вакцинации. Рекомбинантный ортопоксвирус и/или авипоксвирус согласно настоящему изобретению также может использоваться в гетерологичных режимах «прайм-буст», в которых одна или более прайм-вакцинаций производится ортопоксвирусом, как определено выше, и в которых одна или более бустер-вакцинаций производитсядругим типом вакцины, например, авипоксвирусом, как определено в настоящем документе, или другой вирусной вакциной, белковой или нуклеотидной вакциной.
[0157] Рак предпочтительно включает, но не ограничивается ими, рак молочной железы, колоректальный рак, рак легких, рак желудка, рак поджелудочной железы, рак мочевого пузыря, рак предстательной железы и рак яичников.
[0158] Пациентом с раком может быть любое млекопитающее, включая мышь или крысу. Предпочтительно, пациент с раком является приматом, наиболее предпочтительно - человеком.
[0159] В одном варианте реализации изобретения одно или более антител, агонистов или антагонистов согласно изобретению и ортопоксвирус, кодирующий полипептид, содержащий опухолевый антиген, вводят в одно и то же время. Комбинированное лечение превосходит какое-либо лечение монопрепаратом.
[0160] В предпочтительных вариантах реализации изобретения ортопоксвирус вводится не позднее чем через 1, 2, 3, 4, 5, 6 или 7 дней после введения агониста и/или антагониста. Ортопоксвирус можно вводить до или после введения агониста и/или антагониста.
[0161] Как правило, доза вводимого пациенту агониста или антагониста составляет от 0,1 мг/кг до 100 мг/кг веса тела пациента. Предпочтительно, доза, вводимая пациенту, составляет от 0,1 мг/кг до 20 мг/кг веса тела пациента, более предпочтительно - от 1 мг/кг до 10 мг/кг веса тела пациента, наиболее предпочтительно - от 3 мг/кг до 10 мг/кг веса тела пациента. Как правило, человеческие и гуманизированные антитела имеют более длительный период полураспада в организме человека по сравнению с антителами других видов из-за иммунного ответа на чужеродные полипептиды. Таким образом, возможно применение более низких доз человеческих антител и менее частое введение.
[0162] Количества активного ингредиента, необходимые для эффективной терапии, будут зависеть от многих различных факторов, включая способ введения, сайт-мишень, физиологическое состояние пациента, а также других вводимых лекарственных средств. Таким образом, для оптимизации безопасности и эффективности лечебные дозы следует титровать. Как правило, дозы, используемые in vitro, могут быть полезным ориентиром для количеств, пригодных для введения активных ингредиентов in situ. Испытания эффективных доз для лечения определенных расстройств у животных обеспечат дополнительный прогнозируемый показатель количества дозы для человека. Различныеаспектыописаны, например, в Goodman and Gilman's the Pharmacological Basis of Therapeutics, 7th Edition (1985), MacMillan Publishing Company, New York, and Remington's Pharmaceutical Sciences 18th Edition, (1990) Mack Publishing Co, Easton Pa. В нем обсуждаются способы введения, включая пероральный, внутривенный, внутрибрюшинный, внутримышечный, трансдермальный, назальный, введение с помощью ионофореза и тому подобные.
[0163] Композиции по настоящему изобретению могут вводиться в различных стандартных лекарственных формах в зависимости от способа введения. Например, стандартные лекарственные формы, пригодные для перорального введения включают твердые лекарственные формы, такие как порошок, таблетки, пилюли, капсулы, драже и жидкие лекарственные формы, такие как эликсиры, сиропы и суспензии. Активные ингредиенты также могут вводиться парентерально в стерильных жидких лекарственных формах. Желатиновые капсулы содержат активный ингредиент и в качестве неактивных ингредиентов - порошкообразные носители, такие как глюкоза, лактоза, сахароза, маннит, крахмал, целлюлоза или производные целлюлозы, стеарат магния, стеариновая кислота, сахарин натрия, тальк, карбонат магния и тому подобное. Примерами дополнительных неактивных ингредиентов, которые могут быть добавлены с целью обеспечения желаемого цвета, вкуса, стабильности, буферной емкости, дисперсии или других известных желательных характеристик, являются красный железооксидный краситель, силикагель, лаурилсульфат натрия, диоксид титана, съедобные белые чернила и тому подобное. Для получения прессованных таблеток могут использоваться аналогичные разбавители. Как таблетки, так и капсулы могут быть изготовлены как продукты замедленного высвобождения с целью обеспечения непрерывного высвобождения лекарственного средства в течение периода в нескольких часов. Прессованные таблетки могут покрываться сахаром или оболочкой для маскирования неприятного вкуса и защиты таблетки от влияния атмосферных факторов, или покрываться кишечнорастворимой оболочкой для селективного расщепления в желудочно-кишечном тракте. Жидкие лекарственные формы для перорального введения могут содержать красители и вкусовые добавки для повышения восприятия пациентом.
[0164] Концентрация композиций по настоящему изобретению в фармацевтических препаратах может широко варьировать, т.е. от менее чем около 0,1%, как правило, на уровне или по меньшей мере около 2% до не менее чем от 20% до 50% или более по весу, и будет выбираться в первую очередь по объемам жидкости, вязкости и т.п., согласно конкретно выбранному способу введения.
[0165] Для получения твердых композиций, могут быть использованы обычные нетоксичные твердые носители, которые включают, например, фармацевтические категирии маннита, лактозы, крахмала, стеарата магния, сахарина натрия, талька, целлюлозы, глюкозы, сахарозы, карбоната магния и тому подобное. Фармацевтически приемлемую нетоксичную композицию для перорального введения получают путем включения любого из обычно используемых вспомогательных веществ, таких как ранее перечисленные носители, и как правило, 10-95% активного ингредиента, то есть одна или более композиции согласно изобретению, и более предпочтительно - в концентрации 25%-75%.
[0166] Для аэрозольного введения композиции по настоящему изобретению предпочтительно доставляются в тонко измельченной форме вместе с сурфактантом и пропеллентом. Предпочтительные относительные количества композиций по настоящему изобретению составляют 0,01% -20% по весу, предпочтительно - 1-10%. Безусловно, сурфактант должен быть нетоксичными и предпочтительно - растворимым в пропелленте. Представителями таких агентов являются сложные эфиры или неполные сложные эфиры жирных кислот, содержащие от 6 до 22 атомов углерода, такие как капроновая, октановая, лауриновая, пальмитиновая, стеариновая, линолевая, линоленовая, олестеровая и олеиновая кислоты с алифатическим многоатомным спиртом или его циклическим ангидридом. Могут использоваться смешанные сложные эфиры, такие как смешанные или природные глицериды. Сурфактант может составлять 0,1% -20% по весу композиции, предпочтительно - 0,25-5%. Оставшейся частью композиции обычно является пропеллент. По желанию также может быть включен носитель, как в случае, например, с лецитином при интраназальном введении.
[0167] Конструкции согласно изобретению дополнительно могут доставляться в системе «депо-тип», инкапсулированной форме или имплантате с помощью методов, хорошо известных в данной области техники. Аналогичным образом, в ткани, представляющие интерес, конструкции могут доставляться с помощью насоса.
[0168] Любой из вышеуказанных составов может быть пригоден для лечения согласно настоящему изобретению, при условии, что активный агент в составе не инактивируется составом и состав является физиологически совместимым.
Терапевтические композиции и применение
[0169] Настоящее изобретение дополнительно относится к применению векторов ортопоксвируса и векторов авипоксвируса согласно изобретению для получения терапевтических композиций или вакцин, которые способны индуцировать или способствовать возникновению или улучшать иммунологическую реакцию на опухолевые эпитопы. Таким образом, в настоящем изобретении предлагаются вирусы или векторы, которые являются пригодными в качестве лекарственного средства или вакцины.
[0170] Соответственно, изобретение относится к иммуногенной композиции, содержащей вектор рекомбинантного ортопоксвируса (например, вируса осповакцины MVA или MVA-BN) и/или вектор рекомбинантного авипоксвируса согласно изобретению в комбинации с одним или более антителами, агонистами или антагонистами согласно настоящему изобретению.
[0171] Таким образом, вектор рекомбинантного ортопоксвируса и вектор рекомбинантного авипоксвируса согласно настящему изобретению могут быть использованы для получения терапевтической композиции или лекарственного средства для лечения рака.
[0172] Изобретение охватывает композицию для применения в профилактических и/или терапевтических режимах вакцинации для лечения опухолей и в особенности как противораковое средство.
[0173] В одном из вариантов реализации изобретение относится к композиции для введения или лечения пациента с раком, таким как, но не ограничиваясь ими, рак предстательной железы, рак молочной железы, колоректальный рак, рак легкого, рак желудка, рак поджелудочной железы, рак мочевого пузыря, или пациента с раком яичников.
[0174] В одном или более предпочтительных вариантах реализации настоящее изобретение охватывает применение композиции для введения или лечения пациента с раком, в частности, пациента с раком молочной железы или пациента с раком предстательной железы.
[0175] В одном варианте реализации изобретения композиция для одновременного или последовательного введения, содержащая вектор MVA согласно настоящему изобретению, и одно или более антител, агонистов или антагонистов согласно настоящему изобретению.
[0176] Композиции и способы, описанные в настоящем документе, дополнительно или в качестве альтернативного варианта могут включать одну или более иммуностимулирующих/регуляторных молекул. Может быть использована любая пригодная иммуностимулирующая/регуляторная молекула, такая как интерлейкин (IL)-2, IL-4, IL-6, IL-12, IL-15, IL-15/IL-15Ra, IL-15/IL-15Ra-Fc, интерферон (ИФН)-γ, фактор некроза опухолей (TNF)-α, B7.1, B7.2, ICAM-1, ICAM-2, LFA-1, LFA-2, LFA-3, CD70, CD-72, RANTES, G-CSF, GM-CSF, OX-40L, 41 BBL, анти-CTLA-4, ингибитор IDO, анти-PDL1, анти-PD1, а также их комбинации. Предпочтительно, композиция включает в себя комбинацию В7.1, ICAM-1 и LFA-3 (называемая также TRICOM). Одна или более иммуностимулирующих/регуляторных молекул могут вводиться в форме вектора (например, рекомбинантный вирусный вектор, такой как поксвирусный вектор), содержащий нуклеиновую кислоту, кодирующую одну или более иммуностимулирующих/регуляторных молекул. Например, одна или более иммуностимулирующих/регуляторных молекул (например, IL-12) могут вводиться в форме плазмиды ДНК с хитозаном или без него.
[0177] В более предпочтительном варианте реализации изобретения, в дополнение к содержанию по меньшей мере одного опухолевого антигена, рекомбинантный ортопоксвирус и/или рекомбинантный авипоксвирус включают одну или более нуклеиновых кислот, кодирующих комбинацию В7.1, ICAM-1 и/или LFA-3 (называемую также TRICOM).
[0178]
ПРИМЕРЫ
Пример 1
Конструкция MVA-BN-mHER2
[0179] Одновременное инфецирование и трансфецирование культур позволяет происходить гомологичной рекомбинации между вирусным геномом и рекомбинационной плазмидой. Вставочно-несущий вирус изолировали, характеризовали и готовили вирусный материал.
[0180] Плазмида pBN279 содержит последовательности, которые также присутствуют в MVA-BN (межгенная область между ORF 64 и 65, IGR 64/65). Последовательность mHER2 вставлялась между последовательностями MVA-BN для обеспечения рекомбинации в вирусном геноме MVA-BN. Таким образом, была сконструирована плазмида, которая содержала последовательность mHER2 после поксвирусного промотора, в частности синтетического промотора вируса осповакцины (PrS). Плазмида также содержала кассету выбора, имеющую промотор PrS перед геном лекарственной устойчивости (гуанин-ксантин фосфорибозилтрансфераза; EcoGPT) и промотор PrS перед мономерным красным флуоресцентным протеином 1 (mRFP1).
[0181] Последовательность HER-2 была модифицирована путем добавления нуклеотидов, кодирующих последовательностей эпитопы р2 и Р30 столбнячного токсина для повышения иммунного ответа против него (mHER2). После вставки mHER2 в геном MVA-BN и удаления кассеты выбора «вставочная область» вируса приобрела следующую структуру (показано в противоположной ориентации по сравнению с окружающей вирусной рамкой считывания):
Промотор PrS - последовательность mHER2. Область вставки фланкирована последовательностями 64/65 межгенной области MVA-BN (Фланк 1 (64) и Фланк 2 (65)), как в бактериальной рекомбинации плазмиды pBN279. Нуклеотидная последовательность конструкции показана ниже.
1 AAAAAAATAA TAATTAACCA ATACCAACCC CAACAACCGG TATTATTAGT TGATGTGACT GTTTTCTCAT
71 CACTTAGAAC AGATTTAACA ATTTCTATAA AGTCTGTCAA ATCATCTTCC GGAGACCCCA TAAATACACC
141 AAATATAGCG GCGTACAACT TATCCATTTA TACATTGAAT ATTGGCTTTT CTTTATCGCT ATCTTCATCA
211 TATTCATCAT CAATATCAAC AAGTCCCAGA TTACGAGCCA GATCTTCTTC TACATTTTCA GTCATTGATA
281 CACGTTCACT ATCTCCAGAG AGTCCGATAA CGTTAGCCAC CACTTCTCTA TCAATGATTA GTTTCTTGAG
351 TGCGAATGTA ATTTTTGTTT CCGTTCCGGA TCTATAGAAG ACGATAGGTG TGATAATTGC CTTGGCCAAT
421 TGTCTTTCTC TTTTACTGAG TGATTCTAGT TCACCTTCTA TAGATCTGAG AATGGATGAT TCTCCAGTCG
491 AAACATATTC TACCATGGAT CCGTTTAATT TGTTGATGAA GATGGATTCA TCCTTAAATG TTTTCTCTGT
561 AATAGTTTCC ACCGAAAGAC TATGCAAAGA ATTTGGAATG CGTTCCTTGT GCTTAATGTT TCCATAGACG
631 GCTTCTAGAA GTTGATACAA CATAGGACTA GCCGCGGTAA CTTTTATTTT TAGAAAGTAT CCATCGCTTC
701 TATCTTGTTT AGATTTATTT TTATAAAGTT TAGTCTCTCC TTCCAACATA ATAAAAGTGG AAGTCATTTG
771 ACTAGATAAA CTATCAGTAA GTTTTATAGA GATAGACGAA CAATTAGCGT ATTGAGAAGC ATTTAGTGTA
841 ACGTATTCGA TACATTTTGC ATTAGATTTA CTAATCGATT TTGCATACTC TATAACACCC GCACAAGTCT
911 GTAGAGAATC GCTAGATGCA GTAGGTCTTG GTGAAGTTTC AACTCTCTTC TTGATTACCT TACTCATGAT
981 TAAACCTAAA TAATTGTACT TTGTAATATA ATGATATATA TTTTCACTTT ATCTCATTTG AGAATAAAAA
1051 TGGAATTCCT GCAGCCCGGG GGATCCTTAA TTAACTGGGT ACCCAAGGCC TTGGGTTTGG GGGATCCTTA
1121 ATTAACTGGG TACCGGGCCC CCCCTCGAGG TCGACGGTAT CGATAAGCTT GATGGCCGCC ACTGTGCTGG
1191 ATATCTGCAG AATTCCACCA CACTGGACTA GTGGATCCGA GCTCGGTACC AAGCTTCTAC AGAATGCCAA
1261 CCACCGCAGA GACGATCTCC AGGTGGCTGG CGCTCACCTT GGGCACGCGC AGCCAGAAGC TCACGGTGAA
1331 GTTGTTGAAG GACGTCAGAG GGCTGGCTCT CTGCTCGGCG GGGCAGCCCT TGTCATCCAG GTCCACACAG
1401 GAGTGGGTGC AGTTGATGGG GCAAGGCTGG CATGCGCCCT CCTCATCTGG AAACTTCCAG ATGGGCATGT
1471 AGGAGAGGTC AGGTTTCACA CCGCTGGGGC AGCGGGCCAC GCAGAAGGGA GGGTCCTTAT AGTGGGCACA
1541 GGCCACACAC TGGTCAGCCT CCGGTCCAAA ACAGGTCACT GAGCCATTCT GGGGCTGACA CTCAGGGTGG
1611 CACGGCAAAC AGTGCCTGGC ATTCACATAC TCCCTGGGGA GCCCCTGCAG TACTCGGCAT TCCTCCACGC
1681 ACTCCTGGCC CCGAAGGAAC TGGCTGCAGT TGACACACTG GGTGGGCCCT GGACCCCAGC AGTGCCCTCG
1751 GGCGCACAGC TGGTGGCAGG CCAGGCCCTC GCCCACACAC TCGTCCTCTG GCCGGTTGGC AGTGTGGAGC
1821 AGAGCTTGGT GCGGGTTCCG AAAGAGCTGG TCCCAGGGCA CCGTGTGCAC GAAGCAGAGG TGGGTGTTAT
1891 GGTGGATGAG GGCCAGTCCA CTGCCCAGTT CCCTCAGTGA GCGCAGCCCC AGCCAGCTGA TGCCCAGCCC
1961 TTGCAGGGTC AGCGAGTAGG CGCCATTGTG CAGAATTCGT CCCCGGATTA CTTGCAGGTT CTGGAAGACG
2031 CTGAGGTCAG GCAGGCTGTC CGGCCATGCT GAGATGTATA GGTAACCTGT GATCTCTTCC AGAGTCTCAA
2101 ACACTTGGAG CTGCTCTGGC TGGAGCGGGG CAGTGTTGGA GGCTGGGTCC CCATCAAAGC TCTCCGGCAG
2171 AAATGCCAGG CTCCCAAAGA TCTTCTTGCA GCCAGCAAAC TCCTGGATAT TGGCACTGGT AACTGCCCTC
2241 ACCTCTCGCA AGTGCTCCAT GCCCAGACCA TAGCACACTC GGGCACAGGG CTTGCTGCAC TTCTCACACC
2311 GCTGTGTTCC ATCCTCTGCT GTCACCTCTT GGTTGTGCAG GGGGCAGACG AGGGTGCAGG ATCCCACGTC
2381 CGTAGAAAGG TAGTTGTAGG GACAGGCAGT CACACAGCTG GCGCCGAATG TATACCGCAG CTCGGTGATA
2451 CCGATGAATT TGGAGTTAGC TTTGATGTAC TGGACCAGGG CTGGGCAGTG CAGCTCACAG ATGCCACTGT
2521 GGTTGAAGTG GAGGCAGGCC AGGCAGTCAG AGTGCTTGGG GCCCGTGCAG CCGGCAGCAC ACTGCTCATG
2591 GCAGCAGTCA GTGGGCAGTG GCCCCTTGCA GCGGGCACAG CCACCGGCAC AGACAGTGCG CGTCAGGCTC
2661 TGACAATCCT CAGAACTCTC TCCCCAGCAG CGGGAGCCCT TACACATCGG AGAACAGGGG TGGCAGGCCC
2731 GAGAGCGGTT GGTGTCTATC AGTGTGAGAG CCAGCTGGTT GTTCTTGTGG AAGATGTCCT TCCACAAAAT
2801 CGTGTCCTGG TAGCAGAGCT GGGGGTTCCG CTGGATCAAG ACCCCTCCTT TCAAGATCTC TGTGAGGCTT
2871 CGAAGCTGCA GCTCCCGCAG GCCTCCTGGG GAGGCCCCTG TGACAGGGGT GGTATTGTTC AGCGGGTCTC
2941 CATTGTCTAG CACGGCCAGG GCATAGTTGT CCTCAAAGAG CTGGGTGCCT CGCACAATCC GCAGCCTCTG
3011 CAGTGGGACC TGCCTCACTT GGTTGTGAGC GATGAGCACG TAGCCCTGCA CCTCCTGGAT ATCCTGCAGG
3081 AAACTTAAGC TGGCATTGGT GGGCAGGTAG GTGAGTTCCA GGTTTCCCTG CACCACCTGG CAGCCCTGGT
3151 AGAGGTGGCG GAGCATGTCC AGGTGGGTCT CGGGACTGGC AGGGAGCCGC AGCTTCATGT CTGTGCCGGT
3221 GCACACTTGG GTGCTCGCGG CTCCGGGGGG CAAGAGGGCG AGGAGGAGCC CCCAGCGGCA CAAGGCCGCC
3291 AGCTCCATGG TGGCGGCTAG ATCGAATTCC TGCAGCCCAA ACCCGATTTA AATTGGCGCC CGTACGGAAG
3361 ATCTTCGACG TCTAAGCGGC CGCAATAGCT AGCTAGTCCG GATATTTATA TTCCAAAAAA AAAAAATAAA
3431 ATTTCAATTT TTGTTTAAAC ACGCGTTCTA GATTTTGTTT AACCACTGCA TGATGTACAG ATTTCGGAAT
3501 CGCAAACCAC CAGTGGTTTT ATTTTATCCT TGTCCAATGT GAATTGAATG GGAGCGGATG CGGGTTTCGT
3571 ACGTAGATAG TACATTCCCG TTTTTAGACC GAGACTCCAT CCGTAAAAAT GCATACTCGT TAGTTTGGAA
3641 TAACTCGGAT CTGCTATATG GATATTCATA GATTGACTTT GATCGATGAA GGCTCCCCTG TCTGCAGCCA
3711 TTTTTATGAT CGTCTTTTGT GGAATTTCCC AAATAGTTTT ATAAACTCGC TTAATATCTT CTGGAAGGTT
3781 TGTATTCTGA ATGGATCCAC CATCTGCCAT AATCCTATTC TTGATCTCAT CATTCCATAA TTTTCTCTCG
3851 GTTAAAACTC TAAGGAGATG CGGATTAACT ACTTGAAATT CTCCAGACAA TACTCTCCGA GTGTAAATAT
3921 TACTGGTATA CGGTTCCACC GACTCATTAT TTCCCAAAAT TTGAGCAGTT GATGCAGTCG GCATAGGTGC
3991 CACCAATAAA CTATTTCTAA GACCGTATGT TCTGATTTTA TCTTTTAGAG GTTCCCAATT CCAAAGATCC
4061 GACGGTACAA CATTCCAAAG ATCATATTGT AGAATACCGT TACTGGCGTA CGATCCTACA TATGTATCGT
4131 ATGGTCCTTC CTTCTCAGCT AGTTCACAAC TCGCCTCTAA TGCACCGTAA TAAATGGTTT CGAAGATCTT
4201 CTTATTTAGA TCTTGTGCTT CCAGGCTATC AAATGGATAA TTTAAGAGAA TAAACGCGTC CGCTAATCCT
4271 TGAACACCAA TACCGATAGG TCTATGTCTC TTATTAGAGA TTTCAGCTTC TGGAATAGGA TAATAATTAA
4341 TATCTATAAT TTTATTGAGA TTTCTGACAA TTACTTTGAC CACATCCTTC AGTTTGAGAA AATCAAATCG
4411 CCCATCTATT ACAAACATGT TCAAGGCAAC AGATGCCAGA TTACAAACGG CTACCTCATT AGCATCCGCA
4481 TATTGTA
(SEQ ID NO:1).
[0182] Инициирующий и терминирующий кодоны НER2 выделены полужирным шрифтом. Фланкирующие последовательности выделены курсивом. Фланк 1 (64): 451-1052, подчеркнутый HER2: 3298-1247 (полужирный), инициирующий: 3298-3296 (полужирный+подчеркнутый), терминирующий: 1249-1247 (полужирный+подчеркнутый), промотор PrS: 3442-3403 (курсив+подчеркнутый), Фланк (65): 3463-4065 (подчеркнутый).
[0183] Трансляция кодируемого полипептида mHER2 приведена ниже:
MELAALCRWGLLLALLPPGAASTQVCTGTDMKLRLPASPETHLDMLRHLYQGCQVVQGNL
ELTYLPTNASLSFLQDIQEVQGYVLIAHNQVRQVPLQRLRIVRGTQLFEDNYALAVLDNG
DPLNNTTPVTGASPGGLRELQLRSLTEILKGGVLIQRNPQLCYQDTILWKDIFHKNNQLA
LTLIDTNRSRACHPCSPMCKGSRCWGESSEDCQSLTRTVCAGGCARCKGPLPTDCCHEQC
AAGCTGPKHSDCLACLHFNHSGICELHCPALVQYIKANSKFIGITELRYTFGASCVTACP
YNYLSTDVGSCTLVCPLHNQEVTAEDGTQRCEKCSKPCARVCYGLGMEHLREVRAVTSAN
IQEFAGCKKIFGSLAFLPESFDGDPASNTAPLQPEQLQVFETLEEITGYLYISAWPDSLP
DLSVFQNLQVIRGRILHNGAYSLTLQGLGISWLGLRSLRELGSGLALIHHNTHLCFVHTV
PWDQLFRNPHQALLHTANRPEDECVGEGLACHQLCARGHCWGPGPTQCVNCSQFLRGQEC
VEECRVLQGLPREYVNARHCLPCHPECQPQNGSVTCFGPEADQCVACAHYKDPPFCVARC
PSGVKPDLSYMPIWKFPDEEGACQPCPINCTHSCVDLDDKGCPAEQRASPLTSFNNFTVS
FWLRVPKVSASHLEIVSAVVGIL.
(SEQ ID NO:2).
[0184] Последовательности эпитопов столбнячного токсина p2 и p30 выделены полужирным шрифтом.
[0185] Культуры CEF инокулировали MVA-BN, а также трансфицировали плазмидной ДНК pBN279. В свою очередь, образцы этих клеточных культур инокулировали в культуры CEF в среде, содержащей препараты выбора, а mRFP1-экспрессирующие вирусные клоны изолировали с помощью очистки бляшек. Вирусный материал, выращенный в присутствии препаратов выбора и экспрессирующий mRFP1, называется MVA-BN-mHER2. Генерация MVA-BN-mHER2 и приготовление вирусного материала включали девять (9) последовательных пассажей, в том числе четыре (4) очистки бляшки.
[0186] MVA-BN-mHER2 пересевали в культуры клеток CEF в отсутствие препаратов выбора. Отсутствие препаратов выбора позволило потерять область, кодирующую гены выбора, gpt и mRFP1 и ассоциированные промоторы (кассета выбора) из встроенной последовательности. Рекомбинация приводит к потере кассеты выбора, опосредованной областью Фланк 1 (F1) и частью этой области, повтором F1 (F1 rpt), который фланкирует кассеты выбора в плазмиде pBN279. Эти дублирующие последовательности были включены для опосредования рекомбинации, что приводит к потере кассеты выбора, оставляя только последовательность mHER2, вставленную в межгенную область 64/65.
[0187] Была получена кассета выбора без вируса, очищенного от бляшек. Такое приготовление включает пятнадцать (15) пассажей, в том числе пять (5) очисток бляшек.
[0188] Наличие последовательности mHER2 и отсутствие родительского вируса MVA-BN в материале MVA-BN-mHER2 подтверждались анализом ПЦР, и гнездовую ПЦР использовали для верификации отсутствия кассеты выбора (гены gpt и mRFP1).
[0189] Экспрессия белка mHER2 была продемонстрирована в клетках, инокулированных с MVA-BN-mHER2 in vitro.
Пример 2
Индуцирование противоопухолевого ответа у мышей, получавших MVA-BN-HER2 и антитела
[0190] Самки мышей BALB/с (в возрасте 6-8 недель, ~20 г) были приобретены у Simonsen Laboratories, Гилрой, Калифорния. Для экспериментальной модели легочных метастазов мышам имплантировали внутривенно 5,0×104 CT26-HER-2 клеток в 300 мкл DPBS, с помощью чего формировали опухоли в легких. В модели солидной опухоли, мышам внутрикожно имплантировали в спину 1,0×105 CT26-HER-2 клеток в 100 мкл DPBS. Опухоли измеряли два раза в неделю, а объем опухоли рассчитывали по формуле: объем опухоли (мм3)=(длина × ширина2)/2.
[0191] Следующие антитела были приобретены у Bio X Cell (Запад, Лебанон, Нью-Хэмпшир): анти-ICOS (Clone 17G9), анти-CTLA-4 (9D9), анти-PD-1 (RMP1-14) и анти-LAG- 3 (C9B7W). Все антитела вводили внутрибрюшинно в концентрации 200 мкг на мышь в 100 мкл PBS в дни, указанные в условных обозначениях к фигурам. При лечении вирусами мышам вводили 7,1 мкл 1,0×107 инф. ед. MVA-BN-mHER2 путем скарификации хвоста (с.х., произведенный Bavarian Nordic [BN], Мартинсрид, Германия).
[0192] Сывороточные титры антител определяли с помощью ELISA, а ИФН-γ - с помощью ELISPOT, как описано в Mandl et al., Cancer Immunol Immunother (2012) 61:19-29. Цельную кровь, селезенку и легкие отбирали для анализа FACS. Легкие разрезали на фрагменты размером 1-2 мм и инкубировали в течение 1 ч при температуре 37°С в среде DMEM с добавлением 10% FBS, 50 ед/мл ДНКазы I и 250 ед/мл коллагеназы I (Worthington Biochemical Corporation, Лейквуд, Нью-Джерси). Эритроциты из легких, селезенки, а также в цельной крови лизировали, а суспензии отдельных клеток окрашивали согласно стандартным протоколам антителами, приобретенными у BioLegend (Сан-Диего, Калифорния): CD3e (145-2c11 или 500A2), CD4 (RM4-5), CD8 (53-6.7), CD278 (ICOS, 7E.17G9), CD279 (PD-1, 29F.1AA12) и CD223 (LAG-3, C9B7W). Регуляторные Т-клетки идентифицировали с использованием FoxP3/Набора транскрипционного фактора, окрашивающего буфер, и антитела FoxP3 (FJK-16s) согласно инструкций изготовителя (eBioscience, Сан-Диего, Калифорния).
[0193] Весь статистический анализ проводили, как описано в условных обозначениях к фигурам, используя GraphPad Prism, версия 6.01 для Windows (GraphPad Software, Ла-Холья, Калифорния).
Пример 3
Лечение с применением MVA-BN-HER2 повышает уровень ICOS на CD8+ и CD4+Т-клетках
[0194] Наивным мышам без опухолей вводили MVA-BN-mHER2 (1E7 инф.ед., с.х.) в день 1 или дни 1 и 15. Органы от 3 мышей в каждый момент времени. Как продемонстрировано на Фигуре 1, лечение с применением MV-BN-mHER2 повышало экспрессию ICOS на CD8+ и CD4+ Т-клетках.
Пример 4
Индуцирование противоопухолевого ответа у мышей, получавших MVA-BN-HER2 с анти-ICOS.
[0195] Мышам Balb/c внутрикожно в день 1 имплантировали клетки 1E5 CT26-HER2. Мышам вводили 1E7 инф.ед. MVA-BN-mHER2 путем скарификации хвоста (с.х.) в дни 1 и 15, и анти-ICOS - в дни 1, 4, 8, 11, 15, 18, 22 и 25 (200, мкг внутрибрюшинно). **, р <0,01, **** р <0,0001, Повторные измерения: двухфакторный дисперсионный анализ (ANOVA) с апостериорным критерием множественного сравнения Тьюки. Как продемонстрировано на Фигуре 2, объем опухоли достоверно уменьшился при применении MVA-BN-mHER2 с анти-ICOS по сравнению с монотерапией MVA-BN-mHER2.
Пример 5
Индуцирование противоопухолевого ответа у мышей, получавших MVA-BN-HER2 с анти-CTLA-4.
[0196] В экспериментальной модели легочных метастазов CT26-HER-2 мышам в день 1 внутривенно имплантировали клетки 5E4 CT26-HER-2, с помощью чего формировали опухоли в легких. Мышам вводили MVA-BN-mHER2 (1E7 инф.ед., с.х.) в дни 4 и 18 и анти-CTLA-4 (200 мкг, внутрибрюшинно) - в дни 3 и 17. **** р <0,0001, логранговый критерий.Как продемонстрировано на Фигуре 3, лечение с применением MVA-BN-mHER2 и анти-CTLA-4 было эффективным с увеличением показателя общей выживаемости.
Пример 6
MVA-BN-HER2 достоверно уменьшает опухолевую нагрузку в легких на день 25.
[0197] В день 1 мышам внутривенно имплантировали клетки 5E4 CT26-HER-2, которые формируют опухоли в легких. Мышам вводили MVA-BN-mHER2 (1E7 инф.ед., с.х.) в дни 4 и 18 и анти-CTLA-4 (200 мкг, внутрибрюшинно) - в дни 3 и 17. А) На день 25 мышей умерщвляли и перфузириовали через трахею трипановым синим. Легких удаляли, на короткое время погружали в перекись водорода и промывали в PBS. У мышей, не получавших лечения и пролеченных анти-CTLA-4, опухоли просматривались как небольшие массы. Каких-либо видимых опухолей в легких у мышей, получавших MVA-BN-mHER2, не было. Масштабная метка составляет 1 см. B) Вес легких на день 25. **** р <0,0001, однофакторный дисперсионный анализ (ANOVA) с критерием множественного сравнения Даннетта. Результаты приведены на Фигуре 4.
Пример 7
Уровень ICOS в легких повышается при лечении MVA-BN-HER2 или легочных опухолях
[0198] В день 1 мышам внутривенно имплантировали клетки 5E4 CT26-HER-2, которые формируют опухоли в легких. Мышам вводили MVA-BN-mHER2 (1E7 инф.ед., с.х.) в дни 4 и 18 и анти-CTLA-4 (200 мкг, внутрибрюшинно) - в дни 3 и 17. Органы у 3 мышей собирали для анализа в каждой временной точке (А и В). Данные представлены как средние значения ±СОС из трех независимых экспериментов с 3-4 мышей на группу (C и D). Как продемонстрировано на Фигуре 5, уровень ICOS в легких повышается при лечении с применением MVA-BN-mHER2.
Пример 8
У мышей с опухолью ICOS+ CD4+ Т-клетки являются FoxP3+
[0199] В день 1 мышам внутривенно имплантировали клетки 5E4 CT26-HER-2, которые формируют опухоли в легких. Мышам вводили MVA-BN-mHER2 (1E7 инф.ед., с.х.) в дни 4 и 18 и анти-CTLA-4 (200 мкг, внутрибрюшинно) - в дни 3 и 17. Органы у 3 мышей собирали для анализа в каждой временной точке (А и В). Данные представлены как средние значения ±СОС из трех независимых экспериментов с 3-4 мышей на группу (C и D). Как продемонстрировано на Фигуре 6, экспрессия ICOS увеличилась как в клетках FoxP3+ Treg и FoxP3- Teff опухоленесущего контроля, так и у мышей, получавших анти-CTLA-4, у которых опухолевая нагрузка была высокой. Уровень ICOS увеличился только на клетках FoxP3- Teff после лечения MVA-BN-mHER2 и отмечался более выраженным при последующей комбинации с анти-CTLA-4.
Пример 9
MVA-BN-HER2 с анти-CTLA-4 повышают соотношение эффекторных к регуляторным Т-клеткам.
[0200] В день 1 мышам внутривенно имплантировали клетки 5E4 CT26-HER-2, которые формируют опухоли в легких. Мышам вводили MVA-BN-mHER2 (1E7 инф.ед., с.х.) в дни 4 и 18 и анти-CTLA-4 (200 мкг, внутрибрюшинно) - в дни 3 и 17. Органы у 3 мышей собирали для анализа в каждой временной точке (А и В). Данные представлены как средние значения ±СОС из трех независимых экспериментов с 3-4 мышей на группу (C и D). Как продемонстрировано на Фигуре 7, лечение с применением MVA-BN-mHER2 и анти-CTLA-4 увеличивало соотношение как CD8, так и CD4 эффекторных Т-клеток к регуляторным Т-клеткам в месте опухоли, а также в селезенке и крови.
Пример 10
Экспрессия PD-1 увеличивается при лечении MVA-BN-HER2
[0201] Наивным мышам без опухолей вводили MVA-BN-HER2 (1E7 инф.ед., с.х.) в день 1 или дни 1 и 15. Органы от 3 мышей в каждый момент времени. Как продемонстрировано на Фигуре 8, лечение с применением MV-BN-mHER2 повышало экспрессию PD-1 на CD8+ и CD4+ Т-клетках.
Пример 11
Индуцирование противоопухолевого ответа у мышей, получавших MVA-BN-HER2 и анти-PD1
[0202] Мышам Balb/c внутрикожно в день 1 имплантировали клетки 1E5 CT26-HER2. Мышам вводили 1E7 инф.ед. MVA-BN-mHER2 путем скарификации хвоста (с.х.) в дни 1 и 15, и анти-PD1 - в дни 1 и 15 (200 мкг, внутрибрюшинно). **** p <0,0001, Повторные измерения: двухфакторный дисперсионный анализ (ANOVA) с апостериорным критерием множественного сравнения Тьюки. Как продемонстрировано на Фигуре 9, объем опухоли достоверно уменьшился при применении MVA-BN-mHER2 с анти-PD1 по сравнению с монотерапией анти-PD-1, а выживаемость достоверно увеличилась по сравнению с монотерапией MVA-BN-mHER2.
Пример 12
Иммунный ответ LAG-3 на MVA-BN-HER2
[0203] Наивным мышам без опухолей вводили MVA-BN-mHER2 (1E7 инф.ед., с.х.) в день 1 или дни 1 и 15. Органы от 3 мышей в каждый момент времени. На Фигуре 10 продемонстрирована экспрессия LAG-3 на CD8+ и CD4+ Т-клетках.
Пример 13
Индуцирование противоопухолевого ответа у мышей, получавших MVA-BN-HER2 и анти-LAG-3
[0204] Мышам Balb/c внутрикожно в день 1 имплантировали клетки 1E5 CT26-HER2. Мышам вводили 1E7 инф.ед. MVA-BN-mHER2 путем скарификации хвоста (с.х.) в дни 1 и 15, и анти-LAG-3 - в дни 1 и 15 (200 мкг, внутрибрюшинно). **** p <0,0001, Повторные измерения: двухфакторный дисперсионный анализ (ANOVA) с апостериорным критерием множественного сравнения Тьюки. Как продемонстрировано на Фигуре 11, лечение с применением MVA-BN-mHER2 в комбинации с анти-LAG3 увеличивало общую выживаемость по сравнению с монотерапией MVA-BN-mHER2 и монотерапией анти-LAG3.
Пример 14
Индуцирование противоопухолевого ответа у мышей, получавших MVA-BN-HER2, анти-PD-1 и анти-LAG-3
[0205] Мышам Balb/c внутрикожно в день 1 имплантировали клетки 1E5 CT26-HER2. На Фигуре 12 мышам вводили 1E7 инф.ед. MVA-BN-mHER2 путем скарификации хвоста (с.х.) в дни 1 и 15, и анти-PD1 и анти-LAG-3 - в дни 1 и 15 (по 200 мкг каждого, внутрибрюшинно) На Фигуре 13 мышам вводили 1E7 инф.ед. MVA-BN-mHER2 путем с.х. в дни 4 и 18, и анти-PD-1и анти-LAG-3 - в дни 4 и 18 (200 мкг, внутрибрюшинно). **** p <0,0001, Повторные измерения: двухфакторный дисперсионный анализ (ANOVA) с апостериорным критерием множественного сравнения Тьюки. Как продемонстрировано на Фигурах 12 и 13, лечение с применением MVA-BN-mHER2 в комбинации с анти-PD1 и анти-LAG3 уменьшало объем опухоли (Фигура 12А и 13А) и увеличивало показатель общей выживаемости (Фигура 12В и 13В) по сравнению с монотерапией MVA-BN-mHER2 и монотерапией анти-PD1 и анти-LAG3.
Пример 15
Индуцирование противоопухолевого ответа у мышей, получавших MVA-BN-HER2, анти-PD-1 и анти-LAG-3
[0206] В экспериментальной модели легочных метастазов CT26-HER-2 мышам в день 1 внутривенно имплантировали клетки 5E4 CT26-HER-2, с помощью чего формировали опухоли в легких. Мышам вводили MVA-BN-mHER2 (1E7 инф.ед., с.х.) в дни 4 и 18 и анти-PD-1 и анти-LAG-3 (по 200 мкг каждого, внутрибрюшинно) - в дни 4 и 18. * P <0,05, *** p <0,001, логранговый критерий.Как продемонстрировано на Фигуре 14, лечение с применением MVA-BN-mHER2 в комбинации с анти-PD-1 и анти-LAG3 увеличивало показатель общей выживаемости по сравнению с монотерапиейанти-PD-1 и анти-LAG3.
Пример 16
Ответ ELISPOT MVA
[0207] Мышам Balb/c внутрикожно в день 1 имплантировали клетки 1E5 CT26-HER2. Мышам вводили 1E7 инф.ед. MVA-BN-mHER2 путем скарификации хвоста (с.х.) в дни 4 и 18, и анти-PD1 и анти-LAG-3 - в дни 4 и 18 (200 мкг, внутрибрюшинно) Через четыре недели после последнего введения специфические Т-клеточные ответы определяли с помощью ИФН-γ ELISPOT, как описано в Mandl et al., Cancer Immunol Immunother (2012) 61:19-29. Как продемонстрировано на Фигуре 15, лечение с применением MVA-BN-mHER2 в комбинации с анти-PD-1 и анти-LAG3 увеличивало уровни ИФН-γ, специфического к опухолевому антигену, по сравнению с монотерапией анти-PD1 и анти-LAG3.
Пример 17
Титры антител
[0208] Мышам Balb/c внутрикожно в день 1 имплантировали клетки 1E5 CT26-HER2. Мышам вводили 1E7 инф.ед. MVA-BN-mHER2 путем скарификации хвоста (с.х.) в дни 4 и 18, и анти-PD1 и анти-LAG-3 - в дни 4 и 18 (200 мкг, внутрибрюшинно) Сывороточные титры антител определяли с помощью ELISA, как описано в Mandl et al., Cancer Immunol Immunother (2012) 61:19-29. 2. Результаты приведены на Фигуре 16.
Пример 18
Индуцирование противоопухолевого ответа у мышей, получавших MVA-BN-CV301 и анти-PD1
[0209] Самкам мышей C57/BL6 (в возрасте 6-8 недель, ~ 20 г, Simonsen Laboratories, Гилрой, Калифорния) в день 1 имплантировали клетки МС38-СЕА (2 × 105, внутрикожно, в боковую поверхность спины). Мышам вводили MVA-BN-CV301 в дни 1 и 15 (1E7 инф.ед., подкожно, выше основания хвоста). Мышам вводили анти-PD-1 в дни 1 и 15 (200 мкг, внутрибрюшинно). Результаты приведены на Фигуре 17. * р <0,05, **** р <0,0001, Повторные измерения: двухфакторный дисперсионный анализ (ANOVA) с апостериорным критерием множественного сравнения Тьюки.
Пример 19
Индуцирование противоопухолевого ответа у мышей, получавших MVA-BN-CV301 и анти-LAG-3
[0210] Самкам мышей C57BL/6 (в возрасте 6-8 недель, ~ 20 г, Simonsen Laboratories, Гилрой, Калифорния) в день 1 имплантировали клетки МС38-СЕА (2×105, внутрикожно, в боковую поверхность спины). Мышам вводили MVA-BN-CV301 в дни 1 и 15 (1E7 инф.ед., подкожно, выше основания хвоста). Мышам вводили анти-LAG-3 в дни 1 и 15 (200 мкг, внутрибрюшинно). Результаты приведены на Фигуре 18. * р <0,01, **** р <0,001, Повторные измерения: двухфакторный дисперсионный анализ (ANOVA) с апостериорным критерием множественного сравнения Тьюки.
Пример 20
Индуцирование противоопухолевого ответа у мышей, получавших MVA-BN-CV301, анти-PD-1 и анти-LAG-3
[0211] Самкам мышей C57BL/6 (в возрасте 6-8 недель, ~20 г, Simonsen Laboratories, Гилрой, Калифорния) в день 1 имплантировали клетки МС38-СЕА (2×105, внутрикожно, в боковую поверхность спины). Мышам вводили MVA-BN-CV301 в дни 1 и 15 (1E7 инф.ед., подкожно, выше основания хвоста). Мышам вводили анти-PD1 и анти-LAG-3 в дни 1 и 15 (по 200 мкг каждого, внутрибрюшинно). ** р <0,01, **** р <0,0001, Повторные измерения: двухфакторный дисперсионный анализ (ANOVA) с апостериорным критерием множественного сравнения Тьюки. Как продемонстрировано на Фигуре 19, комбинированное лечение с применением MVA-BN CV301, анти-PD1 и анти-LAG3 привело к уменьшению объема опухоли по сравнению с монотерапией анти-PD1 и анти-LAG3 или монотерапией MVA-BN-CV301.
Пример 21
Индуцирование противоопухолевого ответа у мышей, получавших PROSTVAC и анти-PD1
[0212] Самцам мышей BALB/c (в возрасте 6-8 недель, ~20 г, Simonsen Laboratories, Гилрой, Калифорния) в день 1 имплантировали клетки E6(RM11-PSA, 1,5×105, внутрикожно, в боковую поверхность спины). Мышам вводили PROSTVAC-V в день 1 (2Е7 инф. ед., подкожно в основание хвоста), а также PROSTVAC-F - в дни 8 и 15 (1E8 инф. ед., подкожно в основание хвоста). Мышам вводили анти-PD-1 в дни 1 и 15 (200 мкг, внутрибрюшинно). Результаты лечения приведены на Фигуре 20.
Пример 22
Индуцирование противоопухолевого ответа у мышей, получавших PROSTVAC и анти-LAG-3
[0213] Самцам мышей BALB/c (в возрасте 6-8 недель, ~20 г, Simonsen Laboratories, Гилрой, Калифорния) в день 1 имплантировали клетки E6(RM11-PSA, 1,5×105, внутрикожно, в боковую поверхность спины). Мышам вводили PROSTVAC-V в день 1 (2Е7 инф. ед., подкожно в основание хвоста), а также PROSTVAC-F - в дни 8 и 15 (1E8 инф. ед., подкожно в основание хвоста). Мышам вводили анти-LAG-3 в дни 1 и 15 (200 мкг, внутрибрюшинно).Результаты лечения приведены на Фигуре 21.
Пример 23
Индуцирование противоопухолевого ответа у мышей, получавших PROSTVAC, анти-PD-1 и анти-LAG-3
[0214] Самцам мышей BALB/c (в возрасте 6-8 недель, ~20 г, Simonsen Laboratories, Гилрой, Калифорния) в день 1 имплантировали клетки E6(RM11-PSA, 1,5×105, внутрикожно, в боковую поверхность спины). Мышам вводили PROSTVAC-V в день 1 (2Е7 инф. ед., подкожно в основание хвоста), а также PROSTVAC-F - в дни 8 и 15 (1E8 инф. ед., подкожно в основание хвоста). Мышам вводили анти-PD-1 и анти-LAG-3 в дни 1 и 15 (по 200 мкг каждого, внутрибрюшинно). Как продемонстрировано на Фигуре 22, комбинированное лечение с применением PROSTVAC, анти-PD1 и анти-LAG3 привело к уменьшению объема опухоли по сравнению с монотерапией анти-PD1 и анти-LAG3 или монотерапией PROSTVAC.
Пример 24
Индуцирование противоопухолевого ответа у мышей, получавших PANVAC (CV301-V/F) и анти-PD-1
[0215] Самкам мышей C57/BL, трансгенным для человеческого CEA ((Tg(CEA)18/B6j,полученным от Джека Шивели (Jack Shively) из Города Надежды Национального медицинского центра, см. также Clarke et al. Cancer Research, 58:1469ff., 1998), в день 1 были имплантированы клетки МС38-СЕА (3,0×105, внутрикожно, в боковую поверхность спины). Мышам в день 4 вводили CV301-вирус осповакцины (CV301-V) (также известный как PANVAC-V) (2E7 инф. ед., подкожно в основание хвоста), а также в дни 11 и 18 - CV301-вирус куриной оспы (CV-301-F) (также известный как PANVAC-F) (1E8 инф. ед., подкожно в основание хвоста). Лечение CV301-V/F комбинировали с вирусом куриной оспы GM-CSF (1E7 инф. ед.) в дни 4, 11 и 18. Мышам вводили анти-PD1 в дни 4, 11 и 18 (200 мкг, внутрибрюшинно). ** р <0,01, **** р <0,0001, Повторные измерения: двухфакторный дисперсионный анализ ANOVA с апостериорным критерием множественного сравнения Тьюки. Как продемонстрировано на Фигуре 23, комбинированное лечение CV301-V/F с анти-PD-1 задерживало рост опухоли по сравнению с мышами группы контроля.
[0216] Будет очевидно, что точные детали способов или композиций, описанных в настоящем документе, могут быть изменены или модифицированы без отклонения от сущности описанного изобретения. Предметом нашего изобретения являются все такие модификации и вариации, которые попадают в пределы объема и сущности приведенной ниже формулы изобретения.