Результат интеллектуальной деятельности: СПОСОБ ЛЕЧЕНИЯ СУБЪЕКТА С РАКОМ ТОЛСТОГО КИШЕЧНИКА ИЛИ РАКОМ ЛЕГКИХ
Вид РИД
Изобретение
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка заявляет приоритет предварительной заявки на патент США с порядковым номером 61/809 575, поданной 8 апреля 2013, содержание которой в полном объеме включено в настоящую заявку посредством ссылки.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
1. Область техники
Настоящее изобретение в основном относится к фармацевтическим композициям и терапевтическим подходам, в которых применяются соединения, обладающие противораковым действием, в частности за счет антипролиферативного механизма.
2. Уровень техники
Теломеры являются высокоспециализированными структурами, которые локализованы на самом конце линейных хромосом. Нормальные соматические клетки человека постепенно теряют свои теломеры при каждом делении клеток, главным образом из-за проблем с репликацией концевых областей. В то время как в большинстве нормальных клеток человека активность теломеразы не проявляется, в 85-90% раковых клеток такая активность имеет место, за счет чего происходит стабилизация их теломеров.
Теломеры являются защитными структурами, которые находятся в конце линейных эукариотических хромосом и состоят из большого числа копий повторяющихся фрагментов ДНК TTAGGG. Теломеры связаны с шестью белками, а именно TRF1, TRF2, TIN2, Rap1, TPP1 и POT1, которые в совокупности именуются комплексом шелтерин (de Lange T., "Shelterin: the protein complex that shapes and safeguards human telomeres", Genes & Development 2005; 19:2100-10). Комплекс шелтерин присутствует на теломерах во время всего клеточного цикла и, как было показано, закрывает концевые участки хромосом, чтобы они не распознавались как поврежденные участки ДНК.
Во всех нормальных соматических клетках теломеры претерпевают последовательное укорачивание при каждом делении клетки из-за проблем с репликацией концевого участка, что в конце концов приводит к старению клеток. Однако укорочению теломеров вследствие репликации может противодействовать рибонуклеопротеидный фермент, именуемый теломеразой. Теломераза представляет собой клеточную обратную транскриптазу (ревертазу), которая присоединяет фрагменты TTAGGG к концевым участкам линейных хромосом. Теломераза включает два компонента, а именно hTERT (каталитической белковый компонент теломеразы) и hTR или hTERC (функциональный компонент теломеразы или шаблон РНК). (Greider CW and Blackburn EH, "Telomers, telomerase and cancer", Scientific American 1996; 274:92-7). Хотя в большинстве нормальных соматических клеток человека активность теломеразы не проявляется, она обнаруживается практически во всех случаях в первичных раковых клетках человека (~85-90%). Таким образом, последовательное укорочение теломеров в нормальных клетках, где не проявляется активность теломеразы, является первичным барьером для образования опухолей.
Таким образом, теломераза и теломеры в раковых клетках представляют собой привлекательные и практически универсальные мишени для терапевтических подходов. Поскольку в большинстве нормальных терапевтических клеток активность теломеразы не проявляется, могут оказаться полезными способы лечения, которые селективно нацелены на активность теломеразы. Кроме того, полезными могут оказаться способы лечения, которые способны препятствовать удлинению теломеров за счет активности теломеразы, направленные на нарушение структуры или функции комплекса шелтерина.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к применению 6-меркаптопурин-рибонуклеозидов и их аналогов для лечения опухолей, рака и гиперпролиферативных заболеваний. Конкретно, соединения по настоящему изобретению могут превращаться в теломерные субстраты in vivo, и могут распознаваться теломеразой с включением в теломеры клеткок с активной теломеразой, что приводит к инициированию смерти клеток с активной теломеразой. Не желая ограничиваться каким-либо конкретным объяснением, отметим, что включение соединений по настоящему изобретению в теломеру, как можно предположить, служит непосредственным терминатором теломерной цепи ДНК и/или распознается как повреждение теломерной ДНК из-за измененной структуры теломеры.
В соответствии с настоящим изобретением, субъекту можно вводить соединение приведенной ниже формулы I
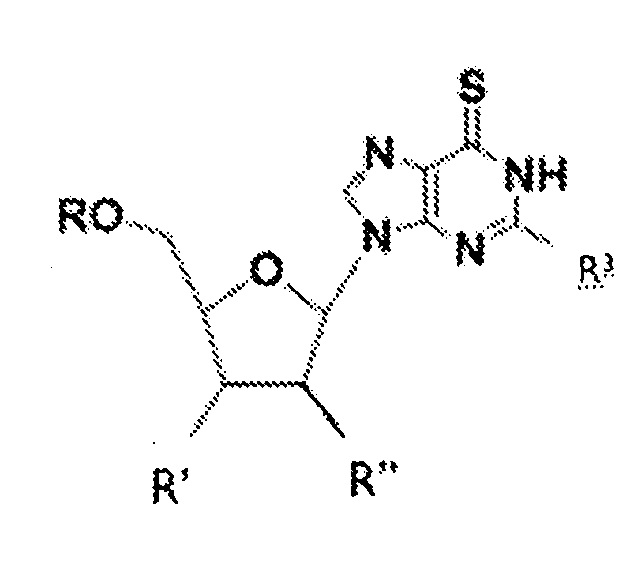
где R может представлять собой H, гидроксильную группу, аминогруппу, алкиламиногруппу, фтор, ацильную группу, C1-C20 алкил или остаток простого эфира, фосфат, дифосфат, трифосфат, фосфонат или фосфодиэфирную группу; R' может представлять собой H, гидроксильную группу, фтор, C1-C20 алкил или остаток простого эфира; R" может представлять собой гидроксильную группу, фтор или аминогруппу в рибо- или арабино-конфигурации; R3 может представлять собой аминогруппу или алкиламиногруппу; а также фармацевтически приемлемые соли, сольваты или полиморфы этих соединений. В различных вариантах осуществления, R представляет собой H, R' означает гидроксильную группу, и R" означает H, и такие соединения именуются в настоящей заявке 6-тио-2'-дезоксигуанозинами.
Согласно настоящему изобретению, субъекту можно вводить соединение приведенной ниже формулы II:

где R может представлять собой H, ацильную группу, C1-C20 алкил или остаток простого эфира, фосфат, дифосфат, трифосфат, фосфонат или фосфодиэфирную группу; R' может представлять собой H, гидроксильную группу, фтор, C1-C20 алкил или остаток простого эфира; R" может представлять собой гидроксильную группу, фтор или аминогруппу в рибо- или арабино-конфигурации; R3 может представлять собой аминогруппу или алкиламиногруппу; а также фармацевтически приемлемые соли, сольваты или полиморфы этих соединений. В различных вариантах осуществления, R представляет собой H, R' означает гидроксильную группу, и R'' означает H.
Согласно настоящему изобретению субъекту можно вводить фармацевтическую композицию, которая может содержать соединение приведенной ниже формулы III:
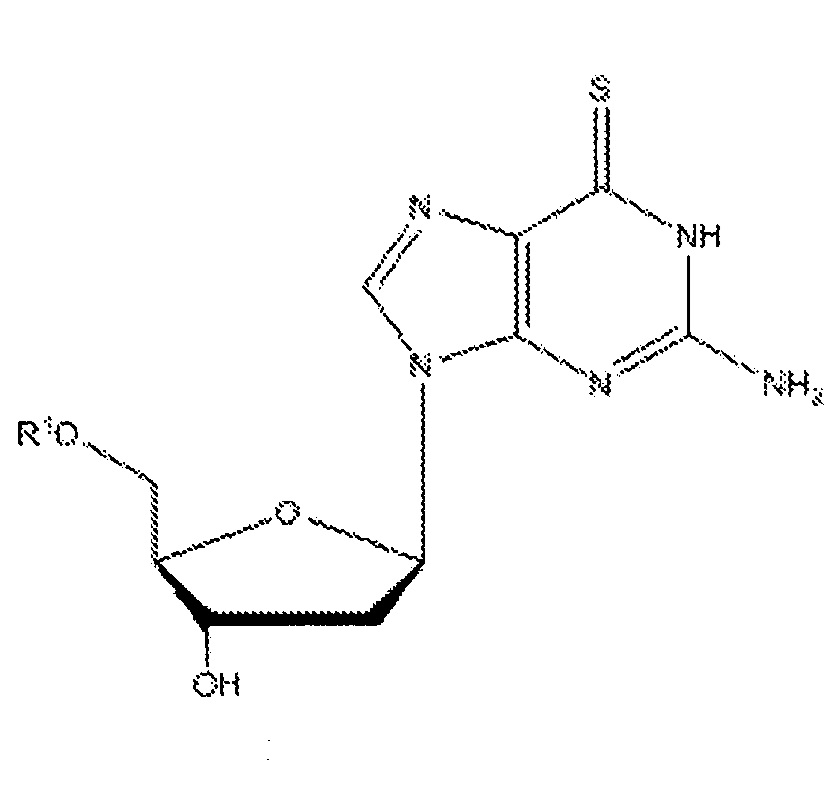
где R1 может представлять собой H, -C(O)(CH2)nCH3, где n=6-16, и такие соединения именуются в настоящей заявке 6-тио-2'-дезоксигуанозинами.
Согласно настоящему изобретению субъекту можно вводить фармацевтическую композицию, которая может содержать соединение приведенной ниже формулы IV:
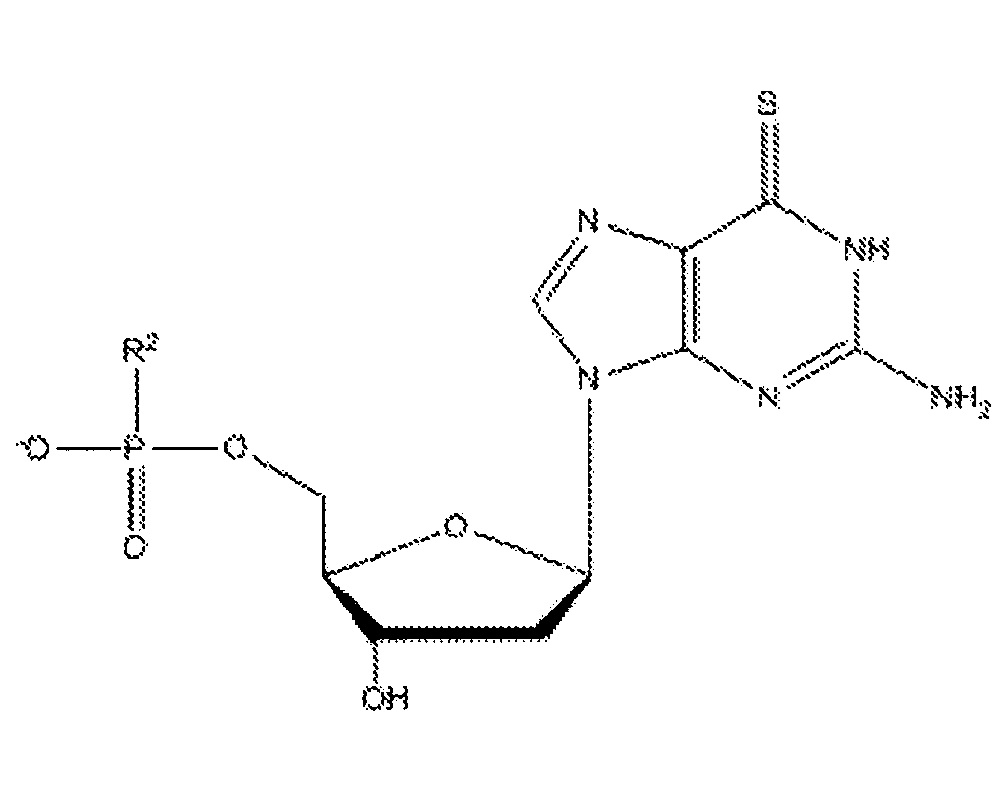
где R2 может представлять собой спермин или спермидин, и такие соединения именуются в тексте заявки 6-тио-2'-дезоксигуанозинами.
Согласно настоящему изобретению субъекту можно вводить фармацевтическую композицию, которая может содержать соединение приведенной ниже формулы V:
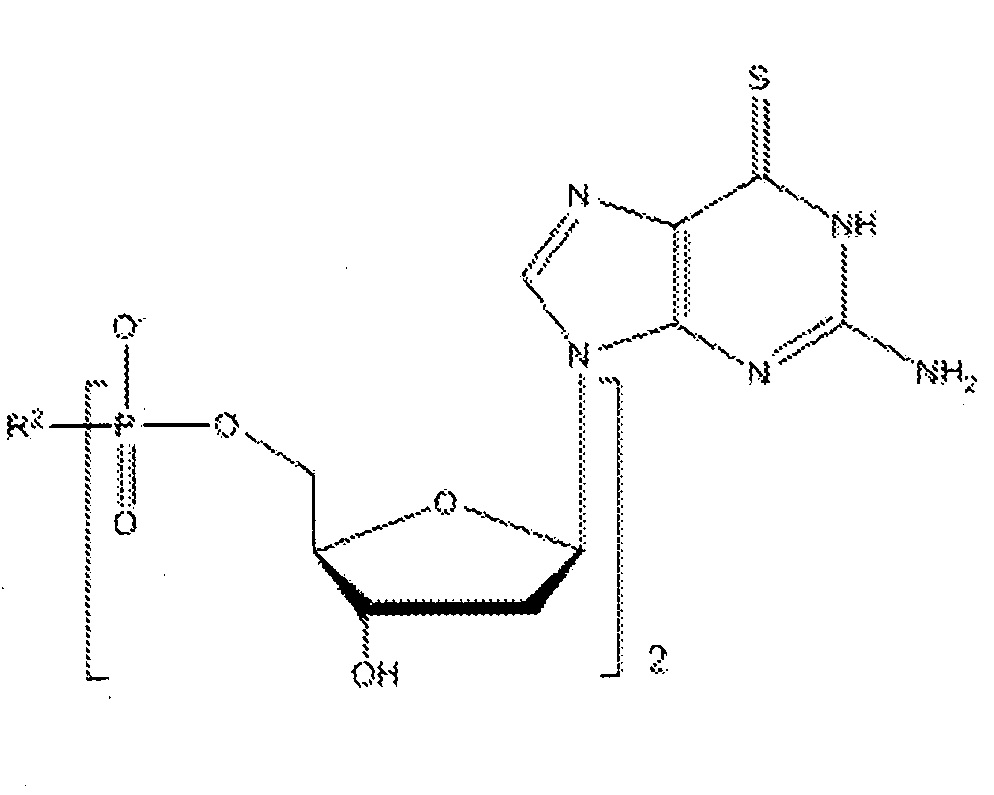
где R2 может представлять собой спермин или спермидин, и такие соединения именуются в тексте заявки 6-тио-2'-дезоксигуанозинами.
Дополнительные аспекты настоящего изобретения относятся к фармацевтическим композициям, содержащим эффективное против рака количество одного или нескольких соединений формулы I, II, III, IV или V, необязательно в комбинации с эффективным количеством как минимум одного дополнительного противоракового агента или как минимум одного носителя, добавки или эксципиента.
Следующий аспект настоящего изобретения относится к способам лечения рака и других гиперпролиферативных заболеваний, в т.ч. опухолей, в частности злокачественных опухолей и рака, а также любых клеток, в которых имеется избыточная активация теломеразы.
Другие аспекты настоящего изобретения включают способ лечения, включающий введение эффективного количества аналога 6-меркаптопурин-рибонуклеозида по настоящему изобретению, а также введение второй фармацевтической композиции, содержащей второй противораковый агент. Введение может происходить одновременно, в виде последовательных стадий, или поэтапного введения, когда стадии по крайней мере частично перекрываются по времени или отделены друг от друга определенным промежутком времени. Введение нескольких противораковых агентов может обеспечить аддитивный эффект или дополнительное синергетическое увеличение противораковой активности одного или обоих противораковых агентов.
Варианты осуществления, которые обсуждаются в контексте способов или композиций по настоящему изобретению, могут применяться в любом другом способе или композиции по настоящей заявке. Так, например, вариант осуществления, относящийся к одному способу или композиции, может также применяться к другим способам и композициям. В настоящем описании, "a" или "an" могут означать один или несколько. В формуле изобретения настоящей заявки, при использовании в комбинации со словом "включающий", артикли "a" или "an" могут также означать один или несколько.
Применение термина "или" в формуле изобретения используется в значении "и/или", если явно не указано, что этот термин относится только к альтернативам или эти альтернативы являются взаимоисключающими, хотя в тексте описания остается в силе определение, которое относится только к альтернативам и "и/или". В настоящем описании "другой" может означать по крайней мере второй или большее число "других".
В тексте данной заявки термин "примерно" используется для указания на присущие указанной величине отклонения, вызванные ошибками измерительного прибора, методикой, применяемой для определения величины, или различий, которые существуют между субъектами исследования.
Другие цели, элементы и преимущества настоящего изобретения станут ясны из приведенного ниже подробного описания. Однако следует понимать, что это подробное описание и конкретные примеры, хотя в них показаны предпочтительные варианты осуществления изобретения, приведены лишь в порядке иллюстрации, поскольку различные изменения и модификации, соответствующие сущности и входящие в объем изобретения, будут очевидны специалисту в данной области техники из этого подробного описания.
КРАТКОЕ ОПИСАНИЕ ИЛЛЮСТРАТИВНОГО МАТЕРИАЛА
Приведенный ниже иллюстративный материал является частью настоящего описания и включен в него для более полной демонстрации ряда аспектов настоящего изобретения. Настоящее изобретение можно будет лучше понять, обратившись к одному или нескольким из приведенных чертежей в комбинации с подробным описанием отдельных вариантов осуществления, приведенных в тексте.
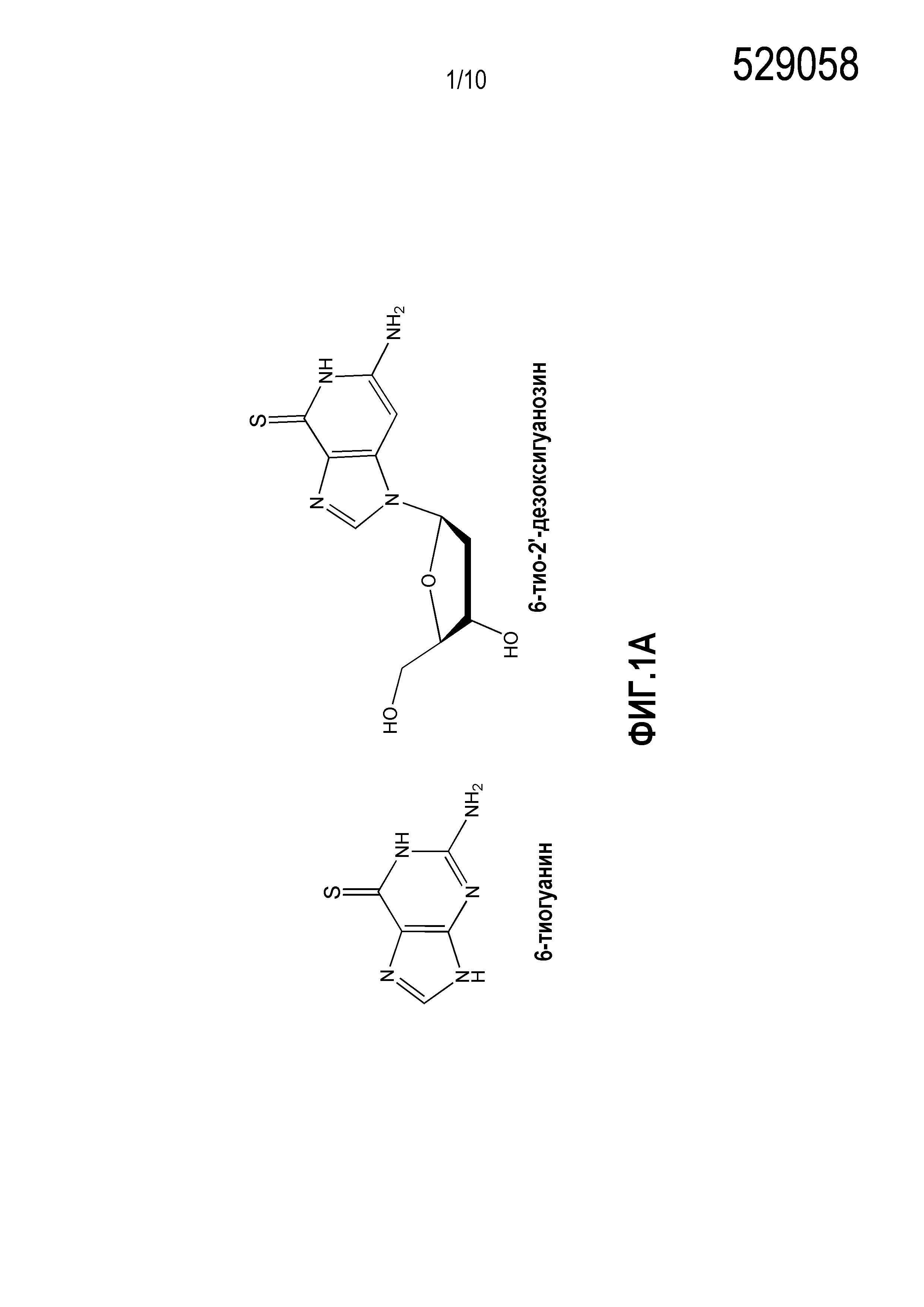
На Фиг. 1A приведены химические структуры 6-тиогуанина (6-тио-G) и 6-тио-дезоксигуанина (6-тио-dG).
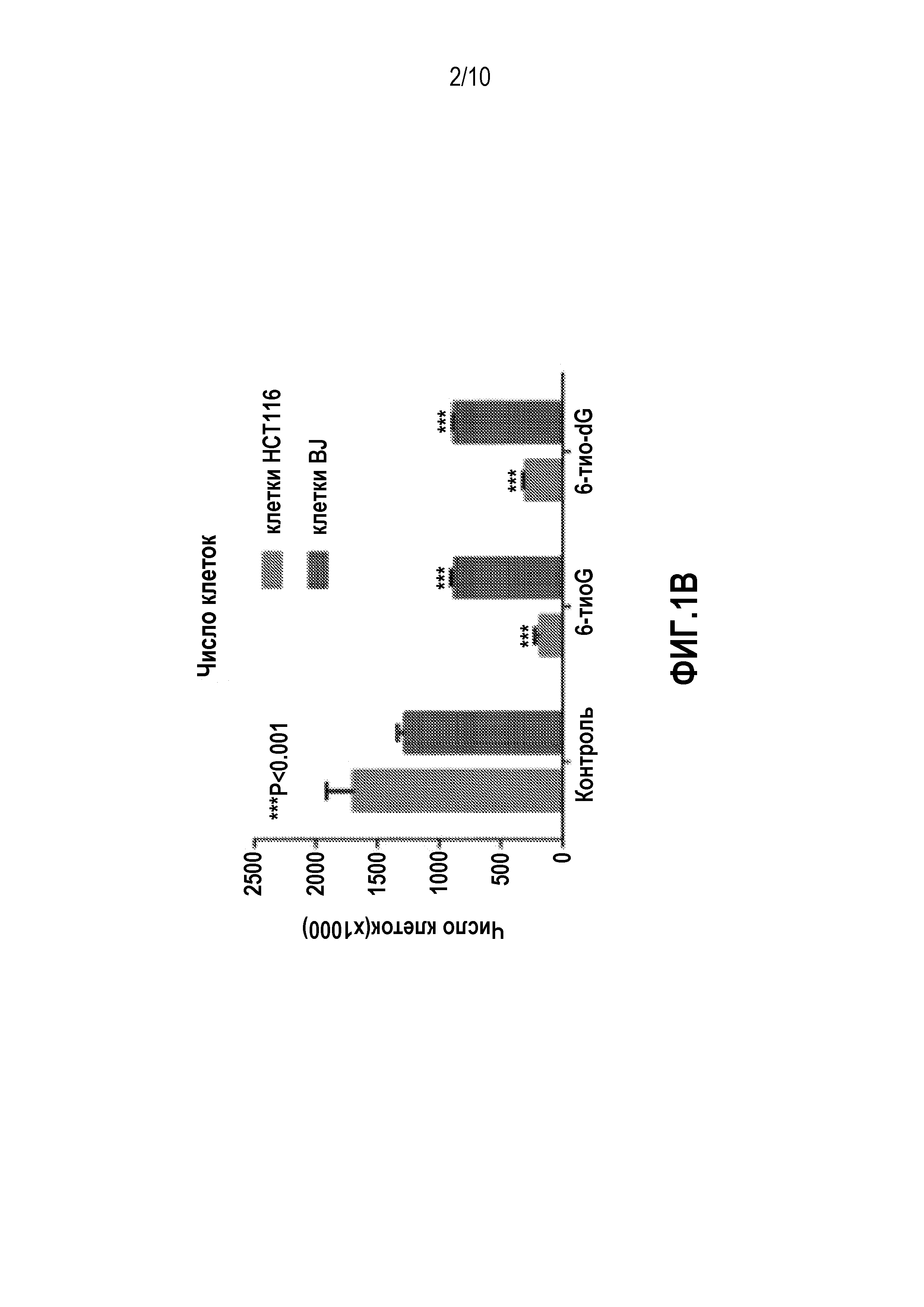
Фиг. 1B представляет собой график, демонстрирующий количества клеток HCT116 и клеток BJ, обработанных 6-тио-dG (3 мкМ) и 6-тио-G (3 мкМ) в течение 1 недели (каждые 3 дня) (контроль: необработанные клетки).
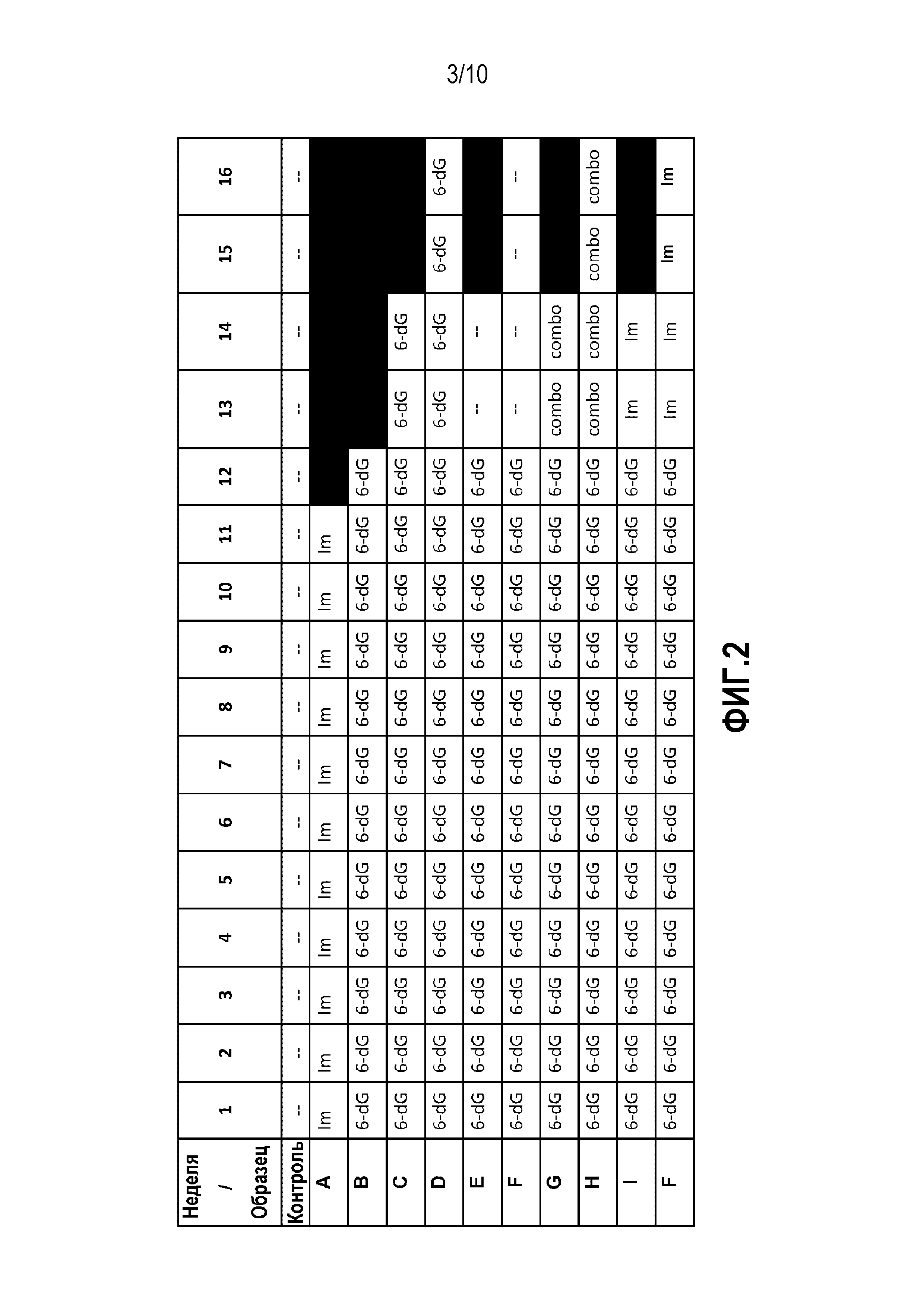
Фиг. 2 представляет собой таблицу, в которой приведено расписание обработки клеток HCT116 согласно протоколу эксперимента составом, не содержащим препаратов (--), 6-тио-dG (6dG), GRN163L(Im) или комбинацией 6-тио-dG и GRN163L (combo). Каждую неделю отбирали образец, содержащий 1×106 клеток для анализа TRF. Клетки HCT116 обрабатывали 10 мкМ 6-тио-dG в течение 12-16 недель. После обработки 10 мкМ 6-тио-dG в течение 12 недель, клетки подвергали обработке комбинацией 10 мкМ 6-тио-dG и 3 мкМ GRN163L в течение 2-4 недель или только GRN163L в течение 2-4 недель, или прекращали введение препаратов на 2-4 недели (контроль: необработанные клетки). Для выявления укорачивания теломеров в конце каждого протокола исследования осуществляли исследование TRF.
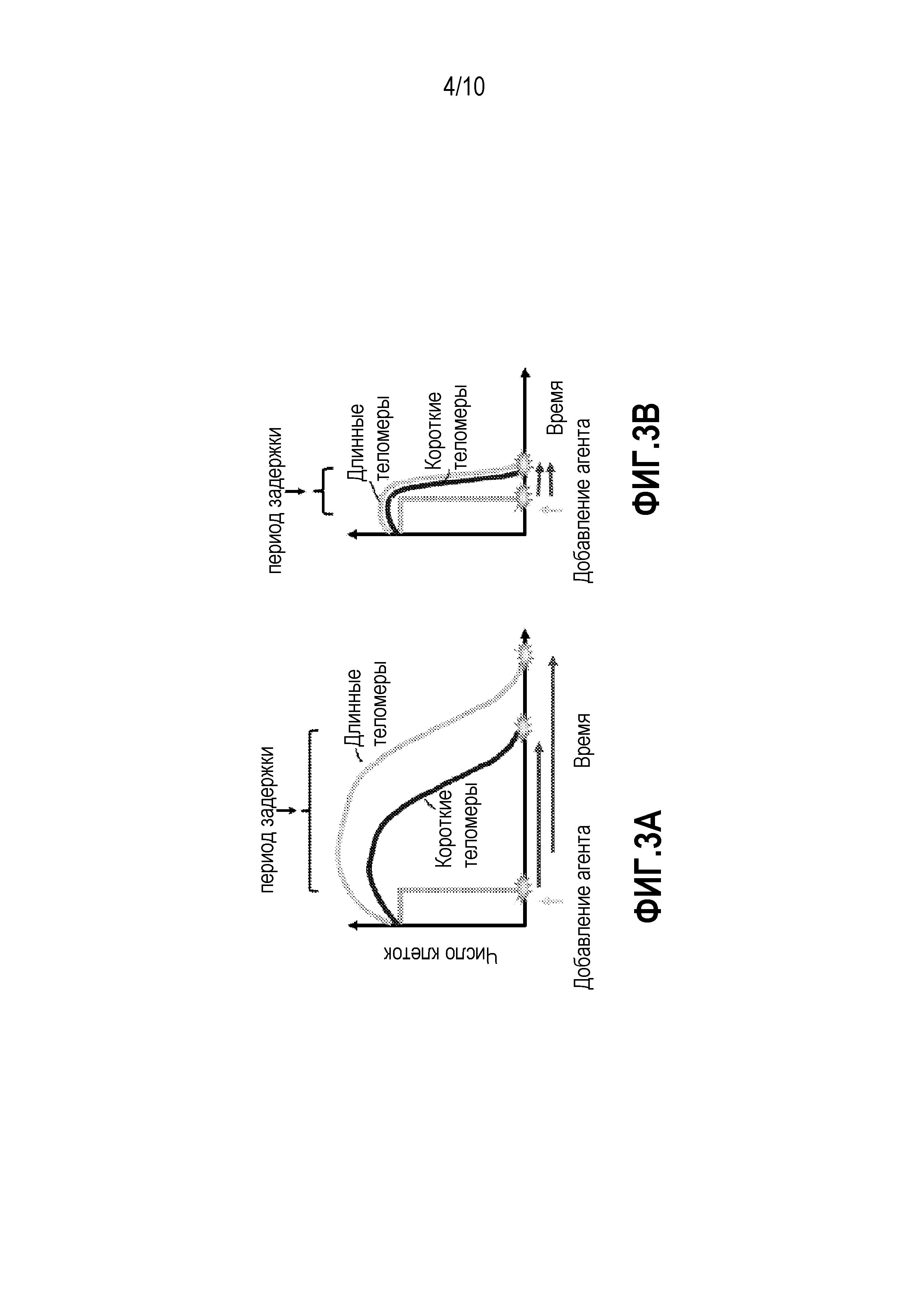
Фиг. 3A и 3B (A) Представляет собой сравнительный график, демонстрирующий лаг-период между введением ингибитора теломеразы и смертью клеток для клеток с короткими теломерами и длинными теломерами. (B) Представляет собой сравнительный график демонстрирующий лаг-период между введением соединений, модифицирующих теломеры, и смертью клеток для клеток с короткими теломерами и длинными теломерами.
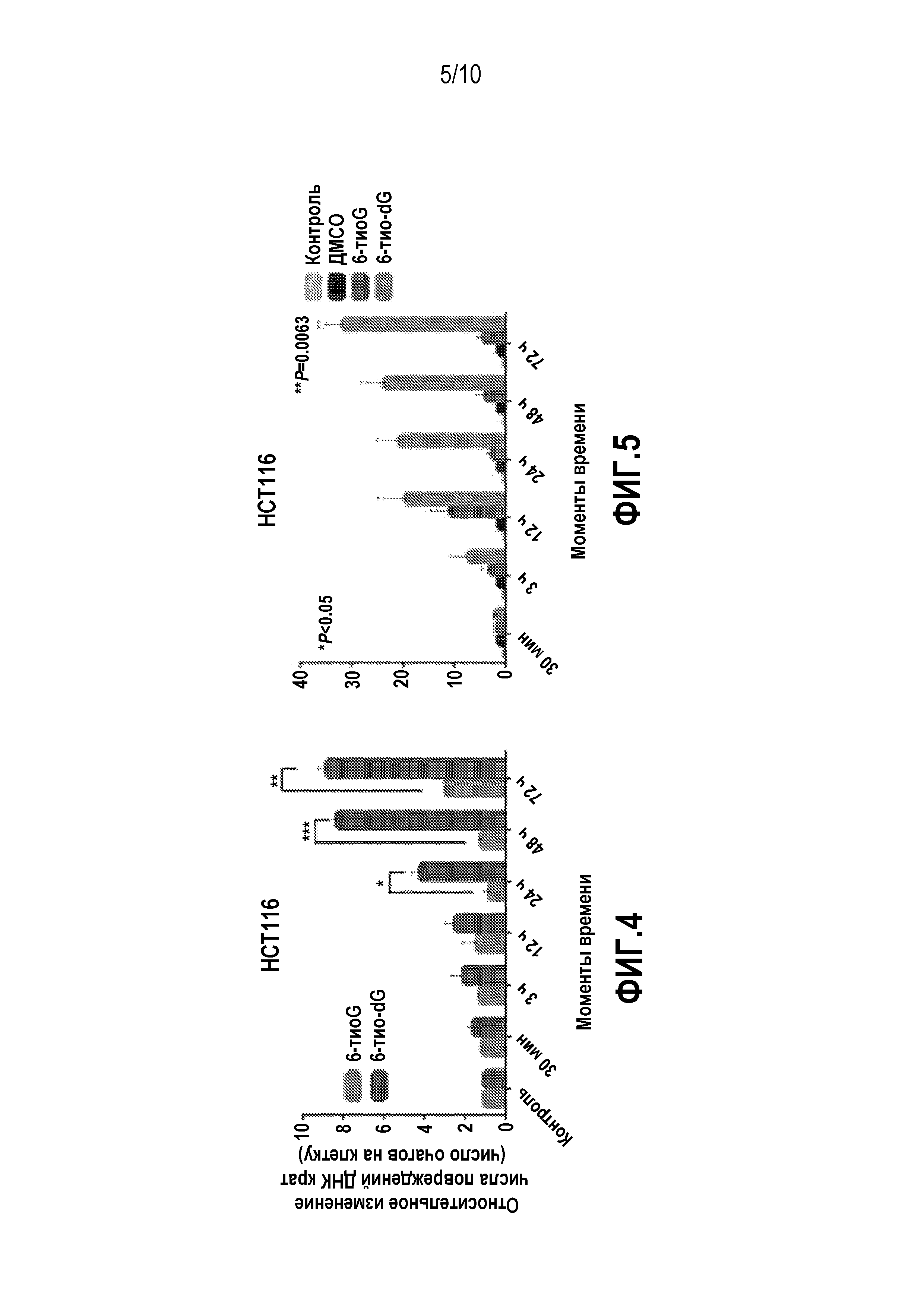
На фиг. 4 показано число очагов повреждения ДНК на клетку. Клетки HCT116 обрабатывали 6-тио-dG (3 мкМ) и 6-тио-G (3 мкМ) (n=75, SDs из двух независимых экспериментов). ***P=0,003, ***P=0,0005, *P=0,0141 (6-тио-G против 6-тио-dG) в t-критерии Стьюдента для независимых выборок. ns отсутствие достоверных различий в t-критерии Стьюдента для независимой выборки. (контроль: необработанные клетки).
Фиг. 5. Индекс TIF (процент TIF-позитивных клеток) для клеток HCT116, обработанных 6-тио-dG (3 мкМ) или 6-тио-G (3 мкМ). Клетки с четырьмя или более очагами гамма-H2AX, со-локализующимися с TRF2, учитывали как TIF-позитивные с помощью программы Imaris (n=75, SDs из двух независимых экспериментов). *P<0,05, **P=0,0063 (относительно контроля, обработанного носителем) в t-критерии Стьюдента для независимой выборки. ns отсутствуют достоверные различия согласно t-критерию Стьюдента для независимой выборки. (контроль: необработанные клетки).
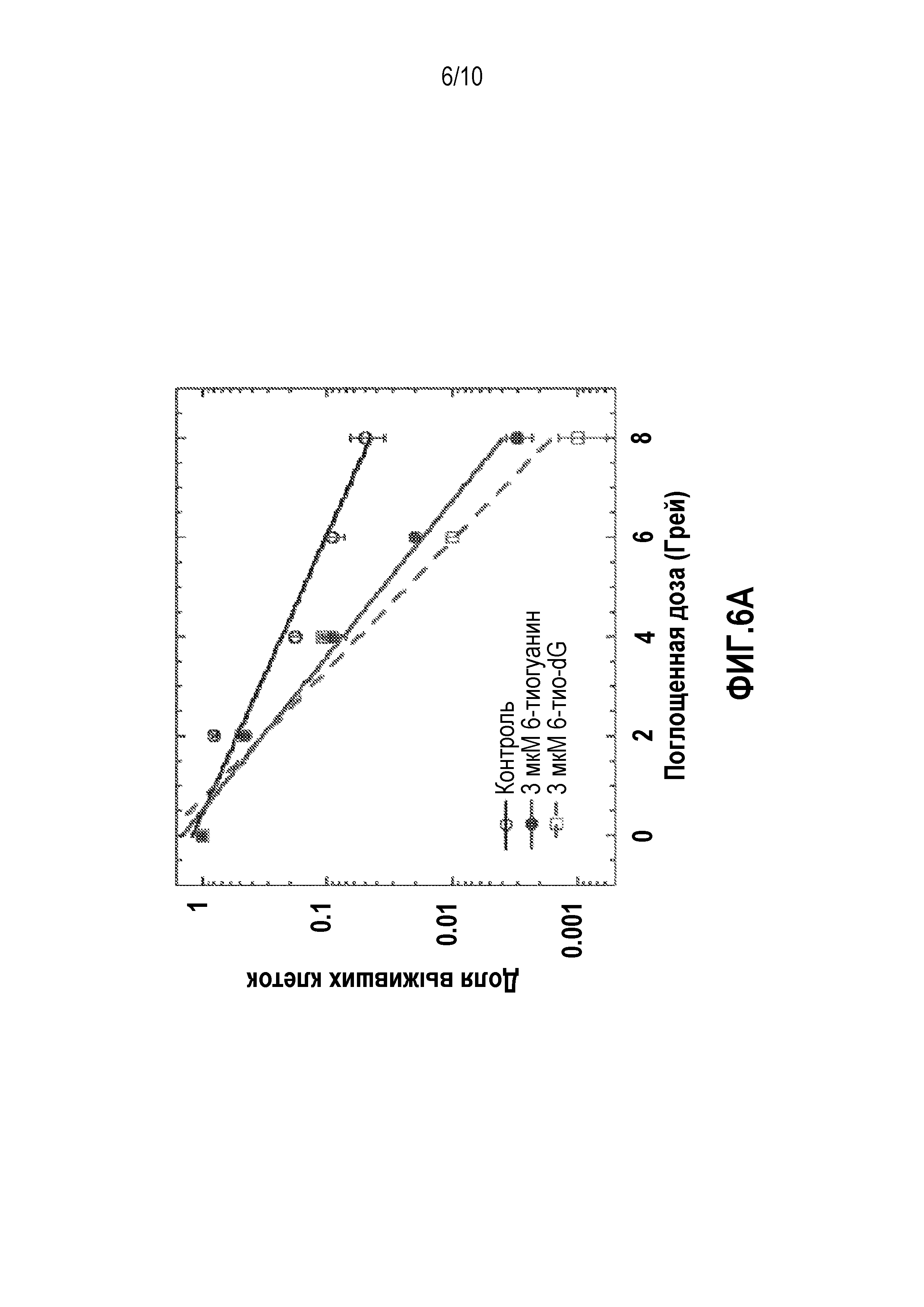
Фиг. 6A и 6B. (A) График, демонстрирующий долю выживших клеток HCT116, обработанных 6-тио-DG (3 мкМ) и 6-тио-G (3 мкМ), и через 72 часа облученных различными дозами ионизирующего излучения. После обработки клетки высевали с различной плотностью посева и культивировали в течение 10 дней. (B) График, показывающий выживаемость клеток, определенную с применением люминесцентного анализа CellTiter-Glo®.
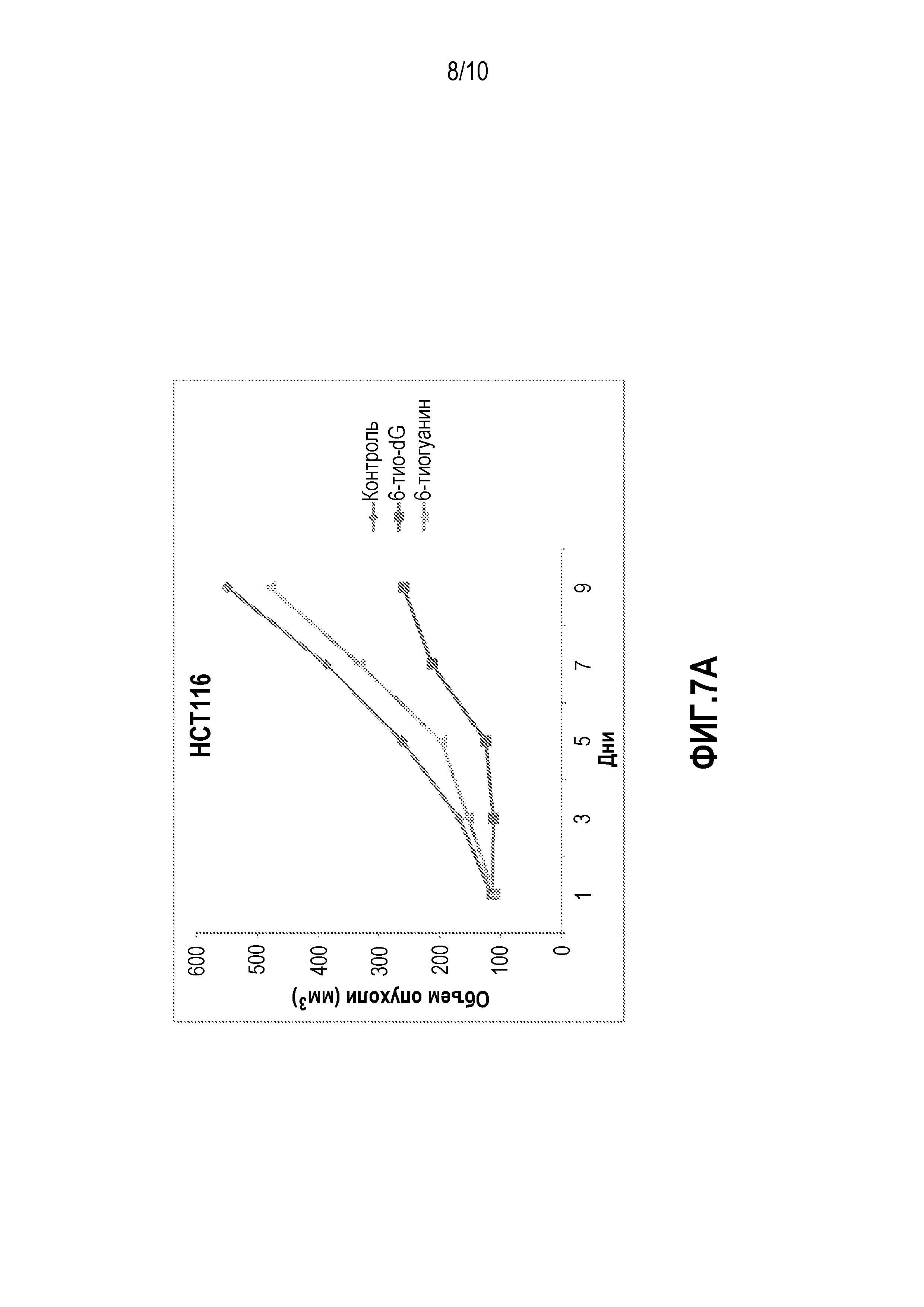
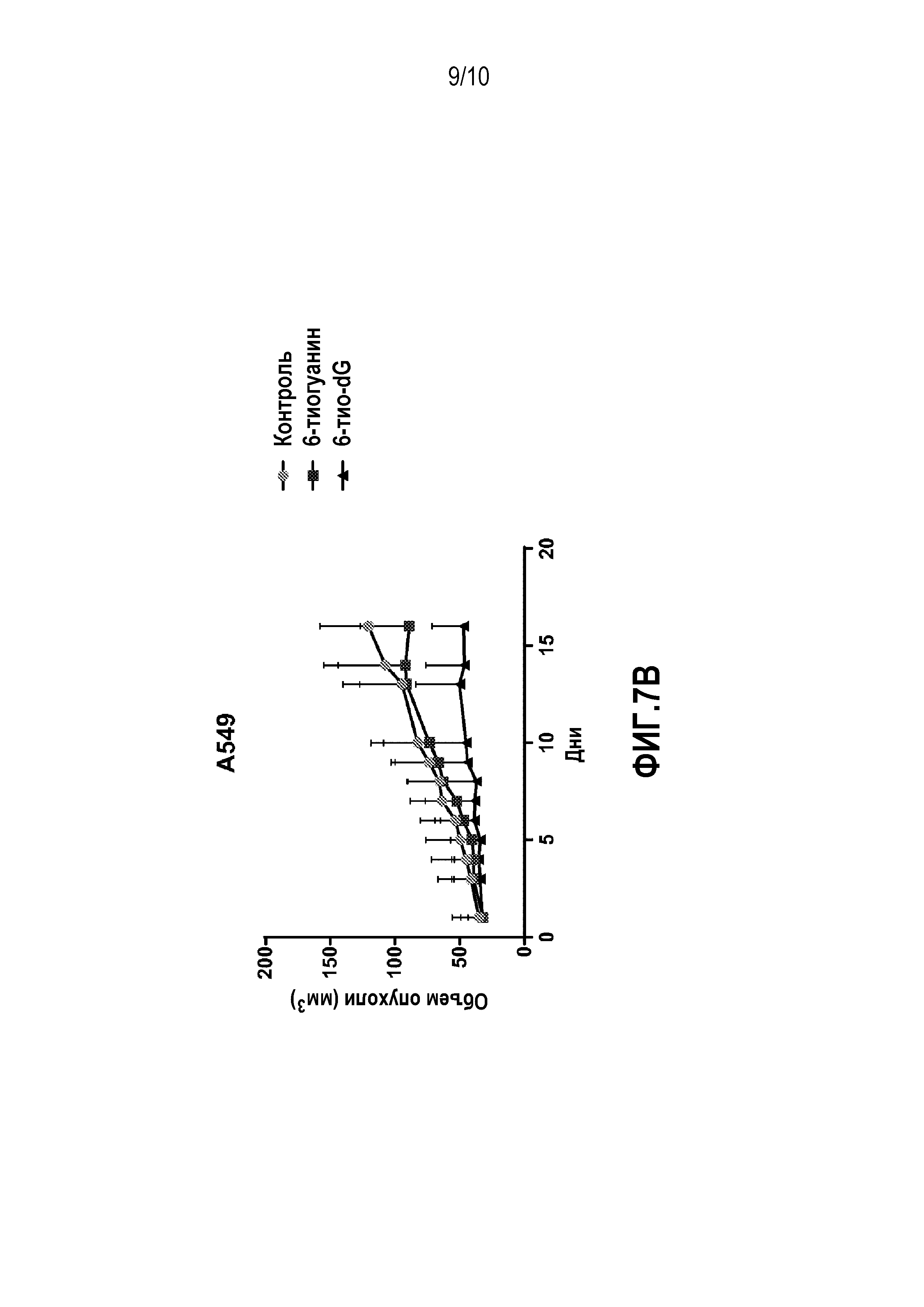
Фиг. 7A и 7B. (A) График, демонстрирующий уменьшение скорости роста опухоли в животных моделях ксенотрансплантата с клетками HCT116. (B) График, демонстрирующий уменьшение скорости роста опухоли в животных моделях ксенотрансплантата с клетками A549.
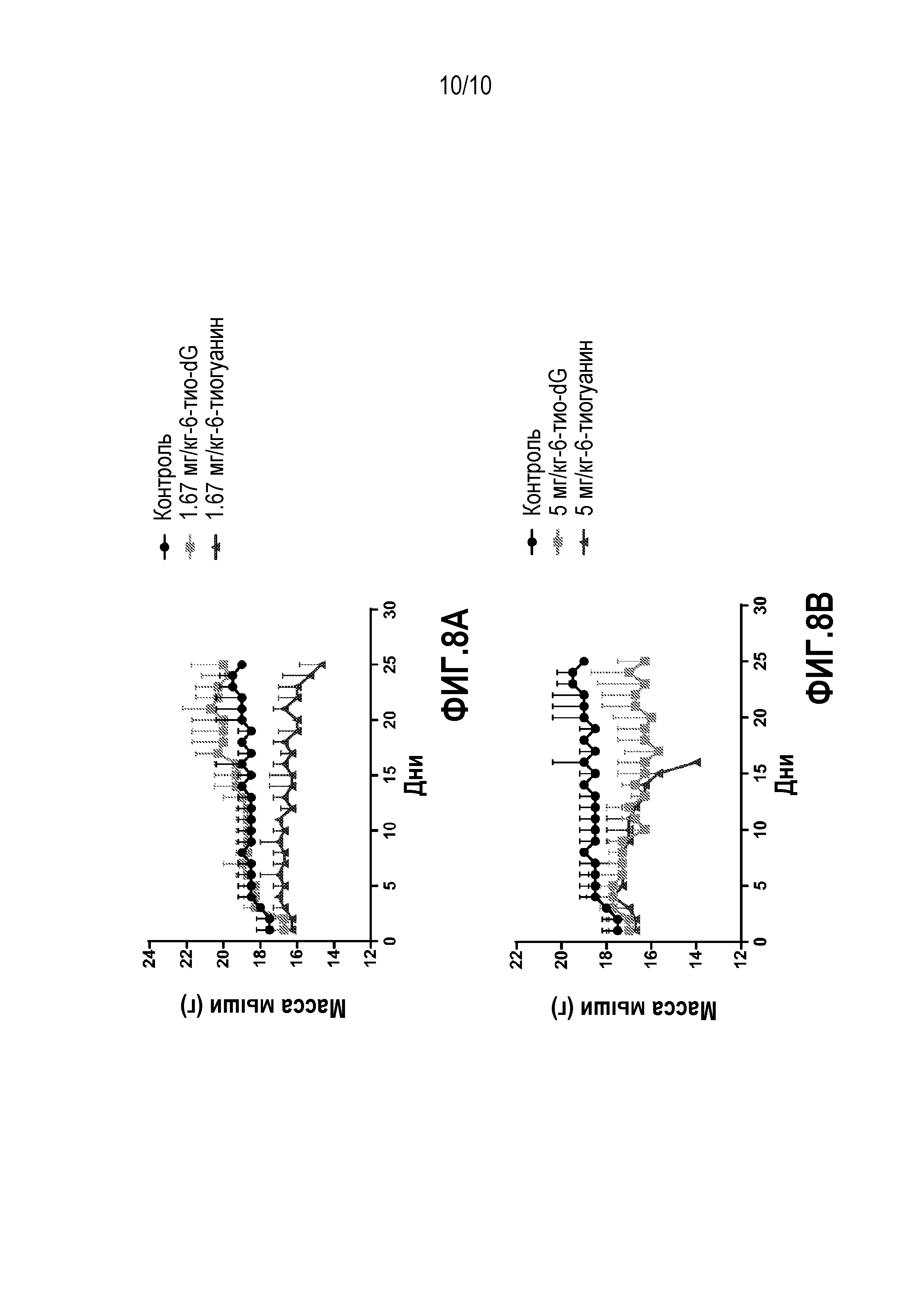
Фиг. 8A и 8B. (A) График, показывающий потерю массы у мышиных моделей WT, получающих 1,67 мг/кг 6-тио-dG или 6-тио-G, по сравнению с контролем. (B) График, демонстрирующий потерю массы у мышиных моделей WT, получавших 5 мг/кг 6-тио-DG или 6-тио-G по сравнению с контролем.
ОПИСАНИЕ ИЛЛЮСТРАТИВНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Настоящее изобретение направлено на фармацевтические композиции и способы лечения, в которых применяются аналоги 6-тиогуанозина в качестве соединений, разрушающих теломеры. Эти аналоги могут превращаться in vivo в 5'-трифосфатные субстраты теломеразы, например, 2'-дезоксигуанозин 5'-трифосфат. Описанные субстраты могут встраиваться в теломеры, вызывая укорачивание теломеров, нарушение функции теломеров или оба этих результата.
Более конкретно, аналоги 6-тиогуанозина по настоящему изобретению могут действовать в качестве молекул, воздействующих на теломеры в раковых клетках, но практически не выполняют эту функцию (или выполняют в значительно меньшей степени) в нормальных клетках, где не проявляется активность теломеразы. Это в основном селективное воздействие является следствием того факта, что аналоги 6-тиогуанозина по настоящему изобретению воздействую на раковые клетки, экспрессирующие теломеразу. Обработка клеток с активной теломеразой соединениями формул I, II, III, IV и/или V может привести к быстрой смерти по крайней мере части или большинства клеток с активной теломеразой. Смерть клеток может являться результатом последовательного укорачивания теломеров или нарушением их функций, например, повреждения ДНК в области теломеров, поскольку некоторые гуаниновые основания будут замещены 6-тиогуаниновыми аналогами, что вызовет реакцию на повреждение ДНК, например, изменение структуры и функции комплекса шелтерина. Кроме того, соединения по настоящему изобретению могут не вызывать или вызывать только незначительное изменение активности теломеразы in vitro, при исследовании согласно протоколу амплификации теломерных повторов (TRAP). Наконец, соединения по настоящему изобретению могут вызывать повреждение геномной ДНК. Следовательно, введение различных фармацевтических композиций по настоящему изобретению представляет собой подход к лечению теломераза-положительных раковых заболеваний у человека на основе бифункционального механизма действия, характеризующегося i) острой цитотоксичностью, возникающей из-за антиметаболических свойств и включения в геномную ДНК и ii) модификацией и укорачиванием теломерной ДНК. Кроме того, настоящее изобретение направлено на способы лечения, включающие комбинированный план лечения или совместное введение со второй фармацевтической композицией.
Согласно настоящему изобретению, фармацевтическая композиция для лечения опухолей, рака и гиперпролиферативных заболеваний может содержать 6-меркаптопурин-рибонуклеозиды и их аналоги. В различных вариантах осуществления, фармацевтическая композиция, которую можно вводить субъекту, может содержать соединение приведенной ниже формулы I:
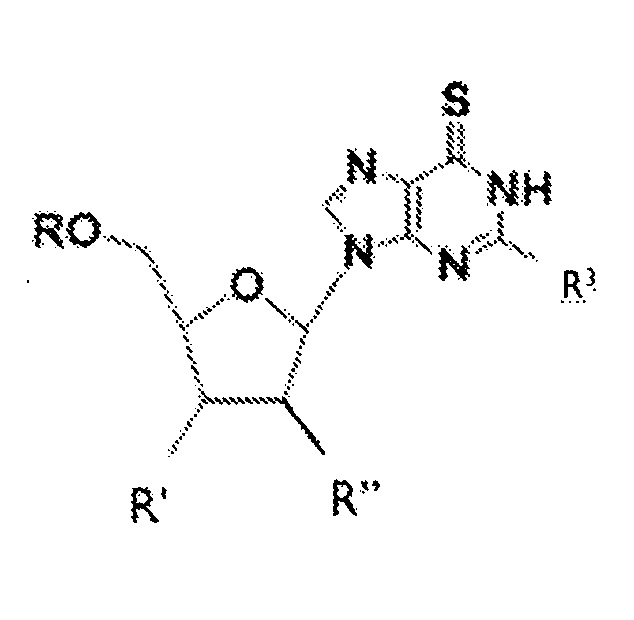
где R может представлять собой H, гидроксильную группу, аминогруппу, алкиламиногруппу, фтор, ацильную группу, C1-C20 алкил или остаток простого эфира, фосфат, дифосфат, трифосфат, фосфонат или фосфодиэфирную группу; R' может представлять собой H, гидроксильную группу, фтор, C1-C20 алкил или остаток простого эфира; R" может представлять собой гидроксильную группу, фтор или аминогруппу в рибо- или арабино-конфигурации; R3 может представлять собой аминогруппу или алкиламиногруппу; а также фармацевтически приемлемые соли, сольваты или полиморфы этих соединений, и такие соединения именуются в настоящей заявке 6-тио-2'-дезоксигуанозинами. В различных вариантах осуществления, R представляет собой H, R' означает гидроксильную группу, и R" означает H.
В различных вариантах осуществления, фармацевтическая композиция, которую можно вводить субъекту, может содержать соединение приведенной ниже формулы II:
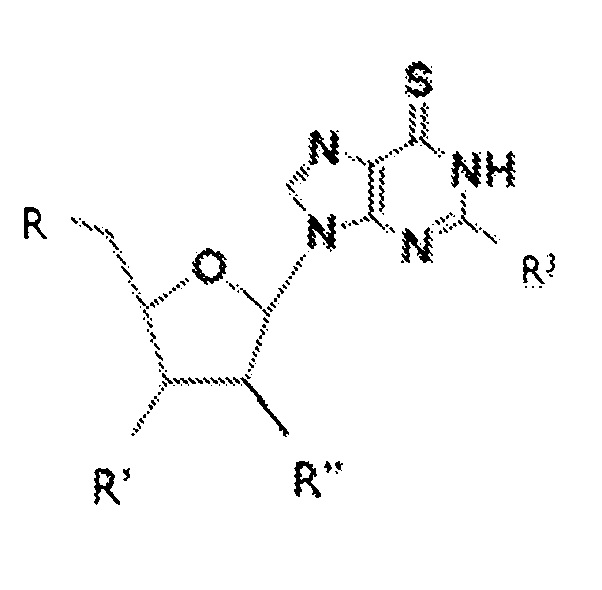
где R может представлять собой H, ацильную группу, C1-C20 алкил или остаток простого эфира, фосфат, дифосфат, трифосфат, фосфонат или фосфодиэфирную группу; R' может представлять собой H, гидроксильную группу, фтор, C1-C20 алкил или остаток простого эфира; R'' может представлять собой гидроксильную группу, фтор или аминогруппу в рибо- или арабино-конфигурации; R3 может представлять собой аминогруппу или алкиламиногруппу; а также фармацевтически приемлемые соли, сольваты или полиморфы этих соединений. В различных вариантах осуществления, R представляет собой H, R' означает гидроксильную группу, и R'' означает H, и такие соединения именуются в настоящей заявке 6-тио-2'-дезоксигуанозинами.
Согласно настоящему изобретению субъекту можно вводить фармацевтическую композицию, которая может содержать соединение приведенной ниже формулы III:
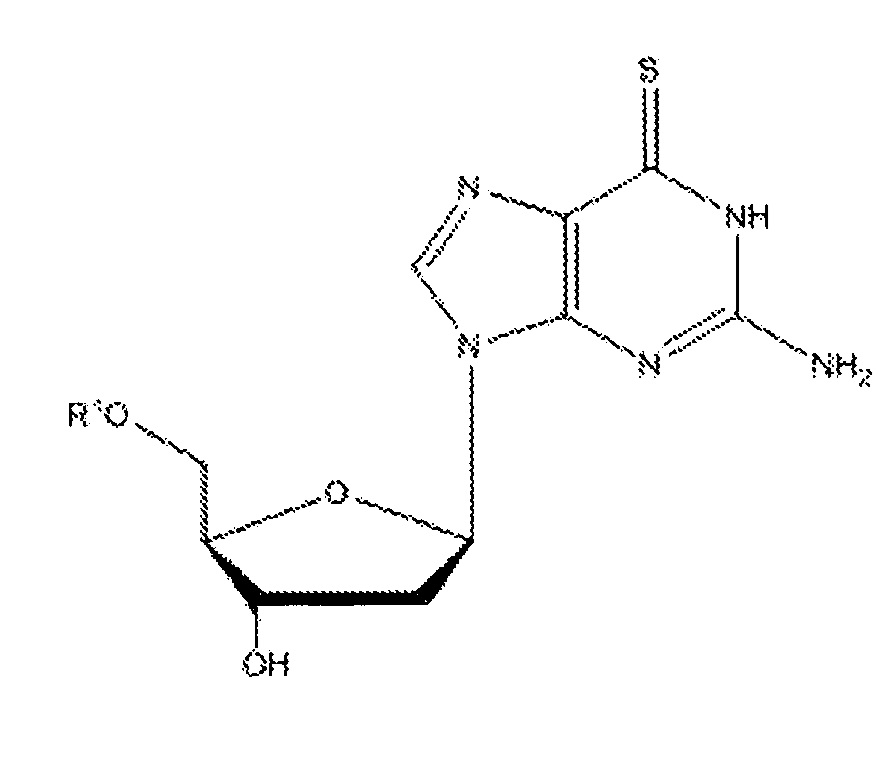
где R1 может представлять собой H, -C(O)(CH2)nCH3, где n=6-16, и их фармацевтически приемлемые соли, сольваты или полиморфы, и такие соединения именуются в настоящей заявке 6-тио-2'-дезоксигуанозинами.
В различных вариантах осуществления, субъекту можно вводить фармацевтическую композицию, которая может содержать соединение приведенной ниже формулы IV:
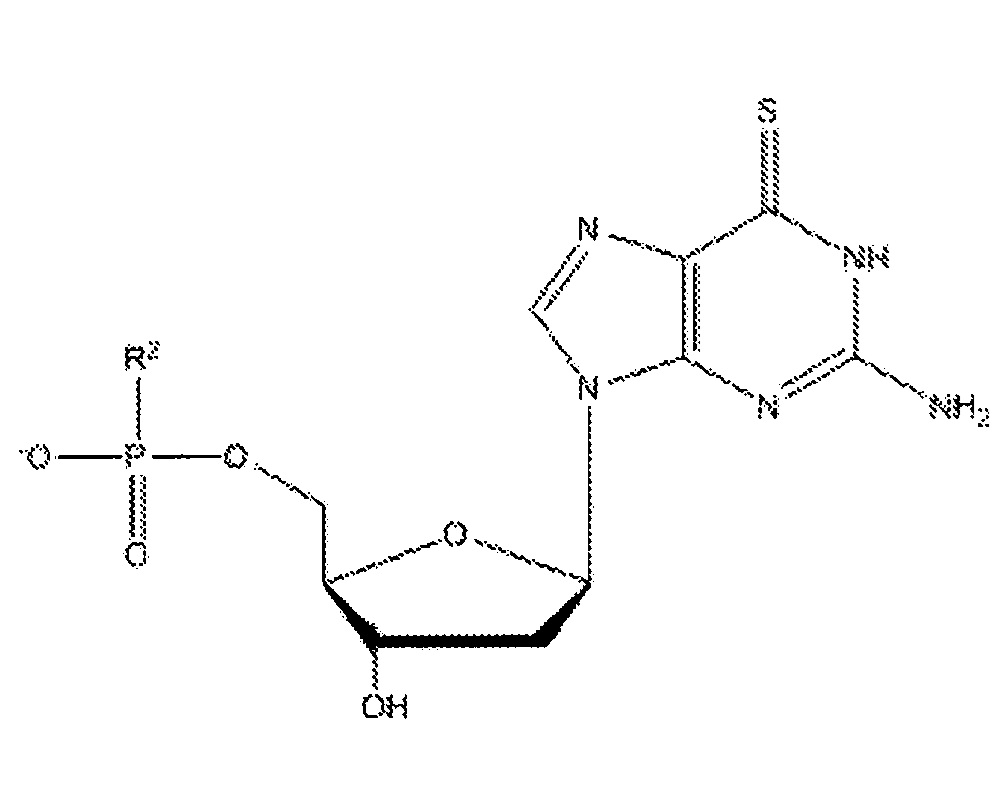
где R2 может представлять собой спермин или спермидин, а также их фармацевтически приемлемые соли, сольваты или полиморфы, и такие соединения именуются в тексте заявки 6-тио-2'-дезоксигуанозинами.
В различных вариантах осуществления, субъекту можно вводить фармацевтическую композицию, которая может содержать соединение приведенной ниже формулы V:
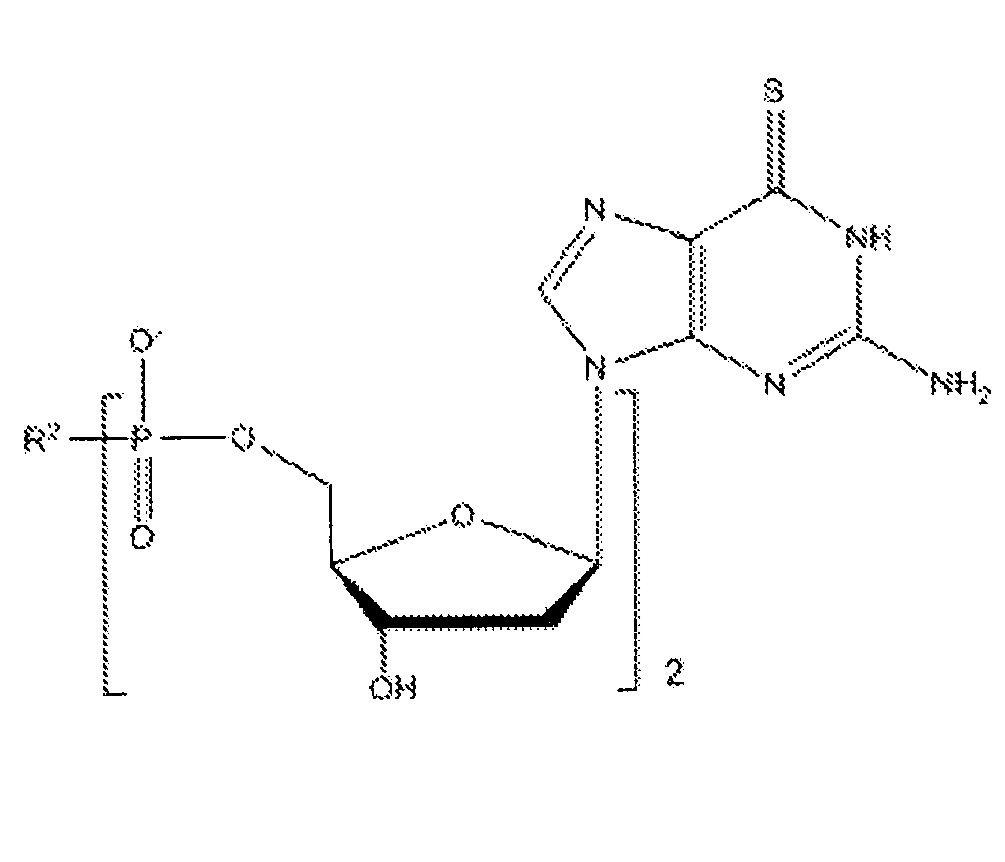
где R2 может представлять собой спермин или спермидин, а также их фармацевтически приемлемые соли, сольваты или полиморфы, и такие соединения именуются в тексте заявки 6-тио-2'-дезоксигуанозинами.
Термин "алкил" в контексте настоящей заявки будет означать C1-C20, предпочтительно C1-C10 линейный, разветвленный или циклический полностью насыщенный углеводородный радикал, который может быть необязательно замещенным, например, фенильной группой. Термин алкил охватывает также аралкильные группы, например, бензильную группу, фенильный фрагмент которой может быть необязательно замещенным. Имеется в виду, что функциональные группы, не указанные в явном виде, представляют собой либо водород, либо алкильную группу, соответствующую данному выше определению. Термин "простой эфир" означает C1-C20 остаток простого эфира, образованный кислородом и алкильной группой в одном из положений остатка сахара соединения по настоящему изобретению, и, предпочтительно, содержит как минимум один кислород в алкильной цепи.
Термин "ацил" используется в тексте описания для описания группы в 5'-положении аналога нуклеозида (например, в положении свободного гидроксила остатка сахара), который включает C1-C20 линейную, разветвленную или циклическую алкильную цепь или родственную группу, описанную в других местах текста. Ацильная группа в 5'-положении (R) в сочетании с соответствующей гидроксильной группой образует сложноэфирный фрагмент, который, после введения в организм, может подвергаться отщеплению с образованием формы свободного нуклеозида по настоящему изобретению.
Термин "фосфодиэфир" относится к моно-фосфатным группам в 5'-положении остатка сахара, которые являются диэтерифицированными, так что фосфатная группа остается нейтральной, т.е. не имеет заряда.
Модификации соединений формул I, II, III, IV или V, в частности по положению 5', могут влиять на растворимость, биодоступность и скорость метаболизма активных молекул, что позволяет управлять доставкой этих активных молекул. Кроме того, модификация может влиять на противораковую активность соединения, в некоторых случаях увеличивая активность по сравнению с природным гуаниновым соединением. Увеличения активности можно добиться путем получения производных и тестирования их противораковой активности способами, описанными в настоящей заявке, или другими способами, известными специалисту в данной области техники.
В настоящем описании термин "лечение" относится к введению или применению терапевтического агента, или осуществлению процедуры или методики в отношении субъекта с целью получения терапевтической пользы в отношении заболевания или состояния, связанного со здоровьем, или профилактического эффекта в отношении заболевания или состояния, связанного со здоровьем. Например, лечение может включать введение субъекту, у которого имеются раковые клетки, фармацевтически эффективного количества аналога 2-амино-6-меркаптопурин-рибонуклеозида. В настоящей заявке термины "терапевтическая польза" или "терапевтически эффективный" относятся к содействию или улучшению состояния здоровья субъекта или увеличению вероятности успешного излечения субъекта от заболевания или состояния, связанного со здоровьем. Это включает, не ограничиваясь перечисленным, уменьшение частоты проявления или тяжести признаков или симптомов заболевания. Например, лечение рака может включать уменьшение размера опухоли, ослабление инвазивности опухоли, уменьшение скорости роста раковой опухоли, старение части клеток, в которых проявляется аномальная активность теломеразы, или предупреждение метастазов или рецидивов. Лечение рака может также относиться к продлению срока жизни субъекта, у которого имеется рак. В настоящей заявке фраза "эффективное количество" описывает количество соединения, которое применяется в контексте изобретения для получения терапевтической пользы.
В настоящей заявке фраза "противораковый эффект" относится к эффекту, который может включать один или несколько результатов из числа подавления дальнейшего роста опухоли или раковых клеток; уменьшения вероятности образования или устранения метастазов; содействия смерти клеток опухоли, раковых клеток или других клеток, в которых имеется аномальная активация теломеразы; сокращение размеров опухоли или уменьшения количеств раковых клеток; или предотвращения повторного роста опухоли или рака после того, как опухоль или рак пациента находились в состоянии ремиссии. Композиции или производные по настоящему изобретению демонстрируют противораковый эффект.
Термин "субъект" относится либо к человеку, либо к живому существу, не являющемуся человеком, например, к приматам, млекопитающим и позвоночным. В конкретных вариантах осуществления, субъект является человеком.
Согласно различным вариантам осуществления, способ лечения может включать введение субъекту фармацевтической композиции, содержащей один или более 6-меркаптопурин-рибонуклеозидов или их аналогов, например, соединений формулы I, II, III, IV и/или V. Этот способ может применяться в лечении рака или других гиперпролиферативных заболеваний или в лечении клеток, демонстрирующих явно выраженную активность теломеразы. Рак может представлять собой солидную опухоль, метастатический рак или не метастатический рак. В некоторых вариантах осуществления, рак может первоначально развиваться в мочевом пузыре, крови, костях, костном мозге, мозге, груди, ободочной кишке, пищеводе, двенадцатиперстной кишке, тонком кишечнике, толстом кишечнике, прямой кишке, анусе, деснах, голове, почках, печени, легких, носоглотке, шее, яичниках, простате, коже, желудке, яичках, языке или матке. Опухоли могут включать злокачественные или доброкачественные опухоли или новообразования.
Конкретно рак может относиться к одному из следующих гистологических типов, хотя и не ограничиваться ими: злокачественная неоплазия; карцинома; недифференцированная карцинома; гигантоклеточная и веретеноклеточная карцинома; мелкоклеточная карцинома; папиллярная карцинома; плоскоклеточная карцинома; лифмоэпителиальная карцинома; базально-клеточная карцинома; пиломатриксная карцинома; переходно-клеточная карцинома; папиллярная переходно-клеточная карцинома; аденокарцинома; злокачественная гастринома; холангиокарцинома; гепатоклеточная карцинома; сочетанная гепатоклеточная карцинома и холангиокарцинома; трабекулярная аденокарцинома; аденокистозная карцинома; аденокарцинома в аденоматозном полипе; аденокарцинома, наследственный полипоз толстой кишки; солидная карцинома; злокачественная карциноидная опухоль; бронхиоло-альвеолярная аденокарцинома; папиллярная аденокарцинома; хромофобная карцинома; ацидофильная карцинома; оксифильная аденокарцинома; базофильная карцинома; светлоклеточная аденокарцинома; зернисто-клеточная карцинома; фолликулярная аденокарцинома; папиллярная и фолликулярная аденокарцинома; неинкапсулированная склерозирующая карцинома; карцинома коры надпочечников; эндометриоидная карцинома; карцинома из придатков кожи; апокринная аденокарцинома; сальная аденокарцинома; аденокарцинома серных желез; мукоэпидермоидная карцинома; цистаденокарцинома; папиллярная цистаденокарцинома; папиллярная серозная цистаденокарцинома; слизистая цистаденокарцинома; слизистая аденокарцинома; перстневидно-клеточная карцинома; инфильтративно-протоковая карцинома; медуллярная карцинома; лобулярная карцинома; воспалительная карцинома; болезнь Паждета молочной железы; ацинозно-клеточная карцинома; аденосквамозная карцинома; аденокарцинома со сквамозной метаплазией; злокачественная тимома; злокачественная опухоль стромы яичников; злокачественная текома; злокачественная гранулеза-клеточная опухоль; злокачественная андробластома; карцинома из клеток Сертоли; злокачественная опухоль из клеток Лейдига; злокачественная опухоль из жировых клеток; злокачественная параганглиома; злокачественная экстрамамиллярная параганглиома; феохромоцитома; гломангиосаркома; злокачественная меланома; амеланотическая меланома; поверхностная распространяющаяся меланома; злокачественная меланома в гигантском пигментированном невусе; меланома эпителиоидных клеток; злокачественный синий невус; саркома; фибросаркома; злокачественная фиброзная гистиоцитома; миксосаркома; липосаркома; лейомиосаркома; рабдомиосаркома; эмбриональная рабдомиосаркома; альвеолярная рабдомиосаркома; стромальная саркома; смешанная злокачественная опухоль; смешанная опухоль Мюллера; нефробластома; гепатобластома; карциносаркома; злокачественная мезенхимома; злокачественная опухоль Бреннера; злокачественная филлоидная опухоль; синовиальная саркома; злокачественная мезотелиома; дисгерминома; эмбриональная карцинома; злокачественная тератома; злокачественное вздутие яичников; хориокарцинома; злокачественная мезонефрома; гемангиосаркома; злокачественная гемангиоэндотелиома; саркома Капоши; злокачественная гемангиоперицитома; лимфангиосаркома; остеосаркома; юкстакортикальная остеосаркома; хондросаркома; злокачественная хондробластома; мезенхимальная хондросаркома; гигантоклеточная опухоль кости; саркома Юинга; злокачественная одонтогенная опухоль; амелобластическая одонтосаркома; злокачественная амелобластома; амелобластическая фибросаркома; злокачественная пинеалома; хордома; злокачественная глиома; эпендимома; астроцитома; протоплазмическая астроцитома; фибриллярная астроцитома; астробластома; глиобластома; олигодендроглиома; олигодендробластома; примитивная нейроэктодермальная опухоль; церебеллярная саркома; ганглионейробластома; нейробластома; ретинобластома; опухоль обонятельного нерва; злокачественная менингиома; нейрофибросаркома; злокачественная неврилеммома; злокачественная зернисто-клеточная опухоль; злокачественная лимфома; болезнь Ходжкина; парагранулема Ходжкина; злокачественная лимфома из малых лимфоцитов; диффузная злокачественная крупноклеточная лимфома; злокачественная фолликулярная лимфома; грибовидный микоз; другие известные неходжкинские лимфомы; злокачественный гистиоцитоз; множественная миелома; тучноклеточная саркома; иммунопролиферативная болезнь тонкого кишечника; лейкоз; лимфоидный лейкоз; плазмаклеточный лейкоз; эритролейкоз; лимфосаркома клеточный лейкоз; миелоидный лейкоз; базофильный лейкоз; эозинофильный лейкоз; моноцитарный лейкоз; тучноклеточный лейкоз; мегакариобластный лейкоз; миелоидная саркома; и волосато-клеточный лейкоз.
Кроме того, считается также, что настоящее изобретение может применяться для лечения не раковых заболеваний, связанных с активацией теломеразы в воспалительных клетках (лейкоцитах) (например, при грибковой инфекции, бактериальной инфекции, вирусной инфекции, острых и хронических воспалительных заболеваний, таких как воспалительные болезни кишечника (болезнь Крона, язвенный колит), ревматоидный артрит и/или нейродегенеративных заболеваний, связанных с воспалением).
Гиперпролиферативные заболевания включают состояния, при которых клетки растут неконтролируемым образом, независимо от того является ли этот рост раковым. Примерами таких заболеваний могут служить псориаз, остроконечные кондиломы, или другие гиперпролиферативные заболевания, в т.ч. гиперпролиферативные заболевания, связанные с кератиноцитами, например, гиперкератоз, ихтиоз, кератодермия или красный плоский лишай, и все эти болезненные состояния можно лечить с применением соединений по настоящему изобретению. Один из аспектов способа по настоящему изобретению включает лечение гиперпролиферативных заболеваний, в т.ч. псориаза, остроконечных кандилом и гиперпролиферативных болезней клеточного роста, в т.ч. гиперпролиферативных заболеваний, связанных с кератиноцитами, таких как гиперкератоз, ихтиоз, кератодермия или красный плоский лишай и других хронических воспалительных заболеваний, таких как остеоартрит, инфекции вируса гепатита C (HCV), где способ лечения включает введение пациенту, которому это необходимо, эффективного количества соединения формулы I, II, III, IV и/или V по настоящему изобретению, необязательно в комбинации как минимум с одним дополнительным противораковым агентом, необязательно в комбинации с фармацевтически приемлемым носителем, добавкой или эксципиентом.
Фармацевтические композиции по некоторым вариантам осуществления настоящего изобретения могут включать эффективное количество одного или нескольких соединений формулы I, II, III, IV или V и, необязательно, дополнительного действующего ингредиента, растворенного или диспергированного в фармацевтически приемлемом носителе.
В настоящей заявке термин "фармацевтически приемлемый" относится к соединениям, материалам, композициям и/или дозированным формам, которые, в рамках обоснованного медицинского суждения, подходят для контакта с тканями людей и животных без чрезмерной токсичности, раздражения, аллергических реакций или других проблем, и соответствующих разумному соотношению польза/риск. Термин "фармацевтически приемлемый носитель" означает фармацевтически приемлемый материал, композицию или носитель, например, жидкий или твердый наполнитель, разбавитель, эксципиент, растворитель или инкапсулирующий материал, принимающий участие в переносе или транспортировке химического агента.
Фармацевтическую композицию по настоящему изобретению можно вводить субъекту любым способом, известным рядовому специалисту в данной области техники. Примеры могут включать, не ограничиваясь перечисленным, внутривенное введение, внутрикожное введение, интратекальное введение, интраартериальное введение, интраперитонеальное введение, внутримышечное введение, подкожное введение; пероральное введение, интраректальное введение, мукозальное введение (интраназальное, интравагинальное и т.д.), поверхностное введение (например, трансдермальное), местное введение, введение с помощью ингаляции (например, ингаляции аэрозоля), введение с помощью инъекции, введение с помощью инфузии, введение с помощью непрерывной инфузии, введение с помощью локализованной перфузии, путем непосредственного орошения целевых клеток, введение через катетер, введение посредством промывания, введение в составе кремов, введение в составе липидных композиций (например, липосом), или с применением других способов или любой комбинации перечисленных способов, которая могла бы быть известна рядовому специалисту в данной области техники (смотрите, например, Remigton's Pharmaceutical Sciences, 18th Ed.Mack Printing Company, 1990, содержание которой включено в настоящую заявку посредством ссылки).
Фармацевтическое соединение по настоящему изобретению может входить в состав композиции в форме свободного основания, а также нейтральной или солевой форме. Фармацевтически приемлемые соли включают кислотно-аддитивные соли, например, образованные со свободными аминогруппами белковоподобных соединений или которые образованы неорганическими кислотами, например, хлористоводородной или фосфорной кислотой, или такими органическими кислотами, как уксусная, щавелевая, винная или миндальная кислоты. Соли, образованные со свободными карбоксильными группами могут также быть производными неорганических оснований, как, например, гидроксидов натрия, калия, аммония, кальция или железа (III); или такими органическими основаниями, как изопропиламин, триметиламин, гистидин или прокаин. После получения состава, растворы должны вводиться путем, который подходит для данной формы дозированного состава и в таком количестве, которое является терапевтически эффективным.
В тех вариантах осуществления, в которых композиция находится в жидкой форме, носитель может представлять собой растворитель или дисперсионную среду, включая, но не ограничиваясь этим, воду, этанол, полиол (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль и т.д.), липиды (например, триглицериды, растительные масла, липосомы), а также их комбинации. Необходимую сыпучесть или текучесть можно поддерживать, например, применением покрытия, такого, как лецитин; путем поддержания требуемого размера частиц за счет диспергирования в носителях, например, таких как жидкий полиол или липиды; применением ПАВ, например, гидроксипропилцеллюлозы; или комбинацией упомянутых способов. Может быть предпочтительным включить в состав изотонические агенты, как, например, сахара, хлорид натрия или их комбинации.
Реальную дозировку композиции по некоторым аспектам настоящего изобретения, которую вводят субъекту, можно определить по ряду физических и физиологических факторов, таких как конкретное применяемое соединение, возраст, общее состояние здоровья субъекта, рацион питания, масса тела, тяжесть состояния, тип заболевания, подвергаемого лечению, предыдущие или одновременно проводимые терапевтические вмешательства, индивидуальные особенности пациента, скорость абсорбции, скорость распределения, скорость инактивации, скорость выведения, время введения, путь введения, и в соответствии с мнением специалиста, осуществляющим надзор за введением. В зависимости от дозировки и пути введения, количество введений предпочтительной дозировки и/или эффективного количества может меняться в соответствии с реакцией субъекта. Действующий ингредиент может вводиться одной дозой, или его можно разделить на ряд меньших доз, которые вводятся через различные интервалы времени. В этом случае предполагается, что для каждого конкретного субъекта, конкретный режим введения может быть отрегулирован через определенное время в соответствии с индивидуальными потребностями и профессиональным суждением специалиста, назначившего или наблюдающего за введением композиций, и что указанные в данной заявке диапазоны концентраций являются только примерными, и не имеется в виду, что они ограничивают объем или практическую реализацию заявленных композиций.
Соединение формулы I, II, III, IV и/или V включено в фармацевтически приемлемый носитель или разбавитель в количестве, достаточном для доставки пациенту терапевтически эффективного количества для желаемого показания, без серьезного токсического действия на пациента, подвергаемого лечению. Предпочтительная доза действующего соединения для всех состояний, упомянутых в тексте заявки, находится в диапазоне от примерно 10 нг/кг до 100 мг/кг, предпочтительно, от 0,1 до 50 мг/кг в сутки, чаще от 0,5 до примерно 25 мг на кг массы тела субъекта в сутки. В качестве неограничивающего примера типовая дозировка может находиться в пределах 0,01-20% масс. в подходящем носителе. Аналогично, соединение может вводиться в любой подходящей дозированной лекарственной форме, содержащей, но не ограничиваясь этим, формы, содержащие менее 1 мг, от 1 мг до 3000 мг или от 5 до 1000 мг действующего ингредиента на единицу дозированной формы.
Композиции по настоящему изобретению могут вводиться на постоянной или непрерывной основе, или по необходимости, или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более раз. Композиции можно вводить каждые 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 часа или 1, 2, 3, 4, 5, 6, 7 дней, или 1, 2, 3, 4, 5 недель, или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 месяцев или более (или любой промежуточный срок). Аналогично, в настоящем изобретении конкретно предусмотрено, что композицию можно вводить один раз в день, два раза в день, три раза в день, четыре раза в день, пять раз в день или шесть раз в день (или любое промежуточное число) и/или как требуется пациенту. Первую дозу можно вводить до или после выявления заболевания или состояния, связанного со здоровьем, или после теста, в котором не будет обнаружено признаков заболевания. В некоторых вариантах осуществления, композицию можно вводить пациенту циклами продолжительностью несколько дней или недель, а в промежутках между циклами введение препарата не осуществляется. Промежуток между циклами может составлять несколько дней или недель, например, 2-8 дней/недель. В некоторых вариантах осуществления, композицию вводят пациенту в течение определенного периода времени или осуществляют введение определенного количества доз, после чего не обнаруживаются признаки наличия заболевания или расстройства.
Аналогично, в различных вариантах осуществления, композиция может вводиться пациенту (или приниматься пациентом) в количестве не менее примерно или не более примерно 0,01-1000 мкл/мин, мкл/час, мкл/день, мкл/неделя, мкл/месяц, мл/мин, мл/ч, мл/день, мл/неделя, мл/месяц, мкг/мин, мкг/час, мкг/день, мкг/неделя, мкг/месяц, мг/мин, мг/час, мг/день, мг/неделя, мг/месяц или в любом промежуточном количестве.
Для увеличения эффективности лечения, может быть желательным скомбинировать композиции по настоящему изобретению со второй методикой лечения или фармацевтической композицией. Например, способ применения по настоящему изобретению может дополнительно включать введение второй фармацевтической композиции, содержащей противораковый агент или другой агент, эффективный в лечении гиперпролиферативного заболевания. Противораковый агент может оказывать отрицательное влияние на рак у субъекта, например, уничтожая раковые клетки, вызывая апоптоз раковых клеток, уменьшая скорость роста раковых клеток, уменьшая частоту появления или количество метастазов, снижая размер опухоли, подавляя рост опухоли, ослабляя кровоснабжение опухолевых или раковых клеток, способствуя иммунной реакции против раковых клеток или опухоли, предупреждая или подавляя прогрессирование рака или повышая продолжительность жизни субъекта, у которого имеется рак. Более обобщенно, вторую фармацевтическую композицию можно вводить в эффективном количестве, или количестве, которое эффективно в составе комбинации, для уничтожения или подавления пролиферации определенных клеток.
В различных вариантах осуществления, способ лечения по настоящему изобретению может включать одновременное совместное введение. Этот способ может предполагать введение в одно и то же время. Этого можно добиться приводя в контакт клетки с одной композицией или фармацевтическим составом, который содержит как соединение формулы I, II, III, IV и/или V, так и другой противораковый агент, или приводя клетки в контакт с двумя различными композициями или составами в одно и то же время, где одна из композиций содержит соединение формулы I, II, III, IV и/или V, а другая содержит второй агент(ы). Аналогично, две композиции можно вводить не одновременно, но с достаточно небольшим временным интервалом друг относительно друга, например, в один и тот же день или на протяжении одной недели. В различных вариантах осуществления, способ лечения может включать первую стадию, на которой осуществляется введение фармацевтической композиции, содержащей соединение формулы I, II, III, IV и/или V, и вторую стадию, на которой осуществляется введение второй фармацевтической композиции. Первая стадия и вторая стадия могут осуществляться друг за другом, они могут быть разделены определенным промежутком времени (минуты, дни, недели или месяцы) или перекрываться по времени. Кроме того, последовательность стадий введения препаратов может быть обратной, или же введение можно осуществлять многократно.
Разумеется, может применяться любая комбинация стадий лечения. В качестве примера, если обозначить введение соединение формулы I, II, III, IV и/или V, как "A", и введение второго агента, как "B":
В контексте настоящего изобретения подразумевается, что введение фармацевтической композиции, содержащей соединение формулы I, II, III, IV и/или V, могло бы применяться в сочетании со способом лечения B, например, генной терапией, химиотерапевтическим, радиотерапевтическим или иммунотерапевтическим лечением, помимо применения других проапоптотических агентов или средств для регулирования клеточного цикла. Кроме того, подразумевается, что различные стандартные способы лечения, а также хирургические вмешательства могут применяться в сочетании с описанной в заявке терапией, направленной на укорочение и нарушения функции теломеров.
a. Химиотерапия
Химиотерапевтические агенты включают, например, цисплатин (CDDP), карбоплатин, прокарбазин, меклоретамин, циклофосфамид, камптотектин, ифосфамид, мелфалан, хлорамбуцил, бусульфан, нитрозмочевину, дактиномицин, даунорубицин, доксорубицин, блеомицин, пликомицин, митомицин, этопозид (VP16), тамоксифен, ралоксифен, агенты, связывающие рецептор эстрогена, таксол, гемцитабин, навелбин, ингибиторы фарнезил-протеин трансферазы, трансплатину, 5-фторурацил, винкристин, винбластин и метотрексат, или любые аналоги или производные перечисленных выше препаратов.
b. Радиационная терапия
Радиационная терапия может вызывать повреждение ДНК и включает то, что широко известно под названиями as-лучи, рентгеновские лучи, и/или направленная доставка радиоизотопов к опухолевым клеткам. В качестве других воздействий, повреждающих ДНК рассматриваются микроволновое излучение и УФ-излучение.
c. Иммунотерапия
Иммуннотерапевтические средства, как правило, основаны на использовании иммунных клеток-эффекторов и молекул для воздействия на раковые клетки и их разрушения. Таким образом, иммунотерапия могла бы применяться в качестве составной части комбинированной терапии, в сочетании с введением фармацевтической композиции, содержащей соединение формулы I, II, III, IV и/или V. Иммунотерапевтические методики способны осуществлять воздействие на опухолевые клетки за счет того, что некоторые маркеры опухолевых клеток подходят для воздействия, т.е. отсутствуют на большинстве других клеток. Существует большое число опухолевых маркеров, и любой из них может оказаться подходящим для воздействия второго терапевтического средства в контексте настоящего изобретения. Широко известные опухолевые маркеры включают раковый эмбриональный антиген, простата-специфический антиген, антиген, ассоциированный с опухолями мочевыводящих путей, эмбриональный антиген, тирозиназу (p97), gp68, TAG-72, HMFG, антиген сиалил Льюис, MucA, MucB, PLAP, рецептор эстрогена, рецептор ламинина, erb B и p155.
d. Генная терапия
В еще одном варианте осуществления, второй способ лечения B представляет собой генную терапию, в которой терапевтический полинуклеотид, кодирующий весь полипептид или его часть, вводят до, после или одновременно в фармацевтической композицией, содержащей соединение формулы I, II, III, IV и/или V. Доставка вектора, кодирующего определенный генетический продукт(ы), связанный с конкретным заболеванием или медицинским состоянием, может иметь комбинированный терапевтический эффект, например оказывать антипролиферативное действие на целевые ткани.
e. Хирургическое лечение
Лечебная хирургия является способом лечения рака, который может применяться в сочетании с фармацевтической композицией, содержащей соединение формулы I, II, III, IV и/или V. Лечебная хирургия включает резекцию, при которой вся раковая ткань или ее часть физически удаляется, иссекается и/или разрушается. Хирургическое удаление опухоли относится к физическому удалению как минимум части опухоли. Помимо резекции опухоли, хирургическое лечение включает лазерную хирургию, криохирургию, электрохирургию и хирургию с микроскопическим контролем (хирургия по Мохе). Кроме того предусматривается, что композицию по настоящему изобретению можно вводить в сочетании с удалением поверхностных видов рака, предопухолевых образований или сопутствующем удалением нормальных тканей. При хирургическом удалении части или всех раковых клеток, ткани или опухоли, в организме может образоваться полость. Лечение может сопровождаться введением фармацевтической композиции, содержащей соединение формулы I, II, III, IV и/или V.
f. Другие противораковые агенты
В изобретении предусмотрено, что другие противораковые агенты могут применяться в комбинации с композициями соединений формулы I, II, III, IV и/или V по настоящему изобретению для обеспечения аддитивного или синергетического усиления терапевтической эффективности лечения.
Эти дополнительные агенты включают иммуномодулирующие агенты, агенты, которые воздействуют на повышающее регулирование рецепторов клеточной поверхности и щелевых контактов, цитостатические и дифференцирующие агенты, ингибиторы клеточной адгезии или агенты, которые повышают чувствительность гиперпролиферативных клеток к индукторам апоптоза. Иммуномодулирующие агенты включают факторы некроза опухолей; интерфероны альфа, бета и гамма; IL-2 и другие цитокины; F42K и другие аналоги цитокинов; или MIP-1, MIP-1бета, MCP-1, RANTES и другие хемокины. Далее, считается, что повышающее регулирование рецепторов клеточной поверхности или их лигандов, например, Fas/лиганда Fas, DR4 или DR5/TRAIL могло бы усиливать способность соединений по настоящему изобретению к индукции апоптоза, за счет аутокринного или паракринного действия на гиперпролиферативные клетки. Увеличение передачи межклеточных сигналов за счет роста числа щелевых контактов могло бы увеличить антипролиферативное действие на соседнюю популяцию гиперпролиферативных клеток. В других вариантах осуществления, цитостатические или дифференцирующие агенты могут применяться в комбинации с соединениями по настоящему изобретению для улучшения анти-гиперпролиферативной эффективности лечения. Ингибиторы клеточной адгезии, как считается, улучшают эффективность соединений по настоящему изобретению. Примерами ингибиторов клеточной адгезии являются ингибиторы киназы фокальной адгезии (FAKs) и ловастатин. Кроме того, считается, что другие противораковые агенты, которые повышают чувствительность гиперпролиферативных клеток к апоптозу, такие как ингибиторы теломеразы, например, иметелстат натрия, и ингибиторы трансдукции сигналов, например, антитело c225, могли бы применяться в комбинации с соединениями по настоящему изобретению для улучшения эффективности лечения. Как показано в разделе примеров, клинически значимая комбинация 6-тио-дезоксигуанозина и иметелстата натрия продемонстрировала аддитивное действие на укорочение теломеров в клетках HCT116. В различных вариантах осуществления, способ лечения может включать введение воздействующей/модифицирующей теломеры композиции, например, соединения формулы I, II, III, IV и/или V, и композиции, ингибирующей теломеразу, например, иметелстата натрия, причем это введение может осуществляться одновременно, последовательно или обоими путями. Такие варианты осуществления могут иметь аддитивное действие на укорочение теломеров.
Наконец, дополнительные агенты могут также включать противораковые агенты, которые можно обобщенно охарактеризовать как антиметаболиты, ингибиторы топоизомеразы I и II, алкилирующие агенты и ингибиторы микротрубочек (например, таксол). Противораковые агенты для применения в настоящем изобретении включают, в числе прочих, например, альдеслейкин; алемтузумаб; алитретинон; аллопуринол; алтретамин; амифостин; анастрозол; триоксид мышьяка; аспарагиназу; живую вакцину BCG; бексаротен в капсулах; бексаротен гель; блеомицин; внутривенный бусульфан; пероральный бусульфан; калустерон; капецитабин; карбоплатин; кармустин; имплант кармустина с полифепросаном 20; целекоксиб; хлорамбуцил; цисплатин; кладрибин; циклофосфамид; цитарабин; липосомальный цитарабин; дакарбазин; дактиномицин; актиномицин D; дарбепоэтин альфа; липосомальный даунорубицин; даунорубицин; дауномицин; денилейкин дифтитокс; дексразоксан; доцетаксел; доксорубицин; липосомальный доксорубицин; дромостанолона пропионат; раствор Эллиотта B; эпирубицин; эпоэтин альфа; эстрамустин; этопозида фосфат; этопозид (VP-16); экземестан; филграстим; флоксуридин (внутриаретериально); флударабин; фторурацил (5-FU); фульвестрант; гемтузумаб озогамицин; госерелина ацетат; гидроксимочевину; ибритумомаб тиуксетан; идарубицин; ифосфамид; иматиниба мезилат; интерферон альфа-2a; интерферон альфа-2b; иринотекан; летрозол; лейковорин; левамизол; ломустин (CCNU); меклоретамин (азотистый иприт); мегестрола ацетат; мелфалан (L-PAM); меркаптопурин (6-MP); месну; метотрексат; метоксален; митомицин C; митотан; митоксантрон; нандролона фенпропионат; нофетумомаб; LOddC; опрелвекин; оксалиплатин; паклитаксел; памидронат; пегадемазу; пегаспаргазу; пегфилграстим; пентостатин; пипоброман; пликамицин; митрамицин; порфимер натрия; прокарбазин; хинакрин; расбуриказу; ритуксимаб; сарграмостин; стрептозоцин; талбувидин (LDT); тальк; тамокисфен; темозоломид; тенипозид (VM-26); тестолактон; тиогуанин (6-TG); тиотепа; топотекан; торемифен; тозитумомаб; трастузумаб; третинон (ATRA); урациловый иприт (урамустин); валрубицин; валторцитабин (монозиготный LDC); винбластин; винорелбин; золедронат; а также их смеси.
Гормональная терапия также может применяться в комбинации с введением фармацевтической композиции, содержащей соединение формулы I, II, III, IV и/или V. Гормоны могут применяться при лечении некоторых видов рака, например, груди, простаты, яичников или шейки матки для понижения уровня или блокирования эффектов определенных гормонов, как, например, тестостерона или эстрогена. Это лечение часто применяется в комбинации как минимум с одним другим видом противораковой терапии в качестве варианта лечения или для снижения риска метастазов.
Получение и введение действующих соединений и композиций
Соединения формулы I, II, III, IV и V можно получать способами, подробно раскрытыми в области техники или другими способами, известными специалисту в данной области техники. В случае соединений, содержащих два действующих агента, связывание соединения формулы I, II, III, IV и/или V с другим действующим агентом может быть легко осуществлено по стандартным методикам. Для формирования связующих групп легко можно использовать подходящие блокирующие группы и агенты.
Приведенные ниже примеры включены в текст заявки для демонстрации предпочтительных вариантов осуществления изобретения. Специалист в данной области техники должен понять, что методики, раскрытые в примерах, являются методиками, предложенными авторами, для правильной практической реализации изобретения, и поэтому их следует рассматривать как предпочтительные пути воплощения изобретения. Однако специалист в данной области техники в свете настоящего описания должен понять, что в конкретные раскрытые варианты осуществления можно внести многочисленные изменения, по-прежнему получая аналогичные или подобные результаты, не отступая от сути и не выходя за пределы объема настоящего изобретения.
ПРИМЕРЫ
Материалы и методики
Клеточные линии
Клетки линии HCT116 представляют собой клетки рака ободочной кишки человека, A549 моделируют клетки рака эпителия легких человека, H2882 моделируют клетки рака эпителия легких человека, HСС2429 моделируют клетки рака эпителия легких человека, HСС827 моделируют клетки рака эпителия легких человека, HСС15 моделируют клетки рака эпителия легких человека, H2087 моделируют клетки рака эпителия легких человека, HСС4017 моделируют клетки рака эпителия легких человека, HСС515 моделируют клетки рака эпителия легких человека, H2009 моделируют клетки рака эпителия легких человека, клетки BJ-hTERT моделируют нормальные фибробласты человека, экспрессирующие теломеразу, причем фибробласты человека BJ (активность теломеразы не проявляется) выращивали в среде Media X (Hyclone, Logan, UT)с добавкой 10% сыворотки Cosmic Calf serum (Hyclone).
Получение препаратов исследуемых веществ
6-тио-DG (Metkinen Oy, Kuopio, Finland) растворяли в смеси ДМСО/вода (1:2), 6-тио-G (Sigma, St Louis, MO) растворяли в среде, не содержащей сыворотки, и GRN163L (Geron Corporation, Menlo Park, CA) растворяли в фосфатном буферном солевом растворе (PBS), получая 50 мМ или 10 мМ исходные растворы, которые затем замораживали при -80°C. После получения исходных растворов, их делили на аликвоты 1 мМ растворов, которые затем разбавляли по мере необходимости для осуществления экспериментов in vitro.
GRN163L (иметелстат натрия) представляет собой 13-мерный тиофосфорамидатный олигонуклеотид, имеющий следующую последовательность: 5'-TAGGGTTAGACAA-3'. На 5'-конце иметелстата имеется пальмитоильная группа, что помогает олигонуклеотиду проникать через клеточные мембраны. Это соединение комплементарно матричной области субъединицы РНК человеческой теломеразы (hTR) и является высокоэффективным прямым и конкурентным ингибитором теломеразы. Обработка опухолевых клеток иметелстатом приводит к ингибированию теломеразы и последовательному укорачиванию теломеров, что ведет к старению или апоптозу клеток in vitro.
Долгосрочные исследования клеточных культур
Для долгосрочных экспериментов над клеточными культурами, клетки HCT116 (1000 клеток/см2) и BJ (10000 клеток/см2) питали средой, содержащей 6-тио-DG (1, 3 и 10 мкМ), каждые три дня. Клетки подсчитывали и повторно распределяли по планшетам каждую неделю в течение 10-16 недель. Кроме того, клетки HCT116 (1000 клеток/см2) питали 6-тио-G (1, 3 и 10 мкМ), каждые три дня, и каждую неделю клетки подсчитывали, собирали для проведения анализа TRF (рестрикция фрагментов теломеров) и повторно распределяли по планшетам. После обработки клеток HCT116 10 мкМ 6-тио-DG в течение 12 недель, их обрабатывали комбинацией 10 мкМ 6-тио-DG и 3 мкМ GRN163L в течение 2-4 недель.
Определение активности теломеразы
Активность теломеразы определяли по методике TRAMP (протокол амплификации теломерных повторов, как описано в Shay J.W and Bacchetti S., "A survey of telomerase activity in human cancer" European Journal of Cancer 1997; 33:787-91). Вкратце, клетки HCT116 обрабатывали 1 или 10 мкМ 6-тио-dG в течение 1-12 недель. Отбирали 1×105 клеток и осуществляли их лизис ледяным буфером для лизиса NP-40 (10 мМ Tris-HCl pH 8,0, 1,0 мМ MgCl2, 1 мМ EDTA, 1% NP-40, 0,25 мМ дезоксихолат натрия, 10% глицерин, 150 мМ NaCl, 5 мМ β-меркаптоэтанол) в течение 30 мин. Для каждой реакции отбирали 1 мкл клеточного лизата, что соответствовало 2500 клеткам. В качестве положительного контроля использовали клетки Hela, а в качестве отрицательного контроля использовали буфер для лизиса. Готовили образцы и затем осуществляли амплификацию продуктов удлинения теломеров под действием теломеразы, используя PCR (95°C в течение 5 мин для инактивации теломеразы, затем 95°C в течение 30 сек, 52°C в течение 30 сек, 72°C в течение 30 сек; 24 цикла). Образцы хроматографировали на 10% не-денатурирующем акриламидном геле и проводили визуализацию с помощью сканирующей системы Typhoon PhosphorImager (Molecular Dynamics, GE Healthcare, Piscataway, NJ), которая способна регистрировать флуоресценцию Cy5.
Исследование длины теломеров (TRF, рестрикция концевых фрагментов)
Отбирали 1×106 клеток и промывали PBS. Изолировали ДНК согласно инструкциям производителя (Qiagen, Valencia, CA). 2,5 мг ДНК расщепляли шестью различными рестрикционными ферментами (HhaI, Hinfl, MSpI, HaeIII, RsaI, AluI) (New England Bio, Ipswich, MA) и инкубировали в течение ночи при 37°C. Расщепленные ДНК отделяли на 0,7% агарозном геле в течение ночи при 70В. Гель концевых фрагментов рестрикции (TRF) денатурировали в течение 20 мин в денатурирующем растворе (0,5М NaOH, 1,5М NaCl, pH 13,2) и высушивали на ватманской бумаге 3ММ в вакууме в течение 3 часов при 56°C. Гель нейтрализовали в течение 15 минут в буфере для нейтрализации (15М NaCl, 0,5М Tris-HCl, pH 8,0) и затем исследовали с помощью теломерного зонда с радиоактивной меткой (C-rich) в течение 16 часов при 42ºC в 5хSSC буфере, 5х растворе Денхардта, 10 ммоль/л Na2HPO4 и 1 ммоль/л Na2H2P2O7. Гель один раз промывали 2ХSSC, 0,1%SDS, дважды 0,5XSSC, 0,1%SDS и затем дважды 0,5XSSC, 1%SDS при комнатной температуре в течение 15 мин. Гели подвергали воздействию PhosphorImager screen в течение ночи и анализировали полученные результаты с использованием сканирующей системы Typhoon PhosphorImager (Molecular Dynamics).
Исследование очагов, вызванных дисфункцией теломеров (TIF)
Исследование TIF основано на со-локализации детектирования повреждения ДНК под действием антител против маркеров повреждения ДНК, таких как, гамма-H2AX, и теломеры за счет теломерного белка TRF2. Вкратце, клетки HCT116 помещали в 4-луночные слайд-камеры, и после того, как клетки прикреплялись к поверхности, в среду добавляли 3 мкМ 6-тио-dG или 3 мкМ 6-тио-G в различные моменты времени (0, 30 мин, 12 ч, 24 ч, 48 ч. 72 ч). Слайд-камеры один раз промывали PBS и фиксировали в 4% параформальдегиде в PBS в течение 10 мин. Затем клетки дважды промывали PBS и пермеабилизировали в 0,5% Nonidet-P40 в PBS, блокировали 0,5% альбумином бычьей сыворотки (BSA) и 0,2% рыбным желатином в PBS в течение 30 мин. Гамма-H2AX (мышиный) (Millipore, Billerica, MA) разбавляли 1:1000, и TRF2 (кроличий) (Abcam, Cambrige, MA) разбавляли 1:200 в блокирующем растворе, и затем эту первичную смесь антител инкубировали на клетках в течение 2 ч. После трех промываний PBST (1xPBS в 0,1 Triton) и 3 промываний PBS, клетки инкубировали козьим антикроличьим антителом, конъюгированным с Alexaflour 488, (1:500) (Invitrogen, Grand Island, NY) и козьим антимышиным антителом, конъюгированным с Alexaflour 568, (1:500) (Invitrogen) в течение 40 мин, затем шесть раз промывали PBS. После высушивания слайд-камеры заливали гистологической средой Vectashield с DAPI (Vector Laboratories, Burlingame, CA). Изображения регистрировали с помощью широкопольного микроскопа Deltavision, после чего осуществляли деконволюцию с использованием программы Autoquant X3. Подсчет очагов TIFs осуществляли с помощью программы Imaris.
Статистический анализ
Сравнения различных групп по статистической достоверности осуществляли с использованием двустороннего t-критерия Стьюдента для независимой выборки. Значения P, равные 0,05 или менее считались статистически достоверными.
Результаты
Влияние 6-тио-dG и 6-тио-G на клеточную морфологию
Раковые клетки HCT116 и нормальные фибробласты BJ обрабатывали 6-тио-dG (3 мкМ) и 6-тио-G (3 мкМ) дважды в течение одной недели. После недельной обработки наблюдали за морфологией клеток, после чего клетки собирали и подсчитывали. На фиг.1 показаны результаты подсчета клеток. Обработка 6-тио-dG приводила к смерти подавляющего большинства клеток HCT116 и, кроме того, меняла их морфологию, тогда как морфология и количество клеток в случае нормальных фибробластов BJ подвергались лишь незначительному влиянию.
6-тио-dG, но не 6-тио-G, приводил к последовательному укорачиванию теломеров в раковых клетках
Для определения того, вызывают ли 6-тио-DG и 6-тио-G последовательное укорачивание теломеров, длину теломеров обработанных клеток оценивали с помощью анализа TRF. Раковые клетки HCT116 и нормальные фибробласты BJ обрабатывали 1мкМ или 10 мкМ 6-тио-dG в течение 1-12 недель каждые три дня. Кроме того, клетки HCT116 обрабатывали также 1 мкМ или 10 мкМ 6-тио-G в течение 1-10 недель каждые 3 дня для определения того, существует ли влияние этой молекулы на сохранение длины теломеров. Контролем служили необработанные клетки. Каждую неделю отбирали образцы для проведения анализа TRF в количестве 1×106 клеток/образец через 1, 5, 12 недель для клеток, которые подвергались обработке 6-тио-dG и через 1, 5 и 10 недель для клеток, обработанных 6-тио-G.
Результаты анализов TRF показали, что укорачивание теломеров можно было обнаружить уже через одну неделю и пять недель, причем еще более существенное укорачивание теломеров наблюдалось после 12 недель непрерывной обработки 6-тио-dG. После 12 недели, как для 1 мкМ, так и для 10 мкМ препаратов наблюдалось резкое укорачивание теломеров. В то же время, обработка 6-тио-G не приводила к какому-либо достоверному влиянию на длину теломеров клеток HCT116 после 10 недель обработки. Это позволяет предположить, что внутриклеточные метаболические пути 6-тио-dG и 6-тио-G являются различными и что 6-тио-dG существенно легче превращается в соответствующий 5'-тиофосфат, который в конце концов распознается теломеразой и включается в структуру теломеров.
Кроме того, фибробласты BJ, обработанные 6-тио-dG или 6-тио-G (данные не показаны) в течение 10 недель не продемонстрировали повышенного укорачивания теломеров по сравнению с необработанными контрольными клетками. При оценке активности теломеразы в клетках HCT116, обработанных 6-тио-dG или 6-тио-G, по методике TRAP, в обоих случаях не было обнаружено ингибирования активности теломеразы. (Для проведения анализа TRAP, клетки обрабатывали 1 и 10 мкМ 6-тио-dG каждые 3 дня в течение 12 недель. Каждую неделю отбирали образцы для анализа TRAP в количестве 1×105 клеток/образец. Контролем служили необработанные образцы). Это позволяет предположить, что 6-тио-dG вызывает укорочение теломеров независимо от ингибирования теломеразы.
6-тио-dG и GRN163L демонстрируют аддитивное влияние на укорачивание теломеров
Клетки HCT116 обрабатывали либо 10 мкМ 6-тио-dG индивидуально в течение 12-16 недель, либо 3 мкМ GRN163L индивидуально в течение 11 недель. Затем, клетки, выжившие после длительной обработки 6-тио-dG, культивировали с комбинацией 6-тио-dG (10 мкМ) и/или GRN163L (3 мкМ) в течение еще 2-4 недель. На Фиг.2 представлена таблица, в которой суммированы типы протестированных протоколов обработки. Обработка GRN163L не привела к какому-либо значимому укорачиванию теломеров через 11 недель по сравнению с контролем. При этом, комбинированная терапия обеспечила аддитивное, или даже синергетическое действие на укорачивание теломеров в клетках HCT116. Конкретно, клетки HCT116 после 12 недель обработки 6-тио-dG обрабатывали либо только GRN163L, либо комбинацией GRN163L + 6-тио-dG в течение еще 2 и 4 недель, для определения того, окажет ли это влияние на длину теломеров. Эти же клетки после 12 недель обработки GRN163L культивировали с 6-тио-dG, либо индивидуально либо в комбинации, что приводило к увеличению интенсивности укорачивания теломеров в клетках HCT116 по сравнению с клетками, культивированными с 6-тио-dG, в течение 12 недель, 14 недель и 16 недель. Эти результаты позволяют предположить, что комбинированная терапия 6-тио-dG и GRN163L может быть более эффективна, чем терапия любым из индивидуальных агентов, т.е. GRN163L или 6-тио-dG.
Обработка теломераза-позитивных раковых клеток только 6-тио-dG или только GRN163L действительно продемонстрировала укорачивание теломеров по сравнению с теломераза-негативными контрольными клетками. Однако клетки HCT116, обработанные 6-тио-dG в течение 12 недель, которые затем продолжали обрабатывать 6-тио-dG, продемонстрировали стабилизацию теломеров. Другими словами, зафиксированная длина теломеров оставалась приблизительно одинаковой через 12 недель и 16 недель. Кроме того, если клетки, культивированные с 6-тио-dG в течение 12 недель, затем возвращали в нормальную среду без препарата на 2-4 недели, теломеры оставались примерно такими же, как и после 12 недель обработки 6-тио-dG. Это позволяет предположить, что обработка 6-тио-dG не позволяет клеткам обратить влияние препарата на длину теломеров по крайней мере в течение 2-4 недель.
Стоит отметить, что ингибиторы теломеразы не вызывают немедленной смерти клеток. После связывания ингибиторов с теломеразой и подавления ее ферментной активности, теломераза теряет способность поддерживать гомеостаз теломеров. В действительности процесс превращения уже коротких теломеров в настолько короткие, чтобы это вызывало смерть клеток (апоптоз), может занимать до нескольких месяцев. Таким образом, в случае классических ингибиторов теломеразы существует значительный временной лаг до гибели раковых клеток. Как показало проведенное авторами исследование GRN163L, имеется задержка процесса укорочения теломеров для GRN163L по сравнению с 6-тио-dG (Фиг.3A (ингибирование теломеразы) и Фиг.3B (изменение теломеров (например, устранение защитных оболочек) в теломераза-позитивных клетках) демонстрируют сравнение соответствующих периодов задержки инициирования смерти клеток). 6-тио-dG значительно сокращал период задержки, поскольку механизм инициирования апоптоза заключается в превращении 6-тио-dG в 6-тио-dGTP в клетках. Продукты такого превращения являются хорошим и специфичным субстратом для теломеразы и могут включаться в структуру теломеров. Таким образом, соединения по настоящему изобретению не ингибируют теломеразу, но служат непосредственным терминатором цепи (который зависит от присутствия теломеразы) который будет распознан, как поврежденная ДНК и приведет к быстрому инициированию апоптоза.
6-тио-dG, но не 6-тио-G приводил к образованию очагов, вызванных дисфункцией теломеров (TIFs), в клетках, экспрессирующих теломеразу.
Нормальные клетки BJ и клетки, экспрессирующие теломеразу BJ-hTRET, высевали в слайд-камеры. После прикрепления клеток, в свежую среду добавляли 6-тио-dG (10 мкм) и 6-тио-G (10 мкМ) для клеток обоих типов. Для выяснения, вызывают ли 6-тио-dG и 6-тио-G дисфункцию теломеров в нормальных клетках, по сравнению с клетками, экспрессирующими теломеразу, проводили анализ TIF. Для каждого типа клеток использовали контрольные образцы, которые получали, добавляя ДМСО к свежей среде. Используя комбинацию гамма-H2AX и иммуноокрашивания TRF2, экспериментаторы получили возможность различать повреждения геномной ДНК и специфических повреждений теломеров через 48 часов. Результаты показаны в таблице 1. Как видно из представленных данных, 6-тио-dG вызывал образование очагов, связанных с дисфункцией теломеров, в клетках BJ-hTERT и демонстрировал более высокую специфичность в отношении клеток, экспрессирующих теломеразу, по сравнению с нормальными клетками. По сравнению с ним, 6-тио-G не вызывал образования очагов, связанных с дисфункцией теломеров. Это показывает, что только клетки, экспрессирующие теломеразу, подвергаются влиянию 6-тио-dG. Такие клетки включают почти все раковые клетки человека, а также клетки, связанные с рядом заболеваний у людей, в т.ч. с острыми и хроническими воспалениями.
|
Обработка 6-тио-dG приводит к дисфункции теломеров в раковых клетках
Раковые клетки HCT116 высевали в слайд-камеры. После прикрепления клеток, в свежую среду добавляли 6-тио-dG (3 мкМ) и 6-тио-G (3 мкМ) в различные моменты времени (0, 30 мин, 2 ч, 12 ч, 24 ч, 48 ч, 72 ч). Для выяснения того, вызывают ли 6-тио-dG и 6-тио-G дисфункцию теломеров в раковых клетках, проводили анализ TIF. Используя комбинацию гамма-H2AX и иммуноокрашивание TRF2, экспериментаторы получили возможность различать повреждения геномной ДНК и специфических повреждений теломеров. Обработка 6-тио-dG вызывала 2,8-кратное увеличение повреждений теломерных областей ДНК по сравнению с 6-тио-G через 72 ч (Фиг. 4). Помимо увеличения повреждения теломеров под действием 6-тио-dG, имело место также общее увеличение повреждения геномной ДНК по сравнению с 6-тио-G (фиг.5). Со-локализация гамма-H2AX и TRF2 показывает наличие нефункциональных теломеров, которые могут оставлять концы хромосом незащищенными и могут вызывать реакцию на повреждение ДНК, как, например, остановку цикла деления клетки, старение, апоптоз и слияние концов хромосом.
Обработка 6-тио-dG снижает выживаемость и жизнеспособность клеток HCT116
Как показано на фиг.6, доля выживших клеток HCT116, которые подвергались обработке 6-тио-dG, ниже, чем выживших клеток, которые подвергались обработке 6-тио-G. Клетки HCT116 обрабатывали 6-тио-dG (3 мкМ) и 6-тио-G (3 мкМ) и через 72 часа облучали различными дозами ионизирующего излучения. После обработки клетки высевали с различной плотностью и культивировали в течение 10 дней. Как показано на фиг.6B жизнеспособность клеток HCT116, обработанных 6-тио-dG была ниже, чем клеток, обработанных 6-тио-G. Выживаемость клеток определяли с использованием люминесцентного анализа Cell Titer Glo®.
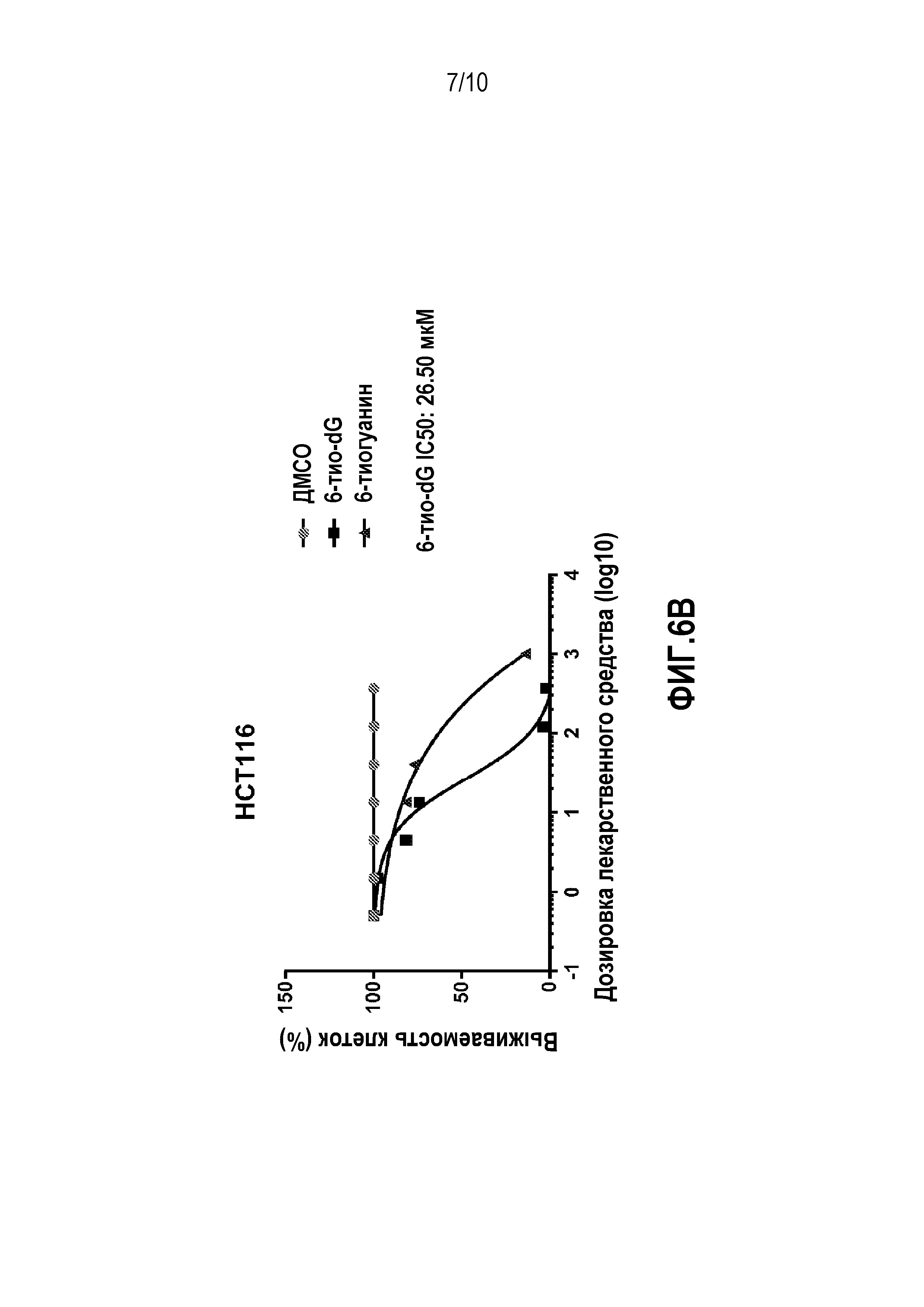
Значения GI50 для нормальных клеточных линий и панели линий раковых клеток демонстрируют, что 6-тио-dG более эффективен при низких дозировках, чем 6-тио-G против ряда линий раковых клеток
Клетки каждой из линий, перечисленных в таблице 2, высевали в слайд-камеры. Определяли значения GI50 для панели линий раковых клеток и линии нормальных клеток BJ для 6-тио-dG и 6-тио-G. Как показано в таблице 2, значения GI50 немного выше для 6-тио-G по сравнению с 6-тио-dG для всех линий раковых клеток за исключением H2087, где эти значения равны. Таким образом, 6-тио-dG оказался более эффективным в низких дозировках против широкого круга линий раковых клеток по сравнению с 6-тио-G. Это позволяет предположить, что 6-тио-dG является более эффективным химиотерапевтическим агентом по сравнению с уже разрешенным к применению соединением 6-тио-G благодаря дополнительному механизму действия. В исследованиях ксенотрансплантатов и токсичности для мышей, которые описаны в следующих разделах, было показано, что 6-тио-dG не только более эффективен в уменьшении опухолевой нагрузки, но и обладает меньшей токсичностью (например, вызывает меньшую потерю массы).
|
Воздействие 6-тио-dG снижает скорость роста опухоли в животных моделях ксенотрансплантата для клеток HCT116 и A549
Осуществляли IP-введение мышам 6-тио-dG в дозировке 2 мг/кг и 6-тио-G в дозировке 2 мг/кг один раз в два дня, проводя по 6 инъекций. В качестве контроля осуществляли инъекции ДМСО. Измеряли объем опухолей. На фиг.7A показано, что скорость роста опухолей была ниже у животных моделей с клетками HCT116, получавших инъекции 6-тио-dG.
После имплантации опухоли и прохождения определенного времени для начала роста опухоли, мышам осуществляли инъекции 6-тио-dG в дозировке 2,5 мг/кг и 6-тио-G в дозировке 2,5 мг/кг. В качестве контроля использовали инъекции ДМСО. Измеряли объем опухоли. На фиг.7B показано, что скорость роста опухоли была меньше в случае животных моделей с клетками рака легких человека A549, получавших инъекции 6-тио-dG, по сравнению с контролем и мышами, получавшими 6-тио-G. Кроме того, при гистологическом сравнении остатков опухолей, препараты опухолей, обработанных 6-тио-dG, были в основном фиброзными и часто включали апоптотические и воспалительные клетки, тогда как образцы 6-тио-G и контрольных опухолей демонстрировали главным образом "здоровые" растущие раковые клетки.
Исследование токсического действия на крыс
Шести крысам вводили 15 мг 6-тио-dG/кг массы тела каждые два дня. Одна крыса умерла после 6 инъекций, оставшиеся пять особей не продемонстрировали признаков нарушения функций организма. Оставшимся 5 особям вводили 50 мг 6-тио-dG/кг массы тела через день. Все крысы умерли через 12 дней.
Оценка токсического действия по потере массы тела мышами WT
Шести мышам WT ежедневно вводили 1,67 мг 6-тио-dG/кг массы тела. Шести мышам WT ежедневно вводили 1,67 мг 6-тио-G/кг массы тела. Шести мышам WT ежедневно вводили 5 мг 6-тио-dG/кг массы тела. Шести мышам WT ежедневно вводили 5 мг 6-тио-G/кг массы тела. Мышам давали соответствующую дозировку и ежедневно взвешивали в течение 25 дней. Результаты показаны на Фиг 8A и 8B. У мышей, получавших более низкую дозу, т.е. 1,67 мг/кг, которая является примером эффективной противораковой дозы, не наблюдалось потери массы при введении 6-тио-dG. Для сравнения, у мышей получавших 6-тио-G в такой же дозировке, потеря массы тела на протяжении 25 дневного введения составляла 1-2 грамма (6-12% исходной массы тела). У мышей, получавших более высокую дозировку 5 мг/кг (2-3 превышение относительно эффективной противораковой дозы), наблюдалась лишь умеренная потеря массы тела в случае введения 6-тио-dG. Для сравнения, у мышей, получавших 6-тио-G в той же дозировке, потеря массы тела составляла примерно 2 грамма, и все мыши умерли на 15-й день введения. Важно отметить, что эти результаты у нормальных мышей позволяют предположить, что ожидаемая токсичность, связанная с введением раковым пациентам 6-тио-dG, по-видимому, будет значительно ниже по сравнению с токсичностью уже одобренного для применения соединения 6-тио-G. Кроме того, существует достоверный эффект уменьшения объема опухоли при введении 6-тио-dG при ~3 раза более низких дозировках, которые не вызывают потери массы у мышей.
Все композиции и способы, описанные и заявленные в настоящем изобретении, могут быть реализованы без чрезмерно большого объема экспериментальной работы в свете настоящего описания. Хотя композиции и способы по настоящему изобретению были описаны с точки зрения предпочтительных вариантов их осуществления, специалисту в данной области техники должно быть очевидно, что в композиции и способы, а также в стадии и последовательность стадий способов по настоящему изобретению могут вноситься изменения, без отступления от концепции и сути изобретения, и без выхода за пределы объема изобретения. Более конкретно, должно быть очевидно, что некоторые агенты, которые являются родственными с химической и физиологической точки зрения, могут применяться вместо агентов, описанных в тексте заявки, причем могли бы быть достигнуты те же самые или аналогичные результаты. Считается, что все подобные замены и модификации, очевидные специалисту в данной области техники, соответствуют сути, объему и концепции настоящего изобретения, которые определяются приложенной формулой изобретения.