Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ НАНОЧАСТИЦ АСПАРАГИНАТА ХИТОЗАНА
Вид РИД
Изобретение
Изобретение относится к области химии полимеров, нанотехнологии, фармацевтической промышленности, медицине и может быть использовано для получения полимерных наночастиц из аспарагината хитозана, перспективного для создания новых, в том числе персонализированных лекарственных форм.
Последнее четвертое поколение лекарственных средств на основе наночастиц - так называемых терапевтических систем - характеризуется высокой эффективностью, отсутствием побочных эффектов, пролонгированным действием, предполагает направленный транспорт лекарственного вещества и его векторное действие в зоне запланированной локализации, а также, и это самое главное, инициирование процесса саногенеза (восстановление механизмов саморегуляции) живого организма. Терапевтически активные наночастицы получают, как правило, инкапсулированием биологически активного вещества (БАВ) в липосомальную или липоплексовую оболочку, полиэлектролитные капсулы, наномицеллы амфифильных полимеров или циклодекстриновые нанополости, либо адсорбцией БАВ на поверхности наночастиц и др. В отличие от классических лекарственных форм, проникновение действующего вещества которых обеспечивается через эндотелий, проникновение наносистем происходит на уровне эндоцитоза.
Наибольшим потенциалом должны обладать наночастицы полностью построенные из БАВ. В качестве потенциального материала для создания таких частиц может рассматриваться аминополисахарид хитозан. Хитозан обладает антибактериальным, противовирусным и фунгицидным действием, проявляет антитоксическую, иммунотропную и противовоспалительную активности. Материалы на основе хитозана совместимы с живыми тканями, биорезорбируемы, способны стимулировать процессы ранозаживления, регенерации тканей, саногенеза.
В настоящее время для получения наночастиц хитозана используют методы сшивания полимерной эмульсии преимущественно глутаровым альдегидом, коацервации/осаждения с использованием растворов неорганических солей, распылительной сушки в присутствии сшивающих агентов или в среде сверхкритических жидкостей, ионотропного гелеобразования с применением натриевой соли триполифосфата и др. (Naskar S., Koutsu K., Sharma S. Chitosan-based nanoparticles as drug delivery systems: a review on two decades of research // Journal of Drug Targeting. 2019. Vol. 27. No 4. P 379-393).
Данные методы получения наночастиц хитозана многостадийны, сложны в аппаратурном оформлении и требуют дорогостоящего оборудования. Некоторые методы предполагают использование органических растворителей, сшивающих реагентов и поверхностно-активных веществ, большинство из которых не разрешено к применению в медико-фармацевтических приложениях и образует токсичные побочные продукты. Все это может оказывать негативное действие на биосовместимость и другие биохимические свойства готового материала, и соответственно, ограничивать его применение в медицинской практике. Кроме того, данные способы не поддаются масштабированию.
Известен способ получения наночастиц глутамата хитозана (см. патент РФ №2562723 по кл. МПК С08В37/08, опуб. 10.09.2015). Способ предусматривает растворение порошка хитозана с молекулярной массой ММ = 3, 9 или 30 кДа в водном растворе глутаминовой кислоты концентрации 0.005-0.1375% в соотношении [хитозан] : [глутаминовая кислота] = 1 : 0.864 при перемешивании со скоростью 200 об/мин в течение 2 час. По первому варианту способа реакционную смесь перемешивают при комнатной температуре, затем в систему вводят этанол и центрифугируют. Твердый осадок фильтруют и сушат в вакуумном сушильном шкафу при температуре 30°С. По второму варианту способа реакционную смесь перемешивают при температуре 70°С. По окончании реакции полученный раствор вакуумируют на роторном испарителе при 70-75°С и при -0.8 - -0.9 атм, а затем при той же температуре в вакууме 0.5-1 мм рт.ст. По данным динамического светорассеяния водной дисперсии способ позволяет получить наночастицы глутамата хитозана размером от 165 до 340 нм.
Однако, в предложенном способе получения наночастиц глутамата хитозана используются только низкомолекулярные образцы хитозана. Реализация способа требует специального дорогостоящего оборудования (термостат, вакуумный сушильный шкаф, роторный испаритель), высоких температур, низких давлений (вакуум), достаточно длительного времени проведения эксперимента. Введение этилового спирта в объем реакционной смеси может вызвать агрегацию нанодисперсий и укрупнение наночастиц. Кроме того, при высаживании частиц этиловым спиртом протекает депротонирование солевой формы хитозана, так что в способе получают частицы не глутамата хитозана, а хитозана в основной форме. Получение биологически активных наночастиц хитозана в способе не ставилось.
Наиболее близким к заявленному является способ получения наночастиц сукцината хитозана (см. патент РФ №2562721 по кл. МПК С08В 37/08, опуб. 10.09.2015). Способ предусматривает растворение порошка янтарной кислоты при температуре 20°С в дистиллированной воде до получения раствора концентрации 0.11-0.17 %, фильтрацию не растворившейся янтарной кислоты, введение в фильтрат предварительно очищенного низкомолекулярного хитозана с ММ = 3, 9 или 30 кДа при перемешивании со скоростью 200 об/мин в течение 2 часов. Затем в раствор добавляют этанол, суспензию центрифугируют, фильтруют и сушат твердый осадок в вакуумном сушильном шкафу при температуре 30°С. По данным динамического светорассеяния способ позволяет получить наночастицы низкомолекулярного хитозана с размером от 165 до 340 нм.
Однако, в способе используют низкомолекулярный, предварительно очищенный образец хитозана. Получение сукцината хитозана предполагает растворение хитозана в предварительно полученном растворе янтарной кислоты. Высаживание солевой формы хитозана органическим растворителем в объеме реакционной среды трудно контролируется и может привести к агрегации и, соответственно, укрупнению наночастиц. Кроме того, введение в водную дисперсию сукцината хитозана этилового спирта должно сопровождаться депротонированием солевой формы хитозана, так что в способе получают наночастицы не сукцината хитозана, а хитозана. Получение биологически активных наночастиц хитозана в способе не ставилось.
Технической проблемой заявляемого изобретения является разработка способа получения биологически активных, устойчивых к агрегации наночастиц на основе аспарагината хитозана и L-аспарагиновой кислоты.
Техническим результатом является получение биологически активных, кинетически стабильных наночастиц аспарагината хитозана размером 50-310 нм при упрощении способа получения и сохранении высокой биологической активности полимерной системы.
Техническая проблема достигается тем, что в способе получения производных хитозана, заключающемся в смешивании хитозана с кислотой и получении целевого продукта, согласно изобретению, используют порошок высокомолекулярного хитозана, в качестве кислоты используют порошок L-аспарагиновой кислоты, которые смешивают и диспергируют в воде для получения раствора аспарагината хитозана с концентрацией в нем хитозана (0.2-1.8)⋅10-2 М и концентрацией L-аспарагиновой кислоты (1.5-3.0)⋅10-2 М при мольном соотношении [хитозан(-NН2)] : [кислота] = 0.07-0.60, в полученный раствор аспарагината хитозана при перемешивании добавляют раствор хлорида натрия для получения водной дисперсии с концентрацией в ней хлорида натрия (2.5-10)⋅10-2 М и содержащей наночастицы аспарагината хитозана.
Для получения стабилизированных наночастиц аспарагината хитозана после добавления раствора хлорида натрия в водную дисперсию дополнительно вводят тетроглицеролат кремния до его концентрации в дисперсии (0.2-0.3)⋅10-2 М и перемешивают смесь в течение 48 часов.
Использование раствора L-аспарагиновой кислоты концентрации более 3.0⋅10-2 М нецелесообразно вследствие ограниченной растворимости порошка кислоты в воде.
При использовании для получения наночастиц водного раствора аспарагината хитозана с концентрацией хитозана более 1.8⋅10-2 М формируются частицы микронного размера. При использовании растворов аспарагината хитозана с СХТЗ < 0.2⋅10-2 М и СAsp < 1.5⋅10-2 М наночастицы не формируются.
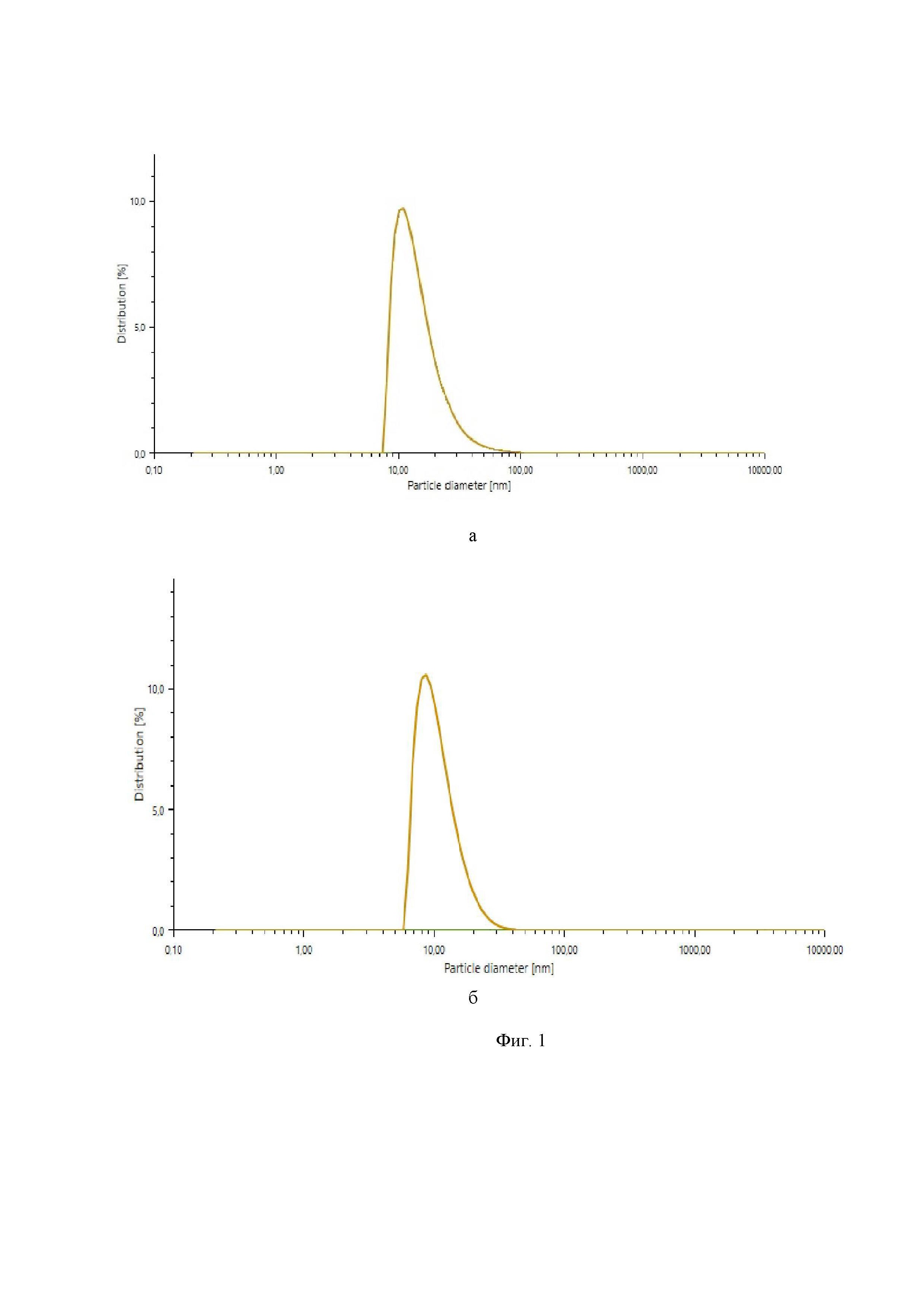
Изобретение поясняется иллюстрациями, где:
- на фиг. 1 представлены кривые объемного распределения наночастиц аспарагината хитозана, полученных методом коацервации без (а) и в присутствии стабилизатора (б);
- на фиг. 2 приведен пример сформированного монослоя фибробластов через 48 час культивирования в питательной среде DMEM с 10% FBS с добавкой водной дисперсии наночастиц аспарагината хитозана.
В основе способа получения наночастиц лежит внутримолекулярная сшивка макромолекул полимера низкомолекулярной солью (принцип коацервации) с сохранением солевой формы аспарагината хитозана (водные дисперсии наночастиц).
Таким образом, наночастицы представляют собой водную дисперсию наночастиц аспарагината хитозана.
Для получения кинетически стабильных наночастиц аспарагината хитозана способ предусматривает получение наночастиц типа «ядро-оболочка» посредством формирования на поверхности наночастиц аспарагината хитозана пленочной оболочки из неорганической сетки ≡Si-О-Si≡ связей путем добавления в систему водно-глицеринового раствора тетроглицеролата кремния.
Используют хитозан со степенью дезацетилирования ≥ 75-80 мольн. % и ММ 200 кДа.
L-аспарагиновая кислота (Asp) - двухосновная, биполярная алифатическая аминокислота, одна из 20 протеиногенных аминокислот организма, выполняет роль нейромедиатора в центральной нервной системе. Данная кислота и ее соли широко используются как компоненты лекарственных средств.
Хлорид натрия (NaCl) - натриевая соль соляной кислоты. Является сильным электролитом, при растворении в воде полностью диссоциирует на ионы Na+ и Cl-. Хлорид натрия (ФС.2.2.0014.15) обладает гидратирующим, дезинтоксикационным действием, нормализует кислотно-щелочной баланс в живом организме, поддерживает соответствующее осмотическое давление плазмы крови и внеклеточной жидкости. В медицинской практике чаще всего используется 0.9% раствор хлорида натрия, который изотоничен плазме крови и гипертонические растворы (3-10%) для внутривенного введения. При наружной аппликации они проявляют противомикробную активность.
Тетроглицеролат кремния (Si(OGly)4) - биологически активное вещество, проявляет транскутанную и антибактериальную активности. В водной среде гидролизуется с протеканием золь-гель реакции и формированием полисилоксановой пространственной сетки ≡Si-О-Si≡ связей, центрами нуклеации которых выступают свободные гидроксигруппы. Золь-гель гидрогели на основе тетроглицеролата кремния обладают ранозаживляющей, транскутанной активностью и рекомендованы для практического использования в качестве самостоятельных лекарственных средств или основ фармацевтических композиций.
Глицерин (Gly(ОН)3) в составе водно-глицериновой среды является растворителем для тетроглицеролата кремния и пластификатором для хитозана. Разрешен к применению в медицине (ФС.2.2.0006.15).
Размер наночастиц аспарагината хитозана в водной дисперсии измеряют на анализаторе частиц Litesizer™500 методом динамического светорассеивания с использованием одноразовых пoлистиpoльных кювет.
В качестве исходных реагентов для получения наночастиц используют хитозан со степенью дезацетилирования ≥ 75-80 мольн. % и ММ = 200 кДа, L-аспарагиновую кислоту, хлорид натрия, раствор тетроглицеролата кремния в глицерине, бидистиллированную воду, дегазированную от СО2 и О2 кипячением при 100°С в течение 1 час.
Способ осуществляется следующим образом.
Готовят водный раствор хитозана и L-аспарагиновой кислоты из расчета в нем концентрации хитозана СХТЗ = (0.2-1.8)⋅10-2 М и концентрации L-аспарагиновой кислоты СAsp = (1.5-3.0)⋅10-2 М при соблюдении мольного соотношения [хитозан(-NН2)] : [кислота] = 0.07-0.60. Процесс растворения компонентов проводят по стандартной методике при комнатной температуре. Для этого навески порошка хитозана и порошка L-аспарагиновой кислоты помещают в колбу заданного объема, добавляют расчетное количество бидистиллированной воды, перемешивают до полного растворения компонентов (формирования аспарагината хитозана) не более 2 часов и фильтруют через фильтр Millipore с диаметром пор ≤ 0.45 мкм. Хранят при +4°С не более двух суток.
Для приготовления раствора хлорида натрия концентрации СNaCl = 0.2 М навеску NaCl массой 1.17 г помещают в колбу объемом 100 мл и доводят бидистиллированной водой до метки.
Тетроглицеролат кремния используют в виде вводно-глицеринового раствора при мольном соотношении [Si(OGly)4] : [Gly(ОН)3]=1:3-1:6.
Для получения наночастиц аспарагината хитозана используют метод коацервации. Для этого в полученный раствор аспарагината хитозана при перемешивании добавляют раствор хлорида натрия до СNaCl в полученном растворе (2.5-10)⋅10-2 М. При использовании раствора с СNaCl < 2.5⋅10-2 М образуется незначительное количество сшивок, а при концентрации СNaCl > 10⋅10-2 М формируются микрочастицы.
Для получения стабилизированных (кинетически стабильных) наночастиц аспарагината хитозана в раствор аспарагината хитозана с добавкой раствора хлорида натрия вводят раствор тетроглицеролата кремния в глицерине до концентрации в полученном растворе СSi(OGly)4 = (0.2-0.3)⋅10-2 М. Систему диспергируют на магнитной мешалке с частотой оборотов 500 об/мин в течение 48 час. Введение Si(OGly)4 позволяет получить стабильные наночастицы типа «ядро-оболочка». Частицы агрегативно устойчивы более одного года.
Пример 1. Готовят водный раствор аспарагината хитозана из расчета концентрация хитозана 0.9⋅10-2 М и концентрация L-аспарагиновой кислоты 3.0⋅10-2 М. Для этого навески хитозана и аспарагиновой кислоты помещают в колбу заданного объема, добавляют расчетное количество бидистиллированной воды, перемешивают в течение 2-х час. Полученный раствор аспарагината хитозана фильтруют через фильтр Millipore с диаметром пор ≤ 0.45 мкм. В систему вводят раствор хлорида натрия до концентрации 2.5⋅10-2 М и перемешивают.
По данным динамического светорассеяния размер частиц аспарагината хитозана в водной дисперсии составляет 300-310 нм.
Пример 2. Все этапы получения наночастиц аспарагината хитозана аналогичны примеру 1. Отличие состоит в том, что концентрация хитозана в растворе составляет СХТЗ = 0.5⋅10-2 М. Размер выделенных частиц 200-220 нм.
Пример 3. Все этапы получения наночастиц аспарагината хитозана аналогичны примеру 1. Отличие в том, что концентрация хлорида натрия в растворе составляет СNaCl = 5⋅10-2 М. Размер выделенных частиц 200-220 нм.
Пример 4. Все этапы получения наночастиц аспарагината хитозана аналогичны примеру 2. Отличие в том, что СNaCl = 5⋅10-2 М. Размер выделенных частиц 180-190 нм.
Пример 5. Все этапы получения наночастиц аспарагината хитозана аналогичны примеру 3. Отличие в том, что СNaCl = 10⋅10-2 М. Размер выделенных частиц 190-200 нм.
Пример 6. Все этапы получения наночастиц аспарагината хитозана аналогичны примеру 4. Отличие в том, что СNaCl = 10⋅10-2 М. Размер выделенных частиц 70-80 нм. Пример объемного распределения наночастиц аспарагината хитозана, полученных методом коацервации, приведен на фиг. 1 а.
Пример 7. Все этапы получения наночастиц аспарагината хитозана аналогичны примеру 5. Отличие в том, что концентрация L-аспарагиновой кислоты в растворе составляет СAsp = 1.5⋅10-2 М. Размер выделенных частиц 90-100 нм.
Пример 8. Все этапы получения наночастиц аспарагината хитозана аналогичны примеру 6. Отличие в том, что СХТЗ = 1.8⋅10-2 М, в полученную систему дополнительно вводят раствор тетроглицеролата кремния в глицерине до концентрации СSi(OGly)4 = 0.3⋅10-2 М и перемешивают в течение 48 час на магнитной мешалке.
По данным динамического светорассеяния размер частиц аспарагината хитозана в водной дисперсии составляет 290-300 нм.
Пример 9. Все этапы получения наночастиц аспарагината хитозана аналогичны примеру 8. Отличие в том, что СХТЗ = 0.9⋅10-2 М. Размер выделенных частиц 80-90 нм.
Пример 10. Все этапы получения наночастиц аспарагината хитозана аналогичны примеру 9. Отличие в том, что СХТЗ = 0.2⋅10-2 М, СSi(OGly)4 = 0.2⋅10-2 М. Размер выделенных частиц 50-60 нм.
Пример 11. Все этапы получения наночастиц аспарагината хитозана аналогичны примеру 10. Отличие в том, что СХТЗ = 0.9⋅10-2 М, СAsp = 1.5⋅10-2 М. Размер выделенных частиц 60-70 нм. Пример объемного распределения наночастиц аспарагината хитозана, полученных методом коацервации в присутствии стабилизатора приведен на фиг. 1 б.
Данные примеров 1-11 представлены в таблице.
Таким образом, показана возможность получения кинетически стабильных наночастиц аспарагината хитозана размером 50-310 нм сравнительно простым способом с использованием принципов коацервации и золь-гель стабилизации.
Способ получения наночастиц аспарагината хитозана экономически выгодно масштабируется.
Пример 12. Оценка цитотоксичности и биосовместимости наночастиц аспарагината хитозана. Используют дисперсию наночастиц аспарагината хитозана, полученную по примерам 2, 6, 10. Оценку цитотоксичности и биосовместимости проводят с использованием культуры человеческих дермальных фибробластов, полученных из биоптатов кожи здоровых взрослых доноров после косметической операции.
В стерильные чашки Петри вносят ростовую среду DMEM (Sigma), дополненную 10% FBS (Hyclone) и 1% антибиотиков (Sigma), водную дисперсию наночастиц аспарагината хитозана в объемном соотношении [водная дисперсия наночастиц] : [ростовая среда] = 1 : 1, а затем суспензию человеческих дермальных фибробластов из расчета 200 тыс. кл./мл и культивируют 72 час в условиях насыщающей влажности в инкубаторе с 5% СО2 при 37°С. Оценивают время формирования зрелого монослоя клеток, которое сравнивают с временем формирования монослоя культуры клеток, выросшей в такой же питательной среде в отсутствии водной дисперсии наночастиц аспарагината хитозана, и относительный индекс пролиферации - отношение количества клеток, выросших в тестовой среде по сравнению с контролем.
Тестирование показало, что время формирования зрелого монослоя человеческих дермальных фибробластов в присутствии наночастиц аспарагината хитозана составляет менее 48 час, а в контроле - более 60 час. Относительный индекс пролиферации клеток фибробластов через 48 час культивирования в присутствии наночастиц аспарагината хитозана равен 2.7, в контроле - 1.0. Пример сформированного монослоя фибробластов через 48 час культивирования в условиях насыщающей влажности в СО2-инкубаторе при температуре 37°С в питательной среде DMEM с 10% FBS с добавкой водной дисперсии наночастиц аспарагината хитозана приведен на фиг. 2.
Полученные результаты показывают, что наночастицы аспарагината хитозана не цитотоксичны и биосовместимы, поскольку не угнетают рост клеточной культуры человеческих дермальных фибробластов. Кроме того, присутствие в ростовой среде наночастиц аспарагината хитозана значительно ускоряет рост клеточной популяции фибробластов.
Таблица
Характеристика исходной системы и размер наночастиц аспарагината хитозана
|