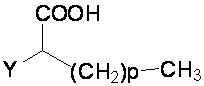СОЕДИНЕНИЯ ФЕНИЛКЕТОНКАРБОКСИЛАТА И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ПРЕДОТВРАЩЕНИЯ И ЛЕЧЕНИЯ ОСТЕОПОРОЗА
Вид РИД
Изобретение
Данное изобретение относится к области медицины. Конкретные аспекты изобретения относятся к соединениям, фармацевтическим композициям и их применению для предотвращения или лечения остеопороза
УРОВЕНЬ ТЕХНИКИ
Ремоделирование костной ткани начинается с удаления старой кости с помощью остеокластов на этапе фазы резорбции, длящейся несколько недель. Затем в трещины, образовавшиеся в результате эрозии, мигрируют остеобласты и на протяжение трех или четырех месяцев откладывают новую костную ткань. В нормальном скелете ремоделирование костной ткани протекает при сочетании активностей остеокластов и остеобластов так, чтобы количество отложенной новой костной ткани было равным количеству удаленной костной ткани, поддерживая таким образом здоровую костную массу. Тем не менее, если резорбция костной ткани превышает её образование, происходит общая потеря костной ткани. Возникшее вследствие этого патологическое состояние, остеопороз, характеризуется излишней резорбцией костной ткани и последующей низкой массой костной ткани с повышенной ломкостью костей.
Остеопороз представляет собой общий термин, используемый в отношении заболеваний костей разнообразной этиологии, которые характеризуются уменьшением костной массы в единице объема до уровня ниже того, что требуется для адекватной механической опоры (Krane, S.M. et al.,“Metabolic Bone Disease” в Harrison’s Principles of Internal Medicine, страница 1889, Издание 11 (1987)). Одна из форм остеопороза представляет собой старческий остеопороз, который является ответственным за большую часть расходов в области здравоохранения на популяцию пожилых людей (Resnick, N.M. et al.“Senile Osteoporosis Reconsidered”, JAMA 261, 1025-1029 (1989)). Две другие наиболее распространенные формы остеопороза представляют собой пери- или постменопаузальный остеопороз и вызванный кортикостероидами остеопороз. У пациентов с хронической болезнью почек (ХБП) могут развиться заболевания костей, которые могут включать остеопороз в результате изменений в минеральном обмене веществ и последующих изменениях в структуре костной ткани. Наиболее часто указанные изменения усугубляются прогрессирующей потерей функции почек. Действительно и, как обобщено в параграфе ниже, ряд патологических состояний может возникать, который повышает вероятность развития остеопороза. Остеопороз, подобный остеомаляции, имеет много подобных симптомов с остеопорозом, таких как потеря кальция. Остеопения относится к более низкой, чем нормальная плотность костной ткани, но не такой низкой, как наблюдается при остеопорозе. Считается, что она предшествует остеопорозу. Незавершенный остеогенез представляет собой врожденное поражение костей, характеризуемое ломкими костями, склонными к переломам. Мраморная болезнь представляет собой редкую наследственную болезнь, при которой кости затвердевают, но являются более ломкими, чем нормальные. Остеонекроз представляет собой заболевание, которое обусловливает смерть костной ткани и коллапс из-за нарушения кровоснабжения костной ткани. Болезнь Педжета обусловлена излишней деградацией и образованием костной ткани с последующим дезорганизованным ремоделированием костной ткани.
Как известно, разнообразные заболевания и патологические состояния могут обусловливать остеопороз: аутоиммунные заболевания, которые включают ревматоидный артрит, волчанку и рассеянный склероз; нарушения со стороны желудочно-кишечного тракта, которые включают глютеиновую болезнь, воспалительное заболевание кишечника, гастрэктомию и желудочно-кишечный анастомоз; эндокринные/гормональные нарушения, которые включают диабеты, гиперпаратиреоз, тиреотоксикоз и синдром Кушинга; нарушения со стороны кроветворной системы, которые включают лейкоз, лимфому, множественную миелому, серповидно-клеточную анемию (нарушения костного мозга) и талассемию; рак, который включает рак груди и предстательной железы; неврологические нарушения, которые включают депрессию, болезнь Паркинсона и повреждение спинного мозга; заболевания органов, которые включают заболевания легких (COPD, эмфизему), печени и хроническое заболевание почек; анкилозирующий спондилоартрит; СПИД/ВИЧ; перелом кости; плохое питание, которое включает расстройства пищевого поведения и недостаточное питание; и менопаузу (пре-менопаузу и пост-менопаузу).
Исторически остеобласт считался главной клеткой, контролирующей развитие остеокласта и, таким образом, резорбцию костной ткани. В настоящее время взаимодействия между клетками иммунной системы и костными клетками позволили пересмотреть представление о регуляции резорбции костной ткани. Идентификация остеокласта и его роли в разрушении костной ткани позволяет создать прицельную терапию для уменьшения резорбционной способности. Такие терапии включают применение агентов, которые могут мешать рецептору-активатору лиганда NFκB (RANKL), одному из ключевых цитокинов, способствующему дифференциации остеокласта. Это может быть достигнуто путем применения рекомбинантного Fc-остеопротегерина (Fc-OPG) или гуманизированного антитела анти-RANKL (Деносумаб), которое разрабатывается Amgen. Оба продукта показали эффективность на доклинических моделях потери костной ткани, Деносумабом проходит клинические исследования; Fc-OPG выведен из клинических исследований из-за иммунных побочных эффектов. Другие ингибиторы остеокластной активности включают бисфосфонаты, ингибиторы c-src, ингибиторы катепсина K и CLC7 ингибиторы канала-переносчика для ионов хлора (Gillespie, M.T.(2007) Arthritis Research & Therapy, Том 9, №2, стр,103-105). Следует заметить, что бисфосфонаты успешно проявили себя в ограничении потери костной ткани на моделях артрита грызунов, хотя азотсодержащие бисфосфонаты (которые включают алдронат, ибандронат, памидронат и золедронат) увеличивают пролиферацию γ/δ T лимфоцитов, в отличие от не содержащих азота бисфосфонатов (например, клодронат), которые её не увеличивают (Gillespie, M.T.(2007) Arthritis Research & Therapy,Том 9, №2, стр,103-105).
В большинстве современных стратегий лечения есть попытка уменьшить потерю кальция костной тканью с целью замедлить манифестацию остеопороза (Dawson-Hughes, B. et al., «A controlled trial of the effect of calcium supplementation on bone density in postmenopausal women» NEJM 323, 878-883 (1990)). Таким образм, соединения, наиболее часто применяемые для лечения остеопороза, принадлежат к классу бисфосфонатов. Они сильно связываются с костной тканью и поглощаются остеокластами для ингибирования резорбции костной ткани. Бисфосфонаты могут быть введены пероральным или внутривенным путями. Алендронат (Fosmax™, пероральный) лекарственное средство наиболее часто прописываемое для лечения постменопаузального остеопороза. Другие одобренные управлением по контролю за продуктами и лекарствами США бисфосфонаты представляют собой Ризедронат (Actonel™, пероральный), Этидронат (Didronel™, пероральный), Золедронат (Aclasta™, вливание) и Памидронат (Aredial™, вливание). Пероральное применение бисфосфонатов связано с побочными эффектами со стороны желудочно-кишечного тракта. Связанные с бисфосфонатами, побочные эффекты в общем больше включают необычные переломы в бедренной кости (берцовая кость), чем в головке кости, что является наиболее часто встречающимся местом перелома. Тем не менее, указанные переломы, связанные с долгосрочным применением бисфосфонатов, являются редкими по сравнению с частотой случаев переломов шейки бедра, связанных с остеопорозом. Тем не менее, существует обеспокоенность, что долгосрочное употреблением бисфосфонатов может приводить к сверхподавлению замены костной ткани с последующей трудностью лечения микротрещин в кости, развитием указанных трещин и в конечном счете атипичными переломами. Дополнительно, повышенный риск рака пищевода связан с долгосрочным пероральным применением бисфосфонатов. Также, сообщалось, что применение бисфосфонатов, особенно Золедроната и Алендроната, представляет собой фактор риска для мерцательной аритмии. В конечном счете, внутривенное введение бисфосфонатов для лечения рака связано с остеонекрозом челюсти.
Паратиреоидный гормон (1-84 PTH) играет центральную роль в кальциевом гомеостазе и, при дробном введении, анаболический эффект на ремоделирование костной ткани. Терипаратид, одобренный управлением по контролю за продуктами и лекарствами США (Forteo), представляет собой рекомбинантную форму части (аминокислоты 1-34) PTH, применяемую для лечения остеопороза у мужчин и женщин в периоде постменопаузы с высоким риском переломов костей. Он может найти некоторое применение без инструкций для ускорения излечивания переломов костей. Терипаратид повышает образование остеобластов и препятствует апоптозу остеобластов. Тем не менее, несмотря на анаболический эффект Терипаратида на костную ткань, его применение для лечения остеопороза контролируется благодаря высокому числу случаев остеосаркомы на моделях животных. Поэтому, Терипаратид не рекомендован для применения пациентам в повышенным риском накостных опухолей.
Вследствие потенциальных побочных эффектов долгосрочной гормонозаместительной терапии (сердечнососудистые нарушения, маточные нарушения и различные виды рака, итд) она больше не рекомендуется для предотвращения остеопороза. Таким образом, это было в некоторой степени заменено введением класса лекарственных средств Селективных Модуляторов Эстрогеновых Рецепторов (СМЭР), как показано на примере Тамоксифена и Ралоксифена. Ралоксифен гидрохлорид одобрен управлением по контролю за продуктами и лекарствами США (Эвиста) для предотвращения остеопороза у женщин в периоде постменопаузы. Причем, непосредственное сравнение с ежедневно принимаемым перорально Алендронатом (бисфосфонат) продемонстрировало, что Ралоксифен ежедневно применяемый перорально, также был эффективен для понижения риска переломов костей. Тем не менее, побочные эффекты Ралоксифена включают повышенный риск летального инсульта и венозного тромбоэмболизма. Другие побочные эффекты включают опухание ног, трудности дыхания и зрительные изменения.
Деносумаб представляет собой полностью человеческое моноклональное антитело для лечения остеопороза, вызванной лечением потери костной ткани, метастазами в кости, множественной миеломы и гигантоклеточной опухоли. Деносумаб был одобрен управлением по контролю за продуктами и лекарствами США (Пролиа) для предотвращения остеопороза у женщин в периоде постменопаузы и (Xgeva) предотвращения родственных случаев, связанных со скелетом, у пациентов с метастазами солидных опухолей. Указанное антитело связывается и ингибирует RANKL (лиганд RANK), белок, который действует в качестве первичного сигнала для удаления костной ткани в большинстве патологических состояний, сязанных с потерей костной ткани. Предшественники остеокластов (пре-остеокласты) экспрессируют рецепторы RANK. Последующее связывание RANKL индуцирует активацию рецептора и мейоз пре-остеокластов в остеокласты. Тем не менее, побочные эффекты Деносумаба включают инфекции мочевыводящих и дыхательных путей, катаракты, констипация, сыпь и боль в суставах.
Как может быть видно из вышеупомянутого, множество вариантов выбора доступно для предотвращения и/или лечения остеопороза, но с данным выбором подразумевается, что нет универсального лекарства, способного предотвратить и/или вылечить остеопороз. Также из вышеупомянутого очевидно, что каждый процитированный выбор лечения сопровождается множеством побочных эффектов. Действительно, вышеупомянутые лекарственные средства одобрены для применения людям, и побочные эффекты хорошо описаны в научной литературе. Например, по субъекту остеопороза и существующим на сегодняшний день терапиям и их побочным эффектам существует относительно недавняя обзорная статья “Osteoporosis - a current view of pharmacological prevention и treatment” Das, S.Crockett, J.C.Drug DЭСgn, Development и Therapy 7, 435-448 (2013). Таким образом, существует необходимость в более универсальном, безопасном (особенно в виду увеличенной длительности жизни и, поэтому увеличенной продолжительности введения лекарств) лекарстве для предотвращения и/или лечения остеопороза. Поэтому существует необходимость в новых способах лечения.
Патент США №6372728 (2002), закрепленный за AstraZeneca AB, описывает улучшенный препарат бисфосфонатов для перорального введения, например, Алендронат. Согласно данному патенту, биодоступность при пероральном введении большинства бисфосфонатов равна 1%-10% между приемами пищи. В улучшенном составе использовали в качестве усилителя абсорбции среднецепочечный глицерид. Патент США №5070108 (1991), закрепленный за Пенсильванским университетом, заявляет о лечении остеопороза с помощью ретиноида, такого как этретинат. Хотя изначально он был одобрен управлением по контролю за продуктами и лекарствами для лечения псориаза, этретинат удалили с североамериканского рынка из-за высокого риска пороков развития. Оданакатиб представляет собой новое лекарственное средство, ингибитор фермента катепсина K, который находится на стадии клинических исследований для лечения остеопороза и метастаз в костной ткани.
Цель данного изобретения решить вопрос необходимости в новых способах лечения, соединениях и фармацевтических композициях для пациентов, страдающих от или подверженных остеопорозу.
Дополнительные отличительные признаки данного изобретения будут очевидны, исходя из обзора дискуссии, фигур и описания данного изобретения.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Общий аспект изобретения относится к фармацевтическому применению соединений Формулы I в соответствии с определением в данном документе и их фармацевтически приемлемых солей.
Конкретные аспекты изобретения относятся к применению соединений и композиций для предотвращения и/или лечения остеопороза. Некоторый аспект касается соединений Формулы I в соответствии с определением в данном документе и их фармацевтически приемлемых солей относится к профилактически эффективным и/или терапевтически эффективным агентам против разнообразных форм остеопороза у субъектов. Согласно конкретным вариантам реализации изобретения, субъект страдает от или подвержен страданию от потери костной ткани, переломам кости и т.п.
Согласно конкретным вариантам реализации изобретения соединения и композиции по данному изобретению пригодны для стимуляции образования костной ткани и/или для стимуляции ремоделирования костной ткани и/или для стимуляции дифференциации и минерализации остеобластов и/или для ингибирования резорбции костной ткани.
Конкретный аспект данного изобретения относится к способу предотвращения и/или лечения остеопороза, включающему стадию введения субъекту, нуждающемуся в этом, соединения Формулы I или его фармацевтически приемлемой соли, в соответствии с определением в данном документе. В некоторых вариантах реализации изобретения остеопороз выбран из группы, состоящей из постменопаузального остеопороза (первичный тип 1), первичного остеопороза типа 2, вторичного остеопороза аномально высокого остеокластогенеза, остеопороза подобного остеомаляции, остеопении, незавершённого остеогенеза, мраморной болезни, некроза кости, болезни Педжета, гипофосфатемии и их комбинаций. В конкретном варианте реализации изобретения остеопороз представляет собой постменопаузального остеопороза (первичный тип 1), первичного остеопороза типа 2 или вторичного остеопороза. В более конкретных вариантах реализации изобретения остеопороз представляет собой постменопаузальный остеопороз (первичный тип 1).
Также данное изобретение относится к способам лечения, в которых соединения по данному изобретению показывают одну или более из следующих биологических активностей у субъекта: ингибирование остеокластогенеза; стимуляцию продуцирования интерлейкина-12 (ИЛ-12) с помощью стимулированных клеток-предшественников остеокластов; уменьшение активности кислой фосфатазы в клетках костной ткани (демонстрирует уменьшение остеокластогенеза); уменьшение соотношения (RANKL/ PG соотношение) лиганда рецептора-активатора NF-қB (RANKL) относительно остеопротегерина (OPG) в костной ткани, которое указывает на уменьшение остеокластогенеза; и повышение содержания коллагена в костной ткани.
Согласно другому аспекту данное изобретение относится к способу предотвращения и/или уменьшения потери костной ткани, включающему стадию введения субъекту, нуждающемуся в этом, соединения Формулы I или его фармацевтически приемлемой соли в соответствии с определением в данном документе. В одном варианте реализации изобретения введение соединения уменьшает потерю кальция. В одном варианте реализации изобретения субъект болен или подвержен остеопорозу. В одном варианте реализации изобретения субъект представляет собой женщину в периоде постменопаузы.
Согласно другому аспекту данное изобретение относится к способу ингибирования остеокластогенеза, включающему этап приведения в контакт клетки-предшественника остеокласта с соединением Формулы I или его фармацевтически приемлемой солью в соответствии с определением в данном документе, в котором соединение ингибирует дифференциацию клетки-предшественника в остеокласт.
Согласно другому аспекту данное изобретение относится к способу стимуляции продуцирования интерлейкина-12 (ИЛ-12) с помощью стимулированной клетки-предшественника остеокласта, включающему этап приведения в контакт указанной стимулированной клетки-предшественника остеокласта с соединением Формулы I или его фармацевтически приемлемой солью в соответствии с определением в данном документе, в котором повышение продуцирования ИЛ-12 измерено в присутствии соединения.
Согласно другому аспекту данное изобретение относится к способу понижения активности кислой фосфатазы в костных клетках, включающему этап приведения в контакт костных клеток с соединением Формулы I или его фармацевтически приемлемой солью в соответствии с определением в данном документе, в котором пониженная фосфатазная активность измерена в присутствии соединения.
Согласно другому аспекту данное изобретение относится к способу понижения экспрессии и/или соотношения лиганд/остеопротегерин (соотношение RANKL/OPG) активности лиганда рецептора-активатора NF-қB в костных клетках, включающему этап приведения в контакт костных клеток с соединением Формулы I или его фармацевтически приемлемой солью в соответствии с определением в данном документе.
Согласно другому аспекту данное изобретение относится к способу повышения содержания коллагена в костной ткани, включающему этап приведения в контакт костной ткани с соединением Формулы I или его фармацевтически приемлемой солью в соответствии с определением в данном документе.
Согласно другому аспекту данное изобретение относится к способу стимуляции образования костной ткани и/или стимуляции ремоделирования костной ткани и/или стимуляции дифференциации и минерализации остеобластов и/или ингибирования резорбции костной ткани, включающему этап приведения в контакт остеобластов в упомянутой костной ткани с соединением Формулы I или его фармацевтически приемлемой солью в соответствии с определением в данном документе.
Дополнительные аспекты данного изобретения относится к способам, упомянутым выше в данном документе, дополнительно включающим этап сопутствующего введения лекарственного средства, выбранного из группы, состоящей из: бисфосфонатов, Оданакатиба, Алендроната, Ризедроната, Этидроната, Золедроната, Памидроната, Терипаратида, Тамоксифена, Ралоксифена и Деносумаба.
Другой родственный аспект данного изобретения относится к фармацевтическим композициям, содержащим соединения Формулы I для производства лекарственных средств, например, лекарственного средства для предотвращения и/или лечения остеопороза. Один конкретный пример представляет собой фармацевтическую композицию для предотвращения или лечения остеопороза, содержащую соединение Формулы I в соответствии с определением в данном документе и фармацевтически приемлемый носитель. Другой конкретный пример представляет собой фармацевтическую композицию для предотвращения или лечения остеопороза, содержащую соединение, указанное в Таблице 1, и более конкретно, фармацевтическую композицию, содержащую Соединение I. Родственный аспект относится к способам предотвращения и/или лечения остеопороза, включающим введение пациенту терапевтически эффективного количества фармацевтической композиции в соответствии с определением в данном документе.
Согласно другому аспекту данное изобретение относится к соединению Формулы I или его фармацевтически приемлемой соли в соответствии с определением в данном документе или композиции, содержащей то же самое, для применения при предотвращении и/или лечения остеопороза.
Дополнительные аспекты данного изобретения будут очевидны специалисту в данной области техники, исходя из следующего подробного описания, формулы изобретения и обобщений в данном документе.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
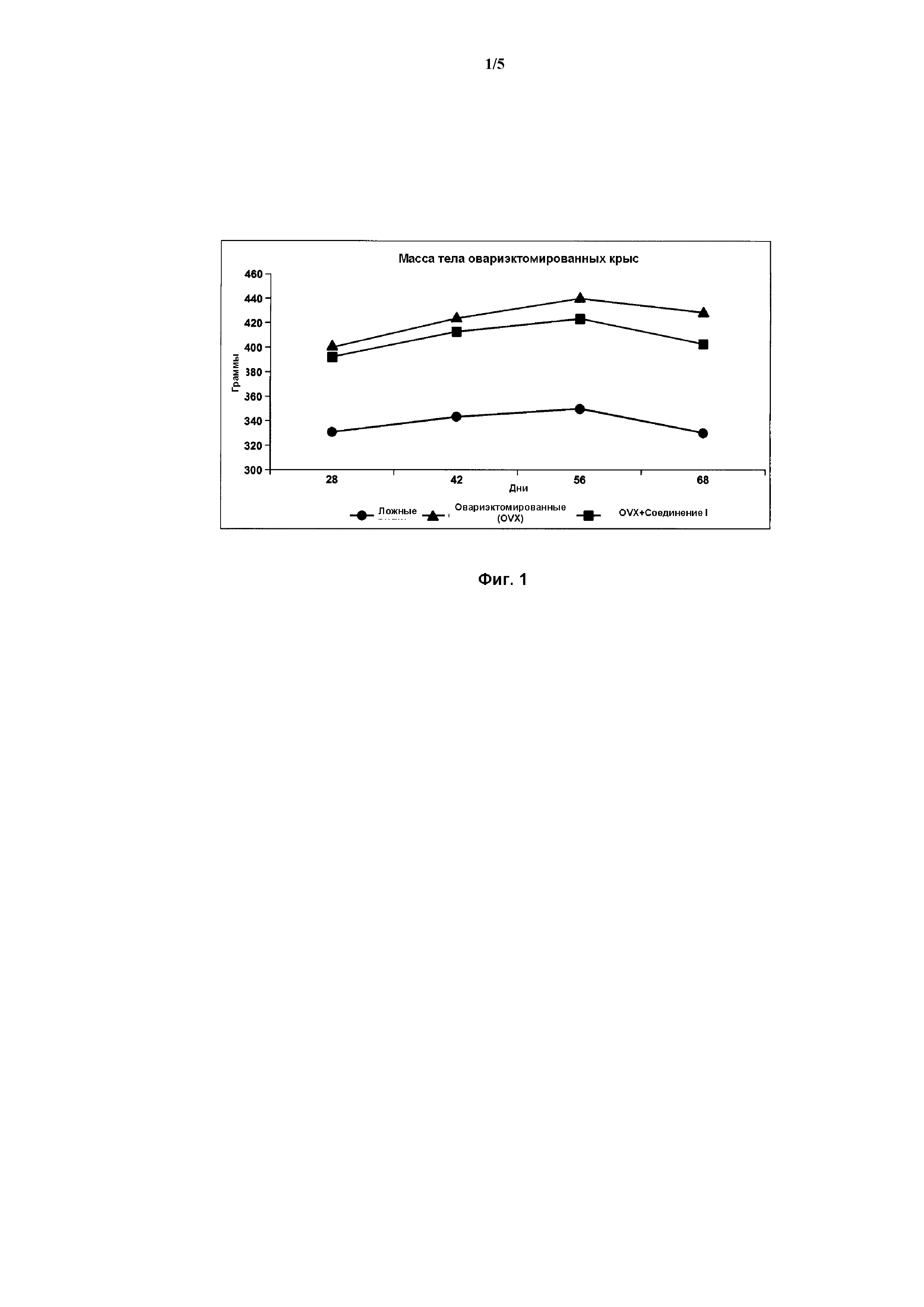
На Фиг. 1 представлена линейная диаграмма, демонстрирующая действие Соединения I на массу тела овариэктомированных (OVX) крыс, согласно Примеру 3.
На Фиг. 2 представлена панель гистограмм, демонстрирующая действие Соединения I на содержания кальция в моче овариэктомированных (OVX) крыс, согласно Примеру 4.
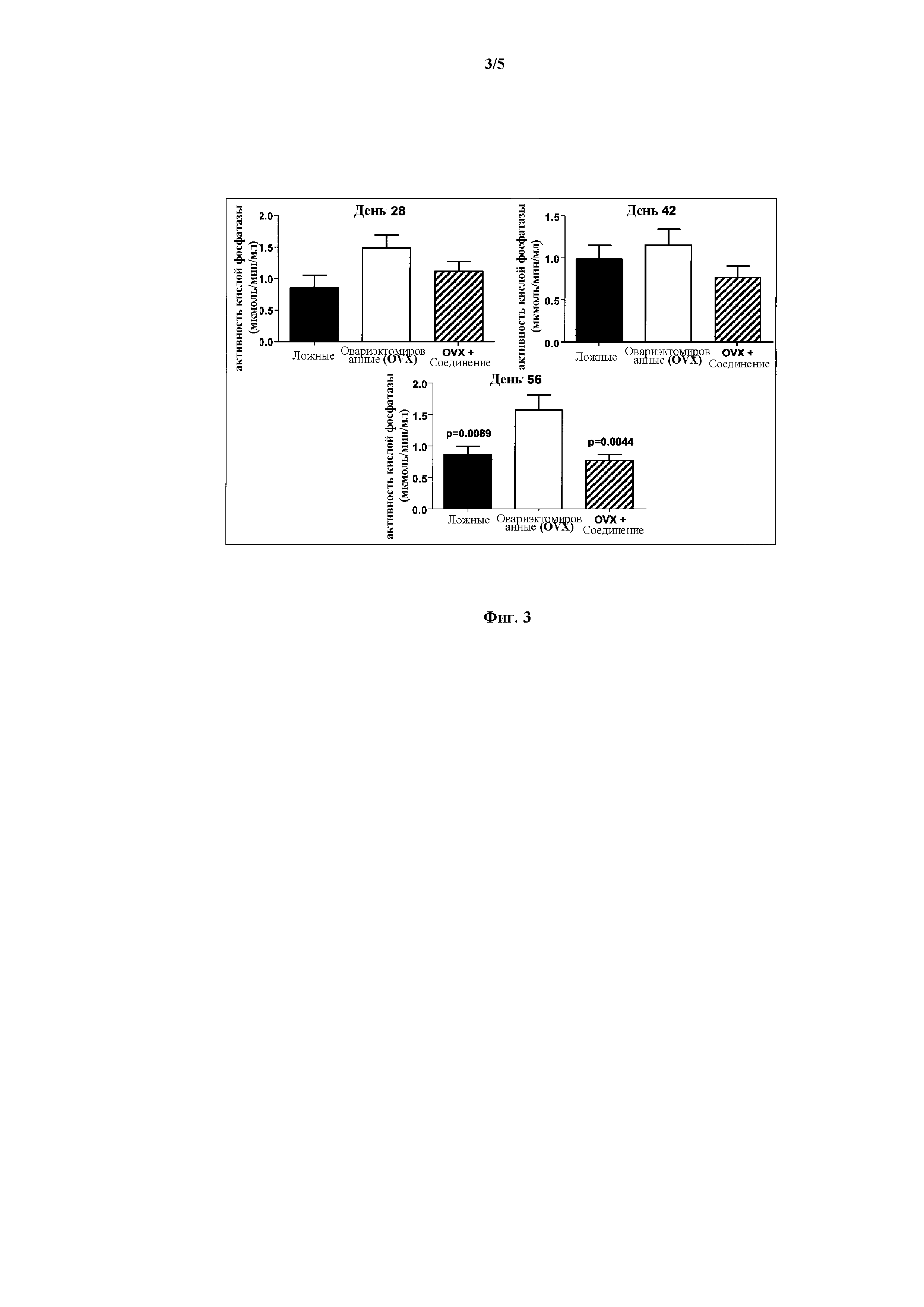
На Фиг. 3 представлена панель гистограмм, демонстрирующая действие Соединения I на активность кислой фосфатазы в сыворотке овариэктомированных (OVX) крыс, согласно Примеру 4.
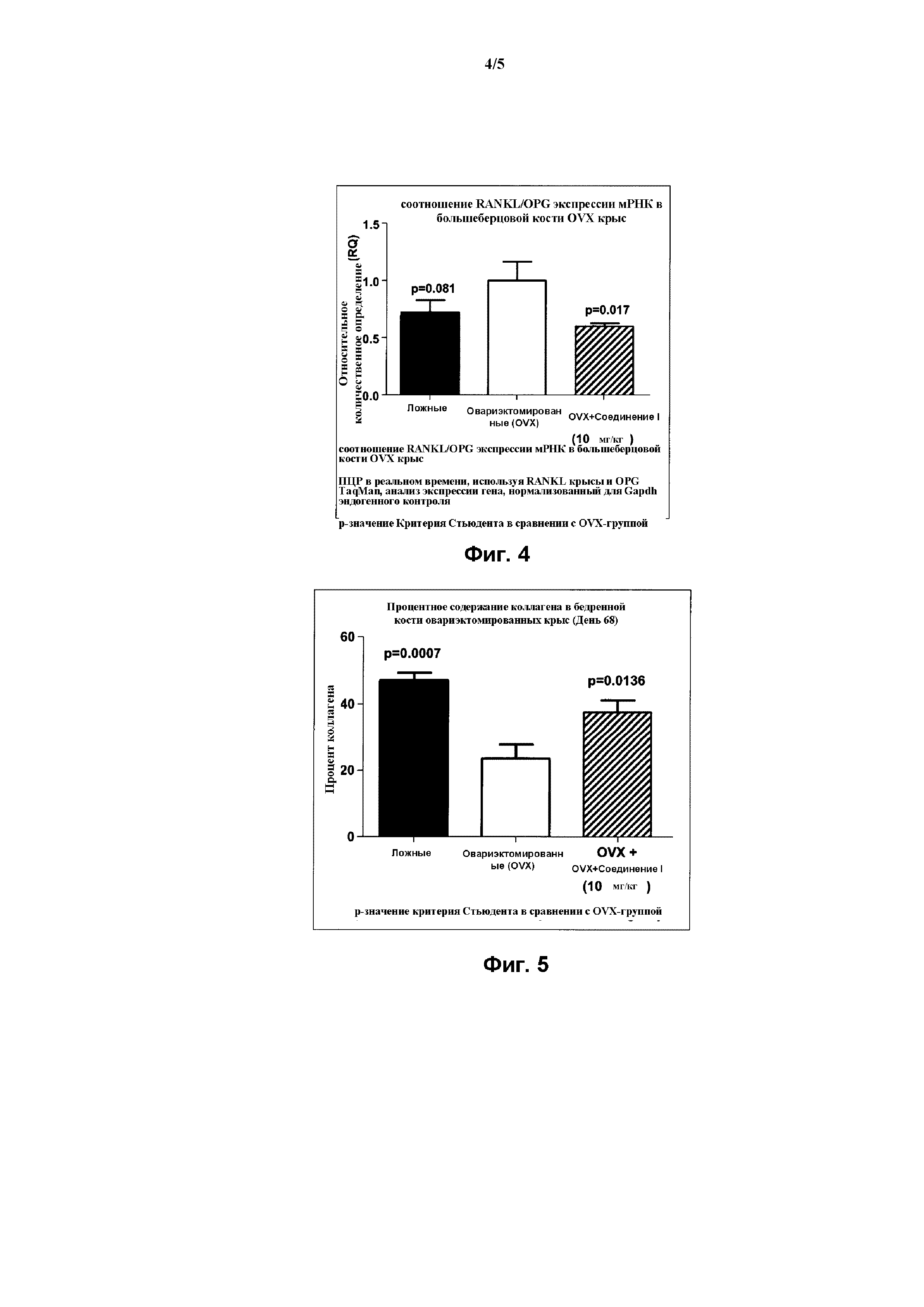
На Фиг. 4 представлена гистограмма, демонстрирующая действие Соединения I на мРНК экспрессию RANKL/OPG остеокластного маркера в большеберцовой кости овариэктомированной (OVX) крысы, согласно Примеру 4.
На Фиг. 5 представлена гистограмма, демонстрирующая действие Соединения I на содержание коллагена в метафизе бедренной кости крысы, согласно Примеру 4.
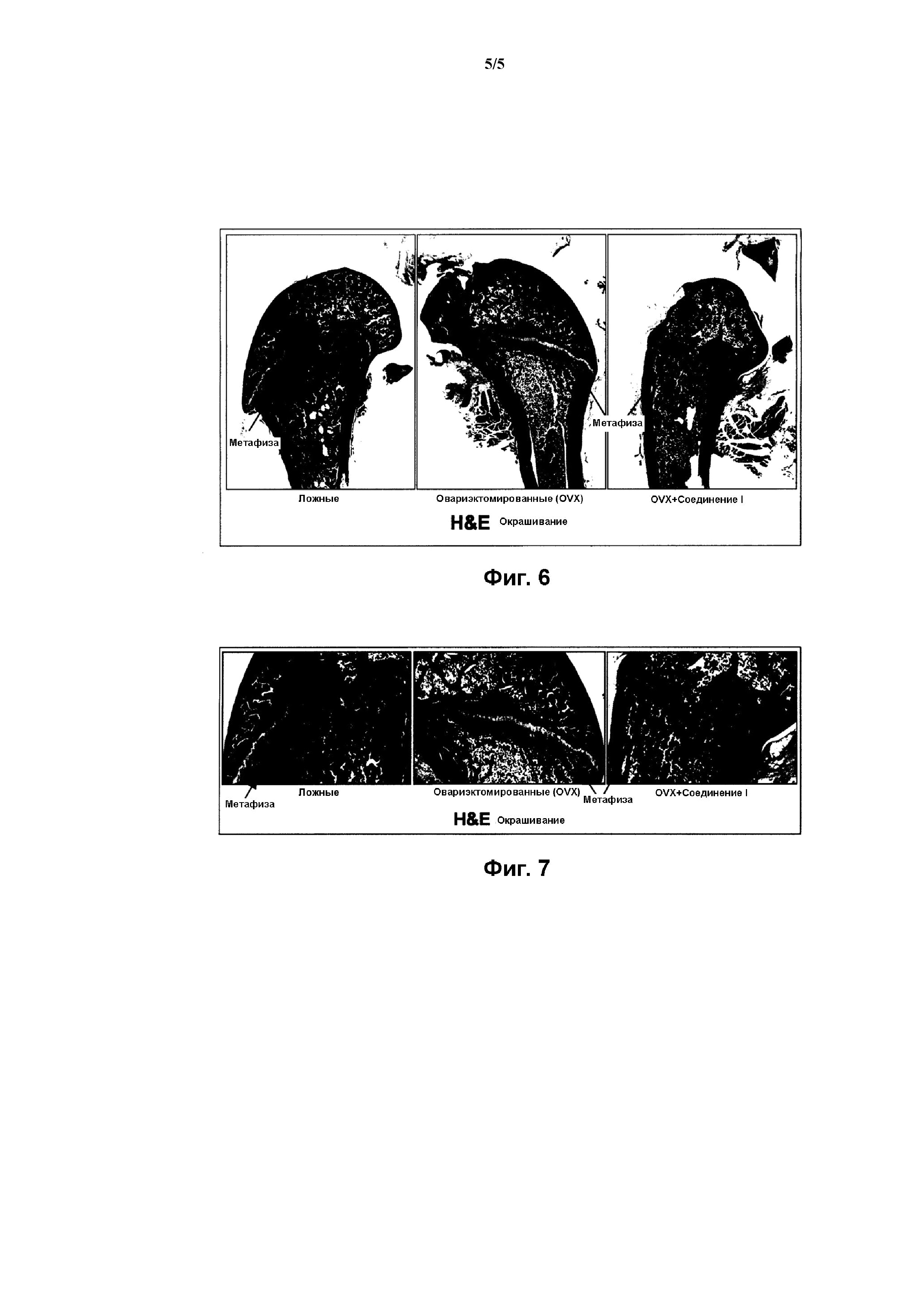
На Фиг. 6 представлена панель графических материалов, иллюстрирующих действие Соединения I на содержание коллагена в метафизе бедренной кости крысы, согласно Примеру 4.
На Фиг. 7 представлена панель с увеличенными изображениями графических материалов, соответствующих графическим материалам Фиг. 6.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В настоящем изобретении описаны соединения Формулы I, их фармацевтически приемлемые соли, содержащие их композиции и их применение. Разнообразные варианты реализации данного изобретения включают:
A) Соединения по данному изобретению
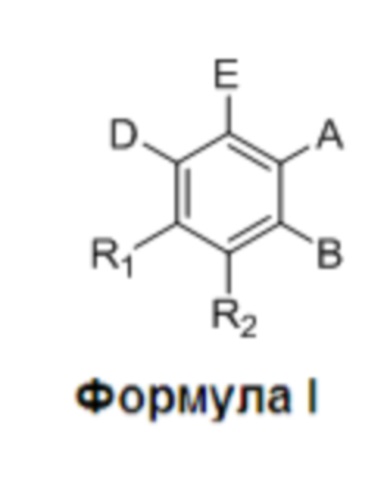
Согласно одному аспекту данное изобретение относится к разнообразным способам фармацевтического применения соединений Формулы I или их фармацевтически приемлемых солей:
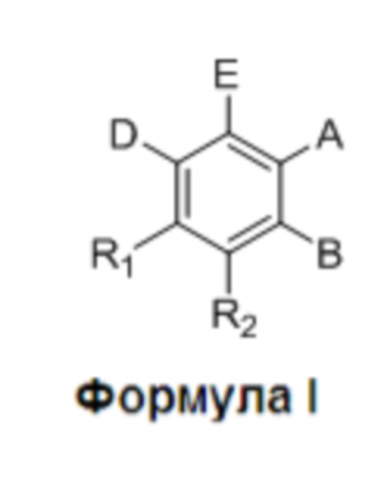
где:
R1 и R2 независимо представляют собой H, F или OH;
A представляет собой (CH2)mCOOH, W(CH2)mCOOH или  , когда B представляет собой H; или B представляет собой (CH2)mCOOH, W(CH2)mCOOH или
, когда B представляет собой H; или B представляет собой (CH2)mCOOH, W(CH2)mCOOH или  , когда A представляет собой H; или
, когда A представляет собой H; или
A и B ковалентно связаны с образованием пяти- (5), шести- (6) или семи- (7)-членного циклоалкила, замещенного COOH;
где:
Y представляет собой O, S, NH или CH2;
W представляет собой O, S или NH;
m равен 0-2; и
p равен 3-7;
D представляет собой CO(CH2)nCH3 или CHOH(CH2)nCH3, или O(CH2)nCH3, где n равен 2-6; и
E представляет собой H или F.
Согласно конкретному варианту реализации изобретения A представляет собой . (CH2)mCOOH, W(CH2)mCOOH или , когда B представляет собой H; или B представляет собой (CH2)mCOOH, W(CH2)mCOOH или
, когда B представляет собой H; или B представляет собой (CH2)mCOOH, W(CH2)mCOOH или 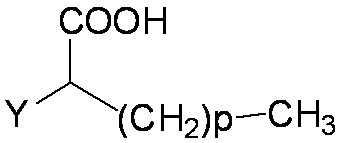 , когда A представляет собой H; и A и B ковалентно не связаны вместе с образованием циклоалкила, замещенного COOH.
, когда A представляет собой H; и A и B ковалентно не связаны вместе с образованием циклоалкила, замещенного COOH.
Согласно конкретному варианту реализации изобретения A представляет собой 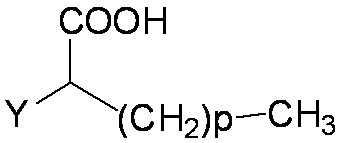 , когда B представляет собой H; или B представляет собой
, когда B представляет собой H; или B представляет собой 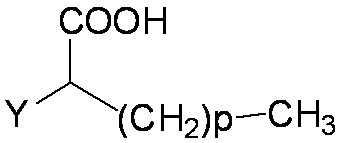 , когда A представляет собой H; или A и B ковалентно связаны вместе с образованием пяти- (5), шести- (6) или семи- (7)-членного циклоалкила, замещенного COOH.
, когда A представляет собой H; или A и B ковалентно связаны вместе с образованием пяти- (5), шести- (6) или семи- (7)-членного циклоалкила, замещенного COOH.
Согласно конкретному варианту реализации n равен 3-6 или n равен 4-6, или n равен 6.
Согласно конкретному варианту реализации R1 представляет собой H и R2 представляет собой H.
Согласно конкретному варианту реализации A представляет собой H и B представляет собой 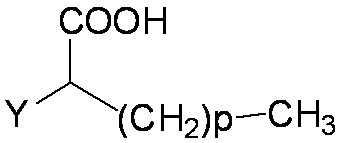 , когда Y представляет собой O, и p равен 5-7 и p предпочтительно равен 7.
, когда Y представляет собой O, и p равен 5-7 и p предпочтительно равен 7.
Согласно конкретному варианту реализации m равен 1-2; и m предпочтительно равен 1 или m предпочтительно равен 2.
Согласно конкретному варианту реализации E представляет собой H; и D представляет собой CO(CH2)nCH3 или CHOH(CH2)nCH3, или O(CH2)nCH3, где n равен 2-6 или n равен 4-6.
Согласно конкретному варианту реализации D представляет собой CO(CH2)nCH3 , где n равен 2-6 или n равен 4-6.
Согласно конкретному варианту реализации E представляет собой H; и D представляет собой CO(CH2)nCH3, где n равен 2-6 или n равен 4-6.
Согласно конкретному варианту реализации соединение Формулы I, где R1 и R2 представляют собой H; A представляет собой H; B представляет собой 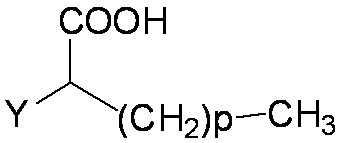 , где Y представляет собой O, и p равен 5-7; E представляет собой H; D представляет собой CO(CH2)nCH3 или CHOH(CH2)nCH3, или O(CH2)nCH3; и n равен 2-6 или n равен 4-6.
, где Y представляет собой O, и p равен 5-7; E представляет собой H; D представляет собой CO(CH2)nCH3 или CHOH(CH2)nCH3, или O(CH2)nCH3; и n равен 2-6 или n равен 4-6.
Согласно конкретному варианту реализации, соединение Формулы I, где R1 и R2 представляют собой H; A представляет собой H; B представляет собой 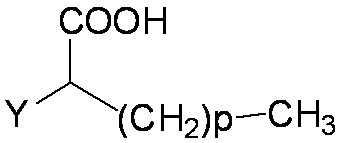 , где Y представляет собой O и p равен 5-7; E представляет собой H; D представляет собой CO(CH2)nCH3; и n равен 2-6 или n равен 4-6.
, где Y представляет собой O и p равен 5-7; E представляет собой H; D представляет собой CO(CH2)nCH3; и n равен 2-6 или n равен 4-6.
Согласно конкретному варианту реализации соединение Формулы I, где n равен 4-6; R1 и R2 представляют собой H; B представляет собой H; A представляет собой 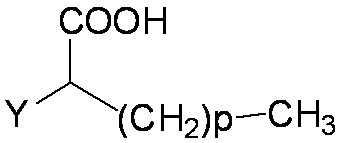 ; Y представляет собой O; и p равен 5-7; E представляет собой H; D представляет собой CO(CH2)nCH3 или CHOH(CH2)nCH3, или O(CH2)nCH3; и n равен 2-6 или n равен 4-6.
; Y представляет собой O; и p равен 5-7; E представляет собой H; D представляет собой CO(CH2)nCH3 или CHOH(CH2)nCH3, или O(CH2)nCH3; и n равен 2-6 или n равен 4-6.
Предусмотрено, что в контексте данного документа термин “циклоалкил” означает моноциклическую насыщенную углеводородную группу, в которой содержится указанное число атомов углерода, например, C5-C7 циклоалкил определяют, как включающий группы, имеющие 5, 6 или 7 атомов углерода в моноциклической форме. Примеры C5-C7 циклоалкила включают, но не ограничиваются ими, циклопентилом, циклогексилом и циклогептилом.
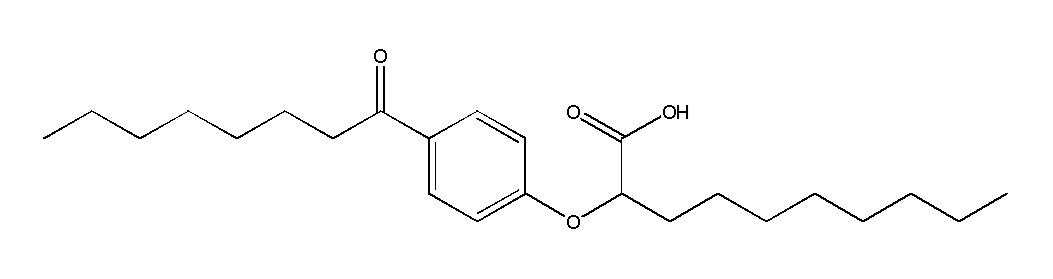
Примеры соединений Формулы I включают, но не ограничиваются ими, Соединения от I до VII, перечисленные далее в Таблице 1. В предпочтительном варианте реализации изобретения соединение представлено кислотной формой или фармацевтически приемлемой солью любого из Соединений от I до VII.
Заявители описали соединения, структура которых родственна структуре некоторых соединений по данному изобретению. Ссылка дана для примера соединений, описанных в заявке на патент № WO 2012/055014, которая включена в данный документ в полном объеме посредством ссылки. Соответственно, в конкретных вариантах реализации изобретения любое одно или все Соединения, описанные в указанной патентной заявке, исключено(ны) из объема данного изобретения.
Соли
В контексте данного документа под термином “фармацевтически приемлемая соль” подразумевают основно-аддитивную соль. Примеры фармацевтически приемлемых солей также описаны, например, в Berge et al.,“Pharmaceutical Salts”, J.Pharm.Sci,66, 1-19 (1977). Фармацевтически приемлемые соли могут быть синтезированы традиционно принятыми химическими методами из исходного агента, который содержит кислотный фрагмент. В общем, такие соли получают, вводя в реакцию формы свободной кислоты указанных агентов со стехиометрическим количеством подходящего основания в воде или в органическом растворителе, или в смеси обоих. Соли могут получать in situ во время финального выделения или очистки агента или путем отдельной реакции очищенного соединения по данному изобретению в форме свободной кислоты с соответствующим желаемым основанием, и выделения соли, образованной таким образом.
Фармацевтически приемлемая соль соединений Формулы I может быть выбрана из группы, состоящей из основно-аддитивных солей натрия, калия, кальция, магния и лития, аммония, марганца, цинка, железа или меди. В предпочтительных вариантах реализации изобретения фармацевтически приемлемая соль соединений по данному изобретению может представлять собой натриевую, калиевую, кальциевую, магниевую или литиевую соль. Более предпочтительно фармацевтически приемлемая соль представляет собой натриевую соль.
Все кислотные, солевые и другие ионные и неионные формы, описанных соединений, включены в виде соединений по данному изобретению. Например, если в данном документе соединение проиллюстрировано в форме кислоты, то формы солей указанного соединения также включены. Аналогичным образом, если в данном документе соединение проиллюстрировано в виде соли, формы кислоты также включены.
Пролекарства
В некоторых вариантах реализации изобретения, соединения по данному изобретению представлены общей Формулой I, в которой заявленные соединения присутствуют в форме, содержащей свободную карбоксильную группу, также могут включать все фармацевтически приемлемые соли, такие их изостерические эквиваленты, как тетразольные формы и формы их пролекарства. Примеры последних включают фармацевтически приемлемые сложные эфиры или амиды, полученные по реакции спиртов или аминов, включая аминокислоты, со свободными кислотами, определенными Формулой I.
Хиральность
Соединения по данному изобретению, их фармацевтически приемлемые соли или пролекарства, могут содержать один или более ассиметрических центров, хиральных осей и хиральных плоскостей и могут, таким образом, приводить к образованию энантиомеров, диастереомеров и других стереоизомерных форм и могут быть определены с помощью терминов абсолютной стереохимии, таким как (R)- или (S)-. В данном изобретении предусмотрено, что оно включает все возможные изомерные, также как, их рацемические и оптически чистые формы. Оптически активные (+) и (-), (R)- и (S)-, изомеры могут получать, используя хиральные синтоны или хиральные реагенты или быть разделены, используя принятые методики, такие как обращенно-фазная ВЭЖХ. Рацемические смеси могут быть получены и затем разделены на индивидуальные оптические изомеры или указанные оптические изомеры могут получать с помощью хирального синтеза. Энантиомеры могут быть разделены с помощью методов известных специалистам в данной области техники, например, с помощью образования диастереомерных солей, которые могут быть разделены путем кристаллизации, газо-жидкостной или жидкостной хроматографией, селективной реакции одного энантиомера с энантиомер-специфичным реагентом. Специалистам в данной области техники будет понятно, что если методом разделения желаемый энантиомер превращается в другое химическое соединение, то требуется дополнительная стадия для образования желаемой энантиометрической формы. Как альтернативный вариант, определенные энантиомеры могут быть синтезированы с помощью асимметрического синтеза, используя оптически активные реагенты, субстраты, катализаторы или растворители или путем превращения одного энантиомера в другой, используя асимметрическое превращение.
Некоторые соединения по данному изобретению могут находиться в цвиттер-ионной форме и данное изобретение включает цвиттер-ионные формы указанных соединений и их смеси.
Гидраты
В дополнение, соединения по данному изобретению также могут существовать в гидратированной и безводной формах. Гидраты любой из формул, описанных в данном документе, включены в виде соединений по данному изобретению, которые могут существовать в виде формы моногидрата или полигидрата.
B) Методы получения
В общем, все соединения по данному изобретению могут получать принятыми методами, используя легкодоступные и/или традиционно получаемые исходные вещества, реагенты и принятые синтетические методики. Особый интерес представляет работа Hundertmark, T.; Littke, A.F.; Buchwald, S.L.; Fu, G.C. Org.Lett,12, 1729-1731 (2000).
Иллюстративный раздел ниже предлагает общие схемы и конкретные, но не ограничивающие, примеры для синтеза Соединений I-VII.
C) Применение в фармацевтических целях
Как указано и проиллюстрировано в данном документе, соединения по данному изобретению обладает благоприятными фармацевтическими свойствами и по отношению к субъектам указанные соединения могут быть пригодными для применения фармацевтических целях. Применение в медицинских и фармацевтических целях, предусмотренное изобретателями, включает, но не ограничивается ими, предотвращение и/или лечение разнообразных форм остеопороза. В контексте данного документа термин “остеопороз” относится к прогрессирующему заболеванию костной ткани, которое характеризуется понижением массы и плотности костной ткани, которые могут приводить к повышенному риску переломов кости. Термин “остеопороз” охватывает первичный остеопороз типа 1 или постменопаузальный остеопороз (наиболее часто встречается у женщин в периоде постменопаузы), первичный остеопороз типа 2 (встречается как у женщин, так и у мужчин обычно после 75 лет), и вторичный остеопороз (который может появляться в любом возрасте, форму, которая обусловлена благоприятствующими ей хроническими медицинскими проблемами или длительное употребление лекарственных средств, таких как глюкокортикоиды (заболевание может далее называться стероидный или глюкокортикоидный остеопороз)). В контексте данного документа термины “остеопороз” также включают заболевания костной ткани, включающие потерю массы и/или плотности костной ткани, такие как аномально высокий остеокластогенез, остеопороз подобный остеомаляции, остеопения, незавершённый остеогенез, мраморная болезнь, некроз кости, болезнь Педжета, гипофосфатемия и их комбинаций.
Как известно, разнообразные заболевания и патологические состояния могут обусловливать остеопороз, и данное изобретение может быть пригодным для предотвращения и/или лечения остеопороза, связанного, прямо или косвенно, с одной или более указанных причин:
• Аутоиммунные заболевания, которые включают ревматоидный артрит, волчанку и рассеянный склероз;
• Нарушения со стороны желудочно-кишечного тракта, которые включают глютеиновую болезнь, воспалительное заболевание кишечника, гастрэктомию и желудочно-кишечный анастомоз;
• Эндокринные/Гормональные нарушения, которые включают диабеты, гиперпаратиреоз, тиреотоксикоз и синдром Кушинга;
• Нарушения со стороны кроветворной системы, которые включают лейкоз, лимфому, множественную миелому, серповидно-клеточную анемию (нарушения костного мозга) и талассемию;
• Рак, включающий рак груди и предстательной железы;
• Неврологические расстройства, которые включают депрессию, болезнь Паркинсона и повреждение спинного мозга;
• Заболевания органов, которые включают заболевания легких (COPD, эмфизему), печени и хроническое заболевание почек (ХБП);
• Анкилозирующий спондилоартрит;
• СПИД/ВИЧ;
• Плохое питание, включающее расстройства пищевого поведения и недостаточное питание; и
• Пери- и постменопаузный остеопороз и кортикостероидный остеопороз.
В одном варианте реализации изобретения остеопороз представляет собой первичный остеопороз типа 1 или постменопаузальный остеопороз. В другом варианте реализации изобретения остеопороз представляет собой первичный остеопороз типа 2.
Термин “субъект” включает живые организмы, в которых может возникать остеопороз или которые подвержены такому заболеванию. Термин “субъект” включает животных, таких как млекопитающие или птицы. Предпочтительно, субъект представляет собой млекопитающее. В некоторых вариантах реализации изобретения мышь исключена из перечня млекопитающих. Более предпочтительно, субъект представляет собой человека. Более предпочтительно, человек представляет собой пациента, нуждающегося в лечении человека. В предпочтительных вариантах реализации изобретения, субъект представляет собой человека, имеющего или страдающего от любого из следующих патологических состояний: первичный тип 1 остеопороз, постменопаузальный остеопороз, менопауза (пре-менопауза и пост-менопауза), первичный остеопороз типа 2, возраст более 75 лет, перелом кости, остеопороз, благоприятствующие хронические медицинские проблемы или заболевание, длительное применение лекарственных средств, таких как глюкокортикоиды, аномально высокий остеокластогенез, остеопороз подобный остеомаляции, остеопения, незавершённый остеогенез, мраморная болезнь, некроз кости, болезнь Педжета, гипофосфатемия и их комбинации. В предпочтительном варианте реализации изобретения субъект представляет собой женщин в периоде постменопаузы.
В контексте данного документа, “предотвращающий” или “предотвращение” относится к по меньшей мере уменьшению вероятности риска (подверженности) развития заболевания или нарушения (т.е. обусловливания не развития по меньшей мере одного клинического симптома заболевания у пациента, который может быть подвержен влиянию или предрасположен заболеванию, но еще не испытывал или не показал симптомов заболевания). Биологические и физиологические параметры для идентифицирования таких пациентов предложены в данном документе и хорошо известны врачам. В предпочтительных вариантах реализации изобретения, “предотвращающий” или “предотвращение” относится к предотвращению уменьшения массы и/или плотности костной ткани и/или уменьшения риска перелома кости.
Термины “лечение” или “лечащий” пациента включает применение или введение соединения по данному изобретению субъекту (или применение или введение соединения по данному изобретению в клетку или ткань, полученную от субъекта) с целью отсрочки, стабилизации, лечения, исцеления, ослабления симптомов, облегчения, изменения, излечивания, меньшего ухудшения, купирования, улучшения или воздействия на заболевание или патологическое состояние, симптом заболевания или патологического состояния или риск (или подверженность) заболеванию или патологическому состоянию. Термин “лечащий” относится к любому проявлению успеха лечения или купирования симптома повреждения, патологии или патологического состояния, включая любой объективный или субъективный параметр, такой как ослабление боли или выраженности симптома, ремиссия; понижение скорости ухудшения; уменьшение тяжести заболевания; стабилизация, ослабление симптомов или воздействие на повреждение, патологию или патологическое состояние, которое делает их более легко переносимыми субъектом; замедление скорости дегенирации или ухудшения; воздействие на конечную точку дегенерации, которое делает ее менее тяжело протекающей; или улучшения физического или интеллектуального самочувствия субъекта. В некоторых вариантах реализации изобретения термин “лечащий” может включать повышение средней продолжительности жизни субъекта и/или отсрочку до того, как дополнительное лечение потребуется. В предпочтительных вариантах реализации изобретения “лечение” или “лечащий” относится к увеличению массы и/или плотности костной ткани, и/или повышенной исцеляемости перелома кости.
Более того, в некоторых вариантах реализации изобретения соединения по данному изобретению применяют в качестве монотерапии для предотвращения и/или лечения остеопороза. В других вариантах реализации изобретения соединения по данному изобретению применяют в комбинации с уже одобренными для таких целей лекарственными средствами, включающими, но не ограничивающимися ими, лекарственные средства, применяемые для лечения остеопороза. Примеры известных относящихся к остеопорозу агентов, которые могут применяться в комбинации с соединениями по данному изобретению, включают, но не ограничиваются ими, бисфосфонаты, Оданакатиб, Алендронат, Ризедронат, Этидроната, Золедронат, Памидронат, Терипаратид, Тамоксифен, Ралоксифен и Деносумаб.
Соответственно, способы лечения по данному изобретению также могут включать совместное введение по меньшей мере одного соединения по данному изобретению или его фармацевтически приемлемой соли, вместе с введением другого терапевтически эффективного агента. Поэтому, дополнительный аспект данного изобретения относится к способам лечения субъекта сопутствующей терапией, включающим введение, нуждающемуся в этом субъекту, эффективного количества первого и второго агента, причем первый агент находится в соответствии с определением Формулы I и второй агент предназначен для предотвращения или лечения любого одного из нарушений или заболеваний перечисленных выше в данном документе. В контексте данного документа, под термином “сопутствующий” или “сопутствующе” в фразах “сопутствующая терапия” или “совместно с” включает введение первого агента в присутствии второго агента. Способ сопутствующей терапии включает способы, в которых первый, второй, третий или дополнительные агенты вводят совместно. Способ сопутствующей терапии также включает способы, в которых первый или дополнительный агенты вводят в присутствии второго или дополнительных агентов, причем второй или дополнительные агенты, например, могут быть уже предварительно введены. Способ сопутствующей терапии могут выполнять поэтапно различные исполнители. Например, один исполнитель может вводить субъекту первый агент, тогда как второй исполнитель может вводить субъекту второй агент и этапы введения могут быть выполнены в одно и то же время или приблизительно одно и то же время, или быть разнесены по времени с момента введения первого агента (и/или дополнительные агенты) до введения второго агента (и/или дополнительные агенты). Исполнитель и субъект могут представлять собой одно и то же существо (например, человека).
Соответственно, данное изобретение также относится к способу предотвращения, уменьшения или устранения симптома или осложнения одного из вышеперечисленных заболеваний или патологических состояний. Способ под данному изобретению включает этап введения, нуждающемуся в этом субъекту, первой фармацевтической композиции, содержащей по меньшей мере одно соединение по данному изобретению и второй фармацевтической композиции, содержащей один или более дополнительных активных компонентов, в которых все активные компоненты вводят в количестве достаточном для ингибирования, уменьшения или устранения одного или более симптомов или осложнений заболевания или патологического состояния, которые требуется вылечить. В одном аспекте изобретения введение первой и второй фармацевтических композиций разведено во времени на по меньшей мере около две минуты. Предпочтительно, первый агент представляет собой соединение Формулы I, в соответствии с определением в данном документе, или его фармацевтически приемлемую соль, например, натриевую соль. Второй агент может быть выбран из перечня соединений, перечисленных выше (например, агентов или лекарств, применяемых для предотвращения и/или лечения остеопороза).
Ингибирование остеокластогенеза
Остеокласты представляют собой тип костной клетки, который резорбирует костную ткань. На молекулярном уровне остеокласт разбирает на части костную ткань с помощью секреции кислоты и коллагеназы. Данный процесс известен как резорбция костной ткани. Остеокластогенез относится к дифференциации клеток-предшественников остеокластов в остеокласты. При предотвращении и/или лечении остеопороза желательно уменьшить остеокластогенез.
Остеобласт представляет собой тип клеток, который синтезирует костную ткань. Остеобласты образуются из мезенхимальных стволовых клеток. При предотвращении и/или лечения остеопороза желательно стимулировать остеобластную дифференциацию
Как проиллюстрировано далее в примерах в данном документе, соединения по данному изобретению способны ингибировать и/или уменьшать остеокластогенез. Это продемонстрировано, например: сильной стимуляцией продуцирования ИЛ-12 в ЛПС-стимулированных клетках RAW264,7 (Пример 3, Таблица 1); уменьшением потери кальция in vivo (Пример 4, Фиг. 2); уменьшением активности кислой фосфатазы in vivo (Пример 4, Фиг. 3); понижением мРНК экспрессии RANKL/OPG in vivo (Пример 4, Фиг. 4); и увеличением содержания коллагена in vivo (Пример 4, Фиг. 5, 6 и 7).
Данные результаты свидетельствуют о способности соединений по данному изобретению предотвращать/лечить остеопороз путем ингибирования и/или уменьшения активности остеокластов
Данные результаты также демонстрируют способность соединений по данному изобретению предотвращать и/или уменьшать потерю костной массы, включая, но не ограничиваясь ею, потерю кальция. Соответственно, данные результаты дополнительно свидетельствуют о способности соединений по данному изобретению предотвращать/лечить остеопороз путем стимуляции остеобластной дифференциации.
Стимуляция продуцирования интерлейкина-12 (ИЛ-12)
Как проиллюстрировано далее в примерах в данном документе, соединения по данному изобретению стимулируют продуцирование ИЛ-1 2 в присутствии ЛПС. Данные результаты свидетельствуют о способности указанных соединений предотвращать и/или лечить остеопороз, вследствие стимуляции ИЛ-12. Это подтверждается научной литературой, в которой сообщается, что ИЛ-12 оказывает непосредственный ингибирующий эффект на остеокластогенез.
Соответственно, в некоторых вариантах реализации изобретения, соединения и композиции по данному изобретению пригодны стимуляции продуцирования интерлейкина-12 (ИЛ-12), включая, но не ограничиваясь ими, продуцирование клетки-предшественника остеокласта.
Уменьшение активности кислой фосфатазы
Как проиллюстрировано далее в примерах в данном документе, соединения по данному изобретению уменьшают ферментную активность кислой фосфатазы, измеренную в сыворотке овариэктомированных крыс. Данные результаты свидетельствуют о способности указанных соединений предотвращать и/или лечить остеопороз вследствие уменьшения ферментной активности кислой фосфатазы.
Соответственно, в некоторых вариантах реализации изобретения, соединения и композиции по данному изобретению пригодны для уменьшения активности кислой фосфатазы в клетках костной ткани.
Уменьшение экспрессии лиганда рецептора-активатора NF-қB (RANKL)
Как проиллюстрировано далее в примерах в данном документе, соединения по данному изобретению уменьшают мРНК экспрессию RANKL, измеренную в большеберцовой кости овариэктомированных крыс. Данные результаты свидетельствуют о способности указанных соединений предотвращать и/или лечить остеопороз в результате уменьшения экспрессии и/или биологической активности RANKL.
Соответственно, в некоторых вариантах реализации изобретения, соединения и композиции по данному изобретению пригодны для уменьшения экспрессии и/или активности RANKL в клетках костной ткани.
Повышение содержания коллагена
Как проиллюстрировано далее в примерах в данном документе, соединения по данному изобретению повышают содержание коллагена в костной ткани, измеренной в метафизе бедренной кости овариэктомированных крыс. Данные результаты свидетельствуют о способности указанных соединений предотвращать и/или лечить остеопороз, как было продемонстрировано путем повышения содержания коллагена в костной ткани.
Соответственно, в некоторых вариантах реализации изобретения, соединения и композиции по данному изобретению пригодны для повышения содержания коллагена в живой костной ткани.
Стимуляция образования костной ткани
В некоторых вариантах реализации изобретения, соединения и композиции по данному изобретению пригодны для стимуляции образования костной ткани и/или для стимуляции ремоделирования костной ткани и/или для стимуляции дифференциации и минерализации остеобластов и/или для ингибирования резорбции костной ткани.
D) Фармацевтические композиции и препараты
Родственный аспект данного изобретения относится к фармацевтическим композициям, содержащим терапевтически эффективное количество описанных выше одного или более соединений по данному изобретению (например, соединения Формулы I). Как было указано выше, фармацевтические композиции по данному изобретению могут быть пригодны: для предотвращения и/или лечения остеопороза; для ингибирования остеокластогенеза; для стимуляции продуцирования интерлейкина-12 (ИЛ-12) с помощью стимулированных клеток-предшественников остеокластов; для уменьшения активности кислой фосфатазы в клетках костной ткани; для уменьшения экспрессии лиганда рецептора-активатора NF-қB (RANKL) в клетках костной ткани; для повышения содержания коллагена в живой костной ткани, для стимуляции образования костной ткани; для стимуляции ремоделирования костной ткани; для стимуляции минерализации костной ткани; и/или для ингибирования резорбции костной ткани.
В контексте данного документа термином “терапевтически эффективное количество” называют количество соединения, которое, при введении субъекту для лечения или предотвращения конкретного нарушения, заболевания или патологического состояния, является достаточным для оказания эффекта, такого как лечение или предотвращения такого нарушения, заболевания или патологического состояния. Дозировки и терапевтически эффективные количества могут изменяться, например, в зависимости от разнообразия факторов, включающих активность специфически примененного агента, возраст, массу тела, общее состояние здоровья, пол и диету субъекта, время введения, путь введения, скорость экскреции и любую комбинацию лекарств, в соответствующих случаях, эффект которых лечащий врач желает, чтобы вещество имело на субъекта (например, суммарный или частичный ответ, который можно засвидетельствовать по факторам, включающим увеличение массы и/или плотности костной массы (или сокращение их уменьшения), снижение риска перелома кости и т.д.), свойства соединений (например, биодоступность, стабильность, активность, токсичность и т.д.), и конкретное нарушение(я) от которых страдает субъект. Дополнительно, терапевтически эффективное количество может зависеть от параметров крови субъекта (например, уровня кальция, липидограммы, уровней инсулина, гликемии), тяжести болезненного состояния, функции органов или основного заболевания или осложнений. Такие подходящие дозы могут быть определены, используя любые доступные анализы, включая анализы, описанные в данном документе. Когда одно или более соединений по данному изобретению будут введены людям, врач может, например, прописать относительно низкую дозу вначале, последовательно повышая дозу до тех пор, пока не будет получен подходящий ответ на лечение. Вводимая доза будет исключительно оставлена на усмотрение врача-онколога. В общем, тем не менее, предусмотрено, что доза соединений по данному изобретению может находиться в диапазоне от около 1 до около 50 мг/кг в день для человека. В выбранных вариантах реализации изобретения диапазон может быть равен между 1 и 30 мг/кг в день для человека. В выбранных вариантах реализации изобретения диапазон может быть равен между 1 и 20 мг/кг в день для человека. В выбранных вариантах реализации изобретения диапазон может быть равен между 5 и 18 мг/кг в день для человека. В выбранных вариантах реализации изобретения диапазон может быть равен между 1 и 18 мг/кг в день для человека.
В контексте данного документа термин “фармацевтическая композиция” относится к наличию по меньшей мере одного соединения по данному изобретению Формулы I, в соответствии с определением в данном документе, и по меньшей мере одного фармацевтически приемлемого носителя, разбавителя, несущей среды или вспомогательного средства. В контексте данного документа под термином “фармацевтически приемлемый носитель”, “фармацевтически приемлемый разбавитель” или “фармацевтически приемлемое вспомогательное вещество” подразумевают, без ограничения, любой адьювант, носитель, вспомогательное вещество, глидант, подсластитель, разбавитель, консервант, краситель/окрашивающее средство, интенсификатор вкусоароматических свойств, поверхностно-активное вещество, увлажняющее средство, диспергирующее средство, суспендирующее средство, стабилизатор, изотоническое средство, растворитель, эмульсификатор или инкапсулирующее средство, такое как липосома, циклодекстрины, инкапсулирующие полимерные системы доставки или полиэтиленгликолевые матрица, пригодные для применения для субъектов, предпочтительно людям. Предпочтительно это относится к соединению или композиции, которые одобрены или заслуживают одобрения федеральным или правительственным регуляторным органом или перечислено в Фармакопее США или других общепризнанных фармакопеях для применения для животных и более конкретно для людей. Фармацевтически приемлемые несущие среды могут представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, многоатомный спирт (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), их пригодные смеси и растительные масла. Дополнительные примеры фармацевтически приемлемых несущих сред включают, но не ограничиваются ими: воду для инъекций (Фармакопея США); водные несущие среды, такие как, но не ограничивающиеся ими, физиологический раствор, раствор для инъекций Рингера, инъекционный раствор декстрозы, раствор для инъекций, содержащий декстрозу и хлорид натрия раствор для инъекций и лактатный раствор Рингера для инъекций; смешивающиеся с водой несущие среды, такие как, но не ограничивающиеся ими, этиловый спирт, полиэтиленгликоль и полипропиленгликоль; и неводные несущие среды, такие как, но не ограничивающиеся ими, кукурузное масло, хлопковое масло, арахисовое масло, сезамовое масло, этилолеат, изопропилмиристат и бензилбензоат. Предотвращение воздействия микроорганизмов может быть достигнуто прибавлением антибактериальных и противогрибковых средств, например, парабенов, хлорбутанола, фенола, аскорбиновой кислоты, тимеросала и т.п. Во многих случаях в композициях включены изотонические средства, например, сахара, хлорид натрия или многоатомные спирты, такие как маннит и сорбит. Пролонгированная абсорбция инъекционных препаратов может быть обеспечена путем включения в композицию агента, замедляющего абсорбцию, например, моностеарата алюминия или желатина.
Композиция по данному изобретению может включать одно или более соединений Формулы I в соответствии с определением в данном документе или их фармацевтически приемлемых производных, солей, пролекарств, аналогов и изомеров или энантиомеров. Препараты активного соединения могут получать для обеспечения фармацевтической композиции в форме, пригодной для энтерального, мукозального (включая сублингвальное, ингаляционное и ректальное), парентерального (включая внутримышечное, внутрикожное, подкожное и внутривенное) или наружного (включая мази, кремы или лосьоны) введения. Препарат может быть представлен, где это целесообразно, в отдельной дозированной лекарственной форме и может быть получен любым из методов, хорошо известным в области фармацевтических препаратов. Все методы включают стадию приведения в контакт активного фармацевтического компонента с жидкими носителями или мелкодисперсными твердыми носителями или ими обоими, по мере необходимости. Где это целесообразно, описанные выше препараты могут быть адаптированы для того, чтобы обеспечивать замедленное высвобождение активного фармацевтического компонента. Применение известных в данной области техники препаратов с замедленным высвобождением включает болюсное вливание, продолжительное вливание, биосовместимые полимеры или липосомы.
E) Комплекты
Соединение(я) по данному изобретению могут быть упакованы как часть комплекта, необязательно включающего контейнер (например, упаковочный, коробку, флакон, и т.д.). Комплект может использоваться в коммерческих целях согласно способам, описанным в данном документе, и может включать инструкции для применения в способе по данному изобретению. Дополнительный комплект компонентов может включать кислоты, основания, буферные средства, неорганические соли, растворители, антиоксиданты, консерванты или металлохелаторы. Дополнительный комплект компонентов содержится в виде чистых композиций или в виде водных или органических растворов, которые включают в состав один или более дополнительных компонентов комплекта. Любые или все компоненты комплекта необязательно дополнительно содержат буферы.
Соединение(я) по данному изобретению могут или не могут вводить пациенту в одно и то же время или одним и тем же путем введения. Поэтому, способы по данному изобретению охватывают комплекты, которые, когда их применяет практикующий врач, могут упростить введение пациенту соответствующих количеств двух или более активных компонентов.
Типичный комплект по данному изобретению содержит единичную лекарственную форму по меньшей мере одного соединения по данному изобретению Формулы I в соответствии с определением в данном документе или его фармацевтически приемлемую соль и единичную лекарственную форму по меньшей мере одного дополнительного активного компонента. Примеры дополнительных активных компонентов, которых могут применять совместно с соединениями по данному изобретению, включают, но не ограничиваются ими, любые указанные выше лекарства (например, лекарства, применяемые для лечения остеопороза), которых могут применять в комбинации с соединением(ями) по данному изобретению.
Комплекты по данному изобретению дополнительно могут содержать фармацевтически приемлемые несущие среды, которых могут применять для введения одного или более активных компонентов. Например, если активный компонент предлагается в твердой форме, которая должна быть перерастворена для парентерального введения, комплект может содержать герметически закрытый контейнер пригодной несущей среды, в которой активный компонент может быть растворен с образованием идеального стерильного раствора, пригодного для парентерального введения. Примеры фармацевтически приемлемых несущих сред предлагаются выше.
ПРИМЕРЫ
Следующие примеры дополнительно иллюстрируют применение данного изобретения на практике, но не предназначены для его ограничения.
Пример 1: Экспериментальные методы получения некоторых иллюстративных примеров соединений
Все ВЭЖХ хроматограммы и масс-спектры записаны на приборе HP 1100 LC-MS Agilent™, используя аналитические колонки C18 (250 × 4,6 мм, 5 микрон) с градиентом в течение 5 мин 15-99% CH3CN-H2O с 0,01% ТФА в качестве элюента и потоком 2 мл/мин.
Соединение I: (RS)-2-[4-Октаноилфенокси]деканоат натрия
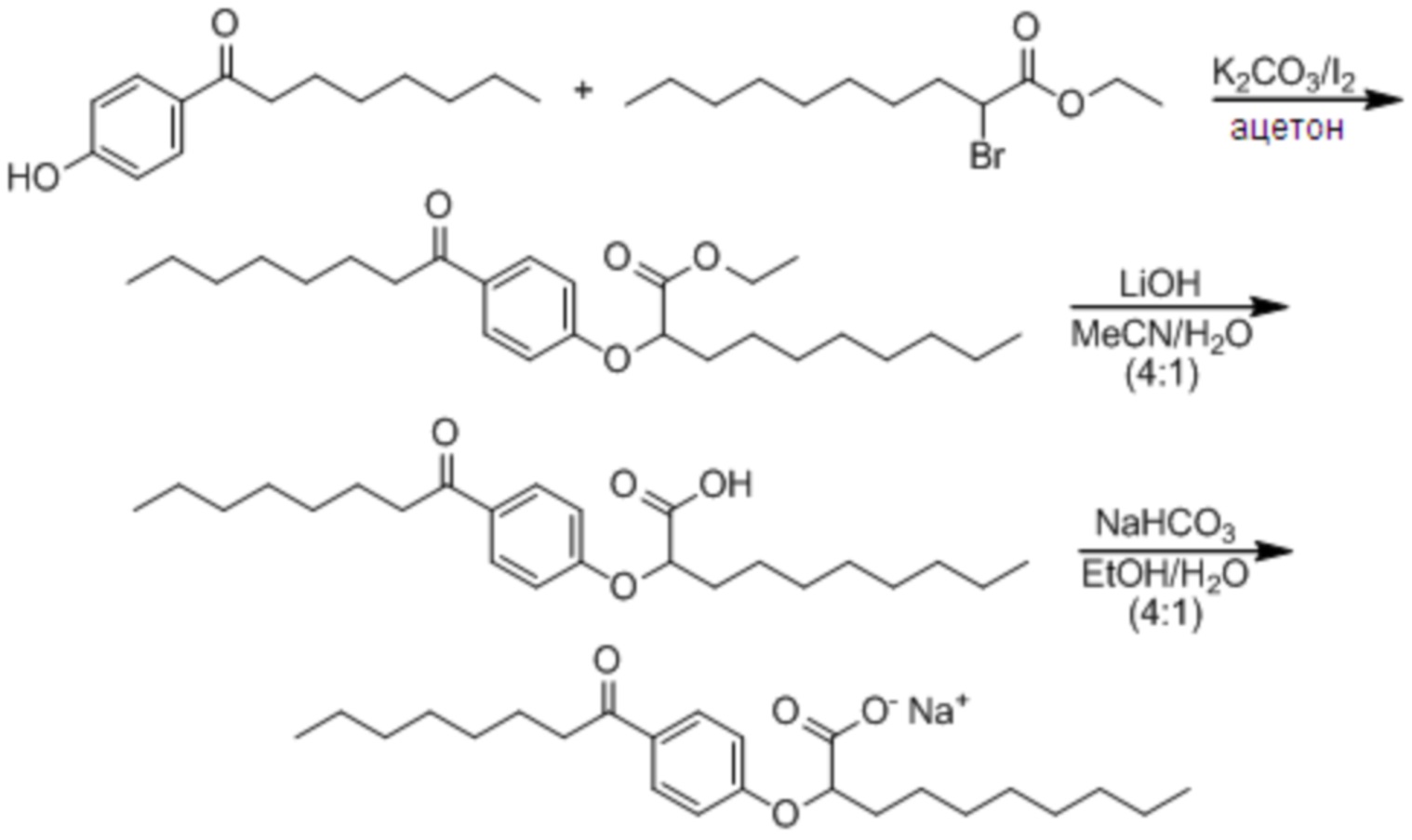
Смесь 1-[4-гидроксифенил]октан-1-она (10,0 г, 45,4 ммоль), K2CO3 (9,4 г, 68,1 ммоль) и иода (1,5 г, 9,1 ммоль) в ацетоне (100 мл) обработали этил-2-бромдеканоатом (13,9 г, 49,9 ммоль) и перемешивали реакционную смесь при комнатной температуре в атмосфере азота в течение ночи. Растворитель выпарили в вакууме и остаток разделили между этилацетатом и водой. Органическую фазу промыли насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, отфильтровали и выпарили в вакууме. Сырой материал очистили, фильтрованием через слой силикагеля, элюируя 5% этилацетат/гексан с получением этил-(RS)-2-[4-октаноилфенокси]деканоат (11,9 г, 62%) в виде бесцветного масла. 1H ЯМР (400 МГц, CDCl3): δ 7,92 (д, J = 9,0 Гц, 2H), 6,89 (д, J = 9,0 Гц, 2H), 4,66 (дд, J = 7,5, 5,2 Гц, 1H), 4,21 (к, J = 7,0 Гц, 2H), 2,89 (т, J = 7,4 Гц, 2H), 1,90-2,03 (м, 2H), 1,66-1,74 (м, 2H), 1,43-1,56 (м, 2H), 1,24-1,37 (м, 18H), 1,24 (т, J = 7,2 Гц, 2H), 0,85-0,89 (м, 6H). Раствор этилового эфира (11,9 г, 28,3 ммоль) в смеси тетрагидрофурана (360 мл), метанола (90 мл) и воды (90 мл) обработали моногидратом гидроксида лития (5,9 г, 141,5 ммоль), и перемешивали смесь при комнатной температуре в течение 20 ч. Прибавили вторую порцию моногидрата гидроксида лития (2,3 г, 54,8 ммоль) и перемешивали реакционную смесь при комнатной температуре в течение дополнительных 3 ч. Реакционную смесь концентрировали в вакууме и остаток разделили между этилацетатом и водой. Органическую фазу промыли насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, отфильтровали и выпарили в вакууме с получением сырого продукта. Очистка фильтрованием через слой силикагеля с элюированием 40% этилацетат/гексан; и перекристаллизацией из гексана дала (RS)-2-[4-октаноилфенокси]декановую кислоту (9,46 г, 86%) в виде белого твердого вещества. т.пл. 45-47°C; 1H ЯМР (400 МГц, CDCl3): δ 7,93 (д, J = 9,0 Гц, 2H), 6,91 (д, J = 9,0 Гц, 2H), 4,72 (дд, J = 6,8, 5,7 Гц, 1H), 2,90 (т, J = 7,4 Гц, 2H), 1,98-2,04 (м, 2H), 1,67-1,74 (м, 2H), 1,46-1,59 (м, 2H), 1,24-1,37 (м, 18H), 0,87 (т, J = 6,9 Гц, 3H), 0,88 (т, J = 6,9 Гц, 3H). Раствор кислоты (9,4 г, 24,1 ммоль) в этаноле (200 мл) обработали раствором гидрокарбоната натрия (2,0 г, 24,1 ммоль) в воде (50 мл), и перемешивали реакционную смесь при комнатной температуре в течение 5 ч. Растворители концентрировали в вакууме и разбавили раствор водой (950 мл), отфильтровали (0,2 мкм), и лиофилизировали с получением (RS)-2-[4-октаноилфенокси]деканоата натрия в виде белого твердого вещества (8,8 g, 88%). т.пл. 275-280°C; 1H ЯМР (400 МГц, CD3OD): δ 7,96 (д, J = 9,0 Гц, 2H), 6,97 (д, J = 9,0 Гц, 2H), 4,72 (дд, J = 6,2, 5,9 Гц, 1H), 2,95 (т, J = 7,4 Гц, 2H), 1,94-1,99 (м, 2H), 1,64-1,72 (м, 2H), 1,49-1,57 (м, 2H), 1,28-1,40 (м, 18H), 0,90 (т, J = 6,9 Гц, 3H), 0,89 (т, J = 6,9 Гц, 3H); 13C ЯМР (101 МГц, CD3OD): δ 200,72, 177,83, 163,37, 130,20, 129,61, 114,70, 79,55, 37,94, 33,19, 31,87, 31,76, 29,45, 29,38, 29,24, 29,22, 29,16, 25,74, 24,85, 22,57, 22,52, 13,29, 13,28; НРМС (ЭС): m/z 391 (M - Na+ + 2H+); ВЭЖХ: 6 мин.
Расщепление Соединения I путем получения вспомогательного хирального сложного эфира:
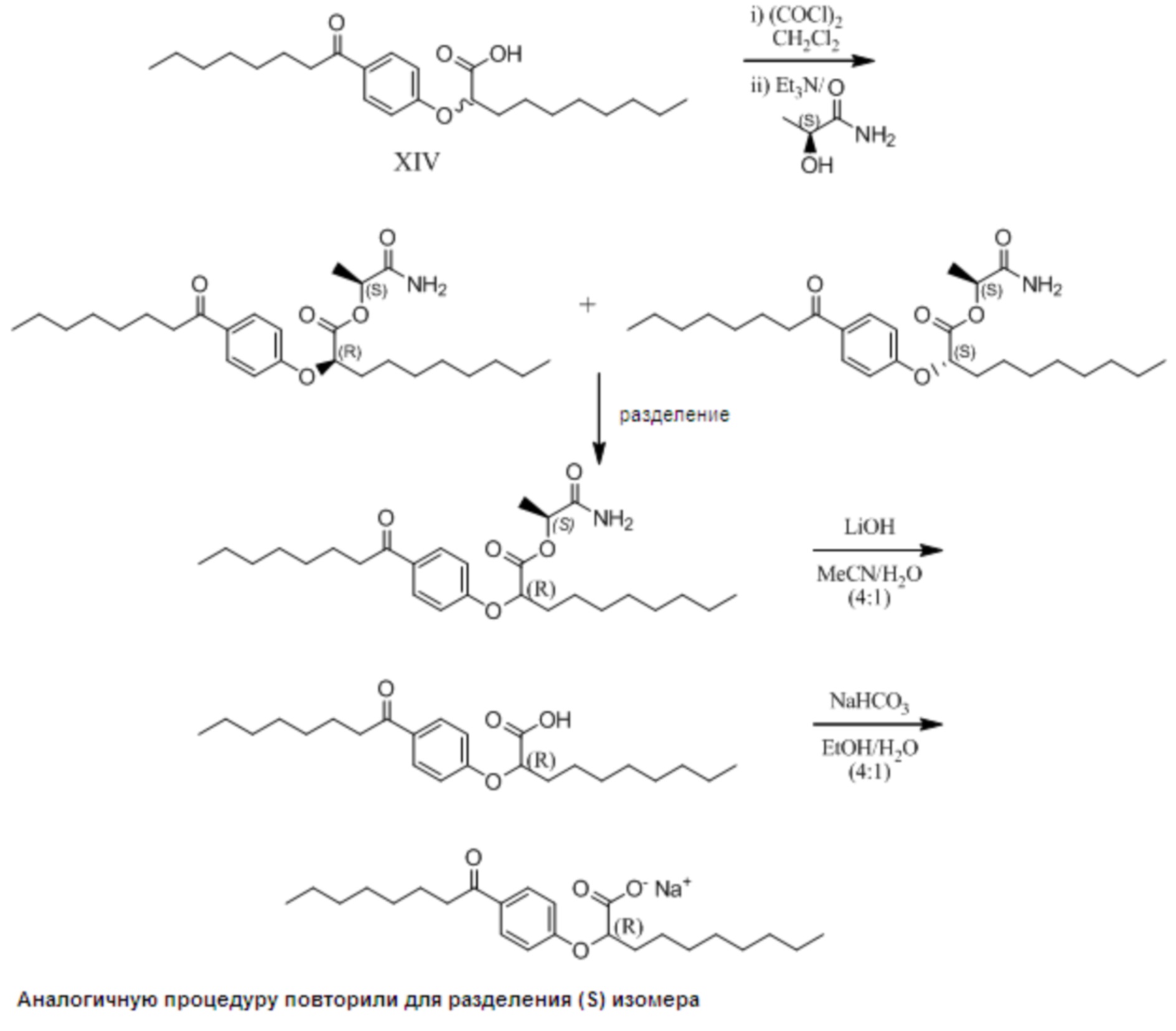
Натриевые соли (R)- и (S)-2-[4-Октаноилфенокси]деканоата
1. Образование и разделение (S)-лактамидных сложных эфиров:
Раствор (RS)-2-[4-октаноилфенокси]декановой кислоты (0,95 г, 2,4 ммоль) в дихлорметане (20 мл) по каплям обработали оксалилхлоридом (0,26 мл, 3,1 ммоль) и перемешивали реакционную смесь при комнатной температуре в течение 1 часа. Прибавили триэтиламин (0,51 мл, 3,7 ммоль) с последующим прибавлением (S)-лактамида (0,54 г, 6,1 ммоль), и перемешивали реакционную смесь при комнатной температуре в течение 20 часов. Затем раствор разбавили этилацетатом (100 мл) и промыли 1M водным раствором HCl (100 мл), водой (100 мл) и насыщенным водным раствором хлорида натрия (50 мл), затем сушили над сульфатом натрия и выпарили в вакууме. Два диастереомера разделили на колонке (силикагель) Biotage™ 40L, элюировали диэтиловый эфир/гексан от 1:4 до 1:1, затем этилацетат/гексан от 1:4 до 1:1. Это позволило разделить чистые диастереомеры.
Первый диастереомер (0,51 г, 45%) в виде белого воскообразного твердого вещества: 1H ЯМР (400 МГц, CDCl3): δ 7,93 (д, J = 9,0 Гц, 2H), 6,91 (д, J = 8,8 Гц, 2H), 5,68 (уш.с., 1H), 5,54 (уш.с., 1H), 5,22 (к, J = 6,8 Гц, 1H), 4,77 (дд, J = 7,3, 5,2 Гц, 1H), 2,88 (т, J = 7,5 Гц, 2H), 1,92-2,08 (м, 2H), 1,69, (тт, J = 7,3, 7,3 Гц, 2H), 1,46-1,56 (м, 2H), 1,47, (д, J = 6,8 Гц, 3H), 1,23-1,38 (м, 18H), 0,86 (т, J = 6,6 Гц, 6H); 13C ЯМР (101 МГц, CDCl3): δ 199,15, 172,34, 170,09, 161,35, 131,47, 130,82, 114,56, 76,70, 71,16, 38,59, 32,90, 32,00, 31,93, 29,57, 29,52, 29,35 (3C), 25,26, 24,68, 22,84 (2C), 17,85, 14,29 (2C).
Второй диастереомер (0,47 г, 42%) в виде вязкого, бесцветного масла: 1H ЯМР (400 МГц, CDCl3): δ 7,90 (д, J = 9,0 Гц, 2H), 6,91 (д, J = 9,0 Гц, 2H), 6,25 (уш.с., 1H), 6,15 (уш.с., 1H), 5,20 (к, J = 6,9 Гц, 1H), 4,79 (дд, J = 6,6, 5,9 Гц, 1H), 2,88 (т, J = 7,5 Гц, 2H), 1,95-2,01 (м, 2H), 1,68, (тт, J = 7,3, 7,3 Гц, 2H), 1,47-1,55 (м, 2H), 1,39, (д, J = 6,8 Гц, 3H), 1,22-1,37 (м, 18H), 0,86 (т, J = 6,8 Гц, 6H); 13C ЯМР (101МГц, CDCl3): δ 199,43, 172,71, 170,29, 161,52, 131,31, 130,60, 114,84, 76,48, 71,13, 38,59, 32,80, 32,00, 31,93, 29,58, 29,53, 29,36 (3C), 25,36, 24,76, 22,84, 17,69, 14,29 (2C).
2. Превращение диастереомеров в соответствующую натриевую соль:
Общий метод синтеза:
Раствор диастереомера сложного эфира (1,73 г, 3,7 ммоль) в ацетонитриле (72 мл) обработали раствором гидроксида лития (0,45 г, 18,7 ммоль) в воде (18 мл) и перемешивали реакционную смесь при комнатной температуре в течение 17 часов. Реакционую смесь погасили путем прибавления 1M водного раствора HCl (150 мл) и экстрагировали этилацетатом (2 x 100 мл). Объединенные экстракты промыли водой (150 мл) и насыщенным водным раствором хлорида натрия (150 мл); затем сушили над сульфатом натрия, отфильтровали и выпарили в вакууме с получением сырой кислоты.
Первый Энантиомер (более высокий Rf, силикагель): Очистка на колонке (силикагель) Biotage™ 40L, с элюированием этилацетат/гексан от 1:9 до 7:3, дала получить очищенный энантиомер кислоты в виде белого твердого вещества (1,28 г, 87%). 1H ЯМР (400 МГц, CDCl3): δ 11,50 (с, 1H), 7,92 (д, J = 8,8 Гц, 2H), 6,90 (д, J = 9,0 Гц, 2H), 4,71 (дд, J = 6,4, 5,9 Гц, 1H), 2,89 (т, J = 7,4 Гц, 2H), 1,97-2,03 (м, 2H), 1,69, (тт, J = 7,1, 7,1 Гц, 2H), 1,45-1,59 (м, 2H), 1,21-1,38 (м, 18H), 0,862 (т, J = 7,0 Гц, 3H), 0,859 (т, J = 6,8 Гц, 3H); 13C ЯМР (101МГц, CDCl3): δ 200,20, 176,59, 161,76, 131,00, 130,77, 114,83, 76,15, 38,59, 32,80, 32,03, 31,93, 29,59, 29,53, 29,39, 29,37 (2C), 25,38, 24,91, 22,89 (2C), 14,30 (2C).
Раствор кислоты (1,28 г, 3,2 ммоль) в этаноле (20 мл) обработали раствором гидрокарбоната натрия (0,27 г, 3,2 ммоль) в воде (5 мл), и реакционную смесь перемешивали при комнатной температуре в течение 3 дней. Растворители выпарили в вакууме с получением сырой соли в виде белого воскообразного твердого вещества. Данный материал растворили в воде (130 мл), отфильтровали (0,2 микрон; найлон) и лиофилизировали с получением чистого энантиомера в виде белого твердого вещества (1,1 г, 97%). 1H ЯМР (400 МГц, CD3OD): δ 7,91 (д, J = 8,6 Гц, 2H), 6,96 (д, J = 8,8 Гц, 2H), 4,46 (т, J = 6,2 Гц, 1H), 2,92 (т, J = 7,3 Гц, 2H), 1,90-1,95 (м, 2H), 1,66, (тт, J = 7,2, 7,2 Гц, 2H), 1,44-1,61 (м, 2H), 1,24-1,39 (м, 18H), 0,890 (т, J = 6,7 Гц, 3H), 0,882 (т, J = 6,7 Гц, 3H); 13C ЯМР(101МГц, CD3OD): δ 200,66, 177,83, 163,37, 130,24, 129,64, 114,73, 79,59, 37,96, 33,20, 31,87, 31,76, 29,46, 29,40, 29,26, 29,22, 29,16, 25,75, 24,86, 22,57, 22,53, 13,32, 13,29; другие данные будут собраны.
Второй энантиомер (более низкий Rf, силикагель): Очистка на колонке (силикагель) Biotage™ 40L с элюированием этилацетатгексан от 1:9 до 7:3, дала получить очищенный энантиомер кислоты в виде белого твердого вещества (1,10 г, 87%). 1H ЯМР (400 МГц, CDCl3): δ 11,51 (с, 1H), 7,91 (д, J = 9,0 Гц, 2H), 6,90 (д, J = 9,0 Гц, 2H), 4,71 (дд, J = 6,6, 5,9 Гц, 1H), 2,89 (т, J = 7,5 Гц, 2H), 1,97-2,03 (м, 2H), 1,69, (тт, J = 7,1, 7,1 Гц, 2H), 1,45-1,58 (м, 2H), 1,21-1,37 (м, 18H), 0,862 (т, J = 7,0 Гц, 3H), 0,858 (т, J = 7,0 Гц, 3H); 13C ЯМР (101МГц, CDCl3): δ 200,16, 176,47, 161,77, 131,03, 130,76, 114,84, 76,18, 38,58, 32,79, 32,02, 31,93, 29,58, 29,52, 29,37, 29,36 (2C), 25,36, 24,91, 22,84 (2C), 14,35, 14,28.
Раствор кислоты (1,1 г, 2,7 ммоль) в этаноле (16 мл) обработали раствором гидрокарбоната натрия (0,23 г, 2,7 ммоль) в воде (4 мл) и реакционную смесь перемешивали при температуре окружающей среды в течение 18 ч. Растворители выпарили в вакууме с получением сырой соли в виде прозрачного бесцветного сиропа. Данный материал растворили в воде (100 мл), отфильтровали (0,2 микрон; найлон) и лиофилизировали с получением чистого энантиомера в виде белого твердого вещества (1,12 г, 99%). 1H ЯМР (400 МГц, CD3OD): δ 7,91 (д, J = 9,0 Гц, 2H), 6,96 (д, J = 9,0 Гц, 2H), 4,46 (т, J = 6,2 Гц, 1H), 2,92 (т, J = 7,4 Гц, 2H), 1,90-1,95 (м, 2H), 1,66, (тт, J = 7,1, 7,1 Гц, 2H), 1,45-1,61 (м, 2H), 1,24-1,39 (м, 18H), 0,890 (т, J = 6,8 Гц, 3H), 0,881 (т, J = 6,9 Гц, 3H); 13C ЯМР (101 МГц, CD3OD): δ 200,65, 177,82, 163,37, 130,20, 129,65, 114,74, 79,58, 37,96, 33,19, 31,87, 31,76, 29,46, 29,40, 29,26, 29,22, 29,16, 25,75, 24,86, 22,57, 22,53, 13,32, 13,29.
Соединение II: (RS)-2-[3-Фтор-4-октаноилфенокси]деканоат натрия
Указанное в заголовке соединение получили, используя методику аналогичную синтезу Соединения I, исходя из 3-фтор-4-октаноилфенола (получили путем ацилирования Фриделя-Крафтса 3-фторфенола). т.пл. 220-226°C; 1H ЯМР (400 МГц, CD3OD): δ 7,78 (дд, JHH = 8,8 Гц, JHF = 8,8 Гц, 1H), 6,79 (дд, JHH = 8,8 Гц, 2,3 Гц, 1H), 6,67 (дд, JHF = 13,7 Гц, JHH = 2,3 Гц, 1H), 4,44 (т, J = 6,3 Гц, 1H), 2,89 (td, JHH = 7,3 Гц, JHF = 2,7 Гц, 2H), 1,89-1,94 (м, 2H), 1,61-1,66 (м, 2H), 1,44-1,60 (м, 2H), 1,24-1,38 (м, 18H), 0,89 (т, J = 6,9 Гц, 3H), 0,88 (т, J = 6,9 Гц, 3H); 13C ЯМР (101 МГц, CD3OD): δ 198,20 (д, JCF = 4,6 Гц), 177,23, 164,63 (д, JCF = 12,3 Гц), 163,62 (д, JCF = 253,7 Гц), 131,60 (д, JCF = 4,6 Гц), 117,92 (д, JCF = 13,1 Гц), 111,72, 102,50 (д, JCF = 27,7 Гц), 80,03, 42,82, 42,75, 33,04, 31,86, 31,73, 29,44, 29,35, 29,21, 29,13, 25,65, 24,26, 22,56, 22,52, 13,29 & 13,27; 19F ЯМР (377 МГц, CD3OD): δ -108,77 (дд, JHF = 13,3 Гц, 9,3 Гц, 1F); НРМС (ЭС): m/z 409,6 (100%, M- Na+ + 2H+); ВЭЖХ: 3,7 мин.
Соединение III: (RS)-4-Октаноилиндан-2-карбоксилат натрия
Метил-(RS)-4-октаноил-2-карбоксилат (71 мг, 4%) выделили в виде побочного продукта при получении его изомера, метил-(RS)-5-октаноил-2-карбоксилата. 1H ЯМР (400 МГц, CDCl3): δ 7,66 (д, J = 7,6 Гц, 1H), 7,35 (д, J = 7,4 Гц, 1H), 7,24 (дд, J = 7,6, 7,6 Гц, 1H), 3,69 (с, 3H), 3,64 (A в ABX, J = 18,0, 9,4 Гц, 1H), 3,48 (B в ABX, J = 18,1, 7,3 Гц, 1H), 3,13-3,34 (м, 3H), 2,90 (т, J = 7,5 Гц, 2H), 1,68 (тт, J = 7,2, 7,2 Гц, 2H), 1,24-1,38 (м, 8H), 0,86 (т, J = 6,9 Гц, 3H); 13C ЯМР (101 МГц, CDCl3): δ 203,01, 176,79, 144,82, 143,67, 134,73, 129,30, 128,35, 127,83, 52,91, 44,06, 40,82, 38,71, 36,44, 32,73, 30,34, 30,19, 25,36, 23,64, 15,10. Метил-(RS)-4-октаноил-2-карбоксилат (71 мг, 0,24 ммоль) омылили согласно стандартной методике с получением (RS)-4-октаноил-2-карбоновой кислоты (66 мг, 96%) в виде белого твердого вещества с металлическим оттенком. 1H ЯМР (400 МГц, CDCl3): δ 7,69 (д, J = 7,6 Гц, 1H), 7,39 (д, J = 7,4 Гц, 1H), 7,26 (дд, J = 7,6, 7,6 Гц, 1H), 3,67 (A в ABX, J = 18,0, 9,0 Гц, 1H), 3,56 (B в ABX, J = 18,0, 6,9 Гц, 1H), 3,19-3,39 (м, 3H), 2,93 (т, J = 7,4 Гц, 2H), 1,70 (тт, J = 7,3, 7,3 Гц, 2H), 1,24-1,38 (м, 8H), 0,88 (т, J = 6,9 Гц, 3H). (RS)-4-Октаноил-2-карбоновую кислоту (66 мг, 0,23 ммоль) превратили в натриевую соль согласно стандартной методике с получением (RS)-4-октаноил-2-карбоксилата натрия (70 мг, 99%) в виде белого твердого вещества с металлическим оттенком. т.пл. 106-110°C, 1H ЯМР (400 МГц, CD3OD): δ 7,69 (д, J = 7,8 Гц, 1H), 7,38 (д, J = 7,4 Гц, 1H), 7,24 (дд, J = 7,6, 7,6 Гц, 1H), 3,37-3,56 (м, 2H), 3,10-3,21 (м, 3H), 2,95 (т, J = 7,3 Гц, 2H), 1,66 (тт, J = 7,3, 7,3 Гц, 2H), 1,26-1,39 (м, 8H), 0,89 (т, J = 6,8 Гц, 3H); 13C ЯМР (101 МГц, CD3OD): δ 203,56, 182,93, 145,34, 143,96, 133,93, 128,26, 126,97, 126,42, 47,62, 39,89, 38,69, 36,70, 31,76, 29,21, 29,17, 24,55, 22,52, 13,28; НРМС (ЭС): m/z 577,6 (сильный, 2M - 2Na+ + 3H+), 289,2 (100%, M - Na+ + 2H+); ВЭЖХ: 3,43 мин.
Соединение IV: (RS)-2-[4-Октаноилфенокси]октаноат натрия
1-[4-Гидроксифенил]-1-октанон (440 мг, 2,0ммоль) и этил-(RS)-2-бромоктаноат (552 мг, 2,2 ммоль) ввели в реакцию согласно методики, использованной для синтеза Соединения I , с получением этил-(RS)-2-[4-октаноилфенокси]октаноата (605 мг, 78%). 1H ЯМР (400 МГц, CDCl3): δ 7,91 (д, J = 9,0 Гц, 2H), 6,88 (д, J = 9,0 Гц, 2H), 4,66 (дд, J = 5,1, 7,4 Гц, 1H), 4,20 (к, J = 7,0 Гц, 2H), 2,88 (т, J = 7,5 Гц, 2H), 1,88-2,02 (м, 2H), 1,70 (тт, J = 7,2, 7,2 Гц, 2H), 1,41-1,56 (м, 2H), 1,25-1,37 (м, 14H), 1,23 (т, J = 7,1 Гц, 3H), 0,87 (т, J = 7,2 Гц, 3H), 0,86 (т, J = 7,2 Гц, 3H); 13C ЯМР (101 МГц, CDCl3): δ 199,41, 171,48, 161,81, 131,01, 130,54 (2C), 114,77 (2C), 76,75, 61,62, 38,56, 32,90, 31,94, 31,78, 29,60, 29,38, 29,07, 25,33, 24,80, 22,85, 22,75, 14,39, 14,31, 14,26. Полученный сложный эфир (605 мг, 1,6 ммоль) омылили гидроксидом лития (186 мг, 7,8 ммоль) согласно методике, использованной для синтеза Соединения I, с получением (RS)-2-[4-октаноилфенокси]октановой кислоты (487 мг, 87%). 1H ЯМР (400 МГц, CDCl3): δ 9,70 (уш.с., 1H), 7,89 (д, J = 9,0 Гц, 2H), 6,89 (д, J = 9,0 Гц, 2H), 4,69 (дд, J = 5,9, 6,6 Гц, 1H), 2,87 (т, J = 7,5 Гц, 2H), 1,95-2,01 (м, 2H), 1,67 (тт, J = 7,2, 7,2 Гц, 2H), 1,43-1,58 (м, 2H), 1,24-1,37 (м, 14H), 0,851 (т, J = 6,8 Гц, 3H), 0,849 (т, J = 7,4 Гц, 3H); 13C ЯМР (101 МГц, CDCl3): δ 200,38, 176,08, 161,84, 130,85, 130,78 (2C), 114,83 (2C), 76,20, 38,56, 32,79, 31,93, 31,76, 29,57, 29,35, 29,05, 25,34, 24,92, 22,84, 22,74, 14,29, 14,23. Затем кислоту (500 мг, 1,4 ммоль) превратили в натриевую соль согласно методике, использованной для синтеза Соединения I, с получением (RS)-2-[4-октаноилфенокси]октаноата натрия (404 мг, 76%) в виде белого твердого вещества. т.пл. 165-170°C; 1H ЯМР (400 МГц, CD3OD): δ 7,91 (д, J = 8,8 Гц, 2H), 6,95 (д, J = 8,8 Гц, 2H), 4,58 (дд, J = 6,1, 6,3 Гц, 1H), 2,91 (т, J = 7,3 Гц, 2H), 1,91-1,96 (м, 2H), 1,62-1,69 (м, 2H), 1,44-1,58 (м, 2H), 1,25-1,39 (м, 14H), 0,87-0,90 (м, 6H); 13C ЯМР (101 МГц, CD3OD): δ 200,50, 176,40, 162,96, 130,28 (2C), 129,94, 114,71 (2C), 78,38, 38,00, 32,98, 31,79, 31,74, 29,27, 29,20, 29,05, 25,50, 24,79, 22,56, 22,51, 13,36, 13,34; НРМС (ЭС): m/z 769 (M2H+), 748 (2M - Na+ + 2H+), 363 (M - Na+ + 2H+); ВЭЖХ: 3 мин.
Соединение V: (RS)-2-[4-Бутирилфенокси]деканоат натрия
1-[4-Гидроксифенил]-1-бутанон (328 мг, 2,0 ммоль) и этил-(RS)-2-бромдеканоат (614 мг, 2,2ммоль) ввели в реакцию согласно методике, использованной для синтеза Соединения IV, с получением этил-(RS)-2-[4-Бутирилфенокси]деканоата (616 мг, 85%) в виде прозрачного бесцветного масла. 1H ЯМР (400 МГц, CDCl3): δ 7,88 (д, J = 9,0 Гц, 2H), 6,86 (д, J = 9,0 Гц, 2H), 4,64 (дд, J = 5,7, 6,8 Гц, 1H), 4,17 (к, J = 7,2 Гц, 2H), 2,83 (т, J = 7,3 Гц, 2H), 1,85-1,99 (м, 2H), 1,65-1,75 (м, 2H), 1,39-1,44 (м, 2H), 1,22-1,34 (м, 10H), 1,20 (т, J = 7,2 Гц, 3H), 0,94 (т, J = 7,4 Гц, 3H), 0,83 (т, J = 7,0 Гц, 3H); 13C ЯМР (101 МГц, CDCl3): δ 199,04, 171,39, 161,80, 130,98, 130,48 (2C), 114,74 (2C), 76,68, 61,55, 40,37, 32,85, 32,01, 29,53, 29,37 (2C), 25,33, 22,84, 18,11, 14,34, 14,29, 14,10. Полученный сложный эфир (616 мг, 1,70 ммоль) омылили гидроксидом лития (203 мг, 8,5 ммоль) согласно методике, использованной для синтеза Соединения IV, с получением (RS)-2-[4-Бутирилфенокси]декановой кислоты (166 мг, 29%). 1H ЯМР (400 МГц, CDCl3): δ 10,06 (уш.с., 1H), 7,91 (д, J = 9,0 Гц, 2H), 6,90 (д, J = 9,0 Гц, 2H), 4,70 (дд, J = 5,9, 6,4 Гц, 1H), 2,87 (т, J = 7,3 Гц, 2H), 1,96-2,02 (м, 2H), 1,68-1,77 (м, 2H), 1,44-1,59 (м, 2H), 1,24-1,37 (м, 10H), 0,97 (т, J = 7,4 Гц, 3H), 0,86 (т, J = 7,0 Гц, 3H); 13C ЯМР(101 МГц, CDCl3): δ 199,95, 176,56, 161,74, 131,03, 130,73 (2C), 114,82 (2C), 76,16, 40,47, 32,79, 32,03, 29,53, 29,39, 29,37, 25,38, 22,86, 18,26, 14,31, 14,12. Затем кислоту (166 мг, 0,5 ммоль) превратили в натриевую соль согласно методике, использованной для синтеза Соединения IV , с получением (RS)-2-[4-бутирилфенокси]деканоата натрия (149 мг, 85%) в виде белого твердого вещества. т.пл. 262-278°C; 1H ЯМР (400 МГц, CD3OD): δ 7,91 (д, J = 9,0 Гц, 2H), 6,96 (д, J = 9,0 Гц, 2H), 4,70 (дд, J = 6,1, 6,5 Гц, 1H), 2,90 (т, J = 7,3 Гц, 2H), 1,88-1,93 (м, 2H), 1,67 (тк, J = 7,4, 7,4 Гц, 2H), 1,41-1,57 (м, 2H), 1,20-1,35 (м, 10H), 0,95 (т, J = 7,4 Гц, 3H), 0,83 (т, J = 6,9 Гц, 3H); 13C ЯМР (101 МГц, CD3OD): δ 201,82, 178,07, 163,36, 130,53 (2C), 129,54, 114,83 (2C), 79,46, 39,99, 33,11, 31,80, 29,40, 29,27, 29,15, 25,72, 22,54, 18,30, 14,46, 14,15; НРМС (ЭС): m/z 713 (M2H+), 669 (2M - 2Na+ + 3H+), 335 (M - Na+ + 2H+); ВЭЖХ: 3 мин.
Соединение VI: (RS)-2-[4-Гексаноилфенокси]деканоат натрия
1-[4-Гидроксифенил]-1-гексанон (384 мг, 2,0 ммоль) и этил-(RS)-2-бромдеканоат (614 мг, 2,2ммоль) ввели в реакцию согласно методике, использованной для синтеза Соединения IV, с получением этил-(RS)-2-[4-гексаноилфенокси]деканоата (628 мг, 80%). 1H ЯМР (400 МГц, CDCl3): δ 7,86 (д, J = 9,0 Гц, 2H), 6,84 (д, J = 9,0 Гц, 2H), 4,60-4,65 (м, 1H), 4,15 (к, J = 7,0 Гц, 2H), 2,83 (т, J = 7,3 Гц, 2H), 1,86-1,97 (м, 2H), 1,61-1,70 (м, 2H), 1,38-1,52 (м, 2H), 1,20-1,34 (м, 14H), 1,18 (т, J = 7,2 Гц, 3H), 0,78-0,87 (м, 6H); 13C ЯМР(101 МГц, CDCl3): δ 199,17, 171,36, 161,78, 130,95, 130,46 (2C), 114,72 (2C), 76,66, 61,51, 38,41, 32,84, 32,00, 31,76, 29,52, 29,35 (2C), 25,31, 24,41, 22,83, 22,74, 14,33, 14,26, 14,14. Полученный сложный эфир (628 мг, 1,6 ммоль) омылили гидроксидом лития (193 мг, 8,0 ммоль) согласно методике, использованной для синтеза Соединения IV, с получением (RS)-2-[4-гексаноилфенокси]декановой кислоты (468 мг, 80%). 1H ЯМР(400 МГц, CDCl3): δ 7,93 (д, J = 9,0 Гц, 2H), 6,91 (д, J = 9,0 Гц, 2H), 5,77 (уш.с., 1H), 4,70 (дд, J = 5,8, 6,6 Гц, 1H), 2,89 (т, J = 7,4 Гц, 2H), 1,97-2,03 (м, 2H), 1,67-1,74 (м, 2H), 1,44-1,60 (м, 2H), 1,23-1,37 (м, 14H), 0,90 (т, J = 6,8 Гц, 3H), 0,87 (т, J = 7,0 Гц, 3H); 13C ЯМР (101 МГц, CDCl3): δ 199,76, 176,29, 161,56, 131,20, 130,70 (2C), 114,81 (2C), 76,12, 38,56, 32,78, 32,03, 31,80, 29,53, 29,40, 29,36, 25,36, 24,51, 22,87, 22,76, 14,33, 14,20. Затем кислоту (468 мг, 1,3 ммоль) превратили в натриевую соль согласно методике, использованной для синтеза Соединения IV, с получением (RS)-2-[4-гексаноилфенокси]деканоата натрия (459 мг, 93%) в виде белого твердого вещества. т.пл. 275-280°C; 1H ЯМР (400 МГц, CD3OD): δ 7,91 (д, J = 8,8 Гц, 2H), 6,96 (д, J = 8,8 Гц, 2H), 4,44-4,48 (м, 1H), 2,89-2,96 (м, 2H), 1,88-1,96 (м, 2H), 1,63-1,71 (м, 2H), 1,44-1,61 (м, 2H), 1,24-1,38 (м, 14H), 0,84-0,93 (м, 6H); 13C ЯМР (101 МГц, CD3OD): δ 200,89, 177,86, 163,36, 130,27 (2C), 129,60, 114,75 (2C), 79,54, 37,94, 33,18, 31,86, 31,49, 29,44, 29,38, 29,21, 25,73, 24,55, 22,58, 22,45, 13,36, 13,23; НРМС (ЭС): m/z 769,8 (M2H+), 747,8 (2M - Na+ + 2H+), 363,2 (M - Na+ + 2H+); ВЭЖХ: 3.мин.
Соединение VII: (RS)-2-[4-Октаноилбензил]деканоат натрия
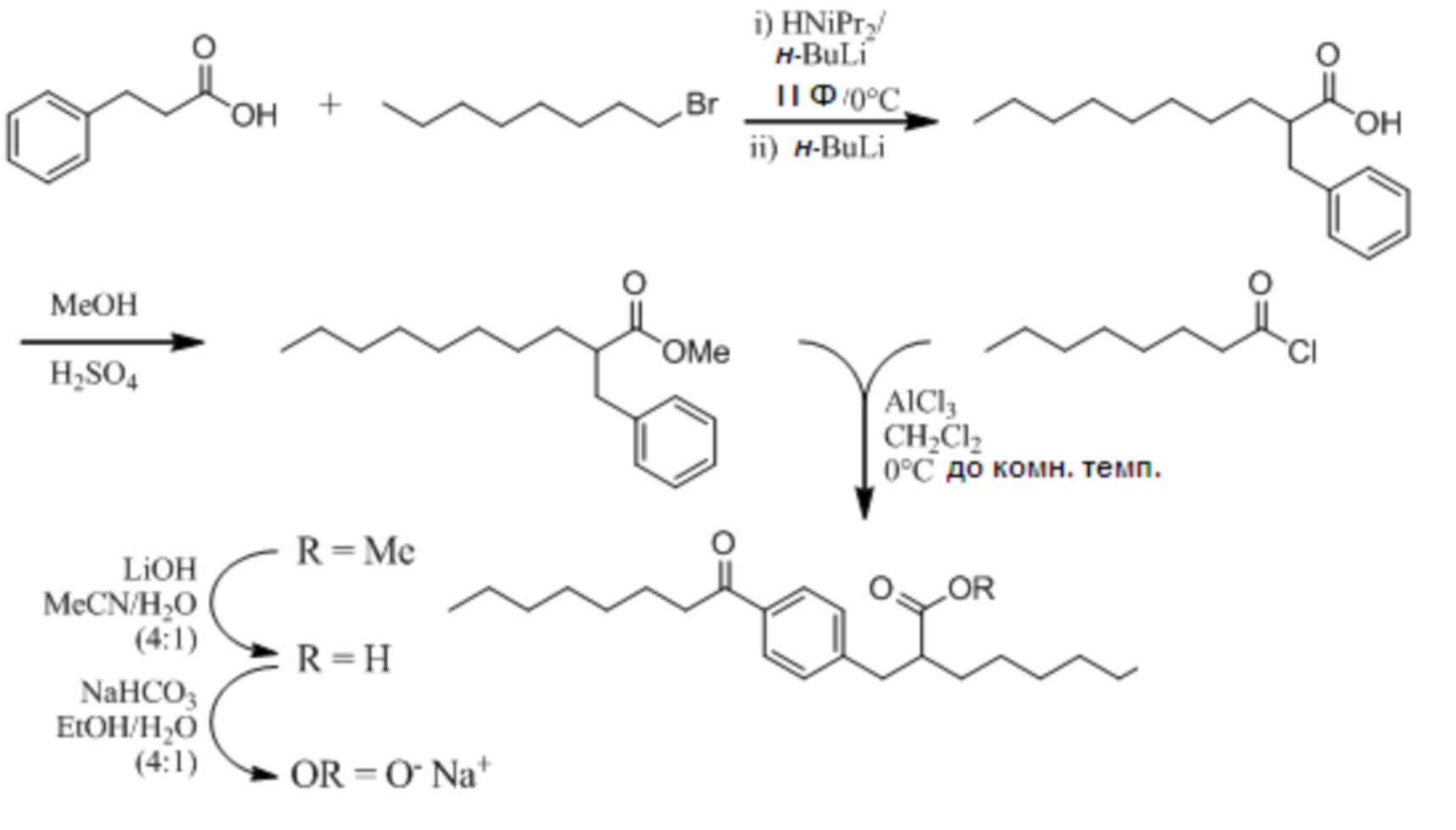
Стадия 1
[00108] Раствор диизопропиламина (1,5 мл, 10,5 ммоль) в безводном тетрагидрофуране (20 мл) охладили до 0°C в атмосфере азота и обработали раствором н-бутиллития в гексане (2,3 M; 4,4 мл, 10,0 ммоль). Через 5 мин прибавили раствор 3-фенилпропановой кислоты (1,5 г, 10,0 ммоль) в безводном тетрагидрофуране (10 мл) с получением белой суспензии. Через 20 мин при 0°C реакционную смесь охладили до -10°C и прибавили вторую порцию н-бутиллития в гексане (2,3 M; 4,80 мл, 11,0 ммоль). Перемешивание при -10°C в течение 10 мин, затем при комнатной температурев течение 40 мин, дало прозрачный, светло-коричневый раствор. Раствор охладили до 0°C и обработали 1-бромоктаном (1,8 мл, 10,5 ммоль). Реакционную смесь перемешивали при 0°C в течение 20 мин и затем при комнатной температуре 3 ч. Прибавили насыщенный водный раствор хлорида аммония (100 мл); (6M) водным раствором соляной кислоты pH привели к 1 и экстрагировали смесь этилацетатом (100 мл). Органический экстракт промыли водой (100 мл) и насыщенным водным раствором хлорида натрия (75 мл); затем сушили над сульфатом натрия; отфильтровали и выпарили в вакууме с получением сырого продукта. Очистка на картридже (силикагель) Biotage™ 40L с элюированием 0-20% этилацетатом в гексане дала получить (RS)-2-бензилдекановую кислоту в виде масла соломенного цвета (1,9 г, 73%). 1H ЯМР (400 МГц, CDCl3): δ 11,51 (уш.с., 1H), 7,14-7,35 (м, 5H), 3,00 (дд, J = 13,7, 7,9 Гц, 1H), 2,77 (дд, J = 13,7, 6,8 Гц, 1H), 2,65-2,72 (м, 1H), 1,62-1,71 (м, 1H), 1,49-1,57 (м, 1H), 1,20-1,42 (м, 12H), 0,90 (т, J = 6,8 Гц, 3H).
Стадия 2
Раствор соединения карбоновой кислоты (1,9 г, 7,3 ммоль) в метаноле (13 мл) обработали серной кислотой (0,35 мл, 6,6 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем реакционную смесь разбавили этилацетатом (175 мл) и раствор промыли (0,5M) водным раствором гидроксида натрия (175 мл), водой (175 мл) и насыщенным водным раствором хлорида натрия (135 мл); затем сушили над сульфатом натрия; отфильтровали и выпарили в вакууме с получением метил-(RS)-2-бензилдеканоата в виде золотисто-желтого масла (2,0 г, 99%). 1H ЯМР (400 МГц, CDCl3): δ 7,14-7,29 (м, 5H), 3,60 (с, 3H), 2,93 (дд, J = 13,4, 8,4 Гц, 1H), 2,74 (дд, J = 13,6, 6,5 Гц, 1H), 2,62-2,69 (м, 1H), 1,60-1,67 (м, 1H), 1,45-1,55 (м, 1H), 1,22-1,37 (м, 12H), 0,88 (т, J = 6,8 Гц, 3H).
Стадия 3
Раствор метилового эфира данного соединения (1,5 г, 5,5 ммоль) и октаноилхлорида (1,4 мл, 8,3 ммоль) в безводном дихлорметане (25 мл) охладили до 0°C в атмосфере азота и на протяжении 160 мин обрабатывали малыми порциями хлорида алюминия в гранулах (2,2 г, 16,6 ммоль). Реакционную смесь перемешивали при 0°C в течение 150 мин и затем погасили путем выливания в смесь льда (150 мл) и воды (150 мл). Смесь перемешивали в течение 10 мин и экстрагировали этилацетатом (150 мл). Органический экстракт промыли водным раствором гидроксида натрия (0,5 M, 200 мл) и насыщенным водным раствором хлорида натрия (100 мл); и затем сушили над сульфатом натрия; отфильтровали и высушили в вакууме с получением сырого соединения. Очистка на картридже (силикагель) Biotage™ 40L с элюированием 0-3% этилацетатом в гексане дала получить метил- (RS)-2-[4-октаноилбензил]деканоат в виде желтого масла (157 мг, 7%). 1H ЯМР (400 МГц, CDCl3): δ 7,83 (д, J = 8,2 Гц, 2H), 7,19 (д, J = 8,2 Гц, 2H), 3,54 (с, 3H), 2,93 (дд, J = 13,6, 8,8 Гц, 1H), 2,88 (т, J = 7,4 Гц, 2H), 2,75 (дд, J = 13,6, 6,2 Гц, 1H), 2,60-2,68 (м, 1H), 1,58-1,71 (м, 3H), 1,42-1,50 (м, 1H), 1,18-1,35 (м, 20H), 0,84 (т, J = 6,8 Гц, 3H), 0,83 (т, J = 6,8 Гц, 3H); 13C ЯМР (101 МГц, CDCl3): δ 200,21, 175,88, 145,12, 135,58, 129,19, 128,43, 51,57, 47,51, 38,69, 38,59, 32,47, 32,02, 31,92, 29,63, 29,57, 29,55, 29,40, 29,37, 27,46, 24,58, 22,84, 22,83, 14,28 и 14,26.
Стадия 4
[00111] Раствор метилового эфира данного соединения (156 мг, 0,3 ммоль) в ацетонитриле (4 мл) обработали раствором гидроксида лития (46 мг, 1,9 ммоль) в воде (1 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 дней, при 60°C в течение 20 ч, и затем при комнатной температуре в течение дополнительных 4 дней. Реакционную смесь разделили между этилацетатом (20 мл) и водным раствором соляной иклсоты (1M, 20 мл). Органическую фазу промыли водой (20 мл) и насыщенным водным раствором хлорида натрия (20 мл); затем сушили над сульфатом натрия; отфильтровали и выпарили в вакууме с получением частично гидролизованной смеси метилового эфира и карбоновой кислоты. Очистка на картридже (силикагель) Biotage™ 12M с элюированием 0-30% этилацетатом в гексане дала получить (RS)-2-[4-октаноилбензил]декановую кислоту в виде бесцветного масла (46 мг, 31%). 1H ЯМР (400 МГц, CDCl3): δ 7,88 (д, J = 8,2 Гц, 2H), 7,26 (д, J = 8,2 Гц, 2H), 3,01 (дд, J = 13,8, 8,1 Гц, 1H), 2,93 (т, J = 7,4 Гц, 2H), 2,81 (дд, J = 13,8, 6,5 Гц, 1H), 2,65-2,72 (м, 1H), 1,61-1,75 (м, 3H), 1,46-1,55 (м, 1H), 1,23-1,40 (м, 20H), 0,88 (т, J = 6,9 Гц, 3H), 0,87 (т, J = 6,7 Гц, 3H).
Стадия 5
Раствор гидрокарбоната натрия (10 мг, 0,12 ммоль) в воде (0,25 мл) обработали раствором карбоновой кислоты (46 мг, 0,12 ммоль) в этаноле (1,0 мл) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Растворители выпарили в вакууме и остаток растворили в воде (4 мл), отфильтровали (0,2 микрон, PES) и лиофилизировали с получением смолы. Выпаривание из раствора ацетона дало получить (RS)-2-[4-октаноилбензил]деканоат натрия в виде белого твердого вещества с металлическим оттенком (45 мг, 93%). 1H ЯМР (400 МГц, CD3OD): δ 7,86 (д, J = 8,4 Гц, 2H), 7,35 (д, J = 8,4 Гц, 2H), 2,94-3,00 (м, 3H), 2,69 (дд, J = 13,3, 6,6 Гц, 1H), 2,46-2,53 (м, 1H), 1,54-1,70 (м, 3H), 1,23-1,40 (м, 21H), 0,89 (т, J = 6,8 Гц, 3H), 0,87 (т, J = 7,2 Гц, 3H); 13C ЯМР (101 МГц, CD3OD): δ 201,60, 182,80, 147,71, 134,81, 129,26, 128,04, 51,14, 39,54, 38,24, 33,04, 31,92, 31,77, 29,76, 29,52, 29,27, 29,23, 29,18, 27,78, 24,62, 22,57, 22,54, 13,33 и 13,31; НРМС (ЭС): m/z 389,7 (100%, [M – Na+ + 2H+]); ВЭЖХ: 3,2 мин.
Пример 2: Действие соединений на ЛПС-стимулированные клетки RAW264,7; предшественника остеокласта.
ЛПС, полученный из бактерий продукт клеточных стенок, долго считали главным фактором в развитии потери костной ткани. ЛПС играет важную роль к резорбции костной ткани, которое включает задействование воспалительных клеток, синтез цитокинов (таких как интерлейкин-6 (ИЛ-6), ИЛ-12 и фактор некроза опухоли-α (TNF-α)), и активацию образования и дифференциации остеокластов.
Клетки RAW264 представляют собой предшественники остеокластов и могут быть дифференцированы с помощью нескольких факторов, включающих лиганд рецептора-активатора NF-қB (RANKL) или липополисахариды (ЛПС). Остеокласты характеризуются высокой экспрессией или устойчивой к тартрату кислой фосфатазой (TRACP) и матричной металлопротеиназой-9 (MMP-9), которые могут быть использованы в качестве маркеров остеокластов. Было показано, что клетки RAW264,7, инкубированные в присутствии каприновой кислоты, приводили к повышению продуцирования ИЛ-12 и уменьшения фосфатазы (TRAP)-положительных клеток (TRAP экспрессия, маркер дифференциации остеокластов) (Wang et al., J. Biol. Chem. (2006), Том 281, № 45, стр. 34457-64). Более того, ЛПС сильно повышало регуляцию уровней мРНК индуцируемой синтазы оксида азота (iNOS) и продуцирования оксида азота (NO), тогда как каприновая кислота ингибировала их. Дополнительно, каприновая кислота также ингибировала мРНК экспрессию моноцитарного хемоаттрактантного белка -1 (MCP-1) .
Исследование действия соединений Формулы I на TRAP (остеокластный маркер) и ИЛ-12 может быть проведено на клетках RAW264,7, клеточной линии мышиных клеток-предшественников остеокластов. Клетки RAW264,7 дифференциируют путем инкубации с ЛПС (1 мкг/мл) в присутствии или отсутствии каприновой кислоты (положительный контроль) или соединения(й), которые предстоит протестировать. Образование остеокластов оценивают на 3-5 день, используя окрашивание устойчивой к тартрату кислой фосфатазы (TRAP).
Действие ЛПС на остеокластогенез в клетках RAW264,7 продемонстрировано путем высокой экспрессии TRAP (темное окрашивание). Если клеток TRAP наблюдают меньше или вообще не наблюдают при приведении в контакт с тестируемым(ыми) соединением(ями), это указывает на то, что клетки не дифференциируются в остеокласты, что свидетельствует о том, что тестируемое(ые) соединение(ия) ингибируют остеокластогенез.
Также сообщалось, что каприновая кислота повышает продуцирования ИЛ-12 в ЛПС-стимулированных RAW264,7 (Wang et al., J.Biol.Chem.(2006), Том 281, №,45, стр.,34457-64). Поскольку каприновая кислота также известна в качестве ингибитора остеокластогенеза, то могут быть проведены эксперименты для определения способны ли соединения Формулы I стимулировать повышение продуцирования ИЛ-12. Соответственно, клетки RAW264,7 культивируют с 100 нг/мл ЛПС в присутствии или в отсутствии соединения(й) в течение 21 ч в увлажненной атмосфере 95% воздух-5% диоксид углерода при 37°C. Концентрацию ИЛ-12 в культурной среде измеряют, используя ИФА ИЛ-12 в соответствии с рекомендациями производителя (BD Biosciences). Сильная стимуляция продуцирования ИЛ-12 в ЛПС-стимулированных клеток RAW264,7 в присутствии разнообразных концентраций тестируемых соединений могла бы подтвердить, что соединения способны стимулировать повышения ИЛ-12.
Пример 3: Действие соединения Формулы I на продуцирование ИЛ-12 в ЛПС-стимулированных клетках RAW264,7; предшественнике остеокласта.
Также сообщается, что ИЛ-12 ингибирует образование остеокластов (Horwood и al., 2001, J. of Immunology, том 166, №,8, стр,4915-4921). Как было упомянуто в Примере 1, ЛПС-стимулированные RAW264,7, инкубированные в присутствии соединений Формулы I, могут повышать ИЛ-12 и уменьшать остеокластогенез (TRAP). Соответственно, in vitro анализ продуцирования ИЛ-12 применили для скрининга потенциальных ингибиторов остеокластогенеза. В Таблице 1 представлено действие иллюстративных примеров соединений Формулы I на продуцирование ИЛ-12. Все тестируемые соединения вызвали значительное увеличение продуцирования ИЛ-12
Таблица 1: Действие иллюстративных примеров соединения Формулы I на продуцирование ИЛ-12
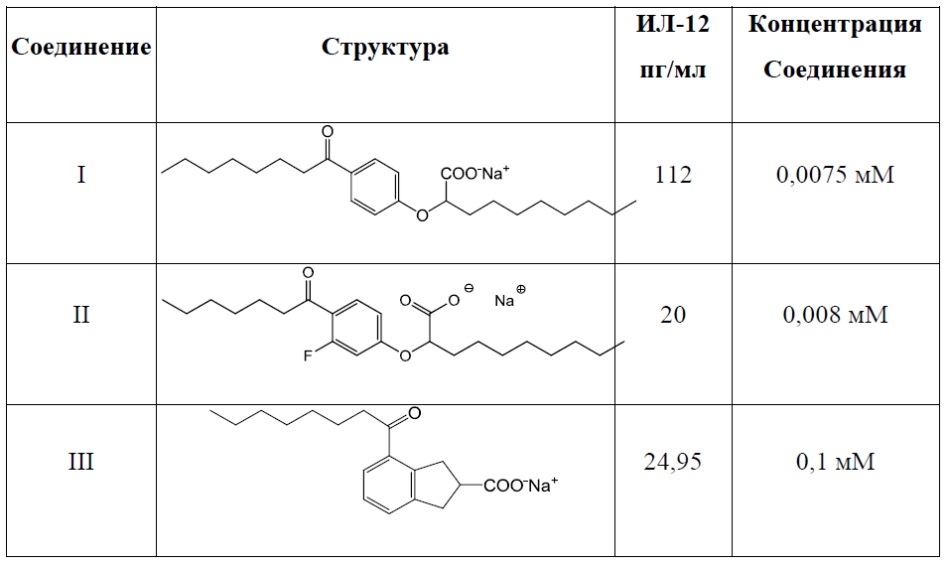
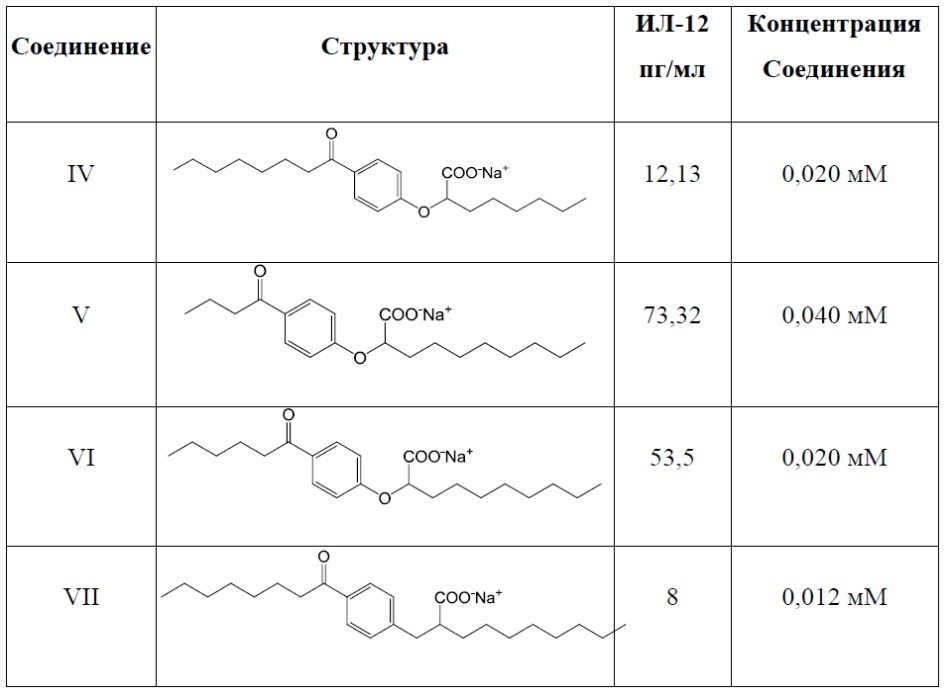
[00121] Данные результаты демонстрируют, что протестированные соединения вызвали продуцирование ИЛ-12 в присутствии ЛПС. Способность продуцировать ИЛ-12 означает, что соединения по данному изобретению могут быть пригодны для предотвращения и/или лечения остеопороза, как следствие стимуляции ИЛ-12. Это подтверждается ссылками, упомянутыми выше в Примере 2, в которых сообщается, что ИЛ-12 имеет непосредственный ингибирующий эффект на остеокластогенез.
Пример 4: Действие Соединения I на уменьшение остеопороза на модели овариэктомированной крысы
Хотя при сравнении с людьми, скелетная масса крыс остается более стабильной на протяжении периода их жизни, с помощью овариэктомии крыс у них можно вызвать дефицит половых гормонов и стимулировать ускорение потери костной ткани, которые происходят у женщин в периоде постменопаузы. Вызванная овариэктомией потеря костной ткани у крысы и постменопаузальная потеря костной ткани имеют много аналогичных характеристик. Указанные характеристики включают: повышенную скорость замены костной ткани с резорбцией превышающей образование; исходную быструю фазу потери костной ткани с последующей более медленной фазой; большую потерю губчатой, чем трубчатой костной ткани; пониженное всасывание кальция в кишечнике; некоторую защиту против потери костной ткани благодаря ожирению; и аналогичный ответ со стороны скелета на терапию эстрогеном, тамоксифеном, бисфосфонатами, паратиреоидным гормоном кальцитонином и упражнением. Указанный широкий диапазон аналогий является веским доказательством в пользу того, что изучение на модели потери костной ткани овариэктомированных крыс пригодно для изучения проблем, которые соответствуют постменопаузальной потери костной ткани.
Крыс Спрага-Доули (250 г) подвергли овариэктомии (OVX) на 0 день. Крыс лечили путем кормления через желудочный зонд Соединением I (10 мг/кг) с 14 дня по 68 день. Оценка различных параметров (массы тела, потери кальция, маркеров остеокластов (мРНК экспрессии RANKL и TRAP), содержания коллагена и гистологии) выполнена на 68 день.
Фиг. 1 иллюстрирует повышение массы тела у овариэктомированных крыс (аналогичным “постменопаузальному ожирению”). Соединение I уменьшило вызванное овариэктомией ожирение.
Фиг. 2 иллюстрирует действие Соединения I на потерю кальция у овариэктомированных крыс. Потеря кальция обнаружена в моче овариэктомированных крыс от 28 дня до 56 дня. Соединение I значительно уменьшило потерю кальция у овариэктомированных крыс.
Более того, известно, что активность кислой фосфатазы в сыворотке указывает на остеокластогенез (Park et al.(2011) PLOS One Том 6, номер 11, стр,1-8). Активность кислой фосфататзы измерили и указанная активность значительно была повышена у овариэктомированных крыс от 28 дня до 56 дня (Фиг. 3). Тем не менее Соединение I понижало активность кислой фосфатазы в сыворотке овариэктомированных крыс (Фиг. 3), понижение указывает на успешное понижение остеокластогенеза
Фиг. 4 представляет эффект Соединения I на соотношение мРНК экспрессии RANKL/OPG на 68 день в большеберцовой кости крысы. Как было проиллюстрировано, мРНК экспрессия RANKL/OPG была повышена у крыс с развивающимся остеопорозом, тогда как она понижалась при лечении Соединением I; понижение указывает на успешное уменьшение остеокластогенеза.
Как следствие потери костной ткани содержание коллагена уменьшалось. Данное явление наблюдали у овариэктомированных крыс. Соединение I повысило содержание коллагена в метафизе бедренной кости овариэктомированных крыс, свидетельствуя об уменьшении потери массы костной ткани (Фиг. 5).
Фиг. 6 и Фиг. 7 иллюстрируют типичные примеры изображений гистологии костной ткани метафизы бедренной кости. Соединение I понижало потерю костной массы в метафизной части бедренной кости.
* * *
Заголовки включены в данный документ для ссылки и для помощи определения расположения некоторых разделов. Указанные заголовки не предназначены для того, чтобы ограничивать объем концепций, описанных в данном документе, и данные концепции могут быть применимы к другим разделам в пределах объема всего описания. Поэтому, данное изобретение не предназначено для того, чтобы быть ограничено вариантами реализации изобретения, проиллюстрированными в данном документе, но чтобы находиться в соответствии с более широким объемом, согласующимся с принципами и новыми отличительными признаками, изложенными в данном документе.
Единичные формы включают соответствующие формы в множественном числе, если контекст ясно подразумевает обратное.
Если не указано иное, должно быть понятно, что все числа, выражающие количества компонентов, реакционные условия, концентрации, свойства, и т.п. использованные в описании и формуле изобретения, изменяются во всех случаях с термином “около”. В крайнем случае, каждый численный параметр должен быть по меньшей мере истолкован в свете численного значения сообщенных значащих цифр и с применением обычных методов округления. Соответственно, если не указано иного, численные параметры, изложенные в данном описании, и прилагаемая формула изобретения являются приближениями, которые могут варьироваться, в зависимости от того, какие свойства желают получить. Несмотря на то, что численные диапазоны и параметры, изложенные в широком объеме вариантов реализации изобретения, являются приблизительными, изложенные в конкретных примерах, численные значения указаны настолько точно, насколько это возможно. Любое численное значение, тем не менее, неотъемлемо содержит некоторые ошибки, возникшие в результате некоторых вариаций в экспериментах, тестовых измерениях, статистических анализах и т.п.
Понятно, что примеры и варианты реализации изобретения, описанные в данном документе, предназначены только для иллюстративных целей и, учитывая их, разнообразные модификации или изменения будут предложены специалистам в данной области техники и включены в описании данного документа и объеме прилагаемой формулой изобретения.