Результат интеллектуальной деятельности: ЛЕЧЕНИЕ ПИГМЕНТНОЙ ДИСТРОФИИ СЕТЧАТКИ N-АЦЕТИЛЦИСТЕИНАМИДОМ
Вид РИД
Изобретение
Перекрестная ссылка на родственные заявки
[0001] Отсутствует.
ТЕХНИЧЕСКАЯ ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0002] Настоящее изобретение в целом относится к области пигментной дистрофии сетчатки, а конкретнее, к способу лечения пигментной дистрофии сетчатки N-ацетилцистеинамидом (NACA).
БЮЛЛЕТЕНЬ ИССЛЕДОВАНИЯ, ФИНАНСИРУЕМОГО ИЗ ФЕДЕРАЛЬНОГО БЮДЖЕТА
[0003] Отсутствует.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
[0004] Пигментная дистрофия сетчатки (RP) является термином, используемый для генетически гетерогенной группы наследственных дегенераций сетчатки. Полученные данные могут быть ограничены зрением, или данные по зрению могут быть частью синдрома, наиболее распространенным из которых является синдром Ашера, при котором глухота сопровождается заболеванием сетчатки. В каждом расстройстве стимулирующим событием является мутация, которая приводит к гибели фоторецепторов палочек, изначально вызывающей ночную слепоту. Палочки являются основными потребителями кислорода в сетчатке, а потеря палочек вызывает увеличение уровня кислорода в ткани сетчатки. Это активирует NADPH-оксидазу, вызывая накопление супероксидных радикалов в цитозоле, а также увеличивает их образование в митохондриях колбочек. Избыточные супероксидные радикалы подавляют супероксиддисмутазу 1 и 2 (SOD1 и SOD2) и вызывают цепную реакцию, при которой образуются другие свободные радикалы, в том числе некоторые, которые являются еще более разрушительными, чем супероксидные радикалы, такие как гидроксильные радикалы и пероксинитрит. Свободные радикалы воздействовуюти на белки, липиды и ДНК, вызывая специфические модификации, которые указывают на то, что произошло окислительное повреждение. Окислительное повреждение липидов приводит к образованию липидных гидропероксидов, которые разрушаются с образованием 4-гидроксинонененала, малонового диальдегида (MDA) и акролеина. Наиболее распространенной модификацией белков от окислительного повреждения является образование карбонильных аддуктов. Определения этих маркеров окислительного повреждения, таких как MDA или карбонильные аддукты, обеспечивают количественную оценку степени окислительного повреждения, которое произошло в ткани. Эти модификации могут наносить ущерб функции макромолекул, и, несмотря на эндогенные процессы восстановления, они подавляются сильным окислительным стрессом, что приводит к снижению клеточной функции и, в конечном счете, апоптозу. После удаления палочек из фоторецепторного слоя окислительный стресс во внешней сетчатке является сильным и приводит к постепенной смерти колбочковых клеток, обычно начинаясь в средней периферии, где плотность колбочек низкая, а затем распространяется по периферии и постериально. Постериальное распространение гибели колбочек приводит к сужению поля зрения и, в конечном счете, к центральному острову зрения, а его устранение вызывает слепоту.
[0005] Клинические признаки RP включают пигментные изменения в сетчатке, часто вокруг кровеносных сосудов и характеризуются как «пигментация, напоминающая костное тельце», сужение сосудов сетчатки и бледность оптического диска. Спектральная оптическая когерентная томография может демонстрировать истончение сетчатки в областях потери фоторецепторных клеток, и с сегментацией потери наблюдаются во внешнем ядерном слое. Проверка поля зрения показывает сужение поля зрения и электроретинограммы показывают уменьшенные амплитуд a- и b-волн.
[0006] В настоящее время отсутствует утвержденная терапия, которая останавливает развитие болезни или восстанавливает зрение. Терапевтический подход ограничивается замедлением дегенеративного процесса путем защиты от солнечных лучей и добавки витамина А, лечением осложнений (катаракты и отека макулы), а также помогает пациентам справиться с социальным и психологическим воздействием слепоты. Хотя система протезирования Argis II Retinal была одобрена FDA в 2013 году как имплантированное устройство для лечения взрослых с несколькими RP, оно производит только ощущение света, тем самым помогая пациентам определять местоположение или движение предметов и людей; устройство не является модифицированием заболевания. Основываясь на исследованиях с использованием животных моделей, описанных ниже, NACA позволяет лечить RP in vivo.
[0007] Ранее авторы настоящего изобретения обнаружили, что N-ацетилцистеин (NAC), известный тиоловый антиоксидант, уменьшает гибель колбочковых клеток и сохраняет колбочковую функцию в моделях RP. N-ацетил-L-цистеин (NAC) является хорошо известным тиолсодержащим антиоксидантом, который был одобрен FDA в качестве антидота для интоксикации ацетаминофеном и использовался в клинике более 50 лет при показаниях, включая муколитическую терапию при респираторных заболеваниях с чрезмерным и/ или обильным образованием слизи, предупреждение нефротоксичности, индуцированной радиоконтрастностью, лечение геморрагического цистита, вызванного циклофосфамидом, и уменьшение симптомов как шизофрении, так и биполярного заболевания. Эффективность NAC в первую очередь объясняется его способностью восстанавливать внеклеточный цистин до цистеина и в качестве источника сульфгидрильных групп. Однако использование NAC было ограничено несколькими недостатками, главным образом, низким проникновением через мембрану и системной биодоступностью <10% для пероральных композиций. Дисульфидная связь с белками и деацетилирование NAC в слизистой оболочке и просвете кишечника, вероятно, являются самыми существенными факторами низкой биодоступности при пероральном введении NAC.
[0008] Таким образом, по-прежнему существует потребность в новых композициях и способах лечения пигментной дистрофии сетчатки.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0009] В соответствии с вариантом осуществления настоящее изобретение относится к способу лечения пигментной дистрофии сетчатки у животного, который включает введение животному терапевтически эффективного количества N-ацетилцистеинамида (NACA). В одном аспекте NACA предоставляется в фармацевтически приемлемом носителе или с ним. В другом аспекте NACA вводят внутриглазно, субретинентально, интравитреально, перорально, внутривенно, внутримышечно, интрамедуально, интратекально, внутрижелудочно, трансдермально, подкожно, внутрибрюшинно, интраназально, энтерально, топически, сублингвально или ректально. В другом аспекте NACA вводят в суточных дозах от примерно 0,5 до 150 мг/ кг. В другом аспекте NACA вводят два или три раза в день. В другом аспекте NACA вводят со вторым активным агентом, выбранным из, по меньшей мере, одного из аскорбиновой кислоты, гидрохлорида цистеина, бисульфата натрия, метабисульфита натрия, сульфита натрия, аскорбилпальмитата, бутилированного гидроксианизола (BHA), бутилированного гидрокситуена (BHT), лецитина, пропилгаллата, α-токоферола, лимонной кислоты, этилендиаминтетрауксусной кислоты (ЭДТК), сорбита, винной кислоты или фосфорной кислоты. В другом аспекте доза для введения составляет 100, 150, 150, 300, 333, 400, 500, 600, 700, 750, 800, 900, 1000, 2500, 5000, 7500 или 10000 мг на дозу. В другом аспекте доза для введения составляет 0,1-0,25, 0,1-0,4, 0,35-0,5, 0,5-1, 1-2, 1-3, 1-4, 1-5, 1-2,5, 2,5-3,5, 4-6, 5-8, 6-9, 7-10 г на дозу. В другом аспекте NACA доставляется перорально посредством мини-таблетки, капсулы, таблетки, шипучего напитка, двойного высвобождения, смешанного высвобождения, саше, порошка или жидкости. В другом аспекте NACA вводят профилактически для предупреждения пигментной дистрофии сетчатки. В другом аспекте животное является человеком.
[0010] В соответствии с другим вариантом осуществления настоящее изобретение включает способ лечения пигментной дистрофии сетчатки, включающий: идентификацию человека, нуждающегося в лечении пигментной дистрофии сетчатки; и введение человеку терапевтически эффективного количества N-ацетилцистеинамида (NACA), достаточного для лечения пигментной дистрофии сетчатки. В одном аспекте NACA предоставляется в или с фармацевтически приемлемым носителем. В другом аспекте NACA вводят внутриглазно, субретинентально, интравитреально, перорально, внутривенно, внутримышечно, интрамедуально, интратекально, внутрижелудочно, трансдермально, подкожно, внутрибрюшинно, интраназально, энтерально, топически, сублингвально или ректально. В другом аспекте NACA вводят в суточных дозах от примерно 0,5 до 150 мг/ кг. В другом аспекте NACA вводят два или три раза в день. В другом аспекте NACA вводят со вторым активным средством, выбранным из, по меньшей мере, одного из аскорбиновой кислоты, гидрохлорида цистеина, бисульфата натрия, метабисульфита натрия, сульфита натрия, аскорбилпальмитата, бутилированного гидроксианизола (BHA), бутилированного гидрокситуена (BHT), лецитина, пропилгаллата, α-токоферола, лимонной кислоты, этилендиаминтетрауксусной кислоты (ЭДТК), сорбита, винной кислоты или фосфорной кислоты. В другом аспекте доза для введения составляет 100, 150, 150, 300, 333, 400, 500, 600, 700, 750, 800, 900, 1000, 2500, 5000, 7500 или 10000 мг на дозу. В другом аспекте, доза для введения составляет 0,1-0,25, 0,1-0,4, 0,35-0,5, 0,5-1, 1-2, 1-3, 1-4, 1-5, 1-2,5, 2,5-3,5, 4-6, 5-8, 6-9, 7-10 г на дозу. В другом аспекте NACA доставляется перорально посредством мини-таблетки, капсулы, таблетки, газированного напитка, двойного высвобождения, смешанного высвобождения, саше, порошка или жидкости. В другом аспекте NACA вводят профилактически для предупреждения пигментной дистрофии сетчатки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0011] Для более полного понимания особенностей и преимуществ настоящего изобретения далее предлагается подробное описание изобретения вместе с сопроводительными чертежами, в которых:
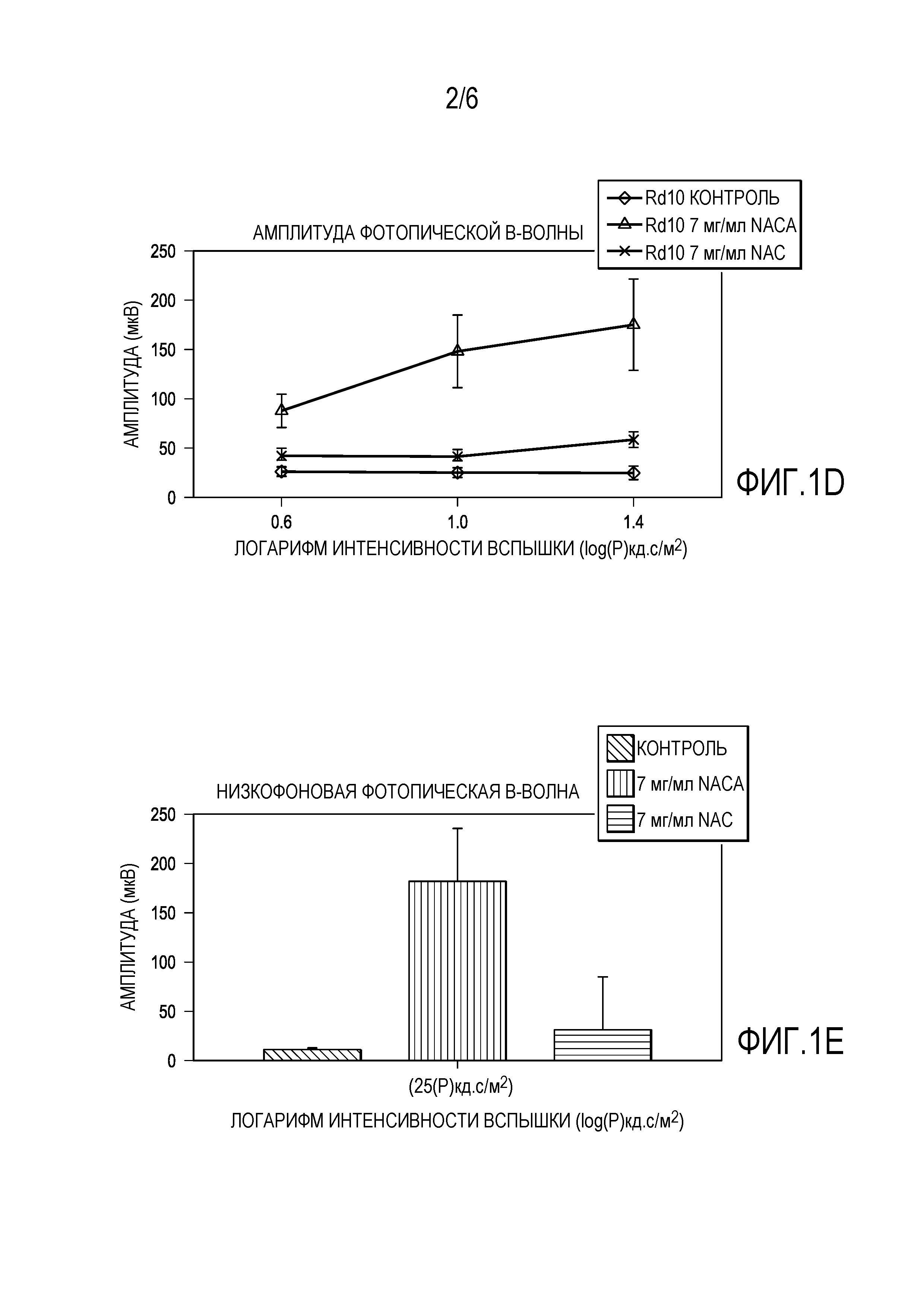
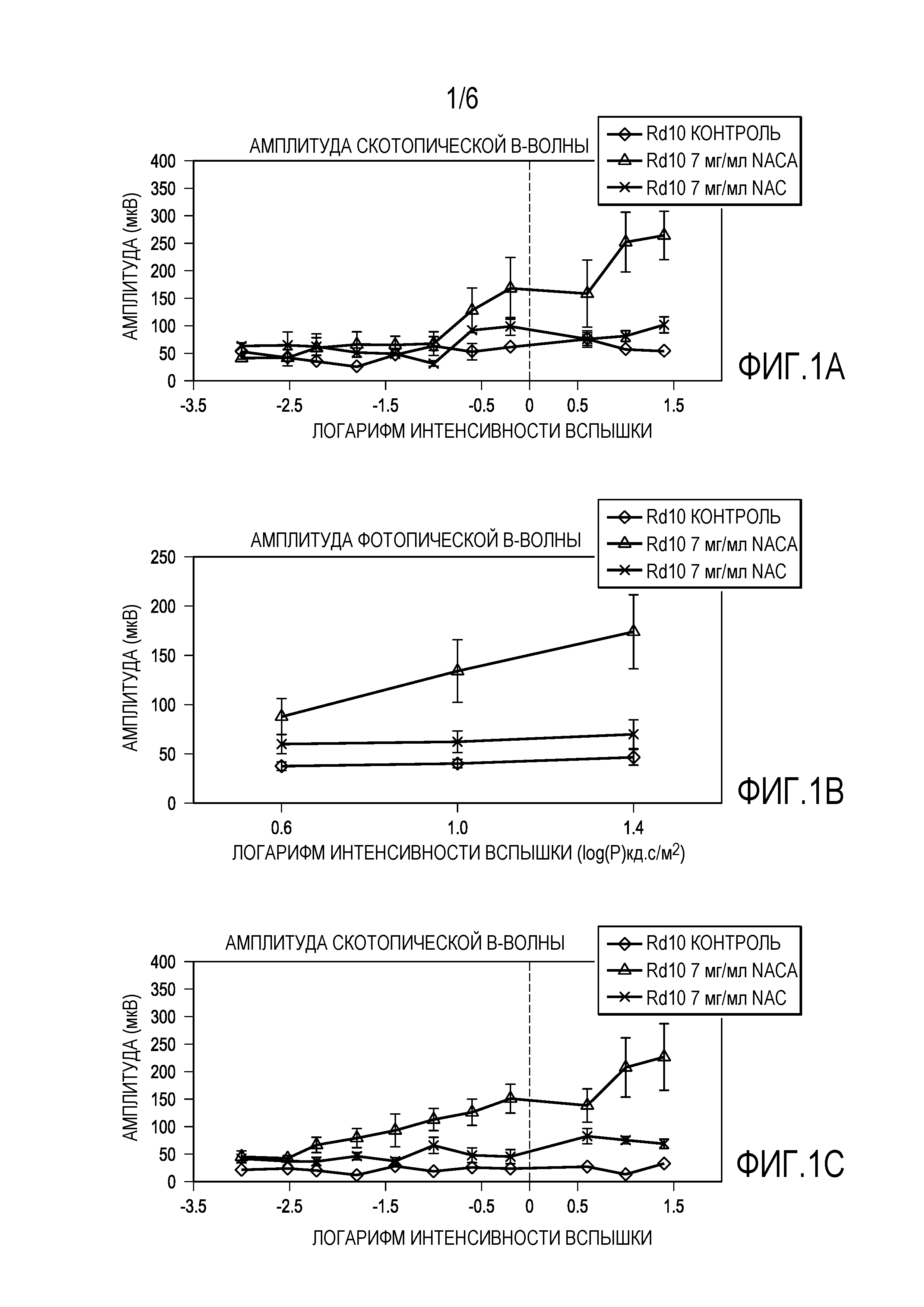
[0012] Фигуры 1A-IE представляют собой графики, которые показывают, что 7 мг/мл NACA обеспечивает лучшие эффекты, чем 7 мг/мл NAC для защиты функции сетчатки.
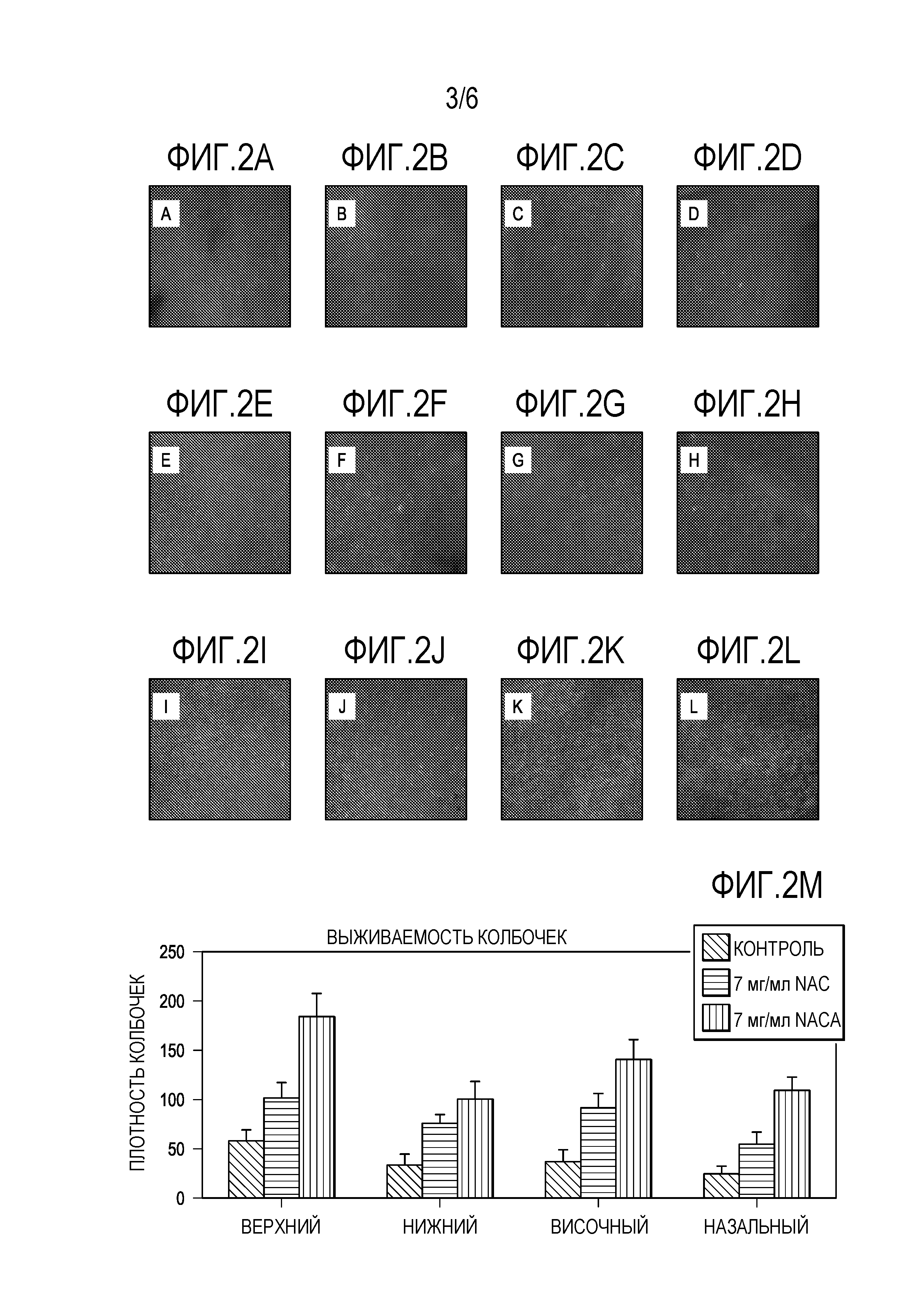
[0013] На фигурах 2A-2L представлены микрофотографии, которые показывают, что 7 мг/мл NACA обеспечивает лучшие эффекты, чем 7 мг/мл NAC для защиты выживаемости колбочковых клеток сетчатки. Фигура 2M представляет собой график, показывающий выживаемость колбочковых клеток сетчатки.
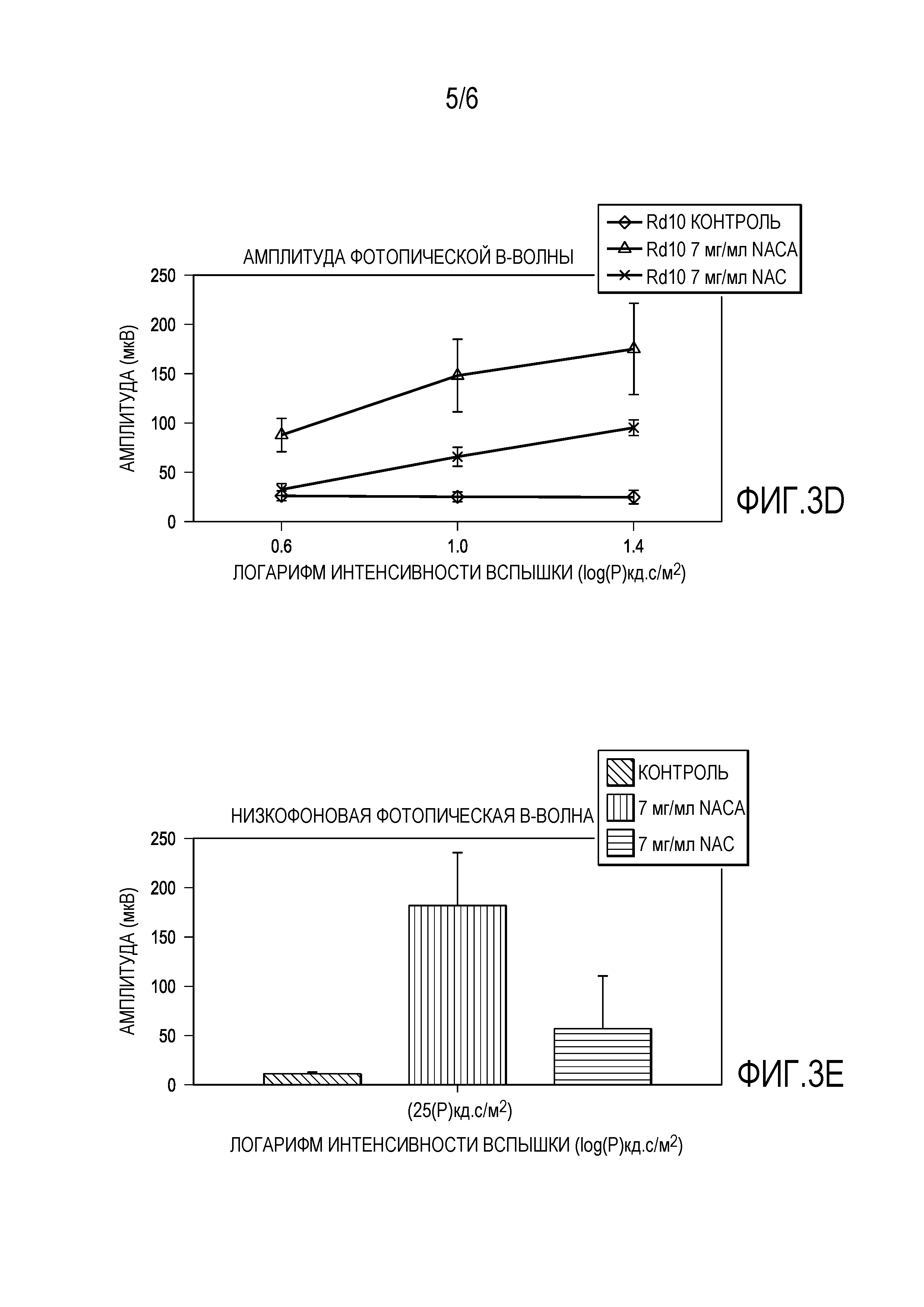
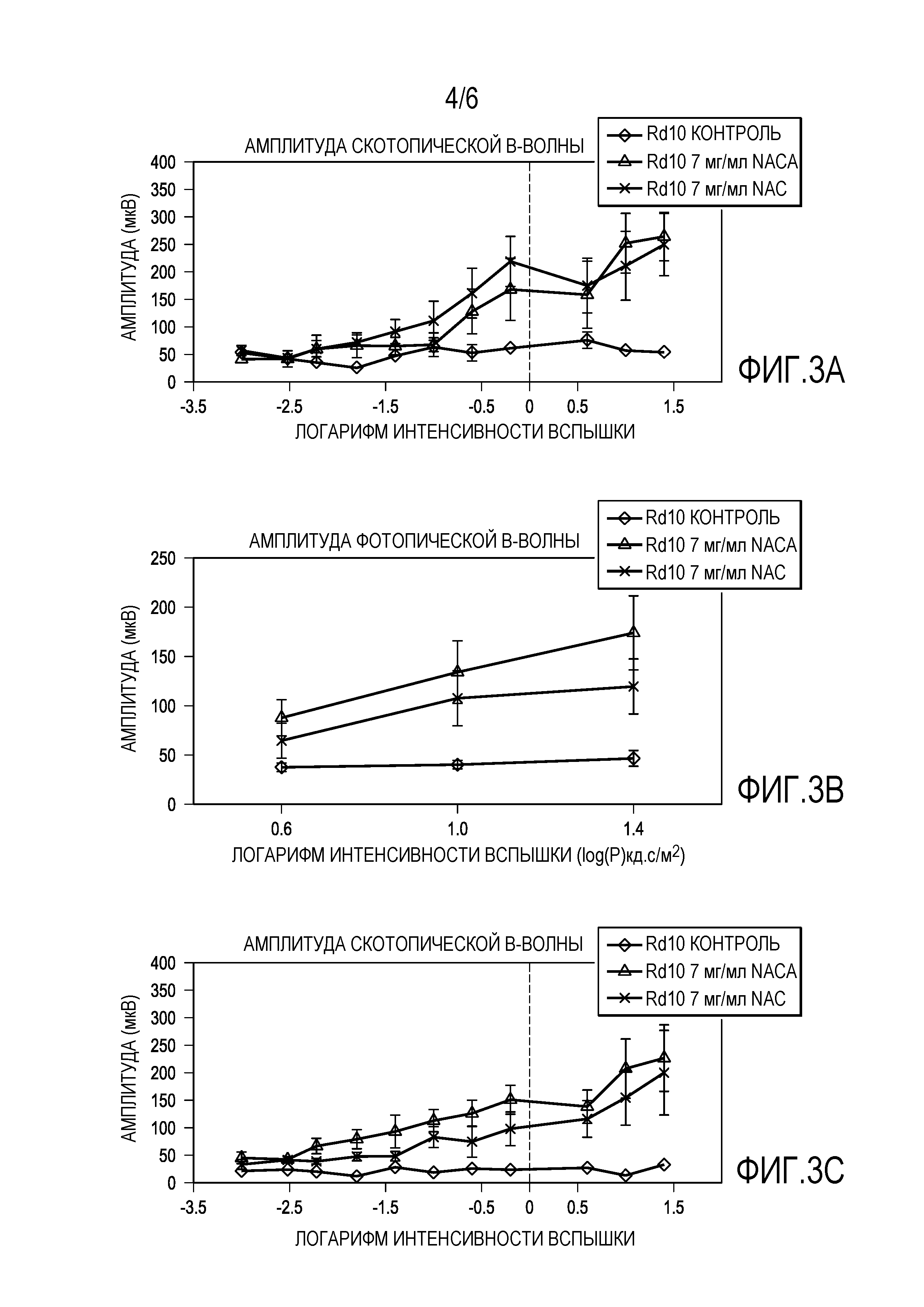
[0014] На фигурах 3A-3E представлены графики, которые показывают, что 7 мг/мл NACA обеспечивает лучшие эффекты для защиты функции сетчатки, чем 20 мг/мл NAC.
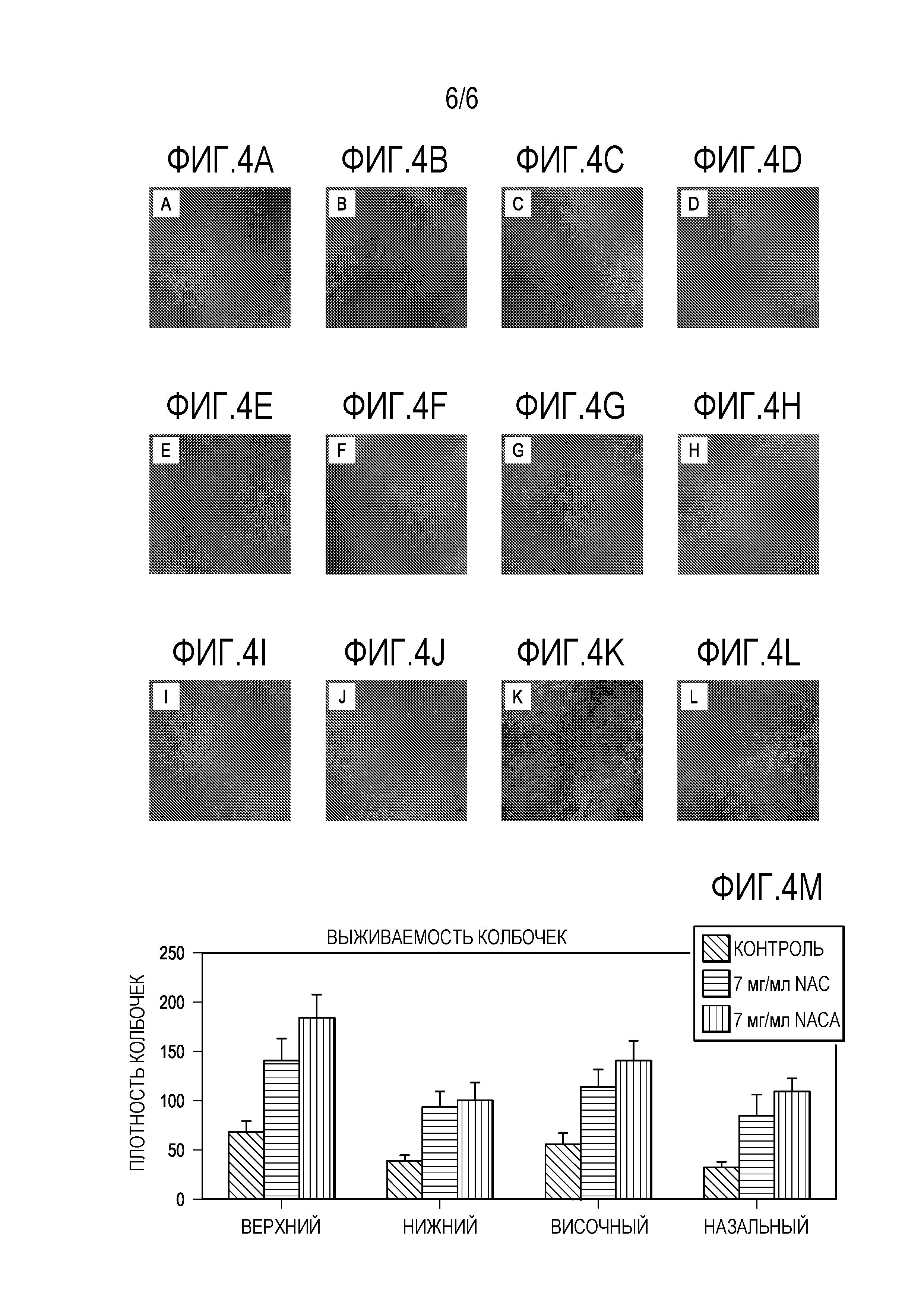
[0015] На фигурах 4A-4L представлены микрофотографии, которые показывают, что 7 мг/мл NACA обладает лучшим эффектом для защиты выживаемости колбочковых клеток, чем 20 мг/мл NAC. Фигура 4M представляет собой график, показывающий колбочковую выживаемость.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0016] Несмотря на то, что изготовление и применение различных вариантов осуществления настоящего изобретения подробно обсуждается ниже, следует понимать, что настоящее изобретение предоставляет множество применимых изобретательских концепций, которые могут быть воплощены в широком спектре конкретных контекстов. Конкретные варианты осуществления, обсуждаемые в настоящем описании, просто иллюстрируют специфические способы создания и применения изобретения и не ограничивают объем изобретения.
[0017] Пигментная дистрофия сетчатки («RP») содержит большую группу наследственных нарушений зрения, которые вызывают прогрессирующую потерю фоторецепторных клеток сетчатки, что приводит к серьезному ухудшению зрения и часто к неизлечимой слепоте. Наиболее распространенной формой RP является палочко-колбочковая дистрофия, при которой первым симптомом является ночная слепота, сопровождаемая прогрессирующей потерей периферического зрительного поля при дневном свете и в конечном итоге приводящая к слепоте через несколько десятилетий. В качестве общей патологии, фоторецепторы палочек погибают раньше, тогда как не чувствительные к свету, морфологически измененные фоторецепторы колбочек сохраняются дольше.
[0018] N-ацетил-L-цистеинамид (NACA), также известный как (R)-2-(ацетиламино)-3-меркаптопропанамид, N-ацетил-L-цистеинамид или ацетилцистеинамид, имеет структуру:
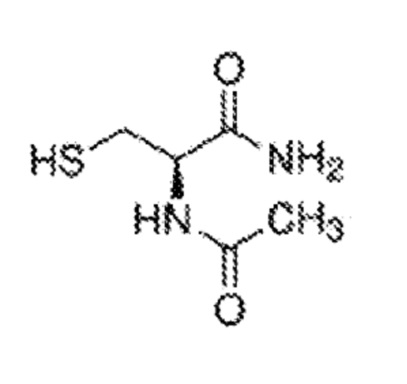
[0019] N-ацетилцистеин-амид (NACA), амидная форма N-ацетил-L-цистеина (NAC), действует как носитель NAC.
[0020] В настоящее время отсутствует одобренная терапия, которая останавливает развитие болезни или восстанавливает зрение. Терапевтический подход ограничивается замедлением дегенеративного процесса путем защиты от солнечных лучей и добавления витамина А, лечения осложнений (катаракты и отека макулы) и оказания помощи пациентам в борьбе с социальным и психологическим воздействием слепоты. Несмотря на то, что система протезирования Argis II Retinal была одобрена FDA в 2013 году в качестве имплантированного устройства для лечения взрослых с тяжелой RP, она лишь продуцирует ощущение света, тем самым помогая пациентам определять местоположение или движение предметов и людей; устройство не является модифицированием заболевания. На основании исследований на животных моделях, описанных ниже, NACA способен лечить RP in vivo.
[0021] Глютатион (GSH) представляет собой трипептид, c-L-глутамил-L-цистеинилглицин, обнаруженный во всех тканях млекопитающих. Он имеет несколько важных функций, включая детоксикацию электрофилов, очистку ROS, поддержание тиолового статуса белков и регенерацию восстановленных форм витаминов С и Е. GSH является доминирующим небелковым тиолом в клетках млекопитающих; поэтому он необходим для поддержания внутриклеточного редокс-баланса и существенного тиольного статуса белков. Кроме того, он необходим для функции некоторых антиоксидантных ферментов, таких как глутатионпероксидазы.
[0022] Уровни внутриклеточного GSH определяются балансом между продуцированием и потерей. Продуцирование является результатом синтеза de novo и регенерации GSH из GSSG GSSG-редуктазой. Как правило, системе GSSG-редуктазы обладает достаточной способностью для поддержания всего внутриклеточного GSH в восстановленном состоянии, поэтому за счет активизации этого пути можно получить немного. Основным источником потери внутриклеточного GSH является транспортировка из клеток. Внутриклеточные уровни GSH варьируют от 1 до 8 мМ, а внеклеточные уровни составляют всего несколько мкМ; этот большой градиент концентрации в существенной степени препятствует переносу GSH в клетки, а как только он транспортируется из клеток, он быстро разлагается γ-глутамилтранспептидазой. Ингибирование GSH-транспортеров теоретически может повысить уровень внутриклеточного GSH, однако это потенциально проблематично, поскольку транспортеры не являются специфичными для GSH, и их подавление может привести к дисбалансу других аминокислот и пептидов. Таким образом, внутриклеточные уровни GSH модулируются в основном изменениями синтеза.
[0023] GSH синтезируется в цитозоле практически всех клеток в результате двух требующих АТФ ферментативных стадий: L-глутамат+L-цистеин+АТФ → γ-глутамил-L-цистеин+AДФ+Pi и γ-глутамил-L-цистеин+L-глицин+АТФ → GSH+AДФ+Pi. Первая реакция является скорость-ограничивающей и катализируется глутаматцистеинлигазой (GCL, EC 6.3.2.2). GCL состоит из тяжелой каталитической субъединицы 73Kd (GCLC) и 30Kd модифицирующей субъединицы (GCLM), которые кодируются различными генами. GCCL регулируется неаллостерическим конкурентным ингибированием GSH (Ki=2,3 мМ) и наличием L-цистеина. Наблюдаемая Km GLC для глутамата составляет 1,8 мМ, а концентрация внутриклеточного глутамата примерно в 10 раз выше, так что глутамат не является ограничивающим, но Km для цистеина составляет 0,1-0,3 мМ, что приближается к его внутриклеточной концентрации. Вторая реакция катализируется GSH-синтазой (GS, EC 6.3.2.3), которая составляет 118 кД и состоит из двух идентичных субъединиц. Хотя GS не считается важным в регуляции синтеза GSH в нормальных условиях, он может играть роль в стрессовых условиях, поскольку в ответ на хирургическую травму уровни GSH и активность GS снижались, а активность GCL не изменялась. Кроме того, по сравнению с повышенной экспрессией только GCLC, повышенная экспрессия как GCLC, так и GS приводила к более высоким уровням GSH. Для того, чтобы максимально увеличить эффекты увеличения синтетических ферментов, необходимо обеспечить повышенный уровень цистеина. В культивируемых нейронах 90% поглощения цистеина происходит через натриево-зависимую возбуждающую систему транспорта аминокислот (EAAT). Существует пять EAAT, и поглощение цистеина нейронами происходит преимущественно с помощью EAAT3, более известного как возбуждающий аминокислотный носитель-1 (EAAC1). При нормальных условиях большая часть EAAC1 находится в ER и только транслоцируется на плазматическую мембрану при активации. Эта транслокация отрицательно регулируется связанным с глутамат-транспортером белком 3-18 (GTRAP3-18), и подавление GTRAP3-18 увеличивает уровни GSH в нейронах. Таким образом, интернализация цистеина создает препятствие для синтеза GSH, но, к счастью, его можно обойти при помощи N-ацетилцистеина (NAC), который легко проникает в клетки даже в отсутствие активированного EAAC1. Системное введение NAC получает доступ к ЦНС, повышает уровень GSH и обеспечивает преимущества при нейродегенеративных нарушениях, при которых окислительный стресс является важной частью патогенеза. Авторы настоящего изобретения продемонстрировали, что перорально вводимый NAC способствует долговременной выживаемости колбочек в модели RP.
[0024] Все клеточные компартменты должны быть защищены от окислительного повреждения, включая цитоплазму, митохондрии и ядро. Авторы настоящего изобретения ранее осуществили перенос генов ферментов, которые детоксифицируют реакционноспособные виды кислорода, однако для этого подхода требуется экспрессия двух ферментов в цитоплазме и двух ферментов в митохондриях. Напротив, настоящее изобретение обеспечивает защиту всех клеточных компартментов с экспрессией только двух ферментов в цитозоле, поскольку GSH способен диффундировать повсеместно в клетках.
[0025] NAC используется для лечения передозировки ацетаминофена в дозе 140 мг/ кг в качестве нагрузочной дозы, затем 17 доз по 70 мг/ кг каждые 4 часа, начиная с 4 часов после нагрузочной дозы. В клинических исследованиях NAC вводили перорально от 400 до 1000 мг один раз в день и от 200 до 600 мг три раза в день. Однако после пероральной дозы 600 мг у людей NAC быстро абсорбируется, а затем быстро выводится. Сообщалось, что период полураспада в плазме для NAC составляет 2,5 часа, и NAC не детектировался через 10-12 часов после введения. Во время абсорбции NAC быстро метаболизируется в цистеин, который является прямым предшественником глутатиона. Исходя из этих свидетельств, в том числе, что NACA является предшественником и/ или носителем для NAC, ожидалось, что NACA будет действовать аналогично NAC in vivo. Однако авторы настоящего изобретения демонстрируют, что NACA действует совсем иначе, чем NAC для лечения RP.
[0026] В соответствии с одним из вариантов осуществления настоящее изобретение относится к способу предупреждения, улучшения состояния или лечения заболевания или состояния, связанного с окислительным стрессом у пациента, включающему введение терапевтически эффективного количества NACA, для увеличения количества глутатиона, экспрессируемого в тканях пациента.
[0027] Используемый в настоящем описании термин «активные формы кислорода» или «реакционноспособные формы кислорода» понимается как перенос одного или двух электронов продуцирует супероксид, анион в форме O2ʺ или перекисные анионы, имеющие формулу O22-ʺ или соединения, содержащие одинарную связь O-O, например пероксиды водорода и пероксиды липидов. Такие супероксиды и пероксиды являются высокореактивными и могут вызывать повреждение клеточных компонентов, включая белки, нуклеиновые кислоты и липиды.
[0028] Под «средством» в настоящем описании понимается включение терапевтически активного соединения или потенциально терапевтически активного соединения, например антиоксиданта. Агент может быть ранее известным или неизвестным соединением. Используемый в настоящем описании средство обычно представляет собой неклеточное соединение, однако средство может включать биологическое терапевтическое средство, например, терапевтический пептид или нуклеиновую кислоту, например, миРНК, shRNA, цитокин, антитело и т. д.
[0029] Используемый в настоящем описании термин «улучшение состояния» или «лечение» понимается как означающий ослабление или уменьшение, по меньшей мере, одного признака, симптома, показания или эффекта конкретного заболевания или состояния. Например, улучшение состояния или лечение пигментной дистрофии сетчатки (RP) может заключаться в уменьшении, задержке или устранении одного или нескольких признаков или симптомов RP, включая, в качестве неограничивающих примеров, снижение ночного видения, снижение общей остроты зрения, уменьшение в поле зрения, уменьшение плотности колбочек в одном или более квадрантах сетчатки, истончение сетчатки, особенно внешнего ядерного слоя, уменьшение амплитуд a- или b-волн на скотопических или фотопических электроретинограммах (ERG) или любых других клинически приемлемых показателей состояния или прогрессирования болезни. Для улучшения состояния и лечения может потребоваться введение более одной дозы средства либо отдельно, либо в сочетании с другими терапевтическими средствами и вмешательствами. При улучшении состояния или лечении не требуется, чтобы болезнь или состояние были вылечены.
[0030] Под «антиоксидантом», как используется в настоящем описании, понимается молекула, способная к замедлению или предотвращению окисления других молекул. Окисление представляет собой химическую реакцию, которая переносит электроны с вещества на оксидант. Такие реакции могут стимулироваться супероксидными анионами или пероксидами или продуцировать супероксидные анионы или пероксиды. Реакции окисления могут образовывать свободные радикалы, которые начинают цепную реакцию, которая повреждает клетки. Антиоксиданты прекращают эти цепные реакции путем удаления свободных радикалов и ингибируют другие реакции окисления, окисляясь сами. В результате антиоксиданты часто представляют собой восстанавливающие средства, такие как тиолы, аскорбиновая кислота или полифенолы. Антиоксиданты включают, в качестве неограничивающих примеров, α-токоферол, аскорбиновую кислоту, Mn(III)тетракис (4-бензойной кислоты) порфирин, α-липоевую кислоту и n-ацетилцистеин.
[0031] Под «совместным введением», как используется в настоящем описании, понимается введение одного или нескольких средств пациенту, так что средства присутствуют одновременно и активны у пациента. Совместное введение не требует подготовки смеси средств или одновременного введения средств.
[0032] Термины «эффективное количество» или «эффективные дозы» относятся к количеству средства, требуемого для получения предполагаемых фармакологических, терапевтических или профилактических результатов. Фармакологически эффективное количество приводит к ослаблению одного или нескольких признаков или симптомов заболевания или состояния или развития заболевания или состояний или приводит к регрессии заболевания или состояния. Например, терапевтически эффективное количество предпочтительно относится к количеству терапевтического средства, которое уменьшает потерю ночного видения, потерю общей остроты зрения, потерю зрительного поля, по меньшей мере, на 10%, по меньшей мере, на 15%, по меньшей мере, на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или более по сравнению с непрошедшим лечение контрольным пациентом в течение определенного периода времени, например, 2 недели, один месяц, 2 месяца, 3 месяца, 6 месяцев, один год, 2 года, 5 лет или дольше. Для обеспечения эффективной дозы может потребоваться более одной дозы.
[0033] Используемые в настоящем описании термины «эффективная» и «эффективность» включают как фармакологическую эффективность, так и физиологическую безопасность. Фармакологическая эффективность относится к способности лечения приводить к желаемому биологическому эффекту у пациента. Физиологическая безопасность относится к уровню токсичности или другим неблагоприятным физиологическим эффектам на клеточном, органном и/ или организменном уровне (часто называемым побочными эффектами) в результате проведения лечения. С другой стороны, термин «неэффективный» указывает на то, что лечение не обеспечивает достаточный фармакологический эффект, чтобы быть терапевтически полезным даже при отсутствии вредных эффектов, по меньшей мере, у нестратифицированной популяции. (Например, лечение может быть неэффективным в подгруппе, которая может быть идентифицирована профилем или профилями экспрессии). «Менее эффективный» означает, что лечение приводит к терапевтически значимому более низкому уровню фармакологической эффективности и/ или терапевтически более высокому уровню неблагоприятных физиологических эффектов, например, к большей токсичности в печени.
[0034] Таким образом, в связи с введением лекарственного средства лекарство, которое является «эффективным в отношении» заболевания или состояния, указывает на то, что введение клинически приемлемым образом приводит к благоприятному эффекту, по меньшей мере, для статистически значимой части пациентов, например, к улучшению симптомов, излечению, уменьшению признаков или симптомов заболевания, продленю жизни, улучшению качества жизни или других эффектов, которые обычно признаются позитивными врачами, знакомыми с лечением определенного типа заболевания или состояния.
[0035] «Глазные нарушения, связанные с оксидативным стрессом», используемые в настоящем описании, включают, но не ограничиваются этим, пигментную дистрофию сетчатки, дегенерацию желтого пятна, включая возрастную дегенерацию желтого пятна (AMD), как влажную, так и сухую, диабетическую ретинопатию, оптическую невропатию Lebers и неврит зрительного нерва.
[0036] «Пероксидазы» или «фермент, метаболизирующий пероксид» представляют собой большое семейство ферментов, которые обычно катализируют реакцию вида:
[0034] ROOR1+донор электронов (2 e-)+2H+ → ROH+R1OH. Для многих из этих ферментов оптимальным субстратом является перекись водорода, где каждый R представляет собой H, а другие более активны с органическими гидропероксидами, такими как пероксиды липидов. Пероксидазы могут содержать гем-кофактор в своих активных участках или остатки редоксактивного цистеина или селеноцистеина.
[0038] Выражение «фармацевтически приемлемый носитель» признано в рассматриваемой области и включает фармацевтически приемлемый материал, композицию или носитель, подходящий для введения соединений по настоящему изобретению млекопитающим. Носители включают жидкий или твердый наполнитель, разбавитель, эксципиент, растворитель или инкапсулирующий материал, предназначенный для переноса или транспортировки рассматриваемого средства из одного органа или части тела в другой орган или часть тела. Каждый носитель должен быть «приемлемым» в смысле совместимости с другими ингредиентами состава и не причинять вреда пациенту. Например, фармацевтически приемлемые носители для введения клеток обычно представляют собой носитель, приемлемый для доставки путем инъекции, и не включают такие средства, как детергенты или другие соединения, которые могут повредить клетки, подлежащие доставке. Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают: сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлоза и ее производные, такие как натрийкарбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; порошкообразный трагакант; солод; желатин; тальк; эксципиенты, такие как масло какао и суппозиторные воски; масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферные вещества, такие как гидроксид магния и гидроксид алюминия; альгиновая кислота; не содержащая пирогенов вода; изотонический физиологический раствор; раствор Рингера; этиловый спирт; фосфатные буферные растворы и другие нетоксичные совместимые вещества, используемые в фармацевтических препаратах, в частности забуференные фосфатом солевые растворы, которые являются предпочтительными для внутриглазной доставки.
[0039] В композициях также могут присутствовать смачивающие вещества, эмульгаторы и смазывающие вещества, такие как лаурилсульфат натрия и стеарат магния, а также красящие вещества, средства высвобождения, покрывающие средства, подслащивающие, ароматизирующие и отдушивающие средства, консерванты и антиоксиданты.
[0040] Примеры фармацевтически приемлемых антиоксидантов включают: водорастворимые антиоксиданты, такие как аскорбиновая кислота, гидрохлорид цистеина, бисульфат натрия, метабисульфит натрия, сульфит натрия и тому подобное; маслорастворимые антиоксиданты, такие как аскорбилпальмитат, бутилированный гидроксианизол (BHA), бутилированный гидрокситолуол (BHT), лецитин, пропилгаллат, α-токоферол и т.п.; металл-хелатообразующие средства, такие как лимонная кислота, этилендиаминтетрауксусная кислота (ЭДТК), сорбит, винная кислота, фосфорная кислота и тому подобное.
[0041] Составы по настоящему изобретению включают соединения, подходящие для перорального, назального, местного, трансдермального, буккального, подъязычного, внутримышечного, внутричерепного, внутриглазного, внутривитового, субретинального и/ или других способов парентерального введения. Конкретный способ введения будет зависеть, в частности, от конкретной клетки-мишени. Составы могут быть удобно представлены в стандартной дозированной форме и могут быть получены любыми способами, известными в области фармации. Количество активного ингредиента, которое можно комбинировать с материалом-носителем для получения отдельной лекарственной формы, обычно является таким количеством соединения, которое дает терапевтический эффект.
[0042] Используемый в настоящем описании термин «множество» понимается как более чем один. Например, множество относится к, по меньшей мере, двум, трем, четырем, пяти или более.
[0043] Под «полипептидом» или «пептидом», как используется в настоящем описании, понимается две или более независимо выбранных природных или неприродных аминокислоты, соединенных ковалентной связью (например, пептидной связью). Пептид может включать 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более природных или ненатуральных аминокислот, соединенных пептидными связями. Полипептиды, как описано в настоящем описании, включают полноразмерные белки (например, полностью процессированные белки), а также более короткие аминокислотные последовательности (например, фрагменты встречающихся в природе белков или синтетические полипептидные фрагменты).
[0044] Используемый в настоящем описании термин «предупреждение» понимают как ограничение, снижение скорости или степени проявления или ингибирование развития, по меньшей мере, одного признака или симптома заболевания или состояния, особенно у пациента, склонного к развитию заболевания или расстройства. Например, у пациента, имеющего мутацию в гене, таком как ген опсина, скорее всего, разовьется RP. Возраст возникновения одного или нескольких симптомов заболевания иногда может определяться конкретной мутацией. Предупреждение может включать задержку возникновения одного или нескольких признаков или симптомов RP и необязательно предотвращать появление, по меньшей мере, одного признака или симптома заболевания на протяжении всей жизни пациента. Предупреждение может потребовать введения более чем одного вещества или терапевтического средства.
[0045] Под «малой молекулой», как используется в настоящем описании, понимают соединение, обычно органическое соединение, имеющее молекулярную массу не более чем примерно 1500 Да, 1000 Да, 750 Да или 500 Да. В одном варианте осуществления малая молекула не включает полипептид или нуклеиновую кислоту, включающие только природные аминокислоты и/ или нуклеотиды.
[0046] «Пациент», используемый в настоящем описании, относится к живым организмам. В некоторых вариантах осуществления живой организм является животным, в определенных предпочтительных вариантах осуществления пациент является млекопитающим, в определенных вариантах осуществления пациент является одомашненным млекопитающим или приматом, в том числе приматом, не являющимся человеком. Примеры пациентов включают людей, обезьян, собак, кошек, мышей, крыс, коров, лошадей, коз и овец. Человеческий индивидуум может также упоминаться как пациент.
[0047] Пациент, «страдающий от или подозреваемый в страданиях от» конкретного заболевания, состояния или синдрома, имеет достаточное количество факторов риска или представляет достаточное количество или комбинацию признаков или симптомов заболевания, состояния или синдрома, так что специалист диагностирует или выскажет предположение, что субъект страдает от болезни, состояния или синдрома. Способы идентификации пациентов, страдающих или подозреваемых в том, что они страдают от таких состояний, как RP и возрастная дегенерация желтого пятна (AMD), находятся в пределах возможностей специалистов в данной области. Пациенты, страдающие от и подозреваемые в страданиях от конкретного заболевания, состояния или синдрома, необязательно представляют собой две различные группы.
[0048] Используемый в настоящем описании термин «супероксиддисмутаза» понимается как фермент, который приводит к дисмутации супероксида в кислород и пероксид водорода. Неограничивающие примеры включают SOD1, SOD2 и SOD3. SOD1 и SOD3 представляют собой две изоформы Cu-Zn-содержащих ферментов супероксиддисмутазы, которые существует у млекопитающих. Cu-Zn-SOD или SOD1 обнаружен во внутриклеточном пространстве, а внеклеточный SOD (ECSOD или SOD3) преимущественно содержится во внеклеточном матриксе большинства тканей.
[0049] «Терапевтически эффективное количество», как используется в настоящем описании, относится к количеству средства, которое является эффективным при однократном или множественном введении в клетку или пациента при продлении выживаемости пациента с таким расстройством, уменьшении одного или нескольких признаков или симптомов расстройства, предотвращения или отсрочки и тому подобного, которые ожидаются в отсутствие такого лечения.
[0050] Средство или другое терапевтическое вмешательство можно вводить пациенту либо отдельно, либо в сочетании с одним или несколькими дополнительными терапевтическими средствами или вмешательствами в качестве фармацевтической композиции в смеси с обычным эксципиентом, например, с фармацевтически приемлемым носителем или терапевтическим лечением.
[0051] Фармацевтические средства можно удобно вводить в виде единичной лекарственной формы, и они могут быть получены любым из способов, хорошо известных в области фармацевтики, например, как описано в Remington's Pharmaceutical Sciences (Mack Pub. Co., Easton, PA, 1985). Составы для парентерального введения могут содержать как обычные эксципиенты, такие как стерильная вода или физиологический раствор, полиалкиленгликоли, такие как полиэтиленгликоль, масла растительного происхождения, гидрированные нафталины и тому подобное. В частности, биосовместимый, биоразлагаемый лактидный полимер, лактидно/ гликолидный сополимер или полиоксиэтилен-полиоксипропиленовые сополимеры могут быть полезными эксципиентами для контроля высвобождения определенных веществ.
[0052] Настоящее изобретение направлено на использование NACA для лечения RP. В одном варианте осуществления настоящее изобретение относится к способу лечения пигментной дистрофии сетчатки у людей, который включает введение человеку терапевтически эффективного количества NACA. В некоторых вариантах осуществления NACA предоставляется в или с фармацевтически приемлемым носителем. В других вариантах осуществления NACA вводят внутриглазно, субретинентально, интравитреально, перорально, внутривенно, внутримышечно, интрамедуально, интратекально, внутрижелудочно, трансдермально, подкожно, внутрибрюшинно, интраназально, энтерально, местно, сублингвально или ректально.
[0053] Понятно, что фактические предпочтительные количества активных соединений, используемых в данной терапии, будут варьировать в зависимости, например, от конкретного используемого соединения, конкретной составленной композиции, способа введения и характеристик пациента, например вида, пола, массы, общего состояния здоровья и возраста пациента. Оптимальные скорости введения для данного протокола введения могут быть легко определены специалистами в данной области с использованием обычных тестов определения дозы, проводимых с учетом вышеприведенных рекомендаций.
[0054] Представленные в настоящем описании диапазоны понимаются как сокращенные для каждого из значений в пределах диапазона.
[0055] Как используется в настоящем описании, варианты осуществления настоящего изобретения определены как включающие его фармацевтически приемлемые производные. «Фармацевтически приемлемое производное» означает любую фармацевтическую соль, сложный эфир, соль сложного эфира или другое производное соединения по настоящему изобретению, которое после введения реципиенту способно обеспечивать (прямо или косвенно) соединение по настоящему изобретению. Особенно предпочтительными производными являются те, которые увеличивают биодоступность соединений по настоящему изобретению, когда такие соединения вводят млекопитающему (например, предоставляя возможность перорально вводимому соединению более легко абсорбировать в крови, повышать стабильность сыворотки или снижать скорость выведения соединения) или которые улучшают доставку исходного соединения в биологический компартмент (например, мозг или лимфатическую систему) относительно родительских видов. Производные включают производные, где группа, которая усиливает растворимость в воде или активный перенос через мембрану кишечника, добавляется к структуре формул, описанных в настоящем описании.
[0056] Варианты осуществления настоящего изобретения могут быть модифицированы путем добавления соответствующих функциональных возможностей для повышения селективных биологических свойств. Такие модификации известны в данной области и включают модификации, которые увеличивают биологическое проникновение в данный биологический компартмент (например, кровь, лимфатическую систему, центральную нервную систему), повышают пероральную доступность, повышают растворимость для предоставления возможности введения путем инъекции, изменяют метаболизм и изменяют скорость экскреции. Фармацевтически приемлемые соли соединений по настоящему изобретению включают соединения, полученные из фармацевтически приемлемых неорганических и органических кислот и оснований. Примеры подходящих кислотных солей включают ацетат, адипат, бензоат, бензолсульфонат, бутират, цитрат, диглюконат, додецилсульфат, формиат, фумарат, гликолят, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидроиодид, лактат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, пальмоат, фосфат, пикрат, пивалат, пропионат, салицилат, сукцинат, сульфат, тартрат, тозилат и ундеконаноат. Соли, полученные из соответствующих оснований, включают соли щелочных металлов (например, натрия), щелочноземельных металлов (например, магния), аммония и N-(алкила)4+. Данное изобретение также предусматривает кватернизацию любых основных азотсодержащих групп соединений, описанных в настоящем описании. Такая кватернизация может быть получена водорастворимыми или диспергируемыми продуктами.
[0057] Варианты осуществления изобретения можно, например, вводить путем инъекции, внутриглазно, интравитреально, субретинально, внутривенно, внутриартериально, подкожно, внутрибрюшинно, внутримышечно или подкожно; или перорально, трансбуккально, назально, трансмукозально, непосредственно в больной орган при помощи катетера, топически или в офтальмологическом препарате, с дозировкой в пределах от примерно 0,001 до примерно 100 мг/ кг массы тела или в соответствии с потребностями в конкретном лекарственном средстве и, более предпочтительно, от 0,5 до 10 мг/ кг массы тела. Понятно, что когда соединение доставляется непосредственно в глаз, такие соображения, как масса тела, меньше влияют на дозу.
[0058] Частота дозирования будет зависеть от вводимого средства, прогрессирования заболевания или состояния пациента и других соображений, известных специалистам в данной области. Например, фармакокинетические и фармакодинамические соображения для композиций, доставляемых в глаз, или даже в компартменты внутри глаза, различны, например, клиренс в субретинальном пространстве очень низок. Таким образом, дозирование может быть нечастым, таким как один раз в месяц, один раз в три месяца, один раз в шесть месяцев, один раз в год, раз в пять лет или реже. Если системное введение антиоксидантов должно выполняться в сочетании с введением экспрессирующих конструкций в субретинальное пространство, ожидается, что частота дозирования антиоксиданта будет выше, чем экспрессирующая конструкция, например, один или несколько раз в день, один или несколько раз в неделю.
[0059] Дозировку можно определять в сочетании с контролем одного или нескольких признаков или симптомов заболевания, например, остроты зрения, поля зрения, сумеречного зрения и т.д. Количество активного ингредиента, которое может быть объединено с материалами-носителями для получения разовой лекарственной формы, будет варьировать в зависимости от проходящего лечение хозяина и конкретного способа введения. Типичный препарат содержит от примерно 1% до примерно 95% активного соединения (мас./мас.). Альтернативно, такие препараты содержат от примерно 20% до примерно 80% активного соединения. Может потребоваться более низкая или более высокая доза, чем указано выше. Конкретные дозировки и режимы лечения для любого конкретного пациента будут зависеть от множества факторов, включая активность конкретного используемого соединения, возраст, массу тела, общее состояние здоровья, пол, диету, время введения, скорость выделения, комбинацию лекарств, степень тяжести и течение заболевания, состояния или симптомов, склонность пациента к заболеванию, состоянию или симптомам и мнение лечащего врача.
[0060] Фармацевтические композиции могут быть в виде стерильного инъекционного препарата, например, в виде стерильной инъекционной водной или масляной суспензии. Эта суспензия может быть подготовлена в соответствии со способами, известными в данной области, с использованием подходящих диспергирующих или смачивающих агентов (таких как, например, TWEEN® 80) и суспендирующих агентов. Стерильный инъекционный препарат может также представлять собой стерильный раствор для инъекций или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. В числе приемлемых носителей и растворителей, которые могут быть использованы, находятся маннит, вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные, жирные масла обычно используют в качестве растворителя или суспендирующей среды. Для этой цели может быть использовано любое мягкое жирное масло, включая синтетические моно- или диглицериды. Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, пригодны для подготовки инъекцируемых продуктов, а также натуральные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, особенно в их полиоксиэтилированных версиях. Эти масляные растворы или суспензии могут также содержать длинноцепочечный спиртовой разбавитель или диспергатор или карбоксиметилцеллюлозу или аналогичные диспергирующие агенты, которые обычно используются в составе фармацевтически приемлемых лекарственных форм, таких как эмульсии и/ или суспензии. Другие общеупотребительные поверхностно-активные вещества, такие как TWEEN® или SPAN® и/ или другие аналогичные эмульгирующие агенты или усилители биодоступности, которые обычно используются при изготовлении фармацевтически приемлемых твердых, жидких или других лекарственных форм, также могут использоваться для целей рецептуры.
[0061] В одном или нескольких вариантах осуществления NACA вводят в суточных дозах от примерно 0,5 до 150 мг/ кг. В других вариантах осуществления NACA вводят два или три раза в день. В другом аспекте NACA вводят со вторым активным агентом, выбранным из аскорбиновой кислоты, цистеингидрохлорида, бисульфата натрия, метабисульфита натрия, сульфита натрия и тому подобного; маслорастворимых антиоксидантов, таких как аскорбилпальмитат, бутилированный гидроксианизол (BHA), бутилированный гидрокситолуол (BHT), лецитин, пропилгаллат, α-токоферол и т.п.; и металл-хелатообразующих веществ, таких как лимонная кислота, этилендиаминтетрауксусная кислота (ЭДТК), сорбит, винная кислота, фосфорная кислота и тому подобное.
[0062] В некоторых вариантах осуществления доза NACA для введения составляет 100, 150, 150, 300, 333, 400, 500, 600, 700, 750, 800, 900, 1000, 2500, 5000, 7500 или 10000 мг на дозу. В другом аспекте доза для введения составляет 0,1-0,25, 0,1-0,4, 0,35-0,5, 0,5-1, 102, 1-3, 1-4, 1-5, 1-2,5, 2,5-3,5, 4-6, 5-8, 6-9, 7-10 г на дозу. В другом аспекте NACA доставляется перорально посредством мини-таблетки, капсулы, таблетки, газированного напитка, двойного высвобождения, смешанного высвобождения, саше, порошка или жидкости. В другом аспекте NACA вводят профилактически для предупреждения RP.
[0063] В другом варианте осуществления настоящее изобретение включает способ лечения RP, включающий: идентификацию человека, нуждающегося в лечении пигментной дистрофии сетчатки; и введение человеку терапевтически эффективного количества NACA, достаточного для лечения RP. Следует понимать, что, как и в других вариантах осуществления, определенных выше, NACA вводят в суточных дозах от примерно 0,5 до 150 мг/ кг. В другом аспекте NACA вводят два или три раза в день. В другом аспекте NACA вводят со вторым активным средством, как описано выше.
[0064] В другом аспекте доза NACA для введения составляет 100, 150, 150, 300, 333, 400, 500, 600, 700, 750, 800, 900, 1000, 2500, 5000, 7500 или 10000 мг на дозу. В другом аспекте доза для введения составляет 0,1-0,25, 0,1-0,4, 0,35-0,5, 0,5-1, 102, 1-3, 1-4, 1-5, 1-2,5, 2,5-3,5, 4-6, 5-8, 6-9, 7-10 г на дозу. В другом аспекте NACA доставляется перорально через мини-таблетку, капсулу, таблетку, газированный напиток, двойное высвобождение, смешанное высвобождение, саше, порошок или жидкость. В другом аспекте NACA вводят профилактически для предупреждения RP.
[0065] Используемый в настоящем описании термин «восприимчивый к» или «склонный к» или «предрасположенный к» конкретному заболеванию или состоянию или тому подобному относится к пациенту, у которого на основе генетических, экологических, медицинских и/ или других факторов риска, скорее всего, будет развиваться болезнь или состояние, чем у населения в целом. Увеличение вероятности развития заболевания может увеличиться примерно на 10%, 20%, 50%, 100%, 150%, 200% и более.
ПРИМЕРЫ
[0066] Начиная с послеродового дня (Р) 14, мыши rd10+/+ получали нормальную питьевую воду (n=6) или воду, содержащую NACA 7 мг/мл или 7 мг/мл NAC или 20 мг/мл NAC (n=8 для каждой группы). Скотопические и фотопические электроретинограммы (ERG) регистрировали при P35. Скопические, фотопические и низкомолекулярные фотоэпидемические ERG регистрировали при P50.
[0067] Плотность колбочек определяли при P50 в четырех областях размером 230 мм × 230 мм (512 × 512 пикселей), расположенных в 0,5 мм выше, к виску, ниже и к носу от центра зрительного нерва в плоских подошвах сетчатки, окрашенных флуоресцеин-меченым агглютинином арахиса (PNA).
[0068] Было обнаружено, что при Р35 как амплитуда среднего пика b-волны скотопической ERG, так и амплитуда среднего пика фотопической b-волны у мышей rd10+/+, получавших 7 мг/мл NACA, были более чем в 2 раза больше, чем у мышей rd10+/+, получавших NAC 7 мг/мл, и в 3 раза больше, чем у контрольных мышей rd10+/+. При P50 b-волны скотопической и фотопической ERG у мышей, получавших NACA, показали в 3 раза большую амплитуду, чем у мышей rd10+/+, получавших 7 мг/мл NAC, или контрольных мышей rd10+/+. На фигурах 1A-IE представлены графики, показывающие, что 7 мг/мл NACA обеспечивает лучшие эффекты, чем 7 мг/мл NAC для защиты функции сетчатки. Как показано на фигурах 1A-IE, были измерены: амплитуда скотопической b-волны (фиг. 1A, 1C), амплитуда фотопической b-волны (рис. IB, ID) и низкая фоновая фотопическая b-волна (рис. IE). Плотность колбочковых клеток была значительно выше в 3 из 4 квадрантов у мышей, получавших NACA, по сравнению с мышами, получавшими NAC, p <0,0001 при помощи ANOVA с коррекцией Даннета для множественных сравнений. На фигурах 2A-2L представлены микрофотографии, которые показывают, что 7 мг/мл NACA обеспечивает лучшие эффекты, чем 7 мг/мл NAC для защиты выживаемости колбочковых клеток. Фигура 2M представляет собой график, показывающий выживаемость колбочковых клеток, измеренную по плотности колбочек в верхней, нижней, височной и назальной областях.
[0069] По сравнению с теми, которые получали 20 мг/мл NAC, мыши rd10+/+, получавшие 7 мг/мл NACA, показывали аналогичную амплитуду среднего пика b-волны скотопической ERG при P35. Амплитуда среднего пика фотопической b-волны была на 41% выше (p=0,024) у мышей, получавших NACA, чем мышей, получавших NAC, и оба они были более чем в 3 раза выше, чем у контрольных. При Р50 амплитуда среднего пика b-волны скотопической ERG у мышей, получавших 20 мг/мл NAC или 7 мг/мл NACA, демонстрировала устойчивые более высокие амплитуды, чем у контрольных со средними амплитудами b-волны, значительно более значимыми у мышей, получавших NACA, по сравнению с мышами, получавшими NAC при 10 из 11 интенсивностей стимулов. Средняя амплитуда b-волны фотопической ERG была на 50% выше (p=0,001) при всех 3 интенсивностях стимула у получавших NACA против мышей, получавших NAC, и более чем в 4 раза превышала контроль. На фигурах 3A-3E представлены графики, которые показывают, что 7 мг/мл NACA обеспечивает лучшие эффекты, чем 20 мг/мл NAC для защиты функции сетчатки. Как показано на фиг.3А-3Е, были измерены: амплитуда скотопической b-волны (фиг. 3А, 3С), амплитуда фотопической b-волны (фиг. 3В, 3D) и низкофоновая фотопическая b-волна (фиг. 3Е). Плотность колбочковых клеток была значительно выше в 2 из 4 квадрантов у мышей, получавших NACA, по сравнению с мышами, получавшими NAC (фиг. 4A-4L). На фигурах 4A-4L представлены микрофотографии, которые показывают, что 7 мг/мл NACA имеет лучший эффект, чем 20 мг/мл NAC для защиты выживаемости колбочковых клеток. Фигура 4M представляет собой график, показывающий выживание колбочек, определенное по плотности колбочек в верхней, нижней, височной и назальной областях.
[0070] Удивительно, но при той же пероральной дозе или даже при значительно более низкой дозе NACA продемонстрировал значительно более высокую защиту функции колбочковых клеток и выживаемости колбочек по сравнению с NAC у мышей rd10+/+. Это удивительно, потому что NACA является предшественником NAC, и не ожидалось, что предшественник приведет к существенно отличному эффекту in vivo.
[0071] Предполагается, что любой вариант осуществления, обсуждаемый в этом описании, может быть реализован применительно к любому способу, набору, реагенту или композиции по изобретению и наоборот. Кроме того, композиции по изобретению могут применяться для достижения способов по изобретению.
[0072] Понятно, что конкретные варианты осуществления, описанные в настоящем описании, показаны в качестве иллюстрации, а не в качестве ограничений изобретения. Основные особенности настоящего изобретения могут быть использованы в различных вариантах осуществления без отхода от объема изобретения. Специалисты в данной области техники признают или могут установить при помощи не более чем обычных экспериментов многочисленные эквиваленты конкретных процедур, описанных в настоящем описании. Такие эквиваленты считаются входящими в объем настоящего изобретения и охватываются формулой изобретения.
[0073] Все публикации и патентные заявки, упомянутые в описании, указывают на уровень квалификации специалистов в данной области, к которой относится настоящее изобретение. Все публикации и заявки на патент включены в настоящее описание посредством ссылки в той же степени, как если бы каждая отдельная публикация или патентная заявка были специально и индивидуально указаны для включения в качестве ссылки.
[0074] Использование слова «a» или «an» при использовании в сочетании с термином «содержащий» в формуле изобретения и/ или спецификации может означать «один», но оно также согласуется со значением «один или несколько», «по меньшей мере, один», «один или более чем один». Использование термина «или» в формуле изобретения используется для обозначения «и/ или», если явно не указано только на альтернативы, или альтернативы являются взаимоисключающими, хотя раскрытие поддерживает определение, которое относится только к альтернативам и «и/ или». В этом приложении термин «около» используется для указания того, что значение включает неотъемлемое изменение ошибки для устройства, способа, используемого для определения значения, или вариацию, существующую среди субъектов исследования.
[0075] Используемые в этом описании и пунктах формулы изобретения слова «содержащий» (и любая форма содержащего, например, «содержат» и «содержит»), «имеющий» (и любая форма имеющего, например «имеют» и «имеет»), «включающий» (и любая форма включающего, например «включают» и «включает») или «содержащий» (и любая форма содержащего, такая как «содержат» и «содержит»), являются охватывающими или допускающими изменения и не исключает дополнительных, неактивных элементов или стадий способа. В вариантах осуществления любой из композиций и способов, описанных в настоящем описании, термин «содержащий» может быть заменен «состоящим в основном из» или «состоящим из». Как используется в настоящем описании, выражение «состоящий в основном из» требует заданного целого числа(ел) или стадий, а также тех, что не оказывают существенного влияния на характер или функцию заявленного изобретения. Используемый в настоящем описании термин «состоящий» используется только для указания наличия повторяющегося целого числа (например, признака, элемента, характеристики, свойства, стадии способа/процесса или ограничения) или группы целых чисел (например, признака(ов), элемента(ов), характеристики(к), свойства(в), стадий способа/процесса или ограничения(ограничений)).
[0076] Используемый в настоящем описании термин «или их комбинации» относится ко всем перестановкам и комбинациям перечисленных элементов, предшествующих термину. Например, «A, B, C или их комбинации» предназначен для включения, по меньшей мере, одного из: A, B, C, AB, AC, BC или ABC, и если порядок важен в конкретном контексте, также BA, CA, CB, CBA, BCA, ACB, BAC или CAB. В продолжение этого примера, специально включены комбинации, содержащие повторы одного или нескольких элементов или терминов, такие как BB, AAA, AB, BBC, AAABCCCC, CBBAAA, CABABB и так далее. Специалист в данной области техники поймет, что, как правило, ограничения на количество элементов или терминов в любой комбинации отсутствуют, если иное не очевидно из контекста.
[0077] Как используется в настоящем описании, слова приближения, такие как, без ограничений, «примерно», «существенный» или «по существу» относятся к условию, что когда такое измененное понимается не обязательно как абсолютное или совершенное, но считалось бы специалистами в данной области достаточно близким, чтобы гарантировать обозначение состояния как присутствующего. Степень, в которой описание может варьировать, зависит от того, насколько значительными могут быть установлены изменения, и любой специалист в данной области по-прежнему признает, что измененная функция все еще имеет требуемые характеристики и возможности немодифицированной функции. В большинстве случаев, но с учетом предыдущего обсуждения численное значение в настоящем описании, которое модифицируется словом приближения, таким как «примерно», может варьировать от указанного значения, по меньшей мере, на ± 1, 2, 3, 4, 5, 6, 7, 10, 12 или 15%.
[0078] Кроме того, заголовки разделов в настоящем описании приведены для согласования с предложениями в 37 CFR 1.77 или иным образом для обеспечения организационных сигналов. Эти заголовки не должны ограничивать или характеризовать изобретение (изобретения), изложенное в каких-либо пунктах формулы изобретения, что может возникнуть в результате этого раскрытия. В конкретном плане и в качестве примера, хотя заголовки относятся к «области изобретения», такие требования не должны ограничиваться языком под этим заголовком для описания так называемой технической области. Кроме того, описание технологии в разделе «Предпосылки создания изобретения» не следует рассматривать как признание того, что технология является прототипом для любого изобретения (изобретений) в этом раскрытии. Кроме того, «краткое изложение» не считается характеристикой изобретения (изобретений), изложенного в заявленных пунктах формулы изобретения. Кроме того, любая ссылка в этом раскрытии на «изобретение» в единственном числе не должна использоваться, чтобы утверждать, что в этом раскрытии имеется только один элемент новизны. Несколько изобретений могут быть изложены в соответствии с ограничениями нескольких пунктов формулы изобретения, вытекающих из этого раскрытия, и такие пункты формулы изобретения соответственно определяют изобретение(я) и их эквиваленты, которые защищены таким образом. Во всех случаях сфера охвата таких пунктов формулы изобретения должна рассматриваться по собственному усмотрению в свете этого раскрытия, но она не должна ограничиваться заголовками, изложенными в настоящем документе.
[0079] Все композиции и/ или способы, раскрытые и заявленные в настоящем документе, могут быть изготовлены и выполнены без излишних экспериментов в свете настоящего раскрытия. Несмотря на то, что композиции и способы по настоящему изобретению были описаны с точки зрения предпочтительных вариантов осуществления, специалистам в данной области техники будет очевидно, что вариации могут быть применены к композициям и/ или способам, а также на стадиях или в последовательности стадий описанного в настоящем описании способа, не отступая от концепции, сущности и объема изобретения. Все подобные аналогичные замены и модификации, очевидные для специалистов в данной области, считаются находящимися в пределах сущности, объема и концепции изобретения, как определено пунктах прилагаемой формулы изобретения.