Лекарственное средство, обладающее ранозаживляющим действием
Вид РИД
Изобретение
Изобретение относится к области медицины и фармацевтической промышленности, а именно к мазям, обладающим ранозаживляющим действием. Описано лекарственное средство в форме мази, обладающее ранозаживляющим действием, отличающееся тем, что в качестве действующего вещества используется салицилат цинка в количестве 0,1-10 масс. %, который перед введением в мазевую основу подвергают механическому взаимодействию с крахмалом, взятым в соотношении 1:1 или 1:2 по массе, а в качестве мазевой основы используется смесь полиэтиленгликолей, необязательно с добавлением других вспомогательных веществ.
Лечение травматических, инфекционных, трофических и других нарушений целостности кожного покрова является актуальной и до конца еще не решенной на сегодняшний день медицинской проблемой [1].
Одной из наиболее важных задач при лечении кожных ран различного генеза является создание оптимальных условий для получения наиболее полноценного регенераторного процесса. Заживление ран - это сложный процесс, итогом которого является восстановление внеклеточного матрикса и функционально активного покрова с формированием или без формирования рубца. За последние 20 лет проведены многочисленные исследования, направленные на поиск фармакологических средств, целенаправленно влияющих на полноту регенерации кожи. Исследованы различные фармакологические группы веществ: протеолитические ферменты, анаболические гормоны, антисептики синтетического ряда, адсорбенты и другие биологически активные вещества, стимулирующие метаболические процессы [2], [3], [4].
Известны лекарственные средства для лечения ран, содержащие такие действующие вещества, как метилурацил, д-пантенол, депротеинизированный гемодериват, различные растительные экстракты и некоторые другие.
В качестве примера можно назвать гель для наружного применения, содержащий салициловую кислоту, хитозан и биорегулятор, выделенный из сыворотки крови крупного рогатого скота и воду [5]. Существенным отличием данной фармацевтической композиции от описанной является наличие в составе воды.
Наиболее близкой к описываемой композиции является мазь «Левомеколь», содержащая в качестве действующих веществ левомицетин (хлорамфеникол) и мелилурацил (диоксометилтетрагидропиримидин), а в качестве мазевой основы смесь полиэтиленгликолей [6]. Существенным признаком данной фармацевтической композиции является отсутствие в составе воды. Однако применение данного лекарственного препарата связано с рядом существенных недостатков, таких как, например, недостаточная клиническая эффективность, высокая частота развития побочных эффектов, высокий риск развития инфекций, вызванных резистентными к левомицетину (хлорамфениколу) микроорганизмами [7].
Другая близкая по составу фармацевтическая композиция - мазь «Метилурацил», не показала достаточную терапевтическую эффективность при изучении развития эритемной реакции в ответ на ультрафиолетовое облучение кожи морских свинок [8], что говорит о низкой ранозаживляющей эффективности. Кроме того, данная фармацевтическая композиция имеет то существенное отличие, что в качестве мазевой основы используется липофильная основа, состоящая из смеси вазелина и ланолина, что не способствует оттоку жидкости из раны, а также создает риск развития анаэробной инфекции.
К общим недостаткам других известных фармацевтических композиций в виде мазей с ранозаживляющим действием также относится недостаточная клиническая эффективность, риск развития побочных реакций, в частности аллергических, а кроме того сложность производства, дефицитность и высокая стоимость сырья, непостоянство состава биологических препаратов.
Известно, что соединения цинка обладают важным биологическим действием, способствуют ускорению регенерации тканей, ион цинка входит в качестве кофактора в состав ряда важных ферментов, участвующих в ключевых процессах жизнедеятельности организма. Катион цинка входит в состав более 300 ферментов и более 2000 факторов транскрипции, регулирующих метаболизм липидов, белков и нуклеиновых кислот [9]. Однако из современного уровня техники не известны фармацевтические композиции в виде мазей на основе смеси полиэтиленгликолей, содержащие салицилат цинка, обладающие ранозаживляющим действием.
Описано применение некоторых соединений цинка (оксид, сульфат, глюконат) для лечения ряда кожных заболеваний (акне, экзема, язвы и др.). Так, например, описана высокая противовоспалительная активность салицилата цинка в модели острого воспаления «формалиновый тест» у крыс [10]. Однако в данной работе не изучалась ранозаживляющая активность, а также не указаны точные характеристики изучавшегося салицилата цинка (безводный или кристаллогидрат), что является существенным для настоящего изобретения.
В настоящее время, эффективному применению соединений цинка для лечения заболеваний и повреждений кожи препятствуют такие свойства как крайне низкая растворимость (оксид цинка), либо, наоборот, высокая растворимость и связанное с этим легкое проникновение в системный кровоток, что повышает риск системного токсического действия (сульфат цинка). Кроме того, поскольку гидроксид цинка является крайне слабым основанием, для растворимых солей цинка характерна подверженность гидролизу даже в физиологических условиях, что ведет к повышению кислотности среды в месте введения, снижению фармакологической активности и местно-раздражающему действию.
В то же время, использование салициловой кислоты для получения солей цинка имеет ряд преимуществ, поскольку салицилат-анион обладает собственной фармакологической активностью (анальгетической, противовоспалительной, антисептической, кератолитической). Кроме того, за счет пространственно близко расположенных карбоксильной и гидроксильной групп в молекуле салициловой кислоты, при образовании солей с ионами цинка имеют место процессы комплексообразования, что также благоприятно влияет на спектр фармакологической активности полученных солей.
Салициловая кислота (о-оксибензойная кислота) - простейшая ароматическая оксикислота, которая представляет собой бесцветные кристаллы, плохо растворимые в воде и хорошо растворимые в органических растворителях; широко распространена в природе, главным образом в виде гликозида ее метилового эфира (метилсалицилата). В промышленности ее обычно получают карбоксилированием фенола. Салициловая кислота обладает слабыми антисептическими, раздражающими и кератолитическими (в больших концентрациях) свойствами. Применяют наружно в мазях, пастах, присыпках и растворах при лечении кожных заболеваний; натриевую соль салициловой кислоты (салицилат натрия), ее амид (салициламид) и ацетилсалициловую кислоту (аспирин) используют как жаропонижающие, противоревматические, противовоспалительные и болеутоляющие средства; благодаря антисептическому действию ее употребляют при консервировании пищевых продуктов. Салициловая кислота токсична в больших дозах, для человека предполагаемая LD50 составляет 1,75 г/кг [5].
Описаны гидратированные и безводные комплексы цинка с салициловой кислотой Zn(Sal)2⋅2H2O и Zn(Sal)2, а также моносалицилат цинка Zn(Sal) [11].
В литературе описано медицинское применение салицилата цинка, однако в большинстве источников не уточняется состав (безводная соль Zn(Sal)2, или кристаллогидрат Zn(Sal)2⋅2H2O, что является существенным для описанного лекарственного средства). Известные на сегодня способы получения салицилатов цинка предполагают проведение реакции обмена в водном растворе между растворимой солью цинка (сульфат, хлорид, нитрат) и растворимым салицилатом (натрия, калия), что имеет ряд недостатков, таких как возможность частичного гидролиза полученного продукта, непостоянство состава, примеси исходных реагентов и других продуктов реакции [12], [13].
Описана фармацевтическая композиция, содержащая салицилат цинка, представляющая собой гидрофильные и гидрофобные кремы для предотвращения раздражения кожи [14]. Существенным отличием от описываемого изобретения является применение лекарственной формы гидрофильного и гидрофобного крема, представляющего собой водно-глицериновые эмульсии, применяемые для предотвращения раздражения неповрежденной кожи. Наличие в составе данных композиций воды создает условия для гидролиза салицилата цинка и снижения фармакологической активности. Ранозаживляющее действие данных композиций не описано.
Таким образом, техническая проблема заключается в том, что фармацевтическая композиция, содержащая салицилат цинка, не должна способствовать его гидролизу. Из уровня техники известны липофильные мазевые основы, например, вазелин - смесь жидких и твердых предельных углеводородов. Однако такие композиции по ряду причин не являются оптимальным выбором для лечения ран, так как, во-первых, препятствуют свободному газообмену, создавая условия для анаэробной инфекции, а во-вторых, снижают биодоступность гидрофильных действующих веществ (в том числе салицилата цинка).
В данном случае, для обеспечения ранозаживляющего действия фармацевтической композиции, известными из уровня техники компонентами мазевой основы могут выступать полиэтиленгликоли (ПЭГ). Кроме того, данные мазевые основы не требуют введения в состав композиции воды, а, следовательно, не создают условий для гидролиза салицилата цинка. Лекарственные средства в форме мазей, обладающих ранозаживляющим действием, содержащие в качестве действующего вещества салицилат цинка, а в качестве вспомогательных веществ (мазевой основы) смесь полиэтиленгликолей, в настоящее время не описаны, следовательно, раскрываемое изобретение обладает признаком «новизна».
Полиэтиленгликоли (ПЭГ) представляют собой водорастворимые неионные полимеры, получаемые полимеризацией этиленоксида с раскрытием цикла. В зависимости от средней молекулярной массы представляют собой вязкие жидкости или твердые вещества. Смеси ПЭГ в различных соотношениях широко применяются в качестве мазевых основ. Мазевые основы, содержащие смеси ПЭГ имеют ряд преимуществ: не имеют запаха, хорошо смешиваются с водой, не растворимы в маслах, не диссоциируют в водной среде, не изменяются в присутствии электролитов; хорошо наносятся на кожу и равномерно распределяются по ней, не препятствуя газообмену и не нарушая деятельности кожных желез, обладают некоторым собственным бактерицидным действием, осмотически активны, что существенно при лечении инфицированных ран [15] [16].
В то же время, известным из уровня техники недостатком мазевых основ, содержащих смеси ПЭГ, является несовместимость с салицилатами и солями тяжелых металлов [16]. Таким образом, лекарственное средство, содержащее салицилат цинка в качестве действующего вещества в составе мазевой основы, состоящей из смеси полиэтиленгликолей, является неочевидной для специалиста в данной области, а, следовательно, обладает признаком «изобретательный уровень».
Таким образом, из уровня техники известны мази на основе полиэтиленгликолей в качестве антимикробных средств, не содержащие салицилат цинка, а также известны кремы с салицилатом цинка в качестве средств для профилактики раздражения кожи, однако не известны мази на основе полиэтиленгликолей, содержащие салицилат цинка, обладающие ранозаживляющим действием, следовательно, имеет место признак новизны. Специалисту в данной области не известны ранозаживляющие свойства салицилата цинка, но известно, что полиэтиленгликоли не совместимы с салицилатами, следовательно, композиция, содержащая салицилат цинка и смесь полиэтиленгликолей, не является ни новой, ни очевидной. Не известно о включении в состав мазей безводного салицилата цинка после механического взаимодействия с крахмалом. Для специалиста в данной области не очевидна стабильность полученной при этом композиции.
Задачей настоящего изобретения является создание нового эффективного, безопасного и стабильного лекарственного средства для наружного применения в форме мази, обладающего ранозаживляющим действием.
Для решения данной задачи разработано лекарственное средство в форме мази, содержащей в качестве действующего вещества салицилат цинка, который предварительно подвергают механическому взаимодействию с крахмалом, а в качестве мазевой основы смесь полиэтиленгликолей, не обязательно с добавлением известных вспомогательных веществ (пропиленгликоля, бензилового и изопропилового спиртов и др.).
Технический результат
Лекарственное средство в форме мази содержит в качестве действующего вещества от 0,1% до 10 масс. % (оптимально 1 масс. %) салицилата цинка, который перед введением в состав композиции подвергают механическому взаимодействию с крахмалом в соотношении 1:1 или 1:2 по массе, а в качестве мазевой основы смесь полиэтиленгликолей, необязательно с добавлением других известных из уровня техники вспомогательных веществ, не взаимодействующих с салицилатом цинка.
Изучение кинетики абсорбции действующего вещества (салицилата цинка) проводили на модели диффузии в агаровый гель с индикатором - хлоридом железа (III). Изучались 2 состава (состав №1 и состав №2), отличающиеся по способу введения салицилата цинка в состав мазевой основы. Состав №1 (с крахмалом) готовили путем добавления при перемешивании к расплавленной смеси ПЭГ1500, ПЭГ400 и изопропилового спирта смеси салицилата цинка с крахмалом, предварительно подвергнутой механическому воздействию (растирание) в течение 10 минут. Перемешивание продолжали в течение 15 минут и затем полученную мазь охлаждали. Состав №2 готовили путем добавления при перемешивании к расплавленной смеси ПЭГ1500 и ПЭГ400 раствора салицилата цинка в изопропиловом спирте. Перемешивание продолжали в течение 15 минут и затем полученную мазь охлаждали.
Изучение диффузии салицилата цинка из мазей разного состава в агаровый гель с хлоридом железа (III) показало, что предварительное растирание салицилата цинка с крахмалом перед введением в состав мазевой основы не препятствует высвобождению действующего вещества, но в то же время способствует более длительному высвобождению, замедляя всасывание в системный кровоток. Тем самым, обеспечивается более длительное присутствие действующего вещества непосредственно в области повреждения. Кроме того, это способствует повышению безопасности лечения, снижая риск местнораздражающего действия и проявления системных токсических реакций.
Таким образом, техническим результатом в данном случае будет являться оптимизация профиля высвобождения действующего вещества и повышение безопасности лечения.
Изучение механизмов ранозаживляющего действия салицилата цинка проводили в ходе исследований метаболической, миграционной и пролиферативной активности, а также биохимических показателей механического повреждения при культивировании в присутствии раствора салицилата цинка на культуре фибробластов крысы. Исследование включало следующие серии экспериментов:
1) Проведение MTS-теста на культуре фибробластов с растворами салицилата цинка (ZS), ацетата цинка (ZA), метилурацила (MU) и салицилата натрия (NS) в 3 концентрациях.
2) Проведение теста на миграционную и пролиферативную активность фибробластов путем скарификации клеточного монослоя при совместном культивировании клеток с растворами салицилата цинка (ZS), ацетата цинка (ZA), метилурацила (MU) и салицилата натрия (NS) в 3 концентрациях.
3) Проведение биохимического анализа степени повреждения и восстановления структуры белков после проведения теста на миграционную активность фибробластов путем скарификации клеточного монослоя при совместном культивировании клеток с растворами салицилата цинка (ZS), ацетата цинка (ZA), метилурацила (MU) и салицилата натрия (NS).
4) Проведение биохимического анализа степени повреждения и восстановления структуры липидов после проведения теста на миграционную активность фибробластов путем скарификации клеточного монослоя при совместном культивировании клеток с растворами салицилата цинка (ZS), ацетата цинка (ZA), метилурацила (MU) и салицилата натрия (NS).
5) Оценка адаптивных возможностей клеток по динамике изменений белковых SH-групп после проведения теста на миграционную активность фибробластов путем скарификации клеточного монослоя при совместном культивировании клеток с растворами салицилата цинка (ZS), ацетата цинка (ZA), метилурацила (MU) и салицилата натрия (NS).
Для изучения механизмов ранозаживляющего действия салицилата цинка (ZS), на культуре фибробластов были выполнены следующие серии экспериментов:
1) MTS-тест: колориметрический тест для оценки метаболической активности клеток.
2) Скретч-тест: определение миграционной активности клеток путем скарификации клеточного монослоя с последующей фиксацией изображений через фиксированные временные интервалы.
3) Определение общей концентрации белка по методу Лоури в:
- контрольной группе клеток без скретч-теста и без добавления исследуемых соединений;
- в группе клеток после скретч-теста, культивирование без исследуемых соединений;
- в группе клеток после скретч-теста, культивирование с исследуемыми соединениями ZS, ZA, MU и NS, каждое в 3 концентрациях.
4) Определение концентрации карбонильных производных белков в следующих группах:
- в контрольной группе клеток без скретч-теста и без добавления исследуемых соединений;
- в группе клеток после скретч-теста, культивирование без добавления исследуемых соединений;
- в группе клеток после скретч-теста, культивирование с добавлением исследуемых соединений ZS, ZA, MU и NS, каждое в 3 концентрациях.
5) Определение концентрации тиобарбитурат(ТБК)-чувствительных продуктов:
- контрольной группе клеток, клетки без скретч-теста и без добавления исследуемых соединений;
- в группе клеток после скретч-теста, культивирование без добавления исследуемых соединений;
- в группе клеток после скретч-теста, культивирование с добавлением исследуемых соединений ZS, ZA, MU и NS, каждая в трех концентрациях.
6) Оценка содержания SH-групп фотометрическим методом с использованием реактива Эллмана в:
- контрольной группе клеток, клетки без скретч-теста и без добавления исследуемых соединений;
- в группе клеток после скретч-теста, культивирование без добавления исследуемых соединений;
- в группе клеток после скретч-теста, культивирование с добавлением исследуемых соединений ZS, ZA, MU и NS, каждое в 3 концентрациях.
Результаты исследования показали, что тестируемые вещества ZS, ZA, MU и NS статистически значимо увеличивают метаболическую и пролиферативную активность в концентрациях 0,5; 2,5 и 10,0 мкмоль/л в течение 24 часов. Наибольшую активность в этом виде исследования продемонстрировали исследуемые вещества ZA и ZS. При оценке миграционной активности было отмечено, что в первые 12 часов исследования она была выше у фибробластов, культивируемых с изучаемым веществом ZS в концентрации 0,5 мкмоль/л.
При изучении степени повреждения белков после скарификационного повреждения было установлено, что восстановление SH-групп белков от повреждений происходило наиболее эффективно под воздействием ZS в концентрации 0,5 мкмоль/л. Кроме того, ZS, в отличие от NS, не вызывал повышения уровня повреждения липидов [18].
Таким образом, показано, что салицилат цинка (ZS) повышает метаболическую и пролиферативную активность фибробластов сопоставимо с ацетатом цинка (ZA). Но, в то же время, салицилат цинка (ZS) в концентрации 0,5 мкмоль/л в большей степени влияет на миграционную активность фибробластов в первые 12 часов после нанесения скарификационного повреждения по сравнению с ацетатом цинка (ZA). В случае метилурацила (MU) и салицилата натрия (NS), напротив, наблюдалось снижение миграционной активности фибробластов.
Таким образом, технический результат применения салицилата цинка в качестве ранозаживляющего вещества реализуется в повышении метаболической и пролиферативной активности, а также в повышении миграционной активности фибробластов (в отличие от ацетата цинка и метилурацила) и защите клеточных липидов от повреждения (в отличие от салицилата натрия).
Доклиническое изучение ранозаживляющей фармакологической активности мази, содержащей в качестве действующего вещества 1 масс. % салицилата цинка, предварительно подвергнутого механическому взаимодействию с крахмалом, а в качестве основы смесь полиэтиленгликолей, проводили, изучая влияние мази на течение раневого (неинфицированного) процесса в условиях моделирования линейной кожной раны на 12 крысах-самцах. Животных разделили на 4 группы по 3 особи (группа №1: контроль - без лечения; группа №2: мазевая основа без салицилата цинка; группа №3: композиция с салицилатом цинка; и группа №4: препарат сравнения - мазь «Левомеколь»). Все препараты наносили ежедневно в течение 8 дней в количестве 0,5 г/животное. Индукция патологии осуществлялась путем нанесения на дорсальной поверхности под общим наркозом по шаблону скальпелем раны на длину 50±0,2 мм до собственной фасции.
На 8-е сутки животных подвергали эвтаназии под эфирным наркозом, вырезали кусок раневой поверхности кожи высотой 7 см и шириной 4 см (по 2 см в обе стороны от рубца) и с помощью электронного динамометра с точностью 5 гр., определяют прочность рубца на разрыв, постепенно увеличивая нагрузку на края раны.
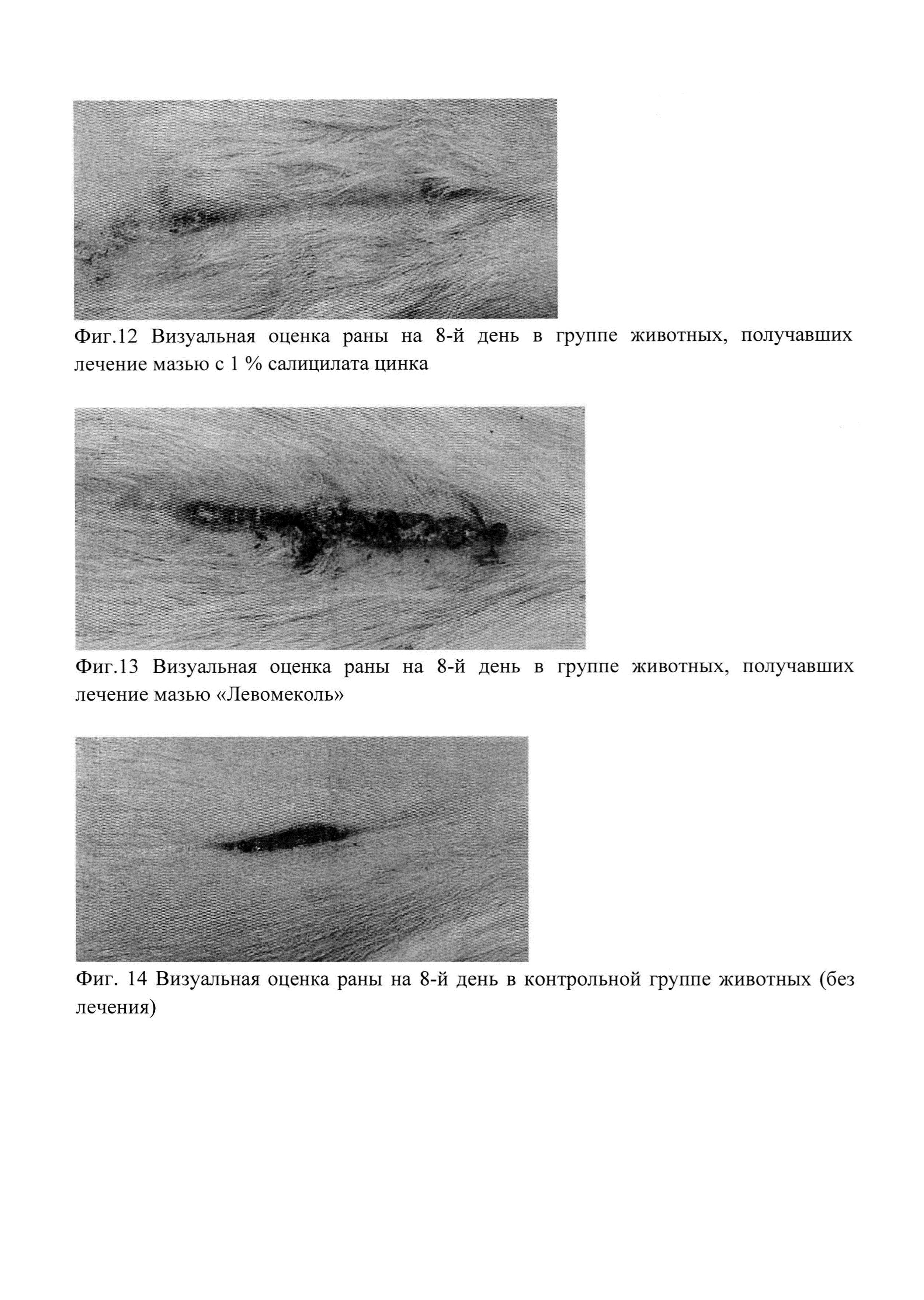
При доклиническом изучении ранозаживляющей фармакологической активности полученного описанным способом лекарственного средства в форме мази на экспериментальной модели линейной асептической кожной раны у крыс показано, что при применении мази, содержащей 1 масс. % салицилата цинка, полученной описанным способом, в дозе 0,5 г/животное, было отмечено не только статистически значимое увеличение усилия, необходимого для разрыва шва (2916,6±236,2 гр.), по отношению к животным других групп (1961,2±405,3 гр. - мазевая основа без салицилата цинка; 1280,6±343,0 гр. - мазь «Левомеколь»; 836,6±65,6 гр. - без лечения), но и наличие выраженных регенераторных свойств. У животных воспалительных процессов при визуальном осмотре не выявлено, рана чистая, заживление без грануляций. Отсутствие гранулем и гнойного воспалительного процесса позволяет сделать вывод о заживлении раны путем первичного натяжения. По всем изученным показателям полученная описанным способом композиция значительно превосходила как мазевую основу (смесь полиэтиленгликолей без добавления салицилата цинка), так и препарат сравнения (мазь «Левомеколь» - комбинация метилурацила и хлорамфеникола в смеси полиэтиленгликолей) [17].
В другом доклиническом исследовании фармакологической активности на экспериментальной модели линейной асептической кожной раны у крыс сравнивали два состава мази, отличающиеся по способу введения салицилата цинка в состав мазевой основы. Состав №1 (с крахмалом) готовили путем добавления при перемешивании к расплавленной смеси ПЭГ1500, ПЭГ400 и изопропилового спирта смеси салицилата цинка с крахмалом, предварительно подвергнутой механическому воздействию (растирание) в течение 10 минут. Перемешивание продолжали в течение 15 минут и затем полученную мазь охлаждали. Состав №2 готовили путем добавления при перемешивании к расплавленной смеси ПЭГ1500 и ПЭГ400 раствора салицилата цинка в изопропиловом спирте. Перемешивание продолжали в течение 15 минут и затем полученную мазь охлаждали.
На 5-й день лечения составом №1 (с крахмалом) линейный размер раны уменьшился в среднем с 5,0 см до 3,9 см, а в группе животных, получавших состав №2 (без крахмала) с 5,0 см до 4,5 см (разница была статистически значимой, р<0,05).
Полученный технический результат (более высокая эффективность лечения) можно объяснить более оптимальным профилем высвобождения действующего вещества (салицилата цинка) и, соответственно, более длительным присутствием действующего вещества в области раны. Полученные результаты полностью согласуются с данными экспериментов по изучению профиля высвобождения действующего вещества (салицилата цинка) из двух составов мази методом диффузии в агаровый гель с индикатором - хлоридом железа(III).
Таким образом, описанное изобретение соответствует признаку «промышленная применимость».
Сущность изобретения может быть проиллюстрирована приведенным ниже примером, который включают в себя но не ограничивается различными вариантами конкретной технической реализации (качественные характеристики исходных компонентов, состав и соотношение вспомогательных веществ мазевой основы, порядок смешивания компонентов, температура и продолжительность перемешивания и т.п.).
Пример
Получение салицилата цинка
Исходные соединения - сульфат цинка, ч.д.а. ZnSO4⋅7H2O и карбонат натрия, ч.д.а. Na2CO3⋅10H2O перекристаллизовывали из дистилированной воды. Для получения карбоната цинка навеску сульфата цинка семиводного (2,927 г, 10,18 ммоль) растворяли в 10 мл дистиллированной воды; навеску карбоната натрия десятиводного (2,871 г, 10,03 ммоль) также растворяли отдельно в 10 мл дистиллированной воды. К раствору сульфата цинка при интенсивном перемешивании постепенно медленно малыми порциями добавляли раствор карбоната натрия при комнатной температуре. После добавления всего раствора карбоната натрия перемешивание продолжали еще в течение от 15 до 30 минут. Затем мешалку выключали и оставляли реакционную смесь при комнатной температуре на 1-3 часа. Затем снова включали мешалку и при интенсивном перемешивании объем смеси доводили дистиллированной водой до 50 мл. Перемешивание продолжали в течение 10-15 минут. Затем выключали мешалку и оставляли смесь при комнатной температуре в течение 3-6 часов до полного отстаивания. Белый зернистый осадок карбоната цинка отфильтровывали (фильтр «белая лента») и промывали дистиллированной водой порциями по 5-10 мл (всего 80-100 мл) до нейтральной реакции промывных вод по фенолфталеину. Избыток воды удаляли между листами фильтровальной бумаги. Продукт до конца не высушивали. Получено 1,401 г осадка (11,24 ммоль в пересчете на 100% ZnCO3).
Полученный карбонат цинка постепенно малыми порциями при интенсивном перемешивании добавляли к 69 мл 2% раствора салициловой кислоты в 70% этиловом спирте (лекарственный препарат «Раствор кислоты салициловой спиртовой 2%»), содержащему 1,38 г (10 ммоль) салициловой кислоты. Перемешивание полученной суспензии молочно-белого цвета продолжали в течение 2-3 часов. Затем мешалку выключали и реакционную смесь оставляли при комнатной температуре на 4-6 часов для отстаивания. После этого раствор салицилата цинка фильтровали (фильтр «белая лента»). Избыток карбоната цинка, не вступивший в реакцию (0,646 г, 5,168 ммоль) говорит об образовании соли состава Zn(Sal)2. Таким образом, реакцию можно описать уравнением:
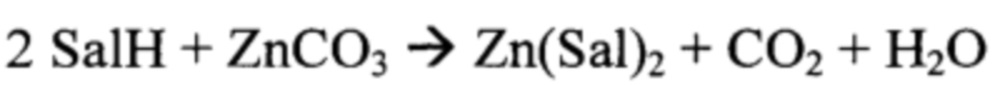
(где SalH - салициловая кислота)
Из спиртового раствора салицилата цинка удаляли растворитель любым приемлемым способом без нагревания выше 50°С. Получено 1,751 г (5,165 ммоль) салицилата цинка, отвечающего формуле Zn(Sal)2, с выходом в пересчете на общее количество карбоната цинка 91,9%, в пересчете на количество вступившего в реакцию карбоната цинка 99,94%.
Идентификацию полученного продукта проводили путем проведения качественных реакций на ионы цинка и салицилат-ионы, а также методами УФ- и ИК-спектроскопии.
Кроме того, полученный салицилат цинка может быть идентифицирован путем проведения известных качественных химических реакций. Водный раствор полученного описываемым способом салицилата цинка дает качественную реакцию на ионы Zn2+ с гексацианоферратом (II) калия (желтой кровяной солью) K4[Fe(CN)6] - образование белого осадка гексацианоферрата (II) цинка, а также качественную реакцию на салицилат-ион с раствором хлорида железа (III) FeCl3 - появление интенсивного красно-фиолетового окрашивания раствора.
Описание состав лекарственных композиций с салицилатом цинка
Лекарственные композиции с полученным описанным способом салицилатом цинка могут включать в себя мази на основе смеси полиэтиленгликолей с различной молекулярной массой в различных соотношениях, содержащие кроме того в качестве вспомогательных веществ крахмал, пропиленгликоль, бензиловый спирт, изопропиловый спирт, винилин и другие не содержащие воды и не взаимодействующие с салицилатом цинка компоненты.
Содержание действующего вещества (салицилата цинка) может составлять от 0,1% до 10%. Содержание крахмала может соответствовать количеству салицилата цинка, либо может быть использован двух- либо трехкратный избыток крахмала.
Ниже в таблице представлен состав изученных вариантов композиции (г).
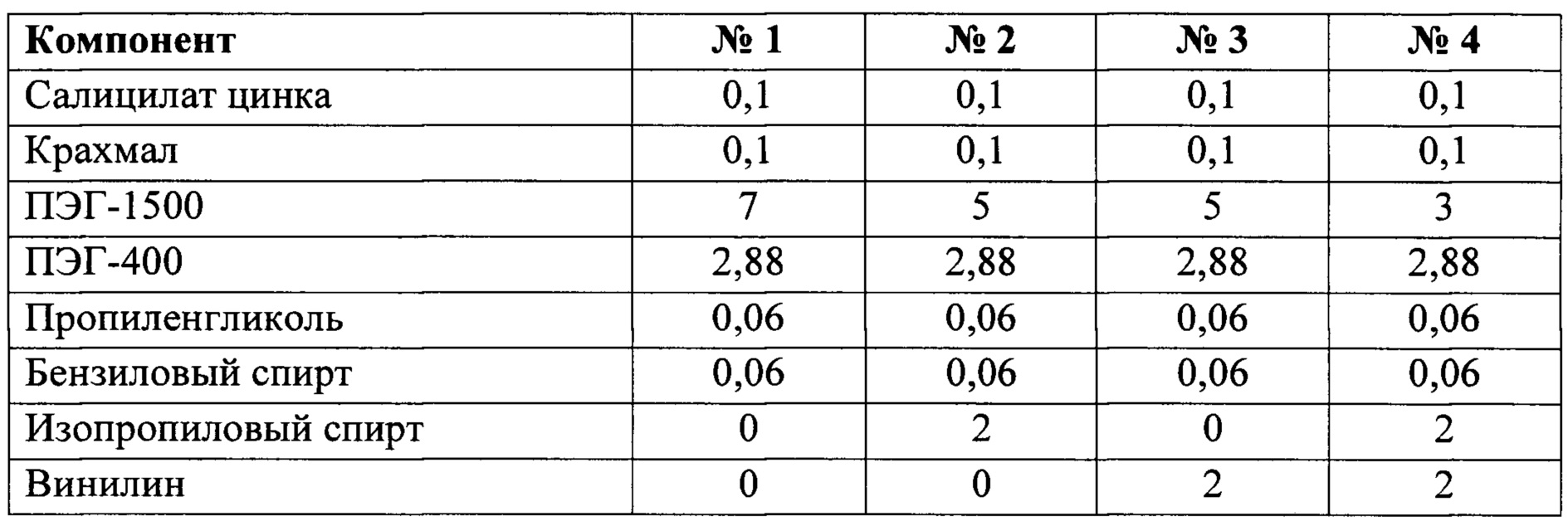
Получение лекарственной композиции в форме мази с салицилатом цинка
Вариант №1
Состав:
Салицилат цинка - 0,1 г
Полиэтиленгликоль-1500 (ПЭГ-1500) - 7 г
Полиэтиленгликоль-400 (ПЭГ-400) - 2,88 мл
Пропиленгликоль - 0,06 мл
Бензиловый спирт - 0,06 мл
Крахмал - 0,1 г
Технология получения: ПЭГ-1500 расплавляют на водяной бане при интенсивном перемешивании. Отдельно растирают в ступке 0,1 г крахмала, добавляют 0,1 г салицилата цинка. Растирание продолжают в течение 5-10 минут. Добавляют к расплавленному ПЭГ-1500 заранее приготовленный раствор ПЭГ-400 с пропиленгликолем и бензиловым спиртом. Перемешивают 2-3 минуты. Затем добавляют тщательно растертую смесь салицилата цинка с крахмалом. Перемешивание продолжают в течение 30-60 минут при нагревании на водяной бане при 50-80°С. Затем выключают мешалку и мазь в горячем виде фасуют в пластиковые банки с завинчивающейся пластиковой крышкой. Охлаждают при температуре 0-4°С.
Вариант №2
Состав:
Салицилат цинка - 0,1 г
Полиэтиленгликоль-1500 (ПЭГ-1500) - 5 г
Полиэтиленгликоль-400 (ПЭГ-400) - 2,88 мл
Пропиленгликоль - 0,06 мл
Бензиловый спирт - 0,06 мл
Крахмал - 0,1 г
Изопропиловый спирт - 2 мл
Технология получения: ПЭГ-1500 расплавляют на водяной бане при интенсивном перемешивании. Отдельно растирают в ступке 0,1 г крахмала, добавляют 0,1 г салицилата цинка. Растирание продолжают в течение 5-10 минут. Добавляют к расплавленному ПЭГ-1500 заранее приготовленный раствор ПЭГ-400 с пропиленгликолем, бензиловым спиртом и изопропиловым спиртом. Перемешивают 2-3 минуты. Затем добавляют тщательно растертую смесь салицилата цинка с крахмалом. Перемешивание продолжают в течение 30-60 минут при нагревании на водяной бане при 50-80°С. Затем выключают мешалку и мазь в горячем виде фасуют в пластиковые банки с завинчивающейся пластиковой крышкой. Охлаждают при температуре 0-4°С.
Чертежи
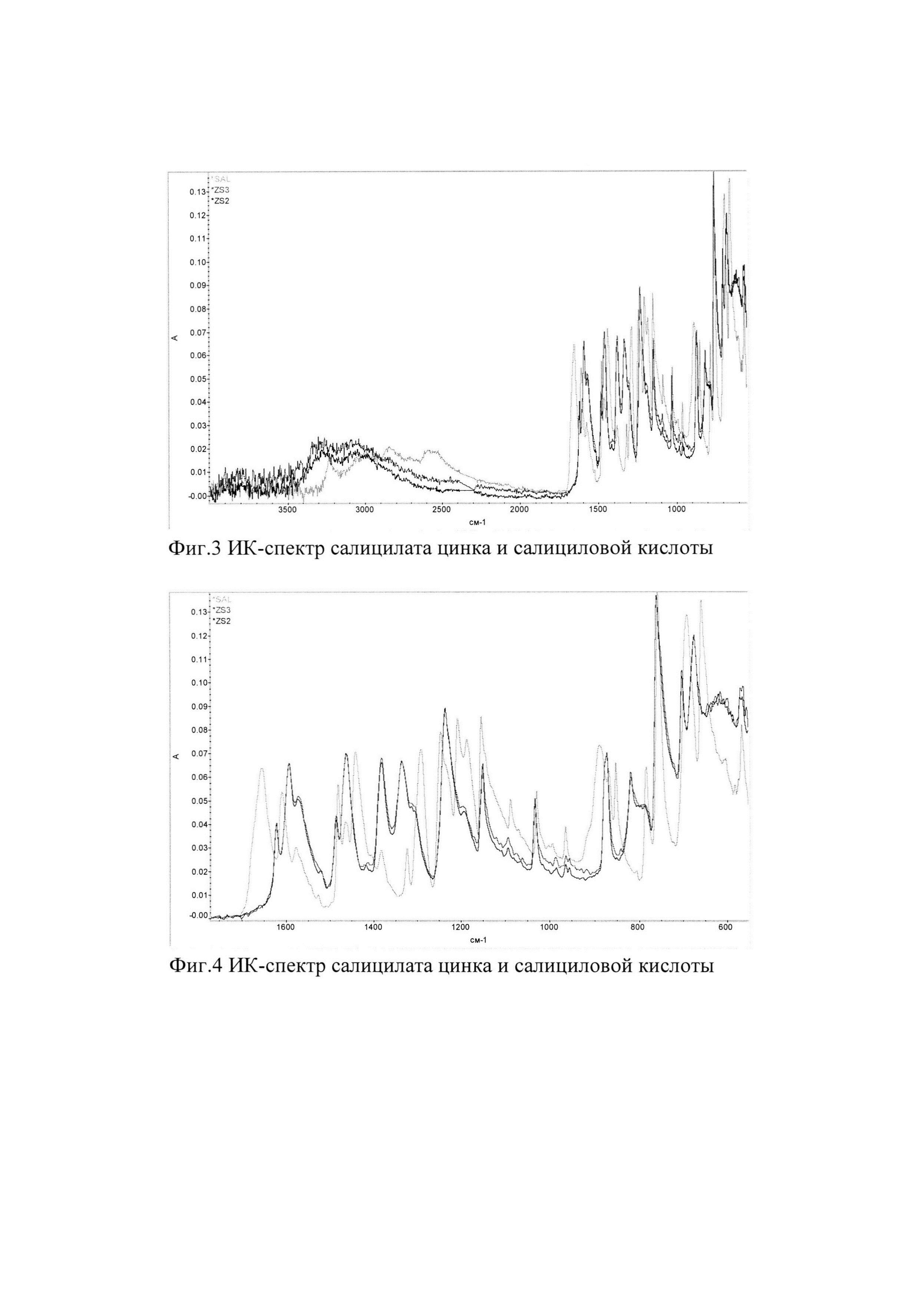
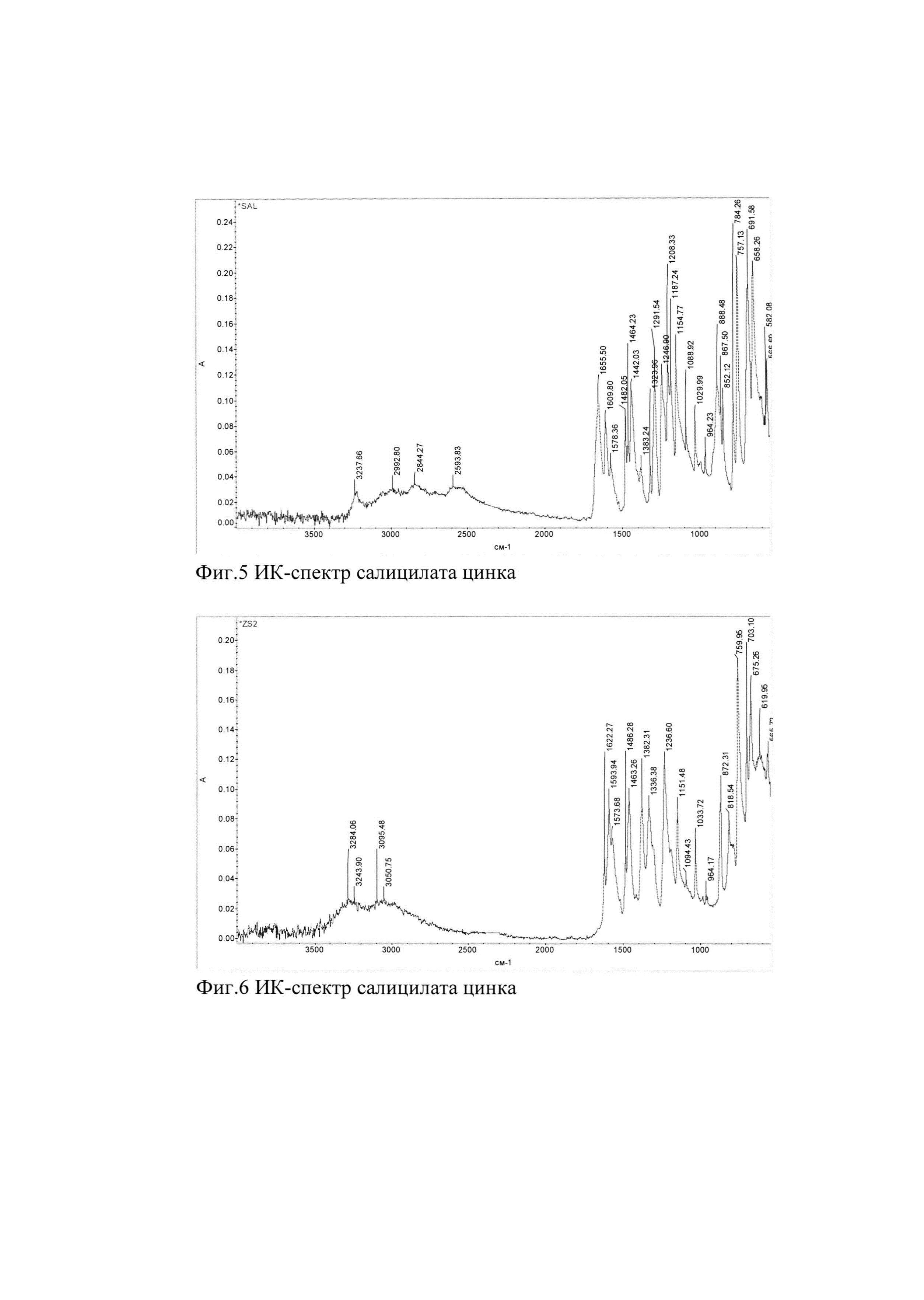
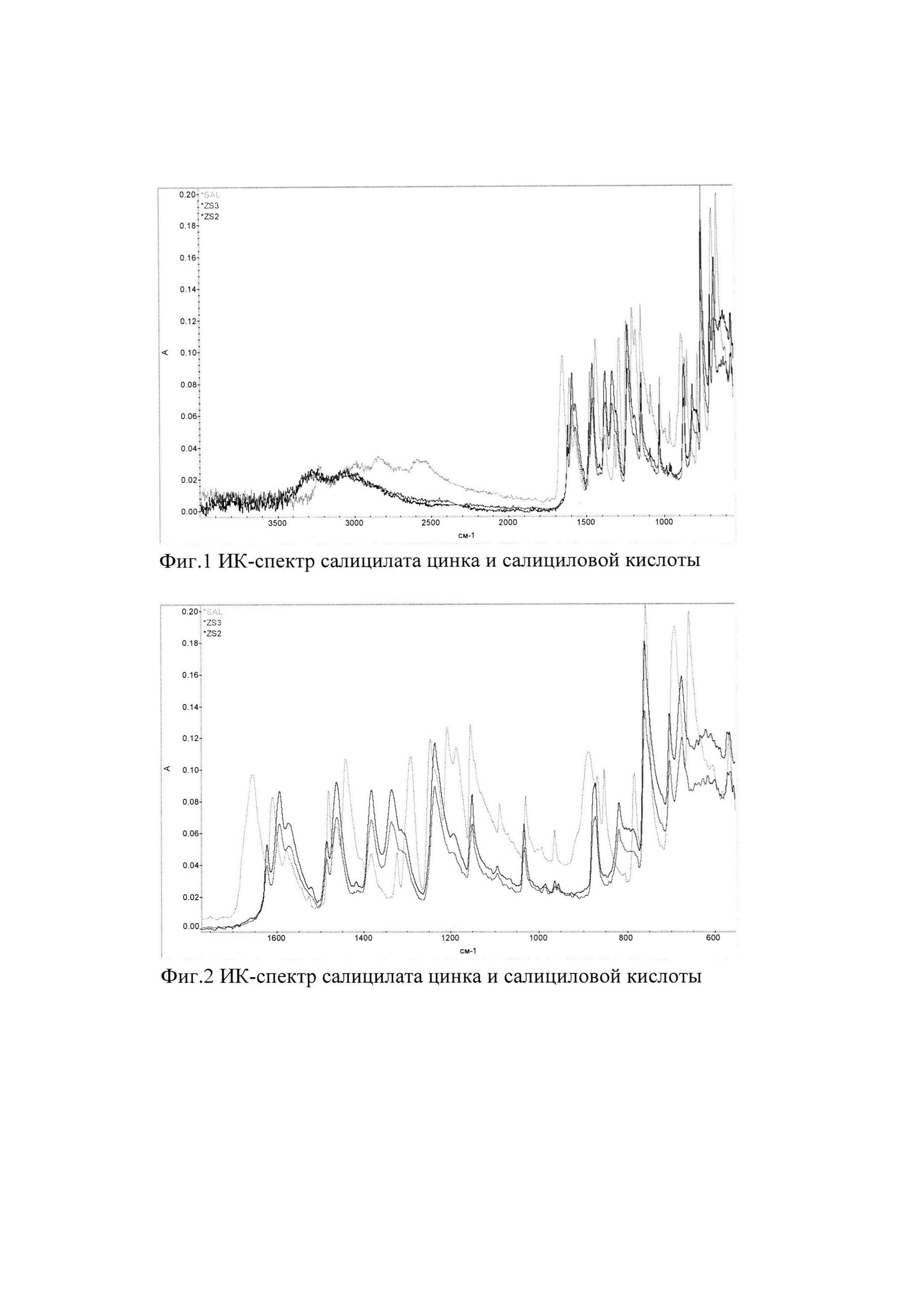
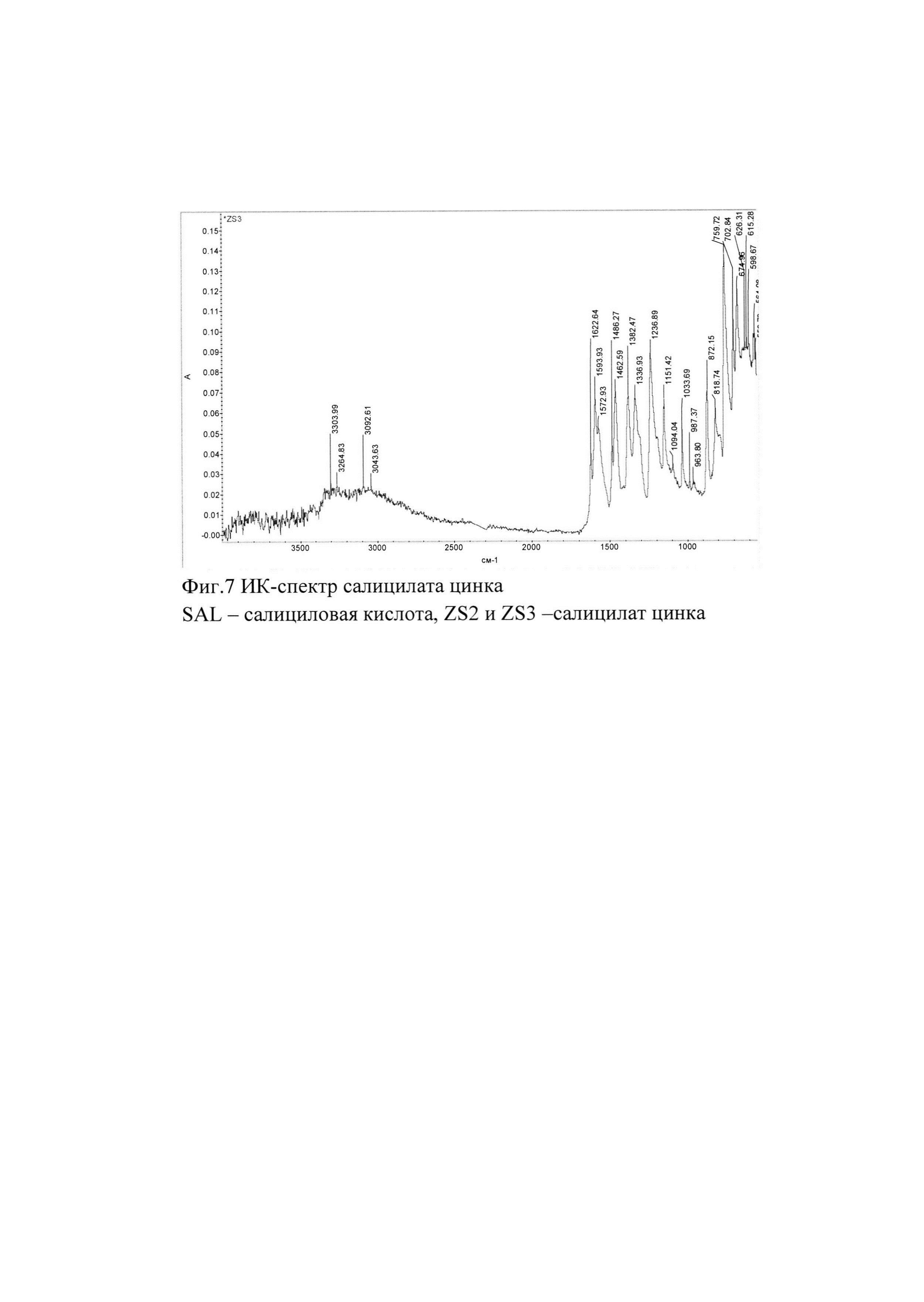
Фигуры 1-7 являются ИК-спектрами салицилата цинка и салициловой кислоты.
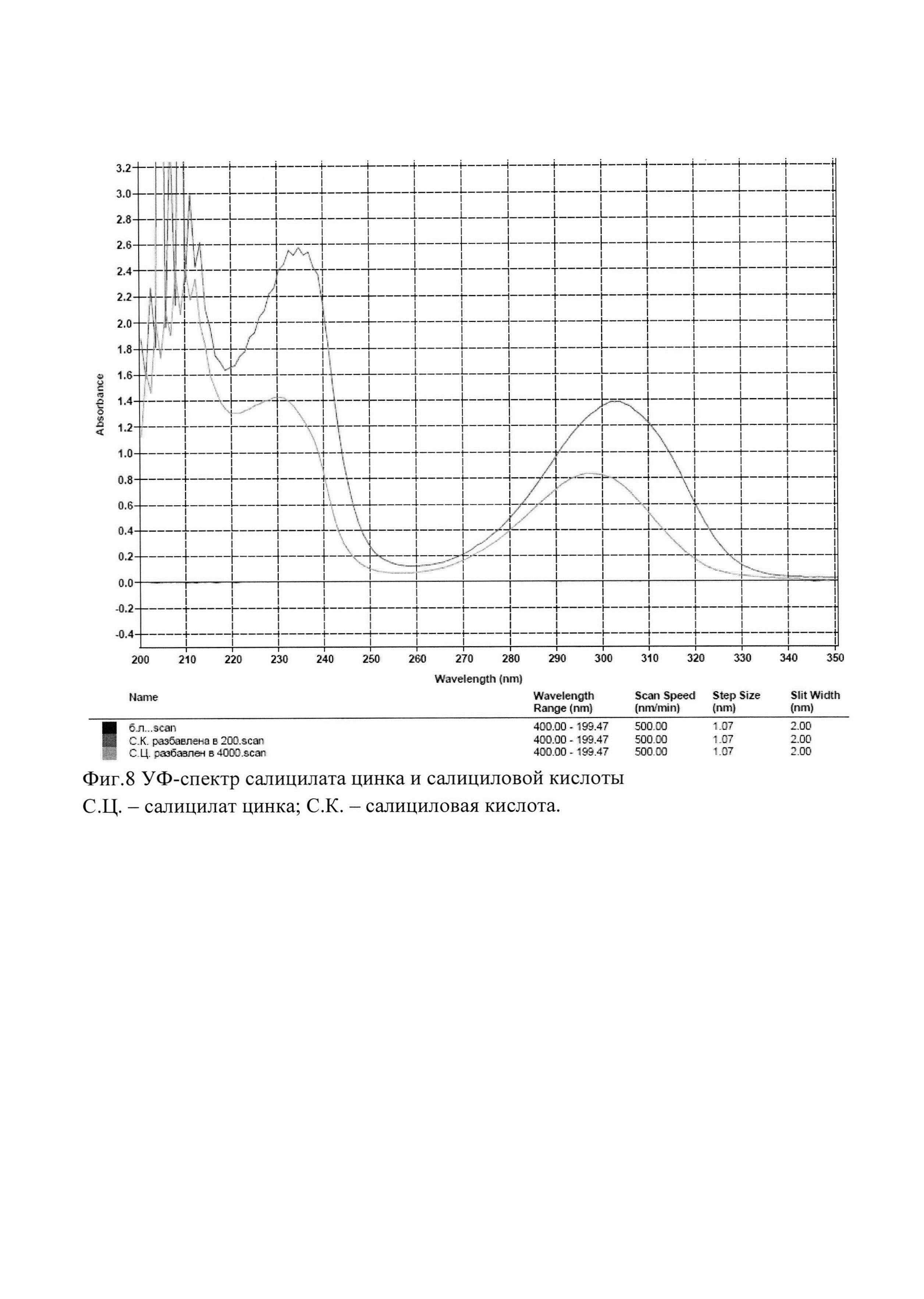
Фигура 8 является УФ-спектром салицилата цинка и салициловой кислоты.
Фигуры 9-10 являются микрофотографиями кристаллов салицилата цинка.
Фигуры 11-14 являются фотографиями раневой поверхности на 8-й день лечения, соответственно, мазевой основой без салицилата цинка, мазью с 1% салицилата цинка, мазью «левомеколь» и контрольной группы животных без лечения.
Список литературы
1. Wayne K. Stadelmann, MD, Alexander G. Digenis, MD, Gordon R. Tobin, MD, Physiology and Healing Dynamics of Chronic Cutaneous Wounds // Am J Surg. 1998;176(Suppl 2A):26S-38S
2. Брайловская Т.В. Морфологическая характеристика течения раневого процесса при экспериментальном моделировании резаных и рвано-ушибленных кожных ран / Т.В. Брайловская, Т.А. Федорина // Биомедицина. - 2009. - Вып. №1. - С. 68-74.
3. Володина Т.А. Исследование репаративных свойств фитогеля, содержащего экстракты чабреца и солодки / Т.А. Володина, Н.А. Пеньевская, С.И. Викторов, М.А. Огай, А.В. Майорова // Фундаментальные исследования, 2012. - Вып. №11 -2. - С. 472-477.
4. Грабарская Е.А. Изучение ранозаживляющей активности новой многокомпонентной мази / Е.А. Грабарская, Н.В. Данилевская, А.А. Дельцов, А.А. Правда // РВЖ МДЖ. - 2015. - Вып. №3. - С. 48-50.
5. Ямсков И.А., и соавт. Патент РФ №2468814. Ранозаживляющий гель. 2011.
6. Mrinal Gupta, Vikram K. Mahajan, Karaninder S. Mehta, and Pushpinder S. Chauhan, Zinc Therapy in Dermatology: A Review // Dermatology Research and Practice Volume 2014, Article ID 709152, http://dx.doi.Org/10.1155/2014/709152
7. Яковчук T.B., Катюшина O.B., Хусаинов Д.Р., Коренюк И.И., Гамма Т.В., Черетаев И.В., Колотилова О.И. Противовоспалительная активность солей салициловой и ацетилсалициловой кислот // Ученые записки Таврического национального университета им. В.И. Вернадского Серия «Биология, химия». Том 24 (63). 2011. №2. С. 332-338.
8. Туйебахова З.К. Колебательные спектры салициловой кислоты и салицилаты кобальта(II), никеля (II), марганца (II), цинка и кадмия. Дисс. к.х.н.; М.: 1984.
9. Pascale Lemoine, Bernard Viossat, Nguyen Huy Dung, Alain Tomas, Georges Morgantc, Frederick T. Greenaway, John R.J. Sorenson, Synthesis, crystal structures, and anti-convulsant activities of ternary [ZnII(3,5-diisopropylsalicylate)2], [ZnII(salicylate)2] and [ZnII(aspirinate)2] complexes // Journal of Inorganic Biochemistry 98 (2004) 1734-1749
10. T.B. Кокшарова, С.В. Курандо, И.В. Стоянова, С.Э. Самбурский. Координационные соединения салицилатов 3d-металлов с 4-фенилтиосемикарбазидом // Вiсник ОНУ, Том 15, випуск 2, 2010, С. 23-28.
11. Отчет по договору № б/н от 13.03.2019 г «Доклиническое изучение ранозаживляющего действия мазевых композиций ПЭГ/ZS и ПЭГ/PG», ФГБОУ ВО РязГМУ, Рязань, 2019.
Лекарственное средство в форме мази, обладающее ранозаживляющим действием, отличающееся тем, что в качестве действующего вещества содержит салицилат цинка в количестве 0,1-10 мас.%, который перед введением в мазевую основу подвергают механическому взаимодействию с крахмалом, взятым в соотношении 1:1 или 1:2 по массе, а в качестве мазевой основы содержит смесь полиэтиленгликолей, необязательно с добавлением других вспомогательных веществ.