Результат интеллектуальной деятельности: РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pPicZαA/BChE-14, СОДЕРЖАЩАЯ ГЕН МОДИФИЦИРОВАННОЙ БУТИРИЛХОЛИНЭСТЕРАЗЫ ЧЕЛОВЕКА, ПРЕДНАЗНАЧЕННАЯ ДЛЯ ЭКСПРЕССИИ ГЕНА БУТИРИЛХОЛИНЭСТЕРАЗЫ В МЕТИЛОТРОФНЫХ ДРОЖЖАХ PICHIA PASTORIS ДЛЯ ТЕРАПИИ ОТРАВЛЕНИЙ ФОСФОРОРГАНИЧЕСКИМИ ТОКСИНАМИ
Вид РИД
Изобретение
Изобретение относится к биотехнологии, а именно: к соданю генетических конструкций для получения рекомбинантной бутирилхолинэстеразы человека (БуХЭ) и может быть использовано в медицине в терапии отравлений фосфорорганическими токсинами.
Объектом исследования является фермент бутирилхолинэстераза, которая является естественным аналогом фермента ацетилхолинэстеразы по механизму действия. Фермент ацетилхолинэстераза является мишенью для большого спектра нервнопаралитических токсинов, наркотических средств. Введение обезьянам (М. mulatto) больших дозировок фермента бутирилхолинэстеразы (30 мг/кг) значимых отклонений от нормы в поведенческой активности и физико-химических показателях крови выявлено не было в течение 4-х недель наблюдения [Lockridge О., Masson P. Neurotoxicology. 2000]. Аналогичные результаты получены и для морских свинок [Saxena A. et al. Biochem Pharmacol. 2011].
Фермент бутирилхолинэстераза является стехиометрическим антидотом, что означает, что один эквивалент фермента необратимо взаимодействует с одним эквивалентом отравляющего вещества. Ранее, рациональным дизайном был создан мутантный вариант бутирилхолинэстеразы - G117H, для которого показана способность гидролизовать субстрат экотиофат [Millard СВ, Lockridge О, Broomfield СА. Biochemistry. 1995]; параоксон [Lockridge О, Blong RM, Masson Р, Froment МТ, Millard СВ, Broomfield СА, Biochemistry. 1997]; метил параоксон и диизопропилфосфат [Schopfer LM et al., J Med Chem Def. 2004]; зарин, зоман, Vx [Millard CB, Lockridge O, Broomfield CA. Biochemistry. 1998].
Известны мутантные формы фермента бутирилхолинэстеразы также способные гидролизовать экотиофат, а именно L286H, L286GHG, L286HG, L286GH, G117E, G117D, W231A, G117H/E197Q, E197Q, G117H/E197D, G117H/E197G, G117H/W82F, G117H/A328G [Schopfer LM et al., J Med Chem Def 2004].
Недостатками всех перечисленных мутантов является резкое падение уровня гидролиза аналогов природных эфирных субстратов ацетилтиохолина и бутирилтиохолина [Wang Y. et al. Toxicol Appl Pharmacol. 2004]. А также все перечисленные мутанты обладают способностью к необратимой инактивации после взаимодействия с фосфатами, называемой «старением» [Millard СВ, Lockridge О, Broomfield СА. Biochemistry. 1998]. Таким образом, наиболее эффективным признан мутант эффективным считается G117H/E197D, обладающий наименьшим эффектом старения.
Известен способ получения бутирилхолинэстеразы человека очисткой плазмы крови. Современный протокол, опубликованный в 2005 г., рассчитан на обработку 100 литров плазмы крови человека за один цикл очистки. Протокол промышленной очистки БуХЭ из плазмы крови защищен патентом US 20060194301 A1. Широкомасштабная очистка БуХЭ из плазмы крови человека по данному протоколу занимает от 14 дней, требует специально подготовленных реактивов и посуды и имеет не более, чем 50%-ный выход, однако позволяет получать чБуХЭ 80%-ной чистоты, а также препарат особой чистоты (>95%), используя дополнительные циклы очитки с помощью ВЭЖХ [Jbilo О. et al. Eur J Biochem. 1994].
Недостатками этого метода являются высокая цена исходного материала. Повышенные требования к качеству сырья вследствие высокой опасности заражения образца опасными вирусами.
Известен способ получения рекомбинантной низкогликозилированной БуХЭ в нелимфоидных клетках линии СНО [Nachon F. et al. Eur J Biochem. 2002]. При наращивании клеток в роллере в течение длительного времени удалось получить 3-5 мг белка на литр ростовой среды.
Недостатком этого способа является крайне низкий уровень продукции, так как для обеспечения рентабельности производства требуется увеличить уровень продукции до 50-100 мг на литр ростовой среды.
Известен способ получения рекомбинантной БуХЭ в трансгенных животных. Ген БуХЭ был помещен под контроль β-казеинового промотора козы. Полученная генетическая конструкция была введена методом микроинъекции в пронуклеосы выращенных in vitro зигот коз. Проведенные исследования показали, что в литре молока трансгенных коз обнаруживается от 1 до 5 грамм активной БуХЭ. Проект оказался перспективным [Yang X., Carter M.G. Proc Natl Acad Sci USA. 2007]. Компания PharmAthene, Inc. анонсировала выпуск препарата Protexia®; в 2009 году трансгенный препарат прошел первую стадию предклинических испытаний (NCT00333528 and NCT00744146), однако позже проект был закрыт в связи с нерентабельностью производства.
Недостатком этого способа является получение фермента с недостаточным гликозилирование, что снижает его фармакологические показатели.
Известен способ получения активной БуХЭ из трансгенных растений табака Бентхама (N. benthamiana) [Geyer B.C. et al. Proc Natl Acad Sci USA. 2010]. Так как представительность кодирующих кодонов в геномах человека и растений различаются, исследователи модифицировали последовательность ДНК БуХЭ человека, заменив часть непредпочтительных кодонов и изменив участки гена, влияющие на эффективность транскрипции и стабильность иРНК. Также было уменьшено количество сайтов моделирования [Geyer B.C. et al. Plant Biotechnol. J. 2010]. В результате исследователям удалось получить трансгенные растения с уровнем экспрессии БуХЭ до 1,3% от общей фракции растворимых белков (около 100 мг на килограмм сырой биомассы).
Недостатками данного способа является измененный профиль гликозилирования, что снижает его фармакологические свойства.
Экспрессии рекомбинантной БуХЭ в клетках Escherichia coli приводила к получению неактивного фермента вследствие отсутствия необходимых посттрансляционных модификаций рекомбинантных полипептидных цепей и образования нерастворимых телец включения [Myers Т.М. et al. Neurotoxicol Teratol. 2012].
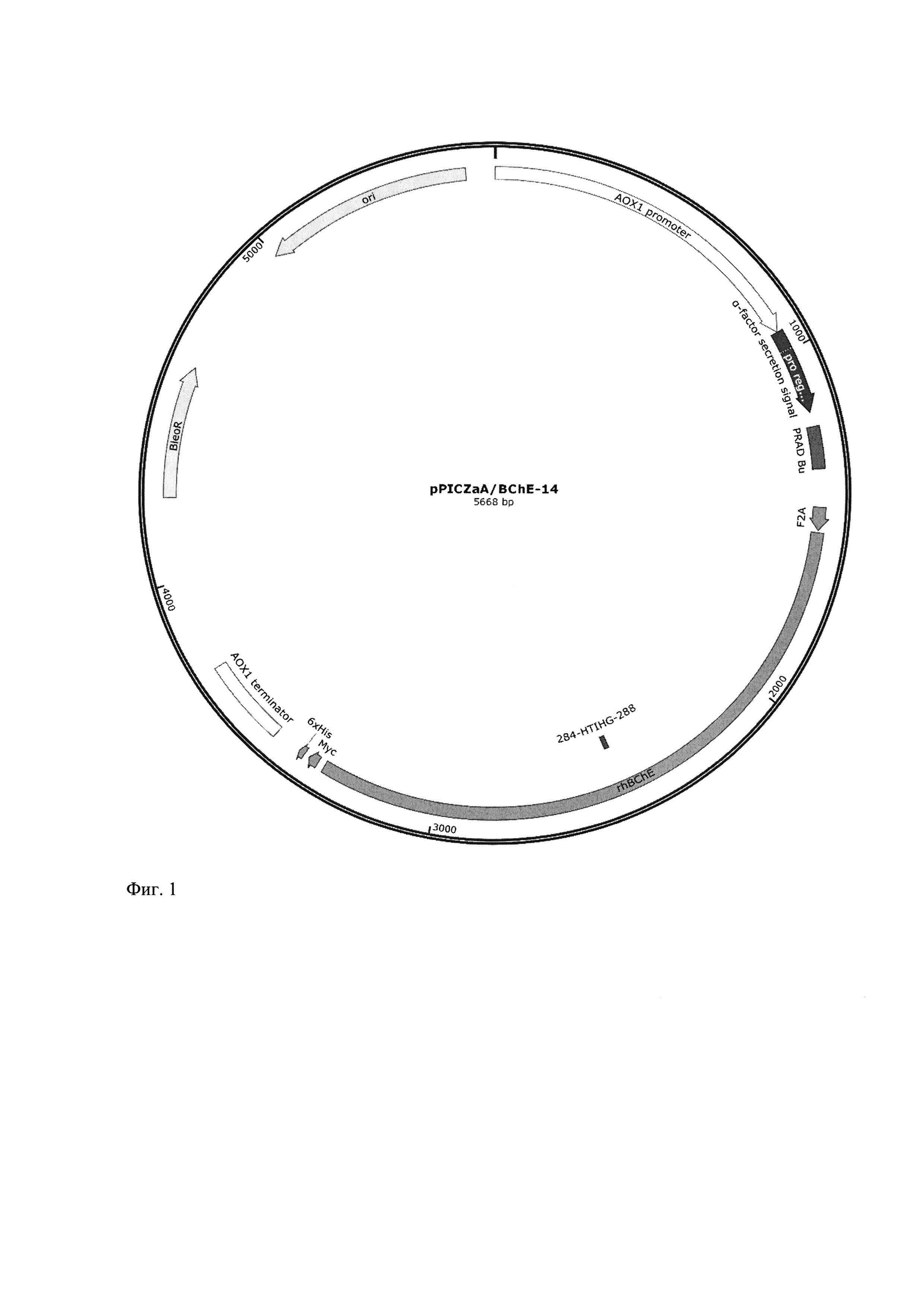
Ближайшим аналогом заявленного изобретения является патент US 2015184138 A1 (Д1) (дата публикации 02.07.2015), из которого известен рекомбинантный вектор, кодирующий бутирилхолинэстеразу и предназначенный для ее экспрессии в клетках дрожжей (см. Д 1, claims 15, 16, 19). Однако заявленное изобретение отличается от ближайшего аналога тем, что плазмидная ДНК pPicZαA/BChE-14 состоит из плазмиды pPicZaA, содержащей промотор гена алкогольоксидазы АОХ 1 дрожжей P. pastoris дикого типа, нативный терминатор и сигнал полиаденилирования АОХ 1 гена, последовательность гена BleoR, нуклеотидную последовательность сигнального пептида альфа-фактора из S.cerevisiae, нуклеотидную последовательность пролинбогатого пептида PRAD, нуклеотидную последовательность самопроцессирующегося пептида F2A, находящийся в единой рамке считывания с геном модифицированной бутирилхолинэстеразы и нуклеотидной последовательности синтетического гена модифицированной бутирилхолинэстеразы человека.
Изобретение решает задачу получения рекомбинантной бутирилхолинэстеразы человека в клетках дрожжей.
Поставленная задача решается за счет создания генетической конструкции - рекомбинантная плазмидная ДНК pPicZαA/BChE, кодирующая БуХЭ человека, состоящая из плазмиды pPicZαA, содержащая:
1) индуцибельный промотор гена алкогольоксидазы АОХ1 дрожжей P. pastoris дикого типа, нативный терминатор и сигнал полиаденилирования АОХ1 гена,
2) последовательность гена BleoR, продукт которого обеспечивает устойчивость трансформантов к антибиотику зеоцину,
3) нуклеотидную последовательность сигнального пептида альфа-фактора из S. cerevisiae, необходимую для секреции экспрессируемых продуктов в культуральную среду,
4) нуклеотидную последовательность пролинбогатого пептида PRAD, обеспечивающего получения тетрамерной формы фермента модифицированной бутирилхолинэстеразы,
5) нуклеотидную последовательность самопроцессирующегося пептида F2A, находящийся в единой рамке считывания с геном модифицированной бутирилхолинэстеразы и нуклеотидной последовательности пролинбогатого пептида PRAD, обеспечивающую одновременную экспрессию генов фермента бутирилхолинэстеразы и пролинбогатого пептида PRAD,
6) нуклеотидную последовательность синтетического гена модифицированной бутирилхолинэстеразы человека, кодирующую вариант фермента бутирилхолинэстеразы с заменой последовательности 284-TPLSV-288 на последовательность 284-HTIHG-288, обеспечивающую продукцию модифицированного фермента rhBChE-14, способного к реактивации после ковалентного ингибирования параоксоном и не подверженного старению
Изобретение иллюстрируют следующими графическими материалами:
Фиг. 1. Схема генетической конструкции - рекомбинантной плазмидной ДНК pPicZαA/BChE-14.
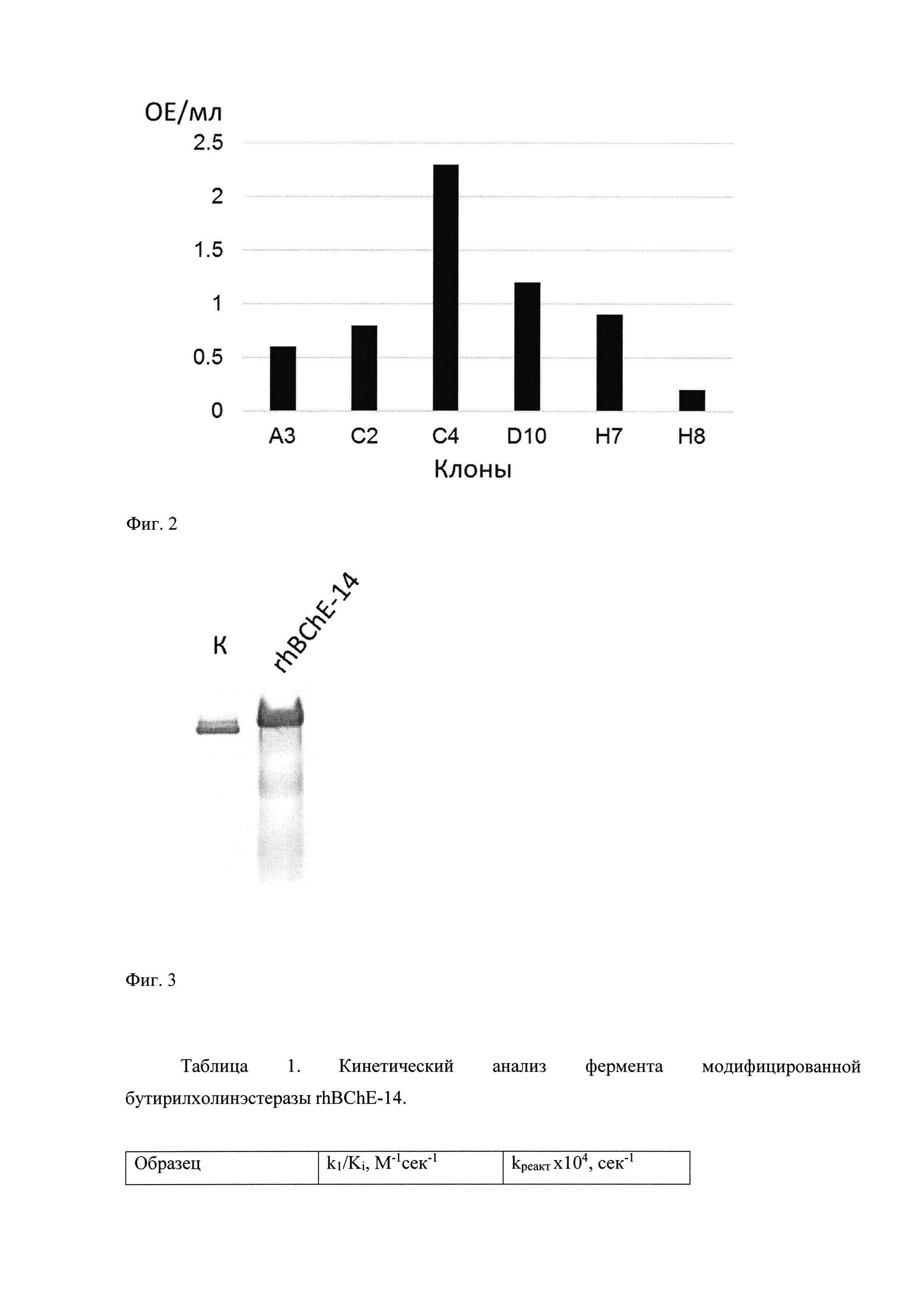
Фиг. 2. Аналитическая экспрессия клонов, полученных после трансформации дрожжей Р. pastoris. Представлена активность фермента в культуральной жидкости лучших клонов из серии трансформации.
Фиг. 3. Анализ олигомерного состава продукции модифицированной бутирилхолинэстеразы.
Таблица 1. Кинетический анализ фермента модифицированной бутирилхолинэстеразы rhBChE-14.
Изобретение иллюстрируют следующими примерами.
ПРИМЕР 1
Создание генетической конструкции pPicZαA/BChE.
Последовательность гена модифицированной бутирилхолинэстеразы получают из генетической конструкции pBudCE/EF/BCHE Ilyushin D.G. et al. Proc. Natl. Acad. Sci. USA. 2013 с использованием ПЦР с перекрывающихся праймеров и набора олигонуклеотидов atctcgaggatagcaaagtcacaatcatatgcat, gtcccctatgggcacaccatccacggt, cacaccatccacggtaactttggtccgac, aagcggccgctcagagacccacacaactttctttct и последующим клонированием в вектор pPicZαA/F2A-PRAD с использованием эндонуклеаз рестрикции NotI и XhoI, с получением генетической конструкции pPicZαA/BChE-14 (Фиг. 1).
Вектор pPicZαA/F2A-PRAD получают из генетической конструкции pFUSE MAR PRAD-F2A-BChE [Terekhov et al., Biochimie 2015] методом ПЦР и набора олигонуклеотидов - aggtcgacaaaagagaagcatggtctcaccct и tcgagcgggcccggggttggactcgacgtca и последующим клонированием в вектор pPicZαA с использованием эндонуклеаз рестрикции SalI и XhoI, и обязательной проверкой гена секвенированием последовательности целевой плазмиды.
ПРИМЕР 2
Трансформация и аналитическая экспрессия генетической конструкции pPicZαA/BChE-14.
Полученную конструкцию pPicZαA/BChE линеаризуют и используют для серии трансформаций клеток штамма GS115 P. pastoris. Селекцию проводят с использованием антибиотика зеоцина в концентрации 1.5 мг/мл. Для отбора клонов штамма-продуцента клетки выращивают в среде BMGY, осаждают центрифугированием, меняют среду на BMMY и культивируют 96 ч, добавляя в культуральную среду метанол до 0.5% каждые 24 ч. По окончании экспрессии аликвоты культуральной жидкости анализируют методом Эллмана (Фиг. 2).
Было установлено, что наибольший уровень экспрессии рекомбинантной БуХЭ, полученной в дрожжах P. pastoris, показал клон С4 - 2.3 ОЕ/мл.
ПРИМЕР 3
Анализ олигомерного состава модифицированной бутирилхолинэстеразы человека rhBChE-14.
Электрофоретическое разделение белков в ПААГ в не денатурирующих условиях проводили по стандартной методике. Пробы, контрольный образец и образец модифицированной бутирилхолинэстеразы человека rhBChE-14, наносили в буфере: 10%-ный глицерин, 0.2 М Трис-HCl, рН 7.5. Электрофорез в концентрирующем геле проводили при силе тока 8-10 мА на 1 пластину геля, а в разделяющем геле при 15-20 мА. По окончании электрофоретического разделения белков в не денатурирующем ПААГ пластина с гелем переносилась в раствор, содержащий 125 мМ NaOH, 125 мМ малеиновой кислоты, 11.6 мМ цитрата натрия, 10мМ CuS04, 550 мкМ гексацианоферрата(III) калия и 2-мМ бутирилтиохолин йодида. Гель инкубировали в растворе в течение 3-8 ч при комнатной температуре на орбитальном шейкере. Оценку олигомерного состава проводили методом денситометрии полиакриламидного геля использование программного обеспечения TotalLab TL120. Анализ результатов свидетельствует о том, что синтезированный целевой продукт модифицированной бутирилхолинэстеразы человека rhBChE-14 активен и соотношение мономерной :димерной:тетрамерной форм равно 17:14:69 процентов, соответственно (Фиг. 3).
ПРИМЕР 4
Анализ кинетических параметров.
Для оценки реакционной способности полученных препаратов по отношению к параоксону проводили кинетические измерения по следующей схеме: образец модифицированной бутирилхолинэстеразы человека rhBChE-14 в концентрации 2 нМ прединкубировали с параоксоном в концентрации 6 мкМ в течение 5 мин в 0,1 М фосфатном буфере (рН = 7.4) при 25°С. После инкубации проводили исследования остаточной активности по стандартной методике Элмана с 1 мМ бутирилтиохолин йодида (ВТС) и 0,5 мМ DTNB в качестве субстрата в 0.1 М калий-фосфатном буфере рН 7.2. Для измерений использовали плашечный спектрофотометрофлуориметр Varioscan (Thermo Scientific, США, ЦКП «Технопарк ИБХ»). Измерения вели при длине волны 405 нм в течении 60 мин Полученные данные анализировали в программе SigmaPlot (ver. 11.0, SYSTAT Software). Количество активных центров БуХЭ определяли титроваванием с диизопропилфторфосфатом (ДФФ) по стандартной методике Элмана. Наблюдаемые константы ингибирования рассчитывали, как угол наклона линейного участка кривой на графике Ln(E/E0) от времени (Таблица 1)
Приложение 1.
Нуклеотдная последовательность рекомбинантной плазмидной ДНК pPicZαA/BChE-14


Приложение 1.
Нуклеотдная последовательность рекомбинантной плазмидной ДНК
pPicZαA/BChE-14
AGATCTAACATCCAAAGACGAAAGGTTGAATGAAACCTTTTTGCCATCCGAC
ATCCACAGGTCCATTCTCACACATAAGTGCCAAACGCAACAGGAGGGGATAC
ACTAGCAGCAGACCGTTGCAAACGCAGGACCTCCACTCCTCTTCTCCTCAAC
ACCCACTTTTGCCATCGAAAAACCAGCCCAGTTATTGGGCTTGATTGGAGCTC
GCTCATTCCAATTCCTTCTATTAGGCTACTAACACCATGACTTTATTAGCCTGT
CTATCCTGGCCCCCCTGGCGAGGTTCATGTTTGTTTATTTCCGAATGCAACAA
GCTCCGCATTACACCCGAACATCACTCCAGATGAGGGCTTTCTGAGTGTGGG
GTCAAATAGTTTCATGTTCCCCAAATGGCCCAAAACTGACAGTTTAAACGCT
GTCTTGGAACCTAATATGACAAAAGCGTGATCTCATCCAAGATGAACTAAGT
TTGGTTCGTTGAAATGCTAACGGCCAGTTGGTCAAAAAGAAACTTCCAAAAG
TCGGCATACCGTTTGTCTTGTTTGGTATTGATTGACGAATGCTCAAAAATAAT
CTCATTAATGCTTAGCGCAGTCTCTCTATCGCTTCTGAACCCCGGTGCACCTG
TGCCGAAACGCAAATGGGGAAACACCCGCTTTTTGGATGATTATGCATTGTC
TCCACATTGTATGCTTCCAAGATTCTGGTGGGAATACTGCTGATAGCCTAACG
TTCATGATCAAAATTTAACTGTTCTAACCCCTACTTGACAGCAATATATAAAC
AGAAGGAAGCTGCCCTGTCTTAAACCTTTTTTTTTATCATCATTATTAGCTTAC
TTTCATAATTGCGACTGGTTCCAATTGACAAGCTTTTGATTTTAACGACTTTTA
ACGACAACTTGAGAAGATCAAAAAACAACTAATTATTCGAAACGATGAGATT
TCCTTCAATTTTTACTGCTGTTTTATTCGCAGCATCCTCCGCATTAGCTGCTCC
AGTCAACACTACAACAGAAGATGAAACGGCACAAATTCCGGCTGAAGCTGTC
ATCGGTTACTCAGATTTAGAAGGGGATTTCGATGTTGCTGTTTTGCCATTTTC
CAACAGCACAAATAACGGGTTATTGTTTATAAATACTACTATTGCCAGCATTG
CTGCTAAAGAAGAAGGGGTATCTCTCGAGAAAAGAGAAGCATGGTCTCACCC
TCAGTTCGAAAAGCAACCTTCTCCGCCTCTTCCCCCGCCTCCGCCCCCACCAC
CTCCTCCTCCGCCTCCGCCCCCTCCACCTCCACCGCCGCTTCCATCTCAATCTG
CACCATCTGCCGGTTCTGCTGCACCGCGGGACTACAAAGACCATGACGGTGA
TTATAAAGATCATGACATCGATTACAAGGATGACGATGACAAGACTAGTGAA
GCCAGACACAAACAGAAAATTGTGGCTCCGGTGAAACAGACTTTGAATTTTG
ACCTTCTCAAGTTGGCGGGTGACGTCGAGTCCAACCCCGGGCCCCTCGAGGA
TAGCAAAGTCACAATCATATGCATCAGATTTCTCTTTTGGTTTCTTTTGCTCTG
CATGCTTATTGGGAAGTCACATACTGAAGATGACATCATAATTGCAACAAAG
AATGGAAAAGTCAGAGGGATGAACTTGACAGTTTTTGGTGGCACGGTAACAG
CCTTTCTTGGAATTCCCTATGCACAGCCACCTCTTGGTAGACTTCGATTCAAA
AAGCCACAGTCTCTGACCAAGTGGTCTGATATTTGGAATGCCACAAAATATG
CAAATTCTTGCTGTCAGAACATAGATCAAAGTTTTCCAGGCTTCCATGGATCA
GAGATGTGGAACCCAAACACTGACCTCAGTGAAGACTGTTTATATCTAAATG
TATGGATTCCAGCACCTAAACCAAAAAATGCCACTGTATTGATATGGATTTAT
GGTGGTGGTTTTCAAACTGGAACATCATCTTTACATGTTTATGATGGCAAGTT
TCTGGCTCGGGTTGAAAGAGTTATTGTAGTGTCAATGAACTATAGGGTGGGT
GCCCTAGGATTCTTAGCTTTGCCAGGAAATCCTGAGGCTCCAGGGAACATGG
GTTTATTTGATCAACAGTTGGCTCTTCAGTGGGTTCAAAAAAATATAGCAGCC
TTTGGTGGAAATCCTAAAAGTGTAACTCTCTTTGGAGAAAGTGCAGGAGCAG
CTTCAGTTAGCCTGCATTTGCTTTCTCCTGGAAGCCATTCATTGTTCACCAGA
GCCATTCTGCAAAGTGGTTCCTTTAATGCTCCTTGGGCGGTAACATCTCTTTA
TGAAGCTAGGAACAGAACGTTGAACTTAGCTAAATTGACTGGTTGCTCTAGA
GAGAATGAGACTGAAATAATCAAGTGTCTTAGAAATAAAGATCCCCAAGAA
ATTCTTCTGAATGAAGCATTTGTTGTCCCCTATGGGCACACCATCCACGGTAA
CTTTGGTCCGACCGTGGATGGTGATTTTCTCACTGACATGCCAGACATATTAC
TTGAACTTGGACAATTTAAAAAAACCCAGATTTTGGTGGGTGTTAATAAAGA
TGAAGGGACAGCTTTTTTAGTCTATGGTGCTCCTGGCTTCAGCAAAGATAACA
ATAGTATCATAACTAGAAAAGAATTTCAGGAAGGTTTAAAAATATTTTTTCC
AGGAGTGAGTGAGTTTGGAAAGGAATCCATCCTTTTTCATTACACAGACTGG
GTAGATGATCAGAGACCTGAAAACTACCGTGAGGCCTTGGGTGATGTTGTTG
GGGATTATAATTTCATATGCCCTGCCTTGGAGTTCACCAAGAAGTTCTCAGAA
TGGGGAAATAATGCCTTTTTCTACTATTTTGAACACCGATCCTCCAAACTTCC
GTGGCCAGAATGGATGGGAGTGATGCATGGCTATGAAATTGAATTTGTCTTT
GGTTTACCTCTGGAAAGAAGAGATAATTACACAAAAGCCGAGGAAATTTTGA
GTAGATCCATAGTGAAACGGTGGGCAAATTTTGCAAAATATGGGAATCCAAA
TGAGACTCAGAACAATAGCACAAGCTGGCCTGTCTTCAAAAGCACTGAACAA
AAATATCTAACCTTGAATACAGAGTCAACAAGAATAATGACGAAACTACGTG
CTCAACAATGTCGATTCTGGACATCATTTTTTCCAAAAGTCTTGGAAATGACA
GGAAATATTGATGAAGCAGAATGGGAGTGGAAAGCAGGATTCCATCGCTGG
AACAATTACATGATGGACTGGAAAAATCAATTTAACGATTACACTAGCAAGA
AAGAAAGTTGTGTGGGTCTCTGAGCGGCCGCCAGCTTTCTAGAACAAAAACT
CATCTCAGAAGAGGATCTGAATAGCGCCGTCGACCATCATCATCATCATCAT
TGAGTTTGTAGCCTTAGACATGACTGTTCCTCAGTTCAAGTTGGGCACTTACG
AGAAGACCGGTCTTGCTAGATTCTAATCAAGAGGATGTCAGAATGCCATTTG
CCTGAGAGATGCAGGCTTCATTTTTGATACTTTTTTATTTGTAACCTATATAGT
ATAGGATTTTTTTTGTCATTTTGTTTCTTCTCGTACGAGCTTGCTCCTGATCAG
CCTATCTCGCAGCTGATGAATATCTTGTGGTAGGGGTTTGGGAAAATCATTCG
AGTTTGATGTTTTTCTTGGTATTTCCCACTCCTCTTCAGAGTACAGAAGATTA
AGTGAGACCTTCGTTTGTGCGGATCCCCCACACACCATAGCTTCAAAATGTTT
CTACTCCTTTTTTACTCTTCCAGATTTTCTCGGACTCCGCGCATCGCCGTACCA
CTTCAAAACACCCAAGCACAGCATACTAAATTTTCCCTCTTTCTTCCTCTAGG
GTGTCGTTAATTACCCGTACTAAAGGTTTGGAAAAGAAAAAAGAGACCGCCT
CGTTTCTTTTTCTTCGTCGAAAAAGGCAATAAAAATTTTTATCACGTTTCTTTT
TCTTGAAATTTTTTTTTTTAGTTTTTTTCTCTTTCAGTGACCTCCATTGATATTT
AAGTTAATAAACGGTCTTCAATTTCTCAAGTTTCAGTTTCATTTTTCTTGTTCT
ATTACAACTTTTTTTACTTCTTGTTCATTAGAAAGAAAGCATAGCAATCTAAT
CTAAGGGGCGGTGTTGACAATTAATCATCGGCATAGTATATCGGCATAGTAT
AATACGACAAGGTGAGGAACTAAACCATGGCCAAGTTGACCAGTGCCGTTCC
GGTGCTCACCGCGCGCGACGTCGCCGGAGCGGTCGAGTTCTGGACCGACCGG
CTCGGGTTCTCCCGGGACTTCGTGGAGGACGACTTCGCCGGTGTGGTCCGGG
ACGACGTGACCCTGTTCATCAGCGCGGTCCAGGACCAGGTGGTGCCGGACAA
CACCCTGGCCTGGGTGTGGGTGCGCGGCCTGGACGAGCTGTACGCCGAGTGG
TCGGAGGTCGTGTCCACGAACTTCCGGGACGCCTCCGGGCCGGCCATGACCG
AGATCGGCGAGCAGCCGTGGGGGCGGGAGTTCGCCCTGCGCGACCCGGCCG
GCAACTGCGTGCACTTCGTGGCCGAGGAGCAGGACTGACACGTCCGACGGCG
GCCCACGGGTCCCAGGCCTCGGAGATCCGTCCCCCTTTTCCTTTGTCGATATC
ATGTAATTAGTTATGTCACGCTTACATTCACGCCCTCCCCCCACATCCGCTCT
AACCGAAAAGGAAGGAGTTAGACAACCTGAAGTCTAGGTCCCTATTTATTTT
TTTATAGTTATGTTAGTATTAAGAACGTTATTTATATTTCAAATTTTTCTTTTT
TTTCTGTACAGACGCGTGTACGCATGTAACATTATACTGAAAACCTTGCTTGA
GAAGGTTTTGGGACGCTCGAAGGCTTTAATTTGCAAGCTGGAGACCAACATG
TGAGCAAAAGGCCAGCAAAAGGCCAGGAACCGTAAAAAGGCCGCGTTGCTG
GCGTTTTTCCATAGGCTCCGCCCCCCTGACGAGCATCACAAAAATCGACGCTC
AAGTCAGAGGTGGCGAAACCCGACAGGACTATAAAGATACCAGGCGTTTCCC
CCTGGAAGCTCCCTCGTGCGCTCTCCTGTTCCGACCCTGCCGCTTACCGGATA
CCTGTCCGCCTTTCTCCCTTCGGGAAGCGTGGCGCTTTCTCAATGCTCACGCT
GTAGGTATCTCAGTTCGGTGTAGGTCGTTCGCTCCAAGCTGGGCTGTGTGCAC
GAACCCCCCGTTCAGCCCGACCGCTGCGCCTTATCCGGTAACTATCGTCTTGA
GTCCAACCCGGTAAGACACGACTTATCGCCACTGGCAGCAGCCACTGGTAAC
AGGATTAGCAGAGCGAGGTATGTAGGCGGTGCTACAGAGTTCTTGAAGTGGT
GGCCTAACTACGGCTACACTAGAAGGACAGTATTTGGTATCTGCGCTCTGCT
GAAGCCAGTTACCTTCGGAAAAAGAGTTGGTAGCTCTTGATCCGGCAAACAA
ACCACCGCTGGTAGCGGTGGTTTTTTTGTTTGCAAGCAGCAGATTACGCGCAG
AAAAAAAGGATCTCAAGAAGATCCTTTGATCTTTTCTACGGGGTCTGACGCT
CAGTGGAACGAAAACTCACGTTAAGGGATTTTGGTCATGAGATC
Рекомбинантная плазмидная ДНК pPicZαA/BChE-14, обеспечивающая продукцию модифицированной бутирилхолинэстеразы человека rhBChE-14 и состоящая из нуклеотидной последовательности с SEQ ID NO.:1.