Результат интеллектуальной деятельности: СОЛИ ИНГИБИТОРА КИНАЗЫ РЕЦЕПТОРА ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет на основании предварительной заявки на патент США №61/611400, поданной 15 марта 2012 г., полное содержание которой включено в настоящую заявку посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[0002] В настоящем изобретении предложены солевые формы соединения, подходящего для применения в качестве мутант-селективных ингибиторов киназы рецептора эпидермального фактора роста (EGFR), включая полиморфные формы некоторых солей. В настоящем изобретении также предложены фармацевтически приемлемые композиции, содержащие солевые формы соединений согласно настоящему изобретению, и способы применения указанных композиций для лечения различных расстройств.
УРОВЕНЬ ТЕХНИКИ
[0003] Протеинтирозинкиназы представляют собой класс ферментов, которые катализируют перенос фосфатной группы от АТФ или ГТФ к остатку тирозина, находящемуся в белковом субстрате. Действие рецепторных тирозинкиназ заключается в том, что они передают сигналы с внешней стороны клетки внутрь путем активации эффекторов вторичного транспорта посредством фосфорилирования. Данные сигналы способствуют различным клеточным процессам, включая пролиферацию, утилизацию углеводов, синтез белка, ангиогенез, рост клеток и выживание клеток.
[0004] Существует серьезный прецедент в отношении участия EGFR в раке человека, поскольку более чем в 60% всех солидных опухолей происходит сверхэкспрессия по меньшей мере одного из этих белков или их лигандов. Сверхэкспрессию EGFR обычно обнаруживают в опухолях груди, легких, головы и шеи, а также мочевого пузыря.
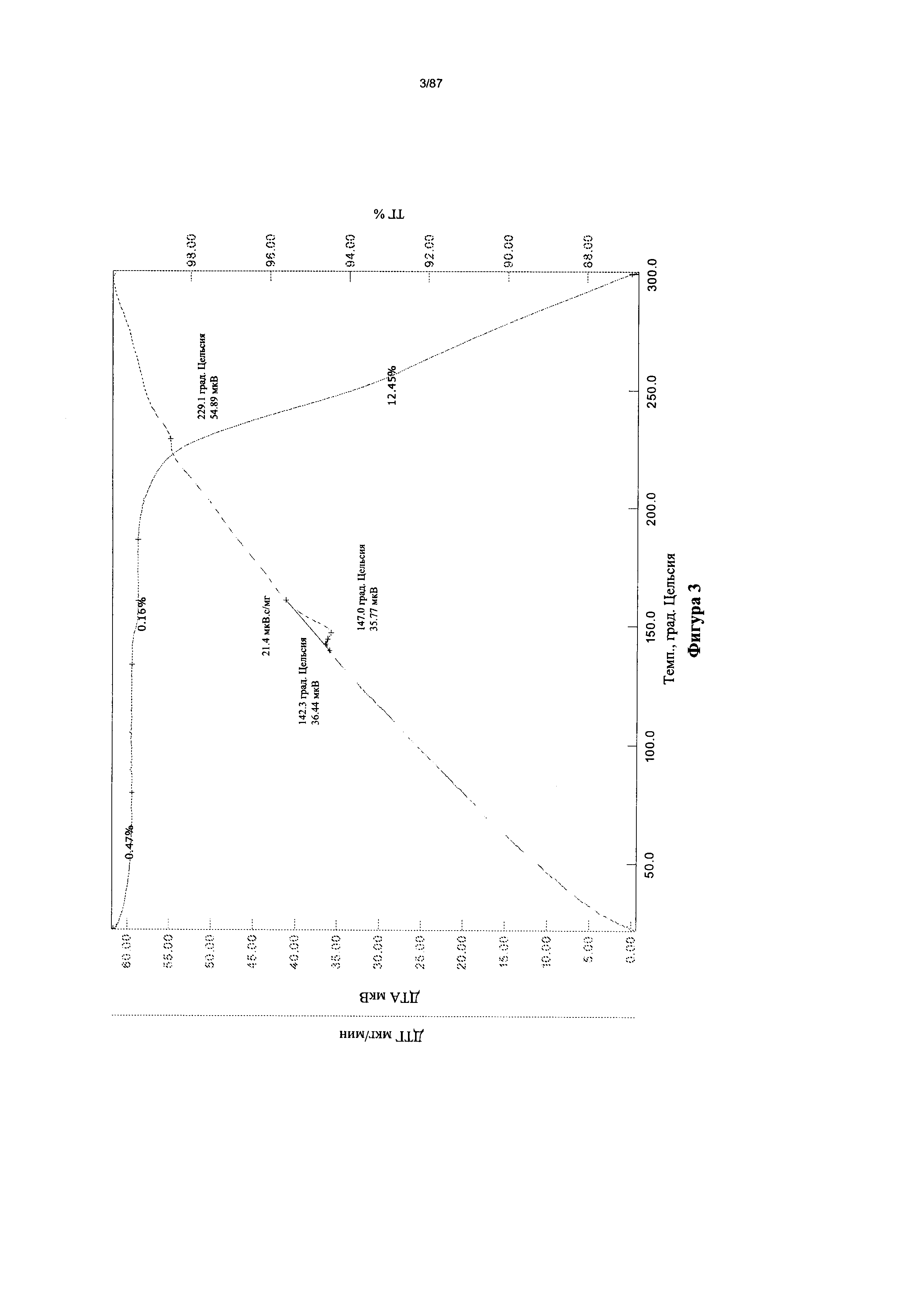
[0005] Активирующие мутации в тирозинкиназном домене EGFR были идентифицированы у пациентов с немелкоклеточным раком легких (Lin, N.U.; Winer, Е.P., Breast Cancer Res 6: 204-210, 2004). Обратимые ингибиторы: Тарцева (эрлотиниб) и Иресса (гефатиниб) - в настоящее время являются терапией первой линии для пациентов, страдающих немелкоклеточным раком легких с активирующими мутациями. Наиболее распространенными активирующими мутациями являются L858R и delE746-A750.
[0006] Кроме того, у большинства пациентов с рецидивами приобретенная устойчивость к лекарственному средству, в том числе вызванная мутацией остатка «привратника» Т790М, была выявлена по меньшей мере у половины таких клинически устойчивых пациентов. Кроме того, Т790М может также предварительно существовать; мутация Т790М может иметь независимую онкогенную роль. Например, существуют пациенты с мутацией L858R/T790M, которые никогда не получали лечения гефитинибом. Кроме того, мутации EGFR Т790М у зародышей связаны с некоторыми наследственными формами рака легких.
[0007] Разрабатываемые в настоящее время лекарственные средства, включающие ковалентные ингибиторы второго поколения, такие как BIBW2992, HKI-272 и PF-0299804, эффективны против устойчивости, вызванной мутацией Т790М, но обладают дозолимитирующей токсичностью ввиду конкурентного ингибирования EGFR дикого типа. Соответственно, остается потребность в нахождении мутант-селективных ингибиторов киназы EGFR, подходящих для применения в качестве терапевтических агентов.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0007] Авторами настоящего изобретения было обнаружено, что новые соли бензолсульфоновой кислоты, камфорсульфоновой кислоты, 1,2-этандисульфоновой кислоты, бромоводородной кислоты, хлороводородной кислоты, малеиновой кислоты, метансульфоновой кислоты, нафталин-2-сульфоновой кислоты, 1,5-нафталиндисульфоновой кислоты, щавелевой кислоты, 4-толуолсульфоновой кислоты или 2,4,6-тригидроксибензойной кислоты согласно настоящему изобретению, а также содержащие их композиции, подходят для применения в качестве мутант-селективных ингибиторов одной или более киназ EGFR и имеют желаемые для этого характеристики. В общем, данные соли и содержащие их фармацевтические композиции подходят для применения для лечения или уменьшения тяжести различных заболеваний или расстройств, подробно описанных в настоящем документе.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0008] На фигуре 1 изображена дифрактограмма рентгеновской порошковой дифракции (XRPD) для бис-безилатной соли соединения 1.
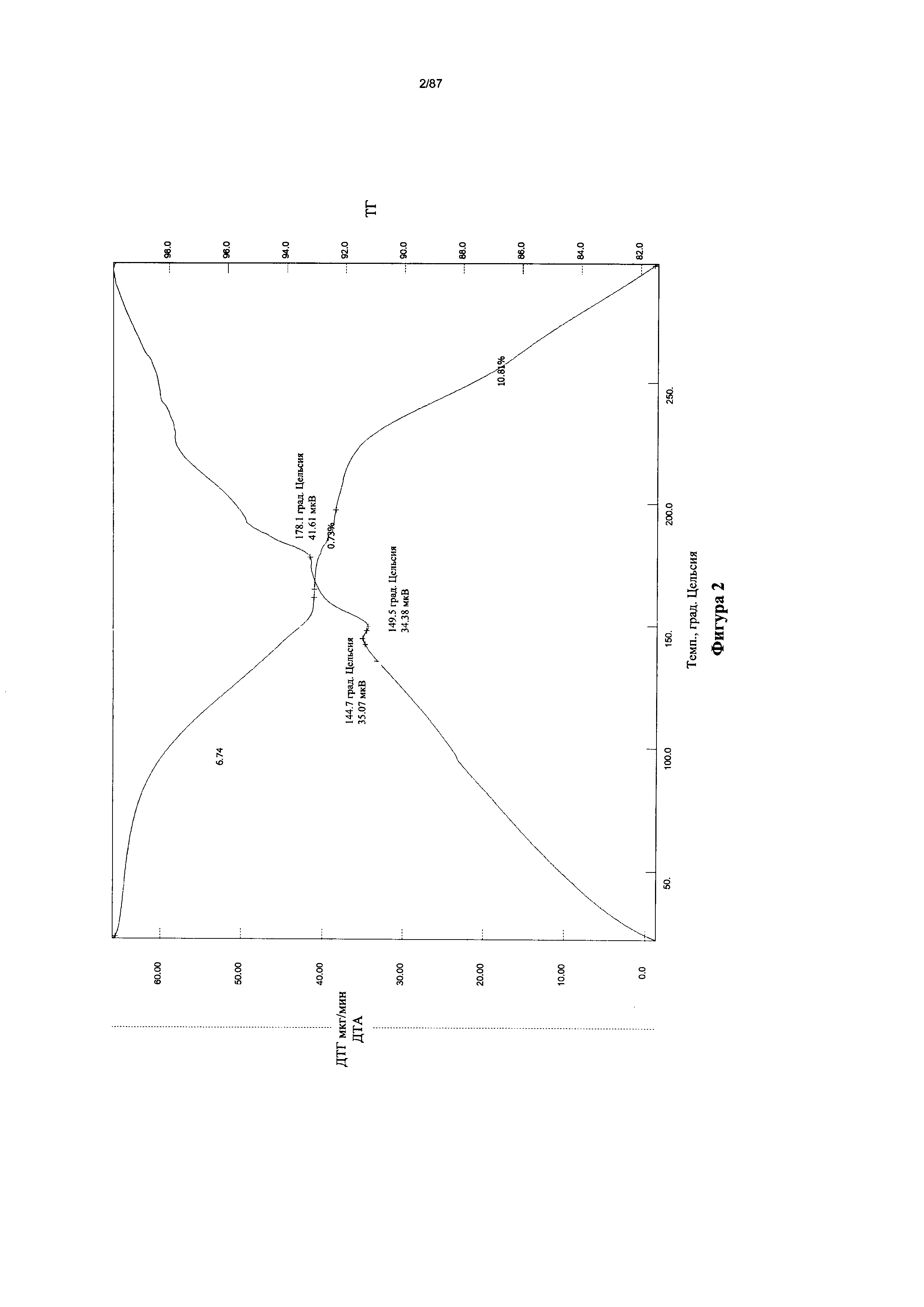
[0009] На фигуре 2 изображены кривые термогравиметрического анализа (ТГА) для бис-безилатной соли соединения 1.
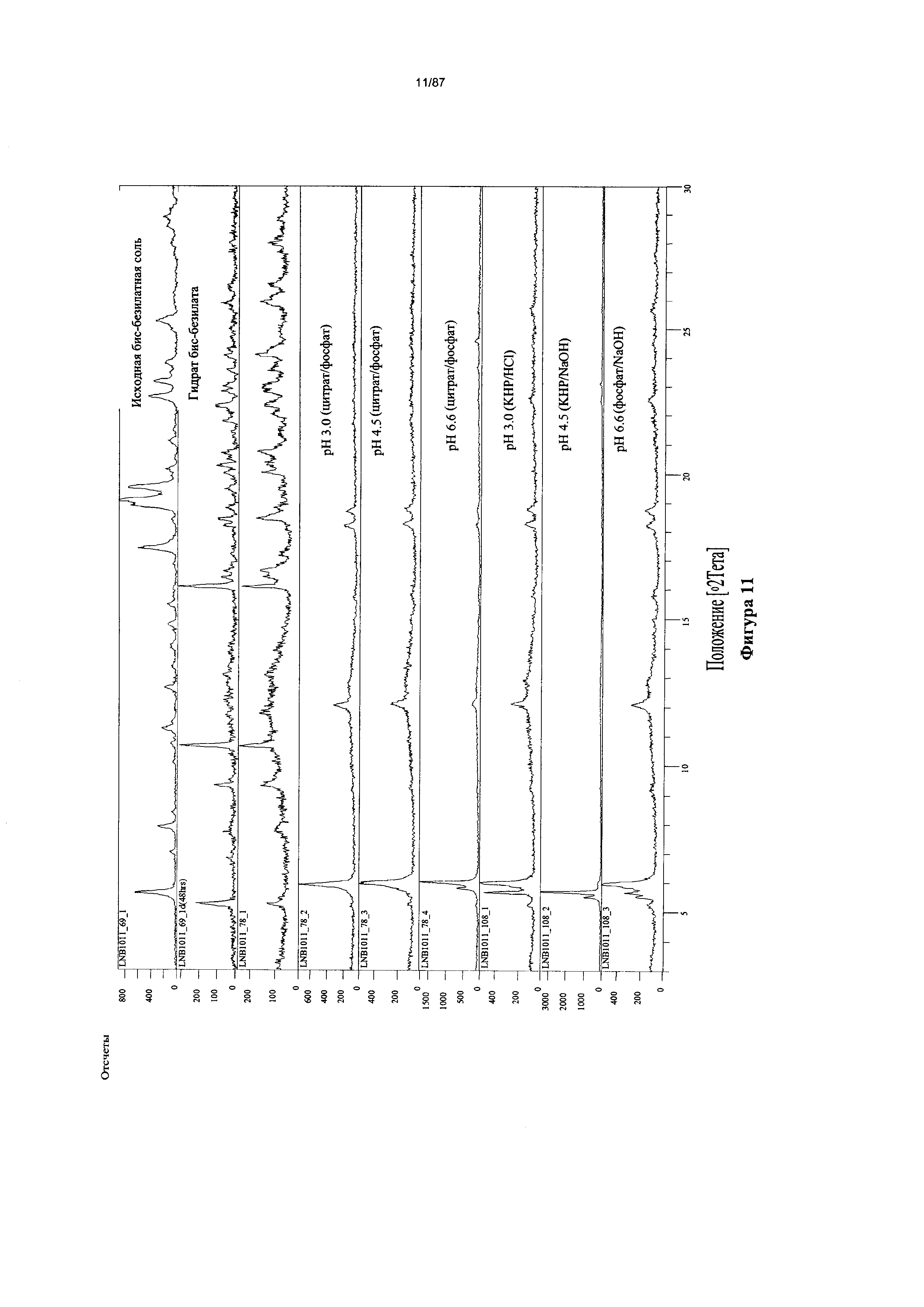
[0010] На фигуре 3 изображены кривые термогравиметрического анализа (ТГА) для дополнительно высушенного образца бис-безилатной соли соединения 1.
[0011] На фигуре 4 изображена термограмма дифференциальной сканирующей калориметрии (ДСК) для бис-безилатной соли соединения 1.
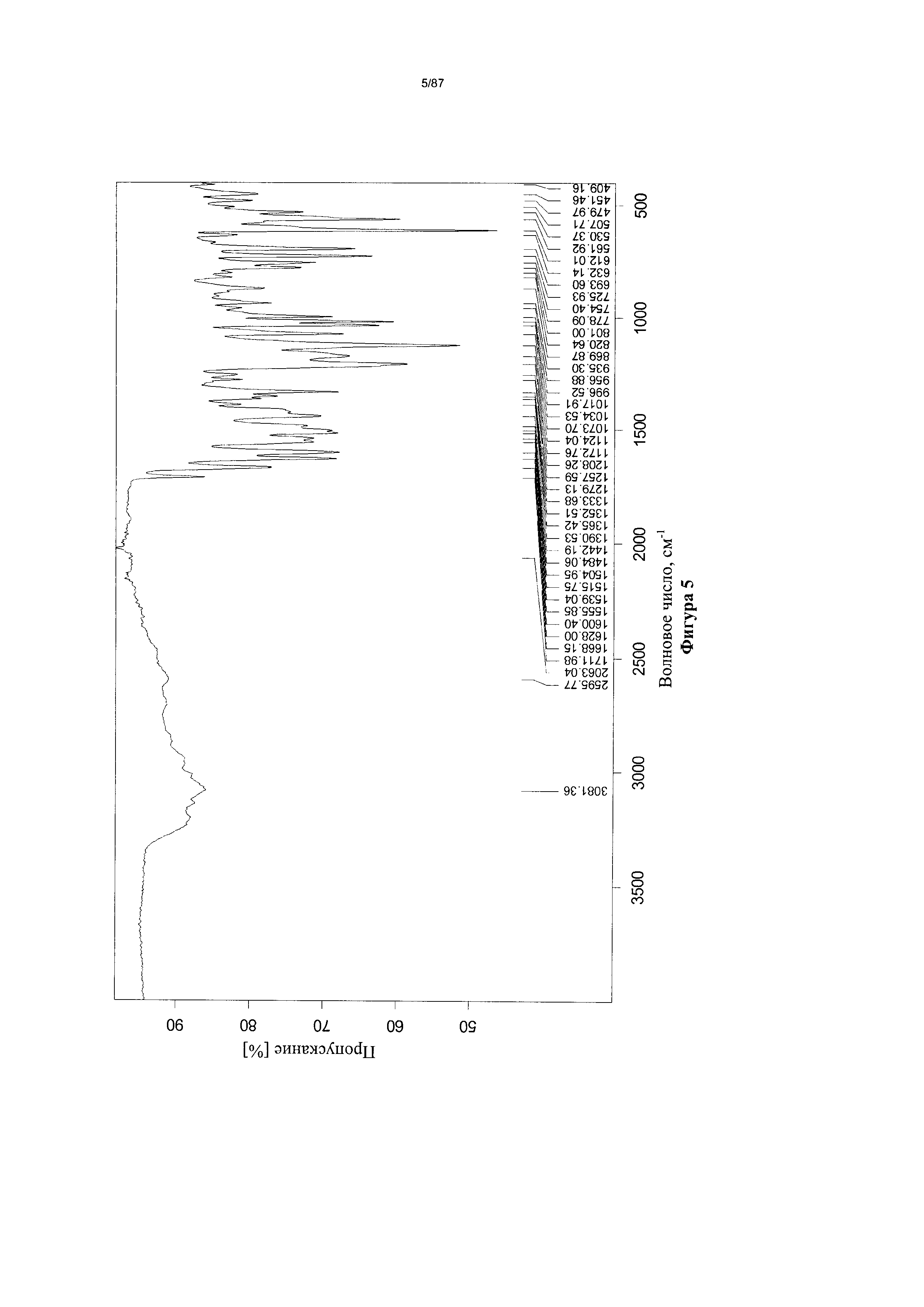
[0012] На фигуре 5 изображен инфракрасный (ИК) спектр бис-безилатной соли соединения 1.
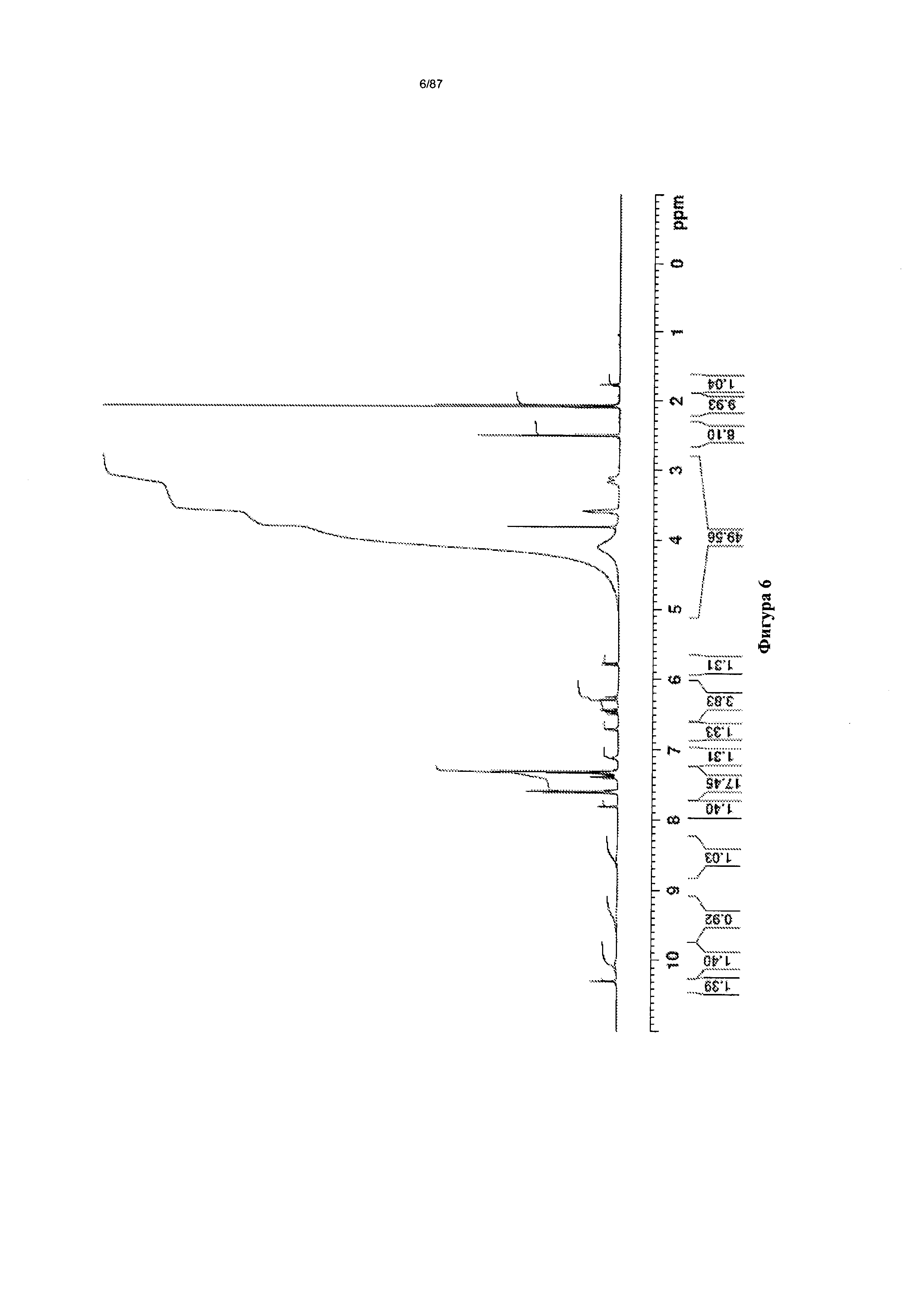
[0013] На фигуре 6 изображен спектр 1Н-ЯМР бис-безилатной соли соединения 1.
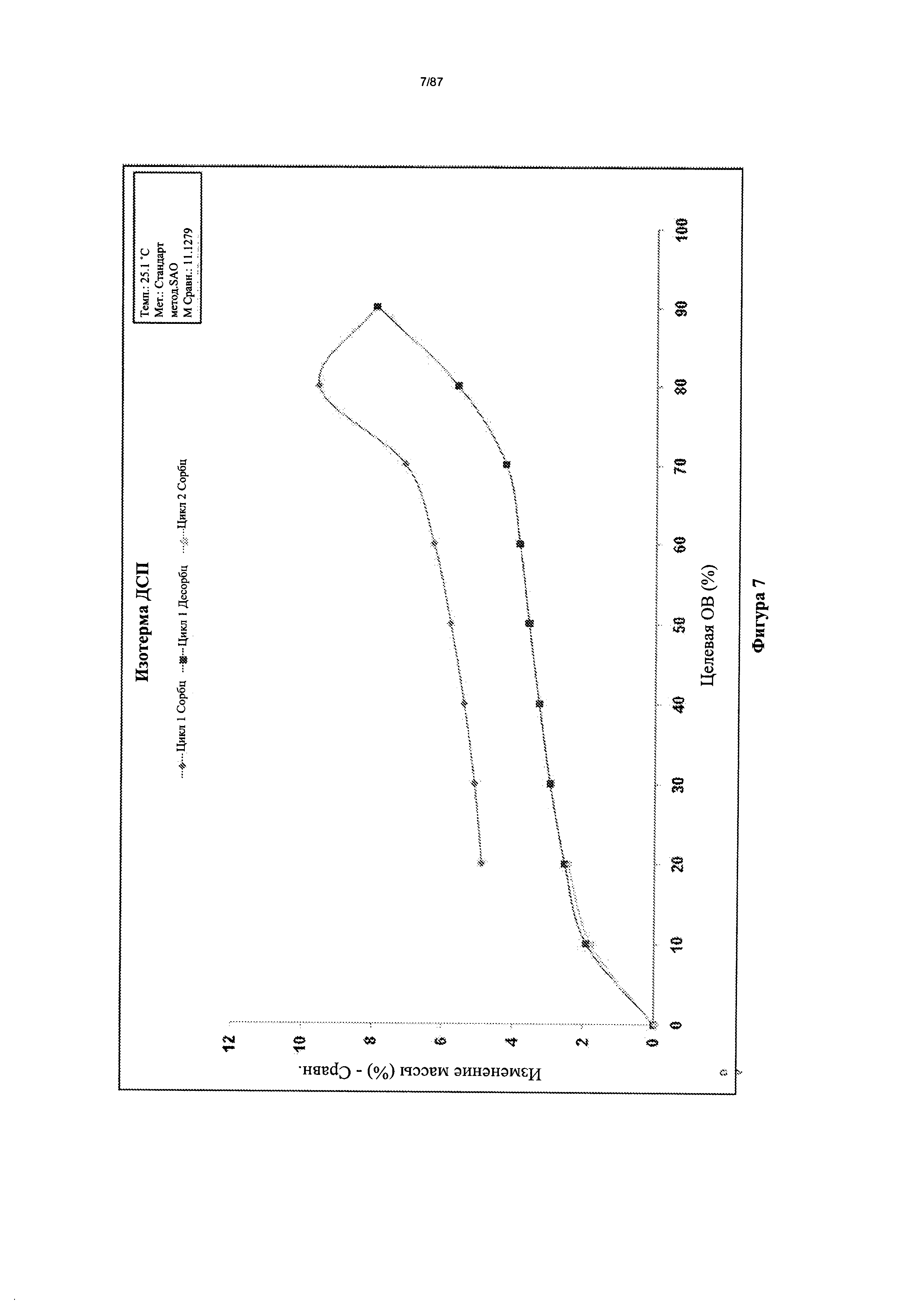
[0014] На фигуре 7 изображен график динамической сорбции пара (ДСП) для бис-безилатной соли соединения 1.
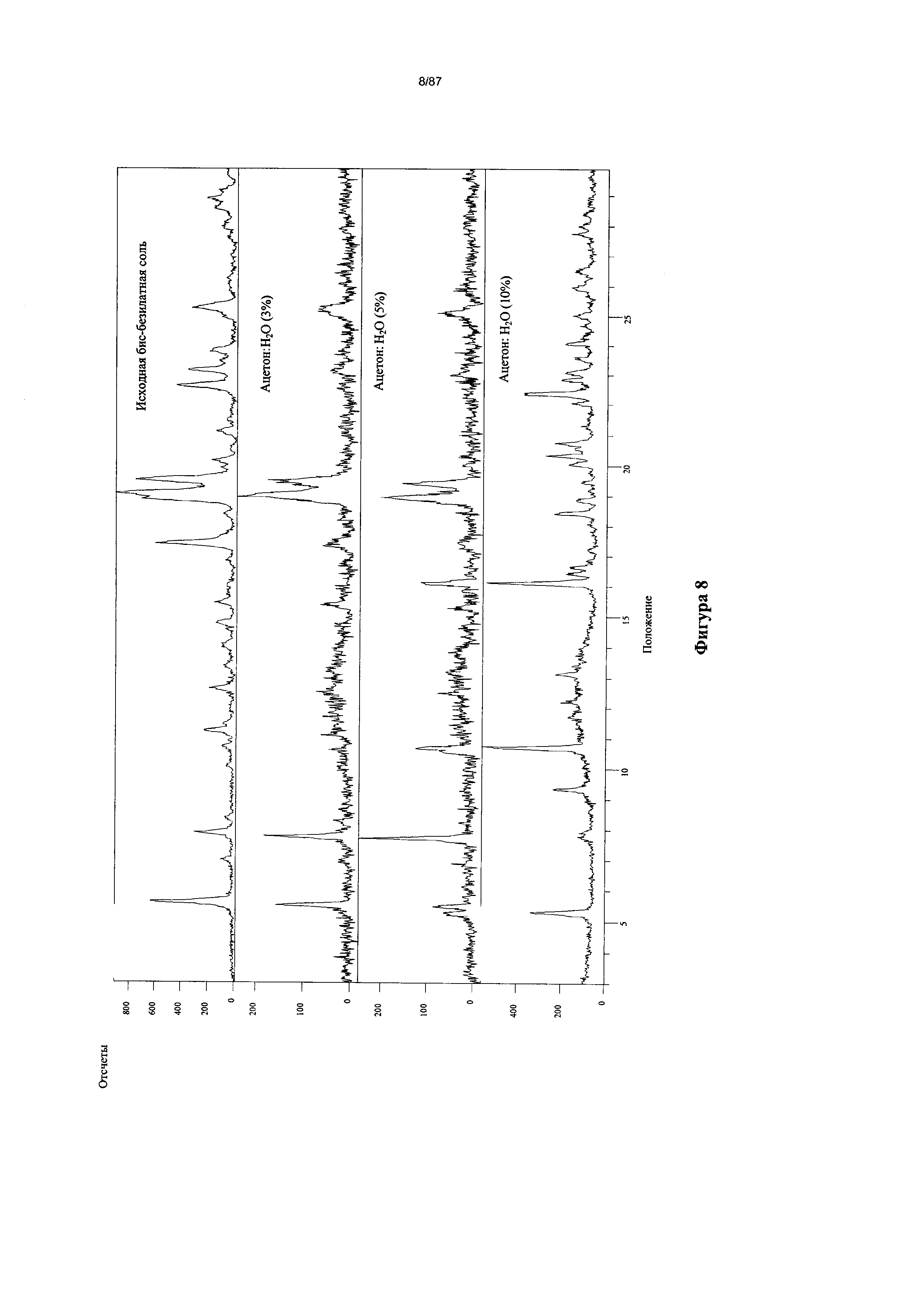
[0015] На фигуре 8 изображены результаты исследования гидратирования бис-безилатной соли соединения 1, полученные путем анализа дифрактограмм XRPD.
[0016] На фигуре 9 изображены результаты исследования диспропорционирования бис-безилатной соли соединения 1, полученные путем анализа дифрактограмм XRPD.
[0017] На фигуре 10 изображены результаты исследования стабильности бис-безилатной соли соединения 1, полученные путем анализа дифрактограмм XRPD.
[0018] На фигуре 11 изображены результаты термодинамического исследования растворимости бис-безилатной соли соединения 1, полученные путем анализа дифрактограмм XRPD.
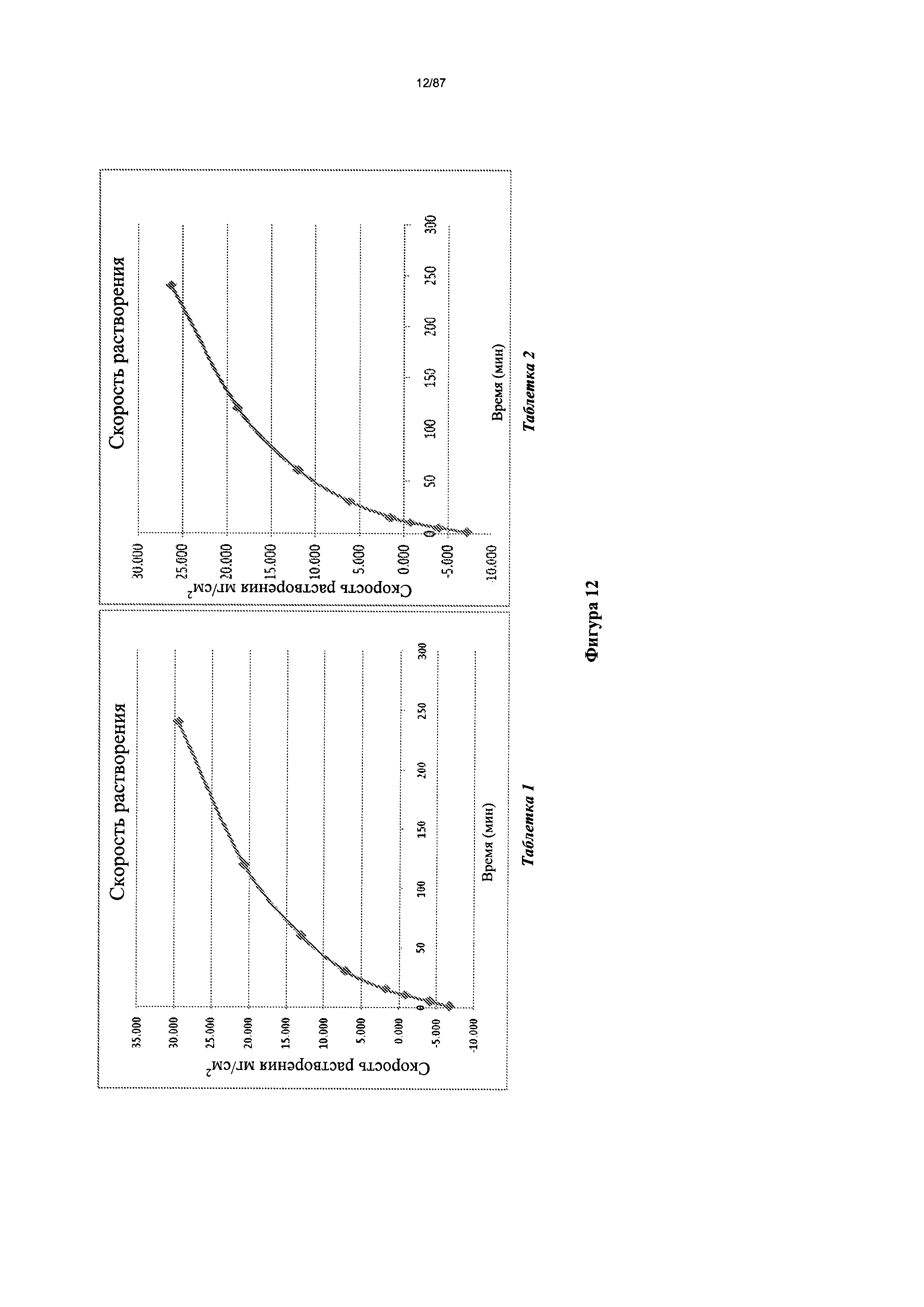
[0019] На фигуре 12 изображено растворение сжатого диска бис-безилатной соли Соединения 1 при pH 4,5.
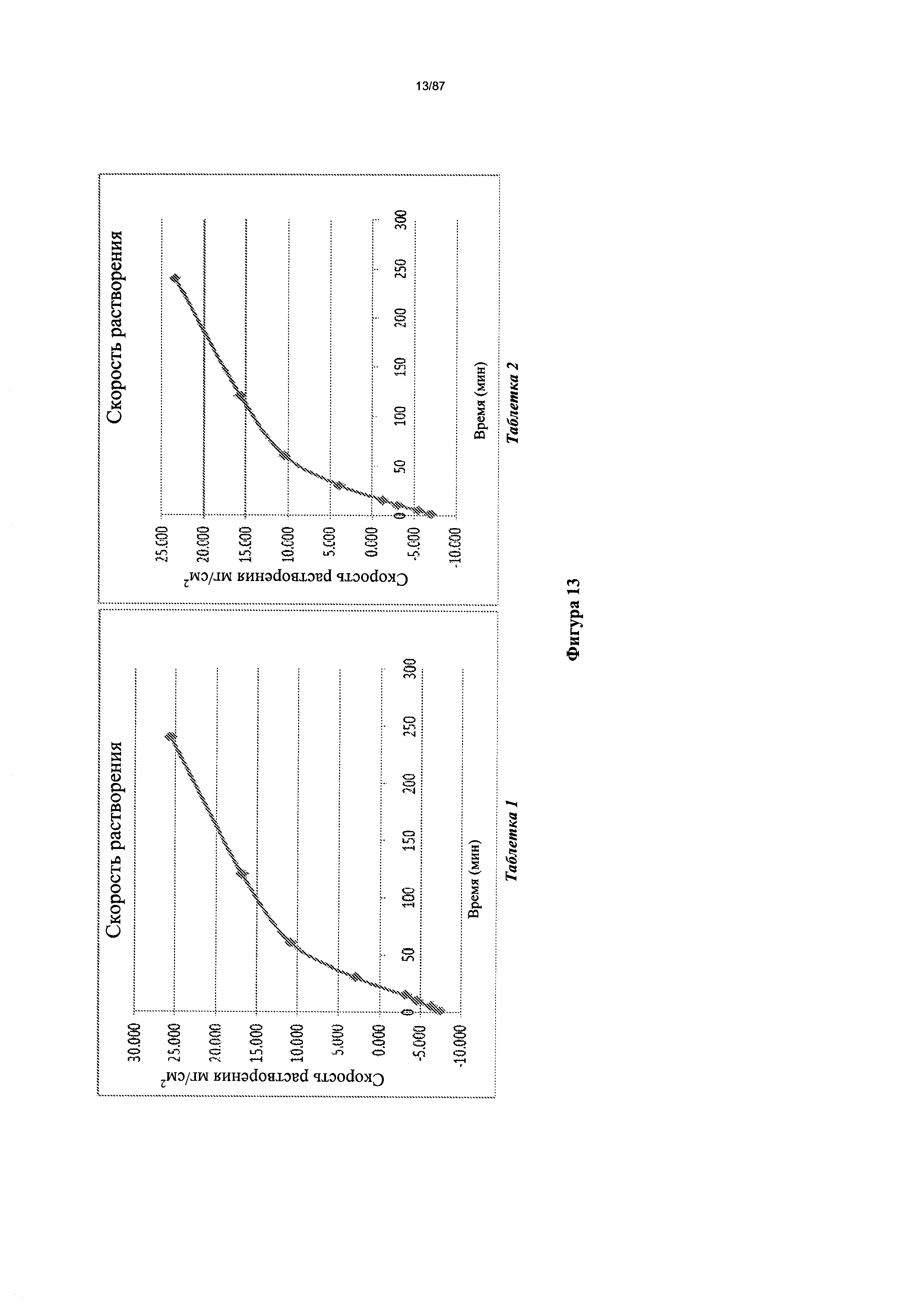
[0020] На фигуре 13 изображено растворение сжатого диска бис-безилатной соли Соединения 1 при pH 3,0.
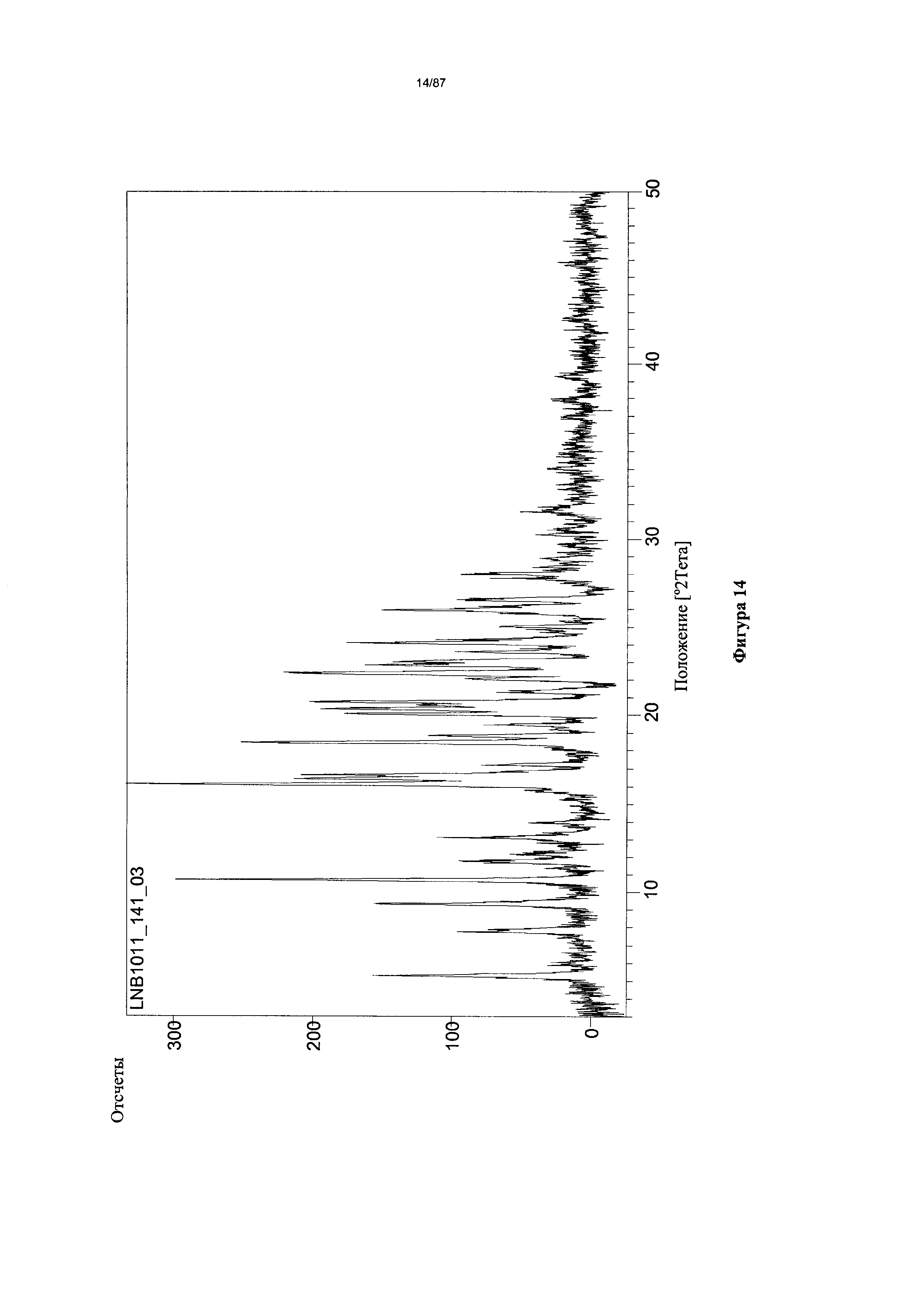
[0021] На фигуре 14 изображена дифрактограмма XRPD для гидрата бис-безилатной соли Соединения 1.
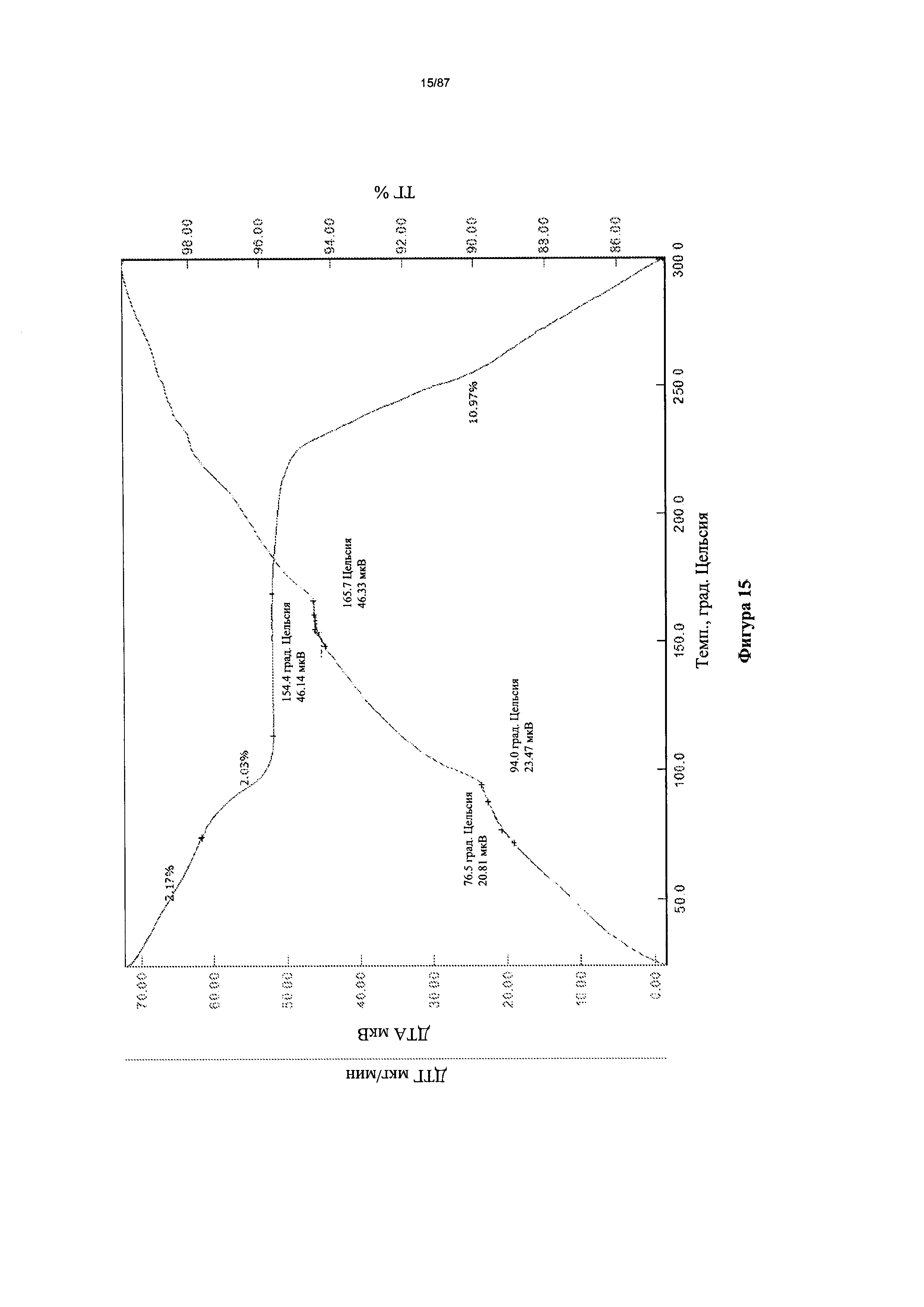
[0022] На фигуре 15 изображены кривые ТГА для гидрата бис-безилатной соли Соединения 1.
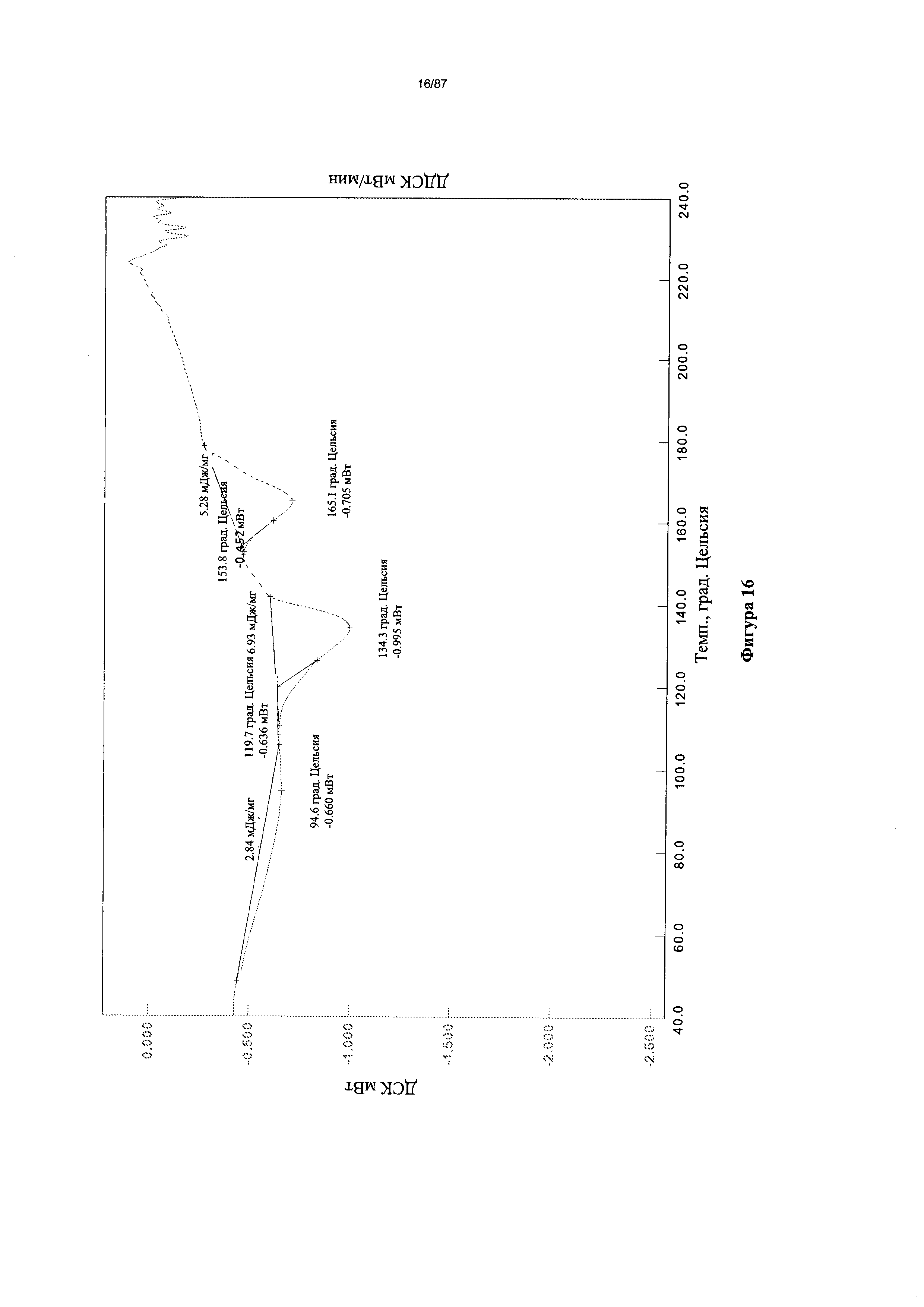
[0023] На фигуре 16 изображена термограмма ДСК для гидрата бис-безилатной соли Соединения 1.
[0024] На фигуре 17 изображен ИК-спектр гидрата бис-безилатной соли Соединения 1.
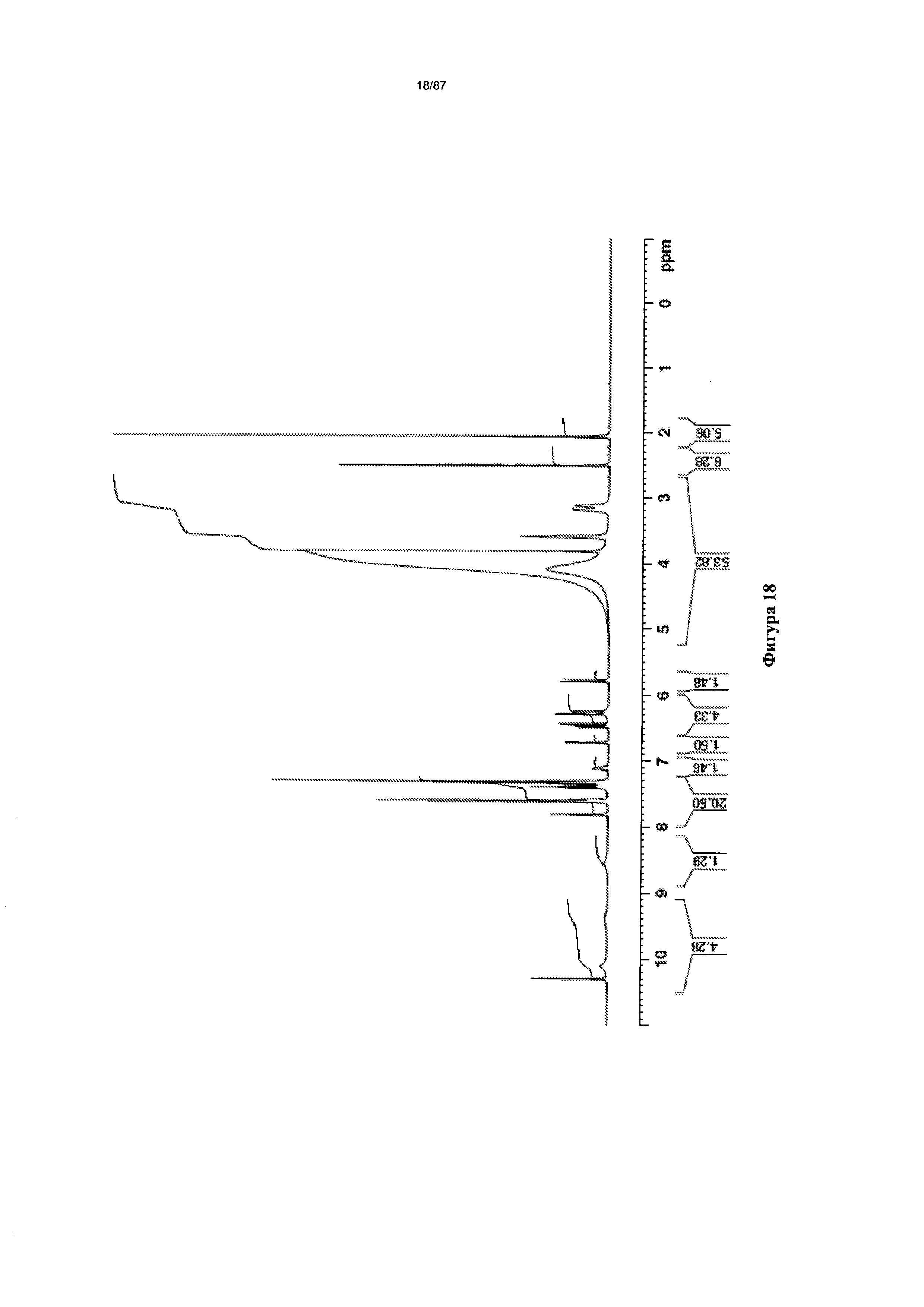
[0025] На фигуре 18 изображен спектр 1Н-ЯМР гидрата бис-безилатной соли Соединения 1.
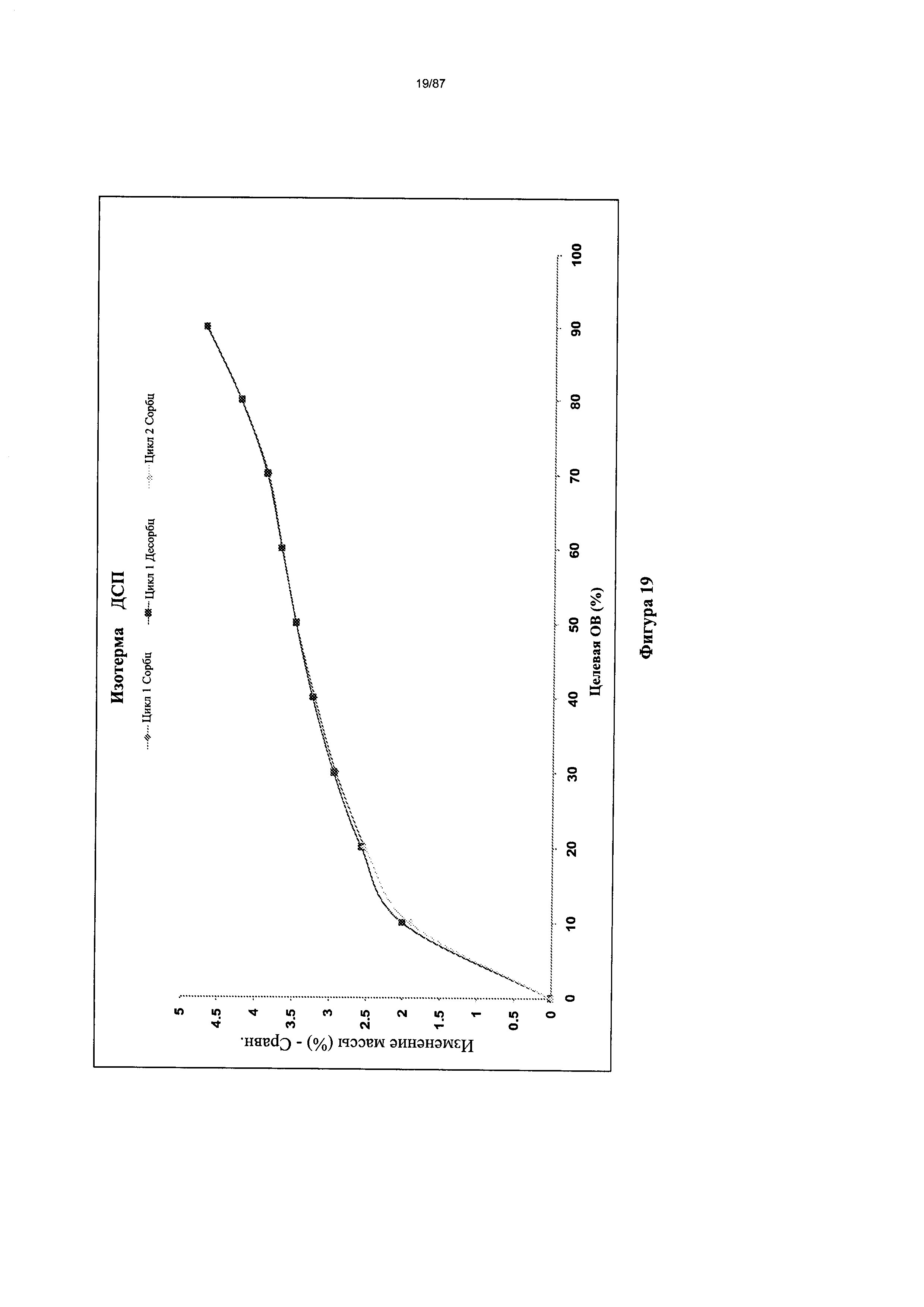
[0026] На фигуре 19 изображен график ДСП для гидрата бис-безилатной соли Соединения 1.
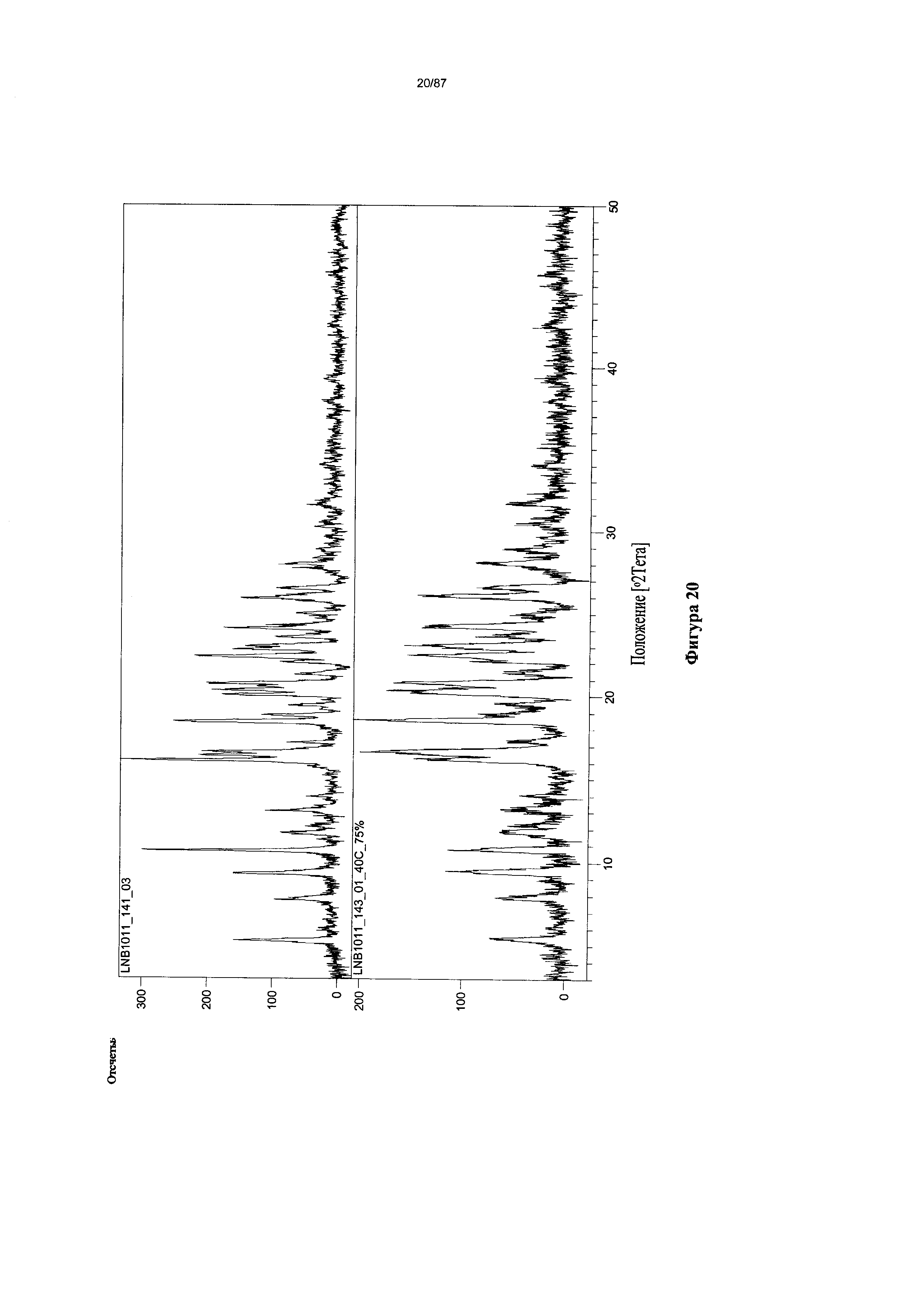
[0027] На фигуре 20 изображены результаты исследования стабильности гидрата бисбезилатной соли Соединения 1, полученные путем анализа дифрактограмм XRPD.
[0028] На фигуре 21 изображены результаты термодинамического исследования растворимости бис-безилатной соли Соединения 1, полученные путем анализа дифрактограмм XRPD.
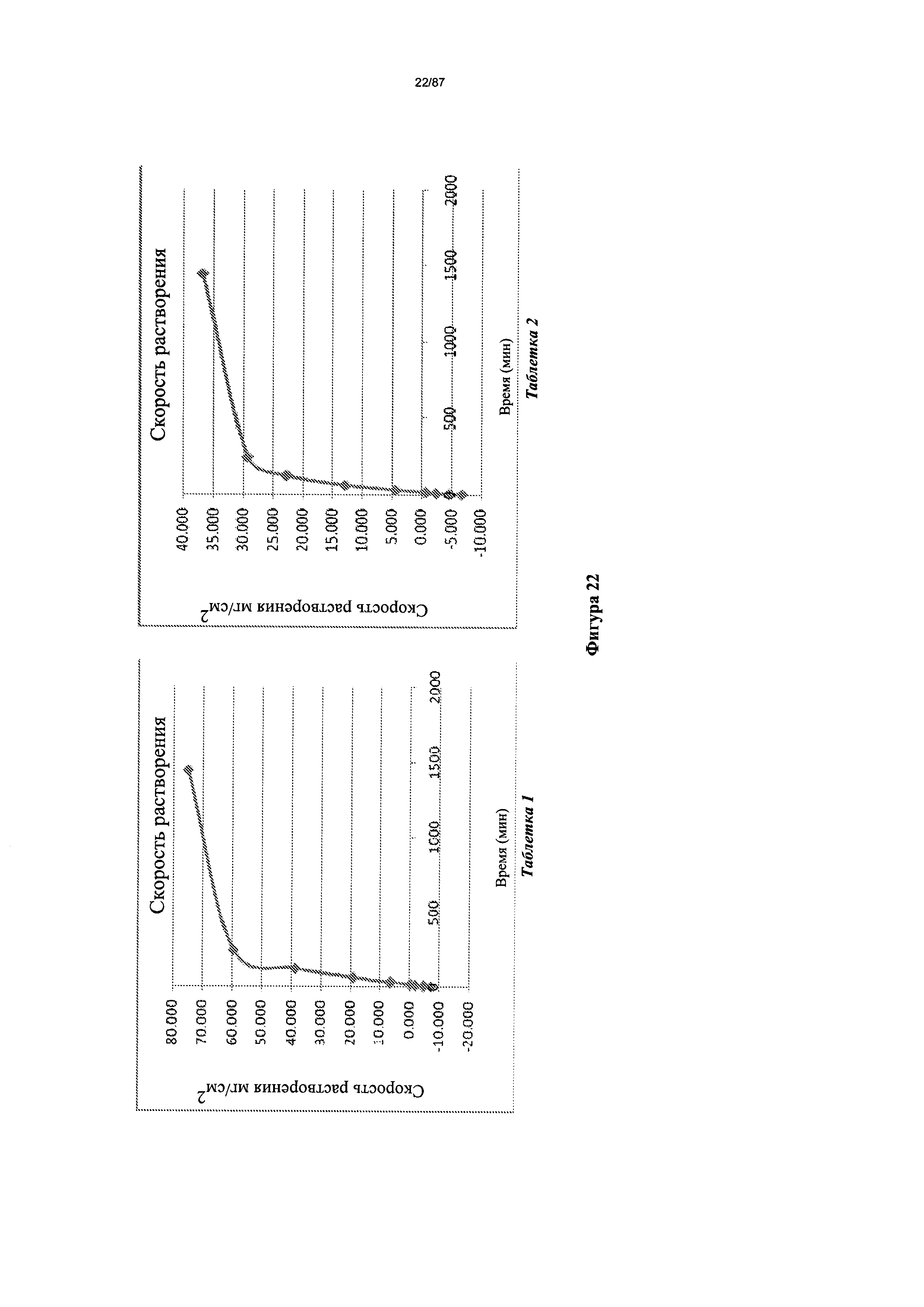
[0029] На фигуре 22 изображено растворение сжатого диска гидрата бис-безилатной соли Соединения 1 при pH 4,5.
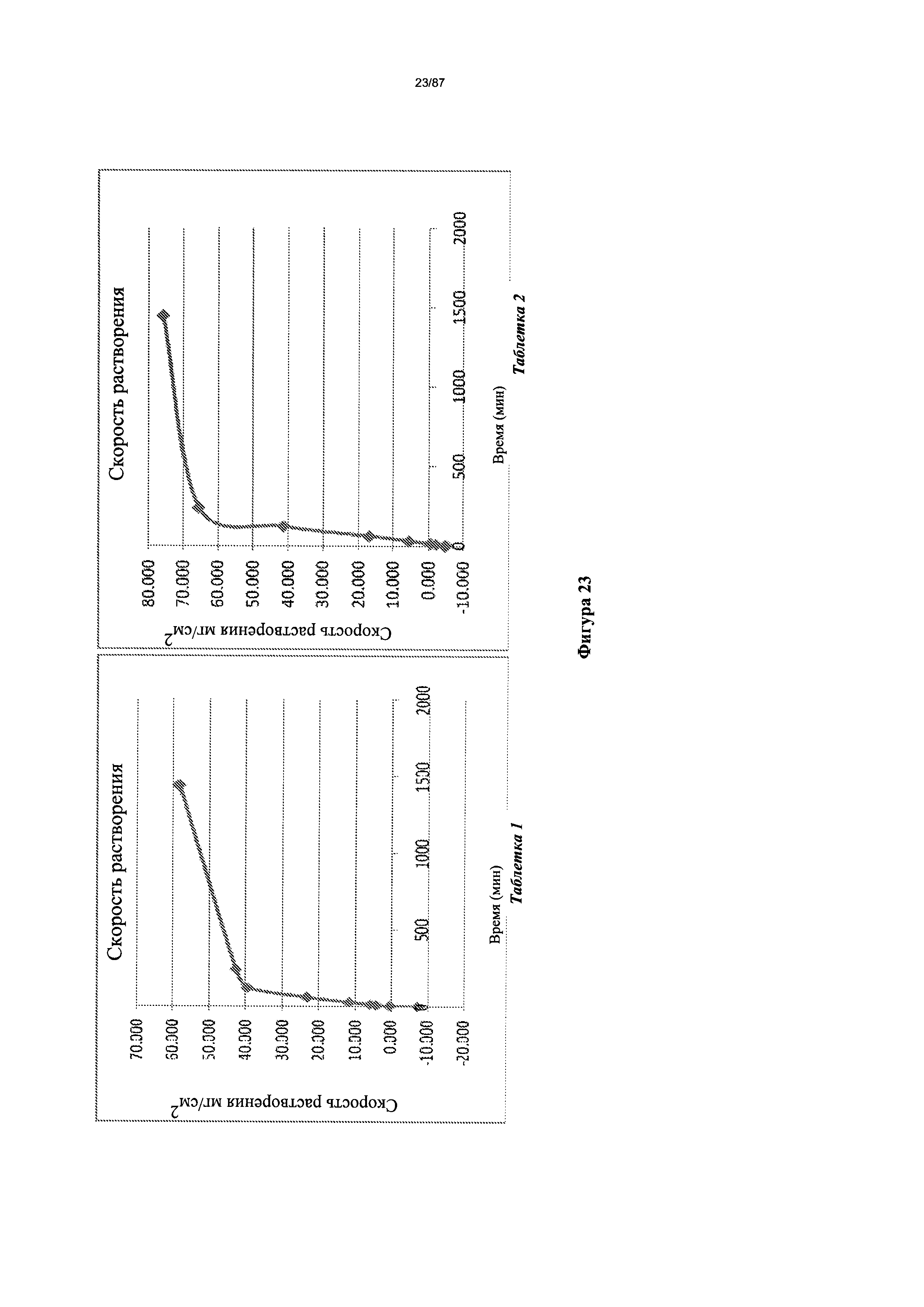
[0030] На фигуре 23 изображено растворение сжатого диска гидрата бис-безилатной соли Соединения 1 при pH 3,0.
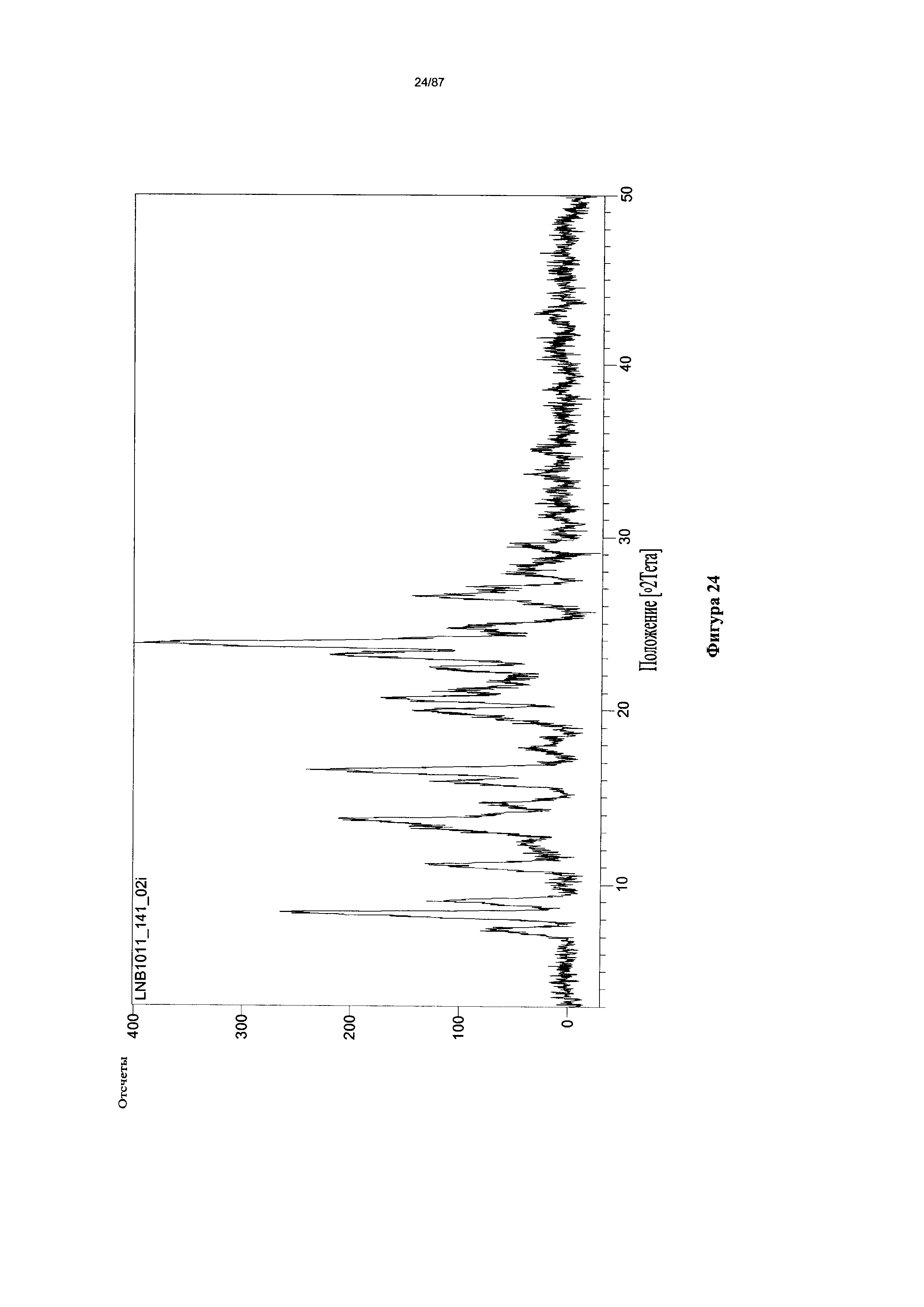
[0031] На фигуре 24 изображена дифрактограмма XRPD для мономалеатной соли Соединения 1.
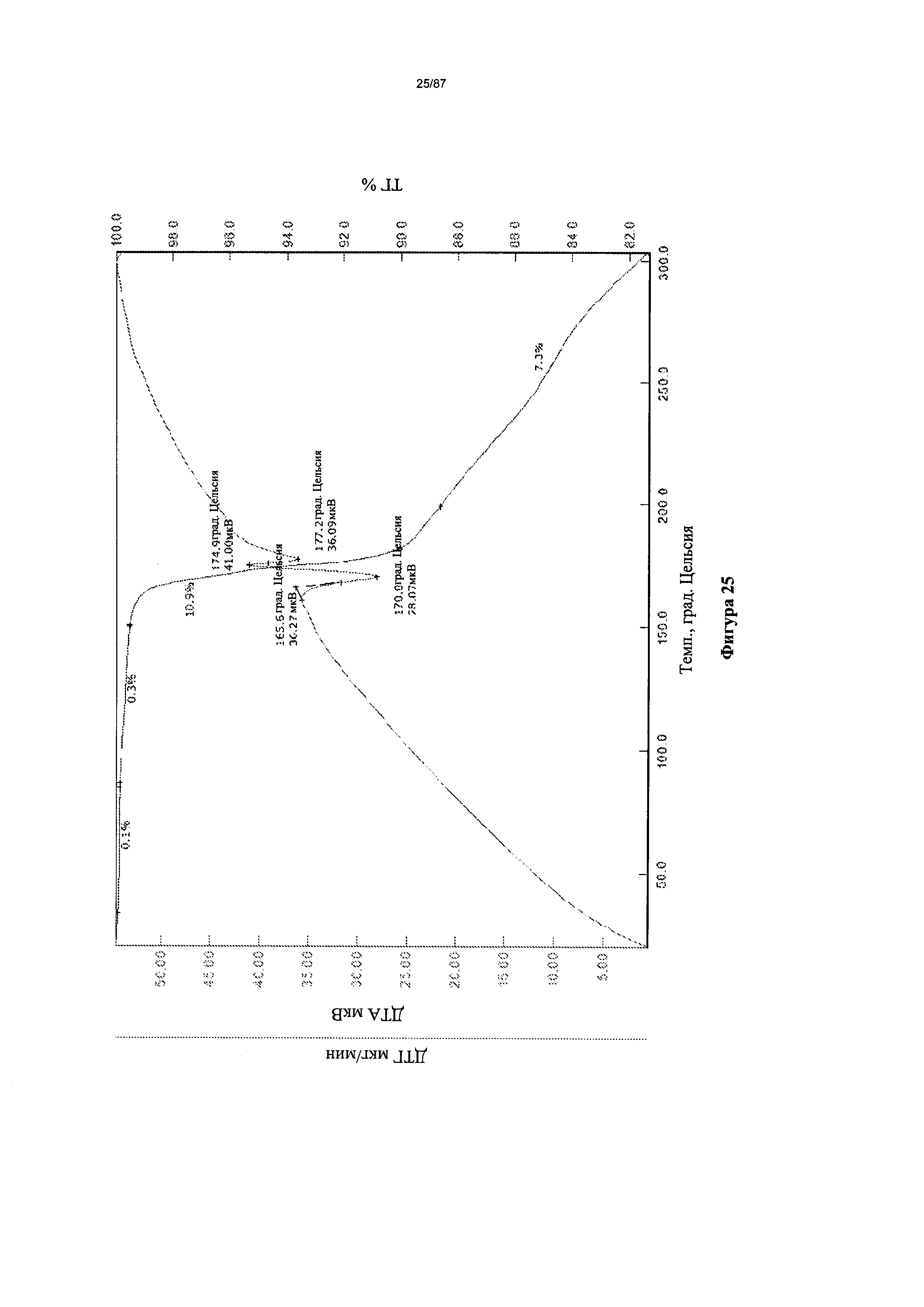
[0032] На фигуре 25 изображены кривые ТГА для мономалеатной соли Соединения 1.
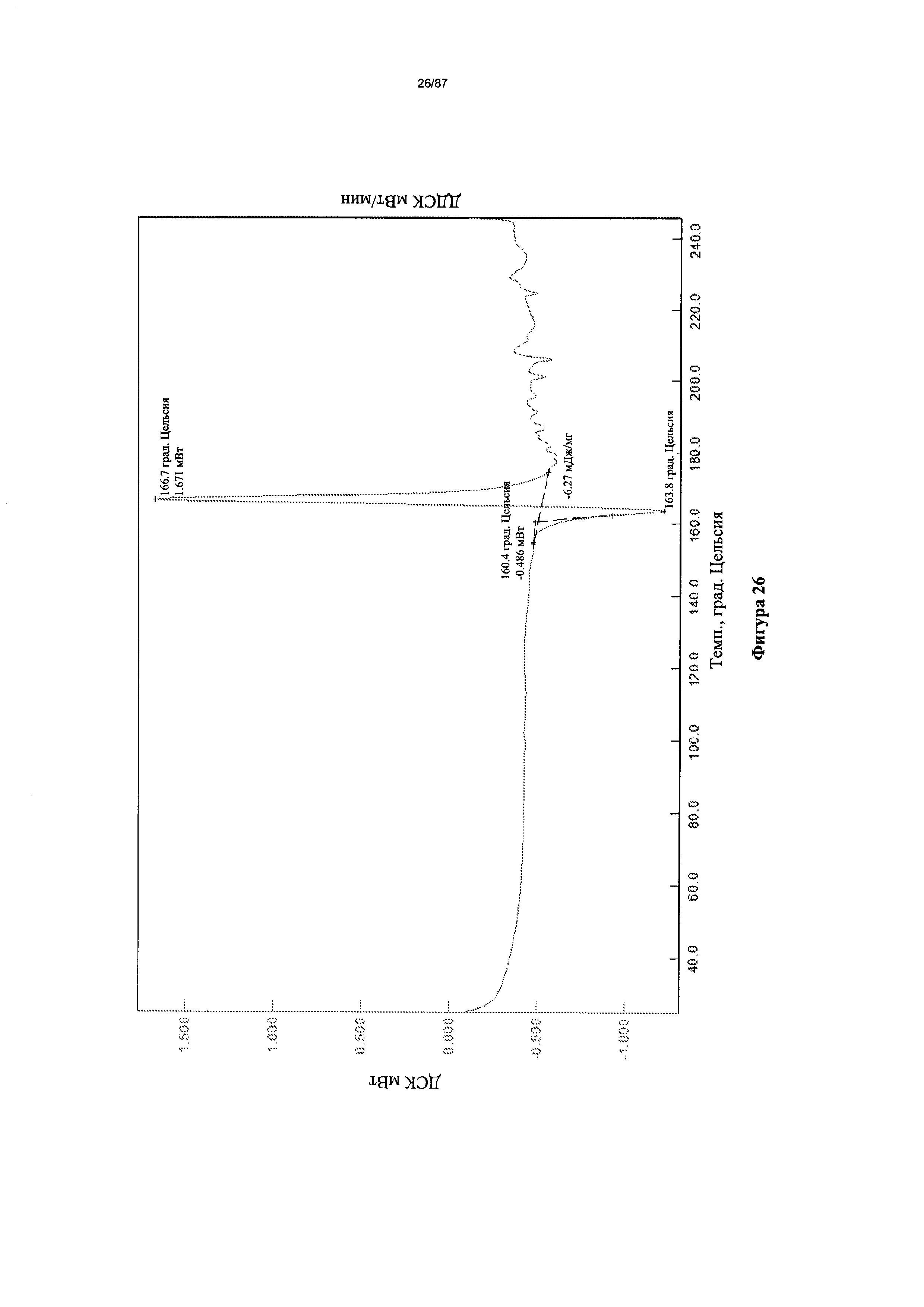
[0033] На фигуре 26 изображена термограмма ДСК для мономалеатной соли Соединения 1.
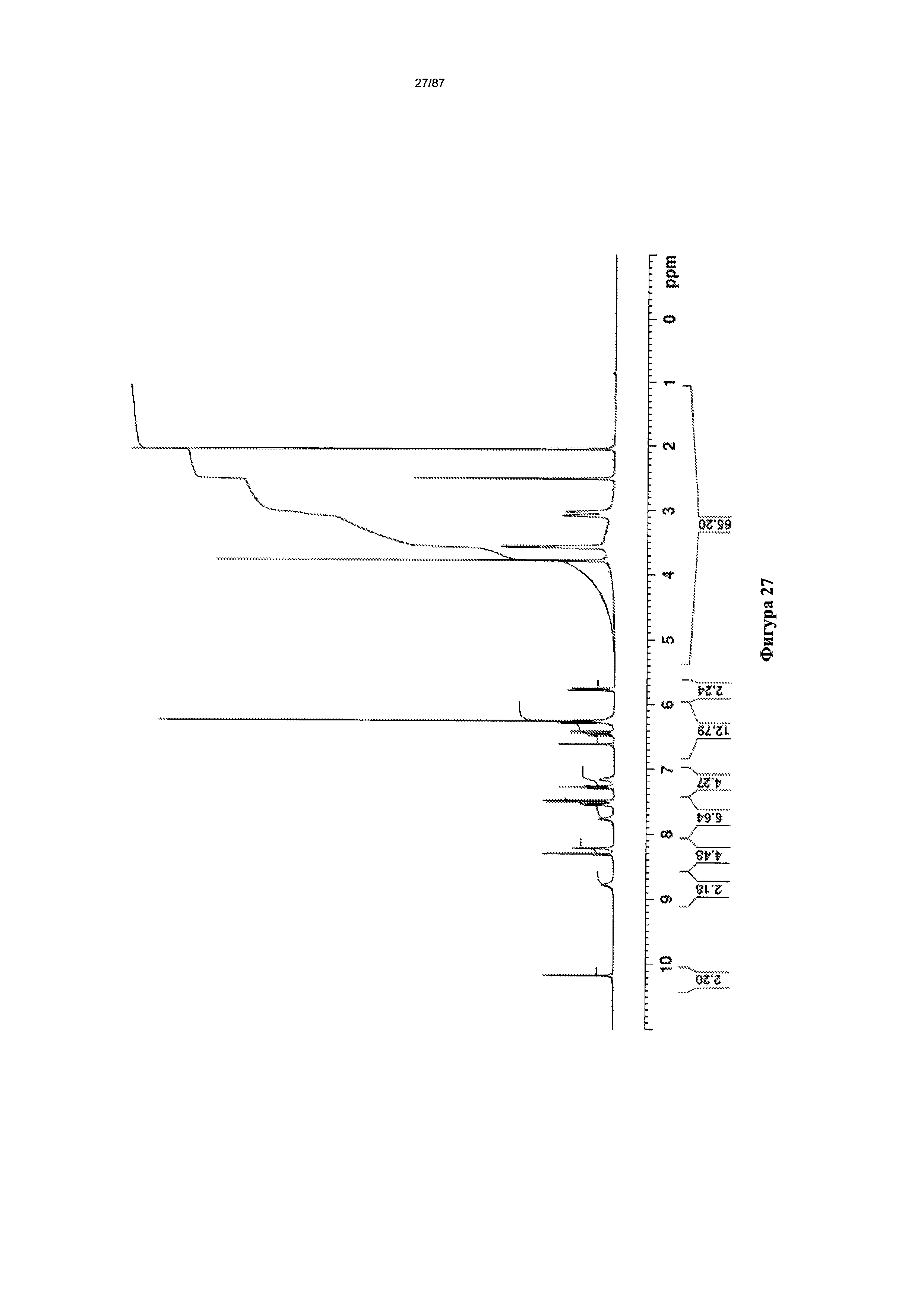
[0034] На фигуре 27 изображен спектр 1Н-ЯМР мономалеатной соли Соединения 1.
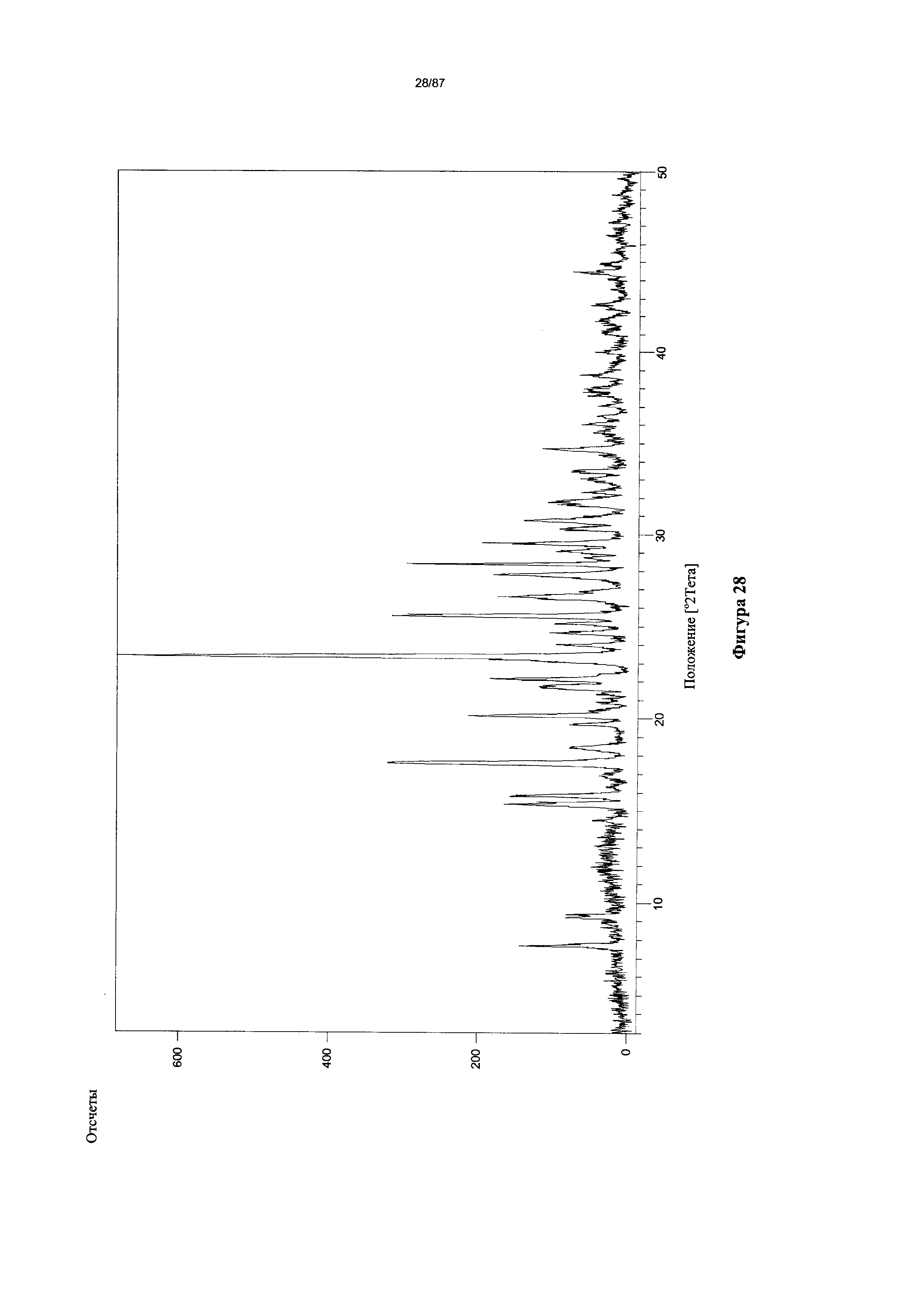
[0035] На фигуре 28 изображена дифрактограмма XRPD для бис-гидрохлоридной соли Соединения 1.
[0036] На фигуре 29 изображены кривые ТГА для бис-гидрохлоридной соли Соединения 1.
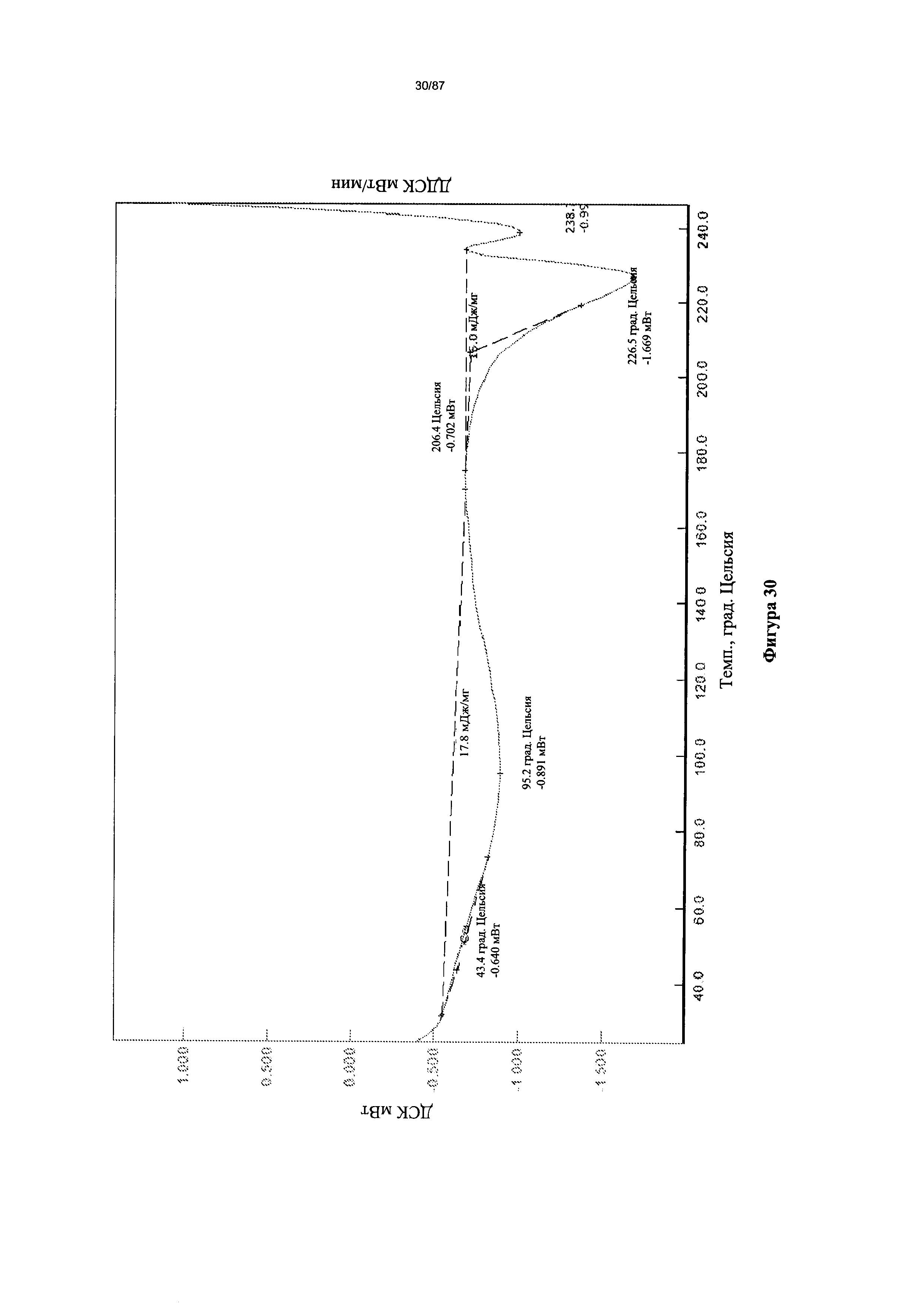
[0037] На фигуре 30 изображена термограмма ДСК для бис-гидрохлоридной соли Соединения 1.
[0038] На фигуре 31 изображен спектр 1Н-ЯМР бис-гидрохлоридной соли Соединения 1.
[0039] На фигуре 32 изображена дифрактограмма XRPD для Формы I гидробромидной соли Соединения 1.
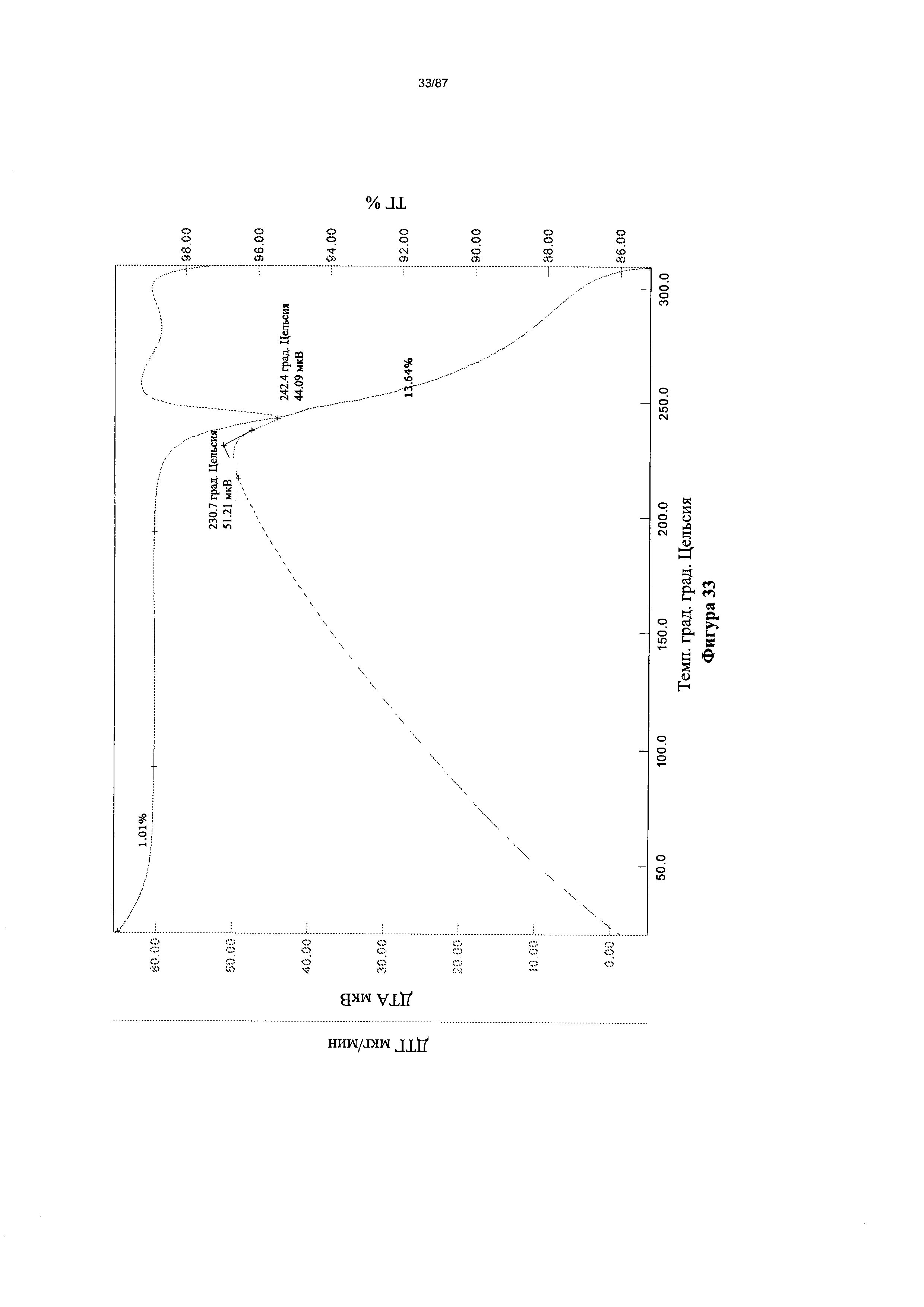
[0040] На фигуре 33 изображены кривые ТГА для Формы I гидробромидной соли Соединения 1.
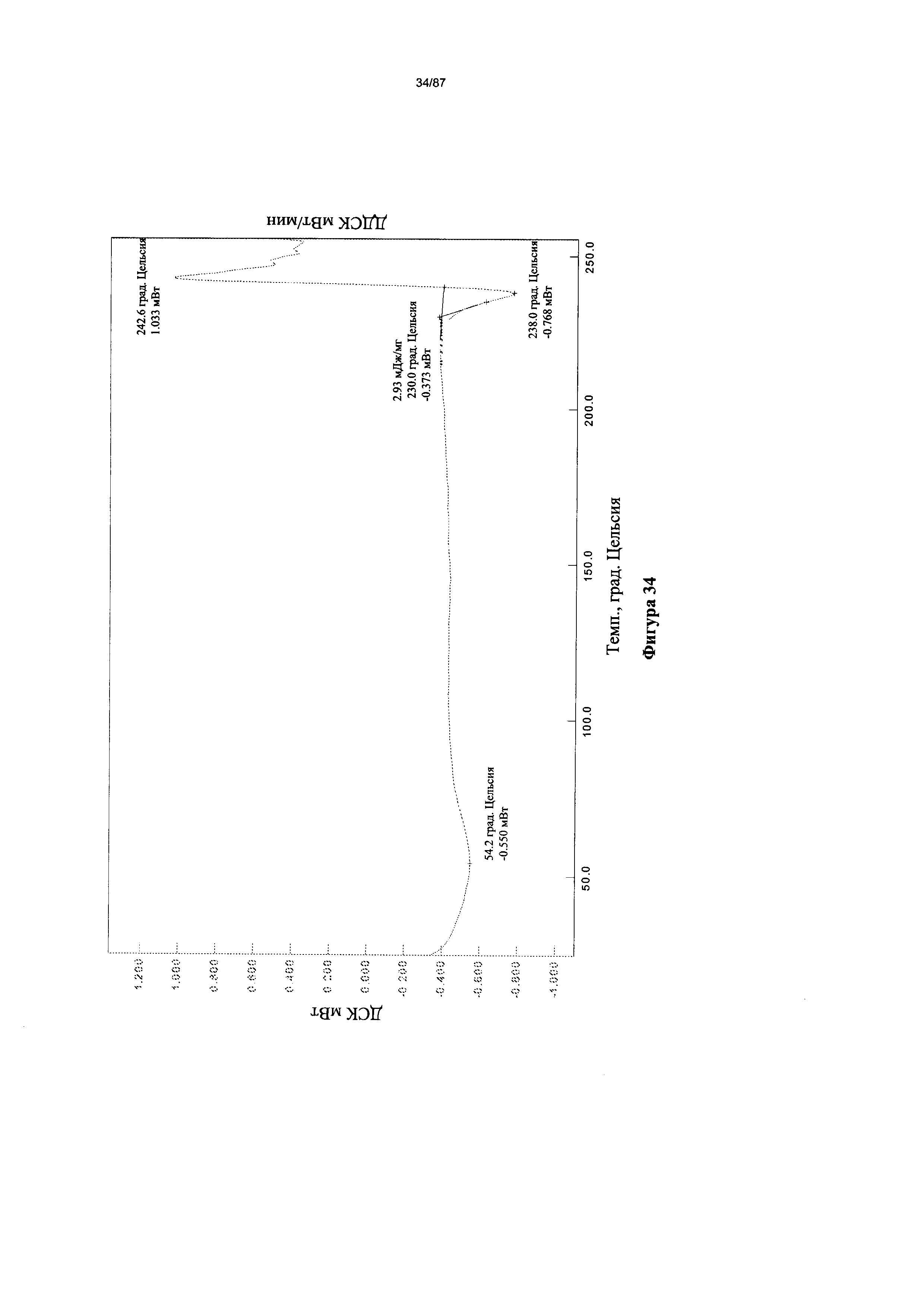
[0041] На фигуре 34 изображена термограмма ДСК для Формы I гидробромидной соли Соединения 1.
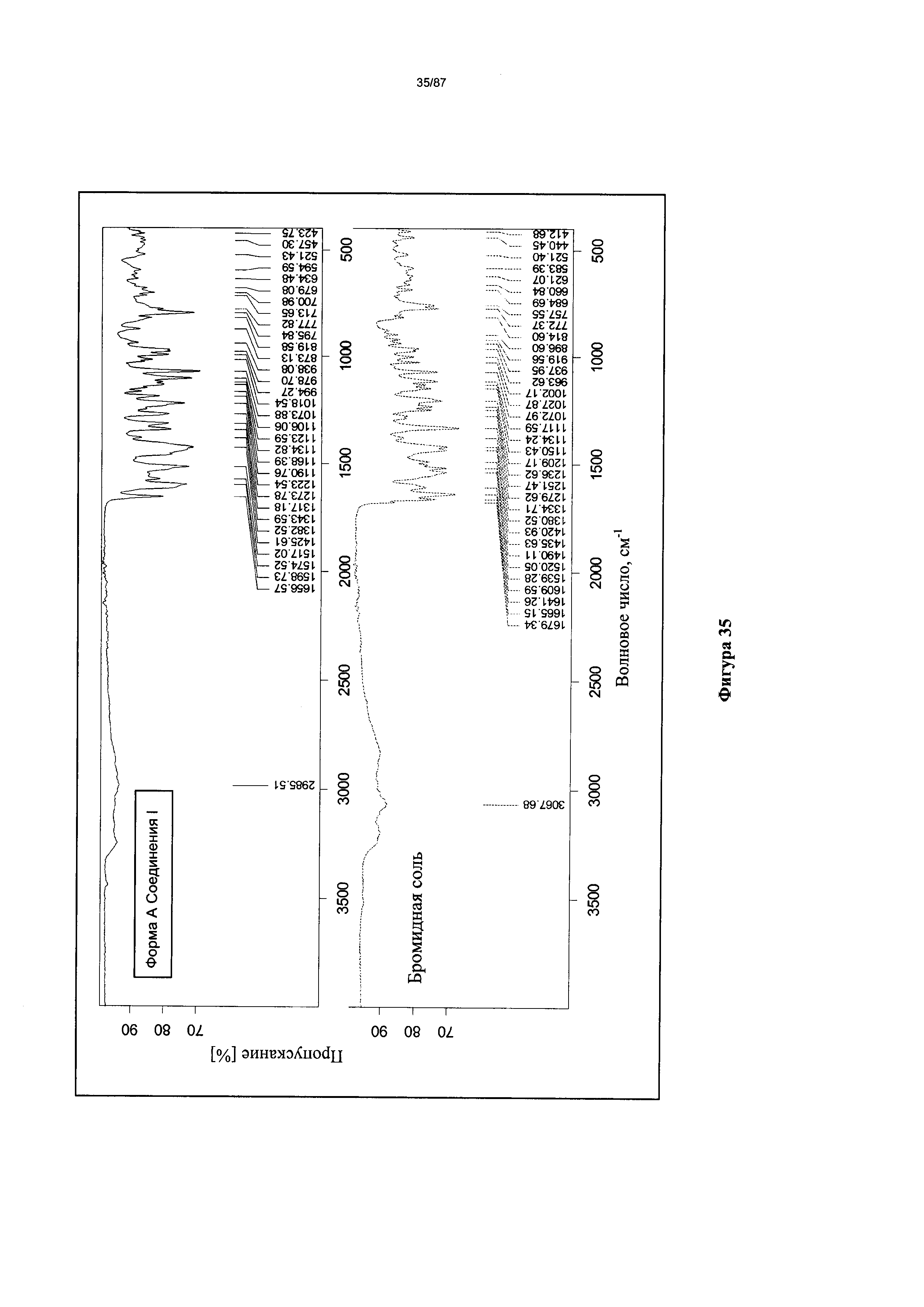
[0042] На фигуре 35 изображен ИК-спектр Формы I гидробромидной соли Соединения 1.
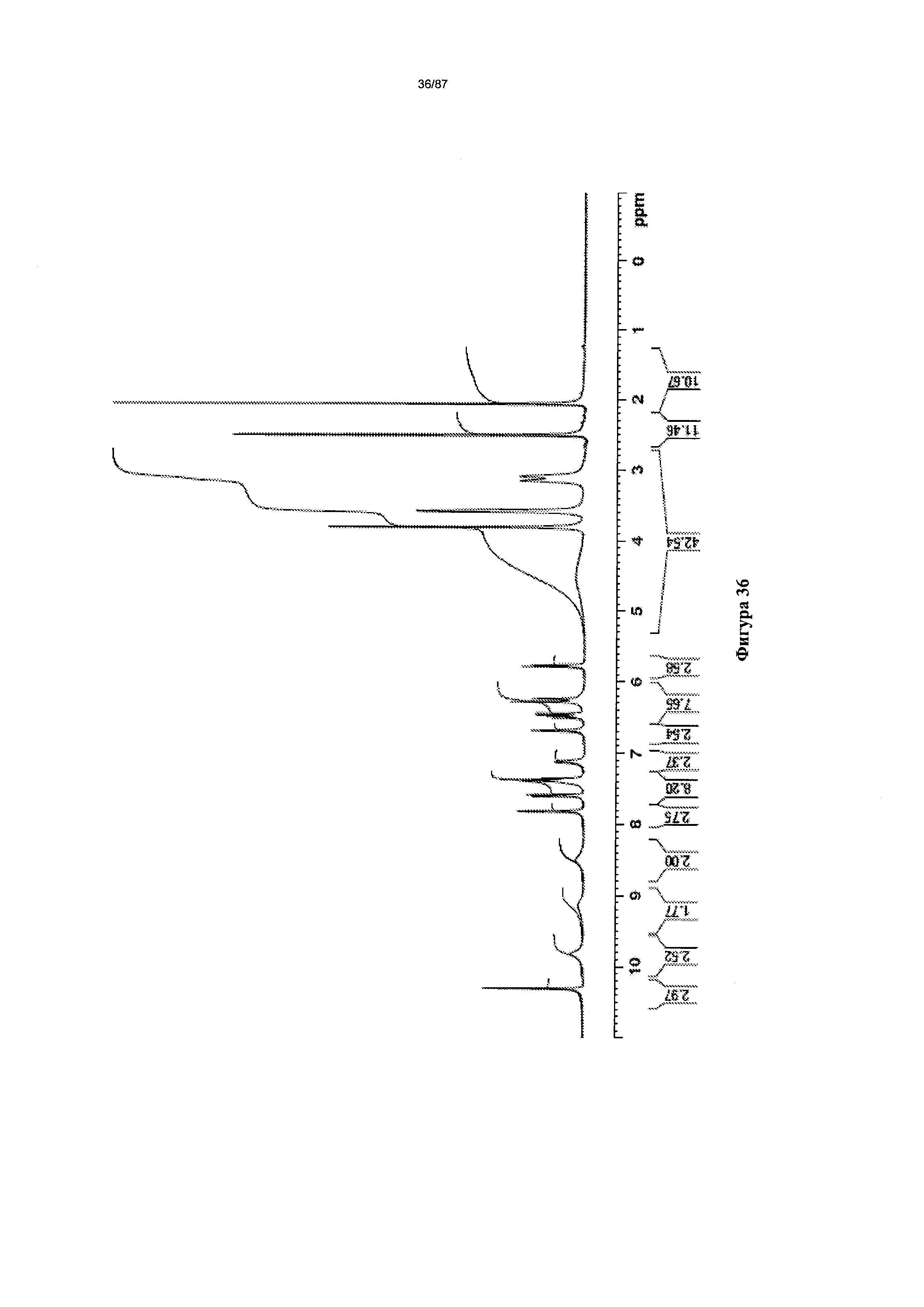
[0043] На фигуре 36 изображен спектр 1Н-ЯМР Формы I гидробромидной соли Соединения 1.
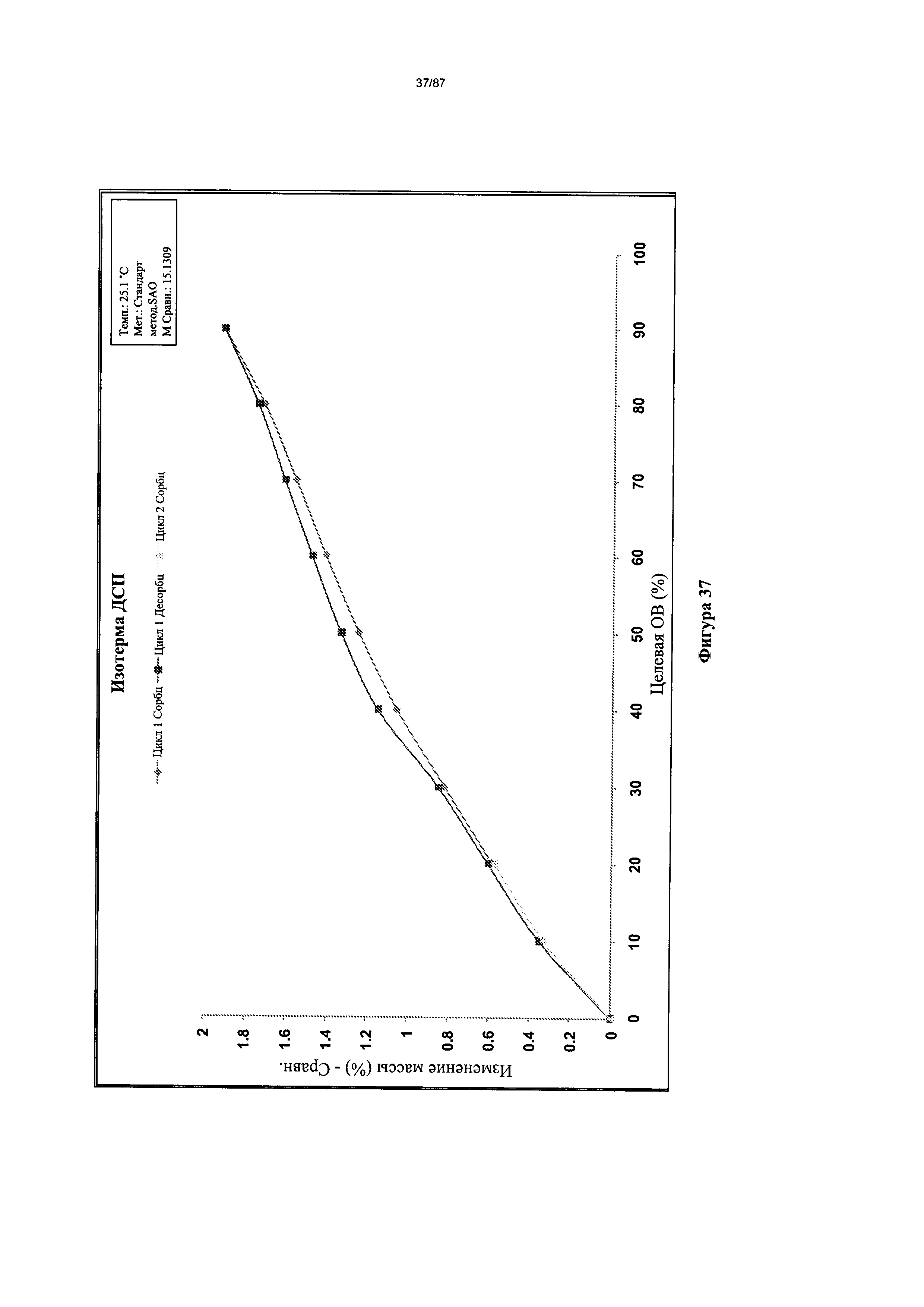
[0044] На фигуре 37 изображен график ДСП для Формы I гидробромидной соли Соединения 1.
[0045] На фигуре 38 изображены результаты исследования гидратирования Формы I гидробромидной соли Соединения 1, полученные путем анализа дифрактограмм XRPD.
[0046] На фигуре 39 изображены результаты исследования диспропорционирования Формы I гидробромидной соли Соединения 1, полученные путем анализа дифрактограмм XRPD.
[0047] На фигуре 40 изображены результаты исследования стабильности Формы I гидробромидной соли Соединения 1, полученные путем анализа дифрактограмм XRPD.
[0048] На фигуре 41 изображены результаты термодинамического исследования растворимости Формы I гидробромидной соли Соединения 1, полученные путем анализа дифрактограмм XRPD.
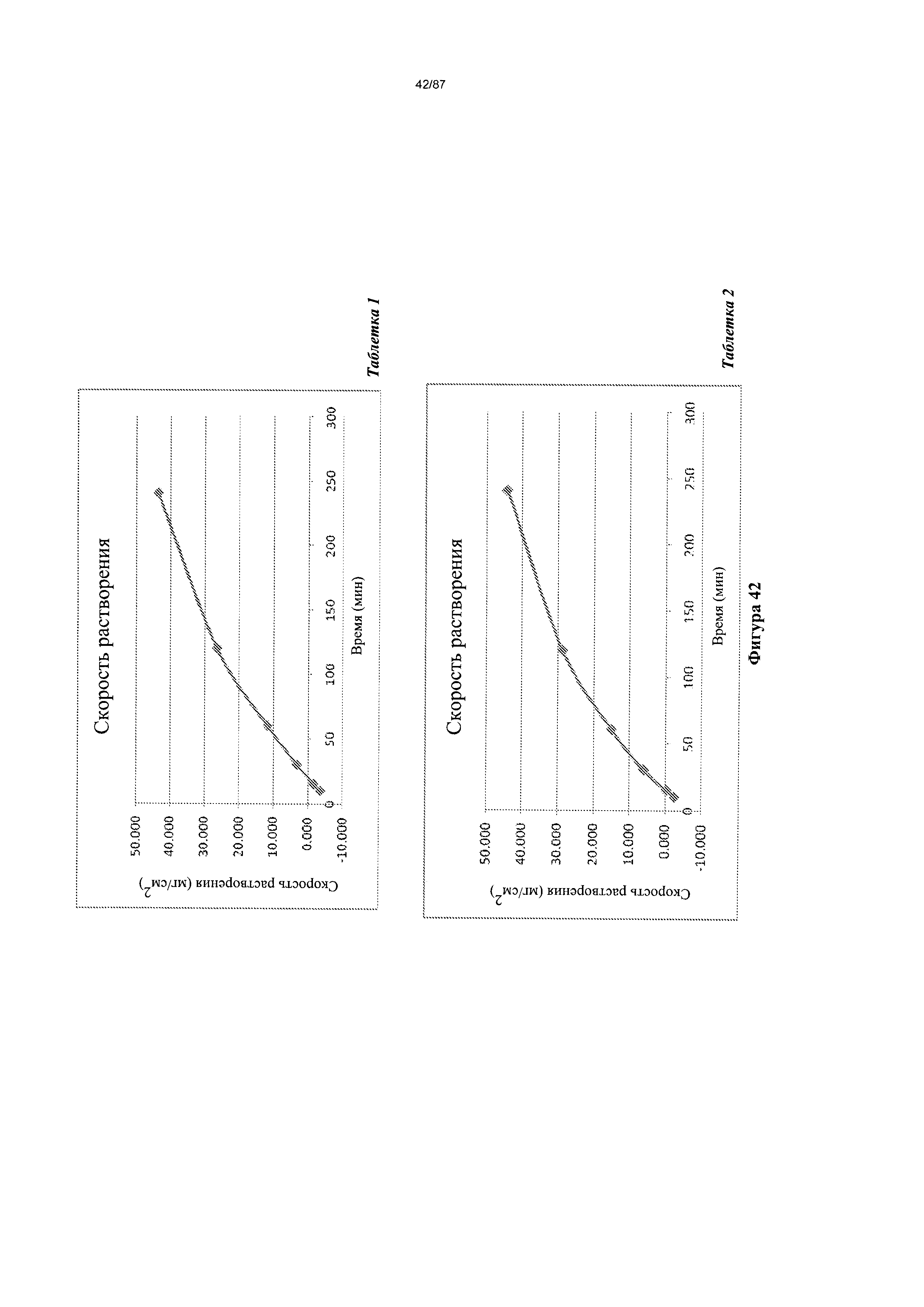
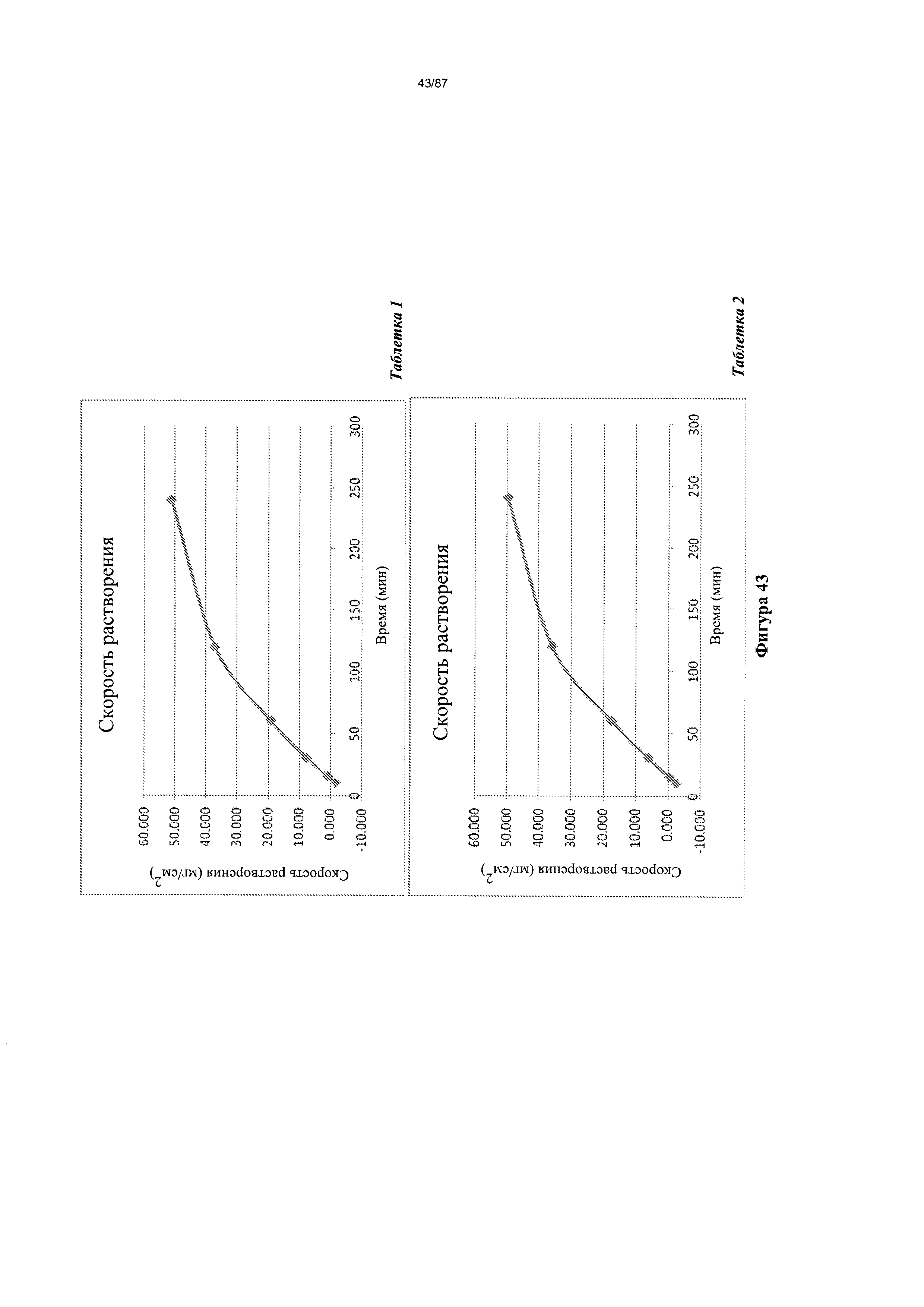
[0049] На фигуре 42 изображено растворение сжатого диска Формы I гидробромидной соли Соединения 1 при pH 4,5.
[0050] На фигуре 43 изображено растворение сжатого диска Формы I гидробромидной соли Соединения 1 при pH 3,0.
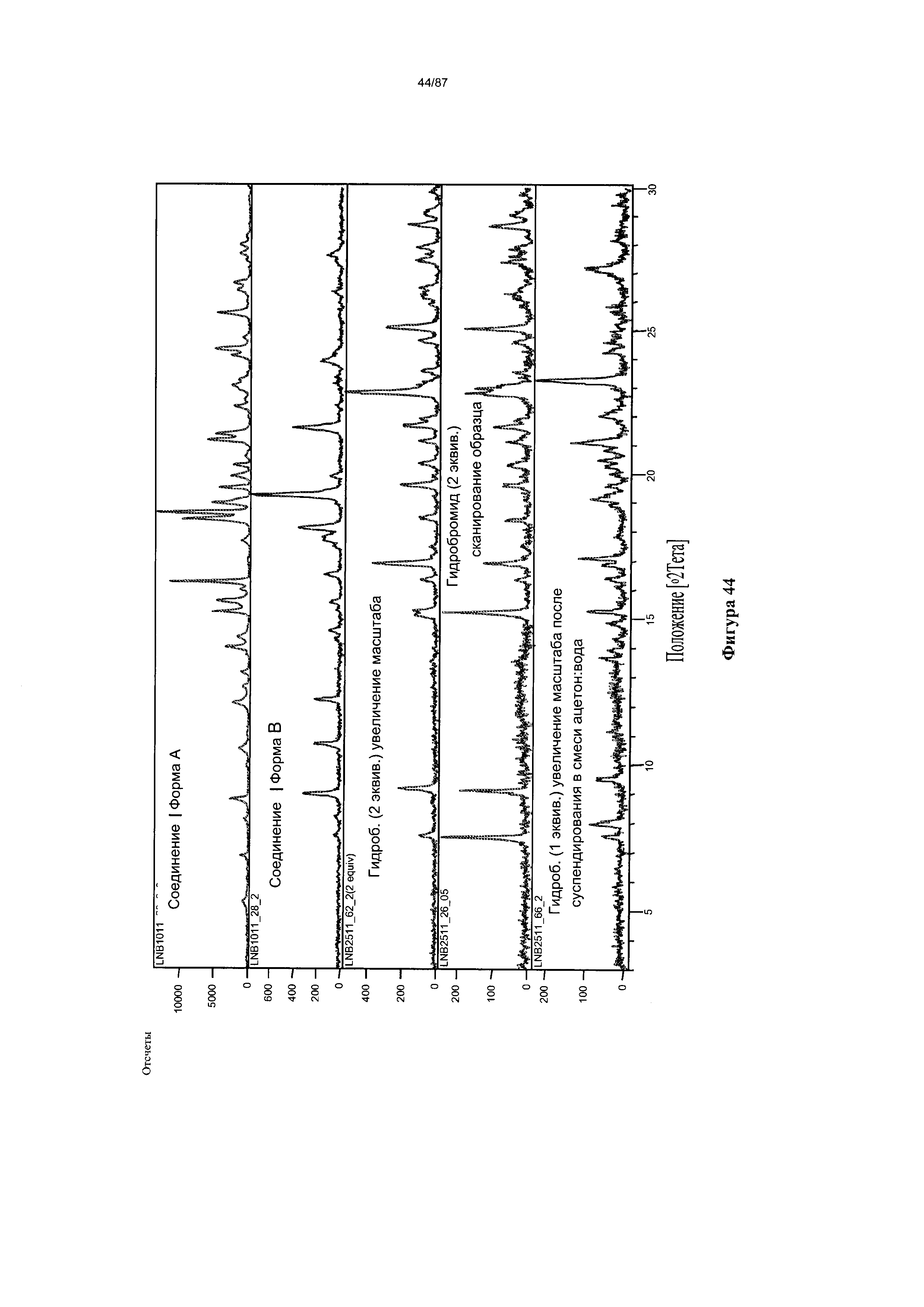
[0051] На фигуре 44 изображена дифрактограмма XRPD для Формы I гидробромидной соли Соединения 1.
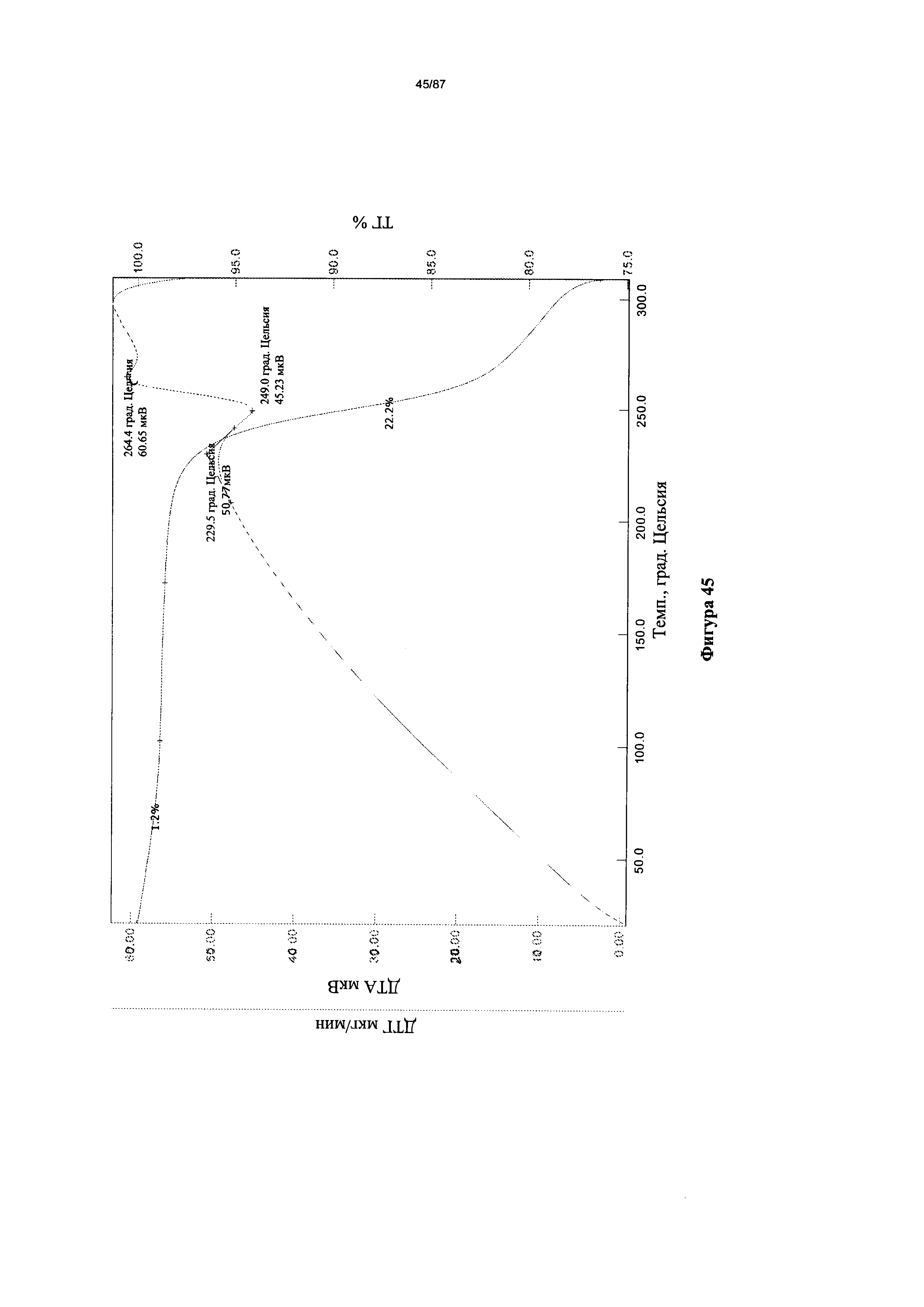
[0052] На фигуре 45 изображены кривые ТГА для Формы I гидробромидной соли Соединения 1.
[0053] На фигуре 46 изображен ИК-спектр Формы I гидробромидной соли Соединения 1.
[0054] На фигуре 47 изображена дифрактограмма XRPD для Формы I гидробромидной соли Соединения 1.
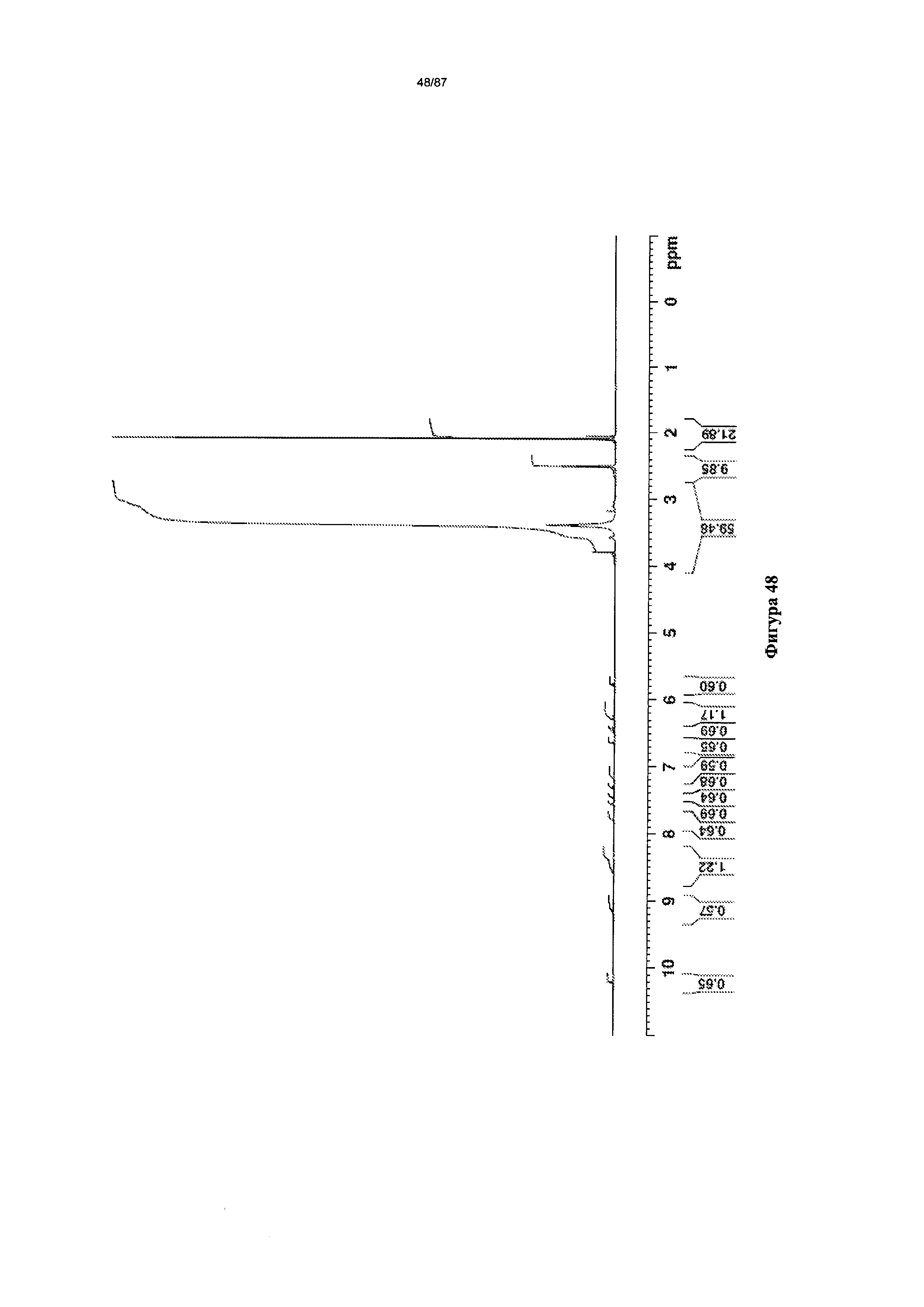
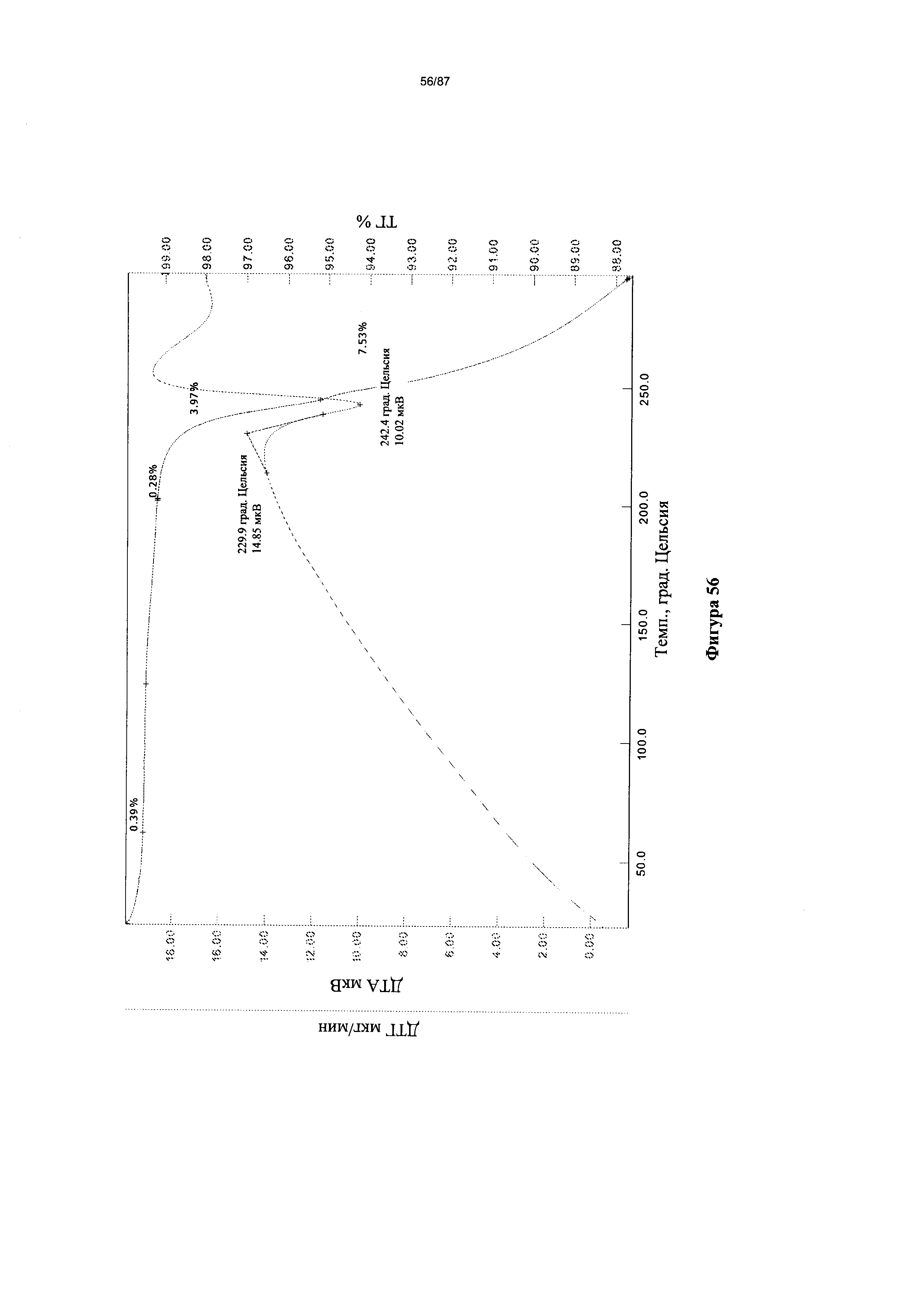
[0055] На фигуре 48 изображен спектр 1Н-ЯМР Формы I гидробромидной соли Соединения 1.
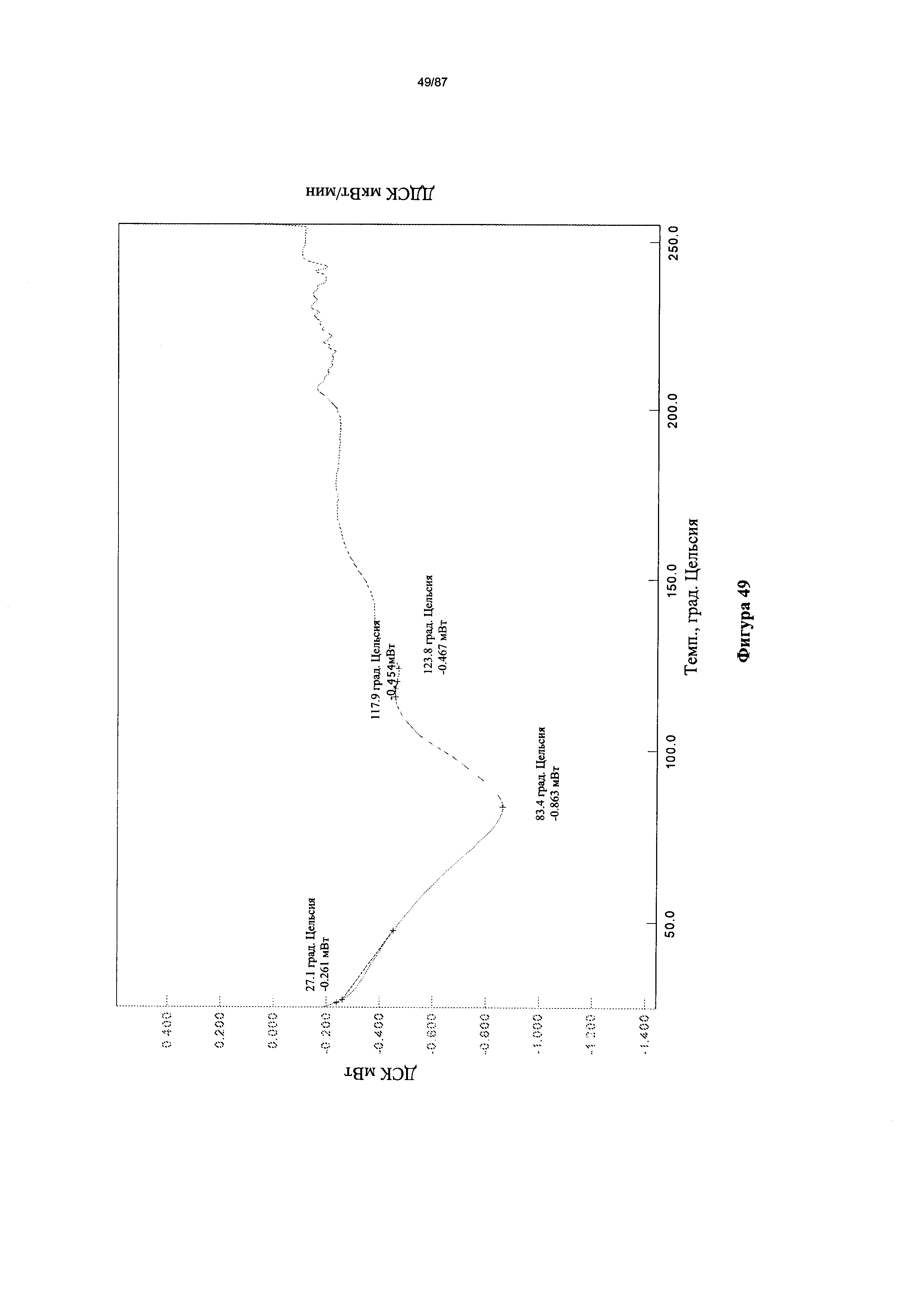
[0056] На фигуре 49 изображена термограмма ДСК Формы I гидробромидной соли Соединения 1.
[0057] На фигуре 50 изображены результаты эксперимента по суспендированию, в котором были задействованы форма свободного основания Соединения 1 и гидрат бис-безилата.
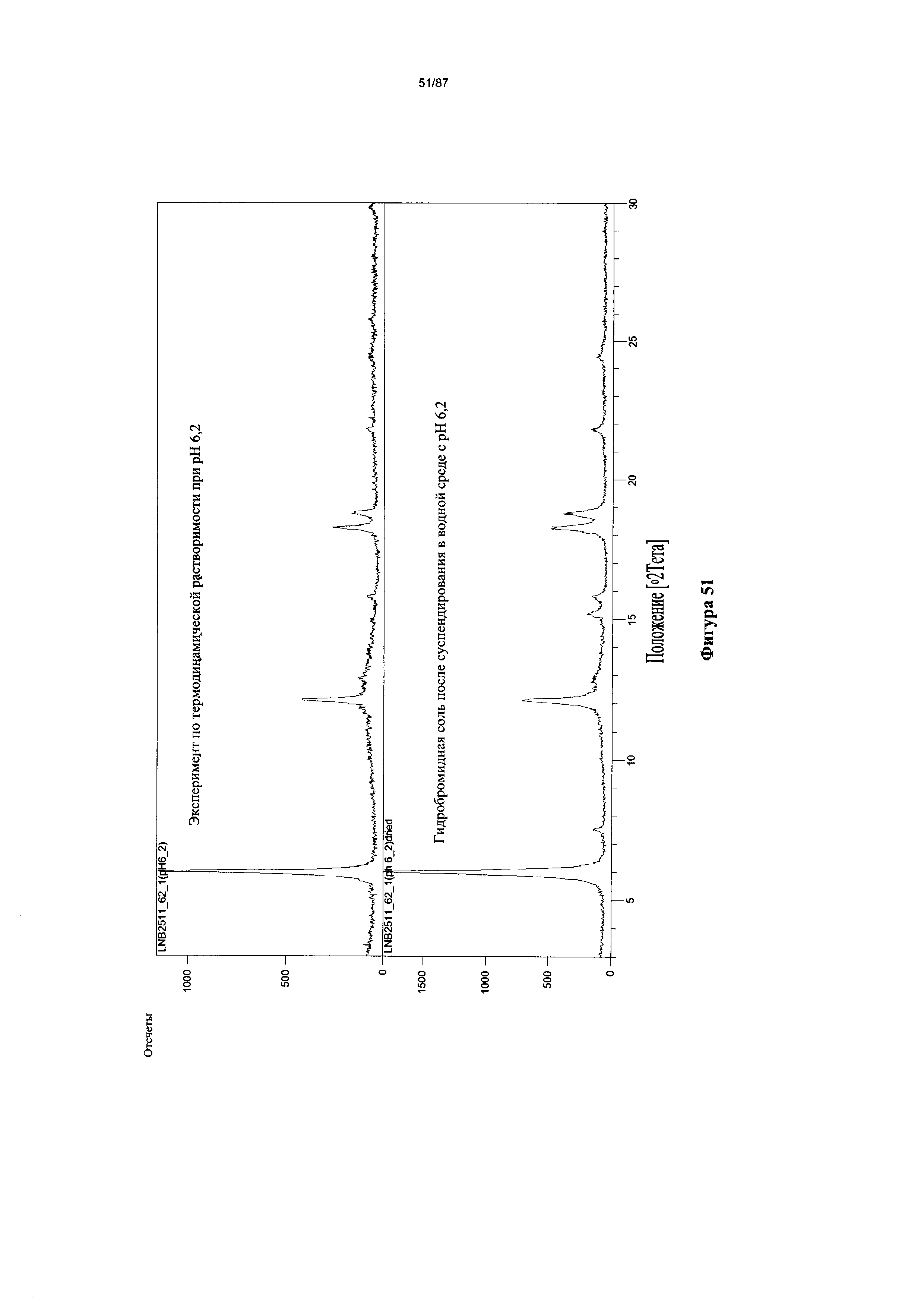
[0058] На фигуре 51 изображены результаты эксперимента по суспендированию, в котором была задействована Форма I гидробромидной соли Соединения 1 при pH 6,2.
[0059] На фигуре 52 изображена дифрактограмма XRPD для Формы I гидробромидной соли Соединения 1.
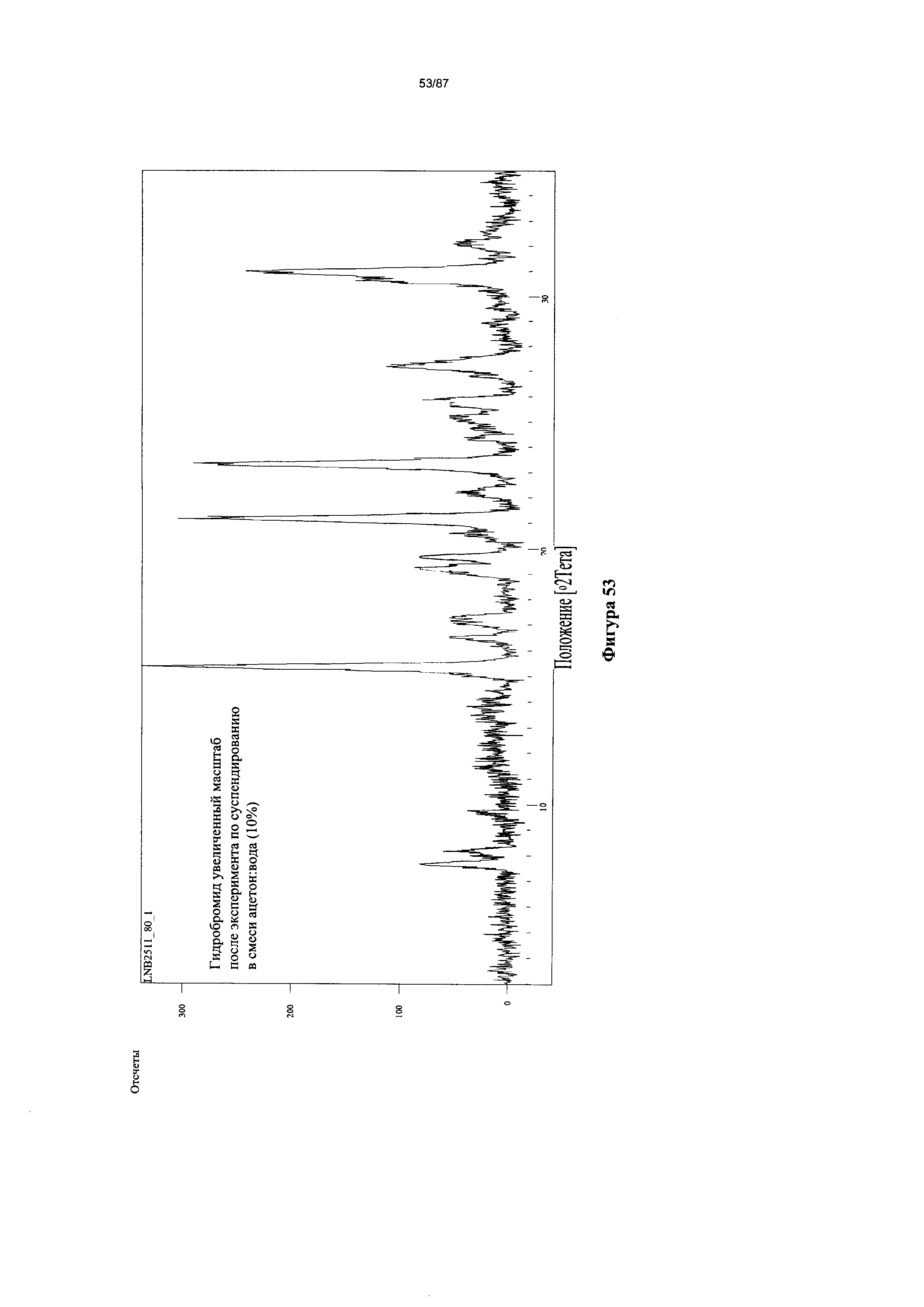
[0060] На фигуре 53 изображена дифрактограмма XRPD для Формы I гидробромидной соли Соединения 1.
[0061] На фигуре 54 изображен ИК-спектр Формы I гидробромидной соли Соединения 1.
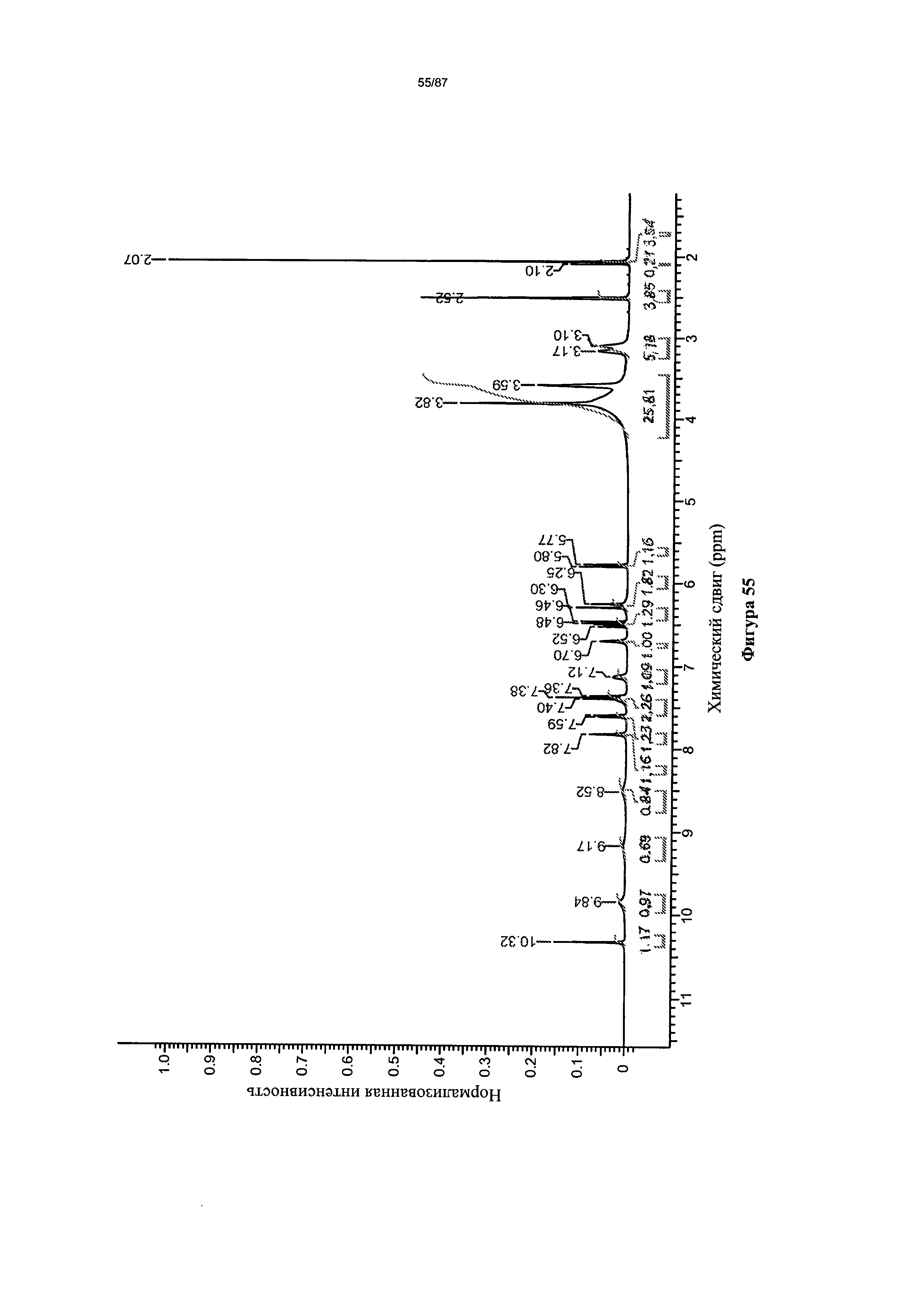
[0062] На фигуре 55 изображен спектр 1Н-ЯМР Формы I гидробромидной соли Соединения 1.
[0063] На фигуре 56 изображены кривые ТГА для Формы I гидробромидной соли Соединения 1.
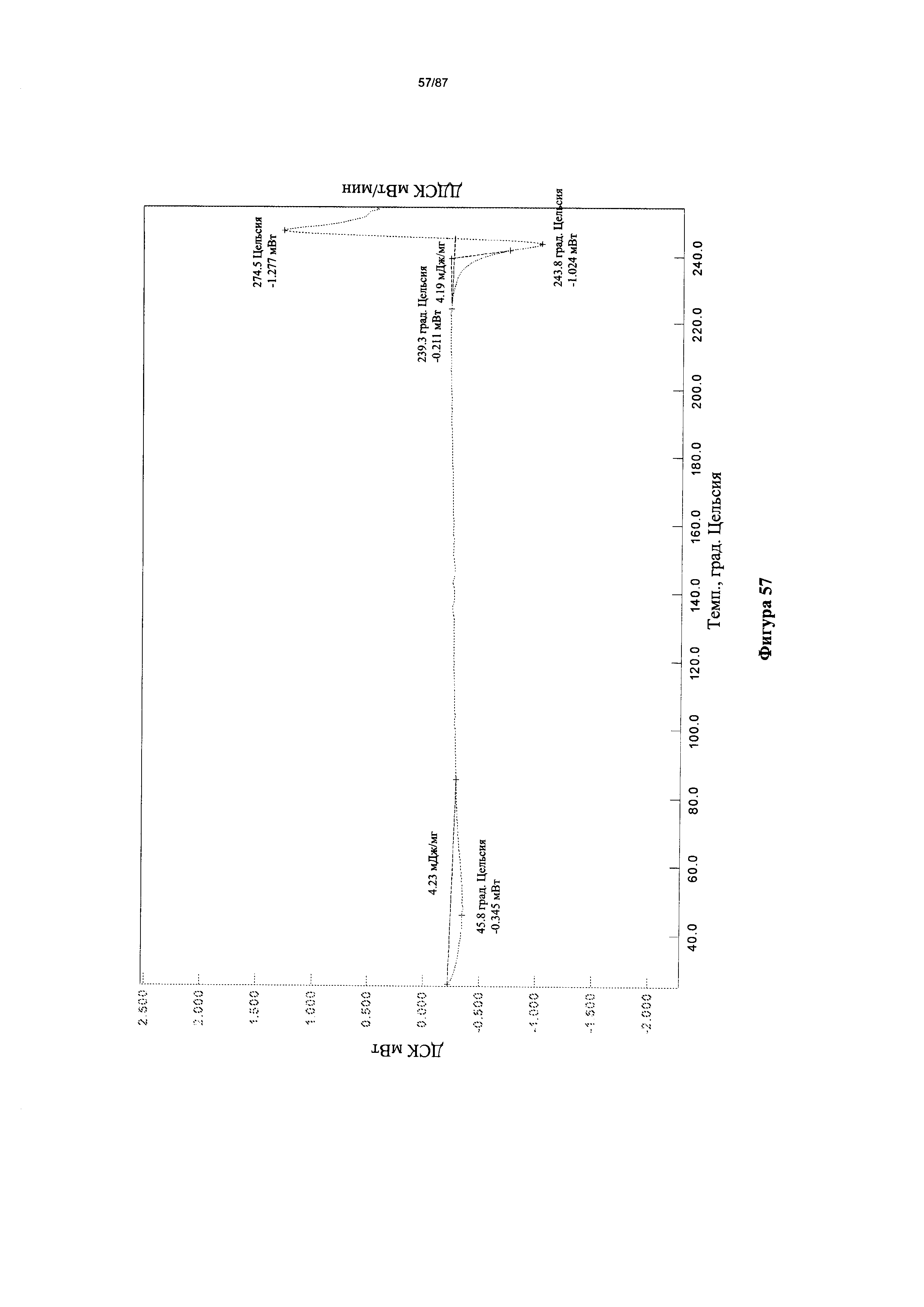
[0064] На фигуре 57 изображена термограмма ДСК для Формы I гидробромидной соли Соединения 1.
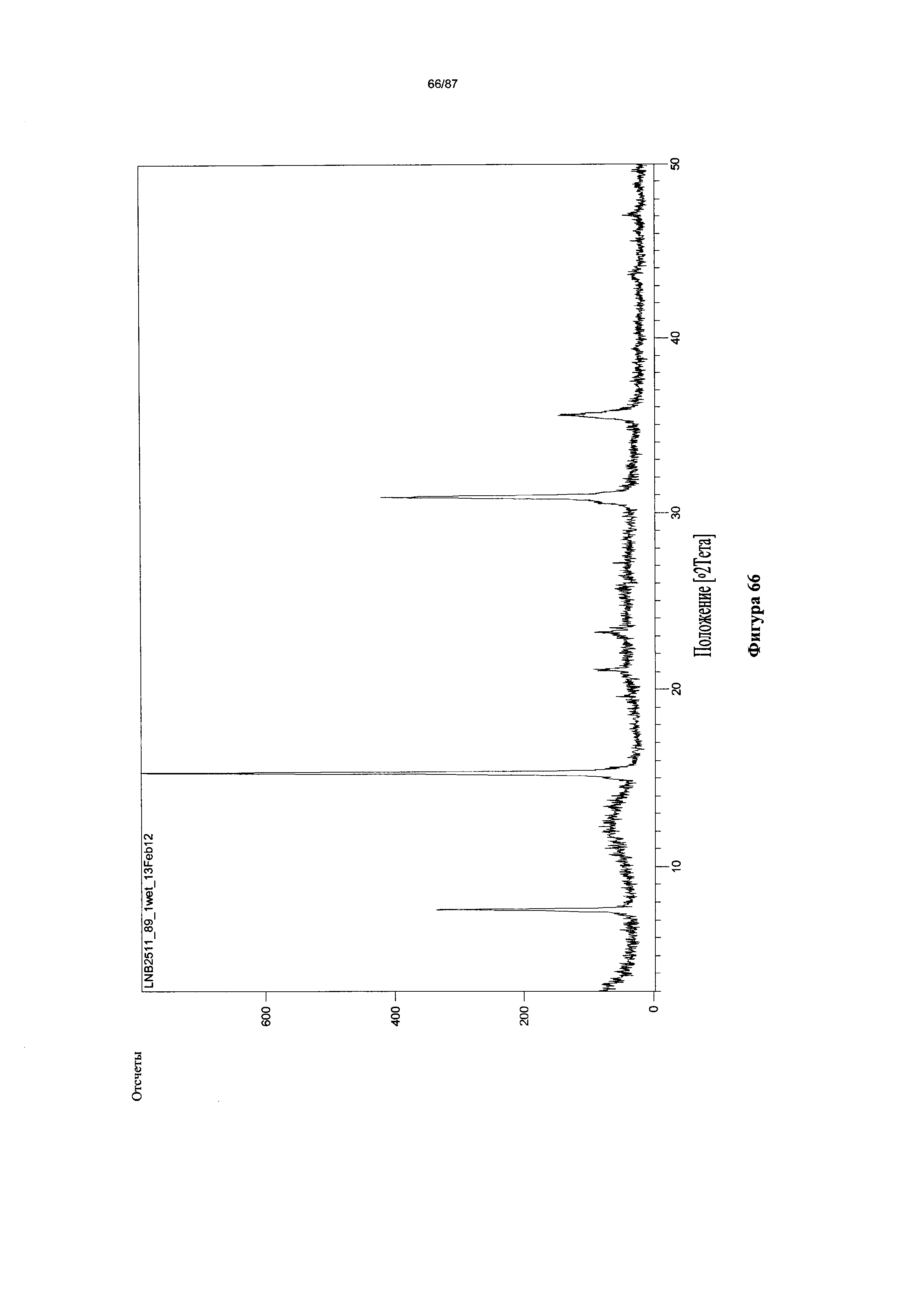
[0065] На фигуре 58 изображена дифрактограмма XRPD для Формы I гидробромидной соли Соединения 1 после нагревания.
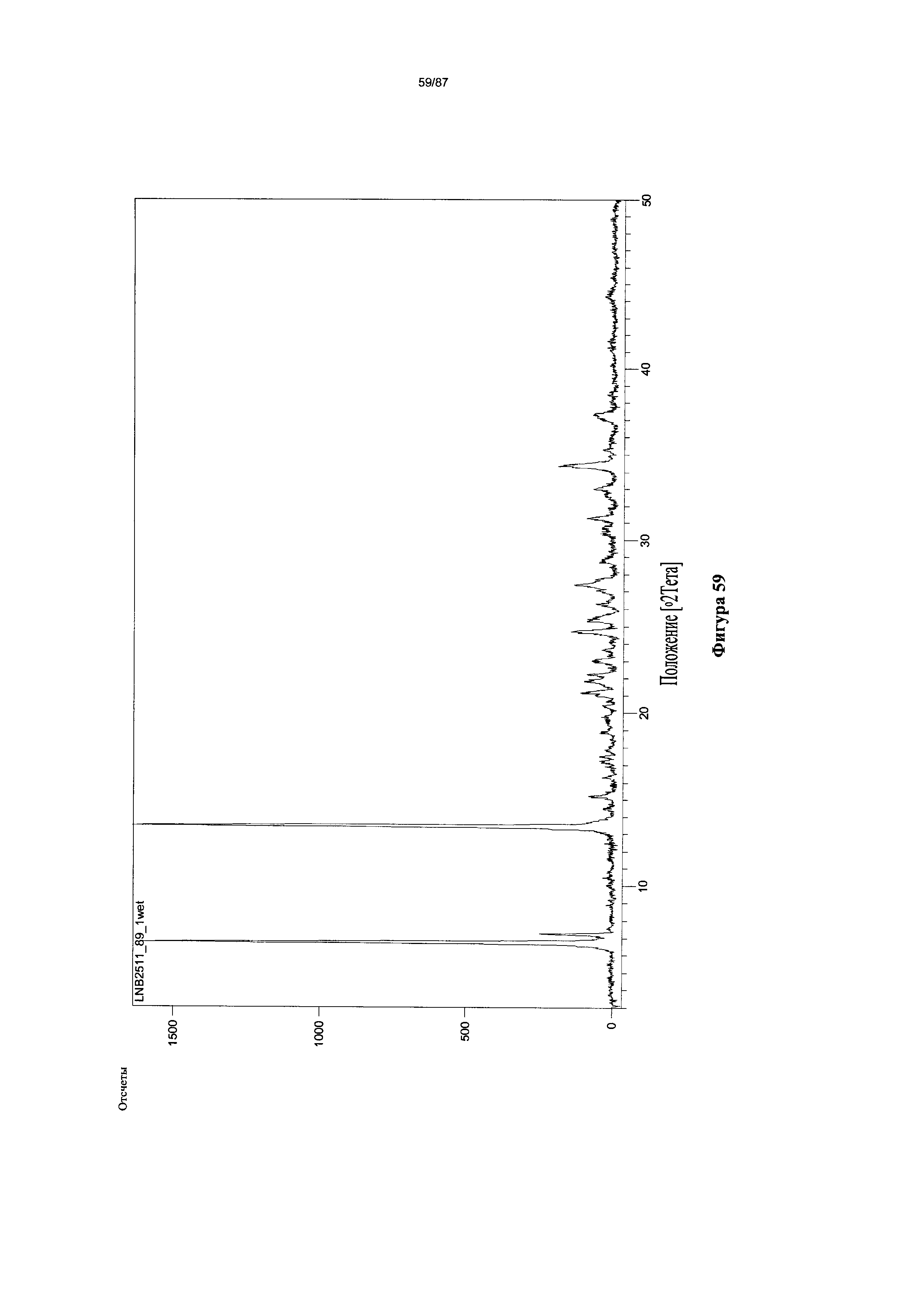
[0066] На фигуре 59 изображена дифрактограмма XRPD для Формы I гидробромидной соли Соединения 1.
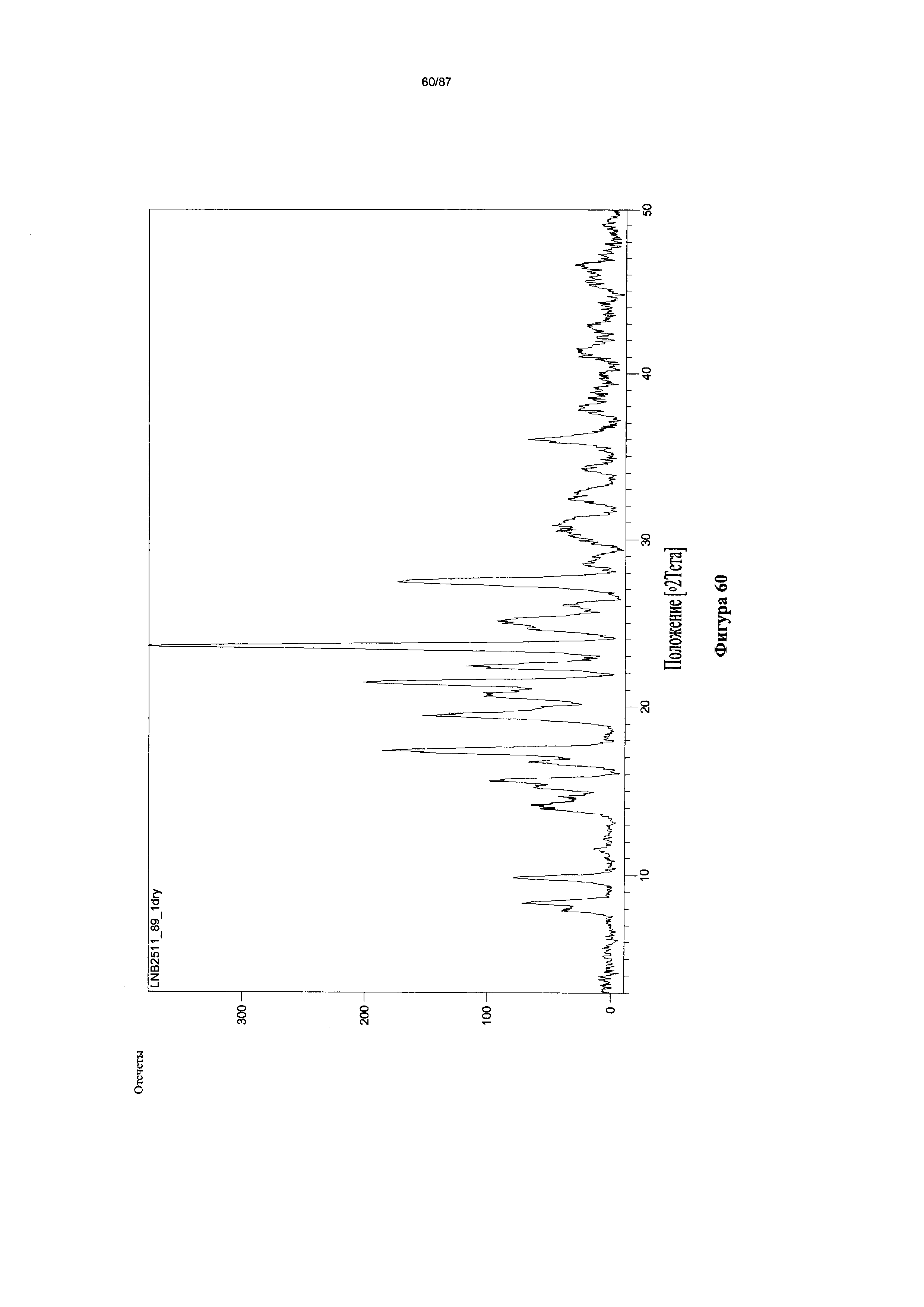
[0067] На фигуре 60 изображена дифрактограмма XRPD для Формы I гидробромидной соли Соединения 1.
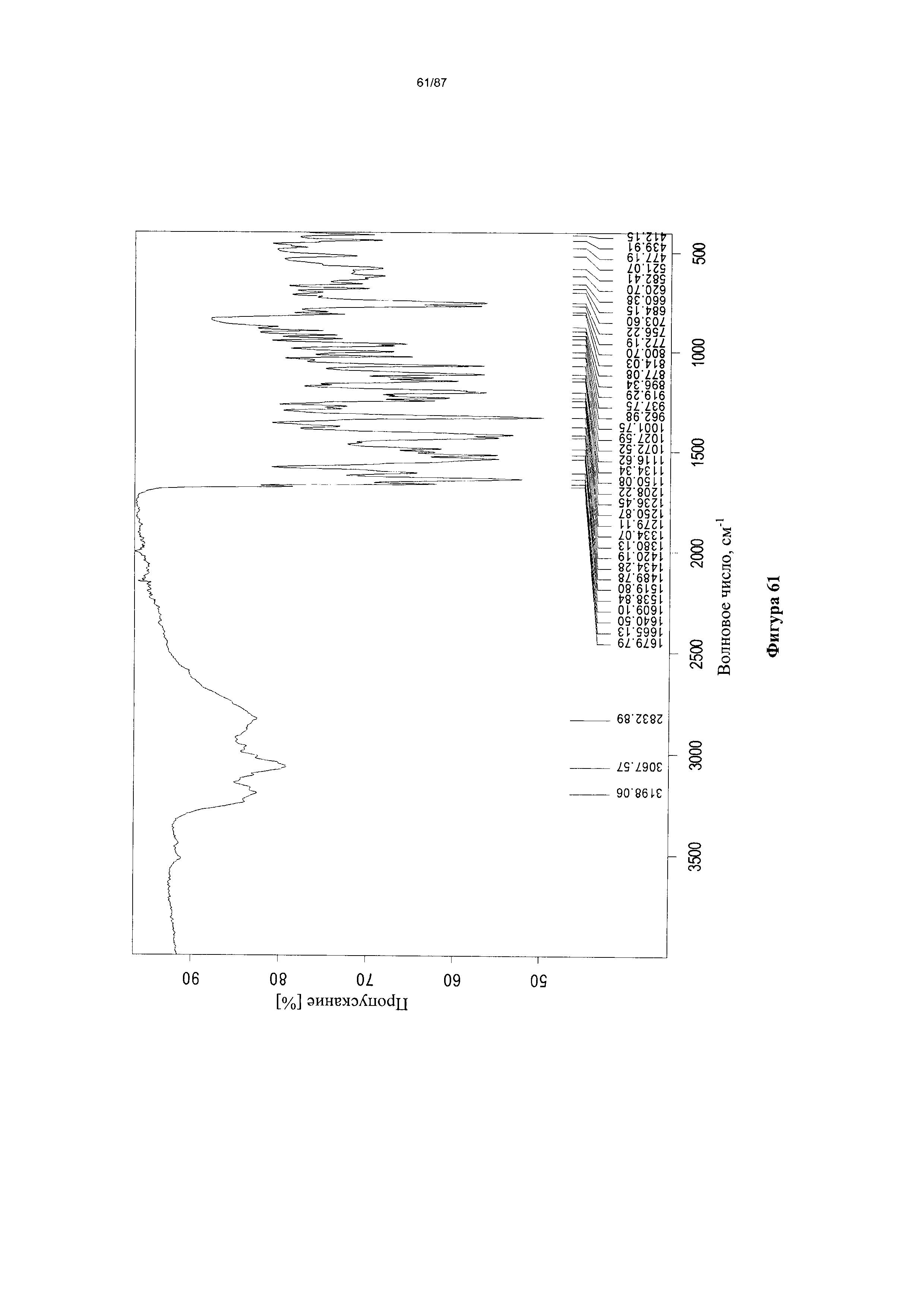
[0068] На фигуре 61 изображен ИК-спектр Формы I гидробромидной соли Соединения 1.
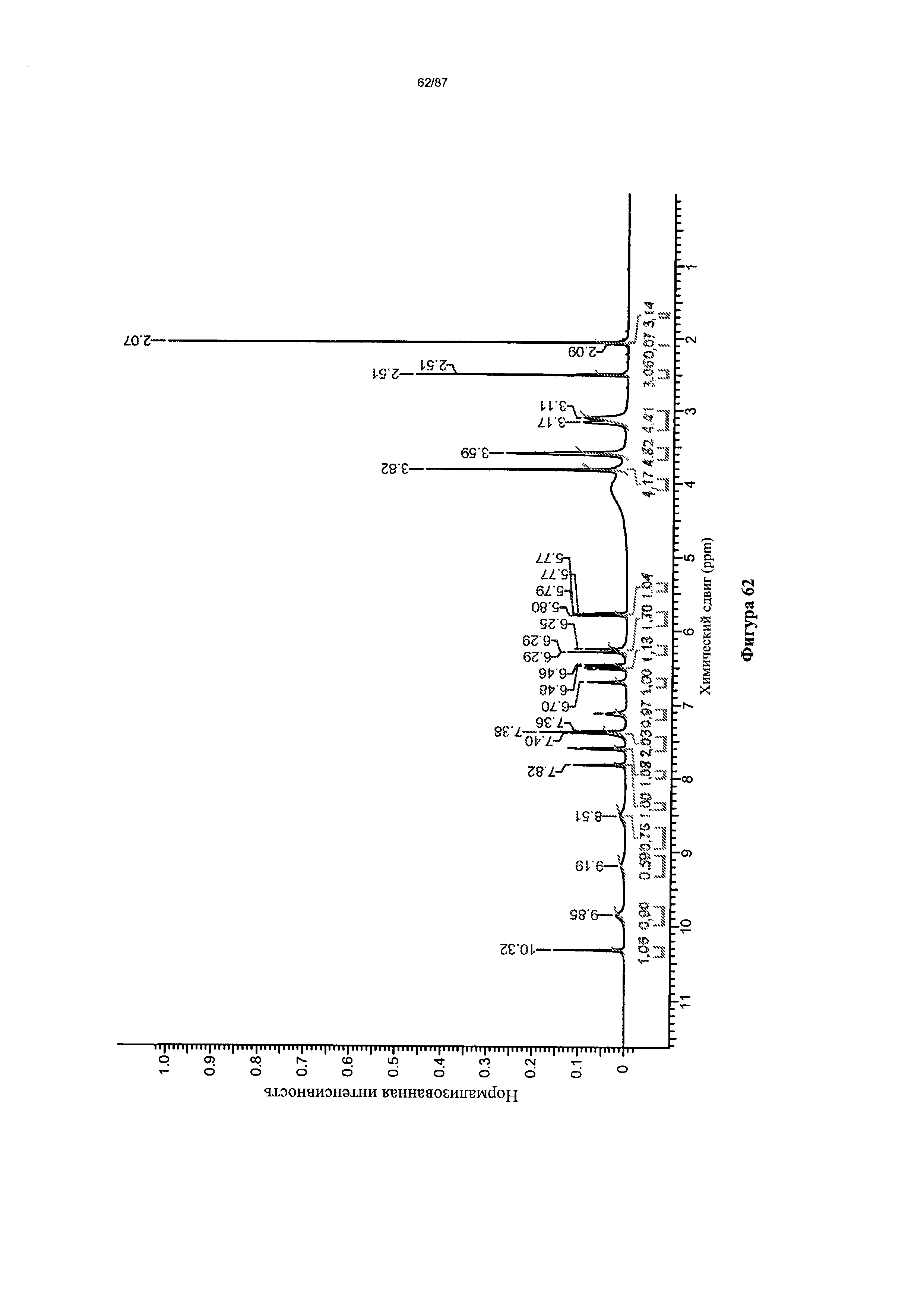
[0069] На фигуре 62 изображен спектр 1Н-ЯМР Формы I гидробромидной соли Соединения 1.
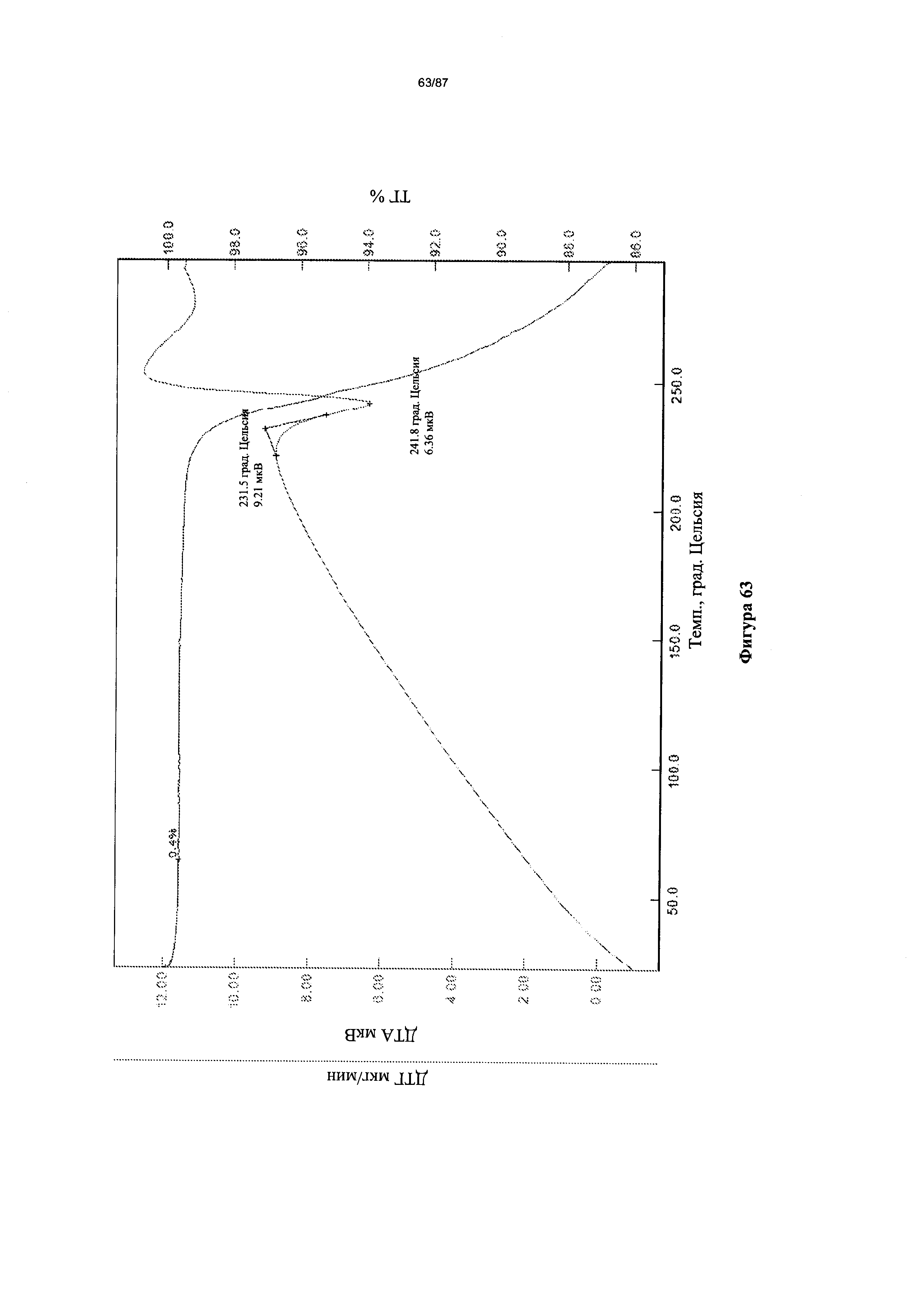
[0070] На фигуре 63 изображены кривые ТГА для Формы I гидробромидной соли Соединения 1.
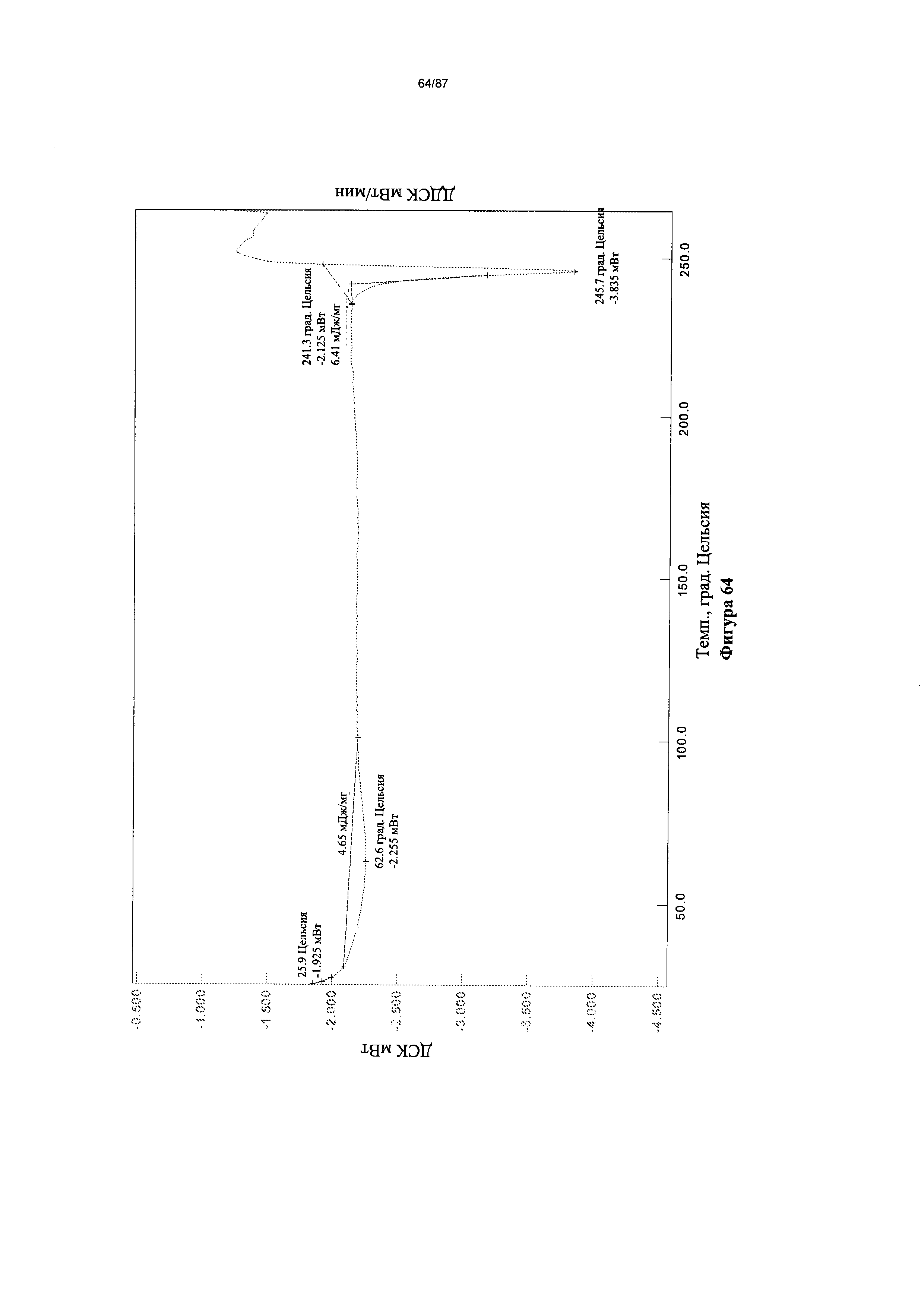
[0071] На фигуре 64 изображена термограмма ДСК для Формы I гидробромидной соли Соединения 1.
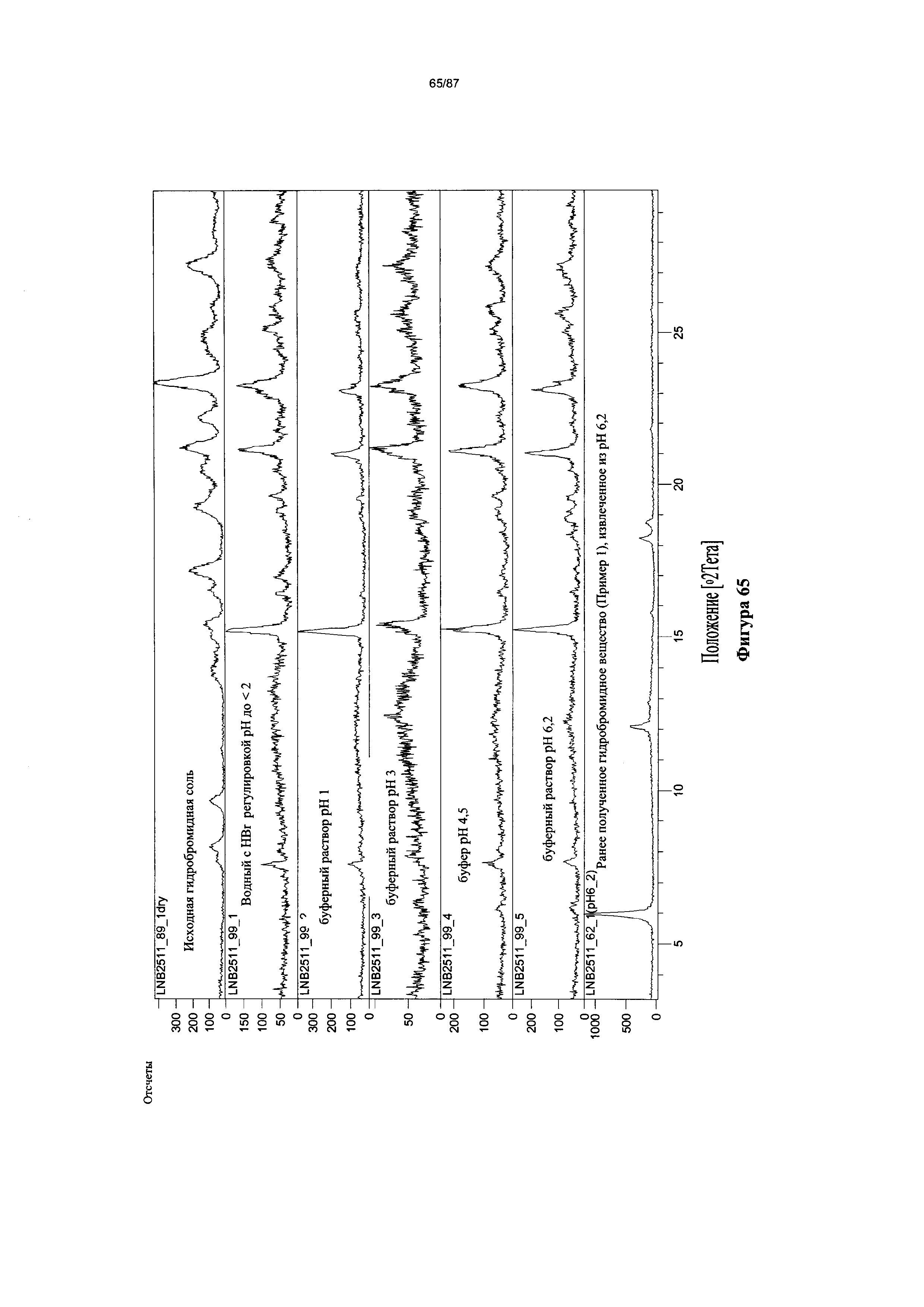
[0072] На фигуре 65 изображены результаты термодинамического исследования растворимости Формы I гидробромидной соли Соединения 1, полученные путем анализа дифрактограмм XRPD.
[0073] На фигуре 66 изображена дифрактограмма XRPD для Формы I гидробромидной соли Соединения 1 после выдерживания в течение 1,5 месяцев.
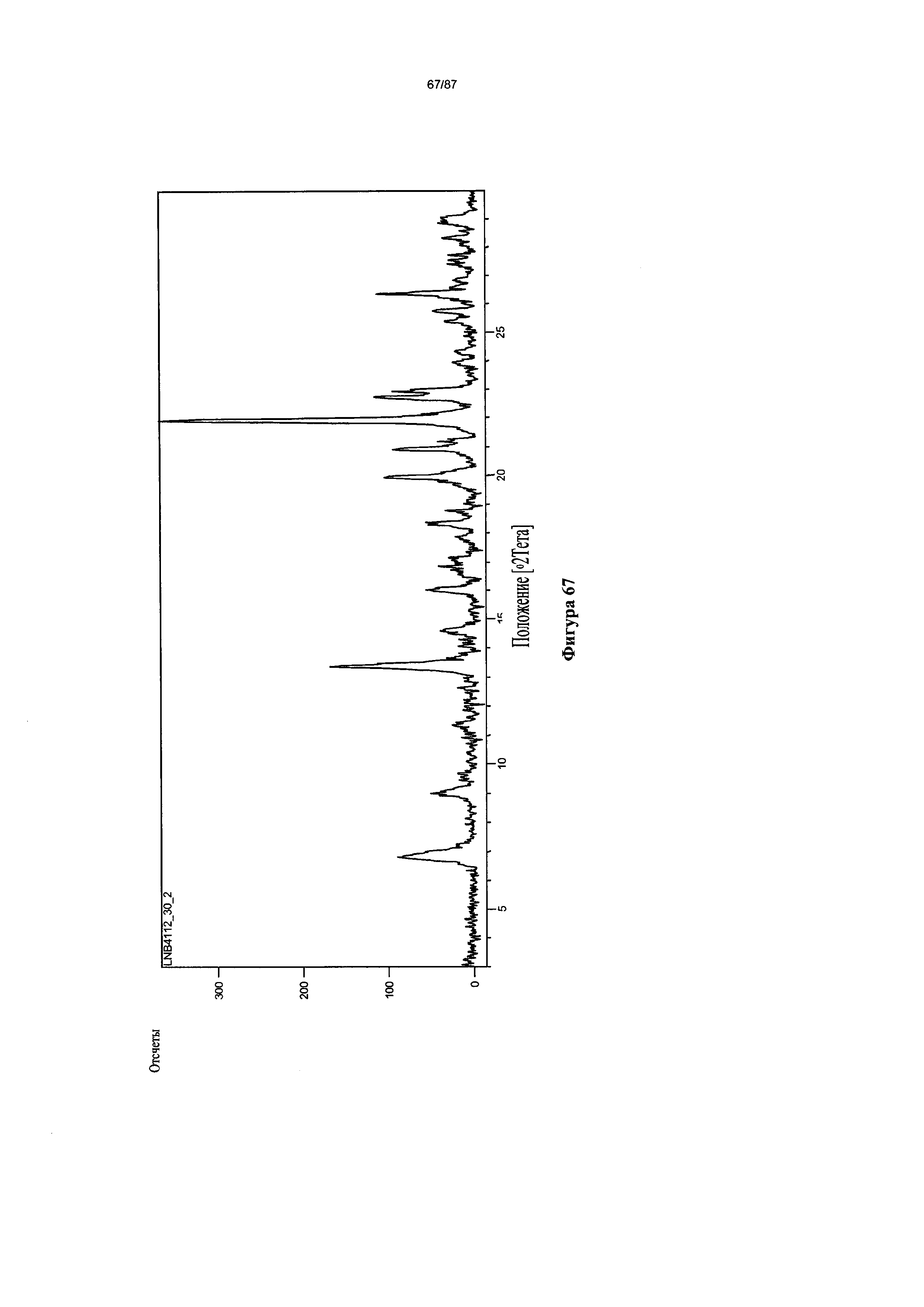
[0074] На фигуре 67 изображена дифрактограмма XRPD для Формы III гидробромидной соли Соединения 1.
[0075] На фигуре 68 изображены кривые ТГА для Формы III гидробромидной соли Соединения 1.
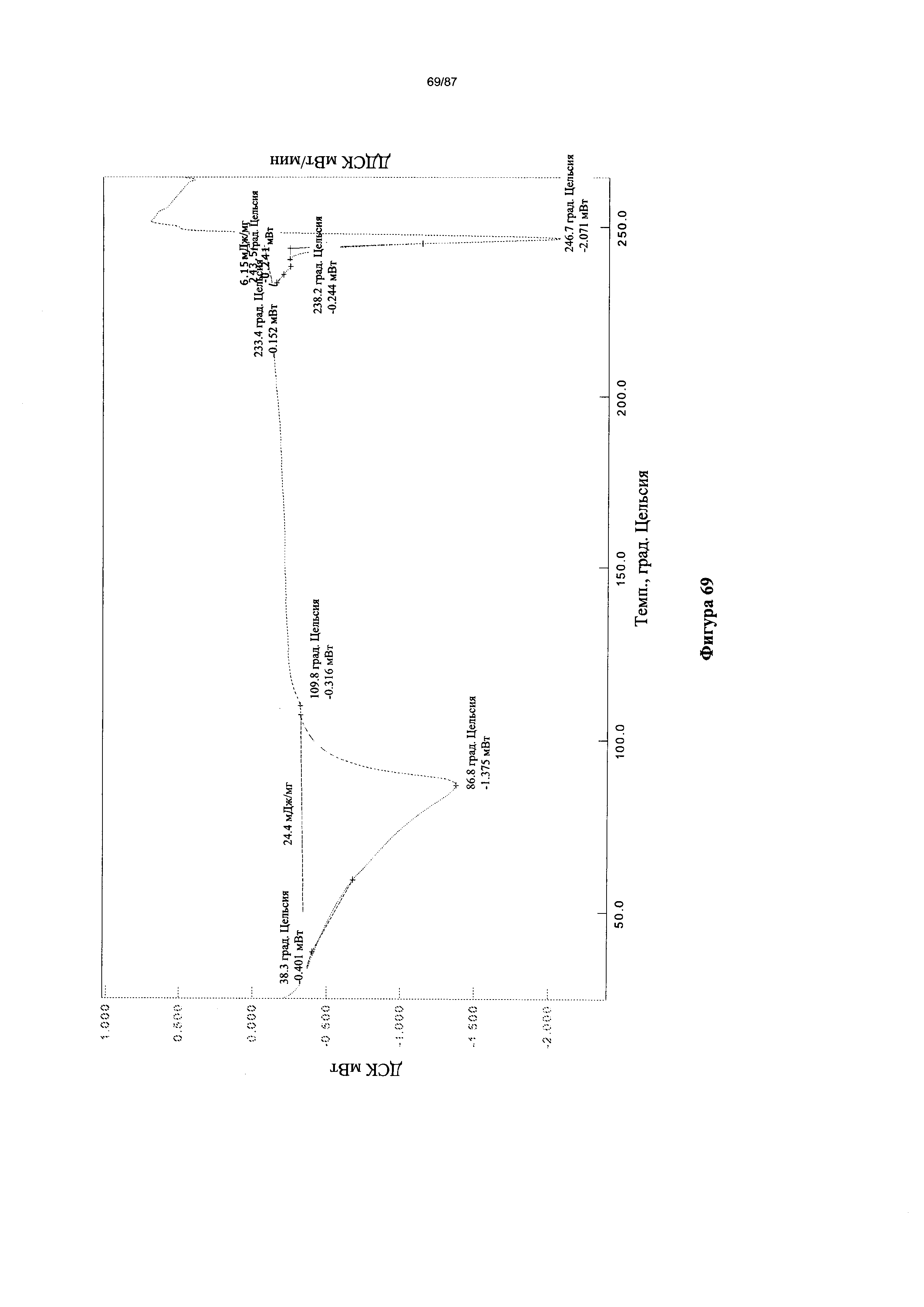
[0076] На фигуре 69 изображена термограмма ДСК для Формы III гидробромидной соли Соединения 1.
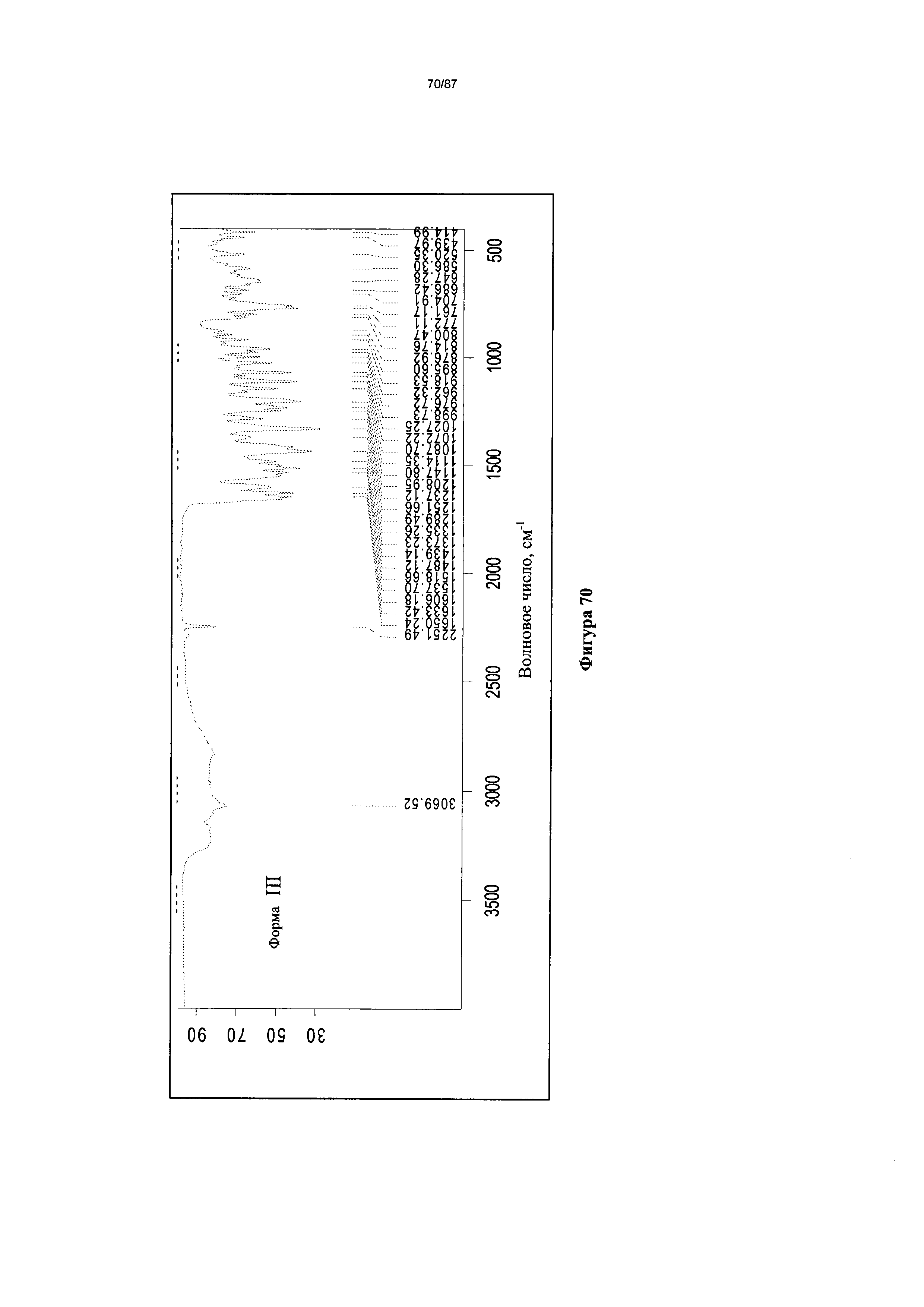
[0077] На фигуре 70 изображен ИК-спектр Формы III гидробромидной соли Соединения 1.
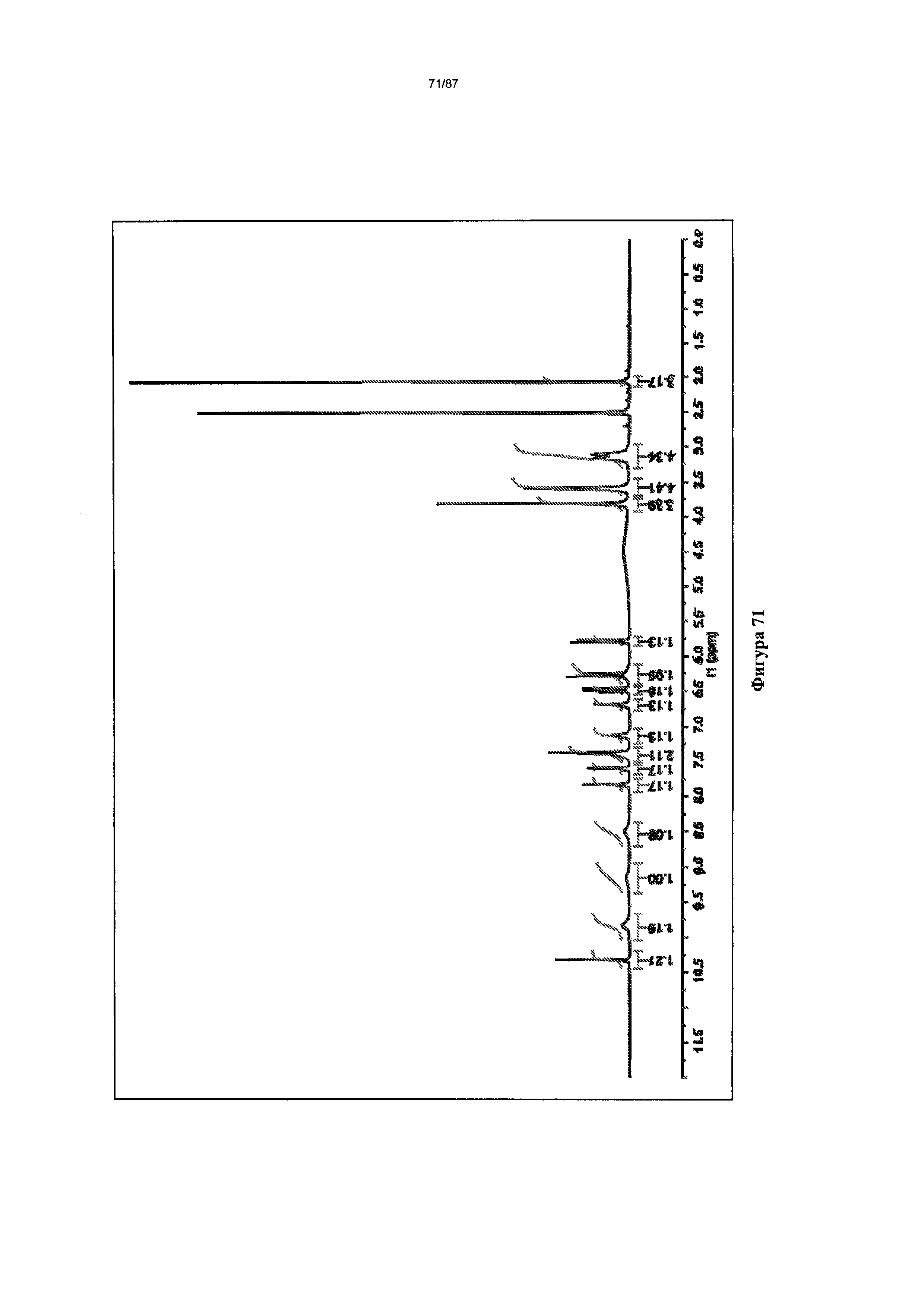
[0078] На фигуре 71 изображен спектр 1Н-ЯМР Формы III гидробромидной соли Соединения 1.
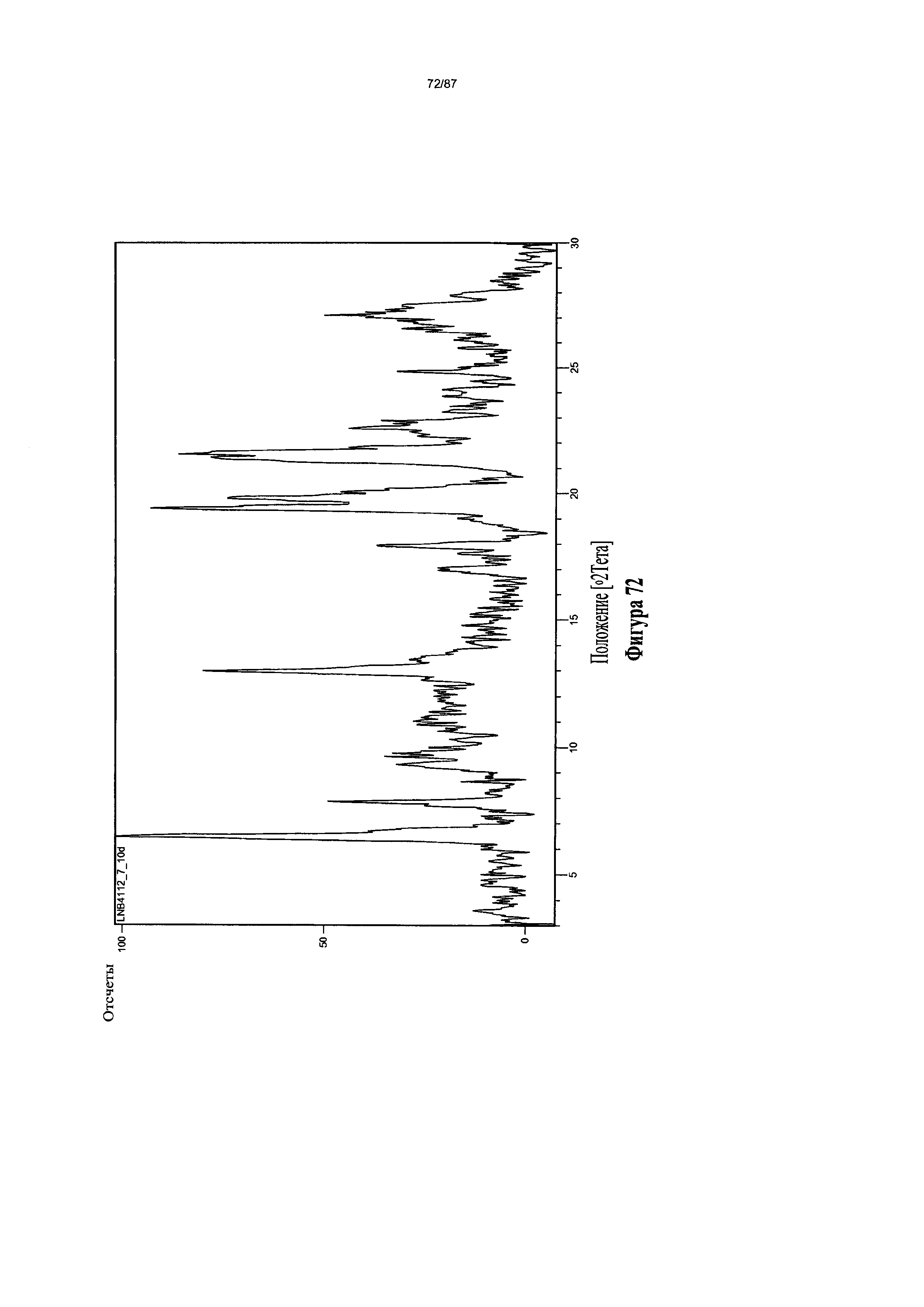
[0079] На фигуре 72 изображена дифрактограмма XRPD для Формы IV гидробромидной соли Соединения 1.
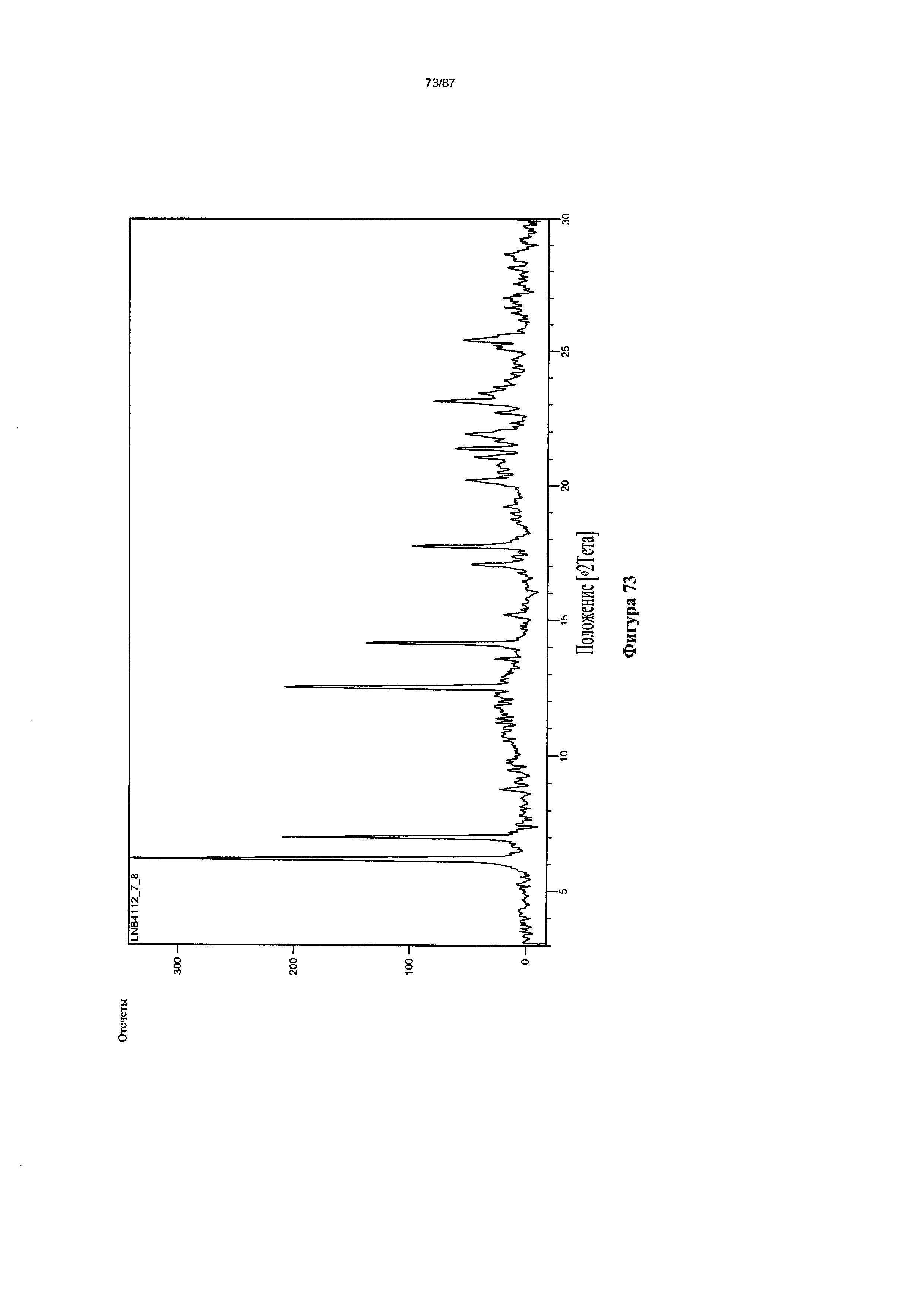
[0080] На фигуре 73 изображена дифрактограмма XRPD для Формы V гидробромидной соли Соединения 1.
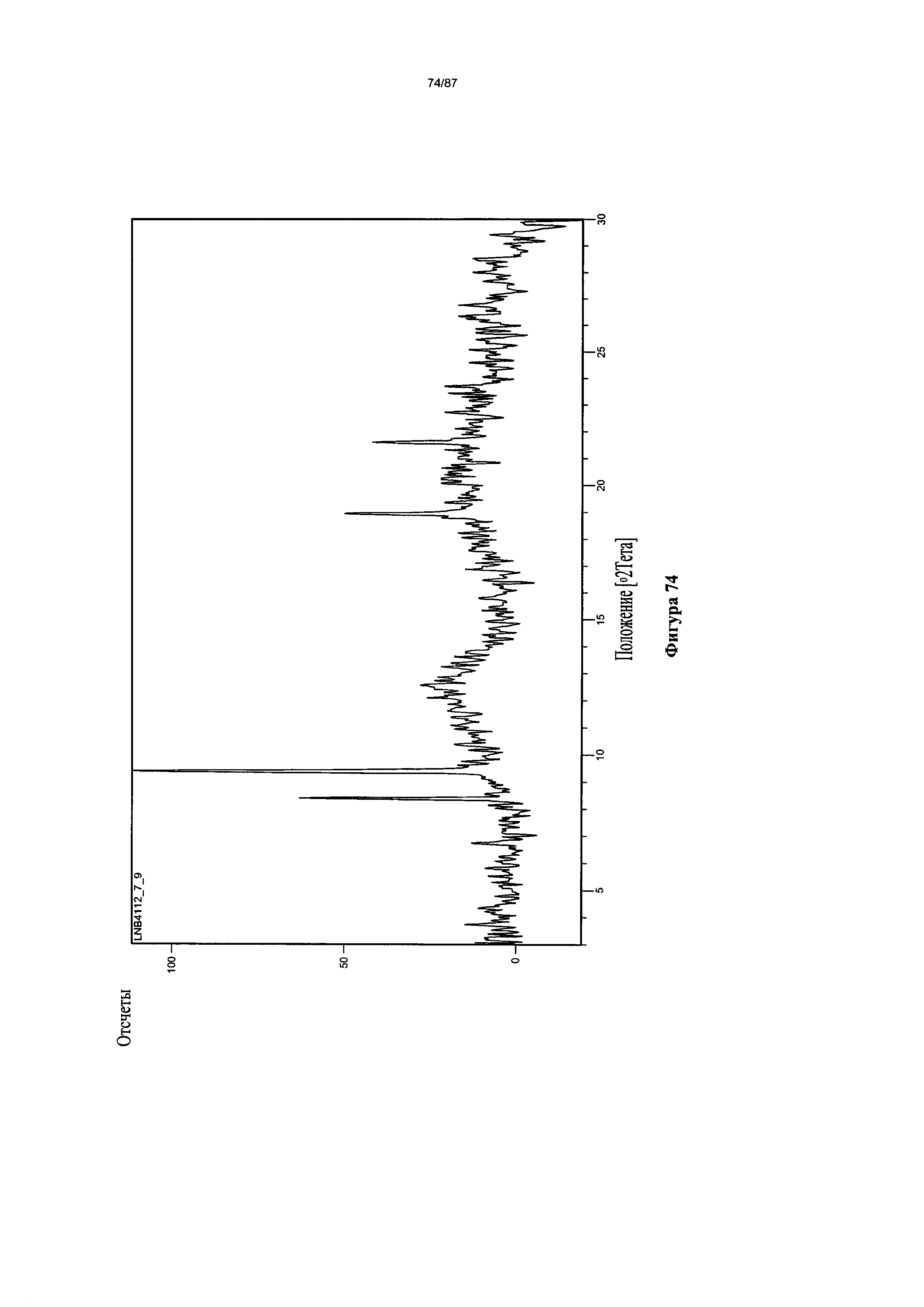
[0081] На фигуре 74 изображена дифрактограмма XRPD для Формы VI гидробромидной соли Соединения 1.
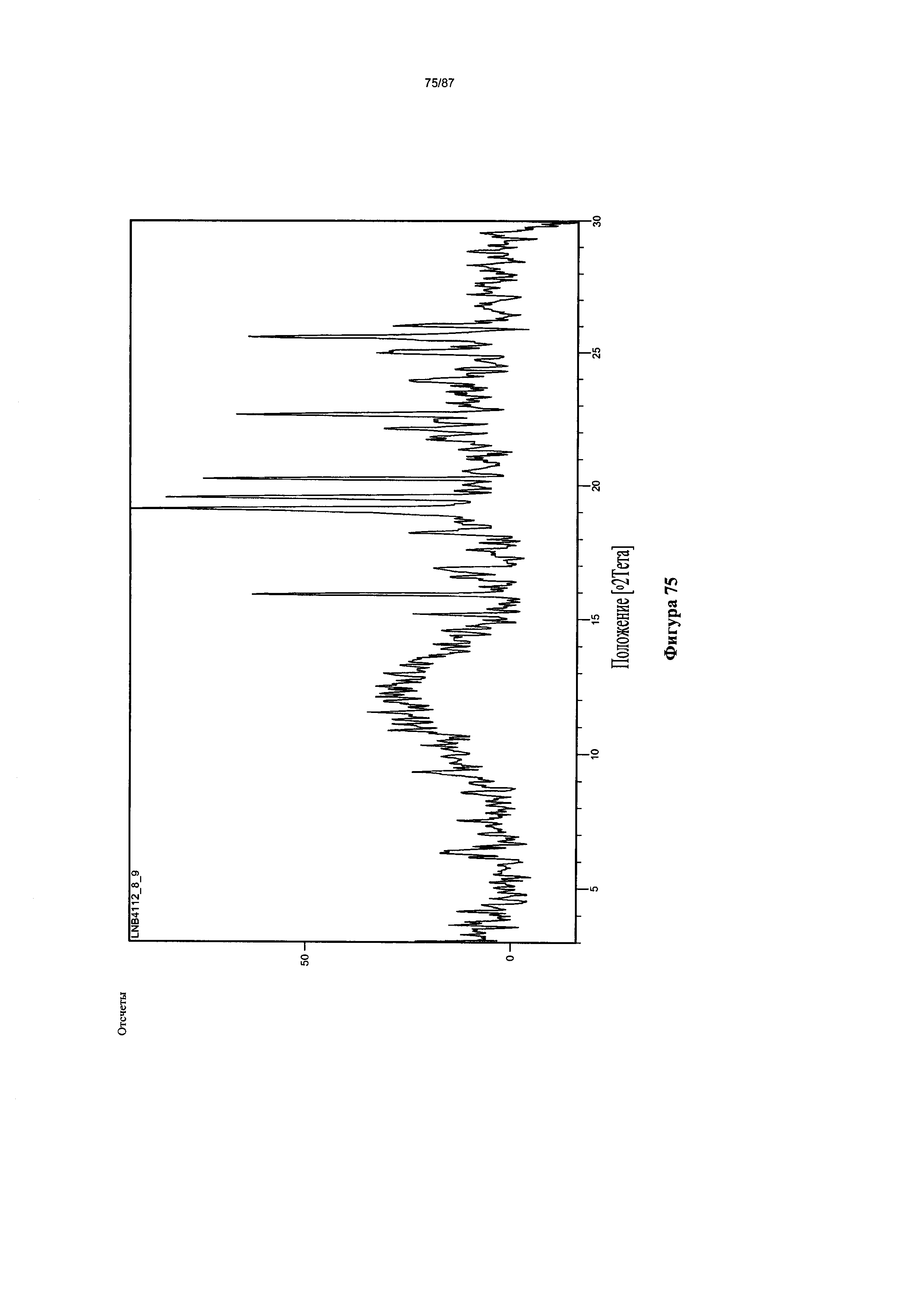
[0082] На фигуре 75 изображена дифрактограмма XRPD для Формы VII гидробромидной соли Соединения 1.
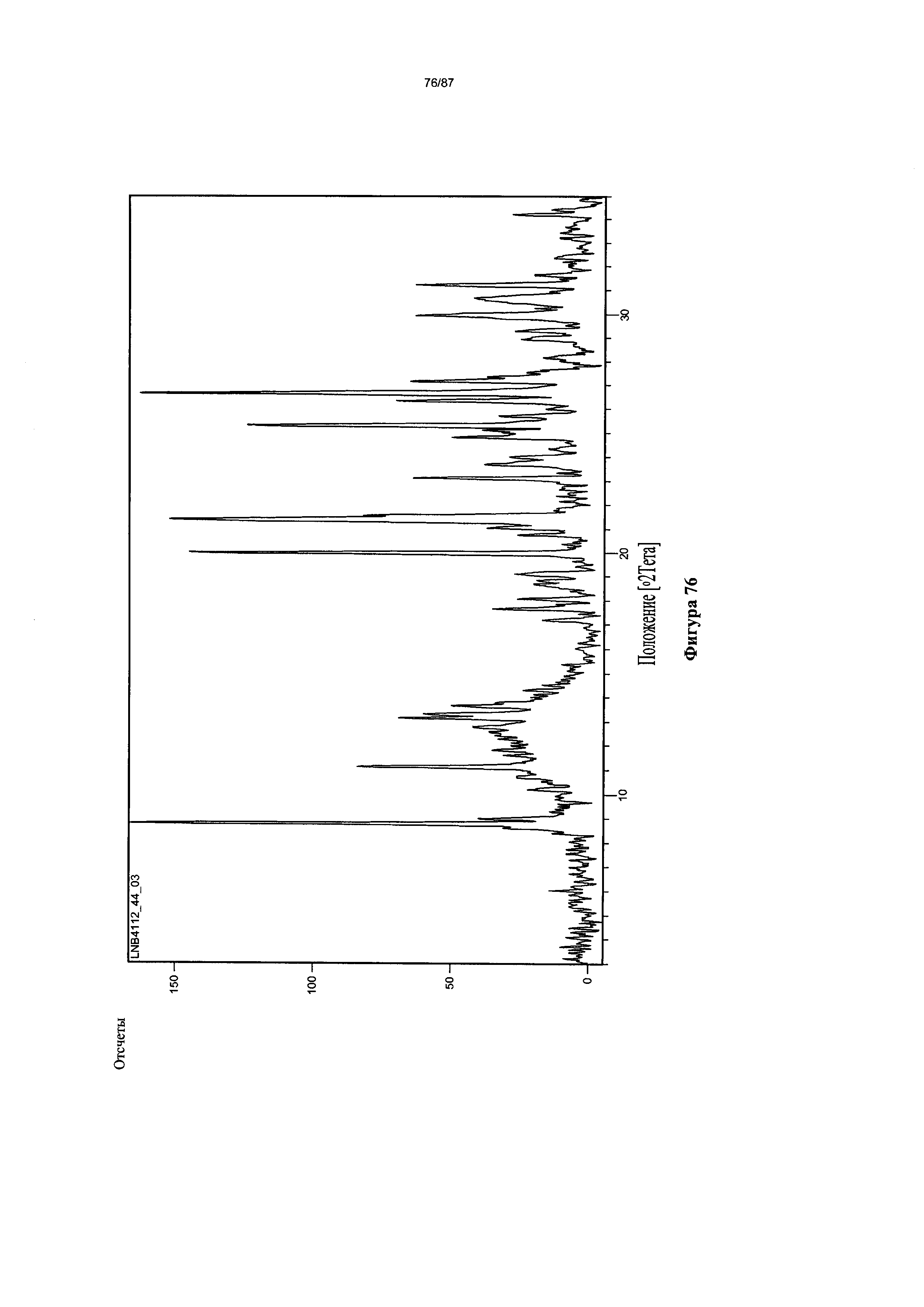
[0083] На фигуре 76 изображена дифрактограмма XRPD для Формы VIII гидробромидной соли Соединения 1.
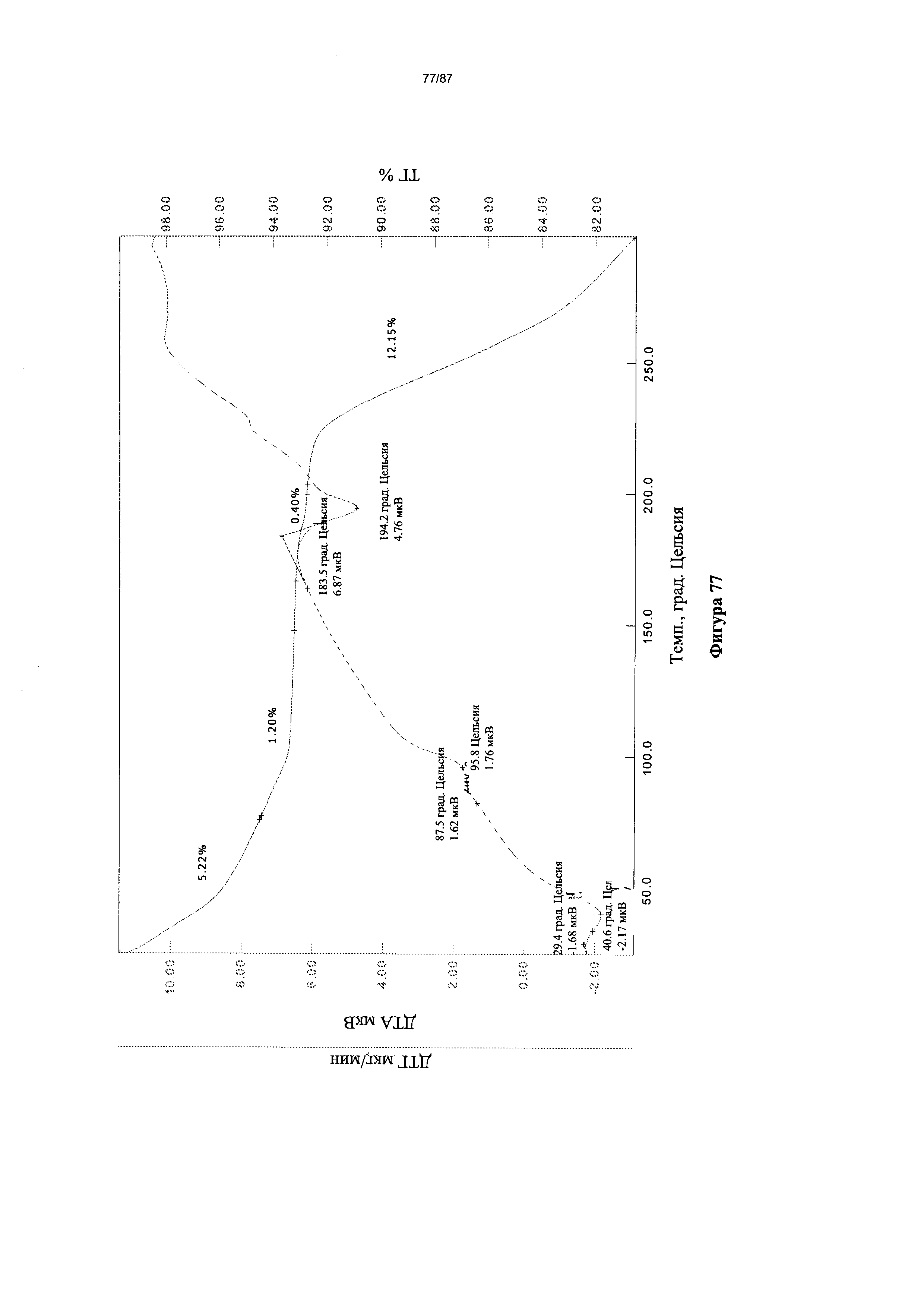
[0084] На фигуре 77 изображены кривые ТГА для Формы VIII гидробромидной соли Соединения 1.
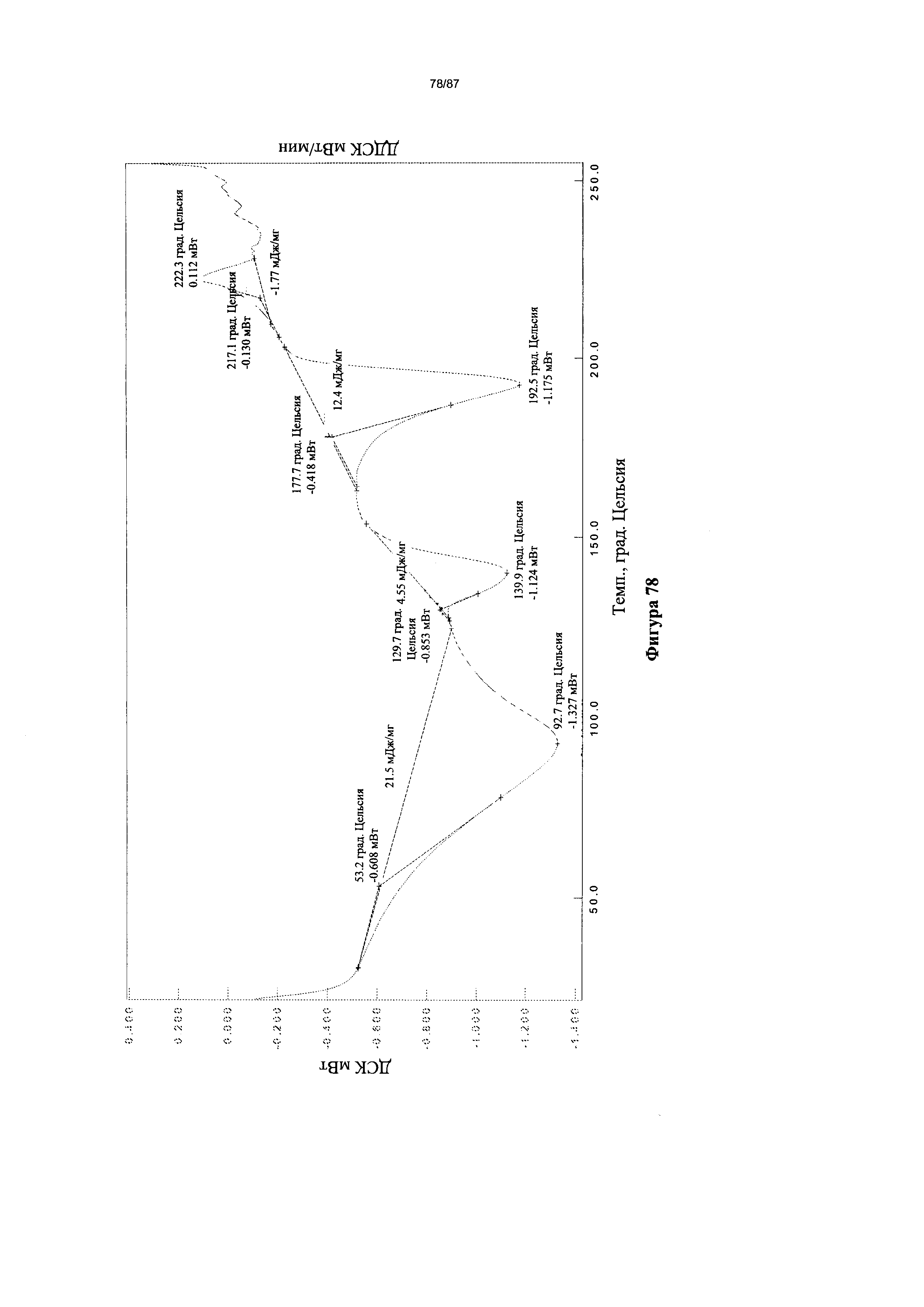
[0085] На фигуре 78 изображена термограмма ДСК для Формы VIII гидробромидной соли Соединения 1.
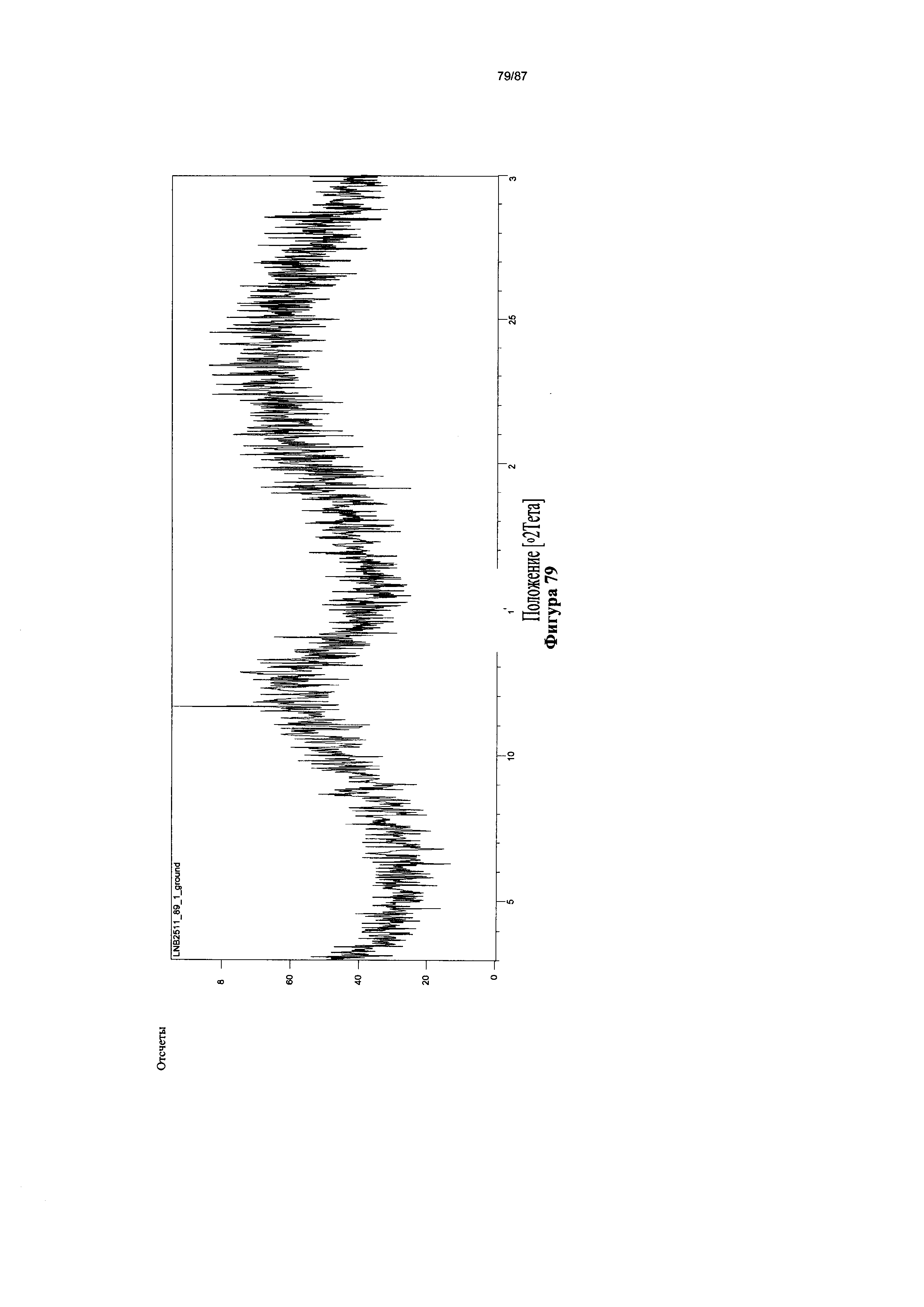
[0086] На фигуре 79 изображена дифрактограмма XRPD для аморфной гидробромидной соли Соединения 1.
[0087] На фигуре 80 изображена дифрактограмма XRPD для Формы V гидробромидной соли Соединения 1 после десольватирования.
[0088] На фигуре 81 изображено исходное вещество Формы I гидробромидной соли Соединения 1 по сравнению с влажным образцом и данное вещество после стадий сушки.
[0089] На фигуре 82 изображены результаты XRPD-анализа Форм I и III гидробромидной соли, полученных в сравнительных экспериментах по суспендированию при температуре окружающей среды (22°C).
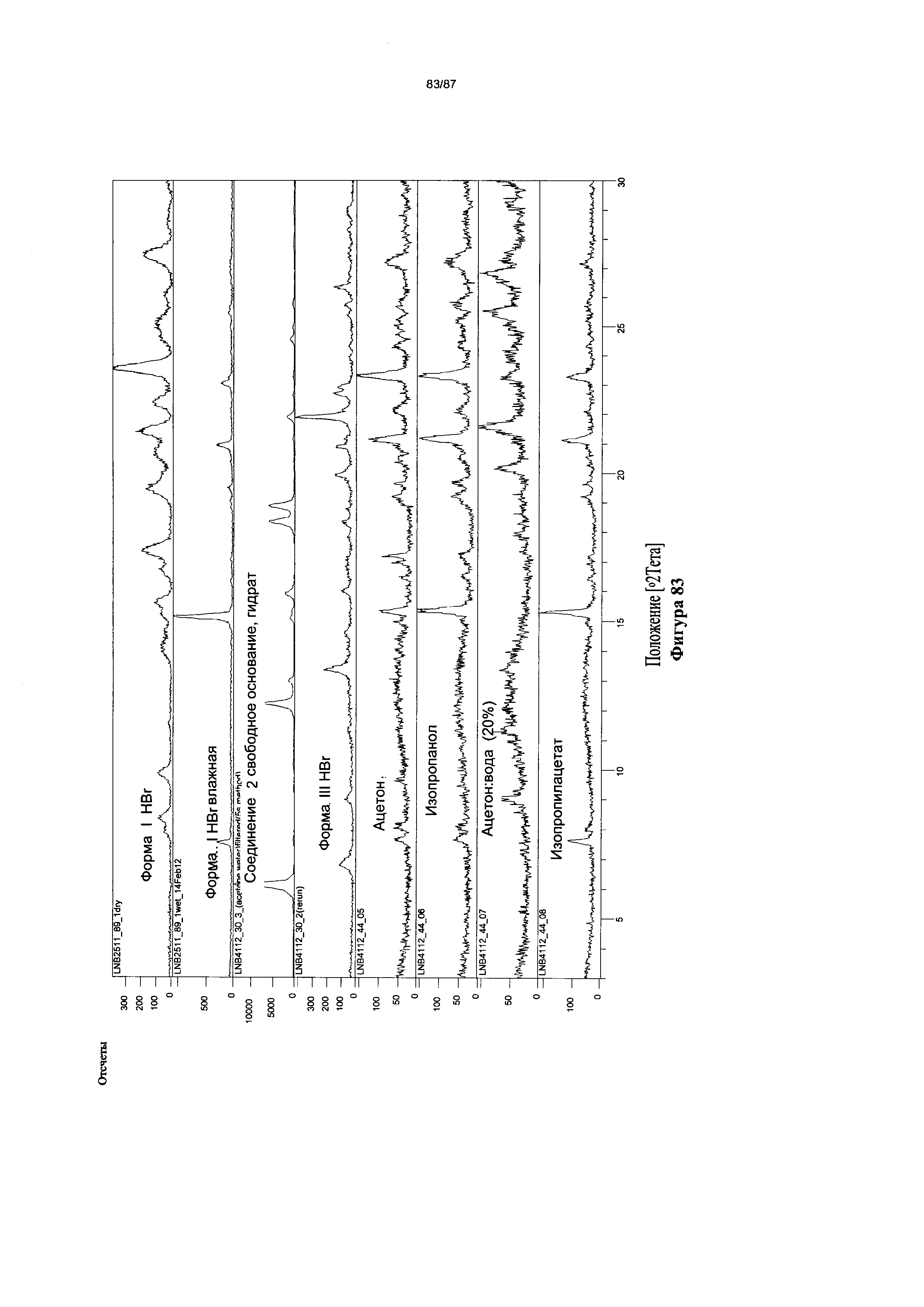
[0090] На фигуре 83 изображены результаты XRPD-анализа Форм I и III гидробромидной соли, полученных в сравнительных экспериментах по суспендированию при 60°C.
[0091] На фигуре 84 изображены результаты XRPD-анализа Формы I гидробромидной соли Соединения 1, суспендированной в смесях EtOH: вода.
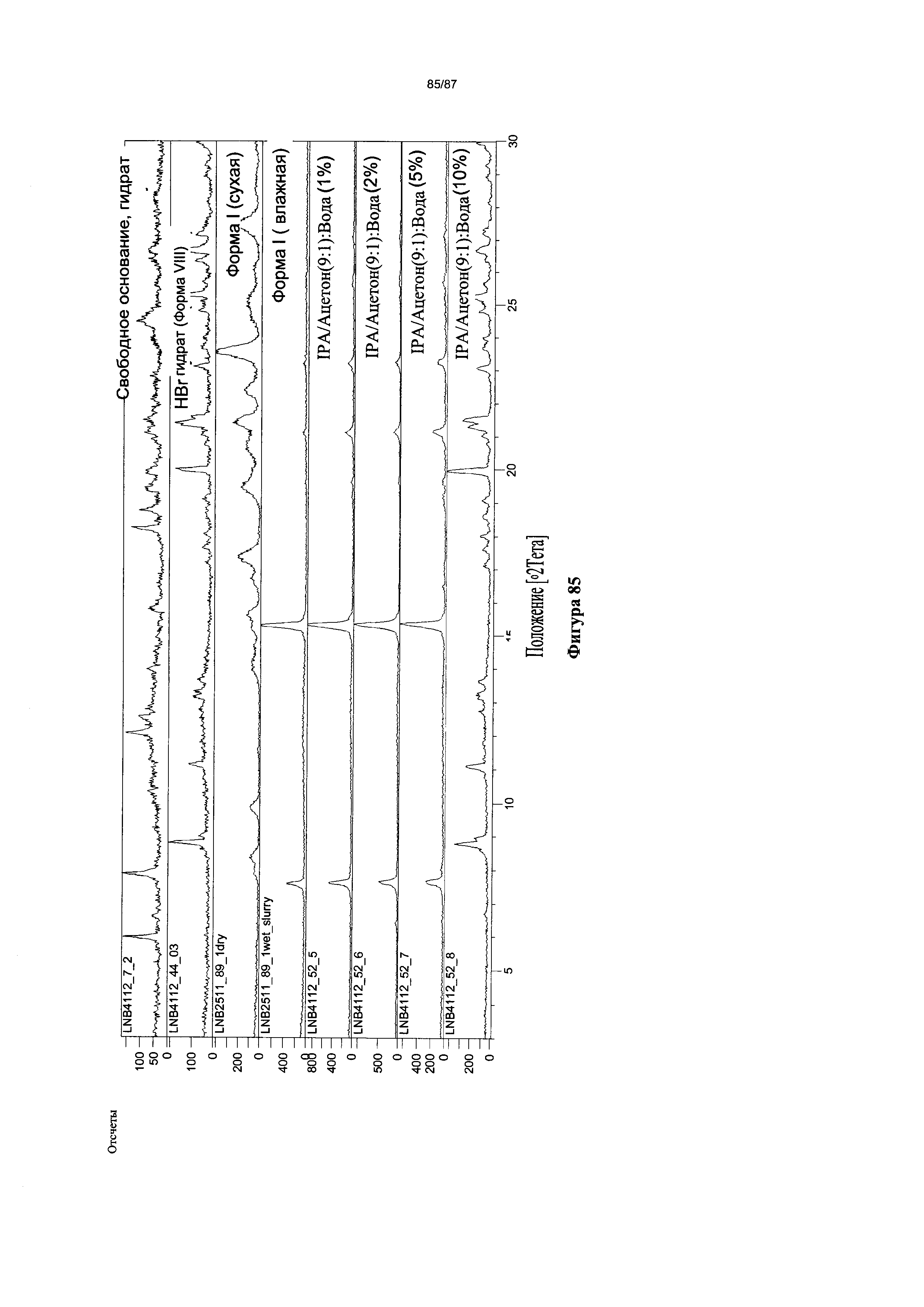
[0092] На фигуре 85 изображены результаты XRPD-анализа вещества, суспендированного в смесях IPA/ацетон (9:1): вода.
[0093] На фигуре 86 изображены результаты XRPD-анализа после исследований гидратации при 15°C и 35°C.
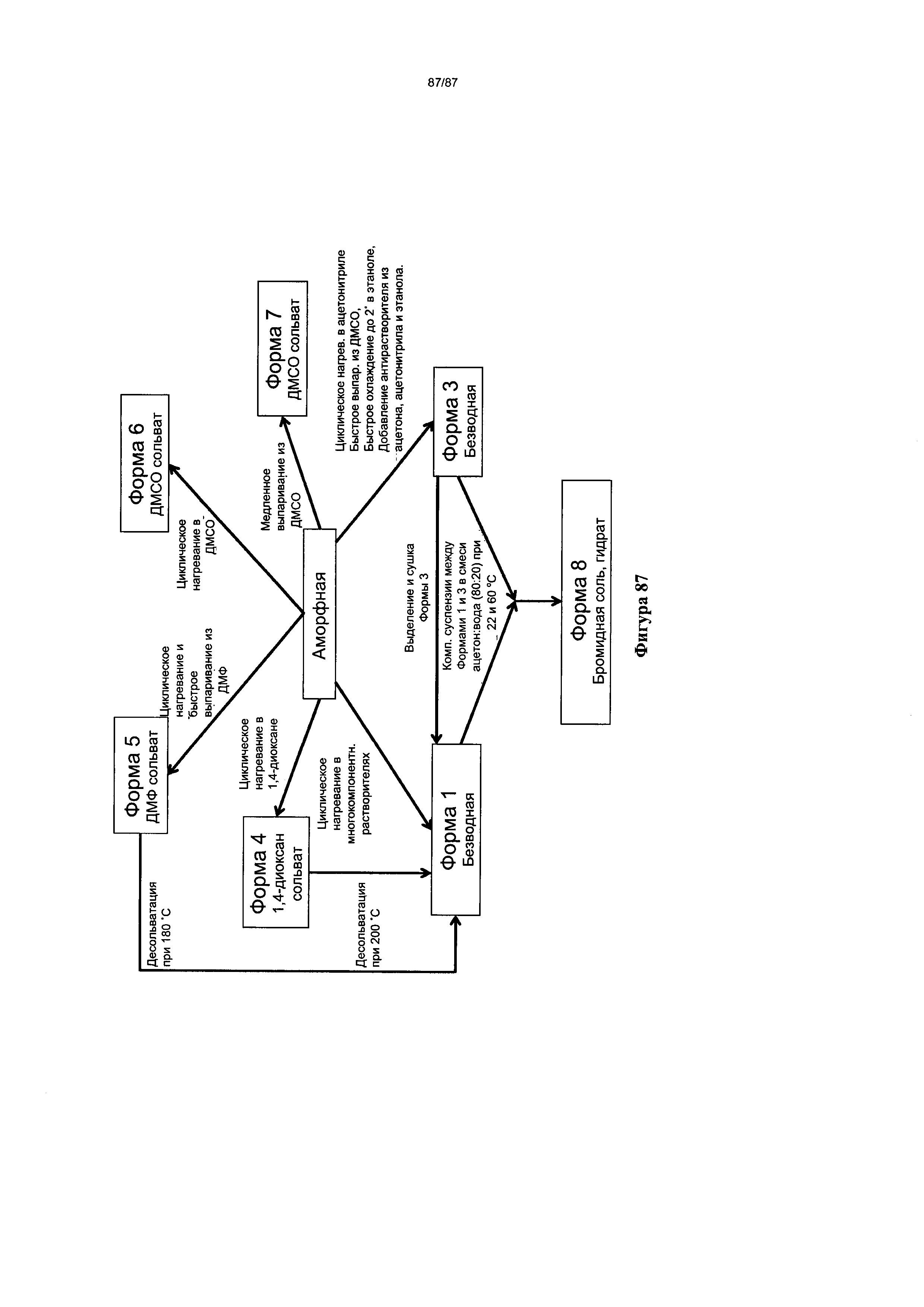
[0094] На фигуре 87 изображена диаграмма форм гидробромидной соли, включающая 7 различных форм и взаимосвязь между данными формами.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Общее описание конкретных аспектов изобретения:
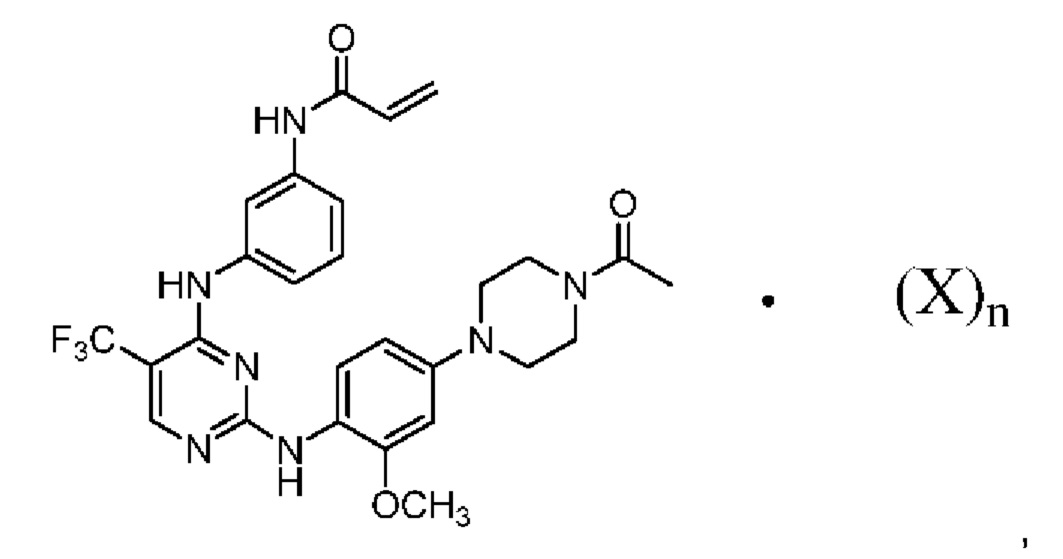
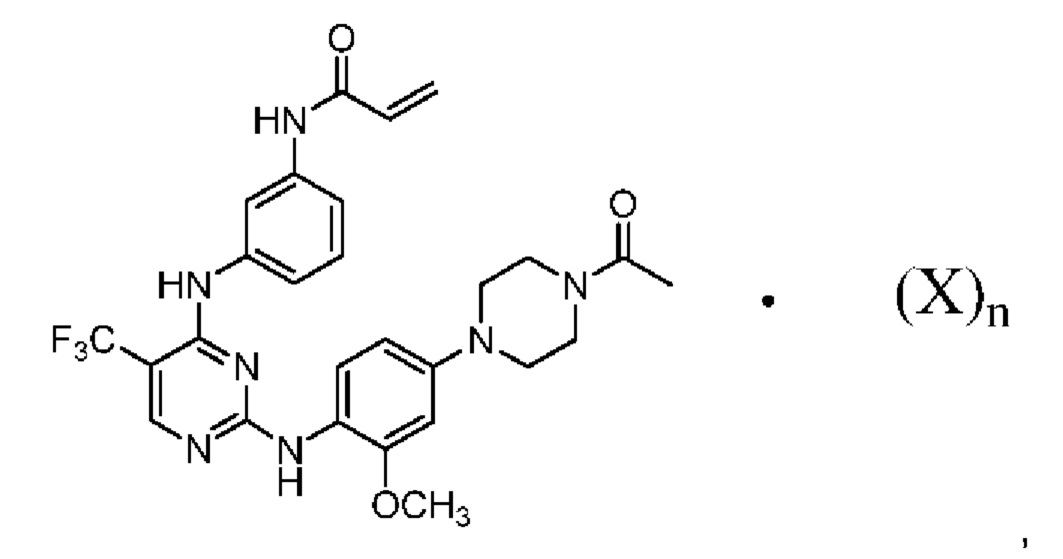
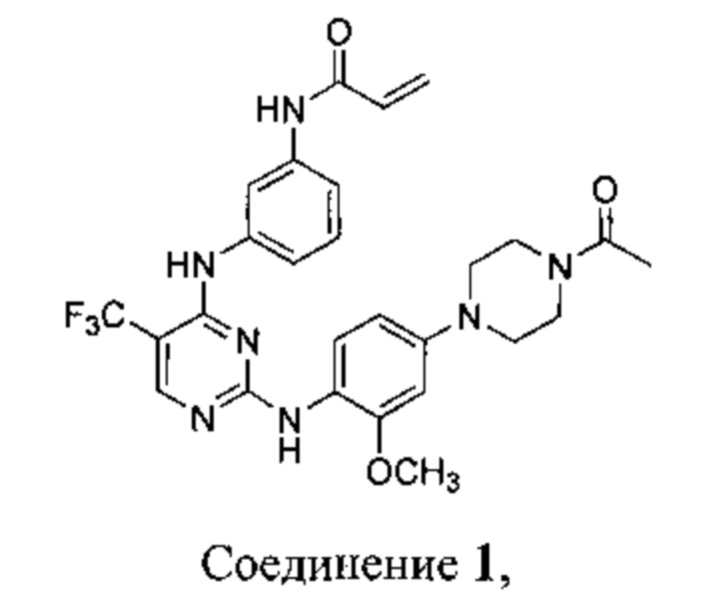
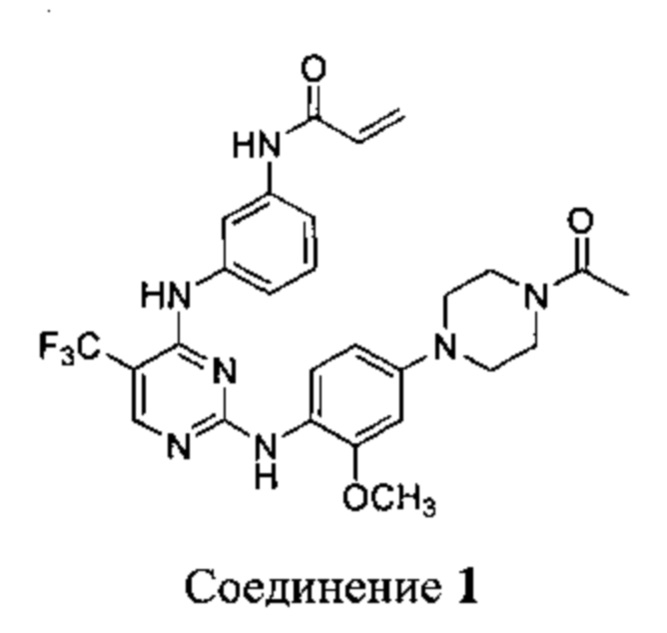
[0095] В заявке на патент США №13/286061, опубликованной как US 2012/0149687 14 июня 2012 г. (далее - заявка ʹ061), поданной 31 октября 2011 г., полное содержание которой включено в настоящую заявку посредством ссылки, описаны некоторые 2,4-дизамещенные пиримидиновые соединения, которые ковалентно и необратимо ингибируют активности киназы EGFR. Такие соединения включают Соединение 1:
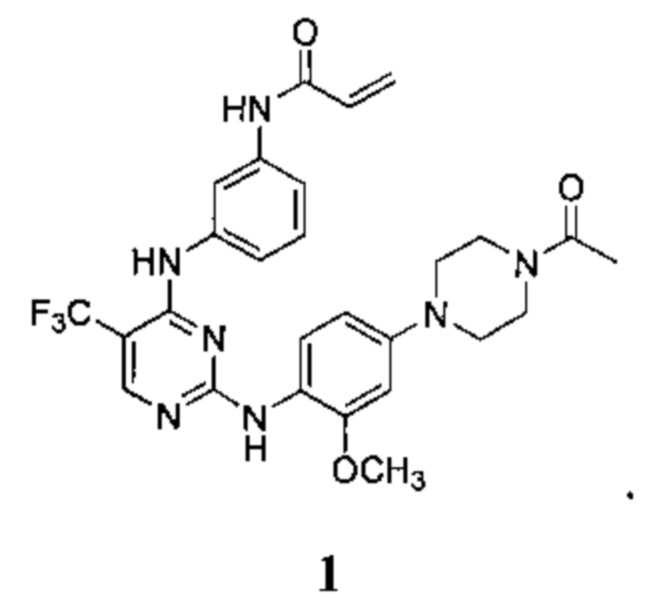
[0096] Соединение 1 (N-(3-(2-(4-(4-ацетилпиперазин-1-ил)-2-метоксифениламино)-5-(трифторметил)пиримидин-4-иламино)фенил)акриламид)) обозначено как соединение I-4, и синтез Соединения 1 подробно описан в примере 3 заявки ʹ061.
[0097] Соединение 1 проявило активность в различных исследованиях и терапевтических моделях, демонстрирующих селективное ковалентное необратимое ингибирование мутантной киназы EGFR (по данным ферментного анализа и анализа на клетках). Следует отметить, что Соединение 1, как было обнаружено, ингибирует пролиферацию клеток немелкоклеточного рака легких человека как in vitro, так и in vivo. Соответственно, Соединение 1 и его соли являются подходящими для лечения одного или более расстройств, связанных с активностью мутантной киназы EGFR.
[0098] Было бы желательно предложить форму Соединения 1, которая, по сравнению с Соединением 1, обладает такими характеристиками, как улучшенная растворимость в воде, стабильность и легкость введения в составы. Соответственно, в настоящем изобретении предложено несколько солей Соединения 1.
[0099] Согласно одному из вариантов реализации в настоящем изобретении предложена соль Соединения 1, представленная в виде Соединения 2:
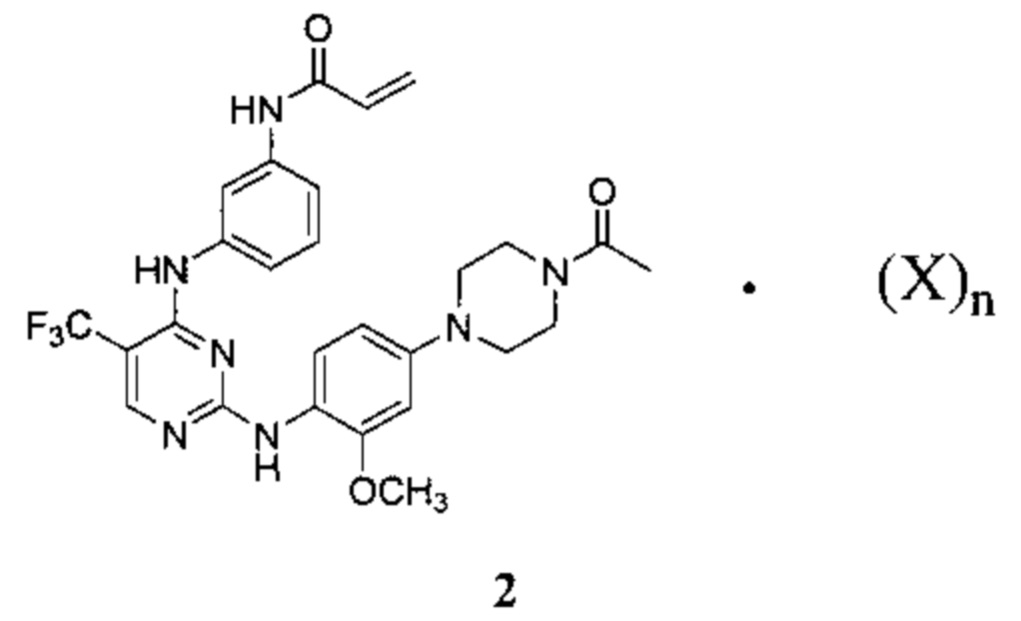
где:
n составляет 1 или 2; и
X представляет собой бензолсульфоновую кислоту, камфорсульфоновую кислоту, 1,2-этандисульфоновую кислоту, бромоводородную кислоту, хлороводородную кислоту, малеиновую кислоту, метансульфоновую кислоту, нафталин-2-сульфоновую кислоту, 1,5-нафталиндисульфоновую кислоту, щавелевую кислоту, 4-толуолсульфоновую кислоту или 2,4,6-тригидроксибензойную кислоту.
[00100] Среднему специалисту в данной области техники очевидно, что кислотный фрагмент, обозначенный "X", и Соединение 1 связаны ионной связью с получением Соединения 2. Предполагается, что Соединение 2 может существовать в различных физических формах. Например, Соединение 2 может быть представлено в форме раствора, суспензии или в твердой форме. В некоторых вариантах реализации настоящего изобретения Соединение 2 представлено в твердой форме. Если Соединение 2 представлено в твердой форме, указанное соединение может быть аморфным, кристаллическим или представлять собой их смесь. Примеры твердых форм более подробно описаны ниже.
[00101] Согласно другим вариантам реализации в настоящем изобретении предложено Соединение 2, по существу не содержащее примесей. В настоящем документе термин «по существу не содержит примесей» означает, что соединение не содержит значительного количества посторонних веществ. Такое постороннее вещество может включать избыток кислоты "X", избыток Соединения 1, остаточные растворители или любые другие примеси, которые могут появиться при получении и/или выделении Соединения 2. В некоторых вариантах реализации настоящего изобретения присутствует по меньшей мере примерно 90% по массе Соединения 2. В некоторых вариантах реализации настоящего изобретения присутствует по меньшей мере примерно 95% по массе Соединения 2. В других вариантах реализации настоящего изобретения присутствует по меньшей мере примерно 99% по массе Соединения 2.
[00102] Согласно одному из вариантов реализации настоящего изобретения Соединение 2 присутствует в количестве по меньшей мере примерно 95, 97, 97,5, 98,0, 98,5, 99, 99,5, 99,8 массовых процентов из расчета на общую массу композиции. Согласно другому варианту реализации настоящего изобретения Соединение 2 содержит общее количество органических примесей не более чем примерно 5,0% по площади пиков ВЭЖХ и в некоторых вариантах реализации содержит общее количество органических примесей не более чем примерно 3,0% по площади пиков ВЭЖХ, а в некоторых вариантах реализации настоящего изобретения содержит общее количество органических примесей не более чем примерно 1,5% по площади пиков ВЭЖХ по отношению к общей площади хроматограммы ВЭЖХ. В других вариантах реализации настоящего изобретения Соединение 2 содержит не более чем примерно 1,0% любой одной примеси по площади ВЭЖХ; не более чем примерно 0,6% любой одной примеси по площади ВЭЖХ и в некоторых вариантах реализации настоящего изобретения - не более чем примерно 0,5% любой одной примеси по площади ВЭЖХ по отношению к общей площади хроматограммы ВЭЖХ.
[00103] Также предполагается, что изображенная структура Соединения 2 включает все таутомерные формы Соединения 2. Кроме того, также предполагается, что структуры, изображенные в настоящем документе, включают соединения, которые отличаются только наличием одного или более изотопно-обогащенных атомов. Например, соединения, имеющие представленную структуру, за исключением замены водорода на дейтерий или тритий или замены углерода на 13С- или 14С-обогащенный углерод, находятся в рамках настоящего изобретения.
Твердые формы Соединения 2:
[00104] Было обнаружено, что Соединение 2 может существовать в различных твердых формах. Такие формы включают полиморфы и аморфные формы. Твердые формы могут представлять собой сольваты, гидраты и несольватированные формы Соединения 2. Все такие формы включены в настоящее изобретение. Согласно некоторым вариантам реализации в настоящем изобретении предложено Соединение 2 в виде смеси одной или более твердых форм Соединения 2.
[00105] В настоящем документе термин «полиморф» относится к различным кристаллическим структурам (сольватированным или несольватированным формам), в которые соединение может кристаллизоваться.
[00106] В настоящем документе термин «сольват» относится к кристаллической форме либо со стехиометрическом, либо с нестехиометрическим количеством растворителя. В случае полиморфов растворитель включен в кристаллическую структуру. Аналогичным образом термин «гидрат» относится к твердой форме либо со стехиометрическим, либо с нестехиометрическим количеством воды. В случае полиморфов вода включена в кристаллическую структуру.
[00107] В настоящем документе термин «примерно» при использовании в отношении значения в градусах 2-тета относится к указанному значению ±0,3 градуса 2-тета (°2θ). В некоторых вариантах реализации настоящего изобретения термин «примерно» относится к ±0,2 градуса 2-тета или ±0,1 градуса 2-тета.
[00108] В некоторых вариантах реализации настоящего изобретения Соединение 2 представляет собой кристаллическое твердое вещество. В других вариантах реализации настоящего изобретения Соединение 2 представляет собой кристаллическое твердое вещество, по существу не содержащее аморфного Соединения 2. В настоящем документе термин «по существу не содержащее аморфного Соединения 2» означает, что соединение не содержит значительного количества аморфного Соединения 2. В некоторых вариантах реализации настоящего изобретения присутствует по меньшей мере примерно 90% по массе кристаллического Соединения 2 или по меньшей мере примерно 95% по массе кристаллического Соединения 2. В других вариантах реализации настоящего изобретения присутствует по меньшей мере примерно 99% по массе кристаллического Соединения 2.
[00109] В некоторых вариантах реализации настоящего изобретения Соединение 2 представляет собой соль бензолсульфоновой кислоты (безилат). Данная соль может представлять собой монобезилат или бис-безилат. Безилатная соль необязательно может быть сольватирована или гидратирована, например, представлять собой моногидрат.
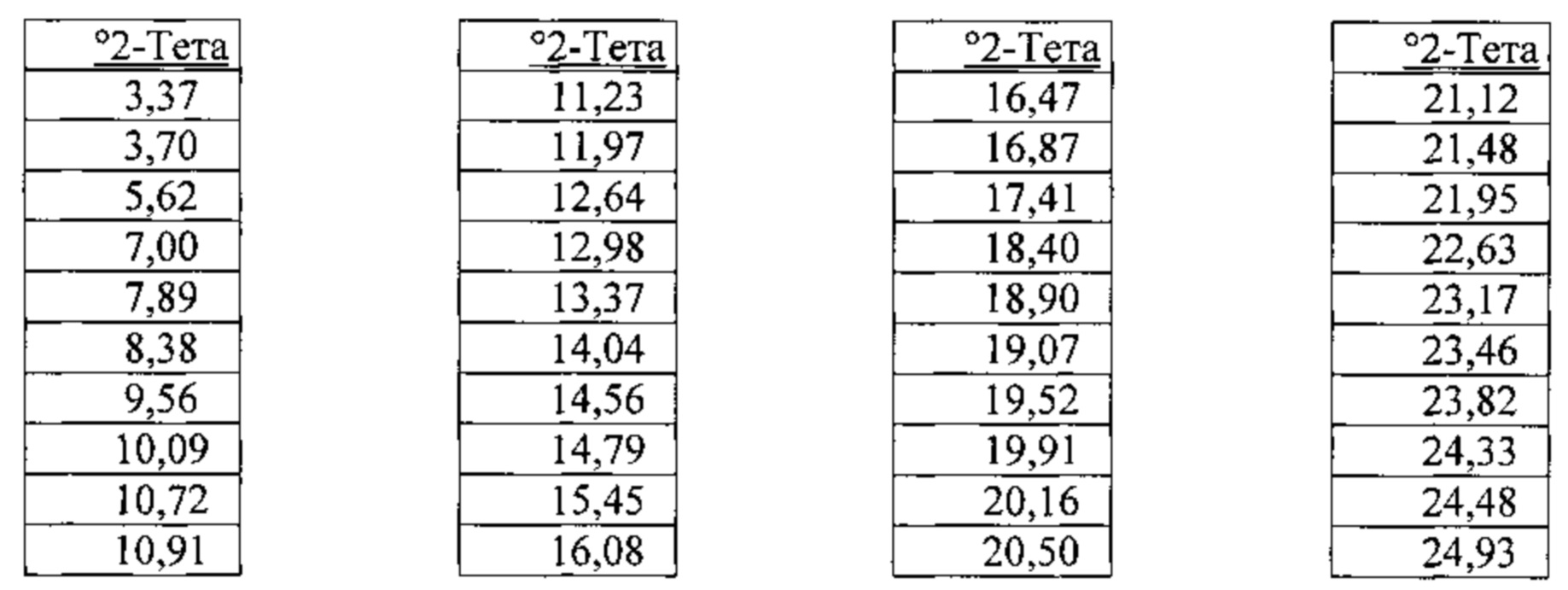
[00110] Согласно одному из аспектов нерастворенная бис-безилатная соль характеризуется дифрактограммой рентгеновской порошковой дифракции, по существу схожей с дифрактограммой, изображенной на Фигуре 1. Согласно одному из вариантов реализации настоящего изобретения несольватированная бис-безилатная соль характеризуется одним или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 5,62, примерно 17,41, примерно 18,90, примерно 19,07 и примерно 19,52 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения несольватированная бис-безилатная соль характеризуется двумя или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 5,62, примерно 17,41, примерно 18,90, примерно 19,07 и примерно 19,52 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения несольватированная бис-безилатная соль характеризуется тремя или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 5,62, примерно 17,41, примерно 18,90, примерно 19,07 и примерно 19,52 градуса 2-тета. В частных вариантах реализации настоящего изобретения несольватированная бис-безилатная соль характеризуется по существу всеми пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 5,62, 7,89, 11,23, 12,64, 17,41, 18,90, 19,07, 19,52, 22,63, 23,17, 25,28 и 28,92 градуса 2-тета. В иллюстративном варианте реализации настоящего изобретения несольватированная бис-безилатная соль характеризуется по существу всеми пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно:
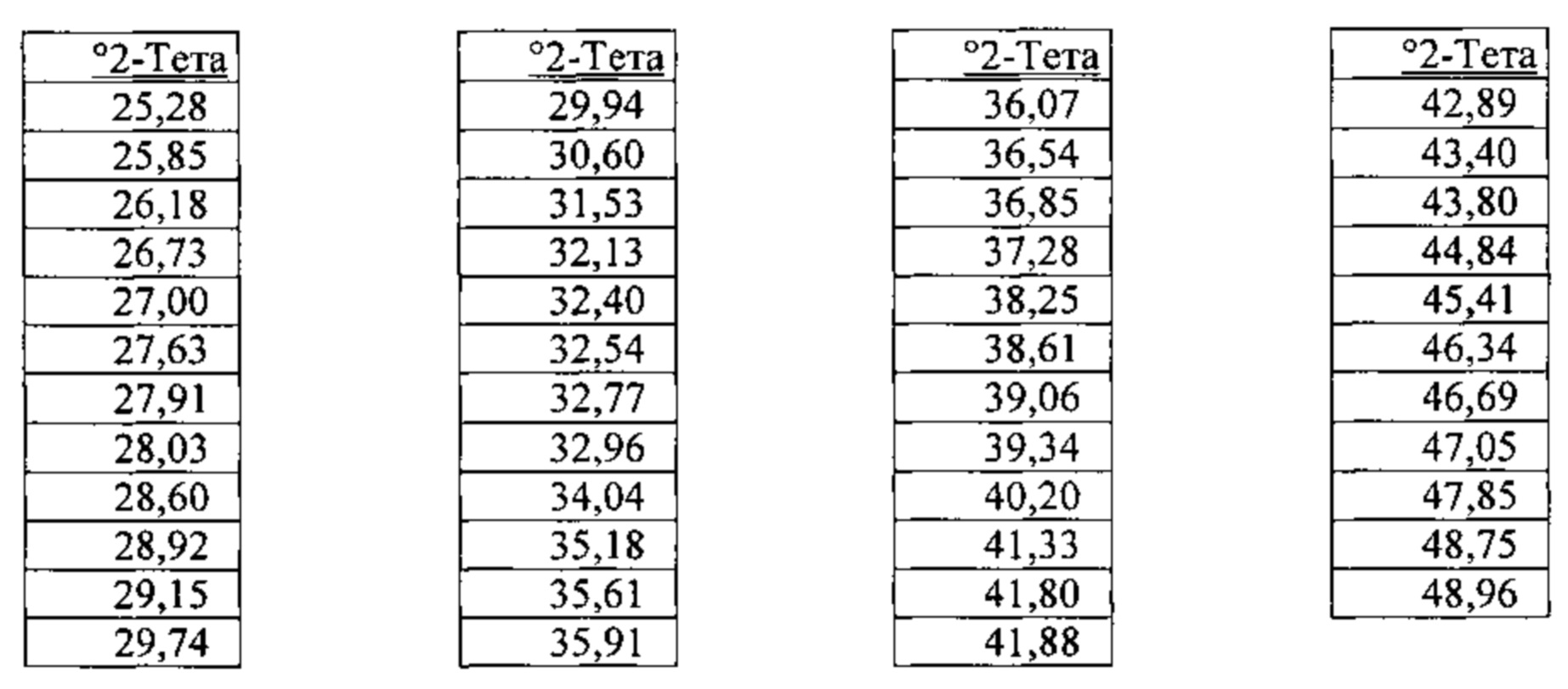
Согласно другому аспекту нерастворенная бис-безилатная соль характеризуется кривыми термогравиметрического анализа, по существу схожими с кривыми, изображенными на фигурах 2 или 3. Согласно еще одному аспекту нерастворенная бис-безилатная соль характеризуется термограммой дифференциальной сканирующей калориметрии, по существу схожей с термограммой, изображенной на фигуре 4. Согласно другому варианту реализации настоящего изобретения нерастворенная бис-безилатная соль характеризуется инфракрасным спектром, по существу схожим со спектром, изображенным на фигуре 5. Согласно другому варианту реализации нерастворенная бис-безилатная соль характеризуется спектром 1Н-ЯМР, по существу схожим со спектром, изображенным на фигуре 6. Согласно другому варианту реализации нерастворенная бис-безилатная соль характеризуется графиком динамической сорбции пара, по существу схожим с графиком, изображенным на фигуре 7. Несольватированная бис-безилатная соль может характеризоваться тем, что ее характеристики по существу схожи с характеристиками, приведенными на двух или более из указанных фигур, одновременно.
[00111] Согласно одному из аспектов, гидрат бис-безилатной соли характеризуется дифрактограммой рентгеновской порошковой дифракции, по существу схожей с дифрактограммой, изображенной на фигуре 14. Согласно одному из вариантов реализации настоящего изобретения, гидрат бис-безилатной соли характеризуется одним или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 10,68, примерно 16,10, примерно 18,44 и примерно 22,36 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения гидрат бис-безилатной соли характеризуется двумя или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 10,68, примерно 16,10, примерно 18,44 и примерно 22,36 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения гидрат бис-безилатной соли характеризуется тремя или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 10,68, примерно 16,10, примерно 18,44 и примерно 22,36 градуса 2-тета. В частных вариантах реализации настоящего изобретения гидрат бис-безилатной соли характеризуется по существу всеми пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 9,33, 10,68, 16,10, 16,43, 16,64, 18,44, 20,05, 20,32, 20,74, 22,36 и 22,83 градуса 2-тета. В иллюстративном варианте реализации настоящего изобретения гидрат бис-безилатной соли характеризуется по существу всеми пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно:
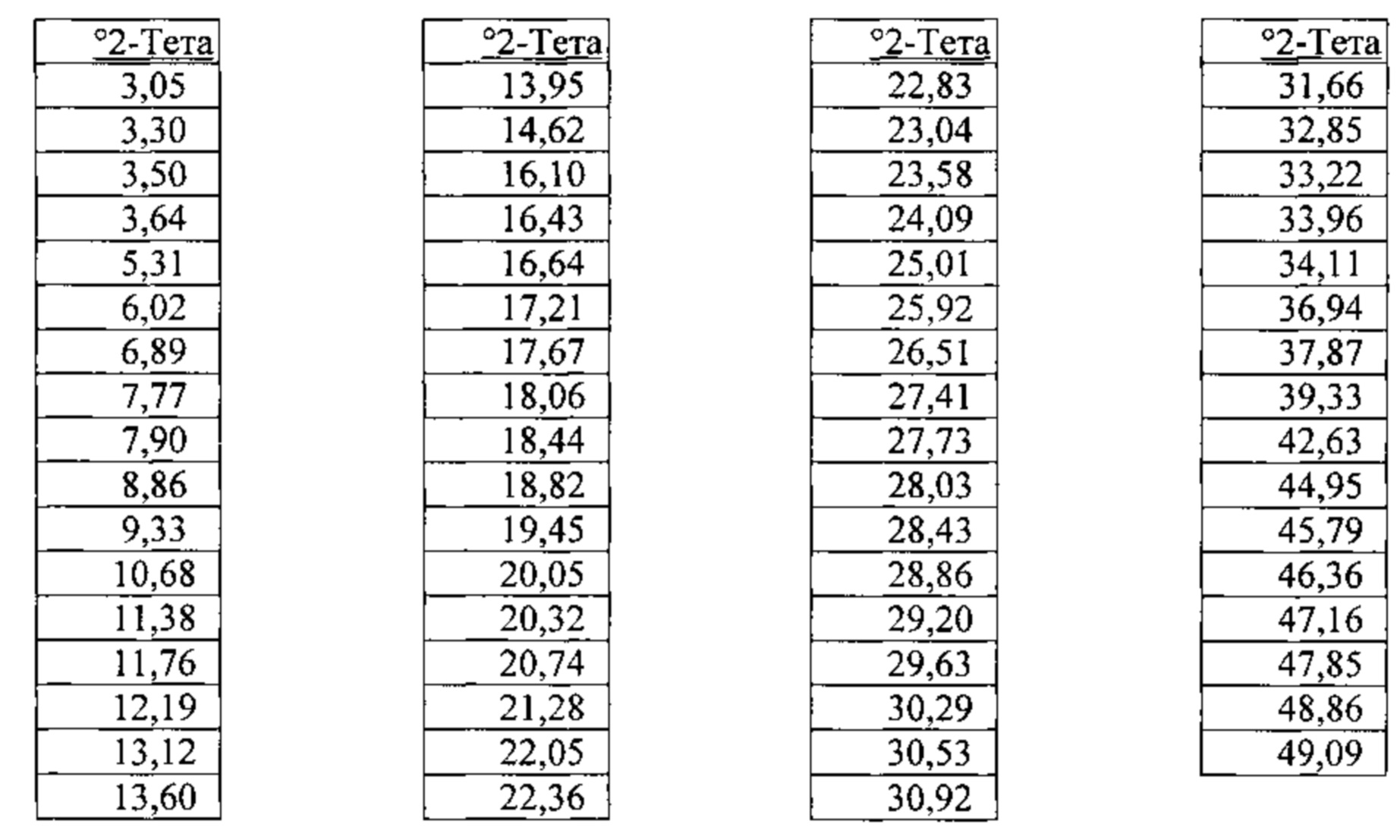
Согласно другому аспекту гидрат бис-безилата характеризуется кривыми термогравиметрического анализа, по существу схожими с кривыми, изображенными на фигуре 15. Согласно еще одному аспекту гидрат бис-безилата характеризуется термограммой дифференциальной сканирующей калориметрии, по существу схожей с термограммой, изображенной на фигуре 16. Согласно другому варианту реализации настоящего изобретения гидрат бис-безилата характеризуется инфракрасным спектром, по существу схожим со спектром, изображенным на фигуре 17. Согласно другому варианту реализации настоящего изобретения гидрат бис-безилата характеризуется спектром 1Н-ЯМР, по существу схожим со спектром, изображенным на фигуре 18. Согласно другому варианту реализации настоящего изобретения гидрат бис-безилата характеризуется графиком динамической сорбции пара, по существу схожим с графиком, изображенным на фигуре 19. Гидрат бис-безилата может характеризоваться тем, что его характеристики по существу схожи с характеристиками, приведенными на двух или более из указанных фигур, одновременно.
[00112] В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой соль камфорсульфоновой кислоты (например, камфор-10-сульфоновой кислоты). В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой моносоль камфорсульфоновой кислоты. В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой биссоль камфорсульфоновой кислоты.
[00113] В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой соль 1,2-этандисульфоновой кислоты. В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой моносоль 1,2-этандисульфоновой кислоты. В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой биссоль 1,2-этандисульфоновой кислоты.
[00114] В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой соль бромоводородной кислоты. В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой безводную моносоль бромоводородной кислоты. В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой безводную биссоль бромоводородной кислоты. Гидробромидная соль необязательно может быть сольватирована или гидратирована. В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой моногидрат соли бромоводородной кислоты. В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой сольватированную соль бромоводородной кислоты. В некоторых таких вариантах реализации настоящего изобретения сольват выбран из диметилсульфоксида (ДМСО), диметилформамида (ДМФА) и 1,4-диоксана. В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой гидробромидную соль, выбранную из Формы I, Формы III, Формы IV, Формы V, Формы VI, Формы VII и Формы VIII, каждая из которых подробно описана ниже.
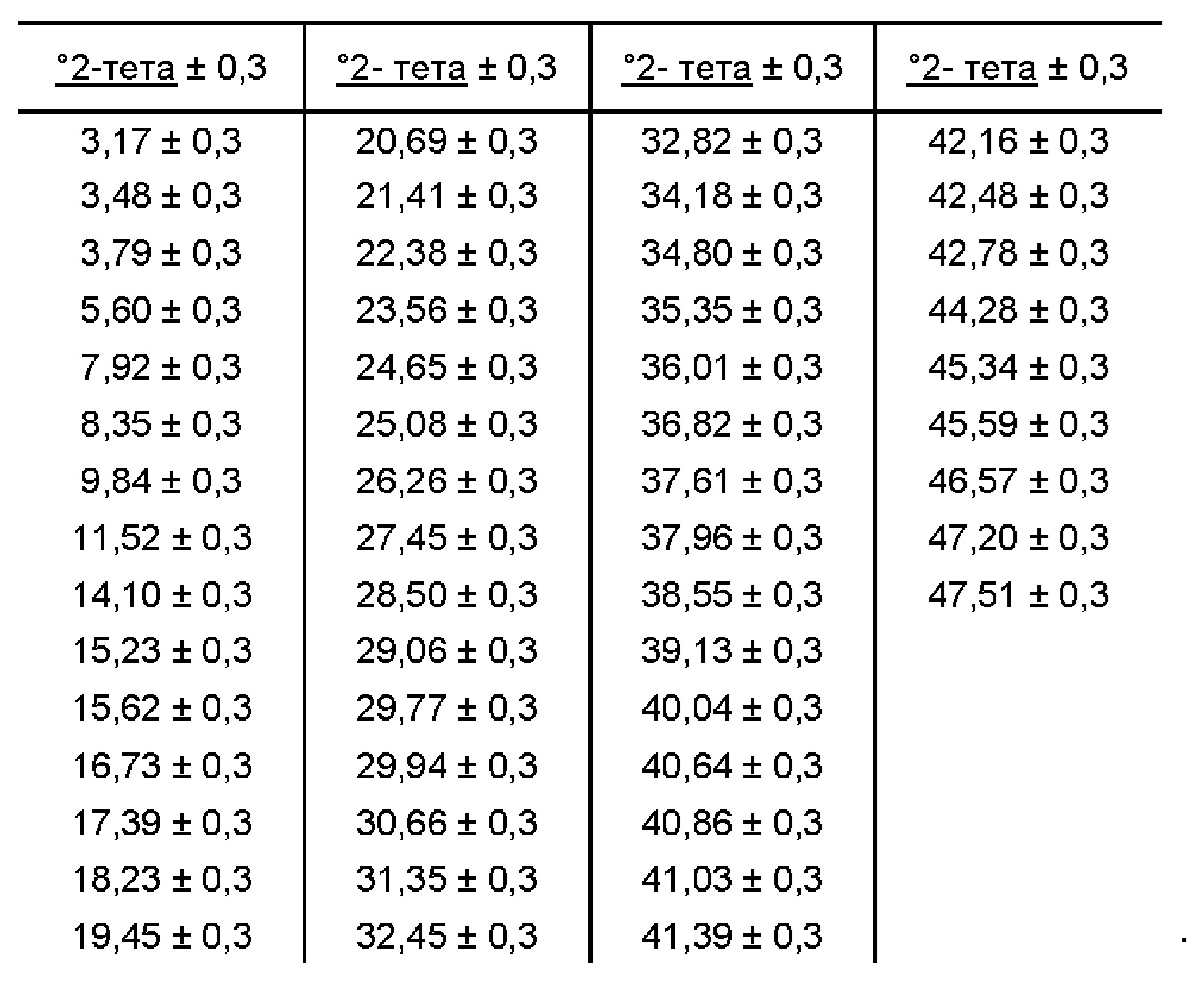
[00115] В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой Форму I гидробромидной соли. В некоторых из таких вариантов реализации настоящего изобретения соединение 2 представляет собой безводную Форму I гидробромидной соли. Согласно одному из аспектов настоящего изобретения Форма I гидробромидной соли характеризуется дифрактограммой рентгеновской порошковой дифракции, по существу схожей с дифрактограммой, изображенной на фигуре 60. В некоторых вариантах реализации настоящего изобретения Форма I гидробромидной соли характеризуется дифрактограммой рентгеновской порошковой дифракции, по существу схожей с дифрактограммой, изображенной на фигуре 59. Согласно одному из вариантов реализации настоящего изобретения Форма I моногидробромидной соли характеризуется одним или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 17,39, примерно 19,45, примерно 21,41, примерно 23,56 и примерно 27,45 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения Форма I моногидробромидной соли характеризуется двумя или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 17,39, примерно 19,45, примерно 21,41, примерно 23,56 и примерно 27,45 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения Форма I моногидробромидной соли характеризуется тремя или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 17,39, примерно 19,45, примерно 21,41, примерно 23,56 и примерно 27,45 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения Форма I моногидробромидной соли характеризуется четырьмя или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 17,39, примерно 19,45, примерно 21,41, примерно 23,56 и примерно 27,45 градуса 2-тета. В частных вариантах реализации настоящего изобретения Форма I моногидробромидной соли характеризуется дифрактограммой рентгеновской порошковой дифракции, которая содержит пики при примерно 9,84, 15,62, 17,39, 19,45, 20,69, 21,41, 22,38, 23,56, 25,08 и 27,45 градуса 2-тета. В иллюстративном варианте реализации настоящего изобретения Форма I моногидробромидной соли характеризуется по существу всеми пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно
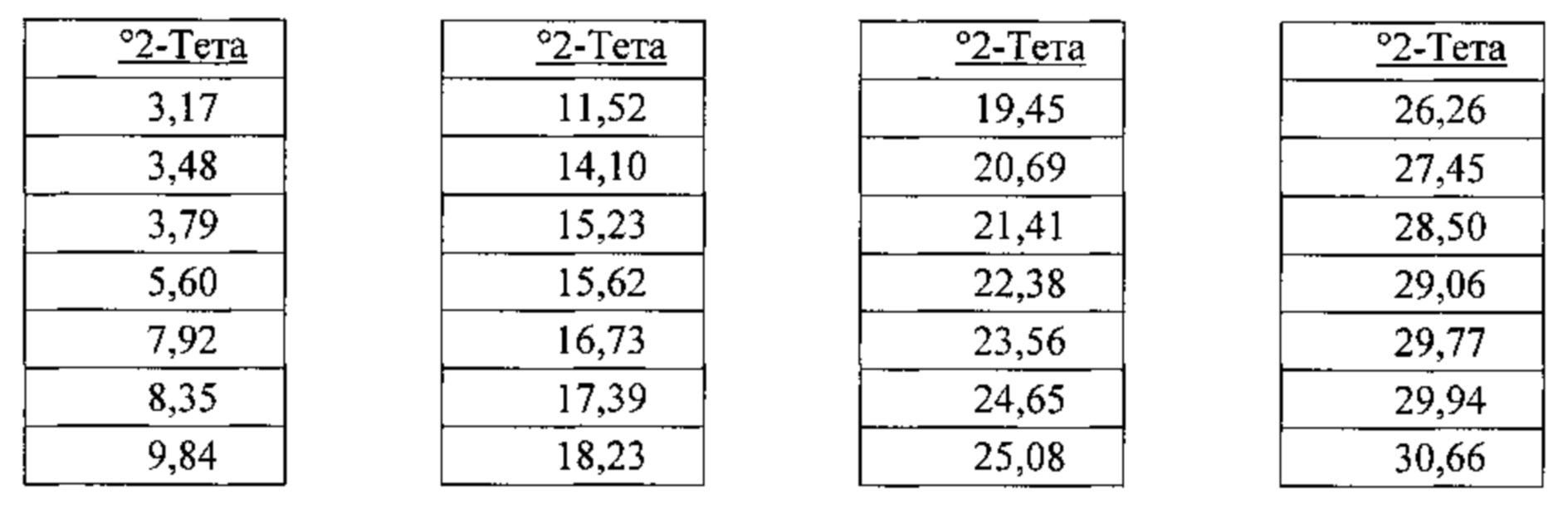
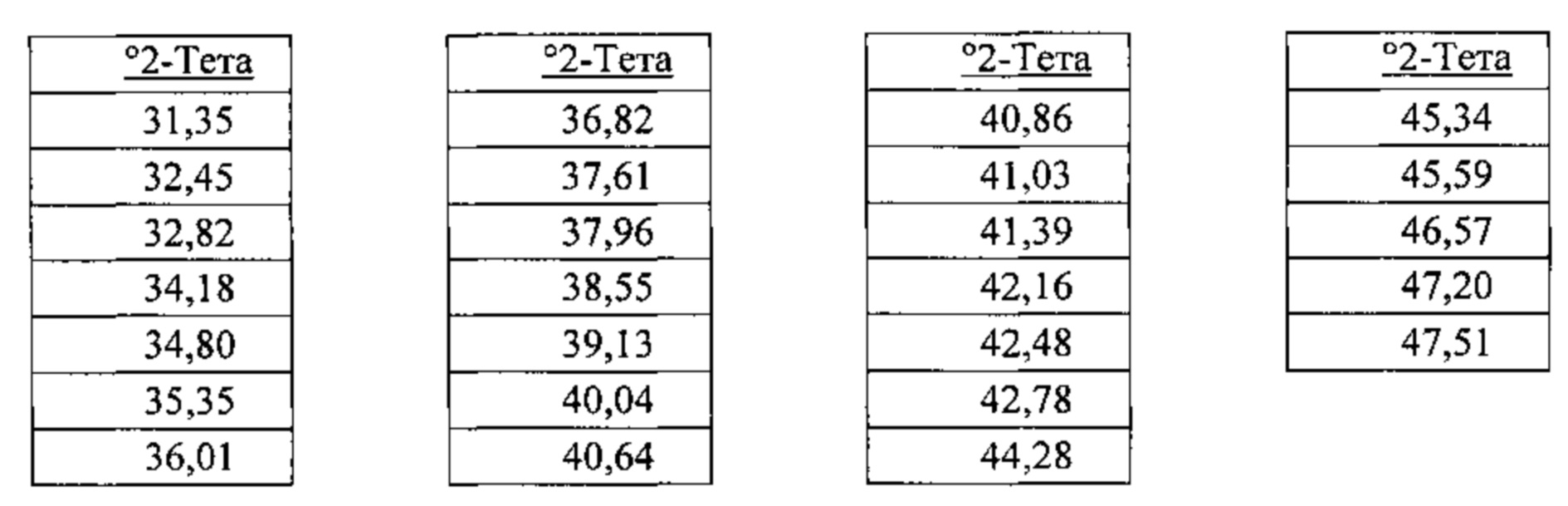
[00116] Согласно другому аспекту Форма I моногидробромидной соли характеризуется кривыми термогравиметрического анализа, по существу схожими с кривыми, изображенными на фигуре 63. Согласно еще одному аспекту Форма I моногидробромидной соли характеризуется термограммой дифференциальной сканирующей калориметрии, по существу схожей с термограммой, изображенной на фигуре 64. Согласно другому варианту реализации настоящего изобретения Форма I моногидробромидной соли характеризуется инфракрасным спектром, по существу схожим со спектром, изображенным на фигуре 61. Согласно другому варианту реализации настоящего изобретения Форма I моногидробромидной соли характеризуется спектром 1Н-ЯМР, по существу схожим со спектром, изображенным на фигуре 62. В некоторых вариантах реализации настоящего изобретения Форма I моногидробромидной соли характеризуется тем, что его характеристики по существу схожи с характеристиками, приведенными на двух или более из указанных фигур, одновременно.
[00117] В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой Форму III гидробромидной соли. В некоторых из таких вариантов реализации настоящего изобретения Соединение 2 представляет собой безводную Форму III гидробромидной соли. В некоторых вариантах реализации настоящего изобретения Форма III гидробромидной соли характеризуется дифрактограммой рентгеновской порошковой дифракции, по существу схожей с дифрактограммой, изображенной на фигуре 67. Согласно одному из вариантов реализации настоящего изобретения Форма III гидробромидной соли характеризуется одним или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 6,79, примерно 13,36, примерно 19,93, примерно 20,89, примерно 21,90, примерно 22,70, примерно 22,91 и примерно 26,34 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения Форма III гидробромидной соли характеризуется двумя или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 6,79, примерно 13,36, примерно 19,93, примерно 20,89, примерно 21,90, примерно 22,70, примерно 22,91 и примерно 26,34 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения Форма III гидробромидной соли характеризуется тремя или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 6,79, примерно 13,36, примерно 19,93, примерно 20,89, примерно 21,90, примерно 22,70, примерно 22,91 и примерно 26,34 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения Форма III гидробромидной соли характеризуется четырьмя или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 6,79, примерно 13,36, примерно 19,93, примерно 20,89, примерно 21,90, примерно 22,70, примерно 22,91 и примерно 26,34 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения Форма III гидробромидной соли характеризуется пятью или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 6,79, примерно 13,36, примерно 19,93, примерно 20,89, примерно 21,90, примерно 22,70, примерно 22,91 и примерно 26,34 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения Форма III гидробромидной соли характеризуется шестью или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 6,79, примерно 13,36, примерно 19,93, примерно 20,89, примерно 21,90, примерно 22,70, примерно 22,91 и примерно 26,34 градуса 2-тета. В частных вариантах реализации настоящего изобретения Форма III гидробромидной соли характеризуется дифрактограммой рентгеновской порошковой дифракции, которая содержит пики при примерно 6,79, примерно 13,36, примерно 19,93, примерно 20,89, примерно 21,90, примерно 22,70, примерно 22,91 и примерно 26,34 градуса 2-тета. В иллюстративном варианте реализации настоящего изобретения Форма III гидробромидной соли характеризуется по существу всеми пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно:
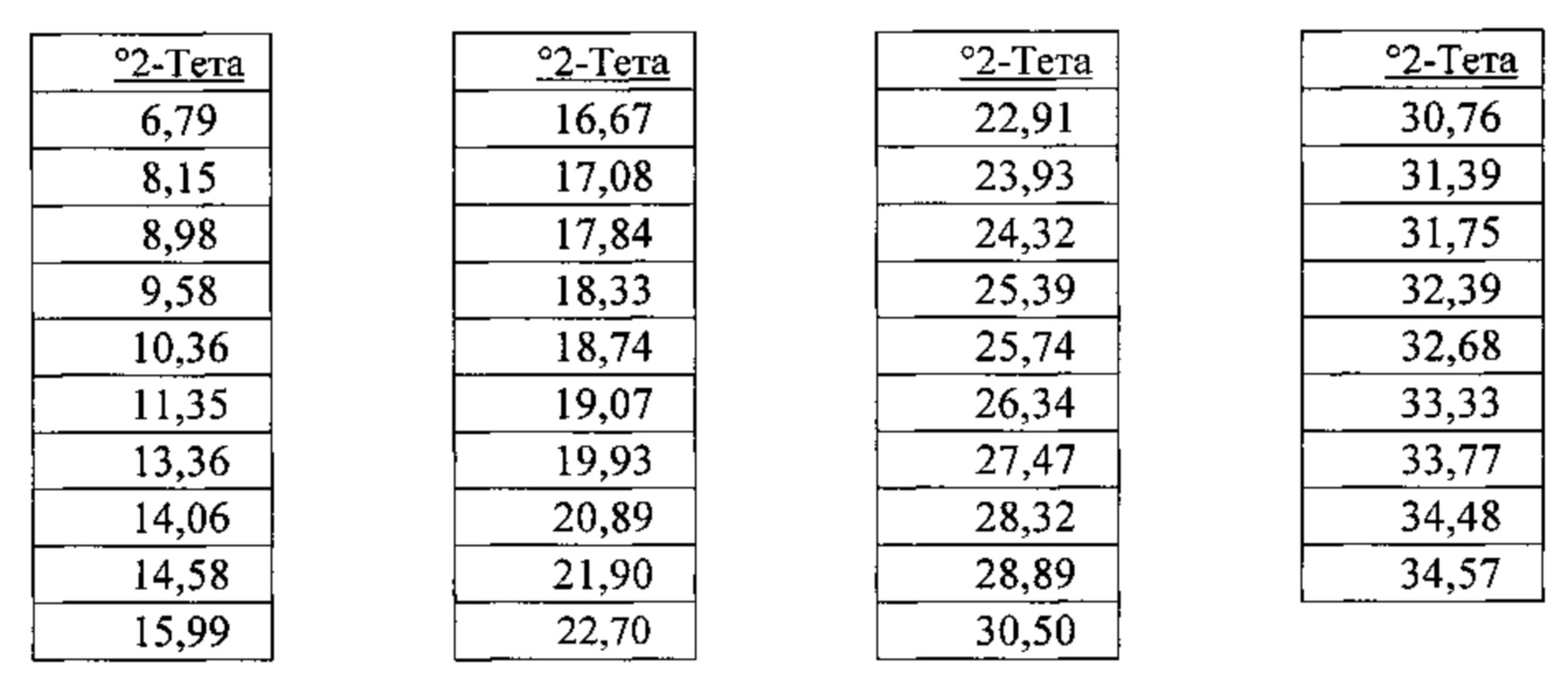
[00118] В некоторых вариантах реализации настоящего изобретения Форма III гидробромидной соли характеризуется кривыми термогравиметрического анализа, по существу схожими с кривыми, изображенными на фигуре 68. В некоторых вариантах реализации настоящего изобретения Форма III гидробромидной соли характеризуется термограммой дифференциальной сканирующей калориметрии, по существу схожей с термограммой, изображенной на фигуре 69. В некоторых вариантах реализации настоящего изобретения Форма III гидробромидной соли характеризуется инфракрасным спектром, по существу схожим со спектром, изображенным на фигуре 70. В некоторых вариантах реализации настоящего изобретения Форма III гидробромидной соли характеризуется спектром 1Н-ЯМР, по существу схожим со спектром, изображенным на фигуре 71. В некоторых вариантах реализации настоящего изобретения Форма III гидробромидной соли характеризуется тем, что его характеристики по существу схожи с характеристиками, приведенными на двух или более из указанных фигур, одновременно.
[00119] В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой Форму IV гидробромидной соли. В некоторых из таких вариантов реализации настоящего изобретения Форма IV гидробромидной соли представляет собой сольват в 1,4-диоксане. В некоторых вариантах реализации настоящего изобретения Форма IV гидробромидной соли характеризуется дифрактограммой рентгеновской порошковой дифракции, по существу схожей с дифрактограммой, изображенной на фигуре 72. Согласно одному из вариантов реализации настоящего изобретения Форма IV гидробромидной соли характеризуется одним или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 6,45, примерно 12,96, примерно 19,38, примерно 19,79, примерно 21,37 и примерно 21,58 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения Форма IV гидробромидной соли характеризуется двумя или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 6,45, примерно 12,96, примерно 19,38, примерно 19,79, примерно 21,37 и примерно 21,58 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения Форма IV гидробромидной соли характеризуется тремя или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 6,45, примерно 12,96, примерно 19,38, примерно 19,79, примерно 21,37 и примерно 21,58 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения Форма IV гидробромидной соли характеризуется четырьмя или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 6,45, примерно 12,96, примерно 19,38, примерно 19,79, примерно 21,37 и примерно 21,58 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения Форма IV гидробромидной соли характеризуется пятью или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 6,45, примерно 12,96, примерно 19,38, примерно 19,79, примерно 21,37 и примерно 21,58 градуса 2-тета. В частных вариантах реализации настоящего изобретения Форма IV гидробромидной соли характеризуется дифрактограммой рентгеновской порошковой дифракции, которая содержит пики при примерно 6,45, примерно 12,96, примерно 19,38, примерно 19,79, примерно 21,37 и примерно 21,58 градуса 2-тета. В иллюстративном варианте реализации настоящего изобретения Форма IV гидробромидной соли характеризуется по существу всеми пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно:
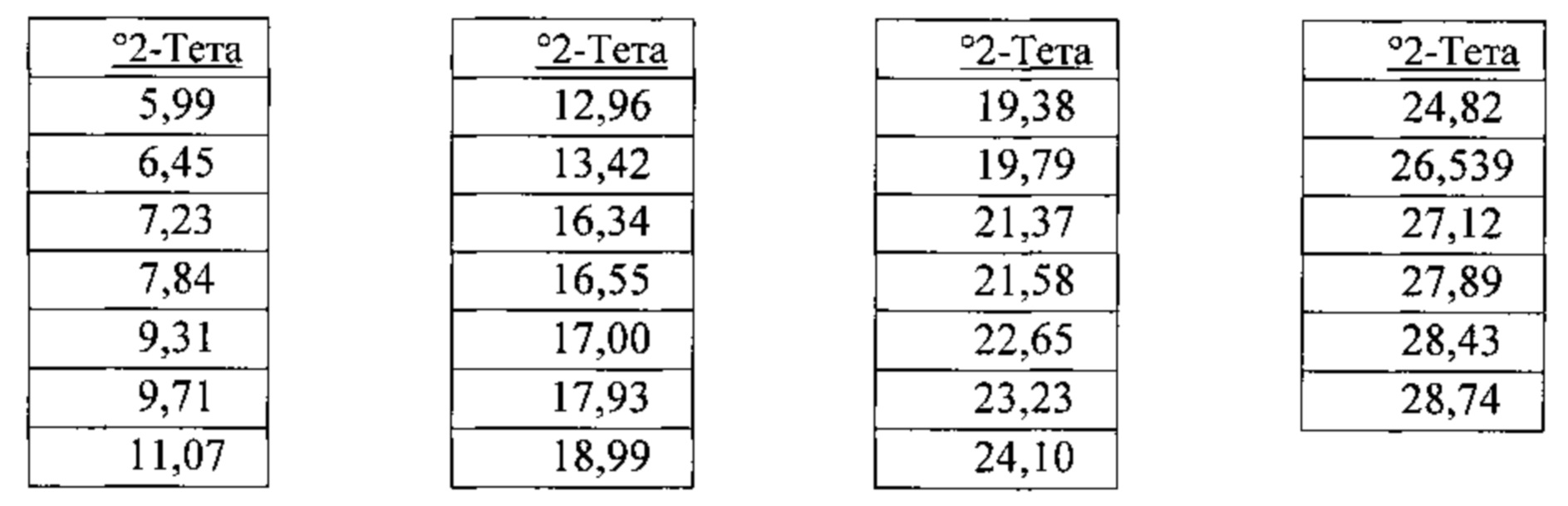
[00120] В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой Форму V гидробромидной соли. В некоторых из таких вариантов реализации настоящего изобретения Форма V гидробромидной соли представляет собой сольват в N,N-диметилформамиде (ДМФА). В некоторых вариантах реализации настоящего изобретения Форма V гидробромидной соли характеризуется дифрактограммой рентгеновской порошковой дифракции, по существу схожей с дифрактограммой, изображенной на фигуре 73. Согласно одному из вариантов реализации настоящего изобретения Форма V гидробромидной соли характеризуется одним или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 6,17, примерно 6,99, примерно 12,50, примерно 14,14, примерно 17,72 и примерно 23,12 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения Форма V гидробромидной соли характеризуется двумя или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 6,17, примерно 6,99, примерно 12,50, примерно 14,14, примерно 17,72 и примерно 23,12 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения Форма V гидробромидной соли характеризуется тремя или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 6,17, примерно 6,99, примерно 12,50, примерно 14,14, примерно 17,72 и примерно 23,12 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения Форма V гидробромидной соли характеризуется четырьмя или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 6,17, примерно 6,99, примерно 12,50, примерно 14,14, примерно 17,72 и примерно 23,12 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения Форма V гидробромидной соли характеризуется пятью или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 6,17, примерно 6,99, примерно 12,50, примерно 14,14, примерно 17,72 и примерно 23,12 градуса 2-тета. В частных вариантах реализации настоящего изобретения Форма V гидробромидной соли характеризуется дифрактограммой рентгеновской порошковой дифракции, которая содержит пики при примерно 6,17, примерно 6,99, примерно 12,50, примерно 14,14, примерно 17,72 и примерно 23,12 градуса 2-тета. В иллюстративном варианте реализации настоящего изобретения Форма V гидробромидной соли характеризуется по существу всеми пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно:

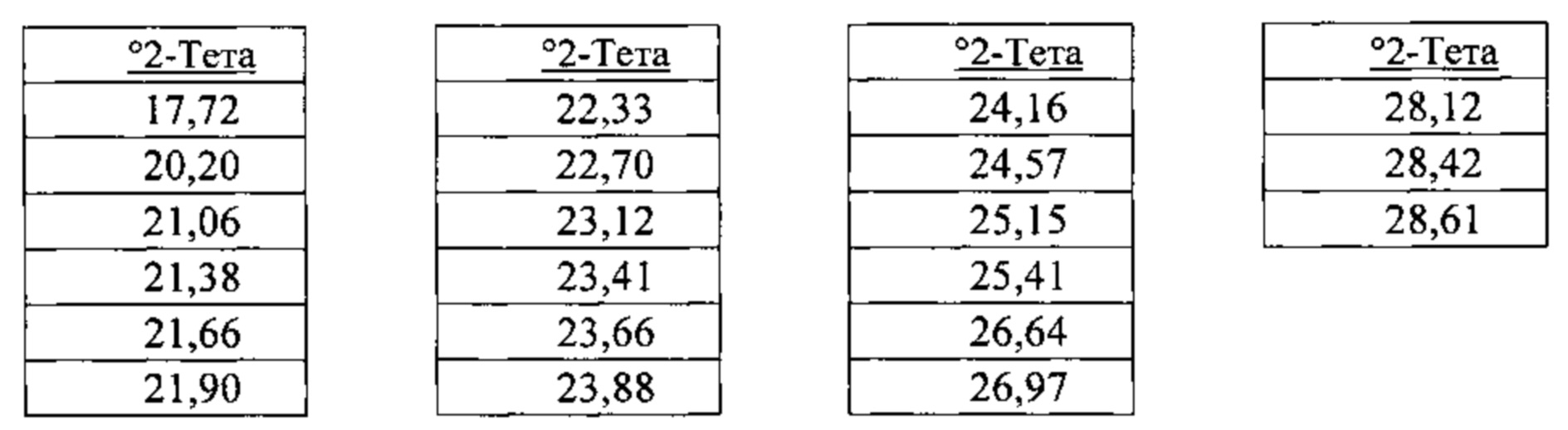
[00121] В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой Форму VI гидробромидной соли. В некоторых из таких вариантов реализации настоящего изобретения Форма VI гидробромидной соли представляет собой сольват в диметилсульфоксиде (ДМСО). В некоторых вариантах реализации настоящего изобретения Форма VI гидробромидной соли характеризуется дифрактограммой рентгеновской порошковой дифракции, по существу схожей с дифрактограммой, изображенной на фигуре 74. Согласно одному из вариантов реализации настоящего изобретения, Форма VI гидробромидной соли характеризуется одним или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 8,38, примерно 9,38, примерно 18,93 и примерно 21,58 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения Форма VI гидробромидной соли характеризуется двумя или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 8,38, примерно 9,38, примерно 18,93 и примерно 21,58 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения Форма VI гидробромидной соли характеризуется тремя или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 8,38, примерно 9,38, примерно 18,93 и примерно 21,58 градуса 2-тета. В частных вариантах реализации настоящего изобретения Форма VI гидробромидной соли характеризуется дифрактограммой рентгеновской порошковой дифракции, которая содержит пики при примерно 8,38, примерно 9,38, примерно 18,93 и примерно 21,58 градуса 2-тета. В иллюстративном варианте реализации настоящего изобретения Форма VI гидробромидной соли характеризуется по существу всеми пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно
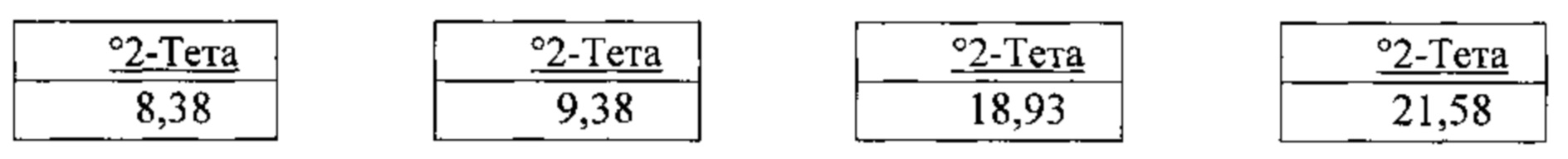
[00122] В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой Форму VII гидробромидной соли. В некоторых из таких вариантов реализации настоящего изобретения Форма VII гидробромидной соли представляет собой сольват в диметилсульфоксиде (ДМСО). В некоторых вариантах реализации настоящего изобретения Форма VII гидробромидной соли характеризуется дифрактограммой рентгеновской порошковой дифракции, по существу схожей с дифрактограммой, изображенной на фигуре 75. Согласно одному из вариантов реализации настоящего изобретения Форма VII гидробромидной соли характеризуется одним или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 15,91, примерно 19,10, примерно 19,53, примерно 20,24, примерно 22,64 и примерно 25,58 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения Форма VII гидробромидной соли характеризуется двумя или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 15,91, примерно 19,10, примерно 19,53, примерно 20,24, примерно 22,64 и примерно 25,58 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения Форма VII гидробромидной соли характеризуется тремя или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 15,91, примерно 19,10, примерно 19,53, примерно 20,24, примерно 22,64 и примерно 25,58 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения Форма VII гидробромидной соли характеризуется четырьмя или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 15,91, примерно 19,10, примерно 19,53, примерно 20,24, примерно 22,64 и примерно 25,58 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения Форма VII гидробромидной соли характеризуется пятью или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 15,91, примерно 19,10, примерно 19,53, примерно 20,24, примерно 22,64 и примерно 25,58 градуса 2-тета. В частных вариантах реализации настоящего изобретения Форма VII гидробромидной соли характеризуется дифрактограммой рентгеновской порошковой дифракции, которая содержит пики при примерно 15,91, примерно 19,10, примерно 19,53, примерно 20,24, примерно 22,64 и примерно 25,58 градуса 2-тета. В иллюстративном варианте реализации настоящего изобретения Форма VII гидробромидной соли характеризуется по существу всеми пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно:
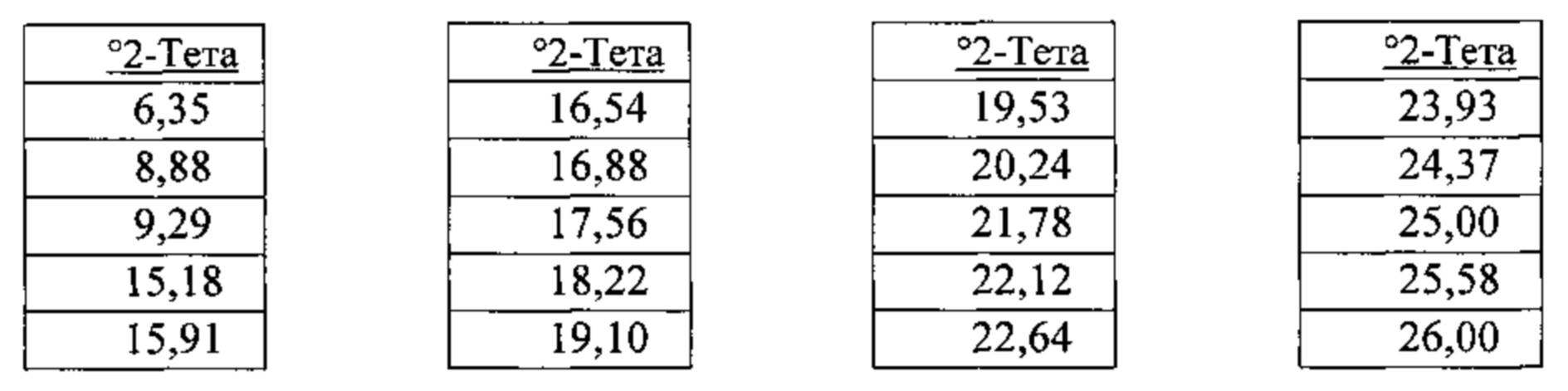
[00123] В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой Форму VIII гидробромидной соли. В некоторых из таких вариантов реализации настоящего изобретения Форма VIII гидробромидной соли представляет собой гидрат. В некоторых вариантах реализации настоящего изобретения Форма VIII гидробромидной соли характеризуется дифрактограммой рентгеновской порошковой дифракции, по существу схожей с дифрактограммой, изображенной на фигуре 76. Согласно одному из вариантов реализации настоящего изобретения Форма VIII гидробромидной соли характеризуется одним или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 8,79, примерно 11,13, примерно 19,97, примерно 21,31, примерно 21,56, примерно 25,30 и примерно 26,65 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения Форма VIII гидробромидной соли характеризуется двумя или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 8,79, примерно 11,13, примерно 19,97, примерно 21,31, примерно 21,56, примерно 25,30 и примерно 26,65 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения Форма VIII гидробромидной соли характеризуется тремя или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 8,79, примерно 11,13, примерно 19,97, примерно 21,31, примерно 21,56, примерно 25,30 и примерно 26,65 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения Форма VIII гидробромидной соли характеризуется четырьмя или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 8,79, примерно 11,13, примерно 19,97, примерно 21,31, примерно 21,56, примерно 25,30 и примерно 26,65 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения Форма VIII гидробромидной соли характеризуется пятью или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 8,79, примерно 11,13, примерно 19,97, примерно 21,31, примерно 21,56, примерно 25,30 и примерно 26,65 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения Форма VIII гидробромидной соли характеризуется шестью или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 8,79, примерно 11,13, примерно 19,97, примерно 21,31, примерно 21,56, примерно 25,30 и примерно 26,65 градуса 2-тета. В частных вариантах реализации настоящего изобретения Форма VIII гидробромидной соли характеризуется дифрактограммой рентгеновской порошковой дифракции, которая содержит пики при примерно 8,79, примерно 11,13, примерно 19,97, примерно 21,31, примерно 21,56, примерно 25,30 и примерно 26,65 градуса 2-тета. В иллюстративном варианте реализации настоящего изобретения Форма VIII гидробромидной соли характеризуется по существу всеми пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно:
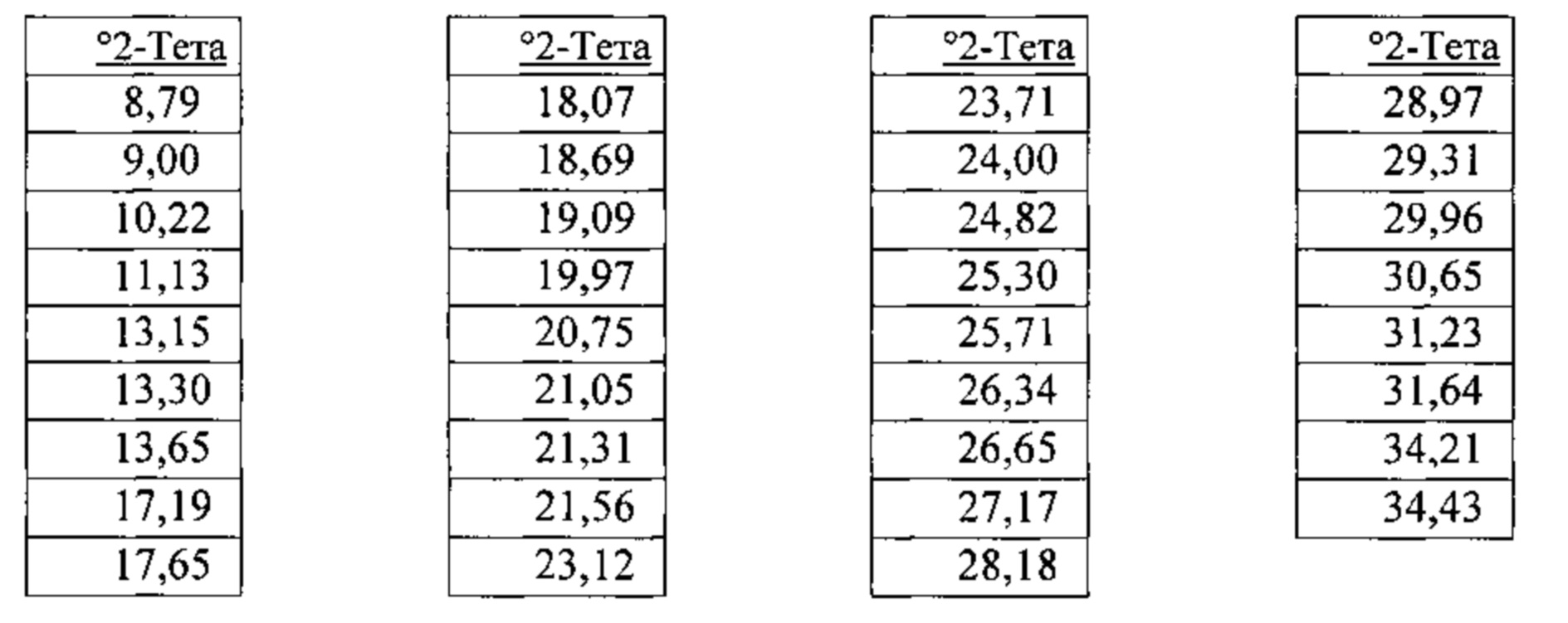
[00124] В некоторых вариантах реализации настоящего изобретения Форма VIII гидробромидной соли характеризуется кривыми термогравиметрического анализа, по существу схожими с кривыми, изображенными на фигуре 77. В некоторых вариантах реализации настоящего изобретения Форма VIII гидробромидной соли характеризуется термограммой дифференциальной сканирующей калориметрии, по существу схожей с термограммой, изображенной на фигуре 78. В некоторых вариантах реализации настоящего изобретения Форма VIII гидробромидной соли характеризуется тем, что его характеристики по существу схожи с характеристиками, приведенными на двух или более из указанных фигур, одновременно.
[00125] В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой соль хлороводородной кислоты. В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой моносоль хлороводородной кислоты. В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой бис-соль хлороводородной кислоты.
[00126] Согласно одному из аспектов настоящего изобретения, бис-гидрохлоридная соль характеризуется дифрактограммой рентгеновской порошковой дифракции, по существу схожей с дифрактограммой, изображенной на фигуре 28. Согласно одному из вариантов реализации настоящего изобретения, бис-гидрохлоридная соль характеризуется одним или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 17,58, примерно 23,32, примерно 25,53 и примерно 28,37 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения бис-гидрохлоридная соль характеризуется двумя или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 17,58, примерно 23,32, примерно 25,53 и примерно 28,37 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения бис-гидрохлоридная соль характеризуется тремя или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 17,58, примерно 23,32, примерно 25,53 и примерно 28,37 градуса 2-тета. В частных вариантах реализации настоящего изобретения бис-гидрохлоридная соль характеризуется по существу всеми пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 17,58, 20,13, 22,14, 23,32, 25,53, 26,60, 27,80 и 28,37 градуса 2-тета. В иллюстративном варианте реализации настоящего изобретения бис-гидрохлоридная соль характеризуется по существу всеми пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно:
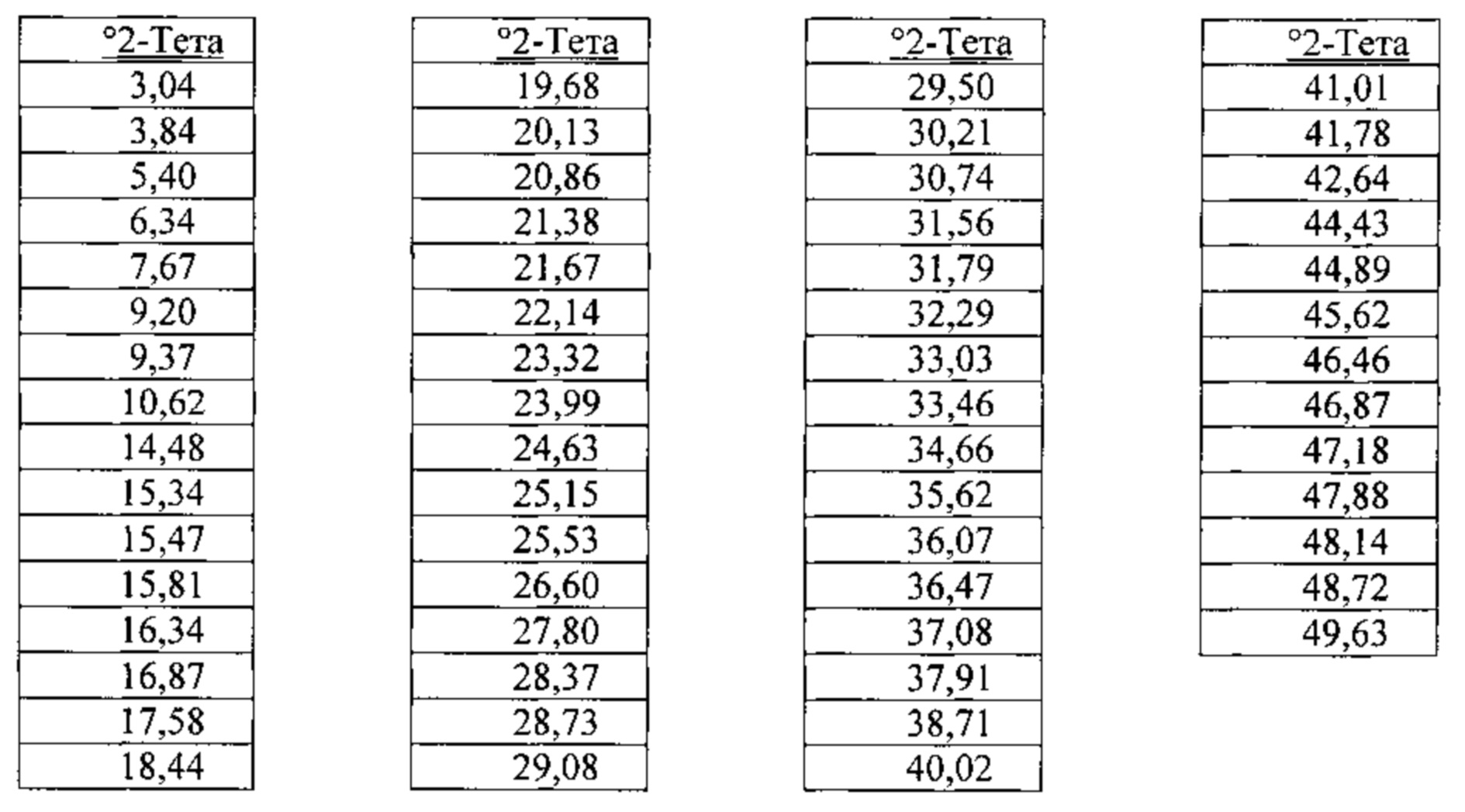
Согласно другому аспекту, бис-гидрохлоридная соль характеризуется кривыми термогравиметрического анализа, по существу схожими с кривыми, изображенными на фигуре 29. Согласно еще одному аспекту, бис-гидрохлоридная соль характеризуется термограммой дифференциальной сканирующей калориметрии, по существу схожей с термограммой, изображенной на фигуре 30. Согласно другому варианту реализации настоящего изобретения, бис-гидрохлоридная соль характеризуется спектром 1Н-ЯМР, по существу схожим со спектром, изображенным на фигуре 31.
[00127] В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой соль малеиновой кислоты. В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой моносоль малеиновой кислоты. В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой биссоль малеиновой кислоты.
[00128] Согласно одному из аспектов настоящего изобретения, мономалеатная соль характеризуется дифрактограммой рентгеновской порошковой дифракции, по существу схожей с дифрактограммой, изображенной на фигуре 24. Согласно одному из вариантов реализации настоящего изобретения, мономалеатная соль характеризуется одним или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 8,38, примерно 23,59 и примерно 23,80 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения мономалеатная соль характеризуется двумя или более пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 8,38, примерно 23,59 и примерно 23,80 градуса 2-тета. В некоторых вариантах реализации настоящего изобретения мономалеатная соль характеризуется тремя пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 8,38, примерно 23,59 и примерно 23,80 градуса 2-тета. В частных вариантах реализации настоящего изобретения мономалеатная соль характеризуется по существу всеми пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно 8,38, 13,74, 16,35, 16,54, 20,67, 23,15, 23,59 и 23,80 градуса 2-тета. В иллюстративном варианте реализации настоящего изобретения мономалеатная соль характеризуется по существу всеми пиками на дифрактограмме рентгеновской порошковой дифракции, выбранными из пиков при примерно:
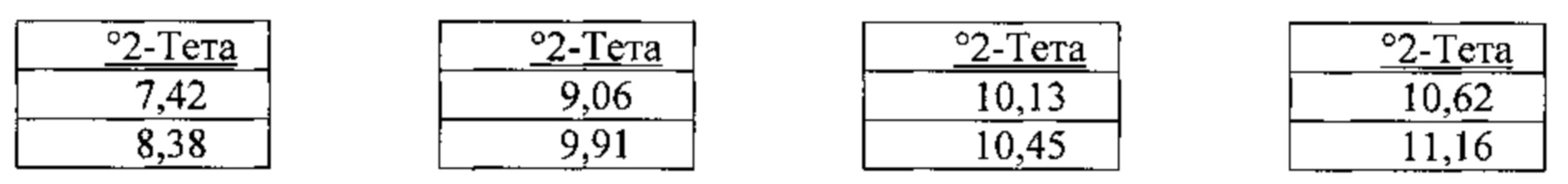

Согласно другому аспекту мономалеатная соль характеризуется кривыми термогравиметрического анализа, по существу схожими с кривыми, изображенными на фигуре 25. Согласно еще одному аспекту мономалеатная соль характеризуется термограммой дифференциальной сканирующей калориметрии, по существу схожей с термограммой, изображенной на фигуре 26. Согласно другому варианту реализации настоящего изобретения мономалеатная соль характеризуется спектром 1H-ЯМР, по существу схожим со спектром, изображенным на фигуре 27.
[00129] Очевидно, что любая из вышеуказанных полиморфных форм может быть охарактеризована, например, путем ссылки на любые из пиков на их соответствующих дифрактограммах рентгеновской порошковой дифракции. Соответственно, в некоторых вариантах реализации настоящего изобретения полиморф, описанный в настоящем документе, характеризуется одним, двумя, тремя, четырьмя, пятью, шестью, семью, восьмью, девятью, десятью, одиннадцатью, двенадцатью, тринадцатью, четырнадцатью, пятнадцатью, шестнадцатью, семнадцатью, восемнадцатью, девятнадцатью, двадцатью или более пиками XRPD (°2θ).
[00130] В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой соль метансульфоновой кислоты. В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой моносоль метансульфоновой кислоты. В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой биссоль метансульфоновой кислоты.
[00131] В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой соль нафталин-2-сульфоновой кислоты. В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой моносоль нафталин-2-сульфоновой кислоты. В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой бис-соль нафталин-2-сульфоновой кислоты.
[00132] В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой соль 1,5-нафталиндисульфоновой кислоты. В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой моносоль 1,5-нафталиндисульфоновой кислоты. В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой бис-соль 1,5-нафталиндисульфоновой кислоты.
[00133] В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой соль щавелевой кислоты. В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой моносоль щавелевой кислоты. В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой бис-соль щавелевой кислоты.
[00134] В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой соль п-толуолсульфоновой кислоты (тозилат). В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой моносоль п-толуолсульфоновой кислоты. В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой бис-соль п-толуолсульфоновой кислоты.
[00135] В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой соль 2,4,6-тригидроксибензойной кислоты. В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой моносоль 2,4,6-тригидроксибензойной кислоты. В некоторых вариантах реализации настоящего изобретения соединение 2 представляет собой бис-соль 2,4,6-тригидроксибензойной кислоты.
[00136] Согласно другому варианту реализации, в настоящем изобретении предложено соединение 2 в виде аморфного твердого вещества. Аморфные твердые вещества хорошо известны среднему специалисту в данной области техники и их, как правило, получают такими методами, как, среди прочих, лиофилизация, плавление и осаждение из сверхкритической жидкости.
Общие способы получения Соединения 2:
[00137] Соединение 1 получают согласно способам, подробно описанным в заявке ʹ061, полное содержание которой включено в настоящее описание посредством ссылки. Соединение 2 получают из Соединения 1, согласно приведенной ниже схеме.
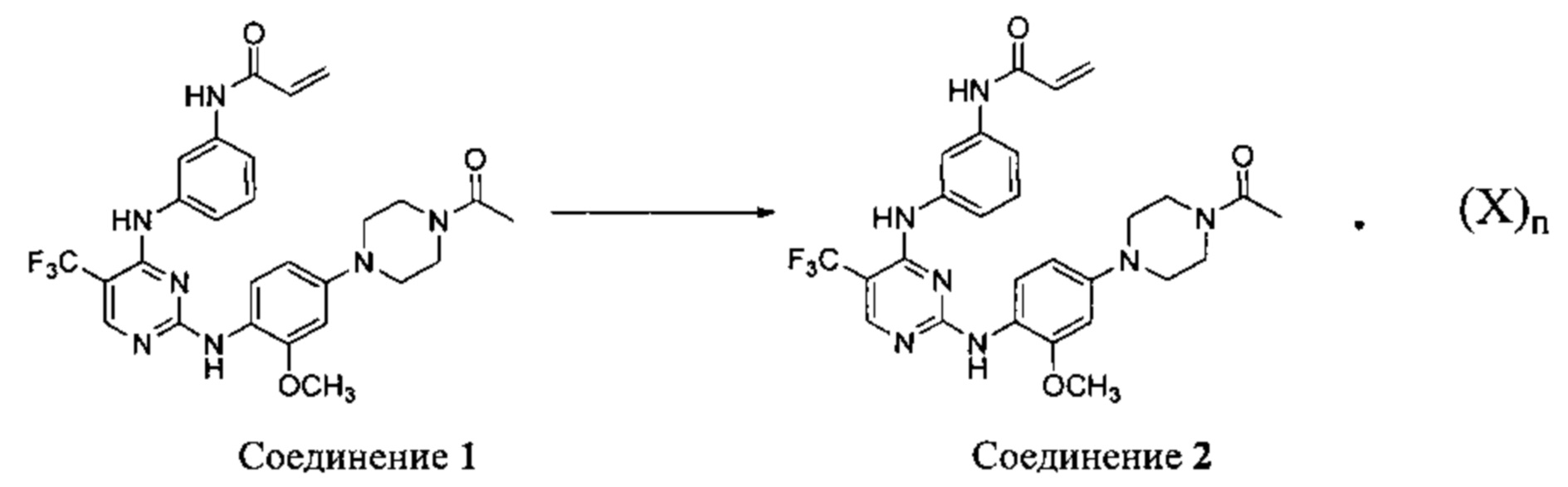
[00138] Как показано на приведенной выше общей схеме, Соединение 2 получают из Соединения 1 путем объединения Соединения 1 либо с одним, либо с двумя эквивалентами бензолсульфоновой кислоты, камфорсульфоновой кислоты, 1,2-этандисульфоновой кислоты, бромоводородной кислоты, хлороводородной кислоты, малеиновой кислоты, метансульфоновой кислоты, нафталин-2-сульфоновой кислоты, 1,5-нафталиндисульфоновой кислоты, щавелевой кислоты, 4-толуолсульфоновой кислоты или 2,4,6-тригидроксибензойной кислоты с получением соли указанных кислот. Таким образом, согласно другому аспекту настоящего изобретения предложен способ получения Соединения 2:
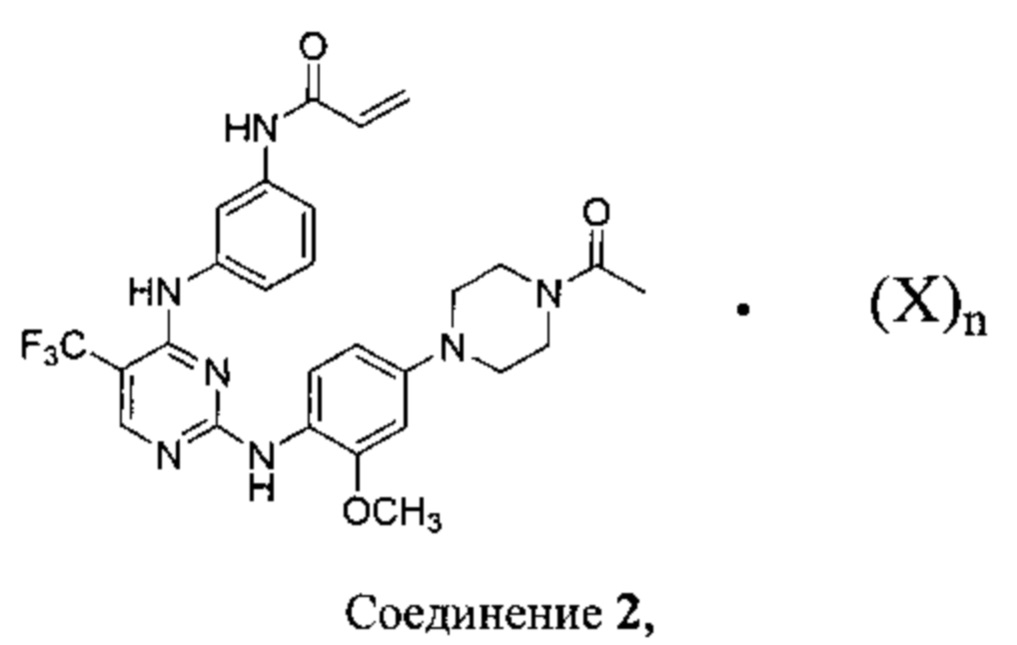
включающий стадии:
обеспечения Соединения 1:
объединения Соединения 1 с одним или двумя эквивалентами бензолсульфоновой кислоты, камфорсульфоновой кислоты, 1,2-этандисульфоновой кислоты, бромоводородной кислоты, хлороводородной кислоты, малеиновой кислоты, метансульфоновой кислоты, нафталин-2-сульфоновой кислоты, 1,5-нафталиндисульфоновой кислоты, щавелевой кислоты, 4-толуолсульфоновой кислоты или 2,4,6-тригидроксибензойной кислоты в подходящем растворителе; и
необязательно, выделения Соединения 2.
[00139] Подходящий растворитель может солюбилизировать один или более компонентов реакции, или, в альтернативном варианте, подходящий растворитель может способствовать перемешиванию суспензии одного или более компонентов реакции. Примерами подходящих растворителей, которые могут быть применены в настоящем изобретении, являются протонные растворители, полярные апротонные растворители, неполярные растворители или их смеси. В некоторых вариантах реализации настоящего изобретения подходящие растворители включают воду, простые эфиры, сложные эфиры, спирты, галогенированные растворители, кетоны или их смеси. В некоторых вариантах реализации настоящего изобретения подходящий растворитель представляет собой метанол, этанол, изопропанол, этилацетат, изопропилацстат, метилэтилкетон, метилизобутилкетон или ацетон. В некоторых вариантах реализации настоящего изобретения подходящий растворитель представляет собой дихлорметан. В других вариантах реализации настоящего изобретения подходящие растворители включают тетрагидрофуран, диметилформамид, диметилсульфоксид, глим, диглим, метил-m-бутиловый эфир, m-бутанол, н-бутанол и ацетонитрил. В некоторых вариантах реализации настоящего изобретения подходящий растворитель представляет собой циклогексан.
[00140] Согласно другому варианту реализации, в настоящем изобретении предложен способ получения Соединения 2:
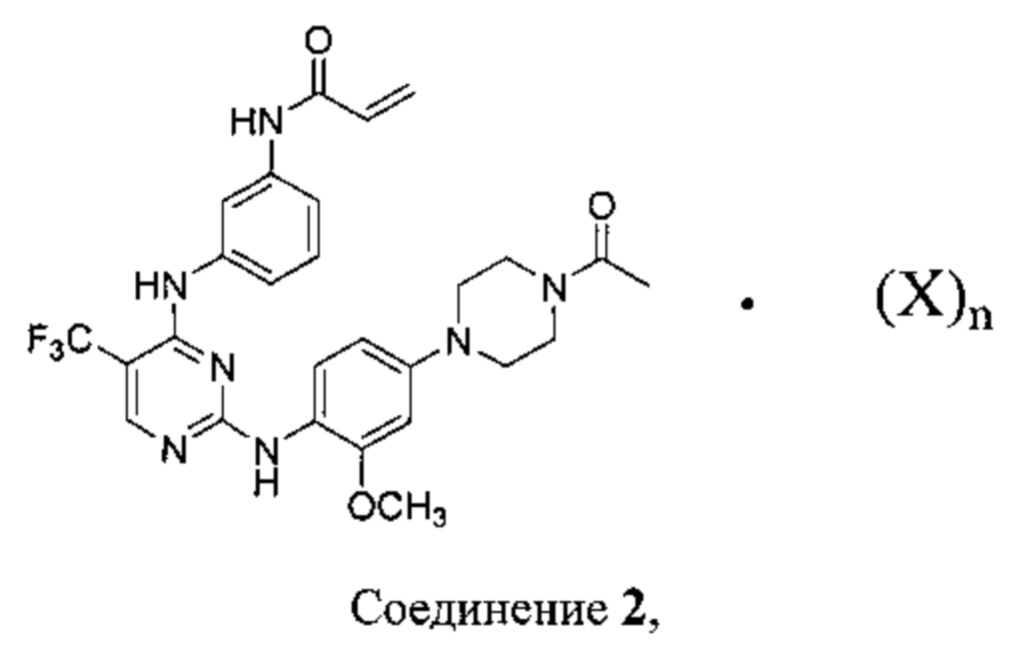
включающий стадии:
объединения Соединения 1:
с подходящим растворителем и, необязательно, нагревания с получением раствора указанного соединения;
добавления одного или двух эквивалентов бензолсульфоновой кислоты, камфорсульфоновой кислоты, 1,2-этандисульфоновой кислоты, бромоводородной кислоты, хлороводородной кислоты, малеиновой кислоты, метансульфоновой кислоты, нафталин-2-сульфоновой кислоты, 1,5-нафталиндисульфоновой кислоты, щавелевой кислоты, 4-толуолсульфоновой кислоты или 2,4,6-тригидроксибензойной кислоты к указанному раствору; и
необязательно, выделение Соединения 2.
[00141] Как в общем описано выше, Соединение 1 растворяют или суспендируют в подходящем растворителе, необязательно, при нагревании. В некоторых вариантах реализации настоящего изобретения Соединение 1 растворяют при температуре от примерно 20 до примерно 60°C. В других вариантах реализации настоящего изобретения Соединение 1 растворяют при температуре от примерно 20 до примерно 25°C, такой как примерно температура окружающей среды. В других вариантах реализации настоящего изобретения Соединение 1 растворяют при температуре кипения растворителя. В других вариантах реализации соединение 1 растворяют без нагревания.
[00142] В некоторых вариантах реализации настоящего изобретения к Соединению 1 добавляют примерно 1 эквивалент бензолсульфоновой кислоты, камфорсульфоновой кислоты, 1,2-этандисульфоновой кислоты, бромоводородной кислоты, хлороводородной кислоты, малеиновой кислоты, метансульфоновой кислоты, нафталин-2-сульфоновой кислоты, 1,5-нафталиндисульфоновой кислоты, щавелевой кислоты, 4-толуолсульфоновой кислоты или 2,4,6-тригидроксибензойной кислоты с получением Соединения 2. В других вариантах реализации настоящего изобретения к Соединению 1 добавляют примерно 2 эквивалента бензолсульфоновой кислоты, камфорсульфоновой кислоты, 1,2-этандисульфоновой кислоты, бромоводородной кислоты, хлороводородной кислоты, малеиновой кислоты, метансульфоновой кислоты, нафталин-2-сульфоновой кислоты, 1,5-нафталиндисульфоновой кислоты, щавелевой кислоты, 4-толуолсульфоновой кислоты или 2,4,6-тригидроксибензойной кислоты с получением Соединения 2. В других вариантах реализации настоящего изобретения к Соединению 1 добавляют более 2 эквивалентов бензолсульфоновой кислоты, камфорсульфоновой кислоты, 1,2-этандисульфоновой кислоты, бромоводородной кислоты, хлороводородной кислоты, малеиновой кислоты, метансульфоновой кислоты, нафталин-2-сульфоновой кислоты, 1,5-нафталиндисульфоновой кислоты, щавелевой кислоты, 4-толуолсульфоновой кислоты или 2,4,6-тригидроксибензойной кислоты с получением Соединения 2. В других вариантах реализации настоящего изобретения к Соединению 1 добавляют от примерно 0,9 до примерно 1,1 эквивалентов бензолсульфоновой кислоты, камфорсульфоновой кислоты, 1,2-этандисульфоновой кислоты, бромоводородной кислоты, хлороводородной кислоты, малеиновой кислоты, метансульфоновой кислоты, нафталин-2-сульфоновой кислоты, 1,5-нафталиндисульфоновой кислоты, щавелевой кислоты, 4-толуолсульфоновой кислоты или 2,4,6-тригидроксибензойной кислоты с получением Соединения 2. В другом варианте реализации к Соединению 1 добавляют от примерно 0,99 до примерно 1,01 эквивалентов бензолсульфоновой кислоты, камфорсульфоновой кислоты, 1,2-этандисульфоновой кислоты, бромоводородной кислоты, хлороводородной кислоты, малеиновой кислоты, метансульфоновой кислоты, нафталин-2-сульфоновой кислоты, 1,5-нафталиндисульфоновой кислоты, щавелевой кислоты, 4-толуолсульфоновой кислоты или 2,4,6-тригидроксибензойной кислоты с получением Соединения 2. В других вараинтах реализации к Соединению 1 добавляют от примерно 1,8 до примерно 2,2 эквивалентов, в частности от примерно 1,98 до 2,02 эквивалентов бензолсульфоновой кислоты, камфорсульфоновой кислоты, 1,2-этандисульфоновой кислоты, бромоводородной кислоты, хлороводородной кислоты, малеиновой кислоты, метансульфоновой кислоты, нафталин-2-сульфоновой кислоты, 1,5-нафталиндисульфоновой кислоты, щавелевой кислоты, 4-толуолсульфоновой кислоты или 2,4,6-тригидроксибензойной кислоты с получением Соединения 2.
[00143] Очевидно, что кислоту можно добавлять к смеси Соединения 1 и подходящего растворителя в любой подходящей форме. Например, кислоту можно добавлять в твердой форме или в виде раствора или суспензии в подходящем растворителе. Подходящий растворитель может представлять собой подходящий растворитель, который объединяют с Соединением 1, или может представлять собой другой растворитель. Согласно одному из вариантов реализации настоящего изобретения кислоту добавляют в твердой форме. В некоторых вариантах реализации настоящего изобретения кислоты объединяют с подходящим растворителем до добавления к Соединению 1. Согласно другому варианту реализации настоящего изобретения кислоту добавляют в виде раствора в подходящем растворителе. В некоторых вариантах реализации настоящего изобретения подходящие растворители включают воду, простые эфиры, сложные эфиры, спирты, галогенированные растворители, кетоны или их смеси. В некоторых вариантах реализации настоящего изобретения подходящий растворитель представляет собой метанол, этанол, изопропанол, этилацетат, изопропилацетат, метилэтилкетон, метилизобутилкетон или ацетон. В некоторых вариантах реализации настоящего изобретения подходящий растворитель представляет собой дихлорметан. В других вариантах реализации настоящего изобретения подходящие растворители включают тетрагидрофуран, диметилформамид, диметилсульфоксид, глим, диглим, метил-m-бутиловый эфир, m-бутанол, н-бутанол и ацетонитрил. В некоторых вариантах реализации настоящего изобретения подходящий растворитель представляет собой циклогексан. В некоторых вариантах реализации настоящего изобретения подходящий растворитель выбран из вышеперечисленных растворителей и является безводным.
[00144] В некоторых вариантах реализации настоящего изобретения полученную смесь, содержащую Соединение 2, охлаждают. В других вариантах реализации настоящего изобретения смесь, содержащую Соединение 2, охлаждают до температуры ниже 20°C, в частности ниже 10°C.
[00145] В некоторых вариантах реализации настоящего изобретения Соединение 2 осаждают из смеси. В другом варианте реализации настоящего изобретения Соединение 2 кристаллизуют из смеси. В других вариантах реализации настоящего изобретения Соединение 2 кристаллизуют из раствора после внесения в раствор затравки (то есть добавления в раствор кристаллов Соединения 2).
[00146] Кристаллическое Соединение 2 может выпадать в осадок из реакционной смеси или может быть получено путем удаления части или всего растворителя посредством таких методов, как выпаривание, дистилляция, фильтрование (например, нанофильтрация, ультрафильтрация), обратный осмос, абсорбция и реакция, путем добавления антирастворителя, такого как вода, метил-трет-бутилового эфира (МТБЭ) или гептан, путем охлаждения или с помощью различных комбинаций этих методов.
[00147] Как в общем описано выше, Соединение 2 необязательно может быть выделено. Очевидно, что Соединение 2 может быть выделено любыми подходящими физическими средствами, известными специалисту в данной области техники. В некоторых вариантах реализации настоящего изобретения осажденное твердое Соединение 2 отделяют от надосадочной жидкости путем фильтрования. В других вариантах реализации настоящего изобретения осажденное твердое Соединение 2 отделяют от надосадочной жидкости путем декантации надосадочной жидкости.
[00148] В некоторых вариантах реализации настоящего изобретения осажденное твердое Соединение 2 отделяют от надосадочной жидкости путем фильтрования.
[00149] В некоторых вариантах реализации настоящего изобретения выделенное Соединение 2 сушат на воздухе. В других вариантах реализации настоящего изобретения выделенное Соединение 2 сушат при пониженном давлении, необязательно, при повышенной температуре.
Применение, приготовление форм и введение
Фармацевтически приемлемые композиции
[00150] Согласно другому варианту реализации, в настоящем изобретении предложена композиция, содержащая Соединение 2 и фармацевтически приемлемый носитель, адъювант или среду. Количество Соединения 2 в композициях согласно настоящему изобретению является таким, которое эффективно для измеримого ингибирования протеинкиназы, в частности киназы EGFR, или ее мутанта, в биологическом образце или у пациента. В некоторых вариантах реализации настоящего изобретения композиция согласно настоящему изобретению приготовлена для введения пациенту, нуждающемуся в такой композиции. В некоторых вариантах реализации настоящего изобретения композиция согласно настоящему изобретению приготовлена для перорального введения пациенту.
[00151] Термин «пациент» в настоящем документе означает животное, предпочтительно млекопитающее, и наиболее предпочтительно человека.
[00152] Термин «фармацевтически приемлемый носитель, вспомогательное вещество или среда» относится к нетоксичным носителям, адьювантам или средам, которые не ухудшают фармакологическую активность соединения, с которым они находятся в композиции. Фармацевтически приемлемые носители, адъюванты или среды, которые могут быть использованы в композициях согласно настоящему изобретению, включают, но не ограничиваются ими, ионообменники, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как сывороточный альбумин человека, буферные вещества, такие как фосфаты, глицин, сорбиновую кислоту, сорбат калия, смеси неполных глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты, такие как сульфат протамина, гидрофосфат натрия, гидрофосфат калия, хлорид натрия, соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, витамин Е-полиэтиленгликоля сукцинат (d-альфа-токоферил-полиэтиленгликоля 1000 сукцинат), натрий-карбоксиметилцеллюлозу, полиакрилаты, воски, блок-полимеры полиэтилен-полиоксипропилен, желатин, поливинилпирролидон-винилацетат, гидроксипропилметилцеллюлозу, стеарат магния, стеариновую кислоту, лимонную кислоту, маннитол и ланолин.
[00153] Композиции согласно настоящему изобретению могут быть введены перорально, парентерально, посредством ингаляционного спрея, местно, ректально, назально, трансбуккально, вагинально или через имплантированный резервуар. Термин «парентеральный» в настоящем документе включает методы подкожных, внутривенных, внутримышечных, внутрисуставных, внутрисиновиальных, интрастернальных, интратекальных, внутрипеченочных, внутриочаговых (внутрь пораженной ткани) и внутричерепных инъекций или инфузий. Предпочтительно, композиции вводят перорально, внутрибрюшинно или внутривенно. Стерильные инъецируемые формы композиций согласно настоящему изобретению могут представлять собой водные или масляные суспензии. Эти суспензии могут быть получены в соответствии со способами, известными в данной области техники, с применением подходящих разрыхляющих или смачивающих агентов и суспендирующих агентов. Стерильный инъецируемый препарат может также представлять собой стерильный инъецируемый раствор или суспензию в нетоксичном приемлемом для парентерального введения разбавителе или растворителе, например, может представлять собой раствор в 1,3-бутандиоле. К приемлемым носителям и растворителям, которые могут быть использованы, относятся, среди прочих, вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды обычно используют стерильные нелетучие масла.
[00154] Для этой цели может быть использовано любое мягкое нелетучее масло, включая синтетические моно или диглицериды. Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, подходят для получения инъецируемых препаратов, также подходят природные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, в частности в их полиоксиэтилированных вариантах. Такие масляные растворы или суспензии могут также содержать длинноцепочечный спиртовой разбавитель или диспергатор, такие как карбоксиметилцеллюлоза или подобные разрыхляющие агенты, которые обычно используются для приготовления фармацевтически приемлемых лекарственных форм, включая эмульсии и суспензии. Для получения лекарственных форм также могут быть использованы и другие обычно используемые поверхностно-активные вещества, такие как Твины (Tweens), Сланы (Spans) и другие эмульгаторы или усилители биодоступности, которые обычно используются при приготовлении фармацевтически приемлемых твердых, жидких или других лекарственных форм.
[00155] Фармацевтически приемлемые композиции согласно настоящему изобретению могут быть введены перорально в любой перорально приемлемой лекарственной форме, включая, но не ограничиваясь ими, капсулы, таблетки, водные и неводные суспензии или растворы. В случае таблеток для перорального применения, обычно используемые носители включают лактозу и кукурузный крахмал. Также обычно добавляют смазывающие агенты, такие как стеарат магния. Для перорального введения в форме капсулы подходящие растворители включают лактозу и высушенный кукурузный крахмал. Когда требуются водные суспензии для перорального применения, активный ингредиент обычно комбинируют с эмульгирующими и суспендирующими агентами. При желании, также могут быть добавлены определенные подсластители, ароматизаторы или красители.
[00156] В качестве альтернативы, фармацевтически приемлемые композиции согласно настоящему изобретению могут быть введены в форме суппозиториев для ректального введения. Они могут быть получены путем смешивания агента с подходящим, не вызывающим раздражения вспомогательным веществом, которое является твердым при комнатной температуре, но жидким при ректальной температуре и, следовательно, будет плавиться в прямой кишке с высвобождением лекарственного средства. Такие материалы включают масло какао, пчелиный воск и полиэтиленгликоли.
[00157] Фармацевтически приемлемые композиции согласно настоящему изобретению можно также вводить местно, в частности, когда цель лечения включает области или органы, легко доступные для местного применения, включая заболевания глаз, кожи или нижней части кишечника. Подходящие составы для местного применения могут быть легко получены для каждой из этих областей или органов.
[00158] Местное применение для нижней части кишечника может быть осуществлено в виде ректальных суппозиториев (см. выше) или в виде подходящего состава для клизмы. Также могут быть использованы трансдермальные пластыри местного действия.
[00159] Для местного применения предложенные фармацевтически приемлемые композиции могут быть приготовлены в виде подходящей мази, содержащей активный компонент, суспендированный или растворенный в одном или более носителей. Носители для местного введения Соединения 2 включают, но не ограничиваются ими, минеральное масло, жидкий петролатум, белый петролатум, пропиленгликоль, полиоксиэтилен, полиоксипропиленовые соединения, эмульгирующий воск и воду. В качестве альтернативы, предложенные фармацевтически приемлемые композиции могут быть приготовлены в виде подходящего лосьона или крема, содержащего активные компоненты, суспендированные или растворенные в одном или более фармацевтически приемлемых носителей. Подходящие носители включают, но не ограничиваются ими, минеральное масло, моностеарат сорбитана, полисорбат 60, воски из цетиловых сложных эфиров, цетеариловый спирт, 2-октилдодеканол, бензиловый спирт и воду.
[00160] Для офтальмологического применения предложенные фармацевтически приемлемые композиции могут быть приготовлены в виде микронизированных суспензий в изотоническом стерильном физиологическом растворе с доведенным pH или предпочтительно в виде растворов в изотоническом стерильном физиологическом растворе с доведенным pH с консервантом, таким как хлорид бензилалкония, или без него. В качестве альтернативы, для офтальмологического применения фармацевтически приемлемые композиции могут быть приготовлены в виде мази, такой как петролатум.
[00161] Фармацевтически приемлемые композиции согласно настоящему изобретению также можно вводить в виде назального аэрозоля или путем ингаляции. Такие композиции получают в соответствии с методиками, хорошо известными в области фармацевтических составов, и могут быть приготовлены в виде растворов в физиологическом растворе с использованием бензилового спирта или других подходящих консервантов, усилителей всасывания для повышения биодоступности, фторуглеродов и/или других традиционных солюбилизирующих или разрыхляющих агентов.
[00162] В некоторых вариантах реализации настоящего изобретения фармацевтически приемлемые композиции согласно настоящему изобретению приготовлены для перорального введения.
[00163] Количество Соединения 2, которое может быть объединено с материалами-носителями для получения композиции в лекарственной форме для однократного введения, будет варьироваться в зависимости от подвергаемого лечению пациента и конкретного способа введения. В некоторых вариантах реализации настоящего изобретения предложенные композиции приготовлены таким образом, чтобы пациенту, получающему данные композиции, можно было бы ввести дозу Соединения 2 от 0,01 до 100 мг/кг массы тела/день.
[00164] Кроме того, следует понимать, что конкретная доза и схема лечения для любого конкретного пациента будет зависеть от множества факторов, включая активность конкретного применяемого соединения, возраст, массу тела, общее состояние здоровья, пол, рацион, время введения, скорость выведения, комбинацию лекарственных средств, а также мнение лечащего врача и тяжесть конкретного заболевания, подлежащего лечению.
Применение соединений и фармацевтически приемлемых композиций
[00165] Соединение 2 и композиции, описанные в настоящем документе, как правило, подходят для ингибирования протеинкиназной активности одного или более ферментов. Примеры киназ, которые ингибирует Соединение 2 и композиции, описанные в настоящем документе, и в отношении которых описанные в настоящем документе способы могут найти применение, включают киназу EGFR или его мутант. Было обнаружено, что Соединение 2 представляет собой селективный ингибитор по меньшей мере одного мутанта EGFR по сравнению с EGFR дикого типа («ДТ»). В некоторых вариантах реализации настоящего изобретения по меньшей мере одна мутация EGFR представляет собой Т790М. В некоторых вариантах реализации настоящего изобретения по меньшей мере одна мутация EGFR представляет собой делеционную мутацию. В некоторых вариантах реализации настоящего изобретения по меньшей мере одна мутация EGFR представляет собой активирующую мутацию. В некоторых вариантах реализации настоящего изобретения Соединение 2 селективно ингибирует по меньшей мере одну устойчивую мутацию и по меньшей мере одну активирующую мутацию по сравнению с EGFR ДТ. В некоторых вариантах реализации настоящего изобретения Соединение 2 селективно ингибирует по меньшей мере одну делеционную мутацию и/или по меньшей мере одну точечную мутацию и не оказывает ингибирующего действия на EGFR ДТ.
[00166] Мутация EGFR может быть выбрана из Т790М (устойчивая или онкогенная), L858R (активирующая), delE746-A750 (активирующая), G719S (активирующая) или их комбинаций.
[00167] В настоящем документе термин «селективно ингибирует», используемый по сравнению с ингибированием EGFR ДТ, означает, что Соединение 2 ингибирует по меньшей мере одну мутацию EGFR (то есть по меньшей мере одну делеционную мутацию, по меньшей мере одну активирующую мутацию, по меньшей мере одну устойчивую мутацию или комбинации по меньшей мере одной делеционной мутации и по меньшей мере одной точечной мутации) по меньшей мере в одном анализе, описанном в настоящем документе (например, биохимическом анализе или анализе на клетках). В некоторых вариантах реализации настоящего изобретения термин «селективно ингибирует», используемый по сравнению с ингибированием EGFR ДТ, означает, что Соединение 2 является по меньшей мере в 50 раз, по меньшей мере в 45 раз, по меньшей мере в 40 раз, по меньшей мере в 35 раз, по меньшей мере в 30 раз, по меньшей мере в 25 раз или по меньшей мере в 20 раз более сильным ингибитором по меньшей мере одной мутации EGFR, определенной и описанной в настоящем документе, по сравнению с ингибитором EGFR ДТ.
[00168] В настоящем документе термин «не действует на EGFR ДТ» означает, что селективный ингибитор по меньшей мере одной мутации EGFR, определенный и описанный выше и здесь, ингибирует EGFR на уровне, соответствующем верхнему пределу определения по меньшей мере одного анализа, такого как описано в заявке ʹ061 (например, биохимического анализа или анализа на клетках, подробно описанных в Примерах 56-58). Анализы in vitro включают анализы, в которых определяют ингибирование активности фосфорилирования и/или последующие функциональные проявления, или АТФазную активность активированного EGFR (ДТ или мутанта). Альтернативные анализы in vitro позволяют количественно оценить способность ингибитора связываться с EGFR (ДТ или мутанта). Связывание ингибитора может быть измерено путем радиоактивного мечения ингибитора перед связыванием, выделения комплекса ингибитор/EGFR (ДТ или мутанта) и определения количества связанной радиоактивной метки. В качестве альтернативы, связывание ингибитора можно определить путем проведения конкурентного эксперимента, в котором новые ингибиторы инкубируют с EGFR (ДТ или мутантом), связанным с известными радиоактивно меченными лигандами. В некоторых вариантах реализации настоящего изобретения термин «не действует на EGFR ДТ» означает, что Соединение 2 ингибирует EGFR ДТ при IC50, составляющей по меньшей мере 10 мкМ, по меньшей мере 9 мкМ, по меньшей мере 8 мкМ, по меньшей мере 7 мкМ, по меньшей мере 6 мкМ, по меньшей мере 5 мкМ, по меньшей мере 3 мкМ, по меньшей мере 2 мкМ или по меньшей мере 1 мкМ.
[00169] В некоторых вариантах реализации настоящего изобретения Соединение 2 селективно ингибирует (а) по меньшей мере одну активирующую мутациию; и (b) Т790М; и (с) не действует на ДТ. В некоторых вариантах реализации настоящего изобретения по меньшей мере одна активирующая мутация представляет собой делеционную мутацию. В некоторых вариантах реализации настоящего изобретения по меньшей мере одна активирующая мутация представляет собой точечную мутацию. В некоторых вариантах реализации настоящего изобретения активирующая мутация представляет собой delE746-А750. В некоторых вариантах реализации настоящего изобретения активирующая мутация представляет собой L858R. В некоторых вариантах реализации настоящего изобретения активирующая мутация представляет собой G719S.
[00170] В некоторых вариантах реализации настоящего изобретения по меньшей мере одна мутация EGFR представляет собой L858R и/или Т790М.
[00171] Не желая связываться какой-либо конкретной теорией, предполагается, что введение Соединения 2 у пациента, содержащего по меньшей мере одну активирующую мутацию, можно предупредить образование устойчивой мутации Т790М. Таким образом, в некоторых вариантах реализации настоящего изобретения предложен способ ингибирования активирующей мутации у пациента, включающий введение указанному пациенту Соединения 2 или содержащей его композиции, описанных в настоящем документе.
[00172] Специалисту в данной области техники очевидно, что некоторые пациенты имеют онкогенную форму мутации Т790М, то есть мутация Т790М присутствует до введения любого ингибитора киназы EGFR пациенту и поэтому является онкогенной. Соответственно, в некоторых вариантах реализации настоящего изобретения предложен способ ингибирования онкогенной Т790М у пациента, включающий введение указанному пациенту предложенного соединения или содержащей его композиции, описанных в настоящем документе.
[00173] В некоторых вариантах реализации настоящего изобретения количество Соединения 2 в композиции является эффективным, чтобы измеримо ингибировать по меньшей мере один мутант EGFR селективно по сравнению с EGFR ДТ и другими протеинкиназами (например, ErbB2, ErbB4, ТЕС-киназой и/или JAK3) в биологическом образце или у пациента.
[00174] В настоящем документе термины «лечение», «лечить» и «проведение лечения» относятся к обращению, облегчению, задержке начала или подавлению развития заболевания или расстройства, или одного или более симптомов, которые описаны в настоящем документе. В некоторых вариантах реализации настоящего изобретения введение для лечения можно осуществлять после того, как развились один или более симптомов. В других вариантах введение для лечения можно осуществлять в отсутствие симптомов. Например, введение для лечения можно осуществлять чувствительному индивидууму до появления симптомов (например, с учетом истории симптомов и/или с учетом генетических или других факторов предрасположенности). Лечение также может быть продолжено после устранения симптомов, например, чтобы предотвратить или задержать их повторное появление.
[00175] Соединение 2 является ингибитором по меньшей мере одного мутанта EGFR и поэтому является подходящим для лечения одного или более расстройств, связанных с активностью одного или более мутантов EGFR (например, делеционной мутации, активирующей мутации, устойчивой мутации или их комбинации). Таким образом, в некоторых вариантах реализации настоящего изобретения предложен способ лечения расстройства, опосредованного мутантным EGFR, включающий стадию введения нуждающемуся в этом пациенту Соединения 2 или содержащей его фармацевтически приемлемой композиции.
[00176] В настоящем документе термин «опосредованные мутантным EGFR» расстройства или состояния означает любое заболевание или другое болезненное состояние, для которого известно, что в нем участвует по меньшей мере один мутант EGFR. В некоторых вариантах реализации настоящего изобретения по меньшей мере один мутант EGFR представляет собой Т790М. В некоторых вариантах реализации настоящего изобретения указанный по меньшей мере один мутант EGFR представляет собой делеционную мутацию. В некоторых вариантах реализации настоящего изобретения указанный по меньшей мере один мутант EGFR представляет собой активирующую мутацию. В некоторых вариантах реализации настоящего изобретения указанный по меньшей мере один мутант EGFR представляет собой L858R и/или Т790М. В некоторых вариантах реализации настоящего изобретения предложенное соединение селективно ингибирует (а) по меньшей мере одну активирующую мутацию, (b) Т790М и (с) не действует на ДТ. В некоторых вариантах реализации настоящего изобретения по меньшей мере одна активирующая мутация представляет собой делеционную мутацию. В некоторых вариантах реализации настоящего изобретения по меньшей мере одна активирующая мутация представляет собой точечную мутацию. В некоторых вариантах реализации настоящего изобретения активирующая мутация представляет собой delE746-А750. В некоторых вариантах реализации настоящего изобретения активирующая мутация представляет собой L858R. В некоторых вариантах реализации настоящего изобретения активирующая мутация представляет собой G719S.
[00177] Соответственно, другой вариант реализации настоящего изобретения относится к лечению или уменьшению тяжести одного или более заболеваний, для которых известно, что в них участвует по меньшей мере один мутант EGFR. В частности, настоящее изобретение относится к способу лечения или уменьшения тяжести заболевания или состояния, выбранного из пролиферативного расстройства, при этом указанный способ включает введение нуждающемуся в этом пациенту соединения или композиции согласно настоящему изобретению.
[00178] В некоторых вариантах реализации настоящего изобретения предложен способ лечения или уменьшения тяжести одного или более расстройств, выбранных из рака. В некоторых вариантах реализации настоящего изобретения рак связан с солидной опухолью. В некоторых вариантах реализации настоящего изобретения рак представляет собой рак молочной железы, глиобластому, рак легкого, рак головы и шеи, колоректальный рак, рак мочевого пузыря или немелкоклеточный рак легкого. В некоторых вариантах реализации настоящего изобретения предложен способ лечения или уменьшения тяжести одного или более расстройств, выбранных из плоскоклеточной карциномы, карциномы слюнных желез, карциномы яичника или рака поджелудочной железы.
[00179] В некоторых вариантах реализации настоящего изобретения предложен способ лечения или уменьшения тяжести нейрофиброматоза типа I (NF1), нейрофиброматоза типа II (NF2), неоплазм шванновских клеток (например, MPNST’s), или шванном.
[00180] Соединение 2 и композиции на его основе в соответствии со способом согласно настоящему изобретению могут быть введены с применением любого количества и любого пути введения, эффективного для лечения или уменьшения тяжести рака. Точное требуемое количество будет варьироваться от субъекта к субъекту в зависимости от вида, возраста и общего состояния субъекта, тяжести инфекции, конкретного агента, способа его введения и тому подобного. Соединение 2 предпочтительно готовят в виде стандартной лекарственной формы для облегчения введения и равномерности дозировки. Выражение «лекарственная форма», используемое в настоящем документе, относится к физически дискретной единице агента, подходящей для пациента, подвергаемого лечению. Следует иметь в виду, однако, что общая суточная доза из соединений и композиций согласно настоящему изобретению будет определяться лечащим врачом в рамках здравого медицинского суждения. Уровень конкретной эффективной дозы для любого конкретного пациента или организма будет зависеть от различных факторов, включая расстройство, подлежащее лечению и тяжесть данного расстройства; активность конкретного применяемого соединения; конкретную применяемую композицию; возраст, массу тела, общее состояние здоровья, пол и рацион пациента; время введения, способ введения и скорость выведения конкретного применяемого соединения; продолжительность лечения; лекарства, применяемые в комбинации или случайно с конкретным применяемым соединением и подобные факторы, хорошо известные в области медицины. Термин «пациент» в настоящем документе означает животное, предпочтительно млекопитающее, и наиболее предпочтительно человека.
[00181] Фармацевтически приемлемые композиции согласно настоящему изобретению могут быть введены людям и другим животным перорально, ректально, парентерально, интрастернально, интравагинально, внутрибрюшинно, местно (в виде порошков, мазей или капель), буккально, в виде перорального или назального спрея или тому подобного в зависимости от тяжести инфекции, подлежащей лечению. В некоторых вариантах реализации настоящего изобретения Соединение 2 может быть введено перорально или парентерально при уровнях доз от примерно 0,01 мг/кг до примерно 60 мг/кг, или от примерно 0,1 мг/кг до примерно 50 мг/кг, или от примерно 0,25 мг/кг до примерно 45 мг/кг и предпочтительно от примерно 0,5 мг/кг до примерно 25 мг/кг массы тела субъекта в день один или более раз в день с получением желательного терапевтического эффекта.
[00182] Жидкие лекарственные формы для перорального введения включают, но не ограничиваются ими, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к Соединению 2 жидкие лекарственные формы могут содержать инертные разбавители, обычно используемые в данной области техники, такие как, например, вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, полиэтиленгликоль (например, ПЭГ 200, ПЭГ 400, ПЭГ 1000, ПЭГ 2000), пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое, арахисовое, кукурузное, масло из ростков, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофурфуриловый спирт, витамин Е-полиэтиленгликоля сукцинат (d-альфа-токоферолполиэтиленгликоля 1000 сукцинат), полиэтиленгликоли и сложные эфиры жирных кислот и сорбитана и их смеси. Кроме инертных разбавителей пероральные композиции также могут содержать адъюванты, такие как смачивающие агенты, эмульгирующие и суспендирующие агенты, подсластители, ароматизаторы и отдушки. Жидкие формы, представленные выше, также могут быть помещены в мягкую или твердую капсулы с получением твердой лекарственной формы. Подходящие капсулы могут быть получены из, например, желатина, крахмала и производных целлюлозы (например, гидроксицеллюлозы, гидропропилметилцеллюлозы).
[00183] Инъецируемые препараты, например стерильные инъецируемые водные или масляные суспензии могут быть приготовлены согласно известным способам с применением подходящих разрыхляющих или смачивающих агентов и суспендирующих агентов. Стерильный инъецируемый препарат может также представлять собой стерильный инъецируемый раствор, суспензию или эмульсию в нетоксичном приемлемом для парентерального введения разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. К приемлемым носителям и растворителям, которые могут быть использованы, относятся, среди прочих, вода, раствор Рингера согласно Фармакопее США и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды обычно используют стерильные нелетучие масла. С этой целью может быть использовано любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, для получения инъецируемых препаратов применяют жирные кислоты, такие как олеиновая кислота.
[00184] Инъецируемые составы могут быть стерилизованы, например, путем фильтрования через фильтр, удерживающий бактерии, или путем включения стерилизующих агентов в форме стерильных твердых композиций, которые перед применением могут быть растворены или диспергированы в стерильной воде или другой стерильной инъецируемой среде.
[00185] Для того чтобы продлить действие Соединения 2 согласно настоящему изобретению, часто желательно замедлить всасывание соединения, введенного путем подкожной или внутримышечной инъекции. Это может быть достигнуто путем применения жидкой суспензии кристаллического или аморфного материала с плохой растворимостью в воде. Скорость всасывания соединения, таким образом, зависит от скорости его растворения, которая, в свою очередь, может зависеть от размера кристаллов и кристаллической формы. Кроме того, замедленное всасывание парентерально вводимой формы соединения достигается путем растворения или суспендирования соединения в масляном носителе. Инъецируемые депо-формы изготавливают путем получения микроинкапсулированных матриц соединения в биоразлагаемых полимерах, таких как полилактид-полигликолид. В зависимости от отношения соединения к полимеру и природы конкретного используемого полимера, регулируют скорость высвобождения соединения. Примеры других биоразлагаемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Инъецируемые депо-составы также получают путем включения соединения в липосомы или микроэмульсии, которые совместимы с тканями организма.
[00186] Композиции для ректального или вагинального введения предпочтительно представляют собой суппозитории, которые могут быть получены путем смешивания Соединения 2 согласно изобретению с подходящими нераздражающими вспомогательными веществами или носителями, такими как какао-масло, полиэтиленгликоль или воск для суппозиториев, которые являются твердыми при температуре окружающей среды, но жидкими при температуре тела и поэтому плавятся в прямой кишке или вагинальной полости и высвобождают активное соединение.
[00187] Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах Соединение 2 смешано по меньшей мере с одним инертным, фармацевтически приемлемым вспомогательным веществом или носителем, таким как цитрат натрия, авицел, гидроксипропилцеллюлоза или дикальцийфосфат, и/или а) наполнителями или увеличителями объема, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота, b) связующими веществами, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон (ПВП), сахароза, ПВП-винилацетат и гуаровая камедь, с) увлажнителями, такими как глицерин, d) дезинтегрирующими агентами, такими как агар-агар, карбонат кальция, картофельный крахмал или крахмал из тапиоки, альгиновая кислота, некоторые силикаты, кроскармеллоза натрия и карбонат натрия, е) замедляющими растворение агентами, такими как парафин, f) ускорителями всасывания, такими как четвертичные аммониевые соединения, g) смачивающими агентами, такими как, например, цетиловый спирт и моностеарат глицерина, h) абсорбентами, такими как каолин и бентонитовая глина, i) смазывающими веществами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия, j) солюбилизирующими агентами, такими как витамин Е - полиэтиленгликоля сукцинат (d-альфа-токоферолполиэтиленгликоля 1000 сукцинат), стеариновая кислота и их смеси. В случае капсул, таблеток и пилюль лекарственная форма также может содержать буферные агенты.
[00188] Твердые композиции подобного типа могут также быть использованы в качестве наполнителей для мягких и твердых заполненных капсул, используя такие вспомогательные вещества, как лактоза или молочный сахар, а также полиэтиленгликоли с высокой молекулярной массой и тому подобное. Твердые лекарственные формы: таблетки, драже, капсулы, пилюли и гранулы - могут быть получены с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие покрытия, хорошо известные в области получения фармацевтических препаратов. Они могут необязательно содержать замутнители и также могут представлять собой композицию, из которой активный(ые) ингредиент(ы) высвобождает(ют)ся исключительно или предпочтительно в определенной части кишечного тракта, необязательно, замедленным образом. Примеры вспомогательных веществ для заливки, которые могут быть использованы, включают полимерные вещества и воски. Твердые композиции подобного типа могут также быть использованы в качестве наполнителей в мягких и твердых заполненных капсулах, в которых использованы такие вспомогательные вещества, как лактоза или молочный сахар, а также полиэтиленгликоли с высокой молекулярной массой и тому подобное.
[00189] Соединение 2 также может быть представлено в форме микрокапсул с одним или более вспомогательных веществ, как отмечалось выше. Твердые лекарственные формы: таблетки, драже, капсулы, пилюли и гранулы - могут быть получены с покрытиями и оболочками, такими как косметические покрытия, энтеросолюбильные покрытия, покрытия, регулирующие высвобождение, и другие покрытия, хорошо известные в области получения фармацевтических препаратов. В таких твердых лекарственных формах активное соединение может быть смешано по меньшей мере с одним инертным разбавителем, таким как полимер, сахароза, лактоза или крахмал. Такие лекарственные формы могут также включать, как в обычной практике, дополнительные вещества, отличные от инертных разбавителей, например смазывающие вещества и другие средства для таблетирования, такие как стеарат магния и микрокристаллическая целлюлоза. В случае капсул, таблеток и пилюль, лекарственные формы могут также содержать буферные агенты. Они могут необязательно содержать замутнители и также могут представлять собой композицию, из которой активный(ые) ингредиент(ы) высвобождает(ют)ся исключительно или предпочтительно в определенной части кишечного тракта, необязательно, замедленным образом. Примеры вспомогательных веществ для заливки, которые могут быть использованы, включают полимерные вещества и воски.
[00190] Лекарственные формы для местного или трансдермального введения Соединения 2 включают мази, пасты, кремы, лосьоны, гели, порошки, растворы, спреи, формы для ингаляций или пластыри. Активный компонент смешивают в стерильных условиях с фармацевтически приемлемым носителем и любыми необходимыми консервантами или буферами, которые могут потребоваться. Состав для глаз, ушные капли и глазные капли, так же, как предполагается, входят в объем настоящего изобретения. Кроме того, в настоящем изобретении предполагается применение трансдермальных пластырей, которые имеют дополнительное преимущество, заключающееся в обеспечении регулируемой доставки соединения в организм. Такие лекарственные формы могут быть получены путем растворения или диспергирования соединения в соответствующей среде. Также могут быть использованы усилители всасывания для увеличения потока соединения через кожу. Скорость можно регулировать либо путем обеспечения регулирующей скорость мембраны, либо путем диспергирования соединения в полимерной матрице или геле.
[00191] Согласно одному из вариантов реализации настоящее изобретение относится к способу ингибирования активности протеинкиназы в биологическом образце, включающему стадию приведения указанного биологического образца в контакт с Соединением 2 или композицией, содержащей указанное соединение.
[00192] Согласно другому варианту реализации настоящее изобретение относится к способу ингибирования активности по меньшей мере одного мутанта EGFR (например, делеционной мутации, активирующей мутации, устойчивых мутаций или их комбинации) в биологическом образце, включающему стадию приведения указанного биологического образца в контакт с Соединением 2 или композицией, содержащей указанное соединение. В некоторых вариантах реализации настоящее изобретение относится к способу необратимого ингибирования активности по меньшей мере одного мутанта EGFR (например, делеционной мутации, активирующей мутации, устойчивой мутации или их комбинации) в биологическом образце, включающий стадию приведения указанного биологического образца в контакт с Соединением 2 или композицией, содержащей заявленное соединение.
[00193] В некоторых вариантах реализации настоящего изобретения Соединение 2 селективно ингибирует в биологическом образце (а) по меньшей мере одну активирующую мутацию и (b) Т790М и (с) не действует на ДТ. В некоторых вариантах реализации настоящего изобретения по меньшей мере одна активирующая мутация представляет собой делеционную мутацию. В некоторых вариантах реализации настоящего изобретения по меньшей мере одна активирующая мутация представляет собой точечную мутацию. В некоторых вариантах реализации настоящего изобретения активирующая мутация представляет собой delE746-A750. В некоторых вариантах реализации настоящего изобретения активирующая мутация представляет собой L858R. В некоторых вариантах реализации настоящего изобретения активирующая мутация представляет собой G719S.
[00194] Используемый в настоящем документе термин «биологический образец» включает, без ограничения, клеточные культуры или экстракты из них; материал биопсии, полученный от млекопитающего, или экстракты из него; и кровь, слюну, мочу, кал, сперму, слезы или другие жидкости организма или экстракты из них.
[00195] Ингибирование активности по меньшей мере одного мутанта EGFR (например, делеционной мутации, активирующей мутации, устойчивой мутации или их комбинации) в биологическом образце является ценным для различных целей, которые известны специалистам в данной области техники. Примеры таких целей включают, но не ограничиваются ими, переливание крови, трансплантация органов, хранение биологических образцов и биологические исследования.
[00196] Другой вариант реализации настоящего изобретения относится к способу ингибирования активности по меньшей мере одного мутанта EGFR (например, делеционной мутации, активирующей мутации, устойчивой мутации или их комбинации) у пациента, включающему стадию введения указанному пациенту Соединения 2 или композиции, содержащей данное соединение. В некоторых вариантах реализации настоящего изобретения предложен способ ингибирования (а) по меньшей мере одной активирующей мутации и (b) Т790М у пациента и (с) неоказания действия на ДТ, причем указанный способ включает введение указанному пациенту Соединения 2 или содержащей его композиции. В некоторых вариантах реализации настоящего изобретения по меньшей мере одна активирующая мутация представляет собой делеционную мутацию. В некоторых вариантах реализации настоящего изобретения по меньшей мере одна активирующая мутация представляет собой точечную мутацию. В некоторых вариантах реализации настоящего изобретения предложен способ ингибирования по меньшей мере одного мутанта EGFR у пациента, при этом активирующая мутация представляет собой delE746-A750. В некоторых вариантах реализации настоящего изобретения предложен способ ингибирования по меньшей мере одного мутанта EGFR у пациента, при этом активирующая мутация представляет собой L858R. В некоторых вариантах реализации настоящего изобретения предложен способ ингибирования по меньшей мере одного мутанта EGFR у пациента, при этом активирующая мутация представляет собой G719S.
[00197] Согласно другому варианту реализации, настоящее изобретение относится к способу ингибирования активности по меньшей мере одного мутанта EGFR (например, делеционной мутации, активирующей мутации, устойчивой мутации или их комбинации) у пациента, включающему стадию введения указанному пациенту Соединения 2 или композиции, содержащей указанное соединение. Согласно некоторым вариантам реализации, настоящее изобретение относится к способу ингибирования активности по меньшей мере одного мутанта EGFR (например, делеционной мутации, активирующей мутации, устойчивой мутации или их комбинации) у пациента, включающему введение указанному пациенту Соединения 2 или композиции, содержащей указанное соединение. В некоторых вариантах реализации настоящего изобретения предложен способ необратимого ингибирования (а) по меньшей мере одной активирующей мутации и (b) Т790М у пациента и (с) неоказания действия на ДТ, причем указанный способ включает введение указанному пациенту Соединения 2 или содержащей его композиции. В некоторых вариантах реализации настоящего изобретения необратимо ингибированная по меньшей мере одна активирующая мутация представляет собой делеционную мутацию. В некоторых вариантах реализации настоящего изобретения необратимо ингибированная по меньшей мере одна активирующая мутация представляет собой точечную мутацию. В некоторых вариантах реализации настоящего изобретения предложен способ необратимого ингибирования по меньшей мере одного мутанта EGFR у пациента, в котором активирующая мутация представляет собой delE746-A750. В некоторых вариантах реализации настоящего изобретения предложен способ необратимого ингибирования по меньшей мере одного мутанта EGFR у пациента, в котором активирующая мутация представляет собой L858R. В некоторых вариантах реализации настоящего изобретения предложен способ необратимого ингибирования по меньшей мере одного мутанта EGFR у пациента, в котором активирующая мутация представляет собой G719S.
[00198] Согласно другим вариантам реализации, в настоящем изобретении предложен способ лечения расстройства, опосредованного одним или более из по меньшей мере одного мутанта EGFR (например, делеционной мутации, активирующей мутации, устойчивой мутации или их комбинации) у нуждающегося в этом пациента, включающий стадию введения указанному пациенту Соединения 2 или содержащей его фармацевтически приемлемой композиции. Такие расстройства подробно описаны в настоящем документе.
[00199] В зависимости от конкретного состояния или заболевания, подлежащих лечению, в композициях согласно настоящему изобретению или в качестве части лечебной схемы, включающей Соединение 2, могут присутствовать дополнительные терапевтические агенты, которые обычно вводят для лечения такого состояния. В настоящем документе дополнительные терапевтические агенты, которые обычно вводят для лечения конкретного заболевания или состояния, известны как «подходящие для заболевания или состояния, подлежащего лечению».
[00200] Например, Соединение 2 или содержащую его фармацевтически приемлемую композицию вводят в комбинации с химиотерапевтическими агентами для лечения пролиферативных заболеваний и рака. Примеры известных химиотерапевтических агентов включают, среди прочих, но не ограничиваются ими, адриамицин, дексаметазон, винкристин, циклофосфамид, фторурацил, топотекан, таксол, интерфероны, производные платины, таксан (например, паклитаксел), алкалоиды барвинка (например, винбластин), антрациклины (например, доксорубицин), эпиподофиллотоксины (например, этопозид), цисплатин, ингибитор mTOR (например, рапамицин), метотрексат, актиномицин D, доластатин 10, колхицин, эметин, триметрексат, метоприн, циклоспорин, даунорубицин, тенипозид, амфотерицин, алкилирующие агенты (например, хлорамбуцил), 5-фторурацил, камптотецин, цисплатин, метронидазол и Гливек (Gleevec™). В других вариантах реализации настоящего изобретения Соединение 2 вводят в комбинации с биологической агентом, таким как Авастин или ВЕКТИБИКС (VECTIBIX).
[00201] В некоторых вариантах реализации настоящего изобретения Соединение 2 или содержащую его фармацевтически приемлемую композицию вводят в комбинации с антипролиферативным или химиотерапевтическим агентом, выбранным из любого одного или более из следующих агентов: абареликс, алдеслейкин, алемтузумаб, алитретиноин, аллопуринол, алтретамин, амифостин, анастрозол, триоксид мышьяка, аспарагиназа, азацитидин, живые бациллы Кальметта-Герена (БЦЖ), бевакузимаб, фторурацил, бексаротен, блеомицин, бортезомиб, бусульфан, калустерон, капецитабин, камптотецин, карбоплатин, кармустин, целекоксиб, цетуксимаб, хлорамбуцил, кладрибин, клофарабин, циклофосфамид, цитарабин, дактиномицин, дарбэпоэтин альфа, даунорубицин, денилейкин, дексразоксан, доцетаксел, доксорубицин (нейтральный), доксорубицина гидрохлорид, дромостанолона пропионат, эпирубицин, эпоэтин альфа, эрлотиниб, эстрамустин, этопозида фосфат, этопозид, эксеместан, филграстим, флоксуридин флударабин, фульвестрант, гефитиниб, гемцитабин, гемтузумаб, гозерелина ацетат, гистрелина ацетат, гидроксимочевину, ибритумомаб, идарубицин, ифосфамид, иматиниба мезилат, интерферон альфа-2а, интерферон альфа-2b, иринотекан, леналидомид, летрозол, лейковорин, лейпролида ацетат, левамизол, ломустин, мегестрола ацетат, мелфалан, меркаптопурин, 6-МР, месну, метотрексат, метокссален, митомицин С, митотан, митоксантрон, нандролон, неларабин, нофетумомаб, опрелвекин, оксалиплатин, паклитаксел, палифермин, памидронат, пэгадемазу, пэгаспаргазы, пэгфилграстим, пеметрексед динатрия, пентостатин, пипоброман, пликамицин, натрия порфимер, прокарбазин, хинакрин, расбуриказу, ритуксимаб, сарграмостим, сорафениб, стрептозоцин, сунитиниба малеат, тальк, тамоксифен, темозоломид, тенипозид, VM-26, тестолактон, тиогуанин, 6-TG, тиотепу, топотекан, торемифен, тозитумомаб, трастузумаб, третиноин, ATRA, урамустин, валрубицин, винбластин, винкристин, винорелбин, золедронат или золедроновую кислоту.
[00202] Другие примеры агентов, с которыми также могут быть объединены ингибиторы согласно настоящему изобретению, включают, без ограничения: агенты для лечения болезни Альцгеймера, такие как донепезила гидрохлорид (Арисепт (Aricept®)) и ривастигмина (Экселон (Exelon®)); агенты для лечения болезни Паркинсона, такие как L-ДОПА/карбидопа, энтакапон, ропинрол, прамипексол, бромокриптин, перголид, тригексефендил и амантадин; агенты для лечения рассеянного склероза (PC), такие как бета-интерферон (например, Авонекс (Avonex®) и Ребиф (Rebif®)), глатиромера ацетат (Копаксон (Copaxone®)) и митоксантрон; агенты для лечения астмы, такие как альбутерол и монтелукаст (Сингуляр (Singulair®)); агенты для лечения шизофрении, такие как зипрекса, риспердал, сероквель и галоперидол; противовоспалительные агенты, такие как кортикостероиды, блокаторы фактора некроза опухоли (ФНО), ИЛ-1 RA, азатиоприн, циклофосфамид и сульфасалазин; иммуномодулирующие и иммуносупрессивные агенты, такие как циклоспорин, такролимус, рапамицин, микофенолата мофетил, интерфероны, кортикостероиды, циклофосфамид, азатиоприн и сульфасалазин; нейротрофические факторы, такие как ингибиторы ацетилхолинэстеразы, ингибиторы моноаминоксидазы (МАО), интерфероны, антиконвульсанты, блокаторы ионных каналов, рилузол и агенты против болезни Паркинсона; агенты для лечения сердечно-сосудистых заболеваний, такие как бета-блокаторы, ингибиторы ангиотензинпревращающего фермента (АПФ), диуретики, нитраты, блокаторы кальциевых каналов и статины; агенты для лечения заболеваний печени, такие как кортикостероиды, холестирамин, интерфероны и противовирусные агенты; агенты для лечения расстройств, связанных с кровью, такие как кортикостероиды, антилейкозные агенты и факторы роста; и агенты для лечения расстройств, связанных с иммунодефицитом, такие как гамма-глобулин.
[00203] В некоторых вариантах реализации настоящего изобретения Соединение 2 или содержащую его фармацевтически приемлемую композицию вводят в комбинации с моноклональным антителом или терапевтическим агентом, содержащим миРНК.
[00204] Дополнительные агенты могут быть введены отдельно от композиции, содержащей Соединение 2, как часть многократного режима дозирования. Кроме того, эти агенты могут быть частью лекарственной формы для однократного введения: их смешивают с Соединением 2 в единую композицию. Если осуществлять введение в виде части многократного режима дозирования, указанные два активных агента могут быть введены одновременно, последовательно или один после другого с перерывом в течение некоторого периода времени (например, один час, два часа, шесть часов, двенадцать часов, один день, одна неделя, две недели, один месяц).
[00205] В настоящем документе, термины «комбинация», «в комбинации» и связанные с ними термины относятся к одновременному или последовательному введению терапевтических агентов в соответствии с настоящим изобретением. Например, Соединение 2 может быть введено с другим терапевтическим агентом одновременно или последовательно в отдельных единичных лекарственных формах или совместно в единичной лекарственной форме для однократного введения. Соответственно, в настоящем изобретении предложена единичная лекарственная форма для однократного введения, содержащая Соединение 2, дополнительный терапевтический агент и фармацевтически приемлемый носитель, адъювант или среду.
[00206] Количество Соединения 2 и дополнительного терапевтического агента (в тех композициях, которые содержат дополнительный терапевтический агент, описанный выше), которые могут быть объединены с материалами-носителями для получения лекарственной формы для однократного введения, будет варьироваться в зависимости от субъекта, подвергаемого лечению, и конкретного способа введения. Предпочтительно, композиции согласно настоящему изобретению должны быть приготовлены таким образом, чтобы можно было бы ввести дозу Соединения 2 0,01-100 мг/кг массы тела/день.
[00207] В композициях, содержащих дополнительный терапевтический агент, данный дополнительный терапевтический агент и Соединение 2 могут действовать синергически. Таким образом, количество дополнительного терапевтического агента в таких композициях может быть меньше, чем требуется для монотерапии, в которой применяют только данный терапевтический агент. В таких композициях, может быть введена дозировка дополнительного терапевтического агента 0,01-1000 мкг/кг массы тела/день.
[00208] Количество дополнительного терапевтического агента, присутствующего в композициях согласно настоящему изобретению, не будет превышать количество, которое, как правило, вводили бы в виде композиции, содержащей данный терапевтический агент в качестве единственного активного агента. Предпочтительно количество дополнительного терапевтического агента в описанных в настоящем документе композициях находится в диапазоне от примерно 50% до 100% от количества, как правило, присутствующего в композиции, содержащей данный агент в качестве единственного терапевтически активного агента.
[00209] Соединение 2 или содержащие его фармацевтические композиции могут быть также включены в композиции для нанесения покрытия на имплантируемое медицинское устройство, такое как протезы, искусственные клапаны, сосудистые трансплантаты, стенты и катетеры. Сосудистые стенты, например, применяют для преодоления рестеноза (повторного сужения стенки сосуда после травмы). Однако пациенты, использующие стенты или другие имплантируемые устройства, имеют риск образования сгустков или активации тромбоцитов. Эти нежелательные эффекты могут быть предотвращены или уменьшены путем предварительного покрытия устройства фармацевтически приемлемой композицией, содержащей ингибитор киназы. Имплантируемые устройства, покрытые Соединением 2, представляют собой еще один вариант реализации настоящего изобретения.
[00210] Все признаки каждого из аспектов изобретения относятся ко всем другим аспектам с соответствующими изменениями.
[00211] Для того чтобы более полно понять описанное в настоящем документе изобретение, представлены следующие примеры. Следует понимать, что эти примеры приведены только для иллюстративных целей и их не следует рассматривать как ограничивающие данное изобретение каким-либо образом.
ПРИМЕРЫ
[00212] Как показано в приведенных ниже примерах, в некоторых иллюстративных вариантах реализации настоящего изобретения соединения получают согласно следующим общим методикам. Очевидно, что хотя приведенные общие методы отображают синтез отдельных соединений согласно настоящему изобретению, приведенные методы и другие методы, известные среднему специалисту в данной области техники, могут быть применены ко всем соединениям и подклассам и разновидностям каждого из соединений, описанных в настоящем документе.
Получение Соединения 1
[00213] Синтез Соединения 1 подробно описан в примере 3 заявки ʹ061.

[00214] В 3-горлую круглодонную колбу вместимостью 25 мл, предварительно снабженную магнитной мешалкой, рубашкой (Thermo pocket) и защитной трубкой с CaCl2, помещали N-Вос-1,3-диаминобензол (0,96 г) и н-бутанол (9,00 мл). Реакционную смесь охлаждали до 0°C. К указанной реакционной смеси по каплям добавляли 2,4-дихлор-5-трифторметилпиримидин (1,0 г) при 0°C. К полученной реакционной смеси по каплям добавляли диизопропилэтиламин (DIPEA) (0,96 мл) при 0°C, и реакционную смесь перемешивали в течение 1 ч при температуре от 0°C до 5°C. После этого реакционную смесь оставляли для нагревания до комнатной температуры. Реакционную смесь перемешивали еще в течение 4 ч при комнатной температуре. Завершение реакции контролировали посредством тонкослойной хроматографии (ТСХ) с использованием смеси гексан: этилацетат (7:3). Осажденное твердое вещество отофильтровывали и промывали 1-бутанолом (2 мл). Полученное твердое вещество сушили при пониженном давлении при 40°C в течение 1 ч. 1Н-ЯМР (ДМСО-d6, 400 МГц) δ 1,48 (S, 9 Н), 7,02 (m, 1 Н), 7,26 (т, 2 Н), 7,58 (S, 1 Н), 8,57 (S, 1 Н), 9,48 (S, 1 Н), 9,55 (S, 1 Н).
Стадия 2:
[00215] К указанному выше неочищенному твердому веществу (3,1 г) в дихлорметане (ДХМ) (25 мл) медленно добавляли трифторуксусную кислоту (ТФУ) (12,4 мл) при 0°C. Реакционной смеси позволяли нагреться до комнатной температуры. Реакционную смесь перемешивали еще в течение 10 мин при комнатной температуре. Неочищенное вещество концентрировали при пониженном давлении.
Стадия 3:
[00216] Концентрированное неочищенное вещество растворяли в DIPEA (2,0 мл) и дихлорметане (25 мл) и далее охлаждали до -30°C. К реакционной смеси медленно добавляли акрилоилхлорид (0,76 г) при -30°C. Реакционную массу нагревали до комнатной температуры в течение 1,0 ч. Ход реакции контролировали посредством ТСХ с применением смеси гексанэтилацетат (7:3) в качестве подвижной фазы. Реакция была завершена через 1 ч. На стадии 3 получали промежуточное соединение 1.
Стадия 4:
[00217] Для получения соли Соединения 1 смесь промежуточного соединения 1 (16 мг) и 2-метокси-4-(4-ацетилпиперазинил)анилина в диоксане (1,0 мл) с каталитическим количеством трифторуксусной кислоты перемешивали в течение ночи при 50°C. Полученное неочищенное вещество концентрировали при пониженном давлении и очищали посредством ВЭЖХ (ТФУ-модификатор) с получением соединения 1 в виде соли ТФУ. 1Н-ЯМР (ДМСО-d6, 400 МГц) δ 10,2 (S, 1 Н), 8,2 (ушир., 1 Н), 8,30 (S, 1 Н), 7,73 (ушир., 1 Н), 7,52 (d, J=7,8 Гц, 1 Н), 7,45 (d, J=7,8 Гц, 1 Н), 7,26 (J=8,2 Гц, 1 Н), 7,14 (be, 1 Н), 6,60 (S, 1 Н), 6,42 (dd, J=11,4, 16,9 Гц, 1 Н), 6,24 (d, J=16,9 Гц, 1 Н), 5,75 (d, J=11,4 Гц, 1 Н), 3,76 (S, 3 Н), 3,04 (ушир., 4 Н), 2,04 (S, 3 Н); расчетная масса для C27H28F3N7O3: 555,2, обнаружено: 556,2 (М+Н+).
Стадия 5:
[00218] Для получения формы свободного основания Соединения 1 из соли ТФУ данную соль добавляли к ДХМ и охлаждали до 0°C. Добавляли раствор Na2CO3 (9,6% масс/масс.) при 0°C. Смесь нагревали до 20°C и перемешивали в течение 35 мин pH водного слоя был >8. Слои разделяли. Водный слой подвергали экстракции с применением ДХМ. Органические слои объединяли и промывали солевым раствором. Органический слой собирали и упаривали с получением твердого Соединения 1.
Общая методика получения Соединения 2
[00219] Для каждого противоиона и системы растворителей приблизительно 25 или 50 мг Соединения 1 в форме свободного основания суспендировали в 200-300 мкл выбранного растворителя. Растворители включали ацетон, дихлорметан, циклогексан, этилацетат, метанол (метилэтилкетон для противоионов, содержащих сульфоновую кислоту), метилизобутилкетон, 2-пропанол (изопропилацетат для противоионов, содержащих сульфоновую кислоту), тетрагидрофуран и смесь ацетонитрил: вода (90:10). Соответствующий противоион также растворяли/суспендировали в 200-300 мкл выбранного растворителя. Противоионы включали бензолсульфоновую кислоту, камфорсульфоновую кислоту, 1,2-этандисульфоновую кислоту, бромоводородную кислоту, хлороводородную кислоту, малеиновую кислоту, метансульфоновую кислоту, нафталин-2-сульфоновую кислоту, 1,5-нафталиндисульфоновую кислоту, щавелевую кислоту, 4-толуолсульфоновой кислоты и 2,4,6-тригидроксибензойную кислоту. Использовали один эквивалент каждого противоиона, а также проводили дополнительные эксперименты с двумя эквивалентами бензолсульфоновой кислоты, хлороводородной кислоты, серной кислоты и п-толуолсульфоновой кислоты. Раствор/суспензию кислоты добавляли к суспензии Соединения 1 в малых аликвотах, чтобы минимизировать риск разложения. pH реакционной смеси контролировали с помощью универсальной индикаторной бумаги.
[00220] Смеси Соединения 1/противоиона/растворителя, полученные с применением приведенной выше методики, подвергали воздействию температурного цикла от приблизительно 0°C до температуры окружающей среды (приблизительно 22°C) при перемешивании в циклах по 1 часу в течение периода, составляющего 1-2 суток. Ночью образцы выдерживали приблизительно при 2-5°C. Смеси контролировали визуально на наличие очевидных признаков разложения (то есть изменений цвета) и затем, если не было визуальных признаков разложения, все присутствующие твердые вещества выделяли и позволяли им высохнуть при условиях окружающей среды перед анализом. Полученные твердые вещества представляли собой выделенное Соединение 2.
Общие методики
[00221] Растворимость возможных солей исследовали с применением метода со встряхиваемой колбой, в котором суспензию каждой соли готовили в деионизованной воде и pH реакционной смеси снижали до значения, меньшего 2, путем добавления малого количества противоиона, использованного для получения соли. pH определяли с помощью универсальной индикаторной бумаги. Приблизительно через 24 часа встряхивания суспензии отфильтровывали для определения растворимости посредством анализа ВЭЖХ.
[00222] Рентгеновская порошковая дифракция. Анализ посредством рентгеновской порошковой дифракции (XRPD) проводили на приборе Siemens D5000, сканируя образцы при значениях °2θ от 3 до 30, 35 или 50°2θ. Для образцов <100 мг, приблизительно 5-10 мг образца аккуратно прессовали на предметном стекле, которое вставляется в держатель образца. Для образцов >100 мг приблизительно 100 мг образца аккуратно прессовали на пластиковом держателе образца таким образом, что поверхность образца была гладкой и была немного выше уровня держателя образца. Измерения проводили при следующих условиях эксперимента:
|
[00223] Поляризационная микроскопия. В поляризационной микроскопии (микроскопии в поляризованном свете МПС), наличие кристалличности (двулучепреломления) определяли с помощью поляризационного микроскопа Olympus ВХ50, оснащенного камерой Motic и программным обеспечением для съемки (Motic Images Plus 2.0). Все изображения были получены с помощью объектива 20х цели, если не указано иное.
[00224] Термогравиметрический анализ. Для термогравиметрического анализа (ТГА) приблизительно 5-10 мг вещества точно взвешивали в открытом алюминиевом тигле и загружали в одновременно термогравиметрический/дифференциальный термический анализатор (ТГ/ДТА) и выдерживали при комнатной температуре. Затем образец нагревали со скоростью 10°C/мин от 25°C до 300°C, и в течение этого времени снимали показания изменения массы образца, а также любых дифференциальных термических изменений (ДТА). В качестве продувочного газа использовали азот с расходом 100 см3/мин.
[00225] Дифференциальная сканирующая калориметрия. Для дифференциальной сканирующей калориметрии (ДСК) приблизительно 5-10 мг вещества взвешивали в алюминиевом тигле для ДСК и негерметично закрывали перфорированной алюминиевой крышкой. Тигель с образцом затем загружали в прибор Seiko DSC6200 (оснащенный охладителем), охлаждали и выдерживали при 25°C. После того как был получен ответ на тепловой поток, исследуемый и эталонный образцы нагревали приблизительно до 260°C-280°C при скорости сканирования 10°C/мин и контролировали полученные значения теплового потока.
[00226] Спектроскопия ядерного магнитного резонанса. Эксперименты 1Н-ЯМР проводили на приборе Bruker AV400 (частота 2Н: 400 МГц). Эксперименты с 1Н для каждого образца проводили в дейтерированном ДМСО, и каждый образец готовили в концентрации приблизительно 1 мг/мл.
[00227] Динамическая сорбция пара. Для динамической сорбции пара (ДСП), приблизительно 10-20 мг образца помещали в тигель из проволочной сетки для баланса сорбции пара и помещали в баланс динамической сорбции пара ДСП-1 компании Surface Measurment Systems. Образец подвергали воздействию профиля повышения относительной влажности (ОВ) от 20 до 90% (RH) с шагом 10%, сохраняя образец при каждой стадии до достижения стабильной массы (99,5% от массы по окончании предыдущей стадии). После завершения цикла сорбции, образец сушили по той же методике, но снижали ОВ до 0% и, наконец, возвращали обратно к исходному значению ОВ 20%. Изменение массы во время циклов сорбции/десорбции наносили на график, что позволяло определить гигроскопические свойства образца.
[00228] Инфракрасная спектроскопия. Анализ методом инфракрасной спектроскопии (ИК) проводили на спектрометре Bruker ALPHA Р. Достаточное количество вещества помещали в центр пластины спектрометра, и снимали спектры при следующих параметрах:
|
[00229] Для кулонометрического титрования методом Карла Фишера (KF) 10-15 мг твердого продукта точно взвешивали во флаконе. Твердое вещество затем вручную вводили в ячейку для титрования компактного титратора Mettler Toledo С30. Флакон снова взвешивали после добавления твердого вещества и вводили в прибор массу добавленного твердого вещества. Титрование начинали после того, как образец в ячейке был полностью растворен. Содержание воды прибор рассчитывал автоматически в процентах, и полученные данные распечатывали.
[00230] Анализ методом обращенно-фазовой градиентной высокоэффективной жидкостной хроматографии (ВЭЖХ) проводили на приборе Agilent 1100, снабженном колонкой С18, 3,0×100 мм×3,5 мкм. Определение проводили на длине волны 240 нм.
[00231] Для исследования растворения использовали баню для растворения Sotax АТ7 (устройство согласно 2й Фармакопее США (USP 2), 2й Европейской Фармакопее (ЕР 2)) с лопастями для перемешивания среды. Все исследования проводили при 37°C и скорости мешалки 100 об/мин.
Пример 1
Первичный скрининг солей
[00232] Результаты первичного скрининга солей, полученных на основании общего примера получения Соединения 2, приведены в таблице 1. В таблице 1 указаны противоион, растворитель и полученная(ые) твердая(ые) форма(ы).
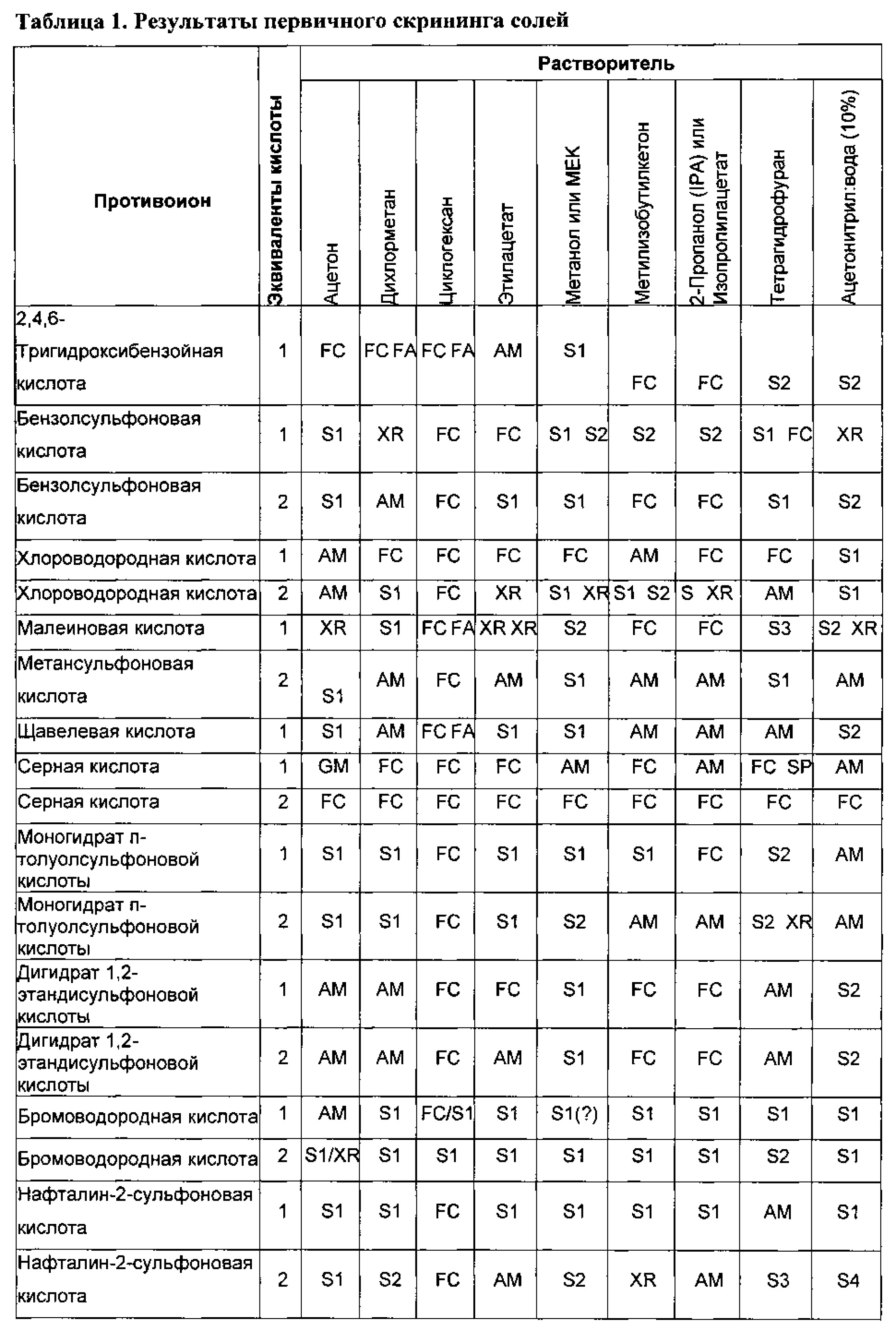
Пример 2
Первичное сканирование солей
[00233] Исследовали стабильность образцов возможных солей, полученных в процессе первичного скрининга солей в примере 1, в течение 1 недели при 40°C/относительной влажности (ОВ) 75% (открытые флаконы) и 80°C (открытые флаконы). ТГА проводили после исследований стабильности для образцов, содержащих достаточное количество вещества. Также исследовали растворимость образцов в водной среде (pH<2). Результаты исследований стабильности и растворимости приведены в таблице 2.


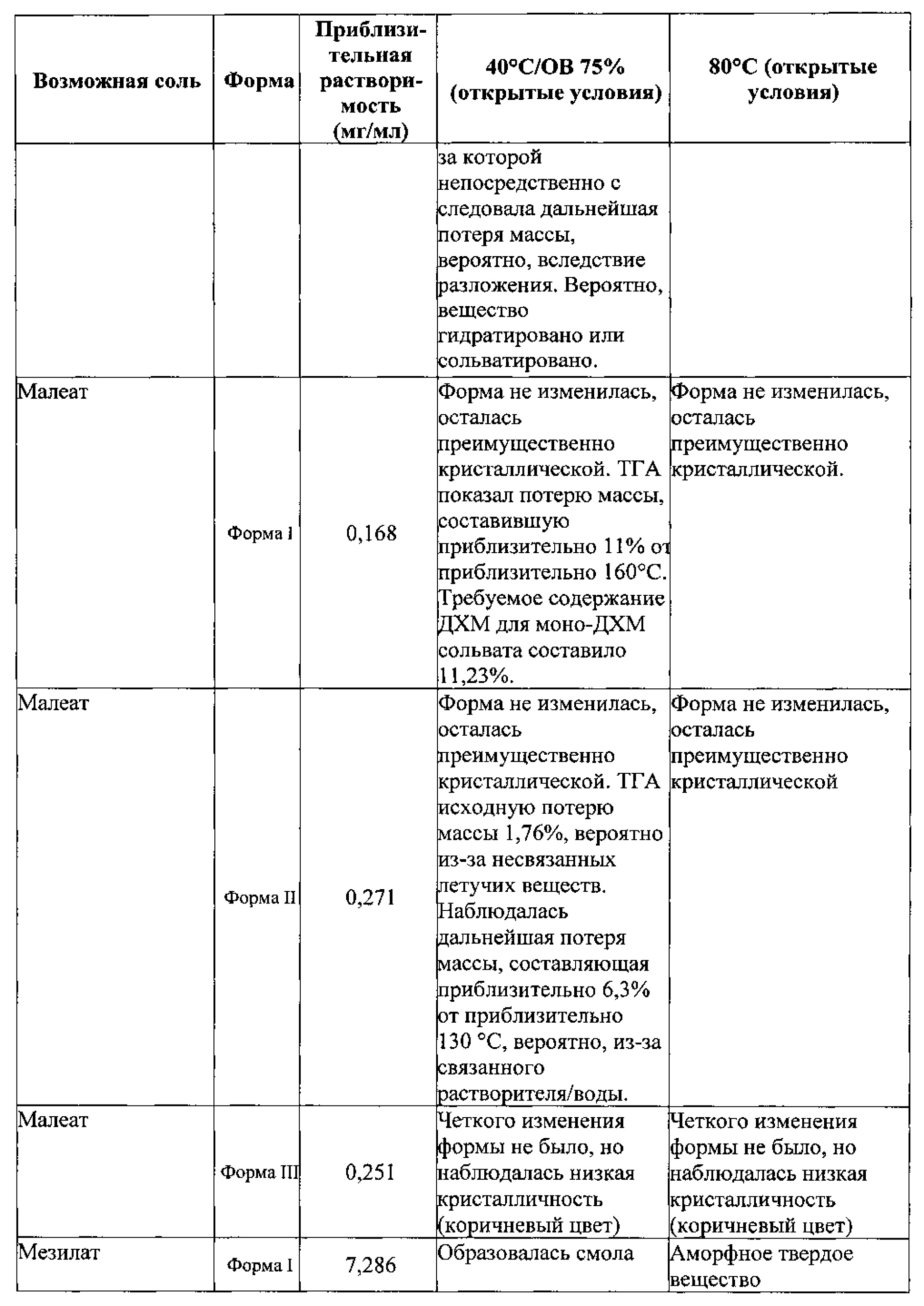
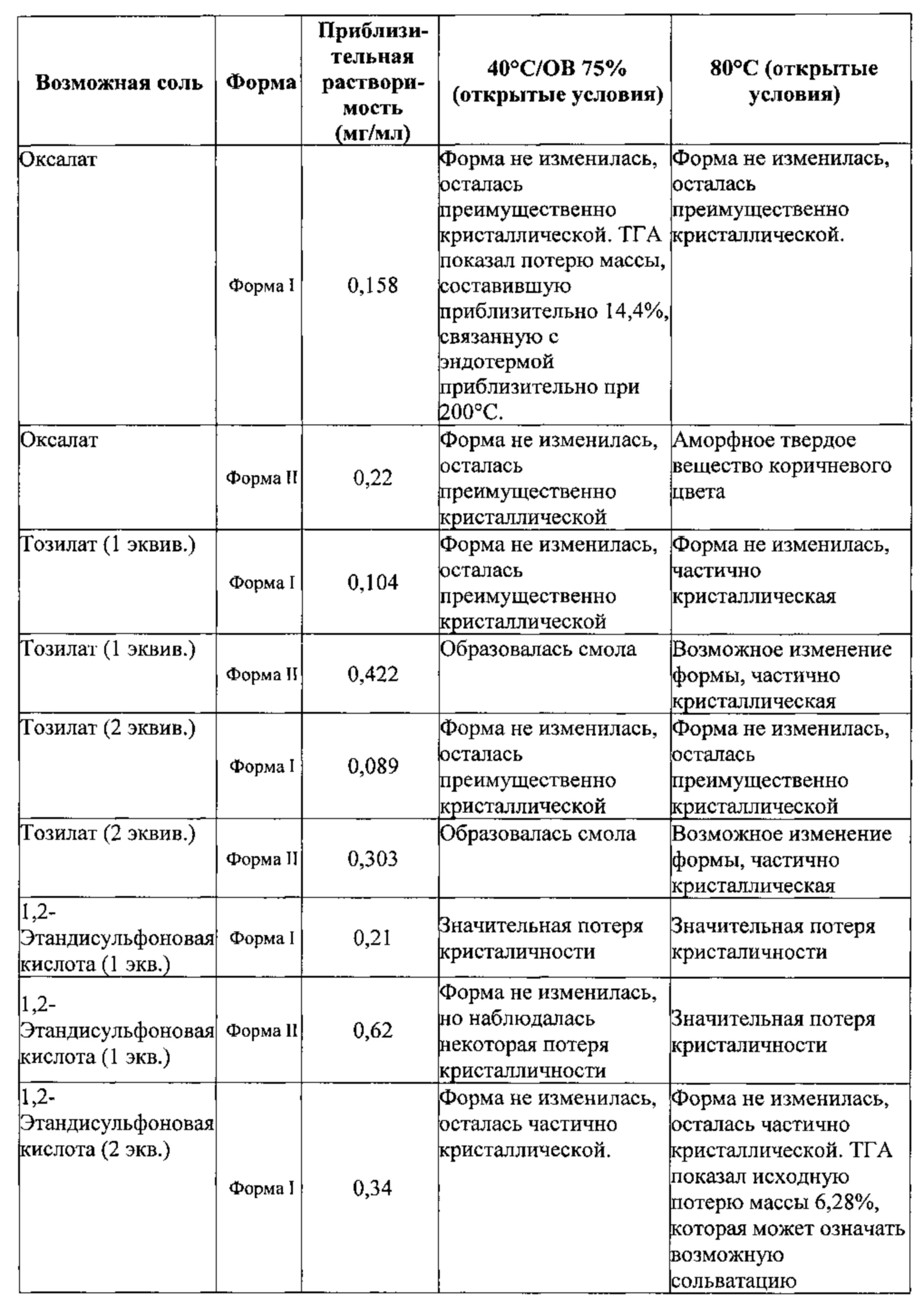
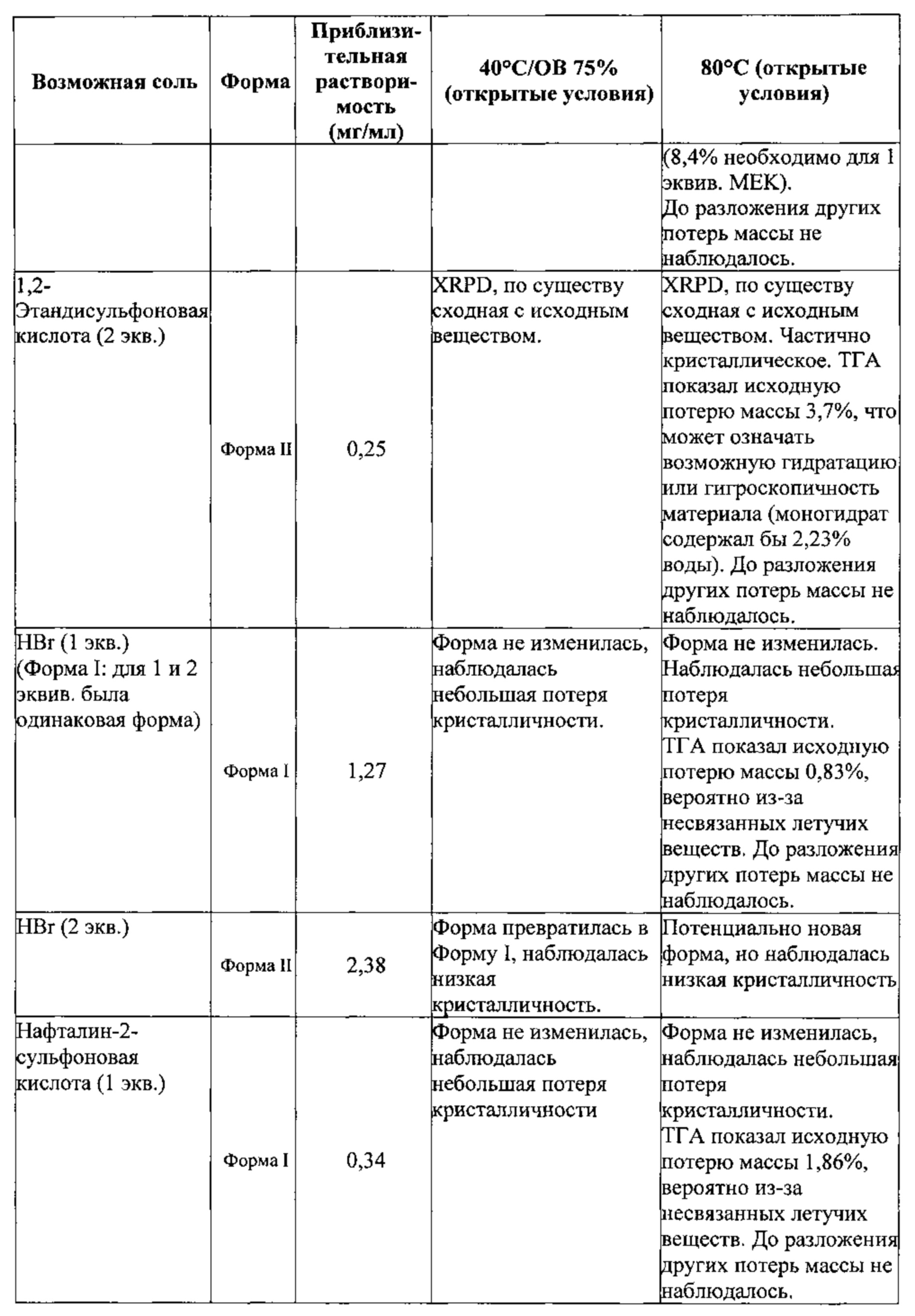
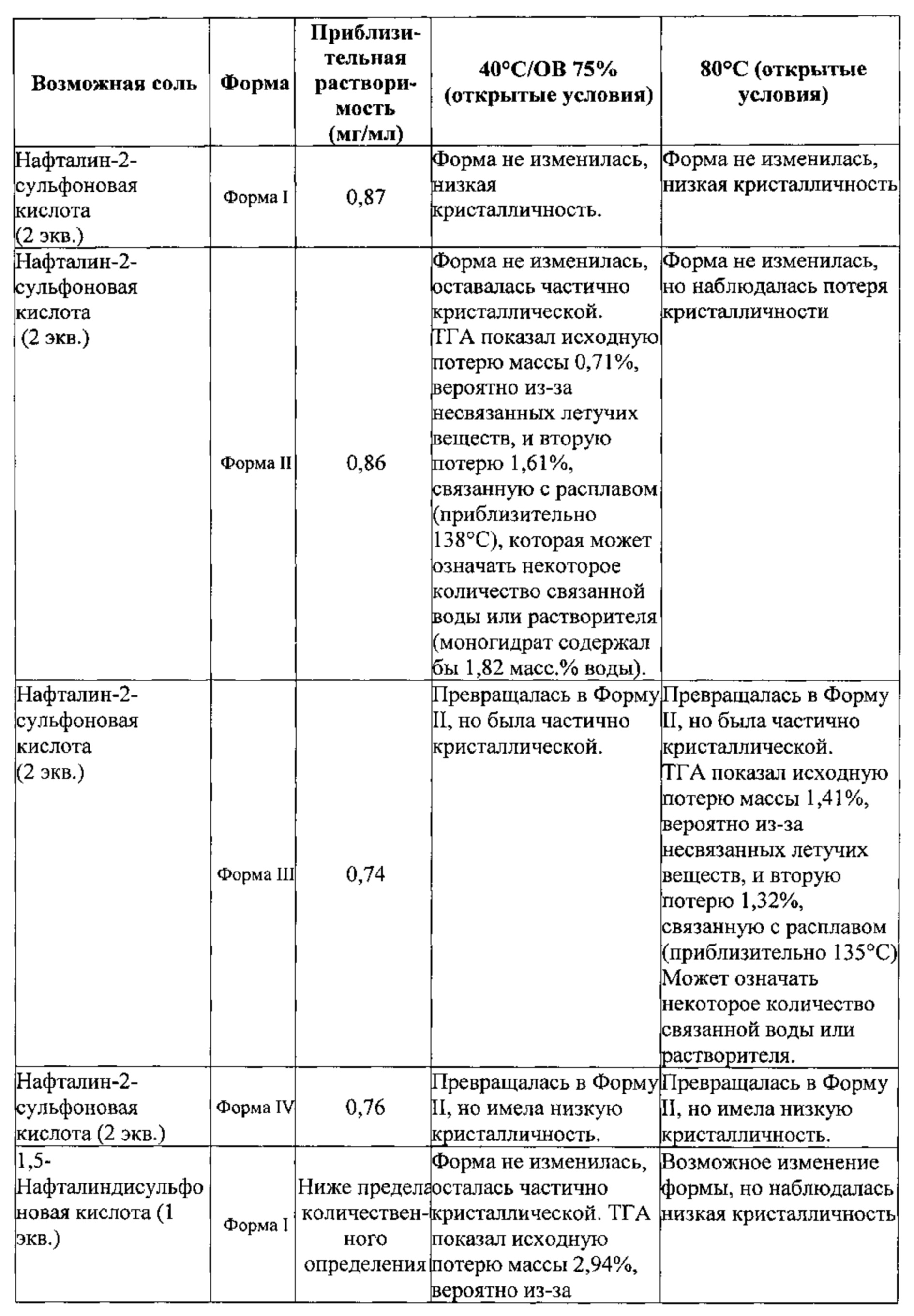
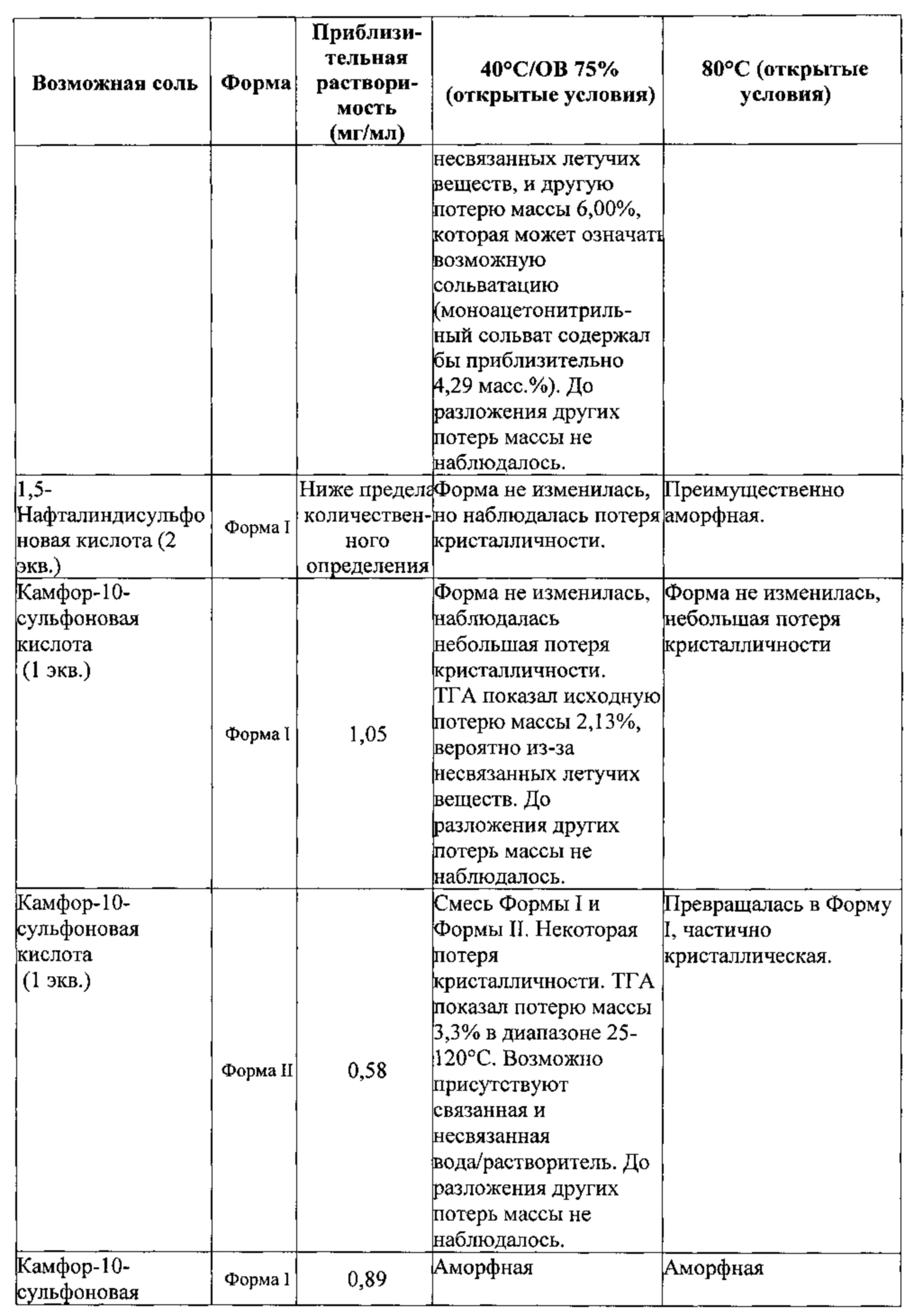

[00234] Исходя из данных результатов, бис-безилатная соль была выбрана для масштабирования ее получения с применением ацетона в качестве растворителя. Кроме того, гидробромидная соль выбрана для масштабирования ее получения с применением смеси ацетонитрил: вода (90:10) в качестве растворителя. Мономалеатная и бис-гидрохлоридная соли также были выбраны для экспериментов по масштабированию, чтобы установить, являются ли данные соли сольватированными/гидратированными.
Пример 3
Вторичный скрининг бис-безилатной соли
[00235] Приблизительно к 800 мг Соединения 1 добавляли приблизительно 5 мл ацетона с получением суспензии. В отдельном флаконе к 2 эквивалентам бензолсульфоновой кислоты добавляли приблизительно 3 мл ацетона для растворения кислоты. Далее полученный раствор кислоты при перемешивании добавляли в малых аликвотах к суспензии указанного свободного основания. После добавления всего объема кислоты сначала образовывалось смоло/масляноподобное вещество, однако приблизительно через 30 минут перемешивания оно превращалось в твердое вещество. Реакционную смесь перемешивали в течение приблизительно 1,5 суток, после чего полученное вещество выделяли и сушили. Полученное вещество сначала сушили при температуре окружающей среды (приблизительно 22°C) под вакуумом в течение 3 суток, однако на данной стадии в веществе все еще присутствовало приблизительно 6,7% ацетона. Далее часть вещества сушили в течение еще 2 суток при 40°C под вакуумом, после чего оставалось приблизительно 2,7% ацетона. Далее полученное вещество сушили в течение еще 2 суток при 60°C под вакуумом. Выход составил 1,1 г вещества (86%).
[00236] Для того чтобы определить, оказывала ли влияние лимонная кислота в буферных растворах на значения растворимости, полученные при pH 3, 4,5 и 6,6, повторяли термодинамические эксперименты по растворимости при данных значениях pH с использованием КНР/HCl для pH 3, KHP/NaOH для pH 4,5 и фосфат/NaOH для pH 6,6. Оставшиеся твердые вещества также подвергали анализу методом XRPD для установления того, происходили ли в твердой форме какие-либо изменения.
[00237] Анализ посредством XRPD (фигура 1) показал, что вещество является кристаллическим. Дифрактограмма соответствовала дифрактограммам для Формы I бис-безилатной соли в малом масштабе, полученным в процессе первичного скрининга солей.
[00238] ТГА/ДТА проводили по истечении 3 дне сушки при температуре окружающей среды под вакуумом, а также после дополнительной сушки в течение 2 суток при 40°C под вакуумом и 2 суток при 60°C под вакуумом. После сушки при температуре окружающей среды ТГА показал потерю массы 6,7% при температуре приблизительно от 50 до 150°C (фигура 2) (для сольвата ацетона 1 моль-эквивалент ацетона составлял бы приблизительно 6,3 масс. %). После дополнительной сушки ТГА показал потерю массы 0,47% от исходного значения, вероятно имеющую место из-за несвязанной влаги или растворителя. Дополнительная небольшая потеря массы 0,16% соответствовала эндотерме при исходном значении приблизительно 142°C (фигура 3).
[00239] Анализ посредством ДСК (фигура 4) показал широкую эндотерму от исходного значения, вероятно имеющую место из-за несвязанного растворителя. Присутствовала вторая эндотерма с началом приблизительно при 139,4°C (пик при 146,1°C).
[00240] Поляризационная микроскопия (не показано) показала наличие частиц с двойным лучепреломлением и нечетко определенной морфологией.
[00241] ИК-спектроскопия (фигура 5) показала ряд различий и сдвигов по сравнению со свободным основанием и бензолсульфоновой кислотой.
[00242] Спектроскопия 1Н ЯМР (фигура 6) показала, что ряд пиков Соединения 1 и бензолсульфоновой кислоты, как оказалось, перекрывается, однако стехическое отношение бензолсульфоновая кислота: Соединение 1 составляет приблизительно 2:1. Ацетон присутствует, как представляется, не в стехиометрическом количестве.
[00243] Анализ посредством ДСП (фигура 7) показал, что поглощение воды составило приблизительно 2,2% при ОВ от 20 до 70%. Различие между массой в первом цикле сорбции и десорбции и втором цикле сорбции при ОВ 20%, вероятно имеет место вследствие потерь избытка ацетона в первом цикле. Вещество также, как представляется, гидратируется в процессе анализа посредством ДСП, как показывают изменения в полиморфной формы, которые можно увидеть посредством XRPD-анализа после анализа посредством ДСП (не показано). Дифрактограмма XRPD также показала некоторую потерю кристалличности.
[00244] Кулонометрический анализ методом Карла Фишера показал содержание воды приблизительно 0,77% (Примечание: в связи с ручным введением твердого вещества в ячейку для титрования, измеренные значения ниже 1%, как правило, несколько выше, чем фактическое содержание воды).
[00245] Оценка чистоты посредством ВЭЖХ (не показана) показала чистоту, составляющую приблизительно 97,6% для бис-безилатной соли с основным пиком, выходящим при времени удерживания приблизительно 13,05 минуты.
[00246] Суспензии бис-безилатной соли готовили в смесях ацетон: вода (3%, 5% и 10%) и перемешивали при температуре окружающей среды приблизительно в течение 4 суток. Далее полученные твердые вещества подвергали анализу посредством XRPD для определения того, происходили ли в твердой форме какие-либо изменения при суспендировании. Результаты исследования гидратирования по данным анализа посредством XRPD (фигура 8) приведены в таблице 3.
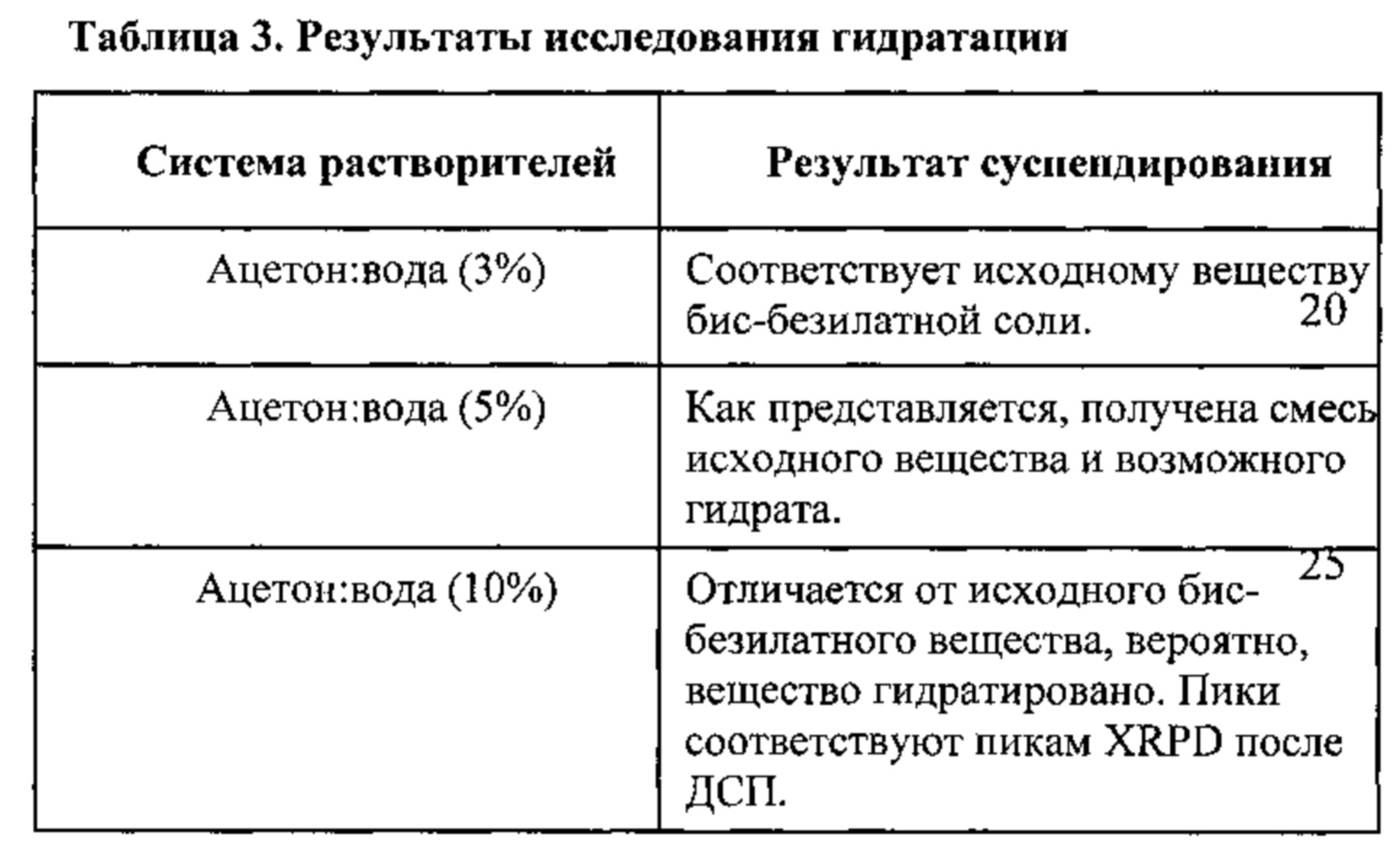
[00247] Бис-безилатную соль суспендировали в деионизованной воде при температуре окружающей среды (приблизительно 22°C). Образцы твердого вещества отбирали в 24 и 48 часа и подвергали анализу посредством XRPD. Также контролировали pH надосадочной жидкости. Результаты исследования диспропорционирования соли, по данным анализа XRPD (фигура 9), приведены в таблице 4.
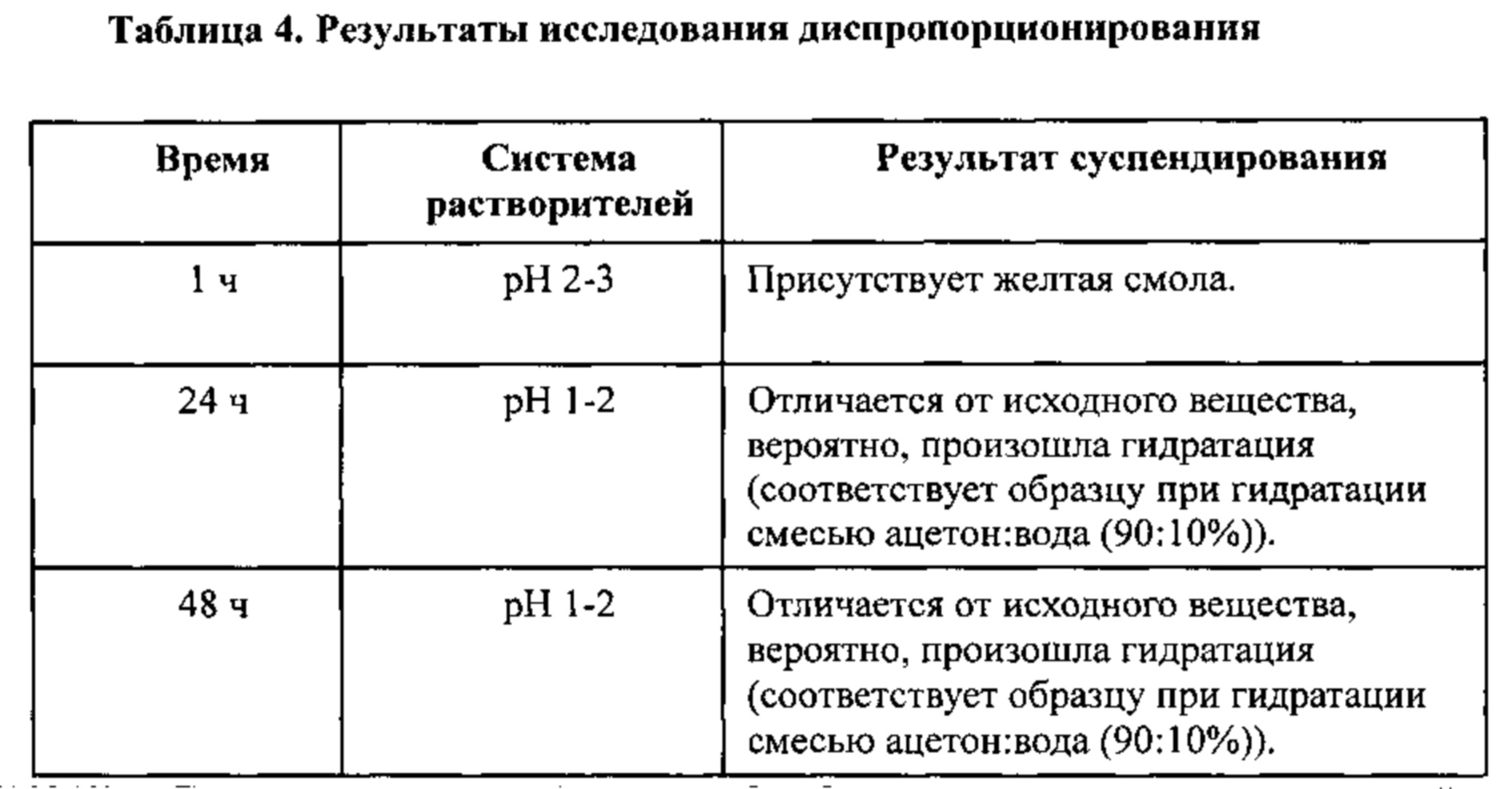
[00248] Для определения стабильности бис-безилатную соль подвергали воздействию условий 40°C/ОВ75% (относительная влажность, открытый и закрытый флаконы) и 80°C (открытый флакон) в течение 1 недели. Полученные твердые вещества подвергали анализу посредством XRPD и ВЭЖХ для установления того, происходили ли в твердой форме какие-либо изменения. Результаты исследования стабильности в течение 1 недели, по данным анализа посредством XRPD (фигура 10) и анализа посредством ВЭЖХ (не показан), при 40°C/ОВ 75% с использованием открытого и закрытого флакона и 80°C с использованием открытого флакона приведены в таблице 5.

[00249] Получали суспензии бис-безилатной соли в средах с различным pH (pH 1; pH 3; pH 4,5 и pH 6,6) и перемешивали встряхиванием в течение приблизительно 24 часов. Через 24 часа суспензии фильтровали, и раствор подвергали анализу посредством ВЭЖХ для определения растворимости при различных уровнях pH. Оставшиеся твердые вещества также подвергали анализу посредством XRPD-анализа для установления того, происходили ли какие-либо изменения в твердой форме. Для приготовления буферных растворов использовали KCl/HCl для получения pH 1 и комбинации цитрат/фосфат для получения pH 3, 4,5 и 6,6. Термодинамические исследования растворимости показали результаты, приведенные в таблице 6.
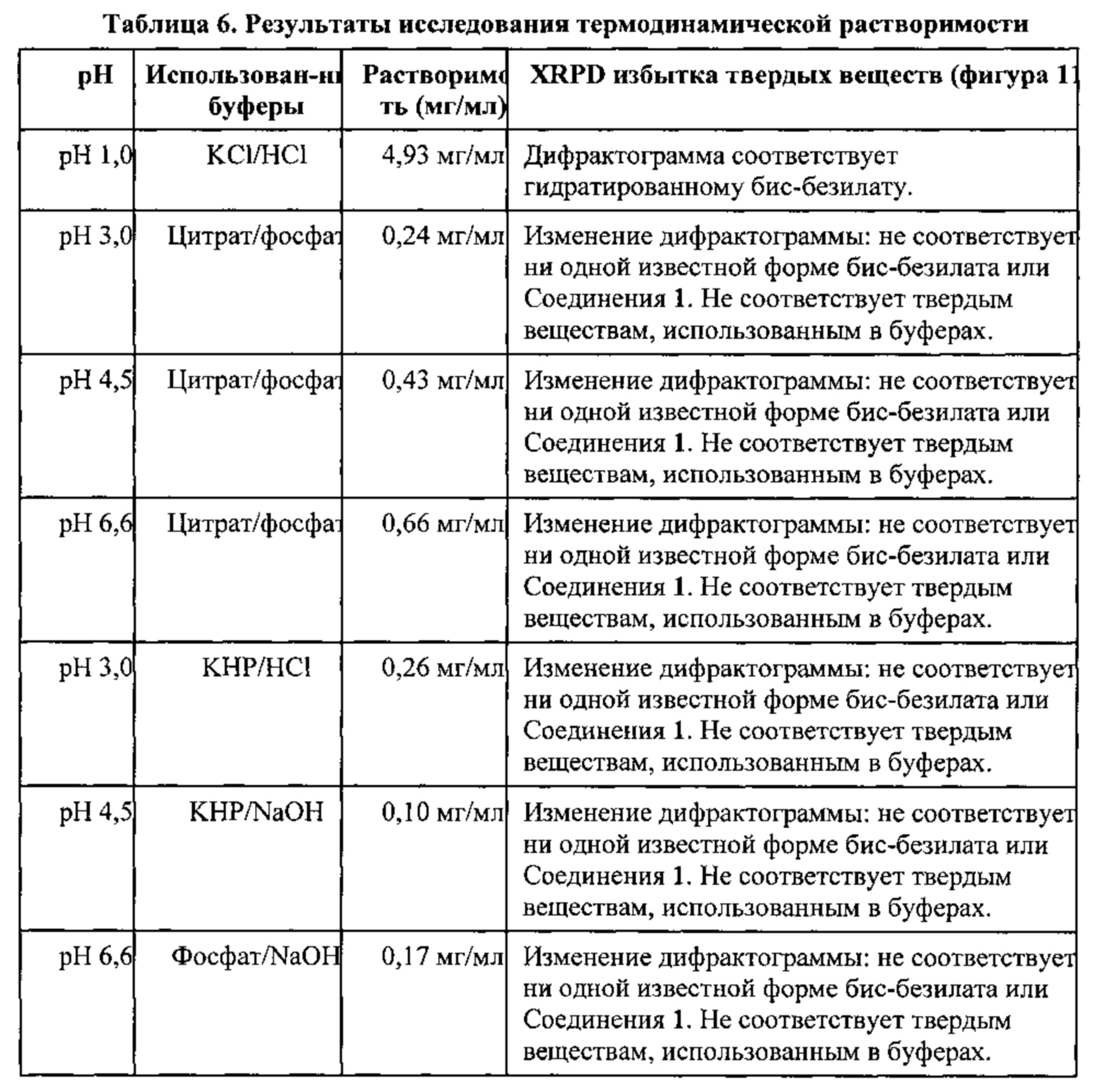
[00250] При первоначальной подготовке суспензий для термодинамического определения растворимости были получены смолы для всех используемых pH сред, однако, при перемешивании встряхиванием, указанные смолы превращались в твердые вещества приблизительно через 2 часа. XRPD-анализ избытка твердого вещества из суспензий после экспериментов по растворимости, показал, что при pH 1 в процессе суспендирования образовывались гидраты бис-безилатной соли. Таким образом, полученная величина растворимости, вероятно, свидетельствует о растворимости гидратированного материала. Дифрактограммы для остальных образцов отличаются от дифрактограммы исходного материала, а также всех идентифицированных форм бис-безилата и свободного основания Соединения 1. Дифрактограммы также отличаются от дифрактограмм для твердых веществ, используемых для приготовления буферов. Значения растворимости, полученные при использовании этих pH-буферов, вероятно, не отражают растворимость бис-безилатной соли, которую изначально помещали в растворы.
[00251] Приблизительно 100-120 мг каждой формы прессовали с получением дисков, помещая вещество в форму (диаметр 13 мм) и прессуя форму под давлением, соответствующим усилию 5 тонн, в гидравлическом прессе в течение приблизительно 2 минут. Для перемешивания сред при 100 об/мин, использовали устройство для растворения Sotax АТ7 (соответствующий ЕР 2 и USP 2), содержащий лопасти. Среды для растворения с pH 3 (1% додецилсульфат натрия) и pH 4,5 (1% додецилсульфат натрия) готовили с применением цитрат/фосфатного буфера. Все вещества исследовали в 750 мл буферной среды. Диски добавляли в момент времени 0 секунд и позволяли им осесть на дно сосуда для растворения, после чего начинали перемешивание. Приблизительно 1 мл аликвот сред извлекали из сосудов для растворения в моменты времени 1, 5, 10, 15, 30, 60, 120, 240 минут и 24 часа и определяли концентрацию растворенной соли посредством ВЭЖХ-УФ. Тесты на растворение проводили в двух повторностях. Для обеих сред, в которых проводили растворение, площади пиков в начальные моменты времени (до 15 минут) находились ниже предела количественного определения, однако на кривой зависимости скорости растворения от времени наклонная часть кривой построена и при данных ранних моментах времени.
[00252] Для pH 4,5 на кривой зависимости скорости растворения от времени (фигура 12) истинные значения растворения, полученные в ранние моменты времени на кривой (наклонная часть кривой), составили приблизительно 0,61 мг/см2/мин для обеих таблеток 1 и 2. В более поздние моменты времени для таблеток 1 и 2 были получены истинные значения растворения, составляющие 0,09 мг/см2/мин и 0,08 мг/см2/мин соответственно.
[00253] Для pH 3,0 на кривой зависимости скорости растворения от времени (фигура 13) истинные значения растворения, полученные в ранние моменты времени на кривой (наклонная часть кривой), составили приблизительно 0,36 мг/см2/мин для таблетки 1 и 0,38 мг/см2/мин для таблетки 2. В более поздние моменты времени для таблеток 1 и 2 были получены истинные значения растворения 0,08 мг/см2/мин и 0,07 мг/см2/мин соответственно.
Пример 4
Вторичный скрининг гидрата бис-безилатной соли
[00254] Приблизительно к 500 мг Соединения 1 добавляли приблизительно 3 мл ацетона с получением суспензии. В отдельном флаконе к 2 эквивалентам бензолсульфоновой кислоты добавляли приблизительно 1 мл ацетона для растворения кислоты. Затем полученный раствор кислоты в малых аликвотах добавляли к суспензии свободного основания при перемешивании. Реакционную смесь перемешивали в течение приблизительно 1 суток, при этом температурный цикл составил от 0°C до температуры окружающей среды (приблизительно 22°C). Через 1 сутки к реакционной смеси добавляли деионизованную воду и оставляли суспензию перемешиваться в течение приблизительно 3 часов, после чего полученное вещество выделяли и сушили под вакуумом.
[00255] Анализ посредством XRPD (фигура 14) показал, что полученное вещество является кристаллическим. Дифрактограмма соответствует гидрату бис-безилата, полученному в исследованиях гидратирования бис-безилатной соли.
[00256] ТГА/ДТА показал потерю массы приблизительно 2,1% при температуре приблизительно от 70 до 100°C (фигура 15). Это соотносится с количеством воды приблизительно 2,03 масс. %, требуемым для образования моногидрата. Приблизительно 2,2% потери массы наблюдалось при нагревании от конечной температуры до приблизительно 70°C, вероятно из-за несвязанной воды. Несмотря на то, что общая потеря массы приблизительно 4,2% соответствует примерно дигидрату, первая потеря массы, возникающая при конечной температуре, с последующей второй четкой потерей массы соответствует моноколичеству воды. Поскольку первая потеря массы возникает приблизительно при 25°C, вероятно, она имеет место из-за несвязанной воды.
[00257] Анализ посредством ДСК показал широкую эндотерму при температуре приблизительно от 40 до 115°C. Также присутствовали две другие эндотермы с началом 119,7°C (пик при 134,3°C) и началом 153,8°C (пик при 165,1°C) (фигура 16).
[00258] Анализ посредством МПС показал некоторое двойное лучепреломление, однако размер частиц был слишком мал, и нельзя было увидеть четкую морфологию (не показано). Анализ посредством высокотемпературной микроскопии проводили на образце гидрата бис-безилата. До плавления вещества и его разложения (цвет вещества становился коричневым) приблизительно при 160°C визуальных изменений не наблюдалось.
[00259] ИК-анализ (фигура 17) показал различия между спектрами свободного основания и бензолсульфоновой кислоты, а также некоторые различия при сравнении спектров исходной бис-безилатной соли со спектром ее гидратированной формы.
[00260] Спектроскопия 1Н ЯМР (фигура 18) показала, что ряд пиков Соединения 1 и бензолсульфоновой кислоты, как оказалось, перекрывается, однако стехиометрическое соотношение бензолсульфоновая кислота: Соединение 1 составляет приблизительно 2:1. Спектр показал присутствие небольшого количества ацетона.
[00261] Анализ посредством ДСП (фигура 19) показал, что поглощение воды составило приблизительно 1,3% при ОВ от 20 до 70%. Между циклами сорбции и десорбции гистерезиса не наблюдалось. Дифрактограмма XRPD вещества после анализа посредством ДСП соответствовала дифрактограмме исходного вещества гидрата бис-безилата (не показано).
[00262] Данные по стабильности в течение 1 недели при 40°C/ОВ 75% (открытая емкость) показали что, по результатам XRPD, вещество оставалось соответствующим исходному материалу, и изменений полиморфной формы не наблюдалось (фигура 20).
[00263] Оценка чистоты посредством ВЭЖХ показала, что исходная чистота составляла приблизительно 98,4%, а чистота после выдерживания в течение 1 недели при 40°C/ОВ 75% составляла приблизительно 98,3%.
[00264] Термодинамические исследования стабильности гидрата бис-безилата показали результаты, приведенные в таблице 7.

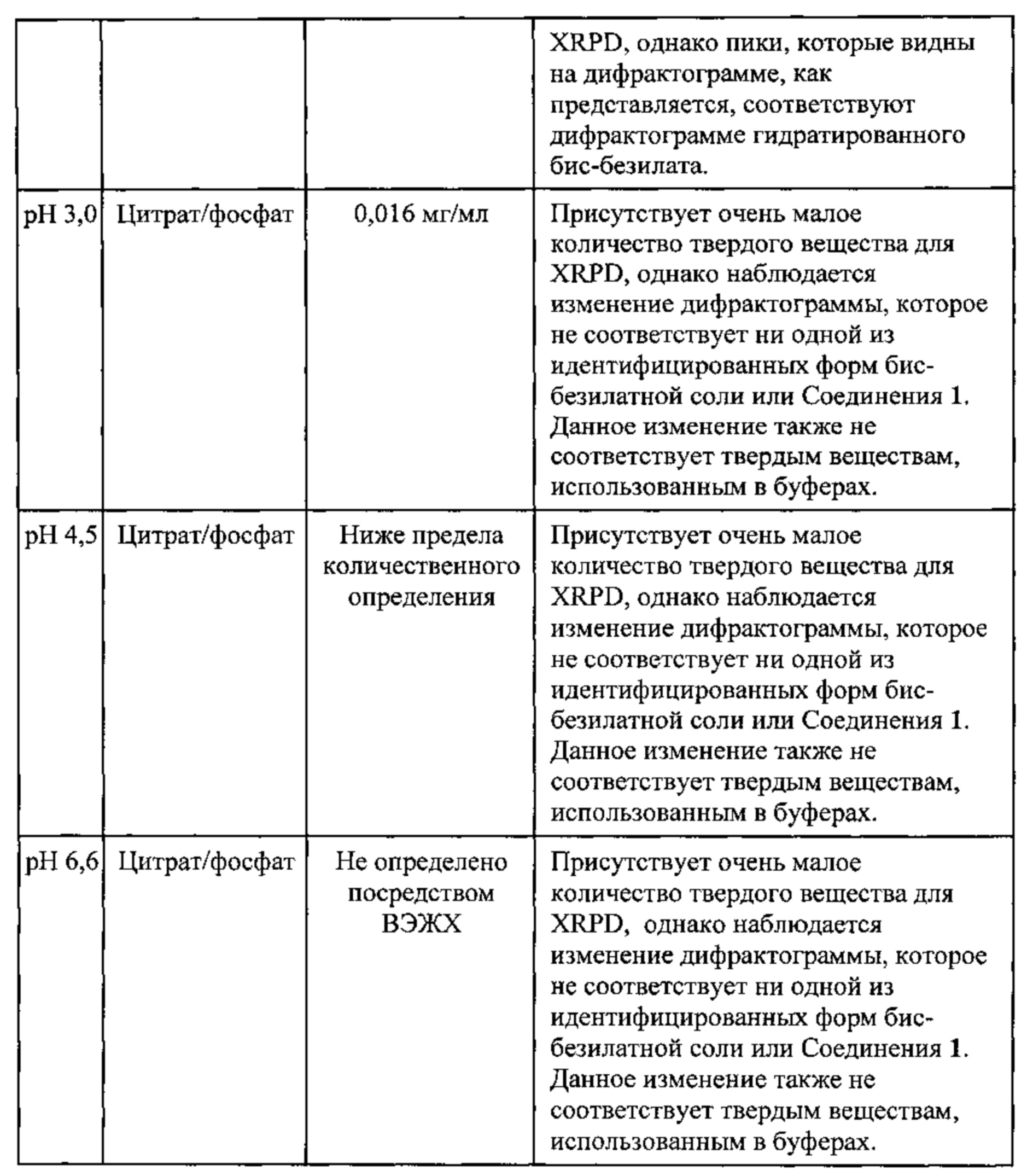
[00265] Тесты на истинную растворимость также проводили при pH 4,5 (1% ДСН) и pH 3,0 (1% ДСН). Для обеих сред, в которых проводили растворение, площади пиков в начальные моменты времени (до 15 минут), находились ниже предела количественного определения, однако на кривой зависимости скорости растворения от времени наклонная часть кривой построена и при данных ранних моментах времени. Для pH 4,5 на кривой зависимости скорости растворения от времени (фигура 22) истинные значения растворения, полученные в ранние моменты времени на кривой (наклонная часть кривой), составили приблизительно 0,43 мг/см2/мин для таблетки 1 и 0,44 мг/см2/мин для таблетки 2. В более поздние моменты времени (до окончания исследования растворения) для таблеток 1 и 2 были получены истинные значения растворения, составляющие 0,012 мг/см2/мин и 0,006 мг/см2/мин соответственно.
[00266] Для pH 3,0 на кривой зависимости скорости растворения от времени (фигура 23) истинные значения растворения, полученные в ранние моменты времени на кривой (наклонная часть кривой), составили приблизительно 0,38 мг/см2/мин для таблетки 1 и 0,39 мг/см2/мин для таблетки 2. В более поздние моменты времени для обеих таблеток 1 и 2 были получены истинные значения растворения 0,01 мг/см2/мин.
[00267] Большую партию гидрата бис-безилатной соли готовили согласно следующей методике. В круглодонной колбе приблизительно к 14 г Соединения 1 добавляли приблизительно 20 мл ацетона с получением суспензии. В отдельной колбе к 2 эквивалентам бензолсульфоновой кислоты добавляли приблизительно 10 мл ацетона для растворения кислоты. Далее полученный раствор кислоты добавляли в малых аликвотах к суспензии указанного свободного основания при перемешивании приблизительно при 0°C. Полученную суспензию оставляли перемешиваться при температуре окружающей среды в течение приблизительно 2 часов. Далее ее помещали в условия приблизительно 5°C на 2 суток, а затем перемешивали еще 3 часа при температуре окружающей среды. Далее удаляли ацетон и к полученному веществу добавляли приблизительно 20 мл воды. Полученную суспензию подвергали температурному циклу (0°C - температура окружающей среды (приблизительно 22°C)) в циклах по 2 часа в течение приблизительно 1 суток. Далее полученное твердое вещество выделяли посредством фильтрования и давали ему высохнуть при условиях окружающей среды под вакуумом, а затем подвергали анализу. Сушку продолжали в течение 10 суток.
[00268] Свойства вещества из данной большей партии были сходными с описанными выше. Кроме описанных выше свойств, было отмечено, что когда гидрат бис-безилата оставляли на 2 часа и проводили повторный ТГА, образец, по-видимому, набирал воду, что общая потеря массы в конечном ТГА составила приблизительно 4,5%. Удалить оставшиеся 2% несвязанной воды посредством сушки не представлялось возможным, поскольку вещество заново набирало воду при условиях окружающей среды. Также титрационным методом Карла Фишера было установлено, что содержание воды в веществе было приблизительно 3,97%. Несмотря на то, что приблизительно 4 масс. % воды теоретически соответствовало бы дигидрату, данная потеря массы в ТГА, как оказалось, начинается от конечной температуры, и после нее следует более четкая потеря массы, которая соответствует приблизительно 1 эквиваленты воды. Данное вещество, вероятно, демонстрирует некоторую гигроскопичность, приводящую к исходной потерей массы в ТГА.
Пример 5
Вторичный скрининг мономалеатной соли
[00269] Приблизительно к 200 мг Соединения 1 добавляли приблизительно 3 мл дихлорметана с получением суспензии. В отдельном флаконе к 1 эквиваленту малеиновой кислоты добавляли приблизительно 1 мл дихлорметана для растворения кислоты. Далее полученный раствор кислоты добавляли в малых аликвотах к суспензии указанного свободного основания при перемешивании. Полученная суспензия имела желтый цвет. Реакционную смесь перемешивали в течение приблизительно 1,5 суток при температуре от 0°C до температуры окружающей среды (приблизительно 22°C) и оставляли приблизительно при 4°C еще на 2 суток, после чего вещество выделяли и сушили при температуре окружающей среды. Полученное вещество сушили при температуре окружающей среды (приблизительно 22°C) под вакуумом в течение приблизительно 2 суток.
[00270] Анализ посредством XRPD (фигура 24) показал, что полученное вещество является кристаллическим. Дифрактограмма соответствует дифрактограмме Формы I мономалеата в малом масштабе, полученной в процессе первичного скрининга солей.
[00271] ТГА/ДТА проводили по истечении 2 дней сушки при температуре окружающей среды под вакуумом. ТГА показал потерю массы 0,4% от конечной, вероятно имеющую место из-за несвязанной влаги или растворителя. Большая (10,9%) потеря массы связана с эндотермическими/экзотермическими условиями при ДТА приблизительно от 145 до 185°C с последующей дополнительной потерей массы вследствие возможного разложения (фигура 25).
[00272] Анализ посредством ДСК показал эндотерму с началом при 160,4°C (пик при 163,8°C) и сразу же после нее экзотерму, вероятно обусловленную рекристаллизацией и затем окончательным разложением (фигура 26).
[00273] Спектроскопия *Н ЯМР (фигура 27) показала стехиометрическое отношение Соединение 1: малеиновая кислота приблизительно 1:1. Спектр показал отсутствие дихлорметана. Таким образом, полученная мономалеатная соль, как представляется, не является сольватированной.
Пример 6
Вторичный скрининг бис-гидрохлоридной соли (Форма I)
[00274] Приблизительно к 200 мг Соединения 1 добавляли приблизительно 1,5 мл смеси ацетонитрил: Н2О (90:10) с получением суспензии. В отдельном флаконе к 2 эквивалентам хлороводородной кислоты добавляли приблизительно 1 мл смеси ацетонитрил: H2O (90:10). Далее полученный раствор кислоты добавляли в малых аликвотах к суспензии свободного основания при перемешивании. Реакционную смесь перемешивали в течение приблизительно 1,5 суток при температуре от 0°C до температуры окружающей среды (приблизительно 22°C) и оставляли приблизительно при 4°C еще на 2 суток, после чего полученное вещество выделяли и сушили при температуре окружающей среды. Полученное вещество сушили при температуре окружающей среды (приблизительно 22°C) под вакуумом в течение приблизительно 2 суток.
[00275] Анализ посредством XRPD (фигура 28) показал, что полученное вещество является кристаллическим. Дифрактограмма соответствует дифрактограмме Формы I бис-гидрохлорида в малом масштабе, полученной в процессе первичного скрининга солей.
[00276] ТГА/ДТА проводили по истечении 2 дней сушки при температуре окружающей среды под вакуумом. ТГА показал ступенчатую потерю массы, составляющую 2,7%, от конечной температуры до приблизительно 180°C. Дополнительная потеря массы, составляющая 4,3%, наблюдалась приблизительно от 180 до 210°C, что соответствует эндотерме на графике ДТА (фигура 29).
[00277] Анализ посредством ДСК показал широкую эндотерму приблизительно от 30 до 160°C. Следующая эндотерма имела начало при 206,4°C (пик при 226,5°C) и сразу после нее следовала меньшая эндотерма с пиком 238,2°C (фигура 30).
[00278] Анализ методом Карла Фишера показал содержание воды приблизительно 3,3% (приблизительно 2,8% воды требовалось для моногидрата).
[00279] Спектроскопия 1Н ЯМР (фигура 31) показала, что спектр был сдвинут по сравнению с Соединением 1, что означало возможное образование соли. Признаков разложения обнаружено не было. Пик свободного основания, как оказалось, частично перекрывается с областью для ацетонитрила, однако, как представляется, значительных количеств ацетонитрила не присутствует.
Пример 7
Вторичный скрининг гидробромидной соли (1 эквив.)
[00280] Приблизительно к 1 г свободного основания Соединения 1 добавляли 5 мл смеси ацетонитрил: вода (10%) с получением суспензии. В отдельном флаконе к 1 эквиваленту бромоводородной кислоты (48%) добавляли приблизительно 3 мл смеси ацетонитрил: вода (10%). Далее полученный раствор кислоты по каплям в течение 1 часа добавляли к суспензии свободного основания при перемешивании и поддержании температуры от 0 до 5°C. После добавления всего объема кислоты, добавляли дополнительные 3 мл смеси ацетонитрил: вода (10%). Реакционную смесь перемешивали в течение приблизительно 1 суток, после чего полученное вещество выделяли и сушили под вакуумом при температуре окружающей среды (приблизительно 22°C). Выход составил приблизительно 79%.
[00281] Анализ посредством XRPD (фигура 32) проводили для влажного образца и образца после сушки. Анализ показал, что в процессе сушки происходит изменение формы вещества. Дифрактограммы вещества, полученного при масштабировании до и после сушки отличались от дифрактограммы гидробромидного образца, полученного при первичном скрининге.
[00282] ТГА/ДТА показал потерю массы 1,01% от конечной, вероятно имеющую место из-за несвязанной влаги или растворителя. Других потерь массы до разложения, начинающегося приблизительно при 230°C, не наблюдалось (фигура 33).
[00283] Анализ посредством ДСК (фигура 34) показал широкую эндотерму от конечной температуры, вероятно имеющую место из-за несвязанного растворителя/воды. Далее наблюдалась вторая эндотерма с началом приблизительно при 230°C (пик при 238°C), после чего, вероятно, следовало разложение.
[00284] Поляризационная микроскопия показала наличие очень маленьких частиц с нечетко определенной морфологией (не показано).
[00285] ИК-спектроскопия (фигура 35) показала ряд различий и сдвигов по сравнению со свободным основанием.
[00286] Спектроскопия 1Н ЯМР (фигура 36) показала ряд сдвигов пиков по сравнению со свободным основанием.
[00287] Анализ посредством ДСП (фигура 37) показал, что поглощение воды составило 0,97% при ОВ от 20 до 70%. Поглощение воды при ОВ от 0 до 90% было обратимым с очень маленьким гистерезисом. Анализ посредством XRPD после ДСП показал, что данная полиморфная форма, как представляется, остается неизменной после воздействия условий с различной ОВ (не показано).
[00288] Кулонометрический анализ методом Карла Фишера показал, что содержание воды составляла приблизительно 1,65%.
[00289] Оценка чистоты посредством ВЭЖХ показала, что чистота гидробромидной соли составила приблизительно 97,5% с основным пиком, выходящим при времени выдерживания приблизительно 13 минут.
[00290] Суспензии гидробромидной соли готовили в смесях ацетон: вода (3%, 5% и 10%) и перемешивали при температуре окружающей среды в течение приблизительно 3 суток. Далее полученные твердые вещества подвергали анализу посредством XRPD для определения того, произошли ли какие-либо изменения при суспендировании. Результаты исследований гидратации, по данным анализа посредством XRPD (фигура 38), приведены в обобщенном виде в таблице 8.

[00291] Гидробромидную соль суспендировали в деионизованной воде при температуре окружающей среды (приблизительно 22°C). Образец твердого вещества отбирали через 1, 24 и 48 часов и подвергали анализу посредством XRPD. Также контролировали pH надосадочной жидкости. Результаты исследования диспропорционирования соли, по данным анализа посредством XRPD (фигура 39), приведены в обобщенном виде в таблице 9.


[00292] Гидробромидную соль подвергали воздействию условий 40°C/ОВ75% (открытый и закрытый флаконы) и 80°C (открытый флакон) в течение 1 недели для определения растворимости. Полученные твердые вещества подвергали анализу посредством XRPD и ВЭЖХ для определения того, произошли ли какие-либо изменения. Результаты исследования стабильности в течение 1 недели, по данным анализа посредством XRPD (фигура 40) и ВЭЖХ, при 40°C/ОВ75% с использованием открытого и закрытого флаконов и при 80°C с использованием открытого флакона приведены в таблице 10.

[00293] Суспензии гидробромидной соли готовили в средах с различным pH (pH 1; pH 3; pH 4,5 и pH 6,2) и перемешивали встряхиванием в течение приблизительно 24 часов. Через 24 часа суспензии фильтровали, и раствор подвергали анализу посредством ВЭЖХ с целью определения растворимости при различных уровнях pH. Оставшиеся твердые вещества также подвергали анализу посредством XRPD для установления того, происходили ли какие-либо изменения в твердой форме. В качестве буферных растворов использовали раствор KCl/HCl для pH 1 и комбинации лимонная кислота/цитрат натрия для pH 3, 4,5 и 6,2. Термодинамические исследования растворимости показали результаты, приведенные в таблице 11.
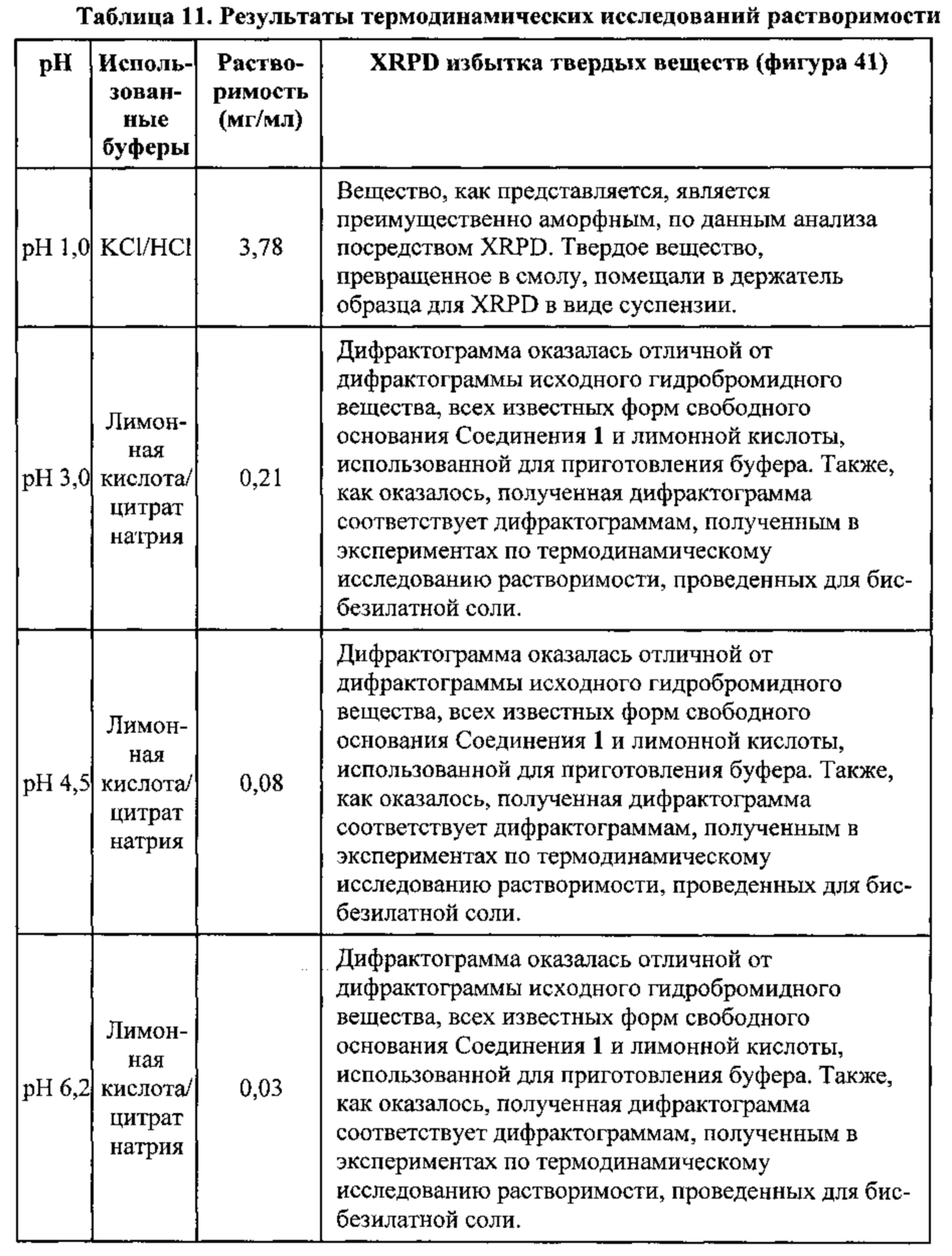
[00294] Дифрактограммы для образцов из экспериментов при pH 3,0, 4,5 и 6,2 оказались отличными от дифрактограмм исходного вещества, а также всех идентифицированных форм гидробромидной соли и свободного основания Соединения 1. Также, как оказалось, полученные дифрактограммы, отличались от дифрактограмм твердых веществ, использованных для приготовления буферов. Значения растворимости, полученные при использовании данных буферах, таким образом, вероятно, не отражают растворимость гидробромидной соли, которую изначально помещали в растворы.
[00295] Приблизительно 100-120 мг вещества прессовали с получением дисков, помещая вещество в форму (диаметр 13 мм) и прессуя форму под давлением, соответствующим усилию 5 тонн, в гидравлическом прессе в течение приблизительно 2 минут. Для перемешивания сред при 100 об/мин использовали прибор для растворения Sotax АТ7 (согласно ЕР2 и USP2), содержащий лопасти. Среды для растворения с pH 3 (1% ДСН) и pH 4,5 (1% ДСН) готовили с использованием цитратного/фосфатного буфера. Исследования всех веществ проводили в 750 мл буферной среды. Диски добавляли в момент времени 0 секунд и позволяли им осесть на дно сосуда для растворения, после чего начинали перемешивание. Приблизительно 1 мл аликвот сред извлекали из сосудов для растворения в моменты времени 1, 5, 10, 15, 30, 60, 120, 240 минут и 24 часа и определяли концентрацию активного фармацевтического ингредиента (АФИ) посредством ВЭЖХ-УФ. Тесты на растворение проводили в двух повторностях. Для обеих сред, в которых проводили растворение, площади пиков в начальные моменты времени (до 15 минут) находились ниже предела количественного определения, однако на кривой зависимости скорости растворения от времени наклонная часть кривой построена и при данных ранних моментах времени.
[00296] Для pH 4,5 на кривой зависимости скорости растворения от времени (фигура 42) истинные значения растворения, полученные в ранние моменты времени на кривой (наклонная часть кривой), составили приблизительно 0,27 мг/см2/мин для таблетки 1 и 0,28 мг/см2/мин для таблетки 2.
[00297] Для pH 3,0 на кривой зависимости скорости растворения от времени (фигура 43) истинные значения растворения, полученные в ранние моменты времени на кривой (наклонная часть кривой), составили приблизительно 0,35 мг/см2/мин для обеих таблеток 1 и 2.
Пример 8
Вторичный скрининг гидробромидной соли (2 эквив.)
[00298] Приблизительно к 200 мг Соединения 1 добавляли приблизительно 1 мл метанола с получением суспензии. В отдельном флаконе к 2 эквивалентам бромоводородной кислоты (48%) добавляли приблизительно 1 мл метанола. Далее полученный раствор кислоты по каплям в течение 1 часа добавляли к суспензии свободного основания при перемешивании и поддержании температуры от 0 до 5°C. После добавления всего объема кислоты добавляли дополнительный 1 мл метанола. Реакционную смесь перемешивали в течение приблизительно 3 часов, после чего полученное вещество выделяли и сушили. Выход составил приблизительно 68%.
[00299] После фильтрования проводили анализ посредством XRPD (фигура 44), и полученная дифрактограмма соответствовала дифрактограмме вещества Формы I, полученной как из 1, так и из 2 эквивалентов HBr в первичном скрининге солей.
[00300] ТГА/ДТА (фигура 45) показал потерю массы 1,2% от конечной температуры до приблизительно 100°C, вероятно имеющую место из-за несвязанной влаги или растворителя. Других потерь массы до разложения, начинающегося приблизительно при 230°C, не наблюдалось. Графики ТГА/ДТА схожи с графиками, полученными для масштабированной формы с 1 эквивалентом согласно Примеру 6.
[00301] ИК-спектроскопия (фигура 46) показала ряд различий и сдвигов по сравнению со свободным основанием и гидробромидной (1 эквив.) солью, полученной при масштабировании.
Пример 9
Вторичный скрининг гидробромидной соли (неизвестная форма)
[00302] В результате экспериментов по термодинамическому исследованию растворимости, проведенных на гидробромидной соли, была получена неизвестная твердая форма. В попытках охарактеризовать данную форму, а также установить скорость превращения в данную форму при суспендировании вещества были проведены следующие эксперименты. Сначала приблизительно 100 мг гидробромидного (1 эквив.) вещества суспендировали в водном растворе с pH 6,2 при температуре окружающей среды и проводили анализ посредством XRPD в моменты времени 5 мин, 1 ч, 2 ч, 4 ч и 8 ч. Дальнейший анализ также проводили для вещества после превращения.
[00303] Анализ посредством XRPD (фигура 47), проведенный для образца гидробромидной (1 эквив.) соли после суспендирования твердого вещества в водной среде с pH 6,2 в течение 5 мин, 1 ч, 2 ч, 4 ч и 8 ч, показал, что превращение в неизвестную твердую форму происходит между 2 и 4 часами.
[00304] Анализ посредством МПС, проведенный для суспензии вещества, показал, что частицы имели очень маленький размер. Наблюдалось некоторое двойное лучепреломление (не показано). После сушки вещество стало стеклообразным.
[00305] Для данного вещества проводили анализ 1Н ЯМР, в результате которого был получен спектр, который отличался по положениям пиков как от спектра свободного основания, так и от спектра гидробромида (фигура 48).
[00306] Для полученного стеклообразного вещества также была произведена попытка анализа посредством ДСК, однако наблюдалась большая широкая эндотерма от конечной температуры до приблизительно 110°C с последующей зависимостью, характерной для аморфного вещества (фигура 49).
[00307] Эксперименты по суспендированию свободного основания Соединения 1 и гидрата бис-безилата (проведенные в попытках получить большее количество данной формы для анализа) были безуспешными и не позволили получить данную неизвестную твердую форму. В случае суспензии свободного основания вещество оставалось в виде Формы I свободного основания, а в случае суспензии гидрата бис-безилата наблюдалась некоторая потеря кристалличности вещества, но вещество оставалось гидратом бис-безилата (фигура 50).
[00308] Дальнейшее масштабирование получения гидробромидной соли (1 эквив.) и последующее суспендирование в водной среде с pH 6,2 позволило получить данную неизвестную твердую форму (фигура 51), однако, все попытки фильтрования данного вещества были безуспешными, поскольку данное твердое вещество из-за малого размера частиц проходило через пористый фильтр и несколько листов фильтровальной бумаги. Опять же, попытки выпаривания растворителя привело к получению стеклообразного вещества. Это, как представляется, означает, что данная неизвестная форма нестабильна при выделении.
Пример 10
Третичный скрининг гидробромидной соли (1 эквив.)
[00309] В круглодонной колбе приблизительно к 20 г Соединения 1 добавляли приблизительно 85 мл смеси ацетонитрил: вода (90:10) с получением суспензии. В отдельной колбе приблизительно к 70 мл смеси ацетонитрил: вода (90:10) добавляли 1 эквивалент бромоводорода (приблизительно 4,073 мл). Далее полученный раствор кислоты добавляли в малых аликвотах к суспензии свободного основания при перемешивании приблизительно при 4°C. Далее полученную суспензию оставляли перемешиваться при температуре окружающей среды в течение приблизительно 2 часов. Суспензию помещали в условия приблизительно 5°C на 1 сутки, а затем перемешивали еще 4 часа при температуре окружающей среды. Реакционную смесь фильтровали, и полученное твердое вещество сушили под вакуумом при температуре окружающей среды (приблизительно 22°C). Сушку продолжали приблизительно 2 суток. Из-за частично кристаллической природы полученного вещества после сушки, данное вещество затем суспендировали приблизительно в 50 мл смеси ацетон: вода (90:10). Реакционную смесь подвергали циклическому изменению температуры приблизительно от 4 до 22°C в циклах по 1 часу при перемешивании в течение приблизительно 2 суток. Далее реакционную смесь фильтровали и сушили при температуре окружающей среды в течение приблизительно 4 дней, а затем подвергали анализу. Выход после дополнительного суспендирования составил 16,4 г (63%).
[00310] Анализ посредством XRPD (фигура 52), проведенный для исходного влажного вещества, полученного при масштабировании, показал, что образец обладал высокой кристалличностью. После сушки полученное твердое вещество превращалось в другую полиморфную форму, и также наблюдалась некоторая потеря кристалличности. Анализ посредством XRPD (фигура 53) вещества после дополнительного суспендирования в смеси ацетон: вода (10%) и последующей сушки показал, что вещество было кристаллическим. Полученная дифрактограмма соответствовала образцу гидробромида, полученному после сушки в примере 1.
[00311] ИК-спектроскопия (фигура 54) показала различия по сравнению со спектром свободного основания. Также, как оказалось, полученный спектр соответствует спектру, полученному для гидробромидной соли в примере 1.
[00312] МПС (не показано) показала наличие маленьких частиц с отсутствием определенной морфологии и небольшим двойным лучепреломлением.
[00313] 1Н ЯМР (фигура 55) показал ряд сдвигов пиков по сравнению со свободным основанием. Спектр показал присутствие небольшого нестехиометрического количества ацетона.
[00314] ТГА/ДТА (фигура 56) показал потерю массы приблизительно 0,4% от конечной, вероятно имеющую место из-за несвязанной влаги или растворителя. Других значительных потерь массы до разложения, начинающегося приблизительно при 230°C, не наблюдалось.
[00315] Анализ посредством ДСК (фигура 57) показал неглубокую широкую эндотерму от конечной температуры, вероятно имеющую место из-за несвязанного растворителя/воды. Далее присутствовала вторая эндотерма с началом приблизительно при 240°C (пик при 244°C), после чего, вероятно, следовало разложение.
[00316] Посредством анализа методом Карла Фишера было определено, что содержание воды в веществе составляло приблизительно 0,76%.
[00317] Определение чистоты посредством ВЭЖХ показало, что чистота вещества составляла 98,1%.
[00318] Содержание углерода, водорода и азота в веществе определяли путем помещения образцов в оловянную капсулу, помещаемую внутрь барабана автосэмплера системы элементного анализа. Среду, окружающую образец, продували непрерывным потоком гелия, и образцы капали с заданными интервалами в вертикальную кварцевую трубку, поддерживаемую при 900°C. Смесь газообразных продуктов сгорания отделяли, и проводили определение с помощью детектора теплопроводности, который дает сигнал, пропорциональный концентрации отдельных компонентов смеси. Содержание брома в веществе определяли путем сжигания образца в колбе с кислородом. После того, как произошло сжигание и поглощение раствором, образцы титровали с применением калиброванного раствора нитрата ртути. Элементный анализ (CHN и бромида) показал следующие процентные содержания:
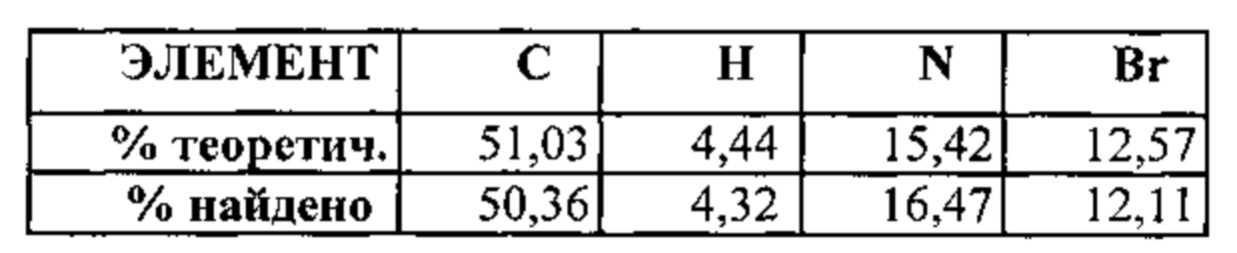
[00319] Ионную хроматографию проводили с использованием компактного ионного хроматографа Metrohm 761 Compact Ion Chromatograph для анализа ионов в водных растворах. Калибровочные стандарты были получены из сертифицированных растворов с концентрацией 1000 частей на миллион (ppm). Ионная хроматография показала присутствие 12,38% бромида.
[00320] Для того чтобы исследовать эффект удаления воды, которая удерживается веществом (несмотря на длительные периоды сушки), небольшой образец нагревали до 100°C в тигле для ТГА и затем проводили Анализ посредством XRPD (фигура 58). Анализ показывал некоторые потери кристалличности, однако полиморфная форма оставалась неизменной после удаления приблизительно 0,5% воды при нагревании. Тем не менее вещество, как представляется, обладает небольшой гигроскопичностью.
Пример 11
Получение гидробромидной соли (1 эквив.) в большом масштабе
[00321] Приблизительно 319 г соединения 1 добавляли приблизительно к 1 л смеси ацетон: вода (90:10) в реакционном сосуде вместимостью 5 л при установленной температуре в реакторе 4°C. Получали суспензию. Полученную суспензию перемешивали при 450 об/мин. В отдельной колбе приблизительно к 750 мл смеси ацетон: вода (90:10) добавляли 1 эквивалент бромоводорода (48%) (приблизительно 65 мл). Далее полученный раствор кислоты добавляли в указанный реактор вместимостью 5 л в течение периода, составляющего 1 час, поддерживая температуру приблизительно 4°C. Через 30 минут в реактор добавляли еще 700 мл смеси ацетон: вода (90:10). После добавления всего объема раствора HBr температуру в реакторе повышали до 20°C на 2 часа. Далее реакционную смесь снова охлаждали приблизительно до 4°C и выдерживали при данной температуре еще 3 часа. Далее реакционную смесь фильтровали и сушили под вакуумом при температуре окружающей среды (приблизительно 22°C) в течение 3 дней. Полученное твердое вещество периодически перемешивали в процессе сушки. Выход после сушки составил 258,1 г (71%).
[00322] Анализ посредством XRPD (фигура 59), проведенный для исходного влажного вещества, полученного при масштабировании, показал, что образец вещества обладал высокой кристалличностью. После сушки полученное твердое вещество превращалось в другую полиморфную форму (фигура 60). Высушенное вещество представляло собой ту же форму, которая была получена при первичном скрининге солей.
[00323] ИК спектроскопия (фигура 61) показала различия при сравнении со спектром свободного основания. Спектр также оказался соответствующим спектрам, полученным для гидробромидной соли, полученной в примерах 1 и 7.
[00324] МПС-анализ показал игольчатую, волокнистую морфологию во влажном состоянии (не показано). После сушки и, следовательно, полиморфного преобразования, игольчатая морфология была утрачена с получением в результате мелких частиц.
[00325] 1Н ЯМР (фигура 62) показал ряд сдвигов пиков по сравнению со свободным основанием. Спектр показал присутствие следовых количеств ацетона.
[00326] ТГА/ДТА (фигура 63) показал потерю массы от конечной температуры приблизительно 0,4%, вероятно имеющую место из-за несвязанной влаги или растворителя. Других значительных потерь массы до разложения, начинающегося приблизительно при 230°C, не наблюдалось. Таким образом, вещество, как представляется, удерживает приблизительно 0,5% воды в условиях окружающей среды, несмотря на длительные периоды сушки и, следовательно, как представляется, обладает небольшой гигроскопичностью.
[00327] Анализ посредством ДСК (фигура 64) показал неглубокую широкую эндотерму от конечной температуры, вероятно имеющую место из-за несвязанного растворителя/воды. Далее присутствовала вторая эндотерма с началом приблизительно при 241°C (пик при 245°C), после чего, вероятно, следовало разложение.
[00328] Анализ методом Карла Фишера показал, что содержание воды в веществе составило приблизительно 0,74%.
[00329] Определение чистоты посредством ВЭЖХ показало, что чистота составила приблизительно 99,1%.
[00330] Суспензии гидробромидной соли готовили в забуференных водных средах при pH 1,0 (буфер HCl/KCl), pH 3,0 (цитратный буфер), pH 4,5 (цитратный буфер) и pH 6,2 (нитратный буфер), а также в водных растворах со значением pH, пониженным до менее 2 посредством HBr (48%). Соответствующие суспензии перемешивали встряхиванием в течение периода 24 часа при 22°C. Далее твердые вещества удаляли фильтрования и подвергали анализу посредством XRPD. Меточные растворы подвергали анализу посредством ВЭЖХ для определения растворимости АФИ. Определение растворимости посредством ВЭЖХ в средах с различным pH показало следующие результаты:

[00331] Анализ посредством XRPD твердых веществ, извлеченных после экспериментов по определению растворимости (фигура 65) показал, все образцы соответствовали преимущественно исходному веществу гидробромидной соли, при этом в образцах в буферах с pH 3,0, 4,5 и 6,2 были обнаружены следы формы, ранее идентифицированной в исследованиях диспропорционирования и предыдущих исследованиях по суспензированию гидробромидной соли в буферах pH с pH>3.
[00332] Элементный анализ (CHN и бромид) показал следующие процентные содержания:
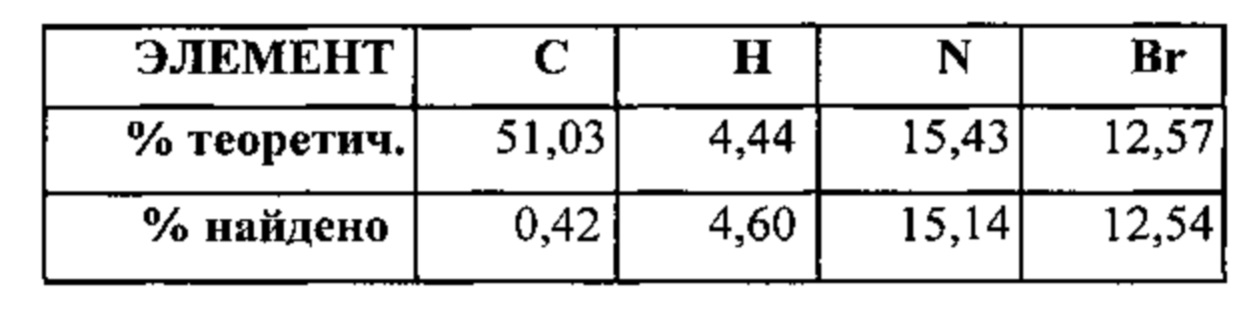
[00333] Небольшое количество суспензии вещества, полученного при данном масштабировании, выдерживали в течение приблизительно 1,5 месяцев приблизительно при 4°C. После повторного анализа вещества посредством МПС, наблюдали кристаллы в виде плоских частиц в форме палочек по сравнению с волокнистыми игольчатыми частицами, которые наблюдали ранее (не показано). Вещество преобразуется в ту же форму, которую получают при сушке с изменением морфологии кристаллов от волокнистых игольчатых кристаллов до плоских палочковидных кристаллов. В результате анализа посредством XRPD (фигура 66) была получена дифрактограма, которая соответствовала сухому веществу гидробромидной соли (пики при 7,59, 15,28, 21,10, 23,21, 30,88, 35,54, 43,58 и 47,13 °2-тета). Данные пики получились очень острыми с некоторой предпочтительной ориентацией на дифрактограмме.
Пример 12
Первичный скрининг полиморфа гидробромидной соли
[00334] Получение аморфного вещества. Вещество гидробромидной соли измельчали в шаровой мельнице Retsch в течение приблизительно 25 минут с 5-минутными перерывами для предотвращения перегрева образца. Далее образец подвергали анализу посредством XRPD для определения формы, а также анализу посредством ВЭЖХ для проверки разложения. Анализ посредством XRPD после измельчения показал, что вещество гидробромидной соли является аморфным с чистотой по ВЭЖХ приблизительно 99,5% (фигура 79). Аморфный материал был желательным для повышения растворимости и для того, чтобы не смещать скрининговое исследование в направлении одной конкретной формы.
[00335] Скрининг растворимости в растворителях. Приблизительно 10 мг аморфной гидробромидной соли помещали в каждый из 24 флаконов, и в каждый флакон добавляли 5 объемных аликвот соответствующей системы растворителей. Между каждым добавлением проверяли растворимость смеси. Эту процедуру продолжали до тех пор, пока не наблюдалось растворение или пока не было добавлено 100 объемов растворителя. Было обнаружено, что аморфное вещество гидробромидной соли хорошо растворимо в 3 из 24 систем растворителей, но обладает низкой растворимостью в остальных растворителях. Приблизительные значения растворимости аморфной гидробромидной соли в 24 системах растворителей представлены в таблице 12:

[00336] Эксперименты с циклическим изменением температуры. Результаты, полученные в экспериментах по определению приблизительной растворимости использовали для получения суспензий для циклического изменения температуры. Суспензии подвергали циклическому изменению температуры от 4°C до 25°C в циклах по 4 часа в течение периода, составляющего 72 часа (суспензии выдерживали при температуре 4°C в течение 4 часов с последующим выдерживанием при температуре окружающей среды в течение 4 часов, при этом скорости охлаждения/нагревания после 4-часовых периодов выдерживания составляли приблизительно 1°C/мин). Твердое вещество затем выделяли для анализа.
[00337] Эксперименты по резкому охлаждению. Эксперименты по резкому охлаждению проводили путем помещения насыщенных растворов вещества в каждой из 24 выбранных систем растворителей в среды от 2°C до -18°C как минимум на 48 часов. Любое твердое вещество затем извлекали для анализа.
[00338] Эксперименты с быстрым испарением. Эксперименты с быстрым испарением проводили путем выпаривания растворителей из насыщенных, профильтрованных растворов вещества в каждой из 24 систем растворителей под вакуумом. Любое твердое вещество затем выделяли и подвергали анализу после того, как растворитель был выпарен досуха.
[00339] Эксперименты по добавлению вещества, препятствующего растворению. Эксперименты по добавлению вещества, препятствующего растворению, проводили при температуре окружающей среды путем добавления выбранного вещества, препятствующего растворению, к насыщенным профильтрованным растворам вещества в каждой из 24 выбранных систем растворителей. Выбранное вещество, препятствующее растворению, представляло собой гептан, трет-бутилметиловый эфир и вода, используемая для растворителей, несмешивающихся с гептаном. Добавление вещества, препятствующего растворению, продолжали до тех пор, пока не было никакого дополнительного осаждения или до тех пор, пока вещество, препятствующее растворению, больше нельзя быть добавить. Любое твердое вещество извлекали и быстро подвергали анализу с целью предотвращения изменения формы.
[00340] Эксперименты по медленному испарению. Эксперименты по медленному испарению проводили путем выпаривания растворителей из насыщенных, отфильтрованных растворов вещества в каждой из 24 систем растворителей в условиях окружающей среды. Любое твердое вещество затем извлекали и после выпаривания растворителя досуха подвергали анализу.
[00341] Десольватация сольватированных форм. Возможные сольватированные формы подвергали нагреванию в приборе для ТГА до температуры, немного выходящей за пределы температуры первоначальной потери массы. Путем последующего анализа посредством XRPD может быть определено, изменилась ли форма в результате потери молекул растворителя. После нагревания до 180°C с использованием прибора для ТГА, было обнаружено, что сольват Формы V вернулся к Форме I, по данным анализа посредством XRPD. Полученная дифрактограмма приведена на фигуре 80. Попытки десольватации Формы VII привели к получению смолы после нагревания.
[00342] Исследование влажного и сухого образцов формы I. Первоначально влажные образцы Формы 1 продемонстрировали некоторые различия в дифрактограммах XRPD по сравнению с такими же сухими образцами. Проводили дальнейшие исследования, включая исследования сушки с последующим анализом посредством XRPD, ТГА и XRPD со спиннингом. В случае Формы I влажный материал показал значительную предпочтительную ориентацию, и на дифрактограммах наблюдалось смещение по сравнению с дифрактограммой сухого вещества. На фигуре 81 показано исходное вещество Формы I по сравнению с влажным образцом и после стадий сушки.
[00343] Результаты экспериментов, проведенных в ходе первичного скрининга полиморфа, приведены в таблице 13. Результаты были получены из анализа МПС и XRPD. В целом видно, что в ходе скрининговых экспериментов было идентифицировано множество потенциальных полиморфных форм.
- Форма I была получена в экспериментах со множеством температурных циклов.
- Форма III, безводная форма, была получена при быстром испарении ДМСО, резком охлаждении до 2°C в этаноле и добавлении анти-растворяющего агента, выбранного из ацетона, ацетонитрила и этанола.
- Форма IV, сольват в 1,4-диоксане, была получена в температурном цикле в 1,4-диоксане.
- Форма V, сольват ДМФА, была получена в температурном цикле и при быстром испарении из ДМФА.
- Форма VI, сольват ДМСО, была получена в температурном цикле в ДМСО.
- Форма VII, сольват ДМСО, была получена при медленном испарении из ДМСО.
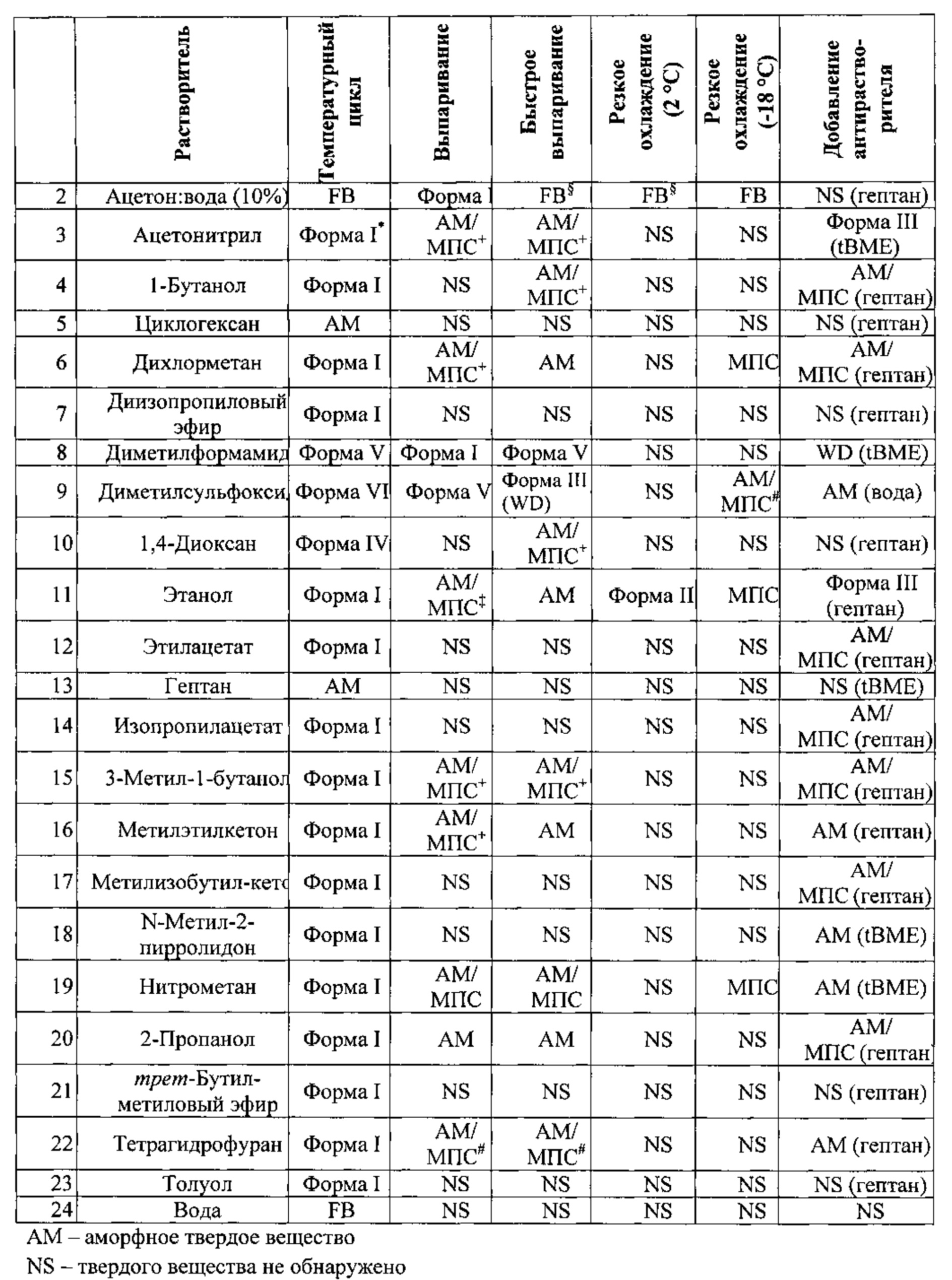
AM/МПС - аморфное по данным XRPD, методом МПС обнаружено двойное лучепреломление
FB - Соединение 1 в форме свободного основания
МПС - двойное лучепреломление по данным МПС
WD - слабые данные
* - низкая кристалличность
+ - нет четкой морфологии
^ - присутствует только 2 пика; игольчатая морфология
# - пластинчатая морфология
† - схожа с Формой VI
‡ - палочковидная морфология
§ - отсутствующие пики.
Пример 13
Вторичный скрининг полиморфов гидробромидной соли и оценка их распространенности
[00344] Форма III гидробромидной соли Соединения 1 (1 экв.) была получена в ходе первичного скрининга полиморфов в результате нескольких экспериментов. Эта форма, таким образом, была усовершенствована с целью масштабирования ее синтеза и дальнейшего анализа.
[00345] Получение Формы III гидробромидной соли. Приблизительно 500 мг гидробромидной соли Соединения 2 в виде аморфного вещества суспендировали в приблизительно 6 мл ацетонитрила. Затем суспензию подвергали циклическому температурному воздействию при температуре 4-25°C и четырехчасовой продолжительности циклов в течение приблизительно 2 суток. При проведении вторичного скрининга анализу подвергали влажное вещество вследствие нестабильности Формы III.
[00346] В процессе масштабирования получения Формы III гидробромидной соли цвет вещества оставался желтым. С помощью анализа посредством XRPD было показано, что вещество, полученное в результате масштабирования, было кристаллическим и его дифрактограмма соответствовала дифрактограмме для Формы III гидробромидной соли, полученной в малом масштабе. Анализ посредством поляризационной микроскопии (МПС) выявил наличие во влажном веществе игольчатых кристаллов, обладающих свойством двойного лучепреломления. Исследование с применением высокотемпературной микроскопии показало, что по мере испарения растворителя при 40-50°C морфология кристаллов изменялась на более столбчатую структуру кристаллов. При температуре приблизительно 250°C наблюдали плавление вещества. Для осуществления термогравиметрического анализа (ТГА)/дифференциального термического анализа (ДТА) влажный образец Формы III помещали в тигель для ТГА. Наблюдали исходную потерю массы 10,3%, обусловленную присутствием несвязанного растворителя. Изменение формы, происходящее, согласно данным высокотемпературной микроскопии, при температуре между 40 и 50°C, было маскировано потерей растворителя. Начало другой эндотермы, соответствующей Форме I гидробромидной соли, наблюдали при начальной температуре приблизительно 239°C (пик приблизительно при 245°C). Анализ посредством ДСК показал первую эндотерму от конечной температуры до приблизительно 100°C. Начало последней эндотермы, которое, как представляется, соответствует, плавлению Формы I, наблюдали приблизительно при 233°C (пик приблизительно при 247°C). Данные ИК-спектроскопии указывали на очень незначительные различия между ИК-спектрами Форм I и III.
[00347] В ходе анализа посредством ДСП были сделаны следующие наблюдения:
- Цикл 1 - Сорбция при ОВ 20-90%
- Образец постепенно поглощал приблизительно 1,045% от своей массы.
- Цикл 2 - Десорбция при ОВ 90-0%
- При изменении ОВ от 90 до 0% масса образца постепенно уменьшилась приблизительно на 1,983%.
- Цикл 3 - Сорбция при ОВ 0-20%
- Поглощение влаги в количестве приблизительно 0,535% при изменении ОВ от 0 до 20%.
[00348] Было обнаружено, что вещество обладает небольшой гигроскопичностью. Анализ посредством XRPD, проведенный после анализа посредством ДСП, указывал на превращение вещества в Форму I гидробромидной соли в процессе анализа посредством ДСП. В результате анализа посредством спектроскопии 1Н ЯМР, проведенном в дейтерированном ДМСО, был получен спектр, который соответствовал спектру Формы I гидробромидной соли. Анализ методом Карла Фишера показал присутствие 1,4% воды. Анализ чистоты посредством ВЭЖХ показал, что чистота составила приблизительно 99,43%. Анализ посредством ионной хроматографии показал присутствие 12,17% бромида (при расчетном количестве приблизительно 12,57% на 1 эквивалент).
[00349] Анализ посредством XRPD, проведенный для твердых веществ, остававшихся через 24 часа при определении термодинамической растворимости, указывал на то, что в экспериментах с pH 6,6 и 4,5 Форма III гидробромидной соли превращалась в форму гидрата свободного основания, твердое вещество из эксперимента с pH 3,0 становилось аморфным, а твердое вещество из эксперимента с pH 1 оставалось преимущественно соответствующим Форме III гидробромида с некоторой потерей кристалличности.
[00350] Исследования стабильности в течение 7 суток при 25°C, 80°C, 40°C/75% ОВ (открытые и закрытые условия). Приблизительно 15 мг Формы III помещали во флаконы и затем подвергали воздействию окружающей среды при 25°C, 80°C и 40°C/75% ОВ (в открытых и закрытых флаконах) в течение 1 недели с целью определения стабильности. Полученные твердые вещества подвергали анализу посредством XRPD и ВЭЖХ для установления любых произошедших изменений. Исследования стабильности в течение 1 недели, проведенные в открытых и закрытых флаконах при температуре 25°C, 80°C и 40°C/ОВ 75%, показали следующие результаты:
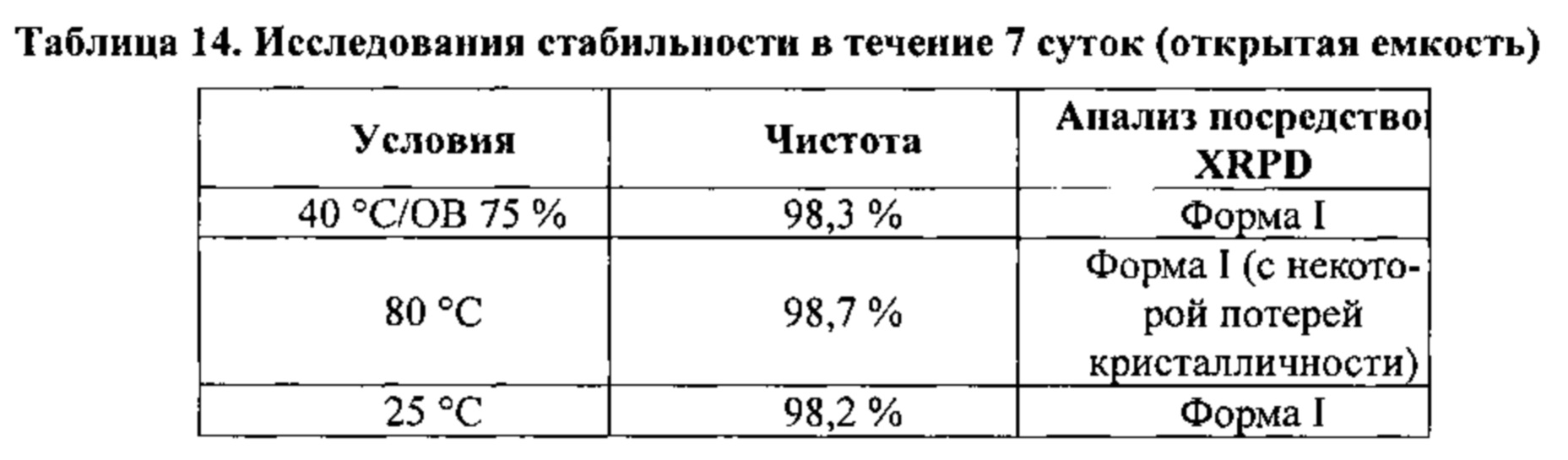
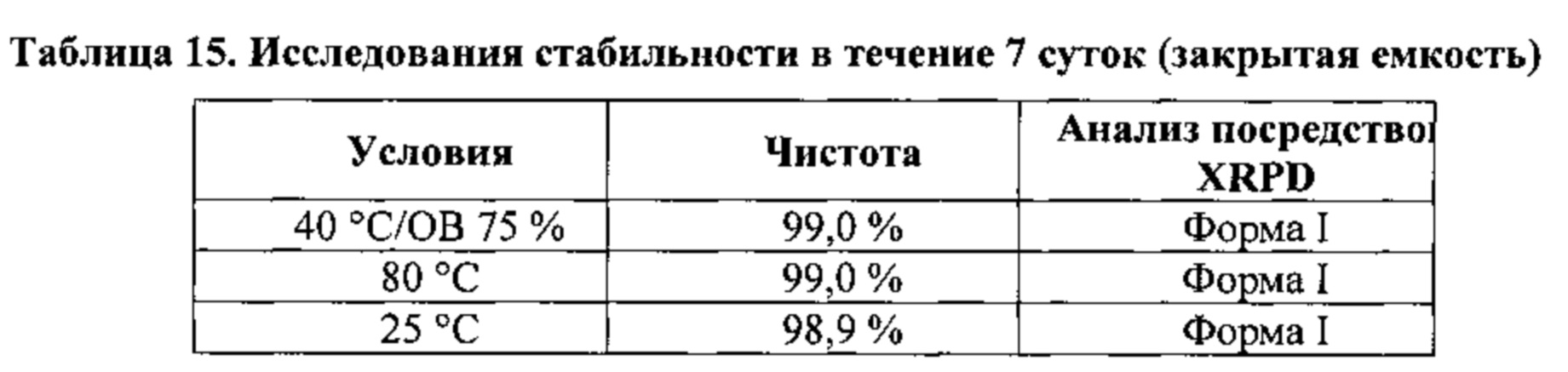
[00351] По характеристике, полученной для Формы III, было определено, что данная форма являлась метастабильной, вероятно, безводной формой гидробромидной соли. Согласно наблюдениям, Форма III была очень нестабильной, при этом она превращалась в Форму I в процессе выделения и высушивания вещества.
[00352] Изучение термодинамической растворимости. Получали суспензии Формы III в средах с различным pH (pH 1; pH 3, pH 4,5 и pH 6,6) и встряхивали в течение приблизительно 24 часов. Через 24 часа суспензии фильтровали, и раствор подвергали анализу посредством ВЭЖХ с целью определения растворимости при различных значениях pH. Для получения буферных растворов применяли KCl/HCl для pH 1 и комбинации цитрат/фосфат для pH 3, 4,5 и 6,6 (10 мМ). pH растворов также измеряли перед анализом методом ВЭЖХ. Анализ посредством XRPD выполняли для твердых веществ, остававшихся через 24 часа после начала встряхивания.
[00353] Эксперименты по определению термодинамической растворимости, проведенные в буферах с pH 1, 3,0, 4,5 и 6,6, показали следующий результат:
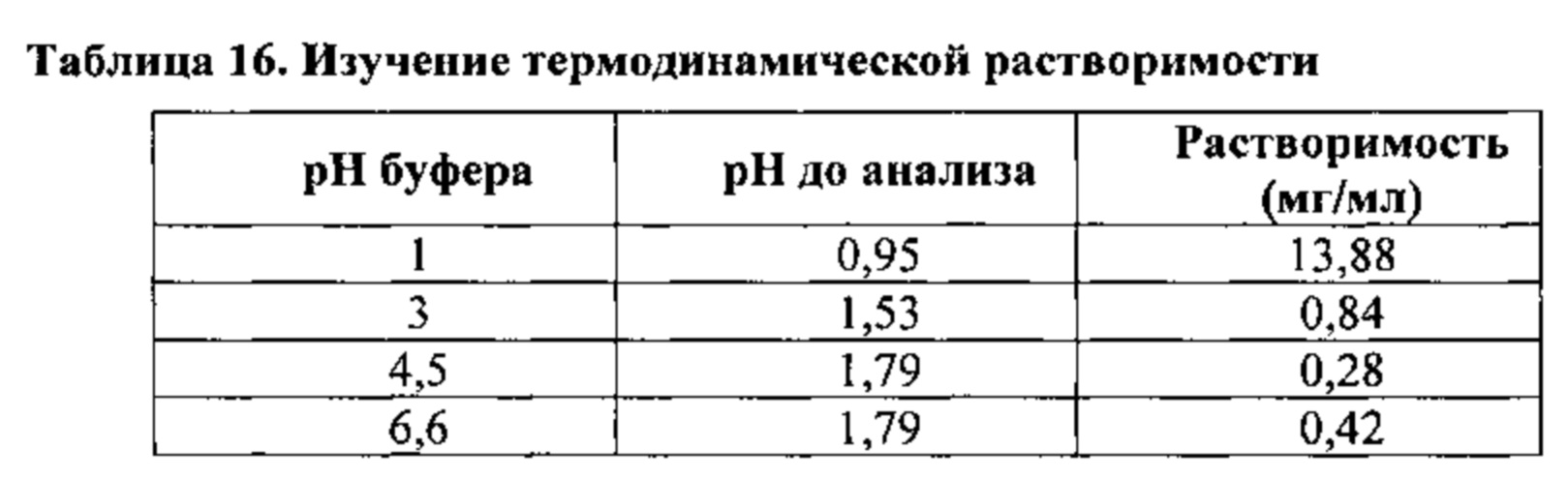
[00354] Сравнительные эксперименты по суспендированию. Сравнительные эксперименты по суспендированию выполняли в ацетоне, изопропаноле, смеси ацетон: вода (80:20) и изопропилацетате при комнатной температуре (приблизительно 22°C) и 60°C. Приблизительно 200 мг вещества каждой из Форм I и III помещали во флакон и добавляли 4 мл соответствующей системы растворителей с получением суспензии. В каждом эксперименте суспензии оставляли перемешиваться в течение приблизительно 3 суток. Далее проводили Анализ посредством XRPD для определения формы полученного твердого вещества. Сравнительные эксперименты по суспендированию Формы I относительно Формы III проводили в 4 системах растворителей, и полученные твердые вещества исследовали посредством XRPD-анализа (фигура 82 и фигура 83). Результаты кратко представлены в таблице 17.
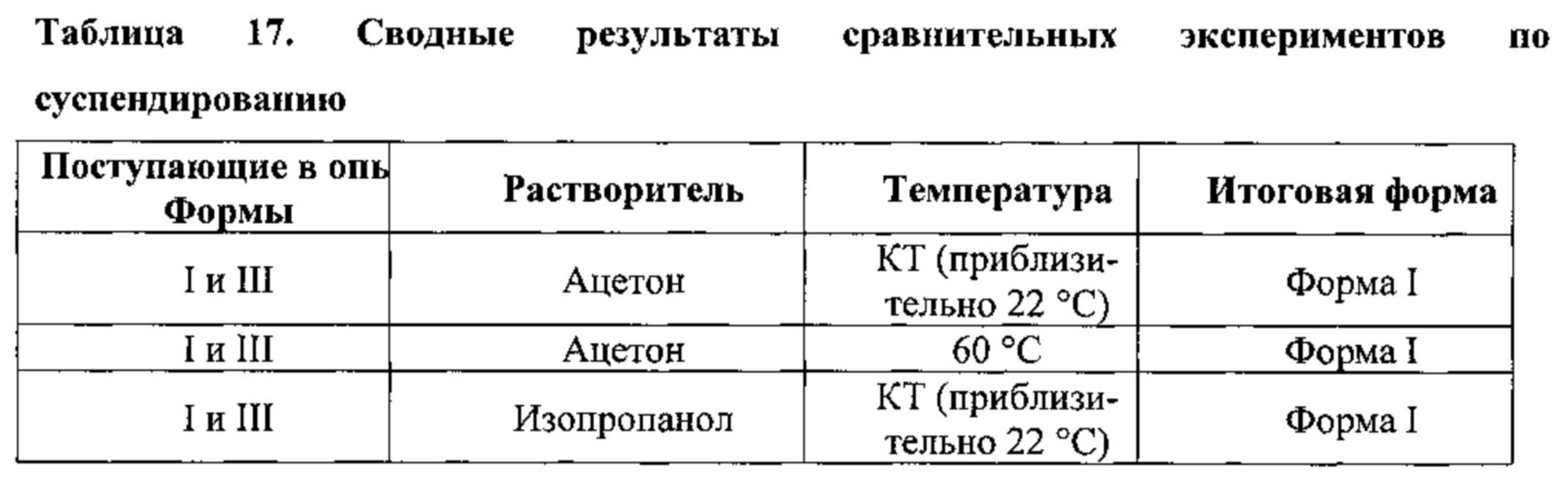

[00355] По результатам сравнительных экспериментов по суспендированию было обнаружено, что Форма I представляла собой наиболее термодинамически стабильную форму в ацетоне, изопропаноле и изопропилацетате как при комнатной температуре, так и при 60°C. В смеси ацетон: вода (80:20) происходило превращение в неустановленную форму (помеченную как Форма VIII).
[00356] Характеристика Формы VIII. Первоначальный анализ Формы VIII, полученной в результате сравнительных экспериментов по суспендированию на Формах I и III в смеси ацетон: вода (80:20), был проведен с целью определения природы указанной формы и оценки ее соответствия веществу в форме свободного основания или гидробромидной соли. Вещество, полученное в результате сравнительных экспериментов по суспендированию, имело светло-желтый цвет. Анализ посредством МПС выявил вещество без четко выраженной морфологии, обладающее свойством двойного лучепреломления. После сушки под вакуумом в течение приблизительно 24 часов ТГА/ДТА показали потерю массы, составлявшую 5,2% от конечной, с последующей второй потерей массы 1,2%, с эндотермами на кривой ДТА приблизительно при 40°C и приблизительно при 96°C. Начало последней эндотермы наблюдали на кривой ДТА приблизительно при 184°C (пик приблизительно при 194°C). При исследовании с помощью высокотемпературной микроскопии наблюдали очень незначительное изменение перед плавлением приблизительно при 197°C. Анализ посредством ДСК выявил широкую эндотерму, начинающуюся с первого шага (пик приблизительно при 93°C), за которой следовали второй эндотермический пик приблизительно при 140°C и третья эндотерма с началом приблизительно при 178°C (пик приблизительно при 193°C). Анализ методом ионной хроматографии свидетельствовал о содержании 12,8% бромида (приблизительно 1 эквивалента).
[00357] Для исследования эффекта десольватации/дегидратации Формы VIII вещество нагревали до 150°C в тигле для ТГА и затем проводили Анализ посредством XRPD. Полиморфная форма, как представляется, оставалась неизменной. После нагревания до 150°C и проведения анализа посредством XRPD то же самое вещество снова подвергали ТГА и обнаруживали потерю массы, составлявшую 6,0% от конечной, за которой следовала вторая потеря массы, составлявшая 0,9%, с эндотермами на кривой ДТА приблизительно при 42°C и приблизительно при 96°C. Начало последней эндотермы наблюдали на кривой ДТА приблизительно при 186°C (пик приблизительно при 194°C). Образец, вероятно, претерпевал регидратацию при воздействии атмосферных условий. Этот факт, вероятно, мог бы объяснить соответствие между дифрактограммами XRPD до и после десольватации/дегидратации.
[00358] Исследование гидратации при 55°C. Суспензии получали с использованием приблизительно 200 мг Формы I соли в 2 мл подходящей системы растворителей. Их перемешивали приблизительно при 55°C в течение 6 часов. Применяемые системы растворителей приведены в таблице 18.

[00359] После исследования гидратации вещество подвергали анализу посредством XRPD для определения того, происходили ли гидратация или диспропорционирование при различных уровнях водной активности. XRPD-анализ образцов в смеси этанол: вода показал, что для водной активности 1, 2, и 5% полученные дифрактограммы соответствовали Форме I поступающей в опыт гидробромидной соли. Для водной активности 10% образовывался гидрат гидробромида. Такая же картина была обнаружена для образцов, суспендированных в смесях IP А/ацетон (9:1): вода, где для водной активности 1, 2, и 5% полученные дифрактограммы соответствовали исходной Форме I гидробромидной соли, однако, для водной активности 10% был получен гидрат гидробромида. Дифрактограммы представлены на фигуре 84 и фигуре 85.
[00360] Исследование гидратации при 15°C и 35°C. Суспензии получали с использованием приблизительно 200 мг Формы I соли в 2 мл подходящей системы растворителей. Их перемешивали приблизительно при 15°C и приблизительно при 35°C в течение 24 часов. Применяемые системы растворителей приведены в таблице 19.

[00361] После исследования гидратации анализ образцов посредством XRPD показал, что полученные дифрактограммы соответствовали Форме I гидробромидной соли, и гидратация не происходила при уровне водной активности 2%. Дифрактограммы представлены на фигуре 86.
[00362] Результаты скрининга полиморфов для гидробромидной соли Соединения 1 (гидробромида Соединения 2) представлены на фигуре 87. Гидробромид Соединения 2 существует в восьми (8) различных твердых формах, включая аморфную, безводную, сольватированную и гидратированную формы. Фигура 87 иллюстрирует взаимное превращение между некоторыми из идентифицированных форм, причем Форма I демонстрировала особую стабильность при различных условиях.
Пример 14
Фармакокинетическое исследование 1 на собаках
[00363] Соединение 1 в форме свободного основания и Соединение 2 в виде Формы I моногидробромидной (HBr) соли оценивали в перекрестном фармакокинетическом (ФК) исследовании на собаках. Капсула с Соединением 1 в форме свободного основания состояла из свободного основания Соединения 1 в витамине Е в форме токоферилполиэтиленгликольсукцината (ТПГС) и ПЭГ 400, помещенных в капсулу. Капсула с Формой I гидробромидной соли состояла исключительно из Формы I гидробромида, помещенной в капсулу.
[00364] Капсулы с Соединением 1 в форме свободного основания и капсулы с Формой I гидробромида вводили перорально натощак 1 раз в сутки в дозах 28,5 и 24,5 мг/кг (в качестве активного ингредиента), соответственно, трем получавшим ранее препараты собакам-кобелям породы бигль (диапазон массы тела: 10,1-10,8 кг) с 5-дневным периодом отмывки. Для стимулирования глотания и обеспечения доставки капсул в желудок вводили перорально приблизительно 5 мл воды из-под крана. Образцы плазмы забирали до введения дозы и через 0,5, 1, 2, 4, 6, 8, 12 и 24 часа после введения дозы. Концентрации Соединения 1 в плазме определяли методом жидкостной хроматографии с тандемной масс-спектрометрией (ЖХ/МС/МС). Результаты приведены в таблице 20.
[00365] В случае, когда Соединение 1 вводили собакам перорально натощак в дозах 24,5-28,5 мг/кг 1 раз в сутки, экспозиция Соединения 1 (определяемая на основании AUC и Cmax) была значительно выше, если препарат вводили в виде Формы I гидробромидной соли по сравнению с формой свободного основания.
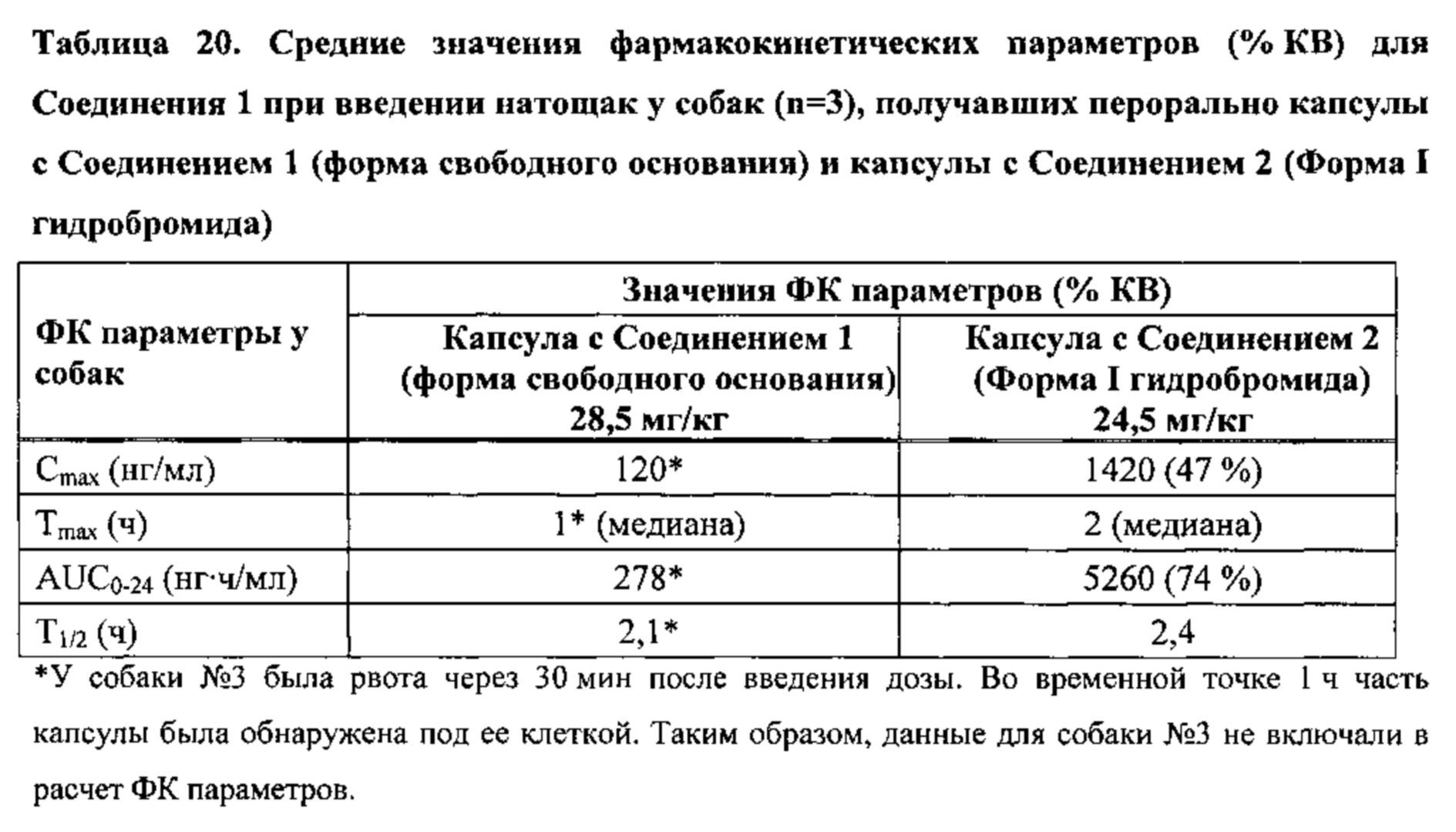
Пример 15
Фармакокинетическое исследование 2 на собаках
[00366] Соединение 1 в форме свободного основания и Соединение 2 в виде Формы I моногидробромидной (HBr) соли оценивали в перекрестном ФК исследовании на собаках, в котором собаки-кобели предварительно получали либо пентагастрин (для уменьшения pH в желудке), либо фамотидин (для увеличения pH в желудке) до перорального введения препаратов с целью контроля pH в желудке. Кроме того, эффект приема пищи на системную экспозицию Соединения 1 также оценивали у собак, получавших Форму I гидробромида с предварительным введением пентагастрина. Капсула с Соединением 1 в форме свободного основания состояла из свободного основания Соединения 1 в витамине Е в форме ТПГС и ПЭГ 400, помещенных в капсулу. Капсула с Формой I гидробромидной соли состояла исключительно из Формы I гидробромида, помещенной в капсулу.
[00367] Капсулы с Соединением 1 в форме свободного основания и Формой I гидробромида вводили перорально 1 раз в сутки в дозе 30 мг/кг (в качестве активного ингредиента) трем получавшим ранее препараты собакам-кобелям породы бигль (диапазон массы тела: 9,6-10,5 кг), которые до введения дозы 1) получали пентагастрин и не получали пищу, 2) получали фамотидин и не получали пищу или 3) получали пентагастрин и пищу. Период отмывки между введением препаратов составлял по меньшей мере 6 суток. В день введения в сытом состоянии собаки получали 60 граммов корма с высоким содержанием жира (Harlan Teklad 2027С), и им позволяли употребить всю пищу в течение 15-20 минут. Животным давали 10-минутный период отдыха и затем вводили капсулы, содержащие дозу. Образцы плазмы забирали до введения дозы и через 0,5, 1, 2, 4, 6, 8, 12 и 24 часа после введения дозы. Результаты приведены в таблице 21.
[00368] В случае, когда Соединение 1 вводили собакам перорально в дозе 30 мг/кг 1 раз в сутки, экспозиция Соединения 1 была значительно выше, если препарат вводили в виде гидробромидной соли по сравнению с формой свободного основания в состоянии и с низким, и с высоким pH в желудке. У собак, получавших капсулы со свободным основанием в состоянии с высоким pH в желудке, наблюдали 32-48-кратное снижение экспозиции Соединения 1 по сравнению с экспозицией в состоянии с низким pH. Влияние изменения pH в желудке на системную экспозицию Соединения 1, измеряемую как Cmax и AUC, было в значительной степени уменьшено при введении Формы I гидробромида. Введение Формы I гидробромида с пищей приводило к увеличению Cmax и AUC Соединения 1 у собак.
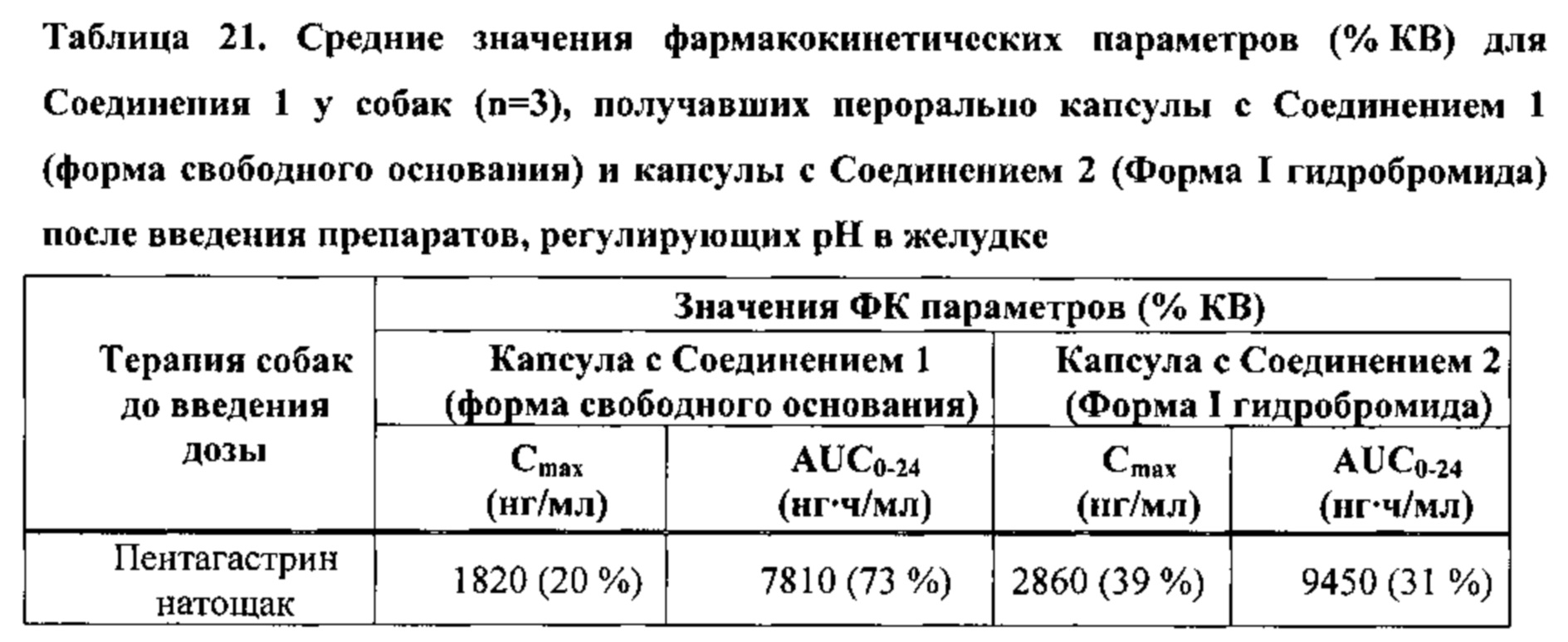
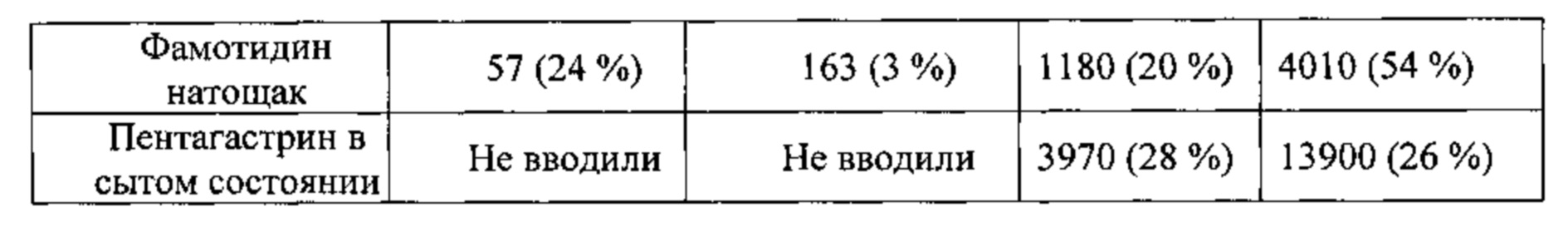
Пример 16
Введение здоровым добровольцам
[00369] Основная цель исследования заключалась в сравнении фармакокинетических (ФК) профилей для Соединения 1, вводимого в однократных дозах в виде составов на основе Формы I моногидробромида, с ФК профилями для Соединения 1 в форме свободного основания у здоровых взрослых мужчин.
[00370] Данное исследование представляло собой одноцентровое, нерандомизированное, открытое исследование с однократным введением на здоровых субъектах-мужчинах. Субъектов отбирали по пригодности для участия в исследовании вплоть до 28 суток до введения дозы. Субъектов принимали в клиническое отделение приблизительно в 9:00 утра в день до введения дозы (День - 1), и они оставались в отделении в течение 24 ч после каждого введения. Каждый субъект должен был прийти на контрольный прием через 4-6 суток после введения последней дозы.
[00371] Одной группе из 12 субъектов вводили препараты с целью получения описанных выше данных. Каждый субъект получал следующие составы в перекрестном исследовании. Введения были разделены по меньшей мере 7-дневным интервалом.
- Схема введения А: капсула, содержащая 150 мг Соединения 1 (в форме свободного основания)
- Схема введения В: состав в форме таблетки, содержащей 50 мг Соединения 2 в качестве активного ингредиента (Форма I гидробромида)
- Схема введения С: состав в форме таблетки, содержащей ≤150 мг Соединения 2 в качестве активного ингредиента (Форма I гидробромида)
[00372] Все составы вводили утром, после ночного голодания. Субъектам разрешали употребление воды вплоть до 2 ч до запланированного времени введения и их обеспечивали 240 мл воды через 2 ч после введения дозы. Начиная со времени обеда в день введения препаратов разрешали неограниченное употребление жидкостей, не содержащих кофеин.
[00373] Если по техническим причинам введение задерживали на более чем 2 ч после ожидаемого времени введения, субъекты получали 200 мл напитка Люкозад Спорт (Lucozade Sport) в первоначально запланированное время введения или раньше, если это было возможно.
[00374] Субъекты были обеспечены легкой закуской и далее воздерживались от употребления любой пищи и напитков (за исключением воды) в течение как минимум 8 часов в день перед введением дозы и вплоть до приблизительно 4 ч после введения, когда субъектов обеспечивали обедом. Ужин обеспечивали приблизительно через 9 ч после введения дозы, а вечерний легкий прием пищи - приблизительно через 14 ч после введения дозы. В последующие дни питание было обеспечено в соответствующее время.
[00375] Образцы венозной крови забирали через постоянный катетер или посредством венепункции в следующие моменты времени после введения дозы (часы): 0,5, 1, 1,5, 2, 4, 8 и 12.
[00376] Первичной конечной точкой исследования являлось сравнение ФК профилей для состава на основе Формы I гидробромида с таковыми для Соединения 1 в форме свободного основания путем измерения следующих параметров: Tlag, Cmax, Tmax, AUC(0-last), AUC(0-∞), AUC%extrap, Frel, lambda-z, Т1/2el. Вторичной конечной точкой исследования являлся сбор информации о безопасности и переносимости Соединения 1 (форма свободного основания) и Соединения 2 (Форма I гидробромидной соли) путем оценки: результатов медицинского осмотра, лабораторных тестов на безопасность, показателей жизненно важных функций, электрокардиограмм (ЭКГ), температуры тела и неблагоприятных эффектов.
[00377] Данные по концентрации в плазме сводили в таблицы и представляли графически для каждого субъекта, для которого концентрации подлежали количественному определению. Проводили ФК анализ полученных показателей концентрации в зависимости от времени с применением подходящих некомпартментных методов с целью получения оценок следующих ФК параметров (в соответствующих случаях).


Оценка пропорциональности дозы (D) по соответствию, например, Cmax/D; AUC/D
[00378] Начальная доза 50 мг гидробромида, выбранная для Схемы В (определенная по AUC), согласно ожиданиям, должна была обеспечить экспозицию, аналогичную таковой для 150 мг свободного основания. Также ожидали, что эта доза обеспечит меньшую вариабельность от пациента к пациенту.
[00379] Был проведен промежуточный анализ после завершения введения согласно Схемам А и В, во время которого рассматривали безопасность, переносимость и ФК данные. Эти данные применяли для оценки необходимости коррекции дозы. При подборе дозы для продолжения данные о безопасности как минимум от 8 подлежащих оценке субъектов (определяемых как субъекты, получившие исследуемый препарат, для которых все оценки безопасности были завершены до 24 ч) в группе должны были быть доступными для анализа. Доза, выбранная для Схемы С, согласно ожиданиям, должна была обеспечить экспозицию, аналогичную таковой для 150 мг свободного основания. Однако, если бы экспозиция для дозы 50 мг гидробромида, применяемой в Схеме В, превышала таковую для 150 мг свободного основания и доза хорошо переносилась и находилась в пределах, определенных в протоколе, Схема С не была бы применена.
[00380] Если дозу изменяли, состав на основе Формы I гидробромида вводили снова в скорректированной дозе (Схема С). Тогда следовал дополнительный период промежуточного анализа для подтверждения того, что доза в соответствии со Схемой С обеспечивала либо 1) более низкую дозу активного соединения по сравнению со Схемой А, которая обеспечивала эквивалентную или более высокую экспозицию и/или меньшую вариабельность от пациента к пациенту, или 2) дозу активного соединения, аналогичную таковой для Схемы А, характеризующуюся более высокой экспозицией и/или обеспечивающую меньшую вариабельность от пациента к пациенту.