ЦИКЛИЧЕСКИЙ С-КОНЦЕВОЙ ПЕПТИД АЦЕТИЛХОЛИНЭСТЕРАЗЫ В ЛЕЧЕНИИ ИЛИ ПРЕДУПРЕЖДЕНИИ РАКА ИЛИ МЕТАСТАЗИРОВАНИЯ
Вид РИД
Изобретение
Настоящее изобретение относится к онкологическим заболеваниям и, в частности, к новым композициям, терапиям и способам лечения, профилактики или ослабления онкологического или метастатического заболевания.
Рак и злокачественные опухоли образуют группу заболеваний, связанных с аномальным ростом клеток, с возможностью захвата или распространения на другие части тела, то есть метастазирование. В 2012 году во всем мире выявлено приблизительно 14 миллионов новых случаев рака. Поэтому существует необходимость улучшать лекарственные средства для лечения рака и метастазов.
Авторы изобретения исследовали влияние циклического пептида, полученного с С-конца ацетилхолинэстеразы (известного как «NBP-14») на различные линии раковых клеток, а также первичные опухолевые клетки, полученные от пациентов и лимфоцитов, полученных от здоровых индивидуумов в соответствующих возрастных группах, и обнаружили, что он показал умеренную апоптозную и антипролиферативную активность в каждой из тестируемых линий раковых клеток. Кроме того, они также продемонстрировали, что циклический пептид не токсичен в нормальных клетках. Соответственно, изобретатели считают, что циклические пептиды будут иметь терапевтическое преимущество при лечении рака, опухолей и метастазов.
Таким образом, в первом аспекте настоящего изобретения предложен циклический полипептид, его производное или его аналог, предназначенные для лечения, уменьшения интенсивности или профилактики онкологического или метастатического заболевания.
Во втором аспекте предложен способ лечения, уменьшения интенсивности или профилактики онкологического или метастатического заболевания у субъекта, причем способ включает введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества циклического полипептида, его производного или аналога.
Как описано в примерах, изобретатели провели исследование цитотоксичности in vitro циклического пептида, полученного с С-конца ацетилхолинэстеразы (известного как «NBP-14») на: (i) образцах первичной хронической лимфоцитарной лейкемии (ХЛЛ), полученных от пациентов с ХЛЛ с рядом прогностических маркеров (клетки МЕС-1); (ii) в KG1a (клеточные линии острой миелоидной лейкемии) и H929, и JJN3 (клеточные линии множественной миеломы); И (iii) в MCF7 и MDA-MB-231 (клеточные линии рака молочной железы). Авторы неожиданно показали, что циклический пептид, NBP-14, продемонстрировал апоптотические эффекты в каждой из клеточных линий, протестированных в концентрациях >0,1 мкМ. Более того, клетки MCF7 продемонстрировали повышенную чувствительность к NBP-14. Циклический пептид, NBP-14, продемонстрировал признаки антипролиферативной активности в клетках MDA-MB-231, и аналогичные эффекты наблюдались также в клетках JJN3, клетках KG1a, клетках МЕС-1 и H929 с концентрациями пептида >0,1 мкМ. Преимущественно они также продемонстрировали, что циклический пептид нетоксичен в нормальных клетках при тех же концентрациях.
Рак, который лечат, может представлять собой лейкемию. Например, рак может представлять собой лимфоцитарный лейкоз или хронический лимфоцитарный лейкоз (ХЛЛ). Рак может представлять собой миелоидный лейкоз или острый миелоидный лейкоз. Рак может представлять собой множественную миелому. Рак может представлять собой рак молочной железы.
Наиболее предпочтительно, чтобы циклический полипептид, его производное или аналог был использован для лечения, уменьшения интенсивности или предотвращения метастатического заболевания.
Циклические полипептиды представляют собой пептидные цепи, чьи N- и С-концы связаны между собой при помощи пептидной связи, которая образует круговую аминокислотную цепь, как показано на фиг. 8В.
Термин «его производное или аналог» может означать полипептид, в котором аминокислотные остатки заменяются остатками (независимо от того, являются ли природными аминокислоты, неприродные аминокислоты или имитирующие аминокислоты) с аналогичными боковыми цепями или свойствами пептидного скелета. Кроме того, концы таких пептидов могут быть защищены N- и С-концевыми защитными группами со свойствами, аналогичными ацетильным или амидным группам.
Производные и аналоги пептидов согласно настоящему изобретению могут также включать те, которые увеличивают период полужизни пептида in vivo. Например, производные или аналоги пептидов согласно настоящему изобретению могут включать пептидные и ретропептоидные производные пептидов, пептидпептидных гибридов и D-аминокислотные производные пептидов.
Пептоиды или поли-N-замещенные глицины представляют собой класс пептидомиметиков, боковые цепи которых присоединены к атому азота пептидного скелета, а не к альфа-углеводам, как если они находятся в аминокислотах. Пептоидные производные пептидов согласно настоящему изобретению могут быть легко сконструированы из знания структуры пептида. Ретропептоиды (в которых все аминокислоты заменены пептоидными остатками в обратном порядке) также являются подходящими производными в соответствии с настоящим изобретением. Предполагается, что ретропептоид связывается в противоположном направлении в лиганд-связывающей канавке по сравнению с пептидным или пептид-пептидным гибридом, содержащим один пептоидный остаток. В результате боковые цепи пептоидных остатков могут находиться в том же направлении, что и боковые цепи в исходном пептиде.
Предпочтительно, циклический полипептид, его производное или аналог содержит или состоит из аминокислотной последовательности, полученной из С-конца ацетилхолинэстеразы (AChE), или ее усечения.
Как описано в примерах, изобретатели были удивлены тем, что циклические AChE-производные полипептиды согласно настоящему изобретению избирательно нацелены на опухолевые клетки, а не на нормальную ткань.
Следовательно, термин «полученный из» может означать аминокислотную последовательность, которая является производным или модификацией аминокислотной последовательности, которая присутствует или образует С-конец AChE, и ее часть.
Термин «его усечение» может означать, что циклический полипептид, полученный из AChE, уменьшается в размерах путем удаления аминокислот. Восстановление аминокислот может быть достигнуто путем удаления остатков с C- или N-конца пептида до циклизации в циклический полипептид согласно изобретению или может быть достигнуто путем делеции одной или более аминокислот изнутри ядра пептида перед циклизацией.
Ацетилхолинэстераза представляет собой сериновую протеазу, которая гидролизует ацетилхолин и хорошо известна специалисту. Основная форма ацетилхолинэстеразы, которая находится в головном мозге, известна как хвостовая ацетилхолинэстераза (Т-AChE). Особенно предпочтительно, чтобы циклический полипептид, его производное или аналог содержали аминокислотную последовательность, полученную с С-конца хвостовой ацетилхолинэстеразы (T-AChE), или ее усечение.
Последовательность белка одного из вариантов ацетилхолинэстеразы человека (Gen Bank: ААА68151.1) имеет 614 аминокислот в длину, приведенная в настоящем документе как SEQ ID No: 1, является следующей:

Понятно, что первые 31 аминокислотные остатки SEQ ID No: 1 удаляются, в то время как белок высвобождается, тем самым оставляя последовательность 583 аминокислот. Соответственно, предпочтительно, чтобы циклический полипептид, его производное или аналог содержал или состоял из аминокислотной последовательности, полученной с С-конца ацетилхолинэстеразы, или ее усечения, причем ацетилхолинэстераза содержит аминокислотную последовательность, по существу, как указано в SEQ ID No: 1, предпочтительно исключая 31 аминокислоты на N-конце.
Предпочтительно, циклический полипептид, его производное или аналог содержит или состоит из аминокислотной последовательности, полученной из последних 300, 200, 100 или 50 аминокислот, образующих С-конец ацетилхолинэстеразы, или ее усечения, наиболее предпочтительно, ацетилхолинэстераза содержит или состоит из аминокислотной последовательности, по существу, как указано в SEQ ID No: 1. Циклический полипептид, его производное или аналог предпочтительно содержит или состоит из аминокислотной последовательности, полученной из последних 40 аминокислот, образующих С-конец ацетилхолинэстеразы, или ее усечения.
Предпочтительно, циклический полипептид, его производное или аналог содержит или состоит из 8-40 аминокислотных остатков, более предпочтительно от 10 до 30 аминокислот и наиболее предпочтительно от 12 до 20 аминокислот. Изобретатель подготовил три последовательности пептидов, которые были получены от С-конца AChE и которые в настоящем документе называются Т30, Т14 и Т15, где число соответствует количеству аминокислот.
Аминокислотная последовательность Т30 (которая соответствует последним 30 аминокислотным остаткам SEQ ID No: 1), представленная в настоящем документе как SEQ ID No: 2, является следующей:
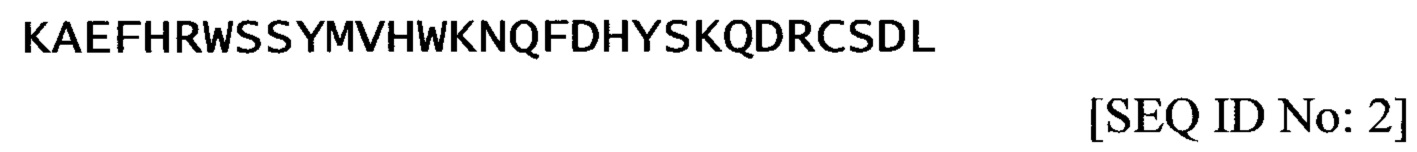
Аминокислотная последовательность Т14 (которая соответствует 14 аминокислотным остаткам, расположенным перед концом SEQ ID No: 1, и не содержит последние 15 аминокислот, обнаруженных в Т30) приведенная в настоящем документе как SEQ ID No: 3, является следующей:

Аминокислотная последовательность Т15 (которая соответствует последним 15 аминокислотным остаткам SEQ ID No: 1), представленная в настоящем документе как SEQ ID No: 4, является следующей:

Понятно, что любая из последовательностей, представленных как SEQ ID No: 2-4 может быть легко циклизована или циклизирована с образованием циклического полипептида согласно первому аспекту. Например, циклизация пептидов может быть достигнута с помощью методик циклизации «боковая цепью к боковой цепи», «боковая цепь к каркасу» или «голова к хвосту» (С-конец с N-концом). В одном предпочтительном варианте реализации изобретения циклизация «голова к хвосту» является предпочтительным способом, посредством которого образуются циклические полипептиды. Циклические полипептиды могут быть синтезированы с использованием либо классической циклизации линейного пептида в форме раствора, либо циклизации на основе смолы. Предпочтительные способы циклизации описаны в примерах. В другом предпочтительном варианте реализации изобретения полипептид получают с использованием подхода циклического расщепления, в котором циклический полипептид синтезируется путем циклизации после ступенчатого синтеза линейного пептида. Преимущество данного способа заключается в том, что боковая цепь не нуждается в закреплении, что делает подход более общим. Предпочтительно перед использованием полученные образцы циклических пептидов могут быть проанализированы с помощью MALDI-TOF MS.
Соответственно, предпочтительный полипептид согласно изобретению содержит или состоит из циклического SEQ ID No: 2, 3 или 4, или его функционального варианта или фрагмента.
Авторы обнаружили, что циклизированный SEQ ID No: 3 (т.е. упоминаемый в настоящем документе как «циклизированный Т14", "СТ14" или "NBP-14") неожиданно продемонстрировал селективную апоптозную и антипролиферативную активность в каждой из линий раковых клеток, испытанную в отношении здоровых клеток, и была нетоксичной в нормальных, не раковых клетках.
Соответственно, наиболее предпочтительный циклический полипептид согласно первому аспекту содержит или состоит из циклического SEQ ID No: 3 или его функционального варианта или фрагмента.
Понятно, что циклический полипептид согласно изобретению может быть использован в лекарственном средстве, которое может быть использовано в качестве монотерапии (т.е. использование циклического полипептида, только его производного или аналога) для лечения, уменьшения интенсивности или профилактики рака или метастаз. Альтернативно, циклический полипептид согласно изобретению может быть использован в качестве дополнения или в сочетании с известными способами лечения, уменьшения интенсивности или профилактики рака.
Циклический полипептид согласно изобретению может быть объединен в композициях, имеющих несколько различных форм, в зависимости, в частности, от способа, которым должна использоваться композиция. Таким образом, например, композиция может быть в виде порошка, таблетки, капсулы, жидкости, мази, крема, геля, гидрогеля, аэрозоля, спрея, мицеллярного раствора, трансдермального пластыря, липосомной суспензии или любой другой подходящей формы, которая может быть введена человеку или животному, нуждающемуся в лечении. Понятно, что носитель лекарственных средств в соответствии с изобретением должен представлять собой носитель, который хорошо переносится субъектом, которому он дается, и предпочтительно обеспечивает доставку циклического полипептида через гематоэнцефалический барьер при лечении опухолей головного мозга.
Циклические полипептиды согласно изобретению также могут быть включены в устройство с медленным или замедленным высвобождением. Такие устройства могут быть, например, введены в кожу или под кожу, и лекарство может выделяться в течение недель или даже месяцев. Устройство может быть расположено, по меньшей мере, рядом с участком лечения. Такие устройства могут быть особенно полезными, когда требуется длительное лечение циклическими полипептидами, используемыми в соответствии с изобретением, и которые обычно требуют частого введения (например, по меньшей мере, ежесуточной инъекции).
В предпочтительном варианте реализации изобретения лекарственные средства в соответствии с изобретением могут вводиться субъекту путем инъекции в кровоток или непосредственно в участок, требующий лечения. Например, лекарственное средство может быть введено, по меньшей мере, рядом с головным мозгом. Инъекции могут быть внутривенными (болюсная или инфузия) или подкожными (болюсная или инфузия) или внутрикожными (болюсная или инфузия).
Понятно, что требуемое количество циклического полипептида определяется его биологической активностью и биодоступностью, которая, в свою очередь, зависит от способа введения, физиохимических свойств циклического полипептида и от того, используется ли он в качестве монотерапии или в комбинированной терапии. На частоту введения будет также влиять период полужизни циклического полипептида в подлежащем лечению субъекте. Оптимальные дозы, которые следует вводить, могут быть определены специалистами в данной области и будут варьировать в зависимости от конкретного используемого циклического полипептида, концентрации фармацевтической композиции, способа введения и развития рака или метастазов. Дополнительные факторы, зависящие от субъекта, подлежащего лечению, приводящие к необходимости корректировки дозировок, включают возраст, вес, пол, диету и время введения.
Как правило, суточная доза между 0,001 мкг/кг массы тела и 10 мг/кг массы тела или между 0,01 мкг/кг массы тела и 1 мг/кг массы тела циклического полипептида согласно изобретению может быть использована для лечения, уменьшения интенсивности или профилактики рака или метастазов, в зависимости от того, какой циклический полипептид используется.
Циклический полипептид можно вводить до, во время или после начала рака. Ежесуточные дозы могут назначаться как однократное введение (например, однократная ежесуточная инъекция или ингаляция нозального спрея). Альтернативно, циклический полипептид может потребовать введения дважды или более раз в течение суток. В качестве примера, циклические полипептиды можно вводить в виде двух (или более в зависимости от тяжести рака или метастазирования) ежесуточных доз от 0,07 до 700 мг (то есть при условии, что масса тела составляет 70 кг). Пациент, получающий лечение, может принимать первую дозу после пробуждения, а затем вторую дозу вечером (в случае режима двух доз) или через 3- или 4-часовые интервалы после этого. Альтернативно, устройство медленного высвобождения может использоваться для обеспечения оптимальных доз циклического полипептида согласно изобретению пациенту без необходимости введения повторных доз.
Известные методики, такие как обычно используемые фармацевтической промышленностью (например, эксперименты in vivo, клинические испытания и т.д.) могут быть использованы для создания конкретных препаратов циклического полипептида в соответствии с изобретением и точных терапевтических режимов (такие как ежесуточные дозы агентов и частота введения). Изобретатели полагают, что они первыми предлагают композицию против рака, основанную на использовании циклического полипептида согласно изобретению.
Следовательно, в третьем аспекте настоящего изобретения предлагается противораковая или антиметастатическая фармацевтическая композиция, содержащая терапевтически эффективное количество циклического полипептида, его производного или аналога в соответствии с первым аспектом, и необязательно фармацевтически приемлемый носитель.
Изобретение также предусматривает в четвертом аспекте способ получения противораковой или антиметастатической фармацевтической композиции в соответствии с третьим аспектом, причем способ включает объединение терапевтически эффективного количества циклического полипептида, его производного или аналога в соответствии с первым аспектом, с фармацевтически приемлемым носителем.
Циклический полипептид, его производное или аналог предпочтительно содержит или состоит из Cyclic Т14 (то есть NBP-14), как описано в настоящем документе, то есть SEQ ID No: 3.
«Субъект» может представлять собой позвоночное, млекопитающее или домашнее животное. Следовательно, лекарственные средства в соответствии с настоящим изобретением могут быть использованы для лечения любого млекопитающего, например, сельскохозяйственного животного (например, лошади), домашних животных или могут использоваться в других ветеринарных целях. Наиболее предпочтительно, однако, субъект представляет собой человека.
«Терапевтически эффективное количество» циклического полипептида представляет собой любое количество, которое при введении субъекту представляет собой количество активного агента, которое необходимо для лечения рака или метастаз, или для достижения желаемого эффекта. Циклический полипептид, его производное или аналог можно использовать в качестве адъюванта для лечения солидных или метастатических опухолей, например, с помощью химиотерапии или лучевой терапии. Это означает, что требуются более низкие дозы и время воздействия химиотерапии и/или лучевой терапии.
Например, терапевтически эффективное количество используемого циклического полипептида может составлять от около 0,001 мг до около 800 мг и предпочтительно от около 0,01 мг до около 500 мг.
«Фармацевтически приемлемый носитель», как указано в настоящем документе, представляет собой любое известное соединение или комбинацию известных соединений, которые известны специалистам в данной области техники для использования в создании фармацевтических композиций.
В одном варианте реализации изобретения фармацевтически приемлемый носитель может быть твердым, а композиция может находиться в форме порошка или таблетки. В то же время фармацевтический носитель может быть жидкостью, а фармацевтическая композиция находится в форме раствора. Жидкие фармацевтические композиции, которые являются стерильными растворами или суспензиями, могут быть использованы, например, для инъекции внутримышечно, интратекально, эпидурально, внутрибрюшинно, внутривенно и в частности подкожно.
Циклический полипептид и композиции согласно изобретению можно вводить перорально в виде стерильного раствора или суспензии, содержащей другие растворенные вещества или суспендирующие агенты (например, достаточное количество солевого раствора или глюкозы, чтобы сделать раствор изотоническим), желчные соли, аравийскую камедь, желатин, моноолеат сорбитана, полисорбат 80 (сложные эфиры олеинов сорбита и его ангидриды, сополимеризованные с этиленоксидом) и тому подобное. Циклический полипептид, используемый в соответствии с изобретением, также может вводиться перорально либо в форме жидкой или твердой композиции. Композиции, подходящие для перорального введения, включают твердые формы, такие как пилюли, капсулы, гранулы, таблетки и порошки и жидкие формы, такие как растворы, сиропы, эликсиры и суспензий. Формы, пригодные для парентерального введения, включают стерильные растворы, эмульсии и суспензии.
Понятно, что изобретение распространяется на любую нуклеиновую кислоту или пептид или вариант, производное или аналог, который содержит по существу аминокислотную или нуклеотидную последовательности любой из последовательностей, упомянутых в настоящем документе, включая функциональные варианты или их функциональные фрагменты. Термины «по существу аминокислотная/нуклеотидная/пептидная последовательность», «функциональный вариант» и «функциональный фрагмент» могут представлять собой последовательность, которая имеет по меньшей мере 40% идентичность последовательности с аминокислотными/нуклеотидными/пептидными последовательностями любой одной из последовательностей, упомянутых в настоящем документе, например, 40% идентичности с последовательностью, идентифицированной как SEQ ID No: 1-4, и так далее.
Аминокислотные/полинуклеотидные/полипептидные последовательности с идентичностью последовательности, которая составляет более 65%, более предпочтительно более 70%, еще более предпочтительно более 75% и еще более предпочтительно более 80% идентичности последовательности с любой из указанных последовательностей, также предусмотрены. Предпочтительно аминокислотная/полинуклеотидная/полипептидная последовательность имеет по меньшей мере 85% идентичности с любой из упомянутых последовательностей, более предпочтительно по меньшей мере 90% идентичности, еще более предпочтительно по меньшей мере 92% идентичности, еще более предпочтительно по меньшей мере 95% идентичности, еще более предпочтительно по меньшей мере 97% идентичности, еще более предпочтительно по меньшей мере 98% идентичности и, наиболее предпочтительно, по меньшей мере 99% идентичности с любой из последовательностей, упомянутых в настоящем документе.
Квалифицированный специалист будет способен рассчитать процентное соотношение между двумя аминокислотными/полинуклеотидными/полипептидными последовательностями. Чтобы рассчитать процентное соотношение между двумя аминокислотными/полинуклеотидными/полипептидными последовательностями, сначала необходимо подготовить выравнивание двух последовательностей с последующим вычислением значения идентичности последовательности. Процент идентичности для двух последовательностей может принимать разные значения в зависимости от: - (i) способа, используемого для выравнивания последовательностей, например, ClustalW, BLAST, FASTA, Smith-Waterman (реализованы в разных программах), или структурное выравнивание от 3D-сравнения; и (ii) параметров, используемых методом выравнивания, например локальное или глобальное выравнивание, используемая матрица парных байт (например, BLOSUM62, РАМ250, Gonnet и т.д.) и штрафы за пропуск в последовательности, например, функциональная форма и константы.
При выравнивании существует множество различных способов вычисления процентной идентичности между двумя последовательностями. Например, можно разделить число тождеств на: (i) длину самой короткой последовательности; (ii) длину выравнивания; (iii) среднюю длину последовательности; (iv) количество нелокальных позиций; или (iv) количество эквивалентных позиций, исключая концевые нуклеотиды. Кроме того, будет понятно, что процентная идентичность также сильно зависит от длины. Следовательно, чем короче пара последовательностей, тем выше идентичность последовательности, которую можно случайно ожидать.
Следовательно, будет понятно, что точное выравнивание последовательностей ДНК или белков является сложным процессом. Популярная программа множественного выравнивания ClustalW (Thompson et al, 1994, Nucleic Acids Research, 22, 4673-4680; Thompson et al, 1997, Nucleic Acids Research, 24, 4876-4882) является предпочтительным способом для генерирования множественных выравниваний белков или ДНК в соответствии с изобретением. Подходящими параметрами для ClustalW могут быть следующие: Для ДНК-выравниваний: Штраф на внесение делеции в выравнивание = 15,0, Штраф на продолжение делеции = 6,66 и Матрица = Identity. Для выравнивания белка: Штраф на внесение делеции в выравнивание = 10,0, Штраф на продолжение делеции = 0,2 и Матрица = Gonnet. Для выравнивания ДНК и белка: ENDGAP=-1, a GAPDIST=4. Специалисты в данной области техники должны знать, что может быть необходимо изменить эти и другие параметры для оптимального выравнивания последовательности.
Предпочтительно вычисление процентных идентичностей между двумя аминокислотными/полинуклеотидными/полипептидными последовательностями затем может быть вычислено из такого выравнивания, как (N/T)*100, где N представляет собой число положений, в которых последовательности имеют одинаковый остаток, а Т - общее количество позиций, включая пробелы, но исключая концевые остатки. Следовательно, наиболее предпочтительный способ вычисления процентной идентичности между двумя последовательностями включает (i) подготовку выравнивания последовательности с использованием программы ClustalW с использованием подходящего набора параметров, например, как указано выше; и (ii) вставку значений N и Т в следующую формулу: - идентичность последовательности = (N/T)*100.
Специалистам в данной области техники будут известны альтернативные способы идентификации подобных последовательностей. Например, по существу подобная нуклеотидная последовательность будет кодироваться последовательностью, которая гибридизуется с последовательностями ДНК или их дополнениями в строгих условиях. Под жесткими условиями мы подразумеваем, что нуклеотид гибридизуется с фильтруемой ДНК или РНК в 3х хлориде натрия /цитрате натрия (SSC) при приблизительно 45°С, за которой следует, по меньшей мере, одна промывка в 0,2х SSC/0,1% SDS при приблизительно 20-65°С. Альтернативно, по существу аналогичный полипептид может отличаться по меньшей мере на 1, но менее 5, 10, 20, 50 или 100 аминокислот из последовательностей, показанных в SEQ ID No: 1-4.
Из-за вырождения генетического кода ясно, что любая последовательность нуклеиновой кислоты, описанная в настоящем документе, может быть изменена или изменена без существенного влияния на последовательность белка, кодируемого таким образом, для обеспечения ее функционального варианта. Подходящими вариантами нуклеотидов являются те, которые имеют последовательность, измененную путем замещения различных кодонов, которые кодируют одну и ту же аминокислоту в последовательности, тем самым вызывая молчаливое изменение. Другими подходящими вариантами являются те, которые имеют гомологичные нуклеотидные последовательности, но содержат все или части последовательности, которые изменяются путем замещения различных кодонов, которые кодируют аминокислоту с боковой цепью с аналогичными биофизическими свойствами с аминокислотой, которую она замещает, для получения консервативной замены. Например, малые неполярные, гидрофобные аминокислоты включают глицин, аланин, лейцин, изолейцин, валин, пролин и метионин. Большие неполярные, гидрофобные аминокислоты включают фенилаланин, триптофан и тирозин. Полярно-нейтральные аминокислоты включают серии, треонин, цистеин, аспарагин и глутамин. Положительно заряженные (основные) аминокислоты включают лизин, аргинин и гистидин. Отрицательно заряженные (кислотные) аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту. Поэтому следует понимать, какие аминокислоты могут быть заменены аминокислотой, имеющей сходные биофизические свойства, и квалифицированный специалист будет знать нуклеотидные последовательности, кодирующие эти аминокислоты.
Все описанные в настоящем документе функции (включая любые сопроводительные формулы изобретения, реферат и графические материалы) и/или все этапы любого раскрытого способа или процесса могут быть объединены с любым из вышеуказанных аспектов в любой комбинации, за исключением комбинаций, где, по меньшей мере, некоторые из таких функций и/или шагов являются взаимоисключающими.
Для лучшего понимания изобретения и для того, чтобы показать, как варианты реализации того же могут быть введены в действие, будет сделана ссылка, в качестве примера, на Фигуры, в которых: -
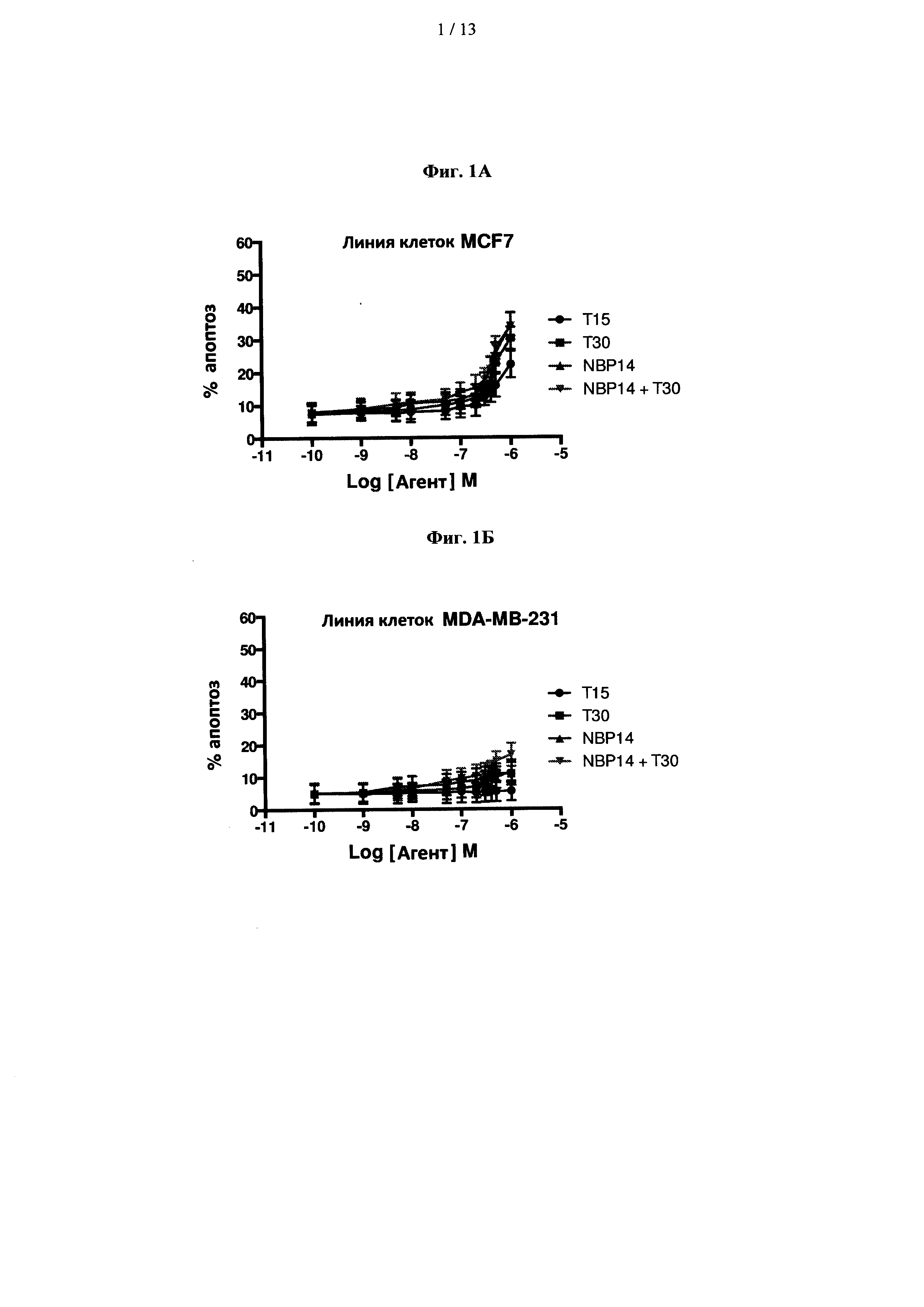
На фиг. 1 показано сравнение цитотоксических эффектов Т15 (SEQ ID No: 4), Т30 (SEQ ID No: 2) и одного варианта реализации циклического полипептида согласно изобретению, то есть NBP-14 (SEQ ID No: 3), в линиях клеток рака молочной железы (A) MCF7 и (В) MDA-MB-231. Все анализы проводили в двух повторностях и представляли в виде среднего (±SD (стандартное отклонение)) трех независимых экспериментов;
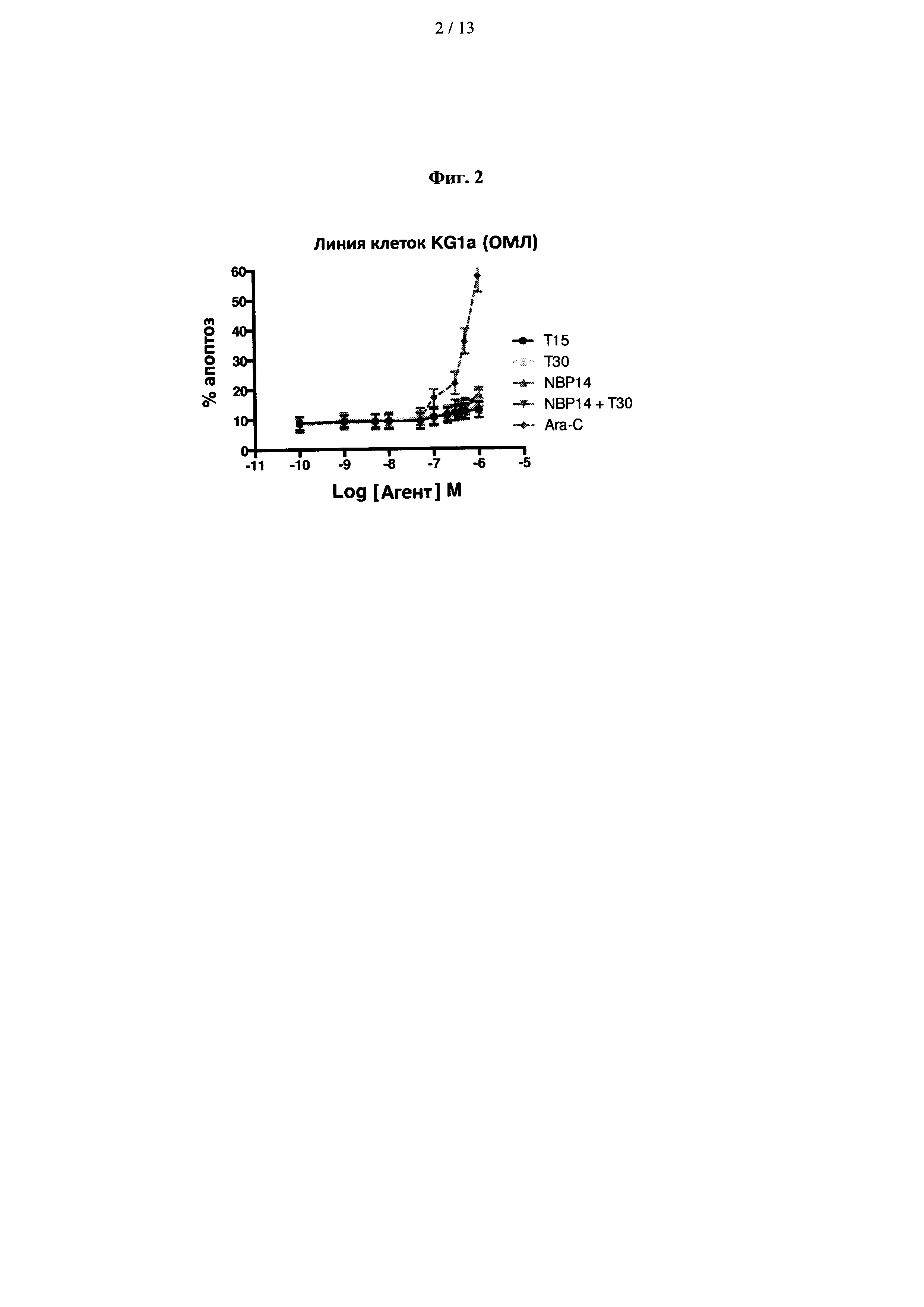
На фиг. 2 показано сравнение цитотоксических эффектов Т15, Т30, NBP-14 и Ara-С в линии клеток KG1a. Все анализы проводили в двух повторностях и представляли в виде среднего (±SD) трех независимых экспериментов;
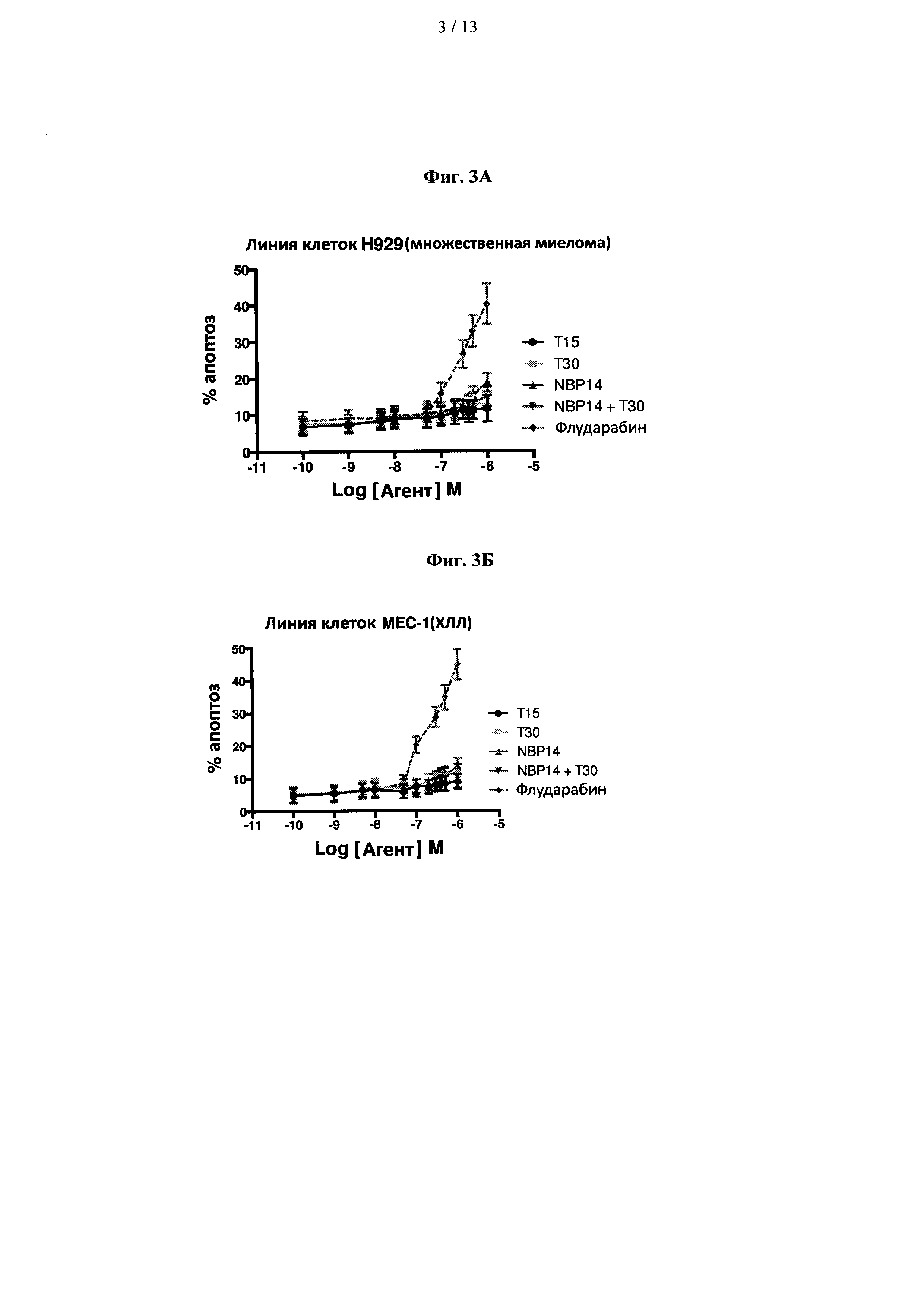
На фиг. 3 показано сравнение цитотоксических эффектов Т15, Т30, NBP-14 и флударабина в линиях клеток (А) H929 и (В) МЕС-1. Все анализы проводили в двух повторностях и представляли в виде среднего (±SD) трех независимых экспериментов;
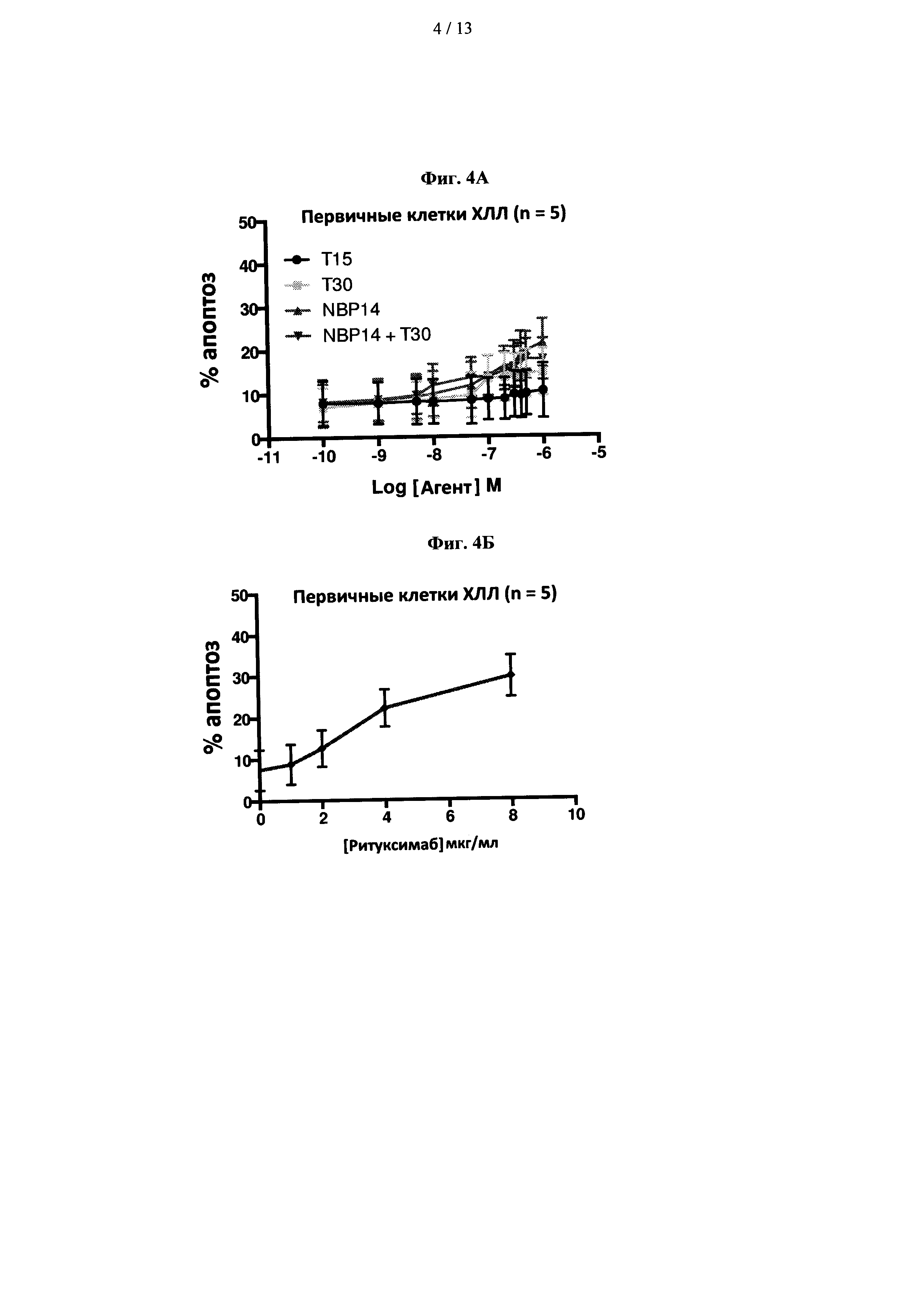
На фиг. 4А показано сравнение цитотоксических эффектов Т15, Т30, NBP-14 в первичных клетках ХЛЛ. На фиг. 4(B) показано влияние моноклонального антитела против CD20, для сравнения приведен ритуксимаб. Все анализы проводили в двух повторностях и представляли в виде среднего (±SD) пяти независимых экспериментов;
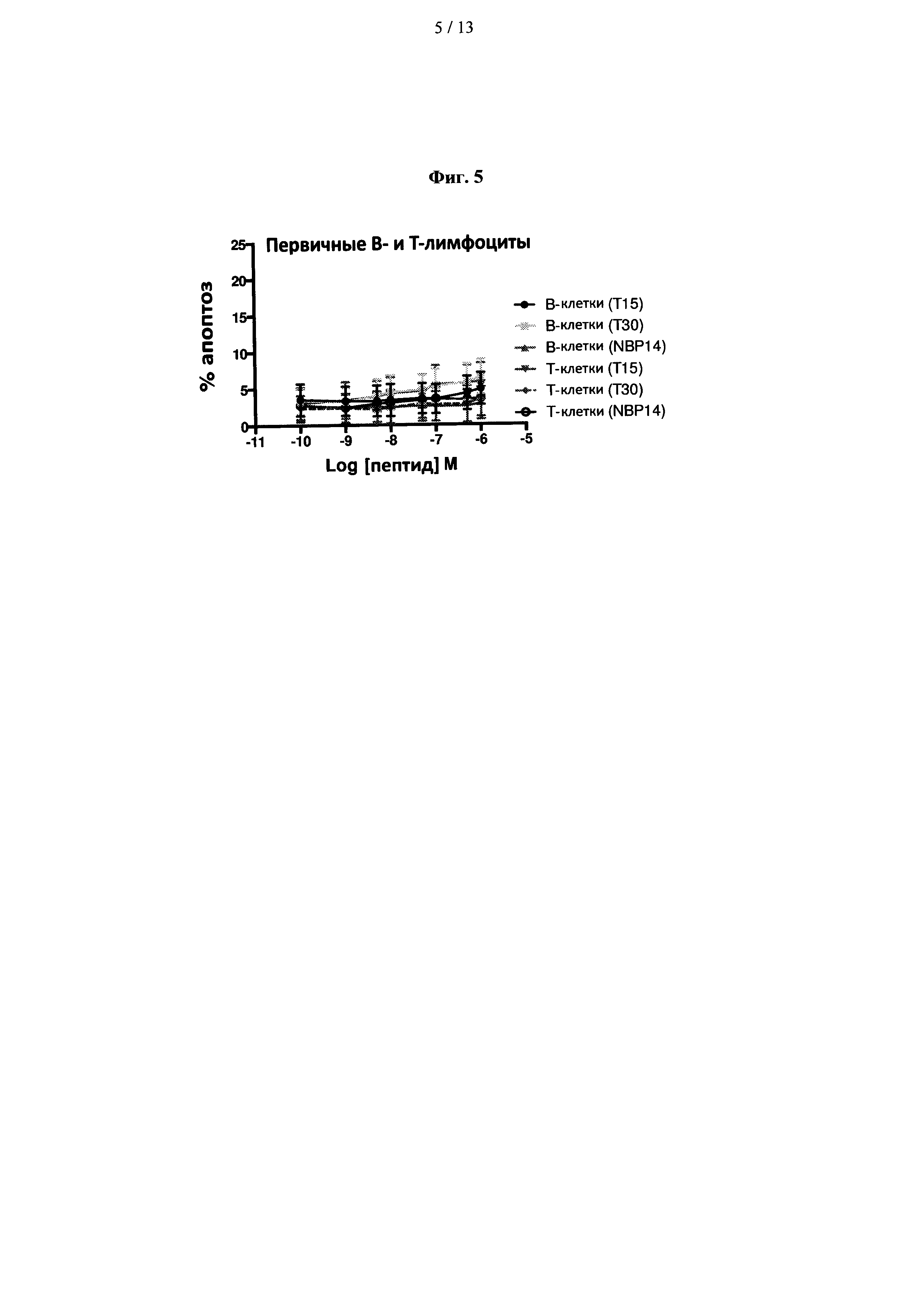
На фиг. 5 показано сравнение эффектов пептидов Т15, Т30 и NBP-14 в нормальных В- и Т-лимфоцитах. Все анализы проводили в двух повторностях и данные представлены в виде среднего (±SD) трех независимых экспериментов;
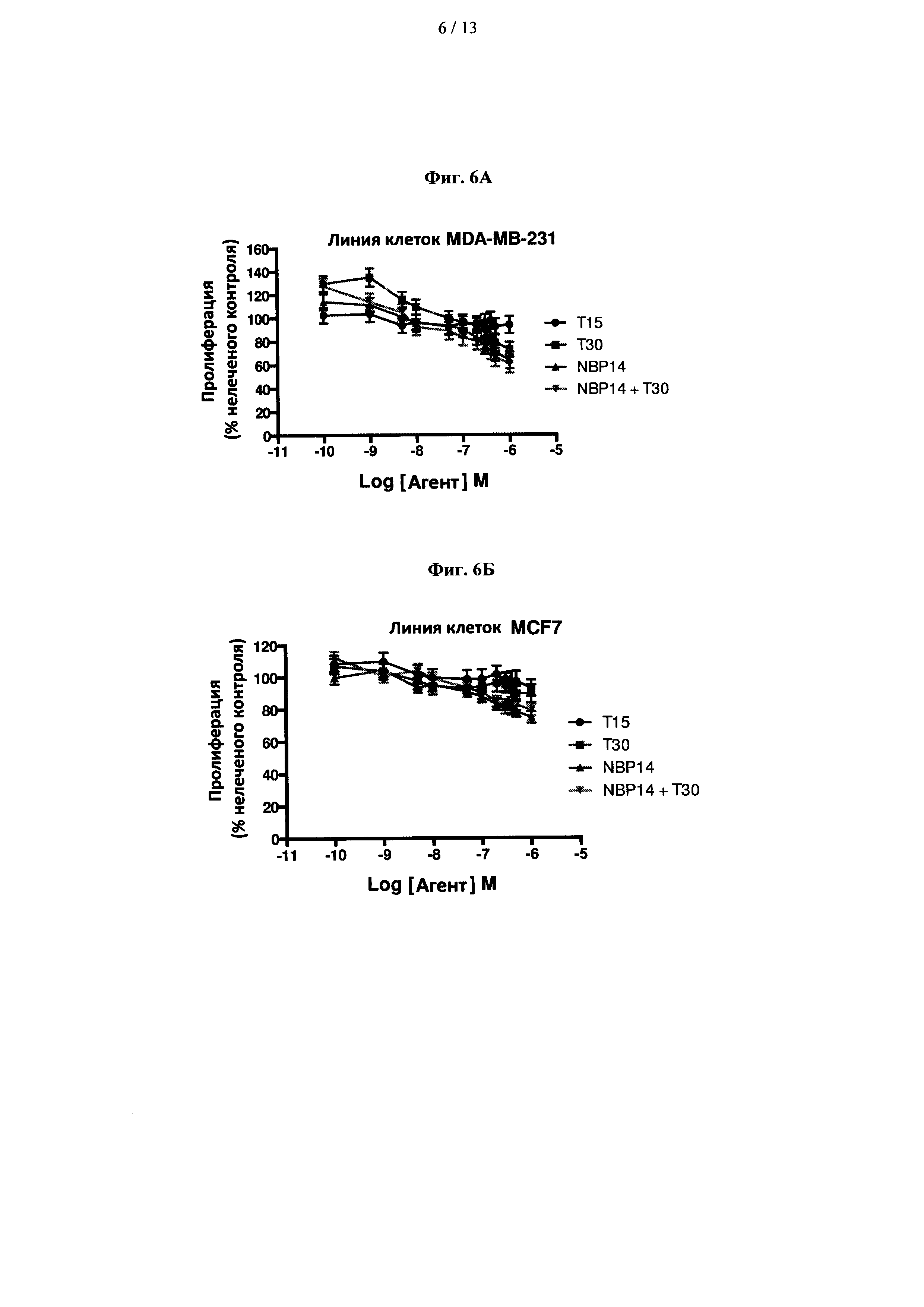
На фиг. 6 показано сравнение антипролиферативных эффектов Т15, Т30 и NBP-14 в клетках (A) MDA-MB-231 и (В) MCF7. Все анализы проводили в двух повторностях и данные представлены в виде среднего (±SD) трех независимых экспериментов;
На фиг. 7 показано сравнение антипролиферативных эффектов Т15, Т30 и NBP-14 в клетках (A) KG1a и (В) клетках МЕС-1 и (С) H929. Все анализы проводили в двух повторностях и данные представлены в виде среднего (±SD) трех независимых экспериментов;
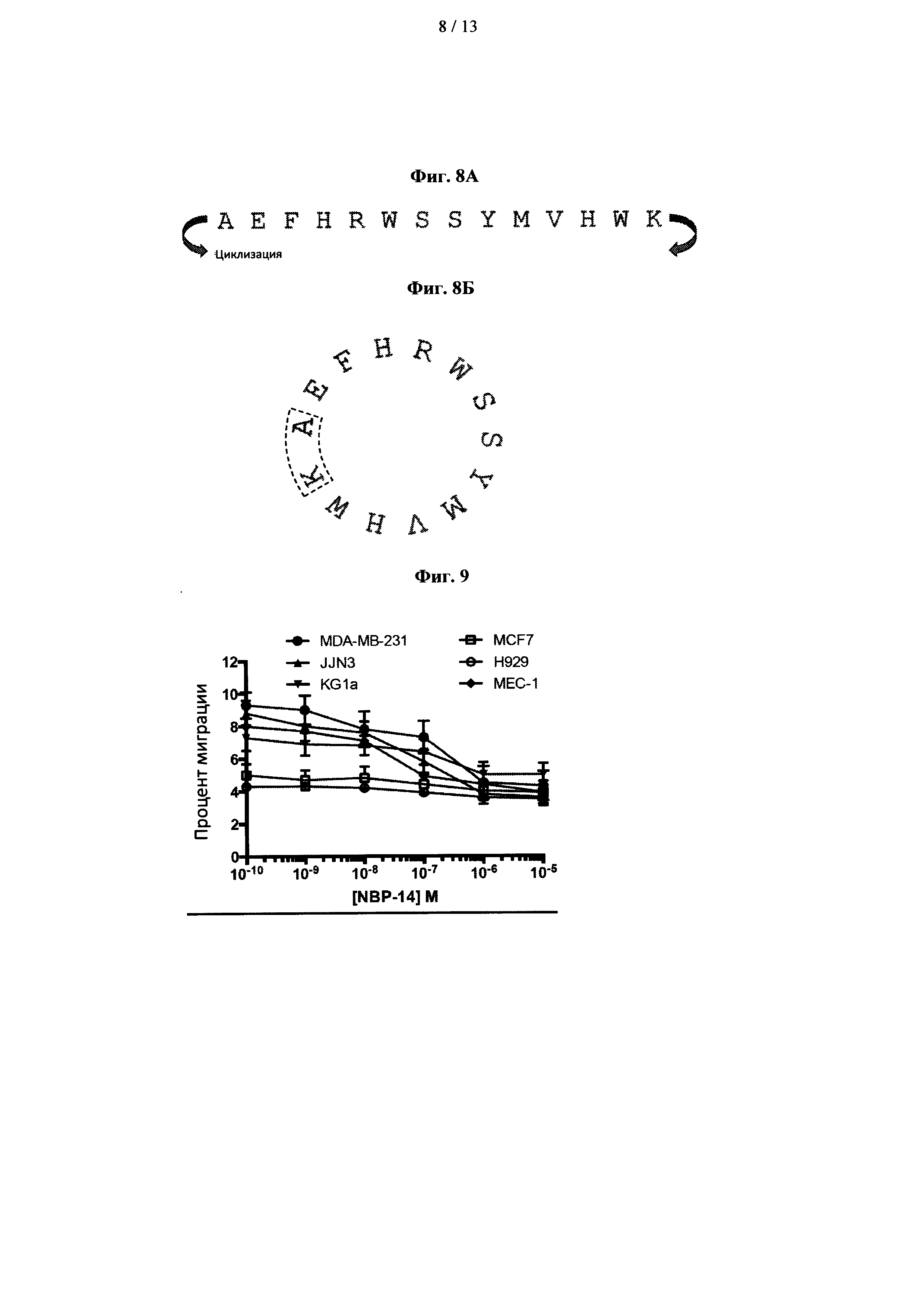
На фиг. 8А показана последовательность NBP-14 с концевыми остатками аланина (А) и лизина (K), образующими сайты циклизации. На фиг. 8В показан циклический пептид NBP-14, в котором концевые остатки аланина и лизина связаны между собой;
На фиг. 9 показано сравнение антимиграционных дозовых реакций, индуцированных пептидом NBP-14 в линиях раковых клеток MDA-MB-231, MCF7, JJN3 и KG1a. Все данные представлены как среднее (±SD) трех независимых экспериментов. *; Р<0,05;
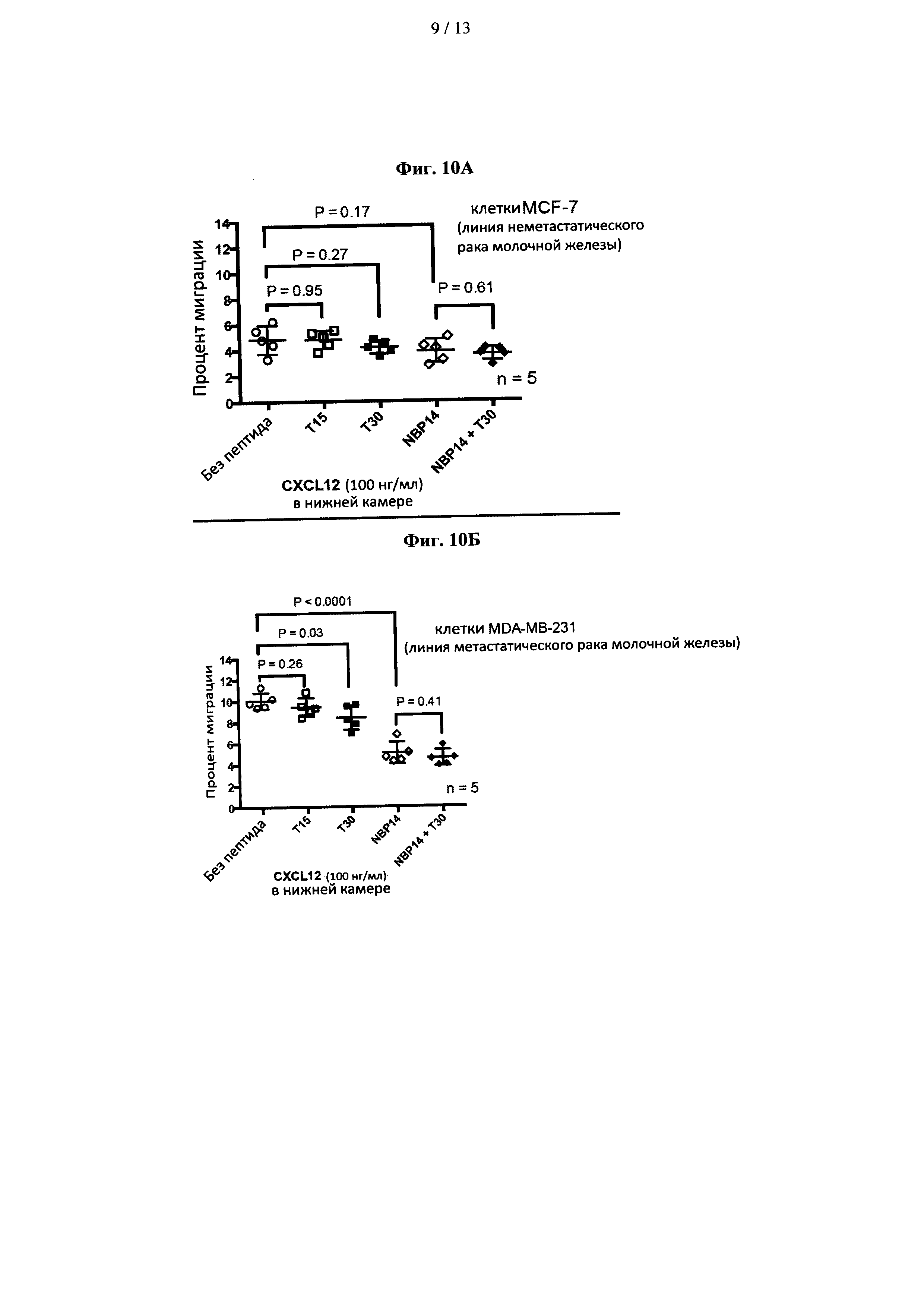
На фиг. 10 показано сравнение противомиграционных эффектов Т15, Т30, NBP-14 в линиях клеток рака молочной железы (A) MCF7 и (В) MDA-MB-231. Все данные представлены как среднее (±SD) пяти независимых экспериментов;
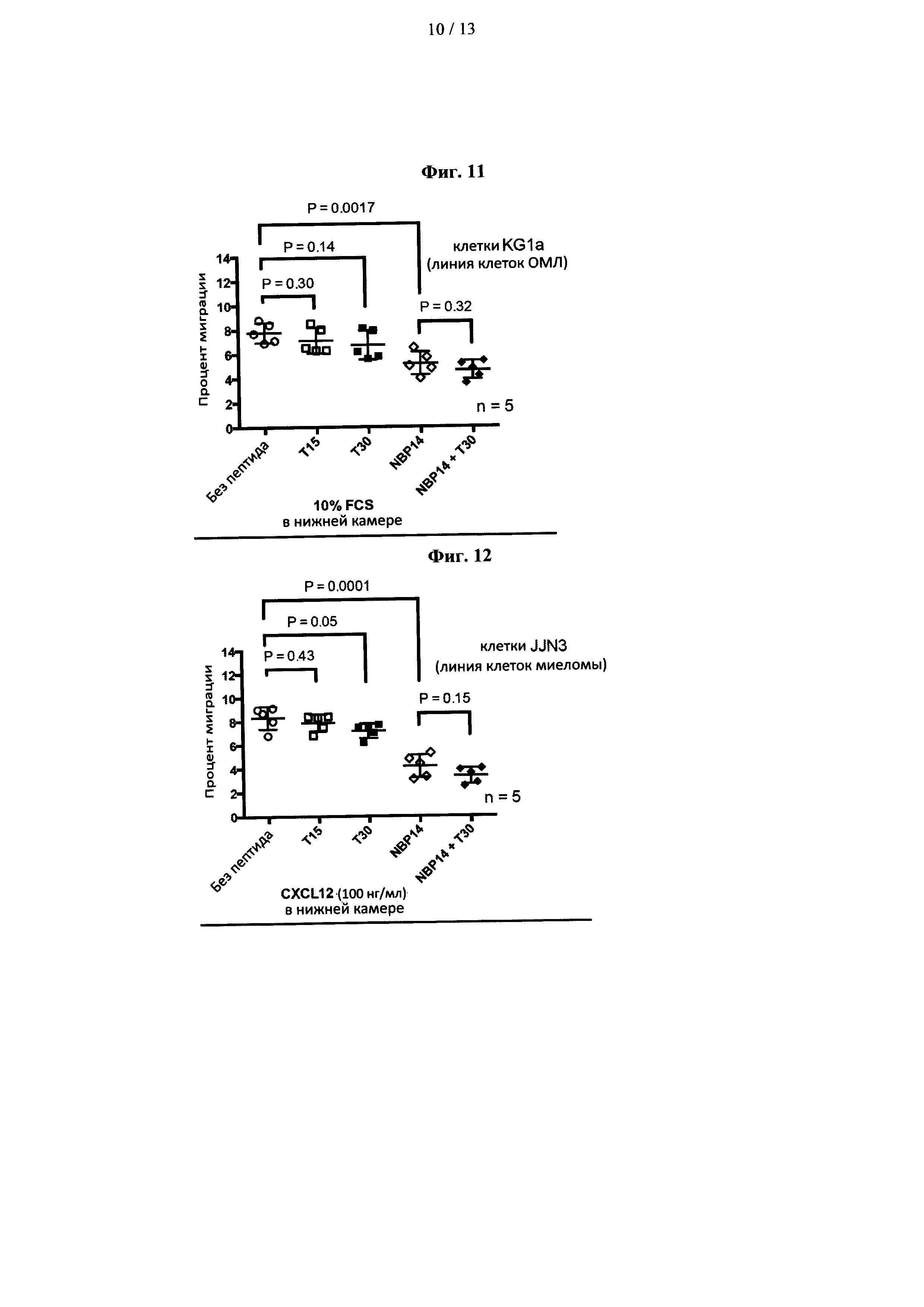
На фиг. 11 показано сравнение противомиграционных эффектов Т15, Т30, NBP-14 в линии клеток KG1a. Все данные представлены как среднее (±SD) пяти независимых экспериментов;
На фиг. 12 показано сравнение противомиграционных эффектов Т15, Т30, NBP-14 в линии клеток JJN3. Все данные представлены как среднее (±SD) пяти независимых экспериментов;
На фиг. 13 показано сравнение цитотоксических эффектов Т15, Т30, NBP-14 в первичных клетках ХЛЛ. Все анализы проводили в двух повторностях и данные представлены в виде среднего (±SD) десяти независимых экспериментов;
На фиг. 14 показано сравнение антимиграционных эффектов пептидов Т15, Т30 и NBP-14 на нормальных В-клетках. Все анализы проводили в двух повторностях и данные представлены в виде среднего (±SD) пяти независимых экспериментов;
На фиг. 15 показано сравнение влияния пептидов NBP-14 в первичных клетках ХЛЛ и нормальных В-лимфоцитах. Все анализы проводили в двух повторностях и данные представлены в виде среднего (±SD) трех независимых экспериментов;
На фиг. 16 показана корреляция между исходным уровнем миграции и процентным уменьшением миграции, вызванным NBP-14;
На фиг. 17 показано количество исходной миграции в различных клеточных линиях в отсутствие NBP-14, включая MDA-MB-231, клетки ХЛЛ, нормальные В-клетки, клетки МЕС-1, JJN3, KG1a, MCF7 и H929; а также
На фиг. 18 показано процентное снижение миграции, индуцированное 1 мкМ NBP-14 в различных клеточных линиях, включая MDA-MB-231, клетки ХЛЛ, нормальные В-клетки, клетки МЕС-1, JJN3, KG1a, MCF7 и H929.
Примеры
Обоснование
Авторы изобретения создали ряд линейных и циклических пептидов на основе С-конца ацетилхолинэстеразы, известные как пептиды Т15, Т30 и NBP-14, и оценили их эффекты в ряде линий клеток и первичных лейкозных клеток, полученных от пациентов. Необходимо отметить, что SEQ ID No: 3 упоминается в настоящем документе как «циклический Т14», «СТ14» или «NBP-14» и представляет собой циклический пептид с аминокислотной последовательностью, полученной из С-конца хвостовой ацетилхолинэстеразы.
Цели
1. Определить цитотоксический и цитостатический профиль NBP-14 в ряде моделей рака человека in vitro; а также
2. Оценить влияние NBP-14 на нормальные В- и Т-лимфоциты.
Материалы и способы
Циклизация пептидов
Для достижения циклизации линейных пептидов, описанных в настоящем документе, использовались три метода, то есть циклизация «боковая цепь к боковой цепи», «боковая цепь к каркасу» или «голова к хвосту» (С-конец с N-концом). Циклизация «голова к хвосту» была широко исследована и может включать направленную Cys-Cys-дисульфидную циклизацию (до двух на молекулу). Тщательный мониторинг реакции обеспечивает 100% циклизацию. Для синтеза используются два общих подхода: (1) классическая циклизация линейного пептида в форме раствора в условиях высокого разбавления; и (2) циклизация на основе смолы. В твердофазном синтезе (1) были использованы два разных протокола (1): -
(a) Была проведена циклизация пептида на смоле, закрепленная через функциональную группу боковой цепи, такую как имидазол, 3 кислота, 4 амин или спирт. Пептид был ортогонально защищен в качестве сложного эфира на С-конце, и затем пептид собирали посредством регулярного синтеза Воc или Fmoc с последующим омылением, циклизацией и расщеплением.
(b) Другим протоколом, который использовался, был подход циклического расщепления, в котором циклический пептид синтезировали путем циклизации после ступенчатого синтеза линейного пептида. Преимущество данного способа заключается в том, что боковая цепь не нуждается в закреплении, что делает подход более общим, чем (a). (Christopher J. White and Andrei K. Yudin (2011) Nature Chemistry 3; Valero et al (1999) J Peptide Res. 53, 76-67; Lihu Yang and Greg Morriello (1999) Tetrahedron Letters 40, 8197-8200; Parvesh Wadhwani et al (2006) J. Org. Chem. 71, 55-61).
KG1a, H929, MCF7, MDA-MB-231, МЕС-1 и первичные условия культивирования клеток ХЛЛ
Клеточная линия острой миелоидной лейкемии (ОМЛ) KG1a поддерживалась в среде RPMI (Invitrogen), дополненной 100 единиц/мл пенициллина, 100 мкг/мл стрептомицина и 20% фетальной телячьей сыворотки. Линия клеток множественной миеломы (MM) H929, две линии клеток рака молочной железы (MCF7 и MDA-MB-231), клетки МЕС-1 и первичные хронические лимфоцитарные лейкозные клетки культивировались на среде RPMI, дополненной 100 единиц/мл пенициллина, 100 мкг/мл стрептомицина и 10% фетальной телячьей сыворотки. Используемая среда содержала ацетилхолин, но после первоначального набора экспериментов в культуральную среду добавляли еще 100 мкМ ацетилхолина. Клетки затем аликвотировали (106 клеток/мл) в 24-луночные планшеты и инкубировали при 37°С в увлажненной 5% атмосфере диоксида углерода в течение 72 часов в присутствии пептидов (Т15, Т30, NBP-14 и комбинации Т30 + NBP-14) при концентрациях от 0,1 до 1 мкМ. Кроме того, подготавливали контрольные культуры, в которые не добавляли пептид. Затем клетки собирали путем центрифугирования и анализировали с помощью проточной цитометрии с использованием анализа аннексином В или рассчитывали с использованием счетчика жизнеспособности клеток V-Cell XR (Beckman Coulter).
Измерение апоптоза in vitro
Культивированные клетки собирали путем центрифугирования, а затем ресуспендировали в 195 мкл богатого кальцием буфера. Затем к клеточной суспензии добавляли 5 мкл аннексина В (eBiosciences) и клетки инкубировали в темноте в течение 10 минут перед отмывкой. Клетки окончательно ресуспендировали в 190 мкл богатого кальцием буфера вместе с 10 мкл пропидиум иодид. Апоптоз оценивали с помощью двухцветной иммунофлуоресцентной проточной цитометрии с использованием проточного цитометра Accuri С6, и данные анализировали с использованием программного обеспечения CFlow (BD Biosciences).
Измерение пролиферации in vitro
Культивируемые клетки собирали путем центрифугирования и затем подсчитывали с использованием счетчика жизнеспособности клеток Vi-Cell XR. Количество жизнеспособных клеток в каждой культуре затем выражали в процентах от жизнеспособных клеток в контрольных культурах (без пептида).
Статистический анализ
Весь статистический анализ был выполнен с использованием программного обеспечения Graphpad Prism 6.0 (Graphpad Software Inc.).
Анализ цитотоксичности in vitro
Чувствительность к лекарственному средству in vitro измеряли с использованием анализа аннексии В/пропидиум иодид. Сравнение эффектов каждого пептида отдельно или в комбинации в различных линиях клеток и первичных клетках показано ниже.
Пример 1 - Циклический Т14 (т.е. "NBP-14")
«Хвостовая» ацетилхолинэстераза (T-AChE) экспрессируется в синапсах, и авторы изобретения ранее идентифицировали два пептида, которые могли быть отщеплены от ее С-конца, один из которых называется «Т14» (длиной 14 аминокислот), а другой известен как «Т30» (длиной 30 аминокислот), и оба они имеют сильную гомологию последовательностей со сравнимой областью β-амилоида.
Аминокислотная последовательность линейного пептида Т14 представляет собой 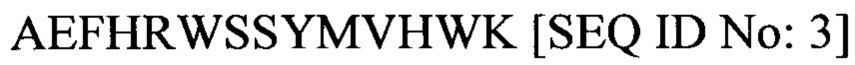 .
.
Аминокислотная последовательность линейного пептида Т30 представляет собой 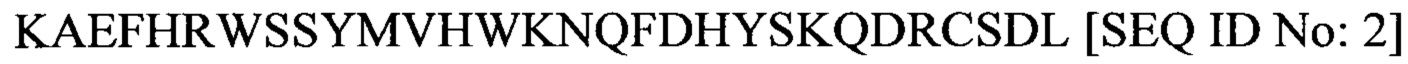 .
.
Другой пептид, обозначаемый как «Т15», соответствует последним 15 аминокислотным остаткам SEQ ID No: 1, т.е. 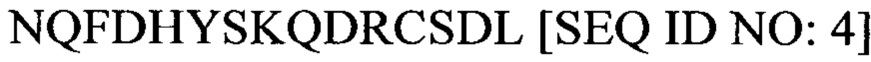 .
.
С-концевой пептид AChE «Т14» был идентифицирован как существенная часть молекулы AChE, ответственная за ее диапазон негидролитических активностей. Синтетический пептидный аналог 14 аминокислот (т.е. "Т14"), и затем более крупная, более стабильная и более активная аминокислотная последовательность, в которую он встроен (т.е. "Т30") отображают действия, сопоставимые с теми, которые были представлены для «нехолинергических» AChE.
На фиг. 8А, показан пептид Т14 длиной 14 аминокислот (т.е. "NBP-14"). Циклический пептид, NBP-14, был циклизован через концевые остатки аланина (А) и лизина (К) и показан на фиг. 8В. Циклизация может быть достигнута несколькими различными способами. Например, Genosphere Biotechnologies (Франция) выполнила циклизацию Т14, превратив линейный пептид в N-концевой-С-концевой лактам. Циклизация Т14 для создания циклического NBP-14 объединяет оба конца, то есть HWK-AEF.
Пример 2. Влияние пептидов, полученных из ацетилхолинэстеразы, на клеточные линии MCF7 и MDA-MB-231
Изобретатели исследовали способность пептидов, полученных из ацетилхолинэстеразы (NBP-14 и/или Т30), индуцировать апоптоз в двух линиях клеток рака молочной железы, и результаты показаны на фиг. 1А и 1В. Клетки MCF7 продемонстрировали признаки апоптоза при концентрациях пептидов выше 0,1 мкМ. Линия клеток MDA-MB-231 менее чувствительна к воздействию пептидов в тех же условиях.
Пример 3 - Влияние пептидов, полученных из ацетилхолинэстеразы, на клеточную линию AML KG1a
Клетки KG1a культивировали с использованием пептидов в течение 72 часов и оценивали их апоптотические эффекты, и результаты показаны на фиг. 2. Для сравнения, клетки KG1a также культивировали с использованием Ara-C, широко применяемого цитотоксического средства, используемого для лечения ОМЛ. Пептиды, полученные из ацетилхолинэстеразы, проявили некоторую токсичность в клетках KG1a, и Ara-С показал дозозависимый эффект при концентрациях выше 0,1 мкМ.
Пример 4 - Влияние пептидов, полученных из ацетилхолинэстеразы, на линии В-клеток H929 и МЕС-1
Пептиды, полученные из ацетилхолинэстеразы, проявили небольшой цитотоксический эффект в клетках H929 и клетках МЕС-1, и результаты показаны на фиг. 3А и 3В. Нуклеозидный аналог флударабина индуцировал дозозависимость в обеих линиях клеток.
Пример 5 - Влияние пептидов, полученных из ацетилхолинэстеразы, в первичных клетках ХЛЛ
Далее авторы рассмотрели влияние пептидов, полученных из ацетилхолинэстеразы, в первичных клетках ХЛЛ, полученных от пациентов, и результаты показаны на фиг. 4А и 4В. NBP-14 продемонстрировал дозозависимый эффект при концентрациях выше 0,1 мкМ. Влияние на жизнеспособность первичных клеток ХЛЛ было умеренным (~20% апоптоза при 1 мкМ). Изобретатели затем сравнили этот ответ с негенотоксическим анти-CD20 моноклональным антителом (ритуксимабом). Ритуксимаб индуцировал более выраженный дозозависимый эффект при клинически используемых концентрациях агента по сравнению cNBP-14.
Пример 6 - Апоптотический эффект пептидов, полученных из ацетилхолинэстеразы, в нормальных В- и Т-лимфоцитах
Чтобы оценить влияние пептидов, полученных из ацетилхолинэстеразы, на нормальные (не злокачественные) клетки, В- и Т-лимфоциты были выделены из нормальных здоровых добровольцев (n=3). Результаты показаны на фиг. 5. Проверенные пептиды показали лишь умеренную токсичность в В- и Т-лимфоцитах.
Пример 7 - Влияние пептидов, полученных из ацетилхолинэстеразы. на пролиферацию линий клеток
Далее авторы изобретения исследовали способность пептидов, полученных из ацетилхолинэстеразы, индуцировать цитостаз, то есть ингибировать пролиферацию в различных линиях клеток, используемых в данном исследовании. Результаты показаны на фиг. 6А и 6В. Две линии клеток рака молочной железы выявили дифференциальные ответы после инкубации с пептидами, полученными из ацетилхолинэстеразы. Более пролиферативная линия клеток MDA-MB-231 продемонстрировала значительное снижение пролиферации с концентрациями пептида NBP-14 выше 0,1 мкМ по сравнению с контрольным пептидом Т15. Этот эффект не был столь значительным в менее пролиферативной линии клеток MCF7. Следует отметить, что линия клеток MDA-MB-231 проявляла повышенную пролиферацию в присутствии субнаномолярных концентраций T30 и NBP-14+T30.
Обращаясь к фиг. 7А-С, линия клеток KG1a, линия клеток МЕС-1 и линия клеток H929 продемонстрировали снижение пролиферации после инкубации с концентрациями NBP-14 выше 0,1 мкМ. Для сравнения показаны эффекты Ara-С (клетки KG1a) и флударабина (клетки МЕС-1 и H929).
Заключение
1. NBP-14 продемонстрировал умеренные апоптотические эффекты в каждой из линий клеток, протестированных в концентрациях >0,1 мкМ. Хотя клетки MCF7 показали относительно повышенную чувствительность к NBP-14, он не был преимущественно цитотоксичным в этих клетках по сравнению с контрольным пептидом (Т15) и токсичным пептидом (Т30).
2. Ни один из тестируемых пептидов не проявлял значительных цитотоксических эффектов в нормальных В- и Т-лимфоцитах.
3. NBP-14 проявлял явную антипролиферативную активность в мигрирующей линии клеток, клетках MDA-MB-231. Подобные эффекты наблюдались также в клетках KG1a, клетках МЕС-1 и клетках H929 с концентрациями пептида >0,1 мкМ. Антипролиферативный эффект на клетки MCF7 был менее выражен, но это самый медленный рост всех клеточных линий, используемых в этом исследовании.
4. Отсутствие токсичности в нормальных клетках NBP-14 обнадеживает.
5. Пептиды, полученные из ацетилхолинэстеразы, включая NBP-14, проявляют антиметастатический эффект.
На основании вышеприведенных выводов изобретатели продемонстрировали, что циклические пептиды, полученные из С-конца хвостовой ацетилхолинэстеразы и, в частности, NBP-14, то есть SEQ ID No. 3, могут быть использованы для лечения рака и предотвращения метастазирования. Соответственно, эти циклические пептиды могут использоваться в качестве адъюванта для лечения солидных или метастатических опухолей с помощью химиотерапии/лучевой терапии. Это означает, что требуются более низкие дозы и время воздействия химиотерапии и/или лучевой терапии.
Пример 8 - Влияние NBP-14 на миграцию в линиях раковых клеток и первичных образцах ХЛЛ
Для оценки потенциальной антимиграционной (антиметастатической) активности NBP-14, показанной на фиг. 8В, были проведены следующие анализы:
1. Изучить влияние NBP-14 на миграцию in vitro KG1a (линия клеток острого миелоидного лейкоза), JJN3 (линия клеток множественной миеломы) и линии клеток рака молочной железы (MDA-MB-231 и MCF-7) с использованием анализов трансвелл.
2. Изучить влияние NBP-14 на миграцию первичных образцов ХЛЛ in vitro с использованием анализов трансвелл.
3. Оцените влияние NBP-14 на миграцию нормальных В-клеток.
Клетки MDA-MB-231, KG1a и МЕС-1 представляют собой линии клеток рака с высокой способностью к миграции. JJN3, CLL и MCF-7 представляют собой линии клеток рака с меньшей способностью к миграции. В-лимфоциты представляют собой нормальные, нераковые клетки.
Обоснование
В предыдущих примерах 1-7 показано, что пептид, полученный из ацетилхолинэстеразы, ингибирует эндоцитарную активность в линии клеток метастатического рака молочной железы человека. Следующие примеры были разработаны для определения того, способен ли пептид NBP-14 ингибировать миграцию ряда линий клеток и клеток первичного лейкоза, полученных от пациентов.
Цели
1. Определить, может ли NBP-14 ингибировать миграцию опухолевых клеток в ряде моделей рака человека in vitro.
2. Оцените влияние NBP-14 на миграцию нормальных В-лимфоцитов.
Материалы и способы
KG1a, JJN3, MCF7, MDA-MB-231 и первичные клетки ХЛЛ, и нормальные условия культивирования В-клеток
Клеточная линия острой миелоидной лейкемии (ОМЛ) KG1a поддерживалась в среде RPMI (Invitrogen), дополненной 100 единиц/мл пенициллина, 100 мкг/мл стрептомицина и 5% фетальной телячьей сыворотки. Линия клеток множественной миеломы (MM) JJN3, две линии клеток рака молочной железы (MCF7 и MDA-MB-231), первичные хронические лимфоцитарные лейкозные клетки и нормальные В-лимфоциты культивировались на среде RPMI, дополненной 100 единиц/мл пенициллина, 100 мкг/мл стрептомицина и 5% фетальной телячьей сыворотки. Кроме того, в культуральную среду добавляли 100 мкМ ацетилхолина, чтобы гарантировать, что доступность ацетилхолина не является ограничивающим фактором в этих экспериментах.
Анализы миграции
Тесты на миграцию in vitro проводили с использованием трансвел пластинок для переноса размером 6,0 мкм (Costar, Корнинг, штат Нью-Йорк). В верхнюю камеру трансвел добавили 106 клеток ХЛЛ в 500 мкл среды RPMI. 100 нг/мл CXCL12 добавляли в базово-боковую камеру для всех типов клеток, испытываемых отдельно от клеток KG1a. Эти клетки не экспрессируют CXCR4 и поэтому не реагируют на CXCL12. Вместо этого в данных экспериментах были добавлены среды, содержащие 10% фетальной телячьей сыворотки. Планшеты инкубировали в течение 24 ч при 37°С в 5% СО2 в присутствии пептидов (Т15, Т30, NBP-14 и комбинации Т30+ НБП-14) в концентрациях от 0,1 до 10 мкМ. Кроме того, подготавливали контрольные культуры, в которые не добавляли пептид. Затем клетки собирали путем центрифугирования и анализировали с помощью проточной цитометрии с использованием проточного цитометра Accuri С6 (BD). Ни одно из протестированных состояний не привело к значительной гибели клеток в культурах. Миграцию клеток ХЛЛ определяли путем подсчета клеток, которые мигрировали в нижнюю (базально-латеральную) камеру пластинки трансвел, а затем выражали в процентах от общего количества клеток, первоначально добавленных в верхнюю (апикальную) камеру.
Статистический анализ
Весь статистический анализ был выполнен с использованием программного обеспечения Graphpad Prism 6.0 (Graphpad Software Inc.).
Результаты
Первоначальные эксперименты проводили для определения того, что пептид, полученный из ацетилхолинэстеразы, NBP-14, изменяет миграцию ряда линий раковых клеток дозозависимым образом. Обращаясь к фиг. 9, тестируемые клеточные линии показали различные исходные уровни миграции (без контрольных пептидов), но три из четырех клеточных линий показали значительное снижение миграции при культивировании с NBP-14 в концентрациях ≥1 мкМ. Только клетки MCF7 не показали значительного снижения миграции, но в любом случае эти клетки показали наименьшую миграционную способность в контроле (без пептида).
Пример 9. Влияние пептидов, полученных из ацетилхолинэстеразы, на клеточные линии MCF7 и MDA-MB-231
Далее изобретатели исследовали способность 1 мкМ пептидов ингибировать миграцию в двух линиях клеток рака молочной железы в 24-часовых трансвел-экспериментах. Как показано на фиг. 10, клетки MCF7 обладают лишь слабым метастатическим потенциалом, тогда как клетки MDA-MB-231 обладают высокой способностью к метастазированию. Соответственно, клетки MCF7 показали меньшую миграцию в течение 24 часов по сравнению с клетками MDA-MB-231. NBP-14 мало повлиял на миграцию клеток MCF7 (Р=0,17). Напротив, миграция клеток MDA-MB-231 была значительно ингибирована NBP-14 (Р<0,0001). Ни Т15, ни пептид Т30 не продемонстрировали существенного влияния на миграцию клеток MCF7, тогда как пептид 1 мкМ Т30 значительно ингибировал миграцию клеток MDA-MB-231 (Р=0,03). Кроме того, пептид Т30 был значительно менее эффективным при ингибировании миграции, чем NBP-14 (Р=0,0013).
Пример 10 - Влияние пептидов, полученных из ацетилхолинэстеразы, на клеточную линию KG1a острого миелоидного лейкоза
Клетки KG1a культивировали с использованием пептидов в течение 24 ч и оценивали их влияние на миграцию. Как показано на фиг. 11, NBP-14 (1 мкМ) значительно ингибирует миграцию клеток KG1a по сравнению с необработанным (без пептида) контролем (Р=0,0017). Напротив, культура клеток KG1a с пептидами Т15 и Т30 не изменяла их миграционную способность (Р=0,30 и Р=0,14 соответственно).
Пример 11 - Влияние пептидов, полученных из ацетилхолинэстеразы, на линию клеток JJN3 множественной миеломы
Как показано на фиг. 12, в соответствии с данными линии клеток MDA-MB-231 пептид Т15 не оказывал значительного влияния на миграцию (Р=0,43), тогда как Т30 и NBP-14 значимо ингибировали миграцию клеток JJN3 (Р=0,05 И Р=0,0001 соответственно). NBP-14 ингибировал миграцию в значительно большей степени по сравнению с Т30 (Р=0,0003), а комбинация пептида NBP-14 и Т30 (оба при 1 мкМ) существенно не изменяла миграцию клеток JJN3 по сравнению с NBP-14, (Р=0,15).
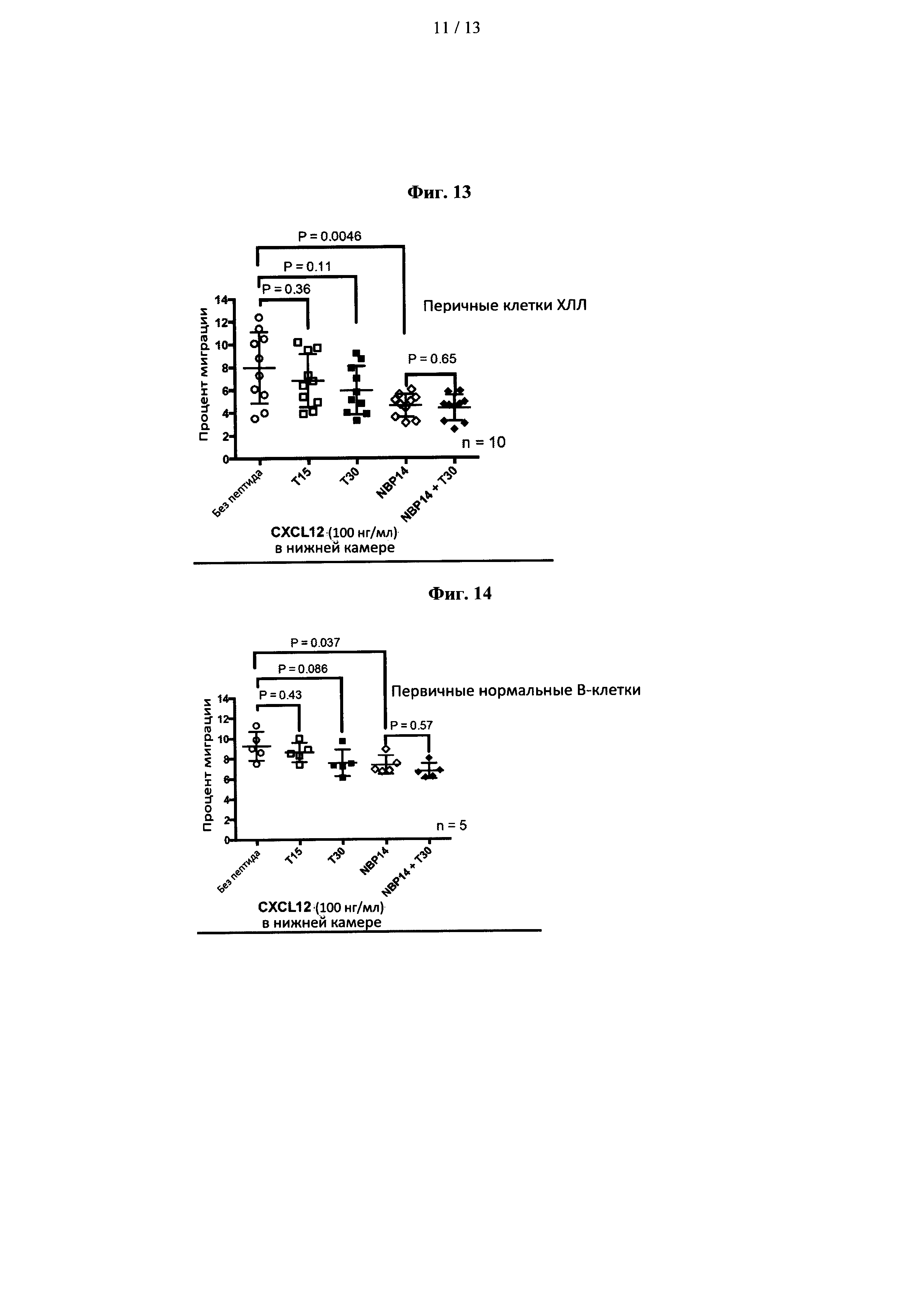
Пример 12 - Влияние пептидов, полученных из ацетилхолинэстеразы, в первичных клетках ХЛЛ
Далее авторы рассмотрели влияние пептидов на миграционную активность первичных клеток ХЛЛ, полученных от 10 пациентов. Ссылаясь на фиг. 13, наблюдалась значительная вариабельность между пациентами в миграционной способности тестируемых клеток ХЛЛ (диапазон 3,5% - 12,4%) в течение 24 часов. Лечение 1 мкМ пептидов Т15 или Т30 существенно не меняло этого (Р=0,36 и Р=0,11 соответственно), тогда как NBP-14 вызывал значительное снижение миграции (Р=0,0046). Комбинация Т30 + NBP-14 не была более эффективной при ингибировании миграции клеток ХЛЛ, чем только NBP-14 (Р=0,65).
Пример 13 - Влияние пептидов, полученных из ацетилхолинэстеразы, на нормальные В-лимфоциты
Чтобы оценить влияние пептидов, полученных из ацетилхолинэстеразы, на нормальные (не злокачественные) клетки, В-лимфоциты были выделены из нормальных здоровых добровольцев (n=5). Как показано на фиг. 14, NBP-14 индуцировал значительное снижение нормальной миграции В-клеток (Р=0,037), тогда как пептиды Т15 и Т30 не оказывали значительного эффекта (Р=0,43 и Р=0,086 соответственно). Комбинация Т30 + NBP-14 существенно не изменяла миграцию нормальных В-клеток по сравнению с только NBP-14 (Р=0,57).
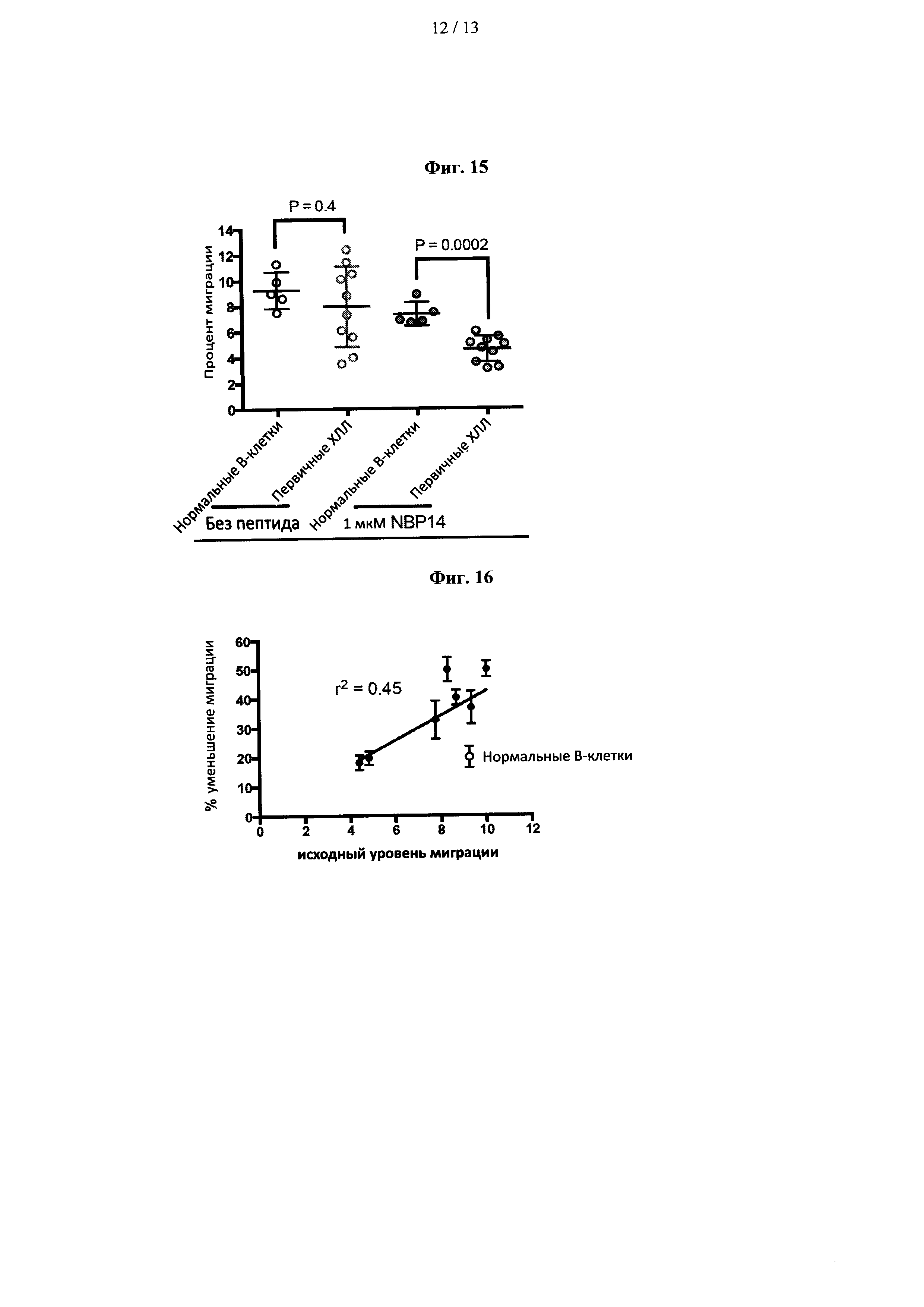
Пример 14 - Сравнение антимиграционного действия NBP-14 в клетках ХЛЛ и нормальных В-клетках
Обращаясь к фиг. 15, NBP-14 значительно ингибирует миграционную активность как первичных клеток ХЛЛ, так и нормальных В-клеток. Анализ исходной миграции нормальных и злокачественных В-клеток не выявил существенной разницы в процентах мигрированных клеток в течение 24 ч (Р=0,4). Несмотря на свойственный им миграционный потенциал, первичные клетки ХЛЛ были значительно более чувствительны к антимигрирующим эффектам NBP-14 по сравнению с нормальными В-клетками (Р=0,0002).
Пример 15 - Связь между базовой миграцией и ответом на NBP-14
Авторы указали средний исходный уровень процентной миграции для каждой из линий клеток и первичных клеток, протестированных против процентного снижения миграции, вызванного 1 мкМ NBP-14. Как показано на фиг. 16, между исходным уровнем миграции и антимиграционным ответом на NBP-14 существует четкая связь; высокая базальная миграция была связана с увеличением процентного снижения миграции. Отношения были еще сильнее, когда нормальные В-клетки были удалены из анализа.
Пример 16 - Сравнение базовой миграции между различными типами клеток и до воздействия NBP-14
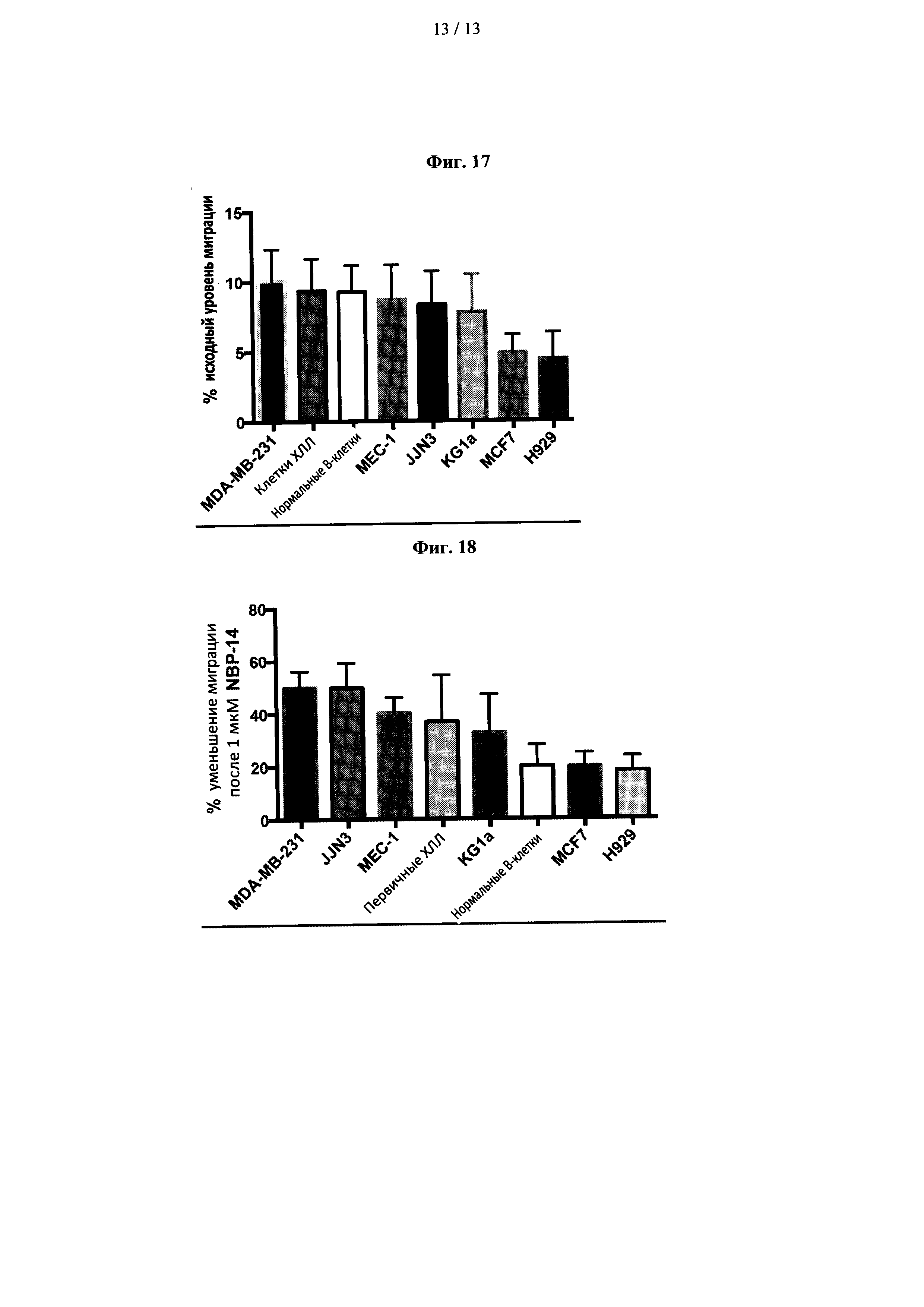
Изобретатели исследовали исходную процентную миграцию (то есть контроль) для различных исследуемых линий клеток, и результаты показаны на фиг. 17.
Затем эти контрольные значения сравнивались в каждой линии клеток после воздействия 1 мкМ NBP-14, и результаты показаны на фиг. 18. Как видно, для всех типов клеток происходит значительное уменьшение миграции клеток. Другими словами, существует явное сокращение метастазирования во всех линиях клеток.
Заключение
1. NBP-14 проявлял значительные антимиграционные эффекты во всех тестируемых линиях клеток, за исключением клеток MCF7, которые показали низкую базальную миграцию в контрольных условиях (без пептида); наблюдение, которое соответствует известному низкому метастатическому потенциалу этих клеток. Анализ дозазависимого эффекта показал, что NBP-14 эффективен при подавлении миграции при концентрациях ≥1 мкМ. Поэтому все последующие сравнения с контрольным пептидом (Т15) и токсическим пептидом (Т30) проводили при 1 мкМ.
2. Ни один из пептидов не вызывал значительных цитотоксических эффектов в линиях клеток или первичных злокачественных и незлокачественных В-клетках при проверенных условиях. Таким образом, наблюдаемые сокращения миграции не были вызваны увеличением клеточной смерти в культурах.
3. Сочетание токсичного пептида (Т30) с NBP-14 не оказывало существенного влияния на миграцию по сравнению с NBP-14 в одной из клеточных линий и оцениваемых первичных клеток.
4. Первичные клетки ХЛЛ продемонстрировали исходную гетерогенность в их миграционной способности. Тем не менее, NBP-14 смог значительно снизить миграцию в этих первичных опухолевых клетках.
5. Первичные клетки ХЛЛ были более чувствительны, чем нормальные В-клетки, к антимиграционному эффекту NBP-14. Это говорит о том, что NBP-14 пригоден в качестве противоракового терапевтического средства, особенно в тех опухолях, которые подвержены метастазированию.
6. Наблюдается значительное снижение миграции клеток или метастазирования во всех тестируемых клеточных линиях.