ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ЦЕЛЕКОКСИБ И ТРАМАДОЛ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к фармацевтической композиции, содержащей целекоксиб, известный в качестве селективного ингибитора COX-2, и трамадол, который представляет собой опиоидный анальгетик.
Предпосылки создания настоящего изобретения
Боль
В соответствии с определением Международной ассоциации по изучению боли, боль определяют как неприятный сенсорный и эмоциональный опыт, ассоциированный с действительным или потенциальным повреждением ткани. Причины боли в основном можно разделить на две группы: перцептивный вариант, вызванный повреждением или воспалением соматической или висцеральной ткани; и нейропатический вариант, возникающий вследствие повреждения нерва. Из них, для перцептивного варианта сообщалось о следующем механизме возникновения боли.
Если ткань повреждена, то повреждающие стимулы, сами по себе, будут возбуждать А-дельта и С-ноцицепторы для передачи боли. Как следствие, из клеток поврежденной ткани и периферических нервных окончаний высвобождаются брадикинин, серотонин, K+, H+, и вещество P. В этом процессе, чувствительность может возникать в периферических ноцицепторах поврежденной области, приводя к более низкому порогу и множественным возбуждениям. Этот болевой сигнал может быть передан в спинной мозг по болевому чувствительному нерву, передан в верхнюю часть спинного мозга и обработан, тем самым вызывая боль. Кроме того, если ткань повреждается, то клеточная мембрана разрушается, и активируется фосфолипаза A с продуцированием арахидоновой кислоты. Затем, посредством циклооксигеназного пути (COX) из арахидоновой кислоты синтезируется простагландин. Простагландин также может повышать чувствительность периферических ноцицепторов, вызывая боль (Study on Pain Mechanism, BioWave Vol. 8 No. 3 2006).
Лекарства для лечения боли
Для снижения боли, анальгетики используют для снижения интенсивности боли, и иногда их используют в сочетании с антидепрессантами, поскольку хроническая боль может вызывать депрессию. Среди них, типичные представители анальгетиков включают в себя опиоидные анальгетики, которые являются наркотическими анальгетиками, и нестероидные противовоспалительные средства (NSAID), которые являются ненаркотическими анальгетиками.
Опиоидные анальгетики представляют собой опиоидные соединения и, как известно, связываются с опиоидными рецепторами для блокирования секреции нейротрансмиттеров, таких как Р-вещество и глутамат, для того, чтобы предотвратить передачу болевого сигнала в головной мозг, тем самым сильно ингибируя боль. Однако в последние годы сообщалось, что длительное использование опиоидных лекарств вызывает побочные эффекты, такие как лекарственное отравление, риск переломов костей, инфаркт миокарда и половая дисфункция. Поэтому, рассматривалась необходимость снижения дозы опиоидных лекарств.
Известно, что нестероидные противовоспалительные средства ингибируют циклооксигеназу для того, чтобы ингибировать синтез простагландинов, тем самым ингибируя воспаление и боль. Первоначально применяли такие нестероидные противовоспалительные средства, как ибупрофен, диклофенак или напроксен. Однако, поскольку сообщалось, что указанные средства могут ингибировать также COX-1, вызывая желудочно-кишечные заболевания, внимание привлек такой селективный ингибитор COX-2, как целекоксиб. Однако указанные лекарства косвенно ингибируют боль посредством своего противовоспалительного действия, а потому их болеутоляющие эффекты не настолько выражены, как у вышеописанных опиоидных анальгетиков.
Совместное введение целекоксиба и трамадола
В качестве альтернативы для усиления болеутоляющего эффекта селективного ингибитора COX-2, в патенте Кореи № 10-0444195 сфокусировано внимание на синергичный эффект совместного введения селективного ингибитора COX-2 и опиоидного анальгетика. В соответствии с приведенным выше патентным документом, анализ в модели замены равноэффективной дозой и нелинейной регрессии, использующий все данные для селективного ингибитора COX-2 и опиоидного анальгетика, обнаруживает существование неожиданно усиленной анальгезирующей активности сочетаний ингибитора COX-2 и опиоидного анальгетика. Поэтому, совместное введение двух лекарств может снижать дозу по сравнению с дозой, когда применительно к той же самой боли два лекарственных средства использовали по отдельности, снижая тем самым номенклатуру и степень тяжести побочных эффектов, вызванных каждым лекарством.
В не прошедшей экспертизу публикации патентной заявки Кореи № 10-2012-0089287 сфокусировано внимание на синергичный эффект трамадола и целекоксиба, с целью избежать побочных эффектов, возникающих вследствие высоких доз и повторного приема опиоидных анальгетиков. В приведенном выше документе раскрыто, что сочетание трамадола и целекоксиба эффективно для лечения тяжелой боли или для смягчения боли, в частности боли, вызванной воспалительными факторами, и особенно эффективно в отношении заболеваний, нарушений или сопутствующей боли, такой как ишиас, синдром «замороженного плеча» или центральная сенсибилизация (например, центральный болевой синдром), в отношении которых эффекты простых отдельных лекарств недостаточны.
Характеристики целекоксиба и трамадола при составлении лекарственных форм
Целекоксиб представляет собой соединение, характеризующееся химическим названием 4-[5-(4-метилфенил)-3-(трифторметил)-1H-пиразол-1-ил]бензолсульфонамид и следующей формулой 1:
[Формула 1]
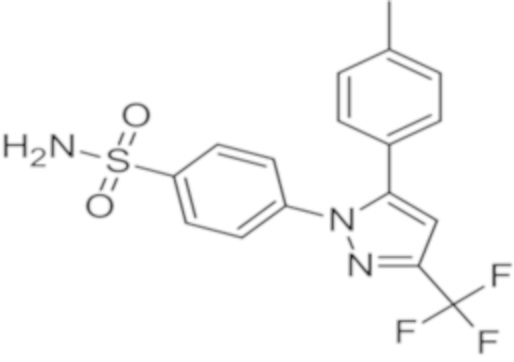
Целекоксиб представляет собой плохо растворимое лекарство, которое непросто включать в состав лекарственных форм. С целью увеличения биодоступности целекоксиба в патенте Кореи № 10-0501034 была предпринята попытка тонкого измельчения частиц целекоксиба, в патенте Кореи № 10-1455901 был использован полоксамер в качестве поверхностно-активного вещества (так называемого «солюбилизатора»), и в патенте Кореи № 10-1237646 была использована методика получения твердых дисперсий, при которой поверхность частиц целекоксиба модифицируют растворимым в воде полимером и поверхностно-активным веществом.
Трамадол представляет собой соединение, характеризующееся химическим названием 2-[(диметиламино)метил]-1-(3-метоксифенил)циклогексанол и следующей формулой 2:
[Формула 2]
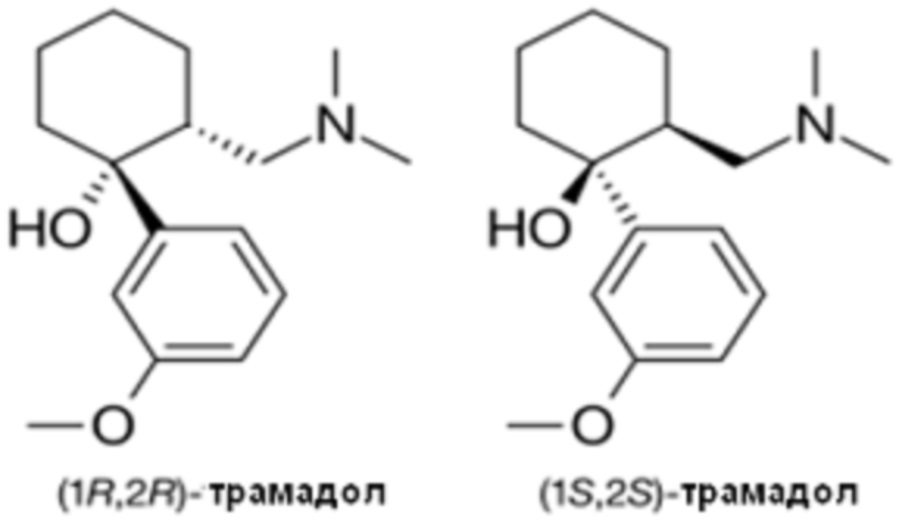
Поскольку трамадол представляет собой растворимое в воде лекарство, которое используется, главным образом, для хронической боли, для повышения удобства применения лекарства и т. п. трамадол эффективно включать в состав лекарственной формы с замедленным высвобождением. Для включения трамадола в состав лекарственной формы с замедленным высвобождением, в патенте Кореи № 10-1455741 добавляли гелеобразующее вещество, способное регулировать высвобождение активного ингредиента путем формирования гидрогеля после контакта с водой, такое как производное целлюлозы или карбоксивиниловый полимер, например, гидроксипропилцеллюлоза, метилцеллюлоза, гидроксипропилметил-целлюлоза, карбоксиметилцеллюлоза натрия или т. п.
Раскрытие
Техническая задача
Авторы настоящего изобретения сфокусировали внимание на синергичном болеутоляющем эффекте сочетания целекоксиба и трамадола, и предприняли попытку включить два разных активных ингредиента в состав одной стандартную лекарственную форму с целью увеличения комплаентности каждого лекарства.
С этой целью, первой задачей явилась разработка паттерна высвобождения каждого лекарства. Многочисленные повторные эксперименты показали, что предпочтительно, чтобы целекоксиб присутствовал в виде компартмента с немедленным высвобождением, а трамадол присутствовал в виде компартмента с замедленным высвобождением.
Далее, перед авторами настоящего изобретения встал вопрос о типе состава, который смог бы обеспечить вышеописанные паттерны высвобождения, но стал понятно, что могут быть применимы различные типы составов. Примеры применимых лекарственных форм включают в себя: таблетку с сердцевиной, содержащую внутреннюю сердцевину, состоящую из компартмента с замедленным высвобождением, и наружный слой, состоящий из компартмента с немедленным высвобождением; капсулу, содержащую частицы, гранулы, драже или таблетки, состоящие из компартмента с замедленным высвобождением, и частицы, гранулы, драже или таблетки, состоящие из компартмента с немедленным высвобождением; многослойную таблетку, содержащую слой, состоящий из компартмента с замедленным высвобождением, и слой, состоящий из компартмента с немедленным высвобождением.
Среди указанных составов, в качестве предпочтительного примера была выбрана многослойная таблетка, затем были совмещены матрица с замедленным высвобождением трамадола и матрица с немедленным высвобождением целекоксиба, а затем был протестирован паттерн высвобождения каждого активного ингредиента. В результате, возникла проблема в достижении желаемого растворения целекоксиба.
Соответственно, авторы настоящего изобретения провели множество повторных экспериментов для разработки нового состава, способного обеспечить желаемые паттерны высвобождения целекоксиба и трамадола, даже в виде единой стандартной лекарственной формы, в результате оформив настоящее изобретение.
Техническое решение
Настоящее изобретение решает описанную выше задачу посредством следующего.
(1) Фармацевтическая композиция, содержащая: первый компартмент, содержащий целекоксиб; второй компартмент, содержащий трамадол, где второй компартмент содержит нерастворимый в воде полимер и воскоподобный липид.
(2) Фармацевтическая композиция согласно пункту (1), где первый компартмент содержит одно или несколько веществ, выбранных из растворимого в воде полимера, поверхностно-активного вещества и сахарида.
(3) Фармацевтическая композиция согласно пункту (2), где растворимый в воде полимер представляет собой одно или несколько веществ, выбранных из гидроксипропилцеллюлозы, гидроксипропил-метилцеллюлозы и сополимера винилпирролидона и винилацетата.
(4) Фармацевтическая композиция согласно пунктам (2) или (3), где поверхностно-активное вещество содержит одно или несколько веществ, выбранных из полиоксиглицерида, полиоксиэтиленового эфира сорбита и жирной кислоты, лаурилсульфата натрия, сложного эфира жирной кислоты и глицерина, макроголглицерида жирной кислоты, моноэтилового эфира диэтиленгликоля и сложного эфира сахарозы и жирной кислоты.
(5) Фармацевтическая композиция согласно любому из пунктов (2)- (4), где растворимый в воде полимер и поверхностно-активное вещество содержатся в количестве от 0,1 до 20 масс.% от общей массы первого компартмента.
(6) Фармацевтическая композиция согласно любому из пунктов (2)- (5), где сахарид содержит одно или несколько веществ, выбранных из маннита, мальтита, лактита, рибита, инозита, ксилита, малтотрита и глюкозы.
(7) Фармацевтическая композиция согласно любому из пунктов (2)- (6), где сахарид содержится в количестве от 10 до 50 масс.% от общей массы первого компартмента.
(8) Фармацевтическая композиция согласно любому из пунктов (1)- (7), где воскоподобный липид содержит одно или несколько веществ, выбранных из глицеринстеарата, глицеринбегената, глицеринпальмитостеарата, макроголглицерида жирной кислоты, моноэтилового эфира диэтиленгликоля, глицерилмонокаприлата и гидрогенизированного касторового масла.
(9) Фармацевтическая композиция согласно любому из пунктов (1)- (8), где нерастворимый в воде полимер содержит одно или несколько веществ, выбранных из полимеров на основе целлюлозы.
(10) Фармацевтическая композиция согласно любому из пунктов (1)- (9), где воскоподобный липид и нерастворимый в воде полимер содержатся в количестве от 1 до 60 масс.% от общей массы второго компартмента.
(11) Фармацевтическая композиция согласно любому из пунктов (1)- (10), где первый компартмент и второй компартмент составлены в виде отдельных слоев, которые наложены один на другой.
Благоприятные эффекты
Настоящее изобретение относится к твердому пероральному комбинированному составу, который характеризуется паттернами высвобождения лекарства, аналогичными наблюдаемым, когда коммерчески доступный пероральный твердый состав, содержащий отдельно целекоксиб, и коммерчески доступный пероральный твердый состав, содержащий отдельно трамадол, соответственно вводят в дозах, которые сходны с дозами в комбинированном составе согласно настоящему изобретению. Конкретно, настоящее изобретение относится к составу, полученному путем включения целекоксиба и трамадола в состав стандартной лекарственной формы, где целекоксиб, который представляет собой плохо растворимое лекарство, солюбилизирован так, чтобы высвобождаться немедленно, а трамадол включен в состав так, чтобы высвобождаться замедленно. Кроме того, взаимодействие между лекарствами в составе сведено к минимуму. Таким образом, состав согласно настоящему изобретению представляет собой комбинированный состав, разработанный таким образом, чтобы эффекты лекарств были комплементарны друг другу и продолжительны, даже если состав вводят один раз в сутки.
Кроме того, многослойная таблетка, реализованная в соответствии с настоящим изобретением, обладает превосходной твердостью и межслойной адгезией, а потому ее легко упаковывать, транспортировать и манипулировать ею. Кроме того, она подходит для массового производства, поскольку дефекты таблеток, такие как кэппинг или расслоение, реже случаются.
Описание чертежей
На Фиг. 1-13 представлены паттерны растворения для каждого примера.
Способы осуществления настоящего изобретения
Настоящее изобретение относится к пероральному твердому комбинированному составу, содержащему: компартмент, содержащий целекоксиб, в композиции с немедленным высвобождением; компартмент, содержащий трамадол, в композиции с замедленным высвобождением. Если два или несколько лекарств, которые должны характеризоваться разными паттернами высвобождения, включают в состав одной лекарственной формы, то состав важно разработать так, чтобы композиция любого компартмента не влияла на паттерн высвобождения лекарства другого компартмента. В частности, если целекоксиб подлежит включению в состав стандартной лекарственной формы, то необходимо добавить специальные солюбилизирующие средства, поскольку лекарство само по себе очень плохо растворимо. Кроме того, оно представляет собой очень чувствительное лекарство, характеризующееся сложностью в достижении удовлетворительных характеристик растворения.
По этой причине, если известный компартмент с замедленным высвобождением, содержащий трамадол, и компартмент, содержащий целекоксиб, просто приводили в контакт друг с другом, то композиция с замедленным высвобождением компартмента трамадола отрицательно влияла на паттерн высвобождения целекоксиба, что и ожидалось. Возможно по этой причине, паттерн высвобождения целекоксиба был неудовлетворительным, хотя компартмент целекоксиба был обеспечен солюбилизирующими средствами.
Соответственно, авторы настоящего изобретения сфокусировались на композиции с замедленным высвобождением компартмента трамадола и композиции, содержащей компартмент целекоксиба, с тем, чтобы свести к минимуму воздействие композиции, содержащей компартмент трамадола, на паттерн высвобождения целекоксиба.
Определения
Термины «целекоксиб» и «трамадол» относятся к возможным формам, которые могут демонстрировать хорошо известные фармакологические эффекты целекоксиба и трамадола в процессе лекарственного метаболизма после введения. Неограничивающие примеры для каждого из целекоксиба и трамадола включают в себя свободную кислоту/свободное основание, соль, сокристалл, рацемат и пролекарство. Например, термин «трамадол» также можно интерпретировать как трамадола гидрохлорид.
Термин «способы солюбилизации» относится к одному из известных способов улучшения растворения плохо растворимых лекарств. Неограничивающие примеры известных способов солюбилизации для целекоксиба включают в себя тонкое измельчение частиц, добавление полоксамера и получение твердое диспергирование.
Термин «растворимый в воде полимер» относится к смолистому или полимерному веществу, которое может быть растворено, вспучено или диспергировано на малые частицы в воде. Неограничивающие примеры растворимого в воде полимера включают в себя гидроксипропилметилцеллюлозу (HPMC), гидроксипропил-целлюлозу (HPC) и поливинилпирролидон (PVP).
Термин «поверхностно-активное вещество» относится к веществу, которое содержит в составе молекулы как гидрофильную группу, так и липофильную группу, и может быть растворено или диспергировано в растворителе и селективно адсорбировано на границе раздела фаз, существенно изменяя тем самым свойства границы раздела фаз. Неограничивающие примеры поверхностно-активного вещества включают в себя лаурилсульфат натрия (SLS) и полоксамер.
Термин «сахарид» относится к углеводному соединению, которое обладает относительно небольшой молекулярной массой и растворяется в воде, придавая ей сладкий вкус. Неограничивающие примеры сахарида включают в себя маннит и мальтит.
Термин «нерастворимый в воде полимер» относится к полимерному веществу, которое не растворяется или не вспучивается в воде. Неограничивающие примеры нерастворимого в воде полимера включают в себя этилцеллюлозу и ацетат целлюлозы.
Термин «воскоподобный липид» относится к липиду, характеризующемуся свойствами, аналогичными таковым у воска. Неограничивающие примеры воскоподобного липида включают в себя сложный эфир глицерина и жирной кислоты и макроголглицерид жирной кислоты.
Если не указано иное, то конкретные компоненты различных добавок, упомянутых в настоящем документе, включая «растворимый в воде полимер», «поверхностно-активное вещество», «сахарид», «нерастворимый в воде полимер» и «воскоподобный липид», могут быть подходящим образом выбраны из фармацевтически приемлемых веществ, известных из HANDBOOK OF PHARMACEUTICAL EXCIPIENTS, и т. д.
Первый компартмент, содержащий целекоксиб
Первый компартмент содержит одно или несколько веществ, выбранных из растворимого в воде полимера, поверхностно-активного вещества и сахарида.
Растворимый в воде полимер предпочтительно представляет собой одно или несколько веществ, выбранных из гидроксипропилцеллюлозы, гидроксипропилметилцеллюлозы и сополимера винилпирролидона и винилацетата. Наиболее предпочтительно, растворимый в воде полимер представляет собой гидроксипропилцеллюлозу. Поверхностно-активное вещество предпочтительно содержит одно или несколько веществ, выбранных из полиоксиглицерида, полиоксиэтиленового эфира сорбита и жирной кислоты, лаурилсульфата натрия, сложного эфира глицерина и жирной кислоты, макроголглицерида жирной кислоты, моноэтилового эфира диэтиленгликоля и сложного эфира сахарозы и жирной кислоты. Сахарид предпочтительно содержит одно или несколько веществ, выбранных из маннита, мальтита, лактита, рибита, инозита, ксилита, малтотрита и глюкозы.
Каждый из растворимого в воде полимера и поверхностно-активного вещества предпочтительно содержится в количестве от 0,1 до 20 масс.% от общей массы первого компартмента. Если содержание каждого из растворимого в воде полимера и поверхностно-активного вещества выходит за вышеописанные пределы, степень растворения целекоксиба может быть снижена приблизительно на 10% или более. Всего важнее, если содержание поверхностно-активного вещества не соответствует нижнему пределу и верхнему пределу описанного выше диапазона, то активность поверхностно-активного вещества может быть существенно снижена приблизительно на 10% или более.
Сахарид предпочтительно содержится в количестве от 10 до 50 масс.% (от общей массы первого компартмента. Если содержание сахарида не соответствует нижнему пределу и верхнему пределу описанного выше диапазона, то достаточная солюбилизация целекоксиба не может быть достигнута, и в процессе таблетирования может возникнуть проблема, или размер таблеток увеличится.
Первый компартмент также может содержать подходящие количества других известных добавок, которые могут быть подходящим образом выбраны в пределах диапазона, не влияющего на желаемый эффект настоящего изобретения.
Второй компартмент, содержащий трамадол
В общем, способы замедления высвобождения лекарства включают в себя способ с нанесением на лекарство покрытия из нерастворимого в воде вещества или способ с диспергированием лекарства в связующем веществе, которое является нерастворимым в воде и проницаемым для воды. Примеры нерастворимого в воде вещества включают в себя белый воск, карнаубский воск, шеллак, производные целлюлозы, глицерилмоностеарат, глицерилтристеарат, синтетический гидрогель и т. п.
Кроме того, как раскрыто в патенте Кореи № 10-1455741, высвобождение лекарства также можно замедлить посредством использования гелеобразующего вещества, такого как производное целлюлозы или карбоксивиниловый полимер, например, гидроксипропилцеллюлоза, метилцеллюлоза, гидроксипропилметил-целлюлоза, карбоксиметилцеллюлоза натрия или т. п., которое способно регулировать высвобождение активного ингредиента путем формирования гидрогеля после контакта с водой.
Однако авторы настоящего изобретения обнаружили, что при приведении в контакт с первым компартментом в отдельном составе описанные выше известные вещества могут индуцировать взаимодействие с первым компартментом и отрицательно влиять на растворение целекоксиба, даже несмотря на то, что такие вещества могут быть предпочтительны с точки зрения замедленного высвобождения самого трамадола.
Соответственно, авторы настоящего изобретения предприняли развернутые попытки найти новый состав, и в результате к удивлению обнаружили, что конкретные нерастворимые в воде вещества обладают меньшим влиянием на паттерн высвобождения целекоксиба первого компартмента. Кроме того, авторы настоящего изобретения обнаружили, что сочетание конкретного нерастворимого в воде вещества с воскоподобным липидом, а не просто выбор только одного вида нерастворимого в воде вещества, наиболее предпочтительно в плане достижения желаемого паттерна высвобождения каждого лекарства первого и второго компартментов.
Второй компартмент содержит нерастворимый полимер в воде и воскоподобный липид.
Нерастворимый в воде полимер предпочтительно представляет собой один или несколько полимеров, выбранных из полимеров на основе целлюлозы. Наиболее предпочтительно, нерастворимый в воде полимер представляет собой этилцеллюлозу.
Воскоподобный липид предпочтительно представляет собой один или несколько липид, выбранных из глицеринстеарата, глицеринбегената, глицеринпальмитостеарата, макроголглицерида жирной кислоты, моноэтилового эфира диэтиленгликоля, глицерилмонокаприлата и гидрогенизированного касторового масла.
Каждый из воскоподобного липида и нерастворимого в воде полимера предпочтительно содержится в количестве от 1 до 60 масс.% от общей массы второго компартмента. Если содержание каждого из воскоподобного липида и нерастворимого в воде полимера не соответствует верхнему и нижнему пределам описанного выше диапазона, то существует возможность, что высвобождение лекарства в пределах 12-24 часов будет вряд ли достигнуто.
Второй компартмент также может содержать подходящие количества других известных добавок, которые могут быть подходящим образом выбраны в пределах диапазона, не влияющего на желаемый эффект настоящего изобретения.
Состав
Неограничивающие примеры конечного состава включают в себя: таблетку с сердцевиной, содержащую внутреннюю сердцевину, состоящую из компартмента с замедленным высвобождением, и наружный слой, состоящий из компартмента с немедленным высвобождением; капсулу, содержащую частицы, гранулы, драже или таблетки, состоящие из компартмента с замедленным высвобождением, и частицы, гранулы, драже или таблетки, состоящие из компартмента с немедленным высвобождением; многослойную таблетку, содержащую слой, состоящий из компартмента с замедленным высвобождением, и слой, состоящий из компартмента с немедленным высвобождением.
Способ применения и дозы
Целекоксиб, как правило, принимают один раз в сутки в количестве 200 мг. Поэтому, коммерчески доступные отдельные составы включают в себя продукты, содержащие 100 мг целекоксиба, и продукты, содержащие 200 мг целекоксиба. Трамадол можно вводить в различных дозах, но, как правило, принимают в количестве 100-200 мг ежесуточно. Поэтому, коммерчески доступные составы включают в себя продукты, содержащие 50 мг трамадола, и продукты, содержащие 100 мг трамадола.
Комбинированный состав в соответствии с настоящим изобретением может быть разработан так, чтобы содержать различные дозы, и может быть приниматься внутрь подходящим образом. Однако согласно одному варианту осуществления настоящего изобретения, целекоксиб предоставляют в виде солюбилизированного слоя с немедленным высвобождением с целью обеспечить первоначальный эффект облегчения боли, а трамадол предоставляют в виде слоя с замедленным высвобождением с целью снизить побочные эффекты и обеспечить продолжительный эффект облегчения боли. В этой связи, содержания лекарств в одном составе устанавливают в количестве 200 мг целекоксиба и 100 мг трамадола, и такой комбинированный состав может демонстрировать удовлетворительный эффект купирования боли, даже если вводить его один раз в сутки.
Как описано в указанном выше варианте осуществления настоящего изобретения, если содержание трамадола в комбинированном составе для введения один раз в сутки установлено в размере 100 мг, то достаточный эффект купирования боли достигается за счет синергического эффекта трамадола и целекоксиба, даже несмотря на то, что количество трамадола мало. В частности, в этом случае, преимуществом является то, что могут ассоциированные с трамадолом побочные эффекты быть снижены.
Тем не менее, описанный выше режим дозирования представляет собой лишь предпочтительный вариант осуществления, и объем настоящего изобретения им не ограничивается.
Далее в настоящем документе, изобретение согласно настоящему изобретению будет описано со ссылками на примеры. Тем не менее, следует понимать, что эти примеры никоим образом не предназначены для ограничения объема настоящего изобретения.
Фундаментальные условия
Целекоксиб, используемый в примерах согласно настоящему изобретению, имеет D90 от 10 до 15 мкм и D50 от 4 до 7 мкм.
Термины «Целебрекс™ капсула 200 мг» и «Тридол™ таблетка 100 мг с замедленным высвобождением» относятся к коммерчески доступным отдельным составам, содержащим целекоксиб и трамадол, соответственно.
Приблизительные основные компоненты названий продуктов, используемых в примерах, представлены ниже в Таблице 1.
Таблица 1
|
Пример 1: Состав после солюбилизации плохо растворимого лекарства
Пример 1-1: Получение состава с использованием растворимого в воде полимера, поверхностно-активного вещества и сахарида - оценка паттерна растворения в соответствии с пропорциями растворимого в воде полимера и поверхностно-активного вещества
Целекоксиб и наполнители, представленные ниже в Таблице 2, вымешивали с увлажнением, высушивали, гранулировали, смешивали и прессовали в таблетки способом влажного гранулирования, и подвергали таблетки тесту на растворение in vitro.
Таблица 2
|
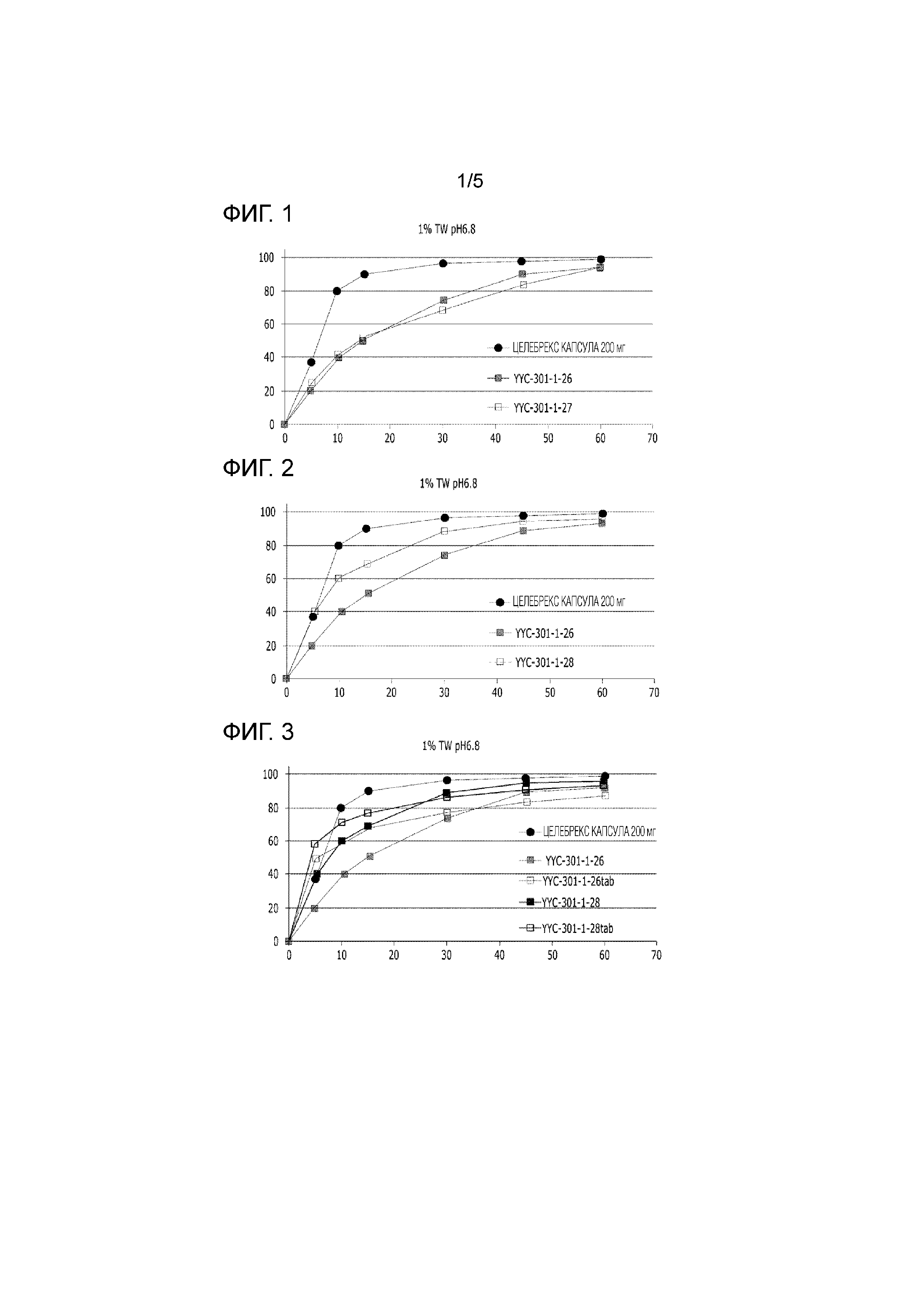
Гранулы только с целекоксибом, представленные выше в Таблице 2, помещали в капсулу, и оценивали растворение капсулы. Результаты представлены ниже в Таблице 3 и на Фиг. 1.
Таблица 3
|
Пример 1-2: Приготовление состава с использованием растворимого в воде полимера, поверхностно-активного вещества и сахарида - оценка паттерна растворения в соответствии с количеством сахарида
Целекоксиб и наполнители, представленные ниже в Таблице 4, вымешивали с увлажнением, высушивали, гранулировали, смешивали и прессовали в таблетки способом влажного гранулирования, и подвергали таблетки тесту на растворение in vitro.
Таблица 4
|
Гранулы только с целекоксибом, представленные выше в Таблице 4, помещали в капсулу, и оценивали растворение капсулы. Результаты представлены ниже в Таблице 5 и на Фиг. 2.
Таблица 5
|
Гранулы с целекоксибом, представленные выше в Таблице 4, подвергали пост-перемешиванию и прессованию в таблетки, и оценивали растворение таблеток. Результаты представлены ниже в Таблице 6 и на Фиг. 3.
Таблица 6
|
Целекоксиб и наполнители, представленные ниже в Таблице 7, вымешивали с увлажнением, высушивали, гранулировали, смешивали и прессовали в таблетки способом влажного гранулирования, и подвергали таблетки тесту на растворение in vitro.
Таблица 7
|
Гранулы с целекоксибом, представленные выше в Таблице 7, подвергали пост-перемешиванию и прессованию в таблетки, и оценивали растворение таблеток. Результаты представлены ниже в Таблице 8 и на Фиг. 4.
Таблица 8
|
Пример 1-3: Приготовление состава с использованием HPMC в качестве растворимого в воде полимера, поверхностно-активного вещества и сахарида - оценка паттерна растворения
Целекоксиб и наполнители, представленные ниже в Таблице 9, вымешивали с увлажнением, высушивали, гранулировали, смешивали и прессовали в таблетки способом влажного гранулирования, и подвергали таблетки тесту на растворение in vitro.
Таблица 9
|
Гранулы с целекоксибом, представленные выше в Таблице 9, подвергали пост-перемешиванию и прессованию в таблетки, и оценивали растворение таблеток. Результаты представлены ниже в Таблице 10 и на Фиг. 5.
Таблица 10
|
Пример 1-4: Приготовление состава с использованием растворимого в воде полимера, сложного сахарного эфира P-1570 в качестве поверхностно-активного вещества и маннита в качестве сахарида - оценка паттерна растворения в соответствии с видом растворимого в воде полимера.
Целекоксиб и наполнители, представленные ниже в Таблице 11, вымешивали с увлажнением, высушивали, гранулировали, смешивали и прессовали в таблетки способом влажного гранулирования, и подвергали таблетки тесту на растворение in vitro.
Таблица 11
|
Гранулы с целекоксибом, представленные выше в Таблице 11, подвергали пост-перемешиванию и прессованию в таблетки, и оценивали растворение таблеток. Результаты представлены ниже в Таблице 12 и на Фиг. 6.
Таблица 12
|
Пример 1-5: Приготовление состава с использованием HPMC в качестве растворимого в воде полимера, сложного сахарного эфира в качестве поверхностно-активного вещества и сахарида - оценка паттерна растворения в соответствии с видом сахарида.
Целекоксиб и наполнители, представленные ниже в Таблице 13, вымешивали с увлажнением, высушивали, гранулировали, смешивали и прессовали в таблетки способом влажного гранулирования, и подвергали таблетки тесту на растворение in vitro.
Таблица 13
|
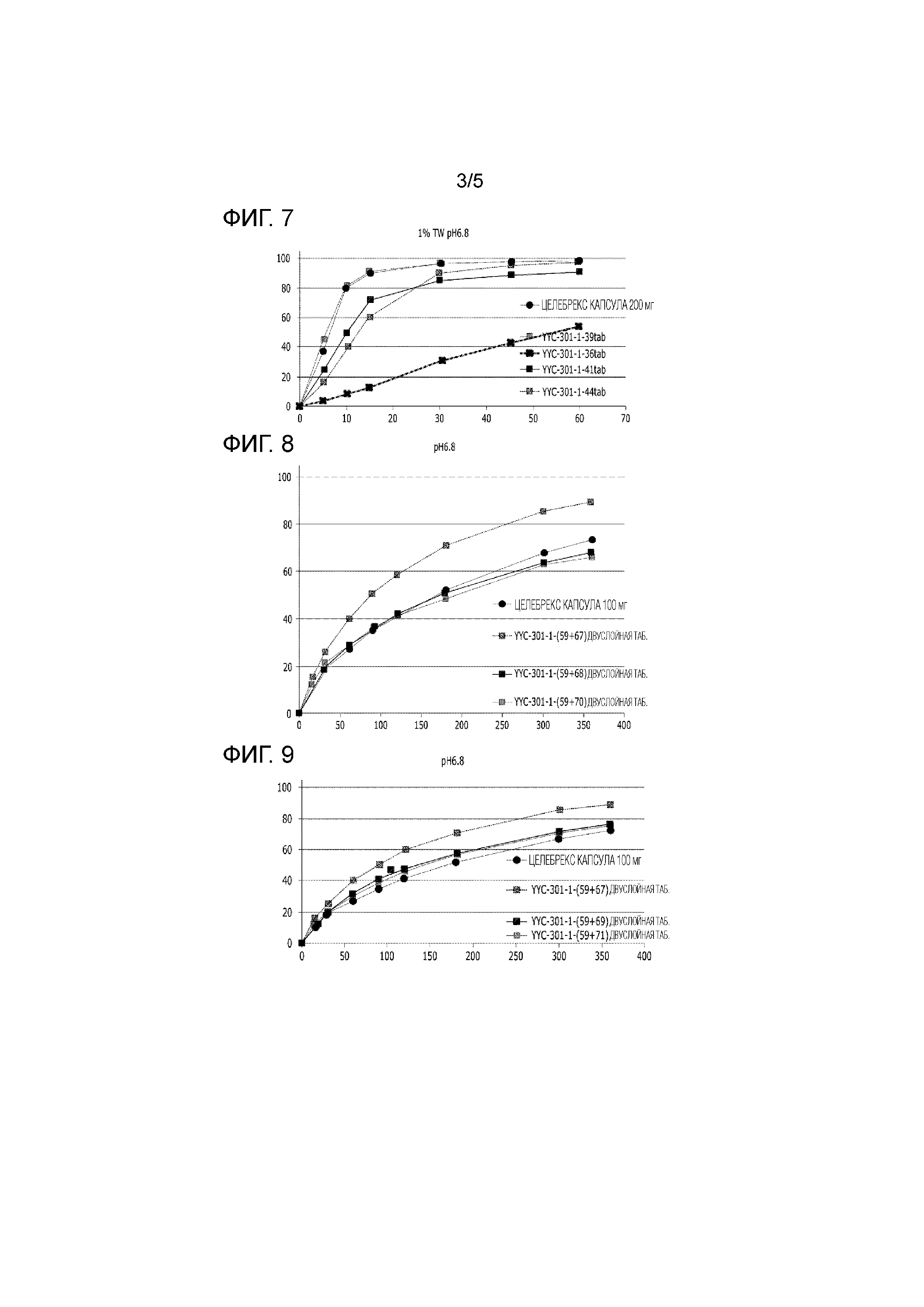
Гранулы с целекоксибом, представленные выше в Таблице 13, подвергали пост-перемешиванию и прессованию в таблетки, и оценивали растворение таблеток. Результаты представлены ниже в Таблице 14 и на Фиг. 7.
Таблица 14
|
Пример 2: Состав с замедленным высвобождением растворимого в воде лекарства
В следующих Таблицах термин «YYC-301-1-(59+XX)» относится к двуслойной таблетке, содержащей компартмент целекоксиба YYC-301-1-59, представленный в Таблице 25, и компартмент трамадола YYC-301-1-XX.
Пример 2-1: Приготовление состава с использованием этилцеллюлозы и воскоподобного липида в качестве наполнителя - оценка паттерна растворения в соответствии с количеством воскоподобного липида
Гидрохлорид трамадола и наполнители, представленные ниже в Таблице 15, вымешивали с увлажнением, высушивали, гранулировали, смешивали и прессовали в таблетки способом влажного гранулирования, и подвергали таблетки тесту на растворение in vitro.
Таблица 15
|
Результаты оценки растворения таблеток, представленных выше в Таблице 15, представлены ниже в Таблице 16 и на Фиг. 8.
Таблица 16
|
Пример 2-2: Приготовление состава с использованием этилцеллюлозы, воскоподобного липида в качестве наполнителя - оценка паттерна растворения в соответствии с количеством этилцеллюлозы
Гидрохлорид трамадола и наполнители, представленные ниже в Таблице 17, вымешивали с увлажнением, высушивали, гранулировали, смешивали и прессовали в таблетки способом влажного гранулирования, и подвергали таблетки тесту на растворение in vitro.
Таблица 17
|
Результаты оценки растворения таблеток, представленных выше в Таблице 17, представлены ниже в Таблице 18 и на Фиг. 9.
Таблица 18
|
Пример 2-2: Приготовление состава с использованием этилцеллюлозы, воскоподобного липида в качестве наполнителя - оценка паттерна растворения в соответствии с видом воскоподобного липида
Гидрохлорид трамадола и наполнители, представленные ниже в Таблице 19, вымешивали с увлажнением, высушивали, гранулировали, смешивали и прессовали в таблетки способом влажного гранулирования, и подвергали таблетки тесту на растворение in vitro.
Таблица 19
|
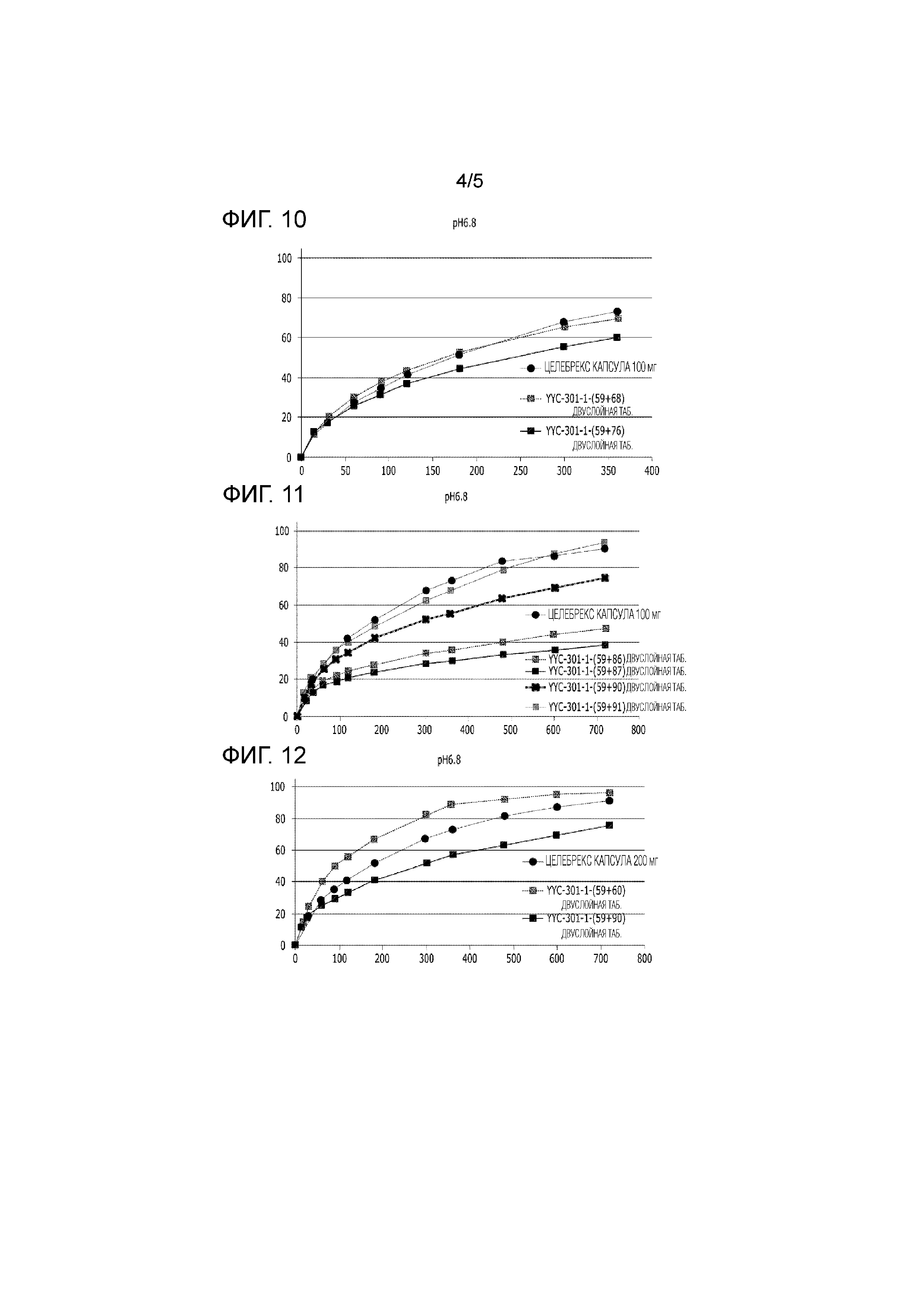
Результаты оценки растворения таблеток, представленных выше в Таблице 19, представлены ниже в Таблице 20 и на Фиг. 10.
Таблица 20
|
Пример 2-4: Приготовление состава с использованием воскоподобного липида в качестве наполнителя - оценка паттерна растворения в соответствии с пропорциями MCC и Лубритаба (гидрогенизированное касторовое масло)
Гидрохлорид трамадола и наполнители, представленные ниже в Таблице 21, вымешивали с увлажнением, высушивали, гранулировали, смешивали и прессовали в таблетки способом влажного гранулирования, и подвергали таблетки тесту на растворение in vitro.
Таблица 21
|
Результаты оценки растворения таблеток, представленных выше в Таблице 21, представлены ниже в Таблице 22 и на Фиг. 11.
Таблица 22
|
Пример 3: Пример воздействия растворимого в воде матрикса на растворение целекоксиба
Каждое вещество из гидрохлорида трамадола и целекоксиба и наполнителей, представленных в следующих Таблицах, вымешивали с увлажнением, высушивали, гранулировали, смешивали и прессовали в таблетки способом влажного гранулирования, и подвергали таблетки тесту на растворение in vitro.
Таблица 23: Состав трамадола
|
Таблица 25: Состав с целекоксибом согласно одному варианту осуществления настоящего изобретения
|
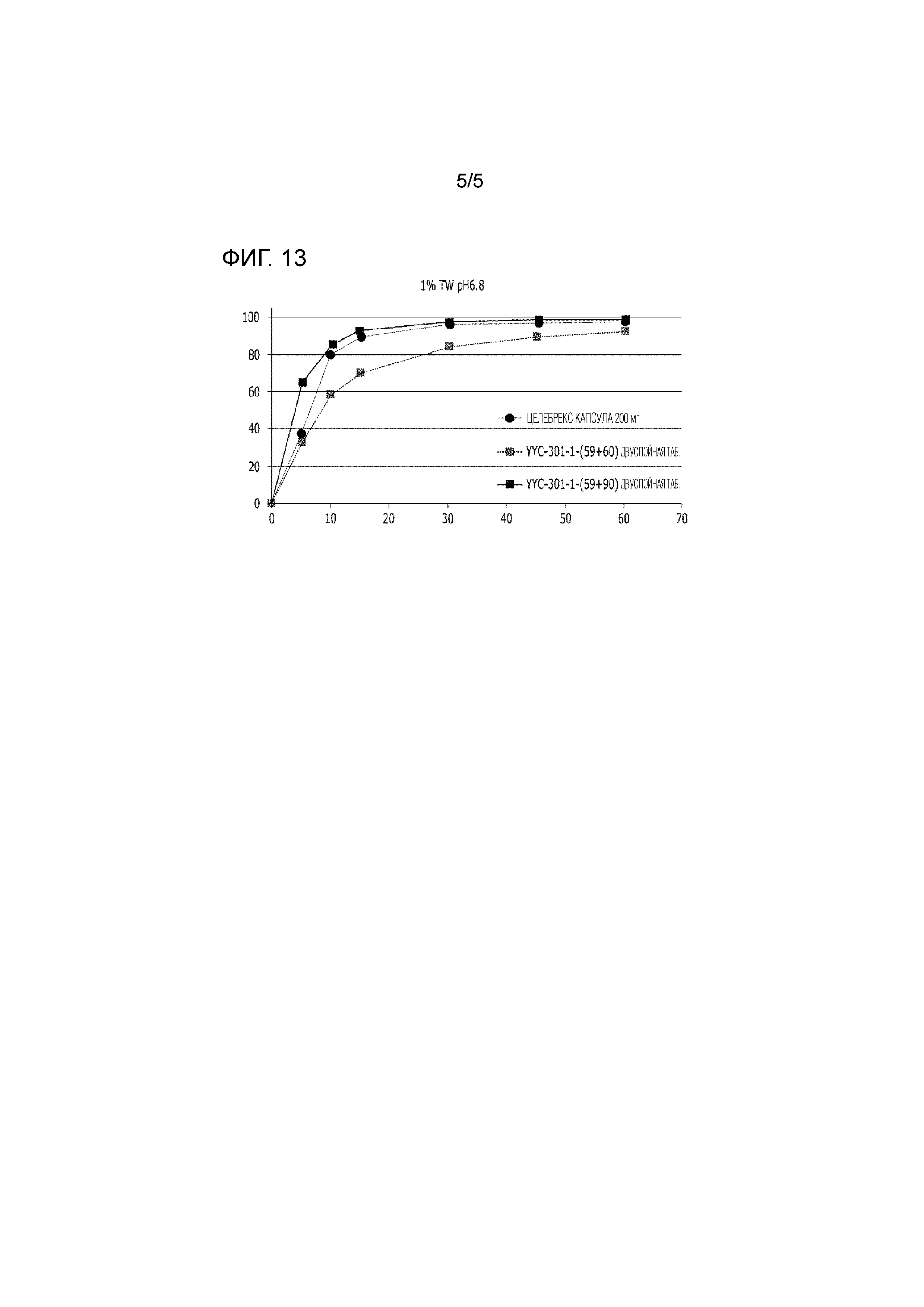
Результаты оценки растворения представлены ниже в Таблицах 26 и 27 и на Фиг. 11 и 13.
Таблица 26
|
Таблица 27
|