Результат интеллектуальной деятельности: ЗАМЕЩЕННЫЕ ЦИКЛИЧЕСКИЕ АМИДЫ В КАЧЕСТВЕ ГЕРБИЦИДОВ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к определенным замещенным циклическим амидам, их N-оксидам и солям, а также к композициям и способам их применения для борьбы с нежелательной растительностью.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Контроль нежелательной растительности чрезвычайно важен для достижения высокой производительности сельскохозяйственных культур. Достижение избирательного контроля роста сорняков, особенно в таких полезных сельскохозяйственных культурах, как рис, соя, сахарная свекла, маис, картофель, пшеница, ячмень, томат и плантационные культуры, среди прочих, является крайне необходимым. Бесконтрольный рост сорняков в таких полезных сельскохозяйственных культурах может вызывать значительное снижение продуктивности и, таким образом, приводить в результате к повышению затрат для потребителя. Контроль нежелательной растительности на незасеваемых участках также является важным. Для этих целей коммерчески доступно множество продуктов, однако остается потребность в новых соединениях, которые являются более эффективными, менее дорогостоящими, менее токсичными, более безопасными для окружающей среды или имеют различные участки приложения действия.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединениям формулы 1 (в том числе всем стереоизомерам), их N-оксидам и солям, к содержащим их композициям для применения в сельском хозяйстве и к их применению в качестве гербицидов:

где
Q1 представляет собой фенильное кольцо или нафталинильную кольцевую систему, причем каждое кольцо или кольцевая система необязательно замещены 1-4 заместителями, независимо выбранными из R7; или 5-6-членное гетероароматическое кольцо или 8-10-членную гетероароматическую бициклическую кольцевую систему, причем каждое кольцо или кольцевая система содержат члены кольца, выбранные из атомов углерода и 1-4 гетероатомов, независимо выбранных из не более 2 атомов O, не более 2 атомов S и не более 4 атомов N, причем не более 3 членов кольца, представляющих собой атом углерода, независимо выбраны из C(=O) и C(=S), а члены кольца, представляющие собой атом серы, независимо выбраны из S(=O)u(=NR8)v, причем каждое кольцо или кольцевая система необязательно замещены не более 4 заместителями, независимо выбранными из R7 при членах кольца, представляющих собой атом углерода, и выбранными из R9 при членах кольца, представляющих собой атом азота;
Q2 представляет собой фенильное кольцо или нафталинильную кольцевую систему, причем каждое кольцо или кольцевая система необязательно замещены не более 5 заместителями, независимо выбранными из R10; или 5-6-членное гетероароматическое кольцо или 8-10-членную гетероароматическую бициклическую кольцевую систему, причем каждое кольцо или кольцевая система содержат члены кольца, выбранные из атомов углерода и 1-4 гетероатомов, независимо выбранных из не более 2 атомов O, не более 2 атомов S и не более 4 атомов N, причем не более 3 членов кольца, представляющих собой атом углерода, независимо выбраны из C(=O) и C(=S), а члены кольца, представляющие собой атом серы, независимо выбраны из S(=O)u(=NR8)v, причем каждое кольцо или кольцевая система необязательно замещены не более 5 заместителями, независимо выбранными из R10 при членах кольца, представляющих собой атом углерода, и выбранными из R11 при членах кольца, представляющих собой атом азота;
T представляет собой J1-A-, при этом свободная связь, направленная вправо, рядом с A указывает на точку соединения J1-A- с Q1; или
T представляет собой R17ON=CR17a-, (R18)2C=NO-, (R19)2NN=CR17a-, (R18)2C=NNR20a-, R20N=CR17a-, (R18)2C=N-, R17ON=CR17aC(R23b)2- или (R18)2C=NOC(R24a)2-, при этом свободная связь, направленная вправо, указывает на точку соединения с Q1;
A представляет собой насыщенную, частично ненасыщенную или полностью ненасыщенную цепь, содержащую 1-3 атома, выбранных из не более 3 атомов углерода, не более 1 атома O, не более 1 атома S и не более 2 атомов N, причем цепь необязательно замещена не более 2 заместителями, независимо выбранными из R15 при атомах углерода и R16 при атомах азота;
каждый из Y1 и Y2 независимо представляет собой O, S или NR12;
J1 представляет собой фенильное кольцо или нафталинильную кольцевую систему, причем каждое кольцо или кольцевая система необязательно замещены не более 5 заместителями, независимо выбранными из R7'; или 4-6-членное гетероциклическое кольцо или 8-10-членную гетероароматическую бициклическую кольцевую систему, причем каждое кольцо или кольцевая система содержат члены кольца, выбранные из атомов углерода и 1-4 гетероатомов, независимо выбранных из не более 2 атомов O, не более 2 атомов S и не более 4 атомов N, причем не более 3 членов кольца, представляющих собой атом углерода, независимо выбраны из C(=O) и C(=S), а члены кольца, представляющие собой атом серы, независимо выбраны из S(=O)u(=NR8)v, причем каждое кольцо или кольцевая система необязательно замещены не более 5 заместителями, независимо выбранными из R7' при членах кольца, представляющих собой атом углерода, и выбранными из R9' при членах кольца, представляющих собой атом азота; или C4-C10циклоалкилалкокси, C4-C10циклоалкилалкил, C2-C8алкенилокси, C2-C8галогеналкенилокси, C2-C8алкоксиалкокси, C2-C8алкилтиоалкил, C2-C8алкилсульфинилалкил, C2-C8алкилсульфонилалкил, C1-C8алкилсульфонилокси, C1-C8галогеналкилсульфонилокси, C1-C8алкилтио, C1-C8галогеналкилтио, C3-C8циклоалкилтио, C1-C8алкилсульфинил, C1-C8галогеналкилсульфинил, C1-C8алкилсульфонил, C1-C8галогеналкилсульфонил, C2-C8алкинил, C2-C8галогеналкинил, C2-C8алкоксиалкил, C2-C8галогеналкоксиалкил, C3-C8галогеналкоксиалкокси, C2-C8галогеналкоксигалогеналкил, C1-C8галогеналкил, C3-C8галогенциклоалкил, C2-C8алкилкарбонилокси или C2-C8галогеналкилкарбонилокси;
J2 представляет собой -CR2R3- или -CR2R3-CR2aR3a-, где фрагмент -CR2R3- соединен c N;
R1 представляет собой H, гидрокси, амино, циано, формил, C3-C8алкилкарбонилалкил, -CPh=N-O(C1-C4алкил), -C(C1-C4алкил)=N-O(C1-C4алкил), -C(O)NH2, C1-C6алкил, C1-C6галогеналкил, C2-C6алкенил, C3-C6алкинил, C2-C6цианоалкил, C3-C6циклоалкил, C4-C8циклоалкилалкил, C2-C8алкоксиалкил, C3-C8алкоксиалкоксиалкил, C2-C8галогеналкоксиалкил, C2-C8алкилтиоалкил, C2-C8алкилсульфинилалкил, C2-C8алкилсульфонилалкил, C2-C8алкилкарбонил, C2-C8галогеналкилкарбонил, C4-C10циклоалкилкарбонил, C2-C8алкоксикарбонил, C2-C8галогеналкоксикарбонил, C4-C10циклоалкоксикарбонил, C2-C8алкиламинокарбонил, C3-C10диалкиламинокарбонил, C4-C10циклоалкиламинокарбонил, C1-C6алкокси, C1-C6алкилтио, C1-C6галогеналкилтио, C3-C8циклоалкилтио, C1-C6алкилсульфинил, C1-C6галогеналкилсульфинил, C3-C8циклоалкилсульфинил, C1-C6алкилсульфонил, C1-C6галогеналкилсульфонил, C3-C8циклоалкилсульфонил, C1-C6алкиламиносульфонил, C2-C8диалкиламиносульфонил, C3-C10триалкилсилил, фенилкарбонил или G1;
каждый из R2 и R3 независимо представляет собой H, галоген, гидрокси, C1-C4алкил, C1-C4галогеналкил или C1-C4алкокси; или
R2 и R3 взяты вместе с атомом углерода, с которым они связаны, с образованием C3-C7циклоалкильного кольца;
каждый из R2a и R3a независимо представляет собой H, галоген или C1-C4алкил; или
R2a и R3a взяты вместе с атомом углерода, с которым они связаны, с образованием C3-C7циклоалкильного кольца;
каждый из R4 и R5 независимо представляет собой H, галоген, гидроксил, C1-C4алкокси или C1-C4алкил;
R6 представляет собой H, гидрокси, амино, C1-C6алкил, C1-C6галогеналкил, C2-C6алкенил, C3-C6алкинил, C2-C8алкоксиалкил, C2-C8галогеналкоксиалкил, C2-C8алкилтиоалкил, C2-C8алкилсульфинилалкил, C2-C8алкилсульфонилалкил, C2-C8алкилкарбонил, C2-C8галогеналкилкарбонил, C4-C10циклоалкилкарбонил, C2-C8алкоксикарбонил, C2-C8галогеналкоксикарбонил, C4-C10циклоалкоксикарбонил, C2-C8алкиламинокарбонил, C3-C10диалкиламинокарбонил, C4-C10циклоалкиламинокарбонил, C1-C6алкокси, C1-C6алкилтио, C1-C6галогеналкилтио, C3-C8циклоалкилтио, C1-C6алкилсульфинил, C1-C6галогеналкилсульфинил, C3-C8циклоалкилсульфинил, C1-C6алкилсульфонил, C1-C6галогеналкилсульфонил, C3-C8циклоалкилсульфонил, C1-C6алкиламиносульфонил, C2-C8диалкиламиносульфонил, C3-C10триалкилсилил или G1;
каждый R7 независимо представляет собой галоген, гидроксил, циано, нитро, C1-C4алкил, C1-C4цианоалкил, C1-C4цианоалкокси, C1-C4галогеналкил, C2-C4алкенил, C2-C4галогеналкенил, C2-C4алкинил, C2-C4галогеналкинил, C1-C4нитроалкил, C2-C4нитроалкенил, C2-C4алкоксиалкил, C3-C8алкоксиалкоксиалкил, C2-C4галогеналкоксиалкил, C3-C4циклоалкил, C3-C4галогенциклоалкил, циклопропилметил, 1-метилциклопропил, 2-метилциклопропил, C1-C4алкокси, C1-C4галогеналкокси, C2-C4алкенилокси, C2-C4галогеналкенилокси, C3-C4алкинилокси, C3-C4галогеналкинилокси, C3-C4циклоалкокси, C1-C4алкилтио, C1-C4галогеналкилтио, C1-C4алкилсульфинил, C1-C4галогеналкилсульфинил, C1-C4алкилсульфонил, C1-C4галогеналкилсульфонил, гидрокси, -CHO, C2-C4алкилкарбонил, C2-C4алкилкарбонилокси, C1-C4алкилсульфонилокси, C1-C4галогеналкилсульфонилокси, амино, C1-C4алкиламино, C2-C4диалкиламино, формиламино, C2-C4алкилкарбониламино, -SF5, -SCN, C3-C4триалкилсилил, триметилсилилметил или триметилсилилметокси; или
два смежных R7 взяты вместе с атомами углерода, с которыми они связаны, с образованием C3-C7циклоалкильного кольца;
каждый R10 независимо представляет собой галоген, гидроксил, циано, нитро, C1-C8алкил, C1-C8галогеналкил, C1-C8нитроалкил, C2-C8алкенил, C2-C4алкоксиалкил, C3-C8алкоксиалкоксиалкил, C1-C4цианоалкил, C1-C4цианоалкокси, C2-C8галогеналкенил, C2-C8нитроалкенил, C2-C8алкинил, C2-C8галогеналкинил, C4-C10циклоалкилалкил, C4-C10галогенциклоалкилалкил, C5-C12алкилциклоалкилалкил, C5-C12циклоалкилалкенил, C5-C12циклоалкилалкинил, C3-C8циклоалкил, C3-C8галогенциклоалкил, C4-C10алкилциклоалкил, C6-C12циклоалкилциклоалкил, C3-C8циклоалкенил, C3-C8галогенциклоалкенил, C2-C8алкоксиалкил, C2-C8галогеналкоксиалкил, C4-C10циклоалкоксиалкил, C3-C10алкоксиалкоксиалкил, C2-C8алкилтиоалкил, C2-C8алкилсульфинилалкил, C2-C8алкилсульфонилалкил, C2-C8алкиламиноалкил, C2-C8галогеналкиламиноалкил, C4-C10циклоалкиламиноалкил, C3-C10диалкиламиноалкил, -CHO, C2-C8алкилкарбонил, C2-C8галогеналкилкарбонил, C4-C10циклоалкилкарбонил, -C(=O)OH, C2-C8алкоксикарбонил, C2-C8галогеналкоксикарбонил, C4-C10циклоалкоксикарбонил, C5-C12циклоалкилалкоксикарбонил, -C(=O)NH2, C2-C8алкиламинокарбонил, C4-C10циклоалкиламинокарбонил, C3-C10диалкиламинокарбонил, гидрокси, C1-C8алкокси, C1-C8галогеналкокси, C2-C8алкоксиалкокси, C2-C8алкенилокси, C2-C8галогеналкенилокси, C3-C8алкинилокси, C3-C8галогеналкинилокси, C3-C8циклоалкокси, C3-C8галогенциклоалкокси, C4-C10циклоалкилалкокси, C3-C10алкилкарбонилалкокси, C2-C8алкилкарбонилокси, C2-C8галогеналкилкарбонилокси, C4-C10циклоалкилкарбонилокси, C1-C8алкилсульфонилокси, C1-C8галогеналкилсульфонилокси, C1-C8алкилтио, C1-C8галогеналкилтио, C3-C8циклоалкилтио, C1-C8алкилсульфинил, C1-C8галогеналкилсульфинил, C1-C8алкилсульфонил, C1-C8галогеналкилсульфонил, C3-C8циклоалкилсульфонил, амино, C1-C8алкиламино, C1-C6галогеналкиламино, C3-C8циклоалкиламино, C2-C8диалкиламино, C2-C8галогендиалкиламино, формиламино, C2-C8алкилкарбониламино, C2-C8галогеналкилкарбониламино, C1-C6алкилсульфониламино, C1-C6галогеналкилсульфониламино, -SF5, -SCN, C3-C12триалкилсилил, C4-C12триалкилсилилалкил, C4-C12триалкилсилилалкокси или G2; или
два смежных R10 взяты вместе с атомами углерода, с которыми они связаны, с образованием C3-C7циклоалкильного кольца;
каждый R7' независимо представляет собой галоген, гидроксил, циано, нитро, C1-C8алкил, C2-C4алкоксиалкил, C3-C8алкоксиалкоксиалкил, C1-C4цианоалкил, C1-C4цианоалкокси, C1-C8галогеналкил, C1-C8нитроалкил, C2-C8алкенил, C2-C8галогеналкенил, C2-C8нитроалкенил, C2-C8алкинил, C2-C8галогеналкинил, C4-C10циклоалкилалкил, C4-C10галогенциклоалкилалкил, C5-C12алкилциклоалкилалкил, C5-C12циклоалкилалкенил, C5-C12циклоалкилалкинил, C3-C8циклоалкил, C3-C8галогенциклоалкил, C4-C10алкилциклоалкил, C6-C12циклоалкилциклоалкил, C3-C8циклоалкенил, C3-C8галогенциклоалкенил, C2-C8алкоксиалкил, C2-C8галогеналкоксиалкил, C4-C10циклоалкоксиалкил, C3-C10алкоксиалкоксиалкил, C2-C8алкилтиоалкил, C2-C8алкилсульфинилалкил, C2-C8алкилсульфонилалкил, C2-C8алкиламиноалкил, C2-C8галогеналкиламиноалкил, C4-C10циклоалкиламиноалкил, C3-C10диалкиламиноалкил, -CHO, C2-C8алкилкарбонил, C2-C8галогеналкилкарбонил, C4-C10циклоалкилкарбонил, -C(=O)OH, C2-C8алкоксикарбонил, C2-C8галогеналкоксикарбонил, C4-C10циклоалкоксикарбонил, C5-C12циклоалкилалкоксикарбонил, -C(=O)NH2, C2-C8алкиламинокарбонил, C4-C10циклоалкиламинокарбонил, C3-C10диалкиламинокарбонил, гидрокси, C1-C8алкокси, C1-C8галогеналкокси, C2-C8алкоксиалкокси, C2-C8алкенилокси, C2-C8галогеналкенилокси, C3-C8алкинилокси, C3-C8галогеналкинилокси, C3-C8циклоалкокси, C3-C8галогенциклоалкокси, C4-C10циклоалкилалкокси, C3-C10алкилкарбонилалкокси, C2-C8алкилкарбонилокси, C2-C8галогеналкилкарбонилокси, C4-C10циклоалкилкарбонилокси, C1-C8алкилсульфонилокси, C1-C8галогеналкилсульфонилокси, C1-C8алкилтио, C1-C8галогеналкилтио, C3-C8циклоалкилтио, C1-C8алкилсульфинил, C1-C8галогеналкилсульфинил, C1-C8алкилсульфонил, C1-C8галогеналкилсульфонил, C3-C8циклоалкилсульфонил, амино, C1-C8алкиламино, C1-C6галогеналкиламино, C3-C8циклоалкиламино, C2-C8диалкиламино, C2-C8галогендиалкиламино, формиламино, C2-C8алкилкарбониламино, C2-C8галогеналкилкарбониламино, C1-C6алкилсульфониламино, C1-C6галогеналкилсульфониламино, -SF5, -SCN, C3-C12триалкилсилил, C4-C12триалкилсилилалкил, C4-C12триалкилсилилалкокси; или
два смежных R7' взяты вместе с атомами углерода, с которыми они связаны, с образованием C3-C7циклоалкильного кольца;
каждый R8 независимо представляет собой H, циано, C2-C3алкилкарбонил или C2-C3галогеналкилкарбонил;
каждый из R9, R9' и R11 независимо представляет собой циано, C1-C3алкил, C2-C3алкенил, C2-C3алкинил, C3-C6циклоалкил, C2-C3алкоксиалкил, C1-C3алкокси, C2-C3алкилкарбонил, C2-C3алкоксикарбонил, C2-C3алкиламиноалкил или C3-C4диалкиламиноалкил;
каждый R12 независимо представляет собой H, циано, C1-C4алкил, C1-C4галогеналкил, C1-C4алкокси, C1-C4галогеналкокси, -(C=O)CH3 или -(C=O)CF3;
каждый G1 независимо представляет собой фенил, фенилметил (т. е. бензил), пиридинилметил, фенилкарбонил (т. е. бензоил), фенокси, фенилэтинил, фенилсульфонил, фенилкарбонилалкил или 5- или 6-членное гетероароматическое кольцо, причем каждый из них необязательно замещен по членам кольца не более 5 заместителями, независимо выбранными из R13;
каждый G2 независимо представляет собой фенил, фенилметил (т. е. бензил), пиридинилметил, фенилкарбонил (т. е. бензоил), фенилкарбонилалкил, фенокси, фенилэтинил, фенилсульфонил или 5- или 6-членное гетероароматическое кольцо, причем каждый из них необязательно замещен по членам кольца не более 5 заместителями, независимо выбранными из R14;
каждый из R13 и R14 независимо представляет собой галоген, циано, гидрокси, амино, нитро, -CHO, -C(=O)OH, -C(=O)NH2, -SO2NH2, C1-C6алкил, C1-C6галогеналкил, C2-C6алкенил, C2-C6алкинил, C2-C8алкилкарбонил, C2-C8галогеналкилкарбонил, C2-C8алкоксикарбонил, C4-C10циклоалкоксикарбонил, C5-C12циклоалкилалкоксикарбонил, C2-C8алкиламинокарбонил, C3-C10диалкиламинокарбонил, C1-C6алкокси, C1-C6галогеналкокси, C2-C8алкилкарбонилокси, C1-C6алкилтио, C1-C6галогеналкилтио, C1-C6алкилсульфинил, C1-C6галогеналкилсульфинил, C1-C6алкилсульфонил, C1-C6галогеналкилсульфонил, C1-C6алкиламиносульфонил, C2-C8диалкиламиносульфонил, C3-C10триалкилсилил, C1-C6алкиламино, C2-C8диалкиламино, C2-C8алкилкарбониламино, C1-C6алкилсульфониламино, фенил, пиридинил или тиенил;
каждый R15 независимо представляет собой галоген, циано, гидрокси, C1-C4алкил, C1-C4галогеналкил, C1-C4алкокси, C1-C4галогеналкокси, C2-C4алкоксиалкил, C2-C4алкилкарбонил, C2-C4алкоксикарбонил или C3-C6циклоалкил;
каждый R16 независимо представляет собой H, циано, C1-C4алкил, C1-C4галогеналкил, C1-C4алкокси, C2-C4алкилкарбонил, C2-C4алкоксикарбонил или C3-C6циклоалкил;
каждый R17 независимо представляет собой H, C1-C6алкил, C3-C8циклоалкил, C4-C8циклоалкилалкил, C1-C6галогеналкил, C2-C6алкенил, C3-C6алкинил, C2-C8алкоксиалкил, C2-C8галогеналкоксиалкил, C2-C8алкилтиоалкил, C2-C8алкилсульфинилалкил, C2-C8алкилсульфонилалкил, C2-C8алкилкарбонил, C2-C8галогеналкилкарбонил, C4-C10циклоалкилкарбонил, C2-C8алкоксикарбонил, C2-C8галогеналкоксикарбонил, C4-C10циклоалкоксикарбонил, C2-C8алкиламинокарбонил, C3-C10диалкиламинокарбонил, C4-C10циклоалкиламинокарбонил, C1-C6алкилсульфинил, C1-C6галогеналкилсульфинил, C3-C8циклоалкилсульфинил, C1-C6алкилсульфонил, C1-C6галогеналкилсульфонил, C3-C8циклоалкилсульфонил, C1-C6алкиламиносульфонил, C2-C8диалкиламиносульфонил, C3-C10триалкилсилил или G1;
каждый R17a независимо представляет собой H, C1-C6алкил, C3-C8циклоалкил, C4-C8циклоалкилалкил, C1-C6галогеналкил, C2-C6алкенил, C3-C6алкинил, C2-C8алкоксиалкил, C2-C8галогеналкоксиалкил, C2-C8алкилтиоалкил, C2-C8алкилсульфинилалкил, C2-C8алкилсульфонилалкил, C1-C6алкокси, C1-C6алкилтио, C1-C6галогеналкилтио, C3-C8циклоалкилтио, C3-C10триалкилсилил или G1;
каждый R18 независимо представляет собой H, гидрокси, C1-C6алкил, C3-C8циклоалкил, C4-C8циклоалкилалкил, C1-C6галогеналкил, C2-C6алкенил, C3-C6алкинил, C2-C8алкоксиалкил, C2-C8галогеналкоксиалкил, C2-C8алкилтиоалкил, C2-C8алкилсульфинилалкил, C2-C8алкилсульфонилалкил, C2-C8алкилкарбонил, C2-C8галогеналкилкарбонил, C4-C10циклоалкилкарбонил, C2-C8алкоксикарбонил, C2-C8галогеналкоксикарбонил, C4-C10циклоалкоксикарбонил, C2-C8алкиламинокарбонил, C3-C10диалкиламинокарбонил, C4-C10циклоалкиламинокарбонил, C1-C6алкокси, C1-C6алкилтио, C1-C6галогеналкилтио, C3-C8циклоалкилтио, C1-C6алкилсульфинил, C1-C6галогеналкилсульфинил, C3-C8циклоалкилсульфинил, C1-C6алкилсульфонил, C1-C6галогеналкилсульфонил, C3-C8циклоалкилсульфонил, C1-C6алкиламиносульфонил, C2-C8диалкиламиносульфонил, C3-C10триалкилсилил или G1;
каждый R19 независимо представляет собой H, C1-C6алкил, C3-C8циклоалкил, C4-C8циклоалкилалкил, C1-C6галогеналкил, C2-C6алкенил, C3-C6алкинил, C2-C8алкоксиалкил, C2-C8галогеналкоксиалкил, C2-C8алкилтиоалкил, C2-C8алкилсульфинилалкил, C2-C8алкилсульфонилалкил, C2-C8алкилкарбонил, C2-C8галогеналкилкарбонил, C4-C10циклоалкилкарбонил, C2-C8алкоксикарбонил, C2-C8галогеналкоксикарбонил, C4-C10циклоалкоксикарбонил, C2-C8алкиламинокарбонил, C3-C10диалкиламинокарбонил, C4-C10циклоалкиламинокарбонил, C1-C6алкокси, C1-C6алкилсульфинил, C1-C6галогеналкилсульфинил, C3-C8циклоалкилсульфинил, C1-C6алкилсульфонил, C1-C6галогеналкилсульфонил, C3-C8циклоалкилсульфонил, C1-C6алкиламиносульфонил, C2-C8диалкиламиносульфонил, C3-C10триалкилсилил или G1;
каждый R20 независимо представляет собой H, гидрокси, амино, C1-C6алкил, C3-C8циклоалкил, C4-C8циклоалкилалкил, C1-C6галогеналкил, C2-C6алкенил, C3-C6алкинил, C2-C8алкоксиалкил, C2-C8галогеналкоксиалкил, C2-C8алкилтиоалкил, C2-C8алкилсульфинилалкил, C2-C8алкилсульфонилалкил, C2-C8алкилкарбонил, C2-C8галогеналкилкарбонил, C4-C10циклоалкилкарбонил, C2-C8алкоксикарбонил, C2-C8галогеналкоксикарбонил, C4-C10циклоалкоксикарбонил, C2-C8алкиламинокарбонил, C3-C10диалкиламинокарбонил, C4-C10циклоалкиламинокарбонил, C1-C6алкокси, C1-C6алкилсульфинил, C1-C6галогеналкилсульфинил, C3-C8циклоалкилсульфинил, C1-C6алкилсульфонил, C1-C6галогеналкилсульфонил, C3-C8циклоалкилсульфонил, C1-C6алкиламиносульфонил, C2-C8диалкиламиносульфонил, C3-C10триалкилсилил или G1;
каждый R20a независимо представляет собой H, C1-C6алкил, C3-C8циклоалкил, C4-C8циклоалкилалкил, C1-C6галогеналкил, C2-C6алкенил, C3-C6алкинил, C2-C8алкоксиалкил, C2-C8галогеналкоксиалкил, C2-C8алкилтиоалкил, C2-C8алкилсульфинилалкил, C2-C8алкилсульфонилалкил, C1-C6алкоксиC3-C10триалкилсилил или G1;
каждый R23b независимо представляет собой H, галоген, циано, гидрокси, C1-C4алкил, C3-C8циклоалкил, C4-C8циклоалкилалкил, C1-C4галогеналкил, C1-C4алкокси, C1-C4галогеналкокси, C2-C4алкоксиалкил, C2-C4алкилкарбонил, C2-C4алкоксикарбонил или C3-C6циклоалкил;
каждый R24a независимо представляет собой H, C1-C4алкил, C3-C8циклоалкил, C4-C8циклоалкилалкил, C1-C4галогеналкил, C1-C4алкокси, C1-C4галогеналкокси, C2-C4алкоксиалкил, C2-C4алкилкарбонил, C2-C4алкоксикарбонил или C3-C6циклоалкил;
каждый из u и v независимо равняется 0, 1 или 2 в каждом случае S(=O)u(=NR8)v, при условии, что сумма u и v равняется 0, 1 или 2;
при условии, что если
a) J1 представляет собой незамещенное фенильное кольцо, A является отличным от -CH2-, -O-, -C≡C-, -C(=O)- или -SO2-; или
b) J1 представляет собой незамещенное пиридинильное кольцо, A является отличным от -CH2-;
c) J1 представляет собой С4-C10циклоалкилалкил, A является отличным от алкила; или
d) J1-A- находится в пара-положении Q1, A является отличным от O, а J1 является отличным от 2-фуранилметила.
Более конкретно, настоящее изобретение относится к соединению формулы 1 (в том числе всем стереоизомерам), его N-оксиду или соли. Настоящее изобретение также относится к гербицидной композиции, содержащей соединение по настоящему изобретению (т. е. в гербицидно эффективном количестве) и по меньшей мере один компонент, выбранный из группы, состоящей из поверхностно-активных веществ, твердых разбавителей и жидких разбавителей. Настоящее изобретение также относится к способу контроля роста нежелательной растительности, предусматривающему приведение в контакт растительности или окружающей ее среды с гербицидно эффективным количеством соединения по настоящему изобретению (например, в виде описанной в данном документе композиции).
Настоящее изобретение также включает гербицидную смесь, содержащую (a) соединение, выбранное из соединения формулы 1, его N-оксидов и солей, и (b) по меньшей мере один дополнительный активный ингредиент, выбранный из (b1) - (b16) и солей соединений (b1) - (b16), как описано ниже.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Подразумевается, что используемые в настоящем документе выражения "содержит", "содержащий", "включает", "включающий", "имеет", "имеющий", "включает в себя", "включающий в себя", "характеризующийся тем, что" или любые другие их варианты распространяются на неисключительное включение, если явно не указано какое-либо ограничение. Например, композиция, смесь, процесс, способ, изделие или прибор, которые содержат перечень элементов, не обязательно ограничиваются только этими элементами, но могут включать другие элементы, которые не перечислены явно или присущи такой композиции, смеси, процессу, способу, изделию или прибору.
Переходная фраза "состоящий из" исключает любой неуказанный элемент, стадию или ингредиент. При наличии в пункте формулы изобретения такая фраза не будет допускать включение в пункт формулы изобретения материалов, отличных от тех, которые перечислены, за исключением примесей, обычно связанных с ними. Если фраза "состоящий из" появляется в отличительной части пункта формулы изобретения, а не сразу после ограничительной части, она ограничивает только элемент, изложенный в этой отличительной части; при этом другие элементы не исключаются из пункта формулы изобретения в целом.
Переходная фраза "по сути состоящий из" применяется для обозначения композиции, способа или прибора, что включает материалы, стадии, признаки, компоненты или элементы, в дополнение к буквально раскрываемым, при условии, что эти дополнительные материалы, стадии, признаки, компоненты или элементы существенно не влияют на основную и новую характеристику(характеристики) заявленного изобретения. Выражение "по сути состоящий из" занимает промежуточное положение между "содержащий" и "состоящий из".
Если заявители определили настоящее изобретение или его часть неограничивающим выражением, таким как "содержащий", явно следует понимать, что (если не указано иное) описание следует толковать как также описывающее такое изобретение с применением выражений "по сути состоящий из" или "состоящий из".
Кроме того, если прямо не указано обратное, "или" относится к включающему "или", а не к исключающему "или". Например, условие А или В удовлетворяет любым из следующих условий: А истинно (или присутствует) и B ошибочно (или не присутствует), А ошибочно (или не присутствует) и B истинно (или присутствует), и как А, так и B истинны (или присутствуют).
Также подразумевается, что упоминание элемента или компонента настоящего изобретения в единственном числе не предполагает ограничения в отношении числа примеров (т. е. случаев присутствия) элемента или компонента. Поэтому единственное число следует понимать как включающее одно или по меньшей мере одно, а форма единственного числа для обозначения элемента или компонента также включает множественное число, за исключением случаев, когда явно подразумевается единственное число.
Как изложено в данном документе, выражение "проросток", применяемое либо отдельно, либо в комбинации слов, означает молодое растение, развивающееся из зародыша семени.
Как изложено в данном документе, выражение "широколиственный", применяемое либо отдельно, либо в таких словах, как "широколиственный сорняк", означает двудольное или двудольное растение, выражение, применяемое для описания группы покрытосеменных растений, характеризующихся наличием двух семядоль у зародышей.
В вышеуказанных перечислениях выражение "алкил", используемое либо отдельно, либо в сложных словах, таких как "алкилтио" или "галогеналкил", включает линейный или разветвленный алкил, такой как метил, этил, н-пропил, изопропил или различные изомеры бутила, пентила или гексила. "Алкенил" включает линейные или разветвленные алкены, такие как этенил, 1-пропенил, 2-пропенил, и различные изомеры бутенила, пентенила и гексенила. "Алкенил" также включает полиены, такие как 1,2-пропадиенил и 2,4-гексадиенил.
"Алкокси" включает, например, метокси, этокси, н-пропилокси, изопропилокси и различные изомеры бутокси, пентокси и гексилокси. "Алкоксиалкил" обозначает замещение алкокси по алкилу. Примеры "алкоксиалкила" включают CH3OCH2-, CH3OCH2CH2-, CH3CH2OCH2-, CH3CH2CH2CH2OCH2- и CH3CH2OCH2CH2-. "Алкоксиалкоксиалкил" обозначает замещение алкокси по фрагменту алкокси фрагмента алкоксиалкила. Примеры "алкоксиалкоксиалкила" включают CH3OCH2OCH2-, CH3CH2O(CH3)CHOCH2- и (CH3O)2CHOCH2-. "Алкоксиалкокси" обозначает замещение алкокси по алкокси. "Алкенилокси" включает линейные или разветвленные алкенилокси-фрагменты. Примеры "алкенилокси" включают H2C=CH=CH2O-, (CH3)2C=CH=CH2O-, (CH3)CH=CH=CH2O-, (CH3)CH=C(CH3)CH2O- и CH2=CH=CH2CH2O-. "Алкинилокси" включает линейные или разветвленные алкинилокси-фрагменты. Примеры "алкинилокси" включают HC≡CCH2O-, CH3C≡CCH2O- и CH3C≡CCH2CH2O-. "Алкилтио" включает разветвленные или линейные фрагменты алкилтио, такие как метилтио, этилтио и различные изомеры пропилтио, бутилтио, пентилтио и гексилтио. "Алкилсульфинил" включает оба энантиомера алкилсульфинильной группы. Примеры "алкилсульфинила" включают CH3S(O)-, CH3CH2S(O)-, CH3CH2CH2S(O)-, (CH3)2CHS(O)- и различные изомеры бутилсульфинила, пентилсульфинила и гексилсульфинила. Примеры "алкилсульфонила" включают CH3S(O)2-, CH3CH2S(O)2-, CH3CH2CH2S(O)2-, (CH3)2CHS(O)2- и различные изомеры бутилсульфонила, пентилсульфонила и гексилсульфонила. Примеры "алкилсульфониламино" включают CH3S(O)2NH-, CH3CH2S(O)2NH-, CH3CH2CH2S(O)2NH-, (CH3)2CHS(O)2NH- и различные изомеры бутилсульфониламино, пентилсульфониламино и гексилсульфониламино. Примеры "алкилсульфонилокси" включают CH3S(O)2O-, CH3CH2S(O)2O-, CH3CH2CH2S(O)2O-, (CH3)2CHS(O)2O- и различные изомеры бутилсульфонилокси, пентилсульфонилокси и гексилсульфонилокси. "Алкилтиоалкил" обозначает замещение алкилтио по алкилу. Примеры "алкилтиоалкила" включают CH3SCH2-, CH3SCH2CH2-, CH3CH2SCH2-, CH3CH2CH2CH2SCH2- и CH3CH2SCH2CH2-. "Цианоалкил" обозначает алкильную группу, замещенную одной цианогруппой. Примеры "цианоалкила" включают NCCH2, NCCH2CH2- и CH3CH(CN)CH2-. «Цианоалкокси" обозначает алкоксигруппу, замещенную одной цианогруппой. Примеры "цианоалкокси" включают NCCH2O-, NCCH2CH2O- и CH3CH(CN)CH2O-. "Алкилсульфинилалкил" обозначает замещение алкилсульфинила по алкилу. Примеры "алкилсульфинилалкила" включают CH3S(=O)CH2-, CH3S(=O)CH2CH2-, CH3CH2S(=O)CH2- и CH3CH2S(=O)CH2CH2-. "Алкилсульфонилалкил" обозначает замещение алкилсульфонила по алкилу. Примеры "алкилсульфонилалкила" включают CH3S(=O)2CH2-, CH3S(=O)2CH2CH2-, CH3CH2S(=O)2CH2- и CH3CH2S(=O)2CH2CH2-. "Алкиламино", "диалкиламино" и т. п. определены аналогично вышеприведенным примерам. Примеры "алкиламиноалкила" включают CH3NHCH2-, (CH3)2CHNHCH2- и CH3NHCH(CH3)-. Примеры "алкиламинокарбонила" включают CH3NHC(O)-, (CH3)2CHNHC(O)- и CH3CH2NHC(O)-. Примеры "диалкиламиноалкила" включают (CH3)2NCH2-, (CH3)2NC(CH3)H- и (CH3)(CH3)NCH2-. Примеры "алкиламинокарбонила" включают CH3NC(O)- и CH3 CH2NC(O)-. Примеры "диалкиламинокарбонила" включают (CH3)2NC(O)-. Примеры "диалкиламиносульфонила" включают (CH3)2NS(O)2-.
"Циклоалкил" включает, например, циклопропил, циклобутил, циклопентил и циклогексил. Выражение "алкилциклоалкил" обозначает замещение алкила по фрагменту циклоалкила и включает, например, этилциклопропил, изопропилциклобутил, 3-метилциклопентил и 4-метилциклогексил. Выражение "циклоалкилалкил" обозначает замещение циклоалкила по фрагменту алкила. Примеры "циклоалкилалкила" включают циклопропилметил, циклопентилэтил и другие фрагменты циклоалкила, связанные с линейными или разветвленными алкильными группами. Выражение "циклоалкокси" обозначает циклоалкил, соединенный посредством атома кислорода, например, циклопентилокси и циклогексилокси. "Циклоалкоксиалкил" обозначает замещение циклоалкила по фрагменту алкила. Примеры "циклоалкоксиалкила" включают циклопропоксиметил, циклопентоксиэтил и другие фрагменты циклоалкокси, связанные с линейными или разветвленными алкильными группами. "Циклоалкилалкокси" обозначает циклоалкилалкил, связанный посредством атома кислорода, присоединенного к алкильной цепи. Примеры "циклоалкилалкокси" включают циклопропилметокси, циклопентилэтокси и другие фрагменты циклоалкила, связанные с линейными или разветвленными алкокси-группами. "Циклоалкенил" включает группы, такие как циклопентенил и циклогексенил, а также группы с более чем одной двойной связью, такие как 1,3- и 1,4-циклогексадиенил.
Выражение "галоген" либо отдельно, либо в сложных словах, таких как "галогеналкил", или при использовании в описаниях, таких как "алкил, замещенный галогеном", включает фтор, хлор, бром или йод. Кроме того, при использовании в сложных словах, таких как "галогеналкил", или при использовании в описаниях, таких как "алкил, замещенный галогеном", указанный алкил может быть частично или полностью замещен атомами галогена, которые могут быть одинаковыми или разными. Примеры "галогеналкила" или "алкила, замещенного галогеном" включают F3C-, ClCH2-, CF3CH2- и CF3CCl2-. Выражения "галогенциклоалкил", "галогеналкокси", "галогеналкилтио", "галогеналкенил", "галогеналкинил" и подобные им определяются аналогично выражению "галогеналкил". Примеры "галогеналкокси" включают CF3O-, CCl3CH2O-, HCF2CH2CH2O- и CF3CH2O-. Примеры "галогеналкилтио" включают CCl3S-, CF3S-, CCl3CH2S- и ClCH2CH2CH2S-. Примеры "галогеналкилсульфинила" включают CF3S(O)-, CCl3S(O)-, CF3CH2S(O)- и CF3CF2S(O)-. Примеры "галогеналкилсульфонила" включают CF3S(O)2-, CCl3S(O)2-, CF3CH2S(O)2- и CF3CF2S(O)2-. Примеры "галогеналкенила" включают (Cl)2C=CH=CH2- и CF3CH2CH=CH=CH2-. Примеры "галогеналкинила" включают HC≡CCHCl-, CF3C≡C-, CCl3C≡C- и FCH2C≡CCH2-. Примеры "галогеналкоксиалкокси" включают CF3OCH2O-, ClCH2CH2OCH2CH2O-, Cl3CCH2OCH2O- и разветвленные производные алкила.
"Алкилкарбонил" обозначает линейные или разветвленные фрагменты алкила, связанные с фрагментом C(=O). Примеры "алкилкарбонила" включают CH3C(=O)-, CH3CH2CH2C(=O)- и (CH3)2CHC(=O)-. Примеры "алкилкарбонилалкокси" включают CH3C(=O)CH2O-, CH3CH2CH2C(=O)CH2O- и (CH3)2CHC(=O)CH2O-. Примеры "алкоксикарбонила" включают CH3OC(=O)-, CH3CH2OC(=O)-, CH3CH2CH2OC(=O)-, (CH3)2CHOC(=O)- и различные изомеры бутокси- или пентоксикарбонила. "Алкилкарбонилокси" обозначает алкилкарбонильный фрагмент, связанный посредством атома кислорода, присоединенного к карбонилу. Примеры "алкилкарбонилокси" включают CH3C(=O)O-, CH3CH2CH2C(=O)O- и (CH3)2CHC(=O)O-.
Общее число атомов углерода в группе заместителя обозначают приставкой "Ci-Cj", в которой i и j являются числами от 1 до 12. Например, C1-C4алкилсульфонил определяет группы от метилсульфонила до бутилсульфонила; C2алкоксиалкил определяет CH3OCH2-; C3алкоксиалкил определяет, например, CH3CH(OCH3)-, CH3OCH2CH2- или CH3CH2OCH2-; и C4алкоксиалкил определяет различные изомеры алкильной группы, замещенной алкокси-группой, содержащей всего четыре атома углерода, при этом примеры включают CH3CH2CH2OCH2- и CH3CH2OCH2CH2-.
Если соединение замещено заместителем, содержащим индекс, который указывает на то, что число указанных заместителей может превышать 1, то указанные заместители (если их число превышает 1) независимо выбраны из группы определенных заместителей (например, [(R10)n], причем n равняется 1, 2, 3, 4 или 5). Кроме того, если индекс указывает диапазон, например, (R)i-j, то число заместителей может быть выбрано из целых чисел от i до j включительно. Если группа содержит заместитель, которым может быть водород, например, (R1 или R6), то в случае, когда этот заместитель представляет собой водород, это понимают как равнозначное тому, что указанная группа является незамещенной. Если показано, что переменная группа необязательно присоединена к положению, например, [(R10)n], где n может равняться 0, то водород может находиться в данном положении, даже если это не указано в определении переменной группы. Если одно или несколько положений в группе указаны как "без заместителей" или "незамещенные", то атомы водорода присоединены с заполнением любой свободной валентности.
Выражение "полностью насыщенный" в отношении кольца атомов означает, что все связи между атомами кольца являются одинарными. Выражение "полностью ненасыщенный" в отношении кольца означает, что связи между атомами в кольце являются одинарными или двойными связями в соответствии с теорией валентных связей, и, кроме того, связи между атомами в кольце включают наибольшее возможное число двойных связей, при этом двойные связи не должны быть кумулированными (т. е. без C=C=C, N=C=C и т. д.). Выражение "частично ненасыщенный" в отношении кольца обозначает кольцо, содержащее по меньшей мере один член кольца, связанный со смежным членом кольца посредством двойной связи, и которое теоретически может содержать число некумулированных двойных связей между смежными членами кольца (т. е. в своей полностью ненасыщенной соответствующей форме), большее, чем число присутствующих двойных связей (т. е. в своей частично ненасыщенной форме). Если полностью ненасыщенное кольцо удовлетворяет правилу Хюккеля, то оно также может быть описано как ароматическое.
Если не указано иное, "кольцо" или "кольцевая система" как компонент формулы 1 (например, заместитель Q1) являются карбоциклическими или гетероциклическими. Выражение "кольцевая система" обозначает два или более конденсированных кольца. Выражения "бициклическая кольцевая система" и "конденсированная бициклическая кольцевая система" обозначают кольцевую систему, состоящую из двух конденсированных колец, в которой каждое кольцо может быть насыщенным, частично ненасыщенным или полностью ненасыщенным, если не указано иное. Выражение "конденсированная гетеробициклическая кольцевая система" обозначает конденсированную бициклическую кольцевую систему, в которой по меньшей мере один атом кольца не представляет собой углерод. "Мостиковая бициклическая кольцевая система" образуется путем связывания сегмента из одного или нескольких атомов с несмежными членами кольца в кольце. Выражение "член кольца" означает атом или другой фрагмент (например, C(=O), C(=S), S(O) или S(O)2), образующий каркас кольца или кольцевой системы.
Выражения "карбоциклическое кольцо" или "карбоциклическая кольцевая система" обозначают кольцо или кольцевую систему, где атомы, образующие остов кольца, выбраны только из углерода. Если не указано иное, карбоциклическое кольцо может быть насыщенным, частично ненасыщенным или полностью ненасыщенным кольцом. Если полностью ненасыщенное карбоциклическое кольцо удовлетворяет правилу Хюккеля, то указанное кольцо также называют "ароматическим кольцом". "Насыщенный карбоциклический" относится к кольцу, имеющему остов, состоящий из атомов углерода, соединенных друг с другом одинарными связями; если не указано иное, оставшиеся валентности углерода заполнены атомами водорода.
Выражения "гетероциклическое кольцо", "гетероцикл" или "гетероциклическая кольцевая система" обозначают кольцо или кольцевую систему, в которой по меньшей мере один атом, образующий остов кольца, не является углеродом, например, азот, кислород или сера. Как правило, гетероциклическое кольцо содержит не более 4 атомов азота, не более 2 атомов кислорода и не более 2 атомов серы. Если не указано иное, гетероциклическое кольцо может быть насыщенным, частично ненасыщенным или полностью ненасыщенным кольцом. Если полностью ненасыщенное гетероциклическое кольцо удовлетворяет правилу Хюккеля, то указанное кольцо также называют "гетероароматическим кольцом". Выражение "гетероароматическая бициклическая кольцевая система" обозначает гетероциклическую кольцевую систему, в которой по меньшей мере одно кольцо кольцевой системы является ароматическим. Если не указано иное, гетероциклические кольца и кольцевые системы могут быть присоединены посредством любого доступного углерода или азота путем замещения водорода по указанному углероду или азоту.
"Ароматический" указывает, что каждый из атомов кольца находится по сути в той же плоскости и имеет p-орбиталь, перпендикулярную плоскости кольца, и что (4n+2) π электронов, где n является положительным целым числом, связаны с кольцом в соответствии с правилом Хюккеля. Выражение "ароматическая кольцевая система" обозначает карбоциклическую или гетероциклическую кольцевую систему, в которой по меньшей мере одно кольцо кольцевой системы является ароматическим.
Выражение "необязательно замещенный" по отношению к гетероциклическим кольцам относится к группам, которые являются незамещенными или имеют по меньшей мере один заместитель, не являющийся водородом, который не подавляет биологическую активность, которой обладает незамещенный аналог. Следующие определения, используемые в данном документе, применяются если не указано иное. Выражение "необязательно замещенный" применяют взаимозаменяемо с фразой "замещенный или незамещенный" или с выражением "(не)замещенный". Если не указано иное, необязательно замещенная группа может иметь заместитель в каждом замещаемом положении группы и каждое замещение не зависит от другого.
Как отмечено выше, Q1, J1 и Q2 могут представлять собой (среди прочего) фенил, необязательно замещенный одним или несколькими заместителями, выбранными из группы заместителей, которые определены в кратком описании настоящего изобретения. Примером фенила, необязательно замещенного одним-пятью заместителями, является кольцо, показанное как U-1 в приложении 1, где, например, Rv представляет собой R7 или R7′, определенные в кратком описании настоящего изобретения для Q1 или J1, а r представляет собой целое число (от 0 до 4); или Rv представляет собой R10, определенный в кратком описании настоящего изобретения для Q2, и r представляет собой целое число (от 0 до 5).
Как отмечено выше, Q1, J1 и Q2 могут представлять собой (среди прочего) 5- или 6-членное полностью ненасыщенное гетероциклическое кольцо, необязательно замещенное одним или несколькими заместителями, выбранными из группы заместителей, которые определены в кратком описании настоящего изобретения. Примеры 5- или 6-членного полностью ненасыщенного гетероциклического кольца, необязательно замещенного одним или несколькими заместителями, включают кольца U-2 - U-61, показанные в приложении 1, где Rv представляет собой любой заместитель, определенный в кратком описании изобретения для Q1, J1 и Q2, а r представляет собой целое число от 0 до 4, ограниченное числом доступных положений в каждой группе U. Поскольку U-29, U-30, U-36, U-37, U-38, U-39, U-40, U-41, U-42 и U-43 имеют только одно доступное положение, для этих групп U r ограничено целыми числами 0 или 1, и при этом r, равный 0, означает, что группа U является незамещенной, а водород присутствует в положении, указанном (Rv)r.


Как отмечено выше, Q1, J1 и Q2 могут представлять собой (среди прочего) 8-10-членную гетероароматическую бициклическую кольцевую систему, необязательно замещенную одним или несколькими заместителями, выбранными из группы заместителей, которые определены в кратком описании настоящего изобретения (т. e. R7, R7′ и R10). Примеры 8-10-членной гетероароматической бициклической кольцевой системы, необязательно замещенной одним или несколькими заместителями, включают кольца U-62 - U-100, показанные в приложении 2, где Rv представляет собой любой заместитель, который определен в кратком описании настоящего изобретения для Q1, J1 или Q2, а r, как правило, представляет собой целое число от 0 до 4 или 5.

Некоторые примеры 4-6-членного насыщенного гетероциклического кольца, необязательно замещенного одним или несколькими заместителями, включают без ограничения кольца U-101 - U-104, показанные в приложении 3, где Rv представляет собой любой заместитель, который определен в кратком описании настоящего изобретения для Q1 или Q2, а r, как правило, представляет собой целое число от 0 до 4 или 5.

Хотя группы Rv показаны в структурах U-1 - U-104, следует отметить, что нет необходимости в их присутствии, поскольку они являются необязательными заместителями. Следует отметить, что если Rv представляет собой Н при присоединении к атому, то это то же самое, как если бы указанный атом являлся незамещенным. Атомы азота, которые должны быть замещены для заполнения их валентности, являются замещенными H или Rv. Следует отметить, что если точка присоединения между (Rv)r и группой U показана как плавающая, то (Rv)r могут быть присоединены к любому доступному атому углерода или атому азота группы U. Следует отметить, что если точка присоединения в группе U показана как плавающая, то группа U может быть присоединена к остальной части соединения формулы 1 посредством любого доступного углерода или азота группы U путем замещения атома водорода. Предпочтительно, для наибольшей гербицидной активности группа U присоединена к остальной части соединения формулы 1 посредством доступного углерода или азота на полностью ненасыщенном кольце группы U. Следует отметить, что некоторые группы U могут быть замещены только менее 4 группами Rv (например, U-2 - U-5, U-7 - U-48 и U-52 - U-61).
Из уровня техники известен широкий ряд способов синтеза с возможностью получения ароматических и неароматических гетероциклических колец и кольцевых систем; для подробных обзоров см. издание в восьми томах Comprehensive Heterocyclic Chemistry, A. R. Katritzky and C. W. Rees editors-in-chief, Pergamon Press, Oxford, 1984 и издание в двенадцати томах Comprehensive Heterocyclic Chemistry II, A. R. Katritzky, C. W. Rees and E. F. V. Scriven editors-in-chief, Pergamon Press, Oxford, 1996.
Соединения по настоящему изобретению могут существовать в виде одного или нескольких стереоизомеров. Различные стереоизомеры включают энантиомеры, диастереомеры, атропоизомеры и геометрические изомеры. Стереоизомеры представляют собой изомеры идентичной структуры, но отличающиеся по расположению их атомов в пространстве, и включают энантиомеры, диастереомеры, цис-транс изомеры (также известные как геометрические изомеры) и атропоизомеры. Атропоизомеры являются результатом ограниченного вращения вокруг одинарных связей, где барьер вращения достаточно высок для обеспечения возможности разделения видов изомеров. Специалисту в данной области техники будет понятно, что один стереоизомер может быть более активным и/или может проявлять положительные эффекты при обогащении по сравнению с другим(другими) стереоизомером(стереоизомерами) или при отделении от другого(других) стереоизомера(стереоизомеров). Кроме того, специалисту в данной области техники известно, как отделять, обогащать и/или избирательно получать указанные стереоизомеры. Соединения по настоящему изобретению могут присутствовать в виде смеси стереоизомеров, отдельных стереоизомеров или в виде оптически активной формы. В частности, если каждый из R4 и R5 представляет собой H, то заместители C(O)N(Q2)(R6) и Q1, как правило, в большинстве случаев представлены в термодинамически предпочтительной транс-конфигурации на пирролидиноновом кольце.
Например, фрагмент C(O)N(Q2)(R6) (связанный с углеродом в 3-положении пирролидинонового кольца, где как Y1, так и Y2 представляет собой кислород, и J2 представляет собой -CR2R3, и как R2, так и R3 представляет собой H) и Q1 (связанный с углеродом в 4-положении пирролидинонового кольца) обычно встречаются в транс-конфигурации. Эти два атома углерода (т. е. каждый в 3- и 4-положениях имеет центральное кольцо формулы 1) оба имеют хиральный центр. Две наиболее распространенные пары энантиомеров изображены как соединение формулы 1' и соединение формулы 1", где указаны хиральные центры (т. е. как 3R,4S или как 3S,4R). Специалисту в данной области техники будет понятно, что в некоторых вариантах осуществления настоящего изобретения обозначение R или S определяется относительно других заместителей вокруг одного и того же углерода, и, поэтому, соединению по настоящему изобретению также может быть присвоено обозначение 3S,4S. Для исчерпывающего обсуждения всех аспектов стереоизомерии см. Ernest L. Eliel and Samuel H. Wilen, Stereochemistry of Organic Compounds, John Wiley & Sons, 1994.
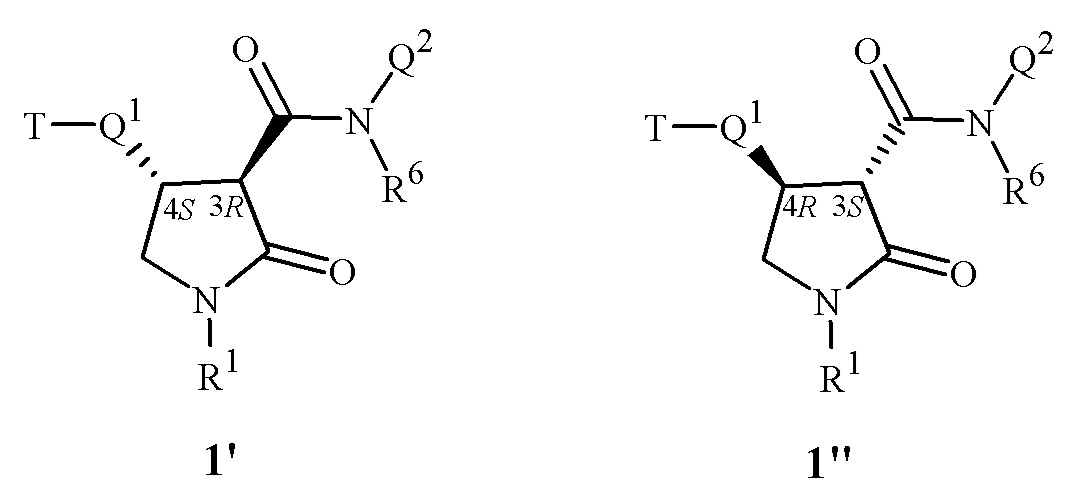
Рисунки молекул, изображенные в данном документе, созданы с соблюдением стандартных правил создания изображений в стереохимии. Для того, чтобы показать стереоконфигурацию, связи, направленные вверх относительно плоскости рисунка и направленные к наблюдателю, изображены в виде сплошных клиньев, причем широкий конец клина соединен с атомом, направленным вверх относительно плоскости рисунка в направлении к наблюдателю. Связи, направленные вниз относительно плоскости рисунка и направленные от наблюдателя, изображены пунктирными клиньями, причем узкий конец клина соединен с атомом, находящимся дальше от наблюдателя. Линии постоянной толщины показывают связи, противоположно или нейтрально направленные относительно связей, показанных в виде сплошных или пунктирных клиньев; при этом линии постоянной толщины также показывают связи в молекулах или частях молекул, в которых не предполагается указывать конкретную стереоконфигурацию.
Настоящее изобретение предусматривает рацемические смеси, например, равные количества энантиомеров формул 1' и 1". Кроме того, настоящее изобретение включает соединения, обогащенные по сравнению с рацемической смесью энантиомером формулы 1. Также включены практически чистые энантиомеры соединений формулы 1, например, формулы 1' и формулы 1".
После обогащения энантиомером (т. e. энантиообогащении) один энантиомер присутствует в большем количестве, чем другой, и степень обогащения может быть определена выражением энантиомерного избытка ("ee"), который определяют как (2x-1)·100%, где x является мольной долей преобладающего энантиомера в смеси (например, ee 20% соответствует соотношению энантиомеров 60:40). Соединения по настоящему изобретению можно получать энантиомерно обогащенными (т. e. энантиообогащенными) путем применения соответствующего энантиомерно обогащенного промежуточного соединения в ходе синтеза. В этих случаях энантиомерный избыток не измеряют в конечном продукте, но его считают "энантиомерно обогащенным" на основании эквивалентных известных из литературы химических преобразований.
Предпочтительно композиции по настоящему изобретению характеризуются энантиомерным избытком более активного изомера, составляющим по меньшей мере 50%; более предпочтительно энантиомерным избытком, составляющим по меньшей мере 75%; еще более предпочтительно энантиомерным избытком, составляющим по меньшей мере 90%; и наиболее предпочтительно энантиомерным избытком, составляющим по меньшей мере 94%. Особый интерес представляют энантиомерно чистые варианты осуществления более активного изомера.
Соединения формулы 1 могут содержать дополнительные хиральные центры. Например, заместители и другие составляющие молекулы, такие как R2 и R3, могут сами по себе содержать хиральные центры. Настоящее изобретение предусматривает рацемические смеси, а также обогащенные и, по сути, чистые стереоконфигурации при таких дополнительных хиральных центрах.
Соединения по настоящему изобретению могут существовать в виде одного или нескольких конформационных изомеров в связи с ограниченным вращением вокруг амидной связи (например, C(O)N(Q2)(R6)) в формуле 1. Настоящее изобретение предусматривает смеси конформационных изомеров. Кроме того, настоящее изобретение включает соединения, которые обогащены одним конформером по отношению к другим.
Соединения формулы 1, как правило, существуют в более чем одной форме, и формула 1, следовательно, включает все кристаллические и некристаллические формы соединений, в которых они представлены. Некристаллические формы включают варианты осуществления, которые представляют собой твердые вещества, такие как воски и смолы, а также варианты осуществления, которые представляют собой жидкости, такие как растворы и расплавы. Кристаллические формы включают варианты осуществления, которые представляют собой, по сути, один кристаллический тип, и варианты осуществления, которые представляют собой смесь полиморфов (т. е. различных кристаллических типов). Выражение "полиморф" относится к определенной кристаллической форме химического соединения, которое может кристаллизоваться в различные кристаллические формы, причем данные формы имеют разные расположения и/или конформации молекул в кристаллической решетке. Хотя полиморфы могут иметь одинаковый химический состав, они также могут отличаться по составу в связи с присутствием или отсутствием совместно кристаллизованной воды или других молекул, которые могут быть слабо или сильно связаны в решетке. Полиморфы могут отличаться такими химическими, физическими и биологическими свойствами, как форма кристалла, плотность, твердость, цвет, химическая стабильность, температура плавления, гигроскопичность, способность к суспендированию, скорость растворения и биологическая доступность. Специалисту в данной области техники будет понятно, что полиморф соединения формулы 1 может проявлять положительные эффекты (например, возможность применения для получения полезных составов, улучшенная биологическая эффективность) по отношению к другому полиморфу или смеси полиморфов того же соединения формулы 1. Получение и выделение определенного полиморфа соединения формулы 1 можно осуществлять с помощью способов, известных специалистам в данной области техники, включая, например, кристаллизацию с применением выбранных растворителей и температур. Для исчерпывающего обсуждения полиморфизма см. R. Hilfiker, Ed., Polymorphism in the Pharmaceutical Industry, Wiley-VCH, Weinheim, 2006.
Специалисту в данной области техники будет понятно, что не все содержащие азот гетероциклы могут образовывать N-оксиды, поскольку азоту нужна доступная неподеленная пара для окисления до оксида; специалисту в данной области техники будут известны такие содержащие азот гетероциклы, которые могут образовывать N-оксиды. Специалисту в данной области техники также будет известно, что третичные амины могут образовывать N-оксиды. Способы синтеза для получения N-оксидов гетероциклов и третичных аминов хорошо известны специалистам в данной области техники, в том числе окисление гетероциклов и третичных аминов пероксикислотами, такими как перуксусная и мета-хлорпербензойная кислота (MCPBA), пероксидом водорода, гидропероксидами алкилов, такими как гидропероксид трет-бутила, перборатом натрия и диоксиранами, такими как диметилдиоксиран. Эти способы получения N-оксидов были подробно описаны и рассмотрены в литературе, см., например: T. L. Gilchrist in Comprehensive Organic Synthesis, vol. 7, pp 748-750, S. V. Ley, Ed., Pergamon Press; M. Tisler and B. Stanovnik in Comprehensive Heterocyclic Chemistry, vol. 3, pp 18-20, A. J. Boulton and A. McKillop, Eds., Pergamon Press; M. R. Grimmett and B. R. T. Keene in Advances in Heterocyclic Chemistry, vol. 43, pp 149-161, A. R. Katritzky, Ed., Academic Press; M. Tisler and B. Stanovnik in Advances in Heterocyclic Chemistry, vol. 9, pp 285-291, A. R. Katritzky and A. J. Boulton, Eds., Academic Press; G. W. H. Cheeseman and E. S. G. Werstiuk in Advances in Heterocyclic Chemistry, vol. 22, pp 390-392, A. R. Katritzky and A. J. Boulton, Eds., Academic Press.
Специалисту в данной области техники известно, что поскольку в окружающей среде и в физиологических условиях соли химических соединений находятся в равновесии с их соответствующими несолевыми формами, то соли обладают такой же биологической применимостью, что и несолевые формы. Таким образом, широкий спектр солей соединения формулы 1 является пригодным для контроля нежелательной растительности (т. е. является подходящим с точки зрения сельского хозяйства). Соли соединения формулы 1 включают соли присоединения кислоты с неорганическими или органическими кислотами, такими как бромистоводородная, хлористоводородная, азотная, фосфорная, серная, уксусная, масляная, фумаровая, молочная, малеиновая, малоновая, щавелевая, пропионовая, салициловая, винная, 4-толуолсульфоновая или валериановая кислоты. Если соединение формулы 1 содержит кислотный фрагмент, такой как карбоновая кислота или фенол, то соли также включают соли, образованные органическими или неорганическими основаниями, такими как пиридин, триэтиламин или аммиак, или амиды, гидриды, гидроксиды или карбонаты натрия, калия, лития, кальция, магния или бария. Соответственно, настоящее изобретение предусматривает соединения, выбранные из соединений формулы 1, их N-оксидов и подходящих с точки зрения сельского хозяйства солей.
Варианты осуществления настоящего изобретения, описанные в кратком описании изобретения, включают следующие (где соединение формулы 1, как применяется в следующих вариантах осуществления, включает его N-оксиды и соли).
Вариант осуществления 1. Соединение формулы 1, где, если Q1 представляет собой 5-6-членное гетероароматическое кольцо или 8-10-членную гетероароматическую бициклическую кольцевую систему, то каждое кольцо или кольцевая система необязательно замещены не более 4 заместителями, независимо выбранными из R7 при членах кольца, представляющих собой атом углерода, и выбранными из R9 при членах кольца, представляющих собой атом азота.
Вариант осуществления 2. Соединение согласно варианту осуществления 1, где Q1 не является замещенным R7 или R9.
Вариант осуществления 3. Соединение формулы 1, где Q1 представляет собой фенильное кольцо или нафталинильную кольцевую систему, причем каждое кольцо или кольцевая система необязательно замещены 1-4 заместителями, независимо выбранными из R7.
Вариант осуществления 4. Соединение согласно варианту осуществления 3, где Q1 представляет собой фенильное кольцо, необязательно замещенное 1-2 заместителями, независимо выбранными из R7.
Вариант осуществления 5. Соединение согласно варианту осуществления 4, где Q1 представляет собой фенильное кольцо, замещенное 1 заместителем, выбранным из R7.
Вариант осуществления 6. Соединение согласно варианту осуществления 4, где Q1 представляет собой фенильное кольцо, незамещенное R7.
Вариант осуществления 7. Соединение формулы 1 или согласно любому из варианта осуществления 1 - варианта осуществления 6, где, если Q2 представляет собой 5-6-членное гетероароматическое кольцо или 8-10-членную гетероароматическую бициклическую кольцевую систему, то каждое кольцо или кольцевая система необязательно замещены не более 5 заместителями, независимо выбранными из R10 при членах кольца, представляющих собой атом углерода, и выбранными из R11 при членах кольца, представляющих собой атом азота.
Вариант осуществления 8. Соединение формулы 1 или согласно любому из варианта осуществления 1 - варианта осуществления 6, где Q2 представляет собой фенильное кольцо, необязательно замещенное 1-5 заместителями, независимо выбранными из R10.
Вариант осуществления 9. Соединение согласно варианту осуществления 8, где Q2 представляет собой фенильное кольцо, необязательно замещенное 1-3 заместителями, независимо выбранными из R10.
Вариант осуществления 10. Соединение согласно варианту осуществления 9, где Q2 представляет собой фенильное кольцо, необязательно замещенное 1-2 заместителями, независимо выбранными из R10.
Вариант осуществления 11. Соединение формулы 1 или согласно любому из варианта осуществления 1 - варианта осуществления 10, где Q2 представляет собой фенильное кольцо, имеющее по меньшей мере один заместитель, выбранный из R10, в орто-положении (и необязательно другие заместители).
Вариант осуществления 12. Соединение формулы 1 или согласно любому из варианта осуществления 1 - варианта осуществления 9, где, если Q2 представляет собой фенильное кольцо, замещенное по меньшей мере двумя заместителями, выбранными из R10, то по меньшей мере одни заместитель находится в орто-положении, и по меньшей мере один заместитель находится в пара-положении фенильного кольца.
Вариант осуществления 13. Соединение формулы 1 или согласно любому из варианта осуществления 1 - варианта осуществления 9, где Q2 представляет собой фенильное кольцо, замещенное тремя заместителями, выбранными из R10, и три заместителя находятся в орто-, мета- и пара-положениях фенильного кольца.
Вариант осуществления 14. Соединение формулы 1 или согласно любому из варианта осуществления 1 - варианта осуществления 13, где T представляет собой J1-A-.
Вариант осуществления 15. Соединение согласно варианту осуществления 14, где A представляет собой насыщенную, частично ненасыщенную или полностью ненасыщенную цепь, содержащую 1-3 атома, выбранных из не более 3 атомов углерода, не более 1 атома O, не более 1 атома S и не более 2 атомов N, причем цепь необязательно замещена не более 2 заместителями, независимо выбранными из R15 при атомах углерода и R16 при атомах азота.
Вариант осуществления 16. Соединение согласно варианту осуществления 15, где A представляет собой -CH2-, -CH2O-, -CH2NH-, -CH=CH-, -C≡C-, -NH-, -O-, -S-, -SO- или -SO2-.
Вариант осуществления 17. Соединение согласно варианту осуществления 16, где A представляет собой -CH2-, -CH2O-, -CH2NH-, -CH=CH-, -C≡C-, -NH- или -O-.
Вариант осуществления 18. Соединение согласно варианту осуществления 17, где A представляет собой -CH2O- или -O-.
Вариант осуществления 19. Соединение формулы 1 или согласно любому из варианта осуществления 1 - варианта осуществления 18, где J1 представляет собой фенильное кольцо или нафталинильную кольцевую систему, причем каждое кольцо или кольцевая система необязательно замещены не более 5 заместителями, независимо выбранными из R7'; или 4-6-членное гетероциклическое кольцо или 8-10-членную гетероароматическую бициклическую кольцевую систему, причем каждое кольцо или кольцевая система содержат члены кольца, выбранные из атомов углерода и 1-4 гетероатомов, независимо выбранных из не более 2 атомов O, не более 2 атомов S и не более 4 атомов N, причем не более 3 членов кольца, представляющих собой атом углерода, независимо выбраны из C(=O) и C(=S), а члены кольца, представляющие собой атом серы, независимо выбраны из S(=O)u(=NR8)v, причем каждое кольцо или кольцевая система необязательно замещены не более 5 заместителями, независимо выбранными из R7' при членах кольца, представляющих собой атом углерода, и выбранными из R9 при членах кольца, представляющих собой атом азота; или C4-C10циклоалкилалкокси, C4-C10циклоалкилалкил, C2-C8алкенилокси, C2-C8галогеналкенилокси, C2-C8алкоксиалкокси, C2-C8алкилтиоалкил, C2-C8алкилсульфинилалкил, C2-C8алкилсульфонилалкил, C1-C8алкилсульфонилокси, C1-C8галогеналкилсульфонилокси, C1-C8алкилтио, C1-C8галогеналкилтио, C3-C8циклоалкилтио, C1-C8алкилсульфинил, C1-C8галогеналкилсульфинил, C1-C8алкилсульфонил, C1-C8галогеналкилсульфонил, C2-C8алкинил, C2-C8галогеналкинил, C2-C8алкоксиалкил, C2-C8галогеналкоксиалкил, C3-C8галогеналкоксиалкокси, C1-C8галогеналкил, C3-C8галогенциклоалкил, C2-C8алкилкарбонилокси или C2-C8галогеналкилкарбонилокси.
Вариант осуществления 20. Соединение согласно варианту осуществления 19, где J1 представляет собой фенильное кольцо или нафталинильную кольцевую систему, причем каждое кольцо или кольцевая система, необязательно замещены не более 4 заместителями, независимо выбранными из R7'.
Вариант осуществления 21. Соединение согласно варианту осуществления 20, где J1 представляет собой фенильное кольцо, необязательно замещенное не более 3 заместителями, независимо выбранными из R7'.
Вариант осуществления 22. Соединение согласно варианту осуществления 21, где J1 представляет собой фенильное кольцо, необязательно замещенное 1 заместителем, независимо выбранным из R7'.
Вариант осуществления 23. Соединение согласно варианту осуществления 22, где J1 представляет собой фенильное кольцо, незамещенное R7'.
Вариант осуществления 24. Соединение согласно варианту осуществления 19, где J1 представляет собой 4-6-членное гетероциклическое кольцо или 8-10-членную гетероароматическую бициклическую кольцевую систему, причем каждое кольцо или кольцевая система содержат члены кольца, выбранные из атомов углерода и 1-4 гетероатомов, независимо выбранных из не более 2 атомов O, не более 2 атомов S и не более 4 атомов N, причем не более 3 членов кольца, представляющих собой атом углерода, независимо выбраны из C(=O) и C(=S), а члены кольца, представляющие собой атом серы, независимо выбраны из S(=O)u(=NR8)v, причем каждое кольцо или кольцевая система необязательно замещены не более 5 заместителями, независимо выбранными из R7' при членах кольца, представляющих собой атом углерода, и выбранными из R9' при членах кольца, представляющих собой атом азота.
Вариант осуществления 25. Соединение согласно варианту осуществления 24, где J1 представляет собой 4-6-членное гетероциклическое кольцо, содержащее члены кольца, выбранные из атомов углерода и 1-3 гетероатомов, независимо выбранных из не более 2 атомов O, не более 2 атомов S и не более 3 атомов N, причем не более 2 членов кольца, представляющих собой атом углерода, независимо выбраны из C(=O) и C(=S), а члены кольца, представляющие собой атом серы, независимо выбраны из S(=O)u(=NR8)v, причем каждое кольцо или кольцевая система необязательно замещены не более 3 заместителями, независимо выбранными из R7' при членах кольца, представляющих собой атом углерода, и выбранными из R9' при членах кольца, представляющих собой атом азота.
Вариант осуществления 26. Соединение согласно варианту осуществления 25, где J1 представляет собой 5-6-членное гетероароматическое кольцо, необязательно замещенное 1 заместителем, выбранным из R7' при членах кольца, представляющих собой атом углерода.
Вариант осуществления 27. Соединение согласно варианту осуществления 26, где J1 представляет собой незамещенное пиридиновое кольцо.
Вариант осуществления 28. Соединение согласно варианту осуществления 19, где J1 представляет собой С4-C10циклоалкилалкокси, C4-C10циклоалкилалкил, C2-C8алкенилокси, C2-C8галогеналкенилокси, C2-C8алкоксиалкокси, C2-C8алкилтиоалкил, C2-C8алкилсульфинилалкил, C2-C8алкилсульфонилалкил, C1-C8алкилсульфонилокси, C1-C8галогеналкилсульфонилокси, C1-C8алкилтио, C1-C8галогеналкилтио, C3-C8циклоалкилтио, C1-C8алкилсульфинил, C1-C8галогеналкилсульфинил, C1-C8алкилсульфонил, C1-C8галогеналкилсульфонил, C2-C8алкинил, C2-C8галогеналкинил, C2-C8алкоксиалкил, C2-C8галогеналкоксиалкил, C3-C8галогеналкоксиалкокси, C2-C8галогеналкоксигалогеналкил, C1-C8галогеналкил, C3-C8галогенциклоалкил, C2-C8алкилкарбонилокси или C2-C8галогеналкилкарбонилокси.
Вариант осуществления 29. Соединение формулы 1 или согласно любому из варианта осуществления 1 - варианта осуществления 13, где T представляет собой R17ON=CR17a-, (R18)2C=NO-, (R19)2NN=CR17a-, (R18)2C=NNR20a-, R20N=CR17a-, (R18)2C=N-, R23ON=CR17aC(R23b)2- или (R18)2C=NOC(R24a)2-, при этом свободная связь, направленная вправо, указывает на точку соединения с Q1.
Вариант осуществления 30. Соединение согласно варианту осуществления 29, где каждый R17 независимо представляет собой H, C1-C6алкил, C3-C8циклоалкил, C4-C8циклоалкилалкил или C1-C6галогеналкил.
Вариант осуществления 31. Соединение согласно варианту осуществления 29, где каждый R17a независимо представляет собой H, C1-C6алкил, C3-C8циклоалкил, C4-C8циклоалкилалкил или C1-C6галогеналкил.
Вариант осуществления 32. Соединение согласно варианту осуществления 29, где каждый R18 независимо представляет собой H, гидрокси, C1-C6алкил, C3-C8циклоалкил, C4-C8циклоалкилалкил или C1-C6галогеналкил.
Вариант осуществления 33. Соединение согласно варианту осуществления 29, где каждый R19 независимо представляет собой H, C1-C6алкил, C3-C8циклоалкил, C4-C8циклоалкилалкил или C1-C6галогеналкил.
Вариант осуществления 34. Соединение согласно варианту осуществления 29, где каждый R20 независимо представляет собой H, гидрокси, амино, C1-C6алкил, C3-C8циклоалкил, C4-C8циклоалкилалкил или C1-C6галогеналкил.
Вариант осуществления 35. Соединение согласно варианту осуществления 29, где каждый R20a независимо представляет собой H, C1-C6алкил, C3-C8циклоалкил, C4-C8циклоалкилалкил или C1-C6галогеналкил.
Вариант осуществления 36. Соединение согласно варианту осуществления 29, где каждый R23b независимо представляет собой H, галоген, циано, гидрокси, C1-C4алкил, C3-C8циклоалкил, C4-C8циклоалкилалкил или C1-C4галогеналкил.
Вариант осуществления 37. Соединение согласно варианту осуществления 29, где каждый R24a независимо представляет собой H, C1-C4алкил, C3-C8циклоалкил, C4-C8циклоалкилалкил или C1-C4галогеналкил.
Вариант осуществления 38. Соединение формулы 1 или согласно любому из варианта осуществления 1 - варианта осуществления 37, где J2 представляет собой -CR2R3-.
Вариант осуществления 39. Соединение формулы 1 или согласно любому из варианта осуществления 1 - варианта осуществления 37, где J2 представляет собой -CR2R3-CR2aR3a-.
Вариант осуществления 40. Соединение формулы 1 или согласно любому из варианта осуществления 1 - варианта осуществления 39, где R1 представляет собой H, гидрокси, амино, C1-C6алкил, C1-C6галогеналкил, C2-C6алкенил, C3-C6алкинил, C2-C6цианоалкил, C3-C6циклоалкил или C4-C8циклоалкилалкил.
Вариант осуществления 41. Соединение согласно варианту осуществления 40, где R1 представляет собой H, C1-C6алкил или C1-C6галогеналкил.
Вариант осуществления 42. Соединение согласно варианту осуществления 41, где R1 представляет собой H, Me, Et или CHF2.
Вариант осуществления 43. Соединение согласно варианту осуществления 42, где R1 представляет собой H, Me или Et.
Вариант осуществления 44. Соединение согласно варианту осуществления 43, где R1 представляет собой H.
Вариант осуществления 45. Соединение согласно варианту осуществления 43, где R1 представляет собой Me.
Вариант осуществления 46. Соединение формулы 1 или согласно любому из варианта осуществления 1 - варианта осуществления 45, где R2 представляет собой H или CH3.
Вариант осуществления 47. Соединение согласно варианту осуществления 46, где R2 представляет собой H.
Вариант осуществления 48. Соединение формулы 1 или согласно любому из варианта осуществления 1 - варианта осуществления 47, где R3 представляет собой H или CH3.
Вариант осуществления 49. Соединение согласно варианту осуществления 48, где R3 представляет собой H.
Вариант осуществления 50. Соединение формулы 1 или согласно любому из варианта осуществления 1 - варианта осуществления 49, где R2a представляет собой H или CH3.
Вариант осуществления 51. Соединение согласно варианту осуществления 50, где R2a представляет собой H.
Вариант осуществления 52. Соединение формулы 1 или согласно любому из варианта осуществления 1 - варианта осуществления 51, где R3a представляет собой H или CH3.
Вариант осуществления 53. Соединение согласно варианту осуществления 52, где R3a представляет собой H.
Вариант осуществления 54. Соединение формулы 1 или согласно любому из варианта осуществления 1 - варианта осуществления 53, где R4 представляет собой H или CH3.
Вариант осуществления 55. Соединение согласно варианту осуществления 54, где R4 представляет собой H.
Вариант осуществления 56. Соединение формулы 1 или согласно любому из варианта осуществления 1 - варианта осуществления 55, где R5 представляет собой H или CH3.
Вариант осуществления 57. Соединение согласно варианту осуществления 56, где R5 представляет собой H.
Вариант осуществления 58. Соединение формулы 1 или согласно любому из варианта осуществления 1 - варианта осуществления 57, где R6 представляет собой H или CH3.
Вариант осуществления 59. Соединение согласно варианту осуществления 58, где R6 представляет собой H.
Вариант осуществления 60. Соединение формулы 1 или согласно любому из варианта осуществления 1 - варианта осуществления 59, где каждый R7 независимо представляет собой галоген, циано, нитро, C1-C4алкил, C1-C4цианоалкил, C1-C4цианоалкокси, C1-C4галогеналкил, C2-C4алкенил, C2-C4галогеналкенил, C2-C4алкинил, C2-C4галогеналкинил, C1-C4нитроалкил, C2-C4нитроалкенил, C2-C4алкоксиалкил, C2-C4галогеналкоксиалкил, C3-C4циклоалкил, C3-C4галогенциклоалкил, циклопропилметил, метилциклопропил, C1-C4алкокси, C1-C4галогеналкокси, C2-C4алкенилокси, C2-C4галогеналкенилокси, C3-C4алкинилокси, C3-C4галогеналкинилокси, C3-C4циклоалкокси, C1-C4алкилтио, C1-C4галогеналкилтио, C1-C4алкилсульфинил, C1-C4галогеналкилсульфинил, C1-C4алкилсульфонил, C1-C4галогеналкилсульфонил, гидрокси, формил, C2-C4алкилкарбонил, C2-C4алкилкарбонилокси, C1-C4алкилсульфонилокси, C1-C4галогеналкилсульфонилокси, амино, C1-C4алкиламино, C2-C4диалкиламино, формиламино, C2-C4алкилкарбониламино, -SF5, -SCN, C3-C4триалкилсилил, триметилсилилметил или триметилсилилметокси.
Вариант осуществления 61. Соединение согласно варианту осуществления 60, где каждый R7 независимо представляет собой галоген, циано, C1-C2алкил, C1-C3галогеналкил или C1-C3алкилсульфонил.
Вариант осуществления 62. Соединение согласно варианту осуществления 61, где каждый R7 независимо представляет собой галоген или C1-C2галогеналкил.
Вариант осуществления 63. Соединение согласно варианту осуществления 62, где каждый R7 независимо представляет собой галоген или CF3.
Вариант осуществления 64. Соединение согласно варианту осуществления 63, где каждый R7 независимо представляет собой F или CF3.
Вариант осуществления 65. Соединение формулы 1 или согласно любому из варианта осуществления 1 - варианта осуществления 64, где каждый R10 независимо представляет собой галоген, циано, нитро, C1-C2алкил, C1-C3галогеналкил или C1-C3алкилсульфонил.
Вариант осуществления 66. Соединение согласно варианту осуществления 65, где каждый R10 независимо представляет собой галоген или C1-C2галогеналкил.
Вариант осуществления 67. Соединение согласно варианту осуществления 66, где каждый R10 независимо представляет собой галоген или CF3.
Вариант осуществления 68. Соединение согласно варианту осуществления 67, где каждый R10 независимо представляет собой F или CF3.
Вариант осуществления 69. Соединение согласно варианту осуществления 68, где каждый R10 независимо представляет собой F.
Вариант осуществления 70. Соединение формулы 1 или согласно любому из варианта осуществления 1 - варианта осуществления 69, где каждый R7' независимо представляет собой галоген, циано, нитро, C1-C8алкил или C1-C8галогеналкил.
Вариант осуществления 71. Соединение согласно варианту осуществления 70, где каждый R7' независимо представляет собой галоген.
Вариант осуществления 72. Соединение формулы 1 или согласно любому из варианта осуществления 1 - варианта осуществления 71, где Y1 представляет собой O.
Вариант осуществления 73. Соединение формулы 1 или согласно любому из варианта осуществления 1 - варианта осуществления 72, где Y2 представляет собой O.
Вариант осуществления 74. Соединение формулы 1 или согласно любому из варианта осуществления 1 - варианта осуществления 73, где как Y1, так и Y2 представляет собой O.
Вариант осуществления 75. Соединение формулы 1 или согласно любому из варианта осуществления 1 - варианта осуществления 74, где каждый из R9, R9' и R11 независимо представляет собой C1-C3алкил или C3-C6циклоалкил.
Вариант осуществления 76. Соединение формулы 1, где T присоединен в 2- или 3-положении Q1.
Вариант осуществления 77. Соединение формулы 1, где T присоединен в 3-положении Q1.
Вариант осуществления 78. Соединение формулы 1, где T представляет собой R17ON=CR17a-, (R18)2C=NO- или (R19)2NN=CR17a-, при этом свободная связь, направленная вправо, указывает на точку соединения с Q1.
Вариант осуществления 79. Соединение согласно варианту осуществления 77, где T представляет собой R17ON=CR17a- или (R19)2NN=CR17a-, при этом свободная связь, направленная вправо, указывает на точку соединения с Q1.
Вариант осуществления 80. Соединение формулы 1, где J1 представляет собой фенильное кольцо или нафталинильную кольцевую систему, причем каждое кольцо или кольцевая система необязательно замещены не более 5 заместителями, независимо выбранными из R7'; или 4-6-членное гетероциклическое кольцо или 8-10-членную гетероароматическую бициклическую кольцевую систему, причем каждое кольцо или кольцевая система содержат члены кольца, выбранные из атомов углерода и 1-4 гетероатомов, независимо выбранных из не более 2 атомов O, не более 2 атомов S и не более 4 атомов N, причем не более 3 членов кольца, представляющих собой атом углерода, независимо выбраны из C(=O) и C(=S), а члены кольца, представляющие собой атом серы, независимо выбраны из S(=O)u(=NR8)v, причем каждое кольцо или кольцевая система необязательно замещены не более 5 заместителями, независимо выбранными из R7' при членах кольца, представляющих собой атом углерода, и выбранными из R9' при членах кольца, представляющих собой атом азота.
Вариант осуществления 81. Соединение формулы 1, где J1 представляет собой С4-C10циклоалкилалкокси, C4-C10циклоалкилалкил, C2-C8алкенилокси, C2-C8галогеналкенилокси, C2-C8алкоксиалкокси, C2-C8алкилтиоалкил, C2-C8алкилсульфинилалкил, C2-C8алкилсульфонилалкил, C1-C8алкилсульфонилокси, C1-C8галогеналкилсульфонилокси, C1-C8алкилтио, C1-C8галогеналкилтио, C3-C8циклоалкилтио, C1-C8алкилсульфинил, C1-C8галогеналкилсульфинил, C1-C8алкилсульфонил, C1-C8галогеналкилсульфонил, C2-C8алкинил, C2-C8галогеналкинил, C2-C8алкоксиалкил, C2-C8галогеналкоксиалкил, C3-C8галогеналкоксиалкокси, C2-C8галогеналкоксигалогеналкил, C1-C8галогеналкил, C3-C8галогенциклоалкил, C2-C8алкилкарбонилокси или C2-C8галогеналкилкарбонилокси.
Вариант осуществления 82. Соединение согласно варианту осуществления 80, где J1 представляет собой С4-C10циклоалкилалкокси, C2-C8алкенилокси, C2-C8галогеналкенилокси, C2-C8алкоксиалкокси, C2-C8алкилсульфонилалкил, C1-C8алкилсульфонилокси, C1-C8галогеналкилсульфонилокси, C1-C8алкилтио, C1-C8галогеналкилтио, C3-C8циклоалкилтио, C1-C8алкилсульфинил, C1-C8галогеналкилсульфинил, C1-C8алкилсульфонил, C1-C8галогеналкилсульфонил, C3-C8галогеналкоксиалкокси, C2-C8алкилкарбонилокси или C2-C8галогеналкилкарбонилокси.
Вариант осуществления 83. Соединение согласно варианту осуществления 81, где J1 представляет собой С4-C10циклоалкилалкил, C2-C8алкилтиоалкил, C2-C8алкилсульфинилалкил, C2-C8алкилсульфонилалкил, C2-C8алкинил, C2-C8галогеналкинил, C2-C8алкоксиалкил, C2-C8галогеналкоксиалкил, C1-C8галогеналкил или C3-C8галогенциклоалкил.
Вариант осуществления 84. Соединение согласно варианту осуществления 83, где J1 представляет собой С2-C8алкилтиоалкил, C2-C8алкилсульфинилалкил, C2-C8алкилсульфонилалкил, C2-C8алкоксиалкил или C2-C8галогеналкоксиалкил.
Вариант осуществления 85. Соединение формулы 1 или согласно варианту осуществления 15, где A представляет собой насыщенную, частично ненасыщенную или полностью ненасыщенную цепь, содержащую 2-3 атома, выбранных из не более 3 атомов углерода, не более 1 атома O, не более 1 атома S и не более 1 атома N, причем цепь необязательно замещена не более 2 заместителями, независимо выбранными из R15 при атомах углерода и R16 при атомах азота.
Вариант осуществления 86. Соединение согласно варианту осуществления 85, где A представляет собой насыщенную, частично ненасыщенную или полностью ненасыщенную цепь, содержащую 2-3 атома, выбранных из не более 3 атомов углерода, не более 1 атома O и не более 1 атома N, причем цепь необязательно замещена не более 2 заместителями, независимо выбранными из R15 при атомах углерода и R16 при атомах азота.
Вариант осуществления 87. Соединение согласно варианту осуществления 86, где A представляет собой цепь, содержащую 2-3 атома, выбранных из не более 2 атомов углерода, не более 1 атома O и не более 1 атома N, причем цепь необязательно замещена не более 2 заместителями, независимо выбранными из R15 при атомах углерода и R16 при атомах азота.
Вариант осуществления 88. Соединение формулы 1, где A представляет собой -CH2-, -CH2O-, -OCH2-, -CH2NH-, -CH2CH2-, -CH=CH-, -C≡C-, -NH-, -O-, -S-, -SO- или -SO2-.
Вариант осуществления 89. Соединение формулы 1, где A представляет собой -CH2-, -CH2O-, -OCH2-, или -O-, -SO-, или -SO2-.
Вариант осуществления 90. Соединение формулы 1, где A представляет собой -CH2O-, -OCH2-, -CH2CH2-, -CH=CH- или -C≡C-.
Вариант осуществления 91. Соединение формулы 1 или согласно любому из вариантов осуществления 16-19 или 88-90, где свободная связь, направленная вправо, указывает на точку соединения A с Q1, а свободная связь, направленная влево, указывает на точку соединения A с J1.
Вариант осуществления 92. Соединение формулы 1, где, если J2 представляет собой -CR2R3-, а J1 представляет собой фенильное кольцо, необязательно замещенное не более 5 заместителями, независимо выбранными из R7', то R7' является отличным от галогена, гидроксила, циано, нитро, C1-C6алкила, C1-C6галогеналкила, C2-C6алкенила, C2-C6алкинила, CHO, C2-C8алкилкарбонила, C2-C8галогеналкилкарбонила, -C(=O)OH, C2-C8алкоксикарбонила, C4-C10циклоалкоксикарбонила, C5-C12циклоалкилалкоксикарбонила, -C(=O)NH2, C2-C8алкиламинокарбонила, C3-C10диалкиламинокарбонила, гидрокси, C1-C6алкокси, C1-C6галогеналкокси, C2-C8алкилкарбонилокси, C1-C6алкилтио, C1-C6галогеналкилтио, C1-C6алкилсульфинила, C1-C6галогеналкилсульфинила, C1-C6алкиламино, C2-C8диалкиламино, C2-C8алкилкарбониламино, C1-C6алкилсульфониламино или C3-C10триалкилсилила.
Вариант осуществления 93. Соединение формулы 1, где, если J2 представляет собой -CR2R3-CR2aR3a-, а J1 представляет собой пиридильное кольцо (т. e. 6-членное гетероциклическое кольцо, необязательно замещенное не более 5 заместителями, независимо выбранными из R7' при членах кольца, представляющих собой атом углерода), то R7' является отличным от галогена, гидроксила, циано, нитро, C1-C6алкила, C1-C6галогеналкила, C2-C6алкенила, C2-C6алкинила, CHO, C2-C8алкилкарбонила, C2-C8галогеналкилкарбонила, -C(=O)OH, C2-C8алкоксикарбонила, C4-C10циклоалкоксикарбонила, C5-C12циклоалкилалкоксикарбонила, -C(=O)NH2, C2-C8алкиламинокарбонила, C3-C10диалкиламинокарбонила, гидрокси, C1-C6алкокси, C1-C6галогеналкокси, C2-C8алкилкарбонилокси, C1-C6алкилтио, C1-C6галогеналкилтио, C1-C6алкилсульфинила, C1-C6галогеналкилсульфинила, C1-C6алкиламино, C2-C8диалкиламино, C2-C8алкилкарбониламино, C1-C6алкилсульфониламино или C3-C10триалкилсилила.
Вариант осуществления 94. Соединение формулы 1, где Q1 представляет собой 5-6-членное гетероароматическое кольцо или 8-10-членную гетероароматическую бициклическую кольцевую систему, причем каждое кольцо или кольцевая система необязательно замещены не более 4 заместителями, независимо выбранными из R7 при членах кольца, представляющих собой атом углерода, и выбранными из R9 при членах кольца, представляющих собой атом азота.
Вариант осуществления 95. Соединение формулы 1, где Q1 представляет собой фенильное кольцо, необязательно замещенное 1-4 заместителями, независимо выбранными из R7; или 5-6-членное гетероароматическое кольцо, содержащее члены кольца, выбранные из атомов углерода и 1-4 гетероатомов, независимо выбранных из не более 2 атомов O, не более 2 атомов S и не более 4 атомов N, необязательно замещенное не более 4 заместителями, независимо выбранными из R7 при членах кольца, представляющих собой атом углерода, и выбранными из R9 при членах кольца, представляющих собой атом азота.
Вариант осуществления 96. Соединение формулы 1 или согласно варианту осуществления 95, где Q1 представляет собой фенильное кольцо, необязательно замещенное не более 4 заместителями, независимо выбранными из R7.
Вариант осуществления 97. Соединение формулы 1, где Q2 представляет собой фенильное кольцо, необязательно замещенное не более 5 заместителями, независимо выбранными из R10; или 5-6-членное гетероароматическое кольцо, содержащее члены кольца, выбранные из атомов углерода и 1-4 гетероатомов, независимо выбранных из не более 2 атомов O, не более 2 атомов S и не более 4 атомов N, необязательно замещенное не более 5 заместителями, независимо выбранными из R10 при членах кольца, представляющих собой атом углерода, и выбранными из R11 при членах кольца, представляющих собой атом азота.
Вариант осуществления 98. Соединение формулы 1 или варианта осуществления 97, где Q2 представляет собой фенильное кольцо, необязательно замещенное не более 4 заместителями, независимо выбранными из R10.
Вариант осуществления 99. Соединение формулы 1, где J1 представляет собой фенильное кольцо, необязательно замещенное не более 5 заместителями, независимо выбранными из R7'; или 4-6-членное гетероциклическое кольцо, содержащее члены кольца, выбранные из атомов углерода и 1-4 гетероатомов, независимо выбранных из не более 2 атомов O, не более 2 атомов S и не более 4 атомов N, необязательно замещенное не более 5 заместителями, независимо выбранными из R7' при членах кольца, представляющих собой атом углерода, и выбранными из R9' при членах кольца, представляющих собой атом азота.
Вариант осуществления 100. Соединение формулы 1 или согласно варианту осуществления 99, где J1 представляет собой фенильное кольцо, необязательно замещенное не более 4 заместителями, независимо выбранными из R7'; или 6-членное гетероциклическое кольцо, содержащее члены кольца, выбранные из атомов углерода и 1-3 гетероатомов, независимо выбранных из не более 3 атомов N, необязательно замещенное не более 4 заместителями, независимо выбранными из R7' при членах кольца, представляющих собой атом углерода, и выбранными из R9' при членах кольца, представляющих собой атом азота.
Вариант осуществления 101. Соединение формулы 1, где R7 независимо представляет собой галоген, CH3, CH2CH3 или CF3.
Вариант осуществления 102. Соединение формулы 1, где R10 независимо представляет собой галоген, CH3, CH2CH3 или CF3.
Вариант осуществления 103. Соединение формулы 1, где каждый R10 независимо представляет собой циано или CH3.
Вариант осуществления 104. Соединение формулы 1, где каждый R16 представляет собой H.
Вариант осуществления 105. Соединение формулы 1, где каждый R16 является отличным от H.
Варианты осуществления настоящего изобретения, включая вышеуказанные варианты осуществления 1-105, а также любые другие варианты осуществления, описанные в данном документе, могут быть объединены любым способом, и описание переменных в вариантах осуществления подходит не только для соединений формулы 1, но также для исходных соединений и промежуточных соединений, пригодных для получения соединений формулы 1. Кроме того, варианты осуществления настоящего изобретения, в том числе вышеизложенные варианты осуществления 1-105, а также любые другие варианты осуществления, описанные в данном документе, и любая их комбинация подходят для композиций и способов по настоящему изобретению.
Далее проиллюстрированы комбинации вариантов осуществления 1-105.
Вариант осуществления A. Соединение формулы 1, где
Q1 представляет собой фенильное кольцо, замещенное не более 2 заместителями, выбранными из R7;
Q2 представляет собой фенильное кольцо, замещенное 1-3 заместителями, независимо выбранными из R10; и
A представляет собой -CH2-, -CH2O-, -CH2NH-, -CH=CH-, -C≡C-, -NH-, -O-, -S-, -SO- или -SO2-.
Вариант осуществления B. Соединение согласно варианту осуществления A, где
J1 представляет собой фенильное кольцо, необязательно замещенное 1 заместителем, независимо выбранным из R7';
J2 представляет собой -CR2R3-;
как Y1, так и Y2 представляет собой O;
R1 представляет собой H, Me или Et;
R4 представляет собой H;
R5 представляет собой H;
R6 представляет собой H;
каждый R7 независимо представляет собой галоген или CF3;
каждый R7' независимо представляет собой галоген, циано, нитро, C1-C8алкил или C1-C8галогеналкил; и
каждый R10 независимо представляет собой галоген или CF3.
Вариант осуществления C. Соединение согласно варианту осуществления A, где
J1 представляет собой 5-6-членное гетероароматическое кольцо, необязательно замещенное 1 заместителем, выбранным из R7' при члене кольца, представляющем собой атом углерода;
J2 представляет собой -CR2R3-;
как Y1, так и Y2 представляет собой O;
R1 представляет собой H, Me или Et;
R4 представляет собой H;
R5 представляет собой H;
R6 представляет собой H;
каждый R7 независимо представляет собой галоген или CF3;
каждый R7' независимо представляет собой галоген, циано, нитро, C1-C8алкил или C1-C8галогеналкил; и
каждый R10 независимо представляет собой галоген или CF3.
Вариант осуществления D. Соединение согласно варианту осуществления B, где
Q1 представляет собой фенильное кольцо, незамещенное R7;
Q2 представляет собой фенильное кольцо, замещенное по меньшей мере двумя заместителями, выбранными из R10, причем по меньшей мере один заместитель находится в орто-положении, и по меньшей мере один заместитель находится в пара-положении фенильного кольца;
A представляет собой -CH2-, -CH2O-, -CH2NH-, -CH=CH-, -C≡C-, -NH- или O;
J1 представляет собой фенильное кольцо, незамещенное R7';
R2 представляет собой H; и
R3 представляет собой H.
Вариант осуществления E. Соединение согласно варианту осуществления D, где
A представляет собой -CH2O- или -O-.
Вариант осуществления F. Соединение согласно варианту осуществления C, где
Q1 представляет собой фенильное кольцо, незамещенное R7;
Q2 представляет собой фенильное кольцо, замещенное по меньшей мере двумя заместителями, выбранными из R10, причем по меньшей мере один заместитель находится в орто-положении, и по меньшей мере один заместитель находится в пара-положении фенильного кольца;
A представляет собой СH2, -CH2O-, -CH2NH-, -CH=CH-, -C≡C-, -NH- или O;
J1 представляет собой 5-6-членное гетероароматическое кольцо, необязательно замещенное не более 1 заместителем, выбранным из R7' при члене кольца, представляющем собой атом углерода;
R2 представляет собой H; и
R3 представляет собой H.
Вариант осуществления G. Соединение согласно варианту осуществления F, где
J1 представляет собой незамещенное пиридиновое кольцо;
Q2 представляет собой фенильное кольцо, замещенное тремя заместителями, выбранными из R10, и три заместителя находятся в орто-, мета- и пара-положениях (фенильного кольца); и
A представляет собой -CH2O- или -O-.
Вариант осуществления Н. Соединение формулы 1, где
Q1 представляет собой фенильное кольцо, необязательно замещенное 1-4 заместителями, независимо выбранными из R7; или 5-6-членное гетероароматическое кольцо, содержащее члены кольца, выбранные из атомов углерода и 1-4 гетероатомов, независимо выбранных из не более 2 атомов O, не более 2 атомов S и не более 4 атомов N, необязательно замещенное не более 4 заместителями, независимо выбранными из R7 при членах кольца, представляющих собой атом углерода, и выбранными из R9 при членах кольца, представляющих собой атом азота;
Q2 представляет собой фенильное кольцо, необязательно замещенное не более 5 заместителями, независимо выбранными из R10; или 5-6-членное гетероароматическое кольцо, содержащее члены кольца, выбранные из атомов углерода и 1-4 гетероатомов, независимо выбранных из не более 2 атомов O, не более 2 атомов S и не более 4 атомов N, необязательно замещенное не более 5 заместителями, независимо выбранными из R10 при членах кольца, представляющих собой атом углерода, и выбранными из R11 при членах кольца, представляющих собой атом азота;
J1 представляет собой фенильное кольцо, необязательно замещенное не более 5 заместителями, независимо выбранными из R7'; или 4-6-членное гетероциклическое кольцо, содержащее члены кольца, выбранные из атомов углерода и 1-4 гетероатомов, независимо выбранных из не более 2 атомов O, не более 2 атомов S и не более 4 атомов N, необязательно замещенное не более 5 заместителями, независимо выбранными из R7' при членах кольца, представляющих собой атом углерода, и выбранными из R9' при членах кольца, представляющих собой атом азота;
R1 представляет собой H, гидрокси, амино, C1-C6алкил, C1-C6галогеналкил, C2-C6алкенил, C3-C6алкинил, C2-C6цианоалкил, C3-C6циклоалкил или C4-C8циклоалкилалкил; и
A представляет собой насыщенную, частично ненасыщенную или полностью ненасыщенную цепь, содержащую 2-3 атома, выбранных из не более 3 атомов углерода, не более 1 атома O, не более 1 атома S и не более 1 атома N, причем цепь необязательно замещена не более 2 заместителями, независимо выбранными из R15 при атомах углерода и R16 при атомах азота.
Вариант осуществления I. Соединение формулы 1 или варианта осуществления H, где
Q1 представляет собой фенильное кольцо или нафталинильную кольцевую систему, причем каждое кольцо или кольцевая система необязательно замещены 1-4 заместителями, независимо выбранными из R7;
Q2 представляет собой фенильное кольцо, необязательно замещенное 1-5 заместителями, независимо выбранными из R10; и
J1 представляет собой фенильное кольцо или нафталинильную кольцевую систему, причем каждое кольцо или кольцевая система необязательно замещены не более 4 заместителями, независимо выбранными из R7'.
Вариант осуществления J. Соединение согласно варианту осуществления I, где
A представляет собой -CH2-, -CH2O-, -CH2NH-, -CH=CH-, -C≡C-, -NH-, -O-, -S-, -SO- или -SO2-;
каждый R7 независимо представляет собой галоген, циано, C1-C2алкил, C1-C3галогеналкил или C1-C3алкилсульфонил;
каждый R10 независимо представляет собой галоген, циано, нитро, C1-C2алкил, C1-C3галогеналкил или C1-C3алкилсульфонил;
каждый R7' независимо представляет собой галоген, циано, нитро, C1-C8алкил или C1-C8галогеналкил;
как Y1, так и Y2 представляет собой O.
Вариант осуществления K. Соединение формулы 1 или согласно варианту осуществления H, где
Q1 представляет собой фенильное кольцо или нафталинильную кольцевую систему, причем каждое кольцо или кольцевая система необязательно замещены 1-4 заместителями, независимо выбранными из R7;
Q2 представляет собой фенильное кольцо, необязательно замещенное 1-5 заместителями, независимо выбранными из R10; и
J1 представляет собой 4-6-членное гетероциклическое кольцо, содержащее члены кольца, выбранные из атомов углерода и 1-3 гетероатомов, независимо выбранных из не более 2 атомов O, не более 2 атомов S и не более 3 атомов N, причем не более 2 членов кольца, представляющих собой атом углерода, независимо выбраны из C(=O) и C(=S), а члены кольца, представляющие собой атом серы, независимо выбраны из S(=O)u(=NR8)v, причем каждое кольцо или кольцевая система необязательно замещены не более 3 заместителями, независимо выбранными из R7' при членах кольца, представляющих собой атом углерода, и выбранными из R9' при членах кольца, представляющих собой атом азота.
Вариант осуществления L. Соединение согласно варианту осуществления K, где
A представляет собой -CH2-, -CH2O-, -CH2NH-, -CH=CH-, -C≡C-, -NH-, -O-, -S-, -SO- или -SO2-;
каждый R7 независимо представляет собой галоген, циано, C1-C2алкил, C1-C3галогеналкил или C1-C3алкилсульфонил;
каждый R10 независимо представляет собой галоген, циано, нитро, C1-C2алкил, C1-C3галогеналкил или C1-C3алкилсульфонил;
каждый R7' независимо представляет собой галоген, циано, нитро, C1-C8алкил или C1-C8галогеналкил; и
как Y1, так и Y2 представляет собой O.
Вариант осуществления M. Соединение формулы 1 или согласно варианту осуществления H, где
Q1 представляет собой 5-6-членное гетероароматическое кольцо или 8-10-членную гетероароматическую бициклическую кольцевую систему, причем каждое кольцо или кольцевая система необязательно замещены не более 4 заместителями, независимо выбранными из R7 при членах кольца, представляющих собой атом углерода, и выбранными из R9 при членах кольца, представляющих собой атом азота;
Q2 представляет собой фенильное кольцо, необязательно замещенное 1-5 заместителями, независимо выбранными из R10; и
J1 представляет собой 4-6-членное гетероциклическое кольцо, содержащее члены кольца, выбранные из атомов углерода и 1-3 гетероатомов, независимо выбранных из не более 2 атомов O, не более 2 атомов S и не более 3 атомов N, причем не более 2 членов кольца, представляющих собой атом углерода, независимо выбраны из C(=O) и C(=S), а члены кольца, представляющие собой атом серы, независимо выбраны из S(=O)u(=NR8)v, причем каждое кольцо или кольцевая система необязательно замещены не более 3 заместителями, независимо выбранными из R7' при членах кольца, представляющих собой атом углерода, и выбранными из R9' при членах кольца, представляющих собой атом азота.
Вариант осуществления N. Соединение согласно варианту осуществления M, где
A представляет собой -CH2-, -CH2O-, -CH2NH-, -CH=CH-, -C≡C-, -NH-, -O-, -S-, -SO- или -SO2-;
каждый R7 независимо представляет собой галоген, циано, C1-C2алкил, C1-C3галогеналкил или C1-C3алкилсульфонил;
каждый R10 независимо представляет собой галоген, циано, нитро, C1-C2алкил, C1-C3галогеналкил или C1-C3алкилсульфонил;
каждый R7' независимо представляет собой галоген, циано, нитро, C1-C8алкил или C1-C8галогеналкил; и
как Y1, так и Y2 представляет собой O.
Вариант осуществления O. Соединение формулы 1 или согласно варианту осуществления H, где
Q1 представляет собой 5-6-членное гетероароматическое кольцо или 8-10-членную гетероароматическую бициклическую кольцевую систему, причем каждое кольцо или кольцевая система необязательно замещены не более 4 заместителями, независимо выбранными из R7 при членах кольца, представляющих собой атом углерода, и выбранными из R9 при членах кольца, представляющих собой атом азота;
Q2 представляет собой фенильное кольцо, необязательно замещенное 1-5 заместителями, независимо выбранными из R10; и
J1 представляет собой фенильное кольцо или нафталинильную кольцевую систему, причем каждое кольцо или кольцевая система необязательно замещены не более 4 заместителями, независимо выбранными из R7'.
Вариант осуществления P. Соединение согласно варианту осуществления O, где
A представляет собой -CH2-, -CH2O-, -CH2NH-, -CH=CH-, -C≡C-, -NH-, -O-, -S-, -SO- или -SO2-;
каждый R7 независимо представляет собой галоген, циано, C1-C2алкил, C1-C3галогеналкил или C1-C3алкилсульфонил;
каждый R10 независимо представляет собой галоген, циано, нитро, C1-C2алкил, C1-C3галогеналкил или C1-C3алкилсульфонил;
каждый R7' независимо представляет собой галоген, циано, нитро, C1-C8алкил или C1-C8галогеналкил; и
как Y1, так и Y2 представляет собой O.
Конкретные варианты осуществления включают соединения формулы 1, выбранные из группы, состоящей из:
N-(2,4-дифторфенил)-2-оксо-4-[3-(феноксиметил)фенил]-3-пирролидинкарбоксамида и
2-оксо-4-[3-(2-пиридинилокси)фенил]-N-(2,3,4-трифторфенил)-3-пирролидинкарбоксамида.
Настоящее изобретение также относится к способу контроля нежелательной растительности, предусматривающему внесение в месторасположение растительности гербицидно эффективных количеств соединений по настоящему изобретению (например, в виде композиции, описанной в данном документе). Примечательными в качестве вариантов осуществления, относящихся к способам применения, являются варианты осуществления, включающие соединения согласно описанным выше вариантам осуществления. Соединения по настоящему изобретению являются особенно полезными для селективного контроля сорняков сельскохозяйственных культур, таких как пшеница, ячмень, маис, соя, подсолнечник, хлопчатник, масличный рапс и рис, и особенно сельскохозяйственных культур, таких как сахарный тростник, цитрусовые, плодовые и орехоплодные культуры.
Также заслуживают внимания в качестве вариантов осуществления гербицидные композиции по настоящему изобретению, содержащие соединения согласно описанным выше вариантам осуществления.
Настоящее изобретение также включает гербицидную смесь, содержащую (a) соединение, выбранное из соединения формулы 1, его N-оксидов и солей, и (b) по меньшей мере один дополнительный активный ингредиент, выбранный из (b1) ингибиторов фотосистемы II, (b2) ингибиторов синтазы ацетогидроксикислот (AHAS), (b3) ингибиторов ацетил-CoA-карбоксилазы (ACCазы), (b4) миметиков ауксина, (b5) ингибиторов 5-енол-пирувилшикимат-3-фосфат (EPSP) синтазы, (b6) диверторов электронов фотосистемы I, (b7) ингибиторов протопорфириноген-оксидазы (PPO), (b8) ингибиторов глутамин-синтетазы (GS), (b9) ингибиторов элонгазы жирных кислот с очень длинной цепью (VLCFA), (b10) ингибиторов транспорта ауксина, (b11) ингибиторов фитоен-десатуразы (PDS), (b12) ингибиторов 4-гидроксифенил-пируватдиоксигеназы (HPPD), (b13) ингибиторов гомогентизат-соленезил-трансферазы (HST), (b14) ингибиторов биосинтеза целлюлозы, (b15) других гербицидов, в том числе средств, прерывающих митоз, органических мышьяковистых соединений, асулама, бромобутида, цинметилина, кумилурона, дазомета, дифензоквата, димрона, этобензанида, флуренола, фосамина, фосамин-аммония, гидантоцидина, метама, метилдимрона, олеиновой кислоты, оксазикломефона, пеларгоновой кислоты и пирибутикарба, и (b16) антидотов гербицидов; и солей соединений (b1)-(b16).
"Ингибиторы фотосистемы II" (b1) представляют собой химические соединения, которые связываются с белком D-1 в области связывания QB и, следовательно, блокируют транспорт электронов от QA к QB в тилакоидных мембранах хлоропластов. Электроны, перенос которых в фотосистеме II заблокирован, транспортируются посредством ряда реакций с образованием токсичных соединений, которые разрушают клеточные мембраны и вызывают набухание хлоропластов, просачивание через мембрану и, в конечном итоге, полное разрушение клетки. Область связывания QB имеет три различных сайта связывания: сайт связывания A связывает триазины, такие как атразин, триазиноны, такие как гексазинон, и урацилы, такие как бромацил, сайт связывания B связывает фенилмочевины, такие как диурон, и сайт связывания C связывает бензотиадиазолы, такие как бентазон, нитрилы, такие как бромоксинил, и фенилпиридазины, такие как пиридат. Примеры ингибиторов фотосистемы II включают аметрин, амикарбазон, атразин, бентазон, бромацил, бромофеноксим, бромоксинил, хлорбромурон, хлоридазон, хлоротолурон, хлороксурон, кумилурон, цианазин, даимурон, десмедифам, десметрин, димефурон, диметаметрин, диурон, этидимурон, фенурон, флуометурон, гексазинон, иоксинил, изопротурон, изоурон, ленацил, линурон, метамитрон, метабензтиазурон, метобромурон, метоксурон, метрибузин, монолинурон, небурон, пентанохлор, фенмедифам, прометон, прометрин, пропанил, пропазин, пиридафол, пиридат, сидурон, симазин, симетрин, тебутиурон, тербацил, тербуметон, тербутилазин, тербутрин и триэтазин.
"Ингибиторы AHAS" (b2) представляют собой химические соединения, которые ингибируют синтазу ацетогидроксикислот (AHAS), также известную как ацетолактат-синтаза (ALS), и, следовательно, уничтожают растения посредством ингибирования продуцирования разветвленных алифатических аминокислот, таких как валин, лейцин и изолейцин, которые требуются для синтеза белка и клеточного роста. Примеры ингибиторов AHAS включают амидосульфурон, азимсульфурон, бенсульфурон-метил, биспирибак-натрий, клорансулам-метил, хлоримурон-этил, хлорсульфурон, циносульфурон, циклосульфамурон, диклосулам, этаметсульфурон-метил, этоксисульфурон, флазасульфурон, флорасулам, флукарбазон-натрий, флуметсулам, флупирсульфурон-метил, флупирсульфурон-натрий, форамсульфурон, галосульфурон-метил, имазаметабенз-метил, имазамокс, имазапик, имазапир, имазаквин, имазетапир, имазосульфурон, йодосульфурон-метил (в том числе натриевую соль), иофенсульфурон (2-йод-N-[[(4-метокси-6-метил-1,3,5-триазин-2-ил)амино]карбонил]бензолсульфонамид), мезосульфурон-метил, метазосульфурон (3-хлор-4-(5,6-дигидро-5-метил-1,4,2-диоксазин-3-ил)-N-[[(4,6-диметокси-2-пиримидинил)амино]карбонил]-1-метил-1H-пиразол-5-сульфонамид), метосулам, метсульфурон-метил, никосульфурон, оксасульфурон, пеноксулам, примисульфурон-метил, пропоксикарбазон-натрий, пропирисульфурон (2-хлор-N-[[(4,6-диметокси-2-пиримидинил)амино]карбонил]-6-пропилимидазо[1,2-b]пиридазин-3-сульфонамид), просульфурон, пиразосульфурон-этил, пирибензоксим, пирифталид, пириминобак-метил, пиритиобак-натрий, римсульфурон, сульфометурон-метил, сульфосульфурон, тиенкарбазон, тифенсульфурон-метил, триафамон (N-[2-[(4,6-диметокси-1,3,5-триазин-2-ил)карбонил]-6-фторфенил]-1,1-дифтор-N-метилметансульфонамид), триасульфурон, трибенурон-метил, трифлоксисульфурон (в том числе натриевую соль), трифлусульфурон-метил и тритосульфурон.
"Ингибиторы ACCазы" (b3) представляют собой химические соединения, которые ингибируют фермент ацетил-CoA-карбоксилазу, которая отвечает за катализ на ранней стадии при синтезе липидов и жирных кислот у растений. Липиды представляют собой основные компоненты клеточных мембран, и без них невозможно образование новых клеток. Ингибирование ацетил-CoA-карбоксилазы и последующий дефицит образования липидов приводит к потере целостности клеточной мембраны, особенно в участках активного роста, таких как меристемы. В конечном счете рост побега и ризомы прекращается, и меристемы побега и почки ризомы начинают отмирать. Примеры ингибиторов ACCазы включают аллоксидим, бутроксидим, клетодим, клодинафоп, циклоксидим, цигалофоп, диклофоп, феноксапроп, флуазифоп, галоксифоп, пиноксаден, профоксидим, пропаквизафоп, квизалофоп, сетоксидим, тепралоксидим и тралкоксидим, в том числе разделенные формы, такие как феноксапроп-P, флуазифоп-P, галоксифоп-P и квизалофоп-P и сложноэфирные формы, такие как клодинафоп-пропаргил, цигалофоп-бутил, диклофоп-метил и феноксапроп-P-этил.
Ауксин представляет собой растительный гормон, который регулирует рост многих растительных тканей. "Миметики ауксина" (b4) представляют собой химические соединения, имитирующие растительный гормон роста ауксин, таким образом вызывая неконтролируемый и неорганизованный рост, приводящий к гибели чувствительных видов растений. Примеры миметиков ауксина включают аминоциклопирахлор (6-амино-5-хлор-2-циклопропил-4-пиримидинкарбоновую кислоту) и его метиловые и этиловые сложные эфиры, и его натриевые и калиевые соли, аминопиралид, беназолин-этил, хлорамбен, клацифос, кломепроп, клопиралид, дикамбу, 2,4-D, 2,4-DB, дихлорпроп, флуроксипир, галоксифен (4-амино-3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-2-пиридинкарбоновую кислоту), галоксифен-метил (метил-4-амино-3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-2-пиридинкарбоксилат), MCPA, MCPB, мекопроп, пиклорам, квинклорак, квинмерак, 2,3,6-TBA, триклопир и метил-4-амино-3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-5-фтор-2-пиридинкарбоксилат.
"Ингибиторы EPSP синтазы" (b5) представляют собой химические соединения, которые ингибируют фермент, 5-енол-пирувилшикимат-3-фосфат-синтазу, которая вовлечена в синтез ароматических аминокислот, таких как тирозин, триптофан и фенилаланин. Гербициды-ингибиторы EPSP легко абсорбируются листвой растений и переносятся по флоэме к точкам роста. Глифосат представляет собой относительно неселективный послевсходовый гербицид, который принадлежит к этой группе. Глифосат включает сложные эфиры и соли, такие как аммониевая, изопропиламмониевая, калиевая, натриевая (в том числе натриевая сесквисоль) и тримезиевая (альтернативно называемая сульфосатом).
"Диверторы электронов фотосистемы I" (b6) представляют собой химические соединения, которые принимают электроны от фотосистемы I и после нескольких циклов образуют гидроксильные радикалы. Эти радикалы являются чрезвычайно реакционноспособными и легко разрушают ненасыщенные липиды, в том числе жирные кислоты мембраны и хлорофилл. Это нарушает целостность клеточной мембраны так, что клетки и органеллы "протекают", что приводит к быстрому увяданию и засыханию листьев и, в конечном итоге, к гибели растения. Примеры этих ингибиторов фотосинтеза второго типа включают дикват и паракват.
"Ингибиторы PPO" (b7) представляют собой химические соединения, которые ингибируют фермент протопорфириногеноксидазу, что быстро приводит к образованию у растений чрезвычайно реакционноспособных соединений, которые разрушают клеточные мембраны, вызывая вытекание жидких компонентов клеток. Примеры ингибиторов PPO включают ацифлуорфен-натрий, азафенидин, бензфендизон, бифенокс, бутафенацил, карфентразон, карфентразон-этил, хлометоксифен, цинидон-этил, флуазолат, флуфенпир-этил, флумиклорак-пентил, флумиоксазин, флуорогликофен-этил, флутиацет-метил, фомесафен, галосафен, лактофен, оксадиаргил, оксадиазон, оксифлуорфен, пентоксазон, профлуазол, пираклонил, пирафлуфен-этил, сафлуфенацил, сульфентразон, тидиазимин, трифлудимозаксин (дигидро-1,5-диметил-6-тиоксо-3-[2,2,7-трифтор-3,4-дигидро-3-оксо-4-(2-пропин-1-ил)-2H-1,4-бензоксазин-6-ил]-1,3,5-триазин-2,4(1H, 3H)-дион) и тиафенацил (метил-N-[2-[[2-хлор-5-[3,6-дигидро-3-метил-2,6-диоксо-4-(трифторметил)-1(2H)-пиримидинил]-4-фторфенил]тио]-1-оксопропил]-β-аланинат).
"Ингибиторы GS" (b8) представляют собой химические соединения, которые ингибируют активность фермента глутамин-синтетазы, который растения используют для превращения аммиака в глутамин. Следовательно, аммиак накапливается, а уровни глутамина снижаются. Повреждение растения, вероятно, происходит вследствие суммарных эффектов токсичности аммиака и недостатка аминокислот, необходимых для других метаболических процессов. Ингибиторы GS включают глюфосинат и его сложные эфиры и соли, такие как глюфосинат аммония и другие производные фосфинотрицина, глюфосинат-P ((2S)-2-амино-4-(гидроксиметилфосфинил)бутановую кислоту) и биланафос.
"Ингибиторы элонгазы VLCFA" (b9) представляют собой гербициды с широким спектром химических структур, которые ингибируют элонгазу. Элонгаза представляет собой один из ферментов, расположенных в хлоропластах или рядом с ними, которые вовлечены в биосинтез VLCFA. У растений жирные кислоты с очень длинной цепью являются главными составляющими гидрофобных полимеров, которые предотвращают высыхание поверхности листьев и обеспечивают стабильность пыльцы. Такие гербициды включают ацетохлор, алахлор, анилофос, бутахлор, кафенстрол, диметахлор, диметенамид, дифенамид, феноксасульфон (3-[[(2,5-дихлор-4-этоксифенил)метил]сульфонил]-4,5-дигидро-5,5-диметилизоксазол), фентразамид, флуфенацет, инданофан, мефенацет, метазахлор, метолахлор, напроанилид, напропамид, напропамид-M ((2R)-N,N-диэтил-2-(1-нафталинилокси)пропанамид), петоксамид, пиперофос, претилахлор, пропахлор, пропизохлор, пироксасульфон и тенилхлор, в том числе разделенные формы, такие как S-метолахлор, и хлорацетамиды, и оксиацетамиды.
"Ингибиторы транспорта ауксина" (b10) представляют собой химические вещества, которые ингибируют транспорт ауксина у растений, как например, путем связывания с белком-переносчиком ауксина. Примеры ингибиторов транспорта ауксина включают дифлуфензопир, напталам (также известный как N-(1-нафтил)фталамовая кислота и 2-[(1-нафталиниламино)карбонил]бензойная кислота).
"Ингибиторы PDS" (b11) представляют собой химические соединения, которые ингибируют путь биосинтеза каротиноидов на стадии фитоен-десатуразы. Примеры ингибиторов PDS включают бефлубутамид, дифлуфеникан, флуридон, флурохлоридон, флуртамон, норфлурзон и пиколинафен.
"Ингибиторы HPPD" (b12) представляют собой химические вещества, которые ингибируют биосинтез при синтезе 4-гидроксифенилпируватдиоксигеназы. Примеры ингибиторов HPPD включают бензобициклон, бензофенап, бициклопирон (4-гидрокси-3-[[2-[(2-метоксиэтокси)метил]-6-(трифторметил)-3-пиридинил]карбонил]бицикло[3.2.1]окт-3-ен-2-он), фенквинотрион (2-[[8-хлор-3,4-дигидро-4-(4-метоксифенил)-3-оксо-2-хиноксалинил]карбонил]-1,3-циклогександион), изоксахлортол, изоксафлутол, мезотрион, пирасульфотол, пиразолинат, пиразоксифен, сулькотрион, тефурилтрион, темботрион, толпиралат (1-[[1-этил-4-[3-(2-метоксиэтокси)-2-метил-4-(метилсульфонил)бензоил]-1H-пиразол-5-ил]окси]этилметилкарбонат), топрамезон, 5-хлор-3-[(2-гидрокси-6-оксо-1-циклогексен-1-ил)карбонил]-1-(4-метоксифенил)-2(1H)-хиноксалинон, 4-(2,6-диэтил-4-метилфенил)-5-гидрокси-2,6-диметил-3(2H)-пиридазинон, 4-(4-фторфенил)-6-[(2-гидрокси-6-оксо-1-циклогексен-1-ил)карбонил]-2-метил-1,2,4-триазин-3,5(2H,4H)-дион, 5-[(2-гидрокси-6-оксо-1-циклогексен-1-ил)карбонил]-2-(3-метоксифенил)-3-(3-метоксипропил)-4(3H)-пиримидинон, 2-метил-N-(4-метил-1,2,5-оксадиазол-3-ил)-3-(метилсульфинил)-4-(трифторметил)бензамид и 2-метил-3-(метилсульфонил)-N-(1-метил-1H-тетразол-5-ил)-4-(трифторметил)бензамид.
"Ингибиторы HST" (b13) нарушают способность растения к превращению гомогентизата в 2-метил-6-соланил-1,4-бензохинон, тем самым нарушая биосинтез каротиноидов. Примеры ингибиторов HST включают галоксидин, пирихлор, циклопириморат (6-хлор-3-(2-циклопропил-6-метилфенокси)-4-пиридазинил-4-морфолинкарбоксилат), 3-(2-хлор-3,6-дифторфенил)-4-гидрокси-1-метил-1,5-нафтиридин-2(1H)-он, 7-(3,5-дихлор-4-пиридинил)-5-(2,2-дифторэтил)-8-гидроксипиридо[2,3-b]пиразин-6(5H)-он и 4-(2,6-диэтил-4-метилфенил)-5-гидрокси-2,6-диметил-3(2H)-пиридазинон.
Ингибиторы HST также включают соединения формул A и B:

где Rd1 представляет собой H, Cl или CF3; Rd2 представляет собой H, Cl или Br; Rd3 представляет собой H или Cl; Rd4 представляет собой H, Cl или CF3; Rd5 представляет собой CH3, CH2CH3 или CH2CHF2; и Rd6 представляет собой OH или -OC(=O)-i-Pr; и Re1 представляет собой H, F, Cl, CH3 или CH2CH3; Re2 представляет собой H или CF3; Re3 представляет собой H, CH3 или CH2CH3; Re4 представляет собой H, F или Br; Re5 представляет собой Cl, CH3, CF3, OCF3 или CH2CH3; Re6 представляет собой H, CH3, CH2CHF2 или C≡CH; Re7 представляет собой OH, -OC(=O)Et, -OC(=O)-i-Pr или -OC(=O)-t-Bu; и Ae8 представляет собой N или CH.
"Ингибиторы биосинтеза целлюлозы" (b14) ингибируют биосинтез целлюлозы у определенных растений. Они являются наиболее эффективными при использовании перед прорастанием или после прорастания на молодые или быстрорастущие растения. Примеры ингибиторов биосинтеза целлюлозы включают хлортиамид, дихлобенил, флупоксам, индазифлам (N2-[(1R,2S)-2,3-дигидро-2,6-диметил-1H-инден-1-ил]-6-(1-фторэтил)-1,3,5-триазин-2,4-диамин), изоксабен и триазифлам.
"Другие гербициды" (b15) включают гербициды, которые действуют посредством ряда различных способов действия, как например, средства, прерывающие митоз (например, флампроп-M-метил и флампроп-M-изопропил), органические мышьяковистые соединения (например, DSMA и MSMA), ингибиторы 7,8-дигидроптероат-синтазы, ингибиторы синтеза изопреноидов в хлоропластах и ингибиторы биосинтеза клеточной стенки. Другие гербициды включают такие гербициды с неизвестными способами действия, или не попадающие под конкретную категорию, перечисленную в (b1)-(b14), или действующие посредством комбинации вышеперечисленных способов действия. Примеры других гербицидов включают аклонифен, асулам, амитрол, бромобутид, цинметилин, кломазон, кумилурон, даимурон, дифензокват, этобензанид, флуометурон, флуренол, фосамин, фосамин-аммоний, дазомет, димрон, ипфенкарбазон (1-(2,4-дихлорфенил)-N-(2,4-дифторфенил)-1,5-дигидро-N-(1-метилэтил)-5-оксо-4H-1,2,4-триазол-4-карбоксамид), метам, метилдимрон, олеиновую кислоту, оксазикломефон, пеларгоновую кислоту, пирибутикарб и 5-[[(2,6-дифторфенил)метокси]метил]-4,5-дигидро-5-метил-3-(3-метил-2-тиенил)изоксазол.
"Антидоты гербицидов" (b16) представляют собой вещества, добавляемые в гербицидные составы для устранения или снижения фитотоксичных эффектов гербицида в отношении определенных сельскохозяйственных культур. Эти соединения защищают сельскохозяйственные культуры от повреждения гербицидами, но, как правило, не препятствуют контролю гербицидом нежелательной растительности. Примеры антидотов гербицидов включают без ограничения беноксакор, клоквинтосет-мексил, кумилурон, циометринил, ципросульфамид, даимурон, дихлормид, дициклонон, диэтолат, димепиперат, фенхлоразол-этил, фенклорим, флуразол, флуксофеним, фурилазол, изоксадифен-этил, мефенпир-диэтил, мефенат, метоксифенон, нафталиновый ангидрид, оксабетринил, N-(аминокарбонил)-2-метилбензолсульфонамид и N-(аминокарбонил)-2-фторбензолсульфонамид, 1-бром-4-[(хлорметил)сульфонил]бензол, 2-(дихлорметил)-2-метил-1,3-диоксолан (MG 191), 4-(дихлорацетил)-1-окса-4-азоспиро[4.5]декан (MON 4660), 2,2-дихлор-1-(2,2,5-триметил-3-оксазолидинил)этанон и 2-метокси-N-[[4-[[(метиламино)карбонил]амино]фенил]сульфонил]бензамид.
Соединения формулы 1 можно получать посредством основных способов, известных в области синтетической органической химии. Один или несколько из следующих способов и вариантов, которые описаны на схемах 1-18, можно применять для получения соединений формулы 1. Определения R1, R2, R3, R4, R5, R6, Q1, Q2, J1, J2, T, Y1 и Y2 в соединениях формул 1-19 ниже являются такими, как определено выше в кратком описании изобретения, если не указано иное.
Как показано на схеме 1, соединения формулы 1a (т. e. формулы 1, где T представляет собой -A-J1, R1, R4 и R5 представляют собой H, а Y1 и Y2 представляют собой O) можно получить путем проведения реакции кислот формулы 2 с аминами формулы 3 в присутствии обезвоживающего реагента для реакции сочетания, такого как пропилфосфоновый ангидрид, дициклогексилкарбодиимид, N-(3-диметиламинопропил)-N'-этилкарбодиимид, N,N'-карбонилдиимидазол, 2-хлор-1,3-диметилимидазолия хлорид или 2-хлор-1-метилпиридиния йодид. Реагенты на полимерной подложке, такие как циклогексилкарбодиимид на полимерной подложке, также являются подходящими. Данные реакции, как правило, проводят при значениях температуры в диапазоне 0-60°C, в растворителе, таком как дихлорметан, ацетонитрил, N,N-диметилформамид или этилацетат, в присутствии основания, такого как триэтиламин, N,N-диизопропиламин или 1,8-диазабицикло[5.4.0]ундец-7-ен. См. Organic Process Research & Development 2009, 13, 900-906 для условий сочетания, использующих пропилфосфоновый ангидрид. Способ согласно схеме 1, в котором применяют пропилфосфоновый ангидрид, проиллюстрирован стадией F примера синтеза 2.

Как показано на схеме 2, соединения формулы 2 можно получить путем гидролиза сложных эфиров формулы 4 с помощью способов, хорошо известных специалистам в данной области техники. Гидролиз проводят с помощью водного раствора основания или водного раствора кислоты, как правило, в присутствии сорастворителя. Подходящие для проведения реакции основания включают без ограничения гидроксиды, такие как гидроксид натрия и калия, и карбонаты, такие как карбонат натрия и калия. Подходящие для проведения реакции кислоты включают без ограничения неорганические кислоты, такие как хлористоводородная кислота, бромистоводородная кислота и серная кислота, и органические кислоты, такие как уксусная кислота и трифторуксусная кислота. Широкий спектр сорастворителей, являющихся подходящими для проведения реакции, включает без ограничения метанол, этанол и тетрагидрофуран. Реакцию проводят при значениях температуры в диапазоне от -20°C до температуры кипения растворителя и, как правило, от 0 до 100°C. Способ согласно схеме 2 проиллюстрирован стадией Е примера синтеза 2.

Как показано на схеме 3, соединение формулы 4a или 4b можно получить путем восстановления соединения формулы 5a и 5b, соответственно, и последующей in situ циклизации полученного в результате промежуточного амина. Из литературы известен широкий спектр способов восстановления алифатической нитро- или нитрильной группы в соединениях формулы 5a или 5b. Способы, хорошо известные специалистам в данной области техники, включают каталитическую гидрогенизацию в присутствии палладиевого катализатора на углеродном носителе или никеля Ренея, металлического железа или цинка в кислотной среде (см., например, Berichte der Deutschen Chemischen Gesellschaft 1904, 37, 3520-3525) и алюмогидрида лития. Восстановления алифатической нитрогруппы также можно достичь с помощью йодида самария(II) в присутствии источника протонов, такого как метанол (см., например, Tetrahedron Letters 1991, 32 (14), 1699-1702). В качестве альтернативы, можно использовать борогидрид натрия в присутствии никелевого катализатора, такого как ацетат никеля(II) или хлорид никеля(II) (см., например, Tetrahedron Letters 1985, 26 (52), 6413-6416). Способ согласно схеме 3, в котором применяют борогидрид натрия в присутствии хлорида никеля(II), проиллюстрирован стадией D примера синтеза 1.

Как показано на схеме 4, соединение формулы 5a или 5b можно получить путем проведения реакции сложных диэфиров формулы 6 с нитроалканами формулы 7a или с нитрилами формулы 7b, как правило, в присутствии основания. Подходящие для проведения реакции основания включают низшие алкоксиды щелочных металлов, такие как метоксид натрия в метаноле или этоксид натрия в этаноле. Соединения формулы 6 можно легко получить с помощью способов, известных специалистам в данной области техники, например, путем конденсации Кневенагеля альдегидов и малонатов (см., например, G. Jones, Organic Reactions Volume 15, John Wiley and Sons, 1967).

Соединения формул 5c или 5d (т. e. формул 5a или 5b, где R2 и R3 представляют собой H) можно получить путем проведения реакции соединений формул 8a или 8b с малонатами формулы 9 в присутствии основания, как показано на схеме 5. Подходящие для данной реакции основания включают без ограничения низшие алкоксиды щелочного металла, такие как метоксид натрия в метаноле или этоксид натрия в этаноле, или основания, такие как бис(триметилсилил)амид лития, бис(триметилсилил)амид натрия и диизопропиламид лития в растворителях, таких как тетрагидрофуран. Как правило, реакцию проводят в диапазоне от -78°C до 23°C. См. Synthesis 2005, 2239-2245 для условий с целью осуществления данного преобразования. Условия для осуществления данного преобразования в нагреваемой с обратным холодильником воде в отсутствие катализатора были изложены в Synthetic Communications 2013, 43, 744-748.

Соединения формулы 6 можно легко получить путем конденсации Кневенагеля альдегидов формулы 14 и малонатов 9, как показано на схеме 6. Также, как показано на схеме 6, соединения формул 8a и 8b можно получить путем конденсации Кневенагеля альдегидов формулы 14 и нитрометана.

Как показано на схеме 7, альдегиды формулы 14 можно получить путем проведения реакции альдегидов формулы 20 с соответствующими электрофилами формулы 21 в присутствии основания с металлическим катализатором или без такового. В формуле 21 G обозначает уходящую группу, т. е. нуклеофуг. В зависимости от выбора J1 подходящие для проведения реакции электрофилы могут включать арил- или алкилгалогениды, такие как хлориды, бромиды и йодиды, алкилсульфонаты, ангидриды кислот, такие как трет-бутоксикарбонилангидрид и уксусный ангидрид, и галогеналкилсиланы, такие как хлортриметилсилан. Подходящие для проведения реакции основания включают неорганические основания, такие как гидроксиды, алкоксиды, карбонаты и фосфаты щелочного или щелочноземельного металла (например, лития, натрия, калия и цезия), и органические основания, такие как триэтиламин, N,N-диизопропилэтиламин и 1,8-диазабицикло[5.4.0]ундец-7-ен. Подходящие катализаторы включают палладий, никель, родий или медь с лигандом или без, таким как фосфины или N-гетероциклические карбены. Широкий спектр растворителей, являющихся подходящими для проведения реакции, включают, например, без ограничения тетрагидрофуран, дихлорметан, N,N-диметилформамид, N,N-диметилацетамид, N-метилпирролидинон, ацетонитрил, C2-C6спирты и ацетон, а также смеси этих растворителей. Данную реакцию проводят при значениях температурах в диапазоне от -20 до 200°C и, как правило, от 0 до 50°C. Например, если A представляет собой -CH2OH, см. Organic and Biomolecular Chemistry 2013, 11, 3046-3056. Альдегиды формулы 20 являются коммерчески доступными или их легко получить из коммерчески доступного вещества специалистом в данной области техники.

Если A содержит 1-3 атома C, то специалист в данной области техники может получить соединение формулы 14 с использованием стандартных способов катализируемого переходными металлами кросс-сочетания. Для типичной процедуры катализируемого палладием сочетания Хека см.: Bioorg. Chem. 2010, 38, 139-143. Для примера процедуры катализируемой палладием реакции арилгалогенида и триалкилвисмута см.: Synlett 2010, 19, 2936-2940. Для катализируемых палладием реакций типа Сузуки см.: J. Med. Chem. 2000, 43, 3076, и J. Med. Chem. 2012, 43, 1831-1843.
Соединения формул 5a' и 5a'' можно получить стереоселективно путем проведения реакции нитроалкенов формулы 8а с малонатами формулы 9 в присутствии хирального катализатора и необязательно в присутствии подходящего основания, как показано на схеме 7A. Подходящие катализаторы включают без ограничения Ni(II) с вицинальными диаминовыми лигандами, такими как Ni(II) бис[(R,R)-N,N'-дибензилциклогексан-1,2-диамин]дибромид, Ni(II) бис[(S,S)-N,N'-дибензилциклогексан-1,2-диамин]дибромид или бромид никеля(II) с диаминами хирального 1,1'-би(тетрагидроизохинолин) типа. Подходящие для данной реакции органические основания включают без ограничения пиперидин, морфолин, триэтиламин, 4-метилморфолин или N,N-диизопропилэтиламин. Данное преобразование можно осуществлять в чистом виде или в растворителях, таких как тетрагидрофуран, толуол или дихлорметан. Как правило, реакцию проводят в диапазоне от -78°C до 80°C с использованием 0-1 эквивалента катализатора и необязательно 0-1 эквивалента основания. Условия для осуществления данного преобразования были изложены в J. Am. Chem. Soc. 2005, 9958-9959, или в Eur. J. Org. Chem. 2011, 5441-5446 для условий. Нитроалкены формулы 8а можно легко получить из альдегидов и нитрометана с помощью способов, известных специалистам в данной области техники.

Как показано на схеме 8, соединения формулы 1aa и 1ab также можно получить путем восстановительной циклизации соединений формулы 10a и 10b аналогично способу согласно схеме 3. Как также показано на схеме 8, соединения формулы 1ba и 1bb (т. е. формулы 1, где R1 представляет собой OH, R4 и R5 представляют собой H, а Y1 и Y2 представляют собой O) можно получить из соединений формулы 10b путем каталитической гидрогенизации с переносом водорода с формиатом аммония в присутствии палладиевого катализатора на углеродном носителе и последующей in situ циклизации промежуточного гидроксиламина. См. J. Med. Chem. 1993, 36, 1041-1047 для условий каталитической гидрогенизации/циклизации с переносом водорода с целью получения N-гидроксипирролидинонов.

Как показано на схеме 9, соединения формулы 10a и 10b можно получить путем проведения реакции соединений формулы 11 с соединением формулы 7a или с соединением формулы 7b в растворителе, в присутствии основания, аналогично способу, описанному на схеме 4.

Как показано на схеме 10, соединения формулы 10aа (т. е. формулы 10а, где R2а и R3а представляют собой H) можно получить, аналогично способу согласно схеме 5, путем проведения реакции нитроалкенов формулы 8 с малонатами формулы 12.

Как показано на схеме 11, соединения формулы 11 можно получить путем проведения реакции амида малоновой кислоты формулы 12 с альдегидами формулы 14 с помощью способов, известных специалистам в данной области техники. Как также показано на схеме 11, амиды малоновой кислоты формулы 12 можно легко получить из малонилхлоридов низшего алкила формулы 13, таких как метилмалонилхлорид и амины формулы 3, с помощью способов, известных специалистам в данной области техники.

Как показано на схеме 12, смеси соединений формулы 1c (т. е. формулы 1, где R1 и R5 представляют собой H, R4 представляет собой галоген, а Y1 и Y2 представляют собой O) и формулы 1d (т. е. формулы 1, где R1 и R4 представляют собой H, R5 представляет собой галоген, а Y1 и Y2 представляют собой O) можно получить путем проведения реакции соединений формулы 1a с источником галогена в растворителе, в присутствии или отсутствие инициатора. Разделения региоизомеров, полученных в данной реакции, можно достичь с помощью стандартных способов, таких как хроматография или фракционная кристаллизация. Подходящие источники галогена для данной реакции включают бром, хлор, N-хлорсукцинимид, N-бромсукцинимид и N-йодсукцинимид. Подходящие инициаторы для данной реакции включают 2,2'-азобисизобутиронитрил (AIBN) и пероксид бензоила. Как правило, реакцию проводят в растворителях, таких как дихлорметан в диапазоне от 0°C до температуры кипения растворителя.

As shown in Scheme 13, compounds of Formula 1e (i.e. Formula 1 wherein R1 is
NH2, R4 и R5 представляют собой H, а Y1 и Y2 представляют собой O) можно получить путем проведения реакции соединений формулы 1a с аминирующим реагентом, таким как O-(дифенилфосфинил)гидроксиламин и гидроксиламино-O-сульфокислота. Для процедур, условий и реагентов см. Bioorg. & Med. Chem. Lett. 2009, 19, 5924-5926, и J. of Org. Chem. 2002, 67, 6236-6239.

Как показано на схеме 14, соединения формулы 1f (т. е. формулы 1, где R4, R5 и R6 представляют собой H, а Y1 и Y2 представляют собой O) можно получить путем проведения реакции соединений формулы 15 с изоцианатами (т. е. формулы 16, где Y2 представляет собой O) или изотиоцианатами (т. е. формулы 16, где Y2 представляет собой S) в присутствии основания. Примеры основания, которое можно использовать для способа по настоящему изобретению, включают такие, перечисленные для способа согласно схеме 4. Температуру реакции можно выбрать из диапазона от -78°C до температуры кипения используемого инертного растворителя. Как правило, реакцию проводят при значениях температуры в диапазоне от -78°C до 100°C в растворителях, таких как толуол.

Как показано на схеме 15, соединения формулы 15 можно получить путем проведения реакции соединений формулы 17 с соответствующими электрофилами формулы 18 в присутствии основания. В формуле 18 G обозначает уходящую группу, т. е. нуклеофуг. В зависимости от выбора R1 подходящие для проведения реакции электрофилы могут включать алкилгалогениды, такие как хлориды, бромиды и йодиды, алкилсульфонаты, кислотные ангидриды, такие как трет-бутоксикарбонилангидрид и уксусный ангидрид, и галогеналкилсиланы, такие как хлортриметилсилан. Подходящие для проведения реакции основания включают неорганические основания, такие как гидроксиды, алкоксиды, карбонаты и фосфаты щелочного или щелочноземельного металла (например, лития, натрия, калия и цезия), и органические основания, такие как триэтиламин, N,N-диизопропилэтиламин и 1,8-диазабицикло[5.4.0]ундец-7-ен. Широкий спектр растворителей, являющихся подходящими для проведения реакции, включают, например, без ограничения тетрагидрофуран, дихлорметан, N,N-диметилформамид, N,N-диметилацетамид, N-метилпирролидинон, ацетонитрил, C2-C6спирты и ацетон, а также смеси этих растворителей. Данную реакцию проводят при значениях температуры в диапазоне от -20 до 200°C и, как правило, от 0 до 50°C.

Как показано на схеме 16, соединения формулы 17 можно получить путем декарбоксилирования кислот формулы 2 с помощью способов, хорошо известных специалистам в данной области техники. Декарбоксилирование проводят путем нагревания соединений формулы 2 в растворителе, как правило, в присутствии кислоты. Подходящие кислоты для реакции включают без ограничения п-толуолсульфокислоту. Широкий спектр сорастворителей, являющихся подходящими для реакции, включает без ограничения толуол, изопропанолацетат и изобутилметилкетон. Реакцию проводят при значениях температуры в диапазоне от -20°C до температуры кипения растворителя и, как правило, от 0 до 150°C.

Как показано на схеме 17, соединения формулы 1g (т. е. формулы 1, где R1 представляет собой H, R4 и R5 представляют собой H, а Y1 и Y2 представляют собой S) можно получить путем проведения реакции соединений формулы 1a по меньшей мере с двумя эквивалентами тионирующего реагента, такого как реагент Лавессона, тетрафосфорный декасульфид или дифосфорный пентасульфид в растворителе, таком как тетрагидрофуран или толуол. Как правило, реакцию проводят при значениях температуры в диапазоне от 0 до 115°C. Специалист в данной области техники понимает, что использование менее двух эквивалентов тионирующего реагента может обеспечить смеси, содержащие продукты формулы 1, где Y1 представляет собой O и Y2 представляет собой S, или Y1 представляет собой S и Y2 представляет собой O, которые можно разделить традиционными способами, такими как хроматография и кристаллизация.

Как показано на схеме 18, соединения формулы 1h (т. е. формулы 1, где R1, R4, R5 представляют собой H, Y2 представляет собой O, и Y1 представляет собой NH) можно получить путем алкилирования соединений формулы 1a триэтилоксония тетрафторборатом (реагентом Меервейна) с последующей обработкой полученного в результате иминоэфира формулы 19 водным аммиаком.

Специалисту в данной области техники будет понятно, что различные функциональные группы можно превращать в другие группы с получением различных соединений формулы 1. В качестве надежного источника, в котором просто и ясно проиллюстрировано взаимное превращение функциональных групп, см. Larock, R. C., Comprehensive Organic Transformations: A Guide to Functional Group Preparations, 2nd Ed., Wiley-VCH, New York, 1999. Например, промежуточные соединения для получения соединений формулы 1 могут содержать ароматические нитрогруппы, которые можно восстанавливать до аминогрупп и затем превращать посредством реакций, хорошо известных из уровня техники, таких как реакция Зандмейера, в различные галогениды с получением соединений формулы 1. Также во многих случаях вышеприведенные реакции можно осуществлять в альтернативном порядке.
Следует понимать, что некоторые вышеописанные реагенты и условия реакции для получения соединений формулы 1 могут быть несовместимыми с определенными функциональными группами промежуточных соединений. В таких случаях включение в синтез последовательностей для защиты/снятия защиты или взаимопревращений функциональных групп будет способствовать получению необходимых продуктов. Применение и выбор защитных групп будут очевидны для специалиста в области химического синтеза (см., например, Greene, T. W.; Wuts, P. G. M. Protective Groups in Organic Synthesis, 2nd ed.; Wiley: New York, 1991). Специалисту в данной области техники будет понятно, что, в некоторых случаях, после введения данного реагента, как показано на любой отдельной схеме, может быть необходимо осуществление дополнительных общепринятых стадий синтеза, не описанных подробно, для выполнения синтеза соединений формулы 1. Специалисту в данной области техники также будет понятно, что может быть необходимо осуществление комбинации стадий, проиллюстрированных на вышеуказанных схемах в порядке, отличном от предполагаемого конкретным порядком, представленным для получения соединений формулы 1.
Также специалисту в данной области техники будет понятно, что соединения формулы 1 и промежуточные соединения, описанные в данном документе, можно подвергнуть различным электрофильным, нуклеофильным, радикальным, металлоорганическим реакциям, реакциям окисления и восстановления с целью добавления заместителей или модификации существующих заместителей.
Без дополнительного уточнения предполагается, что специалист в данной области техники с применением предшествующего описания может использовать настоящее изобретение в наиболее полном его объеме. Следующие неограничивающие примеры иллюстрируют настоящее изобретение. Стадии в следующих примерах иллюстрируют процедуру для каждой стадии в суммарном синтетическом преобразовании, и исходное вещество для каждой стадии не обязательно должно быть получено посредством конкретного подготовительного этапа, процедура которого описывается в других примерах или стадиях. Значения процентного содержания приведены по весу, за исключением смесей хроматографических растворителей или случаев, когда указано иное. Доли и значения процентного содержания для смесей хроматографических растворителей приведены по объему, если не указано иное. 1H ЯМР спектры представлены в ppm в сторону слабого поля от тетраметилсилана в CDCl3 при 500 MГц, если не указано иное; "s" означает синглет, "d" означает дуплет, "t" означает триплет, "q" означает квартет, "m" означает мультиплет, "d" означает дуплет. Масс-спектры (MS) представлены в виде молекулярной массы исходного иона с наиболее высоким относительным содержанием изотопа (M+1), образованного при добавлении H+ (молекулярная масс 1) к молекуле, или (M-1), образованного при потере H+ (молекулярная масса 1) молекулой, наблюдаемого при применении жидкостной хроматографии совместно с масс-спектрометрией (LCMS) с применением химической ионизации при атмосферном давлении (AP+), где "amu" означает атомные единицы массы.
ПРИМЕР СИНТЕЗА 1
Получение N-(2-фторфенил)-2-оксо-4-[3-(2-пиридинилокси)фенил]-3-пирролидинкарбоксамида (соединения 34)
Стадия A. Получение 3-(2-пиридинилокси)бензальдегида
2-Фторпиридин (20,0 г, 164 ммоль) растворяли в 150 мл N,N-диметилформамида, а затем обрабатывали трет-бутоксидом калия (19,9 г, 177 ммоль). Реакционная смесь выделяла тепло до 57°C, а затем обеспечивали ее охлаждение до температуры окружающей среды в течение 1 часа. Добавляли 3-гидроксибензальдегид (13,9 мл, 162 ммоль) и смесь нагревали до 120°C в течение ночи. Обеспечивали охлаждение реакционной смеси до температуры окружающей среды, а затем разделяли между этилацетатом и 1 н. водным раствором HCl. Органический слой промывали солевым раствором, высушивали над сульфатом магния и концентрировали с получением коричневого остатка, который затем растирали с диэтиловым эфиром. Полученное в результате твердое вещество выделяли посредством фильтрации и высушивали на воздухе с получением 14,9 г указанного в заголовке соединения.
1H ЯМР (DMSO-d6) δ 10,01 (s, 1H), 8,17 (m, 1H), 7,91 (m, 1H), 7,78 (m, 1H), 7,66 (t, 1H), 7,63 (s, 1H), 7,50 (m, 1H), 7,16-7,20 (m, 1H), 7,13 (d, 1H).
Стадия B. Получение 2-[3-[(1E)-2-нитроэтенил]фенокси]пиридина
К раствору 3-(пирид-2-илокси)бензальдегида (также известного как 3-(2-пиридинилокси)бензальдегид, т. e. продукт со стадии A, 20,1 г, 101 ммоль) в 250 мл 1-хлорбутана добавляли нитрометан (6,54 мл, 121 ммоль), пиперидин (0,988 мл, 10,0 ммоль) и ледяную уксусную кислоту (0,577 мл, 10,0 ммоль). Затем смесь нагревали с обратным холодильником в течение 48 часов c азеотропным удалением воды. Обеспечивали охлаждение реакционной смеси до температуры окружающей среды. Реакционную смесь концентрировали на диатомитовом вспомогательном фильтрующем материале Celite®, а затем очищали с помощью жидкостной хроматографии среднего давления (0% - 15% этилацетат в смеси гексанов в качестве элюента) с получением 19,2 г указанного в заголовке соединения в виде желтого масла.
1H ЯМР δ 8,19 (m, 1H), 7,99 (d, 1H), 7,74 (m, 1H), 7,56 (m, 1H), 7,48 (t, 1H) 7,36 (m, 2H), 7,29 (m, 1H), 7,05 (m, 1H), 6,99 (d, 1H).
Стадия C. Получение 1,3-диэтил-2-[2-нитро-1-[3-(2-пиридинилокси)фенил]этил]пропандиоата
2-[3-[(1E)-2-Нитроэтенил]фенокси]пиридин (т. e. продукт со стадии B, 19,4 г, 105 ммоль), диэтилмалонат (14,5 мл, 95,2 ммоль) и Ni(II) бис[N,N'-дибензилциклогексан-1,2-диамин]дибромид (0,955 г, 1,19 ммоль) нагревали с обратным холодильником в дихлорметане в течение 48 часов. Реакционную смесь затем охлаждали до температуры окружающей среды, концентрировали на диатомитовом вспомогательном фильтрующем материале Celite® при пониженном давлении, а затем очищали с помощью жидкостной хроматографии среднего давления с элюированием 0% - 50% этилацетатом в смеси гексанов с получением 30,2 г указанного в заголовке соединения в виде бесцветного масла.
1H ЯМР (500 МГц, DMSO-d6) δ 8,15 (m, 1H) 7,86 (m, 1H) 7,34 (m, 1H) 7,15 (m, 3H) 7,03 (m, 1H) 6,96 (m, 1H) 4,99 (m, 2H) 4,17 (m, 2H) 4,09 (m, 1H) 4,03 (m, 1H) 3,89 (m, 2H) 1,18 (t, 3H) 0,92 (t, 3H).
Стадия D. Получение этил-2-оксо-4-[3-(2-пиридинилокси)фенил]-3-пирролидинкарбоксилата
1,3-Диэтил-2-[2-нитро-1-[3-(2-пиридинилокси)фенил]этил]пропандиоат (т. e. продукт со стадии C, 30,1 г, 74,9 ммоль) растворяли в 500 мл этанола при температуре окружающей среды. Добавляли NiCl2.6H2O (17,8 г, 74,9 ммоль) и смесь перемешивали до полного растворения. Реакционную массу затем охлаждали до 0°C в ледяной бане, а затем медленно добавляли борогидрид натрия (8,50 г, 225 ммоль) так, чтобы температура не превышала 5°C. По завершении добавления ледяную баню удаляли, а реакционную массу перемешивали при температуре окружающей среды в течение ночи. Затем этанол удаляли при пониженном давлении, добавляли 500 мл этилацетата и 1,25 л насыщенного раствора хлорида аммония и реакционную смесь перемешивали до следующего дня. Органический слой отделяли от водного слоя, а затем концентрировали на силикагеле при пониженном давлении, а затем очищали с помощью MPLC с элюированием 0% - 100% этилацетатом в смеси гексанов с получением 7,5 г указанного в заголовке соединения в виде желтого масла.
1H ЯМР δ 8,19 (m, 1H), 7,71 (m, 1H), 7,37 (m, 1H), 7,05 (m, 4H), 6,93 (m, 1H), 6,37 (bs, 1H), 4,24 (m, 2H), 4,13 (m, 1H), 3,82 (m, 1H), 3,55 (d, 1H), 3,45 (m, 1H), 1,27 (m, 3H).
Стадия E. Получение N-(2-фторфенил)-2-оксо-4-[3-(2-пиридинилокси)фенил]-3-пирролидинкарбоксамида
Этил-2-оксо-4-[3-(2-пиридинилокси)фенил]-3-пирролидинкарбоксилат (т. e. продукт со стадии D, 0,40 г, 1,2 ммоль) добавляли к 2-фторанилину (2,0 мл, 6,8 ммоль) и нагревали в реакторе CEM Microwave в течение 45 минут при 190°C. Реакционную смесь охлаждали до температуры окружающей среды, а затем разбавляли 200 мл дихлорметана. Данный раствор концентрировали при пониженном давлении на Celite®, а затем очищали с помощью MPLC (0% - 100% этилацетат в смеси гексанов в качестве элюента) с получением 0,23 г указанного в заголовке соединения, продукта согласно настоящему изобретению, в виде твердого вещества.
1H ЯМР δ 10,04 (s, 1H), 8,13 (m, 2H), 8,00 (m, 1H), 7,83 (m, 1H), 7,38 (m, 1H), 7,12 (m, 8H), 4,00 (m, 2H), 3,70 (t, 1H), 3,25 (t, 1H).
ПРИМЕР СИНТЕЗА 2
Получение N-(2,3-дифторфенил)-2-оксо-4-[3-[[3-(трифторметил)-1H-пиразол-1-ил]метил]фенил]-3-пирролидинкарбоксамида (соединения 25)
Стадия A. Получение 3-[[3-(трифторметил)-1H-пиразол-1-ил]метил]бензальдегида
3-(Трифторметил)пиразол (0,82 г, 6,0 ммоль), 3-(бромметил)бензальдегид (1,0 г, 5,0 ммоль) и карбонат калия (2,1 г, 15 ммоль) объединяли в 50 мл N,N-диметилформамида и нагревали до 80°C в течение 18 часов. Реакционную смесь охлаждали до температуры окружающей среды, а затем разделяли между этилацетатом и солевым раствором. Органический слой высушивали над сульфатом магния и концентрировали при пониженном давлении с получением зеленого масла, которое абсорбировали на силикагеле, а затем очищали с помощью MPLC с элюированием 0% - 100% этилацетатом в смеси гексанов с получением 0,82 г указанного в заголовке соединения.
1H ЯМР δ 10,01 (s, 1H), 7,86 (m, 1H), 7,76 (s, 1H), 7,56 (m, 1H), 7,50 (m, 1H), 7,45 (m, 1H), 6,58 (d, 1H), 5,44 (s, 2H).
Стадия B. Получение 1-[[3-[(1E)-2-нитроэтенил]фенил]метил]-3-(трифторметил)-1H-пиразола (т. e. 1-[[3-[(1E)-2-нитроэтенил]фенил]метил]-3-(трифторметил)-1H-пиразола)
К раствору 3-[[3-(трифторметил)-1H-пиразол-1-ил]метил]бензальдегида (т. e. продукта со стадии A, 16,5 г, 65 ммоль) в 100 мл 1-хлорбутана добавляли нитрометан (4,2 мл, 78 ммоль), пиперидин (0,64 мл, 6,5 ммоль) и ледяную уксусную кислоту (0,37 мл, 6,5 ммоль). Затем смесь нагревали с обратным холодильником в течение 48 часов c азеотропным удалением воды. Обеспечивали охлаждение реакционной смеси до температуры окружающей среды. Реакционную смесь концентрировали на диатомитовом вспомогательном фильтрующем материале Celite®, а затем очищали с помощью MPLC с элюированием 0% - 15% этилацетатом в смеси гексанов с получением 11,2 г указанного в заголовке соединения в виде желтого твердого вещества.
1H ЯМР (500 МГц, ХЛОРОФОРМ-d) δ 7,97 (d, 1H), 7,55 (m, 2H), 7,46 (m, 2H), 7,38 (m, 2H), 6,58 (d, 1H), 5,40 (s, 2H).
Стадия C. Получение 1,3-диэтил 2-[2-нитро-1-[3-[[3-(трифторметил)-1H-пиразол-1-ил]метил]фенил]этил]пропандиоата
1-[[3-[(1E)-2-Нитроэтенил]фенил]метил]-3-(трифторметил)-1H-пиразол (т. e. 1-[[3-[(1E)-2-нитроэтенил]фенил]метил]-3-(трифторметил)-1H-пиразол, т. e. продукт со стадии B, 11 г, 38 ммоль), диэтилмалонат (6,9 мл, 45 ммоль) и бис[N,N'-дибензилциклогексан-1,2-диамин]дибромид Ni(II) (0,46 г, 0,57 ммоль) перемешивали в дихлорметане в течение примерно 16 часов. Затем реакционную смесь охлаждали до температуры окружающей среды, концентрировали на диатомитовом вспомогательном фильтрующем материале Celite® при пониженном давлении, а затем очищали с помощью MPLC с элюированием 0% - 50% этилацетатом в смеси гексанов с получением 11 г указанного в заголовке соединения в виде желтого масла.
1H ЯМР δ 7,34 (m, 2H), 7,23 (d, 1H), 7,15 (m, 2H), 6,54 (d, 1H), 5,32 (m, 2H), 4,88 (m, 2H), 4,21 (m, 3H), 3,98 (q, 2H), 3,78 (d, 1H), 1,25 (t, 3H), 1,01 (t, 3H).
Стадия D. Получение этил-2-оксо-4-[3-[[3-(трифторметил)-1H-пиразол-1-ил]метил]фенил]-3-пирролидинкарбоксилата
1,3-Диэтил-2-[2-нитро-1-[3-[[3-(трифторметил)-1H-пиразол-1-ил]метил]фенил]этил]пропандиоат (т. e. продукт со стадии C, 30,1 г, 74,9 ммоль) растворяли в 500 мл этанола при температуре окружающей среды. Добавляли NiCl2-6H2O (17,8 г, 74,9 ммоль) и смесь перемешивали до полного растворения. Реакционную массу затем охлаждали до 0°C в ледяной бане, а затем медленно добавляли борогидрид натрия (8,50 г, 225 ммоль) так, чтобы температура не превышала 5°C. По завершении добавления ледяную баню удаляли, а реакционную массу перемешивали при температуре окружающей среды в течение 3 часов. Добавляли 300 мл этилацетата и 300 мл насыщенного раствора хлорида аммония и реакционную смесь перемешивали, пока органический слой не становился прозрачным, а водный слой голубым. Органический слой отделяли от водного слоя и водный слой снова экстрагировали этилацетатом. Объединенные органические слои промывали хлоридом аммония, высушивали над сульфатом магния, затем концентрировали на силикагеле при пониженном давлении, а затем очищали с помощью MPLC с элюированием 0% - 100% этилацетатом в смеси гексанов с получением 3,5 г указанного в заголовке соединения в виде желтого масла с некоторыми примесями, которое использовали без дополнительной очистки. MS (M-1)=380 amu.
Стадия E. Получение 2-оксо-4-[3-[[3-(трифторметил)-1H-пиразол-1-ил]метил]фенил]-3-пирролидинкарбоновой кислоты
Этил-2-оксо-4-[3-[[3-(трифторметил)-1H-пиразол-1-ил]метил]фенил]-3-пирролидинкарбоксилат (т. e. продукт со стадии D, 3,78 г, 9,1 ммоль) растворяли в 65 мл этанола, а затем в течение 5 минут добавляли 1,4 мл 50% раствора натрия гидроксида. Затем реакционную смесь перемешивали в течение ночи при температуре окружающей среды. Смесь разбавляли водой до растворения белого осадка. Органический слой дважды экстрагировали с помощью 125 мл диэтилового эфира, а затем подкисляли до pH 2 концентрированной хлористоводородной кислотой. Затем водный слой экстрагировали этилацетатом. Слой этилацетата промывали солевым раствором, высушивали над сульфатом магния и концентрировали при пониженном давлении с получением 1,9 г указанного в заголовке соединения в виде розового стеклообразного вещества.
1H ЯМР (DMSO-d6) δ 12,74 (bs, 1H), 8,09 (d, 2H), 7,33 (m, 3H), 7,12 (m, 1H), 6,74 (d, 1H), 5,41 (s, 2H), 3,83 (m, 2H), 3,51 (m, 2H).
Стадия F. Получение N-(2,3-дифторфенил)-2-оксо-4-[3-[[3-(трифторметил)-1H-пиразол-1-ил]метил]фенил]-3-пирролидинкарбоксамида
2-Оксо-4-[3-[[3-(трифторметил)-1H-пиразол-1-ил]метил]фенил]-3-пирролидинкарбоновую кислоту (т. e. продукт со стадии E, 0,33 г, 0,92 ммоль), триэтиламин (0,38 мл, 0,28 ммоль) и 2,3-дифторанилин (0,14 г, 1,1 ммоль) растворяли в 25 мл дихлорметана и перемешивали при температуре окружающей среды в течение 15 минут, а затем обрабатывали 50% пропилфосфоновым ангидридом (T3P®) в этилацетате (1,8 мл, 3,1 ммоль) и перемешивали в течение ночи. Реакционную смесь концентрировали при пониженном давлении, а затем очищали с помощью MPLC с элюированием 0% - 100% этилацетатом в смеси гексанов с получением 0,092 г указанного в заголовке соединения, продукта согласно настоящему изобретению, в виде твердого вещества.
1H ЯМР (DMSO-d6) δ 10,22 (s, 1H), 8,21 (s, 1H), 8,07 (d, 1H), 7,77 (m, 1H), 7,34 (m, 3H), 7,16 (m, 3H), 6,71 (d, 1H), 5,42 (s, 2H), 4,02 (m, 1H), 3,92 (m, 1H), 3,67 (t, 1H), 3,26 (t, 1H).
ПРИМЕР СИНТЕЗА 3
Получение N-(2-фторфенил)-4-[3-[(метоксиимино)метил]фенил]-1-метил-2-оксо-3-пирролидинкарбоксамида (соединения 53)
Стадия A. Получение 1,3-диэтил-2-[(3-йодфенил)метилен]пропандиоата
К раствору 3-йодбензальдегида (10 г, 43 ммоль) в бензоле (100 мл) добавляли диэтилмалонат (8,3 г, 52 ммоль) и пиперидин (0,73 г, 8,6 ммоль) при 5°C. Реакционную смесь нагревали до температуры флегмы растворителя с помощью прибор Дина-Старка для удаления воды в течение 24 часов. Реакционную смесь выпаривали с получением неочищенного продукта, который очищали с помощью колоночной хроматографии на силикагеле с элюированием 5% - 20% градиентом этилацетата в петролейном эфире с получением указанного в заголовке продукта (17 г).
1H ЯМР (400 МГц) δ 7,80 (s, 1H), 7,60 (s, 1H), 7,40 (m, 1H), 7,30 (s, 1H), 7,10 (m, 1H), 4,35 (m, 4H), 1,77 (m, 6 H).
Стадия B. Получение 1,3-диэтил-2-[1-(3-йодфенил)-2-нитроэтил]пропандиоата
К раствору 1,3-диэтил-2-[(3-йодфенил)метилен]пропандиоата (т. e. соединения, полученного на стадии A, 17 г, 45 ммоль) в этаноле (170 мл) добавляли нитрометан (28 г, 450 ммоль) и 20% метоксид натрия в метаноле (0,25 г, 4,55 ммоль) при 5°C и реакционную смесь перемешивали при температуре окружающей среды в течение 16 часов. Реакционную смесь выпаривали с получением указанного в заголовке неочищенного соединения (16 г), которое использовали без дополнительной очистки.
1H ЯМР (400 МГц) δ 7,60 (t, 2H), 7,20 (d, 1H), 7,10 (t, 1H), 4,95 (m, 2H), 4,20 (m, 3H), 4,00 (m, 2H), 3,75 (d, 1H), 1,20 (m, 6 H).
Стадия C. Получение этил-4-(3-йодфенил)-2-оксо-3-пирролидинкарбоксилата
К раствору 1,3-диэтил-2-[1-(3-йодфенил)-2-нитроэтил]пропандиоата (т. e. соединения, полученного на стадии B, 16 г, 36 ммоль) в этаноле (150 мл)/воде (32 мл) добавляли порошок железа (10 г, 180 ммоль), хлорид аммония (1,0 г, 18 ммоль) и реакционную смесь нагревали при 110°C в течение 24 часов. Реакционную смесь фильтровали через диатомитовый вспомогательный фильтрующий материал Celite® и фильтрат концентрировали. К неочищенному остатку добавляли воду и смесь экстрагировали (3 ×) этилацетатом. Объединенные органические слои промывали водой, солевым раствором, а затем высушивали над сульфатом натрия. Растворитель выпаривали с получением указанного в заголовке соединения в виде неочищенного промежуточного соединения (15 г). 500 мг образца неочищенного промежуточного соединения очищали с помощью препаративной тонкослойной хроматографии с получением 250 мг указанного в заголовке соединения.
1H ЯМР (400 МГц) δ 7,60 (m, 2H), 7,20 (m, 1H), 7,10 (m, 1H), 6,10 (s, 1H), 4,20 (m, 2H), 4,00 (m, 1H), 3,63 (t, 1H), 3,40 (m, 1H), 3,30 (m, 1H), 1,23 (m, 3H).
Стадия D. Получение 4-(3-йодфенил)-2-оксо-3-пирролидинкарбоновой кислоты
К раствору этил-4-(3-йодфенил)-2-оксо-3-пирролидинкарбоксилата (т. e. соединения, полученного на стадии C, 9,0 г, 25 ммоль) в тетрагидрофуране (50 мл) и воде (10 мл) добавляли моногидрат гидроксида лития (1,6 г, 38 ммоль) при 0°C и реакционную смесь перемешивали при температуре окружающей среды в течение 4 часов. Реакционную смесь затем выпаривали и твердое вещество смешивали с водой. Водную смесь экстрагировали этилацетатом и органический слой удаляли. Водный слой подкисляли концентрированной хлористоводородной кислотой при 0°C. Полученное в результате твердое вещество собирали посредством фильтрации и высушивали в вакууме с получением указанного в заголовке соединения (5 г) в виде грязно-белого твердого вещества.
1H ЯМР (400 МГц) δ 12,89 (s, 1H), 8,10 (s, 1H), 7,65 (d, 1H), 7,53 (d, 1H), 7,39 (d, 1H), 7,18 (t, 1H), 3,81 (m, 1H), 3,50 (m, 2H), 3,20 (m, 1H).
Стадия E. Получение 4-(3-йодфенил)-1-метил-2-оксо-3-пирролидинкарбоновой кислоты
Трет-бутоксид калия (37 мл, 1 M раствор в тетрагидрофуране) охлаждали до 0°C. К данному раствору медленно добавляли 4-(3-йодфенил)-2-оксо-3-пирролидинкарбоновую кислоту (т. e. соединение, полученное на стадии D, 5,0 г, 15 ммоль) в тетрагидрофуране и перемешивали в течение 10 минут. Добавляли метилбромид (25% в ацетонитриле, 14 мл, 38 ммоль) и реакционную смесь перемешивали в течение 4 часов. Реакционную смесь разбавляли ацетонитрилом и подкисляли 1 н. водной хлористоводородной кислотой при 0°C. Реакционную смесь затем экстрагировали (3 ×) этилацетатом, объединенные органические вещества промывали солевым раствором и высушивали над сульфатом натрия с получением неочищенного остатка, который промывали диэтиловым эфиром с получением указанного в заголовке соединения (2,3 г) в виде грязно-белого твердого вещества.
1H ЯМР (400 МГц) δ 12,77 (s, 1H), 7,74 (s, 1H), 7,65 (d, 1H), 7,38 (d, 1H), 7,15 (t, 1H), 3,81 (m, 2H), 3,62 (m, 1H), 3,45 (d, 1H), 2,80 (s, 3H).
Стадия F. Получение N-(2-фторфенил)-4-(3-йодфенил)-1-метил-2-оксо-3-пирролидинкарбоксамида
К раствору 4-(3-йодфенил)-1-метил-2-оксо-3-пирролидинкарбоновой кислоты (т. e. соединения, полученного на стадии E, 0,5 г, 1,4 ммоль) и 2-фторанилина (0,15 мл, 1,6 ммоль) в N,N-диметилформамиде (10 мл) добавляли триэтиламин (0,6 мл, 4,3 ммоль) и перемешивали при температуре окружающей среды в течение 10 минут. Затем добавляли раствор пропилфосфонового ангидрида (T3P®) (50% в этилацетате, 1,7 мл, 2,89 ммоль) при 0°C и перемешивали в течение 2 часов. Реакционную смесь затем разбавляли водой и экстрагировали этилацетатом. Объединенные органические слои промывали водой и солевым раствором, а затем высушивали над сульфатом натрия. Растворитель выпаривали с получением неочищенного остатка, который промывали диэтиловым эфиром/пентаном с получением указанного в заголовке соединения (0,4 г) в виде грязно-белого твердого вещества.
1H ЯМР (400 МГц) δ 10,08 (s, 1H), 8,00 (m, 1H), 7,75 (s, 1H), 7,63 (d, 1H), 7,37 (d, 1H), 7,35 (m, 1H), 7,15 (m, 3H), 3,95 (m, 2H), 3,77 (m, 1H), 3,41 (m, 1H), 2,80 (s, 3H).
Стадия G. Получение N-(2-фторфенил)-4-(3-формилфенил)-1-метил-2-оксо-3-пирролидинкарбоксамида
Раствор N-(2-фторфенил)-4-(3-йодфенил)-1-метил-2-оксо-3-пирролидинкарбоксамида (т. e. соединения, полученного на стадии F, 0,5 г, 1,1 ммоль) и тетракис(трифенилфосфин)палладия(0) (0,086 г, 0,075 ммоль) в N,N-диметилформамиде (5 мл) в сосуде высокого давления перемешивали в атмосфере газообразного монооксида углерода (100 фунтов/кв. дюйм) в течение 30 минут. Давление понижали, добавляли трибутилсилан (0,83 мл) и реакционную смесь перемешивали в атмосфере газообразного монооксида углерода (100 фунтов/кв. дюйм) при температуре окружающей среды в течение 48 часов. Реакционную смесь затем разбавляли водой и экстрагировали этилацетатом. Объединенные органические слои промывали водой и солевым раствором и высушивали над сульфатом натрия. Растворитель выпаривали с получением неочищенного остатка, который очищали с помощью колоночной хроматографии на силикагеле с элюированием 20% этилацетатом в петролейном эфире с получением указанного в заголовке соединения (0,27 г) в виде светло-коричневого твердого вещества.
1H ЯМР (400 МГц) δ 10,15 (s, 1H), 10,00 (s, 1H), 8,15 (t, 1H), 7,82 (m, 1H), 7,64 (m, 1H), 7,55 (m, 1H), 7,39 (m, 1H), 7,12 (m, 3H), 4,20 (m, 1H), 3,80 (t, 1H), 3,31 (d, 1H), 3,22 (m, 1H), 3,10 (s, 3H).
Стадия H. Получение N-(2-фторфенил)-4-[3-[(метоксиимино)метил]фенил]-1-метил-2-оксо-3-пирролидинкарбоксамида
К раствору N-(2-фторфенил)-4-(3-формилфенил)-1-метил-2-оксо-3-пирролидинкарбоксамида (т. e. соединения, полученного на стадии G, 0,15 г, 0,41 ммоль) и гидрохлорида метоксиламина (0,054 г, 0,64 ммоль) в тетрагидрофуране (10 мл) добавляли ацетат натрия (0,047 г, 0,57 ммоль) и перемешивали при температуре окружающей среды в течение 2 часов. Реакционную смесь затем разбавляли водой и экстрагировали этилацетатом. Объединенные органические слои промывали водой и солевым раствором и высушивали над сульфатом натрия. Растворитель выпаривали с получением неочищенного продукта, который очищали с помощью препаративной тонкослойной хроматографии на силикагеле в 40% этилацетате/петролейном эфире с получением (0,07 г) указанного в заголовке соединения, соединения по настоящему изобретению, в виде грязно-белого твердого вещества.
1H ЯМР (400 МГц) δ 9,85 (s, 1H), 8,25 (t, 1H), 8,10 (s, 1H), 7,55 (s, 1H), 7,45 (s, 1H), 7,25 (s, 2H), 6,99 (m, 3H), 4,25 (m, 1H), 4,10 (s, 3H), 3,75 (d, 1H), 3,50 (m, 1H), 3,33 (m, 1H), 3,00 (s, 3H).
ПРИМЕР СИНТЕЗА 4
Получение (3S,4S)-4-[3-[(5-фтор-2-пиридинил)окси]фенил]-1-метил-2-оксо-N-(2,3,4-трифторфенил)-3-пирролидинкарбоксамида (соединения 87)
Стадия A. Получение 3-[(5-фтор-2-пиридинил)окси]бензальдегида
Раствор 3-гидроксибензальдегида (20 г, 164 ммоль) в N,N-диметилформамиде (150 мл) обрабатывали трет-бутоксидом калия (23,0 г, 205 ммоль) в течение периода 1 часа. Полученную в результате смесь перемешивали при 25°C в течение 1 часа, а затем обрабатывали 2,5-дифторпиридином (18,64 г, 162 ммоль). Полученную в результате реакционную смесь перемешивали при 120°C в течение 18 часов. Реакционную смесь затем охлаждали и разделяли между этилацетатом и солевым раствором. Органическую фазу промывали солевым раствором, высушивали над MgSO4 и концентрировали при пониженном давлении на диатомитовом вспомогательном фильтрующем материале Celite®. Очистка с помощью твердофазной хроматографии с элюированием с градиентом этилацетата в смеси гексанов (0-35%) обеспечивала 10,0 г указанного в заголовке соединения в виде белого твердого вещества.
1H ЯМР (DMSO-d6) δ 10,00 (s, 1H), 8,18 (d, 1H), 7,88 (m, 1H), 7,78 (m, 1H), 7,66 (t,1H), 7,62 (m, 1H), 7,50 (m, 1H), 7,23 (m, 1H).
Стадия B. Получение 5-фтор-2-[3-[(1E)-2-нитроэтенил]фенокси]пиридина
Раствор 3-[(5-фтор-2-пиридинил)окси]бензальдегида (т. e. продукта, полученного на стадии A, 10 г, 46,0 ммоль) в 1-хлорбутане (250 мл) обрабатывали нитрометаном (3,36 г, 55,2 ммоль), а затем пиперидином (391 мг, 4,6 ммоль) и уксусной кислотой (276 мг, 4,6 ммоль). Полученную в результате реакционную массу перемешивали при нагревании с обратным холодильником c азеотропным удалением воды в течение 18 часов. Неочищенную реакционную смесь затем концентрировали при пониженном давлении и очищали с помощью хроматографии (0-25% этилацетат в смеси гексанов в качестве элюента) с получением 8,7 г желтого масла.
1H ЯМР δ 8,02 (d, 1H), 7,98 (d, 1H), 7,55 (d, 1H), 7,49 (m, 2H), 7,38 (d, 1H), 7,31 (m, 1H), 7,26 (m, 1H), 6,98 (m, 1H).
Стадия C. Получение 1,3-диметил-2-[(1S)-1-[3-[(5-фтор-2-пиридинил)окси]фенил]-2-нитроэтил]пропандиоата
Перемешанную смесь 5-фтор-2-[3-[(1E)-2-нитроэтенил]фенокси]пиридина (т. e. продукта, полученного на стадии B, 8,67 г, 33,3 ммоль) и диметилмалоната (5,5 г, 41,7 ммоль) в толуоле (150 мл) обрабатывали бис[(R,R)-N,N'-дибензилциклогексан-1,2-диамин]бромидом Ni(II) (полученным, как описано в J. Am. Chem. Soc. 2005, 127, 9958-9959; 0,400 г, 0,499 ммоль). Реакционную массу перемешивали при 80°C в течение 18 часов. Полученную в результате смесь охлаждали до 25°C, фильтровали и концентрировали при пониженном давлении с получением 13,0 г масла янтарного цвета, которое использовали без дополнительной очистки на следующей стадии.
1H ЯМР δ 8,05 (d, 1H), 7,45 (m, 1H), 7,35 (t, 1H), 7,06 (m, 2H), 6,99 (m, 1H), 6,87 (m, 1H), 4,90 (m, 2H), 4,25 (m, 1H), 3,85 (d, 1H), 3,75 (s, 3H), 3,62 (s, 3H).
Стадия D. Получение метил-(3R,4S)-4-[3-[(5-фтор-2-пиридинил)окси]фенил]-2-оксо-3-пирролидинкарбоксилата
Перемешанную смесь 1,3-диметил 2-[(1S)-1-[3-[(5-фтор-2-пиридинил)окси]фенил]-2-нитроэтил]пропандиоата (13,0 г, 33,1 ммоль), гексагидрата хлорида никеля(II) (7,88 г, 33,1 ммоль) и метанола (300 мл) охлаждали на ледяной бане и обрабатывали борогидридом натрия (т. e. продуктом, полученным на стадии C, 3,76 г, 99,3 ммоль) путем добавления в течение 60 минут 0,5 г порций. Полученную в результате смесь перемешивали при 25°C в течение 18 часов. Затем добавляли насыщенную этилендиаминтетрауксусную кислоту, раствор динатриевой соли (800 мл) и этилацетат (500 мл) и смесь перемешивали в течение 18 часов, а затем фильтровали через подушку из диатомитового вспомогательного фильтрующего материала Celite® для удаления нерастворимых частиц. Слои фильтрата разделяли и водный слой экстрагировали этилацетатом (2 × 500 мл). Объединенные органические экстракты промывали насыщенным раствором хлорида аммония (800 мл) и солевым раствором (1000 мл). Органический экстракт высушивали над MgSO4 и концентрировали при пониженном давлении с получением вязкого серого масла (8,99 г), которое использовали без дополнительной очистки.
1H ЯМР δ 8,02 (d, 1H), 7,45 (m, 1H), 7,37 (t, 1H), 7,09 (m, 1H), 7,02 (m, 2H), 6,94 (m, 2H), 4,13 (m, 1H), 3,82 (m, 1H), 3,78 (s, 3H), 3,58 (d, 1H), 3,42 (m, 1H).
Стадия E. Получение (3R,4S)-4-[3-[(5-фтор-2-пиридинил)окси]фенил]-2-оксо-3-пирролидинкарбоновой кислоты
Смесь метил-(3R,4S)-4-[3-[(5-фтор-2-пиридинил)окси]фенил]-2-оксо-3-пирролидинкарбоксилата (т. e. продукта, полученного на стадии D, 8,49 г, 25,7 ммоль) и водного раствора гидроксида натрия (50 вес. %, 6,16 г, 77,2 ммоль) в метаноле (125 мл) перемешивали при 25°C в течение 18 часов. Затем реакционную смесь разбавляли водой (250 мл) и экстрагировали диэтиловым эфиром (2 × 150 мл). Эфирный экстракт удаляли и водную фазу подкисляли концентрированной хлористоводородной кислотой до pH 2. Подкисленную водную фазу экстрагировали этилацетатом (2 × 300 мл). Объединенные органические экстракты промывали солевым раствором, высушивали (MgSO4) и концентрировали при пониженном давлении с получением 5,5 г бежевого стеклообразного вещества, которое использовали на следующей стадии без дополнительной очистки.
1H ЯМР (DMSO-d6) δ 12,7 (s, 1H), 8,16 (d, 1H), 8,07 (s, 1H), 7,83 (m, 1H), 7,37 (m, 1H), 7,17 (m, 1H), 7,12 (m, 2H), 7,01 (m, 1H), 3,88 (m, 1H), 3,62 (m, 1H), 3,51 (d, 1H), 3,21 (t, 1H).
Стадия F. Получение (3R,4S)-4-[3-[(5-фтор-2-пиридинил)окси]фенил]-1-метил-2-оксо-3-пирролидинкарбоновой кислоты
К раствору трет-бутоксида калия (4,75 г, 42,4 ммоль) в 42,4 мл тетрагидрофурана при 0°C добавляли раствор (3R,4S)-4-[3-[(5-фтор-2-пиридинил)окси]фенил]-2-оксо-3-пирролидинкарбоновой кислоты (т. e. продукта, полученного на стадии E, 5,5 г, 17,4 ммоль) в тетрагидрофуране (50 мл). Полученную в результате реакционную массу перемешивали в течение 15 минут при 0°C. Каплями добавляли йодметан (6,24 г, 44 ммоль) в 40 мл тетрагидрофурана в течение 20 минут. Обеспечивали нагревание полученной в результате смеси до 25°C и перемешивали в течение ночи. Реакционную массу концентрировали при пониженном давлении и разделяли между этиловым эфиром и водой. Органическую фазу удаляли, а водную подкисляли до pH 1 концентрированной хлористоводородной кислотой. Подкисленный водный слой экстрагировали этилацетатом. Органический экстракт высушивали (MgSO4) и концентрировали при пониженном давлении с получением 4,0 г желтого стеклообразного вещества, которое использовали без дополнительной очистки.
1H ЯМР δ 9,29 (s, 1H), 8,03 (d, 1H), 7,46 (m, 1H), 7,37 (m, 1H), 7,13 (m, 1H), 7,06 (m, 1H), 7,02 (m, 1H), 6,92 (m, 1H), 3,96 (m, 1H), 3,79 (m, 1H), 3,57 (d, 1H), 3,50 (m, 1H), 2,97 (d, 3H).
Стадия G. Получение (3S,4S)-4-[3-[(5-фтор-2-пиридинил)окси]фенил]-1-метил-2-оксо-N-(2,3,4-трифторфенил)-3-пирролидинкарбоксамида
К раствору (3R,4S)-4-[3-[(5-фтор-2-пиридинил)окси]фенил]-1-метил-2-оксо-3-пирролидинкарбоновой кислоты (т. e. продукта, полученного на стадии F, 500 мг, 1,51 ммоль) в 5,0 мл тетрагидрофурана при 25°C добавляли триэтиламин (632 мкл, 4,54 ммоль). Реакционную смесь перемешивали в течение 5 минут, а затем обрабатывали 2,3,4-трифторанилином (208 мкл, 1,97 ммоль). После перемешивания в течение еще 5 минут смесь обрабатывали пропилфосфоновым ангидридом (50% в этилацетате, 1,63 г, 2,57 ммоль). Полученную в результате смесь перемешивали в течение ночи при 25°C. Неочищенную смесь концентрировали при пониженном давлении и очищали с помощью хроматографии на силикагеле с элюированием 0-15% этилацетатом дихлорметане с получением 278 мг указанного в заголовке соединения, соединения по настоящему изобретению, в виде вязкого желтого масла.
1H ЯМР δ 9,86 (s, 1H), 8,02 (d, 1H), 7,93 (m, 1H), 7,45 (m, 1H), 7,39 (t, 1H), 7,19 (m, 1H), 7,12 (m, 1H), 7,03 (m, 1H), 6,93 (m, 1H), 6,90 (m, 1H), 4,11 (m, 1H), 3,80 (m, 1H), 3,62 (d, 1H), 3,50 (m, 1H), 2,99 (d, 3H).
С помощью процедур, описанных в данном документе, совместно со способами, известными из уровня техники, можно получить следующие соединения из таблиц 1-6120. Далее приведены сокращения, применяемые в следующих таблицах: t означает третичный, s означает вторичный, n означает нормальный, i означает изо, c означает цикло, Me означает метил, Et означает этил, Pr означает пропил, Bu означает бутил, i-Pr означает изопропил, c-Pr циклопропил, t-Bu означает третичный бутил, c-Bu означает циклобутил, Ph означает фенил, OMe означает метокси, OEt означает этокси, SMe означает метилтио, NHMe означает метиламино, CN означает циано, NO2 означает нитро, TMS означает триметилсилил, SOMe означает метилсульфинил, C2F5 означает CF2CF3 и SO2Me означает метилсульфонил.
Таблица 1

J2 представляет собой -CH2-; A представляет собой -CH2-; Q2 представляет собой Ph(2-F); и J1 представляет собой



Таблица 2 составлена таким же образом, за исключением того, что заголовок строки "J2 представляет собой -CH2-; A представляет собой -CH2-; Q2 представляет собой Ph(2-F); и J1 представляет собой" заменен на заголовок строки, приведенный в таблице 2 ниже (т. e. "J2 представляет собой -CH2-; A представляет собой -CH2-; Q2 представляет собой Ph(2,3-ди-F); и J1 представляет собой"). Таким образом, первая запись в таблице 2 представляет собой соединение формулы 1, где J2 представляет собой -CH2-; A представляет собой -CH2-; Q2 представляет собой Ph(2,3-ди-F); и J1 представляет собой Ph(3-Cl) (т. e. 3-хлорфенил). Таблицы 3-360 составлены подобным образом.
|
Таблица 361
Таблица 361 составлена таким же образом, что и таблица 1 выше, за исключением того, что структура заменена следующей:

Таблицы 362-720
Настоящее раскрытие также включает таблицы 362-720, причем каждая таблица составлена таким же образом, как и таблицы 2-360 выше, за исключением того, что структура заменена структурой в таблице 361 выше.
Таблица 1081
Таблица 1081 составлена таким же образом, что и таблица 1 выше, за исключением того, что структура заменена следующей:

Таблицы 1082-1440
Настоящее раскрытие также включает таблицы 1082-1440, причем каждая таблица составлена таким же образом, как и таблицы 2-360 выше, за исключением того, что структура заменена структурой в таблице 1081 выше.
Таблица 1441
Таблица 1441 составлена таким же образом, что и таблица 1 выше, за исключением того, что структура заменена следующей:

Таблицы 1442-1800
Настоящее раскрытие также включает таблицы 1442-1800, причем каждая таблица составлена таким же образом, как и таблицы 2-360 выше, за исключением того, что структура заменена структурой в таблице 1441 выше.
Таблица 1801
Таблица 1801 составлена таким же образом, что и таблица 1 выше, за исключением того, что структура заменена следующей:

Таблицы 1802-2160
Настоящее раскрытие также включает таблицы 1802-2160, причем каждая таблица составлена таким же образом, как и таблицы 2-360 выше, за исключением того, что структура заменена структурой в таблице 1801 выше.
Таблица 2161
Таблица 2161 составлена таким же образом, что и таблица 1 выше, за исключением того, что структура заменена следующей:

Таблицы 2162-2520
Настоящее раскрытие также включает таблицы 2162-2520, причем каждая таблица составлена таким же образом, как и таблицы 2-360 выше, за исключением того, что структура заменена структурой в таблице 2161 выше.
Таблица 2521
Таблица 2521 составлена таким же образом, что и таблица 1 выше, за исключением того, что структура заменена следующей:

Таблицы 2522-2880
Настоящее раскрытие также включает таблицы 2522-2880, причем каждая таблица составлена таким же образом, как и таблицы 2-360 выше, за исключением того, что структура заменена структурой в таблице 2521 выше.
Таблица 2881
Таблица 2881 составлена таким же образом, что и таблица 1 выше, за исключением того, что структура заменена следующей:

Таблицы 2882-3240
Настоящее раскрытие также включает таблицы 2882-3240, причем каждая таблица составлена таким же образом, как и таблицы 2-360 выше, за исключением того, что структура заменена структурой в таблице 7561 выше.
Таблица 3241
Таблица 3241 составлена таким же образом, что и таблица 1 выше, за исключением того, что структура заменена следующей:

Таблицы 3242-3600
Настоящее раскрытие также включает таблицы 3242-3600, причем каждая таблица составлена таким же образом, как и таблицы 2-360 выше, за исключением того, что структура заменена структурой в таблице 3241 выше.
Таблица 3601
Таблица 3601 составлена таким же образом, что и таблица 1 выше, за исключением того, что структура заменена следующей:

Таблицы 3602-3960
Настоящее раскрытие также включает таблицы 3602-3960, причем каждая таблица составлена таким же образом, как и таблицы 2-360 выше, за исключением того, что структура заменена структурой в таблице 3601 выше.
Таблица 3961
Таблица 3961 составлена таким же образом, что и таблица 1 выше, за исключением того, что структура заменена следующей:

Таблицы 3962-4320
Настоящее раскрытие также включает таблицы 3962-4320, причем каждая таблица составлена таким же образом, как и таблицы 2-360 выше, за исключением того, что структура заменена структурой в таблице 3961 выше.
Таблица 4321
Таблица 4321 составлена таким же образом, что и таблица 1 выше, за исключением того, что структура заменена следующей:

Таблицы 4322-4680
Настоящее раскрытие также включает таблицы 4322-4680, причем каждая таблица составлена таким же образом, как и таблицы 2-360 выше, за исключением того, что структура заменена структурой в таблице 4321 выше.
Таблица 4681
Таблица 4681 составлена таким же образом, что и таблица 1 выше, за исключением того, что структура заменена следующей:

Таблицы 4682-5040
Настоящее раскрытие также включает таблицы 4682-5040, причем каждая таблица составлена таким же образом, как и таблицы 2-360 выше, за исключением того, что структура заменена структурой в таблице 4681 выше.
Таблица 5041
Таблица 5041 составлена таким же образом, что и таблица 1 выше, за исключением того, что структура заменена следующей:

Таблицы 5042-5400
Настоящее раскрытие также включает таблицы 5042-5400, причем каждая таблица составлена таким же образом, как и таблицы 2-360 выше, за исключением того, что структура заменена структурой в таблице 5041 выше.
Таблица 5401
Таблица 5401 составлена таким же образом, что и таблица 1 выше, за исключением того, что структура заменена следующей:

Таблицы 5402-5760
Настоящее раскрытие также включает таблицы 5402-5760, причем каждая таблица составлена таким же образом, как и таблицы 2-360 выше, за исключением того, что структура заменена структурой в таблице 5401 выше.
Таблица 5761
Таблица 5761 составлена таким же образом, что и таблица 1 выше, за исключением того, что структура заменена следующей:

Таблицы 5762-6120
Настоящее раскрытие также включает таблицы 5762-6120, причем каждая таблица составлена таким же образом, как и таблицы 2-360 выше, за исключением того, что структура заменена структурой в таблице 5761 выше.
Состав/Полезность
Соединение по настоящему изобретению обычно будут использовать в качестве гербицидного активного ингредиента в композиции, т. е. в составе, по меньшей мере с одним дополнительным компонентом, выбранным из группы, состоящей из поверхностно-активных веществ, твердых разбавителей и жидких разбавителей, которые служат в качестве носителя. Ингредиенты состава или композиции выбирают таким образом, чтобы они соответствовали физическим свойствам активного ингредиента, способу применения и факторам окружающей среды, таким как тип почвы, влажность и температура.
Пригодные составы включают как жидкие, так и твердые композиции. Жидкие композиции включают растворы (в том числе эмульгируемые концентраты), суспензии, эмульсии (в том числе микроэмульсии, эмульсии типа масло в воде, текучие концентраты и/или суспоэмульсии) и т. п., которые необязательно можно загущать в гели. Основными типами водных жидких композиций являются растворимый концентрат, суспензионный концентрат, капсульная суспензия, концентрированная эмульсия, микроэмульсия, эмульсия типа масло в воде, текучий концентрат и суспоэмульсия. Общими типами неводных жидких композиций являются эмульгируемый концентрат, микроэмульгируемый концентрат, диспергируемый концентрат и масляная дисперсия.
Основными типами твердых композиций являются пылевидные препараты, порошки, гранулы, пеллеты, дробинки, пастилки, таблетки, заполненные пленки (включая покрытия для семян) и т. п., которые могут быть диспергируемыми в воде ("смачиваемыми") или водорастворимыми. Пленки и покрытия, образованные из пленкообразующих растворов или текучих суспензий, особенно пригодны для обработки семян. Активный ингредиент может быть (микро)инкапсулирован с дальнейшим образованием суспензии или твердого состава; в качестве альтернативы, весь состав активного ингредиента может быть инкапсулирован (или подвергнут "нанесению покрытия"). Посредством инкапсулирования можно регулировать или задерживать высвобождение активного ингредиента. Эмульгируемая гранула сочетает преимущества как состава эмульгируемого концентрата, так и сухого гранулированного состава. Концентрированные композиции в основном применяют в качестве промежуточных продуктов для дальнейшего составления.
Распыляемые составы, как правило, разбавляют в подходящей среде перед распылением. Такие жидкие и твердые составы составляют с возможностью немедленного разбавления в среде распыления, обычно в воде, но иногда в другой подходящей среде, такой как ароматический или парафиновый углеводород или растительное масло. Объемы для распыления могут находиться в диапазоне от приблизительно одного до нескольких тысяч литров на гектар, но, более типично, находятся в диапазоне от приблизительно десяти до нескольких сотен литров на гектар. Из распыляемых составов может быть приготовлена баковая смесь с водой или другой подходящей средой для обработки листвы посредством авиационного нанесения или внесения в почву, или внесения в субстрат для выращивания растений. Жидкие и сухие составы можно отмерять непосредственно в системы капельного орошения или отмерять в борозду во время посадки.
Составы, как правило, будут содержать эффективные количества активного ингредиента, разбавителя и поверхностно-активного вещества в следующих приблизительных диапазонах, которые составляют в сумме 100 процентов по весу.
|
Твердые разбавители включают, например, глины, такие как бентонит, монтмориллонит, аттапульгит и каолин, гипс, целлюлозу, диоксид титана, оксид цинка, крахмал, декстрин, сахара (например, лактозу, сахарозу), диоксид кремния, тальк, слюду, диатомовую землю, мочевину, карбонат кальция, карбонат и бикарбонат натрия и сульфат натрия. Типичные твердые разбавители описаны в Watkins et al., Handbook of Insecticide Dust Diluents and Carriers, 2nd Ed., Dorland Books, Caldwell, New Jersey.
Жидкие разбавители включают, например, воду, N,N-диметилалканамиды (например, N,N-диметилформамид), лимонен, диметилсульфоксид, N-алкилпирролидоны (например, N-метилпирролидинон), алкилфосфаты (например, триэтилфосфат), этиленгликоль, триэтиленгликоль, пропиленгликоль, дипропиленгликоль, полипропиленгликоль, пропиленкарбонат, бутиленкарбонат, парафины (например, светлые минеральные масла, нормальные парафины, изопарафины), алкилбензолы, алкилнафталины, глицерин, триацетат глицерина, сорбит, ароматические углеводороды, деароматизированные алифатические углеводороды, алкилбензолы, алкилнафталины, кетоны, такие как циклогексанон, 2-гептанон, изофорон и 4-гидрокси-4-метил-2-пентанон, ацетаты, такие как изоамилацетат, гексилацетат, гептилацетат, октилацетат, нонилацетат, тридецилацетат и изоборнилацетат, другие сложные эфиры, такие как алкилированные сложные эфиры молочной кислоты, сложные эфиры двухосновных кислот, алкил- и арилбензоаты и γ-бутиролактон, и спирты, которые могут быть линейными, разветвленными, насыщенными или ненасыщенными, такими как метанол, этанол, н-пропанол, изопропиловый спирт, н-бутанол, изобутиловый спирт, н-гексанол, 2-этилгексанол, н-октанол, деканол, изодециловый спирт, изооктадеканол, цетиловый спирт, лауриловый спирт, тридециловый спирт, олеиловый спирт, циклогексанол, тетрагидрофурфуриловый спирт, диацетоновый спирт, крезол и бензиловый спирт. Жидкие разбавители также включают сложные эфиры глицерина и насыщенных и ненасыщенных жирных кислот (как правило, C6-C22), такие как масла семян растений и плодов (например, масла маслины, клещевины, семян льна, кунжута, кукурузы (маиса), арахиса, подсолнечника, виноградных косточек, сафлора, семян хлопчатника, соевых бобов, семян рапса, кокосового ореха и ядер кокосового ореха), жиры животного происхождения (например, говяжье сало, свиное сало, топленое свиное сало, жир печени трески, рыбий жир) и их смеси. Жидкие разбавители также включают алкилированные жирные кислоты (например, метилированные, этилированные, бутилированные), где жирные кислоты можно получить путем гидролиза сложных эфиров глицерина из источников растительного и животного происхождения и можно очищать путем перегонки. Типичные жидкие разбавители описаны в Marsden, Solvents Guide, 2nd Ed., Interscience, New York, 1950.
Твердые и жидкие композиции по настоящему изобретению часто включают одно или несколько поверхностно-активных веществ. При добавлении к жидкости поверхностно-активные вещества (также известные как "поверхностно-активные средства"), как правило, модифицируют, чаще всего уменьшают, поверхностное натяжение жидкости. В зависимости от природы гидрофильной и липофильной групп в молекуле поверхностно-активного вещества поверхностно-активные вещества можно применять в качестве смачивающих средств, диспергирующих средств, эмульгаторов или пеногасителей.
Поверхностно-активные вещества могут быть классифицированы как неионогенные, анионные или катионные. Неионогенные поверхностно-активные вещества, пригодные для композиций по настоящему изобретению, включают без ограничения алкоксилаты спиртов, такие как алкоксилаты спиртов на основе природных и синтетических спиртов (которые могут быть разветвленными или линейными) и полученные из спиртов и этиленоксида, пропиленоксида, бутиленоксида или их смесей; этоксилаты аминов, алканоламиды и этоксилированные алканоламиды; алкоксилированные триглицериды, такие как этоксилированные соевое, касторовое и рапсовое масла; алкоксилаты алкилфенолов, такие как этоксилаты октилфенола, этоксилаты нонилфенола, этоксилаты динонилфенола и этоксилаты додецилфенола (полученные из фенолов и этиленоксида, пропиленоксида, бутиленоксида или их смесей); блок-сополимеры, полученные из этиленоксида или пропиленоксида, и блок-сополимеры обратного типа, в которых концевые блоки получены из пропиленоксида; этоксилированные жирные кислоты; этоксилированные сложные эфиры жирных кислот и масел; этоксилированные метиловые сложные эфиры; этоксилированные тристирилфенолы (в том числе полученные из этиленоксида, пропиленоксида, бутиленоксида или их смесей); сложные эфиры жирных кислот, сложные эфиры глицерина, производные на основе ланолина, полиэтоксилированные сложные эфиры, такие как полиэтоксилированные сложные эфиры сорбитана и жирных кислот, полиэтоксилированные сложные эфиры сорбита и жирных кислот и полиэтоксилированные сложные эфиры глицерина и жирных кислот; другие производные сорбитана, такие как сложные эфиры сорбитана; полимерные поверхностно-активные вещества, такие как статистические сополимеры, блок-сополимеры, алкидные ПЭГ (полиэтиленгликолевые) смолы, привитые или гребнеобразные полимеры и звездообразные полимеры; полиэтиленгликоли (ПЭГ); сложные эфиры полиэтиленгликоля и жирных кислот; поверхностно-активные вещества на основе кремнийорганических соединений и производные сахаров, такие как сложные эфиры сахарозы, алкилполигликозиды и алкилполисахариды.
Пригодные анионные поверхностно-активные вещества включают без ограничений алкиларилсульфоновые кислоты и их соли; карбоксилированные этоксилаты спиртов или алкилфенолов; дифенилсульфонатные производные; лигнин и производные лигнина, такие как лигносульфонаты; малеиновая или янтарная кислоты или их ангидриды; олефинсульфонаты; сложные эфиры фосфорной кислоты, такие как сложные эфиры фосфорной кислоты и алкоксилатов спиртов, сложные эфиры фосфорной кислоты и алкоксилатов алкилфенола и сложные эфиры фосфорной кислоты и этоксилатов стирилфенола; поверхностно-активные вещества на основе белка; производные саркозина; сульфат простого эфира стирилфенола; сульфаты и сульфонаты масел и жирных кислот; сульфаты и сульфонаты этоксилированных алкилфенолов; сульфаты спиртов; сульфаты этоксилированных спиртов; сульфонаты аминов и амиды, такие как N,N-алкилтаураты; сульфонаты бензола, кумола, толуола, ксилола и додецил- и тридецилбензолов; сульфонаты конденсированных нафталинов; сульфонаты нафталина и алкилнафталина; сульфонаты нефти, фракционированной путем перегонки; сульфосукцинаматы и сульфосукцинаты и их производные, такие как диалкилсульфосукцинатные соли.
Пригодные катионные поверхностно-активные вещества включают без ограничения амиды и этоксилированные амиды; амины, такие как N-алкилпропандиамины, трипропилентриамины и дипропилентетраамины, и этоксилированные амины, этоксилированные диамины и пропоксилированные амины (полученные из аминов и этиленоксида, пропиленоксида, бутиленоксида или их смесей); соли аминов, такие как аминоацетаты и соли диаминов; четвертичные соли аммония, такие как простые четвертичные соли, этоксилированные четвертичные соли и дичетвертичные соли; и аминоксиды, такие как алкилдиметиламиноксиды и бис-(2-гидроксиэтил)алкиламиноксиды.
Также пригодными для композиций по настоящему изобретению являются смеси неионогенных и анионных поверхностно-активных веществ или смеси неионогенных и катионных поверхностно-активных веществ. Неионогенные, анионные и катионные поверхностно-активные вещества и их рекомендуемые пути применения раскрыты во множестве опубликованных литературных источников, в том числе в McCutcheon's Emulsifiers and Detergents, ежегодных американских и международных изданиях, публикуемых McCutcheon's Division, The Manufacturing Confectioner Publishing Co.; Sisely and Wood, Encyclоpedia of Surface Active Agents, Chemical Publ. Co., Inc., New York, 1964; и A. S. Davidson and B. Milwidsky, Synthetic Detergents, Seventh Edition, John Wiley and Sons, New York, 1987.
Композиции по настоящему изобретению также могут содержать вспомогательные вещества и добавки для составления, известные специалистам в данной области техники в качестве вспомогательных средств для составления (некоторые из которых могут рассматриваться также как выполняющие функцию твердых разбавителей, жидких разбавителей или поверхностно-активных веществ). Такие вспомогательные вещества и добавки для составления могут регулировать pH (буферы), пенообразование в ходе изготовления (противовспениватели, такие как полиорганосилоксаны), осаждение активных ингредиентов (суспендирующие средства), вязкость (тиксотропные загустители), развитие микроорганизмов в таре (противомикробные средства), замораживание продуктов (антифризы), цвет (дисперсии красителей/пигментов), смывание (пленкообразователи или клейкие вещества), испарение (замедлители испарения) и другие свойства состава. Пленкообразователи включают, например, поливинилацетаты, сополимеры поливинилацетата, сополимер поливинилпирролидона и винилацетата, поливиниловые спирты, сополимеры поливиниловых спиртов и воски. Примеры вспомогательных веществ и добавок для составления включают перечисленные в McCutcheon's Volume 2: Functional Materials, ежегодных международных и североамериканских изданиях, опубликованных McCutcheon's Division, The Manufacturing Confectioner Publishing Co.; и PCT публикации WO 03/024222.
Соединение формулы 1 и любые другие активные ингредиенты, как правило, включают в композиции по настоящему изобретению посредством растворения активного ингредиента в растворителе или посредством измельчения в жидком или сухом разбавителе. Растворы, в том числе эмульгируемые концентраты, можно получить посредством простого смешивания ингредиентов. Если растворитель жидкой композиции, предназначенной для применения в качестве эмульгируемого концентрата, не смешивается с водой, обычно добавляют эмульгатор для эмульгирования растворителя, содержащего активное вещество, при разбавлении водой. Мокрый помол взвесей активного ингредиента с диаметрами частиц не более 2000 мкм можно проводить с применением мельниц для размола в среде с получением частиц со средними значениями диаметра менее 3 мкм. Водные взвеси можно превращать в готовые суспензионные концентраты (см., например, патент США № 3060084) или дополнительно обрабатывать посредством сушки распылением для образования диспергирующихся в воде гранул. Для сухих составов, как правило, требуются способы сухого помола, с помощью которых получают частицы со средними значениями диаметра в диапазоне от 2 до 10 мкм. Пылевидные препараты и порошки можно получать путем смешивания и, как правило, измельчения (например, молотковой мельницей или струйной мельницей). Гранулы и пеллеты можно получать путем распыления активного материала на предварительно полученные гранулированные носители или с помощью методик гранулирования. См., Browning, "Agglomeration", Chemical Engineering, December 4, 1967, pp 147-48, Perry's Chemical Engineer's Handbook, 4th Ed., McGraw-Hill, New York, 1963, страницы 8-57 и далее, и WO 91/13546. Пеллеты можно получать, как описано в патенте США № 4172714. Диспергируемые в воде и водорастворимые гранулы можно получить, как указано в патентах США № 4144050, № 3920442 и в патенте Германии № 3246493. Таблетки можно получать, как указано в патентах США № 5180587, № 5232701 и № 5208030. Пленки можно получать, как указано в патенте Великобритании № 2095558 и в патенте США № 3299566.
Дополнительную информацию касательно технологии составления см. в T.S. Woods, "The Formulator's Toolbox - Product Forms for Modern Agriculture" in Pesticide Chemistry and Bioscience, The Food-Environment Challenge, T. Brooks and T. R. Roberts, Eds., Proceedings of the 9th International Congress on Pesticide Chemistry, The Royal Society of Chemistry, Cambridge, 1999, pp. 120-133. См. также патент США № 3235361, от столбца 6, строки 16, до столбца 7, строки 19, и примеры 10-41; патент США № 3309192, от столбца 5, строки 43, до столбца 7, строки 62, и примеры 8, 12, 15, 39, 41, 52, 53, 58, 132, 138-140, 162-164, 166, 167 и 169-182; патент США № 2891855, от столбца 3, строка 66, до столбца 5, строка 17, и примеры 1-4; Klingman, Weed Control as a Science, John Wiley and Sons, Inc., New York, 1961, pp 81-96; Hance et al., Weed Control Handbook, 8th Ed., Blackwell Scientific Publications, Oxford, 1989; и Developments in formulation technology, PJB Publications, Richmond, UK, 2000.
В следующих примерах все значения процентного содержания приведены по весу и все составы получают традиционными способами. Номера соединений ссылаются на соединения в таблице индексов A. Без дополнительного уточнения полагают, что специалист в данной области техники, используя предыдущее описание, может применять настоящее изобретение в его наиболее полном объеме. Таким образом, следующие примеры следует рассматривать только как иллюстративные и не ограничивающие каким-либо образом настоящее раскрытие. Значения процентного содержания приведены по весу, за исключением случаев, где указано иное.
Пример A
|
Пример B
|
Пример C
|
Пример D
|
Пример E
|
Пример F
|
Пример G
|
Пример H
|
Пример I
|
Настоящее раскрытие также включает примеры A-I выше, за исключением того, что "Cоединение 20" замещено "Cоединением 1", "Соединение 2", "Соединение 3", "Соединение 4", "Соединение 5", "Соединение 6", "Соединение 7", "Соединение 8", "Соединение 9", "Соединение 10", "Соединение 11", "Соединение 12", "Соединение 13", "Соединение 14", "Соединение 15", "Соединение 16", "Соединение 17", "Соединение 18", "Соединение 19", "Соединение 21", "Соединение 22", "Соединение 23", "Соединение 24", "Соединение 25", "Соединение 26", "Соединение 27", "Соединение 28", "Соединение 29", "Соединение 30", "Соединение 31", "Соединение 32", "Соединение 33", "Соединение 34", "Соединение 35", Соединение 36, Соединение 37, Соединение 38, Соединение 39, Соединение 40, Соединение 41, Соединение 42, Соединение 43, Соединение 44, Соединение 45, Соединение 45, Соединение 46, Соединение 47, Соединение 48, Соединение 49, Соединение 50, Соединение 51, Соединение 52, Соединение 53, Соединение 54, Соединение 55, Соединение 56, Соединение 57, Соединение 58, Соединение 59, Соединение 60, Соединение 61, Соединение 62, Соединение 63, Соединение 64, Соединение 65, Соединение 66, Соединение 67, Соединение 68, Соединение 69, Соединение 70, Соединение 71, Соединение 72, Соединение 73, Соединение 74, Соединение 75, Соединение 76, Соединение 77, Соединение 78, Соединение 79, Соединение 80, Соединение 81, Соединение 82, Соединение 83, Соединение 84, Соединение 85, Соединение 86, Соединение 87, Соединение 88, Соединение 89 Соединение 90, Соединение 91, Соединение 92, Соединение 93 или Соединение 94.
Результаты тестов указывают на то, что соединения по настоящему изобретению являются высокоактивными предвсходовыми и/или послевсходовыми гербицидами и/или регуляторами роста растений. Соединения по настоящему изобретению обычно проявляют наиболее высокую активность в отношении послевсходового контроля сорняков (т. е. их вносят после появления проростков сорняков из почвы) и предвсходового контроля сорняков (т. е. их вносят до появления проростков сорняков из почвы). Многие из них применимы для пред- и/или послевсходового контроля широкого спектра сорняков на участках, где желательным является полный контроль всей растительности, как например, вокруг резервуаров для хранения топлива, промышленных складских площадок, мест стоянки автомобилей, кинотеатров для автомобилистов, аэродромов, берегов рек, ирригационных и других водных путей, около рекламных щитов и сооружений автомагистралей и железных дорог. Многие из соединений по настоящему изобретению, в силу избирательного метаболизма у сельскохозяйственных культур по сравнению с сорняками или избирательной активности в месте физиологического подавления у сельскохозяйственных культур и сорняков, или избирательного размещения в окружающей среде или в ее пределах смеси сельскохозяйственных культур и сорняков, являются полезными для избирательного контроля травянистых и широколиственных сорняков в смеси сельскохозяйственных культур/сорняков. Специалисту в данной области техники будет понятно, что предпочтительную комбинацию этих факторов избирательности с соединением или группой соединений можно легко определить путем осуществления стандартных биологических и/или биохимических анализов. Переносимость соединений по настоящему изобретению могут проявлять важные с агрономической точки зрения сельскохозяйственные культуры, в том числе без ограничения люцерна, ячмень, хлопчатник, пшеница, рапс, разновидности сахарной свеклы, кукуруза (маис), сорго, разновидности сои, рис, разновидности овса, разновидности арахиса, овощи, томат, картофель, многолетние плантационные культуры, в том числе кофе, какао, масличная пальма, каучуконосы, сахарный тростник, цитрусовые, разновидности винограда, фруктовые деревья, орехоплодные деревья, банан, банан райский, ананас, разновидности хмеля, чай и лесные культуры, такие как эвкалипт и хвойные (например, сосна ладанная), и виды дернообразующих трав (например, мятлик луговой, августинова трава, овсяница тростниковая и бермудская трава). Соединения по настоящему изобретению можно использовать для сельскохозяйственных культур, которые подверглись генетической трансформации или селекции для приобретения устойчивости к гербицидам, для экспрессии белков, токсичных для беспозвоночных вредителей (как например, токсин Bacillus thuringiensis), и/или экспрессии других полезных признаков. Специалистам в данной области техники будет понятно, что не все соединения в равной степени эффективны против всех сорняков. В качестве альтернативы, заявленные соединения являются полезными для модификации роста растений.
Соединения по настоящему изобретению могут демонстрировать удивительную селективную активность в отношении контроля видов сорняков, произрастающих в рисе, в том числе без ограничения частуха обыкновенная (Alisma plantago-aquatica L.), сыть разнородная (Cyperus difformis L.), сыть ирия (Cyperus iria L.), ежовник пирамидальный (Echinochloa colonum (L.) LINK), ежовник обыкновенный (Echinochloa crus-galli (L.) P.BEAUV.), ежовник рисовидный (на стадии, характеризующейся наличием 2 листков; Echinochloa oryzoides (ARD.) FRITSCH), рисовое просо (на стадии характеризующейся наличием 2 листков; Echinochloa phyllopogon (STAPF) KOSS./VASC.), болотница сладкая (Eleocharis dulcis (BURM.f.) TRIN. ex HENSCHEL), гетерантера илистая (Heteranthera limosa (SW.) WILLD./VAHL), тонкоколосник пучковатый (Leptochloa fascicularis (LAM.) GRAY), монохория (Monochoria vaginalis (BURM.f.) C.PRESL ex KUNTH), стрелолист широколистный (Sagittaria latifolia WILLD.), стрелолист монтевидеоский (Sagittaria montevidensis СHAM. & SCHLECHT.), стрелолист жесткий (Sagittaria rigida PURSH), камыш ситниковидный (Scirpus juncoides ROXB.) и камыш остроконечный (Scirpus mucronatus L.).
Соединения по настоящему изобретению также демонстрируют особенную активность (биологическую активность) в отношении контроля видов сорняков, произрастающих в зерновых культурах, в том числе без ограничения лисохвост мышехвостниковидный (Alopecurus myosuroides HUDS.), метлица обыкновенная (Apera spica-venti (L.) BEAUV.), овсюг (Avena fatua L.), плевел многоцветковый (Lolium multiflorum LAM.), канареечник малый (Phalaris minor RETZ.), щетинник зеленый (Setaria viridis (L.) P.BEAUV.).
Поскольку соединения по настоящему изобретению характеризуются (как предвсходовой, так и послевсходовой) гербицидной активностью, для контроля нежелательной растительности путем уничтожения или повреждения растительности, или уменьшения ее роста, соединения можно подходящим образом наносить с помощью ряда способов, включающих приведение в контакт гербицидно эффективного количества соединения по настоящему изобретению или композиции, содержащей указанное соединение и по меньшей мере одно из поверхностно-активного вещества, твердого разбавителя или жидкого разбавителя, с листвой или другой частью нежелательной растительности, или вносить в среду, окружающую нежелательную растительность, такую как почва или вода, в которой растет нежелательная растительность или которая окружает семена нежелательного растения или другую его часть для вегетативного размножения.
Гербицидно эффективное количество соединений по настоящему изобретению определяется рядом факторов. Эти факторы включают: выбранный состав, способ внесения, количество и тип присутствующей растительности, условия роста и т. д. В целом, гербицидно эффективное количество соединений по настоящему изобретению составляет приблизительно 0,001-20 кг/га с предпочтительным диапазоном приблизительно 0,004-1 кг/га. Специалист в данной области техники может легко определить гербицидно эффективное количество, необходимое для желаемого уровня контроля сорняков.
В одном обычном варианте осуществления соединение по настоящему изобретению вносят, как правило в форме составленной композиции, в место произрастания, содержащее желательную растительность (например, сельскохозяйственные культуры) и нежелательную растительность (т. е сорняки), каждый из которых может представлять собой семена, проростки и/или более большие растения, в контакте со средой для произрастания (например, почвой). В данном месте произрастания композицию, содержащую соединение по настоящему изобретению, непосредственно применяют по отношению к растению или его части, особенно по отношению к нежелательной растительности, и/или к среде для произрастания, которая находится в контакте с растением.
Виды и сорта растений желательной растительности в месте произрастания, обработанном с помощью соединения по настоящему изобретению, можно получать традиционными способами размножения и селекции или способами генной инженерии. Генетически модифицированные растения (трансгенные растения) являются такими растениями, у которых гетерологичный ген (трансген) был стабильно интегрирован в геном растения. Трансген, который характеризуется его конкретным положением в геноме растения, называют трансформантом или трансгенным объектом.
Генетически модифицированные сорта растений в месте произрастания, которые можно обрабатывать в соответствии с настоящим изобретением, включают сорта растений, устойчивые к одному или нескольким видам биотического стресса (вредители, такие как нематоды, насекомые, клещи, грибы и т. д.) или абиотического стресса (засуха, низкая температура, засоленность почв и т. д.), или характеризующиеся другими необходимыми характеристиками. Растения можно генетически модифицировать для проявления признаков, например, переносимости гербицида, устойчивости к насекомым, модифицированных профилей масел или засухоустойчивости. Пригодные генетически модифицированные растения, содержащие трансформанты отдельного гена или комбинации трансформантов, приведены в приложении С. Дополнительную информацию по генетическим модификациям, приведенным в приложении С, можно получить из общедоступных баз данных, поддерживаемых, например, Министерством сельского хозяйства США.
Следующие сокращения, T1-T37, применяют в приложении С для признаков. "-" означает, что запись не доступна; "переносим." означает "переносимость", и "уст." означает устойчивый.
|
Приложение C
|
* Аргентинский (Brassica napus), ** польский (B. rapa), # баклажан
Хотя, как правило, соединения по настоящему изобретению применяют для контроля нежелательной растительности, приведение в контакт желательной растительности в обработанном месте произрастания с соединениями по настоящему изобретению может привести в результате к сверхаддитивным или синергическим эффектам с генетическими признаками желательной растительности, в том числе с признаками, введенными с помощью генетической модификации. Например, устойчивость к растительноядным вредителям-насекомым или болезням растений, устойчивость к биотическим/абиотическим стрессам или стабильность при хранении может быть больше ожидаемых как результат генетических признаков в желательной растительности.
Соединения по настоящему изобретению также можно смешивать с одним или несколькими другими биологически активными соединениями или средствами, включая гербициды, антидоты гербицидов, фунгициды, инсектициды, нематоциды, бактерициды, акарициды, регуляторы роста, такие как ингибиторы линьки насекомых и стимуляторы укоренения, хемостерилизаторы, химические сигнальные вещества, репелленты, аттрактанты, феромоны, стимуляторы питания, питательные вещества растений, другие биологически активные соединения или энтомопатогенные бактерии, вирусы или грибы, с образованием многокомпонентного пестицида, обеспечивающего еще более широкий спектр защиты сельскохозяйственных культур и продукции. Смеси соединений по настоящему изобретению с другими гербицидами могут расширить спектр активности против дополнительных видов сорняков и подавлять пролиферацию любых устойчивых биотипов. Таким образом, настоящее изобретение также относится к композиции, содержащей соединение формулы 1 (в гербицидно эффективном количестве) и по меньшей мере одно дополнительное биологически активное соединение или средство (в биологически эффективном количестве) и может дополнительно содержать по меньшей мере одно из поверхностно-активного вещества, твердого разбавителя или жидкого разбавителя. Другие биологически активные соединения или средства можно составлять в композиции, содержащие по меньшей мере одно из поверхностно-активного вещества, твердого или жидкого разбавителя. Для смесей по настоящему изобретению одно или несколько других биологически активных соединений или средств можно составлять вместе с соединением формулы 1 с образованием премикса, или одно или несколько других биологически активных соединений или средств можно составлять отдельно от соединения формулы 1, и составы можно объединять вместе перед внесением (например, в резервуаре распылителя) или, в качестве альтернативы, вносить последовательно.
Для контроля сорняков может быть особенно пригодной смесь одного или нескольких из следующих гербицидов с соединением по настоящему изобретению: ацетохлора, ацифлуорфена и его натриевой соли, аклонифена, акролеина (2-пропеналя), алахлора, аллоксидима, аметрина, амикарбазона, амидосульфурона, аминоциклопирахлора и его сложных эфиров (например, метилового, этилового) и солей (например, натриевой, калиевой), аминопиралида, амитрола, сульфамата аммония, анилофоса, асулама, атразина, азимсульфурона, бефлубутамида, беназолина, беназолин-этила, бенкарбазона, бенфлуралина, бенфуресата, бенсульфурон-метила, бенсулида, бентазона, бензoбициклона, бензoфенапа, бициклопирона, бифенокса, биланафоса, биспирибака и его натриевой соли, бромацила, бромобутида, бромофеноксима, бромоксинила, бромоксинилоктаноата, бутахлора, бутафенацила, бутамифоса, бутралина, бутроксидима, бутилата, кафенстрола, карбетамида, карфентразон-этила, катехина, хлометоксифена, хлорамбена, хлорбромурона, хлорфлуренол-метила, хлоридазона, хлоримурон-этила, хлоротолурона, хлорпрофама, хлорсульфурона, хлортал-диметила, хлортиамида, цинидон-этила, цинметилина, циносульфурона, клацифоса, клефоксидима, клетодима, клодинафоп-пропаргила, кломазона, кломепропа, клопиралида, клопиралид-оламина, клорансулам-метила, кумилурона, цианазина, циклоата, циклопиримората, циклосульфамурона, циклоксидима, цигалофоп-бутила, 2,4-D и его бутотилового, бутилового, изооктилового и изопропилового сложных эфиров и его диметиламмониевой, диоламинной и троламинной солей, даимурона, далапона, далапон-натрия, дазомета, 2,4-DB и его диметиламмониевой, калиевой и натриевой солей, десмедифама, десметрина, дикамбы и ее дигликольаммониевой, диметиламмониевой, калиевой и натриевой солей, дихлобенила, дихлорпропа, диклофоп-метила, диклосулама, дифензокват-метилсульфата, дифлуфеникана, дифлуфензопира, димефурона, димепиперата, диметахлора, диметаметрина, диметенамида, диметенамида-P, диметипина, диметиларсиновой кислоты и ее натриевой соли, динитрамина, динотерба, дифенамида, дикват-дибромида, дитиопира, диурона, DNOC, эндотала, EPTC, эспрокарба, эталфлуралина, этаметсульфурон-метила, этиозина, этофумезата, этоксифена, этоксисульфурона, этобензанида, феноксапроп-этила, феноксапроп-P-этила, феноксасульфона, фенквинотриона, фентразамида, фенурона, фенурона-TCA, флампроп-метила, флампроп-M-изопропила, флампроп-M-метила, флазасульфурона, флорасулама, флуазифоп-бутила, флуазифоп-P-бутила, флуазолата, флукарбазона, флуцетосульфурона, флухлоралина, флуфенацета, флуфенпира, флуфенпир-этила, флуметсулама, флумиклорак-пентила, флумиоксазина, флуометурона, флуорогликофен-этила, флупоксама, флупирсульфурон-метила и его натриевой соли, флуренола, флуренол-бутила, флуридона, флурохлоридона, флуроксипира, флуртамона, флутиацет-метила, фомесафена, форамсульфурона, фосамин-аммония, глюфосината, глюфосината аммония, глюфосината-P, глифосата и его солей, таких как аммониевая, изопропиламмониевая, калиевая, натриевая (в том числе натриевая сесквисоль) и тримезиевая (альтернативно называемая сульфосатом), галауксифена, галауксифен-метила, галосульфурон-метила, галоксифоп-этотила, галоксифоп-метила, гексазинона, гидантоцидина. имазаметабенз-метила, имазамокса, имазапика, имазапира, имазаквина, имазаквин-аммония, имазетапира, имазетапир-аммония, имазосульфурона, инданофана, индазифлама, иофенсульфурона, йодосульфурон-метила, иоксинила, иоксинил-октаноата, иоксинил-натрия, ипфенкарбазона, изопротурона, изоурона, изоксабена, изоксафлутола, изоксахлортола, лактофена, ленацила, линурона, гидразида малеиновой кислоты, MCPA и ее солей (например, MCPA-диметиламмония, MCPA-калия и MCPA-натрия), сложных эфиров (например, MCPA-2-этилгексила, MCPA-бутотила) и сложных тиоэфиров (например, MCPA-тиоэтила), MCPB и ее солей (например, MCPB-натрия) и сложных эфиров (например, MCPB-этила), мекопропа, мекопропа-P, мефенацета, мефлуидида, мезосульфурон-метила, мезотриона, метам-натрия, метамифопа, метамитрона, метазахлора, метазосульфурона, метабензтиазурона, метиларсоновой кислоты и ее кальциевой, моноаммониевой, мононатриевой и динатриевой солей, метилдимрона, метобензурона, метобромурона, метолахлора, S-метолахлора, метосулама, метоксурона, метрибузина, метсульфурон-метила, молината, монолинурона, напроанилида, напропамида, напропамида-M, напталама, небурона, никосульфурона, норфлуразона, орбенкарба, ортосульфамурона, оризалина, оксадиаргила, оксадиазона, оксасульфурона, оксазикломефона, оксифлуорфена, паракват-дихлорида, пебулата, пеларгоновой кислоты, пендиметалина, пеноксулама, пентанохлора, пентоксазона, перфлуидона, петоксамида, петоксиамида, фенмедифама, пиклорама, пиклорам-калия, пиколинафена, пиноксадена, пиперофоса, претилахлора, примисульфурон-метила, продиамина, профоксидима, прометона, прометрина, пропахлора, пропанила, пропаквизафопа, пропазина, профама, пропизохлора, пропоксикарбазона, пропирисульфурона, пропизамида, просульфокарба, просульфурона, пираклонила, пирафлуфен-этила, пирасульфотола, пиразогила, пиразолината, пиразоксифена, пиразосульфурон-этила, пирибензoксима, пирибутикарба, пиридата, пирифталида, пириминобак-метила, пиримисульфана, пиритиобака, пиритиобак-натрия, пироксасульфона, пироксулама, квинклорака, квинмерака, квинокламина, квизалофоп-этила, квизалофоп-P-этила, квизалофоп-P-тефурила, римсульфурона, сафлуфенацила, сетоксидима, сидурона, симазина, симетрина, сулькотриона, сульфентразона, сульфометурон-метила, сульфосульфурона, 2,3,6-TBA, TCA, TCA-натрия, тебутама, тебутиурона, тефурилтриона, темботриона, тепралоксидима, тербацила, тербуметона, тербутилазина, тербутрина, тенилхлора, тиазопира, тиенкарбазона, тифенсульфурон-метила, тиобенкарба, тиафенацила, тиокарбазила, толпиралата, топрамезона, тралкоксидима, триаллата, триафамона, триасульфурона, триазифлама, трибенурон-метила, триклопира, триклопир-бутотила, триклопир-триэтиламмония, тридифана, триэтазина, трифлоксисульфурона, трифлудимоксазина, трифлуралина, трифлусульфурон-метила, тритосульфурона, вернолата, 3-(2-хлор-3,6-дифторфенил)-4-гидрокси-1-метил-1,5-нафтиридин-2(1H)-она, 5-хлор-3-[(2-гидрокси-6-оксо-1-циклогексен-1-ил)карбонил]-1-(4-метоксифенил)-2(1H)-хиноксалинона, 2-хлор-N-(1-метил-1H-тетразол-5-ил)-6-(трифторметил)-3-пиридинкарбоксамида, 7-(3,5-дихлор-4-пиридинил)-5-(2,2-дифторэтил)-8-гидроксипиридо[2,3-b]пиразин-6(5H)-она, 4-(2,6-диэтил-4-метилфенил)-5-гидрокси-2,6-диметил-3(2H)-пиридазинона, 5-[[(2,6-дифторфенил)метокси]метил]-4,5-дигидро-5-метил-3-(3-метил-2-тиенил)изоксазола (ранее метиоксолин), 4-(4-фторфенил)-6-[(2-гидрокси-6-оксо-1-циклогексен-1-ил)карбонил]-2-метил-1,2,4-триазин-3,5(2H,4H)-диона, метил-4-амино-3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-5-фтор-2-пиридинкарбоксилата, 2-метил-3-(метилсульфонил)-N-(1-метил-1H-тетразол-5-ил)-4-(трифторметил)бензамида и 2-метил-N-(4-метил-1,2,5-оксадиазол-3-ил)-3-(метилсульфинил)-4-(трифторметил)бензамида. Другие гербициды также включают биогербициды, такие как Alternaria destruens Simmons, Colletotrichum gloeosporiodes (Penz.) Penz. & Sacc., Drechsiera monoceras (MTB-951), Myrothecium verrucaria (Albertini & Schweinitz) Ditmar: Fries, Phytophthora palmivora (Butl.) Butl. и Puccinia thlaspeos Schub.
Соединения по настоящему изобретению также можно применять в комбинации с регуляторами роста растений, такими как авиглицин, N-(фенилметил)-1H-пурин-6-амин, эпохолеон, гибберелловая кислота, гиббереллин A4 и A7, белок харпин, мепикват-хлорид, прогексадион кальция, прогидрожасмон, нитрофенолят натрия и тринексапак-метил, и организмами, модифицирующими рост растений, такими как Bacillus cereus штамм BP01.
Основные справочные материалы по применяемым в сельском хозяйстве защитным средствам (т. е. гербицидам, антидотам гербицидов, инсектицидам, фунгицидам, нематоцидам, акарицидам и биологическим средствам) включают The Pesticide Manual, 13th Edition, C. D. S. Tomlin, Ed., British Crop Protection Council, Farnham, Surrey, U.K., 2003, и The BioPesticide Manual, 2nd Edition, L. G. Copping, Ed., British Crop Protection Council, Farnham, Surrey, U.K., 2001.
Для вариантов осуществления, где применяют один или несколько данных разных объектов смешивания, объекты для смешивания применяют, как правило, в количествах аналогичных обычным количествам, когда объекты смешивания применяют по отдельности. Более конкретно, в смесях активные ингредиенты часто применяют при норме внесения, составляющей от половины до полной нормы внесения, указанной на этикетке продукта для применения активного ингредиента отдельно. Данные количества приведены в справочных материалах, таких как The Pesticide Manual и The BioPesticide Manual. Весовое соотношение данных различных объектов смешивания (в сумме) к соединению формулы 1, как правило, составляет от приблизительно 1:3000 до приблизительно 3000:1. Следует отметить весовые соотношения от приблизительно 1:300 до приблизительно 300:1 (например, соотношения от приблизительно 1:30 до приблизительно 30:1). Специалист в данной области техники путем простого проведения опытов может легко определить биологически эффективные количества активных ингредиентов, необходимые для требуемого спектра биологической активности. Будет очевидно, что включение этих дополнительных компонентов может расширить спектр подлежащих контролю сорняков за рамки спектра контроля только с помощью соединения формулы 1.
В определенных случаях комбинации соединения по настоящему изобретению с другими биологически активными (в частности, гербицидными) соединениями или средствами (т. е. активными ингредиентами) могут приводить в результате к эффекту, большему, чем аддитивный (т. е. синергическому) в отношении сорняков и/или к эффекту, меньшему, чем аддитивный (т. е. эффекту антидота) в отношении сельскохозяйственных культур или других желаемых растений. Снижение количества активных ингредиентов, высвобождаемых в окружающую среду при обеспечении эффективного контроля вредителей, всегда является желательным. Возможность применения больших количеств активных ингредиентов для обеспечения более эффективного контроля сорняков без чрезмерного повреждения сельскохозяйственного растения также является желательной. В случае синергизма гербицидных активных ингредиентов в отношении сорняков при нормах внесения, обеспечивающих агрономически удовлетворительные уровни контроля сорняков, такие комбинации могут быть предпочтительными для уменьшения затрат на производство в растениеводстве и снижения нагрузки на окружающую среду. Если имеет место воздействие гербицидных активных ингредиентов по типу антидота на сельскохозяйственные культуры, такие комбинации могут быть предпочтительными для повышения защиты сельскохозяйственных культур путем снижения конкуренции с сорняками.
Следует отметить комбинацию соединения по настоящему изобретению по меньшей мере с одним другим гербицидным активным ингредиентом. Следует отдельно отметить такую комбинацию, в которой другой гербицидный активный ингредиент имеет место приложения действия, отличное от соединения по настоящему изобретению. В определенных случаях комбинация, в которой по меньшей мере один другой гербицидный активный ингредиент действует в сходном спектре контроля, но отличается местом приложения действия, будет особенно предпочтительной для контроля устойчивости. Таким образом, композиция по настоящему изобретению может дополнительно содержать (в гербицидно эффективном количестве) по меньшей мере один дополнительный гербицидный активный ингредиент со сходным спектром контроля, но отличающимся местом приложения действия.
Соединения по настоящему изобретению также можно применять в комбинации с антидотами гербицидов, такими как аллидохлор, беноксакор, клоквинтосет-мексил, кумилурон, циометринил, ципросульфонамид, даимурон, дихлормид, дициклонон, диэтолат, димепиперат, фенхлоразол-этил, фенклорим, флуразол, флуксофеним, фурилазол, изоксадифен-этил, мефенпир-диэтил, мефенат, метоксифенон, нафталиновый ангидрид (1,8-нафталевый ангидрид), оксабетринил, N-(аминокарбонил)-2-метилбензолсульфонамид, N-(аминокарбонил)-2-фторбензолсульфонамид, 1-бром-4-[(хлорметил)сульфонил]бензол (BCS), 4-(дихлорацетил)-1-окса-4-азоспиро[4.5]декан (MON 4660), 2-(дихлорметил)-2-метил-1,3-диоксолан (MG 191), этил-1,6-дигидро-1-(2-метоксифенил)-6-оксо-2-фенил-5-пиримидинкарбоксилат, 2-гидрокси-N,N-диметил-6-(трифторметил)пиридин-3-карбоксамид и 3-оксо-1-циклогексен-1-ил-1-(3,4-диметилфенил)-1,6-дигидро-6-оксо-2-фенил-5-пиримидинкарбоксилат, 2,2-дихлор-1-(2,2,5-триметил-3-оксазолидинил)этанон и 2-метокси-N-[[4-[[(метиламино)карбонил]амино]фенил]сульфонил]-бензамид для повышения безопасности определенных сельскохозяйственных культур. Эффективные в качестве антидота количества антидотов гербицидов можно вносить одновременно с соединениями по настоящему изобретению или использовать для обработок семян. Таким образом, аспект настоящего изобретения относится к гербицидной смеси, содержащей соединение по настоящему изобретению и эффективное в качестве антидота количество антидота гербицида. Обработка семян является особенно полезной для избирательного контроля сорняков, поскольку это физически ограничивает антидотное действие по отношению к культурным растениям. Таким образом, особенно пригодным вариантом осуществления настоящего изобретения является способ избирательного контроля роста нежелательной растительности в сельскохозяйственной культуре, предусматривающий приведение в контакт места произрастания сельскохозяйственной культуры с гербицидно эффективным количеством соединения по настоящему изобретению, где семя, из которого выращивают сельскохозяйственную культуру, обрабатывают эффективным в качестве антидота количеством антидота. Специалист в данной области техники путем простого проведения экспериментов может легко определить эффективные в качестве антидота количества антидотов.
Соединения по настоящему изобретению можно также смешивать с: (1) полинуклеотидами, включая без ограничения ДНК, РНК, и/или химически модифицированные нуклеотиды, которые влияют на количество определенной мишени путем подавления, интерференции, супрессии или сайленсинга генетически выведенного транскрипта, что оказывает гербицидное действие; или (2) полинуклеотидами, включая без ограничения ДНК, РНК, и/или химически модифицированные нуклеотиды, которые влияют на количество определенной мишени путем подавления, интерференции, супрессии или сайленсинга генетически выведенного транскрипта, что оказывает антидотное действие.
Следует отметить композицию, содержащую соединение по настоящему изобретению (в гербицидно эффективном количестве), по меньшей мере один дополнительный активный ингредиент, выбранный из группы, состоящей из других гербицидов и антидотов гербицидов (в эффективном количестве), и по меньшей мере один компонент, выбранный из группы, состоящей из поверхностно-активных веществ, твердых разбавителей и жидких разбавителей.
Предпочтительными для лучшего контроля нежелательной растительности (например, меньшая рабочая концентрация, как, например, в результате синергизма, более широкий спектр контролируемых сорняков или повышенная безопасность для сельскохозяйственной культуры) или для предотвращения развития устойчивых сорняков являются смеси соединения по настоящему изобретению с другим гербицидом. В таблице A1 перечислены конкретные комбинации компонента (a) (т. е. конкретного соединения по настоящему изобретению) с другим гербицидом в качестве компонента (b), иллюстрирующие смеси, композиции и способы по настоящему изобретению. Соединение 20 в столбце компонента (a) определено в таблице индексов A. Во втором столбце таблицы A1 перечислен компонент (b), представляющий собой конкретное соединение, (например, "2,4-D" в первой строке). В третьем, четвертом и пятом столбцах в таблице A1 перечислены диапазоны весовых соотношений для норм, в которых компонент (a), представляющий собой соединение, как правило, наносят на растущие в полевых условиях сельскохозяйственные культуры, по сравнению с компонентом (b) (т. е. (a):(b)). Таким образом, например, в первой строке в таблице A1, в частности, раскрыта комбинация компонента (a) (т. е. соединения 17 в таблице индексов A) с 2,4-D, которую, как правило, вносят в весовом соотношении 1:192-6:1. Остальные строки в таблице A1 также следует толковать подобным образом.
ТАБЛИЦА A1
|
Таблица A2 составлена таким же образом, как и таблица A1 выше, за исключением того, что записи под заголовком столбца "компонент (a)" (т. e. "20") заменены на соответствующую запись в столбце для компонента (a), показанную ниже. В столбце для компонента (a) № соединения определен в таблице индексов A. Таким образом, например, в таблице A2 во всех записях под заголовком столбца "компонент (a)" упоминается "соединение 1" (т. е. соединение 1, определенное в таблице индексов A), и в первой строке под заголовками столбцов в таблице A2, в частности, раскрывается смесь соединения 1 с 2,4-D. Таблицы A3-А94 составлены подобным образом.
|
Предпочтительными для лучшего контроля нежелательной растительности (например, меньшая рабочая концентрация, как, например, в результате синергизма, более широкий спектр контролируемых сорняков или повышенная безопасность для сельскохозяйственной культуры) или для предотвращения развития устойчивых сорняков являются смеси соединения по настоящему изобретению с гербицидом, выбранным из группы, состоящей из хлоримурон-этила, никосульфурона, мезотриона, тифенсульфурон-метила, флупирсульфурон-метила, трибенурона, пироксасульфона, пиноксадена, темботриона, пироксулама, метолахлора и S-метолахлора.
Следующие тесты демонстрируют эффективность контроля, характерную для соединений по настоящему изобретению в отношении конкретных сорняков. Контроль сорняков, обеспечиваемый соединениями, тем не менее, не ограничивается этими видами. См. таблицы индексов A для описаний соединений. Далее приведены сокращения, применяемые в следующих таблицах индексов: t означает третичный, s означает вторичный, n означает нормальный, i означает изо, c означает цикло, Me означает метил, Et означает этил, Pr означает пропил, i-Pr означает изопропил, Bu означает бутил, c-Pr означает циклопропил, t-Bu означает трет-бутил, Ph означает фенил, OMe означает метокси, OEt означает этокси, SMe означает метилтио, SEt означает этилтио, -CN означает циано, -NO2 означает нитро, TMS означает триметилсилил,
(-CH2O)2CH означает  , 3-CH3-3-оксетанил означает
, 3-CH3-3-оксетанил означает  ,
,
а нафтил означает нафталинил. (R) или (S) обозначает абсолютную хиральность асимметричного углеродного центра. Сокращение "(d)" указывает на то, что соединение, по-видимому, разлагается при плавлении. Сокращение "№ соед." обозначает "№ соединения". Сокращение "Прим." обозначает "пример", и после него следует число, указывающее, в каком примере получено соединение. Масс-спектры представлены с предполагаемой точностью в пределах±0,5 Да в виде молекулярной массы исходного иона (M+1) с самой высокой распространенностью изотопа, образованного добавлением H+ (молекулярная масса 1) к молекуле, отслеживаемой с применением химической ионизации при атмосферном давлении (AP+).
ТАБЛИЦА ИНДЕКСОВ A

|
* см. пример синтеза 1 для данных 1H ЯМР.
** см. пример синтеза 2 для данных 1H ЯМР.
*** свободная связь, направленная вправо, указывает на точку соединения A с Q1 (т. e. с фенилом), и свободная связь, направленная влево, указывает на точку соединения A с J1.
a указывает на то, что соединение получают энантиообогащенным по положениях 3 и 4.
ТАБЛИЦА ИНДЕКСОВ B

|
ТАБЛИЦА ИНДЕКСОВ C

|
ТАБЛИЦА ИНДЕКСОВ D

|
a указывает на то, что соединение получают энантиообогащенным по положениях 3 и 4.
БИОЛОГИЧЕСКИЕ ПРИМЕРЫ ИЗОБРЕТЕНИЯ
ТЕСТ А
Семена видов растений, выбранных из ежовника обыкновенного (Echinochloa crus-galli), кохии (Kochia scoparia), амброзии (амброзии полыннолистной, Ambrosia elatior), многоцветкового плевела (Lolium multiflorum), гигантского щетинника (Setaria faberii) и амаранта (Amaranthus retroflexus), высаживали в смесь суглинистой почвы и песка и обрабатывали до появления всходов направленным распылением на почву с использованием тестируемых химических продуктов, составленных в смешанном нефитотоксичном растворителе, который содержал поверхностно-активное вещество.
Вместе с тем, растения, выбранные из этих видов сорняков, а также лисохвоста мышехвостниковидного (Alopecurus myosuroides), подмаренника (подмаренника цепкого, Galium aparine), пшеницы (Triticum aestivum) и кукурузы (Zea mays) высаживали в горшки, содержащие ту же смесь суглинистой почвы и песка, и обрабатывали путем послевсходового внесения тестируемых химических продуктов, составленных таким же образом. В случае послевсходовой обработки растения располагали в порядке по высоте от 2 до 10 см и они находились на стадии развития, характеризующейся наличием одного-двух листьев. Обработанные растения и необработанные контроли поддерживали в теплице в течение примерно 10 дней, после чего все обработанные растения сравнивали с необработанными контролями и визуально оценивали в отношении повреждения. Оценки реакции растений, кратко изложенные в таблице A, основаны на шкале от 0 до 100, где 0 означает отсутствие эффекта, а 100 означает полный контроль. Тире (-) означает отсутствие результатов теста.
Таблица A Соединения
500 г а.и./га 1 2 3 4 5 6 7 8 9 10 11 12 13 14
После появления всходов
Ежовник обыкновенный 0 0 60 80 20 70 70 70 60 60 90 90 60 60
Лисохвост мышехвостниковидный 0 0 30 40 0 20 40 20 0 0 40 60 20 0
Кукуруза 0 0 20 0 0 20 20 20 20 0 20 60 0 0
Щетинник гигантский 0 10 70 80 50 70 70 70 50 30 90 90 70 70
Подмаренник 0 0 40 0 0 0 40 0 0 0 30 50 40 0
Кохия 0 0 40 0 0 0 0 0 0 0 0 20 20 0
Амарант 0 0 0 30 0 0 0 0 0 0 20 20 0 0
Амброзия 30 0 0 40 0 0 20 10 0 0 40 30 0 0
Плевел многоцветковый 0 10 30 40 20 0 20 0 0 0 20 50 30 0
Пшеница 0 0 20 0 0 20 40 0 0 0 20 50 0 0
Таблица A Соединения
500 г а.и./га 15 16 17 18 19 20 21 22 23 24 25 26 27 28
После появления всходов
Ежовник обыкновенный 0 50 40 20 50 70 20 60 30 0 60 70 70 20
Лисохвост мышехвостниковидный 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Кукуруза 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Щетинник гигантский 20 20 40 0 40 60 30 60 20 0 60 60 50 20
Подмаренник 0 0 30 0 0 0 0 0 0 0 0 0 0 0
Кохия 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Амарант 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Амброзия 30 0 0 0 0 0 0 0 0 0 0 0 0 0
Плевел многоцветковый 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Пшеница 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Таблица A Соединения
500 г а.и./га 29 30 31 32 33 34 35 36 37 38 39 40 41 42
После появления всходов
Ежовник обыкновенный 20 60 0 10 50 60 60 90 100 100 100 40 50 60
Лисохвост мышехвостниковидный 0 0 0 0 0 20 0 50 70 70 40 30 30 0
Кукуруза 0 0 0 0 0 0 0 90 90 100 70 0 40 0
Щетинник гигантский 20 50 0 20 50 80 70 80 90 90 80 60 70 70
Подмаренник 0 0 20 40 20 50 0 70 70 70 30 40 60 30
Кохия 0 0 0 0 40 0 0 50 50 60 0 0 60 0
Амарант 0 0 0 0 0 0 0 50 70 70 20 0 80 0
Амброзия 0 0 0 0 0 0 0 40 70 80 30 0 0 0
Плевел многоцветковый 0 0 0 0 0 30 30 50 60 80 20 0 20 0
Пшеница 0 0 0 0 0 0 0 60 70 70 60 20 40 0
Таблица A Соединения
500 г а.и./га 43 44 45 46 47 48 49 50 51 52 53 54 55 56
После появления всходов
Ежовник обыкновенный 90 90 90 90 90 50 90 30 30 80 90 30 80 30
Лисохвост мышехвостниковидный 50 50 30 30 20 0 40 0 0 40 20 0 0 0
Кукуруза 80 80 50 50 80 40 40 20 30 70 0 0 0 0
Щетинник гигантский 80 80 80 80 80 80 90 70 40 90 90 20 80 60
Подмаренник 80 80 60 70 70 60 70 40 50 60 30 0 30 20
Кохия 60 60 60 60 60 70 0-30-0 0 0 0
Амарант 50 80 60 70 70 90 20 30 0 60 0 0 0 0
Амброзия 0 0 0 0 0 0 40 0 20 60 0 0 0 0
Плевел многоцветковый 30 30 30 30 30 40 50 0 30 60 0 0 30 0
Пшеница 50 50 20 20 30 30 40 0 20 40 0 0 0 0
Таблица A Соединения
500 г а.и./га 57 58 59 60 61 62 63 64 65 66 67 68 69
После появления всходов
Ежовник обыкновенный 60 60 30 90 80 90 0 0 0 0 0 40 20
Лисохвост мышехвостниковидный 30 0 0 30 50 30 0 0 0 0 0 20 0
Кукуруза 30 0 0 50 90 30 0 0 0 0 0 0 0
Щетинник гигантский 70 60 20 90 90 90 0 0 0 0 0 60 30
Подмаренник 20 20 0 60 70 60 0 0 0 0 0 0 0
Кохия 20 20 0 - - - 0 0 0 0 0 0 0
Амарант 20 0 0 40 70 30 0 0 0 0 0 0 0
Амброзия 30 0 0 40 50 40 0 0 0 0 0 0 0
Плевел многоцветковый 0 0 0 50 70 30 0 0 0 0 0 0 0
Пшеница 0 0 0 70 80 30 0 0 0 0 0 0 0
Таблица A Соединения
125 г а.и./га 1 2 3 4 5 6 7 8 9 10 11 12 13 14
После появления всходов
Ежовник обыкновенный 0 0 10 40 0 0 40 0 30 10 50 70 0 10
Лисохвост мышехвостниковидный 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Кукуруза 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Щетинник гигантский 0 0 20 40 20 0 20 0 0 0 50 70 40 10
Подмаренник 0 0 20 0 0 0 20 0 0 0 0 0 0 0
Кохия 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Амарант 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Амброзия 0 0 0 0 0 0 0 0 0 0 30 30 0 0
Плевел многоцветковый 0 0 0 0 20 0 0 0 0 0 0 20 0 0
Пшеница 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Таблица A Соединения
125 г а.и./га 15 16 17 18 19 20 21 22 23 24 25 26 27 28
После появления всходов
Ежовник обыкновенный 0 0 30 0 20 40 20 40 0 0 20 30 40 0
Лисохвост мышехвостниковидный 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Кукуруза 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Щетинник гигантский 10 0 30 0 20 40 30 20 0 0 20 30 40 0
Подмаренник 0 0 50 0 0 0 0 0 0 0 0 0 0 0
Кохия 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Амарант 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Амброзия 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Плевел многоцветковый 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Пшеница 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Таблица A Соединения
125 г а.и./га 29 30 31 32 33 34 35 36 37 38 39 40 41 42
После появления всходов
Ежовник обыкновенный 0 20 0 0 0 30 30 90 90 100 70 50 50 40
Лисохвост мышехвостниковидный 0 0 0 0 0 0 0 20 40 70 0 0 0 0
Кукуруза 0 0 0 0 0 0 0 40 70 90 30 0 0 0
Щетинник гигантский 0 30 0 0 0 30 30 80 70 90 70 40 50 50
Подмаренник 0 0 0 0 0 20 0 40 50 50 0 40 40 0
Кохия 0 0 0 0 0 0 0 0 0 30 0 0 20 0
Амарант 0 0 0 0 0 0 0 30 40 50 0 0 40 0
Амброзия 0 0 0 0 0 0 0 0 20 20 0 0 0 0
Плевел многоцветковый 0 0 0 0 0 0 0 0 0 70 0 0 0 0
Пшеница 0 0 0 0 0 0 0 0 20 50 0 0 0 0
Таблица A Соединения
125 г а.и./га 43 44 45 46 47 48 49 50 51 52 53 54 55 56
После появления всходов
Ежовник обыкновенный 90 90 90 90 70 20 80 0 0 70 70 0 30 0
Лисохвост мышехвостниковидный 30 30 30 0 0 0 0 0 0 30 0 0 0 0
Кукуруза 40 40 0 40 20 0 30 0 0 50 0 0 0 0
Щетинник гигантский 80 70 80 70 60 60 70 50 10 70 80 0 70 0
Подмаренник 70 70 60 60 60 60 20 0 40 40 0 0 0 0
Кохия 40 30 40 40 0 30 0-0-0 0 0 0
Амарант 30 50 30 50 60 60 0 0 0 40 0 0 0 0
Амброзия 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Плевел многоцветковый 0 0 0 0 0 0 0 0 20 30 0 0 0 0
Пшеница 30 0 0 0 0 0 0 0 0 0 0 0 0 0
Таблица A Соединения
125 г а.и./га 57 58 59 60 61 62 63 64 65 66 67 68 69 71
После появления всходов
Ежовник обыкновенный 0 0 0 70 70 70 0 0 0 0 0 10 0 70
Лисохвост мышехвостниковидный 0 0 0 0 40 0 0 0 0 0 0 0 0 0
Кукуруза 30 0 0 30 70 30 0 0 0 0 0 0 0 20
Щетинник гигантский 40 30 0 80 90 80 0 0 0 0 0 0 0 70
Подмаренник 0 0 0 30 60 30 0 0 0 0 0 0 0 50
Кохия 0 0 0 - - - 0 0 0 0 0 0 0 20
Амарант 0 0 0 0 40 0 0 0 0 0 0 0 0 50
Амброзия 0 0 0 0 40 0 0 0 0 0 0 0 0 30
Плевел многоцветковый 0 0 0 30 70 0 0 0 0 0 0 0 0 0
Пшеница 0 0 0 0 50 0 0 0 0 0 0 0 0 0
Таблица A Соединения
125 г а.и./га 72 73 74 87 88 89 90
После появления всходов
Ежовник обыкновенный 90 70 90 80 80 70 0
Лисохвост мышехвостниковидный 60 40 20 60 0 20 0
Кукуруза 20 20 20 90 20 0 0
Щетинник гигантский 90 90 80 80 70 70 0
Подмаренник 60 60 70 60 40 40 0
Кохия 20 20 50 30 30 0 0
Амарант 30 60 60 70 20 50 0
Амброзия 30 30 20 0 0 0 0
Плевел многоцветковый 50 40 30 70 0 20 0
Пшеница 20 20 20 40 60 0 0
Таблица A Соединения
31 г а.и./га 71 72 73 74 87 88 89 90
После появления всходов
Ежовник обыкновенный 30 60 60 60 50 30 30 0
Лисохвост мышехвостниковидный 0 20 0 0 30 0 0 0
Кукуруза 0 0 20 0 60 0 0 0
Щетинник гигантский 20 80 60 70 70 30 30 0
Подмаренник 30 40 50 40 30 30 30 0
Кохия 0 0 0 20 0 0 0 0
Амарант 0 0 50 0 0 0 0 0
Амброзия 0 0 0 0 0 0 0 0
Плевел многоцветковый 0 20 0 0 40 0 0 0
Пшеница 0 0 20 0 0 0 0 0
Таблица A Соединения
500 г а.и./га 1 2 3 4 5 6 7 8 9 10 11 12 13 14
До появления всходов
Ежовник обыкновенный 0 30 70 90 50 80 90 80 70 0 90 90 80 80
Щетинник гигантский 0 20 80 90 90 90 90 90 70 0 90 90 90 90
Кохия 0 0 20 30 0 0 0 0 0 0 40 40 0 0
Амарант 0 0 0 20 30 50 60 0 0 0 30 30 0 0
Амброзия 0 0 0 0 0 20 0 0 0 0 0 0 0 0
Плевел многоцветковый 0 0 20 20 0 0 30 0 0 0 20 20 0 0
Таблица A Соединения
500 г а.и./га 15 16 17 18 19 20 21 22 23 24 25 26 27 28
До появления всходов
Ежовник обыкновенный 60 60 70 0 70 70 40 30 20 0 40 90 20 30
Щетинник гигантский 40 70 80 20 80 80 60 80 50 0 80 90 30 30
Кохия 0 0 30 0 40 30 20 0 20 0 20 0 0 0
Амарант 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Амброзия 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Плевел многоцветковый 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Таблица A Соединения
500 г а.и./га 29 30 31 32 33 34 35 36 37 38 39 40 41 42
До появления всходов
Ежовник обыкновенный 40 50 0 0 80 90 60 90 90 100 90 90 90 80
Щетинник гигантский 40 90 0 40 80 90 90 90 100 100 100 90 90 90
Кохия 0 0 0 0 0 0 0 40 70 70 50 90 60 0
Амарант 0 0 0 0 0 0 0 40 80 100 0 0 90 10
Амброзия 0 0 0 0 0 0 0 50 80 80 50 20 70 0
Плевел многоцветковый 0 0 0 0 0 0 0 90 50 100 60 0 60 0
Таблица A Соединения
500 г а.и./га 43 44 45 46 47 48 49 50 51 52 53 54 55 56
До появления всходов
Ежовник обыкновенный 80 80 80 80 80 90 90 40-90 90 20 80 70
Щетинник гигантский 90 90 90 90 90 90 90 90 90 90 90 70 90 0
Кохия 30 0 20 20 0 20 70 30 50 80 70 0 20 0
Амарант 80 80 70 70 50 70 20 20 0 70 0 0 0 0
Амброзия 80 60 30 30 60 0 40 30 0 80 0 0 0 0
Плевел многоцветковый 80 90 80 80 70 30 70 0 20 40 0 0 20 0
Таблица A Соединения
500 г а.и./га 57 58 59 60 61 62 63 64 65 66 67 68 69
До появления всходов
Ежовник обыкновенный 90 90 40 90 90 90 0 0 0 0 0 50 0
Щетинник гигантский 90 90 50 90 90 90 0 0 0 0 0 90 50
Кохия 0-0 80 80 60 0 0 0 0 0 0 0
Амарант 0 0 0 50 90 50 0 0 0 0 0 0 0
Амброзия 0 0 0 50 60 50 0 0 0 0 0 0 0
Плевел многоцветковый 0 20 0 70 90 20 0 0 0 0 0 0 0
Таблица A Соединения
125 г а.и./га 1 2 3 4 5 6 7 8 9 10 11 12 13 14
До появления всходов
Ежовник обыкновенный 0 0 40 60 0 20 60 50 10 0 60 90 0 10
Щетинник гигантский 0 0 60 70 30 70 90 80 10 0 80 90 80 30
Кохия 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Амарант 0 0 0 0 0 60 60 0 0 0 0 0 0 0
Амброзия 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Плевел многоцветковый 0 0 0 0 0 0 30 0 0 0 0 0 0 0
Таблица A Соединения
125 г а.и./га 15 16 17 18 19 20 21 22 23 24 25 26 27 28
До появления всходов
Ежовник обыкновенный 0 0 20 0 30 20 0 0 0 0 20 40 0 0
Щетинник гигантский 10 10 50 0 30 30 20 40 20 0 50 40 20 0
Кохия 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Амарант 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Амброзия 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Плевел многоцветковый 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Таблица A Соединения
125 г а.и./га 29 30 31 32 33 34 35 36 37 38 39 40 41 42
До появления всходов
Ежовник обыкновенный 0 0 0 0 60 20 20 90 90 90 70 50 20 40
Щетинник гигантский 0 20 0 0 60 70 70 90 90 100 90 90 80 80
Кохия 0 0 0 0 0 0 0 0 0 30 30 0 30 0
Амарант 0 0 0 0 0 0 0 0 60 80 0 0 70 0
Амброзия 0 0 0 0 0 0 0 0 0 40 0 0 20 0
Плевел многоцветковый 0 0 0 0 0 0 0 0 20 80 0 0 20 0
Таблица A Соединения
125 г а.и./га 43 44 45 46 47 48 49 50 51 52 53 54 55 56
До появления всходов
Ежовник обыкновенный 80 80 80 70 50 80 90 0 20 70 90 0 0 30
Щетинник гигантский 90 90 90 90 90 80 90 90 90 90 90 0 80 0
Кохия 30 0 0 0 0 0 20 0 20 70 60 0 0 0
Амарант 40 30 40 40 0 70 0 20 0 60 0 0 0 0
Амброзия 0 0 0 0 0 0 0 0 0 40 0 0 0 0
Плевел многоцветковый 30 30 30 20 0 30 40 0 0 30 0 0 0 0
Таблица A Соединения
125 г а.и./га 57 58 59 60 61 62 63 64 65 66 67 68 69 71
До появления всходов
Ежовник обыкновенный 40 30 0 90 90 90 0 0 0 0 0 20 0 70
Щетинник гигантский 60 60 0 90 90 90 0 0 0 0 0 60 0 90
Кохия - 0 0 70 60 30 0 0 0 0 0 0 0 30
Амарант 0 0 0 60 70 30 0 0 0 0 0 0 0 80
Амброзия 0 0 0 40 30 0 0 0 0 0 0 0 0 0
Плевел многоцветковый 0 0 0 20 80 0 0 0 0 0 0 0 0 0
Таблица A Соединения
125 г а.и./га 72 73 74 87 88 89 90
До появления всходов
Ежовник обыкновенный 90 90 90 90 30 70 0
Щетинник гигантский 90 90 100 90 90 90 0
Кохия 0 20 40 60 30 0 0
Амарант 0 0 80 70 20 60 0
Амброзия 0 0 0 0 0 0 0
Плевел многоцветковый 50 40 80 80 20 40 0
Таблица A Соединения
31 г а.и./га 71 72 73 74 87 88 89 90
До появления всходов
Ежовник обыкновенный 0 90 50 70 60 0 30 0
Щетинник гигантский 70 90 80 90 90 30 40 0
Кохия 0 0 0 0 0 0 0 0
Амарант 20 0 0 0 70 0 0 0
Амброзия 0 0 0 0 0 0 0 0
Плевел многоцветковый 0 0 0 30 0 0 0 0
ТЕСТ B
Виды растений в тесте с затоплением по типу рисового поля, выбранные из риса (Oryza sativa), сыти, разнородной (мелкоцветной сыти разнородной, Cyperus difformis), гетерантеры илистой (Heteranthera limosa) и ежовника обыкновенного (Echinochloa crus-galli), выращивали до стадии, характеризующейся наличием 2 листьев, для тестирования. Во время обработки тестируемые горшки затапливали до уровня на 3 см выше поверхности почвы, обрабатывали путем внесения тестируемых соединений непосредственно в затопляющую воду, а затем поддерживали при такой толщине слоя воды в течение периода теста. Обработанные растения и контроли поддерживали в теплице в течение 13-15 суток, после чего все виды сравнивали с контролями и визуально оценивали. Оценки реакции растений, кратко изложенные в таблице B, основаны на шкале от 0 до 100, где 0 представляет собой отсутствие эффекта и 100 представляет собой полный контроль. Тире (-) означает отсутствие результатов теста.
Таблица B Соединения
500 г а.и./га 22 23 24 25 34 35 42 63 64 65 66 67 68 69
Затопление
Ежовник обыкновенный 30 0 0 0 20 0 0 0 0 0 0 0 20 0
Гетерантера илистая 0 0 0 60 85 90 80 35 35 0 0 0 80 70
Рис 0 0 0 15 0 15 0 0 0 0 0 0 0 0
Сыть разнородная 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Таблица B Соединения
250 г а.и./га 1 2 4 5 6 7 8 9 10 11 12 14 15 16
Затопление
Ежовник обыкновенный 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Гетерантера илистая 65 0 0 65 0 75 35 30 60 0 20 70 50 30
Рис 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Сыть разнородная 30 0 0 0 0 0 0 30 40 0 0 20 0 30
Таблица B Соединения
250 г а.и./га 33 36 37 38 39 40 41 43 44 45 46 47 48 49
Затопление
Ежовник обыкновенный 0 60 30 60 0 20 0 50 40 40 0 0 0 0
Гетерантера илистая 50 0 100 80 75 70 100 98 90 70 30 0 80 100
Рис 0 30 20 0 0 0 20 15 0 15 0 0 0 0
Сыть разнородная 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Таблица B Соединения
250 г а.и./га 50 51 52 53 54 57 58 59 60 61 62 87 88 89
Затопление
Ежовник обыкновенный 0 0 40 30 0 0 0 0 65 40 40 60 0 0
Гетерантера илистая 70 40 100 70 0 0 0 0 100 100 100 85 50 70
Рис 0 0 0 0 0 0 0 0 0 0 20 0 0 0
Сыть разнородная 0 0 0 0 0 0 0 0 0 0 0 0 0 0
Таблица B Соединение
250 г а.и./га 90
Затопление
Ежовник обыкновенный 0
Гетерантера илистая 0
Рис 0
Сыть разнородная 0



