Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ СЛОЖНЫХ ЭФИРОВ МОЛОЧНОЙ КИСЛОТЫ ИЗ САХАРОВ
Вид РИД
Изобретение
Настоящее изобретение относится к новым способам получения сложных эфиров молочной кислоты и 2-гидрокси-3-бутеновой кислоты или α-гидроксиметиониновых аналогов, подходящих для непрерывны поточных способов.
Уровень техники
Углеводы представляют собой самую большую фракцию биомассы, и устанавливаются различные стратегии их эффективного использования в качестве сырья для получения коммерческих химикатов. Биомасса представляет особый интерес благодаря ее потенциалу к дополнению и, в конечном счете, замене нефти. Одним из таких коммерческих химикатов, получаемых из биомассы, является молочная кислота. Производное молочной кислоты, метиллактат, является подходящим строительным блоком для возобновляемых и биоразлагаемых растворителей и полимеров.
Производные молочной кислоты, в частности сложные эфиры молочной кислоты, могут быть получены из сахаров с помощью различных путей процесса реакции, включая биохимический (ферментативное брожение, энантиомерно чистый продукт) и синтетический (каталитическое превращение, рацемический продукт). Особое внимание было уделено синтетическим (каталитическим) путям, поскольку они обеспечивают коммерчески и экологически выгодную альтернативу биохимическим путям, помимо обеспечения рацемического продукта. Рацемический продукт является предпочтительным, если полимеры, которые требуют стехиометрических количеств обоих энантиомеров молочной кислоты, являются желательными в качестве исходных веществ, например, полимолочная кислота (PLA).
Из уровня техники установлено, что рацемические смеси сложных эфиров молочной кислоты и 2-гидрокси-3-бутеновой кислоты могут быть получены из сахаров в присутствии катализатора на основе кислоты Льюиса.
Сложные эфиры молочной кислоты и 2-гидрокси-3-бутеновой кислоты или α-гидроксиметиониновых аналогов могут быть получены периодическим или непрерывным поточным способом из сахаров в присутствии катализатора на основе кислоты Льюиса. Как в Science (2010) 328, рр 602-605, так и в ЕР 2184270 В1 раскрываются периодические реакции для способа, в котором растворителем является метанол только или метанол и 2.5 мас. % воды. В обоих ссылочных источниках также раскрывается периодическая реакция, в которой растворителем является вода, в результате обеспечивающая молочную кислоту (30%) из сахарозы.
Чтобы получить промышленно осуществимый способ получения сложных эфиров, описанных выше, существенным является, чтобы катализатор на основе кислоты Льюиса оставался стабильным, т.е. активным, в ходе увеличенной длительности процесса. Общеизвестная проблема состоит в том, что катализаторы на основе кислоты Льюиса деактивируются со временем в ходе реакции и должны быть регенерированы путем кальцинирования. Деактивация катализатора на основе кислоты Льюиса требует остановки процесса, и катализатор должен быть выделен и кальцинирован в течение по меньшей мере 12-18 часов. В Science (2010) 328, рр 602-605 и ЕР 2184270 В1 раскрывается, что для всех периодических реакций катализатор регенерируется путем кальцинирования через 20 часов.
В Science (2010) 328, рр 602-605 также раскрывается непрерывный поточный способ превращения сахара (фруктозы) в метиллактат в присутствии катализатора на основе кислоты Льюиса (Sn-BEA) и органического растворителя (метанол). Фиг. 7 иллюстрирующего материала показывает, что процентный выход метиллактата из фруктозы со временем в потоке (TOS) уменьшается на по меньшей мере 50%, от около 23% через 3 часа до около 11% через 80 часов. Эта фигура показывает, что Sn-BEA дезактивируется постепенно как функция от времени в потоке. Подобно периодическим реакциям, катализатор регенерируется путем кальцинирования. Отмечено, что Sn-BEA и Sn-Beta (как применяется в настоящей заявке) являются идентичными.
Кроме того, в Science (2010) 328, рр 602-605 проиллюстрировано, что присутствие воды в процессе реакции является недостатком с точки зрения стабильности катализатора. Когда растворителем в способе является только вода, осаждение углерода на катализаторе значительно увеличивается, что в значительной степени способствует дезактивации катализатора. Например, когда растворителем в способе является вода, на катализатор осаждается 7 мас. % углерода на грамм катализатора по сравнению с 1,3 мас. % когда в способе используют только метанол в качестве растворителя.
Еще один пример недостатка добавления воды в процесс, в котором используется катализатор на основе кислоты Льюиса, описан в Journal of Catalysis (2003) 220, pp. 326-333. В этом ссылочном источнике описывается альдольная конденсация альдегидов типа Мукаяма с силиленольным простым эфиром над катализатором на основе силиката титана и кислоты Льюиса (Ti-BETA или TS-1). В этом ссылочном источнике сообщается, что добавление небольшого количества воды в порционную реакционную среду в ходе начального периода реакции уменьшает активность катализатора. Полагают, что катализаторы на основе кислоты Льюиса отравляются водой и поэтому становятся неактивными. Для альтернативных реакций в ChemSusChem (2014) 7, стр. 2255-2265 сообщается тот же эффект для катализируемых Sn-BEA периодических реакций.
Еще один пример недостатка добавления воды в процесс, в котором применяется катализатор на основе кислоты Льюиса, был сообщен в Journal of Catalysis (2014) 311, pp. 244-256. Этот ссылочный источник направлен на исследование реакционных путей каталитического дезоксигенирования пропанала (пропиональдегида). В этом ссылочном источнике упоминается, что сайты кислоты Льюиса катализатора не могут участвовать в каталитической реакции, когда присутствует вода, потому что вода регидратируется или физисорбируется на этих участках.
Задачей настоящего изобретения является обеспечение средств стабилизации катализатора на основе кислоты Льюиса для применения в непрерывном процессе реакции для получения сложных эфиров молочной кислоты и 2-гидрокси-3-бутеновой кислоты из сахара. Другой задачей настоящего изобретения является обеспечение сложных эфиров молочной кислоты и α-гидроксиметиониновых аналогов из сахара.
В дополнение к уменьшению осаждения углерода на катализатор, другой задачей настоящего изобретения является обеспечение средств стабилизации катализатора на основе кислоты Льюиса, содержащего Sn, где выщелачивание Sn из катализатора уменьшено, и достигается значительно более высокий выход сложных эфиров 2-гидрокси-3-бутеновой кислоты. Уменьшение выщелачивания Sn приводит к более чистому продукту и более дешевому способу (так как требуется меньше Sn). Кроме того, сложные эфиры побочного продукта 2-гидрокси-3-бутеновой кислоты представляют собой ценные химические вещества и могут обеспечивать дополнительный продукт процесса. Более конкретно, добавление значительно увеличенного выхода сложных эфиров 2-гидрокси-3-бутеновой кислоты обеспечивает более высокий объединенный выход сложных эфиров молочной кислоты и 2-гидрокси-3-бутеновой кислоты, вместе с обеспечением более высокого превращения сахара. Эти преимущества также применяются для получения α-гидроксиметиониновых аналогов.
Описание изобретения
Авторами настоящего изобретения было обнаружено, что присутствие воды в органическом растворителе в непрерывной реакции в потоке усиливает стабильность катализатора на основе кислоты Льюиса для непрерывных реакций в потоке. Осаждение углеродосодержащих компонентов на катализатор, приводящее к деактивации и отравлению активных сайтов катализатора на основе кислоты Льюиса, не наблюдалось до какой-либо промышленно значимой степени. Сохранение активности, т.е. стабильности катализатора, приводит к продолжительным высоким выходам целевого продукта в течение длительного периода времени реакции непрерывных реакций в потоке.
Настоящее изобретение относится к непрерывному поточному способу получения одного или более сложных эфиров молочной кислоты и 2-гидрокси-3-бутеновой кислоты или α-гидроксиметиониновых аналогов из сахара в присутствии твердого катализатора на основе кислоты Льюиса и растворителя, содержащего органический растворитель и воду, где вода присутствует в количестве до или равном 10 об. % от органического растворителя.
Если α-гидроксиметиониновый аналог является желательным, серосодержащее соединение должно присутствовать в дополнение к твердому катализатору на основе кислоты Льюиса и растворителю, содержащему органический растворитель и воду.
Непрерывный поточный способ означает реакцию или процесс, который происходит в течение (пролонгированного) периода времени, и реагент подается через реакционную камеру в растворитель. Общим ссылочным источником, в котором продемонстрированы непрерывные поточные способы, является Perry's Chemical Engineers' Handbook, eighth edition, McGraw-Hill, 2008.
Термины непрерывный поточный способ, процесс, реакция и реакционный процесс, как подразумевается, являются взаимозаменяемыми.
Более конкретно, настоящее изобретение относится к непрерывному поточному способу, в котором количество воды, присутствующей в растворителе, составляет 10 объемных процентов (об. %) от органического растворителя. Объемный процент означает отношение объема к объему двух растворителей; например, 10 об. % означает отношение 10:90 первого растворителя и второго растворителя. Например, согласно настоящему изобретению 10 об. % воды в органическом растворителе означает отношение объемов 10:90 воды и органического растворителя. Настоящее изобретение может быть осуществлено, когда об. % воды, присутствующей в органическом растворителе, составляет от более чем 0 до 30 об. % или от более чем 0 до 20 об. %. В предпочтительном варианте выполнения настоящего изобретения, об. % воды, присутствующей в органическом растворителе, составляют от более чем 0 до значения, равного или менее 10 об. %. Например, об. % воды, присутствующей в органическом растворителе, могут составлять около 5 об. %, около 1 об. % или около 0.25 об. %.
В варианте выполнения настоящего изобретения, об. % воды, присутствующей в органическом растворителе, может быть выбран, чтобы влиять на выход либо сложных эфиров молочной кислоты, либо сложных эфиров 2-гидрокси-3-бутеновой кислоты или α-гидроксиметиониновых аналогов. Например, когда об. % воды, присутствующей в органическом растворителе, составляет от более чем 0 до 2 об. %, оптимальный выход сложных эфиров молочной кислоты может быть получен. Кроме того, когда об. % воды, присутствующей в органическом растворителе, составляют от 3 до 10 об. %, оптимальный выход сложных эфиров 2-гидрокси-3-бутеновой кислоты (MVG) может быть получен.
Настоящее изобретение также относится к применению сахарного сиропа в качестве сырья. Сахарные сиропы представляют собой смеси сахара и воды низкой стоимости, которые составляют особенно полезное сырье согласно настоящему изобретению. В одном варианте выполнения настоящего изобретения, сахарный сироп смешивается с органическим растворителем с обеспечением конечной реакционной смеси, содержащей сахар, воду и органический растворитель. Содержание воды может быть при необходимости установлено путем выбора концентрации сахара или путем добавления большего количества воды непосредственно в сироп. Сахарные сиропы имеют содержание сахара в качестве сухого вещества выше 30%, более предпочтительно выше 50% или еще более предпочтительно выше 64%. Термин "сахар" относится к моно- и дисахаридам и может быть выбран из группы, состоящей из гликольальдегида, глицеринового альдегида, дигидроксиацетона, эритрозы, эритрулозы, треозы, ксилозы, арабинозы, глюкозы, фруктозы, маннозы, галактозы, сахарозы, лактозы, мальтозы и их смесей. Примерами сахарных сиропов являются паточный сироп, кукурузный сироп с высоким содержанием фруктозы, сахарные сиропы на основе сока сахарного тростника, инвертный сахарный сироп, сахарный сироп на основе сока сахарной свеклы (густой сок), гемицеллюлозные сиропы (содержащие смеси ксилозы, глюкозы, маннозы и других сахаров) и гликольальдегидные сиропы (главным образом содержащие гликольальдегид, получаемый, например, как описано в WO 2014/131743).
Органический растворитель означает один или более растворители, выбранные из группы, состоящей из метанола, этанола, 1-пропанола, 1-бутанола и изопропанола.
Сложные эфиры молочной кислоты и 2-гидрокси-3-бутеновой кислоты означают один или более сложные эфиры молочной кислоты и один или более сложные эфиры 2-гидрокси-3-бутеновой кислоты. Например, если органический растворитель в способе представляет собой только метанол, тогда будет образовываться только сложный метиловый эфир молочной кислоты и 2-гидрокси-3-бутеновой кислоты.
Настоящее изобретение дополнительно относится к способу, в котором выход одного или более сложных эфиров молочной кислоты уменьшается в ходе непрерывного поточного способа. Например, выход одного или более сложных эфиров молочной кислоты может уменьшаться на до 0.01, 0.02, 0.03, 0.05, 0.10, 0.15, 0.20 или 0.25% на час в потоке в среднем.
Уменьшение выхода на час в потоке в среднем означает уменьшение процентного выхода одного или более сложных эфиров молочной кислоты за период времени, как только непрерывный поточный способ достиг установившегося режима, поделенный на число часов в этот период. Например: для способа, который достиг установившегося режима, 5% уменьшение выхода одного или более сложных эфиров молочной кислоты, например от 50% до 45%, наблюдается за период времени, равный 100 часов, соответствующий уменьшению, равному 0.05% выходу на час в потоке в среднем.
Уменьшение выхода одного или более сложных эфиров молочной кислоты может также быть выражено уменьшением выхода через период времени в потоке, в частности как только способ достиг установившегося состояния. Например, выход одного или более сложных эфиров молочной кислоты может уменьшаться до и включая 5% в общем через 50, 100, 150, 200, 250, 300, 400, 500 или 6000 часов в потоке. Этот пример непосредственно относится к способу, описанному в Примере 1; вариация времени может варьироваться и вероятно зависит от способа и промышленного масштаба.
Установившейся режим означает, что условия непрерывного поточного способа достигли установившегося режима; например, поток растворителя и реагентов через реакционную камеру является постоянным. Это можно определить, например, при наблюдении, что выход одного или более сложных эфиров молочной кислоты не увеличивается на около 5% за период времени, равный около 5 ч. Этот пример непосредственно относится к способу в Примере 1 и приводится в целях иллюстрации; вариация выхода вероятно зависит от способа и промышленного масштаба и не предназначена для ограничения объема настоящего изобретения.
Время (часы) в потоке (TOS) означает время, за которое сырье проходит через слой катализатора.
Настоящее изобретение также относится к способу, в котором выход одного или более сложных эфиров молочной кислоты или объединенный выход обоих сложных эфиров молочной кислоты и 2-гидрокси-3-бутеновой кислоты выше чем 40% через 50 часов в потоке. Например: выход одного или более сложных эфиров молочной кислоты выше 40% через 50, 100, 150, 200, 250, 300, 400 или 500 часов в потоке.
Настоящее изобретение также относится к способу, в котором выход одного или более сложных эфиров молочной кислоты или объединенный выход обоих сложных эфиров молочной кислоты и 2-гидрокси-3-бутеновой кислоты выше 40% через 50 часов в потоке. Например: выход одного или более сложных эфиров молочной кислоты выше 40%, 45%, 50%, 55%, 60%, 65%, 70% или 75% через 50 часов в потоке.
В другом варианте выполнения настоящего изобретения, серосодержащее соединение добавляется в способ, если желательно получить α-гидроксиметиониновый аналог.
Серосодержащее соединение выбирается из группы, состоящей из С1-С5 алкилтиола, солей С1-С5 алкилтиола, диметилмеркаптана и диметилдисульфида. С1-С5 алкилтиол означает моно- и дизамещенные тиолы с заместителем, содержащим насыщенную алифатическую алкильную группу с неразветвленной или разветвленной цепью, содержащую один, два, три, четыре или пять атомов углерода. В частности, С1-С5 алкилтиол означает алкилтиол, выбранный из группы, состоящей из метантиола, этантиола, пропантиола с неразветвленной или разветвленной цепью, бутантиола с неразветвленной или разветвленной цепью и пентантиола с неразветвленной или разветвленной цепью.
Соль С1-С5 алкилтиола означает соль щелочного или щелочноземельного металла и С1-С5 алкилтиола. В частности, соль С1-С5 алкилтиола означает С1-С5 алкилтиол в солевой форме, в которой катион выбирается из группы, состоящей из натрия, калия, лития, магния и кальция. В частности, соль С1-С5 алкилтиола означает С1-С5 алкилтиол, выбранный из одного или более из группы, состоящей из NaSCH3, KSCH3, Ca(SCH3)2 и Mg(SCH3)2.
α-Гидроксиметиониновые аналоги выбираются из группы, состоящей из 2-гидрокси-4-(С1-С5алкилтио)бутановой кислоты, ее солей и сложных эфиров. С1-С5алкилтио соответствует С1-С5 алкилтио серосодержащему соединению, присутствующему в способе. Предпочтительно, α-гидроксиметиониновые аналоги выбираются из группы, состоящей из 2-гидрокси-4-(метилтио)бутановой кислоты, ее солей и сложных эфиров. Предпочтительно, α-гидроксиметиониновые аналоги выбираются из группы, состоящей из 2-гидрокси-4-(метилтио)-бутановой кислоты, ее солей щелочных и щелочноземельных металлов и С1-С5 алкиловых сложных эфиров.
C1-8 алкиловые сложные эфиры означают сложные эфиры, содержащие алкильную группу, выбранную из группы, состоящей из метила, этила, пропила, бутила, изопропила, изобутила, пентила, гексила, гептила, октила и 2-этилгексила. Солями щелочных и щелочноземельных металлов являются солями кислот, в которых катион соли выбирается из металлов группы I и группы II.
В одном варианте выполнения настоящего изобретения α-гидрокси аналогом метионина является 2-гидрокси-4-(метилтио)бутановая кислота.
Во втором варианте выполнения настоящего изобретения α-гидрокси аналоги метионина выбираются из группы, состоящей из 2-гидрокси-4-(метилтио)бутановой кислоты метилового сложного эфира, 2-гидрокси-4-(метилтио)бутановой кислоты этилового сложного эфира, 2-гидрокси-4-(метилтио)бутановой кислоты пропилового сложного эфира, 2-гидрокси-4-(метилтио)бутановой кислоты бутилового сложного эфира, 2-гидрокси-4-(метилтио)бутановой кислоты изопропилового сложного эфира, 2-гидрокси-4-(метилтио)бутановой кислоты пентилового сложного эфира, 2-гидрокси-4-(метилтио)бутановой кислоты гексилового сложного эфира, 2-гидрокси-4-(метилтио)бутановой кислоты гептилового сложного эфира, 2-гидрокси-4-(метилтио)бутановой кислоты октилового сложного эфира и 2-гидрокси-4-(метилтио)бутановой кислоты 2-этилгексилового сложного эфира.
Добавление серосодержащего соединения в процесс реакции приводит к получению α-гидроксиметионинового аналога, как можно увидеть в Таблице 1, в которой приводятся периодические реакции превращения сахаров в α-гидрокси аналоги метионина.
Ожидается, что периодические реакции могут переноситься на непрерывный процесс, соответствующий процессу, в котором получают 2-гидрокси-3-бутеновую кислоту и ее сложные эфиры.
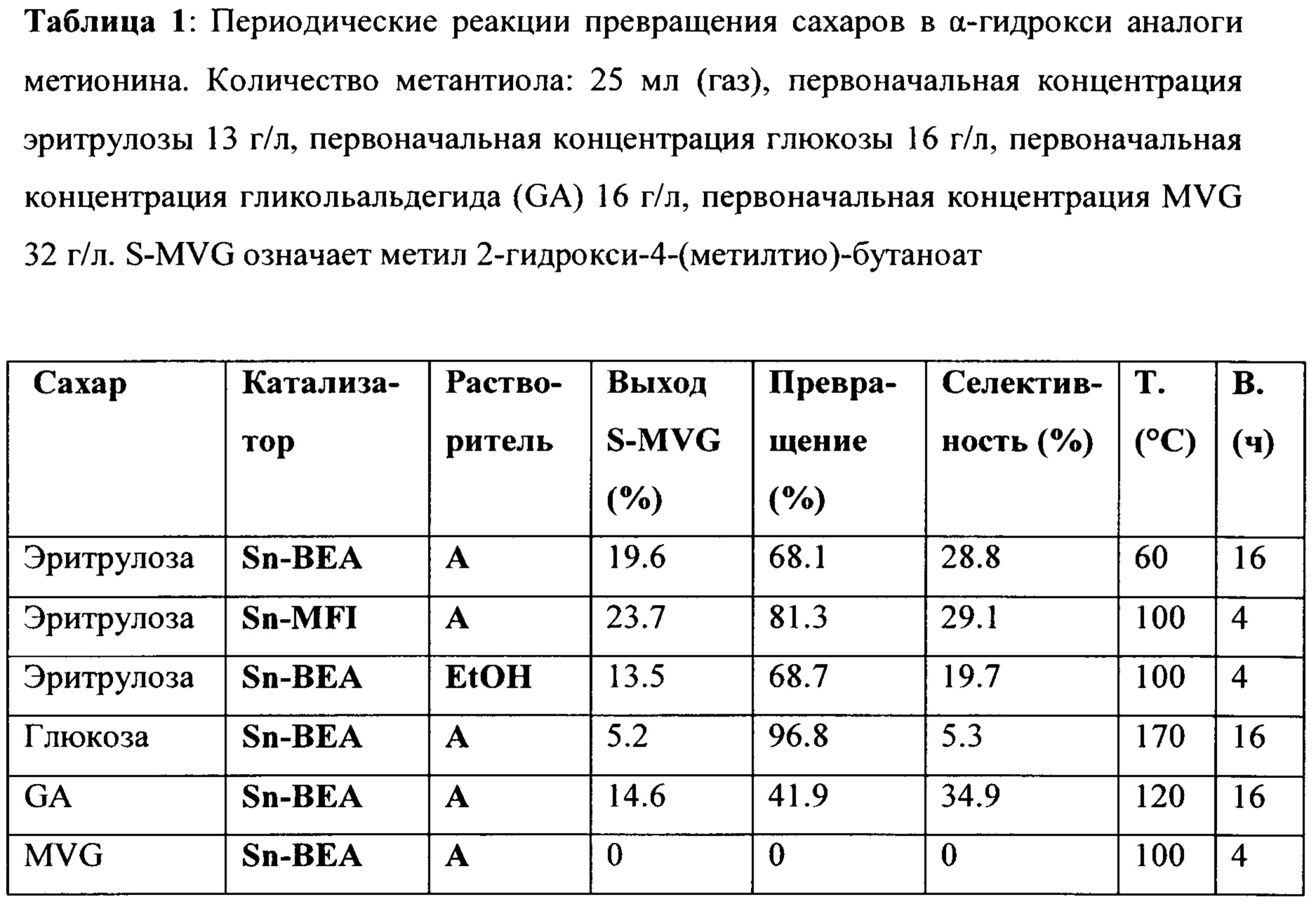
Т. = температура; в. = время Растворитель А: MeOH + 0.13 ммоль К2СО3 GA = гликольальдегид
Настоящее изобретение относится к способу, в котором твердый катализатор на основе кислоты Льюиса кальцинируется через 80 часов, через 450 часов, через 500 часов или через 6000 часов непрерывного поточного способа.
Настоящее изобретение также может быть проиллюстрировано посредством массы превращенного сахара на массу присутствующего катализатора. Например: Уменьшение в выход на час одного или более сложных эфиров молочной кислоты составляет до 0.25%, когда по меньшей мере 0.45 г сахара на грамм катализатора было превращено; уменьшение в выход на час одного или более сложных эфиров молочной кислоты составляет до 5% когда по меньшей мере 25 г сахара на грамм катализатора было превращено; выход одного или более сложных эфиров молочной кислоты составляет более 40%, когда по меньшей мере 25 г сахара на грамм катализатора было превращено, когда по меньшей мере 30 г сахара на грамм катализатора было превращено, когда по меньшей мере 200 г сахара на грамм катализатора было превращено или когда по меньшей мере 2500 г сахара на грамм катализатора было превращено.
В способе согласно настоящему изобретению твердый катализатор на основе кислоты Льюиса представляет собой материал цеотипа или кремнистый пористый материал. Материал цеотипа представляет собой материал, в котором атомы алюминия цеолитного материала частично или полностью замещены на металл (атомы металла), такой как цирконий (Zr), титан (Ti) и олово (Sn). Цеолитные материалы представляют собой кристаллические алюминосиликаты с микропористой кристаллической структурой, согласно Corma et al., Chem. Rev. 1995, 95 рр 559-614. Альтернативно может применяться пористый материал, такой как МСМ-41 и SBA-15.
В способе согласно настоящему изобретению, каркасная структура твердого катализатора на основе кислоты Льюиса выбирается из группы, состоящей из ВЕА, MFI, FAU, MOR, FER и MWW, и пористых материалов, таких как МСМ-41 и SBA-15.
Настоящее изобретение относится к способу, в котором твердая кислота Льюиса содержит активный металл, выбранный из одного или более из группы, состоящей из Sn, Ti, Pb, Zr, Ge и Hf.
Твердый катализатор на основе кислоты Льюиса предпочтительно выбирается из группы, состоящей из Sn-BEA, Sn-MFI, Sn-FAU, Sn-MOR, Sn-MWW, Sn-MCM-41 HSn-SBA-15.
Количество потери Sn вычисляется как потеря Sn из твердого катализатора на основе кислоты Льюиса в момент времени после начала процесса, поделенная на начальное количество Sn в твердом катализаторе на основе кислоты Льюиса в начале процесса.
Предпочтительно, что твердый катализатор на основе кислоты Льюиса содержит Sn, и что потеря Sn из твердого катализатора на основе кислоты Льюиса менее или равна 0.11% от начального количества Sn на час в потоке в среднем, предпочтительно менее или равна 0.05% от начального количества Sn на час в потоке, более предпочтительно менее или равна 0.02% от начального количества Sn на час в потоке.
Настоящее изобретение относится к способу, в котором твердый катализатор на основе кислоты Льюиса содержит Sn, и потеря Sn из твердого катализатора на основе кислоты Льюиса менее или равна 8% от начального количества Sn через 50 часов в потоке, менее или равна 50% от начального количества Sn через 400 часов в потоке, предпочтительно менее или равна 40% от начального количества Sn через 400 часов в потоке, предпочтительно менее или равна 15% от начального количества Sn через 400 часов в потоке.
Предпочтительно выход одного или более сложных эфиров 2-гидрокси-3-бутеновой кислоты составляет более 10%, более предпочтительно более или равен 12%.
В способе согласно настоящему изобретению, сахар предпочтительно выбирается из одного или более из группы, состоящей из глюкозы, фруктозы, маннозы, сахарозы, ксилозы, эритрозы, эритрулозы, треозы и гликольальдегида.
В некоторых случаях предпочтительно, чтобы ион щелочноземельного металла или щелочного металла присутствовал в процессе реакции. Когда GA применяется в качестве сырья, щелочь не требуется.
Согласно настоящему изобретению, щелочь может быть получена путем добавления в процесс одного или более соединений, выбранных из группы, состоящей из K2CO3, KNO3, KCl, KOH, ацетат калия (CH3CO2K), лактат калия (СН3СН(ОН)CO2K), NaCl, NaOH, Na2CO3, Li2CO3 и Rb2CO3.
В настоящем изобретении один или более сложных эфиров молочной кислоты предпочтительно выбираются из группы, состоящей из метиллактата и этиллактата.
Экспериментальные данные для фигур собраны в примерах 1 и 2. Для ясности данные, полученные в режиме непрерывного потока, представлены на фигурах, а результаты из периодических экспериментов приведены в таблицах.
Фигуры 1-5 охватывают превращение С6-сахаров (фруктозы) в режиме непрерывного потока. Фигуры 1-3 относятся к уменьшению выщелачивания Sn и уменьшению деактивации катализатора. Фигуры 4 и 5 демонстрируют улучшение выхода MVG, когда присутствует вода. Более конкретно, фигуры имеют следующие значения:
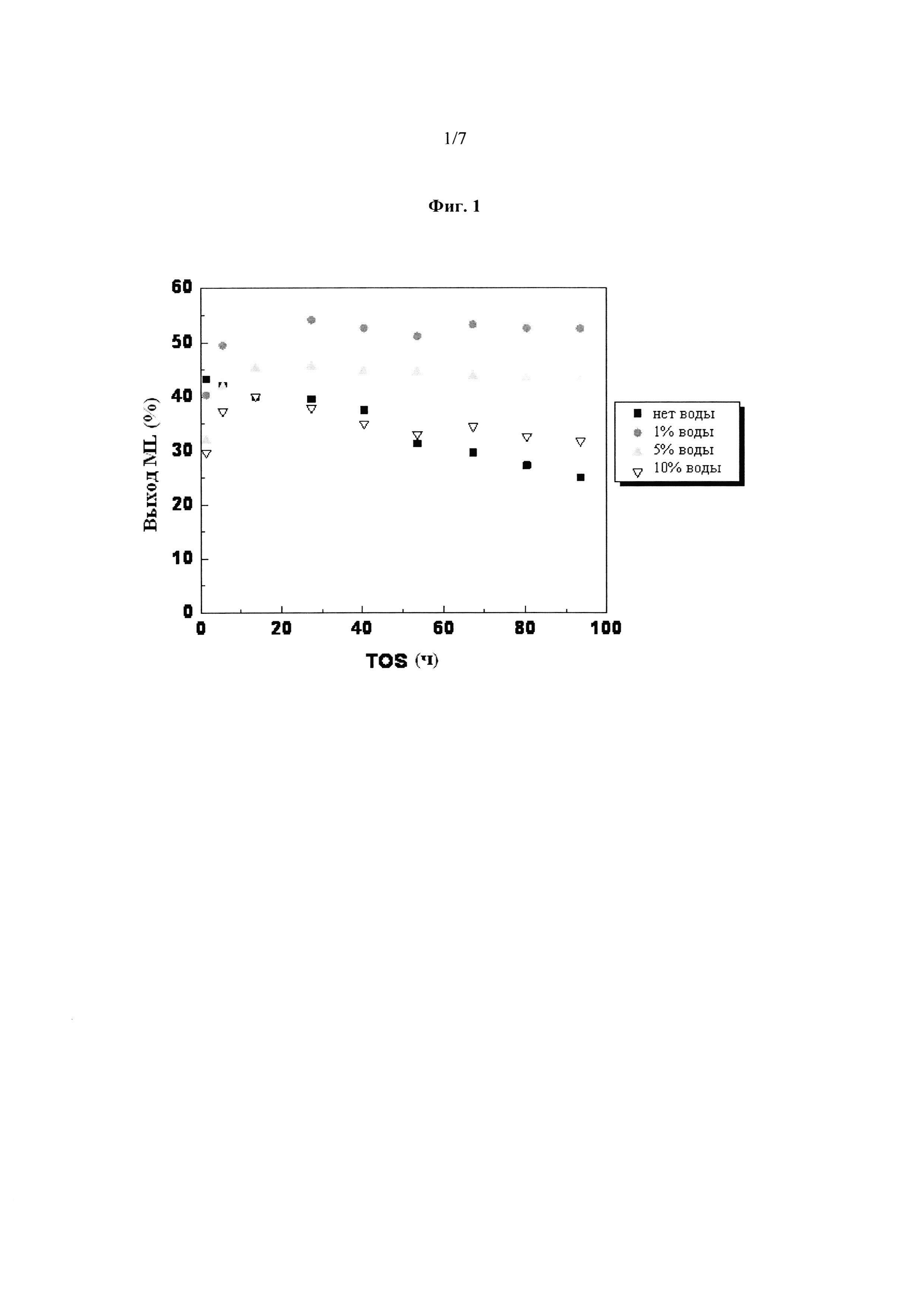
Фиг. 1: Улучшенная стабильность катализатора Sn-BEA на основе кислот Льюиса с 1%, 5% и 10% воды, добавленной к растворителю в способе, по сравнению с отсутствием воды, добавленной к растворителю в способе. Стабильность катализатора проиллюстрирована последующим значительным выходом продукта метиллактата.
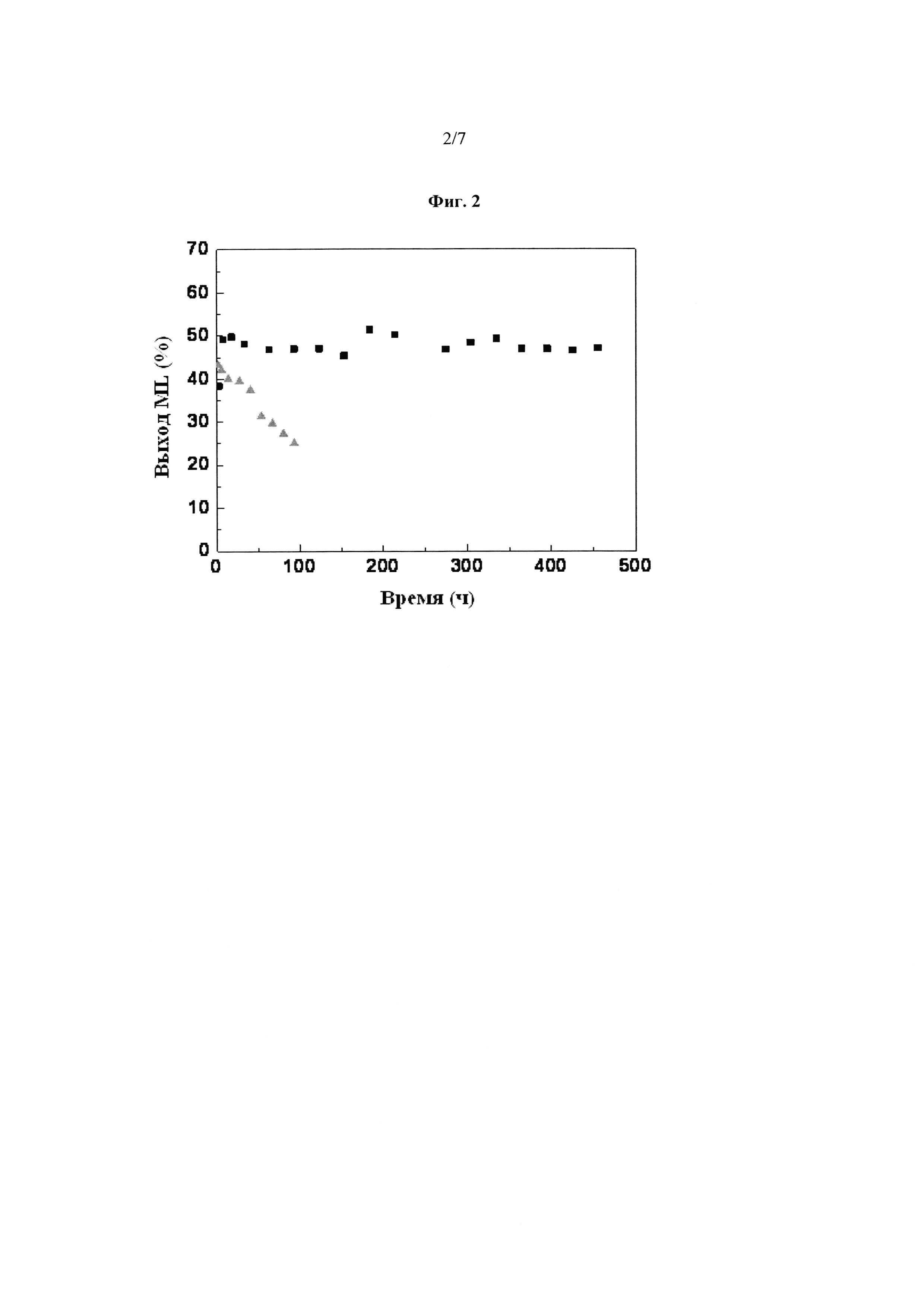
Фиг. 2: Улучшенная стабильность катализатора Sn-BEA на основе кислот Льюиса с 1% воды, добавленной к растворителю в способе (квадраты), по сравнению с отсутствием воды, добавленной к растворителю в способе (треугольники). Стабильность катализатора проиллюстрирована последующим значительным выходом продукта метиллактата, наблюдаемым за пролонгированный период времени процесса в потоке (около 500 часов).
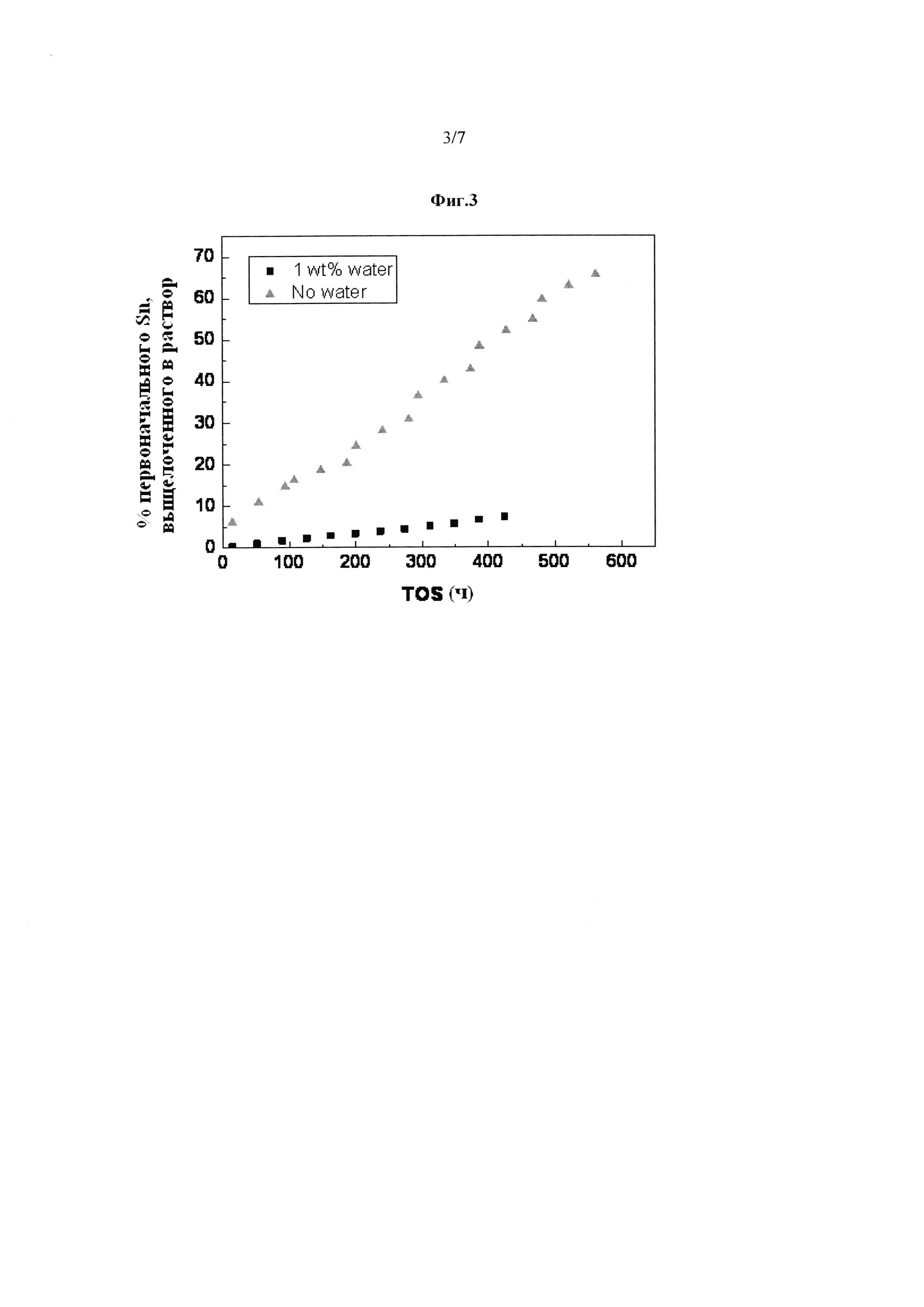
Фиг. 3: Улучшенная стабильность катализатора Sn-BEA на основе кислот Льюиса с 1% воды, добавленной к растворителю в способе (квадраты), по сравнению с отсутствием воды, добавленной к растворителю в способе (треугольники). Улучшенная стабильность проиллюстрирована значительным уменьшением выщелачивания Sn (потеря Sn) из катализатора.
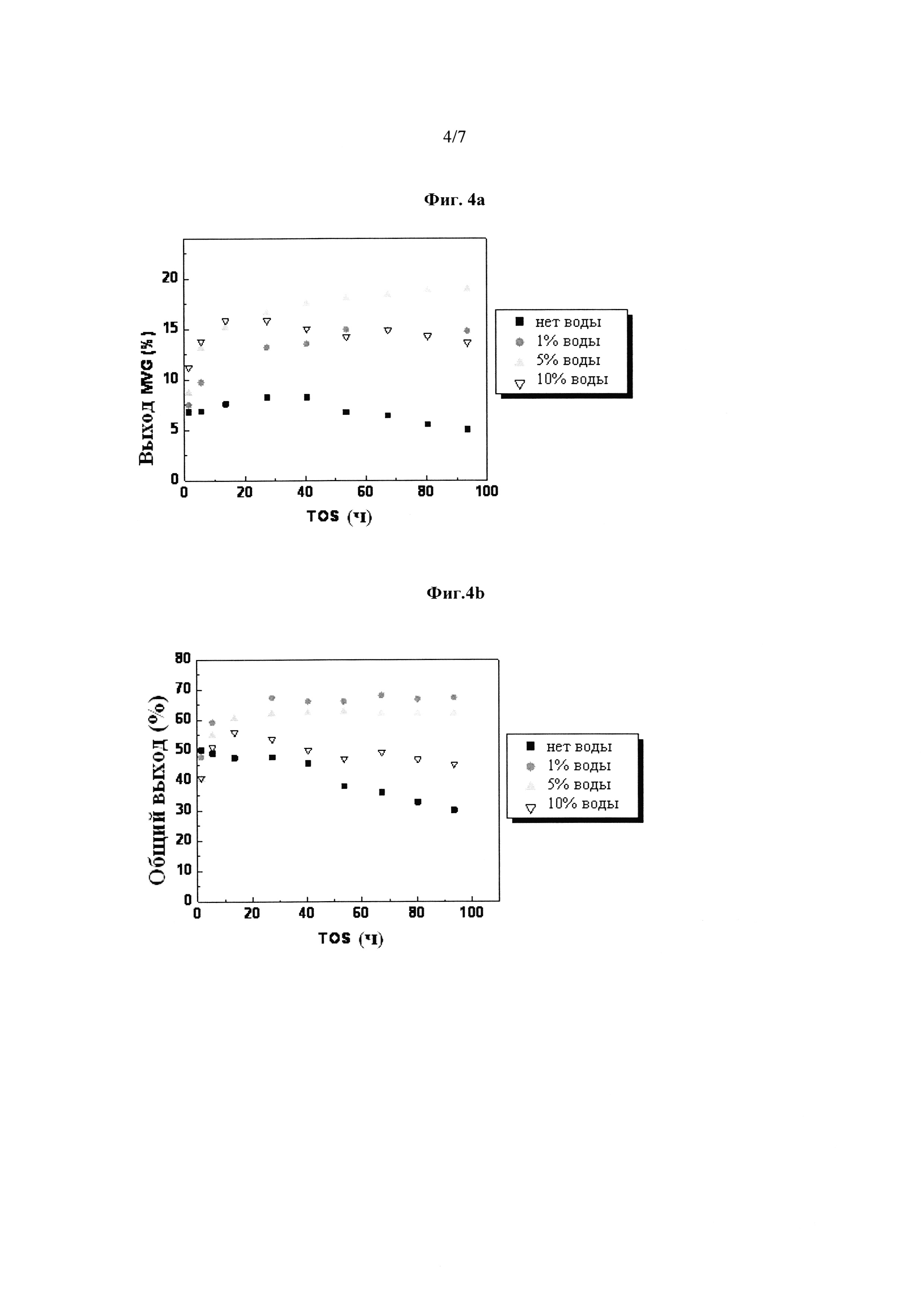
Фиг. 4: Улучшенный выход сложных эфиров 2-гидрокси-3-бутеновой кислоты с добавлением воды в непрерывный поточный способ: (а) выход 2-гидрокси-3-бутеновой кислоты метилового сложного эфира (MVG); (b) объединенный выход сложных эфиров молочной кислоты (метиллактат) и 2-гидрокси-3-бутеновой кислоты метилового сложного эфира (MVG).
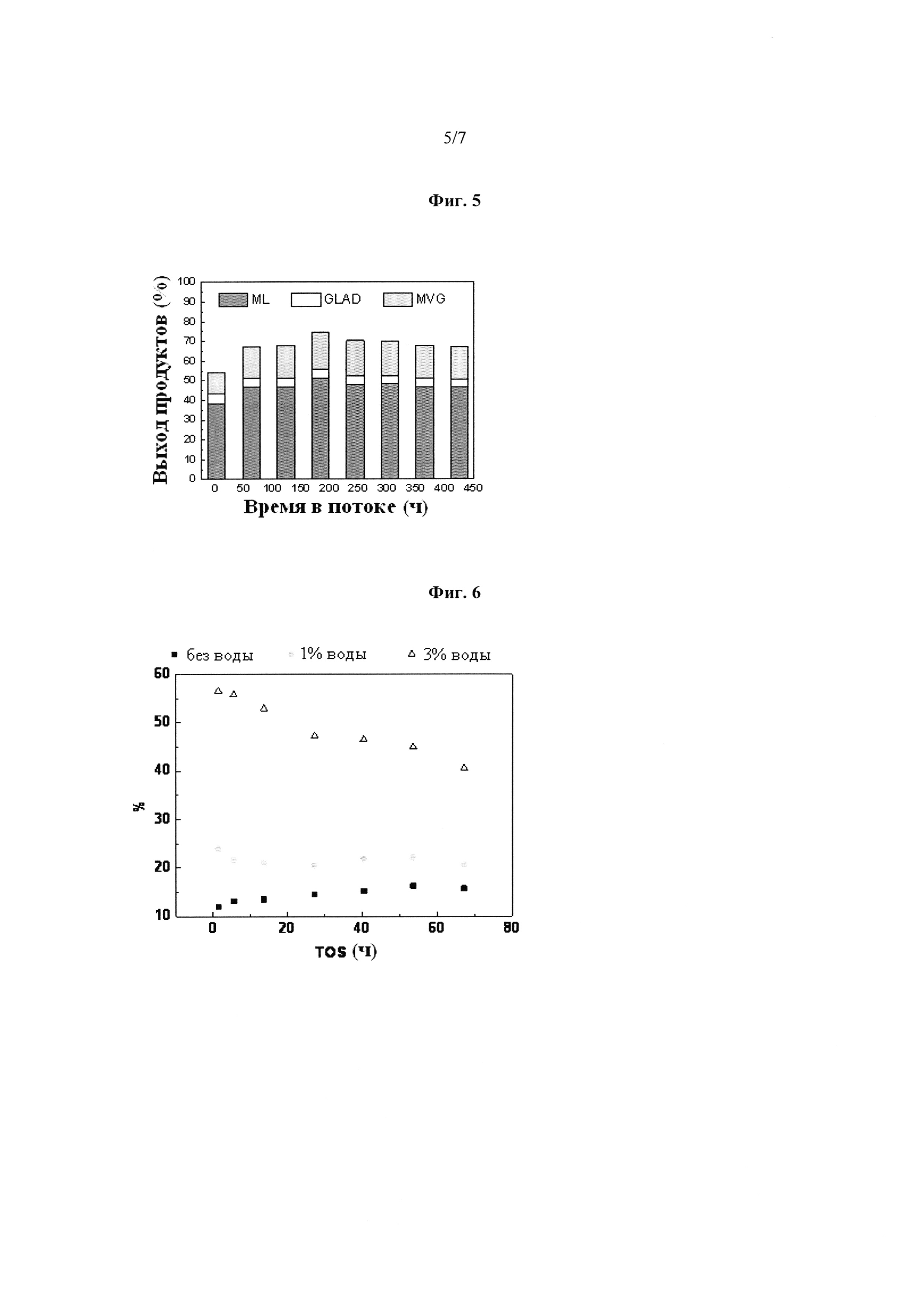
Фиг. 5: Выход биомономеров, полученных из фруктозы, при применении Sn-Beta цеолита в потоке. Общий выход [метиллактат (ML), гликольальдегида диметилацеталь (GLAD) и метилвинилгликолят (MVG)] составляет 70% из фруктозы и является стабильным в течение 400 ч. Метилвинилгликолят (MVG) является эквивалентом 2-гидрокси-3-бутеновой кислоты метилового сложного эфира.
Фигуры 6-8 охватывают превращение С2-сахара (гликольальдегида) в режиме непрерывного потока. Фигуры 6 и 7 относятся к улучшению выхода MVG, когда вода присутствует. Фигура 8 относится к улучшению выхода S-MVG, когда присутствуют вода и метантиол. Более конкретно, фигуры имеют следующие значения:
Фиг. 6: Улучшенный выход метилвинилгликолята (MVG) из гликольальдегида с добавлением воды в режиме непрерывного потока. Сырьевая композиция: 20 г/л гликольальдегида в метаноле в качестве растворителя. Метилвинилгликолят (MVG) является эквивалентом 2-гидрокси-3-бутеновой кислоты метилового сложного эфира.
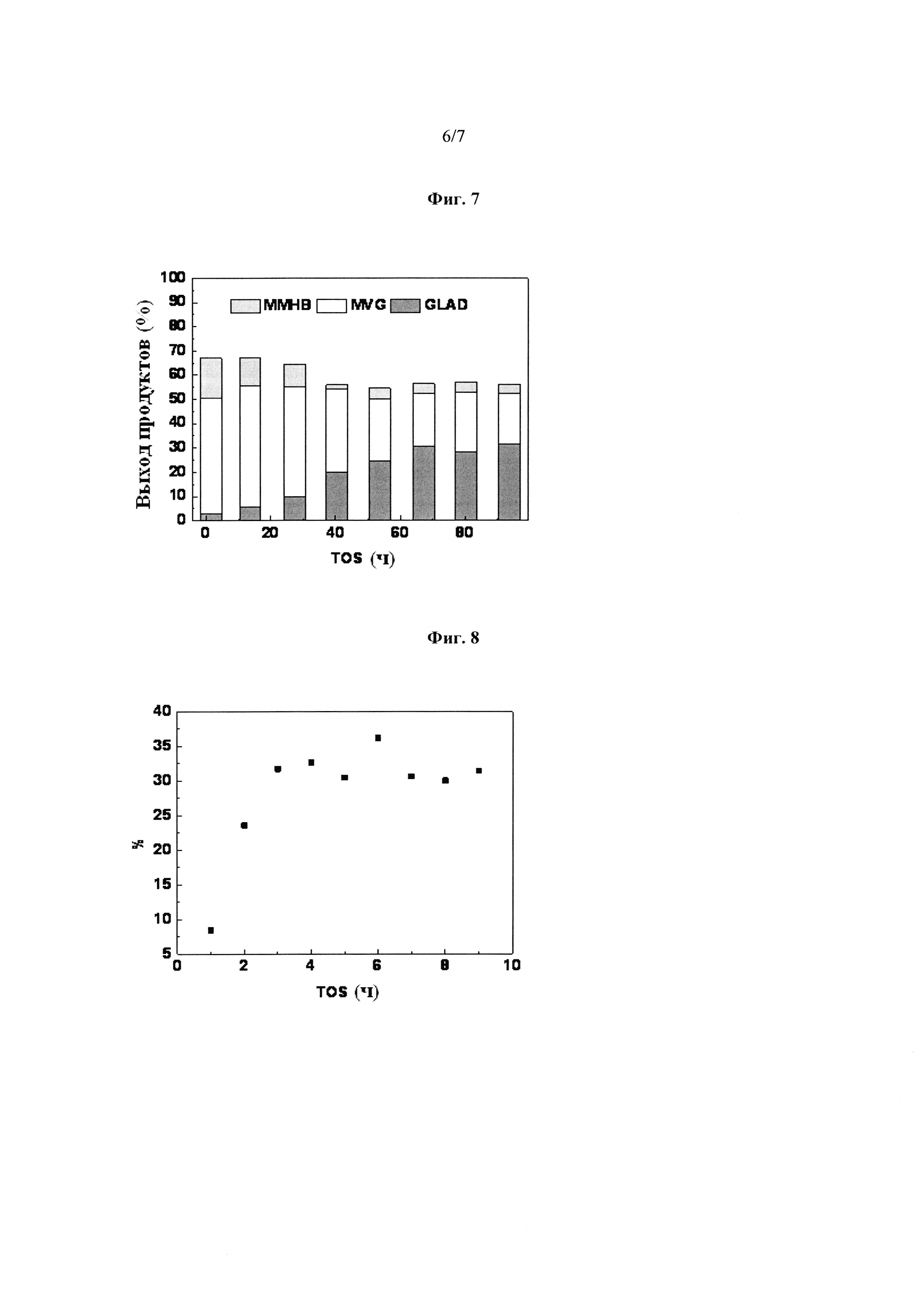
Фиг. 7: Выход биомономеров, полученных из гликольальдегида, при применении Sn-Beta цеолита в потоке. Сырьевая композиция: 20 г/л гликольальдегида в метаноле в качестве растворителя, 8.5 мас. % воды. Общий выход [гликольальдегида диметилацеталь (GLAD), метилвинилгликолят (MVG) и метил-4-метокси-2-гидрокси-бутеноат (ММНВ)] составляет 65% из гликольальдегида в начале реакции. Метилвинилгликолят (MVG) является эквивалентом 2-гидрокси-3-бутеновой кислоты метилового сложного эфира.
Фиг. 8: Выход метилового сложного эфира α-гидроксиметионинового аналога с Sn-BEA в качестве катализатора в присутствии воды и метанола в непрерывной реакции в потоке из гликольальдегида. Сырьевая композиция: 9 г/л гликольальдегида в метаноле в качестве растворителя, 8.5 мас. % воды, 1.2 г/л метантиола.
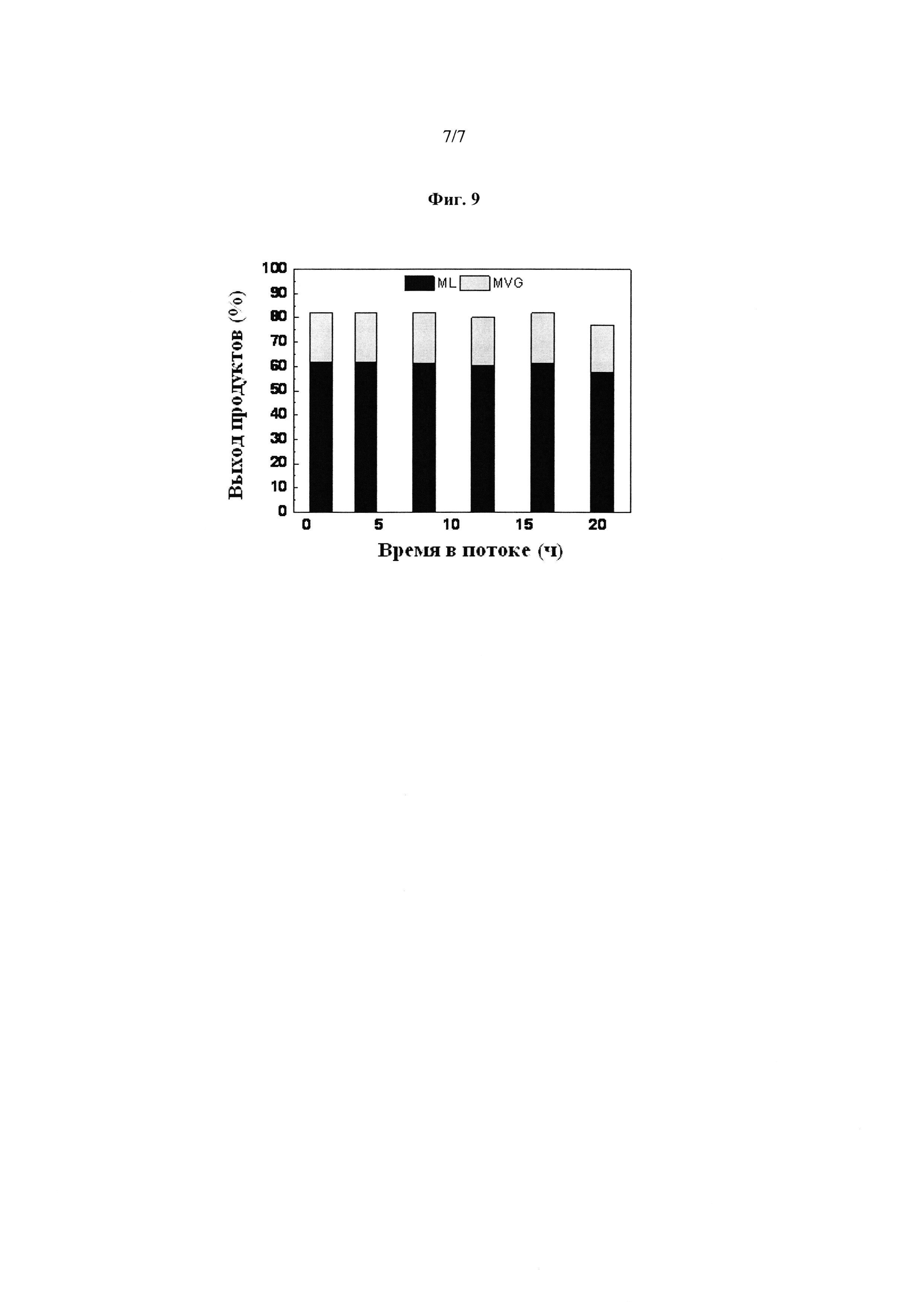
На Фиг. 9 приводится пример применения сиропа в качестве сырья в реакции. Демонстрируется улучшение выхода MVG, когда вода присутствует, и применение сахара в форме сахарного сиропа. Более конкретно, фигура имеет следующее значение:
Фиг. 9: Выход биомономеров, полученных из сиропа сахарозы, при применении Sn-Beta цеолита в потоке. Сырьевая композиция: 55 г/л сахарозы. Общий выход [метиллактат (ML), метилвинилгликолят (MVG)] составляет 80% из сиропа сахарозы и является стабильным. Метилвинилгликолят (MVG) является эквивалентом метилового сложного эфира 2-гидрокси-3-бутеновой кислоты.
Способ согласно настоящему изобретению далее проиллюстрирован следующими примерами.
Пример 1
Получение катализатора
Sn-BEA (Si/Sn=125) получают согласно модификации методики, описанной в US 4,933,161. Коммерчески доступный цеолит бета (Zeolyst, Si/Al 12.5, аммониевая форма) кальцинируют (550°C в течение 6 ч) с получением Н форма (деалюминированная форма) и обрабатывают 10 граммами концентрированной азотной кислоты (Sigma-Aldrich, 65%) на грамм порошка цеолита бета в течение 12 ч при 80°C. Полученное твердое вещество фильтруют, обильно промывают водой и кальцинируют (550°C в течение 6 ч) с получением деалюминированного бета. Это твердое вещество пропитывают согласно методологии придания влажности при отношении Sn/Si, равном 125. С этой целью, хлорид олова (II) (0.128 г, Sigma-Aldrich, 98%) растворяют в воде (5.75 мл) и добавляют к деалюминированному бета (5 г). После процесса пропитки образцы высушивали 12 ч при 110°C и снова кальцинировали (550°C в течение 6 ч).
Каталитическая реакция в режиме непрерывного потока:
Фруктозу (Sigma-Aldrich, 99%) растворили в метаноле (Sigma-Aldrich, 99.9%) при комнатной температуре до достижения концентрации, равной 12.5 г/л. Кроме того, деионизованную воду (0, 10, 50 или 100 мл/л) и карбонат калия (Sigma-Aldrich, 99%, 2.5 мг/л) добавили в сырьевой раствор. Катализатор Sn-Beta (Si:Sn 125), полученный согласно вышеописанному получению, раздробили (0.25 г, 300-600 мкм.) и поместили в реактор из нержавеющей стали, объемом 0.25 дюйма. Стекловату применяли, чтобы удерживать катализатор на месте. Реактор поместили в печь, и температура реактора увеличилась до 160°C. Когда температура превысила 140°C, насос запустился с потоком 0.15 мл/мин 1.25 мас. % раствора фруктозы в метаноле.
Гликольальдегид (гликольальдегид димер, Sigma) растворили в метаноле (Sigma-Aldrich, 99.9%) при комнатной температуре до достижения концентрации, равной 9 г/л. Кроме того, деионизованную воду (0, 10, 30 мл/л) и, если необходимо, метантиол (Sigma, 1.7 бар) добавили в сырьевой раствор. Катализатор Sn-Beta (Si:Sn 125), полученный согласно вышеописанному получению, раздробили (0.25 г, 300-600 мкм.) и поместили в реактор из нержавеющей стали, объемом 0.25 дюйма. Стекловату применяли, чтобы удерживать катализатор на месте. Реактор поместили в печь, и температура реактора увеличилась до 160°C. Когда температура превысила 140°C, насос запустился с потоком 0.05 мл/мин (смотрите Фиг. 8).
Сироп сахарозы (65 мас. %, KNO3 1 г/л) и метанол (Sigma-Aldrich, 99.9%) накачивали по отдельности и смешивали при 160°C с достижением концентрации сахарозы, равной 55 г/л. Катализатор Sn-BEA (Si:Sn 125), полученный согласно вышеописанному получению, экструдировали (40 г, 1/32'' цилиндры) и поместили в реактор из нержавеющей стали. Стекловату применяли, чтобы удерживать катализатор на месте. Реактор поместили в печь, и температура реактора увеличилась до 160°C (смотрите Фиг. 9).
Образцы собрали через различное время в потоке и проанализировали посредством ВЭЖХ (Agilent 1200, Biorad Aminex НРХ-87Н колонка при 65°C, 0.05 М H2SO4, 0.6 мл/мин) для определения количества непревращенных гексоз и дигидроксиацетона (DHA), глицеринового альдегида (GLA); и GC (Agilent 7890 с колонкой Phenomenex Solgelwax) применяли для определения количества: метиллактата (ML), метилвинилгликолята (MVG, метил 2-гидрокси-3-бутеноата), гликольальдегида диметилацеталя (GLAD) и сера-метилвинилгликолята (S-MVG, метил 2-гидрокси-4-(метилтио)-бутаноат).
Пример 2
Определение общего количества растворимого олова в жидкой среде:
Определение общего количества растворимого олова (Sn) осуществили, применяя масс-спектрометрию с индукционной плазмой (ICP-MS). Образец метанола разбавили по массе смесью 80/20 ксилол/2-пропанол. Общее содержание Sn определили количественно посредством ICP-MS (устройство Agilent 7500се ICP-MS) при изотопных массах Sn 118 и 120 путем сравнения с калибровочной кривой, полученной из 900 ppm Conostan стандарта металлоорганического Sn, разбавленного ксилолом. Индий применяется как внутренний стандарт для коррекции сдвига и матричных эффектов. Удаление молекулярных помех в анализе ICP-MS проводится с помощью селекции кинетической энергии гелия. Сертифицированный стандарт EnviroMAT "Used oil", который дает информационную величину для Sn (305 мг/кг), анализируется с каждой партией образцов для проверки точности способа.
Пример 3
Этот пример иллюстрирует превращение С2-сахаров (гликольальдегид) в MVG с увеличенным выходом благодаря влиянию воды в периодических экспериментах.
Каталитические реакции в периодическом режиме:
В сосуд высокого давления из нержавеющей стали (40 см3, Swagelok) загрузили 15.0 г метанола (Sigma-Aldrich, >99.8%), требуемое количество воды, 0.200 г гликольальдегида (гликольальдегид димер, Sigma) и 0.150 г катализатора. Реактор закрыли и нагрели до 160°C при перемешивании (900 оборотов в минуту). Реакцию продолжали в течение 16 часов, и после этого периода времени, реакцию погасили путем погружения сосуда в холодную воду. Образцы из реакционного сосуда отфильтровали и проанализировали посредством ВЭЖХ (Agilent 1200, Biorad Aminex НРХ-87Н колонка при 65°C, 0.05 М H2SO4, 0.5 мл/мин) для количественного определения непревращенного гликольальдегида (GA); и GC (Agilent 7890 с колонкой Phenomenex Solgelwax) применяли для количественного определения следующего: метиллактат (ML), метилвинилгликолят (MVG, метил-2-гидрокси-3-бутеноат), гликольальдегида диметилацеталь (GLAD) и метил-4-метокси-2-гидроксибутаноат (ММНВ).
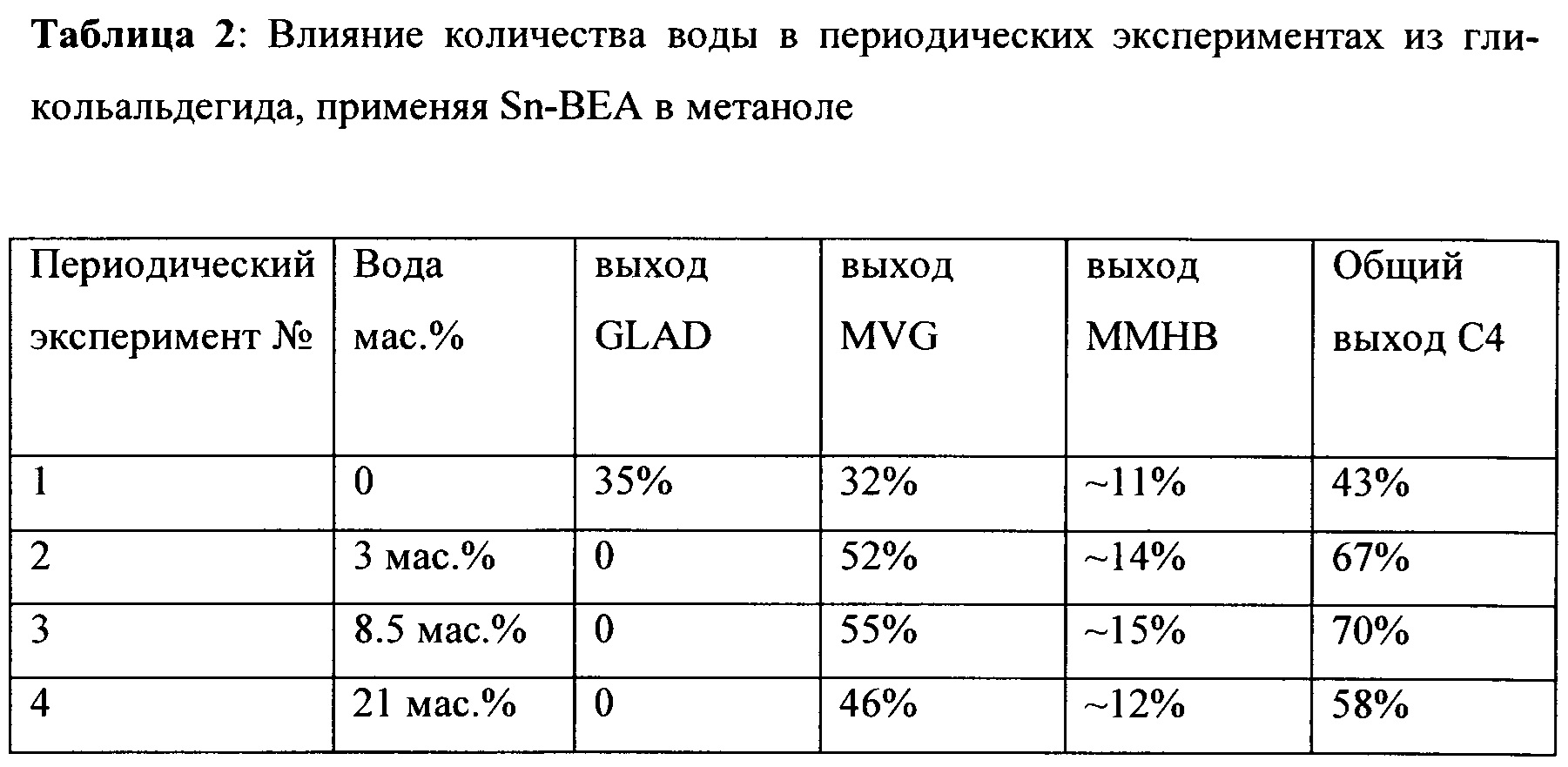
Таблица 2 показывает влияние количества воды в периодических экспериментах из гликольальдегида, применяя Sn-Beta в метаноле. Улучшенный выход метилвинилгликолята (MVG) и метил-4-метокси-2-гидроксибутаноата (ММНВ) получен при добавлении воды в периодическую реакцию. Метилвинилгликолят (MVG) является эквивалентом метилового сложного эфира 2-гидрокси-3-бутеновой кислоты.
В Таблице 3 показано влияние присутствия (количества) щелочи в периодических экспериментах из гликольальдегида, применяя Sn-Beta в метаноле. Улучшенный выход метилвинилгликолята (MVG) и метил-4-метокси-2-гидроксибутаноата (ММНВ) достигается при добавлении воды в периодическую реакцию в отсутствии щелочи. Этот эксперимент показывает, что вода является компонентом, отвечающим за увеличение выходов, тогда как присутствие щелочи является менее важным. Однако предпочтительно работать в отсутствии щелочи. Результаты в периодическом эксперименте №7 сопоставимы с условиями, указанными в Green Chemistry 2012, 14, p. 702. Результаты из указанного документа: ML 16%, MVG 27%, ММНВ 6%.
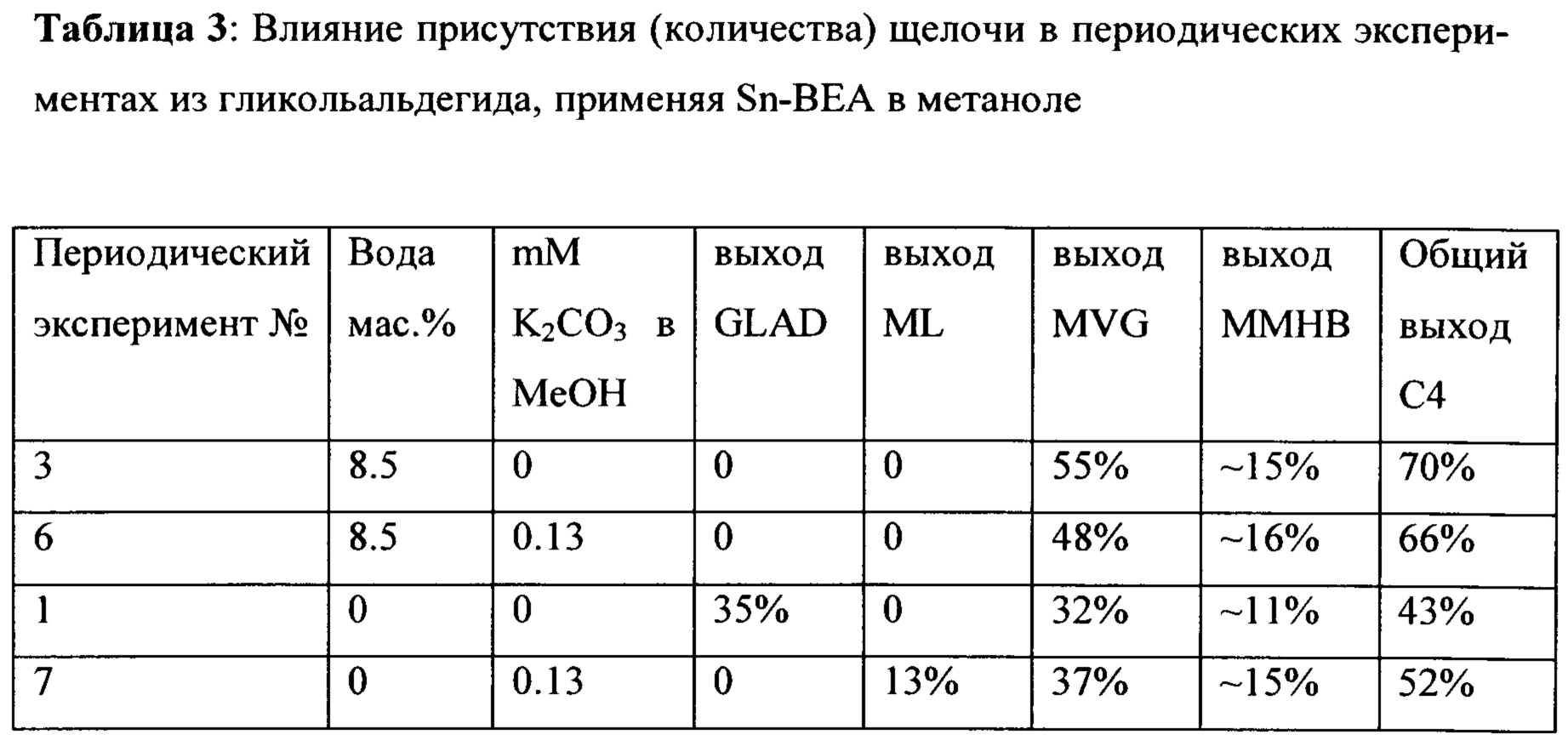
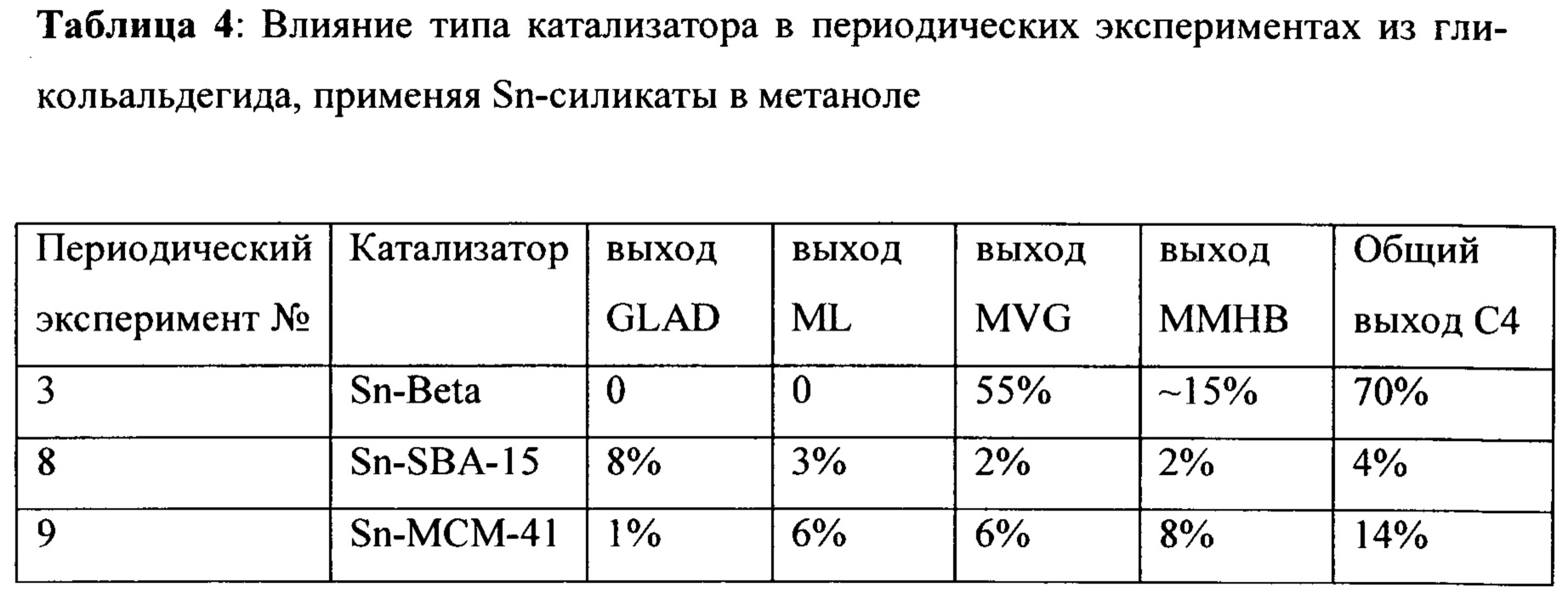
Таблица 4 показывает влияние типа катализатора в периодических экспериментах с гликольальдегидом, применяя различные оловосодержащие силикаты в метаноле. Оптимальный выход метилвинилгликолята (MVG) и метил-4-метокси-2-гидроксибутаноата (ММНВ) получен с Sn-BEA в качестве катализатора.
Пример 4
Этот пример относится к каталитическим реакциям в периодическом режиме для получения сера-метилвинилгликолята (S-MVG, метил 2-гидрокси-4-(метилтио)-бутаноат) и сера-этилвинилгликолята (S-EVG, этил 2-гидрокси-4-(метилтио)-бутаноат) из С2-сахаров (гликольальдегид).
1.6 г водного раствора, содержащего гликольальдегид (34.2 г/л), полученный из технического гликольальдегида (Гликольальдегид димер, Sigma) или полученный в результате фрагментации 40 мас. % глюкозного сиропа (WO 2014/131743), смешали либо с чистым метанолом (13.8 г; Sigma-Aldrich 99.9%), либо с чистым этанолом (13.8 г; CCS Healthcare 99.9%). Затем добавили 0.16 г катализатора и желаемое количество метантиола (Sigma, 1.7 бар), и смесь реагирует в реакторе под давлением при 160°C (температура масляной бани) при перемешивании при 900 оборотах в минуту при автогенном давлении. Начальный образец реакционной смеси применяли для вычисления превращения и выходов. Образцы собрали через 16 ч реакции и проанализировали посредством ВЭЖХ (Agilent 1200, Biorad Aminex НРХ-87Н колонка при 65°C, 0.05 М H2SO4, 0.6 мл/мин) для определения количества непревращенных С2 сахаров и образовавшихся С4 сахаров; и GC (Agilent 7890 с колонкой Phenomenex Solgelwax) применяли для определения количества следующего: Метилвинилгликолят (MVG, метил 2-гидрокси-3-бутеноат), этилвинилгликолят (EVG, этил 2-гидрокси-3-бутеноат), сера-метилвинилгликолят (S-MVG, метил 2-гидрокси-4-(метилтио)-бутаноат) и сера-этилвинилгликолят (S-EVG, этил 2-гидрокси-4-(метилтио)-бутаноат).
Таблица 5 показывает периодические реакции превращения гликольальдегида в сложные эфиры α-гидрокси аналога метионина с Sn-BEA в качестве катализатора в присутствии воды и растворителя. Количество метантиола: 3.6 ммоль. Оптимальный выход был получен в метаноле для S-EVG.
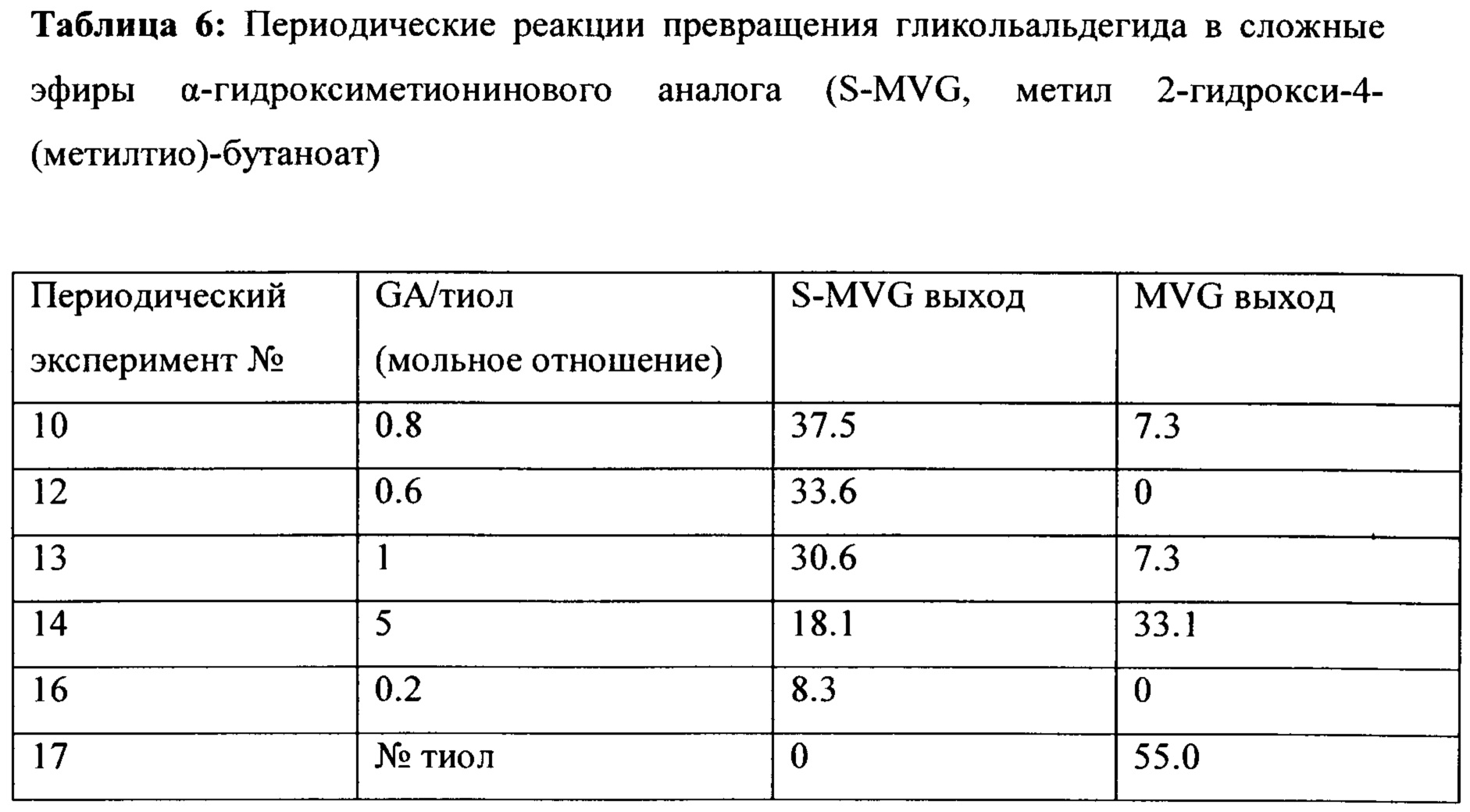
Таблица 5: Периодические реакции превращения гликольальдегида в сложные эфиры α-гидрокси аналога метионина [метилвинилгликолят (MVG, метил 2-гидрокси-3-бутеноат), этилвинилгликолят (EVG, этил 2-гидрокси-3-бутеноат), сера-метилвинилгликолят (S-MVG, метил 2-гидрокси-4-(метилтио)-бутаноат) и сера-этилвинилгликолят (S-EVG, этил 2-гидрокси-4-(метилтио)-бутаноат)]
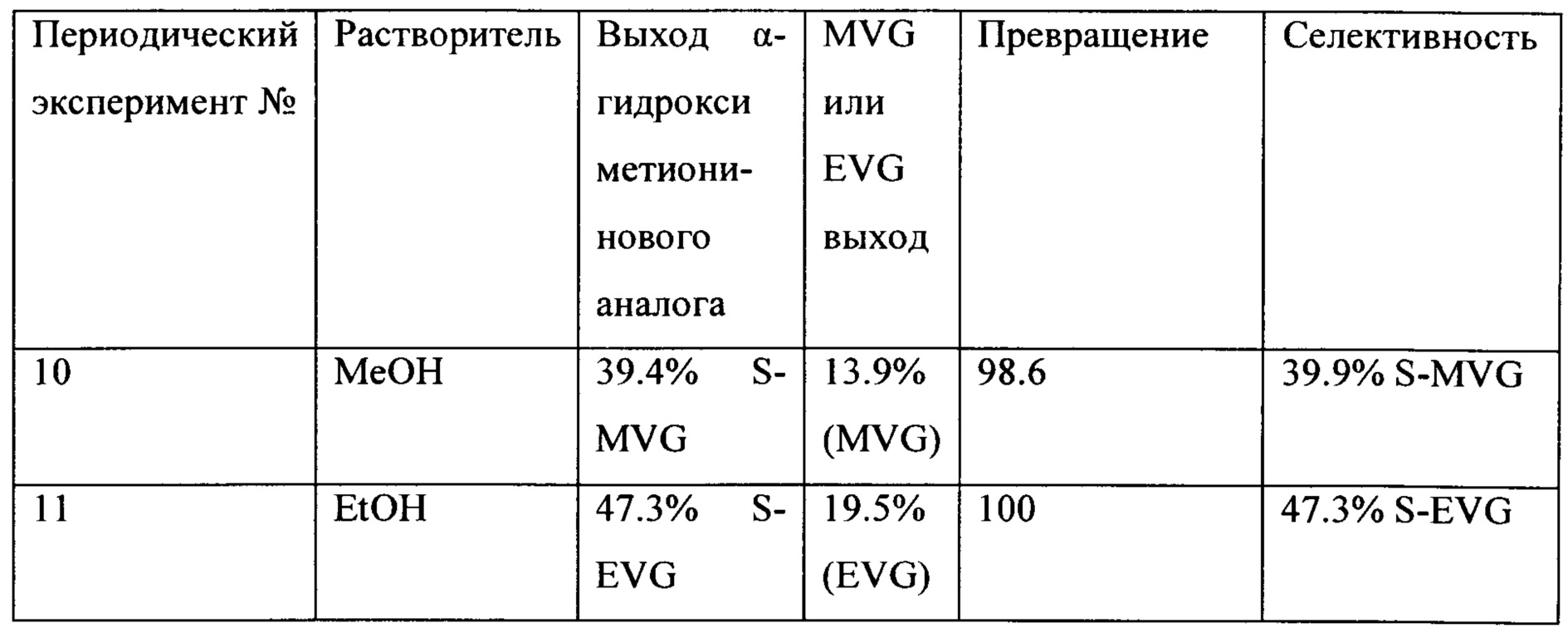
Таблица 6 показывает периодические реакции превращения гликольальдегида в сложные эфиры α-гидрокси аналога метионина с Sn-Beta в качестве катализатора в присутствии воды и метанола. Результаты иллюстрируют эффект мольного отношения GA/тиола. Оптимальный выход для S-MVG получен при мольном отношении, равном 0.8.