Результат интеллектуальной деятельности: НЕЙТРАЛИЗУЮЩИЕ МОНОКЛОНАЛЬНЫЕ ЧЕЛОВЕЧЕСКИЕ АНТИТЕЛА ПРОТИВ ИНТЕРЛЕЙКИНА-33
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Данное изобретение относится к человеческим нейтрализующим моноклональным антителам против интерлейкина-33 и к конкурирующим с ними антителам; к ингибитору экспрессии цитокина, включающему какое-либо из таких антител; и к фармацевтической композиции, содержащей какое-либо из таких антител, для лечения, предотвращения или ослабления заболеваний, связанных с интерлейкином-33.
Уровень техники
Интерлейкин-33 (далее в настоящем документе обозначаемый IL-33) - это цитокин, принадлежащий семейству интерлейкина-1, который, как считается, участвует в воспалительных состояниях. IL-33 конститутивно экспрессируется в ядре эпителиальных клеток и клеток эндотелия сосудов; он высвобождается при разрушении клеток вследствие повреждения тканей, вызванном инфекцией, физическим или химическим воздействием, и служит эндогенным активатором воспаления и врожденного иммунитета (алармином). Считается также, что имеются механизмы, путем которых экспрессия и секреция IL-33 усиливается под действием липополисахаридов или подобных агентов. Высвободившийся во внеклеточное пространство IL-33 связывается с соответствующими рецепторами, экспрессирующимися в клетках и присутствующими на их поверхности, и таким образом активирует внутриклеточные механизмы передачи сигналов. Рецепторы IL-33 экспрессируются в различных клетках иммунной системы и в эпителиальных клетках, где имеются индуцируемые IL-33 внутриклеточные механизмы передачи сигналов.
Считается, что IL-33 индуцирует воспалительный процесс при аллергических реакциях (например, при астме, атопическом дерматите, поллинозе и анафилактическом шоке), вызывая образование цитокинов типа Th2 (например, интерлейкинов IL-4, IL-5, IL-6 и IL-13) продуцируемых хелперными лимфоцитами Th2, тучными клетками, эозинофилами, базофилами, естественными Т-киллерами (NKT-клетками) и врожденными лимфоидными клетками второй группы в числе клеток иммунной системы, в которых экспрессируются рецепторы IL-33 (NPL 1: Tatsukuni Ohno et al., Allergy, 2012, Vol. 67, p. 1203). Среди клеток, в которых экспрессируются рецепторы, в тучных клетках и макрофагах воздействие IL-33 вызывает образование IL-1β, IL-6 и фактора некроза опухолей α (TNF-α), который, как предполагается, участвует в развитии артрита, индуцируемого аутоантителами (в модели ревматоидного артрита) (NPL 2: Damo Xu et al., Journal of Immunology, 2010, Vol. 184, p. 2620). Предполагается, что антагонисты IL-33 эффективны при остром поражении почек (NPL 3: АН Akcay et al., Journal of American Society Nephrology, 2011, Vol. 22, p. 2057). Усиленная экспрессия IL-33 наблюдается при различных воспалительных заболеваниях человека (например, при ревматоидном артрите, астме, системной склеродермии, фиброзе - например, фиброзе печени и легких, псориазе, язвенном колите, болезни Крона, рассеянном склерозе и анкилозирующем спондилите); считается также, что IL-33 участвует в развитии и течении различных заболеваний (NPL 4: Yasushi Matsuyama et al., Journal of Rheumatology, 2010, Vol. 37, p. 18; NPL 5: David Prefontaine et al., Journal of Allergy and Clinical Immunology, 2010, Vol. 125, p. 752; NPL 6: Koichi Yanaba et al., Clinical Rheumatology, 2011, Vol. 30, p. 825; NPL 7: A.L. Rankin et al., Journal of Immunology, 2010, Vol. 184, p. 1526; NPL 8: Tamar Mchedlidze et al., Immunity, 2013, Vol. 39, p. 357; NPL 9: Liang-An Hu et al., Asian Pacific Journal of Cancer Prevention, 2013, Vol. 14, p. 2563; NPL 10: Luca Pastorelli et al., Proceedings of the National Academy of Sciences of the United States of America, 2010, vol. 107, p. 8017).
На базе знаний о связи IL-33 с различными заболеваниями, в частности с воспалительными заболеваниями, разрабатывались агонисты и антагонисты IL-33 (PTL 1-4). Среди агонистов и антагонистов IL-33 привлекают внимание антитела против IL-33 в силу их специфичности и потенциальной эффективности. В числе таких агентов были разработаны антитела, направленные против мышиных антител, не специфичных к соответствующему эпитопу (PTL 1); антитела, распознающие как эпитоп участок IL-33, включающий сайт расщепления каспазой (аминокислотные остатки с 155-го по 198-й последовательности SEQ ID NO: 226; см. Перечень последовательностей), на основании сведений о сайте специфичного расщепления каспазой в IL-33 и о том, что активной формой IL-33 является его не расщепленная форма (PTL2); кроме того, в продаже имеется ряд подходящих козьих поликлональных антител. На интернет-сайте компании AnaptysBio, Inc. в статье, датированной 10.01.2014, сообщается об успешном получении препарата ANB020, являющегося кандидатом на разработку терапевтических антител против IL-33 с использованием созданной в этой фирме технологии соматического гипермутагенеза (платформы SHM-XEL) (NPL 11: Hamza Suria, 'AnaptysBio announces development of novel anti-IL-33 therapeutic antibody', [on line], 2014, [retrieved on 11 January 2014], Retrieved from Internet: <URL: http://www.anaptysbio.com/anti-il-33/>). В работе Murphy et al. сообщается, что получены 20 типов человеческих моноклональных антител против IL-33 с использованием технологии Veloclmmune на трансгенных мышах, несущих гены, кодирующие вариабельную область человеческих антител (PTL 5), но эпитоп для этих антител не описывается. Кроме того, аминокислотные последовательности каркасных областей этих 20 типов человеческих моноклональных антител против IL-33 отличаются от человеческих последовательностей зародышевой линии двумя или более аминокислотными остатками. Из-за такой разницы введение указанных антител людям вызывает иммунный ответ с образованием антител против человеческих иммуноглобулинов (НАНА), что нежелательным образом уменьшает эффект введенных антител и приводит к воспалению или иным побочным эффектам.
Перечень цитируемых источников
Патентные публикации
PTL 1: WO 2005/079844
PTL 2: WO 2008/132709
PTL 3:WO 2011/031600
PTL 4: WO 2008/144610
PTL 5: WO 2014/164959
Непатентные публикации
NPL 1: Tatsukuni Ohno et al., Allergy, 2012, Vol. 67, p. 120
NPL 2: Damo Xu et al., Journal of Immunology, 2010, Vol. 184, p. 2620
NPL 3: Ali Akcay et al., Journal of American Society Nephrology, 2011, Vol. 22, p. 2057
NPL 4: Yasushi Matsuyama et al., Journal of Rheumatology, 2010, Vol. 37, p. 18
NPL 5: David Prefontaine et al., Journal of Allergy and Clinical Immunology, 2010, Vol. 125, p. 752
NPL 6: Koichi Yanaba et al., Clinical Rheumatology, 2011, Vol. 30, p. 825
NPL 7: A.L. Rankin et al., Journal of Immunology, 2010, Vol. 184, p. 1526
NPL 8: Tamar Mchedlidze et al., Immunity, 2013, Vol. 39, p. 357
NPL 9: Liang-An Hu et al., Asian Pacific Journal of Cancer Prevention, 2013, Vol. 14, p. 2563
NPL 10: Luca Pastorelli et al., Proceedings of the National Academy of Sciences of the United States of America, 2010, vol. 107, p. 8017
NPL 11: Hamza Suria, 'AnaptysBio announces development of novel anti-IL-33 therapeutic antibody', [on line], 2014, [retrieved on 11 January 2014], Retrieved from Internet: <URL: http://www.anaptysbio.com/anti-il-33/>
Раскрытие изобретения
Задачи изобретения
В последние годы связь IL-33 с некоторыми заболеваниями прояснилась, и на повестку дня встала разработка нейтрализующих моноклональных антител против IL-33, обладающих антагонистическим в отношении этого цитокина эффектом. Действие нейтрализующего моноклонального антитела против IL-33 в значительной степени определяется областью IL-33, в которой находится эпитоп, связываемый этим антителом. Поскольку IL-33 высвобождается во внеклеточное пространство при разрушении клеток, он, скорее всего, расщепляется лизосомальными протеолитическими ферментами, в результате чего образуется так называемый зрелый IL-33 и множество происходящих из него фрагментов, обладающих активностью IL-33. Если эти фрагменты включают эпитоп, состоящий из непрерывной аминокислотной последовательности, то моноклональные антитела, способные связываться с эпитопом, состоящим из непрерывной аминокислотной последовательности IL-33, более предпочтительны, чем моноклональные антитела, способные связываться с эпитопом, состоящим из дискретной аминокислотной последовательности, поскольку первые способны прочно связываться с непрерывной аминокислотной последовательностью одного из фрагментов и подавляют связывание этого фрагмента с рецепторами IL-33. Однако было трудно идентифицировать такой эпитоп, состоящий из непрерывной аминокислотной последовательности, для получения моноклональных антител против IL-33, обладающих желаемым антагонистическим эффектом.
Нейтрализующие моноклональные антитела против IL-33, способные связываться с эпитопом, состоящим из непрерывной аминокислотной последовательности IL-33, предпочтительно проявляют низкую антигенность при введении человеку или иному субъекту. Человеческие антитела предпочтительно проявляют низкую антигенность при введении человеку, и в них имеются каркасные области, содержащие аминокислотные последовательности каркасных участков зародышевой линии человека или аминокислотные последовательности, состоящие из их комбинаций. Однако когда платформу SHM-XEL или подобную технологию используют применительно к человеческим антителам, входящим в библиотеку человеческих генов антител, то мутации аминокислотной последовательности имеют место не только в областях, определяющих комплементарность (CDR), но также в каркасных областях. Кроме того, если трансгенных мышей с геном человеческого антитела иммунизировать человеческим белком IL-33 для получения человеческих нейтрализующих моноклональных антител против IL-33, то неизбежны мутации в аминокислотных последовательностях каркасных участков нейтрализующих моноклональных антител против IL-33. Соответственно, трудно выделить изолированные человеческие моноклональные антитела против IL-33, включающие каркасные участки, содержащие аминокислотные последовательности каркасных областей зародышевой линии человека, или аминокислотные последовательности, состоящие из их сочетаний. Техническое решение
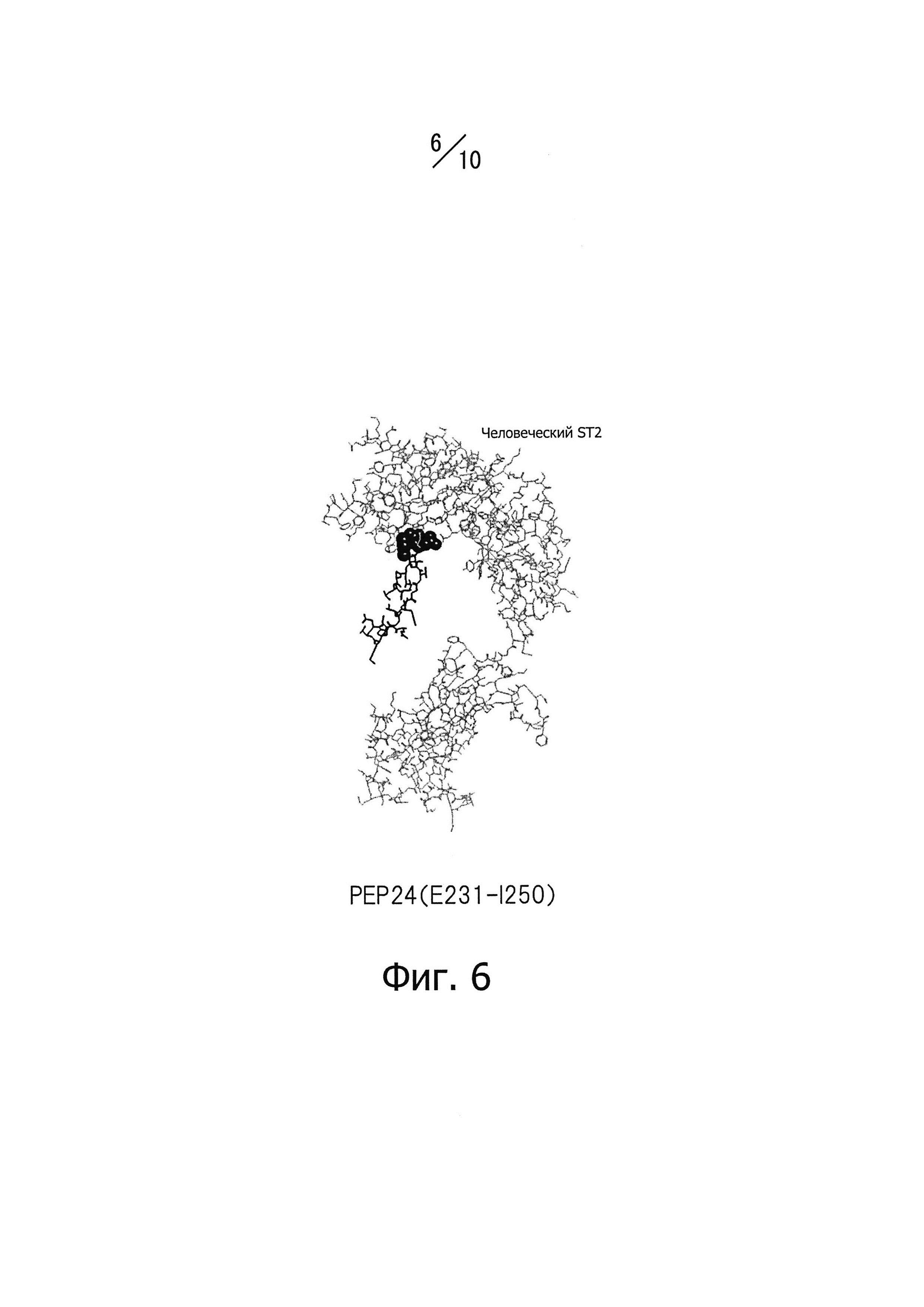
Авторы данного изобретения, предприняв большие усилия для решения указанных проблем, обнаружили, что антитела, способные прочно связываться с эпитопом, который принято было считать предпочтительным, то есть с эпитопом, представленным последовательностью аминокислотных остатков в положениях с 155-го по 198-е полипептидной цепи IL-33, обладают небольшим антагонистическим эффектом и что обладающие антагонистическим эффектом антитела, способные связываться с IL-33, взаимодействуют, скорее всего, с эпитопом, состоящим из непрерывной аминокислотной последовательности, представленной аминокислотными остатками в положениях с 101-го по 154-е или с 199-го по 270-е полипептидной цепи IL-33, в частности в положениях с 111-го по 130-е, с 131-го по 150-е, с 231-го по 250-е или с 251-го по 270-е; эта работа привела к данному изобретению.
Авторы данного изобретения также выделили из библиотеки человеческих антител человеческие нейтрализующие моноклональные антитела против IL-33 и добились мутаций только в участках, определяющих комплементарность, чтобы идентифицировать определяющие комплементарность участки с высокой способностью к связыванию и желаемыми физическими свойствами. В результате этой работы авторы данного изобретения успешно получили человеческие антитела, в которых имеются каркасные участки, состоящие из аминокислотных последовательностей без мутаций - по сравнению с аминокислотными последовательностями человеческих каркасных участков зародышевой линии, и которые способны связываться с человеческим IL-33, тем самым нейтрализуя его функционирование. Данное изобретение включает следующие объекты.
[1]. Моноклональные антитела, способные связываться с эпитопом, состоящим из непрерывной аминокислотной последовательности, включающей аминокислотные остатки в положениях с 101-го по 154-е или с 199-го по 270-е последовательности SEQ ID NO: 226, приведенной в Перечне последовательностей.
[2]. Антитела по пункту 1, в котором эпитоп, состоящий из непрерывной аминокислотной последовательности, включающей аминокислотные остатки в положениях с 101-го по 154-е или с 199-го по 270-е последовательности SEQ ID NO: 226, приведенной в Перечне последовательностей, состоит из непрерывной аминокислотной последовательности, включающей аминокислотные остатки в положениях с 111-го по 130-е, с 131-го по 150-е, с 231-го по 250-е или с 251-го по 270-е последовательности SEQ ID NO: 226, приведенной в Перечне последовательностей.
[3]. Антитела по пункту 1 или 2, в котором эпитоп, состоящий из непрерывной аминокислотной последовательности, включающей аминокислотные остатки в положениях с 101-го по 154-е или с 199-го по 270-е последовательности SEQ ID NO: 226, приведенной в Перечне последовательностей, состоит из аминокислотной последовательности, включающей аминокислотные остатки, выбираемые из Р118, 1119, Т120, Y122, L123, R124, S125, L126, S127, Y129, N130, D131, Q132, S133, Т135, А137, L138, Е139, S142, Y143, Е144, 1145, Y146, Е148, D149, L150, D244, N245, Н246, K266, L267, S268 и Е269.
[4]. Антитела по любому из пунктов 1-3, в котором эпитоп, состоящий из непрерывной аминокислотной последовательности, включающей аминокислотные остатки в положениях с 101-го по 154-е или с 199-го по 270-е последовательности SEQ ID NO: 226, приведенной в Перечне последовательностей, состоит из непрерывно расположенных аминокислотных остатков в положениях с 111-го по 130-е, с 131-го по 150-е, с 231-го по 250-е или с 251-го по 270-е последовательности SEQ ID NO: 226, приведенной в Перечне последовательностей.
[5]. Антитела по любому из пунктов 1-4, в котором эпитоп, состоящий из непрерывной аминокислотной последовательности, включающей последовательность, охватывающую положения с 101-го по 154-е или с 199-го по 270-е последовательности SEQ ID NO: 226, приведенной в Перечне последовательностей, состоит из непрерывной аминокислотной последовательности, включающей аминокислотные остатки в положениях с 138-го по 147-й или с 139-го по 147-е последовательности SEQ ID NO: 226, приведенной в Перечне последовательностей.
[6]. Антитела по любому из пунктов 1-5, в котором моноклональные антитела, способные связываться с эпитопом, состоящим из непрерывной аминокислотной последовательности, включающей аминокислотные остатки в положениях с 101-го по 154-е или с 199-го по 270-е последовательности SEQ ID NO: 226, приведенной в Перечне последовательностей, являются антагонистами IL-33.
[7]. Антитела по любому из пунктов 1-6, в котором моноклональные антитела, способные связываться с эпитопом, состоящим из непрерывной аминокислотной последовательности, включающей аминокислотные остатки в положениях с 101-го по 154-е или с 199-го по 270-е последовательности SEQ ID NO: 226, приведенной в Перечне последовательностей, подавляют связывание IL-33 с его рецепторами.
[8]. Фармацевтическая композиция для лечения, предотвращения или облегчения заболевания, ассоциированного с IL-33, содержащая антитела по любому из пунктов 1-7.
[9]. Ингибитор экспрессии цитокинов, содержащий антитела по любому из пунктов 1-7.
[10]. Ингибитор по пункту 9, который подавляет экспрессию TNF-α, IFN-γ, IL-1β, IL-4, IL-5, IL-6 или IL-13.
[11]. Ингибитор по пункту 9 или 10, который подавляет экспрессию IFN-γ, IL-5, IL-6 или IL-13.
[12]. Эпитоп, выбираемый из группы, состоящей из:
1) эпитоп по любому из пунктов 1-5;
2) эпитоп, состоящий из аминокислотной последовательности, в которой в непрерывной аминокислотной последовательности эпитопа по подпункту 1 заменены, изъяты или добавлены один или несколько аминокислотных остатков; и
3) эпитоп, состоящий из аминокислотной последовательности, которая по меньшей мере на 90% идентична непрерывной аминокислотной последовательности указанного эпитопа.
[13]. Антитела, созданные или найденные при скрининге с использованием эпитопа по пункту 12.
[14]. Антитела по любому из пунктов 1-7, в котором моноклональные антитела, способные связываться с эпитопом, состоящим из непрерывной аминокислотной последовательности, включающей аминокислотные остатки в положениях с 101-го по 154-е или с 199-го по 270-е последовательности SEQ ID NO: 226, приведенной в Перечне последовательностей, являются химерными, гуманизированными или человеческими.
[15]. Антитела по пункту 14, в котором аминокислотные последовательности каркасных участков являются аминокислотными последовательностями каркасных участков человеческой зародышевой линии или комбинацией их аминокислотных последовательностей.
[16]. Антитела по пункту 15, в котором аминокислотную последовательность каркасного участка 1 легкой цепи составляют аминокислотные остатки в положениях с 1-го по 22-е последовательности SEQ ID NO: 317, приведенной в Перечне последовательностей; аминокислотную последовательность каркасного участка 2 легкой цепи составляют аминокислотные остатки в положениях с 36-го по 50-й последовательности SEQ ID NO: 317, приведенной в Перечне последовательностей; аминокислотную последовательность каркасного участка 3 легкой цепи составляют аминокислотные остатки в положениях с 58-го по 89-е последовательности SEQ ID NO: 317, приведенной в Перечне последовательностей; аминокислотную последовательность каркасного участка 4 легкой цепи составляют аминокислотные остатки в положениях с 3-го по 12-е последовательности SEQ ID NO: 401, приведенной в Перечне последовательностей; аминокислотную последовательность каркасного участка 1 тяжелой цепи составляют аминокислотные остатки в положениях с 1-го по 30-е последовательности SEQ ID NO: 367 или с 1-го по 30-е последовательности SEQ ID NO: 368, приведенных в Перечне последовательностей; аминокислотную последовательность каркасного участка 2 тяжелой цепи составляют аминокислотные остатки в положениях с 36-го по 49-е последовательности SEQ ID NO: 367 или с 36-го по 49-е последовательности SEQ ID NO: 368, приведенных в Перечне последовательностей; аминокислотную последовательность каркасного участка 3 тяжелой цепи составляют аминокислотные остатки в положениях с 67-го по 98-е последовательности SEQ ID NO: 367 или с 67-го по 98-е последовательности SEQ ID NO: 368, приведенных в Перечне последовательностей; и аминокислотную последовательность каркасного участка 4 тяжелой цепи составляют аминокислотные остатки в положениях с 5-го по 15-е последовательности SEQ ID NO: 407, приведенной в Перечне последовательностей.
[17]. Антитела по пункту 15 или 16, в котором аминокислотную последовательность каркасного участка 1 легкой цепи составляют аминокислотные остатки в положениях с 1-го по 22-е последовательности SEQ ID NO: 317, приведенной в Перечне последовательностей; аминокислотную последовательность каркасного участка 2 легкой цепи составляют аминокислотные остатки в положениях с 36-го по 50-й последовательности SEQ ID NO: 317, приведенной в Перечне последовательностей; аминокислотную последовательность каркасного участка 3 легкой цепи составляют аминокислотные остатки в положениях с 58-го по 89-е последовательности SEQ ID NO: 317, приведенной в Перечне последовательностей; аминокислотную последовательность каркасного участка 4 легкой цепи составляют аминокислотные остатки в положениях с 3-го по 12-е последовательности SEQ ID NO: 401, приведенной в Перечне последовательностей; аминокислотную последовательность каркасного участка 1 тяжелой цепи составляют аминокислотные остатки в положениях с 1-го по 30-е последовательности SEQ ID NO: 367, приведенной в Перечне последовательностей; аминокислотную последовательность каркасного участка 2 тяжелой цепи составляют аминокислотные остатки в положениях с 36-го по 49-е последовательности SEQ ID NO: 367, приведенной в Перечне последовательностей; аминокислотную последовательность каркасного участка 3 тяжелой цепи составляют аминокислотные остатки в положениях с 67-го по 98-е последовательности SEQ ID NO: 368, приведенной в Перечне последовательностей; и аминокислотную последовательность каркасного участка 4 тяжелой цепи составляют аминокислотные остатки в положениях с 5-го по 15-е последовательности SEQ ID NO: 407, приведенной в Перечне последовательностей.
[18]. Выделенные человеческие нейтрализующие антитела против IL-33, в которых комбинацию аминокислотных последовательностей участка 1 легкой цепи, определяющего комплементарность (LCDR1), участка 2 легкой цепи, определяющего комплементарность 2 (LCDR2), участка 3 легкой цепи, определяющего комплементарность (LCDR3), участка 1 тяжелой цепи, определяющего комплементарность (HCDR1), участка 2 тяжелой цепи, определяющего комплементарность (HCDR2), и участка 3 тяжелой цепи, определяющего комплементарность (HCDR3) выбирают из комбинаций, представленных в таблице 1 обозначениями с С1 по С30.
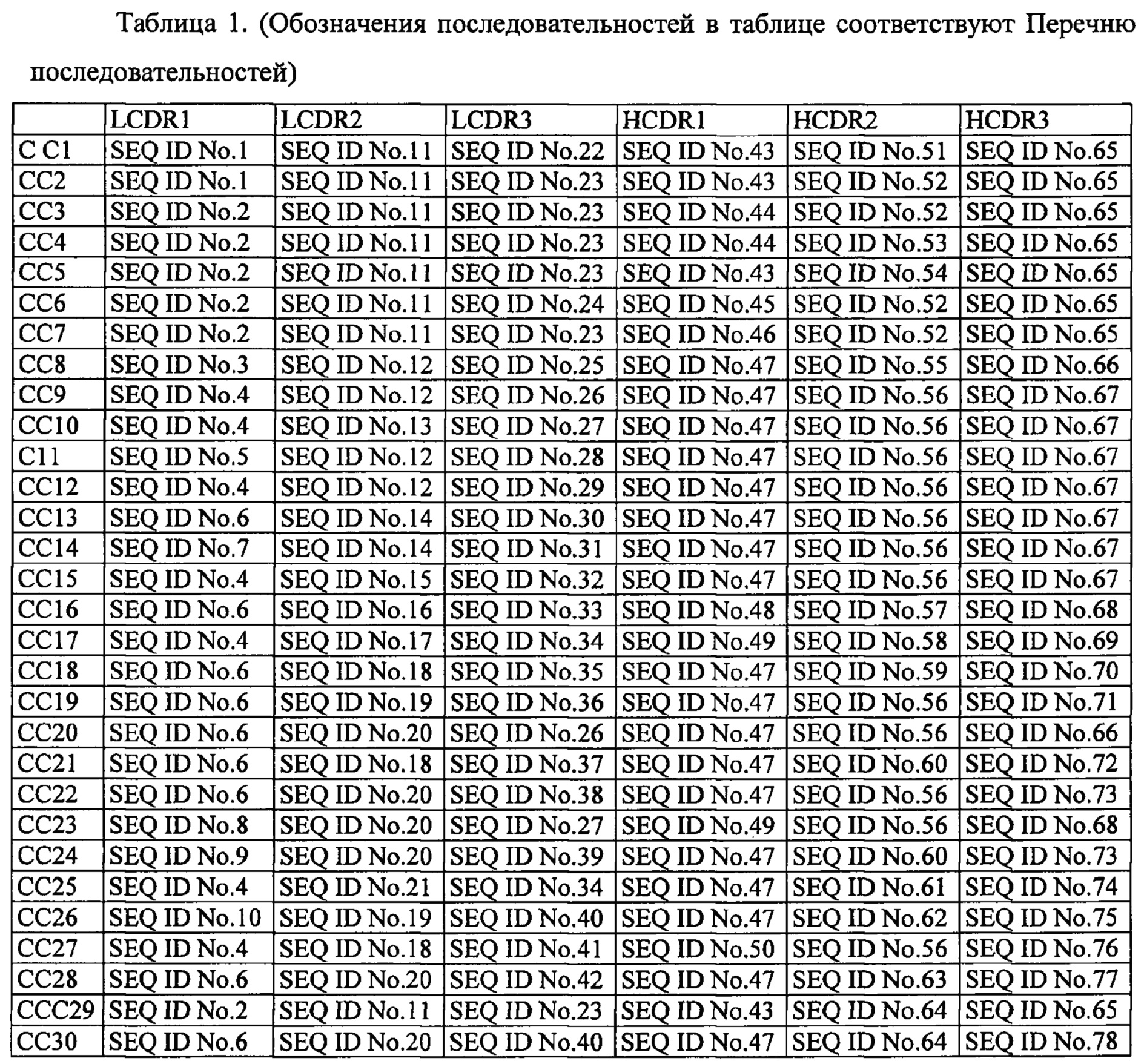
[19]. Человеческие нейтрализующие моноклональные антитела против IL-33 по пункту 18, в котором комбинацию аминокислотных последовательностей участка 1 легкой цепи, определяющего комплементарность (LCDR1), участка 2 легкой цепи, определяющего комплементарность 2 (LCDR2), участка 3 легкой цепи, определяющего комплементарность (LCDR3), участка 1 тяжелой цепи, определяющего комплементарность (HCDR1), участка 2 тяжелой цепи, определяющего комплементарность (HCDR2), и участка 3 тяжелой цепи, определяющего комплементарность (HCDR3) выбирают из комбинаций, представленных в таблице 1 обозначениями с C1 по С28.
[20]. Человеческие нейтрализующие моноклональные антитела против IL-33 по пункту 18 или 19, в котором комбинацию аминокислотных последовательностей участка 1 легкой цепи, определяющего комплементарность (LCDR1), участка 2 легкой цепи, определяющего комплементарность 2 (LCDR2), участка 3 легкой цепи, определяющего комплементарность (LCDR3), участка 1 тяжелой цепи, определяющего комплементарность (HCDR1), участка 2 тяжелой цепи, определяющего комплементарность (HCDR2), и участка 3 тяжелой цепи, определяющего комплементарность (HCDR3) выбирают из комбинаций, представленных в таблице 1 обозначениями C1, С8, С15, С17 и С18.
[21]. Человеческие нейтрализующие моноклональные антитела против IL-33 по любому из пунктов 18-20, в котором аминокислотная последовательность каркасного участка антитела является аминокислотными последовательностями каркасных участков человеческой зародышевой линии или комбинацией их аминокислотных последовательностей.
[22]. Человеческие нейтрализующие моноклональные антитела против IL-33 по любому из пунктов 18-21, в котором аминокислотную последовательность каркасного участка 1 легкой цепи составляют аминокислотные остатки в положениях с 1-го по 22-е последовательности SEQ ID NO: 317, приведенной в Перечне последовательностей; аминокислотную последовательность каркасного участка 2 легкой цепи составляют аминокислотные остатки в положениях с 36-го по 50-е последовательности SEQ ID NO: 317, приведенной в Перечне последовательностей; аминокислотную последовательность каркасного участка 3 легкой цепи составляют аминокислотные остатки в положениях с 58-го по 89-е последовательности SEQ ID NO: 317, приведенной в Перечне последовательностей; аминокислотную последовательность каркасного участка 4 легкой цепи составляют аминокислотные остатки в положениях с 3-го по 12-е последовательности SEQ ID NO: 401, приведенной в Перечне последовательностей; аминокислотную последовательность каркасного участка 1 тяжелой цепи составляют аминокислотные остатки в положениях с 1-го по 30-е последовательности SEQ ID NO: 367 или с 1-го по 30-е последовательности SEQ ID NO: 368, приведенных в Перечне последовательностей; аминокислотную последовательность каркасного участка 2 тяжелой цепи составляют аминокислотные остатки в положениях с 36-го по 49-е последовательности SEQ ID NO: 367 или с 36-го по 49-е последовательности SEQ ID NO: 368, приведенных в Перечне последовательностей; аминокислотную последовательность каркасного участка 3 тяжелой цепи составляют аминокислотные остатки в положениях с 67-го по 98-е последовательности SEQ ID NO: 367 или с 67-го по 98-е последовательности SEQ ID NO: 368, приведенных в Перечне последовательностей; и аминокислотную последовательность каркасного участка 4 тяжелой цепи составляют аминокислотные остатки в положениях с 5-го по 15-е последовательности SEQ ID NO: 407, приведенной в Перечне последовательностей.
[23]. Человеческие нейтрализующие моноклональные антитела против IL-33 по любому из пунктов 18-22, в котором комбинацию соответствующих аминокислотных последовательностей вариабельных областей легких и тяжелых цепей выбирают из комбинаций, приведенных в таблице 2 под обозначениями с V1 по V30.
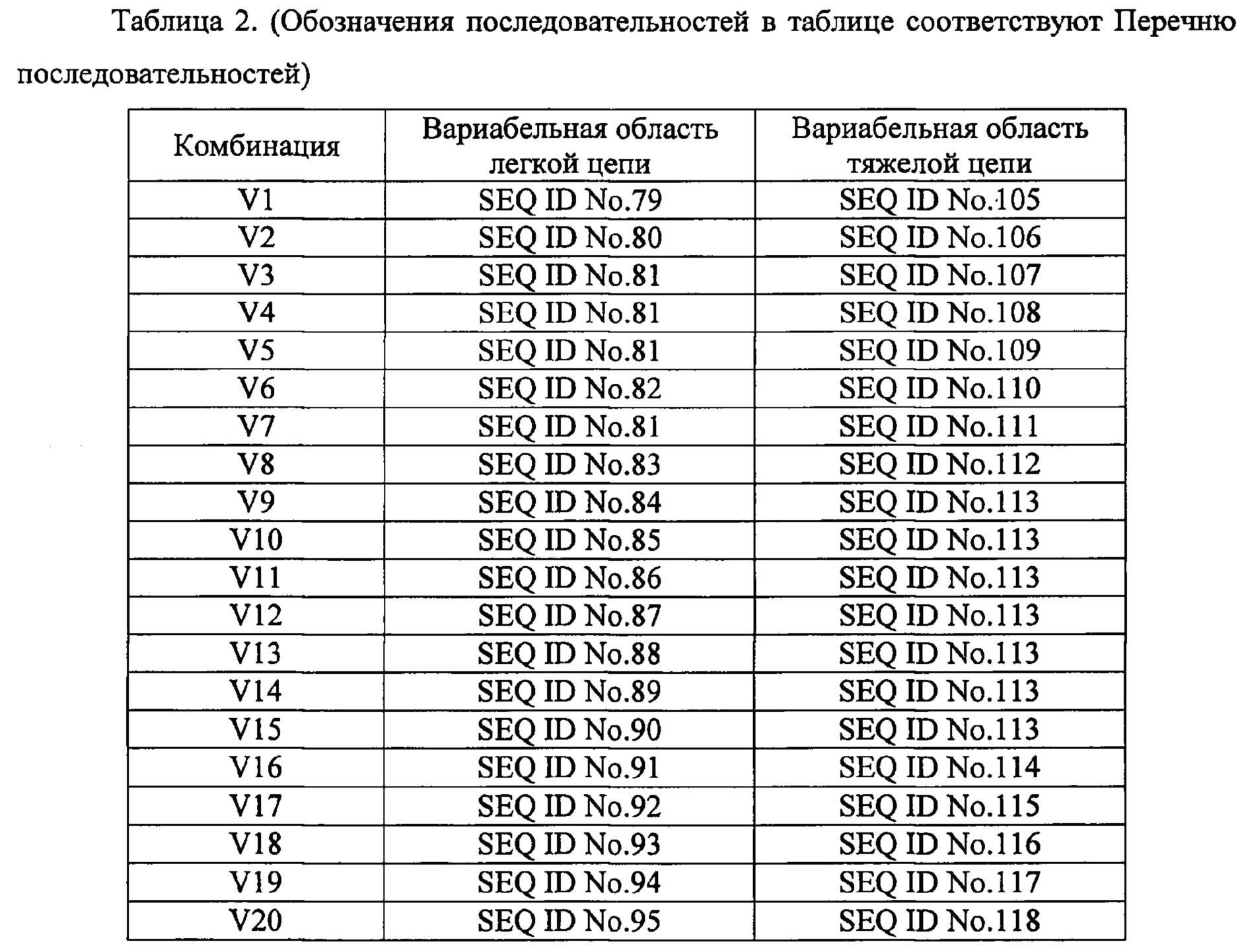
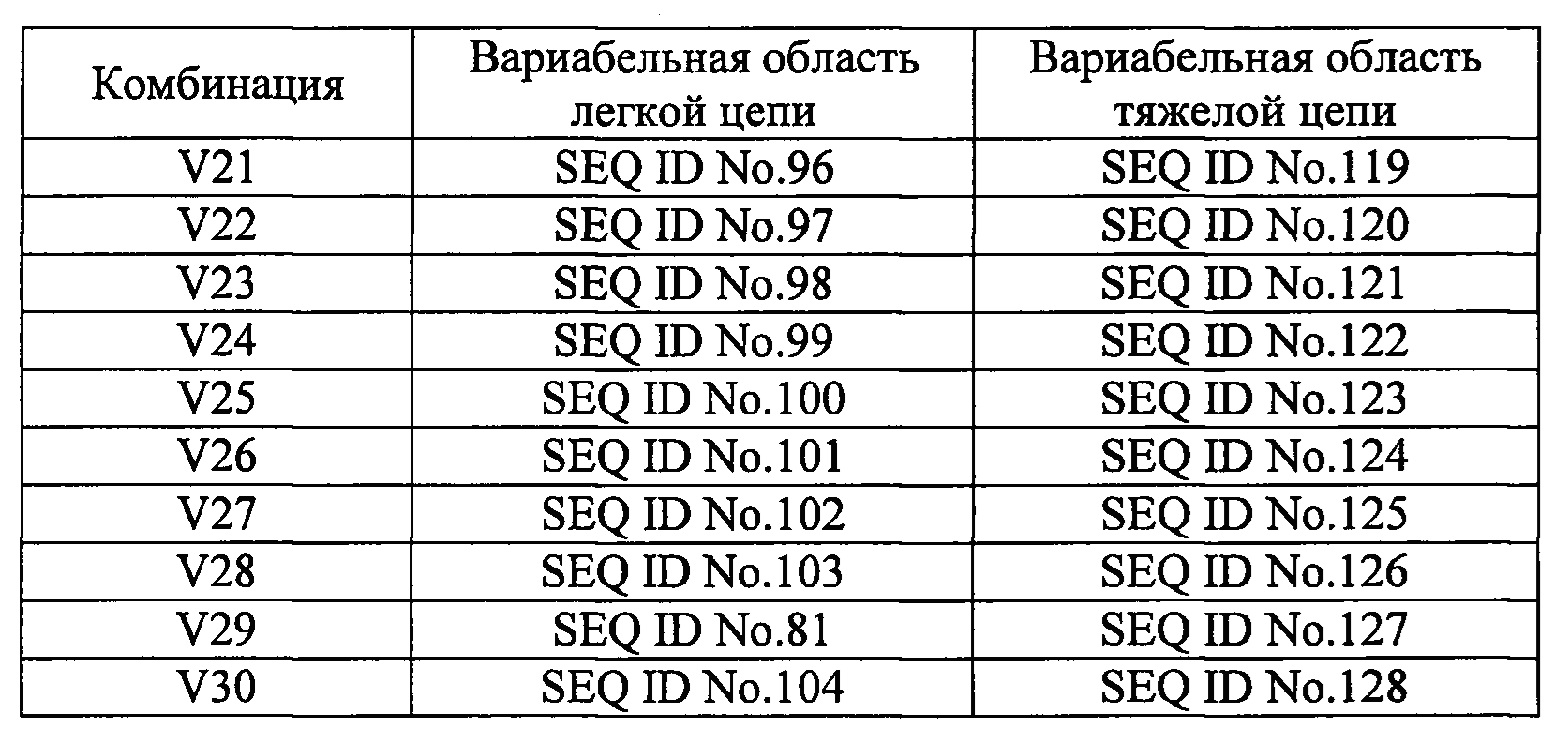
[24]. Человеческие нейтрализующие моноклональные антитела против IL-33 по пункту 23, в котором комбинацию соответствующих аминокислотных последовательностей вариабельных областей легких и тяжелых цепей выбирают из комбинаций, приведенных в таблице 2 под обозначениями с V1 по V28.
[25]. Человеческие нейтрализующие моноклональные антитела против IL-33 по пункту 23 или 24, в котором комбинацию соответствующих аминокислотных последовательностей вариабельных областей легких и тяжелых цепей выбирают из комбинаций, приведенных в таблице 2 под обозначениями V1, V8, V15, V17 и V18.
[26]. Человеческие нейтрализующие моноклональные антитела против IL-33 по любому из пунктов 18-25, в котором легкая цепь является цепью типа X.
[27]. Человеческие нейтрализующие моноклональные антитела против IL-33 по любому из пунктов 18-26, в котором человеческие нейтрализующие моноклональные антитела против IL-33 являются иммуноглобулинами класса G (IgG).
[28]. Человеческие нейтрализующие моноклональные антитела против IL-33 по любому из пунктов 18-27, в котором антиген является человеческим или обезьяньим IL-33.
[29]. Молекула нуклеиновой кислоты, кодирующая белковую часть человеческих нейтрализующих моноклональных антител против IL-33 по любому из пунктов 18-28.
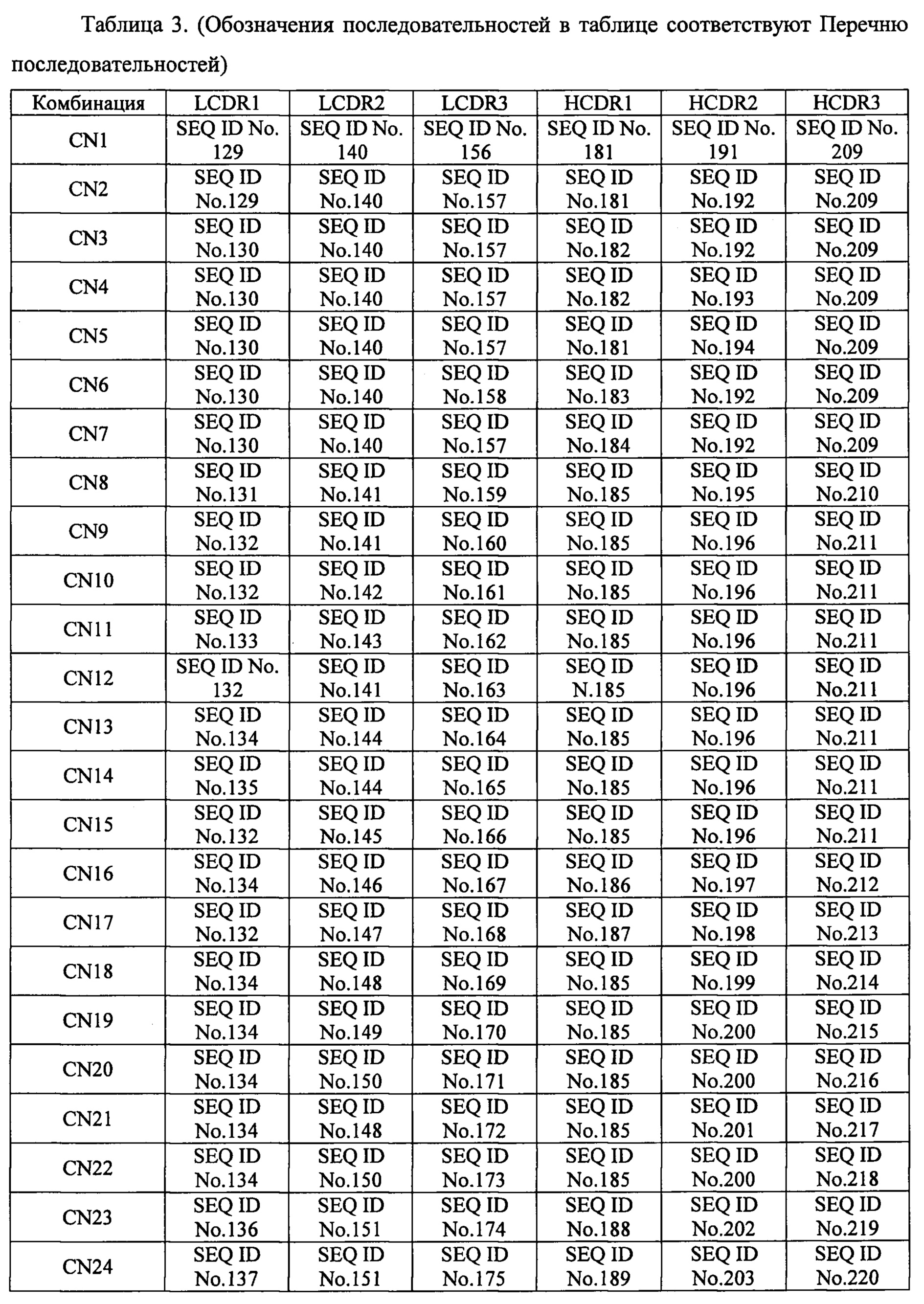
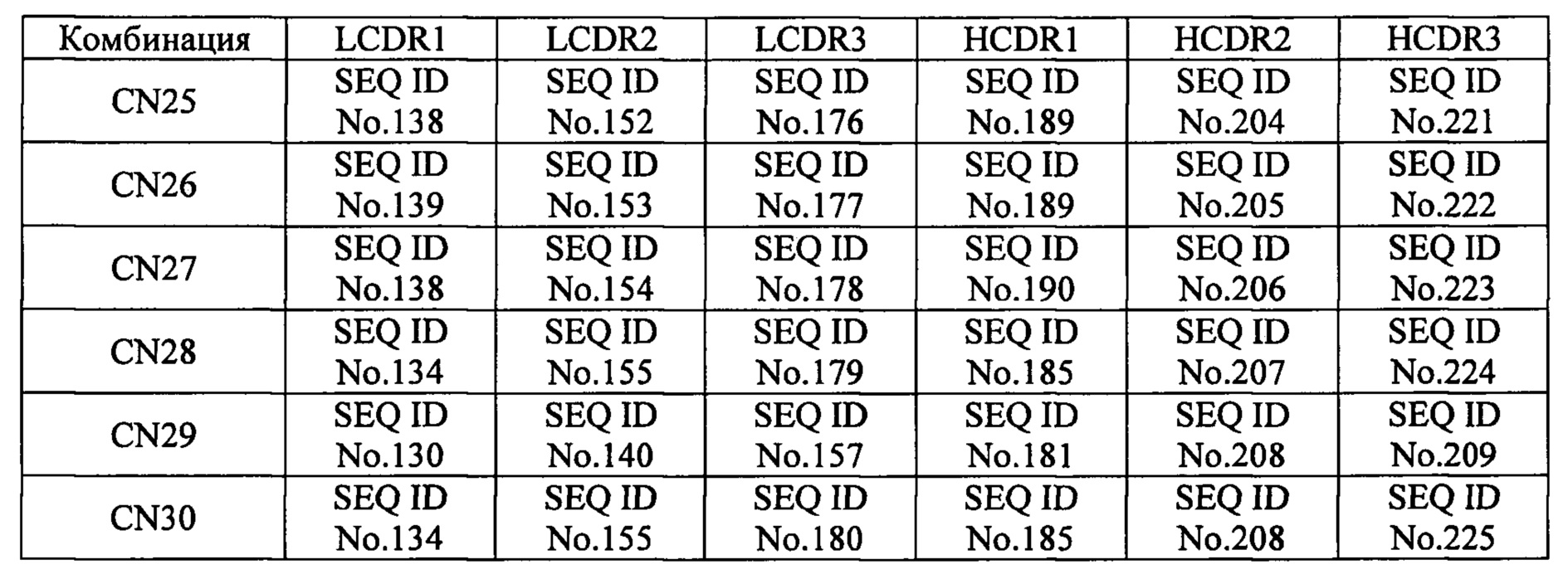
[30]. Молекула нуклеиновой кислоты по пункту 29, в котором комбинацию нуклеотидных последовательностей, соответственно кодирующих аминокислотные последовательности С участка 1 легкой цепи, определяющего комплементарность (LCDR1), участка 2 легкой цепи, определяющего комплементарность 2 (LCDR2), участка 3 легкой цепи, определяющего комплементарность (LCDR3), участка 1 тяжелой цепи, определяющего комплементарность (HCDR1), участка 2 тяжелой цепи, определяющего комплементарность (HCDR2), и участка 3 тяжелой цепи, определяющего комплементарность (HCDR3) выбирают из комбинаций, представленных в таблице 3 обозначениями с CN1 по CN3:
[31]. Вектор, содержащий молекулу нуклеиновой кислоты по пункту 29 или 30.
[32]. Клетка-хозяин, несущая вектор по пункту 31.
[33]. Способ получения человеческих нейтрализующих моноклональных антител против IL-33 по любому из пунктов 18-28, включающий культивирование клеток-хозяев по пункту 32.
[34]. Ингибитор экспрессии цитокинов, содержащий человеческие нейтрализующие моноклональные антитела против IL-33 по любому из пунктов 18-28.
[35]. Ингибитор по пункту 34, в котором этот ингибитор подавляет экспрессию TNF-α, IFN-γ, IL-1β, IL-4, IL-5, IL-6 или IL-13.
[36]. Ингибитор по пункту 34 или 35, в котором этот ингибитор подавляет экспрессию IFN-γ, IL-5, IL-6 или IL-13.
[37]. Фармацевтическая композиция, содержащая человеческие нейтрализующие моноклональные антитела против IL-33 по любому из пунктов 18-28.
[38]. Фармацевтическая композиция по пункту 37 для лечения, предотвращения или облегчения заболеваний, ассоциированных с IL-33.
[39]. Фармацевтическая композиция по пункту 38, в котором заболевание, ассоциированное с IL-33, выбирают из группы, состоящей из астмы, атопического дерматита, поллиноза, анафилактического шока, синусита (включая эозинофильный синусит), болезни Крона язвенного колита, артрита, системной красной волчанки, пузырчатки, пемфигоида, склеродермии, анкилозирующего спондилита, фиброза печени (включая первичный билиарный цирроз), фиброза легких, хронических обструктивных заболеваний легких (COPD), острого поражения почек, васкулита и рака.
[40]. Нейтрализующие моноклональные антитела против IL-33, конкурирующие с антителами по пункту 20 или 25 за связывание с IL-33.
[41]. Способ лечения, предотвращения или облегчения симптомов у индивида, страдающего заболеванием, ассоциированным с IL-33, который включает введение указанному индивиду антител по любому из пунктов 1-7 и 18-28.
[42]. Способ по пункту 41, в котором заболевание, ассоциированное с IL-33, выбирают из группы, состоящей из астмы, атопического дерматита, поллиноза, анафилактического шока, синусита (включая эозинофильный синусит), болезни Крона язвенного колита, артрита, системной красной волчанки, пузырчатки, пемфигоида, склеродермии, анкилозирующего спондилита, фиброза печени (включая первичный билиарный цирроз), фиброза легких, хронических обструктивных заболеваний легких (COPD), острого поражения почек, васкулита и рака.
[43]. Применение антител по любому из пунктов 1-7 и 18-28 для изготовления лекарственного средства для лечения, предотвращения или облегчения заболевания, ассоциированных с IL-33.
[44]. Применение по пункту 43, в котором заболевание, ассоциированное с IL-33, выбирают из группы, состоящей из астмы, атопического дерматита, поллиноза, анафилактического шока, синусита (включая эозинофильный синусит), болезни Крона язвенного колита, артрита, системной красной волчанки, пузырчатки, пемфигоида, склеродермии, анкилозирующего спондилита, фиброза печени (включая первичный билиарный цирроз), фиброза легких, хронических обструктивных заболеваний легких (COPD), острого поражения почек, васкулита и рака.
[45]. Применение антител по любому из пунктов 1-7 и 18-28 для лечения, предотвращения или облегчения заболевания, ассоциированных с IL-33.
[46]. Применение по пункту 45, в котором заболевание, ассоциированное с IL-33, выбирают из группы, состоящей из астмы, атопического дерматита, поллиноза, анафилактического шока, синусита (включая эозинофильный синусит), болезни Крона язвенного колита, артрита, системной красной волчанки, пузырчатки, пемфигоида, склеродермии, анкилозирующего спондилита, фиброза печени (включая первичный билиарный цирроз), фиброза легких, хронических обструктивных заболеваний легких (COPD), острого поражения почек, васкулита и рака.
[47]. Способ лечения, предотвращения или облегчения симптомов у индивида, нуждающегося в подавлении экспрессии цитолкинов, который включает введение указанному индивиду антител по любому из пунктов 1-7 и 18-28.
[48]. Способ по пункту 47, в котором цитокин является TNF-α, IFN-γ, IL-1β, IL-4, IL-5, IL-6 или IL-13.
[49]. Применение антител по любому из пунктов 1-7 и 18-28 для изготовления ингибитора экспрессии цитокинов.
[50]. Применение по пункту 49, в котором цитокин является TNF-α, IFN-γ, IL-1β, IL-4, IL-5, IL-6 или IL-13.
Преимущества изобретения
Поскольку моноклональные антитела по данному изобретению способны связываться с эпитопом, состоящим из непрерывной аминокислотной последовательности, эти антитела легко проявляют свой нейтрализующий эффект, связываясь с непрерывной аминокислотной последовательностью, даже в том случае, когда IL-33 расщеплен на фрагменты.
Вероятность того, что моноклональные антитела по данному изобретению, будучи введены человеку, индуцируют антитела против иммуноглобулинов человека (НАНА), направленные против их каркасных участков и/или участков, определяющих комплементарность, невелика. Антитела по данному изобретению могут обладать длительным эффектом нейтрализации IL-33 in vivo, если они не ингибируются НАНА. Кроме того, антитела по данному изобретению безопасны в применении, если воспаление не вызвано связыванием с НАНА. Моноклональные антитела по данному изобретению способны связываться с человеческим IL-33, нейтрализуя его действие, и таким образом их можно применять в качестве нового фармацевтического средства для диагностирования, предотвращения, лечения или облегчения заболеваний, ассоциированных с IL-33.
Краткое описание иллюстраций
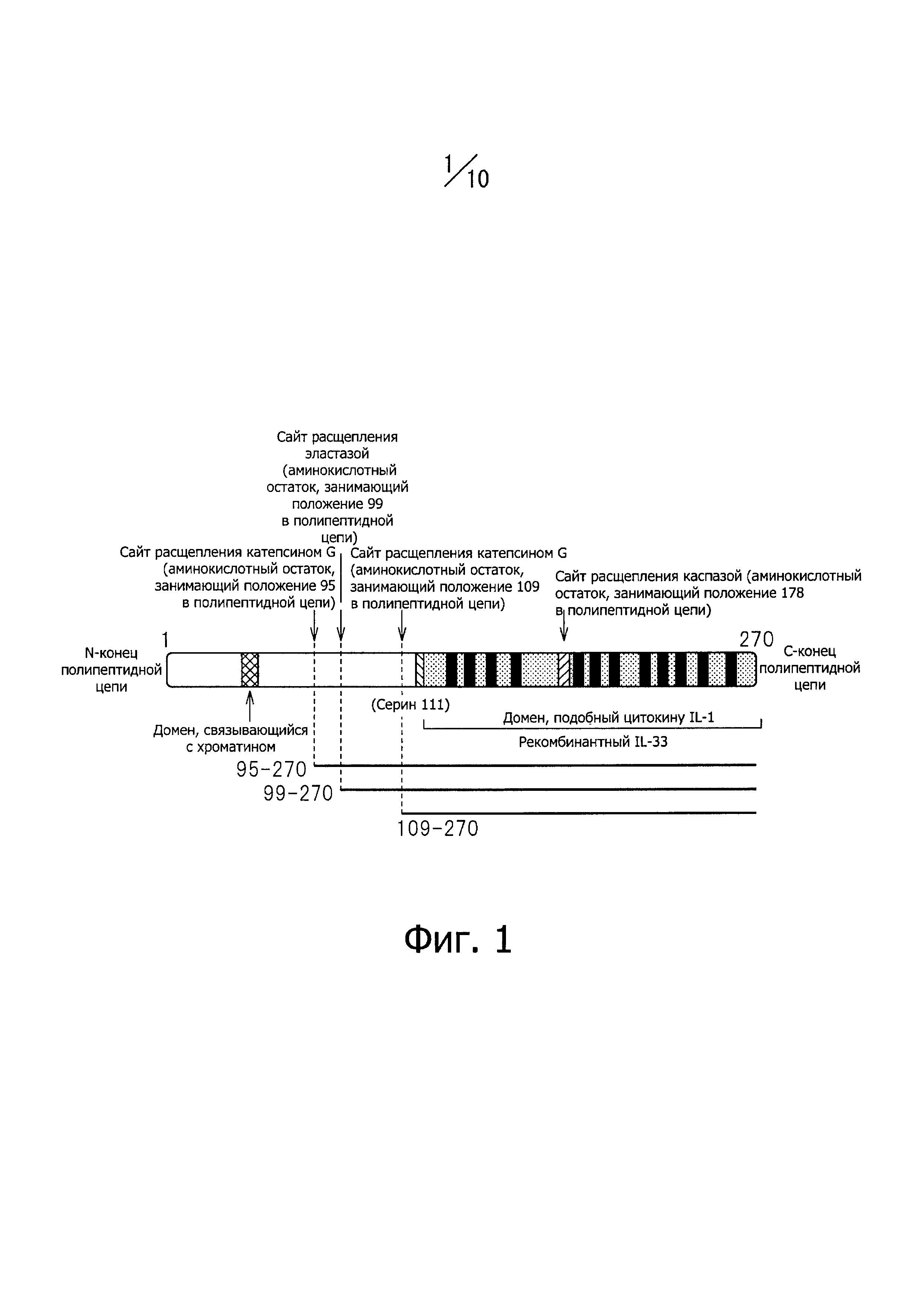
Фиг. 1 представляет схему строения белка IL-33 с изображением всех доменов и сайтов расщепления.
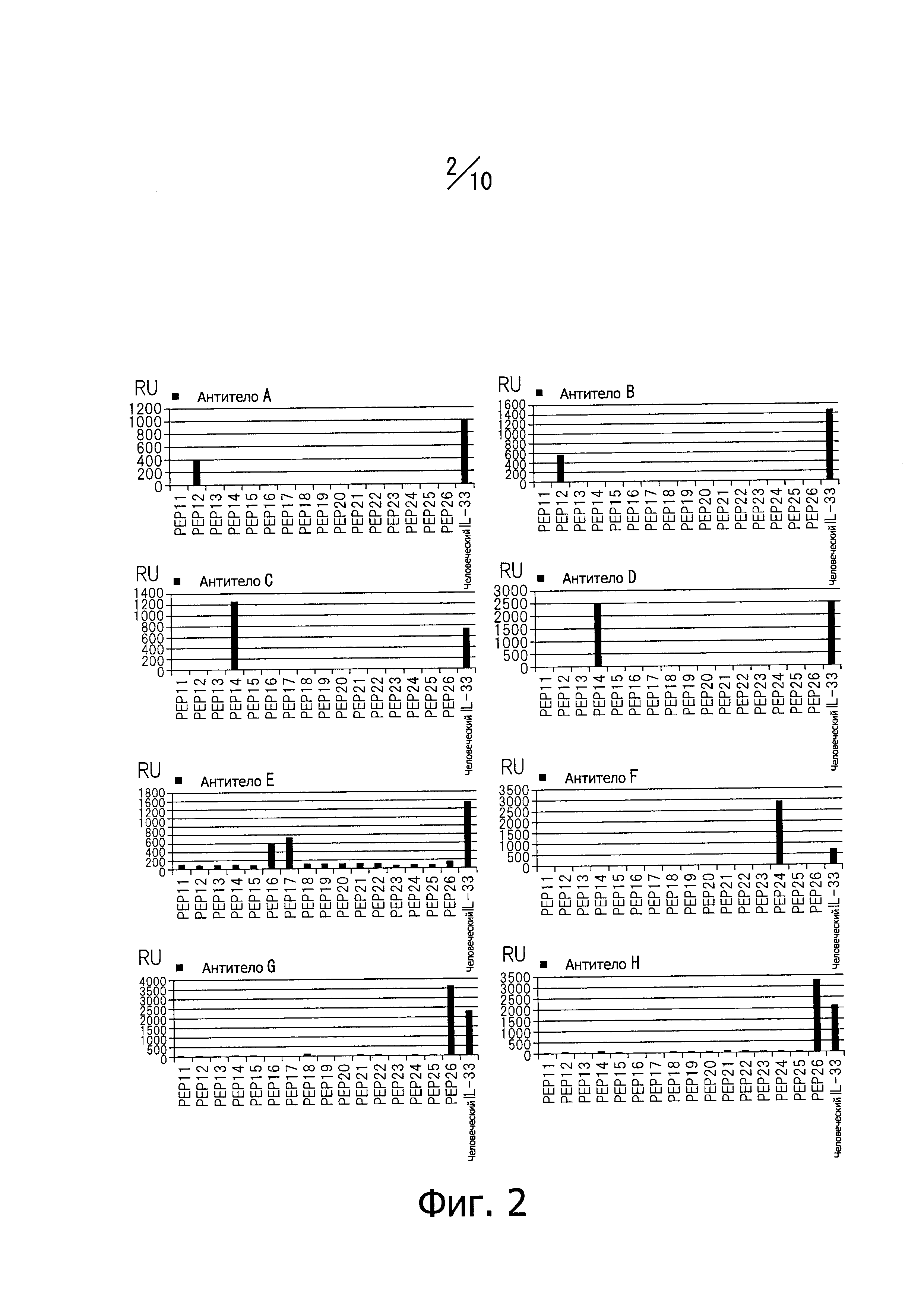
Фиг. 2 изображает связывающую активность антител против человеческого белка IL-33 (аминокислотные остатки с 112-го по 270-й) и их частичных пептидных фрагментов (PEP11-РЕР26).
Фиг. 3 изображает конформационную модель комплекса зрелого человеческого IL-33 (аминокислотные остатки с 117-го по 270-й) (на этом рисунке обозначено "S117-Т270") и человеческого ST2 (hST2).
Фиг. 4 изображает часть конформационной модели, представленной на фиг. 3; изображены человеческий ST2 и частичная конформация эпитопа PEP 12 человеческого IL-33 (соответствующая аминокислотным остаткам, занимающим положения с 117-го по 130-е последовательности, представленной как SEQ ID NO: 226 в Перечне последовательностей, и обозначенная на этом рисунке "S117-N130"; далее другие эпитопы представлены таким же образом).
Фиг. 5 изображает часть конформационной модели, представленной на фиг. 3; показаны только эпитоп PEP 14 человеческого IL-33 и человеческий ST2.
Фиг. 6 изображает часть конформационной модели, представленной на фиг.3; показаны только эпитоп PEP 24 человеческого IL-33 и человеческий ST2.
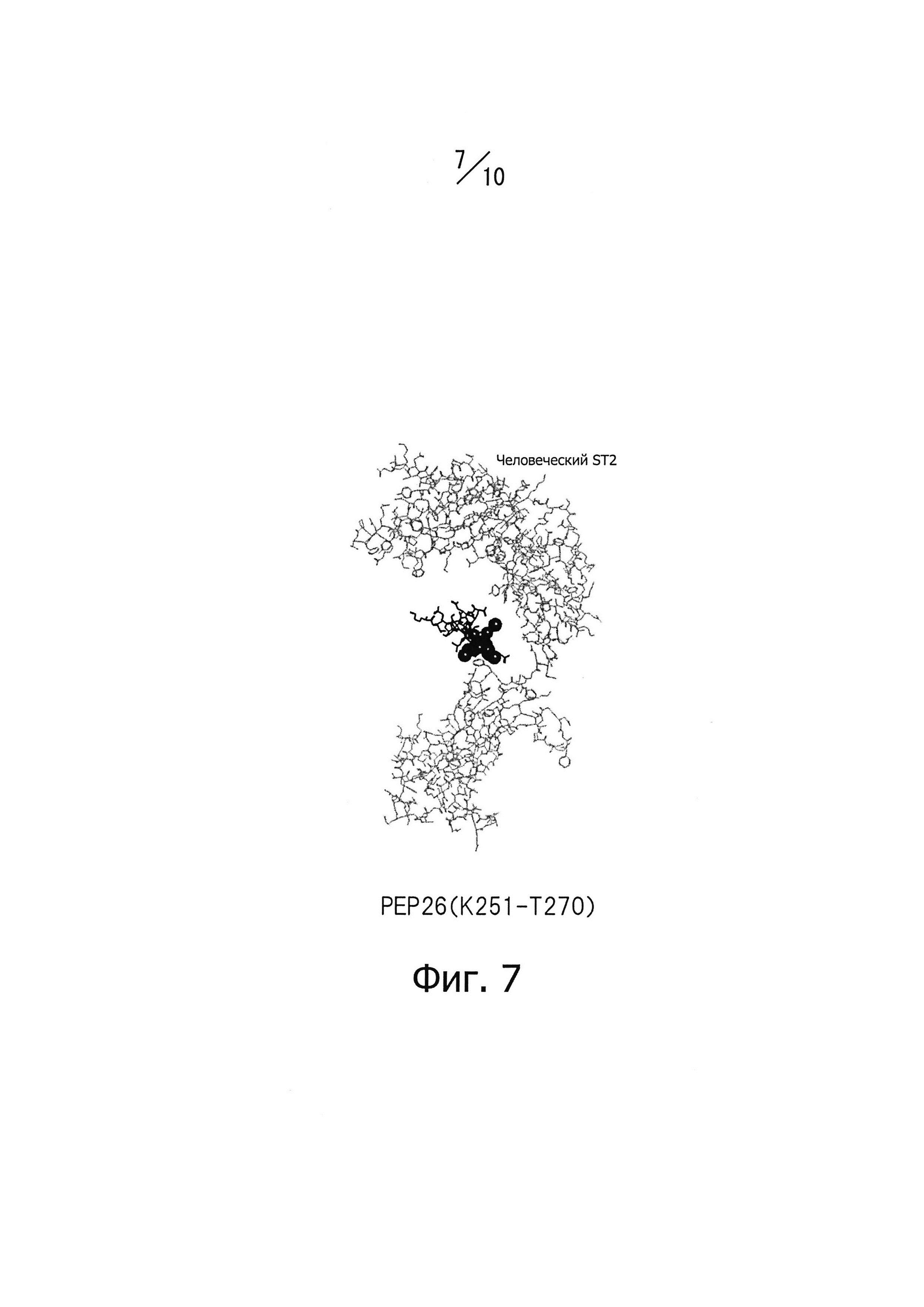
Фиг. 7 изображает часть конформационной модели, представленной на фиг.3; показаны только эпитоп PEP 26 человеческого IL-33 и человеческий ST2.
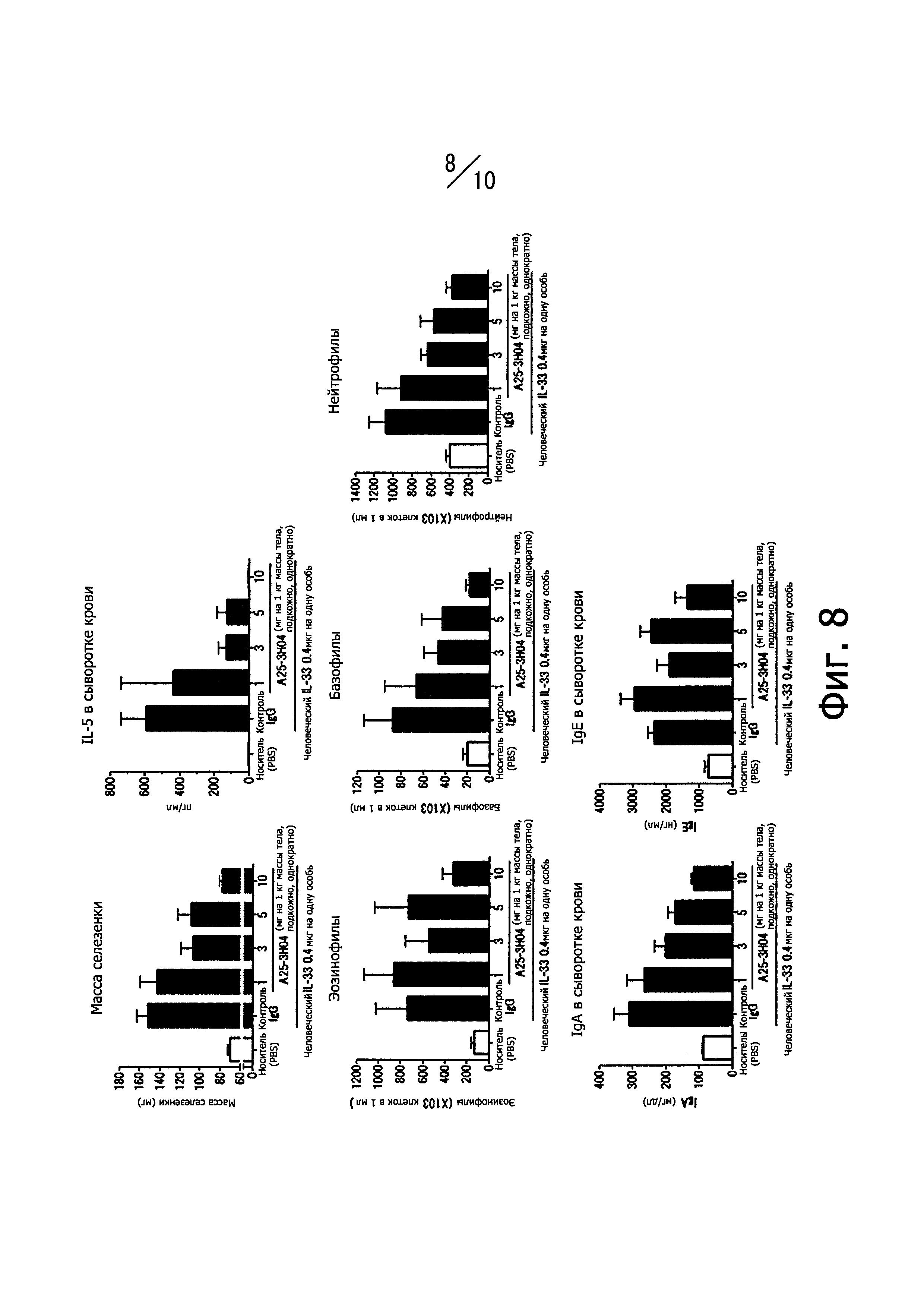
Фиг. 8 иллюстрирует влияние человеческих нейтрализующих моноклональных антител против IL-33, обозначенных А25-3Н04, на воспаление, вызванное внутрибрюшинным введением человеческого IL-33, и характеризуемое следующими показателями воспаления: массой селезенки, концентрацией IL-5 в сыворотке крови, количеством эозинофилов в крови, количеством базофилов в крови, количеством нейтрофилов в крови, концентрацией IgA и IgE в сыворотке крови).
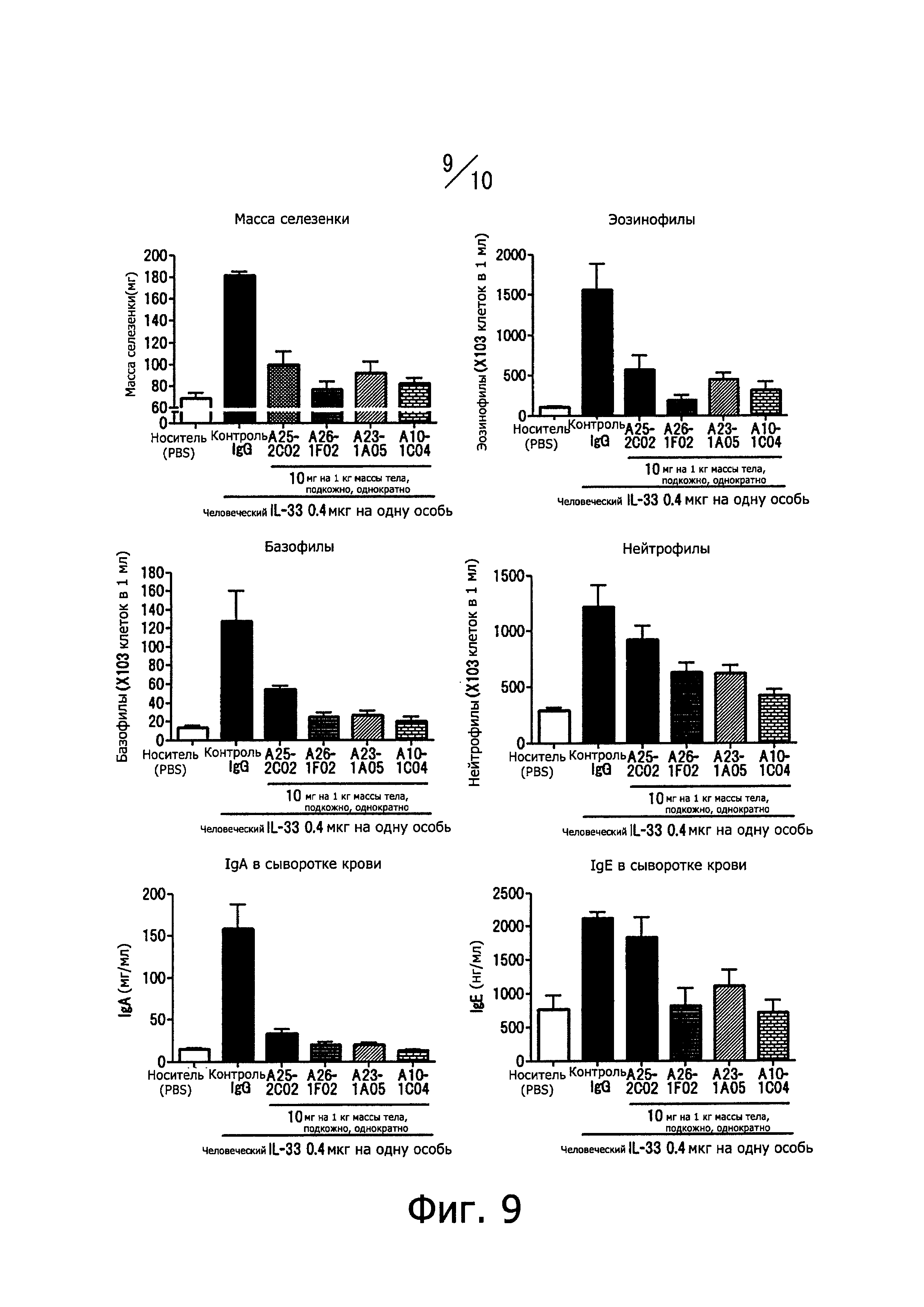
Фиг. 9 иллюстрирует влияние человеческих нейтрализующих моноклональных антител против IL-33, обозначенных А10-1С04, А23-1А05, А25-2С02 и A26-1F02, на воспаление, вызванное внутрибрюшинным введением человеческого IL-33, и характеризуемое следующими показателями воспаления: массой селезенки, концентрацией IL-5 в сыворотке крови, количеством эозинофилов в крови, количеством базофилов в крови, количеством нейтрофилов в крови, концентрацией IgA и IgE в сыворотке крови).
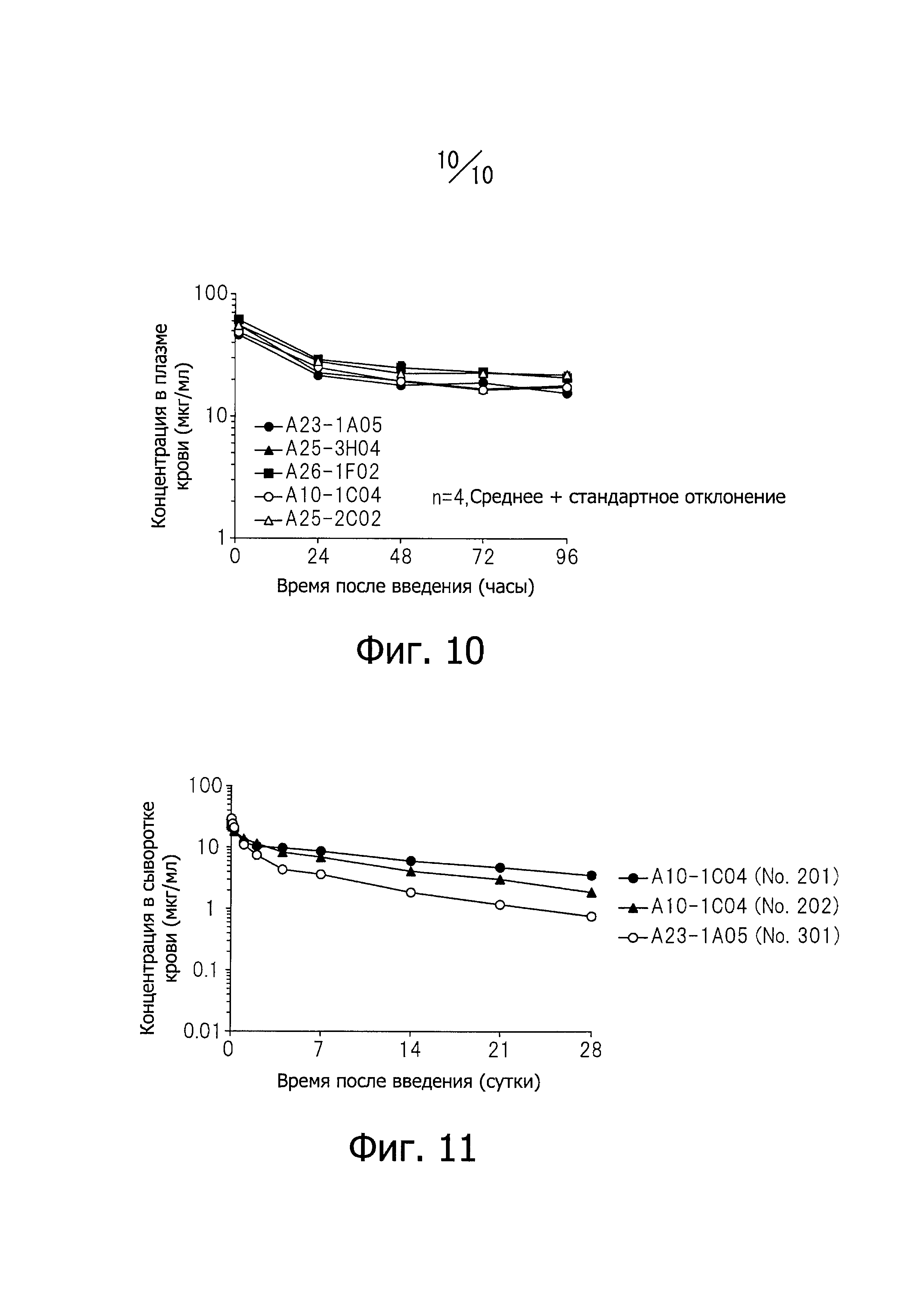
Фиг. 10 иллюстрирует вариации концентрации человеческих нейтрализующих моноклональных антител против IL-33, обозначенных А23-1А05, А25-3Н04, A26-1F02, А10-1С04 и А25-2С02, в плазме крови у мышей.
Фиг. 11 иллюстрирует вариации концентрации человеческих нейтрализующих моноклональных антител против IL-33 (А10-1С04 и А23-1А05), в сыворотке крови у обезьян.
Описание воплощений изобретения
Для лучшего понимания данного изобретения ниже представлены определения терминов, употребляемых в настоящем документе. Эпитоп
В настоящем документе термин «эпитоп» относится к части антигена, распознаваемой антителом. В настоящем документе термин «эпитоп» относится к непрерывной аминокислотной последовательности, необходимой для узнавания антигена антителом.
Связывание
В настоящем документе термин «связывание» применительно к взаимодействию моноклонального антитела с эпитопом относится к образованию комплекса путем возникновения связей между антителом и пептидом, являющимся эпитопом. Примеры связей между молекулой моноклонального антитела и эпитопом включают (но не ограничиваются перечисленным здесь) ионные, водородные, гидрофобные и ван-дер-ваальсовы связи. Способность моноклональных антител связываться с эпитопом определяют с помощью, например, пептидных чипов или методом кинетического эксклюзионного анализа (KinExA), приведенных в описании.
Антитело
Термин «антитела» в настоящем документе употребляется в широком смысле и включает моноклональные и поликлональные антитела, обладающие желаемой специфичностью связывания. Антитела по данному изобретению могут быть антителами человека или животного, например мыши, крысы, кролика, козы или верблюда.
Моноклональные антитела
В контексте термина «антитела» по данному изобретению термин «моноклональные антитела» относится к популяции антител, образовавшейся из одного клона, то есть эта популяция включает в основном молекулы одного вида в смысле аминокислотной последовательности. Моноклональные антитела включают химерные антитела, гуманизированные антитела, человеческие антитела, полиспецифичные антитела и искусственные антитела, а также функционально модифицированные их формы, конъюгаты, содержащие какое-либо из таких антител и фрагменты таких антител. Моноклональные антитела по данному изобретению могут быть получены любым известным в данной области техник методом, в том числе с использованием, например, гибридом, фагового дисплея и генно-инженерным путем.
Химерные антитела
Термин «химерные антитела» относится к антителам, содержащим легкие цепи и/или тяжелые цепи, включающие вариабельные области животного (не человеческого) происхождения и константные области человеческого происхождения.
Гуманизированные антитела
Термин «гуманизированные антитела» относится к антителам, содержащим вариабельные области, в которых участки, определяющие комплементарность, имеют животное (не человеческое) происхождение, а каркасные участки происходят из человеческих антител, и константные области, которые происходят из человеческих антител.
Человеческие антитела
Термин «человеческие антитела» относится к антителам, в которых легкие и тяжелые цепи имеют человеческое происхождение. Человеческие антитела включают следующие изотипы, различающиеся константными областями тяжелых цепей: IgG (в том числе IgG1, IgG2, IgG3 и IgG4, в которых тяжелые цепи представлены типом γ; IgM, в которых тяжелые цепи представлены типом μ; IgA, в которых тяжелые цепи представлены типом α (включая IgA1 и IgA2); IgD, в которых тяжелые цепи представлены типом 8; и IgE, в которых тяжелые цепи представлены типом ε Что касается легких цепей, то в человеческих антителах они представлены типом κ или λ.
Полиспецифичные антитела
Термин «полиспецифичные антитела» относится к асимметричным антителам, в которых имеются два или более независимых сайтов, распознавания антигенов, и которые специфичны в отношении двух или более различных антигенов. Примеры полиспецифичных антител включают биспецифичные антитела, способные специфично связываться с двумя антигенами, и триспецифичные антитела, обладающие специфичностью в отношении трех антигенов. В молекуле IL-33 есть один или более антигенов, распознаваемых полиспецифичными антителами по данному изобретению.
Искусственные антитела
Термин «искусственные антитела» относится, например, к белковым структурам, которые не обладают строением антитела, но функционально ему подобны. Примеры таких белковых структур, которые можно применять по данному изобретению, включают домен Куница ингибиторов сериновых протеаз человека, внеклеточный домен фитбронектина человека, анкирин и липокалин. Белковая структура, способная связываться с эпитопом по данному изобретению, может быть получена путем модифицирования последовательности сайта связывания мишени на этой структуре (Clifford Mintz et.al., BioProcess International, 2013, Vol. 11 (2), pp. 40-48).
Функционально модифицированные антитела
В настоящем документе термин «функционально модифицированные антитела» относится к антителам, функции или свойства которых - за исключением функции связывания антигена - изменены, например цитотоксическое действие, активация комплемента, время полужизни в кровотоке, причем изменение достигается в основном путем модификации аминокислотных остатков или сахарных цепей в Fc-области молекулы антитела.
Конъюгированные антитела
В настоящем документе термин «конъюгированные антитела» относится к антителам, образующим конъюгат (единое целое) с функциональными веществами, не являющимися антителами, например с непептидными полимерами, включая полиэтиленгликоль (PEG); радиоактивные агенты, токсины, низкомолекулярные соединения, цитокины, альбумин и ферменты; объединение молекулы антитела с молекулами указанных агентов достигается химическим или генно-инженерным путем.
Фрагмент
В настоящем документе термин «фрагмент антитела» относится к белковым структурам, являющимся частью молекулы антитела и способным связываться с антигеном. Примеры фрагментов антител включают структуры, обозначаемые Fab, Fv, F(ab')2, Fab' и scFv.
Эти антительные фрагменты могут быть конъюгированы с функциональными молекулами, не являющимися антителами, например с непептидными полимерами, включая полиэтиленгликоль (PEG); радиоактивные агенты, токсины, низкомолекулярные соединения, цитокины, альбумин и ферменты; объединение фрагмента антитела с молекулами указанных агентов достигается химическим или генно-инженерным путем.
Интерлейкин-33 (TL-33')
IL-33 является цитокином из семейства IL-1. Человеческий IL-33 состоит из 270 аминокислотных остатков, последовательность которых представлена SEQ ID NO: 226 в Перечне последовательностей. В молекуле IL-33 N-концевой домен связывает хроматин, а С-концевой домен, подобный IL-1, выполняет цитокинную функцию; в С-концевой домене, молекулярная масса которого 18 кДа, имеется 12 участков со структурой β-слоя, сайты расщепления катепсином G в 95-м и 109-м положениях полипептидной цепи, сайт расщепления эластазой в 99-м положении и сайт расщепления каспазой - в 178-м положении (см. фиг. 1). Считается, что при некрозе клеток IL-33 расщепляется ферментами, содержащимися в лизосомах, - эластазой, катепсином G и протеиназой 3, на различные фрагменты; в том числе образуется так называемый зрелый IL-33, например IL-33 (аминокислотные остатки с 95-го по 270-й). Термин "IL-33 (аминокислотные остатки с 95-го по 270-й)" относится к фрагменту полипептидной цепи IL-33, включающему аминокислотные остатки, находящиеся в положениях с 95-го по 270-е в N-концевой части аминокислотной последовательности, представленной SEQ ID NO: 226 в Перечне последовательностей. Д ругие фрагменты представлены таким же образом: IL-33 (аминокислотные остатки с 99-го по 270-й), IL-33 (аминокислотные остатки с 109-го по 270-й) и IL-33 (аминокислотные остатки с 112-го по 270-й) и выполняют цитокинную функцию. При запрограммированной гибели клеток (апоптозе) IL-33 расщепляется по положению 178, каспазой, которая активируется в ходе апоптоза, с образованием неактивных форм IL-33, например IL-33 (аминокислотные остатки с 179-го по 270-й).
Когда IL-33 высвободился из клеток в качестве цитокина, он связывается с рецепторами IL-33 и в тех клетках, в которых экспрессируется рецептор IL-33, это вызывает внутриклеточную передачу сигнала. Индуцированная IL-33 передача сигнала осуществляется при участии механизмов, включающих (но не ограничивающихся перечисленным здесь) сигнальные пути NF-κВ и MAPKK. В итоге индуцируется образование различных цитокинов, хемокинов и медиаторов воспаления. Примеры индуцируемых IL-33 цитокинов включают TNF-α, IL-1β, IFN-γ, IL-3, IL-4, IL-5, IL-6 и IL-13. В частности, они вызывает образование IFN-γ, IL-5, IL-6 и IL-13. Примеры индуцируемых IL-33 хемокинов включают CXCL2, CCL2, CCL3, CCL6, CCL17 и CCL24. Примеры индуцируемых IL-33 медиаторов воспаления включают PGD2 и LTB4. Индуцируемые IL-33 цитокины, хемокины и медиаторы воспаления участвуют в миграции клеток иммунной системы, образовании ими цитокинов и высвобождении содержимого их везикул («дегрануляции»); все вместе это проявляется воспалением. По данному изобретению в качестве IL-33 может использоваться полноразмерная молекула либо любой ее активный фрагмент, а также любое ее производное или вариант -постольку, поскольку они способны связываться с рецептором IL-33, описанным ниже, и вызывать свой эффект. Можно использовать человеческий IL-33 или же происходящий из какого-либо другого живого существа. В числе различных IL-33 предпочтителен человеческий IL-33, который имеет аминокислотную последовательность, представленную SEQ ID NO: 226, приведенную в Перечне последовательностей.
Рецептор, с которым связывается IL-33, представляет собой гетеродимерный комплекс, образованный белком ST2 и добавочным белком рецептора интерлейкина-1 (IL-1RAcP. В рецепторе IL-33 во внеклеточном домене ST2 имеется сайт связывания, специфично распознающий IL-33, Рецептор IL-33 экспрессируется в различных клетках иммунной системы, в том числе в (не ограничиваясь перечисленным здесь) лимфоцитах Th2, тучных клетках, эозинофилах, базофилах, макрофагах, дендритных клетках, естественных киллерах (клетках NK и NKT), врожденных лимфоидных клетках второй группы (естественных хелперов), нуоцитах, врожденных хелперных клетках второго типа (клетки Ih2) и эпителиальных клетках.
Заболевания, ассоциированные с IL-33
В настоящем документе термин «заболевания, ассоциированные/связанные с IL-33» относится к заболеваниям, обусловленным избыточным высвобождением IL-33 из клеток. Заболевания, ассоциированные с IL-33, можно предотвращать, лечить или облегчать с помощью агентов, способных подавлять функции IL-33. Заболевания, ассоциированные с IL-33, включают, например, астму, атопический дерматит, поллиноз, анафилактический шок, синусит (включая эозинофильный синусит), болезнь Крона, язвенный колит, артрит, системную красную волчанку, пузырчатку, пемфигоид, склеродермию, анкилозирующий спондилит, фиброз печени (включая первичный билиарный цирроз), фиброз легких, хронические обструктивные заболевания легких (COPD), острое поражение почек, васкулит и рак.
Каркасный участок
Термин «каркасный участок» относится к части вариабельной области молекулы иммуноглобулина, отличной от участков, определяющих комплементарность. В каждой легкой и тяжелой цепи имеются четыре каркасных участка (обозначаемые цифрами 1, 2, 3 и 4). В настоящем документе нумерация каркасных участков молекул иммуноглобулинов соответствует системе нумерации Кабата (Kabat et al., 1987, Sequences of Proteins of Immunological Interest, US Department of Health and Human Services, NIH, USA).
Зародышевая линия
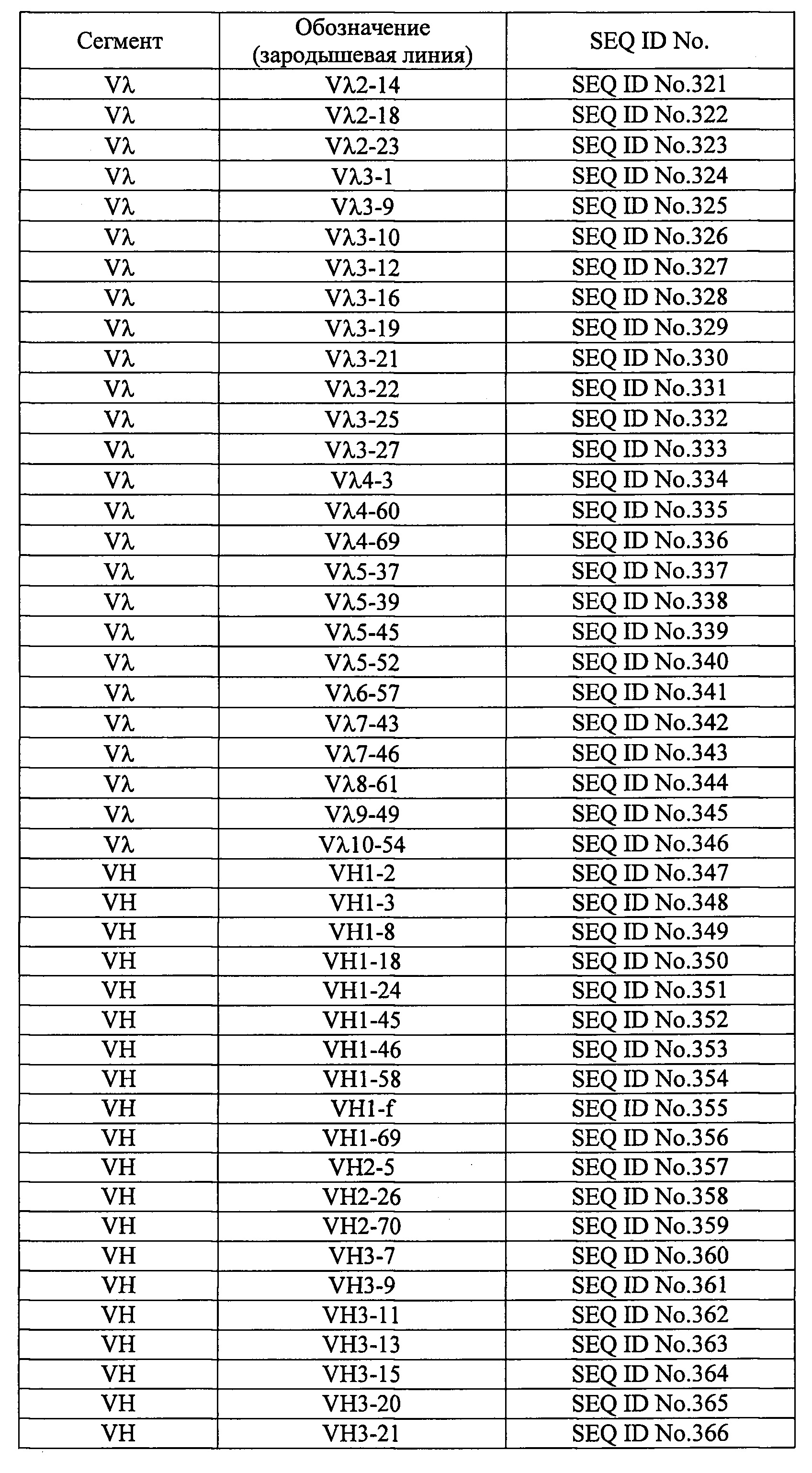
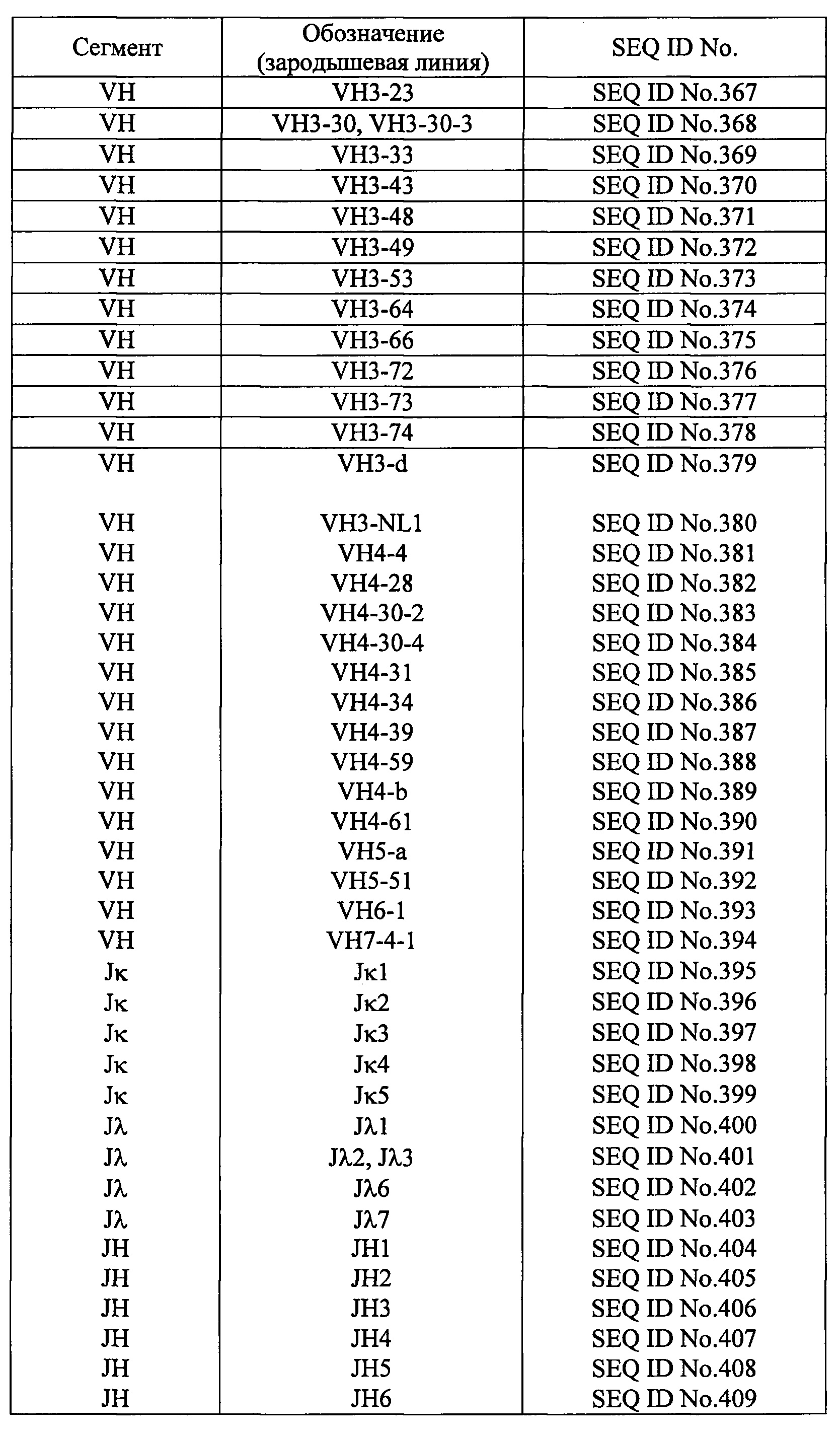
Термин «зародышевая линия» относится к группе клеток, из которых образуются гаметы - сперматозоиды и яйцеклетки; в настоящем документе, если не указано иного, он относится к человеческой зародышевой линии. Гены иммуноглобулинов клеток зародышевой линии не несут мутаций - в отличие от В-клеток, в которых экспрессируются антитела. Соответственно, выражение «аминокислотная последовательность (аминокислотные последовательности) каркасного участка (каркасных участков) зародышевой линии» относится к аминокислотной последовательности (аминокислотным последовательностям), в которой (в которых) нет мутаций по сравнению с аминокислотной последовательностью (аминокислотными последовательностями) каркасного участка (каркасных участков) иммуноглобулина. Выражение «комбинация аминокислотных последовательностей каркасных участков зародышевой линии» подразумевает, что один или более из четырех каркасных участков имеет аминокислотную последовательность каркасного участка другой зародышевой линии. Ген, кодирующий вариабельную область легких цепей иммуноглобулинов человека разделен на два сегмента: в легких цепях типа κ это сегменты Vκ и J, а в легких цепях типа λ-Vλ и Jλ. Каркасные участки с 1-го по 3-й кодируются в сегментах Vκ и Vλ, а каркасный участок 4 - в сегментах Jκ и Jλ. Ген вариабельной области тяжелых цепей иммуноглобулинов человека разделен на три сегмента: VH, DH и JH. Каркасные участки с 1-го по 3-й кодируются в сегменте VH, а каркасный участок 4 - в сегменте JH. Аминокислотные последовательности, кодируемые сегментами Vκ, Vλ, VH, Jκ, Jλ, и JH генов иммуноглобулинов человека зародышевой линии, представлены в таблице 4.

Человеческие моноклональные антитела
Термин «человеческие моноклональные антитела» относится к моноклональным антителам, содержащим вариабельные и константные области иммуноглобулинов человека зародышевой линии. По данному изобретению человеческие моноклональные антитела могут быть рекомбинантными, полученными путем частичной или полной замены вариабельных областей вариабельными областями какого-либо другого моноклонального антитела человека. Рекомбинантное антитело может быть результатом рекомбинации на границах между каркасными участками и участками, определяющими комплементарность, чтобы избежать нежелательного влияния на способность антитела связываться со своей мишенью. Рекомбинантное антитело может быть результатом рекомбинации каркасных участков 1-4 соответственно с каркасными участками 1-4 какого-либо другого моноклонального антитела человека, чтобы избежать нежелательного увеличения иммуногенности. Человеческие моноклональные антитела по данному изобретению могут быть вариантами человеческих моноклональных антител. Чтобы снизить иммуногенность, сохраняя или увеличивая способность связываться с антигеном, человеческие моноклональные антитела по данному изобретению предпочтительно включают аминокислотные последовательности участков, определяющих комплементарность, с мутациями и аминокислотные последовательности каркасных участков зародышевой линии без мутаций.
Выделенный/изолированный
Определение «выделенный/изолированный» применительно к антителу означает, что данное антитело идентифицировано и отделено (и/или выделено) от компонентов его естественного окружения. В контексте данного изобретения загрязняющими компонентами в естественном окружении антитела являются субстанции, которые могут мешать диагностическому или терапевтическому использованию данного антитела, включая ферменты, гормоны и другие белковые и не белковые растворенные вещества. Вообще говоря, выделенное/изолированное антитело может быть получено путем по меньшей мере одного этапа очистки; антитела, очищенные в результате по меньшей мере одного этапа очистки называются выделенными/изолированными.
Нейтрализация
В настоящем документе термин «нейтрализация» относится к акту связывания с нужной мишенью и подавления ее функций. Конкретно, термин «нейтрализующие моноклональные антитела против IL-33» относится к моноклональным антителам, которые подавляют биологическую активность, индуцируемую полипептидом IL-33, путем связывания с ним. Подлежащая подавлению биологическая активность IL-33. включает (но не ограничивается перечисленным здесь) образование цитокинов, индуцируемых IL-33, например IL-6. Показатели биологической активности IL-33 можно определить с помощью одного или более аналитических методов in vivo или in vitro, известных в данной области техники. Термин «человеческие нейтрализующие моноклональные антитела против IL-33» относится к человеческим моноклональным антителам, способным, связываясь с IL-33, подавлять его функции.
Антагонист
В настоящем документе термин «антагонист» служит обобщающим термином для субстанций, обладающих нейтрализующим эффектом в отношении нужной мишени. Конкретно, термин «антагонист IL-33» относится к субстанциям, способным, связываясь с IL-33, подавлять его функции; например, антагонистом IL-33 являются нейтрализующие моноклональные антитела против IL-33.
Участок, определяющий комплементарность
Термин «участки, определяющие комплементарность» (CDR), относится к участкам в вариабельных областях молекулы иммуноглобулина, формирующим сайт связывания антигена. Эти участки также называют гипервариабельными, отражая тот факт, что в этих участках аминокислотная последовательность у разных молекул иммуноглобулинов особенно сильно варьирует. Легкие и тяжелые цепи иммуноглобулинов содержат соответственно по три участка, определяющих комплементарность, которые обозначаются цифрами 1, 2 и 3. По данному изобретению участки, определяющие комплементарность, нумеруются согласно системе нумерации Кабата (Kabat et al., 1987, Sequences of Proteins of Immunological Interest, US Department of Health and Human Services, NIH, USA).
Конкуренция
В настоящем документе формулировка «антитело конкурирует с моноклональным антителом» означает, что в присутствии данного моноклонального антитела значительно уменьшается связывание антитела, о котором идет речь, с IL-33 по данным, полученным методом поверхностного плазмонного резонанса (SPR), как излагается в описании.
В настоящем документе выражение «нейтрализующие моноклональные антитела против IL-33, которые конкурируют…» включает химерные антитела, гуманизированные антитела, человеческие антитела, полиспецифичные антитела, искусственные антитела и функционально модифицированные их формы, а также конъюгаты, содержащие какое-либо из таких антител, и фрагменты этих антител.
Ниже описываются воплощения данного изобретения. Они носят иллюстративный характер и их не следует считать как-либо ограничивающими объем изобретения.
Данное изобретение относится к моноклональным антителам, способным связываться с эпитопом IL-33. Поскольку моноклональные антитела, способные связываться с эпитопом человеческого IL-33, могут нейтрализовать его активность, эпитоп предпочтительно содержит последовательность аминокислотных остатков, находящихся в положениях с 101-го по 154-е или с 199-го по 270-е, более предпочтительно с 11-го по 130-е (PEP 12), с 131-го по 150-е (PEP 14), с 231-го по 250-е (РЕР24) или с 251-го по 270-е (РЕР26) последовательности, представленной как SEQ ID NO: 226 в Перечне последовательностей. Часто IL-33 в процессе высвобождения из клеток расщепляется. Если эпитоп формируется в результате сворачивания полипептидной цепи белка аминокислотными остатками, расположенными раздельно в первичной структуре (аминокислотной последовательности) IL-33, то его расщепление может привести к тому, что нужные для формирования эпитопа аминокислотные остатки окажутся на разных фрагментах, которые к тому же будут сворачиваться иначе, чем в нативном белке; в результате может значительно снизиться аффинность антител. Поэтому эпитоп, с которым связываются моноклональные антитела против IL-33 по данному изобретению, предпочтительно представлен непрерывной аминокислотной последовательностью.
Для достижения нейтрализующего эффекта моноклональных антител, способных связываться с эпитопом IL-33, нужно, например, чтобы подавлялось связывание IL-33 с его рецепторами. Таким образом, эпитоп по данному изобретению предпочтительно находится не только на поверхности белковой молекулы IL-33, но также в тесной близости от рецепторов IL-33. Авторы данного изобретения провели конформационное моделирование на основе кристаллографических данных о структуре NPL 11, чтобы идентифицировать аминокислотные остатки, содержащие атомы, расположенные на расстоянии 5А или менее от атома в составе рецептора, когда эти два атома находятся в наиболее тесной близости (то есть атомы контактной области), как описано ниже в разделе «Примеры». Примеры аминокислотных остатков, содержащих атомы контактной области, включают Р118 (обозначение "Р118" относится к остатку пролина, занимающему 118-е положение последовательности, представленной SEQ ID NO: 226 в Перечне последовательностей; далее аминокислотные остатки обозначаются аналогично), 1119, Т120, Y122, L123, R124, S125, L126, S127, Y129 и N130 в PEP12; D131, Q132, S133, Т135, А137, L138, Е139, S142, Y143, Е144, 1145, Y146, Е148, D149 и L150 в PEP 14; D244, N245, и Н246 в РЕР24; K266, L267, S268 и Е269 в РЕР26. Функциональный эпитоп, с которым специфично связывается моноклональное антитело, способное нейтрализовать IL-33, предпочтительно включает аминокислотные остатки, содержащие атомы контактной области. Нейтрализующий эффект моноклональных антител, способных специфично связываться с функциональным эпитопом IL-33, зависит, как считается, от числа и пространственного расположения атомов контактной области, содержащихся в функциональном эпитопе; впрочем, здесь не подразумевается каких-либо теоретических ограничений.
Одно из предпочтительных воплощений данного изобретения имеет своей целью моноклональные антитела, для которых эпитоп, состоящий из непрерывной аминокислотной последовательности, включающей положения с 101-го по 154-е или с 199-го по 270-е последовательности, представленной SEQ ID NO: 226 в Перечне последовательностей, состоит из непрерывной аминокислотной последовательности, включающей положения с 111-го по 130-е (РЕР12), с 131-го по 150-е (РЕР14), с 23-го по 250-е (РЕР24) или с 25-го по 270-е (РЕР26) последовательности, представленной SEQ ID NO: 226 в Перечне последовательностей. В более предпочтительном воплощении данного изобретения представлены моноклональные антитела, для которых эпитоп состоит из непрерывной аминокислотной последовательности, включающей положения с 13-го по 147-е или с 139-го по 147-е последовательности, представленной SEQ ID NO: 226 в Перечне последовательностей.
Авторы данного изобретения изучили минимальную аминокислотную последовательность, необходимую для образования функционального эпитопа, используя для этого два различных моноклональных антитела, связывающихся с PEP 14, и определили, что непрерывная аминокислотная последовательность, включающая положения с 138-го по 147-е и с 139-го по 147-е последовательности SEQ ID NO: 226, представленной в Перечне последовательностей, является минимальной для эпитопа IL-33. Соответственно, данное изобретение относится к эпитопу, состоящему из непрерывной аминокислотной последовательности, включающей положения с 138-го по 147-е и с 139-го по 147-е последовательности, представленной SEQ ID NO: 226 в Перечне последовательностей.
Связывание моноклональных антител с эпитопом по данному изобретению можно удостоверить каким-либо из обычно практикуемых в данной области техники методов, например путем твердофазного иммуноферментного анализа (ELISA), иммунопреципитации, поверхностного плазмонного резонанса (SPR) и кинетического эксклюзионного анализа (KinExA). Например, если моноклональные антитела испытываются в отношении пептидов эпитопа по данному изобретению с использованием пептидных чипов методом SPR, как описано в разделе «Примеры» настоящего документа, то связывание моноклональных антител с эпитопом определяют по существенному возрастанию значений RU. В случае применения метода KinExA, как описано в разделе «Примеры» настоящего документа, определяют константу диссоциации (Kd). Константа диссоциации для пептида эпитопа предпочтительно низкая - предпочтительно 10 мкМ или менее, 1 мкМ или менее, 100 нМ или менее, 10 нМ или менее, 1 нМ или менее, 100 пМ или менее либо 10 пМ или менее.
Другое воплощение данного изобретения относится к фармацевтической композиции, содержащей моноклональные антитела по данному изобретению, способные связываться с эпитопом, состоящим из непрерывной аминокислотной последовательности, включающей положения с 101-го по 154-е или с 199-го по 270-е последовательности, представленной SEQ ID NO: 226 в Перечне последовательностей. Данное изобретение также относится к способу диагностирования, лечения, предотвращения или облегчения заболеваний, ассоциированных с IL-33, причем этот способ включает введение моноклональных антител по данному изобретению; и к применению моноклональных антител по данному изобретению для изготовления лекарственного средства для диагностирования, лечения, предотвращения или облегчения заболеваний, ассоциированных с IL-33.
Примеры заболеваний, ассоциированных с IL-33 (приведенные здесь примеры не имеют ограничительного характера), включают астму, атопический дерматит, крапивницу, поллиноз, анафилактический шок, синусит (включая эозинофильный синусит), аллергический энцефаломиелит, гиперэозинофильный синдром, ревматическую полимиалгию, ревматические заболевания сердца, рассеянный склероз, артрит (например, ревматоидный артрит, юношеский артрит, псориатический артрит, деформирующий артроз и синдром Рейтера), системную красную волчанку (включая дискоидную красную волчанку), пузырчатку, пемфигоид, псориаз, анкилозирующий спондилит, гепатит (например, аутоиммунный гепатит и хронический активный гепатит), воспалительные заболевания кишечника (например, язвенный колит, болезнь Крона, глютеновую энтеропатию), синдром Шегрена, аутоиммунную гемолитическую анемию, аутоиммунные воспалительные заболевания глаз, аутоиммунную неонатальную тромбоцитопению, аутоиммунную нейтропению, аутоиммунные оофорит и орхит, аутоиммунную тромбоцитопенитю, аутоиммунный тиреоидит, полимиозит, дерматомиозит, миастению (myasthenia gravis), резистентность к агонистам адренергических рецепторов, очаговую алопецию, антифосфолипидный синдром, аутоиммунные поражения надпочечников (например, аутоиммунную болезнь Аддисона), дерматит Дюринга (целиакию, синдром мальабсорбции), синдром хронической усталости/синдром иммунной дисфункции (CFIDS), холодовую агглютининовую болезнь, эссенциальную смешанную криоглобулинемию, фибромиалгию-фибромиозит, гломерулонефрит, (например, IgA-нефропатию), болезнь Грейвса, гипертиреоидизм (тиреоидит Хасимото), идиопатическую тромбоцитопеническую пурпуру (ITP), смешанное заболевание соединительной ткани, сахарный диабет типа 1 или иммуно-опосредованный диабет, пернициозную анемию, полихондрит, полигландулярный синдром, синдром мышечной скованности, витилиго, саркоидоз, полиэндокринопатию, другие эндокринопатии, артериосклероз, фиброз печени (например, первичный билиарный цирроз), фиброз легких (например, идиопатический фиброз легких), хронические обструктивные заболевания легких (COPD), склеродермию, включая лимитированную склеродермию (синдром CREST) и болезнь Рейно, тубулоинтерстициальный нефрит, болезнь плотного осадка, острое поражение почек, миокардит, кардиомиопатию, неврит (например, синдром Гийена-Барре), узелковый полиартериит, кардиотомический синдром, хроническую воспалительную демиелинизирующую полинейропатию, IgA-нефропатию, плоский лишай, болезнь Меньера, постмиокардитический кардиосклероз, увеит, периодическую офтальмию, васкулит, первичную агаммаглобулинемию, раковые заболевания (например, опухоли головного мозга, рак гортани, губ и полости рта, гипофарингеальный рак, рак щитовидной железы, рак пищевода, рак молочной железы, рак легких, рак желудка, карциному коры надпочечников, рак желчных протоков, рак желчного пузыря, рак печени, рак поджелудочной железы, рак мочевого пузыря, рак толстой кишки, рак матки, рак яичника, рак предстательной железы, рак яичка, хронический лимфоцитарный лейкоз, хронический миелоидный (миелогенный) лейкоз, опухоль Юинга, болезнь Ходжкина, неходжкинскую лимфому, меланому, мезотелиому и множественную миелому), инфекции, устойчивые к иммунной защите (например, тяжелый острый респираторный синдром (SARS)), летальную гиперцитокинемию, связанную с инфекцией высоко вирулентным вирусом гриппа, и сепсис. Предпочтительно болезнями, ассоциированными с IL-33, по данному изобретению являются астма, атопический дерматит, поллиноз, анафилактический шок, синусит (включая эозинофильный синусит), болезнь Крона, язвенный колит, артрит, системная красная волчанка, пузырчатка, пемфигоид, склеродермия, анкилозирующий спондилит, фиброз печени (включая первичный билиарный цирроз), фиброз легких, хронические обструктивные заболевания легких (COPD), острое поражение почек, васкулит и рак.
Другое воплощение данного изобретения относится к ингибитору экспрессии, направленному против цитокинов, хемокинов или медиаторов воспаления, содержащему моноклональное антитело, способное связываться с эпитопом, состоящим из непрерывной аминокислотной последовательности, включающей аминокислотные остатки, находящиеся в положениях с 101-го по 154-е или с 199-го по 270-епоследовательности, представленной как SEQ ID NO: 226 в Перечне последовательностей.
Цитокином, экспрессия которого подлежит подавлению ингибитором экспрессии цитокинов, хемокинов или медиаторов воспаления по данному изобретению, является один из цитокинов, индуцируемых IL-33, в том числе TNF-α, IFN-γ, IL-1β, IL-3, IL-4, IL-5, IL-6 и IL-13. Хемокином, экспрессия которого подлежит подавлению указанным ингибитором, является один из хемокинов, индуцируемых IL-33, в том числе CXCL2, CCL2, CCL3, CCL6, CCL17 и CCL24. Медиатором воспаления, экспрессия которого подлежит подавлению указанным ингибитором, является один из медиаторов воспаления, индуцируемых IL-33, в том числе PGD2 и LTB4. В особенно предпочтительном воплощении данного изобретения ингибитор экспрессии цитокинов, хемокинов или медиаторов воспаления, содержащий моноклональное антитело против IL-33, подавляет экспрессию IFN-γ, IL-5, IL-6 или IL-13. Более предпочтительно, что указанный ингибитор подавляет экспрессию IL-6.
В другом своем воплощении данное изобретение относится к эпитопу, с которым связывается моноклональное антитело против IL-33. По данному изобретению на этот эпитоп направлена последовательность из 6-20 аминокислотных остатков, необходимую для распознавания эпитопа антителом. В другом воплощении данного изобретения указанный эпитоп может также включать аминокислотные остатки, расположенные в тесной близости от аминокислотных остатков в этой установленной последовательности - линейно (в аминокислотной последовательности) либо конформационно (в свернутой полипептидной цепи), то есть может быть сформирован другой эпитоп. Однако предпочтительно, что указанный эпитоп не содержит аминокислотных остатков, расположенных не непрерывно.
Непрерывная аминокислотная последовательность эпитопа по данному изобретению состоит из по меньшей мере пяти, предпочтительно по меньшей мере из шести, более предпочтительно по меньшей мере из семи, более предпочтительно по меньшей мере из восьми, еще более предпочтительно - по меньшей мере из девяти аминокислотных остатков. Для достижения большей антигенности указанная непрерывная аминокислотная последовательность состоит из по меньшей мере 10, более предпочтительно по меньшей мере из 15, еще более предпочтительно - по меньшей мере из 20 аминокислотных остатков. Однако если этот эпитоп содержит чрезмерно длинную аминокислотную последовательность, то в нем может быть два или более сайта, распознаваемых антителом по данному изобретению, что может мешать получению или скринингу антител с желаемым нейтрализующим эффектом. Поэтому длина аминокислотной последовательности эпитопа по данному изобретению составляет предпочтительно 30 или менее аминокислотных остатков, более предпочтительно 20 или менее аминокислотных остатков, еще более предпочтительно 15 или менее, чтобы быть уверенными в проявлении антителом, способным связывать эпитоп по данному изобретению, желаемого нейтрализующего эффекта. Количество аминокислотных остатков в непрерывной аминокислотной последовательности, содержащейся в эпитопе по данному изобретению выбирают из, например, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 и 20.
В указанном эпитопе может быть одна или несколько мутаций, а именно замен аминокислот, делеций или вставок, если только мутации не изменяют его антигенность. Предпочтительно наличие пяти мутаций или менее, более предпочтительно трех или менее, наиболее предпочтительно, чтобы в эпитопе была одна мутация. Кроме того, эпитоп может быть модифицирован, например, цепочками сахаров исходного белка; также возможна концевая модификация. В другом воплощении данного изобретения указанный эпитоп может состоять из аминокислотной последовательности, которая идентична по меньшей мере на 90%, более предпочтительно по меньшей мере на 95%, более предпочтительно по меньшей мере на 97%, еще более предпочтительно по меньшей мере на 98%, наиболее предпочтительно на 99%, непрерывной аминокислотной последовательности, определенной по данному изобретению, если только не изменяется антигенность эпитопа. Когда эпитопный пептид используется как «наживка» для поиска, он может нести метку - гистидин или биотин и др., а при использовании в качестве вакцины он может быть связан с белком-переносчиком, например с гемоцианином лимфы улитки (KLH).
«Степень идентичности последовательности (в процентах)» применительно к референсной аминокислотной последовательности полипептида, идентифицированного, как описано в настоящем документе, - это доля аминокислотных остатков (в процентах) в составе рассматриваемой последовательности, которые одинаковы с аминокислотными остатками в определенной референсной аминокислотной последовательности после выравнивания и при необходимости введения пропусков для достижения максимальной степени идентичности, не включая в идентичность последовательностей консервативные замены. Выравнивание аминокислотных последовательностей с целью определения степени их идентичности можно осуществлять с помощью различных методов, известных специалистам в данной области техники, например, используя общедоступные компьютерные программы - BLAST, BLAST-2, ALIGN или Megalign (DNASTAR, Inc.). Специалист в данной области техники может определить подходящие параметры для количественной характеристики выравнивания, в том числе алгоритм, требующийся для достижения максимального выравнивания полноразмерных последовательностей, подлежащих сравнению. Для целей, описанных в настоящем документе, значения (в процентах) степени идентичности аминокислотных последовательностей определяют путем попарного сравнения с использованием компьютерной программы BLAST для сравнения последовательностей. В ситуации, когда программа BLAST используется для сравнения аминокислотных последовательностей, степень идентичности (в процентах) данной аминокислотной последовательности А данной аминокислотной последовательности В рассчитывается следующим образом:
Отношение X/Y×100
где X - это число аминокислотных остатков, засчитанных как совпадения в результате выравнивания последовательностей А и В с помощью программы BLAST, a Y - это общее число аминокислотных остатков в последовательности В. Следует учесть, что разница в длине между аминокислотными последовательностями А и В отражается в разнице степеней идентичности сравниваемых последовательностей, то есть аминокислотной последовательности А относительно последовательности В и последовательности В относительно последовательности А. Все приведенные в настоящем документе значения (в процентах) степеней идентичности аминокислотных последовательностей определяли с помощью компьютерной программы BLAST, как описано выше, если только не оговорено иного.
Поиски эпитопа по данному изобретению были направлены на функциональный эпитоп, с которым специфично связываются нейтрализующие антитела против IL-33. Таким образом, новые антитела, обладающие антагонистическим эффектом в отношении IL-33 могут быть с успехом получены с помощью функционального эпитопа по данному изобретению. Конкретно говоря, моноклональные антитела, обладающие антагонистическим эффектом в отношении IL-33, можно получить путем скрининга моноклональных антител, используя для идентификации антител, способных связываться с функциональным эпитопом по данному изобретению, полноразмерный IL-33 или зрелый IL-33. Соответственно, в другом своем воплощении данное изобретение относится к способу поиска антител, обладающих антагонистическим эффектом против IL-33, с использованием функционального эпитопа IL-33. АВ именно, если из библиотеки природных антител путем фагового дисплея получают клон антител, обладающих антагонистическим эффектом против IL-33, отбор в библиотеке сначала осуществляется с использованием в качестве белка-приманки полноразмерного или зрелого IL-33; клоны антител, связывающихся с одним или более разных эпитопов на поверхности IL-33 обогащаются и подвергаются отбору с использованием в качестве пептида-приманки функционального эпитопа по данному изобретению. Такой способ обеспечивает эффективный скрининг для выявления антител, способных специфично связываться с функциональным эпитопом и обладающих антагонистическим эффектом в отношении белка IL-33.
В разделе «Примеры» авторы описывают исследование моноклональных антител, которые, как было установлено, связывались с эпитопами длиной 20 аминокислотных остатков, с целью определения их антагонистической активности в отношении IL-33 при различных концентрациях антител для выявлении эпитопов, пригодных для получения или скрининга антител., обладающих указанным антагонистическим эффектом. Полученные результаты показывают, что явное увеличение антагонистического эффекта, проявляющегося зависимым от концентрации образом наблюдается у антител, связывающихся с эпитопом, выбираемым из группы, состоящей из аминокислотных последовательностей, содержащих аминокислотные остатки, находящиеся в положениях с 111-го по 130-е (PEP 12), с 131-го по 150-е (PEP 14), с 231-го по 250-е (РЕР24), с 251-го по 271-е (РЕР26) аминокислотной последовательности, приведенной как SEQ ID NO: 226 в Перечне последовательностей. Эти результаты демонстрируют, что указанные эпитопы являются функциональными эпитопами, пригодными для получения или скрининга антител, обладающих антагонистическим эффектом. Соответственно, в одном из своих воплощений данное изобретение относится к эпитопу, содержащему последовательность, которая состоит по меньшей мере из шести, предпочтительно по меньшей мере из 10, более предпочтительно по меньшей мере из 15, подряд расположенных аминокислотных остатков в участке полипептидной цепи, выбираемом из группы, состоящей из последовательностей аминокислотных остатков, занимающих положения с 111-го по 130-е, с 131-го по 150-е, с 231-го по 250-е, с 251-го по 271-е (РЕР26) аминокислотной последовательности, приведенной как SEQ ID NO: 226 в Перечне последовательностей. В другом своем воплощении данное изобретение относится к эпитопу, выбираемому из группы, состоящей из последовательностей аминокислотных остатков, занимающих положения с 111-го по 130-е, с 131-го по 150-е, с 231-го по 250-е, с 251-го по 270-е аминокислотной последовательности, приведенной как SEQ ID NO: 226 в Перечне последовательностей.
Эпитоп по данному изобретению может быть получен любым методом синтеза пептидов, обычно применяемым в данной области техники. Полученный и очищенный эпитопный пептид можно использовать для иммунизации животных, чтобы у них образовались антитела к этому эпитопу. Или же очищенный эпитопный пептид используют в методе фагового дисплея для получения и скрининга моноклональных антител, способных связываться с этим эпитопом. Эпитопный пептид можно также использовать в качестве вакцины; при этом его комбинируют с адъювантом.
Данное изобретение относится к моноклональным антителам, способным связываться с эпитопом, состоящим из непрерывной аминокислотной последовательности, включающей аминокислотные остатки, находящиеся в положениях с 101-го по 154-е или с 199-го по 270-е последовательности, представленной как SEQ ID NO: 226 в Перечне последовательностей. Примеры таких моноклональных антител включают химерные антитела, гуманизированные антитела, человеческие антитела, полиспецифичные антитела, искусственные антитела и функционально модифицированные их форм; а также конъюгаты, содержащие какое-либо из указанных антител, и фрагменты указанных антител. Моноклональные антитела по данному изобретению могут принадлежать человеку или животному, например это могут быть мьшганые, крысиные, кроличьи, козьи или верблюжьи антитела. Моноклональные антитела по данному изобретению могут быть получены различными известными в данной области техники методами, включая, например, использование гибридом, фаговый дисплей и генно-инженерный подход.
По гибридомной технологии животных, в частности крыс или мышей, иммунизируют тем или иным иммуногеном, берут у них из селезенки или лимфатических узлов В-лимфоциты и сливают эти клетки с бессмертными клетками, например с клетками миеломы, так что образуются гибридомы. Среди полученных гибридомных клеток выявляют те, в которых образуются антитела, обладающие искомой связывающей способностью. Выявленные гибридомы используют для продуцирования этих антител. Человеческие антитела можно получить, используя трансгенных мышей, несущих человеческий ген нужных антител. Желаемые моноклональные антитела получают из гибридомных клеток путем, например, культивирования последних обычно применяемыми в таких случаях методами и последующего сбора культурального супернатанта. Или же гибридомные клетки вводят млекопитающему, с которым они совместимы, в его организме они пролиферируют, и собирают асцитную жидкость. Первый метод подходит для получения антител высокой степени чистоты, а второй - для производства антител в больших количествах. Моноклональные антитела по данному изобретению можно получать любым известным в данной области техники методом, например, согласно описаниям, приведенным в книге Current Protocols in Immunology, Wiley and Sons Inc., Chapter 2.
По методу фагового дисплея проводят скрининг фаговой библиотеки, используя нужный иммуноген, и отбирают фаги, обладающие желаемой связывающей способностью в отношении этого иммуногена. Затем выделяют или определяют последовательность, имеющуюся у отобранных фагов и соответствующую искомому антителу, и на основе выделенной или установленной последовательности конструируют экспрессионный вектор, включающий полинуклеотид, кодирующий это антитело. Полученный экспрессионный вектор вводят путем трансфекции в клетки подходящей линии, и трансфицированные клетки культивируют, чтобы получить продуцируемые ими нужные моноклональные антитела. Человеческие антитела с нужной связывающей способностью можно получить, используя для создания фаговой библиотеки библиотеку человеческих антител.
По генно-инженерной технологии получают рекомбинантные антитела путем введения мутаций в последовательность, соответствующую участкам, определяющим комплементарность (CDR), или в любую другую последовательность в составе генной последовательности, кодирующей нужное антитело; полученную в результате последовательность включают в экспрессионный вектор и трансформируют этим вектором подходящие клетки-хозяева (см., например, работу Borrebaeck С.А. K. and Larrick J.W. THERAPEUTIC MONOCLONAL ANTIBODIES, Published in the United Kingdom by MACMILLAN PUBLISHERS LTD, 1990).
По данному изобретению можно использовать также химерные антитела, гуманизированные антитела, полиспецифичные антитела и искусственные антитела (миметики), например, в целях снижения ксеноантигенности для человека или придания иных функций. Такие антитела могут быть получены любым известным в данной области техники методом.
Химерные антитела можно получить путем лигирования ДНК, кодирующей вариабельные области не человеческих антител, с ДНК, кодирующей константные области человеческих антител, включения полученной «сшитой» ДНК в экспрессионный вектор, и трансформирования этим вектором подходящих клеток-хозяев, в которых в результате экспрессируются желаемые антитела (см. Европейский патент №125023 и публикацию WO 92/19759). Таким путем можно получить химерные антитела, используемые по данному изобретению.
Гуманизированные антитела можно получить путем лигирования ДНК, кодирующей участки, определяющие комплементарность (CDR), не человеческих антител, с ДНК, кодирующей остальную часть молекулы человеческих антител, включения полученной «сшитой» ДНК в экспрессионный вектор, и трансформирования этим вектором подходящих клеток-хозяев, в которых в результате экспрессируются желаемые антитела.
Термин «полиспецифичные антитела» относится к асимметричным молекулам антител, в которых имеются два или более сайтов, распознающих разные антигены.
Полиспецифичные антитела (например, биспецифичные) можно получить генно-инженерным путем, взяв участки связывания антигена двух или более моноклональных антител. Такие генно-инженерные процедуры уже разработаны в данной области техники. Например, нужное биспецифичное антитело можно получить, применяя метод DVD-Ig, позволяющий тандемно соединять участки, связывающие антиген, двух разных моноклональных антител (см. Wu et al., Nature Biotechnology 25 (11), 1290 (2007)), или применяя метод с использованием ART-Ig (от англ. Asymmetric Re-engineering Technology - Immunoglobulin) - при этом модифицируют область Fc, чтобы объединить тяжелые цепи двух разных антител, способных связывать разные антигены (см. Kitazawa et al., Nature Medicine 18(10), 1570(2012)).
Термин «искусственные антитела» относится, например, к белковым структурам, не имеющим свойственной антителам молекулярной структуры, но функционально подобных антителам. Примеры применимых по данному изобретению белковых структур включают домены Куница ингибиторов сериновых протеаз, внеклеточные домены человеческого фибронектина, анкирин и липокалин. Белковую структуру, способную связываться с эпитопом по данному изобретению, можно получить путем модифицирования последовательности участка связывания мишени этой структуры (PTL 4; Clifford Mintz et.al BioProcess International, 2013, Vol. 11 (2), pp. 40-48).
Моноклональные антитела по данному изобретению могут быть модифицированы в аминокислотной последовательности или в структуре цепочек сахаров областей Fc с целью изменить их функции или свойства - за исключением функции связывания антигена - например, изменить цитотоксическое действие, активацию комплемента и время полужизни в кровотоке (см. Strohl, Current Opinion in Biotechnology, 2009, vol. 20, p. 685). Такие функционально модифицированные антитела можно получить, например, путем описанного ниже способа. Моноклональные антитела, продуцируемые клетками-хозяевами СНО, лишенными гена α1,6-фукозилтрансферазы (FU1Т8),отличаются пониженным содержанием фукозы в сахарных цепочках, что отражается в усилении цитотоксического действия, а антитела, продуцируемые клетками-хозяевами СНО. трансфицированными геном FUT 8, отличаются ослабленным цитотоксическим действием (см. публикации WO 2005/035586, WO 2002/31140 и WO 00/61739). На такую функцию антител, как активация комплемента, можно повлиять, модифицируя область Fc путем изменения аминокислотных остатков (см. патенты США №№6737056, 7297775 и 7317091). Время полужизни антител в кровотоке можно увеличить, если взять вариант области Fc с повышенной способностью связывания с одним из рецепторов Fc, а именно FcRn (см. Shuhei Hashiguchi et al., SEIKAGAKU (The Journal of Biochemistry), 2010, Vol. 82(8), p. 710). Такие функционально модифицированные антитела можно получить генно-инженерными методами.
Моноклональные антитела, используемые по данному изобретению, могут быть конъюгированными, то есть соединенными с какими-либо молекулами, например с не пептидными полимерами (например, полиэтиленгликолем), с радиоактивными агентами и токсинами. Такие конъюгированные антитела могут быть получены путем химической модификации имеющихся антител. Методы химической модификации антител уже разработаны в данной области техники. Такие конъюгированные антитела тоже входят в число моноклональных антител по данному изобретению (см. D.J. King., Applications and Engineering of Monoclonal antibodies., 1998 T.J. International Ltd, Monoclonal Antibody-Based Therapy of Cancer., 1998 Marcel Dekker Inc; Chari et al., Cancer Res., 1992 Vol. 152: 127; Liu et al., Proc Natl Acad Sci USA., 1996 Vol 93:8681).
По данному изобретению кроме полноразмерных антител, описанных выше, в число используемых антител входят также фрагменты моноклональных антител и их модифицированные формы - коль скоро они обладают способностью связываться с нужным эпитопом и проявляют антагонистическую активность. Примеры фрагментов антител включают фрагменты Fab, Fv, F(ab')2, Fab' и одноцепочечные Fv (scFv), содержащие области Fv тяжелых (Н) и легких (L) цепей, соединенные подходящей линкерной структурой. Эти антительные фрагменты могут быть связаны с функциональными молекулами не антительной природы, например с не пептидными полимерами (например, полиэтиленгликолем), с радиоактивными агентами, токсинами, низкомолекулярными соединениями, цитокинами, альбумином и ферментами.
Для получения моноклональных антител может использоваться любая система продуцирования in vitro или in vivo. Системы продуцирования in vitro по данному изобретению включают системы с использованием эукариотических клеток, например клеток животных, растений или грибов, и системы с использованием прокариотических клеток, например клеток бактерий, например Escherichia coli и Bacillus subtilis. Пригодные для целей данного изобретения клетки включают клетки животных, в частности млекопитающих, например такие широко используемые клетки, как СНО, COS, миеломные клетки, BHK, HeLa и Vero; клетки насекомых и растительные клетки. Системы продуцирования in vivo по данному изобретению включают системы продуцирования в растительном или животном организме. Примеры систем продуцирования в животных включают использование млекопитающих и насекомых. Примеры пригодных для целей данного изобретения млекопитающих включают коз, свиней, овец, мышей и крупный рогатый скот. (См. Vicki Glaser, SPECTRUM Biotechnology Applications, 1993). Примеры пригодных для целей данного изобретения насекомых включают шелковичных червей. Примеры пригодных для целей данного изобретения растений включают табак.
При использовании описанных выше систем продуцирования in vitro или in vivo для получения моноклональных антител ДНК, кодирующая тяжелые цепи (Н-цепи), и ДНК, кодирующая легкие цепи (L-цепи), могут быть включены в состав отдельных экспрессионных векторов для совместной трансформации этими векторами организма-хозяина или же ДНК Н-цепей и ДНК L-цепей включаются вместе в единый экспрессионный вектор для трансформации этим вектором организма-хозяина (см. публикацию WO 94/11523).
Полученные, как сказано выше, антитела, могут быть очищены до однородности. Для разделения и очистки моноклональных антител можно применять любой метод, обычно применяемый для разделения и очистки белков. Например, моноклональные антитела можно разделять и очищать путем соответственно подобранных или скомбинированных методик и оборудования, включая (но не ограничиваясь перечисленным здесь) аффинную хроматографию на колонках, фильтрование, ультрафильтрацию, высаливание, диализ, электрофорез в полиакриламидном геле с додецилсульфатом натрия и изоэлектрическое фокусирование (см. Antibodies: А Laboratory Manual. Ed Harlow and David Lane, Cold Spring Harbor Laboratory, 1988). Колонки для аффинной хроматографии в целях данного изобретения включают колонки с белком А и колонки с белком G. Примеры колонок с белком А включают колонки Hyper D, POROS и с сефарозой FF (Amersham Biosciences).
Моноклональные антитела, способные связываться с эпитопом, состоящим из непрерывной аминокислотной последовательности, включающей аминокислотные остатки, находящиеся в положениях с 101-го по 154-е или с 199-го по 270-е последовательности, представленной как SEQ ID NO: 226 в Перечне последовательностей, по данному изобретению являются химерными антитела, гуманизированными антитела или человеческие антителами, причем человеческие антитела наиболее предпочтительны, учитывая их потенциально низкую антигенность при введении людям. Среди человеческих антител предпочтительны те, в которых аминокислотные последовательности каркасных участков соответствуют аминокислотным последовательностям каркасных участков антител зародышевой линии человека или комбинациям аминокислотных последовательностей этих участков. Таким образом, данное изобретение относится к нейтрализующим человеческим моноклональным антителам против IL-3, в которых аминокислотные последовательности каркасных участков соответствуют аминокислотным последовательностям каркасных участков антител зародышевой линии человека или комбинациям аминокислотных последовательностей этих участков.
Поскольку каркасные участки вариабельной области таких нейтрализующих человеческих моноклональных антител против IL-3 содержат аминокислотные последовательности каркасных участков зародышевой линии человека или комбинации аминокислотных последовательностей этих участков, такие нейтрализующие человеческие моноклональные антитела против IL-3 отличаются очень низкой или нулевой иммуногенностью, обусловленной этими участками, и в то же время способны связываться с IL-33, подавляя его функции. Таким образом, когда указанные антитела используются в качестве фармацевтического агента, маловероятно, что они будут индуцировать у человека антитела, направленные против человеческих иммуноглобулинов (НАНА), и тем самым in vivo избегут выведения из организма. В результате антитела по данному изобретению обладают продленным нейтрализующим действием в отношении IL-33 и в то же время они безопасны, потому что не вызывают воспалительной реакции, обусловленной связыванием с НАНА.
По данному изобретению аминокислотными последовательностями легких и тяжелых цепей зародышевой линии человека могут служить любые аминокислотные последовательности каркасных участков зародышевой линии человека. Примерами пригодных для целей данного изобретения последовательностей включают аминокислотные последовательности, кодируемые последовательностями ДНК, кодирующими каркасные участки тяжелых и легких цепей человеческих антител, зарегистрированные в таких базах данных, как NCBI (http://www.ncbi.nlm.nih.gov/igblast/showGermline.cgi), и аминокислотные последовательности каркасных участков зародышевой линии, представленные в таблице 4. Для целей данного изобретения вариабельная область легкой цепи моет быть вариабельной областью легкой цепи типа λ или типа κ. По данному изобретению используются предпочтительно те каркасные участки легких и тяжелых цепей, которые часто встречаются in vivo и часто используются. Примеры таких каркасных участков тяжелых цепей включают каркасные участки 1, 2 и 3 зародышевых линий VH3-23, VH3-30, VH4-39 и VH4-34 и каркасный участок 4 зародышевой линии JH4. Примеры каркасных участков легких цепей, которые часто встречаются in vivo, включают каркасные участки 1, 2 и 3 зародышевых линий Vλ1-47, Vλ2-14, Vκ3-20 и Vκ1-39 и каркасный участок 4 зародышевой линии Jλ2. По данному изобретению каркасные участки тяжелых цепей могут представлять собой любую комбинацию любых каркасных участков тяжелых цепей человеческих антител. Например, можно взять каркасные участки 1 и 2 зародышевой линии VH3-23 и каркасный участок 3 зародышевой линии VH3-30 и использовать их комбинацию в качестве каркасных участков тяжелых цепей. Каркасные участки легких цепей тоже могут представлять собой любую комбинацию любых каркасных участков легких цепей человеческих антител.
По данному изобретению предпочтительны аминокислотные последовательности каркасных участков зародышевых линий VH3-23, VH3-30, JH4, Vλ1-47 и Jλ2. Конкретно говоря, каркасные участки предпочтительно имеют следующие аминокислотные последовательности: аминокислотную последовательность каркасного участка 1 легкой цепи составляют аминокислотные остатки, находящиеся в положениях с 1-го по 22-е последовательности, представленной как SEQ ID NO: 317 в Перечне последовательностей; аминокислотную последовательность каркасного участка 2 легкой цепи составляют аминокислотные остатки, находящиеся в положениях с 36-го по 50-е последовательности, представленной как SEQ ID NO: 317 в Перечне последовательностей; аминокислотную последовательность каркасного участка 3 легкой цепи составляют аминокислотные остатки, находящиеся в положениях с 58-го по 89-е последовательности, представленной как SEQ ID NO: 317 в Перечне последовательностей; аминокислотную последовательность каркасного участка 4 легкой цепи составляют аминокислотные остатки, находящиеся в положениях с 3-го по 12-й последовательности, представленной как SEQ ID NO: 401 в Перечне последовательностей; аминокислотную последовательность каркасного участка 1 тяжелой цепи составляют аминокислотные остатки, находящиеся в положениях с 1-го по 30-е последовательности, представленной как SEQ ID NO: 367 в Перечне последовательностей или же аминокислотные остатки, находящиеся в положениях с 1-го по 30-е последовательности, представленной как SEQ ID NO: 368 в Перечне последовательностей; аминокислотную последовательность каркасного участка 2 тяжелой цепи составляют аминокислотные остатки, находящиеся в положениях с 36-го по 49-е последовательности, представленной как SEQ ID NO: 367 в Перечне последовательностей, или аминокислотные остатки, находящиеся в положениях с 36-го по 49-е последовательности, представленной как SEQ ID NO: 368 в Перечне последовательностей; аминокислотную последовательность каркасного участка 3 тяжелой цепи составляют аминокислотные остатки, находящиеся в положениях с 67-го по 98-е последовательности, представленной как SEQ ID NO: 367 в Перечне последовательностей, или аминокислотные остатки, находящиеся в положениях с 67-го по 98-е последовательности, представленной как SEQ ID NO: 368 в Перечне последовательностей; аминокислотную последовательность каркасного участка 4 тяжелой цепи составляют аминокислотные остатки, находящиеся в положениях с 5-го по 15-е последовательности, представленной как SEQ ID NO: 407 в Перечне последовательностей. Более предпочтительно, каркасные участки имеют следующие аминокислотные последовательности: аминокислотную последовательность каркасного участка 1 легкой цепи составляют аминокислотные остатки, находящиеся в положениях с 1-го по 22-е последовательности, представленной как SEQ ID NO: 317 в Перечне последовательностей; аминокислотную последовательность каркасного участка 2 легкой цепи составляют аминокислотные остатки, находящиеся в положениях с 36-го по 50-е последовательности, представленной как SEQ ID NO: 317 в Перечне последовательностей; аминокислотную последовательность каркасного участка 3 легкой цепи составляют аминокислотные остатки, находящиеся в положениях с 58-го по 89-е последовательности, представленной как SEQ ID NO: 317 в Перечне последовательностей; аминокислотную последовательность каркасного участка 4 легкой цепи составляют аминокислотные остатки, находящиеся в положениях с 3-го по 12-е последовательности, представленной как SEQ ID NO: 401 в Перечне последовательностей; аминокислотную последовательность каркасного участка 1 тяжелой цепи составляют аминокислотные остатки, находящиеся в положениях с 1-го по 30-е последовательности, представленной как SEQ ID NO: 367 в Перечне последовательностей; аминокислотную последовательность каркасного участка 2 тяжелой цепи составляют аминокислотные остатки, находящиеся в положениях с 36-го по 49-е последовательности, представленной как SEQ ID NO: 367 в Перечне последовательностей; аминокислотную последовательность каркасного участка 3 тяжелой цепи составляют аминокислотные остатки, находящиеся в положениях с 67-го по 98-е последовательности, представленной как SEQ ID NO: 368 в Перечне последовательностей; аминокислотную последовательность каркасного участка 4 тяжелой цепи составляют аминокислотные остатки, находящиеся в положениях с 5-го по 15-е последовательности, представленной как SEQ ID NO: 407 в Перечне последовательностей.
В другом своем воплощении данное изобретение относится к выделенным человеческим нейтрализующим моноклональным антителам против IL-33, в которых аминокислотные последовательности участка 1, определяющего комплементарность, легкой цепи (LCDR1), участка 2, определяющего комплементарность, легкой цепи (LCDR2), участка 3, определяющего комплементарность, легкой цепи (LCDR3), участка 1, определяющего комплементарность, тяжелой цепи (HCDR1), участка 2, определяющего комплементарность, тяжелой цепи (HCDR2), участка 3, определяющего комплементарность, легкой цепи (HCDR3) соответствуют комбинациям аминокислотных последовательностей участков, определяющих комплементарность, представленных под обозначениями с С1 по С30 в таблице 1.
В одном из предпочтительных воплощений данного изобретения человеческие нейтрализующие моноклональные антитела против IL-33 содержащие комбинацию участков, определяющих комплементарность, представленную под обозначениями с С1 по С30 в таблице 1, обладают связывающей способностью и нейтрализующей активностью в отношении, в частности, зрелого IL-33, способного связываться с рецептором IL-33, тем самым проявляя свою активность, например в их числе IL-33 (аминокислотные остатки с 95-го по 270-й), IL-33 (аминокислотные остатки с 99-го по 270-й), IL-33 (аминокислотные остатки с 109-го по 270-й) и IL-33 (аминокислотные остатки с 112-го по 270-й). Более предпочтительно, IL-33. Более предпочтительно, человеческие нейтрализующие моноклональные антитела против IL-33, содержащие IL-33 комбинацию участков, определяющих комплементарность, представленную под обозначениями с С1 по С30 в таблице 1, обладают связывающей способностью в отношении IL-33 (аминокислотные остатки с 131-го по 150-й).
В одном из предпочтительных воплощений данного изобретения комбинация аминокислотных последовательностей участков, определяющих комплементарность. обеспечивает улучшенные связывающую способность и/или физические свойства антител по данному изобретению. В одном из особенно предпочтительных воплощений данного изобретения верхний предел значений константы скорости диссоциации (koff) с человеческим IL-33 составляет около 3,5×10-5/с или менее, более предпочтительно около 2,0×10-5/с или менее, более предпочтительно около 1,5×10-5/с или менее, еще более предпочтительно около 1,0×10-5/с или менее; нижний предел константы скорости диссоциации составляет (но не ограничивается приведенным здесь значением) 10-7/с или более, предпочтительнее 10-6/с или более, предпочтительнее около 5×10-6/с или более.
В числе человеческих нейтрализующих моноклональных антител против IL-33 предпочтительнее те, которые характеризуются малой константой диссоциации (Kd) с человеческим IL-33. Верхний предел значений константы диссоциации (Kd) составляет 10-9М или менее, более предпочтительно 10-10М или менее, еще более предпочтительно 10-12М или менее, например. Нижний предел константы скорости диссоциации составляет (но не ограничивается приведенными здесь значениями) 10-14М или более, предпочтительнее 10-13М или более.
Человеческие нейтрализующие моноклональные антитела против IL-33 по данному изобретению подавляют образование IL-6 клетками эндотелия пупочной вены человека (HUVEC), стимулированными IL-33. В частности, предпочтительны антитела с более выраженным подавляющим действием. Конкретно говоря, в одном из предпочтительных воплощений данного изобретения предпочтительны человеческие нейтрализующие моноклональные антитела против IL-33, подавляющие на 50% или более, предпочтительнее около 70% или более, еще предпочтительнее около 90% или более (степень подавления) образование IL-6 клетками HUVEC, стимулированными IL-33 в концентрации 100 нг/мл, как описано ниже в примере 10.
Человеческие нейтрализующие моноклональные антитела против IL-33 по данному изобретению подавляют образование IL-5, IL-6 и/или IL-13 клетками человека с базофильным лейкозом в стадии бластного криза (линия KU-812), стимулированными IL-33. В частности, предпочтительны антитела с более выраженным подавляющим действием. Конкретно говоря, в одном из предпочтительных воплощений данного изобретения предпочтительны человеческие нейтрализующие моноклональные антитела против IL-33, подавляющие на около 30% или более, предпочтительнее около 50% или более, еще предпочтительнее около 70% или более (степень подавления) образование IL-5, IL-6 и/или IL-13 клетками KU-812, стимулированными IL-33 в концентрации 100 нг/мл, как описано ниже в примере 11.
Человеческие нейтрализующие моноклональные антитела против IL-33 по данному изобретению подавляют образование IFN-γ человеческими мононуклеарными клетками периферической крови, стимулированными IL-33. В частности, предпочтительны антитела с более выраженным подавляющим действием. Конкретно говоря, в одном из предпочтительных воплощений данного изобретения предпочтительны человеческие нейтрализующие моноклональные антитела против IL-33, подавляющие на около 80% или более, предпочтительнее около 90% или более, еще предпочтительнее около 95% или более (степень подавления) образование IFN-γ человеческими мононуклеарными клетками периферической крови, стимулированными IL-33 в концентрации 10 нг/мл, как описано ниже в примере 12.
Человеческие нейтрализующие моноклональные антитела против IL-33 по данному изобретению подавляют у мышей воспаление, вызванное введением человеческого IL-33.
В частности, предпочтительны антитела с более выраженным противовоспалительным действием. Конкретно говоря, в одном из предпочтительных воплощений данного изобретения предпочтительно ежедневное на протяжении семи суток внутрибрюшинное введение человеческих нейтрализующих моноклональных антител против IL-33 в дозе 10 мг/кг массы тела мыши, что обеспечивает степень подавления проявлений воспаления: увеличения массы селезенки, концентрации иммуноглобулинов A (IgA) и Е (IgE) в сыворотке крови, содержание нейтрофилов, базофилов и эозинофилов в циркулирующей крови и/или концентрации интерлейкина-5 (IL-5) вы сыворотке крови, - вызванных непрерывным на протяжении семи суток введением человеческого IL-33 в количестве 0,4 мкг на одну особь на около 30% или более, предпочтительнее на около 50% или более, еще предпочтительнее на около 80% или более, как описано в примере 13.
Человеческие нейтрализующие моноклональные антитела против IL-33 по данному изобретению предпочтительно обладают превосходными физическими свойствами. В частности, указанные антитела предпочтительно не характеризуются бимодальным распределением по размерам частиц и отличаются очень низкой степенью агрегации при определении этого параметра методом динамического светорассеяния. Человеческие нейтрализующие моноклональные антитела против IL-33 по данному изобретению предпочтительно характеризуются высоким параметром взаимодействия (kD), что указывает на коллоидную стабильность. Например, указанный параметр взаимодействия составляет предпочтительно -12,4 мл/г или более, предпочтительнее -10 мл/г или более, еще предпочтительнее -8,5 мл/г или более.
Человеческие нейтрализующие моноклональные антитела против IL-33 по данному изобретению предпочтительно обладают отличной термодинамической стабильностью. Например, предпочтительные антитела характеризуются такой термодинамической стабильностью, что состояние свернутой конформации иммуноглобулиновой молекулы исчезает при температуре (Tm) 65°С или более, предпочтительно 68°С или более, предпочтительнее 70°С или более, еще предпочтительнее 73°С или более.
Человеческие нейтрализующие моноклональные антитела против IL-33 по данному изобретению предпочтительно обладают высокой молекулярной стабильностью. Стабильность антител можно определить любым обычно применяемым для подобных целей методом, например, определяя стабильность при хранении или при принудительном окислении. В одном из предпочтительных воплощений данного изобретения молекулы антител характеризуются долей мономеров 90% или более, предпочтительнее 95% или более и связывающей активностью в отношении человеческого белка IL-33 95% или более, предпочтительнее 99% или более по результатам определения стабильности при хранении при 40°С в течение 4 недель, как описано в примере 21
Как описано в примере 22, человеческие нейтрализующие моноклональные антитела против IL-33 по данному изобретению после принудительного окисления 1%-ным раствором перекиси водорода при температуре 37°С в течение 24 часов предпочтительно обладают связывающей активностью в отношении человеческого белка IL-33 80% или более, предпочтительнее 85% или более, еще предпочтительнее 90% или более.
В свете сказанного выше предпочтительны человеческие нейтрализующие моноклональные антитела против IL-33, выбираемые из комбинаций участков, определяющих комплементарность, представленных в таблице 1. В более предпочтительном воплощении данного изобретения в человеческих нейтрализующих моноклональных антителах против IL-33 участки, определяющие комплементарность. имеют аминокислотные последовательности соответственно определенным комбинациям, а именно C1, С8, С15, С17 или С18, приведенным в таблице 1.
Человеческие нейтрализующие моноклональные антитела против IL-33, идентифицируемые по комбинации аминокислотных последовательностей соответствующих участков, определяющих комплементарность, могут иметь аминокислотные последовательности любых каркасных участков в вариабельных областях - постольку, поскольку сохраняется способность связывания антигена. Соответствующие аминокислотные последовательности каркасных участков - это предпочтительно аминокислотные последовательности каркасных участков зародышевой линии человека или комбинации их аминокислотных последовательностей. Более предпочтительны аминокислотные последовательности каркасных участков какой-либо часто используемой in vivo (у людей) зародышевой линии.
По данному изобретению в аминокислотных последовательностях каркасных участков предпочтительно имеются следующие аминокислотные последовательности: аминокислотная последовательность каркасного участка 1 легкой цепи - это аминокислотные остатки, занимающие положения с 1-го по 22-е в последовательности, представленной как SEQ ID NO: 317 в Перечне последовательностей; аминокислотная последовательность каркасного участка 2 легкой цепи - это аминокислотные остатки, занимающие положения с 36-го по 50-е в последовательности, представленной как SEQ ID NO: 317 в Перечне последовательностей; аминокислотная последовательность каркасного участка 3 легкой цепи - это аминокислотные остатки, занимающие положения с 58-го по 89-е в последовательности, представленной как SEQ ID NO: 317 в Перечне последовательностей; аминокислотная последовательность каркасного участка 4 легкой цепи - это аминокислотные остатки, занимающие положения с 3-го по 12-е в последовательности, представленной как SEQ ID NO: 401 в Перечне последовательностей; аминокислотная последовательность каркасного участка 1 тяжелой цепи - это аминокислотные остатки, занимающие положения с 1-го по 30-е в последовательности, представленной как SEQ ID NO: 367 в Перечне последовательностей или с 1-го по 30-е в последовательности, представленной как SEQ ID NO: 368 в перечне последовательностей;
аминокислотная последовательность каркасного участка 2 тяжелой цепи - это аминокислотные остатки, занимающие положения с 36-го по 49-е в последовательности, представленной как SEQ ID NO: 367 в Перечне последовательностей или с 36-го по 49-е в последовательности, представленной как SEQ ID NO: 368 в перечне последовательностей; аминокислотная последовательность каркасного участка 3 тяжелой цепи - это аминокислотные остатки, занимающие положения с 67-го по 98-е в последовательности, представленной как SEQ ID NO: 367 в Перечне последовательностей или с 67-го по 98-е в последовательности, представленной как SEQ ID NO: 368 в перечне последовательностей; и аминокислотная последовательность каркасного участка 4 тяжелой цепи - это аминокислотные остатки, занимающие положения с 5-го по 15-е в последовательности, представленной как SEQ ID NO: 407 в Перечне последовательностей. Более предпочтительно, что в аминокислотных последовательностях каркасных участков имеются следующие аминокислотные последовательности: аминокислотная последовательность каркасного участка 1 легкой цепи - это аминокислотные остатки, занимающие положения с 1-го по 22-е в последовательности, представленной как SEQ ID NO: 317 в Перечне последовательностей; аминокислотная последовательность каркасного участка 2 легкой цепи - это аминокислотные остатки, занимающие положения с 36-го по 50-е в последовательности, представленной как SEQ ID NO: 317 в Перечне последовательностей; аминокислотная последовательность каркасного участка 3 легкой цепи - это аминокислотные остатки, занимающие положения с 58-го по 89-е в последовательности, представленной как SEQ ID NO: 317 в Перечне последовательностей; аминокислотная последовательность каркасного участка 4 легкой цепи - это аминокислотные остатки, занимающие положения с 3-го по 12-е в последовательности, представленной как SEQ ID NO: 401 в Перечне последовательностей; аминокислотная последовательность каркасного участка 1 тяжелой цепи - это аминокислотные остатки, занимающие положения с 1-го по 30-е в последовательности, представленной как SEQ ID NO: 367 в Перечне последовательностей или с 1-го по 30-е в последовательности, представленной как SEQ ID NO: 367 в перечне последовательностей; аминокислотная последовательность каркасного участка 2 тяжелой цепи - это аминокислотные остатки, занимающие положения с 36-го по 49-е в последовательности, представленной как SEQ ID NO: 367 в Перечне последовательностей; аминокислотная последовательность каркасного участка 3 тяжелой цепи - это аминокислотные остатки, занимающие положения с 67-го по 98-е в последовательности, представленной как SEQ ID NO: 368 в перечне последовательностей; и аминокислотная последовательность каркасного участка 4 тяжелой цепи - это аминокислотные остатки, занимающие положения с 5-го по 15-е в последовательности, представленной как SEQ ID NO: 407 в Перечне последовательностей. Примеры предпочтительных комбинаций аминокислотных последовательностей вариабельных областей тяжелых и легких цепей антител по данному изобретению приведены в таблице 2.
В одном из предпочтительных воплощений данного изобретения человеческие нейтрализующие моноклональные антитела против IL-33 содержат вариабельные области, которые имеют аминокислотные последовательности, соответствующие любой комбинации с V1 по V28, приведенных в таблице 2.
В одном из более предпочтительных воплощений данного изобретения человеческие нейтрализующие моноклональные антитела против IL-33 содержат участки, определяющие комплементарность, которые имеют аминокислотные последовательности, соответствующие одной из определенных комбинации, представленных в таблице 2, а именно V1, V8, V15, V17 или V18.
В зависимости от различий в константных областях тяжелых цепей иммуноглобулины (Ig) человека разделяют на следующие типы: IgG (включая IgGl, IgG2, IgG3 и IgG4), имеющие тяжелые цепи типа γ; IgM, имеющие тяжелые цепи типа μ; IgA (включая IgA1 и IgA2), имеющие тяжелые цепи типа α; IgD, имеющие тяжелые цепи типа δ и IgE, имеющие тяжелые цепи типа ε. Все эти типы входят в константные области человеческих нейтрализующих моноклональных антител против IL-33 по данному изобретению. Легкие цепи бывают типов κ и λ, различающиеся хромосомной локализацией соответствующих генов. В легких цепях антител по данному изобретению входят оба этих типа легких цепей. При получении антител в фармацевтических целях предпочтительны антитела с легкими цепями типа κ - с точки зрения склонности к агрегации, однако антитела с легкими цепями типа λ также можно использовать, поскольку у легких цепей типа λ иная аминокислотная последовательность, чем у легких цепей типа κ, а разнообразие сходное. Человеческие нейтрализующие моноклональные антитела против IL-33 по данному изобретению - это предпочтительно IgG с легкими цепями типа λ и тяжелыми цепями типа γ, более предпочтительно - IgG1 с легкими цепями типа λ и тяжелыми цепями типа γ1 - с точки зрения стабильности в крови.
Аминокислотная последовательность белка IL-33 у разных видов животных различна; так, аминокислотная последовательность IL-33 человека, представленная как SEQ ID NO: 226 в Перечне последовательностей, отличается от таковой IL-33 обезьяны, представленной как SEQ ID NO: 227 в Перечне последовательностей. Вообще-то, обезьяны используются в качестве подопытных животных в фармакологических испытаниях и для определения безопасности фармацевтической продукции (антител в данном случае), а человеческие нейтрализующие моноклональные антитела против IL-33 по данному изобретению, кроме того, предпочтительно способны связываться с обезьяньим белком IL-33, более предпочтительно - связываться с обезьяньим белком IL-33, проявляя сродство связывания, сходное с таковым в отношении человеческого IL-33. В одном из особенно предпочтительных воплощений данного изобретения отношение код при связывании с человеческим IL-33 к koff при связывании с обезьяньим IL-33 составляет не более около 20 раз, более предпочтительно не более около 10 раз, еще более предпочтительно не более около 5 раз.
Иллюстративные примеры антительных фрагментов, используемых по данному изобретению, включают фрагменты Fab, Fv, F(ab')2, Fab' и scFv. Эти фрагменты антител могут быть присоединены к функциональным молекулам не антительной природы, например непептидным полимерам, например полиэтиленгликолю (PEG); радиоактивным агентам, токсинам, низкомолекулярным соединениям, цитокинам, альбумину и ферментам.
Человеческие нейтрализующие моноклональные антитела против IL-33 по данному изобретению могут быть присоединены к антителам, обладающим специфичностью в отношении антигена, отличного от IL-33, так что получается полиспецифичное антитело, например биспецифичное антитело. Примеры антигенов, отличных от IL-33 (не имеющие ограничительного характера) включают фактор некроза опухолей «альфа» (TNF-α), рецепторы интерлейкина-6 (IL-), лимфоцитарные белки CD3 и CD20, интегрин α4, стимулятор В-лимфоцитов BLys, тимусный стромальный лимфопоэтин (TSL), иммуноглобулин Е (IgE), интерлейкины IL-1, IL-2, IL-4, IL-5, IL-6, IL-13, IL-17, IL-23 и IL-25.
Человеческие нейтрализующие моноклональные антитела против IL-33 и их фрагменты по данному изобретению могут иметь модифицированную аминокислотную последовательность или модифицированные сахарные цепочки в областях Fc, что дает функционально модифицированные антитела с измененными желаемым образом функциями или свойствами, например цитотоксическим действием, функцией активации комплемента и временем полужизни в циркулирующей крови (Kenya Shitara, Journal of the Pharmaceutical Society of Japan, 2009, Vol. 129 (1), p. 3; Akiko Ishii et al., Folia Pharmacologica Japonica, 2010, Vol. 136 (5), p.280; Shuhei Hashiguchi et al., SEIKAGAKU (The Journal of Biochemistry), 2010, Vol. 82 (8), p. 710; Strohl, Current Opinion in Biotechnology, 2009, vol. 20, p. 685).
Человеческие нейтрализующие моноклональные антитела против IL-33 и их фрагменты по данному изобретению могут быть присоединены к другим функциональным молекулам, так что получаются конъюгаты антител. Например, антителам или их фрагментам по данному изобретению можно добавить новые функции, связывая их с такими функциональными агентами, как непептидные полимеры, например полиэтиленгликолю (PEG); радиоактивные вещества, токсины, низкомолекулярные соединения, альбумин, цитокины и ферменты.
Другие воплощения данного изобретения относятся к молекулам нуклеиновых кислот (полинуклеотидам, или нуклеотидным последовательностям), кодирующим белковую часть человеческих нейтрализующих моноклональных антител против IL-33, содержащей каркасные участки с аминокислотными последовательностями зародышевой линии (линий); к векторам, включающим эти нуклеотидные последовательности; к клеткам-хозяевам, несущим эти векторы; к способам получения человеческих нейтрализующих моноклональных антител против IL-33, включающим культивирование указанных клеток-хозяев.
В других своих воплощениях данное изобретение относится к композиции, содержащей описанные выше человеческие нейтрализующие моноклональные антитела против IL-33. Поскольку IL-33 вызывает воспаление и подобные явления, ожидается, что человеческие нейтрализующие моноклональные антитела против IL-33 применимы при диагностировании, лечении, профилактике или ослаблении заболеваний, ассоциированных с IL-33. Соответственно, в одном из своих воплощений данное изобретение относится к фармацевтической композиции, содержащей человеческие нейтрализующие моноклональные антитела против IL-33, предназначенной для диагностирования, лечения, профилактики или ослабления заболеваний, ассоциированных с IL-33. Поскольку IL-33 индуцирует образование цитокинов, хемокинов и медиаторов воспаления, данное изобретение в еще одном из своих воплощений относится к ингибитору экспрессии цитокинов, хемокинов или медиаторов воспаления, содержащему человеческие нейтрализующие моноклональные антитела против IL-33.
Цитокином, экспрессия которого подлежит подавлению ингибитором экспрессии цитокинов, хемокинов или медиаторов воспаления по данному изобретению, является один из цитокинов, индуцируемых IL-33, включая TNF-α, IFN-γ, IL-1β, IL-3, IL-4, IL-5, IL-6, IL-13 и др. Хемокином, экспрессия которого подлежит подавлению ингибитором экспрессии цитокинов, хемокинов или медиаторов воспаления по данному изобретению, является один из хемокинов, индуцируемых IL-33, включая CXCL2, CCL2, CCL3, CCL6, CCL17, CCL24 и др. Медиатором воспаления, экспрессия которого подлежит подавлению ингибитором экспрессии цитокинов, хемокинов или медиаторов воспаления по данному изобретению, является один из медиаторов воспаления, индуцируемых IL-33, включая PGD2, LTB4 и др. В одном из особенно предпочтительных воплощений данного изобретения ингибитор экспрессии, содержащий человеческие нейтрализующие моноклональные антитела против IL-33, предназначен для подавления экспрессии IFN-γ, IL-5, IL-6 или IL-13. Более предпочтительно, чтобы указанный ингибитор подавлял образование IL-6.
В другом своем воплощении данное изобретение относится к фармацевтической композиции, содержащей моноклональные антитела по данному изобретению. Данное изобретение относится также к способу диагностирования, лечения, предотвращения или ослабления заболеваний, ассоциированных с IL-33, причем этот способ включает введение в организм пациента моноклональных антител по данному изобретению IL-33. В этом своем воплощении данное изобретение также относится к использованию моноклональных антител по данному изобретению для изготовления лекарственного препарата для диагностирования, лечения, предотвращения или ослабления заболеваний, ассоциированных с IL-33.
Заболевания, ассоциированные с IL-33, включают (но не ограничиваются перечисленным здесь) астму, атопический дерматит, крапивницу, поллиноз, анафилактический шок, синусит (включая эозинофильный синусит), аллергический энцефаломиелит, гиперэозинофильный синдром, ревматическую полимиалгию, ревматические заболевания сердца, рассеянный склероз, артрит (например, ревматоидный артрит, юношеский артрит, псориатический артрит, деформирующий артроз и синдром Рейтера), системную красную волчанку (включая дискоидную красную волчанку), пузырчатку, пемфигоид, псориаз, анкилозирующий спондилит, гепатит (например, аутоиммунный гепатит и хронический активный гепатит), воспалительные заболевания кишечника (например, язвенный колит, болезнь Крона, глютеновую энтеропатию), синдром Шегрена, аутоиммунную гемолитическую анемию, аутоиммунные воспалительные заболевания глаз, аутоиммунную неонатальную тромбоцитопению, аутоиммунную нейтропению, аутоиммунные оофорит и орхит, аутоиммунную тромбоцитопению, аутоиммунный тиреоидит, полимиозит, дерматомиозит, миастению (myasthenia gravis), резистентность к агонистам адренергических рецепторов, очаговую алопецию, антифосфолипидный синдром, аутоиммунные поражения надпочечников (например, аутоиммунную болезнь Аддисона), дерматит Дюринга (целиакию, синдром мальабсорбции), синдром хронической усталости/синдром иммунной дисфункции (CFIDS), холодовую агглютининовую болезнь, эссенциальную смешанную криоглобулинемию, фибромиалгию-фибромиозит, гломерулонефрит, (например, IgA-нефропатию), болезнь Грейвса, гипертиреоидизм (тиреоидит Хасимото), идиопатическую тромбоцитопеническую пурпуру (ITP), смешанное заболевание соединительной ткани, сахарный диабет типа 1 или иммуно-опосредованный сахарный диабет, пернициозную анемию, полихондрит, полигландулярный синдром, синдром мышечной скованности, витилиго, саркоидоз, полиэндокринопатию, другие эндокринопатии, артериосклероз, фиброз печени (например, первичный билиарный цирроз), фиброз легких (например, идиопатический фиброз легких), хронические обструктивные заболевания легких (COPD), склеродермию, включая лимитированную склеродермию (синдром CREST) и болезнь Рейно, тубулоинтерстициальный нефрит, болезнь плотного осадка, острое поражение почек, миокартид, кардиомиопатию, неврит (например, синдром Гийена-Барре), узелковый полиартериит, кардиотомический синдром, хроническую воспалительную демиелинизирующую нейропатию, IgA-нефропатию, плоский лишай, болезнь Меньера, постмиокардитический кардиосклероз, увеит, периодическую офтальмию, васкулит, первичную агаммаглобулинемию, раковые заболевания (например, опухоли головного мозга, рак гортани, губ и полости рта, гипофарингеальный рак, рак щитовидной железы, рак пищевода, рак молочной железы, рак легких, рак желудка, карциному коры надпочечников, рак желчных протоков, рак желчного пузыря, рак печени, рак поджелудочной железы, рак мочевого пузыря, рак толстой кишки, рак матки, рак яичника, рак предстательной железы, рак яичка, хронический лимфоцитарный лейкоз, хронический миелоидный (миелогенный) лейкоз, опухоль Юинга, болезнь Ходжкина, неходжкинскую лимфому, меланому, мезотелиому и множественную миелому), инфекции, устойчивые к иммунной защите (например, тяжелый острый респираторный синдром (SARS)), летальную гиперцитокинемию, связанную с инфекцией высоко вирулентным вирусом гриппа, и сепсис.Предпочтительно болезнями, ассоциированными с IL-33, являются астма, атопический дерматит, поллиноз, анафилактический шок, синусит (включая эозинофильный синусит), болезнь Крона язвенный колит, артрит, системная красная волчанка, пузырчатка, пемфигоид, склеродермия, анкилозирующий спондилит, фиброз печени (включая первичный билиарный цирроз), фиброз легких, хронические обструктивные заболевания легких (COPD), острое поражение почек, васкулит и рак.
Фармацевтическая композиция, содержащая человеческие нейтрализующие моноклональные антитела против IL-33, по данному изобретению может также содержать фармацевтически приемлемый носитель, разбавитель или иной эксципиент, в добавление к человеческим нейтрализующим моноклональным антителам против IL-33, которые играют роль активного ингредиента. Фармацевтическая композиция по данному изобретению может также содержать дополнительный активный ингредиент, отличный от человеческих нейтрализующих моноклональных антител против IL-33 по данному изобретению, например противовоспалительный агент или агент, подавляющий иммунную систему. Такая композиция предлагается в лекарственной форме, подходящей для парентерального или перорального введения в организм пациента. С точки зрения использования композиции по данному изобретению в качестве антительного фармацевтического препарата предпочтительно парентеральное введение. Примеры парентерального введения включают (но не ограничиваются перечисленным здесь) внутривенное, интраартериальное, подкожное, местное, внутрибрюшинное, внутримышечное, интраназальное, глазное, чрескожное, введение через слизистые оболочки, интратекальное, ректальное и интрацеребральное введение.
Фармацевтическая композиция по данному изобретению может предлагаться в любой лекарственной форме в зависимости от пути введения. Примеры лекарственных форм, пригодных по данному изобретению, включают формы для введения путем инъекций, порошки, формы для введения путем инфузии, гранулы, таблетки и суппозитории. В рамках парентерального введения предпочтительны лекарственные формы, пригодные для введения путем инъекции, инфузии или порошки, которые растворяют перед использованием. Эти препараты могут также содержать какие-либо из различных дополнительных ингредиентов, используемых в фармацевтических препаратах. Конкретные примеры таких дополнительных ингредиентов включают носители и другие добавочные компоненты, например консерванты, стабилизирующие, обезболивающие и эмульгирующие агенты.
Человеческие нейтрализующие моноклональные антитела против IL-33, по данному изобретению можно вводить в организм пациента путем непрерывной инфузии, делая между вливаниями перерывы, например раз в сутки, раз в неделю или в месяц, или от одного до семи раз в год. Или же их вводят отдельными разовыми дозами; такое введение может быть внутривенным, подкожным, местным, пероральным, интраназальным, ректальным, внутримышечным или интравентрикулярным; возможно также введение путем вдыхания. Предпочтительный протокол введения препарата по данному изобретению подразумевает введение максимально возможной дозы или максимально возможную частоту введения, при которых еще удается избежать серьезных негативных побочных эффектов. Суммарная доза за неделю составляет, как правило, по меньшей мере около 0,05 мкг на 1 кг массы тела, чаще - по меньшей мере около 0,2 мкг/кг, чаще всего по меньшей мере около 0,5 мкг/кг, обычно по меньшей мере около 1 мкг/кг, более обычно по меньшей мере около 10 мкг/кг, наиболее обычно по меньшей мере около 100 мкг/кг, предпочтительно по меньшей мере около 0,2 мг/кг, более предпочтительно по меньшей мере около 1,0 мг/кг, наиболее предпочтительно по меньшей мере около 2,0 мг/кг, оптимально по меньшей мере около 10 мг/кг, более оптимально по меньшей мере около 25 мг/кг, наиболее оптимально по меньшей мере около 50 мг/кг.
Человеческие нейтрализующие моноклональные антитела против IL-33, по данному изобретению можно использовать для, например, диагностических анализов с целью выявления экспрессии IL-33 в определенных клетках или тканях, или в сыворотке крови у индивидов, страдающих заболеваниями, ассоциированными с IL-33. Для диагностического применения человеческие нейтрализующие моноклональные антитела против IL-33, по данному изобретению предпочтительно являются, как правило конъюгированными с меткой, позволяющей их выявлять.
В другом своем воплощении данное изобретение относиться к нейтрализующим моноклональным антителам против IL-33, которые конкурируют за связывание с IL-33 с нейтрализующими моноклональными антителами против IL-33, содержащими аминокислотные последовательности, соответствующие комбинациям определенных аминокислотных последовательностей участков, определяющих комплементарность, (С1, С8, С15, С17 или С18, представленных в таблице 1) или соответствующие комбинациям определенных аминокислотных последовательностей вариабельных областей (V1, V8, V15, V17 или V18, представленных в таблице 2).
Нейтрализующие моноклональные антитела против IL-33, которые конкурируют за связывание с IL-33 с нейтрализующими моноклональными антителами против IL-33, содержащими аминокислотные последовательности, соответствующие комбинациям определенных аминокислотных последовательностей участков, определяющих комплементарность, или соответствующие комбинациям определенных аминокислотных последовательностей вариабельных областей, можно получить следующим образом: антитела против IL-33 образуются генно-инженерным путем, например с помощью фагового дисплея или с использованием гибридом; проводят скрининг полученных антител против IL-33, например, методом поверхностного плазмонного резонанса (SPR), как описано ниже.
В качестве лиганда берут биотинилированный человеческий белок IL-33 в концентрации 4 мкг/мл; для иммобилизации его наносят на сенсорный чипа с иммобилизованным авидином в количестве, эквивалентном 1300-1600 RU. В качестве аналита берут антитела против IL-33 в концентрации 15 мкг/мл, которые наносят на чип, чтобы они связались с человеческим белком IL-33, иммобилизованным на сенсорном чипе. Эту процедуру повторяют несколько раз до тех пор, пока молекулы человеческого белка IL-33, иммобилизованные на сенсорном чипе, не свяжутся с антителами против IL-33, то есть пока не наступит в этом смысле насыщение. Затем определяют уровень связывания при насыщении (уровень связывания при насыщении 1).
Такой же эксперимент проводят с человеческими нейтрализующими моноклональными антителами против IL-33 содержащими участки, определяющие комплементарность, которые имеют аминокислотные последовательности, соответствующие определенным комбинациям по данному изобретению, или с человеческими нейтрализующими моноклональными антителами против IL-33, содержащими вариабельные области, которые имеют аминокислотные последовательности, соответствующие определенным комбинациям по данному изобретению. И в этом случае определяют уровень связывания при насыщении (уровень связывания при насыщении 2).
После насыщения человеческого белка IL-33 на сенсорном чипе человеческими нейтрализующими моноклональными антителами против IL-33 содержащими участки, определяющие комплементарность, которые имеют аминокислотные последовательности, соответствующие определенным комбинациям по данному изобретению, или человеческими нейтрализующими моноклональными антителами против IL-33, содержащими вариабельные области, которые имеют аминокислотные последовательности, соответствующие определенным комбинациям по данному изобретению, наносят в качестве аналита какое-либо антитело против IL-33 в концентрации 15 мкг/мл. Определяют, происходит ли дополнительное связывание этого аналита с человеческим белком IL-33, насыщенным человеческими нейтрализующими моноклональными антителами против IL-33 содержащими участки, определяющие комплементарность, которые имеют аминокислотные последовательности, соответствующие определенным комбинациям по данному изобретению, или человеческими нейтрализующими моноклональными антителами против IL-33, содержащими вариабельные области, которые имеют аминокислотные последовательности, соответствующие определенным комбинациям по данному изобретению.
Если какое-либо антитело против IL-33 дополнительно связывается с человеческим белком IL-33, насыщенным человеческими нейтрализующими моноклональными антителами против IL-33 содержащими участки, определяющие комплементарность, которые имеют аминокислотные последовательности, соответствующие определенным комбинациям по данному изобретению, или человеческими нейтрализующими моноклональными антителами против IL-33, содержащими вариабельные области, которые имеют аминокислотные последовательности, соответствующие определенным комбинациям по данному изобретению, и при этом сохраняется уровень насыщения 1, рассчитанный, как описано выше, то данное антитело против IL-33 считается не конкурирующим. Если не происходит дополнительного связывания данного антитела с человеческим белком IL-33, насыщенным человеческими нейтрализующими моноклональными антителами против IL-33 содержащими участки, определяющие комплементарность, которые имеют аминокислотные последовательности, соответствующие определенным комбинациям по данному изобретению, или человеческими нейтрализующими моноклональными антителами против IL-33, содержащими вариабельные области, которые имеют аминокислотные последовательности, соответствующие определенным комбинациям по данному изобретению, то данное антитело против IL-33 считается конкурирующим. Если данное антитело против IL-33 дополнительно связывается с человеческим белком IL-33, насыщенным человеческими нейтрализующими моноклональными антителами против IL-33 содержащими участки, определяющие комплементарность, которые имеют аминокислотные последовательности, соответствующие определенным комбинациям по данному изобретению, или человеческими нейтрализующими моноклональными антителами против IL-33, содержащими вариабельные области, которые имеют аминокислотные последовательности, соответствующие определенным комбинациям по данному изобретению, но уровень этого дополнительного связывания ниже, чем уровень насыщения 1, рассчитанный, как описано выше, причем разница существенная, то данное антитело против IL-33 считается конкурирующим. Существенная ли наблюдается разница, определяют обычными статистическими методами (например, с помощью t-критерия Стьюдента). Уровень значимости считается равным или меньше 5% или 1%.
Нейтрализующие моноклональные антитела против IL-33, которые конкурируют за связывание с IL-33 с человеческими нейтрализующими моноклональными антителами против IL-33, содержащими аминокислотные последовательности, соответствующие комбинациям определенных аминокислотных последовательностей участков, определяющих комплементарность, или соответствующие комбинациям определенных аминокислотных последовательностей вариабельных областей, могут быть антителами человека или животного, например, мыши, крысы, кролика, козы или верблюда; они могут быть также химерными или гуманизированными антителами, полученными путем комбинирования указанных антител.
Предпочтительно нейтрализующие моноклональные антитела против IL-33, которые конкурируют за связывание с IL-33 с человеческими нейтрализующими моноклональными антителами против IL-33, содержащими аминокислотные последовательности, соответствующие комбинациям определенных аминокислотных последовательностей участков, определяющих комплементарность, или соответствующие комбинациям определенных аминокислотных последовательностей вариабельных областей, являются химерными, гуманизированными или человеческими антителами, наиболее предпочтительно - человеческими антителами.
Нейтрализующие моноклональные антитела против IL-33, которые конкурируют за связывание с IL-33 с человеческими нейтрализующими моноклональными антителами против IL-33, содержащими аминокислотные последовательности, соответствующие комбинациям определенных аминокислотных последовательностей участков, определяющих комплементарность, или соответствующие комбинациям определенных аминокислотных последовательностей вариабельных областей, включают антительные фрагменты. Примеры фрагментов антител включают фрагменты Fab, Fv, F(ab')2, Fab' и scFv. Предпочтительны антительные фрагменты, связанные с полиэтиленгликолем.
Далее описывается способ получения нейтрализующих моноклональных антител против IL-33 и т.п. по данному изобретению. Человеческие нейтрализующие моноклональные антитела против IL-33 могут быть получены генно-инженерным путем: последовательность ДНК, которая содержит нуклеотидные последовательности, кодирующие желаемую комбинацию участков, определяющих комплементарность, и желаемую комбинацию каркасных участков, и кодирует вариабельные области легких и тяжелых цепей, встраивают в экспрессионный вектор; этим экспрессионным вектором трансформируют клетки-хозяева; затем эти клетки-хозяева культивируют (см., например, Borrebaeck С.А.K. and Larrick J.W. THERAPEUTIC MONOCLONAL ANTIBODIES, Published in the United Kingdom by MACMILLAN PUBLISHERS LTD, 1990). Или же получают последовательности ДНК, которые соответственно кодируют полноразмерную тяжелую цепь и полноразмерную легкую цепь; для этого соединяют последовательность ДНК, кодирующую константную область легкой цепи, с последовательностью ДНК, кодирующей вариабельную область легкой цепи, и соединяют последовательность ДНК, кодирующую константную область тяжелой цепи, с последовательностью ДНК, кодирующей вариабельную область тяжелой цепи. Комбинация последовательностей ДНК, кодирующих соответственно полноразмерную тяжелую цепь и полноразмерную легкую цепь предпочтительных человеческих нейтрализующих моноклональных антител против IL-33 по данному изобретению, включает, например, таковую IgG1, в котором имеется легкая цепь типа λ, представленная в таблице 5. Если антитела, о которых идет речь, получают генно-инженерным путем с использованием животных клеток, С-концевой остаток лизина может отсутствовать. Поэтому в нуклеотидных последовательностях, кодирующих тяжелые цепи, может отсутствовать триплет нуклеотидов «AAG» на 3'-конце нуклеотидной последовательности, кодирующей тяжелую цепь, представленной в таблице 5 (SEQ ID NO: 254-277 в Перечне последовательностей).
Для получения антител может можно использовать продукционную систему in vitro. Примеры продукционных систем in vitro включают эукариотические клетки, например животные клетки, растительные клетки или клетки грибов; прокариотические клетки, например клетки бактерий, например, Escherichia coli и Bacillus subtilis. Примеры пригодных для целей данного изобретения животных клеток включают клетки млекопитающих, например таких обычно используемых линий, как СНО, COS, миеломные клетки, BHK, HeLa, Vero, 293, NSO, Namalwa и YB2/0; можно также использовать клетки насекомых и растительные клетки. Предпочтительны по данному изобретению клетки линий 293 и СНО.

Если моноклональные антитела по данному изобретению получают в какой-либо из описанных выше продукционных систем in vitro, то ДНК, кодирующая тяжелую цепь, и ДНК, кодирующая легкую цепь, могут находиться в составе разных экспрессионных векторов, которыми вместе трансформируют клетки-хозяева, или же они могут быть встроены в один и тот же экспрессионный вектор, которым трансформируют клетки-хозяева (см. публикацию WO 94/11523). Примеры предпочтительных по данному изобретению векторов, пригодных для животных клеток, включают (но не ограничиваются перечисленным здесь) pConPlus, pcDM8, pcDNA I/Amp, pcDNA3.1 и pREP4.
Полученные антитела можно очистить до однородности. Для разделения и очистки антител можно применять известные в данной области техники методы, обычно служащие для разделения и очистки белков. Например, антитела по данному изобретению можно разделить и очистить, подбирая и сочетая методы и оборудование, включающие (но не ограничивающиеся перечисленным здесь) аффинную хроматографию на колонках, фильтрование, ультрафильтрацию, высаливание, диализ, электрофорез в полиакриламидном геле с додецилсульфатом натрия и изоэлектрическое фокусирование (см. Antibodies: A Laboratory Manual. Ed Harlow and David Lane, Cold Spring Harbor Laboratory, 1988). Колонки для аффинной хроматографии в целях данного изобретения включают колонки с белком А и колонки с белком G. Примеры колонок с белком А включают колонки Hyper D, POROS и с сефарозой FF (Amersham Biosciences).
Человеческие нейтрализующие моноклональные антитела против IL-33 по данному изобретению можно связать с каким-либо антителом, обладающими специфичностью связывания в отношении антигена, отличного от IL-33, и таким образом получить полиспецифичные антитела, например биспецифичные антитела. Уже хорошо известны несколько химических способов получения биспецифичных антител (см. Nisonoff, A. et al., Archives of biochemistry and biophysics., 1961, Vol. 90, p. 460-462, Brennan, M. et al., Science, 1985, Vol. 299, pp. 81-83). В этих методах два различных гетерологичных антитела по отдельности подвергают ферментативному гидролизу, затем дисульфидные связи в тяжелых цепях расщепляют восстанавливающим агентом, после чего смешивают эти антитела и подвергают смесь окислению. Таким образом получается бивалентное антитело. Недавно описано получение антител с использованием поперечно-сшивающих агентов, например глутарового альдегида или карбодиимида (см. выложенную заявку на патент Японии №2-1556). В данной области техники уже имеется ряд установившихся генно-инженерных методик для получения полиспецифичных антител, например биспецифичных. Нужные биспецифичные антитела могут быть получены путем соединения один за другим участков, связывающих антиген, двух различных моноклональных антител (метод иммуноглобулинов с двойным вариабельным доменом -DVD-Ig; см. Wu et al., Nature Biotechnology 25 (11), 1290 (2007)), или путем модифицирования области Fc антитела для объединения тяжелых цепей двух различных антител, способных связывать разные антигены (метод ART-Ig - от англ. Asymmetric Re-engineering Technology - Immunoglobulin; см., например, Kitazawa et al., Nature Medicine 18 (10), 1570 (2012)).
Функционально модифицированная форма человеческих нейтрализующих моноклональных антител против IL-33 по данному изобретению или конъюгаты, содержащие антитела по данному изобретению могут быть получены, например, способом, описанным ниже. Если человеческие нейтрализующие моноклональные антитела против IL-33 по данному изобретению продуцируются клетками СНО, лишенными гена α1,6-фукозилтрансферазы (FUT8), то в получающихся антителах понижено содержание фукозы в сахарных цепочках, что проявляется усилением цитотоксического действия; тогда как антитела, продуцируемые клетками СНО, трансфицированными геном FUT 8, обладают ослабленным цитотоксическим действием (см публикации WO 2005/035586, WO 2002/31140 и WO 00/61739). На такую функцию антител, как активация комплемента, можно влиять, изменяя область Fc антитела путем модификации ее аминокислотных остатков (см. патенты США №№6737056, 7297775 и 7317091). Время полужизни антител в крови можно увеличить, взяв вариант области Fc с повышенной способностью связывания с одним из рецепторов Fc, а именно FcRn (см. Shuhei Hashiguchi et al., SEIKAGAKU (The Journal of Biochemistry), 2010, Vol. 82 (8), p. 710). Такие функционально модифицированные антитела можно получить генно-инженерным путем.
Человеческие нейтрализующие моноклональные антитела против IL-33 по данному изобретению могут быть связаны с другими функциональными веществами, образуя конъюгированные антитела. В качестве такого функционального вещества можно использовать полиэтиленгликоль (PEG), например (не ограничиваясь перечисленным здесь) PEG с молекулярной массой от 2000 Да до 100000 Да, более предпочтительно от 10000 Да до 50000 Da. При этом молекулы полиэтиленгликоля могут быть не разветвленными или же разветвленными. Молекула PEG может быть присоединена к N-концевой аминогруппе полипептидной цепи антитела с помощью активной группы NHS. Примеры радиоактивных агентов, используемых в качестве функциональных молекул для присоединения к антителам по данному изобретению, включают 131I, 125I, 90Y, 64Cu, 99Тс, 77Lu, 211At и др. Радиоактивные агенты могут быть прямо связаны с молекулой антитела, что достигается любым подходящим методом, например с использованием хлорамина Т. Примеры токсинов, используемых в качестве функциональных молекул для присоединения к антителам по данному изобретению, включают бактериальные токсины (например, дифтерийный токсин), фитотоксины (например, рицин), низкомолекулярные токсины (например, гелданамицин), мейтанзиноид и калихеамицин. Примеры низкомолекулярных соединений, используемых в качестве функциональных молекул для присоединения к антителам по данному изобретению, включают дауномицин, доксорубицин, метотрексат, митомицин, неокарзоностатин, виндезин и флуоресцентные красители, например изотиоцианатные производные флуоресцеина (FITC). Примеры ферментов, используемых в качестве функциональных молекул для присоединения к антителам по данному изобретению, включают люциферазу (например люциферазу светлячка и бактериальную люциферазу; см. патент США №4737456), малатдегидрогеназу, уреазу, пероксидазу (например, пероксидазу хрена), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизоцим, оксидазы сахаров (например, глюкозооксидазу, галактозооксидазу и глюкозо-6-фосфат-дегидрогеназу), оксидазы гетероциклических соединений (например, уриказу и ксантиноксидазу), лактопероксидазу и микропероксидазу. Примеры линкерньгх структур, используемых для химического присоединения токсинов, низкомолекулярных соединений или ферментов к молекулам антител по данному изобретению, включают двухвалентные радикалы (например, алкилен, арилен и гетероарилен); линкеры, описываемые формулой CR2)nO(CR2)n- (где R - любая замещающая группа); повторяющиеся элементы - алкоксигруппа (например, полиэтиленокси-, полиэтиленнгликоль и полиметиленокси-), алкиламиногруппа (например, полиэтиленамино- и Jeffamine™), эфиры и амиды дикарбоновых кислот (включая сукцинаты, сукцинамиды, дигликолаты, малонаты и капрамиды). В данной области техники разработан ряд методов химической модификации для присоединения функциональных агентов к молекулами антител (см. D.J. King., Applications and Engineering of Monoclonal antibodies., 1998 T.J. International Ltd, Monoclonal Antibody-Based Therapy of Cancer., 1998 Marcel Dekker Inc; Chari et al., Cancer Res., 1992 Vol. 152: 127; Liu et al., Proc Natl Acad Sci USA., 1996 Vol. 93: 8681).
Нейтрализующие моноклональные антитела против IL-33, которые конкурируют за связывание с IL-33 с человеческими нейтрализующими моноклональными антителами против IL-33, содержащими аминокислотные последовательности, соответствующие комбинациям определенных аминокислотных последовательностей участков, определяющих комплементарность (C1, С8, С15, С17 или С18 в таблице 1), или соответствующие комбинациям определенных аминокислотных последовательностей вариабельных областей (V1, V8, VI5, V17 или V18 в таблице 2), могут быть антителами человека или какого-либо животного, например мыши, крысы, кролика, козы или верблюда; они могут быть также химерными или гуманизированными антителами, полученными путем сочетания таких антител. Эти нейтрализующие моноклональные антитела против IL-33 можно получить любым подходящим из известных методов, например с использованием гибридом, фагового дисплея и генно-инженерного подхода. В частности, по данному изобретению предпочтительно получать такие антитела генно-инженерным путем.
Для получения химерных антител ДНК, кодирующую вариабельные области антител не человеческого происхождения, лигируют с ДНК, кодирующей константные области человеческих антител; полученную объединенную ДНК встраивают в экспрессионный вектор и трансформируют этим вектором клетки-хозяева, в которых экспрессируются нужные антитела (см. Европейский патент №125023 и публикацию WO 92/19759).
Для получения гуманизированных антител ДНК, кодирующую участки, определяющие комплементарность (CDR), антител не человеческого происхождения, лигируют с ДНК, кодирующей остальную часть молекулы человеческого антитела; полученную объединенную ДНК встраивают в экспрессионный вектор и трансформируют этим вектором клетки-хозяева
Человеческие антитела могут быть получены способом, описанным в разделе «Примеры» ниже. Человеческие антитела могут быть также получены любым подходящим методом, например с использованием триом, гибридом из В-клеток человека (Kozbor et al., 1983 Immunol Today 4: p. 72) и гибридом, трансформированных вирусом Эпштейна-Барр (EBV) (Cole et al., 1985, MONOCLONAL ANTIBODIES AND CANCER THERAPY, Alan R. Liss, Inc., p. 77). Человеческие антитела можно также получить путем иммунизации трансгенных мышей, которым ввели ген человеческих антител, антигенным белком для образования гибридом. Примеры трансгенных мышей включают линии HuMab (зарегистрированная торговая марка Medarex), KMTM (Kirin Pharma), KM (FCγRIIb-KO) и VelocImmune (Regeneron Pharmaceuticals, Inc.).
В другом своем воплощении данное изобретение относится к искусственным антителам, которые конкурируют за связывание с IL-33 с нейтрализующими моноклональными антителами против IL-33, содержащими аминокислотные последовательности, соответствующие комбинациям определенных аминокислотных последовательностей участков, определяющих комплементарность (C1, С8, С15, С17 или С18 в таблице 1), или соответствующие комбинациям определенных аминокислотных последовательностей вариабельных областей (V1, V8, V15, V17 или V18 в таблице 2), В качестве искусственного антитела можно использовать, например, десятый повтор типа III домена человеческого фибронектина (FNfn10). Искусственные антитела, способные связываться с нужной мишенью, можно получить путем введения мутаций в петли ВС, DE и/или FG определенного повтора в полипептидной цепи фибронектина. Помимо доменов фибронектина в качестве искусственных антител можно использовать домен Куница сериновых протеаз и такие пептиды, как анкирин и липокалин. Эти искусственные антитела можно получить генно-инженерным путем, включающим введение вектора, содержащего молекулу нуклеиновой кислоты, которая кодирует нужный пептид, в клетки бактерий (например, Escherichia coli), дрожжей или животных; культивирование полученных клеток-хозяев; затем выделение и очистку культурального супернатанта.
Отбор искусственных антител проводят из рандомизированной библиотеки последовательностей, включающей случайные комбинации аминокислот, чтобы найти низкомолекулярные пептиды, способные специфично связываться с эпитопом по данному изобретению, например с антителом; это делается вместо использования аминокислотной последовательности определенного белка или его части, как описано выше (см., например, Hipolito et al., Current Opinion in Chemical Biology, 2012 Vol. 16: 196; Yamagishi et al., Chemistry & Biology, 2011 Vol. 18: 1562). Такой пептид можно также получить не методами генной инженерии, а путем химического синтеза, например с использованием фторенилметилоксикарбонила (Fmoc) или трет-бутилоксикарбонила (Boc).
Комбинации последовательностей антител
Комбинации с С1 по C30, представленные в таблице 1, то есть комбинации аминокислотных последовательностей участков, определяющих комплементарность; комбинации с V1 по V30, представленные в таблице 2, то есть комбинации аминокислотных последовательностей вариабельных областей; комбинации с CN1 по CN30, представленные в таблице 5, то есть комбинации нуклеотидных последовательностей, кодирующих участки, определяющие комплементарность; и комбинации с IGN1 по IGN30, представленные в таблице 5, то есть комбинации нуклеотидных последовательностей, кодирующих человеческие нейтрализующие моноклональные антитела против IL-33, описанные в настоящем документе, соответствуют идентичным последовательностям определенных клонов. Соответствие между последовательностями представлено в таблице 6. Например, участки, определяющие комплементарность, у клона А10-1С04 соответствуют шести аминокислотным последовательностям участков, определяющих комплементарность, комбинации С1, и эта комбинация аминокислотных последовательностей участков, определяющих комплементарность, соответственно кодируется шестью нуклеотидными последовательностями комбинации CN1. У данного клона вариабельные области тяжелых и легких цепей соответствуют двум аминокислотным последовательностям комбинации VI. Аминокислотные последовательности легкой цепи типа λ и тяжелой цепи типа γ, включая вариабельные области, в комбинации VI соответственно кодируется двумя нуклеотидными последовательностями комбинации IGN1.
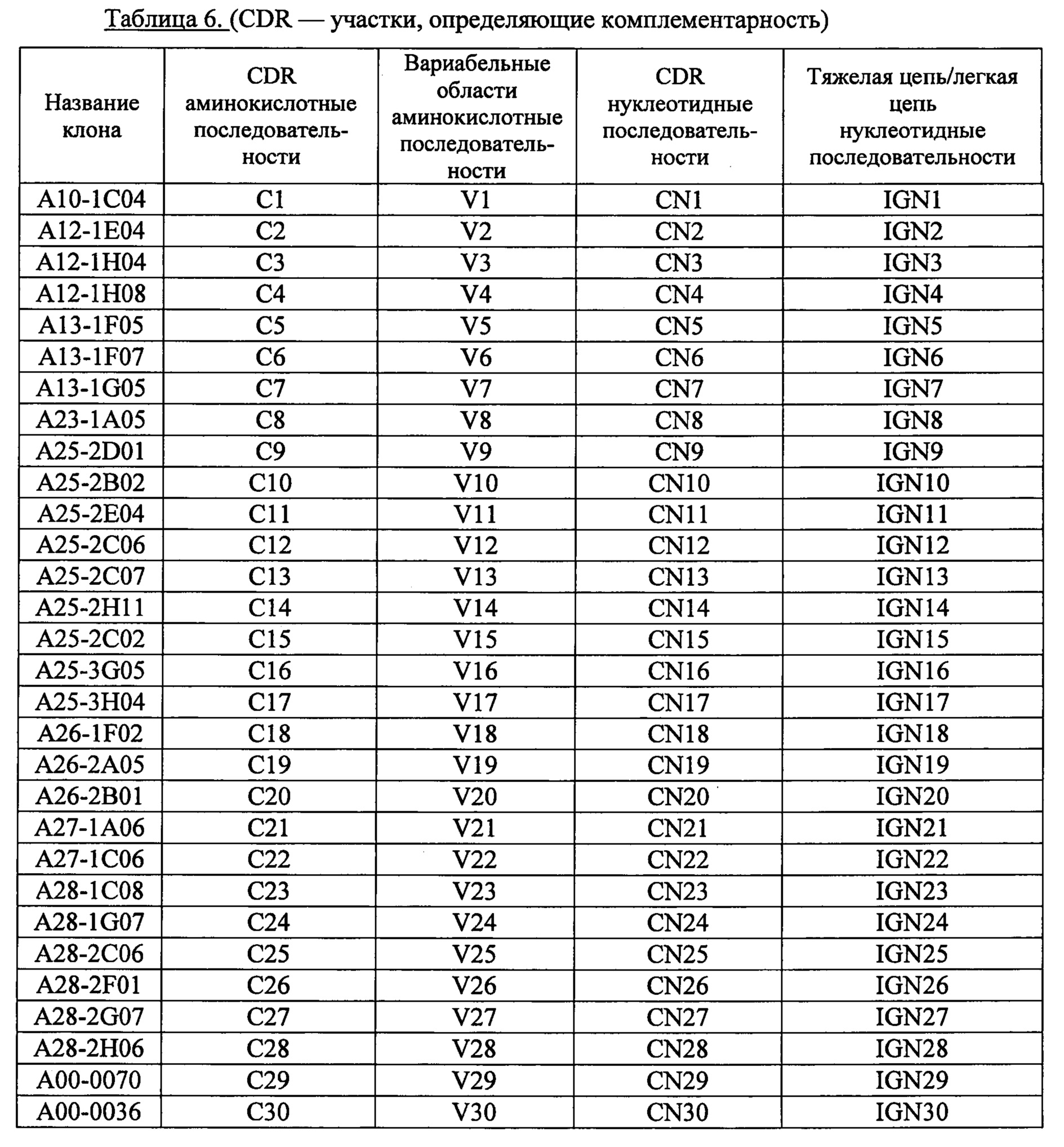
Примеры
Далее данное изобретение описывается подробнее с помощью примеров, которые не следует рассматривать как ограничивающие объем изобретения, если только не оговорено иного.
Пример 1. Получение антител против IL-33 и идентификация эпитопных пептидов
Получение антител
Животных иммунизировали человеческим белком IL-33 для получения гибридом из клеток селезенки и таким образом моноклональных антител. Из клеток селезенки иммунизированного животного выделяли РНК, чтобы создать библиотеку антител данного животного. Из этой библиотеки и из наивной библиотеки человеческих антител, применяя метод фагового дисплея, клонировали антитела, способные связываться с человеческим белком IL-33. Было получено 8 моноклональных антител против IL-33 (антитела А против Н).
Сканирование набора пептидов
Для идентификации эпитопа для получаемых антител против IL-33, было проведено сканирование пептидного чипа, чтобы определить связывание каждого из антител с каждым из пептидов - отрезков полипептидной цепи IL-33 по 20 аминокислотных остатков длиной. Были синтезированы пептиды, состоящие из 20 аминокислотных остатков, со сдвигом на 10 аминокислотных остатков в пределах последовательности, охватывающей остаток валина, находящегося в положении 101 от N-конца полипептидной цепи IL-33 (V101) и остаток треонина, находящегося в положении 270 (Т270) от N-конца полипептидной цепи IL-33, что включает большую часть молекулы зрелого человеческого IL-33. Таким образом всего было синтезировано 16 пептидов (РЕР11 - РЕР26). Последовательность и положение каждого из них показаны в таблице 7.

У каждого пептида N-конец биотинилировали и в качестве лиганда иммобилизовали на сенсорном чипе NeutrAvidin системы поверхностного плазмонного резонанса (SPR) ProteOn XPR36, предоставленной компанией Bio-Rad Laboratories, Inc. Для положительного контроля брали зрелый человеческий IL-33 (аминокислотные остатки с 112-го по 270-й), N-конец которого был присоединен к последовательности Avitag sequence, и биотинилировали с биотин-лигазой, специфичной к последовательности AviTag. Полученный в результате белок (hIL-33) использовали в качестве лиганда, который иммобилизовали на сенсорном чипе для SPR. Затем на сенсорный чип, несущий иммобилизованный лиганд, наносили в качестве аналита испытываемое антитело, либо белок-рецептор человеческого IL-33 (рекомбинантный химерный белок человеческий ST2-Fc) (ALX-201-367-C050, предоставлен компанией Enzo Life Science, Inc.), либо только буферный раствор (0,05% Tween20/PBS), чтобы определить связывание аналита с лигандом; при этом концентрация антител были 10 мкг/мл; скорость потока 100 мкл/мин. После промывания измеряли количество аналита (количество антител), связавшееся с лигандом на сенсорном чипе, в единицах резонанса (RU). Полученные результаты представлены на фиг.2.
Каждое антитело получило обозначение в зависимости от положения соответствующего эпитопа в человеческом белке IL-33: антитело к эпитопу, занимающему положение, ближайшее к N-концевой части IL-33, обозначили «Антитело А». Антитела А и В связывались с РЕР12, Антитела С и D связывались с РЕР14, Антитело Е связывалось и с PEP16, и с PEP17, Антитело F связывалось с РЕР24, Антитела G и Н связывались с РЕР26. Имеющиеся в продаже поликлональные антитела против человеческого IL-33 (AF3625, предоставленные компанией R&D Systems, Inc.) связывались с большинством из 16 изученных пептидов человеческого IL-33. Рецептор человеческого IL-33 (ST2) связывался с человеческим белком IL-33, но практически не связывался с его пептидами (PEP11-РЕР26). В этом эксперименте не было установлено какая часть IL-33 существенна для связывания с ST2. Никакого связывания с лигандом не наблюдалось, когда в качестве аналита брали один только буферный раствор или мышиный IgG (МАВ002, предоставленный компанией R&D Systems, Inc.). Испытываемые антитела сравнили по способности связываться с hIL-33 (аминокислотные остатки с 112-го по 270-й). По связыванию с hIL-33 (аминокислотные остатки с 112-го по 270-й) антитела расположились в следующем порядке убывания связывающей способности: Антитело G, Антитело Н, Антитело D, Антитело Е, Антитело В, Антитело А, Антитело С и Антитело F.
Пример 2. Определение нейтрализующей активности моноклональных антител против IL-33 -1
Определяли способность антител А, В, Е и F нейтрализовать IL-33, показателем чего служил эффект ингибирования связывания иммобилизованного человеческого ST2 с человеческим IL-33. Рекомбинантный химерный белок человеческий ST2-Fc (ALX-201-367-С050 от компании Enzo Life Science, Inc.), разведенный солевым раствором, забуференным фосфатом (PBS), до концентрации 1 мкг/мл вносили в лунки 96-луночного микропланшета (NuncTM, #442404) в количестве по 50 мкл в каждую лунку и оставляли на ночь при температуре 4°С. На следующий день микропланшет промывали один раз PBS, содержащим 1% бычьего сывороточного альбумина (BSA) (PBS-B), добавляли в лунки по 250 мкл PBS-B (для блокирования) и оставляли на 2 часа при комнатной температуре. После блокирования смешанный раствор каждого из испытываемых антител разводили PBS-B до конечной концентрации 10 мкг/мл, прибавляли в лунки микропланшета рекомбинантный человеческий белок IL-33 (ILC0701, предоставлен компанией ATGen Co. Ltd) концентрацией 1 мкг/мл в количестве 50 мкл на одну лунку и инкубировали при комнатной температуре в течение 2 часов. После этого микропланшет промывали пять раз PBS, содержащим 0,1% Tween 20 (PBS-T). Затем вносили в лунки микропланшета козьи антитела против человеческого IL-33 (AF3625, предоставлены компанией R&D Systems, Inc.) разведенные PBS-B до концентрации 1 мкг/мл в количестве 50 мкл на одну лунку и инкубировали при комнатной температуре в течение 1 часа. После этого микропланшет промывали пять раз PBS-T, затем прибавляли кроличьи антитела против козьего Ig, меченные пероксидазой хрена (Invitrogen: 61-1620) разведенные в 2000 раз PBS-B, в количестве 50 мкл на одну лунку и инкубировали при комнатной температуре в течение 1 часа. После этого микропланшет промывали пять раз PBS-T, затем прибавляли субстрат пероксидазы SureBlueTM ТМВ Microwell Peroxidase Substrate (KPL:52-00-01) в количестве 50 мкл на одну лунку и давали реакции протекать при комнатной температуре в течение 20 минут. Реакцию останавливали добавлением раствора ТМВ Stop Solution (KPL: 50-85-05) в количестве 50 мкл на одну лунку. С помощью спектрофотометра для микропланшетов SpectraMax 190 (производство Molecular Devices, LLC.) определяли разницу в поглощении при длинах волны 450 нм и 620 нм. Для измерения фонового сигнала брали образец, который получали, взяв вместо человеческого IL-33 человеческий IL-1β (PeproTech, 200-01 В) в концентрации 1 мкг/мл. Определяли подавление связывания ST2 и IL-33 (конкурентное ингибирование в процентах в системе связывания IL-33/ST2) каждым из испытываемых антител, рассчитывая ингибирование (в процентах) связывания каждым из указанных антител относительно связывания, наблюдаемого с образцом, содержащим один только IL-33 (конечная концентрация 1 мкг/мл). Согласно полученным результатам антитело А (эпитоп PEP 12) проявляло 66%-ное ингибирование, антитело В (эпитоп PEP 12) - 55%-ное, антитело Е (эпитопы PEP 16 и PEP 17) не ингибировало (0%), антитело F (эпитоп РЕР24)-е 39%-ное. Как видим, из четырех испытанных антитела, все кроме антитела Е, то есть антитела А, В и F, в конечной концентрации 10 мкг/мл обладали ингибирующим эффектом более 30%.

Пример 3. Определение нейтрализующей активности моноклональных антител против IL-33-2
Определяли способность антител А, В, Е и F нейтрализовать IL-33 по степени подавления индуцируемого человеческим IL-33 образования IL-6 в нормальных клетках эндотелия пупочной вены человека (HUVEC) (CLC2517A, предоставлены фирмой LONZA Group Ltd.). Клетки HUVEC высевали на 96-луночный микропланшет (IWAKI, МТ4940-010) в количестве 6×103/0,1 мл на одну лунку и убеждались в достаточной конфлуэнтности клеток. В среду EGM-2 (CLCC-3156 и CLCC-4176, предоставлено фирмой LONZA Group Ltd.), в которой находились клетки, вносили испытываемое антитело против IL-33 (конечная концентрация 10 мкг/мл) и рекомбинантный человеческий IL-33 (ILC0701, предоставлен фирмой ATGen Co. Ltd; конечная концентрация 100 нг/мл) в объеме 0,2 мл на одну лунку и инкубировали при температуре 37°С в течение 24 часов. После этого в среде измеряли концентрацию IL-6 с помощью имеющегося в продаже набора для твердофазного иммуноферментного анализа (ELISA kit EH2IL6 производства Thermo Scientific). Собирали среду и определяли жизнеспособность клеток с помощью набора для подсчета клеток (345-06463 производства Dojindo Molecular Technologies, Inc.), чтобы убедиться, что подавление образования IL-6 не было обусловлено снижением количества жизнеспособных клеток. Чтобы определить нейтрализующую в отношении IL-33 активность каждого из испытанных антител, а именно подавление (в процентах) образования IL-6 в системе с клетками HUVEC), рассчитывали эффект подавления (%) образования IL-6 относительно продукции IL-6, вызванной отдельно взятым (без антител) рекомбинантным человеческим IL-33. Согласно полученным результатам в случае антитела А (эпитоп PEP 12) наблюдалось 51%-ное подавление, для антитела В (эпитоп РЕР12) - 48%-ное, С (эпитоп РЕР14) - 33%-ное, D (эпитоп PEP 14) - 38%-ное, в случае антитела Е (эпитопы PEP16 и PEP17) подавления образования IL-6 не наблюдалось (0%), антитело F (эпитоп РЕР24) подавляло его на 38%, антитело G (эпитоп РЕР26) - на 48% и антитело Н (эпитоп РЕР26) - на 56%. Из восьми испытанных антител за исключением антитела Е, все проявили более чем 30%-ную способность подавлять индуцируемое человеческим IL-33 образование IL-6 в клетках HUVEC (см. таблицу 9). Среди этих антител те, которые были способны связываться с эпитопом, состоящим из аминокислотной последовательности, выбираемой из группы, состоящей из последовательностей, образованных аминокислотными остатками, занимающими положения с 111-го по 130-е, с 131-го по 150-е, с 231 по 250-е и с 251-го по 270-е в последовательности, представленной как SEQ ID NO: 1 в Перечне последовательностей, проявляли значительно повышенную нейтрализующую способность при концентрациях антител 3, 10 и 30 мкг/мл (например, подавляющий эффект антитела D в указанных концентрациях составлял 23%, 42% и 61% соответственно). Эти результаты демонстрируют, что такие эпитопы подходят для получения антител, обладающих антагонистическим действием.
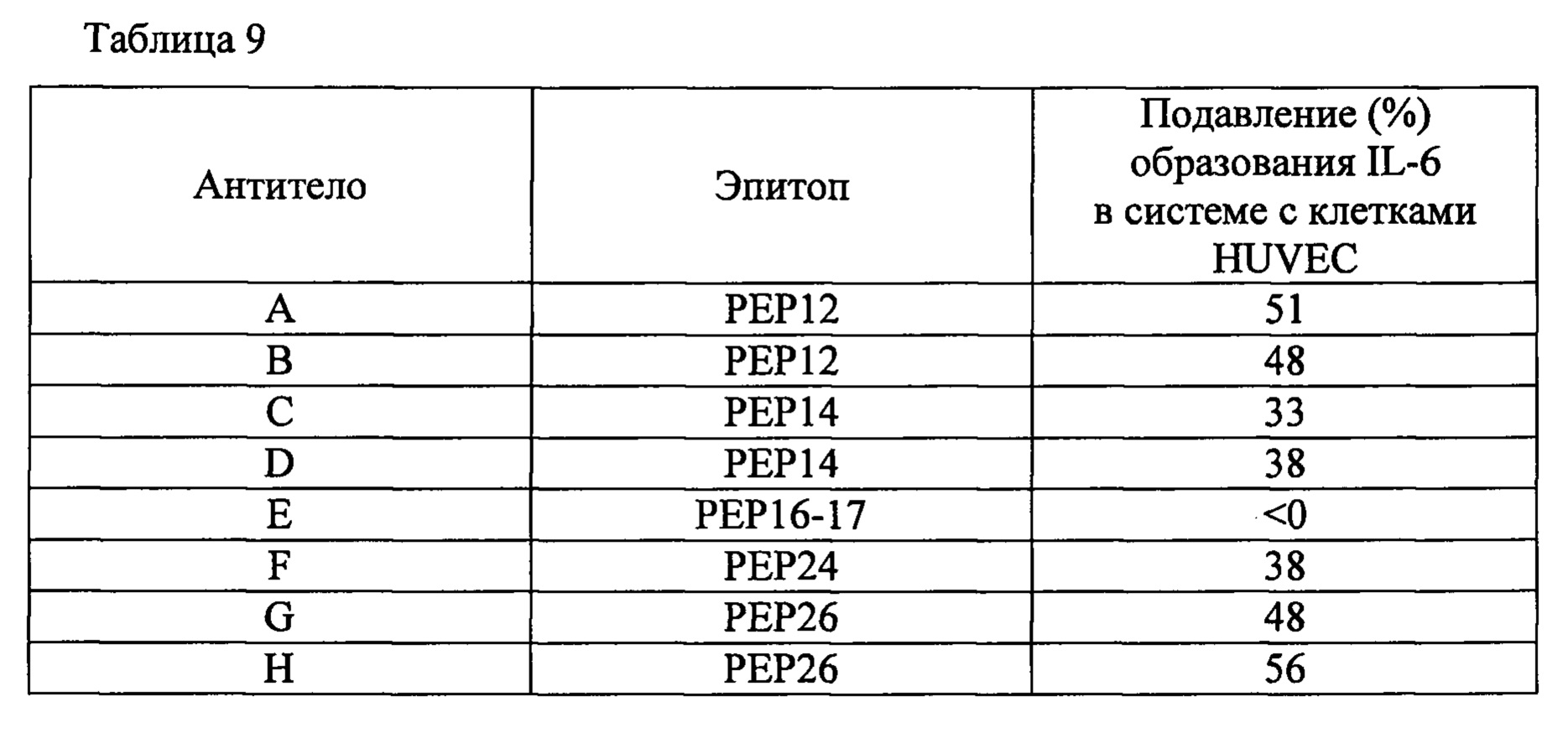
Антитело Е связывалось с hIL-33 (см. фиг.2), но не проявляло функциональной нейтрализующей активности (см. таблицы 8 и 9). В публикации PTL 2 (WO 2008/132709) описываются три эпитопа: эпитоп 1 (аминокислотные остатки, занимающие положения с 155-го по 198-е), эпитоп 2 (аминокислотные остатки, занимающие положения с 165-го по 188-е) и эпитоп 3 (аминокислотные остатки, занимающие положения с 175-го по 178-е). Как демонстрирует настоящий эксперимент, аминокислотные последовательности этих эпитопов перекрываются с аминокислотными последовательностями эпитопных пептидов для антитела Е (аминокислотные остатки, занимающие положения с 151-го по 180-е), что подтверждается отсутствием нейтрализующей активности в отношении IL-33. Эти результаты позволяют полагать, что антитела, распознающие эпитопы, описанные в публикации PTL 2, не могут в достаточной степени подавлять связывание IL-33 с его рецептором ST2 и обладают лишь очень низкой нейтрализующей активностью в отношении IL-33 или не обладают ею вовсе.
Теоретически, причинами отсутствия у антитела Е нейтрализующей активности в отношении IL-33 могут быть несовершенство эпитопа и недостаточная аффинность. По сравнению с антителом Е антитела D, G и Н имеют меньшую авидность с hIL-33, но обладают выраженной нейтрализующей активностью в отношении IL-33. Коль скоро такие клоны существуют, отсутствие нейтрализующей активности вряд ли обусловлено недостаточной аффинностью. На основании сделанных наблюдений можно считать, что четыре эпитопа, найденные авторами данного изобретения (PEP12, PEP14, РЕР24 и РЕР26) являются функциональными эпитопами, когда стоит задача нейтрализации цитокина IL-33, поскольку авидность антител, распознающих эти эпитопы, в отношении IL-33 связана с их нейтрализующей IL-33 активностью - в отличие от эпитопов, описанных в публикации PTL 2. Антитела, способные связываться с функциональными эпитопами, обладают выраженным антагонистическим действием в отношении IL-33, тогда как антитела, способные связываться с нефункциональными эпитопами, обладают лишь очень слабым антагонистическим действием в отношении IL-33 или вовсе им не обладают.
Пример 4. Картирование эпитопных пептидов в пространственной структуре человеческого IL-33
Чтобы идентифицировать атомы контактной области (атомы в составе молекулы IL-33, расположенные на расстоянии 5Å или менее от атомов, входящих в состав ST2, когда эти атомы находятся в максимальной близости друг от друга) предпочтительного эпитопа для получения антител по данному изобретению, обладающих антагонистическим эффектом, было проведено картирование четырех эпитопных пептидов, то есть определение их положения в пространственной структуре комплекса, образуемого человеческим IL-33 и человеческим ST2. В структуре комплекса, образуемого человеческим IL-33 и человеческим ST2, установленной методом рентгеновской кристаллографии (Исследовательская коллаборация по структурной биоинформатике - RCSB, Research Collaboratory for Structural Bioinformatics: PDB ID 4KC3) нет частичной структуры белка IL-33, и поэтому невозможно показать положения всех эпитопных пептидов, идентифицированных по данному изобретению. Авторы данного изобретения на основании структуры, установленной методом рентгеновской кристаллографии (4KC3), создали модель по гомологии в качестве матрицы (см. фиг. 3; использовали программу Accelrys Discovery Studio 3.5) и картировали на этой модели эпитопные пептиды (PEP12, PEP14, РЕР24 и РЕР26), соответствующие антителам, проявлявшим нейтрализующую активность в описываемых в настоящем документе экспериментах (см. фиг. 4-7). На фиг. 4-7 человеческий IL-33 и эпитопные пептиды изображены темно-серым цветом, a ST2, связанный с IL-33 или эпитопными пептидами, изображен светло-серым цветом. Атомы контактной области выделены тем, что изображены более крупными шариками, чтобы яснее показать положение контактной области между белком IL-33 и его рецептором на поверхности белковой глобулы IL-33. Полученные результаты демонстрируют, что в каждом из этих эпитопных пептидов (PEP12, PEP14, РЕР24 и РЕР26) имеются аминокислотные остатки, содержащие атомы контактной области. Примеры аминокислотных остатков, содержащих атомы контактной области, включают Р118, 1119, Т120, Y122, L123, R124, S125, L126, S127, Y129 и N130 из PEP12; D131, Q132, S133, Т135, А137, L138, Е139, S142, Y143, Е144, 1145, Y146, Е148, D149 и L150 из PEP14; D244, N245 и Н246 из РЕР24; и К266, L267, S268 и Е269 из РЕР26. Предпочтительный эпитоп, с которым должны специфично связываться антитела обладающие антагонистическим эффектом, предположительно содержит аминокислотные остатки, в которых имеются атомы контактной области.
Пример 5. Получение человеческих антител против IL-33 (исходных клонов)
Используя библиотеку человеческих scFv для фагового дисплея (n-CoDeR, предоставлена фирмой BioInvent International АВ) (см. Soderlind et al., Nature biotechnology, 2000 Vol. 18 (8), p. 852), были получены два различных исходных клона (scFv) (это означает, что молекулярной формой является scFv; ниже обозначается так же), обозначенные А00-0070 и А00-0036), способные связываться со зрелым IL-33 (аминокислотные остатки, занимающие положения с 112-го по 270) и таким образом подавлять связывание IL-33 с ST2 и активность IL-33-по данным, полученным при определении зависимого от IL-33 образования IL-6 в нормальных клетках эндотелия пупочной вены человека (HUVEC), как описано ниже. Эти антитела секвенировали, чтобы получить их базовые аминокислотные последовательности и аминокислотные последовательности вариабельных областей легких и тяжелых цепей. А00-0070 и А00-0036 имели аминокислотные последовательности вариабельных областей легких и тяжелых цепей, отвечающие комбинациям соответственно V29 и V30, представленных в таблице 2.
Пример 6. Определение аминокислотных замен для улучшения участков, определяющих комплементарность
Участки, определяющие комплементарность, двух исходных клонов модифицировали, используя методы рибосомного и фагового дисплея применительно к фрагментам Fab, чтобы увеличить аффинность в отношении IL-33 и улучшить физические свойства клонов (то есть снизить гидрофобность поверхности и соответственно ослабить агрегацию, а также увеличить растворимость). Участки, определяющие комплементарность, двух исходных клонов модифицировали в два этапа: первый этап состоял в определении одиночных аминокислотных замен для повышения аффинности в отношении IL-33 и улучшения физических свойств; второй этап состоял в определении комбинаций таких одиночных аминокислотных замен (см. Fujino et al., Biochem. Biophys. Res. Commun., 2012 Vol. 428 (3), p. 395).
Вектор для рибосомного дисплея фрагментов Fab составили на основе последовательностей вариабельных областей легких и тяжелых цепей двух исходных клонов. Затем провели многошаговую полимеразную цепную реакцию с сайт-направленным мутагенезом и амплификацией перекрывающихся последовательностей, чтобы получить достаточную библиотеку вариантов с одиночными аминокислотными заменами в пределах шести участков, определяющих комплементарность (LCDR1, LCDR2, LCDR3, HCDR1, HCDR2 и HCDR3), антитела. Аминокислотные остатки заменяли соответственно остатками двадцати природных аминокислот. Рибосомный дисплей для фрагментов Fab (Fujino et al., Biochem. Biophys. Res. Commun., 2012 Vol. 428 (3), p. 395) осуществляли в реконструированной бесклеточной системе трансляции PURE (PUREfrex, производство GeneFrontier Corporation) (Shimizu et al., Nature Biotechnology, 2001, Vol. 19 (8), p. 751) с представительной библиотекой вариантов одиночных аминокислотных замен. Отбор для обогащения библиотеки проводили в несколько повторяющихся циклов, используя в качестве «приманки» рекомбинантный человеческий белок IL-33 (ILC0701, производство ATGen Co. Ltd). Каждый из клонов Fab (название клонов показывает, что молекулярная форма у данного клона - фрагмент Fab; ниже употребляется то же обозначение) библиотеки секвенировали до обогащения (то есть сразу после конструирования) и после обогащения с помощью секвенатора нового поколения (Roche, 454), чтобы определить базовые последовательности вариабельных областей легких и тяжелых цепей. Было получено несколько тысяч прочтений для библиотеки до и после обогащения, чтобы рассчитать частоту каждого из вариантов с одиночными аминокислотными заменами в участках, определяющих комплементарность. Для каждого из вариантов с одиночными аминокислотными заменами рассчитывали отношение изменения частоты в библиотеке до и после обогащения. Величину степени обогащения библиотеки служила показателем для определения полезности различных одиночных аминокислотных замен для увеличения аффинности в отношении человеческого белка IL-33. На основании общего числа одиночных аминокислотных замен и распределения в аминокислотной последовательности определяли, в каких положениях полипептидной цепи нужно сделать эти замены для создания пользовательской библиотеки на втором этапе.
В исходном клоне А00-0070 было установлено введение аминокислотных замен в следующих положениях аминокислотной последовательности: аспарагин в положении 12 LCDR1 (SEQ ID NO: 2 в Перечне последовательностей); глутамин в положении 4 LCDR2 (SEQ ID NO: 11 в Перечне последовательностей); серии в положении 2, тирозин в положении 3 и серии в положении 6 LCDR3 (SEQ ID NO: 23 в Перечне последовательностей); аспарагиновая кислота в положении 1 и аспарагин в положении 5 HCDR1(SEQ ID NO: 43 в Перечне последовательностей), серии в положении 4, серии в положении 5, серии в положении 7, и изолейцин в положении 9 HCDR2 (SEQ ID NO: 64 в Перечне последовательностей). В исходном клоне А00-0036 было установлено введение аминокислотных замен в следующих положениях аминокислотной последовательности: аспарагин в положении 9 и аспарагин в положении 13 LCDR1 (SEQ ID NO: 6 в Перечне последовательностей); аргинин в положении 6 и лейцин в положении 7 LCDR2 (SEQ ID NO: 20 в Перечне последовательностей); аланин в положении 1, аланин в положении 9 и валин в положении 10 LCDR3 (SEQ ID NO: 40 в Перечне последовательностей); аспарагин в положении 1 HCDR1 (SEQ ID NO: 47 в Перечне последовательностей); серии в положении 4, серии в положении 5, серии в положении 6, серии в положении 7, тирозин в положении 8, изолейцин в положении 9, тирозин в положении 10, тирозин в положении 11, аспарагиновая кислота в положении 13 и лизин в положении 16 HCDR2 (SEQ ID NO: 64 в Перечне последовательностей); и глицин в положении 2, гистидин в положении 5 и аспарагиновая кислота в положении 6 HCDR3 (SEQ ID NO: 78 в Перечне последовательностей).
С целью улучшить физические свойства клонов было созданы модели по гомологии двух исходных клонов с использованием программы анализа белковой структуры (Discovery Studio, предоставлена фирмой Accelrys), чтобы предсказать, какие места в участках, определяющих комплементарность, обладают высокой гидрофобностью поверхности, и затем определить положения, в которых следует произвести аминокислотные замены для снижения гидрофобности поверхности в этих местах. Для исходного клона А00-0070 было определено введение следующих аминокислотных замен: тирозин в положении 3 LCDR3 (SEQ ID NO: 23 в Перечне последовательностей); серии в положении 7 и изолейцин в положении 9 HCDR2 (SEQ ID NO: 64 в Перечне последовательностей). Для исходного клона А00-0036 было определено введение следующих аминокислотных замен: аргинин в положении 6 и лейцин в положении 7 LCDR2 (SEQ ID NO: 20 в Перечне последовательностей); серии в положении 7, тирозин в положении 8 и изолейцин в положении 9 HCDR2 (SEQ ID NO: 64 в Перечне последовательностей). На основании данных по степени обогащения, полученным при анализе мутаций с использованием представительной библиотеки вариантов с одиночными аминокислотными заменами, было определено, какие аминокислотные замены должны быть полезны для снижения гидрофобности поверхности в нужных местах без влияния на способность связываться с человеческим белком IL-33.
Пример 7. Получение антител против человеческого IL-33 с модифицированными участками, определяющими комплементарность
Чтобы создать полную пользовательскую библиотеку для модифицирования участков, определяющих комплементарность, объединяли две или более аминокислотных замены для улучшения аффинности и физических свойств антител, как описано выше. Были сконструированы векторы для рибосомного и для фагового дисплея применительно к фрагментам Fab. Чтобы создать пользовательскую библиотек для усовершенствования участков, определяющих комплементарность, в которой положения участков, определяющих комплементарность, были рандомизированы на основании описанного выше, с вектором для рибосомного дисплея фрагментов Fab провели многошаговую полимеразную цепную реакцию с сайт-направленным мутагенезом и амплификацией перекрывающихся последовательностей, а вектор для фагового дисплея фрагментов Fab использовали как матрицу для осуществления сайт-специфичного мутагенеза по методу Кункеля (Fellouse et al., J. Mol. Biol. 2007 Vol. 373, p. 924). Провели рибосомный и фаговый дисплей фрагментов. Для обогащения библиотеки осуществили отбор в несколько повторяющихся циклов, используя в качестве «приманки» человеческий белок IL-33 и белок IL-33 макака-крабоеда (GenBank: ЕНН57404; от остатка Ser 112 до остатка Glu 269 в последовательности, представленной как SEQ ID NO: 227 в Перечне последовательностей).
Во второй половине из проделанных циклов отбора осуществляли отрицательный отбор, используя колонки с гидрофобными носителями, например, октилсефарозой (GE Healthcare) или фенилсефарозой (GE Healthcare) перед проведением связывания с указанными белками IL-33, чтобы достигнуть обогащения фрагментами Fab, обладающими высокой аффинностью к белку IL-33 и низкой гидрофобностью поверхности.
Рекомбинантные белки, которые служили «приманкой», получали следующим образом. Чтобы получить экспрессионный вектор для образования рекомбинантного белка, нуклеотидную последовательность, кодирующую зрелый человеческий IL-33 (аминокислотные остатки, занимающие положения с 112-го по 270-е) и зрелый белок IL-33 макака-крабоеда (аминокислотные остатки, занимающие положения с 112-го по 269-е последовательности, представленной как SEQ ID NO: 227 в Перечне последовательностей) с меткой 6His tag-AviTag HaN-конце, встроили в вектор рЕТ30а(-). Клетки Escherichia coli штамма BL21(DE3), несущие полученный экспрессионный вектор, культивировали в 5 мл среды LB, затем 1 мл этой культуры инокулировали в 50 мл среды для экспрессии Overnight Express (производство Merck Millipore Corporation) с добавлением канамицина. Для экспрессии нужного белка бактериальные клетки культивировали в течение 18 часов при температуре 30°С и скорости вращения 200 об/мин. Затем клетки собирали, промывали, подвергали воздействию реагента для лизиса BagBuster (производство Novagen) и отделяли супернатант. Содержавшийся в полученном супернатанте белок IL-33 макака-крабоеда (аминокислотные остатки с 112-го по 269-й), связанный с гистидиновой и биотинилируемой (Avi-tag) метками очищали путем аффинной хроматографии на колонке с никель-нитрилоацетатной агарозой (Ni-NTA; предоставлена QIAGEN), и биотинилировали. Для модификации биотином, специфичной для участка с меткой AviTag, использовали имеющуюся в продаже биотин-лигазу (BirA, производство Avidity LLC).
Полученную после обогащения библиотеку использовали для создания библиотеки Escherichia coli, секретирующих экспрессирующийся Fab. В культуральных супернатантах от нескольких сотен клонов Escherichia coli определяли константу скорости диссоциации (koff) методом поверхностного плазмонного резонанса (SPR), используя систему ProteOn XPR36 (производство Bio-Rad Laboratories, Inc.). Биотинилированный человеческий белок IL-33 (4 мкг/мл) и белок IL-33 макака-крабоеда (4 мкг/мл) в качестве лигандов наносили на сенсорный чип NLC (производство Bio-Rad Laboratories, Inc.); человеческий белок IL-33 иммобилизовался в количестве, эквивалентном 1300-1600 RU, белок IL-33 макака-крабоеда - в количестве 1100-1500 RU. Затем в качестве аналита наносили культуральный супернатант Escherichia coli и получали сенсограмму (фаза ассоциации 1 минута, фаза диссоциации 10-30 минут). В сенсограмму вводили необходимые поправки, в том числе на «холостой» опыт, используя программу для анализа данных SPR ProteOn Manager v3.1.0 (предоставлена Bio-Rad Laboratories, Inc.), и затем определяли значения koff путем анализа диссоциации по модели Ленгмюра.
Среди клонов (Fab) с модифицированными участками, определяющими комплементарность, для исследования на более высоком уровне, как описано в примере 8 и в последующих примерах, были отобраны 28 клонов (соответствующие V1-V28; см. таблицу 2), которые обладали повышенной аффинностью в отношении человеческого белка IL-33 и были способны связываться с белком IL-33 макака-крабоеда, Как показано в таблице 10, отобранные клоны (Fab) обладали более высокой аффинностью (то есть характеризовались более низкими значениями koff) в отношении человеческого белка IL-33 и белка IL-33 макака-крабоеда по сравнению с исходными клонами (Fab). У этих клонов не было аминокислотных замен в каркасных участках вариабельных областей. У двух вариантов были одинаковые одиночные аминокислотные замены в участках, определяющих комплементарность, но эффект от повышения аффинности в случае вариантов с одиночными аминокислотными заменами и в случае вариантов с двумя или более аминокислотными заменами был различным. По этой причине в последовательностях тех 28 клонов, которые были отобраны для более подробного исследования, некоторые аминокислотные замены встречаются часто, хотя на первом этапе представительной библиотеки одиночных аминокислотных замен степень обогащения вариантов с одиночными аминокислотными заменами, содержащих такие замены, была низкой (и наоборот).
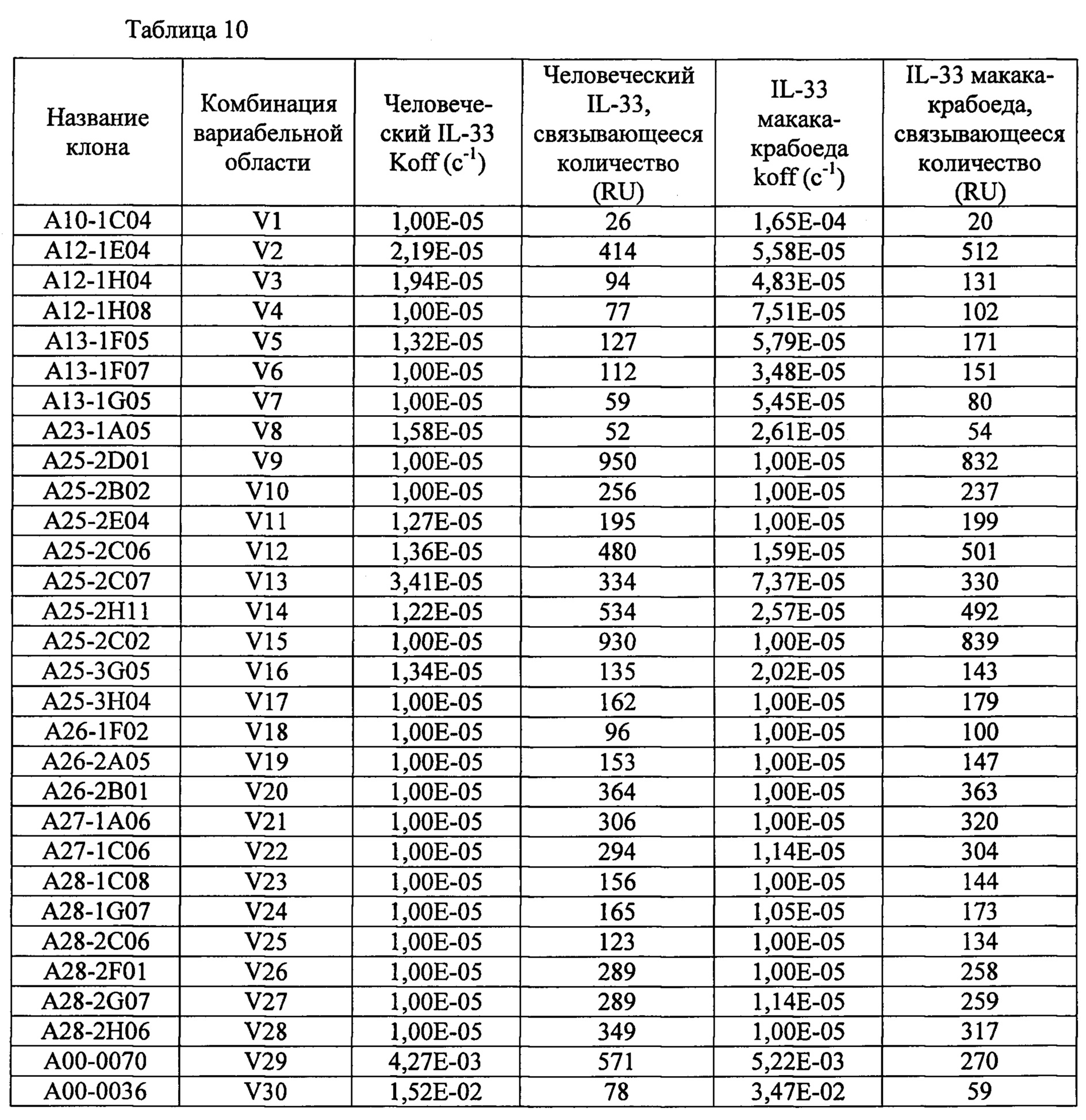
Пример 8. Получение антител IgG
Чтобы создать экспрессионные векторы для экспрессии IgG в клетках млекопитающих, молекулы ДНК, кодирующие аминокислотные последовательности соответственно легкой и тяжелой цепей семи клонов антител против человеческого IL-33 (А10-1С04, А23-1А05, А25-2С02, А25-3Н04, A26-1F02, А00-0070 и А00-0036), полученных, как описано выше, встроили в сторону 3'-конца от промотора CMV. Последовательности ДНК для легких цепей указанных клонов - это последовательности, представленные как SEQ ID NO: 228, 232, 239, 241, 242, 230 и 253 в Перечне последовательностей. Последовательности ДНК для тяжелых цепей указанных клонов - это последовательности, представленные как SEQ ID NO SEQ ID NO: 254, 261, 262, 264, 265, 276 и 277 в Перечне последовательностей. Каждым из полученных экспрессионных векторов трансфицировали клетки линии FreeStyle 293-F (Life Technologies), используя реагент для трансфекции NeoFection-293-l (предоставлен Astec Co., Ltd.). После трансфекции клетки культивировали в течение пяти суток, затем собирали культуральный супернатант.Стабильные линии клеток СНО получали с глутаминсинтетазной системой (GS; предоставлена LONZA Group Ltd.), используя вектор pConPlus и клетки СНО K1SV. Стабильные линии клеток СНО культивировали, начиная с концентрации 0,3×106 клеток/мл, используя систему для культивирования клеточных культур WAVE Bioreactor SYSTEM 20/50 ЕНТ (GE Healthcare), и собирали культуральный раствор, содержащий секретированные клетками IgG. Из культурального супернатанта IgG очищали путем аффинной хроматографии, используя хроматографическую систему AKTA explorer 100 (GE Healthcare) и смолу на основе белка A (HiTrap MabSelect SuRe, предоставлена GE Healthcare). Связавшиеся с носителем (смолой на основе белка A) IgG элюировали буферным раствором с рН 3,2 и полученный элюат сразу же нейтрализовали до приблизительно нейтральных значений рН, после чего проводили диализ с PBS (рН 7,2). После очистки на колонке с белком A IgG очищали далее, используя смолу на основе керамического гидроксиапатита типа I (СНТ; предоставлена Bio-Rad Laboratories, Inc.). Связавшиеся с СНТ IgG элюировали в градиенте концентрации NaCl. Нужные фракции собирали и подвергали диализу с PBS (с рН 7,2). Антитела, полученные в результате описанной очистки, в настоящем документе называются антителами, очищенными в нейтральной среде.
Проводили также другую очистку, включавшую перед этапом элюирования IgG со смолы на основе белка А (как описано выше) этап промывания колонки шестикратным объемом буферного раствора карбоната натрия (100 мМ; рН 11,0) в течение шести минут. Антитела, полученные путем такой очистки, в настоящем документе называются антителами, очищенными в щелочной среде. Значения степени извлечения после каждого этапа очистки для отдельных антител, очищенных в щелочной среде, представлены в таблице 11. Антитела, очищенные в щелочной среде, концентрировали путем центрифужной ультрафильтрации с помощью устройства VIVASPIN Turbo15 30000 MWCO (Sartorius AG).
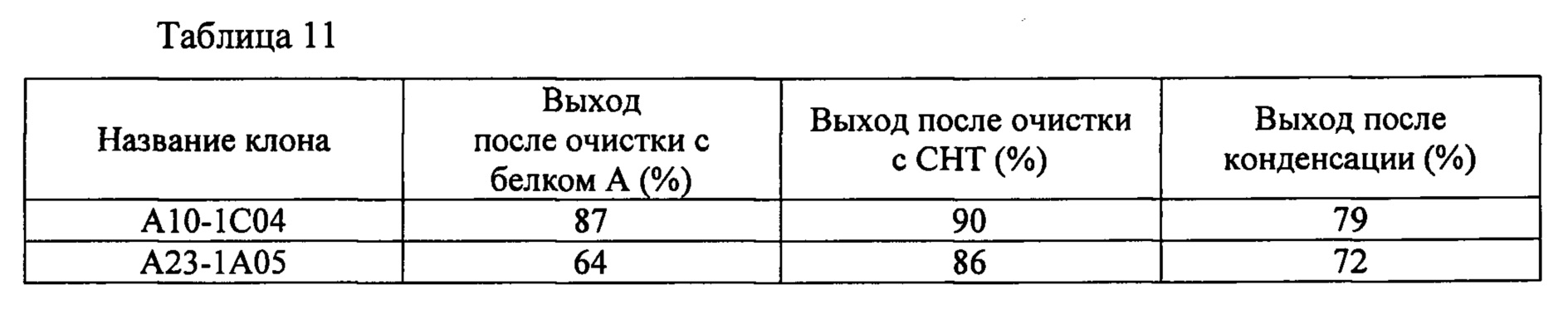

Пример 9. Аффинность в отношении белка IL-33
Для каждого из испытываемых антител (IgG) (обозначение "антитело (IgG)" означает, что молекулярная форма данного антитела IgG; ниже в настоящем документе употребляется такое же обозначение) определяли аффинность в отношений человеческого белка IL-33, измеряя константу диссоциации (Kd) взаимодействия каждого их испытываемых антител с человеческим белком IL-33 в растворе PBS методом кинетического эксклюзионного анализа, используя анализатор KinExA3200 (производство Sapidyne Instruments, Inc.). Образцы готовили, смешивая испытываемое антитело с человеческим белком IL-33 (ILC0701, предоставлен ATGen Co. Ltd) Человеческий белок IL-33 титровали до постоянной концентрации испытываемого антитела (конечная концентрация от нескольких десятков пикомолей до нескольких сотен пикомолей) в широком диапазоне концентраций человеческого белка IL-33 (так что охватывались концентрации человеческого белка IL-33, получающиеся при 12 шагах серийного двукратного разведения, то есть от 1 до 2048-кратного с верхним пределом конечной концентрации от нескольких наномолей до нескольких десятков наномолей). Образцы (смесь антитела с белком IL-33) инкубировали при комнатной температуре до тех пор, пока реакция взаимодействия антигена с антителом не достигала равновесия. Когда в образце достигалось равновесие, определяли содержание (в процентах) свободных антител против IL-33 с помощью KinExA3200. Рассчитывали значения Kd по графику зависимости процентного содержания антител против IL-33, не связавшихся с человеческим белком IL-33 (по оси ординат) от концентрации антигена (по оси абсцисс) и теоретической формуле используя программу для анализа данных KinExA (KinExA Pro Software v3.5.3, предоставлена Sapidyne Instruments, Inc.). Для получения шариков, захватывающих антитела против IL-33, суспендировали 50 мг азлактоновых шариков (Sapidyne) в 1 мл покрывающего раствора (10 мкг/мл человеческого белка IL-33 (ILC0701, предоставлен ATGen Co. Ltd); 50 мМ карбонат натрия с рН 9,6) и инкубировали при комнатной температуре в течение 1 часа. Для детекции использовали антитела против человеческого F(ab)'2-DyLight649 (Jackson, 309-495-006). Как показывает таблица 12, если брали антитела, очищенные в нейтральной среде, то антитела с модифицированными участками, определяющими комплементарность, (А10-1С04, А23-1А05, А25-2С02, А25-3Н04, A26-1F02) проявляли аффинность в отношении человеческого белка IL-33 с Kd от 231 пМ (это самое низкое значение у А23-1А05) до 720 фМ (это самое высокое значение у А25-2С02).
У антител, очищенных в щелочной среде, с помощью анализатора KinExA определяли аффинность в отношении человеческого белка IL-33 (аминокислотные остатки с 112-го по 270-й) (ILC0701, предоставлен ATGen Co. Ltd) или полноразмерного человеческого белка IL-33 (см. таблицу 12), как описано выше. Были получены следующие показатели аффинности в отношении человеческого белка IL-33 (аминокислотные остатки с 112-го по 270-й): А10-1С04-Kd=100,3 пМ; А23-1А05-Kd=195,3 пМ; А25-2С02-Kd=700 фМ; А25-3Н04-Kd=7,7 пМ; A26-1F02-Kd=5,3 пМ. Аффинность в отношении полноразмерного человеческого белка IL-33 получилась следующая: А10-1С04-Kd=179,8 пМ, и A26-1F02-Kd=10,4 пМ.
Рекомбинантные белки, которые использовали в качестве лиганда, получали следующим образом. Чтобы получить экспрессионный вектор для образования рекомбинантного белка, нуклеотидную последовательность, кодирующую полноразмерный человеческий IL-33 с меткой, включающей NusA tag, 6 His tag и последовательность, расщепляемую TEV-протеазой, на N-конце, встроили в вектор рЕТ30а(+). Клетки Escherichia coli штамма J3L21(DE3), несущие полученный экспрессионный вектор, предварительно культивировали, затем инокулировали в 50 мл среды LB плотностью, характеризующейся OD=0,5, и еще культивировали со встряхиванием в течение 4 часов при температуре 37°С. По истечении 4 часов, температуру культивирования снижали до 13°С, и клетки культивировали со встряхиванием в течение 30 минут. Прибавляли изопропилтиогалактозид (IPTG) до конечной концентрации 0,1 мМ и клетки культивировали далее со встряхиванием в течение 72 часов при температуре 13°С. Таким образом получали клетки Escherichia coli, в которых экспрессировался полноразмерный. Затем клетки Escherichia coli, в которых экспрессировался полноразмерный белок IL-33, подвергали лизису с помощью реагента BugBuster Master Mix (Novagen) и путем центрифугирования собирали супернатант. Этот супернатант очищали путем иммобилизующей металл-аффинной хроматографии (IMAC), используя колонки HisTrap FF Crude (GE Healthcare), а потом путем анионообменной хроматографии, используя колонки CaptoQ Impress (GE Healthcare). Каждый образец, полученный после анионообменной хроматографии, концентрировали путем центрифужной ультрафильтрации, используя устройство VIVASPIN6 (5,000 MWCO). К 1750 мкл концентрата прибавляли 100 мкл протеазы Turbo TEV (Nacalai Tesque, Inc.) и 4,5 мкл 1-молярного раствора дитиотреитола (DTT). Полученный раствор при температуре 4°С, чтобы произошло расщепление NusTag и HisTag. После расщепления указанных меток раствор пропускали через колонку с Ni-сефарозой (Ni Sepharose Excel; GE Healthcare), чтобы удалить NusTag и протеазу Turbo TEV (соединенную с HisTag). Собирали элюат, добавляли к нему DTT до конечной концентрации 3,3 мМ, и полученный продукт использовали как полноразмерный человеческий белок IL-33 в кинетическом эксклюзионном анализе.
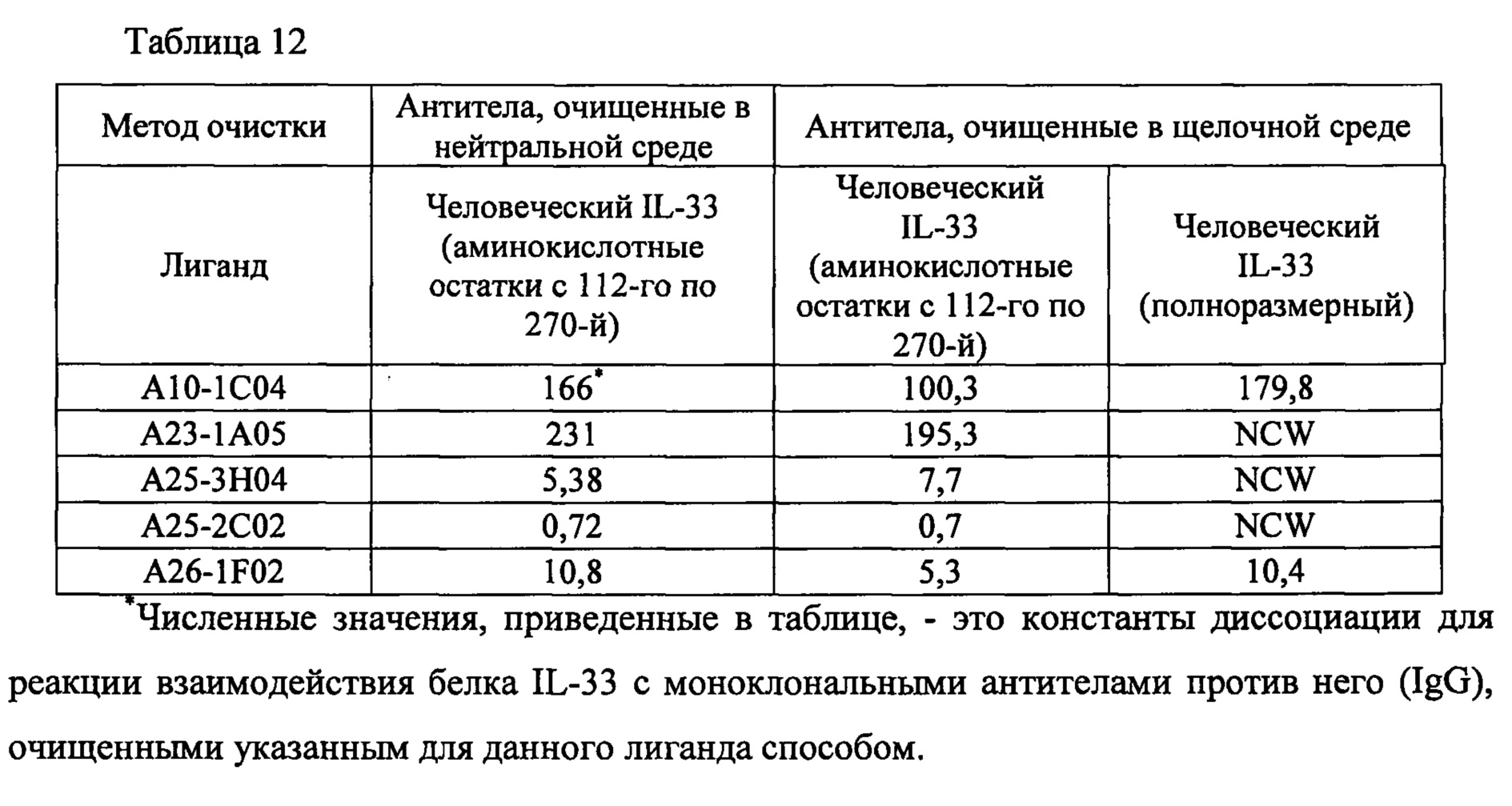
Пример 10. Определение нейтрализующей активности, направленной против человеческого IL-33. in vitro в клетках HUVEC
Для каждого из испытываемых антител (IgG) определяли in vitro нейтрализующую активность, направленную против IL-33, показателем которой служило зависимое от IL-33 образование IL-6 в клетках HUVEC. В качестве положительного контроля использовали имеющиеся в продаже поликлональные антитела против IL-33 (AF3625, производство R&D Systems, Inc.). Клетки HUVEC (CLC2517A, предоставлены LONZA Group Ltd.) суспендировали в среде EGM-2 (CLCC-3156 и CLCC-4176, производство LONZA Group Ltd.) и высевали на 96-луночный микропланшет (IWAKI) в количестве 6×103 клеток на одну лунку; плотность клеток была достаточной для их конфлуэнтности. В среду с клетками прибавляли раствор, в котором были смешаны то или иное из испытываемых антител (конечная концентрация 1 мкг/мл, то есть около 6,7 нМ) и рекомбинантный человеческого белок IL-33 (ILC0701, производство ATGen Co. Ltd) (конечная концентрация 100 нг/мл, то есть около 5 нМ) и инкубировали при температуре 37°С в течение 24 часов. После этого собирали культуральную среду и определяли концентрацию IL-6 в культуральном супернатанте с помощью имеющегося в продаже набора для твердофазного иммуноферментного анализа (ELISA kit EH2IL6, производство Thermo Scientific). После сбора культуральной среды определяли жизнеспособность клеток с помощью набора для подсчета клеток (345-06463 производства Dojindo Molecular Technologies, Inc.), чтобы убедиться, что подавление образования IL-6 не было обусловлено снижением количества жизнеспособных клеток. Чтобы определить нейтрализующую в отношении IL-33 активность каждого из испытанных антител, а именно подавление (в процентах) образования IL-6, рассчитывали эффект подавления (%) образования IL-6 относительно продукции IL-6, вызванной отдельно взятым (без антител) IL-33. Для антител, очищенных в нейтральной среде, были получены следующие результаты: антитело А10-1С04 вызывало подавление образования IL-6 на 67%, А23-1А05 - на 74%, А25-2С02 - на 96%, А25-3Н04 на 97%, A26-1F02 - на 96%, А00-0070 - на 4% и А00-0036 - на 2%. Эти результаты показывают, что испытанные клоны обладают высокой нейтрализующей активностью, тогда как исходные клоны проявляли лишь очень низкую нейтрализующую активность. При повышении концентрации антител до 10 мкг/мл у исходных клонов наблюдалась умеренная нейтрализующая активность: антитело А00-0070 подавляло образование IL-6 на 42%, А00-0036 - на 38%. В случае имеющихся в продаже поликлональных антител (AF3625, производство R&D Systems, Inc.) в конечной концентрации 1 мкг/мл наблюдалось снижение продукции IL-6 на 30%, то есть умеренная нейтрализующая активность.
Таким же образом, как описано выше, на клетки HUVEC воздействовали раствором, в котором смешивали какое-либо из антител, очищенных в щелочной среде (конечная концентрация 0,1-10 мкг/мл, то есть около 0,67-67 нМ) и рекомбинантный человеческий белок IL-33 (ILC0701, производство ATGen Co. Ltd) (конечная концентрация 100 нг/мл, то есть около 5 нМ). Чтобы определить нейтрализующую в отношении IL-33 активность каждого из испытанных антител, а именно подавление образования IL-6, относительно продукции IL-6, вызванной отдельно взятым (без антител) IL-33, рассчитывали IC50, были получены следующие результаты: антитело А10-1С04 характеризовалось IC50=0,35 мкг/мл; у варианта А23-1А05 было IC50=0,27 мкг/мл; у А25-2С02 - IC50=0,19 мкг/мл; у А25-3Н04 - IC50=0,21 мкг/мл; у A26-1F02 - IC50=0,23 мкг/мл.
Также каждым из испытываемых антител, очищенных в щелочной среде (конечная концентрация 0,1-3 мкг/мл), воздействовали на клетки HUVEC, смешивая его с рекомбинантным белком IL-33 макака-крабоеда (полученного, как описано в примере 7 и использовавшегося без биотинилирования) (конечная концентрация 100 нг/мл). Чтобы определить нейтрализующую в отношении IL-33 активность каждого из испытанных антител, а именно подавление образования IL-6, относительно продукции IL-6, вызванной отдельно взятым (без антител) IL-33, рассчитывали IC50, Были получены следующие результаты: для антитела А10-1С04 наблюдалось IC50=0,43 мкг/мл, и уровни его нейтрализующей активности, направленной против человеческого белка IL-33 и против белка IL-33 макака-крабоеда, были близкими.
Пример 11. Определение нейтрализующей активности, направленной против человеческого IL-33, in vitro в клетках KU-812
Для каждого из испытываемых антител (IgG) определяли in vitro нейтрализующую активность, направленную против IL-33, показателем которой служило зависимое от IL-33 образование IL-5, IL-6 и IL-13 в клетках KU-812. В качестве положительного контроля использовали имеющиеся в продаже поликлональные антитела против IL-33 (AF3625, производство R&D Systems, Inc.). Человеческие клетки линии KU-812 (базофильный лейкоз; ЕСАСС, ЕС90071807) высевали на 96-луночный микропланшет (Falcon) в количестве 1×104 клеток на одну лунку. В среду с клетками прибавляли раствор, в котором были смешаны то или иное из испытываемых антител (конечная концентрация 3 мкг/мл, то есть около 20 нМ) и рекомбинантный человеческий белок IL-33 (ILC0701, производство ATGen Co. Ltd) (конечная концентрация 100 нг/мл, то есть около 5 нМ) и инкубировали при температуре 37°С в течение 24 часов. Определяли концентрацию IL-5, IL-6, и IL-13 в среде RPMI-1640, содержащей 10% эмбриональной сыворотки крупного рогатого скота (FBS) с помощью наборов для обнаружения интерлейкинов-5, -6 и -13 человека путем проточной цитометрии с использованием флуоресцентных частиц (Human IL-5 Flex set, Human IL-6 Flex set, Human IL-13 Flex set; BD™ Cytometric Bead Array, BD Biosciences. После сбора культуральной среды определяли жизнеспособность клеток с помощью набора для подсчета клеток (345-06463 производства Dojindo Molecular Technologies, Inc.), чтобы убедиться, что подавление образования IL-5, -6 и -13 не было обусловлено снижением количества жизнеспособных клеток. Для антител, очищенных в нейтральной среде, были получены следующие результаты: антитело A26-1F02 подавляло образование IL-5, IL-6 и IL-13 на 70%, 82%, и 72% соответственно. Эти результаты показывают, что антитело A26-1F02 обладает более высокой нейтрализующей активностью, а именно способностью подавлять образование указанных цитокинов, чем имеющиеся в продаже поликлональные антитела, для которых наблюдалось подавление образования IL-5, IL-6 и IL-13 на 47%, 51% и 41% соответственно.
Таким же образом, как описано выше, на клетки KU-812 воздействовали раствором, в котором смешивали какое-либо из антител, очищенных в щелочной среде (конечная концентрация 100-0,01 мкг/мл, то есть около 667-0,067 нМ), с рекомбинантным человеческим белком IL-33 (ILC0701, производство ATGen Co. Ltd) (конечная концентрация 3 нг/мл, то есть около 0,15 нМ), человеческим IL-3 (PeproTech, 200-03; конечная концентрация 10 нг/мл, то есть около 0,67 нМ) и человеческим компонентом системы комплемента С5а (С5788, производство Sigma-Aldrich Со. LLC.)(конечная концентрация 1 нМ). Указанный раствор инкубировали с клетками при температуре 37°С в течение 24 часов. Определяли концентрации IL-5 и IL-13 в среде RPMI-1640, содержащей 10% FBS. После сбора культуральной среды определяли жизнеспособность клеток с помощью набора для подсчета клеток, чтобы убедиться, что подавление образования IL-5 и IL-13 не было обусловлено снижением количества жизнеспособных клеток. Для антител, очищенных в щелочной среде (А10-1С04, А23-1А05, А25-2С02, А25-3Н04 и A26-1F02) наблюдался эффект подавления продукции IL-5 и IL-13 на 50% или больше по сравнению с таковым при конечной концентрации антител 1 мкг/мл.
Пример 12. Определение нейтрализующей активности, направленной против человеческого IL-33, in vitro в человеческих мононуклеарах периферической крови
Для каждого из испытываемых антител (IgG) определяли in vitro нейтрализующую активность, направленную против IL-33, показателем которой служило зависимое от IL-33 образование IFN-γ в человеческих мононуклеарных клетках периферической крови (РВМС). В качестве положительного контроля использовали имеющиеся в продаже поликлональные антитела против IL-33 (AF3625, производство R&D Systems, Inc.). Подготовленные клетки РВМС высевали на 96-луночный микропланшет в количестве 2×105 клеток на одну лунку и прибавляли в лунки рекомбинантный человеческий IL-12 (Wako Pure Chemical Industries, Inc.) (конечная концентрация 10 нг/мл). Затем в лунки вносили смесь того или иного из испытываемых антител с рекомбинантным человеческим белком IL-33 (10 нг/мл) и инкубировали при температуре 37°С в течение 48 часов. После этого собирали культуральный супернатант и определяли уровень образования IFN-γ с помощью набора AlfaLISA™ human IFN-γ immunoassay kit (PerkinElmer Inc.), чтобы оценить нейтрализующую активность, направленную против IL-33. Для антител, очищенных в щелочной среде, при их конечной концентрации 10 мкг/мл были получены следующие данные (приведен эффект подавления продукции IFN-γ в процентах): А10-1С04 - 96,9%, А23-1А05 - 97,5%, А25-2С02 - 98,75%, А25-ЗН04 - 97,9% и A26-1F02 - 98,25%.
Пример 13. Определение влияния на воспаление, вызванное внутрибрюшинным введением человеческого IL-33
У мышей внутрибрюшинное введение человеческого IL-33 вызывает различные изменения, связанные с воспалительным процессом, а именно в крови повышаются уровни IgE, IgA и IL-5, численность нейтрофилов, эозинофилов и базофилов, возрастает количество клеток в селезенке (увеличивается ее масса) и происходят патологические изменения различных органов со слизистыми оболочками. Рассматривая эти изменения как показатели, авторы данного изобретения определяли противовоспалительный эффект антител (IgG) по данному изобретению in vivo.
Самцам мышей линии C57BL6 (Charles River Laboratories International, Inc.) в возрасте 6-8 недель вводили внутрибрюшинно человеческий белок IL-33 (R&D Systems, 3625-IL-010) в дозе 0,4 мкг на одну особь в течение 7 суток (дни 0-6). Также в течение 7 суток (дни 0-6) животным вводили испытываемые антитела (IgG). Через семь суток после начала введения (день 7) у тех подопытных мышей, которым вводили PBS вместо человеческого белка IL-33 (на фигурах представлен как «носитель»), масса селезенки составляла в среднем 76±4 мг, тогда как у особей, получавших белок IL-33 она составляла 90±7 мг. Особи, которым помимо белка IL-33 вводили внутрибрюшинно человеческий контрольный IgG (MP Biomedicals, 55908) в дозе 10 мг на 1 кг массы тела (на фигурах представлено как "mpk") масса селезенки в указанный день составляла в среднем 93+4 мг, в то время как животные, которым помимо белка IL-33 вводили внутрибрюшинно одно из антител, очищенных в нейтральной среде, а именно A26-1F02 масса селезенки в указанный день составляла в среднем 66±3 мг.
Затем определяли эффект антител, очищенных в щелочной среде. Эти антитела вводили подкожно только один раз в день накануне введения человеческого белка IL-33 (день -1) и животных осматривали. Через семь суток после начала введения (день 7) у тех подопытных мышей, которым вводили PBS вместо человеческого белка IL-33, масса селезенки составляла в среднем 70 мг, тогда как у особей, которым помимо белка IL-33 вводили подкожно однократно человеческий контрольный IgG в дозе 10 мг на 1 кг массы тела, масса селезенки составляла в среднем 152 мг. А у тех особей, которым помимо белка IL-33 вводили подкожно однократно антитело А25-3Н04 в дозе 1, 3, 5 или 10 мг/кг, масса селезенки в среднем составляла 143, 106, 109 и 78 мг соответственно (представлено на фиг. 8). Эти результаты показывают, что А25-3Н04 подавляет обусловленное воспалением увеличение селезенки зависимым от дозы образом. Кроме противовоспалительного эффекта, выражающегося в подавлении увеличения селезенки, антитело А25-3Н04 обладало противовоспалительным эффектом, выражающимся в подавлении вызванного введением человеческого IL-33 увеличения концентрации IgA, IgE и IL-5 в сыворотке крови, численности нейтрофилов, эозинофилов и базофилов (см. фиг.8). Эти результаты подтверждают, что антитела А25-3Н04 обладают подавляющим эффектом в отношении воспалительной реакции, вызванной IL-33 in vivo. Через семь суток после начала введения (день 7) у подопытных мышей определяли концентрацию А25-3Н04 в крови. Для доз антитела 1, 3, 5 и 10 мг на 1 кг массы тела были получены значения 0,6; 3,7; 6,5 и 20,3 мкг/мл.
У других испытываемых антител (IgG) также определяли противовоспалительные эффекты in vivo, следуя описанному выше протоколу (подкожное введение в дозе 10 мг на 1 кг массы тела). При этом у мышей, получавших подкожно человеческий контрольный IgG, масса селезенки в среднем составляла 181 мг, а у особей, которым помимо белка IL-33 вводили подкожно антитела, очищенные в щелочной среде (А10-1С04, А23-1А05, А25-2С02 или A26-1F02), масса селезенки составляла в среднем 82 мг, 92 мг, 100 мг и 77 мг соответственно (представлено на фиг.9). Эти результаты показывают, что все указанные антитела подавляли увеличение массы селезенки, обусловленное воспалением. Кроме противовоспалительного эффекта в отношении увеличения массы селезенки все антитела, очищенные в щелочной среде (А10-1С04, А23-1А05, А25-2С02 и A26-1F02) обладали противовоспалительным эффектом, выражающимся в подавлении вызванного введением человеческого IL-33 увеличения концентрации IgA, IgE и IL-5 в сыворотке крови, численности нейтрофилов, эозинофилов и базофилов (см. фиг. 9). Эти результаты подтверждают, что не только антитело А25-3Н04 но и антитела А10-1С04, А23-1А05, А25-2С02 и A26-1F02), обладают эффектом подавления in vivo проявлений воспалительной реакции, вызванной IL-33.
Пример 14. Определение влияния на легочные расстройства, вызванные интратрахеальным введением человеческого IL-33
Мышам вводили интратрахеально человеческий белок IL-33 и затем собирали жидкость, получаемую при бронхо-альвеолярном лаваже (BALF). В ней обнаруживалось увеличение суммарного количества клеток, увеличение количества эозинофилов и нейтрофилов, а также присутствие цитокинов, например IL-4, IL-5, IL-6 и IL-13. Кроме того, наблюдалась гиперплазия слизистой оболочки трахеи. Влияние испытываемых антител (IgG) на эти признаки оценивали путем внутрибрюшинного, подкожного или внутривенного введения этих антител.
Пример 15. Определение влияния на гиперчувствительность дыхательных путей, вызванную интраназальным введением человеческого IL-33
Интраназальное введение человеческого белка IL-33 вызывает гиперчувствительность дыхательных путей к последующему вдыханию метахолина. Влияние испытываемых антител (IgG) на гиперчувствительность дыхательных путей оценивали путем внутрибрюшинного, подкожного или внутривенного введения этих антител.
Пример 16. Определение влияния человеческого IL-33 на мышей, нокинных по человеческому IL-33
Введение антигена клещей Dermatophagoides или папаина мышам, нокинным по человеческому IL-33, путем закапывания в нос или интратрахеального введения вызывает у них воспаление дыхательных путей. У таких животных в жидкости, полученной путем бронхо-альвеолярного лаважа, у таких животных обнаруживается увеличение суммарного количества клеток. О воспалении дыхательных путей, вызванном антигеном Dermatophagoides или папаином, известно, что протеазная активность антигена Dermatophagoides или папаина приводит к высвобождению IL-33 из эпителиальных клеток дыхательных путей (Oboki et al., Proceedings of the National Academy of Sciences of the United States of America, 2010, vol. 107, p18581). Влияние испытываемых антител (IgG) на обусловленное протеазной активностью и IL-33 воспаление дыхательных путей in vivo оценивали путем внутрибрюшинного, подкожного или внутривенного введения этих антител.
Пример 17. Определение противовоспалительного действия в модели сепсиса, вызванного внутрибрюшинным введением липополисахарида
У мышей, нокинных по человеческому IL-33, внутрибрюшинное введение липополисахарида (LPS) вызывает сепсис (Oboki et al., Proceedings of the National Academy of Sciences of the United States of America, 2010, vol. 107, p18581). Внутрибрюшинное, подкожное или внутривенное введение испытываемых антител (IgG) перед введением липополисахарида позволяет оценить влияние этих антител на смертность среди указанных мышей. После введения липополисахарида в течение нескольких часов в крови обнаруживаются в высоких концентрациях воспалительные цитокины, например IL-6 и TNF-α. Измеряя концентрацию этих воспалительных цитокинов, определяют противовоспалительный эффект испытываемых антител.
Пример 18. Определение влияния на раковые заболевания у мышей in vivo
Мышам вводили подкожно или внутривенно вводили клетки линий человеческих или мышиных раковых клеток, и затем вводили человеческий IL-33. Сколько нужно вводить указанных клеток, определяется в зависимости от клеточной линии и места введения клеток в организм подопытного животного. Мышам вводили (внутрибрюшинно, подкожно или внутривенно) то или иное из испытываемых антител (IgG), и после введения раковых клеток определяли путем соответствующего исследования количество (численность или по объему) раковых клеток в месте первичного рака и в местах метастатических поражений в других органах. Таким образом можно оценить влияние испытываемых антител на раковое заболевание.
Пример 19. Определение коллоидной стабильности антител
Коллоидную стабильность испытываемых антител (IgG) исследовали, определяя присутствие агрегатов методом динамического светорассеяния. Антитела, очищенные в щелочной среде, концентрировали до уровня приблизительно 50 мг/мл с помощью устройства для центрифужной ультрафильтрации VIVASPIN или VIVASPIN TURBO (производство Sartorius AG; отсечка по молекулярной массе MWCO от 10000 до 50000 дальтон). Центрифугировали при температуре 4°С, а скорость вращения и продолжительность центрифугирования нужным образом меняли. Раствор каждого из испытываемых антител последовательно разводили по 200-250 мкл каждого образца использовали для измерений методом динамического светорассеяния (анализатор размеров частиц Nanotrac UPA UT-151, производство NIKKISO CO., LTD.), чтобы получить данные в диапазоне концентраций от приблизительно 1 мг/мл до приблизительно 50 мг/мл. Для каждого из антител (А10-1С04, А23-1А05, А25-2С02, А25-3Н04 и A26-1F02) рассчитывали распределение по размерам частиц на основании значений, полученных за 200 секунд и по этим данным судили о присутствии агрегатов. При увеличении концентрации антител наблюдался очень небольшой сдвиг пика распределения частиц по размерам от приблизительно 10 нм в сторону более крупных частиц; для частиц крупнее нескольких десятков нанометров пика не было, то есть не было пика, не зависимого от концентрации антител и обусловленного необратимой агрегацией. Эти результаты подтверждают, что испытываемые антитела обладают превосходной коллоидной стабильностью.
Чтобы количественно оценить коллоидную стабильность, рассчитывали параметр взаимодействия (kD). Этот параметр взаимодействия характеризует зависимость коэффициента диффузии (обратно пропорционального размеру частиц) от концентрации и является важным показателем, который используется при разработке препаратов, содержащих белки в высоких концентрациях, например препаратов антител. Сообщалось, что параметр взаимодействия, превышающий -12,4 мл/г свидетельствует о высокой коллоидной стабильности и низкой степени спонтанной ассоциации частиц из-за взаимного отталкивания (Saito et al., Pharm. Res., 2013. Vol. 30 p. 1263). Испытываемые антитела, растворенные в PBS (рН 7,2), концентрировали путем ультрафильтрации до концентрации порядка несколько десятков мг/мл и делали серийные двукратные разведения с тем же растворителем, получая таким образом образцы. В каждом образце определяли размер частиц методом динамического светорассеяния, используя анализатор
Nanotrac UPA UT 151 (производство NIKKISO CO., LTD.). На основании измеренного размера частиц рассчитывали коэффициент диффузии по уравнению Стокса-Эйнштейна:
Математическая формула 1
где D - коэффициент диффузии (см2/с); KB - постоянная Больцмана (J/K); Т - абсолютная температура в Кельвинах (K); π - число «пи»; η - вязкость в пуазах (П) разведенного раствора; и d - размер частиц в нанометрах (нм).
Чтобы определить параметр взаимодействия, строили график зависимости коэффициента диффузии от концентрации, который описывается следующим уравнением:
Математическая формула 2
где D - коэффициент диффузии, рассчитанный по уравнению Стокса-Эйнштейна; D0 - коэффициент диффузии при бесконечном разбавлении; и с - измеренная концентрация данного испытываемого антитела (г/мл). Исходя из этого уравнения, рассчитывали параметр взаимодействия (kD), представляющий наклон эмпирической кривой. Были получены следующие результаты: у А10-1С04 параметр взаимодействия kD составил 8,1 мл/г (диапазон измерений: 0,41-63,7 мг/мл); у А23-1А05 KD=-5,6 мл/г (диапазон измерений: 0,40-61,8 мг/мл); у А25-2С02 kD=-6,2 мл/г (диапазон измерений: 0,43-66,3 мг/мл); у А25-3Н04 kD=-7,5 мл/г (диапазон измерений 0,34-56,5 мг/мл); у А26-1F02 kD=-6,7 мл/г (диапазон измерений: 0,35-62,7 мг/мл). Эти результаты демонстрируют, что у всех испытанных антител параметр взаимодействия превышает -12,4 мл/г, что говорит о превосходной коллоидной стабильности.
Пример 20. Определение термодинамической стабильности антител
У испытываемых антител (IgG) определяли термодинамическую стабильность при температуре, при которой полипептидная цепь молекулы иммуноглобулина «разворачивается» (температура плавления, Tm). К раствору испытываемого антитела, взятого в концентрации порядка нескольких десятков мкг/мл прибавляли краситель, связывающийся с исследуемым белком Protein Thermal Shift Dye (Life Technologies) согласно инструкциям руководства по применению технологии PTS. Измеряли интенсивность флуоресценции разведенного раствора, используя систему детекции и определения количества нуклеиновых кислот в режиме реального времени Real-Time PCR 7500 Fast (Life Technologies), увеличивая температуру со скоростью 1°С/мин. По полученным данным с помощью программного обеспечения Protein Thermal Shift (Life Technologies) определяли температуру плавления антител (Tm). Если получались два или более значений Tm, то меньшее обозначали Tm1, второе по порядку возрастания величины - Tm2, и т.д. Для антител, очищенных в нейтральной среде, были получены следующие результаты: А10-1С04-Tm=73,9°С; А23-1А05-Tm1=69,3°С и Tm2=77,6°С; А25-2С02-Tm1=69,3°С и Tm2=80,3°С; А25-3Н04-Tm1=70,0°С и Tm2-76,4°С; A26-1F02-Tm=74,5°С. Для антител, очищенных в щелочной среде, были получены следующие результаты: А10-1С04-Tm=73,7°С; А23-1А05-Tm1=69,5°С и Tm2=77,5°С; А25-2С02-Tm1=69,5°С и Tm2=80,4°С; А25-3Н04-Tm1=70,1°С и Tm2=76,4°С; и A26-1F02-Tm=74,4°С. Эти результаты показывают, что у всех испытанных антител температура плавления ™ превышает 65°С, что говорит о превосходной термодинамической стабильности.
Пример 21. Определение стабильности антител при хранении
Для определения стабильности испытываемых антител (IgG) при хранении антитела, очищенные в щелочной среде, растворяли в цитратном буферном растворе (лимонная кислота 50 мМ; хлорид натрия 150 мМ NaCl; рН 6,3) в концентрации около 10 мг/мл и хранили при температуре 40°С в течение четырех недель. Для оценки мономерной чистоты испытываемых антител после хранения этот параметр определяли методами эксклюзионной хроматографии (SEC) и капиллярного электрофореза в полиакриламидном геле с додецилсульфатом натрия на микрочипе (mCE-SDS) Также определяли связывающую активность этих антител методом поверхностного плазмонного резонанса.
Соединяли две колонки TSKgel G3000SWXL (производство Tosoh Bioscience LLC) и ставили в систему для высокоэффективной жидкостной хроматографии HPLC Beckman System Gold (модуль с титратором 126 Solvent Manager, детектор 166, автосамплер 508)и проводили гель-фильтрацию. Подвижной фазой служил фосфатный буферный раствор (0,1 М; рН 6,7), содержащий сульфат натрия (0,1 М). Скорость потока для всех образцов составляла 0,5 мл/мин; детекцию осуществляли, измеряя поглощение при длине волны 215 нм. Для получения образца хранившийся раствор испытываемого антитела концентрацией около 10 мг/мл разбавляли в около 100 раз; на колонку наносили 50 мкл такого образца. Результаты определения мономерной чистоты методом эксклюзионной хроматографии представлены в таблице 13. Эти результаты свидетельствуют, что все испытанные антитела (А10-1С04, А23-1А05, А25-2С02, А25-3Н04 и A26-1F02) после хранения при температуре 40°С в течение четырех недель обладали мономерной чистотой более 90, что демонстрирует их превосходную стабильность при хранении.
Капиллярный электрофорез в полиакриламидном геле с додецилсульфатом натрия на микрочипе проводили, используя систему для автоматического электрофореза Lab Chip GX II (производство PerkiriElmer Inc.). Каждый образец обрабатывали восстанавливающим реагентом из набора, предназначенного для данной системы, а именно НТ Protein Express Reagent (производство PerkinElmer Inc.), согласно стандартному протоколу, предоставленному производителем, в денатурирующих условиях. В качестве образца для анализа брали 2 мкл хранившегося раствора антитела с концентрацией около 10 мг/мл. Реагент для электрофореза из указанного набора добавляли к нужному чипу (НТ Protein Express Lab Chip, версия 2; производство PerkinElmer Inc.), и измерение проводили согласно прилагаемому к системе протоколу для анализа антител, а именно НТ Antibody 200. Как видно из таблицы 13, в денатурирующих и восстанавливающих условиях все испытанные антитела (А10-1С04, А23-1А05, А25-2С02, А25-3Н04 и A26-1F02) после хранения при температуре 40°С в течение четырех недель обладали мономерной чистотой более 90%, что демонстрирует их превосходную стабильность при хранении.
Чтобы убедиться в наличии или отсутствии после хранения необратимой агрегации, не зависящей от концентрации антител, определяли размер частиц в хранившихся препаратах испытываемых антител. Для получения образца для анализа хранившийся раствор антитела концентрацией около 10 мг/мл разводили в 10 раз цитратным буферным раствором (лимонная кислота 50 мМ; хлорид натрия 150 мМ NaCl; рН 6,3), так что конечная концентрация составляла около 1 мг/мл. Чтобы установить размеры частиц в полученных образцах, их анализировали методом динамического светорассеяния с помощью анализатора размеров частиц Nanotrac UP A UT-151 (производство NIKKISO CO., LTD.) Время накопления - 200 секунд. Ни для одного из испытанных антител (А10-1С04, А23-1А05, А25-2С02, А25-3Н04, A26-1F02, А00-0070, А00-0036) не было обнаружено агрегатов после хранения при температуре 40°С в течение четырех недель, что демонстрирует превосходную стабильность этих антител при хранении.
Чтобы убедиться в наличии у антител после хранения способности связывать антиген, определяли их антигенсвязывающую активность методом поверхностного плазмонного резонанса, используя систему Biacore Т200 (производство GE Healthcare). Человеческий белок IL-33 (ILC0701, производство ATGen Со, Ltd) иммобилизовали на сенсорный чип СМ5 (GE Healthcare) (количество иммобилизованного белка составляло от около 3000 до около 6000 RU) с помощью набора для иммобилизации по аминогруппе Amine Coupling Kit (GE Healthcare). Хранившиеся растворы антител разводили в 10 раз цитратным буферным раствором (лимонная кислота 50 мМ; хлорид натрия 150 мМ NaCl; рН 6,3) и в полученных растворах измеряли суммарную концентрацию белка, используя спектрофотометр для микрообъемов Astragene II (Astranet Systems, Ltd,) (концентрация белка составляла около 1 мг/мл). Растворы антител после измерения суммарной концентрации белка разводили в 1000 раз буферным раствором HBS-EP (10 мМ HEPES; 150 мМ NaCl; 3 мМ EDTA; 0,05% (объем/объем) Surfactant Р20; рН 7,4)), получая таким образом аналит. Измерения проводили при температуре 25°С. Для получения сенсограммы фазы ассоциации каждый аналит пропускали в течение 36 секунд при двух скоростях потока - 5 мкл/мин и 100 мкл/мин. По сенсограммам проводили анализ концентрации без калибровки с помощью программы для анализа данных SPR (GE Healthcare, Biacore Т200 Evaluation Software v1,0), определяя концентрацию антител, обладающих антигенсвязывающей активностью. Для контроля у каждого из испытываемых антител определяли антигенсвязывающую активность после хранения при температуре 4°С в течение четырех недель и рассчитывали долю антигенсвязывающей активности, сохраняющейся после хранения при температуре 40°С в течение четырех недель. Как видно из таблицы 13, у всех испытанных антител (А10-1С04, А23-1А05, А25-2С02, А25-3Н04 и A26-1F02) после хранения при температуре 40°С в течение четырех недель антигенсвязывающая активность сохранялась более чем на 90%, что говорит о превосходной стабильности при хранении.
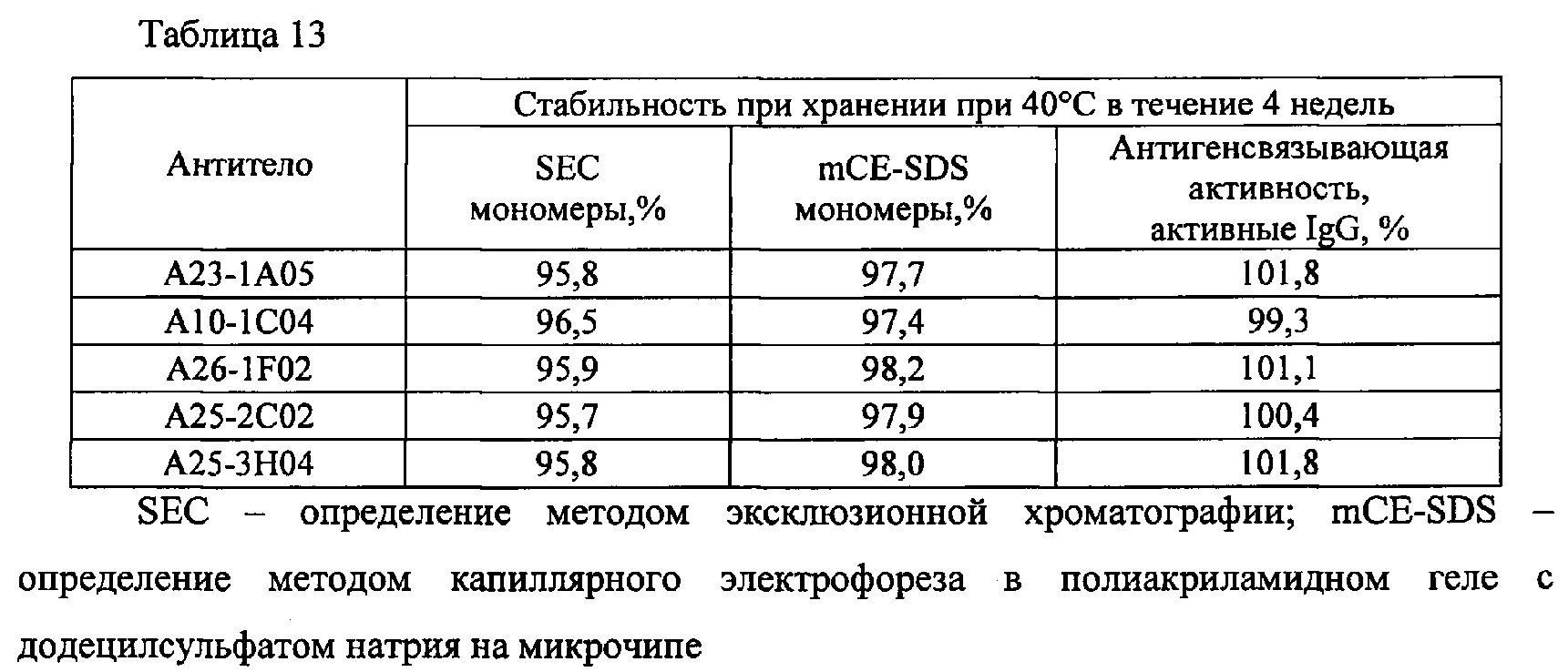
Пример 22. Определение стабильности антител при принудительном окислении Определяли влияние окисления на антигенсвязывающую активность испытываемых антител (IgG). К раствору каждого из испытываемых антител, очищенных в щелочной среде, (конечная концентрация 1 мг/мл) прибавляли раствор перекиси водорода (конечная концентрация 1%) и давали реакции окисления протекать при температуре 37°С в течение 24 часов. Чтобы прекратить окисление, к полученному раствору прибавляли раствор метионина (80 мМ). Затем растворы испытываемых антител обессоливали с PBS на колонке Zebaspin (производство Thermo Scientific). У окисленных антител определяли антигенсвязывающую активность, используя систему для поверхностного плазмонного резонанса Biacore Т200 (GE Healthcare), как описано в Примере 21. Рассчитывали отношение антигенсвязывающей активности окисленных антител к таковой не обработанных окислителем антител. Были получены следующие результаты: у антитела А10-1С04 антигенсвязывающая активность сохранялась на 83%, у А23-1А05 - на 95%, у А25-2С02 - на 100,5%, у А25-3Н04 - на 98,7% и у A26-1F02 - на 89,5%. Эти данные свидетельствуют, что все испытанные антитела (А10-1С04, А23-1А05, А25-2С02, А25-3Н04 и A26-1F02) обладают стабильностью, проявляющейся в сохранении антигенсвязывающей активности более чем на 80%, даже после принудительного окисления путем обработки 1%-ным раствором перекиси водорода.
Пример 23. Определение агрегации, вызванной физическим воздействием (перемешиванием)
Испытываемое антитело (IgG) разводили PBS до концентрации 0,2 мг/мл и полученный раствор перемешивали в ячейке лазерного анализатора агрегации Aggregates Sizer (производство Shimadzu Corporation). Физическое воздействие, состоящее в активном перемешивании, достигалось путем вертикального движения перемешивающего устройства при комнатной температуре в течение 30 минут (190 движений в минуту), после этого в образце определяли концентрацию агрегатов с размером частиц от 40 нм до 20 мкм. Для антител, очищенных в щелочной среде, были получены следующие значения концентрации указанных агрегатов: 17,2 мкг/мл для А10-1С04; 16,4 мкг/мл для А23-1А05; 13,3 мкг/мл для А25-2С02; 23,4 мкг/мл для А25-3Н04; и 17,0 мкг/мл для A26-1F02. Эти данные свидетельствуют, что у всех испытанных антител агрегация в результате физического воздействия происходила не более чем на 15%, что говорит об устойчивости всех испытанных антител к физическому воздействию.
Пример 24. Определение концентрации антител в плазме крови у мышей
Флуоресцентно меченные испытываемые антитела (IgG) вводили внутривенно в дозе 3 мг на 1 кг массы тела самцам мышей линии C57BL6 возрастом 8-10 недель (предоставлены Charles River Laboratories International, Inc,). По интенсивности флуоресценции определяли концентрацию испытываемых антител в плазме крови этих животных. Как видно на фиг, 10, у всех испытанных антител, очищенных в щелочной среде (А10-1С04, А23-1А05, А25-2С02, А25-3Н04 и A26-1F02) время полужизни в крови составляло не менее 100 часов, что говорит о хорошем фармакокинетическом профиле.
Пример 25. Определение концентрации антител в сыворотке крови у обезьян
Испытываемые антитела (IgG) вводили внутривенно в дозе 1 мг на 1 кг массы тела самцам макака-крабоеда возрастом 2-3 года (предоставлены Hamri Со,, Ltd,), и определяли у этих животных концентрацию антител в сыворотке крови с помощью набора для иммуноферментного анализа Human Therapeutic IgGl EIA Kit (500910, производство Cayman Chemical). Двум особям (№201 и №202) было введен антитело, очищенное в щелочной среде А10-1С04, а одной особи (№301) - антитело, очищенное в щелочной среде А23-1А05. Как видно на фиг, 11, период полувыведения для А10-1С04 составил 16,56 суток у особи №201 и 11,40 суток у особи №202), клиренс составил 3,598 мл/сут/кг у особи №201 и 5,451 мл/сут/кг у особи №202). У антитела А23-1А05 период полувыведения составил 10,87 суток, клиренс - 10,7 мл/сут/кг. Оба испытанных в этом тесте антитела обладали хорошим фармакокинетическим профилем у макака-крабоеда.
Пример 26. Определение иммуногенности антител
Определяли иммуногенный потенциал испытываемых антител (IgG) с помощью аналитического набора In Vitro T-cell assay (производство LONZA Group Ltd.). У 50 доноров, представляющих группу населения, нуждающуюся в обсуждаемом лечении, брали образцы - дендритные клетки и CD4-положительные Т-клетки периферической крови. К дендритным клеткам донорской крови прибавляли испытываемые антитела, очищенные в щелочной среде, в количестве 50 мкг/мл; антитела поглощались дендритными клетками. Выделяли CD4-положительные Т-клетки периферической крови того же донора и культивировали их вместе с дендритными клетками, поглотившими антитела, для того, чтобы определить реакцию (пролиферацию) CD4-положительных Т-клеток. В качестве отрицательного контроля служил буферный раствор PBS, не содержащий антител, с которым инкубировали CD4-положительные Т-клетки, и сравнивая полученные в таком опыте результаты с данными, полученными с раствором, содержащим то или иное из испытываемых антитела, определяли иммуногенный потенциал данного антитела. Полученные результаты показывают, что ни одно из испытанных антител (А10-1С04, А25-2С02, А25-3Н04, и A26-1F02) не обладала иммуногенным потенциалом в условиях эксперимента.
Пример 27. Определение перекрестной реактивности испытываемых антител с человеческими тканями
Определяли перекрестную реактивность испытываемых антител (IgG) с тканями человека. Для этого были взяты замороженные образцы 35 тканей от одного донора, удовлетворяющие требованиям Управления по контролю качества пищевых продуктов, медикаментов и косметических средств США (FDA) и Европейского агентства лекарственных средств (ЕМА), для анализа которых применяли иммуногистохимическое окрашивание (Covance Laboratories Ltd.). Эти 35 тканей включали надпочечники, мочевой пузырь, клетки крови, костный мозг, молочную железу, мозжечок, кору головного мозга, толстую кишку, эндотелиальные клетки (кровеносных сосудов), глазное яблоко, маточную трубу, желудочно-кишечный тракт (включая гладкую мускулатуру), сердце, почку (клубочки и почечные канальцы), печень, легкое, лимфатический узел, яичник, поджелудочную железу, паращитовидную железу, слюнную железу, периферический нерв, гипофиз, плаценту, предстательную железу, кожу, спинной мозг, селезенку, поперечнополосатую мышцу, яичко, тимус, щитовидную железу, миндалину (небную), мочеточник и матку (область шейки и эндометрий). Результаты, полученные для антител, очищенных в щелочной среде (А10-1С04, А23-1А05, A26-1F02 и А25-2С02), показывают, что все эти антитела давали интенсивное окрашивание в случае эндотелиальных клеток сосудов (положительный контроль). Известно, что в эндотелиальных клетках сосудов имеет место выраженная экспрессия IL-33. В ряде тканей, например в эпителии, интерстициальных клетках, нервной ткани, мышечной ткани и в клетках крови наблюдалась перекрестная реактивность в цитоплазме или ядре, но ни в одной из тканей не было обнаружено перекрестной реактивности в цитоплазматической мембране. Согласно требованиям Международного совета по гармонизации ICH S6(R1) и другим установлениям (Toxicologic Pathology 2010, 38 (7): 1138-1166), перекрестная реактивность в ядре или цитоплазме, куда in vivo проникновение антител маловероятно, имеет меньшую токсикологическую значимость. Таким образом, ни одно из испытанных антител (А10-1С04, А23-1А05, A26-1F02 и А25-2С02) не вызывает опасений с токсикологической точки зрения.
Пример 28. Сужение эпитопных областей антител А10-1С04 и А25-3Н04
Моноклональные антитела против IL-33, обозначенные А10-1С04 и А25-3Н04, связываются с эпитопом PEP14, как описано в примере 1. Были проведены эксперименты с применением метода фагового дисплея для библиотеки непрерывных аминокислотных последовательностей, которые входят в состав PEP14, состоящий из 20 аминокислотных остатков, и которые короче PEP14, и были обнаружены два различных эпитопа, а именно LEDESYEIYV (представлен последовательностью SEQ ID NO: 426 в Перечне последовательностей) и EDESYEIYV (представлен последовательностью SEQ ID NO: 427 в Перечне последовательностей). Пептид LEDESYEIYV соответствует последовательности полипептидной цепи человеческого IL-33, представленного последовательностью SEQ ID NO: 226 в Перечне последовательностей, от аминокислотного остатка, занимающего в ней 138-е положение до аминокислотного остатка, занимающего 147-е положение. Пептид EDESYEIYV соответствует последовательности полипептидной цепи человеческого IL-33, представленного последовательностью SEQ ID NO: 226 в Перечне последовательностей, от аминокислотного остатка, занимающего в ней 139-е положение до аминокислотного остатка, занимающего 147-е положение. Эти пептиды были синтезированы и была определена аффинность к ним антител по данному изобретению, очищенных в щелочной среде, характеризуемая Kd, которую определяли путем кинетического эксклюзионного анализа, как описано в примере 9 (см. таблицу 14).

Промышленная применимость
Антитела, обладающие нейтрализующим эффектом, по данному изобретению можно использовать в фармацевтических композициях для диагностирования, лечения, предотвращения или облегчения заболеваний, связанных с IL-33.