Результат интеллектуальной деятельности: СПОСОБ ОЧИЩЕНИЯ КИШЕЧНИКА И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ
Вид РИД
Изобретение
Настоящее изобретение относится к области медицины и фармакологии, а именно к набору для осуществления способа очищения кишечника, обеспечивающему растворимый шипучий слабительный лекарственный препарат и способу очищения кишечника на его основе.
Слабительные лекарственные препараты уменьшают время прохождения пищи через желудочно-кишечный тракт и предназначены для лечения запоров и очистки кишечника перед проведением рентгенологических и эндоскопических исследований, а также хирургических операций и манипуляций. По механизму действия слабительные препараты подразделяются на несколько классов, а именно, препараты, способствующие смягчению каловых масс, код анатомо-терапевтическо-химической классификации (ATX) А06АА; контактные слабительные препараты, код ATX А06АВ; слабительные препараты, увеличивающие объем кишечного содержимого, код АТХ А06АС; слабительные препараты с осмотическими свойствами, код ATX A06AD; слабительные препараты в клизмах, код ATX A06AG; и прочие слабительные лекарственные препараты, код ATX А06АХ. В составе слабительных препаратов с осмотическими свойствами для очистки кишечника часто используют растворы полиэтиленгликоля, других осмолитов, и электролитов в объемах от 2 до 12 л. Burke DA et al. Postgrad Med J. 1988, 64(756):772-4. Lee TJ et al. Recent advances in colonoscopy. F1000Res. 2016, pii: F1000 Faculty Rev-328. eCollection 2016.
Уменьшение объема принимаемого пациентом раствора является основным направлением совершенствования слабительных препаратов с осмотическими свойствами, так как делает процедуру очистки кишечника более быстрой и удобной для пациента.
Аскорбиновая кислота (L-аскорбиновая кислота) является осмотически активным веществом, применение которого в составе слабительных препаратов обеспечивает уменьшение объема вводимого раствора. Поэтому ряд технических решений в уровне техники касается попыток создания эффективных составов на ее основе и способов их использования.
Например, известен патент US 5274001 А, который раскрывает слабительный изотонический раствор, эффективный при использовании в количестве 2-3,5 л и содержащий 0,25-50 г/л аскорбиновой кислоты или ее соли, 30-60 г/л полиэтиленгликоля и 0,2-20 г/л сульфата натрия. Данный источник не касается сухих шипучих слабительных препаратов.
Патент RU 2353412 С2 раскрывает сухие композиции для очищения толстой кишки и набор для очищения толстой кишки, содержащий первый контейнер и второй контейнер, где первый контейнер содержит первую сухую композицию, которая на один литр приготовляемого из нее раствора содержит следующие компоненты, г:
полиэтиленгликоль от 90 до 150,
сульфат щелочного металла или щелочноземельного
металла или смесь сульфатов щелочных металлов
или щелочноземельных металлов от 5 до 10,
хлорид натрия от 2 до 4 и
хлорид калия от 0,5 до 1,3;
второй контейнер содержит вторую сухую композицию, содержащую смесь аскорбиновой кислоты и ее соли при их соотношении по массе от 2:8 до 8:2 в количестве от 5 до 15 г. Композиция может содержать необязательно бикарбонат натрия до осмоляльности 300-700 мОсмоль/кг. Не упоминается возможность включения данного компонента в набор и не раскрыто его количество.
Высокое содержание аскорбиновой кислоты в данной композиции увеличивает эффективность очистки, но придает раствору неприятный вкус и может вызывать тошноту и рвоту у значительной части пациентов, что усложняет процедуру очистки кишечника. Продукт обеспечивает очищение кишечника при принятии 1,5-3 л раствора, однако, по результатам клинических испытаний тошнота и рвота наблюдалась соответственно у 31-42% и 7-10% пациентов, принимавших указанный препарат. Найдено в Интернет: https://clinicaltrials.gov/ct2/show/results/NCT01732692.
В качестве ближайшего аналога может быть выбран патент ЕА 028866. Патент раскрывает композицию для очищения толстой кишки для смешивания с водой, включающую от 150 до 400 ммоль аскорбат-аниона, образуемого смесью аскорбиновой кислоты и, по меньшей мере, одной соли аскорбиновой кислоты в мольном отношении от 1:4,5 до 1:7,0, и от 5 до 100 г полиэтиленгликоля (ПЭГ), при растворении которой получается раствор с содержанием от 300 до 800 ммоль аскорбат-аниона и от 10 до 200 г полиэтиленгликоля на литр раствора. Раскрывается также набор для получения композиции для смешивания с водой в двух или более частях, содержащих компоненты раствора в сухом виде. Набор может содержать: а) от 150 до 400 ммоль аскорбат-аниона, обеспечиваемого смесью: (i) аскорбиновой кислоты и (и) одной или нескольких солей аскорбиновой кислоты, при этом компоненты (i) и (ii) находятся в мольном отношении от 1:4,5 до 1:7,0; b) от 5 до 100 г ПЭГ со средней молекулярной массой от 3000 до 4000 Да; с) хлорид натрия и хлорид калия; d) необязательно сульфат натрия; е) необязательно одну или несколько вкусовых добавок; f) необязательно один или несколько подсластителей.
В одном варианте осуществления набора он включает: А) первый пакет-саше содержит полиэтиленгликоль и/или сульфат натрия; В1) второй пакет-саше содержит один или несколько компонентов, выбранных из полиэтиленгликоля, одного или нескольких сульфатов щелочных металлов, сульфатов щелочноземельных металлов или их смеси и электролитов; и В2) третий пакет-саше содержит одну несколько солей аскорбиновой кислоты и, в соответствующем случае, саму аскорбиновую кислоту; при этом вместе взятое содержимое пакетов-саше (В1) и (В2) обеспечивает компоненты для второго очищающего раствора.
Устранение соленого вкуса достигается путем добавления вкусовых добавок таких как сукралоза, аспартам и предпочтительно их смесь и их дегустации.
Таким образом, существует необходимость в снижении неприятного вкуса высоких концентраций аскорбиновой кислоты при использовании слабительных препаратов с ее высоким содержанием.
Задача настоящего изобретения заключается в разработке эффективного способа очистки кишечника с помощью слабительного препарата на основе аскорбиновой кислоты, лишенного недостатков известных аналогов.
Задача решается разработанным набором сухих компонентов для получения нового шипучего слабительного лекарственного препарата, который после смешивания с водой эффективно очищает кишечник. Набор состоит из трех частей при следующем содержании компонентов в каждой части, г:

Изобретение отличается от ближайшего аналога тем, что первая часть набора содержит дополнительно хлорид натрия и хлорид калия, вторая часть содержит в качестве электролитов хлорид натрия и хлорид калия, и дополнительно бикарбонат натрия в определенных количествах.
Техническим результатом настоящего изобретения является снижение неприятного вкуса раствора с высоким содержанием аскорбиновой кислоты, приготовляемого смешиванием сухих компонентов с водой, что облегчает применение препарата пациентом. Также техническим результатом является обеспечение высокой стабильности при хранении.
Технический результат достигается разделением компонентов для очищения кишечника на три части, которые после растворения в воде обеспечивают достижение необходимого лечебного эффекта слабительного лекарственного препарата как целого при снижении неприятного вкуса раствора с высоким содержанием аскорбиновой кислоты.
Первая часть набора не содержит аскорбиновой кислоты и вводится пациенту после смешивания с водой на первом этапе, чтобы обеспечить предварительную очистку кишечника и чтобы уменьшить общий объем раствора, который содержит аскорбиновую кислоту, что является одним из факторов достижения технического результата.
Введение раствора, полученного смешиванием частей 2 и 3 набора с водой обеспечивает возможность выделения углекислого газа вследствие реакции бикарбоната и L-аскорбиновой кислоты в момент приготовления раствора непосредственно перед его введением пациенту, что обеспечивает высокую концентрацию углекислого газа в растворе в момент введения пациенту и за счет этой высокой концентрации углекислого газа в растворе обеспечивается снижение неприятного вкуса раствора с высоким содержанием аскорбиновой кислоты.
Разделение L-аскорбиновой кислоты, бикарбоната натрия и сульфата натрия в составе набора на три отдельные части обеспечивает стабильность при хранении, в том числе из-за невозможности самопроизвольной реакции с выделением углекислого газа, которая могла бы произойти в случае, если бы они входили в состав одной части.
В целом, лекарственный препарат, полученный из компонентов набора настоящего изобретения, относится к так называемым шипучим лекарственным формам, которые выделяют углекислый газ при смешивании с водой непосредственно перед применением. Растворение лекарственного препарата в воде при приготовлении раствора сопровождается выделением углекислого газа, что обеспечивает снижение неприятного вкуса, который может приводить к симптомам тошноты и рвоты и ограничить эффективность при применении препарата у пациентов.
Части могут быть выполнены в виде таблетки, гранул или порошка.
Термин «полиэтиленгликоль» означает полимер этиленгликоля с общей химической формулой HO-(CH2-CH2-O)n-OH, CAS номер 25322-68-3. Предпочтительно, в настоящем изобретении используется полиэтиленгликоль с молекулярной массой от 2000 до 8000 Дальтон, фармакопейного качества. В настоящем изобретении молекулярная масса полиэтиленгликоля указывается рядом с названием, например, «полиэтиленгликоль 2000» означает полиэтиленгликоль с молекулярной массой 2000 Дальтон, «полиэтиленгликоль 3350» означает полиэтиленгликоль с молекулярной массой 3350 Дальтон, а «полиэтиленгликоль 8000» означает полиэтиленгликоль с молекулярной массой 8000 Дальтон.
Сульфат натрия или сернокислый натрий имеет химическую формулу Na2SO4, CAS номер 7757-82-6. Предпочтительно, в настоящем изобретении используется сульфат натрия в виде безводной соли Na2SO4,, фармакопейного качества, но также может использоваться в виде кристаллогидрата Na2SO4⋅10Н2О. В последнем случае, количество сульфата натрия в составе лекарственного препарата изобретения рассчитывается на количество безводной соли.
Хлорид натрия имеет химическую формулу NaCl, CAS номер 7647-14-5. Предпочтительно используется в настоящем изобретении в виде безводной соли, фармакопейного качества.
Хлорид калия имеет химическую формулу KCl, CAS номер 7447-40-7. Предпочтительно используется в настоящем изобретении в виде безводной соли, фармакопейного качества.
Бикарбонат натрия имеет химическую формулу NaHCO3, CAS 144-55-8. Предпочтительно используется в настоящем изобретении в виде безводной соли, фармакопейного качества.
L-Аскорбиновая кислота, CAS номер 50-81-7, имеет химическую формулу C6H8O6 и структурную формулу:
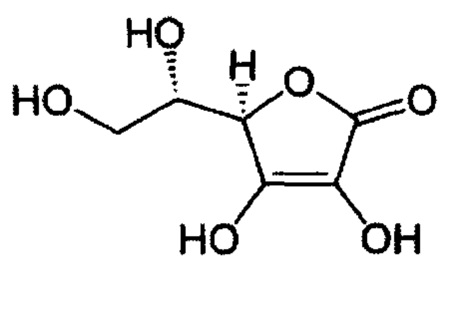
и используется в настоящем изобретении в виде сухого вещества фармакопейного качества.
Термин «млекопитающий» означает любое млекопитающее, предпочтительно человека и домашних млекопитающих (собака, кошка, и лошадь), а также грызунов.
Набор по настоящему изобретению составляется способами хорошо известными из уровня техники, например, с использованием процедур, хорошо известных из уровня техники и описанных в фармацевтическом руководстве Ремингтона. Remington's Pharmaceutical Sciences, seventeenth edition, ed. Alfonso R. Gennaro, Mack Publishing Company, Easton, Pa., Eighteenth edition, 1990.
Предпочтительно, часть 1 набора представляет собой пакет-саше, заполненный полиэтиленгликолем, сульфатом натрия, хлоридом натрия и хлоридом калия в количествах, указанных выше; часть 2 набора представляет собой пакет-саше, заполненный полиэтиленгликолем, хлоридом натрия, хлоридом калия и бикарбонатом натрия в количествах, указанных выше; и часть 3 набора представляет собой пакет-саше, заполненный аскорбиновой кислотой в количестве, указанном выше.
Набор по настоящему изобретению снабжается инструкцией по применению.
Набор по настоящему изобретению может необязательно содержать компоненты для улучшения вкуса и запаха (ароматизаторы). Примеры ароматизаторов включают, но не ограничиваются, экстрактами таких плодов, как яблоко, клюква, груша, персик, слива, абрикос, нектарин, виноград, вишня, смородина, малина, крыжовник, бузина, ежевика, черника, клубника, лимон, лайм, мандарин, апельсин, грейпфрут, купуаку, картофель, помидор, салат, сельдерей, шпинат, капуста, кресс-салат, одуванчик, ревень, морковь, свекла, огурец, ананас, кокос, гранат, киви, манго, папайя, банан, арбуз, маракуйя, мандарин, дыня, и орех колы; а также маслами аниса, ванили, ванилина, какао, шоколада, ментола, винограда, мяты, клевера, лавра, эвкалипта, тмина, кедровых листьев, мускатного ореха, горького миндаля, корицы, цитрусовых, лимона, апельсина, лайма, и грейпфрута. Примеры улучшителей вкуса включают, но не ограничиваются, сахарозой, фруктоза, глюкозой и их смесями, глицирризином, стевиа, сахарином, цикламатами и аспартамом.
Далее, еще одним объектом настоящего изобретения является способ очищения кишечника, характеризующийся тем, что слабительный лекарственный препарат настоящего изобретения, полученный после смешивания с водой, вводят в виде раствора перорально млекопитающему, нуждающемуся в очищении кишечника, в два этапа, на первом этапе млекопитающему вводят раствор, полученный смешиванием с 400-600 мл воды части 1 набора, а на втором этапе этому же млекопитающему вводят раствор, полученный смешиванием с 400-600 мл воды частей 2 и 3 набора.
Предпочтительно, лекарственный препарат вводят последовательно двумя дозами. Для этого, часть 1 лекарственного препарата растворяют в 500 мл воды и вводят пациенту в течение 30 мин. После перерыва 2-12 ч, по выбору пациента и врача, части 2 и 3 лекарственного препарата растворяют в 500 мл воды и вводят пациенту в течение 30 мин. После каждого приема препарата пациенту вводят еще не менее 500 мл воды. Введение растворов, полученных растворением части 1 и частей 2 и 3 набора, может быть осуществлено в один день или в течение двух дней, исходя из удобства пациента.
Настоящее изобретение может быть также использовано для исследований на экспериментальных моделях раздраженной кишки или колоректального рака лабораторных животных, требующих очищения кишечника перед экспериментальными манипуляциями.
Следующие примеры иллюстрируют изобретение.
Пример 1.
Часть 1 набора получают путем смешения компонентов в количествах, указанных в Таблице 1, после чего полученную сухую смесь помещают и герметически закрывают в пакете-саше.

Часть 2 набора получают путем смешения компонентов в количествах, указанных в Таблице 2, после чего полученную сухую смесь помещают и герметически закрывают в пакете-саше.

Часть 3 набора получают путем смешения компонентов в количествах, указанных в Таблице 3, после чего полученную сухую смесь помещают и герметически закрывают в пакете-саше.
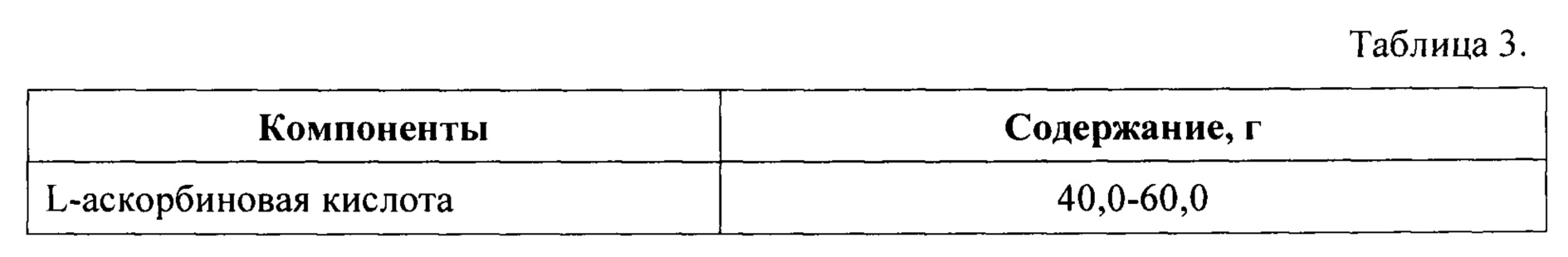
Части 1, 2, и 3 набора помещают в общую упаковку и снабжают инструкцией по применению.
Пример 2.
Часть 1 набора получают путем смешения компонентов в количествах, указанных в Таблице 4, после чего полученную сухую смесь помещают и герметически закрывают в пакете-саше.
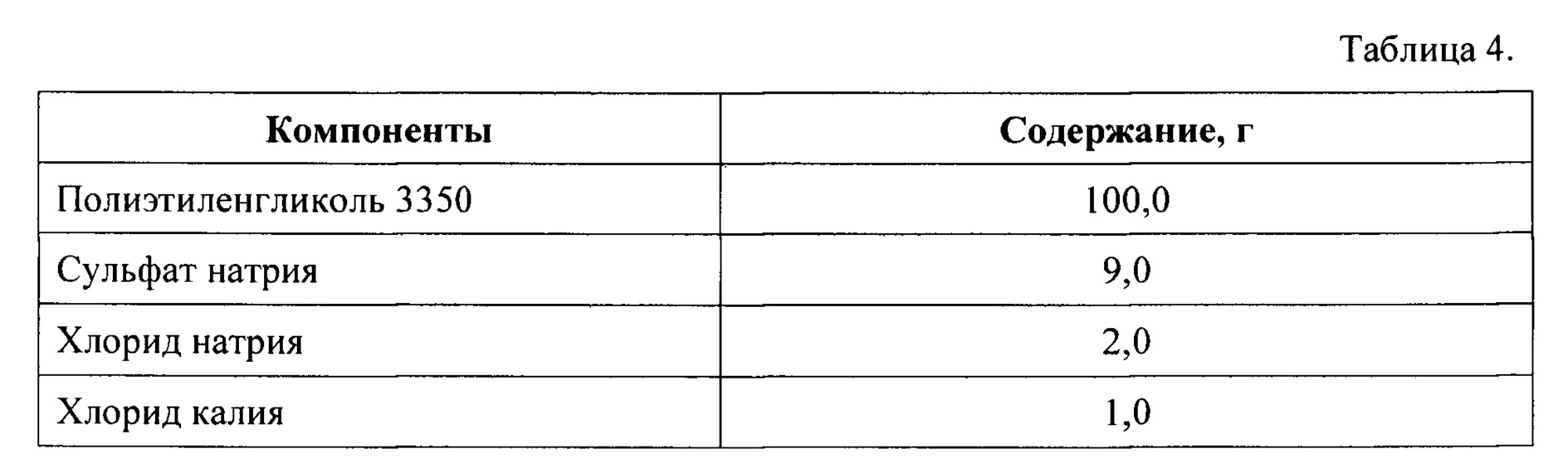
Часть 2 набора получают путем смешения компонентов в количествах, указанных в Таблице 5, после чего полученную сухую смесь помещают и герметически закрывают в пакете-саше.
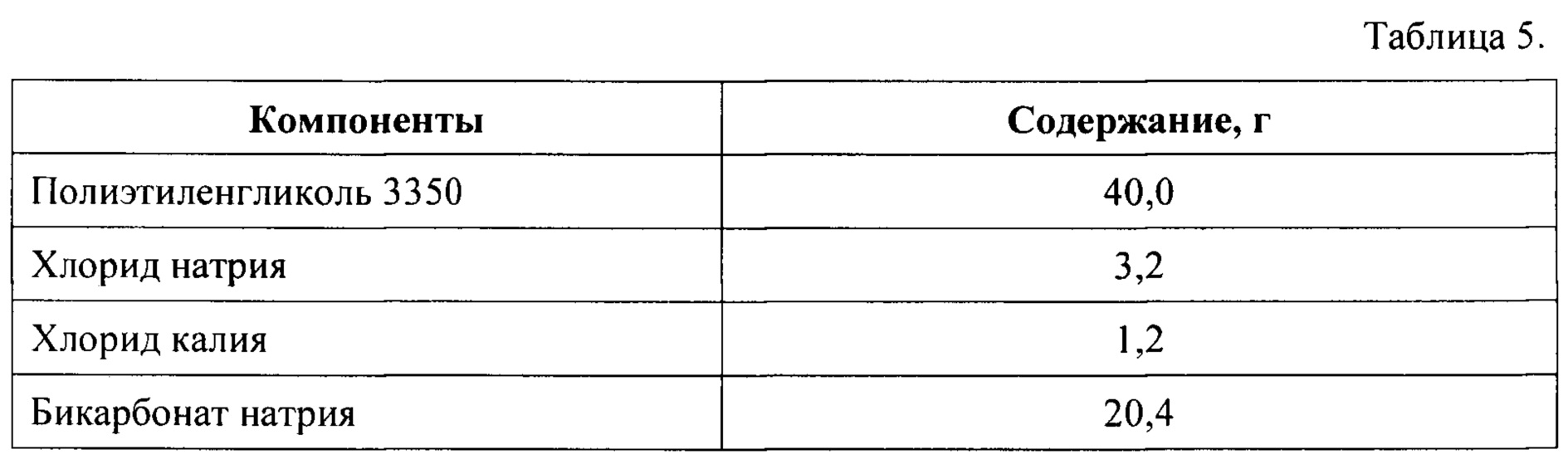
Часть 3 лекарственного препарата получают путем смешения компонентов в количествах, указанных в Таблице 6, после чего полученную сухую смесь помещают и герметически закрывают в пакете-саше.
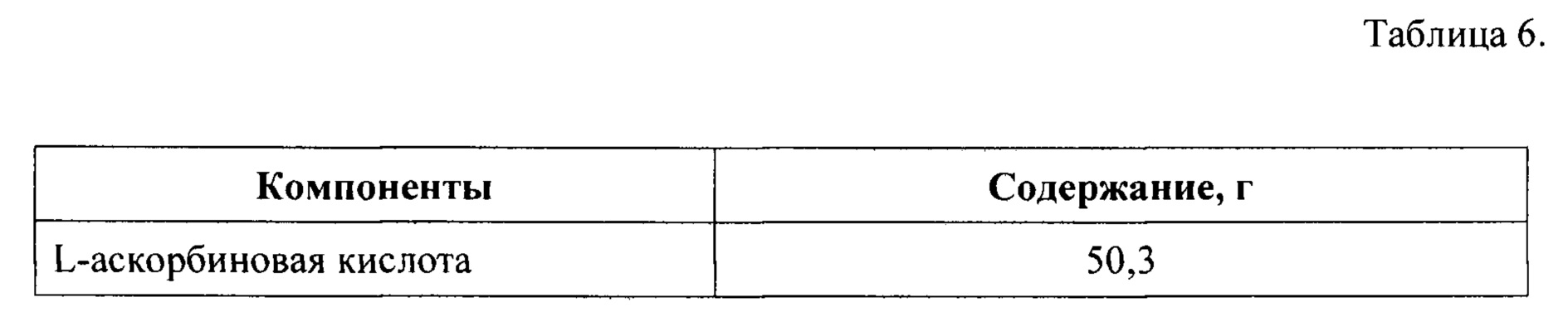
Части 1, 2, и 3 набора помещают в общую упаковку и снабжают инструкцией по применению.
Пример 3.
Часть 1 набора получают путем смешения компонентов в количествах, указанных в Таблице 7, после чего полученную сухую смесь помещают и герметически закрывают в пакете-саше.
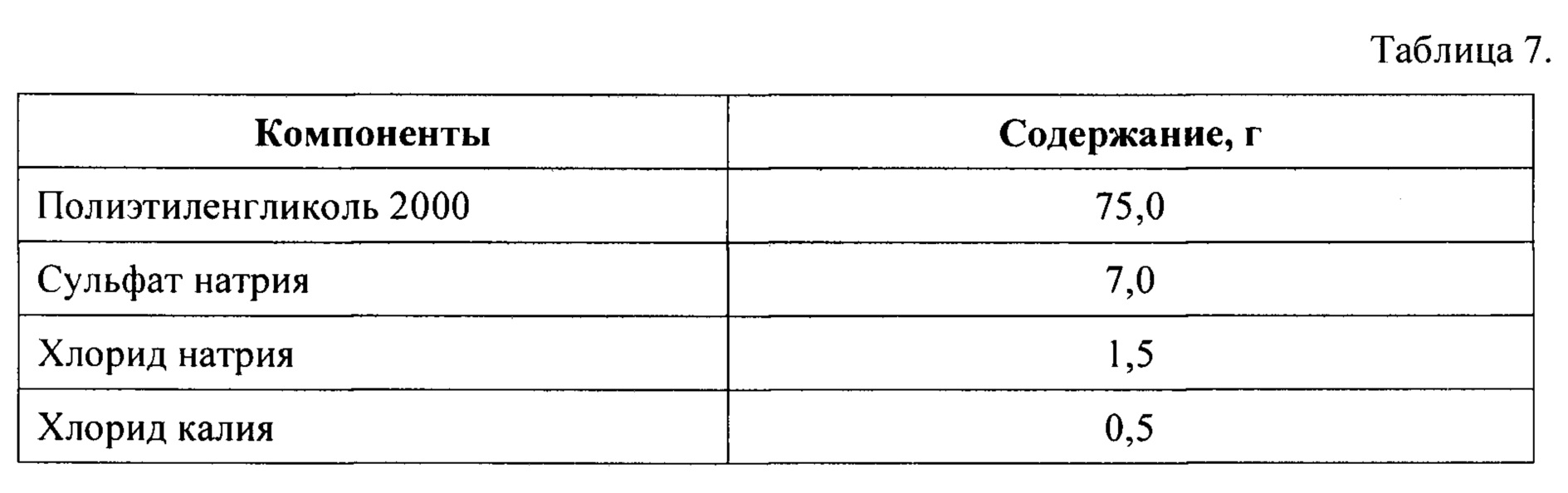
Часть 2 набора получают путем смешения компонентов в количествах, указанных в Таблице 8, после чего полученную сухую смесь помещают и герметически закрывают в пакете-саше.
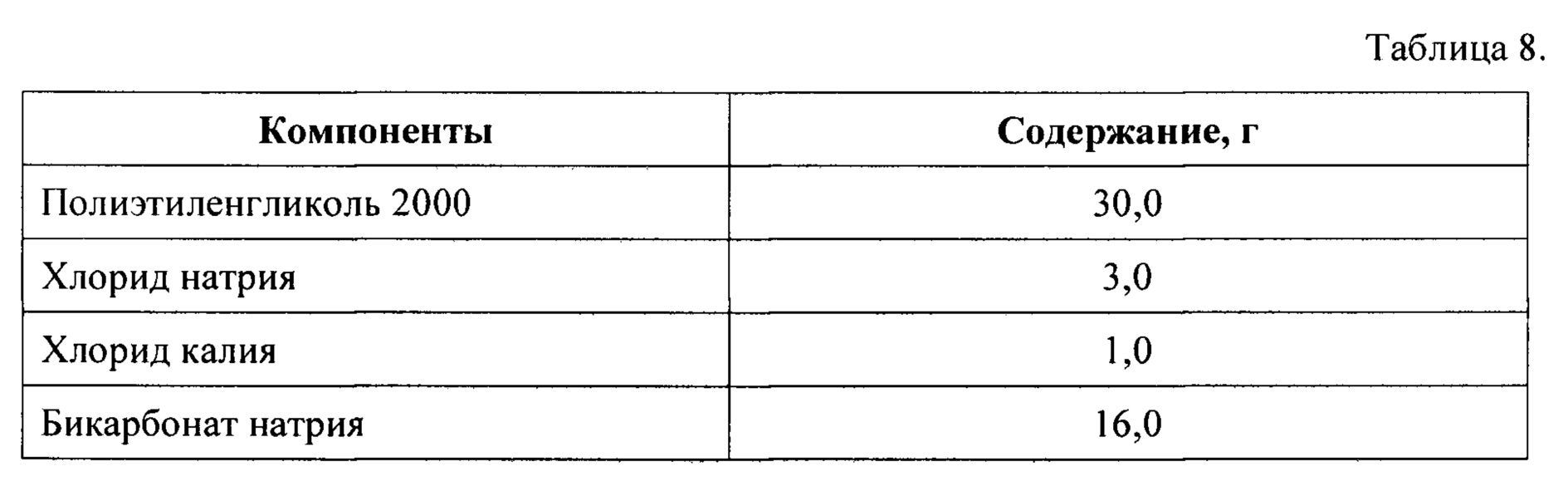
Часть 3 набора получают путем смешения компонентов в количествах, указанных в Таблице 9, после чего полученную сухую смесь помещают и герметически закрывают в пакете-саше.
Части 1, 2, и 3 помещают в общую упаковку и снабжают инструкцией по применению.
Пример 4.
Часть 1 набора получают путем смешения компонентов в количествах, указанных в Таблице 10, после чего полученную сухую смесь помещают и герметически закрывают в пакете-саше.
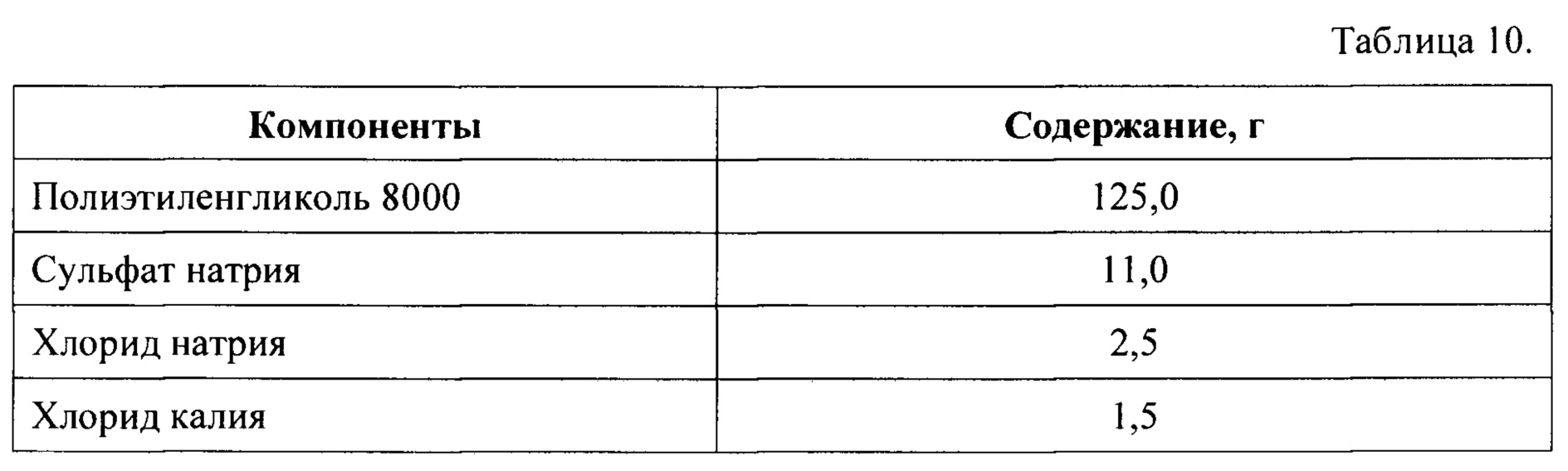
Часть 2 набора получают путем смешения компонентов в количествах, указанных в Таблице 11, после чего полученную сухую смесь помещают и герметически закрывают в пакете-саше.
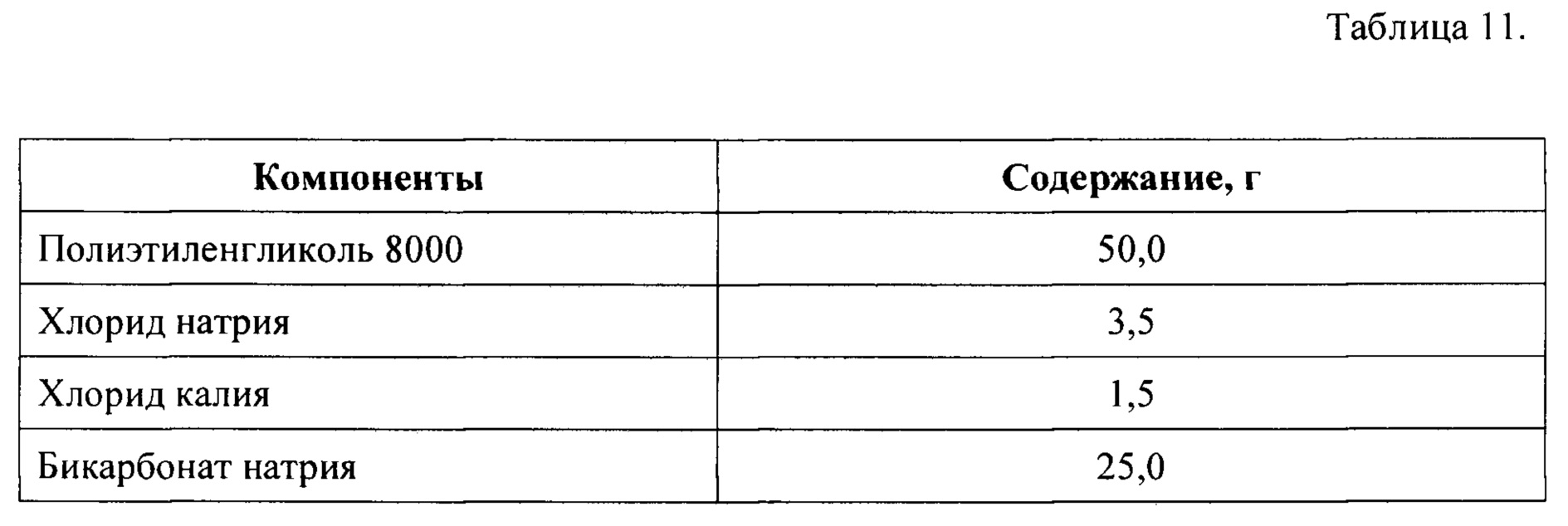
Часть 3 набора получают путем смешения компонентов в количествах, указанных в Таблице 12, после чего полученную сухую смесь помещают и герметически закрывают в пакете-саше.
Части 1, 2, и 3 помещают в общую упаковку и снабжают инструкцией по применению.
Пример 5. Изучение эффективности.
Эффективность растворов, полученных с помощью заявленного набора, оценивали по влиянию на общее время прохождения перорально введенной метки, а именно карминового красного, через желудочно-кишечный тракт. Карминовый красный не абсорбируется из просвета кишечника и широко используется как метка для оценки времени прохождения пищевых масс через желудочно-кишечный тракт. Kimball ES et al. Am J Physiol Gastrointest Liver Physiol. 2005, 288(6):G1266-73. Мыши-самцы C57B1/6, массой 20-22 г, имели свободный доступ к воде и пище и были распределены случайным образом в несколько групп. В группе №1 животным вводили через зонд в желудок 15 мл/кг дистиллированной воды (контроль), подкрашенной до ярко-красной окраски 6% раствором карминового красного, суспендированного в 0,5% метилцеллюлозе. В группе №2 животным через зонд в желудок вводили 15 мл/кг раствора (эквивалент введению 1000 мл раствора человеку весом 70 кг), полученного растворением частей 1, 2, и 3 набора примера №2 в 1 л воды и подкрашенного вышеуказанным раствором карминового красного. В группе №3 животным через зонд в желудок вводили 15 мл/кг раствора, полученного растворением частей 1, 2, и 3 набора примера №3 в 1 л воды и подкрашенного вышеуказанным раствором карминового красного. В группе №4 животным через зонд в желудок вводили 15 мл/кг раствора, полученного растворением частей 1, 2, и 3 набора примера №4 в 1 л воды и подкрашенного вышеуказанным раствором карминового красного. В группе №5 животным через зонд в желудок вводили 7,5 мл/кг раствора (эквивалент введению 500 мл раствора человеку весом 70 кг), полученного растворением части 1 набора из примера №2 в 500 мл воды и подкрашенного вышеуказанным раствором карминового красного, и через 30 мин вводили еще 7,5 мл/кг раствора, полученного растворением частей 2 и 3 набора из примера №2 в 500 мл воды. Визуально контролировали появление фекалий окрашенных карминовым красным, начиная момента введения раствора и далее через каждые 10 мин. Общее время прохождения желудочно-кишечного тракта определяли как интервал между введением подкрашенного раствора и временем первого наблюдения окрашивания фекалий карминовым красным. Результаты представлены в таблице 13 как среднее значение ± ошибка среднего общего времени прохождения метки через желудочно-кишечный тракт (n=6 в группе). Отличия между группами оценивались с использованием t-критерия Стьюдента и считались достоверными при р<0,05.

Таблица 13 показывает, что введение млекопитающему раствора, полученного смешиванием частей набора настоящего изобретения с водой достоверно снижает общее время прохождения желудочно-кишечного тракта по сравнению с контролем, что указывает на сильный слабительный эффект, достигаемый как при введении раствора одной дозой, полученной смешиванием всех трех частей 1, 2, и 3 лекарственного препарата (группы 2-4), так и при последовательном введении двумя дозами, где первая доза получается растворением части 1 набора в воде, а вторая доза получается растворением частей 2 и 3 набора в воде (группа 5).
Пример 6. Вкус раствора слабительного лекарственного препарата.
Для оценки вкусовых качеств раствора лекарственного препарата, полученного с помощью набора настоящего изобретения, было приготовлено несколько дополнительных контрольных наборов (Таблицы 14-16), отличающихся от составов настоящего изобретения только тем, что вместо бикарбоната натрия в их состав было введено эквимолекулярное количество гидроксида натрия, поэтому растворы, полученные растворением этих компонентов контрольных наборов в воде отличались от растворов, полученных растворением компонентов набора настоящего изобретения только отсутствием углекислого газа, который выделяется при растворении частей набора настоящего изобретения в воде.
Далее, для сравнения были приготовлены пары растворов, отличающихся только наличием углекислого газа. Первая пара была получена растворением в одном литре воды частей 1, 2, и 3 набора из примера №2 (раствор 1) и примера №6, Таблица 14 (контроль 1). Вторая пара была получена растворением в одном литре воды частей 1, 2, и 3 набора из примера №3 (раствор 2) и примера №6, Таблица 15 (контроль 2). Третья пара была получена растворением в одном литре воды частей 1, 2, и 3 набора из примера №4 (раствор 3) и примера №6, Таблица 16 (контроль 3). Пары растворов были предложены для тестирования группе из 7 человек. Раствор из пары, вкус которого был признан лучшим при тестировании, получал 1 балл, а вкус, которого был признан худшим, получал 0 баллов. Баллы для каждого раствора и контроля в группе (n=7) суммировались. Результаты представлены в Таблице 17.

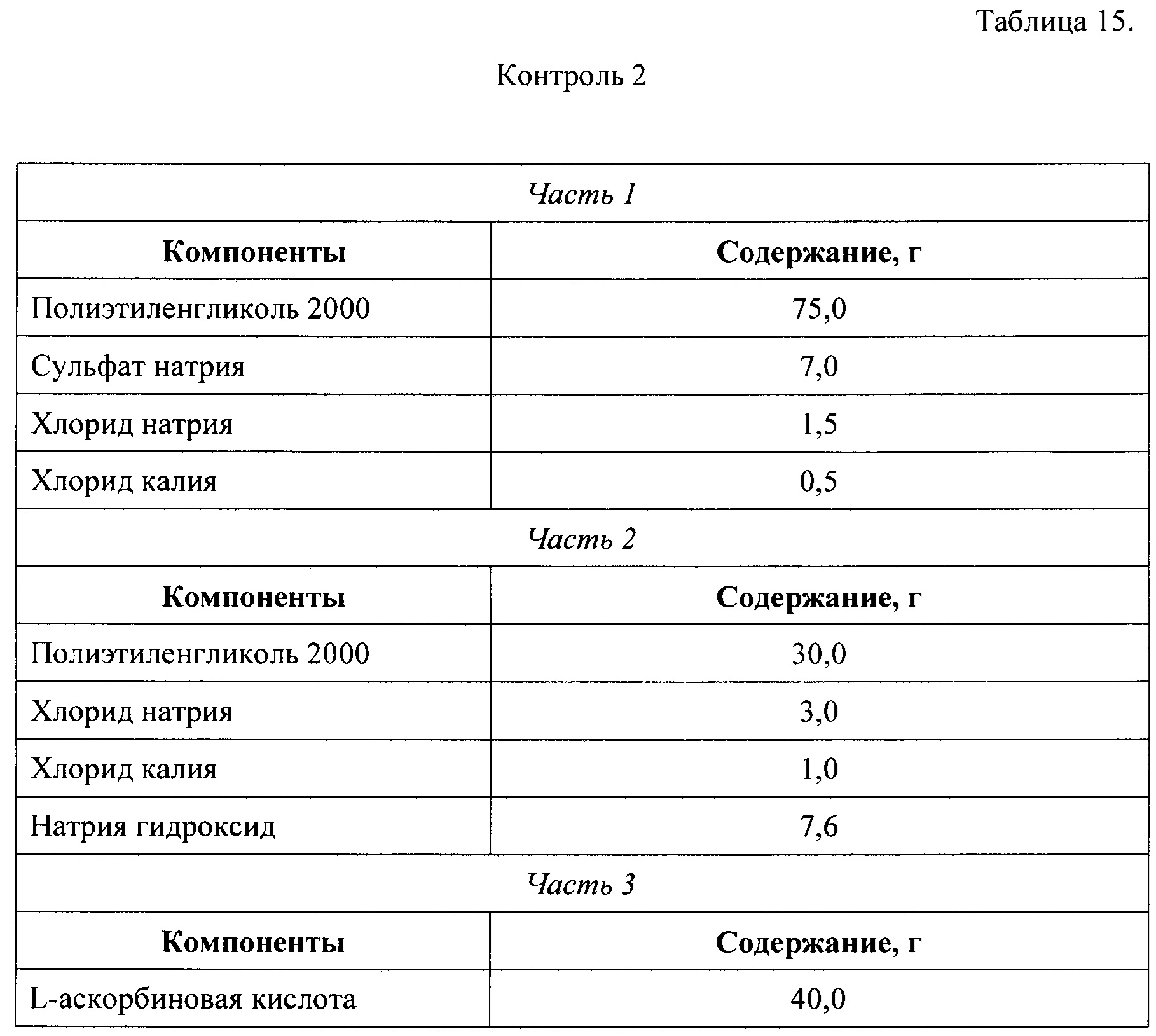
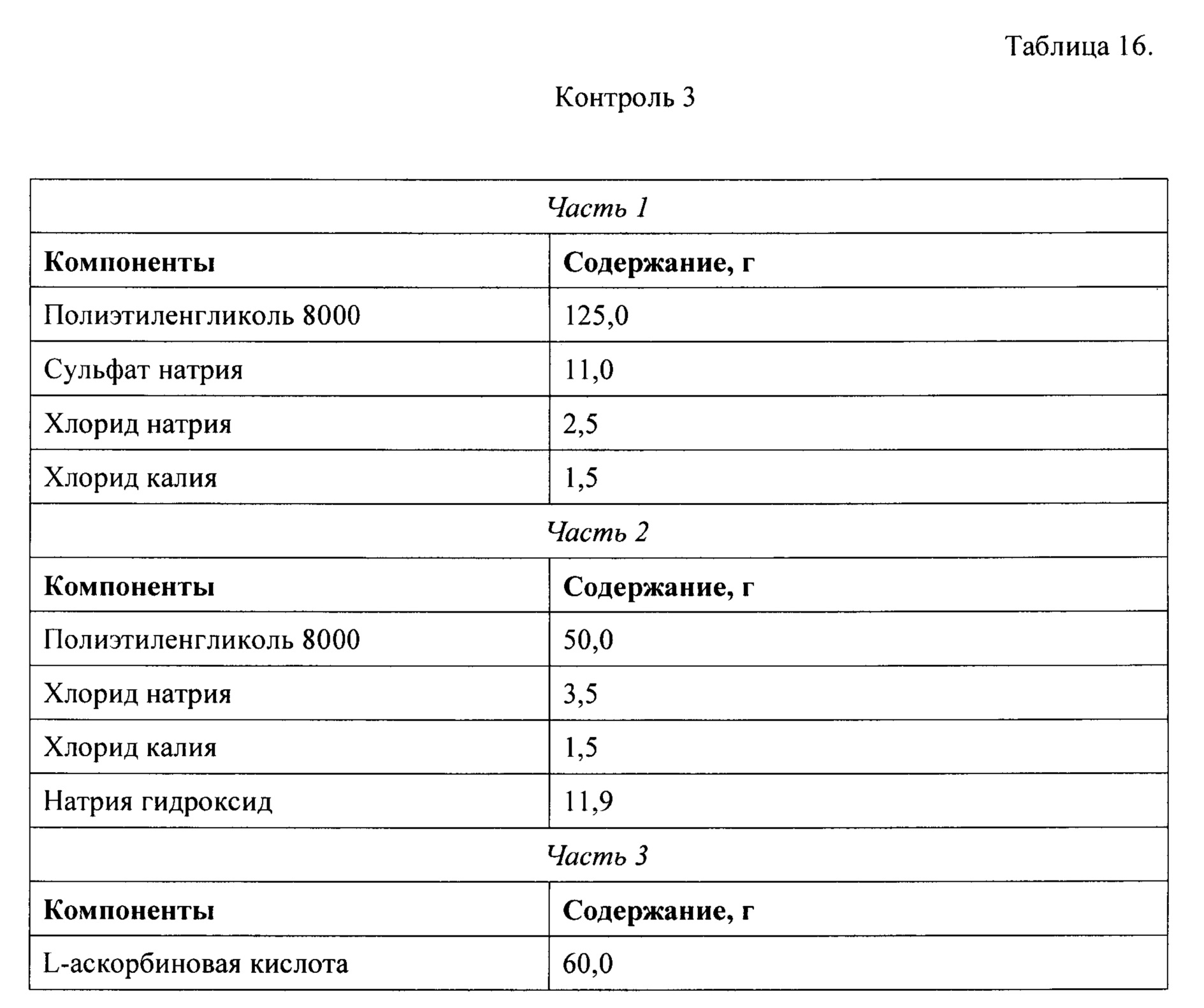
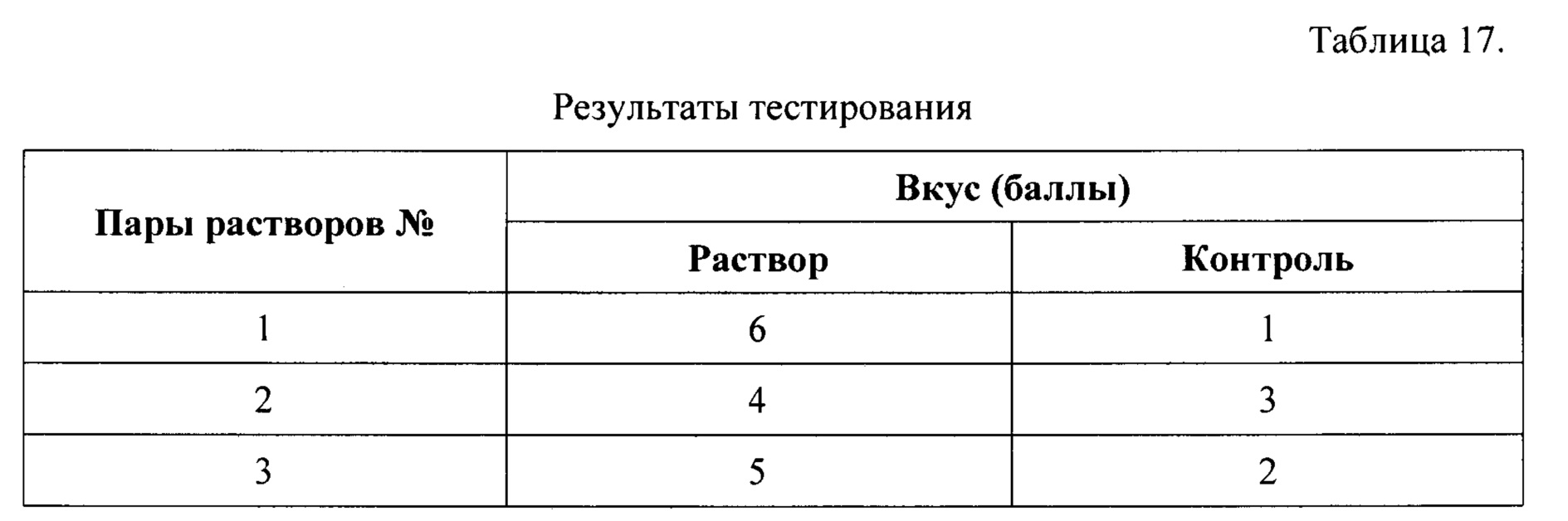
Таблица 17 показывает, что среднее значение (± ошибка среднего) для растворов, полученных по настоящему изобретению, было достоверно выше 5,0±0,6 баллов (р<0,05; t-тест Стьюдента), чем в контроле 2,0±0,6 баллов. Таким образом, введение в состав набора настоящего изобретения отдельных лекарственных форм, выделяющих углекислый газ в момент приготовлении раствора непосредственно перед введением пациенту, обеспечивает улучшение неприятного вкуса раствора слабительного лекарственного препарата настоящего изобретения во всем диапазоне заявленного количественного содержания.
Пример 7. Вкус раствора частей 2 и 3 слабительного лекарственного препарата С учетом того, что лекарственный препарат применяется двумя дозами, и аскорбиновая кислота введена в составе второй дозы, были приготовлены и протестированы следующие пары растворов, отличающихся только наличием углекислого газа. Первая пара была получена растворением в 500 мл воды частей 2 и 3 набора из примера №2 (раствор 1) и примера №6, таблица 14 (контроль 1). Вторая пара была получена растворением в 500 мл воды частей 2 и 3 набора из примера №3 (раствор 2) и примера №6, таблица 15 (контроль 2). Третья пара была получена растворением в 500 мл воды частей 2 и 3 набора из примера №4 (раствор 3) и примера №6, таблица 16 (контроль 3). Пары растворов были предложены для тестирования группе из 7 человек. Раствор из пары, вкус которого был признан лучшим, получал 1 балл, а вкус, которого был признан худшим, получал 0 баллов. Баллы для каждого раствора и контроля суммировались в группе (n=7). Результаты представлены в Таблице 18.

Таблица 18 показывает, что среднее значение (± ошибка среднего) для растворов лекарственных форм (Б) и (В) препарата настоящего изобретения было достоверно выше 5,7±0,3 баллов (р<0,01; t-тест Стьюдента), чем в контроле 1,3±0,3 баллов. Таким образом, введение в состав набора настоящего изобретения отдельных лекарственных форм, выделяющих углекислый газ при приготовлении раствора непосредственно перед введением пациенту, обеспечивает улучшение неприятного вкуса раствора аскорбиновой кислоты в составе набора для получения слабительного лекарственного препарата во всем диапазоне заявленного количественного содержания компонентов лекарственных форм.



